Author: Бухало А.С.
Tags: систематика растений ислам грибы экология растений этология растение и окружающая среда биология микробиология
ISBN: 5-12-000267-6
Year: 1988
Text
А.С. Бухало
Высшие
съедобные
хгзидиомицеты
5 ЧИСТОЙ
сультуре
АКАДЕМИЯ НАУК УКРАИНСКОЙ ССР
Институт ботаники им.Н.Г .Холодного
А.С.Б УХ АЛО
ВЫСШИЕ СЪЕДОБНЫЕ БАЗИДИОМИЦЕТЫ
В ЧИСТОЙ КУЛЬТУРЕ
Киев Внукова думка 1988
УЖ 582 (284+287.23) :635.8+581.5 581.14
Высшие съедобные базидиомнцеты в чистой культуре / Бухало А.С.; Отв. ред. Дудка И.А.; АН УССР.
Ин-т ботаники им.Н.Г.Холодного. - Киев : Наук, думка, 1988. - 144 с. - ESBN 5-12-000267-6.
В монографии обобщены данные о морфологии и биологии высших съедобных базидио-
мицетов в чистой культуре, имеющие важное значение для таксономии и практического ис-
пользования этих грибов как продуцентов белка и биологически активных веществ. В чистой
культуре исследовано более 100 видов высших съедобных базидиомицетов, представителей
разных экологических групп и таксонов. Изложены методы выделения культур, установлена
таксономическая значимость морфологических и физиолого-биохимических критериев для
идентификации этих грибов при получаши пищевой биомассы в глубинной культуре. Приве-
дены научные основы многоуровневого селекционного отбора продуцентов, а также законо-
мерности, характеризуюпще рост и морфогенез высших базидиомицетов при глубинном куль-
тивировании.
Для микологов, ъакробиологов, специалистов лесного и сельского хозяйства, преподава-
телей и студентов вузов.
Ид. 53. Табл. 13. Библиогр.: с. 125—142.
Ответственный редактор ИЛ .Дудка
Утверждено к печати ученым советом Института ботаники нм. Н.Г .Холодного АН УССР !
Редакция биологической литературы
Редактор Т.Л.Горбань
Научное издание
БУХАЛО Ася Сергеевна
ВЫСШИЕ СЪЕДОБНЫЕ БАЗИДИОМНЦЕТЫ В ЧИСТОЙ КУЛЬТУРЕ
Художник обложки ВЛ.Потиевский
Художественный редактор ЛЛ.Комяхова
Технический редактор Л.НМуравцева
Оператор ТЛ.Мотенко
Корректоры Е.С. Коваль, О.В.Собкевич
ИБ№9194.
Сдано в набор 19.01.88. Подл, в печ. 10.06.88. Формат 70x108/16. Бум. офс. № 1. Гарн. Пресс Роман.
Офс. печ. Усл.печ.л. 15,40. Усл.кр.-отт. 15,75. Уч.-издл. 16,05 + вкл. 2,96 = 19,01. Тираж 920 экз
Заказ 8-103.Цена 3 р. 90 к.
Оригинал-макет) подготовлен в издательстве ’’Паукова думка”. 252601 Киев 4, ул. Репина, 3.
Киевская книжная типография научной книги. 252004 Киев 4, ул. Репина, 4.
с_2004000000-449
Б М221 (04) -88 КУ-2-326-88
ISBN 5-12-000267-6
© Издательство ’’Паукова думка”, 1988
ПРЕДИСЛОВИЕ
Рациональное использование природных ресурсов, поиск новых биологических
объектов для получения полноценной белковой пищи является одним из сущест-
венных аспектов народного хозяйства. Источником увеличения ресурсов белка,
получаемого путем микробиологического синтеза, может быть промышленное
производство мицелия высших грибов, который по питательным и вкусовым ка-
чествам обладает несомненным преимуществом перед многими продуктами рас-
тительного происхождения. Получение белка из грибов может внести вклад в ре-
шение мировой проблемы ликвидации белкового дефицита.
Практически все ценные съедобные грибы, традиционно употребляемые чело-
веком для питания, относятся к высшим базидиомицетам, насчитывающим около
10 тыс. видов (Hawksworth et al., 1983). Исследования высших базидиомицетов -
в культуре были начаты в 80-х годах прошлого столетия, однако вопрос о возмож-
ности практического использования чистой мицелиальной культуры этих грибов
возник только в 50-х годах XX ст. в связи с общим прогрессом промышленного
культивирования мицелиальных грибов для производства антибиотиков.
Теоретические исследования высших базидиомицетов в чистой культуре свя-
заны с разработкой систематикиг экологии, биологии грибов этой группы. Прак-
тические работы направлены на получение мицелиальной биомассы для пищевых
и кормовых целей, ценных биологически активных и химических веществ, на ис-
пользование глубинного мицелия для получения плодовых тел.
В результате исследований, начатых в 50-е годы нашего столетия в США и про-
долженных позже в Советском Союзе, некоторых социалистических и развитых
капиталистических странах, появилась возможность культивирования высших
базидиомицетов глубинным методом, широко используемым в современной мик-
робиологической промышленности (Pat. 21845, USA; Pat. 2618900, USA; Pat.
2648163, USA; Eddy, 1958; Бухало, 1968, 1973a, 1978, 1982a; Worgan, 1968; Низ-
ковская, 1972, 1978; Solomons, 1975; Dijkstra, 1976; Промышленное культиви-
рование .... 1978; Zetelaki, 1981; Высшие съедобные базидиомицеты ..., 1983).
Принципиальное значение имеет установление сходства химического состава при-
родных плодовых тел и культурального мицелия, выращенного глубинно на элек-
тивных питательных средах. Воздействуя на условия культивирования, в мицелии
можно улучшать такие важные биохимические показатели, как содержание белка,
отдельных аминокислот, липидов и других питательных компонентов (Биосинте-
тическая деятельность ..., 1969; Hattula, (jyllenberg, 1969а, b; Dijkstra, 1976;
Промышленное культивирование ..., 1978; Высшие съедобные базидиомице-
ты..., 1983).
При культивировании мицелиальных форм съедобных грибов возникают спе-
цифические проблемы, связанные с идентификацией культур по признакам, обыч-
но не использующимся в традиционной систематике высших базидиомицетов.
Задача усложняется тем, что существует обширная группа микофильных грибов,
обитающих на плодовых телах высших базидиомицетов, что постоянно таит опас-
ность выделения в культуру вместо базидиомицетов грибов из других системати-
ческих групп.
Недооценка важности микологических аспектов проблемы глубинного куль-
тивирования высших базидиальных грибов, в частности получения чистой культу-
ры, привела к тому, что практически все штаммы, отобранные в 50—70-е годы
для промышленного культивирования, оказались несовершенными гифомицета-
ми, а производимый продукт был лишен соответствующего вкуса и аромата. Это
привело к определенному пессимизму^ оценке возможного использования выс-
ших съедобных базидиомицетов в качестве продуцентов биомассы и затормозило
исследования в этой области. Культивированию ложных штаммов базидиомицетов
способствовало распространение ошибочной концепции, утверждающей, что в глу-
бинной культуре образуются физиологические мутанты с несвойственными выс-
шим базидиомицетам спороношениями.
В чистой культуре изучено незначительное количество видов вышшх базидио- 3
мицетов, преимущественно из .порядка Aphyllophorales. Большинство ценных
съедобных грибов, представителей порядков Agaricales s.L, Boletales, группы по-
рядков Gasteromycetes не исследовались в культуре достаточно полно, многие
'из них вообше не интродуцированы в чистую культуру. Литературные данные
об отдельных видах, полученные в разных условиях культивирования, трудно
сопоставимы. Во многих работах отсутствует морфологическая характеристика
культур, не приводятся фамилии авторов изученных таксонов, что не позволяет
с уверенностью судить о систематическом положении объектов исследования,
использовать полученные результаты.
В СССР ранее не проводились исследования, направленные на интродукцию
высших съедобных базидиомицетов в чистую культуру в качестве продуцентов
пищевой биомассы. И хотя возможность глубинного культивирования высших
съедобных базидиомицетов в принципе установлена, однако на пути к ее практи-
ческому осуществлению предстоит решить ряд проблем, касающихся получения
чистых культур, их идентификации, физиологии и морфологии роста в глубинной
культуре определенных видовАНе были ранее обоснованы требования, которым
должен отвечать высший баэидиоьпшет — продуцент пищевой биомассы^ Ряд тре-
бований к продуцентам, которые выдвигались отдельными авторами, основыва-
лись на недостоверных, экспериментально не подтвержденных данных.
Таким образом, исследования в культуре высших базидиомицетов открывают
возможности для проведения работ в области биологии и систематики этих гри-
бов, для решения такой важной в практическом отношении задачи, как получение
дополнительного источника белка на основе промышленного культивирования
видов съедобных базидиомицетов.
В связи с изложенным выше целью исследования, результаты которого приво-
дятся в монографии, является создание научных основ культивирования высших
съедобных базидиомицетов — продуцентов пищевой биомассы, включаюшее сле-
дующие основные задачи: получение чистых культур высших базидиомицетов и
разработка научных подходов к их идентификации; установление существенных
признаков для проведения селекционного отбора штаммов съедобных грибов —
продуцентов пищевой биомассы в глубинной культуре; определение оптималь-
ных условий культивирования селектированных штаммов.
В чистой культуре автором проведено исследование 219 штаммов 119 видов
высших базидиомицетов, относящихся к 56 родам, 24 семействам, 10 порядкам.
В монографии дана оценка перспективы использования видов высших съедобных
базидиомицетов, представителей разных экологических групп и таксонов, в ка-
честве объектов глубинного культивирования для получения пищевой биомассы.
Изложены научные основы многоуровневого селекционного отбора высших ба-
зидиомипетов — продуцентов пищевой биомассы, описаны закономерности, ха-
рактеризующие рост этих грибов в глубинной культуре.
Установлена таксономическая значимость критериев, используемых для иден-
тификации высших базидиомицетов в культуре. Выявлены морфологические,
физиолого-биохимические особенности культур, являющиеся дополнительными
таксономическими признаками на видовом уровне. Полученные дшшые имеют
важное значение для идентификации культур, уточнения систематического поло-
жения и эволюционной продвинутое™ таксонов.
Изучен морфогенез высших базидиомицетов в глубинной культуре, что позво-
лило опровергнуть теорию об образовании при глубинном культивировании му-
тантов, коренным i образом отличающихся от исходных культур. На значительном
количестве видов показано, что при глубинном культивировании образуются гене-
тически закрепленные формы вегетативного и бесполого спороношення, характер-
ные для определенных видов как в глубинной культуре, так и при их культивиро-
вании на плотных питательных средах. Экспериментальные исследования проводи-
лись со штаммами коллекции культур макромицетов, созданной автором.
Большое научно-практическое значение имеют материалы, отражающие резуль-
таты разработки принципов и методов многоуровневого селекционного отбора
штаммов съедобных грибов для глубинного культивирования. На основе этих
принципов селектированы штаммы ценных съедобных грибов: Pleurotus ostreatus
ИВР 1300, Panus tigrinus ИБК 131, Fiammulina velutipes ИБК 112, защищенные
авторскими свидетельствами в качестве продуцентов пищевой биомассы
(А.с. 427993, 727687, 883177, СССР). Приведены данные о продуктивности, ско-
рости роста, физиолого-биохимических свойствах селектированных штаммов.
В монографии обобщены большой экспериментальный материал и теоретиче-
ские положения по культивированию макромицетов с целью получения пищевой
биомассы. Работа является теоретическим фундаментом для использования выс-
ших базидиальных грибов в качестве источника нишевого белка и биологически
активных веществ, получаемых путем микробиологического синтеза.
За ценные советы при выполнении работы и критический просмотр рукописи
автор выражает благодарность доктору биологических наук И А Дудке за помощь
при подготовке рукописи к печати — ВЛЛСачуровской, ЛЛЛархоменко,
Г.Б.Шимбергу.
Математическая обработка экспериментальных данных проведена в вычисли-
тельном центре Института ботаники им.Н.Г.Холодного АН УССР при участии
Е.ГКосмаиа. Электронно-микроскопические исследования микроструктур выс-
ших базидиомицетов и составление таблиц с микрофотографиями проведено сов-
местно с кандидатом биологических наук О.А.Закордонцем..
Рисунки и микрофотографии, приведенные в книге, оригинальны, отдельные
рисунки заимствованы из литературных источников, на которые в тексте есть
соответствующие ссылки.
ГЛАВА 1
ОСНОВНЫЕ НАПРАВЛЕНИЯ ИССЛЕДОВАНИЙ
ВЫСШИХ СЪЕДОБНЫХ БАЗИДИОМИЦЕТОВ В ЧИСТОЙ КУЛЬТУРЕ
И ПЕРСПЕКТИВЫ ИХ ПРАКТИЧЕСКОГО ИСПОЛЬЗОВАНИЯ
В последнее время грибы помешают в самостоятельное царство живых организ-
мов. базидиомнцеты выделяют в отдел Basidiomycotina (Hawksworth et al.,
1983) или класс Basidiomycetes (Горленко, 1984). К высшим базидиомицетам,
которые не являются систематической категорией, относят представителей гиме-
номицетов и гастеромицетов с макроскопическими плодовыми телами, насчиты-
вающих около 10 тыс. видов (Hawksworth et al.. 1983). Высшие съедобные
базидиомнцеты являются представителями различных экологических групп,
преимущественно микоризообразователей, сапротрофов, лигнотрофов, коп-
ротрофов.
Большинство видов грибов, традиционно употребляющихся человеком в пи-
шу, принадлежат к высшим базидиомицетам. Съедобность являетекатегорией,
включающей понятия вкусовой, физиологической и эстетической приемлемости
(Cochran, 1978). Это свойство вида, которое отражает генетически закрепленные
, особенности химического состава и морфологии плодовых тел.
Ассортимент употребляемых в пишу видов съедобных грибов в различных ре-
гионах зависит от имеющегося выбора, традиций и вкуса людей. По литературным
данным, количество съедобных грибов в разных регионах Советского Союза ва-
рьирует от 200 до 500 видов, однако широко использующихся в пищу обычно не
более 20-50 (Васильков,. 1948; Зерова, 1970; Васильева, 1973, 1978; Нахуцриш-
вили. 1975; Вассер, Солдатова, 1977; Зерова и др., 1979; Горленко и др., 1980;
Мелик-Хачатрян, 1980; Сержанина, 1984; Сержанина, Змитрович, 1986).
М.Я.Зерова и др. (1979) для УССР приводят 346 съедобных и 40 условно-
съедобных видов. Наибольшим количеством съедобных видов, по данным этих
авторов, в украинской микобиоте представлены порядки Boletales, Agaricales
и Russulales. в частности 10—35 съедобных видов насчитывают роды Russula,
Boletus. Cortinarius, Hygrophorus, Lyophyllum, Lactarius, Agaricus, Lepiota,
Clitocybe, Entoloma, Pholiota, Pluteus и Tricholoma. У многих видов высших ба-
зидиомицетов, редко встречающихся, с мелкими или жесткими плодовыми телами
съедобность до сих пор не установлена. Относительно съедобности некоторых ви-
дов имеются противоречивые данные (Васильков, 1948; Зерова, 1970; Smith,
1978; Michael et al., 1979; Зерова та iH., 1984). Решение вопроса о съедобности
таких видов требует специальных биохимических и токсикологических иссле-
дований.
Теоретические аспекты изучения высших базидиомицетов в чистой культуре
очень разноплановы и здесь не представляется возможным полно их осветить.
Основное внимание мы уделили вопросам выделения и идентификации культур,
оценки критериев, имеющих таксономическое значение, образованию бесполого
и полового спороиошения у высших базидиомицетов в культуре и некоторым
другим.
Вопрос о возможности практического использования стерильной мицелиаль-
ной культуры высших базидиомицетов был поставлен в 50-х годах XX ст. в связи
с общим прогрессом промышленного культивирования мицелиальных грибов для
производства антибиотиков.
Практическое использование высших съедобных базидиомицетов в чистой
культуре возможно в 3 основных аспектах: производство мицелия для пищевых
и кормовых целей; производство посевного мицелия для получения плодовых
тел; получение на основе культивирования мицелия съедобных грибов биологи-
чески активных и ценных химических веществ. В связи с основными задачами
нашей работы в данном разделе более полно освещается проблема исполь-
зования культурального мицелия высших базидиомицетов в качестве источ-
6 ника питания.
1.1. Использование культурального метода
для таксономических исследовании
1.1.1. Критерии идентификации высших базидиомицетов в культуре
Исследования культуральных особенностей представителей различных таксонов
высших базидиомицетов проводятся с 30-х годов нашего столетия, при этом пока-
зано значение культуральных особенностей для таксономии и филогенетических
построений (Brodie, 1936; Fries, 1949; McKeen, 1952; Возняковская, 1954;
Maxwell, 1954; Nobles, 1958, 1965, 1971; Pantidou, 1961a, b; 1962; SemerdEieva,
1965, 1966; Pantidou, Groves, 1966; Semerdzieva, Cejp, 1966; Рипачек, 1967;
Miller, 1967, 1969, 1971; Частухин, Николаевская, 1969; Pantidou, Watling, 1970,
1973; Суворов, 1971; Гарибова, Сафрай, 1972; Гарибова, Шалашова, 1973; Да-
видкина, 1973, 1978, 1980; Taylor, 1974; Дудка и др., 19766; Martin, Gilbertson,
1976; Промышленное культивирование ..., 1978; Stalpers, 1978; Galland et al.,
1979; Pantidou et al., 1983; и др.) .
Более полно, хотя еще и недостаточно, в чистой культуре изучались дерево-
разрушающие грибы, преимущественно из порядка Aphyllophorales в связи с тем.
что они являются возбудителями болезней растений и гнилей древесины (Nobles,
1965, 1971; Рипачек, 1967; Бойко и др., 1978; Stalpers, 1978). Агарикальные.
болетальные, гастеромицетальные грибы исследовались в культуре недостаточно,
в то время как идентификация мицелиальных форм этих грибов приобретает все
большее значение в связи с их практическим использованием как объектов куль-
тивирования.
При идентификации культур высших базидиомицетов по комплексу призна-
ков используются как описательно-морфологические, так и физиолого-биохими-
ческие, электронно-микроскопические и другие методы исследования.
Таксономическим критерием для идентификации высших базидиомицетов
наравне с базидией является наличие специфической структуры в межклеточной
перегородке, так называемой долипоры (Moore, McAlear, 1962; Moore, 1978).
Долипоровые септы обычно состоят из нескольких слоев различной электронной
плотности и характеризуются резко и симметрично утолщенной околопоровой
зоной, образующей валик. Сумчатым, ржавчинным и дейтеромицетам присущи
’’аскомицетные” септы с характерным 1—3-слойным строением (Moore, McAlear,
1962; Moore, 1965, 1978; Камалетдинова, Васильев, 1982). С помощью долипо-
ровой структуры осуществляется миграция ядер, обеспечивающая функциональ-
ную диплоидию. В гифе ядро проходит через многочисленные перегородки. Пред-
полагают (Chang, 1978), что при этом происходит энзиматическая деградация
перегородки. Движение ядер в гифальных кончиках более активно в период уд-
линения клеток. Однако в гифальной нити высшего базидиомицета могут встре-
чаться и перегородки без характерной долипоры. Такие перегородки наблюдают-
ся обычно в скелетных гифах (Nobles, 1971).
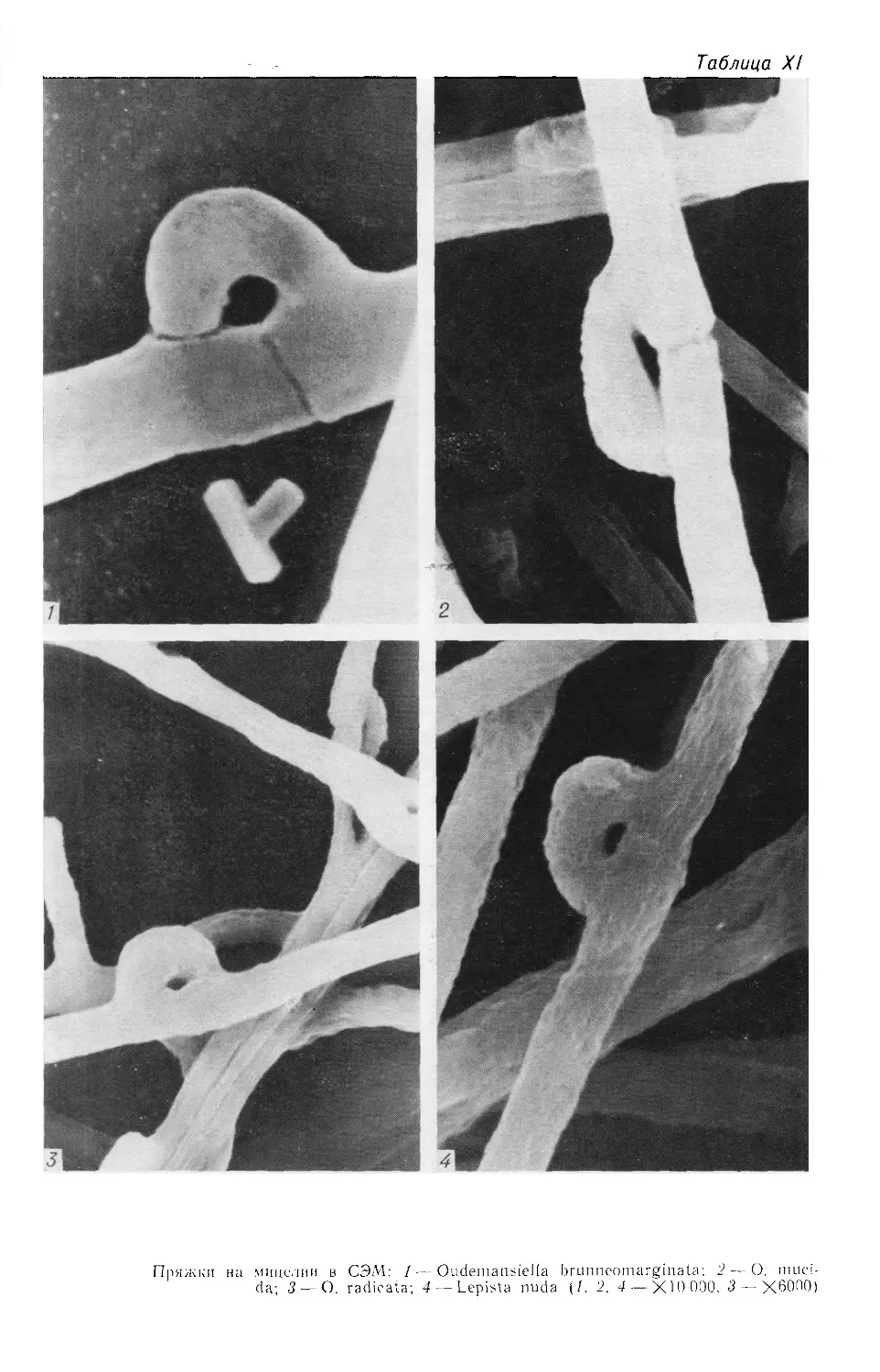
Характерная морфологическая особенность гиф высших базидиомицетов —
наличие пряжек на диплоидном мицелии, которые представляют собой неболь-
шие, дугообразной формы клетки, расположенные против поперечной перегород-
ки гифы. Пряжки встречаются не у всех видов. Они редко наблюдаются у видов
родов Boletus, Agaricus, Amanita, Armillariella и других и, напротив, обычны
у видов родов Pleurotus, Flammulina, Panus, Marasmius, Lepista, Cortinarius,
Clitocybe, Pholiota и многих других. Этот признак является постоянным для
вида, и иногда для рода. В тех случаях, когда пряжки имеются, частота их
встречаемости и расположение на гифах у различных видов бывают неодинако-
выми. Из всех микроструктур именно пряжки имеют важнейшее таксономиче-
ское значение (Nobles, 1965,1971; Stalpers, 1978).
Наличие пряжек на мицелии высших базидиомицетов трактуется (Nobles,
1971; Singer, 1975; Kiihner, 1980) как примитивный признак и учитывается
в построениях эволюционных схем различных таксонов. Так, Л.В.Гарибова
и Н .Б .Шалашова (1973) в роде Agaricus у A. campestris и A. subperonatus обна-
ружили характерные пряжки. На основании этого при построении системы рода 7
авторы рассматривают данные виды как примитивные и древние. Пряжки, по дан-
ным А.Смита (Smith, 1966), отсутствуют у более высокоорганизованных гастеро-
мицетов, у многих болетальных. В то же время пряжки обнаружены у большинст-
ва полипоровых грибов (Lentz, 1971).
Дж.Сталперс (Stalpers, 1978) выделяет 4 группы афиллофоральных грибов по
типу образования и распределения пряжек: пряжки образуются на всех перегород-
ках; пряжки редки или отсутствуют в зоне роста, но имеются у всех других ниже-
расположенных перегородок; пряжки редко встречаются, возле перегородок
могут возникать множественные или мутовчатые пряжки; пряжки отсутствуют.
Дж.Сталперс считает, что для таксономии очень важно выделение групп видов,
сочетающих наличие и характер распределения пряжек с наличием лакказы :, или
других ферментов.
Вегетативная система базидиомицетов, как и большинства грибов, является
вариацией системы ветвящихся гиф, которые различаются в довольно узких пре-
делах по ширине, длине клеток, толщине клетоздых стенок, характеру ветвления.
По мнению Д.Парметера (Parmeter, 1965), который основывается на статистиче-
ских данных, вегетативная система у многих видов грибов сходна и не может быть
использована с достаточной степенью достоверности как таксономический приз-
нак. Однако по мере изучения все большего количества видов накапливается ма-
териал для обобщения и сравнения. Так, Л.В.Гарибовой и ВЛМокеевой (1974)
проведены измерения и статистическая обработка размеров клеток мицелия видов
рода Agaricus в определенной фазе роста. Установлено, что для 11 изученных ви-
дов этого рода разность средних значений длины клеток между большинством ви-
дов достоверна и имеет таксономическое значение. Дж.Сталперс (Stalpers, 1978)
выделяет 5 типов гиф по их толшине: тоньше 1,5 мкм; от 1,5 до 3 мкм; от 3,5 до
5 мкм; от 5 до 7,5 мкм; толще 7,5 мкм.
У высших базидиомицетов описано большое разнообразие видоизмененных
гиф.. Предпринимались попытки их классификации по типу ветвления, выполняе-
мой функции, толшине клеточных стенок, причудливым скоплениям внутри или
снаружи гиф и другим признакам (Nobles, 1958,1965,1971; Donk, 1968). Выделя-
ют 3 основных типа гиф: генеративные, скелетные, связывающие, хотя предложе-
на и более подробная классификация видоизмененной гифальной системы. Так,
Дж.Сталперс (Stalpers, 1978) дает описание 26 типов видоизмененных гифальных
структур, многие из которых, на наш взгляд, трудно различимы.
Генеративные гифы имеются во всех культурах. Они тешкостенные, с перего-
родками, ветвящиеся, с пряжками или без них. Генеративные гифы дают начало
скелетным и связывающим гифам.
Скелетные гифы обычно без перегородок, иногда со вторичными перегород-
ками, неразветвленные или редко разветвленные, толстостенные, прямые или
слегка извилистые. У видов, лишенных пряжек, практически невозможно отли-
чить скелетную гифу от толстостенной генеративной гифы, поэтому вводится по-
нятие скелетовидной (sceletoid) гифы. Скелетная гифа происходит из генератив-
ной, она возникает как ее верхушечный вырост. Однако положение о том, что ске-
летная гифа может быть интеркалярной частью генеративной, не является обще-
признанным. У многих видов такие гифы образуются через две недели роста в
культуре или более.
Связывающие гифы (рис. 1) образуются из генеративной гифы как боковые
выросты. У некоторых видов эти гифы в культуре обильные, длинные, образуют
плотный переплетенный слой. У других видов показателем этого типа дифферен-
циации являются многотасленные короткие ветки или выросты с толстыми, жест-
кими, преломляющими свет стенками.
При дифференциации гиф в культуре образуются различные микроструктуры.
Некоторые из них характерны для отдельных видов, другие не несут дополнитель-
ной таксономической информации. Характерными микроструктурами являются
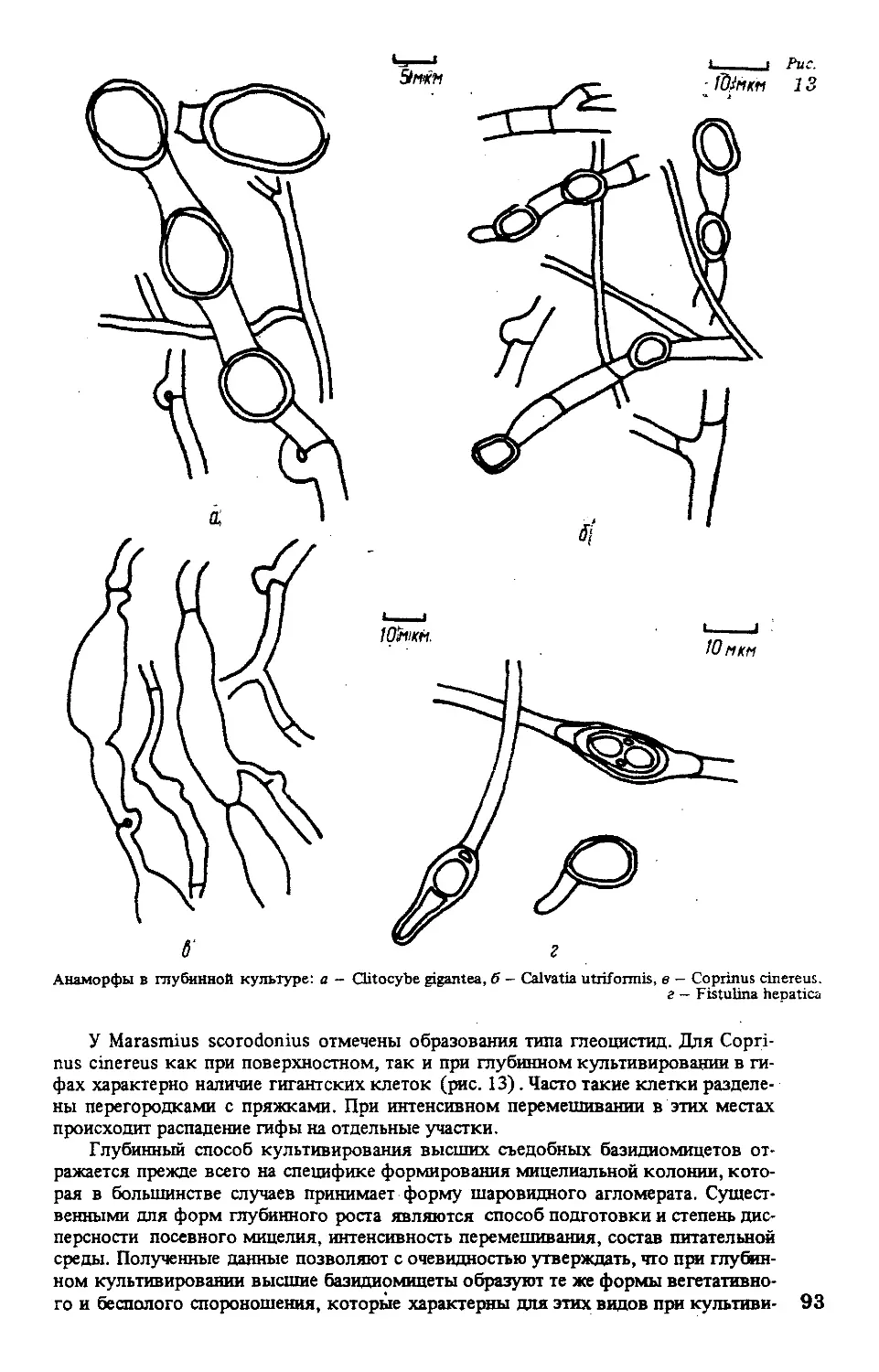
так называемые ведьмины метлы (рис. 1), отмечающиеся чаше всего в зоне роста,
например у Pem ophora incamatajGanoderma lucidum и др. Гифы с шипами или с вы-
ростами, состоящими из материала клеточной стенки, наблюдаются у видов родов
8 Schizophyllum, Coriolus и др. (Stalpers, 1978).
Дифференциация гиф культурального мицелия (Miller, 1971; Stalpers, 1978). а - округлая, б - угло-
ватая, в - переплетенная, г - эпидермоидная, д - сглаженная структуры, е - гифы, образующие
ведьмины метлы, ж - связывающие гифы, з — цистилы, и - глеоцистиды
Значительный интерес представляет работа О .Миллера (Miller, 1971), посвя-
щенная культуральным особенностям Tricholomataceae как дополнительному
таксономическому критерию. В исследование включено 125 штаммов 70 видов
из различных ботанико-географических районов США. На основании изучения
культуральных особенностей показано, что семейство Tricholomataceae не являет-
ся естественным, хотя многие из входящих в него родов, по-видимому, связаны
друг с другом. Виды некоторых родов (Lent inellus, Lentinus, Xeromphalina, Flam-
mulina и др.) имеют в культуре четкие отличительные признаки, а виды родов
Clitocybe, Collybia, Tricholoma таковых не имеют. Автор отмечает большое разно-
образие форм и размеров цистидиальных конечных клеток (рис. 1), обычно тон-
костенных и неокрашенных, но в отдельных случаях, как, например, у видов ро-
да Panus, с утолщенными стенками. В культуре часто образуются глеоцистиды
(рис. 1), щетинки, щетиночные гифы, вздутия разных типов, гифальные узлы или
луковицы, стефаноцисты, монилиоидные гифы, аллоцисты, склероции, которые
могут использоваться для культурально-морфологической характеристики от-
дельных видов и их идентификации (Nobles, 1965; Miller, 1971; Stalpers, 1978).
О-Миллер (Miller, 1971) для характеристики типов клеточной дифференциа-
ции в культуре использовал классификацию РКорфа (Korf, 1958), предложен-
ную им для таксономической характеристики дискомицетов. Согласно этой сис-
теме выделяют пять типов структур (рис. 1): округлая (textura globosa), угло-
ватая (textura angularis), переплетенная (textura intricata), эпидермоидная
(textura epidermoidea) сглаженная (textura oblita). По данным О .Миллера, нали-
чие определенного типа структур характерно для штаммов одного и того же вида
из различных ботанико-географических эон.
Описания культурально-морфологических особенностей представителей боле-
тальных грибов в литературе немногочисленны. ЕА4елин (Melin, 1922, 1923) раз- 9
делил болетальные грибы на 2 группы по типу ветвления мицелия и по наличйю
ппяжек. К 1-й он отнес виды, у которых мипелий имел многочисленные пряжки и
характерное ’’парное” ветвление, например, Suillus luteus, S. variegatus. Во 2-ю
группу он поместил виды с простым ветвлением, без пряжек или когда они встре-
чались очень редко, например. Boletus elegans. Изучению в культуре болетальных
грибов из родов Boletus, Suillus, Xerocomus, Puiveroboletus и других посвяшены
работы нескольких авторов (Pantidou, 1961а, Ь; 1962, 1964а, b; Hubsch. 1965;
Pantidou, Groves. 1966; Pantidou, Watling, 1970,1973; Pantidou et al., 1983).
Высшие базидиомипеты, как и грибы других систематических групп, обра-
зуют различные структуры бесполого и вегетативного размножения (анамор-
фы), которые в ряде случаев имеют несомненное таксономическое значение на
уровне вида, а в отдельных случаях — таксонов более высокого ранга. Однако,
несмотря на то что такие вторичные репродуктивные структуры у некоторых
видов высших базидиомицетов были описаны еще О.Брефельдом (Brefeld, 1889),
изучению их стали уделять внимание лишь в последнее время, а для большинства
видов съедобных базидиальных грибов они вообше не описаны. Различные спосо-
бы бесполого и вегетативного спороношения у представителей высших базидио-
мипетов исследованы более полно у афиллофоральных и в значительно меньшей
мере у агарикальных, болетальных и гастеромицетов (Nobles, 1965; Semerdzieva,
1965; Sigler, Carmichael, 1976; Stalpers, 1978; Arita, 1979a; Cole, Sampson,
1979; Kendrick, Watling, 1979; Watling, 1979a, b; Решетников, 1982a—в; Решет-
ников, Дудка, 1983; Pantidou et al.. 1983). В настоящее время конидиальное
и вегетативное спороношение установлено более чем у 180 видов агарикальных
грибов, в том числе у таких видов съедобных базидиомицетов, как Panus tigrinus,
Pleurotus cystidiosus, P.dryinus. Oudemansiella radicata. Pholiota aurivella, видов
рода Coprinus и др. (Kendrick, Watling. 1979: Решетников, 1982a; Buchalo et
al.. 1985).
Наиболее обычным для высших базидиомицетов является образование артро-
конидий. различающихся по типу конидиогенеза (Sigler, Carmichael, 1976; Kend-
rick, Watling, 1979; Ingold, 1980, 1981; Решетников. Дудка, 1983), что специфич-
но для определенных видов. Однако у Flammulina velutipes установлено два типа
артроконидиогенеза: энтеро-и голартрический (Ingold, 1981; Решетников, Дуд-
ка. 1983), что свидетельствует о необходимости получения дополнительных дан-
ных о конидиогенезе у высших базидиомицетов.
Более редкое явление у высших базидиомицетов — образование бластокони-
диального спороношения, специфичность которого показана (Miller, 1969; Kiihner,
1977. 1980; Arita, 1979а; Stalpers.- 1983) для Pleurotus cystidiosus. Pholiota
. aurivella. Fistulina hepatica. видов Hohenbuechelia и некоторых других. Кониди-
альное спороношение у высших базидиомицетов образуется как на гаплоидном,
так и на дикариотическом мицелии.
У высших базидиомицетов в культуре отмечены органы бесполого размно-
жения — хламидоспоры, образующиеся на дикариотическом мицелии. О.Миллер
(Miller, 1971) обнаружил хламидоспоры у многих исследованных им видов се-
MeftcTBaTricholomataceae и показал, что они сходны у разных штаммов одного и
того же вида. Строение хламидоспор у отдельных видов очень характерно и мо-
жет служить таксономическим критерием, как, например, у анаморфы Nyctalis
parasitica и N.lycoperdoides. Pleurotus dryinus (Watling, 1978b). Тип конидиоге-
неза может быть специфичен на уровне рода и даже порядка. Так, установлены раз-
личия в типе конидиогенеза у леуко- и хромоспоровых видов порядка Agaricales:
у представителей семейства Cortinariaceae, Bolbitaceae и Coprinaceae образование
конидий происходит путем конденсации протоплазмы (Watling, 1979а; Ingold,
1981; Решетников, 1983). Типичным для отдельных видов является образование
в культуре таких структур бесполого размножения, как склероции, ризоморфы,
бромации, аллоцисты и другие (Bille-Hansen. 1973; Watling, 1979а. b; Pantidou
et al., 1983).
Слияние клеток гиф одного и того же или разных мицелиев у высших гри-
бов — широко распространенное явление, хотя механизмы его возникновения по-
10 ка неясны (Lentz, 1971; Burnett, 1976; Захаров, 1984). Между клетками обычно
возникают анастомозы, которые могут служить для создания баланса клеточного
содержимого мицелия. Цитоплазма, ядра, пищевой материал по анастомозам пере-
текают из одной части мицелия в другую. Большинство гиф в мицелии переплета-
ются и образуют анастомозы на ранней стадии роста. Таксономическое значение
анастомозов не установлено.
Для видовой таксономии наравне с интерфертильным скрещиванием мицелия
видов одного рода используют явление хоминга, т.е. специфического взаимодейст-
вия артроконидий с гифами (Brodie, 1972; Kemp, 1977; Fries, 1983а. с).
Важной дополнительной таксономической характеристикой видов и родов
базидиомицетов может служить ядерное состояние мицелия (Kiihner, 1977,1980).
По этому признаку ЯБуоден (Boidin, 1971) выделяет 5 групп: базидиоспоры од-
ноядерные, клетки вторичного мицелия двуядерные; базидиоспоры двуядерные,
клетки первичного мицелия сначала многоядерные, потом становятся одноядер-
ными, клетки вторичного мицелия двуядерные; споры двуядерные, первичный
мицелий многоядерный, вторичный двуядерный; базидиоспоры одноядерные,
клетки первичного мицелия многоядерные, клетки основных гиф вторичного
мицелия (обычно наблюдающиеся по краю колонии) многоядерные, остальные
двуядерные; базидиоспоры одно- и двуядерные, клетки как первичного, так и
вторичного мицелия многоядерные, что распространяется и на плодоношение. Во
всех перечисленных группах молодые базидии двуядерные.
Однако на ядерное состояние значительное влияние оказывают условия внеш-
ней среды. У некоторых видов с многоядерной терминальной клеткой первичного
мицелия отмечена нестабильность в дикариотическом вторичном мицелии с пряж-
ками, если они выращиваются'в условиях недостаточной аэрации. Такой мицелий
без пряжек с многоядерными терминальными клетками напоминает первичный,
однако он в корне отличается от гаплоидного, так как состоит из двух типов сов-
местимых ядер и, если нормальная аэрация восстанавливается, ревертирует в ди-
кариотический мицелий с пряжками (Kiihner, 1977). М.Габриель для Panellus
serotinus и Phlebia radiata (Gabriel, 1967) показал, что образование псевдопервич-
ного мицелия обусловлено накоплением СО2, а не понижением парциального дав-
ления кислорода, как предполагалось. У других видов с многоядерным первич-
ным мицелием анаэробиоз не влияет на характер вторичного мицелия. Таким об-
разом, принимая несомненную значимость ядерного состояния для систематиче-
ской оценки на уровне вида, следует признать, что этот критерий при идентифика-
ции культур высших базидиомицетов может быть использован только как допол-
нительный, особенно если учесть большую вариабельность в ядерном состоянии
на протяжении жизненного цикла гриба и в зависимости от экологических условий.
Характеристика мицелиальной колонии — один из существенных культураль-
ных признаков, имеющих таксономическое значение. Колония, образуемая выс-
шим базидиомицетом в глубинной или поверхностной культуре на жидкой пита-
тельной среде, часто не содержит специфических морфологических структур, по
которым можно судить о систематическом положении гриба.
Идентификация культуры проводится на плотной агаризованной питательной
среде, по возможности стандартной. Для высших базидиомицетов такими взаимо-
заменяемыми средами являются агаризованное пивное сусло и мальц-агар (Nobles.
1958, 1965; Semerdiieva, Cejp, 1966; Бухало, 19736,19826; Дудка та iH., 19766;
Промышленное культивирование ..., 1978; Stalpers, 1978).
Дж.Сталперс (Stalpers, 1978), который представил наиболее полное описание
мицелиальной колонии у высших базидиомицетов, различает 15 типов колоний,
отличающихся по характеру воздушного мицелия: 1) воздушный мицелий отсут-
ствует, имеется только погруженный; 2) колония пушистая, воздушный мицелий
состоит из хорошо развитых прямых коротких гиф, колония обычно просвечиваю-
щаяся; 3) колония мучнистая, порошковидная; 4) колония гранулированная,
зернистая; 5) колония шелковистая, с длинными радиально параллельными гифа-
ми или гифальными тяжами, распростертая, часто растет язычками; 6) колония
ватная, воздушный мицелий высокий, отдельные мицелиальные гифы переплете-
ны во всех направлениях; 7) колония шерстистая, очень длинные спутанные гифы,
напоминающие изделия из шерсти; 9) колония хлопьевидная, с небольшими ra-
il
свальными пучками, поднимающимися от агара или воздушного мицелия; 9) ко-
лония перистая с мицелиальными пучками гиф, радиально отходящими от цент-
ральной оси, часто веерообразно расположенными; 10) колония кожистая, плен-
чатая, образована тонким, низким сцепленным мицелием; 11) колония войлоч-
ная, воздушный мицелий ватообразный или шерстистый, свалявшийся, отсутст-
вуют поднимающиеся гифы; 12) колония бархатистая, состоит из плотного слоя
прямых, коротких гиф воздушного мицелия; 13) колония корковая, гифы об-
разуют твердую, крепкую корку, обычно темно-коричневую, иногда кремовую
или белую; 14) колония лакунозная, мицелиальная поверхность с углублениями,
зазубренная, выдолбленная; 15) колония зональная, с концентрическими круга-
ми или сегментами разной фактуры. Цвет колонии обычно описывается с по-
мощью принятых терминов или по шкале цветов. Существенной характеристикой
колонии служит зона роста, или край колонии. Он бывает погруженным, прижа-
тым, поднимающимся. Внешняя линия колонии может быть гладкой, бахромчатой
или с выступами. Важный признак — окраска обратной стороны колонии, или
реверзума. Оценке запаха придается небольшое значение, так как он обычно труд-
но определим, воспринимается субъективно, для его характеристики не установле-
ны общепринятые названия.
Дж.Сталперс (Stalpers, 1978) привел данные о культуральных особенностях
550 видов порядка Aphyllophorales. оценку таксономического значения отдельных
культуральных и морфологических признаков, а также ключ для определения
видов. В качестве примера эффективного использования культуральных призна-
ков для идентификации культур более 200 видов лигнотрофных базидиомицетов,
когда особое внимание уделялось скорости роста, морфологическим и физиологи-
ческим особенностям, а также опенке этих признаков в эволюционном плане,
можно привести исследования М.Ноблз (Nobles, 1958,1965,1971). Ею составлены
ключи для определения видов с применением этих критериев. М.Ноблз считает
(Nobles, 1971), что изоляты одного и того же вида могут значительно отличаться
по цвету и текстуре колоний, а более постоянными признаками являются скорость
роста, отношение к температуре, микроскопические особенности гифальной систе-
мы. наличие или отсутствие определенных ферментов. Подтверждено таксономи-
ческое значение таких критериев, как скорость роста, внешний вид колоний, мик-
роскопические особенности гифальной системы и эффективность комплексного
использования культуральных признаков для решения вопросов систематики
деоеворазрушаюших грибов и в работах П.А.Суворова (1971); Т.АДавыдкиной
(1973,1980).
М.Семерджиева и КДейп (Semerdzieva, 1965; Semerdzieva, Cejp, 1966) про-
вели культурально-морфологическое изучение 57 видов агарикальных грибов на
25 средах и отметили таксономическое значение ряда признаков, проявляющихся
в культуре. Этими авторами для характеристики роста колонии на агаризованной
среде помимо диаметра колонии, как это делается обычно, предложено учитывать
также ее высоту (мм) и плотность, которая оценивается по трехбалльной системе
(редкая, средняя, плотная). По скорости роста высшие базидиомицегы подразде-
ляют на 3 основные группы (Nobles, 1965; Semerdzieva, Cejp, 1966; Бухало,
19736: Stalpers. 1978): быстрорастущие - многие лигнотрофные виды: Pleurotus
ostreatus, Oudemansiella mucida. Fiammulina velutipes, Kuehneromyces mutabilis,
а также сапротрофные виды: Agaricus subperonatus, Coprinus comatus, C. sterqui-
linus, Marasmius scorodonius и др.; грибы co средней скоростью роста — многие
гумусовые и подстилочные сапротрофы, а также некоторые лигнотрофы: Macrole-
piota procera, Marasmius oreades, Phoiiota adiposa, Ph. aurivella, Agaricus arvensis,
Calocybe gambosa, Sparassis crispa, Clitocybe nebularis, Lepista luscina, L. nuda
и др.; медленно растущие — большинство микоризообразующих видов, а также
виды из других экологических групп с повышенными питательными потребностя-
ми. Среди медленнорастущих называют Boletus edulis, Suillus variegatus, Agaricus
silvaticus, Armillariella mellea, Amanita rubescens, Clitopilus prunulus, Collybia
peronata и другие виды. Для таксономии высших базидиомицетов используют био-
химические признаки (Судьхна, Мельничук, 1976; Черотченко, 1977, 1980; Мои-
12 ches et al., 1979; Parmasto, Parmasto, 1979; Дьяков, 1980; Poppe, Welvaert, 1983;
и др.). На уровне вида и в некоторых случаях рода общепризнано значение ряда
ферментов, в первую очередь фенолоксидаз: лакказы, тирозиназы, пероксидазы
(Demoulin, 1967; Stalpers, 1978; Marr. 1979, 1984; Miller et al., 1983).
KMapp (Marr, 1979) исследовал 72 вида высших базидиомицетов и разделил
их по наличию ферментов на 4 группы. К 1-й относятся виды, у которых цветовые
химические реакции на ферменты лакказу и тирозиназу положительны и протека-
ют быстро: Lactarius vellereus, Russula alutacea, Russula emetica, Russula fragiiis
и др. Ко 2-й — содержащие только лакказу: Cantharellus lateritius, Hygrophorus
pratensis, Pleurotus ostreatus, Tricholoma resplendens и др. К 3-й — только тирози-
назу: Amanita rubescens, Laetiporus sulphureus, Collybia dryophila, Marasmius orea-
des и др. В 4-ю группу включены грибы с негативной реакцией на фенолоксидазы
через 30 мин: Coprinus micaceus, Flannnulina velutipes,Oudemansiella radicata и дг
Интересно, что различные штаммы видов Agaricus campestris, Cantharellus lateri-
tius отнесены KJdappoM к разным группам, что свидетельствует о необходимости
изучения большего количества штаммов одного и того же вида, особенно изолятов
из географически удаленных местообитаний.
Х.Молиторис (Molitoris, 1978), АЪрезинский с соавт. (Bresinsky et al.,
1977), изучая разрушение древесины высшими базидиомицетами и роль в этом
процессе фенолоксидаз, исследовали в чистой культуре более 30 видов высших
базидиомицетов, в том числе съедобные виды родов Paxillus, Suillus, Pleurotus,
Kuehneromyces.Ими установлено, что наличие фенолоксидаз может служить важ-
ной характеристикой на видовом уровне при идентификации культур высших
базидиомицетов в отсутствии плодовых тел. Экстрацеллюлярные фенолоксидазы
не отмечены у микоризообразующих представителей порядка Boletales. Изучение
фенолоксидаз у монокарионов, дикарионов и гибридов показало, что моно- и
дикарионы сходны в отношении наличия фенолоксидаз, а гибриды отличаются от
исходных пар.
Для характеристик отдельных видов О-Миллер (Miller, 1''71) использует
реакцию на амиллоидность (раствор Мельцера с 3%-ным раствором КОН и Н2 О).
Протекание реакции зависит от времени и температуры выращивания культуры,
так как при более высокой температуре и длительном инкубировании количество
амиллоидиого материала значительно уменьшается. О.Миллер не связывает приз-
нак амиллоидности с какой-либо таксономической группой семейства Tricho-
lomataceae.
Для тестирования культур болетальных грибов используются некоторые
цветовые химические реакции, применяющиеся при идентификации плодовых тел
(Pantidou, 1961а, 1962; Meixner, 1975; Singer, 1975).
О специфической реакции разных видов высших базидиальных грибов на
температуру и возможности использования этого критерия для таксономической
оценки культур на уровне вида существуют противоречивые точки зрения, что
связано, очевидно, с недостаточной изученностью данного вопроса. Так, М.Ноблз
(Nobles, 1971) считает, что отношение к температуре — существенный признак при
идентификации культур, а В.Рипачек (1967) высказывает мнение, что деление
базидиальных грибов на группы по температурному фактору является ис-
кусственным, так как значения температурного оптимума и максимума для
культур одного и того же вида гриба, взятого из разных мест обитания, не
всегда одинаковы.
Как таксономический признак на уровне вида используют тип половой сов-
местимости (Гарибова, Мокеева, 1976; Esser, Hoffmann, 1977; Galland, Kemp,
1979; НПЬег, 1982; Guillaumin et al., 1983; и др.). Однако у некоторых видов
установлен внутривидовой антагонизм, препятствующий слиянию вегетативных
мицелиев (Tokimoto et al., 1973; Kiihner, 1977, 1980; Eger et al., 1979; Todd,
Rayner, 1980; Adams, Todd, 1981). Отсюда следует, что тип половой совместимос-
ти, служащий критерием при таксономических исследованиях, с успехом приме-
няемый для решения вопросов систематического положения близких видов или
внутривидовых таксонов, мало эффективен при идентификации дикариотических
изолятов высших базидиомицетов. Результаты, полученные этим методом, долж-
ны интерпретироваться с достаточной осторожностью.
13
Идентификация с использованием таких критериев, как половая дифферен-
циация. явление хоминга, поведение в смешанной культуре, которые имеют
несомненное таксономическое значение, требует проведения специальных трудо-
емких исследований. В настоящее время перечисленные критерии могут быть
применены лишь для отдельных видов при выяснении спорных или сомнительных
вопросов их систематического положения. Ряд признаков, например вариация па-
оаметров гифальной системы, ядерное состояние клеток гифы и некоторые дру-
гие, необходимо экспериментально исследовать на большем количестве объектов.
‘ Дополнительные данные позволят сделать заключение о возможности использова-
ния этих признаков для таксономических исследований.
.1.2. Получение в чистой культуре стадии телеоморфы
Наиболее надежным способом правильного определения вида в культуре является
идентификация образующихся при культивировании нормально развитых плодо-
вых тел, т.е. стадии телеоморфы. При культивировании в лабораторных условиях
получены телеоморфы некоторых видов лигнотрофных и сапротрофных агари-
кальных и афиллофоральных съедобных грибов — представителей родов Agaricus,
Agrocybe, Coprinus, Flammulina, Lepista, Lentinus, Panus, Pleurotus, Pholiota, Clito-
cybe. Polyporus и др. (Galleymare, 1949; Fries, 1953; Aschan, 1954a, b; Kinugawa,
Turukawa, 1965; Kinugawa, 1967; Bigelow, 1970; Eilers, 1973; Гарибова и др.,
1974; Трембач. 1974; Vetter, 1977; Brain et al., 1979; Гарибова, 1982). Такие
виды, как Coprinus cinereus, C.congregatus, Panus tigrinus, Schizophyllum commu-
ne, ввиду их способности легко плодоносить в лабораторных условиях служат
модельными объектами при изучении биологии плодоношения (Niederpruem,
1963; Wessels. 1969; Семерджиева, 1977; Esser, 1978; Horriere, 1979).
До настояшего времени плодоношение обязательно связывали с половым
процессом, а монокариотическое плодоношение считалось редким и не очень
значительным явлением. Исследования, проведенные на представителях афилло-
форальных и агарикальных грибов (Polyporus ciliatusAgrocybe aegerita, Schizo-
phyllum commune) (Esser, Stahl, 1973; Esser, 1978; Meinhardt, 1978), позволили
выдвинуть новую концепцию, согласно которой плодовые тела высших базидио-
мицетов могут образовываться как в половом, так и в бесполом циклах, причем
плодоношение обусловлено единственным геном_в обоих циклах. У этих трех ви-
дов, далеких по систематическому положению, установлен одинаковый контроль
плодоношения.
Наиболее полно изучены условия плодоношения видов съедобных грибов,
которые культивируются в промышленных масштабах для получения плодовых
тел: Agaricus bisporus, Pleurotus astreatus, Flammulina velutipes, Lentinus edodes,
Kuehneromyces mutabiiis. Volvariella volvaceae и некоторые др. (Singer, 1961;
Гарибова и др., 1974; Дудка и др., 1976а; Промышленное культивирование ...,
1978; Chang, Hayes, 1978; Гаврилова, 1982; Гарибова, 1982; Высшие съедобные
базидиомицеты:..., 1983). Попытки получения в культуре плодовых тел многих
микоризообразуюших грибов были неудачны. МЛантиду (Pantidou, 1961а) на-
блюдала образование в культуре зачатков плодовых тел некоторых видов родов
Boletus, Leccinum. Xerocomus, Pulveroboletus.Она получила нормальные карпофо-
ры с трубчатым гименофором и зрелыми базидиоспорами Pulveroboletus sulphure-
us. Boletus armarellus, Xerocomus illudens, X. badius (Pantidou, 1961a, b, 1964b;
Pantidou, Watling, 1970, 1973). Об образовании в культуре плодовых Ten'Boletus
edulis сообщают И.Картшнский (Karpinski. 1961), И.Ояма с соавт. (Oyama et al.,
1974). В аксенической культуре получены также плодовые тела Boletus rubinellus
и Tilopillus felleus (McLaughlin, 1970, 1974). Н.Гилтрэп (Giltrap, 1981) на агари-
зованных средах наблюдал образование примордиев и незрелых плодовых тел
Boletus badius, В. porosporus, В. subtomentosus и Suillus piperatus.
Плодоношение в культуре получено у некоторых гастеромицетов: Lycoperdon
pusillus, Cyathus stercoreus, C. olla, Sphaerobolus stellatus, Nidularia pulvinata,
14 Mutinus caninus (Warcup, 1959; Bulmer, 1964; Lu, 1965;Flegler,|1979a—c).
Состав питательной среды является одним из определяющих факторов, влияю-
щих на плодоношение высших базидиомицетов в условиях чистой культуры. Изу-
чение влияния компонентов питательной среды на плодоношение, проведенное
на синтетических средах рядом исследователей, позволило сделать определенные
выводы, суммированные Ф.Орриер (Horriere, 1979). Для получения плодоноше-
ния в чистой культуре питательные среды должны соответствовать определенным
требованиям. Источник углерода в наиболее часто используемых для плодоноше-
ния средах вносится в виде углеводов (глюкозы, мальтозы, сахарозы, спирта). У не-
которых видов, как это показано для Coprinus lagopus и Pleurotus ostreatus. до-
бавление в питательную среду фильтровальной бумаги или соломы стимулирует
плодоношение. Азот в такие среды вносится в органической (в виде а-аланина, ас-
парагина, других аминокислот) или минеральной форме. В последнем случае
предпочтение отдается аммонийным солям.
В питательной среде большое значение имеет отношение С: N. При его очень
высоких показателях плодоношение обычно отсутствует, при очень низких — об-
разуется много зачатков, но плодовые тела не развиваются (Plunkett, 1953; Ма-
delin, 1956: Sugimori et al., 1971; HorriSre, 1979). Оптимальное значение отноше-
ния С: N приближается к 30, оно зависит от состава среды (Horriere, 1979), уве-
личение в которой азота и уменьшение углерода ускоряют появление плодоноше-
ния. Последнее часто ингибируется недостатком в среде минеральных элементов,
в частности фосфатных и сульфатных ионов, К, Mg, ряда других микроэлементов
(железа, пинка, марганца, меди, бора и молибдена). Обязательным компонентом
питательных сред для плодоношения является тиамин.
Вещества, близкие к нуклеиновым кислотам, ауксинам, кинетинам и цикло-
3-5-аминозин монофосфат (АМФ), оказывают стимулирующее действие на обра-
зование плодовых тел (Mayr et al., 1984). И.Ояма с соавт. (Oyama et а!.. 1974)
изучал действие циклического АМФ на микоризные грибы, в частности на Boletus
edulis и Boletus aerues. Установлено, что это соединение играет важную роль в об-
разовании плодовых тел. Карпофоры B.edulis были получены на среде со смесью
АМФ и теофиллина, последний является ингибитором фосфодиэстеразы, разру-
шающей АМФ. Эти исследования открывают возможности для получения стадии
телеоморфы ценных съедобных микоризообразуюших грибов в культуре.
Аналогичное действие АМФ отмечено на образование примордиев и плодовых
тел у монокариотического штамма Coprinus macrorhizus(Uno, Ishikawa, 1983а, b).
Однако У.Нетцер (Netzer, 1978), исходя из собственных экспериментальных
данных, считает, что в плодоношении Pleurotus ostreatus действие АМФ
не столь важно.
Питательная среда должна обеспечивать хороший рост мипелия, так как его
питательные резервы имеют большое значение для последующего плодоношения
(Bille-Hansen, 1953; Robert, 1977, 1979; Wright, Hayes, 1979; Morimoto et al.,
1981). При использовании традиционных методов культивирования вегетативная
и репродуктивная фазы развития грибов проходят на едином субстрате. В методах
японских авторов (Oyama et al., 1974; Shiio et al., 1974) вегетативная и репродук-
тивная фазы обеспечиваются оптимальными условиями питания на разных средах.
Показано (Wessels, 1969; Kitamoto et al., 1974), что после появления зачатков
плодовых тел все используемые соединения азота поступают из мицелия. Плодо-
вые тела таких видов, как Coprinus cinereus, Fiammulina velutipes, Panus tignnus,
Pleurotus ostreatus и других, легко плодоносящих в культуре, образуются на том
же субстрате, на котором сохраняется в лаборатории культура гриба.
В качестве питательных субстратов для получения плодовых тел в лаборатор-
ных исследованиях используют пористые субстраты, например смоченные разбав-
ленным пивным суслом или минеральной средой древесные опилки и древесную
муку, мелко нарезанные веточки и хвою, высушенный ржаной хлеб с водой, ка-
шицу из хлебных крошек, размягченную в 40 %-ном растворе лимонной кислоты.
Многие исследователи занимались разработкой питательных сред для получе-
ния плодоношений отдельных видов высших базидиомицетов: Boletus edulis
(Oyama et al., 1974), В. rubinellus (McLaughlin, 1970), Fiammulina velutipes (Plun-
kett, 1953; Aschan. 1954a), Coprinus congregatus (Horriere, 1979), C.lagopui
15
(Madelin, 1956), Lentinus edodes (Leatham, 1983), Panus tigrinus (Faro, 1972),
Pleurotus ostreatus (Hashimoto, Takahashi, 1974; Macaya-Lizano, 1975), Lepista
nuda (Wright, Hayes, 1979) и др. Однако трудно судить, оптимальны ли предло-
женные среды, так как отсутствуют качественные и количественные данные о
продуктивности плодоношения грибов на этих средах.
Оптимальный для плодоношения pH среды обычно лежит в более узких пре-
делах, чем pH среды, благоприятный для мицелиального роста гриба. Для плодо-
ношения Flammulina velutipes благоприятен рЯТ 5—6, для Lentinus edodes и Heri-
cium erinaceum около 4, для Agaricus bitorquis — 5—6, для Coprinus congregatus
он находится в шелотаой зоне (Horriere, 1979). Плодоношение образуется как на
твердых, так и на жидких средах в поверхностной культуре, но на жидкой среде
плодовые тела обычно появляются позднее. Время появления плодовых тел раз-
лично, оно зависит от вида и штамма гриба, условий выращивания и состояния
культуры. Обычно плодовые тела появляются при достаточном количестве мице-
лия через 3—12 недель.
Появление плодоношения можно стимулировать, если на поверхность коло-
нии поместить кусочек плодового тела гриба даже другого вида. Плодовое тело
образуется на некотором расстоянии от кусочка, использованного в качестве сти-
мулятора (Bhavani, 1980). На примере Coprinus congregatus показано (Manache-
re, 1976, 1977а, b), что в плодовых телах образуются вещества неизвестной
природы, которые проникают в мицелий и вызывают образование новых пло-
довых тел.
Питательные потребности того или иного вида, обеспечивающие его плодоно-
шение, находятся в тесной связи с совокупностью так называемых климатических
факторов: света, температуры, влажности, аэрации и др.
Свет — одно из наиболее существенных условий для развития плодовых тел
в культуре. У многих видов в темноте или при недостаточном освещении образу-
ются лишь зачатки плодовых тел в виде цилиндрических или другой формы вы-
ростов. Интенсивность и продолжительность освещения влияют на сроки появле-
ния плодоношения, веливдну, окраску, форму и степень развития плодовых тел.
Г .Эгер (Eger, 1980) предложена классификация высших базидиомицетов по
потребности в освещении для образования плодовых тел. Она выделяет 4 группы.
У 1-й образование начальных стадий плодоношения происходит одинаково в тем-
ноте и на свету: Agaricus bisporus. Во 2-ю группу входят виды грибов, у которых
начальные стадии плодоношения осуществляются как в темноте, так и на свету,
последующие стадии проходят нормально только на свету: Lentinus edodes. Гри-
бам 3-й группы для начала и завершения плодоношения необходим свет, а на про-
межуточных стадиях они требуют темнового периода. Представителем этой груп-
пы Т.Эгер называет Coprinus congregatus. Потребность в темновом стимулирую-
щем факторе у этого гриба описана несколькими авторами (Durand, 1975, 1983;
Hamada et al., 1978; Manachere, 1978; Durand, Robert, 1980), в том числе с по-
мощью оригинального метода прививок плодовых тел, выращенных в разных ус-
ловиях освещения (Hamada, Tsuji, 1979). У представителей 4-й группы, к которой
отнесен Favolus arcularius, все стадии плодоношения осуществляются на свету.
По ьшеиию Г.Эгер, такая классификация до определенной степени условна.
Для получения плодовых тел используют рассеянный солнечный, искусствен-
ный дневной и УФ свет. Образование плодовых тел у Flammulina velutipes и Copri-
nus lagopus стимулируется синей частью видимого спектра (наиболее эффективен
свет с длиной волны 520 мк). Для формирования плодовых тел некоторых видов
высших базидиомицетов эффективен свет в голубой, синей и УФ части спектра;
очень слабое действие оказывают зеленая и красная части спектра (Badham, 1980).
Потребность разных видов в освещении при плодоношении различна. Напри-
мер, для получения плодовых тел Pleurotus comucopiae требуется инкубация в те-
чение 8—12 сут при интенсивности освещения 75—500 лк, а образование приморди-
ев у Psilocybe cubensis стимулируется очень короткими диапазонами света (Del-
mas, Mamoun, 1982). Для плодоношения Pleurotus ostreatus необходимо освеще-
ние свыше 150 лк (Eger, Gottwald, 1974; Jablonsky, 1975; Фомина, Гав рило-
lb ва,1978).
У разных видов оптимальная температура плодоношения определяется эколо-
гическими условиями, в которых оно происходит в природе. Оптимальная темпе-
ратура плодоношения часто не совпадает с таковой роста мицелия. К группе видов
с максимальной температурой плодоношения не выше 24 °C, а оптимальной около
20 °C относятся Flammulina velutipes, Agaricus bisporus, Lentinus edodes, Pleuro-
tus sapidus, Hericium erinaceum (Kinugawa, Turukawa, 1965; Трембач, 1974; Гав-
рилова, 1982). Обильное образование плодовых тел Flammulina velutipes происхо-
дит при 10—15 °C, в то время как оптимальная температура для роста мицелия
составляет 22—26 °C. Плодоношению F.velutipes способствует колебание темпера-
туры между 5 и 20 °C. Образование плодоношения стимулируется временным по-
нижением температуры до5-10°Сиу Lepista nuda, Coprinus congregatus (Brain
et al., 1979; Durand, Robert, 1980).
К группе видов с оптимальным плодоношением при температуре 20—24 °C
и максимальным — 28 °C относятся Pholiota adiposa, Agaricus bitorquis, A. rubel-
lus, Tremella fuciformis и др. Для Oudemansiella radicata, Coprinus lagopus, Pleuro-
tus rhodophyllus, Ganoderma lucidum и других видов оптимальное плодоношение
происходит при 24—27 °C, максимальное — 30—36 °C.
Аэрация и влажность влияют на образование и формирование плодовых тел
(Niederpruem, 1963). Снабжение культур свежим воздухом с относительной
влажностью 80—90 % благоприятно сказывается на развитии плодовых тел. Уста-
новлено (Гарибова, 1982), что на плодоношение гумусовых сапротрофов Agaricus
bitorquis, A.bisporus, A.campester существенно воздействует концентрация СО2.
Высокая концентрация СО2 (не ниже 0,6—0,7 %) стимулирует образование при-
мордиев, а выше 0,7 % — ингибирует развитие плодовых тел. В то же время у под-
стилочного сапротрофа Agaricus silvaticus и лигнотрофа Pleurotus ostreatus кон-
центрация СО2 0,7—0,8 % влияет на плодоношение только на более поздней стадии
развития плодовых тел, нарушая формирование шляпок (Гарибова, 1982).
При высоком содержании в среде СО2 у Flammulina velutipes наблюдаются
появление абортивных плодовых тел и задержка развития шляпки, изменяются ее
размеры и появляются другие морфологические изменения карпофоров (Plun-
kett, 1956).
Таким образом, полученный к настоящему времени экспериментальный мате-
риал по плодоношению высших съедобных базидиомицетов в культуре позволяет
выделить ряд факторов, существенных для образования плодовых тел: состав
питательной среды, температура, влажность, аэрация. Определяющим условием
плодоношения является генетическое и физиологическое состояние культуры. Од-
нако факторы, регулирующие плодообразование в культуре большинства видов
базидиальных грибов, остаются мало или совсем не изученными.
1.1.3. Выделение чистых культур
Важную роль в изучении высших базидиомицетов играет разработка методов вы-
деления чистых культур, что дает возможность расширить круг исследуемых
объектов и сделать доступными для всестороннего изучения грибы разных таксо-
нов и экологических групп.
О.Брефельд (Brefeld, 1877, 1889) первым предложил метод выделения куль-
тур из плодовых тел и базидиоспор, использованный позже Б. Дуггаром (Duggar,
1901, 1905), Р.Фальком (Falck, 1902), Я.Фуксом (Fuchs, 1911), Л.Матрушо
(Matruchot, 1912) и др.Объектами исследований этих авторов служили преимуще-
ственно подстилочные сапротрофы, копротрофы и лигнотрофы.
Метод выделения культур высших базидиомицетов из плодовых тел был впо-
следствии широко использован (Melin, 1922; Modess, 1941; Возняковская, 1951;
Sobotka, 1954, 1955; Mikola, 1955; Hiromoto, 1961; Pantidou, 1961a, b, 1962,
1964a; Шемаханова, 1962; Мозер, 1963; Semerdzieva, 1965; Рипачек, 1967; Нит-
ковская, 1969а; Частухин, Николаевская, 1953, 1969; Pantidou, Watling,
1970, 1973; Watling, 1971, 197.7; Pantidou et ah, 1983).., Отмечен хороший
рост культур отдельных видов poflOBjT^S^STX^ybi^Mycena, Clitocybe, 17
Melanoleuca. Lvophyllum. Naucoria. Hebeioma. Lepiota. Agaricus. Conocybe, Rhodo-
oaxillus и других, выделенных из тканей карпофоров. В то же время указано, что
в культуре не росли многие виды родов Inocybe, Russula. Boletus. Tricholoma,
Rhodonhyllus и Lactarius. Базидиоминеты лучше росли на натуральных средах, чем
на синтетических. Ниже приведен состав некоторых агаризованных питательных
сред, используемых для культивирования высших базидиомицетов.
Сусло-агар (Пидопличко, 1953k: пивное сусло 8° по Баллингу — 1 л, агар —
20 г, pH среды 5,8.
Мальц-агар (Stalpers. 1978): мальц-экстракт — 12,5 г, агар — 20 г, Н2О — 1 л.
Среда Норкранс (Norkrans, 1953): глюкоза — 10 г, аммоний виннокислый —
1 г. КН2РО - 1 г. MgSO4-7H2O - 0,5 г, железо лимоннокислое — 5 мг, ZnSO4 х
х 7Н2О - 4.4 мг. MgS04 - 5 мг, СаС1: - 55,5 мг, витамин Bj — 40 мг, вода — 1 л.
Сусло-агар с отваром дубовой коры (Бухало, 1973а) : пивное сусло 4° по Бал-
лингу - 1 л. агар — 20 г, отвар дубовой коры - 5 мл, pH среды 5 Д.
Глюкозо-глютаминовый агар (Semerdzieva, Cejp, 1966): глюкоза — 20 г, глю-
та{ииновая кислота — 0,5 г, MgSO4‘7H2O — 0,5 г, КН2РО4 — 1 г, FeCO3 — 10 ка-
пель (1 %-ный раствор), тиамин — 200 мкг, Н2О — 1л, агар — 20 г, pH среды 5,5.
Агар с вишневым отваром (Stalpers, 1978) : отвар прокисших вишен — 200 г,
агар — 20 г. Н2 О — 800 мл, pH среды 3,8—4.6.
Агар из проростков пшеницы (Semerdzieva. Cejp, 1966): проростков пшени-
цы — 100 rJi2O — 900 мл. агар — 15 г, pH среды 5,5. Проростки кипятятся с водой
15 мин, центрифугируются, объем доводится до первоначального.
Овсяный агар (Semerdzieva, Cejp, 1966) : овсяная мука — 30 г, Н2О — 970 мл,
агар — 15 г, pH среды 5.8. Овсяная мука кипятится в воде 1 ч при перемешивании,
Фильтруется через фильтр Гаузе, доводится до объема 1 л.
Морковный агар (Semerdzieva. Cejp, 1966): экстракт моркови — 400 мл,
Н20 - 600 мл. агар - 15 г, pH среды 6.0. Раздробленная морковь смешивается
с водой'в соотношении 2:5, отваривается 30 мин, фильтруется, доводится до
объема 1 л.
Агар Модесса (Modess. 1941) : глюкоза — 5 г. мальп-экстракт — 5 г, NH4C1 —
0.5 г, MgSO4’7H2O — 0,5 г. КН2РО4 - 0.5 г. FeCI3 - 10 капель (1 %-ный раст-
вор) . Н2О— 1 л. тиамин — 150 мкг, pH среды 5.6.
КНО-агар (Semerdzieva. Cejp. 1966): глюкоза - 5 г, гидролизат казеина — 1 г,
мальц-экстракт — 5 г. NH4C1 — 6.5 г. MgSO4-7H2O - 05 г, КН^РО4 —05 r,FeS04 х
х 7Н2 О — 0.05 г, Н2 О — 1 л. агар — 15 г.
Гидролизат казеина стерилизуется через бактериальный фильтр и добавляется
в теплый агар.
Картофельно-глюкозная среда (Пидопличко. 1953): картофель — 200 г, глю-
коза — Юг, Н2О — 1 л. агар — 20 г, pH среды оптимальное для каждого вида. Кар-
тофель. нарезанный ломтиками, предварительно очищенный и обмытый, варится
30 мин в 1 л воды, отфильтровывается, добавляются агар и вода до объема 1 л.
Агар Возняковской (Возняковская, 1954) : глюкоза — 10 г. гидролизат казеи-
на - 0,75 г, NH4NO3 - 1.0 г, КН2РО4 - 1,0 г, СаС12 - 0,2 г, MgSO4-7H2O - 05 г,
FeCl2 — 1 мг. CuS04- 5Н2О — 1,6 мг, дрожжевой автолизат — 10 мл, тиамин —
150 мкг. агар - 15 г. Н2О — 1 л. pH среды 55. Гидролизат казеина и дрожжевой
автолизат стерилизуются через бактериальный фильтр и добавляются в теплый агар.
Агар Планкетта (Plunkett. 1953): сахароза — 50 г, аспарагин — 1 г, MgS04 х
х 7Н2О — 2,5 г, КН2РО4 — 5,0 г, FeSO4-7H2O — 0,03 г, тиамин — 500 мкг, агар —
20 г, Н2 О — 1 л, pH среды 5.8.
Несмотря на широкое использование метода изоляции культур из плодовых
тел, пока нет единого мнения о способах стерилизации плодовых тел, возрасте
карпофоров, пригодных для выделения из них тканевого изолята, наиболее благо-
приятного места взятия инокулята, его размеров, методов устранения загрязнения
посторонней ъшкрофлорой. Далеко не все виды легко образуют мицелиальную
культуру из тканевых изолятов. Так, О.Модесс (Modess, 1941) и Р.Микола (Miko-
la, 1955) приводят большие списки грибов, которые в культуре не растут. М.Эс-
пеншейд (Espenshade, 1962) указывает, что в культуру им были выделены лишь
18 около 50 % видов, из которых изолировались тканевые культуры. В основном
грибы, которые не выделяются в культуру, могут быть разделены на 3 категории.
У грибов 1-й категории на перевивочном кусочке ткани плодового тела появляет-
ся только пушок воздушного мицелия высотой 1—2 мм, который быстро прекра-
щает рост, не переходя на питательную среду. Грибы 2-й категории не имеют мице-
лиального роста на тканевом инокуляте. У грибов 3-й категории отмечается обиль-
ное инфицирование инокулята посторонней микрофлорой, от которой не удается
избавиться. Среди грибов, которые многими исследователями не изолированы в
культуру, наиболее часто встречаются виды родов Russula, Lactarius, Cortinarius,
Gomphidius, Cantharellus. Трудности и неудачи при выделении мицелиальных
культур из тканей плодовых тел объясняют (Modess, 1941; Шемаханова, 1962;
Semerdzieva, 1965) неблагоприятным физиологическим состоянием мицелия
плодового тела в момент выделения или непригодностью, токсичностью каких-
либо компонентов питательной среды. Относительно того, какую часть плодово-
го тела предпочтительнее брать для получения инокулята (шляпку, ножку, гиме-
ний, место перехода шляпки в ножку и тд.), существуют различные мнения
(Mikola, 1955; Мозер, 1963; Бухало, 1966, 19736; Watling, 1971, 1977),что,оче-
видно, можно объяснить разнообразием строения, размеров консистенции плодо-
вых тел у высших базидиомицетов, а также личным опытом исследователей.
ЕЛ4елин (Melin, 1922а) считает, что вообще не имеет значения из какой части
плодового тела берут инокулирующую ткань. Большинство авторов обращает
внимание на тот факт, что рост культуры происходит значительно лучше, если тка-
невой изолят берется из молодого^ не начавшего даже образовывать споры, плодо-
вого тела. А .Соботка (Sobotka, 1955) выделял культуры из плодовых тел разного
возраста, даже подвергшихся воздействию мороза. МЛантиду (Pantidou, 1961а)
отмечает, что культуры, выделенные как из молодых, так и из старых плодовых
тел болетальных грибов, растут хорошо, но в последнем случае горазда_чаще на-
блюдается бактериалыюедагрязнение.
Для дезинфекции плодовыхтея -используют различные антисептические жид-
кости, как, например, формальдегид (1:100), 0,1 %-ный раствор сулемы, 3 %-ный
раствор перекиси водорода, этиловый спирт и другие вещества, а также обжигание
плодового тела над пламенем горелки. Имеются существенные расхождения во
взглядах различных авторов относительно оптимальных размеров кусочка иноку-
лирующей ткани.
Успехи в получении культур некоторых высших базидиальных грибов были
достигнуты в связи с использованием антибиотиков и фунгицидов, которые стали
добавлять в питательную среду для подавления роста посторонних микроорганиз-
мов, загрязняющих тканевой инокулят и растущий мицелий (Шемаханова, 1962,
Бухало, 1966,19826; Walting, 1971).
Значительное внимание многими исследователями уделяется получению куль-
тур высших базидиомицетов из базидиоспор. Монокариотические культуры, вы-
деленные из одной базидиоспоры, применяются в экспериментах, связанных
с гибридизацией культивируемых видов, изучением таксономии, генетики, поло-
вой дифференциации, морфологии бесполых спороношений и других вопросов
у высших базидиомицетов.
Проращиванием базидиоспор различных видов высших съедобных базидио-
мицетов занимается шведский миколог Н.Фриз (Fries, 1949, 1977, 1979а, Ь,
1981, 1983а, Ь). Из базидиоспор он получил мицелиальные культуры некоторых
видов из родов Boletus, Leccinum, Amanita, Mycena, Laccaria, Paxillus, Cantharellus
и др., что не удавалось другим исследователям. Успех работ Н.Фриза можно объяс-
нить тем, что он использовал широкий спектр питательных сред, для стимуляции
применил культуры дрожжей Torula sanguinea и Rhodotorula glutinans. Прораста-
ние базидиоспор видов рода Leccinum он получил лишь в присутствии мицелия
тех же видов грибов (Fries, 1981).
Положительных результатов в проращивании базидиоспор добились М.Н-Шема-
ханова (1962), В.Я.Частухин, М.А.Николаевская (1969) и др. Отмечены быстрая
потеря способности прорастания и снижение процента прорастания у базидиоспор
даже при непродолжительном их хранении, а способность к прорастанию сохраня-
ется лучше при низких температурах (Fries, 1943, 1949; G: xtlieb, 1950; Шемахй-
19
нова. 1962 ). Некоторым видам для прорастания базидиоспор требуется определен-
ный период покоя, например, Calvatia gigantea. Suillus luteus и S.granulatus (Ше-
маханова, 1962: Bulmer, Beneke. 1962; Sussman. Halvorson, 1966). Однако метод
выделения из базидиоспор остается пока неприемлемым для получения культур
определенных экологических и таксономических групп грибов из-за значительных
трудностей или вообще невозможности прорастить базидиоспоры.
После анализа литературных данных мы сделали заключение, что наиболее
универсальным является метод выделения культур высших базидиомицетов из
плодовых тел. Он особенно удобен для видов с карпофорами, которые имеют
толстый слой ткани шляпки или ножки. Несомненное преимущество этого мето-
да — непосредственное, без дополнительных скрещиваний гаплоидного мицелия
получение дикариотической мицелиальной культуры. Выделение культур из суб-
стратов и микоризных окончаний требует их дополнительной идентификации пу-
тем получения в культуре плодовых тел, в большинстве случаев это невозможно.
В литературных источниках не представлена детализация методов получения
чистых мицелиальных культур отдельных видов, произрастающих в разных эколо-
гических условиях и отличающихся строением, габитусом, консистенцией, сте-
пенью загрязненности плодовых тел и другими показателями. Не обобщены и не
описаны методы получения культур многих видов агарикальных, болетальных,
гастеромипетальных грибов, к которым относят большинство съедобных.
Поэтому нами было уделено значительное внимание дальнейшему совершен-
ствованию методов выделения высших съедобных базидиомицетов в чистую
культуру (Бухало. 1966, 19736. 19826; Промышленное культивирование ...,
1978: Bukhalo, 1974).
1.2. Глубинное культивирование высших съедобных базидиомицетов
для получения пишевой биомассы
1.2.1. Интродукция съедобных базидиомицетов в глубинную культуру
Съедобные гпибы привлекают внимание исследователей в первую очередь с точки
зрения возможности получения пищевого белка, дефицит которого стал остро
ощущаться в совоеменном мире. Проявлению повышенного интереса к этой груп-
пе грибов способствует то. что показана принципиальная возможность выращивать
высшие базидиомицеты в глубинной культуре, открывающая реальную перспекти-
ву получения быстрого роста мицелия в контролируемых условиях, а следователь-
но. и его производства на промышленной основе.
Эксперименты по глубинному культивированию съедобных грибов, разрабо-
танные на основе методов, используемых при культивировании мицелиальных
грибов из других таксономических групп, главным образом несовершенных, дали
обнадеживающие результаты, представляющие значительный интерес для промы-
шленной микробиологии. Высшие базидиомицеты, ранее культивировавшиеся
только для получения плодовых тел или исследовавшиеся в статической культуре,
считались медленно растущими, в связи с чем не представлялось возможным ис-
пользовать их в промышленном производстве.
В 1945 г. П.Буркхольдер и Б.Синнот (Burkholder, Sinnott, 1945) сообщили
о культивировании глубинным методом 150 видов мицелиальных грибов, среди
которых было несколько базидиомицетов. Однако они не привели данных ни об
урожае мицелия, ни о характере роста исследованных грибов.
Д.3юс и НЛонкерс в 1948 г. (Pat. 21845. USA; Pat. 2648163, USA; Pat.
2761246. USA: Pat. 2850841. USA) впервые получили патенты на глубинное куль-
тивирование съедобных грибов. В них указана возможность культивирования
таких видов, как Pleurotus ostreatus, Cantharellus cibarius, Tricholomopsis sp.
и др., однако никаких данных о росте этих грибов не приведено.
МДженнисон и МЛюком (Jennison, 1948, 1956; Jennison et al., 1955).изучая
физиологию роста мицелия дереворазрушающих грибов в погруженной культуре
20 в колбах на качалке, установили ряд факторов, способствующих росту мицелия
некоторых съедобных грибов: Armillarielia meliea, Poiyporus sulphurous, Lentmus
iepideus, Panus tigrinus и др. Наиболее существенными из них были температура
аэрация, pH, содержание определенных питательных веществ и стимуляторов в
среде, их соотношение. Оптимизация исходной минеральной среды с глюкозой
позволила значительно увеличить выход мицелия этих грибов.
Первые обнадеживающие результаты в области глубинного выращивания ми- .
целия съедобных грибов побудили некоторых исследователей испытать более ши-
рокий набор видов. ИЛ1тарка (Starka, 1955) культивировал на качалке 25 штам-
мов высших базидиомицетов, в том числе съедобные Poiyporus squamosus, Pleuro-
tus ostreatus, Clitocybe nebularis и Coprinus comatus.
В глубинной культуре (Sugihara, Humfeld, 1954; Falanghe, 1962) отмечен
хороший рост таких видов, как Armillarielia meliea, Coprinus comatus, Pleurotus
ostreatus, Tricholoma nudum, Collybia velutipes, различных, видов Macrolepiota,
которые образуют 40-50 % сухого мицелия в пересчете на потребленный сахар. '
В .Эдди (Eddy, 1958) показал, что Armillarielia meliea, Coprinus comatus, Lepiota
naucina, Macrolepiota procera, M. rhacodes и Pleurotus ostreatus в глубинной
культуре продуцируют более 20 г/л сухого мицелия. Однако урожай биомассы
грибов, по данным В.Эдди, был примерно наполовину меньше, чем полученный
Т.Сугихарой и Г.Хумфельдом (Sugihara, Humfeld, 1954) для этих же видов.
В то же время испытанные В.Эдди культуры Marasmius oreades и Pleurotus comu-
copiae росли лучше, чем сообщалось для этих видов Т.Сугихарой и Г.Хумфельдом.
ВДирилло и др. (Pat. 2928210, USA) в патенте на глубинное выращивание съедоб-
ных грибов на сульфитном шелоке в качестве лучших продуцентов биомассы
предлагают использовать Tricholoma nudum и Fiammulina velutipes. Дж.Ворган
(Worgan, 1968), изучавший рост 15 видов на среде с ксилозой, отмечает хороший
рост Tricholoma nudum, Boletus indecisus, Poiyporus betulinus, Agaricus campestns
и др. Этим же автором была использована коллекция американских штаммов
базидиомицетов. которые культивировали в колбах на качалке на среде с глюко-
зой и соевым белком.
П.Вольц и Е.Бенеке (Volz, Beneke, 1969) в погруженной культуре на средах г
разными источниками углеродного и азотного питания исследовали рост Agaricus
bisporus. A. campestris, Cantharellus clavatus, C. cibarius, Pleurotus ostreatus.
Tricholoma nudum, Volvariella volvaceae. M Атакадор-Рамос с соавт. (Atacador-Ra-
mos et al., 1967) оптимизировали среду с сахарозой и мочевиной для глубинного
культивирования Volvariella volvaceae. Максимальный выход мицелия этого гриба
составил 18 г/л по сухой массе за 3 сут.
В литературе приведены краткие сообщения о культивировании отдельных
видов высших съедобных базидиомицетов (Gilbert, Robinson, 1957; Robinson,
Davidson, 1959; Singer, 1961; Espenshade, 1962; Chen Yue-mae et al..1963a. b:
Teng, 1966;- Ghosh, Sengupta, 1977; Delmas, 1978; Matosic et al.. 1981: Zetelaki.
1981; и др.).
Максимальное образование мицелия в глубинной культуре у Boletus sp. и
Macrolepiota procera отмечено (Chen Yue-mae et al., 1963a, b) через 24 ч, причем
выход мицелия составил 45-50 % использованного сахара.
В обзоре Дж.Воргана (Worgan, 1968) подведен итог 20-летнего периода иссле-
дований в области глубинного культивирования съедобных грибов, в частности
приведен список 70 видов базидиомицетов, упомянутых в литературе как выра-
щивавшиеся глубинно. Однако автором не представлены данные о морфологии
культур, составе питательных сред, условиях культивирования, урожае мицелия.
Многие виды грибов из списка Дж.Воргана не съедобные. Это прежде всего отно-
сится к видам родов Fomes, Poria, Poiyporus, Trametes, Daedalea и др. К тому вре-
мени в глубинной культуре более детально были исследованы штаммы Agaricus
campestris и Tricholoma nudum, которые, как оказалось впоследствии (Molitoris,
1962), были неправильно идентифицированы как базидиомицеты. Основное вни-
мание, к сожалению, Дж.Ворган уделил культивированию в лабораторных усло-
виях и в крупных масштабах, а также питательной ценности мицелия именно
этих штаммов.
В нашей стране исследования по выращиванию высших базидиомицетов в гпу- 21
бинной культуре были начаты во второй половине 60-х годов XX ст. Показана
перспективность глубинного культивирования Pleurotus ostreatus. Panus tigrinus,
Flammulina velutipes, Tricholoma fulvum и некоторых других видов съедобных
грибов (А.с. 427993, 727678, 883177, СССР; Фалина и др., 1965а, б; Бухало,
1966, 1968, 1971, 1973а. 1975, 1978, 1982а, 19836; Низковская, 1969а, 1972,
1978; Бухало и др., 1975, 1978, 1983; Промышленное культивирование ..., 1978;
Соломко и др., 1978; Фалина. 1978; Buchalo et al., 1979; Вечери др., 1979; Капич
и др., 1980; Высшие съедобные базидиомицеты ..., 1983; Дудка и др., 1983; Ка-
• пичи др., 1983: Вассер и др., 1984; и др.).
Работы отечественных авторов, представителей ленинградской школы (Кор-
мовые белки .... 1965; Шиврина, 1965; Продукты биосинтеза ..., 1966; Биосинте-
тическая деятельность ..., 1969; Высшие грибы ..., 1973; и др.), полно отразили
достижения в области биохимии, физиологии, культивировашш высших базидио-
мицетов. Здесь, помимо анализа обширного литературного материала, подытоже-
ны собственные многолетние исследования биосинтетической активности, глав-
ным образом дереворазрушаюших грибов. Среди изучавшихся видов высших 5а-
зидиоминетов были и съедобные, хотя вопросу их культивирования специальное
внимание не уделялось. В разделе монографии о применении высших грибов в
практике народного хозяйства отмечается, что выращивание гребного мицелия
в производствежых условиях — наиболее перспективный путь для использования
грибов этой систематической группы.
Начиная с 60-х годов нашего столетия наряду с продолжающимся поиском но-
вых видов и штаммов высших съедобных базидиомицетов, способных расти в глу-
бинной культуре, проводится ряд более углубленных исследований отдельных
представителей высших базидиомицетов с целью разработки путей управления их
биосинтетической активностью для получения пищевой биомассы или других цен-
ных продуктов их метаболизма в условиях культуры. Объектами исследований
служат как быстрорастущие виды сапротрофных грибов, так, в отдельных случа-
ях, и микоризообразуюшие виды, ранее причислявшиеся к особенно медленно-
растущим. При этом ученые уделяют внимание достоверности идентификации
исследуемых штаммов.
Изучая в глубинной культуре съедобные грибы Финляндии, М.Хаттула и
ХТилленберг (Hattuia. Gyllenberg, 1969а, b) среди перспективных видов указы-
вают Hydrophoropsis aurantiaca, Suillus bovinus, S. luteiis, S. variegatus, S. grevil-
lei. Leccitum testaceoscabrum, Armillariella mellea, Lyophyllum lorycatum, Kuehne-
romyces mutabilis и Cortinarius hemitrichus. Наиболее высокий коэффициент
использования сахаров (57 г сухого мицелия на 100 г потребленного сахара) отме-
чен у Cortinarius hemitrichus. наиболее высокое содержание протеина в мицелии
(49,7 %) — у Kuehneromyces mutabilis, глубинный культуральный мицелий Suillus
luteus рекомендуется в качестве хорошей пищевой добавки, богатой водораство-
римых® витаминами и белком.
Показано ускорение роста мицелия в условиях глубинной культуры по сравне-
нию с поверхностной. В то же время В.Шашек и В.Мусилек (Sasek,' Musilek, 1971),
изучая рост 17 видов базидиомицетов из родов Clitopihis, Lactarius, Rhizopogon,
Russula. Scleroderma. Suillus. Tricholoma и Xerocomus, образующих микоризу
c Pinus. не наблюдали разницы в скорости роста этих грибов при глубинном и по-
верхностном способе их выращивания. В литературе встречаются значительные
расхождения в опенке роста отдельных грибов, что можно объяснить неодинако-
выми условиями их культивирования, а также, возможно, штаммовых® различия-
ми испытанных культур.
О.П.Ниэковская (1972, 1978) приводит данные о росте агарикальных грибов
из разных систематических и экологических групп в поверхностной и глубинной
культуре на жидких средах. Рост исследованных штаммов в основном определяет-
ся их принадлежностью к той или иной экологической группе. Лучше всего росли
дереворазрушающие грибы, -затем подстилотаяе сапротрофы. На жидких средах
лучше произрастали виды родов Suillus и Xerocomus, которые некоторыми авто-
рами рассъютриваются как факультативные микоризообразователи. Попытки вы-
22 рашгаать на жидкой среде Boletus edulis, Leccinum aurantiacum и L. scabrum не
увенчались успехом. ОЛ-Низковская отмечает, что выращивание на качалке поз-
воляет значительно увеличить (примерно в 2- раза) скорость роста изученных
штаммов агарикальных грибов по сравнению с поверхностной культурой, хотя
на продуктивность способ культивирования практически не влияет. Установлены
различия в продуктивности штаммов одного и того же вида. У некоторых видов,
развивающихся в природных условиях в древесине при недостатке кислорода
(представители родов Amillariella и Schizophyllum, семейства Strophariaceae),
наблюдался лучший рост в поверхностной культуре.
В настоящее время получены положительные результаты по выращиванию
в глубинной культуре облигатных микоризообразователей: Boletus aereus, В. va-
riegatus, В. edulis (Pedersen, Lindeberg, 1970; Oyama et al., 1974; Poitou et al.,
1981). И.Ояма с соавт. (Oyama et al., 1974) рассматривают процесс выращивания
глубинного мицелия микоризообразующих грибов, в том числе и Boletus edulis,
как способ достижения Массовой культуры и высокой скорости роста в вегета-
тивной фазе, предшествующей более Длительной и с более сложным контролем
регенеративной фазе. Мицелий В. edulis выращивался в глубинной культуре на
качалках при флюоресцентном освещении на жидкой среде с пектином (2 %)
в качестве источника углерода, аминокислотами (0,1 %), витаминами. Хороший
рост в глубинной культуре на качалках представителей семейства Boletaceae был
получен благодаря добавлению в питательную среду сафлорового масла (Schisler,
Volkoff, 1977), что способствует сокращению лат-фазы. О росте в глубинной
культуре В. edulis сообщают также Г.Еуберген и В.Шефферс (Eybergen, Scheffers,
1972). Они выращивали этот вид на качалке на среде с глюкозой и тиамином. Вре-
мя удвоения биомассы в период быстрого роста составляло 2,5—3,5 сут, однако
лаг-фаза длительная. Авторы выражают уверенность в возможности глубинного
выращивания В. edulis на более простой и дешевой среде.
ФДийкстра (Dijkstra, 1976) занимался глубинным культивированием мице-
лия Agaricus bisporus и Coprinus comatus как источника белка и ароматических
веществ. По его мнению, основные препятствия для разработки экономически '
выгодного процесса производства мицелия съедобных грибов — медленный рост
большинства исследованных видов и отсутствие специфического грибного арома-
та в получаемой биомассе. Значительной трудностью при выращивании мицелия,
является также необходимость строгого соблюдения стерильности в процессе
ферментации, что диктуется небольшой скоростью роста продуцентов, оптималь-
ным для их роста значением pH среды (обычно между 6 и 7), а также ее богатым
составом, что повышает опасность загрязнения посторонней микрофлорой. Луч-
шие результаты получены Ф.Дийкстра (Dijkstra, 1976) при культивировании на
комплексных средах, содержащих порошок обезжиренного молока, казеин, овощ-
ной и мясной экстракты, мочевину, техническую мальтозу, мальц-экстракт и др.
На этих средах урожай мицелия по сухой массе составляет 15-25 г/л, оптимальное
время культивирования в ферментере - 7 сут. Такую скорость роста и использова-,
ние дешевых источников питания из органических материалов, непригодных для
питания человека, в сочетании со способностью образовывать ароматические веще-
ства автор считает достаточными для производства грибного мицелия на экономи-
чески выгодной основе.
В работе Г.Соломонса (Solomons, 1975) проводится мысль о том, что много-
летний опыт промышленного производства вторичных метаболитов грибов может
быть использован для получения биомассы как конечного продукта. При выращи-
вании биомассы съедобных грибов основное внимание должно быть уделено полу-
чению удовлетворительных показателей скорости роста, урожая биомассы, форм
роста и запаха. По литературным данным, приведенным Г.Соломонсом, урожай
съедобных грибов составляет от 7—8 до 30 г/л сухого мицелия, урожай биомассы
по углероду 0,5 можно считать хорошим при условии, что углерод является
единственным лимитирующим фактором^Продуцент, по мнению Г.Соломонса,
должен отвечать ряду требований, наиболее существенными из которых являются:
высокое содержаниё~бёлка~в мицелии и его хорошие питательные качества; удо-
влетворительная скорость роста; большой урожай; способность расти на сравни-
тельно простой среде и обязательно использовать аммиак или аммоний в качестве
источника азота; способность расти в глубинной культуре до плотности клеток
10—40 г/л сухого вещества; расти в виде нитей, а не шариков: Автор приводит до-
воды в пользу преимущества съедобных грибов как продуцентов пищевой биомас-
сы перед другими микроорганизмами.
ГТЛ4орозова с соавт. (1978а) в обзоре, посвященном промышленному полу-
чению мицелия высших грибов, на основании литературных данных делают вывод
о целесообразности использования в качестве продуцента селектированного нами
штамма вешенки (А.с. 427993. СССР) для организации отечественного промыш-
' ленного производства пищевого мицелия. Авторы отмечают, что виды родов
Pleurotus, Fiammulina, Pholiota, Lentinus, Poiyporus, будучи первичными деструк-
торами древесины, неприхотливы в питательных потребностях. Это значительно
облегчает задачу поиска экономически выгодных субстратов для их культивиро-
вания. Акцентировано внимание на необходимости расширения и ускорения науч-
но-исследовательских и опытных работ для быстрейшего создания промышленно-
го производства мицелия высших грибов. Обзор в значительной степени построен
на данных о культивировании ложных штаммов базидиомицетов (Agaricus cam-
pestris, A.blazei, Tricholoma nudum, Cantharellus cibarius, Poiyporus squamosus
и др.).
При рассмотрении вопросов глубинного культивирования высших съедобных
базидиомицетов во многих публикациях широко используются данные об опыте
культивирования съедобных сумчатых грибов, главным образом из рода Morchella.
В природе они образуют, как и высшие базидиомицеты, крупные плодовые тела.
. Глубинно культивируемые штаммы ’’морелей” с характерным для них и не типич-
ным для большинства известных съедобных грибов запахом были предложены
Т.Сугихарой и Г.Хумфельдом (Sugihara, Humfeld, 1954). Культивирование этих
грибов в промышленных масштабах, в основном как носителей специфического
аромата, осуществлено в США (Pat. 2761246 USA, Reusser et al., 1958a; Gilbert,
1960; Litchfield et al., 1963; Litchfield et al., 1963; Litchfield, 1967; Worgan,
1968; Janardhanan et al., 1970; LeDuy et al., 1974) . В нашей работе мы использова-
ли литературные данные о культивировании сумчатых съедобных макромицетов
в ограниченной степени как материал для сравнения.
Таким образом, несмотря на достигнутые к 70-м годам обнадеживающие на
первый взгляд результаты глубинного культивирования съедобных грибов, про-
мышленное получение их мицелия для пищевых целей так и не было осуществле-
но. Причина этому — недооценка важности и сложности проблемы получения дей-
ствительно чистой мицелиальной культуры высшего съедобного базидиального
гриба. Получила распространение ошибочная теория, согласно которой высший
базидиомицет — продуцент пищевой биомассы при культивировании обязательно
должен образовывать ’’вторичные” споры как признак его высокой приспособляе-
мости к специфическим условиям культивирования, обеспечивающей большую
скорость роста и продуктивность. По этому показателю были отобраны штаммы
Agaricus campestris, Tricholoma nudum, Agaricus blazei, A.placomyces, Boletus
edulis, Poiyporus squamosus и некоторые другие (Humfeld, 1948, 1950/1951,
Humfeld, Sugihara, 1949, 1952; Pat. 2618900, USA; Block et al., 1953,1959; Sugi-
hara, Humfeld, 1954; Reusser et al., 1958a, b; Block, 1960; Falanghe, 1962; Rehafcek
et al., 1962; Falanghe et al., 1964; Worgan, 1968; Hamid et al., 1972; Торев, 1973),
оказавшиеся при последующей идентификации видами дейтеромицетов (Molitoris,
1962; Бухало, 1978а; Бухало, Еланська, 1983; Бухало, Элланская, 1984; Зобнина
и др., 1983). Продукт культивирования этих штаммов, был лишен вкуса и арома-
та, присущего съедобным грибам, и не пригоден для образования плодовых тел.
Такие результаты отрицательно сказались на развитии исследований в области глу-
бинного культивирования базидиомицетов с целью получения пищевой биомассы.
В то же время, несмотря на культивирование отдельных ложных штаммов бази-
диомицетов, накоплен определенный опыт выращивания и диспергирования посев-
ного мицелия, отъемно-доливного способа культивирования, сушки и применения
глубинного мицелия для изготовления различных пищевых продуктов. Это отно-
сится и к другим технологическим процессам, общим для культивирования мице-
24 лиальных грибов различных таксонов.
В глубинной культуре виды родов Agaricus, Pleurotus, Lentinus. Flammulina.
Macrolepiota, Coprinus, Suiilus и некоторые другие — преимущественно представи-
тели экологических групп лигнотрофов и сапротрофов — имеют хороший рост.
Достижения и ошибки, которые были при глубинном культивировании съедоб-
ных грибов, определили дальнейшую судьбу развития данной области микологии,
заставили пересмотреть некоторые критерии и методические подходы, поставили
определенные задачи перед современными исследователями.
1.2.2. Субстраты для глубинного культивирования
Одно из основных свойств, которым должны обладать микроорганизмы — проду-
центы пищевого и кормового белка, — это способность усваивать субстраты, со-
держащие отхода промышленности и сельского хозяйства. Высшие съедобные ба- •
зидиомицеты, представляющие собой чрезвычайно пеструю в экологическом от-
ношении группу и обладающие богатой ферментной системой, открывают неогра-
ниченные возможности поиска различных субстратов для культивирования. Уже
в начале исследований по этой проблеме отмечалось, что мицелий съедобных гри-
бов гораздо лучше растет на субстратах, содержащих органические соединения
азота. В качестве питательных сред для выращивания съедобного мицелия показа-
на целесообразность использования богатых сахарами отходов, получаемых при
переработке фруктов, сахарной свеклы, овошей, кукурузы, молока и других про-
дуктов сельскохозяйственного производства (Eddy, 1958; Robinson, Davidson,
1959; Worgan, 1968; Бабицкая, Лобанок, 1976; Dijkstra. 1976; Zadrazil, 1976.
1978; Бухало, 1978; Морозова и др., 1978а, б; Промышленное культивирова-
ние ..., 1978; Вечер и др.. 1979: Капич и др., 1980; Высшие съедобные базидиоми-
петы ..., 1983; Залашко, 1983; Капич и др., 1983; Капич и др., 1984) .
Р.Сакамото с соавт. (Sakamoto et al., 1978а, b) показали эффективность
культивирования Pleurotus ostreatus и Lentinus edodes на средах с высоким
(7—10%) содержанием, крахмала.
Для выращивания в глубинной культуре съедобных грибов могут успешно
использоваться также и неуглеводные источники углерода, например, алифатиче-
ские спирты, и-алканы, органические кислоты трикарбонового цикла (Sugimori
et al., 1971). Так, выход мицелия у Pleurotus ostreatus на среде с 2 %-ным этано-
лом составляет 10,5 г/л через 72 ч, мицелий содержит 55—60 % белка и имеет бо-
лее приятный запах, чем на среде с углеводами.
В настоящее время чрезвычайно актуальна задача использования растительно-
го сырья и продуктов его переработки для получения различных продуктов кор-
мового и пищевого назначения. Прямая микробная биоконверсия углеводов рас-
тений в разные органические соединения используется для получения продуктов
питания, кормов, медикаментов, химикатов, топлива. Проблема биоконверсии
важна также для решения вопросов охраны окружающей среды. В процессах
биоконверсии важная роль отводится высшим базидиомицетам, которые, обла-
дая мощной ферментной системой, могут осуществлять прямое превращение
целлюлозы, лигнина, крахмала в удобную для пишевых и кормовых целей форму
их использования.
В качестве прогрессивной ферментации некоторые исследователи предлагают
твердофазную, т.е. такую ферментацию, когда процесс после инокуляции твердого
субстрата ведется нестерильно. Обсуждаются ее преимущества перед традиционной
глубинной ферментацией на жидких средах (Eggins, Allsopp, 1975; Zadrazil;1976,
1978; Rosenberg, 1979; Виестур, 1982). Однако, по мнению У.Э.Виестура (1982),
у твердофазной ферментации, привлекающей простотой, есть и ряд недостатков.
Это прежде всего невозможность осуществлять аэрацию, перемешивание и под-
держивать температуру в толстом слое субстрата, которым служат обычно соло-
ма, опилки. Вследствие этого приходится вести ферментацию в очень тонком
(5-10 см) слое, что приводит к большим (до 30—50 %) потерям сухого вещества
по сравнению с глубинной ферментацией, где такие потери составляют всего
3—5 %. В случае нестерильной твердофазной ферментации возникает также серьеэ- 25
ная проблема изоляции людей, участвующих в ферментации, от культуры грйба.
В зависимости от субстрата, продуцента, масштабов производства в разных случа-
ях экономически выгодной может оказаться как глубинная, так и твердофазная
ферментапи?.
Как перспективные для глубинной ферментации в нашей стране некоторые
авторы предлагают, крахмалосодержащие субстраты, отходы сахарных, молоко-
перерабатывающих, пивоваренных, картофелеперерабатываюших предприятий.
Могут использоваться также отходы лесной и лесоперерабатывающей промыш-
ленности: древесная меласса, продукты неполного гидролиза древесины с высо-
ким содержанием целлюлозы, гидролизаты растительных отходов и др. (Бухало,
1978а; Морозова и др., 1978а, б; Соломко и др., 1978; Вечер и др., 1979; Афри-
кян и др., 1982; Беккер, 1982; Лобанок и др., 1982; Высшие съедобные базидио-
мипеты .... 1983; Капич и др., 1984).
Отмечается перспективность высших съедобных базидиомицетов из родов
Panus, Pleurotus как продуцентов белка при биоконверсии (Zadraf.il, 1974,1978;
Бухало, 1978, 1982а; Морозова и др., 1978а, б; Промышленное культивирова-
ние ..., 1978; Головлева, 1982; Лобанок и др., 1982; Высшие съедобные базйдио-
мицеты ..., 1983; Kahlon, Parveen, 1983; Капич и др., 1984).
Сырье, используемое для культивирования мицелия, должно быть недорогим,
удобным для транспортировки и хранения. Кроме того, при выборе субстратов
для промышленного производства мицелия исходят из анализа ресурсов сырья
в регионе, нетоксичности (Морозова и др., 1978а; Высшие съедобные базидиоми-
цеты ..., 1983).
1.2.3. Питательная ценность культурального мицелия
Использование культурального мицелия для кормовых и пищевых целей в значи-
тельной мере связано с оценкой питательных свойств получаемой в культуре био-
массы, а также с определением степени качественного сходства ее химического
состава с таковым плодовых тел, произрастающих в природе и традиционно ис-
пользующихся человеком в пищу.
Обсуждается возможность использования съедобных грибов в качестве пище-
вой добавки. Так, отмечено (Gilbert, Robinson, 1957; Фалина, Андреева, 1965;
Зерова, Мельничук, 1972; Kurtzman, 1975; Dijkstra. 1976; Kreula et al., 1978;
Torev, 1978; Тревельян, 1979; Эйлворд, 1979; Hayes, Wright, 1979), что в настоя-
щее время выращенную на отходах биомассу съедобных грибов следует рассматри-
вать как деликатесную приправу или добавку к продуктам.
По мнению Дж.Воргана (Worgan, 1968), биомасса высших съедобных базидио-
мицетов не является токсичной, как у многих культивируемых плесеней. Автор
делает вывод, что мицелий грибов, добавленный в изделия из кукурузы, риса,
обогащает их протеином, рибофлавином, никотиновой кислотой, лизином, трип-
тофаном, восполняя таким образом дефицит витаминов и аминокислот в продук-
тах из зерновых культур.
Высокую ценность высших базидиальных грибов как пищевого продукта от-
мечают В.Хейс и СЛ*айт (Hayes, Wright, 1979). Содержание истинного белка у съе-
добных грибов по данным этих авторов составляет 35 %, перевариваемость — бо-
лее 80 %. Грибной белок богат лизином, триптофаном и витаминами. Авторы счи-
тают, что роль грибов в питании человека должна в будущем постоянно возрастать
в связи с увеличением доли растительной пищи.
Сведения о качественном сходстве химического состава плодовых тел и куль-
турального мицелия съедобных грибов (Hattuia, Gyllenberg, 1969b) представлены
в табл. 1. Количественное содержание химических компонентов в культуральном
мицелии и плодовых телах одного и того же вида, даже штамма, может заметно
изменяться в зависимости от возраста культуры и плодовых тел, субстрата и неко-
торых других факторов. По данным А.Гоша и С.Сенгупты (Ghosh, Sengupta,
1977), у Volvariella volvaceae содержание растворимых и нерастворимых утлево-
26 дов в мицелии в несколько раз больше, чем в плодовых телах, я содержяяие-жиря
и протеина значительно ниже. Предпола-
гается, что низкая концентрация протеи-
на в данном конкретном случае является
результатом неблагоприятного соотноше-
ния азота и углерода или недостатка в
среде органических форм азота. На изме-
нение количественного состава свобод-
ных аминокислот в зависимости от воз-
раста культуры, используемых источни-
ков углеродного и азотного питания ука-
зывает Р.А.Маслова (1978а, б).
Питательная ценность как плодовых
тел съедобных грибов, так и культураль-
ного мипелия определяется прежде всего
количественным содержанием в них бел-
ка, его качественным составом и усвояе-
мостью.
Содержание общего или сырого про-
теина в микроорганизмах, растениях и
продуктах питания обычно рассчитывают
по содержанию общего азота, используя
коэффициент пересчета 6Д5 (табл. 1),
основываясь на том, что большинство бе
Таблица ]. Содержание (% сухой массы) сырого
протеина (Nx6,25) в плодовых телах и глубинном
мицелии некоторых съедобных грибов (Hattula,
Gyllenberg, 1969а)
Вид Мицелий Плодо- вое тело
Cantharellus cibarius 28,5 21,6
Suillus grevdlei 36,4 —
S.luteus 23,8 16.4
S. bovinus 25,9 20,9
S. variegatus 303 9,8
Boletus edulis 37,6 33,8
Leccinum testaceo-scabrum 38.5 28.7
Leccinum scabruin 47,1 32.0
Paxillus involutus 30,4 29,7
Hygrophorus aurantiaca 23,2 —
Lyophyllum loricatum 38.3 —
Armillarielia meliea 18,9 21,0
Collybia dryophila 22,1 30.4
Agaricus arvensis 42,4 55,1
Coprinus comatus 39.2 23,0
Kuehneromvces mutabHis 49,7 —-
Cortinarius hemitrichus 40,9 —
Lactarius necator 21,4 22,3
L. rufus 17,8 34,2
содержит 16 % азота и они имеют
100 %-ную перевариваемость. Предполагается, что в продукте присутствует лишь
незначительное количество небелкового азота. Данные большинства исследовате-
лей о содержании белка в природных плодовых телах грибов и в культуральном
мицелии приведены с учетом указанного критерия. Однако в связи с тем, что у не-
которых грибов перевариваемость протеина составляет около 70 % (Crisan, Sands,
1978), в ряде работ использован коэффициент 4,38.
У большинства исследованных видов содержание протеина в культуральном
мицелии выше, чем в плодовых телах (табл. 1), хотя он получен на синтетической
среде, не оптимальной для роста многих высших базидиомицетов. Объяснить сни-
жение концентрации протеина в мицелии у некоторых видов в условиях культуры
по сравнению с плодовыми телами можно неблагоприятными условиями культи-
вирования. На благоприятных средах в культуральном мицелии образуется боль-
ше протеина, нежели в плодовых телах (Шиврина и др., 1969).
В плодовых телах одних и тех же видов грибов может содержаться различное
количество сырого протеина, так как и в природных условиях^ при культивирова-
нии мицелия в жидких питательных средах на содержание белковых веществ, поми-
мо видовой принадлежности, влияет несколько факторов. Как показали Г .Г .Мель-
ничук иМ.Я.Зерова (1972),вплодовыхтелахAgaricuscampesterKonH4ecTBo6enKa
изменяется в зависимости от возраста плодовых тел. Например, на стадии закрытой
шляпки сырой протеин составляет около 52 %, на стадии открытой — 46 %. Анало-
гичная зависимость показана и в работе А.Гух и АЪанерджи (Guha, Banerjee,
1974) при глубинном выращивании этого же вида на синтетической среде в фер-
ментере. На 6-е сутки роста содержание сырого протеина в мицелии составляет 50%,
а на 7-е — 42 %. Аналогичные данные получены в опытах с Stropharia rugosoannu-
lata (Vetter, Rimoczi, 1978), у этого гриба наиболее высокое содержание перева-
риваемого протеина обнаружено перед отделением базидиоспор.
Не менее существенным фактором является питание. При выращивании Agari-
cus bisporus в жидкой синтетической среде сырой протеин составляет 38 % на су-
хую массу, а на среде с молоадой сывороткой — около 68 % (Dijkstra, 1976).
Для Coprinus comatus эти значения составляют 39 и 52 % соответственно. Т.Суги-
мори с соавт. (Sugimori et al., 1971) показали, что содержание основных компо-
нентов мицелия зависит от источника углерода. Так, на среде с глюкозой у Lenti-
nus edodes сырой протеин составляет 32 %, а на среде с этанолом в качестве источ-
ника углерода — 55,1 %. В мицелии Schizophyllum sp., выращенном на глюкозе,
количество сырого протеина равно 32,2 %, а на.среде с этанолом — 62,8 %. 27
Таблица 2. Сравнительная питательная ценность
грибов и важнейших продуктов питания по амино-
кислотному составу (Crisan, Sands, 1978)
Индекс неза- менимых ами- нокислот (ИНА)* Индекс амино- кислотного скора (ИАС)* Питательный 1 индекс (ПИ) г
100 рвинина, куры, говя- дина 100 свинина 59 куры
99 молоко 98 куры, говя- 43 говядина
98 грибы дина 91 молоко 35 свинина
91 картофель, фасоль 89 грибы 31 соевые бобы
88 зерно 63 капуста 28 грибы
86 огурцы 59 картофель 26 шпинат
79 арахис 53 арахис 25 молоко
76 шпинат, сое- вые бобы 50 зерно 21 фасоль
72 грибы 46 фасоль 20 арахис
69 репа 42 огурцы 17 капуста
5 3 морковь 33 репа 14 огурцы
44 томаты 32 грибы 11 зерно
31 морковь 10 репа 28 шпинат 9 картофель 23 соевые бобы 8 томаты 18 томаты 6 морковь 5 грибы
количество незаменимых аминокислот
л ® исследованном продукте
ИНА —------------------------------——- *
количество незаменимых аминокислот в
эталонном белке
аминокислота, мг/белок исследуемого
**ИАС - г________________________.
аминокислота, мг/эталонный белок, г
»«»пи ИНА / белок %
11 •' 100
Оценивая питательную ценность гри-
бов по сравнению с другой пишей, Э.Кри-
зан и А.Сандс (Crisan, Sands, 1978) отме-
чают, что по наиболее высоким показате-
лям некоторые виды базидиомицетов
могут стоять в одном ряду с мясом, мо-
локом и значительно выше, чем бобовые
и овощи. Другие виды по тем же показате-.
лям можно сравнить с овощами (табл.2).
В качестве наиболее весомого показателя
в оценке питательности грибов предлага-
ется использовать сравнительное содер-
жание незаменимых аминокислот в гри-
бах и в белке куриного яйца или эталон-
ном белке ФАО (Crisan, Sands, 1978).
М.Хаттула и ХДжилленберг (Hattu-
la, Gyllenberg, 1969а) проанализировали
аминокислотный состав плодовых тел и
глубинного мицелия 33 видов съедобных
грибов финской флоры, включающих
представителей 22 родов: Boletus, Suil-
lus, Leccinum, Tricholoma, Lactarius,
Tricholomopsis,Hygrophoropsis, Lyophyl-
lum, Agaricus, Marasmius, Macrolepiota,
Armillariella, Clavaria, Cantharellus,Colly-
bia, Cystoderma, Cortinarius, Kuehnero-
myces, Hypholoma, Coprinus, Micromphale,
Paxillus. Авторы приходят к выводу об
их качественном и количественном сход-
стве (табл. 3). По сравнению с эталоном
ФАО только валин и метионин в исследо-
ванных грибах содержатся в меньшем
количестве, однако финские грибы бога-
ты цистином, заменяющим в диете
метионин.
Идентичность качественного аминокислотного состава мицелия и плодовых
тел для некоторых видов афиллофоральных грибов, в том числе для съедобного де-
реворазрушающего гриба Laetiporus sulphurous, убедительно показана Р.А.Масло-
вой (19786). Автор отмечает, что по уровню содержания отдельных аминокислот бе-
лок исследованных грибов отвечает потребности в них человека и животных. Содер-
жание метионина и триптофана у этих грибов выше, чем у плесневых. Изучению бел-
ков у высших съедобных базидиомицетов и, в частности, амшюкислотного соста-
ва посвящен ряд работ (Zakia et al., 1963; Фалина и др., 1965а, б; Zakia et al.,
1971; Kalberer, Kunsch, 1974; Patel, 1980; Гаврилова, 1981).
Показано (Маслова, 1978a, 6; Crisan, Sands, 1978), что в высших базидиаль-
ных грибах содержатся все незаменимые аминокислоты и большинство обычных
несущественных амидов. В общем составе аминокислот незаменимые составляют
10—15 %, из них примерно 25-30 % — свободные, остальные связаны в белках.
У исследованных съедобных базидиомицетов отмечен лимит по 1—2, а иногда и по
5—7 аминокислотам. Чаше всего лимитными оказываются серосодержащие и аро-
матические аминокислоты.
У разных видов базидиомицетов обнаружены также редкие или необычные
амшгокислоты (Шиврина и др., 1969; Маслова, 1978а, б; Crisan, Sands, 1978). При
этом высказано предположение, что наличие именно этих аминокислот и обуслов-
ливает специфический вкус грибов. М.Альтамура с соавт. (Altamura et al., 1967)
выявили 57 различных соединений азота в экстрактах Agaricus bisporus. Для опре-
деления пищевой ценности белка важно установить доступность для пищевого ис-
28 пользования каждой аминокислоты. Так, исследование содержания лизина у не-
скольких видов базидиомицетов показа-
ло (Lasota et al., 1968), что только от 10
до 62 % этой аминокислоты усваивалось
организмом.
Г.Соломонс (Solomons, 1975) нашел,
что белки отдельных видов грибов впол-
не полноценны и их можно поставить в
один класс с животными белками (моло-
ком, маслом). Изучая перевариваемость
глубинно выращенного мицелия Lenti-
nus edodes и Pleurotus ostreatus, Т.Суги-
мори с соавт. (Sugimori et aL, 1971) ус-
тановили, что не только количество про-
теина, но в какой-то степени и его пере-
вариваемость зависят от субстрата. На-
пример, перевариваемость белка мице-
лия Pleurotus ostreatus, полученного на
жидкой среде с глюкозой, составила
89,1 %, а на этаноле — 90,7 %.
Хотя исследования химического сос-
тава съедобных грибов были направлены
в основном на изучение белковой фрак-
ции, в настоящее время еще мало извест-
но о содержании в плодовых телах и ми-
целии истинного белка, его переваривае-
мости и питательности. Часто для одних и тех же видов приводятся данные, кото-
рые трудно сравнить. Это объясняется различиями в условиях культивирования,
Количество аминокислоты
Таблица 3. Содержание (г/16 г белкового азота)
аминокислот в белках плодовых тел и глубинного
культурального мицелия высших съедобных бази-
диомицетов (Hattuia, Gyllenberg, 1968а)
Аминокислота в белке
Плодовое тело ! Мицелий
Аспарагиновая кислота Треонин Серин Глютаминовая 6,06-10,09 2,07-5,23 2,57—5,10 2,66-9,92 1,83-5,32 2,10-5.24
кислота 6,52—15,31 3,41-13,72
Пролин 2,76-5,44 2,69-5,75
Глицин 3,32—5,55 1.96-4.70
Аланин 2.83-6.31 3,82-5,78
Валин 0-0,80 0-1,57
Цистин 3,47—5,78 1,66-5,87
Метионин 0-0.80 0-1.08
Изолейцин 0-6,39 0-14.13
Лейцин 0-8,82 2,01-8,09
Тирозин 0-4.62 1,12-3.86
Орнитин 0-3,93 0-1,09
Триптофан 1,32-3,17 1,24—3.72
Лизин 3,31-6,14 1,35-3,39
Гистидин * 1,91—3,44 0,91—3,44
Аргинин 3,31-6,77 1,61-8,39
точностью химических методов определения белка, штаммовыми различиями и т.д.
Грибы являются хорошим истовдиком витаминов. В плодовых телах съедоб-
ных грибов содержится много витаминов группы В, витаминов С, Д, РР. Содержа-
ние этих витаминов в грибах часто выше, чем в большинстве овощей (Atacador-
Rhamos et al., 1967; Hattuia, Gyllenberg, 1968a, b; Шиврина и др., 1969; Crisan,
Sands, 1978; Каросене, Станкявичене, 1984). Эргостеролом наиболее богаты виды
родов Boletus и Agaricus. Содержание витаминов в плодовых телах разных съедоб-
ных грибов колеблется в следующих пределах: тиамин (Вг) — от 1,0 до 130, рибо-
флавин (В2) — от 36 до 2100, кобаламин (Вп) — от 0,007 до 1,4, никотиновая
кислота (РР) - от 300 до 1600, аскорбиновая кислота (С) — от 500 до 5000 мг/кг
сухой массы (Шиврина, 1965; Шиврина и др., 1969; Шиврина, Черотченко, 1970;
Hattuia,Gyllenberg, 1969а, b; Черотченко, 1977,1980).
Богат витаминами и культуральный мицелий. У видов Marasmius содержание
тиамина и рибофлавина в нем выше, чем в плодовых телах (табл. 4). Мицелий,
выращенный на жидких средах, содержит аскорбиновую кислоту, практически все
витамины группы В, эргостерин, а некоторые виды и (3-каротин (Atacador-Rhamos
etal., 1967; Hattuia, Gyllenberg, 1969a, b; Черотченко, 1977).
В настоящее время жиры и углеводы не являются дефицитными в питании че-
ловека, поэтому при оценке питательной ценности грибов им не придается такое
важное значение, как азотсодержащим компонентам. Липиды в грибах могут
составлять от 1 % и менее до 20-25 % на сухую массу. Большое количество жира
отмечено у видов родов Amanita, Tricholoma, Fomes, Polyporus и др. В среднем
в грибах содержится 2—8 % жира (Sawada, 1965; Шиврина и др., 1969; Crisan,
Sands, 1978; Соломко и др., 1984). Общее содержание липидов в мицелиальной
биомассе высших грибов варьирует в широких пределах и зависит от вида гриба,
состава питательной среды, соотношения в ней азота и углерода, условий культи-
вирования (Sugimori et al., 1971; Высшие съедобные базидиомицеты ..., 1983).
Laetiporus sulphureus на 7-е сутки глубинного культивирования на питатель-
ной среде с глюкозой накапливает до 57 % жира к массе сухого мицелия (Nour el
Dein, Abdallah, 1967; Биосинтетическая деятельность ..., 1969).
Качественный состав липидов Agaricus bisporus, Suillus luteus, Boletus edulis, 29
Таблица 4. Содержание (мг/кг абсолютно сухой мас-
сы) тиамина и рибофлавина в плодовых телах и куль-
туральном мицелии видов рода Marasmius (Зерова
и др., 1970)
Тиамин
Рибофлавин
Вид 1'1
I Плодо-' Мицелий! Плода-1 Мицелий
|воетело| |воетело|
Marismius al-
liaceus 4.34 13,60 12,60 14,00
М. prasiosmus 5,99 16,90 11,56 11,52
М. scorodonius 5,52 47,40 16,44 24,30
М. oreades 4.34 13,60 12,70 14,00
Lactarius deliciosus, Pleurotus ostrta-
tus приближается к растительным мас-
лам (Высшие съедобные базидиомице-
ты 1983; Соломко и др., 1984).
Свежие грибы содержат много
связанных углеводов (3-28 %). При
исследовании состава углеводной
фракции высших грибов отмечено
большое количество маннита (Litch-
field, 1967; Worgan, 1968), но его
ценность как пищевого вещества еше
недостаточно изучена. Содержание
зольных элементов как в природных
плодовых телах, так и в искусственных культурах зависит от субстрата, на кото-
ром растет плодовое тело, или состава питательной среды. При культивировании
на минеральных питательных средах золы в культуральном мицелии в 2—3 раза
больше, чем при культивировании на органических средах (Jennison, et aL, 1955).
В составе зольных элементов чаше всего преобладают калий и фосфор, причем со-
держание фосфора может быть выше, чем в рыбных продуктах (Дудченко, Мель-
ничук, 1973).
О .М Ефименко (1973, 1976) показано, что алкалоиды (ядовитые азотсодер-
жащие вещества) присутствуют в плодовых телах некоторых видов высших бази-
диомицетов. Их содержание значительно варьирует в зависимости от экологиче-
ских условий. Автором получены данные, свидетельствующие о том, что если ал-
калоиды присутствуют в плодовых телах, то они обнаруживаются и в культураль-
ном мицелии. Алкалоиды не обнаружены у Pleurotus ostreatus, Agaricus campes-
ter, Lepista nuda, Leccinum scabrum, Suilius variegatus, Laetiporus sulphureus,
Xerocomus subtomentosus. Однако алкалоиды найдены в плодовых телах и куль-
туральном мицелии некоторых съедобных грибов, например Armillarielia meliea,
Marasmius oreades, Amanita strobiliformis и др. Сведения о налиэди алкалоидов
у высших съедобных базидиомицетов должны учитываться при проведении отбора
продуцентов пищевой биомассы.
Таким образом, имеющиеся литературные данные свидетельствуют о том, что
культуральный мицелий высших съедобных базидиомицетов, полученный в усло-
виях глубинной культуры, по качественному составу основных питательных ком-
понентов сходен с плодовыми телами этих грибов, являющихся традиционной
пищей человека. Грибной белок содержит все незаменимые аминокислоты, пере-
вариваемость его достигает 80—90 %. Для отдельных видов показано, что коли-
чественное содержание белка, аминокислот, жиров, углеводов, зольных элемен-
тов в культуральном мицешш и его перевариваемость зависят от условий куль-
тивирования и могут регулироваться в процессе получения пищевой биомассы.
Однако до настоящего времени химический состав и питательная ценность
плодовых тел и ьицелия многих видов высших съедобных базидиомицетов изуче-
ны крайне недостаточно или не исследовались вовсе, что не позволяет в полной
мере судить об их пищевых достоинствах. В литературе отсутствуют данные о
медико-биологических испытаниях глубинного мицелия высших съедобных ба-
зидиомицетов как пищевого продукта. Практически не исследовано влияние ус-
ловий глубюшого культивирования на качественный и количественный состав
основных питательных компонентов в культуральном мицелии конкретных ви-
дов ценных съедобных грибов, являющихся перспективными продуцентами
биомассы.
1.2.4. Образование грибного аромата
при глубинном культивировании мицелия
Мицелиальная масса высших съедобных базидиомицетов, получаемая в процессе
глубинного культивирования, должна обладать не только высокиьш питательны-
30 ми, но и отличными вкусовыми свойствами. В значительной степени это зависит от
присутствия грибного аромата как в свежем, так в сушеном и консервирован-
ном продукте. С первых шагов глубинного культивирования мицелия съедобных
грибов для пишевых целей большое внимание уделялось сохранению и усилению
грибного аромата, подбору видов и штаммов, обладающих запахом грибов в куль-
туре. Грибной аромат, который в основном определяется органолептически, отме-
чался при глубинном культивировании Agaricus bisporus, Coprinus comatus, Pleu- .
rotus ostreatus, Panus tigrinus, Flammulina velutipes, Lepiota rhacodes, Lentinus
edodes, Boletus edulis и др. (Eddy, 1958; Бухало, 1971, 1973a, 1978; Sugimori et
al., 1971; Eybergen, Scheffers, 1972; Промышленное культивирование ..., 1978;
Высшие съедобные базидиомицеты ..., 1983).
В то же время есть сведения о том, что при глубинном культивировании неко-
торых съедобных базидиомицетов характерный грибной аромат отсутствует или
же он значительно отличается от такового в плодовых телах (Eddy, 1958; Musilek
et al., 1969; Ginterova, 1973a). Высказывается предположение (Worgan, 1968),
что в культуральном мицелии высших базидиомицетов отсутствуют специальные
клетки, возможно имеющиеся в плодовых телах, в которых происходит образова-
ние грибного аромата.
Использование методов газовой хроматографии и масс-спектрометрии позво-
лило изолировать вещества, обусловливающие грибной аромат большинства из-
вестных ценных съедобных грибов, установить их химическую структуру и осу-
ществить синтез (Freytag, Ney, 1968; Jasumoto et al., 1974; Wasowicz, 1974; Ду-
дарева. 1975; Dijkstra, 1976; Kurkela, Matikainen, 1978; Pyysalo, 1979; Takama
et al., 1979/1980).
Основным веществом, несущим характерный грибной аромат, является оп-
тически активный спирт (—) 1-октен-З-рл. Очень высокое его содержание обнару-
жено в плодовых телах Pleurotus ostreatus, Agaricus bisporus, Boletus edulis,
Armillariella mellea, CalvaFia glgantea, видах родов Pholiota, Agrocybe. Из плодо-
вых тел Lentinus edodes выделен в кристаллической форме предшественник ос-
новного вещества, несущего грибной запах, названный. пентиновой кислотой
(Jasumoto et al., 1974). Изучена структура кислоты и предложена реакция полу-
чения из этого предшественника ароматоносителя лентинина. У L. edodes важным
фактором запаха является также гуанозин-5-монофосфат (5-ГМФ) и в меньшей
мере аденозин-5-монофосфат (5-АМФ), которые стимулируют запах некоторых
аминокислот, особенно глютаминовой, которая в чистом виде почти не пахнет.
Однако запах L. edodes отличается от традиционного грибного аромата таких гри-
бов, как шампиньон, белый и др.
Й.3юс и Н.Йонкерс (Pat. 2693664, USA) получили патент на способ усиления
грибного аромата в культуральном мицелии. Они предложили выращивать мице-
лий на питательной среде с добавлением лецитиновой эмульсии или любых других
съедобных жиров. Влажный мицелий (90 % воды), отделенный от питательной сре-
ды, рекомендуют смешать с поваренной солью в количестве 2—4 % массы. Смесь
оставляют при температуре 4 °C. После обработки солью в мицелии происходят
ферментативные процессы, способствующие усилению запаха. Максимальное уси-
ление запаха отмечается примерно через 8 сут. Полученный продукт, как отмечают
авторы, не теряет вкуса при хранении и особенно хорош для приготовления гриб-
ной эссенции, супов или соусов. Поваренную соль, по мнению Й.3юса и Н.Йонкер-
са, можно заменить любыми пищевыми солями или компонентами, нарушающими
рост и метаболизм грибного мицелия.
Вещества, придающие грибной аромат плодовым телам и культуральному ми-
целию, одни и те же, хотя количественное содержание их может быть различным
(Dijkstra, 1976). Причем условия культивирования могут способствовать боль-
шему, чем в плодовых телах, накоплению ароматических веществ. Образование
грибного аромата при глубинном культивировании происходит более интенсивно
на комплексных средах, содержащих овощные экстракты, дрожжевой экстракт,
мальц-экстракт и др. (Block, 1960; Moustafa, 1960; Litchfield, 1967; Dijkst-
ra, 1976).
ФДийкстра (Dijkstra, 1976) установил, что большое влияние на образование
ароматических веществ в глубинной культуре оказывает перемешивание, Для
каждого штамма могут быть установлены количественные характеристики. В глу- 31
бинной культуре Coprinus comatus и Agaricus bisporus 1-октен-З-ол образуется
в первые 7 сут роста мицелия. Через 28 сут происходит образование другого аро-
матического кешества, также содержащегося в плодовых телах, а именно 5-ГМФ.
Это соединение, появляющееся, как предполагают, при лизисном распаде РНК,
стимулирует также запах аминокислот, сахаров и некоторых других органических
компонентов, придавая специфический аромат различным видам грибов. Очевид-
но, усиление грибного запаха в процессе автолиза, отмечавшееся Й.Зюсом и Н.Йон-
керсом (Pat. 2693664, USA), связано с образованием в культуральном мицелии
5-ГМФ. Однако такой путь ароматизации культурального мицелия нежелателен
из-за значительной потери биомассы и ухудшения ее питательных свойств.
Таким образом, при глубинном культивировании высших съедобных базидио-
мицетов возможно получать биомассу с интенсивным грибным ароматом. Макси-
мальный урожай ароматной биомассы достигается в течение нескольких суток,
т.е. в период быстрого роста мицелия и максимального содержания в нем белка,
что особенно важно. Осуществленный синтез носителя грибного аромата открыва-
ет возможность пищевого использования также тех быстрорастущих в глубинной
культуре видов съедобных грибов, которые сейчас отвергаются в качест-
ве продуцентов вследствие недостаточно интенсивного запаха культурально-
го мицелия.
1.2.5. Применение глубинного инокулюма для получения плодовых тел
Глубинный мицелий съедобных грибов помимо непосредственного использования
для пищевых и кормовых целей может найти также применение в технологии про-
изводства плодовых тел промышленно культивируемых видов как один из спосо-
бов быстрого получения большого количества посевного мицелия и обеспечения
оптимальных условий роста гриба в вегетативной фазе. Этой проблеме уделяется
все большее внимание исследователями разных стран (Shiio et al., 1974; Zadrazil,
Schliemann. 1974; Zadrazil. 1978).
Использование глубинного инокулюма нашло практическое применение в про-
изводстве плодовых тел Kuehneromyces mutabiiis. В.Лютхард (Luthardt. 1969)
использовал мицелий, выращенный на жидкой среде на качалках, для приготовле-
ния прививочной пасты. Культуральный мицелий использовался не только для
приготовления стерильного инокулируюшего субстрата, но и непосредственно
для инокуляции древесины. По данным Г.Граммса (Gramms. 1978), для инокуля-
ции 10-литрового контейнера с инокулируюшим субстратом требуется 400 мп сус-
пензии мицелиальных шариков культуры Kuehneromyces mutabiiis. вырашенной
на качалке в 500-миллилитровых колбах при 23 “С в течение нескольких суток.
В нашей стране опыты по выращиванию этих видов с использованием прививочной
пасты проводятся в Белоруссии (Федоров, Иванов, 1978) .
Предложено (Zadrazil. Schliemann, 1974; Zadrazil, 1976) использовать мице-
лий, выращенный в ферментерах, для получения плодовых тел Pleurotus ostreatus,
Flammulina velutipes, Agrocybe aegenta.
Возможность использования глубинного мицелия Flammulina velutipes в каче-
стве посевного материала для промышленного получения плодовых тел этого три-'
ба обсуждается в работе ТШиис с соавт. (Shiio et al., 1974). Мицелиальная культу-
ра F.velutipes, выращенная в 40-литровом ферментере, центрифугируется и отмы-
вается. 10 г влажного мицелия помешается на проволочную сетку в 500-миллилит-
ровую колбу со 100 мл среды. Урожайность плодовых тел составляет 500 % в пере-
счете на сухое вещество среды, значительно сокрашается срок плодоношения. По-
лученные результаты позволили сделать вывод о важности и перспективности ис-
пользования глубинной посевной культуры в процессе выращивания в промыш-
ленности плодовых тел съедобных грибов, в частности Flammulina velutipes и
Pleurotus ostreatus, срок культивирования которых сокрашается при этом почти
наполовину, а продуктивность возрастает в 3—4 раза.
Несомненный интерес представляет исследование, в результате которого в чис-
32 1 той культуре с использованием глубинного мицелия были получены плодовые те-
ла Boletus edulis и некоторых других видов родов Boletus, Tricholoma, Lyophyllum
(Oyama et al., 1974).
Таким образом, доказана принципиальная возможность получения плодовых
тел высших базидиомицетов из глубинного мицелия. Это позволяет вести иссле-
дования в направлении использования такого мицелия в качестве посевного ма-
териала в процессе выращивания плодовых тел различных видов съедобных .
грибов.
1.3. Образование в культуре оиологически активных веществ
Одним из важных направлений в исследованиях высших базидиомицетов в куль-
туре является изучение продуцируемых ими биологически активных веществ —
ферментов, антибиотиков, онкостатических веществ и др. Изучение биологически
активных веществ у съедобных грибов специально не проводилось. Данные о нали-
чии их у отдельных видов не систематизированы. Между тем сведения о таких ве-
ществах, особенно у грибов, перспективных в качестве продуцентов пищевого
мицелия, имеют существенное значение для оценки безвредности мицелия или ис-
пользования продуктов ферментации. Изучение биологически активных ве-
ществ у высших базидиомицетов не являлось основной задачей данной ра-
боты, -поэтому мы упомянем лишь наиболее важные работы, ведущиеся в
этом направлении.
Значительные исследования в области биологически активных вешеств бази-
диомицетов выполнены советскими учеными (Низковская, Милова, 1963, 1966;
Маттисон и др., 1965, 1966; Шиврина, 1965; Маттисов, Низковская, 1967; Низ-
ковская, 1969а, б; Биосинтетическая деятельность ..., 1969; Маттисон, Фалина.
1973; Федорова, Шиврина, 1974, 1975; Черотченко, 1977, 1980; Низковская и
др., 1979,1981; Денисова, 1982а, б; Федорова, Дроздова, 1982; и др.).
Большое внимание уделяется изучению антибиотической активности высших
базидиомицетов. Их активность в культуре в основном соответствует таковой
в плодовых телах, а в ряде случаев сильнее проявляется в условиях культуры
(Bose, 1953; Низковская, Милова, 1963; Sasek, Musilek, 1968а, b; Низковская,
19696; Биосинтетическая деятельность ..., 1969; Musilek et al., 1969). На антибио-
тическую активность высших базидиомицетов значительно влияют способ культи-
вирования, состав, питательной среды, возраст культуры, аэрация и другие факто-
ры (Bose, 1953; Sasek, Musilek, 1968а, b; Низковская, 1969а, б; Nerud, Musilek,
1976). Выделены антибиотические вещества и установлена их химическая приро-
да у Agrocybe dura, Coprinus quadrifidus, C. picaceus, Lactarius deliciosus, Maras-
mius ramealis, Clitocybe nebularis, Pleurotus mutilis, P. ostreatus, Sparassis ramosa,
Clitocybe gigantea, Agaricus campestris, A.bisporus, Oudemansiella mucida, Panus
conchatus, Flammulina velutipes и других видов (Низковская, Милова, 1963; Шив-
рина, 1965; Kozova, Rehacek, 1967; Sasek, Musilek, 1968a, b; Низковская, 1969a,
6; Musilek et al., 1969; Cochran, 1978).
ВДЙашек и В.Мусилек (Sasek, Musilek, 1968a), ,М.Я.Зерова с соавт. (1976)
сообщили об антибиотических веществах у Clitopilus prunulus, Rhizopogon roseo-
lus, Russula fragilis, Tricholoma albobrunneum, T. saponaceum, Marasmius alliaceus,
M. prasiosmus. Установлены (Benedict, Brady, 1972; Мелик-Хачатрян, Вартапе-
тян, 1977; Мелик-Хачатрян, 1980) антибиотические свойства отдельных видов ро-
дов Clitocybe, Tricholoma, Pleurotus, Oudemansiella. О-ПЛизковская (19696)
считает, что полученные экспериментальные данные позволяют сделать заключе-
ние, что различные экологические и систематические группы высших Basidiomyce-
tes отличаются характером антибиотического спектра. Образование антибиотиков
более присуще дереворазрушающим базидиомицетам, чем микоризообразующим.
Среди первых свойство образовывать антибиотики в большей мере характерно
для возбудителей бурой гнили древесины.
Многие высшие базидиомицеты в культуре проявляют антифунгальное дейст-
вие, оно отмечено и у съедобных видов: Oudemansiella mucida, О. radicata, Tricho-
loma saponaceum, Rhizopogon roseolus, Clitopilus prunulus, Lactarius helvus, Aga- 33
ricus bisporus, Lentinus edodes и др. (Bohus et ai., 1961; SaSek, Musilek, 1968ай b,
1974; Гарибова, 1968; Низковская, 1969a, 6; Musilek et al., 1969; Зерова и др.,
1976; Мелик-Хачатрян, Вартапетян, 1977; Cochran, 1978; Chaumont, Simeray, 1982).
t Наряду с антибиотической активностью установлены противоопухолевые
свойства плодовых тел и культур некоторых съедобных грибов, например, Boletus
edulis, Calvatia cyathiformis, Collybia radicata, Pleurotus ostreatus, Clitocybe illu-
dens, C. nebularis, Lepista luscina, Tricholoma panaeoluih, Mycena pura, Hygrophorus
hypotheus, Pholiota aurivella, Ph.mutabilis и других видов (Yoshida et al., 1962;
' Beneke, 1963; Низковская, Милова, 1966; Gregory et al., 1966; Ikekawa et al.,
1969; Бухало и др., 1971a; Yoshioka et al., 1972,1973; Lucas et al., 1975; Cochran,
1978). Из некоторых видов съедобных грибов получены противоопухолевые пре-
параты: из Flammulina velutipes — фламмулин, из Lampteromyces japonicus -
ламптерол, из Calvatia gigantea — кальвацин (Yoshida et al., 1962; Beneke, 1963;
Komatsu et al., 1963; Nakanishi et al., 1963; Yoshioka et al., 1973). У съедобных
грибов Boletus frostii, Calvatia gigantea, Chlorophyllum molybdites, Agaricus
campestris, Piptoporus betulinus обнаружена активность против вируса полиомие-
лита, активными против вируса гриппа оказались Boletus edulis, Calvatia gigantea,
Suillus luteus, Lentinus edodes (Cochran, 1978; Hayes, Wright, 1979). Пищевое ис-
пользование таких грибов является хорошей профилактикой против вирусных
инфекций. Экстракт Lentinus edodes индуцирует образование интерферона.
Перспективными для медицинской промышленности и ценным диетическим
продуктом могут оказаться грибы, обладающие гипогликемической активностью,
т.е. способностью понижать холестерин в крови. Такая активность отмечена у Aga-
ricus bisporus, Flammulina velutipes, особенно высока она у Lentinus edodes. У по-
следнего вида установлено активное начало - зритаденин (Cochran, 1978). Экс-
тракты глубинного мицелия Volvariella volvacea обладают гемаглютинирующей
активностью (Banerjee et al., 1982). Ф.Неруд с соавт. исследовали липолитическую
активность у 16 видов высших базидиомицетов (Nerud et aL, 1982).
В последние годы высшие базидиомнцеты особенно интенсивно изучаются с
целью поиска среди них продуцентов ферментов, пригодных для использования
в медицине, пищевой промышленности, сельском хозяйстве и тд. Обнаружены
высшие съедобные базидиомнцеты, перспективные продуценты протеолитических
ферментов (Маттисон и др., 1965; Борисова и др., 1971; Бухало та in., 19716;
Маттисон, Фалина, 1973; Федорова, 1973; Федорова, Шиврина, 1974, 1975; Гаври-
лова, Фалина, 1975; Фалина, 1978; Низковская и др., 1979; Гаврилова и др.,
1980; Денисова, Фалина, 1981; Giovanozzi-Sermanni, Lunna, 1981; Musilek, 1981;
Денисова, 1982а, б, 1984; Дроздова, Белова, Г982; Псурцева, Денисова. 1982;
Федорова, Дроздова, 1982). Н.П Денисова (19826) отмечает, что в настоящее вре-
мя исследована протеолитическая активность почти у тысячи штаммов высших ба-
зидиомицетов. Среди афиллофоральных грибов наиболее полно изучены предста-
вители семейств Polyporaceae и Hymenochaetaceae, среди Agaricales (s.l.) — се-
мейств Tricholomataceae, Strophariaceae и Cortinariaceae. Из Russula decolorans
получен ферментный препарат, обладающий сычужным действием. Из Flammulina
velutipes выделен ферментный препарат с высокой тромболитической актив-
ностью (Денисова, Фалина, 1981). Высокой протеолитической активностью харак-
теризуются виды Panus tigrinus, Pleurotus ostreatus, Armillariella mellea, Lyophyl-
lumiulmarium, Panellus stipticus, Coprinus domesticus, C.cmereus, Lepista luscina,
Fistulina hepatica (Бухало та iH., 1971; Денисова, 19826).
Сведения о целлюлозолитической активности высших базидиомицетов. в том
числе съедобных, имеются в ряде работ отечественных и зарубежных авторов. Так,
В Л.Билан с соавт. (1982) приводят данные о целлюлозолитической активности
разных видов дереворазрушающих грибов, в том числе некоторых видов высших
съедобных базидиомицетов. У высших съедобных базидиомицетов изучалась ак-
тивность ферментов, участвующих в разложении целлюлозо-лигнинового комп-
лекса. Исследовалась ферментативная активность Armillariella mellea, Panus tigri-
nus, Piptoporus betulinus, Laetiporus sulphureus, Lentinus lepideus, видов родов
Pleurotus, Tricholoma, Pholiota и др. (Norkrans, 1950,1967; Lyr, 1956,1964,1965;
34 Starka, JSchanel, 1962; Маттисон, Низковская, 1967; Зарудная, 1971; Федоров,
Бадыль, 1973; Molodtsov et al., 1974; Zadrazil, 1974,1976,1978; Даниляк, Пана-
сенко, 1979; Rose, 1979a; Даниляк, 1980; Ginterova et al., 1980,1981; Афанасье-
ва, Серебренников, 1981; Мельничук, Даниляк, 1981; Низковская и др., 1981;
Musilek, 1981; Giovanozzi-Sermanni, Lunna, 1981; Дроздова, Белова, 1982; Мель-
ничук та iH., 1982; Freer, Detroy, 1982; Высшие съедобные базидиомицеты ...,
1983; Веттер, 1983; Babos, Vetter, 1983; Highley, 1983).
Несмотря на то что исследованию фенолоксидаз уделяется большое внимание,
их биологическая функция все еще не выяснена окончательно. Существует мнение
(Molitoris, 1978), что фенолоксидазы у высших базидиомицетов принимают учас-
тие в следующих процессах: разложении древесины и деградации лигнина; защит-
ном действии против радиации, микробного воздействия; детоксикации ядов при
разложении древесины; плодообразовании; взаимоотношениях гриба и растения-
хозяина; терминальной оксидации. При исследовании в чистой культуре плодовых
тел, мицелия, культуральной жидкости у представителей родов Pleurotus, Paxillus,
Suillus, Omphalopsis, Rhizopogon, Kuehneromyces и др. показано (Bresinsky et al..
1977; Molitoris, 1978; Веттер, 1983), что фенолоксидазы, в частности лакказа, игра-
ют важную роль в деградации нативного лигнина, однако механизм их действия
остается не до конца выясненным. Фенолоксидазы индуцируются соединениями
лигнина и его предшественниками. Существует обратная зависимость между рос-
том грибов и продукцией фенолоксидаз.
Имеющиеся в настоящее время данные об образовании высшими съедобными
базидиомицетами в культуре ферментов, антибиотиков и других биологически
активных веществ свидетельствуют о важности и перспективности проведения
дальнейших исследований в этом направлении. Биологически активные и ценные
химические вещества могут явиться как конечным продуктом при культивирова-
нии мицелия съедобных грибов, так и побочным при промышленном производстве
пищевой биомассы.
*
Таким образом, литературные данные, хотя и очень неполные, позволяют считать,
что в условиях глубинной культуры могут быть достигнуты такие показатели ско-
рости роста, продуктивности, питательной ценности культурального мицелия, ко-
торые дают основание рассматривать высшие съедобные базидиомицеты как по-
тенциальные продуценты пищевой биомассы. В то же время имеющиеся в литера-
туре сведения не дают ответ на вопросы о методах получения чистых культур выс-
ших базидиомицетов, их идентификации, о видовом составе съедобных грибов,
которые могут культивироваться глубинно, физиологии и морфологии роста в
глубинной культуре конкретных видов. Не обоснованы критерии, которым дол-
жен соответствовать высший съедобный базидиомицет — продуцент пищевой
биомассы. Некоторые требования к продуцентам, которые выдвигаются отдель-
ными авторами, основываются на недостоверных или экспериментально не подт-
вержденных данных относительно биологических особенностей культивируемых
видов и влияния на проявление свойств грибов специфических условий куль-
тивирования.
Состояние изученности высших базидиомицетов в чистой культуре и их прак-
тического использования определило основные направления нашего исследования,
положенного в основу данной монографии. Большое внимание уделялось совер-
шенствованию методов выделения в культуру конкретных видов, критической
оценке признаков, использующихся для их идентификации в вегетативной стадии
роста, изучению физиологии выделенных в культуру грибов, подбору питательных
сред для культивирования их в крупных масштабах, разработке принципов селек-
ционного отбора съедобных базидиомицетов.
ГЛАВА 2
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1. Получение чистых культур высших базидиомицетов •
В настоящее время методы выделения высших базидиомицетов в чистую культуру
разработаны недостаточно полно. Изоляция в культуру многих ценных съедобных
грибов представляет значительные трудности, что делает невозможным их исследо-
вание и практическое использование. В связи с этим много внимания уделялось
нами разработке воспроизводимых методов получения чистых культур определен-
ных видов грибов (Бухало, 1966; 19736, 19826) . Мицелиальные культуры выде-
ляли из ткани плодовых тел, базидиоспор, в отдельных случаях из субстратного
мицелия, склероциев, ризоморф и т.д.
Плодовые тела собирали по возможности в период их обильного плодоноше-
ния, отбирали молодые, неповрежденные карпофоры — наиболее подходящий ма-
териал для изолирования тканевой культуры. Грибы собирали в дни, когда не бы-
ло осадков, так как пропитанные водой плодовые тела обычно сильно инфициро-
ваны посторонней микрофлорой. Каждое плодовое тело помешали отдельно в по-
лиэтиленовый мешочек или бумажный конверт и хранили в холодильнике при
температуре 4—10 °C. Если сбор материала в условиях экспедиции длился 2—3 сут,
плодовые тела до выделения тканевой культуры помещали в специальные дере-
вянные ящики, разделенные на ячейки и устланные сухим мхом. Ящики с гриба-
ми хранили в прохладном месте открытыми.
Виды Coprinus, плодовые тела которых быстро расплываются, собирали так:
часть субстрата, пронизанную мицелием, с зачатками плодовых тел подсушивали
на воздухе и. когда позволяло время, инкубировали во влажной камере до обра-
зования плодовых тел.
Плодовые тела гастеромипетов для выделения тканевой культуры собирали,
как правило, молодыми, до побурения глебы. Исключением были виды рода
Scleroderma, у которых и в молодом возрасте глеба темноокрашенная. Виды ро-
дов Cyathus. Crucibulum. Nidularia собирали до разрыва пленчатого покрывала,
закрывающего ’’корзиночки” с перидиолами, а виды Phallus - до разрыва пери-
дия, что обеспечивает стерильность тканевой культуры.
При сборе плодовых тел отмечали важные для идентификации признаки, изме-
няющиеся при высыхании: цвет, запах, консистенцию шляпки, перидия, наличие
чешуек, волосков, покрывала, изменение цвета отдельных частей плодового тела
при разрезании, надавливании и тл. (Бондарцев, Зингер, 1950; Вассер, 1980).
Для сбора спорового материала использовали стерильные бумажные пакеты.
Шляпку плодового тела на несколько часов закладывали в такой пакет пластин-
ками или трубочками книзу и после получения спорового отпечатка удаляли. Па-
кет закрывали и хранили в холодильнике до момента выделения культуры. Анало-
гичным образом споровые отпечатки получали в чашках Петри.
Для выделения культур гастеромицетов из спорового материала собирали как
плодовые тела в молодом возрасте, так и неповрежденные зрелые грибы. В пер-
вом случае плодовые тела сохраняли до потемнения глебы и изменения ее консис-
тенции до порошистой и сухой. Если выделение предполагали проводить из споро-
вой массы не сразу, то плодовые тела высушивали при комнатной температуре
неразрезанными и хранили завернутыми в чистую бумагу.
Когда культуры высших базидиомицетов выделяли из субстратов (почвы,
древесины, растений), их образцы, пронизанные мицелием, помещали в стериль-
ные бумажные пакеты, пробирки или чашки Петри и хранили в холодильнике при
температуре 4—10 °C обычно несколько суток. Почвенные образцы отбирали по
общепринятой методике (Кириленко, 1982).
Выделение мицелиальных культур из плодовых тел. С поверхности шляпки и
ножки плодового тела, предназначенного для выделения культуры, скальпелем
удаляли прилипшие растительные остатки, частички почвы. Если плодовые тела
36 были не очень гигроскопичны, их быстро промывали сначала в проточной, а затем
в стерильной воде и сушили на чистой фильтровальной бумаге. Так обрабатывали
молодые плодовые тела грибов родов Agaricus, Boletus, Tricholoma, Clitocybe,
Leccinum, Paxillus, Tricholomopsis, Polyporus, Lycoperdon, Calvatia, Bovista,
Scleroderma и других с аналогичным габитусом и консистенцией. Чтобы плодовые
тела не напитались водой у более старых экземпляров, а также у слизистых карпо-
форов видов родов Collybia, Laccaria, Marasmius, Oudemansiella и др., после меха-
нической очистки плодовое тело обтирали горящей ватой, предварительно обильно
смоченной этиловым спиртом, или обжигали его над пламенем горелки.
Подготовленное одним из описанных выше способов плодовое тело помещали
вблизи горелки, разламывали. Кусочек ткани из внутренней части, не соприкасаю-
щейся с поверхностными участками, стерильным скальпелем или копьем перено-
сили в чашку Петри на фильтровальную бумагу или хорошо застывшую поверх-
ность агаризованной питательной среды. Размер тканевого инокулята достаточно
большой: 0,3—1,5 см в диаметре. Если плодовое тело слишком маленькое и из не-
го невозможно извлечь стерильную ткань, его быстро обжигали над пламенем го-
релки, а затем нарезали ножницами или пинцетом прямо над открытой чашкой
Петри с питательной средой. Такой метод выделения испольЗоваЛи для получения
культур видов родов Marasmius и Laccaria. . *.
Студенистые плодовые тела Hirneola auricula-judae с неровной и обычно инфи-
цированной поверхностью протирали спиртом и мелко нарезали. Однако сильное
загрязнение, как правило, препятствовало успешному выделению культуры это-
го гриба,
У грибов с крупными плодовыми телами, мясистой ножкой и шляпкой изоли-
ты брали из разных мест: шляпки, ножки, места перехода шляпки в ножку, гиме-
нофора. Наиболее успешно изоляция происходила у грибов с достаточно толстой
ножкой, например Boletus edulis и некоторых других болетальных, если для ино-
кулята брали крупные кусочки ткани из основания ножки.
Хорошие результаты получены нами при выделении культур из гименофора
молодых плодовых тел видов родов Agaricus, Armillariella, Suillus, Pholiota.
Coprinus, еще закрытых покрывалом. Из более зрелых плодовых тел, гименофор
которых значительно инфицирован, инокулят выделяли только на границе гиме-
ниального слоя и мякоти шляпки. Аналогично поступали с плодовыми телами,
у которых гименофор закладывается открыто.
Для выделения в культуру Asterophora lycoperdoides использовали хламидо-
споры, располагающиеся в виде толстого порошистого слоя на шляпке. Они про-
растали в течение нескольких суток.
Мицелиальные культуры гастеромицетов родов Lycoperdon, Calvatia, Bovista.
Scleroderma получали из молодых карпофоров, предварительно простерилизован-
ных этиловым спиртом.
Культуры Phallus impudicus выделяли на стадии ’’яйца”, когда плодовое тело
еще окружено слоем слизи и заключено в плотный перидий. Для инокулята ис-
пользовали кусочки глебы или другой стерильной ткани. При выделении в культу-
ру Cyathus striatus и C.olla инокулятом служили перидиоли из молодых плодовых
тел с неразорванным перидием.
Существенных различий в морфологии колонии и скорости роста мицелия
у изолятов из разных частей плодового тела не отмечено.
Выделение культур производили обычно на плотную среду: сусловый или кар-
тофельно-глюкозный агар. Если выделение шло плохо и мицелий не образовывал
колонии вокруг инокулированной ткани, в состав среды добавляли дрожжевой
автолизат, отвар дубовой коры или листьев растений (крапивы, клевера) в коли-
честве 0,1—0,5 %, водные экстракты из плодовых тел грибов. Для предотвращения
бактериального загрязнения культур использовали подкисленную среду (pH 4,0—
5,0) или среду с добавлением 100—200 ЕД/мл пенициллина и стрептомицина.
Как только молодой мицелий начинал расти на поверхности агаризованной
среды, его вместе с кусочком этой среды переносили в пробирку с питательным
агаром для дальнейшего роста. При необходимости делали несколько пассажей
на среде, содержащей антибиотики. При выделении из инфицированных кар-
пофоров, использовали (Watling, 1971) метод перевернутого агара.
37
Если обрастание тканевого инокулята происходило плохо, например у некото-
рых видов родов Boletus, Suillus, Russula, Lactarius и других, то кусочек карпофо-
ра помешали на несколько дней в чашку Петри на влажную фильтровальную бума-
гу, используя метод накопительной культуры (Пидопличко, 1953). После того,
как на поверхности тканевого изолята появлялся пушок растущих гиф, изолят
переносили на питательную среду.
Чтобы избежать переноса инфекции с одного тканевого изолята на другой,
вместо обычных чашек Петри диаметром 9—11 см использовали чашки для ткане-
вых культур диаметром 4—5 см, куда помешали лишь один изолят. Если рост ми-
целия начинался поздно, инокулят помещали в пробирку с достаточным количест-
вом питательной среды, что сохраняло в течение длительного времени необходи-
мую влажность воздуха и среды.
В полевых условиях, когда из-за большого риска загрязнения и подсыхания
питательной среды невозможно было проводать выделение в чашках Петри, тка-
невой изолят сразу помешали в небольшие пробирки на агаризованное сусло
с антибиотиком.
В жаркое время года тканевой изолят на 1—2 сут помещали в холодильник
при температуре 5—10 °C, а затем переносили в термостат. Это способствовало
успешному выделению в культуру видов родов Boletus, Suillus, Tricholoma и
других, рост которых угнетался при температуре выше 28 °C.
Легко выделяются в культуру из тканевых изолятов плодовых тел Pleurotus
ostreatus, Р. dryinus, Panus tigrinus, Coprinus comat us, Armillariella mellea, Lepista
mfda, Clitocybe nebularis, Macrolepiota procera, Pholiota squarrosa, Polyporus squaxno-
sus, Lycoperdon perlatum, Calvatia excipulifornris, Cyathus olla, C.striatus и др.
Некоторые виды медленно образуют мицелиальную колонию при выделении
из тканевого изолята и начинают расти быстрее, лишь адаптировавшись к питатель-
ной среде, после нескольких пассажей. К ним относятся Suillus hiteus, S. granula-
tus, Boletus edulis, B. erythropus, Agaricus siivaticus, Xerocomus badius. Tricholo-
ma flavovirens, Paxillus involutus, P. atramentarius, Amanita rubescens, Amuscaria,
Langermannia gigantea и др.
В ряде случаев не наблюдалось даже обрастания тканевого инокулята гифами
воздушного мицелия, хотя загрязнения посторонней микрофлорой не отмечалось.
Наиболее показательным примером может служить ценный съедобный гриб Сап-
tharellus cibarius, обычно обильно плодоносящий в естественных условиях. Мы
собирали его на протяжении многих лет в различных ботанико-географических
районах Украины и других регионах СССР, но так и не смогли выделить в культу-
ру. Не были выделены в культуру, несмотря на наши неоднократные попытки,
также Lactarius torminosus, L. deliciosus, L. rufus, L. n ecat or, Russula delica,
R.vesca, R.virescens и некоторые другие виды, хотя выделение их проводили на
питательной среде с витаминами, растительными стимуляторами, использовали
влажную камеру и охлаждение.
Метод выделения мицелиальных культур из базидиоспор использовался для
получения чистых культур копротрофов, лигнотрофов, подстилочных сапротро-
фов и грибов некоторых других экологических групп, для которых характерно
быстрое прорастание базидиоспор.
Для проращивания мы использовали, как правило, свежий споровый материал
и лишь в отдельных случаях выделение проводили из спор, хранившихся при тем-
пературе 5—10 °C от нескольких суток до нескольких месяцев. Для проращивания
базидиоспор из свежих плодовых тел использовали метод, предложенный Н.Фри-
зом (Fries, 1950). Шляпка плодового тела гриба, собранного в день выделения
или 1—2 сут хранившегося в холодильнике, отрезалась от ножки и с помощью
вазелина прикреплялась под крышку пустой стерильной чашки Петри. Агаровая
среда разливалась в другие чашки, крышки которых поочередно на 5 мин заменя-
лись крышкой с плодовым телом. За это время в чашку успевают попасть от не-
скольких сотен до нескольких тысяч базидиоспор. Если плодовые тела малы, то
их шляпки прикреплялись не в центре крышки, а по периферии и крышку враща-
ли вокруг оси так, чтобы споры из шляпки попадали на разные участки поверхнос-
38 ти среды. Этот же метод оказался очень удобным при выделении в культуру выс-
ших базидиомицетов в полевых условиях. Кусочек шляпки или если это малень-
кое плодовое тело, то целая шляпка, предварительно протертые этиловым спир-
том, иглой, булавкой или энтомологической иглой, прикалывали к пробке про-
бирки так, чтобы споры’с гименофора падали на скошенную поверхность агаризо-
ванной среды. Через несколько часов булавку со шляпкой стерильно удаляли,
пробирку закрывали этой же пробкой и хранили при комнатной температуре.
Споры обычно вскоре прорастали и через 2-4 недели образовывалась хорошо
развитая дикариотическая мицелиальная колония. Этот метод оправдал себя во
время продолжительных экспедиций при выделении видов родов Agaricus, Colly-
bia, Marasmius, Fiammulina, Oudemansiella и др.
Для проращивания базидиоспор споровую суспензию сеяли на агаризованную
питательную среду поверхностно или глубинно. Концентрацию спор, оптимальную
для прорастания, определяли в каждом конкретном случае, так как она не была
постоянной для отдельных видов и даже плодовых тел. Процент прорастания спор,
как правило, невелик и у некоторых видов не превышает 0,001. Прорастание ба-
зидиоспор наблюдали под микроскопом, проросшие базидиоспоры переносили в
чашки Петри или пробирки с питательной средой. Для выделения культур из ба-
зидиоспор обычно использовали сусло-агар (4° по Баллингу) и картофельно-глю-
козный агар. На этих средах без внесения каких-либо дополнительных стимулято-
ров прорастали споры Fiammulina velutipes, Panus tigrinus, Oudemansiella brun-
neomarginata, видов родов Pleurotus, Coprinus, Pholiota, Agaricus. Если проращи-
вание базидиоспор проводилось из плодовых тел, произрастающих в природе, то
в среду добавляли антибиотики. Для сохранения высокой влажности в чашках
Петри их заклеивали лейкопластырем.
При выделении культур часто происходит загрязнение другими мицелиальны-
ми грибами, среди которых обычно встречаются представители родов Penicillium,
Aspergillus, Fusarium, Trichoderma, Chaetomium, Mucor и др. Избавиться от гриб-
ного загрязнения в ряде случаев не удавалось даже при многократных пассажах.
Нами и в работах некоторых авторов (Watling, 1971; Hale, Savory, 1976) показа-
но, что дереворазрушающие базидиомицеты могут использовать некоторые фе-
нольные соединения, токсичные как для бактерий, так и для других грибов. При
выделении культур высших базидиомицетов как эффективное средство, ингиби-
рующее рост некоторых гифомицетов-контаминантов, могут быть использованы
фунгициды — беномия и фундозол. На сусло-агаре с добавлением разного коли-
чества они оказывают на грибы различное действие. Беномил, фундазол не инги-
бируют Marasmius alliaceus, Crinipellis chevczenkovi. Рост Pleurotus ostreatus и
Fiammulina velutipes при внесении как беномила, так и фундазола в количестве
10—25 мг/л не отличается от контроля и несколько замедляется при концентрации
фунгицидов 50 мг/л. Более чувствительным к действию испытанных фунгицидов
оказался Panus tigrinus, для которого хороший рост отмечен на среде с беноми-
лом в концентрации 10 мг/л и слабый — 50 мг/л. Испытанные фунгициды пол-
ностью подавляют рост одного из наиболее быстрорастущих и часто встречающих-
ся грибов-контаминантов Trichoderma lignorum. При концентрации 25—50 мг/л
фундазола не росли также Aspergillus niger и Fusarium oxysporum. Беномил
в меньшей мере, чем фундазол, ингибирует рост Aspergillus niger. Оба фунгици-
да не оказывают отрицательного воздействия на испытанный штамм Rhizopus
nigricans.
Выделение из субстратов. Органы полового спороношения, т.е. плодовые те-
ла, у высших съедобных базидиомицетов образуются, как правило, на протяжении
непродолжительного периода их жизненного цикла. В природе эти грибы, кроме
видов афиллофоральных грибов с многолетними плодовыми телами, существуют
преимущественно в форме вегетативного мицелия, развивающегося в различных
субстратах — почве, живой и мертвой древесине, растительных остатках, на корнях
высших растений и тд. Споры высших базидиомицетов обнаруживаются в воздухе
и воде (Инголд, 1957).
При изучении микофлоры почв с применением метода разведения обычно изо-
лируются стерильные мицелиальные формы. Только незначительное количество
изолированных таким методом культур из почв рисовых полей можно отнести
39
к базидиомицетам (Бухало, 1984). Из исследованных нами 190 культур crepWib-
ных мицелиальных форм, выделенных из почв, лишь 12 были отнесены к базидио-
мицетам по наличию пряжек на мицелии. Дж.Воркап (Warcup, 1959) использовал
метод непосредственного изолирования из почвы гиф и ризоморф базидиомице-
тов. Однако метод, который он применил, также не позволяет достаточно полно
выделить виды высших базидиомицетов, обитающие в почве, и установить их ви-
довую принадлежность. Из 170 культур грибов, выделенных Дж.Воркапом, 32 бы-
ли отнесены им к базидиомицетам и только 6 из них были идентифицированы,
до вида.
Для выделения культур высших базидиомицетов из живой и мертвой древе-
сины, растительных остатков, лесной подстилки обычно используется метод нако-
пительной культуры (Рипачек. 1967: Бухало, 19826). Кусочки субстрата, прони-
занные грибнипей, помешают на влажную стерильную фильтровальную бумагу
в чашки Петри, изолируют развивающийся на субстрате воздушный мицелий.
В литературе достаточно полно описаны методы выделения культур микори-
зообразующих высших базидиомицетов из корней высших растений (Шемахано-
ва, 1962; Мозер, 1963; Harley, Smith; 1983). Это трудоемкие методы. Ош осно-
ваны на тщательной механической очистке и многократном отмывании корней
растений. Их кусочки затем помещаются во влажную камеру или на различные
питательные среды, которые обеспечивают рост мицелия грибов, образующих
микоризу.
Можно констатировать, что практикуемое при специальных исследованиях
изолирование культур высших базидиомицетов из субстратов из-за несовершенст-
ва методов выделения часто не дает возможности достаточно полно выявить и ус-
тановить видовой состав грибов этой систематической группы, обитающих в ис-
следующихся субстратах. Значительным препятствием при идентификации выде-
ленных культур является то, что большинство мицелиальных изолятов не образу-
ют плодовых тел.
Культуры хранили в холодильнике в пробирках с 20 см3 питательной среды,
чтобы избежать высыхания. Проводился периодический пересев культур на агари-
зованном пивном сусле (pH 4.5—5,0 и 7,0; сахаристость 8° поБаллингу) один раз
в 10—11 месяцев. Культуры некоторых видов болетальных сохраняли наагаризо-
ванном пивном сусле с добавлением отвара дубовой коры.
Рост многих культур на картофельно-глюкозной среде, особенно на морков-
ном и хлебном агаре, которые испытывали в начале наших исследований как воз-
можные среды для хранения музейных культур, как правило, был хуже, а некото-
рые культуры на этих средах погибали. При пересеве культур проводили их мик-
робиологический контроль.
2.2. Краткая характеристика исследованных культур
Исследовались культуры высших базидиомицетов из коллекции отдела миколо-
гии Института ботаники им.Н.Г.Холодного АН УССР. Для расположения материала
использовали системы Г.Крайзеля (Kreisel, 1969) — для агарикальных, АЛилата
(Pilat, 1958) — для гастеромипетов, МДонка (Donk, 1964) — для афилло-
форальных.
Всего исследовано 119 видов (219 штаммов), относящихся к 56 родам, 24 се-
мействам, 10 порядкам высших базидиомицетов.
Выделение в культуру проводили с 1964 г. в окрестностях Киева, а также во
время экспедиционных выездов в 1976-1978 гг. в Киевскую, Житомирскую, Ро-
венскую, Волынскую, Львовскую, Закарпатскую, Тернопольскую, Хмельницкую,
Черниговскую, Сумскую, Черкасскую, Харьковскую, Полтавскую, Донецкую,
Ворошиловградскую, Запорожскую, Крымскую области УССР. В 1980 г. выделе-
ны культуры съедобных грибов в Алтайском и Приморском краях (РСФСР). От-
дельные культуры — из образцов, собранных в других регионах Советского Союза.
Часть культур получена в порядке обмена из лаборатории биохимии грибов
40 Ботанического института им.ВЛКомарова АН СССР (Ленинград), Всесоюзной
коллекции типовых культур микроорганизмов, Института биохимии и физиоло-
гии микроорганизмов АН СССР (Москва), Института леса Карельского филиала
АН СССР (Петрозаводск), отдела экспериментальной микологии Микробиологи-
ческого института ЧСАН- (ЧССР, Прага), Лесного института в Эберсвальде Сельхоз-
академии ГДР, Естественно-исторического музея ВНР (Будапешт).
Ниже приводится список исследованных культур высших базидиомицетов с
указанием номера культуры в коллекции; шифр коллекции ”ИБК” (Институт
ботаники им.Н.ГКолодного, Киев) опушен:
Auricuiariales Schroet
Auriculariaceae Ft.
Hirneola auricula-judae (Bull.: St-Amans) Berk. 733
Aphyllophorales Cda
Corticiaceae Herter
Peniophora gigantea (Fr.) Mass. 333
Hymenochaetaceae Donk. em Parm.
Phellinus igniarius (L.) Quel. 720
Phellinus tremulae (Bond.) Bond, et Boriss. 332
Polyporaceae Cda
Coriolus zonatus (Fr.) Quel. 301,320
Gloeophyllum sepiarium (Fr.) Karst. 305, 325, 326
Laetiporus sulphureus (Bull.: Fr.) Bond, et Sing. 306, 307, 308
Piptoporus betulinis (Bull.: Fr.) Karst. 303, 327
Poiyporus squamosus Huds.: Fr. 309, 311
Schizophyllaceae Roze
Schizophyllwn commune Fr.: Fr. 96,97.
Fistulinaceae Lotay
Fistuhna hepatica Schaeff.: Fr.
Sparassisaceae
Sparassis crispa Fr.: Wulf. 304, 312, 314
Boletales Gflb.
Boletaceae Chev.
Boletus edulis Bull.: Fr. 602, 604
B.erythropus (Fr.: Fr.) Seer. 605
B. impolitus Fr. 606
Suillus bovinus (L.: Fr.) O.Kuntze 610,611,614
S. granulatus (L.: Fr.) O.Kuntze 608
S. grevillei (Klotzsch) Sing. 617
S. luteus (L.: Fr.) S.F.Gray 601,612, 721
S. sibiricus Sing. 627
S. variegatus (Sow.: Fr.) O.Kuntze 613,615
Xerocomus chrysenteron (Bull.: St-Amans) Qudl. 625
Paxillaceae R. Mre apud R.Mre, Dumee et Lutz
Paxillus acheruntius (Humb.: Fr.) Schroet. 115
Agaricales Clem.
Pleurotaceae Over.
Pleurotus abalonus Han, Chen et Cheng 221
P. calyptratus (Lindbl. in Fr.) Sacc. 189
P. columbinus Quel. apud. Bres. 128
P. comucopiae (Paul.: Pers.) Roll. 82, 88,106,187.
P. cystidiosus O.K.Miller 190
P. dryinus (Pers.: Fr.) Kumm. 197, 207
P. eryngii: (DC.: Fr.) Qu61.10
P. florida Fowose 89
P. lignatibus (Pers: Fr.) Kumm. 722
P. ostreatus (Jacq.: Fr.) Kumm. 69, 91-94, 98,102,107-110,132,134,169,170,171,
198,1300
P. pulmonarius (Fr.) Qu61. Ill, 230
P. salignus (Fr.) Kumm. s. Romagn. 181,182
Panus conchatus (Bull.: Fr.) Fr. 81,135
P. tigrinus (Bull.: Fr.) Sing. 83,131, 201
Lentinus edodes (Berk.) Sing. 57
L. lepideus (Fr.: Fr.) Fr. 66
Tricholomataceae Roze ex Over.
Asterophora lycoperdoides (Bull.) Ditm.: S J .Gray 257
Gerronema josserandi Sing. 196
Laccaria amethystine (Fr.) Mun. 121
L. laccata (Scop.: Fr.) Berk, et Br. 120
Calocybe gambose (Fr.) Donk. 736
Clitocybe clavipes (Fr.) Kumm. 152,159
C. gigantea (Fr.: Sow.) Quel. 7
C. nebularis (Fr.) Kumm. 42,43
C. odora (Fr.) Kumm. 45
Tricholomopsis rutilans (Fr.) Sing. 101
T. sulphureoides (Peck) Sing. 195
Tricholoma flavovirens (Pers.: Fr.) Lund, et Nannf. 723
T. focale (Fr.) Ricken 99 , . 41
42
T. imbricatum (Fr.)*Kumm. 100,148
Lyophytlum ulmarium (Fr.) Kuhn. 67
Armillariella mellea (Vahl.: Fr.) Karst. 32,40,41,724, 735,742, 745
Panellus serotinus (Pers.: Fr.) Kuhn. 252
Oudemansiella brunneomarginata L.Vass. 260
O. mucida (Fr.) Hoehn. 223~. 226
O. radicata (Rehl.: Fr.) Berk. 80,222
Flammulina velutipes (Curt.: Fr.) Sing. 9; 29, 50, 52—54, 261,112 i
MarasmiusaHiaceus(Jacq.: Fr.) Fr. 77
M. androsaceus (L. : Fr.) Fr. 136
M. oreades (Bolt. : Fr.) Fr. 76
M. scorodonius (Fr.) Fr. 78,116
Crinipellis schevczenkovi Buchalo 31
Lepista luscina (Fr.: Fr.) Sing. 64
L. nuda (Bull.: Fr.) Cke 61, 62, 63,149,179
Entolomataceae Roze
Clitopiius prunulus (Scop.: Fr.) Kumm. 46,178
Amanitaceae Heim
Amanita rubescens (Pers.: Fr) S.F.Gray 38, 731
Pluteus cervinus (Schaef.: Fr.) Kumm. 251
Agaricaceae (Fr.) Cohn
Agaricus arvensis Schaeff.: Seer. 14,15,16
A.bernardiiformis Bohus 156
A. bisporus (J.Lge) Imbach 18,19, 20, 21-, 22,23, 739, 740
A. bitorquis (Qu61.) Sacc. 143
A. campestris L.: Fr. 144
A. cupreobrunneus (J. Schaeff. et Steer) Pil. 730
A. ftssuratus (Moell.) Moell. 208
A. hortensis (Cke) Pil. 36
A. macrocarpus (Moell.) Moell. 150
A. maskae Pil. 157
A. squamuliferus (Moell.) Pil. 158
A. silvaticus Schaeff.: Seer. 1, 37
A. silvicola (Vitt.) Sacc. 17
A. subperonatus (Vitt.) Mos. 216
Macrolepiota procera (Scop.: Fr.) Sing. 68, 72, 74, 75, 725
M. puellaris (Fr.) Mos. upud Grams 255
M. rhacodes (Vitt.) Sing. 209, 250
Leucocoprinus bresadolae (Schulz.) S.Wasser 160
Coprinaceae Rose ex Over.
Coprinus comatus (Mull.: Fr.) S.F.Gray 47,48
C. cinereus (Schaeff.: Fr.) S.F.Gray 199, 200
C. ephemeras (Bull.: Fr) Fr.8
C. micaceus (Bull.: Fr) Fr.728
Montagnea arenaria (DC.) Zeller 234
Bilbitiaceae Sing.
Agrocybe aegerita (Brig.) Sing. 12,167
Strophariaceae Sing, et A.H.Sm,
Stropharia rugoso-annulata Farl. ex Mun. 140,141, 258
Hypholoma fasciculare (Fr.) Kumm. 56
Pholiota adiposa (Fr.) Kumm. 85, 86, 741
Ph. aurivella (Fr.) Kumm. 84,146
Ph. narrieko (T. Ito) S.Ito et Imai 105
Ph. squarrosa (Fr.) Kumm. 87
Kuehneromyces mutabilis . (Fr.) Sing, et A.H.Sm. 58,122
Russulales Kreis.
Russulaceae Roze
Russula decolorans (Fr.) Fr. 95,138
R. grisea (Pers: Seer.) Fr. 125
Lactarius deliciosus (L.: Fr.) S.F.Gray 151 ’
L. helvus (Fr.) Fr. 60
L. necator (Bull, em Pers.: Fr.) Karst. 119
PhaDales Bessey
Phallaceae E.Fisch.
Phallus impudicus L.: Pers. 421,422
Clathraceae E.Fisch
Anthurus archeri (Berk.) E.Fisch 427
Rhizopogonales Kreis.
Rhizopogonaceae Dodge
Rhizopogon roseolus (Cda) Th.M.Fr. 423
Rh. luteolus Fr.: Nordth. 424
Lycoperdaies Piiat
Ly coperdaceae Cda
Calvaria utriformis (Bud.: Pers.) OJaap. 402, 726
C. exapuliformis (Pers.) Perd. 727,407
Langermannia gigantea (Batsch : Pers.) Rost. 732
Lycoperdon periatum Pers. 403,406,412,413,416
L. pyrifonne Schaeff.: Pers. 414,415 I
Sderodermatales Pilat
Sclerodermataceae E.Fisch :
Scleroderma citrinum Pen. 425
Nidubriales Pilat ,
Nidulariaceae Fr.
Cyathus olla Batsch: Pen. 411
C. striatus Pers.: Pen. 409
2.3. Методы лабораторных исследований
Микробиологические методы, применявшиеся при выполнении данного исследова-
ния, являются общепринятыми при работе с чистыми культурами непатогенных
микроорганизмов, в том числе мицелиальных грибов (Мейнелл, Мейнелл,1967;
Кашкин, Блинов, 1968; Методы экспериментальной микологии, 1982).
2.3.1. Культивирование на агаризованных
и жидких питательных средах
Исследование роста и морфологии чистых культур высших базидиомицетов про-
водили на агаризованных питательных средах разного состава. Культуры, кроме
специальных опытов, инкубировались при температуре 26—28 °C.
В качестве стандартной питательной среды использовали агаризованное пивное
сусло (Пидопличко, 1953). Рост культур исследовали также на картофельно-глю-
козной среде (Пидопличко, 1953) и среде Норкранс (Norkrans, 1953).
Культуру гриба инокулировали на агар в центр чашки Петри. Повторность
опытов 3-4-кратная. Каждые 2—3 сут в течение 30 сут измеряли диаметр колонии
в 3 направлениях, а также высоту колонии (мм). Отмечали плотность колонии
по трехбалльной системе (1 — редкая, 2 — средняя, 3 — плотная). На основании
полученных данных вычисляли ростовой коэффициент (РК) по предложенной
нами формуле: dftg
РК =-----,
t
где d — диаметр колонии, мм; h — высота колонии, мм; g — плотность колонии,
балл; t — возраст колонии, сут.
При исследовании роста культур при разных температурах в качестве пита-
тельной среды использовали агаризованное пивное сусло. Инокулированные мице-
лиальной культурой чашки Петри помещали в термостат при температуре 22, 28,
37 и 42 °C, а также в холодильник при 4—5 °C. Рост оценивали так же, как при
изучении роста культур на питательных средах разного состава.
Исследование питательных потребностей культур на жидких синтетических
средах. Изучали влияние различных источников углерода й азота на культуры гри-
бов. Для этого их выращивали поверхностно в 100-миллиметровых колбах Эрлен-
мейера, в которые наливали по 30 мл питательной среды, и глубинно на качалке
в пробирках с 10 мл среды. Опыты проводили в 5—10-кратной повторности. Для
определения отношения культур к источнику углерода использовали питательную
среду следующего состава (г): источник углерода - эквивалентно 20 г глюкозы,
NH4NO3 - 3; КН2РО4 - 1; К2НРО4 - 1; MgSO4-7H2O - 0,5; FeSO4-7H2O-
0,005; ZnSO4*7H2O — 0,005; CuSO4 —0,003; MnSO4’4H2O — 0,005; тиамин-хло-
рид — 300 мкг; Н2ОдиСТ — 1000. Целлюлозу добавляли в среду в виде толченой
фильтровальной бумаги, жидкий парафин (температура плавления 26—28 °C) —
по 1 мл в каждую колбу, pH среды доводили до нужной величины с помощью
1 н. NaOH или НС1. Соотношение С : N было 8:1.
Для определения отношения исследовавшихся видов к источникам азота ис-
пользовали питательную среду, содержащую 15 г глюкозы, источник азота — эк-
вивалентно 2 г NaNOj. Остальные компоненты те же, что в приведенной выше
питательной среде, использовавшейся при изучении углеродного питания.
Засев проводили суспензией мицелия, выращенного поверхностно на життк-пм
(4° по Баллингу) сусле в 250 мл колбах Эрленмейера с фарфоровыми бусами. 43
В колбы наливали по 50 мл среды. Когда мицелий образовывал пленку,его 3—4фа-
за промывали стерильной дистиллированной водой, измельчали путем встряхива-
ния и в каждую колбу вносили по 2 мл суспензии. Культивировали на пробироч-
ной качалке. В каждую пробирку вносили 2 мл инокулюма, приготовленного опи-
‘ санным выше способом. По окончании опыта измеряли значение pH среды и учи-
тывали сухую массу мицелия.
___Для определения отношения исследовавшихся культур к источникам мине-
рального питания использовали те же питательные среды с оптимальным содержа-
нием С и N для каждого вида, которое устанавливали предварительно.
Оптимальное значение pH среды определяли на той же питательной среде, что
и при изучении углеродного питания. Источником углерода служила глюкоза.
Для создания необходимого pH среды, который измеряли на потенциометре до и
после стерилизации, добавляли 1 %-ный раствор NaOH и НС1. Эту же питательную
среду использовали при изучении потребностей в витаминах и стимуляторах.
Витамин Bj (тиамин) вносили асептически в количестве 300 мкг/л после
стерилизации.
Отвары растений готовили следующим образом: 1,5 кг зеленой массы залива-
ли 6 л воды, кипятили 30 мин, настаивали в течение суток, отфильтровывали
и стерилизовали при 50,662 кПа (0,5 атм). Оптимальную концентрацию в каждом
конкретном случае подбирали эмпирически.
Питательная среда для глубинного культивирования Pleurotus ostreatus
1300 с отваром красного клевера (г): сахароза — 30; пептон — 3; КН2РО4 — 2;
КС! — 1,2; MgSO4-7H2O — 0,25; отвар клевера — 100 мл; агар —0,1; Н2О — 1 л;
pH 6,0.
Первично штаммы, активнорастушие в глубинной культуре, отбирали на
комплексных питательных средах. В качестве универсальной питательной среды,
служившей контролем в ряде опытов, использовали пивное сусло, разведенное
водой до содержания углеводов 2,0±0,2 %, что соответствует 8 сахаристости по
Баллингу. Такой же отбор проводили на комплексных питательных средах, где
в качестве основного источника углерода использовали свекловичную мелассу,
картофельную муку, крахмал, концентрат картофельного сока (ККС) с содержа-
нием сухих веществ 40.0±2,0 %, послеспиртовую барду, молочную сыворотку,
сульфитные щелока, автолизат синезеленых водорослей. Для комплексных сред
использовали следующую минеральную основу (г/л) : (NH4)2SO4 — 3,0,КН2РО4 —
1,2, MgSO4-7H2O — 0,25, NaCl - 0,05, прокипяченная и отфильтрованная водо-
проводная вода 1 л, pH среды 6,0.
Как стимулирующие добавки в ряде случаев использовали отвары кормовых
растений, крапивы, дубовой коры, дрожжевой экстракт (ДЭ), кукурузный экст-
ракт (КЭ) и ККС в количестве 1,0 и 0,1 %.
Глубинное культивирование в лабораторных условиях проводили на жидких
питательных средах на круговых качалках при 180—220 об/мин. Соотношение
жидкой и воздушной фаз во встряхиваемых сосудах составляло 1:10, Отобранные
штаммы культивировали в лабораторных ферментерах ’’АНКУМ-2” с рабочим
объемом 1,8 л. Некоторые ферментации были проведены в ферментерах ’’Biotec”
с рабочим объемом среды 6 л и ’’Gallencamp” — 3 л. Для инокуляции ферментеров
использовали 5-суточный глубинный мицелий (10 % объема), выращенный в кол-
, бах на качалке и стерильно измельченный в дезинтеграторе. Во время ферментации
осуществляли контроль за основными параметрами: накоплением биомассы, рас-
ходом компонентов и изменением pH питательной среды, содержанием в
культуральной жидкости метаболитов, аэрацией, скоростью перемешивания,
температурой.
Опытно-промышленное глубинное культивирование штаммов Pleurotus ost-
reatus 1300 и Panus tigrinus 131 осуществляли в ферментерах емкостью 100,140 л,
3 м3, перемешивание — барботажем воздуха, инокулюм — 10 % объема. Получен-
ная биомасса промывалась водой и сушилась при температуре 60 °C на
ленто’вюй сушилке, в вакуумной сушилке, сушильных шкафах специаль-
441 ной конструкции.
2.3.2. Анализ биомассы и культуральных жидкостей
В зависимости от целей экспериментов биомассу учитывали и анализировали пос-
ле различного времени культивирования. При изучении динамики роста — каждые
4—6 ч, в других случаях — на 3, 5, 7,10-е с^тки культивирования. Химически ана-
лизировали мицелий, высушенный при 60 ЬС. Полученные результаты пересчиты-
вали на абсолютно сухую массу. Последнюю определяли после высушивания об-
разцов промытого мицелия в откалиброванных стеклянных флаконах при 105 С
(Кашкин и др., 1968).
Удельную скорость роста (дтах) рассчитывали по формуле
_ 2,3 (Igm, - lgm0) i
Mm ах : ~ 4 1
* 1 *0
где т0 и т i — концентрации биомассы, соответствующие времени Го и ti — экспо-
ненциальной фазы роста.
Экономический коэффициент (У) рассчитывали по источнику углерода на ос-
новании данных определения абсолютно сухой массы мицелия и редуцирующих
веществ в культуральной жидкости по формуле (Перт, 1978)
где X — урожай биомассы, г/л; So и S — начальное и конечное содержание редуци-
рующих веществ (РВ) в культуральной жидкости, г/л. РВ в культуральной жид-
кости определяли в пересчете на глюкозу без гидролиза и после 5-часового кислот-
ного гидролиза эбулиобтатическим методом (Агеева, Корольков, 1953).
Общий азот в образцах биомассы определяли по методу Кьельдаля (Сказкин
и др., 1958). При расчете сырого протеина использовали общепринятый коэффи-
циент 6.,25. При определении аминного азота связанных и свободных внутрикле-
точных аминокислот пользовались методом Хардинга и Мак-Лина в описании
Л.А.Закордонец (1982). Белок определяли после щелочного гидролиза по методу
Лоури (Lowry et al., 1951).
Полный аминокислотный состав образцов биомассы поверхностного мицелия
исследовали методом бумажной хроматографии (Закордонец, 1982). Связанные
аминокислоты исследовали на аминокислотном анализаторе марки ’’ААА-881”
после удаления свободных аминокислот спиртовой экстракцией (Закордонец,
1982). Скор незаменимых аминокислот рассчитывали общепринятым методом
(Химический состав ..., 1979). Содержание хитина в образцах сухой биомассы
рассчитывали по разности содержания М-ацетил-В-глюкозамина после гидролиза
НС1, используя коэффициент пересчета глюкозамина на хитине (Петрушко, Ка-
люжный, 1971). Определение перевариваемости сырого протеина проводили по
методу А.В.Хотянович и др. (1972) с молочной кислотой и пепсином.
Наличие у исследуемых штаммов высших базидиомицетов оксидаз (лакка-
зы, тирозиназы, пероксидазы) устанавливали с помощью качественных цветовых
химических реакций, которые проводили путем нанесения капли реактива на по-
верхность растущей на агаризованной среде колонии- (Stalpers, 1978). Изменение
окраски отмечали через 30 мин, 3,24 и 72 ч.
1. Реакция с а-нафтолом на наличие лакказы. Каплю спиртово-водного раство-
ра а-нафтола (2,5 г а-нафтола, 50 мл 95 %-ного этилового спирта, 50 мл воды) на-
носили на растущий край колонии. При положительной реакции наблюдали фиоле-
товое или темно-пурпурное окрашивание мицелия.
2. Реакция с р-крезолом на наличие тирозиназы. Каплю 1 %-ного раствора
р-крезола в дистиллированной воде наносили на растущий край и в центр коло-
нии. При положительной реакции наблюдали оранжево- или красно-коричневое
окрашивание мицелия.
3. Реакция с пирогаллолом и перекисью водорода. Каплю 1 %-ного раствора
пирогаллола и 0,4 %-ного раствора Н2 О2, смешанных в равных количествах, нано-
сили на край растущей колонии. При положительной реакции наблюдали оранже-
во-коричневое или морковно-красное окрашивание.
45
4. Реакция на наличие оксидаз по методу Бавендамма (Методы 1992).
Культуру выращивали на агаризованном пивном сусле с добавлением 1 % галло-
вой кислоты. О наличии оксидаз судили по появлению темной окраски вокруг
колонии.
Протеолитическую активность определяли спектрофотометрически по методу
Кунитца (Бухало на iH., 1971) при значениях pH среды 3,0 и 7,0. В качестве суб-
страта использовали 1 %-ный раствор казеина. Для определения пероксидазной
активности культур использовали метод НМ Лидопличко с соавт. (1968).
Антибактериальную и аитифунгальную активность определяли на жидких
питательных средах методом серийных разведений. Действие культуральной
жидкости исследуемых культур на фитопатогенные грибы устанавливали методом
колодцев (Методы ..., 1982).
Изучение противоопухолевых свойств производили в опытах in vitro на тест-
микробе Вас. megatherium методом витальной окраски (Айзенман и др., 1960),
в реакции подавления дегидраз (Талызина, 1959). Образцы культуральных жид-
костей, оказывавшие выраженное действие in vitro, испытывали в опытах на
животных с перевиваемыми асцитическими опухолями. 1
2.4. Микроскопическое исследование культур
Культуры изучены в световом микроскопе ’’Ergaval” (ГДР) (проходящий свет,
• фазовый контраст) по общепринятой методике (Методы ..., 1982). Исследовали
препараты, приготовленные в воде или препаровальной смеси (вода : спирт : гли-
церин — 1 : 1 : 1), а также живые препараты в аг£ризованной среде по методу
НМ.Пидопличко (1953). Препараты зарисовывали с помощью рисовального пре-
парата РА-4 или фотографировали, используя фотонасадку.
Культуры исследовали с помощью сканирующего электронного микроскопа
(СЭМ) JSM-35C (Япония) при увеличении до 20 000. Для исследования использо-
вали метод Е.Квательбаума и Г.Карнера (Quattelbaum, Camer, 1980). Культуры
грибов выращивали на сусло-агаровой (среде в чашках Петри. В центре чашки Пет-
ри проводили инокуляцию мицелием с агарового косяка музейной культуры. На
поверхность агаризованной среды на расстоянии 3—4 см от центра чашки помеща-
ли квадратные (0,4 х 0,4 см) простерилизованные в спирте и над пламенем горел-
ки кусочки покровного стекла. Когда край колонии нарастал на кусочки покров-
•ного стекла, их вместе с мицелием стерильным скальпелем вырезали из агаровой
среды и помешали для фиксации на предметное стекло в бюкс, на дно которого
была налита 1 %-ная осьмиевая кислота. Препарат культурального мицелия фикси-
ровали в парах осьмиевой кислоты в течение 96 ч. Затем erb переносили в чашку
Петри и сушили в течение 72 ч. После этого напыляли золотом в напылительной
установке JII-4X с наклоном и вращением объекта, исследовали в СЭМ. При изу-
чении Asterophora lycoperdoides и Pleurotus dryinus хламидоконидии без пред-
варительной фиксации наносили на смазанный клеем препаровальный столик и
затем напыляли золотом.
При математической обработке экспериментальных данных проводился од-
нофакторный дисперсионный анализ с последующим парным сравнением выборок
по r-критерию. Данные обрабатывали согласно принятым математическим мето-
дам планирования медико-дологических экспериментов (Лисенков, 1979).
Процедура математической обработки экспериментальных данных программно
реализована на диалоговом языке высокого уровня в операционной системе
РАФОС. Расчеты выполнены на ЭВМ СМ-3.
ГЛАВА 3
ИДЕНТИФИКАЦИЯ ВЫСШИХ БАЗИДИОМИЦЕТОВ
В КУЛЬТУРЕ И ТАКСОНОМИЧЕСКОЕ ЗНАЧЕНИЕ
КУЛЬТУРАЛЬНЫХ ПРИЗНАКОВ
Идентификация является заключительным и наиболее ответственным этапом в
процессе получения чистых культур высших съедобных базидиомицетов. Тради-
ционная систематика высших базидиомицетов базируется на морфологии плодо-
вых тел и слагающих его элементов. При идентификации высших базидиомицетов
в культуре, когда исследованию подвергаются грибы преимущественно в вегета-
тивной фазе роста, т.е. в мицелиальной форме, основное внимание уделяется так-
сономической оценке отдельных культуральных и микроскопических признаков,
а также их совокупности. При культивировании мицелиальных форм съедобных
грибов в отсутствии высшего базидиального спороношения возникают специфиче-
ские проблемы их идентификации на уровне как класса, так и таксонов более низ-
кого ранга. Разработка критериев, позволяющих надежно идентифицировать в
культуре конкретные виды базидиомицетов, приобретает большое значение в свя-
зи с расширением работ по их культивированию. Здесь преследуют различные це-
ли: от получения биомассы и биологически активных веществ до использования
культур грибов при космических полетах.
Видовая принадлежность культуры, о таксономическом положении которой
отсутствует необходимая информация, с полной достоверностью может быть
установлена при получении стадии телеоморфы, т.е. зрелых плодовых тел. Однако
до настоящего времени плодоношение у многих видов высших базидиомицетов
в условиях культуры не получено, хотя вегетативный рост мицелия удовлетвори-
тельный. При выделении культуры из плодовых тел или базидиоспор предвари-
тельно идентифицированного вида гриба видовая принадлежность культуры уста-
навливается по характерным культуральным и микроскопическим признакам.
Мы в первую очередь уделили внимание изучению с нашей точки зрения важ-
ных для идентификации признаков: росту, морфологии и плодоношению на авизо-
ванных средах, микроскопическим особенностям культурального мицелия, некото-
рым физиологическим свойствам культур (отношению к температуре, наличию оп-
ределенных ферментов). Установленные существенные критерии использованы на-
ми для определения таксономического положения выделенных культур.
3.1. Рост исследованных культур высших съедобных базидиомицетов
на агаризованных питательных средах
Для большинства видов съедобных базидиомицетов сведения о скорости роста,
текстуре, окраске и других морфологических особенностях мицелиальной коло-
нии отсутствуют или недостаточно полны. Практически неисследованной остается
изменчивость отдельных культуральных признаков на различных средах. Прове-
денное нами изучение культурально-морфологических особенностей определенных
видов на стандартной питательной среде, результаты которого приводятся ниже,
дало возможность сравнить данные, приводимые разными исследователями, и по-
лучить воспроизводимые результаты.
В качестве питательных сред использовались агаризованное пивное сусло
(СА), картофельно-глюкозный агар (КГА) и агаризоваиная синтетическая среда
Норкранс (СН). СА, наряду с близким по составу мальц-агаром, применяется во
многих лабораториях для культивирования высших базидиомицетов (Nobles,
1965; Semerdzieva, Ceip, 1966; Walting, 1971; Дудка и др., 1976; Stalpers, 1978;
Pantidou et al., 1983; и др.). Для некоторых видов, особенно представителей по-
рядка Boletales, отмечается хороший рост на КГ А, хотя другие виды значительно
хуже растут на этой питательной среде (Semerdzieva, Ceip, 1966). СН широко ис-
пользуется при физиологических исследованиях высших базидиомицетов (Nork-
rans, 1953; Биосинтетическая деятельность ...,1969). 47
РК
2
. 240/
200/
160/
120/
60/
40/
$ Количество _ Оидой
Распределение исследованных видов лигнртрофов (в), микотрофов и копротрофов (б) по величине
ростового коэффициента (РК)
Наиболее точно рост грибов можно оценить по накоплению биомассы, что при-
меняется при культивировании на жидких средах, но не представляется возмож-
ным на агаризованных питательных средах. В исследованиях как высших базидио-
мицетов, так в представителей других систематических групп скорость роста на
агаризованных средах часто оценивается по увеличению диаметра колонии (Bur-
nett, 1976). Но при одинаковом диаметре колонии рост культуры может быть
хорошим и плохим. На благоприятной питательной среде образуется максимально
плотная, высокая колония. На неблагоприятной питательной среде часто наблюда-
ется быстрый рост мицелия по поверхности агара, образуется очень рыхлая, при-
жатая к субстрату колония. При равном диаметре колонии могут значительно от-
личаться по плотности и высоте, а следовательно, по количеству образуемой био-
48 массы, характеризующей рост. Для оценки роста культур высших базидиомицетов
на агаризованных средах нами предложен ростовой коэффициент (РК), который
учитывает диаметр колонии d и высоту h (мм) ? плотность g (баллы по трехбалль-
ной шкале: 1 - редкая, 2 - средняя, 3 - плотная), возраст t (сут.). РК =^-.
РК позволяет сравнивать рост культур разного возраста и колоний с различ-
ной текстурой. Его определяли, когда колония достигала максимального размера
или дорастала до краев чашки Петри.
По скорости роста на стандартной среде (СА) при температуре 26—28 С ис-
следованные штаммы условно разделены нами на 3 группы: быстрорастущие
(РК > 100), растущие со средней скоростью (РК = 50—100), медленнорастущие
(РК<50).
К 1-й группе отнесено 9 видов. РК Piptoporus betulinus, Schizophylhim com-
mune и Crinipellis schevczenkovi более 250. У Laetiporus sulphurous, Pleurotus
calyptratus, P. comucopiae, Panus tigrinus, Lyophyllum ulmarium РК не превышает
110 (та£л. 5), у Gerronema josserandi РК достигает 155. Виды, входящие в группу
быстрорастущих, являются лигнотрофами (рис. 2). С. schevczenkovi, хотя и не
обитает в природе непосредственно на древесине, однако активно разлагает бога-
тые целлюлозой корни сахарной свеклы.
Во 2-й группе 10 видов. Среди них Pleurotus cystidiosus, Р. ostreatus, Armilla-
riella mellea, Flammulina velutipes, Pholiota adiposa, P. squarrosa. Они — лигнотро-
фы. Macrolepiota procera, Coprinus conatus, Pleurotus eryngii, представляющие
соответственно экологические группы подстилочных сапротрофов, копротрофов
и гербофилов, в природе также связаны с разложением целлюлозосодержащих
субстратов. Лишь 1 вид — Suillus sibiricus является микоризообразователем.
Наиболее высокий РК'в этой группе отмечен у Pleurotus ostreatus 1300. У Г. cys-
tidiosus, Armillariellamellea равен 45,Macrolepiota procera — 75 (табл. 5).
К 3-й группе, медленнорастущих, относится большинство исследованных ви-
дов. В нее входят представители всех экологических групп (рис. 2), в том числе
лигнотрофные виды Lycoperdon pyriforme, Oudemansiella brunneomarginata,
Tricholomopsis rutilans, а также некоторые штаммы Pleurotus ostreatus и Flam-
mulina velutipes. Относительно большой РК среди представителей 3-й группы име-
ют гумусовый сапротроф Stropharia nigosoannulata и микоризообразоватепи
Boletus edulis, Lactarius necator, Scleroderma citrinum (табл. 5).
У 22 медленнорастущих штаммов РК не превышает 10. Таким медленным
ростом характеризуются виды родов Laccaria, Chtocybe, Russula, представляющие
экологическую группу микоризообразователей, а также гумусовые сапротрофы:
Marasmius androsaceus, М. oreades, Agaricus bemardiiformis, A. fissuratus, A. mas-
kae, Macrolepiota puellaris, Langermannia gigantea и др., некоторые виды лигнотро-
фов: Fistulina hepatica, Sparassis crispa, Tricholomopsis sulphureoides, Pluteus
cervinus (табл. 5).
На СА рост большинства испытанных штаммов лучше, чем на других испытан-
ных средах. На КГ А и СН обычно развиваются менее плотные и более низкие ко-
лонии (табл. I1).
Однако некоторые виды лучше растут на КГА по сравнению с СА: Suillus
luteus (табл. I), Leucocoprinus bresadolae, Pleurotus calyptratus. Laccaria ame-
thystine, L. laccata, Marasmius androsaceus. Agaricus squamuliferus, A. bemar-
diiformis, Stropharia nigosoannulata и др. Самые высокие значения РК на этой
питательной среде отмечены у Gerronema josserandi (155,7) и Pleurotus calyp-
tratus (115,7).
Среда СН оказалась наименее благоприятной для большинства исследованных
штаммов. Tricholomopsis sulphureoides, Amanita rubescens, Agaricus maskae не
растут на этой среде совсем. Хороший рост на СН отмечен у Suillus luteus, Panus
tigrinus, Lentinus edodes, Gerronema josserandi, Laccaria amethystina, Clitocybe
odora, Tricholomopsis rutilans и др. PK Polyporus squamosus, Agaricus fissuratus
и Pholiota nameko на CH больше, чем на СА и КГА. Самый высокий РК на этой
среде (74,4) определён у штамма Pleurotus ostreatus 1300.
1 Табл. I—XXXVI Ол. на вклейке.
49
Таблииа 3, Ростовой коэффициент (УК) исследованных культур высших базидиомицетов на агМри*
зованном пивном сусле при различных температурах
Порядок, семейство, вид, штамм 4°C 22°C |28eC 37'C ^Порядок, семейство, ji вид, штамм 4°C 1 22’C 28°C 37 °C
Aphvllophoiales Fiammulina velu- 3,6 78,0 40,0
Polyporaceae tipes 50 —
Laetiporus sulphu- reus 307 F. velutipes 53 80,0 35,0 44,0 —
6,0 93,0 1033 — F. velutipes 112 43,0 36,0 60,0 —
Gloeophyllum se- 9,3 Marasmius аШа-
piarium 325 — 16,0 24.0 ceus 77 4,2 12,0 14,6 —
Piptoponis betu- M. androsaceus 136 6,0 1,4 5,1 —
linus 303 — 261,0 294,0 — M. oreades 76 23 2,7 5,5 —
Poiyporus squa- 22,0 Crinipelhs schev-
• mosus 311 ) — 18,6 — czenkovi 31 — 186,0 235,7 61,2
Scmzophyliaceae Amanita ceae
Schizophvllum Amanita rubes-
commune 96 — 81,7 250,7 95,0 cens 38 7,7 10,9 15,1 —
Fistulinaceae Pluteus cervi-
Fistulina •nepati- nus 251 — 8,9 8,9 —
ca 302 ‘ 1,1 73 7,3 — Agaricaceae
Sparassisaceae Agancus bemar-
Sparassis cnspa diiformis 156 — 8,0 8,4 2,4
304 — 63 13,7 — A. bitorquis 143 6,3 8,5 223 13
S. cnspa 312 — 13,7 8,1 — A. fissuratus 208 — 9,4 6,6 __
Boletaies A. znaskae 157 — 6,4 6,9
Boietaceae A. squamulife-
Boletus edulis 604 — 29,8 36.6 36,0 rus 158 4,3 9,0
Suillus luteus 601 0,1 11,1 12,0 — Macrolepiota
S. sibiricus 627 3.1 46,3 51,4 38,6 procera 72 e;o 42,4 43,3 —
Paxiliaceae M. procera 75 12,6 69,4 90,0 —
Paxillus acherunti- M. puellaris 255 1,3 10,3 5,6 —
us 116 — . 6,0 10,7 6,5 Leucocoprinus
Agancaies bresadolae 160 — — 20,9 —
Pleurotaceae Coprinaceae
Pleurotus calyp- Coprinus coma-
tratus 189 — 47,6 108,0 37,7 tus 47 — 26,7 61,3 —
P. comucopiae 82 9,6 90,0 108,0 16,4 Bolbitiaceae
P. cystidiosus 190 — 34,3 94,3 32,1 Agrocvbe aege-
P. drvinus 197 - — 18,2 24,6 3,0 rita 12 2,9 11,1 19,1 4,4
P. eryngii 10 — 43,2 51,0 4,2 Strophariaceae
P. florida 89 29,1 38.6 38,6 57,4 Stropharia rugo-
P. ostreatus 1300 26,7 84,0 90,0 6.3 soannulata 141 — 14,8 14,8 7,7
P. ostreatus 102 6.7 34,0 46,0 3,3 S. rugosoannu-
Panus tigrinus 83 4,7 63.0 — 79,7 lata 258 — 223 31,2 14,6
P. tigrinus 131 28,0 109,3 16,0 Ph. adiposa 85 28,0 —
Lentinus edodes 57 — 26,2 30,9 — Ph. adiposa 86 5,1 49,8 51.0 —.
Tricholoma taceae Ph. auriveila 84 1,5 11,1 19,3
Gerronema josse- Ph. auriveila 146 22,9 23,4 22,6
randi 196 10,0 48,1 157,5 25,5 Ph. nameko 105 15,9 28,9 39,2
Laccaria amethysti- 2,4 Ph. squarrosa 87 6,7 71,0 89,0 —
na 121 — 0,8 — Kuehneromyces mu - '»
L. iaccata 120 — 6,0 5,4 tabilis 122 48,0 45,4
Ciitocybe clavi- Russulales
pes 152 — 2,8 2,4 — Russulaceae
C. gigantea 7 0.3 2,9 3.2 2,6 Russula decolo-
C. odora 45 1,1 3.4 33 — rans 138 3,8 6,0 0,7
Lepista nuda 62 — 28,5 23,0 — Lactarius леса-
Tncholom opsis tor 119 77.1 41,8
rutilans 101 — 28,9 373 — Phallales
T. suiphureoi- Phallaceae
des 195 1.4 5,6 7,7 7,0 Phallus impudi-
Lyophyllum ulma- cus422 — 13,7 9,9
rium 67 — 72,0 102,0 — Lycoperdales
Armillanella mel- 15,9 18,9 Lycoperdaceae
lea 724 — — Caiyatia excipu-
A. meliea 41 — 27,9 333 — liformis 407 3,1 13,1 11,7
A. meliea 40 — 49,0 22,0 — C. utriformis 726 1,2 1,7 23
A. meliea 32 — 20,0 24,9 — Langermannia gi-
A. meliea 742 — 733 913 — gantea 732 93 7,6
A. meliea 755 — 78,0 913 — Lycoperdon per-
A. meliea 39 • — 273 20,0 — latum 406 6,0 293
A. meliea 735 — 48,0 51,0 — L. perlatum 413 26,0 9,0
Panellus seroti- 25,4 18,6 L. pyriforme414 3,1 3,1
nus 252 — — L. pyrifonne415 3,8 37,6 333
Oudemansiella Sclerodermatales
brunneomargina- Sderodermataceae
ta 260 9,7 24,0 37,7 133 Scleroderma cat-
Asterophora lyco- rinum 425 6,6 34,7 32,1
peroides 257 0,4 6,1 9.6
У большинства видов морфология колоний более четко выражена при культи-
вировании на СА. По классификации Дж.Сталперса (Stalpers, 1978) у съедобных
базидиомицетов наиболее часто встречается войлочный тип колоний. Войлочная
колония характерна для Piptoporus betulinus, Fistulina hepatica, Laetiporus sul- .
phufeus, Pleurotus puellaris, P. cystidiosus, P. dryinus, Crinipellis schevczenkovi,
Lentinus edodes, Lycoperdon pyriforme, Phallus impudicus (табл. II). Ватная коло-
ния развивается у Suillus sibiricus и некоторых штаммов Agaricus bisporus.
Для Amanita rubescens, Boletus edulis, Suillus luteus, Tricholomopsis rutilans,
Macrolepiota nuellaris, Pluteus cervinus, Clitocybe odora, Marasmius oreades
(табл. Ill, IV) характерна бархатистая колония.
Кожистая колония, обычно пигментированная, наблюдается у Panus tigrinus,
Oudemansiella radicata, Marasmius alliaceus, M. scorodonius (табл. Ш). Кожистую
темно-коричневую колонию образует Armillariella mellea (табл. Ill, IV). У Clito-
cybe clavipes развивается шелковистая колония, в центре она вишнево-коричне-
вого цврта. Лакунозный тип колонии отмечен у Pholiota adiposa (табл. Ill). Муч-
нистая колония характерна для Flammulina velutipes (табл. IV) и Calvatia exci-
puliformis (табл. П1). Пушистая белая колония образуется у Scleroderma cit-
rinum (табл. II).
Концентрическая зональность колонии наблюдается у Fistulina hepatica.
Pleurotus dryinus, P. ostreatus, P. florida, Crinipellis schevczenkovi, Gerronema
josserandi, Macrolepiota rhacodes, Armillariella mellea, Pholiota aurivella (табл. II,
IV) и др. Обычно концентрическая зональность наиболее четко заметна на моло-
дой колонии. Радиальная складчатость колонии наблюдается у Macrolepiota puel-
laris, Paxillus ache run tius, Leucocoprinus bresadolae, Calvatia excipuliformis,
Pleurotus cervinus, Clitocybe odora (табл. II, III).
Мицелиальные тяжи хорошо выражены у Lycoperdon pyriforme, L. perlatum,
Phallus impudicus, Pleurotus cystidiosus, P. conucopiae и Lentinus edodes
(табл. I, II).
Окраска колонии в 1-е сутки роста обычно белая, затем у некоторых видов -
приобретает желтые, серые, коричневые, красноватые тона. В отдельных случаях
колония сохраняет оттенок, характерный для плодовых тел этого вида. Так, ко-
лонии серовато-сиреневого цвета наблюдаются у некоторых изолятов Lepista
nuda. Выраженная фиолетовая окраска типична для колонии Laccaria amethystina.
Желто-оранжевая колония свойственна Laetiporus sulphureus, розовая — Anthurus
archeri, черная — Lactarius necator.
Во время роста культур многих видов происходит изменение цвета реверзума
или питательной среды вокруг колонии. Пигментация среды отмечена в культурах
болетальных грибов: Boletus edulis, В. erythropus, Suillus luteus, Marasmius orea-
des (табл. TV), Paxillus acheruntius, Xerocomus chrysenterou. Потемнение агара
наблюдается также при культивировании Oudemansiella radicata, Armillariella
mellea, Lepista luscina, Leucocoprinus bresadolae, Agaricus maskae, Macrolepiota
puellaris, Clitocybe clavipes. Реверзум колонии Lactarius necator черного цвета.
У Laccaria amethystine в зоне роста агар окрашивается в интенсивный фиолето-
вый цвет. На поверхности колонии некоторых видов, например Gloeophyllum
sepiarium, Leucocoprinus bresadolae, выделяются капли эксудата.
Некоторые виды имеют четко выраженные морфологические структуры,
которые являются хорошим диагностическим признаком при идентификации
культур. Так, у Armillariella mellea образуются ризоморфы. Склероции развива-
ются у Coprinus cinereus и Leucocoprinus bresadolae (табл. П). Pleurotus cysti-
diosus образует конидиальное спороношение в виде коремий с черными головка-
ми (табл. П). Коремии развиваются на зачатках плодовых тел или могут быть
равномерно распределены по всей поверхности колонии.
Для Pleurotus dryinus характерно образование оливково-коричневых хлами-
доспор сначала в виде темного кольца в средней части колонии (табл. II), затем —
порошистой массы по всей ее поверхности.
При культивировании на других питательных средах помимо РК могут значи-
тельно меняться текстура и окраска колонии, окраска реверзума и другие показа-
тели. Так, у Agaricus bitorquis, Crinipellis schevczenkovi, Gerronema josserandi, 51
Fistulina hepatica и других видов при росте на КГА и СН не наблюдается зональ-
ность, которая четко выражена у них в процессе роста на С А. У Agaricus fissuratus
зональность наблюдается только с применением СН. Polyporus squamosus, Pipto-
porus betulinus, Crinipellis schevczenkovi, Pleurotus comucopiae, P. eryngii, Tri-
cholomopsis rutilans, Sparassis crispa, Gerronema josserandi, F. velutipes, когда
растут на СА, образуют обильный воздушный мицелий. При культивировании на
КГА и СН у этих видов развивается в основном погруженный мицелий, а воздуш-
ный мицелий заметен в виде очень рыхлой паутинистой или мучнистой мицелиаль-
ной пленки на поверхности агара. Р. florida образует тяжи при росте на СН (табл. I).
Suillus luteus при культивировании на СА и КГ А окрашивает агар в темный
цвет. При росте на СН темная окраска не наблюдается, хотя колонии на этой пита-
тельной среде растут хорошо (табл. I). У Laccaria amethystina отсутствует харак-
терная фиолетовая окраска колонии и реверзума, если культура выращивается
наСН. -
Таким образом, при изучении роста 82 штаммов, относящихся к 65 видам
высших съедобных базидиомицетов, показаны значительные различия в скорости
роста отдельных видов на стандартной питательной среде (СА) при Т = 27—28 °C
(табл. 5). Величина РК у разных видов при культивировании на СА равна 2,4—294.
Быстрорастущие виды в большинстве относятся к экологической группе лигно-
трофов. В систематическом отношении это представители порядков Aphyllopho-
rales и Agaricaies (семейства Pleurotaceae и Tricholomataceae). Среди грибов со
средней скоростью роста также преобладают виды, приуроченные к растительным
субстратам. Они представляют порядки Boletales, Agaricales (семейства Pleuro-
taceae, Tricholomataceae, Agaricaceae и Strophariaceae). Наиболее обширной явля-
ется группа медленнорастущих видов. В экологическом отношении главным обра-
зом представлены микоризообразоватепи и гумусовые сапротрофы, в меньшей
мере — лигнотрофы и подстилочные сапротрофы.
Фенотипическая изменчивость выражается в различной скорости роста штам-
мов одного вида. Так, РК штаммов Armillariella mellea составляет 18,9-91,5.
Pleurotus ostreatus — 46—90, Flammulina velutipes — 40—60, Macrolepiota procera—
43—90. Значительно отличаются по РК виды родов Pleurotusи Agaricus.
Из полученных данных можно заключить, что РК на стандартной питательной
среде при постоянной температуре культивирования существенно характеризу-
ет вид.
3.2. Отношение культур к температуре
Крайне недостаточно изучен вопрос зависимости роста и морфогенеза культур
высших базидиомицетов от температурного фактора. Для большинства видов
съедобных базидиомицетов такие данные вообще отсутствуют. Таким образом,
вопрос о возможности использования температурного критерия в качестве таксо-
номического признака остается нерешенным (Рипачек, 1967; Nobles, 1971). В свя-
зи с этим представляло интерес определить температурные границы и оптимальные
температуры роста культур нашей коллекции. Всего испытано 85 штаммов 71 ви-
да высших базидиомицетов, относящихся к 17 семействам, 8 порядкам.
Нами исследован рост культур при температуре 4 °C, где находится нижний
предел развития большинства грибов, при 22 и 27 °C, т.е. в пределах оптимума
мкцелиального роста, при 37 °C, являющейся для большинства высших базидио-
мицетов максимальной границей роста (Беккер, 1963; Campbell, Расе, 1968;
Crisan, 1973: Жданова, Василевская, 1982). Отдельные виды, которые хорошо
росли при 37 °C, культивировали при 42 ° С.
Для большинства исследованных видов оптимальной для роста была темпера-
тура 27 °C. У Tricholomopsis rutilans, Lepista nuda, Panellus serotinus, Agaricus
fissuratus, Macrolepiota puellaris, Lactarius necator и др. оптимум роста отмечен
при 22 °C. Значения РК при температуре 22 и 27 °C очень близки или не различают-
ся у Sparassis crispa, Clitocybe clavipes, Pluteus cervinus, Agaricus bernardiiformis,
>2 Lycoperdon pyriforme и др. (табл. 5).
Оптимальный рост при 4 °C отмечен.только у некоторых штаммов Flammulina
velutipes и Marasmius androsaceus. Большинство видов имеют РК не выше 10 при
4 °C. Наибольший рост при 37 °C отмечен у Pleurotus florida.
У многих видов при 4 °C наблюдается только обрастание инокулята. Если чаш-
ку Петри переносят в термостат при 27 °C, то из инокулята развивается нормаль-
ная колония. Культуры же, которые не растут при 37 °C, обычно не возобновляют
рост, если их переносят в условия более низкой температуры.
При температуре от 4 до 37 °C растут 12 штаммов из 85, т.е. 14 % исследован-
ных. Хороший рост в этом температурном диапазоне характерен для Pleurotus
comucopiae, Р. florida, Tricholomopsis sulphureoides, Panus tigrinus, Gerronema
josserandi, Calocybe gambosa, Oudemansiella brunneomarginata, Agaricus bitorquis,
Agrocybe aegerita, Suillus sibiricus. Большинство видов, относящихся к этой
группе, отличаются мощным ростом в условиях культуры и соответственно
большим РК.
22 щтамма (26 %) растут при температуре от 4 до 27 °C. Это виды родов
Marasmius, Flammulina, Asterophora, Macrolepiota, Pholiota, Amanita, Pleurotus
и отдельные виды из порядков Aphyllophorales, Boletales, Gasteromycetes. В этой
группе также имеются виды с достаточно высоким РК.
16 штаммов (19 %) не растут при 4 °C и хорошо развиваются при 37 °C. Это -
Gloeophyllum sepiarium, Schizophyllum commune, Boletus edulis, Paxillus acherun-
tius, некоторые виды рода Pleurotus, Crinipellis schevczenkovi, Agaricus bernar-
diiformis, Stropharia rugosoannulata, Pholiota aurivella, Russula decolorans и др.
К группе видов, которые не растут при 4 и 37 °C, отнесено 34 штамма (40 %).
Среди них Piptoporus betulinus, Lyophyllum ulmarium, Armillariella mellea, Kue-
hneromyces mutabilis обладали высоким РК.
Следовательно, отмечено большое разнообразие исследованных культур, как
по оптимальным, так и по крайним температурам роста. Культуры по их росту
в определенном температурном интервале можно отнести к 4 группам: 4 — 37,
4 - 27, 21 — 27, 21 — 37 °C, некоторые — при 42 °C. По температурному оптимуму
эти культуры можно отнести к 5 следующим группам: 4, 21,21 — 27, 27, 37 °C.
У представителей одной и той же экологической группы, например у лигно-
трофов и микотрофов (рис. 3), установлены различия в уровне РК, температур-
ных границах роста и оптимальных температурах. Температурные кривые отли-
чаются также у штаммов одного вида: Armillariella mellea, Flammulina velutipes,
Pleurotus ostreatus. Штаммы A. mellea и F. velutipes сходны по температурным
границам роста, однако различаются по оптимальной температуре (рис. 4). Р. flo-
rida четко отличается как по температурным границам, так и по температурному
оптимуму от Р. ostreatus. В ряде случаев наши данные совпадают с литературны-
ми в отношении как оптимальных, так и максимальных температур роста отдель-
ных видов. Например, В.Рипачек (1967) приводит аналогичные результаты иссле-
дований некоторых видов дереворазрушающих грибов: Gloeophyllum sepiarium,
Polyporus squamosus, Piptoporus betulinus, Panus tigrinus, Schizophyllum commu-
ne. В то же время имеются расхождения с этим автором относительно температур-
ных границ Pleurotus ostreatus и Armillariella mellea.
До настоящего времени нет единого мнения по поводу разделения грибов на
группы в зависимости от их отношения к температуре. Наиболее четко выделены
группы психрофилов и термофилов, хотя температурные границы роста у них
точно не установлены. Пока неясны различия между мезофильными, психро- и
термотолерантными,психрофильными и психротолерантными, термотолерантными
и термофильными видами.
В некоторых случаях при выделении таксона температурный критерий может
быть решающим. Так, основываясь на существенном отличии Pleurotus florida
от Р. ostreatus по верхней температурной границе роста, мы принимаем Р. florida
как самостоятельный вид, хотя данные о половой совместимости этих видов
позволяют рассматривать Р. florida как форму Р. ostreatus (Bresinski et al.,
1976; Hilber, 1978, 1982). При этом мы исходим из теории микроэволюпии
(Майр, 1971; Тимофеев-Ресовский, Яблоков, 1974; Горленко, 1984), согласно
которой возникновение новых видов может происходить путем появления в по-
53
Термограммы исследованных видов базидиомицетов: а — лигнотрофные виды: 1 — Agrocybe aege-
rita, 2 — Oudemansiella brunneomarginata, 3 — Tricholomopsis rutilans, 4 — Panus tigrinus, 5 — Gerronema
josserandi. 6 - Schizophyllum commune, 7 — Piptoporus betulinus; б — микоризообразующие виды:
7: Clitocybe clavipes. 2 — Suillus luteus, 3 — Boletus edulis, 4 — Suillus sibiricus, 5 — Lactarius necator
Термограммы исследованных видов базидиомицетов: а - Flammulina velutipes: 1 — штамм 53, 2 -
штамм 112, 5 — штамм 50; б — Armillariella mellea : 1 — штамм 724; 2 — штамм 32, 3 - штамм 39,
4 - штамм 40,5 - штамм 735,6 - штамм 45, 7 — штамм 761
пуляции изолированных форм, отличающихся от исходных физиологическими
свойствами. В то же время они близки по морфологическим признакам и сохраня-
ют половую совместимость.
Таким образом, можно заключить, что температурный критерий может учиты-
ваться как дополнительный таксономический признак при идентификации куль-
тур высших съедобных базидиомицетов на видовом уровне. При этом наиболее
значимы отличия в росте, наблюдающиеся при минимальных и максимальных
температурах.
3.3. Цветовые химические реакции на наличие фенолоксидаз
В систематике высших базидиомицетов на уровне вида таксономическое значение
имеет признак наличия фенолоксидаз, в первую очередь лакказы, тирозиназы и
пероксидазы. Однако до настоящего времени большинство видов съедобных бази-
диальных грибов с этой стороны не охарактеризованы. В связи с этим мы исследо-
вали культуры нашей коллекции на наличие у них реакций на данные ферменты.
54 Фенолоксидазы определяют различными методами, в том числе с помощью ха-
Таблица 6. Цветовые химические реакции на лакказу, тирозиназу, пероксидазу у высших баз иди с-
мииетов
Порядок, семейство, вид, штамм Лакказа | Тирозиназа I Пероксидаза Порядок, семейство, вид,.штамм [Лакказа Тирозиназа Пероксидаза '
Aphyilophorales Polyporaceae Laetiporus sulphureus 306 Armillariella mellea 40 A. mellea 41 A. mellea 745 4- 4 4 4 4 1 i
Piptoporus betulinus 303 + 4 — Oudemansiella brunneomarginata 260 4- 4 4
Polyporus squamosus 309 + + 4 0. radicata 80 + 4
Fistulinaceae Fistulina hepatica 302 + 4 Flammulina velutipes 50 Marasmius alliaceus 77 — 4 4 -
Sparassisaceae Sparassis crispa 304 4- M. oreades 76 Crinipellis schevczenkovi 31 4 4 -*• 4
S. crispa 314 — —- 4- Lepista nuda 61 4 — 4
S. crispa 312 — — 4 L. nuda 62 4 — +•
Boletales Boletaceae Boletus edulis 604 Suillus luteus 601 4- + + Amanitaceae Amanita rubescens 38 Agaricaceae Agaricus bemardiiformis 156 4 4 •*- *
S. sibiricus 627 4 — 4 A. bitorquis 143 4 4
Paxillaceae Paxillus acherun tius 115 4, 4. 4 Agaricus maskae 157 A. squamuliferus 158 4 •t -r
Agaricales Pleurotaceae Pleurotus calyptratus 189 P. comucopiae 106 + 4 4 4 + Macrolepiota procera 75 Leucocoprinus bresadolae 160 Bolbitiaceae Agrocybe aegerita 12 4 + 4
Pleurotus cystidiosus 190 P. dryinus 197 ' + — + Strophariaceae Stropharia rugosoannulata 258 4- 4 4
P. eryngii 10 + 4 + Pholiota adiposa 86 — 4 4
P. florida 89 4 — 4- Ph. aurivella 146 4 4 -p
P. ostreatus 1300 4 4 4 Ph. aurivella 84 4- 4 4
P. ostreatus 102 4 4 + Ph. nameko 105 + 4 4
Panus tigrinus 131 4 __ — Kuehneromyces mutabilis 122 4 4
Lentinus edodes 57 T richolomataceae Asterophora lycoperdoides 257 4 4. + + Russulales Russuiaceae Lactarius deliciosus 151 4 4 -*
Gerronema josserandi 196 Laccaria laccata 120 Calocybe gambosa 736 + 4 + 4 Lycoperdales Lycoperdaceae Calvatia excipuliformis 407
Clitocybe clavipes 159 4 + 4- C. utriformis 726 4 — 4
C. gigantea 7 — — 4- Lycoperdon perlatum 406 — 4 4
C. odora 45 Tricholomopsis rutilans 101 T. sulphureoides 195 4 4 + 4- Sderodermatales Sclerodermataceae Scleroderma citrinum 425 4 4
Lyophyllum ulmarium 67 4 + 4-
Примечание. (+) - положительная, (-) - отрицательная реакции.
рактерных цветовых химических реакций на поверхности мицелиальной колонии
(Stalpers, 1978; Marr, 1979). При изучении биологической активности культур
нашей коллекции использовались и другие методы (см. гл. 2).
Для выявления фенолоксидаз на поверхности мицелиальной колонии с по-
мощью цветовых химических реакций применялись следующие тесты: для опреде-
ления лакказы — с а-нафтолом, тирозиназы — с р-крезолом, пероксидазы — с пи-
рогаллолом и Hi О2.
В табл. 6 приведены данные о наличии цветовых реакций на лакказу, тирозина-
зу, пероксидазу у высших базидиомицетов. Реакции проводили при выращивании
культур на СА, КГ А, СН при температуре Т1 °C, а также на СА при температуре
4,21 и 37 °C.
В отдельных случаях наблюдались различия в скорости окрашивания колоний
или его интенсивности, однако характер реакций для каждого вида при всех испы-
танных условиях, как правило, постоянен. Большинство культур обнаружили по-
ложительную реакцию на лакказу. У 31 культуры отмечена положительная реак-
ция на все три фермента: Pleurotus calyptratus, Р. eryngii, Р. comucopiae, Amanita
rubescenc и др. Laetiporus sulphureus и Calvatia excipuliformis имели отрицатель-
ную реакцию на все тесты.
Отдельные виды отличались характерными цветовыми реакциями. В некого- 55
рых случаях (Armillariella mellea) отмечена разница у штаммов одного и того/же
вида. Специфичности в наличии тех или иных ферментов у грибов таксонов более
высокого ранга, чем вид, нами не отмечено.
Реакции на экстрацеллюлярные оксидазы многих видов изучены нами впер*
вые. Данные о тех из них, которые исследовались на наличие реакций к этим фер-
ментам другими авторами, в ряде случаев совпадают. Это — Laetiporus sulphureus,
Fistulina hepatica, Sparassis crispa, Polyporus squamosus (Stalpers, 1978). В то же
время Дж.Сталперс у Piptoporus betulinus не обнаружил лакказу. По нашим на-
блюдениям, у него была четко выражена положительная реакция на этот фермент.
Характер цветовых реакций на фенолоксидазы для плодовых тел приведен
в работе KJvlappa (Marr, 1979). Нами на мицелиальных культурах этих же видов -
Pleurotus ostreatus, Laetiporus sulphureus, Clitocybe clavipes, Marasmius oreades,
Oudemansiella radicata получены другие результаты. Мутанты Panus tigrinus,
выделенные в эксперименте с помощью химического мутагена, от исходных
культур отличаются по наличию внеклеточной фенолоксидазной активности
(Nicholson, Robinson, >1983). Разгораются по образованию фенолоксидаз моно-,
дикариотические и гибридные штаммы Pleurotus ostreatus (Molitoris, 1978).
Х-Молиторис (Molitoris, 1978), исследовавший 55 видов высших базидиоми-
цетов, отмечает, что мнкоризообразующие грибы из родов Paxillus и Suillus проду-
цируют только очень небольшие количества внутриклеточной лакказы. Этим они
отличаются от грибов, вызывающих белую гниль древесины, например Kuehnero-
myces mutabiiis, видов рода Pleurotus и других, интенсивно образующих внекле-
точную лакказу. Нами отмечено образоветие лакказы и других фенолоксидаз
у микориэообразующих грибов: Boletus edulis, Suillus sibiricus, Calocybe gam-
bosa, Suillus luteus, Amanita rubescens и др. В то же’время у некоторых видов и
штаммов дереворазрушаюших грибов реакция на лакказу отрицательная. К ним
относятся Laetiporus sulphureus, Sparassis crispa, Pleurotus dryinus, Tricholomop-
sis rutilans, отдельные штаммы Armillariella mellea, Pholiota adiposa. Таким обра-
зом, наши исследования не подтверждают выводов Х.Молиториса о существенных
различиях в реакциях на фенолоксидазы у представителей разных экологических
групп высших базидиомицетов и об отсутствии фенолоксидаз у микоризообразо-
вателей. Отмеченные в ряде случаев нами и другими исследователями (Molitoris,
1978; Stalpers, 1978; Marr, 1979; Hilber, 1982) разлитая в проявлении этих реак-
ций у штаммов одного и того же вида свидетельствуют о необходимости изучения
большого количества культур различного происхождения с тем, чтобы оценить
вариабельность этого признака в полной мере. Анализ оригинальных и литератур-
ных данных позволяет заключить, что цветовые химические реакции могут слу-
жить дополнительным таксономическим критерием при идентификации культур
на видовом уровне.
3.4. Образование в чистой культуре стадии телеоморфы
Вопросы плодообразования у высших съедобных базидиомицетов специально на-
ми не исследовались, но при идентификации культур мы стремились получить ста-
дию телеоморфы как наиболее надежную для определения вида. При этом, учиты-
вая литературные данные об образовании высшего плодоношения у базидиомице-
тов, рассмотренные в главе 1, в опыте мы моделировали комплекс наиболее бла-
гоприятных условий для образования плодовых тел. В результате было получено
плодоношение у 36 видов. Все исследованные виды образовывали плодовые тела
в чистой культуре на СА. В некоторых случаях применялись другие агаризованные
питательные среды, а также опилки, солома, отруби.
Для получения плодоношения использовали колбы Эрленмейера разлитаой
еяасости, чашки Петри, чашки Коха, большие пробирки. При выращивании на со-
ломе, отрубях, опилках субстрат перед стерилизацией увлажняли жидкой средой
Чапека без истотаика углерода, а затем в процессе роста гриба — стерильной водо-
проводной водой.
56 После инокуляции культуры помещали в термостат при температуре 26-28 °C
для получения быстрого роста мицелия, а затем (примерно через 7—14 сут) вы-
ставляли на рассеянный дневной свет при 18—22 °C. Культуры Flammulina veiuti-
pes и Lepista nuda перед тем, как выставить на свет, помещали на несколько суток
в холодильник при 5—10 °C.
. Panus tigrinus, Fistulina hepatica, Sparassis crispa, Agrocibe aegerita, Coprinus
cinereus и Asterophora lycoperdoides продуцируют зрелые плодовые тела уже в
первые 7—10 сут инкубации в термостате. Нормально развитые плодовые тела с
прорастающими базидиоспорами образуют на СА Sparassis crispa, Schizophyllum
commune, Panus tigrinus, Lentinus edodes, Gerronema josserandi, Lyophyllum
uhnarium, Oudemansiella brunneomarginata, O. radicata, O.mucida, Marasmius scoro-
donius, Agrocybe aegerita, M.alliaceus, Lepista nuda, Hypholoma sulbateritium, Pho-
liota adiposa, Ph.aurivella, Crinipellis schevczenkovi, Fistuiina hepatica, Flammulina
velutipes и др. (табл. V—VII). У Agaricus bitorquis и Stropharia rugosoannulata
отмечается лишь образование недифференцированных зачатков. Примордии и
зрелые рлодовые тела формируются у Pleurotus ostreatus, Р. calyptratus, Р. sa-
iignus, Р. florida и Р. comucopiae (табл. V).
Представители секции Pleurotus coremioides одновременно с зачатками плодо-
вых тел обильно образуют типичное конидиальное спороношение в виде головок
коремий. У Р. cystidiosus коремии появляются не только на поверхности колонии,
но и на ножках зачаточных плодовых тел. Pleurotus dryinus, продуцирующий на
поверхности колонии массу темно-оливковых хламидоспор, плодовых тел на С А.
соломе и опилках не образует. Отсутствие плодоношений в чистой культуре у это-
го вида отмечает также О.Гилбер (Hilber, 1982). Нами не наблюдалось формиро-
вания плодовых тел и у Р. eryngii. Таким образом, способность к плодообразова-
нию в условиях чистой^культуры в большей степени проявили представители сек-
ций Р. ostreatus и Р. calyptratus.
Asterophora lycoperdoides, которая в природе поражает плодовые тела выс-
ших базидиомицетов, в культуре плодоносит даже при очень скудном развитии
мицелия, на котором рано образуются хламидоспоры. Шляпки плодовых тел
этого гриба (даже очень маленькие, размером с булавочную головку) через не-
сколько суток после появления также покрываются слоем порошащих оливко-
вых хламидоспор (табл. VII). Хламидоспоры, высеянные на СА, через 2—3 сут
прорастают. Если на поверхности мицелиальной культуры A. lycoperdoides поло-
жить кусочек шляпки с хламидоспорами, то вокруг него через сутки начинают
появляться плодовые тела.
Некоторые виды, плодоносящие в культуре, при хранении в холодильнике
образуют зачатки плодовых тел или зрелые плодовые тела. При температуре
4—10 °C нами отмечено плодоношение у Flammulina velutipes, Pholiota adiposa,
Ph. aurivella, Marasmius alliaceus, Ganoderma lucidum, формирование зачатков
плодовых тел у Sparassis crispa, Fistulina hepatica, Pleurotus salignus, P. cysti-
diosus, Lentinus edodes, Agrocybe aegerita, Lepista nuda.
При температуре 20—24 °C плодоносят Pleurotus florida, Schizophyllum
commune и Oudemansiella brunneomarginata. Культура Crinipellis schevczenkovi
выделена из почвы в Киргизии, где гриб интенсивно развивается в жаркое время
года. В лаборатории этот вид плодоносил при 28—30 °C.
Pleurotus ostreatus, Panus tigrinus, Pholiota adiposa и Ph. aurivella образуют
нормально развитые плодовые тела на соломе, опилках, отрубях, однако плодо-
ношение по сравнению с плодоношением на сусло-агаре наступает в более поздние
сроки. Pleurotus calyptratus на соломе и опилках вообще не плодоносит, хотя
потребляет субстрат почти полностью и образует обильный мицелий.
Как отмечено выше, представители порядка Boletales редко плодоносят в ус-
ловиях чистой культуры. Из болетальных грибов, представленных в нашей кол-
лекции, в лабораторных условиях зачатки плодовых тел образуют Boletus edulis
и Suillus sibiricus. Причем В. edulis формирует зачатки только в изолятах из ниж-
ней части ножек плодовых тел при первом пересеве культуры. Плодовые тела дос-
тигают высоты 1—1Л см, дифференцированы на темную шляпку без гименофора
диаметром 0Л—0,8 см, аналогично тому, что наблюдал И-Карпинский (Karpinski,
1961). Плодоношение Suillus sibiricus описано нами впервые, плодовые тела
57
у этого гриба с опушенной ножкой длиной 2—3 см и зачаточной шляпкой
(табл. VII).
Нами не наблюдалось плодоношения у исследованных видов гастеромицетов,
хотя, как мы указывали выше, в литературе имеются данные об образовании
в культуре плодовых тел некоторыми представителями этой систематической
группы. У Oudemansiella brunneomarginata, Crinipellis schevczenkovi и Suillus
sibiricus стадия телеоморфы в чистой культуре получена впервые.
Условия в наших опытах по плодоношению не были оптимальными для уро-
жая карпофоров и сроков плодоношения. Однако с целью выяснения потенциаль-
ной возможности образования стадии телеоморфы в чистой культуре применяв-
шиеся нами методы приемлемы и могут использоваться при идентификации
культур.
' Виды, у которых в чистой культуре нами получена стадия телеоморфы, явля-
ются в большинстве представителями экологической группы лигнотрофов, в мень-
шей мере — гумусовых и подстилочных сапрогрофов, копротрофов, микотрофов.
3.5 Микроструктуры
При микроскопическом исследовании культур высших съедобных базидиомице-
тов в световом и электронном микроскопах особое внимание было уделено струк-
турам, которые могут иметь таксономическое значение на уровне вида: пряжкам,
бесполым спороношениям, морфологическим особенностям гифальной системы.
Некоторые структуры впервые изучались с помощью метода сканирующей элек-
тронной микроскопии.
5.1. Пряжки
В качестве одного из наиболее важных таксономических признаков при иденти-
фикации высших базидиомицетов в культуре учитывается наличие уникальной
структуры — пряжек, которые встречаются на мицелии многих представителей
высших базидиомицетов. Разные виды характеризуются определенными различия-
ми в расположении пряжек на мицелии, частоте их образования, размерах и тл.
(Nobles, 1965, 1971; Stalpers, 1978).
Характер пряжек разных видов высших базидиомицетов в основном изучает-
ся в световом микроскопе. Возможность в полной мере судить о форме и струк-
турных особенностях пряжек открывает метод сканирующей электронной мик-
роскопии (СЭМ). В литературе данные о структуре пряжек/получаемые методом
СЭМ, представлены только 2 видами (Flegler, Hooper, 1978; Hashioka, 1981).
Методом СЭМ нами исследованы пряжки на культуральном мицелии 15 видов
высших базидиомицетов. Культуры выращивались на СА, изучались пряжки в зо-
не роста и в центральной части колонии.
У Piptoporus betulinus, наряду с одиночными пряжками, обычны множествен-
ные, мутовчатые и парные пряжки, наблюдаются также пряжки, переходящие
одна в другую (табл. VIII). Пряжки у P.betulinus значительно варьируют по фор-
ме: большие и маленькие, короткие и длинные, слабо- и крутоизогнутые, ме-
дальонные и почти без зазора между пряжкой и гифой. У Peniophora gigantea
пряжюс встречаются редко, они расположены на более толстых осевых гифах
(табл. IX), единичные или в мутовках. Тонкие боковые гифы, распадающиеся на
артроконидии, лишены пряжек. Беспорядочного скопления пряжек, как у Pipto-
porus betulinus, у Р. gigantea не отмечено.
У Pleurotus ostreatus на культуральном мицелии образуются многочисленные
одиночные, парные, множественные пряжки. У этого вида пряжки разнообразны
по форме: плоские и высокие, круто- и слабоизогнутые, маленькие и большие,
медальонные и без зазора (табл. VHI). У Pleurotus cystidiosus пряжки более одно-
образные по форме (табл. IX), одиночные и в мутовках. Каких-либо структурных
58 образований на пряжках у исследованных видов рода Pleurotus не отмечено.
У Panus tigrinus пряжки одиночные, парные, реже множественные, преимуще-
ственно медальонные. У этого вида большинство пряжек имеют характерную фор-
му, они как бы наклонены вперед так, что угол между пряжкой и гифой составля-
ет с одной стороны 90°, а с другой — около 120°, часто наблюдается прорастание
пряжки в боковую гифу (табл. X).
У Marasmius oreades и Lepista nuda (табл. XI, ХП) пряжки преимущественно
одиночные, стабильной округлой формы, чаще медальонные. У Lyophyllum ulma-
rium поверхность участка гифы, образующая крючок пряжки в зоне роста, как
правило, имеет специфическую морщинистую поверхность’ (табл. IX), которая ха-
рактерна для клеточных стенок молодых растущих гиф этого гриба. На более старых
участках колонии, где происходит образование множественных анастомозов, в том
числе с участием пряжек, поверхность пряжек не структурирована (табл. IX).
У Coprinus comatus, C.cinereus и Pholiota adiposa, относящихся к семейству
Strophariaceae, пряжки, как и у представителей семейства Tricholomataceae.
преимущественно одиночные, медальонные, реже без зазора, однотипные по
форме (табл. IX, X, XII).
У 3 видов рода Oudemansiella преобладают медальонные одиночные пряжки.
Пряжки О. mucida - характерной приплюснутой формы. Этим они отличаются
от О. brunneomarginata и О. radicata, у которых округлые пряжки, типичные для
большинства исследованных видов агарикальных грибов (табл. XI).
У Cyathus olla — представителя гастеромицетальных грибов - пряжки в основ-
ном одиночные, реже парные и множественные, с небольшим зазором между ги-
фой и пряжкой,без каких-либо структурных образований (табл. ХП). Пряжка
иногда образует анастомоз с соседней гифой (табл. ХП).
В результате сравнительного изучения пряжек на мицелии представителей
разных таксонов в-юших съедобных базидиомицетов, впервые проведенного на-
ми методом СЭМ, показано, что у исследованных видов отсутствуют структурные
образования, аналогичные отмеченным С.Флеглером и Г.Хопером для Cyathus
stercoreus (Flegler, Hooper, 1978). Авторы обнаружили пряжки с утолщением
в виде пояска, расположенного в зоне перегородки на гифе. У всех исследованных
нами видов в месте образования пряжки мы наблюдали две обычно перпендику-
лярные перегородки без значительных утолщений. Морщинистая структура по-
верхности пряжек, выявленная у Lyophyllum ulmarium, не свойственна только
пряжкам, а характерна вообще для молодых растущих участков гифальной систе-
мы этого вида. Для отдельных видов (Panus tigrinus и Oudemansiella mucida)
форма пряжек специфична. Достаточно стабильным таксономическим признаком
для определенных видов является расположение пряжек на мицелии: одиночное,
мутовчатое, хаотическое и тд.
Отмечено значительное варьирование формы пряжек и их хаотическое скоп-
ление у Piptoporus betulinus по сравнению с исследованными видами агарикаль-
ных и гастеромицетов, что может до некоторой степени служить подтверждением
концепции примитивности Aphyllophorales.
3.5.2. Анаморфы
Процесс спорообразования и морфология спор в стадии как телеоморфы, так и
анаморфы у грибов - наиболее существенный таксономический критерий (Ches-
ters, 1968). Анаморфы высших базидиомицетов, имеющие важное значение в их
распространении в природе, могут использоваться для таксономической характе-
ристики отдельных видов и, возможно, таксонов более высокого ранга (Wat-
ling, 1979а, b).
Из 175 видов агарикальных грибов, у которых в настоящее время известно
образование бесполых спороношений, 138 образуют артроконидии, 38 — хламидо-
споры, 8 - бластоконидии (Kendrick, Watling, 1979; Watling, 1979а, b; Решетни-
ков, 1982а). Такие же бесполые спороношения формируются и у афиллофораль-
ных грибов. Однако у последних более распространенными являются бластокони-
дии (Stalpers, 1978). 59
Таллический и бластическяй. типы развития конидий были охарактеризованы
на первом рабочем совещании в Кананаскисе (Канада) в 1979 г. К таллическому
типу (артроконидии, хламидоспоры) отнесены конидии, образующиеся из всей
конидиальной клетки, к бластоконидиям - такие, которые формируются de
novo. В ряде случаев у гифомицетов наблюдаются бластические и таллические
способы развития одной конидии (Ingold, 1981). На этом основании предлагается
ограничить термин ’’бластоконидия”, сохранив его лишь для типа, сравнимого
с дрожжеподобным почкованием. О недостаточно четком разграничении понятий
артро- и бластоконидий свидетельствует также тот факт, что разными авторами
конидиальное спороноШение одного и того же вида, например Pholiota aurivella,
трактуется и как артроконидиальное (Решетников, 1982а), и как бластокониди-
альное (Vandendries, Martens, 1933). Артроконидии, в свою очередь, подразделя-
ют на голартрические и энтероартрические (Cole, Sampson, 1979). Голартрокони-
дии характеризуются тем, что в процессе образования включают в состав оболоч-
ки все слои клеточной стенки конидиогенной гифы, а энтероартроконидии обра-
зуют вокруг себя вторичную оболочку, наружные слои конидиогенной гифы не
принимают участия в ее формировании.
Б .Кендрик и Р.Ватлинг (Kendrick, Watling, 1979) отмечают, что до настояще-
го времени нет удовлетворительного определения понятия хламидоспоры. Наибо-
лее существенными признаками для определения этой структуры бесполого спо-
роношения авторами предлагаются следующие: таллическая, толстостенная, не-
опадающая, покоящаяся клетка, расположенная интеркалярно или терминально
на мицелии.
Бластоконидии и хламидоспоры приурочены к дикариотической фазе, в то
время как артроконидии найдены многими исследователями на монокариотиче-
ском мицелии. У некоторых видов (Flammulina velutipes, Pholiota aurivella) опи-
сано образование артроконидии как на моно-, так и на дикариотическом мицелии
(Vandendries, Martens, 1933; Aschan, 1954b; Arita, 1979a; Ingold, 1980; Решет-
ников, 1982a, 6).
В соответствии с задачами исследования объектами нашего изучения были
дикариотические культуры и лишь в отдельных случаях, когда это требовалось
для уточнения идентификации вида, например Coprinus comatus, — монокарио-
тические.
При микроскопировании культур у ряда видов, представляющих все иссле-
дованные порядки, выявлена стадия анаморфы. Процесс конидиогенеза нами
специально не изучался и о типе спороношения мы судили по наблюдавшимся
разным стадиям образования конидиальных структур.
Для порядка Aphyllophorales характерными бесполыми спороношениями
являются артроконидии, хламидоспоры и бластоконидии (Stalpers, 1978). Арт-
роконидии, образующиеся по голартрическому типу, наблюдаются у Pemophora
gigantea и Gloeophyllum sepiarium. Особенно четко расчленение артроконидий
прослеживается у первого вида при исследовании в СЭМ (табл. XIII). Артроко-
нидии у Peniophora gigantea образуются на симподиально разветвленных кони-
диеноспах.
В СЭМ исследовалась анаморфа Fistulina hepatica. Бластоконидии у этого
вида образуются на конидиеноспах одиночно, в цепочках или плотных кисточках
(табл. XIII, XIV). У F.hepatica наблюдаются также интеркалярные лимоновидные
хламидоспоры (табл. XIV). Дж.Сталперс и Л.Влуг (Stalpers, Vlug, 1983) приводят
сходное описание бластоконидиального спороношения у F. hepatica. По энтеро-
артрическому типу происходит образование конидий у Polyporus squamosus
(рис. 5). У Laetiporus sulphureus в культуре описано образование бластоконидий
(Nobles, 1965; Stalpers, 1978). Наблюдаются также терминальные и интеркаляр-
ные хламидоспоры, которые отмечены нами и при глубинном культивировании
этого гриба. Терминальные хламидоспоры развиваются на воздушном мицелии
Sparassis crispa.
Образование анаморфы обнаружено у 2 видов порядка Boletales. У Boletus
edulis наблюдаются вздутые круглые клетки, которые можно рассматривать
60 как хламидоспоры, а также круглые вздутия на гифах, не отпепанные перегород-
Анаморфы: а — Boletus edulis, б - Paxillus acheruntius, в — Polyporus squamosus, г — Laetiporus sul-
phureus (глубинный мицелий)
ками (рис. 5), которые некоторыми исследователями трактуются как цистиды
(Stalpers, 1978).
У Paxillus acheruntius (сем. Paxillaceae) клетки гифы с плотным содержимым,
чередующиеся с пустыми клетками, следует рассматривать как артроконидии,
а утолщенные клетки, обильно образующиеся на гифах, скорее можно трактовать
как хламидоспоры (рис. 5).
Изученные нами представители порядка Agaricales образуют в культуре раз-
личные типы конидиального спороношения. У 2 видовсемейства Pleurotaceae:
Pleurotus cystidiosus и Р. abalonus в СЭМ исследовано уникальное для высших
базидиомицетов спороношение в виде коремий. Кроме этих видов коремиальное
спороношение описано еще только у одного базидиального гриба — Collybia гасе-
mosa (Watling, Kendrick, 1977). Р. cystidiosus был выделен в новый вид из
Р. dryinus (Miller, 1969) в связи с наличием у него специфического коремиально- ,
го спороношения (табл. XV). У Р. cystidiosus коремии возникают на ножке пло-
дового тела, реже на уплотненных участках мицелия, которые предшествуют по-
явлению примордиев. Сначала вегетативные гифы образуют колонку, состоящую
из стерильных гиф, которая затем приобретает булавовидную форму (табл. XVI). 61
Анаморфы: а — Lyophyllum ulmarium, б - Gerronema josserandi, в - Agaricus maskae, г - Marasmius
androsaceus
На поверхности коремиальной головки формируются цепочки конидий в виде чер-
ной блестящей массы (табл. XVII). На воздушном мицелии, а также гифах, обра-
зующих ножку коремия, возникают одиночные бластоконидии (табл. XVII,XVIII).
Они расположены на тонких веточках, напоминающих стеригму. У исследованного
штамма Р. abalonus коремии появляются на всей поверхности колонии. Морфоло-
гия формирования. конидиального спороношения P.abalonus полностью сходна
с таковой Р. cystidiosus (табл. XV—XVII), что дает основание рассматривать
•Р. abalonus как синоним P.cystidiosus (SaSek et al., 1986).
62 ' На поверхности мицелиальной колонии Pleurotus dryinus образуются цепочки
Анаморфы: а - Agaricus bisporus, б - Agaricus arvensis, в - A.cupreobrunneus, г - A.silvaticus
толстостенных хламидоспор, которые разделяются пряжками. У Panus tigrinus -
представителя этого же семейства, в культуре постоянно присутствуют характер-
ной формы хламидоспоры. Впервые обнаружено, что у 4 видов семейства Tricho-
lomataceae имеется артроконидиальное спороношение: Lepista nuda, Lyophyllum
ulmarium, Gerronema josserandi, Oudemansiella brunneomarginata. Анаморфы
3 видов исследованы в СЭМ. У L. nuda наблюдаются длинные цепочки артрокони-
дий на симподиально разветвленных конидиеносцах (табл. XVIII). Формирование
конидий происходит по голартрическому типу. У L. nuda образуются хламидоспо-
ры. У Lyophyllum ulmarium на отдельные артроконидии распадаются молодые
боковые веточки (табл. XIX). Конидиальное спороношение у этого вида более
отчетливо просматривается в световом микроскопе (рис. 6). Артроконидии у
L. ulmarium размером 5—15 х 2—2,5 мкм голартрического типа. Артроконидии
возникают путем распадания тонких боковых веточек и у Oudemansiella brun-
neomarginata (табл. XIX). У Gerronema josserandi при микроскопическом иссле- 63
Анаморфы и гигантские клетки: а, б - Calvatia exdpulifonnis, в, г - Langermannia gigantea
довании в световом микроскопе постоянно наблюдается масса отдельных конидий
или конидиальных цепочек. Конидии образуются в результате распадения ветвя-
щихся участков гиф (рис. 6). У Lepista nuda и Gerronema josserandi стадия ана-
морфы наблюдается в культуре одновременно со стадией телеоморфы. Форми-
рование артроконидий у Fiammulina velutipes исследовано детально (Aschan, 1954b,
1960; Kemp, 1980; Ingold, 1980). Установлено, что у F. velutipes возникновение
артроконидий на гаплоидных гифах происходит по голарктическому типу, а на
дикариотических — по энтероартрическому (Решетников, 1982а, б). Нами у
F.velutipes отмечено образование терминальных и интеркалярных хламидоспор.
В СЭМ исследованы хламидоспоры Asterophora 1усорегёо1беБ(телеоморфа
Nyctalis asterophoraiy этого гриба поверхность шляпки и пластинок превращает-
ся в массу сухих орнаментированных хламидоспор (табл. XX). Хламидоспоры
64 формируются в результате модификации клеток гифы путем возникновения но-
Анаморфы и вегетативные гифы: а - Scleroderma citrinum; б - Lycoperdon pyriforme; в, г - Phallus
impudicus
вой толстой стенки и сжатия протоплазмы, что сопровождается вздутием. Р.Ват-
линг (Watling, 1979в) отмечает значительное сходство образования хламидоспор
и артроконидий видов рода Nyctalis. На перегородках, разделяющих хламидоспо-
ры, имеются пряжки (табл. XX).
Таксономическая значимость морфолого-культуральных особенностей видов
рода Agaricus показана Л.В Гарибовой с соавт., СЛ.Вассером (Гарибова, Сафрай,
1972; Гарибова, Шалашова, 1973; Гарибова, Мокеева, 1974; Гарибова, Сафрай,
1980; Гарибова, 1982; Вассер, 1985). К специфическим видовым признакам
A.arvensis, A.abruptibulus, A-campester, A.silvaticus Л.В.Гарибова (1982)
относит конидиальные спороношения (артроспоры), обнаруженные у этих
видов. При микроскопическом исследовании культур видов рода Agaricus нами
обнаружены артроконидии и хламидоспоры. Артроконидии в культуре на агари-
зованных средах отмечены у A.arvensis, A. cupreobrunneus, A.maskae, A. silvati- 65
cus. Для A. maskae характерно также формирование терминальных хламидоспор.
У A.silvaticus наблюдается образование цепочек интеркалярно расположенных
клеток, их ширина превышает ширину гифы, на которой они формируются. Такие
утолшения клетки могут рассматриваться как хламидоспоры (рис. 7). Интерка-
лярные утолщенные клетки, наблюдающиеся на гифах A.bisporus (рис. 7), также
можно трактовать как хламидоспоры. Гифы A.arvensis распадаются на отдельные
артроконидии. У A.cupreobrunneus между артроконидиями заметны участки пус-
тых клеток, образовавшиеся, очевидно, в результате конденсации протоплазмы
(рис. 7). У Macrolepiota procera формируются округлые хламидоспоры.
У 2 видов семейства Coprinaceae с помощью СЭМ исследовалось конидиальное
спороношение на дикариотическом (Coprinus comatus) и монокариотическом
(C.cinereus) мицелии.У C.comatus впервые методом СЭМ исследована структура
конидий, развивающихся на древовидно разветвленных конидиеносцах, так назы-
ваемых дендровидных структур (Orton, Watling, 1979), которые не прорастают и
не обнаруживают явления хоминга.
Нами установлено, что на концах разветвленных конидиеносцев образуются
не эллипсоидальные клетки конидий, как было описано при исследовании этого
вида в световом микроскопе, а структуры с радиально расположенными игольча-
тыми лучами (табл. XXI), которые при меньшем увеличении выглядят как ок-
руглые клетки. Аналогичные структуры у высших базидиомицетов до настоящего
времени не описаны. В культуре у C.comatus также наблюдаются цепочки хлами-
доспор, расчленяющиеся по пряжкам, подобно тому, что мы отмечали у Pleurotus
dryinus.
На монокариотическом мицелии C.cinereus образуется конидиальное спороно-
шение в виде слизистых головок (табл. XXII), состоящих из цепочек конидий на
симподиально разветвленных конидиеносцах. Характерным для C.cinereus являет-
ся также формирование склероциев (табл. XXI) в виде плотного сплетения гиф.
Конидиальное спороношение на дифференцированных конидиеносцах извест-
но у видов Pholiota (Ph. adiposa. Ph. aurivella. Ph. nameko). Конидиальные споро-
ношения видов этого рода описаны в литературе (Vandendries, Martens, 1932,
1933; Hughes, 1953; Arita, 1979a: Watling, 1979a, b). C.B .Решетников (19826,
1983) установил, что конидиогенные структуры образуются как на гаплоидном,
так и на диплоидном мицелии. В результате исследований Ph.adiposa нами показа-
но, что конидии этого гриба развиваются на дикариотическом мицелии с пряжка-
ми на симподиально разветвленных конидиеносцах или коротких веточках, отхо-
дящих от гифы (табл. XXII). Конидии в цепочках или одиночные.
Сложными структурами таксономического значения являются склероции,
образование которых характерно для Coprinus cinereus, Leucocopnnus bresadolae
и Crinipellis schevczenkovi. У первых 2 видов склероции мелкие, черные, обра-
зующиеся в результате переплетения вегетативных гиф (табл. XXI). У Crinipellis
schevczenkovi склероции крупные, до 2 см в диаметре, дифференцированные на
плотную белую центральную часть и более темную — корковую. Плодовое тело
у С.schevczenkovi развивается в непосредственной близости к склероцию и прочно
прикреплено к нему основанием ножки.
Несомненно значимым таксономическим признаком является образование
в культуре ризоморф, наблюдающееся у Armillariella mellea.
Хламидоспоры найдены у Russula grisea, который в культуре образует также
тяжи из параллельно расположенных гиф. Образование хламидоспор отмечено на-
ми у видов гастеромицетов: Calvatia excipuliformis, Langermannia gigantea, Sclero-
derma citrinum (рис. 8,9).
3.5.3. Вегетативные структуры мицелия
Рассматривая критерии, используемые для идентификации культур высших бази-
диомицетов, мы указывали (см. гл. 1), что описаны различные видоизменения
строения вегетативных гиф, их инкрустация, чему придается таксономическое
66 значение. У Peniophora gigantea на поверхности гиф образуются характерные круп-
ные кристаллы в форме цветка, у Armillarielia meliea (табл. ХХП1) и Pholiota
adiposa — мелкие игольчатые кристаллы. Сферические кристаллы во вздутых
клетках гиф имеются у Anthurus archeri, Phallus impudicus (рис. 9), ромбические
кристаллы — в культурах Clitocybe odora, Kuehneromyces mutabilis.
Бородавчатость определяется у Fistulina hepatica (табл. ХХШ) возле клеточ-
ных перегородок и на растущих кончиках гиф. Дж.Сталперс (Stalpers, 1983)
рассматривает ее как выделение эксудата. Бородавчая орнаментация гиф отмеча-
ется также у некоторых микоризообразующих грибов (Thomas, Jackson, 1982).
Она заметна у Oudemansiella bnmneomarginata и О. mucida на гифах, образующих
петли (табл. XXIII, XXIV) .
Нами впервые с помощью СЭМ у Coprinus comatus и Armillarielia meliea обна-
ружены гифы с волосками (табл. XXIV). Волоски на гифах высших базидиомице-
тов до сих пор не были описаны.
У некоторых видов в культуре образуются крупные, вздутые, часто непра-
вильной формы клетки. Они встречаются у Phallus impudicus, Calvatia excipuli-
formis, Langermannia gigantea и Clitocybe gigantea, Coprinus cinereus (рис. 8,9).
В культуре некоторых видов образуются плотные переплетения гиф мицелия,
напоминающие ткани (Miller, 1971). Так, textura epidermoides формируется у
Panus tigrinus, когда колония приобретает кожистую консистенцию: textura
intricate — у Clitocybe gigantea; textura oblita — у Armillarielia meliea.
Russula grisea, Scleroderma citrinum и Lycoperdon pyriforme (рис. 9) имеют
тяжи из параллельно расположенных или извитых гиф.
У Oudemansiella bnmneomarginata и O.mucida в СЭМ обнаружены петли, пред-
ставляющие собой более толстые, свернутые в спираль вегетативные гифы
(табл. XXIV). Аналогичные образования на мицелии некоторых видов высших
базидиомицетов в культуре наблюдала также МЛантиду с соавт. (Pantidou et
al., 1983).
Универсальным у высших базидиомицетов, как и у высших аскомицетов, яв-
ляется слияние гиф, осуществляющееся с помощью анастомозов (Stalpers, 1978;
Gregory, 1984). Многоклеточный, разветвленный мицелий высших грибов благо-
даря слиянию гиф представляет собой сеть, которая обеспечивает эффективный
обмен и передвижение питательных веществ в мицелии. Однако, несмотря на
универсальность, это явление до настоящего времени специально не исследовалось
и о его механизме, биохимической природе и других свойствах почти ничего не
известно (Gregory, 1984).
При микроскопическом исследовании анастомозы наблюдаются у многих
видов: Peniphora gigantea, Pleurotus ostreatus (монокариотические и дикариоти-
ческие изоляты), Р. calyptratus, Panus tigrinus, Gerronema josserandi, Clitocybe
clavipes, Tricholomopsis rutilans, Lyophyllum ulmarium, Marasmius oreades, Aga-
ricus arvensis, A.bemardiiformis, Macrolepiota procera, Coprinus -comatus, Cya-
thus striatus, Phallus impudicus и др. Анастомозы на мицелии некоторых упомяну-
тых выше видов исследовались в СЭМ. В одних случаях анастомозы образуются
короткими боковыми выростами гиф, как у Peniophora gigantea, или же анастомо-
зирующие гифы находятся на значительном удалении друг от друга (табл. XXV) .
На соединяющей гифе может образовываться пряжка. На более старом участке
колонии часто происходит срастание гиф без образования моста анастомоза. Ана-
стомоз может образовываться в результате слияния гифы с пряжкой. По нашему
мнению, характер образования анастомоза не является специфичным для опреде-
ленного таксона.
Ниже приведен список исследованных нами видов с указанием обнаруженных
у них микроструктур, стадий телеоморфы и анаморфы: 1
Порядок, семейство, вид
AphyUphorales
Polyporaceae
GloeophyUum septarium
Laetiporus sulphuieus
Piptoporus betulinus
Poiyporus squamosus
Peniophora gigantea
Телеоморфа я анаморфа, микроструктуры
Артоконидии, пряжки
Бластоконидии
Пряжки, анастомозы
Телеоморфа, артроконидии, пряжки
Артроконидии, .пряжки, анастомозы
67
Schizophyllaceae
Schizophyllum commune
Fistulina ceae
Fistulina hepatica
Sparassisaceae
Sparassis crispa
Boletales
Boletaceae
Boletus edulis
B. erythropus
Boletus impolitus
Suillus bovinus
S. granulatus
S. luteus
S. sibiricus
S. variegatus
Paxillaceae
Paxillus acheruntius
Agaricales
Pleurotaceae
P. calyptratus
P. columbinus
P. comucopiae
P. cystidiosus
P. dryinus
P. eryngii
P. ostreatus
P. pulmonanus
Panus conchatus
P. tigrinus
Lentinus edodes
L. lepideus
Tricholomataceae
Asterophora lycoperdoides
Gerronema josserandi
Laccaria amethystina
L.laccata
Clitocybe clavipes
C. gigantea
C. hebularis
C. odora
Lyophyllum ulmarium
Armillariella mellea
Oudemansiella brunneomarginata
O. mucida
O. radicata
Flammulina velutipes
Marasmius androsaceus
M. oreades
M. scorodonius
Crinipellis schevczenkovi
Lepista luscina
L. nuda
Tricholomopsis sulphureoides
Amanitaceae
Amanita rubescens
Agaricaceae
Agaricus arvensis
A. bemardiiformis
A. bitorquis
A. campestris
A. cupreobrunneus
A. hortensis
A. maskae
A. silvaticus
Macrolepiota procera
M. puellaris
M. rhacodes
Leucocoprinus bresadolae
Coprinaceae
Coprinus comatus
Coprinus cinereus
C. micaceus
Bolbitiaceae
Agrocybe aegerita
Strophariaceae
Stropharia wigratnMumlat»
Телеоморфа, пряжки
Телеоморфа* бластоконидии, хламидоспоры (пряжки) **
Телеоморфа, хламидоспоры, пряжки
Телеоморфа, хламидоспоры
Хламидоспоры, анастомозы
Анастомозы
Хламидоспоры, анастомозы (пряжки) •*
Анастомозы (пряжки)**
Анастомозы
Телеоморфа
Пряжки
Артроконидии, хламидоспоры, пряжки
Телеоморфа, пряжки, анастомозы
Телеоморфа, пряжки
То же
Телеоморфа, коремии, хламидоспоры, пряжки
Хламидоспоры, пряжки
Пряжки
Телеоморфа, пряжки
То же
♦»
Телеоморфа, хламидоспоры, пряжки
Телеоморфа, пряжки
Пряжки
Телеоморфа, хламидоспоры, пряжки
Телеоморфа, артроконидии, пряжки, анастомозы
Пряжки
»э
Пряжки, анастомозы
Хламидоспоры, пряжки, анастомозы
Пряжки
Телеоморфа, артроконидии, пряжки
Ризоморфы, анастомозы, волоски на гифах
Телеоморфа, артроконидии, пряжки
Телеоморфа, пряжки
То же
Телеоморфа, артроконидии
Хламидоспоры
Пряжки, глеопистиды
Телеоморфа
Телеоморфа, склероции, пряжки
Телеоморфа, пряжкй, хламидоспоры
Телеоморфа, артроконидии, хламидоспоры, пряжки
Хламидоспоры
(Пряжки) **
Артроконидии, пряжки, анастомозы
То же
Анастомозы
Пряжки
Артроконидии
Хламидоспоры
Артроконидии
Артроконидии, хламидоспоры, пряжки
Телеоморфа* пряжки, анастомозы
Анастомозы ,
Хламидоспоры
Склероции, пряжки
Телеоморфа, пряжки, дендроидные структуры
Телеоморфа, конидии, склероции, пряжки, гигантские
клетки
Хламидоспоры, пряжки
i
Телеоморфа, пряжки
Телеоморфа*, пряжки
68
Pholiota adiposa Ph. aurivella Ph. nameko Ph. squanosa Kuehneromyces mutabiiis Phallales Phallaceae Phallus impudicus Тепеоморфа, артроконидии, пряжки To же »» м Пряжки Пряжки, анастомозы, гигантские клетки, кристаллы в гифах
Anthurus archeri Rhizopogonales Rhizopogonaceae Rhizopogon luteolus Lycoperdales Lycoperdaceae Calvatia utriformis C. excipuliformis Langermannia gigantea Lycoperdon perlatum L. pyriforme Nidulariales Nidulariaceae C. striatus Scleroderma tales Sclerodermataceae Scleroderma citrinwn Гигантские клетки, iq. .сталлы в гифах Пряжки, анастомозы Хламидоспоры Хламидоспоры, гигантские клетки То же Хламидоспоры Пряжки Тепеоморфа* пряжки, анастомозы Пряжки, анастомозы Пряжки
♦Образуются только примордии.
** Признаки, которые не всегда наблюдаются.
Таким образом, проведенное нами микроскопическое исследование высших
съедобных базидиомицетов в чистой культуре позволило получить новые данные,
характеризующие особенности вегетативной стадии конкретных видов, и оценить
таксономическую значимость выявленных у них микроструктур.
3.6. Идентификация некоторых культур,
имеющих практическое значение
Идентификация культур с неустановленным систематическим положением, пред-
варительно отнесенных к высшим базидиомицетам и имеющих практическое зна-
чение, проводилась нами с использованием всех предварительно выявленных так-
сономических критериев. В основном это штаммы, которые предполагалось ис-
пользовать в качестве продуцентов пищевой биомассы, а также культуры — возбу-
дители корневой гнили сахарной свеклы, выделенные из ее корнеплодов во время
вегетации (Шевченко и др., 1974; Бухало, 1983а; Бухало, Элланская, 1984).
В последнее десятилетие в Советском Союзе опубликован ряд работ с сообще-
ниями об успешном культивировании в качестве продуцента пищевой биомассы
и некоторых химических веществ штамма трутовика чешуйчатого Polyporus
squamosus Huds. ex Fr. PS-64, выделенного в Болгарии (Морозова и др., 1978а;
1979, 1981; А.с. 616276, СССР). На основе этого штамма в НРБ организовано не-
большое производство пищевого мицелия (Торев, 1973; Морозова и др., 1978а).
А.К.Торев предлагает этот штамм для получения биомассы повышенной биологи-
ческой ценности, которую предполагается использовать как пищевую добавку
в колбасные изделия, сыры, овощную пасту и тд. (А.с. 616276, СССР).
Нами проведено культурально-морфологическое исследование штамма
P.squamosus PS-64. Гриб выращивали на суслоагаровой среде и среде Чапека, был
использован также метод микрокультур (Билай, Элланская, 1975), рекомендо-
ванный для идентификации грибов рода Fusarium.
На агаризованной среде Чапека и суслоагаровой среде культура штамма
’’PS-64” образует колонии с хорошо развитым хлопьевидно-войлочным воздуш-
ным мицелием. Колонии сначала белые, затем розовеющие, при старении приобре-
тают охряно-коричневые тона. При культивировании на агаризованных средах
и в микрокультуре на фиалидах образуются характерные для Fusarium sambuci-
num Fuck, макроконидии: веретеновидно-серповидные, со слегка согнутой резко
суженной, удлиненной верхней клеткой, с хорошо выраженной ножкой, обычно с 69
3—5 перегородками, 25—38 х 3-.5.5 мкм (табл. XXV). На вегетативном мицелии
обильно образуются коричневатые хламидоспоры, располагающиеся в цепочках,
узлах, клубочках. Гифы шириной 3—12 мкм, имеют перегородки. При старении в
клетках гиф и конидий наблюдается обильное образование жировых включений,
что характерно для Fusarium sambucinum. То, что данный штамм нельзя отнести к
высшим базидиомипетам, подтверждено также и электронно-микроскопическим
исследованием, которое установило отсутствие у него характерной долипоровой
структуры в межклеточных перегородках гиф.
Морфология штамма ’’PS-64” исследовалась .в глубинной культуре на жидкой
среде Чапека на качалках при 220 об/мин, температуре 26 °C в течение 96 ч. Посев
проводили смывом с агаровых косяков. На качалке через 12 ч высеянные макроко-
нидии интенсивна набухают и прорастают как из крайних, так и из средних клеток.
Через 24 ч на фиалидах интенсивно образовываются микроконидий (табл. XXV)
12—18 х 2,8-3,6 мкм. Они, как правило, с 1 перегородкой, активно прорастают,
образуя длинные тонкие ростовые трубки, на концах которых формируются но-
вые микроконидии.
Через 48—72 ч в культуре отмечаются такой же рост и спорообразование. От-
дельные участки гиф заполняются жировыми включениями или становятся полы-
ми, утолщаются, что свидетельствует о старении культуры. Через 96 ч ясно выра-
жены признаки старения культуры, репродукция происходит путем почкования
микроконидий.
Идентификация штамма Poiyporus squamosus ’’PS-64” по культурально-мор-
фологическим признакам позволила отнести его к Fusarium sambucinum Fuck,
var. ossicolum (Berk, et Curt.) Bilai. В связи с тем что в литературе имеются ука-
зания на токсические свойства этого гриба (Билай, Пидопличко, 1970), необхо-
дим пересмотр вопроса о возможности пищевого или кормового использования
штамма ’’PS-64”.
В условиях поливного свеклосеяния значительный ущерб хозяйствам наносит
загнивание корней сахарной свеклы во время вегетации. Оно приобретает угрожа-
ющие размеры, так как в отдельные годы это — одна из основных причин невыпол-
нения поставок свеклы в целом по КиргССР. Из загнивших тканей корнеплода са-
харной свеклы часто выделяется высоко агрессивный гриб. Он не дает плодоноше-
ний и поэтому отнесен к Mycelia sterilia. Корнеплоды поражаются сухой гнилью,
приобретая плотную консистенцию. Часто внутри пораженных корнеплодов
образуются небольшие полости, заполненные белой грибницей (Шевченко
и др., 1974).
Известно, что некоторые высшие базидиальные грибы в районах с жарким
климатом вызывают корневые гнили, ведьмины метлы и другие болезни различ-
ных сельскохозяйственных растений: сахарного тростника, *ия, кофе, какао, ге-
вейи, хлебных злаков, трав, осок и др. Возбудителями.являются преимущественно
виды близких родов Marasmius, Crinipellis, Marasmiellus (Sprague, 1950; Michael
et al., 1979). Для многих из них характерно образование склероциев. Патогенные
виды высших базидиомицетов, описанные в литературе как представители рода
Marasmius, в современной трактовке должны быть отнесены к родам Crinipellis
или Marasmiellus (Singer, 1975). Род Crinipellis очень близок к роду Marasmius.
Он отличается от последнего наличием на шляпке и ножке прижатых волосков или
чешуек. На территории Советского Союза виды, относящиеся к этим родам, изуче-
ны недостаточно, данные об их распространении и биологии малочисленны. Наи-
большее количество видов Crinipellis (5) приводится Л.Н.Васильевой для При-
морского края (1973). В Европе довольно редкий C.stipitaria (Fr.) Pat. — поч-
венный сапротроф или паразит на злаках, мхах и полукустарниках.
В стерильной культуре на свекловичном и сусловом агаре, пшеничной соломе
нами получены зрелые плодовые тела (табл. XXVI) гриба, поражающего корне-
плоды сахарной свеклы, это позволило отнести его к роду Crinipellis и описать
новый для науки вид Crinipellis schevczenkovi Buchalo (Бухало, 1983а). Гриб
назван в честь известного украинского миколога — Василия Николаевича Шевчен-
ко, много лет посвятившего изучению грибных болезней сахарной свеклы и пере-
70 ; давшего нам культуру для идентификации.
Выделение вместо культур базидиомицетов (или совместно с ними) культур
дейтеромицетов, аскомицетов, мукоральных грибов из плодовых тел шляпочных
грибов далеко не всегда является результатом недостаточной опытности экспери-
ментатора. Такое явление до определенной степени закономерно в связи с нали-
чием обширной группы микофильных грибов, приспособившихся к существова-
нию на плодовых телах высших базидиомицетов (Barnett, 1964; Griffith, Bar-
nett, 1967; Gray, Morga-Jones, 1980; Рудаков, 1981). Большинство микофиль-
ных грибов, обитающих на высших базидиомицетах, относится к родам Sepedoni-
um, Mycogone, Ampelomyces, Fusarium, Trichoderma, VerticiUium и др. Это в ос-
новном некротрофы или сапротрофы, которые могут проявлять также и свойства
симбиотрофов. С помошью специальных исследований обнаружено, что даже
внешне здоровые плодовые тела трутовиков содержат симбиотрофные грибницы
таких видов, как Mortierella isabellina, Mucor racemosus, Trichoderma lignorum,
Mucor stoloniferum и др. (Parmasto, 1974; Рудаков, 1981).
Следовательно, правильная идентификация полученной из ткани плодового
тела высшего базидиомицета мицелиальной культуры имеет первостепенное
значение.
При определении вида высшего базидиомицета по вегетативной стадии в от-
сутствии высшего плодоношения исследователь сталкивается с необходимостью
проводить идентификацию по признакам, которые обычно не используются в тра-
диционной систематике грибов этой таксономической группы. Однако для иденти-
фикации могут быть избраны критерии на любой стадии жизненного цикла гриба
(Chesters, 1968; Агх, 1970) . При культуральных исследованиях важно учитывать
признаки на определенной питательной среде и в определенной фазе развития
культуры. Значение отдельных признаков при установлении таксона зависит от их
постоянства и точности, с которой эти признаки могут быть описаны качественно
и количественно.
Не все таксономические признаки одинаково информативны и по-разному
отражают корреляции с естественными таксонами. ЭА1айр (1971) считает, что
систематик должен искать компромисс между использованием слишком большо-
го и слишком малого количества признаков. Анализ чрезмерно обширного мате-
риала требует много времени, приводит к избыточности данных, а результат ос-
тается неизменным.
Наши исследования культур высших съедобных базидиомицетов были направ-
лены в основном на выявление значимых признаков на уровне вида, так как съе-
добность есть свойство вида, не проявляющееся на более высоких таксономиче-
ских уровнях (кроме монотипных родов). Правильная идентификация видовой
принадлежности культур является задачей первостепенной важности. Отдавалось
предпочтение признакам, которые имеют диагностический аспект, однозначно оп-
ределяя объект, и, в меньшей мере, признакам, которые выявляют родство на
уровне более высоких таксонов. Хотя при идентификации грибов главным обра-
зом используются морфологические критерии, современная систематика придает
большое значение также данным, получаемым при изучении физиологии, биохи-
мии, экологии видов. Каждый дополнительно используемый тип признаков увели-
чивает информацию.
Консервативным таксономическим признаком, характеризующим высшие
базидиомицеты на уровне класса, является межклеточная долипоровая перегород-
ка. Долипоровая перегородка Pleurotus ostreatus представлена в табл. XXVU.
При идентификации культур высших базидиомицетов важно правильно оце-
нить индивидуальную изменчивость вида на протяжении жизненного цикла во всех
ее формах, определить возрастные различия, изменения, вызванные факторами
культивирования, установить полиморфизм. Необходимо выяснить, является ли
данный морфотип отдельным видом или только фенотипом внутри изменяющейся
популяции. Для этого необходимо исследовать вид на протяжении его жизнен-
ного цикла. Характеризуя вегетативный морфогенез у высших базидиомице-
тов, Дж.Смитт и ДБерри (Smith, Berry, 1974,1978) указывают на гетерогенность 71
вегетативного мицелия, развивающегося воздушно, на поверхности или внутри
субстрата. Да и сама гифальная нить, как показано экспериментально, гетерогенна
по возрасту и метаболической активности. Субстратные гифы у исследованных
нами культур обычно развивают ризоиды, тяжи и ризоморфы. На воздушных ги-
фах формируются конидиальные спороношения и склероции.
Дж.Барнетт (Burnett. 1976) рассматривает апикальный рост гифалыюй нити
как первичный, а интеркалярный — как вторичный. Ко вторичному росту автор
относит утолшение стенок, образование скелетных гиф, хламидоспор, склероци-
альных клеток, а также секрецию материалов из гифы. Это отмечено нами у
Fistulina hepatica. Образование бластоконидий ДжЪарнетт рассматривает как
деформирующий рост.
Не все формы вегетативного морфогенеза имеют одинаковое таксономиче-
ское значение. К ключевым признакам в понимании ЭМайра (1971) может быть
отнесена стадия анаморфы, и в частности тип конидиального спороношения.
Здесь на первое место выступает редкость признака (Смирнов, 1969). Если ко-
ремиальный тип спороношения, который наблюдается у Pleurotus cystidiosus,
дает возможность с определенностью идентифицировать вид по этому признаку,
то артроконидиальный тип спороношения, какой мы наблюдаем, например, у
Peniophora gigantea, имеется у многих видов. При идентификации он может
быть использован в комплексе с другими признаками. Здесь действует общее
правило: чем реже встречается видовой признак, тем лучше он характеризует
вид (Смирнов, 1969; Майр, 1971).
К редким морфологическим признакам у высших базидиомицетов можно
отнести также образование склероциев у Leucocoprinus bresadolae,1 Crinipellis
schevczenkovi, у некоторых видов рода Coprinus, ризоморф у Armillariella mellea,
окраску колоний у Laccaria amethystina и др. В то же время один и тот же приз-
нак может иметь различную ценность в разных таксонах, что зависит от степени
постоянства данного признака в этой группе. Если признак имеется у всех видов
рода, то он вообще утрачивает значение видового. Примером этому может служить
наличие пряжек на мицелии. Для большинства исследованных видов этот признак
не является определяющим. Большое значение имеют частота встречаемости и рас-
положение пряжек на мицелии, а у некоторых видов (Panus tigrinus, Oudemansiel-
la brunneomarginata) на первое место выступает форма пряжек.
Хламидоспоры многими авторами рассматриваются как наименее дифферен-
цированные органы вегетативного размножения (Miller, 1971; Билай, 1977;
Kendrick, Watling, 1979). Однако в ряде случаев, например у Asterophora lycpper-
doides, Pleurotus dryinus, особенности формирования хламидоспор, их строение
могут служить ключевым признаком при идентификации этих видов. Очевидно,
образование хламидоспор у высших базидиомицетов не является только реакцией
на неблагоприятные условия внешней среды. У многих видов образование хлами-
доспор происходит постоянно в период интенсивного роста мицелия и в неболь-
шой степени зависит от условий культивирования. Это отмечено нами у Panus
tigrinus, Lepista luscina, L. nuda, Marasmius androsaceus, Macrolepiota rhacodes,
Calvatia excipuliformis, C.utriformis и др. К такому же мнению относительно
образования хламидоспор у видов Fusarium приходит В.И.Билай (1977). Автор
во многих случаях наблюдала образование хламидоспор задолго до истощения
питательного субстрата.
У высших базидиомицетов отмечены изменения в морфологии роста и разме-
рах клеток, структуре клеточного содержимого, которые имеют приспособитель-
ный характер или вызваны возрастными изменениями в метаболизме. Очевидно,
искривление гиф, образование извитых гиф, гигантских клеток можно отнести
к показателям физиологического состояния культуры. К таким отклонениям
в морфологии, независимо от вызывающей их причины, применяют термин ’’мор-
фа”, который был впервые введен А.С.Семеновым-Тян-Шанским в 1910 г. (Пала-
марь-Мордвинцева, 1982). АЛ.ТахГаджан (1954) относит подобные тератологиче-
ские процессы к аномалиям, являющимся отклонением в механизмах развития.
Возможно, к такой категории можно отнести и наблюдающееся в культуре образо-
72 вание петель на мицелии, как было показано нами у видов Oudemansiella. Причина
возникновения морф часто неясна и в связи с этим использование их для целей
таксономии вряд ли целесообразно.
У сумчатых, базидиальных и несовершенных грибов происходит слияние гиф
путем образования анастомозов. Чаще происходит слияние гиф одного вида. Од-
нако использование анастомозов в качестве таксономического теста в настоящее
время сомнительно (Burnett, 1976).
При оценке значимости физиологических критериев, используемых при иден-
тификации высших базидиомицетов, следует исходить из теории микроэволюции
грибов (Горленко, 1984). Она предполагает наличие внутри вида физиологических
или экологических рас, отличающихся по ряду биологических свойств, в том числе
по образованию биологически активных веществ. Нами исследовались такие фи-
зиологические критерии, как скорость рдста, отношение к температурному факто-
ру и наличие определенных ферментов (фенолоксидаз). Присутствие окислитель-
ных ферментов в культурах высших базидиомицетов, хотя и является достаточно
постоянным у изолятов одного вида, однако не может быть отнесено к редким
признакам, так как реакции сходны у многих исследованных видов. Следователь-
но, этот признак для идентификации также должен использоваться в комплексе.
Скорость роста, текстуру и окраску мицелиальной колонии на стандартной
питательной среде следует отнести к дополнительным признакам, хотя у некото-
рых видов они могут выступать как ключевые.
При оценке температурного критерия нужно придавать значение характерис-
тике роста культур при крайних температурах, где отмечены наибольшие разли-
чия у разных видов. Здесь так же, как и в отношении скорости роста, имеется
определенная штаммовая вариабельность, которая должна быть оценена исходя
из общей картины вариабельности данного признака в пределах вида. Вариабель-
ность исследованных физиологических признаков в пределах вида может быть
установлена более полно при изучении возможно большего количества штаммов
одного вида.
Следовательно, к ключевым признакам на видовом уровне, которые отлича-
ются малой изменчивостью, можно отнести образование в культуре стадии телео-
морфы, для отдельных видов — стадии анаморфы, расположение пряжек на мице-
лии, их форму. К признакам, более изменчивым или широко распространенным
у большинства исследованных видов, которые могут использоваться как допол-
нительные, следует отнести наличие пряжек на мицелии, текстуру и окраску коло-
ний, скорость роста, отношение к температурному фактору. Выявленные таксоно-
мические признаки отражают биологические особенности высших базидиальных
грибов.
Изучение высших съедобных базидиомицетов на агаризованных питательных
средах послужило предварительным этапом отбора штаммов, перспективных в ка-
честве продуцентов биомассы. На этом этапе были охарактеризованы морфологи-
ческие особенности выделенных культур и отобраны штаммы с достаточно четки-
ми морфологическими признаками, позволяющими с уверенностью отнести их к
высшим базидиомицетам. Из последующего исследования были исключены штам-
мы, проявившие очень слабый рост и инфицированные бактериями.
Дальнейшим этапом селекционного скрининга явился отбор на жидких пита-
тельных средах, который проводился непосредственно в условиях глубинного
культивирования.
ГЛАВА 4
ПЕРВИЧНЫЙ ОТБОР ШТАММОВ СЪЕДОБНЫХ ГРИБОВ
ДЛЯ ГЛУБИННОГО КУЛЬТИВИРОВАНИЯ
Первичный отбор штаммов высших съедобных базидиомицетов для получения
пишевой биомассы является необходимым этапом на долгом пути селекции про-
дуцентов. Промышленная генетика неизбежно проходит через отбор (скрининг)
нужного генотипа. Если он не найден,, вся дальнейшая работа бессмысленна.
Селекция штаммов грибов для промышленного производства имеет два ас-
пекта: улучшение использующихся продуцентов и поиск новых (Rowlands, 1983).
Примером постоянного улучшения в процессе селекции могут служить штаммы,
использующиеся в производстве антибиотиков, продуктивность которых за мно-
гие годы возросла в десятки тысяч раз по сравнению с начальной. Селекция штам-
мов высших съедобных базидиомицетов — продуцентов пищевой биомассы нахо-
дится на начальном этапе, в связи с чем особенно важно выработать правильную
стратегию проведения скрининга.
Изучение микроэволюционных процессов началось в 30-е годы нашего столе-
тия. Показано (Тимофеев-Ресовский и др., 1973), что главная особенность всех
видов живых организмов — огромная гетерогенность и пластичность природных
популяций. Основной источник изменчивости — мутационный процесс. Хотя му-
тации в природных популяциях сравнительно редки и слабо выражены, разные
популяции могут значительно отличаться по частоте и выраженности мутаций,
что вызывает необходимость постоянного выдележя новых диких штаммов, же-
лательно из разных частей ареала (Тимофеев-Ресовский, Яблоков, 1974; Row-
lands, 1983; Горленко. 1984; Захаров, 1984). М.В.Горленко (1984) подчеркивает,
что гетерогенность у грибов имеет важное практическое значение, она требует вес-
ти поиск продуцентов в разных климатических районах и географических зонах,
где могут встречаться различные физиологические или экологические расы одного
и того же морфологического вида гриба.
Промышленная генетика использует два типа отбора: скрининг ’’наугад”,
т.е. когда на желаемое качество испытываются все штаммы, и ’’рациональный”
скрининг, основанный на какой-либо форме предварительного отбора.
Проведенное нами изучение культур высших съедобных базидиомицетов на
агаризованных питательных средах явилось предварительным этапом отбора по
морфологическим признакам, а также до некоторой степени по скорости роста
и продуктивности. Однако показатели скорости роста и продуктивности на агари-
зованных средах не всегда коррелируют с таковыми в глубинной культуре. Дан-
ные, полученные на агаризованных средах по этим показателям, следует использо-
вать ограниченно. В принципе всякий рациональный скрининг, основанный на кор-
реляции каких-либо признаков с желаемыми свойствами продуцентов, несет эле-
мент субъективности и может не оправдаться, если коррелирующий признак обу-
словлен другими причинами.
Корреляция установлена при скрининге некоторых вторичных метаболитов,
например между антибиотической и протеолитической активностью (Rowlands,
1983). При отбре штаммов, обладающих противоопухолевым действием, нами
использована корреляция между антибиотической и антибластомной активностью.
Существуют различные теории образования у грибов вторшшых метаболитов,
которые определяют стратегию поиска продуцентов. Согласно теории несбаланси-
рованного питания, развиваемой А.Роузом (Rose, 1979а), при лимитации питания
метаболизм перестраивается с роста на поддержание своего существования. Поэто-
му поиск продуцентов следует вести в условиях широкого варьирования питания,
где имеется селективное воздействие таких факторов, как бедные почвы, повы-
шенная сухость, периодическое затопление.
По теории отклонения метаболизма, развиваемой ГДахнером (Zahner, 1978),
продукция вторичных метаболитов является результатом мутационного процесса.
В связи с этим поиски продуцентов проводят в условиях, при которых происходят
74 интенсивные мутации (радиоактивные почвы, лабораторная мутагенная популяция).
По теории Энсинга (Rose, 1979а), вторичные метаболиты имеют свою функ-
цию в организме — ингибируют конкурентную микрофлору, процессы прораста-
ния и т д. Они постоянно поддерживаются в популяции. На наш взгляд, эта теория
наиболее обоснованна. Образование биологически активных веществ — неотъем-
лемое свойство высших базидиальных грибов, которые в природе постоянно осу-
ществляют разложение многих сложных субстратов, вступают во взаимодействие
с конкурентной микрофлорой. Деструкция природн’та биополимеров (целлюло-
зы, лигнина, хитина и др.) грибами происходит под воздействием вырабатывае-
мых ими полиферментных систем (Клесов, 1984). Апикальный рост гифы у ми-
целиальных грибов сопровождается образованием таких ферментов, как протеа-
зы, глюканазы (Smith, Berry, 1974).
В то же время эта теория не указывает путей поиска активных штаммов. Ло-
гично предположить наличие у конкретных видов грибов определенных биологи-
чески активных веществ в связи с их функцией в природе, т.е. экологической
приуроченностью. Следует, однако, учитывать, что в настоящее время существуют
значительные трудности идентификации трофических групп высших базидиомице-
тов. Дискуссионен вопрос о различиях между двумя основными экологическими
группами макромицетов: сапротрофами и микоризообразователями. Л.Г.Бурова
(1984) считает, что выделенные трофические группы отличаются лабильностью
типа питания и неустойчивостью связи с определенной древесной породой или
субстратом. Многие симбиотрофы более или менее продолжительное время суще-
ствуют сапротрофно в стадии свободноживущего мицелия. Автором в раститель-
ных сообществах, находящихся в неблагоприятных условиях температуры, влаж-
ности, питания, отмечена потеря облигатности связей симбиотрофов с определен-
ными растениями. В то же время Л.Г Дурова придерживается взглядов некоторых
авторов о том, что симбиотрофы лишены ферментов, участвующих в разложении
лигнинового комплекса, в частности лакказы, не образуют антибиотиков. Такая
точка зрения не подтверждается рассмотренными выше литературными данными
и проведенными нами исследованиями. Так, положительная реакция на лакказу
(табл. 6) определена нами у симбиотрофных видов родов Boletus, Suillus, Amani-
ta, Clitocybe, Lactarius и др. Антибиотические вещества известны у таких микори-
зообразователей, как Lactarius deliciosus, Clitocybe nebularis, C. gigantea, C.illu-
dens и др. (Биосинтетическая деятельность ..., 1969). Это свидетельствует об ис-
кусственном, до определенной степени, характере выделяемых в настоящее время
экологических групп макромицетов, диктует необходимость уточнения и nejr -
смотра критериев, на основании которых выделены эти группы.
При селекционном отборе штаммов высших съедобных базидиомицетов нами
применялся наиболее рациональный многоступенчатый скрининг. Он позволяет
устранить артефакты и отобрать штаммы с несколькими желаемыми свойствами,
отвечающими условиям культивирования продуцента на конечном этапе. В случае
многоступенчатого отбора селекционное воздействие осуществляется последова-
тельным чередованием условий культивирования на каждом уровне. Следующим
этапом после отбора на агаризованных средах явился отбор быстрорастущих и
продуктивных штаммов в глубинной культуре на качалках на стандартной лабора-
торной питательной среде (пивном сусле).
Отбор проведен нами среди представителей разных таксономических и эколо-
гических групп по ряду признаков, существенных для продуцентов биомассы в
глубинной культуре. Отбирались штаммы, активно накапливающие биомассу.
Исследовался морфогенез, была определена штаммовая специфичность к основ-
ным источникам питания, стимуляторам роста, pH среды. Проводился подбор
субстратов для глубинного культивирования из отходов промышленности и сель-
ского хозяйства. Для более полной характеристики штаммов съедобных грибов,
интродуцируемых в глубинную культуру, исследовалось образование некоторых
биологически активных веществ.
75
4.1. Изучение питательных потребностей грибов
Выращивание мицелия высших базидиальных грибов в искусственных условиях
требует изучения их отношения к факторам внешней среды, которые регулируют
накопление биомассы или желаемых продуктов метаболизма. Изучение питатель-
ных потребностей позволило установить физиологические особенности определен-
ных штаммов, а также использовать полученные результаты в дальнейшей работе
по оптимизации. питательных сред, выбору субстратов для крупномасштабного
культивирования. На жидких синтетических питательных средах исследовали
рост при различном значении показателя концентрации водородных ионов (pH)
в питательной среде, на питательных средах с разными источниками углерода,
азота, стимуляторами.
4.1.1. Концентрация водородных ионов в питательной среде
Одним из важнейших факторов, регулирующих рост и метаболизм высших бази-
диомицетов в культуре, является pH питательной среды. Большинство видов спо-
собно расти при значительных изменениях показателей кислотности, хотя для мно-
гих оптимальные значения находятся в пределах pH 5—6 (Шиврина и др., 1969).
Существует мнение, что настоящие микоризообразоватепи хорошо растут при кис-
лых значениях pH среды, хуже — при нейтральных, а при щелочных совсем не раз-
виваются (Melin, 1922, 1923; Modess, 1941; .Шемаханова, 1962). Грибы, принад-
лежащие одной и той же экологической или систематической категории, могут
значительно отличаться по отношению к исходному pH среды, изменяя его в бла-
гоприятную или неблагоприятную для роста сторону. Это зависит как от состава
питательной среды, так и от физиологических особенностей гриба (Шиври-
на и др., 1969).
В.Рипачек (1967) указывает на свойство видов, способных разрушать целлю-
лозу (возбудителей белой гнили), регулировать кислотность среды до более низ-
ких значений pH, по сравнению с лигниноразрушаюшими грибами (возбудителями
бурой гнили). По его мнению, штаммы одного и того же вида, выделенные из раз-
ных местообитаний, различаются по отношению к pH среды. О.П.Низковская и
НМ .Милова (1973), изучавшие влияние исходного pH питательной среды на обра-
зование мицелия культурами базидиомицетов, установили, что имеются культуры
как с высокой, так и с низкой оптимальной кислотностью, у некоторых видов от-
мечено два оптимума кислотности.
Концентрация водородных ионов в среде оказывает существенное влияние на
характер метаболических процессов. В связи с этим представляется необходимым
предварительно установить те пределы pH, в которых происходит активный рост
исследуемых штаммов. Учитывая при этом, что оптимальный pH среды будет раз-
личным на разных средах, зависеть от других условий культивирования и может
быть точно определен лишь для конкретных условий проведения ферментацион-
ного процесса.
Среди представителей порядка Agaricales в диапазоне pH от 1—3 до 10 растет
32 % исследованных штаммов. Это преимущественно лигнотрофные виды Pleuro-
tus ostreatus, Panus conchatus, P.tigrinus, Lentinus lepideus, Pholiota aurivella,
а также некоторые виды сапротрофов и микоризообразователей: Clitocybe nebula-
ris, Lepista nuda, Agaricus arvensis, Coprinus comatus. В узких границах кислот-
ности среды растут Marasmius oreades, Armillariella mellea, Coprinus ephemeras.
У Agaricus bisporus, Armillariella mellea, Coprinus ephemeras и Marasmius scorodo-
nius максимальное количество мицелия образуется при кислых исходных значени-
ях pH среды. В процессе роста эти грибы подкисляют среду.
Некоторые штаммы таких видов, как Suillus variegatus, Oudemansiella radica-
ta, Flammulina velutipes, Lepista nuda и другие, образуют наибольшее количество
мицелия при нейтральных и щелочных начальных значениях pH. Panus tigrinus,
P.conchatus, Marasmius oreades, Pholiota adiposa и другие виды в процессе роста
76 изменяют pH среды до оптимальных для их роста значений. У некоторых видов
максимальное образование мицелия отмечено при двух значениях pH среды:
у Agaricus arvensis — 5 и 9, у Pholiota adiposa и Pleurotus ostreatus — 6 и 9.
54 % штаммов исследованных представителей порядка Aphyllophorales растут
при pH среды от 2—3 до 10. В кислой зоне при pH 1—6 хорошо растут Fistulina
hepatica, Sparassis crispa и Piptoporus betulinus. Мы не отметили существенной
разницы в изменении кислотности среды видами, вызывающими белую и бурую
гнили. Гастеромицеты, кроме Phallus impudicus, начинают расти при pH среды не
ниже 4 и в процессе роста подкисляют среду.
На основании полученных данных о влиянии pH среды на рост изученных
45 видов высших базидиомицетов, среди которых имеются представители 8 по-
рядков и различных экологических групп, можно сделать вывод, что значения
pH среды, благоприятные для роста, специфичны и определяются физиологиче-
скими особенностями штамма. В широких границах кислотности среды растут
многие лигнотрофные виды. Тот факт, что все исследованные штаммы активно
растут при pH 5—6, дает основание рекомендовать проводить первичный отбор
штаммов высших базидиомицетов при данном значении pH. Оптимальный pH
для роста каждого отобранного активно растущего штамма на более поздних
этапах отбора устанавливался непосредственно на той питательной среде, кото-
рая была подобрана для его культивирования.
4.1.2. Источники углерода
Углеродсодержащие субстраты играют главную роль в питании грибов, обеспечи-
вая грибной организм углеродом, необходимым для синтеза веществ живой клет-
ки и участия в процессах окисления, где он является единственным источником
энергии. Высшие базидиомицеты, представляющие собой различные экологические
группы, сталкиваются в природе с большим разнообразием углеводов, чаще всего
с полимерными формами простых сахаров. При искусственном культивировании
они предпочитают сахара другим источникам"углерода. Существует мнение, что
глюкоза является универсальным источником углерода для всех высших базидио-
мицетов, хотя она и не всегда обеспечивает максимальный рост мицелия. Для
большинства этих грибов таким же хорошим источником углерода, как глюкоза,
служит фруктоза (Шиврина и др., 1969; Berry, 1975).
Многие подстилочные и дереворазрушающие грибы из пентоз хорошо исполь-
зуют ксилозу, в то время как арабиноза утилизируется ими очень слабо (Fries,
1955; Worgan, 1968; Berry, 1975). По литературным данным, на ксилозе лучше
всего растут виды рода Agaricus (Treschow, 1944), хорошо растут — Coprinus
(Fries, 1955; Зарудная, 1971). Для многих базидиомицетов из спиртов пригодны
маннит и глицерин (Шиврина и др., 1969; Бухало и др., 1972; Маслова, 1973;
Berry, 1975; Gupta, Pathak, 1982).
Всеми высшими базидиомицетами из дисахаридов потребляются мальтоза и
целлобиоза. Сахароза не является универсальным источником углерода для этих
грибов, а лактоза используется наименьшим количеством исследованных штам-
мов (Шиврина и др., 1969; Johri, Brodie, 1972; Маслова, 1973; Berry, 1975;
Wright, Hayes, 1979).
Наилучшим источником углерода для ряда видов является крахмал (Fries,
1955; Worgan, 1968; Маслова, 1973; Sakamoto et al., 1978a, b). Для видов родов
Tricholoma, Agaricus хорошим источником углерода служат пектиновые вещества,
хуже усваиваются декстрины (Treschov, 1944; Fries, 1955; Worgan, 1968; Oyama
et al., 1974).
Базидиомицеты в природе принимают участие в разложении целлюлозы и хо-
рошо используют этот высокомолекулярный углевод при искусственном культи-
вировании. Лигнин используется многими дереворазрушающими и подстилочны-
ми грибами в природе. Однако в культуре для усвоения грибами он должен нахо-
диться в доступной форме, и грибы, как правило, должны быть к нему адаптиро-
ваны (Шиврина и др., 1969; Berry, 1975).
Усвоение высшими базидиомицетами углеводородов в литературе освещено 77
Таблица 7. Рост исследованных культур высших базшвюмииетов на средах с разными источниками
углерода
Мицелий, % сухой массы на среде с глюкозой
Вид, штамм кси- лоза галак- тоза саха- роза лак- тоза маль- тоза рафи- ноза крах- мал ман- нит
Himeola auricula-iudae 733 79 121 114 250 193 107 143 357
Coriolus zonatus 301 44 52 96 148 152 22 152 56
Gloebphyllum sepiari- um 326 87 166 74 84 61 79 92 63
Schizophyllum commu- ne 96 60 69 107 82 118 56 87 60
S. commune 97 121 184 ПО 152 100 95 189 200
Sparassis crispa 314 52 65 94 87 109 91 61 65
Pleurotus ostreatus 1300 74 56 100 44 78 81 74 107
Panus conchatus 81 94 23 0,7 50 69 18 92 29
P.tigrinus 131 227 227 218 254 472 363 436 173
Armillarielia meliea 40 43 19 10 39 99 19 72 18
Fiammulina velutipes 112 115 62 77 115 96 62 96 73
Marasmius scorodonius 78 67 100 100 150 933 17 150 67
очень неполно. Т.Сугимори с соавт. (Sugimori et al., 1971) приводят данные об ис-
пользовании высшими баэидиомицетами, в том числе Pleurotus ostreatus, Fiammu-
lina velutipes, Lentinus edodes и Schizophyllum commune, неуглеводных источни-
ков углерода:алифатических спиртов, n-алканов, органических кислот трикарбо-
нового цикла.
ФЛийкстра (Dijkstra, 1976) при глубинном культивировании Agaricus bispo-
rus и Coprinus comatus на метаноле, этаноле, декане, тетрадекане и гексадекане
наблюдал слабый рост этих видов.
В качестве единственного источника углерода на синтетической среде нами
испытаны моносахариды — ксилоза, глюкоза, галактоза; дисахариды — сахароза,
мальтоза, лактоза; трисахарид — рафиноза;полисахариды— крахмал, сахароза;
спирт — маннит. Контролем служила питательная среда с глюкозой. Кроме того,
в качестве источника углеродного питания испытаны целлюлоза, лигнин и неугле-
водные источники — мягкий парафин и этанол.
Интенсивность роста исследованных видов, культивированных на питательных
средах с разными источниками углерода, различается (табл. 7). Так, Panus tigri-
nus, Fiammulina velutipes и Kuehneromyces mutabilis лучше усваивают ксилозу
по сравнению с глюкозой, однако большинство видов хуже растут на питательной
среде с ксилозой.
Глюкоза является наилучшим источником углерода для Armillarielia meliea
и Pholiota adiposa. Больше биомассы на среде с галактозой, чем на среде с глюко-
зой, образуют Schizophyllum commune, Panus tigrinus, Coprinus comatus, Agaricus
silvaticus и другие виды.
Из испытанных дисахаридов лучше используется мальтоза. Более активно, чем
на других истоадиках углерода, на ней растут Schizophyllum commune, Panus tig-
rinus, Marasmius scorodonius, Macrolepiota procera, Coprinus ephemeras, Sparassis
crispa, Pholiota auriveila.
Лактоза и рафиноза усваиваются хуже, чем другие источники углерода. Мно-
гие испытанные виды — Agaricus arvensis, Kuehneromyces mutabilis, Panus tigri-
nus, Coprinus comatus и другие глюкозе предпочитают крахмал.
В связи с экологической приуроченностью ьиогих представителей высших
базидиоьицетов к растительным субстратам в настоящее время ведутся поиски
штаммов, способных разлагать целлюлозе- и лигнинсодержащие субстраты, обога-
щать их белком, углеводами, витаьетнами и другими питательными веществами.
Нам представлялось целесообразным охарактеризовать пггаммы, обнаружившие
активный рост в глубинной культуре, с точки зреиця их способности усваивать
эти источники углерода.
На среде Норкранс с фильтровальной бумагой в качестве единственного ис-
торика углерода культивировали 35 видов базидиоьещетов. Многие виды актив-
78 но растут на этой среде. К ним относятся лигнотрофные виды из родов Panus,
Pieurotus, Flammulina, Pholiota, Lepista и Schizophyllum, подстилочные и гумусо-
вые сапротрофы Agaricus arvensis, Macrolepiota procera, Oudemansiella radicata
и др. Способность расти на среде с фильтровальной бумагой обнаружили также
некоторые виды, образующие микоризу: Russula grisea, Suillus variegatus, Lacta-
rius helvus, Lepista nuda и др. БЛоркранс (Norkrans, 1950) отмечает высокую
целлюлозолитическую активность микоризообразующих видов рода Tricholoma.
Не растут на этой питательной среде испытанные штаммы Langermannia gigantea,
Suillus bovinus, S. granulatus и др.
Наиболее высокой активностью целлюлозолитических ферментов характери-
зуются виды, приуроченные в природе к целлюлозосодержащим субстратам:
Panus tigrinus, Pleurotus ostreatus, Flammulina velutipes, Crinipellis schevczenkovi
и Armillariella mellea. Из культуральной жидкости P.ostreatus 1300 выделен фер-
ментный препарат (Даниляк, 1980; Мельничук, Данил як, 1981). Эти виды перс-
пективны для дальнейших исследований.
Нами изучен рост штаммов Panus tigrinus 131 и Pleurotus ostreatus 1300 на
некоторых целлюлозо- и лигнинсодержащих субстратах — отходах сельского
хозяйства и деревообрабатывающей промышленности (отрубях, опилках, соло-
ме) . На этих субстратах, инокулированных глубинным мицелием, оба штамма
растут хорошо, a P.tigrinus плодоносит через 10—15 сут. В процессе роста мицелия
происходят разложение целлюлозы и лигнина, обогащение грибным протеином и
углеводами. Содержание сырого протеина в обогащенной грибным мипелием со-
ломе и пшеничных отрубях составляет 10—20 и 16—26 % соответственно.
Для установления лигнинразрушающей способности высших базидиомицетов
широко применяется реакция Бавендамма (Рипачек, 1967). Из 24 видов базидио-
мицетов, испытывавшихся на среде с галловой кислотой, 19 дали положительную
реакцию. Среди них лигнотрофы Armillariella mellea, Flammulina velutipes, Kuehne-,
romyces mutabiiis, Panus conchatus, Pholiota adiposa, Ph. aurivella и другие, а также
виды, не обитающие в природе на древесных субстратах: Agaricus arvensis, A.silva-
ticus, Macrolepiota procera, Coprinus ephemerus, Lactarius helvus, Scleroderma
citrinum.
О способности грибов разлагать лигнин судят также по наличию характерных
цветовых химических реакций на фенолоксидазы. Результаты проведенных иссле-
дований цветовых реакций у видов высших съедобных базидиомицетов приведены
нами в предыдущей главе (табл. 6).
В качестве источника углерода был испытан мягкий парафин, на котором на-
ми ранее отмечен хороший рост дейтеромицетов (Bilai et al., 1968). На мягком
парафине растут Coriolus zonatus, Schizophyllum commune, Armillariella mellea,
Himeola auricula-judae, Agaricus silvaticus, Coprinus ephemerus, Lepista nuda,
Pholiota aurivella, Pleurotus ostreatus, Scleroderma citrinum. Первые 4 вида растут
лучше остальных при том что рост всех испытанных штаммов очень слабый. Хотя
данные о росте высших базидиомицетов на углеводородах в литературе практиче-
ски отсутствуют, очевидно, базидиомнцеты усваивают их хуже по сравнению с
грибами из других систематических групп (Билай, Коваль, 1980). Полученные
результаты в основном согласуются с литературными сведениями о потребностях
высших базидиомицетов в источниках углеродного питания: лучший рост наблю-
дается на сахарах. Выявлены штаммы, хорошо усваивающие целлюлозу.
4.1.3. Источники азота
Выбор источника азота очень важен для получения хорошего роста мицелия в
культуре и высокого содержания в нем протеина. Потребность грибов в азоте в
значительной мере зависит от снабжения их углеродом, а также от других факто-
ров (Маслова, 1969; Биосинтетическая деятельность ..., 1969; Berry, 1975; Dijkst-
ra, 1976). Высшие базидиомнцеты могут использовать как неорганические, так и
органические формы азота. Основными источниками неорганического азота яв-
ляются аммонийные соли и нитраты. По мнению некоторых исследователей
(Treschow,1944; Биосинтетическая деятельность ..., 1969; Маслова, 1969; Berry, 79
1975; Dijkstra, 1976), нитраты ле усваиваются или усваиваются плохо многими
высшими базидиомицетами. Имеются, однако, сведения, что некоторые виды ро-
дов Tricholoma, Coprinus, Collybia, Lentinus хорошо используют нитраты (Ra-
waid, 1963; Маслова, 1969; Зарудная, 1971; Бухало и др., 1972).
Органический азот обычно обеспечивает лучший рост мицелия, чем минераль-
ные соли азота (Биосинтетическая деятельность ..., 1969; Маслова, 1969; Dijkstra,
1976). Из органических источников азота для выращивания мицелия съедобных
грибов используются мочевина и аминокислоты. Как один из благоприятных ис-
точников азота отмечается аспарагин (Berry, 1975). Хорошими источниками азота
для высших базидиомицетов являются белки, пептоны, свободные аминокислоты,
гидролизат казеина. При исследовании физиологии грибов рода Coprinus (Fries,
1955; Зарудная, 1971) показано, что у них существуют видовые и штаммовые раз-
личия усвоения разных форм азота. Одни штаммы Coprinus fimetarius способны
усваивать нитраты, другие - нитриты. Азотное питание у многих видов высших
съедобных базидиомицетов до настоящего времени не изучалось.
В качестве источника азота на синтетической среде с глюкозой нами испытаны
нитратные и аммонийные соли (NaNO3, NH4C1, NH4NO3), а для некоторых ви-
дов — также органические соединения азота: аспарагин, мочевина и пептон. Конт-
ролем служил рост на среде с NaNO3. Не все испытанные виды растут на среде с
нитратным азотом. Его не усваивают Agaricus bisporus, Lepista nuda, Flammulina
velutipes, слабо утилизируют NaNO3 Pleurotus ostreatus,Panus tigrinus. В то же
время Agaricus hortensis, Armillariella mellea, Macrolepiota procera, Marasmius
scorodonius, Lycoperdon pyriforme и Coprinus micaceus лучше растут на среде
.с нитратным азотом, чем с аммонийным.
На средах с аммонийными источниками азота лучше, чем на среде с нитрат-
WfeiM азотом, растут Schizophyllum commune, Sparassis crispa, Pleurotus ostreatus,
Panus tigrinus, P.conchatus, Oudemansiella radicata, Agaricus arvensis, A. silvaticus,
Coprinus comatus, Scleroderma citrinus, Suillus variegatus и др.
Наилучший рост испытанных штаммов, кроме Macrolepiota procera и Pleuro-
tus ostreatus, отмечен на среде с органическим источником азота — аспарагином.
На среде с мочевиной хороший рост проявляют Pleurotus ostreatus, Kuehneromy-
ces mutabilis и Agaricus arvensis, слабо растут Macrolepiota procera, Agaricus
bisporus, Flammulina velutipes и др.
На среде с NaNO3 и аспарагином большинство испытанных штаммов незначи-
тельно изменяют pH среды в кислую сторону. При культивировании на среде с
аммонийными соединениями азота, являющимися в данном случае солями силь-
ных кислот, 40—50 % испытанных грибов подкисляют питательную среду до
pH 3-4.
Аммонийные соли являются хорошим источником азота для культивирования
высших базидиомицетов. Однако в связи с тем,что на синтетической среде с аммо-
нийных® солями происходит закисление питательной среды, культивирование сле-
дует проводить, используя аммонийные соли слабых кислот.
4.1.4. Стимуляторы роста
Изучение потребностей высших базидиомицетов в стимуляторах роста привлекает
внимание многих исследователей, работающих с этой группой грибов в условиях
эксперимента (Robbins, 1950; Robbins, Hervey, 1958,1963; Rawaid, 1963; Worgan,
1968; Биосинтетическая деятельность ..., 1969; Volz, Beneke, 1969; Berry, 1975;
Dijkstra, 1976).
Высшие базидиомицеты характеризуются сильной гетеротрофностью в отно-
шении витамина В] (тиамина), что выделяет их среди грибов других системати-
ческих .групп. Потребй0СТБ-в витамине Bj была установлена у видов съедобных
грибов, относящихся к родам Boletus, Suillus, Paxillus, Pleurotus, Panus, Lentinus,
Tricholoma, Flammulina, Collybia, Agaricus, Russula, Lepiota, Coprinus, Clitocybe,
Mycena, Pholiota, Lactarius, Stropharia и др. В то же время потребность в витами-
80 не Bi у высших базидиомицетов де является абсолютной. Например, выявлены
штаммы видов Agaricus bisporus, Pleurotus ostreatus, некоторых видов рода
Marasmius, автотрофные в отношении тиамина (Биосинтетическая деятель-
ность ..., 1969; Volz, Beneke, 1969).
Нами исследовано влияние на рост высших базидиомицетов витамина В1(
отваров растений, дрожжевого автолизата, других субстратов, содержащих ви-
тамины.
На синтетической среде с тиамином больше био'тассы, чем в контроле, обра-
зуют Panus conchatus, Armillariella mellea, Coprinus comatus и Macrolepiota pro-
cera, отдельные штаммы Pleurotus ostreatus и Flammulina velutipes. Стимулирую-
щее действие на рост Fistulina hepatica, Pleurotus ostreatus, Armillariella mellea,
Kuehneromyces mutabiiis, Macrolepiota procera, Panus tigrinus, Flammulina velu-
tipes и другие виды оказывают отвары крапивы и дубовой коры, дрожжевой
автолизатС
В качестве стимуляторов на синтетической среде с сахарозой испытаны отвары
зеленой массы различных сельскохозяйственных культур: кукурузы, овса, фасоли
(створки), свеклы столовой, гороха, вики, люпина, люцерны, красного клевера,
а также початков кукурузы в стадии восковой спелости. Наиболее благоприятны-
ми для накопления биомассы являются отвары початков кукурузы и красного
клевера. На средах с добавлением отваров этих растений у Marasmius scorodonius,
Agaricus silvaticus, Macrolepiota procera и Coprinus comatus продукция биомассы
по сухой массе составляет до 5—11,6 г/л. На среде с отваром гороха Agaricus
silvaticus и Coprinus comatus образуют более 5 г/л сухой биомассы, Agaricus
silvaticus и Marasmius scorodonius — на среде с отваром люпина. Испытанные ви-
ды хуже растут на отварах вики, овса, фасоли и зеленой массы столовой свеклы.
Таким образом, на всех средах со стимуляторами, по сравнению с контролем,
Fistulina hepatica, Panus conchatus, Armillariella mellea, Kuehneromyces mutabiiis.
отдельные штаммы Pleurotus ostreatus, Flammulina velutipes и другие виды уве-
личивают продукцию биомассы. Эти культуры слабо растут на контрольной синте-
тической среде. Показана целесообразность использования естественных органиче-
ских субстратов, содержащих витамины и другие стимуляторы, в качестве компо-
нентов питательных сред для улучшения роста и увеличения продукции биомассы
мицелия при культивировании высших съедобных базидиомицетов.
4.2. Отбор на комплексных средах
Одним из требований, которые предъявляются к промышленному продуценту
пищевой биомассы, является наличие у него способности утилизировать дешевые,
недефицитные источники питания и субстраты, содержащие углеводы, органиче-
ский азот, витамины и другие стимулирующие добавки. Это продукты переработ-
ки овощей, фруктов, зерновых, кормовых и технических культур, молочная сы-
воротка. Многие из субстратов — отходы сельского хозяйства и промышленнос-
ти — представляют интерес как экономически выгодные компоненты комплек-
сных питательных сред при производстве пищевой биомассы на промышленной
основе в крупных масштабах.
Первичный отбор штаммов с целью установления их способности расти в глу-
бинной культуре мы проводили на пивном сусле. В дальнейшем штаммы, проя-
вившие активный рост на этом субстрате, испытывали на других комплексных
средах, перспективных для промышленного применения. Поскольку пивное сус-'
ло, помимо углеводов, содержит и органические формы азота, углерод которых
используется грибами, расчет экономического коэффициента (ЭК) по углероду,
как и на других комплексных средах, включающих органический азот, нами не
проводился.
Литературные данные также свидетельствуют о том, что в тех случаях, когда
при культивировании высших базидиомицетов на средах с органическими соеди-
нениями азота проводили расчет ЭК по углероду, исходя из количества содержав-
шихся в них углеводов, значения коэффициента были завышенными (Worgan,
1968; Низковская, 1972). Высокие значения ЭК при глубинном культивировании 81
высших базидиомицетов на минеральной среде с глюкозой и пептоном при пере-
счете на* потребленный сахар для некоторых дереворазрушающих, подстилочных
и микоризообразуюших грибов приводятся О.П.Низковской (1972) и нами (Бу-
хало та ш., 1975) для Pleurotus ostreatus 1300.
Всего нами на пивном сусле в глубинной культуре испытано 75 видов
(104 штамма), относящихся к 41 роду, 19 семействам, 8 порядкам. Некоторые
виды, сохранявшиеся в нашей коллекции на С А, не росли тем не менее в поверх-
ностной культуре на жидком пивном сусле или развивались настолько слабо, что
не давали достаточного количества инокулирующего мицелия для их глубинного
культивирования. Это относится, прежде всего, к представителям болетальных
(отдельные виды родов Boletus, Leccinum, Suillus, Xerocomus), а также некото-
рым видам агарикальных и гастеромицетов (Agaricus maskae, Calocybe gambosa,
Amanita rubescens, Langennannia gigantea и др.).
Ниже представлены данные о накоплении r/л сухого мицелия биомассы испы-
танными штаммами на качалке в колбах:
Порядок, семейство, вид, штамм Мицелий
AphyUophorales
Pohyporaceae
Coriolus zonatus 301 5,4
Gloeophyllum sepiarium 326 2,6
Polyporus squamosus 309 4,0
Laetiporus sulphureus 306 2,9
Piptoporus betulinus 303 3,9
Schizophyllaceae
Schizophyllum commune 97 8,8
Fistulina ceae
Fistulina hepatica 302 53
Sparassisaceae
Sparassis crispa 304 4,1
S. crispa 314 3,9
Bole tales
Boletaceae
Boletus edulis 601 63
B. edulis 604 6,2
Suillus bovinus 610 33
S. bovinus611 1,3
S. granulatus 608 8,6
S. sibiricus 627 7,5
РахШасеае
Paxillus acheruntius 115 4,7
Agaricales
Pleurotaceae
Pleurotus calyptratus 189 15,4
P. columbinus 128 5,1
P. comucopiae 88 8,7
P. comucopiae 187 4,1
P. dryinus 197 13,2 *
P. eryngii 10 9,8
P. ostreatus 94 9,7
Pleurotus ostreatus 91 9,4
P. ostreatus 92 8,6
P. ostreatus 1300 10,2
P. pulmonarius 111 6,7
- P. salignus 181 10,3
Panus tigrinus 131 11,1
Tricholomataceae
Gerronema josserandi 196 16,7
Laccaria laccata 120 4,8
Clitocybe gigantea 7 3,0
C. nebularis 42 ' # 2,1
Tricholomopsis rutilans 101‘ 5,6
T. sulphureoides 195 73
Tricholoma focale 99 2,6
T. imbricatum 100 5,4
Lyophyllum ulmarium 67 9Д
Oudemansiella brunneomarginata 260 8,6
O. radicata 80 2,8
Flammulina velutipes 112 6,8
F. velutipes 50 5,7
F. velutipes 53 63 .
F. velutipes 54 9,0
on F. velutipes 52 73
B2 F. velutipes 261 6,8
Marasmius alliaceus 77 3,0
М. oreades 76 4,6
М. scorodonius 78 5,1
М. scorodonius 116 6,0
Lepista nuda 61 5,6
L. luscina 64 6,8
Entolomataceae
- Clitopilus prunulus 46 43
C. prunulus 178 33
Agaricaceae
Agaricus arvensis 15 33
A. arvensis 16 133
A. bemardiifonms 156 4,7
A. bisporus 23 4,2
A. bisporus 21 5,8
A. bisporus 22 53
A. bisporus 20 5,8
A. bisporus 739 53
A. bisporus 18 4,1
A. bisporus 19 2,8
A. bisporus 740 5,8
A. bitorquis 143 10,0
A. hortensis 36 2,9
A. macrocarpus 150 9,8
A. silvaticus 37 2,6
A. silvaticus 17 13
A. squamuliferus 158 . 23
Macrolepiota procera 72 4,2
M. puellaris 255 13,3
M. rhacodes 209 16,8
Leucocoprinus bresadolael60 5,4
Coprinaceae 33
Coprinus dnereus 199
C. comatus 48 3,6
C. comatus 47 3,2
C. ephemerus 8 43
C. micaceus 728 4,2
Bolbitaceae
Agrocybe aegerita 12 3,0
Strophariaceae
Stropharia nigosoannulata 258 16,6
Pholiota adiposa 741 5,0
Ph. adiposa 85 4,4
№. adiposa 86 5,9
№. aurivella 84 33
№. nameko 105 83
Kuehneromyces mutabiiis 58 8,7
Russulales Russulaceae
Russula decolorans 95 4,0
R. decolorans 138 6,7
R. grisea 125 13
Lactarius helvus 60 -6,7
Phaliales Phallaceae
Phallus impudicus 421 4,4
Lycoperdales
Lycoperdon perlatum 416 33
Lycoperdon perlatum 413 L. perlatum 412 3,4 4,7
L. pyrifonne 415 Calvatia excipuliformis 407 5,1
7,2
C. excipuliformis 727 33
C. utriformis 402 3,2
Sclerodermatales
Scleroderma citrinum 425 6,1
Nidulariales
Cyathus striatus 409 4,1
Ранее нами культивированы некоторые из этих штаммов на круговой проби-
рочной качалке (Бухало, 1973а). Культивирование проводили при более интенсив-
ном массообмене в небольшом объеме питательной среды (7 мл) с добавлением
30 % объема инокулюма. При этом у большинства испытанных штаммов был полу-
чен более высокий урожай биомассы по сравнению с таковым на качалке в кол-
бах, что совпадает с литературными данными (Низковская, 1972).
Испытанные в глубинной культуре на СА виды высших базидиомицетов отно-
сятся к следующим экологическим группам: лигнотрофам (41,2 %), подстилоч-
83
ным и гумусовым сапротрофам 431.9 %), микотрофам (17,6 %). Небольшим ко-
личеством представлены копротрофы, герботрофы, микотрбфы.
Наиболее продуктивны в данных условиях культивирования лигнотрофы:
Gerronema josserandi, Pleurotus calyptratus, P. ostreatus.P.comucopiae.P. dryinus,
P. eryngii, P. salignus, Oudemansiella brunneomarginata, Fiammulina velutipes,
Pholiota nameko, Kuehneromyces mutabilis, Panus tigrinus, Lentinus edodes, Schi-
zophyllum commune (см. рис. 14). Многие из них в природе вызывают белую
гниль древесины. Однако не представляется возможным проанализировать про-
дуктивность отдельных видов по типам вызываемых ими гнилей, так как для
большинства видов таких сведений в литературе нет, а относительно некоторых
видов они противоречивы.
Среди подстилочных и гумусовых сапротрофов лучше других растут Stropha-
ria rugosoannulata, Agaricus bitorquis, A. macrocarpus, Macrolepiota puellans
и M. rhacodes. Из микотрофов наиболее продуктивны Suillus sibiricus, S. granu-
latus, Boletus edulis, Lepista luscina. Russula decolorans. Lactarius helvus и Sclero-
derma citrinum.
Однако анализ продуктивности исследованных видов по экологическому
признаку в значительной мере условный, гак как в природе одни и те же виды
высших базидиомицетов могут встречаться как на почве или подстилке, так и на
древесине, быть факультативными микоризообразователями.
В результате проведенного отбора на пивном сусле виды съедобных базидио-
мицетов разных таксонов и экологических групп оценены с точки зрения их спо-
собности расти в глубинной культуре. Отобраны штаммы, активно накапливаю-
щие биомассу, а также перспективные для дальнейших исследований. Это прежде
всего штаммы видов родов Pleurotus, Panus, Fiammulina, Oudemansiella, Kuehne-
romyces, Agaricus, Gerronema, Stropharia и другие, среди которых имеются пен-
ные съедобные грибы, промышленно культивируемые в мире для получения
плодовых тел.
Дешевым субстратом для получения белка являются отходы переработки
картофеля, которые в нашей стране составляют до 40 % (Бабицкая, Лобанок,
1976). Непищевые крахмалистые отходы переработки картофеля могут служить
источником углеродного питания при глубинном культивировании мицелия выс-
ших базидиомицетов (Капич и др., Маттисон и др., 1966). Вместе с тем сырые
крахмалистые отходы (очистки, нестандартный картофель, клеточный сок и
т.п.) - скоропортящиеся продукты. Этих недостатков лишены консервированные
и сухие продукты безотходной технологии переработки картофеля, в частности
картофельная мука и концентрат картофельного сока (Вечер и др., 1979).
При поверхностном выращивании штаммов Pleurotus ostreatus и Panus tigri-
nus показано, что урожай сухого мицелия в среде с картофельной мукой более
чем в 2 раза превышает таковой в среде с пищевым картофельным крахмалом.
Картофельная мука служит хорошим источником углерода для выращивания раз-
личных видов съедобных грибов. В качестве перспективных для культивирования
на картофельной муке можно считать штаммы видов Lentinus edodes, Marasmius
androsaceus, Marasmius scorodonius, Pleurotus ostreatus, P. comucopiae, P. saiig-
nus. P. eryngii и Poiyporus aquamosus, которые образуют 15—2,5 г/л/сут сухой
биомассы на этом субстрате.
Как субстрат для получения поверхностного и глубинного мицелия высших
базидиомицетов на жидких питательных средах испытан также консервированный
концентрат клеточного сока картофеля (ККС), в состав которого входят углево-
ды, аминокислоты, источники минерального питания (Вечер и др., 1979). На среде
с ККС хорошо растут в основном виды, относящиеся к роду Pleurotus, а также
отдельные штаммы видов Marasmius scorodonius, Crinipellis schevczenkovi, Panus
tigrinus, которые накапливают до 9—11 г/л биомассы с содержанием сырого
протеина 35-49 %. Целый ряд лигнотрофов, копротрофов и подстилочных сапро-
трофов, обнаружившие активный рост на других комплексных средах, не растут
совсем или растут очень слабо на среде с ККС в качестве единственного источника
углерода.
$4 В нашей стране одним из перспективных субстратов в экономическом отноше-
нии является меласса (Морозова и др., 1978а, б), которая может использоваться
как основной источник углеродного питания для глубинного культивирования
мицелия. Наиболее высоким уровнем биомассы (4,5—85 г/л) на среде с мелассой
характеризуются штаммы Fiammulina velutipes. Стимулирующее действие при
культивировании F.velutipes на минеральной среде с мелассой оказывает добавле-
ние 0,1—0,2 % дрожжевого экстракта. На питательной среде с мелассой (2—25 %)
не росли или росли очень слабо исследованные штаммы видов Lentinus edodes.
Agaricus bisporus, A. campestris, Marasmius scorodonius, Oudemansiella radicata.
Caivatia utriformis, C.excipuliformis и др.
Для получения мицелия высших съедобных грибов как возможные виды
сырья могут также рассматриваться послеспиртовая барда, отходы деревообра-
батывающей промышленности, молочная сыворотка (Морозова и др., 1978а. б).
Плохо развиваются испытанные базидиомицеты на неразбавленной молочной
сыворотке. В то же время, как показано для Panus tigrinus 131, молочная сыво-
ротка, разведенная водой 1:1, с добавлением кукурузного экстракта — хороший
субстрат для выращивания этого штамма (Капич и др., 1983, 1984).
Минеральная среда с гидролизатом синезелен . х водорослей оказалась пригод-
ной для роста некоторых исследованных, видов базидиомицетов. Panus tigrinus.
Pleurotus ostreatus, Schizophyllum commune при поверхностном культивировании
на этой среде на 14-е сутки накапливают до 7—11,7 г/л сухого мицелия.
На минеральной среде с 5 %-ной послеспиртовой бардой как в поверхностной,
так и в глубинной культурах хорошо развиваются Pleurotus ostreatus, Panus tigri-
nus, Schizophyllum commune и Agaricus arvensis. Урожай биомассы на 7-е сутки в
глубинной культуре на этой питательной среде у Panus tigrinus достигает 16,7 г/л,
у Fiammulina velutipes — 6,6, у Schizophyllum commune — 19 г/л.
Таким образом, в качестве возможных питательных сред для глубинного
культивирования высших съедобных базидиомицетов кроме отходов переработки
картофеля могут быть рекомендованы также минеральная среда с 2—2,5 %-ным
содержанием мелассы, 50 %-ная послеспиртовая барда со стимулирующими добав-
ками, для отдельных видов — автолизат синезеленых водорослей и разведенная
молочная сыворотка.
4.3. Отбор штаммов, образующих биологически активные вещества
Характеристика ферментативной и антибиотической активностей интродуцируемых
в глубинную культуру съедобных базидиомицетов в процессе первичного отбора
продуцентов биомассы существенна для познания их метаболизма, разработки
безотходной технологии. Одной из задач явилось исследование культур нашей
коллекции, обнаруживших хороший рост на жидких средах в глубинной культуре,
в отношении их способности образовывать вторичные метаболиты.
Нами исследовалась протеолитическая активность 36 видов преимущественно
из порядка Agaricales, а также некоторых представителей порядков Aphyllophora-
les, Auriculariales, Gasteromycetes. Это виды разных экологических групп — ми-
котрофы, гумусовые и подстилочные сапротрофы, лигнотрофы.
У большинства видов увеличение протеолитической активности совпадает
с нарастанием биомассы (табл. 8). У некоторых видов протеолитическая актив-
ность наблюдается как в нейтральной, так и в кислой средах, что свидетельствует
о наличии в культуральной жидкости комплекса протеолитических ферментов,
которые выделяют указанные виды.
Высокую протеолитическую активность проявили виды съедобных базидио-
мицетов: Fiammulina velutipes, Pleurotus ostreatus, Fistulina hepatica, Armilla-
riella meliea, Himeola auricula-judae, Panus tigrinus, Lyophyllum ulmarium, Pholiota
adiposa и др.
Образование пероксидазы высшими базидиомицетами отмечается в основном
в связи с изучением окислительных процессов при разложении древесины. Поэто-
му объектом исследований, как правило, служат лигнотрофы, преимущественно
представители порядка Aphyllophorales (Lyr, 1956, 1965; Рипачек, 1967). Из 85
Таблица 8. Протеолитическая активность* высших базидиомицетов на 8-е (1) и 14-е (2) сутки куль-
тивирования
Порядок, вид, штамм 1 2
Активность Мицелий, г/л Активность Мицелий, г/л
рНЗ | pH 7 рНЗ pH 7
Auricalariries 0,05 0,025 2,1
Hirneola auricula-judae 733 — — 2,8
Aphyllophoraies 7,1 0,7 0,035 12,1
Coriolus zonatus 301 — —
Fistulina hepatica 302 0,43 1,07 1,2 — 036 2,6
Polyporus sp.309 — — 1,4 0,175 — 63
Schizophyllum commune 96 — 153 0,15 оз 4,4
S. commune 97 — — 33 0335 0,66 17,4
Boletales 5,3
Suillus variegatus 613 0,01 0,125 4,1 — —
Agaricaies 0395
Agaricus bisporus 21 0,07 0395 2,2 — 53
A. silvaticus 37 0,07 0,07 1,4 — — 5,3
Armillariella mellea 32 — — 3,5 0,08 0,05 4,1
.Flammulina velutipes 29 — 0385 2,3 — — 5.1
F.velutipes 50 — 0,77 83 031 1,08 10,7
F .velutipes 112 0,1 0,77 5,6 0,085 035 63
Coprinus comatus 47 — — 3,3 0,73 0,64 4,8
Lepista luscina 64 — — 1,8 1,0(5 0,025 3,0
L. nuda 61 0362 0,315 13 0,275 — 3,2
Lyophyllum ulmarium 67 0,005 0,106 3,4 0,025 0,417 4,9
Marasmius oreades 76 — — 1,6 0325 0365 2,1
M.scorodonius 78 —. — 23 0,075 0,05 1,7
Panus conchatus 81 — — 83 — 0,13 123
P. tigrinus 131 03 0,16 5,8 0,2 0,7 123
Pholiota adiposa 86 — — 1,7 0375 038 63
Pleurotus ostreatus 1300 — 032 2,7 — 0,8 123
Russula grisea 125 — 53 0,045 0,055 5,8
Lycoperdales 1,6
Lycoperdon perlatum 413 — 0,15 3,0 — —
Scleroderma tales 8,8
Scleroderma citrinum 425 — 0,7 53 — • оз
•Активность выражается величиной экстинкции Е - 280 нм/мл/г.
128 видов дереворазрушающих базидиомицетов, изученных Х.Лиром, пероксидаз-
ную активность проявили примерно 12 %. Х.Лир (Lyr, 1956) предполагал, что
функция дереворазрушающих грибов состоит в разрушении лигнина путем его
окисления. ВРипачек (1967) считает этот вопрос дискуссионным.
При изучении пероксидазной активности микроскопических грибов показано
(Пидопличко и др., 1968), что индукция пероксидазы скорее является одной из
защитных реакций грибного организма и в меньшей мере связана с освоением
источников углерода. Распространенность в природе микромицетов, образующих
пероксидазу, определяется в основном их экологией. Наибольшее количество
видов, проявляющих пероксидазную активность, обнаружено в элементах лесной
подстилки, где они составляют 30—62 % в зависимости от сроков выделения
(Пидопличко и др., 1968), в то время как в почве их численность не превышает
1,0-1,6 %.
Пероксидазная активность у высших съедобных базидиальных грибов в куль-
туре практически не изучалась. Исследование пероксидазной активности проводи-
лось нами в поверхностной культуре на жидкой морковной среде, позволяющей
выявлять активность у тех культур, которые на обычных средах ее не обнаружи-
вают. Штаммы, проявившие пероксидазную активность на морковной среде, вы-
ращивались на синтетической с дубовым отваром (Пидопличко и др., 1968).
Из испытанных культур лигнотрофов активны Coriolus zonatus, Panus tigri-
nus, P. conchatus, Kuehneromyces mutabilis, Flammulina velutipes, Armillariella
mellea, Pholiota adiposa, Ph. aurivella и др. В то же время не были активными такие
лигнотрофы, как Fistulina hepatica, Gloeophyllum sepiarium и Schizophyllum
commune. Среди видов, проявивших пероксидазную активность, отмечено значи-
тельное количество подстилочных и гумусовых сапротрофов: Agaricus arvensis,
86 A. silvaticus, Oudemansiella radicata, Macrolepiota; procera, Marasmius oreades,
Таблица 9. Антибиотическая активность культур высших базидиомицетов
Тест-объект
Порядок, вид, штамм Staphylo- coccus aureus Escheri- chia coli Bacillus subtilis Proteus vulgaris Mycobac- terium В Candida albicans
Aphyilophorales
Fistulina hepatica 302 — — F — + —
Gloeophyllum sepiarium 326 + + — + —
Schizophyllum commune 96 — — — — — —
Bole tales
Suillus variegatus 613 — — — + — —
Agaricales
Pleurotus ostreatus 1300 —. — — + — —
Panus tigrinus 131 — — — — — —
Lentinus lepideus 66 — — — — —
Armillarielia meliea 32 —- — — — — —
A. meliea 39 — — — — — —
A. meliea 40 — — — — — —
A. meliea 41 + — — — — —
Fiammulina velutipes 112 — — — — — +
F. velutipes 9 — — — — — +
Lepista nuda 61 — — + — — +
L. nuda 62 — — + — 4-
Lyophyllum ulmarium 67 — — — — — —
Agaricus arvensis 14 + — + — — —
A. bisporus 21 — — — — — —
A. silvaticus 37 + + + — — —
Coprinus comatus 47 + + + — + —
Pholiota adiposa 86 — — — — — —
Ph. auriveila 84 — — — — — —
Lycoperdalee
Lycoperdon periatum 413 — — — — — —
L. pyriforme 414 — — + — — +
Примечание: (+) — подавление роста тест-обьекта, (-) - рост тест-обьекта хороший.
М. scorodonius, Langermannia gigantea и др. У представителей облигатных и фа-
культативных микотрофов Amanita rubescens, Suillus bovinus, Lepista nuda и
Scleroderma citrinum отмечена активность, хотя они слабо растут в условиях
опыта. Не были активны или проявили очень слабую активность Boletus impolitus,
Suillus granulatus, Russula grisea и Lactarius helvus.
Следовательно, пероксидазу в культуре образуют представители всех эколо-
гических групп. Наибольшее количество активных культур по отношению к числу
испытанных отмечено среди подстилочных и гумусовых сапротрофов (80 %),
меньшее — лигнотрофов (57 %) и микоризообразователей (42 %). На специфиче-
ских питательных средах высоко активными оказались ценные съедобные грибы:
Fiammulina velutipes, Kuehneromyces mutabilis,Coprinus comatus, Agaricus arven-
sis, A. silvaticus, Macrolepiota procera, Lepista nuda и Marasmius scorodonius.
Результаты изучения антибиотической активности у высших базидиомицетов
свидетельствуют о перспективности исследований в этом направлении (Биосинте-
тическая деятельность ..., 1969; Низковская, 1969а, б; Nerud, Musilek, 1976;
Мелик-Хачатрян, Вартапетян, 1977; Cochran, 1978; Мелик-Хачатрян, 1980; и др.).
Изучена антибиотическая активность некоторых активно растущих в глубин-
ной культуре видов. Из испытанных 19 видов базидиомицетов антибиотическая
активность обнаружена у 12 (табл. 9). Наиболее широким спектром антибиоти-
ческого действия обладают Gloeophyllum sepiarium и Coprinus comatus. Интерес-
но, что около 30 % исследованных культур подавляют рост Candida albicans, что
подтверждает предположение (Биосинтетическая деятельность ..., 1969) о перспек-
тивности поиска среди высших базидиомицетов продуцентов антибиотических
веществ антифунгального действия.
Исследовалось также влияние культуральных жидкостей некоторых видов,
обитающих на древесных субстратах, на фитопатогенные виды родов Fusarium,
Altemaria, Drechslera, Gliocladium,: Ascochyta, Botrytis. Широкий спектр анти-
грибного действия проявляет Gloeophyllum sepiarium. Культуральные фильтраты
этого вида активны также в отношении Aspergillus fumigatus. Oudemansiella
radicata и Pholiota adiposa подавляют рост Ascochyta imperfecta, Botrytis cinerea, 87
Helminthosporium graminearum^Macrosporium solani. Против H.graminearum /ак-
тивны также Flammulina velutipes и Schizophyllum commune.
Из высших базидиомицетов получены препараты противоопухолевого дейст-
вия (Низковская, Милова, 1966; Yoshiokaetal.,1972,1973; Cochran, 1978). Одна-
ко большинство высших базидиомицетов не исследовано в отношении антиблас-
томной активности.
Нами изучались антибластомные свойства культуральных жидкостей некото-
рых видов высших базидиомицетов, проявляющих антибиотическую активность
(Бухало та iH., 1971). Образцы культуральных жидкостей, оказывавшие выра-
женное действие в опытах in vitro, исследовали затем в опытах на животных с пе-
ревиваемыми асцитическими опухолями (карциномой Эрлиха, саркомой 37,
лимфаденозом НК/Ли, саркомой К—239). Параллельно в опытах на животных
испытывали влияние культуральных жидкостей на одну из реакций иммунитета
(продукцию гемагглютининов).
Испытание противоопухолевого действия in vitro, проведенное на 126 мышах
с перевитыми асцитическими опухолями, выявило выраженные антибластомные
свойства культуральной жидкости Gloeophyllum sepiarium. Наибольший эффект
получен при лечении асцитической формы саркомы 37.
В экспериментах на привитых крысиными эритроцитами мышах установлено,
что образцы культуральных жидкостей G. sepiarium вызывают значительное угне-
тение продукции гемагглютининов. Их титр в сыворотках опытных мышей на 10-е
сутки после введения антигена в 2, а через 20 сут — в 4 раза ниже, чем в сыворот-
ках контрольных животных. Это показатель того, что в культуральной жидкости
G.sepiarium содержится вещество или ряд веществ, интенсивно подавляющих про-
лиферирующие физиологические системы организма.
Первичный отбор высших базидиомицетов, образующих в культуре биологи-
чески активные вещества, позволил выявить виды ценных съедобных грибов, об-
ладающие протеолитической, пероксидазной, целлюлозолитической, антибиотиче-
ской И анти бластомной активностью. Представляет интерес дальнейшее исследова-
ние биосинтетической активности видов Pleurotus ostreatus, Panus tigrinus,
Flammulina velutipes, Gloeophyllum sepiarium, Lepista luscina, Kuehneromyces
mutabiiis, Coprinus comatus, Crinipellis schevczenkovi. '
4.4. Морфология видов в глубинной культуре
Морфологические особенности высших базидиомицетов в глубинной культуре
почти не изучались. В литературе описан рост высших базидиомицетов в глубинной
культуре, происходящий в форме мицелиальных агломератов, или ’’шариков”,
более или менее правильной округлой формы, гладких или., пушистых, плотных
или полых. Может наблюдаться также дисперсный рост в виде отдельных гиф. Ха-
рактер роста мицелиальной колонии у одного и того же вида может изменяться
в зависимости от условий культивирования. В отдельных работах обсуждаются
вопросы формирования глубинных колоний, для некоторых видов указывается
наличие пряжек, вторичных спор (Burkholder, Sinnott, 1945; Биосинтетическая
деятельность ..., 1969; Низковская, 1972; Hofsten, Ryden, 1975; Righelato, 1975,
Burnett, 1976; Dijkstra, 1976; Kurtzman, 1978).
Авторы, культивировавшие ложные штаммы базидиомицетов, указывают
(Block et al., 1953; Sugihara, Humfeld, 1954; Falanghe, 1962; Rehaceket al., 1962;
Worgan, 1968; Торев, 1973), что эти штаммы образуют в глубинной культуре
многочисленные вторичные споры. В работе А.Торева (1973) специальный раздел
посвящен биологическим особенностям видов высших грибов, культивируемых
на жидких питательных средах. Автор утверждает, что специфические условия
культивирования вызывают несвойственные базидиомицетам формы размноже-
ния, которые идентичны таковым у ’’низших” грибов. На микрофотографиях,
иллюстрирующих морфологию культивировавшихся А.Торевым штаммов, иден-
тифицированных им как Polyporus squamosus, Cantharellus cibarius, Lactarius
piperatus, Limaceum ebumeum, Coprinus comatus, представлены спороношения,
88 характерные для видов рода Fusarium и некоторых других дейтеромицетов.
Таким образом, культивирование неправильно идентифицированных как ба-
зидиомицеты штаммов дейтеромицетов привело к возникновению представления,
согласно котором}' происходят кардинальные изменения в морфологии высших
базидиомицетов и появление у них спороношений, типичных для родов дейтероми-
цетов, имеющих сумчатую анаморфу под влиянием глубинного культивирования.
Обоснование такой ошибочной концепции привело к тому, что начатое за ру-
бежом промышленное культивирование непригодных для пищевого использова-
ния штаммов дискредитировало саму идею получения белка из высших съедобных
базидиомицетов.
Актуальны исследования морфогенеза высших съедобных базидиомицетов
в глубинной культуре и характеристика встречающихся у определенных видов ти-
пов спороношений по сравнению с таковыми, наблюдающимися у них на агаризо-
ванных питательных средах.
В колбах на качалке культуры растут в виде мицелиальных агломератов более
или менее правильной округлой формы или угловатых, которые у разных испы-
танных видов отличаются по форме и размерам (табл. XXVIII). В определенных
условиях культивирования у каждого вида преобладают однотипные по размерам
и форме шарики, что создает общую картину роста. Scleroderma citrinum растет
в виде крупных пушистых шариков, аналогичный рост отмечен у Schizophyllum
commune, Phellinus igniarius. В случае, когда посев проводится мицелием с агаро-
вого косяка, иногда наблюдается рост в виде одного большого комка мицелия.
У некоторых видов образуются гладкие угловатые или округлые, очень плотные
комочки. Такой рост наблюдается у Coprinus ephemerus, С. micaceus, Agaricus silva-
ticus, Marasmius scorodonius, Phallus impudicus,Pholiota aurivella, Armillariella mel-
lea, Suillus luteus и др. Образование плотных, гладких, неправильной формы коло-
ний вместо пушистых шариков происходит у некоторых видов при культивирова-
нии на бедных синтетических средах в случае плохого роста культуры.
Рост в виде мелких пушистых агломератов наблюдается у Lepista nuda. Lacta-
rius helvus, Russula decolorans, Flammulina velutipes, Panus tigrinus, Agaricus
bisporus, Pholiota adiposa, Fistulina hepatica и др.
Наряду с мелкими плотными пушистыми шариками иногда образуются и бо-
лее крупные гладкие шарики с пустой срединой. Обычно в культуральной жидкос-
ти присутствуют одновременно шарики разной величины — от плохо различимых
невооруженным глазом до крупных,достигающих нескольких миллиметров в диа-
метре. В культуральной жидкости присутствуют также обрывки гиф, длинные
разветвленные гифы, иногда образующие тяжи, рыхлые шариковидные скопления
гиф, даюшие начало крупным шарикам.
При исследовании с помощью сканирующей электронной микроскопии глу-
бинной мицелиальной колонии P.tigrinus отмечено, что центральная часть колонии
состоит из тесно переплетенных гиф, напоминающих ткань (табл. XXIX). Такая
структура, обычная для всех мицелиальных грибов, затрудняет поступление пита-
тельных веществ и кислорода, в результате чего в центральной части мицелиально-
го шарика наступает лизис (Перт, 1978) .
При культивировании Panus tigrinus в ферментере мы установили, что на фор-
му роста значительное влияние оказывает режим механического перемешивания.
Так, при скорости перемешивания 200—250 об/мин образуются плотные пушистые
шарики, от которых отходят пучки разветвленных гиф (табл. XXX). При режиме
перемешивания 500 об/мин отмечен рост в виде плотных гладких шариков, в пе-
риферической части которых образуется густой слой радиально расположенных
слабо разветвленных гиф (табл. XXX).
В Литературе имеются данные, что дисперсному росту мицелия способствует
добавление в среду СаСОз или агар-агара (Pat. 2850841, USA; Биосинтетическая
деятельность ..., 1969). Как показали наши исследования, внесение в питательную
среду небольших количеств (0,01—0,1 %) этих механических мелкодисперсных
компонентов не оказывает заметного влияния на размер и форму мицелиальных
шариков. Добавление агар-агара приводит к увеличению биомассы всех испытан-
ных видов. СаСОз тормозит накопление биомассы у видов, проявляющих тенден-
цию к образованию крупных колоний.
89
Анаморфы и гифы глубинного мицелия: а ~ Panus tigrinus, б - Sparasns crispa, в - Oudemansiella
radicata, г — Agaricus arvensis
На форму роста колонии в глубинной культуре влияет способ инокуляции.
Так, рост в виде плотных гладких шариков на качалке при 200 об/мин наблюдает-
ся обычно при инокуляции мицелием с агаровых косяков или плохо диспергиро-
ванным поверхностным мицелием, выращенным на жидкой питательной среде.
В том случае, когда инокуляция проводится дисперсным поверхностным или глу-
бинным мицелием, рост, как правило, происходит в виде не очень крупных пушис-
тых шариков.
Исследованные в процессе первичного отбора в глубинной культуре на качал-
ке виды базидиомицетов при непродолжительном сроке культивирования образу-
ют нормальные разветвленные септированные гифы с пряжками, если последние
вообще свойственны данному виду. При старении культуры или неблагоприятных
условиях культивирования внутри мицелиальных агломератов наблюдается обра-
зование гиф с утолщенными стенками, искривленных, вздутых, вакуопизирован-
90 ных, с пустыми клетками, многочисленными боковыми ответвлениями (рис. 10).
Анаморфы в’глубинной культуре: а - Suillus bovinus, б - Agaricus silvaticus, в - Lepista nuda
Однако в глубинной культуре гифы не достигают такой степени дифференциации,
как это замечено в мицелиальных колониях на агаризованных питательных средах.
Стадия анаморфы, наблюдающаяся у видов на агаризованных питательных
средах, обычно образуется и при глубинном культивировании. Так, в глубинной
культуре часто образуются терминальные и интеркалярные хламидоспоры, что
характерно для этих же видов при поверхностном культивировании. Хламидоспо-
ры в глубинной культуре наблюдаются у Sparassis crispa, Boletus edulis, Suillus
bovinus, Panus tigrinus, Clitocybe gigantea, Lepista nuda, Agaricus silvaticus,
A. hortensis, A.arverisis, Coprinus ephemeras, Calvatia utriformis, Laetiporus
sulphureus и Fistulina hepatica (рис. 10—13). Хламидоспоры образуются как
терминально, так и интеркалярно.
В результате исследования морфогенеза на агаризованных питательных сре-
дах показано, что артроконидии являются распространенным типом конидиаль-
ного спороношения у высших съедобных базидиомицетов. Образование артроко-
нидий при глубинном культивировании происходит у Lepista nuda (рис. 11), 91
Анаморфы в глубинной культуре: а - Agaricus hortensis, б - A. axvensis, в Pholiota adiposa, г -
Lyophyllum ulmarium
Lyophyllum ulmarium, Pholiota adiposa (рис. 12), Иг. surivella, Gloeophyllum sepi-
arium, Fiammulina velutipes, Pleurotus comucopiae, Agaricus silvaticus, A.hortensis.
Обычно на глубинном мицелии не наблюдается образование длинных цепочек арт-
роконидий, как при культивировании на агаризованных питательных средах. Это,
очевидно, происходит из-за интенсивного механического перемешивания. На гифе,
как правило, наблюдается 1 или 2—3 артроконидии. В поле зрения попадаются
фрагменты гиф с небольшим количеством артроконидиальных локусов или еди-
ничные артроконидии. Место образования артроконидий на гифе часто не удается
заметить.
У некоторых исследованных видов при культивировании на агаризованных
средах отмечен более редкий для базидиомицетов бластоконидиальный тип споро-
ношения. Бластоконидии образуются также и в глубинной культуре. При этом
в условиях интенсивного механического перемешивания происходит редукция
кояидиеносцев, на гифе образуются короткие иеразветвленные конидиеносцы
обычно с одиночной терминальной бластоконидией. Бластоконидиальные споро-
ношения определялись при глубинном культивировании у Laetiporus sulphureus
92 (рис. 5) и Fistulina hepatica (рис. 13).
Анаморфы в глубинной культуре: а - Clitocybe gigantea, б - Calvatia utriformis, в - Coprinus cinereus.
г — Fistulina hepatica
У Marasmius scorodonius отмечены образования типа глеоцистид. Для Copri-
nus cinereus как при поверхностном, так и при глубинном культивировании в ги-
фах характерно наличие гигантских клеток (рис. 13). Часто такие клетки разделе-
ны перегородками с пряжками. При интенсивном перемешивании в этих местах
происходит распадение гифы на отдельные участки.
Глубинный способ культивирования высших съедобных базидиомицетов от-
ражается прежде всего на специфике формирования мицелиальной колонии, кото-
рая в большинстве случаев принимает форму шаровидного агломерата. Сущест-
венными для форм глубинного роста являются способ подготовки и степень дис-
персности посевного мицелия, интенсивность перемешивания, состав питательной
среды. Полученные данные позволяют с очевидностью утверждать, что при глубин-
ном культивировании высшие базидиомицеты образуют те же формы вегетативно-
го и бесполого спороношения, которые характерны для этих видов при культиви- 93
Накопление биомассы представителями разных экологиче-
ских групп высших съедобных базидиомицетов в глубин-
ной культуре на пивном сусле: 1 - биомасса 5 г/л, 2 - био-
масса 5 —8 г/л, 3 - биомасса более 8 г/л
ровании на плотных средах и яв-
ляются генетически закреплен-
ными. Аналогичная закономер-
ность отмечается и для дейтеро-
мицетов (Шарова, Высоцкий,
1983). Утверждение о коренном
изменении морфологии высших
базидиомицетов под влиянием
глубинного культивирования не-
состоятельно.
* • *
Отбор на качалке при культиви-
ровании на благоприятной пита-
тельной среде позволил устано-
вить штаммы, активно накапли-
вающие биомассу в условиях
глубинного. культивирования,
перспективные для дальнейшего
изучения. При отборе в глубин-
ной культуре 75. видов показано,
что из испытанных наиболее ак-
тивными продуцентами биомас?
сы являются представители по-
рядков Agaricales, относящиеся
к семействам Pleurotaceae (роды
Pleurotus, Panus, Lentinus), Aga-
ricaceae (роды Agaricus, Macro-
lepiota) , Tricholomataceae (роды
Flammulina, Gerronema, Oude-
mansiella, Lepista, Marasmius),
Strophariaceae (роды Stropharia, Kuehneromyces, Pholiota), а также отдельные
виды порядка Aphyllophorales. Наибольшее количество видов, обнаруживших ак-
тивный рост в глубинной культуре, отмечено среди лигнотрофов, отдельные ак-
тивнорастушие виды выявлены и среди сапротрофов. Меньше биомассы получено
в глубинной культуре у микоризообразующих базидиомицетов, что можно
объяснить их более высокими и более специфическими питательными по-
требностями (рис. 14).
На следующем этапе при изучении питательных потребностей видов и штам-
мов, обнаруживших активный рост в глубинной культуре, установлена их специ-
фичность по отношению к источникам питания. Среди них отобраны такие, кото-
рые усваивают широкий набор углеводов, хорошо утилизируют органические
источники азота, аммонийные соли. В качестве стимуляторов роста используют
недефицитные естественные субстраты растительного и микробного происхожде-
ния, содержащие витамины, аминокислоты.
Проблема, получения протеина на основе микробиологического синтеза в значи-
тельной мере является экономической проблемой, для решения которой очень
важно использование в качестве субстратов различных непищевых отходов (Wor-
gan, 1968; Бабицкая, Лобанок, 1976; Zadrazil, 1976,1978; Rose, 1976b; Беккер,
1980; Блинов, 1984). Наиболее благоприятными для питательных потребностей
при глубинном культивировании высших съедобных базидиомицетов являются
комплексные среды, обеспечивающие более значительную продукцию биомассы
и более высокое содержание в ней белка по сравнению с синтетическими мине-
ральными средами. На основании данных о питательных потребностях отдельных
активнорастущих видов проведен отбор на субстратах из отходов промышленнос-
.94 ти и сельского хозяйства, которые могут быть использованы для культивирования
этих грибов в крупных масштабах (отходы переработки картофеля, сахарной
свеклы, молочная сыворотка и др.).
В процессе первичного отбора выявлены также штаммы съедобных базидио-
мицетов, образуюшие биологически активные вещества, которые могут явиться
ценным побочным продуктом при получении биомассы.
На жидких питательных средах впервые исследован морфогенез высших ба-
зидиомицетов в глубинной культуре. Показано, что при глубинном культивиро-
вании они образуют те же формы вегетативного и бесполого спороношения, кото-
рые характерны для них при культивировании на плотных средах и являются
генетически закрепленными. Таким образом, утверждения ряда авторов, осно-
ванные на недостоверных экспериментальных данных, о коренном изменении
морфологии высших базидиомицетов под влиянием глубинного культивирования
и появлении несвойственных этой систематической группе типов спороношений
ошибочны.
В результате скрининга для дальнейшей работы отобраны штаммы высших
съедобных базидиальных грибов: Pleurotus ostreatus 1300, Panus tigrinus 131,
Flammulina velutipes 112, обладающие рядом ценных свойств в качестве проду-
центов пищевой биомассы. Следующим этапом явилось углубленное исследова-
ние этих штаммов в погруженной культуре в ферментерах, где условия культи-
вирования оптимизированы и приближены к промышленным.
ГЛАВА 5
ГЛУБИННОЕ КУЛЬТИВИРОВАНИЕ ШТАММОВ-ПРОДУЦЕНТОВ
ПИЩЕВОЙ БИОМАССЫ PLEUROTUS OSTREATUS 1300,
FLAMMULINA VELUTIPES 112, PANUS TIGRINUS 131
Глубинное культивирование способствует более быстрому и продуктивному росту
аэробных микроорганизмов, в том числе высших базидиомицетов по сравнению
с поверхностным культивированием на жидких средах. Оптимизация отдельных
факторов культивирования и компонентов питательных сред может значительно
улучшать показатели роста и биохимического состава мицелия. Полученные экспе-
риментальные результаты открывают реальную перспективу разработки экономи-
чески выгодного процесса производства пищевой биомассы на основе глубинного
культивирования высших базидиомицетов (Hattuia, Gyllenberg, 1969а, b; Solomons,
1975; Dijkstra, 1978; Rose, 1979b; Высшие съедобные базидиомицеты ..., 1983).
Контроль биосинтеза мицелиальных грибов осуществляется путем управления
генотипом или воздействием на физиологию продуцента факторами окружающей
среды (Berry, 1975; Bull, Bushell. 1976; Перт, 1978; Rowlands, 1983; Блинов,
1984). Контроль и регуляция таких факторов, как гомогенность распределения
питательных вешеств в культуральной жидкости, аэрация, температура, pH среды,
могут быть осуществлены при глубинном культивировании в'ферментере.
В процессе глубинного культивирования отмечено взаимодействие факторов
питания и внешней среды, так как потенциальное использование источников пита-
ния может быть осуществлено или нет в зависимости от pH среды, степени аэра-
ции, перемешивания и других условий.
При исследовании высших съедобных базидиомицетов на синтетических и
комплексных средах с целью выявления штаммов для практического использова-
ния нами были отобраны Pleurotus ostreatus 1300, Panus tigrinus 131 и Flammuli-
na velutipes 112. Они отличаются от других способностью в условиях глубинной
культуры быстро накапливать биомассу до концентрации 15—20 г/л, использовать
дешевые и недефицитные источники питания, а также различные комплексные
среды, пригодные для промышленного производства мицелия пищевого назначе-
ния. Эти штаммы характеризуются четкими морфологическими признаками в
культуре и другими наиболее существенными для продуцентов биомассы свой-
ствами. Дальнейшее исследование физиологических особенностей отобранных
штаммов в глубинной культуре на качалках, в лабораторных ферментерах про-
водилось с целью определения условий глубинного культивирования, которые
способствуют быстрому росту, продуктивности, накоплению ценных продуктов
метаболизма в культуральном мицелии. Это необходимо для. более полного вы-
явления потенциальных возможностей отобранных штаммов и разработки техно-
логических основ их промышленного культивирования.
5.1. Культивирование Pleurotus ostreatus 1300
Во многих странах мира наиболее популярным после Agaricus bisporus видом,
культивируемым для получения плодовых тел, является Pleurotus ostreatus (ве-
шенка обыкновенная, устричный гриб). Он привлекает внимание исследователей
простотой получения мицелиальной культуры, быстрым ростом, неприхотли-
востью в отношении источников питания (Дудка и др., 1976а; Промышленное
культивирование ..., 1978; Высшие съедобные базидиомицеты ..., 1983). Р .ostrea-
tus, как мы отмечали выше, является также объектом культивирования и на
жидких питательных средах (Sugihara, Humfeld, 1954; Eddy, 1958; Фалина и др.,
1965б,‘ Sugimori et al., 1971; Бухало и др., 1975; Sakamoto et al., 1978а, b; Bu-
khalo, Solomko, 1979; Zetelaki, 1981; A.c. 427993).
Наиболее высокий урожай P.ostreatus 1300 получен при 6 %-ном начальном
содержании сахарозы. В качестве источника азота в данном опыте использовался
9G пептон. Суточный урожай биомассы составил более 7 г/л. Наши данные совпадают
с тем, что получено Р.Сакамото с соавт. (Sakamoto et al., 1978а, b) для P.ostreatus.
При глубинном культивировании Лого вида на питательной среде с крахмалом
они получили такой же среднесуточный урожай биомассы. Показано, что наиболее
высокие значения экономического коэффициента (ЭК) по сахарозе получены
при 1 %-ном содержании сахарозы в питательной среде, причем сахар в этом вари-
анте используется всего на 63 %.'Очевидно, при дефиците в питательной среде ос-
новного источника углерода происходит потребление углерода из аминокислот,
входящих в состав пептона. При 6 %-ном содержании сахарозы в питательной
среде ЭК составляет 0,20-0,40. На величину ЭК вЛияют не только концентрация
источника углерода, но и источник азота, наличие стимуляторов, минеральных
компонентов в питательной среде и др. (Berry, 1975). При глубинном культиви-
ровании P.ostreatus 1300 на синтетической среде с глюкозой ЭК значительно воз-
растает при добавлении в среду 1 %-ного концентрата картофельного сока (ККС).
Нами исследован рост P.ostreatus 1300 на минеральной среде с крахмалом,
в качестве биостимулятора использовали ККС. Показано, что увеличение содержа-
ния в среде картофельного крахмала от 1 до 7 % способствует более обильному'
накоплению биомассы, однако выход по субстрату с увеличением концентрации
крахмала снижается.
Из неорганических источников азота на синтетической питательной среде
P.ostreatus 1300 лучше усваивает аммонийные соли, чем нитратные, и органиче-
ский азот по сравнению с минеральным. В дальнейшем рост P.ostreatus 1300 испы-
тывали на синтетической среде с аммонийными солями и мочевиной. Среда с мо-
чевиной обеспечивает наибольшей выход биомассы. Наименее благоприятным для
роста исследуемого штамма являются аммоний хлористый и сернистый, представ-
ляющие собой соли сильных кислот.
Важным фактором, влияющим на рост и метаболизм грибов в культуре, яв-
, ляется соотношение углерода и азота в питательной среде. По данным разных ис-
следователей, для роста высших базидиомицетов оптимально соотношение C:N
в пределах от 5:1 до 20:1 (Биосинтетическая деятельность ..., 1969; Маслова,
1971; Dijkstra, 1976). При культивировании P.ostreatus 1300 на средах с глюко-
зой и мочевиной наиболее благоприятно для накопления биомассы соотношение
C:N = 8:1, на средах с глюкозой и аммонием виннокислым — 6:1. Максимальный
рост наблюдается при содержании в среде глюкозы и аммония 27,4 и 33 г/л со-
ответственно. Более высокая концентрация источников углеродного и азотного
питания тормозит рост P.ostreatus 1300.
На жизнедеятельность в культуре высших базидиомицетов существенное
воздействие оказывают элементы минерального питания, в частности соли К, Р,
. Mg. Рост исследуемого штамма лучше при следующем содержании этих солей
(г/л): КН2РО4 - 2, КС1 - 1,2, MgS04 - 0,25.
Нами испытывалось влияние на рост P.ostreatus 1300 отваров различных сель-
скохозяйственных растений. Лучший урожай биомассы отмечен на средах с отвара-
ми вики, люпина, гороха, клевера, люцерны и фасоли. Оптимизация сред обеспечива-
ет хороший рост P.ostreatus 1300 на среде с отваром клевера, сахарозой, минераль-
ными солями, мочевиной по сравнению с ростом на среде с пивным суслом.
Использование питательных сред со стимуляторами растительного происхож-
дения способствует получению мицелия с более высоким уровнем протеина. Так,
в образцах одновозрастного культурального мицелия P.ostreatus 1300, выращен-
ного на пивном сусле, содержание сырого протеина составляет 17,5—27 %, а на
минеральной среде с мелассой и дрожжевым экстрактом — 28—36 %. При глу-
бинном культивировании на качалке на пивном сусле мицелий P.ostreatus 1300
содержит 18,6—203 % сырого протеина, а в таких же условиях на минеральной
среде с ККС — до 40,2 % (табл. 10). На этих же средах 3-суточный мицелий, выра-
щенный в ферментере, при более благоприятных условиях аэрации содержит
27 и 46—48 % сырого протеина соответственно (табл. 10).
При глубинном культивировании P.ostreatus 1300 отмечена стимуляция роста
инертными мелкодисперсными компонентами, которые содержатся в питательной
среде и не принимают участия в метаболизме, например агар-агар, СаСО3
(0,01-0,1%).
97
Таблица 10. Влияние условий глубинного культивирования на рост и содержание белка в мицелии
Pleurotus ostreatus 1300
Способ выращивания и возраст посевного мицелия Условия культивирования Время генера- ции, ч Удельная скорость роста (д) ,ч-‘* Время культи- верста- ния, ч Мицелий, г/л Сырой протеин, % сухой массы
Поверхностный, Пивное сусло Качалка, колбы, 180 об/шш 17,3 0,04 120 8,0 18,6
5 сут Качалка, пробирки, 220 об/мин 13,8 0,05 120 10,0 203
Тоже 13,8 0,05 168 11,4 18,5
Ферментер, 350 об/мин 10,0 0,07 96 10,4 4,7
То же 10,0 0,07 72 6,0 27,2
Ферментер, 500 об/мин 6,0 0,11 72 8,7 272
Глубинный, 1 сут Ферментер, 350 об/мин . 6,0 0,11 24 4,0 28,9
Минеральная среда с ККС
Поверхностный, 5 сут Качалка, пробирки, 220 об/мин 13,8 0,05 72 5,3 40Д
Поверхностный, 5 сут Ферментер, 350 об/мин 8,6 0,08 48 32 48,0
Глубинный, 1 сут Тоже 6,0 0,11 72 8,6 46,3
•Рассчитана в экспоненциальной фазе роста.
Значительное влияние на рост высших базидиомицетов в глубинной культуре
оказывают количество и качество мицелиального инокулюма, в частности его воз-
раст, дисперсность, способ культивирования (Соломко, Шашек, 1984).
При культивировании P.ostreatus 1300 в лабораторных ферментерах
’’АНКУМ-2” урожай глубинного мицелия увеличивается пропорционально количе-
ству вносимого инокулюма (рис. 15, а). Внесение большего количества инокулю-
ма способствует также сокращению лат-фазы. При внесении инокулирующего ми-
целия в количестве 1,4 г/л по сухой массе урожай биомассы составляет 6,5 г/л.
Лаг-фаза заканчивается к 10-му часу культивирования. Максимум биомассы отме-
чен на 72-й час роста. При внесении инокулирующего мицелия в количестве 3,7 г/л
по сухой массе лаг-фаза заканчивается к 5-му часу культивирования, максимум
биомассы (11,6 г/л) получен к 48—50-му часу.
Рост P.ostreatus 1300 исследовался в периодической культуре при различных
условиях перемешивания и аэрации. Культура выращивалась на круговых качал-
ках в колбах и пробирках, а также в лабораторных ферментерах. В колбах и на
качалках соотношение воздушной и водной среды составляло 10:1 при переме-
шивании со скоростью 180 об/мин. Максимальная удельная скорость роста
P.ostreatus 1300 в колбах на качалке была 0,04ч-1 (табл. 10). Продолжитель-
ность лаг-фазы - 15—18 ч. После лаг-фазы скорость роста увеличивается и наступа-
ет фаза экспоненциального роста, которая продолжается, как правило, до 48—
50 ч культивирования. На качалке в пробирках, где аэрация культур лучше бла-
годаря более интенсивному перемешиванию, лаг-фаза длится 10-12 ч. дюах сос'
тавляет 0,05 ч~1. После 48—50 ч культивирования нарастание биомассы продолжа-
ется, но со значительно меньшей скоростью. Это связано, по-видимому, с ухудше-
нием снабжения кислородом из-за увеличения концЕнтртцт биомассы, уплотне-
ния ьншелиальных клубочков.
Режим механического перемешивания оказывает зяачительное влияние на рост
P.ostreatus 1300 в ферментерах. При начальном содержянш мицелия в среде до
1 г/л наиболее благоприятным для накопления биомассы является перемешивание
со скоростью 250—300 об/мин (рис. 15, б). При большей начальной концентрации
биомассы для хорошего развития культуры требуется белее интенсивное пере-
мешивание.
При культивировании без механического перемешивания (барботаж воздухом
1 об/мин) и при низких скоростях перемешивания (150 об/ьян) P.ostreatus 1300
развивается медленно и биомасса маленькая (рис. 15,6).
При культивировании P.ostreatus 1300 в лабораторных ферментерах дтах =
= 0,7-0,11ч"1; время генерации — 6—10 ч, максималытяя концентрация биомассы
98 достигается за 24—72 ч.
Время культибиробания, ч
а б
Рост Pleurotus ostreatus 1300 на пивном сусле в ферментерах ’’АНКУМ-2”: а - при разном количестве
посевного мицелия: 1 - инокулюм 10 % объема, 2 - инокулюм 20 % объема; б — при разном режи-
ме перемешивания: 1 - 250 об/мин, 2 - 500 об/мин, 3 - барботаж воздухом
Скорость роста при глубинном культивировании P.ostreatus изменяется также
в зависимости от того, в поверхностной или глубинной культуре выращен посев-
ной мицелий. При культивировании P.ostreatus 1300 в ферментере на пивном сус-
ле, когда инокуляция производится поверхностным мицелием, лаг-фаза составля-
ет 10—12 ч (табл. 10). Если в качестве инокулюма используется глубинный мице-
лий, находившийся в момент засова в экспоненциальной. Фазе роста, лаг-фаза
длится 3—4 ч. Дтах = ч”1 > время генерации около 6 ч. Такая же скорость рос-
та получена в экспоненциальной фазе роста и при выращивании P.ostreatus 1300
в ферментере на минеральной среде, где в качестве источника углерода использо-
вался ККС. Содержание протеина наиболее высокое в мицелии, который находит-
ся на стадии активного роста (24—48 ч культивирования), при замедлении скорос-
ти роста (72—96 ч) происходит снижение содержания протеина до 18 %.
В отдельных экспериментах в конце фазы экспоненциального роста отбира-
лась половина культуральной жидкости и биомассы, добавлялась свежая питатель-
ная среда до исходного объема. Культивирование продолжалось при тех же усло-
виях. В этом случае после добавления свежей среды лаг-фаза полностью отсутству-
ет. В течение 5—6 ч наблюдается экспоненциальный рост со скоростью 0,14 ч-1
(Соломко и др., 1981; Высшие съедобные базидиомицеты ..., 1983). Это макси-
мальная скорость роста, полученная для P.ostreatus 1300 в условиях глубинного
культивирования. Независимо от способа подготовки инокулята при выращива-
нии мицелия в ферментере, где обеспечивается более интенсивный массообмен,
скорость роста культуры составляет 0,07—0,08 ч”1, что вдвое выше, чем скорость
роста этого же штамма в колбах на качалке (табл. 10). Сокращение лат-фазы и
общего времени культивирования имеет большое значение д ля разработки эконо-
мически выгодного процесса, так как позволяет за одно и то же время попутать
больше продукта и уменьшает вероятность загрязнения культуры посторонней
микрофлорой. Последнее чрежычайно важно, особенно в том случае, если мице-
лий предполагается использовать как источник пищевого белка.
При исследовании P.ostreatus 1300 в глубинной культуре показано, что на ка-
чалках и в ферментере мицелий гриба растет в виде шаровидных мицелиальных
агломератов. В колбах на качалке, как правило, образуются рыхлые клубочки
мицелия, значительно варьирующие в размерах (диаметром 0,1—5 мм). 99
С изменением режима перемешивания изменяется и морфология глубинных
колоний. При 250 об/мин культура растет в виде пушистых, рыхлых клубочков
с длинными мицелиальными тяжами.! Пр® увеличении скорости перемешивания
до 500 об/мин наблюдается рост в виде более гладких плотных шариков с корот-
кими гифами на наружной поверхности, пряжки при этом сохраняются.
В процессе культивирования P.ostreatus 1300 как в ферментере, так и на ка-
чалке шарики мицелия становятся более гладкими и плотными в период замедле-
ния скорости роста, после 5 сут культивирования в колбах на качалке или после
3 сут выращивания в ферментерах. При увеличении времени культивирования
наблюдается образование шариков с плотной гладкой поверхностью и пустым
центром.
Глубинный мицелий P.ostreatus 1300, выращенный на качалках и в фермен-
тере, а также культуральная жидкость обладают приятным грибным ароматом,
который ошушается сильнее после промывания мицелия водой.
Проводилась апробация селектированного штамма P.ostreatus 1300 в опытно-
промышленных условиях. Штамм культивировали в ферментерах емкостью
100—300 л, перемешивание осуществляли с помощью барботажа воздухом. В ка-
честве источника углерода использовали глюкозу, мелассу, источника азота —
пептон, аммоний сернокислый, КЭ. Длительность отдельных ферментаций равна
72—96 ч. Максимальный выход биомассы составляет 10—12 г/л, содержание в ней
сырого протеина достигает 47 %. Биомасса имеет приятный грибной аромат. Су-
ществующее в условиях завода оборудование обеспечивает проведение фермен-
таций при отсутствии посторонней микрофлоры, условия для хорошего роста
испытанного штамма. При опытно-промышленном культивировании показано,
что в результате скрининга получен штамм P.ostreatus 1300, обладающий рядом
ценных свойств продуцента биомассы (Краснобрыжжий и др., 1985).
Работы некоторых авторов (Sakamoto et al., 1978а, b; Zadra£il, 1978; Qui-
mio, Sardsud, 1981; Zetelaki, 1981) подтверждают наши данные о перспективнос-
ти глубинного культивирования P.ostreatus с целью получения биомассы.
5.2. Культивирование Fiammulina velutipes 112
F. velutipes (опенок зимний, зимний гриб) — ценный съедобный гриб, объект
промышленного культивирования в ряде стран мира. Промышленная культура
плодовых тел F. velutipes развивается в Японии, на Тайване, в последние годы
гриб экспериментально культивируется в Европе и СССР (Singer, 1961; Shiio et
al., 1974; Промышленное культивирование ..., 1978, Tonomura, 1978; Гаврилова,
1981). Глубинное культивирование F. velutipes может быть использовано для
получения биомассы пищевого назначения, биологически активных веществ, ино-
кулюма при производстве плодовых тел. Т.Сугихара и Г-Хумфельд (Sugihara,
Humfeld, 1954) отмечают, что урожай мицелия F. velutipes по сухой массе в глу-
бинной культуре на качалке составляет около 30—40 г на 100 г использованной
глюкозы. Однако полученный ими культуральный мицелий был лишен грибного
аромата, что, по мнению авторов, не позволяет использовать F. velutipes в ка-
честве продуцента пищевой биомассы. Продукция глубинного мицелия у этого
вида по данным разных авторов составляет 5—20 г/л по сухой массе, протеин
в культуральном мицелии достигает 25—31 %, ЭК по углероду — 40—50 % (Eddy,
1958; Falanghe, 1962; Фалина, 1978; Вечери.др., 19826,Псурцева, 1983).У этого
гриба установлено наличие комплекса протеолитических ферментов (Гаврилова,
Фалина, 1975; Фалина, 1978; Гаврилова и др., 1980).
В процессе первичного отбора показано, что для F. velutipes 112 характерны
быстрый рост и значительная продукция биомассы в глубинной культуре, способ-
ность использовать субстраты, пригодные для промышленного производства пи-
щевого мицелия, установлена специфичность в отношении некоторых источников
питания.
В глубинной культуре на качалке в среда с глюкозой и пептоном в качестве
100 источника азота исследуемый штамм на 7-е сутки роста образует до 8,5 г/л био-
массы. ЭК уменьшается пропорционаш>но увеличению концентрации глюкозы
- ср.де.
При выращивании на синтетических питательных средах с разными источника-
ми азота F.velutipes 112 хорошо усваивает аммонийные соли, органические источ-
vZ азота. В условиях глубинного культивирования на качалке на питательных
.редах, содержащих в качестве единственного истоздика азота разные аммонийные
соли, больше биомассы образуется на среде с аммонием фосфорнокислым.
На рост F.velutipes стимулирующее действие оказывает добавление в пита-
тельную среду отваров некоторых сельскохозяйственных растений. Лучший ре-
зультат получен на средах с отварами фасоли, люцерны.
Выращивание F.velutipes 112 проводили в лабораторных ферментерах с на-
чпьным объемом среды 4 и 1,6 л. Скорость перемешивания составила 300 об/мин.
В качестве питательной среды использовали пивное сусло при оптимальном для
данного штамма начальном pH среды 9,0. Посевным материалом служил поверх- -
постно или глубинно выращенный мицелий. При посеве поверхностным мицелием
продолжительность лаг-фазы составляет около 18 ч. В случае, когда инокулюмом
служит глубинный мицелий, она сокращается до 10 ч.
Как и при выращивании P.ostreatus, наблюдается определенная закономер-
ность: адаптированный к условиям перемешивания и аэрации глубинный иноку-
люм быстрее переходит в фазу активного роста, чем инокулюм, выращенный
поверхностно на той же среде. Поэтому за такое же время культивирования при
посеве глубинным мицелием получено вдвое больше биомассы. 72-часовый мице-
лий, который находится еще в фазе активного роста, содержит больше протеина
г легкорастворимого белка, чем 93-часовый.
F.velutipes 112 в ферментере растет в виде мелких пушистых шариков, в поле
зрения при микроскопировании проб культуральной жидкости, помимо мицели-
альных агломератов, наблюдается много артроконидий. В гифальных клубочках
на гифах толщиной 2—3 мкм хорошо заметны пряжки. В 93-часовых пробах воз-
растает количество более плотных, крупных и гладких мицелиальных шариков.
Таким образом, показано, что штамм F.velutipes 112 обнаруживает хороший
рост в глубинной культуре на средах, содержащих недорогие и доступные источни-
ки углеродного, азотного и минерального питания. Максимальный выход биомас-
сы составляет 62 г на 100 г потребленной глюкозы.-Культуральный мицелий обла-
дает приятным грибным ароматом, на минеральной среде с 2,5 % мелассы отмече-
но содержание сырого протеина до 37 %. Селектированный штамм F.velutipes 112
является перспективным для дальнейших исследований в условиях, приближен-
ных к промышленным (Buchalo et al., 1979; А.с. 727687; Высшие съедобные ба-
зидиомицеты ..., 1983).
5.3. Культивирование Panus tigrinus 131
P.tigrinus (пилолистник тигровый) — съедобный гриб, распространенный в СССР
(Зерова и др., 1979; Горленко и др., 1980; Сержанина, 1984). Из-за жесткой кон-
систенции в пищу употребляются молодые плодовые тела.
Благодаря легкости выделения в культуру, хорошему росту и плодоношению
в лабораторных условиях P.tigrinus используется как модельный объект при изу-
чении плодоношения высших базидиомицетов (Rypacek, Sladky, 1972).
О культивировании P.tigrinus в колбах на каталке для получения белковой
биомассы упоминают А.Торев и Й.Запрянов (1973). Сведения об урожае биомас-
сы авторами не приводятся, хотя указано, что этот вид обладает низкой
скоростью роста.
P.tigrinus 131 был отобран нами для дальнейших исследований как штамм,
быстро растущий и накапливающий значительную биомассу в условиях глубинной
культуры, хорошо использующий различные комплексные среды, в том числе
перспективные для промышленного получения пищевой биомассы (А.с. 883177;
Капич и др., 1983).
Установлено, что P.tigrinus 131 хорошо растет в поверхностной и глубинной 101
Таблица 11. Накопление биомассы и содержание в ней сырого протеина при глубинном культивиро-
вании Р.tigrinus 131 на средах с сельскохозяйственными отходами
Питательная среда
Мицелий, г/л
Сырой протеин,
% сухой массы
Нестандартная клубневая фракция картофеля 100 г/л (по сырой
массе)
Нестандартная клубневая фракция картофеля 100 г/л (по сырой
массе) + NH4 NO,
Нестандартная клубневая фракция картофеля 150 г/л (по сырой
массе) + 3 г/л NH, NO,
Нестандартная клубневая фракция картофеля 100 г/л (по сырой
массе) + 20 мл/л кукурузного экстракта
Картофельная мезга 20 г/л (по сухой массе)
Картофельная мезга 20 г/л (по сухой массе + минеральная основа)
Клеточный сок картофеля (3 % сухих веществ) + 5 г/л крахмала +
минеральная основа
Свекловичный жом 20 г/л (по сухой массе)
Свекловичный жом 20 г/л (по сухой массе + минеральная основа)
Творожная сыворотка
Творожная сыворотка, разбавленная водой в 2 раза, + 10 г/л куку-
рузного экстракта
9,2-123 . 14,4-23,8
83—10,6 32,5—46,8
10,4-15,8 27,3-38,1
9,0-13,4 443—60,3
10,5-14,2 8,4-20,7
9,8-12,8 21,6-30,4
4,2-5,9 38,9-51,1
10,8-123 16,9-273
9,4—10,9 30,0-40,7
9,9-16,7 34,8—44,9
93—163 27,5-44,9
культурах на минеральных средах с крахмалом и различными отходами переработ-
ки картофеля. Указанные субстраты представляют интерес как компоненты в про-
мышленных средах, поэтому в дальнейшем рост P.tigrinus *131 исследовался на
крахмалистых средах. При выращивании мицелия на среде с картофельным крах-
малом без каких-либо биостимуляторов продолжительность лаг-фазы составляет
18 ч. На средах с картофельной мукой, крахмалом и КЭ или ККС лаг-фаза сокра-
щается до 12 ч. На среде с ККС содержание белка в биомассе значительно выше,
чем на других средах.
На крахмалосодержащих средах P.tigrinus 131 растет в виде рыхлых, мелких
хлопьев, почти гомогенно. В качестве основных компонентов сред для культиви-
рования P.tigrinus 131 испытаны свекловичный жом и творожная сыворотка.
Результаты культивирования P.tigrinus 131 на средах с этими сельскохозяйствен-
ными отходами, полученные с применением различных партий перечисленных
субстратов, приведены в табл. 11. В зависимости от партии субстрата биомасса
и содержание в ней сырого протеина колебались в широких пределах. Использо-
вание нестандартной клубневой фракции картофеля, картофельной мезги и свек-
ловичного жома в качестве основных компонентов питательных сред без внесе-
ния дополнительных источников питания приводит к получению биомассы с низ-
ким содержанием сырого протеина. Основным лимитирующим элементом в этом
случае является азот. Внесение дополнительного источника азота во все перечис-
ленные среды в сочетании с минеральными солями или без них вызывает повыше-
ние содержания сырого протеина в биомассе, хотя выход биомассы при этом не-
сколько снижается. Лучшие результаты получены при добавлении кукурузного
экстракта в среду с нестандартной клубневой фракцией картофеля.
При выращивании P.tigrinus 131 на творожной сыворотке к концу фермента-
ции в среде остается 2—3 % неутилизированных углеводов. Разведение сыворотки
с одновременным добавлением 10 г/л КЭ позволило более экономно использовать
углеводы среды. При этом биомасса и содержание сырого протеина в ней прибли-
зительно равноценны в обоих вариантах.
На питательных средах с картофельной мезгой, свекловичным жомом и не-
стандартной клубневой фракцией картофеля в биомассе P.tigrinus 131 содержатся
остатки этих субстратов, что делает биомассу более пригодной для использования
в корм животным, чем в пищу человеку. В качестве белковых обогатителей пище-
вых продуктов лучше применять биомассу P.tigrinus, получаемую на молочной
сыворотке и нестандартной клубневой фракции картофеля, при содержании по-
следней в питательной среда не более 100 г/л (Капич и др., 1984).
№ минеральных источников азота на синтетической среде максимальное обра-
зование биомассы обеспечивают аммонийные соли. На синтетических средах с от-
варами сельскохозяйственных растений более активному накоплению биомассы
102 способствует добавление отваре» клевера и вики.
Время кулыпибаройания, ч
’ ' д;
Рост Panus tigrinus 131 в ферментерах ’’АНКУМ-2”: а - при отъемно-доливном культивировании до
отъема биомассы (7), после отъема биомассы и долива питательной среды (2); б — при инокуляции
глубинным (?) и поверхностным (2) мицелием
Содержание протеина в биомассе при культивировании в ферментерах ’’АН-
КУМ-2” в значительной мере обусловливается составом питательной среды и зави-
сит от физиологического состояния культуры. На пивном сусле концентрация сы-
рого протеина на 78—94-й ч культивирования составляет 23,5—40,9, на среде с
крахмалом — 43,5—44,5 %.
От состава питательной среды в значительной мере зависит также динамика
роста исследуемого штамма. На глюкозопептонной среде рост P.tigrinus 131 ха-
рактеризуется очень, короткими лаг-фазой и стационарной фазой, удельная ско-
рость роста (Дшах) составляет 0,07 ч“1, максимальное содержание протеина отме-
чается в конце экспоненциальной фазы, на 24-й час культивирования. При
культивировании P.tigrinus 131 на молочной сыворотке дтах = 0,11 ч"1
(Капич и др., 1984).
Рост P.tigrinus 131 в ферментерах на крахмалосодержащих средах происходит
лучше при добавлении таких стимуляторов, как ККС и КЭ в количестве 1 %.
В опытах с P.tigrinus 131 наблюдается та же закономерность, что и в опытах
с P.ostreatus и F.velutipes: при посеве глубинным мицелием, находящимся в фазе
активного роста, длительность лаг-фазы составляет 10—12 ч, а при использовании
поверхностно выращенного инокулюма — 20—28 ч (рис. 16,6). На продолжитель-
ность лаг-фазы оказывает влияние также состав питательной среды.
Особенно отчетливо преимущество активнорастущего посевного глубинного
мицелия проявляется при отъемно-доливном культивировании. При отъеме части
биомассы и культуральной жидкости из ферментера и доливе свежей питательной
средой, что было произведено после 55-го ч культивироваьия, рост исследуемого
штамма в течение следующих 20—35 ч происходит экспоненциалы»», без лаг-фазы
(рис. 16, д)..
На рост P.tigrinus 131 в ферментерах значительное влияние оказывает интен-
сивность перемешивания. При концентрации посевного мннгчня до 2 г/л хороший
рост культуры обеспечивается при 200—300 об/мин. Однако при концентрации
биомассы свыше 4 г/л более быстрому росту P.tigrinus 131 способствует увеличе-
ние скорости перемешивания до 500 об/мин.
Проведено опытное культивироваие P.tigrinus 131 в ферментере емкостью 103
3 м3. Посевной мицелий выращивали в инокуляторе емкостью 100 л. Инокулюм
вносили в количестве 10 % по объему. Для культивирования в качестве питатель-
ной среды использовали разведенную водой молочную сыворотку с КЭ. Переме-
шивание осуществляли по барботажному типу. За 36 ч роста урожай мицелия по
сухой массе составил 10 кг/м3, или 0,28 кг/м3/ч, содержание сырого протеина
в полученной биомассе было 44,7 %.
P.tigrinus впервые интродуцирован нами в глубинную культуру в качестве
продуцента пищевой биомассы (А.с. 883177). Селектированный штамм P.tigrinus
' 131 обладает высокой продуктивностью, образует биомассу с приятным грибным
ароматом и содержанием сырого протеина до 60 %, усваивает многие недефицит-
ные источники питания, в том числе различные отходы сельскохозяйственного
и промышленного производства (Капич и др., 1983). По скорости роста (дтах =
= 0,11 ч“1) P.tigrinus 131 не уступает P.ostreatus 1300 (Капич и др., 1984). Штамм
P.tigrinus 131 устойздв к контаминации посторонней микрофлорой, имеет ха-
рактерные морфологические структуры, позволяющие осуществлять контроль за
чистотой культуры.
5.4. Исследование некоторых биологических особенностей
Panus tigrinus 131 при многократных пассажах в культуре
Использование высших базидиомицетов в качестве промышленных продуцентов
требует, помимо исследования их питательных потребностей и отношения к факто-
рам внешней среды, также решения некоторых специфических вопросов, обуслов-
ленных влиянием культивирования на-биологические свойства этих грибов. Од-
ним из вопросов, которому ранее не уделялось внимания, является изменение
биологических особенностей культур высших базидиомицетов в процессе продол-
жительного культивирования, связанного обычно с многократными пассажами на
агаризованных и жидких средах.
Глубинное культивирование продолжительностью несколько суток при
получении биомассы в периодическом процессе не оказывает значительного воз-
действия на образование пряжек, культуральные признаки, способность культу-
рального мицелия к плодоношению и др. (Luthardt, 1969; Oyama et al., 1974;
Shiio, 1974; Gramms, 1978). Р.Кургцман (Kurtzman, 1978) выращивал на круго-
вых качалках близкий к Pleurotus ostreatus вид, P.sapidus, в течение 30 сут. Пряж-
ки на ьипелии у этого гриба сохранялись весь период культивирования. Через
30 сут на скоплениях глубинного мицелия наблюдалось образование зачатков
плодовых тел, которые развивались в нормальные плодовые тела при помещении
культуры в стационарный режим и благоприятные условия освещения. В то же
время А.Гинтерова (Ginterova, Г973а), выращивая P.ostreatus в глубинной куль-
туре на качалке в течение 14 сут, отмечает исчезновение пряжек и характерного
грибного аромата. Она приходит к выводу, что неудачи в создании технологии
глубинного культивирования высших базидиомицетов связаны с особенностями
их физиологии. Таким образом, вопросы состояния культур высших базидиоми-
цетов при длительном периоде культивирования нуждаются в решении.
P.tigrinus 131 исследовался как перспективный продуцент пищевой биомас-
сы. P.tigrinus был выбран нами также как объект с четкими культурально-морфо-
логическими признаками, имеющий пряжки на мицелии и легко образующий пло-
довые тела в лабораторных условиях. P.tigrinus 131 выращивался глубинно и по-
верхностно на жидком и агаризованиом пивном сусле (РВ - 4,0; pH 6,0). В опыте
использовали одну партию пивного сусла. Опыт проводили в 5—6-кратной повтор-
ности, продолжительность опыта 110 сут.
На качалке (200 об/мин) культуру выращивали в 500-миллнлитровых колбах
Эрпенмейера с 50 мл питательной среды. Инокулировали глубинным мицелием
(10 % по объему). Каждые 7 сут культуру пересевали на свежую питательную сре-
ду. В эти сроки учитывали сухую биомассу, pH среды, содержание в ней РВ, описы-
вали морфологию глубинных колоний и мицелия. При пересеве глубинный миле-
104 лий инокулировали также на агаризованную среду в чашки Петри и в пробирки.
Параллельно P.tigrinus 131 культивировали на СА в чашках Петри и пробирках.
Пересев также производили каждые 7 сут.
На агаризованных средах учитывали следующие показатели: диаметр колонии
на 3, 5, 7-е сут роста, на поверхности колонии проводили капельные цветовые
химические реакции на наличие ферментов лакказы, тирозиназы, пероксидазы,
описывали морфологию колоний и мицелия. Чашки Петри и пробирки с агаризо-
ванной средой 7 сут инкубировали в термостате при 27 °C, затем выставляли на
рассеянный дневной свет при комнатной температуре и учитывали появление
зачатков плодовых тел. Данные статистически обрабатывали, выборки сравнивали
с использованием критерия Фишера.
В глубинной культуре в течение первых 48 сут отмечены однотипный по мор-
фологии рост культуры, наличие пряжек на мицелии. В этот период в культураль-
ной жидкости наблюдаются как мелкие (диаметром 1—2 мм), плотные, пушистые
шарики, так и более крупные (диаметром до 5 мм), гладкие, полые внутри
(табл. XXXI), а также отдельные гифы.
Урожай биомассы. в первые 55 сут составил 0,5—1,5 г/л/сут по сухой массе.
После 55 сут отмечено увеличение среднесуточной продукции биомассы, которое
достоверно больше на 62-е сутки культивирования, достигая 2,4 г/л. В то же время
происходят изменения в морфологии культуры. Образуются очень крупные (диа-
метром до 1 см) колонии, от которых отходят толстые, легко отделяющиеся
пучки гиф, создающие новые центры роста (табл. XXXI). Так как пересев таких
крупных колоний нельзя было осуществить с помощью пипетки, культура сте-
рильно гомогенизировалась в дезинтеграторе при 6 тыс. об/мин. После гомогени-
зации рост происходил в виде сходных по размеру гладких шариков, при этом
сохранялся высокий среднесуточный урожай биомассы (1,8 г/л). На 76—83-е сут-
ки в культуральной жидкости появляется много коротких разветвленных гиф,
лишенных пряжек. В этот период отмечено падение биомассы до 0,7—0,8 г/л/сут.
К 90-м суткам культивирования такие гифы наблюдаются в значительном коли-
честве. В это же время отмечено образование многочисленных рыхлых агломера-
тов и мелких, плотных, пушистых шариков, что сопровождается увеличением
среднесуточной биомассы до 1,8—2,0 г/л. Такой урожай биомассы меньше, чем
на 62-е сутки, но больше, чем в первые 48 сут культивирования. Значение pH сре-
ды и содержание РВ в конце 7-суточной, ферментации сохраняется практически
постоянным на протяжении всего опыта. Повышение pH до 6,2 и снижение РВ до
2,1 совпадает с пиком биомассы на 63-е сутки культивирования. Величины средне-
суточного урожая биомассы за весь период культивирования достоверно раз-
личаются (р > 0,95).
Суспензия дисперсно растущих коротких гиф, лишенных пряжек, была иноку-
лирована на агаровые косяки, которые инкубировались в течение 7 сут в термоста-
те, затем этой культурой были инокулированы колбы с жидким суслом, которые
инкубировались в термостате. В пленке 7-суточного поверхностного мицелия на-
блюдались пряжки. Этим мицелием, предварительно гомогенизированным, были
инокулированы колбы и проведёно глубинное культивирование на качалке.
Среднесуточный урожай биомассы при этом составил 1,2 г/л, пряжки со-
хранялись.
Кривые роста колоний (pic. 17), инокулированных поверхностным и глубин-
ным мицелием, почти совпадают. Они имеют волнообразный характер, что свиде-
тельствует о наличии определенных биоритмов, характерных для роста P.tigrinus
131. Показательно, что точки, в которых отмечены наиболее низкие и наиболее
высокие значения диаметра колоний, совпадают по времени с точками падения и
пиками биомассы в глубинной культуре. При глубинном культивировании в это
время отмечалось появление дисперсного роста в виде коротких разветвленных
гиф, в поверхностной культуре при посеве глубинным мицелием — секторность
колоний (табл. XXXI).
При микроскопическом исследовании культурального мицелия на агаризован-
ной среде в культурах, инокулированных глубинным мицелием, отмечено появле-
ние очень крупных пряжек (длина до 15 мкм; высота до 10 мкм), расположен-
ных на гифах толщиной 3—5 мкм. а
105
Рост Panus tigrinus 131 при многократных пассажах: 1 - глубинная культура; 2 - поверхностная
культура, инокуляция поверхностным мицелием; 3 — поверхностная культура, инокуляция глубин-
ным мицелием
В пробирках и чашках Петри, инокулированных как поверхностным, так и
глубинным мицелием, на рассеянном свету появляются плодовые тела, дифферен-
цированные на ножку и шляпку. Обычно наблюдается или незначительное количе-
ство более крупных плодовых тел,или много более мелких (табл. XXXI). Плодо-
ношению, как правило, предшествует образование на поверхности мицелиальной
колонии коричневой плотной корки, придающей ей кожистый характер. Часто
плодовые тела начинают формироваться в месте инокуляции глубинным мицели-
ем, при этом плодоношения появляются несколько раньше, чем при пассажах по-
верхностной культуры. В пробирках, непосредственно инокулированных дисперс-
ным мицелием, лишенным пряжек, плодообразование не происходит. Однако если
посие-дассажей в поверхностной и глубинной культуре снова образуются пряжки,
то при инокуляции таким мицелием появляются нормальные плодовые тела.
На поверхности колоний, растущих на агаризованной среде, проводили капель-
ные цветовые реакции на наличие лакказы, тирозиназы, пероксидазы. Реакция на
эти тесты была положительной во всех вариантах опытов на протяжении периода
культивирования.
Следовательно, при длительном поверхностном и глубинном кульгивнрованж
P.tigrinus 131, сопровождавшимся многократными пассажами культуры, показа-
но, что на агаризованной и жидкой питательных средах наблюдаются ритмичные
колебания роста, выражающиеся в изменении среднесуточного прироста биомассы
и диаметра колоний. При однофакторном дисперсионном анализе всех выборок
в каждом варианте опыта установлено, что величины, характеризующие среднесу-
точную продукцию биомассы и среднесуточный прирост диаметра колонии на про-
тяжении периода культивирования, достоверно различаются. Периоды более и ме-
нее активного роста продолжительностью 15—17 сут совпадают по времени в глу-
бинной и поверхностной культурах, что свидетельствует о ритмшиюсти роста, ко-
торая присуща данному виду.
196 При глубинном культивировании отмечены также изменения морфологии ко-
лоний и мицелия. Появление пряжек после пересева глубинного мицелия в по-
верхностную культуру свидетельствует об адаптационном характере происходя-
щих изменений. Исчезнование пряжек в процессе культивирования в данном слу-
чае нельзя объяснить влиянием неблагоприятных условий, как это отмечается в
литературе (Gabriel, 1967; Santra, Nandi, 1977), так как условия культивирова-
ния сохранялись постоянными. Здесь может наблюдаться спонтанная дедикариоти-
зация, обнаруженная у некоторых видов высших базидиомицетов, например
Pholiota nameko (Arita, 1979b), обусловленная, возможно, сезонным ритмом.
Изучение биоритмов у грибов, являющихся универсальной особенностью
живых организмов, привлекает все большее внимание исследователей (Беккер
и др., 1978; Дудченко, 1978) .Циркадные ритмы проявляются в культурах грибов
на твердой питательной среде в виде концентрической зональности колоний.
Т.С Шаркова (1971), З.Э.Беккер и соавт. (1978) установили наличие 2-3-суточ-
ных ритмов у некоторых видов грибов в глубинной культуре. У высшего базидио-
мицета Chaetoporellus sp. отмечена трансформация ядерных структур. У Pleurotus
ostreatus и Panus tigrinus обнаружены сезонные изменения ферментативной ак-
тивности, появление сезонноспецифических изоэнзимов (Мельничук, 1980).
Поскольку нами получены первые данные о морфологических и физиологиче-
ских изменениях, происходящих при длительном культивировании высших бази-
диальных грибов, их интерпретация затруднительна, потребует дополнительных
исследований и накопления фактического материала. Однако несомненно, что при
культуральных исследованиях высших базидиомицетов, связанных с их практиче-
ским использованием и идентификацией культур, подобная изменчивость должна
учитываться.
5.5. Питательная ценность культурального мицелия
исследованных штаммов
Вопрос об использовании культурального мицелия высших съедобных базидиоми-
цетов для пищевых целей в значительной мере связан с оценкой его питательных
свойств, что, в первую очередь, определяется количеством содержащегося в полу-
чаемой биомассе белка, его качественным составом и усвояемостью. Как самый
веский показатель в оценке питательности в настоящее время предлагается исполь-
зовать скор незаменимых аминокислот, т.е. отношение содержания незаме-
нимых аминокислот в исследуемом продукте к содержанию этих аминокислот в
эталонном белке ФАО (1970, 1972), а также ряд других показателей.
У различных видов 10—15 % суммы аминокислот могут составлять неза-
менимые аминокислоты, примерно 70—75 % из них связаны в белках (Cri-
san, Sands, 1978).
Перевариваемость и усвояемость получаемой биомассы в значительной степе-
ни зависят от наличия труднодоступных веществ в грибных клеточных оболочках,
особенно хитина. Он является важным структурным компонентом большинства
мицелиальных грибов. В грибных оболочках хитина может быть до 60 %. Его на-
копление зависит от условий культивирования и возраста культуры. Очень слабо
исследованным остается важный для определения питательной ценности вопрос
о перевариваемости грибного белка в культуральном мицелии. Перевариваемость
протеина в плодовых телах некоторых высших базидиомицетов составляет менее
70 % (Crisan, Sands, 1978). Однако Т.Сутимори и др. (Sugimori et al., 1971) сооб-
щают, что перевариваемость грибного протеина глубинного культурального мице-
лия Lentinus edodes и Pleurotus ostreatus достигает 80—90 % в зависимости от
источника углерода в питательной среде.
В этом разделе приведены данные о содержании аминокислот, хитина, сырого
протеина и его перевариваемости в образцах культурального мицелия Pleurotus
ostreatus 1300, Panus tigrinus 131, Flammulina velutipes 112, а также токсиколо-
гических исследованиях биомассы (Бухало и др., 1985).
Биомасса исследованных штаммов P.ostreatus 1300, F.velutipes 112 и P.tig-
rinus 131, выращенная в одинаковых условиях глубинного культивирования. 107
Таблица 12. Содержание связанных аминокислот в культураль-
ном мицелии
Аминокислота: P.ostreatus 1300 F.velutipes 112 P.tigrinus 131
1 2 1 1 2 1 | 2
Лизин 0,4 6,0 0,7 5,1 13 22,3
Гистидин 0,1 12 0.2 13 0,1 13
Аргинин Аспарагиновая 0,4 6,0 0,6 42 Следы Следы
кислота 13 19,4 13 11.4 12 173
Треонин 03 43 0.6 4,9 0,4 5.9
Серин Глютаминовая 0,4 5,8 0,7 5,6 0,5 63
кислота 1,4 20,9 22 18,9 03 43
Пролин 0,2 32 1,0 7,8 03 3,7
Глицин оз 63 0,8 5,7 0,6 83
Аланин 0,6 92 1.1 8,1 0,8 11,9
Валин 0,3 3,7 03 3,6 0,3 33
Изолейцин 02 2.7 0,2 1,7 03 3,9
Лейлин 0,4 6,6 0,7 53 0,6 93
Тирозин Следы Следы 0,1 1,1 Следы Следы
Фенилаланин 0,2 3.4 1.9 14,4 0,4 5,9
Метионин Следы Следы Следы Следы Следы Следы
Примечание: 1 - процент абсолютно сухой массы. 2 — обшей суммы аминокислот. процент
Таблица 13. Аминокислотный состав культурального мицелия
исследованных штаммов базидиомицетов по сравнению с эта-
лонным белком ФАО (г на 100 г белка)
Аминокислота P.ostreatus 1300 F.velutipes 112 1 P.tigrinus 1 131 Эталонный белок ФАО
Лейцин зз 2,4 3.1 7,0
Треонин 4,3 4.8 43 4,0
Лизин 53 4.1 4,8 53
Фенилаланин 3,1 Следы Следы —
Валин 5,0 3,9 3,5 5,0
Изолейцин 5,8 3,4 3,3 4,0
Метионин 2.4 3,0 0,9 —
Триптофан Не опред. Не опред. Не опред 1,0
Цистин Следы Следы Следы —
Аргинин 6,1 3,9 2,4 —
Гистидин 2,3 1,6 2,1 —
Тирозин Следы Следы Следы —
Аланин 3,0 4,2 4,0 —
Глицин 11,6 11,0 14,6 —
Серин Аспарагиновая 3,6 23 33 —
кислота Глютаминовая 6,1 4,2 1,8 —
кислота Сумма аро матиче- 8,6 5,6 4,7 —
ских кислот Сумма серосодер- 3,1 Следы Следы 6,0
жаншх аминокислот 2,4 Сумма незамени- 3,0 0,9 33
мых аминокислот Химический 29,4 21,1 19,9 36,0
скор, % 81,0 59,0 55,0 100,0
мало различается по содержа-
нию общего азота и соответст-
венно расчетного количества
сырого протеина.
Концентрация хитина в ис-
следуемых образцах культу-
рального мицелия невелика и
незначительно отличается у от-
дельных видов. В состав хити-
на входит около 7 % азота. Ис-
ходя из этого, в биомассе ис-
следованных видов на долю
трудногидролизуемых и, по-
видимому, неперевариваемых
клеточных оболочек прихо-
дится около 0,25 % общего
азота. Наиболее существенные
различия обнаружены в рас-
пределении аминного азота
между связанными и свобод-
ными внутриклеточными ами-
нокислотами. Так, у P.ostrea-
tus 1300 свободные амино-
кислоты составляют 21,3 %, у
P.tigrinus 131 — 25 %, а у
F.velutipes 112 — свыше 55 %
аминного азота биомассы.
Исследование состава свя-
занных аминокислот глубин-
ного мицелия данных штам-
мов обнаружило наличие
15 аминокислот, в том числе
всех незаменимых, кроме се-
росодержащих аминокислот,
которые в кислых гидролиза-
тах разрушаются и поэтому
обнаруживаются только в сле-
довых количествах (табл. 12).
Среди, связанных амино-
кислот доминирующими явля-
ются глицин, аспарагиновая и
глютаминовая кислоты, что в
целом характерно для плодо-
вых тел высших базидиомице-
тов (Crisan, Sands, 1978). Ис-
следованные нами виды ха-
рактеризуются и определен-
ной спецификой аминокислотного состава, Так, белки F.velutipes 112 отличает
относительно более высокое содержание незаменимых ароматических аминокис-
лот: фенилаланина и тирозина. В гидролизатах P.tigrinus 131 обнаружен высокий
уровень лизина и аланина, которые составляют соответственно 22,3 и 11,9 % сум-
мы связанных аминокислот биомассы, в то время как содержание аспарагиновой
кислоты значительно ниже, чем у двух других вид».
Результаты исследования общего амниокнслотного состава биомассы трех
культивируемых штаммов представлены в табл. 13, где для сравнения приведен
также расчет химического скора аминокислот по отношению к идеальному белку
ФАО (FAO, 1972).
108 Наиболее сбалансированной по аминокислотному составу является биомасса
P.ostreatus 1300. По сравнению с данными, полученными для плодовых тел этого
вида (Kalberer, Kunsch, 1974), культуральный мицелий исследованного штамма
P.ostreatus 1300 богаче лизоном, валином и изолейнином. Это определило более
высокий, чем в плодовых телах, химический скор незаменимых аминокислот и
поставило культуральный мицелий P.ostreatus по этому показателю в один ряд
с грибами наиболее высокого качества. Биомасса F.velutipes 112 и P.tigrinus 131,
выращенная в таких же условиях на пивном сусле в поверхностной культуре,
имеет более низкий индекс незаменимых аминокислот и лимитирована, кроме
серосодержащих, еще и по ряду других незаменимых аминокислот.
Аминокислотный состав белка био массы P.tigrinus 131, полученной в произ-
водственных условиях на молочной сыворотке в процентах от сырого протеина
следующий: лизин - 4,2, серин - 3,4, гистидин. — 2,5, аргинин — 4,9, аспарагино-
вая кислота — 6,3, треонин — 3,5, глютаминовая кислота — 11,1, пролин — 3,5,
глицин - 2,9, аланин - 4,2, цистин - следы, валин — 3,8, метионин - 1,5, изолей-
цин — 2,4, лейцин - 5,3, тирозин - 8,8, фенилаланин — 4,3, триптофан — 1.4.
В культуральном мицелии исследованных штаммов, выращенных в благо-
приятных условиях культивирования, до 80 % сырого протеина присутствует
в перевариваемой форме.)В образцах биомассы, полученных при выращивании
в колбах на качалке, где условия снабжения культур кислородом менее благо-
приятны, чем в ферментерах, отмечено не только более низкое содержание сыро-
го протеина, но и более низкая степень его перевариваемости. Дальнейшая опти-
мизация параметров культивирования высших базидиомицетов в ферментерах
позволит получать высококачественный продукт — пищевую грибную биомассу
с достаточно высокой питательной ценностью и хорошей перевариваемостью.
В культуральном мицелии P.ostreatus 1300 содержатся те же жирные кисло-
ты, что и в плодовых телах этого вида (Соломко и др., 1984). Преобладает олеи-
новая кислота (до 56 % суммы). В глубинном культуральном мицелии возраста-
ет содержание пальмитолеиновой кислоты (до 3,6 %), которая в плодовых те-
лах P.ostreatus обнаружена в следовых количествах.
При глубинном культивировании штаммов P.ostreatus в мицелии отмечено
увеличение ненасыщенных жирных кислот, незаменимых для животных организ-
мов. Соотношение насыщенных и ненасыщенных жирных кислот у P.ostreatus
1300, по данным Э.Ф .Соломко с соавт. (1984), сходно с таковым в растительных
маслах. Культуральный глубинный мицелий штаммов P.ostreatus содержит вита-
мины группы В (мкг/г сухой массы): тиамин - 6—18, рибофлавин - 30—40,
ниацин - 6-18, пиридоксин — 0,4-1,6 и биотин - 0,14—0,18 (Соломко
и др., 1983).
В опытах на лабораторных животных исследована патогенность (вирулент-
ность, токсичность, токсигенность) культуры глубинного мицелия Р.ostreatus
1300. Мышам и кроликам перорально вводили суспензии лиофилизированной
и свежей 5- и 14-суточной мицелиальной культуры гриба в дозах 0,1-5,0 мл. Од-
нократные и повторные введения у подопытных животных не вызывали призна-
ков заболевания. У них не выявлены патологические изменения внутренних орга-
нов. Аналогичные результаты получены и для культуры P.tigrinus 131. Иссле-
дованы препараты высушенной биомассы глубинного мицелия P.tigrinus 131, ко-
торые вводились в желудок белых крыс в максимально возможной дозе. При
этом не наблюдалось гибели или интоксикации животных.
Таким образом, глубинно выращенный мицелий штаммов P.ostreatus 1300,
P.tigrinus 131 и F.velutipes 112, селектированных нами как продуценты биомассы
пищевого назначения, безвреден, нетоксичен, обладает благоприятным аминокис-
лотным составом, качественно более высоким, чем природные плодовые тела.
В мицелии, полученном в оптимальных условиях культивирования, до 80 % сыро-
го протеина находится в перевариваемой форме.
109
5.6. Использование глубинного мицелия
для культивирования плодовых тел
Возможность получения плодовых тел высших базидиомицетов из глубинного ми-
целия позволяет вести исследования в направлении использования его в качестве
ивокулюма при выращивании плодовых тел различных видов съедобных грибов.
Глубинный маточный мицелий может быть получен в больших количествах за
короткий срок (3—5 сут), что значительно сокращает процесс производства пло-
довых тел в целом и повышает его экономическую эффективность.
Нами неоднократно отмечалось образование зачатков и зрелых плодовых тел
у Pleurotus ostreatus 1300, Panus tigrinus 131 и Flammulina velutipes 112 непо-
средственно в колбах с глубинным мицелием, которые после периода встряхива-
ния в течение 2—3 недель, а иногда и дольше,находились в покое при естественном
дневном освещении и комнатной температуре.
В плане получения плодовых тел особо ценных в пищевом отношении микори- '
зообразуюших базидиомицетов с использованием глубинного мицелия несомнен-
ный интерес представляет исследование, проведенное И.Ояма с соавт. (Oyama et
at, 1974). В чистой культуре они получили плодовые тела Boletus edulis и некото-
рых других видов Boletus, Тricholoma и Lyophyllum. Возможность использования
глубинного мицелия Flammulina velutipes в качестве посевного материала для
промышленного культивирования плодовых тел этого вида обсуждается в рабо-
те ТЛ1иио с соавт. (Shiio et al., 1974). Авторы делают вывод о важности и перс-
пективности использования глубинной культуры в процессе промышленного
выращивания плодовых тел съедобных грибов.
Проведен опыт по заражению отрубков осиновой древесины инокулятом глу-
бинного мицелия Pleurotus ostreatus и Panus tigrinus (табл. ХХХП). Урожай пло-
довых тел P.ostreatus на отдельных отрубах достигал 1800 г, средний — до 550 г,
максимальная масса плодовых тел — 109 г, диаметр шляпки наиболее крупных
плодовых тел — до 15 см. Образование плодовых тел отмечено на 61,3 % отрезков.
У P.tigrinus средняя урожайность с отрезка составляла 135 г.
Проведенные нами эксперименты подтверждают точку зрения о том, что глу-
бинный мицелий'съедобных грибов помимо непосредственного использования для
пишевых и кормовых целей может найти также применение в технологии произ-
водства плодовых тел как .один из способов быстрого получения большого коли-
чества посевного мицелия и обеспечения оптимальных условий роста гриба в ве-
гетативной фазе.
Создание технологий получения продуктов из живых клеток микроорганизмов,
в том числе высокоинтенсивного биотехнологического производства белка, при-
обретает все большее значение (Скрябин, Брошин, 1984). Высказывается мнение
(Zetelaki, 1981; Вассер и др., 1984; Блинов, 1984), что среди очередных задач
в области биотехнологии стоит производство грибных продуктов с естественными
вкусовыми качествами на основе глубинного культивирования съедобных грибов.
Важный начальный этап создания биотехнологии — поиск штаммов с наивыс-
шей продуктивностью. На этом этапе нами были оценены потенциальные возмож-
ности и отобраны для дальнейших исследований штаммы Pleurotus ostreatus 1300,
Flammulina velutipes 112 и Panus tigrinus 131. Стратегия поиска продуцентов пи-
щевой биомассы среди высших съедобных базидиомицетов обсуждалась в преды-
дущей главе.
Дальнейшим этапом создания эффективной биотехнологической системы яв-
ляется подбор питательной среды, обеспечивающей потребности культуры в ком-
понентах, оптимальных для получения целевого продукта. Из большого числа ва-
риантов питательных сред выбирают наилучшие, характеризующиеся доступностью,
технологичностью и дешевизной. На основании изучения питательных потребное -
110 тей селектированных штаммов-продуцентов нами предложены экономичные пита-
тельные среды, включающие в качестве компонентов отходы переработки карто-
феля, молочную сыворотку, мелассу, дешевые и недефицитные биостимуляторы,
источники минерального питания.
Генетический потенциал продуцента реализуется на стадии отработки режима
культивирования. К наиболее важным параметрам роста при получении биомассы
в качестве конечного продукта следует отнести скорость роста, длительность рос-
товых фаз, ЭК, величину урожая и другие (Перт, 1978; Rose, 1979b; Виестур и
др., 1980; Подгорский, 1982; Rowlands, 1983; Блинов, 1984).
Основные исследования по глубинному культивированию мицелия высших
базидиомицетов выполнены с использованием периодического культивирования.
Однако данные, количественно характеризующие рост высших базидиомицетов
в глубинной культуре, практически отсутствуют. А они необходимы для разработ-
ки технологии процессов управляемого культивирования этих грибов, а также для
сравнения потенциальных возможностей базидиомицетов с таковыми других ми- -
делиальных грибов и микроорганизмов, использующихся в качестве промышлен-
ных продуцентов.
Одной из важнейших проблем, в значительной мере ограничивающих практи-
ческое использование многих видов высших базидиомицетов, является незначи-
тельная скорость роста в культуре. Так, для Boletus edulis при выращивании в
глубинной культуре на качалке продолжительность лаг-фазы составляет 2 недели,
время удвоения биомассы в период экспоненциального роста — 2,5—3,5 сут (Eyber-
gen, Scheffers, 1972), ФДийкстра (Dijkstra, 1976) считает, что процесс производ-
ства пищевого мицелия на основе глубинного культивирования высших базидио-
мицетов экономичен, если он длится 7 сут.
Максимальная степень роста определяется внутренними особенностями орга-
низма. Однако если имеются ограничения в снабжении питательными компонента-
ми, то рост не сбалансирован и питательные вещества используются в процессах
метаболизма, не существенных для роста. Задача состоит в том, чтобы с помощью
варьирования состава питательной среды направить метаболизм по пути использо-
вания промежуточных метаболитов и превращения их в клеточное вещество. Ско-
рость роста может значительно варьировать при добавлении в среду различных ис-
точников питания, изменении pH среды, температуры и тд. Например, при исполь-
зовании разных источников азота скорость роста у Achlya bisexualis составляет
0,04—0,81 ч-1 (Bull, Bushell, 1976). У этого гриба отмечена наивысшая скорость,
известная у мицелиальных грибов. Для некоторых несовершенных грибов уста-
новлены низкие скорости роста и введено понятие ’’минимальная скорость роста”.
Последняя определяется как такая, ниже которой вся популяция прекращает
рост и ее жизнедеятельность выражается только в метаболизме или морфологиче-
ской дифференциации.
Удельная скорость роста, которая характеризует прирост единицы биомассы
за единицу времени, является одной из важнейших характеристик штамма. Макси-
мальная удельная скорость роста наблюдается при культивировании в отсутствии
лимита по субстрату в период экспоненциального роста,
Обоснована применимость экспоненциального закона для культур нитчатых
грибов в перемешиваемой культуре (Katz, Goldstein, 1972). Грибы растут экспо-
ненциально до тех пор, пока имеется пространство для роста в форме мицелиаль-
ных шариков и достаточная диффузия питательных веществ в колонию. Если
концентрация биомассы превышает 10—15 г/л сухого мицелия и возникает лимит
питательных веществ внутри шарообразной колонии, а нарастание колонии проис-
ходит только по ее поверхности, то’рост в глубинной культуре происходит по ку-
бическому закону, являющемуся частным выражением экспоненциального закона
(Chiu, Zajic, 1970; Solomons, 1975).
Нами показано, что на скорость роста существенное влияние оказывает способ
выращивания посевного мицелия, состав питательной среды, аэрация и перемеши-
вание. На продолжительность ростовых фаз воздействуют состав питательной сре-
ды, возраст и способ выращивания инокулюма, его количество. Особенно эффек-
тивным для сокращения лаг-фазы и ускорения роста оказались использование в
качестве инокулюма глубинно выращенного мицелия, находящегося в экспонен- 111
циальной фазе, и гомогенизация.инокулюма. Это согласуется с данными, полуден-
ными для других мицелиальных грибов и бактерий (Перт, 1978; Виестур и др.,
1980). Регуляция указанных выше факторов позволила сократить лаг-фазу у ис-
следуемых штаммов при отъемно-доливном культивировании до 1—6 ч, а весь
процесс ферментации — до 48 ч. Показатели, полученные для селектированных
штаммов по скорости роста, вероятно, могут быть улучшены при дальнейшей
оптимизации факторов культивирования.
Установлено, что при глубинном культивировании может быть получена
концентрация биомассы 20—45 г/л и продуктивность 4—7 г/л/сут по сухой массе
(Eddy, 1958; Бухало, 1973а; Промышленное культивирование ..., 1978; Sacamoto
et al., 1978а, b; Высшие съедобные базидиомицеты ..., 1983). Однако такая кон-
uni
центрация обычно достигается при высоком содержании в питательной среде ис-
точников питания и в первую очередь углеродного. В то же время при этом значи-
тельно снижается величина ЭК (Перт, 1978; Высшие съедобные базидиомицеты ...,
1983). Высокая концентрация биомассы (И) г/л и выше по сухой массе) получена
нами в глубинной культуре на качалках в опытах, связанных с исследованием пи-
тательных потребностей штаммов-продуцентов. В ферментерах же при концентра-
ции углерода в питательных средах 1—2 % урожай биомассы обычно не превышает
12 г/л. Содержание сырого протеина в культуральном мицелии на благоприятных
средах составляет 30—60 % (Высшие съедобные базидиомицеты ..., 1983; Капич
и др., 1983).
Важным показателем продуктивности культуры при периодическом культи-
вировании является способность продуцента превращать питательные вещества
субстрата в мицелии, характеризующаяся экономическим коэффициентом (ЭК).
ЭК у грибов обычно составляет 20—40 %. Если происходит образование большого
количества растворимых соединений углерода, то ЭК более низкий. Температура,
источник азота, витамины, ионы металлов, возраст культуры, аэрация, влияя на
образование растворимых метаболитов, косвенно воздействуют и на ЭК, который
можно повышать с помощью этих факторов (Gray, Bushnell, 1955; Perlman, 1965;
Перт, 1978) . Отмечены также изменения катаболизма глюкозы, связанные с варьи-
рованием форм роста, например споруляцией (Bull, Bushell, 1976). Для веливдны
ЭК решающее значение имеют физическая доступность источника С, культураль-
ные условия, включающие наличие и концентрацию других питательных веществ
в среде; pH среды; аэрацию; температуру; адаптацию к субстрату. Для высших
базидиомицетов, как показано нами (Высшие съедобные базидиомицеты ..., 1983)
и другими исследователями (Bull, Bushell, 1976), на величину ЭК в значительной
мере влияет присутствие в питательной среде стимуляторов и, в первую очередь,
витамина В}, хотя гриб может и не испытывать в них абсолютной потребности.
Несомненно, что вопрос экономической эффективности процесса глубинного
культивирования для достижения высокой концентрации биомассы нуждается
в дальнейших исследованиях.
НедостатоФЮ изученными для высших базидиоьвщетов остаются такие пара-
метры глубинного культивирования, как потребность в О, и COj, что специфично
для разных видов и в значительной степени определяется составом питательной
среды, формой роста. Для некоторых видов показано, что снижение подачи возду-
ха в ферментеры от 3,9 до 0,3 л/мин при механическом перемешивании не влияет
на скорость роста и накопление биомассы (Морозова и др., 1978а). Высказывается
мнение (Dijkstra, 1976), что аэрация вообще не лимитирует рост при глубинном
культивировании высших базидиомицетов г- а решающее значение имеет перемеши-
вание. Корректная техника изучения потребности в газовом компоненте для ми-
целиальных грибов разработана относительно недавно (Berry, 1975; Sinclair,
Mavituna, 1983). В то же время показано (Zetelaki, 1981), что скорость переноса
О] при глубинном культивировании Pleurotus ostreatus сказывается на урожае
мицелия и содержании в нем белка, продолжительности ростовых фаз. Причем
лучшие показатели продуктивности и биологической ценности культурального
мицелия получены при разных значениях содержания О,. Установлено, что рост
некоторых шцепиальных грибов замедляется при усиленной аэрации и снижении
112 содержания в питательной среде СО, ниже 20 % (Sinclair, Mavituna, 1983).
Не до конца ясным и решенным остается вопрос о том, какие морфологиче-
ские формы роста мицелиальных грибов в глубинной культуре являются опти-
мальными для скорости роста, накопления биомассы, лучшего снабжения клеток
кислородом и питательными веществами, кулинарных свойств конечного про-
дукта. Рост съедобных грибов в условиях глубинной культуры происходит в виде
рыхлых или плотных мицелиальных клубочков, отдельных нитей. Внутри шари-
ков образуется полый центр или много вакуолизированных, отмирающих и лизи-
рующихся клеток, имеющих низкое содержание белка (Биосинтетическая деятель-
ность 1969; Высшие съедобные базидиомнцеты ..., 1983). В результате исследо-
ваний, проведенных нами в разных условиях глубинного культивирования, пока-
зано, что форма роста у одного и того же вида и штамма может заметно изменять-
ся под влиянием pH и состава питательных сред, степени аэрации и скорости пере-
мешивания. Это отмечается и в некоторых работах по глубинному культивирова-
нию базидиомицетов и других мицелиальных грибов (Burkholder, Sinnott, 1945;
Yoshida et al., 1967, 1968; Taguchi, 1971; Hofsten, Ryden, 1975; Righelato, 1975;
Габинская, 1976; Dijkstra, 1976). Однако закономерности воздействия этих фак-
торов на рост высших базидиомицетов в глубинной культуре пока мало изучены.
Рост в глубинной культуре мицелиальных грибов в форме шаровидных агло-
мератов создает ряд трудностей при разработке способов управляемого культи-
вирования. Основным условием для управляемого культивирования микроорга-
низмов является возможность их равномерного распределения по всему объему
жидкой фазы культиватора и создание оптимальных условий для биосинтеза.
Мицелиальные грибы при культивировании в ферментере с мешалкой обрастают
внутреннюю поверхность ферментера, образуя скопления мицелиальной массы,
что препятствует поступлению питательных веществ в клетки и оттоку продуктов
метаболизма (Виестур и др., 1980; Шкидченко, 1983).
Нами предложен аппарат для выращивания мицелия съедобных грибов в про-
точной культуре на наполнителе. Процесс культивирования идет непрерывно на
скребковом транспортере, помещенном в петлеобразный стеклянный трубопро-
вод (Промышленное культивирование ..., 1978). В этом аппарате обеспечивается
постоянное снабжение культуры свежей питательной средой и удаление продуктов
метаболизма.
В настоящее время ведутся поиски принципиально новых конструкций фер-
ментеров, обеспечивающих постоянное удаление избыточного мицелия с потоком
отработанной среды (Шкидченко, 1983). Однако проблема управляемого культи-
вирования мицелиальных грибов еще далека от решения. Требуются специальные
технические разработки по созданию условий их жизнеобеспечения при глубинном
культивировании.
На завершающей стадии отбора тестом всей выполненной работы является
скрининг в производственных условиях. Это единственный путь убедиться в том,
что проводился правильный селекционный прессинг и улучшенный изолят будет
продуцировать в данной технологической схеме. При опытно-промышленных ис-
пытаниях селектированных в процессе многоуровневого отбора штаммов P.ostrea-
tus 1300 и P.tigrinus 131 показано, что в производственных условиях в ферменте-
рах большой емкости на оптимизированных питательных средах накопление био-
массы происходит более интенсивно, чем в лабораторных условиях (Высшие съе-
добные базидиомнцеты .... 1983; Капич и др., 1984). Учитывая традиционность
потребления высших съедобных базидиальных грибов, а также хорошие органоли-
тические качества культурального мицелия (запах, вкус, сходные с плодовыми
телами) можно предположить, что в ближайшее время он найдет применение как
продукт питания.
ГЛАВА 6
ПРИНЦИПЫ ОТБОРА ВЫСШИХ БАЗИДИОМИЦЕТОВ
С ЦЕЛЬЮ ПОЛУЧЕНИЯ ПИЩЕВОЙ БИОМАССЫ
Идея получения на основе современного промышленного производства грибницы
денных съедобных грибов нашла отражение в ряде работ и патентов (Pat. 21845,
USA; Pat. 2618900, USA; Pat. 2648163, USA; Eddy, 1958; Robinson, Davidson,
1959; Worgan, 1968; Низковская, 1972, 1978; Бухало, 1973a, 1978, 1982a; Solo-
mons, 1975; Dijkstra, 1976; Промышленное культивирование ...,1978; Zetelaki,
1981; Высшие съедобные базидиомицеты ..., 1983; и др.). Еще первые исследова-
тели в области глубинного культивирования высших съедобных базидиомицетов
справедливо считали (Robinson, Davidson, 1959), что практическое решение произ-
водства биомассы съедобных грибов это не взлетающий в небо фейерверк, а труд,
на который уйдут годы.
В настоящее время накоплен значительный экспериментальный материал,
позволяющий лучше осветить вопросы, связанные с глубинным культивированием
высших базидиомицетов. Однако основные принципы и критерии, которые долж-
ны быть использованы при отборе и селекции штаммов-продуцентов пищевой
биомассы, до сих пор не были сформулированы. В ряде случаев это привело к не-
правильной оценке тех или иных признаков в процессе отбора и к отрицательному
конеадому результату. Селекция для глубинного культивирования штаммов
высших съедобных базидиомицетов, которые представляют собой чрезвычайно
разнообразную по биологическим особенностям группу грибов, на современном
этапе находится в стадии становления и требует разработки общих подходов и
принципов.
Такие принципы и подходы, хотя и имеют некоторые общие критерии с ис-
пользуемыми при селекции штаммов съедобных грибов для поверхностного
культивирования (Гарибова, 1966, 1969,1971,1982; Промышленное культивиро-
вание ... 1978; Бисько, 1982; Высшие съедобные базидиомицеты ..., 1983), тем не
менее отличаются от них. Прежде всего, если отбор продуцентов для поверхност-
ного культивирования ведется среди немногочисленных видов съедобных грибов,
которые хорошо плодоносят в искусственных условиях, то круг высших бази-
диомицётов, среди которых может быть проведен отбор объектов глубинного
культивирования, чрезвычайно широк.
В связи с этим с самого начала возникает проблема, какие виды базидиомице-
тов могут быть перспективными как продуценты пищевого белка в глубинной
культуре. Мы считаем, что первым требованием, которое следует предъявить к
интродуцируемому в глубинную культуру виду гриба с целыо-получения пищевой
биомассы, является его съедобность. В систематическом отношении на уровне
выше вида нельзя выделить какую-либо таксономическую единицу, которая
характеризовала бы нетоксичность ее представителей. Таким образом, суждение о
съедобности выделенного в культуру высшего базидиомицета должно основы-
ваться, прежде всего, на точном определении его видовой принадлежности и народ-
ном опыте пищевого использования данного вида гриба.
Съедобность грибов определяется их физиологической и эстетической прием-
лемостью, приятным вкусом,кулинарными достоинствами(СосЬгап, 1978). В ряде
случаев определение гриба как съедобного зависит от индивидуального предпочте-
ния и восприимчивости потребителя. Напрймер, во многих странах мира не упот-
ребляют в пищу грибы рода Dictiophora, их считают неприемлемыми по вкусовым
качествам. В то время как в странах Востока высоко ценится как кулинарный
продукт покрывало Dictiophora indusiata (Worgan, 1968). В разных регионах
по-разному оцениваются различные виды съедобных грибов, поэтому грибы,
которые относятся к съедобным в одной стране, могут считаться подозрительны-
ми в других странах. Так, ДВорган (Worgan, 1968) отмечает, что в ФРГ безопас-
ными считаются лесные грибы, а полевые почти не собираются населением. В Анг-
лии, наоборот, употребляют в пищу в основном полевые грибы. По данным А.Са-
114 дыхова (1968) и Д.Мелик-Хачатрян (1971, 1980), в республиках Закавказья
местное население отдает предпочтение видам родов Pleurotus и Agaricus, в то вре-
мя как виды рода Boletus, особо высоко ценимые в европейской части СССР, ис-
пользуются очень незначительно.
Для получения биомассы съедобных грибов в глубинной культуре основным
показателем съедобности гриба должна быть его нетоксичность, так как постула-
том для интродукции съедобных грибов в глуб-тнную культуру является экспери-
ментально подтвержденный факт качественного сходства химического состава
плодовых тел и культурального мицелия (Биосинтетическая деятельность
1969; Hattula, Gyllenberg, 1969а, Ъ; Промышленное культивирование ..., 1978;
Crisan, Sands, 1978; Высшие съедобные базидиомнцеты ..., 1983). Такие признаки,
как консистенция плодовых тел, их габитус, особенности плодоношения, значения
не имеют. Токсичность, т.е. наличие ядовитых веществ, является диагностическим
признаком для вида, хотя в плодовых те .ах одного и того же вида, размера и мас-
сы содержание этих веществ варьирует, подчиняясь закону нормального распреде-
ления (Smith, 1978). Изменяется количественное содержание токсинов и в плодо-
вых телах разного возраста.
По мнению А.Смита (Smith, 1978), климат незначительно влияет на химиче-
ский состав грибов, а существенное значение имеет состав почвы, на которой про-
израстают плодовые тела. Климатические условия больше влияют на консистен-
цию плодовых тел, не сказываясь на их съедобности. Иногда, по данным этого
автора, встречаются плодовые тела ядовитых видов, не обладающие токсичностью,
которые очевидно являются локальными мутантами. Однако можно предполо-
жить, что если токсичность отмечена для определенного вила в каком-либо регио-
не, то это свидетельствует о присутствии признака токсичности в генофонде гриба
и он может проявиться в процессе культивирования. Поэтому мы считаем, что
следует воздерживаться от интродукции в глубинную культуру тех видов, у кото-
рых при каких-то условиях проявляется токсичность. Известны случаи (Smith,
1978), когда грибы, считающиеся в Европе съедобными, в Северной Америке
зарегистрированы как токсичные, вызывающие отравления, например Phaeoiepiota
aurea. На Аляске известно много случаев отравления этим грибом. По мнению
А.Смита, на Аляске это может быть другой вид, хотя ’’почти такой же", как евро-
пейский. Учитывая сказанное выше, следует, очевидно, принять во внимание сведе-
ния о съедобности того или иного вида гриба в регионе, откуда были собраны
плодовые тела для выделения культуры.
Таким образрм, очевидно, что чрезвычайно важным моментом является пра-
вильная идентификация культуры до вида. Необходимо, чтобы культура, предла-
гаемая в качестве продуцента, имела выраженные морфологические признаки,
по которым можно вести надежный контроль в процессе культивирования: пряж-
ки на мицелии, характерную анаморфу, стадию телеоморфы. При идентификации
гриба в культуре следует использовать также комплекс дополнительных таксоно-
мических признаков: скорость роста, отношение к температуре, тип мицелиальной
колонии, ее окраску, расположение и форму пряжек на мицелии, характер цвето-
вых химических реакций на фенолоксидазы и другие (Lentz, 1971; Miller, 1971;
Nobles, 1971; Бухало, 1973а; Гарибова, Шалашова, 1973; Stalpers, 1978; Watling,
1979b; Бухало, Нассер, 1981а, б). При изменении в процессе культивирования
хотя бы одного из признаков, необходим тщательный контроль культуры, выясне-
ние причин, влияющих на изменение культуральных свойств, исключение возмож-
ности засорения другими мицелиальными грибами. Таксономическое значение
для всех высших базидиомицетов имеет долипоровая межклеточная перегородка
(Moore, McAlear, 1962).
Способность образовывать в лабораторных условиях плодовые тела является
важным положительным свойством продуцента, так как позволяет помимо его
надежной идентификации вести генетические исследования по направленной селек-
ции штаммов с улучшенными свойствами. До настоящего времени в селекции
съедобных базидиомицетов для глубинного культивирования использовали толь-
ко повторяющийся отбор штаммов с более высоким уровнем желаемого свойства
и оптимизацию условий культивирования. Однако в будущем для селекции могут
быть использованы также мутации и рекомбинации, применяемые для селекции 115
штаммов-продуцентов биологически активных веществ, плодовых тел (Семерд-
жиева, 1977). Это потребует постоянного наличия спорового материала, получения
генераций в сжатые сроки.
Решая проблему интродукции в глубинную культуру ценных съедобных видов
базидиомицетов, необходимо прежде всего представить круг объектов, которые
могут стать предметом первоочередного внимания. Инвентаризация флоры отдель-
ных регионов до некоторой степени дает представление о количестве видов
съедобных грибов, которые могут быть интродуцированы в культуре. Для Украи-
ны приводится около 300 видов съедобных грибов, из них всего около 2 десятков
видов разрешены для продажи и идут в заготовку (Зерова и др., 1979). В СССР
по ГОСТу в заготовку допущено 40 видов (Сержанина, Змитрович, 1986). В Бе-
лоруссии (Сержанина, Змитрович, 1986) насчитывается около 200 видов съедоб-
ных грибов. В Грузии из 169 известных по литературе съедобных грибов местное
население употребляет в пищу около 30 (Нахуцришвили, 1975). Примерно столь-
ко же видов указывает для Армении Д.Г .Мелик-Хачатрян (1980), для Дальнего
Востока приводит 176 видов съедобных грибов Л.Н.Васильева (1978) .
Таким образом, из 150—300 видов съедобных грибов, известных в каком-ли-
бо достаточно крупном регионе, местным населением широко используются в пи-
шу не более 30—50 видов. На народный опыт пищевого использования этих видов
можно уверенно полагаться. Задачей, стоящей перед исследователем, задавшимся
целью интродуцировать в глубинную культуру съедобные грибы, является конк-
ретное знание биоты высших съедобных базидиальных грибов определенного ре-
гиона, где будет проводиться сбор плодовых тел и выделение мицелиальной
культуры. При этом необходимо знакомство с традициями местного населения от-
носительно потребления в пишу тех или иных видов в конкретных экологических
условиях. Чрезвычайно важно использовать в работе региональные флоры и опре-
делители, где имеются соответствующие сведения.
С нашей точки зрения, на этом этапе нерационально использовать в качестве
продуцентов биомассы виды грибов, которые перед употреблением должны прой-
ти термическую обработку, отваривание, вымачивание с тем, чтобы удалить содер-
жащиеся в них токсические вещества. Многие из таких видов весьма популярны
среди населения и разрешены ГОСТом для заготовки. Это. например, Boletus
iuridus. Lactarius tormmosus. L. necator, Trichoiomopsis rutilans и др. Есть осно-
вания полагать, что токсические вещества могут содержаться и в культуральном
мицелии этих видов, что, несомненно, усложнит технологию получения пищевой
биомассы. Имеются значительные расхождения в оценке съедобности одних и тех
же видов разными авторами. Съедобность таких грибов должна ставиться под сом-
нение. Интродукция в глубинную культуру многочисленных малоизвестных видов
съедобных грибов или видов, которые не употребляют в пищу из-за неприемлемой
консистенции или габаритов плодовых тел (деревянистые, мелкие, жесткие),
потребует дополнительных медико-биологических исследований. При предвари-
тельном изучении показано, что ряд таких грибов обладает несомненными досто-
инствами , как объекты глубинного культивирования: они накапливают в культу-
ре много белка, сбалансированного по аминокислотному составу, усваивают деше-
вые недефицитные субстраты, обладают значительной скоростью роста, нали-
чием грибного аромата и т.п. (Фалина и др., 19656; Маслова, 1972; Капич
и др., 1980. 1984) .
Видовой состав съедобных грибов, о выращивании которых в условиях глу-
бинной культуры сообщалось в литературе f свидетельствует, что интродукция
съедобных грибов в глубинную культуру была до определенной степени стихий-
ным процессом. Этот процесс направлялся и регулировался в значительной мере
биологическими особенностями интродуцированных видов. Многие виды стали
объектами физиолого-биохимических и культуральных исследований, а затем и
культивирования в более широких масштабах, благодаря свойству легко выде-
ляться в чистую культуру. Мицелий этих грибов быстро и обильно растет на агари-
зованных средах и не проявляет высокой требовательности к субстрату • стествен-
но, что интродукция того или иного вида в глубинную культуру может быть
116 осуществлена только в результате успешного выделения из плодового тела, суб-
страта или базидиоспор чистой мицелиальной культуры гриба и возможности под-
держания ее в жизнеспособном стерильном состоянии неопределенно долгое время.
Методы выделения мицелиальных культур съедобных видов грибов, их очист-
ки от бактериального и грибного заражения постоянно совершенствуются, что
позволяет пополнять виды, выделенные в настоящее время в чистую культуру.
Часто интродуцированные в глубинную культуру виды в природе массово плодо-
носят и имеют крупные плодовые тела. В экологическом отношении грибы, кото-
рые выращиваются наиболее успешно в глубинной культуре, в основном относят-
ся к лигнотрофам, подстилочным и гумусовым сапротрофам, копротрофам и в
значительно меньшей степени — к микоризным грибам. В систематическом отно-
шении большинство высших съедобных базидиомицетов, о глубинном культиви-
ровании которых сообщается в литературе, принадлежит к представителям родов
Agaricus, Coprinus, Pleurotus, Lentinus и др.
Одним из важнейших признаков, учитывающихся при интродукции в глубин-
ную культуру штаммов съедобных грибов и их селекции в качестве продуцентов
мицелиальной биомассы, является их способность усваивать дешевые субстраты,
в частности, непищевые отходы сельского хозяйства и промышленности, что
обеспечивает экономическую эффективность культивирования. Утилизируя
сложные органические вещества, содержащиеся в этих субстратах и недоступные
для человека и животных, грибной мицелий превращает их в усвояемый грибной
белок. К субстратам для глубинного культивирования съедобных грибов, с нашей
точки зрения, кроме их экономической ценности, необходимо предъявлять требо-
вание безусловной безвредности для человека, хотя сами по себе эти субстраты
пищевого значения, как правило, не имеют. При производстве белковых продук-
тов пищевого назначения путем микробного синтеза преимущество следует отда-
вать таковым, которые получены на средах с сахарами, крахмалом и другими
высококачественными продуктами сельского хозяйства (Эйлворд, 1979).
До настоящего времени для глубинного культивирования высших съедобных
базидиомицетов использовали преимущественно сложные среды с натуральными
субстратами, содержащими сахара, целлюлозу, витамины,аминокислоты, органиче-
ские источники азота, растительные масла и др. В качестве таких сложных богатых
сред были в основном использованы отходы сахарной, спиртовой, деревообраба-
тывающей промышленности, отходы переработки овощей, фруктов, сои. В послед-
ние годы появились данные о возможности выращивания съедобных грибов на
неуглеводных источниках углерода, как, например, алифатических спиртах, орга-
нических кислотах трикарбонового цикла, и-алкннах (Sugimori et ai.. 1971:
Dijkstra, 1976), что следует учитывать при первичном отборе.
В нашей стране в качестве субстратов, перспективных для промышленного
выращивания съедобных грибов, могут быть рекомендованы свекловичная мелас-
са, различные отходы переработки картофеля, молочная сыворотка (Бухало и др.,
1978; Морозова и др., 1978а, б; Соломко и др., 1978; Вечери др., 1979; Высшие
съедобные базидиомицеты ..., 1983; Капич и др., 1984).
Возможности изыскания дешевых питательных комплексных сред для куль-
тивирования высших съедобных базидиомицетов неисчерпаемы, так как беско-
нечно разнообразны питательные потребности этих грибов, разлагающих и утили-
зирующих в природе множество сложных соединений. Отбор штаммов для выра-
щивания пищевого мицелия на определенных субстратах должен проводиться на
основании эколого-физиологических особенностей продуцента й наличия местных
дешевых субстратов из числа не имеющих пищевого значения и не токсичных
сельскохозяйственных и промышленных отходов.
Важнейшим показателем, по которому оценивается перспективность штамма
съедобного гриба для глубинного культивирования, является скорость роста его
мицелия. При выделении чистых мицелиальных культур из плодовых тел или ба-
зидиоспор их выращивание проводится, как правило, йа плотных агаризованных
средах и уже на этом этапе обычно дается характеристика скорости роста мицели-
альной культуры. В монографиях и определителях при описании культурально-
морфологических свойств видов из разных систематических групп обычно указы-
вается, какого диаметра достигает колония на определенные сутки культивирова-
117
ния. Даже самая простая количественная характеристика послужила основанием
для выделения быстро-, средне- и медленнорастущих видов среди высших бази-
диомицетов.
При оценке скорости роста грибов на агаризованных средах более объектив-
ным показателем является вычисление предложенного нами ростового коэффи-
циента (РК), который учитывает, помимо диаметра колонии, ее высоту, плот-
ность, а также фактор времени (возраст колонии в сутках в момент учета), явля-
ющийся неотъемлемым элементом характеристики скорости.
Были предприняты попытки более точно выразить скорость роста на агари-
зованных средах, с использованием математических моделей (Pirt, 1967; Trinci,
1971, 1973; Righelato, 1975). Однако нам не представляется необходимым на
начальных этапах отбора быстрорастущих штаммов, т.е. при оценке роста штам-
мов на агаризованных средах, более тоздо характеризовать скорость роста куль-
туры, так как вопрос о коррелировании скорости роста на агаре и в глубинной
культуре остается далеко не ясным (Raper, Каеу, 1978).
Нами отмечено, что штаммы, растущие быстро и обильно на СА, обнаружива-
ют, как правило, хороший рост на жидком пивном сусле во встряхиваемой куль-
туре. Однако скорость роста в глубинной культуре может быть значительно уве-
личена по сравнению с агаризованными средами или ростом на жидких средах
в стационарной культуре у видов, традиционно считающихся медленно растущими.
Это относится к микоризообразующим видам с особо высокими питательными
потребностями и в первую очередь к Boletus edulis.
Установлено (Oyama et al., 1974; Schisler, Volkoff, 1977), что в вегетативной
фазе на соответствующей среде можно получить довольно быстрый рост Boletus
edulis в температурном интервале 20—30 °C при pH среды от 4 до 7. Медленный
рост B.edulis на стационарной питательной среде не должен восприниматься как
непреодолимое препятствие для интродукции особо ценных видов съедобных
грибов в глубинную культуру. Необходимо провести углубленные физиологи-
ческие исследования таких видов для того, чтобы сделать заключение о возмож-
ности их глубинного культивирования. Решающим условием для достижения
удовлетворительной скорости роста гриба является установление штаммовой
специфичности в отношении источников питания и оптимизации питательных
сред, использование ростовых стимуляторов. Рост культуры может быть уско-
рен также при установлении оптимального количества, степени дисперсности,
возраста и физиологического состояния посевного мицелия. В полной мере су-
дить о скорости роста и продуктивности штамма в глубинной культуре можно
лишь, исследуя его рост в ферментерах при достаточной аэрации и перемешива-
нии на благоприятной питательной среде. Максимальная удельная скорость роста
0,14 и 0,11 ч'1, полученная для селектированных нами штаммов Pleurotus ostrea-
tus 1300 и Panus tigrinus 131 соответственно (Соломко и др., 1981; Бухало,
1982а; Высшие съедобные базидиомнцеты ..., 1983; Капич и др., 1984), является
наиболее высокой скоростью известной сейчас для высших базидиомицетов.
Очевидно на данном этапе максимальную удельную скорость в фазе экспоненци-
ального роста 0,1 ч"1 и выше следует считать достаточной для высших базидио-
мицетов — продуцентов биомассы. Однако при почти полном отсутствии экспери-
ментальных данных по кинетике роста базидиомицетов трудно судить о генетиче-
ских пределах скорости роста у представителей этой систематической группы
грибов. При отборе нужно учитывать, что скорость роста значительно колеблется
в разных условиях культивирования, заметно могут отличаться по этому показа-
телю также штаммы одного и того же вида.
Одним из важных признаков, по которому ведется отбор продуцентов, явля-
ется продуктивность, т£. количество образуемой в процессе культивирования
биомассы. Из данных, приведенных выше, следует, что отдельные виды высших
съедобных базидиомицетов способны накапливать в глубинной культуре до 20—
40 г/л мицелия по сухой массе. Однако продуктивность штамма, выраженная
урожаем биомассы, не является самостоятельным показателем. Она должна оце-
ниваться в связи с обшей эффективностью процесса культивирования. Важным
118 показателем оценки продуктивности штамма является экономический коэффи-
циент (ЭК), т.е. использование для роста источников питания и, в первую очередь,
углерода. Наиболее высокие значения ЭК у высших базидиомицетов по углероду
составляют до 50—60 %. Образование большого количества биомассы должно дос-
тигаться в максимально короткие сроки культивирования и при возможно более
высоком содержании в ней белка. Продуктивность штаммов высших съедобных
базидиомицетов, перспективных в качестве продуцентов пищевой биомассы, при
периодическом процессе глубинного культивирования, длящемся не дольше
72 ч, должна быть не ниже 3—5 r/л/сут мицелия при ЭК по углероду около 50 %
и содержании в биомассе сырого протеина в пределах 30—50 %.
В первых работах по глубинному культивированию высказывалось мнение
(Robinson, Davidson, 1959), что для получения пищевой биомассы при отборе
перспективных штаммов предпочтение должно отдаваться тем, которые растут
в форме плотных мицелиальных шариков, а не дисперсно, в виде отдельных
гиф. Как показано при более поздних исследованиях (Hofsten, Ryden, 1975:
Righelato, 1975), а также нашими результатами, в глубинной культуре в зависи-
мости от условий культивирования у одного и того же штамма могут быть полу-
чены разные формы роста. Предполагалось, что при дисперсной форме роста соз-
даются наиболее благоприятные условия снабжения мицелиальной колонии пита-
тельными веществами, в то время как при росте в форме плотных шариков цент-
ральная часть колонии подвергается автолизису из-за недостатка поступления
кислорода из питательной среды. Условиями,определяющими характер роста гриб-
ной колонии, являются перемешивание, аэрация, состав и pH питательной среды,
состояние инокулирующего мицелия. Очевидно, вопрос о предпочтительной фор-
ме роста должен решаться при дальнейшей работе конкретно для каждого отоб-
ранного штамма в зависимости от технологии и требований, предъявляемых
к получаемой биомассе (способ пищевого использования, удобство сепарации,
обезвоживания и др.). Форма роста мицелиальной колонии как варьирующий
признак не должна быть существенным показателем при отборе продуцента на
начальных этапах.
Рядом исследователей (Block et al., 1953; Sugihara, Humfeld, 1954; Worgan.
1968; Торев, 1973), культивировавших ложные штаммы базидиомицетов, как
обязательный признак для продуцента пищевого мицелия указывается способ-
ность образовывать в глубинной культуре так называемые вторичные споры, т.е.
бесполые спороношения. Это рассматривается как высокая адаптационная спо-
собность гриба-продуцента к глубинным условиям культивирования или даже
мутация, позволяющая грибу быстро расти и обеспечивать воспроизводство био-
массы в течение 6—24 ч. Некоторые авторы (Robinson, Davidson, 1959) связывают
с образованием вторичных спор отсутствие грибного аромата и грибного вида у
получаемого продукта. На основании полученных нами данных можно заключить,
что наличие или отсутствие бесполого спороношения у исследованных видов выс-
ших базидиомицетов существенно не влияет на их важнейшие ростовые характе-
ристики в глубинной культуре, поэтому этот признак не следует принимать во
внимание при отборе продуцентов пищевой биомассы как первостепенный.
С первых шагов глубинного культивирования съедобных грибов при отборе
штаммов решающее значение имело наличие грибного аромата в культуральном
мицелии (Eddy, 1958; Worgan, 1968; Dijkstra, 1976). Вещества, придающие гриб-
ной аромат как плодовым телам, так и культуральному мицелию одни и те же,
хотя количественное содержание их может быть различным (Wasowicz, 1974;
Dijkstra, 1976). Определенные условия культивирования (состав питательной
среды, перемешивание, аэрация) могут способствовать накоплению их в культу-
ре. Основной компонент, придающий характерный грибной аромат плодовым
телам и культуральному мицелию (1-октен-З-ол), образуется в глубинной куль-
туре в первые 7 сут роста. При длительном культивировании, а также при автоли-
зе биомассы в процессе хранения, образуется гуанозин-5-монофосфат, также при-
дающий биомассе грибной аромат. В последнем случае происходят значительная
потеря биомассы и ухудшение ее питательных свойств. Следовательно, при отборе
штаммов для глубинного культивирования следует ориентироваться на появление
грибного запаха в первые сутки культивирования и учитывать, что отсутствие 119
запаха может быть обусловлено неблагоприятным составом питательной среды,
недостаточной аэрацией и другими факторами. В то же время осуществление ис-
кусственного синтеза носителя грибного аромата, создание пригодных для пище-
вых целей ароматизирующих добавок и возможность обогащения ими готового
продукта делают требование к наличию интенсивного грибного аромата в куль-
туральном мипелии второстепенным, а не определяющим признаком при выборе
продуцента, перспективного по другим существенным показателям.
Питательная ценность каждого конкретного высшего съедобного базидиоми-
цета, предлагаемого для промышленного получения пищевой биомассы, может
быть оценена только с учетом возраста и физиологического состояния культуры,
состава питательной среды и других важнейших технологических параметров
процесса культивирования, а также способа переработки и хранения конечного
продукта. Установлено, что эти факторы оказывают значительное влияние на со-
держание в биомассе основных питательных компонентов. На разных питательных
средах может быть получена биомасса высших съедобных базидиомицетов с со-
держанием сырого протеина до 60—70 %, перевариваемостью до 80—90 %, с высо-
ким содержанием незаменимых аминокислот, витаминов и др.
Важным признаком, который необходимо учитывать при отборе для глубин-
ного культивирования, является способность продуцента противостоять конта-
минации посторонней микрофлорой. Культивирование съедобных базидиомицетов
ведется на богатых питательных средах при pH в пределах 5—8,создает благо-
приятные условия для загрязнения посторонней микрофлорой и выдвигает жест-
кие требования к стерильности процесса ферментации. Поэтому устойчивость к по-
сторонней микрофлоре, способность конкурировать с другими микроорганизма-
ми является очень ценным качеством продуцента, которому нужно придавать
большое значение при первичном отборе.
В глубинную культуру должны быть интродуцированы также съедобные гри-
бы, культивируемые для получения плодовых тел. Интродукция в глубинную
культуру промышленно культивируемых видов имеет 2 важных аспекта. Во-пер-
вых, глубинный мицелий культивируемых штаммов, выращенный на доброкаче-
ственной среде, может использоваться непосредственно в пищу, как не вызываю-
щий сомнения в своей съедобности и безвредности. Во-вторых, еще со времени
первых работ Г.Хумфельда бытует мнение (Humfeld. 1950/1951; Luthardt, 1969;
Shiio et al., 1974; Zadrazil. 1978; Высшие съедобные базидиомицеты ..., 1983),
что при промышленном культивировании плодовых тел грибов для получения
в короткие сроки массовой маточной посевной культуры должно быть исполь-
зовано глубинное культивирование. При интродукции в глубинную культуру
штаммов грибов, культивируемых для производства плодовых тел, основное
внимание должно уделяться определению факторов, способствующих их быстро-
му и обильному росту в глубинной культуре.
Заключительным этапом селекционного отбора является апробация штаммов
в промышленных условиях. Это позволяет оценить, насколько полно реализованы
его генетические возможности, насколько отбор на лабораторном уровне соот-
ветствует задачам производства (Rowlands, 1983; Блинов, 1984). В результате
опытно-промышленных испытаний селектированных штаммов P.ostreatus 1300
и P.tigrinus 131 в ферментерах большой емкости показано, что процесс фермен-
тации осуществляется соответственно результатам, полученным в лаборатории,
и может быть проведен более продуктивно, чем в лабораторных условиях (Выс-
шие съедобные базидиомицеты ..., 1983; Калич и др., 1984).
Таким образом, осуществляется многоуровневый селекционный отбор штам-
мов съедобных грибов — продуцентов пищевой биомассы. При этом на каждом
этапе отбираются штаммы с конкретными желаемыми свойствами, определяемы-
ми конечной задачей.
Наличие i коллекции культур, исследованных в отношении как их морфоло-
гии, так и важнейших физиологических особенностей, позволяет значительно сок-
ратить сроки интродукции съедобных грибов в глубинную культуру.
Мы рассмотрели основные принципы отбора высших базидиомицетов — про-
120 дуцентов пищевой биомассы в глубинной культуре. Для отбора продуцентов
биологически активных веществ среди грибов этой группы, безусловно, требуются
иные критерии, связанные с особенностями метаболизма и спецификой конечного
продукта, получаемого в процессе культивирования. Очевидно, общими останутся
требования дешевой и доступной питательной среды для культивирования, генети-
ческой стабильности штаммов, устойчивости их к загрязнению посторонней мик-
рофлорой.
На основании анализа проведенных исследований и литературных данных
нами сформулированы следующие принципы отбора высших съедобных базидио-
мицетов для глубинного культивирования с целью получения пищевой биомассы:
— безусловная съедобность интродуцируемого в культуру вида, подтвержден-
ная народным опытом его пищевого использования;
- наличие у продуцента в культуре признаков, характерных для высших ба-
зидиомипетов, стадии телеоморфы, генетическая стабильность;
- продуктивность продуцента при первичном отборе на качалке на благопри-
ятной питательной среде не менее 1 г/л/сут сухой биомассы;
- продуктивность продуцента при культивировании в ферментерах не ниже
4 г/л/сут сухой биомассы, содержание сырого протеина в мицелии 40—50 %,
максимальная удельная скорость роста в экспоненциальной фазе не менее
0,1 ч"1;
- способность продуцента усваивать дешевые, недефицитные, нетоксичные
питательные среды, включающие отходы сельского хозяйства и промыш-
ленности;
- при первичном отборе продуцента в глубинной культуре форма роста и ин-
тенсивность грибного аромата мицелия не являются признаками первичной
значимости;
- отбор проводится поэтапно, многоступенчато, что обеспечивает селекцию
штаммов-продуцентов с разнообразными требуемыми свойствами.
ЗАКЛЮЧЕНИЕ
Прогресс микробиологического производства, эра антибиотиков открыли новые
пути выращивания мицелиальных грибов на промышленной основе. В промышлен-
ности широко используется культивирование грибов глубинным методом на
жидких питательных средах. Глубинное культивирование позволяет принципи-
ально использовать в качестве продуцентов пишевой биомассы многие виды
съедобных грибов, которые из-за биолого-экологических особенностей не могут
пока образовывать плодовые тела в искусственных условиях. В нашей стране глу-
бинное культивирование съедобных базидиомицетов с целью получения биомассы
мицелия оформилось в самостоятельное направление в 60-х годах XX ст. До этого
изучение высших базидиальных грибов, в том числе и некоторых съедобных, ог-
раничивалось преимущественно исследованиями вторичных метаболитов.
Изложенные в книге результаты фундаментальных исследований дают теоре-
тическое обоснование культивирования съедобных базидиомицетов, основанное
на детальном изучении их онтогенеза и эколого-физиологических свойств. Моно-
графия базируется на большом экспериментальном материале. Автором в чистой
культуре изучено 119 видов (219 штаммов) высших базидиомицетов, относящих-
ся к 59 родам, 24 семействам, 10 порядкам. Впервые оценена перспективность
использования видов высших съедобных базидиомицетов, представителей разных
экологических групп и таксонов, в качестве объектов глубинного культивирова-
ния для получения пишевой биомассы.
Разработаны научные основы многоуровневого селекционного отбора высших
базидиомицетов — продуцентов пищевой биомассы в глубинной культуре. В ре-
зультате целенаправленного использования принципов этого отбора показана воз-
можность глубинного культивирования съедобных грибов и получения пишевой
биомассы. Селектированы и защищены авторскими.свидетельствами первые оте-
чественные штаммы-продуценты: Pleurotus ostreatus MMBF—1300, Panus tigrinus
ИБК—131, Flammulina velutipes ИБК—112. Основой для экспериментальных ис-
следований послужила созданная автором специализированная коллекция чистых
культур высших съедобных базидиомицетов Института ботаники им. Н.ГХолод-
ного АН УССР, которая является официальной коллекцией, осуществляющей в
СССР депонирование штаммов съедобных макромицетов — продуцентов мицелия
и плодовых тел.
Автором проведена критическая опенка таксономических критериев культур
высших базидиомицетов в связи со значительными трудностями их идентифика-
ции и важностью получения чистых штаммов-продуцентов. Показано, что наиболее
стабильными таксономическими признаками на уровне вида являются стадия те-
леоморфы, у отдельных видов — стадия аноморфы, наличие и расположение пря-
жек на мицелии, их форма. К более изменчивым таксономическим признакам сле-
дует отнести скорость роста и окраску мицелиальной колонии, отношение к темпе-
ратуре, характер цветовых химических реакций на фенолоксидазы.
Впервые у видов высших съедобных базидиомицетов изучен морфогенез в
глубинной культуре, что имеет практическое значение для правильного отбора
продуцентов биомассы среди грибов этой систематической группы. При глубин-
ном культивировании высшие базидиомицеты образуют те же генетически закреп-
ленные формы вегетативного и бесполого спороношения, которые характерны для
них на плотных питательных средах. В результате опровергнута концепция появле-
ния у высших базидиомицетов в глубинной культуре спороношений, не свойствен-
ных этой систематической группе.
Получены новые для науки данные о культурально-морфологических особен-
ностях вегетативной стадии определенных видов высших съедобных базидиомшг
тов. У 85 видов отмечены специфические микроструктуры, у 14 видов впервые
установлена стадия анаморфы.
Культуры 22 видов, представителей 9 семейств, 3 порядков, исследованы с
применением сканирующей электронной микроскопии (СЭМ). Впервые методом
122 СЭМ проведено сравнительное изучение пряжек — уникальной структуры высших
базидиомицетов. Для отдельных видов установлена специфичность формы пряжек
и расположения их на мицелии. С помощью СЭМ исследованы анаморфы, анастомо-
зы, петли, впервые описаны волоски на гифах. Данные используются для иденти-
фикации культур, уточнения систематического положения и эволюционной про-
двинутости таксонов. Автором идентифицированы культуры с неустановленным
систематическим положением, предварительно отнесенные к высшим базидиоми-
цетам и имеющие практическое значение.
В чистой культуре получена стадия телеоморфы у 36 исследованных видов
высших съедобных базидиомицетов, представителей порядков Agaricaies, Aphyi-
lophorales и Boletales. В экологическом отношении виды, образующие в культуре
стадию телеоморфы, относятся преимущественно к лигнотрофам, в меньшей
мере — к гумусовым и подстилочным сапротрофам, копротрофам, в отдельных
случаях — микотрофам.
Получены новые сравнительные данные о росте и морфологии культур многих
видов высших съедобных базидиомицетов на агаризованных питательных средах
разного состава. Установлены различия в скорости роста, морфологии и окраске
колоний, реверзума у одних и тех же видов на разных средах. Показана необходи-
мость идентифицировать культуры на стандартной питательной среде.
Для оценки роста высших базидиомицетов на агаризованных питательных
средах предложен ростовой коэффициент (РК). Показано, что виды, характери-
зующиеся большим РК, в природе приурочены к растительным субстратам (Pipto-
porus betulinus, Crinipellis schevczenkovi, Schizophyllum commune, Panus tigrinus.
Pleurotus ostreatus, P.comucopiae, P.calyptratus, Lyophyllum ulmarium, Laetiporus
sulphureus и др.). Среди медленнорастущих видов имеются представители всех
экологических групп.
Изучен рост культур высших съедобных базидиомицетов при разных темпера-
турах. По оптимальным и крайним температурам роста исследованные штаммы
отнесены автором к различным группам.
У 55 видов в культуре исследованы цветовые химические реакции на фено-
локсидазы в качестве таксономического теста. Определена специфичность в прояв-
лении этих реакций у разных видов. Впервые на примере Panus tigrinus прослеже-
ны морфологические и физиологические изменения, происходящие у высших ба-
зидиомицетов при длительном культивировании. Установлено чередование 20-су-
точных циклов более и менее активного роста в поверхностной и глубинной куль-
туре.Отмечены изменения в формах глубинного роста, дедикариотизация мицелия,
появление секторности колоний, потеря способности к плодоношению.
Впервые целенаправлено на значительном количестве видов в условиях глу-
бинной культуры проведен отбор высших съедобных базидиомицетов, активно
накапливающих биомассу. Среди испытанных наиболее продуктивными являются
представители порядка Agaricaies, относящиеся к семействам Pleurotaceae (виды
родов Pleurotus, Panus, Lentinus), Agaricaceae (виды родов Agaricus, Macroiepio-
ta), Tricholomataceae (виды родов Flammulina, Gerronema, Oudemansiella, Lepista,
Marasmius), Strophariaceae (виды родов Stropharia, Kuehneromyces, Pholiota).
Наибольшее количество видов и штаммов, обнаруживших активный рост в глу-
бинной культуре, отмечено среди лигнотрофов.
В результате изучения питательных потребностей активнорастуших штаммов
установлено, что наиболее благоприятными для глубинного культивирования яв-
ляются комплексные среды, содержащие углеводы, аммонийные соли, органиче-
ские соединения азота, витамины, которые обеспечивают более значительную про-
дукцию биомассы и более высокое содержание в ней белка по сравнению с синте-
тическими минеральными средами. В качестве компонентов комплексных сред
для глубинного культивирования высших съедобных базидиомицетов предложено
использовать отходы переработки картофеля, сахарной свеклы, молочную сыво-
ротку, мелассу и другие.
Получены новые данные и вскрыты важные закономерности, характеризую-
щие рост высших базидиомицетов в глубинной культуре. Для Pleurotus ostreatus
1300 и Panus tigrinus 131 в экспоненциальной фазе роста определена максималь-
ная скорость 0,11ч"1, продуктивность в ферментерах 4—7 г/л/сут. На скорость
роста, продуктивность, продолжительность ростовых фаз, экономический коэффи-
циент использования субстрата оказывают влияние состав и pH питательной среды,
способ подготовки и количество ннокулюма, его возраст и физиологическое сос-
тоящее, другие факторы культивированияГ~Показана эффективность огьемно-до-
ливного способа культивирования, позволяющего значительно сократить лаг-фазу
и окончить процесс ферментации за 48 ч.
В результате опытно-промышленной апробации Pleurotus ostreatus 1300 и
Panus tigrinus 131 показана возможность получегшя биомассы селектированных
штаммов высших съедобных базидиомицетов глубинным методом на основе
совремешюй микробиологической промышленности; Подтверждено, что тесты,
использовавшиеся на лабораторном уровне при селекционном отборе продуцентов
биомассы, соответствуют условиям^производства.
{дубинный культуральный MHuejntfcPleurotus ostreatus 1300, Panus tigrinus
131, Fiammulina velutipes 112 нетоксичен. Содержание в нем'сырого протеина
при благоприятных условиях культивирования достигает 40—60 % сухой массы,
перевариваемость сырого протеина составляет до 80 %. Культуральный мицелий
этих штаммов содержит все незаменимые аминокислоты. Доминирующими яв-
ляются глицин, аспарагиновая кислота, глютаминовая кислота. У P.ostreatus —
также лизин и аланин, у F.velutipes — фенилаланин и тирозин. Дефицитны серосо-
держащие аьанюкислоты, что характерно для высших базидиомицетов.
Получены данные об образовании в культуре исследованными видами высших
базидиоьицетов ферментов, антибиотиков, антибластомных веществ.
Показано, что глубинный мицелий Pleurotus ostreatus и Panus tigrinus можно
использовать как посевной в технологии производства плодовых тел экстенсив-
ным способом на отходах лесного хозяйства.
Промышленное культивирование мицелия высших съедобных базидиомице-
тов требует решения ряда проблем биологического, технологического, экономи-
ческого и другого плана. Наши исследования были сосредоточены на микологиче-
ских аспектах культивирования, что отражено в данной монографии.
СПИСОК ЛИТЕРА ТУРЫ
Агеева А.М., Корольков С.И. Химико-технологический контроль гидролизного и сульфит-
но-спиртового производства. - М.: Гослесбумиздат, 1953. - 268 с.
Айзенман Б.Е., Мандрик Т.П. Быстрый метод выявления in vitro поврежденных и мерт-
вых клеток карциномы Эрлиха // Антибиотики. — 1960. — 5, ЬР 3. — С. 97-98.
Афанасьева М.М., Серебренников ВМ. Отбор лигнинразрушаюших грибов // Микология и
фитопатология. - 1981. - 15, № 4. - С. 287-290.
Африкян Э.Г., Маркосян Л.С., Карапетян С.К., Унанян ВЛ. Биоконверсия крахмала в
дрожжевой белок // Биоконверсия : Тез. докл. Всесоюз. симпоз. ’’Биоконверсия растительно-'
го сырья” (Рига, 12-16 апр. 1982 г.) . - Рига : 1982. — Т. 1. - С. 136—137.
Бабицкая В.Г., Лобанок А.Г. Микроскопические грибы как возможный источник кормо-
вого и пищевого белка // Микробиол. пром-сть. - 1976. — № 1. — С. 25—32.
Беккер З.Э. Физиология грибов и их практическое использование. — М. : Изд-во Моск,
ун-та. — 1963. — 268 с.
Беккер З.Э., Бурцева Э.И., Рогова Е.С., Селях И.О. Биоритмы грибов в погруженной
культуре //Жури. общ. биологии. - 1978. - 39, № 4. - С. 521-533.
Беккер МБ. Биотехнология микробного синтеза. - Рига : Зинатие, 1980. - 350 с.
Беккер М.Е. Интенсификация прямой микробной биоконверсии растительных материа-
лов // Биоконверсия : Тез. докл. Всесоюз. симпоз. ’’Биоконверсия растительного сырья”
(Рига, 12-16 aim. 1982 г.) . - Рига -. Зинатие, 1982. - Т. 1. - С. 3—4.
Билай В.И. Фузарии. - Киев : Наук, думка, 1977. - 440 с.
Билай В.И., Пидопличко Н.М. Токсинообразуюшие микроскопические грибы и вызывае-
мые ими заболевания человека и животных. - Киев : Наук, думка, 1970. - 290 с.
Билай В.И., Элланская ИЛ. Метод микрокультуры для получения типичного конидиеоб-
разования у фузариев // Микология и фитопатология. - 1975. — 9, № 1. — С. 74—76.
Билай В.И., Коваль Э.З. Рост грибов на углеводородах нефти. - Киев : Наук, думка,
1980. - 337 с.
Билай В.И., Билай Т.И., Мусич Е.Г. Трансформация целлюлозы грибами. - Киев : Наук,
думка, 1982. — 295 с.
Биосинтетическая деятельность высших грибов / А.НДПиврина, О.П.Низковская, Н.Н.Фа-
лина и др. - Л.: Наука, 1969. - 241 с.
Бисько ЯЛ. Принципы первичного отбора высокоурожайных штаммов Agaricus bisporus
(J.Lange) Imbach для поверхностного культивирования // Микология и фитопатология. -
1982.- 16, №5.-С. 377-384.
Бойко М.И., Негруцкий С.Ф., Сычев ЯЛ. Культурально-морфологические особенности
штаммов Fomitopsis annosa (Fr.) Karst. // Там же. - 1978. - 12, № 1. — С. 50-54.
Бондарцев А.С., Зингер РЛ. Руководство по сбору высших базидиальных грибов для
научного их изучения // Тр. Ботан. ин-та им. ВЛ.Комарова АН СССР. Сер. 2. - 1950. - Вып. 6. -
С. 499-543.
Борисова В.И. Определение активности пероксидазы, каталазы, глюкозооксидазы // Ме-
тоды экспериментальной микологии : Справочник. - Киев : Наук, думка, 1982. - С. 175—180.
Борисова ВЛ., Бухало А.С., Двойное Л.М. О пероксидной активности высших базидио-
мицетов // Материалы I конф, по споровым растениям Украины. - Киев : Наук, думка, 1971.-
С. 133-134.
Бурова М.Г. Экология макромицетов в лесных сообществах : Автореф. дис.... д-ра биол.
наук. — М., 1984. — 33 с.
Бухало А.С. Методика кулътивування вищих базищйних грибов // М1кробюл. журн. -
1966. - 28, № 1.-С. 77-81.
Бухало А.С. Современные методы культивирования и перспективы промышленного ис-
пользования высших базидиомицетов /I Материалы П1 Закавк. конф, по споровым растени-
ям. - Тбилиси : Мецниереба, 1968. - С. 84-88.
Бухало А.С. Ист мщелйо Зспвних грибш в умовах культури Ц MiKpo6ion. журн. - 1971.—
33,№6.-С. 717-719.
Бухало А.С. Рост съедобных базидиомицетов в глубинной культуре // Микология и фито-
патология. - 1973а. - 7, № 4. - С. 349-353.
Бухало А.С. Выделение и изучение высших базидиальных грибов // Методы эксперимен-
тальной микологии. — Киев : Наук, думка, 19736. — С. 206-223.
Бухало А.С. Проблемы микробиологического культивирования съедобных грибов //
Тр. IV съезда микробиологов Украины. - Киев : Наук, думка, 1975. — С. 41—42.
Бухало А.С. Актуальные проблемы глубинного культивирования съедобных грибов //
Производство высших съедобных грибов в СССР. - Киев : Наук, думка, 1978. - С. 24-29.
Бухало А.С. Отбор грибов для получения пищевой биомассы // Микология и фитопато-
логия. - 1982а. - 16, вып. 1. - С. 63—70.
Бухало А.С. Чистая культура высших базидиальных грибов // Методы экспериментальной
микологии : Справочник. - Киев : Наук, думка, 19826. — С. 448—461.
Бухало А.С.Crinipellis schevczenkovi Buchalo sp. nova - новый вид агарикального гриба //
Укр. ботан. журн. - 1983а. - 39, № 3. - С. 98-99.
Бухало А.С. Высшие Basidiomycetes — продуценты пищевого белка в глубинной культу-
ре I/ Мицелиальные грибы (физиология, биохимия, биотехнология) : Тез. докл. Всесоюз.
конф. "Мицелиальные грибы” (Лушино, 10-12 окт. 1983 г.). - Пущино, 19836. - С. 99.
Бухало А.С. Микромицеты почв рисовых полей // Микромицеты почв. — Киев : Наук,
думка, 1984. - С. 84-92.
Бухало А.С., Пархоменко Л.П. Влияние концентрации водородных ионов на рост высших
базидиомицетов в культуре // Материалы пятого симпоз. до вопр. исслед. мико- и лихеиофло-
ры Прибалт, республик. - Вильнюс, 1968. - С. 21-24.
Бухало А.С., Загула Д.Г., Резник С.Р., Крымовская С.С. Об антибластомных свойствах
дереворазрушаюшего гриба Gloeophyllum sepiarium (Wulf, ex Fr.) Karst, и его способности по- 125
давлять продукцию гемагглютининов // Материалы I конф, по споровым растениям Украины
(Киев.сент. 1969 г.). Киев : Наук, думка. 1971а. - С. 134-136.
Бухало А.С.. Бълай T.I.. Бесараб Б.М. Протеолггична актившсть деяких виших базишомь
цепв II Мгкробюл. журн. — 19716. — 33. № 5. - С. 663-665.
Бухало А.С., Пархоменко Л.П., Марченко М.Н. Влияние различных источников углерода
и азота в синтетических средах на рост базидиомицетов // Микология и фитопатология. —
1972. - 6, № 3. - С. 241-244.
Бухало А.С., Пархоменко Л.П., Мартиненко ММ. Вирощування мщелпо плеврота черепи-
частого Pleurotus ostreatus (Fr.) Kumm, у чисттй культур! // Шкробюл. журн. — 1975. - 37,
N»2. - С. 181-184.
Бухало А.С., Соломко Э.Ф., Пархоменко Л.П. и др. Опыт глубинного выращивания мице-
лия Pleurotus ostreatus (Ft.) Kumm, на комплексных средах I/ Производство высших съедоб-
ных грибов в СССР. - Киев : Наук, думка. 1978. - С. 29-32.
Бухало А.С., Вассер С.П. Эволюционное и таксономическое значение некоторых культу-
рально-морфологических признаков высших Basidiomycetes // Проблемы эволюционной мор-
фологии в систематике и филогении растений : Докл. респ. семинара (Ялта, 1980 г.). - Киев :
Наук, думка, 1981а. — С. 146-157.
Бухало А.С., Вассер С.П. Значения культурально-морфолопчних ознак виших Basidiomy-
cetes для таксономгчних i еволюшйних побудов // Укр. ботан. журн. — 19816. — 37, № 1. -
С. 93-99.
Бухало А.С., Соломко Э.Ф., Дудка ИА. и др. Рост съедобных базидиомицетов на комп-
лексных средах // Мицелиальные грибы (физиология, биохимия, биотехнология) : Тез. докл.
Всесоюз. конф. ’’Мицелиальные грибы” (Лушино, 10-12 окт. 1983 г.). — Пушино, 1983. - С. 168.
Бухало А.С., Еланська I.O. Тдентифжашя штаму ’’Polypores squamosus Huds. ex Fr. PS-64”
як Fusarium sambucinum Fuck. var. ossicolum (Berk, et Curt.) Bilai. // Укр. ботан. журн. — 1983. —
39, W4. — С. 17-20.
Бухало А.С., Элланская ИА. Идентификация штамма ’’Polypores squamosus Huds. ex
Fr. PS-64”, предлагаемого в качестве продуцента биомассы, как Fusarium sambucinum Fckl.
var. ossicolum (Berk, et Curt.) Bilai // Микология и фитопатология. — 1984. — 18, вып. 6. —
С. 439-444.
Бухало А.С., Соломко Э.Ф., Закордонец ЛА. и др. Изучение питательной ценности куль-
турального мицелйя высших съедобных базидиомицетов // Микробиол. журн. - 1985а. -
47, 4. - С. 30- 34.
Бухало А.С., Закордонец ОА., Шашек В. Исследование культур высших базидиальных
грибов в сканирующем электронном микроскопе. Пряжки // Микология и фитопатология. —
19856. - 19, № 3. - С. 199-202.
Бухало А.С.. Косман Е.Г., Качуровская В.П. Исследование некоторых биологических
особенностей Panus tigrinus (Fr.) Sing, при многократных пассажах в культуре // Там же. -
1985в. - 19. №4. - С. 281-286.
Вассер С.П., Солдатова И.М. Высшие базидиомицеты степной зоны Украины (Boletales.
Agaricales, Russulales и Aphyllophorales). - Киев : Наук, думка, 1977. — 355 с.
Вассер С.П., Дудка И.А.. Бисъко ИА.. Бухало А.С. и др. Технологические аспекты куль-
тивирования съедобных базидиомицетов в поверхностной и глубинной культуре // Мицелиаль-
ные грибы (физиология, биохимия, биотехнология) : Тез. докл. Всесоюз. конф. ’’Мицелиаль-
ные грибы” (Пущино. 10-12 окт. 1983 г.). - Пушино. 1983. - С. 102.
Вассер С.П.. Дудка И.О., Бисъко НА., Бухало А.С. и др. Технолопчн! аспекта культаву-
вання виших юпвних базишомшеттв у поверхневхй i глибиннй культур! // BicH. АН УРСР. -
1984. - 48, № 10. - С. 51-56.
Вассер С.П. Флора грибов Украины : Агариковые грибы (Agaricaeae Cohn.). — Киев : Наук,
думка. 1980. - 328 с.
Вассер С.П. Агаоиковые грибы СССР. - Киев : Наук, думка. 1985. - 184 с.
Васильева Л.Н. Агариковые шляпочные грибы Приморского края. — Л.: Наука, 1973.- 330с.
Васильева Л.Н. Съедобные грибы Дальнего Востока. — Владивосток, Дальневост. кн.
изд-во. 1978. - 245 с.
Васильков Б.П. Съедобные и ядовитые грибы средней полосы Европейской часта СССР. -
М. ; Л. : Изд-во АН СССР, 1948. - 135 с.
ВасильковБ.П. Съедобные и ядовитые грибы. — Л. : Лениздат. 1963. — 45 с.
Веттер Я. Вивчення динамжи росту та позаклггинних монофенолмонооксигеназ у деяких
вишв роду Pleurotus (Fr.) Quel. // Укр. ботан. журн. — 1983. - 40, № 5. - С. 74-76.
Вечер А.С.. Соломко Э.Ф., Скачков Е.Н., Дудка И.А., Бухало А.С. и др. Концентрат карто-
фельного сока как субстрат для культивирования мицелия высших съедобных грибов //
Докл. АН БССР. - 1979. - 23. № 9. - С. 855-858.
Вечер А.С., Паромчик И.И.. Скачков Е.Н. Биотехнология использования безбелкового
клеточного сока картофеля в производстве тетрациклина // Биоконверсия : Тез. докл. Все-
союз. симпоз. ’’Биоконверсия растительного сырья” (Рига. 12-16 апр. 1982 г.) - Рига : Зи-
нине, 1982. - Т. 2. - С. 182-183.
* Вечер А.С., Федоров Н.И.. Паромчик И.И. l др. Накопление биомассы Flammulina velu-
tipes (Fr.) Karst, при выращивании на средах с концентратом картофельного сока // Экология
и биология низших растений : Тез. докл. IX симпоз. микологов и лихенологов Прибалт, сов.
республик и БССР (Минск, 17-19 нояб. 1982 г.) . - Минск, 19826. - С. 33-34.
Виестур У.Э. Принципы создания технологии и аппаратуры для твердофазной фермента1
ции // Биоконверсия : Тез. докл. Всесоюз. симпоз. ’’Биоконверсия растительного сырья”
(Рига, 12-16 апр. 1982 г.). - Рига : Зинатне, 1982. - Т. 1. - С. 138-139.
Виестур У.Э., Кристапсонс МАС., Былинкина Е.С. Культивирование микроорганизмов. -
М. : Пищ. пром-сть. 1980. — 232 с.
Возняковская ЮМ. Проблема микоризы и ее практическое значение // Микробиология. -
1954. - 23. № 2. - С. 204.
Высшие грибы и их физиологически активные соединения. - Л.: Наука, 1973. - 130 с.
Высшие съедобные базидиомицеты в поверхностной и глубинной культуре / НА.Бисъко,
126' А.С.Бухало, С.П.Вассер и др.; Под ред. И.АДудки. - Киев : Наук, думка, 1983. - 312 с.
Габинская К.Н. Влияние состава питательной среды на характер роста TiogemeBa hyalo»-
'ora /, Микробиология. — 1976. — 45, № 3. - С. 322—325.
Гаврилова В.П. Внутриклеточные и внеклеточные белки дереворазрушающего гриба
Fiammulina velutipes (Fr.) Karst. // Микология и фитопатология. — 1981.— 15,Й8 2. — С.121—123.
— Гаврилова В.П., Фалина П.П. Фермент протеолитического действия, полученный из гриба
Fiammulina velutipes (Fr.) Sing. // Там же. — 1975. - 9, № 5. — С. 431—433.
Гаврилова В.П., Гончарова ПА., Шамолина И.П., Вольф ЛА. Выделение ферментов про-
теолитического действия из культурального фильтрата Fiammulina velutipes (Fr.) Karst, с по-
мощью волокнистых ионитов // Там же. — 1980. — 14, №4. — С. 328—331.
-—Гаврилова Л.П. Образование плодовых тел Flammuiir. velutipes в культуре // Итоги и
перспективы научных исследований в области лесного хозяйства: Тез. докл. Всесоюз. науч.-
техн. совещ. (Пущино, 13-15 февр. 1979 г.). — Пущино, 1979. — С. 225—227.
Гаврилова Л.П. Биология дереворазрушающего гриба Fiammulina velutipes (Curt, ex
Fr.) Sing.: Автореф, дне.... канд. биол. наук. — М., 1981. — 15 с.
Гаврилова ЛЛ. Биоэкологические особенности съедобного дереворазрушаюшего гриба
Fiammulina velutipes (Fr.) Sing. // Экология и биология низших растений: Тез. докл. 9 симпоз.
микологов и лихенологов Прибалт, сов. республик и БССР (Минск, 17—19 нояб. 1982 г.). —
Минск, 1982. — С. 38—39.
Гарибова Л.В. Метод создания искусственных многоспоровых штаммов культивируе-
мого шампиньона // Биол. науки. - 1966. - № 2. - С. 104-105.
Гарибова ЛЛ. Об антагонистической активности мицелия культивируемого шампиньона
Agaricus bisporus (J.Lange) Imbach // Микология и фитопатология. — 1968. - 2,f₽2. — С. 81-87.
Гарибова Л.В. Селекция культивируемого шампиньона // Генетические основы селекции
микроорганизмов. - М. : Наука, 1969. - С. 239—260.
Гарибова ЛЛ. Культивирование съедобных шляпочных грибов // Микология и фитопато-
логия. - 1971. - 5, №4. - С. 374-380.
Гарибова Л.В. Морфология, биология и систематика рода Agaricus Fr. Emend. Karst. :
Автореф. дис.... д-ра биол. наук. - М., 1982. - 36 с.
Гарибова Л.В., Сафрай А.И. Оценка некоторых таксономических признаков видов рода
Agaricus Fr. // Микология и фитопатология. — 1972. — 6, >₽ 5. — С. 440—443.
Гарибова Л.В., Шалашова Н.Б. Наличие пряжек на мицелии видов рода Agaricus Fr. II
Там же. - 1973. - 7, № 3. - С. 231-232.
Гарибова Л.В., Мокеева В.Я. О различных методах и последовательности их применения
в систематике (на примере рода Agaricus Fr.) // Там же. - 1974. — 8, № 6. - С. 533-536.
Гарибова ЛЛ., Сафрай А.И., Шалашова Н.Б. Условия плодоношения некоторых видов ро-
да Agaricus Fr. emend. Karst. // Там же. - № 3. - С. 259-264.
Гарибова ЛЛ., Мокеева ВЛ. Использование метода межвидовых скрещиваний для уста-
новления филогенетических связей внутри рода (на примере рода Agaricus Fr.) // Там же. -
1976. - 10, № 1.-С. 53-56.
Гарибова Л.В., Сафрай А.И. Микроморфология мицелия чистых культур видов рода
Agaricus Fr. emend. Karst. // Там же. - 1980. - 14, № 6. - С. 480—485.
Головлева ЛА. Микробная деградация лигнина и лигносульфонатов // Биоконверсия :
Тез. докл. Всесоюз. симпоз. ’’Биоконверсия растительного сырья” (Рига, 12—16 апр. 1982 г.). -
Рига, 1982. - Т. 1. - С.18-19.
Горленко МЛ. Положение грибов в системе органического мира // Эволюция и система-
тика грибов : Теорет. и прикл. аспекты, - Л.: Наука, 1984. - С. 5-9.
Горленко МЛ., Бондарцева МА., Гарибова ЛЛ. и др. Грибы СССР. — М.: Мысль, 1980. -
303 с.
Давыдкина ТА. Культурально-морфологические особенности видов рода Stereum Pers,
ex S.F.Gray s. lato // Микология и фитопатология. — 1973. — 7, № 2. - С. 85—93.
Давыдкина ТА. Стереумовые грибы Советского Союза. — Л.: Наука, 1980. — 150 с.
Даниляк Н.И. Влияние pH и температуры на активность 0-1,4-глюкан-4-глюканогидролаз
экзо клеточного ферментного препарата, выделенного из Pleurotus ostreatus (lacquiner ex Fr.)
Kummer K-69 // Микробюл. жури. - 1980. - 42, № 3. - С. 185—190.
Даниляк M.I., Панасенко Т.В. Вплив бюлопчно активних речовин на продукування екзо-
клпинних целюлаз, 0-глюкозидази i глюкоамшази Pleurotus ostreatus VI (Fr.) Kummer // Укр.
ботан. журн. - 1979. - 36, № 4. - С. 331-333.
Денисова Н.П. Протеолитическая активность культур высших, базидиомицетов различных
систематических и экологических групп // Экология и биология низших растений : Тез. докл.
IX симпоз. микологов и лихенологов Прибалт, сов. республик и БССР (Минск, 17-19 нояб.
1982 г.) .-Минск, 1982а. - С. 52-53.
Денисова Н.П. Протеолитическая активность культур высших грибов Ц Микология и фи-
топатология. - 19826. - 16, № 5. - С. 458—466.
Денисова Н.П. Природа и биологическая роль протеиназ базидиальных грибов // Там же.-
1984. - 18,№2. -С. 116-120.
Денисова Н.П., Фалина Н.Н. Ферментативная активность препарата из зимнего опенка
Fiammulina velutipes (Fr.) Karst. // Там же. - 1981. — 15, № 2. - С. 123-125.
Дроздова Т.Н., Белова НЛ. Ферментный спектр некоторых грибов семейства Polypora-
сеае // Там же. - 1982. - 16, № 1. - С. 33-36.
Дудка ИА., Шена ВЛ., Вассер С.П. и др. Вешенка обыкновенная. - Киев : Наук, думка,
1976а.-ПО с.
Дудка LO., Шепа В.В., Вассер С.П. та in. Культуральш особливосп штаммгв виших базидю-
мшетш з рощв Pleurotus (Fr.) Qu61. та Lentinus Fr. // Укр. ботан. журн..- 19766. — 33,№6. -
С. 582-596.
Дудка И.О., Вассер СП., Солдатова И.М., Береговая В.И. Культуралып особливосп пгга-
мгв Agaricus bisporus (J.Lge) Imbach // Там же. — 1978. — 35, № 3. — С. 258-264.
Дударева Н.Т. Ароматические вещества грибов свежих и сублимационной сушки //
Прикл. биохимия и микробиология. - 1975. — 11, № 1. - С. 147—148.
/Дудка I.O., Бухало А.С., Вассер С.П. n in. Селекщя виших баэищйних грибов для поверх-
невого i гпибинного культивування // BicH. АН УРСР. — 1983. - 46, )₽ 2. — С. 62-70.
127
Дудченко Л.Г. Бюхийчж пос-яви бюоитмГв // Уко. ботан. журн. - 1978. - 35, № Б. -
С. 585-591.
Дудченко Л.Г., Мельничук Г.Г. Значения бюхнлчних дослщжень для практичного вико-
ристання та роэвитку хемотаксономп виших грибов // Там же. - 1973. - 30, № 1. - С. 1—14.
Дьяков Ю.Т. Использование метода электрофореза белков для исследований по хемо-
таксономии и изменчивости грибов // Итоги науки и техники / ВИНИТИ. Сер. Ботаника. -
1980.-Т. 4.-С. 106-149.
Блинов Н.П. Перспективы развития технической микологии в СССР // Эволюция и систе-
матика грибов : Теорет. и прикл. аспекты. - Л. : Наука, 1984. - С. 157—170.
Ефименко ОМ. Исследование базидиальных грибов на содержание алкалоидов // Мико-
логия и фитопатология. - 1973. - 7,№3.- С. 200-202.
Ефименко ОМ. Содержание алкалоидов в высших базидиальных грибах // Там же. -
1976. - 10, №4. - С. 318-319.
Жданова НМ.. Василевская AM. Экстремальная экология грибов в природе и экспери-
менте. - Киев : Наук, думка. 1982. - 168 с.
Закордонец ЛА. Определение аминокислот // Методы экспериментальной микологии :
Справочник. - Киев : Наук, думка, 1982. - С. 225—237.
Залашко М.В. Использование молочной сыворотки для получения белка одноклеточ-
ных // 3-й симпоз. сод. стран по биотехнологии (Братислава, 25-29 апр. 1983 г.). - Брати-
слава, 1983.-С. 9-15.
Зарудная ГМ. Влияние различных источников углерода и азота на рост некоторых видов
грибов рода Copnnus // Микология и фитопатология. — 1971. — 5, № 2. — С. 133—136.
Захаров НА. Генетические механизмы эволюции грибов Ц Эволюция и систематика
грибов : Теорет. и прикл. аспекты. - Л. : Наука, 1984. - С. 18—37.
Зерова М.Я. 1спвш та отруйн! грибн Укршни. - 2-е вид. - К.: Наук, думка, 1970. - 138 с.
-— Зерова М.Я., Дудченко Л.Г., Роженко ГЛ. Вили роду Marasmius в культур! як джерело
бшку та втгампив II Укр. ботан. журн. - 1970. - 27. №6.- С. 753—757.
Зерова М.Я., Мельничук Г.Г. Вили роду Macrolepiota як джерело бюлопчно шнного
бшку I/ Тез. доп. V зЧзду Укр. ботан. т-ва. - Ужгород, 1972. - С. 88—89.
Зерова М.Я., Вичканова СА., Дудченко Л.Г., Мельничук ГД'. Антимикробное действие
грибов из родов Marasmius и Oxvporus /7 Микология и фитопатология. — 1976. -10, №2.-
С. 85-87.
Зерова М.Я.. Сосин П.Е., Роженко Г.Л. Визначник грибгв Укра1ни. - Киев : Наук, думка,
1979.-T.5.KH.2. - 565 с.
Зерова М.Я., Ел!н Ю.Я., Коз’яков СМ. Гриби (iCTiBHi, умовно icriBHi, HeicriBHi, отруй-
Hi)К. : Урожай, 1984. - 201 с.
Зобнина В.П.. Логинова Т.М., Тюрин В.С. и др. Сравнительная характеристика ультра-
структуры глубинных гиф несовершенных и базидиальных грибов // Мицелиальные грибы
(физиология, биохимия, биотехнология) : Тез. докл. Всесоюз. конф. "Мицелиальные грибы”
(Пушино, 10-12 окт. 1983 г.) . - Пушино, 1983. - С. 17-18.
Инголд Ц.Т. Пути и способы распространения грибов. — М.: Изд-во иностр, лит., 1957. -
182 с.
Камалетдинова ФМ.. Васильев А.С. Цитология дискомицетов. - Алма-Ата : Наука, 1982.-
176 с.
" Капич А.Н.. Бабиикая В.Г., Стахеев И.В. Возможность накопления биомассы базидиоми-
петами на отходах промышленности в глубинной культуре // Изв, АН БССР. Сер. биол. наук -
1980. -№ 1. - С. 88-92.
Капич А.Н., Бухало А.С., Стахеев И.В. Изучение роста и синтеза протеина съедобным гри-
бом Panus tigrinus (Fr.) Sing. ИБК-131 на средах с сельскохозяйственными отходами // Мик-
робиол. пром-сть. - 1983. - № 1. - С. 2-3.
Капич А.Н., Стахеев ИЛ., Бабицкая В.Г. Дереворазрушающие базидиомицеты - проду-
центы белка. - Минск, 1984. - 68 с. — (Препринт / АН БССР. Ин-т микробиологии) .
Каросене СА., Станкявичене Д.Р. Содержание витаминов в шляпочных грибах. Сообш.16.
Тиамин и рибофлавин е плодовых телах 13 видов семейств Boletaceae.'Paxilbceae,Tricholoma-
taceae, Amanitaceae, Agaricaceae, Cortinariaceae // Tp. АН ЛитССР. — 1984. — № 1. — C. 85-93.
Кашкин Н.Н., Блинов Н.Л., Кашкин К.П. Микробиология. - Л.: Медицина, 1968. - 362 с.
Кириленко Т.С. Выделение почвенных грибов в чистые культуры // Методы эксперимен-
тальной микологии : Справочник. - Киев : Наук, думка, 1982. — С. 432-441.
Клесов АА. Ферментативный катализ. Ч. 2. Ферментативная деструкция полимеров
(полимерные субстраты). - М. : Изд-во Моск, ун-та, 1984. - 216 с.
Кормовые белки и физиологически активные вещества для животноводства / Под ред.
О.М.Ефименко. - М.; Л. : Наука, 1965. - 127 с,
Краснобрыжжий Н.Я., Полотняк АД., Бухало АС. 'и др. Глубинное культивирование цен-
ного съедобного гриба вешенки обыкновенной в опытно-промышленных условиях // Произ-
водство высших съедобных грибов в СССР. - Киев : Наук, думка, 1985. - С. 123-124.
Лакин Г.Ф. Биометрия. — М.: Высш, шк., 1973. — 343 с.
Лисенков AM. Математические методы пл^Шфования многофакторных медико-биоло-
гических экспериментов. - М.: Медицина, 1979. - 344 с.
Лобанок А.Г., Стахеев ИМ., Бабиикая В.Г. Биоконверсия целлюлозосодержаших суб-
стратов в белок с помощью мицелиальных грибов // Биоконверсия : Тез. докл. Всесоюз.
симпоз. "Биоконверсия растительного сырья” (Рига, 12-16 апр. 1982 г.), - Рига, 1982. -
Т. 1. - С. 23-24.
Мавр Э. Принципы зоологической систематики. - М. : Мир, 1971. - 454 с.
Маслова РА. Влияние различных источников азота на рост дереворазрушающих грибов
в культуре // Микология и фитопатология. - 1969. - 3, №5. - С. 452-457.
Маслова РА. Зависимость роста афиллофоровых грибов от соотношения углерода и азота
в питательных средах Ц Там же. - 1971. — 5, N* 4. — С. 401 -403.
Маслова РА. Рост и развитие некоторых аффилофоровых грибов ня различных питатель-
128 ных средах : Автореф. дне.... канд. биол. наук. - Л., 1972. - 25 с.
Маслова РА. Рост аффилофоровых грибов на средах с различными источниками углерод-
ного питания // Микология и фитопатология. - 1973. - 7, № 2. — С. 95—101.
Маслова РА. О белках грибов рода Pleurotus // Производство высших съедобных грибов
в СССР. - Киев : Наук, думка, 1978а. — С. 84—86.
Маслова РА. Свободные и связанные аминокислоты некоторых аффилофоровых гри-
бов // Микология и фитопатология. - 19786. — 12, № 4. - С. 292-295.
Маттисон НЛ., Фалина Н.Н., Якимов НЛ., Маслова РА. Протеолитическая активность
дереворазрушающих грибов в связи с синтезом белка и биомассы // Кормовые белки и фи-
зиологически активные вещества для животноводства. - М. ; Л. : Наука, 1965. - С. 33-38.
Маттисон Н.Л., Фалина Н.Н., Пасскелъ Г.Г. Активное целлюлолитических ферментов
культуральных фильтратов Fomitopsis annosa (Fr.) Karst, в зависимости от состава питатель-
ной среды // Продукты биосинтеза высших грибов и их использование. - М. ; Л. : Наука,
1966. - С. 14-20.
г Маттисон НЛ., Низковская О Л. Целлюлозоразрушающая способность базидиальных
грибов // Ферментативное расщепление целлюлозы. — М. : Наука, 1967. — С. 103—106.
Маттисон НЛ., Фалина Н.Н. Протеолитическая активность афиллофоровых грибов в по-
верхностной культуре // Микология и фитопатология. — 1973. — 7, № 5. — С. 394—399.
Мейнелл Дж., Мейнелл Э. Экспериментальная микробиология. — М. : Мир, 1967. - 347 с.
Мелик-Хачатрян Дж.Г. Шляповдые грибы Армянской ССР (гастеромицеты и агариковые
грибы) : Автореф. дис.... д-ра биол. наук. - Ереван, 1971. — 58 с.
Мелик-Хачатрян Дж.Г., Вартапетян Б.Г. Антагонистическая активность мицелия Oude-
mansiella radicata (Relh. ex Fr.) Sing, в отношении ьшкофилов // Микология и фитопатология. -
1977. - 11, №2. - С. 166-167.
Мелик-Хачатрян Дж.Г. Микофлора Армянской ССР : Агариковые (шляпочные) грибы. —
Ереван : Изд-во Ерев. ун-та, 1980. — Т. 5. - 543 с.
Мельничук Г.Г. Сезонна мшливгеть 1зоферментких cneicrpiB розчинно) малатдепдрогена-
зи у деякихвищв базидаальиих грибгв // Укр. ботан. журн. — 1980. — 37, N* 5. — С. 77—80.
Мельничук Г.Г., Зерова МЛ. Вида роду Agaricus як джерело битка та впамдав //Там
же. - 1972. - 29, № 6. - С. 755-760.
Мельничук Г.Г., Даниляк Н. I. Динамжа активности екзоклпинних пдролаз деяких ага-
рикальних грибш // Там же. - 1981. — 38, № 4. — С. 55-58.
Мельничук Г.Г., Даниляк M.I. Колеснева Г.В. Поргвняльне вивчення целюлаз i глюко-
амшази грибгв с родини Polyporaceae // Там же. — 1982. - 39, N® 2. — С. 13—16.
Методы экспериментальной микологии : Справочник / Под ред. В.И.Билай. - Киев :
Наук, думка, 1982. - 550 с.
Мозер М. Искусственное заражение микоризными грибами // Микоризы растений. - М.:
Сельхозгиз, 1963. - С. 280-305.
/ Морозова Г.Р., Высоцкий В.Г., Сафонова Н.В., Мамаева Е.М. Промышленное получение
мицелия высших грибов. - М. : Главмикробиопром, 1978а. — 56 с. — (Обзор ОНТИ : Сер. 4) .
t Морозова Г.Р., Сафонова Н.В., Кинаревская Т.В., Тарасенко А.Н. Питательные среды для
промышленного глубинного культивирования мицелия высших грибов // Производство выс-
ших съедобных грибов в СССР. — Киев : Наук, думка, 19786. — С. 87—91.
Морозова Г.Р., Чопяк AM., Глико Т.О. и др. Нуклеиновые кислоты и белковые вещества
мицелия гриба Polyporus squamosus Huds ex Fr. PS-64 // Микробиол. пром-сть. — 1979. — № 1. —
С. 18-19.
Морозова Г.Р., Чернуха БА., Сафонова Н.В. Получение мицелия высших грибов и перс-
пективы его использования как пищевого продукта II Новые источники белка и их примене-
ние : Тез. докл. Всесоюз. совещ. (Тбилиси, нояб. 1980 г.). - Тбилиси : Изд-во Тбил. ун-та,
1980.-С. 31-32.
Морозова Г.Р., Сафонова П.В., Чернуха БА., Кинаревская Т.В. Влияние способа культи-
вирования на содержание белковых веществ в мицелии гриба Polyporus squamosus Huds. ex
Fr. // Теория и практика управляемого культивирования микроорганизмов : Тез. докл. III
Всесоюз. конф. (Киев, 29 сект. - 1 окт. 1981 г.). - Киев : Наук, думка, 1981. - Ч. 2. -
С. 85-86.
Нахуцришвили И.Г. Агарикальные грибы Грузии. - Тбилиси : Мецниереба, 1975. - 209 с.
Неустроева ЛМ. Влияние состава питательной среды на накопление биомассы мицелия
зимнего гриба // Лесоведение и лесн. хоз-во. - 1981. - № 16. - С. 109-112.
Низковскця ОЛ. Физиология грибов // Биосинтетическая деятельность высших грибов. -
Л.: Наука, 1969а. - С. 60-100.
Низковская ОЛ. Антибиотические свойства высших базидиальных грибов // Там же. -
19696. - С. 96-100.
Низковская ОЛ. Рост высших грибов в глубинной культуре // Микология и фитопато-
логия. - 1972. - 6, №4. - С. 306-312.
Низковская ОЛ. Рост грибов из пор. Agaricales в поверхностной и глубинной культурах //
Производство высших съедобных грибов в СССР. - Киев : Наук, думка, 1978. - С. 92—97.
Низковская ОЛ., Милова НМ. Антагонистические свойства базидиальных грибов //
Микробиология. - 1963. - 312, № 5. - С. 771—777.
Низковская О.П., Милова НМ. Первичный отбор культуральных фильтратов высших
грибов, обладающих противоопухолевой активностью // Продукты биосинтеза высших грибов
и их использование. - М.; Л. : Наука, 1966. — С. 5—8.
Низковская ОЛ., Милова НМ. К сравнительно-физиологической характеристике грибов
цз порядка Афиллофоровых и Агариковых в культуре // Кормовые белки и физиологически
активные соединения. - Л.: Наука, 1973. - С. 13-19.
Низковская ОЛ., Федорова Л.Н., Дроздова Т.Н. Протеолитическая активность базидио-
мицетов из порядка Aphyllophorales. II. Казеиназа // Микология и фитопатология. - 1979. -
13, № 3. - С. 217-220.
Низковская ОЛ., Панькова ИМ., Кочетова ГА., Мануковский Н.С. Оценка • лмгнолити-
ческой активности базидиомицетов радиоизотопным методом // Там же. - 1981. - 15, № 5. -
С. 398-401. .
129
ПаламаръМордвиниева ГМ. Десршдиевые водоросли Украинской ССР. - Киев : Н^ук.
думка, 1982. — 240 с.
Пармасто Э.Х. Исследования по афиллофоровым грибам (Aphyllophorales) Советского
Союза И Автореф. дне. д-ра биол. наук. - Тарту, 1969. - 67 с.
Пармасто Э.Х., Каламезс КЛ. Охрана грибов в СССР ft Экология и биология низших рас-
тений : Тез. докл. IX Всесоюз. симпоз. микологов и лихенологов Прибалт, сов. республик и
БССР (Минск, 17-19 нояб. 1982). - Минск, 1982. - С. 120-121.
Перт С Аж Основы культивирования микроорганизмов и клеток. - М. : Мир, 1978. —
332 с.
Петру шенко ГМ., Калюжный М.Я. Хитин дрожжеподобных организмов рода Candida //
Прикл. биохимия и микробиология. — 1971. - 7, N* 6. — С. 637—642.
Пидопличко Н.М. Грибная флора грубых кормов. — Киев : Изд-во АН УССР, 1953. — 487 с.
Пидопличко НМ., Борисова В.Н., Двойное ЛМ. О пероксидазной активности микофлоры
опавших листьев и хвои // Материалы пятого симпоз. по вопр. исслед. мико- и лихенофлоры
Прибалт, республик (Вильнюс, 5—9 сеят. 1968 г.). — Вильнюс, 1968. — С. 132—135.
Пидопличко НМ., Борисова В.Н., Элланская ИЛ. О пероксидазе у микромицетов //
Экспериментальная микология. - Киев : Наук, думка, 1968. - С. 56—63.
Подгорский В.С. Физиология и метаболизм метанолусваивающих дрожжей. - Киев :
Наук, думка, 1982. - 152 с.
Продукты биосинтеза высших грибов и их использование. - М.; Л. : Наука, 1965. — 135 с.
Промышленное культивирование съедобных грибов / И.А.Дудка, С.П.Вассер, А.С.Буха-
ло и др. - Киев : Наук, думка, 1978. - 264 с.
Псуриева HJB. Характеристика роста и развития некоторых штаммов Fiammulina velutipes
(Fr.) Karst. // Микология и фитопатология. - 1983. - 17, № 2. - С. 131—134.
Псуриева Н.В., Денисова Н.П. Тромболитическая активность культур Fiammulina velutipes
(Fr.) Karst. // Там же. - 1982,- 16, № 6. - С. 518-521.
Решетников С. В. Нестатеве та вегетативне розмноження вищих базидаомщетш порядку
Agaricales // Укр. ботан. журн. — 1982а. — 39, № 2. — С. 86—97.
Решетников С.В. Особенности образования конидий у анаморфы агарикального гриба
Fiammulina velutipes (Fr.) Karst. // Там же. - 19826. - 39, № 4. — С. 75—77.
Решетников С.В. У творения конщй незавершеноЗ стадп агарикального гриба Fiammulina
velutipes (Fr.) Karst // Экология и биология низших растений : Тез. докл. IX Всесоюз. симпоз.
микологов и лихенологов Прибалт, сов. республик и БССР (Минск, 17-Г9 нояб. 1982 г.) -
Минск. 1982в. - С. 144-145.
Решетников С.В., Дудка ИЛ. Артроконидиогенез анаморфы агарикального гриба Fiam-
mulina velutipes (Fr.) Karst. // Микологияи фитопатология. - 1983. - 17, № 2. - С. 107-111.
Рипачек В. Биология дереворазрушающих грибов. — М. : Леей, пром-сть, 1967. — 276 с.
РоузЭ. Химическая микробиология. - М.: Мир, 1971. — 294 с.
Рудаков О.Д. Микофильные грибы, их биология и практическое значение. - М. : Наука,
1981. - 159 с.
Садыхов А.С. Шляпочные грибы Ленкоранской зоны Азербайджанской ССР : Автореф.
дис.... канд. биол. наук. - Баку, 1968. - 23 с.
Семичаевский ВД. Динамика активностей внеклеточных эндо-1,4-(3-глюканазы и монофе-
нол-монооксигеназы дереворазрушаюшего базидиомицета Pleurotus ostreatus (Fr.) Kumm. //
Микология и фитопатология. - 1985. - 19. № 1. - С. 54-57.
Семеоджиева М. Генетический анализ мицелиальных культур гименомицетов // Там же. -
1977. - li.№ 3.- С. 199-206.
Сержанина ГМ. Шляпочные грибы Белоруссии. - Минск : Наука и техника, 1984. — 407 с.
Сержанина ГМ., Змитрович ИМ. Макро ми петы. - Минск : Высшэйш. шк., 1986. - 214 с.
Сказкин Ф.Д., Ловчиновская Е.И., Миллер М.С., Аникеев В.В. Практикум по физиологии
растений. — М.: Сов. наука, 1958. - 339 с.
Скрябин Г.К., Брошин В.К. Биотехнологическое получение белка // Биотехнология. -
М. : Наука. 1984. - С. 35-41.
Смирнов Е.С. Таксономический анализ. - М. : Изд-во Моск, ун-та, 1969. - 187 с.
Соломко Э.Ф. Сравнительный химический состав и питательная ценность мицелия съедоб-
ных грибов, выращенных глубинным методом // Производство высших съедобных грибов
в СССР. — Киев : Наук, думка, 1978. — С. 98—104.
Соломко Э.Ф., Бухало А.С., Пархоменко Л.Н., Морозова Г.Р. Подбор штаммов грибов
для глубинного культивирования на промышленных средах с мелассой // Производство выс-
ших съедобных грибов в СССР. - Киев : Наук, думка, 1978. - С. 105-108.
Соломко Э.Ф., Сумневич В.Г., Пчелинцева Р.К., Пархоменко Л.П. Влияние условий глу-
бинного культивирования на рост и химический состав мицелия съедобного гриба Pleurotus
ostreatus (Fr.) Kumm. HMBF-1300 // Микология и фитопатология. — 1981. — 15, № 3. -
С. 217-222.
Соломко Э.Ф., Панченко Л.П., Силъченкова РАС. Содержание липидов и состав жирных
кислот высшего съедобного гриба - вешенки обыкновенной Pleurotus ostreatus (Fr.) Kumm. //
Прикл. биохимия и микробиология. - 1984а. - 2С, 1₽ 2. - С. 273-279.
Соломко Е.Ф., Шашек В. Вдосконалення методики доелшження фвюлогп* та кшетики
^осту Heurotus ostreatus (Fr.) Kumm, у глибиншй культур! // Укр. ботан. журн. — 19846. — 41,
. Соломко Э.Ф., Елисеева Г.С., Рябчук ВЛ., Пчелинцева РАС. Состав плодовых тел и мице-
_ . лия высшего съедобного гриба Pleurotus ostreatus (Fr.) Kumm. // Прикл. биохимия и микробио-
логия. - 1987. - 23,)₽2. - С. 230-236.
Суворов ПЛ. Использование культуральных признаков в Диагностике и систематике
дереворазрушающих грибов // Материалы I конф, по споровым растениям Украины (Киев
сет. 1969 г.).- Киев : Наук, думка, 1971. - С. 234-236.
Судына О.Г., Мельничук Г.Г. Принципи використання бюхгмгчних ознак у таксономи
росяшг на приклад! бшкових комплекав базищальних грибш // Укр. ботан. жури. - 1976 -
33,№6.-С. 561-577.
ч _л,____Талызина ВЛ. Усовершенствование метода первичного отбора антибиотиков, обладаю-
1<Я)иих противоопухолевой активностью // Антибиотики. - 1959. - 4, № 3. - С. 112-113.
Тахтаджян А.Л. Вопросы эволюционной морфологии растений. — Л. : Изд-во Ленингр.
ун-та, 1954. - 212 с.
Тимофеев-Ресовский Н.В., Яблоков А.В. Микроэволюция : Элемент, явления, материал
и факторы эволюц. процесса. — М. : Знание, 1974. - 64 с.
Topee А.К. Промышлена технология за производство на мицел от висши гьби. — София :
БАН, 1973. - 202 с.
Тревельян В.Е. Грибы // Источники пищевого белка. - М. : Колос, 1979. - С. 237-254.
Трембач О.Г. Плодоношение некоторых агариковых грибов в культуре в зависимости
от температуры и освещения // Микология и фитопатология. - 1974. - 8, № 6. - С. 528-530.
Фалина НЛ. Выращивание зимнего опенка (Flammulina Tutipes (Fr.) Sing.) для получения
мицелия и протеолитических ферментов // Производство высших съедобных грибов в СССР. -
Киев : Наук, думка, 1978. - С. 111-113.
Фалина Н.Н., Якимов ПА., Маслова РА. Образование белка некоторыми видами дерево-
разрушаюших грибов в поверхностной культуре // Комплексное изучение физиологически
активных веществ низших растений. - М. ; Л. : Изд-во АН СССР, 1961. — С. 39—43.
Фалина Н.Н., Андреева СМ. К вопросу о питательной ценности культурального мицелия
высших грибов // Кормовые белки и физиологически активные вещества для животноводст-
ва. - М. ; Л. : Наука, 1965. — С. 46-49.
Фалина Н.Н., Маслова РА., Якимов ПА. Сравнительные данные по аминокислотному
составу мицелия глубинной культуры дереворазрушающих грибов // Там. же. - 1965а. -
С.43-45.
Фалина Н.Н., Маслова РА., Якимов ПА. и др. Некоторые итоги изучения базидиальных
грибов как источника получения кормового белка и дефицитных аминокислот // Раст, ресур-
сы. - 19656. - 1, № 1. - С. 122-127.
Фалина Н.Н., Маслова РА., Андреева СМ. Биосинтез некоторых незаменимых аминокис-
лот в мицелии базидиальных грибов // Продукты биосинтеза высших грибов и их использова-
ние. - М.; Л. : Наука, 1966. - С. 28-31.
Федоров Н.И., Бадыль С.В. Целлюлозолитическая активность Armillariella mellea (Fr.)
Karst. // Прикл. биохимия и микробиология. — 1973. - 9, № 2. - С. 408—413,
Федоров НЛ., Иванов В.Д. Перспективы промышленного выращивания опенка летнего
на древесине // Производство высших съедобных грибов в СССР. - Киев : Наук, думка,
1978.-С. 114-117.
Федорова Л.Н. Протеолитическая активность высших грибов в поверхностной и погру-
женной культуре // Микология и фитопатология. - 1973. — 7, № 6. - С. 542—544.
Федорова Л.Н., Шиврина А.Н. Протеазы ’’сычужного” действия в культурах высших гри-
бов // Там же. - 1974. - 8, № 1. - С. 22-25.
Федорова Л.Н., Шиврина А.Н. Динамика протеолитической активности в культурах выс-
ших грибов // Там же. — 1975. - 9, № 4. - С. 307—310.
Федорова Л.Н., Дроздова Т.Н. Физиологическая активность глубинной культуры - про-
дуцента молокосвертывающего фермента // Экология и биология низших растений : Тез. докл.
IX Всесоюз. симпоз. микологов и лихенологов Прибалт, сов. республик и БССР (Минск,
17-19 нояб. 1982 г.). - Минск, 1982. - С. 187-188.
Фомина В.И., Гаврилова ЛЛ. Лабораторные исследования по образованию плодовых
тел Pleurotus ostreatus (Fr.) Kumm, на отходах деревообработки // Производство высших
съедобных грибов в СССР. - Киев : Наук, думка, 1978. - С. 117-120.
Халабуда Т.В. Грибы рода Mortierella Coemans. - М. : Наука, 1973. — 208 с.
Харченко С.Н. Изучение антибиотических свойств грибов // Методы экспериментальной
микологии : Справочник. - Киев : Наук, думка, 1982. - С. 269-286.
Химический состав пищевых продуктов / Под ред. М.Ф.Нестерина, И.М.Скурилина. -
М. : Пищ пром-сть, 1979. - 248 с.
Хотянович А.В., Веденеева НМ., Кубарева З.И. Содержание и перевариваемость белка
в кормовых дрожжах при выращивании их на различных источниках углерода и азота //
Прикл. биохимия и микробиология. - 1972. - 8, № 2. — С. 186-190.
Худяков Я.П., Возняковская ЮМ. Чистые культуры микоризных грибов // Микробио-
логия. - 1951. - 20, № 1. - С. 13-19.
Частухин В.Я., Николаевская МА. Исследования по разложению органических остатков
под влиянием грибов и бактерий в дубравах, степях и полезащитных лесных полосах // Тр.
ботан. ин-та им.В.Д.Комарова АН СССР. Сер. 2. - 1953. - Вып. 8. — С. 201-208.
Частухин В.Я., Николаевская МА. Биологический распад и ресинтез органических ве-
ществ в природе. - Л. : Наука, 1969. — 323 с.
Черотченко ЮЛ. Стерины грибов из сем.' Boletaceae Chev., Coprinaceae Roze и Russulaceae
Roze (nop. Agaricales) и их использование в систематике : Автореф. цис.... канд. биол. наук. -
Л., 1977. - 22 с.
Черотченко ЮЛ. Стерины базидиальных макромицетов как биохимический критерий для
таксономии // Микология и фитопатология. - 1980. - 14, № 3. - С. 217-222.
Шаркова Т.С. Цитохимическая характеристика спорулирующей и вегетативной зон куль-
туры Trichothecium roseum Fr. // Микология и фитопатология. - 1971. — 5, № 6. — С. 490-493.
Шарова М.Б., Высоцкий ВЛ. Электронно-микроскопическое изучение Trichoderma viride
Fr. // Микология и фитопатология. - 1983. - 17, № 4. - С. 296-301.
Шевченко В.Н., Бухало А.С., Топоровская Ю.С. Гриб из рода Crinipellis Pat., вызывающий
гниль корнеплодов сахарной свеклы в Чуйской долине Киргизской ССР // Там же. - 1974. -
8ZN>2.-С. 128-131.
Шемаханова МЛ. Микотрофия древесных пород. - М. : Изд-во АН СССР, 1962. - 276 с.
Шиврина А.Н. Биологически активные вещества высших грибов. - Л. Наука, 1965. -
199 с.
Шиврина АЛ., Черотченко ЮЛ. Изучение стеринов грибов семейства Boletaceae // Мико-
логия и фитопатология. - 1970. - 4, № 2. - С. 187-193.
Шкидченко АЛ. О возможности управляемого культивирования мицелиальных форм
микроорганизмов // Мицелиальные грибы (физиология, биохимия, биотехнология) : Тез.
докл. Всесоюз. конф. ’’Мицелиальные грибы” (Пущино, 10—12 окт. 1983 г.). - Пушино.
1983. - С. 97-98.
131
Эйлворд Ф. Стандарты качества, безвредность и законодательство // Источники пищевого
белка.-М. : Колос. 1979.-С. 275-290. '
А.С. 427993 СССР, (51) MJCi. С 12кЗ(00. Штамм гриба Pleurotus ostreatus (Fr.) Kummer.
HMBF-1300 - продуцент биомассы / Н.МЛидопличко, А.С.Бухало, Л.П.Пархоменко, М.П.Мар-
ченко. - Опубл. 29.10.74, Бюл. № 18.
А.с. 616276 СССР. (51) М.КлЗ. С 12Д 13(06. Способ получения биомассы / А.К.Торев. —
Опубл. 28.09.78, Бюл. № 27.
А.с. 727678 СССР, (51) М.КлЗ. С 12 К 3(00. Штамм Flammulina velutipes HBKF-112-npo-
дупент биомассы / И.АДудка, А.С.Бухало, Э.Ф.Соломко, А.П.Пархоменко, М.Н.Мартыненко,
Р.К.Пчелинцева. - Опубл. 15.04.80, Бюл. № 14.
А.с. 883177 СССР. (51) М.КлЗ. С12 N/P 15(00. Штамм Panus tigrinus (Fr.) Sing. ИБК-131 —
продуцент биомассы // А.С.Бухало, В.Т.Бабицкая, Э.Ф.Соломко, А.Н.Капич, И.А.Дудка,
И.В.Стахеев. - Опубл. 23.11.81, Бюл. № 43.
Adams Todd N.K. Antagonism between dikarvons of Piptoporus betulinus // Trans.
Brit. Mycol. Soc. - 1981. - 76, N 3. - P. 510-513.
Altamura M.R.. Robbins F.M., Andreotti R.E. et al. Mushroom nonhydrin-positive compounds.
Amino acids, related compounds, and other nitrogen substances found in cultivated mushroom Agari-
cus campestris // J. Agr. and Food. Chem. - 1967. - 15, N 5. - P. 1040—1043.
Arita I. Cytological studies on Pholiota // Repts Tottori Mycol. Inst - 1979a. - 17, N 139. -
P. 1-118.
Arita I. The mechanism of spontaneous dedikaryotization in hyphae of Pholiota nameko // Myco-
logia. - 1979b. - 71, N 3. - P. 603-611.
Arx J.A. The genera of fungi sporulating in pure culture. - Lehre : Cramer, 1970. - 288 p.
Aschan K. The production of fruit bodies in Collvbia velutipes. I. Influence of different cultu-
re conditions // Physiol, plant. - 1954a. - 7, N 3. - P. 571-591.
Aschan K. Some factors concerning the incompatibility groups, the dicaryotization and the
fruit body production in Collybia velutipes // Sven. bot. tidskr. — 1954b. — 48. — P. 603—625.
Aschan K. Studies on dedicaryotization mycelia and of F, variation in Collybia velutipes //
Ibid. - 1960. - 54. - P. 311-328.
Atacador-Ramos M., Palo M.A., Villadolid D. V., Cruz D.S. A study on submerged culture pro-
duction of banana mushroon (Volvariella volvacaea). Mycelium as a source of protein, B-vitamins
and food flavour // Philipp. J. Sci. — 1967. - 96, N 1. — P. 191—216.
BaboS K., Verter J. Vizsgilatok fahulladek intenziven novo xilofag gombafajokkal // Mikolog.
kozlerminyek. - 1983. - N 3. - Old. 99-111.
Badham E.R. The effect of light upon basiciocarp initiation in Psilocybe cubensis // Mycologia. -
1980. - 72, N 1. - P. 136-142.
Banerjee PC. Ghosh A.K., Sengupta S. Hemagglutinating activity in extracts of mycelia from
submerged mushroom cultures // Appl. and Environ. Microbiol. - 1982. - 44, N 4. - P. 1009-1011.
Bano Z., Srinivasan R.S. Amino acid composition of the protein from a mushroom (Pleurotus
sp.) // Appl. Microbiol. - 1963. - 11, N 3. - P. 184-187.
Barnett H.L. Mycoparasitism // Mycologia. — 1964. - 56, N 1. - P. 1-19.
Benedict R.G.. Bradv L.R. Antimicrobial activity of mushroom metabolites // J. pharm. Sci. -
1972. - 61. - P. 1820-1822.
Beneke E.S. Calvatia, calvacin and cancer // Mycologia. — 1963. — 55, N 3. — P. 257—270.
Berry D.R. The environmental control of the physiology of filamentous fungi // The Filamen-
tous Fungi. — London : Edward, 1975. — P. 16—32.
Bhavani D. A simple technique for in vitro production of basidiocarp from Volvariella volvaceae
(Buller ex Fr.) Sing. // Indian J. Microbiol. - 1980. - 20, N 3. - P. 341.
Bigelow H.E. On basidiocarp production bv cultured Ciitocybe // Mycologia. — 1970. - 62,
N l.-P. 203-205.
Bilai V.I., Pidoplichko N.M.. Buchalo A.S. et al. Utilization of hydrocarbons by micromycetes
in dependence on their systematic position // Acta mycol. — 1968. - 4, N 2. - P. 393-395.
ВШе-Hensen E. Fructification of coprophilous Coprinus on synthetic medium // Physiol, plant. -
1953. - 6, N 3. - P. 523-528.
Bille-Hansen E. Rizomorph formation in culture by Ciitocybe geotropa // Bot. tidsskr. — 1973. —
67, N 4. -P. 329-332.
Block S.S. Developments in the production of mushroom mycelium in submerged culture //
J. Biochem. Microbiol. Technol. - 1960. — 2, N 3. - P. 243-252.
Block S.S., Steams T.W., Stephens R.L., McCandless R.F.J. Mushroom mycelium. Experiments
with submerged culture // J, Agr. and Food Chem. - 1953. - 1, N 14. — P. 890—893.
Block S„ Tsao G., Han E. Experiments in the cultivation of Pleurotus ostreatus // Mushroom
Sci. - 1959. - 4. - P. 309-325.
Bohus G., Glaz E„ Scheiber E. The antibiotic action of higher fungi on resistant bacteria and
fungi II Acta biol. Acad. sci. hung. - 1961. - 12, N 1. - P. 1-12.
Boidin J. Nuclear behaviour in the mycelium and the evolution of Basidiomycetes // Evolution
in the Higher Basidiomycetes : An Intern, symp. / Ed. R.Peterson. - Knoxville, 1971. - P. 129-148.
Bose S.R. Antibiotics from higher fungi // Arch, Microbiol. - 1953. - 18, N 4. - P. 349-355.
Brain C, Guinberteau J., Pirobe L. Obtention de fructification du pied bleu, Rodopaxillus
nudus (Fr. ex Bui.) en conditions artificieiles // C.r. Acad. agr. France. - 1979. - 65. N16. -
P. 1365—1369.
Brefeld O. Botanische Untersuchungen uber Schimmelpilze. H. 3. Basidiomvceten I. - Leipzig :
Felix, 1877. - 239 S.
Brefeld O. Untersuchungen aus dem Gesammtebiete der Mycologie. H. 8. Basidiomyceten 3.
Autobaridiomyceten. - Leipzig : Felix, 1889. - 317 S.
Bresinsky A., Hilber O., Molitoris H.P. The genus Pleurotus as an aid for understanding the con-
cept of species in Basidiomycetes 11 The species concept in Hymenomycetes / Ed. by H.Clmencon. -
Vaduz : Cramer, 1976. - P. 229-258.
Brodie H.J. The occurrence and function of oidia in the Hymenomycetes Ц Amer. J. Bot. -
1936. - 23, N 5. - P. 309-327.
____ Brodie H.J. Oidial mycelia and the diploidization process in Coprinus lagopus // Ann. Bot. (Gr.
L32 Jtait.). - J.972. - 46, N 5. - P, 727-732.
Buchalo A.S. Cultural studies on edible palisade fungi of the Ukraine // Mushroom Sei. — 1974,—
9, pt. l.-P. 707-713.
Buchalo A.S. Aktualni problemy submersniho pestovani mycelia yedlych hub // Konference
prumyslove pestovani jedlych hub. (Praha, 24-25 kvet. 1977). — Praha, 1977. — P. 108-112.
Buchalo A.S. Principles of selecting edible Basidiomycetes for submerged cultivation // The
3-rd Intern, mycol. congr. (Tokyo, 28th Aug. — 3rd Sept., 1983). — Tokyo, 1983. — P. 398.
Buchalo A.S., Solomko E.F. Submerged culture growth of Pleurotus ostreatus (Fr.) Kumm, on
complex media // Mushroom Sci. — 1979. — 10, pt 1. — P. 833—841.
Buchalo A.S., Solomko E.F., Dudka I.A. Growth of Fiammulina velutipes (Fr.) Sing, on liquid
media // 3-rd Intern, symp. physiol., ecol. and cultivat. of edible .ungi, (Prague, oct. 2-5, 1979). -
Prague, 1979. - P. 60—62.
Buchalo A.S., Solomko E.F. The edible basidiomycetes as an object for submerged fermentati
on // Vl Intern, ferment, symp. (London, Canada, July 20—25,1980). — Summ. — London, 1980. —
P. 142. ,
Buchalo A.S., Zakordonec O.A., Sasek V. Scanning electron microscopic study of clamp conne-
ctions on higher Basidiomycetes // Folia microbiol. — 1983. - 28, N 5. — P. 420—423. z
Buchalo A.S., Solomko E.F. A Pleurotus (Fr.) Kumm. faj. tenyesztese meritett kulturaban //
Poszter bsszefoglalok, - Budapest, 1984. - Old. 31-33.
Buchalo A.S., Sasek V., Zakordonec O.A. Scanning electron microscopic study of anamorphs
of some Basidiomycetes in culture // Folia microbiol. — 1985. - 30, N 6. — P. 506—508.
Bull A.T., Bushell M.E. Environmental control of fungal growth Ц The Filamentous fungi.
Vol. 2. Biosynthesis and metabolism / Eds. J.S.Smith, D.K.Berry.- London : Edward, 1976. -
P. 1-31.
Bulmer G.S. The in vitro production of abortive fructifications of Lycoperdon pusilium Pers. //
Proc. Oklahoma Acad. Sci. - 1964. - 44. - P. 192-195.
Bulmer G.S., Beneke E.S. Studies on Calvatia gigantea. 2. Factors affecting basidiospore germi-
nation // Mycologia. - 1962. - 54, N 1. — P. 34—43.
Burkholder P.R., Sinnott B. W. Morphogenesis of fungus colonies in submerged shaken cultures //
Amer. J. Bot. - 1945. - 32, N 7. - P. 424-431.
Burnett J.H. Fundamentals of mycology. — London : Edward, 1976. — 673 p.
Bynum H.H. Effect of incense-cedar heartwood extract on growth of Poiyporus amarus // Myco-
logia. - 1965. - 57, N 4. - P. 642-648.
Campbell L.L., Pace ^.Physiology of growth at high temperature // J. Appl. Bacteriol. - 1968. -
41, N l.-P. 24-35.
Chang S.T. Nuclear behavior utilizing light microscopy // The biology and cultivation of edible
mushrooms. - New York etc.: Acad, press, 1978. - P. 35-51.
Chang S.T., Hayes W.A. The biology and cultivation of edible mushrooms. - New York etc. :
Acad, press, 1978. - 819 p.
Chaumont J.P., Simeray J. Les proprietes antifongiques de 225 basidiomycetes et ascomycetes
vis-a-vis de 7 champignons pathogenes cultives in vitro // Cryptogam. Mvcol. — 1982. - 3. N 3. -
P. 249-259.
Chen Yue-mae, Chen Jaun-pae, Chiao Yni-shen. Studies on submerged cultivation of mushroom
cultures. I. Submerged cultivation of mushroom mycelia // Acta biol. exp. sin. — 1963a. - 8, N 3/4. -
P. 548-557.
Chen Yue-mae, Chen Yaun-pae, Chiao Yni-shen. Studies on submerged cultivation of mushroom
cultures. 2. Submerged cultivation of globular mycelial bodies // Ibid. — 1963b. — 8, N 314. -
P. 558-565.
Chesters O.G.C. Morphology as a taxonomic criterion. — The Fungi. Vol. 3. Fungal population /
Eds G.S.Ainsworth, A.S.Sussman. - New York ; London : Acad, press, 1968. - P. 517-542.
Chiu Y.S., Zajic J.E. Gompertz’s low on the growth of mycelial pellets // Biotechnol. and Bio-
eng. - 1970. - 18, N 8. - P. 1167-1170.
Cochran K. W. Medical effects // The biology and cultivation of edible mushroms // Eds S.T.Chang,
W.A.Hayes. - New York etc.: Acad, press, 1978. — P. 169—187.
Cole G.T., Sampson R.A. Patterns of development in conidial fungi. — London etc. : Pitman,
1979. - 190 p.
Crisan E. V. Current concept of thermophilic fungi // Mycologia. — 1973. - 55, N 5. - P. 1171-
1198.
Crisan E. V., Sands A. Nutritional value // The biology and cultivation of edible mushrooms. -
New York etc. : Acad, press, 1978. — P. 137—168.
Das Gupta A., Nadi O. Utilisation of carbon sources by some higher fungi // Trans. Bose Res.
Inst. - 1959/1960. - 23. - P. 47-49.
Delmas J. The potential cultivation of various edible fungi // The biology and cultivation of
edible mushrooms I Eds S.T.Chang, W.A.Hayes. — New York etc.: Acad, press, 1978. — P. 699—724.
Delmas J., Mamoun M. Influence de la lumiere sur la fructification in vitro du pleurote en come
d’abondance, Pleurotus cornucopia Fr. ex Fr. // Agronomie. - 1982. - 2, N 4. - P. 379-387.
Demoulin V. Proposition d’un processus de detection des phenoloxydases et peroxydases chez
les macromycetes application a quelques Gasteromycetes // Planta. - 1967. - 76, N 2. - P.129-137.
Dijkstra F. Y. Submerged cultures of mushroom mycelium as sources of protein and flavour
compounds : Ph.D.Thesis, Delft Univ. Technol. - Delft, 1976. - 106 p.
Donk M. A conspectus of the families of Aphyllophorales // Persoonia. — 1964. — 3, N 2 -
P. 199-324.
, Donk M. Progress in study of classification of the higher Basidiomycetes // Intern, symp. evolu-
tion in the higher Basidiomycetes. - Tennesse, 1968. - P. 393-422.
Dorrell W., Page R.M. The use of fragmented mycelial inoculum in the culture of fungi // J. Bac-
teriol. - 1947. - 53, N 3.-P. 360-361.
Duggar B.M. Physiological studies with reference to the germination of certain fungous spores II
Bot. Gaz. - 1901. - 31. - P. 38-66.
Duggar B.M. The principle of mushroom growing and mushroom spawnmaking // U-S.Dept.
Agile. Bur. Plant Ind. Bub. - 1905. - 85. - P. 1—60.
Durand R. Photomorphogen&e d’un basidiomycete, Coprinus congregatus Bull, ex Fr. : influen-
ces de variations quantitatives et qualitatives de la lumUre sur les phases successive du difveloppement 133
des carpophores : Analyse du phenomdne de photoreception : Thfese doct. sci. biol. Univ. Ckyide-
bemard. - Lyon, 1975. - 116 p.
Durand R. Light breaks and fruit-body maturation in Coprinus congregatus : dark inhibitory and
dark recovery process // Plant and Cell Physiol. — 1983. — 24, N 5. — P. 899—905.
Durand R., Robert J. Interactions entre les facteurs lumiere et y’lperature dans le controle de la
morphoeenese des carpophores du Champignon basidiomycete Coprinus congregatus // Physiol,
veget.- 1980. - 18, N 1. - P. 131-145.
Eddy B. Production of mushroom mycelium by submerged culture // J. Sci. Food and Agr. -
1958. - 9, N 10. - P. 644-649.
Eger G. Blue-light photomorohpgenesis in mushroomsfBasidiomycetes) //Blue-light syndrome. —
Berlin etc.. 1980. - S. 555-562. , . . .
Eger G., Gottwald H.D., Netzer I. The action of light and other factors on sporophore initiation
in Pleurotus ostreatus // Muschroom Sd. — 1974. — 9. — P. 575—583.
Eger G„ Li S.. Leal-Lara H. Contribution to the discussion on the spedes concept in the Pleuro-
tus ostreatus complex // Mycologia. — 1979. — 61, N 3. — P. 577—588.
Eggins H.O.W., Allsopp D. Biodeterioration and biodegradation by fungi // The Filamentous
fungi. Vol. 1. Industrial mycology. - London : Edward, 1975. - P. 301-319.
Eilers F.I. Growth regulation in Coprinus radiatus // Arch. Microbiol. — 1973. — 96, N 4. —
P. 353-364.
Espenshade МЛ. Mushrooms and toadstools. Their growth in liquid media using deep culture
techniques // Mushroom Sd. — 1962. - 5. - P. 213-217.
Esser K. Genetic control of fruit body formation in hi^ier Basidiomycetes // Symp. summar.
commun. 10th Intern, congr. sd. and cultivat. edible fungi. Aquitaine etc., June 5—15, 1978. —
Bordeaux. 1978. - P. 1-2.
Esser K., Stahl U. Monokaryotic fruiting in the basidiomycete Polyporus dliatus and its suppres-
sion by incompatibility factors // Nature. - 1973. - 244, N 5414. - P. 304-305.
Esser K., Hoffmann P. Genetic basic for spedation in higher Basidiomycetes with special refe-
rence to the genus Polyporus // The spedes concept in Hymenomycetes. Proc. Herbette sympos.
held Univ. Lausanne, Switzerland, Aug. 16—20,1976 I Ed. H.Clemencon. — Vaduz : Cramer, 1977. —
P. 189-214.
Eybergen G.C., Scheffers W.A. Growth of the mycelium of Boletus edulis on agar media and in
submerged liquid cultures // Antonie van Leeuwenhoek. J. Microbiol, and Serol. — 1972. — 38,
N3.-P. 445-450.
Falanghe H. Production of mushroom mycelium as a protein and fat source in submerged cul-
ture in medium of vinnase // Appl. Microbiol. — 1962. — 10, N 2. - P. 572—576.
Falanghe H., Smith A.K., Rackis J.J. Production of fungal mycelial protein in submerged cultu-
re of soybean whev I! Ibid. - 1964. - 12. N 4. — P. 330-334.
Falck R. Die Kultur der Oidien und ihre Ruckfuhrung in die hohere Fruchtform bei den Basidio-
myzeten // Cohn’s Beitr. Biol. Pflanzen. - 1902. - 8. - S. 307-346.
FAO. Protein advisory group ; PAG statement on aminoadd fortification of foods / FAO (WHO)
UNICEF protein advisory group. - New York ; U.N.. 1970.
FAO. Food composition table for use in East Asia: Food policy and nutr. div / Food Agric.
Org. U.N. - Rome, 1972.
Faro S. Physiological aspects of pigment production in relation to morphogenesis in Panus tigri-
nus I/ Mycologia. - 1972. - 64, N 2. - P. 375-387.
Flegler S.L. An improved method for production of Cyathus stercoreus fruit bodies in culture //
Ibid. - 1979a. - 71, N 3. - P. 625 -627.
Flegler S.L. An improved method for production of fruit bodies of Nidularia pulvinata in cultu-
re I/ Ibid. - 1979b. - 7i, N 4. - P. 875-876.
Flegler S.L. A method for production of Mutinus caninus fruit bodies in culture // Ibid. -
1979. - 71, N 5. - P. 1076-1078.
Flegler S.L.. Hooper G.R. Ultrastructure of Cyathus stercoreus // Ibid. - 1978. - 60, N 6. -
P. 1181-1190.
Freer S.N., Detroy R. W. Biological delignification ofl* C-labeled lignocelluloses by basidiomyce-
tes : degradation and solubilization of the lignin and cellulose components // Ibid. — 1982. - 74,
N6.-P. 943-951.
Freytag W., Ney K.H. Beitrag zum Vorkommen von l-octen-3-ol // Eur. J. Biochem. - 1968. -
2, N4. — P. 315-318.
Fries L. Studies in the physiology of Coprinus. I. Growth substance, nitrogen and carbon requi-
rements /I Sven. bot. tidsskr. - 1955. - 49, N 4. — P. 475-535.
Fries N. Untersuchungen uber Sporenkeimung und Mycelentwicklung bodenbewohnender
Humenomyceten // Symb. bot. upsal. - 1943. - 6, N 4. - S. 1-81.
Fries N. Culture studies in the genus Mycena // Sven. bot. trasskr. - 1949. - 43, N 3. -
P. 316-342.
Fries N. Growth factor requirements of some higher fungi // Ibid. — 1950. — 44, N 3.—
P. 379—386.
Fries N. Factors promoting Coprinus fimetarius under high temperature cinditions // Physiol,
plant. - 1953. - 6, N 4. - P. 551-563.
Fries N. Germination of Laccaria laccata spores in vitro // Mycologia. - 1977. — 69, N 4. —
P. 848-850.
Fries N. Basidiospore germination in some mycorrhiza-forming Hymenomycetes // Trans. Brit.
МусЫ. Soc. - 1978. - 70, N 3. - P. 319-324.
Fries N. Germination of spores of Canthardlus cibarius // Mycologia. - 1979a. — 71, N 1. -
P. 216-219.
Fries N. The taxon-specific spore germination reaction in Leccinum // Trans. Brit. Mycol. Soc. —
1979b. - 73, N 2. - P. 337-341.
Fries N. Recognition reaction between basidiospore and hyphae in Leccinum // Ibid. - 1981. -
77, N 1. - P. 9-14.
Fries N. Spore germination, homing reaction and intersterility .groups in Laccaria laccata (Agari-
134; cales) // Mycologia. - 1983a. - 75, N 2. - P. 221-227.
Fries N. Basidiospore germination in species of Boletaceae // Mycotaxon. - 1983b. — 18, N 2. -
P. 345-354.
Fries N. Intra- and interspecific basidiospore homing reactions in Leccinum // Trans. Brit. Mycol.
Soc. - 1983c. - 81, N 3. - P. 559-561.
Fuchs J. Uber die Beziehungen von Agaricineen und underen humusbewohnenden Pilzen zur
Mycorrhizenbildung der Waldbaume'/ Biblioth. Bot., Stuttgart. — 1911. — 6. — 32 S.
Gabriel M. Recherches sur la physiologie du mycelium des Basidiomycetes an aerobiose et ana-
erobiose : Second thesis Univ, de Lyon. - Lyon, 1967. - 110 p.
GotlandM.C,. Kemp R.F.O., Jurand M.K. The species problem in the Psathyrella candolieana
complex // Mycotaxon. — 1979. — 8, N 2. — P. 329—332.
Galleymore B. The development of fructifications of Lentinus tuberregium Fries in culture //
Trans. Brit. Mycol. Soc. — 1949. — 32, N 3/4. — P. 315—317.
Garrett S.D. Rizomorph behavior in Armillaria mellea (Fr.) Quel. 1. Factors controlling riiizo-
morph initiation by A. mellea in pure culture // Ann. Bot.'(Gr. Brit.). - 1953. - 17, N 65. -
P. 63-80.
Ghosh A.R., Sengupta S. Studies on biochemistry of higher fungi. 1. Submerged growth of
Volvariella volvaceae in synthetic medium // J. Food Sci. and Technol. — 1977. - 14, N 1. - P.6—10.
Gilbert F.A. The submerged culture of Morchella // Mycologia. — 1960. — 52, N 2. - P.201—209.
Gilbert F.A., Robinson R.F. Food from fungi // Econ. Bot. — 1957. — 11, N 2. — P. 126-145.
Giltrap N.J. Formation of primordia and immature fruiting bodies by Ectomycorrhizal fungi m
culture // Trans. Brit. Mycol. Soc. - 1981. - 77, N 1. — P. 204—205.
Ginterova A. Dedikaryotization of higher fungi in submerged culture // Folia microbiol. -
1973a. - 18, N 4. - P. 277-280. r
Ginterova A. Nitrogen fixation by higher fungi // Biologia (CSSR). - 1973b. - 28, N 3. -
P. 199-202.
Ginterova A., Maxianova A. The balance of nitrogen and composition of proteins in Pleurotes
ostreatus on natiral substrates // Folia microbiol. - 1975. — 20, N 3. — P. 246-250.
Ginterova A., Janotkova O., Zemek J. et al. Cellulase activity of higher fungi // Ibid. - 1980. -
25, N 4. - P. 318-323.
Ginterova A., Janotkova O., Findova E. Effect of cultivation conditions on cellulase activity
of higher fungi // Ibid. — 1981. — 26, N 2. — P. 133—136.
Giovanozzi-Sermanni G., Lunna M. Laccase activity of Agaricus bisporus and Pleurotus ostrea-
tus//Mushroom Sci. — 1981. — 11, Pt. 2. —P. 485—496.
Gottlieb D. The physioligy of spore germination in fungi // Bot. Rev. — 1950. — 16. N 5. -
P. 229-257.
Gramms G. Kuehneromyces mutabiiis // The biology and cultivation of edible mushrooms //
Eds S.T.Chang, W.A.Mayes. - New York : Acad, press, 1978. - P. 423—444.
Grappelli A., Cacciaril., Lippi D., Pietrosanti W. Influence of bacterial metabolites on the growth
of Agaricus bisporus in submerged cultures // Mushroom Sci. — 1978. — 10, pt. 1. — P. 335-345.
Gray D.J., Morgan-Jones G. Notes on hyphomycetes. 34. Some mycoparasitic species // Myco-
taxon. - 1980. - 10, N 2. - P. 375-404.
Gray W.D., Bushnell W.R. Biosynthetic potentialities of higher fungi // Mycologia. - 1955. -
47, N 5.-P. 646-663.
Gregory FJ., Healy E.M., Agersborg Jr., Warren G.H. Studies on antitumor substances produ-
ced by Basidiomycetes // Ibid. — 1966. — 58, N 1. — P. 80-90.
Gregory P.H The first benefector’s lecture on the fungal mycelium : an historical perspective //
Trans. Brit. Mycol. Soc. - 1984. - 82, N 1. - P. 1-11.
Griffith N.T., Barnett H.L. Mycoparasitism by Basidiomycetes in culture // Mycologia. - 1967. -
59, N 1. -P. 149-154.
Guha A.K., Banerjee A.B. Some physical and chemical changes during submerged fermentation
of Agaricus campestris //Acta microbiol. pol. B. - 1974. - 6, N 2. - P. 63—65.
Guillaumin J., Berthelay S. Determination spdcifique des armillaires par la methode des groupes
de compatibility sexuelle. Specialisation ecologique des espaces francaises // Agronomie. — 1981. -
l,N10. — P. 897-908.
Guillaumin J., Berthelay S., Savin V. Etude de la potarite sexuelle des armillaires du groiipe
Mdlea//Cryptogam. Mycol. - 1983. - 4, N 3. - P. 301-319.
Gupta S., Pathak N.C. Physico-chemical factors affecting mycelial growth of the mushroom
Pleurotus cystidiosus // KalikaSan. Philipp. J. Biol. - 1982. - 11, N 2/3. — P. 400—404.
Hale M.D.C., Savory J.G. Selective agarmedia for the isolation of basidiomycetes from wood -
a review//Int. Biodeterior. Bull. - 1976. — 12, N 4. — P. 112—115.
Hamada M. Physiologish-morphologische Studien uber Armillaria mellea (Vahl.) Qu&. mit be-
sonderer Rucksicht auf die Oxalsaurebilding // Jap. J. Bot. Trans, and Abstr. — 1940. — 10, N 4. -
S. 364-387.
Hamid A., Shah F.H., Qadeer M.A. Production of mushroom mycelium from industrial wasten //
Pakistan J. Biochem. - 1972. - N 5. - P. 57—60.
Harley J.L., Smith S.E. Mycorrhizal symbiosis. — London ect.: Acad, press, 1983. — 483 p.
Hashimoto K., Takahashi Z. Studies on the growth of Pleurotus ostreatus // Mushroom Sci. -
1974. - 9. - P. 585-593.
Hashioka Y. Scanning and transmission electron-micrographs of shiitake, Lentinus edodes (Berk.)
Sing. I/ Rept. Tottori Mycol. Inst. (Jap.). — 1971. — N 9. — P. 1-10.
Hattula M.L., GyUenberg H.G. Adaptability to submerged culture and amino acid contents of
dertain fleshy fungi common in Finland // Karstenia. — 1969a. — 12, N 9. — P. 39—45.
Hattula M.L., Gyllenberg H.G. Protein and fat composition and vitamin content of Boletus
(Suillus) luteus mycelium produced in submerged culture // Ibid. — 1969b. — P. 46—50.
Hawksworth D.L., Sutton B.C., Ainsworth G.C. Ainsworth et Bisby’s dictionary of file fungi
(including lichens). - 7-th ed. - Kew ; Surrey : Commonwealth Mycol. Inst, 1983. — 445 p.
Hayes W.A., Wright'S. Edible mushrooms // Microbiol, biomass. - London etc., 1979. —
P. 141-176.
Highley T.L. Measurement of cellulose activity in brown and whiterot fungi on dyed cellulose //
Mater, und Organism. — 1983. — 18, N 3. — P. 167—170. 135
Hilber О. Einige Aspekte aus aer. Pleurotus ostreatus Gruppe // Ces. mykol. — 1977. —131,
N 3. — P. 142—154.
Hilber O. Biosystematische Untersuchungen zur Kenntnis von Pleurotus sect. Pleurotus //1. My-
coL - 1978.-44, N 1. - S. 31-50.
Hilber O. Die Gattung Pleurotus (Fr.) Kummer. // Bibl. mycol. - 1982. — 87. - 464 S.
Hiromoto K. Culture of mycelia from tire fruit body of Hymenomycetes by the hymenium-
isolation-method // Bot. Mag. Tokyo. — 1961. — 74, N 873. - P. 154—159.
Hofsten B.V., Ryden A.L. Submerged cultivation of a termotolerant Basidiomycete on cereal
flours and other substrates // Biotechnol. and Bioeng. — 1975. — 17, N 8. - P. 1183—1197.
Horriere F. Etude comparative des exigences trophiques de quelques basidiomycetes superieurs
fructifiant sur milieux synthetiques. Analyse bibliographique // Mushroom Sci. - 1979. - 10, pt. 1. —
P. 665-683.
How J.E. The mycorrhizal relations of Larch I. Study of Boletus elegans Schum. in pure cultu-
re II Ann. Bot. (Gr. Brit.). - 1940. - 4, N 13. - P. 135-150.
Hubsch P. Zur Eignung verschidener Kohlenhydrate fur die Emahrung von Boletazun in Reinkul-
tur II Z. allg. Microbiol. - 1965. - 5, N 2. - P. 112-121.
Hughes SJ. Conidiophores, conidia and classification Ц Can. J.Bot. — 1953. -31.-P.577—659.
Hughes S.J. Phycomycetes, Basidiomycetes and Asoomycetes as Fungi imperfecti // Taxonomy
of Fungi imperfecti / Ed. B.Kendrick. — Toronto : Iniv. Toronto press, 1971. — P. 7-36.
' Humfeld H. The production of mushroom mycelium (Agaricus campestris) in submerged cultu-
re // Science. - 1948. - 107, N 2780. - P. 373-378.
Humfeld H. Production of mushroom mycelium // Year Book U.S. Dep. Agr. — New York,
1950-1951. - 242 p.
Humfeld H., Sugihara T.F. Mushroom mycelium production by submerged propagation // Food
Technol. - 1949. - 3, N 10. - P. 335-356.
Humfeld H., Sugihara T.F. The nutritient requirements of Agaricus campestris grown in submer-
ged culture // Mycologia. — 1952. - 66, N 5. - P. 605—620.
Ikekawa T., Uehara N., Makamishi M., Fukuoka F. Antitumor activity of aqueous extracts of
some edible mushrooms I/ Cancer Res. — 1969. — 29, N 8. — P. 734—735.
Ingold C.T. Mycelium, oidia and sporophore initials in Fiammulina velutipes // Trans. Brit.
Mycol. Soc. - 1980. - 75, N 1. - P. 107-116.
Ingold C.T. The validity of the concept of conidia as either blastic or thallic // Ibid. — 1981. -
77, N 1. - P. 194-196.
Jablonsky I. Ein&uss der Belichtungsintensitat und anderer Faktoren des Milieus auf die Ent-
wicklung der Fruchtkorper des Austemseitling-Pleurotus ostreatus (Jacq. ex Fr.) Kumm. // Ces.
mykol. - 1975. - 29, N 3. - S. 140-152.
Jahrmann H.J., Prillinger H. Das Vorkotnmen eines ”Hefe” - Stadium bei dem Homobasidio-
myceten Asterophora (Nyctalis) lycoperdoides (Bull.) Ditrn. ex S.F.Gray und seine Bedeutung fur
die Phylogenese der Basidiomyceten // Z. Mycol. - 1983. - 49, N 2. - P. 195—235.
Janardhanan K.K., Kaul T.N., Husan A. Use of vegetable wastes for the production of fungal
protein from Morchella species // J. Food Sci. and Technol. — 1970. - 35, N 7. — P. 197—199.
Jasimoto K.. Iwani K., Mitsuda H. Enzymatic formation of aroma from non-volatile precursor
(s) lenthionine from lentinic acid /I IX-th Inten. sci. congr. Cultiv. Edible Fungi, Nov. 4—13, 1974,
Tokyo. - Tokyo, 1974. - P. 24.
Jennison M.W. The growth of wood-rotting fungi in aerated liquid culture // Proc. Soc. Amer.
Bacteriol. - 1948. - N 1. - P. 48-51.
Jennison M.W. Cultivation of mushroom mycelium in submerged culture // Mushroom Sci. -
1956. - 3. - P. 268-269.
Jennison M.W., Newcomb M.D., Henderson R. Physiology of the woodrotting Basidiomycetes.
I. Growth and nutrition in submerged culture in synthetic media// Mycologia. — 1955. — 47, N 3. -
P. 275—304.
Johnston J.R. Strain improvement and strain stability in filamentous fungi // The Filamentous
fungi. Vol. 1. Industrial Mycology / Eds J.E.Smith. D.D.Berry. - London : Edwards, 1975. -
P. 59-78.
Johri B.N., Brodie H. Y. Nutritional study of Cyathus helenae and related species // Mycologia. -
1972. - 64, N 2. - P. 298-303.
Kahlon S.S., Parveen N. Protein enrichment of wheat straw with non-toxic fungus Pleurotus
ostreatus // Res. Punjab Ap. Univ. - 1983. - 20, N 3. - P. 327-331.
Kalberer P., Kunsch U. Amino acid composition of the oyster mushroom (Pleurotus ostreatus) //
J.Food Sci. and Technol. - 1974. - 39, N 7. - P. 242-244.
Kamada T., Kurita R., Takemaru T. Effects of light on basidiocarp naturation in Coprinus mac-
rorinzus // Plant and CeH Physiol. - 1978. - 19, N 2. - P. 263-275.
Kamada T., Tsuji M. Darkness — induced factor affecting basidiocarp maturation in Coprinus mac-
rorhizus //Ibid. - 1979. - 20, N 7. - P. 1445-1448.
Karpinski J. Results of the first stage of studies on the cultivation of fruiting bodies of Boletus
edulis Bull, on an artificial medium in laboratory conditions // Sylwan. — 1961. — 105, N 4. -
P. 55-59.
Katz D., Goldstein D., Rosenberger R.F. Model for branch initiation in Aspergillus nidulans based
on measurements of growth parameters // J. Bacteriol. - 1972. - 109, N 3. - P. 1097-1100.
Kemp R.F.O. Oidial homing and the taxonomy and speciation in Basidiomycetes with special
reference to the genus Coprinus I [The species concept in Hymenomycetes : Proc. Herbette symp. held
Univ. Lausanne, Switzerland, Aug. 16-20,1976. - Berlin : Cramer, 1977. - P. 259-276.
Kemp R.F.O. Production of oidia by dikaryons of Fiammulina velutipes // Trans. Brit. Mycol.
Soc. - 1980. - 74, N 3. - P. 557-560.
Kendrick B., Watling R. Mitospores in Basidiomycetes // The Whole Fungus : Kananaslris 2. /
Ed. B.Kendrick. - Ottawa, 1979. - P. 473-545.
Kinugawa K. Collybia velutipes can fruit under total darkness // Trans. Mycol. Soc. Jap. -
1977. - 18. - P. 353-356. F
, __ , Kinugawa K., Turukawa H. The fruit-body formation in Collybia velutipes induced by the lower
loo (temperature treatment of short duration // Bot Mag. Tokyo. - 1965. - 78. N925. - P. 240-244.
Kitamoto У., Horikoshi T.. Suzuki A. An action spectrum for photoindication of pileus formati-
on m a basidiomycete, Favolus arcularius // Planta. — 1974. - 119, N 1. - P. 81—84.
Kligman A.M. Secondary spores in the mycelium of the cultivated mushroom, Psalliota campest-
ris Fr. //Amer. J. Bot. - 1952. - 29, N 4. - P. 304-308.
Koltin Y. A higher fungus as a model for studies on the genetic control of morphogenesis 11 Rept.
Tottori Mycol. Inst. Jap. - 1975. — N 12. — P. 85-91.
Komatsu N., Terekawa H., Nakanishi K., Watanabe Y. Flammulin, a basic protein of Flammulina
velutipes with antitumor activities // J. Antibiot. A. - 1963. - 16, N 3. — P. 139-143.
Korf R.P. Japanese Discomycete notes // Sci. Repts Yokohama, Nat. Univ. Sec. 2. - 1958. -
11.N3.-P. 7-35. „ .
Kozova J., Rehacek Z. Antibiotics of Flammulina velutipes cultivated in submerged culture //
Folia microbiol. — 1967. — 12, N 6. — P. 567-568.
Kreizel H. Grundzuge eines naturlichen Systems der Pilze. - Jena : Fischer, 1969. - 245 S.
Kreula M., Saarivirta M., Karanka S. Contents of nutrients and dietary fibre in wild and cultiva-
ted mushrooms // Karstenia. — 1978. — 18, N 2. — P. 43—45.
Kurkela R., Matikainen E. Flavour intensity of some edible fungi // Ibid. - P. 35-39.
Kurtzman R.H. Mushrooms as a source of food protein // Protein nutritional quality of foods
and feeds I Ed. M.Friedman. - New York : Dekker, 1975. — Pt. 2. — P. 305—318.
Kurtzman R.H. Nutrition of Pleurotus sapidus : effect of lipids // Mycologia. - 1976. - 68,
N2. -P. 286-295.
Kurtzman R.H. Production of mushroom fruiting bodies on the surface of submerged cultures //
Ibid. - 1978. - 70, N 1. - P. 179-184.
Kiihner R. Variation of nuclear behavior in the Homobasidiomycetes // Trans. Brit. Mycol. Soc.-
1977. - 68, N 1. - P. 1-16.
Kiihner R. Les Hymenomycetes agaricoides (Agaricales, Tricholomatales, Pluteales, Russulales) :
Etude generale et classification // Numer. spec. Bull. mens. Soc. linn. — 1980. — 49. — P. 1025.
Lasota W., Mlodecki H., Wlodarczyk L. Zawartosc lizyny ’’Dostepnej” w niektdrych grzybach //
Rocz. Panst. zakf. hig. - 1968. - 19. - S. 456—462.
Leatham G.F. A chemically defined medium for the fruiting of Lentinus edodes // Mycologia. -
1983. - 75, N 5. - P. 905-908.
LeDuy A., Kosaric M., Zajic J.F. Morel mushroom mycelium growth in waste sulfite liquors as
source of protein and flavouring // Can. Inst. Food Sci. Tectmol. J. — 1974. — N 7. - P. 44-50.
Lentz P. Analysis of modifies hyphae as a tool in taxonomic research in the higher Basidiomy-
cetes // Evolution in the higher Basidiomycetes : An Int. Symp. / Ed. R.Petersen. — Knoxville :
univ.Tenn. press, 1971. — P. 99—122.
Litchfield J.H. Submerged culture of mushroom mycelium // Microbial technology / Ed. H.Pep-
pler. - New York etc.: Reinhold, 1967. - P. 107-144.
Litchfield J.H., Overbeck R.C., Davidson R.S. Factors affecting the growth of Morchella mush-
room mycelium in submerged culture // J.Agr. and Food Chem. — 1963. — 11, N 2. - P. 152-162.
Litchfield J.H., Vely V.G., Overbeck R.C. Nutrient content of morel mushroom mycelium. Ami-
no acid composition of the protein // J. Food. Sci. and Technol. — 1963. - 28, N 6. - P.741-743.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with the folin phe-
nol reagent // J. BioL Chem. - 1951. — 193, N 1. — P. 265—275.
Lu B.C.The role of light in fructification of basidiomyceteCvathus stercoreus // Amer. J. Bot. -
1965. - 52, N 5. - P. 432-437.
Lucas E.H., Ringler R.L., Byerrum R.U. et al. Tumor inhibitors in Boletus edulis and other Ho-
lobasidiomycetes // Antibiot, and Chemother. - 1975. — 7, N 1. — P. 1—4.
Luthardt W. Holzbewohnende Pilze. — Lutherstadt : Ziemsen, 1969. — 122 S.
Lyr H. Untersuchungen uber peroxydasen hoheren Pilze // Planta. - 1956. - 48. N 2 -
S. 239-265.
Lyr H. Alterung und Enzymbildung bei hoheren Pilzen // Z. allg. Microbiol. - 1964. - 4. N 3 -
S. 249-258.
Lyr H. On the toxicity of oxidized polyphenols // Phytopathol. Z. - 1965. - 52. N 3. -
P. 229-240.
Macaya-Lizano A. V. Pleurotus ostreatus (Jacq. ex Fr.) Quelet formes et especes affines : Com-
portement cultural et systematique // Rev. mycol. - 1975. - 39, N 1. - P. 3-38.
Madelin M.F. Studies on the nutrition of Coprinus lagopus Fr. especially as affecting fruiting //
Ann. Bot. (Gr. Brit.). - 1956. - 20, N 79. - P. 307-330.
Manachere G. Substances produites par les carpophores murs de Coprinus congregatus et regu-
larisatrice du rythme de fructification du champignon. D&ais ndcessaires a" laeur liberation // Rev.
mycol. - 1976. - 40, N 4. - P. 329-339.
Manachere G. Coprinus congregatus in modele biologique pour I’&ude de quelques problems
generaux poses por la fructification des champignons superieurs // Mushroom Sd. - 1977a. - 9,
pt. l.-P. 783-798.
Manachere G. Modifications du rythme de fructification de Coprinus congregatus par le depot de
carpophores mfirs exog&ies a la surface des cultures // Physiol, plant. — 1977b. - 39, N 3. -
P. 201-205.
Manachere G. Aspects photoperiodiques de la reproduction chez quelques champignons // Bull.
Soc. bot. France. - 1978. - 125. - P. 243-262.
Manachini P.L. Extracellular amylolytic system of the basidiomycete Schizophyllum commu-
ne /I Ann. microbiol. ed enzimcd. — 1982. - 32. — P. 23-36.
, Mandels G.R. Kinetics of fungal growth // The Fungi. VoL 1. The fungal cell I Eds G.C.Ains-
worth, A.S.Sussman. - New York ; London : Acad, press, 1965. - P. 590-612.
Marczynski R. Studies in the nutrition of Collybia velutipes (Curt.) Quel. // Amer. Midland Na-
tur. -1943. -30, N l.-P. 164-170. -
Makrovetz A J., Cazin J., Allen J.F. Assimilation of alkanes and alkenes by fungi // Appl. Micro-
bid. - 1968. - 16, N 3. - P. 487—489.
Marr CJ). Laccase and tirosinase oxidation of spot-test reagents // My co tax on. - 1979. - 9,
N 1. - P. 244-276.
' Marr CJZ Spot teats for detection of tyrosinase//Ibid. - 1984. — 19, N 1. - P. 299-306. ... 137
Martens P.. Vandendries R. Le cycle conidien. hapioide et deploide. chez Pholiota aurivella /
Cellule. — 1933. — 41. - P. 337-338. *
Martin K.J.. Gilbertson R.L. Cultural and other morphological studies of Sparassis radicals and
related species // Mycologia. — 1976. — 68. N 3. — P. 622—639.
Matruchot L. Sur les cultures pour a partir de la spore de la Lepiota elevel (Lepiota procera
Scop.i // Cj. Acad. Soc. Paris. — 1912. - 155. — P. 226.
’ Maxwell M.B. Studies of Canadian Thelephoraceae.il. Conidium production in the Thelepho-
raceae I/ Can. J. Bot. - 1954. - 32, N 1. - P. 259-280.
Mavr R., Nikolaidis G., Waldrich U., Schwantes H.O. Untersuchungen zum Einflud von Photo-
hormonen auf des Myzelwachstum und die Fruchtkorperbildung einiger Makromyceten II Z. My-
kol. - 1984 - 50, N 1. - S. 101-103.
McKeen C.G. Studies of Canadian Telephoraceae. 9. A cultural and taxonomic study of three
species of Peniophora Ц Can. J. Bot. - 1952. - 30, N 6. - P. 764-787.
McLaughlin DJ. Enviromental control of fruitbody development in Boletus rubinellus in axenic
culture // Mycologia. — 1970. — 62, N 2. - P. 307—331.
McLaughlin DJ. Fruit body formation by Tilopilus felleus in axenic culture // Ibid. - 1974. -
66.N1.-P. 197-207.
Meinhardt F. Genetic of fruit body formation in Polyporus ciliatus, Agrocybe aegerita and
Schizophyllum commune // Summar. commun. 10-th Intern, congr. sci. and cultiv. edible fungi.
Aquitaine ect. June 5-15,1978. — Bordeaux, 1978.P. 2.
Meixner A. Chemische Farbreaktionen von Pilzen. — Vaduz : Cramer, 1975. - 286 S.
Metin E. Untersuchungen uber die Larix-Mykorrhiza. I. Synthese der Mykorrhiza in Reinkul-
tur // Sven. bot. tidsskr. - 1922. — 16, N 2. — P. 161-196.
Metin E. Experimentalle Untersuchungen uber die Konstitution und okologie der Mykorrhizen
von Pinus silvestris L. und Picea abies (L.) Karst. // Mykol. Untersuch. und Ber. - 1923. N 2. -
P. 73-335.
Metin E. Growth factors requirements of mycorrhizal fungi of forest trees Ц Sven. bot.tidsskr. -
1954.-48, N 1. - P. 86-96.
Metin E. Studies on the physiology of tree mycorrhizal Basidiomycetes. I. Growth responce to
nucleic acid constituents // Ibid. - 1959. - 53, N 2. — P. 135.
Metin E., Norkrans B. Amino acids and the growth of Lactarius deliciosus (L.) Fr. // Physiol,
plant. - 1948. - 1, N 2. - P. 176-186.
Metin E.. Nyman B. Weitere Untersuchungen uber die Wirkung von Aneurin und Biotin auf
das Wachstum von Wurzelpilzen // Arch. Microbiol. — 1940. — 11, N 1/4. — S. 318—328.
Mevrath J. Laboratory deep culture of microorganisms using a vibrating stirren // Experientia. —
1964. - 20. - P. 235.
Michael E.. Hennig B„ Kreizel H. Handbuch fur Pilzfreunde. - Jena : Fisher, 1979. — Vol. 1. -
392 S..
Mikola P. Metsatnaan kantasienien pundasviljely II Karstenia. - 1955. - 8, N 3. - P. 5-16.
Miller O.K. The role of light in the fruiting of Panus fragilis // Can. J. Bot. - 1967. — 45, Nil.-
P. 1939-1943.
Miller O.K. A new species Pleurotus with coremioid imperfect stage // Mycologia. - 1969. -
61.N5.-P. 887-893.
Miller O.K. The relationship of cultural characters to the taxonomy of the Agarics // Evolution
in the Higher Basidiomycetes : .An Inten. symp. / Ed. R.Peterson. — Knoxville, 1971. — P. 197-208.
Miller O.K.. Miller S.L., Palmer J.G. Description and identification of selected mycorrhizal
fungi in pure culture // Mycotaxon. - 1983. - 18. N 2. - P. 457-481.
Mittwoch V. The genetics of Coprinus lagopus. 2. Growth rates of wild type strains // J. Genet. -
1954.- 52.-P. 551-555.
Modess O. Zur Kenntnis der Mykorrhizabildner von Kiefer und Fichte // Symb. bot. upsal. -
1941. - 5, N 1. - S. 1-147.
Molitoris HP. Identification of Agaricus campestris strain (NRRL 2334,2335, 2336) as Beauve-
ria tenella (Lelacroix, Seim.) // Nature. - 1962. - 104, N 4823. - P. 316.
Molitoris H.P. Wood degradation phenoloxidases and chemotaxonomy of higher fungi // Mu-
shroom Sci. - 1978. - 10, pt. 1. - P. 243-263.
Molodtsov N.V., Vafina M.G., Sundukova E.V. et al. The distribution of certain glycosidases in
mushrooms // Int. J. Biochem. - 1974. - N 5. - P. 383-389.
Moore R.T. The ultrastructure of fungal cells // The Fungi. Vol. I. The fungal cell / Eds G.C.Ains-
worth, A.S.Sussman. - New York ; London : Acad, press, 1965. - P. 95-118.
Moore R.T. Taxonomic singnificance of septal ultrastructure with particular reference to the
jelly fungi // Mycologia. - 1978. - 70, N 5. - P. 1007-1024.
Moore R.T., McAlear J.H. The fine structure of Mycota. 7. Observations on septa of Ascomycetes
and Basidiomycetes// Amer. J. Bot. - 1962. - 49, N 1. - P. 86-94.
Morimoto N., Suda S., Sagara N. Effect of ammonia on fruit-body induction of Coprinus cinereus
in darkness // Plant and Cell Physiol. - 1981. - 22, N 2. - P. 247-254.
Mouches C., Duthil P., Bove J.M. et al. Caracterisation des champignons superleurs par electro-
phorese de leurs proteines // Mushroom Sci. - 1979. — 10, pt. 1. - P. 491-503.
Moustafa A.M. Nutrition and the development of mushroom flavor in Agaricus campestris myce-
lium // Appl. Microbiol. - 1960. - 8, N 1. - P. 63-67.
Musilek V. Enzymaticka aktivita kultur basidiomycetu. Strucny prehled // Ces. mykoL —1981.—
38, N 4. — S. 196-208.
Musilek V., Cerna J., Sasek V. et al. Antifungal antibiotic of the basidiomycete Oudemansiella
mucida. 1. Isolation and cultivation of a producing strain // Folia microbiol. - 1969. - 14, N 4. -
P. 377-387.
Nakanishi K., Tada M., Yamada J. et al Isolation of lampterol, an antitumor substance from
Lampteromyces japonicus // Nature. - 1963. - 197, N 4864. - P. 292.
Nerud F„ Musilek V. Composition of lipids and production of mucidin in a submerged culture
of the basidiomycete Oudemansiella mucida // Folia microbial. - 1976. - 21, N 6. - P. 488-492.
. Nerud F., Zouchova Z., Musilek V. Lipolytic activity in submerged cultures of some wooddes-
138;troyingBasidiomycetes//Ces. mykol. - 1982. - 36,N 1. -P.45-46,______________
Net ter U. von. Investigations of primordia formation in the Pleurotus ostreatus dikaryon ”868 x
x 381” I/ Mushroom Sci. - 1978. - 10, pt. 1. - P. 703-711.
Nicholson W.L., Robinson A.D. Temperature sensitive mutations affecting extracellular pheno-
loxidase activity in Panus tigrinus // Mycologia. — 1983. — 75, N 1. — P. 176—178.
Niederpruem DJ. Role of carbon dioxide in the control of fruiting of Schizophyllum commu-
ne // J. Bacteriol. - 1963. - 85, N 6. - P. 1300-1308.
Miederpruem DJ., Hobbs H., Henry L. Nutritional studies of development in Schizophyllum
commune //Ibid. - 1964. — 88, N 6. — P. 1721-1729.
Niederpruem D.J., Jersild ВЛ., Lane P.L. Direct microscopic studies of damp connection
formation in growing hypha of Schizophyllum commune // Ar^.i. Microbiol. - 1981. - 80, N 1. -
P. 19-31.
Nobles M.K. Cultural characters as a guide to the taxonomy and phylogeny of the Polyporaceae//
Can. J. Bot. - 1958. - 36, N 6. - P. 883-926.
Nobles M.K. Identification of cultures of wood-inhabiting Hymenomycetes // Ibid. - 1965. -
43.N9.-P. 1097-1139.
Nobles M.K. Cultural characters as a guide to the taxonomy of Polyporaceae // Evolution in the
Higher Basidiomycetes : An Int. Symp. / Ed. R.Peterson. - Knoxville : Univ. Tenn, press. 1971. -
P. 169-192.
Norkrans B. Studies in growth and cellulytic enzymes of Tricholoma with special reference to
mycorrhiza formation // Symb. bot. upsal. — 1950. — 11, N 1. — P. 5—126.
Norkrans B. The effect of glutamic acid, aspartic acid and related compounds on the growth of
certain Tricholoma species // Physiol, plant. — 1953. — N 6. — P. 584—593.
Norkrans B. Cellulose and cellulolysis // Adv. Appl. Microbiol. — 1967. - 9. - P. 91-130.
Nour el Dein M.S., Abdallah N.M. Biosynthesis of fat in submerged culture of Poiyporus sul-
phureus /I Microbiologia.- 1967. - 7, N 1. - P. 29-32.
Orson K., MiUer J. The role of light in the fruiting of Panus fragilis // Can. J. Bot. - 1967. -
45, Nil.- P. 1939-1943.
Orton P.D., Watling R. British fungus flora Agarics and Boleti. 2. Coprinaceae. Pt. 1. Copri-
nus. - Edunburgh : Majesty, 1979. - 149 p.
Oyama J., Joshida T., Taguchi H. The artificial cultivation of mycorrhiza formina Basidiomyce-
tes I/ Mushroom Sci. - 1974. - 9, Pt. 1. - P. 719-731.
Pantidou M.E. Cultural studies of Boletaceae : Gyrodon merulioides and four species of Boleti-
nus II Can. J. Bot. - 1961a. - 39, N 5. - P. 1149-1162.
Pantidou M.E. Carpophores of Phlebopus sulphureus in culture // Ibid. - 1961b. - 39. N 5. -
P. 1163-1167.
Pantidou M.E. Cultural studies of Boletaceae : Carpophores of Phlebopus lignicola in culture //
Ibid. - 1962. - 40, N 10. - P. 1313-1319.
Pantidou M.E. Cultural studies of Boletaceae : Carpophores of Xerocomus badius and Xeroco-
mus illudens in culture // Ibid. - 1964a. - 42, N 9. - P. 1148-1149.
Pantidou M.E. A new Suillus from New York // Ibid. - 1964b. — 42, N 12. - P. 1713-1714.
Pantidou M., Groves W.J. Cultural studies of Boletaceae : some species of Suillus and Fuscobo-
letus // Ibid. - 1966. - 44, N 10. - P. 1371-1392.
Pantidou M., Watling R. A contribution to the study of the Boletaceae — Suilloideae /,' Noles
Roy. Bot. Gard. Edinburgh. - 1970. - 30, N 1. - P. 207-237.
Pantidou M., Watling R. Fruit bodies of Boletus amarellus in pure culture // Ibid. - 1973. -
32, N 3. - P. 439-443.
Pantidou M., Watling R., Gonou Z. Mycelial characters, anamorphs and teleomorphs in genera
and species of various families of Agaricales in culture // Mycotaxon. - 1983. - 17. N 2. - P.409—432
Parmasto E. Helicogonium jacksonii (Dipodascales) found in Caucasus // Folia Crypt. Est. -
1974.-Fasc. 6.-P. 41-48.
Parmasto E., Parmasto I. Thexanthochroic reaction in Aphyllophorales // Mycotaxon. - 1979. -
8, N l.-P. 201-232.
Parmeter J.R. The taxonomy of sterile fungi // Phytopathology, —1965. - 55, N 8. - P. 826-828.
Patel H.H. Amino acid in fleshy fungi // Geobios. — 1980. - 7, N 5. - P. 206-209.
Pedersen TA., Lindeberg G. Growth of Boletus variegatus in surface and shake cultures // Phy-
siol. plant. - 1970. - 23. - P. 1110-1118.
Perlman D. The chemical environment for fungal growth. 2. Carbon sources // The Fungi. Vol. I.
The fungal cell / Eds G.S.Ainsworth, A.S.Sussman. - London ;New York : Acad, press, 1965. -
P. 479-489. „ „
PilatA. Flora CSR : Gasteromycetes. - Praha : Cs. Akad. ved., 1958. - 863 s.
Pirt SJ. A kinetic study of the mode of growth of surface colonies of bacteria and fungi //
J. Gen. Microbiol. - 1967. - 47, N 2. - P. 181-197.
Plunkett B.E. Nutritional and others aspects of fruit body production in pure cultures of
Collybia velutipes (Curt.) Fr. // Arm. Bot. (Gr. Brit.). - 1953. - 17, N 66. - P. 193-217.
Plunkett B.E. The influence of factors of the aeration complex and light upon fruit-body forma-
tion in pure cultures of an Agaric and a Polypore // Ibid. — 1956. - 20, N 80. — P. 563—586.
Poitou N., Mamoun M., Delmas J. Cultures mycelliennes de champignons mycorhiziens en milieu
optimal // Mushroom Sci. - 1981. - 11, pt. 2, - P. 885—892.
Poppe J., Wehaert W. Identification of Hyphomycetes in pure culture by characterization of
their mycelia and trails for artifitial fructification // Meded. гас. landbouwwetensch. Rijksuniv.
Gent. - 1983. -48, N 3. - P. 901-912.
Pyysalo H. On the formation of the aroma of some nothern mushrooms // Mushroom Sci. -
1979/1980. - 10, pt. 2. - P. 669-675.
Quattelbaum E.C., Corner G.R. A technique for preparing Baauveria spp. for scanning electron
microscopy // Can. J. Bot. — 1980. — 58, N 15. — P. 1700—1703.
Quimio Т.Н., Sardsud U. Nutritional requirements of Pleurotus ostreatus (Fr.) Kummer //
Philipp. Agr. - 1981. - 64, N 1. - P. 79-89.
Raper CA. Sexuality and breeding // The biology and cultivation of edible mushrooms / Eds
S.TjChang, W.A.Hayes. - New York etc.: Acad, press, 1978. — P. 83—117.
Raper CA., Kaye G. Sexual and other relationships in the genus Agaricus // J. Gen. Micro-
biol. - 1978. - 105. N 1. - P. 135—151..
139
Raper J.R. Genetics of sexuality in higher fungi. — New York : Ronald, 1966. — 283 p. (
Raweld W. Das Mycelwachstum hoherer Pilze in semen Bezichungen zu naturiichen substraten
und deren Extrakten // Arch. Forstw. — 1963. — 12, N 5. - S. 483-508.
Reheiek L.. Farber G.. Sevtek V. et al. Submerged cultivation of Basidiomycetes Boletus edulis
var. reticulatus // Folia microbiol. — 1962. — 7, N 1. — P. 75—79.
Reimer F„ Spencer J.F.T., Saltans H.R. Protein and fat content of some mushrooms grown in
submerged culture// Appl. Microbiol. — 1958a. — 6, N 1. - P. 1—11.
Reusaer F, Spencer I.F.T., Sallarts H.R. Tricholoma nudum as a source of microbiological prote-
in // Ibid. - 1958b. - 6, N 1. - P. 5-8.
Righelato R.C. Growth kinetics of mycelial fungi // The filamentous fungi. Vol. 1. Industrial
mycology / Eds J.E.Smitii, D.R.Berry. — London : Edward, 1975. — P. 79—103.
Robbins W. A survey of the growth requirements of some Basidiomycetes // Mycologia. —
1950. - 42, N 4. - P. 470-476.
Robbins W., Hervey A. Wood, tomato and malt extracts and growth of some Basidiomycetes //
Ibid. - 1958. - 50, N 5. - P. 745-752.
Robbins И'., Hervey A. Unidentified filtrate growth substances for several fungi // Ibid. - 1963 -
55, N 1.-P. 59-64.
Robert J.C. Fruiting of Coprinus congregatus : relationship to biochemical changes in the whole
culture//Trans. Brit. Mycol. Soc. - 1977. — 68, N 3. — P. 389-395.
Robert J. C. Quelques aspects metaboliques de la fructification du basidiomycete Coprinus con-
gregatus BuU. ex Fr. // MushroomSci. - 1979. - 10, pt. 1. - P. 683—701.
Robinson R.F., Davidson R.S. The large-scale growth of higher fungi // Adv. Appl. Microbiol. -
1959. - 1.-P. 261-278.
Rose A.H. Production and importance of secondary products of metabolism // Econ. microbiol.
Vol. 3. Secondary products of metabolism / Ed. by A.H.Rose. - London etc.: Acad, press, 1979a. -
P. 1-33.
Rose A.H. History and scientific basis of large-scale production of microbial biomass // Economic
microbiol. Vol. 4. Microbial biomass / Ed. A.H.Rose. — London etc. : Acad, press, 1979b. — P. 1—29.
Rosenberg H.. Obrist J., Stohs S.J. Production of fungal proten from oat hulls // Econ. Bot. -
1978/1979. - 32. N 4. - P. 413^17.
Rowlands R.T. Industrial fungal genetics and strain selection // The filamentous fungi. Vol. 4.
Fungal technology. - London : Edward, 1983. — P. 346—372.
Rypacek V., Sladky Z. The character of endogenous growth regulators in the course of develop-
ment in the fungus Lentinus tigrinus // Mycopathol. et mycol. appl. - 1972. — 46, N 1. — P. 65—72.
V Sakamoto R., Nimi T.. Takahashi S. Effect of carbon and nitrogen sources on submerged culture
of edible fungi // J. Agr. Chem. Soc. Jap. - 1978a. - 52, N 2. — P. 75—81.
Sakamoto R.. Nimi T., Takahashi S. Submerged culture of edible fungi in high consistency
starch media // Ibid. — 1978b. - 52, N 2. — P. 83—90.
Santoro T, Casida L.E. Improved method for obtaining vegetative growth of mycorrhizal and
other slow growing fungi // J. Bacteriol. - 1959. - 78, N 3. - P. 449—450.
Santra S.. Nandi B. Monokaryotization of dikaryotic mycelia of some wood-destroying basidio-
mycetes in presence of toxic substances // New Phytol. — 1977. - 79, N 1. - P. 179-181.
Salek V., Musilek К Two antibiotic compounds from mycorrhizal Basidiomycetes // Folia mic-
robiol, - 1968a. - 13, N 1. - P. 43-45.
Sasek V., Musilek^V. Antibiotic activity of mycorrhizal Basidiomycetes and their relation to the.,
host-plant parasites // Ces. mykol. — 1968b. — 22. N l.-P. 50-55.
Saiek V., Musilek M. Growth promotion of slowly growing mycorrhizal Basidiomycetes in sub-
merged culture // Mycorrhizae. Proc, first North Amer. conf, on Mycorrhizae, Apr., 1969, Washing-
ton. Hacskaylo. - Washington : Edward, 1971. - P. 216—218.
SaSek V., Musilek B. Effect of the new antifungal antibiotic mucidin. 2. Morphological changes
brougfh about in sensitive test microorganisms // Folia microbiol. - 1974. - 19, N 2. - P. 142-145.
Sasek V., Buchalo A.S. Poznamky к nomenclature a taxonomick&nu zarizeni n&terych druhu
rodu Pleurotus // Zb. 1. Celoctatny zjazd pestovatelon hlivay, aprila, 1985, Bratislava - Raca
CSVTS. - Samonine, 1985. - P. 125-128.
Saiek V., Buchalo A.S., Zakordonec O.A. Confirmation of identity of Pleurotus ostreatus with
Pleurotus abalonus by scanning electron microscopy of anamorphs // Folia microbiol. - 1986. -
31, N 3. - P. 309-311.
Sawada M. Studies on chemical components of wild mushrooms and toadstools in Japan //
Bull. Tokyo Univ, forest. - 1965. - 59. N 1. - P. 33-162.
Schanel L. New Method of cultivation of wood-decaying fungi. - Folia microbiol. - 1966. -
11, N 5. -P. 408-410.
Schisler L.C.. Volkoff O. The effect of safflower oil on mycelial growth of Boletaceae in sub-
merged liquid cultures // Mycologia. - 1977. - 69. N 1. - P. 118-125.
Schuster A., Yung Y.A. Zur Mizelidentifizierung holzzerstorender Pilze // Phytopathol. Z. -
1981. - 100,,N l.-P. 19-28.
Semerdzieva M. Pestovani a morfologicka pozorovani nekterych nub celedi Agaricaceae in vitro If
Ces. mykol. - 1965. - 19, N 4. - P. 230-239.
Semerdzieva M. Morphological observation of some Pleurotus mycelium // Sydowia. Annal.
Mycol. - 1966. - 19, N 10. - P. 250-258.
Semerdzieva M., Cejp K. Investigation of mycelial growth in some gill fungi under laboratory
conditions // Folia microbiol. — 1966. — 11, N 2. — P. 146—154.
Shiio T., Okunishi M., Okumura S. Fundamental studies on the large-scale cultivation of edible
fungi /I Mushroom Sci. - 1974. - 9, pt. 1. — P. 799—809.
Sigler L„ Carmichael J.W. Taxonomy of Malbranchea and some other Hyphomycetes with art-
hroconidia // My co taxon. - 1976. - 4, N 2. - P. 349—488.
Sinclair C.G., Mavituna F. Mass and energy transfer // The filamentous fungi. Vol. 4. Fungal
technology. — London : Edwards, 1983. - P. 20-76.
Singer R. Mushrooms and Truffles. - London etc., 1961. - 272 p.
v лл Singer R. The Agaricaies in modern taxonomy. - Vaduz : Cramer, 1975. - 912 p.
140 Smith A.H. The hyphal structure of the buridiocarp // The fungi. An advanced treatise. Vol. 2.
The fungal organism / Eds G.C.Ainsworth, A-S-Sussman. - New York ; London : Acad, press, 1966. -
P. 151-177.
Smith A.H. Poisonous mushrooms: their habitats, geographic distribution and physiological va-
riation within species Ц Mushroom poisoning: diagnosis and treatment // Eds B.H.Rumack, ESalz-
man. - Florida : CRC, 1978. - P. 52-65.
Smith J.E. The structure and development of filamentous fungi // The filamentous fungi. Vol. 1
Industrial mycology. - London : Edward, 1975. — P. 3—11.
Smith J.E., Berry D.R. An introduction to biochemistry of fungal development. - London ;
New York : Acad, press, 1974. — 319 p.
Smith J.E., Berry D.R. The filamentous fui^i. Vol. 3. Dt elopmental mycology. - London :
Edward, 1978. — 464 p.
Smith J.E., Berry D.R., Kristianen B. The filamentous fungi. Vol. 4. Fungal technology / Eds
J.E.Smith, D.R.Berry, B.Kristianen. - London : Edward, 1983. - 401 p.
Smith J.E., Galbraith J.C. Biochemical and physiological aspects of differentiation in the fun-
gi//Adv. Microb. Fhysiol. - 1971. - 5. - P. 45-134. , , , , v
Sobotka A. Ciste kultury z plodnic mykorrhitickych hub // Pr. Vyzk. ustavu lesnickych v CSR. -
1954.-N 6.-S. 101-123.
Sobotka A. Pestovani mykorrhiznich hub v dstych kulturach // Sb. Cs. akad. zeme'd. - 1955. -
28. - S. 332-335.
Solomons G.L. Submerged culture production of mycelial biomass // The filamentous fungi.
Vol. I. Industrial mycology./Eds J.E.Smith, D.R.Berry. - London : Edward, 1975.— P. 249-264.
Sprague R. Diseases of cereals and grasses in North America. - New York : Ronald, 1950. -
535 p.
Stalpers J A. Identification of wood-inhabiting Aphyllophorales in pure culture // Stud. Mycol. -
1978.-N 16. -248 p.
Stalpers J A., Vhtg L. Confistulina, the anamorph of Fistulina hepatica // Can. J. Bot. - 1983. -
61, N 6. - P. 1660-1671.
Stdrka J. Submersni pestovani vyssych hub // Ces. mycol. — 1955. - 9, N 3. - P. 97-103.
Stdrka J., Schdnll L. The effect of extracellular enzymes of woodrotting fungi on wood // Fo-
lia microbiol. - 1962. - 7, N 3. - P. 197-198.
Styer J.F. Nutrition of the cultivated mushroom // Amer. J. Bot. - 1930. - 17, N 10. -
P. 938-994.
Sugihara T.F., Humfeld H. Submerged culture of the mycelium of various species of mushrooms I
Appl. Microbiol. - 1954. - 2, N 1. - P. 170-172.
Sugimori T., Oyama Y., Omichi T. Studies on Basidiomycetes. I. Production of mycelium and
fruit body from moncarbohydrate organic substances // J. Fermant. Technol. - 1971. - 49, N 5. -
P. 435-446.
Sussman A.S., Halvorson H.O. Spores, their dormancy and germination. - New York : London :
Harper and Row Publ., 1966. - 354 p.
Taguchi H. The nature of fermentation fluid // Advanced in biochemical engineering. - Berlin :
New York : Springer, 1971. - P. 1-29.
Takania'F.^Sesoki M., Nunomura N. Flavor components of Agrocybe aegerita (Yanagi-Matsuta-
ke) // Mushroom Sci. — 1979/1980. — 10, pt. 2. — P. 677—684.
Taylor J.B. Biochemical tests for identification of mycelial cultures of Basidiomycetes // Ann.
Appl. Biol. - 1974,- 78, N 2. - P. 113-123.
Teng C. Studies on the biology of macrofungi with reference to their cultivation // Acta bot.
sin. - 1966. - 14, N ?.-P. 150-179.
Thomas G.W., Jackson R.M. Scanning electron microscopy of mycology mycorrhizas of Sitka
Spruce // Trans. Brit. Mycol. Soc. - 1982. - 79, N 1. — P. 31—39.
Todd N.K., Rayner A.D.M. Fungal individualism // Sci. Progr. - 1980. - 66. N 263. -
P. 331-354.
Tokimoto 'K.; Komatsu M., Takemaru T. Incompatibility factors in the natural population of
Lentinus edodes in Japan // Rept. Tottorin Mycol. Inst. Jap. - 1973. -,N 10. - P. 371 -376.
Tonomura H. Flammulina velutipes // The biology and cultivation of edible mushrooms / Eds
S.T.Chang, W.A.Hayes. - New York etc. : Acad, press, 1978. - P. 409—421.
Torev A.Industrial production of concentrated protein from edible mushroom mycelium as food
for people // Karstenia. - 1978. — 18, suppl. — P. 20.
Treschow C. Nutrition of cultivated mushroom // Dan. bot. ark. — 1944. — 11, N 6. - P. 9-180.
Trtnci A.P.J. Influence of the width of the peripherical growth zone on the radial growth rate of
fungal colonies on solid media // J. Gen. Microbiol. — 1971. - 67, N 2. - P. 325 —344.
Trinci A.PJ. Growth of wild type and spreading colonial mutans of Neurospora crassa in Batch
culture and on agar medium // Arch. Mikrobiol. - 1973. - 93, N 2. — P. 113—126.
Uno I., Ishikawa T. Purification and, ^identification of the fruiting-inducing substances in Copri-
nus macrorhizus // J. Bacteriol. - 1983a. ± 113, N 3. - P. 1240—1248.
Uno J., Ishikawa T. Metabolism of adenosine 3’5*—cyclic monophosphate and induction of frui-
ting bodies of Coprinus macrorhizus // Ibid. — 1983b. - P. 1249—1255.
Vandendries R. Recherches sur le determinisme sexual des Basidiomycetes // M&n. Acad. roy.
med. Belg. - 1923. - 5, fasc. 1. - P. 1-98.
Vandendries R., Martens P. Oidies haploides et diploides sur mycelium chez Pholiota aurivella
Batsch // Bull. Acad. roy. med. Belg. ser. 5. — 1932. — N 8. — P. 468-472.
Vandendries R., Martens P. Le cycle conidien hapioide et diploide chez Pholiota aurivella //
Cellule. - 1933. - 41, fasc. 3. - P. 337-338.
Vetter J. A tdpkozeg szenes nitrogenforrilsainak hatasa az Argocybe aegeriza in vitro tennotes-
tkepzesere // Bot. kdzl. - 1977. - 64, N 2. - P. 93-99.
Vetter J., Rimoczi I. The trend of the protein factors and fibre content during the development
of fruitbodies of Stropharia nigosoannulata Farlow et Mun. // Acta bot. Acad, sci hung. - 1978. -
24, N 1/2. - P. 205-218.
Vetter J., Rimocsi I. Changes in the protein fractions and crude fiber content of Pleurotus ost-
reatus and Stropharia nigosoannulata during the development // Cryptogam. Mycol. — 1981. —
2.N2.-P. 107-117, .
141
Volz P.. Beneke E.S. blutrifionai regulation of basidiocarp formation and mycelial growt^i of
Agsricaies // MycopathqLet mycol. appl. - 1969. - 37, N 3. - P. 225-253.
Wakita S. Biochernical studies on the velvet mushroom Collybia velutipes. Effect of amino acids
and vitamins on the growth of the mycelium // J. Agr. Chem. Soc. Jap. - 1954. - 28, N 9. -
P. 707-711. . .
Warcup J.H. Studies on the occurcnce and activity of fungi in a wheat-field soil // Trans. Britt.
Mycol. Soc. - 1957. - 40, N 2. - P. 237-259.
Warcup J.H. Studies on Basidiomyqetes in soil//Ibid. - 1959. — 42, N 1. -P. 45-52.
Warcup J.H., Talbot P.H.B. Ecology and identity mycelia from soil II Ibid. - 1965. - 48, N 2. -
P. 249-259.
Wesowicz E. Identification of the volatile flavor compounds in mushroom Agaricus bisporus //
' Bull. Acad. pd. so. Sir. sd. biot — 1974. — 22, N 3. — P. 143—151.
Watling R. Notes on British boleti )/ Trans, and Proc. Bot. Soc. Edinburgh- - 1964. - 39, N 5. -
P. 475-488.
Wetting R. Basidiomycetes : Homobasidiomycetidae. Collecting, isolation, cultivation, mainte-
nance, fructification // Methods in microbiology. - New York ; London : Acad, press, 1971. -
Vol. 4. - P. 219-236.
Watling R. An analysis of the taxonomic characters used in the species of the Bolbitiaceae // The
species concepts in Hymenomycetes : Proc. Herbette Symp. held Univ. Lausanne, Switzerland, Aug.
161-20,1976. - Berlin : Cramer, 1977. - P. 11-53.
Watling R.. Kendrick B. Dimorphism in Colivbia racemom // Mich. Bot. — 1977. - 16, N 2. -
P. 65-72.
Watling R. Anamorph—trieomorph ecology in Basidiomycetes // The Whole fungos : Kananas-
kis 2 / Ed. B.Kendrick. - Ottawa, 1979a. - Vol. l.-P. 633-634.
Watting R. The morphology, variation and ecological significance of anamorps in the Agaricales //
The Whole Fungus : Kananaskis 2 / Ed. B.Kendrick. - Ottawa, 1979b. - Vol. 2. - P. 453-472.
Weinberg E.D. Biosynthesis of secondary metabolites, role of trace metals // Adv. Microbiol,
phys. - 1970. - 4. - P. 1-44.
Welvaert W., Sanyn G., Poppe J. Serological detection of Agaricus bitorquis Quelet and its arti-
ficial fructification from isolates of roots of Platanus acericola // Med. Fac. Landbown Rijksuniv. —
Gen. - 1979. - 44, N 1. - P. 469-476.
Wetseis I.G.H. Biochemistry of sexual morpholenesis in Schizophyllum commune : effect of
mutations affecting the incompatibility system on cell-wall metabolism // J. Bacteriol. - 1969. -
98. N 2. - P. 697-704.
Whitaker A., Long PA. Fungal pelleting Ц Proc. Biochem. - 1973. - 8, N 11. - P. 27-31.
Worgan J.T. Culture of the higher fungi Ц Progr. Ind. Microbiol. - 1968. - 8. - P. 73-139.
Wright S.H., Hayes SA. Nutrition and fruit body formation of Lepista nuda (Bull, ex
Fr.) Cook. /I Mushroom Sci. - 1979. - 10, pt. 1. - P. 873-884.
Yoshida T.O., Rising J A., Nungester W.J. A tumor inhibitor in Lampteromyces japonica //
Proc. Soc. Exp. Biol, and Med. - 1962. - lll.N 3. - P. 676-679.
Yoshida T., Shimizu T., Taguchi H., Teramoto S. Studies on submerged culture of Basidiomyce-
tes. 3. The oxygen transfer Within the beliefs of Lentinus edodes // J. Fermant. Technol. - 1967. -
45, N 12.-P. 1119-1129.
Yoshida T., Taguchi H., Teramoto S. Studies on submerged culture of Basidiomycetes. 4. Distri-
butions of respiration and other metabolic activities in pellets of Shiitake (Lentinus edodes)5// Ibid. -
1968.-46, N 2.-P. 119-124. '
Yoshioka P, Ikekawa T„ Noda M., Fukuoka F. Studies on antitumor activity of some fractions
from basidiomycetes. I. An antitumor acidic polysaccharide fraction from Pleurotus ostreatus (Fr.)
Quel. // Chem. Pharm. Bui. - ’.972. - 20. - P. 1175-1180.
Yoshioka Y., Sana T., Ikekawa T. Studies on antitumor polysaccharides of Fiammulina veluti-
pes (Cur. ex Fr.) Sing. // Ibid. - 1973. - 21. - P. 1772-1776.
Zadralil F. The ecology and industrial production of Pleurotus ostreatus, Pleurotus florida, Pleu-
rotus contucopiae and Pleurotus eryngii // Mushroom Sci. - 1974. - 9, pt. 1. - P. 621-652.
Zadratil F. Influence of CO, concentration on the mycelium growth of tire Pleurotus species //
Eur. J. Appl. Microbiol. - 1975. - 1, N 4. - P. 327-335.
. Zadratil F. The use of plant waste for production of feed and edible fungi // 5-th Intern, ferment,
symp., 4th Intern, spec. symp. yeasts, Berlin, 1976 : Abstr. pap. - Berlin, 1976. - P. 23-25.
- Zadraiil F. Cultivation of Pleurotus // The biology and cultivation of edible mushrooms. - New
York etc.: Acad, press, 1978. - p. 521-557.
Zadraiil F., Schliemann J.'Okologische und biotechnologische Grundlagen der Domestication
von Speispilzen // Mushroom Sci. - 1974. - 9, pt. 2. — P. 199-218.
Zahner H. The search for new'Secondary metabolites // Antibiotics and other secondary meta-
bolutM. biosynthesis and production t 5th FEMS Symp. - London etc.: Acad, press, 1978. - P.1-17.
Zakia B., Srinnasan K.S., Srivastava H.C. Amino arid composition of the protein from a mu-
shroom (Pleurotus Sp.) // Appl. Microbiol. - 1963. - 11. - P. 184-187.
Zakia B., Srinivasan K.S., Singh N.S. Essential amino arid composition of the proteins of a
mushroom (Volvariella dipiasia) // J. Food Sri. and Technol. - 1971. - 8. - P. 180-182.
Zetetida H.K. Effect of oxygen tansfer rate on protein formation and biological value of Pleu-
rotus oatnuau/l Proc. Biochem. — 1981. - 16, N 2. - P. 20-24.
Pat. 21845, USA. Method of growing mushroom mycelium / Y.Szuecs. - Publ. 19.04.48.
Pat. 2618900, USA. Production of mushroom mycelium Agaricus campestris / H.Humfeld. -
Publ. 23.1132.
Att. 2648163, USA. Production of edible mushroom mycelium / Y.Szuecs. - Publ. 11.0433.
Ah. 2693664, USA. Method of enchanring mushroom mycelium flavor I Y.Szuecs, N.G.Yon-
ken. - Publ. 09.1134.
An. 2761246, USA. Mushroom culture / Y3zuecs. - Publ. 04.0936.
Rat. 2850841, USA. Method of growing mushroom mycelium and resulting products/YSzuecs,
N.G.Yonkers. - Publ. 09.0938.
Ан. 2928210, USA. Fermentation process for producing edible mushroom mycelium / V.Ciril-
142 Ifo, WAJfeedwwk, R.D3eetey. - PvbL 15Л430.
ОГЛАВЛЕНИЕ
ПРЕДИСЛОВИЕ 3
ГЛАВА 1. ОСНОВНЫЕ НАПРАВЛЕНИЯ ИССЛЕДОВАНИЙ ВЫСШИХ СЪЕДОБНЫХ БАЗИ-
ДИОМИЦЕТОВ В ЧИСТОЙ КУЛЬТУРЕ И ПЕРСПЕКТИВЫ ПРАКТИЧЕСКОГО ИХ ИСПОЛЬЗО-
ВАНИЯ „
1.1. Использование культурального метода для таксономических исследований
1.1.1. Критерии идентификации высших базидиомицетов в культуре
1.1.2. Получение в чистой культуре стадии телеоморфы
1.1.3. Выделение чистых культур
1.2. Глубинное культивирование высших съедобных базидиомицетов для получения пищевой i
биомассы ' 20
1.2.1. Интродукция съедобных базидиомицетов в глубинную культуру 20
1.2.2. Субстраты для глубинного культивирования 25
1.2.3. Питательная ценность культурального мицелия 26
1.2.4. Образование грибного аромата при глубинном культивировании мицелия 30
1.2.5. Применение глубинного инокулюма для получения плодовых тел 32
1.3. Образование в культуре биологически активных веществ 33
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ 3g
2.1. Получение чистых культур высших базидиомицетов 3g
2.2. Краткая характеристика исследованных культур до
2.3. Методы лабораторных исследований 43
25.1. Культивирование на агаризованных и жидких питательных средах 43
25.2. Анализ биомассы и культуральных жидкостей 45
2.4. Микроскопическое исследование культур 4g
ГЛАВА 3. ИДЕНТИФИКАЦИЯ ВЫСШИХ БАЗИДИОМИЦЕТОВ В КУЛЬТУРЕ И ТАКСОНОМИ-
ЧЕСКОЕ ЗНАЧЕНИЕ КУЛЬТУРАЛЬНЫХ ПРИЗНАКОВ 47
3.1. Рост исследованных культур высших съедобных базидиомицетов на агаризованных пита-
тельных средах 47
3.2. Отношение культур к температуре g2
3.3. Цветовые химические реакции на наличие фенолоксидаз 54
3.4. Образование в чистой культуре стадии телеоморфы gg
3.5. Микроструктуры gg
3.5.1. Пряжки gg
3.5.2. Анаморфы gg
5.5.5. Вегетативные структуры мицелия gg
3.6. Идентификация некоторых культур, имеющих практическое значаще gg
ГЛАВА 4. ПЕРВИЧНЫЙ ОТБОР ШТАММОВ СЪЕДОБНЫХ ГРИБОВ ДЛЯ ГЛУБИННОГО
КУЛЬТИВИРОВАНИЯ 74
4.1. Изучение нитателъных потребностей грибов 7g
4.1.1. Концентрация водородных ионов в питательной среде 7g
4.1.2. Источники углерода 77 '
4.1.3. Источники азота 7g 143
4.1.4. Стимуляторы росте $0
4.2. Отбор ва комвдексвых средах 81
4.3. Отбор штаммов. оВратуипщу бяологическв жпваые вещества 85
4.4. Морфолопм видов в глубинной культуре 88
ГЛАВА 5. ГЛУБИННОЕ КУЛЬТИВИРОВАНИЕ ШТАММОВ-ПРОДУЦЕНТОВ ПИЩЕВОЙ
БИОМАССЫ PLEUROTUS OSTREATUS 1300, FLAMMULINA VELUTIPES 112, PANUS
TIGRINUS 131 96
5.1. Культиввреваавк Pleurotus oatraate 1300 96
5.2. Кулыивар цааввг Паянянйва vetatipes 112 100
5.3. Культвввревввве Paira* tigrinus 131 101
5.4. Иг-с ледова иве некоторых бвологвчеокях особенностей Panus t^rinus 131 при многократных'
пассажах в культуре 104
5.5. Питательная ценность культурального мицелия весле довитых штаммов 107
5.6. Использование глубтнюго мицелия для культивирования плодовых тел 1Ю
ГЛАВА 6. ПРИНЦИПЫ ОТБОРА ВЫСШИХ БАЗИДИОМИЦЕТОВ С ЦЕЛЬЮ ПОЛУЧЕНИЯ
ПИШЕВОЙ БИОМАССЫ Ц4
ЗАКЛЮЧЕНИЕ 122
СПИСОК ЛИТЕРАТУРЫ 125
Таблица I
Колонии Pleurotus cornucopiae (7), Flammulina velutipes (2), Pleurotus florida (<?),
Suillus luteus (#) на агаризованных питательных средах: СА — пивное сусло, КГА —
картофельно-глюкозная среда, СН — среда Норкранс
Таблица II
Колонии Fistulina hepatica (/), Leucocoprinus bresadolae (2), Pleurotus cystidio-
sus (3), P. dryinus (4), Scleroderma citrinum (5), Lycoperdon pyriforme (6) на агаризо-
ванном пивном сусле
Таблица III
Колонии Amanita rubescens (/), Pholiota adiposa (2), Macrolepiota puellaris (3),
Calvatia excipuliformis (4), Armillariella mellea (5), Panus tigrinus (6) на агаризован-
ном пивном сусле
Таблица IV
Колонии Armillariella mellea (/), Agaricus maskae (2), A. bernardiiformis (3),
Flammulina velutipes (4), Suillus luteus (5), Marasmius oreades (6) на агаризованном
пивном сусле
Таблица V
Телеоморфы Pleurotus cornucopiae (/), Oudemansiella brunneomarginata (2), Pa-
nus tigrinus (<?), Pleurotus ilorida (4), Fistulina hepatica (5), Pleurotus ostreatus (6)
в чистой культуре на агаризованном пивном сусле
Таблица ITI
Телеоморфы Schizophyllum commune (1), Marasmius scorodonius (2), Sparassis
crispa (3), Crinipellis schevczenkovi (4), Oudemansiella radicata (5), Lepista nuda (3),
полученные в чистой культуре на агаризованной пивном сусле
Таблица VII
Телеоморфы Agrocybe aegerita (/), Coprinus cinereus (2), Asterophora lycoperdoi-
des (3), Flammulina velutipes (#), Suillus sibiricus (5), Boletus edulis (6) на агаризо-
ванном пивном сусле
Таблица VIII
Пряжки на мпце.пш в СЭМ: 1—3— PiptoporuS. botulinus 4—в- -Pleurotus ostrfc-
atus (X4000)
Таблица IX
Пряжки на мицелии в СЭМ: /, —Peniophora gigantea; 3—Pleurotus cystidio-
sus; -/-^Pholiota adiposa; 5. 6—Lyophvllum ulmarium (2. 3, 5 — X10 000. 1. 4. 6 —
Х60Э0)
Таблица X
Пряжки на мицелии в СЭМ: 1—3 — Panus tigrinus (Х^ООО). 4—6 — Coprinus ео-
matus (Х600Э)
Таблица XI
Пряжки на мицелии в СЭМ: / «Oudeniansiella brunitfipmarginata; £-нО. muci-
da; 3 — О. radicata; 4 — Lepista nuda (/, 2. 4 — >< 10 000. 3 X6000)
Таблица XII
Пряжки на мицелии в СЭМ: 1, 2 — Marasmius oreades; 3—5 — Cyatlius oilaej 6 —
Coprinus cinereus (УчаДй-X6000. 6*^X4800)
Таблица XIII
Анаморфы Peniophora gigantea {1—3} и Fistulina hepatica (-/) в СЭМ (/, 2—•
Х4000, 3— X10 000, 4 —XI 000)
Таблица XIV
Анаморфы Fistulina hepatica в СЭМ: /—$—бластоконидии (Х4000); 4— хлами-
доспоры (Х-АЮ>
Таблица XV
Лнаморфа Pleurotus cystidiosus (/, 2) и Pleurotus abalonus (<У, 4) в СЭМ: /, <?—общий вид коремиев (Х7^):
2, 4 — головка коремия (2 — Х300, 4 — XI30)
Ана.морфа Pleurotus cystidiosus в СЭМ: 1 — зачатки коремиев на ножке плодо-
вого тела ;(Х30); 2— -I— образование коремия (X400j
Таблица XVИ
Лиаморф;: Pleurotus cystidiosus (Л 3) и Pleurotus abalonus (2. 4} в СЭМ: 1. 2 -
спецы на корем.иальной головке; 3, 4— бластоконпдни на мицелии (/, 2— Х1000. 3 —
Х6000. 4 - XI IVИ)
Таблица XVIII
Анаморфы Pleurotus. cystidiosus (/) и Lepista nuda (2—7): 1 — б.тастоконидии
(X4600); 2, 3— артроконидии (X1600); 4 — артроконидии (X3000)
Таблица XIX
Анаморфы Lvophvllum ulmarium (7, 2) и Oudemansiella brunneomarginata (.3. 4}
в СЭМ (/ —Х6000. 2-йф<16(Ю0. <?—Х2000, J^XHOOOl
Таблица XX
Анаморфа и телеоморфа Asterophora lycoperdoides в СЭМ: 1 -^телеоморфа
1X48); 2—4 & хламидоспоры на шляпке плодового тела (AW Х86. 3 — X3000.
4 й? V4000)
Таблица XXI
Анаморфы Coprinus comatus (/—5) и С. einercus (4) в СЭМ: 1—3 — дендроидные
структуры (1 — Х2000, 2. 3— Х^ООО); 4 — склероций (Х1200)
Таблица XXII
Анаморфы Coprinus cinereus (/) и Pholiota adiposa (2—4) в СЭМ (1—3 — Х4000,
4—Х2000)
Таблица XXIII
Кристаллы (/, 2) и бородавчатые гифы (5, 4) в СЭМ: 1 — Peniophora gigantea;
2- Armillariella mellea; 3 — l-'istulina hepatica; 4 — Oudemansiella brunneomarginata
(1. 4 — X6000, 2 — X3000, 3 — X4000)
Таблица XXIV
Петли (Л 2) и волоски (J. 4) ня мицелии в СЭМ: 1 — Oudemansiella mucida
1X2000); 2-Л). briiniieoniarginaia (Х1500): 3 —Coprinus comatus (X4000); J — Ar-
millarielia meliea (X6000)
Таблица XXI/
Анастомозы на мицелии в СЭМ: 1. 3—Peniophora gigantea (Х-ЮОО): $— Agar:-
cus arvensis (X6000): 4 — Panus tigrinus (X2IW4
Таблица XXVI
Таблица XXVII
Электронно-.микроскопическое изображение
долипоровой перегородки Pleurotus ostreatus
1300 (Х15 000)
◄ Crinipellis schevczenkovi на агаризованном
пивном сусле: 1-—телеоморфа; 2 — мицелиальная
колония
Таблица XXVIII
Формы мицелиального роста в глубинной культуре на качалке: 1 — Sclero-
derma citrinum; 2— Agaricus silvaticus; 5 —Coprinus пнсасеиц 4 — Fistulina he-
patica
Таблица XXIX
Fusarium sambucinum var. ossicolum, штамм PS-64: 1 — макроконидии; 2 — 24-
часовая глубинная культура (Х400). Разрез (3, 4) через центральную часть глубинной
колонии Panus tigrinus в СЭМ (<?— Х^Ж 4— Х2000)
Таблица XXX
Рост Panus tigrinus в ферментере при 250 об/мин (/, 2), при 500 об/мин (3. 2):
/, 3 — общий вид колонии: 2. 4 край колонии.
Таблица XXXf
Panus tigrinus: 1, 2 — колонии в
4 — плодоношение на агаризованном
глубинной культуре; 3 — секторная колония;
пивном сусле при инокуляции глубинным
мицелием
Таблица XXX//
Плодоношений* Pleurotus ostreatus 1300 (/) и Panus tigrinus 131 (2) на отрубках
осиновой древесины, инокулированных глубинным мицелием