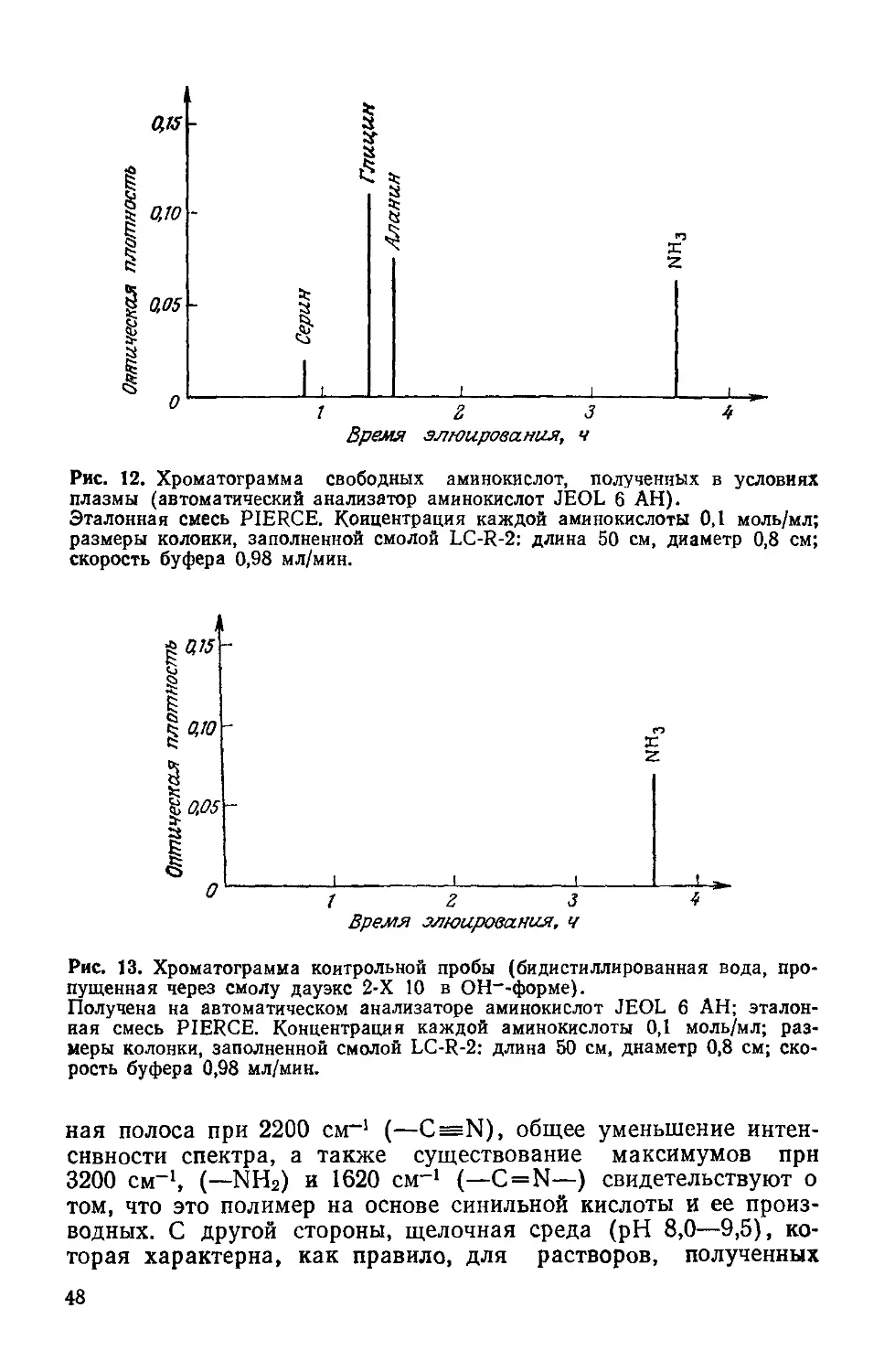
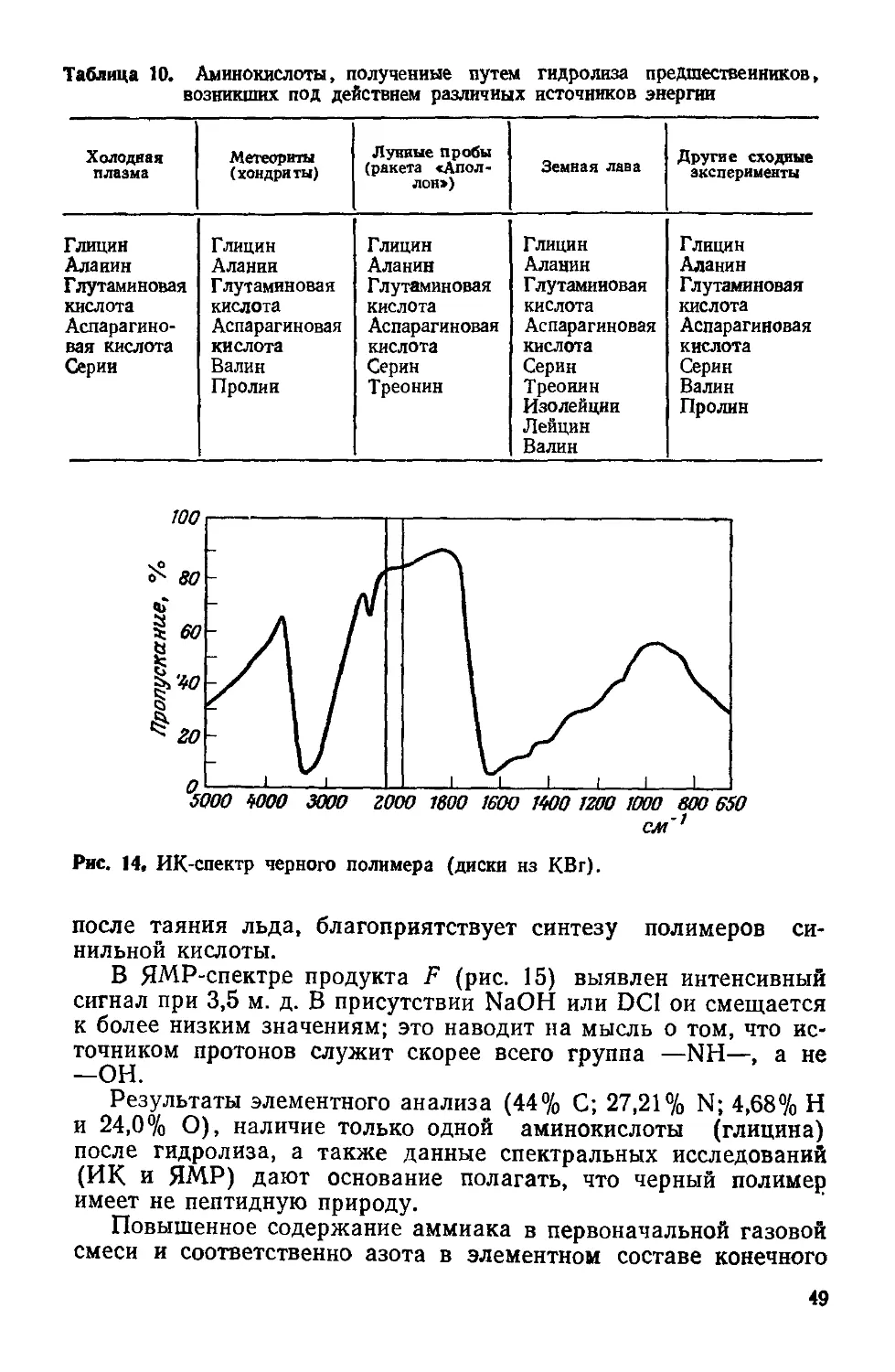
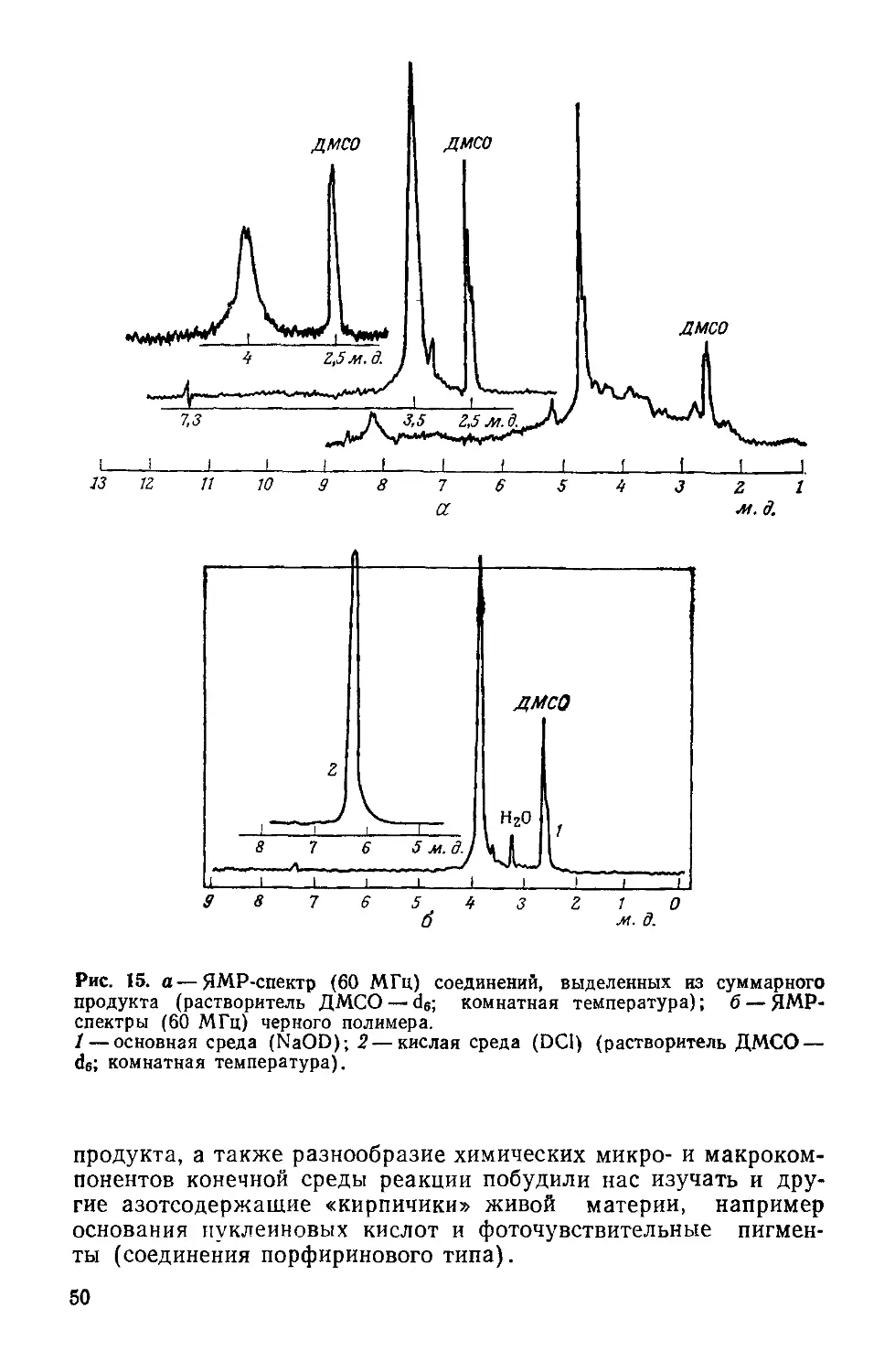
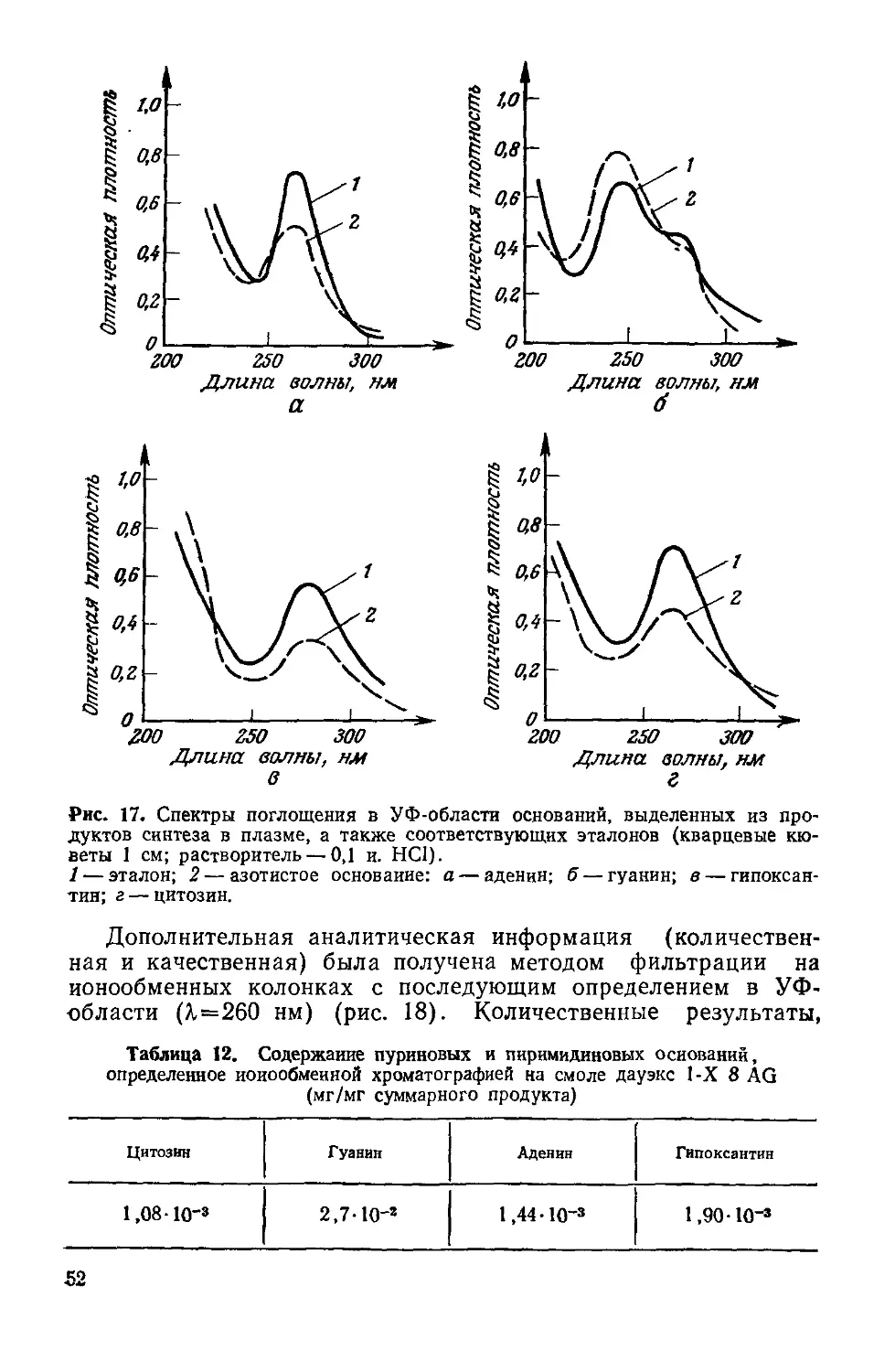
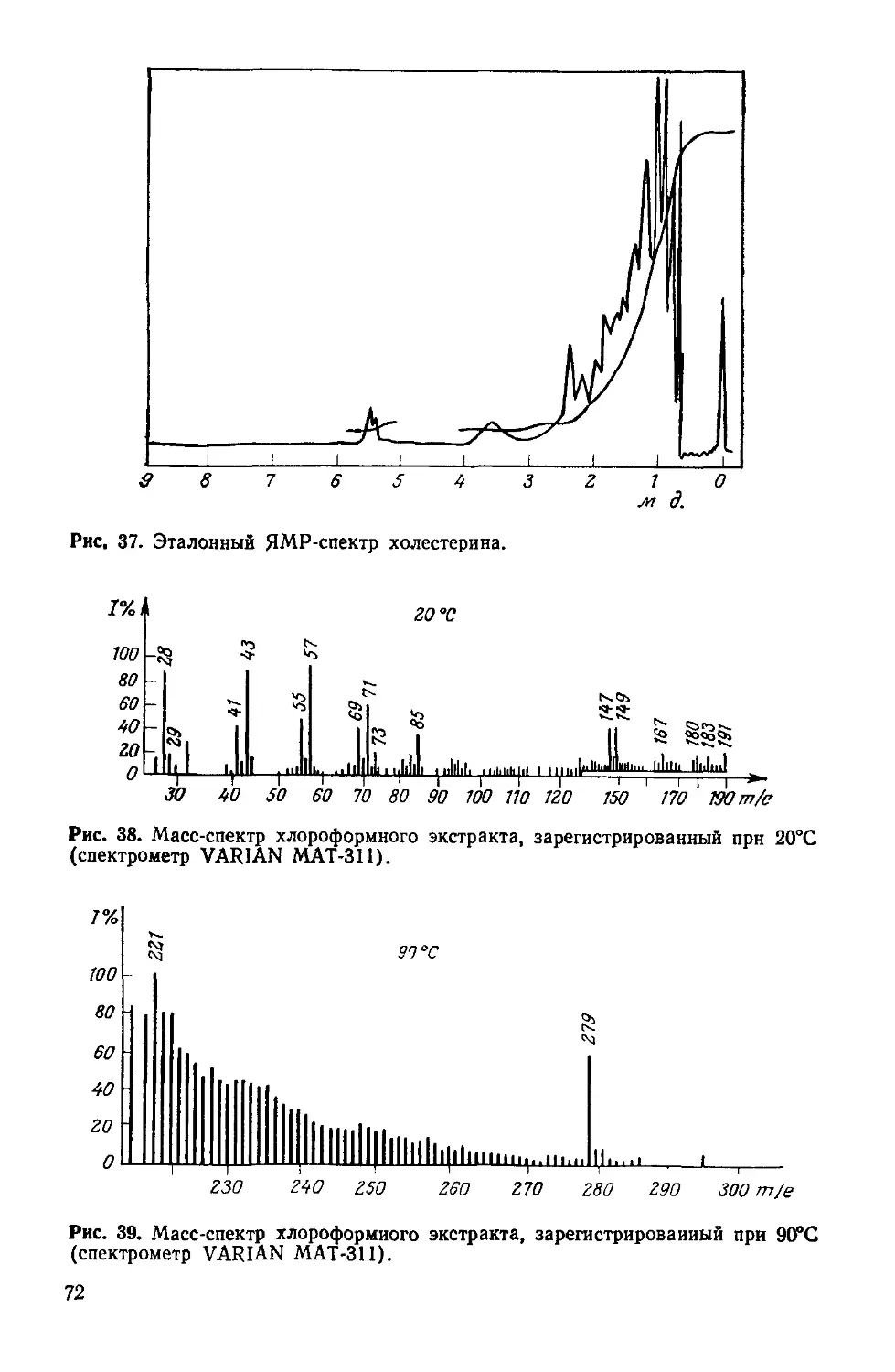
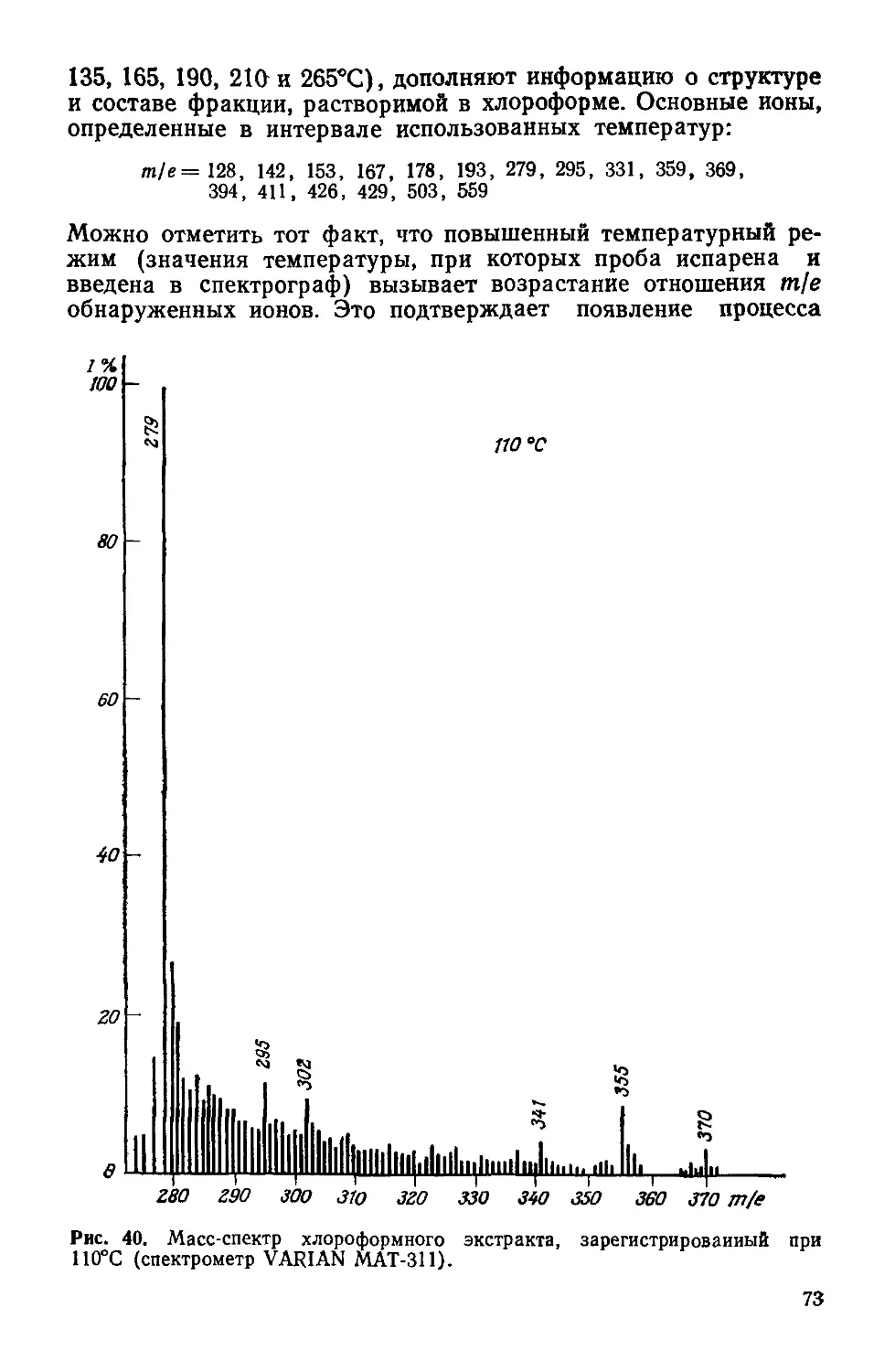
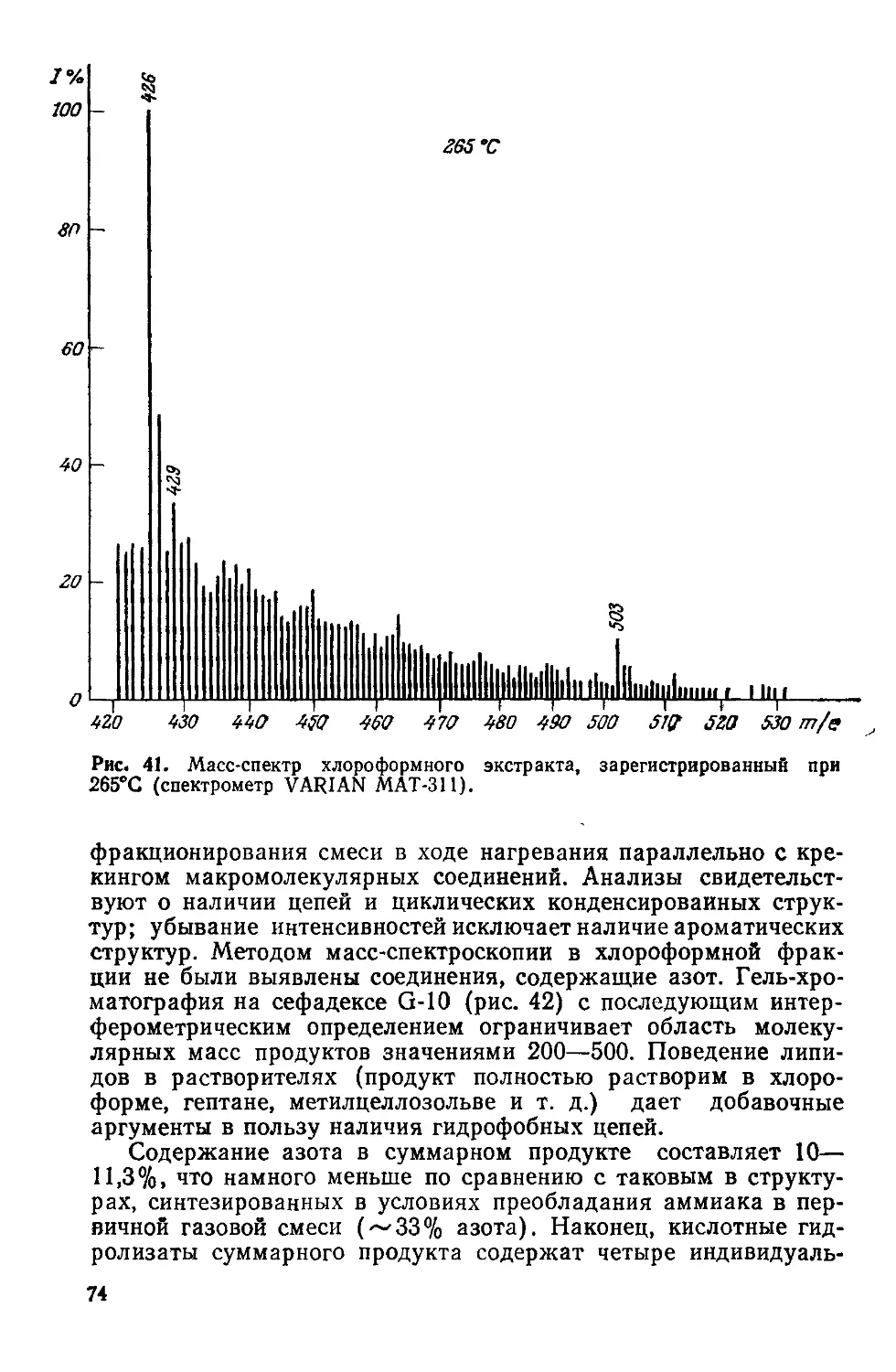
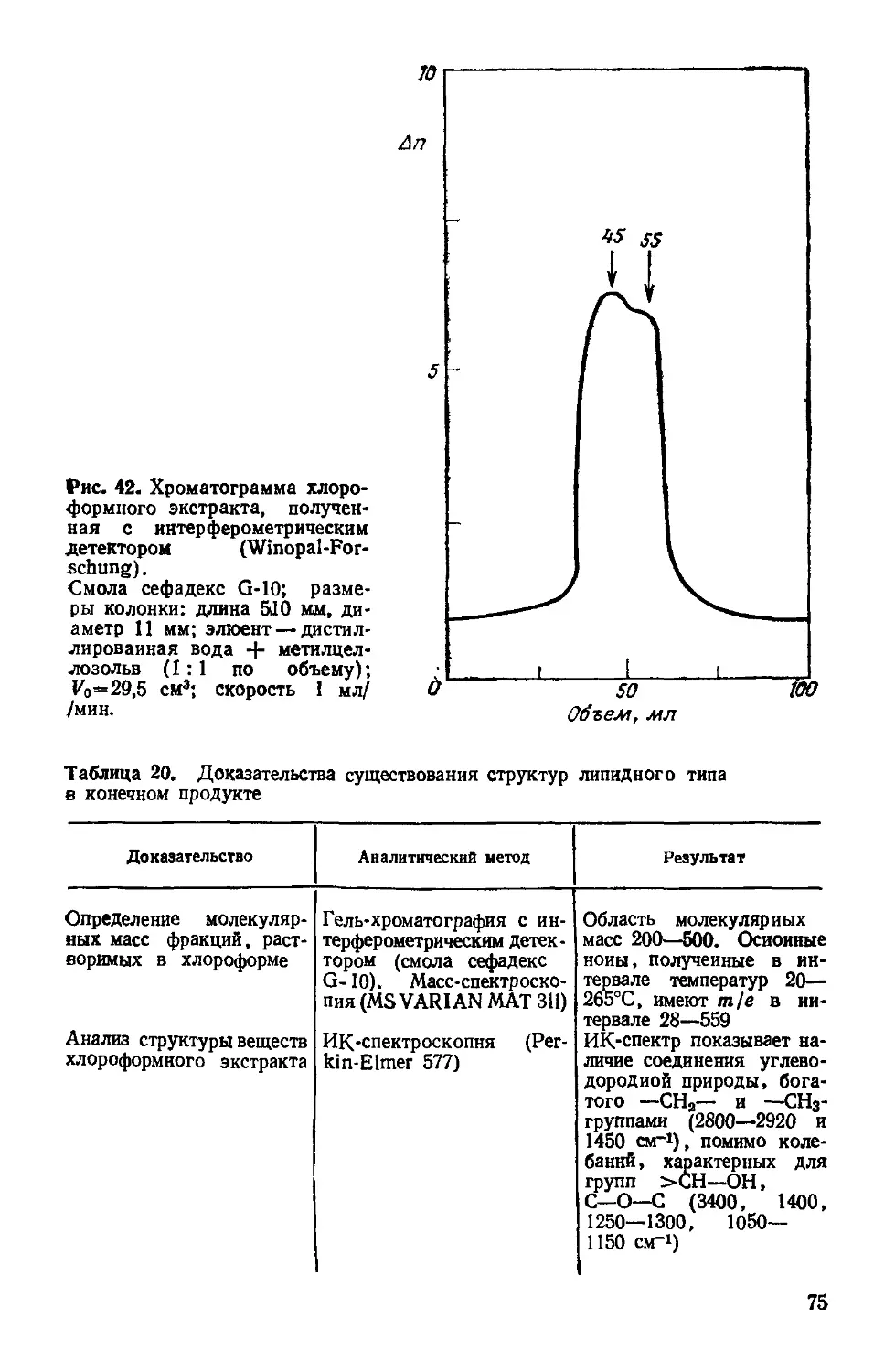
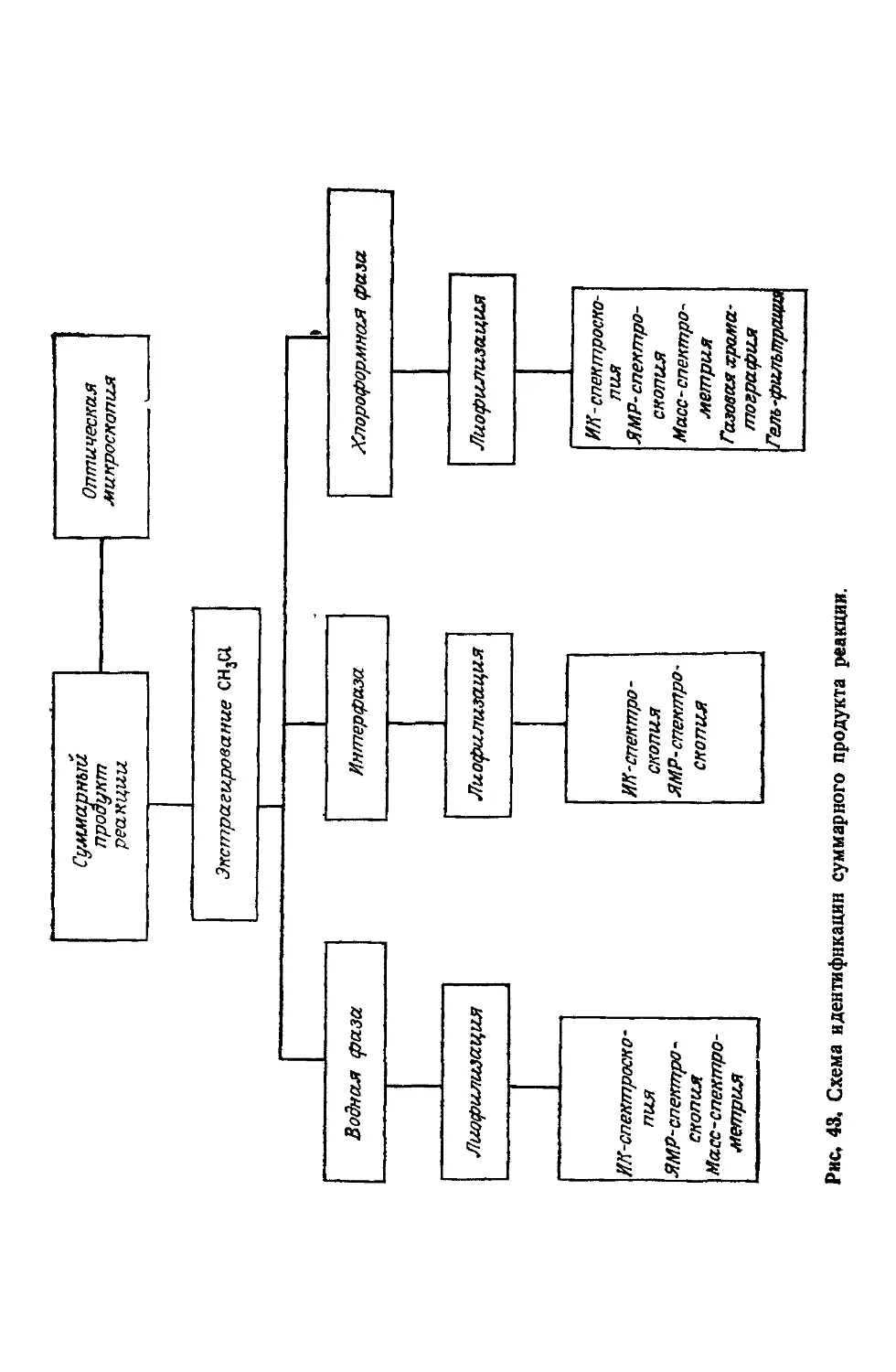
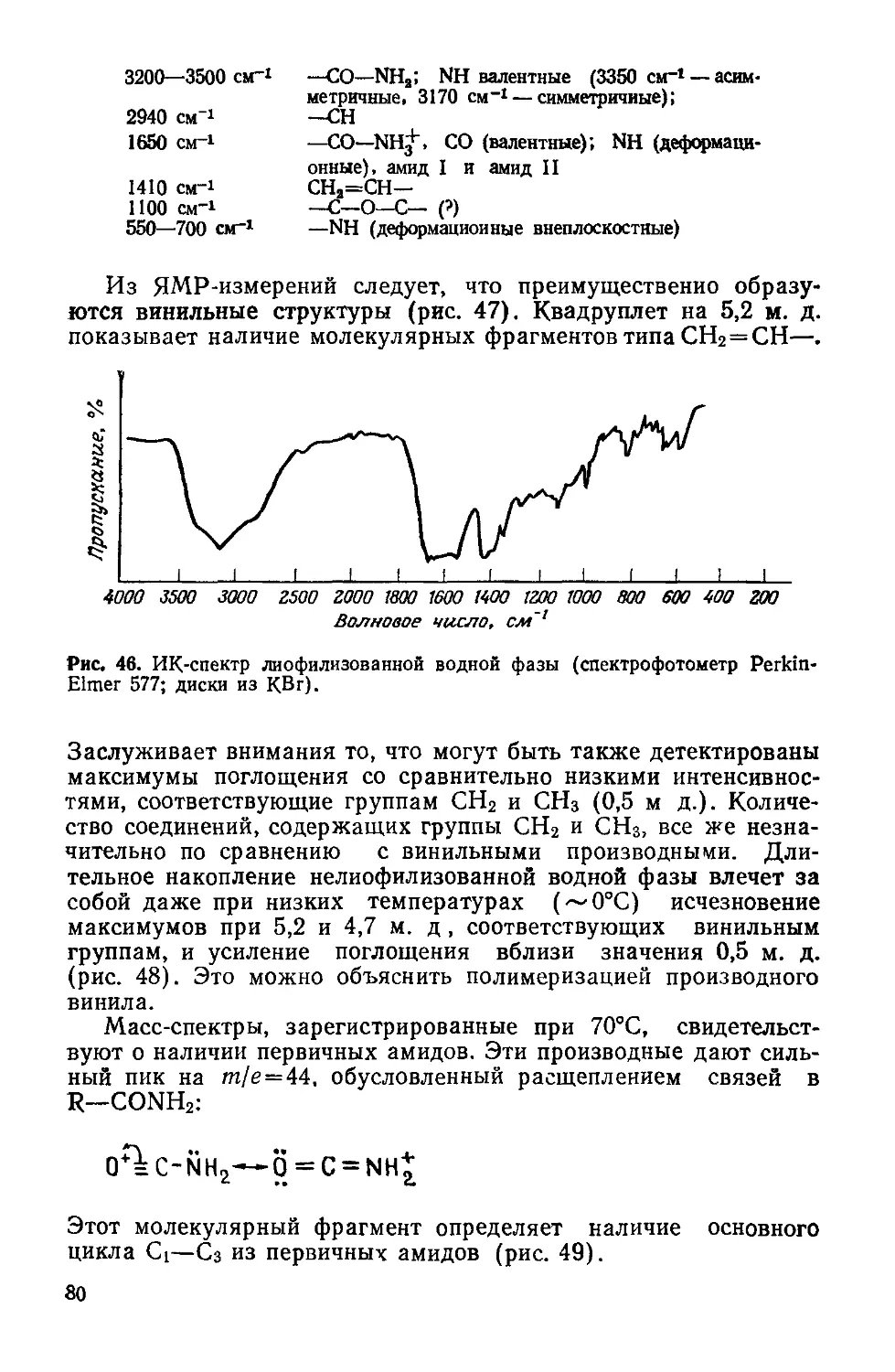
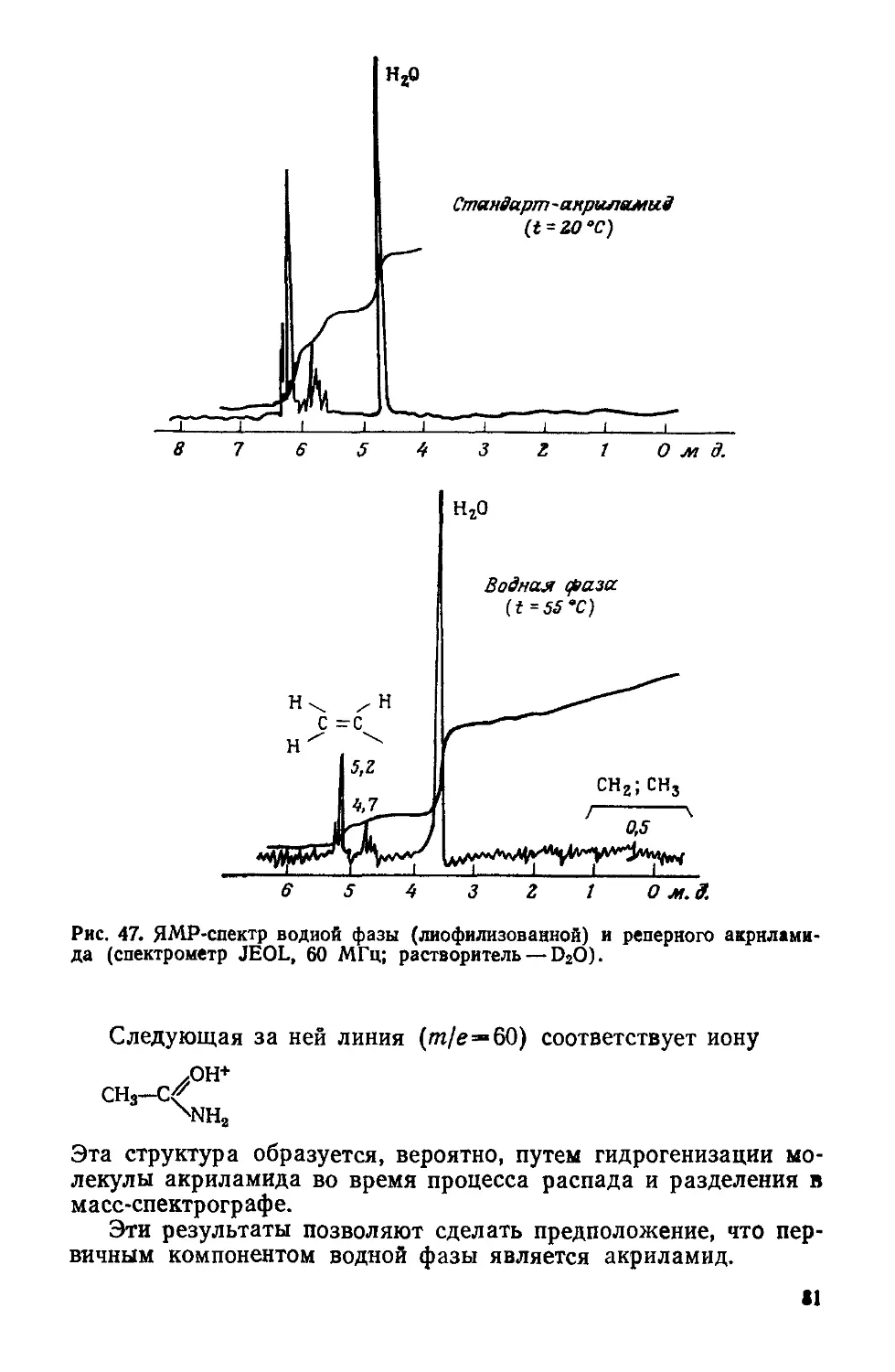
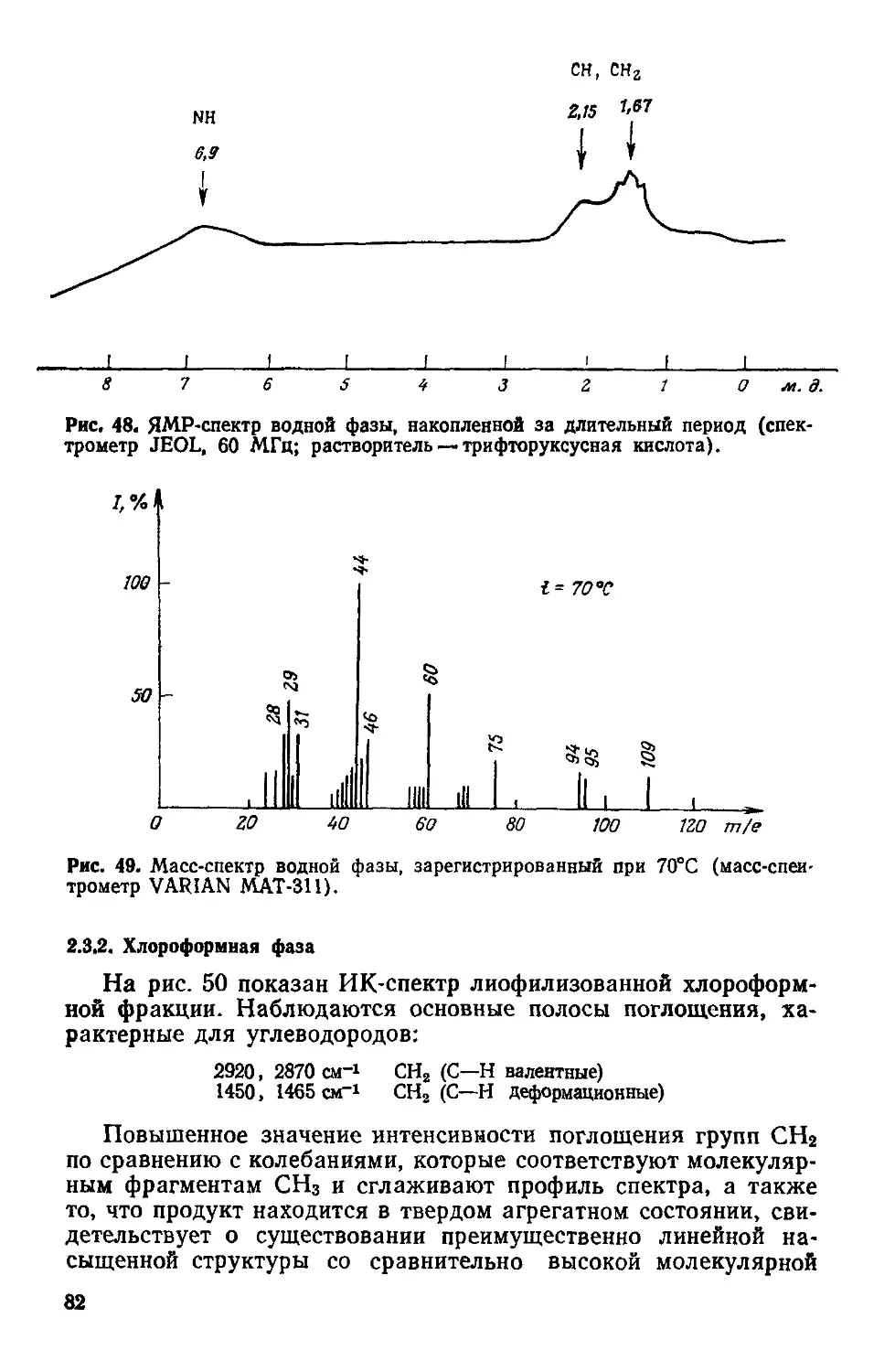
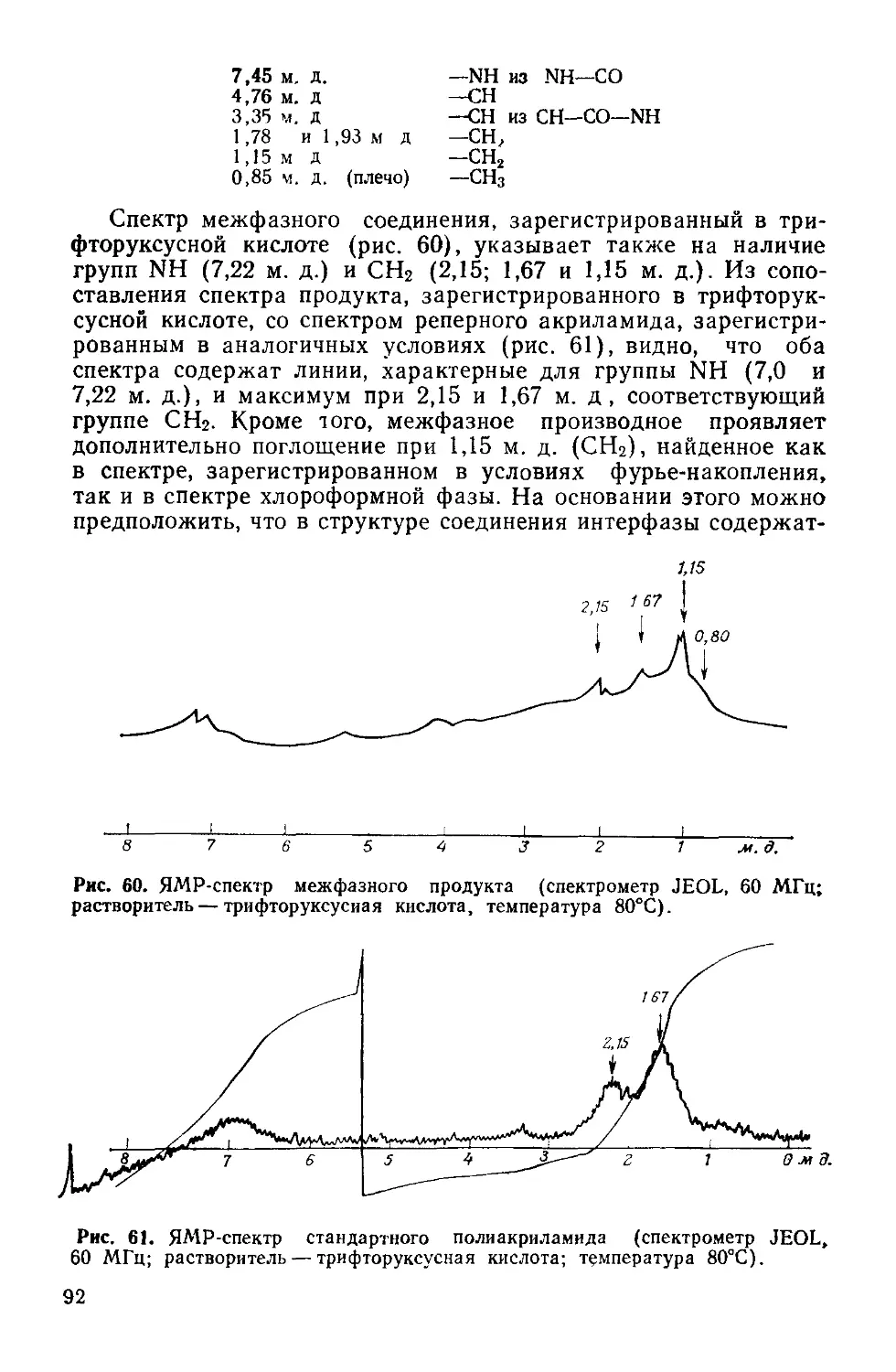
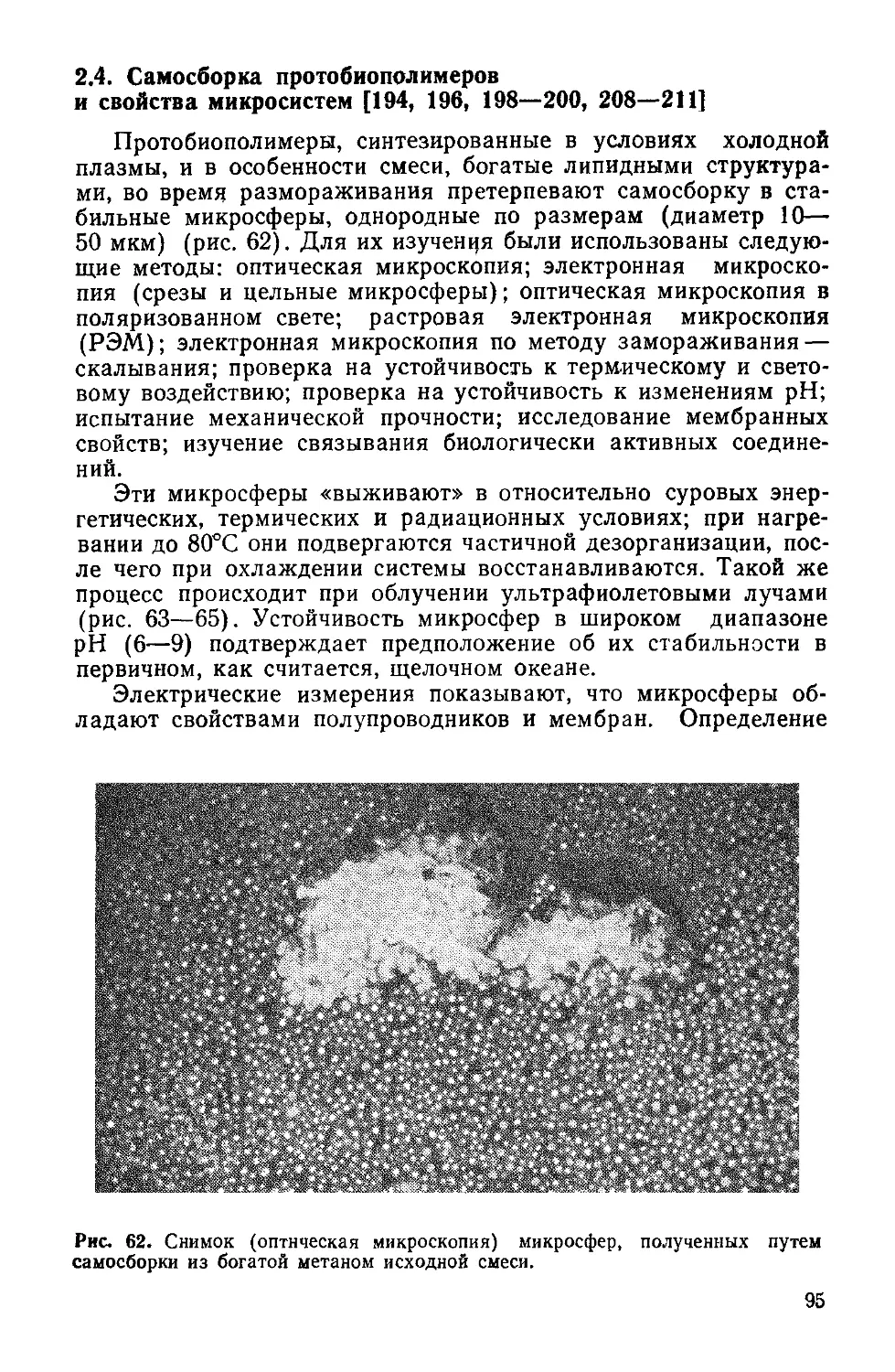
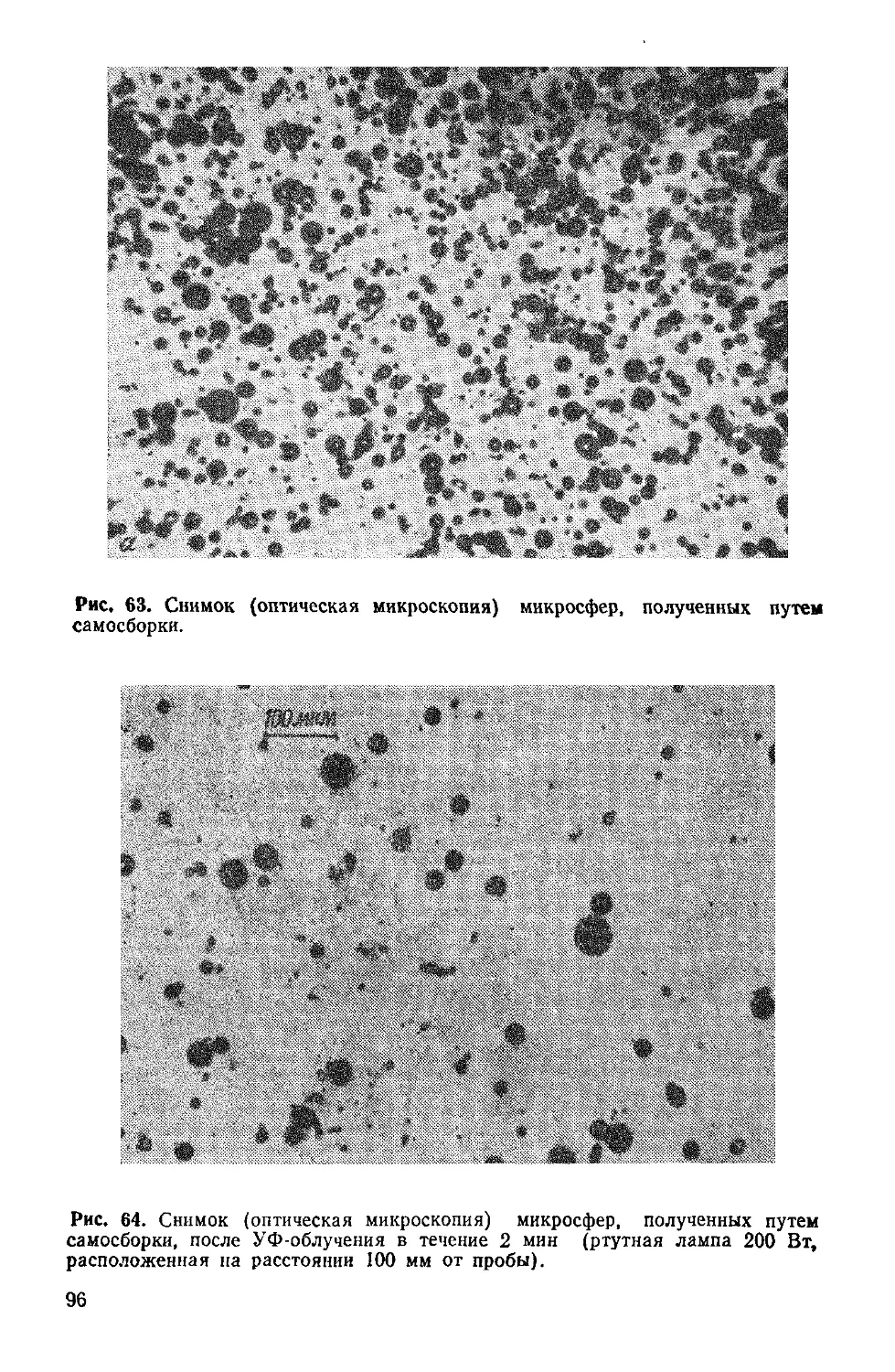
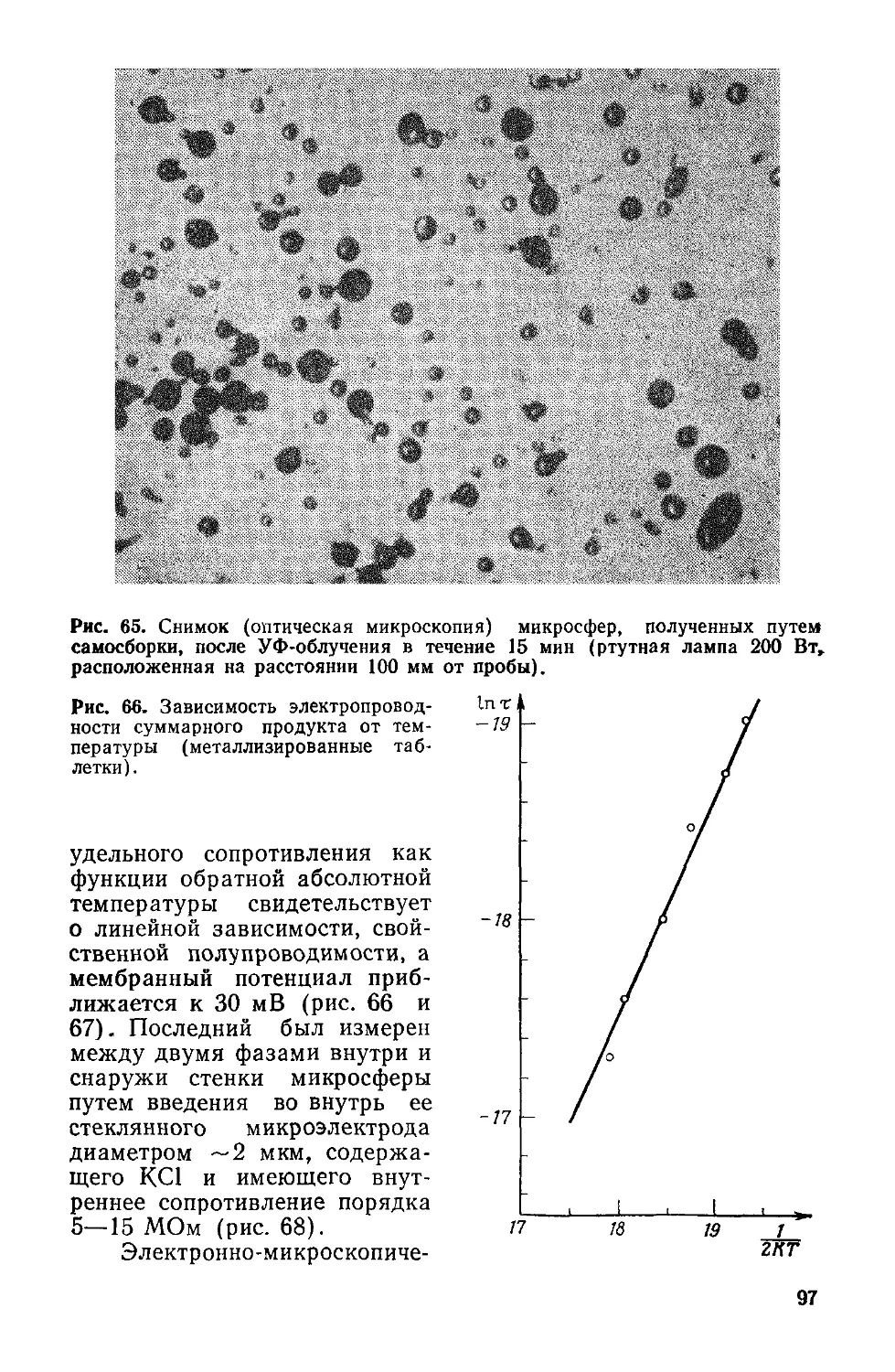
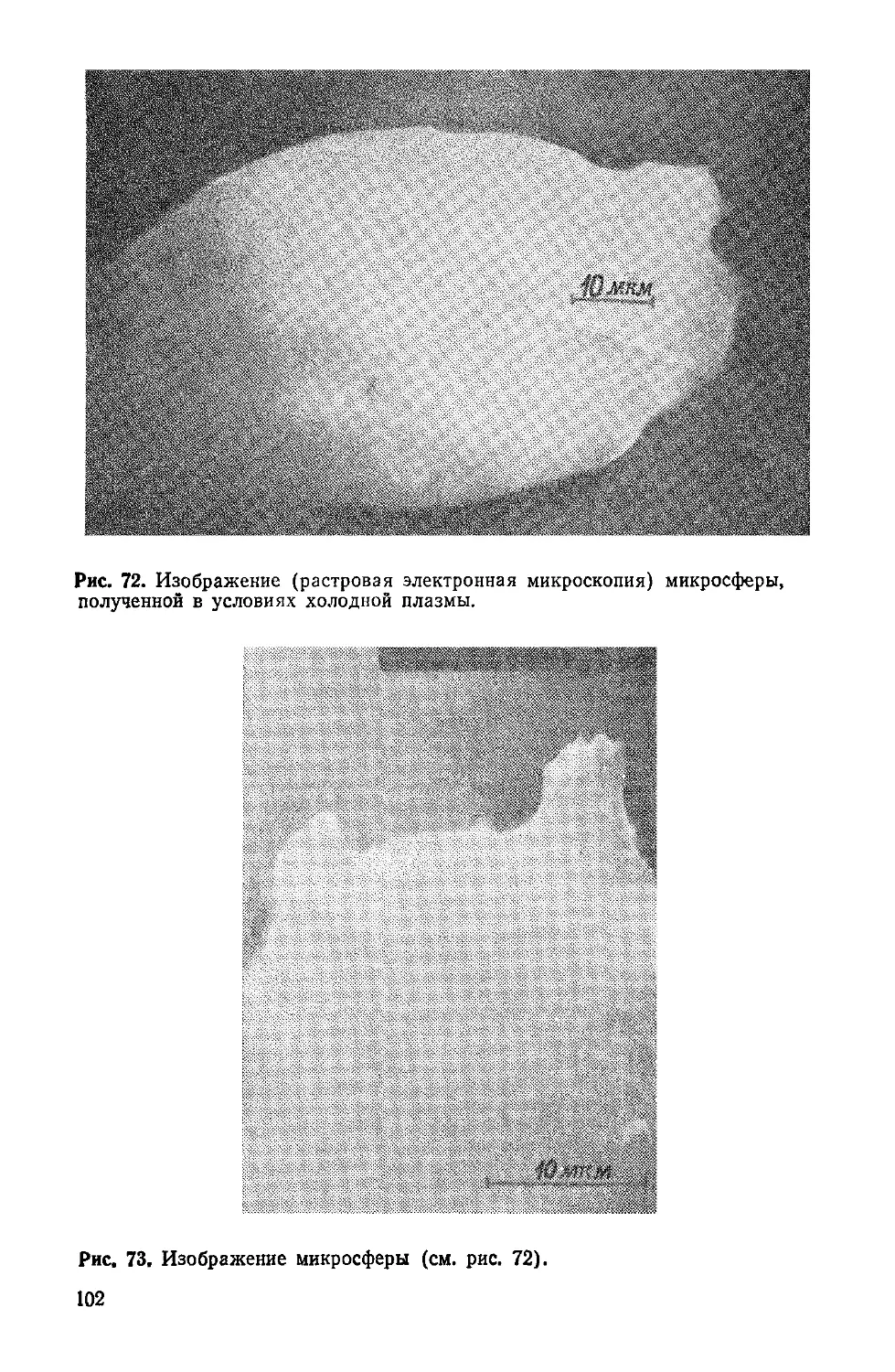
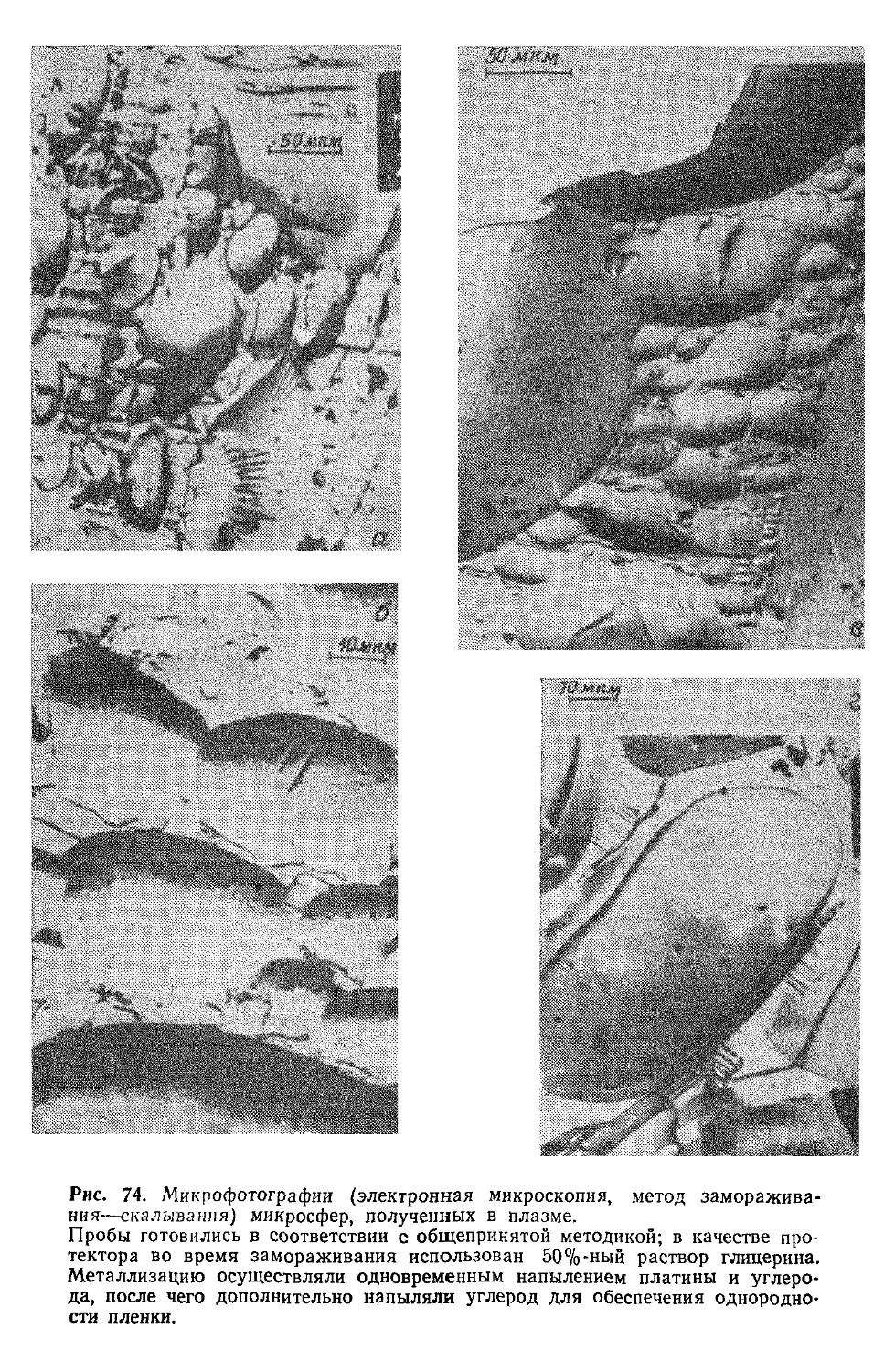
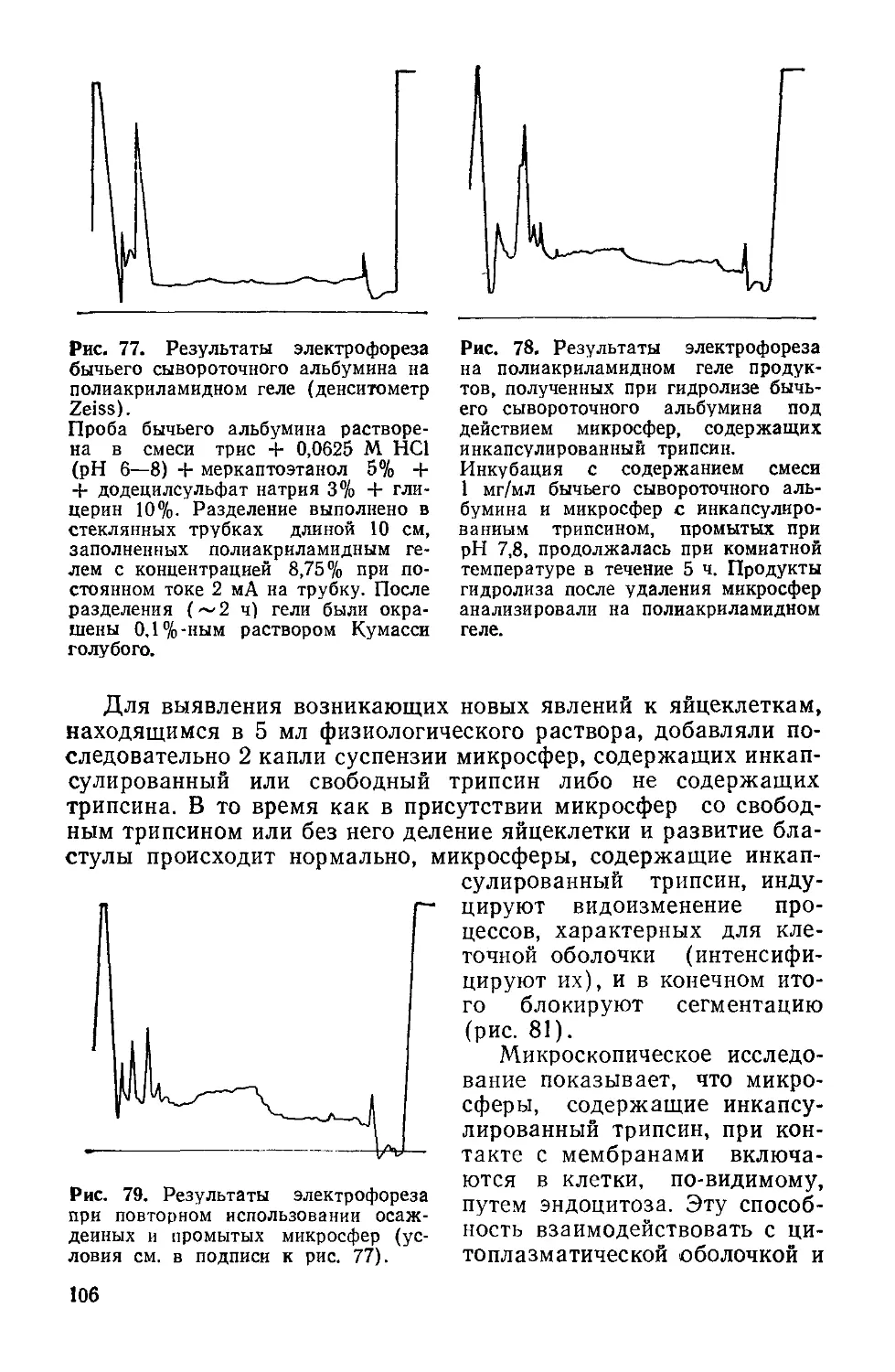
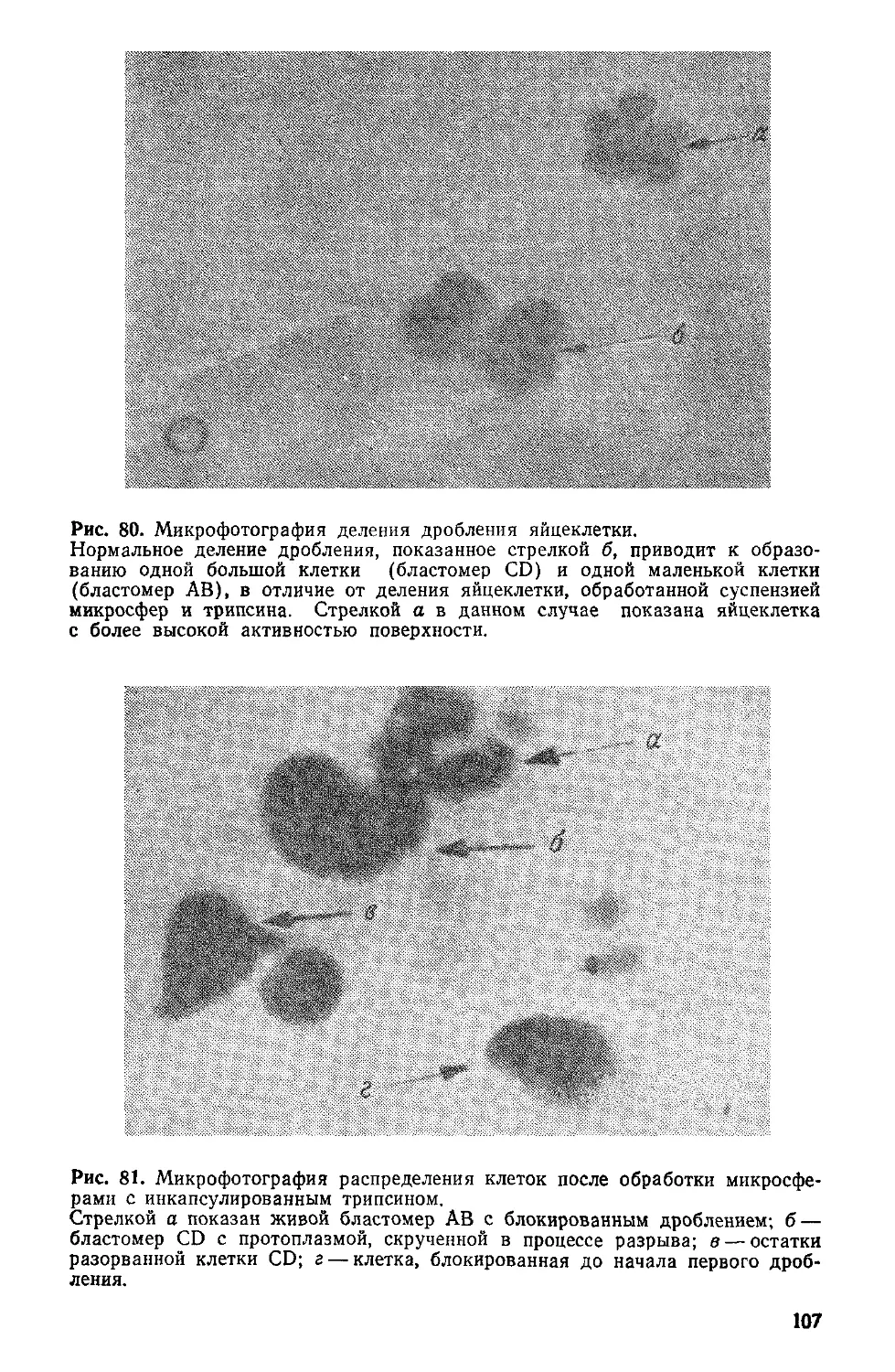
Author: Симионеску К. Денеш Ф.
Tags: биология клетки и субклеточных частиц цитология органическая химия общая биология биология биохимия биология клетки
Year: 1986
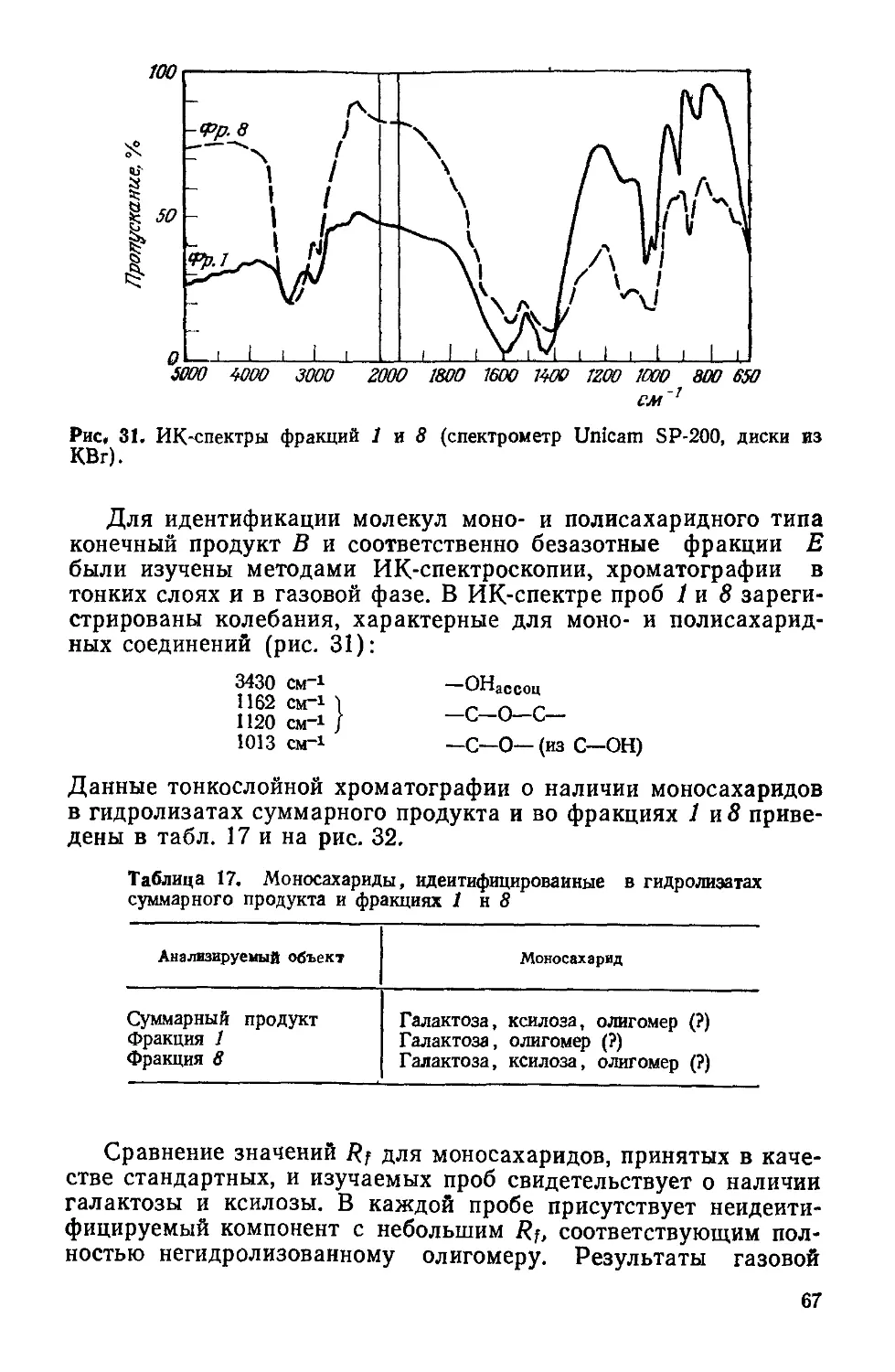
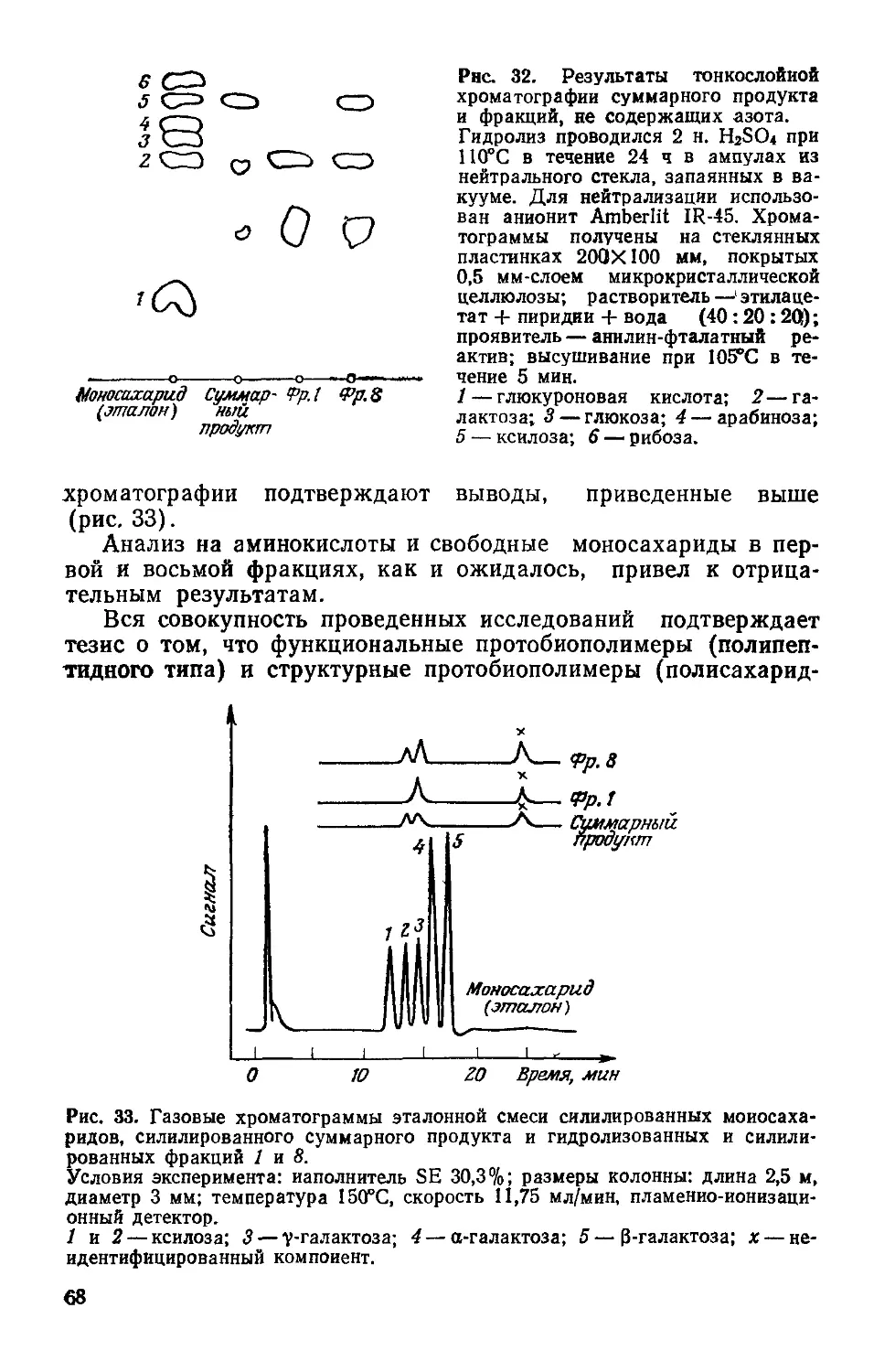
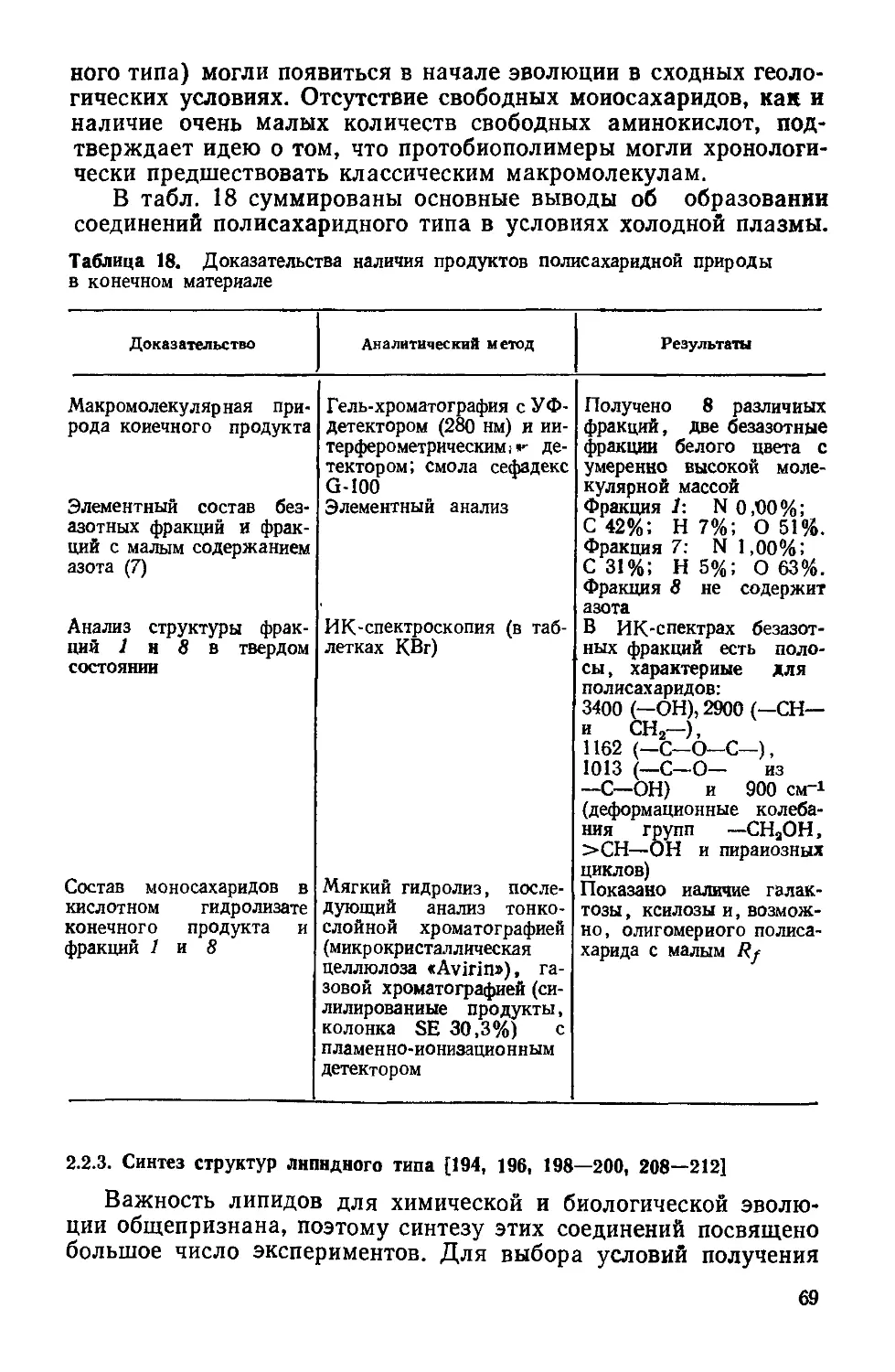
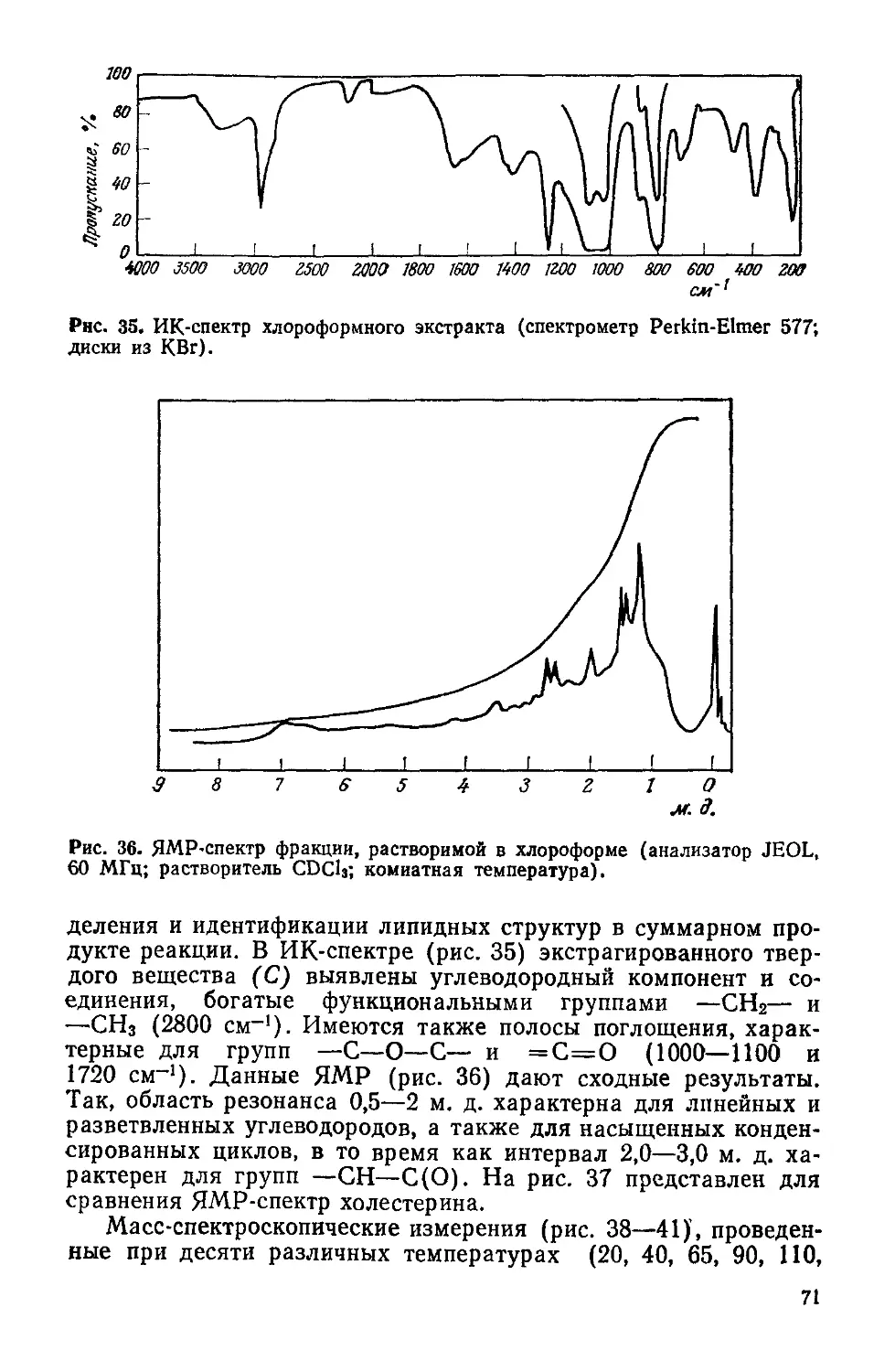
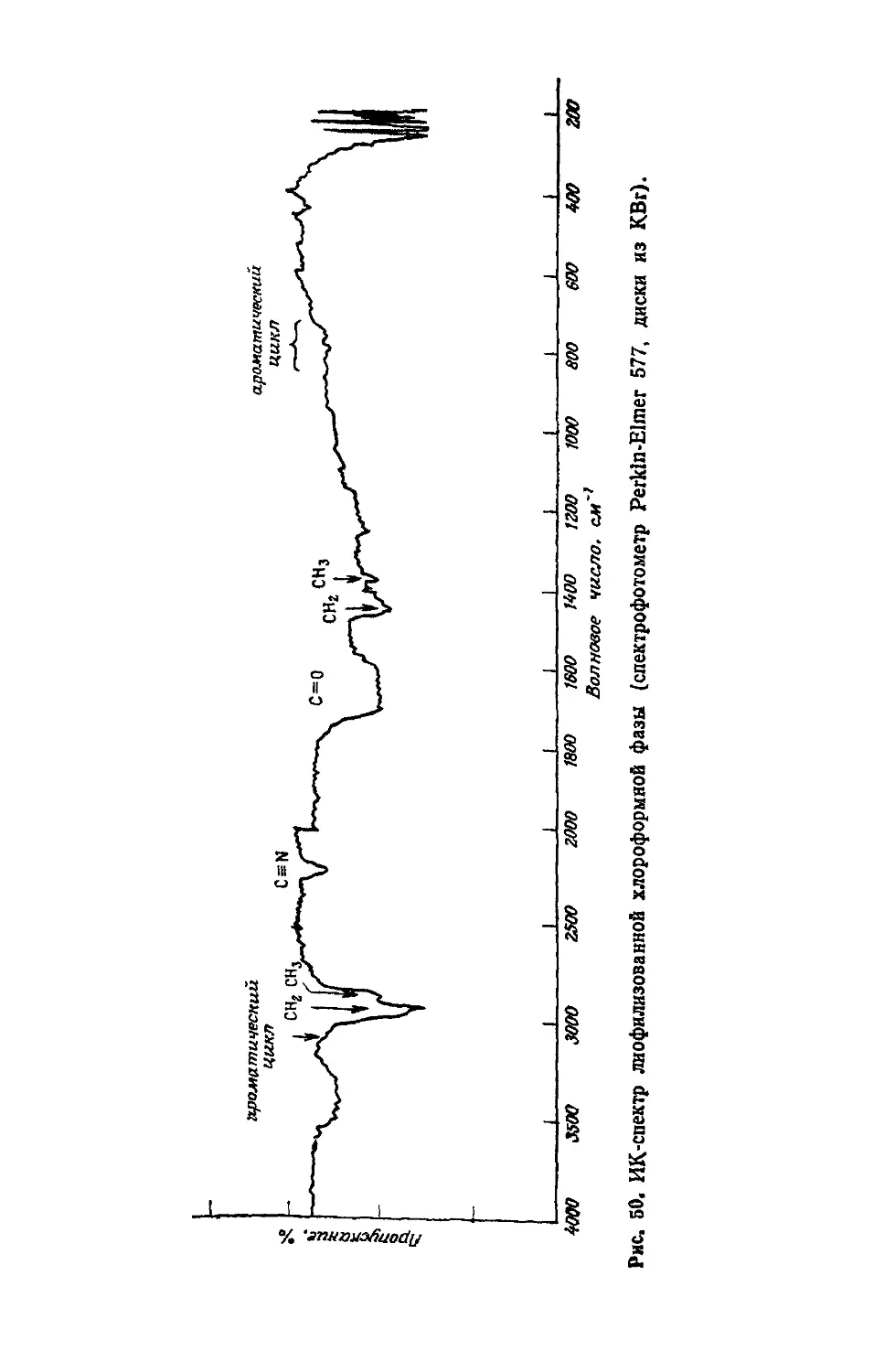
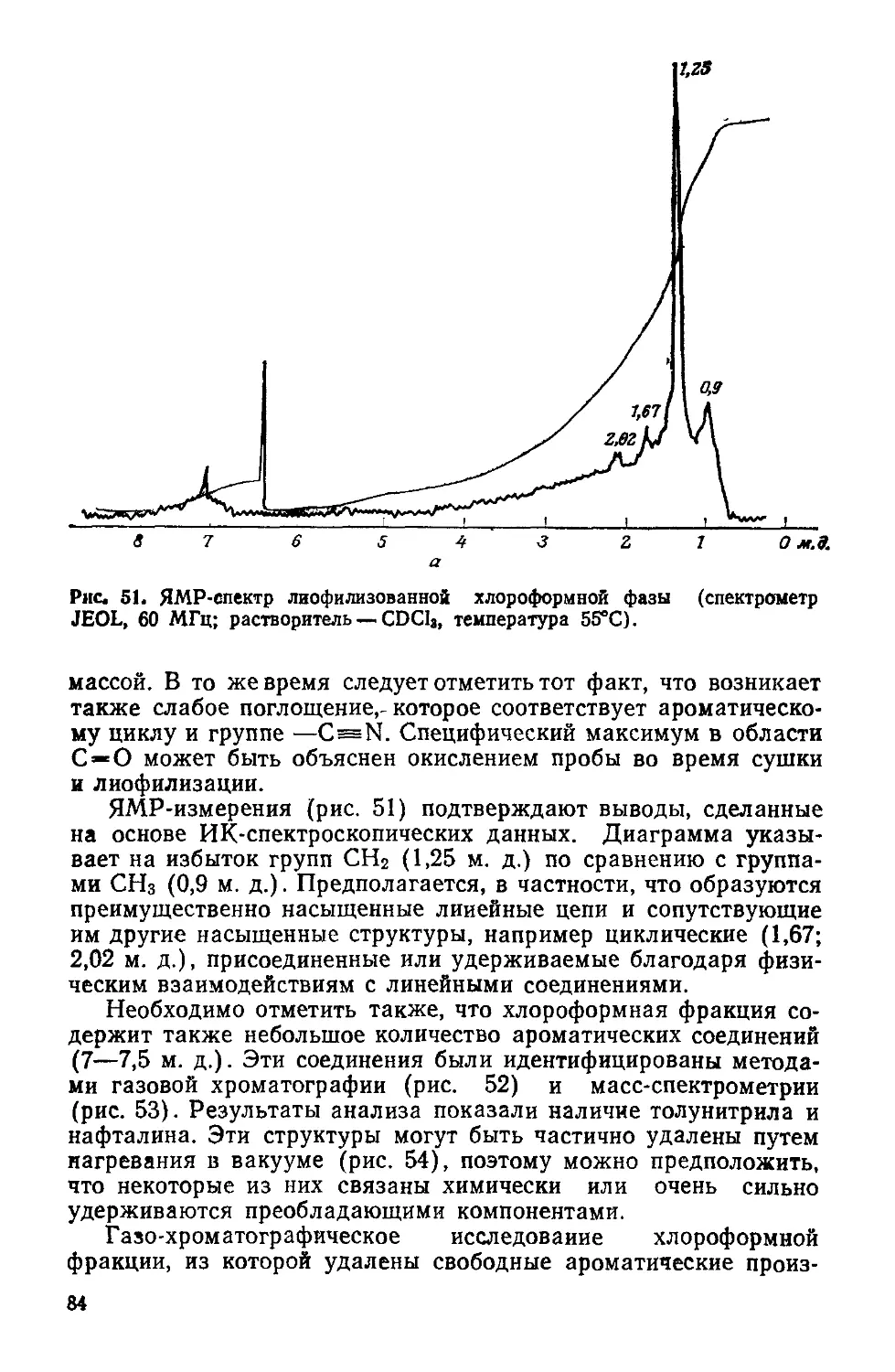
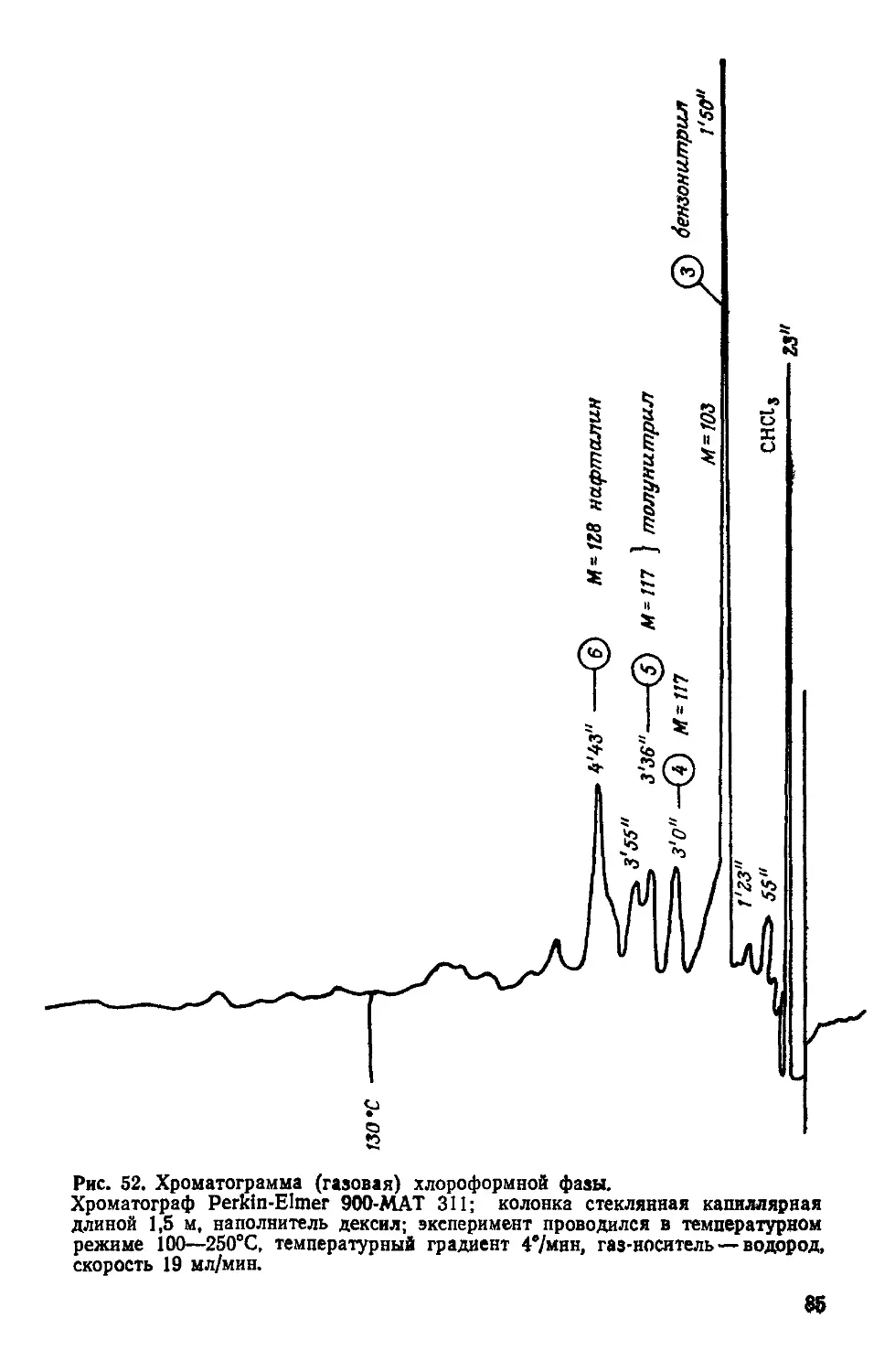
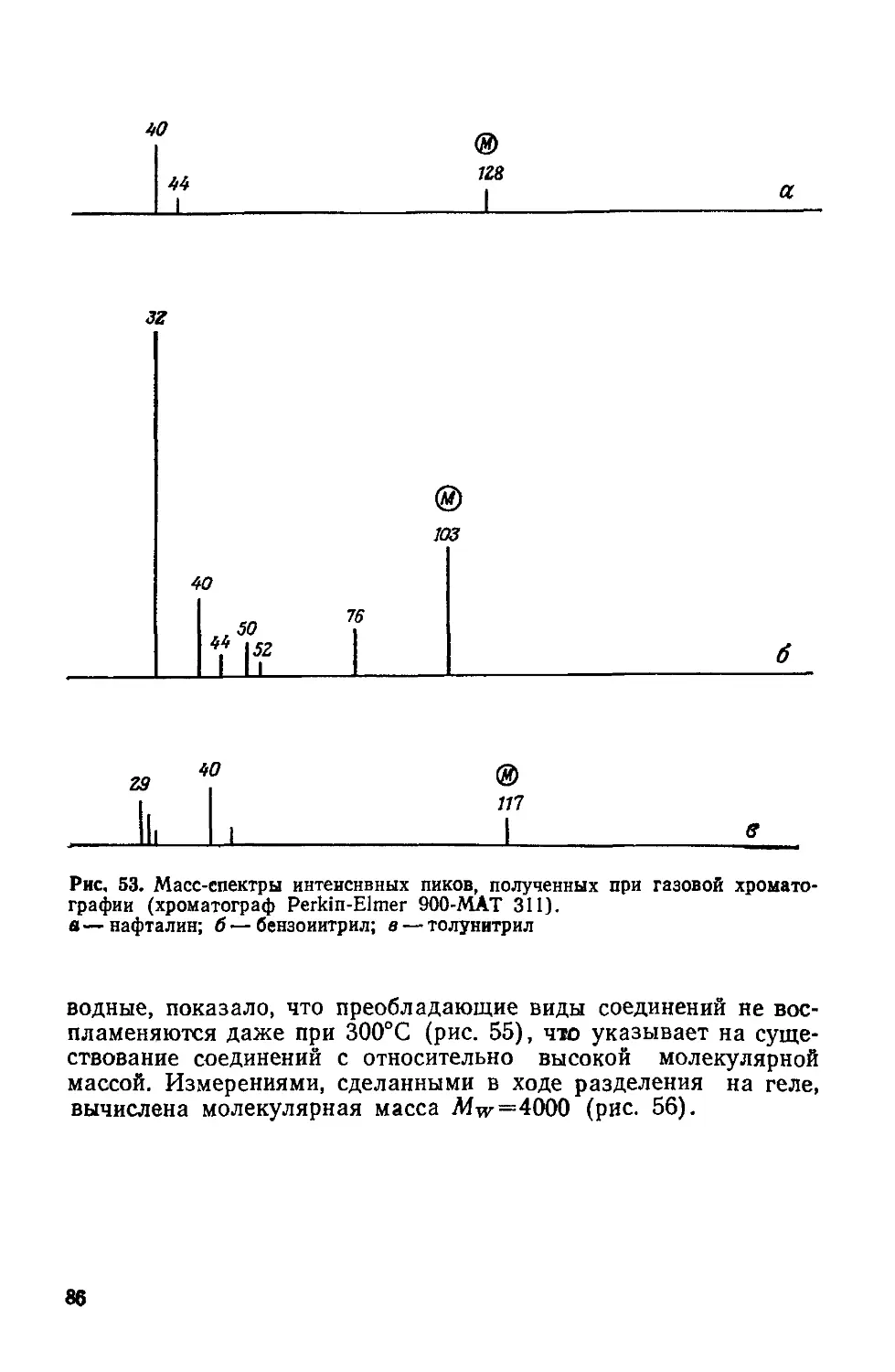
Text
К.СИМИОНЕСКУ
Ф.ДЕНЕШ
ПРОИСХОЖДЕНИЕ
ЖИЗНИ
ХИМИЧЕСКИЕ
ТЕОРИИ
С. I. Simionescu si F. Denes
Originea
vietii
Editura Academiei
Republic» Socialiste Romania
Bucurejti 1983
К.СИМИОНЕСКУ
Ф.ДЕНЕШ
ПРОИСХОЖДЕНИЕ
ЖИЗНИ
ХИМИЧЕСКИЕ
ТЕОРИИ
Перевод с румынского
чл.-корр. АН МССР И. Б. Берсукера
н И. Н. Чобана
МОСКВА «МИР»
1986
ББК 28.0
С37
УДК 576.11+547.9
Симионеску К., Денеш Ф.
С37 Происхождение жизни. Химические теории: Пер. с
румынск.— М.: Мир, 1986.—120 с., ил.
Работа известных румынских ученых посвящена химическим аспектам возник-
новения жизни. В книге критически рассматриваются современные теории, связан-
ные с синтезом протобиополимеров в абиотических условиях, и излагается ори-
гинальная теоретическая модель—низкотемпературная теория цроисхождения
живого, разработанная авторами за последние 10—15 лет.
Предназначена для широкого круга специалистов — главным образом хими-
ков и биологов различного профиля.
„ 2001040000—536
с---------------
041(01)-86
128—86, ч. 1
ББК 28.0
Редакция литературы по химии
Кристофор Снмионеску, Ференц Денеш
ПРОИСХОЖДЕНИЕ ЖИЗНИ
Химические теории
Научный редактор Н. А. Козырева. Младший редактор И А Колчин Художник И. И. Ка-
ледин. Художественный редактор М. Н. Кузьмина. Технический редактор Л. В. Рыбалко.
Корректор В. И. Киселева
ИБ № 5351
Сдано в набор 14.05.85. Подписано к печати 13.11.85. Формат 60X90'/is. Бумага кн. журн.
Печать высокая. Гарнитура литературная Объем 3,75 бум. л. Усл. печ. л. 7,50. Усл.
кр.-отт, 7,76. Уч.-изд. л. 7,69. Изд. № 3/3538. Тираж 4600 экз. Зак. 415. Цена 1 р. 20 к
ИЗДАТЕЛЬСТВО <МИР>
129820, ГСП, Москва, И-110, 1-й Рижский пер., 2
Ярославский полиграфкомбинат Союзполиграфпрома при Государственном комитете
СССР по делам издательств, полиграфии и книжной торговли.
150014, Ярославль, ул. Свободы. 97.
© перевод на русский язык, «Мир», 1986
От редакции
Проблема происхождения жизни в последние десятилетия
привлекает все большее внимание, о чем свидетельствует рост
числа публикаций на эту тему. Теоретические концепции и эк-
спериментальные попытки получения в лаборатории примитив-
ных живых систем вызывают интерес не только «узких» специа-
листов, но и самых широких кругов ученых и практиков, всех тех,
кто сколько-нибудь задумывается о сущности жизни. Решение
этой проблемы имеет огромное значение. 'Речь идет в конечном
итоге о победе материалистического мировоззрения над какими
бы то ни былг идеалистическими трактовками появления жи-
вого. i’
Предлагаемая читателям книга румынских ученых К. Си-
мионеску и Ф. Денеша посвящена химическим аспектам воз-
никновения предбиологических структур. Авторы, опирающие-
ся на концепцию академика А. И. Опарина, стоят на четких ма-
териалистических позициях, рассматривая жизнь как форму су-
ществования материи, закономерно возникающую при опреде-
ленных условиях в процессе химической эволюции. Сущность
их теории, названной «низкотемпературной», заключается как
раз в выявлении тех условий, в которых могла возникнуть
жизнь. Согласно их модели, основным источником энергии, ини-
циировавшим первоначальные химические процессы, была хо-
лодная плазма, вызывавшая образование активных частиц —
радикалов в газовой фазе при низком атмосферном давлении.
Рекомбинация активных частиц на матрицах (например, апа-
титах) привела к образованию макромолекулярных соединений
и далее к протобиополимерам, «выживанию» которых способ-
ствовало наличие на планете обширных поверхностей с низкой
температурой (например, замерзшего первичного океана). Ос-
новными компонентами первичной атмосферы были, по мнению
авторов, аммиак, метан и вода.
К такой теоретической модели К. Симионеску и Ф. Денеш
пришли на основе критического рассмотрения существующих в
этой области концепций: термической (С. В. Фокс), дегидрати-
рующих агентов (С. Поннамперума, Л. Оргел и др.), адсорбци-
онной (А. Качальский). В книге дается их обзор с указанием на
спорные места и противоречия. Подобный критический анализ
5
очень полезен, так как будит творческую мысль исследователя.
Необходимо также отметить, что в отличие от многих работ по
воссозданию протобиополимеров эксперименты авторов книги
проводятся в условиях «открытых систем». Этот подход совер-
шенно правомерен в связи с тем, что все живые системы являют-
ся открытыми, т. е. обмениваются с окружающей средой энерги-
ей, веществом и информацией.
Экспериментальные исследования, подтверждающие низко-
температурную теорию, выполнены на высоком уровне, с прив-
лечением наиболее распространенных методов исследования со-
става и структуры химических соединений: масс-спектрометрии,
инфракрасной спектроскопии, гель-хроматографии с интерферо-
метрическим и УФ-детектированием и др. В результате экспери-
ментов получены производные полипептидов, полисахаридов, ли-
пидов— протобиополимеры, склонные к самосборке в устойчи-
вые микросферы, стенки которых проявляют свойства мембран,
обладают фотовозбудимостью и определенными электрическими
свойствами. Микросферы могут селективно удерживать биологи-
чески активные соединения, благодаря чему развивается их ка-
талитическая активность. Этот процесс авторы рассматривают
как первый шаг в эволюционной цепи самоорганизации материи.
Работы К. Симионеску и Ф. Денеша, выполненные в пос-
ледние 15 лет, впервые публикуются на русском языке в систе-
матизированном виде. И теоретическая модель низкотемпера-
турной теории и ее экспериментальные подтверждения вызовут
несомненный интерес советских ученых, занимающихся проб-
лемой происхождения жизни.
Предисловие
Возникновение жизни — проблема, давно волнующая чело-
веческий разум и в последние три десятилетия привлекающая
внимание все большего числа исследователей. Теоретические
концепции А. И. Опарина и Дж. Б. Холдейна впервые получили
подтверждение в экспериментах Миллера и Юри и стимулиро-
вали становление первых научных школ по изучению молеку-
лярной эволюции.
В данной работе, имеющей оригинальный характер и явля-
ющейся плодом более чем десятилетних систематических иссле-
дований, приводятся убедительные аргументы в пользу материа-
листической концепции происхождения жизни. После короткого
исторического экскурса, в котором обобщены современные
теории, критически излагаются основные соображения по выяв-
лению новых путей в изучении молекулярной эволюции. В основе
книги лежит разработанная авторами модель происхождения
жизни, названная низкотемпературной теорией (теорией осты-
вания). Вначале рассмотрены характеристики состояния пер-
вичной Земли (атмосфера, гидросфера, литосфера, энергетичес-
кие ресурсы), которые поддаются экспериментальному модели-
рованию. Особое внимание уделено холодной плазме и низким
температурам как факторам, однозначно определяющим обра-
зование молекулярных соединений из газов первичной атмосфе-
ры. Дается обоснование выбора экспериментальной лаборатор-
ной модели, которая удовлетворяет требованиям синтеза пред-
шественников живой материи.
Основные положения теоретической модели — одновремен-
ное появление протобиополиме^ов и самосборка этих макромо-
лекулярных структур в упорядоченные надмолекулярные обра-
зования— убеждают нас в возможности воспроизведения в ла-
боратории протоклеток с ферментативной активностью и спо-
собностью к самосборке, которые могут служить потенциальны-
ми предшественниками биомембран. В то же время в результа-
те экспериментов выявляются главные этапы химической эволю-
ции: образование соединений типа полипептидов, полисахари-
дов и липидов, являющихся основой нуклеиновых кислот, угле-
водородов, порфириновых структур и т. д.
В библиографии приведены наиболее существенные (из
7
опубликованных до настоящего времени) работы в этой области,
что должно помочь читателю составить себе ясное представле-
ние о деятельности разных школ по изучению молекулярной
эволюции и ознакомиться с положениями, которые доказывают
правильность диалектико-материалистического представления о
бытии.
Эта первая оригинальная работа по проблеме возникновения
жизни, выполненная в Социалистической Республике Румынии,
свидетельствует о высоком уровне, которого достигла наука в
нашей стране, и стимулирует разработку сложнейших проблем
познания окружающей действительности.
Авторы
I
Современное состояние
проблемы происхождения жизни
Как возникла жизнь? Это один из главных вопросор, на ко-
торые человечеству еще не удалось ответить. Естественнонауч-
ные попытки объяснить происхождение жизни долгое время рас-
сматривались как метафизические. Позже появились разные
теории, объясняющие генезис живых систем, такие, как само-
зарождение, витализм, молекулярная теория (теория «голого
гена») и т. д., которые впоследствии были опровергнуты. Затем
распространилась идея о том, что жизнь попала на Землю с дру-
гих планет. Согласно этой концепции, известной под названием
панспермии, зародыши внеземных организмов под влиянием
разных сил попали на Землю из других солнечных систем. Одна-
ко аргументы панспермии нельзя считать решением проблемы
происхождения жизни, так как по существу она переносит воп-
рос из одного места Вселенной в другое. Хотя два аспекта — ге-
незис и существование живых организмов во Вселенной — тес-
но связаны между собой, фундаментальной проблемой научно-
го исследования остается происхождение жизни. Если мы пой-
мем, что произошло на нашей планете, то сможем представить
себе зарождение жизни в любой части Вселенной.
Путем научных экстраполяций можно установить условия,
существовавшие на первичной Земле (атмосфера, литосфера,
энергетические ресурсы и т. д.), и путем их имитации прове-
рить основные факторы, которые тогда действовали, за исклю-
чением времени. Почти все экспериментальные модели изучают
последовательность событий на неорганической Земле. Однако
для точного воспроизведения зарождения «первоначальных жи-
вых систем» потребовались бы миллиарды лет. В лабораторных
же экспериментах приходится «сжимать время».
Хотя за последние десятилетия вопрос, как возникла жизнь,
доминировал в познавательном процессе, долгое время исследо-
вания в этой области считались бесперспективными. Сегодня
воссоздание условий, в которых возникли первые «зародыши
жизни», имеет принципиальное значение для науки. Велика за-
слуга А .И. Опарина, в 1924 г. предложившего первую концеп-
цию химической эволюции, согласно которой в качестве отправ-
ной точки в лабораторных экспериментах по воспроизведению
условий первичной Земли предлагалась бескислородная ат-
мосфера.
9
В 1953 г. Г. К. Юри и С. Л. Миллер подвергли смесь мета-
на, аммиака и воды действию электрических разрядов. Впервые
с помощью такого эксперимента среди полученных продуктов
были идентифицированы аминокислоты (глицин, аланин, аспа-
рагиновая и глутаминовая кислоты).
Из подобных попыток отметим еще одну, на которую обычно
мало обращают внимания. Имеются в виду опыты Мелвина
Кальвина (1951), в которых путем облучения в циклотроне не-
которой смеси газов были получены различные органические со-
единения. Среди них—муравьиная кислота и формальдегид, по-
следнее соединение является прямым предшественником биопо-
лимеров. Если бы в смесь газов было введено немного метана,
аммиака или азота, мы бы обсуждали теперь приоритет экспе-
риментов М. Кальвина, а не Миллера и Юри. Однако именно
опыты последних стимулировали исследования молекулярной
эволюции и происхождения жизни во многих лабораториях и
привели к систематическому изучению, в ходе которого синтези-
рованы биологически важные соединения. Основные условия на
первобытной Земле, принятые во внимание, приведены в табл. 1.
Таблица 1. Условия на первобытной Земле
Первичная литосфера
В молекулярной эволюции только кора Земли сыграла важную роль. Состав
коры: Al, Са, Fe, Mg, Na, К и др.
Уровень геологических знаний не позволяет сделать убедительных выводов
об изменении во времени состава земной коры.
Первичная гидросфера
На поверхности первичной Земли находилось менее 1/10 объема воды се-
годняшних океанов [1, 2].
Среда воды первичного океана слабощелочная (pH 8—9).
Первичная атмосфера
Первая атмосфера Земли состояла из водорода, который «ушел» в косми-
ческое пространство; вторая (известная как первичная) образовалась из вулкани-
ческих газов.
Было предложено три основных состава первичной атмосферы:
Восстановительная Слабоокнслнтельная Нейтральная
СН4, NH3, Н2О, Н2 СО2, СН4, NH3, n2, н2о ch4, n2, Н2О
(с высоким содержа- (с низким содержанием NH3)
нием NH3)
Есть также предположение о составе атмосферы, содержащей, кроме того.
СО, H2S н РН3.
Давление, как и количественный состав атмосферы, трудно рассчитать.
Оценки, сделанные с учетом «парникового» эффекта, весьма произвольны.
10
Продолжение табл. 1
Запасы свободной энергии иа первичной Земле [16] (оценочные данные)
Главные источники энергии Солнечное излучение Излучение с длиной волны до 200 нм (ультрафио- летовое) Радиоактивность (нз глубины 35 км под корой) Вулканическое тепло Электрические разряды Необходимо также учесть космические лучи и удары Количество энергии, кал-см-2-год-1 17000 30 47 0,15 4 метеоритов
Температура на поверхности первичной Земли
Расчеты, в которых приняты во внимание «парниковый эффект», а также
приблизительная интенсивность солнечной радиации в абиотическую эру [3], при-
вели к значениям на несколько десятков градусов выше температуры замерзания.
Почти все эксперименты по воссозданию условий первичной Земли выполнены
прн температурах 20—200°С. Эта пределы были установлены не путем расчетов
или экстраполяции некоторых теологических данных, а скорее всего с учетом
температурных границ устойчивости органических соединений.
Температуры выше 100°С прн нормальном атмосферном давлении и особенно
свыше 374°С (критическая точка для воды) привели бы к полному испарению
океанов (независимо от давления) и очень быстрому гидролизу всех продуктов
поликонденсации органических соединений. Прн температурах >200°С органиче-
ские структуры неустойчивы, в то время как очень низкие температуры не вы»
зывают их разрушения.
Использование различных смесей газов, подобных газам пер-
вичной атмосферы, различных видов энергии, которые были ха-
рактерны для нашей планеты 4—4,5- 10э лет тому назад, и учет
климатических, геологических и гидрографических условий того
периода позволили во многих лабораториях, занимающихся воз-
никновением жизни, найти доказательства путей абиотического
возникновения таких «микромолекул», как альдегиды, нитриты,
аминокислоты, моносахариды, пурины, порфирины, нуклеотиды
и т. д. (табл. 2).
Возникновение протобиополимеров представляет собой более
сложную проблему. Необходимость их существования во всех
живых системах очевидна. Они ответственны за протофермен-
тативные процессы (например, гидролиз, декарбоксилирование,
аминирование, дезаминирование, перекисное окисление и т. д.),
за некоторые весьма простые процессы, как, например броже-
ние, и за другие, более сложные, например фотохимические реак-
ции, фотофосфорилирование, фотосинтез и т. д.
Наличие воды на нашей планете (первичный океан) и необ-
ходимость ее присутствия во всех живых организмах обуслови-
ли термодинамический барьер на пути возникновения протобио-
11
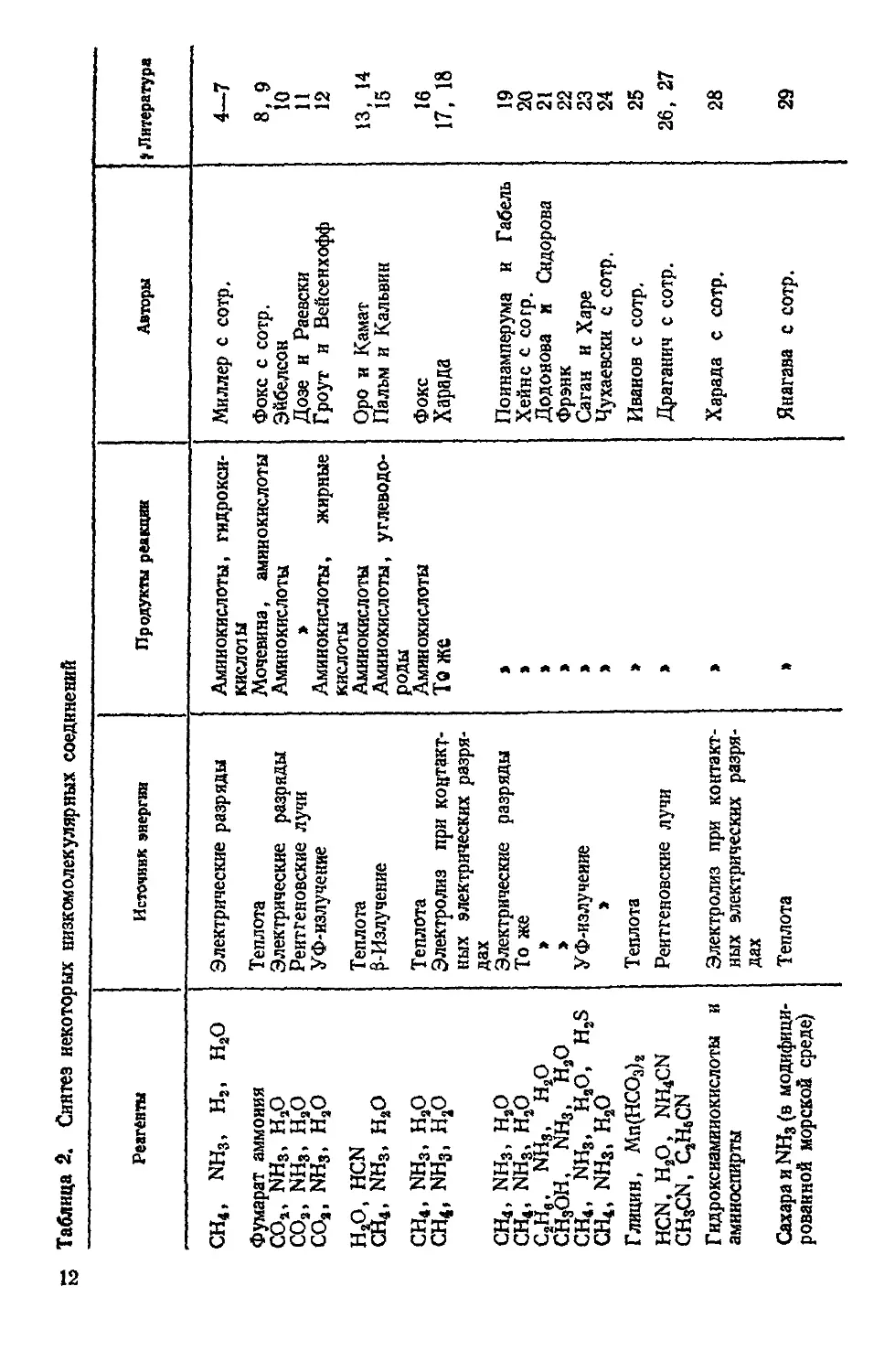
— Таблица 2. Синтез некоторых низкомолекулярных соединений
Реагенты Источник энергии Продукты реакции Авторы $ Литература
СН4, NH3, На, Н2О Электрические разряды Аминокислоты, гидрокси- кислоты Миллер с сотр. 4—7
Фумарат аммония Теплота Мочевина, аминокислоты Фокс с сотр. 8, 9
СОг> NH3> HSO Электрические разряды Аминокислоты Эйбедсон 10
СОа, NH3, НаО СОа, NH3, НаО Рентгеновские лучи > Дозе и Раевски 11
УФ-излучение Аминокислоты, жирные кислоты Гроут и Вейсенхофф 12
НаО, HCN Теплота Аминокислоты Оро и Камат 13, 14
СН4, NH3, НаО ^-Излучение Аминокислоты, углеводе- Пальм и Кальвин 15
СН4, NH3, НаО Теплота роды Аминокислоты Фокс 16
СН4, NH3, HjO Электролиз при контакт- ных электрических разря- дах Те же Харада 17, 18
CH!, NH3, HaO Электрические разряды > Поинамперума и Габель 19
CH4, NH3, НаО То же > Хейнс с corp. 20
C2He, NH3, НаО СН3ОН, NH3, НаО » > Додонова и Сидорова 21
» » Фрэнк 22
СН4, NH3, НаО, HaS УФ-излучеиие » Саган и Харе 23
СН4, NH3, нао > > Чухаевски с сотр. 24
Г лицин, Мп(НСО3)а Теплота » Иванов с сотр. 25
HCN, НаО, NH4CN CH3CN, CaHjCN Рентгеновские лучи » Драганич с сотр. 26, 27
Гидроксиамииокислоты и амииоспирты Электролиз при контакт- ных электрических разря- дах » Харада с сотр. 28
СахараиМН3(в модифици- рованной морской среде) Теплота » Янагава с сотр. 29
COa, Ha0 CH4, H20 CH4, He, NH3, H20 CH4 (на силикагеле) CHaO, H20 СН2О, Н20 СНаО, На0 и карбонат- содержащий апатит СН4> НаО У Ф-изл учение » Электрическая дуга Теплота » 7-Излучение Кипячение Электрические разряды
СО, Da> (NH4)2CO3, FeaO3 Урацил, формальдегид, муравьиная кислота ₽-Алании, мочевина HCN, NH3, НаО СН4, NH3, НаО Теплота » Теплота и УФ-излучение Теплота Электрические разряды
Б ензальдегид, пиррол, НаО СН4, NH3, Н2О, апатит Теплота, УФ- и у-излу- чение Электрические разряды
w
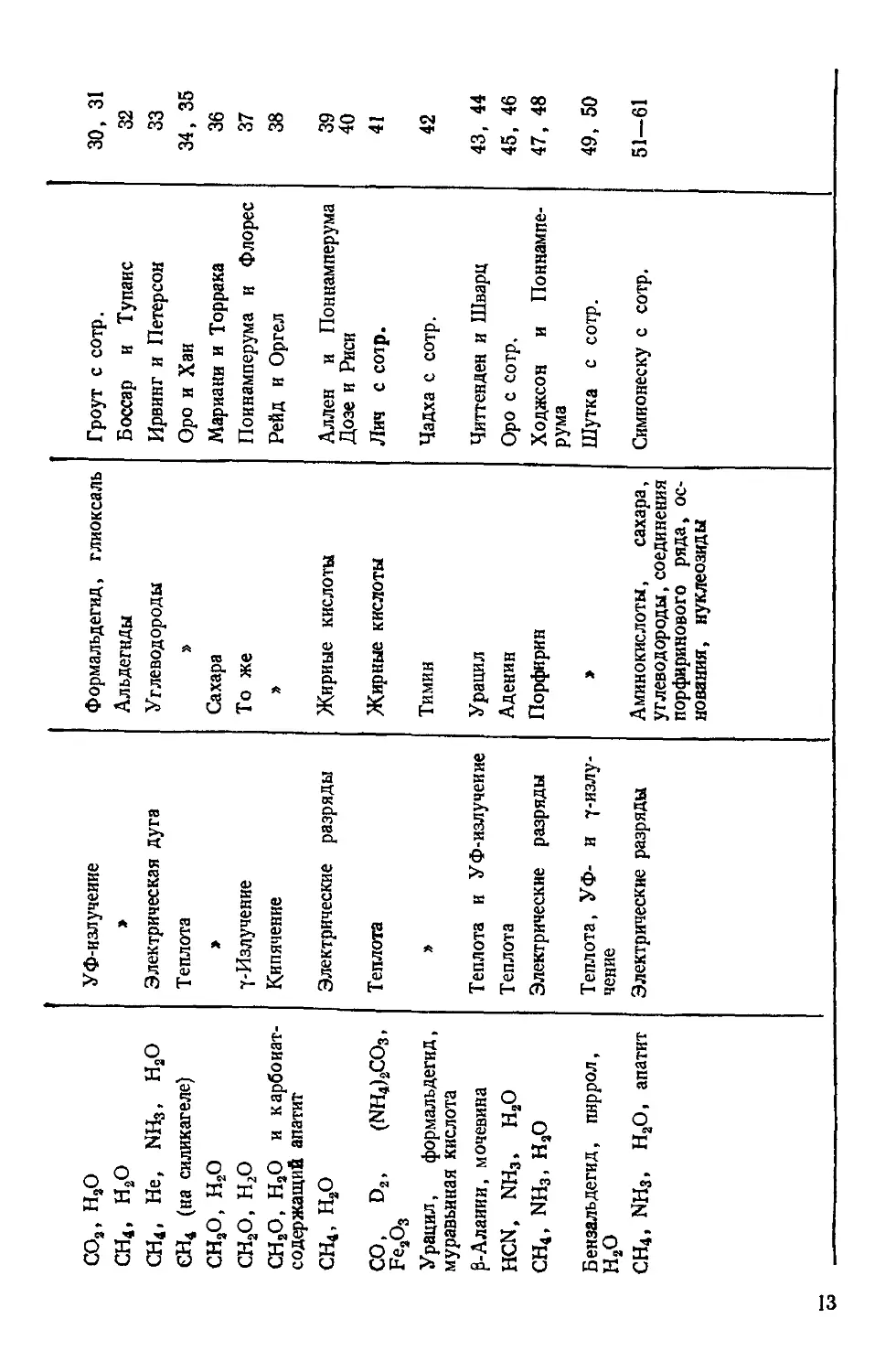
Формальдегид, глиоксаль Троут с сотр. 30, 31
Альдегиды Боссар и Тупаис 32
Углеводороды Ирвинг и Петерсон 33
» Оро и Хаи 34, 35
Сахара Мариани и Торрака 36
То же Поинамперума и Флорес 37
» Рейд и Оргел 38
Жирные кислоты Аллен и Поинамперума 39
Дозе и Риси 40
Жирные кислоты Лич с сотр. 41
Тимин Чадха с сотр. 42
Урацил Читтенден и Шварц 43, 44
Аденин Оро с сотр. 45, 46
Порфирин Ходжсон и Поннампе- рума 47, 48
» Шутка с сотр. 49, 50
Аминокислоты, сахара, углеводороды, соединения порфиринового ряда, ос- нования, нуклеозиды Симионеску с сотр. 51-61
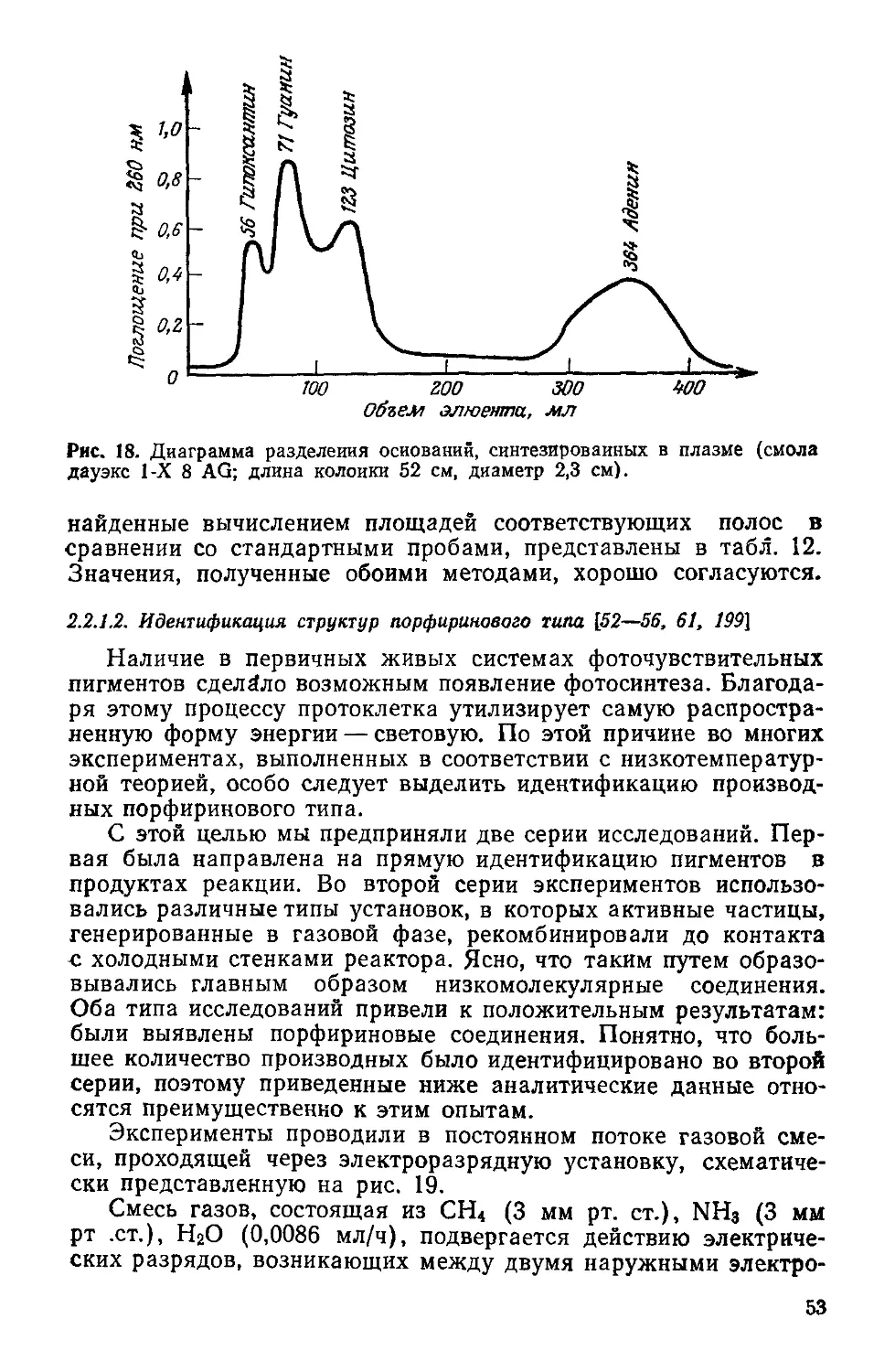
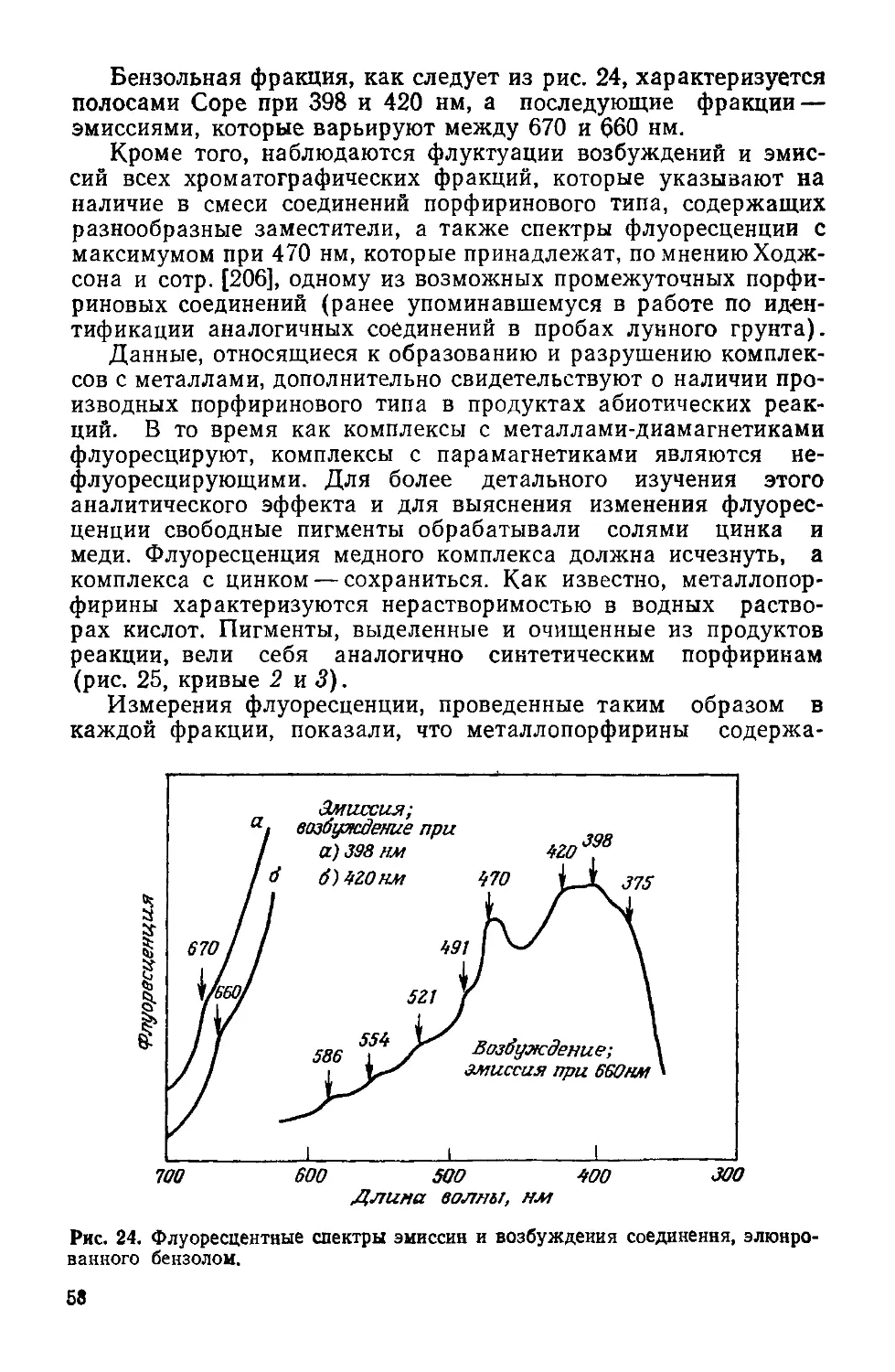
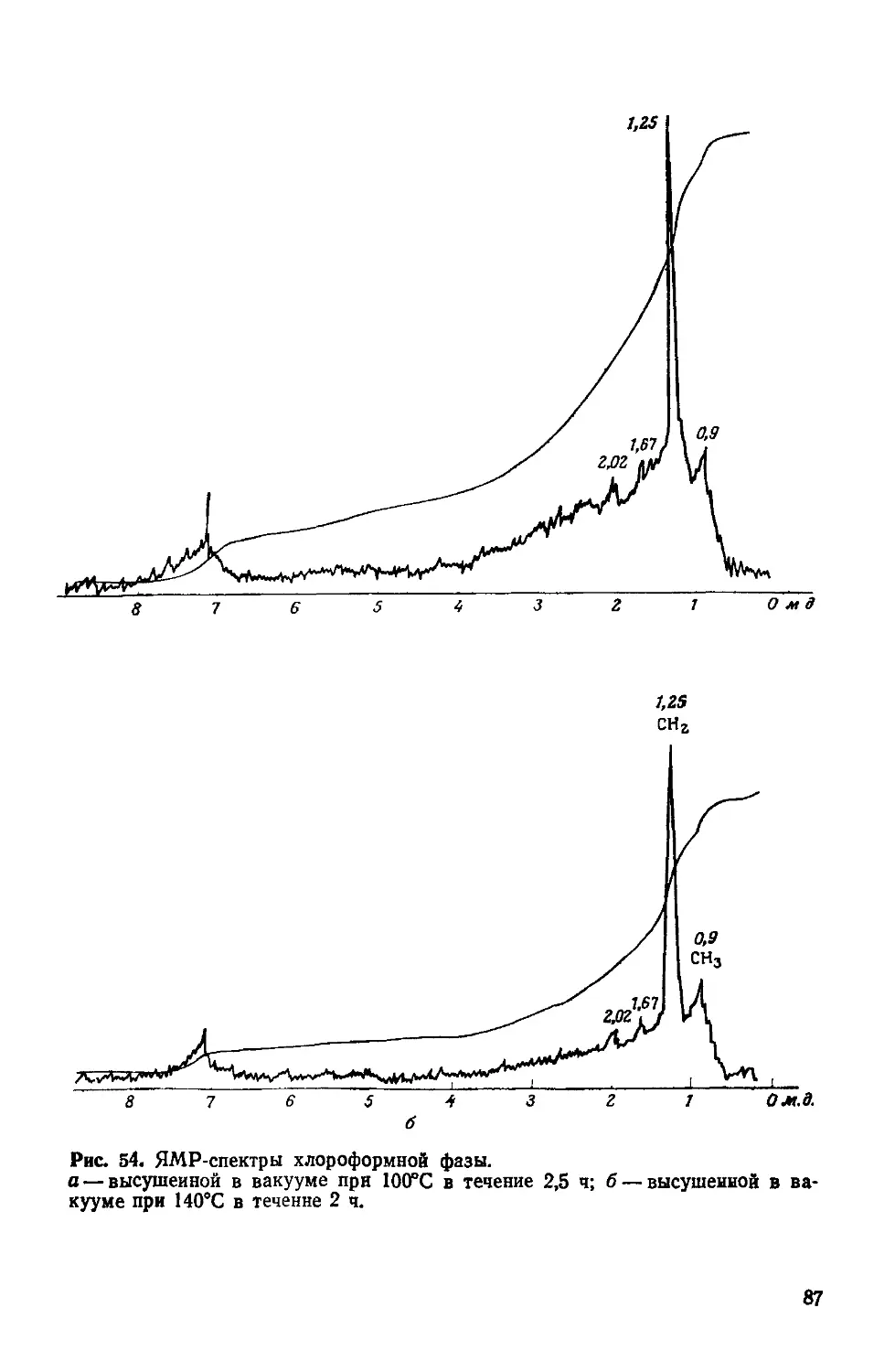
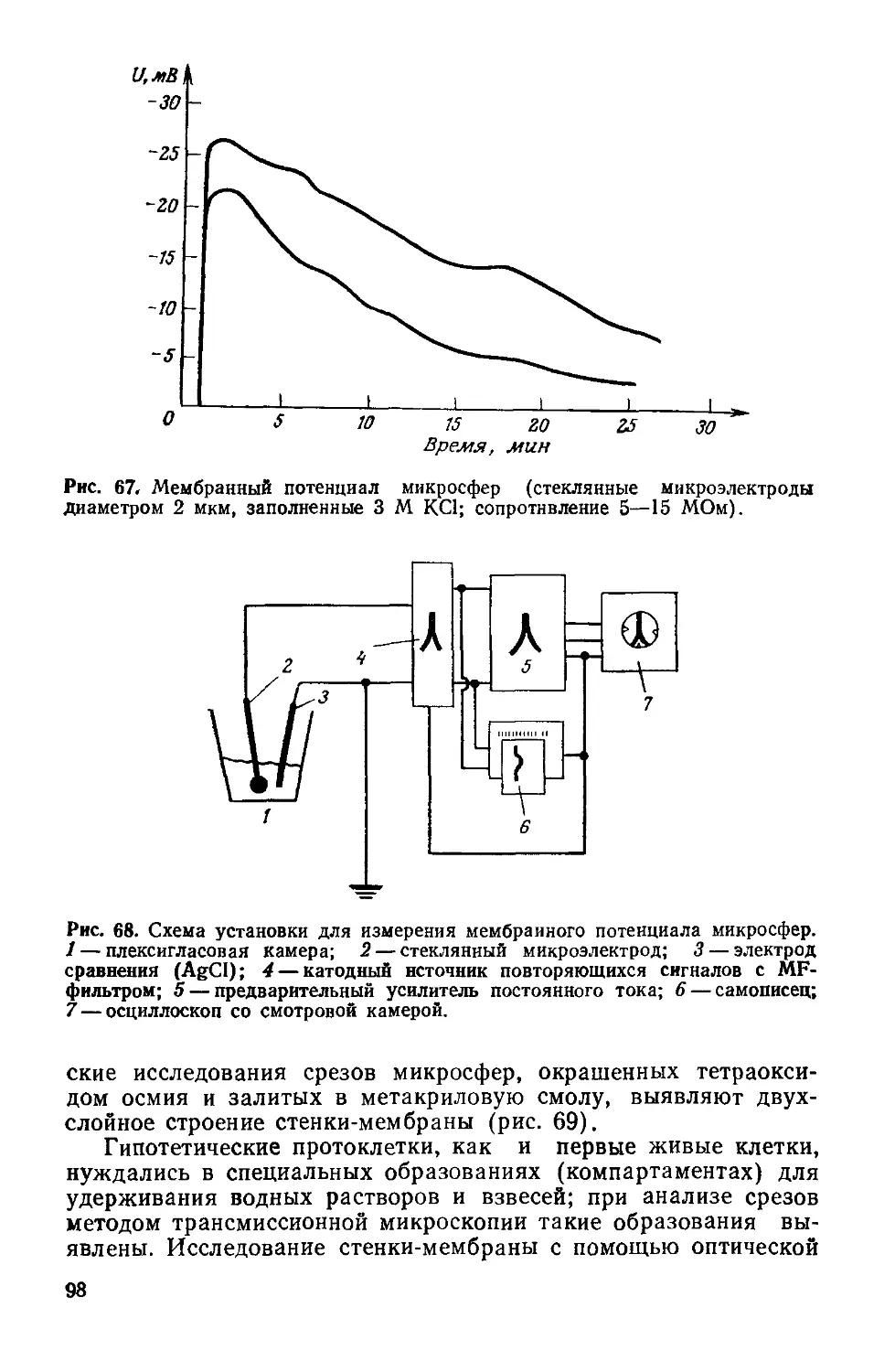
Рис. 1. Перенос энергии в фотосинтезирующих и гетеротропных клетках.
полимеров в процессе поликонденсации. Так, для образования в
водных растворах пептидной связи согласно реакции
H2N—СН—COOH4-H2N— СН-СООН----->
I I
Ri Ra
h2n—ch—conh—ch—cooh+h2o
Ri Ra
(1>
необходимы затраты энергии 2—4 ккал. Этот термодинамичес-
кий барьер еще выше при получении белковых молекул в вод-
ных растворах. Следовательно, для синтеза макромолекул из
«биомономеров» требуется привлечение специфических методов
удаления воды.
В современных живых системах аденозинтрифосфат (АТФ) —
главный энергетический компонент, используемый для образо-
вания полимеров. Свободная энергия пирофосфатных связей
АТФ связана с энергией реакции дегидратации, осуществляемой
посредством ферментов. Циклическое образование АТФ и фер-
ментативные процессы всегда ассоциируются с наличием мем-
бранных структур (рис. 1).
Отметим наиболее важные реакции, приводящие к возник-
новению биополимеров:
а) образование пептидных связей:
h2n —сн — со он + н Inh —сн —соон
I ---------------- I
Kj «г
(2>
б) образование нуклеотидных связей:
14
Основание I
I
N
/I l\
HO H H OH
HO]
Основание 2
l
N
IT
\/ /I l\
P=O H C--C H
\ .____/I l\
o|h ho|h h oh
O|H HO| OH
P = O
OH
По сравнению с другими природными веществами, такими,
например, как целлюлоза и липиды, белки и нуклеиновые кисло-
ты представляют собой самые сложные вещества, входящие в
состав живых организмов. Эта сложность структуры и высокая
молекулярная масса делают почти невозможным их постадийное
воспроизведение в лаборатории. Их специфическое действие,
присущее даже самым простейшим живым организмам, пред-
полагает почти бесконечное многообразие подобных макромоле-
кулярных соединений. Следовательно, исследования, направлен-
ные на реализацию перехода от простых молекул к сложным
полимерам в отсутствие «машины-клетки», безнадежны. Самые
простые макромолекулярные структуры абиотического периода,
которые можно себе представить, возникли, вероятно, иным пу-
тем, чем в современных клетках, а затем постепенно, через эво-
люцию на молекулярном уровне, получались образования со
все более усложняющимися функциями. Поэтому попытки син-
тезировать некоторые биополимеры путем экспериментов, в ко-
торых имитируются условия первобытной Земли, можно срав-
нить с попытками воссоздания классического автомобиля из де-
талей космической ракеты.
За последние три десятилетия много усилий было направле-
но на синтез биополимеров в абиогенных условиях. Ниже рас-
смотрены три основные теории, объясняющие возможные пути
возникновения протобиополимеров.
1.1. Теории происхождения протобиополимеров
1.1.1. Термическая теория
Реакции конденсации, которые привели бы к образованию
полимеров (подобных полипептидам, полисахаридам, полинук-
леотидам) низкомолекулярных предшественников, могут быть
осуществлены путем нагревания некоторых «сухих смесей». По
сравнению с другими компонентами живой материи наиболее
изучен синтез полипептидов. Меньше данных о реакциях полу-
чения олигомеров, нуклеотидов и полисахаридов. Инициатором
синтеза полипептидов термическим путем является С. В. Фокс,
который последние три десятилетия систематически изучал воз-
15
никновение первичных пептидов в условиях, существовавших,
по его мнению, на первобытной Земле [62—67]. Если смесь
аминокислот нагревают до 180—200°С при нормальных атмос-
ферных условиях или в инертной среде, то образуются продук-
ты разложения (как на микро-, так и на макромолекулярном
уровнях), полимеры, содержащие пептидные связи, а также ма-
лые количества пептидов. В случаях когда начальные смеси
обогащаются аминокислотами кислотного или основного типа
(как, например, аспарагиновая и глутаминовая кислоты), доля
пептидов значительно возрастает. Молекулярная масса полиме-
ров, полученных таким путем (особенно полипептидов), может
достигать значений до нескольких тысяч. Такие полимеры в про-
цессе гидролиза освобождают почти все известные аминокисло-
ты, если исходная смесь содержала необходимые компоненты.
Надо отметить, что в полученном продукте наряду с а-связями
имеются связи 0- и у-типов и наблюдались даже е-амино-
пептиды.
Протеиноиды (полимеры, полученные термическим путем из
аминокислот) проявляют многие специфические свойства биопо-
лимеров протеинового типа (табл. 3) [16]. Многообразие этих
Таблица 3. Характеристики полиаминокислот, синтезированных термическим
путем
Свойства Замечания
Качественный состав Гетерогенность Молекулярная масса Цветные реакции Поведение в солевой среде Выход аминокислот после кислотного гидролиза Ферментная активность Растворимость Липидные свойства Тенденция к сборке в коллоидные си- стемы микрочастиц В зависимости от состава исходных соединений протеиноиды могут вклю- чать разнообразные аминокислоты и побочные продукты Лимитированная Порядка нескольких тысяч Например, биуретовая реакция Достаточно высокий процент (зависит от начального состава) Более высокая, чем та, которая ха- рактерна для аминокислот Основное свойство для осуществления естественного отбора в процессе хими- ческой эволюции
полипептидных соединений и их сополимерная природа могли бы
обеспечить на начальных стадиях эволюции необходимую для
адаптации к среде полифункциональность и, следовательно, их
накопление. Наряду с неоспоримой важностью этой термиче-
ской концепции отметим несколько нерешенных вопросов.
Во-первых, как можно объяснить тот факт, что температура
конденсации в окружающем микроклимате не поднялась выше
16
температуры разложения аминокислот и их «полимеров» в про-
цессе химической эволюции? Во-вторых, из смесей, состоящих
только из аминокислот, в ходе термической поликонденсации
получаются большое многообразие соединений и малый про-
цент пептидов. Как можно представить существование повы-
шенных количеств таких «чистых» смесей аминокислот в окру-
жающей среде первобытной Земли и что за конечное соединение
было бы получено, если бы доля кислот в «начальной» смеси
была намного меньше, чем указано в экспериментах Фокса?
Очевидно, в случае конденсации нуклеотидов и моносахари-
дов, имеющих сложную структуру, образование известных сей-
час биополимеров было бы маловероятным.
1.1.2. Теория дегидратирующих агентов
При использовании различных химических агентов дегидра-
тации (конденсации), предположительно существовавших на
первобытной Земле, синтезированы протобиополимеры:
Цианогуанидин
Циановая кислота
Изоциановая кислота
Дициан
Цианацетнлен
Цианвинил фосфат
Карбодиимид
Цианамид
Акрилонитрил
Неорганические фосфаты
Полифосфаты
Пример:
HNx
;с- NH—C=N
h2n/
Н—C=N=O
Н—N=C=O
N==C—C=N
Н—С==С—С=Х
N=C—СН=СН—О—РО*-
R—N=C=N—R
h2n—c=n
Н2С=СН—C=N
О о
II Н+ II /NR
+ H.N-CH-C-O' + RN=C = NR —*+HN—CH-C-O-C.
3 I ’ | XNHR
R, Ri
О О
H ZNR x И
+ H,N-CH-C-O-Cf + + H,N—CH —C —O' —
I XNHR I
R, R2
О О О
x II II II
—+ H3N—CH—C—NH—CH—С—O' + RHN-C-NHR
(4)
R1 Rz
В процессе их гидратации освобождается большое количество
энергии, которая определяет ход реакций конденсации «в гору»
(т. е. в направлении, обратном обычному). Между агентами кон-
17
денсации и соединениями, которые должны конденсироваться,
происходит перенос свободной энергии. Ступень промежуточ-
ных соединений существенна, так как она тормозит выделение
свободной энергии в окружающую среду в виде тепла.
Модели добиологического синтеза, в которых пытаются ис-
пользовать обратные реакции, инициированные агентами деги-
дратации, должны не только доказывать развертывание процес-
сов конденсации и поликонденсации, но и дать ответ на неко-
торые вопросы, относящиеся к появлению биополимеров:
1. Как могли появиться на первобытной Земле подходящие
агенты конденсации и как происходили реакции в мягких тем-
пературных условиях?
2. Как сохранялись эти ненасыщенные высокореакционные
соединения в течение длительного периода в довольно сложной
с химической точки зрения среде?
3. Как могли образовываться и сохраняться полипептиды и
полинуклеотиды в условиях первобытной Земли, когда число
вновь появившихся производных соединений было очень боль-
шим? Частота столкновений двух аминокислот или нуклеотидов
с агентами конденсации (тройные столкновения) должна была
быть незначительной, а многочастичные столкновения, необхо-
димы для образования полимеров с большой массой, — отсут-
ствовать.
4. Почему не протекали реакции гидратации агентов конден-
сации в непосредственном присутствии воды? Анионные атаки
на эти агенты, которые могут происходить под действием воды
(ионы гидроксония), определяются сравнительно низким уров-
нем pH (6—7) и растворимостью неорганических фосфатов.
Эти два фактора взаимозависимы. Следовательно, подходящая
концентрация фосфата кальция, имеющего низкую раствори-
мость в условиях основных значений pH (первичный океан),
не могла быть достигнута.
Конечно, эти вопросы еще ждут ответа, хотя на основе де-
гидратирующих агентов в условиях, приближенных к добиоти-
ческим, были синтезированы полипептиды, полисахариды, нук-
леотиды и производные фосфатов [68—81].
1.1.3. Теория адсорбции
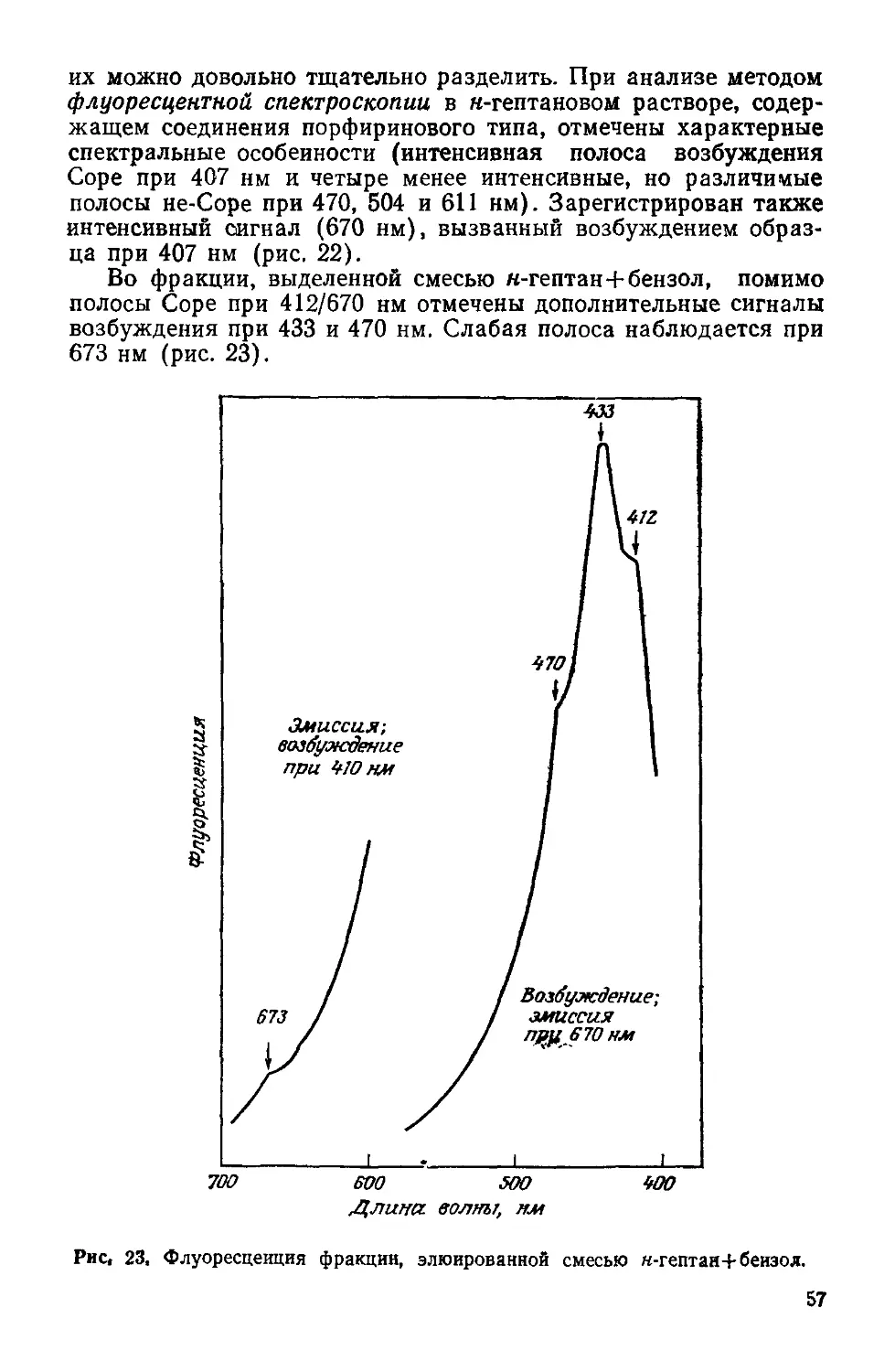
Адсорбция — спонтанный процесс, всегда сопровождаемый
уменьшением энтальпии. На рис. 2 показана зависимость энер-
гии системы от пути (координаты) реакции. Для реагентов, акти-
вированных в процессах хемосорбции, наблюдается некоторый
минимум потенциала Ехим и преобразование их в продукты
хемосорбции благодаря преодолению энергии Екатал (активные
формы). Можно видеть, что существует сниженный энергетиче-
ский барьер, который в каталитических реакциях преодолевается
значительно легче, чем для тех же соединений в неактивирован-
18
ной форме (£гомоген). В резуль-
тате взаимодействия в ходе
адсорбции некоторые связи ос-
лабляются. Реакции происхо-
дят только тогда, когда эти
связи непрерывно ослабляют-
ся за счет процесса, в целом
идущего с выигрышем в энер-
гии. Это и приводит к разру-
шению одних связей и образо-
ванию других. Переходы от ус-
тойчивых реагентов к новым
устойчивым продуктам проис-
ходят через образование акти-
вированных комплексов, энер-
Рис. 2. Энергетическая диаграмма ка-
талитического превращения, предло-
жёиная Поляни.
гия которых на поверхностях
потенциальной энергии соединяет два минимума.
Главными моментами, определяющими скорость гетероген-
ных каталитических реакций, являются: диффузия реагентов
вдоль поверхности катализатора; сорбция исходных материалов;
протекание реакций в сорбированных слоях; десорбция продуктов
реакции; удаление десорбированных соединений с поверхности.
Для создания безводных условий, необходимых для реакций
поликонденсации, А. Качальским предложены неорганические
матрицы (глина). Используя в качестве исходных материалов
аденилаты аминокислот неразбавленных водных растворах,
он экспериментально подтвердил предположение Дж. Д. Берна-
ла о концентрировании разбавленных систем путем «адсорбции
в пресноводных или морских отложениях очень тонких глин».
В безводных условиях и при уменьшении энергии активации,
обеспеченном процессами адсорбции, А. Качальский с сотр.
получил полимеры аминокислот со сравнительно большой моле-
кулярной массой и указал другой путь возможного возникнове-
ния протобиополимеров [82—89]:
NH,
I
с N
ОН ОН
О О
II II
-о-p- O-C-CHj-NHj
он
адсорбция на
глине
+ Н ° °
—> HN—CHe-C-(NH—)п_£—NH—СН2-С—О“+ пАМФ
19
Низкая активность и небольшие молекулярные массы пепти-
дов (ди-, три- и тетрапептидов) определяются, вероятно, малой
скоростью десорбции продуктов реакции, обусловленной фикса-
цией возникших полимеров в полости катализаторов. Эти яв-
ления могли играть важную роль в условиях первобытной
Земли.
Несмотря на то что процессы адсорбции инициируют меха-
низмы, которые могут в ходе химической эволюции привести к
образованию полимеров, следует отметить, что возникновение
аденилатов аминокислот в среде, воссоздающей условия перво-
бытной Земли, еще не доказано [90]. Лабораторные эксперимен-
ты свидетельствуют о том, что в ходе конденсации незамещенных
аминокислот в водной системе, гетерогенно катализируемой
каолинитом, даже при высоких температурах невозможно полу-
чить макромолекулярные продукты [91].
1.1.4. Гибридная теория
Была разработана такая гибридная теория, которая учиты-
вает как условия дегидратации, так и процессы адсорбции.
Чтобы объяснить возникновение гетерополипептидов, предло-
жена схема постепенного замещения полиглицина (С. Акабори)
[92, 93]. При обработке полиглицина, диспергированного на по-
верхности каолина, формальдегидом или ацетальдегидом (в
присутствии основных катализаторов) глициловые остатки час-
тично переходят в серил или треонил:
nNHj-CHa-CN —>(—NH—CHg—С—X,
аминоацетонитрил nh
(—NH—СН2—C-)n + и Н2О—> (—NH—СН2-СО-)П + nNll«
|| полиглицин
NH
( адсорбция на
каолине + ОН
-NH-CH-CO"
I серил
сн2-он
(6)
-NH-CH-CO —
I
СИ— ОН— треонил
СН5
Представлены также данные о возможном способе возник-
новения таких группировок, как аспартил, аланил, фенилала-
нил, гистидил и т. д.:
20
NH
I
ch-ch2-cn
I
NH
I
CH2 +
co
I
NH
I
CH2 = О —C =» CHa;
co
I
I
NH
I
C =CH2 +
co
I
HCN
CO CH3
I I
NH NH
I I
CH-CH2-CN + 2H20 —» CH—CH2—COOH + NH3
CO co
I I
аспартил
(7)
I I
NH NH
I /CN |
—* cf + 2H,0 —♦CH-CH, + CO2 + NH3
I Чсн3 | 3
co co
I I
аланил
l
NH
I
CH2+
co
I
I I I
NH NH NH
I I I
OCH-CeH5-*C = CH-C6Hs, C=CH-С6н5+Н2 —CH-CH2-C6H5
CO co CO
I I I
фенилаланин
В одной из первых фаз предполагается самопроизвольный син-
тез полиглицина через промежуточный аминоацетонитрил (по-
лимеризация нитрилов на твердых поверхностях, например као-
лините, при 130°С с последующим гидролизом). В результате
выделены лишь димеры и тримеры синильной кислоты.
На втором этапе в качестве основы для реакций последова-
тельного замещения были использованы «искусственные» поли-
пептиды с высокой молекулярной массой. В этом случае появ-
ление гетерополипептидов может лимитироваться большим ко-
личеством побочных процессов, порождаемых синильной кисло-
той (параллельно с образованием аминоацетонитрила, формаль-
дегида и аммиака), а также их наличием в первичной среде,
«богатой» химическими компонентами.
Мэтьюз с сотр., предполагая, что гетерополипептиды могут
образовываться непосредственно из HCN, высказываются в
21
пользу образования таким путем макромолекулярных соедине-
ний на первобытной Земле [94—96]. В связи с этой гипотезой
заметим, что получение аминокислот при гидролизе не является
достаточным аргументом при доказательстве появления некото-
рых пептидных связей. Известны химические соединения (напри-
мер, аминомалеонитрил), которые в процессе гидролиза выделя-
ют аминокислоты. С другой стороны, лабораторные экспери-
менты по идентификации пептидных связей в олигомерах си-
нильной кислоты дали отрицательные результаты [97—100].
1.2. Самосборка протобиополимеров.
Возникновение структур липидного типа
Появление протобиополимеров (в категорию полимеров
включаем и «липиды»)—необходимый, но недостаточный про-
цесс для возникновения протоклетки. Если бы мы смогли выде-
лить все главные компоненты из одной современной живой
клетки и перемешали их в пробирке, то, конечно, не получили
бы новое живое существо.
Важным элементом любой системы, выполняющей механиче-
скую работу (фундаментальная характеристика жизни), явля-
ется дифференцированное накопление определенного вида энер-
гии в одном или нескольких изолированных местах, за которым
следует перенос энергии (механическая работа), приводящий на
следующем этапе к установлению равновесия.
Для возникновения протоклеток необходимы два главных
условия: во-первых, самосборка протобиопол,имеров в надмоле-
кулярные системы с разделом фаз; во-вторых, инициирование и
обеспечение первичного циклического потока энергии. Первое
требование предполагает селективное разделение пребиоти-
ческих соединений посредством некоторой мембраноподобной
биологической системы. Этот факт определял в ходе химической
эволюции важное с биологической точки зрения преобразование
первичной хаотической молекулярной смеси в организованную
материю, способную выполнять самые простые клеточные функ-
ции (осмос, фотовозбудимость, донорно-акцепторные реакции
ит. д.). Второе условие сильно зависит от инициирования
электронного переноса через мембрану — явления, связанного
с циклическим поглощением, преобразованием и накоплением
энергии излучения.
Возникновение функциональных мембран является наиболее
важным шагом эволюции материи к живым организмам. Ни
один энергетический процесс не происходит без участия мембра-
ны, независимо от природы или степени развития живой сис-
темы.
Жизнь возникла в воде и не может существовать без нее.
Уникальные физические свойства воды, а также ее способность
растворять и ионизировать вещества были интенсивно изученьС
22
Меньше внимания уделялось поведению в воде нерастворимых
неполярных веществ или частично растворимых соединений, мо-
лекулы которых обладают как полярными, так и неполярными
свойствами (амфифильные молекулы). Благодаря своей структу-
ре амфифильные молекулы специфически ориентируются в вод-
ной среде и, следовательно, образуют упорядоченные структуры.
Именно такие химические компоненты сыграли особую роль в
возникновении, организации и развитии протобиополимеров на
неорганической Земле в процессе их самосборки в индивиду-
альные субструктуры (мицеллы, монослои, бислои, биологиче-
ские липиды и т. д.).
Образование амфифильных молекул подтверждает, таким
образом, возникновение микросистем с разделом фаз и «выжи-
вание» протобиополимеров в «тяжелых» условиях среды (осо-
бенно коротковолнового УФ-излучения). Охват мембранами
функциональных и структурных биополимеров (соединений по-
липептидного и полисахаридного типов) мог определять как
начальные процессы электронного переноса через мембрану,
так и сопротивление протоклетки осмотическому шоку.
Поверхностное натяжение слоев, составленных из амфифиль-
ных молекул, при постоянном объеме микроагрёгата обусловли-
вает минимум поверхности в условиях равновесия между внут-
ренним и внешним давлением. Вероятно, это и есть причина, из-
за которой большинство микросистем с разделением фаз имеет
сферическую форму.
Биохимические процессы in vivo происходят, как правило,
через мембрану или на уровне мембран. Поскольку биополиме-
ры играют центральную роль в реализации функций клеток,
почти все исследователи считают, что и самая простая форма
жизни может возникнуть только при их наличии. Следствием
такой позиции являются многочисленные попытки синтезировать
(в предполагаемых геологических условиях абиотической Зем-
ли) некоторые сложные липиды, подобные найденным в совре-
менных биологических мембранах. Параллельно изучают вос-
произведение функций мембран на относительно простых моде-
лях, в которых используются естественные или синтетические
липидные структуры.
Первая экспериментальная модель возникновения функцио-
нальных протомембран была представлена в термической тео-
рии [16, 67]. Так называемые протеиноиды со значительным со-
держанием гидрофобных макромолекулярных компонентов,
синтезированные путем нагревания некоторых смесей амино-
кислот в безводных условиях, самоорганизуются в однородные
по размеру микросферы со стенками, подобными мембранам.
Процесс относительно прост и происходит быстро; полученные
соединения сложны, как в отношении структуры, так и по хи-
мическому составу. Самосборка в микросферы доказывает, что
определенный качественный скачок произошел непосредственно
23
в ходе взаимодействия некоторых простых компонентов в пре-
биотических условиях. Свойства этих микросфер приведены в
табл. 4.
Таблица 4. Свойства протеиноидных микрочастиц [16]
Стабильность (при стоянии, центрифугировании, приготовлении срезов)
Микроскопические размеры
Вариабельность формы
Однородность размеров
Многочисленность
Способность к окрашиванию
Наличие грамположительных и грамотрицательных форм
Тенденции к сжатию и набуханию в растворе
Наличие поверхностных структур
Ультраструктура (различимая в электронном микроскопе)
Избирательная проницаемость граничных слоев для молекул
Сборка из каталитически активных полимеров
Склонность к ассоциации
Рост путем аккреции и дробление
Рост в питательной среде
Способность размножаться при аккреции и росте
Способность образовывать контакты
Способность преобразовывать молекулы с информационными свойствами
Затем были представлены и другие данные о синтезе органи-
ческих микроструктур, различных липидов (включая мембраны,
составленные из фосфолипидов) и амфифильных молекул. Так,
были получены (с большим выходом) органические микрострук-
туры в дуговом электрическом разряде в смеси моноксида угле-
рода, метана и азота в присутствии воды [101—102]. Эти струк-
туры обладают разнообразной морфологией, многообразием
поверхностей, границей раздела фаз, сходством с микроископае-
мым из архея. Утверждается, что они напоминают сильнорети-
кулярные полипептиды (после продолжительного гидролиза вы-
деляются малые количества аминокислот). Но полипептиды не
единственные вещества, способные высвобождать в ходе гид-
ролиза аминокислоты [100]. Не исключается существование в.
воде некоторой суспензии (макромолекулярные сильноретику-
лярные структуры, как правило, нерастворимы), которая ослаб-
ляет структуры, разделяющие фазы. Необходимо больше анали-
тических данных для того, чтобы определить природу этих сое-
динений, а также их биологическое значение. Наконец, липиды и
фосфолипиды были синтезированы в безводных условиях, исхо-
дя из жирных кислот, альдегидов, моношимилового эфира
глицерина* (он считается предшественником фосфолипидов),
фосфатов и глицерина, и одновременно были опробованы оксид
кремния, каолин и цианамид в качестве возможных агентов..
* Моношимиловый эфир глицерина — производное шимилового спирта,
имеющего молекулярную формулу СН3—(CH2)is—О—СН2—СН—СН2ОН.
Брутто-формула С19Н40О3; Л4=316; т. пл. = 61’С. Содержится в рыбьем жире.
24
конденсации [103]. Водная среда была использована только в
одном эксперименте. При синтезе нейтральных липидов главным
йродуктом реакции был моноглицерид, в то же время иденти-
фицированы ди- и триглицериды. Эксперименты, имеющие
целью получение полярных липидов (фосфолипидов), свиде-
тельствуют о том, что для более высокого выхода необходимо
наличие дицианамида в процессе испарения. Частично очищен-
ные фосфолипиды самоорганизуются в водной среде в компакт-
ные структурные системы, подобные мембране. Сообщалось
также о синтезе на основе цианамида и имидазола некоторых
ацилглицеридов: смесь глицерина, пальмитата аммония, циана-
мида и имидазола нагревали во влажной среде при 60—100°С
в течение 16 ч [104]. Выяснилось, что отсутствие дегидратирую-
щих агентов приводит к очень низкому выходу.
Интересны результаты синтеза в добиотических условиях
некоторых амфифильных молекул. Фракцию С12—См в водном
растворе, содержащем соли Mg2+, Na+, К+, НРО^- и С1~ (ими-
тация морской воды), облучали ультрафиолетовыми лучами в
течение 10—12 ч при 40°С и pH 8,0—8,2 [105, 106]. В полученном
желтом веществе, напоминающем пенку, были ^выделены (опти-
ческой микроскопией в поляризованном свете) анизотропные
агрегаты (смектические жидкие кристаллы). Это наводит на
мысль о наличии амфифильных молекул и возможном образо-
вании некоторых структур, подобных биомембранам.
1.3. Развитие первичных энергетических процессов
Клеточные мембраны представлены мозаичной моделью,
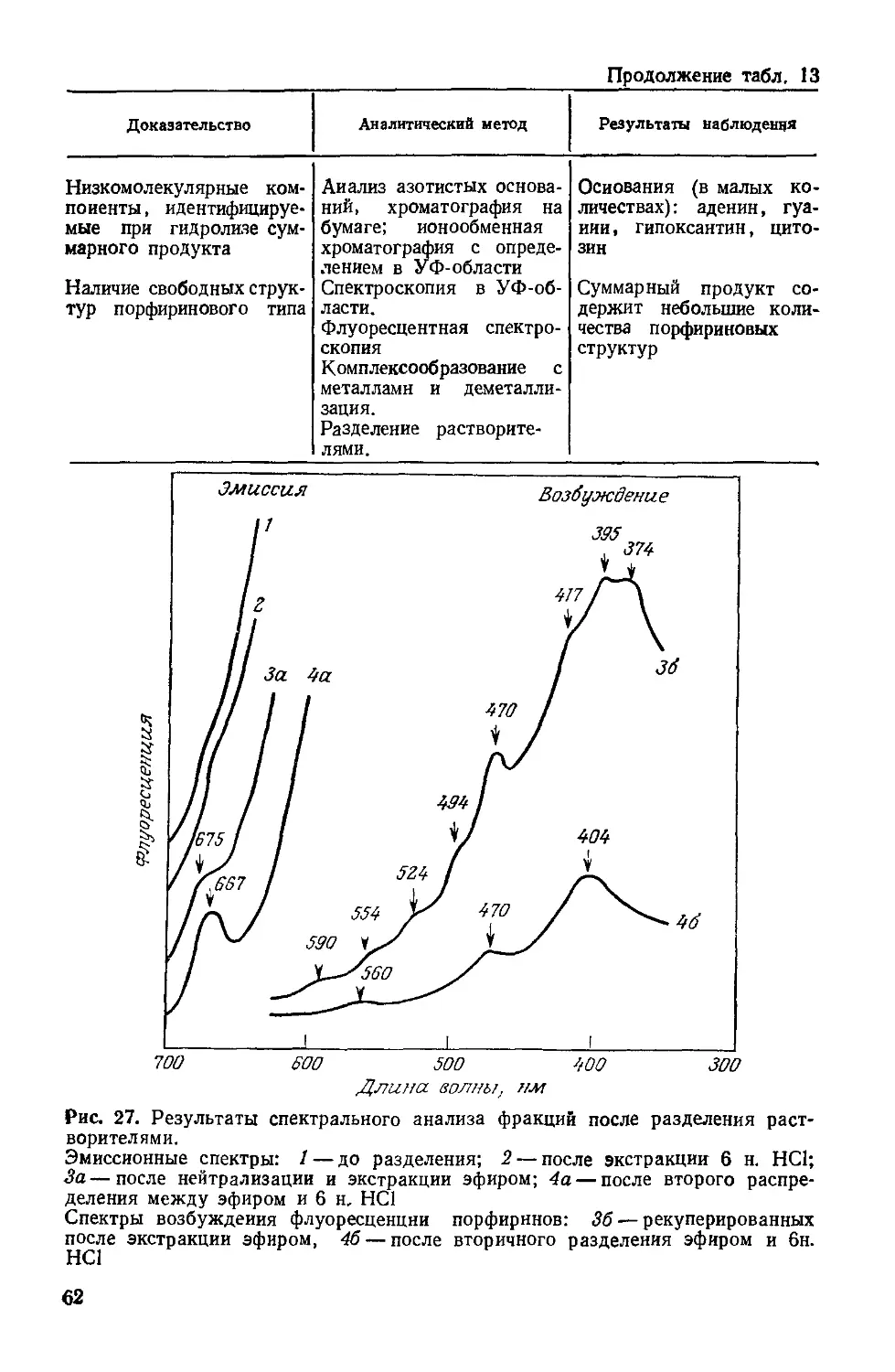
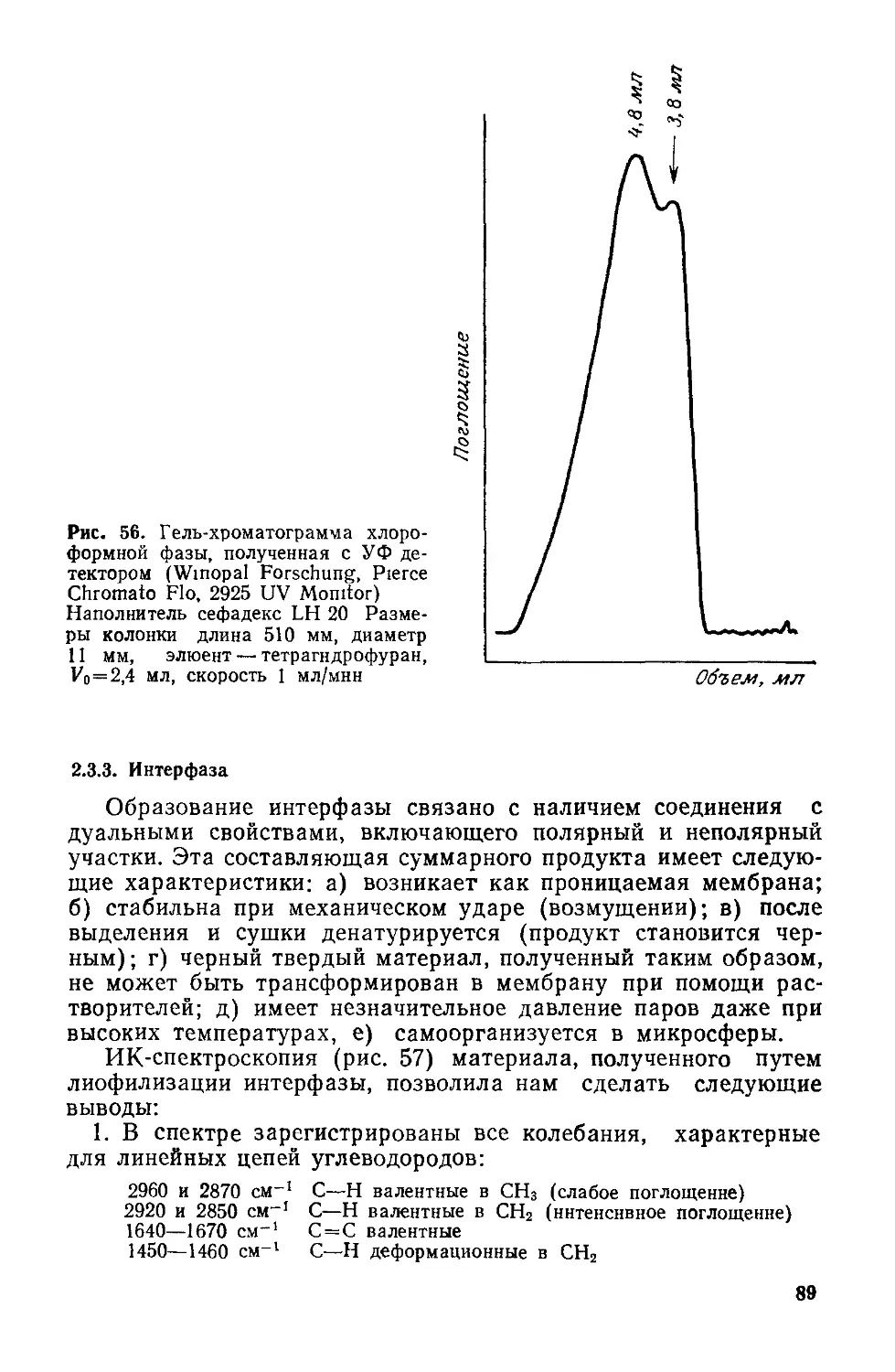
которую предложили С. Дж. Синджер и Г. Л. Николсон [107].
Согласно этой модели, матрица мембраны (рис. 3) — двойной
липидный слой из фосфолипидов и гликолипидов — включает
белки на поверхности и внутри, действуя как барьер проницае-
мости. Электропровод-
ность, обеспечиваемая
переносом заряженных
ионов или электронов, —
одно из главных свойств
мембраны, так как обус-
ловливает реакции окис-
ления — восстановления,
которые протекают на
противоположных сторо-
нах поверхности раздела
мембрана/вода. Наличие
в биомембране цепи пере-
носа электронов обеспе-
чивается белковыми мо-
лекулами.
Рис. 3. Мозаичная модель клеточной мем-
браны.
35
Ф^редмеен
Флоюинсодержашрй
г-df
фермент
НАДФ(Нг)
Пластохинон (ПХ)
Цитохром^
/4АДР^Р^
-О
Донор ё
С^тоо
'Хлорофилл а
jp \Д2?ЯЛ7У|
Цитохром f\<Pt
\АТ<р\
-0,4
СВЕТ
(фотосистема I)
н2о
'-0,8
%Ог
ё
ё
5
СВЕТ
(фотосистема 11)
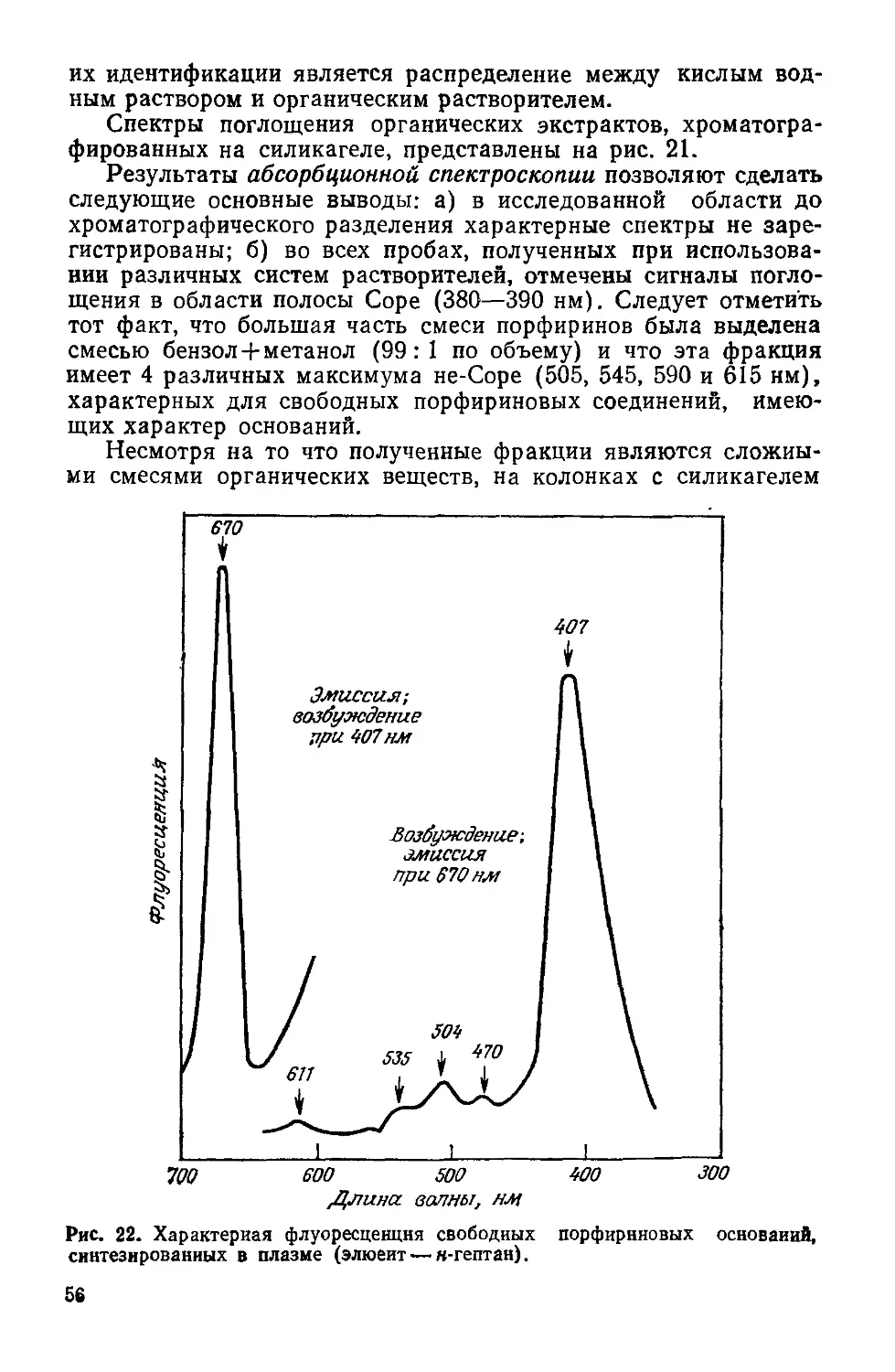
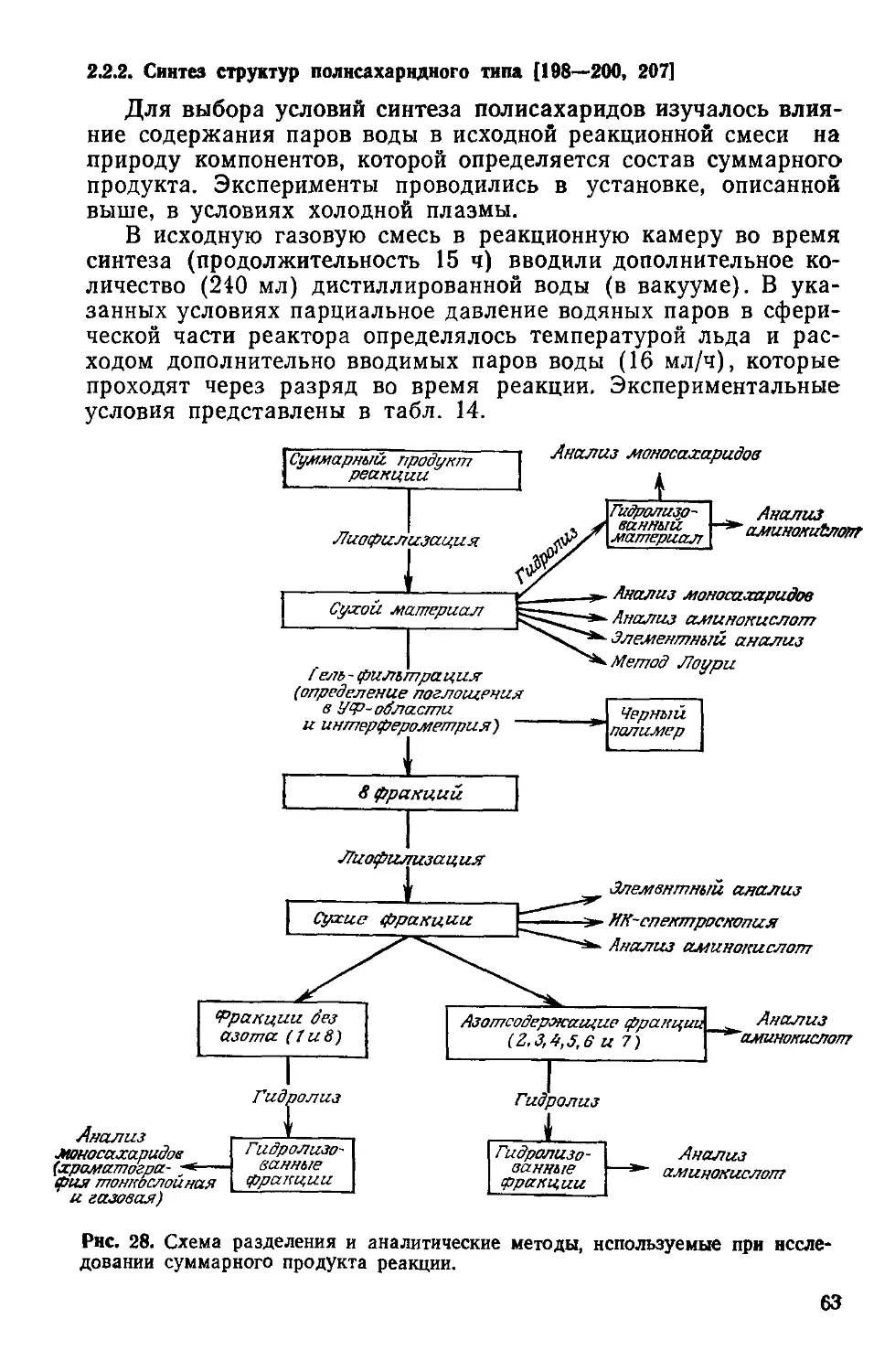
Рис. 4. Предполагаемая связь между фотосистемами I и II для фотосинтези-
рующих растений, выделяющих кислород.
Глюкоза + 36Ф/ + 36 АДФ + 6О2 —>- 6СО2 + 42Н2О + 36 АТФ
Большое различие между электрическими свойствами ис-
кусственных и клеточных мембран состоит в том, что проводи-
мость в матричной модели в 106 раз меньше, чем в природной
мембране (из-за отсутствия белковых молекул — полупровод-
ников). Следовательно, можно предположить, что при одновре-
менном возникновении структурных протобиополимеров (соеди-
нений полисахаридного типа) и функциональных протобиополи-
меров (подобных пептидам) в присутствии амфифильных моле-
кул в среде первобытной Земли создались соответствующие
условия для образования устойчивых и функционирующих мик-
росистем на границе фазы. Благодаря двойственной природе
(наличию полярных и неполярных частей) осуществлялась
самосборка этих веществ (матриц), а структуры полисахарид-
ного типа защищали их от осмотического взрыва.
Живые системы — все-таки нечто большее, чем упорядочен-
ный ансамбль органических веществ. Они обладают собствен-
ными механизмами, которые трансформируют химическую
энергию и энергию излучения в подходящую для клетки форму,
накапливают и затем используют ее для преобразования
«простых» химических компонентов в более сложные. Вся энер-
гия, поставляемая Солнцем, присутствует в двух формах: хи-
мической, включенной в структуру органических соединений,
находившихся на первичной Земле, и энергии излучения (сол-
нечный свет). АТФ — единственное химическое соединение, по-
26
средством которого осуществляется перенос энергии в живых
клетках (рис. 4). Чтобы образовывались молекулы, необходи-
мые для жизни, клетки при помощи ферментов последовательно
(ступенчато) модифицируют простые вещества. Все эти меха-
низмы синтеза или иногда разложения и реконструкции требу-
ют энергии. Как правило, благодаря АТФ происходит снабже-
ние этих процессов энергией. В биохимических реакциях термо-
динамическую движущую силу обеспечивает только АТФ
(ферменты определяют лишь кинетику реакций).
В последние годы многие ученые, среди которых X. и М.
Балчевские, Д. Л. Кейстер, И. С. Кулаев и Р. Нордли, выдвину-
ли идею о том, что гораздо более простые молекулы, как, на-
пример, неорганические пирофосфаты (ПФ,), могли бы заме-
нять АТФ в некоторых химических реакциях [108—115]. ПФ,-
высокоустойчивы и очень просты по сравнению с структурой
АТФ, поэтому допущение возможности существования их на
Первобытной Земле открывает новые пути для понимания пер-
вичных энергетических процессов.
Независимо от природы или сложности живых организмов
образование и разрыв фосфатных связей представляют собой
движущую силу процессов переноса энергии. Следовательно,
одна из главных задач в изучении химической эволюции — за-
дача выявления механизма, посредством которого фосфор мог
участвовать в первичных химических реакциях. Единственным
существенным источником фосфора на поверхности Земли был
апатит — нерастворимый минерал с пониженной реакционной
способностью, содержащийся в вулканических либо осадочных
породах. Подобный минерал вулканического типа почти всегда
содержит фтор (его состав: СацДРО^вЕг), а минерал осадочно-
го типа может содержать С1, СОз или ОН вместо F. Проблема
включения фосфора в органические соединения (например, в
нуклеотиды) связана с его пребиотщческой локализацией в
апатите [116].
Эксперименты по фосфорилированию, выполненные в абиоти-
ческих условиях, должны были дать решение двух задач:
1) объяснить, как апатит становится растворимым; 2) как стало
возможным его непосредственное использование.
Сообщались важные выводы о процессах «предбиологиче-
ского» фосфорилирования при помощи механизма, включающе-
го катализ в присутствии апатита, а также процессы концентри-
рования, удерживания и испарения в растворах или в гетеро-
генных фазах с предбиологическими агентами конденсации или
без них (например, цианат) (табл. 5).
То, что в экспериментах, воссоздающих условия первобыт-
ной Земли, удалось доказать образование фосфорных связей,
богатых энергией, не решает проблему полностью. Для сущест-
вования даже самой простой клетки или протоклетки требуется
циклическое фосфорилирование, индуцированное излучением
27
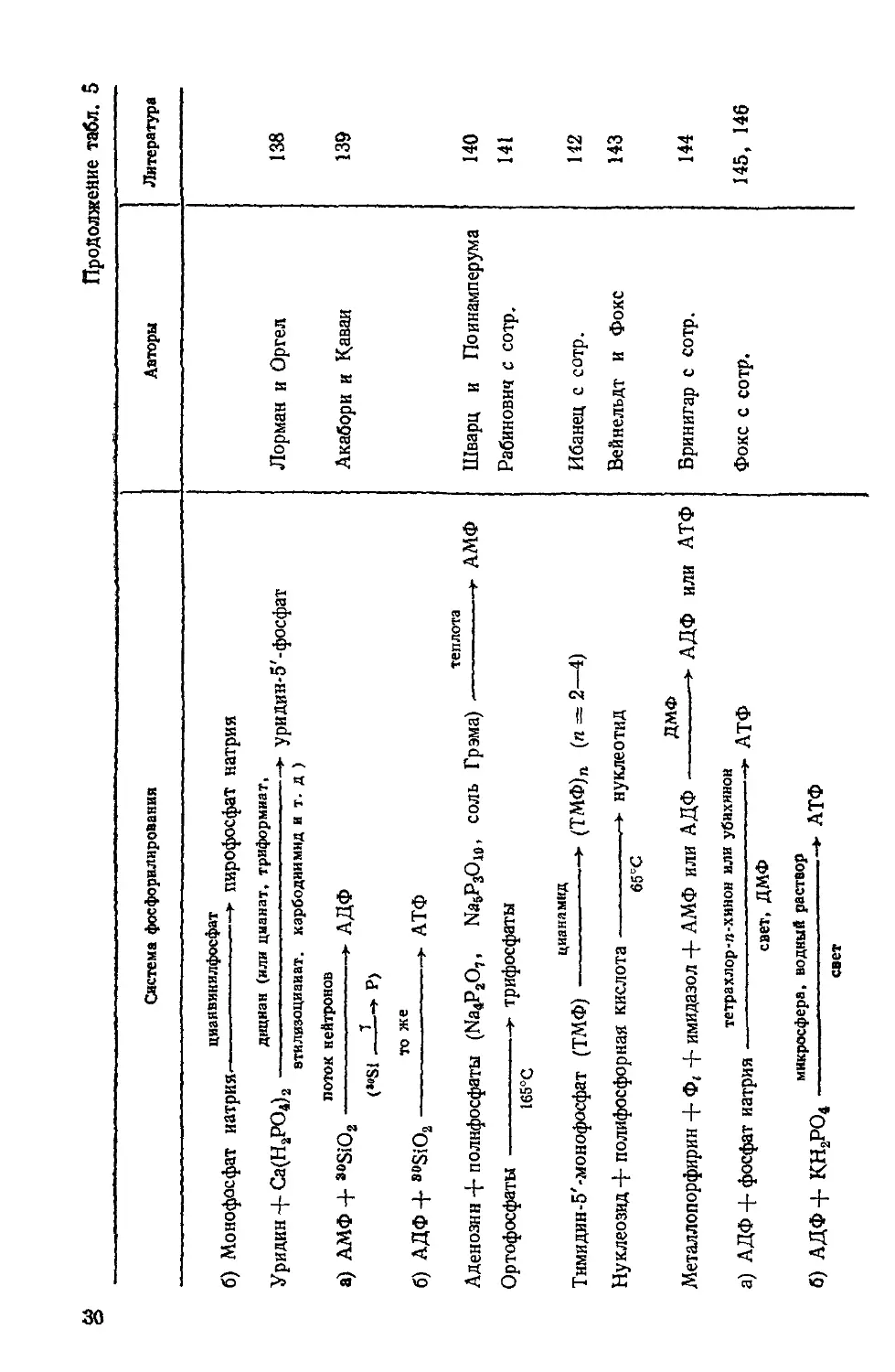
g Таблица 5. Системы фосфорилирования
Система фосфорилирования
Авторы
Литература
теплота Тимидин + Na2HPO4 (или Na4P2O, + Na5P3O10) > тимидинфосфат Бищоп с сотр. 117
цианистый раствор Ортофосфат натрия + апатит >- пирофосфат натрия pH 7 Миллер и Паррис 118
апатит Аденозин + пирофосфат натрия > АМФ NH4CI, NH4HCOs, мочевина Уридин + апатит >- урндинмонофосфат (УМФ) 100°С УФ-излучение а) Аденин + рибоза + этилметафосфат > аденозин + АМФ + АДФ + + АТФ + А4Ф УФ-нзлучение б) Аденозин + этилметафосфат —> АМФ + АДФ + АТФ + А4Ф УФ-излучение в) АМФ + этилметафосфат >- АДФ + АТФ + А4Ф УФ-излучение г) АДФ + этилметафосфат АТФ + А4Ф оксалат аммония + агенты дегидратации Уридин + апатит ► УМФ Нейман с сотр. Л орман и Оргел Поннамперума с сотр. Шварц 119 120 121 122
(дициаиднамид, HCN, цианамид, цианат и т. оксалат аммония 4- агенты дегидратации Тнмидин + фторапатит Д-) •> ТМФ Шварц с сотр. 123
мочевина а) Уридин + NH4H2PO4 ► УМФ 100°С мочевина б) 2', З'-Дидезокситимидин + NH4H,PO4 »- 2', 100°С 3' - дидезокситнмидин- 5' - фосфат Остерберг с сотр. 124
цианамид или цианамид 4-4-амнно-5-имидазол-карбокса-
„ мид (АВДА)
Дезокситимидии-5 -трифосфат (дТ)------------------------------------—————►
(дТ)п 60—90°С, rt= 1-4
мочевина
NH4H2POa--------------->- полифосфат
85—юо°с
нагретый раствор
Аденозин (или дезоксиаденозин) + триметафосфат натрия ---------------------->
щелочи
2 и 3 -аденозинмонофосфат и СНС1з
Бромид 2,3, 5-три-о-бензоил-О-рибофуранозы + фосфат триэтиламмонийдибен-
ннзкая температура
зоата-----------------------> D-рибофураноза-!-фосфат
полифосфорная кислота
Цитидин-2(3)-фосфат------------------------>• олигонуклеотид
65°С
дициан
D-Рибоза + ортофосфат натрия---------------> D-рибофураноза-1-фосфат
циаиат калия
Фосфат натрия-------------------->- пирофосфат натрия
или дициандиамид
цианамид
Глюкоза + фосфорная кислота---------------->- глюкоза-6-фосфат
CN"
Аденин + дезоксирибоза + NH4H2PO4------------дезоксиаденозинфосфат
NaH2PO4
Нуклеозид (аденозин, гуанозин, цитидин, уридин)------------------>- нуклеотид
160 с ,
гидрохлорид 1-этнл-3(3-диметиламннопропил>-
Аденозин + NaH2PO4--------------------------------------------» АМФ
карбодинмида
Уридин-2'(3')-фосфат + уридин-------------->- уридилуридин
160°С
цианвинил фосфат
g а) Уридин + NaH2PO4----------------------► уридинмонофосфат
Стефен-Шервуд
Остерберг и Оргел
Шварц
Райт и Корана
Шварц и Фокс
Галманн с сотр.
Бек и Оргел
Штейнман с сотр.
Поннамперума с сотр.
Сулстон с сотр.
Моравек
Феррис
125
126
127
128
129
130
131
132
133, 134
135
136
137
Продолжение табл. 5
Система фосфорилирования
цианвинилфосфат
б) Монофосфат натрия,-------------------► пирофосфат натрия
дициан (или цианат* триформиат.
Уридин -{- Са(Н2РО4)2-----------------------------------► уридин-5'-фосфат
втилизоциаиат. харбодиимид и т. д )
поток нейтронов
а) АМФ 4- ®°SiO2 ------------------>- АДФ
<»»Si —I—» Р)
то же
б) АДФ 4- ®°SiO2--------------------- АТФ
теплота
Аденозин 4* полнфосфаты (Na4P2O,, Na5P3Ow, соль Грэма),--------------------»- АМФ
Ортофосфаты----------------->- трифосфаты
165°С
цианамид
Тнмидин-5'-монофосфат (ТМФ)-----------------► (ТМФ)П (п = 2—4)
Нуклеозид 4- полифосфорная кислота----------нуклеотид
ДМФ
Металлопорфирин + Ф( ~г имидазол 4- АМФ или АДФ ------*• АДФ или АТФ
тетрахлор-л-хинон или убихинон
а) АДФ 4- фосфат натрия--------------------------—-------->- АТФ
свет, ДМФ
микросфера, водный раствор
б) АДФ 4- КН2РО4------------------------------- АТФ
свет
Авторы Литература
Лорман и Оргел 138
Акабори и Каваи 139
Шварц и Поинамперума 140
Рабинович с сотр. 141
Ибанец с сотр. 142
Вейнельдт и Фокс 143
Бринигар с сотр. 144
Фокс с сотр. 145, 146
хлоранил» ДМФ
в) АДФ + КН2РО4 ----------------► АМФ + АТФ
свет
формамид
Аденозин + NH4H2PO4-----------------► АМФ + АДФ (циклич.) •+• АМФ
70°С
электрические разряды искрового типа
Аденозин + КН2РО4----------------------------------------> 5' и 2'(3')АМФ
водный раствор
водный раствор солей
Аденозин-5'-фосфоримидазолид-----------------------------► олигоаденилаты
Zn’+, Мп», Со»+, РЬ*+
Mg!+
Нуклеотид + триметафосфат---------------* нуклеотидполифосфаты
апатит
СН4 + NH3 + Н2О---------------------► фосфорные эфиры моносахаридов
холодная плазма
матрица
5'-Гуанозин-фосфоримидазолид ------------------>- олигомеры, связанные в положе-
РЬ’+, Sn2+ и т. д.
ниях 2'—5' или 3'—5'
hi, бактериородопсин, АТФ
А ЦФ + Фг-------------------------------► АТФ
мембрана
Шофстолл и Кокко
Ямагата и Ямакава
Саван
Дорман и Оргел
Симионеску с сотр.
Бридсон с сотр.
Рэкер и Стокениус
147
148
149
150
151
152
153
или химической энергией. Такой процесс нельзя представить
без некоторой функциональной мембраны и без существования
полупроводников (белков), акцепторов и доноров электронов.
В этой области единственные удовлетворительные эксперимен-
тальные данные относятся к фосфорилированию в присутствии
микросфер, хотя реакция происходила не в водной среде, а в
ДМФ. Эти данные являются самыми первыми доводами в поль-
зу того, что фосфорилирование может быть реализовано по-
средством «искусственных предбиологических мембран» [146,
154]. Первичные организмы могли, таким образом, производить
полезную энергию посредством цикла АТФ, используя ана-
эробное брожение органических соединений или световую энер-
гию. Последний путь, наверное, главнейший для зарождения и
протекания клеточных процессов (запасы солнечной энергии
огромны, на поверхность Земли попадает лишь ~ 3 1024Дж/год;
отсутствие озонного экрана во времена бескислородной атмо-
сферы определило, конечно, более сильные энергетические по-
токи), но он не мог реализоваться в отсутствие фотовозбуждае-
мых пигментов, так называемых «световых антенн», ответствен-
ных за поглощение солнечной энергии.
В современных фотосинтезирующих организмах (расти-
тельных и микробных) молекулы хлорофилла вовлечены в кон-
версию света через «фотосинтетическую систему» (ФС). Боль-
шинство этих молекул пассивно в ФС (в смысле конверсии све-
та) и действует лишь в направлении адсорбции и переноса энер-
гии светового кванта к ограниченному числу молекул хлорофил-
ла специального вида, которые считаются центрами фотореак-
ций. Это то самое место, в котором энергия одного светового фо-
тона трансформируется в «способность» окислять и восстанав-
ливать для непрерывной генерации химических реакций.
Практически не существует принципиальных различий меж-
ду структурами «антенн» и молекул хлорофилла из центров
фотореакций. Они различаются лишь способом локализации
молекул относительно друг друга в матрице фотосинтетической
мембраны [155]. Из-за иной природы энергии первобытной
эры (наличие сильной УФ-радиации) и, конечно, из-за изменений
окружающей среды во времени структуры фотовозбуждаемых
молекул, а также надмолекулярные матрицы должны были
отличаться от современных. Следовательно, существующая
«пропасть» между двумя фотосинтезирующими системами была
преодолена лишь в ходе эволюции. Представляется естествен-
ным, чтобы имитирующие эволюцию эксперименты были на-
правлены на выявление некоторых более простых фотовозбуж-
даемых пигментов, которые могли появиться одновременно с
другими главными биополимерными структурами и участвова-
ли в надмолекулярных образованиях. В табл. 6 содержатся
данные о синтезе порфиринов в этих условиях.
32
Таблица 6. Синтез соединений порфиринового типа в условиях, имитирующих
абиотические
Реагенты Вид энергии Конечный продукт Авторы Лите- ратура
Бензальдегид + пиррол Теплота Смесь порфи- Ротемунд 156а
Бензальдегид 4- пиррол + -|- соли цинка » > Кальвин с сотр. 157
Пиррол + бензальдегид -J- 4-вода УФ-излуче- ние > Шутка 158
Пиррол -]- бензальдегид + + пиридин + ацетат цинка •(-Излучение а-, ₽-, f- и 6- Фенилпорфирин Шутка с сотр. 159
Пиррол -]- вода + форм- альдегид минерал Теплота Порфирин Красновский и Умрихина, Ходжсон и Бейкер 160 161
а-Аминолевулиновая кис- лота + вода (щелочная среда, условия анаэроб- ные) » Порфобилино- ген Скотт 162
а-Аминолевулиновая кис- лота УФ-излуче- ние Порфириновые пигменты Шутка с сотр. 49, 50
СН4, NH3, Н2О Электриче- Порфириновые Ходжсон 47
ские разряды пигменты Пониамперума и Мак, Симио- неску с сотр.6 48
а Опыты были выполнены не в пребиотических условиях. 6 Си. раздел 2.2.1 2.
1.4. Критические замечания о современных теориях
Протобиополимеры, а не структуры липидного типа и фото-
возбуждаемые пигменты, представляли собой основные компо-
ненты для развития первичных жизненных функций. Разрабо-
танные теории о генезисе макромолекулярных соединений с
данной структурой и функциональностью не согласуются с
«природным» возникновением протобиополимеров, для сущест-
вования которых требуется наличие примитивных живых сис-
тем. Почти во всех имитирующих экспериментах, проведенных
до настоящего времени, вводились «биополимеры», синтезиро-
ванные химическим путем, или естественные экстракты, т. е.
нарушался ход химической эволюции, происходившей непрерыв-
но. Более того, эти теории и соответствующие опыты направле-
ны на исследование возникновения определенного класса био-
полимеров (полипептидов, полисахаридов, нуклеиновых кислот
и т. д.) без учета возможности одновременного образования
ключевых биополимеров (структурных и функциональных), ко-
торая, вероятно, является самым важным шагом в процессе
формирования клетки.
33
Относительно концепций о происхождении протобиополиме-
ров могут быть сделаны следующие общие замечания:
1. Если допустить, что предбиологическая Земля была горя-
чей, тогда нельзя объяснить, как создались необходимые без-
водные условия возникновения протобиополимеров, поскольку
обширные площади (примерно 80% поверхности нашей плане-
ты) были покрыты водой Этим огромным количеством воды
определяются высокие значения парциального давления водя-
ных паров в земной атмосфере, которые увеличиваются с ростом
температуры. Согласно оценкам, повышение температуры окру-
жающей среды на 5°С на уровне моря может привести к полно-
му таянию ледников и, следовательно, покрытию континентов
двухметровым слоем воды. В такой очень влажной атмосфере
исключены процессы поликонденсации.
2. Невозможно аргументировать то обстоятельство, что верх-
ние температурные границы на абиотической Земле были ниже
пределов устойчивости протобиополимеров, так как температу-
ры поликонденсации (150°С) и разрушения (200°С) этих «био-
полимеров» довольно близки. Значительные изменения теплово-
го режима на поверхности Земли в течение длительных проме-
жутков времени благоприятствовали бы интенсивным реакци-
ям разрушения.
3. Трудно представить, как выжили в этих безводных усло-
виях протобиополимерные структуры под действием значитель-
ной энергии излучения.
4. Не поддаются объяснению пониженная реакционная
способность химических соединений, растворенных в океанах,
во время процессов испарения и соответственно устойчивость
агентов дегидратации в разбавленной водной среде, поскольку
известно, что среди большого разнообразия сосуществующих мо-
лекул, биомономеров и агентов дегидратации может возникнуть
неограниченное число взаимодействий.
5. Трудно нарушить равновесие реакции
мономер =₽*= полимер + вода
в условиях разбавленных растворов.
Критически оценив рассмотренные теории, основанные на
важных экспериментальных результатах по синтезу протобио-
полимеров (первых живых систем) и границы их применимости,
мы в течение 15 лет проводили исследования, благодаря кото-
рым разработана новая модель возникновения жизни, известная
под названием «низкотемпературная теория» (теория остыва-
ния).
2
Низкотемпературная теория
происхождения жизни
2.1. Условия на первичной Земле
по низкотемпературной теории
Концептуальные элементы новой модели включают как ар-
гументы и соображения теоретического характера, так и много-
численные экспериментальные данные по воспроизведению не-
прерывной эволюции в абиотических условиях.
2.1.1. Первичная атмосфера
Состав. Нет сомнения в том, что земная атмосфера вначале
была восстановительной и характеризовалась повышенным со-
держанием водорода и гидридов (Н2О, СН4, NH3 и H2S).
Позднее она стала окисленной и в ее составе преобладали
N2, Ог, СО и СОг. Основные аргументы в пользу существования
начальной восстановительной атмосферы таковы: а) наличие
аммиака как стабильного соединения азота в присутствии водо-
рода; б) геохимические данные о соотношении Fe*+ и Fe2+ в
железных рудах; в) наличие предшественников низших орга-
низмов, выделяющих метан; г) между восстановленной и окис-
ленной атмосферой предполагается переходный этап, назван-
ный нейтральным (отсутствие окислительно-восстановительных
процессов) и характеризуемый отсутствием азота и кислорода
в течение примерно одного миллиарда лет [163—165].
Теоретические обсуждения последних нескольких лет указы-
вают на то, что первичная атмосфера, обычно называемая ме-
тан-аммиачной, должна была состоять фактически из метана и
азота со следами аммиака. Эта точка зрения подтверждается
хорошей растворимостью аммиака в воде, что могло бы привес-
ти к образованию иона аммония (NH4), если бы интенсивность
перемешивания океанов и осадков была достаточной для сохра-
нения значений pH в пределах 8 и для протекания реакций
обмена между этими ионами и ионами калия из глины:
+[глина] К+---► К+ + [глина] NH^"
По современным концентрациям ионов калия в океане
(0,01 М) можно сделать вывод о том, что почти все ионы NH*
должны были поглотиться минеральными глинами в начальный
период.
35
Приведем следующие критические соображения относитель-
но атмосферы, бедной аммиаком:
1. Наличие обширных холодных поверхностей, а также по-
стоянное существование полярных ледников определили диф-
ференцированную конденсацию водяных и аммиачных паров —
явление, которое могло бы привести к образованию поверхност-
ных структур, очень богатых аммиаком и ионами аммония.
2. Израсходованный аммиак компенсировался не только за
счет того, который содержался в глине, но и за счет того, ко-
торый имелся в большом числе органических производных.
Часть этих соединений освободилась в процессе дезаминирова-
ния и расщепления.
3. Реакции синтеза аммиака (из азо га и водорода) и его
фиксация в глине длительное время протекали одновременно.
4. Песок пустынь, богатый диоксидом титана, катализировал
в присутствии железа и под действием солнечного света реак-
ции превращения атмосферного азота и водорода в аммиак
[167—170]. Считается, что на каждые 0,5 га пустыни ежегодно
могло бы выделяться 10 кг аммиака.
Обдумав все эти аспекты, мы остановились в своих экспе-
риментах на атмосфере, состоящей из метана, паров воды и ам-
миака в различных пропорциях.
2.1.2. Температура и давление в околоземной среде
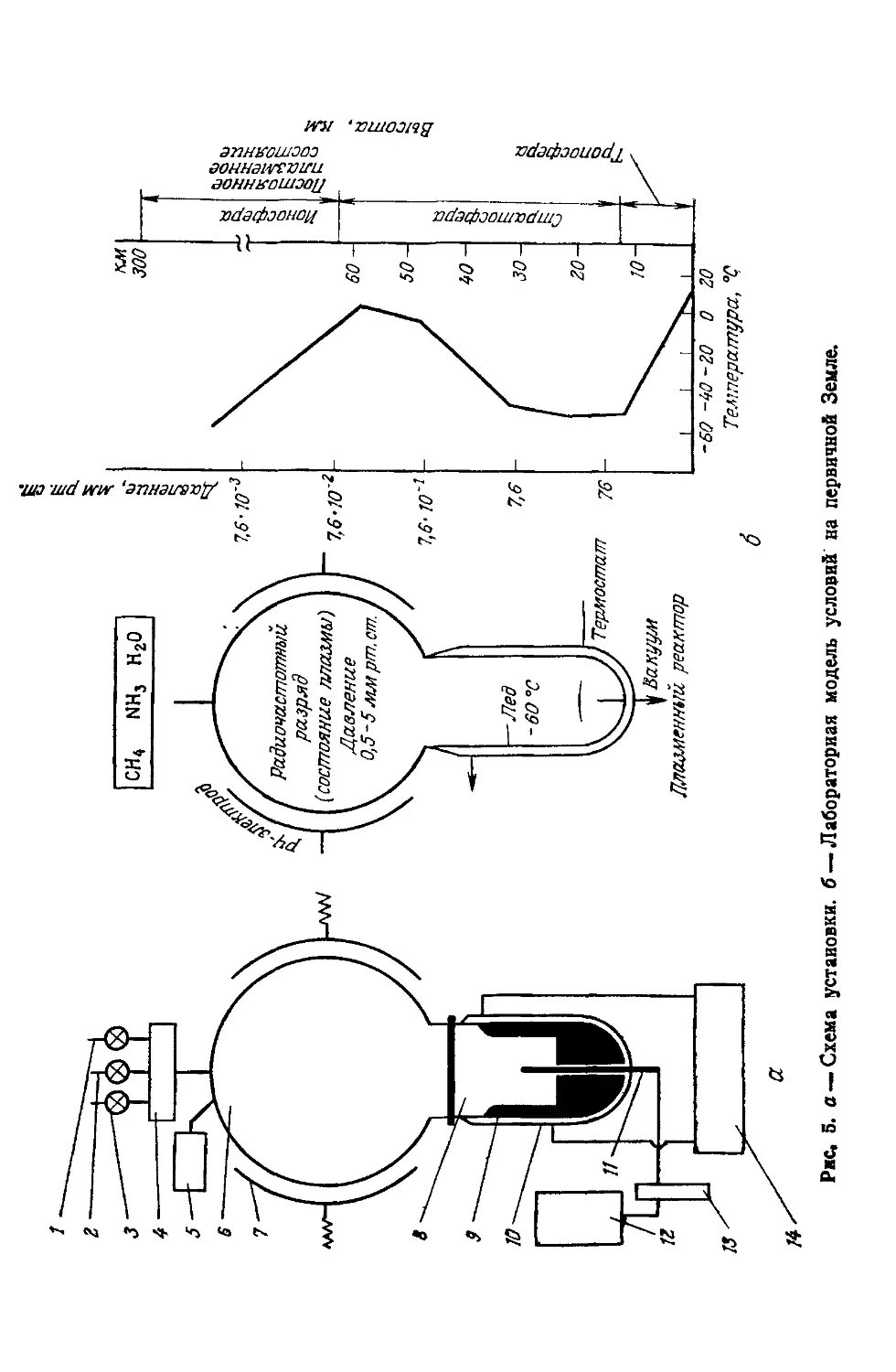
Атмосферное давление экспоненциально падает с увеличе-
нием высоты над поверхностью Земли. Оно достигает почти
30 мм рт. ст. на высоте 20 000 м и менее 1 мм рт. ст. на высоте
40 000 м. Известно также, что с увеличением расстояния от
Земли температура атмосферы понижается до некоторого ми-
нимального уровня (примерно до —60°С). Этот минимум дости-
гается на расстоянии 10 000—20 000 м, после чего наблюдается
известная термическая инверсия. (Следует подчеркнуть, что на
высоте ~ 50 000 м от Земли температура все еще остается ниже
0°С [171].) Поэтому можно считать, что взаимосвязь между тер-
мическим фактором и атмосферным давлением существовала
независимо от состава атмосферы.
Исследования превращений органических, неорганических,
элементоорганических соединений или их смесей в макромоле-
кулы, выполненные за последние два десятилетия с использова-
нием в качестве источника энергии холодной плазмы, показыва-
ют, что во всех процессах, которые приводят к синтезу полиме-
ров, главную роль играют адсорбционные явления. При низких
температурах этот процесс интенсифицируется. На абиотической
Земле могли находиться обширные пространства с пониженным
температурным режимом, что подтверждается наличием полю-
сов, частотой оледенений и отсутствием парникового эффекта.
В наши дни в атмосфере обнаруживаются частицы льда ^ли
36
крупицы космической материи, покрытые льдом. Очевидно,
что именно температурой определялось парциальное давление
составных частей первичной атмосферы на земной поверхности.
Наконец, многокомпонентные системы (активные частицы в
газовой фазе), необходимые для образования макромолекуляр-
ных соединений, являются специфическими гетерогенными сис-
темами, в которых протекают полезные адсорбционные процес-
сы. Важную роль в осуществлении подобных реакций и образо-
вании протобиополимеров в пребиотическую эпоху могло играть
существование оптимальных условий (например, сильно охлаж-
денной поверхности).
Достижение высоких концентраций активных частиц в газо-
вой фазе (в смысле удовлетворения требований для многочас-
тичных столкновений, необходимых для возникновения макро-
молекулярных соединений), уменьшение количества реакций
расщепления или превращения продуктов синтеза, а также ли-
митирование процессов разложения из-за энергетических усло-
вий (термодинамических и радиационных) говорят также в
пользу поверхности с низкой температурой.
Выживание протобиологических соединений, таким образом,
стало возможным благодаря тому, что они улавливались верх-
ними слоями ледяной поверхности (замерзших океанов).
Отрицательный термический режим предопределил также
условия дегидратации для реакций «поликонденсации» (процес-
сы захвата свободных радикалов и их рекомбинации в периоды
потепления). Наличие вокруг Земли среды с пониженной тем-
пературой повлекло за собой следующие события. Во-первых,
уменьшение величины атмосферного давления благодаря частич-
ной конденсации воды и аммиака, что определило практически
свободное проникновение коротковолновой солнечной радиации
через атмосферу, богатую метаном (хронологический приоритет
возникновения структур липидного типа). Во-вторых, концент-
рацию органической материи, поскольку кристаллическая струк-
тура и возможные чередующиеся процессы замораживания —
размораживания способствовали исключению примесей во вре-
мя кристаллизации и направленного соединения молекулярных
фрагментов (стерический и матричный эффект). Кроме того,
захват льдом протобиологических соединений обеспечивал рез-
кое локальное увеличение их концентраций в периоды потеп-
ления.
2.1.3. Источники свободной энергии
Наряду с излучательной, тепловой и механической видами
энергии, существовавшими в абиотической среде и упомянуты-
ми ранее, мы рассматриваем еще один особенно важный источ-
ник энергии, который игнорировали другие исследователи в
37
экспериментах по воссозданию первичных земных условии, а
именно энергию плазменного состояния.
За исключением нашей планетной системы, по имеющимся
оценкам, 99% Вселенной находится в состоянии плазмы. Земля
также окружена слоем плазмы, известным под названием ионо-
сферы. Другие виды естественной плазмы (такие, как полярные
сияния или молнии) возникают в атмосфере на больших высо-
тах над поверхностью Земли. Посредством электрических явле-
ний четвертое агрегатное состояние материи, как известно,
приводит (и могло привести в прошлом) к важным изменениям
в структуре молекул газов — составных частей атмосферы. Наи-
более важным типом плазмы для рассмотрения химической
эволюции является ионосфера (холодная плазма) ввиду ее по-
стоянства и значительности объема. В настоящее время она
представляет собой пояс, который простирается в пределах
60—300 км над поверхностью Земли. Напрашивается вывод о
том, что в условиях наличия больших поверхностей с отрица-
тельной температурой произошла частичная конденсация паров
воды и аммиака — явление, которое привело к значительному
увеличению парциального давления соединений с малым удель-
ным весом (метан). Уменьшение атмосферного давления откры-
ло путь намного более интенсивному развитию процесса иони-
зации и, как следствие, расширило состояние плазмы в сторону
непосредственной близости к Земле. Таким образом, можно по-
казать, что энергия, освобождаемая плазмой, доминировала на
поверхности Земли с пониженными температурами. Высокие
парциальные давления компонентов атмосферы с малыми
удельными весами могли обусловить в это же время определен-
ную последовательность возникновения соединений, важных с
биологической точки зрения (например, преимущественное воз-
никновение структур липидного типа).
Все виды энергии абиотической Земли (излучательная, элек-
трическая, механическая, энергия плазмы), которые могли дей-
ствовать на газообразные компоненты атмосферы, имеют одну
общую характеристику: они преобразуют химические соединения
(особенно органические производные) в значительное количе-
ство активных частиц, таких как моно- и полифункциональные
свободные радикалы [172—187]. Следовательно, в процессе мо-
лекулярной эволюции плотность энергии имела большее значе-
ние, чем ее вид. В этой связи важность постоянства ионосферы
не нуждается в дополнительных объяснениях. Следует отметить,
однако, что рекомбинация активных частиц не подчиняется за-
конам классической химической термодинамики, поскольку для
того, чтобы ее охарактеризовать, необходимо учитывать специ-
фику процессов в ходе эволюции, а макромолекулярные соеди-
нения могут образоваться в результате рекомбинаций в водных
средах.
38
2.1.4. Открытые системы
Особая значимость «открытых систем» обсуждалась много
лет назад Опариным, Фоксом, Пригожиным, Дозе и др. [188—
190, 16, 67]. Имеется достаточно аргументов, которые доказыва-
ют, что эксперименты по воссозданию первичных земных усло-
вий в «закрытой системе» (закупоренный сосуд) значительно
менее показательны и не воспроизводят условий абиотической
Земли. Открытой системе отдается предпочтение на основании
следующих рассуждений:
а) Первичная Земля представляла собой систему, которая
сама способна обеспечить химическое равновесие в течение
длительного периода времени.
б) Закрытые системы на земной поверхности достаточно
редки. Соединения, захваченные льдом, составляли исключение,
существовали в малых количествах и не повлияли значительно
на химическую эволюцию.
в) Закрытая система привела бы к быстрому изменению
состава атмосферы и, следовательно, к непрерывному измене-
нию энергетического равновесия. Это явление находится в про-
тиворечии с длительной химической эволюцией, необходимой
для накопления, преобразования и самосборки биологически
важных органических соединений.
2.1.5. Заключение
Учитывая все приведенные выше аргументы, мы использо-
вали в своих экспериментах следующие основные параметры,
приведенные в табл. 7.
Таблица 7. Условия иа абиотической Земле в соответствии
с низкотемпературной теорией возникновения жизни
Состав атмосферы
Природа твердой поверхности
Температура поверхности
Атмосферное давление
Основной источник энергии
Вид термодинамической системы
Смеси СН4 4- NH3 + НаО в различных
соотношениях
Слой льда
—504—60°С
1—10 мм рт. ст.
Холодная плазма
СИ крытая
Воспользовавшись свойствами поверхностей с низкой темпе-
ратурой для реализации синтеза высокомолекулярных соедине-
ний, используя различные смеси «первичного газа», активиро-
ванного под действием холодной плазмы при относительно низ-
ких давлениях, и обеспечив в то же время требования открытой
системы, мы предприняли в большом числе экспериментов изу-
чение продуктов реакции, образованных из низко- и макромоле-
кулярных соединений. Например, исходя из смеси метана, ам-
39
миака и паров воды, изучив оптимальные условия рекомбинации
активных частиц, полученных в газовой фазе под воздействием
электрических разрядов, мы одновременно получили соединения
полипептидного, полисахаридного и липидного типов вместе с
ограниченным количеством низкомолекулярных производных,
таких, как аминокислоты, сахара и т. д.
2.1.6. Экспериментальная лабораторная модель
Схема установки и соответствующая модель показаны на
рис, 5, а, б.
В классическом эксперименте в приемник 4 вводятся опре-
деленные количества метана, аммиака и паров воды с помощью
игольчатых вентилей 1—3. Полученная газовая смесь непре-
рывно всасывается в сферическую часть реактора 6 (колба из
стекла пирекс вместимостью 6 л), в котором с помощью высо-
кочастотного генератора (мощность 5 кВт, частота 13,6 МГц)
создается холодная плазма. Внешние электроды 7 изготовлены
из серебра. С помощью вакуумного агрегата 12, защищаемого
ловушкой 13, создается вакуум (2—4 мм рт. ст.), контролируе-
мый манометром 5. Активные частицы, образованные в состоя-
нии плазмы, адсорбируются на поверхности льда 9, располо-
женного внутри цилиндрической части реактора 8 и охлажден-
ного до —60°С с абсолютным этиловым спиртом, циркулирую-
щим через охладительную систему 14.
Воссоздание природной плазмы с помощью электрического
разряда основано на следующих соображениях.
1. Радиочастотная плазма — очень сложное состояние, бога-
тое энергией. Она состоит из фрагментов ионизированных моле-
кул, ускоренных электронов, локализованной тепловой энергии
и электромагнитного излучения в широком диапазоне спектра.
Эта «холодная плазма» образуется естественным путем при
относительно низком давлении (несколько мм рт. ст.). Извест-
но, что более высокое давление генерирует «горячую плазму»,
обладающую сильным разрушительным эффектом. Компоненты
системы, равно как и область приложенных давлений, допуска-
ют примерное совпадение характеристик холодной плазмы с
теми, которые были на первичной Земле.
2. Радиочастотный электрический разряд равномерно рас-
пространяется по всему объему реакционной камеры.
3. Состояние плазмы может быть реализовано в непосредст-
венной близости от поверхностей с различной температурой,
что способствует аккумуляции активных частиц на слое льда.
Таким путем может быть достигнута высокая концентрация ак-
тивированных молекулярных фрагментов и, следовательно,
обеспечено основное условие для многочастичных столкновений
и образования макромолекулярных структур.
4. Интенсивность реакций разложения в холодной плазме
40
Постоянное
плазменное
Тропосфера состояние
Высота, км
Рис, 5. а —Схема установки, б —Лабораторная модель условий на первичной Земле.
незначительна по сравнению с горячей плазмой (пламя, дуговой
разряд и т. д.). Этот факт имеет огромное значение, поскольку
обусловливает образование на твердой поверхности, играющей
роль матрицы, больших молекулярных фрагментов.
5. Холодная плазма может быть строго контролируема и
легко управляема, что определяет хорошую воспроизводимость
экспериментов.
Задача обеспечения открытой системы была решена путем
постоянного поддержания в реакторе исходной газовой смеси
и одновременного удаления из него различных соединений с
помощью вакуумной установки. Таким путем на всем протяже-
нии хода реакций поддерживался равновесный состав «первич-
ной атмосферы». Для получения исходной газовой смеси были
использованы различные соотношения метана (чистота 99,99%),
аммиака (чистота 99,9%) и паров воды (бидистиллированная,
очищенная с помощью KMnCU). Расход аммиака и метана регу-
лировался с помощью установки высокого вакуума и системы
игольчатых вентилей. Количество аммиака измеряли дополни-
тельно с помощью расходомера, линейного по массе (Matheson
Gas Products), а парциальное давление паров воды определяли
по температуре находившегося в системе льда (из 50 мл дистил-
лированной воды, при —60°С замороженной на цилиндрических
стенках реактора).
В зависимости от состава исходной газовой смеси в конечном
общем продукте реакции преобладали структуры полипептид-
ного, полисахаридного или липидного типа. Первые два образо-
вывались преимущественно тогда, когда основными компонен-
тами служили аммиак или вода (повышенное содержание ам-
миака или соответственно воды в газовой смеси), в то время
как высокие концентрации метана приводили, как правило, к
липидным структурам.
2.2. Синтез протобиополимеров
2.2.1. Синтез соединений полипептидного типа [191—200, 202]
Экспериментальные условия синтеза структур полипептид-
ного типа представлены в табл. 8.
Следует отметить, что во всех выполненных экспериментах
мощность генератора (5 кВт; 13,6 МГц) и взаимное расположе-
ние электродов в реакторе были постоянными. Синтезы прово-
дили после стерилизации реактора плазменным разрядом в воз-
духе, а пробы готовили в стерильных условиях. Конечный про-
дукт реакции изучали обычными физико-химическими методами
по схеме, приведенной на рис. 6. Сложную смесь А (полу-
ченную после оттаивания реакционной среды) фильтровали для
удаления нерастворимого материала темного цвета, получив-
шего название «черный полимер» F. Небольшое количество
42
Суммарный, продукт
(4/ реакции
Фильтрование
Сухой общий
продукт
Элементный .
анализ
ЯМР, ИК-спектро-
скопия
Черный
нераствори-
мый
полимер
Гидролиз
К
Лиофилизация Ггдролиз
Гомогенный суммар-
ный продукт
(7) Гидрализо-
ванный
продукт
Анализ
аминокислот
Анализ
аминокислот
Гидролиза -
ванный
продукт
Гель-фильтрация
(определение поглощения
в УФ-области и интерфе-
рометрия}
Фракции
Лиофилизация
Лиофилизо-
винные
фракции
Гидролиз
ИГ-спектроскопия
_ Определение пигмея-
"* тов (структур
порфиринового
типа}
ИК-спектроскопия
Анализ аминокислот
Анализ оснований
Элементный анализ
Метод Лоури
Адсорбционная спектроскопия
в Уф-области
Фракции
Гидролизо-
ванные
фракции
Анализ
аминокислот
Тонкослойная
хроматография
Бумажная
хроматография
Рис. 6. Схема разделения и аналитические методы, используемые при изучении суммарного продукта реакции,
Таблица 8. Условия эксперимента по синтезу производных
полипептидного типа
Состав модельной атмосферы
Давление в камере реактора до обра-
зования плазмы
Давление в камере реактора после об-
разования плазмы
Объем льда, первоначально введенно-
го в цилиндрическую часть реактора
Температура льда
Продолжительность реакции
nh3+ch4 + h2o
(1:1:0,1 мм рт. ст.)
2,1 мм рт. ст.
3,5—4,0 мм рт. ст.
50 мл
—60°С
5—8 ч
фракции Н из первоначального продукта после лиофилизации
анализировали методом ИК-спектроскопии для сравнения с
гидролизатом или кислотой I (рис. 7). Можно видеть, что ИК-
спектр суммарного продукта содержит основные полосы, харак-
терные для пептидной связи —СО—NH—:
ззоо
3080
1600
1570
1540
1300
1240
см-1
см-1
см-1
см-1
см-1
см-1
см-1
—NH—
—NH... Н
С=О (амид I)
—NH— (из —NH-CO—)
(8) —NH— (из —NH—СО—) (амид II)
О—с—N; —NH—(амид III)
Наличие очень интенсивного пика при 3130 см-1 (NH^) и ис-
чезновение пиков при 1570 см-1 и 1540 см-1 в ИК-спектре гид-
ролизованного материала подтверждает наличие связей пеп-
тидного типа в суммарном продукте.
По данным метода Лоури [201], в суммарном нелиофилизо-
Рис. 7. ИК-спектр фракции Н. Диски из КВг.
1—негидролизованный продукт; 2 — гидролизованный продукт.
44
ванном продукте В содержится примерно 11 мг/мл полипептид-
ного материала. Данные элементного анализа этого продукта
сходны с полученными при анализе полиглицина:
Содержание, %
Суммарный продукт
Полиглицин
С N Н о
44,96 32,91 7,02 15,11
42,11 24,56 5,23 28,10
Рис. 8. Спектры поглощения в УФ-обла-
сти суммарного продукта и альбумина.
1 — суммарный продукт; 2 — альбумин.
Отметим в то же время
суммарного продукта и аль-
бумина (рис. 8).
Путем фракционирова-
ния гомогенного продукта
В выявлено наличие поли-
меров С с молекулярной
массой несколько десятков
тысяч. Процесс гель-фильт-
рации сопровождался до-
полнительным осаждением в
верхней части колонки не-
большого количества чер-
ного полимера F. Сходные
результаты получены с по-
мощью дискэлектрофореза
(рис. 9).
Полосы, характерные
для пептидов, в гелях, окра-
шенных красителем Кумас-
си голубым (концентрация
0,1%) были определены на
денситометре (Zeiss). Обна-
ружена гомогенная фрак-
ция с молекулярной массой
~30 тысяч (определена пу-
тем сравнения со стандартными образцами). Гель-фильтраци-
ей н определением в УФ-лучах установлены соединения с мо-
лекулярными массами в тех же областях (рис. 10).
Качественные и количественные определения связанных и
свободных аминокислот в суммарном продукте, фракциях и чер-
ном полимере осуществлялись с помощью автоматического ана-
лиза методами тонкослойной и бумажной хроматографии.
Для определения содержания свободных аминокислот при-
меняли главным образом осаждение пептидного материала из
проб пикриновой кислотой. После фильтрации и нейтрализа-
ции (смола дауэкс 2-Х10 в ОН~-форме) пробы подвергали
количественному анализу. Данные о наличии свободных амино-
кислот в суммарном продукте показаны на рис. И—13. Иден-
тифицированы три аминокислоты: серин, глицин, аланин.
В табл. 9 представлены полученные данные о связанных и сво-
45
бодных аминокислотах. Сле-
дует отметить тот факт, что
последние обнаружены в коли-
чествах, пренебрежимо малых
по сравнению со связанными
аминокислотами. В то же вре-
мя степень превращения про-
дукта в аминокислоты отно-
сительно высока (30—40"%),
что свидетельствует в пользу
существования полипептид-
ных структур. (В некоторых
фракциях зарегистрированы
еще более высокие значения.)
Из полимеров на основе си-
нильной кислоты выделяется
при гидролизе только 5—8%
аминокислот, что исключает
им наличие подобных соединений.
То, что в гидролизатах про-
Рис. 9. Результаты диск-электрофо- дуктов, полученных в опытах
реза суммарного продукта н альбу- на основе низкотемпературной
мина- теории, преобладают указан-
ные три аминокислоты, кото-
рые наряду с другими компо-
нентами обнаружены в гидролизатах органических материалов,
доставленных с поверхности Луны или с метеоритов, и в земной
лаве и синтезированы также в других сходных экспериментах
(табл. 10), подтверждает предположение об образовании поли-
Таблица 9. Концентрации свободных и связанных аминокислот
в суммарном продукте и черном полимере3
Анализируемый продукт Концентрация (мг/мг лиофилизованного продукта)
свободные аминокислоты связанные аминокислоты
глицнн треонин глицин аланнн серин лизин фенил- аланин
Суммарный про- 0,0014 Следы 0,36 0,00026 0,0025 Следы 0
дукт Фракция I 0 0 0,27 0,00023 ;0,67-10“6 0 0
Фракция II 0 0 0,13 0,00014 |0,15•10-* 0 0
Фракция III 0 0 0,062 0,00006 |0,87-10-6 0 0
Фракция IV 0 0 0,058 0,00001 0,32-10~6 0 0
Черный полимер 0 0 0,031 0 0 0 Следы
а Получены путем кислотного гидролиза в 6 я. НС1 за 24 ч при 110°С в закрытых пробир-
ках из стекла пирекс и инертной аргоновой среде.
46
Рис. 10. Гель-хроматограмма, полученная с УФ-детектором (280 нм).
Размеры колонки, заполненной сефадексом G-100: диаметр 22 мм, высота
476 мм; объем пробы 10 мл, скорость 2 мл/мин.
Рис. 11. Хроматограмма эталонной смеси аминокислот (получена на автома-
тическом анализаторе JEOL 6 АН).
Эталонная смесь PIERCE. Концентрация каждой аминокислоты 0,1 моль/мл;
размеры колонки, заполненной смолой LC-R-2: длина 50 см, диаметр 0,8 см;
скорость буфера 0,98 мл/мин.
пептидов через посредство «статистических» структур независи-
мо от природы источника энергии.
Как отмечалось ранее, наряду со структурами полипептид-
ного типа обнаруживаются небольшие количества нераствори-
мого черного полимера F. Для выяснения природы этого мате-
риала его исследовали химическими и спектральными методами
анализа. Его ИК-спектр (рис. 14) полностью отличается от
спектра растворимого продукта, изученного ранее. Интенсив-
47
Рис. 12. Хроматограмма свободных аминокислот, полученных в условиях
плазмы (автоматический анализатор аминокислот JEOL 6 АН).
Эталонная смесь PIERCE. Концентрация каждой аминокислоты 0,1 моль/мл;
размеры колонки, заполненной смолой LC-R-2: длина 50 см, диаметр 0,8 см;
скорость буфера 0,98 мл/мин.
Рис. 13. Хроматограмма контрольной пробы (бидистиллированная вода, про-
пущенная через смолу дауэкс 2-Х 10 в ОН_-форме).
Получена на автоматическом анализаторе аминокислот JEOL б АН; эталон-
ная смесь PIERCE. Концентрация каждой аминокислоты 0,1 моль/мл; раз-
меры колонки, заполненной смолой LC-R-2: длина 50 см, диаметр 0,8 см; ско-
рость буфера 0,98 мл/мин.
ная полоса при 2200 см-1 (—C=N), общее уменьшение интен-
сивности спектра, а также существование максимумов при
3200 см-1, (—NH2) и 1620 см-1 (—C = N—) свидетельствуют о
том, что это полимер на основе синильной кислоты и ее произ-
водных. С другой стороны, щелочная среда (pH 8,0—9,5), ко-
торая характерна, как правило, для растворов, полученных
48
Таблица 10. Аминокислоты, полученные путем гидролиза предшественников,
возникших под действием различных источников энергии
Холодная плазма Метеориты (хондриты) Лунные пробы (ракета «Апол- лон») Земная лава Другие сходные эксперименты
Глицин Алании Глутаминовая кислота Аспарагино- вая кислота Серии Глицин Алании Глутаминовая кислота Аспарагиновая кислота Валин Пролии Глицин Аланин Глутаминовая кислота Аспарагиновая кислота Серин Треонин Глицин Аланин Глутаминовая кислота Аспарагиновая кислота Серин Треоиин Изолейции Лейцин Валин Глицин Аланин Глутаминовая кислота Аспарагиновая кислота Серин Валин Пролин
Рис. 14, ИК-спектр черного полимера (диски из КВг).
после таяния льда, благоприятствует синтезу полимеров си-
нильной кислоты.
В ЯМР-спектре продукта F (рис. 15) выявлен интенсивный
сигнал при 3,5 м. д. В присутствии NaOH или DC1 ои смещается
к более низким значениям; это наводит на мысль о том, что ис-
точником протонов служит скорее всего группа —NH—, а не
Результаты элементного анализа (44% С; 27,21% N; 4,68% Н
и 24,0% О), наличие только одной аминокислоты (глицина)
после гидролиза, а также данные спектральных исследований
(ИК и ЯМР) дают основание полагать, что черный полимер
имеет не пептидную природу.
Повышенное содержание аммиака в первоначальной газовой
смеси и соответственно азота в элементном составе конечного
49
Рис. 15. а—ЯМР-спектр (60 МГц) соединений, выделенных из суммарного
продукта (растворитель ДМСО — d6; комнатная температура); б — ЯМР-
спектры (60 МГц) черного полимера.
1 — основная среда (NaOD); 2—кислая среда (DC1) (растворитель ДМСО —
de; комнатная температура).
продукта, а также разнообразие химических микро- и макроком-
понентов конечной среды реакции побудили нас изучать и дру-
гие азотсодержащие «кирпичики» живой материи, например
основания нуклеиновых кислот и фоточувствительные пигмен-
ты (соединения порфиринового типа).
50
2.2.1.1. Идентификация оснований нуклеиновых кислот [51, 57, 203]
Наши исследования суммарного продукта позволили выявить
основания только в его кислотных гидролизатах. С помощью
одномерной хроматографии на
бумаге в сочетании с анализом
выделенных проб в УФ-облас-
ти были изучены четыре осно-
вания (аденин, гуанин, гипо-
ксантин и цитозин). Все про-
бы гидролизованы 70%-ным
раствором НСЮ4 (2 ч, 100°С);
избыток нейтрализован 10 н. Гуанин
КОН, а в надосадочной жид- ^Хнтин
кости предварительно опреде- Цитозин
ляли пуриновые и пиримиди- венин
новые основания путем хрома-
тографии на бумаге с исполь-
зованием соответствующих
стандартов (рис. 16). Для по-
лучения количественных дан-
ных регистрировали УФ-спек-
тры поглощения хроматогра-
фических проб и сравнивали
их со спектрами стандартных
проб, содержащих определен-
ное количество оснований
(рис. 17, а—г). В табл. 11
приводятся концентрации ос-
нований, содержащихся в ко-
нечном продукте реакции.
Рис. 16. Одномерные хроматограммы
азотистых оснований — свидетелей н
связанных азотистых оснований, вы-
деленных при гидролизе суммарного
продукта.
Ватман 1, нисходящий метод, двой-
ное элюирование; элюент — смесь
н-бутилового спирта, уксусной кисло-
ты н воды в соотношении 4:1:5;
проявитель — спиртовой раствор эо-
зина + HgCl2.
Таблица 11. Содержание пуриновых и пиримидиновых оснований
в гидролизованном (70%-ная НС1О4, 2 ч, 100°C) и нейтрализованном (10 и. КОН)
суммарном продукте реакции]
Концентрация оснований в суммарном продукте
Определяемые основания лиофилизованном (мг/мг конечного продукта) иелиофилиэованиом (ммоль/мл)
Аденин Гуании Гипоксантин Цитозин 1,4-Ю-з 2,5-10-2 1,3-10-з 1,0-Ю-з 3,0-Ю-8 4,8-10“* 3,0-Ю-» 7,5-10“*
51
ZOO 250 000
Длина волны, нм
а
Рис. 17. Спектры поглощения в УФ-области оснований, выделенных из про-
дуктов синтеза в плазме, а также соответствующих эталонов (кварцевые кю-
веты 1 см; растворитель — 0,1 и. НС1).
1 — эталон; 2 — азотистое основание: а — аденин; б — гуанин; в — гипоксан-
тин; а — цитозин.
200 250 300
Дополнительная аналитическая информация (количествен-
ная и качественная) была получена методом фильтрации на
ионообменных колонках с последующим определением в УФ-
области (Х=260 нм) (рис. 18). Количественные результаты,
Таблица 12. Содержание пуриновых и пиримидиновых оснований,
определенное иоиообмеиной хроматографией на смоле дауэкс 1-Х 8 AG
(мг/мг суммарного продукта)
Цитозин Гуанин Аденин Гипоксантин
1,08-10-» 2,7-10-3 1,44-10-з 1,90 10-»
52
Рис. 18. Диаграмма разделения оснований, синтезированных в плазме (смола
дауэкс 1-Х 8 AG; длина колонки 52 см, диаметр 2,3 см).
найденные вычислением площадей соответствующих полос в
сравнении со стандартными пробами, представлены в табл. 12.
Значения, полученные обоими методами, хорошо согласуются.
2.2.1.2. Идентификация структур порфиринового типа [52—56, 61, 199]
Наличие в первичных живых системах фоточувствительных
пигментов сделало возможным появление фотосинтеза. Благода-
ря этому процессу протоклетка утилизирует самую распростра-
ненную форму энергии — световую. По этой причине во многих
экспериментах, выполненных в соответствии с низкотемператур-
ной теорией, особо следует выделить идентификацию производ-
ных порфиринового типа.
С этой целью мы предприняли две серии исследований. Пер-
вая была направлена на прямую идентификацию пигментов в
продуктах реакции. Во второй серии экспериментов использо-
вались различные типы установок, в которых активные частицы,
генерированные в газовой фазе, рекомбинировали до контакта
с холодными стенками реактора. Ясно, что таким путем образо-
вывались главным образом низкомолекулярные соединения.
Оба типа исследований привели к положительным результатам:
были выявлены порфириновые соединения. Понятно, что боль-
шее количество производных было идентифицировано во второй
серии, поэтому приведенные ниже аналитические данные отно-
сятся преимущественно к этим опытам.
Эксперименты проводили в постоянном потоке газовой сме-
си, проходящей через электроразрядную установку, схематиче-
ски представленную на рис. 19.
Смесь газов, состоящая из СН4 (3 мм рт. ст.), NH3 (3 мм
рт .ст.), НгО (0,0086 мл/ч), подвергается действию электриче-
ских разрядов, возникающих между двумя наружными электро-
53
Рис. 19. Схема установки для получения ВЧ-плазмы.
1 — камера для смешивания газов; 2 — резервуар для воды; 3 — разрядная
трубка; 4, 5 — манометры; 6 — электроды; 7 — генератор высокой частоты;
8 — фильтр; 9 — ловушки.
дами, соединенными с генератором высокой частоты (электри-
ческое напряжение между электродами 12 кВ; частота разряда
1,66 МГц; мощность 40 Вт). Продукты реакции собираются в
сосуде, охлажденном до температуры жидкого азота. Использо-
вание наружных электродов исключило возможность загрязне-
ния металлами, которые могут катализировать синтез основа-
ний и более сложных промежуточных соединений. Электриче-
ский разряд непрерывно поддерживался в течение 80 ч. Про-
дукт реакции в несколько приемов был подогрет до комнатной
температуры, рекуперирован из реактора декантацией и хранил-
ся в темноте в течение 5 дней. Его подготавливали для иденти-
фикации порфириновых пигментов по классической аналитиче-
ской методике, применяемой при исследовании проб земного
или внеземного происхождения [204—205]. Методика выделения
пигментов порфиринового типа из конечного продукта приведе-
на на рис. 20.
Для идентификации порфириновых соединений были установ-
лены следующие аналитические критерии:
1) В характерной области спектра (350—750 нм) должны по-
явиться полосы поглощения Соре и не-Соре, т. е. за пределами
области полос Соре.
2) Если пробу облучают светом с длиной волны, отвечаю-
щей полосе Соре, должна появиться флуоресценция в области
550—700 нм (спектр излучения). Если проба подвергается воз-
действию света с длинами волн 350—700 нм, в красной зоне
54
Рис. 20. Схема выделения пигментов порфиринового типа из суммарного про-
Рис. 21. Спектр поглощения органического экстракта, очищенного на сили-
кагеле.
Элюенты: 1—н-гептаи; 2 — н-гептаи+беизол (1:1 по объему); 3—бензол;
4 — беизол+метанол (99:1); 5 — бензол + метанол (98:2); 6—бензол+ме-
танол (95:5); 7—бензол+метанол (90:10); 8—метанол, а — органический
экстракт перед хроматографированием.
должна появиться полоса Соре (380—420 нм) (спектр возбуж-
дения) .
3) При комплексообразовании порфириновых пигментов с
двухзарядными катионами флуоресценция может исчезать или
сохраняться, связанные в комплекс пигменты продолжают силь-
но флуоресцировать, а остальные не обладают этим свойством.
4) Свободные порфирины в отличие от металлопорфиринов
можно экстрагировать кислыми растворами. Другим критерием
55
их идентификации является распределение между кислым вод-
ным раствором и органическим растворителем.
Спектры поглощения органических экстрактов, хроматогра-
фированных на силикагеле, представлены на рис. 21.
Результаты абсорбционной спектроскопии позволяют сделать
следующие основные выводы: а) в исследованной области до
хроматографического разделения характерные спектры не заре-
гистрированы; б) во всех пробах, полученных при использова-
нии различных систем растворителей, отмечены сигналы погло-
щения в области полосы Соре (380—390 нм). Следует отметить
тот факт, что большая часть смеси порфиринов была выделена
смесью бензол + метанол (99: 1 по объему) и что эта фракция
имеет 4 различных максимума не-Соре (505, 545, 590 и 615 нм),
характерных для свободных порфириновых соединений, имею-
щих характер оснований.
Несмотря на то что полученные фракции являются сложны-
ми смесями органических веществ, на колонках с силикагелем
Рис. 22. Характерная флуоресценция свободных порфириновых оснований,
синтезированных в плазме (элюент — н-гептан).
56
их можно довольно тщательно разделить. При анализе методом
флуоресцентной спектроскопии в н-гептановом растворе, содер-
жащем соединения порфиринового типа, отмечены характерные
спектральные особенности (интенсивная полоса возбуждения
Соре при 407 нм и четыре менее интенсивные, но различимые
полосы не-Соре при 470, 504 и 611 нм). Зарегистрирован также
интенсивный сигнал (670 нм), вызванный возбуждением образ-
ца при 407 нм (рис. 22).
Во фракции, выделенной смесью н-гептан+бензол, помимо
полосы Соре при 412/670 нм отмечены дополнительные сигналы
возбуждения при 433 и 470 нм. Слабая полоса наблюдается при
673 нм (рис. 23).
Рис, 23, Флуоресценция фракции, элюированной смесью н-гептан+бензол.
57
Бензольная фракция, как следует из рис. 24, характеризуется
полосами Соре при 398 и 420 нм, а последующие фракции —
эмиссиями, которые варьируют между 670 и 660 нм.
Кроме того, наблюдаются флуктуации возбуждений и эмис-
сий всех хроматографических фракций, которые указывают на
наличие в смеси соединений порфиринового типа, содержащих
разнообразные заместители, а также спектры флуоресценции с
максимумом при 470 нм, которые принадлежат, по мнению Ходж-
сона и сотр. [206], одному из возможных промежуточных порфи-
риновых соединений (ранее упоминавшемуся в работе по иден-
тификации аналогичных соединений в пробах лунного грунта).
Данные, относящиеся к образованию и разрушению комплек-
сов с металлами, дополнительно свидетельствуют о наличии про-
изводных порфиринового типа в продуктах абиотических реак-
ций. В то время как комплексы с металлами-диамагнетиками
флуоресцируют, комплексы с парамагнетиками являются не-
флуоресцирующими. Для более детального изучения этого
аналитического эффекта и для выяснения изменения флуорес-
ценции свободные пигменты обрабатывали солями цинка и
меди. Флуоресценция медного комплекса должна исчезнуть, а
комплекса с цинком — сохраниться. Как известно, металлопор-
фирины характеризуются нерастворимостью в водных раство-
рах кислот. Пигменты, выделенные и очищенные из продуктов
реакции, вели себя аналогично синтетическим порфиринам
(рис. 25, кривые 2 и 3).
Измерения флуоресценции, проведенные таким образом в
каждой фракции, показали, что металлопорфирины содержа-
Рис. 24. Флуоресцентные спектры эмиссии и возбуждения соединения, элюиро-
ванного бензолом.
58
лись во всех органических фа-
зах.
Метансульфокислота
(МСК) — отличный реактив
для разрушения комплек-
сов — облегчила деметаллиза-
цию комплексов меди. Посте-
пенное увеличение количества
МСК в кювете спектрофлуори-
метра, где находился раствор
таких комплексов, приводило к
появлению полосы возбужде-
ния Соре. Кислый раствор, со-
держащий свободные порфири-
ны, был нейтрализован ацета-
том натрия. Для рекуперации
свободных пигментов, необхо-
димой для проведения спект-
рального анализа, эфир отде-
лили от фазы ацетата натрия,
насыщенной продуктами, воз-
никающими после обработки
МСК. Характеристики сво-
бодных оснований порфири-
W 400 350
Длина волны, нм
Рис. 25. Спектры возбуждения флуо-
ресценции.
1 — до обработки солями металлов;
2 и 3 — после комплексообразования
с цинком н медью соответственно;
4 — после разрушения медиого ком-
плекса; 5 — после повторной обра-
ботки.
нов, зарегистрированные до
образования комплексов и пос-
ле деметаллизации, сходны, и
это свидетельствует о проте-
кании реакции комплексооб-
разования (рис. 25, кривые
1 и 4).
Свободные основания пор-
фиринов, полученные после
деметаллизации и разделения в
эфире, заново обрабатывали
ацетатом меди. Исчезновение флуоресценции (рис. 25, кривая 5)
свидетельствовало об образовании комплекса. Таким образом,
можно сделать вывод, что пигменты, образующиеся по абиоти-
ческим реакциям при электрических разрядах, ведут еебя так
же, как и природные порфирины.
Для сравнения этих пигментов с порфирином, принятым за
эталон, кислые экстракты анализировали путем распределения
между органическими растворителями ибн. НС1. Соедине-
ния порфиринового типа задерживались в кислых водных рас-
творах и возвращались в органическую фазу под действием аце-
тата натрия. Их способность экстрагироваться водными щелоч-
ными растворами или даже водой свидетельствует о наличии
карбонильных групп в порфириновом цикле. Кислотная экстрак-
ция является, таким образом, приемлемым методом для разде-
59
Элюирование пигментов
смесью бензол *метаноит
(95:5 по объему)
(рис. 27, кривая 46)
Рис, 26. Схема разделения смеси продуктов растворителями н методы иден-
тификации.
ления этих смесей на компоненты. Методика, применявшаяся
для разделения с помощью растворителей, схематично пред-
ставлена на рис. 26. После нескольких разделений производи-
лась дальнейшая очистка. Спектры флуоресценции представле-
ны на рис. 27.
При переходе в кислый раствор свободные порфириновые
основания изменяют интенсивность полос не-Соре, проявляя
склонность к образованию единственного сигнала. Этот при-
знак характерен и для пигментов, полученных в электрическом
разряде, причем полоса при 560 нм включает в себя 4 других
пика (рис. 27, кривые 36 и 46). Следует отметить, что сигнал
при 470 нм появляется как в случае органической, так и кислой
фазы.
В табл. 13 приведены основные доказательства, указываю-
щие на наличие в суммарном продукте реакции структур поли-
пептидного типа, а также низкомолекулярных соединений сво-
бодных или связанных порфиринов.
60
Таблица 13. Доказательства существования в суммарном продукте реакции
структур полипептидного типа и низкомолекулярных соединений (свободных
и связанных) порфиринов
Доказательство Аналитический метод Результаты наблюдения
Компоненты, идентифици- руемые после кислотного гидролиза суммарного продукта Автоматический анализ аминокислот (анализатор JEOL 6АН). Хромато- графия иа бумаге Преобладающие аминокис- лоты: глицин, аланин, кислоты аспарагиновая3 и глутаминовая3. Следы: серин
Молекулярная масса ве- ществ полипептидного типа Степень превращения ко- нечного продукта в ами- нокислоты при кислотном гидролизе Гель-хроматография (УФ- детектор LKB, интерфе- рометрический детектор Waters); сефадекс G-100. Диск-электрофорез Условия гидролиза: 6 н. НС!, трубки из инертного стекла, вакуум Десятки тысяч Около 30%
Идентификация и оценка содержания полипептид- иого материала в суммар- ном продукте реакции Метод Лоури [201] Общее содержание И—• 13 мг/мл
Структурный анализ лио- филизованного суммарно- го продукта ИК-спектроскопия (Uni- cam SP-2200, таблетки КВг) У Ф- спектроскопия В ИК-спектре линии по- глощения , характерные для пептидной связи: 3300 и 3080 см-1 (-NH- и-NH...H), 1630 и 1240 см-1 (с=о и С—О—С), 1570 и 1540 см-! (—NH—СО—)
Структурный анализ гид- ролизоваиного и лиофили- зованного суммарного продукта ИК-спектроскопия 3130 см-! (—NH^ , очень интенсивная); отсутствие полос при 1570 и 1540 см-1
Элементный анализ сум- марного продукта Элементный анализ (ана- лизатор Carlo Erba Mod. 1102) N 33%, С45%,Н7%, О 15%
Соотношение макромоле- кулярного и низкомоле- кулярного материала Гель-хроматография. Анализ свободных амино- кислот Ограниченная гетероген- ность. Преобладают сое- динения пептидного типа. Пониженное количество черного полимера (F), 15% полимера синильной кислоты. Незначительное количество свободных аминокислот и оснований
а См. табл. 16.
61
Продолжение табл, 13
Доказательство Аналитический метод Результаты наблюдения
Низкомолекулярные ком- поненты , идентифицируе- мые при гидролизе сум- марного продукта Наличие свободных струк- тур порфиринового типа Анализ азотистых основа- ний, хроматография на бумаге; ионообменная хроматография с опреде- лением в УФ-области Спектроскопия в УФ-об- ласти. Флуоресцентная спектро- скопия Комплексообразование с металлами и деметалли- зация. Разделение растворите- лями. Основания (в малых ко- личествах) : аденин, гуа- нин , гипоксантин, цито- зин Суммарный продукт со- держит небольшие коли- чества порфириновых структур
Рис. 27. Результаты спектрального анализа фракций после разделения раст-
ворителями.
Эмиссионные спектры: 1 — до разделения; 2 — после экстракции 6 н. НС1;
За—после нейтрализации и экстракции эфиром; 4а— после второго распре-
деления между эфиром ибн. НС1
Спектры возбуждения флуоресценции порфиринов: 36 — рекуперированных
после экстракции эфиром, 46— после вторичного разделения эфиром и 6н.
62
2.2.2. Синтез структур полисахаридного типа [198—200, 207]
Для выбора условий синтеза полисахаридов изучалось влия-
ние содержания паров воды в исходной реакционной смеси на
природу компонентов, которой определяется состав суммарного
продукта. Эксперименты проводились в установке, описанной
выше, в условиях холодной плазмы.
В исходную газовую смесь в реакционную камеру во время
синтеза (продолжительность 15 ч) вводили дополнительное ко-
личество (240 мл) дистиллированной воды (в вакууме). В ука-
занных условиях парциальное давление водяных паров в сфери-
ческой части реактора определялось температурой льда и рас-
ходом дополнительно вводимых паров воды (16 мл/ч), которые
проходят через разряд во время реакции. Экспериментальные
условия представлены в табл. 14.
Рнс. 28. Схема разделения и аналитические методы, используемые при иссле-
довании суммарного продукта реакции.
63
Таблица 14. Условия эксперимента по синтезу соединений
полисахаридного типа
Состав атмосферы (мо-
дельный опыт)
Давление в реакторе пе-
ред образованием плазмы
Давление в реакционной
камере после образования
плазмы
Температура льда
Продолжительность ре-
акции
Н2О:КНз:СН1 = 0,1:0,9:1,0 (мм рт. ст.)
Дополнительно в реакционную камеру во время
синтеза в вакууме было добавлено 240 мл дистил-
лированной воды
2,2—2,4 мм рт. ст.
3,5—4,0 мм рт. ст.
—60°С (50 мл дистиллированной воды в цилиндри-
ческой части реактора)
15 ч
Полученный продукт (темно-желтый раствор) был исследо-
ван общепринятыми аналитическими методами по схеме, при-
веденной на рис. 28.
Путем гель-хроматографии (сефадекс G-100) было выделено
из исходного сырого раствора 8 различных фракций, которые
анализировали интерферометрическим и спектральным (в УФ-
области) методами (рис. 29, а и б).
Как и в предыдущих экспериментах, во время фракциони-
рования в верхней части сепарационной колонки образовывался
нерастворимый материал J черного цвета. Каждая фракция
так же, как и исходный сырой продукт, была сконцентрирова-
на. Данные элементного анализа приведены в табл. 15. Наблю-
дались две бесцветные фракции (/ и 8), в которых отсутствует
азот, и шесть окрашенных в желтый цвет (2—7) с различным
содержанием азота. Также отмечается очень низкое содержание
Таблица 15. Результаты элементного анализа конечного продукта н фракций
Анализируемые объекты Содержание элементов (%)
С N н оа
Суммарный продукт 36,44 32,33 5,95 25,28
Фракция 1 42,14 0,00 6,70 51,18
Фракция 2 30,70 10,60 5,31 53,39
Фракция 3 36,71 29,10 5,64 28,59
Фракция 4 31,00 14,40 5,47 49,13
Фракция 5 30,50 16,50 5,60 47,40
Фракция 6 24,07 5,03 4,80 66,10
Фракция 7 30,90 0,82 5,15 63,13
Фракция 8 б 0 6 б
а Найдено по разности 100—(C-J-H-J-N) %. ® Количество, недостаточное для анализа.
64
io is zz zs 34 40 46 sz ss 64 70
Номер фракции
a
Рис. 29. Гель-хроматограмма суммарного продукта, полученная определением
поглощения в УФ-области (а) и интерферометрией (б).
Смола сефадекс G-100. Условия эксперимента: размеры колонки 20X 520 мм;
растворитель — бидистиллированная вода; объем пробы 10 мл; скорость
2 мл/мин. Определения проводились иа спектрометре LKB 8300 Uvicord II и
интерферометрическом детекторе Waters R-4.
Рис. 30. ИК-спектр суммарного продукта и продукта, полученного путем гид-
ролиза (спектрометр Unicam SP-200, диски из КВг).
1 — суммарный продукт; 2 — гндролнзованный продукт.
65
азота во фракциях 6 и 7. Повышенное содержание азота в сы-
ром продукте объясняется наличием черного нерастворимого
материала (полимер синильной кислоты), который в дальней-
шем выделялся в верхней части геля сефадекс.
Пептидные соединения определяли методом Лоури (0,2 мг/
/мг суммарного продукта). В ИК-спектре полученных проб вы-
явлены связи пептидного типа в азотсодержащих компонентах
(G) и в суммарном продукте (В); в первой и восьмой фракци-
ях (Е) эти связи отсутствуют. На рис. 30 показано, что ИК-
спектр суммарного продукта содержит полосы поглощения пеп-
тидов:
3300 см-1 —NH—
3080 см-1 —NH...H
1630 см“1 С=О (амид I)
1575 см-1 — NH— (из — СО—NH—)
1540 см-1 (8) —NH—(из —СО—NH—) (амид И)
1240 см-1 С—О—С
Кроме того, также зарегистрированы колебания при 1013,
1128, 1161 и 2200 см-1; последнее, принадлежащее группе
—Cs=N, в гидролизате отсутствует. Появление сильной полосы
поглощения при 3130 см-1 свидетельствует в пользу наличия
пептидных связей в суммарном продукте реакции. Все приведен-
ные спектральные данные относятся к фракциям, содержащим
азот.
Количественный анализ свободных и связанных аминокислот
дает дополнительные сведения о структурах пептидного типа
как в суммарном продукте, так и в азотсодержащих фракциях
(G). Количество аминокислот указано в табл. 16. Основные
вещества, обнаруженные в пробах с азотом: глицин, глутами-
новая и аспарагиновая кислоты.
Таблица 16. Содержание свободных и связанных аминокислот
в суммарном продукте н фракциях 2—7
Анализируемые объекты Концентрация (мг/мг лиофилизованного суммарного продукта)
свободные аминокислоты связанные аминокислоты
глицин аспарагино- вая кислота глутаминовая кислота ГЛИЦИН аланин
Суммарный продукт 0,004080 0,003720 0,003540 0,191600 0,006760
Фракция 2 0 0,000186 0,000505 0,033900 0,000281
Фракция 3 0 0,000126 0,000217 0,159000 0,000147
Фракция 4 0 0,000085 0,002020 0,003710 0,000051
Фракция 5 0 0,000076 0,000087 0,003160 Следы
Фракция 6 0 Следы 0,000473 0,001620 0
Фракция 7 0,000074 Следы Следы 0,001020 0
66
TOO
5000 WOO 3000 2000 1800 1600 1W0 1200 1000 800 650
CM'1
Рис, 31. ИК-спектры фракций 1 и 8 (спектрометр Unicam SP-200, диски из
КВг).
Для идентификации молекул моно- и полисахаридного типа
конечный продукт В и соответственно безазотные фракции Е
были изучены методами ИК-спектроскопии, хроматографии в
тонких слоях и в газовой фазе. В ИК-спектре проб 1 и 8 зареги-
стрированы колебания, характерные для моно- и полисахарид-
ных соединений (рис. 31):
3430 см-1
1162 см-1 1
1120 см-1 J
1013 см-1
—OHaocoIl
—С-0—с—
—С—О— (из С—ОН)
Данные тонкослойной хроматографии о наличии моносахаридов
в гидролизатах суммарного продукта и во фракциях 1 иЗ приве-
дены в табл. 17 и на рис. 32.
Таблица 17. Моносахариды, идентифицированные в гидролизатах
суммарного продукта и фракциях 1 и 8
Анализируемый объект Моносахарид
Суммарный продукт Фракция 1 Фракция 8 Галактоза, ксилоза, олигомер (?) Галактоза, олигомер (?) Галактоза, ксилоза, олигомер (?)
Сравнение значений Rf для моносахаридов, принятых в каче-
стве стандартных, и изучаемых проб свидетельствует о наличии
галактозы и ксилозы. В каждой пробе присутствует неидеити-
фицируемый компонент с небольшим Rf, соответствующим пол-
ностью негидролизованному олигомеру. Результаты газовой
67
---------О------о-----о---•—О——
1/Юносахари.д Суммар- Фр.1 Фр.8
(эталон) ный
продукт
Рис. 32. Результаты тонкослойной
хроматографии суммарного продукта
и фракций, не содержащих азота.
Гидролиз проводился 2 н. H2SO4 при
110°С в течение 24 ч в ампулах из
нейтрального стекла, запаянных в ва-
кууме. Для нейтрализации использо-
ван анионит Amberlit IR-45. Хрома-
тограммы получены на стеклянных
пластинках 200X100 мм, покрытых
0,5 мм-слоем микрокристаллической
целлюлозы; растворитель —* 1 этилаце-
тат + пиридин + вода (40:20: 2Q);
проявитель — анилин-фталатный ре-
актив; высушивание прн 105°С в те-
чение 5 мин.
1 — глюкуроновая кислота; 2—га-
лактоза; 3— глюкоза; 4 — арабиноза;
5 — ксилоза; 6 — рибоза.
хроматографии подтверждают выводы, приведенные выше
(рис. 33).
Анализ на аминокислоты и свободные моносахариды в пер-
вой и восьмой фракциях, как и ожидалось, привел к отрица-
тельным результатам.
Вся совокупность проведенных исследований подтверждает
тезис о том, что функциональные протобиополимеры (полипеп-
тидного типа) и структурные протобиополимеры (полисахарид-
Рис. 33. Газовые хроматограммы эталонной смеси силилированных моносаха-
ридов, силилированного суммарного продукта и гидролизованных и силили-
рованных фракций 1 и 8.
Условия эксперимента; наполнитель SE 30,3%; размеры колонны: длина 2,5 м,
диаметр 3 мм; температура 150°С, скорость 11,75 мл/мин, пламенио-ионизаци-
онный детектор.
1 и 2 — ксилоза; 3 — у-галактоза; 4 — а-галактоза; 5 — [J-галактоза; х — не-
идентифицированный компонент.
68
ного типа) могли появиться в начале эволюции в сходных геоло-
гических условиях. Отсутствие свободных моносахаридов, как и
наличие очень малых количеств свободных аминокислот, под-
тверждает идею о том, что протобиополимеры могли хронологи-
чески предшествовать классическим макромолекулам.
В табл. 18 суммированы основные выводы об образовании
соединений полисахаридного типа в условиях холодной плазмы.
Таблица 18. Доказательства наличия продуктов полисахаридной природы
в конечном материале
Доказательство Аналитический метод Результаты
Макромолекулярная при- Гель-хроматография с УФ- Получено 8 различных
рода конечного продукта детектором (280 нм) и ин- терферометрическими де- тектором; смола сефадекс G-100 фракций, две безазотные фракции белого цвета с умеренно высокой моле- кулярной массой
Элементный состав без- азотных фракций и фрак- ций с малым содержанием азота (7) Элементный анализ Фракция 1: N 0,00%; С 42%; Н 7%; О 51%. Фракция 7: N 1,00%; С 31%; Н 5%; 0 63%. Фракция 8 не содержит азота
Анализ структуры фрак- ИК-спектроскопия (в таб- В ИК-спектрах безазот-
ций 1 н 8 в твердом состоянии летках КВг) ных фракций есть поло- сы, характерные для полисахаридов: 3400 (—ОН), 2900 (—СН— и СН2-), 1162 (—С—О—С—), 1013 (—С—О— из —С—ОН) и 900 см-1 (деформационные колеба- ния групп —СНаОН, >СН—ОН и пиранозных циклов) Показано наличие галак-
Состав моносахаридов в Мягкий гидролиз, после-
кислотном гидролизате дующий анализ тонко- тозы, ксилозы и, возмож-
конечного продукта и слойной хроматографией но, олигомерного полиса-
фракций 1 и 8 (микрокристаллическая целлюлоза «Avirin»), га- зовой хроматографией (си- лилированиые продукты, колонка SE 30,3%) с пламенно-ионизационным детектором харида с малым
2.2.3. Синтез структур лнпндного типа [194, 196, 198—200, 208—2121
Важность липидов для химической и биологической эволю-
ции общепризнана, поэтому синтезу этих соединений посвящено
большое число экспериментов. Для выбора условий получения
69
липидных компонентов было изучено влияние содержания мета-
на в указанной выше смеси газов на природу химических ком-
понентов, образующихся в ходе реакции. По сравнению с преды-
дущими опытами исходная смесь была обогащена метаном.
В табл. 19 перечислены условия эксперимента для абиогенного
синтеза этих лнйидных компонентов.
Таблица 19. Условия эксперимента по синтезу структур липидного типа
Состав модельной атмо- сферы Давление в реакционной камере до инициирования плазмы Давление в реакторе пос- ле образования плазмы Температура льда Продолжительность реак- ции CH*: NH3: Н20 = 2,5:0,5:0,1 (мм рт. ст.) 3,1—3,2 мм рт. ст. 4,0—4,5 мм рт. ст. —60°С (50 мл дистиллированной воды в цилиндри- ческой части реактора) 8 ч
Как и в других опытах, расход аммиака и метана контроли-
ровался системой игольчатых вентилей и установкой высокого
вакуума, а парциальное давление паров воды определялось тем-
пературой льда.
На рис. 34 приведена последовательность операций для раз-
Суммарный продукт экстракции
Экстракция
СНСС3(72ч)
Анализ
аминокислот
Элементный
анализ
ИК-спектроскопия
ЯМР- спектроскопия
Масс-спектроскопия
Тесты на
растворимость,
Исследование
полупроводниковых
свойств
Рис. 34. Схема разделения и аналитические методы, используемые для иден-
тификации суммарного продукта реакции.
70
IS’
wo
80
60
40
го
' Г h®
o
4000 3500 3000 2500 2000 1800 1600 1400 1Z00 1000 800 600 400 200
a»'1
Phc. 35. ИК-спектр хлороформного экстракта (спектрометр Perkin-Elmer 577;
диски из КВг).
3 8 7 5 5 4 3 2 13
м. 3.
Рис. 36. ЯМР-спектр фракции, растворимой в хлороформе (анализатор JEOL,
60 МГц; растворитель CDCls; комнатная температура).
4)
§
деления и идентификации липидных структур в суммарном про-
дукте реакции. В ИК-спектре (рис. 35) экстрагированного твер-
дого вещества (С) выявлены углеводородный компонент и со-
единения, богатые функциональными группами —СН2— и
—СН3 (2800 см-1). Имеются также полосы поглощения, харак-
терные для групп —С—О—С— и =С=О (1000—1100 и
1720 см-1). Данные ЯМР (рис. 36) дают сходные результаты.
Так, область резонанса 0,5—2 м. д. характерна для линейных и
разветвленных углеводородов, а также для насыщенных конден-
сированных циклов, в то время как интервал 2,0—3,0 м. д. ха-
рактерен для групп —СН—С(О). На рис. 37 представлен для
сравнения ЯМР-спектр холестерина.
Масс-спектроскопические измерения (рис. 38—41)’, проведен-
ные при десяти различных температурах (20, 40, 65, 90, ПО,
71
Рис. 38. Масс-спектр хлороформного экстракта, зарегистрированный прн 20°С
(спектрометр VARIAN МАТ-311).
Рис. 39. Масс-спектр хлороформного экстракта, зарегистрированный при 9(ГС
(спектрометр VARIAN МАТ-311).
72
135, 165, 190, 210 и 265°С), дополняют информацию о структуре
и составе фракции, растворимой в хлороформе. Основные ионы,
определенные в интервале использованных температур:
т/е= 128, 142, 153, 167, 178, 193, 279, 295, 331, 359, 369,
394, 411, 426, 429, 503, 559
Можно отметить тот факт, что повышенный температурный ре-
жим (значения температуры, при которых проба испарена и
введена в спектрограф) вызывает возрастание отношения т/е
обнаруженных ионов. Это подтверждает появление процесса
Рис. 40. Масс-спектр хлороформного экстракта, зарегистрированный при
110°С (спектрометр V ARIAN МАТ-311).
73
фракционирования смеси в ходе нагревания параллельно с кре-
кингом макромолекулярных соединений. Анализы свидетельст-
вуют о наличии цепей и циклических конденсированных струк-
тур; убывание интенсивностей исключает наличие ароматических
структур. Методом масс-спектроскопии в хлороформной фрак-
ции не были выявлены соединения, содержащие азот. Гель-хро-
матография на сефадексе G-10 (рис. 42) с последующим интер-
ферометрическим определением ограничивает область молеку-
лярных масс продуктов значениями 200—500. Поведение липи-
дов в растворителях (продукт полностью растворим в хлоро-
форме, гептане, метилцеллозольве и т. д.) дает добавочные
аргументы в пользу наличия гидрофобных цепей.
Содержание азота в суммарном продукте составляет 10—
11,3%, что намного меньше по сравнению с таковым в структу-
рах, синтезированных в условиях преобладания аммиака в пер-
вичной газовой смеси (~33% азота). Наконец, кислотные гид-
ролизаты суммарного продукта содержат четыре индивидуаль-
74
Рис. 42. Хроматограмма хлоро-
формного экстракта, получен-
ная с интерферометрическим
детектором (Winopal-For-
schung).
Смола сефадекс G-10; разме-
ры колонки: длина 510 мм, ди-
аметр 11 мм; элюент — дистил-
лированная вода + метилцел-
лозольв (1:1 по объему);
Vo=29,5 си3; скорость 1 мл/
/мин.
Таблица 20. Доказательства существования структур липидного типа
в конечном продукте
Доказательство Аналитический метод Результат
Определение молекуляр- Гель-хроматография с ин- Область молекулярных
ных масс фракций, раст- терферометрическим детек- масс 200—500. Основные
воримых в хлороформе тором (смола сефадекс ноны, полученные в ин-
G-10). Масс-спектроско- пия (MS VARIAN MAT 311) тервале температур 20— 265°С, имеют т/е в ии-
Анализ структуры веществ тервале 28—559
ИК-спектроскопня (Per- ИК-спектр показывает на-
хлороформного экстракта kin-Elmer 577) личие соединения углево- дородной природы, бога- того —СН2— и —СНз- группами (2800—2920 и 1450 см-1), помимо коле- баний , характерных для групп >СН—ОН, С—О—С (3400, 1400, 1250—1300, 1050— 1150 см-1)
75
Продолжение
Доказательство Аналитический метод Результат
Изучение гидрофобности ЯМР-спектроскопия (JEOL, 60 МГц, CDC13) Масс-спектроскопичес кие определения Тесты иа растворимость Область резонанса 0,5— 2,0 м. Д. указывает иа на- личие углеводородных цепей и насыщенных кон- денсированных циклов Основные иоиы, выявлен- ные в интервале 20— 265°С, имеют т/е = 128, 142, 153, 167, 178, 193, 279, 295, 331, 359, 369, 394, 411, 426, 429, 503, 559. Спектры свидетельст- вуют о наличии ионов с тенденцией к группиро- ванию, что характерно Для углеводородных це- пей
ных вещества, которые дают положительную реакцию с нингид-
рином: глицин, аланин и два неидентифицироваиных компонен-
та. Доказательства, подтверждающие образование структур,
подобных липидам, приведены в табл. 20.
2.3. Синтез протомембран
Жизнь могла возникнуть только в среде, состоящей из слож-
ной смеси молекул и макромолекулярных соединений. В этой
смеси было возможно почти бесконечное число неспецифических
химических реакций, далеко не похожих на биологические ре-
акции, контролируемые и управляемые клеткой. Современная
клетка разделена на участки мембранными структурами, благо-
даря которым происходит фактическое разграничение химиче-
ских процессов от очень сложных биохимических. Можно пред-
положить, в частности, что одним из самых важных факторов,
определяющих развитие упорядоченной системы из неупорядо-
ченной смеси химических соединений в первичной окружающей
среде, было возникновение функциональных протомембран.
Поскольку мембраны в живых клетках играют центральную
роль и ни один электрохимический или биоэнергетический про-
цесс не может развиваться в отсутствие этих суперструктур,
многие исследователи пытаются синтезировать (в предположи-
тельно существовавших первичных геологических условиях)
«точные копии» современных биомембран и воссоздать мембран-
ные функции посредством простых моделей. Такая постановка
задачи является спорной. Если следовать идее эволюции, необ-
76
Рис, 43, Схема идентификации суммарного продукта реакции.
Рис. 44. Изображение (оптическая трансмиссионная микроскопия) микросфер,
претерпевших самосборку.
ходимо принять, что биологические мембраны также эволюцио-
нировали. Первичные структуры изменялись на протяжении
длительного времени и за счет многократного отбора на молеку-
лярном уровне в конце концов возникли современные комплекс-
ные суперструктуры. Поэтому проводить исследования в облас-
ти воссоздания предполагаемых первичных земных условий в
ожидании возникновения современных функциональных биопо-
лимеров, по нашему мнению, означает заниматься «алхимией»
возникновения жизни.
Учитывая то, что повышенные значения соотношений
СН4: Н2О : NH3 определяют образование смесей некоторых ли-
нейных и циклических насыщенных углеводородов, а также то,
что для возникновения мембран необходимо наличие амфифиль-
ных молекул, мы изучали образование этих соединений при
сравнительно низких концентрациях метана в смеси газов, мо-
делирующих первичную атмосферу. Так, по сравнению с ранее
выполненными синтезами состав имитируемой атмосферы уста-
новлен соответственно: СН4: NH3: Н2О = 1,5 : 0,5 : 0,1 (мм
рт. ст.), а остальные параметры поддерживались неизменными.
В конце реакции и после таяния льда получен суммарный
продукт реакции желто-коричневого цвета, который был охарак-
теризован по схеме, показанной на рис. 43. И в этом случае ли-
78
Рис. 45. Изображение разделения трех фаз в результате экстракции хлоро-
формом суммарного продукта реакции.
пидные структуры претерпевают самосборку во множество мик-
росфер, которые могут быть обнаружены методом оптической
трансмиссионной микроскопии (рис. 44).
Для установления состава и молекулярной структуры преоб-
ладающих соединений суммарный продукт реакции разделяли
с помощью хлороформа, а три фракции (рис. 45) —водную, хло-
роформную и интерфазу — анализировали в соответствующей
последовательности.
2,3.1. Водная фаза
После лиофилизации твердый материал желтого цвета ана-
лизировали, как описано ранее (разд. 2.2). На рис. 46 приведен
ИК-спектр продукта, в котором можно идентифицировать все
колебания, характерные для групп СН2==СН— и —СО—NH2:
79
3200—3500 см-1
2940 см-1
1650 см-1
1410 см-1
1100 см-1
550—700 см-1
—СО—NH2; NH валентные (3350 см-1 — асим-
метричные, 3170 см-1 — симметричные);
—сн
—СО—NH^-, СО (валентные); NH (деформаци-
онные), амид I и амид II
СНЯ=СН—
—С—О—С— (?)
—NH (деформационные внеплоскостные)
Из ЯМР-измерений следует, что преимущественно образу-
ются винильные структуры (рис. 47). Квадруплет на 5,2 м. д.
показывает наличие молекулярных фрагментов типа СН2 = СН—.
Волновое число, см
Рис, 46. ИК-спектр лиофилизованной водной фазы (спектрофотометр Perkin-
Elmer 577; диски из КВг).
Заслуживает внимания то, что могут быть также детектированы
максимумы поглощения со сравнительно низкими интенсивнос-
тями, соответствующие группам СН2 и СНз (0,5 м д.). Количе-
ство соединений, содержащих группы СН2 и СН3, все же незна-
чительно по сравнению с винильными производными. Дли-
тельное накопление нелиофилизованной водной фазы влечет за
собой даже при низких температурах (~0°С) исчезновение
максимумов при 5,2 и 4,7 м. д, соответствующих винильным
группам, и усиление поглощения вблизи значения 0,5 м. д.
(рис. 48). Это можно объяснить полимеризацией производного
винила.
Масс-спектры, зарегистрированные при 70°С, свидетельст-
вуют о наличии первичных амидов. Эти производные дают силь-
ный пик на т/е = 44, обусловленный расщеплением связей в
R—CONH2:
(Ac-nh2— O = C = NHj
Этот молекулярный фрагмент определяет наличие основного
цикла Ci—Сз из первичных амидов (рис. 49).
80
Рис. 47. ЯМР-спектр водной фазы (лиофилизованной) и реперного акрилами-
да (спектрометр JEOL, 60 МГц; растворитель — D2O).
Следующая за ней линия (т/е™60) соответствует иону
-ОН+
СН3—C<f
xnh2
Эта структура образуется, вероятно, путем гидрогенизации мо-
лекулы акриламида во время процесса распада и разделения в
масс-спектрографе.
Эти результаты позволяют сделать предположение, что пер-
вичным компонентом водной фазы является акриламид.
<1
Рис. 48. ЯМР-спектр водной фазы, накопленной за длительный период (спек-
трометр JEOL, 60 МГц; растворитель — трифторуксусная кислота).
Рис. 49. Масс-спектр водной фазы, зарегистрированный при 70°С (масс-спеи-
трометр VARI AN MAT-311).
2.3.2. Хлороформная фаза
На рис. 50 показан ИК-спектр лиофилизованной хлороформ-
ной фракции. Наблюдаются основные полосы поглощения, ха-
рактерные для углеводородов:
2920 , 2870 см-1 СН2 (С—Н валентные)
1450, 1465 см-1 СН2 (С—Н деформационные)
Повышенное значение интенсивности поглощения групп СН2
по сравнению с колебаниями, которые соответствуют молекуляр-
ным фрагментам СН3 и сглаживают профиль спектра, а также
то, что продукт находится в твердом агрегатном состоянии, сви-
детельствует о существовании преимущественно линейной на-
сыщенной структуры со сравнительно высокой молекулярной
82
Пропускание,
-----------1_________I________I_________I______I_______I_______I_______L. . . .1_____I I I I
4000 3600 3000 2500 2000 1800 1600 1400 1200 1000 800 600 400 ZOO
Волновое число, аи~г
Рис. 50. ИК-спектр лиофилизованной хлороформной фазы (спектрофотометр Perkin-Elmer 577, диски из КВг).
Рис. 51. ЯМР-спектр лиофилизованной хлороформной фазы (спектрометр
JEOL, 60 МГц; растворитель — CDCI3, температура 55°С).
массой. В то же время следует отметить тот факт, что возникает
также слабое поглощение, которое соответствует ароматическо-
му циклу и группе —CsN. Специфический максимум в области
С —О может быть объяснен окислением пробы во время сушки
и лиофилизации.
ЯМР-измерения (рис. 51) подтверждают выводы, сделанные
на основе ИК-спектроскопических данных. Диаграмма указы-
вает на избыток групп СНг (1,25 м. д.) по сравнению с группа-
ми СНз (0,9 м. д.). Предполагается, в частности, что образуются
преимущественно насыщенные линейные цепи и сопутствующие
им другие насыщенные структуры, например циклические (1,67;
2,02 м. д.), присоединенные или удерживаемые благодаря физи-
ческим взаимодействиям с линейными соединениями.
Необходимо отметить также, что хлороформная фракция со-
держит также небольшое количество ароматических соединений
(7—7,5 м. д.). Эти соединения были идентифицированы метода-
ми газовой хроматографии (рис. 52) и масс-спектрометрии
(рис. 53). Результаты анализа показали наличие толунитрила и
нафталина. Эти структуры могут быть частично удалены путем
нагревания в вакууме (рис. 54), поэтому можно предположить,
что некоторые из них связаны химически или очень сильно
удерживаются преобладающими компонентами.
Газо-хроматографическое исследование хлороформной
фракции, из которой удалены свободные ароматические произ-
84
Рис. 52. Хроматограмма (газовая) хлороформной фазы.
Хроматограф Perkin-Elmer 900-МАТ 311; колонка стеклянная капиллярная
длиной 1,5 м, наполнитель дексил; эксперимент проводился в температурном
режиме 100—250°С, температурный градиент 47мнн, газ-носитель — водород,
скорость 19 мл/мин.
85
ю
44
__L
728
т
а
Рис. 53. Масс-спектры интенсивных пиков, полученных при газовой хромато-
графии (хроматограф Perkin-Elmer 900-МАТ 311).
в — нафталин; б — бензонитрил; в — толунитрил
водные, показало, что преобладающие виды соединений не вос-
пламеняются даже при 300°С (рис. 55), что указывает на суще-
ствование соединений с относительно высокой молекулярной
массой. Измерениями, сделанными в ходе разделения на геле,
вычислена молекулярная масса Mw=4000 (рис. 56).
86
1,25
1,25
Рис. 54. ЯМР-спектры хлороформной фазы.
п — высушенной в вакууме при 100°С в течение 2,5 ч; б — высушенной в ва-
кууме при 140°С в течение 2 ч.
87
Рис, 55, а—Газовая хроматограмма хлороформной фазы до высушивания; б — газовая хроматограмма хлороформной фа-
зы после высушивания.
Хроматограф Carlo Erba; стеклянная колонна длиной 22 и; наполнитель SE-54; газ-носитель—азот, скорость 4 мл/мин.
Температурные режимы: 55”С (3 мнн) и 132’С (1 мни) с последующим нагреванием до 206°С. Скорости нагрева, выбран-
ные для интервалов 55—132°С н 132—206°С, составляли 2,1 н 3 град/мнн соответственно.
Рис. 56. Гель-хроматограмма хлоро-
формной фазы, полученная с УФ де-
тектором (Winopal Forschung, Pierce
Chromato Flo, 2925 UV Monitor)
Наполнитель сефадекс LH 20 Разме-
ры колонки длина 510 мм, диаметр
11 мм, элюент — тетрагндрофуран,
Уо=2,4 мл, скорость 1 мл/мнн
2.3.3. Интерфаза
Образование интерфазы связано с наличием соединения с
дуальными свойствами, включающего полярный и неполярный
участки. Эта составляющая суммарного продукта имеет следую-
щие характеристики: а) возникает как проницаемая мембрана;
б) стабильна при механическом ударе (возмущении); в) после
выделения и сушки денатурируется (продукт становится чер-
ным); г) черный твердый материал, полученный таким образом,
не может быть трансформирован в мембрану при помощи рас-
творителей; д) имеет незначительное давление паров даже при
высоких температурах, е) самоорганизуется в микросферы.
ИК-спектроскопия (рис. 57) материала, полученного путем
лиофилизации интерфазы, позволила нам сделать следующие
выводы:
1. В спектре зарегистрированы все колебания, характерные
для линейных цепей углеводородов:
2960 и 2870 см-1 С—Н валентные в СНз (слабое поглощение)
2920 и 2850 см-1 С—Н валентные в СН2 (интенсивное поглощение)
1640—1670 см"1 С = С валентные
1450—1460 см-1 С—Н деформационные в СН2
89
WOO 3500 3000 Z500 ZOOO 1800 1600 KOO 1Z00 1000 800 600 ZOO ZOO
Волновое число, ом'1
Рис. 57. ИК-спектр лиофилизованного межфазного продукта (спектрофото-
метр Perkin-Elmer 577; днскн из КВг).
2. Остальные колебания практически совпадают с теми, ко-
торые идентифицированы в полиакриламидных структурах
(табл. 21).
Таблица 21. Максимумы ИК-спектров межфазного продукта
и полиакриламидного репера
Максимум» см”1 Примечания
межфазный продукт полиакрил- амид
3100—3600 2920—2941 1550—1750 1350—1470 1230—1270 3125—3571 2941 1560—1750 1380—1480 1290—1350 NH валентные, первичный амид с симметричной и асимметричной водородной связью СН алифатическая, валентные С=О валентные, амид I, NH деформационные С—N валентные
Попытки зарегистрировать масс-спектры соединения интерфа-
зы при разных температурах не удались из-за низких значений
давления паров. Это можно объяснить наличием соединений с
высокой молекулярной массой или/и процессами образования
сетчатой структуры, возникающими во время денатурации.
Результаты гель-проникающей хроматографии (рис. 58) ука-
зывают на полимерную природу соединения интерфазы. Моле-
кулярная масса оценивается в ~5000.
Наличие как полярных, так и неполярных концов в молеку-
лах соединения интерфазы доказано также путем ЯМР-измере-
ний. На рис. 59—61 показаны для сравнения ЯМР-спектры
стандартного полиакриламида и соединения интерфазы, изме-
ренные как обычным способом, так и в условиях фурье-накоп-
ления.
В спектре (рис. 59) наблюдаются следующие основные поло-
сы поглощения:
90
Рис. 58. Гель-хроматограмма хлороформной фазы, полученная с интерферо-
метрическим детектором (Waters Associates Model 200).
Наполнитель — стирагель 500 (103 и 104 А). Длина колонки 1,2 м; рабочая
температура 45°С; растворитель — тетрагндрофуран, скорость 1,2 мл/мин.
Рис. 59. ЯМР-спектр межфазного продукта, зарегистрированный в условиях
фурье-накоплення.
Растворитель — ДМСО-ds; рабочая частота SF=89994,500 МГц; ширина
спектра SW=1000 Гц; объем памяти SI=8K; амплитуда спектра NS = 400;
репер Н-ДМСО; температура 20°С.
91
7,45 м. д. —NH из NH—СО
4,76 м. д —СН
3,35 м. Д —СН из СН—СО—NH
1,78 и 1,93 м д —СН,
1,15 м д —СН2
0,85 м. д. (плечо) —СН3
Спектр межфазного соединения, зарегистрированный в три-
фторуксусной кислоте (рис. 60), указывает также на наличие
групп NH (7,22 м. д.) и СН2 (2,15; 1,67 и 1,15 м. д.). Из сопо-
ставления спектра продукта, зарегистрированного в трифторук-
сусной кислоте, со спектром реперного акриламида, зарегистри-
рованным в аналогичных условиях (рис. 61), видно, что оба
спектра содержат линии, характерные для группы NH (7,0 и
7,22 м. д.), и максимум при 2,15 и 1,67 м. д, соответствующий
группе СН2. Кроме того, межфазное производное проявляет
дополнительно поглощение при 1,15 м. д. (СН2), найденное как
в спектре, зарегистрированном в условиях фурье-накопления,
так и в спектре хлороформной фазы. На основании этого можно
предположить, что в структуре соединения интерфазы содержат-
Рис. 60. ЯМР-спектр межфазного продукта (спектрометр JEOL, 60 МГц;
растворитель — трифторуксусиая кислота, температура 80°С).
Рис. 61. ЯМР-спектр стандартного полиакриламида (спектрометр JEOL,
60 МГц; растворитель — трифторуксусная кислота; температура 80°С).
92
ся протоны, характерные как для углеводородных цепей, так и
для полиакриламида. Таким образом, вполне вероятно, что в
структуре соединения интерфазы содержатся как неполярные
частицы (углеводородная цепь), так и полярные фрагменты це-
почки полиакриламида:
углеводородная
цепь
\-СН2-СН2
\ CONHg, /л C0NH2
Эти структуры могли определить специфическую ориентацию
(направленность) молекул в воде, приводящую благодаря по-
верхностному натяжению к образованию надмолекулярных сфе-
рических микроструктур.
В опытах, выполненных параллельно с вышеуказанными, по-
лучены смеси линейных и разветвленных структур с очень низ-
ким выходом по углеводородам. Особая роль в формировании
амфифильных молекул и возникновении углеводородных цепей
с высокой молекулярной массой принадлежит аммиаку. За
расщепление метана ответственны, вероятно, «горячие атомы»
водорода, образующиеся из аммиака, а не холодные радикалы,
возникающие в результате столкновений:
Н-+СН4----->- Н2 + СН3
Н-+СН3----->-СН2 : + Н2 и т. д.
Реакция между NH2 и СН4, даже если бы она протекала
интенсивно, все равно привела бы вновь к образованию аммиа-
ка, который определил бы в свою очередь возникновение новых
«горячих атомов» водорода:
NH2+ СН4--->- СН3 + NH3
Это предположение совпадает с гипотезой «горячих атомов» во-
дорода, развитой Феррисом и Моримото для реакции аммиака
с метаном под действием электромагнитного излучения [213].
Преобладание линейных углеводородов с повышенным содер-
жанием —СНг—, наличие соединения интерфазы в суммарном
продукте реакции и малого количества акриламида в водной фа-
зе позволяют предположить, что эти производные образовались
путем рекомбинации следующих радикальных частиц:
•сн3, : СН2, ; CH, NH2 и : СО
Элементный состав структур указывает в то же время на то, что
радикал :СН2 в зоне реакции присутствовал в наибольшем ко-
личестве.
Малые количества акриламида в водной фазе можно было
93
бы объяснить посредством межфазной блок-сополимеризации
под действием макрорадикалов углеводородов:
СНз (СН2)Л—СН2 4- СН2=СН-► соединение интерфазы
CONH2
Таким образом, повышенное содержание метана в исходной ре-
акционной смеси, а также межфазная полимеризация могли бы
определить направленное формирование длинных цепей линей-
ных углеводородов и межфазного блок-сополимера.
В специальной литературе приводятся сведения о том, что при
полимеризации в условиях холодной плазмы при комнатной тем-
пературе и в закрытых реакторах образуются в основном смеси,
богатые линейными и разветвленными макромолекулярными
соединениями даже в случае единственного исходного компонен-
та [172—182] Благодаря большому количеству активных моле-
кулярных частиц, сосуществующих в зоне реакции (в основном
моно- и полифункциональные радикалы), четвертое состояние
материи обусловливает возникновение в процессах рекомбина-
ции определенных статистических структур смесей. По этой
причине в большинстве случаев преобладают сетчатые (попереч-
но-сшитые) и разветвленные соединения. Основными частицами»
которые могли бы возникнуть под воздействием плазмы в атмос-
фере метана, аммиака и водяных паров, являются:
СН*( СН3: : сн2: ; сн; С)
NH3(-NH2, : NH, : N)
Н2О( ОН, Н и О)
Возможности рекомбинации с учетом возникновения макромо-
лекулярных структур в этом случае практически неограниченны
Наши лабораторные исследования показывают, что в атмо-
сфере, состоящей из метана, аммиака и паров воды, в реакторе,
действующем как открытая система, и при наличии поверхностей
с низкими температурами (лед при —60°С) холодная плазма
может определить развитие некоторых направленных механиз-
мов рекомбинации, приводящих к ограниченному числу (в нашем
случае три) основных компонентов. Два из этих компонентов
имеют полимерную природу и преобладают (по сравнению с
акриламидом) в водной фазе. Макромолекулярные структуры
являются в основном линейными, а амфифильная производная
формируется, вероятно, путем межфазной полимеризации.
Полученные данные свидетельствуют о том, что линейные
органические структуры с относительно высокими молекуляр-
ными массами могли возникнуть на абиотической Земле путем
процессов рекомбинации в отсутствие специальных химических
агентов, а также доказывают возможность возникновения амфи-
фильных (липидных) структур, отличающихся от современных, и
зарождения протомембран.
94
2.4. Самосборка протобиополимеров
и свойства микросистем [194, 196, 198—200, 208—211]
Протобиополимеры, синтезированные в условиях холодной
плазмы, и в особенности смеси, богатые липидными структура-
ми, во время размораживания претерпевают самосборку в ста-
бильные микросферы, однородные по размерам (диаметр 10—
50 мкм) (рис. 62). Для их изучения были использованы следую-
щие методы: оптическая микроскопия; электронная микроско-
пия (срезы и цельные микросферы); оптическая микроскопия в
поляризованном свете; растровая электронная микроскопия
(РЭМ); электронная микроскопия по методу замораживания —
скалывания; проверка на устойчивость к термическому и свето-
вому воздействию; проверка на устойчивость к изменениям pH;
испытание механической прочности; исследование мембранных
свойств; изучение связывания биологически активных соедине-
ний.
Эти микросферы «выживают» в относительно суровых энер-
гетических, термических и радиационных условиях; при нагре-
вании до 80°С они подвергаются частичной дезорганизации, пос-
ле чего при охлаждении системы восстанавливаются. Такой же
процесс происходит при облучении ультрафиолетовыми лучами
(рис. 63—65). Устойчивость микросфер в широком диапазоне
pH (6—9) подтверждает предположение об их стабильности в
первичном, как считается, щелочном океане.
Электрические измерения показывают, что микросферы об-
ладают свойствами полупроводников и мембран. Определение
Рис. 62. Снимок (оптическая микроскопия) микросфер, полученных путем
самосборки из богатой метаном исходной смеси.
95
Рис. 63. Снимок (оптическая микроскопия) микросфер, полученных путем
самосборки.
Рис. 64. Снимок (оптическая микроскопия) микросфер, полученных путем
самосборки, после УФ-облучения в течение 2 мин (ртутная лампа 200 Вт,
расположенная на расстоянии 100 мм от пробы).
96
Рис. 65. Снимок (оптическая микроскопия) микросфер, полученных путем
самосборки, после УФ-облучения в течение 15 мин (ртутная лампа 200 Вт,
расположенная на расстоянии 100 мм от пробы).
И
Рис. 66. Зависимость электропровод-
ности суммарного продукта от тем-
пературы (металлизированные таб-
летки).
удельного сопротивления как
функции обратной абсолютной
температуры свидетельствует
о линейной зависимости, свой-
ственной полупроводимости, а
мембранный потенциал приб-
лижается к 30 мВ (рис. 66 и
67). Последний был измерен
между двумя фазами внутри и
снаружи стенки микросферы
путем введения во внутрь ее
стеклянного микроэлектрода
диаметром ~2 мкм, содержа-
щего КС1 и имеющего внут-
реннее сопротивление порядка
5—15 МОм (рис. 68).
Электронно-микроскопиче-
97
Рис. 67. Мембранный потенциал микросфер (стеклянные микроэлектроды
диаметром 2 мкм, заполненные 3 М КС1; сопротивление 5—15 МОм).
Рис. 68. Схема установки для измерения мембранного потенциала микросфер.
1— плексигласовая камера; 2— стеклянный микроэлектрод; 3 — электрод
сравнения (AgCI); 4— катодный источник повторяющихся сигналов с MF-
фильтром; 5 — предварительный усилитель постоянного тока; 6 — самописец;
7 — осциллоскоп со смотровой камерой.
ские исследования срезов микросфер, окрашенных тетраокси-
дом осмия и залитых в метакриловую смолу, выявляют двух-
слойное строение стенки-мембраны (рис. 69).
Гипотетические протоклетки, как и первые живые клетки,
нуждались в специальных образованиях (компартаментах) для
удерживания водных растворов и взвесей; при анализе срезов
методом трансмиссионной микроскопии такие образования вы-
явлены. Исследование стенки-мембраны с помощью оптической
98
Рис. 69. Снимок (электронная микроскопия) среза микросфер, полученных
в условиях холодной плазмы (контрастирование тетраоксидом осмия; залив-
ка в метакрилат).
микроскопии в поляризованном свете показало наличие надмоле-
кулярной упорядоченности (рис. 70). Свечение объекта, находя-
щегося в поле микроскопа, зависит от угла вращения плоскости
поляризованного света, в то время как форма изображения оп-
ределяется природой молекулярной организации. Как микро-
граммы со срезов проб, так и снимки, полученные в поляризо-
ванном свете, показывают, что мембрана является тонким жид-
ким слоем типа жидкого кристалла.
Результаты, полученные растровой электронной микроскопи-
ей, содержат дополнительные данные о морфологических особен-
ностях наружного слоя микросфер (рис. 71—73). Эллиптическая
форма микрочастиц является следствием сплющивания их при
напылении металла за счет испарения льда из внутренней части
микросистемы. Сферы, содержащие воду (фактически лед,
вследствие испарения в камере для напыления), деформируются
99
Рис. 70. Снимок (оптическая микроскопия в поляризованном свете, скрещен-
ные николи) микросфер, претерпевших самосборку.
при «высыхании», что указывает на существование во внутрен-
ней части микрочастиц полостей, в то время как наружная плот-
ная структура имеет тенденцию к поддержанию первоначальной
сферической формы. На наружной поверхности структур выяв-
лены протуберанцы (рис. 73) — последствия разрыва мембраны
при создании вакуума.
Снимки, полученные методом электронной микроскопии в
сочетании с методом замораживания •— скалывания, дают допол-
нительные доказательства наличия водных включений в микро-
частицах. Указанная методика позволяет визуализировать на-
ружный контур благодаря существованию поверхностей спайно-
сти и дает важные данные в отношении ультраструктуры стенки-
мембраны. На рис. 74 и 75 приведены снимки, полученные мето-
дом замораживания — скалывания, для сравнения нескольких
препаратов микросфер, содержащих отдельные фосфолипидные
везикулы. Наличие поверхностей спайности полусферической и
полуэллиптической формы указывает на то, что гидрофобность
молекул липидного типа отвечает условиям образования липид-
ных мембран. Возникновение разрывов неправильной формы
(вероятно, во время приготовления проб по методу заморажива-
ния — скалывания) является дополнительным свидетельством
существования полостей в структуре микросфер (рис. 74,6).
100
Рис. 71. Изображение (растровая электронная микроскопия) микросфер, по-
лученных в условиях холодной плазмы.
Снимки стенок мембран при большем увеличении ясно демон-
стрируют образование надмолекулярной структуры (рис. 76).
Микросферы избирательно захватывают биологически актив-
ные соединения путем инкапсулирования при намораживании
водного раствора трипсина на охлажденную до—60°С цилиндри-
ческую стенку реактора. После окончания реакции во время тая-
ния льда спонтанно появляются микросферы, включившие в се-
бя фермент. Для изучения способности захватывать биологиче-
ски активные соединения и последующей оценки их активности
несколькими циклами промываний (производились повторные
промывания и центрифугирования) были получены микросферы,
содержащие трипсин. Установлено, что фермент может быть не-
однократно использован для гидролиза белков. Были приготов-
лены следующие образцы: а) 2 мг суспензии предварительно
101
Рис. 72. Изображение (растровая электронная микроскопия) микросферы,
полученной в условиях холодной плазмы.
Рис. 73, Изображение микросферы (см. рис. 72).
102
Рис. 74. Микрофотографии (электронная микроскопия, метод заморажива-
ния—скалывания) микросфер, полученных в плазме.
Пробы готовились в соответствии с общепринятой методикой; в качестве про-
тектора во время замораживания использован 50%-ный раствор глицерина.
Металлизацию осуществляли одновременным напылением платины и углеро-
да, после чего дополнительно напыляли углерод для обеспечения однородно-
сти пленки.
Рис. 75. Микрофотография (электрон-
ная микроскопия, метод заморажива-
ния—скалывания) фосфолипидных
пузырьков (Харгривс и Димер, 1978).
инкапсулированным трипсином
промытых микросфер плюс
трипсин (эталон); б) 2.мг сус-
пензии микросфер, не содер-
жащих трипсин; в) 2 мл воды,
оставшейся от последнего про-
мывания микросфер с инкап-
сулированным трипсином. К
каждому образцу был добав-
лен 1 г бычьего сывороточного
альбумина. Препараты, дове-
денные до pH 6,8, инкубирова-
ли в течение 5 ч при комнат-
ной температуре, а полученные
продукты гидролиза анализи-
ровали после отделения мик-
росфер методом диск-электро-
фореза на полиакриламидном
геле. По денситометрическим
оценкам после окрашивания
проявлялись полосы пептидно-
го типа (рис. 77—79).
Гидролитическая актив-
ность проявляется только в
препарате, содержащем поми-
мо альбумина микросферы с
(рис. 78). Необходимо отметить,
что эта система не теряет свойств при повторном использовании
до трех циклов.
Использованные микросферы с инкапсулированным трипси-
ном интенсивно промывали дистиллированной водой и снова ис-
пользовали; они проявляют гидролитическую активность в отно-
шении бычьего сывороточного альбумина. Как видно из рис. 77—
79, инкубация альбумина с микросферами, содержащими трип-
син, приводит к гидролизу белка; этот процесс выражается в по-
явлении новых максимумов, характерных для более «легких»
белковых фракций (рис. 79).
Для изучения взаимодействия микросфер с инкапсулирован-
ным соединением с определенной биологической системой ис-
пользовалась экспериментальная модель — лишенная оболочки
яйцеклетка червя трубочника Tubifex. Эта клетка характеризу-
ется спиральным типом дробления. Первое деление дробления
особенно чувствительно к воздействию некоторых физико-хими-
ческих факторов. В нормальных условиях первая плоскость пер-
вого деления дробления делит яйцеклетку Tubibex на два бласто-
мера неодинаковых размеров (рис. 80): а — маленькая клетка,
б — большая клетка.
Следующее деление (бластомера б) также асимметрично.
Эта асимметрия является выражением цитоплазматической диф-
104
ммяж
Рис. 76. Микрофотография (электронная микроскопия, метод заморажива-
ния—скалывания) стенки микросферы при большом увеличении.
ференцировки яйцеклетки, благодаря которой в процессе созре-
вания появляются морфофункциональные градиенты. Физиче-
ские или химические факторы, воздействуя в период дифферен-
цировки клеток, приводят к формированию в результате деления
двух клеток одинаковых размеров. Яйцеклетки, в которых плос-
кость первого деления симметрична, не развиваются в нормаль-
ные бластулы. Одновременно с дроблением происходит измене-
ние клеточной оболочки, что позволяет установить, на какой ста-
дии клеточного цикла находится данная клетка.
Такие процессы, характерные для периодов первого деления
и предшествующего ему, были изучены на клетках, лишенных
яйцевой оболочки (имеющих только плазматическую мембрану)
и подвергнутых воздействию микросфер, не содержащих или со-
держащих инкапсулированный трипсин в концентрации, приме-
ненной ранее (1 мг трипсина на 250 мл суспензии микрочастиц).
105
Рис. 78. Результаты электрофореза
на полиакриламидном геле продук-
тов, полученных при гидролизе бычь-
его сывороточного альбумина под
действием микросфер, содержащих
инкапсулированный трипсин.
Инкубация с содержанием смеси
1 мг/мл бычьего сывороточного аль-
бумина и микросфер с инкапсулиро-
ванным трипсином, промытых при
pH 7,8, продолжалась при комнатной
температуре в течение 5 ч. Продукты
гидролиза после удаления микросфер
анализировали на полиакриламидном
геле.
Рис. 77. Результаты электрофореза
бычьего сывороточного альбумина на
полиакриламидном геле (денситометр
Zeiss).
Проба бычьего альбумина растворе-
на в смеси трис + 0,0625 М НС1
(pH 6—8) + меркаптоэтанол 5% +
+ додецилсульфат натрия 3% + гли-
церин 10%. Разделение выполнено в
стеклянных трубках длиной 10 см,
заполненных полиакриламидным ге-
лем с концентрацией 8,75% при по-
стоянном токе 2 мА на трубку. После
разделения (~2 ч) гели были окра-
шены 0,1%-ным раствором Кумасси
голубого.
Рис. 79. Результаты электрофореза
при повторном использовании осаж-
денных и промытых микросфер (ус-
ловия см. в подписи к рис. 77).
Для выявления возникающих новых явлений к яйцеклеткам,
находящимся в 5 мл физиологического раствора, добавляли по-
следовательно 2 капли суспензии микросфер, содержащих инкап-
сулированный или свободный трипсин либо не содержащих
трипсина. В то время как в присутствии микросфер со свобод-
ным трипсином или без него деление яйцеклетки и развитие бла-
стулы происходит нормально, микросферы, содержащие инкап-
сулированный трипсин, инду-
цируют видоизменение про-
цессов, характерных для кле-
точной оболочки (интенсифи-
цируют их), и в конечном ито-
го блокируют сегментацию
(рис. 81).
Микроскопическое исследо-
вание показывает, что микро-
сферы, содержащие инкапсу-
лированный трипсин, при кон-
такте с мембранами включа-
ются в клетки, по-видимому,
путем эндоцитоза. Эту способ-
ность взаимодействовать с ци-
топлазматической оболочкой и
106
Рис. 80. Микрофотография деления дробления яйцеклетки.
Нормальное деление дробления, показанное стрелкой б, приводит к образо-
ванию одной большой клетки (бластомер CD) и одной маленькой клетки
(бластомер АВ), в отличие от деления яйцеклетки, обработанной суспензией
микросфер и трипсина. Стрелкой а в данном случае показана яйцеклетка
с более высокой активностью поверхности.
Рис. 81. Микрофотография распределения клеток после обработки микросфе-
рами с инкапсулированным трипсином.
Стрелкой а показан живой бластомер АВ с блокированным дроблением; б —
бластомер CD с протоплазмой, скрученной в процессе разрыва; в — остатки
разорванной клетки CD; г — клетка, блокированная до начала первого дроб-
ления.
107
проникать через нее можно объяснить только наличием трип-
сина внутри или на поверхности стенки мембраны микросфер.
Эффект ингибирования дробления обусловлен, вероятно, вы-
свобождением компонентов микрочастиц под действие^ вну-
триклеточных ферментов. Следовательно, клеточные ферменты
способны воздействовать на соединения, синтезированные в
абиогенных условиях и подвергшиеся самоорганизации в микро-
сферы. Внутриклеточная деградация микросфер подтверждается
также экспериментальными данными о том, что протобиополи-
меры, полученные в других абиотических условиях, также при-
водят к повышению активности оболочки и блокированию кле-
точного деления. В такой яйцеклетке, дробление которой блоки-
ровано инкапсулированными микросферами, цитолиз, т. е. ги-
бель, наступает только через 48 ч, а это означает, что основные
клеточные функции продолжаются.
2.5. Заключение
Экспериментальные результаты, полученные и интерпретиро-
ванные в свете низкотемпературной теории, приводят к следую-
щим фундаментальным выводам:
1. Холодная плазма — источник первичной энергии — могла
играть существенную роль в ходе химической эволюции.
2. Наличие поверхностей с отрицательным температурным
режимом на абиотической Земле представляло собой определяю-
щий фактор для появления протобиополимеров. Макромолеку-
лярные предшественники живой материи появились путем акку-
мулирования и рекомбинации активных частиц, возникших под
влиянием плазмы в газообразной фазе (первичная атмосфера),
на холодных поверхностях суши или в атмосфере.
3. Структурные и функциональные протобиополимеры генери-
ровались одновременно и накапливались дифференцированно в
зависимости от изменений состава первичной атмосферы. Их об-
разование было результатом определенных рекомбинационных
механизмов во время процесса таяния льда.
4. Основные компоненты имели макромолекулярную структу-
ру (полипептиды, полисахариды и т. д.). Получение в модельных
синтезах незначительного количества биомономеров (аминокис-
лот, сахаров, оснований и т. д.) свидетельствует о том, что про-
тобиополимеры предшествовали соединениям с малой молеку-
лярной массой в хронологии их возникновения. Вещества этой
категории образовались в процессах гидролиза и расщепления.
5. Смеси протобиополимеров, в особенности богатых гидро-
фобными производными, в структурном отношении соответство-
вали требованиям самоорганизации, группируясь в совокупно-
сти индивидуальных фазообособленных частиц. Эта ступень
представляет собой скачок от химических смесей к организован-
ным системам (протоклеткам).
108
ния жизни.
Рис. 82. Схема модели эволюции по низкотемпературной теории возникнове-
6. Функционирование этих систем (с фазовым обособлением,
мембранными, электрическими и др. свойствами) моделирует
этап возникновения первичных переносчиков энергии и самых
простых циклических процессов.
Эти соображения привели нас к созданию модели химической
эволюции, представленной на рис. 82 [198, 199].
За исторически очень короткий, но чрезвычайно фактически
насыщенный период накапливались знания и опыт, в результате
чего выяснены условия отдаленного прошлого земной коры, ко-
торые могли привести к возникновению жизни. Сегодня мы на-
ходимся ближе, чем когда-либо, к наиболее высокой и важной
цели человеческого знания: воспроизведению живой клетки в ла-
боратории. Химики могут синтезировать почти все предшествен-
ники жизни. Отталкиваясь от простых молекул и моделируя пер-
воначальные условия Земли, мы приходим к макромолекуляр-
ным структурам вплоть до тех, которые находят биологи, про-
никая в сокровенные источники живой материи, и, возможно,
еще до начала нового тысячелетия посредством гиперцикличе-
ских процессов или другим путем [214] будет сделан этот гигант-
ский качественный скачок, основанный на понимании и освоении
энергетических механизмов в микросферах.
Литература
1. Rubey W. W„ Geol. Soc. Amer. Bull., 62, 111 (1951).
2. Rubey W. W., Geol. Soc. Amer. Spec. Pap., 62, 631 (1955).
3. Sagan C„ Mullen G„ C. R. S. R„ 460, 1 (1972).
4. Miller S. L., J. Amer. Chem. Soc., 77, 2351 (1955).
5. Miller S. L„ Orgel L. E., The origins of life on the Earth. Prentice Hall
Inc., Englewood, New Jersey, 1974, p. 91.
6. Miller S. L., Science, 117, 528 (1953).
7. Miller S. L, Peris M., Nature, 204, 1248 (1964).
8. Fox S. W., Windson C. R„ Science, 170, 984 (1970).
9. Schwartz A., Fox S. W., Biochem. Biophys. Acta. 87, 696 (1964).
10. Abelson P. H., Paleobiochemistry. Carnegie Inst, of Washington, Year Book,
Vol. 53, 1956, p. 171.
11. Dose K., Rajewsky B., Biochem. Biophys. Acta, 25, 225 (1957).
12. Groth W„ Weyssenhoff H., Naturwiss., 44, 510 (1957).
13. Ord J., Nature, 197, 862 (1963).
14. Ord J., Kamat S. W„ Nature, 190, 442 (1961).
15. Palm C., Calvin M., J. Amer. Chem. Soc., 84, 2115 (1962).
16. Fox S. W., Dose K-, Molecular evolution and the origin of life. W. H. Fre-
eman & Co., San Francisco, 1972.
17. Harada K-, Suzuki S., Nature, 266, 275 (1977).
18. Harada K-> Suzuki S., Ishida H., Experientia, 34, 17 (1978).
19. Ponnamperuma C., Gabel N. W., Space Lite Sci., 1, 64 (1968).
20. Heyns K., Walter W., Meyer E„ Naturwiss., 44, 385 (1957).
21. Додонова H. Я., Сидорова А. И. — Биофизика, 1961, т. 6, № 2, с. 149.
22. Franck В., Chem. Вег., 93, 446 (1963).
23. Sagan C., Khare В. N., Science, 173, 417 (1971).
24. CzuchajowsKy L., Francik H., Gorecka N., Kostuch A., Roczniki Chemii
Ann. Soc. Chim. Polonorum, 43, 1893 (1969).
25. Ivanov Ch. P., Slavcheva N. N., Origins of Life, 8, 13 (1977).
26. Draganic Z., Draganic I., Shimoyawa A. S., Ponnamperuma C., Origins of
Life, 8, 371 (1977).
27. Draganic Z., Draganic I., Shimoyawa A. S., Ponnamperuma C„ Origins oi
Life, 8, 377 (1977).
28. Harada K., Terasawa J., Gunji H., in: Origin of life (ed. Y. Wolman).
D. Reidel Publishing Co., Dordrecht, 1981, p. 173.
29. Yanagawa H., Kobayashi Y., Egami F., in: Origin of life (ed. Y. Wolman).
D. Reidel Publishing Co., Dordrecht, 1981, p. 181.
30. Groth W., Suess H., Naturwiss., 43, 310 (1956).
31. Groth W., Weyssenhoff H„ Naturwiss., 44, 510 (1957).
32. Bossard A., Toupance G., in: Origin of life (ed. Y. Wolman). D. Reidel
Publishing Co., Dordrecht, 1981, p. 93.
33. Irving C. S., Petterson R. C., J. Org. Chem., 32, 3114 (1967).
34. Ord J., Fed. Proc., 20, 352 (1961).
35. Ord J., Han I., Science, 124, 144 (1967).
36. Mariani E., Torraca C., Int. Sugar, 55, 309 (1953).
37. Ponnamperuma C., Flores J., J. Rad. Res., 25, 229 (1965).
38. Reid C., Orgel L. E., Nature, 216, 455 (1967).
110
39. Allen W. V., Ponnamperuma C., Currents Mod. Biol., 1, 24 (1967).
40. Dose K, Risi S., Naturforsch., 23b, 581 (1968).
41. Leach W. W., Nooner D. W., Oro I., in: Origin of life (ed. H. Noda). Cen-
ter for Academic Publications, Japan, 1978, p. 113.
42. Chadha M. S., Subbaraman A. S., Kazi Z. A., Choughuley A. S. U., in:
Origin of life (ed. H. Noda). Center for Academic Publications, Japan,
1978, p. 199.
43. Chittenden G. I. F., Schwartz A. W., Nature, 263, 350 (1976).
44. Schwartz A. Chittenden G. I. F„ BioSystems, 9, 87 (1977).
45. Oro J., Kimball A., Fritz R., Master F., Arch. Biochem. Biophys., 85, 115
(1969).
46. Oro J., Biochim. Biophys. Res. Commun., 2, 407 (1960).
47. Hodgson G. W., Annale of New York Acad, of Sci., 206, 670 (1973).
48. Ponnamperuma C., Mack P., Science, 148, 1221 (1965).
49. Szutka A., Hazel H. Z„ McNable W. M., Rad. Res., 10, 597 (1958).
50. Szutka A., Nature, 212, 401 (1966).
51. Simionescu С. I., Lixandru T., Gorea C., Gorduza V., C. R. Acad. Sci. Pa-
ris, 280, 685 (1975).
52. Simionescu С. I., Simionescu B. C„ Mora R., Leanca M., loanid E., C. R.
Acad. Sci. Paris, Ser. C, 284, 743 (1977).*
53. Simionescu С. I., Simionescu В. C., Mora R., Leanca M., Vasilescu M.,
C. R. Acad. Sci. Paris, Ser. D, 286, 1021 (1978).
54. Simionescu C. L, Simionescu В. C., Mora R., Bioelectrochem. Bioenerg., 5,
1 (1978).
55. Simionescu C. L, Simionescu В. C., Mora R., Leanca M., Origins of Life,
9, 103 (1978).
56. Simionescu C. L, Mora R., Olaru N„ C. R. Acad. Sci. Paris, Ser. D, 11,
147 (1976).
57. Simionescu С. I., Lixandru T., Gorduza V., Gorea C., Origins of Life, 8,
237 (1977).
58. Simionescu С. I., Dumitriu S., Bulacovschi V., Popa V. I., Cell. Chem. and
Techn., 12, 143 (1978).
59. Simionescu С. I., Dumitriu S., Popa V. L, Bulacovschi V., Simionescu В. C.,
Rev. Roumaine Chim., 23, 89 (1978).
60. Simionescu С. I., Dumitriu S., Popa V. L, Z. Naturforsch., 31b, 466 (1976).
61. Simionescu C. L, Simionescu В. C., Leanca M., Ananiescu C., Mora R„
in: Origin of life (ed Y. Wolman). D. Reidel Publishing Co., Dordrecht,
1981, p. 189.
62. Fox S. W., Harada K., J. Amer. Chem. Soc., 82, 3745 (1960).
63. Fox S. W., Harada K-, Arch. Biochem. Biophys., 86, 281 (I960).
64. Fox S. W., Nakashima T., Biochim. Biophys. Acta, 140, 155 (1965).
65. Fox S. W., Waehneldt T. V., Biochim. Biophys. Acta, 160, 246 (1968).
66. Fox S. W., Nakashima T., in: Origin of life (ed. Y. Wolman). D. Reidel
Publishing Co., 1981, p. 271.
67. Fox S. W., Dose K., Molecular evolution and the origin of life. Revised
ed., Dekker, New York, 1977.
68. Steinman G. D., Lemmon R. M., Calvin M., Proc. Nat. Acad. Sci. U. S.,
52, 27 (1964).
69. Lohrmann R., Orgel L. E., Science, 161, 64 (1968).
70. Steinman G. D., Kenyon D. H., Calvin AL, Nature, 206, 707 (1965).
71. Steinman G. D., Kenyon D. H., Calvin M., Biochim. Biophys. Acta, 124,
339 (1966).
72. Steinman G. D., Kenyon D. H., Calvin M., Science, 147, 1574 (1965).
73. Ibanez J. D., Kimball A. P., Oro J., Science, 173, 444 (1971).
74. Halman H„ Sachez R. A., Orgel L. E., J. Org. Chem., 34, 3702 (1969).
75. Miller S. L., Parris M., Nature, 204, 1248 (1964).
76. Lohrmann R., Orgel L. E., Science, 161, 64 (1968).
77. Ferris 1. P., Science, 161, 53 (1968).
78. Stoezel F., Buvet R., in: Origin of life (ed. Y. Wolman). D. Reidel Publi-
shing Co., 1981, p. 241.
Ill
79. Hawker J. R., Ir., Ord J., in: Origin of life (ed. Y. Wolman). D. Reidel
Publishing Co., 1981, p. 225.
80. Nooner D. W., Sherwood E., More M. A., Ord I., J. Mol. Evol., 10, 211
(1977).
81. Ponnamperuma C., Peterson E., Science, 147, 1572 (1965).
82. Paecht-Horowitz M„ Berger I., Katchalsky A., Nature, 228, 636 (1970).
83. Paecht-Horowitz M., Katchalsky A., Biochim. Biophys. Acta, 140, 14 (1967).
84. Katchalsky A., Naturwiss., 60, 215 (1973).
85. Paecht-Horowitz M., Katchalsky A., J. Mol. Evol., 2, 91 (1973).
86. Paecht-Horowitz M., in: Origin of life (ed. Y. Wolman). D. Reidel Publi-
shing Co., 1981, p. 295.
87. Paecht-Horowitz M., in: Origin of life (ed. H. Noda). Center for Academic
Publications, Japan, 1978, p. 289.
88. Paecht-Horowitz M„ m: Chemical evolution and the origin of life (eds.
R. Buvet, C. Ponnamperuma). North Holland, Amsterdam, 1971, p. 245.
89. Katchalsky A., Ailam G., Biochim. Biophys. Acta, 140, 1 (1967).
90. Warden I. T., McCullough J. J., Lemmon R. M., Calvin M., J. Mol. Evol.,
4, 189 (1974).
91. Flegmann A. W., Scholefield D., J. Mol. Evol., 12, 101 (1978).
92. Akabori S., Kagaku, 25, 54 (1955).
93. Akabori S., Okawa K-, Sato M., Bull. Chem. Soc. Japan, 29, 608 (1956).
94. Matthews C. N., Nelson I., Varma P., Minard R., Science, 198, 622 (1977).
95. Minard E., Yang W., Varma P., Nelson J., Matthews C. N„ Science, 190,
387 (1975).
96. Matthews C. N., Origins of Life, 6, 155 (1975).
97. Sanchez R. A., Ferris J. P., Orgel L. E„ J. Mol. Biol., 30, 121 (1967).
98. Labadie M. M., Ducastaing S., Breton J. C., Bull. Soc. Pharm. Bordeaux,
107,61 (1968).
99. Ferris I. P., Donner D. B., Lobo A. P., J. Mol. Evol., 74, 499 (1973).
100. Ferris I. P„ Science, 203, 1135 (1979).
101. Folsome С. E., Naturwiss., 63, 303 (1976).
102. Grossenbacher K. A., Knight C. A., in: Origin of prebiological systems and
their molecular matrices (ed. S. W. Fox). Academic Press, 1965, p. 173.
103. Hargreaves W. R.. Mulvihill S. I., Deamer D. W., Nature, 266, 78 (1977).
104. Eichberg J., Sherwood E., Epps D. E., Ord J., J. Mol. Evol., 10, 3 (1977).
105. Селезнев С. А., Федоров Л. M., Михайлов А. И„ Борисова A. M., Ку-
зина С. И.— Ж. эволюц. биохим. физиол., 1976, т. 12, № 5, с. 411.
106. Seleznev S. A., Fedorov L. M., Kuzina S. L, Mikhailov A. L, Rev. Fr.
Corps., 24, 291 (1977).
107. Singer S. L, Nicolson G. L., Science, 175, 720 (1972).
108. Baltscheffsky H., in: Chemical evolution and the origin of life (eds. R. Bu-
vet, C. Ponnamperuma). North-Holland Publishing Co., 1971, p. 466.
109. Baltscheffsky H., Baltscheffsky M., Ann. Rev. Biochem., 43, 871 (1974).
110. Kulaev S. I., in: The origin of life and evolutionary biochemistry (eds.
K. Dose, S. W. Fox, G. A. Deborin, T. E. Pavlovskaya). Plenum Press,
1974, p. 271.
111. Baltscheffsky H., Acta Chem. Scand., 21, 1973 (1967).
112. Kulaev S. I., in: Molecular evolution (eds. R. Buvet, C. Ponnamperuma).
North-Holland Publishing Co., 1971, p. 458.
113. Keister D. L., Minton N. J., Arch. Biochem. Biophys., 147, 330 (1972).
114. Keister D. L., Minton N. J., Biochem. Biophys. Res. Commun., 24, 510
(1966).
115. Nordlie R. C., Arion W. J., J. Biol. Chem., 239, 1960 (1965).
116. Schwartz A. W., in: Molecular evolution: Prebiological and Biological
(eds. D. L. Rohlfing, A. I. Oparin). Plenum Publishing Co., 1972, p. 129.
117. Bishop M. I., Lohrmann R., Orgel L. E., Nature, 237, 162 (1972).
118. Miller G. L., Parris M., Nature, 204, 1248 (1964).
119. Neuman M. V-, Neuman W. F., Lane K., Currents Mod. Biol., 3, 253 (1970).
120. Lohrmann R., Orgel L. E., Science, 171, 490 (1971).
121. Ponnamperuma C., Sagan C., Mariner R., Nature, 199 (4890), 222 (1963).
112
122. Schwartz A. W., Biochem. Biophys. Acta, 281, 477 (1972).
123. Schwartz A. IF., van der Veen M., Bisseling T., Chittenden J. F., Bio-
Systems, 5 (3), 119 (1973).
124. Osterberg R., Orgel L. E., Lohrmann R., J. Mol. Evol., 2, 231 (1973).
125. Stephen-Sherwood E., Odom D. G„ Oro J., J. Mol. Evol., 3, 323 (1974).
126. Osterberg R„ Orgel L. E„ J. Mol. Evol., 1, 241 (1972).
127. Schwartz A. IF., J. Chem. Soc., Chem. Commun., 1393 (1969).
128. Wright R. S., Khorana H. G„ J. Amer. Chem. Soc., 78, 811 (1956).
129. Schwartz A. IF., Fox S. IF., Biochem. Biophys. Acta, 87, 696 (1964).
130. Halmann M„ Sanchez R. A., Orgel L. E., J. Amer. Chem. Soc., 91, 3702
(1969).
131. Beck A., Orgel L. E., Proc. N. A. S., 54, 664 (1965).
132. Steinman G., Lemmon R. M., Calvin M„ Proc. N. A. S., 52, 27 (1964).
133. Ponnamperuma C., Kirk P., Nature, 203, 400 (1964).
134. Ponnamperuma C„ Mack R., Science, 148, 1221 (1965).
135. Sulston J., Lohrmann R., Orgel L. E., Toddmiles FL, Proc. N. A. S., 409
(1968).
136. Moravek J„ Tetrahedron Letters, 18, 1707 (1967).
137. Ferris J. P., Science, 161, 53 (1968).
138. Lohrmann R., Orgel L., Science, 161, 64 (1968).
139- Akabori M„ Kawai K-, Biochem. Biophys. Acta, 246, 194 (1971).
140. Schwartz A. IF., Ponnamperuma C., Nature, 218, 443 (1968).
141. Rabinowitz J., Chang S., Ponnamperuma C., Nature, 218 (5140), 442 (1968).
142. Ibanez I. D., Kimball A. P., Oro I., Science, 173, 444 (1971).
143. Waehneldt T. V., Fox S. IF., Biochim. Biophys. Acta, 134, 1 (1967).
144. Brinigar IF. S., Knaff D. B., Wang J. H., Biochemistry, 6, 36 (1967).
145. Fox S. IF., Adachi T., Stilwell IF., in: Solar energy. International progress
(ed. T. Nejat Veziroglu). Vol. 2. Pergamon Press, New York, 1980, p. 1056.
146. Fox S. IF., Adachi T., Stilwell IF., Ishima Y., Baumann G., in: Light trans-
ducing membranes (ed. D. Deamer). Academic Press Inc., New York,
1978, p. 61.
147. Schoffstall A. M., Kokko B., in: Origin of life (ed. H. Noda). Center for
Academic Publications Japan, 1978, p. 193.
148. Yamagata Y„ Yamakawa A., in: Origin of life (ed. H. Noda). Center for
Academic Publications Japan, 1978, p. 221.
149. Sawai H., in: Origin of life (ed. H. Noda). Center for Academic Publica-
tions Japan, 1978, p. 227.
150. Lohrmann R., Orgel L. E., in: Origin of life (ed. H. Noda). Center for
Academic Publications Japan, 1978, p. 235.
151. Simionescu С. I., Dumitriu S„ Constantinescu Al., in: Origin of life (ed.
Y. Wolman). D. Reidel Publishing Co., Dordrecht, 1981, p. 165.
152. Bridson P. K., Fakhrai H., Lohrmann R., Orgel L., E., van Roode AL, in:
Origin of life (ed. Y. Wolman). D. Reidel Publishing Co., Dordrecht, 1981,
p. 233.
153. Racker E., Stoeckenius IF., J. Biol. Chem., 26, 662 (1974).
154. Bahn P. R., Fox S. W., BioSystems, 14, 3 (1981).
155. Katz I. L, Janson T. R., Wasielewski M. R., in: Energy and the chemi-
cal sciences (eds. S. D. Christian, J. J. Zuckerman). Pergamon Press,
1978, p. 31.
156. Rothemund P., J. Amer. Chem. Soc., 58, 625 (1936).
157. Calvin M., Ball R. H., Aronoff S., J. Amer. Chem. Soc., 65, 2259 (1943).
158. Szutka A., Nature, 202, 1231 (1964).
159. Szutka A., Hazel I. F., McNabb W. M., Radiation Res., 10, 597 (1959).
160. Krasnovsky A. A., Umrikhina A. V., in: Molecular evolution, Prebiological
and biological (eds. D. L. Rohlfing, A. I. Oparin). Plenum Press, 1972,
p. 141.
161. Hodgson G. W., Baker B. L„ Nature, 216, 29 (1967).
162. Scott J. J., Biochem. J., 62, 6 (1956).
163. Broda E„ The evolution of the bioenergetic processes. Pergamon Press,
Oxford, 1975.
113
164. Broda E., Origins of Life, 8, 87 (1977).
165. Broda E., Comments on the history of atmospheric nitrogen. Working
Party of the Research Group on Cosmochemistry, Chemical Evolution and
Exobiology, 15 and 16 June 1979. Mainz, Institute of Biochemistry (under
the auspices of the Council of Europe).
166. Miller S. L., Orgel L. E., The origins of life on the Earth. Prentice-Hall,
Inc., Englewood Cliffs, New Jersey, 1974, p. 49.
167. Henderson-Sellers A., Schwartz A. W., Nature, 287, 526 (1980).
168. Schrauzer G. N., Guth T. D., J. Amer. Chem. Soc., 99, 7189 (1977).
169. Schrauzer G. N., Guth T. D., Palmer R. M., in: Solar energy: Chemical
conversion and storage (eds R. R. Hautala, R. B. King, C. Kutal). The
Humana Press, Clifton, N. J„ 1979, p. 261.
170. Chittenden G. J. F., Schwartz A. W., BioSystems, 14, 15 (1981).
171. Gordon R. B., Physics of the Earth. Holt, Rinehart and Winston Inc., 1972,
p. 11.
172. McTaggart F. R., in: Plasma chemistry in electrical discharges (ed. Tag-
gart). Elsevier, Amsterdam, 1969.
173. Tseng S. S., Chang S., Origins of Life, 6, 61 (1975).
174. Hollahan J. R., Bell A. T., in: Technics and developments in plasma che-
mistry (eds. J. R. Holland, A. T. Bell). John Wiley, New York, 1974.
175. Venugopalan M., in: Reactions under plasma conditions (ed. M. Venugopa-
lan). Vols. 1, 2, Wiley-Interscience, New York, 1971.
176. Blaustein B. D„ in: Chemical reactions in electrical discharges (ed.
B. D. Blaustein). ACS Publication, Washington D. C., 1969.
177. Lam D. R„ Baddour R. F., J. Macromol. Sci. Chem., A 10, 383 (1976).
178. Wightman J. P., Johnston N. J., Abstracts of Papers 153 Meeting ACS,
Miami Beach (1/66), 1967.
179. Vastola J. F., Wightman J. P., J. Appl. Chem., 14, 69 (1964).
180. Mignonac G., Miquel R., Lecouls H., Bull. Soc. Chem., 2161 (1966).
181. McTaggart F. R., австрал. пат., Appl., No 55010/59 (1959).
182. Yasuda H., Marsh H. C., Tsai T., J. Appl. Polym. Sci., 19, 2157 (1957).
183. Simionescu С. I., Asandei N., Denes F., Studii $i Cercet. Chim., 20, 363
(1972).
184. Simionescu С. I., Asandei N., Dines F., Sandulovici M., Popa Ch., Europ.
Polym. J., 5, 427 (1969).
185. Denes F., Ungurenasu C., Haiduc I., Europ. Polym. J., 6, 1155 (1970).
186. Simionescu С. I., Denes F., Cell. Chem. Technol., 14, 285 (1980).
187. Denes F., Percec V., Totolin M., Rennedy J. P., Polvmer Bull., 2, 499
(1980).
188. Prigogine I., An introduction to the thermodynamics of irreversible proces-
ses. Ch. C. Thomas, Springfield, 1955.
189. Oparin A. L, The origin of life on Earth. Academic Press, New York,
1957.
190. Oparin A. I., in: The origins of prebiological systems (ed. S. W. Eox),
Academic Press, New York, 1965, p. 331.
191. Simionescu С. I., Asandei N., Dines F., Compt. Rend. Acad. Sci. Paris,
213, 599 (1971).
192. Симионеску R. И., Денеш Ф., Маковяну M. — Докл. АН СССР, 1972,
т. 207, с. 469.
193. Simionescu С. Denes F., Macoveanu М., Biopolymers, 12, 237 (1973).
194. Simionescu С. L, Denes F. et al., Compt. Rend. Acad. Sci. Paris, 275, 703
(1972).
195. Simionescu С. I., Denes F., Onac D., Bloos G., Biopolymers, 13, 943
(1974).
196. Simionescu С. I., Denes F., Dragnea M., Compt. Rend. Acad. Sci. Paris,
Ser. C„ 278, 29 (1974).
197. Simionescu C. L, Negulescu I., Totolin M., Bloos G., in: Protein structure
and evolution (eds. J. L. Fox, Z. Deyl, A. Blajez). M. Dekker Inc., New
York, 1976, p. 185.
114
198. Simionescu С. I., Dines F., in: The origin of life (ed. Y. Wolman). D. Rei-
del Publishing Co., 1981, p. 255.
199. Simionescu С. I., Dines F., Cell. Chem. Technol., 14, 285 (1980).
200. Simionescu С. I., Dines F., Negulescu I., J. Polym. Sci., Polym. Syrup.,
64, 261 (1978).
201. Lowry О. H., Rosenbrough N. F., Farr A. L., Randall R. F., J. Biol. Chem.,
193,265 (1951).
202. Simionescu C. L, Dines F., in: The Second ISSOL Meeting and the Fifth
International Conference on the Origin of Life, Kyoto, Japan, April 5—10,
1977.
203. Simionescu C. L, Dines F., Totolin M., неопубликованные данные (1982).
204. Hodgson G, W., Hitchorn B., Taguchi K., Baker B. L., Peake E., Geochim.
Cosmochim. Acta, 32, 737 (1968).
205. Kvenvolden K. A., Hodgson G. Geochim. Cosmochim. Acta, 33, 1195
(1969).
206. Hodgson G, W., Bunnenberg E„ Halperin B., Peterson E., Kvenvolden K. A.,
Ponnamperuma C., in: Proc. Apollo 11 Lunar Sci. Conf. Vol. 2, 1970,
p. 1829.
207. Simionescu C. 1., Totolin M., Dines F., BioSystems, 8/3, 153 (1976).
208. Simionescu С. I., Dines F., Totolin Af.,'BioSystems, 13, 149 (1981).
209. Simionescu С. I., Dines F., Totolin M„ in: The origin of life (ed. Y. Wol-
man). D. Reidel Publishing Co., New York, 1981, p. 263.
210. Simionescu C., Dines F., Totolin M., Bioelectrochem. Bioenergetics, 9, 723
(1982).
211. Simionescu C. L, Dines F., Brandsch R., J. Polym. Sci., Polym. Symp., 61,
66 11979).
212. Simionescu C. L, Dines F„ Totolin M„ The nonrandom formation of some
lipid-like structures under cold conditions. BioSystems. В печати.
213. Ferris I. P„ Morimoto F. Y., Icarus, 48, 118 (1981).
214. Eigen M., Naturwiss., 58, 465 (1971).
Словарь терминов
Абиотический — процесс, явление или
вещество в отсутствие жизни.
Абсорбционные полосы в ИК-области
спектра — поглощение излучения в
инфракрасной области спектра, ха-
рактерное для каждой функцио-
нальной группы.
АДФ — аденозиндифосфат.
Активные частицы — энергетически
возбужденные молекулы или их
фрагменты (ионы, радикалы).
АМФ — адеиозинмонофосфат.
Амфифильные молекулы —> молекулы,
имеющие полярные и неполярные
части (например, молекулы детер-
гентов, липидные структуры н т. д.).
Архей — период времени, относящий-
ся к древнейшим образованиям
земной коры, в общем случае к
кристаллическим породам, возраст
которых свыше 2600 млн. лет.
АТФ — адеиозиитрифосфат.
Бластула—• эмбриональная стадия у
многоклеточных (например, Meta-
zoa); имеет глобулярную форму и
внутреннюю полость; клетки рас-
положены в один слой.
Буферный раствор — раствор, под-
держивающий постоянное значение
pH или других характеристик сре-
ды.
Витализм - идеалистическое направ-
ление в биологии, признающее на-
личие в живых организмах некой
«жизненной силы», якобы управля-
ющей жизненными явлениями.
Гель-фильтрация — аналитический ме-
тод разделения соединений с раз-
личными молекулярными массами,
в котором применяется наполни-
тель в состоянии геля (например,
полиакриламид, сефадекс и др).
Основан на различной способности
116
молекул проникать в поры неионо-
геиного геля.
Гетерополипептиды — полипептиды, в
которые в качестве составных ча-
стей входят различные аминокис-
лоты.
Гиперцикл — термин теории самоор-
ганизации материи, разработанной
лауреатом Нобелевской премии
М. Эйгеном
Денситометр — прибор для опреде-
ления оптической плотности или
прозрачности материалов (напри-
мер, экспонированных фотопленок,
прозрачных гелей с неоднородно
распределенными красителями и
т. д.).
Диамагнетики — вещества, намагни-
чивающиеся во внешнем магнитном
поле в направлении, портивополож-
ном напряженности поля. Будучи
свободно взвешенными, ориентиру-
ются под действием магнитного
поля перпендикулярно магнитному
меридиану (восток—запад). Тер-
мин предложен М. Фарадеем.
Диск-электрофорез — вариант метода
электрофореза, в котором вместо
бумаги в качестве носителя мигри-
рующего вещества используются
гели в форме цилиндрических ко-
лонок (например, полиакриламид).
Диссипация энергии — переход части
энергии упорядоченного процесса в
энергию неупорядоченного процесса
(например, рассеяние).
ДМФ — диметилформамид.
Дуговой разряд — электрический раз-
ряд между двумя электродами, го-
рящий при атмосферном или более
высоком давлении, сопровождаю-
щийся световым эффектом и имею-
щий высокую температуру.
ИК-спектроскопия — раздел молеку-
лярной и оптической спектроскопии,
изучающий поглощение н отраже-
ние в инфракрасной области.
Ионообмеиники (иониты) — природ-
ные или синтетические, органиче-
ские или неорганические вещества,
обладающие свойством обменивать
свои ионы на эквивалентное коли-
чество других ионов из раствора,
с которым оин контактируют.
Комплексы — сложные химические
структуры, образованные с по-
мощью координационных связей.
Конденсации реакция — процесс об-
разования новой химической связи,
сопровождающийся отщеплением
какой-либо органической или неор-
ганической молекулы, например
Н2О.
Крекинг — получение низкомолеку-
лярных фракций из нефти путем
фрагментации молекул под дейст-
вием высоких температур А. Сак-
сом предложено употреблять этот
термин для указании на частичное
разложение.
Лиофилизация — процесс сублимации
замороженной жидкости при низ-
кой температуре и низком давле-
нии.
Ловушка — сосуд для сбора летучих
продуктов прн низких температу-
рах.
Матрица •— основное вещество или
порода, в которую включен кри-
сталл, минерал нли ископаемое
Метафизика — противоположный ди-
алектике философский метод, от-
рицающий качественное развитие
бытия через противоречия Харак-
теризуется рассмотрением явлений,
предметов и процессов не в их вза-
имосвязи, а изолированно, абсолю-
тизацией некоторых сторон дейст-
вительности.
Метод замораживания — скалыва-
ния — способ подготовки проб для
электронной микроскопии. Процесс
состоит в быстром замораживании
проб прн очень низких температу-
рах, после чего следуют скалыва-
ние образца вдоль плоскостей наи-
меньшего сопротивления и покры-
тие его поверхности тонким слоем
металла.
МСК— метансульфокислота
CH3SO3H
Нуклеозиды — природные соедине-
ния, молекулы которых состоят из
остатка пуринового или пиримиди-
нового основания, связанного с ос-
татком рцбозы или 2'-дезокси-П-ри-
бозы.
Нуклеотиды — фосфорные эфиры ну-
клеозидов. Различают рибонуклео-
тиды, дезоксирибоиуклеотиды, а
также пуриновые и пиримидиновые
нуклеотиды.
Оледенение — процесс значительного
расширения ледников на Земле в
докембрийскую эру, пермский,
угольный и плейстоценовый пе-
риоды.
Олигомер •— соединение, занимающее
по значению молекулярной массы
йромежуточное место между моно-
мерами и полимерами.
Панспермия — теория о повсемест-
ном распространении во Вселенной
зародышей жизни, согласно кото-
рой жизнь занесена на Землю из
космоса
Парамагнетики — вещества, намаг-
ничивающиеся в магнитном поле по
направлению поля. Термин предло-
жен М. Фарадеем.
Парниковый эффект — явление на-
копления солнечной энергии в виде
тепла в системах, покрытых про-
зрачными материалами (стекло, по-
лимерная пленка и т. д.). Часть
солнечных лучей проникает через
эти материалы, поглощается твер-
дыми поверхностями и вновь излу-
чается на более длинных волнах,
для которых стекло нли полимер-
ная пленка непроницаемы
Пептидная связь — —СО—NH—.
Пик спектроскопический — максимум
поглощения или испускания в спек-
тре
Пикриновая кислота — 2,4,6-тринит-
рофенол HOC6H2(NO2)s
Пиримидиновые основания — при-
родные производные пиримидина,
входящие в состав нуклеиновых
кислот (цитозин, урацил, тимин)
Плазма — четвертое состояние мате-
рии, частично или полностью иони-
зованный газ, в котором плотности
положительных и отрицательных
зарядов практически одинаковы В
горячей плазме температура как
электронов, так и молекулярных
частиц очень высока. В холодной
117
плазме температура электронов по-
вышена, а температура молекуляр-
ных частиц сравнительно низка.
Поликонденсация — химический про-
цесс образования полимеров, сопро-
вождающийся выделением низко-
молекулярных веществ, например
Н2О, НС1 и др.
Полосы поглощения Соре и не-Соре —
специфические полосы поглощения
флуоресценции для порфириновых
структур.
Полупроводники — вещества, элек-
трическая проводимость которых
промежуточна между проводи-
мостью металлов и диэлектриков.
Порфирии — природный пигмент, мо-
лекула которого имеет цикличе-
скую тетрапиррольную структуру.
Протеиноиды — структуры, подобные
пептидам. Получаются при терми-
ческой конденсации безводных сме-
сей аминокислот (процесс, разра-
ботанный С. В. Фоксом).
Протобиополимеры — биологически
важные молекулярные соединения,
которые в процессе эволюции пред-
шествовали современным биополи-
мерам.
Протоклетка — клетка, которая в
процессе эволюции предшествовала
современной клетке.
Протопептиды — макромолекуляр-
ные структуры на основе аминокис-
лот, которые в процессе эволюции
предшествовали пептидам.
Протофермеиты — макромолекуляр-
ные соединения, обладающие свой-
ством ускорять химические про-
цессы в живых организмах (т. е.
биокаталитической активностью),
которые в процессе эволюции пред-
шествовали ферментам.
Протуберанец — плазменное образо-
вание в солнечной короне В дан-
ном тексте — образование, появив-
шееся после взрыва мембраны в
процессе покрытия препарата тон-
ким слоем металла в вакууме.
Пуриновые основания — природные
производные пурина, входящие в
состав нуклеиновых кислот (аде-
нин, гуанин, гипоксантин).
Радикалы свободные — реакционно-
способные органические частицы
(молекулярные фрагменты) с не-
спаренными электронами на внеш-
них атомных или молекулярных
орбиталях.
118
Расходомер, линейный по массе, —
прибор для определения расхода
газов (например, аммиака).
Рекомбинация — процесс образова-
ния химических связей путем обоб-
ществления двух неспареиных элек-
тронов, принадлежащих разным
частицам (радикалам, атомам).
Ретикулярный процесс — процесс, в
котором макромолекулярные цепи
связываются друг с другом и с
различными соединениями посред-
ством химических связей
Самопроизвольное зарождение —
теория о возникновении жизни из
неживой материи, существовавшая
до конца XIX в. В 1894 г. Пастер
показал, что экспериментальные
данные опровергают правильность
этой концепции.
Сефадекс — наполнитель колонки
для гелр-фильтрации, изготовлен-
ный на основе декстрана, выпускае-
мого фирмой Pharmacia-Uppsala
Швеция).
Сканирующая (растровая) электрон-
ная микроскопия — техника наб-
людения напыленных объектов при
помощи электронного пучка, пере-
мещаемого последовательно от точ-
ки к точке по всей поверхности об-
разца (тот же принцип лежит в
основе передачи изображения по
телевидению).
Тлеющий разряд — один из видов
стационарного электрического раз-
ряда в газах, который возбуждает-
ся при низких давлениях и низкой
температуре катода.
Трипсин — протеолитический фер-
мент класса гидролаз, вырабаты-
ваемый поджелудочной железой
млекопитающих.
УФ — ультрафиолетовая область
электромагнитного излучения.
Фазовообособлеиные микросистемы —
системы, отделенные от окружаю-
щей среды мембранами.
Флуоресценция — спонтанная люми-
несценция, испускание электромаг-
нитного излучения в виде света в
результате (и только во время)
поглощения световых квантов от
другого источника излучения
Фосфолипиды — компоненты клеточ-
ных мембран, несимметричные ди-
эфнры фосфорной кислоты:
СН,—OCORj
I
ROOC—СН ОН
I I
СН2—О—Р=О
Фотовозбуждение — переход электро-
нов с основных уровней на возбуж-
денные энергетические уровни под
действием электромагнитного из-
лучения.
Фотосинтез — использование прото-
плазмой растительных клеток све-
трвой энергии, происходящее при
участии пигмента хлорофилла и
Приводящее к синтезу органических
молекул из Н2О и СО2
Хемосорбция — поглощение газов
или веществ из разбавленных ра-
створов твердыми поверхностями,
сопровождающееся образованием
химических связей между адсорби-
рованными молекулами н твердым
телом.
Цитолиз — разрушение животных н
растительных клеток.
Цитоплазма — часть протоплазмы
животных н растительных клеток
вне (вокруг) ядра.
Эволюция химическая — совокуп-
ность химических процессов на
абиотической Земле, которая пред-
шествовала появлению первых жи-
вых организмов.
Элюат — раствор вещества в раст-
ворителе (или смесн растворите-
лей), вымываемого с бумаги или
геля в процессе хроматографии,
иначе говоря, раствор, содержащий
продукты хроматографического
анализа.
Элюент — растворитель (или смесь
растворителей), пропускаемый че-
рез носитель для вымывания про-
дуктов хроматографического ана-
лиза.
Эндоцитоз — поглощение твердых
частиц клетками посредством мем-
бранных процессов.
Энтальпия — функция состояния тер-
модинамической системы, вычисляе-
' мая как сумма внутренней энергии
вещества и произведения объема на
давление.
ЯМР-спектроскопия — спектроскопия
ядерного магнитного резонанса,
метод анализа сложных смесей н
исследования строения и реакци-
онной способности молекул, осно-
ванный на избирательном взаимо-
действии магнитной компоненты
радиочастотного электромагнитного
поля с системой ядерных магнит-
ных моментов вещества.
pH — логарифм концентрации ионов
водорода в растворе, взятый с об-
ратным знаком.
Тubtfex — пресноводный червь.
Содержание
От редакции......................... ........................... 5
Предисловие ................................................ 7
1. Современное состояние проблемы происхождения жизни.............. 9
1.1. Теории происхождения протобиополимеров...................... 15
1.1.1. Термическая теория................................... 15
1.1.2. Теория дегидратирующих агентов....................... 17
1.1.3. Теория адсорбции .................................... 18
1.1.4. Гибридная теория..................................... 20
1.2. Самосборка протобиополимеров. Возникновение структур ли-
пидного типа.................................................... 22
1.3. Развитие первичных энергетических процессов................ 25
1.4. Критические замечания о современных теориях................ 33
2. Низкотемпературная теория происхождения жизни................. 35
2.1. Условия иа первичной Земле по низкотемпературной теории . . 35
2.1.1. Первичная атмосфера.................................. 35
2.1.2. Температура и давление в околоземной среде........... 36
2.1.3. Источники свободной энергии.......................... 37
2.1.4. Открытые системы..................................... 39
2.1.5. Заключение........................................... 39
2.1.6. Экспериментальная лабораторная модель................ 40
2.2. Синтез протобиополимеров................................... 42
2.2.1. Синтез соединений полипептидного типа................ 42
2.2.1.1. Идентификация оснований нуклеиновых кислот . . 51
2.2.1.2. Идентификация структур порфиринового типа . . 53
2.2.2. Синтез структур полисахаридного типа................. 63
2.2.3. Синтез структур липидного типа....................... 69
2.3. Синтез протомембран........................................ 76
2.3.1. Водная фаза.......................................... 79
2.3.2. Хлороформная фаза.................................... 82
2.3.3. Интерфаза ........................................... 89
2.4. Самосборка протобиополимеров и свойства микросистем ... 95
2.5. Заключение................................................ 108
Литература....................................................... 110
Словарь терминов.................................................
116