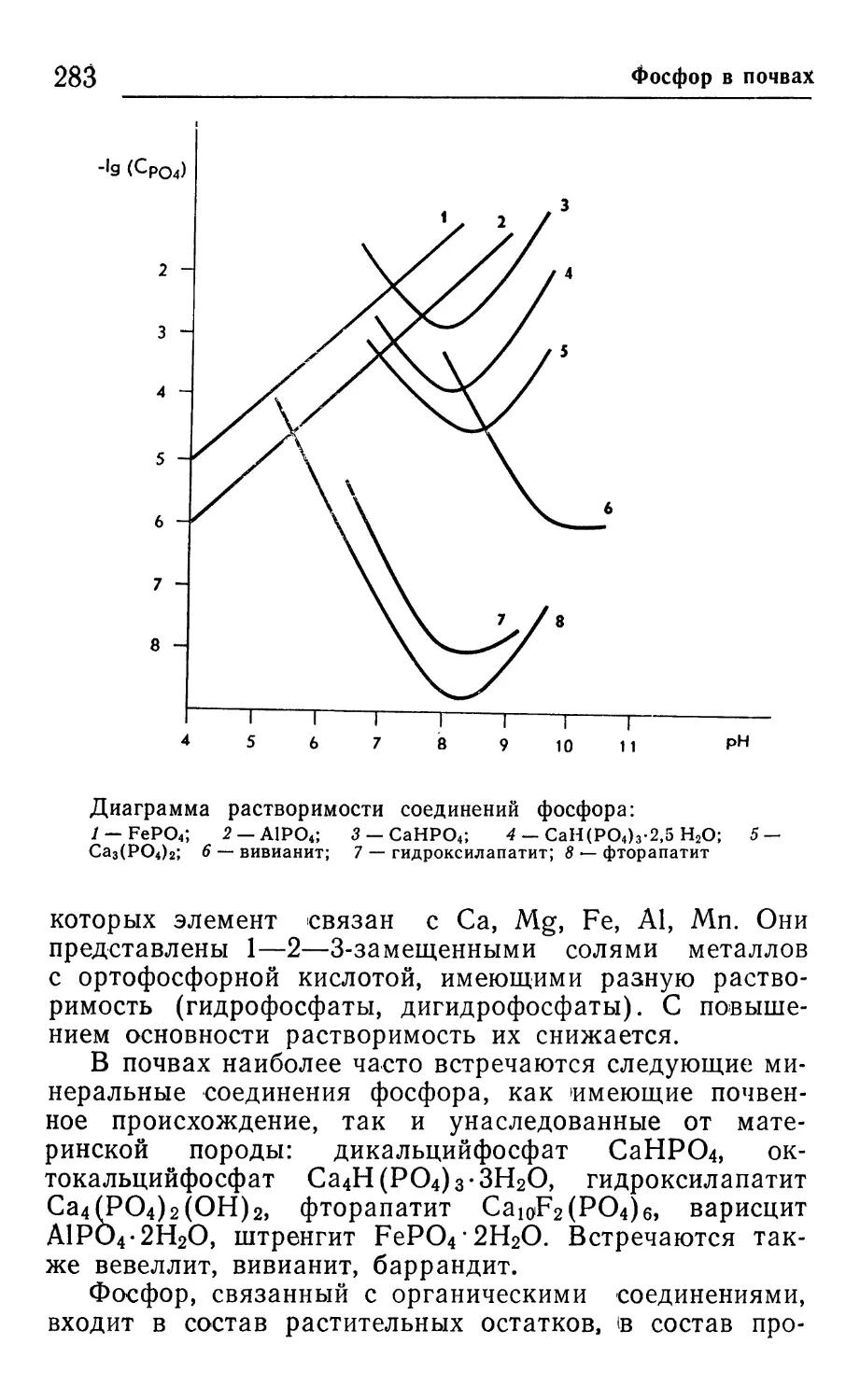
Author: Соколова Т.А. Орлов Д.С. Малинина М.С. Мотузова Г.В. Садовникова Л.К. Лейкина Ю.М.
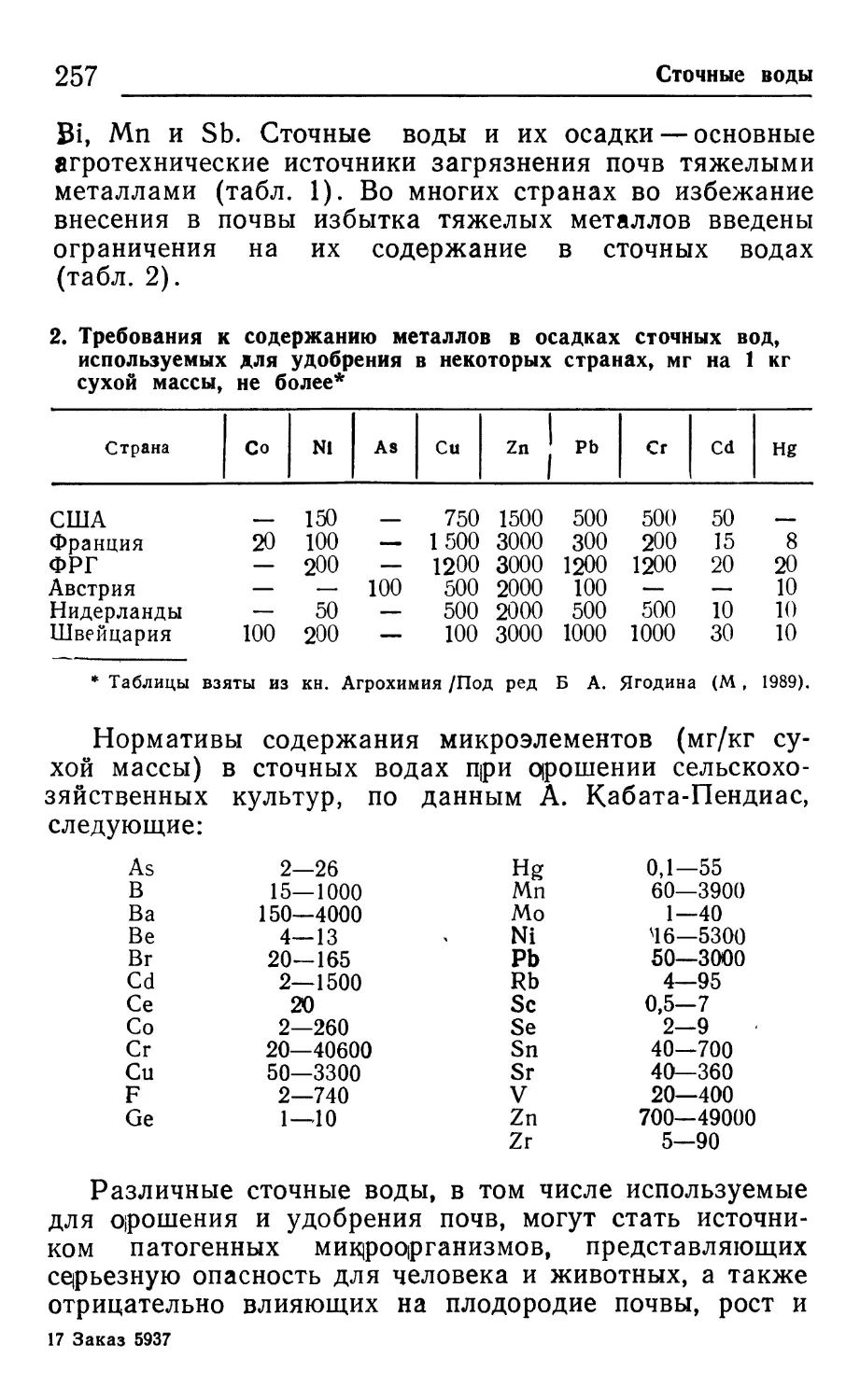
Tags: почвоведение почвенные исследования природа охрана окружающей среды почвы сельское хозяйство агропромиздат
ISBN: 5—10—002334—1
Year: 1991
ИМЯ
о
шш
■а?»
I
-О
<
О
U
ХИМИЧЕСКОЕ
ЗАГРЯЗНЕНИЕ
ПОЧВ
И ИХ ОХРАНА
л*»
/№S
W
'ШЧШа
^ I ХИМИЧЕСКОЕ
i ЗАГРЯЗНЕНИЕ
s почв
" ! И ИХ ОХРАНА
<
О
I—
J
МОСКВА ВО «АГРОПРОМИЗДАТ» 1991
ББК 40.3
Х46
УДК 631.4:502.65(035)
Авторы: Д. С. Орлов, М. С. Малинина, Г. В. Моту-
зова, Л. К. Садовникова, Т. А. Соколова
Редактор Ю. М. Лейкина
Химическое загрязнение почв и их охрана: Сло-
Х46 варь-справочник/Д. С. Орлов, М. С. Малинина,
Г. В. Мотузова и др. — М.: Агропромиздат, 1991,
303 с: ил.
ISBN 5—10—002334—1
Даны определения понятий и краткие справочные
сведения по проблемам охраны почв от химического загрязнения,
химической мелиорации, экологии. Приведены
количественные параметры содержания химических загрязняющих
веществ в почве и понятия, связанные с почвенным
мониторингом Рассмотрены унифицированные термины, используемые
в почвоведении и агрохимии, знание которых важно при
решении экологических проблем
Для почвоведов, агрохимиков и других специалистов АПК.
3702040000—158
X -— 143-91 ББК 40.3
035(01)—91
ISBN 5—10—002334—1 © Коллектив авторов, 1991
ПРЕДИСЛОВИЕ
Во второй половине XX века объемы и темпы техногенного
загрязнения окружающей среды настолько возросли, что
потребовалось принятие специальных международных программ по охране
природы. В 1972 г. была разработана программа ООН по
окружающей среде, включающая проблемы мониторинга природной
среды в целях раннего предупреждения о наступающих естественных
или антропогенных изменениях, которые могут причинить вред
здоровью или благополучию людей.
В СССР создана общегосударственная система наблюдений и
контроля за состоянием и уровнем загрязнения природной среды.
Если в области контроля и охраны атмосферного воздуха и
природных вод имеются определенные достижения, в том числе
создана сеть специальных лабораторий, разработаны методы
анализа и предельно допустимые концентрации для довольно
большого числа веществ и элементов, то в области мониторинга и охраны
почв успехи пока весьма незначительные. Между тем именно
почвенный покров в конечном итоге принимает на себя давление
потока промышленных и коммунальных выбросов и отходов,
выполняя важнейшую роль буфера и детоксиканта Почва аккумулирует
тяжелые металлы, пестициды, углеводороды, детергенты, другие
химические загрязняющие вещества, предупреждая тем самым их
поступление в природные воды и очищая от них атмосферный
воздух. В почве многие химические загрязняющие вещества
претерпевают глубокие изменения. Углеводороды, пестициды, детергенты
и другие соединения, с одной стороны, могут быть минерализованы
или трансформированы в вещества, не оказывающие токсичного
воздействия на микроорганизмы, растения, животных и человека.
С другой стороны, эти же вещества или их производные, а также
тяжелые металлы, фтор, оксиды азота и серы в первоначальном или
преобразованном виде интенсивно связываются минеральными и
органическими веществами почвы, что резко снижает их доступность
растениям и соответственно общий уровень токсичности.
Предисловие 4
Наибольшей буферной емкостью и способностью снижать
негативное влияние загрязняющих веществ на растительные и
животные организмы обладают почвы с высоким содержанием
гумуса, с тяжелым гранулометрическим составом, высокой емкостью
поглощения, обогащенные известковыми материалами (карбонатами).
К таким почвам относятся, прежде всего, наиболее плодородные
черноземы, некоторые рендзины, пойменные земли. Это придает
почвам естественную устойчивость к воздействию химических
загрязняющих веществ различного происхождения и позволяет получать
высокие и качественно полноценные урожаи важнейших
сельскохозяйственных культур даже в промышленно развитых регионах.
К сожалению, природная сопротивляемость почв, их
естественная буферность не беспредельны. Согласно подсчетам Б. Г.
Розанова и других ученых, по разным причинам в мире было потеряно
около 2 млрд га сельскохозяйственных почв. Потери земель,
вызванные только ирригацией, за последние 300 лет составили около
100 млн га, и примерно такая же площадь сейчас занята почвами
с пониженной продуктивностью вследствие засоления. Очень
велики потери гумуса, от которого зависят практически все важнейшие
свойства почв и их устойчивость к неблагоприятным ситуациям.
По-видимому, за период земледельческой культуры почвенный
покров утратил до 15 % исходного запаса органических веществ.
Причем эти негативные явления особенно быстро протекают в
последние десятилетия. Так, скорость потерь гумуса за последние
50 лет примерно в 2,5 раза превысила таковую на протяжении
последних 300 лет, а среднеисторическую скорость потерь гумуса —
примерно в 24 раза.
Особенно сильное техногенное давление испытывают почвы в
районах расположения крупных промышленных предприятий,
больших городов, транспортных артерий. Нередким стало образование
техногенных пустынь на территориях, непосредственно
примыкающих к промышленным зонам различных предприятий, особенно
химической и металлургической промышленности. В ближайшей к
предприятию зоне содержание тяжелых металлов часто значительно
превышает предельно допустимые концентрации; вследствие
суммарного воздействия кислотных дождей и выпадений тяжелых
металлов гибнет растительность, поверхность почвы обнажается; не
защищенная растительным покровом почва подвергается усиленной
эрозии и дефляции, почвенный покров разрушается практически
необратимо, и его восстановление требует уже очень крупных
материальных и трудовых з трат.
При характеристике почв очень трудно использовать широка
5 Предисловие
применяемые при оценке воды, воздуха, продуктов питания и
кормов понятия, например предельно допустимые концентрации тех
или иных загрязняющих веществ. В числе главных причин —
многообразие форм соединений любых элементов и веществ в почвах,
от которых зависит доступность этих компонентов растениям и,
следовательно, их возможный токсический эффект. Поэтому при
разработке принципов и организации почвенно-химического
мониторинга приходится учитывать состав почвы, все ее составляющие,
обладающие высокой сорбционной способностью, влияние условий
на подвижность и доступность химических веществ растениям.
Наиболее значительное влияние оказывают кислотность и щелочность
почв, окислительно-восстановительный режим, содержание гумуса,
легкорастворимые соли.
Кроме того, даже незагрязненные почвы нередко содержат
считающиеся токсичными ионы или соединения. В кислых почвах
токсичных уровней может достигать содержание ионов алюминия и
марганца, а в районах рудопроявления повышенные концентрации
нередки и для многих тяжелых металлов, в том числе для ртути
и др.
Сопротивляемость почв химическому загрязнению также
зависит от упомянутых выше факторов и условий, но не меньшее
значение во многих случаях имеют водный режим, водопроницаемость,
преобладание нисходящих или восходящих токов влаги и т. п. Эти
показатели, наряду с уровнем сорбционной способности почв,
отражаются на защитных функциях почвы по отношению к гидросфере
и атмосфере, влияют на прогрессирующее накопление в почвах
химических загрязняющих веществ.
Рассматривая проблемы загрязнения, мониторинга и охраны
почв, следует остановиться на негативных последствиях применения
органических и минеральных удобрений, различных мелиорирующих
средств. Простейший случай негативных последствий такого рода
связан с уровнем содержания в удобрениях и мелиорантах тяжелых
металлов, фторидов, других химических загрязняющих веществ.
Специальными исследованиями было показано, что в некоторых
регионах опасность загрязнения почв, вод, растений вследствие
химизации земледелия может быть значительно более высокой, чем
загрязнение за счет выбросов промышленных предприятий.
Отмеченные общие закономерности и особенности положены в
основу настоящего словаря-справочника. Все термины и понятия
словаря условно можно объединить в пять групп.
Первая группа включает общие понятия, характеризующие в
целом почвы и ландшафты, соотношения различных компонентов
Предисловие 6
ландшафта, необходимые научные дисциплины и наиболее общие
свойства почвы как природного тела.
Вторая группа освещает характеристики различных химических
элементов и веществ, представляющих наибольшую опасность с
точки зрения загрязнения почв, негативно влияющих на свойства
почв, развитие растений и их пищевую ценность.
Третья группа понятий включает описания важнейших свойств
почв, которые влияют на их устойчивость к химическому
загрязнению, на превращения в почве загрязняющих веществ и
доступность их для растений в природных био- и агробиоценозах.
Четвертая группа объединяет понятия предельно допустимых
концентраций, а также принципы и методы контроля за состоянием
почв и методы ранней диагностики химического загрязнения.
Пятая группа охватывает важнейшие понятия, относящиеся к
приемам химической мелиорации почв, причем эти приемы для
условий химического загрязнения почв разработаны еще далеко не
достаточно.
Понятия и термины словаря-справочника расположены в
алфавитном порядке.
А
АБИОТИЧЕСКАЯ СРЕДА (от греч. а —
отрицательная частица, bios — жизнь). Совокупность условий
неорганической среды, влияющих на живые организмы.
Живые и косные (абиотические) компоненты связаны
между собой в биогеоценозе (см.) обменом веществ и
энергии. Влияние абиотической среды на живое вещество
происходит химическим путем — через химический
состав атмосферы, почвы, природных вод, дойных
отложений и физическим (или климатическим) путем 4qpe3
такие показатели климатических условий, как
температура, осадки, BeTqp, давление атмосферы, строение
земной поверхности (рельеф).
АГРОЛЕСОМЕЛИОРАЦИЯ. Система лесоводствен-
ных м9роприятий, направленных на борьбу с
неблагоприятными природными условиями, препятствующими
получению высоких и устойчивых урожаев, а также
научная дисциплина, разрабатывающая теоретические
основы, организационные формы и технику
лесомелиоративных работ. Агролесомелиорация тесно связана с
агрономией, почвоведением, ботаникой, геологией,
метеорологией и базируется на многих лесоводственных
науках. В России научные основы агролесомелиорации
заложены экспедицией В. В. Докучаева в Каменную степь
(1892 г.).
В целях агролесомелиорации создают защитные
лесные насаждения. Они уменьшают скорость и
турбулентность ветров на полях, улучшают микроклимат,
способствуют перераспределению влаги, снегозадержанию, в
аридных районах сокращают непродуктивные noTqpn
воды с полей, защищают от пыльных бурь и суховеев,
а также уменьшают поверхностный сток и эрозионные
процессы, выполняют многие другие функции.
Например, свойства солонцов и солонцеватых почв в условиях
полупустыни улучшаются под действием некоторых
древесных пород — тамарикса, лоха, скумпии, желтой ака-
Агролесомелиорация 8
ции, клена татарского, клена ясенелистного. На
улучшенных таким образом почвах солонцового комплекса
затем удаляют мелиорирующие посадки, а территорию
используют для сельскохозяйственных культур и
посадок защитных лесных полос.
Основная функция защитных лесных полос —
перераспределение поверхностного стока и влаги. В
большинстве лесов почва покрыта слоем лесной подстилки,
которая выполняет две функции: поглощает часть
осадков; создает благоприятные условия для инфильтрации
в почву основного количества осадков. Почва, покрытая
подстилкой, значительно более водопроницаема, чем без
подстилки.
Лесные полосы играют большую роль при защите
почвенного и растительного покрова от техногенного и
сельскохозяйственного загрязнения (см. Загрязнение
сельскохозяйственное).
Так, для уменьшения загрязнения почв и
растительности от пылевых и дымовых выбросов предприятий,
особенно в зонах полного разрушения экосистемы
(см.)—5—6 км от предприятия — рекомендуют
начинать рекультивацию (см. Рекультивация почв) посевом
пырейника (волоснеца) песчаного, выдерживающего
самые сильные загрязнения.
В следующей по степени загрязнения зоне — 6—
20 км от промышленного предприятия — проводят
рекультивацию посадкой лиственных кустарников и
деревьев (ива, осина, ольха), устойчивых к загрязнению.
Способность некоторых видов древесных и
травянистых растений к концентрированию больших количеств
тяжелых металлов, серы и других загрязняющих
веществ, используют для агролесо-, агрофитомелиорации
и рекультивации загрязненных территорий. Среди таких
растений — концентраторов различных химических
загрязняющих веществ — можно назвать тамарикс —
устойчив к дымогазовым выбросам и способен
накапливать в листьях большое количество серы (более 3%),
лох узколистный — аккумулирует цинк (0,8—0,9%). По
способности концентрировать свинец выделяется
молочай прутьевидный, цинк — пырей ползучий. Эти
растения выполняют роль биогеохимического барьера на
пути миграции токсичных загрязняющих веществ (см.) в
9 Агролесомелиорация
экосистеме и способствуют оздоровлению окружающей
среды.
Для защиты сельскохозяйственных угодий от
выхлопных газов автомобилей вблизи крупных автострад
с интенсивным движением эффективно создавать
растительные защитные полосы шириной 10—30 м (в
зависимости от интенсивности движения и направления
господствующих ветров). Обычно лесозащитные полосы
создают из устойчивых к загрязнению, экологически
пластичных видов растений. Каждая защитная полоса
представляет собой сочетание трех параллельных кулис,
составленных различными растительными
сообществами (биоморфами): первая (от дороги) формируется
травянистыми растениями, вторая — кустарниками,
третья — деревьями (табл.).
Степень устойчивости растений Нечерноземной зоны по отношению
к загрязняющим веществам
Биоморфы
Устойчивые
СреДнеустойчивые
Неустойчивые
(чувствительные)
Деревья Вяз обыкновенный, Липа мелколистная, Береза боро-
рслен американский клен (татарский, ост- давчатая, ясень
ролистный), тополь
(серебристый, черный,
бальзамический)
Кустар- Бересклет европей- Сирень обыкновенная, Пузыреплодник
ники ский, лох серебри- кизильник блестящий, калинолистный,
стый, ива (козья, карагана, бузина рябина обыкно-
белая, голубая) красная, боярышник, венная, роза
смородина, ольха морщинистая,
черная жимолость
татарская
Травы Овсяница (луго- Алиссум фиолетовый, Тимофеевка,
вая, овечья, крас- гречиха сахалинская кострец
ная), мятлик, ежа
сборная, вьюнок,
василек синий
Многие специалисты предлагают создание на
водосборах сельскохозяйственных угодий
агролесомелиоративных систем, состоящих из комплекса
водорегулирующих и противоэрозионных полос на склонах, прибалоч-
ных и балочных лесных полос и насаждений. Эти
лесные полосы и насаждения должны быть спроектирова-
Агроценоз 10
ны и построены с учетом характера рельефа так,
чтобы мелиоративное влияние соседних по склону полос
полностью перекрывало межполосные участки. Таким
образом создается зона сплошной мелиоративной
обстановки, и система вступает в режим стационарного
функционирования.
Установлено, что лесные полосы даже небольшой
ширины (около 10—25 м) не только практически коль-
матируют твердые взвеси, но и существенно снижают
концентрации растворенных удобрений и гербицидов,
поглощая от 50 до 95 % выносимых с полей химических
средств. Поглощение происходит как за счет сорбции
химических загрязняющих веществ органическим
веществом лесных подстилок, так и за счет перевода
значительной части поверхностного стока во внутрипочвен-
ный и грунтовый стоки (Сысуев, 1988). В лесной
подстилке и гумусовом горизонте в основном происходят
процессы частичной трансформации соединений тяжелых
металлов (см.) и других загрязняющих веществ.
Формирование органо-минеральных соединений повышает
миграционные способности металлов, в то же время
снижая их токсичность.
Мощным биогеохимическим барьером на пути
миграции загрязняющих веществ могут служить и
низинные болота. Поэтому наряду с системой
агролесомелиорации на водосборах нужно тщательно сохранять и
даже искусственно создавать подобие низинных болот,
особенно на поймах и террасах речных долин.
АГРОЦЕНОЗ (агро'биопеноз). Основу его
составляют искусственно созданные биотические сообщества.
Агробиогеоценоз представляет собой
совокупность агрофитоценоза и гетеротрофной биоты (см.) в
пределах однородного участка. Это биогеоценоз (см.) с
разрушенными обратными связями, существующий
благодаря целенаправленной деятельности человека.
Агробиоценозы по сравнению с естественными
биоценозами, характерными для того же региона, как
правило, обеднены видами живых организмов. Как
экологические системы агробиоценозы, вследствие нарушения
обратных связей, неустойчивы. Без поддержки
человеком агробиоценозы быстро распадаются, трансформи-
J1 АгроценоЗ
руясь в естественные биоценозы: например, мeлиqpи-
руемые земли — в болота, лесные насаждения — в лес.
Агрофитоценоз — пашенное сообщество, но не
конкретный посев, а ротация культур в севообороте в
пределах однородного участка. Состав агрофитоценоза
контролируется и определяется человеком. Совместно с
прочими компонентами биоты агрофитоценозы
составляют а1робиоценоз.
По степени и характеру воздействия человека
различают алрофитоценозы:
окультуренные — естественные фитоценозы,
измененные в результате интенсивного использования
(планомерно эксплуатируемые луга, пастбища);
полукультурные — искусственные посевы и
насаждения, планомерно и постоянно регулируемые человеком
(сеяные, многолетние луга);
культурные — искусственные посевы и насаждения,
планомерно и постоянно регулируемые человеком
(полевые и овощные культуры, многолетние насаждения);
интенсивные культурные — сообщества,-для которых
создают и постоянно регулируют особые почвенные,
водные и воздушные условия произрастания (парниковые
и рранжерейные; аэропоника, гидропоника).
При замене природных биогеоценозов а1робиоцено-
зами происходят значительные изменения в
биологическом круговороте веществ. Так, вовлечение главных био-
фильных элементов в биологический круговорот после
распашки TeppHTqpnfi по сравнению с исходным
состоянием, по данным Т. И. Евдокимовой, в qpeAHeM
возросло в лесной зоне на 17%, а в степной—почти в
3 раза. Одновременно вынос этих элементов в
геологический круговорот возрос соответственно в 2 и 10 раз.
Минеральные удобрения и пестициды, применяемые
человеком в атробиоценозах в количествах, не
сбалансированных с потреблением сельскохозяйственными
растениями, служат источником загрязнения почв,
растительности, а также почвенных и грунтовых вод,
естественных водоемов, рек и т. д.
Большинство пестицидов потенциально токсичны для
человека, животных, а также для многих компонентов
агробиоценоза (почвенная биота, гидробионты и т. д.).
Только часть применяемого количества этих химиче-
Агроценоз 12
ских средств действует целенаправленно, другая —
большая часть — остается в окружающей среде.
Особенно опасны хлорароматические, устойчивые, трудно-
разлагаемые пестициды — приоритетные загрязняющие
вещества (см. Загрязняющее почву приоритетное
вещество). К ним относятся пестициды (ДДТ, линдан), а
также производные хлорфенолоксикарбоновых кислот
и др. Кроме высокой токсичности для человека и
животных и устойчивости к разложению в разных средах
они способны к миграции, накоплению в отдельных
органах и тканях животных, населяющих биоценоз.
Наиболее радикальная стратегия для ограничения
использования пестицидов — широкое использование
биологических методов борьбы с вредителями.
Применение избыточных количеств минеральных
удобрений в а^рофитоценозе имеет несколько аспектов.
1. Длительное внесение удобрений изменяет
свойства самих почв. Использование физиологически кислых
удобрений в гумидных регионах способствует
уменьшению содержания гумуса, увеличению кислотности почв.
2. Большое количество азота и фосфора с noBqpx-
ностным, внутрипочвенным стоком удаляется с
поверхности почвы и поступает в гидрографическую сеть,
вызывая эвтрофикацию водоемов (см.) и загрязнение вод
нитратами (см. Азот в почвах).
3. Избыточное количество азота в виде нитратов
и других макроэлементов поступает в
сельскохозяйственную продукцию, что приводит при дальнейшем
продвижении по пищевой цепи к токсичности для человека
и сельскохозяйственных животных.
4. Минеральные удобрения служат источником
загрязнения (см.) почв и сельскохозяйственной продукции
тяжелыми металлами (см.) и другими токсичными
элементами.
5. Удобрения могут изменять подвижность тяжелых
металлов в почве и, следовательно, доступность их
растениям, а также усиливать их миграцию в
гидрографическую сеть.
Состояние агробиоценоза можно улучшить
следующими приемами: использованием полного комплекса
мероприятий полезащитной агротехники с применением
искусственных и естественных структурообразователей
13 Азот в почвах
почв, полезащитных севооборотов и севооборотов с
полосным размещением культур, совершенствованием
форм химических средств с применением капсулирован-
ных удобрений и замедлителей растворения,
оптимизацией доз и qpoKOB внесения удобрения и др.
АГРОФИТОЦЕНОЛОГИЯ (от греч. agros — поле,
phyto — растения, Koinos — общий). Наука об агрофи-
тоценозах (см. Агроценоз).
Основная и конечная задача агрофитоценологии—
оптимизация состава агрофитоценозов и на этой основе
экологическая оптимизация ландшафтов. Агрофитоце-
нология — составная часть агроэкологии (см.) Агрофи-
тоценология также занимается проблемой изучения
взаимодействия культурных и сорных компонентов аг-
рофитоценоза, проблемами снижения почвенного
плодородия из-за длительного бессменного выращивания
монокультур и накопления в почве токсинов и патогенов
микроорганизмов (Миркин и др., 1989).
АГРОЭКОЛОГИЯ. Наука об агроэконосистемах (см,
Агроэкосистема).
АГРОЭКОСИСТЕМА. Естественная экосистема (см.),
в которой применяется сельскохозяйственная
деятельность, или совокупность биогенных и абиогенных
компонентов участка суши, используемого для
производства сельскохозяйственной продукции. Часто под агроэко-
системой понимается взаимосвязанная (экономически,
энергетически и экологически) система в масштабе
одного крупного хозяйства.
Изучение агроэкосистем и познание всей
совокупности взаимосвязей будут способствовать
рациональному использованию природных ресурсов, в том числе
почв. В результате изучения агроэкосистем возможно
разделение пахотных почв на экологические катещрии,
для каждой из которых может быть создан агрофито-
ценоз (см. Агроценоз) определенного типа (Миркин
и др., 1989).
АЗОТ В ПОЧВАХ. Находящиеся в почвах
устойчивые соединения азота представлены формами с
валентностями + 3 и +5. Биофильность азота сравнима с био-
фильностью углерода (см. Биофильность элемента).
В настоящее время антропогенез существенно
нарушил естественные процессы биологической фиксации и
Азот в почвах
14
миграции азота, хотя природные источники в
значительно большей степени определяют размеры поступления
азота по сравнению с техногенными — в соотношении
порядка 2:1.
По данным В. А. Ковды, размеры ежегодного
биогенного и техногенного поступления азота в биосферу
составляют, млн. т:
Биогенные источники
Бобовые
сельскохозяйственные культуры
Рис
Другие культуры
Луга и пастбища
Леса
Пустоши
Всего на суше
В морях
Всего
35
4
5
45
40
10
139
36
175
Небиогенные источники
Электрические разряды в
атмосфере
Сжигание ископаемого
топлива
Промышленный синтез:
удобрения
другие продукты
Всего
10
20
55
10
95
Соотношение различных соединений азота в
контрастных по генезису почвах довольно постоянное
(табл.). Во всех трех типах почв преобладают негид-
ролизуемые формы азота, причем в черноземе они
составляют около 40—45 % всего запаса азота, в
сероземе— около 40, в дерново-подзолистой почве —
примерно 30%, Такое соотношение обусловлено повышенной
биологической активностью чернозема и серозема, в
которых происходит преимущественное разложение
лабильных соединений и накопление более устойчивых не-
гидролизуемых форм.
Содержание соединений азота в почвах разного генезиса (в слое
0—(20 см), кг/га
Формы азота
Дерново-подзолистая почва
Типичный
чернозем
Серозем
Весь азот
Азот аминогрупп
Аммонийный азот
Азот аминосахаров
Негидролизуемый азот
3560
426
500
400
1080
9890
1010
1040
670
4340
3420
400
650
220
1400
Влияние антропогенного воздействия на
сложившиеся природные циклы азота выражается в новом
промышленном механизме фиксации азота — в виде азот-
15 Азот в почвах
ных удобрений и поступления оксидов этого элемента
при сжигании различных видов топлива. Техногенные
источники соединений азота в биосфере, как
установлено В. А. Ковдой, удваиваются каждые 6—7 лет. В
современную эпоху заметно усилился процесс обогащения
окружающей qpejiu соединениями азота (или, по
В. А. Ковде, процесс «техногенной азотизации
окружающей рреды»), который сопровождается сложным
комплексом положительных (рост урожая, увеличение доли
белка) и отрицательных (повышение почвенной
кислотности, возникновение различных заболеваний человека и
животных) явлений. О значительном загрязнении
соединениями азота свидетельствует повышение уровня
концентрации нитратов в природных водах в 2—4 раза и
более.
Превращение естественного биологического цикла
азота в агрогеохимический в идеале должно приводить
к улучшению азотного режима разных компонентов
сельскохозяйственных ландшафтов, а продуктивность
таких ландшафтов должна увеличиваться. Негативный
момент в этом процессе — повышение концентраций
аммонийного и нитратного азота до токсичных уровней,
что проявляется в развитии специфических заболеваний
типа метгемоглобинемии либо массовых отравлений
животных и людей.
Если происходит взаимодействие нитритов и аминов
в организме, то образуются нитрозамины,
являющиеся канцерогенами, а также веществами,
способными вызывать нарушения хромосомного аппарата и
наследственные уродства. Опасен с экологической точки
зрения процесс эвтрофикации, или возрастания
концентрации питательных веществ в поверхностных
водах (см. Эвтрофикация водоемов). Естественно,
природные процессы в условиях антропогенеза протекают
более интенсивно за счет бытовых, промышленных,
животноводческих отходов и применения удобрений.
Предельно допустимые количества (ПДК) нитратов
для человека, по рекомендации ФАО, не должны
превышать 500 мг N — N03~ в сутки. Всемирная
организация здравоохранения (ВОЗ) допускает содержание
нитратов в продуктах до 300 мг на 1 кг сырого вещества.
Значительное количество нитратов способньд накапли-
Аккумуляция в почве биологическая 16
вать некоторые виды растений семейств амарантовые,
мятликовые (злаковые), пасленовые.
Большую проблему в настоящее время представляет
уменьшение толщины озонового слоя ат-
MOC(j)qpbi земли. На этот процесс могут оказывать
влияние неполные оксиды азота, вступающие в реакцию
окисления от N0 до N02 и N03, использующие кислород
озонового слоя.
Таким образом, избыточное вовлечение соединений
азота в биосферу весьма опасно. Чтобы снизить
негативные последствия, целесообразно использовать
совместное внесение органических и минеральных
удобрений, а баланс азота регулировать точным выбором
удобрений, времени и способа их внесения.
Для защиты окружающей среды от избытка
соединений азота необходимо:
уменьшать нормы минеральных удобрений (до 100—
120 кг/га) при одновременном увеличении доли
органических (навоз, зеленые удобрения);
запрещать внесение удобрений по снегу, с
самолетов;
разрабатывать формы азотных удобрений с
небольшой скоростью растворения;
рационально использовать жидкие органические,
удобрения; запрещать сброс отходов животноводства в
окружающую яреду.
АККУМУЛЯЦИЯ В ПОЧВЕ БИОЛОГИЧЕСКАЯ.
Накопление в почве органических, органо-минераль-
ных и минеральных веществ в результате
жизнедеятельности растений, почвенной микрофлоры и фауны.
АККУМУЛЯЦИЯ В ПОЧВЕ ХИМИЧЕСКИХ
ЗАГРЯЗНЯЮЩИХ ВЕЩЕСТВ. Накопление в почве
химических загрязняющих веществ в результате
техногенного загрязнения (см. Загрязняющее почву химическое
вещество).
АКТИВНОСТЬ ИОНОВ В ПОЧВАХ. Активность
ионов и солей служит мерой их реального участия в
химических реакциях. Понятие активности введено
Г. Льюисом для того, чтобы к реальным растворам
можно было применять законы идеальных систем. Для
почвенных условий использование понятия активности
становится особенно необходимым, поскольку отклоне-
17 Активность ионов в почвах
ния от идеальных систем осложняются гетерогенностью
и многофазностью почвы. Активность может быть
определена через химический потенциал
компонента:
\а =\ii)+RT\nai,
где jLii — химический потенциал 1-го компонента в системе; ji° —
то же в условно выбранном стандартном состоянии; R — газовая
постоянная; Т — абсолютная температура; а* — активность /-го
компонента.
Активности различных компонентов почвенного
раствора можно измерить непосредственно в почве или
вытяжках с помощью ионселективных электродов или
рассчитать, если известны концентрация компонента и
ионная сила раствора.
а = Суу
где С — концентрация и у— коэффициент активности компонента.
Трудность решения заключается в том, что
теоретически возможно найти активность (коэффициент
активности) только соли, а не отдельного иона.
Расчетные методы определения активности солей
основаны на формуле Дебая— Хюккеля для вычисления
коэффициента активности:
Az+z-iT
Ь Y \+a°BiI
где у± — коэффициент активности соли; Л, В и Ь — постоянные;
z+ и z~ — заряды ионов, на которые диссоциирует соль; а0 —
среднее расстояние сближения ионов в растворе; / — ионная сила
раствора (см. Ионная сила почвенного раствора).
Для одного иона уравнение Дебая — Хюккеля
используют в упрощенном виде. Трудности расчетного
метода связаны с необходимостью определения полного
состава почвенного раствора. Некоторые из
компонентов, например растворимые гумусовые вещества,
фактически учесть не удается, и поэтому расчеты имеют
приближенный характер. Опыт показывает, что xqpo-
шее совпадение расчетных и экспериментально
найденных активностей наблюдается в почвах, сравнительно
богатых легкорастворимыми солями и слабогумусиро-
ванных. Наибольшие расхождения обнаруживаются для
верхних гумусовых (или пахотных) горизонтов.
Активность почв биологическая 18
Для отдельных типов солей величины ионной силы
легко найти, пользуясь простыми пропорциями. Для
солей типа NaCl ионная сила равна молярной
концентрации— / = М, для солей типа СаС12 и Na2S04 — /=ЗМ,
для солей типа CaS04 — /=4М, для Na4P207 — /=10М.
В сильно разбавленных растворах активности ионов
и солей практически не отличаются от концентраций.
По мере нарастания концентрации коэффициенты
активности уменьшаются, и активность становится
меньше концентрации, однако при дальнейшем увеличении
концентрации коэффициенты активности снова
увеличиваются, приближаются к единице и затем даже
превышают ее. В результате активность иона или соли в
концентрированных растворах может оказаться намного
выше концентрации (например, NaOH, СаС12).
Приближенные значения коэффициентов активности важнейших
солей, встречающихся в почвах, при различной ионной силе
почвенных растворов
Ионная сила
Коэффициенты активности ионов
однозарядных
двухзаряДных
трехзарядных
четырех-
зарядных
МО-4 0,99 0,95 0,90 0,83
5-Ю-4 0,97 0,90 0,80 0,67
1 Ю-3 0,96 0,86 0,73 0,56
5-Ю-3 0,92 0,72 0,61 0,30
ЫО-2 0,89 0,63 0,39 0,19
5.10-2 0,81 0,44 0,15 0,04
0,1 0,78 0,33 — —
0,2 0,70 _ _ _
0,5 0,62 — — —
АКТИВНОСТЬ ПОЧВ БИОЛОГИЧЕСКАЯ.
Свойство почвы, отражающее интенсивность протекающих в
ней биологических процессов. Выражается суммарным
проявлением активности биохимических процессов,
обусловленных содержанием в почве определенного
запаса ферментов, выделенных в результате
жизнедеятельности растений и микроорганизмов, а также
аккумулированных почвой после разрушения отмерших
клеток.
19 Активность почв биологическая
Биологическая активность почв ха|ракте|ризует
размеры и направление процессов превращения веществ и
энергии в природных экосистемах (см.) суши;
интенсивность переработки органических остатков и
разрушения минералов.
Показателями биологической активности почв могут
служить количественные характеристики численности и
биомассы разных групп биоты почв (см. Биота
почвенная), их продуктивность, некоторые энергетические
данные, активность основных процессов, связанных с
круговоротом элементов, ферментативная активность почв,
а также количество и скорость накопления некоторых
продуктов жизнедеятельности почвообразующих
организмов.
Биологическую активность почв определяют,
пользуясь различными методами: микробиологическими
(прямой подсчет микроорганизмов разных групп —
бактерий, актиномицетов, грибов; определение количества
микроорганизмов в разных питательных средах),
биохимическими (определение ферментативной активности
почв, АТФ, ДНК), физиологическими (физиологический
метод определения биомассы микроорганизмов,
определение дыхания почвы) и химическими (определение
нитратов, аммиака).
Методы можно разделить на две группы:
методы определения действительной, актуальной
природной биологической активности почв (полевые
методы определения дыхания, азотфиксации, денитри-
фикации; некоторые изотопные методы);
методы определения потенциальной биологической
активности почв, то есть той активности, которая
обнаруживается в лаборатории при оптимальных условиях
для протекания данного процесса (определение
ферментативной активности почв, лабораторные методы
определения нитрификации, азотфиксации, денитрификации,
интенсивности дыхания).
Среди почвенных ферментов наиболее чувствительны
к аэротехногенному загрязнению (см. Загрязнение
почвы), HanpHMqp на дqpнoвo-пoдзoлиcтыx почвах, — дегид-
рогеназа и уреаза, в меньшей степени изменяется
активность каталазы и инвертазы. Ингибирующее
действие аэротехногенного загрязнения почвы на фермента-
Активность почв биологическая 20
тивную активность проявляется на расстоянии около
десятка километров и коррелирует с содержанием
основных компонентов промышленных выбросов в почве
(см. Выбросы загрязняющих веществ).
Внутриклеточные ферменты более устойчивы к воздействию
загрязняющих почву промышленных выбросов, чем почвенные
внеклеточные ферменты. Азотфиксация и денитрифика-
ция — также чувствительные показатели на загрязнение
почвы аэротехногенными выбросами.
При загрязнении почв органическими соединениями
и оксидами серы в почвенной подстилке увеличивается
количество микроорганизмов, учитываемых на мясо-
пептонном агаре (МПА), фенольной среде, и
соответственно возрастают значения таких показателей
биологической активности почв, как накопление свободных
аминокислот на ткани, скорость разрушения
целлюлозы, полифенолоксидазная активность. Это, очевидно,
обусловлено более интенсивным развитием групп
микроорганизмов, участвующих в переработке
дополнительного субстрата — фенолов, углеводородов,
поступающих из атмосферы на поверхность почвы.
Максимальной биологической активностью и
интенсивностью деструкционных процессов (см.
Деструктивная активность) по отношению к органическому
веществу характеризуется самый верхний подгоризонт
подстилки, принимающий на себя основную массу
загрязняющих органических веществ. На фоновых же
участках наибольшей напряженностью процессов отличается
ферментативный подгоризонт подстилки. Активность де-
гидрогеназы, инвертазы, липазы в загрязненных почвах
снижается.
Загрязнение почв тяжелыми металлами (см.)
оказывает ингибирующее действие на биологическую
активность почв. Это действие проявляется в падении
интенсивности дыхания почвы, снижении полифенолоксидаз-
ной, дегидрогеназной, липазной активности,
уменьшении скорости распада клетчатки, появлении токсичности
(см.) почв по отношению к азотобактеру.
Показатели биологической активности почв могут
быть использованы для ранней диагностики загрязнения
почв промышленными выбросами и оценки уровня
загрязнения при условии сравнения с соответствующими
21 Аллофаны
фоновыми почвами. В качестве таких показателей
Л. А. Гришина, Г. Н. Копцик рекомендовали
использовать: изменение скорости распада целлюлозы,
накопление аминокислот на ткани, выделение почвами диоксида
углерода (дыхание почвы), изменение дегидрогеназной
и липазной активности, токсичность почв по отношению
к азотобактеру.
Тяжелые металлы, оксиды серы, серная кислота
токсически влияют на почвенную биоту, ингибируют
многие ее функции, что проявляется в снижении некоторых
показателей биологической активности почв. Влияние
оксидов азота и органических соединений двояко:
высокие концентрации их токсичны, низкие способствуют
росту биологической активности почв и скорости
трансформации органического вещества.
АЛЛОФАНЫ. Группа тонкодисперсных неокристал-
лизованных (peнтгeнoaмqpфныx) минералов,
растворимых в щелочах, имеющих общую формулу
/2Al203miSi02pH20 и содержащих иногда значительные
количества Fe, Ca, Mg и других катионов.
Аллофаны составляют основную часть
тонкодисперсных фракций в вулканических почвах и в почвах на
продуктах выветривания основных щрных пород, а также
в иллювиальных горизонтах иллювиально-железистых
подзолов. Во всех этих почвах аллофаны образуются за
счет синтеза из растворов, содержащих Si и А1. В
почвах на других породах встречаются так называемые а л-
лофаноиды — плохо окристаллизованиые продукты
выветривания глинистых минералов (см.),
растворяющиеся в щелочной вытяжке. Аллофаны и аллофаноиды
характеризуются повышенной способностью к сорбции
анионов. Анионы замещают находящиеся на
поверхности аллофанов гидроксогруппы, давая поверхностные
комплексы. По прочности связи с поверхностью
аллофанов анионы располагаются в ряд: фосфат>арсенат>се-
ленит > молибдат > сульфат > фторид > хлорид>
>нитрат. В связи с этим почва, обогащенная аллофа-
нами, активно поглощает многие загрязняющие
вещества (см.), поступающие в нее в анионной форме.
При высоких значениях рН аллофаны могут
поглощать некоторое количество тяжелых металлов (см.).
Аллофаны — один из носителей переменного заряда (см.
Альбедо 22
Заряд почвенных коллоидов переменный), так как
находящиеся на поверхности этих минералов гидроксо-
группы способны протонироваться и депротонироваться
при изменении рН окружающего раствора.
АЛЬБЕДО. Величина, характеризующая степень
отражения почвой падающего на нее потока
электромагнитных колебаний. Выражается в процентах
отраженного излучения к падающему.
Величина альбедо зависит от структурного
состояния поверхности, влажности почвы, ее химического
состава, содержания гумуса и т. д.
АЛЮМИНИЙ, ТОКСИЧНЫЙ ДЛЯ РАСТЕНИЙ.
Находящиеся в почвенном растворе ионы А13+,
А1(ОН)2+ и А1(ОН)2+, которые, начиная с
определенного уровня концентраций, оказывают токсичное
действие (см. Токсичность) на многие виды растений, в том
числе иа сельскохозяйственные культуры.
Вопрос о токсичности для растений полимерных
ионов гидроксида алюминия окончательно не решен.
Основное токсичное действие ионов алюминия связано
с тем, что они проникают через клеточные мембраны в
растительные ткани, образуя комплексные соединения
(см.) с органическими лигандами, и препятствуют
репликации ДНК в растительном организме. Особенно
вредный эффект токсичного алюминия сказывается на
развитии корневых систем проростков растений.
Алюминий присутствует в токсичных для растений
концентрациях только в кислых почвах. Для оценки
его количества в почвах рекомендуется определять этот
элемент в вытяжке 0,01 М СаС12 после настаивания в
течение пяти суток. Считается, что для нормального
развития большинства сельскохозяйственных культур
содержание алюминия не должно превышать 2—3 мг
на 100 г почвы.
Еще один механизм вредного действия алюминия на
растения заключается в том, что ионы этого элемента,
участвуя в реакциях гидролиза, служат источником
почвенной кислотности (см. Кислотность почв
потенциальная).
Снижения в почвенном pacTBqpe концентрации
алюминия, токсичного для растений, достигают известкова-
23 Антропогенная нагрузка
нием почв и внесением других мелиорантов,
уменьшающих почвенную кислотность.
АНАЛИЗ ВОДЫ. Определение важнейших
показателей состава и свойств природных, технических и
питьевых вод для оценки соответствия их качества
предъявляемым требованиям.
При анализе поливных и почвенно-грунтовых вод
первостепенное значение с позиций охраны почв от
химического загрязнения (см. Загрязнение почвы) имеют
следующие показатели: величина рН, общая щелочность
или кислотность, мутность воды, пермаиганатная окис-
ляемость, а также содержание в водах тяжелых
металлов (см.), фторидов, соединений серы, нитратов и
фосфатов.
АНИОНЫ ОБМЕННЫЕ. Находящиеся в почвенном
поглощающем комплексе (см.) анионы, способные
эквивалентно обмениваться на анионы
взаимодействующего с почвой раствора (см. Почвенный раствор).
Основная часть обменных анионов находится в
почвах на поверхности гидроксидов железа и алюминия
(см.), которые в условиях кислой реакции (см. Реакция
почвы) имеют положительный заряд. Интенсивно
поглощаются анионы органогенными почвами и горизонтами.
В обменной форме в почве могут присутствовать
анионы С1-, N03^, Se042", Мо042~, НМо04~". Обменные
фосфат-, арсенат- и сульфат-анионы могут
содержаться в почвах в небольших количествах, так как эти
анионы прочно поглощаются некоторыми компонентами
твердых фаз почвы и не вытесняются в раствор привоз-
действии других анионов. Поглощение анионов
почвами в неблагоприятных условиях может приводить к
накоплению ряда токсичных веществ.
АНТРОПОГЕННАЯ НАГРУЗКА. Влияние
комплекса источников и факторов воздействия всех видов
хозяйственной деятельности на окружающую среду (см.).
Нагрузка выражается в использовании природных
ресурсов (добыча полезных ископаемых, лесозаготовки)
и в загрязнении (см.) природной среды (воздух, вода,
почва). Выработаны специальные критерии оценки
антропогенной налрузки на природную среду региона,
которые подразделяются на две группы:
Антропосфера 24
потенциальные нагрузки — потенциальная
возможность отрицательного воздействия на природную
среду;
фактические нагрузки, или факторы,
вызывающие непосредственное загрязнение природной
среды, включают: выбросы вредных веществ в атмосферу
(см. Выбросы загрязняющих веществ), сброс сточных
вод (см.), нарушение земель промышленными
разработками, деградацию сельскохозяйственных земель (см.
Деградация почв).
По А. И. Перельману, М. А. Глазовской, в качестве
показателей, характеризующих техногенные нагрузки
на экосистему (см.), используют деструктивную
активность, технофильность (см.), биофильность.
АНТРОПОСФЕРА. Сфера обитания и деятельности
человека; часть биосферы, измененная в результате
производственной деятельности человека.
Воздействие человека на биосферу многообразно,
приводит к необратимым изменениям, которые в наше
время происходят чрезвычайно быстро. Все изменения
антропогенной природы нарушают естественный баланс
экосистемы (см.), сформированный в течение
длительного периода времени. Такие изменения приводят к
деградации естественной среды обитания человека.
АРЕАЛ ПОЧВЕННЫЙ ЭЛЕМЕНТАРНЫЙ.
Площадь, занятая однородным почвенным формированием,
в пределах которой не могут быть выделены две или
более таксономические группы почв. Неоднородность
почв в пределах ареала обусловлена только природным
варьированием, характерным для данного почвенного
выдела.
АРИДНЫЕ ТЕРРИТОРИИ (аридные зоны, аридные
районы). Области с засушливым климатом, где
испаряемость в течение года превышает сумму атмосферных
осадков.
Для почв аридных территорий характерен
непромывной водный режим, что может приводить при
неблагоприятных условиях к накоплению в почвенных
горизонтах легкораетворимых солей, гипса и карбонатов.
Особенно опасно в таких регионах вторичное засоление
(см. Засоление почв вторичное) и осолонцевание почв,
что имеет место при строительстве и эксплуатации не-
25 Баланс гумуса
достаточно теоретически обоснованных оросительных
систем.
Аридные и полуаридные территории наиболее
типичны для ландшафтов Средней Азии, неюгщрых
районов Закавказья, низовьев Волги, юга Украины и
степного Крыма.
АЭРОЗОЛИ. Взвешенные в воздухе частицы
твердых и жидких веществ размером менее 0,1—0,01 см.
Имеют естественное и антропогенное
происхождение. С техногенными аэрозолями связано загрязнение
(см.) атмосферы, природных вод, почв, растений.
Б
БАЛАНС ГУМУСА. Соотношение всех статей
прихода и расхода органических компонентов почвы. В более
узком смысле слова под балансом гумуса понимают
суммарное соотношение статей прихода и расхода
углерода органических соединений, выражающееся в
конечном итоге в процессах накопления, потери или
стабилизации содержания гумуса (органического
вещества) в почве.
Различают три основных типа баланса гумуса:
компенсированный (бездефицитный)
баланс, когда потери органического вещества почвы
уравновешены его поступлением за определенный
промежуток времени на конкретной территории;
положительно-дскомпенсированный
(положительный) баланс, когда поступление свежего
органического вещества превышает его потери;
отрицательно декомпенсированный
(отрицательный) баланс, когда расход превышает
приход, поступление органического материала меньше
его потерь.
Отрицательный баланс обычно складывается в
пахотных почвах при невысокой культуре земледелия.
Для целинных почв характерны компенсированный или
положительный баланс гумуса.
В число важнейших статей прихода входят
поступление свежего органического вещества с остатками
Баланс гумуса 26
растений и животных, поступление прижизненных
выделений (экссудатов), наземный опад, пожнивные
остатки, органические удобрения, семенной материал.
К статьям расхода относятся выделение из
почвы С02, потребление органических веществ живыми
организмами, вымывание органических соединений с
нисходящим водным потоком, потери органического
вещества вследствие эрозии и дефляции.
Для подведения баланса гумуса предложены
расчетные и экспериментальные методы, однако наиболее
надежные результаты получают при непосредственных
длительных наблюдениях за содержанием гумуса в
почве. При расчетных методах оценку баланса гумуса
ведут или по coдqpжaнию азота, или по углероду.
Расчет по азоту, широко принятый во многих
агрохимических учреждениях, несколько проще, но дает весьма
условные результаты, так как азот в почве представлен
различными формами соединений, различающимися и
по содержанию азота, и по доступности процессам
минерализации. Учитываемые в расчетах потери азота
пахотными почвами в результате минерализации
обусловлены главным образом разложением лабильных групп
органических соединений, содержание азота в которых
не соответствует среднему количеству его в гумусе. Это
часто приводит к некорректным выводам.
Определение баланса гумуса необходимо для
расчета потребности почв в органических удобрениях.
Принципиально такой расчет возможен по формуле Чуяна
Y
где Н — ежегодная доза органических удобрений, т/га; Г — запас
гумуса в пахотном слое, т/га; а — коэффициент минерализации
гумуса, А — ежегодное количество поступающих в почву
пожнивных органических остатков, т/га; р и у — коэффициенты
гумификации растительных остатков и органических удобрений
соответственно.
Несмотря на простоту формулы, расчет крайне
затруднен необходимостью нахождения величин А, а, р,
у, которые не остаются постоянными при смене
культуры, почвы, системы земледелия, вида органических
удобрений. Конкретные значения этих параметров окон-
27 Барьеры геохимические
чателыно не установлены даже для сравнительно
простых случаев.
Для обеспечения бездефицитного баланса
используют эмпирически установленные дозы органических
удобрений. Так, считается, что бездефицитный баланс
гумуса может быть обеспечен в черноземной зоне при
внесении на 1 га 6—7 т навоза, в зоие AqpHOBO-noA30-
листых почв—12—15 т. Общая потребность пахотных
почв в органических удобрениях и вероятные ресурсы
в расчете на 1990 г. даны в таблице.
Потребность пахотных почв СССР в органических удобрениях
(в расчете на подстилочный навоз) для обеспечения бездефицитного
баланса гумуса (по И. Н Лозановской и др )
Регион
Потребность
млн т
£г/га
Вероятные ресурсы
млн т
т/га
СССР
РСФСР
Украина
Белоруссия
Узбекистан
Казахстан
Грузия
Азербайджан
Литва
Молдова
Латвия
Киргизия
Таджикистан
Армения
Туркмения
Эстония
1426,8
814,1
276,9
45,6
62,5
123,6
7,0
13,3
16,3
15,0
9,0
10,3
11,8
2,2
14,1
2,4
6,5
6,2
8,6
8,0
16,3
3,5
10,6
10,2
7,4
8,8
5,6
7,9
14,8
4,8
17,6
2,6
Как видно из приведенных данных
1269,7
763,9
309,2
78,9
23,8
32,6
2,5
3,6
25,1
10,9
20,4
3,3
3,6
2,3
3,7
13,0
5,8
5,8
9,6
13,9
6,0
0,9
3,8
2,8
11,4
6,4
12,7
2,5
4,6
5,1
4,6
13,8
даже расчетная
потребность в навозе не покрывается вероятными
ресурсами, хотя принятые в расчетах дозы для
большинства республик, видимо, занижены. Поэтому в числе
важнейших задач обеспечения бездефицитного баланса
гумуса остаются поиски нетрадиционных источников
органических удобрений и наиболее рациональных
способов их приготовления и внесения.
БАРЬЕРЫ ГЕОХИМИЧЕСКИЕ. Зоны ландшафта
(см.), в KOTqpbix на относительно коротком расстоянии
Барьеры геохимические
28
Типы концентрации :
Геохимический
барьер
Кислородный
Сульфидный
(сероводородный)
Глеевый
Щелочной
химических элементов на геохимических
Окислительно-восстановительные и кислотно-основные
3
Al, Fe
Fe, Cu, Hg,
Pb, Cd, Bi,
Sn, As, Sb,
Mo, W, U -
Cu, U, Mo
Mg, Ca, Sr,
Ba, Ra, Mn,
Fe, Co, Ni,
Cu, Zn, Pb,
Cd, Hg, Al,
Ga, Cr, P,
As, U, TR
3-6,5
6,5-8,5
кислородные
Fe, Mn, Co
Ti, Mn, Co,
Ni, Cu, Zn,
Pb, Cd, Hg,
Sn, Cr, Mo,
U
Cu, U, Mo
Mg, Ca, Sr,
Ba, Co, Ni,
Cu, Zn, Pb,
Cd, Hg, Be,
(U), Ra
Mn
Tl, Cr, Mo,
U, Se, Re,
V
Cu, Cr, U,
Mo, Re, Se,
V
8,5
Cu, Ag, Zn,
Cr, Mo, U,
V, As
Cu, Ag, Cr,
Mo, V, Re,
Se, V, As
Кислый
Испарительный
Сорбционный
Na, К, Rb,
CI, Mg, Ca,
Sr, S, Mn,
Fe, Co, Ni,
Cu, Zn, Pb,
Cd, Al, Mo,
U
Al, Sc, Ga,
Si, Ge, P,
V, As
Si,
Cd
Pb
Br,
V,
Ba, Zn,
Ni, Co,
Cu, CI,
I, B, P,
Mo, As
Si, Mo
Li, Na, K,
Rb, Tl, N,
B, F, CI, Br,
I, Mg, Ca,
Sr, S, Zn,
Mo, U, V,
Se
Li, Na, K,
Rb, Tl (CI,
Br, I, B, F,
S, P, V, Mo
As), Zn, Cs
(Cu), (Zn),
Ag, Be, Al,
TR, Si, Zr,
(Ti), (Ge),
Mo, Cr, Ga
Li, Na, K,
Pb, Tl, N,
B, F, CI, Br,
I, Cu, Zn,
Mo, U, Se,
V
Li, Na, K,
Rb, Cs, (CI,
Br, I, B, F,
S, P, V, Mo,
As)
29
Барьеры геохимические
барьерах (по А. И. Перельману)
условия вэд, поступающих к геохимическому барьеру, рН
3
3-6,5
6.5-S5
8,5
глееиые
3,0
3-6,5
6,5-8,5
8,5
сероводородные
Fe
Tl, Pb,
Си, Bi,
Sn
Си, U,
Mo
Mg, Ca,
Sr, Ba,
Mn, Fe,
Co, Ni,
Си, Zn,
Pb, Cd,
Hg, Be,
Ga, P,
As, TR
Na, K,
Rb, Tl,
CI, Mg,
Ca, Sr,
Si, Mn,
Fe, Co,
Ni, Си,
Fe, Mn,
Co
Tl, Fe,
Co, Ni,
Pb, Си,
Zn, Cd,
Hg, U
Си, U,
Mo
Mg, Ca,
Sr, Ba,
Mn, Be,
Fe, Co,
Ni, Zn,
Pb, Cd,
Hg, Al,
Ga, Tl,
Cr, P,As
(U)
(Fe), Mn
Co
Tl, Fe,
Co, Ni,
Си, Zn,
Cd, Hg,
(Mo),
(U)
Mo, U
Mg, Ca,
Sr, Ba,
Zn, Cd,
Mn, Co,
Ni
Si, Mo
Li, Na,
K, Rb,
Tl, N, В
CI, Br,
I, Mg,
Ca, Sr,
S, Zn
, (Mn)
Tl, Си,
Zn, Cd,
Hg, Mn,
(Fe, Co,
Ni, U)
Mo, U
(Си),
(Zn), Be
Al, Ga,
TR, Si,
(Ti), Mo
Sc
Li, Na,
K, Pb,
S, Se,
(Fe)
Mg, Ca,
Sr, Ba,
Mn, Fe,
Co, Ni,
Zn, Pb,
Cd, Al,
Ga, TR,
Cr, P,
As, Be
Li, Na,
K,Rb,
Tl, N, B,F, CI,
F, CI, Br, I, Br,
I, Zn
Mg, Ca,
Sr, S
S, Se
Mg,
Ca,
Sr,
Ba
S, Se S, Se
Se, Ge Be, Al,
Ga,
Sc,
TR,
Si, Ge,
Zr(Ti)
Li, Na, Li, Na,
K, Rb, K, Rb,
F,C1, N,B,
Br, I, F, CI,
Mg, Br, I
Ca, Sr,
S
Zn, Pb,
Cd, Al,
Mo, U
As, Sc,
Ga, Si,
Ge, P, V,
As, Al
Si, Ba, Li, Na, K, Li, Na,
Zn, Cd, Rb, Cs, K, Rb,
Ni, Co, Tl, Zn, Cs, Tl Ge, P,
Pb, Си, (CI, Br, (CI, Br, V, As
U, CI, Br, I, F, B, I, B, F,
I, F, S, S, P) S)
P, Mn, Fe
Al, Sc, Ba, Sr, Li, Na, Li, Na,
Ga,Si, (CI, K,Rb, K,Rb,
Br, I,
F, B,
S, P)
Cs,
(CI,
Br, I,
F, B,
S,P)
Cs,
(CI,
Br, I,
F,B,
P)
Барьеры геохимические 30
в результате специфического сочетания механических,
химических, биологических условий происходит
избирательное накопление одних химических элементов и
удаление других.
Понятие геохимических барьеров разработано
А. И. Перельманом. Геохимические барьеры
формируются в результате закономерной пространственной
эволюции ландшафтов. В связи с аккумуляцией на
геохимических барьерах химических элементов
антропогенного происхождения (см. Аккумуляция в почве
химических загрязняющих веществ) их необходимо
учитывать при характеристике техногенно нарушенных
ландшафтов и при разработке природоохранных
мероприятий.
Распространение основных геохимических барьеров
следующее (по А. И. Перельману):
Сернокислый — рудные тела сульфидных месторождений
Кислый — дерново-подзолистые, красноземные, серые лесные,
бурые лесные почвы, солоди
Нейтральный карбонатный — степные черноземные, каштановые,
сероземные почвы, рендзины
Хлоридно-сульфатный — верхние горизонты некоторых
солончаков степей и пустынь
Содовый — солонцы
Бескарбонатный глеевый — луговые и болотные почвы северных
степей, карбонатные луговые и болотные почвы лесной и тундровой
зон
Соленосный глеевый — солончаки со слабовосстановительной
средой
Гипсовый глеевый — гипсовые горизонты луговых почв
Содовый глеевый — содовые луговые солонцы
Со ленасно-сульфидный — нижние горизоитьв солончаков
Содовый сероводородный — солонцеватые солонцы
Перечень элементов, которые концентрируются на
геохимических барьерах, зависит от состава
поступающих к барьеру вод и от класса барьера, который, в
свою очередь, определяется характером процессов,
приводящих к концентрации химических элементов.
Сочетание указанных факторов положено в основу
классификации геохимических барьеров.
Образование кислородных, или окислительных,
барьеров связано с изменением
окислительно-восстановительных условий в ландшафте. Такие барьеры
формируются на участках резкой смены
восстановительной среды на окислительную. Например, грунтовые
31 Барьеры геохимические
и глеевые воды, обогащенные Fe и Мп, мигрирующими
в форме бикарбонатов или органических комплексов, в
окислительных условиях вблизи поверхности почв, в
болотах и озерах образуют железисто-марганцевые
конкреции, болотные и озерные руды, обогащенные Сг, Со,
Си, Pb, V, Ni и другими элементами. Хотя при оглеении
почв и Мп и Fe подвижны, области миграции этих
элементов полностью не совпадают. Марганец более
подвижен и осаждается только в резкоокислительной
обстановке как самостоятельно, так и совместно с
железом.
Сероводородные восстановительные, или
сульфидные, барьеры образуются в тех зонах
ландшафта, где кислые или глеевые воды контактируют с
сероводородной средой. На этих барьерах рН часто
около или выше 7, Eh ниже 0, в таких условиях
концентрируются металлы, образуя нерастворимые сульфиды
железа, меди, свинца, цинка.
При встрече кислых вод с восстановительной глее-
вой средой, когда Eh ниже 300—200 мВ, в воде нет
кислорода, в воздухе много С02 и СН4, формируются
глеевые восстановительные барьер ы, где
накапливаются в труднорастворимой форме V, Se, Cu, U,
(V5+->V3+, Cu2+-^Cu°). Восстановительные барьеры
распространены в почвах тундры, тайги, лесов
умеренной и тропических областей, в почвах пойм.
Щелочные барьеры возникают в тех
почвенных горизонтах, где наблюдается резкий скачок рН и
смена кислой и слабокислой среды на щелочную.
Особенно контрастные барьеры образуются на контакте
силикатных и карбонатных пород. Например, в таежной
зоне, где под маломощным валунным суглинком
залегает известняк, формируются горизонты, обогащенные
Са, Mg, Mn, Ba, Sr, V, Zn, Cu, Co, Pb, Cd. Такие
барьеры действуют и в зоне окисления сульфидных руд, в
известняках. В техногенной зоне они могут возникать
при нейтрализации кислых атмосферных осадков и
поверхностных вод карбонатными породами, в результате
чего образуются карбонаты металлов.
Кислые геохимические барьеры формируются
в зонах ландшафта при резком изменении условий
среды в более кислую сторону: от щелочных условий к кис-
Барьеры геохимические 32
лым, от сильнощелочиых к слабощелочным, от силыно-
кислых к слабокислым. На кислых барьерах
осаждаются анионогенные элементы As, Mo, Se. Наличие этих
барьеров характерно для зон окисления серных и
сульфидных руд, где создается сернокислая дреда, для лу-
гово-болотных почв, где разлагаются большие массы
qpraiHH4ecKHx остатков в условиях избытка влаги и
накапливаются органические кислоты. К резкому
снижению рН почв могут вести выпадения в промышленной
зоне кислых осадков (см. Кислые дожди) и пылевые
выпадения, богатые серой и сульфидами.
В аридных ландшафтах (см. Аридные территории)
при энергичном испарении грунтовых вод на
поверхности почвы или в почвенном профиле формируются
верхние испарительные барьеры, а на уровне
грунтовых вод — нижние испарительные барьеры.
Примером действия испарительных геохимических барьеров
служит накопление Са, Na, К, Mg, F, S, Sr, CI, Pb, Zn,
V, Ni, Mo в засоленных почвах.
Действие сорбционных барьеров
проявляется за счет обменного и безобменного поглощения
химических веществ тонкодисперсными соединениями почвы
органического и минерального состава (см.
Поглотительная способность почвы). В почвах лесной и
лесостепной зон умеренных широт гумусовые вещества,
глинистые минералы (см.), гидроксиды марганца несут
отрицательный заряд и сорбируют Ni, Co, Cu, Zn, Hg,
Ва и другие металлы. Во влажных тропиках, где
развиты кора выветривания и почвы, содержащие
положительно заряженные коллоиды гидроксидов железа и
алюминия (см. Коллоиды почвенные), на сорбционном
барьере накапливаются CI, S, Р, V, As, Cr, Мо.
Поглощенные ионы удерживаются с различной прочностью;
наибольшей миграционной способностью обладают
обменные соединения, которые могут переходить в
раствор. Глинистые минералы и гумусовые вещества
способны удерживать химические вещества и в необменной
форме (К, Cs, Zn, Cu). Сорбционные барьеры
характерны для иллювиальных горизонтов почв, гумусовых
щризонтов, для зон контактов горизонтов почв, резко
различающихся по гранулометрическому составу.
В зависимости от направления потоков миграции хи-
33 Бензолполикарбоновые кислоты
мических элементов в ландшафте, на пути которых
формируются геохимические барьеры, последние можно
разделить на две группы: (радиальные и латеральные.
Радиальные геохимические барьеры
формируются при вертикальной миграции веществ, они
создают дифференциацию химических веществ в
почвенном профиле.
Латеральные геохимические барьеры
формируются на границах геохимически контрастных
элементов ландшафта, при миграции химических
веществ от автономных ландшафтов к подчиненным
геохимически сопряженного ряда.
БЕЗОТХОДНАЯ ТЕХНОЛОГИЯ. Совокупность
технологических процессов, обеспечивающих работу
производства по замкнутому циклу и полное
использование в процессе производства исходного сырья и
побочных продуктов отхода. Представляет собой самое
эффективное средство сохранения природной среды и
защиты ее от негативного антропогенного воздействия.
БЕНЗОЛПОЛИКАРБОНОВЫЕ КИСЛОТЫ.
Важнейшие продукты искусственного и (частично)
природного расщепления гуминовых веществ, лигнина и
некоторых других природных соединений. Относятся к
кислотам ароматического ряда, в которых два или более
атомов водорода бензольного ядра замещены на
карбоксильные группы.
При окислении природных соединений гумуса (см.)
щелочным раствором перманганата калия или оксидом
меди образуется большой набор собственно бензолполи-
карбоновых кислот и их гидро-оксипроизводных. В
числе выделяемых соединений фталевые кислоты
С6Н4(СООН)2, бензолтрикарбоновые С6Н3(СООН)3,
бензолтетракарбоновые С6Н2 (СООН) 4, бензолпентакар-
боновая кислота С6Н(СООН)5, в небольших
количествах обнаруживается и бензолгексакарбоновая (мелли-
товая) кислота С6(СООН)6. В наибольших количествах
в продуктах окисления гумусовых веществ обычно
присутствуют три- и тетрабензолкарбоновые кислоты, что
соответствует строению таких биополимеров, как лиг-
иин и флаваноиды. Выход бензолполикарбоиовых
кислот используют для оценки строения и относительной
зрелости гуминовых веществ; окисление гуминовых кис-
3 Заказ 5937
Биогеохимические провинции 34
лот дерново-подзолистых, бурых лесных почв,
сероземов и красноземов обычно позволяет получить 5—10 %
бензолполикарбоновых кислот по отношению к
исходному веществу; гуминовые кислоты 4qpH03eMOB образуют
при окислении до 15—20%, а после метилирования —
до 30 % бензолполикарбоновых кислот. Присутствие
этих соединений указывает на генетическую связь гу-
миновых веществ и биополимеров.
Бензолполикарбоновые кислоты могут реагировать с
различными ксенобиотиками (см. Ксенобиотик),
связывая последние в менее подвижные и менее токсичные
для растений соединения.
БИОГЕОХИМИЧЕСКИЕ ПРОВИНЦИИ. Области
на поверхности Земли, различающиеся по содержанию в
почвах, водах и других средах химических элементов
или их соединений, с которыми связаны определенные
биологические реакции со стороны местной фауны и
флоры.
А. П. Винолрадов указывал, что биогеохимические
провинции с резкой недостаточностью или
избыточностью того или иного химического элемента, вероятно,
играли особенно большую роль в геологическом
прошлом.
Эти провинции характзризуютея определенным
постоянством состава мигрирующих и аккумулируемых
соединений, сод9ржание которых может быть ниже или
выше биологического оптимума для некоторых
организмов, включая человека. В. В. Ковальским составлена
карта биогеохимических зон и провинций СССР, на
которой выделены районы распространения ряда
заболеваний человека и животных, связанных с
биогеохимическими свойствами почв, вод и других сред обитания. Им
же крупные биогеохимические зоны разделены на
биогеохимические провинции двух видов:
зональные провинции, которые соответствуют
общим зональным характеристикам, но отличаются
друг от друга по концентрациям и соотношениям
химических элементов;
азональные провинции, признаки которых не
соответствуют общей характеристике зоны.
Азональные провинции — это, как правило, геохими-
35 Биогеохимические провинции
ческие аномалии, связанные с рудопроявлением. Они
возникают на первичных или вторичных ареалах
рассеяния элементов и характеризуются избыточным
накоплением элементов в почвах и отдельных видах
растительности. На этом основаны биогеохимические
методы поиска рудных месторождений. А. Л. Ковалевский
установил закономерности биологического поглощения и
концентрирования металлов разными видами растений,
произрастающих на одной и той же почве в районах
рудопроявления. Изученные виды растений он разделил
по механизму поглощения металлов на безбарьерные и
барьерные.
У растений безбарьерного типа
содержание металлов в золе растет пропорционально
количеству их в почве. Одновременно при небольших
повышениях содержания металлов в почве возрастает и
биопродуктивность растений, при дальнейшем увеличении
продуктивность остается на том же уровне. При еще
большем увеличении содержания металлов в почве
начинается угнетение растений и продуктивность
снижается. В случае превышения предельной концентрации
металла растение гибнет.
У растений барьерного типа сначала
также при повышении содержания элемента в почвах
возрастает количество его в золе растения, затем при
дальнейшем повышении концентрации металлов в субстрате
происходит стабилизация уровня содержания металла
в золе, при этом наблюдается также максимальная
продуктивность. Если содержание металлов в почве и
далее повышается, то в золе растений происходит
уменьшение концентрации металлов. Однако продуктивность
растений не падает. Барьерные виды растений
подразделяются на низко-, средне- и высокобарьерные.
В таблице приведены данные о закономерностях
проявления биологических реакций, вызываемых
избытком или недостатком микроэлементов в почвах.
В настоящее время, когда природные и техногенные
потоки веществ образуют единый технобиогеохимиче-
ский поток, многие исследователи объединяют
биогеохимические, техногенные и геохимические аномалии в
технобиогеохимические провинции (Глазовская, 1988).
Биогеохимия
36
Пороговые концентрации микроэлементов (% воздушно-сухой
почвы) в почвах и возможные реакции живых организмов
(по В. В. Ковальскому)
Пределы содержания
недостаточное (нижняя
пороговая концентрация)
нормальное (в
пределах нормальной
регуляции
функций)
избыточное (верхняя
пороговая
концентрация)
Со 2—7-Ю-4 7—30. Ю-4
Акобальтозы, лизухи (у
животных), анемии, ги-
по- и авитаминозы В12;
усиление эндемии зоба
(у человека)
Си 6—15-Ю-4 15—60-Ю-4
Анемии, лизухи (у
животных), заболевания
костной системы,
эндемическая атаксия.
Полегание и невызревание
злаков, невызревание
плодовых культур
Мп До 4-Ю-2 4—30- Ю-2
Заболевания костной
системы, возможно
усиление зоба (у человека).
Хлороз и некроз
кукурузы, желтуха сахарной
свеклы
Zn До З-Ю-3 3—7. Ю-3
Паракератоз у свиней.
Хлороз, мелколиствен-
ность растений
Мо До 1,5-Ю-4 1,5—4-Ю-4
Заболевания растений
(клевер)
В 3—6- Ю-4 6—30-Ю-4
Отмирание точки роста
стебля, корня растений;
гниль сердечка свеклы,
побурение листьев
цветной капусты и
сердцевины брюквы
БИОГЕОХИМИЯ. Часть геохимии,
химические процессы, происходящие
участии живого вещества.
зо-Ю-4
Может
усиливаться синтез
витамина Bi2
60-10-4
Анемия,
гемолитическая желтуха,
поражение печени.
Хлорозы растений
30-Ю-2
Возможно
токсическое действие на
растения в
условиях кислых почв
7-Ю-3
Анемия, могут
угнетаться процессы
окисления
4-Ю-4
Подагра у
человека, молибденовый
токсикоз у
животных
30-Ю-4
Борные энтериты
у человека и
животных.
Заболевания растений
изучающая гео-
в биосфере при
37 Биогеохимия
Возникновение биогеохимии как науки связано с
именем В. И. Взрнадского. Благодаря его работам
выявлена исключительно важная роль живого вещества в
миграции химических элементов и термодинамике
планеты в целом: «Живые организмы являются функцией
биосферы и теснейшим образом материально и
энергетически с ней связаны, являются огромной
геологической силой, ее определяющей» (Вернадский, 1987).
В глобальном масштабе геохимическую роль живого
вещества следует рассматривать как мощный
исторически сложившийся геологический фактор — массо- и
энергопереноса. Основной движущий фактор развития
процессов в биосфере — биогеохимическая энергия
живого вещества.
По А. И. Перельману, геохимическая деятельность
живых организмов имеет три аспекта.
1. Живые организмы непосредственно
концентрируют отдельные элементы или группы элементов. В
результате селективного концентрирования после отмирания
живых организмов происходит образование горных
пород с органоморфной структурой и текстурой — угли,
коралловые известняки, торф и др.
2. Живое вещество — самый сильный фактор
миграции элементов в экосистемах (см).
3. Деятельность живого вещества — важнейший
фактор миграции элементов за время геологической
истории Земли, определяющий всю геохимию земной коры.
Результатом жизнедеятельности организмов за
миллиарды лет стал биогеохимический круговорот и
дифференциация химических элементов, создавших биосферу
и являющихся основой ее функционирования.
В настоящее время круговорот веществ в природе
определяется совместным действием биологических,
геохимических и геофизических факторов. Разнообразная
хозяйственная деятельность человека привела к тому,
что антропогенный фактор приравнялся к природным
биогеохимическим факторам миграции вещества, а в
некоторых звеньях природных круговоротов стал
главенствующим.
Об этом свидетельствует количественная
характеристика биогеохимических и технохимических агентов в
биосфере (по В, А. Ковде):
Биогеоценоз 38
Биомасса суши 3-Ю12—ЫО13 т
Годичный фотосинтез на суше 1010—1011 т
Годичный оборот зольных органоге- 108—109 т (включая
нов на суше азот — до 1010 т)
Годичный сток pejK:
растворенные вещества 3-Ю9 т
взвешенные вещества 1,6-1010 т
Годичное производство удобрений 3-1О8 т
Пыль промышленная 0,25 • 109 т в год
Мусор, отходы, отбросы 20-109 т в год
Выемка рудных пород 5-109 т в год
Промышленные и городские сброс- До 55-10й м3 в год
ные воды
Аэрозоли и газовые выбросы До 109 тв год
Хозяйственная деятельность человека меняет
направленность биогеохимических циклов. Современная
промышленность минеральных удобрений фиксирует
азот атмосферы и возвращает его в почвы в размерах,
превышающих биологическую фиксацию. Железо,
марганец, медь и другие цветные металлы мобилизуются из
рудных месторождений, поступая в циклы биосферы.
Рассеянные металлы в виде следов — ртуть, свинец,
кадмий — добываются, концентрируются и включаются
в больших количествах в биосферу. Из недр ежегодно
добывают больше, чем включается в биологический
круговорот: кадмия (в 160 раз), сурьмы (в 150), ртути (в
110), свинца (в 35), мышьяка, фтора (в 15), урана (в
6), олова (в 5), меди (в 4), молибдена (в 3 раза). При
сжигании угля ежегодно выделяется больше, чем
включается в биологический круговорот: ртути (в 8700 раз);
мышьяка (в 125); урана (в 60); кадмия (в 40); лития,
иттрия, бqpиллия, циркония (в 10); олова, ванадия (в
3—4 раза) (Глазовская, 1988).
БИОГЕОЦЕНОЗ (от греч. bios — жизнь, gi —
Земля, koinos — общий). Взаимообусловленный комплекс
живых и косных компонентов, связанных между собой
обменом вещества и энергии.
В основе понятия лежит определение В. Н. Сукачева,
согласно которому биогеоценоз — «совокупность на
известном протяжении земной поверхности однородных
природных явлений (атмосферы, горной nqpOAbi,
растительности, животного мира и мира микроорганизмов,
почвы и гидрологических условий), имеющая свою
особую специфику взаимодействий этцх слагающих ее ком-
39 Биогеоценоз
понентов и определенный тип обмена веществом и
энергией их между собой и другими явлениями природы и
представляющая собой внутреннее противоречие,
диалектическое единство, находящееся в постоянном
движении и развитии».
В настоящее время термины «биогеоценоз» и
«экосистема» (см.) часто рассматривают как синонимы.
Однако понятие биогеоценоза, предложенное В. Н.
Сукачевым и относящееся к наземным живым системам,
имеет определенные территориальные рамки, границы.
Понятие экосистемы — безразмерное и может включать
пространство любой протяженности — от капли воды с
живущими в ней микроорганизма;ми до всей биосферы
в целом. Таким образом, понятие «биогеоценоз» по
отношению к понятию «экосистема» — более частное.
Почва — неотъемлемая и важная составная часть
биогеоценоза. Это биокосное образование, продукт
взаимодействия между биотической и абиотической ере-
дой (см.). Почва как компонент биогеоценоза
находится в динамическом равновесии с другими его
компонентами. Биогеоценоз также представляет собой
динамическую систему, непрерывно изменяющуюся во времени и
пространстве. Однако из всех компонентов
биогеоценоза почва — одна из наиболее консервативных
составных частей. Она играет буферную роль в биогеоценозе,
ослабляя воздействие на него внешних факторов. Почва
служит своеобразным экраном, фильтром, изменяющим
состав проходящих через нее потоков вещества. Часть
веществ, необходимых для жизнедеятельности
растительности, микроорганизмов и других живых существ,
в почве задерживается, часть фильтруется 4qpe3
почвенную толщу и рыхлые породы и сбрасывается в
гидрологическую сеть. Таким образом, почва оказывает
определенное влияние на фqpмиpoвaниe качества воды в
окружающей среде.
В современный период, когда антропогенное
воздействие на окружающую среду становится все
большим и геохимическая деятельность человека не уступает
по мощности природным процессам, особенно важной
становится роль почвы в нормальном
функционировании биогеоценоза. Техногенные вещества, поступающие
на поверхность почвы, дифференцируются в пределах ее
Биогеоценология 40
профиля в соответствии с природой почвенных
генетических горизонтов и химическим составом поступающих
загрязняющих веществ (см.). Последние включаются
также в миграционные потоки (см. Миграция
химических соединений), и происходит перераспределение
загрязняющих веществ (см.) в почвах и в ландшафте
(см.).
Коэффициенты концентрации техногенных элементов
в почвах аккумулятивных ландшафтов значительно
выше, чем в автономных. По М. А. Глазовской (1988), в
незагрязненных биокосных системах пределы колебаний
концентраций техногенных веществ, а также формы их
нахождения в данной системе должны удовлетворять
следующим условиям.
1. Не нарушаются газовые, концентрационные и
окислителыно-восстановительные функции живого
вещества системы, регулирующие ее геохимическое
самоочищение.
2. Биохимический состав первичной и вторичной
продукции не изменяется настолько, чтобы вызвать
нарушение жизненных функций в каком-либо из звеньев
пищевых цепей не только данной системы, но и за ее
пределами (при отчуждении биологической продукции
в агроценозах).
3. Не понижается биологическая продуктивность
системы.
4. Не понижается информативность системы: сохра-
няется необходимый для ее существования генофонд.
При нарушении этих условий будут происходить
обратимые, а часто и необратимые изменения
биогеоценозов, а при определенных условиях техногенного
воздействия— разрушение его. Примером превышения
критических уровней концентраций тяжелых металлов
вокруг предприятий, например, цветной металлургии,
может служить образование техногенной пустыни вблизи
источника загрязнения (1—6 км). Повышенное же
содержание загрязняющих веществ часто бывает и на
большом расстоянии (десятки километров) от
источника.
БИОГЕОЦЕНОЛОГИЯ (от греч. bios —жизнь, gi —
Земля, koinos — общий, logos — слово, учение). Наука
о взаимосвязанных и взаимодействующих комплексах
41 Биоиндикация
живой и неживой природы— биогеоценозах и их
планетарной совокупности — биосфере.
Поскольку биогеоценозы многокомпонентны и имеют
сложную структуру (см. Биогеоценоз), биогеоценология
возникла на стыке различных дисциплин, изучающих
различные составные части биогеоценоза
—растительность, почву, животный мир, микроорганизмы и т. п.
Поэтому биогеоценология тесно связана с
почвоведением, биогеохимией, лавдшафтоведением, геоботаникой,
микробиологией. В отличие от лавдшафтоведения, в
биогеоценологии акцент делается на изучении связей
компонентов среды, направленных на биоценоз, в то
время как ландшафтоведение в равной степени
занимается изучением связей между всеми компонентами
ландшафта, геосистемы.
Основы биогеоценологии были заложены трудами
В. В. Докучаева, В. И. Вернадского, В. Н. Сукачева,
Г. Ф. Морозова.
Задачи биогеоценологии следующие:
исследование структуры, функций и свойств
компонентов, составляющих биогеоценозы, и расшифровка
механизма их связей;
изучение потоков вещества и энергии в них;
изучение перераспределения потоков вещества и
роли каждого из компонентов биогеоценоза, а также
изучение влияния каждого компонента на биологическую
продуктивность всего комплекса;
выявление реакций компонентов всего биогеоценоза
на антропогенные воздействия, а также на различные
стихийные ситуации;
определение устойчивости биогеоценозов к
различным внешним воздействиям;
исследование взаимосвязей и взаимодействия между
разными биогеоценозами, обеспечивающих единство
биогеосферы и ее крупных частей.
БИОИНДИКАЦИЯ. Обнаружение и определение
биологически и экологически значимых антропогенных
нагрузок (см. Антропогенная нагрузка) на основе
реакций на них живых организмов и их сообществ.
К особенностям биоиндикаторов (см. Индикация
биогеохимическая состояния окружающей среды)
относятся следующие;
Биоиндикация 42
реакция на относительно слабые нагрузки
вследствие эффекта кумуляции дозы;
суммирование действия (различных антропогенных
факторов;
не требуется регистрация химических и физических
параметров, характеризующих состояние окружающей
среды;
фиксация скорости проходящих изменений в
окружающей среде;
обнаружение тенденций развития окружающей
среды;
обнаружение возможных путей попадания
токсикантов в пищевые цепи;
возможность оценки и контроля степени
воздействия загрязняющих веществ на живые организмы и
человека,
Экосистемы (или их звенья), наиболее
чувствительные к неблагоприятному воздействию
антропогенных нагрузок, называются критическими.
К критическим звеньям природных экосистем, где
аккумулируются загрязняющие вещества и создаются
высокие нагрузки на биоту, относятся: лесные
подстилки, лишайниково-моховые сообщества, степной войлок.
К критическим экосистемам относятся хвойные
леса, заметно реагирующие на различные виды
загрязнения (радиоактивное, промышленное и т. п.); в качестве
биоиндикаторов можно использовать доминирующие
виды травянистых растений: мятлик, вейник, клевер,
тысячелистник, полынь (см. Загрязнение радиоактивное,
Загрязнение промышленное).
Под влиянием атмосферного загрязнения в
значительной степени изменяется флористический состав
разных типов растительности — лиственных и хвойных
лесов, болот, пахотных и луговых угодий; изменения в
почвах ведут к смене видового состава растительных
сообществ. Биоиндикационные исследования проводят
на основе наблюдений над отдельными видами и
группами растений, особенно эпифитными лишайниками,
культурными растениями, древесными породами.
Индикатором состояния окружающей среды может
быть древесная растительность. Установлено, например,
что в ряде районов Подмосковья плохое состояние одно-
43 Биоиндикация
возрастных, особенно чистых, ельников объясняется
загазованностью, запыленностью окружающей qpeAU,
уплотнением почвы, а также неблагоприятными
условиями роста и развития деревьев внутри самого леса.
Изменяется строение, состав ельников, появляются
специфические болезни ели.
Заболевания деревьев и гибель лесов в результате
деятельности человека требуют интенсивного изучения.
Особенно сильно страдают леса верхнего высотного
пояса в горах и в основном зрелые насаждения из
хвойных пород — пихты, ели, сосны; заболевания
затрагивают также буковые леса.
В ФРГ контроль за выбросами металлов (см.
Выбросы загрязняющих веществ) на больших площадях
проводят с помощью стандартных растительных инди-
KaTqpoB — райграса, ели, HeKOTqpbix
сельскохозяйственных культур, а также мхов и лишайников. Наряду с
учетом повреждений растений (обесцвечивание,
опадение листьев, некрозы и др.) проводят биохимические и
экологические исследования, химические анализы.
По степени пораженности листьев предложена
система оценки устойчивости (чувствительности) хвойных
и широколиственных древесных пqpoд к загрязняющим
веществам (S02, фториды) для дальнейшей оценки
экологического ущерба и степени воздействия загрязнений
на лесные ресурсы.
При биоиндикационных исследованиях используют
показатель — биосферный потенциал леса,
представляющий собой произведение продуктивности на
биомассу. Для различных типов леса, как и для разных
пород деревьев, этот потенциал будет неодинаковым.
В качестве биоиндикаторов можно использовать
животных, особенно почвенную фауну, составляющую до
99 % биомассы и 95 % всех видов, входящих в
наземный зооценоз (HanpHMqp, дождевые черви). Главные
требования при выборе животных-биоиндикаторов:
высокая численность, интенсивный обмен веществ,
интенсивное размножение, легкость отбора, чувствительность
к изучаемому фактору.
Структурные реакции сообществ на антропогенное
воздействие заключаются в качественных и
количественных нарушениях разнообразия и видового состава:
Биоредуценты 44
на уровне популяции — в изменении величины
значимости отдельных видов (численность вида,
проективное покрытие, фито- или биомасса);
на уровне особи — в аномалии общей морфологии,
микроанатомии, химического состава.
Б И О Р ЕД У ЦЕ НТЫ. Микроорганизм ы, способные
разлагать органические вещества до простых
минеральных химических веществ в естественных и в
антропогенно нарушенных экосистемах (см. Экосистема).
Биоредуценты применяют для биологической
очистки сточных вод, особенно используемых вторично в
качестве удобрений.
БИОТА ПОЧВЕННАЯ (от греч. biote —жизнь). Вся
совокупность живых обитателей почвы. Синоним —
термин «эдафон», введенный немецким биологом Р.
Франсе для обозначения совокупности. организмов,
обитающих в почве и представляющих замкнутое сообщество.
В почве функционируют высшие растения (их
корневые системы) и низшие — водоросли. Почва служит
местообитанием для различных животных—как
позвоночных, так и беспозвоночных, простейших. В почве
находятся такие низшие организмы, как почвенные
грибы, лишайники и различные микроорганизмы
(бактерии, актиномицеты, вирусы).
От деятельности почвенной биоты в значительной
мере зависят структура почвы, образование гумуса,
содержание в почве азота, превращения ряда
минеральных веществ. Почва, с одной стороны, выступает как
среда обитания для населяющей ее биоты. С другой
стороны, живой компонент почвы, ее
биота—неотъемлемая часть почвы, определяющая ее функциональную
роль в биогеоценозах суши (см. Биогеоценоз). Среди
других почвенных компонентов биота — самый
динамичный, она наиболее быстро реагирует на
поступающие извне воздействия. Сообщества почвенных
организмов— это интегральный показатель
функциональных свойств почвы и индикатор ее состояния.
Показатели, характеризующие состояние почвенной
биоты и биологическую активность почв (см.
Активность почв биологическая), можно использовать для
контроля антропогенного воздействия на почву (Бабье-
ва, Зенова, 1989). Почвенная биота играет громадную
45 Биота почвенная
роль в самоочищении почв (см.) от химического
загрязнения (см. Загрязнение почвы химическое).
При загрязнении пестицидами (см.) почвенные
микроорганизмы участвуют в трансформации этих
веществ, иногда вызывая полную потерю токсических
свойств препаратов, иногда трансформируя пестициды
в другие токсические соединения с разными спектрами
ингибирующего или стимулирующего действия.
При многократном использовании и высоких дозах
некоторых пестицидов возможно селективное угнетение
биоты или отдельных биохимических процессов.
Например, фунгициды, применяемые против фитопатогенных
грибов, могут подавлять также сапрофитные почвенные
микромицеты и другие почвенные микроорганизмы.
Гербициды триазинового ряда вызывают подавление про-
теазы, в некоторых почвах — фосфатазы и увеличение
активности инвертазы и уреазы. Хлорорганические
пестициды, как показано И. П. Бабьевой, вызывают
подавление фосфатазы на 30—60%. Процесс
нитрификации в почве особенно сильно подавляется прометрином,
а также галогенированными фенолами, нитрофенолами,
хлоридами, хлоратами.
Биоиндикаторами на загрязнение почв тяжелыми
металлами (см.) могут быть различные группы
почвенных микроорганизмов. Из низших растений лишайники
концентрируют тяжелые металлы. Ведется разработка
методов определения степени загрязнения среды по
химическому составу лишайников (см. Лихеноиндикация).
Загрязнение почв нефтью приводит к увеличению в
почвах микроорганизмов, способных разлагать
углеводороды. Это в основном группы аэробных грамотрица-
тельных бактерий Pseudomonas, Methylococus, Methylo-
bacter, Methylosinus и др. Обнаружены также метано-
окисляющие дрожжи Candida и других родов. Нефть
стимулирует рост почвенных грибов родов Poeclimyces,
Fusarium. Скорость самоочищения почв от
нефтепродуктов в разных регионах нашей страны неодинакова.
На севере, особенно на поверхности заболоченных почв,
они могут сохраняться многие десятки лет, в степях
разложение нефтепродуктов идет быстрее. Так, в
полупустынных серо-коричневых солонцеватых почвах
содержание нефти за год снизилось на 65 %, при этом минера-
Ьиофильность элемента 46
лизовалось около 30%, а примерно 40% превратилось
в другие органические продукты.
БИОФИЛЬНОСТЬ ЭЛЕМЕНТА. Отношение
среднего содержания элемента в живом веществе планеты к
его кларку.
БИТУМЫ ПОЧВЕННЫЕ. См. Липиды почвенные.
БОНИТЕТ. Качественный показатель свойств лесов,
почв, лугов, других угодий с точки зрения их
хозяйственного использования.
БОНИТИРОВКА ПОЧВ (от лат. bonitas —
доброкачественность) . Сравнительная оценка качества почв по
их плодородию.
Оценку качества почвы проводят в условных
единицах (баллах), причем градации оценок существенно
различаются для почв разных зон и регионов. Бонитиро-
вочные материалы имеют существенное экономическое и
плановое значение, поскольку с ними связаны
ожидаемые уровни получения сельскохозяйственной продукции
и эффективность различных агрономических приемов
использования почв. Критерии бонитировки химически
загрязненных почв (см. Загрязнение почвы химическое)
практически не разработаны.
БРОМ В ПОЧВАХ. Содержание брома в земной
коре колеблется от 0,2 до 10 мг/кг, причем максимальные
концентрации характерны для глинистых отложений.
Содержание брома в горных породах
следующее, мг/кг:
Магматические горные
породы
Улътраоснсхвные (дуниты, перидотиты,
пироксениты)
Основные (базальты, габбро)
Средние (диориты, сиениты)
Кислые (граниты, гнейсы)
Кислые вулканические (риолиты,
трахиты, дациты)
Осадочные горные породы
Глины
Сланцы
Песчаники
Известняки, доломиты
0,2—1,0
0,5—3,0
1—4
0,3—4,6
0,2—1,0
5—10
6—10
1-^5
6
Большинство соединений брома по свойствам
аналогично соединениям хлора, поэтому в разных типах
горных пород наблюдается тесная связь между этими эле-
47 Буферная способность почв
ментами, а отношение Вг: О используют как показатель
для выделения различных геологических единиц.
К числу природных минералов брома относятся AgBr,
Ag(Br, CI, I), а также несколько полигалидов,
нестабильных в условиях гипергенеза.
Основные антропогенные источники загрязнения
почв бромом: автомобильные выхлопы, применение
фумигантов или пестицидов в газо- и парообразном
состоянии, использование калийных удобрений.
Содержание брома в почвах колеблется от 5 до
40 мг/кг. В торфах и почвах, обогащенных органическим
веществом, количество брома может достигать 120—
170 мг/кг. В почвах прибрежных районов Японского
моря содержание брома повышено до 500 мг/кг.
БУРТОВАНИЕ ГУМУСОВОГО ГОРИЗОНТА.
Складирование гумусового горизонта почв при проведении
планировочных работ, отчуждении территории для
дорожного строительства, горнодобывающей
промышленности и т. п.
Необходимость буртования вытекает из
исключительной и невоспроизводимой ценности гумусовых
горизонтов почв, обусловливающих почвенное плодородие и
уровни получения сельскохозяйственной продукции.
Сложенные в бурты гумусовые горизонты могут быть
эффективно использованы для повышения плодородия
почв, рекультивации различного рода отвалов, техно-
генно нарушенных земель, а также для восстановления
плодородия почв, загрязненных тяжелыми металлами,
нефтепродуктами и другими веществами (см.
Загрязнение почвы, Загрязнение тяжелыми металлами и
неметаллами).
БУФЕРНАЯ СПОСОБНОСТЬ ПОЧВ. Способность
почвы поддерживать химическое состояние на
неизменном уровне при воздействии на нее потоков химических
веществ природного или антропогенного характера.
Различают буфчрную способность к кислотам и
щелочам, окислительно-восстановительную, к
определенным катионам и анионам и химическим веществам.
Если сузить это понятие и из показателей химического
состояния выбрать важнейший и с экологической
позиции, и с точки зрения плодородия почв — состав и
свойства почвенного раствора, то буферность почв следует
Буферность почв кислотно-основная 4 ]
понимать как способность сопротивляться изменению
состояния почвенного раствора.
Мерой буферности может служить та величина
внешнего воздействия на почву (количество
миллилитров, миллиграммов, молей, добавленных к почве
кислоты или щелочи, окислителя или восстановителя,
катиона или аниона), которая ведет к изменению показателя
состава или свойства почвенного раствора (рН, Eh,
концентрации элемента в растворе) на единицу. Например,
таким показателем может служить количество кислоты,
которое необходимо добавить к почве, чтобы изменить
рН раствора на единицу, или то количество фосфора,
которое требуется внести в почву, чтобы изменить на
единицу концентрацию этого элемента в растворе.
Способность почв сопротивляться изменению свойств
почвенного раствора обусловлена существованием
стационарного состояния, квазиравновесия между
химическими элементами в почвенном растворе и в твердых
фазах почв. Внесенное химическое вещество в почвы,
обладающие буферностью, не поступает в почвенный
раствор, а удаляется из него в результате
взаимодействия с твердыми фазами почвы: образование
труднорастворимой соли, комплексного соединения, сорбция,
ионный обмен (см. Комплексные соединения, Сорбция
химических веществ почвой, Обмен ионный). В
зависимости от того, какой из этих процессов доминирующий,
различными будут природа буферности в разных
почвах, конкретный способ ее определения и влияние на
буферность почвенно-химических условий.
Как правило, чем богаче почва органическим
веществом и тонкодисперсными фракциями, чем выше
ЕКО почв (см. Емкость катионного обмена), тем более
устойчива она к химическому воздействию. В связи с
этим черноземные почвы обладают большей
буферностью, чем подзолистые; суглинистые почвы более
устойчивы к загрязнению, чем песчаные (см. Загрязнение
почвы.)
БУФЕРНОСТЬ ПОЧВ КИСЛОТНО-ОСНОВНАЯ.
Способность почвы противодействовать изменению рН
при добавлении к ней кислоты или щелочи.
Кислотно-основная буферность почвенного раствора
обусловлена присутствием в нем буферных систем, со-
Буферность почв кислотно-основная
держащих слабую кислоту и ее соль или слабое
основание и его соль, например:
СН3СООН-чН20—GH3iCOONa (1)
NH4OH—Н20—NH4CI (2)
Кислотно-основные свойства буферных систем в
растворе выражаются уравнением Гендерсона — Хассель-
баха:
[СНзСОО-]
pH = „K,+le 1Ш" (S)
^ ^ S [NH4OH] ^ '
Здесь рКа, рКо — константы диссоциации кислоты (1)
и основания (2), в скобках — концентрации
(активности) кислоты, основания и их солей.
Буферная способность этих систем связана с тем, что
при добавлении к первой из них сильной кислоты, а ко
второй сильного основания образуются слабодиссоции-
рующая кислота СН3СООН или слабодиссоциирующее
основание NH4OH, которые связывают добавленные
ионы Н+ и ОН~, и реакция среды при этом меняется
незначительно. Максимальная буферность раствора
проявляется при отношении соль/кислота =1 и соль/осно-
вание=1, когда рН = рК.
Буферность почвы в целом как гетерогенной
системы связана с присутствием в составе твердых фаз
химических веществ, способных вступать в реакции
нейтрализации с поступающими в почву кислотами или
основаниями. Наибольшую актуальность приобретает
изучение этого свойства почвы в связи с возрастающим
выпадением кислых осадков (см. Кислые дожди).
Из методов определения буферности почв к
воздействию кислот или оснований наиболее распространена
оценка по общему количеству кислоты (основания),
которое необходимо добавить к почве (почвенной
вытяжке), чтобы изменить рН на единицу. Для этого,
например, проводят потенциометрическое титрование.
Величина буферности зависит от рН. Существование
этой зависимости связано с тем, что природа
буферности обусловлена определенным характером взаимодейст-
Буферность почв по отношению к загрязняющим их металлам 50
вия добавленных кислоты или основания с
компонентами почвы.
Буферность почв к кислотным выпадениям при
рН>6,2 связана с растворением карбонатов. В области
1рН 4,2—5 буфзрность к кислотам обусловлена
обменными реакциями и вытеснением из ППК (см.
Почвенный поглощающий комплекс) обменных катионов. В
области рН<<4,2 устойчивость к кислотам связана с
растворением соединений железа и алюминия.
Изменению буферности почв способствует
растворение алюмосиликатов. В широком диапазоне рН
нейтрализующее действие на кислоты оказывают органические
вещества почв, буферность которых на порядок
превышает буферность минеральных компонентов почвы.
В соответствии с изложенными закономерностями
наибольшей буферностью к кислотным выпадениям
обладают почвы: хорошо гумусированные, карбонатные,
богатые тонкодисперсными минqpaлaми, с высокой
емкостью катионного обмена (см.) и преобладанием qpeAH
обменных катионов (см. Катионы обменные) кальция и
магния.
БУФЕРНОСТЬ ПОЧВ ПО ОТНОШЕНИЮ К
ЗАГРЯЗНЯЮЩИМ ИХ МЕТАЛЛАМ. Способность почвы
поддерживать концентрацию металлов в почвенном
растворе (см.) на постоянном уровне.
Это свойство почвы обусловлено присутствием в
почвенном растворе анионов, с которыми металлы могут
образовывать труднорастворимые осадки, а также
ионным обменом (см. Обмен ионный) с участием
внесенных металлов и безобменным поглощением их TBqpAbi-
ми фазами почвы. Чем больше в почве подвижных
соединений металлов в твердых фазах, тем больше
способность ее сохранять концентрацию этих металлов в
растворе.
Буферность почв по отношению к металлам можно
определять различными способами. Приводя в
равновесие почву с солевыми растворами, содержащими
переменные концентрации металлов, находят то количество
металла, которое требуется внести в почву, чтобы его
концентрация в растворе повысилась на единицу. Чем
больше эта величина, тем выше буферная способность почв.
По результатам этого эксперимента можно вычис-
51 Буферность почв по отношению к фосфору
лить буферную способность по отношению к металлам
так же, как и при определении буферности почв по
отношению к фосфору (см.): приводя почву в равновесие
с растворами 0,01 М СаС12, содержащими переменные
концентрации металлов, определить равновесные
концентрации и по результатам опыта построить график
зависимости ±А Me — Сме, где ±Д Me — количество
металла, поглощенного из почвы, Сме — количество
металла, отданного почвой в раствор. По графику (см.
Буферность почв по отношению к фосфору) находят
QMe и /ме и вычисляют потенциальную буферную
способность (ПБС) по отношению к данному металлу:
nBCMe=QMe//Me.
Используют и такой способ определения буферности
почв по отношению к металлам: количество подвижных
соединений металлов определяют в вытяжке 1 н.
CH3COONH4, за характеристику равновесной
концентрации Me в растворе принимают его концентрацию в
слабосолевой вытяжке, например 0,1 н. КО, 0,01 М
СаС12, 0,01 М Ca(iN03)2 и находят ПБСМе как частное
от деления а^ржания металла в первой вытяжке на
содержание его во второй.
Определять буферность почв по отношению к
металлам целесообразно для предварительной оценки
допустимых размеров антропогенной нагрузки на почвы, для
выделения почв, в различной степени способных
сопротивляться загрязнению металлами, а также при
проведении различных экологических экспертиз, цель
которых— получение сведений об устойчивости почв к
загрязнению.
БУФЕРНОСТЬ ПОЧВ ПО ОТНОШЕНИЮ К
ФОСФОРУ. Способность почвы поддерживать концентрацию
фосфатов в почвенном растворе (см.) на постоянном
уровне.
Буферность почв по отношению к фосфору
обусловлена присутствием в растворе Са, Mg, Fe, A1, Мп, с
которыми фосфат-ионы образуют осадки, а также
взаимодействием фосфат-ионов с поверхностью твердых фаз
почвы. Это могут быть реакции хемосорбции
поверхностью кальцита с образованием нового химического
соединения или реакции обменного и безобменного
поглощения с участием ионов ППК (см. Почвенный по-
Буферность почв по отношению к фосфору
52
- ДР
График для определения буферности почв по
отношению к фосфору
глощающий комплекс). Чем больше в почве подвижных
фосфатов, тем выше устойчивость почв по отношению
к поступившим дополнительным количествам фосфора.
Показатель информативен при прогнозе концентрации
фосфора в растворе почв, подверженных загрязнению
фосфорными соединениями, поступающими с
удобрениями или имеющими техногенное происхождение.
Понятие потенциальной буферной способности почв
по отношению к фосфору (ПБСР) введено П. Бекеттом
и Р. Уайтом. Определяют ПБСР следующим образом.
Несколько навесок почвы заливают растворами 0,01М
СаС12, содержащими переменные количества фосфат-
ионов. После установления равновесия в растворе
определяют концентрацию фосфат-ионов и рН. Если
равновесная концентрация фосфат-ионов ниже, чем
исходная, значит, почва поглотила из раствора фосфат-ионы
( + АР). Если равновесная концентрация фосфат-ионов
выше исходной, то почва отдала ионы в раствор из
состава твердых фаз ( — АР). Благодаря возможности
протекания этих реакций почва обладает способностью
53 Вермикулиты
сопротивляться изменению концентрации фосфат-ионов
в растворе.
На основании этого строят график (рис.), где ось
абсцисс — равновесная концентрация фосфат-ионов в
растворе; ось ординат — количество поглощенного
почвой из раствора или отданного в раствор фосфора
(±АР). Линия графика пересекает ось абсцисс в точке
/, соответствующей концентрации фосфат-ионов в
реальном почвенном растворе. Точка пересечения линии
графика с осью ординат (Q) соответствует количеству
подвижных фосфатов в почве. Отношение Q/I служит
мерой потенциальной буферной способности почв по
отношению к фосфору. Чем выше этот показатель, тем
более постоянен уровень фосфора в почвенном растворе.
В связи с разнообразием реакций, в которых может
участвовать фосфор, почвы могут проявлять буферность
к фосфору в широком диапазоне почвенно-химических
условий. Низкая буферность свойственна легким,
бедным органическим веществом почвам.
в
ВЕРМИКУЛИТЫ. Широко распространенные в
почвах трехслойные ди- и триоктаэдрические
глинистые минералы с обобщенными формулами (Са,
Mg...) (Mg, Fe) з (ОН) 2 [Al, Si) 4O10] - 4H20.
Обладая высокой поглотительной способностью,
вермикулиты могут снижать концентрацию загрязняющих
веществ в почвенном растворе. Характеризуются
средней величиной постоянного отрицательного заряда
(0,6—0,7 на элементарную ячейку), расположенного в
тетраэдрах и возникающего за счет изоморфного
замещения Si на А1. Заряд компенсируется катионами,
расположенными на поверхности частиц и в межпакетных
промежутках (см. Глинистые минералы).
Вермикулиты способны к межпакетной сорбции
веществ (см.) и поэтому обладают высокой емкостью ка-
тионного обмена (см.) —до 160 мг-экв на 100 г
минерала. Так же, как и монтмориллониты (см.),
вермикулиты поглощают многие тяжелые металлы (Cd2+, Co2+,
Cu2+, ,Ni2+, Pb2+, Zn2+) и радионуклиды (90Sr), причем
Войлок 54
основной механизм поглощения — ионный обмен (см.
Обмен ионный). Вермикулиты обладают способностью
к сорбции пестицидов, которые удерживаются на
поверхности этих минералов водородными связями и ван-
дерваальсовыми силами.
В отличие от низкозарядных монтмориллонитов,
вермикулиты, как имеющие более высокий заряд,
характеризуются ограниченной способностью к набуханию и
высокой фиксирующей способностью по отношению к
катионам К+, Rb+, NH4+ и Cs, в том числе к
радиоактивному 137Cs (см. Фиксация катионов почвами).
Вермикулиты в составе илистой фракции (см.
Илистая фракция почв) наиболее широко распространены в
подзолистых почвах западных и северо-западных
регионов европейской части СССР, где этот минерал
составляет до 20—40 % илистой фракции. В почвах
других регионов вермикулит встречается преимущественно
в верхних горизонтах как продукт выветривания слюд
и иллитов, его содержание обычно не превышает
нескольких процентов массы илистой фракции.
ВОЙЛОК. Аналогичный лесной подстилке слой в
травянистых растительных сообществах,
ВОСКО-СМОЛЫ. См. Липиды почвенные.
ВРЕМЯ САМООЧИЩЕНИЯ ПОЧВ (синоним —
скорость детоксикации). Продолжительность периода, за
который почва с нарушенными свойствами, процессами
возвращается в свое первоначальное состояние.
Время самоочищения почв зависит от защитных
буферных свойств самой почвы, природы нарушений и
биоклиматического пояса, в котором находится почва,
то есть от скорости биологического круговорота веществ
и других факторов (см. Самоочищение почв, Детокси-
кация почв). В ряде случаев, напримзр по отношению к
стойким загрязняющим веществам (см.), когда
самоочистительная способность почв близка к нулю, время
самоочищения приближается к бесконечности.
Продолжительность пребывания химических
загрязняющих веществ в почвах гораздо больше, чем в
других компонентах биосферы, и загрязнение почв,
особенно тяжелыми металлами (см.), по-видимому,
практически вечно (Кабата-Пендиас, Пендиас, 1989).
Металлы, накапливающиеся в почве, медленно удаляются
55 Время самоочищения почв
с током нисходящей миграции вниз по профилю (см.
Миграция химических соединений), при потреблении
растениями (вовлечение в биологический круговорот),
при эрозии и дефляции. Это происходит вследствие
того, что тяжелые металлы слабо вовлекаются в
биологический круговорот (не являются элементами питания
растений), их соединения подвержены слабой
химической 'I^paнcфqpмaции в почвах, и почвенные
микроорганизмы могут оказывать только небольшое воздействие
на снижение загрязнения почвы тяжелыми металлами.
К опасной группе химических загрязняющих веществ
относятся также пестициды, представляющие собой яды
широкого спектра действия (см. Загрязнение
пестицидами). Особую опасность представляют стойкие и
кумулятивные пестициды, персистентность которых
достигает нескольких лет. Полная детоксикация пестицидов
происходит лишь при их распаде на нетоксичные
компоненты. Разложению токсикантов способствуют
реакции окисления, восстановления, гидролиза. Наиболее
активно разлагаются пестициды микроорганизмами.
Длительность токсического действия некоторых
биоцидов (а их счет ведется на тысячи), по данным ФАО,
следующая, лет:
Инсектициды Гербициды
Гептахлор 9 Диурон 16
Альдрин 9 Симазин 17
ДДТ 10 Атразин 17
ГХГЦ 11 Монурон 36
Наибольшей стойкостью к разложению отличаются
хлорорганические пестициды группы диенов. Они
сохраняются в почве в течение нескольких лет. Фосфорорга-
нические соединения и их производные теряют свою
токсичность менее чем за три месяца и при распаде не
образуют токсичных метаболитов.
Время самоочищения почв от пестицидов зависит от
применяемой дозы препарата. Как правило, с
увеличением дозы возрастает время самоочищения почв. С
повышением температуры почвы период полураспада
пестицидов уменьшается. Например, период полураспада
линдана сокращается на 14,2 дня при увеличении
температуры почвы от 4 до 40 °С. На время детоксикации
Время самоочищения почв
56
б
а
(
£
Хлордан
1
ДДТ
1
"" '""" ' ГХЦГ
|_
'Гешахлор
1 1 1 1
D 1 2 3 4 f
Го,
i
Трифлуралин
|
"J2M-4X
12,4-Д
1
Пропазин
1
^.имазин
1
Атразин,монурон
1
Фенурон,диурон
■Прометрин
\ I I I I I I I I I I
) 0 2 4 6 8 10 12 14 16 18 20
цы Месяцы
Г
ТХА
1
Далапон
|
3
1 1 1 1 1 1 1 1 1 I 1 1 I
3 123456 0 2468 10 \2
Месяцы Недели
Время детоксикации в почве некоторых пестицидов (по
А. Реуце):
а — хлорорганические инсектициды, гербициды на основе, б —
мочевины, триазинов и пиклорама, в — феноксиацетатов, толуидина и
нитрилов, г — карбонатов и алифатических кислот
пестицида большое влияние оказывает как природа
самого химического вещества, так и свойства почв. Фос-
фороргаыические пестициды, например, весьма
устойчивы в слабокислой среде. На нейтральных почвах
(чернозем) метафос сохраняется около 1,5 месяца, на опод-
золенных черноземах с рН 5,5 — около года; фозалон в
этих же условиях распадается за 3 месяца и 1,5 года
соответственно.
Устойчивость пестицидов в почве по классам
соединений показана на рисунке.
Загрязнение почв нефтью и нефтепродуктами (см.
Загрязнение нефтью и нефтепродуктами) приводит к
заметному сдвигу в составе биоты Появляется много
новых групп микроорганизмов, способных разлагать
углеводороды. К настоящему времени признаны разлагае-
57 Время самоочищения почв
мыми следующие ароматические углеводороды: с одно-
кольцевой структурой — бензол, толуол, ксилол, триме-
тилбензол, тетраметилбензол, циклоалкилбензол; с
двухкольцевой структурой — нафталин, метилнафталин,
диметилнафталин; с трехкольцевой структурой — фе-
нантрен, антрацен; полициклические соединения — пи-
рен, бензпирен, бензантрацен.
Скорость самоочищения почв от нефти и
нефтепродуктов различна для разных природных зон. В
аридных областях (см. Аридные территории) основная
тяжесть по снижению концентрации нефти в почвах
ложится на микроорганизмы. В холодных гумидных
областях продуктивность микроорганизмов ниже, зимой
она вовсе незначительна. Основные причины снижения
содержания нефти в почвах следующие: испарение
легких фракций, минерализация нефти, физический вынос,
гумификация (превращение в HepacTBqpHMbie в
нейтральных органических растворителях продукты
микробного метаболизма). От соотношения этих факторов
и будет зависеть время самоочищения почв от
загрязнения нефтью и нефтепродуктами. Так, содержание
нефти, внесенной в светлые серо-коричневые почвы сухих
субтропиков, за первые т]ри месяца снизилось больше
чем наполовину, а через год — на 65 %. Расчет баланса
углерода показал, что за год минерализовалось не
более 27 % внесенной нефти. Основное же количество
остаточной нефти уменьшалось за счет гумификации и
частично минерализации. В гумидной зоне средней и
южной тайги за три месяца содержание остаточной
нефти снизилось до 30 %, а за год — до 10 % от
внесенного количества. Причем основная масса нефти была
вынесена водным стоком. Таким образом, более
высокая скорость самоочищения почвы в этой зоне только
кажущаяся. Нефть подвергается не разложению, а
рассеивается, загрязняя почву сопряженных территорий и
грунтовые воды. На севере, в зоне тундры на noBqpx-
ности заболоченных почв и болот нефть и
нефтепродукты могут сохраняться десятки лет.
Пребывание в почвах бензпирена — одного из
наиболее опасных канцерогенных полициклических
ароматических углеводородов — при многократном
поверхностном попадании в почву в условиях промышленного
Выбросы загрязняющих веществ 58
загрязнения (см. Загрязнение промышленное)
оценивается пзриодом времени около двух лет. Снижение
концентрации бензпирена в верхних слоях почвы
происходит как за счет его деградации в результате процессов
окисления, биодеградации, сорбции корнями растений,
так и за счет миграции вещества в глубь почвы.
ВЫБРОСЫ ЗАГРЯЗНЯЮЩИХ ВЕЩЕСТВ.
Отходы, образующиеся в результате антропогенной
деятельности, поступление которых в окружающую среду —
неотъемлемое звено техногенеза (см.).
Выбросы подразделяют на газопылевые, жидкие,
твердые, газо-, парообразные. Выбросы различных
отраслей промышленности различаются по количеству и
качественному составу. Так, современные тепловые
электростанции выбрасывают в атмосферу до 50 %
оксида серы от их общего выброса в атмосферу. В черной
металлургии при выплавке каждой тысячи тонн стали
в атмосферу выбрасывается 40 т пыли, 30 т диоксида
серы, 50 т оксида углерода. В химической
промышленности при производстве серной и азотной кислот на
каждую тысячу тонн продукции приходится до 20 т
оксидов азота и диоксида серы.
Выбросы загрязняющих веществ по отдельным
отраслям промышленности распределяются в следующем
соотношении, %:
Общий выброс пыли 100
Промышленность стройматериалов 35
ТЭЦ 30
Автотранспорт 16
Черная металлургия 12
Химическая промышленность 4,6
Цветная металлургия 2
Нефтеперерабатывающая промышленность 0,5
Общий выброс оксида серы 100
ТЭЦ 50
Автотранспорт 20
Цветная металлургия 18
Черная металлургия 7
Нефтеперерабатывающая промышленность 2
Химическая промышленность 1
Промышленность стройматериалов 0,4
Общий выброс оксидов азота 100
ТЭЦ 72
Автотранспорт 17
Черная металлургия б
59 Выбросы загрязняющих веществ
Промышленность стройматериалов 2
Химическая промышленность 1,7
Нефтеперерабатывающая промышленность 0,6
В зависимости от характера выбросов их делят на
массовые и немассовые. Массовые (или
залповые) выбросы загрязняющих веществ необходимо
учитывать в первую очередь, так как они резко
изменяют санитарно-гигиеническое состояние природной
среды. При аварийных ситуациях немассовые выбро-
с ы могут стать массовыми, например, в случае
взаимодействия с другими загрязняющими веществами.
Различные возможности контроля выбросов
обусловили их деление на две группы: организованные и
неорганизованные.
Организованные (или согласованные)
выбросы вредных веществ в атмосферу, водоемы,
почвы ведут с использованием специальных устройств:
труб, компрессоров, очистных сооружений, заводских
факелов, печей сжигания, шламовых площадок, шламо-
накопителей. Организованные выбросы обычно
содержат значительные количества токсических веществ,
которые можно контролировать, устанавливая предельно
допустимые согласованные выбросы (ПДСВ) для
данной территории.
Неорганизованные выбросы невозможно
вывести в нейтрализующую среду. К ним относятся
утечки через неплотности в аппаратах, арматуре,
магистралях; испарение с поверхности сточной жидкости в
системах канализации и сооружениях очистки сточных
вод; испарение продуктов из резервуаров и хранилищ;
разливы и залповые выбросы продуктов при авариях и
пожарах. Появление неорганизованных выбросов
связано с причинами производственного xapaKTqpa. В этом
случае контроль загрязнения проводят определением
содержания поллютантов (см. Загрязняющие вещества) в
различных объектах окружающей среды (см.).
При инвентаризации вредных выбросов определяют
источник и место выброса, состав и количество
загрязнений в отходящих газах или сточных водах (см.), а
также максимальную расчетную концентрацию
вредных веществ в приземном слое после рассеивания.
Вытяжка из почв водная 60
ВЫТЯЖКА ИЗ ПОЧВ ВОДНАЯ. Раствор,
полученный при добавлении дистиллированной воды к почве для
определения содержания и катионно-анионного состава
солей в почвах, а также других водорастворимых
веществ.
Такую вытяжку традиционно используют при
обследовании и контроле солевого режима почв. Согласно
ГОСТ 26423—85 — ГОСТ 26428—85, водные вытяжки
из засоленных почв готовят при отношении почвы к
воде 1:5 и взбалтывании в течение 3 мин или
настаивании суспензии — 5 мин.
Водную вытяжку анализируют непосредственно после
ее получения. В ней с помощью рН-метра
определяют рН.
Кондуктометром в вытяжке измеряют удельную
электрическую проводимость, а при отсутствии
кондуктометра находят плотный остаток вытяжки.
Карбоиат-ионы определяют титрованием раствором
серной кислоты до рН 8,2 (конечную точку титрования
устанавливают по изменению окраски фенолфталеина);
бикарбонаты — титрованием раствором серной кислоты
по индикатору метиловому оранжевому до рН 4,4.
Xлqpид-иoны в водной вытяжке анализируют одним
из трех методов: аргентометрически по способу Мора,
основанному на образовании осадка хлорида серебра;
методом прямой ионометрии с использованием хлорид-
ного ионселективного электрода; методом ионометриче-
ского титрования, сущность которого состоит в
титровании иона хлорида раствором нитрата серебра и
индикации конечной точки титрования с помощью
ионселективного электрода.
Сульфат-ионы определяют после их осаждения
хлоридом бария либо весовым, либо турбидиметрическим
методом.
Кальций и магний определяют комплексонометриче-
ски при последовательном комплексонометрическом
титровании в одной пробе сначала ионов кальция при рН
12,5—13, затем ионов магния при рН~10 с
применением в качестве индикатора хрома кислотного темно-
синего. Анализируют вытяжку на содержание кальция и
магния также атомно-абсорбционным методом, исполь-
61 Вытяжки из почв для извлечения подвижных соединений
зуя аналитические линии 422,7 нм и 285,2 нм
соответственно.
Натрий и калий определяют пламеннофотометриче-
ским методом по аналитическим линиям 589 и 589,9 нм
(Na) и 766,5 и 769,9 нм (К).
Результаты анализа выражают в следующих
единицах: %, мг-экв/100 г, мг/л, ммоль/л.
Анализы водных вытяжек проводят также при
исследовательских работах с целью идентификации
соединений химических элементов в твердых фазах почв.
Для идентификации соединений химических элементов
используют диаграммы растворимости (см.).
Имеется опыт исследования водных вытяжек из
загрязненных почв на содержание металлов. Проводили
анализы техногенно нарушенных почв зоны
промышленного загрязнения и почв, искусственно загрязненных
пылью с фильтров промышленных предприятий или
оксидами металлов (до 500 мг Hg, Са, Pb, Zn на 1 кг
почвы) в условиях вегетационных или микрополевых
опытов. Установлено повышенное по сравнению с
контролем содержание металлов в водных вытяжках из
загрязненных почв (особенно заметное в начальные
сроки наблюдения), которое через 1—3 года после
загрязнения на порядок и более превышает контрольный
уровень. Концентрация металлов в водных вытяжках
зависит от дозы, химических особенностей металлов и от
свойств почв.
вытяжки из почв для извлечения
подвижных СОЕДИНЕНИЙ МИКРОЭЛЕМЕНТОВ.
Растворы, полученные при взаимодействии почв с
растворами разбавленных кислот, солей и комплексообра-
зователей для оценки обеспеченности почв
микроэлементами, для разработки на этой основе рекомендаций по
внесению микроудобрений, для выявления почв,
загрязненных этими элементами, и исключения их из
сельскохозяйственного пользования.
Выбор реагентов для извлечения микроэлементов
основан на удовлетворительном соответствии
экстрагируемых количеств и содержания их в растениях,
выращенных на тех же почвах в условиях вегетационного
или полевого опыта.
Вытяжки из почв для извлечения подвижных соединений 62
Характеристики методов и вытяжек для извлечения
из почв микроэлементов, а также градации
обеспеченности некарбонатных почв микроэлементами,
определяемыми этими методами (в разных вытяжках), приведены
в таблицах.
В загрязненных почвах, подверженных
антропогенному воздействию, наблюдается повышенное
содержание металлов (Си, Zn, Cd, Pb, Cr, Ni), извлекаемых
растворами: 1 н. CH3COONH4 и 1 н. HN03. Вытяжку 1 н.
HN03 готовят при отношении почва : раствор 1 : 10 и
взбалтывании суспензии в течение 1 ч.
По уровням содержания металлов в этих вытяжках
устанавливают зоны загрязнения. Информативность
вытяжки 1 н. HN03 связана с тем, что этот экстрагент
растворяет оксиды металлов, в форме которых
преимущественно поступают пылевые выбросы в зону
загрязнения.
Согласно ГОСТ 3210—85, ПДК в почвах цинка,
экстрагируемого 1 н. CH3COONH4, составляет 23 мг/кг.
вытяжки из почв для извлечения
подвижных СОЕДИНЕНИИ ФОСФОРА И КАЛИЯ.
Растворы, полученные при взаимодействии почв с
разбавленными кислотами и солевыми растворами,
определение в которых концентрации фосфора и калия
позволяет оценить обеспеченность сельскохозяйственных
культур, выращиваемых на этих почвах, фосфором и
калием, а также пригодность почв для
сельскохозяйственного использования.
Методы получения и анализа вытяжек в
модификации ЦИНАО приведены в ГОСТ 26204—84 —
ГОСТ 26213—84. В таблице даны характеристики этих
методов и вытяжек, применяемых для извлечения
фосфора и калия, установлены градации обеспеченности
почв подвижными соединениями фосфора и калия с
учетом специфических особенностей
сельскохозяйственных культур. Например, некарбонатные почвы в qpeA-
ней степени обеспечивают зерновые культуры при
содержании 8—15 мг Р205 в вытяжке 0,2 М НС1 и 5—
10 мг Р205 на 100 г почвы в вытяжке 0,5 М СН3СООН,
а овощные культуры соответственно при содержании
подвижных фосфатов 20—30 и 15—20 мг на 100 г
почвы.
63
Вытяжки из почв для извлечения подвижных соединений
09
Э*
О
С
м
S
02
О
н
S
4>
2
эле:
о
сх
м
S
2
tX
Я
О)
S
еди
о
о
X
з
S
*
S
03
г*
о
Б
ния
<Ь>
В*
0>
Ч
са
«
s
к
Ч
Pt
S
*
*
К
н
з
ей
сз
*
о
Н
о>
S
2
(X
о
*-
а
<
3
0Q
S*
°
С-
05
*£
* 2
Но
«в §
2 н
to °
m 3
к ю
ю
а>
S..O.
н с о.
О
°*
а»
н
<■>
СЗ
а.
«в
s
2
о*
я
се
си
н
а
и
CD !
н
и
а>
ч
СО
О
сх
Н
сх
О)
сх
О
о
о
PQ
*
о
Н
я
я
я
а,
а я
я сз
v§ °*°
4
Is.
ex £
ex :
О
о
4
it
о
ю
а.
я w
о
Н
о я
тГ* Я
»Я
3
я
сх
а>
•в-
vo
со
со"
3 сх
О
с*
ч
ей
ё
О
В
о
ел
CJ
X
и
X
о
Z
д
^н ^ ^ <
»я
3
я
Он
О
00
»Я о,
3
Е £
Я аз
сх
»я
3
я
сх
О)
со"
*Я Q,
д сх
н
Во
Я ctJ
< сх
СО
о
с
3
о
с*
N
Вытяжки из почв для извлечения подвижных соединений 64
05 «
Я ^
*^
° £
о 3
са
s
S CQ
X X
* s
« 2
о 5
!1
X
о>
аг
О)
обесп
s
S
а*
а
X
о.
с
ентов
2
ч
<Т>
о
t=C О.
сз
£
CuS
U
г
ЛЛЛЛЛЛ
т
—Гю о" —« ci od
ЛЛЛЛЛЛ
Nbobcob
о
т
ОО^ОООООО
о
я
о
со
«
сЗ
Г^ОСО о СО О
1 1 1 1 1 1
rf —н Tf LO О СО
ocn'"!^ *-Го
о
I
ОСТ) —^об*
~ ■ I I I I
^ОСОЮСОО
dco V dd
Tt« СО —н о> СМ -ч
ЛЛЛЛЛЛ
rh со ^^ оь »-н
,1111 t
О
Я
н
>> ^TcoOcQCN'^'
« I I I I I 1
О
С
■^
Ч^Лю0.00.
0<NO(N^O
1 1 II 1 1
CM <Ji ОО '—• "* CS
о~о~Я о о
о
о
а
СО
^OCN^CQO
о" со" о" ю о" со
1 1 1 1 II
М^ОЮЦЗО
о^г-г^-г^
о о
я
с
а>
о
о
X
>>
ю
cn оо^^оосо
777777
^ оюсо со со
©~ГЯ<©о©
о
00
С^О^С? О ^ СЧ
о" о" сГ ^ о о
VVVVVV
оюю
VVVVVV
1Л
г^О О СО СО СО
о—^ocdoo*
VVVVVV
«CjSSUN
«и«5<ЗЙ
«5ss5«S
65
Вытяжки из почв для извлечения подвижных соединений
3
Си
X
си
о
о
о
ign
05 Н О О
SO м
<u« 2
3 CL,
X
2
5
CQ
&
CD
а
я
о
Я
S
CD
я
сЗ
«. CL, CQ
« »c
ч a |
•• CO •• S
— Л—i Я
s
s
я
Эгнер — P
Доминго
a
s
я
Эгнер — P
Маслова
Аррениус
<u
UJ
я
e-
яЗ
Я
О
\o
я
н
03
я
о
\о
сх
03
и*
* <м <м
а I I
С7> оо
СО —• --
т
очвь
с
<\)
о
CQ
D*
•—•
|бон
оз
«
CD
X
S*
'^t*
7
1
см
<М
о
СМ
U
X
см
о
О
с/)
ю
о
о
К
( )
О
и
U
iQ
О
О
О
сэ
X
X
—Q. .
^£
—i G,
О
см
Я я
о. я
о
Ю R
4> g(j со
Ю 4CJ Л
Л I
озю
о «
ер
я.
Л Л нч
рГ оГ оГ
PqSK
о
о
и
£
х
я
о
к
*=3
03
|=3
ас *
X CU
Гажа 66
Содержание подвижных соединений фосфора и
калия в почвах используют как показатель деградации
антропогенно нарушенных почв, а также как косвенный
показатель состояния загрязненных почв.
г
ГАЖА (синоним — землистый гипс). Природное
глинисто-гипсовое, иногда карбонатно-глинисто-гипсовое
образование, содержащее не менее 20 %
мелкокристаллического гипса и обычно не имеющее в своем составе
легкорастворимых солей.
Гажа встречается в виде прослоек и слоев
различной мощности в почвах и почвообразующих породах
аридных территорий (см.). Ее используют для
гипсования солбнцовых и содовых почв.
ГАЛОГЕНЫ. В число галогенов входят фтор F, хлор
С1, бром Вг, иод I.
Все они могут быть опасными загрязняющими
веществами (см.).
Из элементов, входящих в группу галогенов, только
хлор содержится в почвах в макроколичествах, фтqp,
бром, иод относятся к микроэлементам. Галогены в
природных условиях образуют простые анионы, для
иода характерны кислородные соединения. Галогены
подвижны в почвах и земной коре. Иод энергично
образует соединения с органическими веществами.
ГИДРОКСИДЫ ЖЕЛЕЗА И АЛЮМИНИЯ.
Широко распространенная в почвах группа минералов
класса оксидов, представленных преимущественно тонкими
частицами (<5 мкм).
Из этой группы в почвах чаще всего встречаются
следующие минералы: гетит a-FeOOH, лепидокрокит
7-FeOOH и гиббсит А1(ОН)3. В почвах влажных
тропических и экваториальных регионов содержание этих
минералов достигает 20—40 % массы тонких фракций; в
почвах умеренного пояса гиббсит обычно отсутствует, а
содержание гетита и лепидокрокита составляет от
нескольких десятых процента,до нескольких процентов от
массы тонких фракций.
57 Гидролиз почвенных соединений
Гетит представлен цепочечными структурами, лепи-
докрокит — слоями октаэдров, в центре которых
находится железо, а в вершинах — ионы кислорода и
гидроксогруппы. Часть Fe в октаэдрах может быть
замещена А1. Гиббсит имеет сложную структуру. Слои
состоят из октаэдров, в центре которых находится Al, a
в вершинах — гидроксогруппы.
Находящиеся на поверхности частиц гидроксидов
железа и алюминия гидроксогруппы и ионы кислорода,
в зависимости от рН окружающего раствора, способны
протонироваться и депротонироваться, - обусловливая
при этом соответственно положительный или
отрицательный заряды поверхности. Поэтому минералы
гидроксидов железа и алюминия в почвах — одни из главных
носителей заряда, зависимого от рН и рН ЕКО (см.
Заряд почвенных коллоидов переменный, Емкость
катонного обмена), обладают способностью к сорбции
анионов при рН ниже точки нулевого заряда (см.) и
сорбции катионов при значениях рН выше (см.
Сорбция анионов почвами, Сорбция химических веществ
почвой) точки нулевого заряда.
По способности адсорбироваться на поверхности
гидроксидов железа и алюминия анионы располагаются в
ряд: фосфат>арсенат>селенит>молибдат>сульфат>
>фторид>хлорид>нитрат. В почвах, имеющих
значения рН, превышающие точку нулевого заряда, гидро-
ксиды железа и алюминия могут поглощать из
раствора тяжелые металлы (см.).
ГИДРОЛИЗ ПОЧВЕННЫХ СОЕДИНЕНИИ (греч.
hydor — вода, lysis — разложение). Реакция разложения
вещества с помощью воды, при которой ионы Н+ или
ОН" воды связываются ионами растворенного вещества
с образованием менее диссоциированного, чем вода, или
т)pyднqpacтвopимoгo соединения.
В природе распространены реакции гидролиза солей
и минералов. Гидролиз играет важную роль в
процессах выветривания и почвообразования.
Породообразующие минералы при выветривании подвергаются
гидролизу. При этом медленно разрушается кристаллическая
решетка силикатов. Чем богаче силикат катионами, тем
менее он устойчив * к выветриванию. Например,
гидролиз полевых Шпатов (отроклаз) йротекает по реакции
Гидролиз почвенных соединений
68
KAlSi308+H20—^Al2,Si205(OH)*+'[Si40Io']+H+
ортоклаз каолинит
Результат процесса десиликации — образование
каолинита и освобождение из решетки полевого шпата ор-
токремниевой кислоты, которая в зависимости от
почвенных условий может вымываться за пределы
почвенного профиля или давать осадки аморфного
кремнезема или аллофанов (см.). Образующийся каолинит
может дальше подвергаться гидролизу:
Al2Si205(OH)4 + H20—>Al(OH)3+;[Si4O10]
» гиббсит
В результате этого процесса получается гиббсит и
ортокремниевая кислота.
Гидролиз мусковита описывает следующая реакция:
КА12 (Si3AlO10) (ОНЬ+НзО—^ЩОЦЬ+^ЦОю]
Гидролизу в почвах подвергаются многие
соединения тяжелых металлов — Fe, Al, P, S:
Fe2(003)3+H20-^Fe(OH)3 + C02
A12S3 + H20—^Al(OH)3 + H20
ZnCl2+H20—^Zi*(OH)2 + H+
В зоне сильного техногенного загрязнения пылевые
выбросы, богатые тяжелыми металлами (см. Выбросы
загрязняющих веществ), в результате гидролиза их
соединений могут обусловливать подкисление почв, а при
загрязнении фторидами — подщелачивание.
Реакции гидролиза влияют на состав частиц
химических элементов в почвенном растворе {см.), что имеет
значение в связи с различной токсичностью (см.) и
миграционной способностью элементов (см. Миграция
химических соединений). Например, А1 при рН<4
присутствует в почвенном растворе преимущественно в
форме иона А13+, при рН 4,5—6,5 в результате реакций
гидролиза преобладают частицы А1(ОН)2+, при рН>
>8 —частицы А1(ОН)4-\
Гидролизу подвзргаются и удобрения,
представляющие собой гидролитически кислые или гидролитически
щелочные соли:
NH4C1 + Н20—*NH4OH + Н+
NH4N03+Н20 -=* NH4OH+H*
69 Гидрослюды
Возможен кислотный гидролиз полифосфатов и
поликремниевых кислот в почвенном растворе, который
влияет на миграцию и поглощение элементов
растениями. Кислотный гидролиз растительных остатков — одна
из первых стадий их химического разложения, в
результате образуются моносахариды и аминокислоты.
В природных условиях на гидролиз влияет
количество осадков и дренаж территории — при хорошем
дренаже процесс гидролиза ускоряется в связи с выносом его
продуктов.
ГИДРОМОРФНЫЕ ПОЧВЫ. Большая группа почв
различных типов, формирование которых происходит в
условиях некоторого избыточного по сравнению с авто-
морфными почвами атмосферного или грунтового
увлажнения.
Это преимущественно болотные, а также различные
глеевые почвы (некоторые из них относятся к полугид-
роморфным почвам). В ряде случаев гидроморфные
почвы, особенно если они занимают пониженные
элементы рельефа или бессточные впадины, могут служить
аккумуляторами химических залрязняющих веществ
(см. Загрязняющее почву химическое вещество),
поступающих из атмосферы, с речным и поверхностным
стоком.
Гидроморфные почвы составляют основной
мелиоративный фонд, хотя следует иметь в виду, что
мелиорация (осушение) многих таких почв может вызвать
нарушение общего водного баланса окружающей
территории.
ГИДРОСЛЮДЫ (синоним — иллиты). Широко
распространенные в почвах трехслойные глинистые
минералы, обобщенные формулы которых: (К, Са,
Mg) (Fe2+, Mg)s(OH)2[(Al, Si)4Oi0] — триоктаэдриче-
ские гидрослюды и (К, Са, Mg)Al(OH)2[(Al, Si)4Oi0] —
диоктаэдрические.
Трехслойные пакеты (см. Глинистые минералы)
имеют высокий отрицательный заряд (0,8—0,9 на
элементарную ячейку), возникающий в тетраэдрах за счет
изоморфного замещения Si4+ на А13+. Отрицательный
заряд компенсируется межпакетными катионами,
преимущественно— калием. Гидрослюды не способны к
обмену большей части калия в межпакетных позициях и к
Гипс в почвах 70
межпакетной сорбции вещества, имеют сравнительно
низкие значения удельной поверхности (десятки м2 на
1 г минерала) и ЕКО (единицы, реже -*- десятки мг-экв
на 100 г минерала)—см. Удельная поверхность почвы,
Емкость катионного обмена. Гидрослюды способны
поглощать из раствора небольшие количества ионов К+,
Rb+, Cs+ (в том числе 137Cs), NH4+ и очень прочно
удерживать их в межпакетных промежутках в краевых
зонах частиц (см. Фиксация катионов почвами).
Гидрослюды могут поглощать вносимые в почву пестициды за
счет образования водородных связей и вандерваальсо-
вых сил.
Эти мин9ралы составляют значительную часть
илистой фракции (см. Илистая фракция почв) в
большинстве почв зонального ряда на рыхлых породах. В
северной части европейской TqppHTopnn СССР на
моренных, водно-ледниковых и покровных отложениях
содержание гидрослюд в илистой фракции уменьшается от
40—60 % в почвах западных регионов до 10—30.% в
почвах Приуралья. В южной части европейской
территории СССР в почвах на лёссовидных отложениях
гидрослюды составляют 30—50% илистой фракции.
В глеево-подзолистых и наиболее кислых подзолистых
почвах содержание этих минералов в илистой фракции
горизонта А2 меньше, чем в нижележащих горизонтах.
В дерново-подзолистых, серых лесных почвах,
черноземах, каштановых почвах, солонцах и особенно в соло-
дях содержание гидрослюд в илистой фракции в
гумусовом горизонте выше, чем в нижележащих горизонтах
почвенного профиля.
В почвах и материнских породах гидрослюды
образовались в результате магматических и
постмагматических процессов, но часть гидрослюд, особенно в
верхних горизонтах аридных почв, имеют почвенное
происхождение— они образуются за счет необменного
поглощения калия кристаллическими решетками
вермикулитов (см.) и высокозарядных монтмориллонитов (см.).
ГИПС В ПОЧВАХ. Минерал клаюса сульфатов,
имеющий формулу CaS04-2H20.
Встречается в почвах аридных областей — южных
черноземах, каштановых, серо-бурых пустынных,
засоленных. Содержание в зональных почвах обычно не
71 Гипс в почвах
превышает нескольких процентов, но в гидромарфных и
полугидроморфных почвах иногда встречаются
прослойки гипса с преобладанием этого минерала в составе
твердых фаз.
Наиболее широко распространены следующие
морфологические формы гипсовых скоплений: налеты,
выцветы, примазки, корочки, бородки, гипсовые кутаны,
прожилки, трубки, гипсовые «розы», сферолиты, гнезда.
Обычно крупные гипсовые аккумуляции (сферолиты,
гнезда) наследуются почвой от материнской породы, в
то время как скопления тонкодиспфсного гипса —
выцветы, налеты, трубочки представляют собой продукт
почвообразования.
Содержание гипса определяют различными
химическими методами, предварительно растворяя его в
горячей воде или НС1, или (при высоком содержании этого
минерала) с помощью термического анализа.
Растворимость гипса в воде составляет 2 г/л.
Гипс широко используют для мелиорации солонцов
и солонцовых почв, так как при растворении его в
почвенный раствор поступает Са2+, который замещает Na+
в почвенном поглощающем комплексе (см.), в
результате чего улучшаются химические и физические
свойства почв (см. Гипсование почв). Этот прием называется
гипсованием солонцов.
В том случае, если гипс содержится в почвенном
профиле не с самой поверхности, но в пределах
верхнего полуметра, его вовлекают в пахотный горизонт путем
плантажной вспашки — самогипсование
солонцов.
Дозу гипса (М, экв/га) рассчитывают по формуле
M = mHd-l№09
где т — содержание обменного Na+, мг-экв на 100 г почвы; Н —
мощность мелиорируемой толщи, см; d — объемная масса почвы,
г/см3.
Часто для мелиорации солонцов используют фос-
ф о г и п с — отход, получаемый при сернокислотной
обработке сырья в процессе производства суперфосфата и
аммофоса и состоящий в основном из гипса. При
внесении в почвы фосфогипса возникает угроза загрязнения
почв фтором (см. Фтор в почвах), содержание которого
в фосфогипсе составляет 0,5—0,8%. Применение фос-
Гипсование почв 72
фогипса в обычных дозах приводит к поступлению в
пахотный горизонт десятков и даже сотен килограммов
фтора на 1 га. Есть сведения о том, что при внесении
фосфогипса в солонцы каштановой зоны этот мелиорант
подвергается перекристаллизации в течение первых 2—
3 лет и теряет значительную часть содержащегося в нем
фтора. Определенное количество фтора при этом может
связываться щелочноземельными катионами с
образованием флюорита CaF2, плохоокристаллизованного
CaF2—ратовкита и селлаита MgF2. Однако нужно
иметь в виду, что растворимость этих минералов
обусловливает существенное превышение ПДК для фтqpa
в питьевой воде. Основное количество фтора
закрепляется в почве на гидроксидах железа и алюминия (см.)
и на боковых сколах каолинитов (см.).
В тропических почвах гипс и фосфогипс используют
для улучшения кальциевого питания растений,
увеличения количества Са2+ в ППК и уменьшения токсичного
действия алюминия, который дает прочные комплексы
с сульфат-ионом в почвенном растворе.
ГИПСОВАНИЕ ПОЧВ. Способ мелиорации солонцов
и солонцеватых почв, заключающийся во внесении
гипса или гипссодержащих материалов.
При гипсовании происходит реакция вытеснения
поглощенного натрия, обусловливающего
неблагоприятные физические и химические свойства таких почв, и
замещение его на катион кальция:
nN!a2 + CaS04-2H20—►nCa + Na2S04
Здесь П — почвенный поглощающий комплекс.
Образующийся в результате реакции сульфат натрия
Na2S04 удаляют из почвенной толщи путем промывок.
Насыщенная кальцием почва приобретает
благоприятные физические свойства: структурность,
водопроницаемость и водоудерживающую способность,
достаточную пористость; улучшаются и химические
свойства— снижается рН, удаляется токсичный для растений
ион натрия, уменьшается щелочность.
Дозу гипса или гипссодержащих материалов
рассчитывают с учетом содержания натрия в мелиорируемом
слое почвы, при этом считается допустимым остаточное
количество ионов натрия, составляющее 5 % емкости
катионного обмена (см.).
73 Глинистые минералы
Для гипсования используют размолотый природный
гипс, а также различные промышленные отходы, в том
числе фосфогипс— отход производства суперфосфата и
преципитата. Фосфогипс кроме гипса о^ржит серную,
ортофосфорную, qpTOKpeMHHeByio кислоты, что
усиливает его мeлиqpиpyющee действие. В то же время в состав
фосфогипса могут входить заметные количества ионов
стронция и фтора. Из природных материалов кроме
гипсового камня используют также сырой озерный гипс,
гипсовые коры и гипсовые прослойки, глиногипс и др.
При близком залегании в почвенном профиле гипсо-
носных горизонтов возможна мелиорация за их счет.
В этом случае проводят глубокую вспашку и
солонцовый горизонт пqpeмeшивaeтcя с гипсоносными слоями
(см. Гипс в почвах).
ГЛИНИСТЫЕ МИНЕРАЛЫ. Широко
распространенная в почвах группа минералов подкласса слоистых
силикатов, представленная 'тонкодисперсными
частицами.
Основная часть глинистых минералов в почвах
находится во фракции <1 мкм (см. Илистая фракция почв).
Содержание этих минералов возрастает от нескольких
процентов в песчаных почвах до нескольких десятков
процентов в суглинистых и глинистых.
Благодаря высокой дисперсности и особенностям
строенця кристаллических решеток глинистые минералы
имеют высокую удельную поверхность (см. Удельная
поверхность почвы), измеряемую десятками и сотнями
квадратных метров на 1 г минерала.
Глинистым минералам свойственна высокая
химическая активность — они легко образуют водородные
связи, могут участвовать в процессах окисления,
восстановления, во многих процессах играют роль кислых
катализаторов.
Кристаллические решетки глинистых минералов
состоят из 3aKOHOMqpHoro сочетания двух типов
многогранников— тетраэдров и октаэдров. Тетраэдр (рис., а)
представляет собой четырехгранник, в центре KOTqporo
находится ион Si4+, а в вершинах — ионы кислорода.
В HeKOTqpbix глинистых мш^ралах ионы Si4+ в
тетраэдрах замещены А13+. Тетраэдры, сочленяясь в
пространстве чзрез общие вершины, образуют двухмерную
Глинистые минералы 74
Глинистые минералы в почвах:
а — тетраэдр; б — тетраэдрическая сетка; в — октаэдр, г — октаэдриче-
ская сетка, д — пакет
тетраэдрическую сетку (рис., б). Октаэдр (рис., в)
представляет собой восьмигранник, в центре которого
находятся катионы Al3+, Mg2+, Fe2+, а в вершинах —
гидроксопруппы и ионы кислчрода. Октаэдры,
сочленяясь в пространстве через общие ребра (рис., г),
образуют двухмерную октаэдрическую сетку.
В зависимости от типа заполнения октаэдров
катионами глинистые минералы делятся на диоктаэдрические
и триоктаэдрические структуры. В диоктаэдрических
минералах катионы (преимущественно А13+) заполняют
2/з всех октаэдрических позиций, а в триоктаэдричес-
ких минералах катионами (преимущественно Mg2+ и
Fe2+) заняты все октаэдрические пустоты.
В кристаллических решетках глинистых минералов
75 Глинистые минералы
тет|раэдрические и октаэдрические сетки образуют
закономерные сочетания, которые называются
пакетами (рис. д), а пространства между ними — меж
пакетными промежутками. Кристаллические
решетки многих глинистых минералов несут постоянный
отрицательный заряд за счет замещения катионов с
большей валентностью катионами с меньшей
валентностью— Si4+ на А13+ в тетраэдрах и А1+3 на Mg2+ в
октаэдрах (см. Заряд почвенных коллоидов
постоянный). Заряд компенсируется катионами, находящимися
в межпакетных промежутках и на поверхности
минералов. В двухслойных глинистых минералах (1:1)
кристаллическая решетка состоит из одной тетраэдричес-
кой и одной октаэдрической сетки, в трехслойных (2:
: 1)—из двух тетраэдрических сеток и одной
октаэдрической, в четырехсложных (2:1:1) —из трехслойных
пакетов, чередующихся с добавочным октаэдрическим
слоем.
Наиболее широко распространены в почвах: из
двухслойных силикатов — каолиниты (см.), из
трехслойных— гидрослюды (синоним — иллиты), вермикулиты и
монтмориллониты (см.), из четырехслойных — xлqpиты.
В почвах часто присутствуют также смешаннослойные
глинистые минзралы, в которых чередуются слои
индивидуальных минералов (например, иллит — вермикулит,
иллит — смектит, вермикулит — xлqpит и др.).
Для идентификации глинистых минералов в почвах
используют Ha6qp инструментальных методов,
включающий рентгеновский фазовый анализ, термический
анализ, электронографию, микродифракцию, электронную
микроскопию. Для определения аморфных и плохо ок-
ристаллизованных глинистых минералов широко
применяют селективное растворение в различных вытяжках
в сочетании с термическим анализом и инфракрасной
спектроскопией.
Обладая высокой сорбционной способностью и
большой удельной поверхностью, глинистые минералы
играют важнейшую роль в аккумуляции, миграции и де-
токсикации загрязняющих веществ. Обогащенные
глинистыми минералами почвы накапливают значительные
количества тяжелых металлов, в ряде случаев — фтора,
пестицидов и детергентов. Фиксация загрязняющих ве-
Гуминовые кислоты 76
ществ понижает их токсичное влияние на растения и
опасность загрязнения почвенно-грунтовых вод, однако
это защитное действие ограничено.
ГУМИНОВЫЕ КИСЛОТЫ. Специфические
природные высокомолекулярные соединения кислотного харак-
тера, образующиеся при трансформации
преимущественно растительных остатков вне живых организмов под
действием мезофауны, микроорганизмов и абиотических
факторов.
Гуминовые кислоты встречаются в почвах, торфах,
донных отложениях, иле, сапропеле, лечебных грязях,
природных водах и активно влияют на миграцию и
аккумуляцию в природных средах тяжелых металлов
и других загрязняющих веществ как минеральных, так
и органических (см. Миграция химических соединений,
Аккумуляция в почве химических загрязняющих ее-
ществ). Гуминовые кислоты были впервые выделены из
торфа немецким химиком Ф. Ахардом, но их строение
до сих пор не установлено, хотя известен состав,
структурные фрагменты, некоторые молекулярные параметры.
Эти вещества илрают основную роль в формировании
почвенных свойств.
В состав гуминовых кислот входят 46—61 % С
(массовые доли), 3—6 —N, 3—5 —Н, 33—38% О, а также
Р, S, некоторые зольные элементы. Структурные
фрагменты представлены углеводами (20—30%),
аминокислотами (5—10%), входящими в так называемую гид-
ролизуемую часть гуминовых кислот, отщепляемую при
кипячении последних с крепкими кислотами. Негидро-
лизуемый остаток содержит фрагменты, построенные на
основе производных бензола (бензолоподобные или бен-
зоидные фрагменты), которыми представлено от 3—5
до 25—30 % всего углерода гуминовых кислот.
Химическая и биологическая активность гуминовых
кислот обусловлена высоким содержанием и большим
набором двойных С = С связей, хиноидных и фенольных
группировок, кислородсодержащих функциональных
групп, таких, как карбоксильные группы COOHh, фе-
нольные и спиртовые гидроксогруппы ОН~, альдегидные
группировки, а также аминогруппы NH2+.
Гуминовые кислоты практически нерастворимы в
природных условиях в воде и растворах кислот, но в
77 Гуминовые кислоты
той или иной степени растворимы в щелочах. В почвах
гуминовые кислоты, как правило, представлены в
форме соединений с катионами различных металлов Ca,Mg,
Fe или адсорбированы на поверхности частиц
высокодисперсных глинистых минералов (см.), оксидов и гид-
роксидов железа и алюминия. Обладая высокой ем-
костью катионного обмена (см.) —до 500—700 мг-экв
на 100 г почвы и высокой хелатирующей способностью,
гуминовые кислоты активно связывают практически все
тяжелые металлы (см.), поступающие в почвы, воды и
торфа, препятствуя таким образом их миграции в
сопредельные среды и ограничивая поступление этих
загрязняющих веществ в растения природных биоценозов и в
сельскохозяйственные культуры.
О способности гуминовых кислот связывать тяжелые
металлы судят по величинам констант устойчивости
соответствующих комплексов, которые существенно
зависят от величины рН. С повышением рН устойчивость
гуматов тяжелых металлов растет. Так, логарифмы
констант устойчивости составляют для гуматов:
меди — 7—12, никеля — 5—9, кадмия — 5—9, цинка
— 5—10.
Устойчивость гуматов железа с увеличением рН
снижается, поскольку ион Fe3+ образует очень
труднорастворимые гидроксиды.
Гуминовые кислоты могут адсорбировать или
химически связывать различные пестициды и другие
органические соединения.
Кроме прямого воздействия на доступность и
подвижность загрязняющих веществ гуминовые кислоты
оказывают общее благоприятное действие на свойства
почвы, чем снижают негативное (токсичное) влияние
загрязняющих веществ на растения и почвенную биоту
(см. Биота почвенная) в целом. Положительное
влияние гуминовых кислот связано с тем, что они
способствуют формированию водопрочной агрономически
ценной структуры, повышают емкость катионного обмена,
кислотно-основную и окислительно-восстановительную
буферность почвы (см. Буферная способность почв, Бу-
ферность почв кислотно-основная), создают в почве
долговременный запас азота, фocфqpa и других
элементов питания растений, включая микроэлементы.
Гумус 78
Гуминовые кислоты интенсивно поглощают
электромагнитные колебания в видимой области спектра и
придают почве темную окраску, способствующую более
быстрому ее прогреванию.
Несмотря на то что эти кислоты относятся к числу
наиболее стабильных органических веществ почвы и их
возраст по радиоуглеродному датированию колеблется
от сотен до тысяч лет, при интенсивной обработке,
внесении минеральных удобрений и недостатке
органических остатков происходит постепенная минерализация
гуминовых кислот и потеря их почвами. Даже
черноземы за последние сто лет потеряли до 20—50 %
содержавшегося в них гумуса (см.), в том числе и
гуминовых кислот. Для сохранения и повышения запасов этих
кислот в почвах необходимы: внесение органических
удобрений (от 10—12 до 25—30 т навоза на 1 га
ежегодно), травосеяние, известкование наряду с
применением минеральных удобрений, щадящий режим
механических обработок почвы. Хороший результат дает
глубокая заделка навоза.
ГУМУС. Совокупность всех органических «соединений,
находящихся в почве, но не входящих в состав живых
организмов или образований, сохраняющих
анатомическое строение, не участвующих в построении тканей
растительных и животных остатков. Согласно этому
определению, в состав гумуса входят гуминовые
вещества (специфические гумусовые вещества), к
которым относятся гуминовые кислоты, гиматомелановые
кислоты, фульвокислоты (по Форситу) и гумин,
различного рода индивидуальные органические
соединения биологического происхождения (как
низкомолекулярные, так и биополимеры), а также техногенные
органические соединения, попадающие в почву при
внесении удобрений, пестицидов, обработке почвы и ее
техногенном загрязнении (см. Загрязнение промышленное).
В специальной и популярной литературе нередко в
качестве синонимов используют термины «гумус»,
«органическое вещество почвы», «органическая часть почвы»,
что недопустимо, так как они обозначают разные
составные части почвы, в частности «гумус» представляет
собой только часть органического вещества почвы.
В качестве синонимов можно употреблять следую-
79 Гумус
щие термины: «гумус» и «перегной» или «органическая
часть почвы» и «органическое вещество почвы». Не
следует также употреблять термин «гумус» для
обозначения лесной подстилки и любых других (j)qpM
накопления органического вещества на земной поверхности или
на дне водоемов. Гумус и гумусообразование — это
специфические почвенные понятия и процессы;
гумусообразование происходит только в почвах в отличие от
гумификации, которая имеет общепланетарный
характер, протекает не только в почвах, но и в торфах,
водоемах, иле и других природных телах и приводит к
формированию особого класса природных соединений —
гуминовых кислот (см.).
Роль гумуса в почвообразовании, плодородии почв,
их охране чрезвычайно велика. С гумусом связаны
основные запасы элементов питания растений и
микроорганизмов, в его состав входят многие физиологически
активные вещества (ферменты, антибиотики, а также
гуминовые вещества), он служит источником углерода
и энергии для почвенных микроорганизмов. Гумус
способствует формированию благоприятного
водно-воздушного режима, высокой буферности почв (см. Буферная
способность почв) и их устойчивости к неблагоприятным
внешним условиям и химическому загрязнению.
Накоплено немало данных о прямой связи между
урожайностью сельскохозяйственных культур и
содержанием в почве гумуса или его отдельных составных
частей. Наиболее эффективное влияние гумуса на
производственные показатели при сельскохозяйственном
использовании и охране почв может быть достигнуто
только при оптимальном для каждой почвы (зоны) и
сельскохозяйственной культуры сочетании содержания
гумуса, его состава и качественных особенностей. Не
следует упрощенно представлять оптимальное гумусное
состояние почв (см.), в том числе и оптимальное
содержание гумуса только как конкретную величину его
запасов, достижение которой позволит решить задачу
получения наибольших урожаев и реализации
потенциальных возможностей культуры. В общем виде
оптимальным можно считать такое о^ржание гумуса, которое
благоприятно для получения запланированного урожая
при обязательном условии наиболее эффективного ис-
Гумус 80
пользования применяемых удобрений и максимальной
эффективности агротехнических мероприятий. Почва с
оптимальным содержанием гумуса максимально
устойчива к действию разрушающих факторов (эрозия,
дефляция), влиянию химических загрязняющих веществ,
засухам или переувлажнению.
Обязательное требование к оптимальному
содержанию гумуса— высокая экономическая эффективность.
Обогащение почв гумусом — дорогостоящее
мероприятие, и затраты на повышение запасов гумуса (за
исключением работ по рекультивации) не должны
превышать дополнительной прибыли от получанных
прибавок сельскохозяйственной продукции.
Сельскохозяйственное использование почв при
невысокой культуре земледелия обычно приводит к потере
гумуса пахотными почвами. Наиболее быстрые потери
происходят при распашке целины. При последующем
использовании содержание гумуса постепенно
стабилизируется на HeKOTqpoM пониженном уровне в
зависимости от системы земледелия. При высоком уровне
производства и применении ррганических удобрений
содержание гумуса в почвах может повышаться.
В числе главных причин потерь гумуса пахотными
почвами можно назвать следующие:
снижение количества растительных остатков,
поступающих в почвы;
усиление минерализации гумуса в результате
повышения аэрации и интенсификации деятельности микро-
qpraHH3MOB;
усиление минерализации при осушении
переувлажненных почв;
эрозионные и дефляционные потери.
В литературе имеются сведения, что при бессменном
возделывании 3qpHOBbix культур ежегодные потери
гумуса в типичном черноземе достигают 0,5—1 т/га,
пропашных— до 1,5 т/га. По данным некоторых
исследователей, за последние сто лет интенсивно
распахиваемые черноземы потеряли до 25—30 % всего количества
гумуса.
В настоящее время верхние гумусовые горизонты
главных типов почв содержат от долей процента до 10—
15% гумуса (редко выше). Так, в горизонтах А1А2 и
81 Гумусное состояние почв
А1 иллювиально-гумусовых подзолов и
дерново-подзолистых почв содержится 1,5—5 % гумуса (в
поверхностном слое целинных почв количество гумуса может быть
и более высоким); в горизонте А1А2 серых лесных
почв—1,5—3%, в горизонте А1—до 3—7%. Верхние
щризонты выщелоченных и типичных черноземов
содержат до 8—12 % гумуса, а южных черноземов и темно-
каштановых почв — до 4—5%. Эти величины имеют
qpneHTHpOB04Hoe значение, вариабельность содержания
гумуса очень велика и количество его даже в пределах
почв одного типа может изменяться в 1,5—2 раза.
ГУМУСНОЕ СОСТОЯНИЕ ПОЧВ. Важнейшая
характеристика целинных и антропогенных почв,
отражающая обогащенность и обеспеченность почв и
почвенной биоты (см. Биота почвенная) энергией и
элементами питания, влияющая на особенности почвенной
структуры, емкость катионного обмена (см.), кислотно-
основной и окислительно-восстановительный режимы.
С гумусиым состоянием непосредственно связана
устойчивость почв к эрозии и дефляции, предельно
допустимые уровни содержания химических
загрязняющих веществ в почвах, влияние почв на тепловой режим
и газовый состав атмосферы.
Для характеристики гумусного состояния почв
используют различные системы показателей. Одна из
таких систем, разработанная для широкого зонального
ряда почв, приведена в таблице. Эта система
рассчитана на рравнителыную характеристику главных типов
почв и поэтому охватывает диапазон практически всех
известных уровней содержания органического вещества
(включая торфяные почвы). Для оценки и
характеристики почв отдельных регионов необходимо использовать
системы показателей с меньшими диапазонами и более
дробными интервалами.
Важное значение в последнее время приобрели
такие показатели гумусного состояния, как соотношение
лабильных и устойчивых органических компонентов
почвы, показатели баланса гумуса (см.), а также
нормы и дозы qpraHH4ecKHx удобрений, необходимых для
обеспечения бездефицитного баланса гумуса в пахотных
почвах. От соотношения лабильных и устойчивых
компонентов органического вещества зависит численность
Гумусное состояние почв
82
и видовой состав почвенных организмов, изменение
этого отношения приводит к смене условий обеспечения
микроорганизмов углеродом и азотом и вызывает смены
ассоциаций микроорганизмов, неодинаковые в разных
типах почв. Этот показатель позволяет определять
рациональные формы и дозы органических веществ,
вносимых в почвы или поступающих в целинные
экосистемы.
Характеристика гумусного состояния почв (по Л. А. Гришиной,
Д. С. Орлову)
Показатели
Уровень, характер
проявления
Градации
показателей
Мощность подстилки (для
лесных почв), см
Отношение запасов органического
вещества в подстилке и в
минеральном профиле
Содержание гумуса в гумусовых
(поверхностных) горизонтах, %
Запас гумуса в слоях 0—20 см
(0—100 см), т/га
са в почвенной толще
Обогащенность гумуса азотом, по
отношению С : N
Очень мощная
Мощная
Средней мощности
Маломощная
Распределение:
эктоморфное
мезоморфное
эндоморфное
Очень высокое
Высокое
Среднее
Низкое
Очень низкое
Очень высокий
Высокий
Средний
Низкий
Очень низкий
Резко убывающее
Постепенно
убывающее
Равномерное
Нарастающее
Бимодальное
Очень высокая
Высокая
Средняя
Низшая
Очень низкая
>ю
5—10
2—5
<2
>1
Около 1
<1
>10
6—10
4-6
2—4
<2
>200
(>600)
150—200
(400-600)
100—150
(200—400)
50—100
(100—200)
<50
«100)
—
—
' ;
<5
5—8
8—11
11—14
>14
83
Гумусное состояние почв
Продолжение
Показатели
Уровень, характер
проявления
Градации
показателей
Степень гумификации
органического вещества, (С™ : Собщ) -,100%
Тип гумуса, Сгк : Сфк
Содержание «свободных» гуми-
новых кислот, % к сумме ГК
Содержание гуминовых кислот,
связанных с Са2+, % к сумме ГК
Содержание прочносвязанных
гуминовых кислот, % к сумме ГК
Оптическая плотность гуминовых
кислот, Е°'™<™
Очень высокая
Высокая
Средняя
Слабая
Очень слабая
Гуматный
Фульватно-гумат-
ный
Гуматно-фульват-
ный
Фульватный
Очень высокое
Высокое
Среднее
Низкое
Очень низкое
Очень высокое
Высокое
Среднее
Низкое
Очень низкое
Высокое
Среднее
Низкое
Очень высокая
Высокая
Средняя
Низкая
Очень низкая
>40
30—40
20—30
10—20
<ю
>2
1—2
0,5—1
<0,5
>80
60—80
40—60
20—40
<20
>80
60—80
40—60
20—40
<20
>20
10—20
<Ю
>0,20
0,10—0,20
0,06—0,10
0,03—0,06
<0,03
Примечания: 1. С
' общ
С фк — соответственно
углерод: гуминовых кислот, общий, фульвокислот; ГК — гуминовые кислоты.
2. Для оценки степени гумификации органического вещества торфов и
многогумусных почв Т. А. Горелова предложила использовать следующий
показатель:
[ГК] [Е],
где [ГК] — доля гуминовых кислот в составе органического вещества,
% к С общ; [Е] — оптическая плотность.
Преимущество этого показателя в том, что он учитывает не только
количество органического вещества, преобразованного в гуминовые кислоты,
но и их условную «зрелость».
К лабильным компонентам относят легко-
минерализуемые микроорганизмами органические
соединения, в том числе простые углеводы (моносахариды,
частично олигосахариды), аминокислоты и простые
пептиды, низкомолекулярные кислоты, спирты, пигменты
Двойной электрический слой 84
и др. Устойчивые компоненты представлены
лигнином, частично целлюлозой, гуминовыми кислотами
(см.), гумином (см. Гумус). Полная классификация
органических веществ по их устойчивости не разработана.
Устойчивые компоненты органического вещества почв
одновременно придают последним консервативные,
долговременные признаки, характерные для каждого
почвенного типа и обусловливающие их специфичность.
Так, с гуминовыми кислотами и гумином связаны
окраска почв и некоторые тепловые свойства, структурное
состояние, водный и воздушный режимы, содержание
обменных катионов (см. Катионы обменные), степень
кислотности или щелочности почвы.
д
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ.
Определенное расположение ионов, наблюдаемое в жидкой фазе
коллоидных систем вблизи поверхности заряженных
коллоидных частиц, характер которого обусловливает
механизмы и прочность связи загрязняющих веществ с
твердыми фазами почвы.
Большая часть почвенных коллоидов имеет
постоянный отрицательный заряд (см. Заряд почвенных
коллоидов постоянный). В растворах электролитов они
окружены компенсирующими заряд ионами
противоположного знака (противоионами), то есть катионами.
Максимальная концентрация катионов наблюдается
непосредственно у отрицательно заряженной поверхности,
при удалении от поверхности она уменьшается по
экспоненциальному закону. Поэтому из загрязняющих
веществ интенсивно поглощаются катионы тяжелых
металлов.
Таким образом, двойной электрический слой
включает плотный слой противоионов,
прилегающий к самой частице, и диффузный слой
противоионов, в пределах которого концентрация ионов
постепенно уменьшается. Плотный и диффузный слой
известны соответственно под названием слоев Штерна и
Гюи — Чапмена.
Толщина двойного электрического слоя — это тол-
85 Деградация почв
щина слоя жидкости, в пределах которого
концентрация ионов отличается от общей концентрации их в рас-
TBqpe. Содержащиеся в двойном электрическом слое
ионы находятся под влиянием двух противоположна
направленных сил: электростатического притяжения к
частице и стремления отдиссоциировать от нее в
соответствии с градиентом концентрации. Поэтому
повышение концентрации электролита приводит к сжатию этого
слоя и снижению диссоциации катионов тяжелых
металлов. Поскольку ионы слоя находятся в жидкой фазе,
толщина его не может быть больше толщины водной
пленки. В почвах тяжелого гранулометрического
состава количество воды, приходящейся на двойной
электрический слой, может достигать 0,5 см3 на 1 г почвы.
ДЕГРАДАЦИЯ ПОЧВ (от лат. degradatio —
снижение, движение назад, ухудшение, снижение качества).
Постепенное ухудшение качества почвы в результате
изменений, разрушающих ее структуру, ведущих к
появлению негативных химических свойств и утрате ее
плодородия.
Деградация почвы может происходить как в
результате стихийных природных явлений (землетрясение,
природное изменение условий почвообразования,
извержение вулканов, ураганы), так и в результате
нерегулируемой хозяйственной деятельности человека. Часта
сопровождается потерей способности выполнять ресур-
со- и дредовоспроизводящие функции.
Явления деградации почв можно разделить на
следующие семь основных групп, связанных с различными
направлениями нарушений почвенного покрова и
процессов, происходящих в почвах и экосистемах (Ковда,
1989).
1. Нарушение биоэнергетического режима почв и
экосистем:
девегетация почв;
дегумификация почв;
почвоутомление и истощение почв.
2. Патологическое состояние почвенных горизонтов
и профиля почв:
отчуждение и выключение почв из действующих эко*
систем;
эрозия и дефляция почв;
Деградация почв 86
образование бесструктурных кор и переуплотненных
.горизонтов.
3. Нарушение водного и химического режима почв:
сухость и опустынивание почв;
селевые разливы и оползни;
вторичное засоление почв;
природная и BTqpH4Han кислотность почв;
nqpeocyineHHe почв.
4. Затопление, разрушение и засоление почв водами
водохранилищ:
затопление пойменных и первых надпойменных
террас;
подъем уровня грунтовых вод и подтопление почв;
абразия берегов и засоление дельт;
размыв и уничтожение почв приморских дельт;
загрязнение и содовое (щелочное) засоление вод и
почв.
5. Загрязнение и химическое отравление почв (см.
Загрязнение почвы),
6. Переохлаждение и вторичная мерзлотность почв:
деградация ландшафтов и почв районов с
распространением многолетней мерзлоты;
разрушение и исчезновение «ледяных земель».
7. Разрушение почв военными действиями, атомной
радиацией:
обычные войны;
ядерные войны и атомная радиация;
аварии на АЭС и утечки радиоактивных материалов.
Деградационные изменения, связанные с нарушением
биоэнергетического режима почв и экосистем
Девегетация почв. Потери почвами лесного,
кустарникового, травянистого растительного покрова, ведущие
к постепенному омертвлению почв, снижению
биопродуктивности и к утрате экологических функций.
Ухудшение и отсутствие растительного покрова почв
приводит к негативным изменениям в климатическом,
газовом (02, N, С02) и водном режимах биосферы.
Для борьбы с этими явлениями следует:
в пастбищном хозяйстве — обеспечить оптимальную
нагрузку поголовья скота, подсевы и подкормки трав,
настбищеобороты с системой загонов и изгородей;
87 Деградация почв?
в полеводстве — соблюдать рациональные
травопольные севообороты, регулярно вносить органические
удобрения, проводить правильную агротехнику
(контурную обработку с учетом рельефа) и т. д.;
в лесном хозяйстве — не допускать вырубки лесов-
на склонах, особенно в районах с наличием сезонной
или вечной мерзлоты, содействовать быстрейшему
возобновлению лесной растительности на вырубках и ее
сохранению;
в горных и склоновых ландшафтах — насаждать
полосы плодовых деревьев и проводить террасирование.
Дегумификация почв. Потеря почвами главного
носителя плодородия — гумуса.
По опубликованным данным, почвы суши теряли в*
среднем за 10 тыс. лет по 30-Ю6 т углерода гумуса в»
год, но в последние 50 лет — уже 700-106 т углерода
ежегодно. На обширных пространствах эродированных,
истощенных, опустыненных почв потери углерода
гумуса составляют от 70—90 до 100 %.
Девегетация почв, минерализация гумуса в
старопастбищных почвах, а также эрозия вызывают уменье
шение гумусовых горизонтов на 5—30 см и более. В
результате этого содержание гумуса сократилось на 20—
50%. Уменьшение мощности гумусового слоя на 1 см
вызывает снижение потенциального урожая зерновых
культур на черноземах на 100 кг с 1 га.
Мероприятия по предотвращению дегумификация
должны включать: регулирование выпаса животных, фи-
томелиорацию, введение и освоение научно
обоснованных травопольных севооборотов, внесение органических,
удобрений, борьбу с эрозией и дефляцией.
Почвоутомление и истощение почв. Процессы,
происходящие в почвах в результате длительного
бессменного возделывания одного и того же вида
сельскохозяйственных культур.
В почвах накапливаются метаболиты и токсины,
выделяемые корнями при вегетации растений,
преобладают однотипные группы микроорганизмов и вредителей,
вызывающих болезни, свойственные этой монокультурен
Резко снижаются урожаи культуры, несмотря на то, чта
дополнительно вносят минеральные удобрения и обраба*
тывают растения пестицидами. В результате «активной»
Деградация почв 38
борьбы со снижением урожайности монокультуры
отравляются почвы, насекомые, птицы, воды,
биопродукция и человек. К таким монокультурам относятся
хлопчатник, свекла, кукуруза, картофель, пшеница и др.
Периодическое использование в севообороте
люцерны, клевера, трав будет способствовать оздоровлению
обстановки.
Деградационные изменения, связанные с патологией
почвенных горизонтов и профиля почвы
Отчуждение и выключение почв из действующих
экосистем. Из различных экосистем биосферы
городами, поселками, дорогами, портами, складами, линиями
электропередач и связи, трубопроводами, шахтами,
карьерами, водохранилищами, каналами, свалками
исключено около 2 млрд га почв мира. Ежегодно из
биосферы утрачивается до 20 млн га продуктивных почв.
На этих территориях поверхностный гумусовый слой
уничтожается или утрамбовывается, закрывается
асфальтом, лишается жизни и отравляется.
Растительность, почвенная фауна, микроорганизмы,
биоэнергетика и биохимия сведены к минимуму. Таким образом, из
биосферы полностью отчуждается значительная часть
биоэнергетического и биохимического потенциала.
Эрозия и дефляция почв. Эрозия почв происходит в
природных и в естественных ландшафтах. Водные
потоки на склонах, даже покрытых растительностью,
смывают верхние слои почвы. Вследствие этого ежегодно
уносится 1—2 т почвы с 1 га. Распашка склоновых
земель, особенно вдоль направления склона, ведет к
смыву 10—15 т/га в год, в период ливней — до 75 т/га.
Подобные процессы часто приводят к смыву за 3—
5 лет верхнего гумусового слоя. Местность становится
засушливой, ухудшается баланс диоксида углерода
(углекислого газа) и азота, утрачиваются запасы
питательных элементов. В мире эрозией охвачено до 70—
80 % сельскохозяйственных угодий.
Дефляция — -выдувание почв из верхних гумусовых
горизонтов, характерна для засушливых областей,
особенно усиливается она в результате неправильной
распашки.
Для предотвращения эрозии и дефляции нужно про-
89 Деградация почв
водить комплекс мероприятий: исключать из распашки
склоны круче 3—5°, отводить их под пастбища;
защищать поля лесными полосами в сочетании с контурной
(по горизонталям) организацией территории и
террасированием особо опасных массивов; вводить в
севообороты травы; вносить органические удобрения;
применять безотвальную обработку почвы; предотвращать
рост оврагов.
Образование бесструктурных кор и переуплотненных
горизонтов. Причины этого обычно следующие:
обработка полей тяжелой техникой при влажности,
превышающей «физическую спелость» почв. Особенно
проявляется на краях полей из-за поворотов и
остановок машин. Объемная масса пахотного горизонта при
этом увеличивается с 1,2—1,3 до 1,5—1,8 г/см3, почва
становится глыбистой бесструктурной;
орошение черноземных почв слабощелочными
водами. В этих условиях под влиянием тяжелых машин
образуются вязкие и малопроницаемые горизонты,
впоследствии цементирующиеся и превращающиеся в
тяжелую кору. Сельскохозяйственные культуры погибают;
образование подпахотного уплотненного горизонта
на старых пашнях: горизонт формируется на глубине
20—40 и до 80 см. Условия произрастания растений на
таких почвах становятся неблагоприятными.
К мерам, предупреждающим образование
бесструктурных и переуплотненных почв, относятся: применение
облегченной техники на полях, уменьшение числа
обработок, периодическое рыхление почв, травосеяние,
применение в севооборотах органических удобрений.
Деградационные изменения, связанные с нарушением
водного и химического режимов почв
Сухость и опустынивание почв. Результат как
общеземного послеледникового процесса опустынивания, так
и непродуманной хозяйственной деятельности человека
(до 10—15% суши).
Ежегодно по антропогенным причинам опустынива-
ется до 50 тыс. км2 земель. Опустынивание возникает
из-за сведения лесов и кустарников, чрезмерно высокого
поголовья скота, выпас которого приводит к
разрушению дернины, бесструктурности и образованию корки
Деградация почв 90
на поверхности. Песчаные пустыни — пример
разрушения биосферы и ее локальных экосистем.
Для предотвращения этих деградационных
процессов необходимо: проводить работы по закреплению
песков и созданию лесозащитных полос, фитомелиорации;
вводить пастбищеобороты; чередовать чистые и занятые
пары; приводить в соответствие поголовье скота и
биопродуктивные возможности пастбищ, а также
использовать комплекс мер, способствующих сохранению влаги в
почве, — снегозадержание, минимальную безотвальную
обработку почвы с рыхлением на большую глубину.
Селевые разливы и оползни. Причины этих
процессов— непродуманное сведение растительности в горных
районах.
Почвы склонов без растительности смываются очень
интенсивно, через 3—5 лет на поверхность выходит
горная порода. Селевые потоки приуроченные к моменту
снеготаяния или ливневых осадков, выносят на
равнины массы воды, ила, камней, обломков скал, разрушая
сельскохозяйственные угодья речных долин.
Катастрофические оползни также стали учащаться, нанося
огромный ущерб биосфере и народному хозяйству.
Почвенный покров в районах оползней сильно нарушается.
Меры по предотвращению этих процессов: облесение
местности, строительство заградительных плотин и
защитных инженерных сооружений.
Вторичное засоление почв. Происходит в результате
неправильного орошения почв как минерализованными,
так и пресными водами.
Этот процесс усиливается тем, что оросительные
каналы не соответствуют экологическим требованиям,
нормы полива не соблюдаются. В итоге 50—60 %
оросительных вод фильтруется в грунт. Грунты в засушливых
районах большей частью сильно засолены, грунтовые
воды также засолены. Фильтрационные воды, смыкаясь
с солеными грунтовыми, поднимают их уровень к
поверхности.
При достижении грунтовыми водами уровня 3—1,5 м
от поверхности, наступает вторичное засоление почв.
Вторично засоленные почвы малопродуктивны. В СССР
из 20 млн га орошаемых земель засолилось и утратило
плодородие около половины, #
91 Деградация поч*
Необходим комплекс мер для предупреждения
процессов вторичного засоления: реконструкция
оросительных систем для ликвидации потерь фильтрационной во-
ды, капельное орошение, строительство глубоких
дренажных сооружений (2,5—3 м).
Природная и вторичная кислотность почв.
Оптимальная реакция почв для многих сельскохозяйственных
растений находится в интервале рН 5,5—8. Плодородие
и общая биопродуктивность кислых почв тем ниже, чем
выше их кислотность.
В последние десятилетия в промышленно развитых
странах наблюдается резкое возрастание кислотности
атмосферных осадков, озерных вод, поверхностного сто-
ка и почв за счет поступления из атмосферы соединений
кислот промышленного, транспортного и другого
происхождения. При подкислении почв в них значительно
повышается содержание химических веществ,
вызывающих токсические реакции растений, животных,
человека. Большую роль в подкислении пахотных почв играет
несбалансированное применение физиологически кислых
минеральных удобрений без одновременного
известкования.
В результате развития вторичной кислотности почв
и природных вод в глобальном масштабе ухудшается
состояние растительности, особенно лесов, происходит
их массовая гибель.
Необходим переход на безотходные технологии и
сжигание горючего на предприятиях без выбросов оксидов
азота и серы.
Переосушение почв. Следствие неправильно
проводимых осушительных мелиорации.
При осушении часто необходимо установить и
обеспечить оптимальный уровень залегания грунтовых вод
на полях, при котором происходит подпочвенное
увлажнение растений в сухие периоды. На почвах разного
гранулометрического состава оптимальная глубина
подпочвенных вод различна (на песках и супесях — 70—
80, на суглинках— 100—180 см).
К переосушке и снижению плодородия почв, а также
к недосушке («вымочке») участков тяжелых почвогрунтов
приводит неправильное расположение дрен и водо-
отводящих каналов без. учета мезорельефа и грануло-
Деградация почв 92
метрического состава почв и грунтов. При
проектировании осушительных систем нужно проводить
картографирование рельефа и литологии почв и грунтов в
масштабах 1 : 1000— 1 : 3000. Результаты
картографирования учитывают при устройстве каналов.
К переосушке пойменных почв, часто с содовым
засолением, приводит спрямление русел малых рек в
результате мелиоративных работ в поймах. При этом
происходит потеря воды на пойменных лугах и пастбищах,
исчезает периодическое паводковое увлажнение и
плодородный ил, приносимый паводковыми водами.
Деградационные изменения почв,
вызываемые затоплением, разрушением
и засолением почв водами водохранилищ
Создание водохранилищ при строительстве
гидроэлектростанций (особенно крупных) приводит к
изменениям всего природного комплекса и почвенно-экологи-
ческих условий в том числе. Антропогенное воздействие
на почвенно-экологическую систему состоит из
затопления, инфильтрации, подъема грунтовых вод, эрозии,
абразии, анаэробиозиса, испарения и других факторов.
Степень воздействия этих факторов определяется
размерами водохранилищ, высотой подбора воды, ее
химическим составом, степенью изменения климата.
Сооружение водохранилищ вызывает изменение
почвенного покрова прилегающих территорий, связанное с
усилением гидроморфизма почв, их заболачиванием,
анаэробиозисом. Эти изменения вызываются главным
образом фильтрацией подпертых плотиной речных вод.
На песках и супесях подтопление наблюдается при
положении поверхности почвы над нормальным
подпорным горизонтом (НПГ) от 0,2 до 1 м. На тяжелых
породах— глинах и суглинках — подтопление почв
сказывается на высотах от 1—1,5 до 2—3 м над НПГ. В
северных районах подтопление имеет необратимый
отрицательный характер в силу особенностей мерзлотно-тер-
мического режима. В результате вторичного накопления
влаги происходит снижение теплообеспеченности почв.
Почвенный покров в зоне водохранилищ изменяется
с разной скоростью. Затопление вызывает быстрые
изменения— за 1—2 года, подъем уровня грунтовых вод—
93 Деградация почв
в течение 4—8 лет. Общий подъем уровня грунтовых
вод, засоление и оглеение развиваются через
десятилетия.
Разновидности деградационных процессов,
связанных со строительством водохранилищ, перечислены на
с. 86. Подробнее рассмотрим химическое загрязнение и
содовое (щелочное) засоление вод и почв.
Водохранилища превращают реку в систему стоячих и
полустоячих озер. Сток, таким образом, ослабляется, что
постепенно приводит к загрязнению водоемов химическими
загрязняющими веществами и засолению за счет
притока неочищенных промышленных и городских стоков,
фильтрационных и дренажных вод с оросительных
систем и сбросных вод крупных животноводческих
комплексов, а также избыточному поступлению минеральных
удобрений и пестицидов на поля. В водохранилищах
складывается сильный дефицит кислорода, происходит
анаэробное образование метана, ацетилена, десульфи-
рование и денитрификация. При этом улетучиваются
H^S, NOx, углеводороды. Одновременно образуются
сульфиды натрия Na2S, которые, взаимодействуя с
углекислым газом, ведут к образованию бикарбонатов и
карбонатов натрия, карбоната аммония. Щелочность вод
возрастает до рН 8—8,5. При поливах и при испарении
таких вод почвы становятся содовозасоленными с рН
до 9 и выше, насыщаются обменным натрием, имеют
плохие физические свойства. Плодородие этих почв
низкое, их выключают из пользования. Такое биогенное
содообразование имеет место на Украине, в Молдове,
РСФСР.
Для предотвращения негативных процессов берега
водохранилища должны быть прочными, необходимы:
максимальное удаление органических остатков при
строительстве водохранилищ, их периодическая
аэрация, защита от попадания избытка удобрений,
городских, животноводческих стоков, применение кислых
удобрений на орошаемых полях.
Деградационные изменения, вызываемые
переохлаждением и вторичной мерзлотностью почв
Деградация ландшафтов и почв районов с
распространением многолетней мерзлоты происходит следующим
Деградация почв 94
образом. Почвы и ландшафты этих районов крайне
хрупки и неустойчивы к антропогенным факторам.
Любое воздействие, ведущее к уничтожению почвенно-рас-
тительного покрова, обусловливает протаивание
мерзлых грунтов и развитие деградационных, эрозионных
и других процессов.
Кормовые запасы пастбищ, площадь которых
постоянно сокращается из-за промышленного освоения
районов Севера, возобновляются крайне медленно
(ягельный покров восстанавливается не менее 20 лет).
Необходимо решение основной проблемы —
сохранение и восстановление всей территории пастбищ,
упорядочение пастьбы, переход на запасание кормов (в
критических ситуациях) и т. д.
Деградационные изменения почв военными действиями
и атомной радиацией
Обычные войны. Интенсивное передвижение
людских масс, армий, транспорта, артиллерии, танков,
рытье противотанковых рвов, окопов и т. д., взрывы
бомб и гранат ведут к полному уничтожению экосистем
и почв. На многих полях военных действий почвенный
покров и поныне не восстановлен.
Ядерные войны и атомная радиация. Взрывы
атомных бомб разрушают продуктивные ландшафты
огромных территорий, на несколько десятков и сотен лет
образуются регионы почв высокой атомной радиации.
Биологическая продукция этих регионов также
отличается повышенной радиацией, сохраняющейся
десятилетиями. Повышенная радиация почв связана с
поглощением и накоплением в сорбированном состоянии
многочисленных радиоактивных изотопов (стронция, цезия,
плутония, углерода и др.). В момент взрыва
разрушается почвенный покров и растительность (мощной
взрывной волной, сверхвысокой температурой). В дальнейшем
радиоактивные изотопы поглощаются почвенными
коллоидными частицами и накапливаются в верхних 5—
25 см почвы. Особенно опасны долгоживущие
(десятилетия, столетия) радиоизотопы 90Sr, 106Ru, I29I, 137Cs,
220Ra, 232Th, 238U.
Аварии на АЭС и утечки радиоактивных материалов»
К источникам радиации и загрязнения радиоактивные
95
Деструктивная активность
ми изотопами экосистем относятся: испытательные
взрывы атомных бомб, утечки и аварии на АЭС, рудники
урановых руд, предприятия, изготовляющие
радиоактивные препараты, загрязненные строительные
материалы, медицинские специальные препараты, зола и
дым некоторых видов каменного угля, примеси к
фосфорным удобрениям и др.
Серьезные радиационные аварии, зафиксированные в период с 1945
по 1987 г. (Бюлл. МАГАТЭ, 1988, № 4)
Тип установки
Количество
случаев
Сильное
облучение
Смертельные
случаи
Ядерные установки
Неядерные установки:
промышленные
исследовательские
медицинские
27(34%) 272 (64%) 35 (59%)
42 (52%) 84 (20%) 20 (34%)
7 (9%) 10 (2%) -
4 (5%) 62 (14%) 4 (1%)
Особенно опасны ядерные аварии на АЭС. Почвы,
отравленные радиацией, нельзя использовать в
сельском хозяйстве. Поэтому территории с почвами
повышенной радиации приходится выключать на десятки
лет из использования либо вывозить верхний
радиоактивный слой за пределы данной территории и создавать
новый насыпной горизонт с радиоактивностью, не
превышающей естественный фоновый уровень. Эти
мероприятия крайне сложны и дороги. Поэтому в районах
АЭС должен быть организован регулярный контроль
радиоактивности почв, пищи, воздуха, вод и
медицинское обследование населения.
Деградация почв влечет за собой не только
снижение плодородия, резкое уменьшение количества
сельскохозяйственной продукции. Деградация почв приводит к
патологическим явлениям в здоровье, развитии и
физиологии человека, его умственной деятельности и
психике. Поэтому очень важно проводить почвенно-хими-
ческий экологический мониторинг (см.),
биогеохимическое районирование всей территории СССР.
ДЕСТРУКТИВНАЯ АКТИВНОСТЬ. Отношение
массы элемента в годовой добыче и выбросах в
окружающую среду при сжигании угля к массе элемента в
биологической продукции наземных растений за год.
Детергенты < 96
Деструктивная активность может служить
глобальным и региональным показателем экологического
мониторинга. С увеличением технофильности (см.) и
уменьшением биофильности (см.) деструктивная
активность возрастает.
Глобальные показатели деструктивной активности
элементов (по М. А. Глазовской):
Ртуть /г-105—я-104
Кадмий, фтор /г-103
Сурьма, мышьяк, свинец, уран я-102
Селен, бериллий, барий, олово я-10
Прочие элементы техногенеза 1
(см.)
ДЕТЕРГЕНТЫ. Поверхностно-активные
синтетические вещества, которые используются в
промышленности и быту как эмульгаторы и моющие средства.
Относятся к числу химических загрязняющих
веществ. Детергенты трудно поддаются разложению
микроорганизмами, нарушают кислородный баланс,
ухудшают органолептические качества воды, изменяют
состав микрофлоры, вредно воздействуют на живые
организмы.
Для предупреждения загрязнения вод применяют
двухступенчатые циклы биохимической и
дополнительной биологической очистки стоков, аэрацию воды и
удаление пены. В последнее время промышленность
переходит на выпуск так называемых мягких моющих
средств и эмульгаторов, что предохраняет
окружающую среду от загрязнения детергентами.
ДЕТОКСИКАЦИЯ ЗАГРЯЗНЯЮЩЕГО ПОЧВУ
ХИМИЧЕСКОГО ВЕЩЕСТВА. Превращение
загрязняющего почву химического вещества (см.) в нетоксичные
для живых организмов соединения.
ДЕТОКСИКАЦИЯ ПОЧВ. 1. Совокупность
процессов, происходящих в почве и приводящих к
ослаблению или полному освобождению от токсического
действия загрязняющих веществ (см.) различной природы,
См. также Самоочищение почв.
2. Совокупность приемов, методов, направленных на
создание в загрязненных (отравленных) почвах
условий, способствующих и приводящих к ослаблению или
полному освобождению от токсического действия за-
97 Детритогенез
грязняющих веществ различной природы (см.
Рекультивация почв).
ДЕТРИТ (от лат. detritus — истертый).
Разложившиеся, гумифицированные органические остатки,
практически утратившие исходное строение, но не
превратившиеся полностью в гуминовые вещества.
Считается, что детритом представлена наиболее
легкоминерализуемая часть органического вещества,
которая может служить источником элементов питания
и энергии для микроорганизмов и высших
(культурных) растений. Установившегося определения понятия
«детрит» и методов его анализа нет. Для выделения из
почвы и определения содержания в ней детрита
используют, например, разделение органического вещества в
тяжелых жидкостях.
ДЕТРИТОГЕНЕЗ. Процессы накопления в
ландшафтах неразложившихся и полуразложившихся
остатков растений и животных.
По продолжительности существования в
ландшафте и скорости биогеохимического круговорота можно
выделить:
детрит, возобновление которого происходит в
течение единиц и десятков лет (сухостой в лесах,
валежник, лесная подстилка, степной войлок);
скопления мертвого органического вещества,
возраст которого измеряется тысячелетиями (торф,
сапропель).
Запасы живого и мертвого органического вещества на суше,
среднегодовая первичная продукция (по Н. И. Базилевич)
Объект
Количество органического
вещества
Ю9 т
% от суммы
Живая фитомасса 2402,5 44,8
Детрит (мертвые органические остатки: 563,8 10,7
сухостой, ветошь, степной и луговой
войлок, подстилка, торф)
Гумус 2400,0 44,5
Сумма
5366,3 100
Диаграммы растворимости 98
ДИАГРАММЫ РАСТВОРИМОСТИ. Графическое
изображение зависимости содержания какого-либо
химического элемента в насыщенном растворе от условий,
влияющих на растворимость соединений этого элемента.
Диаграммы строят, используя термодинамические
константы по рассчитанным значениям растворимости
тех минеральных соединений химических элементов в
почвах (соли, оксиды, гидроксиды), с растворением
которых предположительно связан уровень концентрации
этих элементов в растворе. На диаграммах по оси
ординат чаще всего откладывают концентрацию,
активность химических элементов, по оси абсцисс — уровни
тех показателей, которые влияют на растворимость хи-
'9 CFe,
моль/л
2 ~
о н
"Т-
10
рН
Диаграммы растворимости соединений железа:
/-«FeOOH; 2-Fe(OH)3; 3-Fe(OH)2; 4 - Fe3(P04)2-8H20; 5-Fe3(OH)s;
6 — Fe(C03)2 -
99 Дистанционные методы исследования окружающей среды
мических соединений (рН, Eh, концентрация
органических и неорганических лигандов — см. Комплексные
соединения). В этих полях располагают полученные в
эксперименте данные. Диаграммы растворимости
используют для характеристики почвенного раствора и
твердых фаз почвы.
По диаграммам растворимости и известным
значениям рН можно найти, например, возможную
концентрацию в почвенном растворе Fe, Zn, Pb и других
металлов.
Например, судя по диаграмме, показанной на
рисунке, при доминирующем влиянии Fe(OH)3 на
уровень концентрации железа в природных водах
концентрация его в почвенном растворе при рН 5—6 не
превышает Ю-7 моль/л с учетом только реакций гидролиза.
Диаграммы растворимости позволяют
предположительно идентифицировать то соединение в твердых
фазах, с растворением которого связана концентрация
химического элемента в растворе.
Использование диаграмм растворимости расширяет
возможности научно обоснованного прогнозирования
поведения тяжелых металлов в ландшафте, так как
позволяет предсказывать условия выпадения в осадок и
уровни концентрации тяжелых металлов в природных
водах.
ДИСТАНЦИОННЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
ОКРУЖАЮЩЕЙ СРЕДЫ. Методы изучения
окружающей среды и природных ресурсов с помощью
космической техники, самолетов и других технических средств
позволяют вести наблюдения на различном удалении
от объекта.
Большие перспективы для изучения загрязнения
почвенного покрова открываются в связи с развитием
современных дистанционных методов исследования
окружающей среды. В системе мониторинга используют
различные дистанционные методы регистрации:
визуальные, фотографические, телевизионные,
спектрометрические, радиолокационные. Исследования могут
проводиться с помощью многозональной съемки с
самолетов-лабораторий, спутников, космических кораблей и
станций. Космический мониторинг окружающей среды
позволяет выявить очаги и характер ее нарушений с
Дренаж 100
минимальной инерцией во времени, прослеживать и
картографировать распространение антропогенных
воздействий, оценивать их интенсивность.
Картографирование загрязнения почв проводят
аэрокосмическими методами и традиционным методом
картографии путем отбора и анализа образцов.
ДРЕНАЖ. Способ осушения избыточно увлажненных
почв с помощью искусственных закрытых (подземных)
или открытых дрен, последние могут быть свободными
или заполненными водопроводящими материалами.
Строго согласованное понятие дренажа отсутствует,
некоторые специалисты понимают под дренажем
осушение только с помощью закрытых дрен, другие
допускают как закрытые, так и открытые дрены. Дренаж —
не только важнейшее средство осушения
переувлажненных почв, но и прием предупреждения вторичного
засоления и осолонцевания на орошаемых землях.
Кроме избытка солей дренаж позволяет проводить сброс
нитратов, ряда загрязняющих веществ. Дренажные
воды, в свою очередь, могут оказаться серьезным
источником загрязняющих веществ для водоемов и
территорий, куда эти воды сбрасывают.
ДЫХАНИЕ ПОЧВЫ. Один из показателей
биологической активности почв. Общая интенсивность дыхания
почвы обусловлена всей ее биологической активностью
и определяется количеством потребленного кислорода и
количеством продуцированного диоксида углерода
(углекислого газа).
Интенсивность и пространственное распределение
дыхания почвы зависят от множества факторов — от ее
температуры, влажности, содержания органического
вещества и изменения во времени деятельности
микроорганизмов, развития корней высших растений. При
одной и той же температуре интенсивность дыхания
выше весной, чем осенью. Это связано с большим
развитием микробной массы весной и с большей
доступностью в это время года неразложившихся
растительных остатков. Дыхание значительно сильнее на
занятых сельскохозяйственными культурами участках по
сравнению с паром, что обусловлено как дыханием
корней, так и усиленной микробиологической деятель-
101 Емкость катионного обмена (ЕКО)
ностыо. Суточные колебания почвенного дыхания
следуют за ходом температуры.
Дыхание почвы как показатель ее биологической
активности может служить индикатором при ранней
диагностике загрязнения почв промышленными
выбросами (см. Активность почв биологическая).
Методы определения дыхания почвы основаны на
измерении выделяемого С02.
Е
ЕМКОСТЬ АНИОННОГО ОБМЕНА (ЕАО). Общее
количество анионов, способных к эквивалентному
обмену с анионами взаимодействующего с почвой
раствора.
ЕАО выражают в мг-экв на 100 г почвы, а по
Международной системе СИ — в сантимолях
положительного заряда на 1 кг почвы. Реально определить величину
ЕАО трудно, поскольку ряд анионов образует с
почвенными частицами прочные внутрисферные
комплексы, и поэтому ЕАО сильно зависит от вытесняющего
аниона. ЕАО возрастает с уменьшением рН
вытесняющего раствора, то есть зависит от кислотно-основных
условий.
Основные носители ЕАО в почвах'—минералы —
гидроксиды железа и алюминия (см.), которые имеют
на поверхности частиц гидроксогруппы, легко
замещаемые анионами. Поэтому величина ЕАО в почвах с
низким содержанием гидроксидов Fe и А1 (это большая
часть пахотных почв на территории нашей страны)
невелика и измеряется десятыми долями мг-экв на 100 г
почвы. В почвах тропических и субтропических
регионов с высоким содержанием гидроксидов Fe и А1 ЕАО
может достигать нескольких мг-экв на 100 г почвы.
При изучении загрязнения почв определение ЕАО
имеет большое практическое значение, поскольку
некоторые загрязняющие компоненты адсорбируются
почвами в форме обменных анионов (см. Анионы
обменные) .
ЕМКОСТЬ КАТИОННОГО ОБМЕНА (ЕКО)
(синоним— емкость поглощения). Общее количество катио-
Емкость катионного обмена (ЕКО) 102
нов, способных к эквивалентному обмену с катионами
взаимодействующего с почвой раствора.
ЕКО выражают в мг-экв на 100 г, а по
Международной системе СИ — в сантимолях на 1 кг почвы.
Поскольку ЕКО одной и той же почвы зависит от рН
раствора, которым вытесняют обменные катионы,
различают несколько видов ЕКО.
1. ЕКО стандартную определяют путем
вытеснения из почвы обменных катионов катионом забуфе-
ренного солевого раствора; чаще всего для этой цели
используют раствор ВаСЬ с рН 6,5. В зарубежных
странах широко применяют забуференный раствор той
же соли с рН 8,2.
2. ЕКО реальная (эффективная)
определяется при использовании незабуференных
вытесняющих растворов солей или буферных растворов,
имеющих такие же значения рН, как и изучаемый
почвенный образец. Иногда реальную ЕКО определяют по
сумме обменных катионов.
3. ЕКО дифференциальную (зависимую от
рН ЕКО) оценивают по разности между величинами
ЕКО, найденными при значениях рН 6,5 и 8,2.
Основные носители обменных позиций, то есть
основные источники ЕКО в почвах — глинистые
минералы (см.) и органо-минеральиые соединения. Обменные
позиции глинистых минералов формируются за счет
изоморфного замещения Si4+ на Al3* и А13+ на Mg2+ в
кристаллических решетках (см. Глинистые минералы,
Заряд почвенных коллоидов постоянный), а также за
счет разорванных связей на боковых гранях глинистых
частиц.
Наивысшими значениями ЕКО (до 120—160 мг-экв
на 100 г минерала) характеризуются монтмориллониты
и вермикулиты, средними значениями (10—40 мг-экв
на 100 г)—иллиты, минимальными величинами (5—
15 мг-экв на 100 г)—каолиниты. ЕКО гидроксидов Fe
и А1 и аллофанов связана с наличием слоя потенциал-
определяющих ионов на поверхности частиц этих
минералов (см. Заряд почвенных коллоидов переменный).
ЕКО органического вещества формируется
преимущественно за счет диссоциации карбоксильных групп,
а в условиях щелочной реакции — также за счет дис-
103
Железо в почвах
социации фенольных ipynn. EKO органического
вещества почв в 10—30 раз превышает ЕКО глинистых
минералов и достигает 600—800 мг-экв и более на 100 г
органического вещества.
С повышением ЕКО почвы возрастает способность
к поглощению загрязняющих веществ и буферность
почв по отношению к этим веществам. В соответствии
с гранулометрическим составом и содержанием гумуса
максимальные величины ЕКО свойственны типичным
суглинистым и глинистым черноземам, минимальные —
песчаным подзолистым почвам (табл.).
Стандартная емкость катионного обмена разных почв, мг-экв
на 100 г почвы
Почва
Горизонт
Глубина, см
ЕКО
Дерново-сильноподзолистая
суглинистая под лесом
Дерново-подзолистая
песчаная пахотная
Серая лесная суглинистая
Чернозем типичный
суглинистый под луговой степью
Светло-каштановая
суглинистая пахотная
Серозем типичный
суглинистый пахотный
А1
А2
В2
С
Апах
В2
ВЗ
Апах
В1
В2
А1
А1
А1
А1
Апах
В1
В'2
С
Апах
В
В1
с
2-8
8—15
60—70
1/20—1130
0—'10
50—60
75—85
0—10
30—35
47—52
4—ID
'10—30
40—50
56—66
0—10
20—30
50—6)0
90—100
0—Ш
10—25
25—30
40—50
25
10
20
23
4
1
1
14
13
17
74
63
63
58
24
22
29
30
11
11
16
16
ж
ЖЕЛЕЗО В ПОЧВАХ. Обязательный химический
элемент, присутствующий во всех почвах.
Железо в почвах 104
Содержание его составляет от долей процента
до 10—12%. Входит в состав твердых и жидких фаз
почвы. Железо твердых фаз представлено
породообразующими обломочными минералами, глинистыми
минералами (см.), оксидами и гидроксидами, входит в
карбонатные, силикатные, фосфатные минералы. Из
силикатов богаты железом островные силикаты, пироксены,
амфиболы, слюды; из рудных — сульфиды (пририт,
халькопирит), сидерит, сульфат.
Большое значение в формирований почвенного
профиля играют свободные (несиликатные) соединения
железа. Они представлены аморфными гидроксидами
Fe(OH)3, магнетитом Fe304, гематитом a-Fe203, гети-
том a-FeOOH, гидрогетитом или лепидокрокитом
Y-FeOOH, ферригидритом Fe203-FeOOH-2,6H20.
Железистые минералы в почвах подвергаются
химическим превращениям. Формирующееся соотношение
форм соединений железа служит диагностическим
показателем почв и почвенных горизонтов. Оно определяется
свойствами почвообразующих пород,
гидротермическими условиями, внутрипочвенными процессами. Каждый
из этих факторов может быть доминирующим.
Выявлены некоторые общие закономерности:
соотношение свободного и силикатного железа
может быть показателем интенсивности выветривания
минеральной части почвы; чем больше относительное
содержание свободных форм Fe, тем интенсивнее
выветривание;
соединения двухвалентного железа образуются при
анаэробных условиях, которые создаются при
избыточном грунтовом или поверхностном увлажнении, в этих
условиях преобладают амqpфныe его соединения;
доля аморфных соединений железа мала в почвах
с высокими средними температурами, отсутствием
сезонного переувлажнения почв.
Концентрация железа в природных водах
определяется осаждением — растворением Fe(OH)3, зависит от
рН, содержания органического вещества и минеральных
солей. В почвенном растворе железо находится в
форме свободных ионов и в составе комплексов с
органическими (специфическими и неспецифическими) и
неорганическими (ОН", F-, С1-, С032-, НР042-) лиганда-
105 Жидкая часть почвы
ми (см. Комплексные соединения). Присутствие в
растворе фульвокислот ведет к повышению
концентрации Fe на порядок и более.
В природных условиях при выветривании
железосодержащих минералов Fe поступает в состав
поверхностных и почвенных вод, легко гидролизуется и образует
коллоиды Fe(OH)3. С выпадением гидроксида железа
связан и уровень концентрации Fe в природных водах,
и количество подвижного железа в почве.
Подвижное железо определяют в вытяжках
разбавленных лислот —1 н. H2S04, 0,1 н. H2S04, 1 н. HC1.
Наибольшее количество подвижного железа в почвах
с кислой реакцией: в дерново-подзолистых, дерново-
глеевых, луговых и тундровых. В кислых почвах с
избыточным увлажнением в составе подвижных
соединений содержится в значительном количестве Fe2+. В
таких почвах Fe2+ оказывает токсичное действие на
растения — нарушаются
окислительно-восстановительные процессы и кислородный обмен в растительном
организме.
Формирующиеся в почве железистые осадки, как
правило, обогащены тяжелыми металлами, в том числе
и поступающими из антропогенных источников. Поэтому
железистые аккумуляции, действуя как сорбционные
геохимические барьеры, ограничивают миграцию
тяжелых металлов в ландшафте (см. Барьеры геохимические,
Миграция химических соединений).
ЖИДКАЯ ЧАСТЬ ПОЧВЫ (жидкая фаза почвы).
Природные воды, включающие пленочную
(адсорбированную), капиллярную (поровую) и гравитационную
воду. Это деление условное, резких границ между
указанными формами воды в почве нет.
Пленочная вода обладает отличными от
свободной воды свойствами в результате
непосредственного воздействия твердых фаз, которые она покрывает:
в ней меньше концентрация солей, ионы пленочной
воды испытывают электростатическое взаимодействие
с твердыми фазами. С этой формой воды связано
понятие «нерастворяющего» объема влаги. Пленочная вода
находится в динамическом равновесии с капиллярной
водой.
К почвенному раствору можно условно отнести ка-
Загрязнение 106
пиллярную воду, которая занимает меж- и внутри-
агрегатные капилляры. Состав почвенного раствора
зависит от свойств твердых фаз, с которыми капиллярная
вода находится в динамическом равновесии.
Гравитационная вода передвигается в почве
под влиянием силы тяжести, о ее составе можно судить
по составу лизиметрических вод. На состав
гравитационной воды влияет также состав капиллярной воды,
свойства взаимодействующих с ней твердых фаз почвы,
характер поступающих в почву вод (атмосферных,
поливных), растительность. С гравитационной водой
связано перемещение химических веществ по почвенному
профилю.
Используют следующие методы анализа
состава жидкой фазы почвы.
Полевые исследования:
измерение активности ионов с помощью ионселек-
гивных электродов;
сбор и анализ лизиметрических вод.
Лабораторные исследования:
выделение почвенных растворов;
получение водных вытяжек.
Наиболее распространены потенциометрические
методы — использование ионселективных электродов,
измерение окислительно-восстановительных потенциалов.
Из прямых методов определения количества солей в
почвенных водах применяют кондуктометрический
метод, основанный на измерении электрического
сопротивления растворимых солей.
В природоохранных целях жидкую фазу почв
анализируют на содержание нитратов, тяжелых металлов,
пестицидов, что позволяет оценить загрязнение
ландшафта и миграционную способность загрязняющих
веществ. С помощью таких методов, например,
установлено поступление нитратов из толщи получающих
минеральные удобрения почв в грунтовые воды, залегающие
на глубине 2—3 м.
з
ЗАГРЯЗНЕНИЕ. Природное и (или) -вызванное
деятельностью человека увеличение содержания различ-
107 Загрязнение гербицидами
ных веществ в абиотических и биотических средах,
обусловливающее негативные токсико-экологические
последствия.
ЗАГРЯЗНЕНИЕ ГЕРБИЦИДАМИ. Химические ве
щества, применяемые для избирательного или полного
уничтожения нежелательных травянистых (иногда
кустарниковых и древесных) растений, называются
гербицидами (от лат. herbum — трава, saedo — убиваю).
Гербициды — одна из групп пестицидов.
По характеру действия на растения гербициды
делятся на две подгруппы:
сплошного действия — к ним чувствительны
все виды растений; такие гербициды применяют для
уничтожения нежелательной растительности вокруг
промышленных объектов, на лесных вырубках, в
питомниках, водоемах, на обочинах шоссейных дорог и т. д.;
избирательные (селективные) — опасны
для одних видов растений и безопасны для других; эти
гербициды используют для уничтожения сорняков в аг-
роценозах.
Данное деление — условно, так как одни и те же
вещества в зависимости от концентраций и норм расхода
на единицу обрабатываемой площади могут проявлять
себя и как гербициды сплошного действия и как
избирательные.
По внешним признакам воздействия на растения
и способам применения гербициды подразделяют на три
подгруппы:
контактного действия;
системного действия;
действующие на корневую систему растений или на
прорастание семян.
К гербицидам контактного действия
относятся вещества, при непосредственном контакте с
которыми поражаются листья и стебли растений. Такие
гербициды поражают те участки растений, на которые
попал препарат.
К гербицидам системного действия
относятся вещества, способные передвигаться по
сосудистой системе растений. Попав на листья и корни, они
быстро распространяются по всему растению, вызывая
Загрязнение инсектицидами 108
его гибель. Применение препаратов системного действия
особенно ценно в борьбе с сорняками.
Ге р б и ц и д ы следующей подгруппы применяют для
уничтожения прорастающих семян и
корней сорных растений. Такие препараты вносят в почву.
Дефолианты и десиканты (см. Загрязнение
пестицидами) по характеру действия близки к
гербицидам контактного действия, в то же время контактные
гербициды используют часто в качестве дефолиантов и
десикантов, если они безопасны для семян
обрабатываемой культуры.
К гербицидам в большинстве случаев относят также
арборициды и альгициды (см. Загрязнение
пестицидами).
Негативные последствия применения гербицидов
проявляются в их способности накапливаться и
сохраняться в природной среде длительное время (см. Время
самоочищения почв), вызывая токсические реакции поч*
венной биоты. Уничтожение существенной части флоры
химическим способом, помимо непосредственного
токсического эффекта, приводит к значительному
сокращению источников питания для живых организмов, что
нарушает внутриценотические связи и обусловливает
сдвиг экологического равновесия в биосфере.
ЗАГРЯЗНЕНИЕ ИНСЕКТИЦИДАМИ. Химические
вещества, применяемые для уничтожения насекомых,
нежелательных в хозяйстве или природных
сообществах, называются инсектицидами. Инсектициды —
одна из групп пестицидов. Вредное действие
инсектицидов сводится к трем моментам:
они уничтожают многие полезные или хозяйственно-
нейтральные виды и обедняют экосистемы;
служат причиной появлений устойчивых популяций
вредителей, от которых становится все труднее
избавляться;
накапливаются в экосистемах и могут сохраняться
в них в течение нескольких лет, это в особенности
относится к остаточным инсектицидам типа ДДТ,
количество которого на Земле (в распыленном состоянии) в
настоящее время достигло 1 млн т.
Инсектициды токсичны как для вредных, так и для
полезных животных. В настоящее время, ввиду инток-
109 Загрязнение канцерогенными углеводородами
сикации хлорорганическими препаратами, сильно
сократилась численность птиц, особенно хищных. Велика
токсичность инсектицидов для плотоядных животных, так
как эти препараты постепенно концентрируются в
живом 01рганизме по мере продвижения к конечным
пищевым цепям. Основная опасность заключается в том, что
повторное введение мелких доз влечет развитие
хронической интоксикации, с трудом поддающейся
диагностике. Инсектициды действуют как кумулятивные яды.
Нарушение естественного равновесия в природе —
следствие действия инсектицидов на животных.
Непредвиденным результатом массового применения
синтетических инсектицидов стало появление резистентных
линий. Так, в мире насчитывается порядка 200 видов,
приобретших устойчивость к разным инсектицидам, из
них 8Q — переносчики болезней, подобно малярийному
комару.
ЗАГРЯЗНЕНИЕ КАНЦЕРОГЕННЫМИ
УГЛЕВОДОРОДАМИ. Сжигание угля, нефтепродуктов, газа,
битумов и других веществ сопровождается
поступлением в атмосферу, почвы и водную среду значительных
масс канцерогенных веществ, среди которых особенно
опасны полициклические ароматические
углеводороды (ПА У) и бензпирен (БП).
Автотранспорт, авиация, паровозы, коксохимические и
нефтеперегонные заводы, нефтепромыслы способствуют
загрязнению окружающей среды этими канцерогенами.
Антропогенные источники выбрасывают в атмосферу
канцерогенный 3,4-бензпирен, другие токсичные
соединения.
Присутствие повышенных количеств БП в воздухе,
водах, почвах, пище установлено в городах,
промышленных регионах, вокруг предприятий,
железнодорожных станций, аэропортов, вдоль дорог. Главный
конечный резервуар аккумуляции БП — почвенный покров.
Загрязненность бензпиреном почв непромышленных
районов, по данным Л. М. Шабада, в среднем за три
года составила, мкг/кг:
Район жилой застройки:
старой 0,34
новой 0,'20
Поселок 0,07
Обрабатываемое поле 0,07
Загрязнение канцерогенными углеводородами
ПО
Содержание бензпирена в
почве вблизи коксохимических
заводов (по Л. М. Шабаду)
Расстояние от завода, м
Контроль (лесная
почва, отобранная вдали от
промышленного
предприятия)
500
1000
2000
Глубина слоя
почвы, см
0-5
25
50
0-5
25
50
0-5
25
50
0-5
25
50
Количество БП
в смоле,
полученной из почвы,%
0,0003
0,0002
0,00002
0,0032—0390
0,0005—0,034
0,0008—0,032
'0,0001—0,0234
0,0014—0,01)32
0,0005—0,0043
0,0008—0,0102
0,0003—0,1660
0,004—0,00183
в почве,
мкг/кг
0,6
0,6
0,1
25,4—43)2,0
3,5—.220,0
1,1—214,0
)Ш,0—62,0
1,4—15,0
1,2—5,0
8,6—1)1,6
0,8—'12,5
0,8—7,9
Наблюдается тенденция увеличения содержания БП
в пространстве и во времени. Больше всего бензпирена
накапливается в гумусовом горизонте почв. С
почвенной пылью, грунтовыми водами, в результате водной
эрозии, с продуктами питания бензпирен поступает в
общие биогеохимические циклы на суше,
распространяясь повсеместно.
Почвы обладают некоторой способностью
разлагать БП. По-видимому, низшие организмы, грибы,
почвенные микроорганизмы служат (как и в случае с
гербицидами) факторами «самоочищения» почв от
бензпирена. Этому же способствует солнечный свет. Однако
механизм самоочищения не всегда справляется с
растущей массой бензпиренов, поступающих в воздух и на
сушу. Более того, можно предполагать, что в
анаэробных условиях, в заболоченных почвах возможен синтез
БП или близких к нему веществ. Почва может,
по-видимому, фиксировать БП и сохранять его, освобождая
при сменах влажности, аэр,ации или реакции (рН)
среды.
Все эти вопросы нуждаются в фундаментальных
исследованиях применительно к различным типам почв,
ландшафтам и сезонам года. Показатели содержания
ПАУ (БП) в почвах, водах, урожае, продуктах питания
] 11 Загрязнение нефтью и нефтепродуктами
должны быть обязательными параметрами в
экологическом мониторинге среды и в оценке качества почвенного
покрова как среды обитания человека и как
производителя биомассы. Опасность онкологических заболеваний
и их связь с накоплением канцерогенных веществ в
воздухе, воде, продуктах питания и почвах заставляют
максимально совершенствовать технологии производства
и сжигания горючего в целях ликвидации или снижения
поступления ПАУ в окружающую среду.
Накопление БП в растениях, по-видимому, —
установленный факт (семена подсолнечника, клубни
картофеля). Поэтому массивы почв, уже зараженные
канцерогенными ПАУ, не должны быть использованы для
производства продовольствия.
ЗАГРЯЗНЕНИЕ НЕФТЬЮ И
НЕФТЕПРОДУКТАМИ. Ежегодно в мире добывается свыше 2,5 млрд т
сырой нефти. Негативное последствие интенсификации
нефтедобычи — загрязнение (см.) природной среды
нефтью и продуктами ее переработки. При добыче,
транспортировке, переработке и использовании нефти и
нефтепродуктов их теряется около 50 млн т в год. В
результате нефтяного загрязнения значительные
территории становятся непригодными для
сельскохозяйственного использования.
С поступлением в почвы сырой нефти и
нефтепродуктов начинается процесс их естественного
фракционирования и разложения. При этом легкие фракции нефти
постепенно испаряются в атмосферу, некоторая часть
нефти механически выносится водой за пределы
площади загрязнения и рассеивается на путях движения
водных потоков. Часть нефти подвергается химическому
и биологическому окислению.
Нефть — это сложные смеси газообразных, жидких
и твердых углеводородов, различных их производных
и органических соединений других классов. Основные
элементы в составе нефти — углерод (83—87 %) и
водород (12—14%). Из других элементов в ее состав в
заметных количествах входят сера, азот и кислород.
Содержание серы колеблется в широких пределах: от
тысячных и сотых долей процента до 6—14%.
Содержание азота и кислорода составляет
соответственно 0,02—1,7 и 0,005—3,6%. Кроме того, нефть, как
Загрязнение нефтью и нефтепродуктами 112
правило, содержит незначительные количества
микроэлементов. В составе нефти идентифицировано
свыше 1000 индивидуальных соединений. Из них 250
содержат серу, около 85 — кислород и свыше 30 — азот.
Более 700 индивидуальных углеводородов, входящих
в состав нефти, имеют углеродный скелет от d до С4о-
В жидких углеводородах нефти растворены смолис-
то-асфальтеновые вещества, которые представляют
высокомолекулярные органические соединения,
содержащие в рреднем до 88% С, до 10 —Н и до 14% гете-
роатомов.
Для оценки нефти как вещества, загрязняющего
природную среду, Ю. И. Пиковский предлагает
использовать следующие признаки: содержание легких
фракций (Лшп<200°С), содержание парафина, и серы.
Количество легких фракций тесно связано с плотностью и
вязкостью нефти, количеством смолистых компонентов,
групповым углеводородным составом. Легкие фракции
обладают повышенной токсичностью для живых
организмов, в то же время их высокая испаряемость
способствует быстрому самоочищению компонентов
природной среды. Парафин не оказывает сильного
токсического действия на живые организмы, но благодаря
высокой температуре застывания существенно влияет
на физические свойства почв. По степени парафинисто-
сти нефти и содержанию легких фракций можно судить
о характере воздействия нефтяного загрязнения на
почву и устойчивости этого воздействия. Содержание
серы — также важный признак при оценке влияния
нефти на природную среду. С увеличением сернистости
нефти возрастает опасность сероводородного
загрязнения почв.
Основные загрязняющие вещества для почв:
пластовая жидкость, состоящая из сырой нефти, газа,
нефтяных вод; газ газовых шапок нефтяных залежей;
законтурные воды нефтяных пластов; нефть, газ и сточные
воды, полученные в результате отделения пластовой
жидкости и первичной подготовки нефти; подземные
воды; буровые растворы; нефтепродукты. Эти вещества
попадают в окружающую среду вследствие нарушения
технологии, различных аварийных ситуаций и т. д.
Компоненты газовых потоков осаждаются на поверхно-
113 Загрязнение пестицидами
сти растений, почв, водоемов, частично углеводороды
возвращаются на земную поверхность с осадками, при
этом происходит вторичное загрязнение суши и
водоемов.
С поступлением нефти и нефтепродуктов в
окружающую среду наряду с процессами микробиологического
и химического разложения происходит их испарение,
что может служить источником загрязнения атмосферы
и почв. Нефтяные вещества способны накапливаться в
донных отложениях, а затем с течением времени
включаться в физико-химическую, механическую и
биогенную миграции вещества. Преобладание тех или иных
процессов превращения, миграции и аккумуляции
нефтепродуктов чрезвычайно сильно зависит от природно-
климатических условий и свойств почв, в которые
поступают эти загрязняющие вещества. При попадании
нефти в почву происходят глубокие, необратимые
изменения морфологических, физических,
физико-химических, микробиологических свойств, а иногда и
существенные изменения почвенного профиля,, что приводит к
потере загрязненными почвами плoдqpoдия и
отторжению территорий из сельскохозяйственного
использования.
ЗАГРЯЗНЕНИЕ ПЕСТИЦИДАМИ. Химические
вещества, употребляемые для уничтожения тех или иных
видов вредных организмов, называются
пестицидами (от лат. pestis — зараза, saedo — убиваю).
В зависимости от направления использования
пестициды разделяются на следующие группы.
1. Гербициды — для борьбы с сорными растениями.
2. Альгициды — для уничтожения водорослей и
другой водной растительности.
3. Арборициды — для уничтожения нежелательной
древесной и кустарниковой растительности.
4. Фунгициды — для борьбы с грибными болезнями
растений.
5. Бактерициды — для борьбы с бактериями и
бактериальными болезнями.
6. Инсектициды — для борьбы с вредными
насекомыми.
7. Акарициды — для борьбы с клещами.
8. Зооциды — для борьбы с грызунами.
8 Заказ 5937
Загрязнение пестицидами 114
9. Лимациды — для борьбы с моллюсками.
10. Нем ато ц и д ы — для борьбы с круглыми червями.
11. Афициды — для борьбы с тлями.
К пестицидам относятся также химические средства
стимулирования и торможения роста растений,
препараты для удаления листьев (дефолианты) и
подсушивания растений (десиканты).
Пестициды в значительных количествах вносят в
почвы во всех экосистемах. Наиболее обширную группу
веществ среди пестицидов как по/объемам
применения (40—50%), так и по ассортименту выпускаемых
препаратов (около 40%) составляют гербициды.
Применение пестицидов резко снижает потери
урожаев сельскохозяйственных культур, в 2—3 раза
сокращает затраты труда в сельском хозяйстве, позволяет
ежегодно сохранять сельскохозяйственную продукцию
на 10—12 млрд руб. Затраты на пестициды в сельском
хозяйстве в течение сезона окупаются в несколько раз.
Высокая экономическая эффективность пестицидов
обусловливает рост объемов их применения. Годовое
производство пестицидов в мире к настоящему времени
превысило 2 млрд т; мировой ассортимент пестицидных
препаратов насчитывает более 100 тыс. наименований
на основе более чем 700 химических веществ,
принадлежащих к самым различным классам органических и
неорганических соединений.
Признавая несомненный положительный эффект
химического способа борьбы с сорными растениями,
следует учитывать возможное побочное действие
гербицидов на другие компоненты природных экосистем: на
животный мир, культурные и дикорастущие полезные
растения, атмосферу, почву, водоемы. Нежелательные
последствия возникают чаще всего при систематической
обработке больших площадей и связаны с появлением
как токсикологических, так и экологических проблем.
Наибольшую опасность представляют стойкие
пестициды и их метаболиты, способные накапливаться и
сохраняться в природной среде до нескольких десятков
лет, что может вызывать загрязнение почв, водоемов,
кормов, продуктов питания. При определенных
условиях из метаболитов пестицидов образуются
метаболиты второго порядка, роль, значение и влияние которых
115 Загрязнение почвы глобальное
на окружающую среду во многих случаях остаются
неизвестными. Последствия неумеренного применения
пестицидов могут быть самыми неожиданными, а
главное— биологически непредсказуемыми; на смену одним
видам вредных организмов часто приходят другие,
которые вырабатывают иммунитет к препаратам и
способны выживать даже после самых эффективных
обработок. Для преодоления иммунитета устойчивых особей
к пестицидам необходимо увеличивать дозу препаратов,
а это усиливает опасность загрязнения окружающей
среды.
Вследствие миграции пестицидов с воздушными,
водными потоками в биологическом круговороте веществ
последствия токсического действия химических
препаратов могут быть обнаружены на территории, где их
никогда не применяли. Уничтожение существенной
части флqpы химическим способом, помимо
непосредственного токсического эффекта, сопровождается
значительным сокращением источников питания для фауны и
микроорганизмов, что приводит к нарушению внутри-
ценотических связей и в конечном итоге — сдвигу
экологического равновесия в биосфере.
Возрастание объемов применения пестицидов, в
частности гербицидов, во всем мире обусловливает особую
актуальность детального и всестороннего изучения и
прогнозирования всевозможных изменений,
возникающих в биосфере под влиянием этих веществ.
Необходима разработка эффективных мероприятий по
предупреждению нежелательных последствий интенсивной
химизации либо по управлению функционированием
экосистем в условиях загрязнения.
ЗАГРЯЗНЕНИЕ ПОЧВЫ. Накопление в почве ряда
веществ и организмов в таких количествах, которые
снижают технологическую, питательную и санитарно-
гигиеническую ценность выращиваемых культур,
ухудшает качество других природных объектов и может
приводить к деградации почвы (см.).
ЗАГРЯЗНЕНИЕ ПОЧВЫ ГЛОБАЛЬНОЕ. Химиче
ское загрязнение почвы (см.), возникающее вследствие
дальнего переноса загрязняющих веществ (см.) в
атмосфере и имеющее общепланетарный характер.
Загрязнение почвы локальное 116
ЗАГРЯЗНЕНИЕ ПОЧВЫ ЛОКАЛЬНОЕ.
Химическое загрязнение почвы (см.) вблизи источников загряз-
нения (см.).
ЗАГРЯЗНЕНИЕ ПОЧВЫ РЕГИОНАЛЬНОЕ.
Химическое загрязнение почвы -(см.), возникающее
вследствие совокупного влияния переноса в атмосфере
загрязняющих веществ (см.) и других источников загрязнения
(см.) и охватывающее крупные территории
интенсивного хозяйственного пользования.
ЗАГРЯЗНЕНИЕ ПОЧВЫ ХИМИЧЕСКОЕ.
Изменение химического состава почвы в результате
антропогенной деятельности, способное вызвать ухудшение ее
качества. При этом изменение химического состава
может быть обусловлено не только появлением новых
химических веществ^ которых нет в незагрязненной
природной почве, но и увеличением содержания
некоторых веществ, обычно присутствующих в незагрязненной
природной почве.
ЗАГРЯЗНЕНИЕ ПРИРОДНОЙ СРЕДЫ. Широкое
понятие, охватывающее поступление в окружающую
среду продуктов техногенеза (см.), оказывающих
вредное воздействие на человека, на биологические
компоненты, а также на технические сооружения (порча
зданий, разрушение подводных конструкций).
В соответствии с положением В. И. Вернадского
о ведущей геохимической роли живого вещества в
биосфере и слагающих ее биокосных телах основным
критерием загрязненности (или незагрязненности)
территории является состояние и функционирование присущих
данной системе живых организмов.
По М. А. Глазовской (1988), в незагрязненных
биокосных системах пределы колебаний концентрации
техногенных веществ, а также формы их нахождения в
данной системе должны удовлетворять следующим
условиям:
не нарушаются газовые, концентрационные и
окислительно-восстановительные функции живого вещества
системы, регулирующие ее геохимическое
самоочищение;
биохимический состав первичной и вторичной
продукции не изменяется настолько, чтобы вызвать
нарушение жизненных функций цепей не только данной
117 Загрязнение промышленное
системы, но и за ее пределами (при отчуждении
биологической продукции);
не понижается биологическая продуктивность
системы;
не понижается информативность системы:
сохраняется необходимый для существования системы генофонд.
При нарушении этих условий происходит
техногенная трансформация природной системы, при
критических уровнях техногенного воздействия — ее
разрушение.
ЗАГРЯЗНЕНИЕ ПРОМЫШЛЕННОЕ (техногенное).
Загрязнение (см.) почв и других компонентов
биосферы за счет функционирования промышленности.
Основные пути промышленного загрязнения: через
атмосферу при осаждении паров, аэрозолей, пыли или
растворенных соединений поллютантов (см.
Загрязняющие вещества) с дождем и снегом. Значительная доля
загрязняющих веществ попадает в воздух из труб и
вентиляционных каналов, большая часть — осаждается
вблизи (1—2 км) предприятий, некоторое количество
переносится дальше и выпадает в пределах 3—4 и
до 8 км. Намного меньше газопылевых выбросов
поглощается почвой на расстоянии 10—50 км от источника
загрязнения.
Протяженность зоны интенсивного загрязнения и
направление движения потока загрязняющих веществ
зависят от скорости и частоты ветров данного румба
(розы ветров), высоты труб, характера выбросов в
атмосферу (дисперсность частиц, плотность веществ),
рельефа территории, растительного покрова. Значительное
количество тонкодисперсных аэрозолей и газов остается
в атмосфере и переносится на большие расстояния,
поступая в глобальный круговорот на планете.
Пыль с высоким содержанием поллютантов с
территории завода, трассы, по которой перевозят руду или
концентрат, с отвалов из отходов производства и т. д.
легко, особенно в сухое время года, переносится ветром
на прилегающие пространства и захватывается
воздушными потоками, уносящими ее на несколько
километров. Ливневые потоки размывают и уносят грунт,
покрывающий территорию завода и содержащий
значительные количества токсических соединений.
Загрязнение промышленное 118
На плавильных заводах, расположенных, как
правило, вблизи рек или водоемов, складируют шлаки на
террасах или высокой пойме, на берегах водоема,
периодически заливаемых во время половодья, что ведет к
переносу шлака и загрязнению пойменных почв и
берегов водоема. Атмосферные осадки, промывая шлаки,
дают сток, обогащенный загрязняющими веществами.
Промышленные сточные воды непосредственно или
через отстойники и очистные сооружения могут
загрязнять реки, замкнутые бассейны, куда идет сток.
Использование воды из таких источников для полива
сельскохозяйственных культур, пастбищ приводит к
загрязнению почв (см. Загрязнение почвы).
Помимо плавильных и обрабатывающих заводов,
источниками загрязнения являются обогатительные
фабрики. Загрязнение городов, поселков и
пригородного комплекса может происходить за счет сброса отвалов
пустой породы, занимающих большие территории.
Обогатительные фабрики, как правило, расположены в
местах добычи руды, в горных районах. Таким
фабрикам требуются значительные объемы воды для
флотации.
Флотационные растворы сбрасывают в бассейн-
отстойник. При флотации применяют специальные
реагенты (пенообразователи, активаторы, ингибиторы
и т. п.), которые сами могут быть органическими и
неорганическими загрязняющими веществами (например,
цианистый натрий, медный купорос и др.). Часть
флотационных реагентов окисляют, нейтрализуют и
осаждают, другие в неизменном виде попадают в бассейны-
отстойники. Шлам от жидкой фазы отделяется в
фильтрующих отстойниках, раствор из них имеет часто
прямой сток в реки, которыми богаты горные районы. В них
же стекают сильнокислые рудничные воды, как
правило, без очистки, имеющие высокие концентрации
загрязняющих веществ.
В долины горных рек, в депрессии с постоянным или
временным стоком нередко сваливают хвосты
обогатительных фабрик (шламы), пустую породу, имеющие
повышенное содержание сульфидов и других
соединений тяжелых металлов. Сброшенный материал
постепенно размывается и уносится потоками, особенно в
119 Загрязнение радиоактивное
период таяния снежного покрова, при разливе рек, во
время ливней.
Воду рек в зонах умеренного климата и аридной
используют для ирригации долинных почв, в больших
количествах разбирают для полива подгорных равнин
и прилегающих низменностей. Вода таких рек,
используемая в значительных объемах (до 2—8 тыс. м3 на 1 га
за вегетационный период), может принести с собой, даже
при малой массовой концентрации, значительные
количества загрязняющих веществ. При фильтрации и
испарении воды вся масса поллютантов, поступившая с
поливной водой, поглощается поверхностным пахотным
слоем почвы до глубины 20—30 см.
В таких условиях ежегодно повышается содержание
загрязняющих веществ в корнеобитаемом слое
сельскохозяйственных угодий. Подобная ситуация типична для
большинства районов разработки месторождений
цветных металлов. Аналогично влияют на окружающую
среду предприятия черной металлургии,
коксохимические комбинаты, теплоэлектростанции.
ЗАГРЯЗНЕНИЕ РАДИОАКТИВНОЕ. Под радиоак
тивным загрязнением понимают антропогенное или
природное накопление радионуклидов, вызывающее
негативные токсико-экологические последствия.
Источниками радиоактивного загрязнения
территории могут быть осадки, выпадающие при ядерных
взрывах, отходы атомной промышленности, аварийные
выбросы на атомных предприятиях. Наибольшая доля в
радиоактивных осадках приходится на стронций-90,
иод-131 и цезий-137, которые могут накапливаться в
тканях организма человека. Иод скапливается в
щитовидной железе, а стронций в костной ткани, поскольку
по своим химическим свойствам он близок к кальцию.
Вред, связанный с накоплением в организме
радиоактивных элементов, может быть индивидуальным
(например, развитие рака) или генетическим, в последнем
случае возрастает частота мутаций и появляется
потомство с врожденными уродствами. Опасность возрастает
еще и потому, что радиоактивные элементы, подобно
инсектицидам, постепенно концентрируются в пищевых
цепях.
Радиоактивное загрязнение может происходить и за
Загрязнение радиоактивное 120
счет промышленных отходов. Их сбрасывание в море
в герметических контейнерах опасно, так как в
результате коррозии стенок контейнеров отходы могут попасть
в морскую воду до того, как их радиоактивность
снизится в достаточной мере. В 1957 г. радиоактивность
всех отходов производства достигла 7,4-1016 Бк
(2 млн Ки).
Действие радиации зависит от энергии частиц и
силы излучения, то есть числа частиц, вылетающих в
единицу времени. Сила излучения измеряется в беккерелях
или кюри. Один кюри соответствует числу
нестабильных ядер 1 г радия, распадающихся в 1 с, то есть
3,7.1010Бк.
Дозу излучения, поражающую организм, находят
путем измерения количества поглощенной им энергии.
В качестве единиц радиоактивности используют
также: Кл/кг (1 Кл/кг = 3,9-103 рентген); грей (1 Гр =
= 100 рад); зиверт (1 Зв=100 бэр).
Максимальные дозы, не причиняющие вреда
организму человека, в случае их многократного действия
равны 3-Ю-3 Гр (0,3 рад) в неделю и в случае
единовременного действия — 0,25 Гр (25 рад). Доза
полученного естественного облучения зависит от высоты над
уровнем моря и природы подстилающих почву пород.
Радиочувствительность разных организмов весьма
различна. Летальная доза для бактерий составляет
около 104 Гр (106 рад), для насекомых—103 Гр (105рад),
а для млекопитающих—10 Гр (103 рад).
Радиочувствительность изменяется с возрастом. Наибольшей
радиочувствительностью обладает молодой организм: дети
в возрасте до четырех лет накапливают стронций-90 в
несколько раз быстрее взрослых и оказываются более
чувствительными.
Период полураспада радиоактивного
элемента— это время, необходимое для распада половины
количества его атомов. У некоторых элементов период
полураспада очень короткий, и в медицинском
отношении они не представляют большой опасности. Важное
значение имеют те элементы, которые входят в состав
тела животных организмов и могут служить
«маркировщиками» при изучении обменных процессов, а
также элементы, образующие радиоактивные осадки и
121 Загрязнение сельскохозяйственное
загрязняющие биосферу. В таблице приведены основные
характеристики наиболее важных радиоактивных
веществ.
Характеристика радиоактивных веществ
Элемент
Период
полураспад'а
Вид
излучения
Элемент
Период
полураспада
Вид
излучения
Углерод-14 5568 лет Р Стронций-90 28 лет Р
Калий-4'2 1'2,4 часа Р» Y Цезий-И37 33 года у
Цинк-65 250 суток Р> Y Плуто- 2,4-104 лет а, у
Иод-131 8 суток Р> Y ний-<239
Кобальт-60 5,27 лет р, у
ЗАГРЯЗНЕНИЕ СЕЛЬСКОХОЗЯЙСТВЕННОЕ. За
грязнение окружающей среды в результате
неправильного использования пестицидов, внесения
сверхнормативных доз минеральных и органических удобрений,
поступления отходов и стоков животноводческих ферм
и т. д. Вид антропогенного загрязнения.
В мире ежегодно производят около 100 млн т
действующего вещества удобрений. При внесении
удобрений требуются точные расчеты доз, строгое соблюдение
техники и последовательности их применения, в
частности, нежелательны высокие дозы азота
—более 100—150 кг/га.
Ведутся поиски экологически безопасных форм
удобрений. Работы в этом направлении проводят в
СССР, Англии, Японии. Рассматриваются возможности
управления окислительно-восстановительным режимом
почв, механизмом процессов восстановления и
окисления, фиксации соединений азота. Изучаются пути
уменьшения потерь азота в растворах и газообразной
фqpмe.
Внесение органических и минеральных удобрений,
а также оптимизация водного режима почв — важные
средства управления почвенным плодородием и
увеличения продуктивности земледелия. Однако страны, где
применяют высокие дозы минеральных удобрений,
начинают чувствовать отрицательные последствия этого.
Так, наблюдается проникновение нитратов, нитритов,
аммония в подземные воды на десятки метров водонос-
Загрязнение тяжелыми металлами и неметаллами 122
ных горизонтов. Повышается содержание нитратов,
аммония в речных, озерных водах, в эстуариях.
Потери азотных удобрений в результате вымывания
могут быть также очень большими, достигая 15—20 %
внесенного количества. Вместе с нитратами городских
нечистот, стоков навозной жижи, продуктами
выхлопных газов и других отходов нитраты удобрений могут
достигать опасных концентраций (более 40 мг/л) в
овощах, питьевой воде, становясь канцерогенами.
Фосфорные и другие удобрения, как основная или
побочная продукция предприятия, в зависимости от
состава исходного сырья и технологии получения,
содержат переменные, часто повышенные количества
различных химических элементов. К побочным продуктам
многих предприятий относится серная кислота, которая
не всегда достаточно чиста, но используется для
производства фосфорных удобрений.
Главный путь загрязнения фосфором — эрозионный
смыв почвы вместе с гумусом, стоки в районах
интенсивного животноводства, сток городских отходов. Все
это дает 60—70 % фосфора, поступающего в воды.
Поэтому весьма актуальны вопросы экономного
применения фосфорных удобрений и повторного использования
в сельском хозяйстве отходов, содержащих фосфор.
Минеральные ресурсы фосфора на Земле ограничены, и,
если бесхозяйственно обращаться с его запасами и не
использовать повторно в виде компостов отходы
органических соединений этого элемента, может начаться
фосфорный «голод».
Сельскохозяйственное загрязнение может заметно
повышать фоновое содержание тяжелых металлов (см.)
в природных ландшафтах. Внесение минеральных
удобрений, использование пестицидов, мелиорантов ведет
к загрязнению почв тяжелыми металлами и другими
химическими элементами. В связи с этим особенно
важно научно обоснованное применение химических средств
в сельском хозяйстве и экологическая их оценка.
ЗАГРЯЗНЕНИЕ ТЯЖЕЛЫМИ МЕТАЛЛАМИ И
НЕМЕТАЛЛАМИ (фтор, мышьяк). В современном
мире ежегодно на каждого человека в среднем приходится
до 5 т органических и минеральных отбросов и
отходов, что составляет в целом для планеты величину
123 Загрязнение тяжелыми металлами и неметаллами
порядка 20-109 т. Эти вещества загрязняют почтенный
покров, воды и воздух, причем из водной и воздушной
среды прямыми или косвенными путями попадают в
почву.
В числе таких веществ много инертных и
безвредных соединений, но также немало токсичных,
опасных, вызывающих болезни и мутации.
В окружающую среду поступают отбросы, отходы и
побочные продукты производств, сбросные воды, шлаки,
зола, аэрозоли, газы. Наиболее токсичными считаются
свинец, ртуть, кадмий, цинк (см. Тяжелые металлы),
а также сероводород, cqpoyглepoд, сернистый ангидрид,
фтористоводородная кислота, хлор, силикатная пыль,
сажа, оксид углерода, фенолы. Все эти продукты
генерируются и концентрируются в промышленных
центрах, городах и вокруг них на разных расстояниях
(до 100 км).
Различные газы, аэрозоли, химические средства,
применяемые в (сельском, лесном, водном, 'морском
хозяйствах, продукты и отходы работы транспорта
имеют тенденцию распространяться на всю сушу и
океан.
При сжигании угля и нефти в современных условиях
в окружающую среду, то есть в конечном итоге в
почвы, воды и пищу поступает огромное количество
различных химических элементов и их соединений.
Летучая тонкая зола только в США поступает в
атмосферу в количествах 38—40 млн т ежегодно; рН
золы и аэрозолей весьма разнообразен и колеблется
от 2,8—3 до 9—12. Таким образом, в зависимости от
типов почв и их водного режима шлаки, зола, летучие
компоненты могут вызывать подкисление или подщела-
чивание почв, быть источниками дополнительного
питания растений на бедных почвах, средствами
нейтрализации крайних уровней реакции среды, причиной
токсикозов и болезней живых организмов. Это невозможно
предсказать заранее в обобщенном виде.
Установлено, что к особо токсичным относятся: Сг,
As, Ni, Pb, Mo, Cd, Hg, F. Поэтому необходимо
проводить регулярные наблюдения за источниками
поступлений этих элементов в почвы, за уровнем содержания
их в почвах, продуктах питания, питьевых водах и
Загрязненность почвы химическим веществом 124
сопоставление почвеино-геохимических карт с данными
о здоровье, болезнях и смертности населения.
Предприятия, строения, городское хозяйство, отходы
быта и нечистоты населенных пунктов и промышленных
районов не только отчуждают почвенный покров из
биосферы. Они на десятки, сотни и тысячи километров
нарушают нормальную биогеохимию и биологию поч-
венно-экологических систем.
Весьма опасно накопление свинца и цинка в
промышленных центрах, в почвах напряженного
транспорта, вдоль автострад. Почвы сельской местности
содержат в 10—20 раз меньше свинца, чем городских
районов. Содержание свинца и цинка в почвах и
растительности (особенно в моховом покрове) вдоль дорог на
расстоянии 15—20 м от них резко повышено по
сравнению с фоновым содержанием, что отрицательно
сказывается на качестве сельскохозяйственной продукции,
выращенной вблизи дорог.
Источник тяжелых металлов — главным образом
промышленные выбросы. При этом лесные биоценозы
страдают значительно больше, чем почвы
сельскохозяйственных угодий и культурные растения, так как угодья
перепахиваются, удобряются, в них регулируется
величина рН, а культуры выращивают, как правило,
однолетние.
В последнее время некоторые исследователи
загрязнения окружающей среды не считают тяжелые металлы
причиной гибели лесов, выдвигая на первое место по
токсичности опасные синтетические углеводороды и
пестициды.
ЗАГРЯЗНЕННОСТЬ ПОЧВЫ ХИМИЧЕСКИМ
ВЕЩЕСТВОМ. Величина, характеризующая степень
изменения нативного химического состава почвы.
ЗАГРЯЗНЯЮЩЕЕ ПОЧВУ ПРИОРИТЕТНОЕ
ВЕЩЕСТВО. Загрязняющее почву химическое вещество
(см.), которое подлежит контролю в первую очередь
(см. Контроль загрязнения почв).
ЗАГРЯЗНЯЮЩЕЕ ПОЧВУ ХИМИЧЕСКОЕ
ВЕЩЕСТВО. Химическое вещество, попадающее в почву в
результате антропогенной деятельности или природных
процессов и способное оказать неблагоприятное
воздействие на качество почвы и растительность.
125 Загрязняющие вещества
ЗАГРЯЗНЯЮЩИЕ ВЕЩЕСТВА (поллютанты).
Химические соединения, повышенное содержание которых
в биосфере и ее компонентах вызывает негативную ток-
сико-экологическую ситуацию.
Загрязняющие вещества по агрегатному состоянию
подразделяют на твердые, жидкие и газообразные
(парообразные).
Твердые загрязняющие вещества в зависимости
от размера частиц составляют следующий убывающий
ряд: обычные макрочастицы —сажа (агломераты
углеродных частиц)—пыль — летучая зола — дым. Эти
вещества, за исключением макрочастиц, рассеяны в
сплошном потоке газовой или жидкой среды. Жидкие и
газообразные загрязняющие вещества по размеру
частиц не подразделяют.
При воздействии на живое вещество особую
опасность представляют загрязняющие вещества,
оказывающие мутагенное влияние, результатом которого
могут быть нарушения в системе воспроизводства
потомства, и канцерогенное, обусловливающее развитие
злокачественных новообразований.
В практике природоохранной деятельности
загрязняющие вещества классифицируют с учетом их
химических свойств; выделяют неорганические и органические
вещества; используют также более дробное деление на
оксидь^ кислоты, щелочи, соли. Видовыми
характеристиками загрязняющих веществ могут служить их
физические свойства: цвет, запах, содержание и природа
твердых частиц, скорость осаждения, температура,
плотность, характеристики потоков (расположение,
направление и скорость), скорость диффузии.
Нередко загрязняющие вещества делят на группы
в зависимости от отраслей хозяйства, их производящих:
загрязняющие вещества химической,
нефтеперерабатывающей, целлюлозно-бумажной промышленности,
черной и цветной металлургии, автотранспорта,
теплоэнергетики. Это деление — нестрогое, так как в разные
группы может входить одно и то же загрязняющее вещество.
Например, диоксид серы S02 поступает в окружающую
среду с выбросами и предприятий цветной металлургии,
и заводов химической промышленности, и с выбросами
теплоэлектростанций. Однако такую классификацию
Загрязняющие вещества 126
успешно применяют при разработке системы
природоохранных мероприятий. Для каждого конкретного типа
предприятия можно составить список поллютантов,
поступающих в окружающую среду:
Химические заводы Аммиак, сернистый газ,
сероводород, фосфорный ангидрид,
фтористые соединения, оксиды азота,
хлор, пары кислот, предельные и
непредельные углеводороды,
разнообразные продукты сгорания
отходов
Автотранспорт Азот, оксид и диоксид углерода,
оксиды азота, углеводороды,
альдегиды, сажа, бензпирен,
тяжелые металлы
Предприятия цветной Ионы тяжелых металлов, мышья-
металлургии ка, фтора, сурьмы, остатки фло-
тоагентов (цианиды, ксантогена-
ты, нефтепродукты), сульфаты,
хлориды, оксиды серы, азота
Нефтеперерабатываю- Оксид углерода, диоксид серы,
щие предприятия — раз- сероводород, оксиды азота, угле-
рывы нефтепроводов, водороды, фенол, аммиак, мине-
аварии скважин ральные соли
Общий перечень наиболее важных загрязняющих
веществ окружающей среды согласован странами,
входящими в ООН, участвующими в мероприятиях по
улучшению и охране окружающей среды. В число
загрязняющих веществ входят:
сернистый газ S02;
взвешенные частицы;
оксид углерода СО;
диоксид углерода С02;
оксиды азота N20, NO, N02;
фотоокислители и реакционноспособные
углеводороды;
ртуть Hg;
свинец РЬ;
кадмий Cd;
хлорированные органические соединения (ДДТ — ди-
хлордифенил трихлорэтан, ПХБ — полихлорбифенилы);
нефть;
микотоксины;
нитраты N03~, нитриты N02"~, нитрозамины;
127 Запасы гумуса
аммиак;
отдельные микробные загрязняющие вещества;
радиоактивные вещества.
ЗАМУСОРИВАНИЕ. Загрязнение объектов
окружающей среды (почвы, воды) бытовым и
производственным мусором, легко- и трудноразлагающимся. Вид
механического загрязнения. Существенно ухудшает
качество окружающей среды и создает предпосылки для
вторичного загрязнения.
ЗАПАСЫ ГУМУСА. Величина, характеризующая
содержание гумуса (органического вещества) в
отдельно взятом генетическом или пахотном горизонте или в
любом выбранном слое почвы в расчете на условно
выбранную площадь.
Наиболее часто запасы гумуса (см.) вычисляют на
площадь, равную 1 м2 или 1 га для пахотного слоя Апах,
для толщи 0—20, 0—50 или 0—100 см. Оценка запасов
необходима для расчета доз органических удобрений
при обеспечении бездефицитного баланса гумуса (см.),
она нужна и для правильного понимания изменения
гумусного состояния почв (см.) при их
сельскохозяйственном использовании или природных процессах
почвообразования.
По процентному содержанию гумуса в генетических
горизонтах или слоях почвы не всегда возможно
выявить аккумуляцию или потерю органического
вещества, поскольку при этом одновременно изменяются
плотность почвы и мощность горизонтов. Достаточной и
полной xapaKTqpncTHKoft в этих случаях служит запас
гумуса.
Запасы гумуса, как и запасы любых других
компонентов почвы, вычисляют по формуле
3 = CHV,
где з — запасы гумуса, т/га; С — его процентное содержание в
почве (массовая доля); Н — мощность горизонта или слоя, см;
V — плотность почвы, г/см3.
Так, при содержании гумуса в слое 0—20 см
чернозема, равном 5%, и плотности почвы 1,2 г/см3 запасы
гумуса составят 120 т/га. В таблице приведены
усредненные запасы гумуса, азота, фосфора и органической
серы в почвах СССР.
Заповедник
128
Запасы гумуса, азота, фосфора и органической
Почва
Гумус
серы
в некоторых
Азот
слой почвы, см
0-20
0-100
0-20
0-100
Дерново-подзолистая
Лесостепная оподзоленная
Чернозем:
выщелоченный
типичный
обыкновенный
Темно-каштановая
Серозем
Краснозем
53
109
192
224
137
99
37
153
99
215
549
709
426
229
82
282
3,2
6,0
9,4
11,3
7,0
5,6
2,5
4,7
Не
6,6
12,0
26,5
35,8
24,0
опреде
лено
7,5
10,5
ЗАПОВЕДНИК. Законодательно выделенная
территория для сохранения ее в качестве природного
эталона, где полностью исключена хозяйственная
деятельность. От прилегающей территории заповедник отделен
буферной зоной с ограниченным режимом
хозяйствования.
Цели создания заповедников следующие:
сохранение, восстановление, развитие в естественных
условиях участков как типичных биогеографических
провинций, так и уникальных, ценных или исчезающих
представителей животного и растительного мира;
сохранение для научно-исследовательских работ
неизмененных производственной деятельностью человека
экосистем заповедников как природных эталонов для
сравнения с аналогичными экосистемами
антропогенной среды и наблюдения за естественными природными
процессами на территории заповедников;
охрана разнообразия ландшафтов различных
природных зон, ценных в природоведческом и эстетическом
отношении.
До Октябрьской революции в России было два
заповедника—Беловежская пуща и Лагодежский, в 1919—
1920 гг. созданы Астраханский и Кавказский
заповедники. Большинство заповедников основано в 1924—1940 гг.
и 1945—1949 гг., в настоящее время в СССР 156 запо-
129
почвах СССР, т/га (по М. М. Кононовой)
Почва
Р206 в пахотном слое
минеральный
органический
Дерново-подзолистая 1,3—1,5 0,5—0,6
Лесостепная оподзоленная 1,7 1,3
Чернозем:
выщелоченный Не определено
типичный 2i9 1,6
обыкновенный Не определено
Темно-каштановая 2,1 0,6
Серозем 1,7-1,9 0,3
Краснозем
Заповедник
S08
органический в
пахотном слое
0,3-0,8
0,6
0,7
Не
определено
0,5
1,1
1,0
Не определено
ведников. Режим работы заповедников определяет
«Положение о государственных заповедниках СССР». Все
заповедники в стране имеют статус государственных и
подчинены государственным учреждениям союзного и
республиканского значения (Академии наук СССР,
Государственному комитету СССР по охране природы
и др.). В структуре каждого заповедника существуют
природоохранные и научно-исследовательские отделы.
В заповедниках создается уникальный документ
«Летопись природы», в котором регулярно регистрируют
наблюдения всех специалистов (зоологов различного
профиля, ботаников, почвоведов) и где собран банк
многолетних и разносторонних характеристик
экосистемы (см.).
В соответствии с Международной программой
ЮНЕСКО «Человек и биосфера» для 22 заповедников
СССР утвержден статус биосферных. Биосферные
заповедники представляют собой уникальные в глобальном
масштабе экосистемы и ландшафты, занимающие
достаточно большие территории, свободные от
антропогенного влияния.
Научные исследования в биосферных заповедниках,
наряду с выполнением основных задач этих
учреждений, направлены на решение двух проблем: анализ
структуры и функционирования экосистем, их эволюции
Заряд почвенных коллоидов переменный
130
в естественных условиях и оценка глобального
антропогенного влияния на экосистемы различных
биогеографических зон планеты. Результаты многолетних
сравнительно-экологических исследований в биосферных
заповедниках обобщают на международном уровне.
Статус биосферных имеют заповедники: Березинский, При-
окско-террасный, Центральный лесной, Кавказский,
Астраханский, Баргузинский, Сихотэ-Алинский, Сары-
Челекский, Чаткальский, Репетекский, Кроноцкий,
Черноморский, Аскания-Нова, Вильсандийский,
Воронежский, Кандалакшский, Окский, Боровое.
ЗАРЯД ПОЧВЕННЫХ КОЛЛОИДОВ
ПЕРЕМЕННЫЙ (синонимы — зависящий от рН заряд, «протонный
заряд). Заряд, возникающий на поверхности почвенных
частиц за счет наличия слоя потенциалопределяющих
ионов.
Поскольку у определенной группы почвенных
коллоидов (см. Коллоиды почвенные) потенциалопределя-
ющими служат ионы Н+ и ОН-, знак и величина
переменного заряда зависят, прежде всего, от рН среды.
К основным минеральным носителям переменного
заряда относятся минералы — оксиды и гидроксиды
железа и алюминия (см.) а также аллофаны (см.) и имого-
лит, имеющие на поверхности гидроксогруппы,
способные протонироваться и депротонироваться в
зависимости от рН среды. Ниже приведена схема возникновения
положительного и отрицательного зарядов на
поверхности частицы гидроксида железа:
\
\
• он2
1 у/
1 \
о он2
1 он2
-J
3 +
ЗН +
(
>
>
Fe:
ОН
ОН
ОН
^ зон- \
^_ о о
>'•
+ зн2о
131 Заряд почвенных коллоидов переменный
На основании схемы можно заключить, что должна
существовать величина рН, при которой заряд
коллоидной частицы равен 0. Эта величина называется точкой
нулевого заряда (см.).
Минеральные коллоиды с переменными величиной
и знаком заряда характерны для почв тропических и
экваториальных областей, так как этим" почвам
свойственно высокое содержание гидроксидов железа и
алюминия. В почвах бореального пояса минеральные
коллоиды с переменным зарядом (аллофаны, имоголит)
в заметных количествах присутствуют в андосолях
(вулканических почвах) и в горизонтах В иллювиально-же-
л?зистых подзолов и подбуров. В остальных почвах
бореального пояса, развитых на породах с
преобладанием трехслойных глинистых силикатов в составе или-
стой фракции почв (см.), роль переменного заряда
минеральных почвенных коллоидов сравнительно невелика.
Его возникновение связано с наличием гидроксогрупп
на боковых гранях кристаллов глинистых минералов
(см.) в местах выхода на поверхность октаэдрического
слоя.
Еще один источник переменного заряда в почвах
всех природных областей — органическое вещество. Оно
содержит карбоксильные, фенольные и другие
функциональные группы, которые ионизируются (депротони-
руются) при разных значениях рН. Основная часть
карбоксильных групп ионизируется в диапазоне рН от 3
до 7, фенольных — в диапазоне рН от 7 до 9. В отличие
от переменного заряда минеральных коллоидов, заряд
органических коллоидных частиц, возникающий за счет
диссоциации функциональных групп, всегда имеет
знак (—), но величина заряда различна и определяется
степенью диссоциации функциональных групп, которая
зависит от рН.
Содержание в почвах коллоидов с переменным
зарядом сильно влияет на сорбционные свойства почв.
Самая общая и хорошо известная закономерность
заключается в том, что с увеличением рН возрастает
емкость катионного обмена (см.) и уменьшается
емкость анионного обмена (см.). Эта закономерность
оказывает самое непосредственное влияние на способность
почв поглощать различные загрязняющие вещества. В
с*
Заряд почвенных коллоидов постоянный 132
частности, почвы, где преобладают коллоиды с высоким
переменным зарядом, при значениях рН ниже точки
нулевого заряда приобретают способность к
преимущественному поглощению анионов — фосфатов, арсенатов,
селенатов, молибдатов и других, а при значениях рН
выше точки нулевого заряда — к преимущественному
поглощению катионов, в том числе и тяжелых металлов:
Zn, Pb, Cd, Co, Cu, Ni и др. Коллоидные частицы,
способные изменять заряд в зависимости от рН среды,
называются амфолитоидами, а способность к
проявлению кислотных или основных свойств в связи с
величиной рН определяется как а м ф о тер н о с т ь.
ЗАРЯД ПОЧВЕННЫХ КОЛЛОИДОВ
ПОСТОЯННЫЙ. Электрический заряд, возникающий в
минеральных почвенных частицах коллоидного размера за счет
замещений в кристаллических решетках ионов одной
валентности ионами другой валентности.
Наиболее широко распространен постоянный
отрицательный заряд кристаллических решеток трехслойных
глинистых минералов (см.), связанный с изоморфным
замещением Si4+ на А13+ в тетраэдрах и А13+ на Mg2+
в октаэдрических позициях. Постоянный отрицательный
заряд глинистых минералов компенсируется катионами,
находящимися в межпакетных позициях и на
поверхности частиц.
Значительно реже встречается постоянный
положительный заряд, возникающий в оксидах железа за счет
замещения Fe3+ на Ti4+. Величина и положение заряда
определяют важнейшие сорбционные свойства
трехслойных глинистых минералов — независимую от рН
емкость катионного обмена (см.) и способность минералов
к межпакетной сорбции материала (см.
Монтмориллониты, Вермикулиты, Гидрослюды).
Мерой постоянного заряда служит плотность
заряда — величина, которую выражают в кулонах,
единицах статического электричества, или в
миллиграмм-эквивалентах (миллимолях) заряда на единицу
поверхности. Иногда плотность заряда рассчитывают как
отношение емкости катионного обмена (ЕКО) к
удельной поверхности. Определенная таким образом
плотность заряда составляет (в мг-экв/м2): для
монтмориллонитов—0,75—1,6, для вермикулитов—1,5—2,7, для
133 Засоление почв
гидрослюд — до 4,4. Для гидрослюд расчеты такого
рода не вполне правомерны, так как в этих минералах
значительная часть межпакетного калия,
компенсирующего отрицательный заряд слоя, не вытесняется при
определении ЕКО, и поэтому ЕКО значительно ниже
постоянного отрицательного заряда, а истинная
плотность заряда выше расчетной величины. В
вермикулитах и монтмориллонитах отрицательный заряд
соответствует ЕКО независимо от рН.
Отрицательно заряженные коллоиды сорбируют и
удерживают такие загрязняющие вещества, как
катиону тяжелых металлов; положительно заряженные —
связывают преимущественно анионы: сульфаты, селена-
ты, соединения мышьяка.
ЗАСОЛЕНИЕ ПОЧВ. Процесс накопления в почвах
аридных и полуаридных областей легкорастворимых
солей (см.).
В естественных условиях засоление почв происходит
за счет выпадения солей из засоленных грунтовых вод
или в связи с эоловым привносом солей из морей и
океанов и с территорий, где широко распространены
соляные оз^ра. Важным источником солей в
ландшафте, в том числе и в грунтовых водах и в почвах, служат
засоленные материнские породы, особенно — соляные
купола. Некоторое количество солей может поступать в
верхние горизонты почвы с опадом растений — галофи-
тов (солянок). На орошаемых массивах существенным
источником солей в почвах могут быть оросительные
воды.
Один из основных способов оценки процесса
засоления—это составление солевого баланса для
данной почвы или земельного массива.
Главные элементы солевого баланса:
суммарный запас легкорастворимых солей в почве;
приходные статьи баланса — поступление
солей из грунтовых вод, эоловый привнос солей,
поступление солей из оросительных вод, из
минерализующихся растительных остатков, из удобрений;
расходные статьи баланса — отток солей
из почвы в грунтовые воды с просачивающимися
атмосферными осадками, вынос с оросительными водами,
Засоление почв вторичное 134
выдувание солей ветром с поверхности почвы, вынос
солей с урожаем сельскохозяйственных культур.
Выделяют три типа солевого баланса почв:
стабильный, при котором запас солей в
почвенной толще не изменяется;
баланс засоления, при котором запас солей
в почве возрастает;
баланс рассоления, при котором запас солей
в почвенной толще уменьшается.
По составу солей, принимающих участие в процессах
засоления почв, В. А. Ковда выделяет на территории
нашей страны следующие провинции соленакоп-
л ен и я:
хлоридного соленакопления (Прикаспийская);
сульфатно-хлоридного засоления (Туранская,
Причерноморская и Балхаш-Зайсанская);
хлоридно-сульфатного соленакопления (Поволжско-
Уральская, Центрально-Казахстанская, некоторые
районы Средней Азии);
сульфатно-содового засоления (Придунайская, Сред-
неукраинская, Среднерусская, Средневолжская,
Западносибирская, Восточносибирская, Якутская).
Неблагоприятное влияние засоления почвы на
развитие сельскохозяйственных культур связано не только
с повышенным осмотическим давлением почвенного
раствора, ухудшением водно-физических свойств почв,
особенно в провинциях содового засоления (см.
Легкорастворимые соли), неблагоприятным солевым составом,
но и с повышенной концентрацией соединений бора,
которая может достигать токсичного для растений
уровня— 1—0,3 мг/л. К числу наиболее чувствительных к
6qpy культур относятся почти все плодовые деревья.
ЗАСОЛЕНИЕ ПОЧВ ВТОРИЧНОЕ. Накопление в
почвах легкорастворимых солей (см. Засоление почв,
Легкорастворимые соли), происходящее вследствие
искусственного изменения водно-солевого режима, чаще
всего — при неправильном орошении, реже — при
неумеренном выпасе на лурах, при неправильном
регулировании паводков, неправильном осушении территории
и т. д.
Процесс вторичного засоления может накладываться
на почвы естественно засоляющиеся, остаточно-засолен-
135 Засоление почв вторичное
ные, исходно незасоленные или глубокорассоленные.
Основные механизмы этого процесса — привнос солей
с оросительными водами в растворимом или взвешенном
состоянии и выпадение солей в почвенной толще из
минерализованных грунтовых вод, уровень которых при
орошении часто поднимается. Последнее явление имеет
особенно широкое распространение на равнинных,
плохо дренированных территориях. При недостаточном
дренаже вторичное засоление может иметь
катастрофические последствия, так как из-за большого
накопления солей в почвах обширные массивы орошаемых
земель становятся непригодными для земледелия, и их
приходится выводить из сельскохозяйственного
использования.
В. А. Ковда выделяет следующие стадии процесса
вторичного засоления почв, которые генетически
связаны между собой и закономерно сочетаются в
пространстве:
1) засоление почв вдоль новых каналов;
2) общее засоление орошаемой территории;
3) рассоление староорошаемых территорий при
одновременном засолении некоторых внутриоазисных
пространств и периферии оазисов.
Поскольку при орошении на поливных землях часто
развивается чашевидный мезорельеф, вторичное
засоление обычно сопровождается рассолением приподнятых
периферических частей чашевидных депрессий и
одновременным засолением их центральных частей.
Вторичное засоление почв может быть сезонным, когда оно
развивается только в наиболее жаркие месяцы года
и проявляется не сплошь, а отдельными пятнами. В
этом случае его определяют как пятнистое.
Вторичное засоление почв на орошаемых участках
часто сопровождается загрязнением почв тяжелыми
металлами, пестицидами, гербицидами, нитратами,
соединениями бора. Все эти вещества в районах
интенсивного сельскохозяйственного использования попадают в
почву как из оросительных, так и из грунтовых вод.
При вторичном засолении происходят существенные
изменения многих химических свойств почв:
одновременно с накоплением легкорастворимых солей
аккумулируются гипс и карбонаты, оказывающие благоприят-
Земельные ресурсы 136
Некоторые химические свойства незасоленных и вторично засоленных
Глубина, см
Незаселенный серозем
Обменные катионы, % от суммы
Са2 +
Mg2+
К +
Na+
CaS04)
%
sio,
К
мг/ 00 г почвы
0—15 82 12 6 Нет 0,03 Нет 6
15—25 71 20 9 » 0,05 » 6
30—40 60 30 10 3—4 0,05 » 4
50—60 60 30 10 1—2 0,10 » 4
ное воздействие на физические свойства почв; в
неблагоприятную сторону изменяется состав почвенного
поглощающего комплекса, в котором Са2+ замещается
ионами Mg2+ и Na+, возрастает подвижность
соединений калия, кремния и железа (табл.).
ЗЕМЕЛЬНЫЕ РЕСУРСЫ. Земли, используемые в
хозяйственной деятельности человека или пригодные
для этого, часть природных ресурсов.
ЗЕМЕЛЬНЫЙ КАДАСТР. Свод документов о земле,
оценивающих количество земель, их качество,
экономическую эффективность использования; правовые нормы
землепользования.
ЗЕМЛЕДЕЛЬЧЕСКИЕ ПОЛЯ ОРОШЕНИЯ.
Площади, орошение и удобрение которых проводят
сточными водами (см.), прошедшими предварительную
очистку. Оборудованы специальными сооружениями для
приема вод.
ЗОНЫ БУФЕРНОСТИ ПОЧВ ПО ОТНОШЕНИЮ
К КИСЛОТАМ. Зоны, соответствующие определенным
диапазонам значений рН, в пределах которых буфер-
ность почв по отношению к кислотам (см. Буферность
почв кислотно-основная) контролируется какой-либо
определенной протекающей в почве химической
реакцией.
Б. Ульрих выделяет пять буферных зон.
1. Карбонатная буферная зона (значения рН 6,2—
8,6). Основная часть протонов расходуется на
растворение карбонатов. Продукт реакции —Са(НС03) 2,
который подвергается выщелачиванию из почвы.
137 Зоны загрязнения
сероземов
Глубина, см
Вторично засоленный серозем
Обменные катионы, % от суммы
Са2+
Mg2 +
К
Na+
CaSO<,
%
SiO,
МГ/ЮО
К
г почвы
0—15 65 28 3 4 0,30 б 13
15—25 65 24 6 6 0,25 4 10
30—40 53 33 3 Ю 0,30 5 8
5в—60 41 52 3 3 0,20 4 7
2. Силикатная буферная зона (весь диапазон
значений рН, который отмечается в почвах). Протоны
расходуются на растворение силикатов. Продуктами
реакции могут быть окристаллизованные или неокристалли-
зованные глинистые минералы (см.), что
сопровождается увеличением ЕКО (см. Емкость катонного обмена).
3. Буферная зона, связанная с реакциями ионного
обмена (значения рН 4,2—5). Продукты реакции —
необменные ионы пА\(ОН)х*-ху формирующиеся на
поверхности и в межпакетных промежутках глинистых
минералов, что сопровождается снижением ЕКО.
4. Алюминиевая буферная зона (рН<4,2). Протоны
расходуются на растворение межпакетных прослоек
гидроксида алюминия, что обусловливает появление
ионов А13+ в растворе и в ППК (см. Почвенный
поглощающий комплекс).
5. Буферная зона, связанная с растворением
оксидов железа (рН<3,2). В результате этих реакций
происходит обеднение почвенного материала железом.
Разработка представлений о зонах буферное™ почв
по отношению к кислотам имеет большое значение в
связи с подкислением почв и поверхностных грунтовых
вод при выпадении кислых дождей (см.).
ЗОНЫ ЗАГРЯЗНЕНИЯ (импактного, локального).
Выделяются на картах-схемах загрязнения с различной
топографической основой 1:10 000—1:100 000 при
картографировании загрязненных территорий.
При выделении зон загрязнения используют
валовое содержание или содержание подвижных соединений
Зоомеханогенез 138
загрязняющих веществ (см.) в почвах. На характер и
конфигурацию зон загрязнения влияют роза ветров,
рельеф местности и другие факторы.
Методы составления карт и карт-схем загрязнения
аналогичны методам составления агрохимических карт.
На картах-схемах выделяют общую площадь
загрязнения и отдельные зоны загрязнения, а также наличие
природных аномалий зоны рудопроявления (или
ареалы рассеяния). Карты загрязнения отражают
современное техногенное загрязнение почвенного покрова,
служат основой создания прогностических карт
загрязнения, позволяют выявить динамику загрязнения,
являются основой балансовых расчетов и моделирования
процесса загрязнения территории. Помимо зон загрязнения
почв, на картах можно выделить зоны загрязнения
растительности, снежного покрова. Такие исследования
обычно проводят в рамках почвенно-химического
мониторинга (см.).
Критерием для выделения зон загрязнения служат
ПДК элементов в почвах (см. Предельно допустимое
количество загрязняющего почву химического вещества)
или превышения над фоновыми значения;ми, что дает
возможность получить санитарно-гигиеническую
оценку состояния почв (в первом случае) и геохимическую
(во втором).
ЗООМЕХАНОГЕНЕЗ. Сочетание биогеохимических
процессов механического перемещения твердых масс
органических и минеральных веществ в результате
жизнедеятельности животных, что обусловливает как
радиальное, так и латеральное перемещение
химических элементов в ландшафтах (Глазовская, 1988).
Примером зоомеханогенеза может быть деятельность
дождевых червей, которые транспортируют
органические и минеральные вещества, подщелачивают среду с
помощью особых «карбонатных желёзок», формируют
новообразования, перерабатывают растительные
остатки, оструктуривают почву. Велика также роль
млекопитающих в перемещении почвенных масс (выбросы
кротов). Существенное значение в механической миграции
твердых масс вещества и легкорастворимых солей (см.)
имеют землерои в сухих степях и полупустынях. В зоне
пустынь проявляется деятельность термитов.
139 Известкование
и
ИЗВЕСТКОВАНИЕ. Химическая мелиорация
кислых почв, которая применяется для снижения
почвенной кислотности.
В качестве мелщрантов используют различные
материалы и соединения, действующее начало которых
СаСОз. К ним относятся кальцит СаС03, доломит
CaMg(C03)2, доломитизированные известняки, мергели,
то есть глинисто-карбонатные осадочные породы,
содержащие 50—70 % карбонатов. Кроме того,
используют известковые туфы и )различные промышленные
отходы: дефекат (отходы свеклосахарного
производства), доменные шлаки.
При внесении СаСОз в кислую почву происходит
следующая реакция (П — почвенный поглощающий
комплекс):
ПН2+ +СаС03—>ПСа2++Н2СОз—*
—►■ ГЮа 2++(Н20 +СОа f
ПА123+ +ЗСаС03 + ЗН20—^ПСа23+ + 2А1 (ОН)3 + ЗС02|
Почвенный поглощающий комплекс (см.)
насыщается кальцием; в почвенном растворе образуется слабая
угольная кислота, которая, разлагаясь, выделяет в
приземный слой С02, необходимый для фотосинтеза. Дозу
извести (в расчете на 100 % СаСОз) рассчитывают по
величине рН солевой вытяжки с учетом
гранулометрического состава почв (табл.).
Дозы извести в зависимости от рН и гранулометрического состава
почвы, т/га (по В. Д. Панникову, В. Г. Минееву)
I рН солевой вытяжки
Гранулометрический
состав
Песчаный
Супесчаный
Легкосуглинистый
Среднесуглинистый
Тяжелосуглинистый
Глинистый
4,5 4,6 4,8
2,5
3,5
4,5
4,5
7,0
8,0
2,1
3,0
4,0
5,0
6,5
7,5
1,6
2,5
3,5
4,5
6,0
7,0
5,0 5,2 5,4-5,5
1,3
2,0
3,0
4,0
5,5
6,5
1,0
1,5
2,5
3,5
5,0
6,0
0,7—0,5
1,2—1,0
2,0
3,0
4,5
5,5
Илистая фракция почв 140
Эффективность известкования зависит от качества
извести и способа внесения ее в почву.
Защитное действие извести на почвах, обладающих
фитотоксичностью вследствие значительного содержания
подвижных форм тяжелых металлов (см.), проявляется
на различных уровнях:
изменяется состав поглощенных катионов в твердой
фазе почвы, водород замещается кальцием,
увеличивается емкость поглощения катионов;
повышение рН активизирует деятельность
микроорганизмов, усиливается процесс биологического
поглощения металлов;
обогащение почвы кальцием способствует
коагуляции почвенных коллоидов, укреплению почвенных
агрегатов, улучшению почвенной структуры;
увеличение концентрации кальция создает условия
для проявления антагонизма ионов.
Растения, выращенные на известкованных почвах,
содержат значительно меньше тяжелых металлов, чем
на почвах, где известь не вносили.
ИЛИСТАЯ ФРАКЦИЯ ПОЧВ. Совокупность
почвенных частиц размером <1 мкм по шкале
гранулометрических элементов Н. А. Качинского, принятой в нашей
стране, и <2 мкм по шкале Аттерберга, принятой в
большинстве зарубежных стран.
Илистая фракция частично наследуется почвой от
материнской породы, частично образуется в процессе
почвообразования и состоит из глинистых минералов
(см.), органического вещества и органо-минеральных
соединений. В небольших количествах в составе
илистой фракции могут присутствовать кварц, полевые
шпаты и другие компоненты. Благодаря высокой
дисперсности и большой химической активности входящих в
эту фракцию компонентов, содержание и состав ее
служат основным фактором, определяющим сорбционные
свойства почвы и взаимодействие почвы с
загрязняющими веществами (см. Почвенный поглощающий
комплекс, Обмен ионный).
Содержание илистой фракции возрастает от
нескольких процентов в песчаных и супесчаных почвах до
нескольких десятков процентов в суглинистых и
глинистых.
141 Индикация биогеохимическая состояния окружающей среды
Выделяют четыре типа распределения илистой
фракции в профиле почв.
1. Равномерный — содержание илистой фракции не-
дифференцировано по горизонтам; такое распределение
илистой фракции свойственно обыкновенным и
несолонцеватым южным черноземам и каштановым почвам.
2. Аккумулятивный — содержание илистой фракции
убывает с глубиной; такое ее распределение
наблюдается в почвах разных типов, развитых на богатых
песках и массивно-кристаллических породах.
3. Элювиальный — содержание илистой фракции
постепенно возрастает вниз по профилю, достигая
максимума в почвообразующей породе; элювиальное
распределение ила присуще большинству профилей
суглинистых подзолистых почв.
4. Элювиально-иллювиальный — верхние горизонты
обеднены, а горизонты В обогащены илистой фракцией
по сравнению с почвообразующей породой; такой тип
распределения наблюдается в дерново-карбонатных,
бурых лесных оподзоленных почвах, некоторых
подзолистых и серых лесных почвах, солонцах, солодях.
Элювиально-иллювиальному распределению илистой
фракции способствует наличие в профиле карбонатного
горизонта, над которым обычно накапливаются илистые
частицы.
ИНДИКАЦИЯ БИОГЕОХИМИЧЕСКАЯ
СОСТОЯНИЯ ОКРУЖАЮЩЕЙ СРЕДЫ. Определение степени
загрязнения среды путем измерения содержания пол-
лютантов (см. Загрязняющие вещества) в компонентах
биоты (растениях, грибах, животных, а также
отдельных их частях, продуктах выделения и т. д.).
Определяющее в этом отношении — введенное
В. И. Вернадским представление о концентрирующей
функции живого вещества как «скопления отдельных
элементов из их рассеяния в окружающей среде».
Концентрирование химических элементов живыми
организмами обусловлено их собственными
физиологическими потребностями. Поэтому содержание в
организме химических элементов, как установлено В. И.
Вернадским, «для каждого организма есть видовой признак»,
что справедливо для фоновых территорий (см. Фоновые
почвы). На участках с повышенным содержанием хи-
Иод в почвах 142
мических элементов конкретные организмы, или
биоиндикаторы, могут аккумулировать те или иные элементы,
содержащиеся в повышенных количествах.
ИОД В ПОЧВАХ. Содержание иода в земной коре
колеблется от 0,01 до 6 мг/кг, достигая максимума в
обогащенных органическим веществом сланцах.
В горных пqpoдax количество иода следующее, мг/кг:
Магматические породы
Ультраосновные (дуниты, перидотиты, пирок- 0,01—0,50
сениты)
Основные (базальты, габбро) 0,08—0,50
Средние (диориты, сиениты) 0,3—0,5
Кислые (граниты, гнейсы) 0,2—0,5
Кислые вулканические (риолиты, трахиты, 0,1—0,5
дациты)
Осадочные породы
Глины 1,0—2,2
Сланцы 2—6
Песчаники 0,5—1,5
Известняки, доломиты 0,5—3,0
Иод образует ряд самостоятельных минералов и
может быть изоморфной примесью. Большая часть
минеральных соединений иода легкорастворимы, поэтому он
энергично выносится при выветривании горных пород
в гидросферу. Биогеохимия иода как биофильного
элемента во многом обусловлена его участием в
биологических процессах. Иод входит в состав пироксина —
гормона щитовидной железы, недостаток этого
элемента ослабляет ее деятельность, приводя к заболеваниям
животных и человека (зоб).
В почвах — от 0,1 до 40 мг иода на 1 кг при
среднем его содержании порядка 3 мг/кг (табл.). В почвах
некоторых островов (Ирландия, Япония, Новая
Зеландия) количество иода может достигать 80 мг/кг, что
обусловлено высоким содержанием его в морской воде.
Почвы прибрежной зоны также обогащены иодом.
Почвы, сформированные на современных ледниковых
отложениях, обычно обеднены иодом в связи с низким
количеством этого элемента в атмосферных осадках. Легкие
почвы гумидных районов, как правило, обеднены иодом,
а высокогумусные и оглеенные — обогащены.
143 Ионная сила почвенного раствора
Содержание иода в гумусовых горизонтах некоторых почв, мг
на 1 кг сухой массы (по А. Кабата-Пендиас, X. Пендиас)
Почвы
Пределы
колебаний
Среднее
Подзолистые и песчаные
Суглинистые и глинистые
На ледниковой морене
На вулканическом пепле
Рендзины
Каштановые и бурые
Солончаки
Черноземы
Луговые
Лесные
0,3—10,0
0,5—8,3
0,1—6,3
32—40
0,3—4,9
0,3—7,3
0,1—6,0
0,4—10,8
0,4—3,4
0,06—25,4
1,1
1,8
1,7
—
1,7
2,8
2,1
3,8
1,7
13,1
При обычных условиях иод существует в виде иоди-
дов, иодатов, иодорганических соединений. Накоплению
иода в почвах способствует обогащение их
коллоидными частицами и (органическим веществом. Подвижность
иода возрастает в кислых почвах, что способствует его
потерям, особенно при легком гранулометрическом
составе почвы.
Загрязнение окружающей среды иодом и его
соединениями возможно в районах автомагистралей, при
сжигании угля (вблизи ТЭЦ). Некоторые осадки
сточных вод могут служить источником загрязнения
поверхностных горизонтов почвы иодом. При умеренном гу-
мидном климате иод обладает высокой подвижностью
и не представляет серьезной экологической опасности.
В связи с развитием ядерной энергетики особую
актуальность приобретает система выбросов и обогащения
биосферы долгоживущими радионуклидами 1291, 1311.
ИОННАЯ СИЛА ПОЧВЕННОГО РАСТВОРА. Один
из важнейших показателей состава и свойств
почвенного раствора, определяющий степень участия
компонентов этого раствора в почвенно-химических реакциях.
Ионная сила определяется по формуле
/ —, f
2
где / — ионная сила раствора; а — молярная концентрация t-ro
иона раствора; г* — заряд *-го иона.
Источник загрязнения 144
От величины ионной силы зависят коэффициенты
активности ионов, входящих в состав раствора, влияние
почвенного раствора на электрокинетический потенциал
и на коагуляцию почвенных коллоидов. Степень
влияния химических загрязняющих веществ на свойства
почвы обусловлена, наряду с другими факторами,
величиной ионной силы почвенных растворов.
Статистически величина ионной силы коррелирует с величинами
удельной электропроводности почвенных растворов и
может быть использована как мера уровня (степени)
загрязнения почвы (см.) легкорастворимыми солями.
Для растворов, содержащих только одну
какую-либо соль, ионную силу рассчитывают по таким правилам.
Если в растворе присутствует только одно-,
одновалентный электролит (соль 1,1, например, NaCl), то ионная
сила этого раствора равна молярной концентрации
раствора: / = М. Для солей типа 2,1 и 1,2, например для
СаС12 и Na2S04, ионная сила равна утроенной величине
их молярной концентрации: /=ЗМ.
Знание величин ионных сил почвенных растворов
различных типов почв необходимо для расчета
активностей любых компонентов почвенного раствора (см.
Активность ионов в почвах), а следовательно, и степени
влияния химических загрязняющих веществ на свойства
и продуктивность почв.
ИСТОЧНИК ЗАГРЯЗНЕНИЯ. Природный или
антропогенный объект, вызывающий в биосфере или ее
компонентах повышение содержания загрязняющих
веществ (см.).
Источники загрязнения подразделяются на
природные, обусловленные существованием различных
месторождений (рудные, газовые, нефтеносные),
природных аномалий, и антропогенные, связанные с
хозяйственной деятельностью человека (промышленные,
или техногенные, транспортные, сельскохозяйственные).
Источники загрязнения атмосферы могут быть
следующими (по А. А. Беусу и др.):
Природные
Вулканы, фумаролы, сольфатары (газы, вулканическая пыль,
пары ртути)
Естественные выходы нефти и природного газа (углеводороды)
145 Источник загрязнения
Месторождения сульфидов (сернистый газ)
Хлориды и сульфаты, выдуваемые ветром с поверхности морей
и океанов
Месторождения радиоактивных руд (радон)
Подземные угольные пожары (С02, СО, S02, углеводороды)
Естественно возникающие лесные и степные пожары
Ароматические и другие летучие вещества, выделяемые
растениями
Антропогенные
Сжигание твердого и жидкого топлива (С02> S02,
углеводороды, пары ртути, свинец, кадмий)
Переработка руд черных, цветных и редких металлов (S02,
пары ртути, различные металлы с пылью)
предприятия химической промышленности (различные летучие
вещества)
Атомная промышленность (радиоактивные вещества, другие
поллютанты)
Ядерные взрывы (радиоактивные изотопы)
Предприятия цементной промышленности (пыль)
Взрывы при строительных работах, на открытых рудниках
(пыль)
Лесные и степные пожары, вызванные человеком
Потери природного газа при добыче нефти и газа
(углеводороды) i
Антропогенные источники загрязнения по характеру
поступления в окружающую среду делятся на две
группы:
отходы производства — преобладают отходы
промышленной, коммунально-бытовой и
сельскохозяйственной деятельности;
средства химизации — пестициды, отходы
промышленности, используемые как удобрения.
По характеру распространения загрязняющих
веществ источники загрязнения делятся на точечные
(ТЭЦ, добыча полезных ископаемых), площадные
(земледелие, крупные промышленные зоны),
линейные (транспорт).
К источникам загрязнения воздуха относятся добыча
полезных ископаемых, производство энергии,
транспорт. Источники загрязнения природных вод — добыча
полезных ископаемых, производство энергии,
коммунальное хозяйство. В обоих случаях неизбежно
загрязнение почв, а также растений, произрастающих на
загрязненных почвах.
Источник химического загрязнения почвы промышленный 146
ИСТОЧНИК ХИМИЧЕСКОГО ЗАГРЯЗНЕНИЯ
ПОЧВЫ ПРОМЫШЛЕННЫЙ.Ясгоадшс загрязнения
(см.), обусловленный влиянием промышленных и
энергетических предприятий на почву.
ИСТОЧНИК ХИМИЧЕСКОГО ЗАГРЯЗНЕНИЯ
ПОЧВЫ СЕЛЬСКОХОЗЯЙСТВЕННЫЙ. Источник за-
грязнения (см.), обусловленный сельскохозяйственным
производством: внесение избыточных количеств
минеральных удобрений, применение химических средств
защиты растений, отходы от переработки продукции
сельского хозяйства, животноводческие стоки и т. д.
источник химического загрязнения
ПОЧВЫ ТРАНСПОРТНЫЙ. Источник ) загрязнения
(см.), обусловленный эксплуатацией транспортных
средств: выхлопы автотранспорта, в результате чего в
почве происходит накопление избыточных количеств
тяжелых металлов (свинец, кадмий и т. д.) и токсичных
органических веществ (углеводороды) и др.
ИСТОЧНИК ХИМИЧЕСКОГО ЗАГРЯЗНЕНИЯ
ПОЧВЫ ХОЗЯЙСТВЕННО-БЫТОВОЙ. Источник
загрязнения (см.), обусловленный хозяйственно-бытовой
деятельностью человека: отходы коммунального
хозяйства, сточные воды и т. д.
ИСТОЩЕНИЕ ЗЕМЕЛЬ. Снижение и потеря
плодородия в результате антропогенной деятельности (см.
Деградация почв).
к
КАЛИЙНЫЙ ПОТЕНЦИАЛ. Один из
термодинамических показателей калийного состояния почв,
характеризующий прочность связи обменного калия (см.
Катионы обменные) с твердыми фазами почвы.
Калийный потенциал (КП) вычисляют по формуле
КП=-5,707.10» (рК-0,5 рСа),
где 5,707-103-—коэффициент для расчета в Дж/моль (при расчете
в ккал/моль коэффициент равен 1,364); рК и рСа —
отрицательные логарифмы активностей соответственно ионов К+ и Са2+ в
растворе, находящемся в равновесии с твердыми фазами почвы
(см. Активность ионов в почвах).
147 Каолиниты
Величина калийного потенциала соответствует
энергии, которую необходимо затратить, чтобы
заместить 1 моль обменного калия половиной моля кальция
в почвенном поглощающем комплексе (см.).
Согласно градациям, разработанным Вудруффом, на
почвах, имеющих калийный потенциал более 14,6—
16,7 кДж/моль, растения страдают от недостатка калия;
почвы с КП 14,6—16,7 кДж/моль обеспечены калием.
При КП в почве ниже 10,5 кДж/моль растения хорошо
обеспечены этим питательным элементом. Однако эти
градации могут сильно варьировать в зависимости от
типа почв и видов сельскохозяйственных культур.
калийный потенциал рассчитывают также по
упрощенной формуле Kn = lgaK+—0,51gaca2+ (а
—активности) и выражают в условных единицах. Величины
активностей ионов К+ и Са2+ в почвенной суспензии
можно измерить непосредственно с помощью ионселек-
тивных электродов.
КАОЛИНИТЫ. Широко распространенные в почвах
двухслойные диоктаэдрические минералы, имеющие
формулу Al4(OH)8[Si4Oio].
Между атомами кислорода одного и гидроксоионами
соседнего двухслойного пакета (см. Глинистые минера-
лы) имеется прочная водородная связь, поэтому
каолиниты не способны к межпакетной сорбции веществ и
характеризуются сравнительно низкими величинами
удельной поверхности (см. Удельная поверхность
почвы)— десятки квадратных метров на 1 г минерала и
емкости катионного обмена (см.)—единицы
миллиграмм-эквивалентов на 100 г минзрала. Структурно-
разупорядоченные каолиниты имеют более высокие
значения удельной поверхности и емкости катионного
обмена.
Каолиниты способны к поглощению небольшого
количества анионов, особенно фосфатов и арсенатов, в
кислой среде; сорбционные центры расположены на
боковых гранях частиц каолинита и связаны с выходом
на поверхность (А1—ОН)-групп, которые в условиях
кислой реакции почвы превращаются в А1—ОН2+.
Основные механизмы поглощения — электростатическое
притяжение между разноименно заряженными частицами
Карбонаты в почвах 148
и лигандный обмен (см. Комплексные соединения)
ОН-групп на анион.
Из-за низкой емкости катионного обмена каолиниты
лишь в малой степени способны поглощать
загрязняющие вещества, присутствующие в катионной форме, но
за счет образования водородных связей и вандервааль-
совых сил могут поглощать многие пестициды.
Происхождение каолинитов в составе почвообразую-
щих пород связано с постмагматическими процессами
и с процессами интенсивного выветривания в условиях
влажного и жаркого климата.
Каолиниты — преобладающие компоненты илистой
фракции (80—90%) в красноземах и желтоземах
Западной Грузии и в почвах разных типов, развитых на
древних корах выветривания (см. Илистая фракция
почв). Последние особенно широко распространены на
Южном Урале и в Северном Казахстане. В почвах
северной части европейской территории СССР на
четвертичных отложениях содержание каолинитов в составе
илистой фракции уменьшается от 40—60 % в западных
регионах до 10—20% в Приуралье. В почвах южной
части европейской территории СССР на лёссовидных
суглинках содержание каолинитов не превышает 10—
30%. В подзолистых, серых лесных, бурых лесных
оподзоленных и некоторых других почвах каолиниты,
как наиболее устойчивые, накапливаются в верхних
минеральных горизонтах за счет разрушения и выноса
других компонентов илистой фракции.
КАРБОНАТЫ В ПОЧВАХ. Минералы класса
карбонатов, представляющие собой соли угольной кислоты.
Карбонаты обусловливают щелочность почв и с ними
связаны вспышки щелочности при орошении.
В составе твердых фаз почвы чаще всего
встречаются карбонаты натрия и щелочноземельных элементов.
Карбонаты натрия (сода, трона, нахколит) могут
содержаться в засоленных почвах и в солонцах, имеют
высокую растворимость и неблагоприятно влияют на
физические и химические свойства почв (см.
Легкорастворимые соли).
Наиболее широко распространены в почвах
карбонаты кальция и магния, которые в разных
морфологических формах и в разных количествах (от десятых долей
149 Карбонаты в почвах
процента до нескольких десятков процентов)
присутствуют по всему профилю или в отдельных генетических
горизонтах серых лесных почв, черноземов, солонцов,
засоленных почв. Встречаются они также в почвах гу-
мидных областей, развитых на карбонатных породах
(дерново-карбонатных, бурых лесных, рендзинах и др.)-
Карбонаты кальция имеют формулу СаС03 и
представлены кальцитом, люблинитом (игольчатым кальцитом)
и арагонитом; карбонаты магния представлены
минералом — магнезитом MgC03. Иногда в почвах находится
двойной карбонат кальция и магния — доломит
CaMg(C03)2.
• Карбонаты в почвах присутствуют как в рассеянных
формах, не видимых простым глазом, но
обнаруживаемых по вскипанию от НС1, так и в виде различных
скоплений— новообразований. Последние представлены
налетами, выцветами, псевдомицелием, кутанами,
примазками, прожилками, тубулами, белоглазкой, журавчика-
ми, желваками, дутиками, прослойками, панцирями,
сплошными аккумуляциями лугового мергеля.
Большая часть почв зонального ряда, начиная с
серых лесных и южнее, имеет в профиле один или
несколько иллювиально-карбонатных горизонтов,
характеризуемых максимальным по профилю содержанием
карбонатов и обычно наибольшим количеством
карбонатных новообразований.
Для определения количества карбонатов в образцах
почв используют химические методы (объемный и аци-
дометрический) и термический анализ.
Растворимость карбонатов в воде при 20 °С
характеризуется следующими величинами: кальцит — 0,065,
магнезит — 0,092 г/л.
Карбонаты щелочноземельных металлов в целом
благоприятно действуют на почвенные свойства: они
обеспечивают нейтральную или слабощелочную
реакцию среды, преобладание кальция и магния в
почвенном поглощающем комплексе (см.), достаточно высокую
концентрацию ионов Са2+ и Mg2+ в почвенном растворе.
Присутствие карбонатов оказывает большое
влияние, как прямое, так и косвенное, на поведение в
почвах многих загрязняющих веществ. В условиях
нейтральной или слабощелочной реакции резко снижается
Картографирование почв 150
концентрация в почвенных растворах большинства пол-
лютантов, в том числе тяжелых металлов (см.) и
радионуклидов, а также алюминия, токсичного для растений
(см.), и водородных ионов. Именно поэтому карбонаты
кальция и магния, прежде всего известь и доломитовая
мука, состоящие в основном из СаС03 и CaMg(C03)2
соответственно, широко используются для мелиорации
кислых почв. Для некоторых загрязняющих веществ
карбонаты щелочноземельных металлов служат
эффективным сорбентом. На поверхности карбонатов прочно
адсорбируются фосфат- и арсенат-анионы, происходит
поглощение фтора и нитрат-ионов. В кристаллической
решетке доломита возможно замещение ионов Mg2+
ионами Zn2+.
В определенных условиях присутствие кальцита
может вызывать повышение рН почвы до 10, что
оказывает неблагоприятное влияние на сельскохозяйственные
культуры.
КАРТОГРАФИРОВАНИЕ ПОЧВ. Составление
почвенных карт или картосхем отдельных свойств почв.
Составление карт загрязнения почв, растительности,
воздуха, вод позволяет выявить не только зону
техногенного воздействия, но и установить пространственные
закономерности степени этого воздействия на основные
компоненты биосферы. Оценочные и прогнозные карты
загрязнения природной среды в зависимости от
масштаба и точности могут быть схематическими и
детальными, аналитическими и комплексными. Так, в Польше
на основе аналитических карт составлена карта
нарушения и загрязнения окружающей среды. Изданы
атласы загрязнения среды в Японии, Франции. Ведутся
методические исследования по составлению
схематических мелкомасштабных карт для условий рассеяния
продуктов техногенеза (см.) в атмосфере, проведено
районирование территории СССР по особенностям
миграции и разложения продуктов техногенеза в воде,
воздухе, почве. Несмотря на многочисленность работ по
картографированию нарушений природной среды,
детальных конкретизированных карт пока мало.
При составлении карт необходимо иметь в виду, что
промышленные объекты обусловливают загрязнение
различных по протяженности и площади территорий.
151 Картографирование почв
Это зависит от мощности источника загрязнения (см.),
розы ветров, интенсивности, продолжительности и
высоты выбросов (см. Выбросы загрязняющих веществ),
рельефа, климатических факторов. Так, инверсия
(изменение скорости и направления ветра) замедляет
рассеяние выбросов; скорость ветровых потоков влияет на
степень загрязнения отдельных территорий: чем больше
сщрость ветра, тем меньше выпадает поллютантов на
единицу площади.
В тех населенных пунктах, где преобладают
холодные низкие выбросы промышленных предприятий,
максимальные концентрации загрязняющих веществ в
атмосфере можно ожидать при скорости ветра 4—7 м/с.
Считается, что зона максимального загрязнения
находится в пределах расстояния, равного 10—40-кратной
высоте трубы при высоком и горячем выбросах и 5—
20-кратной — при низком и холодном выбросах. Радиус
зоны загрязнения может составлять от единиц до сотен
километров.
Районирование территории СССР по особенностям
миграции и разложения продуктов техногенеза
проводят на основе принципов ландшафтно-геохимического
картографирования, заключающегося в отборе проб с
различных элементов ландшафта (см.). Так,
многолетние комплексные исследования, проведенные в
окрестностях г. Мончегорска, показали, что устойчивость се-
веро-таежных природных комплексов к техногенному
воздействию в несколько раз ниже, чем
южно-таежных.
При картографировании загрязнения почв
промышленными выбросами применяют также экспрессный
метод определения потока загрязняющих веществ на
поверхность почвы — анализ снежного покрова. Также
анализируют химический состав атмосферных осадков
в зоне поступления поллютантов (см. Загрязняющие
вещества) на поверхность земли.
В. С. Аржанова предложила индикацию пылевых
атмосферных выпадений методом отмывки листьев,
позволяющим установить качественный и количественный
состав выбросов, оценить интенсивность накопления
загрязняющих веществ на поверхности растений для
определения сферы влияния предприятия.
Катионы обменные 152
Картографирование загрязнения различными поллю-
тантами можно проводить также по оценке косвенных
признаков, с помощью биоиндикации (см. Индикация
биогеохимическая состояния окружающей среды).
Картографический метод удобно применять для
изучения пространственных особенностей распределения
поллютантов в слое почвы. Карты-схемы загрязнения
можно строить вручную на основании точечных данных
о содержании загрязняющего почву элемента. Однако
современный способ — это автоматическое построение
изолиний концентраций загрязняющих элементов.
Изолинии проводят на картографической основе с
нанесенными на ней гидросетью, населенными пунктами и
точками пробоотбора или без них.
КАТИОНЫ ОБМЕННЫЕ (синоним — катионы
поглощенные). Находящиеся в почвенном поглощающем
комплексе (см.) катионы, способные к эквивалентному
обмену на катионы взаимодействующего с почвой
раствора.
Обменные катионы находятся на обменных позициях
глинистых минералов (см.) и органического вещества, и
их состав сильно различается в почвах разных
природно-климатических зон. В гумидных областях в
тундровых, подзолистых, бурых лесных почвах, красноземах
и желтоземах среди этих катионов преобладают ионы
А13+, А1(ОН)2+, А1(ОН)2+ и Н+. В аридных почвах —
черноземах, каштановых, сероземах обменные катионы
представлены преимущественно Са2+ и Mg2+, а в
засоленных почвах — также Na+. Во всех почвах среди
обменных катионов всегда есть небольшое количество К+.
Некоторые тяжелые металлы (Zn2+, Pb2+, Cd2+ и др.)
могут присутствовать в почвах в качестве обменных
катионов. Обменные Са2+, Mg2+, K+ и Na+ иногда
называют обменными основаниями.
КИСЛОТНОСТЬ ПОЧВ АКТУАЛЬНАЯ.
Кислотность почвенного раствора (водной вытяжки).
Характеризуется двумя показателями: активностью ионов Н+
(степень кислотности) и содержанием кислотных
компонентов (количество кислотности).
Степень кислотности (рН) определяют потен-
циометрически со стеклянным электродом
непосредственно в почве, в почвенном растворе или в водной вы-
153 Кислотность почв актуальная
тяжке, полученной при отношении почва : вода=1: 2,5.
Количество кислотности находят путем
титрования почвенных растворов или водных вытяжек
щелочью.
Кислотность почвенного раствора обусловлена раст-
BqpeHHbiMH в нем химическими веществами. На
величину рН почвенного раствора влияют свободные
органические кислоты: винная, муравьиная, масляная, коричная,
уксусная, фульвокислоты и другие, что связано с
высокой степенью их диссоциации; константы устойчивости
этих кислот составляют Ю-4—Ю-5. Из минеральных
кислот большое значение имеет угольная кислота Н2СО3,
нг количество которой влияет растворение в почвенном
растворе диоксида углерода С02. Величина рН
почвенного раствора зависит от парциального давления СОг
в почвенном воздухе, степени диссоциации
образующейся угольной кислоты и общей ионной силы раствора
(см. Ионная сила почвенного раствора). Только за счет
СОг рН раствора может снижаться до 4—5,6.
От количества титруемых кислотных компонентов
зависит кислотно-основная буферность почвенного
раствора (см. Буферность почв кислотно-основная). Если
актуальную кислотность определяют в водной вытяжке из
почв, то на результаты анализа может повлиять состав
твердых фаз почвы, что связано с диссоциацией и
обменом катионов почвенного поглощающего комплекса
(см.) в процессе приготовления вытяжек, гидролизом
солей двух- и трехвалентных металлов:
MgCl2 Н-НзО—>Mg(OH)2 + №
FeS + H20—►Fe(OH)2+H+
и растворением карбонатов:
СаСОз + Н20—^Са2++НС03 +СО|"
Классификация почв по уровням актуальной
кислотности почвы следующая:
Сильнокислые рН 3—4 Слабощелочные рН 7—8
Кислые рН 4—5 Щелочные рН 8—9
Слабокислые рН 5—6 Сильнощелочные рН 9—11
Нейтральные рН 7
Актуальная кислотность почв, имеющих рН<7, под
действием кислых дождей (см.) снижается на 1—2
единицы, Избыточная кислотность токсична для многих
Кислотность почв потенциальная 154
растений. Прямое отрицательное действие кислотности
ведет к повреждению корневой системы растений,
нарушению обмена веществ между растением и средой.
Уменьшение рН почвенного раствора вызывает
увеличение подвижности Al, Mn, Fe, Cu, Zn, что обусловливает
снижение активности ферментов и ухудшение свойств
протоплазмы растений.
Для устранения избыточной кислотности в почвы
вносят известь, органические удобрения, гипс,
силикатные и фосфорные удобрения. Целесообразно на таких
почвах выращивать культуры, устойчивые к
повышенной кислотности.
КИСЛОТНОСТЬ ПОЧВ ПОТЕНЦИАЛЬНАЯ.
Форма почвенной кислотности, связанная с твердыми
фазами почвы и проявляющаяся только при взаимодействий
почвы с солевыми растворами.
В составе потенциальной кислотности различают
обменную кислотность, определяемую при
взаимодействии почвы с раствором нейтральной соли
(обычно 1 н. КС1, рН 6,5), и гидролитическую,
определяемую при действии на почву гидролитически
щелочной соли (1 н. CH3COONa, рН 8,2).
Природа обменной кислотности дискуссионна.
Предполагается, что она связана с обменными ионами Н+
и А13+. Согласно гипотезе об обменном Н+, при
действии нейтральной соли на почвенный поглощающий
комплекс — ППК (см.) в результате обменной реакции
в раствор поступает дополнительное количество ионов
Н+, которые могут взаимодействовать с гидроксидом
алюминия, что ведет к появлению ионов А13+ в
растворе. Согласно гипотезе об обменном А13+, при получении
вытяжки обменный А13+ вытесняется из ППК по
уравнению: почва — А1 + KCl-мючва—К+А1С13.
Образующаяся соль A1CU подвергается гидролизу, в результате
чего в pacTBqpe появляется дополнительное количество
ионов Н+. Таким образом, и в том и в другом случае
в растворе присутствуют и ионы Н+ и ионы А1+3, что
затрудняет выяснение источников возникновения
кислотности.
При одновременном присутствии в растворе ионов
Н+ и А13+ содержание каждого из них может быть
определено по методу А. В. Соколова. Для этого в анализи-
155 Кислые дожди (кислотные дожди, кислые осадки)
руемую вытяжку добавляют раствор NaF, свободный
А13+ связывается во фторидный комплекс и в
дальнейшем не влияет на кислотность титруемого раствора.
По современным представлениям, в минеральных
почвах обменная кислотность формируется за счет
обменного А13+, в гумусированных существенно влияние
обменного Н+.
Гидролитическая кислотность, определяемая в
вытяжке 1 н. CH3COONa, как правило, выше обменной.
Это связано, во-первых, с более полной диссоциацией
протона из ППК в условиях слабощелочной реакции
раствора CH3COONa, во-BTqpbix, с присутствием в
растворе ацетат-иона, что способствует более полному
прохождению реакции вытеснения протона.
При однократной обработке почвы раствором
CH3COONa все способные к обмену ионы Н+ полностью
не вытесняются, поэтому их содержание находят чаще
всего расчетным путем, увеличивая полученный
результат в 1,75 раза. К. К. Гедройц под гидролитической
кислотностью понимал не всю титруемую кислотность
СН3СО(Жа-вытяжки, а только разность между
результатами титрования слабощелочной (CH3COONa) и
нейтральной (КО) вытяжек, то есть приращение
кислотности, обусловленное действием гидролитически
щелочной соли.
Сведения о потенциальной кислотности нужны для
определения доз извести при известковании (см.)
кислых почв. При загрязнении почв растворимыми солями
промышленного или сельскохозяйственного
происхождения обменная кислотность может быть причиной
снижения рН почвенного раствора, что связано с
вытеснением ионов Н+ из ППК. Особенно токсичен А13*,
переходящий в pacTBqp в результате обменных реакций. В
связи с этим уровень обменной кислотности подлежит
обязательному контролю при почвенном мониторинге
и характеристике загрязненных почв. На основе
сведений о потенциальной кислотности почв возможен
прогноз влияния кислых осадков (см. Кислые дожди) на
кислотно-основные свойства почв.
КИСЛЫЕ ДОЖДИ (КИСЛОТНЫЕ ДОЖДИ,
КИСЛЫЕ ОСАДКИ). Атмосферные осадки, имеющие
сильнокислую реакцию (рН менее 5).
Кислые дожди (кислотные дожди, кислые осадки) 156
При сжигании различных видов топлива, а также
с выбросами различных предприятий в атмосферу
поступает значительное количество оксидов азота и серы,
при взаимодействии которых с атмосферной влагой
образуются азотная и серная кислоты. В дальнейшем эти
кислоты выпадают на поверхность суши или водоемов
в виде кислых дождей или иных атмосферных осадков.
Термин «кислые дожди» был введен английским
химиком А. Смитом в начале 70-х годов XX в. при
выявлении зависимости между уровнем загрязнения воздуха
над г. Манчестером и кислотностью осадков. Однако
полностью осознать экологические последствия кислых
осадков удалось лишь в течение последнего десятилетия.
Жидкие (в виде дождей) кислые осадки
выпадают преимущественно в скандинавских странах и
Канаде, в сухом виде (аэрозоли)—на Среднем
Западе США, в Чехословакии. Наиболее сильно
загрязнена атмосфера S02 в Финляндии, Люксембурге,
Чехословакии, Венприи, Канаде. В Финляндии, Швеции,
Норвегии, Нидерландах и Австрии загрязнение атмосферы
S02 вследствие привноса оксидов из других стран
намного превышает выбросы их собственной
промышленности.
Проблема кислых дождей принимает угрожающие
размеры. В Европе и Северной Америке кислые осадки
образуются в результате поступления в атмосферу S02,
N(\ и других соединений главным образом с дымовыми
выбросами ТЭЦ и промышленных предприятий. Только
в Северной Европе ежегодно поступает 30—60 кг серы
и 15—30 кг азота на 1 га. Антропогенные и природные
выбросы в атмосферу оцениваются в 100 млн т серы в
год. Под действием кислых осадков в подземных водах
резко повышается содержание металлов, в частности
РЬ, Си, Zn, Cd, и особенно А1, который поступает через
корневые системы в древесные ткани и оказывает
токсическое или даже летальное действие на растения.
Кислые осадки в виде дождя, тумана, росы
вызывают изменение состояния растений в зависимости от
концентрации в них Н+, S, N. Видимые повреждения
растений наблюдаются при рН 2—3,6, а нарушения
роста без признаков повреждения — при рН 3,5—4.
Кислотность дождевых осадков, прошедших через древес-
157 Коагуляция почвенных коллоидов
ный полог, обычно снижается из-за выщелачивания
кальция и магния с поверхности листьев. В результате
ухудшается рост деревьев, может наступить их гибель.
Отрицательная роль кислых дождей и тяжелых
металлов (см.) усиливается при совместном действии,
вызывая синергический эффект, что приводит к резкому
угнетению растений. Так, на корнях молодых елей
отсутствует микориза, в несколько раз возрастает
содержание токсических элементов в древесине.
От кислых дождей в ФРГ погибло 1500 га леса, в
Швеции в 2000 озф исчез лосось; 90 % серы,
выпадающей на поля, леса, озера Европы и Северной Америки
и неблагоприятно воздействующей на них, связано с
промышленными выбросами.
В результате кислых дождей происходит деградация
хвойных, особенно пихтовых, лесов во Франции.
Опадает хвоя, загнивает древесина. В ФРГ к 1980 г.
отмечалось резкое угнетение 75 % пихтовых и 40 % еловых
лесов. С 1983 г. признаки заболевания леса
проявляются в Эльзасе и Лотарингии.
Значительный ущерб от выпадения кислых осадков
на природные экосистемы (см.) очевиден. Однако
многие стороны этой проблемы не ясны, особенно
биологические аспекты: изменение продуктивности лесных пород
и сельскохозяйственных культур, различия в реакции на
кислые дожди разных экосистем.
КОАГУЛЯЦИЯ ПОЧВЕННЫХ КОЛЛОИДОВ.
Процесс соединения коллоидных частиц друг с другом с
образованием более крупных частиц (см. Коллоиды
почвенные).
Если при этом формируются отдельные мелкие
хлопья, коагуляцию определяют как флоккуляцию,
при формировании более крупных и плотных частиц
коагуляцию называют агрегацией. Частный случай
коагуляции — образование гелей — студнеобразных
или твердых систем с пространственной структурой,
формируемой частицами дисперсной фазы. Коагуляцию
следует отличать от процесса седиментации, который
заключается в осаждении частиц.
Один из важнейших факторов, вызывающих
коагуляцию почвенных коллоидов, — добавление в систему
электролита. В этом случае происходит сжатие двойно-
Коллоиды почвенные 158
го электрического слоя (см.), и коллоидные частицы
приобретают способность сближаться друг с другом
на такое расстояние, что начинает действовать вандер-
ваальсово притяжение. Кроме того, в присутствии
катиона возможно электростатическое взаимодействие
между катионом и несколькими отрицательно
заряженными частицами. Минимальная концентрация
электролита, при которой начинается быстрая, видимая
простым глазом, коагуляция коллоидной системы,
называется критической концентрацией. В
отечественной литературе эту величину обычно называют
порогом коагуляции. При этом растворы
поливалентных катионов оказывают значительно более сильное
коагулирующее действие на коллоидные системы, чем
растворы одновалентных катионов. Эта зависимость
известна как правило Шульца-Гарди. Ее иллюстрирует
приведенная ниже таблица.
Порог коагуляции (мг-экв/л) коллоидных растворов
монтмориллонита при добавлении электролитов
Коллоидный раствор
NaCl
Cacij
Na-монтмориллонит, 0,25 %-ный 12—16 2,3—3,3
Са-монтмориллонит, 0,25 %-ный 1,0—1,3 0,17—0,23
Процесс коагуляции почвенных коллоидов
способствует образованию в почвах хорошей структуры. На этом
основан один из благоприятных эффектов гипсования
солонцов (см. Гипсование почв) —при внесении гипса
сравнительно высокая концентрация CaS04 в почвенном
растворе приводит к коагуляции коллоидов и
улучшению структуры почвы.
КОЛЛОИДЫ ПОЧВЕННЫЕ. Совокупность
минеральных, органо-минеральных и органических
почвенных частиц, имеющих определенные размеры и
способных образовывать коллоидные растворы. Верхний
предел размеров коллоидных частиц, по данным разных
авторов, условно установлен 0,2—1 мкм; нижний
предел точно не определен, но всегда превышает размеры
молекулярных и ионных частиц в истинных растворах.
159 Комплексные соединения
Коллоидные растворы рассматривают как
дисперсные системы, в которых твердые частицы
(дисперсная фаза) равномерно рассеяны в жидкости
(дисперсионной среде). Иногда коллоидные частицы
представляют собой ассоциаты молекул, в этом случае
их определяют как коллоидные мицеллы.
Почвенные коллоиды называются
гидрофильными (лиофильными), если в водной среде
коллоидные частицы притягивают молекулы воды. К
гидрофобным (лиофобным) почвенным коллоидам
относя^ вещества, частицы которых отталкивают молекулы
воды (или другой жидкости, являющейся дисперсионной
средой).
Большая часть почвенных коллоидов обладает
электрическим зарядом (см. Заряд почвенных коллоидов
переменный, Заряд почвенных коллоидов постоянный),
и между одноименно заряженными частицами в
коллоидном растворе возникают электростатические силы
отталкивания. Вместе с тем при сближении частиц друг
с другом в процессе броуновского движения между
ними возникают вандерваальсовы силы притяжения. Если
силы отталкивания преобладают, коллоидный раствор
достаточно устойчивый. При преобладании сил
притяжения частицы начинают соединяться друг с другом,
и коллоидный раствор коагулирует (см. Коагуляция
почвенных коллоидов).
На почвенных коллоидах адсорбируются многие
загрязняющие вещества, присутствующие в почве в ка-
тионной форме — тяжелые металлы, радионуклиды (на
отрицательно заряженных коллоидах) и в форме
анионов (на положительно заряженных коллоидных
частицах).
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ. Сложные
соединения, в составе которых различают комплексооб-
разователь (центральный атом) и лиганды, или
адденды (молекулы или ионы, непосредственно
связанные с центральным атомом).
Комплексообразователями могут быть как металлы
(особенно часто переходные), так и неметаллы,
преимущественно В, Р, Si, As. В качестве лигандов обычны
такие анионы, как ОН-, остатки различных кислот,
включая органические, нейтральные молекулы (Н20,
Комплексные соединения
160
NH3, амины и др.). Количество атомов, непосредственно
связанных с центральным атомом, равно его
координационному числу.
Образование комплексных соединений в почвах
играет важнейшую роль в растворении твердых#фаз
почвы, миграции различных элементов, питании
растений.. В такой форме в почвах и природных водах
мигрируют многие элементы: железо, алюминий, кремний,
частично кальций и магний. Большинство химических
загрязняющих веществ образуют в почвах
нерастворимые или, наоборот, легкорастворимые и подвижные
комплексные соединения. В их числе тяжелые
металлы— Pb, Cu, Hg, Cd, Zn, многие пестициды, детергенты
(см.), фтор-ион и др.
Гуминовые вещества почвы обладают ярко
выраженной способностью образовывать комплексные
соединения различных типов. В качестве лигандов или хелато-
образующих соединений выступают гуминовые кислоты,
гиматомелановые кислоты, фульвокислоты, многие
неспецифические соединения (см. Гумус). По Л. Н.
Александровой, одно из центральных мест в системе
почвенных органо-минеральных соединений занимают комп-
лексно-гетерополярные соли и адсорбционные
комплексы.
В комплексно-гетерополярных солях
металл входит в анионную часть молекулы, образуя
соединение типа:
соо
_ (СООН)п.х
J (он)т.у
Здесь М — может быть представлен Fe(OH)2+,
Fe(OH)2+, а также аналогичными частицами другого
состава, HanpHMqp, с "участием алюминия, свинца,
кадмия и т. д. Поскольку такое комплексное соединение
имеет свободные карбоксильные и фенольные группы, то
оно может образовать еще и простые гетерополярные
соли:
161
Контроль загрязнения почв
СОО
ОН
п COOMt
OMi
Здесь Mi — катионы сильных оснований: Na+, К+;
в этой же позиции могут находиться и катионы других
металлов: Са, Mg, Al, Pb и др. Комплексно-гетеропо-
лярные соли имеют различный уровень растворимости;
химические загрязняющие вещества в такой форме
могут или свободно мигрировать в ландшафте, или
накапливаться в отдельных горизонтах почвенного профиля.
Практически неподвижны в почвенном профиле
соединения, относящиеся к адсорбционным
комплексам. Они образуются в результате взаимодействия
свободных гумусовых веществ или их комплексных и
комплексно-гетерополярных соединений с глинистыми
минералами (см.) почв. Образование адсорбционных
комплексов происходит как за счет межмолекулярных,
так и путем ионных или координационных связей. В
этой форме в почвенном профиле закрепляются и
накапливаются органические вещества (гумусовые)', но в
этой же форме могут аккумулироваться загрязняющие
вещества как органической (пестициды, углеводороды,
детергенты), так и неорганической (тяжелые металлы)
природы.
КОНТРОЛЬ ЗАГРЯЗНЕНИЯ ПОЧВ. Контроль за
соответствием почв нормативам их качества по
содержанию в допустимых количествах химических веществ,
которые в случае превышения этих количеств
представляют экологическую опасность.
Система контроля предусматривает выявление
источников загрязнения (см. Источник загрязнения),
изменения почв и экосистемы (см.) в целом под действием
загрязняющих веществ, информацию о состоянии почв.
Контроль загрязнения почв — обязательный элемент
общего контроля загрязнения окружающей среды (см.
Загрязнение природной среды), который проводят
организации Госкомгидромета СССР, а также учреждения
здравоохранения и др. Региональная сеть подразделений
U Закм S0S7
Контроль загрязнения почв 162
этих служб оценивает качество воздуха, вод, почв,
растений по соответствию их санитарно-гигиеническим
нормативам.
В почвах пахотных угодий предусмотрено
регулярное определение содержания остатков пестицидов, а
именно ДДТ и его метаболитов (ДДД, ДДЭ), гексахлор-
циклогексана (ГХЦГ), полихлорпинена (ПХП), поли-
хлоркамфена (ПХК), триазиновых гербицидов (симази-
на, атразина, прометрина), гербицидов типа 2,4-Д и
2М-4Х, фосфорорганических пестицидов (карбофоса,
метафоса, фозалона, фосфамида, бутифоса).
В зонах расположения нефтепромыслов,
нефтеперерабатывающих заводов, нефтепроводов, нефтехранилищ
проводят контроль загрязнения почв нефтепродуктами
от места разлива их до зоны промежуточной или
конечной аккумуляции.
Контроль загрязнения почв металлами вокруг
промышленных предприятий предполагает регулярное
обследование почв преимущественно пахотных угодий.
Подлежат контролю следующие почвенные показатели:
содержание Pb, Co, Cd, Ni, Cu, Zn (общее
количество и содержание подвижных форм);
биохимические показатели — активность дегидроге-
назы, уреазы, фосфатазы, интенсивность дыхания по
выделению С02;
показатели химического состояния почв —
кислотность, общее содержание углерода, количество
водорастворимого органического вещества, подвижных
соединений фосфора и сульфатов, аммонийный и нитратный
азот.
Наблюдения за глобальным загрязнением (см.
Загрязнение почвы глобальное) проводят станции
фонового мониторинга (см. Мониторинг фоновый).
Предполагается оценка содержания As, Pb, Zn, V, Си, Ni, Сг,
Cd, В, хлорорганических пестицидов, ДДТ,
фосфорорганических инсектицидов, кислотности, содержания азота
и фосфора в почвах.
Общегосударственная служба контроля загрязнения
окружающей среды обобщает систематическую и
экстренную информацию. Цель обобщения экстренной
информации — выявление угрожающих уровней
загрязнения окружающей среды и принятие срочных мер*
]g3 Коэффициент биологического поглощения
Систематическая информация обеспечивает
характеристику источников загрязнения, оценку уровней
загрязнения почв и тенденцию их изменения. Уровни
содержания металлов и пестицидов оценивают по величинам
ПДК (см. Предельно допустимое количество
загрязняющего почву химического вещества), а при отсутствии
установленных ПДК — на основе многократного
превышения регионального фонового содержания (см.
Фоновое содержание в почвах химических веществ) или
кларков химических веществ для почв.
КОЭФФИЦИЕНТ БИОЛОГИЧЕСКОГО
ПОГЛОЩЕНИЯ. Эмпирический биогеохимический показатель,
характеризующий интенсивность биологического
поглощения элементов. Его вычисляют по формуле А. И. Пе-
рельмана
А - 1х
Пх
где Ах — коэффициент биологического поглощения (КБП); 1Х и
пх — содержание элемента х соответственно в золе растений и в
горной породе или почве, на которой произрастает растение, кларк
литосферы.
Этот показатель предложен Б. Б. Полыновым, назван
А. И. Перельманом. При необходимости
характеризовать химические особенности отдельных растений, их
способность к накоплению химического элемента
следует использовать коэффициент биологического
поглощения, рассчитанный на кларк литосферы. Если же
требуется оценить влияние растений на состав почвы, то
рассчитывают этот коэффициент относительно
содержания элемента в горной породе и почве. Коэффициенты
биологического поглощения — не константные величины,
они меняются в зависимости от времени, фазы
вегетации, возраста растений, почвы, ее химических и
других свойств.
По величине биологического поглощения Б. Б. По-
лынов и А. И. Перельман выделили пять групп
элементов, имеющих следующие коэффициенты поглощения:
Энергично накопляемые 10—100
Сильно накопляемые 1—Ю
Слабого накопления и среднего захвата 0,1—1,0
Слабого захвата 0,01—0,1
Очень слабого захвата 0,001—0*01
Коэффициент биологического поглощения
164
Уровень концентрации элементов в земной коре
редко совпадает со степенью поглощения живым
веществом. Одни элементы, наиболее важные в жизненных
процессах и наиболее распространенные в земной коре,
поглощаются сильнее, другие слабо аккумулируются
(табл. 1).
1. Значения коэффициентов биологического поглощения (КБП)
для элементов различной физиологической важности
(по Дж Фортескью)
Э леменгы
Физиологическая роль
Сильное поглощение
Бор
Велика
Среднее поглощение
Сера
Цинк
Фосфор
Марганец
Серебро
Кальций
Стронций
Медь
Калий
Барий
Селен
С л а
Молибден
Магний
Никель
Кобальт
Уран
Железо
Очень
Натрий
Рубидий
Редкоземельные
Хром
Литий
Кремний
Ванадий
Титан
Алюминий
Велика
>
»
»
Незначительна
Велика
Незначительна
Велика
»
Незначительна
Велика
бое поглощение
Велика
»
Незначительна
»
»
Велика
слабое поглощение
Незначительна
>
»
»
»
>
>
>
»
КБП
1,70
0,96
0,90
0,88
0,40
0,25
0,14
0,13
0,13
0,12
0,12
0,10
0,040
0,034
0,030
0,020
0,020
0,012
0,007
0,007
0,003
0,003
0,0015
0,0006
0
0,000
0,0003
165 Коэффициент биологического поглощения
Поглощение элементов из почвы зависит также от
вида растений. Известны растения-концентраторы
металлов— лишайники, мхи и другие виды высших
растений. Также неодинаково поглощают химические
элементы и отдельные органы растений — стебли, корни,
листья, хвоя, древесная кора. А. Л. Ковалевский
разделил растения по типу поглощения металлов на
безбарьерные и барьерные. Содержание микроэлементов в золе
безбарьерных растений растет
пропорционально содержанию их в почве, в барьерных — имеется
порог концентрации, выше которого растения
прекращают поглощать микроэлемент, несмотря на
дальнейшее увеличение его содержания в субстрате (см.
Биогеохимические провинции). Для сравнения химического
состава различных видов растений А. Л. Ковалевским
предложен коэффициент относительного поглощения,
или ОСВР (относительное содержание элемента в видах
растений):
ОСВР=^,
Сэт.в
где Сиз,в и Сэт.в — концентрации элемента в золе соответственно
изучаемого и эталонного вида растений.
В качестве эталонного вида растений можно
принимать один из наиболее распространенных или важных
для данного исследования видов. Различия в величинах
ОСВР часто возникают на участках с повышенным
содержанием химических элементов, обычно на
биогеохимических аномалиях. Корни большинства видов
растений — безбарь^рные органы по отношению к большим
концентрациям, например свинца в надземной части
растения.
А. Л. Ковалевский предложил также серию
коэффициентов, связанных с поглощением растениями
элементов из почвы, водной и газообразной фаз среды, их
окружающей.
В их число входят три типа коэффициентов.
1. Растительно-почвенный коэффициент
(РПК), равный КБП по А. И. Перельману.
2. Растительно-водный (корневой)
коэффициент (РВКв), вычисляемый как отношение kqh-
Коэффициент биологического поглощения 166
центраций изучаемого элемента в растении и в водной
среде, имеющей контакт с корнями:
РВКв = Ср/Св.р,
где Ср и Св.р — процентное содержание изучаемого элемента в
золе растений и водном растворе.
Этот параметр при изучении поглощения элементов
живыми организмами, миграции радиоактивных
изотопов в водных средах используют и под другими
названиями— коэффициент накопления,
коэффициент концентрации или коэффициент
дискриминации.
3. Растительно-газовый коэффициент
(РГК), используемый для исследования поглощения
химических элементов из газообразной фазы. Особенно
важен при изучении химических элементов, образующих
газообразные соединения, — серы, хлора, фтора, иода,
ртути, азота и др.
РГК=.(Ср-РПК-Сп)/СВ|
где Ср, Сп и С в — содержание изучаемого элемента
соответственно в золе растений, почве и воздухе; РПК —
растительно-почвенный коэффициент, определенный в аналогичных условиях, когда
газовое питание растений отсутствует или им можно пренебречь.
В экспериментах с радиоактивными или
стабильными изотопами формула для РПК упрощается:
РПК = СР/СВ'.
Сопоставление параметров, характеризующих
интенсивность поглощения химических элементов из твердой,
жидкой и газообразной фаз среды, окружающей
растение, показано в таблице 2. Наибольшую интенсивность
имеет поглощение надземными частями растений из
газообразной фазы, наименьшую — из почвы.
2. Типичные значения РПК, РВК и РГК химических элементов
(по А. Л. Ковалевскому)
Коэффициент
Пределы
колебаний
Среднее
Растительно-почвенный 1Q—2—-102 1,0
Растнтельно-водный (корневой) 10?-—10* 3-Ю3
-Растительно-газовый (надземный) . 10*—107 3-Ю5
167 Коэффициент водной миграции
Воздействие на растение антропогенных
экологических нагрузок выражает также акропетальный
коэффициент (АК), предложенный Д. Сэбином:
АК=С0/СХ,
где Со — концентрация элемента в отдельной части растения;
Сх — концентрация элемента в эталонной части данного
растительного вида.
Акропетальные коэффициенты для растений одного
вида часто сходны. Изменение этих коэффициентов
свидетельствует о значительном экологическом стрессе,
испытываемом растением.
Все виды коэффициентов биологического
поглощения могут быть использованы при изучении воздействия
среды на растительность. Изменение свойств среды
происходит на почвах, развитых на биогеохимических
аномалиях; в связи с загрязнением почв, атмосферы и вод
около промышленных предприятий и в других случаях
антропогенного воздействия. Многие растения могут
служить индикаторами неблагополучного состояния
окружающей среды.
КОЭФФИЦИЕНТ ВОДНОЙ МИГРАЦИИ (предло
жен А. И. Перельманом). Показатель,
характеризующий интенсивность водной миграции различных
элементов— отношение содержания элемента в минеральном
остатке воды к его содержанию в горных породах,
дренируемых этими водами:
„ m*-100
Кх = ~ »
апх
где Кх — коэффициент водной миграции элемента х\ тх —
содержание элемента в воде, г/л; а — сумма минеральных веществ,
растворенных в воде, г/л; пх — содержание элемента в породах, %•
Показатель Кх используют в геохимии, почвенной
химии для дравнения интенсивности миграции главных и
второстепенных элементов. С его помощью можно
оценить относительную подвижность элементов в реках в
связи с их реальной концентрацией в момент отбора
проб.
Для оценки интенсивности водной
миграции по значениям Кх используют следующие градации
этого коэффициента:
Коэффициент водной миграции 168
Очень подвижные мигранты я-10—я* 100
Легкоподвижные мигранты п—л-10(л<2)
Подвижные мигранты 0, л—п(п<5)
Слабоподвижные и инертные мигранты 0,0л и менее
Параметр Кх подвержен колебаниям в зависимости
от условий среды. На его величину могут повлиять
изменения условий миграции: например, кислотности вод
в результате кислотных выпадений или стоков,
содержания в водах органического в^цества, поступления
элементов из загрязненного воздуха.
В разных обстановках, даже типах ландшафта
(автономный — окислительный, аквальный —
восстановительный) элементы ведут себя по-разному. Отсюда А. И. Пе-
рельман выводит понятие контрастности миграции,
показателем которой служит коэффициент
контрастности, равный отношению Кх разных процессов.
Этот показатель характеризует изменение
интенсивности миграции в одних и тех же условиях среды в
зависимости от формы элемента, что важно при оценке сте-
Содержание растворимых форм рассеянных элементов в речных
водах и интенсивность их водной миграции
(по В. В. Добровольскому)
F
Sr
Br
Zn
Ва
В
Мп
Сц
I
Ti
Zr
Li
As
Ni
Cr
90
80
20
20
20
10
10
7
5
3
2,6
2
2
2
1
3300,0
2600,0
740,0
740,0
740,0
370,0
370,0
260,0
185,0
110,0
96,0
74,0
74,0
74,0
37,0
1,04
2,90
75,91
3,27
0,23
8,30
0,12
2,64
82,00
0,01
0,13
0,57
8,95
0,65
0,2*
Mo
Pb
Sb
V
Y
Sn
U
Co
Ag
Cd
Se
Th
Ga
Hg
Sc
1
1
1
0,9
0,7
0,5
0,5
0,3
0,3
0,2
0,2
0,1
0,09
0,07
0,04
37,0
37,0
37,0
33,0
26,0
19,0
19,0
11,0
11,0
7,4
7,4
3,7
3,3
2,6
1,5
6,38
0,52
41,50
0,10
0,16
1,56
0,96
0,34
52,08
8,50
12,14
0,06
0,04
17,58
0,03,
169 Коэффициенты накопления
пени загрязненности среды и изменении формы
миграции в результате загрязнения воды.
Коэффициент водной миграции можно использовать
и для оценки интенсивности миграции элементов в
различных компонентах ландшафта (грунтовые воды,
почвы). При оценке этого показателя в глобальном
масштабе можно рассчитывать отношение среднего
содержания в сухом остатке речных вод к кларковому
значению элемента в литосфере (Добровольский, 1983). В
таблице представлены средние концентрации
растворимых форм рассеянных элементов и значения их
коэффициентов водной миграции.
КОЭФФИЦИЕНТЫ НАКОПЛЕНИЯ. Серия
эмпирических биогеохимических показателей, характеризующих
избирательное накопление химических элементов в
различных компонентах экосистемы, ландшафта, почвы
и т. д.
Коэффициенты элювиально-аккумулятивные —
параметры почвы, характеризующие миграцию химических
элементов в почвенном профиле. Их используют для
установления аккумуляции или вымывании элементов
из того или иного почвенного генетического горизонта по
сравнению с исходной материнской почвообразующей
породой. Эти коэффициенты вычисляют по формуле
Аэ-а== £>г.г/ £>м.п>
где /Сэ-а —элювиально-аккумулятивный коэффициент; Сг.г и См.п—
концентрации химического элемента соответственно в генетическом
горизонте почвы и в материнской породе.
Сравнение с почвообразующей породой возможно в
том случае, когда установлено, что почва образована
именно на этой породе. В случае насыпных грунтов
такое сравнение не имеет смысла.
Элювиально-аккумулятивные коэффициенты позволяют установить
отдельные закономерности перераспределения химических
элементов в почвенном профиле.
Коэффициенты концентрации — показатели,
служащие для характеристики и выявления локальных
техногенных аномалий, связанных с газопылевыми выбросами
отдельных промышленных предприятий, их накоплением
в урбанизированных территориях, вдоль автотрасс, и т.д.
Ксенобиотик 170
Коэффициенты концентрации равны частному от
деления концентрации химического элемента в отдельных
компонентах загрязненной территории на концентрацию
его в компонентах «фоновой» (незагрязненной)
территории. В связи с ^ем, что загрязнение экосистем носит
комплексный характер, то есть происходит химическое
загрязнение не одним элементом, а группой химических
элементов, Ю. Е. Сает предложил использовать
суммарный показатель загрязнения, равный
сумме коэффициентов концентрации накапливающихся
в пределах техногенной аномалии элементов. Этот
показатель может характеризовать интенсивность
техногенного потока на экосистему. Техногенные аномалии
имеют сложную структуру, отражающую современную
миграционную структуру тех ландшафтов (см. Ландшафт),
в которые втqpгaeтcя техногенный поток (Глазовская,
1988). Поэтому коэффициенты концентрации
рекомендуется рассчитывать для ландшафтов одного типа.
Коэффициенты местной миграции (концентрации) —
показатели, отражающие интенсивность и направление
миграции химических элементов в почвах
геохимического ландшафта. По определению А. И. Перельмана,
геохимический ландшафт — «это парагенетическая
ассоциация сопряженных элементарных ландшафтов,
связанных между собой миграцией элементов».
Коэффициент местной миграции численно равен
частному от деления содержания химического элемента
в каком-либо горизонте почв в аккумулятивном
ландшафте на содержание того же элемента в подобном
горизонте почв элювиального ландшафта. Этот
показатель позволяет оценивать интенсивность латеральной
миграции (почвенно-поверхностной, внутрипочвенной) в
геохимически подчиненные ландшафты депрессий
рельефа и речных долин. Аккумуляции микроэлементов
способствуют не только природные процессы, но и
техногенное воздействие.
КСЕНОБИОТИК. Чужеродное для данного
организма или сообщества вещество (пестициды, препараты
бытовой химии и т. д.), способное вызвать нарушение
нормального протекания биотических процессов,
заболевания и гибель живых организмов.
UI Ландшафт
л
ЛАНДШАФТ (от нем. land —земля, schaft —
суффикс, выражающий взаимосвязь, взаимозависимость).
1. Конкретная территория, однородная по
происхождению и истории развития, обладающая единым
геологическим основанием, однотипным рельефом,
единообразным сочетанием почв, растительности и отличающаяся
от других территорий структурой, характером
взаимосвязи и взаимодействия между отдельными
компонентами этой территории.
2. Природно-территориальный комплекс любого
ранга. Ландшафт при этом выступает как территориальная
система, в которой взаимосвязаны как природные, так
и антропогенно-техногенные элементы.
В основу классификации ландшафтов положены
принципы геохимической миграции элементов, а также
понятие об элементарном ландшафте, выдвинутые
Б. Б. Полыновым (см. Элементарный геохимический
ландшафт). Впоследствии идеи Б. Б. Полынова были
развиты М. А. Глазовской и А. И. Перельманом.
Согласно Б. Б. Полынову, все элементарные
ландшафты суши делятся по условиям миграции
химических элементов на три группы:
1. Элювиальные ландшафты — обычно
располагаются на повышенных элементах рельефа, с
хорошим дренажем и глубоким залеганием грунтовых вод.
В элювиальных ландшафтах происходит
преимущественный вынос вещества с нисходящими токами влаги.
Часть элементов не выносится, а закрепляется
растительностью, интенсивно вовлекаясь в биологический
круговорот.
2. Супер аквальные (надводные)
ландшафты — приурочены к пониженным элементам
рельефа, грунтовые воды располагаются близко к
поверхности и оказывают значительное влияние на почвы и
растительность. В супераквальных ландшафтах происходит
частичная аккумуляция элементов, принесенных как
грунтовыми водами, так и из элювиальных ландшафтов.
Ландшафт 172
3. Субаквальные (подводные)
ландшафты — образуются на дне водоемов и представляют
собой зону аккумуляции вещества.
М. А. Глазовская дает более подробную
классификацию элементарных ландшафтов, выделяя четыре
подтипа элювиальных ландшафтов (собственно
элювиальные, трансэлювиальные,
трансэлювиально-аккумулятивные и элювиально-аккумулятивные). Супераквальные и
субаквальные ландшафты она подразделяет на две
группы — ландшафты проточных вод и стоячих вод.
Парагенетическая ассоциация элементарных
ландшафтов (элювиальных, супераквальных и аквальных),
которые сопряжены в пределах той или иной
территории, по определению А. И. Перельмана, образует
геохимический ландшафт. Отдельные компоненты
и элементарные ландшафты связаны в геохимическом
ландшафте миграционными потоками вещества. За
основу классификации принимается миграция
химических элементов в элювиальных
ландшафтах, по отношению к которым супераквальные
ландшафты рассматриваются как подчиненные.
А. И. Перельманом подробно разработана
геохимическая классификация ландшафтов, основные
таксономические единицы которой следующие:
Таксономическая единица Критерии Для выделения
Ряд ландшафтов Форма движения материи
(физическая, химическая, биологическая), с
которой связана миграция элементов
в ландшафте
Группа ландшафтов Биологический круговорот
воздушных мигрантов: соотношение между
общей массой живого вещества и
ежегодной продукцией, типы
организмов, осуществляющих круговорот
Тип ландшафтов Биологический круговорот
воздушных мигрантов: ежегодная
продукция живого вещества, скорость
разложения остатков организмов
Семейство ландшаф- Продукция живого вещества в пре-
тов делах типа
Класс ландшафтов Типоморфные элементы и ионы
водной миграции
Род ландшафтов Интенсивность водообмена и
механической миграции
Вид ландшафтов Второстепенные особенности
миграции (подлежат уточнению)
173 Легкорастворимые соли в почвах
В соответствии с этой классификацией А. И. Перель^
ман подразделяет ландшафты на два основных ряда:
абиогенные — главную роль играют процессы
физического, механического и химического
выветривания;
биогенные — в них миграция элементов во
многом определяется биологическим круговоротом веществ.
Далее в зависимости от условий круговорота
элементов выделены четыре группы ландшафтов: 1) лесные;
2) луговые и степные; 3) тундровые—биогенные; 4)
примитивно-пустынные — абиогенные.
Типы ландшафтов выделяют на основе особенностей
растительного покрова; семейства — по определенным
сочетаниям растительности и почв; классы — по
доминирующим типoмqpфным элементам водной миграции
(Н-класс, Са-класс и т. д.); роды — на основе
особенностей механической миграции элементов и
интенсивности водообмена, то есть с учетом рельефа местности;
виды —по условиям и особенностям миграции
химических элементов, и чаще всего связаны с конкретными
свойствами горных пород.
М. А. Глазовская придает почвам как компоненту
ландшафта большое значение, считая, что «почва — это
один из самых информативных блоков ландшафтно-
геохимической системы, в котором встречаются и
взаимодействуют потоки вещества и энергии, связывающие
все компоненты ландшафта в единое целое».
В настоящее время на самом высоком
таксономическом уровне выделяют техногенные ландшафты. К
техногенным ландшафтам относят такие, в которых
биологический круговорот элементов в значительной
степени нарушен, а определяющий вид миграции
—техногенная (социальная). При дальнейшем делении
техногенных ландшафтов на более низкие таксономические
единицы используют в основном те же принципы и
критерии, что и при классификации природных ландшафтов
(СхМ. также Техногенный ландшафт).
ЛЕГКОРАСТВОРИМЫЕ СОЛИ В ПОЧВАХ.
Группа соединений, относящихся к классам хлоридов,
нитратов, сульфатов и карбонатов и характеризующихся
высокой растворимостью в воде — более 2 г/л. Наиболее
широко распространены в почвах следующие минералы
Легкорастворимые соли в почвах 174
и группы легкорастворимых солей: галит NaCl,
мирабилит Na2SO4-10H2O, тенардит Na2S04, эпсомит MgS04X
Х7Н20, гексагидрит MgS04-6H20, астраханит
Na2Mg(S04)2-4H20, нахколит NaHC03, трона
Ыа3СОзНСОа-2Н20, сода Na2C03- 10H2O. Эти минералы
в разных количествах и пропорциях содержатся в
засоленных почвах. В солончаках они накапливаются на
поверхности почвы, в автоморфных, полугидроморфных
и гидроморфных солонцах — соответственно в нижней,
средней и верхней частях профиля (см. Засоление почв).
Общее содержание легкорастворимых солей в
почвах и количество отдельных катионов и анионов
оценивают по данным анализа водной вытяжки,
минералогический состав этих солей определяют методами
рентгеновского фазового анализа и термического анализа
препарированных образцов солевых аккумуляций. Об
общем количестве солей в почвах судят по удельной
электропроводности жидкой фазы почвы или по величине
плотного остатка.
Суммарное содержание солей в почвенном растворе
(плотный остаток, мг-л-1) связано с
электропроводностью (ЭП, мСм/см) эмпирической формулой
Плотный остаток=0,64 ЭП.
Присутствие в почвах легкорастворимых солей
неблагоприятно влияет на рост и развитие растений.
Большая часть зерновых культур снижает урожайность
при электропроводности, составляющей 4—6 мСм/см.
Для овощных культур и плодовых деревьев эти
величины еще ниже— 1—2 мСм/см.
Отрицательный эффект влияния легкорастворимых
солей на растения связан с совокупным действием трех
различных механизмов.
Преобладающую роль играет обычно высокое
осмотическое давление почвенного раствора, возникающее
из-за содержания растворенных солей и приводящее к
плохой усваиваемости влаги растениями. Поэтому
растения в засоленных почвах часто страдают от засухи
даже при высокой влажности почвы.
Еще один фактор, препятствующий нормальному
росту растений,— специфическое воздействие ионов С1~,
S042- НСО3-, Na+ Са2+, Mg2+, иногда N03- и К+. Ког-
175 Лессиваж
да в листьях накапливается более 0,5% С1 или
более 0,2 % Na (в расчете на сухую массу), то происходит
обгорание листьев, они приобретают бронзовую
окраску, возникают некрозы. Предполагается, что при
высокой концентрации в растворе ионов Na+ и С1~ в расте-
йиях нарушается процесс транспирации. Наиболее
чувствительные к хлору растения проявляют признаки
угнетения при концентрации С1~ в вытяжке из насыщенной
почвы, составляющей 5—10 мг-экв/л, наименее
чувствительные— при концентрации выше 30 мг-экв/л.
Высокая концентрация в почвенном растворе солей Са2+
приводит к нарушению питания растений катионами
Mg2+ и К+. Высокое содержание в растворе натрия
ухудшает условия питания растений кальцием и
магнием, а присутствие в почвах соды обусловливает
щелочную реакцию среды, что препятствует
нормальному развитию большинства сельскохозяйственных
культур.
Еще один механизм неблагоприятного воздействия
легкорастворимых солей на растения заключается в
резком ухудшении физических свойств почв в присутствии
катионов натрия. При этом почва теряет структуру,
ухудшается ее водный и воздушный режимы.
Основной мелиоративный прием, направленный на
повышение продуктивности засоленных почв, —
промывки водой, приводящие при наличии дренажа к удалению
из почвенного профиля легкорастворимых солей.
Особенно плохо поддаются мелиорации почвы содового
засоления, не содержащие гипса, так как они имеют
плохую водопроницаемость. Для повышения урожайности
сельскохозяйственных культур в этих случаях
необходим подбор солеустойчивых видов растений.
ЛЕССИВАЖ. Перенос по почвенному профилю
илистой фракции (илистых частиц) без химического
разрушения компонентов (см. Илистая фракция почв),
Лессиваж приводит к текстурной дифференциации
почвенного профиля, вызывает уплотнение и заиливание
глубоких горизонтов. В процессе лессиважа возможно
перемещение в почве загрязняющих веществ,
представленных высокодисперсными частицами, например, пыли,
оксидов различных металлов и др.
Лизиметрические воды 176
ЛИЗИМЕТРИЧЕСКИЕ ВОДЫ. Воды (раствор),
профильтровавшиеся через почву и собранные в
специальных устройствах-лизиметрах.
При снеготаянии, выпадении дождей, поливе
почвенная влага передвигается под действием силы
тяжести, что приводит к миграции химических веществ по
почвенному профилю (см. Миграция химических
соединений). Состав лизиметрических вод зависит от состава
твердых фаз той части почвенного профиля, через
которую был профильтрован раствор, а также от степени
антропогенного воздействия (промышленное
загрязнение, применение минеральных удобрений, пестицидов
и т. д.) на конкретной территории.
Лизиметры для сбора вод устанавливают обычно на
уровне границ почвенного профиля или отдельных
почвенных горизонтов. Лизиметрические воды содержат
органические и минеральные вещества. В этих водах
определяют минерализованность, содержание металлов,
кислотность или щелочность, количество
водорастворимых органических веществ. Для выражения результатов
анализа используют следующие единицы измерения:
мг/л, мг-экв/л, моль/л.
В техногенной зоне химический состав
лизиметрических вод существенно отличается от вод фоновых
территорий. Например, в лизиметрических водах
техногенных почв Приморья отмечено снижение рН вод с 5,2—6,7
до 4,3—5,1, изменение состава вод от карбонатно-каль-
циевых к сульфатно-кальциевым, от 3—5-кратного
до 100—1000-кратного превышения над фоновым
содержания в водах Pb, Co, Cu, Zn.
ЛИПИДЫ ПОЧВЕННЫЕ. Большая группа
органических соединений, входящих в состав органического
вещества почвы. Термин «липиды» нельзя пока считать
установившимся, обычно под этой группой веществ
понимают органические соединения, извлекаемые из почв
действием органических растворителей. В качестве
растворителей, как правило, применяют спирто-бензольную
смесь в отношении 1:1. Новейшие исследования
позволяют рекомендовать более рациональный состав смеси
спирт : бензол, равный 1 : 2.
Для веществ, извлекаемых спирто-бензольной смесью,
использовали различные наименования; в разное время
177 Л ихеноиндикация
их называли жирами, битумами, воско-смолами.
Наиболее правильно эти вещества называть липидами, под
которыми в биохимии понимают группу соединений,
извлекаемых из органических тканей органическими
растворителями. В связи с этим Д. С. Орлов предложил
новый термин для рассматриваемой группы веществ —
орсолиды.
В группу липидов входят преимущественно жиры,
воска и смолы, но при экстракции липидов в их состав
могут также попадать некоторые гуминовые вещества,
в частности гиматомелановые кислоты (см. Гумус) и
многие неспедифические соединения нелипидной
природы, в том числе простые аминокислоты, аминосахара,
низкомолекулярные жирные кислоты и др. Поэтому сам
термин недостаточно ясно определяет состав веществ,
входящих в группу липидов.
Экстракцию липидов из почвы обычно проводят в
аппаратах Сокслетта или Греффе, а при последующей
характеристике снимают спектры поглощения в видимой
и ультрафиолетовой областях (при наличии максимумов
около 660 нм рассчитывают содержание хлорофилла),
снимают также инфракрасные спектры липидов на
пластинах КВг в тонком слое, определяют элементный
состав этих веществ, а также кислотное, йодное и эфирное
число.
Указанных показателей обычно бывает достаточно
для полной характеристики состава и свойств липидной
фракции. В эту фракцию могут входить многие
физиологически активные вещества — как стимуляторы, так
и ингибиторы физиологических процессов. Из-за
недостаточной изученности проблемы весьма затруднительно
дать однозначное определение положительного или
негативного влияния компонентов липидной фракции на
почвенные, биохимические и физиологические процессы,
а также их воздействия на токсико-экологическую
ситуацию в ландшафте.
ЛИХЕНОИНДИКАЦИЯ. Вид биоиндикационных
исследований, который заключается в изучении в качестве
биоиндикатора лишайников (см. Биоиндикация).
Лишайники крайне чувствительны к повышению
кислотности и загрязнению окружающей среды. Для
многих техногенных ландшафтов (см. Техногенный ланд-
12 Заказ 5937
Марганец в почвах 178
шафт) характерна интенсивная делихенизация,
или деградация лишайников. Например, в Канаде лй-
хеноиндикацию используют для оценки загрязнения
окружающей среды более чем 30 химическими
элементами. В Австрии существует специальная сеть лихено-
индикации, предусматривающая контроль за состоянием
лишайников.
Очень чувствительны к загрязнению атмосферы так
называемые бородатые лишайники. Лишайники растут
на субстрате, сохраняющемся после их гибели, и
способны накапливать в своих телах значительное
количество поллютантов (см. Загрязняющие вещества),
м
МАРГАНЕЦ В ПОЧВАХ. Химический элемент,
обязательно присутствующий в почвах и живых организмах.
Марганец участвует в важнейших химических
реакциях: окисления-восстановления, фотосинтеза, дыхания,
белкового и углеводного обмена, образования
ферментов и витаминов, поэтому живые организмы очень
чувствительны к уровню его содержания и страдают при
недостатке этого элемента или при избыточном его
поступлении, связанном с загрязнением почвы.
Среднее содержание марганца в почвах составляв
ет 850 мг/кг. В породообразующих минералах (биотит,
роговая обманка, амфиболы) он находится в форме
Мп2+. Освобождающийся при выветривании марганец
выпадает в форме вторичных оксидов и гидроксидов,
в составе которых чаще всего элемент присутствует в
форме Мп4+. Наиболее распространены пиролюзит МпОг,
манганит МпООН, гаусманит Мп304, браунит МпзОз,
родохрозит МпСОз, а также разнообразные соединения
сложного состава.
Соотношение между соединениями марганца
различной окисленности и гидратированности неустойчиво, за^
висит от влажности почвы, воздушного режима,
микробиологической деятельности, кислотно-основных
условий, что определяет сезонную динамику элемента в
почвах.
179 Межпакетная сорбция веществ
Содержание марганца в природных водах
колеблется от сотых долей до 1—2 мг/л. В почвенном растворе
марганец находится в форме свободных ионов, ассоциа-
тов, аква- и гидроксокомплексов, комплексов с
органическими и неорганическими лигандами (см.
Комплексные соединения).
На трансформацию соединений марганца влияют
микродрганизмы. Предполагается, что они инициируют
образование конкреций в почвах и донных отложениях,
в составе которых сосредоточены основные запасы
марганца.
Наиболее подвижен этот элемент в кислых почвах
с промывным режимом. Задерживается он в тех зонах
ландшафта (см.), где действуют кислородный и
щелочной геохимические барьеры (см. Барьеры
геохимические) и где элемент образует осадки оксидов и гидро-
ксидов, а также в почвенных горизонтах тяжелого
гранулометрического состава и богатых органическим
веществом в результате процессов сорбции (см.
Сорбция химических веществ почвой).
Определение подвижных соединений марганца
обычно проводят в вытяжках, где в качестве экстрагентов
используют растворы разбавленных кислот (0,1 н. H2S04,
1 н. НС1). Вредные для растений уровни подвижного
марганца образуются в сильнокислых почвах. Из
образцов луговых, тундровых почв с рН<5,5 в кислотные
вытяжки переходит до 600—800 мг марганца на 1 кг.
В аналогичных условиях приобретает подвижность
марганец антропогенного происхождения (зола углей,
осадки сточных вод, отходы предприятий цветной
металлургии). Для снижения токсичного действия марганца в
кислых почвах эффективно известкование.
МАССОВАЯ ДОЛЯ ЗАГРЯЗНЯЮЩЕГО ПОЧВУ
ХИМИЧЕСКОГО ВЕЩЕСТВА. Отношение массы
загрязняющего почву химического вещества (см.) к
общей массе воздушно-сухой или абсолютно-сухой пробы
почвы.
МЕЖПАКЕТНАЯ СОРБЦИЯ ВЕЩЕСТВ. Обрати-
мое или необратимое поглощение различных соединений
в межпакетных промежутках HeKOTqpux глинистых
минералов.
12*
Методы фракционирования соединений железа 180
Из-за особенностей строения кристаллической
решетки наибольшей способностью к межпакетной
сорбции веществ обладают монтмориллониты и
вермикулиты (см. Глинистые минералы, Монтмориллониты,
Вермикулиты). В межпакетные промежутки могут входить
катионы, молекулы воды и некоторых органических
соединений. Из загрязняющих веществ путем
межпакетной сорбции может быть поглощена большая часть
тяжелых металлов, присутствующих в почвах в катион-
ной форме (Zn2+, Cd2+ Pb2*, Ni2+, Cu2+ и др.), и неко-
Tqpbie пестициды, особенно в тех случаях, когда они
превращаются в катионы при протонировании.
МЕТОДЫ ФРАКЦИОНИРОВАНИЯ
СОЕДИНЕНИЙ ЖЕЛЕЗА. Система экстракции железа из почв
в целях условного выделения силикатных и свободных
несиликатных соединений и разделения последних на
две фракции: предположительно находящихся в
аморфном и кристаллическом состоянии.
Цитрат-дитионитовая вытяжка Мера — Джексона
переводит в раствор, по-видимому, несиликатные
свободные соединения железа. Разность между общим
содержанием железа и извлекаемым цитрат-дитионитовой
вытяжкой характеризует содержание железа в составе,
феррисиликатов. Оксалатная вытяжка Тамма
предположительно растворяет аморфные гидроксиды железа.
Разность между содержанием железа в
цитрат-дитионитовой и оксалатной вытяжках, вероятно, показывает
количество свободных кристаллических соединений
железа.
Цитра т-'д итионитовую вытяжку Мера —\
Джексона получают многократной (2—5 раз)
обработкой почвы смесью 0,3 М раствора цитрата натрия, 1 М
раствора гидрокарбоната натрия при добавлении
гидросульфита (дитионита) натрия. В результате железо
восстанавливается и связывается в цитратный комплекс:
Fe (ОН) з+iNa3C6H507 + Na2S204 + NaHC03 —+
—^/Na2S04 + Fe2C6H507 + C02 + H20
Обработку почвы повторяют до исчезновения бурой
окраски и получения остатка серого цвета.
Оксалатную вытяжку Тамма получают
двукратной обработкой почвы смесью 0,25 М pacTBqpa ща-
1S1 Миграция химических соединений
велевой кислоты и 0,5 М раствора оксалата аммония
(рН 3,2), отношение почва: раствор 1:50. Реакция
основана на растворении соединений железа в условиях
слабокислой реакции, восстановлении его и связывании
в цитратный комплекс:
Fe(OH)^+(iNH4)2C204 + H2C204—^О02 + Н20+
+ CN.H4)8 ( I ^)Fe
LV0 = C—О J J
В вытяжку Мера — Джексона переходит в разных
почвах 10—90 % общего запаса железа, в вытяжку Там-
ма — 2—30 % валового и 30—80 % несиликатных
соединений железа.
Соотношение экстрагируемых количеств железа и
характер распределения их по почвенному профилю имеет
диагностическое значение. По С. В. Зонну, почвы, из
которых вытяжка Мера — Джексона извлекает 54—90 °/о
общего количества железа, относятся к сиаллит-
н ы м, 17—56 % — к ф ер р а л л и т н ы м, среднее
содержание характерно для феррсиаллитных почв.
Имеется опыт использования этих вытяжек для
фракционирования соединений металлов почв естественных
и техногенных ландшафтов (см. Ландшафт),
предположительно связанных со свободными соединениями
железа. Последние играют роль активных сорбентов кати-
оногенных и анионогенных загрязняющих веществ, что
ограничивает миграцию их в почвенном профиле и
ландшафте. Поступающие из естественных и
антропогенных источников железо и другие металлы
перераспределяются по почвенному профилю под влиянием
окислительно-восстановительных процессов,
элювиальной миграции и сегрегации, биохимической
аккумуляции, в результате которых формируются геохимические
барьеры (см. Барьеры геохимические), содержание в
которых Pb, Cd, Zn, Co, Ni, Сг, как правило, повышено.
МИГРАЦИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ.
Перемещение, перераспределение химических элементов в:
земной коре и на ее поверхности. Термин введен
А. Е. Ферсманом.
Интенсивность и направление миграции химических
элементов зависят как от особенностей ионов, формы,
Миграция химических соединений 182
в которой присутствует элемент, его химических свойств
(внутренние факторы миграции), так и от
физико-химических и биологических условий миграции (щелочно-
кислотные и окислительно-восстановительные условия,
водный режим, температура, давление, влияние
жизнедеятельности растений и других организмов).
Внутренние факторы миграции
Электростатические свойства ионов. Эту группу
-факторов следует учитывать только при миграции
элементов в виде ионов. Ионная миграция различных
элементов характерна для водных растворов,
магматических расплавов, газовых смесей, живого вещества.
Электростатические свойства ионов во многом
обусловлены размерами ионных радиусов элементов: с
увеличением радиуса иона обычно возрастает дальность
миграции. Показателями электростатических свойств
ионов служат ионный потенциал Картледжа и
энергетические коэффициенты ионов.
Ионный потенциал Картледжа
рассчитывают по формуле
W
lORi9
тде №—валентность иона; R{ — радиус иона, нм.
По этому показателю химические элементы делятся
«а три группы;
1 — потенциал Картледжа ниже 3. Элементы с
такими значениями потенциала обычно легко переходят
в природные воды из твердых фаз в виде ионов и не
образуют комплексных соединений, например: К, Na,
-Са, Li, Rb, Cs, Ba;
2— потенциал Картледжа от 3 до 12. Как правило,
элементы с такими потенциалами образуют труднораст-
гворимые гидролизованные соединения. К элементам
этой группы относятся Fe, Al, Zr, V, Сг и др.;
3 —потенциал Картледжа более 12. Элементы,
имеющие указанный ионный потенциал, соединяясь с
кислородом, образуют комплексные растворимые ионы. В эту
группу входят В, С, N, P, S.
183 Миграция химических соединений
Кремний и молибден попадают в пограничную групт
пу, у них ионный потенциал составляет от 9,5 до 12.
Ионные потенциалы позволяют предсказать
изменение состояния элементов при химическом выветривании
и, следовательно, оценить их концентрацию или
рассеяние в продуктах выветривания. Между значениями
ионных потенциалов и подвижностью элементов имеется
прямая зависимость.
Энергетические коэффициенты ионов
(ЭК) определяют по формулам
ЭКкат=—^-0,75(10^+0,20);
20а г
W2
ЭКан = ——Г
20#г
Энергетические коэффициенты отражают
последовательность кристаллизации минералов из растворов и
расплавов и обусловлены в основном энергией их
кристаллических решеток. Ионы с большими значениями
ЭК раньше выпадают из растворов. В процессах
выветривания они, как менее подвижные, накапливаются в
элювии.
Форма, в которой присутствует элемент, химические
свойства соединений. Металлы в земной коре и на ее
поверхности могут в виде карбонатов, оксидов,
сульфатов, сульфидов и т. д. На земной поверхности
кислородные соединения металлов более устойчивы, чем
сульфиды.
Таким образом, на миграцию элементов влияют
многочисленные условия, и доминирующий фактор выявить
сложно.
Внешние факторы миграции
Температура. С повышением температуры увели^
чивается миграционная способность элементов, нахо-^
дящихся в.расплавах и растворах, повышается скорость
протекания химических реакций.
Давление. Это фактор, который необходимо
учитывать при рассмотрении гидротермальных,
магматических и метаморфических процессов. В пределах био-
Миграция химических соединений 184
сферы и почв давление существенного влияния не
оказывает в связи с тем, что резкого и значительного его
изменения в этих сферах не происходит.
Степень электролитической диссоциации.
Характеризует количество ионов, образовавшихся при
растворении веществ. Показателем степени диссоциации
служит константа диссоциации вещества, которая зависит
от природы растворенного вещества и растворителя.
Степенью электролитической диссоциации определяется
последовательность выпадения вещества в осадок.
Концентрация водородных ионов, или
кислотно-основные условия среды. Оказывают значительное
влияние на водную миграцию элементов в зоне гипергенеза.
Этот фактор контролирует осаждение из растворов
многих труднорастворимых соединений, коагуляцию
коллоидов, влияет на поступление элементов в растения и на
подвижность многих металлов.
Ниже приведены значения рН осаждения гидрокси-
дов некоторых элементов из разбавленных
(концентрация 0,025—0,0025 М) растворов (по В. А. Алексе-
енко):
Fe3+ 2,0 А13+ 4,1 Cd2+ 6,7 Рг3+ 7,1
2г4+
Sn2+
Се4+
Hg+
1п3+
Th4+
2,0
2,0
2,7
3,0
3,4
3,5
U6+
Сг3+
Си2+
Fe2+
Ве2+
РЬз+
4,2
5,3
5,3
5,5
5,7
6,0
Ni2+
Со2+
уз+
Sm3+
Zn2+
Nd3+
6,7
6,8
6,8
6,8
7,0
7,0
ВД+
Ce3+
La3+
Ag+
Mn2+
Mg2+
7,3
7,4
8,4
7,5-8,0
8,5-8,8
10,5
Окислительно-восстановительные условия. Эти
условия во многом влияют на миграцию элементов.
Важнейший окислитель в почвенной среде — кислород, а
также другие элементы и соединения, способные
принимать электроны, — трехвалентное железо,
четырехвалентный марганец, вода и др. К восстановителям
относятся двухвалентная сера, двухвалентное железо,
органические вещества, газообразный водород.
В бескислородной глеевой обстановке увеличивается
миграционная способность катионогенных и
уменьшается миграция анионогенных элементов, ускоряется
разложение алюмосиликатной части почв. В
восстановительной cepoBOAqpoAHofl обстановке сероводород всту-
185 Миграция химических соединение
пает в реакции со многими металлами, вызывая их
осаждение из раствора.
Жизнедеятельность организмов (биогенный фактор).
В зоне гипергенеза этот фактор — один из важнейших.
Включение элементов питания растений в
биологический круговорот способствует перераспределению и
аккумуляции в верхнем гумусовом горизонте почв многих
веществ. В результате жизнедеятельности организмов из
химических соединений выделяются кислород, азот„
диоксид углерода, образуются органические кислоты,
способствующие усилению миграции многих химических
элементов.
Коллоиды. Особую роль играют при водной
миграции веществ. Миграция в коллоидной форме
характерна для гумуса (см.), соединений кремния, алюминия
(см. Аллофаны), железа, марганца (см. Железо в
почвах, Марганец в почвах), циркония, олова, титана,
ванадия, хрома, никеля и многих других элементов.
Большое значение имеет миграция элементов в
коллоидной форме в почвах, обладающих большим
количеством коллоидов разной химической природы (см. Кол-
лоиды почвенные). Одна из важнейших особенностей
процесса сорбции на коллоидах — селективность. Состав
cqp6nipyeMbix веществ во многом определяется зарядом
сорбентов, а также другими химическими законами.
Преимущественно сорбируются ионы, имеющие с
сорбентом общую атомную группировку (правило
Пескова— Фаянса); лучше сорбируются поливалентные, чем
одновалентные ионы, а среди одновалентных — те, чей
радиус больше.
К сорбентам почвенного происхождения (см.
Сорбция химических веществ почвой) относятся гумусовые
вещества, оксиды и гидроксиды железа, алюминия,
марганца, кремнезема, вторичные глинистые минералы почв
(монтмориллонит, каолинит и др.).
Виды миграции
А. И. Перельман выделил следующие виды
миграции химических элементов.
Механическая миграция. Наиболее простой вид
миграции, подчиняющийся законам механики и за-
Миграция химических соединений - 186
висящий от величины частиц, их плотности, скорости
движения вод, ветра и т, д. Вещество при этом
передвигается в твердой фазе.
Физико-химическая миграция. Подчиняется
законам физики и химии и обусловливается такими
процессами, как диффузия, растворение, осаждение,
сорбция, десорбция и др. Подразделяется на ионную
миграцию и миграцию в коллоидной форме. В первом
случае передвижение происходит в ионной форме, во
втором — в сорбированном виде на коллоидных
частицах или в виде самих коллоидных частиц.
Биогенная миграция. Одна из наиболее
сложных форм миграции, обусловленная совокупной
жизнедеятельностью живых организмов.
Техногенная миграция. Связана с
происходящими социальными процессами. Она определяется
видом техногенного загрязнения — промышленного,
сельскохозяйственного, транспортного и т. д.
Общая миграция химических загрязняющих веществ
в почвах и ландшафтах обусловлена комплексом
различных видов миграций.
Интенсивность миграции
и классификация элементов
по особенностям миграции
Интенсивность миграции, по А. И. Перель-
ману, выражается скоростью перехода в подвижное
состояние одного грамма вещества данного элемента:
где Рх — интенсивность миграции; Вх — число атомов, перешед-
dBx
ших в подвижное состояние; . — число атомов элемента, пере-
dt
шедшего в подвижное состояние за время dt.
Чем больше величина Вх, тем меньше интенсивность
миграции. Величина Вх зависит от кларка элемента.
При сходных химических свойствах элемент с меньшим
кларком мигрирует интенсивнее.
Ниже приведена схема геохимической
классификации элементов по особенностям их миграции в
ландшафтах (по А. И. Перельману)» .
187 Миграция химических соединений?
Воздушные мигранты
АКТИВНЫЕ .... ПАССИВНЫЕ
(образуют химические соеди- (не образуют химических со-
нения) единений)
(О) (Н) (С) (N) (I) (Ar) (He) (Ne) (Кг) (Хе) (Rn)
Водные мигранты
Катионогенные элементы Анионогенные элементы
Очень подвижные (Кх Юп—100л)
с постоянной валентностью*
(U)(Br)
с переменной валентностью*
(S)
Подвижные с переменной валентностью (Кх0,п—
10я)
Слабоподвижные (Кх 0,п—п)
с постоянной валентностью
(K)(Ba)(Rb)(Li)(Be)(Cs) (Si) (P)
с переменной валентностью
(Ge) (Sn) (Sb) (As)
Подвижные и слабоподвижные в окислительной
обстановке (Кх 0,я—п) и инертные в
восстановительной сероводородной обстановке (Кх<0,п)г
осаждаются на сероводородном барьере
Хорошо мигрируют в кислых водах,
окислительной и глеевой обстановок и
осаждаются на щелочном барьере
(Zn) (Cn) [Ni].[Pb][Cd]
Мигрируют в кислых и щелочных
водах окислительной обстановки
„ [Hg] [Ag]
Подвижные и слабоподвижные в окислительной'
обстановке (Кх 0,п—п), инертные в
восстановительных (глеевой и сероводородной) обстановка х,
осаждаются на сероводородных и глеевых
барьерах vj
(V)(Mo)(Se)[UHRe]
Малоподвижные в большинстве обстановок
(КхО,п—0,0 п и менее)
Слабая миграция с органиче- Слабая миграция с
органическими комплексами. Частично скими комплексами. Частично*
мигрируют мигрируют
В сильнокислой среде В щелочной среде
"п rrrl гм — Гг— " - [Ztf] [Nb] [Та] [W1 ГНе] [Те]
Минерализованное™ природных вод 188
Не образуют или почти не образуют химических
соединений. Характерно самородное состояние
[Os] [Pd] [Ru] [Pt] (Au) [Rh]'[Zr]
() Биогенное накопление играет существенную роль в истории
элемента
{] Биогенное накопление отсутствует или не существует
Кх — коэффициент водной миграции
МИНЕРАЛИЗОВАННОСТЬ ПРИРОДНЫХ ВОД
(засоленность). Степень обогащения вод различного
происхождения минеральными компонентами,
преимущественно солями.
При нарастании минерализованности вод
изменяется и качественный состав солей. По В. А. Ковде,
существует несколько стадий минерализованности вод,
различающихся как составом, так и содержанием солей:
Воды по стадиям минерализации
Пресные силикатные
Пресные гидрокарбонатно-натриевые
Гидрокарбонатно-натриевые
То же, но при накоплении сульфатов,
хлоридов
Хлоридно-сульфатные
Сульфатно-хлоридные
Концентрация
солей, г/л
Менее 0,1
0,2—0,3
0,5—0,7
0,5—3,0
2,5—5,0
10—15
и выше
В мелиоративных целях часто различают и
используют следующие градации: пресные воды —менее 1 г/л,
солоноватые—1—25 и соленые — выше 25 г/л. Для
характеристики вод употребляют термин
«минерализация», который означает процесс накопления солей (а не
их содержание) или разложение органических
компонентов до минеральных солей.
МОБИЛИЗАЦИЯ ПИТАТЕЛЬНЫХ ЭЛЕМЕНТОВ.
Естественная или антропогенная трансформация труд-
HopacTBqpHMbix или недоступных растениям соединений
питательных элементов в более простые или
легкодоступные. Происходит, как правило, в результате
деятельности микроорганизмов, частично путем химических
реакций окисления и гидролиза. Мобилизация играет
важную роль в оптимизации питания культурных
растений, однако искусственная несбалансированная
мобилизация неизбежно приводит к разрушению
органических веществ почвы, потере гумуса £cwu)f разломе-
189 Мониторинг
нию почвенного поглощающего комплекса (см.), что
влечет за собой деградацию почв (см.) и потерю
почвенного плодородия. Принципиально допустима лишь
частичная мобилизация питательных элементов только в
некоторых почвах, например, избыточно обогащенных
органическим веществом. При разработке любых
приемов мобилизации обязательным требованием должно
быть обеспечение сохранности почв и почвенного
покрова.
МОНИТОРИНГ (от лат. monitor —
предупреждающий, предостерегающий). Система длительных
регулярных наблюдений в пространстве и времени, дающая
информацию об окружающей среде (см.) с целью
оценки настоящего ее состояния и прогноза изменения в
будущем.
Мониторинг не включает управление. Цель
мониторинга— выявление и прогноз антропогенных изменений
природной среды, оценка степени нарушений в
биосфере и их источников.
Различают мониторинг локальный, региональный и
фоновый (см. Мониторинг фоновый).
При локальном (синонимы импактный,
биоэкологический) мониторинге предполагается
контроль за содержанием токсичных для человека
химических веществ в атмосфере, природных водах,
растительности, почве, подверженных воздействию
конкретных источников загрязнения (промышленные
предприятия, стройка, рудник, мелиоративная система,
предприятие энзргетики и т. д.). При этом выявляют
источник загрязнения (см.) и степень загрязнения природных
сред. При локальном мониторинге состояние
окружающей среды оценивают с точки зрения здоровья
человека, что служит самым важным, емким и комплексным
показателем состояния окружающей среды. Проводят
локальный мониторинг природоохранные службы.
Региональный (синонимы
геоэкологический, геосистемный, п риродн
©-хозяйственны й) мониторинг должен давать оценку
антропогенного влияния на природную рреду в ходе
обычной хозяйственной деятельности человека, которая
обязательно предполагает тот или иной вид
взаимодействия с природой (градостроительство^ сельское хозяй-
Мониторинг 190
ство, промышленность, энергетика, лесное хозяйство,
рыбоводство, коммунально-бытовая деятельность и т. д.)-
При региональном мониторинге оценивают
взаимодействие человека и природы во всех проявлениях, дают
характеристику общего нарушения природной среды,
привноса и выноса из природных систем вещества и
энергии. Региональный мониторинг проводят агрослуж-
ба, гидроклиматическая, лесоустроительная,
сейсмологическая и другие службы.
Мониторинг фоновый предполагает контроль
за общепланетарными изменениями в биосфере,
которые связаны с деятельностью человека.
Уже сейчас негативное влияние на живые
организмы оказывают изменение климата вследствие всех
видов хозяйственной деятельности человека; нарушение
озонового слоя в результате поступления в атмосферу
оксидов азота и фреонов, разрушающих озон;
загрязнение мирового океана нефтепродуктами.
Особый уровень в системе мониторинга занимает
национальная система наблюдений, так как на этом
уровне чаще всего принимают и реализуют решения об
охране окружающей среды (см.).
Для всех сред наибольшую опасность представляют
следующие химические вещества:
диоксид серы, поступающий в атмосферу, а далее
с осадками в водоемы и почвы в форме сульфатов и
серной кислоты;
тяжелые металлы (см.), прежде всего Pb, Cd, Hg,
способные к миграции в ландшафте, к трансформации
в высокотоксичные соединения и биологическому
поглощению;
нефтепродукты, медленно разлагающиеся в
экосистеме (см. Загрязнение нефтью и нефтепродуктами);
пестициды, особенно хлорорганические (см.
Загрязнение пестицидами).
Система мониторинга носит комплексный характер,
так как компоненты биосферы невозможно
рассматривать в отрыве друг от друга. Почвенному мониторингу
в ней принадлежит особенно важная роль. Почва
представляет собой звено геологического и биологического
круговорота химических веществ, в котором эти
вещества накапливаются, защищая атмосферу и гидросферу.
191
Мониторинг
I
Я
s£
«о
о .
flu
«>;
о s
t- о
2 * '
Я О
о л
М Ч
2> о
S в
с о
3S о,
ою
as
§«
1°
О с
до
9 5Г
4 °
Я я
Я о
5 «
Я а)
Я Н
о ез
О 2
о* >»
О) О.
Н Я
о я
о
х 5
Э *
Я о
S S,
о
fcf И
о л
X Ч
о <i>
о я
Л Ч
ч ч:
° 5
о о,
о
я £
я S
о Я
Я Л
ф Ю
н о
Я m
Я Л
a 2
я
я
2 **
2 °
я я
3 о
Я S
о >>
х о,
СЗ Я
я 2 я
В £, §
Я- «в
S >Я ?
О Я я
О- о)
2 *
£ я
Я о
£< w
о«
О) ы.
я 2
5 »я
ч О)
о
я
о
»я о
я я
Он Я
О О)
н п
я н
л а
л 85
а> я
н со
s
з
я
:цит
я
•&
ф
Ч
о
я
о
я
о
я
я
о
я
еме:
ч
СГ)
X
Я
3
»я
а>
я
я
Л
•=5
U
I
*§
о
я
Л я
fa °
2 *s
Ч о
Ю и
а о
Я
Я я
Я я
8|
°< 5
я «
ю
° X
Я
1 в
я я
СО л.
II
2
>я >,
О CQ
М Н
О О
SJ «я
СГ CD
Я Ч
к &
эЯ
о 3
я я
ет S
ч
I э
Он я
н
я я
о н
Л о
я
f 1
Я о
<U я
я
я я
я $
я я
сз а>
Я со
Я Я
к х ™
аГ « Э
а ° 3
S м [Г
я g о
о, •&
о
со
о
я
я
о _
ч о
я S
§ §
я о
я
Он
я
ч:
о.
я
X
3
ч
в
S
о
о«
я
я к
я я п
О СО ^
U 1
£ S м
^ со х
2 з
2 ю я
я я
#« о я
е 2 н
Р о о
я ю 5
^ я w
Я я X
0J О
н м
д s а
я о>
S* « °
§ 2 х
§ § I
я I'
я й я
5 я й
О е 3
с § S
Ч S
о <и
н я
о я
м со
* я
.- о,
Л fa
м сз
2 со
я
О)
Он s
fa Л
° ч
я 5
8§
Si о
Я «s»
я
& 3
со
со
н S
О ф
03
S
||
Ч О со со
о ^ о о
ftM а; 51
н S Л л
я а> *« ^
о я « в
м я vo «
ату-
Оц
а>
с
2
<L>
Н
ти;
о
о
я
ств;
«
о
m
о
ических
1НИЯ
РЗ
Н
Я
я
нтов
а>
2
Он Я
с 2
ч
I g
S ё
сз 5
ч •&
4 2
о я
Он
5 ..
9, 3
« Он
я Л
5 §
Я Ч^
я о
о в
н
° S
:*
Л я
i §
О со
Он О)
S °
S 5
о а>
^§
о л
о о.
я
СЗ
Он
5
ч
Мониторинг фоновый ^^ 192
Однако все изменения в почве неизбежно сказываются
на состоянии растений, животных и человека. Система
комплексного почвенного мониторинга представлена в
таблице.
МОНИТОРИНГ ФОНОВЫЙ (синоним глобальный,
биосферный). Система наблюдений за природными
объектами на фоновых территориях. Цель — выявление
изменений фонового состояния экосистемы в результате
антропогенного воздействия.
Фоновый мониторинг проводят в соответствии с
Глобальной системой мониторинга окружающей среды,
Международной программой «Наблюдения за
планетой», Программой ЮНЕСКО «Человек и биосфера»,
Программой ООН по окружающей среде ЮНЕП,
Программой СЭВ в области комплексного фонового
мониторинга.
Основные задачи фонового MOHHTqpHHra определены
в одном из разделов Международной программы
«Человек и биосфера» и состоят в следующем:
установление взаимосвязи между загрязнением,
структурой и функционированием экосистем, их звеньев,
популяций или отдельных организмов;
определение перечня тех показателей и измерений,
которые необходимы для наблюдения и оценки
существующего состояния экосистемы и прогноза изменения
его в будущем;
анализ путей и скоростей преобразования
загрязняющих веществ в экосистеме;
определение критических уровней показателей
окружающей среды.
Программу работ выполняют на станциях фонового
мониторинга. На территории СССР эти станции
действуют в заповедниках: Березинском, Приокско-террас-
ном, Центральном лесном, Кавказском, Астраханском,
Баргузинском, Сихотэ-Алинском, Сары-Челекском, Чат-
кальском, Репетекском, Кроноцком, Вильсандийском,
Боровое; леднике Абрамова, в пунктах Сыктывкар, Но-
вопятигорск, Туруханск, Курган, Иркутск. Программа,
станций фонового мониторинга предполагает регуляр-
ный пробоотбор и определение следующих показателей:
в атмосфере — взвешенные частицы; мутность; озон;
193 Монтмориллониты
Со2; S02; NO, N02; углеводороды; сульфаты; 3,4-бензпи-
рен;ДДТ;
в атмосферных выпадениях — Pb, Hg, Cd, As,
3,4-бензпирен, рН;
в поверхностных, подземных водах, в донных
отложениях— Pb, Hg, метилртуть, Cd, As, ДДТ,
3,4-бензпирен, биогенные элементы;
в почвах—Pb, Hg, Cd, As, ДДТ, 3,4-бензпирен,
биогенные элементы.
Анализ проб унифицированными методами выполняют
в двух аналитических центрах —в Ленинграде и
Ташкенте. Координирует и обобщает работы по комплексному
фоновому мониторингу Лаборатория мониторинга
природной среды и климата Госкомгидромета СССР.
МОНТМОРИЛЛОНИТЫ (синоним—смектиты).
Широко распространенные в почвах трехслойные ди- и три-
октаэдрические глинистые минералы (см.) с
обобщенной формулой (Ca,Mg,Na)(Al,Mg)2.(OH)2[;(Al,Si)4O10]X
ХяН20.
Монтмориллониты имеют очень высокую
дисперсность (размеры частиц десятые и сотые доли
микрометра) и низкое значение постоянного отрицательного
заряда. Заряд возникает за счет изоморфного замещения
Si на А1 в тетраэдрах (такие минералы называются
бейделлитами) или А1 на Mg в октаэдрах (такие
минералы относят к собственно
монтмориллонитам). Заряд компенсируется катионами,
находящимися в межпакетных промежутках и на поверхности
частиц. Благодаря низкой величине заряда слабые
электростатические притяжения между трехслойным
пакетом и межпакетными катионами не препятствуют
вхождению катионов и других веществ в межпакетные
промежутки, то есть монтмориллониты способны к
межпакетной сорбции материала (см. Межпакетная
сорбция веществ), которую иногда называют межслоевой
сорбцией.
Благодаря малому размеру частиц и способности
к межпакетной сорбции веществ монтмориллониты
имеют очень высокие удельную поверхность—до 600—
700 м2 на 1 г минерала (см. Удельная поверхность
почвы), емкость катионного обмена (см.) — 120—140 мг-экв
на 100 г минерала—'И сильно набухают.
Мышьяк ё почвах 194
Поэтому монтмориллониты — активные сорбенты для
многих загрязняющих веществ. Они поглощают
тяжелые металлы (Cd2+, Co2+, Cu2+ Ni2+, Pb2+, Zn2+) и
радионуклиды (90Sr, 137Cs) в процессе ионного обмена;
пестициды — за счет образования воддродных связей и
действия вандерваальсовых сил.
В почвах СССР минералы монтмориллонитовой
группы и смешанно-слойные минералы с участием монтмо-
риллонитовых пакетов широко распространены на всей
территории европейской части, цроме северо-западных
и западных регионов, и в Западно-Сибирской
низменности. Особенно высокое содержание монтмориллонитов
отмечено в почвах Приуралья, где оно достигает 60—
80 % илистой фракции.
В почвах с текстурно-дифференцированным
профилем (подзолистых, серых лесных, солонцах, солодях,
оподзоленных бурых лесных, оподзоленных черноземах
и др.) илистая фракция верхних горизонтов (см.
Илистая фракция почв) обеднена монтмориллонитами,
потому что они как самые тонкодисперсные и гидрофильные
минералы в первую очередь подвергаются разрушению
и выносу из этих горизонтов.
МЫШЬЯК В ПОЧВАХ. Химический элемент,
отнесенный к группе наиболее опасных для живых
организмов при нахождении его в воздухе, водах, почвах в
повышенных количествах.
В природе известно более 120 минералов,
содержащих мышьяк. Из собственных минералов мышьяка
встречаются оксиды As203; сульфиды: реальгар AsS, аури-
пигмент As2S3, арсенопирит FeAsS, мышьяковый
колчедан FeS2, кобальтовый блеск Со AsS; никелевый
колчедан NiAs2.
Содержание мышьяка в породообразующих
минералах колеблется от 1 мг/кг в амфиболах, пироксенах,
полевых шпатах до 2—16 мг/кг в магнетитах. Среднее
количество этого элемента в кислых изверженных
породах составляет около 2 мг/кг, в средних и
основных — 2—3, в кристаллических и глинистых
сланцах— 2—18 мг/кг. Содержание в почвообразующих
породах колеблется от 2—5 до 8—11 мг/кг; в почвах—-
от 1 до 40 мг/кг. Минеральные соединения мышьяка
представлены арсенатами железа и алюминия, преоб-
195 Мышьяк в почвах
Eh,MB
2 4 6 8 10 12 14
Поля устойчивости ионных форм мышьяка в растворе
ладающими в кислых почвах, и арсенатами кальция,
устойчивыми в нейтральных и щелочных почвах.
Мышьяк входит в состав растительных остатков и
продуктов их разложения. Концентрация элемента в
природных водах составляет 0,1 — 10 мг/л.
Форма мышьяка в растворе зависит от кислотно-
основных и окислительно-восстановительных условий
(рис.). Снижение потенциала (Eh) ведет к увеличению
pacTBqpHMocTH арсенатов. В кислых и нейтральных сла-
боаэрируемых почвах преобладают токсичные арсенит-
ионы. Наибольшее количество их в затопленных
болотных почвах с Eh 25—100 мВ, богатых органическим
веществом. Токсичны и соединения As с органическими
веществами в составе метиларсоновой (СНз) AsO(OH)
и диметиларсоновой (CH3)2AsO(OH) кислот, образова-
13*
Насыщенные основаниями почвы 196
ние которых связано с микробиологической
деятельностью. Грибная микрофлора способствует
возникновению газообразных соединений мышьяка в
восстановительной среде.
Токсичность мышьяка и уровень концентрации его
в растворе могут снижаться в результате выпадения в
осадок солей этого элемента с металлами, а также в
результате сорбции почвенными компонентами. Гидроксид
железа активно поглощает элемент при нейтральных
и слабощелочных условиях, гидроксид алюминия — в
кислых условиях (см. Гидроксиды железа и алюминия).
Арсенат-ионов в аналогичных условиях поглощается
в 3 раза меньше, чем наиболее токсичных арсенит-ионов.
Глинистые минералы (см.) максимально поглощают
мышьяк при рН 5, при повышении и понижении рН
сорбция As (V) уменьшается, As (III) при рН<3 этими
минералами практически не сорбируется. Концентрация
мышьяка в загрязненных почвах может быть повышена
на порядок и более по сравнению с незагрязненными.
Загрязнение почв происходит в зоне воздействия
теплоэлектростанций, предприятий по переработке
полиметаллических сульфидных руд, предприятий
полиграфической, лакокрасочной промышленности. Почвы
сельскохозяйственных угодий загрязняются при удобрении
их суперфосфатом, при обработке посевов овощных
культур, хлопчатника, плодовых насаждений
пестицидами, в состав которых входят Na2As04, Ca(As02b,
CH3AsO (ОН)2, (СН3)2AsO (ОН), Na (CH3) 3AsO (ОН),
(CH3)2As02(ONa).
Частичное самоочищение почв (см.) от мышьяка
происходит за счет его выщелачивания и улетучивания.
н
НАСЫЩЕННЫЕ ОСНОВАНИЯМИ ПОЧВЫ.
Почвы, не содержащие в своем составе обменных водорода
и алюминия.
Обменные катионы (см. Катионы обменные) в таких
почвах представлены только обменными основаниями,
количество которых соответствует величине реальной
емкости катионного обмена (см.).
197 Натриевое адсорбционное отношение
Насыщенные основаниями почвы — это
преимущественно степные почвы: черноземы, каштановые,
сероземы, бурые и серо-бу|рые степные, а также почвы
различных зон, сформированные при участии жестких
грунтовых вод или на карбонатных породах. Особую группу
представляют солонцеватые почвы, солонцы, солончаки,
содержащие в значительных количествах обменный
натрий.
Почвы, насыщенные основаниями, по отношению к
химическому загрязнению относительно устойчивы,
особенно к таким видам загрязнения, как выпадение
кислых дождей (см.). В случаях загрязнения тяжелыми
металлами (см.) при содержании в почвах большого
количества карбонатов подвижные соединения металлов
переводятся в труднодоступное состояние.
Степень насыщенности почв основания-
м и определяют по формуле
V=—.100,
т
где V — степень насыщенности почв основаниями, % от емкости
катионного обмена; S — сумма обменных оснований; Т — емкость
катионного обмена.
НАТРИЕВОЕ АДСОРБЦИОННОЕ ОТНОШЕНИЕ
(или показатель адсорбируемости натрия).
Специфический показатель, характеризующий вероятность
вхождения ионов натрия из поливных (оросительных) или
других вод в состав почвенного поглощающего
комплекса (см.) и, следовательно, опасность осолонцевания
почв.
Натриевое адсорбционное отношение обозначается
в латинской транскрипции символом SAR (sodium
adsorptian ratio) или в русской транскрипции символом
ПАН (показатель адсорбируемости натрия).
Величину SAR находят по результатам определения
концентрации катионов в ирригационной воде или
почвенном растворе:
SAR= Л^1_.
ПСа2+ЖМ&+2]
где в квадратных скобках — концентрации соответствующих
катионов в воде, мг-экв/л.
Натрий в почвах 198
Поскольку опасность осолонцевания почв зависит не
только от величины SAR, но и от общей минерализации
поливных вод, то при оценке потенциальной опасности
засоления и осолонцевания почв учитывают оба
указанных показателя. Критерии такой оценки воды,
предложенные Ричардсоном, приведены в таблице.
Оценка качества воды по ее опасности в отношении засоления
и осолонцевания почв
Общая
минерализация
воды, г/л
Опасность
засоления почвы
Уровни SAR при опасности
осолонцевания
низкой
средней
высокой
очень
высокой
<1 Низкая 8—10 15—18 22—26 >26
1—2 Средняя 6—8 12—15 18—22 >22
2—3 Высокая 4—6 9—12 14—18 >18
>3 Очень высокая 2—4 6—9 11—14 >14
Приведенные в таблице градации имеют
ограниченный и условный характер, поскольку степень
воздействия зависит от содержания гумуса и минералогического
состава почв так же, как и от рН среды.
Натриевое адсорбционное отношение широко
используют не только при оценке качества поливной воды, но
и для характеристики почвенных растворов и прогнозов
изменения генетических свойств почв в результате
природных или антропогенных процессов. Независимо от
области применения величину SAR нельзя
рассматривать как некоторый абсолютный показатель, поскольку
на соотношение в pacTBqpe ионов натрия и ионов
щелочноземельных катионов влияет не только состав
почвенного pacTBqpa (ирригационных вод), но и
свойства почвенного поглощающего комплекса, которые
находят отражение в величинах констант ионного обмена
или коэффициентов селективности (см. Обмен ионный,
Селективность катионного обмена). Однако в первом
приближении и величина SAR позволяет
прогнозировать изменения свойств почв при смене водного режима,
ирригационных или осушительных мелиорациях.
НАТРИЙ В ПОЧВАХ. Присутствие ионов натрия в
почвах оказывает негативное влияние на свойства почв,
Ш Натрий в почвах
почвенного раствора и почвенно-грунтовых вод, а также
на состояние растений, включая сельскохозяйственные
культуры.
Ион натрия необходим животным организмам, но
на растения оказывает главным образом токсичное
воздействие, уровень которого зависит от концентрации и
формы соединений натрия в почве. К числу наиболее
токсичных почвенных соединений натрия относится сода
Na2CO3-10H2O.
Натрий содержится практически во всех почвах, но
в почвах районов гумидного климата он присутствует
преимущественно в форме крупнодисперсных
алюмосиликатов, тогда как в почвах полузасушливых и
засушливых областей он может находиться уже как в
составе почвенного поглощающего комплекса (обменный
натрий), так и в составе легкорастворимых солей (см.
Катионы обменные, Легкорастворимые соли в почвах).
Среднее содержание натрия в литосфере около 2%,
в почвах — около 0,06%. В почвах и горных породах
натрий содержится в составе полевых шпатов (альбит),
фельдшпатидов, сульфатов, боратов, нитратов,
карбонатов и хлоридов. Ион натрия имеет небольшой ионный
радиус (98 пм) и поэтому не закрепляется в составе
слюд и других тонкодисперсных почвенных минералов.
Наибольшее количество натрия обычно бывает
приурочено к гранулометрическим фракциям тонкого песка и
средней пыли, тогда как ион К+ часто аккумулируется
преимущественно в илистой фракции.
Ион Na+ содержится главным образом в солонцах,
солонцеватых землях и некоторых солончаках,
оказывая существенное влияние на их свойства. В
солонцеватых почвах и солонцах Na+ входит в состав почвенного
поглощающего комплекса (см.) в форме обменного
катиона и, как считают многие исследователи,
обусловливает неблагоприятные почвенные свойства:
возрастание рН, пептизируемость, бесструктурность, слитость
и др. Поэтому одна из важнейших задач, связанных
с охраной почв, заключается в предупреждении не
только накопления натриевых солей в почвах аридных ре-
. гионов, но и вхождения натрия в состав ППК в
обменной форме (см. Натриевое адсорбционное отношение).
С высоким уровнем содержания натрия в ППК свя-
Нейтрализующая способность почв
200
зывают свойства и происхождение солонцов и
солонцеватых почв. Под солонцовым процессом понимают, как
правило, внедрение ионов Na в ППК с последующими
неблагоприятными изменениями свойств почвенной
массы (диспергируемость, плотность, слитость, щелочная
реакция). По содержанию обменного натрия в
горизонте В принято подразделять солонцы на мало
натриевые (до 10 % Na от емкости катионного обмена),
средненатриевые (10—25%) и
многонатриевые (до 25% и более). Для незасоленных почв
диагностику степени солонцеватости можно проводить
измерением активности ионов натрия в почвенных
суспензиях (табл.).
Группировки почв по*степени солонцеватости
По Н. Г. Зырину, Д. С. Орлову
pNa измерение
в водной
суспензии
>3,0
2,4—3,0
1,5—2,4
<1,5
ст епень
солонцеватости
Несолонцеватые
Слабосолонцеватые
Среднесолонцева-
тые
Солонцы
По Л
pNa,измерение
в пасте
>3,0
2,6—3,0
1,85—2,6
<1,85
А. Чаусовой
степень
солонцеватости
Несолонцеватые
Остаточно-солон-
цеватые
Средне- и
сильносолонцеватые
Солонцы
Регулирование натриевого режима почв и
мелиорация солонцов и солонцеватых почв достигается
внесением в почвы химических мелиорирующих веществ, в
числе которых наиболее распространены гипс, фосфо-
гипс, серная кислота, железный купорос, некоторые
лёссовые породы. Мелиорацию солонцовых почв проводят
также термическими методами, при которых
обнаженную поверхность вспаханной почвы подвергают
действию излучения солнца, а также биологическими
методами— посевом натриевоустойчивых трав с развитой
корневой системой.
НЕЙТРАЛИЗУЮЩАЯ СПОСОБНОСТЬ ПОЧВ
(почвенного раствора). Общее количество кислоты,
которое может быть нейтрализовано почвой (почвенным
раствором) вследствие различных процессов,
протекающих с потреблением протонов.
201 Ненасыщенные основаниями почвы
Такими процессами могут быть реакции ионного
обмена (см. Обмен ионный), протонизация зависящих от
рН обменных позиций, растворение минералов и др.
Понятие нейтрализующей способности почв близко к
понятию буферности почв по отношению к кисло-
там (см.).
Иногда рассматривают потенциальную и
эффективную нейтрализующую способность почв. Первая
обусловлена медленно протекающими реакциями,
преимущественно— растворения силикатов и оксидов;
вторая — быстро идущими процессами ионного обмена,
протонизации зависящих от рН позиций, растворения
карбонатов.
При оценке нейтрализующей способности почвенного
раствора (НСП) ее выражают в молях на литр и
рассчитывают по следующей формуле в случае, если
кислотность раствора связана главным образом с
соединениями алюминия:
НСП = i[,HC03-] + [ОН-] —[Н+] -3[А13+] -
- 2[А1 (ОН) 2+] - [А1 (ОН) 2+ ]
При высоком содержании в растворе оснований и
анионов сильных кислот:
НСП = 2[Са2+] +2[Mg2+] + [Nia+]+([K+] - [N03-] -
-[Cl-]-2[S042-]
В обоих уравнениях квадратные скобки обозначают
концентрацию компонентов в растворе (моль/л).
Понятие нейтрализующей способности раствора и
ее конкретная величина для разных почв имеют
большое экологическое значение, так как попадание кислот,
фильтрующихся через почву, в грунтовые воды, реки и
озера возможно только при отрицательных значениях
НСП почвенного раствора. В реальных системах
фильтрация кислот через почвы в грунтовые и
поверхностные воды наблюдается только при содержании в
почвенном растворе сильных минеральных или
органических кислот.
НЕНАСЫЩЕННЫЕ ОСНОВАНИЯМИ ПОЧВЫ.
Почвы, содержащие в обменном состоянии ионы
водорода и алюминия.
В эту группу входят подзолистые, дерново-подзолис-
тые, болотные, серые и бурые лесные почвы, некоторые
Ноосфера 202
черноземы и почвы влажных субтропиков (красноземы
и желтоземы). Указанные почвы обладают малой бу-
ферностью к химическому загрязнению (см. Буферная
способность почв), особенно к воздействию кислых
осадков (см. Кислые дожди), загрязнению тяжелыми
металлами, резко увеличивается их кислотность и в
случае применения физиологически кислых
минеральных удобрений. При этом возрастает степень
ненасыщенности почв основаниями, увеличивается доля
водорода и а'люминия в составе ППК (см. Почвенный
поглощающий комплекс). Значительное количество
алюминия в ППК приводит к появлению в почвенном
растворе концентраций А13+, токсичных для растительности.
Поэтому почвы, ненасыщенные основаниями, менее
устойчивы к различным видам загрязнения, чем
насыщенные основаниями.
НООСФЕРА. Сфера разума, понятие, введенное
французским ученым Е. Леруа для характеристики
воздействия человеческого разума на развитие
биосферы, геологические процессы.
Наиболее подробно эту идею развил академик
В. И. Вернадский, который подчеркивал как
положительные, так и негативные последствия деятельности
человечества. К числу негативных проявлений
нарушения экологического равновесия в природных системах
относятся: химическое загрязнение компонентов
биосферы, реальная опасность неконтролируемого и
неуправляемого использования атомной энергии. Однако
В. И. Вернадский выражал твердую убежденность в
том, что человечество неизбежно встанет на
прогрессивный путь развития, он, в частности, писал:
«Исторически длительные печальные и тяжелые явления,
разлагающие жизнь, приводящие людей к самоистреблению,
к обнищанию неизбежно будут преодолены. Учесть эту
работу человечества — дело будущего, как в будущем
видим мы ее неизбежный расцвет».
НОРМИРОВАНИЕ СОДЕРЖАНИЯ В ПОЧВЕ
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ. Установление их
предельно допустимых количеств (ПДК). Нормирование —
одно из наиболее существенных мероприятий в системе
охраны почв от химического загрязнения (см.
Загрязнение почвы химическое).
203 Нормирование содержания в почве химических элементов
Общие принципы нормирования химических
загрязняющих веществ в объектах окружающей среды
изложены в Методических рекомендациях по
гигиеническому обоснованию ПДК химических веществ в почве,
утвержденных Минздравом СССР в 1982 г.
Санитарно-гигиеническое нормирование учитывает
четыре показателя:
транслокационный (переход загрязняющих веществ
из почвы в растения через корневую систему);
миграционный водный;
миграционный воздушный;
общесанитарный — влияние загрязняющего
вещества на самоочищающую способность почвы и ее
биологическую активность (см. Самоочищение почв,
Активность почв биологическая).
Существуют различные подходы к оценке ПДК
загрязняющих веществ.
1. По снижению урожая сельскохозяйственных
культур на определенную величину в сравнении с
контролем.
2. На основе почвенно-экологического подхода, в
соответствии с которым показателем нормального
функционирования почвенной системы служит
количество и качество вновь создаваемого живого вещества:
биологическая продуктивность не должна снижаться, а
в биомассе не должны накапливаться химические
элементы или их соединения в количествах, нарушающих
жизненно-важные функции.
Единого значения ПДК загрязняющих веществ для
почв различных типов не существует. В настоящее
время предложена шкала экологического нормирования
тяжелых металлов с учетом генетического типа почв
(табл.).
Главное значение имеет не валовое количество
тяжелых металлов, а формы соединений, которые
существуют в почве. Формы соединений, их количество и
/ трансформация зависят от величины рН, содержания
гумуса, емкости поглощения почв, числа лигандных
групп, способных образовывать с ионами тяжелых
металлов новые соединения (см. Комплексные
соединения).
Нормирование содержания в почве химических элементов
204
U
3,
се
о
е;
ч
сЗ
н
а>
S
X
2
Ч
4>
ТЯЖ
к
S
X
ей
со
о
фМИр
W
X
о
8
9Х
исло
as
X
эХ
о
ч
о
X
X
о
Л
ч
о
о
о
00
В"
о
с
ации
X
ST
о
емов
Л
•&
W
ч
CQ
Я" О
о
о
о
ев
О эХ
г
X
U
о
ч
о
US
СП
ала
м
а
О
м
'i
ВР
X
£
X
g
к
К
>•>
ю
о
S
<
о
с
эХ
X
Я"
us
at
Ч о)
О
о
V
о
V
о
о
1
Ю
о
о
о
С4
1
о
'—'
ю
О!
о
1
о
о
о
ю
1
о
сч
о
ю
о
1
Ю
CN
о
о
1^
J,
ю
о
о
>—'
1
о
ю
о
о
о
1
о
^
CN
1
о
ю
1
о
о
I
о
о
V
о
о о о
ю оо ~
I I I
ю о о
—' tO 00
о
о
со
I
о
щ
<N
I
о
ю
о
о
CD
о
о
со
о
о
ю
I
о
ю
Л
о
о
со
Л
о
о
to
Л
X <-• сч
LO
1—1
V
S3
1
1
Ю
О
IS
1
1
о
СО
О
о
1
1
о
ь-
о
Ю
1
1
о
о
'—'
о
о
CN
1
1
о
in
'—'
о
о
сч
1
1
о
ю
1—1
8
to
1
1
о
о
<м
<ь
о
1
1
о
о
ю
о
о
о
Л
ю
О
о"
V
ю
V
о
т_,„
о
1
LO
сэ
о
о
»"■«
1
to
ю
^
о"
1
о
»—^
о
ю
со
1
о
*—'
о
"Я.
о
1
ю
(N
о
о
h-
1
со
о
ол
«—«
1
о
ю
о
о
о
»-ч
1
о
1^.
<м
^
о
ю
«—•
1
о
t>
<м
J^
о
ю
»—<
1
о
о
т—«
ю
1
(N
о
о
ю
1
о
to
о
т
ю
о
о
о
I
о
to
о
»—•
о
о
о
Л
03
о.
а>
сод
►Q
CQ
о
Оч
р»
эЯ
Я
м
Я
я
л
я
<v
V
о
эЯ
я
*
со
я
я
*я
я
я
ч
О)
о.
о
»я
я
м
о
эЯ
я
«
о
a
►Q
я
ия (ПДК
я
0)
я
СО
к
агр
со
Л
»я
я
м
ысо
ш
о
a
я
ю
*Q
чен
о
205 Озон
о
ОБМЕН ИОННЫЙ. Процесс эквивалентного
обмена находящихся в почвенном поглощающем комплексе
(см.) катионов и анионов на катионы и анионы
взаимодействующего с твердыми фазами почвы раствора
(см. Емкость катионного обмена, Емкость анионного
обмена, Катионы обменные, Анионы обменные).
Из загрязняющих компонентов в ионном обмене в
почвах участвуют катионы тяжелых металлов (Zn2+,
Cd2+, Pb2+, Со2+, Cu2+ и др.) и анионы (N03~, As043-,
НМ0О4-, М0О42-, Se032" ).
ОБЪЕМ НЕРАСТВОРЯЮЩИЙ. Часть почвенной
влаги, прочно связанная на поверхности частиц почвы;
может быть выражен в массовой доле, в объемных
процентах.
При соприкосновении с растворами различных
веществ, как минеральных, так и органических, влага
нерастворяющего объема не изменяет своего состава и
концентрации. При добавлении к высушенной при
105 °С почве раствора глюкозы или хлоридов часть
добавленной воды связывается сухой почвой в форме
нерастворяющего объема. В результате концентрация
глюкозы или хлорид-ионов повышается, что позволяет
рассчитать величину нерастворяющего объема. На
этом явлении основаны методы определения
рассматриваемого показателя.
Учет нерастворяющего объема необходим при
точном определении сорбционной способности почв по
отношению к различным веществам, в том числе и
загрязняющим.
ОЗОН. Содержание озона 03 в атмосфере
незначительно и составляет 4• 10-5 % (по объему), или
6-10-5 % (по массе).
Озон образуется в атмосфере под действием
электрических разрядов, синтезируется из кислорода под
влиянием космической ультрафиолетовой радиации.
В пределах атмосферы повышенные концентрации
озона образуют озоновый слой, имеющий важное
значение для жизнеобеспечения на Земле. Границы слоя
варьируют в зависимости от широты и времени года.
Окислительно-восстановительная емкость почвы 206
Существенное влияние на размеры озонового слоя
оказывает степень загрязнения атмосферы.
Максимальная концентрация озона характерна для верхней
зоны, в пределах которой задерживается значительная
доля ультрафиолетового излучения и происходит
синтез молекул озона. Если бы коротковолновое
ультрафиолетовое излучение достигло биосферы при
начальной интенсивности, произошло бы губительное
воздействие его на живые организмы. Следовательно,
озоновый слой экранирует и защищает Землю от гибельного
действия ультрафиолетовых лучей. Однако излишне
высокое содержание озона так же нежелательно, как и
недостаток. Озон может оказывать токсичное,
разрушительное воздействие на живые организмы из-за его
окислительных свойств.
В последнее время появились тревожные сообщения
о наличии в районе Антарктиды озоновой «дыры»,
появление которой связывали с значительными
масштабами производства фреонов (см.) — компонентов
холодильных агрегатов, аэрозольных баллонов. Была
принята конвенция, ограничивающая или в некоторых
случаях запрещающая производство и применение
фреонов. В 1990 г. отмечено значительное уменьшение
размера «дыры», что не исключает необходимости
постоянного контроля за ее размерами.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ
ЕМКОСТЬ ПОЧВЫ. Общее количество окислителей или
восстановителей, которое может связать почва в
определенном (условно выбранном) интервале
окислительных потенциалов.
Для определения окислительной емкости
используют растворы бихромата или перманганата калия,
некоторые другие соединения. Окислители связываются
главным образом органическими веществами почвы, а
также оксидами железа (II), или закисью железа,
сульфидами марганца, хлоридами (в засоленных
почвах) . Связывание восстановителей также происходит
за счет органических соединений, трехвалентного
железа, в некоторых случаях нитратов, сульфатов.
ОКРУЖАЮЩАЯ СРЕДА. Среда обитания и произ- .
водственной деятельности человека. Подразделяется на
природную и социальную окружающую среду.
207 Окружающая среда
Природная среда — часть окружающей среды,
ее природные компоненты, явления, процессы.
Природная среда под влиянием человека может перестроиться
в природн о-антропогенную, в которой уже
проявляется антропогенная деятельность, но еще не
имеет доминирующего значения. Помимо природной
среды понятие окружающая среда включает также
социально-экономические компоненты в их историческом
развитии.
Физические компоненты окружающей среды
подразделяются также на природные и созданные
человеком. К природным физическим
компонентам относятся минеральные и энергетические ресурсы,
вода, воздух, почва, флора и фауна. К этим факторам
можно отнести также географическое положение
местности, характер поверхности, климат, которые
оказывают существенное влияние на человека и его
производственную деятельность.
Природные процессы и явления многообразны и
протекают в разных сферах. К ним относятся процессы:
геологические — вулканизм, землетрясения,
тектонические подъемы и опускания участков суши, оползни,
сели, цунами и т. д.;
атмосферные — грозы, ливни, ураганы, засухи;
гидросферные — наводнения, размывания речных
берегов, подъем грунтовых вод, формирование подземных
пресных вод;
биосферные — преобразование, создание и
разрушение органического вещества, взаимоотношения между
различными группами организмов и т. д.
Степень изменения человеком природных
физических компонентов непрерывно нарастает. Особенно
большие изменения наблюдаются в распределении
растительного покрова, животного мира, почв.
Созданные человеком физические
компоненты окружающей среды включают всю
совокупность предметов и явлений и представлены
искусственными материальными телами (машины, орудия),
синтетическими материалами и продуктами
(пластмассы, удобрения, детергенты, пестициды, сплавы,
нефтепродукты), строениями (производственными и
жилыми), транспортом и т. п.
Опадо-подстилочный коэффициент 208
Социально-экономические компоненты
окружающей среды представляют собой ее важную и
неотъемлемую составную часть. Их действие на
человека проявляется как через экономические факторы,
определяющие возможности удовлетворения потребностей
человека, так и социальные.
В процессе взаимодействия человека и природы
имеются положительные и отрицательные последствия
вмешательства его в регулирование природных
явлений. Почва как компонент природной среды в
результате производственной деятельности человека
претерпела значительные изменения. Большая часть этих
изменений имеет негативный характер и приводит к
деградации почв (см.). В настоящее время процессы
разрушения и деградации почв преобладают над
процессами создания высокопродуктивных и биосферно
активных экосистем (см. Экосистема) и почв. На
Земле утрачено не менее 2 млрд га почвенно-экологичес-
ких систем. Механизм самоуправления экосистем
почва — растение нарушается человеком в результате
неразумной хозяйственной деятельности.
Важнейшие практические задачи современности
заключаются не только в охране почв от деградации для
сохранения и увеличения их продуктивности, но и в
обеспечении условий, позволяющих реализовать
общепланетарную роль почвы, а именно:
наиболее полное поглощение антропогенно
выработанного диоксида углерода и вовлечение его биомассы
в органические соединения полезной биопродукции и
гумуса;
расширение эмиссии кислорода и накопление в
почвах биогенного азота и биофильных соединений;
удовлетворение потребностей человека в новых
экологически чистых источниках биогенной энергии
.(древесина, спирты, горючие масла, биогазы).
ОПАДО-ПОДСТИЛОЧНЫЙ КОЭФФИЦИЕНТ.
Отношение массы подстилки к массе ежегодно
поступающего наземного опада.
Характеризует скорость разложения наземных
органических остатков.
ОПАСНЫЕ ЭКОТОКСИКОЛОГИЧЕСКИЕ
СИТУАЦИИ (токсико-экологические ситуации). Возника-
209 Опасные экотоксикологические ситуации
ют в природной среде при интенсивном протекании
техногенных процессов и могут приводить к
чрезвычайному обострению экологической обстановки.
На токсико-экологические ситуации и уровень
загрязнения окружающей среды влияют:
биопродуктивность почв и содержание в них гумуса
(см.);
кислотно-основные условия (см. Реакция почвы);
окислительно-восстановительные режимы;
концентрация почвенных растворов (см. Почвенный
раствор);
поглотительная способность почв (см.);
гранулометрический состав почв;
тип водного режима (см. Режим почв водный).
Наиболее острые токсикологические ситуации
вызывают промышленные предприятия, расположенные в
тундровой подзоне. Такие специфические
природно-климатические условия, как суровая почвенно-гидрологи-
ческая обстановка при наличии многолетней мерзлоты,
резко сокращают продолжительность периода
возможной миграции соединений поллютантов (см.
Загрязняющие вещества). Глееобразование способствует
восстановлению ряда элементов и ведет к выносу
легкоподвижных соединений, мигрирующих в ландшафте и
загрязняющих его. Вследствие, интенсивного техногенного
воздействия при неоднородности почвенного покрова и
дифференцированной чувствительности растений к пол-
лютантам существенно изменяется флористический
состав: даже на значительном расстоянии от источника
загрязнения (см.) выпадают лишайники, страдают
древесные породы, формируется пустынная территория с
погибшими деревьями.
Опасные токсико-экологические ситуации интенсивно
развиваются в процессе техногенеза (см.) и в подзоне
кислых подзолистых, дерново-подзолистых и бурых
лесных оподзоленных почв. Низкобуферные, ненасыщенные
основаниями (см. Ненасыщенные основаниями почвы),
малогумусные почвы с преобладанием агрессивных
органических соединений в условиях высокой кислотности,
подобно тундровым биоценозам, испытывают
значительное воздействие загрязняющих веществ. Накопление
поллютантов в гумусовом горизонте в 2—5 раз и более
14 Заказ 5937
Оптические свойства почв 210
превышает таковое в материнской породе в условиях
кислой среды; в присутствии значительного количества
органических и неорганических лигандов (см.
Комплексные соединения) поллютанты трансформируются в
более подвижные, миграционно-способные соединения,
которые поступают в нижележащие слои, в почвенно-
грунтовые воды и за пределы данного техногенного
ландшафта (см. Техногенные ландшафты), усиливая
неблагоприятное экологическое воздействие.
В трансэлювиальных ландшафтах развиваются
процессы сноса верхних гумусовых и нижележащих
горизонтов, водной и ветровой эрозии, что приводит к
образованию техногенной пустыни.
В низкобуферных ландшафтах неблагоприятные
экологические последствия химического загрязнения
прослеживаются визуально: поражается древесный и
кустарниковый ярусы, частично или полностью выпадают
травянистый покров и отдельные растительные виды,
развиваются эрозионные процессы, образуются
территории техногенного происхождения.
Развитие опасных экотоксикологических ситуаций в
природной среде средне- и высокобуферных ландшафтов
аридного или семиаридного климата (черноземы, темно-
каштановые почвы, сероземы) в процессе техногенеза
не всегда прослеживается визуально. В условиях
нейтральной или щелочной реакции почвенного раствора,
присутствия гумусовых соединений, преобладания
тяжелых гранулометрических фракций с большой
величиной удельной поверхности (см. Удельная поверхность
почвы) поллютанты находятся в неактивной,
малодоступной для растений форме, практически не мигрируют
и накапливаются преимущественно в верхней части
почвенного профиля. Поскольку буферные свойства почвы
не беспредельны, со временем могут произойти
необратимые нарушения в системе почва — поллютант.
ОПТИЧЕСКИЕ СВОЙСТВА ПОЧВ. Свойства почв
и ее компонентов, проявляющиеся во взаимодействии с
электромагнитными колебаниями в видимом диапазоне
спектра.
Формы этого взаимодействия разнообразны. Для
почвенных компонентов наиболее характерны
поглощение, рассеивание и отражение энергии электро-
211 Ориентировочно-допустимое количество
магнитных колебаний, хотя имеют место также
преломление света и вращение плоскости поляризации. Для
поверхности почвы свойственно диффузное
отражение света, мерой которого служат спектральные
коэффициенты отражения (СКО) или спектральные
коэффициенты яркости (СКЯ).
Величина спектрального коэффициента
отражения выражается как процентное отношение
общего количества отраженной энергии к интенсивности
исходного светового потока. Измеряют эту величину
спектрофотометрически с помощью интегрирующей
сферы в лабораторных условиях. Значение СКО не
зависит от угла наблюдения, СКО — функция важнейших
свойств почвы: структурного состояния; влажности;
содержания гумуса, соединений железа, карбонатов,
легкорастворимых солей. Минимальные значения СКО
характерны для синей области спектра (длина волны
около 400 нм), максимальные — для красной (около
750 нм). По мере увеличения размера почвенных
агрегатов или содержания гумуса СКО уменьшается по
экспоненциальному закону. Аналогично влияет на СКО
загрязнение почвы нефтью и нефтепродуктами — на этой
зависимости основаны методы дистанционного
наблюдения за изменением содержания гумуса и степенью
загрязнения почв. Карбонаты, легкорастворимые соли и
гипс увеличивают СКО по линейному закону.
Величина спектрального коэффициента
яркости — это процентное отношение отраженной
под определенным углом энергии электромагнитных
колебаний к интенсивности электромагнитных колебаний,
отраженных под тем же углом стандартной (белой)
поверхностью. Значение СКЯ зависит от угла
наблюдения, высоты стояния солнца над горизонтом,
облачности и других условий. На основе величин СКО
разработаны методы диагностики и классификации почв и
почвенных генетических горизонтов.
ОРИЕНТИРОВОЧНО-ДОПУСТИМОЕ
КОЛИЧЕСТВО ЗАГРЯЗНЯЮЩЕГО ПОЧВУ ХИМИЧЕСКОГО
ВЕЩЕСТВА. Предельно допустимое количество за-
грязняющего почву химического вещества (см.),
определенное расчетными методами.
Ортштейн 212
ОРТШТЕЙН. Почвенное новообразование, обычно
округлой формы, хотя встречаются также угловатые и
трубчатые формы.
Крупные ортштейны размером более 3 мм называют
бобовинами, их скопления в некоторых,
преимущественно пойменных почвах, формируют бобовинную
железную руду. Ортштейны в различных почвах
различаются также по твердости— от очень твердых до мягких,
легко разминаемых вручную.
В состав ортштейнов входят преимущественно гид-
роксиды железа, марганца и органические вещества.
Содержание, размеры и состав ортштейнов могут быть
диагностическими признаками заболоченных почв.
Ортштейны представляют собой своеобразные
аккумуляторы различных химических веществ, в том числе
фосфатов, некоторых тяжелых металлов. Богатые орт-
штейнами почвенные генетические горизонты
выполняют таким образом функции геохимического барьера
(см. Барьеры геохимические).
ОХРАНА ПОЧВ. Комплекс мероприятий по
сохранению, улучшению, целенаправленному изменению и
рациональному использованию почв как одного из
важнейших ландшафтообразующих компонентов и
объектов антропогенного воздействия.
Включает в себя защиту почв от эрозии,
загрязнения, истощения, мероприятия по восстановлению
нарушенных земель (см. Рекультивация почв), повышению
плодородия почв, рационализации их использования.
Охрану почв необходимо проводить без отрыва от
защиты сопредельных с почвой сред — вод, атмосферы,
растительности, животного мира.
Охрана почв и почвенного покрова регулируется
рядом правовых и общественных актов. Разрабатываются
международные программы и соглашения. Из
международных программ следует назвать Всемирную
почвенную хартию, принятую ФАО в 1982 г., и Основы
мировой почвенной политики, принятые ЮНЕП в 1983 г.
Охрана почв от эрозии включает систему
приемов предупреждения эрозии почв и борьбы с ней. В
основе противоэрозионных мероприятий должна лежать
противоэрозионная организация территории. Это обос-
213 Охрана почв
нование такого состава, соотношения и размещения
различных видов сельскохозяйственных угодий, которые
максимально ограничивают или исключают развитие
эрозии почв. Противоэрозионные мероприятия
включают кроме организационно-хозяйственных
агротехнические и лесомелиоративные меры.
Защита почв от загрязняющих ее
продуктов техногенеза должна быть основана на
совершенствовании технологии и принципов организации
производства. Создание замкнутых технологических
систем, организация производства без отходов приводит
к резкому сокращению поступления в почву продуктов
техногенеза (см.). Кроме этого разработаны приемы,
приводящие к детоксикации продуктов техногенеза в
уже загрязненных почвах (см. Детоксикация
загрязняющего почву химического вещества). Так, при
загрязнении почв тяжелыми металлами их переводят в
недоступное для растений состояние путем внесения извести,
органических удобрений, цеолитов (см.), ионообменных
смол. Эти вещества способствуют переводу
подвижных соединений тяжелых металлов в адсорбированное
состояние и тем самым ограничивают их миграцию в
почвах и ландшафтах. Иногда на сильно загрязненных
почвах проводят посадку растений — концентраторов
тяжелых металлов (см. Агролесомелиорация).
При техногенном подкислении почв соединениями
азота и серы применяют известкование, снижающее как
подкисление почв, так и содержание в них токсичных
соединений алюминия (см. Алюминий, токсичный для
растений).
Несбалансированное применение минеральных
удобрений и пестицидов также вызывает химическое
загрязнение почв. Для защиты от этого вида загрязнения
используют агролесомелиоративные приемы (см.
Агролесомелиорация), препятствующие площадному стоку с
распаханных земель. Основной акцент следует делать на
строгом соблюдении оптимальных доз, сроков и
способов применения химических средств. Существует и
другой путь защиты почв от загрязнения избытками
удобрений. Это замена, например, азотных удобрений
экологически безопасными биологическими источниками
азота в почве (посев бобовых культур).
Пептизация почвенных коллоидов 214
Охрана почв от различных форм
деградации возможна только на основе хорошо налаженной
системы почвенного мониторинга (см), дающего
необходимую информацию о состоянии почвенного покрова
в различных пунктах страны (см. Деградация почв).
п
ПЕПТИЗАЦИЯ ПОЧВЕННЫХ КОЛЛОИДОВ.
Процесс, обратный коагуляции, при котором более
крупные почвенные частицы распадаются на более тонкие,
способные образовывать коллоидные растворы (см.
Коллоиды почвенные, Коагуляция почвенных
коллоидов).
В наибольшей степени пептизация проявляется при
высоком содержании Na+ в почвенном поглощающем
комплексе (см.) и при низкой концентрации
электролита. Обменный Na+ способствует пептизации коллоидов,
так как этот катион при увлажнении почвы сильно гид-
ратируется и с гидратной оболочкой входит в
межпакетные пространства глинистых минералов (см.).
Пептизация органических и минеральных коллоидов
в наибольшей степени свойственна автоморфным
солонцам и солонцеватым почвам, особенно если в них
содержится сода, так как именно в этих почвах высокое
содержание обменного натрия (см. Натрий в почвах)
может сочетаться с невысокой концентрацией в
почвенном растворе легкорастворимых солей (см.
Легкорастворимые соли в почвах). Пептизация коллоидов — это
чрезвычайно неблагоприятные для почвенного
плодородия явления, при которых почва становится
бесструктурной.
Поскольку пептизация коллоидов обычно
сопровождается увеличением общей поверхности почвенных
частиц и снижением водопроницаемости, способность почв
к поглощению загрязняющих веществ может возрастать.
ПЕРСИСТЕНТНОСТЬ ЗАГРЯЗНЯЮЩЕГО ПОЧВУ
ХИМИЧЕСКОГО ВЕЩЕСТВА. Устойчивость
загрязняющего почву химического вещества (см.),
характеризуемая продолжительностью сохранения его
215 Плодородие почв
биологической активности (см. Активность почв
биологическая) .
ПЛОДОРОДИЕ ПОЧВ. Способность почв
удовлетворять потребности растений в питательных элементах,
воде, обеспечивать корневые системы достаточным
количеством воздуха, тепла и благоприятной
физико-химической средой для нормального роста и развития (по
И. С. Кауричеву).
Различают естественное, искусственное, эффективное,
или экономическое, и потенциальное плодородие.
Естественное плодородие — это плодородие
не тронутых человеком почв. Для разных почв оно
различно, что связано со сложным взаимодействием свойств
и режимов почв, и характеризуется определенной
продуктивностью произрастающих на них биоценозов.
Искусственное плодородие — это то
плодородие, которое возникает в почвах при их изменении,
вызванном сельскохозяйственной деятельностью
человека. В чистом виде оно наблюдается при создании
субстратов для выращивания растений в теплицах, парниках,
в условиях гидропоники и т. п.
Эффективное, или экономическое, плодородие —
совокупное проявление естественного и искусственного
плодородия, обусловленного сельскохозяйственным
производством. Эффективное плодородие зависит от
повышения и трансформирования естественного плодородия
под влиянием вложенного человеком труда.
По тенциальн,ое плодородие — способность
почвы в благоприятных условиях (оптимальные для
растений водный, воздушный, тепловой режимы)
длительное время поддерживать необходимое количество
питательных элементов, обеспечивая высокий уровень
эффективного плодородия. Наиболее высоким
потенциальным плодородием обладают такие почвы, как
черноземы, болотные низинные торфяные почвы, низким —
подзолистые почвы.
Развитие культурного почвообразовательного
процесса приводит к улучшению почв и повышению их
плодородия (то есть к расширенному воспроизводству).
В результате такой деятельности человека создаются и
поддерживаются оптимальные свойства почв —
сочетание количественных показателей свойств и режимов
Поверхностная плотность химического загрязнения 216
почв, при котором могут быть максимально
использованы все жизненно важные для растений факторы,
наиболее полно реализованы возможности выращиваемых
культур и обеспечен наивысший урожай при хорошем
его качестве.
К основным показателям химических и физических
свойств почв, которые требуют контроля, относятся
следующие.
1. Показатели гумусного состояния почв (см.) —
содержание и состав гумуса, его запасы, мощность
гумусового слоя.
2. Показатели, характеризующие питательный
режим почв, — содержание доступных элементов питания
растений.
3. Показатели физических свойств почв — плотность,
агрегированность, полевая влагоемкость,
водопроницаемость, аэрация.
4. Показатели, характеризующие морфологическое
строение профиля почв, — мощность пахотного
горизонта и в целом гумусового профиля.
5. Показатели физико-химических свойств — реакция
почвы (см.), емкость поглощения, состав обменных
катионов, степень насыщенности основаниями (см.
Катионы обменные, Насыщенные основаниями почвы).
6. Показатели, отражающие уровень почвенного
плодородия почв разных климатических зон, — уровень
содержания токсических веществ — подвижных форм
алюминия и марганца, показатели солевого режима и т. д.
Химическое загрязнение почв приводит к деградации
почвенно-растительного покрова и снижению или даже
утрате почвенного плодородия (см. Загрязнение почвы,
Техногенная пустыня).
ПОВЕРХНОСТНАЯ ПЛОТНОСТЬ
ХИМИЧЕСКОГО ЗАГРЯЗНЕНИЯ. Масса загрязняющего почву
химического вещества (см.) в слое заданной глубины,
отнесенная к единице поверхности почвы.
ПОГЛОТИТЕЛЬНАЯ СПОСОБНОСТЬ ПОЧВЫ.
Способность почвы поглощать из растворов и газовой
фазы и удерживать различные компоненты.
По К. К. Гедройцу, который определял
рассматриваемый показатель как способность почвы
«задерживать те или другие вещества, приходящие в соприкосцо-
217 Поглотительная способность почвы
вение с ее твердой фазой через циркулирующие в ней
воды», различают пять видов поглотительной
способности:
механическую — способность задерживать
твердые частицы различных размеров при фильтрации через
почву суспензий и коллоидных растворов (см.
Коллоиды почвенные);
химическую — поглощение вследствие
образования труднорастворимых соединений, выпадающих в
осадок;
физическую — удержание различных веществ
у поверхности твердой фазы за счет адсорбционных
сил;
физик о-х имическую (ионнообменная
способность) — поглощение катионов и анионов путем ионного
обмена (см. Обмен ионный);
биологическую — поглощение различных
соединений микроорганизмами и корнями растений.
Наиболее важное значение имеет физико-химическая
(ионообменная) способность, с которой связаны такие
свойства почвы, как количество обменных катионов, бу-
ферность (см. Катионы обменные, Буферная
способность почв), запас элементов питания для растений;
величина физико-химического поглощения обусловлена
емкостью катионного (анионного) обмена (см.).
Благодаря различным видам поглотительной
способности почвы в той или иной мере задерживают
попадающие в них загрязняющие вещества (тяжелые металлы,
пестициды, нефтепродукты и др.)» препятствуя их
поглощению растениями и просачиванию в грунтовые
воды.
Если образующиеся при этом соединения обладают
низкой подвижностью и слабой доступностью
растениям, то такой процесс снижает токсичное действие
различных соединений, накапливаемых при загрязнении
почв. Например, токсичное действие соединений
свинца, поступающего в почву извне, проявляется при
значительно меньших концентрациях на малогумусных, с
низкой емкостью катионного обмена дерново-подзолистых
почвах, чем на черноземах, обладающих высокой и
очень высокой емкостью катионного обмена.
Подвижность химических элементов 218
ПОДВИЖНОСТЬ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
Способность химических элементов переходить из
состава твердых фаз почвы в жидкую фазу.
Понятие подвижности неразрывно связано с
миграционной способностью химических элементов (см.
Миграция химических соединений), так как поступая в
раствор, они могут перемещаться в ландшафте,
выпадать в осадок, улетучиваться в атмосферу,
потребляться растениями. Запас подвижных соединений может
пополняться при поступлении их в почвенную систему
извне в результате естественных и антропогенных
процессов или уменьшаться при удалении из почвенной массы.
Наиболее подвижные (миграционно способные, по
А. Я- Перельману) химические элементы — CI, Br, F, В,
Na, Ca, Mg, Ba (см. также Миграция химических
соединений). Миграцию в ландшафте химических
элементов ограничивают процессы осаждения их на
геохимических барьерах (см. Барьеры геохимические), прежде
всего на кислородном, сероводородном, глеевом. На этом
основании химические элементы делятся на группы:
подвижные и слабоподвижные в глеевой
обстановке, инертные в сероводородной: Zn, Cu, Ni, Pb, Cd;
подвижные и слабоподвижные в окислительной и
инертные в восстановительной обстановке (глеевой и
сероводородной): V, Mo, Se;
подвижные и слабоподвижные в восстановительной
глеевой среде, инертные в окислительной и
восстановительной сероводородной: Fe, Mn, Со.
В соответствии с закономерностями геохимической
миграции в почве распределяются и имеющие
антропогенное происхождение химические элементы,
попадающие в нее как загрязняющие вещества.
Подвижные соединения химических элементов
представляют собой наиболее важную с точки зрения
питания растений группу соединений. Их извлекают из
почвы различными растворителями, действие которых
предположительно сопоставимо с действием природных вод
и растений, — это разбавленные растворы солей,
кислот и оснований, комплексообразователей. Подвижные
соединения фосфора (см.) и калия извлекают из почв
растворами разбавленных кислот (методы Кирсанова,
Ониани, Чирикова) и растворами солей и комплексооб-
219 Подстилка
разователей (методы Мачигина, Эгнера — Рима). Для
извлечения подвижных соединений микроэлементов
используют и индивидуальные для каждого из них
растворители и групповые экстрагенты. В качестве
последнего чаще всего применяют раствор 1 н. CH3COONH4.
В загрязненных тяжелыми металлами почвах
отмечено повышенное содержание их подвижных соединений,
определяемых в составе вытяжек. По количеству
подвижных соединений металлов и по соответствию их
ПДК устанавливают загрязнение почв и выделяют зоны
загрязнения территории.
ПОДКИСЛЕНИЕ ПОЧВ. Природный или
техногенный процесс, при котором обменные катионы (см.
Катионы обменные) почвенного поглощающего
комплекса (см.) замещаются на ионы водорода или алюминия.
Причинами подкисления могут быть внесение
минеральных удобрений без известкования (или при
недостаточных дозах извести), природный промывной
режим, при котором почвы теряют обменные катионы
кальция и магния, а поглощающий комплекс постепенно
заполняется ионами водорода и алюминия за счет
присутствующих в почвенном растворе слабых кислот
(включая угольную), реакций растворения гидроксидов
алюминия или разрушения решеток алюмосиликатов, а
также вследствие выпадения кислых (кислотных) осадков
(см. Кислые дожди), обогащенных техногенными
оксидами серы и азота. Подкисление кислых почв с
промывным водным режимом неблагоприятно сказывается на их
свойствах и урожаях культур: происходит вынос Са, К,
Mg за пределы почвенного профиля, снижается рН,
разрушается почвенный поглощающий комплекс.
Для предупреждения и устранения подкисления
используют известкование (см.). Подкисление
карбонатных почв аридных регионов может иметь
положительное значение, поскольку при этом повышается
доступность растениям многих питательных элементов.
ПОДСТИЛКА. Слой лежащих на поверхности
почвы измельченных и затронутых разложением мертвых
органических остатков наземного древесного опада.
Подстилку обычно причисляют к верхнему
почвенному горизонту. Ее можно рассматривать и как
самостоятельное органическое новообразование, связанное
Показатели загрязнения почв 220
с почвой переходным горизонтом. Мощность и запасы
подстилки изменяются в зависимости от типа леса и
условий его местообитания.
Содержание загрязняющих веществ (см.) в
подстилке используют в качестве показателя при мониторинге
(см.) загрязнения различными поллютантами.
ПОКАЗАТЕЛИ ЗАГРЯЗНЕНИЯ ПОЧВ. Перечень
почвенных свойств, количественные уровни которых
позволяют выявить отрицательные изменения почв под
влиянием антропогенных факторов.
Оценку изменений свойств почв, подверженных
антропогенному влиянию, проводят на различных
уровнях — выявляют изменение почвенного покрова,
деградацию почв (см.), их загрязнение (см. Загрязнение
почвы) и с различными целями: например, для
определения техногенного и сельскохозяйственного влияния.
С этим связано разнообразие подходов к
классификации и номенклатуре контролируемых свойств почв.
По Г. В. Добровольскому, Д. С. Орлову, Л. А.
Гришиной, в основе почвенного мониторинга (см.) должны
лежать три группы показателей: сезонные изменения
почв, долгосрочные изменения, ранняя диагностика
неблагоприятных изменений. Система показателей
химического состояния почв, предложенная Д. С. Орловым,
Л. А. Воробьевой, включающая параметры химических
свойств почв и химических процессов в них,
информативна не только для природных ландшафтов, но и для
почв антропогенно нарушенных территорий.
Разработанная Э. И. Гапонюк, С. Г. Малаховым
комплексная система показателей экологического
мониторинга основана на характеристике элементарных поч-
венно-биологических процессов, которые отражают
ферментативную активность, трансформацию
органического вещества, азотный и фосфатный режимы почвы.
Для характеристики загрязнения почв тяжелыми
металлами (см.) Л. К. Садовникова, Н. Г. Зырин
рекомендуют использовать прямые показатели содержания
их в почвах (общее количество; техногенная фракция,
растворимая в 1 н. HN03, содержание в водных
вытяжках и в вытяжках солевыми растворами 1 н.
CH3COONH4, 1н. Ca(N03b) и косвенный показатель
загрязнения (отношение количества металлов в почве к
221 Показатели загрязнения почв
содержанию в ней органического вещества). Указанные
показатели позволяют выявить почвы с различными
уровнями загрязнения на техногенно нарушенной
территории.
В целях мониторинга свойств почв Д. С. Орлов,
Г. В. Мотузова, Л. А. Воробьева выделяют:
прямые показатели загрязнения почв;
показатели изменения свойств почв под действием
загрязняющих веществ;
показатели способности почв противостоять
загрязнению.
В организациях Госкомгидромета СССР действует
Отраслевой стандарт «Охрана природы. Номенклатура
показателей оценки последствий загрязнения почв
химическими веществами» (1988), в котором приведены
следующие показатели: общее содержание
загрязняющих веществ, содержание подвижных
(экстрагируемых) соединений загрязняющих веществ, мощность
загрязненного слоя, подвижность органо-минеральных
соединений почвы и загрязняющих почву веществ,
скорость миграции загрязняющих веществ в сопряженные
компоненты биогеоценоза, кислотно-основная
характеристика почвенной суспензии, общая щелочность,
степень насыщенности почв основаниями, удельная
электропроводность водных вытяжек,
окислительно-восстановительный потенциал, степень насыщенности почв
обменным натрием, содержание гумуса, мощность гумуси-
рованного слоя, содержание гидролизуемого азота,
содержание подвижных соединений фосфора и калия,
агрегатный состав почвы, микроагрегатный состав,
водопроницаемость, активность почвенных ферментов, фи-
тотоксичность, спектральный коэффициент яркости
почв.
Особенность оценки загрязнения почв, предложенной
В. Б. Ильиным, М. Д. Степановой, состоит в том, что
состояние загрязненных почв и растений характеризуют
относительными показателями в сравнении с
незагрязненными контрольными. Активное загрязнение почв
находят по отношению содержания в почвах подвижных
соединений веществ; общее загрязнение растений.— по
отношению количеств элемента в надземной массе
сравниваемых растений; внутритканевое загрязнение расте-
Показатели химического состояния почв 222
ний — по отношению содержания элемента в листьях и
семенах.
Суммарный показатель загрязнения, по Ю. Е. Сае-
ту, Р. С. Смирновой, равен сумме коэффициентов
концентрации (отношение содержаний элемента в
загрязненной и незагрязненной почвах) элементов,
накапливающихся в техногенных аномалиях. Он позволяет
определить ассоциации химических элементов,
загрязняющих почвы техногенно-нарушенных территорий и
выявить зоны с различными уровнями загрязнения.
При анализе почв, загрязненных нефтепродуктами
(см. Загрязнение нефтью и нефтепродуктами),
определяют их содержание в вытяжках органическими
растворителями. Для первичной оценки загрязнения почв в
районах добычи, переработки и транспортировки
нефтепродуктов предложено использовать спектральную
отражательную способность и выявлять в разной степени
загрязненные почвы по величинам интегрального
отражения.
Степень загрязнения почв пестицидами (см.
Загрязнение пестицидами) оценивают по содержанию в них
пестицидов и токсичных продуктов деструкции этих
веществ.
ПОКАЗАТЕЛИ ХИМИЧЕСКОГО СОСТОЯНИЯ
ПОЧВ. Характеристики химических свойств почвы,
отражающие ее статическое состояние на момент
исследования, и характеристики почвенных процессов,
дающие представление о направлении и скорости
природного или антропогенного почвообразования. Показатели
почвенных процессов могут служить для прогноза
изменения свойств почв при техногенезе (см.) или
сельскохозяйственном использовании.
В число показателей химических свойств
входят: элементный состав, запасы химических
элементов, содержание водорастворимых солей, гипса,
карбонатов, содержание органических веществ, групповой
состав элементов и соединений, их подвижность,
кислотно-основные и ионообменные свойства.
Показатели подвижности химических элементов
подразделяются на интенсивные — концентрация,
химические потенциалы и экстенсивные — запасы подвижных
форм соединений. Показатели кислотно-основных
223 Поля орошения
свойств включают: степень кислотности (щелочности),
количество кислотности (щелочности), известковый
потенциал (см. Потенциал известковый), обменную и
гидролитическую кислотность, общую и частную
щелочность (см. Реакция почвы). Ионообменная способность
почв характеризуется емкостью катионного обмена
(см.) —стандартной, реальной, дифференциальной,—
суммой обменных катионов и оснований, константами
ионного обмена, коэффициентами селективности.
Химические показатели почвенных
процессов делят на две группы:
показатели направления процессов — профильное
распределение соединений или элементов, элювиально-
аккумулятивные коэффициенты, показатели накопления
тяжелых металлов, коэффициент токсичности
гербицидов и т. д.;
показатели скорости процессов — скорости
засоления, осолонцевания (см. Засоление почв), потерь
гумуса, загрязнения почв токсичными веществами.
Единицы измерения показателей разработаны пока
недостаточно. Преобладают общепринятые единицы,
сложившиеся в практике почвенных исследований.
Для показателей свойств общепринятые единицы можно
легко преобразовать в единицы СИ. Единицы для
показателей процессов часто условны или не установлены,
а использование для этих целей единиц СИ не всегда
оказывается рациональным.
ПОЛЯ ОРОШЕНИЯ. Земельные участки,
специально подготовленные для естественной биологической
очистки сточных вод (см.) путем фильтрации их через
почвенные горизонты при одновременном орошении
культивируемых на полях орошения сельскохозяйственных
растений.
На таких полях возделывают в основном кормовые
растения — кукурузу на силос, корнеплоды,
многолетние травы. Имеющиеся в бытовых сточных водах
питательные вещества (азот, фосфор, калий, кальций)
представляют собой ценные удобрения для растений.
Однако производственные и бытовые сточные воды
могут быть источником токсичных для человека и
растений загрязняющих веществ (см.) органического и
минерального происхождения. Поэтому перед применением
Поля фильтрации 224
сточных вод для орошения необходимо наладить
постоянный контроль за содержанием в них потенциально
опасных загрязняющих веществ. Особенно сильно
загрязнены этими веществами осадки сточных вод.
ПОЛЯ ФИЛЬТРАЦИИ. Земельные участки с
легкими грунтами (пески, супеси, суглинки),
подготовленные в составе очистных сооружений для естественной
биологической очистки сточных вод (см.)
просачиванием через почвенные горизонты.
На поля фильтрации поступают сточные воды,
очищенные от механических примесей, яиц гельминтов.
Для очистки небольших количеств сточных вод
встраивают подземные поля фильтрации (сточная жидкость
поступает в почву при этом через дрены).
ПОТЕНЦИАЛ ИЗВЕСТКОВЫЙ. Один из
термодинамических показателей интенсивности почвенной
кислотности.
Известковый потенциал рассчитывают по формуле
ПИ = рН-1/2 рСа,
где ПИ — потенциал известковый; рСа=—\g а Са2+ (а —
активность ионов Са2+ в почвенном растворе).
Необходимые величины для расчета активностей
ионов Н+ и Са2+ определяют с помощью, ионселективных
электродов в суспензии или вытяжке из почв после
достижения равновесия. Преимущество известкового
потенциала как показателя почвенной кислотности
заключается в том, что он в меньшей степени, чем, например,
величина рН, зависит от соотношения твердых и жидкой
фаз почвы.
ПОТЕНЦИАЛЬНАЯ БУФЕРНАЯ СПОСОБНОСТЬ
ПОЧВ ПО ОТНОШЕНИЮ К КАЛИЮ. Один из
показателей калийного состояния почв, характеризующий
способность почвы отдавать калий в раствор или
связывать калий из раствора в ответ на изменение
активности этого элемента.
Метод определения потенциальной буферной
способности почв по отношению к калию был разработан
П. Бекеттом и заключается в следующем. Берут
несколько навесок почвы и заливают равным
количеством 0,002 М раствора СаС12, содержащего переменные
концентрации К+. Полученные суспензии взбалтывают
225 Потенциальная буферная способность почв
и фильтруют. В фильтрате измеряют концентрации
калия и кальция на пламенном фотометре или активности
их ионселективным электродом.
По результатам определения активностей К+, Са2+
строят график. Построение его аналогично
рассмотренному при описании буферности почв по отношению к
фосфору (см.). По оси абсцисс откладывают отношение
активностей К+ и Са2+ в растворе (/), по оси ординат—
изменение содержания К+ в равновесном растворе. На
основании этой величины вычисляют калийный
потенциал (см.).
Общее количество легкообменного калия, которое
может быть отдано почвой в раствор (Q), находят,
продолжая прямолинейный участок графика до
пересечения с осью ординат. Потенциальную буферную
способность почв по отношению к калию (ПБО)
определяют как отношение QJI.
Поскольку ПБО характеризует способность почвы
поглощать К+ из раствора и отдавать его в раствор, эта
величина определяется общим числом обменных
позиций, то есть значениями ЕКО — емкости катионного
обмена (см.). Поэтому в большинстве почв между ЕКО и
ПБО наблюдается прямая линейная зависимость.
Численные значения ПБО колеблются от нескольких
единиц в песчаных почвах до нескольких сот в
глинистых с высоким содержанием минералов группы
монтмориллонита.
Определенное преимущество ПБО как показателя
калийного состояния почв по сравнению с некоторыми
другими (например, содержанием обменного калия)
состоит в относительной стабильности этой величины для
данной почвы.
Внесение больших доз калийных удобрений в
суглинистых почвах заметно снижает ПБО, так как при этом
лабильные силикаты трансформируются в иллиты (см.
Гидрослюды) за счет необменного поглощения калия,
и общее число обменных позиций сокращается. Поэтому
при загрязнении почв ионами калия можно ожидать
заметное снижение ПБО. Длительное и сильное
истощение суглинистых почв по калию приводит к
обратным результатам — мобилизуется часть необменного
калия, находящегося в кристаллических решетках иллитов,
Почвенный ключ 226
и последние превращаются в лабильные минералы. При
этом возрастают ЕКО и ПБСК.
ПОЧВЕННЫЙ КЛЮЧ (ключевой участок, ключ).
Небольшой по площади (1—10 га и более) участок
картографируемой территории, размеры которого зависят
от сложности почвенного покрова и рельефа.
Ключи на обследуемой территории размещают так,
чтобы они характеризовали все возможные ландшафт-
но-геохимические условия, разнообразие генезиса,
состав и сочетание почв, типичные биоценозы, целинные
и распаханные угодья и обязательно — фоновые и
техногенные участки региона (см. Фоновые почвы,
Техногенный ландшафт). Если это возможно, желательно в
разных зонах загрязнения иметь ключи, сходные по
ландшафтно-геохимическим условиям и почвенному
покрову.
На ключевом участке подробно изучают почвенный
покров, составляют почвенную карту, проводят сбор
материалов для анализа.
ПОЧВЕННЫЙ ПОГЛОЩАЮЩИЙ КОМПЛЕКС
(ППК). Совокупность органических, минеральных иор-
гано-минеральных компонентов почвы, способных к
поглощению и обмену ионов (см. Поглотительная
способность почв, Обмен ионный).
Поглощение ионов обусловлено наличием заряда,
который возникает в результате следующих процессов:
механическое разрушение решетки минералов и
разрыв связей между ионами;
гетеровалентное изоморфное замещение в
минералах — например, замещение в структуре силикатов
Si4+ на А13+, а А13+ на Fe2+, Mg2+;
адсорбция ионов на поверхности ППК;
отдиссоциация ионов ППК, например, протонов из
гидроксогрупп алюмосиликатов, а также из
карбоксильных групп и фенольных гидроксогрупп органических
веществ;
ориентация полярных молекул вблизи поверхности
раздела твердых и жидкой фаз.
В связи с тем, что в естественных условиях ППК
имеет отрицательный заряд, обменно поглощаются
преимущественно катионы. Положительный заряд в ППК
возникает на сколах кристаллов минералов, на поверхнос-
227 Почвенный раствор
ти гидроксидов железа и алюминия (см.), за счет
аминогрупп органических веществ. Компенсируется
положительный заряд ППК поглощением анионов.
Количество поглощенных веществ, прочность их
удерживания зависят от свойств ППК (дисперсность,
минералогический состав, состав органических и орга-
но-минеральных веществ), от кислотно-основных и
окислительно-восстановительных условий, от свойств
поглощаемых химических веществ.
Главная функция ППК с точки зрения охраны почв:
участие его в обменных реакциях с загрязняющими
веществами (см.), поступающими в почву. Реакции
обмена с этими веществами протекают в эквивалентных
количествах и обратимы, если не сопровождаются хемо-
сорбцией. Скорость и соотношение обменивающихся
ионов зависят от валентности ионов загрязняющих
веществ в растворе, их радиуса, концентрации. С
повышением рН увеличивается поглощение катионов Cd, Pb,
Zn, Hg и других, уменьшение рН ведет к большему
поглощению As, Se, Sb, Mo.
Результаты вегетационных и полевых опытов,
исследование почв техногенно-нарушенных территорий
показывают, что при одном и том же уровне содержания в
почвах тяжелых металлов (см.) признаки угнетения
растений в наибольшей степени проявляются на тех
почвах, где ППК имеет мало активных центров, способных
к обменным реакциям с металлами, где низка ЕКО —
емкость катионного обмена (см.). Почвы с ЕКО менее
20 мг-экв/100 г наиболее подвержены загрязнению
тяжелыми металлами, пестицидами и другими
химическими веществами; при ЕКО выше 50 мг-экв/100 г почвы
более устойчивы к загрязнению. Защитные функции
ППК проявляются в способности обменных катионов за
счет ионообменных реакций нейтрализовать кислые
осадки (см. Кислые дожди) и ограничить миграцию
тяжелых металлов.
ПОЧВЕННЫЙ РАСТВОР. Раствор химических ве
ществ в воде, который находится в квазиравновесии с
твердыми и газообразной фазами почвы и заполняет ее
поровое пространство. Почвенный раствор можно
рассматривать как гомогенную жидкую фазу, имеющую
переменный состав,
15*
Почвенный раствор
На формирование состава почвенного раствора
влияют атмосферные осадки, состав грунтовых вод и водный
режим почв, климат, растительность. Состав
почвенного раствора зависит от его взаимодействия с твердыми
фазами в результате процессов осаждения —
растворения, сорбции — десорбции, ионного обмена, комплексо-
образования, растворения газов почвенного воздуха,
разложения животных и растительных остатков.
Количественными характеристиками состава и
свойств почвенного раствора служат ионная сила, мине-
рализованность, электропроводность,
окислительно-восстановительный потенциал, титруемая кислотность
(щелочность), активности и концентрации ионов, рН
(см. Ионная сила почвенного раствора, Минерализован-
ность природных вод, Активность ионов в почвах,
Реакция почвы).
Химические элементы могут находиться в составе
почвенного раствора в форме свободных ионов, аква-
комплексов, гидроксокомплексов, комплексов с
органическими и неорганическими лигандами, в виде ионных
пар и других ассоциатов. Ассоциаты ионов
представляют собой два или три иона, удерживающихся вместе
кулоновскими силами притяжения. Эти частицы
находятся в равновесии с простыми ионами, они могут нести
электрический заряд или быть нейтральными.
Непосредственно в растворе определяют активность свободного
иона с помощью ионселективных электродов или
суммарное содержание элемента (его аналитическую
концентрацию). Количество других частиц находят по
уравнениям ионных равновесий с учетом термодинамических
констант диссоциации, ионизации, комплексообразова-
ния.
Ионный состав почвенного раствора определяют
непосредственно в почве, используя ионселективные
электроды, или проводят анализ раствора, отделенного
от твердых фаз одним из следующих методов: отпрес-
совыванием, центрифугированием, вытеснением
раствора несмешивающейся с ним жидкостью. Иногда о
составе почвенного раствора судят по составу водных
вытяжек.
Концентрацию химических веществ в почвенном
растворе выражают в массовых абсолютных единицах.
229 Почвоутомление
В единицах СИ получают молярную концентрацию,
показывающую количество вещества в молях,
содержащееся в единице объема раствора. Выражение
результатов анализа почвенного раствора с использованием
эквивалентной массы позволяет судить о правильности
анализа: при отсутствии погрешностей и учете всех
частиц почвенного раствора число эквивалентов катионов
должно быть равным числу эквивалентов анионов.
Общую минерализованность почвенного раствора (мг/л)
находят как сумму сухих солей после выпаривания
раствора. Электропроводность измеряют
кондуктометром.
Классификация природных вод, к которым относятся
и почвенные растворы, по концентрации солей в них
приведена в таблице.
Классификация природных вод (почвенных растворов) в зависимости
от их минерализованности
По О. А. Алекину
минерализованность, %
класс вод
По ГОСТ СТСЭВ 5184-85 „Качество
воД. Термины и определения*
минерализованность, %
класс вод
1 Пресные 1 Пресные
1—25 Солоноватые 1 —10 Солоноватые
25—50 Соленые 10—25 Соленые
Почвенные растворы разных типов почв имеют
карбонатный, гидрокарбонатный, сульфатный или хлорид-
ный анионный состав с преобладанием среди катионов
Са, Mg, К, Na.
В настоящее время в практике экологического
мониторинга все шире применяют анализ почвенных
растворов на содержание тяжелых металлов, пестицидов и
других химических веществ. Эти показатели
информативны и позволяют выявить загрязнение ландшафта и
миграционную способность загрязняющих веществ.
ПОЧВОУТОМЛЕНИЕ. Резкое снижение урожаев
сельскохозяйственных растений при бессменном
возделывании культур или частом возвращении на одно и то
же поле.
Предельно допустимое количество (концентрация) 230
Наиболее ярко проявляется при выращивании
клевера (клевероутомление), льна (льноутомление), сахарной
свеклы (свеклоутомление), хлопчатника. Это связано с
тем, что в почве накапливаются метаболиты, токсины
и болезнетворные микроорганизмы, специфичные для
определенных растений, например, при монокультуре
хлопчатника — вилт, комсток, совка и др.
Сопровождается подобное явление развитием вредных насекомых,
сорняков и односторонним истощением почвы (см.
Деградация почв).
ПРЕДЕЛЬНО ДОПУСТИМОЕ КОЛИЧЕСТВО
(КОНЦЕНТРАЦИЯ) ЗАГРЯЗНЯЮЩЕГО ПОЧВУ
ХИМИЧЕСКОГО ВЕЩЕСТВА (ПДК). Максимальное
содержание загрязняющего почву химического
вещества, не вызывающее прямого или косвенного негативного
влияния (включая отдаленные последствия) на
окружающую среду и здоровье человека, а также не
приводящее к накоплению токсичных элементов в
сельскохозяйственных культурах.
Величины ПДК изменяются в зависимости от
конкретной почвенно-геохимической обстановки. При
установлении ПДК вещества в воздухе рабочей зоны или
в воздушном бассейне населенных мест ориентируются
на токсикологический показатель вредности или
рефлекторную реакцию организма.
Для санитарной оценки воздушной сре-
д ы используют следующие показатели.
ПДКрз — предельно допустимая концентрация
вредного вещества в воздухе рабочей зоны, мг/м3. Эта
концентрация не должна вызывать у работающих при
ежедневном вдыхании в пределах 8 ч (в течение всего
рабочего стажа) заболеваний или отклонений в состоянии
здоровья, обнаруживаемых современными методами
исследования. Рабочей зоной считается пространство
высотой до 2 м над уровнем пола или площадки, на
которой находятся места постоянного или временного
пребывания работающих.
ПДКмр—максимальная разовая концентрация
вредного вещества в воздухе населенных мест, мг/м3. Это
количество вещества не должно вызывать рефлекторных
(в том числе субсенсорных) реакций в организме
человека.
231 Предельно допустимое количество (концентрация)
ПДКс.с — среднесуточная предельно допустимая
концентрация вредного вещества в воздухе населенных мест,
мг/м3. Эта концентрация не должна оказывать на
человека прямого или косвенного вредного воздействия в
условиях неопределенно долгого круглосуточного
вдыхания.
ЛК50 — летальная концентрация вещества,
вызывающая при вдыхании гибель 50% животных, мг/л.
Значение ЛКбо выражают также в миллимолях на 1 л
(мМ/л). Для перевода мг/л в мМ/л необходимо
разделить исходное значение ЛК50 на молекулярную массу
вещества.
НКсг.р — пороговая концентрация, вызывающая
изменения в характеристике безусловного сгибательного
рефлекса у кроликов при 40-минутном воздействии,
мМ/кг.
Пкум — поправка на кумуляцию, определяемая как
отношение концентраций: пороговой при однократном
воздействии к пороговой при 6-недельном опыте.
При установлении ПДК вредных
веществ в воде ориентируются на минимальную
концентрацию вещества по одному из следующих
показателей.
ППКорл — подпороговая концентрация (1 балл)
вещества в водоеме, определяемая по изменению органо-
лептических характеристик (запах, цвет, привкус), мг/л.
ППКс.р.в — подпороговая концентрация вещества,
определяемая по влиянию на санитарный режим
водоема сапрофитной и другой микрофлоры, мг/л.
ППКт — подпороговая концентрация вещества в
водоеме, определяемая по токсикологическим
характеристикам, мг/л.
ПДКв — предельно допустимая концентрация
вещества в воде водоема, мг/л.
ЛД5о — летальная доза вещества, вызывающая при
введении в организм гибель 50 % животных, мг/кг.
Значения ЛД5о выражают также в миллимолях на 1 кг
(мМ/кг). Для перевода мг/кг в мМ/кг надо исходное
значение ЛД5о разделить на молекулярную массу и
умножить на число атомов металла, входящих в молекулу
вещества.
Предельно допустимое количество (концентрация) 232
В СССР действуют утвержденные Государственной
санитарной инспекцией «ПДК вредных газов, паров и
аэрозолей в воздухе рабочей зоны» для 445
загрязняющих веществ и «ПДК вредных веществ в атмосферном
воздухе населенных мест» для 103 загрязняющих
веществ, наиболее важные из которых приведены в
таблице 1.
1. ПДК вредных веществ в атмосферном воздухе
(по Г. П. Беспамятнову, Ю. А. Кротову)
Вещество
ПДК,мг/мз
максимальная разовая
среднесуточная
Сернистый ангидрид
Хлор
Сероводород
Оксид углерода
Сажа (копоть)
Фосфорный ангидрид
Серная кислота
Фенол
Мышьяк
Свинец
Ртуть металлическая
Бензол
Бензин (нефтяной)
0,5
0,10
0,03
3,0
0,15
0,15
0,3
0,01
—
—
—
1,5
5,0
0,05
0,03
0,01
1,0
0,05
0,05
0,1
0,01
0,003
0,0007
0,0003
0,8
1,5
За основу установления ПДК в воде принято
гигиеническое нормирование с учетом органолептических
свойств воды (запах, вкус, окраска), биохимических
процессов минерализации органических веществ в
водоемах. При определении ПДК вредных веществ в воде
ориентируются на их минимальную концентрацию; ПДК
установлены для 420 наименований вредных веществ.
Ниже приведены показатели ПДК (мг/л) для
важнейших вредных веществ в воде (Беспамятное, Кротов,
1985):
Бензол 0,5 Цианиды 0,1
Нитробензол 0,2 Этилмеркурхлорид 0,01
Нитрофенол 0,06 Бензин 0,1
Вольфрам 0,1 Керосин 0,1
Мышьяк 0,05 Нефть 0,1
Никель 0,1 Карбофос 0,05
233
Предельно допустимое количество (концентрация)
Ртуть
Свинец
Сурьма
Фтор
0,005
0,1
0,05
1,5
Хлорофос 0,05
ПАВ (поверхностно- 0,5
активные вещества)
В СССР утверждены нормативы ПДК
радиоактивных веществ в воздухе и воде (табл. 2).
2. ПДК радиоактивных веществ в воздухе и воде
Элемент
Уран
Фосфор-32
Сера-35
Кобальт-60
Стронций
Следует о-
Воздух рабочи
Бк/л
5,55-108
3,7
37
(1,8)5
0,185
гметить,
х помещений
кюри/л
Вода открытых водоемов
Бк/л
0,015 1,85-109
Ы0-10 3,7-102
МО-9 11,85-105
5.-10-11 1,85-102
5-аО"12 18,5
что все указанные
кюри/л
0,05
1-10-8
5-Ю-6
5-Ю-9
5-'Ю-10
нормативы
ПДК периодически уточняются.
Наиболее сложен вопрос установления ПДК
вредных веществ (биоцидов, нефтепродуктов, тяжелых
металлов) в почвах.
ПДК некоторых загрязняющих веществ в почве
(мг/кг воздушно-сухой почвы) характеризуются
следующими показателями:
ддт
гхцг
Линдан
Полихлорпинен
Полихлоркамфен
Севин
Прометрин
Хлорофос
1,0
1,0
1,0
0,5
0,5
0,05
0,5
0,5
Карбофос
Хлорамин
Бензпирен
Бутилацетат
Метанол
Метафос
2,0
0,005
0,02 (над
фоном)
0,1
1,5
0,008
Нормативы содержания в почве установлены для
сравнительно небольшого набора загрязняющих
веществ, преимущественно биоцидов и ПАУ.
Разрабатываются такие нормативы содержания в
почвах тяжелых металлов.
Пробоотбор 234
В ФРГ, например, приняты следующие ПДК
элементов в почве, мг/кг:
Мышьяк
Кадмий
Кобальт
Хром
Медь
Стронций
Олово
20
3
»50
100
100
10
50
Ртуть
Молибден
Никель
Свинец
Сурьма
Ванадий
Цинк
2
5
50
100
5
50
300
В СССР указанные нормативы для почв имеют
следующие значения:
Мышьяк
Ртуть
Свинец
20
2 Л
20 (над
фоном)
Хром
лентный
Кадмий
Никель
шестива- 0,
5
60
Разработка ПДК для почв позволит установить
критерии для ограничения выбросов предприятий.
Важнейшие задачи в этом отношении — установление
предельно допустимых экологических
нагрузок на регион (ПДЭН) и предельно
допустимых величин выбросов предприятий (ПДВ).
Это требует особой системы исследований, так как надо
учитывать физико-географические условия района,
экологическую ситуацию, размещение населения,
технологический уровень предприятий, климат и т. д. Единого
ПДК для почв не должно быть — эти показатели будут
сильно варьировать в зависимости от конкретной поч-
венно-экологической обстановки, в которой необходимо
учитывать свойства почвы.
ПРОБООТБОР. Отбор проб объектов окружающей
среды (почв, растений, природных и промышленных вод,
горных пород, ила и т. д.), который проводят при мо-
ниторинге (см.) окружающей среды (см.).
Для районов интенсивной зоны земледелия
принципы пробоотбора соответствуют методике
агрохимического картографирования. Рекомендуется составлять
объединенные пробы из 5—8 индивидуальных
способом двойного смешивания в различных точках участка
площадью 100—200 м2. Согласно методике Почвенного
института, оптимальной площадкой для взятия проб бу-
235 Пробоотбор
дет участок площадью 1 га. Объединенную пробу
составляют из 20 почвенных проб, отобранных на глубине
0—20 см на пашне и на глубинах 0—5 и 0—20 см в лесу
и на лугу соответственно. На площадке закладывают
также почвенный разрез. Картографической основой
служат почвенные карты с использованием
топографических и ботанических карт. Отбор проб ведут по
восьми направлениям розы ветров.
По методике Госкомгидромета СССР (Ю. А. Из-
раэль, Н. К. Гасилина) основной пробоотбор объектов
природной среды проводят вокруг промышленно-энерге-
тических предприятий — один раз в год, весной, после
таяния снега в 64 точках, расположенных по восьми
направлениям розы ветров в радиусе до нескольких
десятков километров от предприятия. Кроме того,
дополнительно после уборки урожая отбирают пробы в 16
точках по четырем направлениям розы ветров.
На факультете почвоведения МГУ совместно с
Институтом экспериментальной метеорологии разработаны
«Методические указания по проведению полевых и
лабораторных исследований почв и растений при контроле
загрязнения окружающей среды металлами», которые
широко применяют при картографировании загрязнения
почв вокруг предприятий цветной металлургии. В
соответствии с Методическими указаниями пробоотбор
проводят следующим образом.
В полевой период отбирают объединенные пробы
почв на целине или многолетней залежи с глубины
0—10 см; на пашне — с глубины 0—20 см; на
территориях, занятых лесом, — из лесной подстилки; на
болотных почвах — верхний торфяной слой 0—20 см.
Объединенные пробы отбирают по основным направлениям
розы ветров. На характерных участках закладывают
разрезы, в которых по всей глубине почвенного профиля
отбирают пробы почв из генетических горизонтов.
Кроме того, берут пробы почв на пестроту
(вариабельность) содержания тяжелых металлов, пробы
растительного покрова, природных вод. Для выявления
потоков тяжелых металлов закладывают почвенно-геомор-
фологические профили, включающие элювиальный
(автономный), транзитный и аккумулятивный ландшафты
(см. Ландшафт).
Пробоотбор 236
Особенности выбора мест пробоотбора в населенных
пунктах
На территориях, прилегающих непосредственно к
заводу, обогатительной фабрике или руднику природные
ландшафты, а часто и рельеф нарушены, водосток
зарегулирован. Часто такие площади несут на поверхности
насыпной материал, в горных условиях, кроме того,
возможно террасирование склонов. Морфология и
состав насыпного слоя отличаются от соответствующих
признаков зональных почв, растительный покров
искусственный и, как правило, сильно угнетен.
Вокруг плавильных заводов, реже обогатительных
фабрик и рудников, расположены постройки бытового
назначения и жилые дома. Часто плавильные и
металлообрабатывающие предприятия, иногда обогатительные
фабрики, могут размещаться в черте города. Если
предприятие расположено в населенном пункте, городе, то
программа исследований и сбор проб для анализа на
тяжелые металлы должны учитывать планировку
населенного пункта, гипсометрические особенности
местности, высоту построек, густоту их расположения;
влияние этих факторов на направление потоков воздуха,
распределение атмосферных осадков и ливневого стока,
долю участия в загрязнении территории города
автотранспорта и местных предприятий.
В городе и поселке может оказаться несколько
источников загрязнения (см. Источник загрязнения),
неизбежны бытовое (локальное) загрязнение и наличие
неорганизованных старых или временных свалок,
сжигание мусора. В этих условиях землю (почву) приходится
брать под посадками деревьев вдоль улиц, в садах и
дворах. Там же собирают растительные образцы.
Пригородная зона имеет меньшую густоту застройки,
но обычно в ней расположено большое число
промышленных и бытовых предприятий, складов, мусорохрани-
лищ, кладбищ. Условия сбора материалов для анализа
во многом аналогичны городским.
В городах и пригородах территория имеет
искусственный рельеф, однако сохраняются повышенные
участки, с которых во время обильного снеготаяния и
ливней при отсутствии асфальтового или бетонного покры-
237 Пробоотбор
тия на дорогах происходит смыв почвы и пыли и
аккумуляция материала в пониженных частях улиц и
площадей, что следует учитывать при сборе проб для анализа
и интерпретации получаемых данных.
Особенности выбора мест пробоотбора в природных
и сельскохозяйственных ландшафтах
Пробоотбор в природных и сельскохозяйственных
ландшафтах ведут в соответствии с рельефом местности
и выделением сопряженных элементарных
геохимических ландшафтов (ЭГЛ) —см. Ландшафт.
Расчленение территории на ЭГЛ позволяет отобрать
пробы для анализа с учетом важнейших природных
явлений, которые могут изменить содержание тяжелых
металлов в отдельных компонентах техногенного
ландшафта (см. Техногенный ландшафт) и природной среды.
Так, в горных и речных долинах, депрессиях на плако-
ре, в балках, оврагах, макро- и мезозападинах
целесообразно выбрать площадки отбора так, чтобы включить
водораздел, склоны и понижения. Если склоны или дно
понижения с водотоком (горная или речная долина)
служат местом выбросов материалов, загрязняющих
почвы, площадки взятия проб располагают выше (по
долине, склону), затем в местах выбросов и ниже их, на
том участке, который непосредственно или в результате
приноса вещества водным потоком может содержать
поллютанты (см. Загрязняющие вещества).
При сочетании таких природных фаций, как горные
и предгорные ландшафты (склоны, шлейфы склонов,
подгорные равнины, низменности), отбор проб проводят
вдоль перечисленных форм рельефа, учитывая при этом
локальные сочетания — местные водоразделы —
склоны— понижения (долины). Для таких территорий
характерно изменение материнских пород, а если
превышение высот достигает 100 м, то выражена вертикальная
поясность растительного покрова и почв. Вдоль
сочетания: водоразделы — склоны — шлейфы склонов —
террасы рек — поймы площадки взятия проб также
располагают по направлениям, пересекающим все элементы
рельефа, сочетания биогеоценозов и с учетом
расположения источников загрязнения.
Промывка засоленных почв 238
ПРОМЫВКА ЗАСОЛЕННЫХ ПОЧВ. Прием
снижения концентрации солей в почвенном профиле до
допустимых для сельскохозяйственных культур уровней.
Для этого проводят поверхностное затопление
почвы, в результате которого нисходящий ток влаги
растворяет и выносит легкорастворимые соли за пределы
почвенного профиля. При промывке содовых
солончаков и солонцовых почв одновременно ведут химическую
мелиорацию, внося в почву гипс, отработанную серную
кислоту, железный купорос и т. д.
р
РЕАКЦИЯ ПОЧВЫ. Свойство почвы,
характеризующее степень ее кислотности или основности, которое
оценивают по содержанию ионов Н+ или ОН- в
почвенном растворе, водных или солевых вытяжках из почв.
Различают сильнокислую, кислую, слабокислую,
нейтральную, слабощелочную, щелочную и
сильнощелочную реакцию. Нейтральной считается реакция при
рН»7. В реальных почвах, не содержащих карбонатов,
только за счет С02 почвенного воздуха может
сформироваться кислая реакция со значениями рН до 4,5—5.
Поэтому рН около 6—7 уже свидетельствуют о
процессе накопления оснований в почвах.
Регулирование реакции осуществляют
известкованием кислых почв или кислованием щелочных. Реакция
почв — одно из важнейших свойств, влияющих на
растворимость в почвах токсичных веществ, в том числе
оксидов и гидроксидов тяжелых металлов.
Регулированием реакции можно в значительной степени снизить
токсичность накопленных в почве химических
загрязняющих веществ.
РЕГЛАМЕНТАЦИЯ КОЛИЧЕСТВА
ЗАГРЯЗНЯЮЩЕГО ПОЧВУ ХИМИЧЕСКОГО ВЕЩЕСТВА.
Ограничение количества загрязняющего почву вещества,
установленное нормативно-технической документацией
(см. Загрязняющее почву химическое вещество).
РЕЖИМ ПОЧВ ВОДНЫЙ. Совокупность всех
процессов и явлений поступления влаги в почвы, ее
передвижения, расхода и изменения физического состояния.
239 Режим почв водный
К числу процессов и явлений, которые определяют
как элементы водного режима, относятся:
поступление в почву дождевых и талых вод, конденсация
парообразной влаги, капиллярный подъем, замерзание,
размерзание, поверхностный и внутрипочвенный сток,
физическое испарение, поглощение влаги корнями
растения (десукция). В зависимости от количественного
соотношения этих явлений и, следовательно,
преобладающего направления передвижения почвенной влаги и
пределов колебаний влажности создаются различные
типы водного режима. Особенно большое значение для
водного режима почв имеет коэффициент
увлажнения— отношение среднегодовой суммы осадков к
среднегодовой величине испаряемости.
По классификации Г. Н. Высоцкого и А. А. Роде
выделяют следующие типы водного режима:
мерзлотный — наблюдается в тундровых и мерзлот-
но-таежных почвах области вечной мерзлоты.
Характерно постепенное оттаивание почвы сверху вниз с
образованием надмерзлотной верховодки, влага которой
расходуется на испарение и десукцию. Осенью почва
замерзает сверху, и мерзлота смыкается с вечномерзлым
слоем;
промывной — формируется в подзолистых, бурых
лесных, красноземных, желтоземных почвах тех
регионов, где осадки преобладают над испаряемостью
(коэффициент увлажнения >1). Характерно ежегодное
однократное или многократное промачивание почвенной
толщи до грунтовых вод;
периодически-промывной — свойствен серым лесным
почвам, выщелоченным и оподзоленным черноземам и
другим почвам областей, где сумма осадков примерно
равна испаряемости. Промачивание почвенной толщи
неежегодное;
непромывной — формируется в южных черноземах,
каштановых, бурых пустынных почвах, сероземах и
некоторых других почвах тех регионов, где испаряемость
превышает сумму осадков (коэффициент увлажнения
<1). Промачивание почвы происходит лишь на
определенную глубину, ниже находится слой с влажностью,
близкой к влажности завядания;
выпотной — формируется в почвах регионов, где ис-
Рекультивация почв 240
паряемость значительно выше суммы осадков, но при
условии близкого к поверхности залегания грунтовых
вод. Капиллярная кайма в течение всего года или в
отдельные сезоны достигает поверхности, грунтовые
воды выходят на поверхность;
десуктивно-выпотной — близок к выпотному водному
режиму, но капиллярная кайма залегает глубже и
влага расходуется преимущественно за счет десукции. Вы-
потной и десуктивно-выпотной типы водного режима
типичны для солончаков и солончаковатых почв.
Водный режим оказывает большое влияние на
миграцию в почвах растворимых загрязняющих веществ.
Очевидно, что в почвах с промывным, непромывным и
выпотным режимом эти вещества будут
соответственно попадать в грунтовые воды, накапливаться у нижней
границы промачиваемой толщи или в поверхностном
горизонте почв. Мерзлотный водный режим препятствует
удалению веществ, в том числе и загрязняющих, из
почвенного профиля.
РЕКУЛЬТИВАЦИЯ ПОЧВ. Система приемов по
восстановлению и оптимизации нарушенных
ландшафтов.
Рекультивацию земель, нарушенных
горными разработками, проводят в три этапа.
1. Подготовительный — обследование нарушенных
территорий, составление технико-экономического
обоснования, проекта рекультивации.
2. Горно-техническая рекультивация — этот этап
может включать химическую мелиорацию; выемку и
складирование гумусированного слоя почв и нетоксичных
пород для последующего использования; формирование
и планирование поверхности отвалов; формирование
потенциально плодородного корнеобитаемого слоя.
3. Биологическая мелиорация — направлена на
восстановление плодородия подготовленных в процессе
горно-технической рекультивации земель, превращение их
в полноценные лесные или сельскохозяйственные угодья
(посевы многолетних бобовых культур, люпина,
донника, люцерны с последующей запашкой, посадка
древесных пород).
В местах распространения плодородных почв и
нетоксичных вскрышных пород проводят сельскохозяйст-
241 Рекультивация почв
венную рекультивацию, состоящую из следующих
этапов: известкование, рыхление до глубины 60 см,
внесение удобрений, посев злаково-бобовой смеси, введение
специального севооборота с выращиванием многолетних
трав.
Рекультивация золоотвалов и
шламовых полей металлургических и других
промышленных предприятий заключается в консервации и
озеленении: поверхность отвалов покрывают
2—3-сантиметровым слоем почвы или плодородного грунта, затем
высевают многолетние травы (люцерна, донник, эспарцет,
кострец, ежа сборная, овсяница луговая), высаживают
саженцы древесных пород (береза, клен, осина).
При рекультивации шламовых полей предварительно
проводят мероприятия по закреплению поверхности
(битумизация, силикатизация, цементация, использование
полимеров, жидкого стекла с хлористым кальцием).
Рекультивацию выработанных
торфяников проводят в зависимости от типа выработки,
мощности слоя торфа, его качества, водного режима,
возраста выработки, степени загрязнения. На
торфяниках верхового типа после создания благоприятного
водного режима, внесения извести и минеральных
удобрений возделывают овес, вико-овсяную смесь, озимую
рожь. Торфяники низинного типа осваивают под
пропашные культуры, способствующие быстрой
минерализации органических соединений азота и фосфора.
Рекультивация почв, загрязненных
тяжелыми металлами и другими поллютан-
т а м и предполагает:
удаление загрязненного слоя и его захоронение;
инактивацию или снижение токсического действия
поллютантов с помощью ионообменных смол,
органических веществ, образующих хелатные соединения;
известкование, внесение органических удобрений,
сорбирующих поллютанты либо снижающих их
поступление в растения;
внесение минеральных удобрений (например,
фосфорные снижают токсическое действие свинца, меди,
цинка, кадмия);
выращивание культур, устойчивых к загрязнению.
16 Заказ 5937
Самоочищение почв 242
с
САМООЧИЩЕНИЕ ПОЧВ. Совокупность процессов,
происходящих в почве и приводящих к ослаблению или
полному освобождению от токсического действия
загрязняющих веществ (см.) различной природы.
Всю совокупность процессов самоочищения (деток-
сикации) почв можно разделить условно на
физические, биологические и химические (см. Детоксикация
почв).
Физическое самоочищение наиболее
значимо для веществ, не претерпевающих химических
превращений за время пребывания в почве. При физической
детоксикации большую роль играет
гранулометрический состав почв (легкие или тяжелые почвы).
Химические свойства почв играют второстепенную роль.
Физическое самоочищение может проходить при участии
таких процессов, как разбавление, фильтрация с водами
(или, наоборот, физическая адсорбция загрязняющих
веществ) в почвах.
Биологическое самоочищение
представляет собой совокупность процессов метаболизма (в
случае легкоусваиваемых биогенных веществ) и
биоконцентрирования за счет комплексообразования, сорбции
(см. Комплексные соединения, Сорбция химических
веществ почвой), а также биодеградации вещества. Легко-
усваиваемые или биогенные вещества вовлекаются в
биологический круговорот. Их содержание при низких
уровнях загрязнения регулируется метаболическими
процессами. Химически инертные соединения могут
биологически адсорбироваться, что приближает их к
физическим процессам самоочищения. Микробиологическая
деградация загрязняющих веществ, способных к
химическим превращениям, зависит от биологической
активности почв (см. Активность почв биологическая) и
природы загрязняющих веществ.
Химическое самоочищение происходит
посредством вступления химических загрязняющих
веществ в реакции с химическими компонентами почв —
например, реакции гидролиза, окисления —
восстановления, химической сорбции, различные каталитические
243 Самоочищение почв
реакции. Химическая детоксикация почв зависит от
химического состава почвенного поглощающего
комплекса (см.), содержания гумуса (см.) и других
компонентов почв.
Способность к самоочищению в результате
естественных процессов служит показателем устойчивости почв
к воздействию химических загрязняющих веществ. По
данным М. А. Глазовской, почвы, относящиеся к одной
геохимической ассоциации, обладают одинаковой
устойчивостью к химическим загрязняющим веществам
(нейтрализация кислых загрязняющих веществ в щелочных
почвах и щелочей в кислых почвах).
Факторы, характеризующие способность к детокси-
кации продуктов техногенеза в природной среде и
почвах, по М. А. Глазовской (1988), могут быть объединены
в три основные группы.
1. Факторы, определяющие интенсивность выноса и
рассеяния продуктов техногенеза: осадки (по сезонам);
скорость ветра (по сезонам); сток (по сезонам);
соотношение осадков и испаряемости, геоморфологическое
положение в ландшафтной системе; гранулометрический
состав почв и грунтов.
2. Факторы, определяющие интенсивность
метаболизма продуктов техногенеза: сумма солнечной
радиации, кДж/год; сумма температур выше 0°С; количество
ультрафиолетовой радиации; число гроз в году; скорость
разложения органического вещества (опадо-подстилоч-
ный коэффициент — см.); интенсивность
фотохимических реакций.
3. Факторы, определяющие возможность и
интенсивность закрепления в ландшафтах продуктов
техногенеза или их метаболитов: щелочно-кислотные условия;
окислительно-восстановительные условия; сорбционная
емкость; количество гумуса; тип геохимических арен
(открытые — замкнутые, контрастные — неконтрастные);
геохимические барьеры (см. Барьеры геохимические)-,
исходный запас элементов, участвующих в техногенных
потоках; минералогический состав почв и грунтов;
процессы надмерзлотной ретинизации; число и
продолжительность туманов в году; число и продолжительность
штилей в году.
Рассмотренные показатели носят в основном клима-
Санитарная охрана почв 244
тический или почвенно-геохимический характер. Почвен-
но-геохимическими барьерами, задерживающими и
изменяющими форму химических загрязняющих веществ,
служат щелочно-кислотный,
окислительно-восстановительный, сорбционный, биогенный. Эти барьеры
находятся в пределах почвенного профиля и играют
большую роль в детоксикации различных загрязняющих
веществ.
Классификация М. А. Глазовской учитывает в
основном физико-химическое самоочищение почвы.
Существенную роль в разложении и детоксикации
загрязняющих веществ в почве играют микроорганизмы,
особенно это касается веществ, имеющих органическую
природу (пестициды, углеводороды нефти).
От химического и микробиологического состава почв
в значительной мере зависит скорость детоксикации
или время самоочищения почв (см.).
САНИТАРНАЯ ОХРАНА ПОЧВ. Система
организационных и санитарно-технических мероприятий,
направленная на предотвращение загрязнения почв
нечистотами, промышленными и бытовыми сточными водами, а
также не допускающая внесение в почвы
экскрементов животных, аэрозолей микробиологических
производств.
С бытовыми отбросами в почву могут попадать
потенциально опасные микроорганизмы — патогенные и
токсикогенные, способные вызвать кишечные инфекции
и пищевые отравления у человека, эпидемические
заболевания у животных» токсикозы у растений.
В санитарно-эпидемиологических почвенных
исследованиях определяют содержание в почвах бактерий
кишечной палочки (Escherichia coli), возбудителей
столбняка (Clostridium tetani), сибирской язвы (Bacillus
anthracis), газовой гангрены (Clostridium perfringens)
и др.
Бактериальные энтомопатогенные препараты (энто-
бактерин, дендробациллин, боверин) содержат споры
бацилл, которые в течение многих лет сохраняются и
размножаются в почве. Часто патогенные
микроорганизмы попадают в почву с илом сточных вод, применяемых
в качестве удобрений и с экскрементами животных.
Санитарное состояние почв зависит от способности
245 Санитарная охрана почв
почв к самоочищению (см. Самоочищение почв).
Механизмы, лежащие в основе самоочищения, могут быть
разнообразными. Время самоочищения почв (см.)
зависит как от условий, в которые попадают патогенные
микроорганизмы, так и от их вида. В почве Salmonella
typhi существует до 120 дней после внесения ее с илом
сточных вод, другие сальмонеллы — более 250 дней;
Streptococcus faecalis — до 80 дней, Endamoeba
histolytica— 6—8 дней (во влажной почве) и Ascarisova —
более 2000 дней, а некоторые из них могут
существовать на овощах 60 дней.
В некоторых случаях при загрязнении небольших
территорий рекомендуются для очистки почв
химические дезинфицирующие средства (формалин, оксид
этилена, тиазол и др.) или специфические препараты
пестицидов. Одна и та же доза загрязняющего вещества
может вызвать повреждения разной степени, поэтому
при нормировании следует учитывать, что единого
значения ПДК для различных почв не существует.
При внесении осадков сточных вод в
качестве удобрения необходимо для сохранения
нормального санитарного состояния почв соблюдать
следующие требования:
использовать осадки под полевые культуры не ранее
чем после трех месяцев хранения. Свежие осадки
применять не рекомендуется, поскольку они содержат
различных жизнеспособных паразитов;
осадки, предназначенные для использования в
качестве удобрений на пастбищах, должны храниться в
течение шести месяцев;
осадки, которые заделывают в почвы вспашкой на
участках, где высевают различные кормовые культуры,
могут храниться лишь один месяц;
средства, на которых транспортировали осадки,
хранившиеся менее трех месяцев, нужно подвергать
дезинфекции каждый раз перед использованием для других
перевозок;
в случае эпидемий или эпизоотии чумы свиней,
ящура, а также болезней, вызываемых другими быстро
распространяющимися возбудителями (туберкулез, острый
сальмонеллез, бруцеллез), рекомендуется накрывать
стеллажи для сушки осадков пленкой.
Селективность катионного обмена 246
Осадки сточных вод употребляют обычно после
компостирования с навозом. Добавление
концентрированного ила (до 50—85 % влаги) и частичная ферментация
в равных количествах с навозом дает возможность
получить компост, более богатый питательными и
органическими веществами, чем компостированный навоз. При
компостировании такого ила создается температура
60—70 °С, что способствует уничтожению патогенов, и
конечный продукт отвечает санитарным нормам.
СЕЛЕКТИВНОСТЬ КАТИОННОГО ОБМЕНА.
Избирательное (преимущественное) поглощение почвой
катионов одного рода по сравнению с катионами
другого рода в процессе катионного обмена.
Это значит, что при равных активностях (см.
Активность ионов в почвах) в равновесном растворе один из
двух катионов поглощается почвой в больших
количествах и удерживается более прочно. Селективность
катионного обмена зависит от свойств катионов ;и от
состава ППК (см. Почвенный поглощающий комплекс).
При прочих равных условиях предпочтительнее
поглощаются катионы с более высоким зарядом и с более
высокой атомной массой. Поэтому во многих случаях
селективность катионного обмена возрастает в рядах:
Li+<Na+<iNH4+<K+<Rb+<Cs +
Mg2+<Ca^<Ba2+
Al3+<Fe3+
Для преобладающих в почве глинистых минералов
(см.) ряды поглощения выглядят следующим образом:
монтмориллонит Li-b<Nia+<K+< Rb+ <(Mg2+<;
<Ca2+=Sr2+<Ba2+
каолинит Li+<Na+<K+< Rb+<Mg2+<Ca2+=
= Sr2+=Ba2+
мусковит Li+<Na+<Mg2+ <jCa2+<Sr2+<Rb+<
<Cs+<K+<Ba2+
При обмене на монтмориллонитах, вермикулитах
(см.) и других минералах с лабильной решеткой часть
катионов входит в межпакетные промежутки (см.
Межпакетная сорбция веществ). В этом случае в
большем количестве поглощаются катионы наименее гидра-
тированные и соответствующие по размерам величинам
247 Селективность катионного обмена
пустот в тетраэдрической сетке, то есть К+, Rb+, Cs+.
Поэтому многими почвами, обедненными органическим
веществом, с высоким содержанием глинистых
минералов указанные катионы поглощаются более энергично,
чем двухвалентные.
Активными центрами органической части ППК
служат кислые функциональные группы — карбоксильные
и фенольные. Селективность катионного обмена на этих
центрах обусловлена различной прочностью связи
катионов с функциональными группами и зависит от
расположения последних в молекулах специфических
органических кислот. В целом органическое вещество почв
более селективно к поливалентным катионам по
сравнению с одновалентными.
Селективность катионного обмена оценивают
величиной коэффициента селективности (/Сс), который в
самой общей форме может быть рассчитан как частное от
деления отношения содержания двух катионов в ППК
на отношение их активностей в равновесном растворе.
Большая часть современных подходов к оценке
коэффициентов селективности основана на законе
действующих масс. Существует несколько уравнений для
вычисления /Сс. Они отличаются друг от друга, поскольку
отдельные авторы несколько по-разному записывают
исходную реакцию обмена катионов и пользуются
различными размерностями для оценки количества катиона в
твердых и жидкой фазах. Наиболее широко
распространенные уравнения для вычисления коэффициентов
селективности даны на примере катионообменной
реакции с участием Na+ и Са2+.
Уравнение Вэнслоу
ПСа + 2Na+^nNia + Са2+
M2NaaCa2+
Ас = *
МСа aW
Уравнение Никольского
nCa0,5 + Na+^nNa + 0,5Ca2+
MNa aVca*
^•с==: M'/2CaaNa+
Уравнение Гапона '(полуэмпирическое)
П Gao,5 +(Na+=e*n Na + 0,5Са2+
Сера в почвах 248
v 5NaaV2Ga2+
д с =
OCaaNa4"
В этих уравнениях: П — твердые фазы почвы; а^А+ и
Яса2+ — активности ионов Na+ и Са2+ в равновесном
растворе; М — мольная доля катионов в ППК; 5 —
количество катионов в ППК, мг-экв на 100 г почвы.
Основная трудность в определении Кс заключается
в том, что эта величина не постоянна и сама зависит от
доли катиона в ППК, поскольку последний обладает
полуфункциональностью — наличием энергетически
разнородных адсорбционных центров с разной
селективностью по отношению к тому или иному катиону.
Поэтому коэффициент селективности следует рассматривать
скорее не как константу обмена, а как коэффициент
распределения катионов между твердыми фазами и
раствором, который сам изменяется по мере изменения
доли катиона в ППК.
Величины коэффициентов селективности широко
используют для оценки селективного поглощения
почвами многих загрязняющих веществ, поступающих в
почвы в катионной форме.
СЕРА В ПОЧВАХ. Сера — необходимый для живых
организмов элемент, обязательный в питании растений.
Сера попадает в окружающую среду при вулканической
деятельности, окислении сероводорода, поступающего в
результате жизнедеятельности бактерий — десульфури-
заторов; при окислении с поверхности рудных
месторождений.
Значительный источник серы в настоящее время —
техногенные выбросы предприятий металлургической,
нефтяной и других видов промышленности. Технофиль-
ность (см.) серы, равная отношению массы ежегодной
добычи этого элемента к его кларку, высока и
составляет 4-Ю8. Присутствие оксидов серы в атмосфере
оказывает негативное влияние на жизнедеятельность
животных и растений: сера взаимодействует с кислородом
воздуха с образованием S03 и в конечном счете H2S04.
Выброс техногенного сернистого газа в атмосферу
составляет 30 °/о общего поступления серы в атмосферу.
Ежегодный прирост серы в форме S042~ составляет
около 1,54-1012 моль/год (без учета поступления
техногенного S042- из отходов переработки сульфидных руд).
249 Сода в почвах
Прирост серы в океане (за счет S042~) оценивается как
ЫО12 моль/год, что составляет менее 3• 10-6 % общего
количества серы в воде.
Содержание серы в осадочных породах выше, чем в
изверженных и составляет 0,3 %. Среди осадочных
пород наиболее обеспечены серой глины (0,24 °/о),
несколько меньше ее в карбонатных породах (0,12 %),
наименьшее количество серы в песчаниках (0,024 %). Среди
изверженных магматических пород высокое содержание
серы отмечается в интрузиях, к которым приурочены
сульфидные руды.
В пахотных горизонтах разных почв обнаружены
следующие количества серы, мг/100 г почвы:
Дерново-среднеподзолиста я
почва
легкосуглинистая
Дерново-подзолистая суглинистая
кровном суглинке
Чернозем обыкновенный
» южный
Черноземы оподзоленные на
Темно-каштановая почва
Каштановая »
Светло-каштановая »
Желтозем
Краснозем
А'ллювиально-луговая почва
Торф
почва
суглинках и ]
на
пошлинах
il 7,0
30,5
65,8
55,0
54,1
34,0
26,5
32,1
31,0
60,0
30,0
240—1940
Сера в почвах представлена органическими и
неорганическими соединениями, соотношение которых
зависит от типа почвы и глубины залегания генетического
горизонта. Наиболее доступна растениям сульфатная
форма, ее содержится не более 10—25 % общего
количества серы.
Формы поступления серы в почвы зависят от
многообразия ее соединений в атмосфере, состава газовых
выбросов предприятий, погодных условий, времени
нахождения в аэрозольном состоянии. Основные
поступления серы в почву происходят с пылью и кислыми
дождями (см.), причем, по данным М. А. Глазовской,
В. И. Учватова, с пылевой фракцией серы поступает в
десятки раз больше, чем с кислыми дождями.
СОДА В ПОЧВАХ Na2CO3-10H2O. Натриевая соль
угольной кислоты, вызывает крайне отрицательные ток-
сико-экологические ситуации как в отношении свойств
Сорбция анионов почвами 250
почв, так и в отношении развития растений и получения
урожаев сельскохозяйственных культур.
Чаще всего содой называют просто карбонат натрия,
хотя в почвах может встречаться не только собственно
сода, но также нахколит NaHC03 и трона Na2C03X
XNaHC03-2H20. Единой теории происхождения соды в
почвах пока нет. Предложены гипотезы образования
соды за счет выветривания кристаллических пород, в
результате реакции карбоната кальция с хлоридом
натрия (или сульфатом натрия), за счет ионообменных
реакций (К. К. Гедройц) или путем развития процессов
сульфатредукции в переувлажненных, богатых гумусом
и сульфатами почвах. Ни одна из этих гипотез не нашла
окончательного подтверждения, но можно полагать, что
отдельные из перечисленных механизмов реализуются
в конкретных ситуациях.
Вспышки щелочности в почвах далеко не всегда
вызваны образованием соды, во многих случаях они
обусловлены растворением и гидролизом карбонатов
кальция в условиях, изолированных от поступления С02 из
почвенного воздуха (атмосферы).
СОРБЦИЯ АНИОНОВ ПОЧВАМИ. Процесс
удаления из почвенного раствора химических элементов в
форме отрицательно заряженных частиц (фосфора,
фтора, мышьяка, молибдена, селена, сурьмы).
Они поступают в почвы в естественных условиях при
выветривании и почвообразовании, на антропогенно
нарушенных территориях — при внесении в составе
удобрений и химических средств защиты растений и как
загрязняющие вещества техногенного происхождения.
Формы и соотношение частиц, в составе которых анио-
ногенные элементы находятся в растворе, обусловлены
реакцией среды, окислительно-восстановительным
потенциалом, солевым составом раствора. Анионы
поглощаются преимущественно — тонкодисперсными
алюмосиликатами, свободными оксидами и гидроксидами
железа и алюминия (см.), органическими веществами.
Особенно активно процесс поглощения протекает в
условиях кислой реакции, когда свободные оксиды и гид-
роксиды железа и алюминия, органические вещества
белковой природы несут положительный заряд и
способны к ионообменному поглощению анионов (см. Об-
251 Сорбция химических веществ почвой
мен ионный). При рН выше 6 ионообменная сорбция
анионов снижается.
Наибольшие количества анионов удерживают гид-
роксиды алюминия, особенно аморфные и свежеосаж-
денные: 1 кг гидроксида поглощает до 50 г фтора и до
90 г мышьяка. Почвы в целом поглощают на порядок
меньше анионов, чем чистые препараты гидроксидов.
Адсорбированные соединения медленно
трансформируются в поверхностные соединения типа фторалюмоси-
ликатов или ферроалюмофосфатов.
При взаимодействии анионогенных химических
элементов с металлами почвенного раствора возможно
образование солей, например, арсенатов марганца или
свинца, флюорита.
Снижая концентрацию As, Se, Sb, Mo в почвенном
растворе, процессы сорбции играют важную роль в
регулировании уровня загрязнения почв этими
элементами, а также в способности почв сопротивляться
загрязнению.
СОРБЦИЯ ХИМИЧЕСКИХ ВЕЩЕСТВ ПОЧВОЙ.
Поглощение химических веществ из растворов и газов
твердыми фазами почвы.
Сорбцию загрязняющих веществ часто описывают
уравнением Лэнгмюра:
Уравнение связывает максимальную предельную
сорбцию (Soo), представляющую собой характеристику
той поверхности, на которой происходит сорбция,
показатель способности вещества сорбироваться (К —
отношение скоростей процессов сорбции и десорбции
вещества), равновесную концентрацию (С) и количество
сорбированного вещества (S). Графическое изображение
этой зависимости — изотерма сорбции загрязняющих
веществ часто имеет S-образную форму, связанную со
ступенчатым характером поглощения.
Знание количественных закономерностей сорбции
загрязняющих веществ позволяет прогнозировать уровень
их концентрации в почвенном растворе, прочность связи
с твердыми фазами почв, оценивать максимальную
сорбционную способность почв в отношении этих
веществ и способность последних к миграции.
Стандартизация 252
Сорбционные процессы влияют на плодородие
почвы и ее защитные функции. С этими процессами
связано создание водопрочной структуры, удерживание
питательных элементов, эффективность известкования
кислых почв и гипсования солонцов, поглощение токсичных
веществ, буферность почв при воздействии на них
кислых осадков и тяжелых металлов.
СТАНДАРТИЗАЦИЯ. Установление строго
определенных нормативов (качества), порядка работ, или
правил, обязательных для предприятий, организаций.
К объектам стандартизации в области охраны почв
и рационального природопользования относятся:
термины и определения, классификация, номенклатура
показателей качества природных сред, правила,
требования, нормы и нормативы, методики, методы и
средства контроля. Один из важных этапов стандартизации
методов исследования — создание стандартных
образцов разного назначения.
Стандартные образцы почв предназначены
для контроля правильности измерений содержания
различных химических элементов и веществ в почвах
физико-химическими и химическими методами, а также для
градуирования анализаторов состава.
Например, в СССР изготовлены следующие
стандартные образцы в соответствии с ГОСТ 14263—69,
внесенные в Государственный реестр мер и измерительных
приборов СССР (по разделу «стандартные образцы»):
СП-1 (курский чернозем); СП-2 (дерново-подзолистая
почва); СП-3 (светло-каштановая почва) и др.
В стандартных образцах аттестовано содержание
следующих компонентов: Si02, Ti02, A1203, Fe203, МпО,
MgO, CaO, K20, Na20, P205, S, B, Ba, Be, Co, Cr, Cu,
Cs, F, Ga, La, Li, Mo, Nb, Ni, Pb, Rb, Se, Sn, Sr,T, Yb,
V, Zn, Zr (в % на материал, высушенный при 105 °С),
и дана характеристика вещественного минерального
состава образца: определено процентное содержание
кварца, полевых шпатов, слюд и гидрослюд, других
первичных минералов, хлорита, монтмориллонита,
каолинита, смешанно-слойных минералов, оксидов и гидрок-
сидов железа.
Разработаны и аттестованы стандартные
образцы растений: СБМТ-02 — злаковая травосмесь
053 Стандартизация
(№ 3170—85 по ГОСТ); СБМК-02 — клубни
картофеля (№ 3169—85); СБМП-01—зерно пшеницы
(№ 1484—78). В стандартных образцах растений
аттестовано содержание следующих компонентов: белок,
сырая зола, сырая клетчатка, крахмал, углеводы,
аминокислоты: аланин, аргинин, аспарагиновая кислота, ва-
лин, гистидин, глицин, глутаминовая кислота, изолей-
цин, лейцин, лизин, метионин, пролин, серии, тирозин,
треонин, фенилаланин, цистеин (в % на материал,
высушенный при 105 °С).
Важнейшее направление и форма стандартизации —
разработка систем справочных данных (СД). Для этих
целей создана государственная служба стандартных
справочных данных (ГСССД) Госстандарта.
В соответствии с планами государственной
стандартизации с 1974 г. разрабатывается комплекс стандартов
в области охраны природы и рационального
использования природных ресурсов (номер комплекса 17). ГОСТ
этого комплекса 17.0.0.01—76 (СТ СЭВ 1364—78)
«Система стандартов в области охраны природы и
рационального использования природных ресурсов. Основные
положения» определяет цели, задачу и структуру
комплекса, а также объекты стандартизации в области
охраны природы.
Группа стандартов по охране природы и
рациональному использованию почв разрабатывается с 1979 г. и
имеет номер 17.4. В настоящее время в этой группе
утверждены и введены в действие ряд ГОСТ, в том
числе ГОСТ по терминам химического загрязнения,
классификации химических веществ для контроля загрязнения,
методам отбора и подготовки проб почвы для
химического, бактериологического и гельминтологического
анализа, требования к контролю и охране почв от
загрязнения, общие требования к методам определения
загрязняющих веществ.
Стандарты по почвам (агротехнические нормы,
методы определения, термины) входят также в группы
COO, C02, С09 (раздела «С» — сельское и лесное
хозяйство. Помимо стандартов, относящихся
непосредственно к почвам, существуют стандарты в смежных с
почвоведением областях (ТЧО, Т02, СОО):
например, 17.1 — Охрана природы. Гидросфера; 17.2 —Охра-
Стандартизация
254
S К
s s
=f X
cd a
m cq
s о
D. 2
cd S3
r< О
X С
л о
Н ВС
<-> о
о.
SI
ш о
О U
н о
X X
<l> A
s ч^
>> 5 си
* Е 3
О О и
ских д
и раци
ународ)
cu R.
£з*
X О *
н я s
мативно-
раны пр
в СССР
»«х си
о о s
*
**£
X *-> 2Г*
£ «в £
S в Н
1!^
с м>—'
г
н
О)
а
о
о»
и
коичание
о
| введение 1
2 1
X
V
о
ч
0)
S
X
се
о
X
со
я
S
СО
а:
к
S
о,
t,
<и
н
ed
а
1
я
я
cd О
р. Н
(П
Ю Ю <N LO ^*
00 00 00 000О
—«' ~ оо о—*
р р о —«о
о о S SS
я
я
я
а>
&•
я
я
Cd
U3
$5
р
О
<L)
О
£: со ю
90 оо оо
2 ^ "* s
О о о О
S
я
я
я
си
S4
сз
я
со
о
ХО
о
а
я
я
S
о,
О)
н
О)
я
н
О)
VO «
о
я
я
ч
ч:
я
3 ь
о- &
о» я
н
. « й
>—^ я я
Ея£
&S
as *
я °°
£ P «
8 S
• CD •*
a S я
g Я-&
о s я
я g
cd 5
О
R
cd
\o
о
ex
я
>»
о,
о
xo
н
о
я
я
я
О я *§С
НиО о-О
о.
*!
cd S
со о
Я £
ч
о
?£
яс
So
cd
_ Ч
-OI Я
Н-* W О
££ .
о а> f-<
8so
о 2
2 ^
я \о
Sgo
ЯВ|-н
>> edl—I
Оняг<
cd <ut=?
я чО
я я
о я
ч я
о си
ч
О <D
я л
И" Н Я
§ о о
о 55 s
«=t О, cd
° м **
4 5 р
Я л Н
я си
ej « S
« ч
* °° 5
о «и g
* 5S <
tf О
я » 2
s §н
8 Is
<У № Я
о
я
я
о
я
2
§
Он
н
я
о
«
CD
я
вО
нВД
ogo
О) Я
я я
cd
X Я
я о
я*\о
9 а,я
я н s
я я
со . а>
Км Я
*-* С R
Cd /-ч Он
со vJ t_
я
Я
Я
о
ч
§1
н
ХО Я
о я
я л
ч
я
8°
So
я
я о
ч
cd О
ОнЯ
О Он
хо «
о « ed
«d со
„хо я
а ч
5-2
о о я
ed
cd
^!хо
О о
и о
'с-н О Ьх
О) О
с * ¥
ОЙ5
00
I
со
Н
О
СО
оо
I I
Н
U
о
со°о
Р go
(N ^f CM
о Go
U
СО го ^
°oS°o
I I I
oJJq
CO 00 CO
Ouo
UwU
Гю СГЮ
Ml1
J, со Л"^
PpSp
Tf CO Th CO
"^ ^JH* "St4 ^jH
CQ ^ PQ b."
UhUh
Muhu
и
о
а
о
255
Стандартизация
§
Я
X
я
о>
анич
сх
U
о
со
CU
Ю .
оо
.01.9
.01.9
оо
я
я
я
аниче
о же
схн
и1^
о
со
<L>
Е4
о
о
о
оо
Г-00
So
оо
о о
So
CD
оо
О
00
о
ю
00
о
и
й ^£
Й 2 ч
л* я
5 s Д
со со £
oS agi
^S я я со
Е <и со
IS сх a, cu 5
я м S
3 — о, я о
я
сз
CQ
Я
ч
О*
^ ,
о S я ц о
ч а » s "
S-u §
2 3 со со я
oSoo S2оо
ex000
g я •
^ я л
III
2 «5
О СХЮ
ю a £
со ^
.- « Ч
я я >>
u я «
о «J <"
о, «Л
Я н о
Я о> СХ
CO jg Я
slg-
си vo
|£|'
я S
н си
я со
я
О й>
"I
о о
я я
со
я
2 о
я &
я s
ф
ч я
а> сх
с=С С
а>
« £-Я
I о «
Я w £Г
я о
л « я
CQ
CU №
5 S о
я я ч
0) Я cj
со са
* 8 о .
я
м
я
н
Я
я
о
я
1=1
о
я
а, а,
о
я я
я
я х
си я
II
си со
5 <и
, о я
« о
gB
Я я
5*
&>§
58
S*
СХ
X
я Я
я
5 э
Ш я
Я /~Ч
сх п
cu g
s2
1*
SH о сх g
о . о ХС0 Я
м *=c за. S,
схй Ч Я Д о
нО я чО я
С
о
о
я
л
ч»я
cd <Х)
Я «=С
«8
с я
си
Я
я я
я н
га х
£ я
2
я £
!-Г °^
ез
Я
cd
cu
»Я
Ч ^
CU R
ш о
СХМ
§5
»&| СО
Я
У х
2 §
ч g
^ си
« Я
я я
я х
я
о" оо со со
HUhh
UHCJU
£^22
CO rf<
oooo
l i
9^
COCO
CD
о
CO
Ю
U
О
u
2? я x
О я s
а сх
оо
I
см
о
н я
ф СО
СП
О я
СХ ез
н Я
IS
J^ О су
Они
я
я
я я
Я к
S сх
« я
я к
я я
я я
со си
я д
о
о
д°
Н я
ч
О к
я я
О V
s §
Я н
я сх
я о
я я
сх
CU
л
с с
с с
о о
ю
н
О
О
о
о
со
ю
CQ
U
Н
О
ю
00
J,
о
со
ю
PQ
U
В
ю
00
о
см
ю
PQ
(D
О
Н
U
оо оо
oU
О О
СМ СМ
ю ю
CQ PQ
О) (Г)
О U
н н
и и
Стандарты качества окружающей среды
256
на природы. Атмосфера; 17.5 — Охрана природы.
Земли; СОО — Лесоводство; ТОО — Агрометеорология;
Т02 — Картография; ТЧО — Климат (табл.).
СТАНДАРТЫ КАЧЕСТВА ОКРУЖАЮЩЕЙ
СРЕДЫ. Совокупность единых требований к состоянию
природных и промышленных объектов.
В них предусмотрены меры, позволяющие обеспечить
оптимальное состояние окружающей среды, ее качество.
Состоят из технических, экономических,
организационных норм, определяющих качественные параметры
окружающей среды.
СТОЧНЫЕ ВОДЫ. Воды, отводимые после
использования в производственной и бытовой деятельности.
К сточным водам относят также дождевые ливневые
стоки с застроенных территорий.
В сточных водах содержится много вредных для
человека загрязняющих веществ органической и
минеральной природы. Поэтому они подлежат очистке и
обеззараживанию на очистных сооружениях, полях
орошения (см.), фильтрации (см. Поля фильтрации),
биологических прудах и т. д. Состав сточных вод весьма
разнообразен и зависит от характера производства, вида
вод. Высокое содержание тяжелых металлов (см.) в
стоках — наиболее важное препятствие для
использования сточных вод в сельском хозяйстве при орошении
культурных растений. Длительное орошение сточными
водами повышает в почвах уровень содержания Zn, Ca,
Ni, Cr, Pb, Cd, Hg.
При поливе сточными водами следует
контролировать также уровни содержания Ag, Ba, Co, Sn, As, Mo,
1. Содержание тяжелых металлов в осадках коммунальных
сточных вод, мг на 1 кг сухой массы*
Металл
Вид осадка
анаэробный
аэробный
Другие
Металл
Вид осадка
анаэробный
аэробный
Другие
Мп
Со
Н*
Мо
РЬ
400
8,8
1100
30
1640
420
—
7
29
720
250
4,3
810
27
1630
Zn
Си
Ni
Cd
Cr
2280
11420
400
106
2070
2170
940
150
135
1270
2140
1020
360
70
6390
257
Сточные воды
Bi, Mn и Sb. Сточные воды и их осадки — основные
агротехнические источники загрязнения почв тяжелыми
металлами (табл. 1). Во многих странах во избежание
внесения в почвы избытка тяжелых металлов введены
ограничения на их содержание в сточных водах
(табл. 2).
2. Требования к содержанию металлов в осадках сточных вод,
используемых для удобрения в некоторых странах, мг на 1 кг
сухой массы, не более*
Страна
США
Франция
ФРГ
Австрия
Нидерланды
Швейцария
Со
20
—
—
—
100
N1
150
100
200
—
50
200
As
—
—
100
—
—
Си
-!
750 1500
1500 3000
1200 3000
500 2000
500 2000
100
3000
РЬ
500
300
1200
100
500
1000
Сг
500
200
1200
—
500
1000
Cd
50
15
20
—
10
30
Hg
8
20
10
10
10
* Таблицы взяты из кн. Агрохимия /Под ред Б А. Ягодина (М , 1989).
Нормативы содержания микроэлементов (мг/кг
сухой массы) в сточных водах при орошении
сельскохозяйственных культур, по данным А. Кабата-Пендиас,
следующие:
As
В
Ва
Be
Br
Cd
Се
Со
Сг
Си
F
Ge
2—26
15—1000
150—4000
4—13
20—165
2—1500
20
2—260
20—40600
50—3300
2—740
1—10
Hg
Mn
Mo
Ni
Pb
Rb
Sc
Se
Sn
Sr
V
Zn
Zr
0,1—55
60—3900
1—40
46-5300
50—3000
4—95
0,5—7
2—9
40—700
40—360
20—400
700—49000
5-90
Различные сточные воды, в том числе используемые
для орошения и удобрения почв, могут стать
источником патогенных микроорганизмов, представляющих
серьезную опасность для человека и животных, а также
отрицательно влияющих на плодородие почвы, рост и
17 Заказ 5937
Сульфатредукция 258
развитие растений, качество, сельскохозяйственной
продукции. Опасность заражения зависит от
продолжительности жизни патогенов в почве и на растениях после
внесения с осадками сточных вод. Эти осадки,
используемые в сельском хозяйстве, должны быть
безвредными с точки зрения гигиены (см. Санитарная охрана
почв).
СУЛЬФАТРЕДУКЦИЯ. Восстановление почвенных
сульфатов до сульфидов в анаэробных условиях при
достаточном содержании в почве органического
вещества, осуществляемое с помощью сульфатредуцирую-
щих бактерий, относящихся к родам Desulfovibrio,
Desulfatomaculum и др.
В результате сульфатредукции происходит
непрерывная цепь превращений органического вещества и
сульфатов, KOTqpyio в обобщенной форме можно
выразить схемой
Na2S04 + 2С — + Nia2S + 2С02
Na2S + C02 + H20—^H2S+№2C03
Образующаяся сероводородная кислота связывается
в труднорастворимые соединения типа сульфидов
железа и других металлов, а в почвах накапливается сода.
Этот механизм образования и накопления соды вполне
реален для глубоких слоев озерных и морских вод, для
постоянно затопленных и богатых органическим
веществом ильменных и некоторых болотных почв.
т
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА ПОЧВЫ.
Свойства почвы, которые характеризуют ее как
термодинамическую систему, представленную твердыми,
жидкими и газообразными веществами.
Почва — биокосная система, где постоянно
происходят процессы физического и химического выветривания,
разложения растительного опада и отмерших почвенных
организмов, при этом из продуктов разложения
образуются вторичные глинистые минералы (см.), гумусовые
вещества (см. Гумус), и органо-минеральные
соединения. Водная миграция, гравитация, диффузия, фильтра-
259 Термодинамические свойства почвы
ция, адсорбция воды также изменяют состав почвы.
Постоянно происходящие в почве процессы обмена
веществом и энергией с внешней средой характеризуют
почву как термодинамически открытую систему.
Состояние любой термодинамической системы
определяет совокупность независимых параметров ее
состояния, или термодинамические свойства.
Термодинамическая система предполагает существование в ней
термодинамического равновесия, то есть
предельного устойчивого термического, механического,
химического равновесия, когда термодинамические
потенциалы системы минимальны и постоянны. Наряду
с этим в реальной системе возможны метастабильные
состояния, характеризуемые локальными участками
минимумов термодинамических потенциалов. Д. С. Кор-
жинский развил понятие о «мозаичном» равновесии,
при котором система в целом неравновесна, но в ней
протекают стационарные процессы, в результате чего
на отдельных участках создаются локальные
равновесия. В этих условиях параметры системы приобретают
постоянные значения либо последние меняются
медленнее, чем устанавливается равновесие. Такой подход
позволяет использовать аппарат равновесной
термодинамики для анализа состава природных вод, в том
числе почвенных растворов, для расчета условий
осаждения в почве солей, для анализа диаграмм состав —
свойство, рН-, ЕЬ-диалрамм.
Термодинамические свойства делятся на
интенсивные и экстенсивные. Те свойства, которые не зависят
от количества почвы, называются интенсивными.
К ним относятся температура, давление, химический
потенциал. Экстенсивные свойства: энтропия, объем,
масса — зависят от количества почвы.
Каждое из интенсивных и экстенсивных свойств
характеризует термодинамическое равновесие системы по
данному свойству. Изменение любого из основных
термодинамических свойств свидетельствует о протекании
в почве процесса и об установлении нового равновесия
со специфическим сочетанием свойств.
Количественные оценки процессов в почве,
протекающих с участием загрязняющих веществ, могут быть
получены путем анализа термодинамических систем,
Техногенез
260
содержащих эти вещества. Например изменение свойств
почвы при загрязнении ее кадмием можно изучать в
лабораторном эксперименте с системой, состоящей из
Са-монтмориллонита, Cd-монтмориллонита (см.
Монтмориллониты), находящихся в равновесии со
смешанным водным раствором солей СаСЬ и CdCb. При
увеличении количества CdCl2 в растворе происходит
квазиобратимый ионообменный процесс, который ведет к сдвигу
равновесия и к изменению в составе системы долей
СаС12, CdCl2, Са-монтмориллонита, Cd-монтмориллонита.
ТЕХНОГЕНЕЗ. Совокупность геохимических и
геофизических процессов, связанных с деятельностью
человека (Глазовская, 1988).
Техногенез включает:
извлечение химических элементов из природной
среды (литосферы, атмосферы, гидросферы) и их
концентрацию;
перегруппировку химических элементов, изменение
химического состава соединений, в которые входят эти
элементы; создание новых химических веществ;
рассеяние вовлеченных в техногенез элементов в
окружающей среде (рис.).
ТЕХНОГЕННАЯ ПУСТЫНЯ. Территория в зоне
интенсивного техногенного воздействия,
характеризующаяся сильными эрозионными процессами, отсутствием
верхнего гумусового горизонта, травянистого и
кустарникового яруса в составе растительного покрова,
значительным угнетением древесного яруса (суховершин-
ностью или полным выпаданием деревьев).
Представляет собой крайнюю степень деградации техногенного
ландшафта (см.).
Для техногенной пустыни характерно существенное
ухудшение механических, водно-физических свойств,
развитие вследствие этого такыровидной формы
поверхности. Техногенная пустыня часто развивается в
малоустойчивых, низкобуферных ландшафтах тундры,
средней тайги и хвойно-широколиственных лесов с
тундровыми глеевыми, дерново-подзолисто-глеевыми и
кислыми подзолисто-бурыми почвами.
ТЕХНОГЕННЫЙ ЛАНДШАФТ. Ландшафт, который
формируется под влиянием интенсивного техногенного
воздействия.
261
Техногенез
г»!
» et О
§ £
I i i I a
/К
I
2; - *
« л ±
ц i о
с ►- ш
° 2 о
2 X *
Я s-
» >. о.
f S 8
I V ш * I
1_^ 0 к о _|
* Г К X
9- S
ill
i ** л
^ л =С
2 § rf
и < и
Г»
0)
-8-
:->
о о 5
£ х *
1*т
I
I
I
<
о
с
Я
ч
СЗ
S
о
я
Я
X о Я
So о
5
" я.
I Е- - т ? ч"
I—.Ш л J О _Х о
Q.
о л
2 * '
9г о ;
tt Q. !
5 .= ..;
2 х
8 о.
Q. 0)
X О
5
2
its
о о 3
X О Л
5." 8
X X < Д
X с
OS j
X
6
а
о
&
и
к
я
я
о
а.
я
S3
а.
о
•&
Я
я
Тех нофильк ость 262
Вновь возникающие техногенные ландшафты
обладают различной устойчивостью и способностью к
восстановлению. Для техногенных ландшафтов (см.
Ландшафт) характерна техногенная, по А, И. Перельману,
миграция элементов (см. Миграция химических
соединений); это городские ландшафты, TeppHTqpnn действия
промышленных предприятий, горных разработок и т. д«
Возможны следующие варианты формирования
техногенных ландшафтов (Глазовская, 1988).
1. Техногенное воздействие совместимо с
направлением природных процессов, усщряет их:
воздействие кислых атмосферных осадков (см. Кис-
лые дожди) на кислые подзолистые почвы;
воздействие минерализованных пластовых нефтяных
вод на ландшафты аридных областей.
2. Техногенное воздействие несовместимо с
направлением природных процессов, компоненты ландшафта
характеризуются буферностью: воздействие кислых
атмосферных осадков на серо-бурые пустынные почвы,
сероземы, черноземы.
Техногенное воздействие на ландшафт может быть
стихийным, непредусмотренным (аварийный сброс
загрязняющих веществ, аварийные разливы нефти и т. д.)
и целенаправленным (химизация сельского хозяйства).
При переходе природных ландшафтов к
техногенным выделяют следующие основные этапы.
1. Накопление химических загрязняющих веществ до
критического уровня.
2. Значительное изменение физических и химических
свойств почв — сдвиги рН в неблагоприятную сторону,
§нижение ЕКО (см. Емкость катионного обмена),
потеря почвенной структуры.
3. Угнетение растительности.
4. Эрозия, дефляция.
5. Разрушение и смыв почвенных горизонтов,
деградация почв (см.).
6. Образование техногенной пустыни.
ТЕХНОФИЛЬНОСТЬ. Отношение массы элемента в
ежегодной добыче к кларку в земной коре (литосфере).
Технофильность служит мерой использования данного
элемента и изменяется во времени.
Наиболее высокая технофильность характерна для
263 Толерантность
углерода, высока и продолжает расти технофильность
xлqpa, свинца, ртути, цинка, никеля, меди, сурьмы,
хрома, олова, молибдена.
ТОКСИЧНОСТЬ. Вредное воздействие химических
элементов или их соединений (в зависимости от уровня
концентрации) на живые организмы.
Главные реакции, связанные с токсичным действием
избытка элементов в живых организмах, и основные
элементы, вызывающие эти реакции, приведены ниже.
1. Изменение проницаемости клеточных мембран —
Ag, Au, Br, Cd, Ca, F, Hg,I, Pb, U02.
2. Реакции тиольных R—SH групп с катионами Ag,
Hg, Pb.
3. Конкуренция с жизненно важными
метаболитами — As, Sb, Se, Те, W, F.
4. Большое сродство к фосфатным группам и
активным центрам в АДФ и АТФ — Al, Be, Se, Y, Zr,
лантаноиды, все тяжелые металлы.
5. Замещение жизненно важных ионов — Cs, Zi, Rb,
Se, Sr.
6. Захват в молекулах позиций, занимаемых
жизненно важными функциональными группами типа фосфата
или нитрата (арсенат, фторид, борат, бромат, селенат,
теллурат, вольфрамат).
Токсичность зависит от того, в каких соотношениях
находятся ионы в растворе (например, токсичность ар-
сената и селената снижается в присутствии избытка
фосфата или сульфата), от формы соединений
элементов (так, кислородные анионы элементов более
токсичны, чем их простые катионы).
ТОЛЕРАНТНОСТЬ. Способность растений
сохранять жизнедеятельность в условиях избытка элемента
в окружающей щреле (почве). Высшие растения,
толерантные к микроэлементам, относятся к следующим
семействам: гвоздичные, капустные, осоковые, мятлико-
вые, бобовые, маревые.
В основе формирования толерантности лежат
следующие метаболические процессы:
селективное поглощение ионов;
пониженная проницаемость мембран или другие
различия в их структуре и функциях;
иммобилизация ионов в корнях, листьях, семенах;
Точка нулевого заряда 264
удаление ионов путем отложения (образования
запасов) в фиксированных или нерастворимых фдрмах в
различных органах и органеллах;
изменение характера метаболизма — усиление
действия энзиматических систем, возрастание содержания
антагонистических метаболитов или восстановление
метаболических цепей за счет пропуска ингибированной
позиции;
адаптация к замещению в энзиме физиологически
необходимого элемента токсичным;
удаление ионов из растений вымыванием через
листья, соковыделением, сбрасыванием листьев,
выделением через корни.
Устойчивость (толерантность) растений к
повышенному содержанию элементов и способность
накапливать предельно высокие их количества представляет
значительную опасность при проникновении
загрязняющих веществ в пищевые цепи.
ТОЧКА НУЛЕВОГО ЗАРЯДА. Значение рН, при
котором зависящий от рН заряд почвенных компонентов
равен нулю (см. Заряд почвенных коллоидов
переменный).
Наиболее широко распространенные представления
о точке нулевого заряда и методах ее определения
основаны на приложении к почвенным коллоидам теории
двойного электрического слоя, в частности уравнения
Гюи — Чапмена.
во = (2nekT/n) '/* • sin h (zef0J2kT) <
где о о — плотность заряда; п — концентрация электролита; г —
диэлектрическая постоянная среды; k — константа Больцмана; Т —
абсолютная температура; sJtiA— обозначение гиперболической
функции sin Н(у) = ; z — валентность противоиона; е —
заряд электрона; \f0 — потенциал поверхности.
Если потенциалопределяющими являются только
ионы Н+ и ОН~, уравнение принимает вид (при 25 °С)
-ф =59 (рНо-рН) ;•
где рН0 — значение рН, при котором потенциал равен 0.
Очевидно, что при этом в соответствии с уравнением
Гюи — Чапмена заряд поверхности тоже будет равен 0.
Величина рН, при которой и потенциал и заряд по-
265 Трансформация загрязняющих веществ в почвах
верхности равны 0, и есть точка нулевого заряда.
Определение точки нулевого заряда основано на том, что
-фо и со равны нулю независимо от потенциала
электролита. Поэтому при определении точки нулевого заряда
используют метод потенциометрического титрования
следующим образом: серию одинаковых навесок почвы
заливают растворами электролита разной концентрации,
и полученные суспензии титруют кислотой или
основанием. Для каждой суспензии строят график зависимости
количества поглощенных почвой ионов Н+ и ОН- от рН.
Если в почвах преобладают коллоидные частицы с
переменным зарядом и система подчиняется уравнению
Гюи — Чапмена, потенциометрические кривые,
полученные для растворов электролитов разных концентраций,
пересекаются в одной точке, причем эта точка лежит
на горизонтальной оси и соответствует.условию, когда
почва поглоща-ет равное количество ионов Н+ и ОН-,
то есть точке нулевого заряда. Величину точки нулевого
заряда можно приблизительно определить по
эмпирическому уравнению рН0=2(рНкс1) —1рНн2о.
Значение точки нулевого заряда почв важно для
решения экологических проблем, так как если реальная
величина рН почвы ниже точки нулевого заряда, то
почва будет поглощать преимущественно анионы; если
величина рН превышает это значение, почва обладает
способностью к преимущественному поглощению
катионов.
ТРАНСФОРМАЦИЯ ЗАГРЯЗНЯЮЩИХ ВЕЩЕСТВ
В ПОЧВАХ. Преобразование форм соединений
химических загрязняющих веществ под влиянием смены
условий, переход загрязняющих веществ в качественно
новое состояние под влиянием физико-химических,
биологических и других факторов (см. Загрязняющее почву
химическое вещество).
Техногенные вещества, поступающие на поверхность
почвы и проникающие в глубь ее, дифференцируются
в пределах генетического профиля, в котором
различные горизонты выступают в качестве геохимических
барьеров (см. Барьеры геохимические), задерживающих
часть техногенного потока. Загрязненные воды, проходя
через почву, частично или полностью очищаются от
техногенных продуктов. Сама почва при этом может за-
Трансформация загрязняющих веществ в почвах 266
грязняться. Однако почва не загрязняется, если
химические превращения загрязняющих веществ в ней
приводят к ликвидации их токсичности. В качестве примеров
можно привести процессы нейтрализации минеральных
кислот в карбонатных, щелочей — в кислых почвах,
разложение и минерализацию органических загрязняющих
веществ (пестицидов, углеводородов), вхождение
некоторых токсичных металлов в кристаллическую решетку
вторичных алюмосиликатов и переход их в
малоподвижное состояние, окислительно-восстановительные
реакции и переход в связи с этим некоторых химических
загрязняющих веществ в неподвижное состояние или
нетоксичные формы.
Степень и направление трансформации соединений
в почвах зависят как от свойств почв, так и от вида
загрязняющих веществ.
Тяжелые металлы. Формы поступления тяжелых
металлов (см.) достаточно разнообразны. В составе
газопылевых выбросов часть металлов и токсичных
элементов находится в газообразной форме (сурьма,
мышьяк, кадмий, цинк), часть в составе пылевой
фракции (сульфиды, сульфаты, оксиды, арсениты металлов).
Затем происходит их оседание на растительный и
почвенный покров. Этот процесс может происходить также
с осадками, в которых некоторые металлы находятся
в растворимой форме. Максимальное техногенное
воздействие испытывают обычно верхние гумусовые
горизонты почв и подстилка. В них удерживается основная
часть металлов. Здесь же и происходит первичная
трансформация попавших в почву соединений (см.
Загрязнение тяжелыми металлами и неметаллами).
Тяжелые металлы обладают высокой способностью
к многообразным химическим, физико-химическим и
биологическим реакциям. Многие из них имеют переменную
валентность и участвуют в
окислительно-восстановительных процессах. При изменении степеней окисления
миграционные способности большинства тяжелых
металлов существенно различны. Значительное влияние
оказывают и кислотно-основные свойства почв. В
условиях кислой среды нерастворимая часть фракции
тяжелых металлов переходит в растворимые формы, и при
прохождении техногенного потока металлов через почву
267 Трансформация загрязняющих веществ в почвах
масса растворимой фракции в кислых почвах может
нарастать. Изменяется и соотношение металлов в
почвенном растворе.
В зависимости от условий миграции (см. Миграция
химических соединений) одни металлы имеют большую
скорость, другие задерживаются в почве. На фоне
окислительно-восстановительных и кислотно-основных
условий действуют также сорбционные факторы (см.
Сорбция химических веществ почвой). Большое влияние на
трансформацию тяжелых металлов в гумусовых
горизонтах почв оказывает почвенная биота (см. Биота
почвенная). Миграция соединений тяжелых металлов
происходит в значительной степени в виде органо-минераль-
ной составляющей. Часть органических соединений, с
которыми связываются металлы, представлена
продуктами микробиологической деятельности. Ртуть
характеризуется способностью аккумулироваться в звеньях
пищевой цепи. Микроорганизмы почвы могут давать
устойчивые к ртути популяции, которые превращают
металлическую ртуть в токсические для высших
организмов вещества. Некоторые водоросли, грибы и
бактерии способны аккумулировать ртуть в клетках. В
условиях нейтральной или слабощелочной реакции почв
и почвенного раствора при значительном содержании
гумуса, тяжелом гранулометрическом составе тяжелые
металлы находятся в малодоступной форме и
накапливаются в почвах. В этих же условиях токсичные
элементы, мигрирующие в виде анионов (ванадий, цинк,
хром, мышьяк, молибден, сурьма, селен), представляют
главную опасность.
Пестициды. Почвенные условия способствуют
разложению пестицидов, обусловленному биотическими
и абиотическими факторами и процессами. В основном
пестициды (см. Загрязнение пестицидами)
накапливаются в верхнем горизонте почвы и лесных подстилках,
но способны мигрировать до глубины 1 м и более.
Органическое вещество почвы, оксиды и гидроксиды
металлов выполняют роль катализаторов во многих
реакциях трансформации пестицидов. При участии
почвенной влаги происходит гидролиз пестицидов. На этот
процесс влияют температура, влажность, рН. В почве
идут также реакции окислительно-восстановительного
Трансформация загрязняющих веществ в почвах 268
типа, которым подвергаются многие серосодержащие
пестициды. При низких значениях рН (3—4) и избытке
нитратов происходит разложение пестицидов с образо?
ванием нитрозосоединений. Содержание в почве
свободных радикалов и фотохимические реакции
способствуют разложению пестицидов, особенно тех, которые
внесены на поверхность почвы.
Биотическому разложению пестицидов принадлежит
в почвах важная роль. Известны четыре пути
трансформации пестицидов почвенной микробиотой:
энзиматическое воздействие, ведущее к полной
потере токсичности пестицида, его детоксикации;
трансформация в токсические вещества — активация;
трансформация пестицидов в другие вещества с иным
спектром ингибирующего действия;
трансформация с образованием
соединения-стимулятора.
В процессе самоочищения почв (см.) от пестицидов
участвуют также многие группы почвенных животных.
Ногохвостки, клещи и другие инактивируют пестициды,
изменяя их химический состав. Крупные
беспозвоночные (дождевые черви) и роющие животные
способствуют перемещению загрязненной почвы в глубокие слои.
Нефтепродукты. Механизмы трансформации
нефтепродуктов также зависят от состава почв,
температурного и водного режимов, интенсивности
воздействия микробиоты.
Трансформация нефти (см. Загрязнение нефтью и
нефтепродуктами) начинается сразу после ее попадания
в почву. Общие черты процесса трансформации:
разложение метано-нафтеновой фракции, снижение
содержания полициклических углеводородов и нафтено-арома-
тической фракции, относительное увеличение доли
смолистых веществ в нефти, переход нефтяных
компонентов в нерастворимые в органических растворителях
формы. Скорость изменения отдельных углеводородов и их
фракций зависит от природно-климатической зоны,
свойств почвы и исходной нефти. Главную роль в
процессах биодеградации нефти играют микроорганизмы,
осуществляющие внутриклеточное окисление
углеводородов. Для активизации процессов разложения
углеводородов нефти почву заражают определенными группа-
259 Тяжелые металлы
ми микроорганизмов и обильно удобряют
азотсодержащими веществами, создавая оптимальные условия
функционирования этих микроорганизмов.
Известно, что в экологических системах существуют
так называемые «пищевые цепи», которые
связывают между собой химический состав почв, вод и
растений, травоядных и плотоядных животных и человека,
потребляющего растительную и животную пищу. В
каждом новом звене пищевых цепей происходит все
большее накопление токсических веществ, — примерно в 10—
15 раз по отношению к предыдущему звену. Поэтому
даже низкие примеси токсинов и токсических веществ
в почвах могут создавать опасные концентрации
отравляющих веществ в продуктах питания. Зная основные
закономерности трансформации загрязняющих веществ
в почвах, следует создавать условия, способствующие
детоксикации продуктов техногенеза (см.).
ТЯЖЕЛЫЕ МЕТАЛЛЫ. К тяжелым металлам
относится более 40 химических элементов периодической
системы Д. И. Менделеева, масса атомов которых
составляет свыше 50 атомных единиц (а. е. м.).
Эта группа элементов активно участвует в
биологических процессах, входя в состав многих ферментов,
Группа «тяжелых металлов» во многом совпадает с
понятием «микроэлементы». Для экзогенных, повышенных
концентраций элементов термин «микроэлементы»
непригоден. В таких случаях обычно применяют термин
«тяжелые металлы». Таким образом, под термином
«тяжелые металлы» подразумевают такие элементы, как
свинец, цинк, кадмий, ртуть, молибден,
марганец, никель, олово, кобальт, титан,
медь, ванадий. Ранее применявшееся определение
«токсические элементы» следует считать устаревшим,
так как они токсичны для живых организмов при
определенных концентрациях и условиях окружающей среды.
Источники поступления тяжелых металлов делятся
на природные (выветривание горных пород и
минералов, эрозионные процессы, вулканическая
деятельность) и техногенные (добыча и переработка
полезных ископаемых, сжигание топлива,, влияние
транспорта, сельского хозяйства). Часть техногенных выбросов,
поступающих в окружающую среду в виде тонких аэро-
Тяжелые металлы 270
золей, переносится на значительное расстояние и
вызывает глобальное загрязнение (см. Загрязнение почвы
глобальное). Другая часть поступает в бессточные
водоемы, где тяжелые металлы накапливаются и
становятся источником вторичного загрязнения.
Тяжелые металлы накапливаются в почвенной
толще, особенно в верхних гумусовых горизонтах и
медленно удаляются при выщелачивании, потреблении
растениями, эрозии и дефляции. Период
полуудаления (или удаления половины от начальной
концентрации) составляет продолжительное время: для цинка —
от 70 до 510 лет, для кадмия — от 13 до 110, для меди —
от 310 до 1500 и для свинца — от 740 до 5900 лет (Ка-
бата-Пендиас, Пендиас, 1989).
Тяжелые металлы сорбируются на поверхности
почвенных частиц, входят в состав кристаллических
решеток глинистых минералов (см.), дают собственные
минералы в результате изоморфного замещения,
находятся в растворенном состоянии в почвенной влаге и в
Газообразном состоянии в почвенном воздухе, входят в
состав органических остатков, в частности в виде элементо-
органических соединений, являются составной частью
почвенной биоты (см. Биота почвенная).
Характер профильного распределения тяжелых
металлов в естественных и техногенных ландшафтах (см.)
существенно различается. Так, для техногенных
территорий независимо от типа почвы характерен
регрессивно-аккумулятивный тип распределения. В целом, на
характер профильного распределения влияет комплекс
почвенных факторов: гранулометрический состав почв,
актуальная кислотность, содержание органического
вещества, емкость катионного обмена, наличие
геохимических барьеров, дренаж.
Гранулометрический состав почвы оказывает
прямое влияние на закрепление и высвобождение тяжелых
металлов, поэтому опасность их поступления в растения
на тяжелых почвах меньше. Минимальное поступление
тяжелых металлов в растения происходит при рН 6,5
(см. Реакция почвы).
Тяжелые металлы способны к образованию сложных
комплексных соединений (см.) с органическим вещест-
271 Углеводороды в почвах
вом почвы, поэтому в почвах с высоким содержанием
гумуса (см.) они менее доступны растениям.
Чем выше емкость катионного обмена (см.), тем
больше удерживающая способность почв по отношению
к тяжелым металлам, что снижает доступность их расте*
ниям и живым организмам.
Избыток влаги способствует появлению тяжелых
металлов в более растворимых формах, имеющих
низкую степень валентности. Анаэробные условия
повышают доступность тяжелых металлов растениям.
у
УГЛЕВОДОРОДЫ В ПОЧВАХ. Соединения,
состоящие из углерода и водорода и постоянно
присутствующие во многих типах почв. Наиболее распространены
предельные углеводороды состава СпН2п+2, некоторые
непредельные углеводороды и ароматические
соединения.
К числу предельных углеводородов относится
метан СН4, этан С2Нб, пропан С3Н8, из непредельных
наиболее характерен этилен СН2=СН2. В числе
ароматических соединений — многие полициклические
ароматические углеводороды, некоторые из которых
обладают канцерогенным действием.
Углеводороды образуются преимущественно в
переувлажненных и затопляемых почвах, откуда они
попадают в атмосферу; такие почвы — основной источник
обогащения атмосферы этими веществами.
Поступающие в атмосферу углеводороды, наряду с С02,
обусловливают возникновение парникового эффекта. Это
связано с тем, что газообразные углеводороды
практически не поглощают излучение в видимом диапазоне
спектра, но очень активно поглощают (задерживают)
длинноволновое (инфракрасное) излучение, исходящее
от нагретой поверхности Земли.
Полициклические ароматические
углеводороды (ПАУ) относятся к числу наиболее
опасных канцерогенных веществ.
Углерод в почвах 272
УГЛЕРОД В ПОЧВАХ. Углерод находится в почвах
в форме органических и неорганических соединений. В
почвах практически отсутствует углерод как простое
вещество: графит, алмаз. Главнейшие почвенные формы
соединений углерода — карбонаты и органические
вещества.
В числе карбонатов преобладают карбонаты
кальция СаС03, магния MgC03, натрия Na2C03.
Органические соединения углерода
чрезвычайно разнообразны, они представлены простыми
углеводородами, низкомолекулярными кислотами, спиртами,
моносахаридами, аминокислотами,
высокомолекулярными продуктами распада растительных и животных
остатков (полисахаридами, лигнинами, белками), их
производными, различными гуминовыми веществами (см.
Гумус).
Уровни накопления органических соединений углерода
в почвах зависят от биоклиматических условий
почвообразования, накопление неорганических соединений —
от характера материнской породы и водного режима.
С почвенными соединениями углерода связаны такие
важнейшие свойства почв, как кислотность и
щелочность (см. Реакция почвы), емкость катионного обмена
(см.), тепловой баланс и отражательная способность,
структурное состояние, устойчивость к неблагоприятным
погодным условиям и химическому загрязнению.
Поддержание бездефицитного баланса органических
соединений углерода в почвах — одно из главных условий
сохранения и повышения почвенного плодородия.
УДЕЛЬНАЯ ПОВЕРХНОСТЬ ПОЧВЫ. Площадь
поверхности почвы массой 1 г. Единицы измерения:
см2-г-1, м2-г-1.
Увеличение поверхности твердых фаз почвы ведет к
повышению поверхностной энергии, поглощения воды,
минеральных и органических веществ из раствора, а
также паров и газов. По отношению к загрязняющим
веществам поверхность почвенных частиц выполняет
барьерные функции, задерживая и ограничивая их
миграцию.
Различают внешнюю поверхность дисперсного
почвенного материала и поверхность внутри
элементарной почвенной частицы. Поверхности
273 Удельная поверхность почвы
почвы энергетически неравноценны. Энергетическими
характеристиками поверхности служат теплота
смачивания и теплота адсорбции.
Методы определения удельной поверхности
основаны на способности почвенных частиц поглощать
химические вещества. Широко распространено определение
удельной, поверхности почвы по уравнению
полимолекулярной адсорбции воды (изотермы БЭТ). Для этого
почвы насыщают влагой при разных уровнях давления
водяных паров, определяют количество
адсорбированной влаги, по полученным экспериментальным точкам
строят изотерму адсорбции и с ее помощью находят
количество воды, покрывающее почву монослоем.
Учитывая площадь, занимаемую одной молекулой воды,
рассчитывают площадь поверхности сначала всей навески,
а затем 1 г почвы.
По методу Кутилека определяют количество
поглощенной влаги при единственном значении
относительной упругости водяного пара, равной 0,2, и далее
расчетным путем аналогично описанному выше методу
находят площадь поверхности 1 г почвы.
Удельную поверхность определяют не только по
количеству поглощенной воды, но и по количеству
поглощенных газообразных веществ (N2, паров бензола).
В отличие от молекул воды, проникающих даже в узкие
дорщ, крупные молекулы газообразных веществ
сорбируются главным образом на внешней поверхности
почвенных частиц. Результаты, полученные двумя разными
методами с использованием в качестве адсорбируемых
веществ паров воды и газообразных веществ, позволяют
оценить размеры внутренней и внешней удельной
поверхности.
Удельная поверхность почвы зависит от
гранулометрического и минералогического состава, качества и
количества органического вещества, характера
почвенного поглощающего комплекса, пористости почв.
Результаты определения удельной поверхности почвы
зависят также от свойств и размеров адсорбируемых
молекул, поэтому получают относительную или
эффективную величину удельной поверхности и указывают
метод, которым она была определена.
Общая удельная поверхность каолинита составляет
18 Заказ 5937
Удобрения как источник загрязнения 274
10—20, монтмориллонита — 200—300 м2/г. В
суглинистых почвах удельная поверхность может иметь
значения 100—200 м2/г, снижаясь до 20—50 м2/г в легких
почвах при низком содержании органического вещества.
УДОБРЕНИЯ КАК ИСТОЧНИК ЗАГРЯЗНЕНИЯ.
Применение минеральных удобрений в сельском
хозяйстве направлено на повышение содержания в почве
элементов питания растений для повышения урожайности.
Однако часто удобрения вносят в количествах, не
сбалансированных с потреблением сельскохозяйственными
растениями, поэтому они становятся мощными
источниками загрязнения почв, сельскохозяйственной
продукции, почвенных грунтовых вод, а также естественных
водоемов, рек, атмосферы, то есть окружающей среды.
Применение избыточных количеств минеральных
удобрений может иметь следующие негативные
последствия.
Во-первых, длительное внесение удобрений изменяет
свойства почв. Применение физиологически кислых
удобрений увеличивает кислотность почв, ведет к
значительным потерям гумуса в некоторых пахотных
почвах.
Во-вторых, внесение больших количеств азотных
удобрений приводит к загрязнению почв,
сельскохозяйственной продукции и пресных вод нитратами, а
атмосферы — оксидами азота. При этом происходит эвтрофи-
кация водоемов. То же касается и фосфорных
удобрений. Негативные воздействия обусловлены тем, что
1. Содержание в минеральных удобрениях тяжелых металлов
(мг/кг), извлекаемых 0,1 н. НС1 (по М. А. Глазовской)
Удобрение
Fe
Mn
Cu
Ni
Or
Pb
Zn
Cd
Апатит 710 49,5 11,3 3,5 1,75 89,8 7,50 0
Нитрофоска 360 67,5 11,3 6,0 3,30 14,8 9,00 0,03
Суперфосфат прос- 643 113,5 32,0 6,0 3,30 15,3 17,50 0,25
той
Суперфосфат двои- 1467 455,0 1,0 15,0 6,80 31,8 17,30 0,48
ной
Фосфоритная мука 865 172,5 2,5 20,8 6,50 14,5 42,80 0,23
Нитроаммофос 272 181,0 8,5 0,8 8,80 9,8 0,3820,0
275 Удобрения как источник загрязнения
сельскохозяйственные растения используют только часть
питательных элементов, содержащихся в удобрениях.
В-третьих, минеральные удобрения служат
источником загрязнения почв тяжелыми металлами (табл. 1).
Количество металлов в минеральных удобрениях
зависит от исходного сырья и способов его переработки.
Наиболее загрязнены тяжелыми металлами фосфорные
удобрения. Кроме того, фосфорные удобрения
загрязнены и другими токсичными элементами — фтором,
мышьяком. Так, фосфориты содержат около 3% фтора.
В почву на 1 га с нитратами и сульфатами, а также
с мочевиной попадает от 1 до 10 г мышьяка; с двойным
суперфосфатом — до 30—300 г этого элемента.
Фосфорные удобрения — источник загрязнения почв
естественными радионуклидами — ураном, торием,
радием. Содержание урана в сырье фосфорсодержащих
удобрений некоторых районов СССР колеблется от 0,11
до 35, а тория — от 8 до 32 мг/кг. При средней а-радио-
активности почв 30 Бк/кг нитрофоска Новомосковского
химического комбината содержала радиоактивные
элементы, дающие около 30 Бк/кг, фосфоритная мука
комбината «Фосфорит» — около 600, апатиты Кольского
полуострова — также около 30, концентрат фосфатов
Маарду — 444 Бк/кг (Алексеев, 1987).
Существенное количество тяжелых металлов
попадает в почвы и с органическими удобрениями (табл. 2).
Это происходит в основном не за счет высокого
содержания металлов и токсичных элементов в навозе, а за
счет высоких (по сравнению с минеральными) доз
внесения. Часто вносят не один навоз, а торфонавозные
и другие компосты. Торф же является концентратором
тяжелых металлов и при больших дозах (до 100 т/га)
может значительно повысить их уровень в пахотных
почвах.
В-четвертых, минеральные и органические
удобрения как источники загрязнения почв тяжелыми
металлами могут изменять подвижность последних в почве и,
следовательно, доступность их растениям.
Одновременно увеличиваются потоки миграции металлов в
аккумулятивные ландшафты и гидрографическую сеть.
Для предотвращения загрязнения почв и ландшафтов
различными элементами в результате внесения удобре-
Удобрения как источник загрязнения
276
S
»s
о
X
>>
о
м О
ь. «=(
Оч>>
О
Си
Я
<и
X
со
К
U.
и
СО
s
S
X
В"
о
н
о
о
сз
я
|=Г
К
о;
С
X
о
сз
я
tf
к
о
Р« о
«5.
3 Я
СО К?
о со
« к
н Л
и си
G. о»
2 в*
•&VO
CJ О
в*
<и я
§3
1 1
см
СМ
00
мм
о
см
ММ
смоо
ГТ< «-Ч
1 1
оо
о
1 °
1 со
IS
10 е0. -ч°о т^юо °1ю ою
(N00^0 СМЮСО О i£> CO CO «-« со
• »g | | | | | |^2 | , i i ю
к^
СО СО CN СО СО СОСМСМ
о" ~о~ о~ю~
»о(
Фоюоосооюсасоооо
о о
о
см
i I
<М
CM
2ю
t^oo
OOO
^o~
<NO)lO
i'TTT i
Tf CN —i
юсо
a>
CM
I i
CO
О
tF h-
t^- CO CM
II 1 M
-N(N
О
CO"
1 1 "1
^f
~
Mill
^ О _ Q io
^ ю ~ о. ю см
12 I IIS I Ml
о 2 °- © —
^ о
о to ^^
о о I I rt ^ I \
о — о о орю^
><©
ото
см | см
о
ою
СМ гг<
77°
емю w
о
СО-г-
о
о
°io OCX) CM
т-н СМ Ф СО CM
сМ I I I I I I I I . .
.—i CO *-< О '—• О «—' t""« h~
со О О ^ о"
Ю 0- ^
00 °
Ю О О
CN-ФООО
Г=1СМ CO CO
^TI I I I
oo
о о ою
OiQOOCOOtD^
CO CM —< Ю CM CO —• —«
NiOCOiOOOCNO
°. °
oo
CO О О
CM —• Tt«
I I I
CM ЮО
*—Ю
О
ЮО
cOvp
о
о о
о о о
_ ср о о о оо оо
СООСО^ОЮОЭОСООЮ О CD
CMrtHC0t>-'-^LOC0^tHLPC0C^t>-O^l>-C0
I I I I II M M I II I II
(NOO(N^--hO^^O^iO(NOO
СМЮ -ГСО'^Ю o*~ ^ ^
о
о
о
CD О
I I
ОЮ
о
s5 5
s S S я <я
Cu Ct, О «=t оо \0
я
я
- «=t о л
£* £Н »Я
£ g »я»я я *
4S g«s««go5s§g«
■Золайщо cvS> ^сон^.Зкса^ааЗ^НсЗ ^та j5-i5•
277 Фаза
ний следует применять комплекс агротехнических,
агролесомелиоративных и гидротехнических приемов в
сочетании с интенсификацией природных механизмов
очистки, то есть целенаправленное преобразование агробио-
ценозов в сбалансированные комплексы (Сысуев, 1986).
К таким приемам можно отнести: полезащитную
агротехнику с применением искусственных и естественных
структурообразователей почв, полезащитных
травопольных севооборотов и севооборотов с полосным
размещением культур поперек склона, минимальную обработку
почв, совершенствование ассортимента средств
химизации с включением замедлителей растворения, а также
капсулирующих веществ, мало- и микрообъемное
внесение удобрений вместе с семенами, оптимизацию
сроков, доз внесения и создание агролесомелиоративных
систем. Одновременно следует организовать систему
контроля химического состава минеральных удобрений
на содержание тяжелых металлов и токсических
элементов.
ф
ФАЗА. Совокупность частей какой-либо системы,
тождественных по химическому составу и
термодинамическим свойствам (см.). Однородность фазы оценивают
при отсутствии воздействия на систему внешних полей
(сила тяжести, электрический градиент и т. д.).
Почва представляет собой многофазную систему, в
которой совокупность компонентов, однородных по
составу и свойствам, образует одну фазу. Так, совокупность
кристаллов каолинита (или кварца, кальцита,
некоторых органических кристаллических или аморфных
веществ и т. д.) образует одну фазу. Почвенный раствор,
по крайней мере, в пределах одного горизонта также
образует одну фазу, состав которой может несколько
модифицироваться при наложении внешних полей. То
же относится к почвенному воздуху.
Описание почвы как трехфазной системы, состоящей
из жидкой, твердой и газообразной фаз, следует
признать устаревшим. По современным представлениям,
Фазовые равновесия в почвах 278
жидкое, твердое, газообразное — это состояния
вещества, а не фазы.
ФАЗОВЫЕ РАВНОВЕСИЯ В ПОЧВАХ. Состояние,
при котором составы всех фаз почвы остаются
практически неизменными.
Если перенос вещества между фазами (см. Фаза)
не связан с изменением электрических зарядов, то при
равновесии активность компонента во всех фазах будет
одинаковой (химические потенциалы любого
компонента во всех фазах равны). При наличии скачка
потенциала между фазами условием равновесия будет
равенство электрохимических потенциалов:
[ii+zF<tyi = \i2 + zFty2>
где щ и jm2 — химические потенциалы компонента в двух
равновесных фазах; z — заряд компонента; F — число Фарадея; ipi и г|)2—
электрические потенциалы в соответствующих фазах.
Твердые фазы почв и компоненты почвенных
растворов представлены полярными веществами, поэтому
равновесие в почвах обусловлено уже равенством
электрохимических потенциалов. Как правило, состояние
равновесия в почвах не достигается, что вызвано
медленным протеканием (кинетикой) многих химических
процессов, а также суточной и сезонной динамикой
температуры почвы, увлажнения, уровня почвенно-грунто-
вых вод и развития почвенной биоты.
ФИКСАЦИЯ КАТИОНОВ ПОЧВАМИ. Процесс
необменного поглощения почвой катионов из раствора.
Общее количество катионов, которое почва может необ-
менно поглощать из раствора, называется
фиксирующей способностью почв по отношению к данному
катиону.
К основным компонентам почв, способным
фиксировать катионы, относятся глинистые минералы —
вермикулиты, гидрослюды (см.) и наиболее высокозарядные
монтмориллониты (см.). Фиксированные катионы
располагаются в пустотах тетраэдрической сетки (см.
Глинистые минералы) и не могут быть вытеснены
катионами растворов нейтральных солей, используемых обычно
для извлечения обменных катионов.
Наиболее активно и прочно фиксируются
кристаллическими решетками глинистых минералов ионы
К+, Rb+, Cs+ и NH4+, которые мало гидратированы и по
279 Фоновое содержание в почвах химического вещества
размерам хорошо соответствуют величинам пустот тетра-
эдрических сеток. При этом гидрослюды закрепляют
катионы более прочно, но в меньших количествах, чем
вермикулиты и монтмориллониты, поскольку они
обладают большей величиной электростатического заряда
(см. Заряд почвенных коллоидов постоянный) при
меньшей емкости катионного обмена (см.).
Фиксация катионов влияет на состояние почв и
хозяйственную деятельность. Например, на почвах с
высокой калий- и аммонийфиксирующей способностью дозы
калийных и аммонийных удобрений приходится
повышать в несколько раз, так как фиксированные К+ и
NH4+ недоступны растениям. В то же время способность
почв необменно поглощать радиоактивный элемент
137Cs препятствует попаданию этого радионуклида в
растения, поверхностные и грунтовые воды.
ФОНОВОЕ СОДЕРЖАНИЕ В ПОЧВАХ
ХИМИЧЕСКОГО ВЕЩЕСТВА. Уровень содержания
химического вещества, сравнение с которым позволяет
обнаружить превышение его в исходно аналогичных почвах
под влиянием антропогенных факторов.
За фоновое содержание может быть принято
количество элемента в погребенных почвах, в датированных
музейных образцах. Кроме того, можно использовать
ранее опубликованные сведения о прежнем состоянии
исследуемых почв, результаты, найденные расчетным
путем на основе анализа многолетней динамики
содержания контролируемых элементов в почвах. Наиболее
часто о фоновом содержании химических веществ
судят по составу почв фоновых территорий (см. Фоновые
почвы) у удаленных от локальных источников
загрязнения на 50—100 км.
Фоновое количество химических веществ в почвах
характеризует региональный фон, который образуется в
результате совокупного действия всех факторов
почвообразования в данном районе, прежде 'всего почвооб-
разующих пород. Вклад вносят также химические
вещества антропогенного происхождения, поступающие в
почвы фоновых территорий в результате глобального
рассеяния.
Если показатели содержания химических веществ в
почвах фоновых территорий распределены по нормаль-
Фоновые почвы
280
Частота встречаемости,%
80
70
60
.SO
40
30
20
10
10
14
16
18
А$,мг/кг
Распределение содержания мышьяка в почвах Сихотэ-Алинского
заповедника
ному закону, то за фоновое содержание принимают
среднее арифметическое из этих данных. В случае,
когда кривая распределения отличается от нормальной, за
оценку среднего значения может быть принято
медианное значение. Если характер распределения имеет вид
бимодальной кривой (рис.), за фоновое содержание
принимают левый максимум функции. Правый максимум
на кривой распределения, как правило, отражает
проявление очаговой геохимической аномалии
рассматриваемого химического вещества.
ФОНОВЫЕ ПОЧВЫ (почвы фоновых территорий).
Почвы, сопоставление с состоянием которых позволяет
установить и оценить превышение естественного уровня
содержания контролируемых элементов и загрязнение
почв на локальном, региональном, глобальном уровнях.
При оценке локального (см. Загрязнение почвы
локальное) и регионального загрязнения в качестве фона
служат почвы, удовлетворяющие трем условиям:
принадлежат к тому типу биогеоценоза (см.), что и
исследуемые загрязненные почвы; на них не ведется
хозяйственная деятельность; они удалены от источников
загрязнения на 50—100 км (см. Источник загрязнения).
Для оценки глобального загрязнения (см.
Загрязнение почвы глобальное) служат почвы комплексных
281 Фосфор в почвах
станций фонового мониторинга (см. Мониторинг
фоновый) и биосферных заповедников, которые размещены
в пределах различных биогеоценозов и в наименьшей
степени подвержены антропогенному воздействию.
ФОСФОР В ПОЧВАХ. Обязательный химический
элемент в почвах. Он необходим для нормальной
деятельности живых организмов: входит в состав нуклеозид-
фосфатов (передатчиков энергии) и нуклеиновых
кислот (хранителей генетической информации), участвует
в фотосинтезе, окислительно-восстановительных
процессах, в углеводном обмене.
Для соединений фосфора наиболее характерны
следующие степени окисления: —3 (фосфин РН3), +3
(РС13), +5 (ортофосфорная кислота). Среднее
содержание фосфора в земной коре 0,09%. Хотя это в несколько
раз больше, чем, например, количество серы и хлора
(S — 0,05%, С1 — 0,02%) в земной коре, его водная и
воздушная миграция относительно невысока. Несмотря
на значительное разнообразие минеральных и
органических соединений фосфора, в природе в виде минералов
встречаются практически только производные ортофос-
форной кислоты — ортофосфаты, причем до 95% всех
природных фосфатов составляют фосфаты кальция.
В земной коре значительная часть соединений фосфора
представлена разновидностями апатита,
преимущественно фторапатитом CasF(P04)3.
В апатитах присутствуют также примеси кадмия,
мышьяка, фтора, хлора.
К природным источникам фосфора относятся
магматические породы (габбро, андезиты, сиениты), при
выветривании которых фосфор поступает в биосферу, а
также осадочные породы типа апатитов, фосфоритов
желваковых и конкреционных, вивианита, вевеллита.
Кроме того, фосфор попадает в биосферу с космической
пылью и метеоритами. Известны и техногенные пути
поступления фосфора в окружающую среду. Так,
значительные количества фосфорных соединений входят в
состав моющих средств. Стиральные порошки содержат
10—12% пирофосфата калия или от 4—5 до 40—50%
триполифосфата натрия и некоторые другие
компоненты. Фосфор входит в состав инсектицидов, например
хлорофоса:
Фосфор в почвах 282
ОН О
I 11^оснз
ecu — сн — р
осн3
С промышленными и бытовыми сточными водами
техногенные соединения фосфора могут поступать в
почвы и почвенно-грунтовые воды.
В последнее время явно обозначился и
сформировался новый процесс антропогенного происхождения —
фосфатизация суши, или возрастание общего
содержания соединений фосфора в окружающей среде.
Этот процесс протекает неравномерно, и наиболее ярко
выражен на территории промышленно развитых стран,
импортирующих агроруды, сырье и т. д.
Антропогенные поступления представляют
существенную часть в балансе фосфора. Применение удобрений,
химическое загрязнение биосферы в целом, эрозионные
процессы играют решающую роль в фосфатизации
биосферы. Решение противоречивой проблемы — дефицит
фосфора и эвтрофикация водоемов (см.) —требует
разработки комплекса мер, направленных как на
максимальное снижение потерь фосфора при переработке,
внесении удобрений, так и на недопущение загрязнения
окружающей среды соединениями фосфора.
Элементы баланса фосфора в биосфере имеют
следующие значения, т:
Поступления на суше Привнос в гидросферу
Все виды 2,1 • Ю7 Все виды 2,8-107
В том числе: В том числе:
удобрения и химические за счет эрозии п-107
препараты 3—4-106 из рек и сточных вод
промышленные 2—3-106 5-Ю6
прочие /г-106 с осадками 3-Ю6
из почв 6-Ю6
Содержание фосфора в почвах колеблется от сотых
долей до 0,3%. Наиболее распространенные
фосфорсодержащие минералы земной коры — апатиты, а самые
богатые этим элементом минералы — фосфориты.
В процессе выветривания и почвообразования
образуются вторичные минеральные соединения фосфора, в
283 Фосфор в почвах
-'д (Ср04)
| I I I i 1 1
5 6 7 8 9 10 11 Рн
Диаграмма растворимости соединений фосфора:
1 — FeP04; 2 — А1Р04; 3 — CaHP04; 4 — СаН(Р04)3-2,5 Н20; 5 —
Са3(Р04)2; 6 — вивианит; 7 — гидроксилапатит; 8 — фторапатит
которых элемент связан с Са, Mg, Fe, Al, Mn. Они
представлены 1—2—3-замещенными солями металлов
с ортофосфорной кислотой, имеющими разную
растворимость (гидрофосфаты, дигидрофосфаты). С
повышением основности растворимость их снижается.
В почвах наиболее часто встречаются следующие
минеральные соединения фосфора, как 'имеющие
почвенное происхождение, так и унаследованные от
материнской породы: дикальцийфосфат СаНР04, ок-
токальцийфосфат Са4Н (Р04) з • ЗН20, гидроксилапатит
Са4(Р04)2(ОН)2, фторапатит CaioF2(P04)6, варисцит
А1Р04-2Н20, штренгит FeP042H20. Встречаются
также вевеллит, вивианит, баррандит.
Фосфор, связанный с органическими соединениями,
входит в состав растительных остатков, (в состав про-
Фреоны 284
дуктов биологического синтеза типа фосфолипидов, ино-
зитфосфатов. Фосфор в составе специфических
органических соединений предположительно связывается с
ними через ионы Fe3+, А13+, Са2+.
Ортофосфаты в водных растворах легко гидролизуют-
ся, в результате чего растворы щелочных металлов
имеют щелочную реакцию, а фосфатов кальция — кислую.
На рисунке показана зависимость растворимости
фосфатов от рН. Фосфаты кальция более устойчивы в
щелочной среде, а фосфаты железа и алюминия — в кислой.
В нейтральных и карбонатных почвах преобладают
минеральные соединения фосфора, предположительно
связанные с кальцием, в кислых — с железом и
алюминием.
В природных водах фосфор существует в форме
молекул и анионов ортофосфорной кислоты Н3Р04. В
водах также присутствуют полифосфорные кислоты
естественного или антропогенного происхождения,
разнообразные фосфатные комплексы. Содержание фосфора в
природных водах колеблется от тысячных долей до
0,1—0,2 мг/л; до 10%. входит в состав органических
веществ.
Подвижные соединения фосфора в. твердых фазах
представлены адсорбированными или осажденными на
поверхности почвенных частиц соединениями.
Определяют их в составе кислотных и солевых вытяжек.
ФРЕОНЫ (от лат. frigor — холод). Группа фтор-
и фторхлоруглеводородов жирного ряда, главным
образом метана, которые благодаря своим
термодинамическим свойствам нашли широкое применение в практике
как хладоносители в холодильных машинах. Входят в
состав аэрозольных баллонов.
Фреоны представляют собой газообразные или
жидкие вещества, как правило, хорошо растворимые в
органических растворителях, а также во многих
смазочных маслах и практически нерастворимые в воде.
Фреоны негорючие, не образуют взрывоопасных смесей
с воздухом и относительно химически инертны. Они не
действуют на большинство металлов (до 200°С), стойки
к окислителям, кислотам. При контакте с открытым
пламенем разлагаются с образованием токсичных
дифтор- и фторхлорфосгена.
285 Фтор в почвах
Известны следующие фреоны:
CF4 фреон-14 CHC1F2 фреон-22
CC1F3 фреон-13 CC13F фреон-11
CC13F2 фреон-12 СВгРз фреон-13
Наибольшее значение имеет фреон-12; его получают
при действии трехфтористой сурьмы на четыреххлори-
стый углерод (катализаторы Вг или SbCU):
3CCl4+2SbF3 = 3CCl2F2 + 2SbCl.3
Производство фреона-12 достигает 85% всей
мировой продукции фторорганических соединений. Фреоны
устойчивы к действию серной кислоты и
концентрированных щелочей, не взаимодействуют с большинством
металлов. Однако их воздействие на окружающую
среду может иметь и негативные последствия —
образование озоновой «дыры» (см. Озон).
ФТОР В ПОЧВАХ. В природных условиях фтор
находится, как правило, в одновалентном состоянии.
Соединения фтора по своим свойствам значительно
отличаются от других галогенпроизводных.
Кларк фтора, по данным А. Е. Ферсмана, в земной
коре составляет 0,08%; в гидросфере — /г-10~5, в живом
веществе — /г-10~4% (массовая доля).
Фтор образует 92 минерала, в том числе: фторапатит
3Ca3(P04)2-CaF2 (до 42% F); флюорит CaF2(48,7% F);
криолит 3NaF-AlF3 (54,3% F); биотит, мусковит
(3—4%. F); фосфориты (апатиты, химически связанные
в разной пропорции с фосфатами кальция — 0,1—6% F).
Фторсодержащие минералы обычно находятся в
горных породах и почвах в рассеянном состоянии, но
встречаются и в виде месторождений.
Главные источники фтора в окружающей среде, в
том числе в почве, следующие:
разрушающиеся горные породы, содержащие в
среднем 0,03% F и их минералы (апатит, турмалин, биотит,
мусковит, другие слюды);
вулканические газы;
газопылевые выбросы предприятий по выпуску
алюминия, стали, стекла, фосфорных солей. В составе
выбросов содержатся NaF, KF, Na3Al3F6, Na3Al3F4,
NaAlF4, A1F3, CaF2, HF, SiF4;
Характеристика состояния соединений
286
фосфорные удобрения (от 1 до 4% фтора), фосфогипс
(0,3—0,8% F), другие химические мелиоранты.
Например, по данным Ю. А. Потатуевой, при внесении
фосфорных удобрений из расчета 60—90 кг P2Os на 1 га
в почву поступает 6—8 кг фтора.
Содержание фтора в почвах определяется его
количеством в материнской породе. Среднее количество
фтора в почвах земного шара составляет 320 мг/кг. Для
большинства почв содержание фтора колеблется в
пределах 150—400 мг/кг (табл.).
Содержание фтора в верхних горизонтах различных почв,
мг на 1 кг сухой массы
Почвы
Пределы
колебаний
Среднее
Тундровые
Подзолы и песчаные
Лёссовые и пылеватые
Суглинистые и глинистые
Флювисоли
Лесные
Каштановые
Солончаки
Черноземы
Красноземы
300—200
20—200
120—230
ПО—7Б0
176—11360
130—320
100—320
400—1000
130—240
70—150
—
85
а 75
450
1—
«—
—
—
—
»—
Об оптимальных количествах фтора, необходимых
для питания человека, пока нет единого мнения. Так,
поражение зубов «пятнистой эмалью» наступает при
содержании фтора в питьевой воде выше ПДК (1,2 мг/л).
В то же время, согласно А. П. Виноградову,
эндемический флюороз возникает при количестве фтора в
почве более 0,05%, а в питьевой воде — свыше 0,5 мг/л.
X
ХАРАКТЕРИСТИКА СОСТОЯНИЯ СОЕДИНЕНИЙ
ХИМИЧЕСКОГО ЭЛЕМЕНТА В ПОЧВЕ.
Совокупность уровней .содержания химических веществ,
образованных этим элементом и входящих в состав всех фаз
287 Характеристика состояния соединений
почвы каждого из морфонов и (или) горизонтов,
сочетание которых образует почвенный профиль.
Например, характеристика состояния железа в
исследуемой дерново-подзолистой почве приведена в
таблице. В почве железо в форме Fe (III) и Fe (II)
присутствует и в растворе, и в составе твердых фаз.
Соединения железа в дерново-подзолистой почве
Форма
же леза
Почвенный раствор
Твердые фазы
Fe(III) Fe3+, Fe(OH)2+, Fe(OH)2+ Ферросиликаты,
ре(ОН))з°, Fe(OH)4-, FeOK, aFe203, vFe203,
FeOHOK, FeS04+, FeHS042+, aFeOOH, у FeOOH,
Fe2(SO4)30, FeC03+, FeHC(V+, Fe304, FeP04,
Fe2(C03)3°,FeHP04+, FeH2P042+, Fe^(S04)3, Fe(0H)3
FeP04° и другие комплексы с и другие соли
органическими и
неорганическими лигандами
Fe2+, FeOH+, Fe(OH)2°,
Fe(II) Fe(OH)3, Fe(OH)4-, FeOK, Fe(OH)2, Fe3(OH)3,
FeOHOK, FeSOA FettS04(+, Fe3(P04)2, FeHP04
Fe2C03, FeHC03+, FeHP04°, и другие соли
FeH2P04+ и другие
комплексы с органическими и
неорганическими лигандами
Примечание. ФК — фульвокислоты.
Взаимодействие соединений железа в твердых и
жидких фазах ведет к созданию термодинамического
квазиравновесия или стационарного состояния в системе
соединений элемента. Количественные уровни показателей
этого состояния, найденные эмпирическим или
расчетным способом, характеризуют систему соединений
железа. К таким показателям относятся, например,
аналитическая концентрация железа или активность ионов
Fe3+ в растворе, количество Fe в составе силикатов
или Fe203.
Почвенный профиль дифференцирован по уровням
этих показателей в различных горизонтах, в каждом
из которых устанавливается определенный интервал
возможных значений признака. Пространственную
неоднородность характеризуют статистические показатели
Химические мелиоранты 288
варьирования признаков. Профильную
дифференциацию отражают производные показатели — например,
элювиально-аккумулятивные коэффициенты или
коэффициенты радиальной дифференциации элемента.
ХИМИЧЕСКИЕ МЕЛИОРАНТЫ. Вещества,
используемые для коренного улучшения физических и
химических свойств почв. С помощью одних и тех же веществ
часто достигают улучшения различных свойств почв.
Так, при известковании и гипсовании улучшается состав
обменных катионов, изменяется реакция почв,
улучшается почвенная структура.
Наибольшее распространение в качестве химических
мелиорантов для известкования (см.) кислых почв
получили известковые материалы; для гипсования (см.)
солонцовых почв — гипс, глино-гипс, фосфогипс; для
мелиорации содово-засоленных почв — кислоты и
железный купорос.
К числу химических мелиорантов следует отнести
также органические удобрения (навоз, компосты, торф,
сапропель и др.), внесение которых в почву не только
способствует получению высоких урожаев, но и
улучшает в целом химическое состояние почв, повышает
запасы гумуса, влияет на его качественный состав,
способствует оптимизации структуры и теплового режима
почвы.
ХИМИЧЕСКАЯ МЕЛИОРАЦИЯ. Коренное
улучшение свойств почвы, достигаемое внесением химических
веществ {химических мелиорантов — см.).
К наиболее распространенным и эффективным видам
химической мелиорации относятся: известкование,
гипсование, кислование, внесение органических удобрений.
Химической мелиорацией иногда считают и применение
минеральных удобрений, однако, способствуя
повышению урожаев, минеральные удобрения (особенно без
известкования или органических удобрений) часто не
только не приводят к длительному и устойчивому
улучшению свойств почв, но и вызывают некоторые
негативные явления. Так, на дерново-подзолистых почвах
минеральные удобрения без известкования вызывают
повышение кислотности, содержания обменного
алюминия и марганца, деградацию почвенного поглощающего
комплекса.
289 Цеолиты
ХЛОР В ПОЧВАХ. Химия соединений хлора в почве
сравнительно проста. Практически все встречающиеся
в почвах хлориды NaCl, KC1, СаС12, MgCl2
легкорастворимы. Растворимы также хлориды большинства
микроэлементов, за исключением хлорида серебра и хлорида
ртути. Хлорид-ион может удерживаться в почве в виде
обменного аниона (см. Анионы обменные), что
характерно для органогенных почв с повышенной плотностью
положительных зарядов в почвенном поглощающем
комплексе. Уровни содержания хлоридов колеблются в
пределах от 1—10 мг на 1 кг почвы в гумидных
областях до нескольких процентов в засоленных почвах.
Миграция и накопление соединений хлора зависят,
преимущественно от температурного и водного режимов
территории. Максимальное накопление характерно для
бессточных впадин аридных районов.
Негативные экологические последствия избыточного
содержания хлоридов в почве возможны в виде
ухудшения физико-химических свойств почв, а также
загрязнения грунтовых и поверхностных вод.
ц
ЦЕОЛИТЫ. Группа минералов подкласса каркасных
силикатов; кристаллическая решетка состоит из
трехслойного каркаса тетраэдров, в которых часть Si
замещена А1; отрицательный заряд компенсируется главным
образом ионами Са2+, Na+, K+, которые способны к
обмену (см. Обмен ионный). В структуре много полостей
и каналов диаметром от 0,32 до 0,9 нм, в которых
присутствует молекулярная вода, способная замещаться на
анионы.
Наиболее широко распространены следующие
цеолиты: натролит Na2[Al2Si2Oi0] -2Н20, шабазит
(Са, Na)[AlSi206].6H20; гейландит Ca[Al2Si70i8]-6H20,
десмин Ca;[Al2Si70i8]-7H20; цеолиты, близкие к гейлан-
диту, но содержащие некоторое количество Na и К,
выделяются как самостоятельная группа минералов —
клиноптилолиты.
Из-за большого количества пустот цеолиты
представляют собой как бы молекулярные сита, они — эффек-
Щелочность почв 290
тивные сорбенты, способные поглощать воду,
органические соединения, катионы и анионы раствора. Емкость
катионного обмена (см.) цеолитов достигает 170—
230 мг-экв на 100 г минерала. Поэтому они могут быть
использованы в целях мелиорации почв (см. Химическая
мелиорация), загрязненных тяжелыми металлами и
радионуклидами, а также для повышения емкости
катионного обмена, особенно в почвах легкого
гранулометрического состава с низким содержанием органического
вещества. Цеолиты поглощают находящиеся в
почвенном растворе загрязняющие компоненты и таким
образом препятствуют поступлению их в растение и в
грунтовые воды. Цеолиты неустойчивы к выветриванию и
редко встречаются в нативных почвах, за исключением
некоторых сильно засоленных почв, имеющих
щелочную реакцию.
В СССР месторождения цеолитов имеются в
Закавказье, Закарпатье, на Камчатке.
щ
ЩЕЛОЧНОСТЬ ПОЧВ. Содержание в почве
соединений, обусловливающих ее щелочную реакцию (см.
Реакция почвы).
Щелочность создается за счет солей слабых кислот,
образующих при гидролизе слабодиссоциирующие
молекулы, например:
Na*C03 + 2H20—*2Na+ +20H-+H2C03
Возникающую при этом степень щелочности (рН)
можно рассчитать по константам кислотности и
основности реагирующих компонентов или воспользовавшись
справочными данными о степени гидролиза солей.
Как правило, в большинстве почв щелочность
обусловлена карбонатами натрия, кальция и магния.
Кроме того, причиной ее может быть присутствие боратов,
фосфатов, сульфидов, силикатов и солей некоторых
органических кислот, преимущественно гуматов. Большой
вклад в формирование щелочности вносит карбонатно-
кальциевая система.
291 Эвтрофикация водоемов
При анализе водных вытяжек из почв принято
различать щелочность от карбонатов и гидрокарбонатов.
Общую щелочность находят путем титрования
водной вытяжки кислотой в присутствии метилоранжа до
рН 4,4, три этом оттитровываются как нормальные
карбонаты, так и гидрокарбонаты. Чтобы найти только
нормальные карбонаты, вытяжку титруют по
фенолфталеину до рН 8,2, в этих условиях нормальные карбонаты
превращаются в гидрокарбонаты. Для нахождения
общего содержания нормальных карбонатов результат
анализа необходимо удвоить. Присутствовавшие в
исходной вытяжке гидрокарбонаты на этой стадии
анализа не титруются.
Со щелочностью связаны многие неблагоприятные
свойства почв: пептизируемость, слитость, осолонцева-
ние. На орошаемых почвах наблюдаются сравнительно
кратковременные вспышки щелочности, отрицательно
влияющие на состояние растений. Для устранения
щелочности прибегают к гипсованию почв (см.),
используют в качестве мелиорирующих средств также серную
кислоту, железный купорос.
ЭВТРОФИКАЦИЯ ВОДОЕМОВ. Повышение
биологической продуктивности водоемов в результате
накопления в воде биогенных элементов.
В природных и антропогенных ландшафтах водоемы
служат местами естественного стока и накопления
различных химических элементов, переносимых в процессе
миграции (см. Миграция химических соединений).
Миграционные потоки биогенных элементов значительно
увеличиваются при сбросе в водоемы сточных вод, а
также при использовании избыточных количеств
удобрений (несбалансированных с потреблением растениями)
и нерациональной агротехнике. В результате
поступления значительных количеств азота, фосфора, калия и
других биогенных элементов происходит вспышка роста
организмов, населяющих водоем. Резкое увеличение
биомассы растительности приводит к повышению
потребления кислорода и ухудшению условий
существования рыб и других живых организмов. В конечном итоге
в водоеме возникает восстановительная среда,
усиливается накопление органических веществ в осадках и
образуются гнилостные болота.
Экологическая химия
292
ЭКОЛОГИЧЕСКАЯ ХИМИЯ. Один из разделов
учения об охране окружающей среды от химического
загрязнения; изучает химические процессы, влияющие
на состояние и свойства окружающей среды —
атмосферы, гидросферы и почв.
Экологическая химия включает химические аспекты
описания и управления динамическим равновесием в
экосистеме (см.), касающиеся в основном учета
качественного и количественного состава химических антропо-.
генных загрязнений природной среды под влиянием
производственной и сельскохозяйственной деятельности
человека и изучения химических превращений
загрязняющих веществ в окружающей среде. По определению
М. Барбье (1978), под экологической химией
понимается наука об антропогенных химических загрязнениях и
о механизмах их превращений в биосфере. Взаимосвязь
Элементарные реакции в газовой
и жидкой фазе,механизмы
процессов окисления с участием
солнечного света,металлов,
кислорода,свободных радикалов
(химическая кинетика)
Молекулярные механизмы
процессов жизнедеятельности,обмен
клетки с внешней средой
(биохимия,водная токсикология)
т
эк
I
ЭКОЛОГИЧЕСКАЯ ХИМИЯ
т
.и я
I
Процессы на границах раздела
фаз.массоперенос веществ
и их перераспределение
в объектах окружающей среды
(физическая химия)
Контроль загрязнения,прогнози-
рование и управление
состоянием объектов окружающей среды
(аналитическая химия,физико-
химические методы анализа,
математика,экономика)
Взаимосвязь экологической химии с другими научными
дисциплинами (по Ю. И. Скурлатову)
293 Экологическая химия
экологической химии с другими дисциплинами
схематически представлена на рисунке.
Задачи экологической химии следующие.
1. Изучение возможностей снижения уровня
химического загрязнения объектов окружающей среды
наиболее опасными для экосистемы загрязняющими
веществами (см.).
2. Совершенствование технологических процессов
переработки сырья и очистки отходов.
3. Прогнозирование поведения химического
загрязнения под влиянием различных природных факторов и
антропогенных воздействий.
4. Разработка способов управления состоянием
природной среды.
Решение первой задачи связано с разработкой новых
технологий с учетом требований охраны окружающей
среды и модификацией существующих с целью
повышения их «экологичное™». Это достигается
одновременно несколькими путями: инженерно-организационными
(комплексное использование сырья, безотходное
производство, водооборотные схемы) и
химико-технологическими (повышение селективности процессов,
разработка новых катализаторов, оптимизация режима, замена
отдельных стадий процессов на более «экологичные»).
Для решения второй группы задач необходима
организация очистки выбрасываемых в атмосферу газов
и сбрасываемых в водоемы сточных вод от наиболее
вредных веществ, что зависит от экономики
производства. Если переход на безотходные технологии требует
больших капитальных затрат, то текущие затраты на
очистку отходов зависят от требуемой степени очистки.
Существует некоторый предел очистки, определяемый
экономикой производства, после которого производство
может быть нерентабельным. Здесь имеется целый
пакет задач, связанных не только с локальной очисткой
выбросов цехов, предприятий, но и с очисткой
городских сточных вод, утилизацией твердых и жидких
отходов.
Третья группа задач связана с оценкой воздействия
на окружающую среду загрязняющих веществ. Здесь
имеется два аспекта: с одной стороны, — проблема
токсичности (см.) того или иного вещества, поступающего
Экология 294
в окружающую среду, с другой, — миграция и
трансформация веществ под влиянием природных факторов. Роль
экологической химии — определяющая в оценке
скоростей трансформации загрязняющих веществ в
зависимости от факторов среды (см. Трансформация
загрязняющих веществ в почвах).
ЭКОЛОГИЯ (от греч. oikos — дом, место, жилище;
logos — учение). Термин введен Э. Геккелем в 1869 г.
Тогда экология относилась к разделу биологической
науки о взаимоотношениях организмов растительного и
животного мира и окружающей среды. В настоящее время
этот термин имеет много значений и употребляется для
обозначения биологической науки, изучающей
организацию и функционирование надорганизменных систем
различных уровней: популяций, видов, биогеоценозов,
экосистем, биогеоценозов и биосферы в целом (см.
Биогеоценоз, Экосистема).
Существует также понятие частной экологии,
которая занимается изучением ограниченных групп какого-
либо таксономического ранга — популяционная экология,
экология сообществ (биоценология), биогеоценология,
экология растений, экология животных и т. д. Экология,
изучающая большой круг разнообразных явлений,
тесно связана со многими науками о функционировании
организмов на разных уровнях (генетика, физиология,
биогеография, экология, биохимия и т. п.) и науками
о среде обитания живых организмов (биогеоценология,
ландшафтоведение, почвоведение, гидрология,
гидрохимия, климатология, биогеохимия).
Экологический подход к проблемам, стоящим перед
любой из указанных наук, объясняется усилением
интереса к вопросам охраны окружающей среды,
сохранения на земле всего живого в связи с увеличением
воздействия человека на природу. Экология, экологический
подход при проведении мероприятий по охране природы
должны быть в основе научных рекомендаций не только
при выявлении отрицательных последствий
промышленного и сельскохозяйственного производства, но и при
строительстве новых объектов промышленности,
энергетики и других отраслей производства. С этой целью
организуют комиссии из специалистов разных областей
науки, которые проводят экологическую экспертизу (см.).
295 Экосистема
ЭКОЛОГИЧЕСКАЯ ЭКСПЕРТИЗА. Особый вид
экологического исследования, направленный на
получение экологических заключений о фактическом,
наиболее вероятном ожидаемом или оптимальном состоянии
конкретных экосистем (см. Экосистема) при
планировании определенных антропогенных воздействий или при
их осуществлении.
Экологическая экспертиза представляет собой
организованную деятельность экологов-экспертов,
включающую анализ конкретных проблем природопользования с
широким применением методологии системного подхода,
постановку точного диагноза и выработку экологически
обоснованного заключения.
Цель экологической экспертизы — получение
конкретного заключения или экологической оценки.
Экологическую экспертизу подразделяют на три основные
группы:
ретроспективная экологическая экспертиза —
изучение последствий реализованных ранее проектов,
подведение итогов незапланированных промышленных
экспериментов по воздействию на окружающую среду
(см.);
оперативная экологическая экспертиза —
расследование экологических проблем, связанных с
аварийными ситуациями и с необходимостью получения
конкретных данных по экологической обстановке в различных
пунктах, регионах;
перспективная экологическая экспертиза —
рассмотрение широкого круга проблем природопользования
локального, регионального и глобального уровней.
ЭКОСИСТЕМА (от греч. oikos — дом, место;
systema — целое, состоящее из частей). Природный
комплекс (биокосная система), образованный живыми
организмами (биоценоз) и средой их обитания (косной —
например, атмосфера или биокосной — почва, вода),
связанными между собой обменом вещества и энергии.
Термин ввел английский ботаник А. Тенсли.
Понятие применяется как к системам, в которые
входит один организм, так и к системам, которые
включают совокупность организмов. Все реальные экосистемы
Земли — открытые системы, обменивающиеся с
окружающей их средой веществом и энергией. Термин «эко-
Экотоксикология 296
система» может в некоторых случаях отождествляться
с понятиями «биогеоценоз» (см.), «природный
ландшафт» (см.), «природная геосистема». Однако в
экосистеме анализ связей имеет биоценотический аспект, то
есть выясняется весь круг проблем, связанный с
влиянием на живые компоненты экосистемы. Элементы к
связи в природных ландшафтах и геосистемах
равнозначны, причем одинаковое внимание уделяется как
прямым, так и обратным связям. По отношению к
биогеоценозу понятие «экосистема» носит более общий
характер, так как понятие «биогеоценоз» ограничено
пространственными рамками. Термин «экосистема», как
правило, применяют, если на первое место ставятся
вопросы охраны живого, биоты, а термин «природная
геосистема» — в тех случаях, когда основное внимание
уделяется охране других компонентов природы.
Конкретная экосистема обладает характерной для нее
биологической продуктивностью.
ЭКОТОКСИКОЛОГИЯ. Один из разделов учения об
охране окружающей среды, занимающийся выяснением
механизмов (особенно биохимических и
физиологических) токсического действия антропогенных факторов на
живые организмы в природной среде. Часто
используется и как общее название для работ по биоиндикации
(см.) и биологическому мониторингу (см.) окружающей
среды.
Экотоксикологию можно рассматривать как
междисциплинарное направление, развивающееся на
пограничных направлениях токсикологии, экологии, биологии,
геохимии, почвоведения и других наук. Например,
сведения об источниках поступления и закономерностях
распространения и превращений в окружающей среде
химических веществ, вызывающих у живых организмов
токсические эффекты, экотоксикология получает из
почвоведения, гидрохимии, биогеохимии, экологической
химии.
Индикация и изучение токсических эффектов,
вызываемых загрязнением у живых организмов,
предусматривает обязательное знание нормы содержания
загрязняющих химических веществ, поскольку экотоксиколо-
гические исследования должны входить непременной
составной частью в биоиндикационные.
297 Элементарный геохимический ландшафт
Фактически экотоксикология представляет собой
биоиндикацию на уровне внутриклеточных структур. Не
заменяя биоиндикационных исследований в природе,
экотоксикология служит их непременным дополнением.
ЭЛЕМЕНТАРНЫЙ ГЕОХИМИЧЕСКИЙ
ЛАНДШАФТ. По Б. Б. Полынову, это определенный элемент
рельефа с однородными породами, почвами и
растительным покровом. Термин «элементарный ландшафт»
близок к понятиям «биогеоценоз» и «ландшафтная
фация» (см. Ландшафт).
ЛИТЕРАТУРА
Алексеев Ю. В. Тяжелые металлы в почвах и растениях. Л.,
1987.
Алексеенко В. А. Геохимические методы поисков
месторождений полезных ископаемых. М., 1989.
Бабье в а И. П., Зенова Г. М. Биология почв. М., 1989.
Барбье М. Введение в химическую экологию. М., 1978.
Бертокс П., Радд Д. Стратегия защиты окружающей среды
от загрязнения. М., 1980.
Беспамятно в Г. П., Кротов Ю. А. Предельно допустимые
концентрации химических веществ в окружающей среде:
Справочник. Л., 1985.
Биоиндикация загрязнений наземных экосистем/Под ред.
Р. Шуберт. М., 1985.
Большая Советская Энциклопедия. В 30 т. 3-е изд. М., 1969—
1981.
Б у р д и н К. С Основы биологического мониторинга. М., 1985.
Вернадский В. И. Химическое строение биосферы Земли. М.,
1987.
Воронин А. Д. Основы физики почв. М., 1986.
Глазовская М. А. Геохимия природных и техногенных
ландшафтов. М., 1988.
Гудериан Р. Загрязнение воздушной среды. М., 1979.
Д а ж о Р. Основы экологии. М., 1975.
Добровольский В. В. География микроэлементов.
Глобальное рассеяние. М., 1983.
Добровольский Г. В., Гришина Л. А. Охрана почв. М.,
1985.
К а б а т а-П еидиас А., Пендиас X. Микроэлементы в почвах
и растениях. М., 1989.
Ковалевский А. Л. Биогеохимические методы поиска рудных
месторождений. М., 1974.
Ковальский В. В. Геохимическая экология. М., 1974.
К овд а В. А. Биогеохимические циклы в природе и их нарушение
человеком. М., 1975.
К о в д а В. А. Патология почв и охрана биосферы планеты. Пу-
щино, 1989.
Ков да В. А. Почвенный покров, его улучшение, использование и
охрана. М., 1981.
Малашевич Е. В. Краткий словарь-справочник по охране
природы. Минск, 1987.
М и р к и н Б. М., Р о з е н б е р г Г. С, Н а у м о в а Л. Г. Словарь
понятий и терминов современной фитоценологии. М., 1989.
299 Литература
Методические рекомендации по проведению полевых и
лабораторных исследований почв и растений при контроле
загрязнения окружающей среды металлами/Под ред. Н. Г. Зырина,
С. Г. Малахова. М., 1981.
Новиков Г. А. Основы общей экологии и охраны природы. Л.,
1979.
Овчинникова М. Ф. Химия гербицидов в почве. М., 1987.
Орлов Д. С. Химия почв. М., 1985.
Охрана ландшафтов: Толковый словарь. М., 1982.
Охрана окружающей среды: Справочник. Л., 1978.
Почвоведение/Под ред. И. С. Кауричева. М., 1989.
ПДК вредных веществ в воздухе и воде. Л., 1975.
Р е й м е р с Н. Ф. Природопользование: Словарь-справочник. М.,
1990.
Реуцэ А., Кырстя И. Охрана почв от химического загрязнения.
М., 1987.
Розанов Б. Г. Генетическая морфология почв. М., 1975.
Розанов Б. Г. Основы учения об окружающей среде. М., 1984.
Скурлатов Ю. И. Роль экологической химии в решении
проблем сохранения и улучшения качества природной водной сре-
ды//Экологическая химия водной среды. М., 1988.
Современные физические и химические методы исследования
почв/Под ред. А. Д. Воронина, Д. С. Орлова. М., 1987.
Сысуев В. В. Моделирование процессов в ландшафтно-геохими-
ческих системах. М, 1986.
Техногенные потоки вещества в ландшафтах и состояние
экосистем/Под ред. М. А. Глазовской. М., 1981.
Толковый словарь по почвоведению. М., 1975.
Фортескью Дж. Геохимия окружающей среды. М., 1983.
Химия тяжелых металлов, мышьяка и молибдена в почвах. М,
1986. .
СОДЕРЖАНИЕ
Предисловие ...,..* 3
Абиотическая среда
Агролесомелиорация .
Агроценоз
Агрофитоценология
Агроэкология
Агроэкосистема
Азот в почвах . .
Аккумуляция в почв*
биологическая . . .
Аккумуляция в почве хи
мических загрязняющих
веществ
Активность ионов в
почвах
Активность почв
биологическая
Аллофаны
Альбедо
Алюминий, токсичный
для растений
Анализ воды .
Анионы обменные
Антропогенная нагрузка
Антропосфера . . .
Ареал почвенный элемен
тарный .....
Аридные территории .
Аэрозоли ...
Баланс гумуса . . .
Барьеры геохимические
Безотходная технология
Б;ензолполикарбоновые
кислоты
Биогеохимические про
винции . . .
Биогеохимия
Биогеоценоз
Биогеоценология . .
Биоиндикация . .
Биоредуценты
Биота почвенная . . .
Биофильность элемента
7
7
10
13
13
13
13
16
16
16
18
21
22
22
23
23
23
24
24
24
25
25
27
33
33
34
33
38
40
41
44
44
46
Битумы почвенные . . 46
Бонитет 46
Бонитировка почв ... 46
Бром в почвах ... 46
Буртование гумусового
горизонта 47
Буферная способность
почв 47
Буферность почв
кислотно-основная ... 48
Буферность почв по
отношению к
загрязняющим их металлам . 50
Буферность почв по
отношению к фосфору . . 51
Вермикулиты ... 53
Войлок ....... 54
Воско-смолы ..... 54
Время самоочищения
почв 54
Выбросы загрязняющих
веществ ...... 58
Вытяжка из почв
водная ....... . 60
Вытяжки из почв для
извлечения подвижных
соединений
микроэлементов ... 61
Вытяжки из почв для
извлечения подвижных
соединений фосфора и
калия 62
Гажа 66
Галогены ... 66
Гидроксиды железа и
алюминия ...... 66
Гидролиз почвенных
соединений - 67
Гидроморфные почвы . 69
Гидрослюды 69
Гипс в почвах ... 70
Гипсование почв ... 72
Глинистые минералы . 73
301
Содержание
Гуминовые кислоты . .
Гумус
Гумусное состояние почв
Двойной электрический
слой .......
Деградация почв . . ,
Деструктивная
активность ... • .
Детергенты ....
Детоксикация
загрязняющего почву химического
вещества ....
Детоксикация почв .
Детрит
Детритогенез
Диаграммы растворимо
сти
Дистанционные методы
исследования окружаю
щей среды ....
Дренаж
Дыхание почвы
Емкость анионного об
мена (ЕАО) . . .
Емкость катионного об
мена (ЕКО) . . .
Железо в почвах . .
Жидкая часть почвы .
Загрязнение
Загрязнение гербицидами
Загрязнение
инсектицидами
Загрязнение
канцерогенными углеводородами
Загрязнение нефтью и
нефтепродуктами . . .
Загрязнение
пестицидами . ......
Загрязнение почвы
Загрязнение почвы
глобальное
Загрязнение почвы
локальное
Загрязнение почвы
региональное
Загрязнение почвы
химическое
3-агрязнение ^природной
среды
Загрязнение
промышленное
76
78
81
84
85
95
96
96
96
97
97
98
99
100
100
101
101
103
105
106
107
108
109
111
113
115
115
116
116
116
116
117
Загрязнение
радиоактивное 119
Загрязнение
сельскохозяйственное 121
Загрязнение тяжелыми
металлами и
неметаллами . 122
Загрязненность почвы
химическим веществом . 124
Загрязняющее почву
приоритетное вещество . . 124
Загрязняющее почву
химическое вещество . . 124
Загрязняющие вещества 125
Замусоривание . 127
Запасы гумуса ... 127
Заповедник ..... 128
Заряд почвенных
коллоидов переменный . . 130
Заряд почвенных
коллоидов постоянный . . 162
Засоление почв . . 133
Засоление почв
вторичное 134
Земельные ресурсы . . 136
Земельный кадастр . . 136
Земледельческие поля
орошения ...... 136
Зоны буферности почв
по отношению к
кислотам . . 136
Зоны загрязнения ... 137
Зоомеханогенез , . . . 138
Известкование ... 139
Илистая фракция почв 140
Индикация
биогеохимическая состояния
окружающей среды ... 141
Иод в почвах ... 142
Ионная сила почвенного
раствора ....... 143
Источник загрязнения . 144
Источник химического
загрязнения почвы
промышленный .... 146
Источник химического
загрязнения почвы
сельскохозяйственный . . 146
Источник химического
загрязнения почвы
транспортный 146
Содержание
302
Источник химического
загрязнения почвы
хозяйственно-бытовой . . 146
Истощение земель . . 146
Калийный потенциал . 146
Каолиниты 147
Карбонаты в почвах . 148
Картографирование почв 150
Катионы обменные . . 152
Кислотность почв
актуальная 152
Кислотность почв
потенциальная ...... 154
Кислые дожди
(кислотные дожди, кислые
осадки) 155
Коагуляция почвенных
коллоидов . . 157
Коллоиды почвенные . 158
Комплексные соединения 159
Контроль загрязнения
почв 161
Коэффициент
биологического поглощения . . . 163
Коэффициент водной
миграции . 167
Коэффициенты
накопления 169
Ксенобиотик ..... 170
Ландшафт ..!... 171
Легкорастворимые соли
в почвах 173
Лессиваж 175
Лизиметрические воды . 176
Липиды почвенные . . 176
Лихеноиндикация . . . 177
Марганец в почвах . . 178
Массовая доля
загрязняющего почву
химического вещества ... 179
Межпакетная сорбция
веществ ...... 179
Методы
фракционирования соединений железа 180
Миграция химических
соединений 181
Минерализованность
природных вод 188
'Мобилизация
питательных элементов . -. . . 188
Мониторинг 189
Мониторинг фоновый . 192
Монтмориллониты . . 193
Мышьяк в почвах . . 194
Насыщенные
основаниями почвы ..... 196
Натриевое
адсорбционное отношение .... 197
Натрий в почвах ... 198
Нейтрализующая
способность почв 200
Ненасыщенные
основаниями почвы .... 201
Ноосфера 202
Нормирование
содержания в почве химических
элементов 202
Обмен ионный .... 205
Объем нерастворяющий 205
Озон 205
Окислительно-восстановительная емкость почвы 206
Окружающая среда . . 206
Опадо-подстилочный
коэффициент 208
Опасные экотоксикологи-
ческие ситуации . . . 208
Оптические свойства почв 210
Ориентировочно-допустимое количество
загрязняющего почву
химического вещества . . 211
Ортштейн 212
Охрана почв .... 212
Пептизация почвенных
коллоидов ..... 214
Персистентность
загрязняющего почву
химического вещества .... 214
Плодородие почв ... 215
Поверхностная плотность
химического загрязнения 216
Поглотительная
способность почвы .... 216
Подвижность химических
элементов 218
Подкисление почв . . 219
Подстилка ..... 219
Показатели загрязнения
почв 220
Показатели химического
состояния почв .... 221
Поля орошения . . . 232
303
Содержание
Поля фильтрации . . 224
Потенциал известковый 224
Потенциальная буферная
способность почв по
отношению к калию . . . 224
Почвенный ключ
(ключевой участок, ключ) . 226
Почвенный поглощающий
комплекс (ППК) . . . 226
Почвенный раствор . . 227
Почвоутомление . . . 229
Предельно допустимое
количество
(концентрация) загрязняющего
почву химического
вещества (ПДК) ..... 230
Пробоотбор ..... 234
Промывка засоленных
почв 238
Реакция почвы . . . 238
Регламентация
количества загрязняющего почву
химического вещества . 238
Режим почв водный . 238
Рекультивация почв . . 240
Самоочищение почв . . 242
Санитарная охрана почв 244
Селективность катион-
ного обмена . . . . 246
Сера в почвах .... 248
Сода в почвах . . . 249
Сорбция анионов
почвами 250
Сорбция химических
веществ почвой .... 251
Стандартизация' . . . 252
Стандарты качества
окружающей среды . . 256
Сточные воды . . . 256
Сульфатредукция . . 258
Термодинамические
свойства почвы 258
Техногенез ..... 260
Техногенная пустыня . 260
Техногенный ландшафт 260
Технофильность . . . 262
Токсичность .... 263
Толерантность .... 263
Точка нулевого заряда 264
Трансформация
загрязняющих веществ в
почвах 265
Тяжелые металлы . . . 269
Углеводороды в почвах 271
Углерод в почвах . . 27 2
Удельная поверхность
почвы ....... 272
Удобрения как источник
загрязнения , 274
Фаза 277
Фазовые равновесия в
почвах 278
Фиксация катионов
почвами 278
Фоновое содержание в
почвах химического
вещества 279
Фоновые почвы . . . 280
Фосфор в почвах ... 281
Фреоны 284
Фтор в почвах . . . 285
'Характеристика
состояния соединений
химического элемента в
почве . . 286
Химические мелиоранты 288
Химическая мелиорация 288
Хлор в почвах .... 289
Цеолиты 289
Щелочность почв . . . 290
Эвтрофикация водоемов 291
Экологическая химия . 292
Экология ..... 294
Экологическая
экспертиза 295
Экосистема 295
Экотоксикология . . . 296
Элементарный
геохимический ландшафт . . 297
Литература 298
Справочное издание
Орлов Дмитрий Сергеевич, Малинина Мария Сергеевна,
Мотузова Галина Васильевна,
Садовникова Людмила Константиновна,
Соколова Татьяна Алексеевна
ХИМИЧЕСКОЕ ЗАГРЯЗНЕНИЕ ПОЧВ И ИХ ОХРАНА:
Словарь-справочник
Зав. редакцией Л. С. Максимова
Художник JI. Ч. Гоцлавский
Художественный редактор К. Е. Мацегорин
Технический редактор В. А. Боброва
Корректор Л. Г. Гладышева
ИБ № 7367
Сдано в набор 05.11.90. Подписано к печати 13.02.91. Формат
84хЮ87з2. Бумага кн.-журн. Гарнитура Литературная. Печать
высокая. Усл. печ. л. 15,96. Усл. кр.-отт. 15,96. Уч.-изд. л. 15,84.
Изд. № Ю4. Тираж 10 000 экз. Заказ № 5937. Цена 2 р. 50 к.
Ордена Трудового Красного Знамени ВО «Агропромиздат», 107807,
ГСП-6, Москва, Б-78, ул. Садовая-Спасская, 18.
Областная типография управления издательств, полиграфии и
книжной торговли Ивановского облисполкома. 153628, г. Иваново,
ул. Типографская, 6.