Author: Беккерт М.
Tags: металлургия развитие металлургии история металлургии металлобработка все о метале
Year: 1980
Text
МИР
МЕТАЛЛА
М.Беккерт
Издательство МИР
Москва198С
Prof. Dr. sc. techn.
MANFRED BECKERT
WELT
DER
METALLE
VEB Fachbuchverlag.
Leipzig. 1977
М.Беккерт
Перевод с немецкого
М.Я. Аркина
под редакцией
д-ра техн, наук проф. В. Г. Лютцау
ИЗДАТЕЛЬСТВО «МИР»
МОСКВА 1980
6ПЗ(09)
Б42
Б42 * Беккерт М.
Мир металла. Пер. с нем. М.Я. Аркина/Под ред. В. Г. Лют-
цау.—М.: Мир, 1980.
152 с. с ил.
Вся история человеческой цивилизации неразрывно связана с металлами:
со времен Древнего Египта и до наших дней они всегда были рядом
с человеком.
О многовековой истории развития металлургии и металлообработки, об
удивительных свойствах металлов, о фантастических перспективах «космиче-
ской металлургии» будущего рассказывает книга ученого из ГДР Манфреда
Беккерта.
Простота и доступность изложения, богатые иллюстрации делают, книгу
интересной для самого широкого круга читателей.
31101—175
Б 041(01)—80
175-80
2605000000
6ПЗ(09)
Редакция научно-популярной и научно-фантастической литературы
© VEB Fachbuch verlag, Leipzig, 1977
© Перевод на русский язык, «Мир», 1980
От редактора русского перевода
Металлы относятся к числу наиболее распространенных материалов, которые
человек использует для обеспечения своих жизненных потребностей. В наши дни
трудно найти такую область производства, научно-технической деятельности
человека или просто его быта, где металлы не играли бы существенной роли.
На протяжении многих веков человек с самого раннего возраста привыкал
к окружающим его металлическим предметам домашнего обихода, хозяй-
ственным орудиям и машинам, оружию и украшениям. Многие специфические
свойства металлов также издавна известны людям. Развитие металлургии по
праву следует считать весьма существенным аспектом истории человеческого
общества. Роль металлов в научно-техническом прогрессе и изменении про-
изводственных отношений на каждой стадии развития общественных формаций
исчерпывающе оценена в работах классиков исторического материализма.
В наше время уровень общеобразовательной подготовки учащихся в школах
и неспециализированных высших учебных заведениях достаточен для формиро-
вания общего представления о «природе вещей» и, в частности, о роли и значе-
нии металлов. Однако человеку свойственно стремление к расширению и углу-
блению своих познаний о мире, при этом особенно высок интерес людей
к современным достижениям в области науки и техники. Серьезные научные мо-
нографии, рассчитанные на специалистов, по своему уровню недоступны широ-
кому кругу читателей, поэтому роль научно-популярной литературы здесь труд-
но переоценить.
Предлагаемый вниманию читателя русский перевод книги «Мир металла»
восполняет определенный пробел, существующий в издании научно-популярной
литературы о металлах. Автор книги Манфред Беккерт—доктор технических
наук, профессор с большим педагогическим и научным опытом, плодотворно
работающий в области металловедения и сварки металлов на заводах и в инсти-
тутах ГДР. Как показывает написанная им книга, он удачно сочетает в себе эру-
дицию и опыт ученого и инженера с пытливостью историка и талантом литера-
тора. Он не ограничился сухими научно-техническими сведениями
и историческими датами, а, собрав богатый материал о каждом этапе развития
металлургии и науки о металлах, создал интересную и увлекательную повесть
о металлах, изложив в ней в занимательной форме историю металлургии, строе-
5
ние и свойства металлов, особенности их производства и переработки; большое
внимание он уделил также вопросам применения различных металлических ма-
териалов в технике, науке и народном хозяйстве. При этом, вводя читателя в со-
временные представления о природе металлов, автор не теряет научной строго-
сти и логической последовательности изложения?
Нет нужды перечислять здесь разделы и параграфы книги—читатель сам
без труда сможет сориентироваться в излагаемом материале. Однако следует
отметить удачную связь в книге проблем технического и научного характера
с вопросами исторического и диалектического развития общества. Эти грани по-
вествования в первую очередь полезны молодежи.
Книга прекрасно иллюстрирована, что облегчает восприятие материала
людьми, не имеющими специальной подготовки. Она рассчитана на самый ши-
рокий круг читателей: неспециалисты найдут в ней основные сведения о строе-
нии металлов, их роли в нашей жизни, способах получения и переработки; спе-
циалистам же безусловно будут интересны многие факты и занятные казусы из
истории развития металлургии.
В. Лютцау
От автора
Участь предисловий и послесловий обычно незавидна—чаще всего они остают-
ся непрочитанными. Но уж если книга должна иметь предисловие, ничего не
поделаешь—автору приходится его писать. И чтобы этот труд не был на-
прасным, автор стремится объяснить в предисловии значение и цель своей ра-
боты, а иногда предпринимает попытку оправдаться перед критически на-
строенным читателем за действительные или кажущиеся недостатки книги.
По замыслу автора, «Мир металла»—научно-популярная книга. Такая книга
должна удовлетворять ряду специфических требований, которые довольно труд-
но выполнить. В этом сразу убеждается каждый, кто берется популярно изло-
жить научный материал. Это замечают и читатели. Научно-популярная книга
должна занимательно учить и поучительно занимать. Поэтому автор заранее
просит взыскательного читателя быть снисходительным, ибо, возможно, неко-
торые места в книге покажутся ему излишне поучительными, а другие, наобо-
рот,—тривиально занимательными. Прежде всего довольно трудно объяснить
научные или технические факты и процессы общедоступно, на основе обычных
и всем известных явлений, не теряя при этом строгости и точности. Не менее
трудно также правильно и соразмерно отобрать те факты и явления, которые не-
обходимо рассмотреть или хотя бы упомянуть, чтобы поставленная цель была
достигнута, и те, которые можно или нужно опустить, чтобы сохранить доступ-
ность изложения.
Металлы как группа материалов представляют интерес с многих точек зре-
ния. В первую очередь мы остановимся на строении и свойствах металлов, их
поведении в процессах переработки и практических применениях, однако нема-
ловажна и их история. В разные исторические эпохи носителями человеческого
опыта и прогресса были различные классы. Поэтому историю металлов необхо-
димо рассматривать на фоне исторического развития общества.
В данной книге нашло отражение только то из «мира металла», что, по мне-
нию автора, является наиболее важным. Если это вызовет у читателя интерес
и побудит его обратиться к какой-либо из многих специальных книг или учебни-
ков по металловедению, металлургии или металлообработке, чтобы расширить
и углубить свои знания, то автор будет считать свою основную задачу
выполненной.
7
Автор глубоко признателен за полезные советы, рекомендации и информа-
цию своим друзьям и коллегам, прежде всего проф., д-ру техн, наук Хорсту Блю-
менауэру, заведующему кафедрой материаловедения Высшего технического
училища им. Отто фон Герике в Магдебурге и проф., д-ру философии Эберхарду
Вехтлеру, заведующему кафедрой истории производительных сил Фрейбергской
горной академии. Автор хотел бы выразить благодарность всем, кто помог ему
в подборе иллюстративного материала к книге. Здесь в первую очередь следует
назвать Гейнца Клемма из Пирны, приславшего превосходные микрофотогра-
фии, проф., д-ра Манфреда фон Арденне, который предоставил автору уни-
кальные иллюстрации по истории техники из своего архива, а также Вольфганга
Шрётера, чьи безупречные в техническом и художественном отношении фото-
графии гармонично дополняют текст.
Автор также искренне благодарен машинистке, редактору, оформителю
и всем работникам издательства, немало способствовавшим успешной работе
над книгой.
М. Беккерт
Металлы вчера
и сегодня
По мере развития человеческого общества—вплоть до наших
дней—использование металлов непрерывно расширялось.
В первобытную эпоху, которая составляет самый продолжи-
тельный период истории человечества, металлы долгое время
вообще не имели никакого значения и лишь где-то в конце эпохи
начали играть очень незаметную роль. Однако в последующих
общественно-экономических формациях они постепенно стано-
вились все более важными и нужными для людей. Современную
технику невозможно представить без металлических материа-
лов.
Человек открывает металлы
Металлы появились у человека не вдруг, не в результате ка-
кого-то революционного скачка в развитии общества—они по-
степенно входили в его жизнь в течение некоторого переходного
периода между каменным веком и веком металлов.
В древнекаменном веке (палеолите), начало которого от-
стоит от нас на сотни тысяч лет, человек пользовался «инстру-
ментами» из камня. Вначале это были грубые, нешлифованные
клинья-рубила, которые изготовляли, раскалывая найденные
камни подходящей формы. За многие тысячелетия приемы
обработки камня постепенно совершенствовались. Металлов
человек палеолита не знал. Вероятно, время от времени ему слу-
чайно попадались встречающиеся в природе куски металлов
(самородки), и он использовал их как необычные украшения.
Может быть, он обнаруживал, что такие куски—в противопо-
ложность хрупким камням—поддаются ковке. Но о технике
обработки металлов тогда еще не было и речи.
С окончанием последнего большого ледникового периода,
около десяти тысяч лет назад, на смену палеолиту пришел сред-
ний, а затем новый каменный век (неолит). Человек научился
шлифовать и сверлить каменные орудия.
Удивительным техническим достижением людей периода
неолита можно считать добычу кремней в настоящих шахтах
с вертикальным стволом глубиной 10 м и короткими штреками.
«Века» истории
в древних мифах
Греческий поэт Гесиод (около
700 г. до н. э.) писал, что в неза-
памятные времена земля сама
давала пропитание роду челове-
ческому. Люди жили без трудов
и печалей, всю свою долгую
земную жизнь были молоды,
а после смерти становились доб-
рыми небожителями. На смену
этому «золотому веку» пришел
другой, когда люди, уже не
столь послушные богам, выну-
ждены были обрабатывать зем-
лю. В этот «серебряный век»
люди после короткой земной
жизни уже не попадали на
Олимп, но все же становились
почитаемыми божествами под-
земного мира. Затем по воле
Зевса возникло племя гигантов
«бронзового века»—диких, во-
инственных, кровожадных, вла-
девших медным и бронзовым
оружием; они бесславно сошли
в Аид. Тогда Зевс создал четвер-
тое племя—героев. Но и они
погибли в битвах под Фивами
и Троей и теперь, освобо-
жденные от забот, живут на
краю земли, на островах вечно-
го блаженства. А во времена Ге-
сиода наступил «железный век»,
полный постоянных трудов, тре-
вог и страданий. Люди стали
9
алчными, лживыми и раз-
вратными.
Тоска угнетенных о счастли-
вом «золотом веке», без войн
и ссор, без тяжелого труда (и,
разумеется, без частной соб-
ственности), нашла свое художе-
ственное выражение в поэзии.
Гесиод и многие другие поэты
древности не оставляли надеж-
ды на возвращение «золотого
века». Прославленный римский
поэт Овидий (43 г. до
н. э.—18 г. н. э.), напротив, гово-
рил в своих произведениях о не-
возможности осуществления та-
кой социальной утопии.
Что же касается металлов, то
из всех этих прекрасных сказа-
ний можно сделать такой вы-
вод: человеку сначала стало из-
вестно золото, потом серебро,
бронза и, наконец, железо. Но
если даже было и так, поэтиче-
ские мифы все равно нельзя счи-
тать научным обоснованием для
подобного окончательного вы-
вода.
Накопленный при этом опыт пригодился людям потом для до-
бычи руды.
Люди перешли к земледелию и скотоводству. Ф. Энгельс пи-
сал: «Из достижений этой ступени в области промышленной
деятельности особенно важное значение имеют два: первое—
ткацкий станок, второе—плавка металлических руд и обработ-
ка металлов. Самыми важными из них были медь и олово, а так-
же выплавляемая из них бронза; бронза давала пригодные
орудия и оружие, но не могла вытеснить каменные орудия; это
было под силу только железу, а добывать железо еще не умели»
(К. Маркс и Ф. Энгельс. Соч., изд. 2-е, т. 37, с. 229).
Нельзя точно установить, когда именно люди начали добы-
вать и обрабатывать металлы. Можно лишь предполагать, ка-
кой из металлов первым нашел практическое применение. Оче-
видно, это были металлы, которые встречаются в природе
в чистом виде—в самородках. Тогда речь может идти только
о меди и золоте. Железо тоже встречается в природе в чистом
виде (в метеоритах), но чрезвычайно редко; еще реже можно
найти самородное железо в горных породах.
Скорее всего, золото было первым металлом, который люди
стали использовать. Правда, из него нельзя было сделать ору-
Золото всегда привлекало людей
своим блеском. ,В природе оно
встречается преимущественно в ви-
де самородков.
10
Больше 100 кг золота пошло на
саркофаг фараона Тутанхамона. Да-
же в наши дни вызывает восхищение
искусство древних золотых дел ма-
стеров, которые в совершенстве
овладели техникой обработки ме-
таллов.
дня труда или оружие, но знакомство и обращение с золотом принесло людям
опыт, который пригодился им в дальнейшем при обработке других металлов.
К концу позднего неолита первобытнообщинный строй в долинах Нила, Тигра
и Евфрата стал распадаться, на смену ему пришли государства с рабовладельче-
ским строем. В остальной Азии и в Европе общество развивалось медленнее; од-
нако золото было известно и там.
Шумеры, жившие на рубеже III—IV тысячелетий до и. э. по рекам Тигр и Ев-
фрат, изготовляли из золота изделия, которые и сегодня остались такими же
чистыми и блестящими, какими были в те далекие времена. В Египте обработка
золота тоже началась в позднем неолите.
Еще в 2900 г. до и. э. основатель древнеегипетского государства Менее пове-
лел называть своим именем единицу стоимости, выраженную слитком золота
весом 14 г. Сотни лет золото текло к фараонам из Нубии, где им принадлежали
золотые прииски. Из археологических раскопок мы узнали о той раскоши, кото-
рой окружали себя господствующие классы в древнем Египте, об их неисчис-
лимых богатствах. Так, настоящей сокровищницей оказалась гробница фараона
Тутанхамона, умершего молодым около 1350 г. до н. э. Один лишь его искусно
отделанный золотой саркофаг весил 110,4 кг. Можно себе представить, что об-
наружили бы современные археологи в гробницах великих фараонов, если бы их
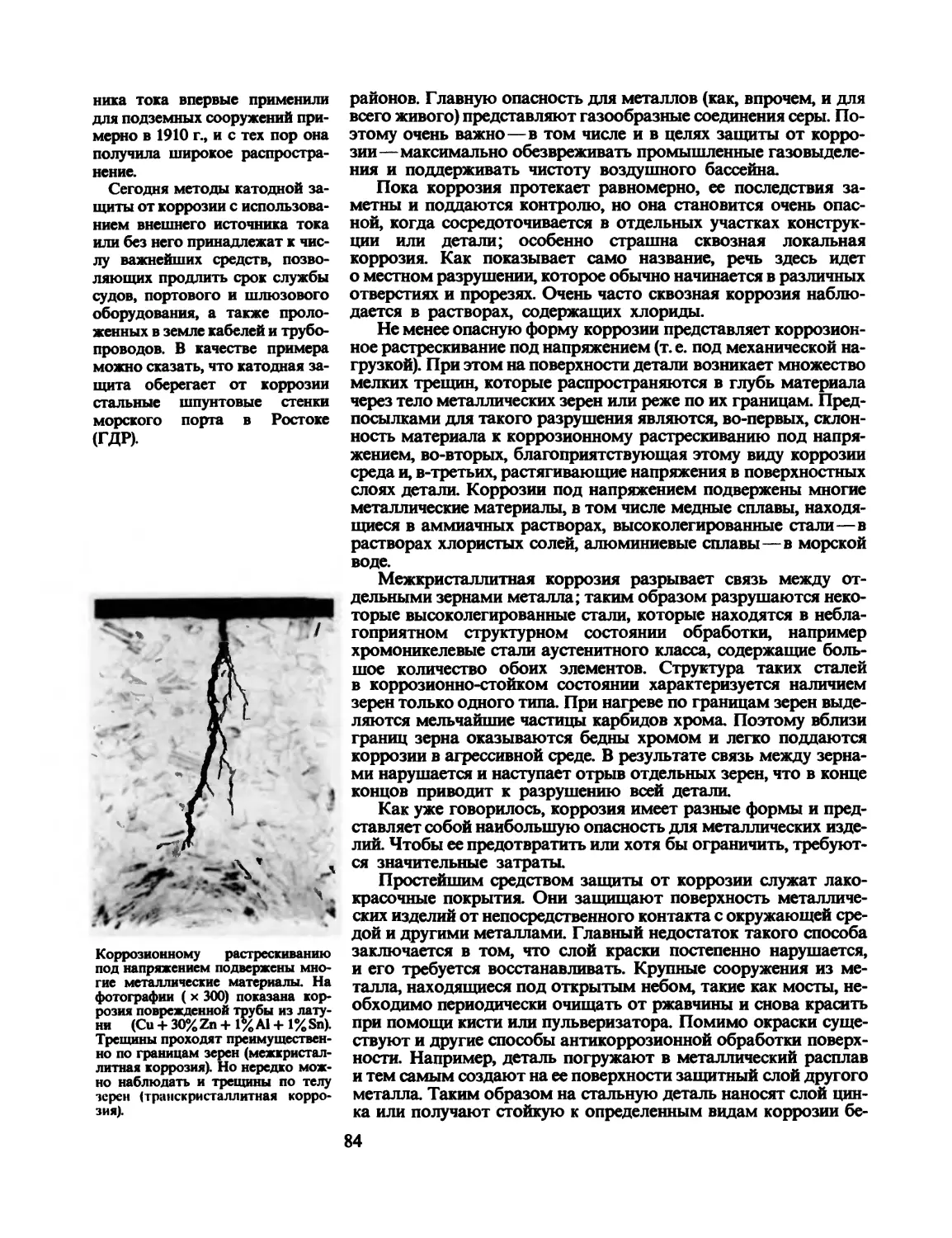
не разграбили древние кладоискатели.
О технике обработки металлов, достигнутой в Египте четыре тысячелетия
назад, можно судить по изображениям, найденным в гробнице фараона Мереру-
ба (VI династия Древнего царства). Чиновник отвешивает металл (золото), и пи-
сец записывает его количество. На следующем рисунке—шесть человек разду-
вают плавильный горн трубками, похожими на стеклодувные. Дальше—мастер
разливает расплавленный металл из тигля в форму, стоящую на земле, а помощ-
ник в это время задерживает шлак. Слиток отбивают камнями (молотками)
и доводят до готового изделия. В верхней части изображения можно видеть из-
готовленные таким образом сосуды.
В то время техника плавки имела две особенности: дутье осуществляли с
помощью трубок и легких человека, а для ковки металла использовали
камни.
Сегодня общепринято считать, что бронзовому веку предшествовал период,
когда оружие и инструменты делали из меди. В тот период еще далеко не исчез-
ли из употребления и кремневые орудия, поэтому его называют каменно-
медным веком.
Медь встречается в природе в виде самородков, и, очевидно, первые мелкие
медные изделия, такие, как наконечники для стрел и копий, выковывали из най-
денных самородков. Люди обнаружили, что при холодной ковке медь не только
принимает нужную форму, но и становится тверже и прочнее. Затем, скорее все-
го случайно, люди открыли, что упрочненный холодной ковкой металл можно
снова сделать мягким, если нагреть его на огне. Использование обоих процес-
сов: холодного упрочнения и смягчающего отжига—свидетельствует о том, что
человеку уже стали известны существенные свойства металлов. Прошло немало
времени, прежде чем люди научились плавить медь и отливать ее в формы.
Правда, археологам удалось найти медный топор, отлитый в открытую форму
около 4000 г. до и. э., но познания человека в металлургии тогда еще были на-
столько ничтожны, что едва ли можно говорить о какой-то технике литья. Во
времена фараона Снофру, примерно в середине III тысячелетия до н. э., в раз-
личных областях египетского государства медь добывали уже шахтным
способом.
Были найдены и более крупные изделия из меди, расплющенной в лист, на-
12
Изображение, обнаруженное в гробнице фараона Мереруба (VI династия Древ-
него царства, 2315—2190 гг. до н. э.\ свидетельствует о том, что технология
переработки металлов в Египте достигла высокого уровня еще четыре тысяче-
летия назад.
пример котел диаметром больше 0,5 м в гробнице фараона Пе-
рибсена (2695—2665 до н. э.), что говорит о заметно возросшем
в этот период мастерстве ремесленников в обработке металла.
Тогда же начали все шире применять литье в закрытые формы.
Появились постоянные формы, в которых можно было много-
кратно получать отливки. Люди научились также паять медь се-
ребряной проволокой.
Техника обработки металлов достигла удивительно высоко-
го для того времени уровня. Люди поверили в новый материал.
Но знания о металлах и умение с ними обращаться не были
всеобщим достоянием. Узок был круг посвященных, и они не
стремились его расширять, дабы не ослабить своего положения
в обществе. Были ли такие умельцы свободными людьми или
рабами, они пользовались привилегиями по сравнению с прочи-
ми, хотя нередко эти привилегии превращались в цепи: правите-
ли всегда стремились удержать в своих руках тех, кто овладел
искусством добычи и обработки металлов, и всячески ограничи-
вали их свободу.
При всех своих достоинствах медь имела и существенный не-
достаток: медные орудия и инструменты, например ножи, бы-
стро затуплялись. Даже в холодноупрочненном состоянии проч-
ность, износостойкость и другие свойства меди были не
настолько высоки, чтобы медные инструменты и орудия могли
полностью заменить каменные. Решающий шаг в этом напра-
влении позволил сделать только сплав меди—бронза.
Сплав определяет историческую эпоху
Если к меди добавить олово, то получится сплав—так назы-
ваемая оловянистая бронза. Кроме нее существуют и другие
бронзы, причем важнейший легирующий элемент, как правило,
упоминается в названии: свинцовистая, мышьяковистая, сурь-
мянистая бронзы и т. п.
Главные преимущества бронз по сравнению с медью заклю-
чаются в их лучших литейных свойствах, больших твердости
и прочности, а также в более сильном упрочнении в результате
холодной деформации.
Xронологическая
систематика, построенная
одним датчанином
Датскому знатоку древней ис-
тории Христиану Юргенсену
Томсену (1788—1865) в 1816 г.
было поручено руководство Ко-
ролевской комиссией по охране
и содержанию памятников ста-
рины, которая заседала до этого
несколько лет, но ничего суще-
ственного не сделала. Бывший
коммерсант решил поставлен-
ную перед ним задачу умело
и основательно. Сегодня со-
зданный его стараниями Нацио-
нальный музей в Копенгагене—
самый крупный и богатый
в Скандинавских странах. Осо-
бая заслуга Томсена состояла
в последовательной системати-
зации археологических находок.
Распределяя их в хронологиче-
ском порядке в зависимости от
материала, он пришел к привыч-
ному теперь для нас делению
древней истории на три перио-
да: каменный век, бронзовый
век и железный век. Научное
значение такой систематики
оценил и К. Маркс: «Как ни
мало историческая наука знает
до сих пор развитие материаль-
ного производства, следова-
тельно, основу всей обществен-
ной жизни, а потому и всей
действительной истории, одна-
ко, по крайней мере, доистори-
ческие времена делятся на пе-
риоды на основании естествен-
но-научных, а не так называе-
мых исторических изысканий,
по материалу орудий и оружия:
каменный век, бронзовый век,
железный век» (К. Марс и Ф. Эн-
гельс. Соч., изд 2-е, т. 23, с. 191).
Очевидно, используемые ма-
териалы представляют собой
важный признак, характеризую-
щий качество и ступень разви-
тия орудий труда. Для доисто-
рических времен это действи-
тельно основополагающий
и определяющий критерий, но
и в более поздние общественно-
экономические формации он
имел существенное значение.
13
Бронзовое литье в Египте (около
1450 г. до и. э.). Изображение из
гробницы чиновника времен XVIII
династии Нового царства.
Чаша с подставкой (египетская
бронза, примерно 1400 г. до н. э.).
Фигура ибиса (египетская бронза
позднего периода, около 700 г. до
н. э.Х
Вполне возможно, что еще до оловянистой бронзы или одно-
временно с ней применялись и иные бронзы, скажем легко под-
дающиеся литью мышьяковистая и мышьяковисто-сурьмяни-
стая. Такие особые бронзы получались при смешивании
различных руд, использовались также руды определенных ме-
сторождений, которые помимо основных металлов—меди
и олова—содержали и другие, сопутствующие металлы.
Техника металлургии и металлообработки развилась до-
вольно поздно по сравнению с гончарным делом и ткачеством
и с самого начала находилась в руках специалистов. Можно
предполагать, что металлургия и металлообработка бронзово-
го века зародилась в первых крупных культурных центрах древ-
ности—в долинах Тигра и Евфрата, а также Нила. Считается,
что в Египте бронзовые изделия стали изготовлять в начале II
тысячелетия до н. э.; на Среднем Востоке бронзовый век начал-
ся несколько раньше.
В гробнице высокопоставленного египетского чиновника
XVIII династии (Новое царство, около 1450 г. до н. э.) найдено
изображение технологического процесса получения бронзовых
отливок в те времена. Трое рабочих (скорее всего, это рабы) под
наблюдением надсмотрщика с палкой подносят металл. Двое
рабочих с мехами и еще один с кочергой раздувают огонь. Выше
и ниже этих сценок изображены плавильные тигли и кучи дре-
весного угля. При помощи простого состоящего из двух прутьев
приспособления двое рабочих вынимают тигель из горна. В цен-
тре показана операция разливки. Пространный иероглифиче-
ский текст поясняет, что это картины, рисующие отливку боль-
ших бронзовых дверей для храма, и что металл по приказу
фараона доставлен из Сирии.
Применение мехов для дутья вместо прежних похожих на
стеклодувные трубок означало большой шаг вперед. Тот факт,
что в середине II тысячелетия до н. э. древние мастера произво-
дили отливку дверей храма, позволяет считать, что к тому вре-
мени уже был накоплен достаточный опыт в области бронзово-
го литья, так как столь крупное изделие требует от металлургов
знаний и умения.
Большой спрос на ценную бронзу стимулировал развитие
н других отраслей хозяйства. Совершенствовалось горное дело,
расширялась торговля. В Италии были обнаружены рудники
глубиной до 130 м, заложенные в бронзовом веке; в них еще со-
хранилась шахтная крепь с деревянными стойками и обшивкой.
Олово, необходимое для выплавки бронзы, встречается далеко
не везде. Финикийцы—лучшие мореплаватели и торговцы древ-
ности—добрались до юго-западной части Британских островов
и нашли там месторождение оловянной руды (касситерита).
Благодаря торговле бронзу узнали и другие народы. В Европе
начало бронзового века приходится на II тысячелетие до н.э.
14
Очаги бронзовой культуры возникали и развивались во многих
уголках древнего мира.
Из бронзового века дошло до нас немало выдающихся изде-
лии ремесла различных народов. Оружие, инструменты, украше-
ния, посуда и другие предметы свидетельствуют об удивитель-
ном искусстве древних мастеров, которым были хорошо
известны специфические свойства меди и ее сплава—бронзы.
Наряду с бронзой люди все чаще стали использовать и дру-
гой металл, еще более подходящий для изготовления инстру-
ментов и оружия,—железо. Его история также начинается в глу-
бокой древности.
Гора Агиос-
Пергам Г еоргиос
Расположение пергамского напор-
ного водопровода.
Железный век
Пока еще не удалось установить, где и как впервые начали
добывать железо в больших количествах,—выражаясь совре-
менным языком, «в промышленных масштабах». Самое древнее
железное изделие, найденное в Египте, относится к IV тысячеле-
тию до н. э., оно представляет собой ожерелье из прокованных
полосок метеоритного железа. Метеоритный металл легко от-
личить от железа земного происхождения, так как он содержит
никель (в среднем 8—10% по весу). На юге Месопотамии, где
когда-то находился шумерский город-государство Ур, найден
кинжал с позолоченной рукояткой, изготовленный тоже из ме-
теоритного железа приблизительно в 3100 г. до н. э. Метеорит-
ное железо обрабатывали так же, как медь. При холодной ковке
оно приобретает нужную форму и одновременно становится
прочнее и тверже, а отжиг в огне снова делает кованый металл
мягким.
В древности железо было окружено ореолом таинственно-
сти—очевидно, из-за своего происхождения. Шумеры называли
его «небесной медью». В хеттских клинописных табличках, где
указано географическое происхождение всех известных тогда
металлов, про железо говорится, что оно «происходит с неба».
Египтяне всегда изображали железные предметы синими—цве-
та неба. Но и позже, когда железо стали получать из руд, оно не
утратило этой своей репутации. Люди, добывавшие и перера-
батывавшие железо, были окружены большим почетом и уваже-
нием, к которым обычно примешивался страх перед их
«сверхъестественными» способностями. Такое отношение к куз-
нецам ярко выражалось, например, в том, что на них зачастую
не распространялись общепринятые нормы поведения, морали,
им предоставлялись особые, чуть ли не царские привилегии.
С другой стороны, народные сказания и мифы нередко на-
деляют кузнецов устрашающей, безобразной внешностью, раз-
ными телесными недостатками и дурными чертами характера.
Вначале много железа появилось у халибров—легендарного
народа, жившего в Закавказье около 1500 г. до н. э.; они выпла-
вляли его из руд. По сравнению с медью железо обладало тем
преимуществом, что месторождения железных руд встречались
гораздо чаще. Там, где неподалеку от руды есть и древесина, т. е.
почти всюду, можно было получать железо. В сыродутных гор-
нах железную руду восстанавливали древесным углем и получа-
ли ковкое, так называемое кричное железо. Такая технология
прямого получения железа из руд долгое время оставалась
неизменЦой.
Античный водопровод
Пергамский царь Эвмен II
в 180 г. до н.э. повелел соору-
дить напорный водопровод дли-
ной Зкм. На горе Агиос-Геор-
гиос находились сборный бас-
сейн и отстойник для питьевой
воды, которая поступала с Ма-
дарских гор (расположенных
в 60 км отсюда) по трем линиям
труб, сделанных из обожженной
глины. От сборного бассейна
трубопровод пришлось про-
кладывать вниз, а потом снова
вверх с перепадом высот около
200 м; соответственно рабочее
давление в нем достигало
20атм. Обычные гончарные
трубы для этого не годились.
Есть основания полагать, что
здесь древние гидростроители
использовали металлические
трубы длиной около 1 м,
укладывая их в просверленные
камни. Трубы, скорее всего, от-
ливали из бронзы. До наших
дней дошли только камни с от-
верстиями, которые и указы-
вают трассу водопровода. Мно-
гие камни расколоты: вероятно,
таким образом кто-то извлекал
из них ценные бронзовые трубы.
Подобный водопровод—боль-
шое техническое достижение
для того времени. Построенные
римлянами еще в 100 г. до н.э.
водопроводы с их мощйЫми ак-
ведуками также вызывают наше
восхищение. Вечный город снаб-
жали водой 10 линий общей
длиной 404км, с поперечным се-
чением водопроводов больше
7,5 м2, что соответствует диаме-
тру трубы около 3 м. Но пергам-
ский напорный водопровод—
единственное в своем роде соору-
жение, техническое достижение
15
того времени, и только теперь
вновь стали строить трубопро-
воды с таким высоким давле-
нием.
Небесный металл
Ежедневно на Землю падает
в среднем б тыс. т вещества.
Большей частью это метеорит-
ная пыль, т.е. частицы диаме-
тром в несколько микрон. Но
иногда в земную атмосферу за-
летают и более крупные тела,
которые мы видим на ночном
небе как «падающие звезды»
или огненные шары—болиды.
Их вещество не всегда пол-
ностью распыляется в атмос-
фере, иногда довольно весо-
мые обломки этих тел дос-
тигают поверхности земли с
громоподобным шумом. Ме-
теориты средней величины за-
рываются в землю на несколь-
ко метров, а большие—образу-
ют огромные воронки. Наиболее
известна из них Чертова долина
в Аризоне—кратер диаметром
1200м и глубиной около 200м.
Здесь в доисторические времена
упал железный метеорит, массу
которого специалисты оцени-
вают в 10 млн. т. Об этом собы-
тии говорится в передаваемых
из поколения в поколение и до-
шедших до наших дней преда-
ниях индейцев племени навахо:
«в этом месте в незапамятные
времена огненный дух сошел
с неба на землю». По-видимому,
еще большую массу имел метео-
рит, кратер от которого обнару-
жен при аэрофотосъемке в бра-
зильских джунглях: диаметр
этого кратера достигает Зкм,
а глубина—500м.
Метеориты бывают железные
и каменные. Первые состоят
Железо не вытеснило бронзу. В железном веке стало даже
больше бронзовых изделий, чем их было в самбм бронзовом ве-
ке. Первое время железо ценилось очень дорого. Один из асси-
рийских царей, живший три тысячелетия назад, славился своими
железными сокровищами, которые были для него дороже золо-
та. Ахилл, герой древнегреческого мифа, убил своего противни-
ка, чтобы завладеть его железными доспехами.
Если во II тысячелетии до и. э. железо было в 15—20 раз до-
роже меди, то позднее цена на него упала, однако оно по-преж-
нему оставалось настолько дорогим, что крицы (чушки необра-
ботанного железа особой формы) хранились в царских
сокровищницах. Такой клад—160 т железа—был, например,
найден во дворце царя Саргона II (722—705 до н. э.) при раскоп-
ках вблизи его столицы Ниневии.
Поначалу этот металл представлял собой ковкое железо, или
очень мягкую сталь (пока для простоты мы будем называть
сталью сплав железа с малым количеством углерода). Были из-
вестны и более твердые сорта стали, однако способы их получе-
ния кузнецы держали под строжайшим секретом. А секрет со-
стоял прежде всего в повышении содержания углерода: такая
сталь приобретает способность к закалке.
В истории народов Востока тоже можно отчетливо просле-
дить бронзовый и железный века. Воинственные кочевники из
Средней Азии имели металлические доспехи и железное оружие.
Как говорят предания, колыбелью монголов и туркменов были
богатые рудами Алтайские горы, а вышли они из этой колыбели
при помощи кузнечных горнов; верховными богами эти народы
считали тех, которые ведали кузнечным искусством. Бесспорно,
что эти пришедшие с Востока народы внесли большой вклад
в распространение металлургии и металлообработки.
В Китае железный век, по-видимому, начался позже, чем
в странах, лежащих западнее него. Интересно отметить, что
здесь из руды получали не непосредственно ковкое железо, а вы-
плавляли чугун, из которого затем либо приготовляли сталь пу-
тем процесса пудлингования, либо делали отливки. В Китае чу-
гун был распространен гораздо шире, чем в других странах,
и литейная техника там раньше достигла высокого совершен-
ства. ВI тысячелетии н. э. китайцы уже изготовляли необычайно
крупные отливки. Некоторые из них сохранились, например чу-
гунный колокол высотой 4 м, диаметром 3 м и веерм почти
60 т, отлитый примерно в 1000 г. н. э.
Впечатляющие шедевры были созданы и металлургами
древней Индии. Индийцы научились делать большие поковки.
В Дели стоит знаменитая Кутубская колонна весом 6 т, высо-
той 7,5 м и диаметром 40 см. Она сооружена из отдельных
криц, сваренных в кузнечном горне. Еще большее удивление,
чем размеры колонны, вызывает тот факт, что до сих пор на ней
не образовалось ржавчины. Очевидно, это объясняется чистотой
материала, сухим климатом или какими-то другими факторами,
но уж, конечно, не тем (как иногда утверждают), что эта колон-
на—творение инопланетных пришельцев. К тому же надпись на
ней гласит, что колонна сделана примерно в 380—330 гг. до н. э
Древнеиндийские металлурги славились также своей сталью
В захоронениях найдено стальное оружие, изготовленное в сере-
дине I тысячелетия до н. э. Индийские мечи высоко ценилиа
в древности. Уже тогда индийцы овладели искусством пригото-
вления «настоящей» дамасской стали.
16
Сегодня в Индии действуют современные домны и сталеплавильные заводы,
но еще 50 лет назад индийские крестьяне получали железо в примитивных гор*
нах, пришедших из прошлого тысячелетия.
Дамасские клинки получили свое название от города Дамаска, который еще во
времена римского императора Диоклетиана (243—316) славился своими кузне-
цами-оружейниками. Вероятно, там обрабатывали и индийскую сталь.
в основном из железа, в котором
содержится (по весу) 8—10% ни-
келя, 0,5% кобальта и до 1% дру-
гих элементов: фосфора, серы,
углерода, хрома и меди. Метео-
ритное железо поддается ковке
в холодном состоянии. Несом-
ненно, первые железные пред-
меты, которыми люди стали
пользоваться в глубокой древ-
ности, были сделаны из метео-
ритного железа. Даже в наше
время такие ножи и наконечники
для копий можно было найти
у коренных жителей Гренлан-
дии. Американский полярный
исследователь Роберт Эдвин
Пири (1856—1920) в отчете об
экспедиции в Гренландию опи-
сал встречу с одним эскимосом,
который привел его к огромно-
му, наполовину ушедшему в зе-
млю железному метеориту. Это
было поблизости от мыса Йорк.
Вероятно, метеорит столетиями
служил эскимосам источником
материала для изготовления
оружия и инструментов. Они
просто отламывали от него кус-
ки и молотом, без всякого на-
грева,придавалиимнужную фор-
му. Железный метеорит к тому
времени, когда его видел Пири,
еще имел массу 37 т. Сегодня он
находится в Музее естественной
истории в Нью-Йорке.
На глиняной чаше (изготовлена
около 500 г. до н. э.) изображен про-
цесс бронзового литья в греческой
мастерской.
2-430
17
Народы Южной Европы—греки и римляне—сначала знали только привоз-
ное железо. Однако позднее дорийцы начали добывать железную руду в самой
Греции и внесли свой заметный вклад в дальнейшее развитие металлообработ-
ки. Современные представления о замечательной эллинской культуре зачастую
слишком односторонни. Общеизвестны успехи, достигнутые эллинами в из-
образительном искусстве и архитектуре, их литературные шедевры, такие, как
эпические поэмы Гомера. Но мало кто знаком с их техническими достижения-
ми—а ведь именно они обеспечили материальную базу для высочайшего разви-
тия античного искусства.
Об этом может, например, свидетельствовать роспись на глиняной чаше, на
которой изображен процесс изготовления статуй (вероятно, из бронзы) в грече-
ской литейной мастерской. Чаша сделана в V—IV вв. до н. э. и предназначена,
как гласит надпись, в подарок двум мальчикам. Мы видим, как создаются
две колоссальные статуи, не менее чем в два человеческих роста. Два мас-
тера заглаживают литейные швы и полируют статую воина, замахнувшегося
копьем, а два посетителя, опершись на посохи, наблюдают за работой. Третий
мастер прикрепляет (скорее всего, приклепывает) руку к пока еще безголовой
статуе обнаженного юноши с поднятыми руками. Рядом с этими производ-
ственными сценами изображены рабочие инструменты. Трое рабочих заняты
у металлургической печи, которая явно представляет собой некую комбинацию
плавильного и кузнечного горнов. Один рабочий кочергой перемешивает угли,
второй, наполовину скрытый печью, раздувает огонь мехом. Третий рабочий
стоит несколько в стороне, опираясь на молот,—возможно он принадлежит
к первой «бригаде», потому что молот у него такой же, как у того, кто прикре-
пляет руку к безголовой статуе юноши. Как можно судить по этому и неко-
торым другим изображениям, в те времена в качестве кузнечного горна нередко
использовали шахтную печь.
Доказано, что греческие архитекторы при строительстве зданий применяли
железные дюбели. Гермоген из Приона (около 200 г. до н.э.), один из просла-
вленных зодчих эллинской эпохи, построил храм Артемиды в городе Магнезия,
по размерам и великолепию уступавший только дидимскому и эфесскому хра-
мам. Барабаны колонн храма, сделанные из белого мрамора, скреплены
мощными железными дюбелями длиной 130 мм, шириной 90 мм и толщиной
15 мм. Как показало металлографическое исследование, дюбели состоят из не-
однородного железного материала: одни их участки представляют собой сталь
(т.е. имеют такое высокое содержание углерода, что поддаются закалке), а дру-
гие—мягкое железо чрезвычайно высокой чистоты. Прочность дюбеля состав-
ляет в среднем 38 кг/мм1 2, как у современной конструкционной стали 38. Правда,
по качеству эти стали неодинаковы: современные стали многим отличаются от
древних железных материалов, в том числе равномерностью состава по сечению
изделия.
В Центральной Европе ранний железный век приходится приблизительно на
1000—450 гг. до н. э. Эту эпоху называют галыптатской по названию города
в Австрии в окрестностях которого археологи нашли много железных предме-
тов того времени \ Наряду с железными инструментами тогда широко приме-
нялись и бронзовые. Из железа сначала делали только оружие, а потом стали из-
готовлять рабочие инструменты и другие орудия труда. Поэтому первоначаль-
но железо лишь в небольшой степени способствовало развитию производи-
тельных сил. Но по мере распространения этот новый металлический материал
все больше влиял на характер производства. Бронза по-прежнему широко при-
1 Детальные анализы состава и структуры, а также видов и способов обработки галыптатско-
го железа были выполнены проф. Феттерсом (Австрия) и проф. Шаабером (ФРГ) в период
1955—1975 гг. современными аналитическими методами.—Прим, рей.
18
менялась во многих областях, в первую очередь для изготовле-
ния украшений. Бронза обладает тем преимуществом, что ее
можно без особого труда расплавлять и заливать в формы.
С железом, у которого температура плавления гораздо выше,
в те времена так обращаться не умели.
В последующий период—поздний железный век—стало по-
являться все больше железных предметов. Общепризнано, что
значительный вклад в распространение железа внесли кельты.
Европейский поздний железный век назван латенской культурой
(по месту в Швейцарии, где в основном были найдены следы
кельтской культуры). Уже в галыптатский период возникли
связи между предками кельтов и греческими городами-государ-
ствами, а также Этрурией. Позднее эти связи и торговые отно-
шения широко развивались. Повсюду оставила следы передовая
по тем временам кельтская технология добычи и переработки
железа. Большое переселение кельтов началось на рубеже V в.
до н.э. Кельтские племена населяли восточную Галлию, запад-
ную и среднюю Германию, Англию и Шотландию на севере, те-
перешнюю Польшу на востоке. Они достигли Балкан и Пире-
нейского (тогда Иберийского) полуострова. Кельты овладели
мастерством обработки железа, и утгоминаемые в германских
сагах искусные кузнецы, несомненно, имели своим прообразом
кельтских кузнецов. Даже кельтское название железа «изарнон»
переняли все германские племена (сегодня по-немецки это зву-
чит «айзен», а по-английски—«айрон»). Иберийские кельты
(кельтиберы) прославились своей сталью. Чтобы получить осо-
бенно хорошую сталь, они закапывали железные полосы в зем-
лю, с тем чтобы те частично проржавели, а затем оставшийся
металл проковывали. Обычные железные изделия и заготовки
в то время всегда были неоднородны: они состояли из мягкого
железа и собственно стали. Ржавчина разрушала в первую оче-
редь мягкое железо, так что описанный метод кельтиберских
кузнецов позволял получить более однородную и твердую
сталь.
Барабаны колонн скреплены же-
лезными дюбелями.
Древнегреческие архитекторы в ка-
честве соединительных элементов
применяли металлические скобы
и дюбели. Здесь показан железный
дюбель из храма Артемиды в Маг-
незии, построенного Гермогеном
(одним из лучших архитекторов
Древней Греции) в первой половине
II в. до н. э. Металлографическое
исследование показало, что этот
дюбель состоит частично из мягко-
го железа, а частично из стали.
2*
19
Виланд-кузнец
Главный герой одной из старей-
ших древнегерманских саг—
кузнец Виланд, крепкий парень,
с которым судьба не раз играла
злые шутки, но и сам он обхо-
дился с людьми без особых це-
ремоний. Одному из конкурен-
тов, чьи работы угрожали его
славе лучшего кузнеца, он пред-
ложил коварные условия: пусть
тот изготовит шлем и прочие
доспехи, а Виланд сделает меч,
и тогда будет видно, чья работа
лучше. Оба принялись за рабо-
ту. Виланд выковал меч со всей
старательностью и мастер-
ством. Чтобы проверить остро-
ту меча, он опустил его в ручей
и пустил туда птичье перо.
Лишь только течение слегка
прижало перо к лезвию, этого
оказалось достаточно, чтобы
меч разрезал перо. Однако Ви-
ланд остался недоволен своей
работой. Он изрубил меч на
мелкие кусочки и подмешал их
в корм гусям. Но даже гусиный
желудок не в состоянии перева-
рить железо, и Виланд собрал
его снова из гусиного помета.
Нужно полагать, что металл,
пройдя через пищеварительный
тракт гуся, все же претерпел ка-
кие-то изменения. Желудочный
сок слабее действовал на ча-
стицы стали, богатые углеро-
дом, чем на более мягкие,
бедные им, так что материал,
пройдя такую обработку, стал
богаче твердой сталью. Воз-
можно, при этом в металл про-
ник азот, а азотированная сталь,
как сегодня известно, обладает
большей твердостью. Во всяком
случае, оказалось, что кусочки
железа, извлеченные из гусиного
помета, гораздо лучше подхо-
дят для изготовления меча. Пов-
торив еще раз подобную свое-
образную обработку, Виланд
получил металл, по качеству
удовлетворявший самым высо-
ким его требованиям. В день со-
стязания Виланд встал перед
противником, положил свой меч
Подобно гигантской лестнице (высотой 800 м), возвышается Рудная гора
в Штирии. Столетиями здесь добывают превосходную руду. Предание гласит,
что когда-то в местном озере рыбаки поймали сетью водяного. За свое
освобождение он предложил на выбор: золота—на один год, серебра—на де-
сять лет или железа—на вечные времена. Местные жители выбрали железо.
Немалый путь пройден от узких, мрачных кельтских и римских штолен до со-
временных карьерных разработок. На месте древних рудников в наши дни ве-
дутся взрывные работы и руду добывают здесь открытым способом.
20
Сыродутный кричный горн в принципе представлял собой яму, над которой
возвышалась куполообразная шахта с воздушными каналами для дутья. Крицу
извлекали из печи через пролом в стенке шахты.
Сыродутный горн в местности Гера-Тинц в Тюрингии (I—III вв.).
ему на голову, защищенную
шлемом, и без особых усилий
прорезал насквозь шлем, голо-
ву, кольчугу и тело.
Затем последовали другие
драматические события. Вилан-
да захватил в плен король Нид-
хад, перерезал ему сухожилия на
ногах и заставил калеку рабо-
тать в кузнице. Но король же-
стоко поплатился за это: кузнец
обесчестил его дочь, убил двух
маленьких сыновей, а сам,
подобно Икару, улетел на само-
дельных крыльях. Но в отличие
от Икара, упавшего в море, Ви-
ланд благополучно завершил
свой полет.
Различные подробности саги
указывают на то, что собира-
тельным прообразом Виланда
послужили кельты. Представи-
тели этого народа в те времена
были «абсолютными чемпиона-
ми» по добыче и переработке
железа. Достоверно доказано,
что они могли изготовлять пре-
восходную сталь и научились ее
закаливать.
Металлы—богатство Земли
Тысячи лет человек пользуется
земными запасами металлов.
Может быть, они неисчер-
паемы? Совсем нет! Правда, мы
часто слышим об открытии
новых месторождений, но уже
заметно ощущается нехватка
многих широко применяемых
металлов, особенно некоторых
тяжелых цветных металлов. По-
стоянно совершенствуются ме-
тоды разработки ископаемых
и процессы обогащения руд,
развивается металлургия. Люди
научились извлекать металлы из
все более бедных и труднообра-
батываемых руд. Однако по-
требность человечества в метал-
лах растет быстрее1. Вместе со
спросом на металлы повы-
1 В последние десятилетия все
большее внимание уделяется изуче-
нию запасов ряда металлов на
океанском дне, особенно в виде кон-
креций.—Прим. ред.
21
шаются и цены на них на миро-
вом рынке. Например, в неко-
торых промышленно развитых
странах стоимость металла
в медных монетах оказалась те-
перь в 1,5—2 раза выше их
номинала, вследствие чего эти
монеты изымают из обращения.
Запасы металлов на нашей
планете в настоящее время оце-
нены довольно точно. В земной
коре (литосфере) на глубине
приблизительно до 1 км содер-
жатся следующие элементы (их
доля указана в весовых процен-
тах):
Кислород 46,6
Кремний 27,7
Алюминий 8,0
Железо 5,0
Магний 2,1
Титан 0,6
Медь 0,01
Никель 0,01
Олово 0,004
Цинк 0,004
Свинец 0,0016
Серебро 0,00001
Золото 0,0000005
Платина 0,00000005.
Самые распространенные эле-
менты—кислород и кремний;
земная кора почти на три чет-
верти состоит из этих элемен-
тов. Довольно много на Земле
металлов, таких, как алюминий,
железо, магний и титан. Но вме-
сте с тем нужно учитывать, что
только часть металлов находит-
ся в месторождениях такой кон-
центрации, которая делает их
добычу рациональной с техниче-
ской и экономической точек зре-
ния. Мало на Земле тяжелых
цветных металлов: меди, нике-
ля, олова, цинка и свинца. Их
приходится экономить и приме-
нять только там, где ввиду
своих особых свойств они не мо-
гут быть заменены другими ме-
таллическими или неметалличе-
скими материалами. Вот почему
народное хозяйство во все боль-
шей степени должно покрывать
часть потребностей в металлах
путем повторного использова-
ния металлолома и других отхо-
дов.
Другие металлы
Наряду с золотом, серебром, медью, оловом и железом лю-
ди давно узнали свинец, ртуть и сурьму. По поводу платины
мнения историков расходятся. Некоторые утверждают, что этот
благородный металл обрабатывали в Египте еще в 1500 г. до
н. э. Во всяком случае, достоверно известно, что индейцы в Аме-
рике давно были знакомы с платиной, и оттуда ее доставляли
в Европу.
Мягкий и относительно легко доступный свинец в древности
использовали для разных целей. Известно, например, что из
гнутых свинцовых листов изготовляли трубы, сваривая про-
дольные швы и соединительные муфты. Римляне при сооруже-
нии своих знаменитых водопроводов даже ввели стандартиза-
цию свинцовых труб по диаметру и поперечному сечению. Это
упростило расчет и проектирование водопроводной сети.
Древние строители также использовали свинец—для закре-
пления каменных плит и заделки швов. Из свинца чеканили мо-
неты, медали и печати, изготовляли грузила для рыболовной
снасти и якоря для судов. На тонких свинцовых пластинках гра-
вировали текст и, сшивая их, делали свинцовые книги.
Предположительно, первые сведения о свинце происходят из
Индии. Свинцовые чушки в форме кирпичей служили предме-
том торговли, они упоминаются и в списках товаров, которые
египетские фараоны получали в качестве дани. На островах Сре-
диземного моря, в Италии, на побережье Греции и во многих
местах Западной и Центральной Европы сохранились следы ан-
тичных свинцовых рудников.
Римляне называли свинец и олово одним и тем же сло-
вом—«плюмбум». Правда, они различали «плюмбум альбум»
(белый) и «плюмбум нигрум» (черный), но часто путали оба ме-
талла. Нередко «плюмбум» называли сплавы свинца и олова.
Гораздо меньше, чем свинец, была известна сурьма—сере-
бристо-белый, с сильным блеском, очень хрупкий металл. В Ва-
вилоне из нее изготовляли сосуды уже в 3000 г. до н.э. Однако
гораздо шире использовали не металлическую сурьму, а ее со-
единения, в частности в косметике. Очевидно, сурьма служила
и как легирующий элемент при выплавке сурьмянистых бронз,
которые обладают превосходными литейными свойствами (хо-
рошо заполняют форму).
Много позже, в период увлечения алхимией, сурьма приобре-
ла особое значение, прежде всего потому, что в расплавленном
виде она хорошо растворяет многие другие металлы—«пожи-
рает» их. И в качестве символа этого металла алхимики выбра-
ли волка.
Ртуть римляне называли «аргентум вивум»—живое сереб-
ро. Примерно то же означает и современное немецкое название
ртути Quecksilber. Этот удивительный металл—единственный,
который при нормальных температурах остается в жидком со-
стоянии. Ртуть нетрудно получить из ее природного соединения
с серой—широко известной киновари. Первое письменное
упоминание о ртути принадлежит Аристотелю и относится при-
мерно к 350 г. до н.э., но, как показывают археологические на-
ходки, она была известна много раньше.
22
Для каких целей служил этот металл? В древности ртуть широко применяли
для золочения. Золото легко растворяется в ртути и образует с ней сплав—зо-
лотую амальгаму, которую наносят на обрабатываемое изделие. Затем его на-
гревают, ртуть испаряется, а на изделии остается слой золота. В наше время от
такого процесса огневого золочения отказались, потому что пары ртути чрезвы-
чайно вредны для здоровья. Растворимость золота в ртути можно использовать
также и при его извлечении, скажем, из золототканой одежды. Подобный про-
цесс был положен в основу разработанного в XVI в. способа извлечения раз-
личных металлов—так называемого амальгамирования (или амальгамации):
измельченную руду обрабатывают ртутью, в которой металлы растворяются;
затем ртуть выпаривают, а металлы остаются в твердом виде.
В период распада Римской империи, когда начался переход к новому обще-
ственному строю—феодализму, люди уже располагали солидными познаниями
в области металлургии. Они освоили добычу и переработку многих металлов:
золота, серебра, меди, железа, олова, свинца, ртути и сурьмы. Помимо бронзы
и стали были известны сплавы свинца и олова, а наряду с оловянистыми начали
применяться сурьмянистые и мышьяковистые бронзы.
Наконец, следует упомянуть и о таком давно известном к тому времени мед-
ном сплаве, как латунь. Если медь легировать цинком, то она по виду будет на-
поминать золото. Латунь применялась еще во времена Гомера (VIII в. до н. э.).
По-видимому, моссиноики—народ, обитавший на Черном море—первыми
стали сплавлять медь с цинковой рудой, получая таким образом латунь. От них
и происходит немецкое слово messing, означающее латунь. При императоре Ав-
густе (63 г. до н. э.—14 г. н. э.) в Риме чеканили латунные монеты.
Однако тогда еще не было известно, что латунь содержит другой металл—
цинк. Европа узнала о цинке только в XVIII в. от металлурга из Фрейберга1 Ио-
ганна Фридриха Хенкеля (1675—1744). Сегодня мы знаем, что китайцам этот ме-
талл был известен раньше.
Металлы во времена средневековья
Упадок и крушение Римской империи сопровождались глубокими со-
циальными потрясениями, которые в итоге привели к революционным измене-
ниям в обществе. На смену рабовладельческому пришел новый общественный
строй. Основой его служила собственность господствующих классов на землю,
которую обрабатывали уже не рабы, а феодально зависимые крестьяне. Процесс
распространения и укрепления феодализма продолжался столетиями; этот об-
щественный строй был преобладающим в течение всего средневекового периода
и позднее: примерно в V—XVII вв.
На вопрос о роли науки в этот период трудно ответить однозначно. Наука
возникает и развивается только в тесной взаимосвязи с производством. Кон-
троль технологических процессов, стремление усовершенствовать их—это
и стимул развития и ближайшая, непосредственная цель науки. Совершенство-
вание техники на первых порах дает определенные преимущества тому классу
(или классам), который недавно пришел к власти, и для него наука приобретает
особое значение. Но картина меняется, как только новые общественные отноше-
ния начинают стабилизироваться. Так было и при феодализме: вскоре власть
имущие признали главной задачей науки поддержание религиозных представле-
ний, а не дальнейшее развитие и совершенствование технологии производства.
Перед наукой была поставлена единственная цель: обосновывать и подкреплять
своим авторитетом «божественный порядок» во Вселенной и существующие об-
щественные отношения. Тех же, кто придерживался иных взглядов, не совпадаю-
1 В городе Фрейберге теперь находится Горно-металлургическая академия ГДР.—Прим,
перев.
23
Алхимические
и химические символы
Для обозначения веществ, ме-
таллов и понятий алхимики
пользовались своей особой сим-
воликой, которая непосвя-
щенным представлялась таин-
ственной абракадаброй. Тесная
связь алхимии с астрономией
проявлялась, в частности, в том,
что металлы и светила имели
одни и те же обозначения. На-
пример, золото обозначалось
так же, как Солнце, серебро—
как Луна, а планетам соответ-
ствовали другие металлы.
В дальнейшем с развитием
естественных наук возникла не-
обходимость представлять
вновь приобретенные знания
в точной и ясной форме. Моло-
дая наука—химия тоже испы-
тывала настоятельную потреб-
ность в единой системе химичес-
ких символов. Такую систему
предложил в 1814 г. шведский
химик Йенс Якоб Берцелиус
(1779—1848). Благодаря этой си-
стеме химические формулы ста-
ли понятны ученым всего мира.
Некоторые из химических эле-
ментов Берцелиус обозначил
первой буквой их латинского на-
звания, а для остальных доба-
вил еще одну из последующих
букв:
Н—Hydrogenium—водород
О—Oxygenium—кислород
Au—Aurum—золото
Ag—Argentum—серебро
Си—Cuprum—медь
Sn—Stannum—олово
Hg—Hydrargyrum—ртуть
Система единых химических
обозначений получила широкое
признание и остается общепри-
нятой до сих пор.
Задолго до того как в Европе полу-
чили цинк металлургическим спосо-
бом (XVIII в.), в Китае выплавляли
этот металл в закрытых тиглях.
У таинственной, мистической алхи-
мии металлургия и химия заимство-
вали немало методов.
24
щих с официальными, преследовали как еретиков и безжалостно истреб-
ляли.
Однако, несмотря на неблагоприятные условия, в мрачные средние века бы-
ли заложены довольно существенные основы науки о металлах. Одним из
истоков этой науки послужила алхимия—таинственная и сумрачная полунаука,
полумагия, которая зародилась, по-видимому, в Александрии в III—IV вв. н. э.
Арабские врачи и металлурги преодолели предубеждение античных ученых
перед ремесленной, практической работой. Они первыми начали эксперименти-
ровать и создали многие лабораторные методы и устройства, составившие впос-
ледствии базу для развития экспериментальной химии. Они расплавляли, пере-
гоняли, выпаривали самые разнообразные вещества. Несомненно, в своих
трудах алхимики использовали и познания древних, дошедшие до них из Вави-
лона и Египта.
Происхождение слова «алхимия» не вполне ясно. Возможно, оно складывает-
ся из арабского определенного артикля «ал» и древнеегипетского «хеме», озна-
чавшего, в частности, черный цвет. Вместе с тем, согласно недавним исследова-
ниям, название этой науки, возможно, идет от греческого слова «химиа», что
означало «металлическая отливка».
Как бы то ни было, алхимия пришла в Европу в XI—XII вв. и в последующие
500—600 лет оказывала сильное влияние на развитие естествознания. Было бы
несправедливо считать алхимию сплошным шарлатанством и надувательством,
хотя такие высказывания тоже можно иногда встретить. В действительности
именно она ознаменовала собой раннюю стадию развития химической науки.
Но, безусловно, пытаясь связать и объяснить реальные факты и наблюдения на
основе мистических представлений, алхимия совершила множество ошибок, ко-
торые закрепились надолго. И когда времена господства алхимии подошли
к концу, она, с одной стороны, еще долго оставалась главным препятствием для
рационального подхода к химическим веществам и процессам, но, с другой сто-
роны, послужила отправной точкой для создания многих современных гипотез
и теорий.
Главную свою задачу, высшую цель алхимики видели в получении философ-
ского камня («ляпис философорум») и универсального растворителя («ликвор
алкагест»). Оба они должны были служить для того, чтобы превращать неблаго-
родные металлы в благородные. (В соответствии с представлениями того вре-
мени все вещества образовались из двух алхимических элементов: серы и ртути.
Парацельс (1493—1541) в качестве третьего элемента добавил еще и соль.) Но
в поисках этих двух чудесных средств алхимики должны были непрерывно рас-
ширять свои естественно-научные познания, разрабатывать новые химические
и металлургические методы; на этом пути было сделано много различных от-
крытий и изобретений—от пороха до фарфора.
Одним из высших авторитетов в алхимии был легендарный врач и химик
Джабир ибн-Хайян (латинизированное имя—Гебер), живший, по-видимому,
в VIII в. Ему приписывают разделение металлов на благородные и неблаго-
родные по их поведению на воздухе и в огне. Другой алхимик —бенедиктин-
ский монах Базилий Валентинус, живший в Эрфурте в XV в., разделял вещества,
которые выглядят как металлы, на настоящие металлы и их «пасынки», полуме-
таллы. Например, сурьму он считал пасынком свинца, а висмут—пасынком
олова. К полуметаллам относили и некоторые соединения, например ртути
с серой.
Позднее, когда вокруг алхимии стало собираться все больше мошенников,
она приобрела дурную славу. Особенно это характерно для XVII—XVIII вв.
Владетельные князья надеялись с помощью этих мнимых «делателей золота»
поправить свои пошатнувшиеся из-за непомерного тщеславия финансовые
дела.
В то же время средневековье было и периодом расцвета многих ремесел, свя-
занных с металлообработкой. Широкое практическое применение металлов при-
25
Искусство плетения кольчуг из про-
волоки было известно еще во време-
на викингов. Как описывал пресви-
тер Теофил, в X в. для изготовления
проволоки использовали воло-
чильные доски со многими отвер-
стиями.
Шедевр технического и художе-
ственного мастерства—бронзовое
надгробие (высотой 1,99 м), устано-
вленное архиепископу Фридриху
фон Веттину,—был изготовлен
в 1160 г. в знаменитой магдебург-
ской литейной мастерской. Это
древнейший памятник ремесленно-
го искусства, сохранившийся в Маг-
дебургском соборе.
Георг Бауэр,
он же Георгий Агрикола
XVI век—один из самых
бурных периодов истории Гер-
мании. Социальная напряжен-
ность, вызванная бесправием
крестьянства и началом разви-
вело к тому, что люди смогли ближе и глубже познакомиться
с их свойствами и особенностями, в том числе технологически-
ми. Кузнецы, жестянщики, литейщики, лудильщики и многие
другие металлисты приобрели богатый опыт в обращении
с металлами.
Предметы обихода и художественные изделия, отлитые или
выкованные из металла, свидетельствуют о высоком искусстве
и больших технических возможностях мастеров средневековья.
Они освоили металл и научились придавать ему самые разноо-
бразные формы. Примерно в 800 г. были отлиты из бронзы зна-
менитые двустворчатые ворота Аахенского собора. Каждая
створка этих «Волчьих ворот» имеет высоту почти 4 м, ширину
1,35 и вес 1700 кг. Литой металл содержит 85,3% меди, 9,6% оло-
ва, 3,5% свинца и 0,6% железа.
Бронзовое литье достигло наивысшего расцвета в XI в.
Бронзовые скульптуры того времени по своему художественно-
му и техническому совершенству превосходят все, что было со-
26
здано раньше, и принадлежат к самым значительным творениям средневековья.
Новых высот достигли только мастера эпохи Возрождения. В литейном искус-
стве почти столетие лидерство принадлежало нюрнбергской мастерской Фише-
ров. Отлитые членами этой семьи бронзовые статуи были шедеврами литейного
мастерства.
Кузнец совсем иначе, чем «рудоплавилыцик», заставляет металл принять
нужную форму. Он использует способность металла к пластической деформа-
ции в нагретом состоянии. На протяжении всего средневековья кузнецы счита-
лись самой почтенной и уважаемой категорией ремесленников. Они давно уже
начали специализироваться по отдельным металлам и видам изделий. Были спе-
циалисты по золоту, серебру и меди, одни мастера делали ножи, другие под-
ковывали лошадей, третьи изготовляли гвозди, мечи, посуду и многое другое.
Правда, не всех кузнецов ценили одинаково. Наибольшим почетом, несомненно,
пользовались оружейники. До нас дошли многие примеры высокого признания
и почестей, которыми в те времена были окружены кузнецы. Император Макси-
милиан I приказал вырезать по дереву семейный портрет своих оружейников.
Карл V заплатил своему аугсбургскому кузнецу за латы большую сумму, чем за
картину Тициана.
В средние века успехов достигла не только металлообработка. Горняки и ме-
таллурги совершенствовали способы добычи и выплавки металлов. О том, ка-
кую роль это сыграло в развитии общества, Ф. Энгельс писал: «Добыча золота
и серебра послужила последним толчком, поставившим Германию
в 1470—1530 гг. в экономическом отношении во главе Европы и тем самым сде-
лавшим ее центром первой буржуазной революции в религиозном облачении
так называемой Реформации» (К. Маркс и Ф. Энгельс. Соч., изд. 2-е, т. 23,
с. 191).
Именно тогда Агрикола (Георг Бауэр, 1494—1555) создал свой фундамен-
тальный труд «О металлах», посвятив ему двадцать лет жизни. За это время он
изучил множество источников и предпринял несколько путешествий (так сказать
«творческих командировок»), что позволило ему охватить в своей работе об-
ширный опыт и познания, накопленные людьми в данной области. Между
горным делом и металлургией тогда еще не было четкой границы, и нередко до-
бычей руды и выплавкой металлов занимались одни и те же люди. Во времена
Агриколы обе эти отрасли переживали период расцвета. На территории Герма-
нии в период около 1500 г. ежегодно производилось 30 тыс. т железа, во
Франции—10 тыс. т, в Англии и Швеции—по 5 тыс. т и во всей остальной
Европе еще 10 тыс. т. Якоб Фуггер из Аугсбурга (1459—1525), возглавив осно-
ванный его отцом торговый дом, стал «рудным королем» того времени. Он за-
владел почти всеми рудниками в Штирии, Тироле, Северной Венгрии и Испании.
Ему принадлежала монополия на торговлю медью. Баснословное богатство по-
зволяло Фуггеру ссужать деньгами императоров и церковь. .
В эту эпоху развивающегося раннего капитализма и появился трактат Агри-
колы, ознаменовавший собой рождение научной металлургии. Первые шесть то-
мов его были посвящены горному делу, седьмой—«пробирному искусству», т. е.
способам опытной плавки руд для определения содержания металлов. В вось-
мом томе речь шла об обогащении и подготовке руд к металлургической пере-
работке, а в девятом были описаны способы выплавки чернового металла. В де-
сятом томе рассматривались методы разделения металлов, например серебра
и свинца. Одиннадцатый том содержал подробные сведения о металлургиче-
ском оборудовании, и, наконец, в последнем, двенадцатом томе были описаны
процессы получения соли, соды, селитры, квасцов, купороса, серы, битума, а так-
же производство стекла.
Труд Агриколы был выдержан в совершенно ином духе, нежели сочинения
алхимиков. Здесь четко и ясно описаны технологические процессы и оборудова-
ние. В изложении не было никакой мистической таинственности—наоборот, ав-
тор стремился сделать свой труд понятным любому образованному человеку,
даже не обладающему специальными познаниями. Не последнюю роль здесь
сыграли и знаменитые иллюстрации—292 гравюры на дереве. В течение двух
27
тия капитализма, привела
к крестьянской войне и к город-
ским восстаниям. Наука и искус-
ство переживали подъем, веду-
щим течением в духовной жизни
общества стал гуманизм, ко-
торый опирался в своих идеях на
воззрения античного мира.
24 марта 1494 г. в саксонском
городке Глаухау родился Георг
Бауэр—человек, который позд-
нее, по распространенному тог-
да в ученом мире обычаю, при-
нял латинизированное имя Ге-
оргий (или Георгиу с) Агрикола.
Школу он посещал в Глаухау и,
вероятно, в Цвиккау, потом
учился в Лейпцигском универси-
тете. Он был преподавателем,
проректором и ректором
в Цвиккау и в Лейпциге, затем
продолжал учебу в Италии, от-
куда вернулся доктором меди-
цины. Работал городским вра-
чом в шахтерских городках
Яхимов и Хемниц (ныне Карл-
Маркс-Штадт). Трижды зани-
мал пост бургомистра Хемница.
Умер Георгий Агрикола
в 1555 г. и похоронен в кафе-
дральном соборе города Цейц.
Уже современники высоко це-
нили его обширные и многосто-
ронние познания. Агрикола был
учителем, врачом и аптекарем,
добился больших успехов как
бургомистр. Он заложил ос-
новы нескольких наук: минера-
логии и геологии, горного дела
и металлургии; ему принадле-
жали выдающиеся работы
в области истории государства,
теории чисел и теории мно-
жеств, экономики. И главный
труд его жизни—опубликован-
ная посмертно 12-томная моно-
графия «О металлах»—и дру-
гие многочисленные работы
свидетельствуют о том, что это
был большой, далеко опередив-
ший свое время ученый-энци-
клопедист и общественный дея-
тель.
Роскошные латы, покрытые чернью и позолотой,—свидетельство высокого
мастерства и художественного совершенства работы ремесленников средневе-
ковья (Антверпен, 1560—1565).
28
Георгий Агрикола.
столетий книга оставалась основополагающей и самой авторитетной в своей
области. По научному значению труды Агриколы вполне можно оценить даже
выше работ его современника—прославленного Парацельса, потому что
у Агриколы речь идет о науке, опирающейся на реальные знания и опыт, сво-
бодной от веры в чудеса и от фантастических чисто умозрительных рассужде-
ний.
Во времена Агриколы и Фуггера немецкие горнорудные промыслы пережи-
вали свой расцвет, однако во второй половине XVI в. они начали приходить
в упадок. Тому было много причин. Снизилась добыча руды в уже вырабо-
танных рудниках, больше металлов, особенно драгоценных, стали привозить из
Америки. Вместе с тем уже начиная с XIV в. назревали чреватые последствиями
перемены в способах получения железа. Возрастающий спрос на железные изде-
лия требовал новой, более производительной технологии выплавки железа из
руды. Три тысячелетия железо получали в виде губчатой, но твердой «крицы»
малопроизводительным способом—путем восстановления древесным углем
при невысоких температурах, а теперь благодаря переходу на доменный процесс
удалось во много раз поднять производительность труда. При этом из печей вы-
пускали чугун в расплавленном, жидком состоянии. Таким образом, железные
материалы стали оказывать все более заметное преобразующее влияние на об-
щественное производство.
Столетие стали
Промышленная революция, начавшаяся в текстильном производстве в Ан-
глии, к концу XVIII в. затронула и черную металлургию, т. е. металлургию желе-
за и стали. Следующее XIX столетие принесло с собой большую часть открытий
и изобретений, которые составляют основу современного производства железа
и стали. Чтобы правильно оценить необычайно быстрое развитие металлургии
в XIX в., нужно вернуться к прошлому.
С древнейших времен ковкое губчатое железо получали путем «прямого вос-
становления» непосредственно из руды. В XVIII в. этот так называемый сыро-
дутный процесс был широко распространен. В Европе он сохранился вплоть до
1850 г., а в Северной Америке—даже до 1890 г. В наше время сыродутные
(кричные) горны еще можно встретить у народов Центральной Африки и
в Китае.
С технологией сыродутного процесса мы можем познакомиться по описа-
нию и гравюрам, приведенным в книге Агриколы. В рабочее пространство горна
слоями загружают древесный уголь и измельченную руду. Перед горном стоит
плавильщик, или горновой, и управляет дутьем, регулируя задвижкой поток во-
ды, приводящий в действие кузнечный мех. Лицо плавильщика защищено вой-
29
Гравюры из книги Агриколы «О металлах»: получение кричного железа в сыродутных горнах.
лочной маской. Из горна через боковое отверстие стекает шлак. После 4—8 ча-
сов тяжелого ручного труда рабочие при помощи железных стержней извлекают
из горна слипшуюся губчатую массу, содержащую железные зерна вместе со
шлаковыми включениями,—крицу. (В зависимости от размеров горна крица мо-
гла иметь вес до 150 кг.) Двое рабочих долго обрабатывают крицу молотами,
чтобы уплотнить ее и выдавить часть шлака. Затем крицу разделяют на части,
которые проковывают на .наковальне, придавая им форму, нужную для
продажи.
По свидетельству Агриколы, такой «самостоятельный металлургический за-
вод» уже означал значительный технологический прогресс по сравнению с при-
митивными земляными горнами, которые использовались прежде в отдельных
рудниках. Производительность еще более возросла благодаря введению выло-
женных из кирпича сыродутных печей вместо подовых. И те, и другие вели свое
происхождение от простых плавильных ям. Вначале появились небольшие
шахтные печи с естественной тягой, которые устанавливали на открытом месте,
а позднее—уже настоящие шахтные печи с открытым выпускным порогом
и мехом для дутья. Работа одного средневекового металлургического завода
с сыродутными шахтными печами описана Агриколой. Измельченную руду
и древесный уголь загружали в печь сверху. Для извлечения крицы из печи нуж-
но было открыть ее порог, закрытый кирпичной кладкой и обмазанный глиной.
Затем крицу обрабатывали так же, как говорилось выше. В XV в. металлурги
Штирии пользовались сыродутными горнами средним объемом 1,1—1,7 м3.
Они давали за сутки 1200—1300 кг металла, а выработка на одного рабочего со-
ставляла около 250 кг. За последующие 200 лет эти показатели возросли со-
30
ответственно до 3,4—4,5 м3 и 1800—2100 кг на одну печь и до 390 кг на одного
рабочего.
С увеличением размеров сыродутных горнов и интенсификацией труда воз-
растало и содержание углерода в железе. При этом температура плавления же-
леза оказывалась ниже и часть его вытекала из горна в расплавленном виде вме-
сте со шлаком. Таким образом, металлурги стали получать побочный продукт,
который в твердом состоянии хрупок и легко разбивается молотом. Это был чу-
гун. Вначале его просто выбрасывали, но потом научились использовать. Чтобы
приготовить из чугуна ковкое железо, необходимо удалить из него углерод, т. е.
подвергнуть его дальнейшей обработке, которая у металлургов получила назва-
ние «кричный передел», или «фришевание» (от немецкого слова frisch—свежий,
здоровый, чистый) либо «рафинирование» (от французского raffiner—очи-
щать).
Открытие и освоение такого способа обработки позволило постепенно
перейти от кричных сыродутных горнов к рудоплавильным печам—домницам.
В них стали получать жидкий чугун, который затем превращали в мягкое железо
(а позднее—в сталь), удаляя избыточный углерод. Так возник двухступенча-
тый—через промежуточный продукт (чугун)—способ производства стали. Это
типичный пример того, как простое увеличение размеров оборудования, в дан-
ном случае сыродутных горнов, может привести к принципиально новой
технологии.
Вместе с ростом потребности в ковком железе и стали постоянно возрастал
спрос и на древесный уголь, однако в богатых рудой районах леса были выру-
блены. Особенно заметно это было в Англии. Но шахтные печи для выплавки
чугуна (теперь их называют домнами), как и печи для дальнейшего его передела,
нуждались в древесном угле. В 1709 г. Абрахаму Дерби из английского города
Колбрукдейл впервые удалось применить в доменной печи каменноугольный
кокс и тем самым модернизировать первую ступень процесса производства ста-
ли. Однако для переработки чугуна в сталь по-прежнему был необходим дре-
весный уголь. Каменный уголь тогда еще не умели использовать для этой цели:
содержащаяся в нем сера переходила в сталь, делая ее непригодной. Проблему
решил англичанин Генри Корт в 1784 г. Изобретенный им способ пудлингова-
ния (от английского puddle—месить, перемешивать) означал новый большой
шаг вперед, и это по праву можно считать началом современной металлургии
стали.
В пудлинговой печи топливо уже не соприкасается с чугуном, подлежащим
переработке. Каменный уголь сгорает в топке, которая отделена от горна поро-
гом. Первые пудлинговые печи имели две дымовые трубы: одну непосредствен-
но над топкой, другую с противоположного конца печи, над плавильным гор-
ном, или ванной. Пудлингование—это очистка чугуна в пламенной печи.
Процесс начинается с загрузки чугуна в горн. Чтобы ускорить плавку, куски чу-
гуна весом 10—30 кг (всего обрабатывается около 150 кг) помещают вблизи по-
рога топки, где температура самая высокая. Примерно через 45 мин чугун рас-
плавляется. Пудлинговщик вставляет в загрузочное окно печи железную штангу
с крюком на конце и проводит ею борозды по тестообразной чугунной массе
(массу металла, расплавленного в печи, металлурги называют ванной). При
этом чугун хорошо перемешивается и поверхность ванны увеличивается. Закры-
вая горн и забрасывая влажный шлак, пудлинговщик регулирует температуру
ванны. Кроме того, в ванну добавляют песок, который, вступая в химическую
реакцию с футеровкой печи, образует шлак; последний окисляет углерод в чугу-
не. В период кипения ванна сильно бурлит за счет окисления углерода, и чем
больше его окисляется, тем сильнее разжижается ванна, и железные зерна соби-
раются там в комья.
31
Промышленный шпионаж
в XVIII веке.
Изобретатель литой стали ан-
глийский часовщик Бенджамен
Хантсмен долгое время пытался
сохранить секрет разработанно-
го им процесса. Многие тонны
стали—результат бесчис-
ленных опытов—он втайне за-
капывал вблизи своего завода
в Хэнсуорсе, около Шеффилда.
Его конкуренты пускались на
все хитрости, чтобы проникнуть
в тайну. Например, владелец ме-
таллургического завода в Рот-
тердаме Сэмюэл Уокер од-
нажды холодной зимней ночью
1748 или 1749 г. в одежде нищего
бродил перед заводом Хантсме-
на. Рабочие пожалели «бедного
старика» и пустили его обо-
греться у печей. Так Уокеру
представился случай основа-
тельно понаблюдать, что дела-
ли со сталью. Вскоре в Англии
получил распространение про-
цесс плавки стали, «открытый»
Уокером.
Другие любопытные, преиму-
щественно из континентальной
Европы, приезжали к Хантсмену
под видом покупателей, надеясь
при этом узнать что-нибудь
о технологии производства ли-
той стали. Один такой посети-
тель явился даже в сопровожде-
нии священника. Это должно
было произвести особое впечат-
ление на Хантсмена—ортодок-
сального квакера, для которого
духовное лицо было вне всяких
подозрений. Проще, но вполне
успешно действовал швед Бенгт
Квист. Он прибыл на завод
Хантсмена, запасшись изрядной
суммой денег, и с помощью взя-
ток разузнал технологический
процесс во всех подробностях.
Пудлинговщик ломом много раз переворачивает массу и на-
конец разделяет ее на три-пять частей—криц. Они еще горячи-
ми попадают к кузнецу, который к каждой крице приваривает
железный стержень дюймовой толщины и проковывает их
в «колбаски» диаметром 7—10 см и длиной около 50 см. Эти за-
готовки в прокатной машине раскатывают в полосы, затем сно-
ва разделяют на куски длиной 50 см и еще раз прокатывают, на-
кладывая по 4 полосы одна на другую. Для процесса
пудлингования были характерны именно эти операции прокатки
криц, которые требовались не столько для придания заготовке
формы, сколько для того, чтобы сварить зерна и комки железа.
В результате получалось так называемое сварочное железо (или
сварочная сталь).
Одна пудлинговая печь за сутки давала 3500 кг крупнозерни-
стого кричного железа либо 1600 кг мелкозернистого железа—
пудлинговой стали.
32
Пудлингование означало существенный прогресс по сравне-
нию с прежним сыродутным способом и кричным переделом.
Во-первых, вместо дефицитного древесного угля теперь можно
было обходиться каменным углем. Во-вторых, пудлинговые пе-
чи оказались намного производительнее. И наконец, в результа-
те пудлингования получали сварочное железо (или сварочную
сталь)—материал с отличными свойствами. Насколько высоко
ценилось сварочное железо, можно судить хотя бы по тому, что
уже после изобретения процессов производства литой стали ме-
таллурги искали и нашли способ приготовления из нее «искус-
ственного» сварочного железа. Американцы, в частности, заме-
тили, что сварочное железо в мостах и других сооружениях под
открытым небом втрое устойчивее к коррозии, чем литая (или
прокатанная из слитков) сталь. Поскольку приготовление сва-
рочного железа в пудлинговых печах стоило слишком дорого,
был разработан специальный метод производства сварочного
железа из литой стали. Это «астон-железо», названное так по
имени его изобретателя и по своим свойствам не уступавшее
сварочному. Его изготовляли и применяли еще до второй миро-
вой войны.
В пудлинговой печи топка отделена порогом от очищаемого чугуна. Поэтому
здесь вместо древесного угля можно использовать каменный уголь или кокс, не
опасаясь загрязнения железа серой, присутствующей в каменном угле в боль-
ших количествах.
Однако сварочное железо и сварочная сталь имели и серь-
езный недостаток—неравномерность состава по поперечному
сечению. Английский часовщик Бенджамин Хантсмен
(1704—1776) пришел к мысли, что состав этих материалов мож-
но выровнять путем переплавки. Эта идея была не нова, и рань-
ше не раз пытались таким путем улучшить однородность и каче-
ство сварочной стали, но безуспешно. Чтобы получить жидкую
сталь, Хантсмен использовал тигель из огнеупорного материала
и обогреваемую коксом печь с дутьем и высоким горном. Это
принесло успех. Французские кузнецы первыми изготовили из
литой стали, твердой и потому труднее поддающейся ковке, но-
жи, которые оказались лучше шеффилдских. Старшины шеф-
филдского цеха кузнецов обратились в палату общин англий-
ского парламента с просьбой запретить вывоз из страны литой
Из словаря металлургов
Язык, на котором разговари-
вают между собой специалисты,
особенно представители таких
древних профессий, как метал-
лурги, для «простых смертных»
порой звучит весьма странно.
Происхождение многих спе-
циальных терминов часто не
удается установить однозначно,
а язык металлургов очень богат
такими специальными выраже-
ниями.
Названия для массы металла
нередко заимствованы из мира
животных. Так, немецкое назва-
ние крицы, т.е. губчатой желез-
ной или стальной массы, полу-
ченной из кричного горна,—
«люппе» (Luppe) происходит от
итальянского слова lupo (лат. lu-
pus, франц, loup)—волк. Чугун-
ную чушку во Франции назы-
вают geuse, что в переводе
означает «гусь». Немецкие ме-
таллурги называют «свиньей»
(Sau), а русские—«козлом», на-
стыль—плотную массу застыв-
шего металла, которая обра-
зуется на стенке или на поду
печи при нарушениях хода про-
цесса. Такую настыль очень
трудно удалить. В XIV в. рас-
плавленный чугун считался не-
нужным продуктом, его сливали
в выкопанную перед печью яму
и называли «поросячьим желе-
зом» (Ferkeleisen). Порцию
шихты, т.е. смесь руды и доба-
вок к ней, называют Moller—ве-
роятно, от Moll или Maulwutf
(крот), так как кучи шихты на
шихтовом дворе напоминают
кучки земли у кротовых нор
До сего времени мало кто за-
нимался исследованиями исто-
рии металлургической термино-
логии, а такие исследования,
очевидно, помогли бы устано-
вить некоторые взаимосвязи
в истории культуры и техники.
3-430
33
Генри Бессемер (1813—1898). Он
первым получил жидкую сталь из
чугуна, продувая через него воздух.
Сидней Джилкрист Томас
(1850—1883), получивший в конвер-
тере сталь из фосфористого чугуна.
стали. Их просьба была отклонена. Тогда шеффилдским кузне-
цам пришлось преодолеть свое предубеждение против литой
стали. Производство стальных изделий в Англии стало быстро
развиваться, и вскоре по этому показателю она вышла на первое
место в мире. Значительно расширился экспорт не только го-
товых стальных изделий, но и стальных слитков.
Высококачественная тигельная сталь обладала превос-
ходными свойствами в литом состоянии. Спустя столетие после
изобретения Хантсмена из нее стали делать паровозные оси,
а еще позже----орудийные стволы. В 1851 г. на Лондонской
всемирной выставке был показан стальной слиток весом
2150 кг. Чтобы получить такую большую отливку, пришлось
сливать в миксер (копильник) расплавленную сталь из многих
тиглей емкостью по 45 кг каждый.
В эпоху промышленной революции потребность в железе на-
столько сильно возросла, что ее не мог удовлетворить и пудлин-
говый процесс. К тому же различные новые технические приме-
нения пудлингового железа показали, что оно не выдерживает
больших нагрузок. Например, так как железнодорожные локо-
мотивы становились тяжелее и быстроходнее, рельсы, изгото-
вленные из пудлинговой стали, все чаще ломались.
Основателем сталеплавильного производства следует счи-
тать Генри Бессемера (1813—1898). В 1885 г. он впервые получил
ковкое железо, вернее сталь, путем продувки воздухом 5 кг сы-
рого чугуна, расплавленного в тигле из огнеупорной глины.
Оказалось, что при продувке воздухом расплавленный чугун не
только не охлаждается, как предполагали прежде, но, напротив,
его температура возрастает настолько, что ванна остается жид-
кой, хотя сталь, которая образуется из чугуна благодаря продув-
ке, имеет более высокую температуру плавления. 17 октября
1855 г. Бессемер получил английский патент на свое изобрете-
ние. Прусское патентное ведомство в Берлине отказалось вы-
дать ему патент, мотивировав свой отказ следующим образом:
«Нельзя никому запретить продувать воздух через жидкое желе-
зо». Вот весьма выразительный пример непонимания сущности
технического прогресса.
Новый процесс получения стали из чугуна «без топлива и без
топки» прошел длинный, усеянный множеством неудач путь,
прежде чем стало ясно, что хорошую сталь дает только мало-
фосфористый чугун. Если же в чугуне много фосфора, то про-
дукт получается хуже, чем ковкое железо,—он оказывается по-
ристым «красноломким» и «холодноломким» (т.е. хрупким
в горячем и в холодном состояниях). Вследствие этих сложно-
стей бессемеровский процесс распространялся весьма медлен-
но—сначала он был принят в Швеции, затем—в Австрии
и только позднее—в Англии. Широкому его распространению
препятствовало то, что он нуждался в малофосфористом чугуне.
В результате главной проблемой стала очистка чугуна от фос-
фора. Среди многих металлургов, которые пытались решить эту
проблему, первым достиг успеха Сидней Джилкрист Томас
(1850—1885).
Томас имел две специальности. Он служил писарем в лон-
донском полицейском суде, чем зарабатывал на жизнь, и одно-
временно изучал химию и металлургию в Горном училище, где
и заинтересовался проблемой удаления фосфора из чугуна.
В 1877 г. Томас подал первую заявку (а в 1878—1879 гг.—еще
две) на способ получения стали, который позднее был назван его
именем.
34
Свои первые опыты Бессемер про-
изводил в закрытом тигле, продувая
расплав воздухом через введенную
сверху трубу. Тигель был установ-
лен в печи—Бессемер не знал, что
в данном случае дополнительный
обогрев не требуется.
Кислым
Шлак
Чугун с малым
содержанием
фосфора
Бессемеровский процесс
Рутеровка
Чугун с
большим
содержанием
фосфора
Основной
Томасовский процесс
Известь
Томасовский процесс отличается от бессемеровского составами загружаемого
чугуна (содержанием в нем фосфора), шлака и футеровки конвертера.
Непосвященный не увидит особой разницы между бессеме-
ровским и томасовским процессами. В основе обоих процессов
лежит один и тот же принцип: чугун, из которого получают
сталь, очищают, продувая через него воздух. Сосуд, где проте-
кает реакция,—конвертер—имеет грушевидную форму с от-
крытой горловиной вверху; он укреплен на горизонтальной оси,
что позволяет его наклонять. Конвертеры Бессемера и Томаса
по внешнему виду одинаковы. Главное различие заключается
в том, что бессемеровский конвертер изнутри выложен кислой
(т.е. кислотной по своему химическому характеру) огнеупорной
футеровкой и в нем нельзя удалить фосфор из богатого им чугу-
на в основной шлак (т. е. по своим химическим свойствам подоб-
ный основаниям), потому что такой шлак быстро разъедает кис-
лую футеровку. Томасовский же конвертер имеет основную
футеровку, поэтому здесь, добавляя известь, можно получить
основной шлак, который хорошо извлекает фосфор из чугуна,
но не разрушает основной футеровки.
Конвертер—будь то бессемеровский или томасовский—по-
зволяет за 20 мин превратить в сталь до 20 т чугуна. Для про-
изводства такого же количества стали в горне способом крично-
го передела потребовалось бы три недели, а в пудлинговой
печи—неделя.
Так металлурги получили в свое распоряжение два высоко-
производительных процесса, что позволило удовлетворять не-
прерывно возрастающий в промышленных странах спрос на
сталь. Бессемеровский и томасовский конвертеры были необхо-
димы для массового производства стали общего назначения,
тогда как высококачественные специальные стали продолжали
выплавлять в тиглях. Но техника не стояла на месте.
Братья Вильгельм и Фридрих Сименсы изобрели регенера-
тивный способ обогрева печей и, после того как Фридрих Си-
менс получил патент на это изобретение, построили опытную
печь. Основная идея регенеративного обогрева заключается
з*
35
Конвертерное производство стали в прошлом веке. Пока в левый конвертер заливают из ковша
жидкий чугун, в правом идет процесс плавки. В центре—готовую сталь разливают в изложницы.
в предварительном подогреве воздуха, необходимого для горения топлива, от-
ходящими газами—продуктами горения. Для этого через определенные проме-
жутки времени воздух направляют то через один, то через другой регенератор
(пока воздух для горения, проходя через один регенератор и охлаждая его, сам
нагревается, отходящие газы подогревают другой регенератор). В опытной печи
братьев Сименсов стальные напильники через 6 ч расплавились, а тигель, поме-
щенный в топочную камеру, превратился в шлак.
Первые практические попытки выплавить тигельную сталь в подобной печи
на сталелитейном заводе в Шеффилде закончились неудачей. Вместе со сталью
плавились тигель и стенки печи.
8 апреля 1864 г. на одном из заводов Южной Франции Пьеру Мартену
(1824—1915) впервые удалось сварить хорошую сталь в регенеративной печи, по-
строенной при участии Вильгельма Сименса. Шихта (загружаемые в печь ис-
ходные материалы) состояла из чугуна, выплавленного из гематита—красного
железняка с острова Эльба, чушек пудлингового железа и стального лома.
Мартеновский процесс (немцы его называют сименс-мартеновским) наряду
с бессемеровским и томасовским ознаменовал еще один важный шаг в развитии
сталелитейного производства *. Этот процесс сохранил большое практическое
значение до наших дней; особенно широко он используется для повторного про-
изводства стали из лома и стальных отходов (как говорят металлурги, из
«скрапа»).
Интересно заметить, что Генри Бессемер изобрел свой конвертер, а Виль-
гельм Сименс—регенеративную печь примерно в одно и то же время, живя на
соседних улицах в Лондоне и ничего не зная друг о друге.
1 Новый процесс получил широкую известность после Парижской выставки 1867 г. В России
первую мартеновскую печь построили в 1869—1870 гг. на Сормовском заводе А. А. Износков
и Н.Н. Кузнецов. Прим, перев.
36
Наконец мир избавился от «стального голода». Получив
в свое распоряжение такие высокопроизводительные технологи-
ческие процессы, Англия благодаря изобретениям Бессемера
и Сименса упрочила свое положение ведущей промышленной
державы. Уже в 1870 г. производство стали в Англии превысило
5 млн. т и продолжало быстро расти. Таким образом, за столе-
тие был достигнут примерно стократный прирост: во второй
половине XVIII в. в Англии производилось за год порядка
50—100 тыс. т стали.
Семимильные шаги прогресса
В 1975 г. газеты сообщили, что в Кривом Роге начала рабо-
тать самая большая в мире доменная печь объемом 5000 м\ по-
строенная также в рекордные сроки—всего за два года.
Каждый год эта печь дает больше 4 млн. т чугуна. Домне
«образца 1800 г.» пришлось бы работать 24 года, чтобы выпла-
вить столько чугуна, сколько дает криворожский гигант за
сутки.
За сухими газетными строками стоит мощное техническое
развитие черной металлургии в наше время. Советский Союз за-
нимает ведущее место в мире по производству чугуна и стали,
и новая крупнейшая домна, вероятно, недолго будет оставаться
единственной. Чтобы удовлетворить растущую потребность
в «хлебе промышленности», нужны агрегаты еще более
мощные.
Одновременно растут требования к качеству и равномерно-
сти состава металлических материалов, поэтому в последние де-
сятилетия ученые и инженеры прилагают немало усилий, напра-
вленных на усовершенствование металлургических процессов.
В металлургии стали особенно эффективным оказался кисло-
родно-конвертерный способ, при котором в жидкий чугун про-
От низкошахтных печей—
к облегченным
металлоконструкциям
Весной 1950 г. в ГДР было
принято решение о создании
мощной промышленной базы
черной металлургии. Инженеры
и рабочие успешно справились
с трудной технической задачей:
научиться получать металлурги-
ческий кокс из бурого угля и
с этим коксом выплавлять чугун
из «тощих», бедных железом
руд в низкошахтной печи. Уже
через год после закладки объек-
та в. Кальбе была задута первая
печь, а весной 1953 г. сданы
в эксплуатацию все десять пе-
чей. Республика выиграла битву
за металл. Больше 5 млн. т чугу-
на выплавили металлурги из
Кальбе до 8 мая 1970 г.—в этот
день состоялся последний вы-
пуск металла. С того времени
город Кальбе «переквалифици-
ровался» на изготовление новых
видов продукции.
В 1969—1971 гг. здесь были
созданы крупные предприятия
по производству оцинкованных
стальных изделий, газобе-
тонных строительных элемен-
тов и облегченных металлокон-
струкций. На цинковальном за-
воде наносят защитное покры-
тие на стальные детали и узлы
общей длиной до 16 м.
Стальные строительные эле-
менты из Кальбе, особенно ли-
стовые балки, повсюду находят
широкий спрос. Большое значе-
ние для строительства имеет
и выпускаемый здесь газобетон.
Четверть века назад магде-
бургская газета «Фольксштим-
ме» писала: «Золотыми буквами
должны быть записаны в книгу
истории достижения трудящих-
ся Кальбе». Эти слова справед-
ливы и сегодня.
Современная доменная печь принадлежит к числу самых высокопроизводи-
тельных агрегатов для переработки веществ. Помимо чугуна она дает колош-
никовый газ и доменный шлак, которые также используются в промышленно-
сти. Суточная производительность крупнейших домен сейчас достигает
10000 т чугуна
37
Доменный цех в Эйзенхюттенштад-
те (название этого города (ГДР)
в переводе означает «металлургиче-
ский город», или «город при метал-
лургическом заводе»).
В трудных условиях металлурги го-
рода Кальбе выплавили в низко-
шахтных печах из бедной руды на
буром угле свыше 5 млн. т чугуна.
дувают чистый кислород. Первое предложение использовать чистый кислород
для дутья в производстве стали—оно датируется 1856 г.—исходило еще от Ген-
ри Бессемера. Но только в 1949 г. австрийским металлургам в городах Линце
и Донавице удалось, наконец, преодолев все технические трудности, получить
сталь в опытном тигле с кислородным дутьем1. В 1953 г. в этих городах возни-
кли первые в мире заводы по производству стали кислородно-конвертерным
способом (который во многих странах называют «ЛД-процессом»—по первым
буквам названий городов).
При продувке чистым кислородом содержащиеся в жидком чугуне углерод,
марганец, фосфор, сера, кремний и другие примеси или сопутствующие эле-
менты, нежелательные в стали, быстро сгорают. Приблизительно через 20 мин
металлическая ванна достигает состава, который соответствует мягкой, так на-
зываемой «неуспокоенной» углеродистой стали. Кислородный конвертер обес-
печивает экономичный способ получения стали повышенной прочности, а также
нелегированных цементуемых и термически улучшаемых сортов стали. Полу-
ченная таким образом сталь отличается низким содержанием азота, серы и фос-
фора, большой чистотой и однородностью. Доля кислородно-конвертерной ста-
ли в общем мировом производстве стали в 1957 г. составляла 1%, в 1963 г.
возросла до 12%, а в 1977 г. превысила 25%.
В настоящее время продолжает развиваться вакуумная металлургия. Сама
идея—поместив расплавленный металл в вакуум, изолировать его от воздей-
ствия атмосферы и таким путем удалять из него газы—возникла давно, но тог-
да невозможно было построить необходимое вакуумное оборудование. Быстрое
1 Первые опыты по кислородно-конвертерной выплавке стали осуществил в СССР
в 1933—1934 гг. А. И. Мозговой.—Прим, перев.
Сталеплавильный цех с кислородным дутьем.
39
Путь от чугуна и лома к стали.
развитие вакуумной металлургии началось после второй мировой войны. Сегод-
ня сталевары имеют возможность обрабатывать в вакууме расплавы весом до
100 т.
В вакуумной металлургии следует различать операцию вакуумной обработ-
ки и собственно процесс вакуумной плавки. В первом случае выплавленный обы-
чным способом металл подвергают вакуумной обработке во время выпуска из
печи или в разливочном ковше и таким путем очищают его от газов—дегази-
руют. Во втором случае шихту сначала расплавляют в вакууме, дегазируют и за-
тем, сохраняя вакуум, сталь разливают на слитки или фасонные отливки. Ва-
куумную плавку производят в индукционных, дуговых и электронно-лучевых
вакуумных печах.
Электронно-лучевой способ вакуумной плавки обладает рядом преимуществ
по сравнению с другими. Здесь плавку проводят в медном тигле, охлаждаемом
водой, что позволяет избежать реакций расплава со стенками тигля. Пучком
электронов в расплавленной ванне создается локальный перегрев, благодаря че-
му металл хорошо очищается. В электронно-лучевой печи можно переплавлять
все без исключения металлы и сплавы, даже тугоплавкие и сильно реактивные
(которые, например, нельзя плавить на воздухе, потому что они очень быстро
окисляются).
Металлургия—лишь одна из дисциплин, связанных с металлами. Помимо
этого металлами занимаются такие науки, как металловедение и физика метал-
лов. Металлургия и металловедение возникли и развились из практики добычи
и переработки металлов. Опыт научил многому, но только с появлением и раз-
витием естественных наук удалось подвести теоретическую базу под нако-
пленные веками практические знания о металлах, объяснить их и целенаправлен-
но использовать. В развитии научной металлургии особенно плодотворную
роль сыграла химия, однако в наши дни еще большее значение, несомненно, при-
обрела физика. Об этом свидетельствует уже сам термин «физическая
металлургия».
Металловедение вначале тоже было сильнее связано с химией, чем с физикой,
но теперь и здесь картина изменилась. В тесном взаимодействии с физикой ме-
40
Многокамерная электронно-луче-
вая цечь.
1 —источник электронов («электронная пушка»);
2—переплавляемый пруток или слиток; 3—вто-
рой пруток металла, который переплавляют по-
переменно с первым; 4—медный кристаллиза-
топ с водяным охлаждением.
Процесс переплава в многокамерной электронно-лучевой печи.
Многокамерная электронно-луче-
вая печь, разработанная по замыслу
проф. Манфреда фон Арденне и по-
строенная в Дрездене всего за 7 мес.
Это металлургическая печь нового
типа, предназначенная для плавки
металлов высокой чистоты.
В сталеплавильном цехе стальные
слитки извлекают из изложниц (раз-
девают) и отправляют на про-
катный стан или оставляют осты-
вать в яме.
талловсдение за последние 50 летразвилось в науку, которая на-
ходит все более действенное практическое применение и вопло-
щение. Современные методы исследования металлов приносят
результаты, благодаря которым непрерывно совершенствуются
технология получения и переработки металлов, а также способы
использования металлических материалов.
В одной книге невозможно было бы представить во всей пол-
ноте знания о металлах, накопленные за текущее столетие, ко-
торые к тому же почти ежедневно углубляются и расширяются.
Некоторые факты и явления мы рассмотрим здесь, о других
только упомянем, но, безусловно, многое останется за предела-
ми нашего внимания.
Что такое металлы ?
Что же такое металлы? Ответить на этот вопрос довольно труд-
но. Сегодня мы знаем о металлах больше, чем любое предше-
ствующее поколение, но многие вопросы до сих пор так и оста-
лись не выясненными до конца. Это и не удивительно. Наука
о металлах молода, а корни, на которых она произросла,—
точные естественные науки—простираются в глубины веков.
Больше двухсот лет назад великий русский ученый М.В. Ло-
моносов (1711 —1765) в своем труде «Первые основания метал-
лургии или рудных дел» дал металлам такое определение: ме-
таллы суть ковкие блестящие тела. Для того времени эта
краткая формулировка была достаточно верной. Ломоносов на-
зывал шесть металлов: золото, серебро, медь, железо, свинец
и олово. Ртуть и сурьма, известные и применявшиеся еще в древ-
ности, не подходили под его определение металлов, потому что
ртуть при нормальных условиях—жидкость, а сурьма слишком
хрупка и ее нельзя ковать.
Позже, объясняя понятие «металлы», стали называть и дру-
гие «металлические свойства». Так, в энциклопедическом слова-
ре Мейера (1897) о металлах говорится следующее: «...элементы,
которые являются хорошими проводниками тепла и электриче-
ства, обладают характерным сильным блеском, непрозрачны (в
не слишком тонком слое) и образуют с кислородом соединения
преимущественно основного типа». Сегодня к этому определе-
нию следует добавить также, что электро- и теплопроводность
металлов уменьшаются с повышением температуры.
К металлам относятся 80 элементов периодической системы
Менделеева. Каждый металл обладает своими особенностями.
Некоторые металлы по ряду свойств сходны между собой, и их
можно объединить в группы. Одну из таких групп составляют
так называемые благородные металлы: золото, серебро, плати-
на и другие. Общее между ними заключается в том, что они
стойки на воздухе и сохраняют свой блеск.
Сравнивая между собой разные металлы, мы видим, что на-
ряду с общими свойствами и поведением они имеют и явные
различия. Например, металлы сильно различаются по темпера-
туре плавления. Ртуть при комнатной температуре остается
жидкой и затвердевает только при —38,5° С; галлий плавится,
если его держать в руке—его температура плавления составля-
Михаил Васильевич
Ломоносов
19 ноября 1711 г. в маленькой
деревне Мишанинская, вблизи
Холмогор, у рыбака Василия
Ломоносова родился сын Ми-
хаил. Ему удалось получить со-
лидное образование в Москве,
а затем (1736—1742) основатель-
но усовершенствовать свои по-
знания в Германии—в Мар-
бургском университете и Фрей-
бергской горной академии.
В 1745 г. он стал профессором
химии Петербургской Академии
наук. Ломоносов принадлежит
к числу наиболее выдающихся
личностей XVIII в., которые не
только подарили миру новые
знания в области различных гу-
манитарных и естественных на-
ук, но и оказали значительное
воздействие на последующие
поколения. Обширная научная
и педагогическая деятельность
Ломоносова была связана пре-
имущественно с химией. Но он
же заложил в России основы на-
учной металлургии, геологии,
метеорологии. В своем труде
«Первые основания металлур-
гии или рудных дел», опублико-
ванном в Петербурге в 1763 г.,
он дал обобщающее научное из-
ложение обеих дисциплин.
Ломоносов был также по-
этом—его перу принадлежат
43
Михаил Васильевич Ломоносов.
многочисленные оды—и фило-
логом—его «Трактат о стилях
речи» имел основополагающее
значение для развития русского
литературного языка. Его уни-
версальный ум достиг больших
высот во многих областях на-
уки. Умер Ломоносов 15 апреля
1765 г. в Петербурге. Сегодня
его имя носит самый крупный
в Советском Союзе Московский
университет.
ет 29,5 ° С, а чтобы расплавить вольфрам, его нужно нагреть до
3450° С.
По определению металлы являются хорошими проводника-
ми электричества. Для серебра и железа это справедливо без
оговорок, хотя серебро проводит электрический ток приблизи-
тельно в шесть раз лучше, чем железо, а электропроводность по-
следнего в несколько тысяч раз больше, чем германия—тоже
металла. Разница, как видим, весьма существенна.
Еще один пример. В определенных границах металлы упру-
ги. Это означает, что изменения их формы и размеров, вы-
званные нагрузкой, при снятии ее исчезают. Упругие свойства
металлов хорошо знакомы нам из повседневной жизни. Доста-
точно вспомнить хотя бы спиральные пружины, которые сжи-
маются под нагрузкой и восстанавливают свою первоначаль-
ную форму после того, как нагрузка снята. Количественно
упругость металлов характеризуется так называемым модулем
упругости. У железа этот модуль в тринадцать раз больше, чем
у свинца, и в сотню раз больше, чем у цезия.
Нетрудно было бы привести еще множество примеров зна-
чительных различий в свойствах разных металлов. Естественно
может возникнуть вопрос: какие же свойства металлов—общие
или разные—преобладают? Безусловно, для металлов харак-
терны определенные общие свойства, но чтобы их четко устано-
вить, необходимо все металлы каким-то образом упорядочить,
привести в систему. Тогда встает очередной вопрос: по какому
признаку следует классифицировать металлы? Если их располо-
жить в ряд, скажем, по цвету, либо температуре плавления, либо
по плотности, то это не приведет к какому-либо удовлетвори-
тельному результату. Однако все металлы—химические эле-
менты, поэтому вернее всего будет прибегнуть к химическому
принципу классификации, т.е. воспользоваться периодической
системой элементов.
Горно-металлургическая
энциклопедия 1805 года
В 1805 г. саксонский металлург
К.Ф. Рихтер опубликовал свой
двухтомный труд «Новейший
горный и металлургический лек-
сикон», который он снабдил
подзаголовком: «Алфавитное
объяснение всех встречающихся
в горном деле и металлургии ра-
бот, инструментов и спе-
циальных выражений, собрано
и составлено на основе лучших
сочинений по минералогии
и металлургии».
В то время в науке еще гос-
подствовала флогистонная тео-
рия, утверждавшая, что при го-
рении выделяется особое веще-
ство—флогистон. Эта теория,
хотя и ошибочная, представляла
собой первую серьезную попыт-
ку дать единое истолкование хи-
мическим процессам. Француз-
Металлы как химические элементы
Прежде чем говорить о металлах как о химических элемен-
тах, следует разобраться еще в одном весьма каверзном вопро-
се. Ведь если к металлам относить лишь химические элементы,
то тогда сталь и чугун, бронза и латунь, т. е. все сплавы, не дол-
жны быть металлами? Разумеется, это не так. Большинство ме-
таллов применяется не в чистом виде, а в виде сплавов. Но
чтобы составить представление о металлических свойствах как
таковых, следует для начала ограничиться только чистыми ме-
таллами. Способность образовывать сплавы—это, по сути де-
ла, не что иное, как одно из металлических свойств. Поэтому да-
лее мы прежде всего рассмотрим чистые металлы.
В периодической системе элементы располагаются в поряд-
ке возрастания их атомного номера (заряда ядра их атомов).
Когда Лотар Мейер (1830—1895) и Д.И. Менделеев
(1834—1907) независимо друг от друга пришли к периодической
системе, еще не существовало общеизвестной сегодня модели
строения атома, да и самого понятия «строение атома» («атом»
по-гречески—«неделимый»). Место элемента в системе опреде-
лялось его относительной атомной массой (до недавнего вре-
мени было принято говорить «атомный вес»). Но из известных
44
тогда 63 элементов только 36 подчинялись принципу возраста-
ния атомной массы. 20 элементов не полностью соответствова-
ли этому правилу, у 7 остальных элементов Менделеев скоррек-
тировал величину атомной массы, исходя из убеждения, что
место элемента в периодической системе должно определяться
не одним-единственным его физическим свойством, т.е. атом-
ной массой, но и другими свойствами. Последовательное при-
менение этого фундаментального принципа привело Менделе-
ева к замечательному успеху—ему удалось предсказать
свойства еще не открытых в то время химических элементов.
Чтобы уяснить себе внутреннюю закономерность периоди-
ческой системы, следует рассмотреть взаимосвязь между место-
положением в ней элемента и строением его атома. Эту зависи-
мость помогает понять модель атома, созданная Бором. Она
напоминает Солнечную систему в миниатюре: атом состоит из
расположенного в центре ядра—Солнца и оболочки, в которой
вокруг ядра по орбитам вращаются электроны—своего рода
планеты этой крошечной Солнечной системы. Размеры атома
настолько малы, что их трудно себе представить. 100 миллионов
атомов, плотно уложенных один к другому, составили бы цепоч-
ку длиной всего в 1 см. Как и в Солнечной системе, где планеты
движутся по орбитам на огромных расстояниях от Солнца,
в атоме расстояния между атомным ядром и орбитами электро-
нов тоже очень велики (в масштабах атома). Диаметр Солнца
(1,4406 км) находится примерно в таком же отношении к разме-
ру Солнечной системы (6-Ю13 км), как диаметр атомного ядра
(порядка 10“13 см) к размеру атома (порядка 10“ 8 см).
Чтобы более наглядно выразить эти соотношения, допу-
стим, что диаметр атома равен 100 м. Тогда диаметр ядра дол-
жен составить около 1 см, а электрона—1 мм. Это означает,
что все атомы, содержащиеся в 1 м3 платины (массой
21500 кг)—если бы удалось сжать их до размеров ядра (а имен-
но в ядре сосредоточена почти вся масса атома),—заняли бы
объем всего лишь в 1 мм3.
Но атомное ядро не только заключает в себе почти всю мас-
су атома, оно несет и положительный электрический заряд
(равный, по величине заряду всех электронов атома), который
и определяет порядковый номер атома Z и его место в периоди-
ческой системе. В оболочках атома на орбитах находится столь-
ко же электронов, т.е. отрицательных элементарных зарядов,
сколько положительных зарядов содержит ядро. Поэтому в це-
лом атом электрически нейтрален. Один из основоположников
ядерной физики датчанин Нильс Бор (1885—1962) сформулиро-
вал в 1913 г. знаменитые принципы; первый из них утверждает,
что в атоме есть орбиты, двигаясь по которым, электрон не из-
лучает энергию. Такие орбиты называются стационарными.
Оболочки атомов по мере увеличения зарядов ядер заполняют-
ся электронами в строго определенной последовательности: от
внутренних (ближайших к ядру) оболочек к внешним. Энергети-
ческое состояние каждого отдельного электрона характеризует-
ся четырьмя так называемыми квантовыми числами, а именно
главным, побочным, или азимутальным, магнитным и спи-
новым*.
Главное квантовое число п определяет круговую орбиту, по
которой движется электрон, и последовательно принимает зна-
чения чисел натурального ряда: 1, 2, 3 и т.д.
Соответствующие этим значениям главного квантового
числа оболочки обозначаются латинскими буквами К, L, М
45
ский химик Антуан Лавуазье
(1743—1794) опроверг ее экспе-
риментально и показал, что при
горении вещество не выделяет
флогистон (в России он назы-
вался «теплород»), а присоеди-
няет кислород, однако его ре-
зультаты в то время еще не
получили широкой известности
и признания. В труде Рихтера по
поводу разделения металлов на
«благородные» и «неблаго-
родные» говорилось следую-
щее: «Те металлы, в которых
флогистон настолько прочно
связан и устойчив к огню, что
его невозможно удалить обык-
новенным пламенем, называют-
ся благородными; напротив, ме-
таллы, которые, подобно благо-
родным, в холодном или горя-
чем состоянии под молотом
способны растягиваться в длину
и ширину, но на воздухе или
в огне теряют большую часть
флогистона, превращаясь
в ржавчину или известь, и тот не
может быть в них возвращен
иначе, как путем добавления при
плавке, называются неблаго-
родными; те же металлы, ко-
торые не способны растягивать-
ся под молотом и поэтому не
обладают ковкостью, назы-
ваются полуметаллами».
С точки зрения флогистонной
теории задачу металлургов при
получении металлов из «метал-
лических известей» (т. е. окисных
руд) можно было сформулиро-
вать очень просто: руду следует
обработать так, чтобы ввести
в нее флогистон и таким обра-
зом получить металл.
Схематическое изображение атома
магния.
и т.д. Как показал Арнольд Зоммерфельд (1868—1951), орбита
электрона, определяемая главным квантовым числом, не обяза-
тельно должна быть круговой, возможны также эллиптические
орбиты с различными отношениями большой и малой осей.
Эти оболочки разделяются на подоболочки в соответствии
со значениями азимутального квантового числа I = 0,1,2,..., (и —
— 1). Самый низкий энергетический уровень с I = 0 соответ-
ствует круговой орбите (или подоболочке); более высоким зна-
чениям I соответствуют эллиптические орбиты. Так, в М-о5о-
лочке (п = 3) наряду с круговой орбитой (/ = 0) существуют еще
две эллиптические орбиты (/ = 1 и I = 2). Эти орбиты обозна-
чаются буквами s, р, d,f и т. д. Магнитное квантовое число mt ха-
рактеризует взаимную ориентацию отдельных плоскостей ор-
бит, и при данном азимутальном квантовом числе I может
принимать 2/ + 1 различных значений. Спиновое квантовое чис-
ло (или, как говорят, спин) ms для каждого электрона может при-
нимать только два значения: +1/2 и —1/2. Спин—это соб-
ственный момент вращения электрона вокруг своей оси при
его движении по орбите вокруг ядра; здесь также можно усмо-
треть аналогию с Солнечной системой: обращаясь вокруг Солн-
ца, планеты вращаются еще и вокруг собственной оси.
Дмитрий Иванович
Менделеев
Когда 2 февраля 1907 г. в Пе-
тербурге умер великий русский
ученый Дмитрий Иванович
Менделеев, главный труд его
жизни—периодическая система
элементов—уже получил в на-
уке всеобщее и полное призна-
ние. Менделеева по праву назы-
вали «Коперником микрокос-
ма» (т. е. атома), потому что его
система позволила упорядочить
знания в этой области, понять
и объяснить действующие в ней
закономерности и взаимосвязи.
Менделеев родился 7 февраля
1834 г. в Тобольске и уже в 22 го-
да стал профессором Петер-
бургского университета. Он
многое сделал для технического
Ученик Зоммерфельда швейцарский физик Вольфганг Пау-
ли (1900—1958), открывший спин электрона и определивший его
значение, сформулировал также принцип запрета (названный
его именем), согласно которому в одном атоме или группе ато-
мов не может быть двух электронов, у которых все четыре кван-
товых числа совпадают. Это принцип составляет одно из фунда-
ментальных положений атомной физики.
Теперь вернемся к периодической системе (см. табл. 1). Она
начинается с самого легкого элемента—водорода. Его атом
устроен просто: в К-оболочке с главным квантовым числом п =
= 1 находится один электрон. Следующий элемент—гелий
с порядковым номером Z = 2 содержит в К-оболочке два элек-
трона. Такая К-оболочка заполнена целиком и не может больше
принять ни одного электрона. С третьего элемента, щелочного
металла лития, начинается построение новой L-оболочки
с главным числом п = 2. При построении ряда бериллий—
бор—углерод—азот—кислород—фтор—неон в эту внеш-
нюю оболочку последовательно добавляется по одному элек-
трону, наконец, их число достигает восьми, и тогда L-оболочка
тоже оказывается заполненной целиком. Далее электронами по-
степенно заполняется третья М-оболочка, которая характери-
зуется главным квантовым числом п = 3. Этот третий период
тоже начинается со щелочного металла—натрия. В следующих
элементах М-оболочка разделяется на подоболочки (энергети-
ческие уровни) 3s и Зр. Период заканчивается благородным, или
инертным, газом—аргоном. Хотя в М-оболочке еще остаются
вакансии (не занят весь энергетический уровень 3J), со щелочно-
го металла калия начинается новый период, в котором форми-
руется четвертая N-оболочка. Атом следующего элемента, ще-
лочно-земельного металла кальция, содержит в N-оболочке два
электрона на энергетическом уровне 4s. Только в ряду скан-
дий—цинк заканчивается заполнение электронами энергетиче-
ского уровня 4s в М-оболочке, а далее—до криптона—еще
шесть электронов принимает ЛГ-оболочка.
46
В дополнительных периодах периодической системы
имеются и такие элементы, у которых не заполнены (или «не за-
селены», как говорят физики) определенные энергетические
уровни внутренних оболочек. Их называют переходными метал-
лами. Примером может служить железо с порядковым номером
Z = 26. Его электронная оболочка К содержит два электрона 1s,
а оболочка L—соответственно два электрона 2s и шесть 2р, т.е.
эти оболочки заполнены целиком. В М-оболочке находится все-
го четырнадцать электронов, в том числе два 3s, шесть Зр
и шесть 3d. Хотя эта оболочка еще не заполнена до конца: энер-
гетический уровень 3d может принять еще десять электронов,—
последние (внешние) два электрона находятся уже на уровне 4s
TV-оболочки, а заполнение уровня 3d заканчивается только на
элементе с Z = 29 (медь).
Переходные металлы с их специфической электронной
структурой ведут себя иначе, чем остальные металлы. Напри-
мер, благодаря незаполненному энергетическому уровню 3d же-
лезо, кобальт и никель обладают ферромагнитными свойства-
ми. И вообще, распределение электронов между отдельными
оболочками атома определяет важнейшие свойства данного
элемента. Так, на химическое поведение элементов решающее
влияние оказывает способность их атомов принимать или отда-
вать электроны. Атомы щелочных металлов, с которых на-
чинается каждый период в периодической системе, имеют на
внешней оболочке только один электрон. Этот единственный
электрон гораздо слабее связан с ядром, чем остальные элек-
освоения минеральных богатств
России, но, безусловно, самое
выдающееся его достижение—
периодическая система элемен-
тов. Одновременно и независи-
мо от него подобную систему
разработал немецкий химик Ло-
тар Мейер (1830—1895), так что
слава этого открытия по праву
принадлежит обоим ученым.
Однако именно Менделеев
предсказал свойства еще не от-
крытых элементов. В то время,
когда он разрабатывал периоди-
ческую систему, было известно
только 63 элемента, из них
около 50 металлов. Химики еще
не знали галлия и германия.
Менделеев установил их место
в периодической системе, назвав
соответственно экаалюминием
и экасилицием, и теоретически
определил их свойства, которые
впоследствии—когда эти эле-
менты были обнаружены в при-
роде—блестяще подтверди-
лись.
Таблица I
1а | На | Illa |lVa| Va |Vla|Vlla| | Villa | lb | lib |lllb|lVb[ Vb|vib|vilb| |~О]
Периодическая система элементов.
47
Дмитрий.Иванович Менделеев (слева) и Клеменс Винклер. Профессор Фрейбергской академии
Винклер открыл элемент германий и подтвердил его свойства, теоретически предсказанные
Менделеевым.
троны, поэтому атомы щелочных металлов легко теряют его и превращаются
в положительно заряженные ионы Li+, Na +, К + и т. д. Наоборот, атомам фто-
ра, хлора, брома и других галогенов (т. е. «солеродных» элементов) не хватает
одного электрона, чтобы заполнить целиком внешнюю оболочку и тем самым
сделать ее наиболее устойчивой. Такие атомы «охотно» принимают один элек-
трон, превращаясь в отрицательно заряженные ионы С1 “, F “, Вг “. Несомнен-
но, для металлов более характерна способность к образованию положительных
ионов. В периодической системе элементы постепенно теряют эту способность
при рассмотрении их слева направо, и все неметаллы располагаются в правой
части таблицы (за исключением водорода, который иногда помещают над ще-
лочными металлами).
Металлические свойства элементов усиливаются и в направлении сверху
вниз. Однако в периодической системе нельзя провести четкую границу между
металлами и неметаллами. Некоторые элементы могут быть как металлами, так
и неметаллами. Например, олово помимо металлической имеет и неметалличе-
скую модификацию. Селен встречается не только в стабильной металлической
форме, но и в двух метастабильных (т.е. неустойчивых) неметаллических моди-
фикациях. Даже такой явно выраженный неметалл, как фосфор, в виде так назы-
ваемого черного фосфора обладает металлическими свойствами. Некоторые ме-
таллы, располагающиеся в периодической системе вблизи границы между
металлами и неметаллами, например мышьяк, сурьму, висмут, называют иног-
да полуметаллами или металлами 2-го рода.
Периодическая система элементов и ее взаимосвязь со строением атома
имеют очень большое значение для науки о металлах. Однако рассмотрение
свободного, отдельно взятого атома не объясняет, почему тот или иной элемент
является металлом или неметаллом. Очевидно, металлические свойства эффек-
тивно проявляются только в веществе, т. е. при объединении многих одинаковых
или разнородных атомов.
48
Типы связен в металлах н неметаллах
Внутренняя связность вещества—это результат сил взаимодействия между
составляющими его частицами, которые могут взаимно притягиваться или от-
талкиваться. Если расстояние между частицами очень велико, то силы притяже-
ния и отталкивания практически равны нулю, но при сближении частиц взаимо-
действие между ними возрастает. На определенном расстоянии силы
притяжения и отталкивания становятся одинаковыми по величине, т. е. частицы
оказываются в состоянии равновесия.
При дальнейшем сближении частиц силы отталкивания возрастают быстрее,
и снова восстанавливается равновесное положение. Если же частицы начинают
удаляться друг от друга, то результирующая сила притяжения сначала возра-
стает до некоторой максимальной величины, но при дальнейшем увеличении
расстояния между частицами асимптотически падает до нуля. Эту максималь-
ную силу притяжения называют также атомной когезионной прочностью или
усилием отрыва. Возникновение и величина сил взаимодействия между частица-
ми, образующими вещество, зависят от типа их связи. Различают четыре ос-
новных типа связи: 1) ионная (или электростатическая, гетерополярная), 2) кова-
лентная (или гомополярная), 3) металлическая и 4) межмолекулярная.
Первые три типа связи действуют только между атомами (или ионами),
а межмолекулярная связь объединяет между собой более крупные структурные
единицы.
Ионная связь возникает между такими атомами, у одного из которых на
внешней оболочке содержится мало электронов, а у другого она почти заполне-
на. Металлы имеют на внешней оболочке мало электронов и легко отдают их.
Неметаллические элементы, у которых на внешних оболочках много электро-
нов, напротив, стремятся заполнить их до конца, приняв дополнительные элек-
троны. Например, при взаимодействии атомов металла магния и неметалла
кислорода магний отдает кислороду два электрона со своей внешней оболочки,
и тогда у обоих атомов внешние оболочки оказываются заполненными. Обра-
зуется окись магния, молекулы которой состоят из положительно заряженных
ионов магния и отрицательно заряженных ионов кислорода. Внутренняя связ-
ность такого вещества, состоящего из противоположно заряженных ионов,
обусловлена силами электростатического взаимодействия между этими ионами.
Ковалентная связь возникает, когда соседние атомы, стремясь заполнить
свои внешние оболочки, объединяют (обобществляют) требуемые для этого
электроны. Например, селен имеет на внешней оболочке шесть электронов, т.е.
до полного насыщения ему не хватает еще двух электронов. Каждый атом селе-
на непрерывно обменивается электронами с двумя другими ближайшими ато-
мами. В результате возникают положительные и отрицательные ионы, между
которыми действуют электростатические силы, связывающие вещество.
У сурьмы на внешней оболочке находится пять электронов. Отдельные
атомы этого элемента могут создавать устойчивую восьмиэлектронную обо-
лочку, объединяя по одному электрону с каждым из трех ближайших соседних
атомов. Таким путем образуются плоские, дискообразные молекулы сурьмы,
связанные между собой относительно слабыми межмолекулярными силами.
Этим объясняется слоистая структура сурьмы.
Ковалентная связь возможна только между такими атомами, у которых на
внешней оболочке не меньше четырех электронов. Если же их меньше—что ти-
пично для металлов,—то все внешние электроны атомов внутри структурной
единицы вещества образуют так называемый электронный газ, при этом
каждый электрон свободно движется между атомными остовами (т.е. ионами,
состоящими из ядра и внутренних электронных оболочек) и не принадлежит ни
отдельному атому, ни какой-либо малой группе их. Такая связь, называемая ме-
таллической, обусловлена взаимодействием между отрицательно заряженным
4-430
49
*д о
Ионная связь в ионном кристалле
окиси магния. Два внешних электро-
на атома магния переходят к атому
кислорода, заполняя его внешнюю
оболочку; в результате образуются
два разноименных иона, связанных
электростатическим притяжением.
электронным газом и положительно заряженными
ионами—остовами атомов. В дальнейшем, рассматривая ме-
таллическое состояние, мы снова встретимся с этим типом
связи.
Межмолекулярная связь обусловлена силами, которые назы-
вают силами Ван-дер-Ваальса. Их природа пока недостаточно
ясна.
Дендрит («елочный кристалл»)
в усадочной раковине.
В металле вырастают
«деревья»
Иногда в металлах можно на-
блюдать интересные образова-
ния: от толстого ствола отходят
в стороны ветви с мелкими ве-
точками. Такие кристаллы—а
именно о них идет речь—вы-
глядят как маленькие елочки.
Сходство еще более усиливается
тем, что боковые ветки к «вер-
шине»—в направлении роста
кристалла—становятся короче.
Это сходство нашло отражение
и в терминологии: такие образо-
вания называются дендритами
(от греческого слова «ден-
дрон»—дерево), а по-немецки
их называют Tannenbaumkristal-
le—«елочные кристаллы». Ден-
дриты можно часто наблюдать
в усадочных раковинах—поло-
стях, которые образуются вну-
три слитка при затвердевании
Металлы—это кристаллы
Когда говорят о кристаллах, большинство из нас предста-
вляют себе некие правильные, ограниченные плоскими поверх-
ностями твердые тела. Такое представление соответствует
строению многих минералов: каждому ясно виден кристалличе-
ский характер горного хрусталя, всем нам хорошо знакомы ле-
дяные кристаллы, которые образуются зимой на холодном
оконном стекле, или прелестные кристаллики—снежинки. Но
трудно себе представить, что вилка, которую мы держим в руке,
кастрюля на плите или металлическая дверная ручка тоже
имеют кристаллическое строение. И тем не менее это так.
Иногда мы, правда, можем заметить, что металлическое изде-
лие состоит из множеств мелких кристаллов, это обнаруживает-
ся, например, на поверхности излома. На поверхности распро-
страненных когда-то цинковых (вернее, оцинкованных) ванн со
временем возникали узоры, напоминающие морозные узоры на
окнах. Эти узоры создавали кристаллы цинка, выросшие на
стальном листе. Кристаллы можно также наблюдать на поверх-
ности расплавленного металла при его затвердевании и в так на-
зываемой усадочной раковине (полости, которая образуется
внутри отливки). Металлы—кристаллические тела, и многие их
свойства объясняются именно их кристаллическим строением.
Еще в давние времена многие ученые высказывали предпо-
ложение, что характерный внешний вид кристаллов соответ-
ствует их правильной внутренней структуре. Теорию строения
кристаллов разрабатывали прославленный астроном Иоганн
Кеплер (1571—1630), голландский физик и математик Христиан
Гюйгенс (1629—1695), шведский химик Торберн Олаф Берг-
ман (1735—1784), французский минералог Рене-Жюст Аюи
(1745—1822). Они пытались связать закон постоянства углов ме-
жду гранями кристаллов, который Николаус Стено (латинизи-
рованное имя Нильса Стенсена, 1638—1686) сформулировал
в 1669 г., исходя из внешней геометрии кристаллов, с их вну-
тренней структурой. Путем измерений Стено установил, что
угол между соответствующими гранями различных кристаллов
одного и того же вещества всегда остается постоянным незави-
симо от величины кристаллов.
50
Получить доказательство регулярного внутреннего строения
кристаллов удалось только в 1912 г., когда Макс фон Лауэ
(1879—1960), Вальтер Фридрих (род. в 1883 г.) и Пауль Книппинг
(1883—1935) поставили свой знаменитый эксперимент. Узкий
пучок рентгеновских лучей они направили на кристалл серно-
кислой меди, за которым поместили фотографическую пластин-
ку. Помимо центрального черного пятна от пучка, прямо про-
шедшего через кристалл, на пластинке было отчетливо видно
множество расположенных в строгом порядке черных точек от
лучей, которые при прохождении через кристалл отклонились
от центрального пучка под разными углами. Такой результат
заключал в себе экспериментальное доказательство сразу двух
фундаментальных фактов: во-первых, рентгеновское излучение
по своей природе представляет собой электромагнитные волны
и, во-вторых, кристалл—это трехмерная периодическая решет-
ка, расстояния между узлами которой по порядку величины
близки к длине волны рентгеновского излучения. Если атомы
металла представить в виде крошечных теннисных мячей, то,
разместив регулярно множество таких мячей в пространстве,
мы получим упрощенную картину кристаллического строения
металла.
Такое представление атомов в виде теннисных мячей тем бо-
лее соответствует реальной картине, что теннисные мячи при
сжатии деформируются; примерно так же ведут себя и атомы
металла. Если уложить такие мячи, т. е. атомы, в трех перпенди-
кулярных направлениях (по трем пространственным осям) и изо-
бразить центр каждого мяча-атома в виде маленького шарика
(ядра), то мы получим простейшую пространственную решетку.
Решетка построена из регулярно повторяющихся «кирпичи-
ков»—самых малых ее элементов. На рисунке элемент, ко-
торый называют элементарной ячейкой пространственной ре-
шетки, выделен жирными линиями (см. стр. 53).
В рассматриваемом простейшем случае он представляет со-
бой куб, в каждой вершине которого находится атом (вернее,
центр атома), а длина ребер соответствует шагу (или периоду,
межплоскостному расстоянию) решетки. Легко убедиться, что
каждый атом в такой решетке принадлежит одновременно вось-
ми соседним элементарным ячейкам и каждая ячейка содержит
восемь раз по одной восьмой атома, т.е. один атом.
Металлы, за редкими исключениями, образуют именно про-
стую пространственную решетку, при этом наиболее типичны
три системы расположения атомов: две кубические и одна гекса-
гональная. Элементарная ячейка объемно-центрированной ку-
бической решетки (а) отличается от описанной выше простей-
шей кубической тем, что в центре каждого кубика находится еще
один атом, т.е. такая элементарная ячейка содержит два атома:
8 х 1/8+1. В гранецентрированной кубической решетке (б)
в вершинах куба находится восемь атомов и еще по одно-
му в центре каждой из его шести граней. Каждый атом в центре
грани принадлежит данной ячейке наполовину, следовательно,
такая ячейка содержит (8 х 1/8) + (6 х 1/2) = 4 атома. Гексаго-
нальная решетка (в) построена из ромбических призм (на рисун-
ке одна из них показана жирными линиями), причем каждые три
из них образуют гексагональную призму.
В пространственной решетке можно выделить плоскости, от-
личающиеся по плотности «заселения», или заполнения, атома-
ми. Например, в гранецентрированной кубической решетке пло-
скости граней куба не так плотно заполнены атомами, как
расплавленного металла. Их
возникновение объясняется тем,
что кристаллы в разных напра-
влениях (относительно их про-
странственной решетки) растут
с неодинаковой скоростью.
В одном определенном напра-
влении кристалл в расплаве рас-
тет особенно быстро, образуя
ствол дендрита. В других напра-
влениях из ствола растут бо-
ковые ветви, а от них в свою оче-
редь могут отрастать мелкие
веточки. У многих сплавов ден-
дритную кристаллизацию не-
редко можно наблюдать не
только в полостях, но и в ком-
пактном металле.
Дендритную форму имеют
первичные кристаллы, т.е. те,
которые выделяются из жидко-
го металла первыми; особенно
это характерно для металлов,
содержащих примеси, или спла-
вов, если примеси, которые
в этом случае называются леги-
рующими элементами, введены
в них преднамеренно. Легирую-
щие элементы и примеси рас-
пределяются в металле неравно-
мерно. Как правило, их меньше
содержится в первичных кри-
сталлах и больше—в позднее
затвердевших зонах, т.е. между
ветвями дендритов. Подобные
различия концентраций связаны
и с дендритной кристаллизацией
в компактном металле.
Вильгельм Конрад Рентген
Вильгельм Конрад Рентген ро-
дился 27 марта 1845 г. в городке
Леннеп, в Рейнской области.
Окончив физический факультет,
он работал в университетах
Страсбурга (1876), Гисена (1879),
Вюрцбурга (1888) и Мюнхена
(1900). За это время он сделал
ряд важных открытий в физике,
опубликовав около 40 научных
работ. В 1895 г. Рентген открыл
«новый вид лучей», которые он
назвал «икс-лучами» и которые
в его честь получили название
рентгеновских.
4*
51
О глубине и основательности
научной работы Рентгена гово-
рит хотя бы тот факт, что толь-
ко в 1905 г. был сделан следую-
щий шаг в объяснении природы
нового вида излучения. С тех
пор рентгеновские лучи нашли
широкое применение во многих
областях науки и техники, в том
числе и в металловедении; они
помогли расширить и углубить
знания, сыграв важнейшую роль
в дальнейшем развитии пред-
ставлений физики кристаллов.
За свои научные заслуги Рент-
ген был удостоен многих поче-
стей. В 1901 г. он получил
Нобелевскую премию в области
физики. Умер Рентген в Мюн-
хене 10 февраля 1923 г.
Эта серебряная руда имеет ярко вы-
раженный кристаллический харак-
тер. Она состоит из красных частич-
но прозрачных блестящих кристал-
лов.
На поверхности куска висмута
видны кристаллы, которые в про-
цессе затвердевания выросли из
жидкого остатка расплава.
В усадочной раковине слитка часто
можно наблюдать свободно вырос-
шие металлические кристаллы.
Здесь изображен железный кристалл
длиной около 15 см.
По-видимому, так могла бы выгля-
деть каменистая, пустынная поверх-
ность мертвой планеты. На фото-
графии показана поверхность изло-
ма сплава никель—хром: отчетливо
видно, что множество соприкасаю-
щихся друг с другом кристаллов (зе-
рен) образуют компактные метал-
лические тела правильной формы.
«плоскости октаэдра», которые рассекают куб, проходя через диагонали его гра-
ней и противолежащие вершины. Наличие в пространственной решетке плотно
«заселенных» плоскостей существенно для некоторых свойств металлов. Весьма
важную роль в формировании свойств металлов играет также то обстоятель-
ство, что в их кристаллической структуре почти всегда имеются нарушения—
дефекты. Правильное, регулярное внутреннее строение кристаллической решет-
ки—это лишь идеальная схема, реальная же структура всегда от нее отличается.
Дефекты кристаллической решетки принято разделять на три группы.
К первой группе принадлежат так называемые точечные дефекты. Если во время
роста кристалла место одного атома в решетке остается свободным—это то-
чечный дефект \ У металлов в процессе кристаллизации при температурах не-
много ниже точки плавления незанятым остается одно место в решетке пример-
но на каждые десять тысяч—миллион атомов. Вторую группу составляют
линейные дефекты. Это так называемые дислокации (смещения, перестанов-
ки)—нарушения правильной структуры кристалла, возникающие либо при его
росте, либо в процессе пластического деформирования. Существуют различные
типы дислокаций. Один из них—ступенчатая, или краевая, дислокация, которая
представляет собой линейный дефект в пространственной решетке, содержащей
лишнюю полуплоскость, что напоминает топор, застрявший в куске дерева
(см. рис. 74 а, б). Первоначально понятие дислокации возникло как чисто теоре-
тическое—для объяснения природы пластической деформации металлов.
1 Другим видом точечного дефекта кристаллической решетки является расположение атома
не в «отведенном» ему месте—в узле решетки, а в промежутке—в междоузлии. Оба вида точечных
дефектов нарушают равновесие сил взаимодействия между окружающими дефект атомами, что
проявляется в изменении свойств металлов.—Прим. ред.
Схематическое изображение про-
стейшей кубической пространствен-
ной решетки кристалла и ее элемен-
тарной ячейки. Атомы расположены
равномерно во всех трех направле-
ниях.
Элементарные ячейки трех наиболее
типичных для металлов кристалли-
ческих решеток:
а) кубическая объемно-центриро-
ванная (а-железо);
б) кубическая гранецентрированная
(медь, никель);
в) гексагональная (цинк).
53
В наши дни рентгеновская дефекто-
скопия представляет собой один из
важнейших методов ^разрушаю-
щих испытаний металлов. Мало ко-
му известно, что такие испытания
проводил еще Рентген—в частно-
сти, на своем охотничьем ружье.
И только позднее удалось непосредственно доказать существование дислокаций
и даже наблюдать их в металлическом кристалле.
И наконец, к третьей группе относятся поверхностные дефекты (здесь речь
идет не о наружной поверхности металлических предметов, а о геометрических
поверхностях в пространстве, в том числе и внутри металла). Металлические из-
делия в подавляющем большинстве состоят не из одного-единственного кри-
сталла, а из множества мелких кристалликов, т.е. представляют собой поликри-
сталлические тела. Отдельные кристаллики, или зерна, в таком теле разделены
границами. Последние и представляют собой двумерные нарушения простран-
ственной решетки для обоих примыкающих один к другому кристаллов. Как мы
увидим в дальнейшем, от величины зерен во многом зависят прочностные свой-
ства металлов.
Металлы под микроскопом
Микроскоп как никакой другой прибор помог раскрыть многие секреты ме-
таллов. Кристаллическая структура металлов, проявляющаяся на поверхностях
излома, особенно отчетливо видна под микроскопом. Но самые обширные
и важные сведения принесло исследование под микроскопом плоских, спе-
циальным образом обработанных металлических поверхностей.
До конца первой четверти текущего столетия основным методом исследова-
ния металлов являлась металлография. Сегодня наряду с оптическим микроско-
пом широкое применение находит также электронный микроскоп. Оба эти при-
бора позволили глубоко изучить и понять свойства и поведение металлических
материалов.
Прежде чем производить наблюдения структуры металлов при помощи оп-
тического микроскопа, плоскую поверхность металлического образца подвер-
гают шлифовке, полировке и травлению. Увидеть в микроскоп какую-то карти-
ну на полированной поверхности можно только в том случае, если металл
содержит различные составляющие, заметно отличающиеся по своим оптиче-
ским свойствам. Например, на поверхности чугунного образца удается просле-
дить форму графитных включений и их распределение в массе основного метал-
ла. Чтобы на поверхности шлифа проявилось расположение мелких кристаллов
(зерен), ее, как правило, необходимо протравить. Травление оказывает на металл
химическое или электрохимическое воздействие, что и позволяет раскрыть его
54
a
б
Столь обыкновенный предмет, как этот алюминиевый ключ, состоит из множества мелких кри-
сталликов, что нетрудно обнаружить после его металлографической обработки (а). При неболь-
шом увеличении отчетливо проявляется структура металла (б).
Вакуумная кинокамера высоковольтного электронного микроскопа, с по-
мощью которого снимали процессы плавления и спекания металлов.
Кадры показывают, как постепенно изменяется форма мельчайших кристалли-
ков золота при нагреве почти до температуры плавления. Эти снимки—в свое
время уникальные—получены Манфредом фон Арденне в 1940 г. На среднем
кадре показан масштаб (1ц (микрон) = 10 ~ 6 м).
Первый высоковольтный элек-
тронныймикроскоп(ускоряющее на-
пряжение 200—300 кВ), разрабо-
танный Манфредом фон Арденне
в 1941—1942 гг. в Дрездене, позво-
лил исследовать металлы при высо-
ких температурах (до 2500ъС).
б
Микрофотографии одного и того же
образца электротехнического алю-
миния, полученные на растровом
электронном микроскопе при раз-
личных увеличениях: примерно 1800
(а), 5500 (б) и 9100 (в) крат. По-
верхность образца предварительно
обрабатывалась методом ионной
бомбардировки.
структуру. Отдельные участки поверхности металлического образца подвер-
гаются растворению либо на них осаждается тончайшая окрашенная пленка.
Различные типы кристаллов при растворении ведут себя по-разному, причем
границы между зернами—в зависимости от выбранного травителя—раство-
ряются сильнее, и, таким образом, на металлическом шлифе возникает микро-
рельеф, становится видна структура образца.
Увеличение оптического микроскопа в лучшем случае достигает 1500 крат,
тогда как электронный микроскоп обеспечивает значительно большее увеличе-
ние. В электронном микроскопе наблюдают, как правило, на просвет либо сами
металлические образцы, либо снятые с их тщательно отполированной поверхно-
сти отпечатки (реплики) толщиной меньше тысячной доли миллиметра. Иссле-
довать поверхность образца позволяет растровый (сканирующий) электронный
микроскоп. В нем узкий электронный луч обегает (сканирует) всю поверхность
образца, возникающий при этом ток отраженных или рассеянных от поверхно-
сти электронов создает соответствующее изображение на экране. Увеличение
56
такого микроскопа составляет от 20 до 100000 крат. Суще-
ственным преимуществом его является большая глубина резко-
сти изображения. Благодаря этому с его помощью удается до-
статочно четко наблюдать поверхности с глубоким рельефом,
например поверхности излома.
Если оптическая микроскопия позволила впервые увидеть
строение металлических материалов, то электронная микроско-
пия дала не менее ценную информацию. Оптическая металло-
графия открыла нам типы, расположение и процесс образования
структурных составляющих в металле; электронная же метал-
лография стала незаменимой для наблюдения дефектов кри-
сталлической решетки, от которых в значительной мере зависят
свойства металлов.
В микроскопе образец металла
укладывают на столик вниз той пло-
скостью, на которой приготовлен
металлографический шлиф. Обра-
зец наблюдают через бинокуляр или
на матовом стекле (на приборе сле-
ва) либо фотографируют, заменив
матовое стекло фотопленкой. На
переднем плане показан совре-
менный микроскоп фирмы «Цейсс»
(ГДР), на заднем плане—одна из
старых моделей, которая была
обычной несколько десятков лет
назад.
57
На экране электроннооптической ус-
тановки, дающем позитивное изоб-
ражение, можно видеть рельеф не-
травленой поверхности вольфрама.
Металлическое состояние
Итак, из всех наших рассуждений должен следовать вывод,
что металлы отличаются от других веществ только некоторыми
свойствами, которые мы назвали металлическими: блеск, хоро-
шая тепло- и электропроводность, прочность и способность
к пластической деформации и т.д. У разных металлов на-
званные свойства выражены в различной степени, и в зависимо-
сти от того, какие из них считать определяющими, одно веще-
ство будет более «металлическим», а другое—менее. С этой
точки зрения, по-видимому, не так уж неправ был Ломоносов,
который не причислял к металлам ртуть—ведь существенными
признаками металлов он считал блеск и ковкость.
А возможно ли, чтобы вещество, которое мы без колебаний
относим к числу неметаллов, при определенных условиях про-
являло металлические свойства? Действительно, подобное на-
блюдается при очень высоких давлениях. Например, красный
фосфор превращается в черный и приобретает металлические
свойства. Не менее удивительные результаты получены для
58
кремния и углерода. Если эти неметаллы подвергнуть высокому
давлению, порядка 10000 МПа (мегапаскалей), или 100000 ат, то
оба они переходят в металлическое состояние.
Особенно интересным кажется предположение о металличе-
ских свойствах водорода. Как известно, при нормальных усло-
виях водород—газ, при температуре — 253° он становится жид-
костью, а при — 259^С затвердевает. Во всех трех состояниях
водород—явно выраженный неметалл. Однако, согласно совре-
менной теории твердого тела, при достаточно высоком давле-
нии и низкой температуре все вещества должны переходить
в металлическое состояние. Известны даже условия, при ко-
торых должен наступить такой переход у водорода: давление
около 200000 МПа (2 млн. ат) и температура приблизительно
— 260° С. Еще совсем недавно такие условия находились за
пределами экспериментальных возможностей. Однако, по сло-
вам академика А. М. Прохорова, в Институте высоких давлений
АН СССР удалось получить доказательство того, что при
чрезвычайно низких температурах и высоком давлении водород
действительно превращается в металл.
Предполагают, что металлический водород является сверх-
проводником, т. е. его электрическое сопротивление практически
равно нулю. Если бы сверхпроводимость удалось сохранить при
нормальном давлении и температуре лишь немного ниже ком-
натной, то сверхпроводники можно было бы использовать для
передачи энергии, и это, безусловно, ознаменовало бы собой ре-
волюционный переворот в технике.
Вопрос о том, что же все-таки следует понимать под метал-
лическим состоянием, давно занимает ученых. Пауль Друде раз-
работал в 1900 г. модель металлического состояния, которая по-
зволила наглядно объяснить оптические и особенно электриче-
ские свойства металлов. В основе этой модели лежит понятие
металлической связи: кристалл металла состоит не из атомов,
а из положительных металлических ионов, которые возникают,
когда отдельные атомы металла отдают «в общее пользование»
свои внешние электроны. Свободно двигаясь в кристаллической
решетке металла, эти электроны образуют так называемый
электронный газ. Именно присутствием такого газа объясняется
хорошая электропроводность металлов. Применив к электрон-
ному газу классическую теорию газов, удалось даже установить
некоторые его количественные характеристики.
Однако вскоре оказалось, что далеко не все явления в метал-
лах можно объяснить с помощью электронного газа. Несмотря
на первые обнадеживающие результаты, он все же никак «не хо-
тел» подчиняться классическим газовым законам. Здесь дей-
ствуют другие, не менее строгие законы. Исследуя эти законы,
знаменитый итальянский физик Энрико Ферми (1901—1954)
пришел к понятию «вырожденного электронного газа». Чтобы
его объяснить, нам придется обратиться к расчетам; впрочем,
чтобы не затруднять читателя вычислениями, мы приведем
только их результаты. В одном кубическом сантиметре меди со-
держится приблизительно столько же свободных электронов,
сколько в нем атомов (точнее говоря, металлических ионов),
а это примерно в тысячу раз больше, чем количество молекул,
содержащихся в 1 см3 водорода при нормальных условиях.
Чтобы такое количество молекул водорода «втиснуть» в объем,
равный 1 см3, их пришлось бы сжать под давлением свыше
100 МПа (1000 ат). Следовательно, согласно классическим зако-
нам, электронный газ должен находиться под таким огромным
59
Открытие важного
исследовательского
метода
Хотя достоверно известно, что
задолго до описанного ниже со-
бытия уже проводились неко-
торые металлографические ис-
следования —например, еще
Р.А. Реомюр (1683—1757) сооб-
щал о макротравлении раз-
личных сортов стали,—тем не
менее именно это событие при-
нято считать «днем рождения»
металлографии.
Все началось с весьма редкого
и примечательного явления при-
роды: 22 мая 1808 г. вблизи мо-
равского местечка Штаннерн
упал железный метеорит. Ди-
ректор венского придворного
минералогического кабинета
Карл Шрейбер (1775—1852) уго-
ворил своего коллегу, директора
кабинета промышленных изде-
лий Алоиса фон Видманштетта
(1754—1849) заняться исследова-
нием метеорита. Результаты
опытов Видманштетта Шрейбер
описал в статье, опубликован-
ной в 1820 г. В ней, в частности,
говорилось: «Интересная струк-
тура метеоритного железа...
самым отчетливым образом
видна на совершенно ровных,
чисто отшлифованных и тонко
отполированных плоскостях по-
сле того, как на эти плоскости
в течение некоторого времени
воздействовали соляной кисло-
той. Через несколько минут,
а иногда и сразу же проявляется
структура,... как будто налет на
поверхности». Дальше в статье
сообщалось, что при более дли-
тельном травлении на поверхно-
сти возникает рельеф, который
можно использовать как клише,
позволяющее размножить
изображение структуры. Такая
«металлография» соответство-
вала известному тогда способу
печати—литографии.
Структуру такого же типа, ка-
кая была обнаружена в метеорит-
ном железе, можно наблюдать
и в стальных отливках, и в пере-
гретой стали. В честь открывше-
го ее ученого она называется
видманштеттовой структурой.
Металлография приобрела
особенно большое значение по-
сле того, как стало возможным
рассматривать травленые ме-
таллические образцы под ми-
кроскопом1. Развитие методов
травления и успехи микроско-
пии открыли перед металлогра-
фией самое широкое поле дея-
тельности.
1 Родоначальником металлогра-
фии следует считать русского горно-
го инженера Павла Петровича
Аносова (1797—1851), который
впервые применил световой микро-
скоп для изучения микроструктуры
металлов и расшифровал секрет бу-
латной стали. Его фундамен-
тальный труд «О булатах» был опу-
бликован в России в 1841 г.—Прим,
ред.
Видманштеттова структура в желез-
ном метеорите (а) и стальной от-
ливке (б).
давлением. У идеального газа энергия частиц падает с пониже-
нием температуры, и при абсолютном нуле (0 по шкале Кель-
вина равен приблизительно —273 °C) кинетическая энергия,
а следовательно, и скорость движения частиц тоже равны нулю.
В электронном газе дело обстоит иначе. Здесь приходится пред-
положить, что при абсолютном нуле электроны обладают еще
очень большой энергией, и соответствующие ей скорости частиц
составляют порядка 10б м/с. В обычном газе частицы могут до-
стигнуть такой средней скорости лишь при температуре около
80000° С.
Если в идеальном газе частицы могут обладать любыми воз-
можными скоростями и распределение их по скоростям, или,
что то же самое, распределение по кинетической энергии, подчи-
няется статистическому закону Максвелла, то для электронного
газа приходится применять совсем другой закон—статистику
Ферми. При абсолютном нуле электроны обладают самыми
различными скоростями, но при некотором определенном зна-
чении температуры их энергетический спектр (т.е. распределе-
ние электронов по кинетическим энергиям) резко обрывается.
И дальнейшее повышение температуры металла не вносит ка-
ких-либо существенных изменений в картину распределения
Ферми. Лишь очень немногие электроны достигают достаточно
высокой энергии и покидают кристаллическую решетку метал-
ла. Даже при температурах около 3000° С это способен сделать
только один электрон из миллиарда.
Большой вклад в понимание сущности металлического со-
стояния внесла атомная физика. Вспомним хотя бы принцип за-
прета Паули. Он гласит, что два электрона, находящиеся в ато-
ме на одном энергетическом уровне, не могут обладать
одинаковыми спинами, или, другими словами, у них не могут
совпадать все четыре квантовых числа. Принцип Паули распро-
страняется и на электроны, образующие электронный газ в про-
странственной решетке металлического кристалла, ибо все они
входят в одну «обобществленную» атомную оболочку. Этим
объясняется и поведение электронного газа при температуре аб-
солютного нуля: только два электрона, обладающие разными
спиновыми квантовыми числами, могут иметь нулевую ско-
рость. Все остальные электроны—таково непреложное след-
ствие принципа запрета Паули—вынуждены занимать более
высокие энергетические уровни и соответственно должны иметь
какую-то положительную скорость и энергию. Возможные, т.е.
«разрешенные», значения энергии свободных электронов обра-
зуют практически непрерывные интервалы (зоны), которые раз-
делены «запрещенными» зонами. Таким образом, энергетиче-
ский спектр электронного газа имеет зонную структуру.
Энергетический спектр свободных атомов состоит из четко от-
деленных друг от друга и обозначаемых линиями энергетиче-
ских уровней (так называемый линейчатый спектр). При сближе-
нии атомов в кристаллической решетке их внешние электроны
начинают взаимодействовать между собой, объединяясь в элек-
тронный газ, характерный для металлов. При этом создается
очень большое (но все же конечное) число близко лежащих один
к другому энергетических уровней, из которых и формируются
разрешенные зоны, разделенные между собой запрещенными
зонами.
Зонная модель позволила объяснить металлические свой-
ства. Рассмотрим, например, такое характерное свойство метал-
лов, как электропроводность. Разрешенные энергетические зоны
60
Белые пятна на карте
Карта состояний вещества.
могут быть «заселены» электронами полностью или частично
либо могут оставаться совершенно свободными. В атомах ще-
лочных металлов уровни 2s или 3s и т. д. имеют только по одно-
му электрону, т. е. разрешенные энергетические уровни (состоя-
ния) 2s или 3s зоны заполнены лишь наполовину. Наличие
свободных мест означает, что электроны могут перемещаться
в пределах некоторой зоны—это зона проводимости. Итак,
электрическая проводимость металлов объясняется существова-
нием частично заполненных энергетических зон. В изоляторе од-
ни энергетические зоны заполнены целиком, а другие, совершен-
но свободные, отделены от них запрещенными зонами и отстоят
настолько далеко, что энергии электронов, находящихся в за-
полненной зоне, не хватает на то, чтобы преодолеть расстояние
до ближайшей свободной зоны, где они могли бы беспрепят-
ственно двигаться. В полупроводниках запрещенная зона узкая,
поэтому многочисленные электроны из заполненной зоны, по-
лучив небольшую порцию энергии (например, в результате на-
Нынешнему поколению не су-
ждено совершать географиче-
ские открытия—на картах мира
не осталось белых пятен. Рас-
крыты тайны истоков Нила
и бассейна Амазонки, исследо-
ваны Центральная Африка, Ги-
малаи и Антарктида. Карто-
графы и геодезисты прошли по
всем параллелям и меридианам
нашей планеты, не оставив ни
клочка «герра инкогнита»—
неизвестных земель или морей,
которые так влекли к себе Ко-
лумба и Магеллана, Гумбольд-
та и Семенова-Тян-Шанского.
Но нашим пытливым современ-
никам (впрочем, и потомкам то-
же) предстоят не менее захваты-
вающие путешествия в глубь
неизведанных областей веще-
ства. Если представить себе
«карту» состояний вещества, на
которой вместо географических
долготы и широты нанесены
температура и давление, то точ-
ка с координатами 20° С и 1ат
(101325 Па) на ней соответ-
ствует нормальным физическим
условиям. Но чем дальше от
этой точки, тем беднее наши
знания и вместе с тем шире
перспектива для открытий.
Область «материя инкогнита»
простирается на этой «карте» от
абсолютного нуля до десятков
миллионов градусов, от глубо-
чайшего вакуума, характеризуе-
мого давлением меньше трил-
лионных долей атмосферы, до
десятков миллионов атмосфер.
Двигаясь по «параллели»
средних давлений вправо, мы
при температуре около 10000° С
попадаем в область плазмы.
В таком состоянии вещество
диссоциирует, т.е. распадается
на ионы и электроны (физики
называют это состояние «холод-
ной плазмой»). Несомненно, на-
станет день, когда удастся до-
стигнуть температур в сотни
миллионов градусов, и тогда
перед человечеством откроются
неограниченные возможности
61
управляемого термоядерного
синтеза.
Перемещаясь по нашей «кар-
те» снизу вверх, мы придем
к высоким и высочайшим давле-
ниям. Правда, сегодня уже
удается с помощью взрыва
создать на долю секунды дав-
ления до миллиона и даже де-
сяти миллионов атмосфер
(105—10ъ МПа), но мы еще
очень мало знаем о свойствах
вещества при таких давлениях.
В этом направлении белое пятно
на «карте» простирается до да-
влений порядка 10 млн. ат (1
млн. МПа). Здесь, как предпола-
гают ученые, образуется плазма
совершенно особого типа. Из
такой «вырожденной» плазмы,
по-видимому, состоят так назы-
ваемые белые карлики—
звезды, имеющие массу, при-
мерно равную массе Солнца, но
много меньшие размеры. Масса
1 см3 вещества такой звезды до-
стигает многих тонн.
Двигаясь по нашей карте от
начальной точки влево вверх,
т. е. к низким температурам
и высоким давлениям, мы попа-
даем в область металлического
состояния. При достаточно боль-
ших давлениях и низких темпе-
ратурах все вещества превра-
щаются в металлы, потому что
в таких условиях внешние элек-
троны отрываются от своих
атомов и образуют в веществе
электронный газ, который, как
мы знаем, является носителем
многих металлических свойств.
«Карта» состояний вещества
показывает, что те свойства ве-
ществ, которые на первый
взгляд кажутся очевидными, на
самом деле составляют особен-
ность, присущую только привы-
чному нам миру низких давле-
ний и невысоких температур—
маленькому (и такому уютно-
му!) островку, лежащему в ле-
вом нижнем углу «карты»
огромного, неведомого мира.
гревания), могут перейти в свободную зону. Впрочем, подобное
явление возможно и в изоляторе, если его электроны получают
достаточную дополнительную энергию при нагревании или
приложении высокого электрического напряжения. Тогда они
преодолеют запрещенную зону, отделяющую их от свободной
разрешенной зоны, и, двигаясь в последней, создают электриче-
ский ток—происходит, как говорят, пробой изолятора. Таким
образом, между изоляторами и полупроводниками нет такого
принципиального различия, как между металлами и неметалла-
ми.
О поведении металлов
При использовании металлов человек основывается на особенностях их по-
ведения и специфических свойствах. Металлы можно расплавлять и отливать из
них различные изделия, а в твердом состоянии им можно придавать нужную
форму путем пластической деформации. Многие физико-механические свойства
металлов, такие, как прочность или вязкость, а также некоторые химические
свойства, например стойкость к коррозии, удается существенно улучшить пу-
тем легирования (введения примесей) и специальной обработки. Поведение
и стойкость металлического материала под нагрузкой зависят в первую очередь
от его химического состава и состояния обработки. Существенную роль при
этом играют и условия окружающей среды—температура, состав атмосферы
и т.д. При высоких температурах металл под нагрузкой начинает деформиро-
ваться раньше, чем при нормальной температуре; в агрессивной среде металл
постепенно разрушается. Применяя металлический материал для той или иной
цели, можно не опасаться неприятных сюрпризов только в том случае, если пра-
вильно учитывать особенности данного металла или сплава. Изучением зависи-
мостей, связывающих химический состав и состояние обработки металлических
материалов с их поведением при различных воздействиях и при определенных
условиях окружающей среды, занимается специальная научно-техническая дис-
циплина—металловедение. Знание этих зависимостей помогает обеспечить воз-
можно большую надежность применения металлов и их экономичное использо-
вание.
Особенно важно при этом выяснить, почему тот или другой металл ведет се-
бя так, а не иначе. Механические свойства металлов обусловлены прежде всего
их кристаллической структурой и ее дефектами. Оптические, магнитные и элек-
трические свойства металлов в основном определяются взаимодействием ме-
жду электронным газом и атомными остовами—ионами, а ядерно-физические
свойства—строением атома и его ядра.
В настоящей главе мы будем говорить о «классических», т.е. давно из-
вестных и широко используемых, свойствах металлических материалов: о пла-
влении и затвердевании, о легировании, об их упругом и пластическом
поведении.
Плавление и затвердевание
Плавление металла—процесс хорошо известный, и большинству из нас он
представляется совершенно обычным. Например, легкоплавкий металл свинец
переходит из твердого состояния в жидкое, если его нагреть до 327° С. Свинец
63
можно без труда расплавить на газовой плите в ложке, сделанной из металла
с более высокой температурой плавления.
Предположим, что, нагоевая свинец, мы все время измеряем его температу-
ру. Что же мы обнаружим? Пока металл остается твердым, его температура не-
прерывно повышается, и, как только она достигнет точки плавления, свинец на-
чинает плавиться. С этого момента температура смеси еще твердого и уже
жидкого свинца больше не меняется, даже если мы прибавляем пламя горелки.
Только после того, как весь свинец расплавится, его температура снова начинает
непрерывно возрастать. Теперь выключим горелку и оставим свинец остывать:
его температура падает до начала затвердевания, но затем с момента появления
из расплава первых кристалликов свинца остается постоянной. И наконец, когда
свинец полностью затвердеет, его температура снова начинает непрерывно
снижаться.
Может быть, такая особенность поведения присуща только свинцу? Оказы-
вается, нет. Аналогичным образом ведут себя все чистые металлы и некоторые
сплавы; подобный ход плавления и затвердевания можно наблюдать и у неме-
таллов. Например, температура смеси воды и льда всегда равна 0° С и повы-
шается лишь с того момента, когда весь лед растает. И наоборот, если смесь ох-
лаждать, то ее температура упадет ниже 0° С только после того, как вся вода
превратится в лед.
В соответствии с температурой плавления и затвердевания металлы делятся
на низкоплавкие (легкоплавкие), высокоплавкие и тугоплавкие. В первую группу
металлов—точка плавления ниже 1000° С—входят свинец, олово, цинк и алю-
миний. Ко второй группе—точка плавления лежит в интервале от 1000 до
2000° С—принадлежат железо, титан и др. К тугоплавким металлам с точкой
плавления выше 2000° С относятся, например, молибден, тантал и вольфрам.
Что же собственно происходит с металлом при плавлении? Очевидно, нару-
шается порядок расположения атомов—пространственная кристаллическая ре-
Время
Время
Кривые нагрева и охлаждения для чистых металлов, характеризующие поведение металлов при
плавлении и затвердевании: кривая нагрева—от начала до конца плавления температура остается
постоянной (а); кривая охлаждения—от начала до конца затвердевания температура остается по-
стоянной (б).
64
Разрез в вольфрамовом листе, сделанный ми-
кроплазменной горелкой. Струя плазмы
имеет диаметр всего 0,1 мм (для сравнения
рядом сфотографирована почтовая марка).
Вольфрам обладает самой высокой точкой
плавления среди металлов—около 3500° С.
Металлы подвергают плавлению не только при литье, но и в процессах сварки и резки. Например,
в современном методе плазменной резки тоже используется способность металлических материа-
лов к расплавлению. Показанная на фотографии горелка создает узкую струю плазмы с температу-
рой около 20000° С, что позволяет получить очень тонкий рез.
тетка,—существующий в твердом состоянии. В металлическом кристалле
атомы (вернее, ионы) колеблются около своих положений равновесия. При на-
греве с повышением температуры амплитуда колебаний возрастает и наконец
достигает такой величины, при которой решетка разрушается. Для такого раз-
рушения требуется дополнительная тепловая энергия, поэтому в процессе рас-
плавления температура не повышается, даже если источник тепла продолжает
действовать. Эта так называемая скрытая теплота плавления при затвердевании
снова выделяется в виде теплоты затвердевания, благодаря чему температура
материала остается постоянной, хотя он продолжает отдавать теплоту в окру-
жающее пространство. В табл. 3 (см. стр. 83) приведены температура и теплота
плавления наиболее распространенных металлов. Как видно из таблицы, эти ве-
личины заметно отличаются для разных металлов.
Чтобы расплавить кусок металла массой 1 кг, необходимо сначала подвести
столько тепла, чтобы нагреть его от комнатной температуры до точки плавле-
ния, а затем дополнительное количество тепла, равное теплоте плавления. Рас-
смотрим в качестве примера свинец. Для нагревания 1 кг свинца в твердом со-
стоянии на 1°С требуется 0,130 кДж тепловой энергии, следовательно, чтобы
нагреть его от комнатной температуры 20° С до точки плавления, необходимо
затратить в 307 раз больше тепла, т. е. 39,7 кДж. Для расплавления свинца к этой
величине нужно добавить еще 23,8 кДж. Итак, для расплавления 1 кг свинца, на-
ходящегося первоначально при комнатной температуре, требуется 63,8 кДж.
А чтобы расплавить 1 кг меди, нужно затратить тепла почти в 10 раз больше
(613,8 кДж).
При затвердевании атомы металла вновь выстраиваются в определенном
порядке в пространственной кристаллической решетке. В металлическом рас-
плаве затвердевание, как правило, начинается сразу во многих точках. Возникает
и одновременно растет много кристаллов, которые сначала—пока металл в ос-
новном находится в состоянии расплава—не мешают друг другу. Но по мере
5-430
65
Рожковое дерево и атомные
проценты
Всем известно, что драгоценные
камни и золото оценивают в ка-
ратах. Но что означают выраже-
ния «бриллиант в четверть кара-
та» или «кольцо из 18-каратного
золота»?
Слово «карат» ведет свое про-
исхождение от греческого «кера-
тион» через арабское «кират».
Так назывался стручок неболь-
шого рожкового дерева, кото-
рое с древних времен выращива-
ли на берегах Средиземного
моря. Высушенное семя из этого
стручка использовали не только
в пищу, но и как меру веса дра-
гоценных камней и золота. Мас-
са этого семени составляла
в среднем 205 мг (0,205 г). В наше
время в большинстве стран вве-
ден так называемый метриче-
ский карат (равный 200мг), что
облегчает пересчет каратов
в граммы. Например, брил-
лиант в четверть карата имеет
массу ^4 х 0,2 = 0,05 г. Золото
тоже когда-то измеряли карата-
ми, главным образом в Африке.
Позднее карат в применении
к золоту стал означать не абсо-
лютное его количество, а отно-
сительное содержание в сплаве.
Приняли, что чистому золоту
соответствует 24 карата. Тогда
сплавы, которые состоят из зо-
лота наполовину или на три че-
тверти, оцениваются соответ-
ственно в 12 или 18 карат.
Сегодня для ювелирных изде-
лий общепринята метрическая
система—на них отмечают про-
бу, которая показывает, сколько
граммов золота содержится
в килограмме сплава или какое
количество частей золота при-
ходится на 1000 частей сплава.
При этом 18-каратное золото
получает пробу 750. Подобная
система введена также для сере-
бра и других драгоценных ме-
роста они все чаще сталкиваются, препятствуют росту друг дру-
га, и иногда большие кристаллы буквально «пожирают» своих
меньших собратьев. В конце концов из многих кристаллов обра-
зуется металлическое тело. Будет ли оно состоять из малого
числа крупных кристаллов или из множества мелких кристалли-
ков—это зависит от того, в скольких местах одновременно за-
рождаются кристаллы и как быстро они растут. Эти соотноше-
ния удается определенным образом регулировать. Так, доба-
вляя в металлический расплав так называемую затравку, или
модификатор, можно получить после затвердевания мелкозер-
нистую структуру. Например, алюминий высокой чистоты бу-
дет иметь в литом состоянии очень мелкое зерно, если перед за-
твердеванием в расплав добавить титан в количестве всего
0,03% (по массе). Разработаны методы, позволяющие выращи-
вать из расплава отдельные крупные кристаллы—монокри-
сталлы, что дает возможность изучать физические свойства
самого металла, исключив влияние границ кристаллов или зе-
рен, которые всегда присутствуют в поликристаллическом теле.
Сплавы
Подавляющее большинство металлических материалов—
это не чистые металлы, а сплавы. Правда, для специальных це-
лей приготавливают особо чистые металлы, но даже металлы
самой высокой чистоты, строго говоря, представляют собой
сплавы. Даже при чистоте 99,9999% (по массе) каждый грамм
металла все еще содержит сотни триллионов инородных атомов
примесей.
Для приготовления сплавов—легирования—в металл спе-
циально добавляют один или несколько других металлов или
даже неметаллов. Легирование позволяет изменять свойства
данного металла. Например, относительно мягкая медь, легиро-
ванная оловом, превращается в значительно более твердую
бронзу. Чтобы повысить прочность изделий из золота, к нему
добавляют различные металлы, поскольку чистое золото мяг-
кое и легко деформируется. Из железа в основном вследствие
легирования углеродом получают сталь, которую называю!
углеродистой. Легированные стали помимо углерода содержат
и другие специально введенные (легирующие) элементы, такие
как марганец, никель, хром и т.д.
Цель легирования заключается в том, чтобы улучшить экс-
плуатационные и технологические свойства металлического ма-
териала. Нередко, если не удается одновременно улучшить все
свойства материала так, как этого хотелось бы, приходится ис-
кать какое-то компромиссное решение. Например, бронза про-
чнее меди, но менее пластична. Чистый алюминий проводит
электрический ток лучше, чем любой его сплав, но прочность
его значительно ниже. Поэтому при изготовлении сплавов ме-
таллурги исходят из того, какие свойства в данном конкретном
применении сплава особенно важны и, следовательно, должны
быть, насколько это возможно, усилены, а какими свойствами
можно несколько поступиться. Нож или топор должны долго
оставаться острыми; колокол должен звучать громко и чисто;
литейный материал в расплавленном виде должен хорошо за-
полнять форму, и поэтому расплав должен обладать высокой
текучестью, т.е. малой вязкостью; конструкционная сталь для
сооружения мостов должна быть прочной, вязкой и хорошо сва-
66
риваться; металл для подшипников должен быть стойким к из-
носу. В большинстве случаев, чтобы получить нужные свойства
металла, его приходится легировать несколькими элементами
и подвергать определенной обработке. В те времена, когда на-
учные основы легирования были неизвестны, приготовление
сплавов представлялось таинственным искусством, магией
и многие случайно открытые закономерности этого процесса
составляли секрет семьи или цеха.
Когда металлургов спрашивают, что такое сплав, они обыч-
но дают какое-нибудь общее определение типа: сплав—это со-
единение металла с одним или несколькими другими металлами
или с металлами и неметаллами. Порой, прежде чем ответить,
они просят сначала уточнить, о каком основном металле идет
речь и какие металлы или неметаллы используются как леги-
рующие, ибо в сплаве могут присутствовать разнородные со-
единения металлов с металлами и неметаллами, в том числе со-
таллов (платины, палладия)1.
Состав сплавов, применяемых
в технике, определяют и указы-
вают в массовых (весовых) или
атомных процентах содержания
легирующего элемента (содер-
жание элемента 1 ат.% означает,
что на 100 атомов сплава прихо-
дится 1 атом данного элемента).
1 В СССР для золота (в ювелир-
ном деле) установлены пробы 350,
500, 583, 750 и 958; для сере-
бра—750, 800, 875, 916, 925 и 960;
для платины—950.—Прим, перев.
Металлургия индейцев
Развитие металлообработки
в доколумбовой Америке, как
и в Старом свете, начиналось
с двух металлов: золота и меди,
хотя это еще нельзя считать до-
казательством существования
связей между древними амери-
канскими индейцами и народа-
ми Средиземноморья. Такая па-
раллель в развитии народов
разных континентов вполне
объяснима тем, что оба на-
званных металла встречаются
в относительно чистом само-
родном виде. Доказано, что ин-
дейские племена, жившие вбли-
зи озера Верхнего в Северной
Америке, уже примерно в 3000 г.
до н.э. добывали медь и путем
холодной ковки изготовляли из
нее оружие, инструменты,
а иногда и украшения. Техноло-
гия плавки и литья им была не-
известна. В Центральной и Юж-
ной Америке металлообработ-
ка, по-видимому, возникла неза-
висимо, но пока мы знаем об
этом очень мало. Археологиче-
ские находки ничего не говорят
Самый распространенный вид обра-
ботки металлических материалов—
резание. Например, при обточке на
токарном станке с материала заго-
товки снимают стружку. При этом
вязкие материалы дают длинную
спиральную стружку, а хрупкие—
короткую, ломкую.
5*
67
о применении железа, а брон-
зовый век начался в Южной
Америке только около 700 г. н. э.
Производительные силы разви-
вались в древней Америке гораз-
до медленнее, чем в Европе,
в связи с чем и общественно-эко-
номический строй там очень
долгое время оставался неиз-
менным. Однако до нас дошли
свидетельства выдающегося ис-
кусства и глубоких познаний ин-
дейских металлургов. Приме-
ром может служить «тумба-
га»— так индейцы называли
сплав золота с медью \ который
обрабатывался значительно лег-
че, чем чистое золото, и обхо-
дился гораздо дешевле. Если
у золота точка плавления сос-
тавляет 1063° С, а у меди
1083° С, то сплав «тумбага» пла-
вится уже при 880° С. Оба ме-
талла, т. е. золото и медь, обра-
зуют между собой непрерывный
ряд твердых растворов; все эти
сплавы характеризуются неко-
торым интервалом температур
плавления; исключение состав-
ляет лишь один их них, который
имеет весовой состав 82% золо-
та и 18% меди. Только этот
сплав имеет определенную тем-
пературу плавления, которая ни-
же, чем у всех других сплавов.
Кроме того, он сильно упроч-
няется при холодной обработке,
что, несомненно, заметили древ-
ние индейские кузнецы. Много-
численные анализы найденных
изделий позволяют считать, что
индейцы вполне сознательно
приготовляли сплав именно та-
кого состава.
единения химического типа. Например, сталь содержит соедине-
ние железа с углеродом—карбид железа Fe3C, а сплав
алюминия с медью—соединение этих металлов Л12Си. В неко-
торых сплавах отдельные металлы образуют только механиче-
ские смеси: так, сплав железо—свинец представляет собой
смесь железных и свинцовых кристаллов, сплав висмут—кадмий
является смесью кристаллов висмута и кадмия. В этих случаях
разнородные кристаллы, хотя бы частично, располагаются
в определенном, характерном порядке. И наконец, два металла
могут вместе образовывать новый вид кристаллов; такие «сме-
шанные кристаллы» называют твердыми растворами.
Твердые растворы бывают двух типов: либо отдельные
атомы в кристаллической решетке замещаются атомами леги-
рующего элемента: например, в решетке медного сплава неко-
торые атомы меди замещаются атомами никеля; либо атомы
легирующего элемента настолько малы, что им удается
«устроиться» между атомами основной решетки. Именно таким
образом водород внедряется в кристаллическую решетку
железа.
Соответственно в первом случае образуются так назы-
ваемые твердые растворы замещения, а во втором—твердые
растворы внедрения. Теперь мы можем понять, почему метал-
лурги затрудняются сразу же коротко ответить на вопрос: что
такое сплав? Сплав может представлять собой химическое со-
единение или содержать такое соединение, он может также быть
механической смесью кристаллов или твердым раствором. Не-
редко в зависимости от содержания легирующих элементов
сплав может одновременно включать все эти составляющие
в различных пропорциях.
Чтобы не запутаться в таком многообразии сплавов, метал-
ловеды стремятся, и небезуспешно, как-то упорядочить все эти
знания и создать удобную для понимания и обозрения систему.
Очень полезными здесь оказались кривые нагрева и охлажде-
ния. С подобными кривыми для чистых металлов мы уже позна-
комились. Они позволяют точно установить температуру пла-
вления и затвердевания того или иного металла. У сплавов
в зависимости от их состава на таких кривых наблюдаются
перегибы, участки с большей или меньшей крутизной, а также
горизонтальные участки, характерные для чистых металлов. Все
изменения хода кривой указывают на протекание в сплаве опре-
деленных процессов. Например, ход кривой охлаждения меняет-
ся, когда из расплава начинают расти твердые кристаллы. Ис-
пользуя кривые нагрева и охлаждения, металловеды строят
1 Очевидно, от этого слова про-
изошло «томпак»—так в наше вре-
мя называют стойкий к коррозии
и декоративный сплав меди
с 3—12% цинка.—Прим, перев.
Многие сплавы представляют собой
твердые растворы внедрения или за-
мещения. В первом случае (а)
атомы (ионы) легирующего элемен-
та размещаются в свободном про-
странстве между атомами решетки
основного металла. Во втором слу-
чае (б) атомы (ионы) легирующего
элемента занимают в решетке места
атомов основного металла.
б
68
диаграммы состояния сплавов (на которых по оси абсцисс отло-
жено уже не время, а содержание элементов).
В настоящее время диаграммы состояния построены для
очень многих сплавов (или, как говорят металловеды, систем—
двойных, т.е. состоящих из двух элементов, тройных и т.д.).
Примером может служить диаграмма состояния сплавов
медь—никель. Медь и никель, соединяясь в любых пропорциях,
образуют непрерывный ряд твердых растворов: атомы никеля
способны заместить в кристаллической решетке все атомы ме-
ди. Точка плавления меди составляет 1083° С, никеля—1445° С.
Как видно из диаграммы состояния, построенной для этого ря-
да сплавов, они плавятся и затвердевают не при одной какой-то
определенной температуре, а в некотором температурном ин-
тервале, в пределах которого одновременно существуют
и твердый металл, и расплав. На диаграмме этот интервал огра-
ничен двумя линиями, соединяющими точки плавления чистых
меди и никеля: верхняя линия обозначает конец расплавления
при нагреве или начало затвердевания при охлаждении, ниж-
няя—соответственно начало плавления или конец затвердева-
ния. Таким образом, подобная простейшая диаграмма состоя-
ния разделяется на три области. Область существования
жидкого расплава лежит выше верхней линии, соединяющей
точки плавления меди и никеля, а область существования кри-
сталлических твердых растворов—ниже нижней линии. Между
ними находится двухфазная область, в которой одновременно
существуют расплав и твердый раствор. Верхняя граница этой
области получила название линии ликвидуса, а нижняя—линии
солидуса (по-латыни liquid—жидкий, solid—твердый).
Совсем иной вид имеет диаграмма состояния висмут—кад-
мий. Эти металлы образуют между собой механические смеси,
и в твердом состоянии кристаллы висмута и кадмия распола-
гаются рядом. Область существования расплава в этом случае
ограничена снизу ломаной линией, соединяющей точки плавле-
ния висмута и кадмия через точку Е. Точка Е указывает темпера-
туру плавления сплава, содержащего 60% (по массе) висмута
и 40% кадмия. Это единственный из сплавов висмута с кадмием,
Диаграмма состояния медь—ни-
кель. Состав пространственной ре-
шетки твердых растворов меняется
непрерывно от чистой меди до чи-
стого никеля.
Ложка плавится
в горячем пунше
V наших дедушек были ложки,
которые плавились в горячем
напитке, что служило излюблен-
ной шуткой за рождественским
столом. Всеобщее веселье вызы-
вало ошеломленное лицо гостя,
увидевшего, как его ложка вдруг
расплавилась в горячем пунше
или гроге.
За исключением ртути и гал-
лия, который начинает плавить-
ся, если его просто взять в руку
(при 29,8° С), все остальные
чистые металлы имеют темпе-
ратуру (точку) плавления намно-
го выше комнатной. Однако не-
которые сплавы определенного
состава ведут себя совершенно
иначе. Эти так называемые эв-
тектические сплавы, как
и чистые металлы, имеют точку
(а не интервал) плавления, но
она лежит значительно ниже,
чем точки плавления металлов,
образующих сплавы. Например,
сплав из 56,5% висмута и 43,5%
свинца плавится уже при 125° С,
хотя температура плавления
свинца составляет 327,4° С,
а висмута—271,3°С. Вводя
в сплав несколько разных ме-
таллов, можно получить еще
меньшую температуру плавле-
ния. Так, сплав Вуда (содержа-
щий 50% висмута, 25% свинца и
по 12,5% олова и кадмия) пла-
вится при 60,5° С. Еще ниже тем-
пература плавления у неко-
торых других сплавов висмута
и галлия. Но конечно, рекорды
в этом отношении принадлежат
сплавам ртути. Например, ее
сплав с 8,5% галлия становится
твердым только при —60° С.
Эти характеристики сплавов
и чистых металлов позволяют
составить шкалу точек плавле-
ния с узкими «делениями», кото-
рая оказалась полезной в реше-
69
нии многих технических задач.
По ней градуируют точные при-
боры для измерения темпера-
тур, приготовляют из раз-
личных металлов и сплавов
плавкие индикаторы и предох-
ранители, которые распла-
вляются при строго заданной
температуре. Например, при
возникновении пожара в поме-
щении они, расплавляясь, вклю-
чают сигнализацию тревоги или
открывают путь воде в спе-
циальных противопожарных
устройствах. Плавкие индика-
торы позволяют определять ло-
кальную температуру в деталях
энергетических установок во
время их работы, например
в поршнях двигателей внутрен-
него сгорания, роторах турбин
и т. д. Для этого в соответствую-
щих местах деталей высверли-
вают небольшие отверстия,
в которые вставляют короткие
стерженьки из металла или
сплава приблизительно с такой
же температурой плавления, как
и предполагаемая рабочая тем-
пература, либо несколько выше
или ниже ее. Действительную
рабочую температуру в таком
случае указывают последний
расплавившийся и первый не
расплавившийся стерженьки.
имеющий точку плавления, в которой температуры ликвидуса
и солидуса одинаковы. Все остальные их сплавы плавятся и за-
твердевают в пределах температурного интервала, который
снизу ограничен горизонтальной линией солидуса. Особый
сплав, характеризующийся точкой плавления, называется эвтек-
тическим; в нем очень мелкие кристаллы висмута и кадмия на-
ходятся в определенном взаимном расположении и образуют
дисперсную смесь—эвтектику.
Кристаллы
висмута
Кристаллы Эвтектика Кристаллы Кристаллы
висмута кадмия кадмия
и эвтектика и эвтектика
Диаграмма состояния висмут—кад-
мий. В интервале между точками,
соответствующими этим двум
чистым металлам, все сплавы со-
стоят из кристаллов висмута и кри-
сталлов кадмия. Особый сплав со-
держит 60% висмута и 40% кадмия,
он плавится и затвердевает, как
чистый металл, т.е. при определен-
ной температуре (в температурной
точке).
Эвтектический сплав свинца с 11,1%
сурьмы. Структура сплава состоит
из мелких пластинчатых кристалли-
ков свинца и сурьмы.
70
Как мы уже говорили, диаграммы состояния построены для
большинства двухкомпонентных сплавов и для важнейших
трехкомпонентных. Для сплавов, содержащих четыре и больше
компонентов, это сделать гораздо сложнее, поскольку их диа-
грамма состояния должна иметь четыре или больше измерений.
В подобных случаях, например для сплава из четырех металлов,
процентное содержание двух из них принимают постоянным
и изображают вполне наглядную диаграмму двухкомпонентной
системы, которая представляет собой как бы разрез четырех-
мерной общей диаграммы.
Диаграммы состояния дают нам важную информацию
о строении сплава и его поведении в процессе нагрева, плавле-
ния и затвердевания, но они строго соответствуют действитель-
ности только тогда, когда сплав находится в равновесном со-
стоянии. Такое состояние возникает, если расплав охлаждается
и переходит из жидкого состояния в твердое достаточно мед-
ленно. В противном случае образование кристаллов определен-
ного типа может задерживаться, и тогда при комнатной темпе-
ратуре мы обнаружим в сплаве такую структуру, которая,
согласно диаграмме состояния, должна существовать только
при высоких температурах. Подобные явления наблюдаются
в переохлажденных растворах.
Многие сплавы применяются для
получения отливок. На этом разли-
вочном участке технологический
процесс литья заканчивается, и ме-
талл начинает затвердевать в фор-
мах.
71
Упругость, пластичность и прочность
В давние времена, когда любители зрелищ не могли удовлетворить свою
страсть, сидя дома перед телевизором, они отправлялись на ярмарку, где могли
увидеть не только клоунов или фокусников, но и «силачей», которые без видимо-
го труда освобождались от железных цепей, ломали подковы или гнули мас-
сивные металлические брусья. Иногда устроители таких представлений предла-
гали приз тому из зрителей, кто сможет снова выпрямить согнутый брус. Но
если желающие находились, то, как они ни напрягали мускулы, им удавалось
лишь повеселить публику. При этом едва ли кто из зрителей обращал внимание,
что сами «силачи» только сгибали брусья, но никогда не выпрямляли их. Публи-
ка не знала, что для этого необходимо брус нагреть в кузнечном горне и отжечь
до мягкого состояния, а после правки еще раз отжечь, чтобы реквизит можно
было использовать снова. Во время гибки или правки металл деформируется
и упрочняется, причем сильнее всего в наиболее деформированных участках. Об
этом эффекте знали ярмарочные атлеты и умело использовали его. Если сами
они гнули отожженные, мягкие брусья, то смельчаку из зрителей приходилось
иметь дело с упрочненным металлом, и потому он, как правило, терпел неудачу.
В середине прошлого века не было известно, что же собственно происходит
в металле, когда он деформируется, хотя на практике люди уже в течение 6000
лет деформировали металлы и, конечно, замечали наступающие при этом изме-
нения, в том числе и упрочнение. Чтобы представить себе поведение металла
в процессе деформирования, воспользуемся простой моделью. Мы знаем, что
металл представляет собой кристаллическое тело и имеет упорядоченную вну-
треннюю структуру: атомы в кристалле, как солдаты в строю, располагаются
шеренгами и колоннами. Мы не будем вникать в сложное внутреннее строение
атомов (вернее, атомных остовов—ионов в решетке металла), а представим их
в виде упругих шариков. Такое допущение вполне достаточно для модели, кото-
рая позволит наглядно объяснить процессы деформирования и упрочнения
металлов.
Если согнуть пальцами (но не слишком сильно) тонкий кусок металла, на-
пример лезвие безопасной бритвы, а потом отпустить, то оно снова примет пер-
воначальную форму и никаких следов деформации не останется: лезвие ведет се-
бя упруго. Но если согнуть медную проволоку, то она останется деформиро-
ванной после того, как мы ее отпустим: проволока ведет себя пластично.
Разные металлы в разных условиях реагируют на нагрузку упруго или пластич-
но. Лезвие бритвы из закаленной стали не способно к пластической деформации
и ломается, если его согнуть слишком сильно. Холоднотянутая медная проволо-
ка при малых нагрузках тоже ведет себя упруго, а при более сильном изгибе—
пластично. Излом наступает только после пластической деформации определен-
ной величины, которая зависит от степени упрочнения, приобретенного
проволокой в процессе волочения.
Вернемся к нашей модели и попытаемся ответить на вопрос, что происходит
в металле, когда он деформируется. В ненагруженном состоянии в простой куби-
ческой решетке существует идеальный порядок атомов, а под упругой нагруз-
кой, например при изгибе, он меняется. После снятия нагрузки атомы мгновенно
возвращаются в свое первоначальное положение. Если же какая-то деформация
остается (ее называют остаточной деформацией), то это означает, что одна по-
ловина нашей модели сместилась по отношению к другой на одно или несколь-
ко межатомных расстояний. Как подсчитали металлофизики, для того, чтобы
сдвинуть таким образом две половинки кристалла чистого железа поперечным
сечением в 1 мм2, потребовалась бы сила 8400 Н (850 кг). В действительности
для этого достаточно силы 10 Н (986 г). Следовательно, наша модель несовер-
шенна—она неверно воспроизводит действительные соотношения. Но чего же
в ней не хватает?
72
Английский металлофизик Н. Ф. Мотт предложил следую-
щую наглядную аналогию. Чтобы сдвинуть расстеленный на
полу большой ковер, можно поступить двумя способами: либо
ухватиться за один край ковра и тянуть его целиком в нужную
сторону, либо сделать с другого края складку (волну) и, аккурат-
но прижимая, постепенно перемещать ее в том же направлении.
Второй способ требует гораздо меньших усилий, чем первый.
В металлическом кристалле, правда, нет складок, но там есть от-
клонения от идеального порядка в расположении атомов—так
называемые дислокации. В процессе пластического деформиро-
вания они перемещаются, «мигрируют» через кристалл. При
этом атомы меняют свое местоположение по отношению к сосе-
дям не одновременно по всей плоскости сдвига, а поочередно.
Аналогия с перемещением складки ковра вполне очевидна и по-
зволяет понять, почему для деформации реального кристалла
нужна во много раз меньшая сила, чем для деформации идеаль-
ного кристалла, не имеющего нарушений в структуре.
Как мы уже упоминали, первоначально дислокации рассма-
тривали как чисто теоретическую модель, которая позволяла
Кто, попав впервые в прокатный цех, не восхищался зрелищем раскаленных до-
красна стальных слитков, которые постепенно превращались в листы или про-
фили? Этот технологический процесс основан на способности металла
к деформации.
Разноцветное золото
Цвет металла зависит от его
способности отражать свет в ви-
димом диапазоне длин волн.
Коэффициенты отражения поли-
рованных металлических по-
верхностей изменяются в интер-
вале 50—95%. Серебро предста-
вляется нам белым, потому что
оно одинаково хорошо отра-
жает свет во всем видимом диа-
пазоне длин волн (в оптической
области спектра). Золото погло-
щает свет в коротковолновой
части спектра (синий, фиоле-
товый), а красный и желтый свет
отражает практически пол-
ностью. Поэтому золото мы ви-
дим желтым.
Эти особенности оптических
свойств различных металлов
можно объяснить на основе зон-
ной модели. В металлах с их не-
заполненными зонами проводи-
мости свободные электроны под
действием света переходят на
более высокие энергетические
уровни; затем, возвращаясь на
прежний уровень, они переизлу-
чают поглощенную энергию
в виде квантов света—фотонов.
Этот процесс происходит на
самой поверхности металла или
на глубине не более нескольких
атомных слоев под ней, поэтому
большую часть света металли-
ческая поверхность отражает.
Коротковолновый свет, обла-
дающий большей энергией, про-
никает в металл глубже и ча-
стично поглощается, в результа-
те его доля в отраженном
поверхностью свете оказывает-
ся меньше. У золота поглоще-
ние становится значительным,
начиная с длины волны зеленого
света. Большинство же метал-
лов интенсивно поглощает свет
лишь за пределами видимого
диапазона—в ультрафиолето-
вой области, так что падающий
видимый свет отражается от их
поверхности равномерно, и эти
металлы представляются нам
неокрашенными, белыми.
Путем легирования можно
придать металлическому мате-
73
риалу иную окраску. Например,
латунь—сплав красной меди
и белого цинка—имеет желтый
цвет. Но отсюда вовсе не сле-
дует, что по цвету металла мож-
но однозначно судить о содер-
жании в нем легирующего эле-
мента. Действительно, с увели-
чением содержания цинка цвет
латуни меняется с красного на
красноватый, переходя затем
в красновато-желтый и зелено-
вато-желтый, но при определен-
ном содержании цинка цвет на-
чинает меняться в обратной
последовательности. Интересна
цветовая гамма сплавов золота:
в зависимости от различных со-
держаний меди и серебра они
могут быть желто-золотыми,
красными, розовыми, серыми,
зелеными или белыми. Напри-
мер, в зеленом золоте на 1000
весовых частей сплава прихо-
дится 750 частей золота, 166 ча-
стей серебра и 84 части кадмия.
В Японии получают сплавы
золота с медью («сакдо») и с се-
ребром («сибниси»). Если по-
верхность этих сплавов обрабо-
тать солевым раствором, то они
приобретают цвет от фиолето-
вого до иссиня-черного.
Микрофотография дислокаций в ау-
стенитной хромоникелевой стали.
Три кристаллита, разделенные гра-
ницами зерен, имеют разную плот-
ность дислокаций. Фотография сде-
лана при помощи высоковольтно-
го электронного микроскопа с ус-
коряющим напряжением 1000 кВ
(х5000).
Схема движения дислокаций в кристалле при пластическом деформировании:
ступенчатая (краевая) дислокация на левом краю кристалла (а); дислокация
в центре кристалла (б); дойдя до правого края кристалла, дислокация покидает
его (в).
объяснить поведение металлов при деформации. Довольно
долго велись споры о том, являются ли дислокации только
атрибутом теоретической модели или же существуют в ре-
альных материалах. Наконец, благодаря специальным методам
дислокации в металле удалось сделать видимыми. При разра-
ботке этих методов специалисты исходили из того, что зоны
дислокаций под действием химических реактивов должны вести
себя несколько иначе, чем основной металл. Вблизи дислокаций
металл менее стоек к реактиву, и присутствие дислокаций про-
является на металлографическом шлифе в виде ямок травления.
Еще более убедительные доказательства дал электронный ми-
кроскоп. С его помощью можно наблюдать не только сами дис-
локации в тонких металлических пленках, но и их перемещение
в процессе деформирования. Сегодня уже никто не ставит под
сомнение реальное существование дислокаций и их роль в пла-
стическом деформировании металлов.
Каковы же причины возникновения и существования дисло-
каций? Можно считать, что в каждом металлическом кристалле
всегда есть хотя бы несколько «врожденных» дислокаций. Де-
формирование металла осуществляется вследствие их переме-
щения, при этом дислокации либо выходят из кристалла нару-
жу, либо «зацепляются» в поликристаллическом металлическом
теле и уже не участвуют в дальнейшем деформировании. Спо-
собность металла к деформации в таком случае должна была бы
очень быстро исчерпаться. Однако этого не происходит, потому
что непрерывно возникают новые дислокации. Тем не менее
этот процесс не бесконечен, и, как мы знаем по собственному
опыту, металл вначале легко поддается деформированию, но
с увеличением деформации все более сопротивляется воздей-
ствию—становится прочнее. Дислокации позволяют объяснить
и этот эффект. Чем сильнее воздействие на металл, тем больше
в нем образуется дислокаций. В процессе деформирования они
движутся через кристалл и «зацепляются» за препятствия. Плот-
ность дислокаций возрастает. Зацепленные дислокации не толь-
ко бесполезны для дальнейшего процесса деформирования, но
и затрудняют движение вновь возникших дислокаций. Наконец,
упрочнение настолько возрастает, что для дальнейшего дефор-
мирования требуется сила, превышающая силы связи между
атомами и зернами металлического тела. Металл ломается или
трескается.
Чтобы избежать такой катастрофы, необходимо прервать
процесс деформирования и нагреть металл—отжечь его до мяг-
74
кого состояния. Такой нагрев устраняет последствия пластиче-
ской деформации в виде скоплений «зацепленных» дислокаций.
При определенных условиях возможно образование новых зе-
рен в твердом состоянии. Металл как бы обновляется, и теперь
его можно снова деформировать, не опасаясь нарушить целост-
ность.
Прежде чем использовать тот или иной металл, необходимо
узнать его свойства и поведение. Когда конструктор проекти-
рует мост из стали или фюзеляж самолета из алюминиевого
сплава, он пользуется известными данными о прочности этого
материала, которые приведены в справочных таблицах. На ос-
нове этих данных конструктор рассчитывает, какую толщину
должны иметь детали, чтобы конструкция выдержала предпола-
гаемые нагрузки. Для уменьшения риска вводятся коэффи-
циенты запаса. Конструкцию рассчитывают не по максималь-
ной йагрузке, которую способен выдержать материал, а по
некоторой доле ее—так называемому допустимому напряже-
нию.
При определении характеристик прочности металлических
материалов особенно важную роль играют испытания на раз-
рыв (или на растяжение). В этом самом распространенном виде
испытаний материал подвергают действию плавно возрастаю-
щей растягивающей нагрузки. Стержень определенного попе-
речного сечения (круглого, квадратного или прямоугольного)
постепенно нагружают в продольном направлении и таким
Только что откованный коленчатый
вал для судового дизельного двига-
теля. Сталь подвергали горячей де-
формации в раскаленном состоянии.
Затем (после охлаждения) кованую
заготовку вала будут обрабатывать
резанием на станках.
75
Металл сам себя легирует
Можно ли сделать колокол из
свинца? Ответ представляется
очевидным: ведь всем известно,
что при ударе свинец издает глу-
хой стук. В колоколе из этого
металла колебания затухали бы
очень быстро, и мы не услыша-
ли бы никакого звона. Но
оказывается, существует способ
так изменить свойства свинца,
что из него получится звонкий
колокол—свинец нужно леги-
ровать тоже свинцом. Это зву-
чит довольно странно, так что
попытаемся объяснить.
Свинец деформируется пла-
стически, так как в его простран-
ственной решетке имеются сво-
бодные дислокации. Достаточно
приложить небольшую нагруз-
ку, и эти дислокации приходят
в движение. Чтобы уменьшить
пластичность, или, что то же
самое, увеличить упругость
(благодаря которой в металле
и могут возникать длительно не
затухающие упругие колебания),
дислокации нужно закрепить.
Чем прочнее они закреплены,
тем меньше затухание. С этой
целью свинец помещают в по-
ток нейтронов в ядерном реак-
торе. Быстрые нейтроны, попа-
дая в некоторые атомы металла,
«сталкивают» их с занимаемого
места в пространственной ре-
шетке в некое промежуточное
положение. Эти атомы на-
чинают перемещаться в решетке
из одного промежуточного по-
ложения в другое, пока не до-
стигнут зоны дислокации. Здесь
атомы вступают во взаимодей-
ствие с дислокацией и остана-
вливаются: дислокация и сме-
щенные атомы взаимно удержи-
вают друг друга. Если достаточ-
но долго облучать свинец ней-
тронами, то в нем остается
очень мало свободных дислока-
ций. В результате свинец стано-
вится упругим, и возникающие
в нем при ударе механические
колебания затухают гораздо
медленнее. Колокол из обрабо-
танного таким образом свинца
образом растягивают в длину. Величину силы, действующей
в поперечном сечении образца, пересчитывают в значение на-
пряжения, которое выражается в ньютонах (или килограммах)
на квадратный миллиметр. Удлинение выражают в процентах
от первоначальной длины образца. В результате такого испыта-
ния получают диаграмму напряжение—деформация, характе-
ризующую поведение металла под нагрузкой. При малых на-
грузках (соответственно и малых напряжениях) остаточная
деформация не возникает и образец после снятия нагрузки при-
нимает исходную длину—он ведет себя упруго. В пределах этой
области упругой деформации последняя прямо пропорциональ-
на напряжению, т.е. если напряжение возрастает вдвое, то и де-
формация увеличивается вдвое и т.д. В подобном случае на-
чальный участок диаграммы напряжение—деформация пред-
ставляет собой прямую линию. Крутизна ее подъема в этой
области—она определяется как отношение напряжения к де-
формации—остается постоянной и является характеристиче-
ской величиной данного металла. Ее называют модулем упруго-
сти (или модулем Юнга, модулем Е). Если напряжение
продолжает расти и материал переходит через предел упруго-
сти, то в образце будет накапливаться пластическая деформа-
ция. Теперь после снятия нагрузки образец не возвращается
к исходной длине, а становится длиннее—в соответствии с той
долей, какую составляет пластическая деформация от общей.
Сначала пластическая деформация распределяется равномерно
по всей длине образца, но при дальнейшем росте напряжения
она сосредоточивается в какой-то одной зоне. В этом месте
образец начинает сужаться (образуется «шейка»), его попереч-
ное сечение быстро уменьшается, и наконец, наступает катастро-
фа—целостность материала нарушается, образец рвется.
Кривая растяжения позволяет установить многие важные
характеристики материала. В первую очередь это предел про-
чности на разрыв (на растяжение) т. е. максимальное напря-
жение, которое выдерживает образец без образования шейки,
а также наибольшее растяжение при разрыве, или относитель-
ное удлинение 5. Труднее определить такую величину, как пре-
дел упругости, т. е. точку перехода от упругого поведения к пла-
стическому, и предел пропорциональности—максимальное
напряжение, при котором удлинение еще пропорционально на-
пряжению. Для конструкторов важен так называемый предел
текучести, т. е. напряжение, при котором остаточное относитель-
ное удлинение составляет 0,2%. Эту величину, обозначаемую От
или оод чаще всего используют при практических расчетах про-
чности изделий.
При расчетах необходимо также учитывать условия окру-
жающей среды, прежде всего температуру. Конструктор не мо-
жет пользоваться обычными характеристиками прочности ма-
териала, если проектируемая им машина или какая-то иная
конструкция должна работать при высоких температурах. В та-
ких случаях необходимо учитывать прочность материала при
повышенных температурах (горячую прочность, или жаропроч-
ность). При нагреве многие металлические материалы утрачи-
вают упругость и пластически деформируются даже при неиз-
менной нагрузке. Специалисты называют это явление «ползу-
честью». Особые методы испытаний позволяют построить
кривые ползучести и определить по ним максимальный срок,
в течение которого деформация материала при заданных на-
грузке и температуре еще остается в допустимых пределах.
76
Ползучесть металлов представляет собой сложный процесс,
при котором одновременно происходит и упрочнение, и раз-
упрочнение. У чистого алюминия ползучесть может начинаться
уже при комнатной температуре. В этом легко убедиться, если
сильно затянуть стальной болт, поставив под него шайбу из чи-
стого алюминия. Через короткое время резьбовое соединение
ослабнет. Если его снова и снова затягивать, то каждый раз
алюминий будет «течь» под приложенным постоянным давле-
нием.
В наше время получены металлические материалы, спо-
собные выдерживать нагрузку при температурах 1000° С и вы-
ше. Их высокого сопротивления ползучести (высокого предела
ползучести) удалось достигнуть в результате глубоких, фунда-
ментальных исследований физико-механических свойств спла-
вов.
В середине прошлого века инженер Август Вёлер
(1819—1914) изучал поведение железа и стали при длительном
переменном нагружении. Это необходимое исследование, пото-
му что многие детали машин и целые конструкции подвергают-
ся динамическим нагрузкам, т. е. на них продолжительное время
действуют силы, изменяющиеся по величине и направлению.
В качестве простого примера может служить цепь подъемного
крана. При подъеме и опускании груза на нее действуют растя-
гивающий силы, которые каждый раз меняются по величине от
нуля до максимального значения. С гораздо большей частотой,
чем в крановой цепи, варьируется нагрузка в самых разно-
образных деталях машин, совершающих вращательное или воз-
вратно-поступательное движение. Здесь напряжения меняются
от растягивающих до сжимающих сотни и тысячи раз в секунду.
В таких условиях сталь может не выдержать, она «устает»—
происходит усталостное разрушение. Подобное разрушение
особенно опасно тем, что ему не предшествует заметная пласти-
ческая деформация, которую можно было бы обнаружить за-
благовременно; кроме того, оно наступает при нагрузках, вели-
чина которых значительно ниже предела прочности данной
стали при растяжении, сжатии или изгибе. Усталостный излом
довольно легко узнать по его характерному виду. Обычно он на-
чинается от какого-нибудь надреза, отверстия, дефекта поверх-
ности и т. п. Поверхность усталостного излома гладкая и мато-
вая, иногда на ней можно наблюдать линии, свидетельствующие
о том, что усталостное разрушение временами приостанавлива-
лось; поэтому их называют линиями разгрузки или отдыха.
Усталостное разрушение распространяется в металле в течение
определенного времени. Окончательное разрушение, или авария,
наступает только тогда, когда оставшееся здоровое сечение де-
тали становится слишком мало, чтобы выдержать рабочую
нагрузку.
Вёлер около 20 лет исследовал усталостную прочность ста-
ли и чугуна. В 1876 г. он опубликовал построенные им кривые,
описывающие зависимость между величиной нагрузки и количе-
ством циклов ее изменения до момента, когда наступает уста-
лостное разрушение. Для металлических материалов эти кривые
(сегодня их называют кривыми Вёлера) имеют характерный вид.
Если по вертикальной оси откладывать напряжение, т. е. величи-
ну (амплитуду) переменной нагрузки, а по горизонтальной
оси—число циклов нагрузки, после которого образец разру-
шается, то легко заметить, что при данной нагрузке материал
может выдержать только определенное число циклов. Крутизна
77
мог бы звучать не хуже тех, что
сделаны из лучшей колокольной
бронзы. В данном случае мы
с полным основанием можем
говорить о самолегировании
металла. Для закрепления дис-
локаций можно использовать
и атомы других (легирующих)
элементов. Такие инородные
атомы, занимая промежуточные
положения в пространственной
решетке, будут удерживать дис-
локации так же, как и атомы
свинца, выбитые нейтронами
с их обычных мест в собствен-
ной решетке.
Но пусть читатель не поду-
мает, что автор намерен реко-
мендовать в будущем отливать
колокола из свинца, обработан-
ного в реакторе. Этот пример
приведен просто как наглядная
иллюстрация того, насколько
сильно могут меняться свойства
металла при появлении в нем
очень малого количества другой
структурной составляющей—в
данном случае атомов того же
металла, но занимающих про-
межуточные положения в про-
странственной решетке.
Удлинение (деформация)
Испытание на разрыв позволяет
определить прочность металличе-
ского материала под статической
(т.е. очень медленно возрастающей)
растягивающей нагрузкой.
Кошачьи усы и прочность
кристалла
Кирпичная стена выглядит со-
лидно, прочно и по-своему кра-
сиво, если ее выложил опытный
и добросовестный каменщик.
Он аккуратно укладывает кир-
пич за кирпичом в правильные
ряды, каждый на свое место,
и никогда не допустит, чтобы
где-то ряд ушел в сторону хоть
на полкирпича. Примерно то же
происходит, когда из расплава
возникает и растет кристалл.
Атомы, его «кирпичи», должны
в строгом соответствии с «чер-
тежом» кристаллической решет-
ки занимать заранее опреде-
ленные места, целиком запол-
нять ряд за рядом, слой за
слоем—только таким образом
образуется правильный кри-
сталл. Но природа обычно допу-
скает «небрежность в работе»,
и идеальное строение кристалла
нарушается. Некоторые узлы
в решетке остаются не заняты-
ми—такие дефекты называют
вакансиями. В других участках
решетки атомы оказываются
в промежутках между ее узлами.
Этим так называемым атомам
внедрения приходится «локтя-
ми» расчищать себе место. Они
слегка раздвигают в стороны
соседей, нарушая при этом регу-
лярность кристаллической ре-
шетки.
Среди дефектов решетки, воз-
никающих при росте кристалла
из расплава, чаще всего встре-
чаются дислокации. В 1 см3
«нормального» монокристалла
общая длина линейных дислока-
ций достигает 100 км, и во мно-
гих участках кристаллическая
решетка очень сильно искажена.
Когда к кристаллу приложена
сила, некоторые дислокации на-
чинают двигаться, потому что
они свободны. Внешне такой
процесс проявляется в виде пла-
стической деформации. При
этом возникают новые сво-
бодные дислокации.
Если бы удалось приготовить
кристалл с минимальным коли-
Усталостное разрушение наступает,
когда превышен предел выносливо-'
сти материала. Этот вал подвергали
периодически меняющемуся круче-
нию (крутильные напряжения лежат
в плоскости, перпендикулярной про-
дольной оси вала). Для усталостно-
го излома характерно отсутствие
предшествующей отрыву пластиче-
ской деформации, а также линии
разгрузки и четко выделяющаяся
зона остаточного сечения, где бы-
стро наступает окончательный от-
рыв.
падения кривой постепенно уменьшается, и при некотором на-
пряжении последняя переходит в горизонтальную прямую. Это
означает, что при таких напряжениях материал не подвержен
усталости и может выдержать практически бесконечное число
циклов изменения нагрузки. Эта граничная величина напряже-
ния называется пределом выносливости материала. Чтобы
определить предел выносливости стали, требуется от 2 до
10 млн. циклов нагружения.
Насколько существенна эта характеристика для определе-
ния надежности и срока службы конструкций, работающих под
динамическими нагрузками, свидетельствует тот факт, что
в подавляющем большинстве случаев (свыше 90%) детали ма-
шин ломаются вследствие усталости материала. В последние
годы при усталостных испытаниях стали применяют нагрузки,
изменяющиеся не регулярно (синусоидально), а беспорядочно,
как это и происходит во многих реальных конструкциях. Таким
образом определяют так называемый эксплуатационный предел
выносливости.
Интересное, но практически еще мало используемое явление
представляет собой «тренировка» металлических материалов.
Образец или деталь подвергают переменной нагрузке в течение
примерно 20000 циклов, постепенно повышая напряжение до ве-
личин, близких к пределу выносливости. При этом усталостная
прочность металла повышается подобно тому, как растет вы-
носливость спортсмена в результате тренировок. Не менее инте-
ресен и эффект «отдыха». Установлено, что усталостная про-
чность металлических материалов зависит от продолжительно-
сти и частоты перерывов в нагружении: при одной и той же
величине нагрузки, но больших промежутках между ее воздей-
ствиями число циклов до разрушения может возрасти, словно
сталь «отдыхает» в перерывах.
Коррозия и защита от нее
Все в природе подчиняется строгим законам. Один из этих
законов, в частности, гласит, что из двух состояний с большей
вероятностью реализуется то, которое более устойчиво (ста-
бильно). Например, многие химические соединения, в том числе
окислы металлов, при нормальных термодинамических усло-
78
виях устойчивее, чем металлы. Поэтому в рудах большинство
металлов содержится не в чистом виде, а в форме химических
соединений. Особенно часто встречаются соединения металлов
с кислородом и серой. Важнейшие железные руды—красный
железняк (гематит) и магнитный железняк (магнетит)—состоят
из окислов железа. Боксит включает алюминий в виде окиси;
оловянная руда касситерит представляет собой соединение оло-
ва с кислородом. Приходится применять сложные и чрезвычай-
но энергоемкие металлургические процессы, чтобы извлечь ме-
таллы из химических соединений, в составе которых они
находятся в рудах. Но большую долю результатов этого труда
отнимает у людей злейший враг металлов—коррозия.
Коррозия—это разрушение металлических материалов под
воздействием окружающей среды. В процессе коррозии ме-
таллы снова переходят в состояние химических соединений, по-
добных тем, в которых они содержатся в рудах. Коррозия при-
чиняет огромный ущерб, и мы повседневно замечаем следы ее
опустошительного действия. Только потери стали из-за корро-
зии во всем мире оцениваются в 20 млрд. руб. в год. Помимо
этого коррозия причиняет огромный, не поддающийся учету
ущерб, связанный с выходом из строя корродирующих деталей
машин, оборудования и сооружений. И наконец, очень дорого
обходятся защита от коррозии и ее предупреждение.
Коррозия бывает самых разнообразных видов, но начинает-
ся она чаще всего на поверхности металлических изделий и по-
степенно проникает внутрь. Разные металлы корродируют не
одинаково: одни разрушаются очень быстро, другие оказы-
ваются более стойкими. Однако нет ни одного металла, который
обладал бы абсолютной коррозионной стойкостью. Можно го-
ворить лишь о стойкости при данных условиях окружающей
среды. Даже благородные металлы разрушаются в опреде-
ленных случаях: например, платина корродирует, если ее погру-
зить в «царскую водку». Самые стойкие благородные металлы
лишь очень короткое время способны сопротивляться воздей-
ствию этой смеси соляной и азотной кислот.
Коррозия может быть химической и электрохимической.
Если на металлический материал воздействуют только сухие
газы, то мы имеем дело с химической коррозией. Но более су-
щественна электрохимическая коррозия, которая возникает под
разрушающим воздействием водных растворов.
Сначала мы познакомимся с химической коррозией.
Каждый читатель, несомненно, замечал ее следы, например, на
серебряных предметах. Последние со временем темнеют, пото-
му что в воздухе содержатся газообразные соединения серы, ко-
торые вступают в химическую реакцию с серебром. Образую-
щийся при этом сульфид серебра остается на поверхности
изделий в виде коричневатой или черной пленки.
Другой пример химической коррозии—образование ока-
лины на железе при его нагревании в воздухе. Этот процесс ча-
сто можно наблюдать при ковке или прокатке металлов. Под
молотом или между валками темные слои окалины отпадают
от ярко-красной стали. Окалина состоит из окислов железа
и образуется в результате химической реакции горячего железа
с кислородом воздуха.
Пленки, возникающие на поверхности многих металлов
в газовой среде, чаще всего представляют собой слои окислов.
Некоторые металлы покрываются очень тонкой и плотной
пленкой, которая прочно связана с лежащим под ней металлом
чеством дефектов решетки, со-
всем без дислокаций, то он дол-
жен был бы обладать необыкно-
венной прочностью. И такие
кристаллы—вернее, кристалли-
ки диаметром около 0,1 мм
и длиной до нескольких милли-
метров—действительно научи-
лись выращивать. Ученые,
впервые получившие подобные
нитевидные кристаллы, назвали
их усами1 (причем кошачьими,
потому что английское слово
whisker означает усы у кошки
или тигра, а у человека—бакен-
барды).
Прочность железных усов
примерно в 100 раз выше, чем
массивного куска обычного же-
леза. Усы можно вырастить так-
же из графита, окиси алюминия,
карбида кремния. В наши дни
созданы композиционные мате-
риалы, упрочненные такими уса-
ми, которые по прочности на-
много превосходят все тради-
ционные материалы.
1 Это название принято и в отече-
ственной специальной литерату-
ре.—Прим, перев.
Изобретение проволочного
каната
Еще в древности люди приме-
няли канаты, сплетенные из ме-
таллической проволоки, но то,
что мы сегодня называем прово-
лочным канатом, или тросом,
появилось гораздо позднее.
В начале XVIII в. на рудниках
в Гарце возникли технические
трудности. Глубина шахт дости-
гла 400 м, и из-за возросшего ве-
са обычных железных цепей,
применяемых в подземном
устройстве, участились аварии.
Цепи испытывали слишком
большую нагрузку и рвались.
Эту проблему пытался решить,
но безуспешно, знаменитый ма-
тематик и философ Вильгельм
Лейбниц (1646—1716). Он про-
изводил опыты с цепями, су-
жающимися книзу, и с беско-
нечными (т. е. замкнутыми) це-
79
пями; собственный вес послед-
них можно отчасти компенсиро-
вать соответствующими проти-
вовесами. Старший горный со-
ветник Вильгельм Альберт
(1787—1846) наблюдал за пове-
дением бесконечной цепи в шах-
те глубиной 330 горных саженей
(около 630 м). После 20 недель
работы цепь неожиданно распа-
лась сразу на 30 кусков. Многие
звенья сломались по местам со-
членения, обнаруживая мелко-
зернистый излом, как у стали.
Оказалось, что любое звено
можно разбить не очень
сильным ударом молота (весом
4,5 кг) по его головке. Боковые
же участки звеньев полностью
сохранили прежние мягкость
и гибкость, которыми обладало
железо, тщательно отобранное
для изготовления цепи. И здесь
Альберт, юрист по образова-
нию, проявил незаурядную тех-
ническую интуицию. Он выска-
зал предположение, что изгиб
в сочленении, возникающий под
действием груза, оказывает на
материал такое же влияние, как
удары молота при холодной
ковке. В сжатых местах железо
упрочняется, становится твер-
дым, как пружинная сталь,
и хрупким. Сначала к предполо-
жению Альберта отнеслись
скептически, тогда он скон-
струировал испытательную
установку, провел на ней дли-
тельные опыты, и все сомнения
отпали.
Эксперименты с цепями не да-
ли утешительных результатов,
и Альберт пришел к заключе-
нию, что для подъемной ма-
шины необходима не цепьг а ка-
нат, который не разделяется на
звенья и не содержит сварных
соединений (каждое звено цепи
приходилось сваривать). Это по-
зволило бы полностью исполь-
зовать такое важное свойство
железа, как прочность на растя-
жение.
По предложению Альберта,
был изготовлен канат из трех
пучков по три проволоки диаме-
тром около 3,5 мм каждая. Этот
Выделение Растворение
Схема, иллюстрирующая процесс
электрохимической коррозии. На
одном полюсе растворяется (корро-
дирует) неблагородный металл, на
другом—выделяется водород.
и хорошо защищает его от дальнейшей коррозии. На других ме-
таллах пленка получается рыхАой или быстро отпадает, поэто-
му коррозионное разрушение распространяется в глубь мате-
риала.
На воздухе на поверхности алюминия очень быстро, бук-
вально через несколько секунд, образуется тонкий бесцветный
окисный слой. Если в каком-то месте такой слой поврежден, то
здесь сразу же возникает новый слой, который защищает ме-
талл от дальнейшего разрушения. Защитное действие естествен-
ного окисного слоя на алюминиевых материалах можно уси-
лить. Для этого разработаны различные способы, о которых мы
будем говорить в дальнейшем, рассматривая поверхностную
обработку металлов.
Гораздо чаще встречается и более опасна электрохимиче-
ская коррозия. Ее закономерности довольно хорошо изучены,
и тем не менее время от времени она преподносит неприятные
сюрпризы. В качестве примера приведем случай с одним амери-
канским мультимиллионером, пытавшимся предохранить кор-
пус своей роскошной яхты от коррозии в морской воде. Для об-
шивки корпуса яхты требовался особенно стойкий к коррозии
материал. Выбор пал на сплав никеля с медью, известный под
названием монель-металл. Этот сплав отличается чрезвычайно
высокой стойкостью во многих агрессивных средах, в том числе
и в морской воде. Однако произошло то, чего владелец яхты ни-
как не ожидал. Другие детали корпуса судна были изготовлены
из специальных нержавеющих сталей, т. е. материалов, содержа-
щих железо. Когда яхту спустили на воду, повсюду, где монель-
металл соприкасался со сталью, образовались сильные гальва-
нические элементы, возбудившие электрохимические процессы,
и сталь начала разрушаться настолько быстро, что судну так
и не пришлось отправиться в рейс.
Чтобы понять, как это случилось, придется вспомнить неко-
торые опыты по электрохимии. Если погрузить пластинку ме-
талла в электролит, т. е. в жидкость, проводящую электрический
ток, то металл может начать растворяться. Например, так рас-
творяется цинковая пластинка в разбавленной соляной кислоте.
Переходя в раствор, нейтральные атомы цинка оставляют в ме-
талле приходящиеся на их долю свободные электроны и превра-
щаются в положительно заряженные металлические ионы.
Оставшиеся лишние электроны собираются у поверхности ме-
талла, и она таким образом приобретает отрицательный элек-
трический заряд. В результате возникает электростатическое по-
ле, которое удерживает положительные ионы цинка вблизи
80
отрицательно заряженной металлической пластинки. Чем силь-
нее выражена склонность металла к образованию ионов, тем
выше электрический потенциал на границе металл—раствор.
Если вместо цинка в электролит поместить пластинку меди, то
в принципе процесс пойдет так же: атомы меди при переходе
в раствор будут превращаться в ионы, оставляя электроны в ме-
талле. Однако медь менее склонна к образованию ионов, поэто-
му возникший потенциал будет ниже. Если же одновременно по-
грузить в разбавленную соляную кислоту пластинки цинка
и меди, соединив их снаружи металлическим проводом, то по
нему потечет электрический ток. В цинковой пластинке суще-
ствует избыток электронов, которые по проводу переходят
в медь; там они соединяются с ионами водорода из электроли-
та, образуя нейтральные атомы водорода, и на поверхности
медной пластинки выделяются пузырьки водорода. Но на этом
процесс не заканчивается: в раствор переходят новые атомы
цинка, и новые свободные электроны перетекают по проводу
в медную пластинку. Процесс прекращается лишь тогда, когда
цинковая пластинка целиком растворяется. В качестве электро-
лита можно взять не кислоту, а раствор медной соли, например
водный раствор хлористой меди. Тогда цинк будет вытеснять из
раствора медь и затем станет осаждаться на медной пластинке.
В гальваническом элементе, состоящем из цинковой и медной
пластинок, первая играет роль анода, а вторая—катода.
канат использовали в подъем-
ной машине (с блоком диаме-
тром около 5 м) на той же шах-
те, и после 5000 циклов подъема
на нем не было обнаружено ни-
каких дефектов. Дальнейшие ис-
пытания прошли так же успеш-
но. С того времени проволочные
канаты стали применять для
шахтных подъемников во всем
мире. Помимо изобретения про-
волочного каната, заслуга Аль-
берта состоит и в том, что он од-
ним из первых провел уста-
лостные испытания и на практи-
ке i использовал их результаты.
Методы катодной защиты от коррозии: с «жертвенным» анодом-протектором
(а); с вспомогательным анодом и внешним источником тока (б).
Металл приносят в жертву
Даже прославленным ученым
порой приходилось спотыкаться
о непредвиденные мелочи, когда
они хотели реализовать на прак-
тике свои опробованные в лабо-
ратории идеи. Это случилось и
с Хэмфри Дэви (1778—1829), вы-
дающимся химиком и президен-
том Лондонского королевского
общества—старейшей в мире
академии наук.
Путем лабораторных экспе-
риментов Дэви установил, что
медь можно защитить от корро-
зии в соленой воде при помощи
железа или цинка. Соленая вода
сначала разрушает «менее бла-
городные» металлы—железо
и цинк—и не затрагивает медь,
пока остается хоть немного ка-
ких-то других металлов. Ан-
глийский ученый был не только
блестящим экспериментатором
и гениальным теоретиком.
Каждый вновь открытый на-
учный факт он стремился сразу
же внедрить в практику. Так и
в данном случае он рекомендо-
вал Британскому адмиралтей-
ству для защиты медной обшив-
ки кораблей ниже ватерлинии
прикреплять к корпусу «жер-
твенные» железные листы (в на-
ше время их называют протек-
торами); это и было сделано
в 1824 г. Действительно, корро-
зия меди заметно уменьшилась,
но началось нечто такое, о чем
6-430
81
Дэви не мог даже и предпола-
гать, производя свои лабора-
торные опыты, и что буквально
свело на нет практическую поль-
зу от его предложения. В отсут-
ствие железа морская вода всту-
пала в реакцию с медной обшив-
кой, и у поверхности корпуса
судна создавалась большая кон-
центрация медных ионов. Они
уничтожали морские орга-
низмы, тем самым препятствуя
обрастанию подводной части
корпуса. При наличии железной
обшивки образование медных
ионов почти прекратилось,
и корпус так сильно обрастал
морскими организмами, что ко-
рабли быстро теряли скорость.
По этой причине адмиралтей-
ство отказалось от предложения
Дэви. Много позже, когда кор-
пуса судов начали делать не из
дерева с медной обшивкой, а из
стальных листов, судостроители
снова обратились к идее Дэви,
и на всех кораблях адмиралтей-
ства были установлены для
местной защиты стали «жер-
твенные» аноды в виде цин-
ковых пластин. При этом умень-
шалась коррозионная опасность
и для судовых винтов, изгото-
вленных из латуни.
Коррозионная защита одного
металла при помощи «жертвен-
ного» анода-протектора из дру-
гого металла возможна только
в том случае, если второй ме-
талл стоит впереди первого
в ряду напряжений (т.е. обла-
дает более отрицательным элек-
тродным потенциалом). Напри-
мер, медь можно защитить же-
лезом, а железо—цинком. Сле-
дующий шаг в развитии элек-
трохимической защиты был сде-
лан, когда для этой цели стали
использовать электрический ток
от внешнего источника постоян-
ного тока. К положительному
полюсу источника подключали
вспомогательный анод, изгото-
вленный из железа или графита,
а к отрицательному—защищае-
мую деталь или конструкцию.
Такую катодную защиту с ис-
пользованием внешнего источ-
Чтобы систематизировать различные металлы и сплавы по
их склонности к растворению в электролите и образованию ио-
нов, специалисты измерили их нормальный электродный потен-
циал (он определяется по отношению к водороду) и на основа-
нии этой характеристики составили так называемый электрохи-
мический ряд напряжений. Наиболее электрически отрица-
тельные, т. е. наиболее склонные к реакции, металлы занимают
в этом ряду первые места (табл. 2). К сожалению, нормальные
электродные потенциалы дают возможность лишь ориентиро-
вочно оценить, но не позволяют точно и однозначно предска-
зать для любых условий, какой из металлов в данной комбина-
ции окажется анодом и, следовательно, будет растворяться.
Решающую роль здесь играет коррозионная среда, поэтому
в каждом конкретном случае требуется тщательная проверка.
Электрохимическая коррозия может возникать даже в одном
куске металлического материала, если он состоит из различных
структурных составляющих. На поверхности металла в этом
случае образуются многочисленные локальные гальванические
элементы, а электролитом служит влага, которая остается на
поверхности от дождя, росы, тумана или конденсации водяного
пара.
Очень способствуют коррозии температурные колебания,
поскольку они усиливают конденсацию влаги из воздуха. В тро-
пических и субтропических странах с их неблагоприятными—
во всяком случае, для металлов—климатическими условиями
(высокая влажность воздуха, большие перепады между дневны-
ми и ночными температурами) опасность коррозии особенно
велика1.
Благоприятствует коррозии и загрязнение атмосферы раз-
личными газами и пылью, что характерно для промышленных
1 Именно усиленной защитой от коррозии и отличаются машины, при-
боры и другие изделия в так называемом тропическом исполнении.—Прим,
перев.
Таблица 2
Электрохимический ряд напряжений металлов
Металл Электродная реакция Нормальный потенциал при 2S°C
Литий Li — Li+ + е~ -3,05
Магний Mg — Mg2+ + 2е~ —2,37
Алюминий Al - Al3+ + Зе" -1,66
Титан Ti - Ti2+ + 2е“ -1,63
Цинк Zn - Zn2+ + 2e“ -0,763
Хром Сг - CP+ + 3e~ -0,74
Железо Fe — Fe2+ + 2e~ -0,440
Кадмий Cd —Cd2+ + 2e“ -0,403
Никель Ni — Ni2+ + 2e~ -0,250
Молибден Mo — Mo3+ + 3e“ -0,2
Олово Sn — Sn2+ +2e“ -0,136
Свинец Pb - Pb3+ + 3e“ -0,126
Водород H-H+ +e" -0,000
Медь Cu-Cu2+ +2e" -0,337
Серебро Ag - Ag+ + e~ -0,800
Платина Pt - Pt2+ + 2e“ ~ -1,2
Золото Au - Au3* + 3e~ -1,50
82
Таблица 3
Физические свойства технически важных металлов
Mei алл Химический символ Точка плавления. °C Точка кипения при нормальном давлении, °C Плотность, г/см* Удельная теплоемкость, Дж/г°С Удельная теплота плавления. Лж/i Электропровод- ность, м/Оммм1 Модуль упругости, Н'ММ2 »
1 2 3 4 5 6 7 8 9
Алюминий А1 660 2060 2,7 0,900 388,1 37,6 70830
Бериллий Be 1280 2770 1,82 2,177 1088,6 16,9 287200
Ванадий V 1735 3400 6,0 0,502 - 3,84 147000
Висмут Bi 271,3 1420 9,80 0,142 51,9 0,94 34000
Вольфрам W 3410 5930 19,3 0,134 184,2 . 18,2 407400
Галлий Ga 29,8 2070 5,91 0,330 80,4 1,87 9800
Железо Fe 1541 2740 7,87 0,461 272,1 10,3 211400
Золото Au 1063 2970 19,32 0,130 64,9 45,7 77500
Иридий Ir 2454 5300 22,42 0,130 117,2 18,9 528000
Кадмий Cd 321 765 ' 3,65 0,230 56,9 14,6 62300
Кобальт Co 1495 2900 8,9 0,414 266,3 16,1 208000
Литий Li 186 1370 0,53 3,302 414,5 11,8 11700
Магний Mg 650 1110 1,74 1,047 344,2 22,2 44300
Марганец Mn 1245 2150 7,43 0,481 244,1 0,54 197 800
Медь Cu 1083 2600 8,96 0,385 204,3 60,1 122600
Молибден Mo 2625 4800 10,2 0,255 293,1 19,4 559000
Мышьяк As 814 610 5,73 0,343 - 2,86 -
Натрий Na 97,7 892 0,97 1,235 114,7 23,8 8900
Никель Ni 1455 2730 8,90 . 0,440 301,9 14,6 193300
Олово Sn 231,9 2270 7,3 0,226 59,5 0,16 54000
Осмий Os 2700 5500 22,48 0,130 146,5 10,4 559000
Палладий Pd 1554 4000 12,0 0,243 143,2 9,26 121250
Платина Pt 1773,3 4410 21,45 0,134 113,0 10,2 177000
Рений Re 3170 - 20,5 0,138 - 5,05 520000
Ртуть Hg -38,86 357 13,55 0,138 11,7 1,06 -
Рутений Ru 2370 4150 12,43 0,241 217,7 22,2 380000
Свинец Pb 327,4 1740 11,34 0,130 23,9 4,82 15700
Серебро Ag 960,5 2210 10,49 0,239 104,3 63,0 80000
Сурьма Sb 630,5 1440 6,62 0,205 163,3 5,4 55900
Тантал Ta 3030 4100 16,65 0,151 - 8,1 185000
Титан Ti 1730 - 4,54 0,528 41,9 1,25 118000
Хром Cr 1890 2500 7,19 0,461 190,9 6,7 186400
Цинк Zn 419,5 906 7,14 0,383 111,4 16,9 92200
Цирконий Zr 2350 2900 6,5 0,276 - 2,44 68400
ника тока впервые применили
для подземных сооружений при-
мерно в 1910 г., и с тех пор она
получила широкое распростра-
нение.
Сегодня методы катодной за-
щиты от коррозии с использова-
нием внешнего источника тока
или без него принадлежат к чис-
лу важнейших средств, позво-
ляющих продлить срок службы
судов, портового и шлюзового
оборудования, а также проло-
женных в земле кабелей и трубо-
проводов. В качестве примера
можно сказать, что катодная за-
щита оберегает от коррозии
стальные шпунтовые стенки
морского порта в Ростоке
(ГДР).
Коррозионному растрескиванию
под напряжением подвержены мно-
гие металлические материалы. На
фотографии ( х 300) показана кор-
розия поврежденной трубы из лату-
ни (Си + 30%Zn + 1% Al + l%Sn).
Трещины проходят преимуществен-
но по границам зерен (межкристал-
литная коррозия). Но нередко мож-
но наблюдать и трещины по телу
зерен (транскристаллитная корро-
зия).
районов. Главную опасность для металлов (как, впрочем, и для
всего живого) представляют газообразные соединения серы. По-
этому очень важно—в том числе и в целях защиты от корро-
зии—максимально обезвреживать промышленные газовыделе-
ния и поддерживать чистоту воздушного бассейна.
Пока коррозия протекает равномерно, ее последствия за-
метны и поддаются контролю, но она становится очень опас-
ной, когда сосредоточивается в отдельных участках конструк-
ции или детали; особенно страшна сквозная локальная
коррозия. Как показывает само название, речь здесь идет
о местном разрушении, которое обычно начинается в различных
отверстиях и прорезях. Очень часто сквозная коррозия наблю-
дается в растворах, содержащих хлориды.
Не менее опасную форму коррозии представляет коррозион-
ное растрескивание под напряжением (т. е. под механической на-
грузкой). При этом на поверхности детали возникает множество
мелких трещин, которые распространяются в глубь материала
через тело металлических зерен или реже по их границам. Пред-
посылками для такого разрушения являются, во-первых, склон-
ность материала к коррозионному растрескиванию под напря-
жением, во-вторых, благоприятствующая этому виду коррозии
среда и, в-третьих, растягивающие напряжения в поверхностных
слоях детали. Коррозии под напряжением подвержены многие
металлические материалы, в том числе медные сплавы, находя-
щиеся в аммиачных растворах, высоколегированные стали—в
растворах хлористых солей, алюминиевые сплавы—в морской
воде.
Межкристаллитная коррозия разрывает связь между от-
дельными зернами металла; таким образом разрушаются неко-
торые высоколегированные стали, которые находятся в небла-
гоприятном структурном состоянии обработки, например
хромоникелевые стали аустенитного класса, содержащие боль-
шое количество обоих элементов. Структура таких сталей
в коррозионно-стойком состоянии характеризуется наличием
зерен только одного типа. При нагреве по границам зерен выде-
ляются мельчайшие частицы карбидов хрома. Поэтому вблизи
границ зерна оказываются бедны хромом и легко поддаются
коррозии в агрессивной среде. В результате связь между зерна-
ми нарушается и наступает отрыв отдельных зерен, что в конце
концов приводит к разрушению всей детали.
Как уже говорилось, коррозия имеет разные формы и пред-
ставляет собой наибольшую опасность для металлических изде-
лий. Чтобы ее предотвратить или хотя бы ограничить, требуют-
ся значительные затраты.
Простейшим средством защиты от коррозии служат лако-
красочные покрытия. Они защищают поверхность металличе-
ских изделий от непосредственного контакта с окружающей сре-
дой и другими металлами. Главный недостаток такого способа
заключается в том, что слой краски постепенно нарушается,
и его требуется восстанавливать. Крупные сооружения из ме-
талла, находящиеся под открытым небом, такие как мосты, не-
обходимо периодически очищать от ржавчины и снова красить
при помощи кисти или пульверизатора. Помимо окраски суще-
ствуют и другие способы антикоррозионной обработки поверх-
ности. Например, деталь погружают в металлический расплав
и тем самым создают на ее поверхности защитный слой другого
металла. Таким образом на стальную деталь наносят слой цин-
ка или получают стойкую к определенным видам коррозии бе-
84
дую жесть, обрабатывая стальной лист расплавленным оловом.
Металлические защитные слои можно также наносить метода-
ми плакирования, металлизации либо путем осаждения защит-
ного металла из его паров. При плакировании лист основного
металла с одной или с обеих сторон покрывают тонкими слоя-
ми другого металла и подвергают горячей прокатке1. При ме-
таллизации расплавленный защитный металл наносят на по-
верхность изделия при помощи пульверизатора. Все эти
способы широко применяются, в первую очередь для защиты от
коррозии.
Очень широкие и разнообразные возможности нанесения ме-
таллических покрытий дает гальванотехника. Мало кто из нас
сразу может заметить на металлическом предмете защитный
слой, если он нанесен гальваническим способом. Так, на сто-
ловых приборах можно встретить выбитую цифру 90. Она озна-
чает, что серебряное покрытие в этом случае нанесено гальвани-
ческим способом, и на дюжину ложек или вилок пошло 90 г
серебра. Гальваническое покрытие имеют бампер, декора-
тивные накладки кузова и другие детали легкового автомобиля.
Здесь речь, как правило, идет о комбинированных слоях, напри-
мер из меди, никеля и хрома. Это только два частных примера
гальванических покрытий, которые применяются очень широко
и обладают многими достоинствами; почти все металлы хоро-
шо воспринимают такую поверхностную защиту. Гальваниче-
ским способом наносятся и легированные слои: скажем, можно
получить слой латуни, одновременно осаждая на изделие медь
и цинк.
Принцип гальванического процесса понять нетрудно. Для
никелирования стального изделия его помещают в ванну с рас-
твором никелевой соли, например сернокислого никеля, и вклю-
чают в электрическую цепь как катод. Анодом служит никелевая
пластина приблизительно такой же площади, как и само сталь-
ное изделие. Оба электрода подключают к источнику постоян-
ного тока, предположим к аккумулятору с напряжением на
клеммах 6 В. При протекании тока положительные ионы никеля
движутся к отрицательному полюсу, т.е. стальному изделию,
получают на его поверхности недостающие электроны и оса-
ждаются уже в виде нейтральных атомов. Одновременно на ка-
тоде новые атомы никеля превращаются в ионы и переходят
в раствор. Чтобы гальваническое покрытие имело нужные свой-
ства и процесс был экономичен, его необходимо контролиро-
вать и строго соблюдать установленный для конкретных усло-
вий оптимальный режим.
К гальваническим процессам относится, в частности, и метод
анодного окисления алюминия; он позволяет усилить есте-
ственный слой окисла, который образуется на алюминиевых ма-
териалах на воздухе; путем электролитического оксидирования
можно получить очень твердые и износостойкие, а также окра-
шенные слои. Алюминиевое изделие, подлежащее такой обра-
ботке, включают в цепь как анод. Защитный слой на нем обра-
зуется не путем отложения другого металла, как при
гальваническом никелировании, а непосредственно в результате
окисления самого алюминия и растет в глубь металла. Обычно
толщина такого слоя составляет несколько сотых долей милли-
метра, а на чистом алюминии может быть и больше.
1 Весьма эффективным оказался способ плакирования листами путем свар-
ки взрывами. При таком способе не требуется нагрева деталей и специаль-
ного прокатного оборудования.—Прим. ред.
Источнин
постоянного тона
соли
серебра
Схема процесса гальванического се-
ребрения. Под действием электриче-
ского тока ионы серебра движутся
к обрабатываемому изделию, вклю-
ченному как катод, и осаждаются на
нем. При правильно выбранном ре-
жиме образуется плотный и прочно
связанный слой серебра.
Об античной
гальванотехнике
По общепринятому мнению,
гальванотехника вошла в про-
мышленную практику в первой
трети XIX в. Однако есть осно-
вания полагать, что парфянские
ювелиры уже две тысячи лет на-
зад использовали гальваниче-
ские батареи для получения ме-
таллических покрытий. В пользу
такого предположения может
свидетельствовать найденная
глиняная чаша тбго времени
(ориентировочно—III в. до
85
н.э.), в которой находится ци-
линдр из листовой меди. Дно
цилиндра размером 100 мм
представляет собой круглую
медную пластину, а верх его за-
крыт асфальтовой пробкой. Че-
рез центр пробки внутрь цилин-
дра пропущен железный стер-
жень толщиной 10 мм. Кроме
того, обнаружены остатки же-
лезных и медных стержней—
возможно, это проводники или
запасные части.
Подобные предметы, но более
позднего происхождения нашла
археологическая экспедиция
в районе поселения Ктесифон на
Тигре, в 45 км к юго-востоку от
Багдада. Специалисты Багдад-
ского государственного музея
допускают возможность, что
парфяне, еще не зная электриче-
ства, производили гальваниче-
ское золочение и серебрение из-
делий. Об этом же говорят
и находки, сделанные в гробни-
цах египетских фараонов. Неко-
торые позолоченные изделия,
по-видимому, были изгото-
влены не путем огневого золоче-
ния, как считалось до сего време-
ни, а гальваническим способом.
Точно так же ничто не опровер-
гает предположения, что в Древ-
нем Египте был известен гальва-
нический способ получения
медных покрытий из водных
растворов. Многие деревянные
и глиняные предметы, най-
денные в Мемфисе и Фивах, по-
крыты тонким слоем меди. В та-
ком случае до гальванопластики
оставался всего только шаг.
И действительно, в Египте обна-
ружены статуи в натуральную
величину из тонкой меди. Труд-
но представить, каким еще спо-
собом, если не электролитиче-
ским, они были изготовлены.
К сожалению, до сих пор не
удалось найти никаких пись-
менных упоминаний о суще-
ствовавших в древности техно-
логических методах, так что
наше предположение остается
не более чем гипотезой, хотя
и чрезвычайно интересной.
Чтобы нанести гальваническое покрытие на мелкие детали, их закрепляют
в рамке.
Железо и сталь
Без преувеличения можно утверждать, что научно-технический прогресс был
бы невозможен без железа и стали. С этими металлами мы встречаемся всюду.
Стальные мосты переброшены через реки, тысячи и тысячи километров же-
лезных дорог соединяют между собой города и страны, по стальным трубопро-
водам текут нефть и газ, стальные балки служат несущим каркасом для завод-
ских цехов и крытых стадионов, высотных зданий и телевизионных вышек,
преимущественно из стали сделаны корабли, машины, вагоны и инструменты.
Одно только перечисление всех изделий и сооружений, изготовляемых из стали
и железа, заняло бы целые тома. Потребность человечества в железе и стали рас-
тет очень быстро. Если в 1800 г. мировое производство стали лишь немного
превышало 100000 т, то в 1900 г. оно составило около 7 млн. т (сегодня почти
столько же стали производится за год в одной только ГДР), а в 1960 г. достигло
четверти миллиарда тонн. Спустя 10 лет мировая черная металлургия перешаг-
нула через полумиллиардный рубеж, и, как полагают эксперты, до 1985 г. годо-
вое производство стали в мире увеличится до миллиарда тонн.
Чем же обусловлено господствующее положение железа в технике? Несом-
ненно, важной предпосылкой явилось наличие большого числа пригодных для
промышленной разработки месторождений железных руд. Но не только этим
объясняется большое значение черных металлов. Еще более существенная при-
чина заключается в том, что железо, как ни один другой металл, способно изме-
нять свои технические характеристики в результате легирования и специальной
обработки. В зависимости от рода и количества легирующих элементов метал-
лурги получают металлические материалы с самыми различными свойствами.
Сегодня в технике применяется более 12000 железных сплавов, главным обра-
зом сталей. Теоретически это число можно было бы значительно увеличить, од-
нако не все возможные железные сплавы обладают такими свойствами, которые
позволяют использовать их в качестве технических материалов. Для практиче-
ского применения железные сплавы отбирают в соответствии с техническими
и экономическими требованиями, руководствуясь при этом следующим ос-
новным правилом: материал должен быть хорош настолько, насколько это не-
обходимо для данного конкретного применения, а не насколько это вообще до-
стижимо. В этом состоит общий принцип рационального производства
и применения технических материалов.
Свойства металлического материала, например его прочность, твердость
или коррозионная стойкость, меняются в широких пределах в зависимости от
легирования и способов обработки. Влияние термической обработки особенно
наглядно проявляется в твердости стали. Лучшие инструментальные стали в не-
закаленном состоянии обычно слишком мягки и мало пригодны для работы. Ре-
87
Так может выглядеть ценная желез-
ная руда гематит (красный железняк
Fe2O3), который в такой форме на-
зывают также «красная стеклянная
голова». Он напоминает скорее ка-
кой-то внутренний орган тела, неже-
ли минерал.
Визитные карточки
сталей
Если по роду деятельности вам
приходится часто разъезжать
и знакомиться с многими людь-
ми, то при этом очень удобны
визитные карточки. На них ука-
заны фамилия, звание, долж-
ность, место работы, адрес и но-
мер телефона. Подобную функ-
цию выполняют и обозначения
различных сталей. Если вы смо-
жущий инструмент из такой стали быстро изнашивается да и ре-
жет плохо. Если же раскаленную сталь охладить в воде, то она
закаливается, приобретает высокую твердость и из нее полу-
чается отличный режущий инструмент. При различных состоя-
ниях обработки—мягком и закаленном—сталь ведет себя как
два совершенно разных материала.
Итак, железо и промышленные материалы на его основе (т. е.
чугуны и стали) способны к превращениям, в результате ко-
торых их свойства резко меняются. В чем же заключаются эти
превращения и каковы их причины?
Чистое железо представляет собой серебристо-серый, бле-
стящий похожий на платину металл плотностью 7,87 г/см . Оно
плавится при 1541° С и, следовательно, принадлежит к металлам
с высокой температурой плавления. Кристаллы железа по-
строены из элементарных ячеек с кубической объемно-центри-
рованной решеткой. Если железо нагревать, то его структура су-
щественно изменяется. При температуре 911° С меняется его
пространственная решетка: атомы перестраиваются таким об-
разом, что элементарные ячейки приобретают кубическую гра-
нецентрированную структуру. Но и это состояние не сохраня-
ется до точки плавления: при 1401° С атомы снова пе-
рестраиваются в кубическую объемно-центрированную ре-
шетку. При медленном охлаждении железа от темпера-
туры плавления такая двукратная перестройка структуры
протекает в обратном порядке. Из расплавленного железа рас-
тут кристаллы с кубической объемно-центрированной решет-
кой, сохраняющейся до 1398° С. Ниже этой температуры ре-
шетка превращается в кубическую гранецентрированную, ко-
88
торая остается стабильной до 898° С. При дальнейшем охла-
ждении вновь образуется кубическая объемно-центрированная
решетка. Различные формы существования железа (так назы-
ваемые аллотропические модификации) обозначают как а-, 7-
и 5-железо. Читатель может спросить, почему здесь пропущена
буква р. Действительно, прежде ее употребляли для обозначения
немагнитного (вернее, парамагнитного) a-железа, существующе-
го в температурном интервале 769—911° С. В нормальных усло-
виях железо ферромагнитно: каждый знает, что железный маг-
нит притягивает мелкие предметы. Но если железо нагревать, то
начиная с температуры 769° С оно теряет ферромагнитные свой-
ства. Эта температура названа точкой Кюри в честь выдающе-
гося французского физика Пьера Кюри (1859—1906). Однако по-
теря ферромагнитных свойств не связана с изменением
кристаллической решетки, поэтому от использования буквы
р для обозначения железа отказались.
Изменение пространственной решетки в зависимости от тем-
пературы можно наблюдать не только у железа, но и у иных ме-
таллов, например у титана. Однако ни у какого другого металла
легирование и термическая обработка не вызывают таких зна-
чительных изменений структуры и свойств, как у железа.
Из железа и углерода
Чистое железо мягко, прочность его невелика, но когда
в нем присутствуют легирующие элементы, оно становится
тверже и прочнее. Из железа получают сталь, добавляя к нему
углерод. Этот неметалл буквально творит с железом чудеса.
Самые большие мосты через реки, ущелья, проливы сооружены
из обыкновенной конструкционной стали, которая своей проч-
ностью обязана углероду, содержащемуся в ней в количестве
всего 0,2% (по весу). С увеличением содержания углерода проч-
ность стали возрастает, и она приобретает способность к закал-
ке. Но чем прочнее и тверже сталь, тем меньше ее вязкость
и пластичность. Инструментальные стали, от которых требуют-
ся прежде всего твердость и закаливаемость, содержат 0,4—1,5%
углерода, а иногда и больше. У сталей, особенно стойких к изно-
су, содержание углерода достигает верхнего предела—около
2%.
Если в стали, кроме углерода, нет других легирующих эле-
ментов, то ее называют нелегированной или углеродистой.
Правда, в такой стали тоже содержатся другие металлические
и неметаллические элементы: марганец, кремний, фосфор, сера,
хром, никель, медь, азот, кислород или водород, но они не вве-
дены в нее специально, а попали из исходных веществ (железной
руды, лома, топлива) как неизбежные примеси либо в процессе
выплавки. Тонкими аналитическими методами можно обнару-
жить в нелегированной стали многие элементы периодической
системы, но решающую роль в превращении железа в сталь
играет именно углерод.
С чем сравнить столь сильное влияние углерода? Два про-
милле (т. е. 0,2%) алкоголя в крови человека настолько меняют
его поведение и реакции по сравнению с трезвым состоянием,
что он кажется совсем другим человеком. Аналогично, два про-
милле углерода в железе превращают последнее в конструк-
ционную сталь, т. е. материал с существенно иными свойствами.
Правда, на этом и кончается аналогия между содержанием ал-
жете расшифровать это обозна-
чение, то содержащаяся в нем
информация позволит вам сразу
же установить, с какой сталью
вы имеете дело. Правда, в раз-
ных странах и фирмах исполь-
зуют различные системы обо-
значений для выпускаемых там
марок сталей, и даже специали-
сту не всегда удается ра-
зобраться в этих междуна-
родных «джунглях».
В СССР, а также в ГДР, ФРГ
и некоторых других странах
приняты буквенно-цифровые
системы обозначения сталей:
каждый элемент обозначается
своим соответствующим бук-
венным символом, а цифры
указывают его содержание
в процентах либо в десятых или
сотых долях процента. Особы-
ми буквами обозначаются стали
специального назначения: ин-
струментальные, подшипни-
ковые, автоматные (т.е. пред-
назначенные для обработки на
станках-автоматах) и т. п. По со-
ветским стандартам углерод—
общий легирующий элемент
почти для всех сталей—не
имеет своего буквенного симво-
ла, а цифры, указывающие его
содержание, стоят в обозначе-
нии на первом месте. Например,
широко распространенная угле-
родистая сталь (т. е. не содержа-
щая других, специально доба-
вленных легирующих элемен-
тов) с 0,45% углерода имеет
обозначение Ст 45; низколеги-
рованная конструкционная
сталь, содержащая 0,30% угле-
рода и приблизительно по 1%
хрома (X), марганца (Г) и крем-
ния (С), обозначается ЗОХГС;
высоколегированная нержавею-
щая сталь, которая содержит
около 0,2% углерода, 18% хрома
и 9% никеля, обозначается
2Х18Н9 и т.д.
В настоящее время разра-
батывается единая система обо-
значения марок сталей для
стран—членов СЭВ.
89
коголя в крови человека и содержанием углерода в железе: причины, механизмы
действия и результаты здесь совершенно различны.
Углерод может проникать в железо двумя способами. Так, атомы углерода
могут занимать в пространственной решетке свободное место между атомами
(ионами) железа (по размеру атом углерода приблизительно в два раза меньше
атома железа). Однако при комнатной температуре в пространственной решетке
железа таким способом может поместиться всего лишь 0,0001% углерода.
Остальным атомам углерода приходится находить другие пути для внедрения
в железо, и они находят их, вступая с железом в химическую связь. При этом
образуется карбид железа Fe3C, состоящий из трех атомов железа и одного ато-
ма углерода. Поэтому структура углеродистой (т. е. нелегированной) стали пред-
ставляет собой смесь зерен железа и карбида железа. От количества и формы
карбидных зерен, а также от их распределения в структуре в решающей степени
зависят прочность, твердость и вязкость стали. Металлографы называют зерна
железа ферритом, а зерна карбида железа—цементитом.
Структура, образующаяся при некоторых особых взаимных расположениях
и соотношениях феррита и цементита, получила название «перлит» (букваль-
но—подобный жемчугу). Если сталь содержит много перлита, то пригото-
вленные из нее металлографические шлифы при косом освещении обладают ха-
рактерным перламутровым блеском. Сплав железо—углерод, содержащий
0,80% углерода, целиком состоит из перлита. Строение перлита можно предста-
вить таким образом: в мягкой основной массе феррита очень близко, параллель-
но друг другу «уложены» мельчайшие твердые пластинки цементита. Слоистое
. строение зерна перлита можно наблюдать в его поперечном разрезе. Если сплав
железо—углерод содержит меньше 0,8% углерода, то его структура складывает-
Металлические предметы очень большого сечения без особого труда поддаются газовой резке. Как
только железо начинает гореть, выделяется достаточно тепла, чтобы поддерживать процесс резки.
Сильная струя кислорода выдувает из реза продукты сгорания в виде шлака.
90
ся из зерен феррита и перлита, причем доля последних тем боль-
ше, чем ближе содержание углерода к 0,80%. Если же в сплаве
содержится 0,80—2,06% углерода, то структура такого сплава
состоит из перлита и цементита. Еще большее содержание угле-
рода имеют чугуны; в них помимо перлита и цементита присут-
ствует еще одна структурная составляющая—ледебурит (назва-
на в честь профессора металловедения Фрейбергской академии
Альфреда Ледебура (1837—1906)), представляющая собой эв-
тектику. В заэвтектических чугунах (т. е. содержащих свыше 4,3%
углерода) кроме ледебурита присутствует также карбид железа,
который образуется непосредственно из расплава, и поэтому его
называют первичным цементитом в отличие от вторичного це-
ментита, который при охлаждении выделяется из твердого рас-
твора углерода в железе.
Диаграмма состояния железо—углерод столь же необходи-
ма металловеду, как карта географу. При содержании углерода,
не превышающем 6,67% (эта предельная величина соответствует
100% цементита), такая диаграмма позволяет судить обо всех
структурных состояниях сплавов, которые возможны в зависи-
мости от температуры при условии сохранения термодинамиче-
ского равновесия. Подобно государственным границам на поли-
тической карте, линии на диаграмме железо—углерод разде-
ляют области существования различных фаз. Например,
ломаная линия ABCD на диаграмме состояния железо—угле-
род ограничивает снизу область, где существует только жидкий
расплав. Ломаная линия GOSEING служит границей области,
в которой в виде твердого у-раствора существует железо с куби-
ческой гранецентрированной решеткой. Диаграмма дает спе-
циалисту много важной информации о поведении сплавов желе-
зо—углерод при нагреве и охлаждении. Она совершенно
необходима для понимания процессов термической обработки.
Сегодня металлурги имеют в своем распоряжении более
сложные диаграммы, которые позволяют судить о превраще-
ниях в легированной стали и устанавливать наилучшие режимы
термической обработки. Но начало всему было положено диа-
граммой состояния железо—углерод. Именно она служит осно-
вой и исходной точкой современного развития теории и техно-
логии железных материалов. Начиная с конца прошлого века
ученые и инженеры, теоретики и практики достигли больших ус-
пехов в разработке новых сталей и чугунов. Заслуги уже упо-
минавшегося Альфреда Ледебура и англичанина У. Робертса-
Остена (в старой русской и немецкой транскрипции—Аустен)
отмечены тем, что их именами названы структурные составляю-
щие в сплавах железо—углерод. Это ледебурит (эвтектика желе-
за с углеродом, выделяющаяся из жидкого сплава) и аустенит
(твердый у-раствор углерода в железе с кубической гранецентри-
рованной решеткой). Подобной чести вполне заслужили и мно-
гие другие исследователи, но на их долю не хватило струк-
турных составляющих в сплаве.
Заканчивая описание диаграммы железо—углерод, следует
отметить, что ее часто изображают двумя типами линий, при-
чем пунктирные линии отражают поведение так называемой
стабильной системы железо—графит, а сплошные—поведение
метастабильной системы железо—цементит. Для сталей прак-
тическое значение имеет только вторая система.
Когда железо горит
В рождественскую ночь 1901 г.
было совершено нападение на
земельный банк в Ганновере.
Попытка ограбления не удалась,
и о ней не стоило бы и вспо-
минать, если бы не одно обстоя-
тельство: здесь впервые для
вскрытия сейфа преступники
воспользовались «газовым реза-
ком»—автогенной горелкой.
Принцип такого способа резки
несложен: сталь на узком участ-
ке нагревается в ацетилено-кис-
лородном пламени до очень вы-
сокой температуры и сгорает
в дополнительной струе кисло-
рода. Температура воспламене-
ния железа в кислороде лежит
ниже его точки плавления, т.е.
железо горит, находясь еще
в твердом состоянии. При этом
выделяется так много тепла, что
дальше, пока поступает кисло-
род, процесс идет самопрои-
звольно (по-гречески—аутоген-
но). Образующиеся жидкие
окислы выдуваются из разреза
струей кислорода. Взломщики
в Ганновере (так и оставшиеся
неизвестными) потерпели неуда-
чу, потому что оказались «тех-
нически неграмотными». Не
зная о том, что для горения же-
леза необходим избыток кисло-
рода, они смогли только распла-
вить наружную обшивку сейфа,
изготовленную из обычной ли-
стовой стали толщиной 8 мм, да
и было у них только два балло-
на с горючим газом и кислоро-
дом.
С того «исторического собы-
тия» прошло время, равное жиз-
ни одного поколения. Сегодня
газовая резка—один из самых
производительных способов
термической резки углеро-
дистых и низколегированных
сталей. На многих заводах
имеются сложные и дорогостоя-
щие установки с цифровым
управлением для автоматиче-
ской газовой резки. При этом
толщина разрезаемых стальных
заготовок практически не огра-
ничена. Мировой рекорд здесь
91
Это не пирамиды с птичьего полета
и не археологические раскопки,
а фигуры травления на железе, сфо-
тографированные под металлогра-
фическим микроскопом. Отчетливо
видны кубики, свидетельствующие
о кубической структуре металла.
Самый высокий мост в Европе со-
оружен через долину реки Зиль в Ав-
стрии, южнее Инсбрука. Его длина
составляет 815 м, а максимальная
высота—190 м, так что под ним
могли бы свободно поместиться
многие небоскребы. Такие гигант-
ские сооружения были бы невоз-
можны без высококачественных ста-
лей.
Кривые нагрева и охлаждения желе-
за.
92
Закалка и отпуск
Если раскаленную докрасна сталь погрузить в воду, то она
станет гораздо прочнее и тверже. Это и есть закалка—давно из-
вестный и широко применяемый способ термической обработки
стали. Правда, закалке поддается не каждая сталь. Если в стали
слишком мало углерода (меньше 0,2%), то ее твердость в резуль-
тате закалки возрастает лишь незначительно.
Что же, собственно, происходит в металле при закалке? Это-
го металлурги долгое время не знали. Рецепты передавались из
поколения в поколение под строжайшим секретом, как некое
«колдовское зелье». Не обходилось и без курьезов. Например,
еще в прошлом веке специальное наливное судно доставляло во-
ду из Шеффилда—прославленного английского центра стале-
плавильного производства—через океан в Америку. Заказчики
полагали, что высокое качество шеффилдской стали объясняет-
ся водой, которую используют для ее закалки. Впрочем, такое
предположение не лишено оснований: качество стали в первую
очередь зависит от ее состава, особенно от содержания углеро-
да, но жидкость, в которой производят закалку, тоже оказывает
определенное влияние, хотя и не решающее, как полагали аме-
риканские предприниматели, стремившиеся составить конку-
ренцию шеффилдским сталеварам.
Одна из особенностей железа заключается в том, что кубиче-
ская объемно-центрированная решетка a-железа при нагреве
превращается в кубическую гранецентрированную решетку у-
железа. Для чистого железа температура, при которой происхо-
дит превращение, составляет 911° С. Если же к железу добавить
углерод, то в таком сплаве превращение в у-железо начинается
уже при 723° С1. Линия GOSE на диаграмме железо—углерод
определяет температуру конца превращения. Если a-железо спо-
собно растворить в себе не более 0,02% углерода, то в у-железе
концентрация растворенного углерода может достигать 2%.
Когда сталь нагрета до такой высокой температуры, при кото-
рой она состоит только из у-кристаллов (т. е. аустенита), углерод
в ней целиком переходит в твердый раствор. При последующем
медленном охлаждении растворимость углерода в железе
уменьшается, и он, выделяясь из твердого раствора, вступает
в химическую связь с частью железа и образует цементит. Если
же сталь охладить очень быстро, например закалить в воде, то
углерод не успевает выделиться и остается в пересыщенном
твердом растворе. Но в кристаллической решетке a-железа (т. е.
феррита) для него не хватает места, поэтому элементарные ячей-
ки решетки феррита несколько растягиваются в одном напра-
влении, превращаясь из кубиков в прямоугольные призмы
с квадратным основанием. Металлографический микроскоп по-
зволяет отчетливо наблюдать существенные различия в струк-
турах закаленной и медленно охлажденной сталей. В закаленной
стали вместо ферритно-цементитной смеси образуется новая
структурная составляющая. Она названа мартенситом по имени
немецкого металловеда А. Мартенса (1850—1914).
Однако наряду с увеличением твердости сталь при закалке
приобретает и серьезный недостаток: становится хрупкой и
в самых неблагоприятных случаях ведет себя подобно стеклу;
в таком состоянии она уже не поддается пластическому дефор-
1 Эти «критические точки» открыл в 1868 г. русский ученый Д. К. Чернов,
разработавший теоретические основы термической обработки.—Прим, перев.
пока равен Зм—он принадле-
жит Центральному институту
сварки в Галле (ГДР). О про-
грессе, достигнутом в этой обла-
сти за текущее столетие, мы мо-
жем судить, если сравним (пусть
нам простят это нынешние
обладатели рекорда) названный
рекорд с теми жалкими 8 мм
стали, которые удалось разре-
зать грабителям в 1901 г.
Фрейбергский металлург Альфред
Ледебур (1837—1906) был разносто-
ронним ученым; ему, в частности,
принадлежат первые теории закалки
стали.
Шпага из Толедо
Испанское холодное оружие,
особенно сделанное в Толедо,
всегда отличалось техническим
мастерством, художественным
совершенством и пользовалось
заслуженной славой. Еще
у древних римлян высоко цени-
лись изготовленные кельтибер-
скими кузнецами мечи. Под
влиянием арабского искусства,
а позднее—искусства эпохи
Возрождения испанские оружей-
ники создавали настоящие ше-
девры. Каждая мастерская име-
ла и хранила в тайне свои
собственные технологические
секреты. Клинок обычно приго-
товляли не из одного куска,
а складывали вместе три по-
лосы: две стальные снаружи
и одну из мягкого железа в сере-
дине. Полосы соединяли путем
93
Твердый в-
Твердый
Твердый
Твердый
(феррит)
1600
isw\
1400
1300
1200
1100
1000
900
/-♦а-раСТВОр-^-1
а- раствор----
600
5000 1 2 3 4 5 6
Содержание углерода, вес.%
8.
8
i
^Расплав* кристаллы твердого I Ге'с |
даН "I «-рас™*- I ’ Г (цементит)
т~"1 Л-раствфа | у
Расплав
/-раствор frTi г I ' t*_____
(аустенит) + ‘ -------“-------
7 .Твердый /-раствор* ъ3с
LJ-
аспл, в
1325
1147
T
Твердый ^раствор 7^7
723
б
а
д
Диаграмма состояния железо—углерод и характерные структуры железоугле-
родистых сплавов:
а) диаграмма железо—углерод;
б) не легированная сталь, содержащая около 0,18% углерода, состоит из ферри-
та (светлые участки) и перлита (темные участки) ( х 300);
в) при большем увеличении ( х 800) отчетливо видно, что перлит имеет пла-
стинчатое строение и включает две структурные составляющие—тонкие пла-
стинки цементита перемежаются в нем с более широкими ферритными
участками;
г) в нелегированных инструментальных сталях содержание углерода может
превышать 1%. В структуре таких сталей перлит (темный) заключен в цемен-
титную сетку (светлая). При определенных условиях (при быстром охлажде-
нии) иглы цементита пронизывают перлитные зерна ( х 400);
д) в чугуне содержание углерода значительно больше, чем в стали. В этом доэв-
тектическом чугуне оно составляет около 2,5%. Структура состоит из перлита,
на который распались кристаллы твердого раствора (темный) и ледебурита
( х 300);
е) в заэвтектическом чугуне, где содержание углерода превышает 4,3%, наряду
с ледебуритом наблюдается первичный цементит в игольчатой Форме ( х 300).
94
Огромные резервуары для жидко-
стей и газов изготовляют путем
сварки листовых элементов из высо-
кокачественных конструкционных
сталей.
Еще одно гигантское сооружение
из стали—транспортно-подъемный
мост в карьере Нохтен (ГДР), где
добывают бурый уголь открытым
способом.
95
Эту великолепную шпагу император Максимилиан II в 1575 г. вручил в пода-
рок саксонскому курфюрсту Августу. Клинок испанских кузнецов украшен эфе-
сом ювелирной работы.
кузнечной сварки так, чтобы
средняя мягкая полоса несколь-
ко выступала с одного конца (к
этому концу потом прикрепляли
эфес). Другой конец заготовки,
т.е. лезвие клинка, оттягивали
на наковальне сначала в горя-
чем, затем в холодном состоя-
нии с промежуточными отжига-
ми. Качество холодного оружия
очень зависит от закалки. Кли-
нок, нагретый до красного кале-
ния, охлаждали в проточной во-
де, а чтобы он сохранил доста-
точную вязкость, снова нагрева-
ли до не очень высокой темпера-
туры, т.е. производили отпуск.
Такая термическая обработка
мало чем отличается от самого
распространенного сегодня про-
цесса термического улучшения
стали. Эти технологические при-
емы и правила передавались из
поколения в поколение, и куз-
нецы строго их соблюдали. Тем-
пературы закалки и отпуска они
определяли по цвету раскален-
ного металла и по так назы-
ваемым цветам побежалости
(цвета, которые приобретает по-
верхность стального изделия
после нагрева до определенных
температур). Установлен был
даже угол наклона, под ко-
торым следует погружать зака-
ливаемый клинок в проточную
воду. Предусматривалась также
целая серия испытаний качества.
Чтобы проверить равномер-
ность закалки, клинок уклады-
вали на подушку и изгибали
в разных местах от эфеса до
острия. Затем следовало другое
испытание: клинок вдавливали
острием в лежащую на земле
свинцовую плиту и, не снимая
нагрузки, изгибали и закручива-
ли в разных направлениях. Для
проверки твердости лезвия
и вязкости клинка служила так-
же проба на шлеме: испы-
туемым клинком трижды нано-
сили удар по шлему полукру-
глой формы. Если все испыта-
ния проходили успешно, можно
было приступить к окончатель-
ной обработке и художествен-
ной отделке изделия: выглажи-
96
мированию и ломается под нагрузкой. Чтобы сохранить удо-
влетворительную вязкость стали, после закалки требуется от-
пуск: сталь снова нагревают до определенной температуры
и выдерживают при этой температуре достаточное время. Мак-
симальная температура отпуска составляет 6Q0°C. Комбина-
цию закалки и отпуска называют термическим улучшением. Для
каждой конкретной марки стали необходимо точно установить
и строго соблюдать режим термической обработки, т. е. темпе-
ратуры закалки и отпуска, скорости нагрева и охлаждения, вре-
мя выдержки, иначе не удастся получить желаемые свойства
стали.
Помимо закалки и отпуска существуют и другие виды тер-
мической обработки стали. Некоторые из них известны очень
давно, другие разработаны лишь в последние десятилетия.
К числу новых видов принадлежит, например, так называемая
термомеханическая обработка (ТМО). Это понятие включает
все процессы обработки, в которых сталь подвергают пластиче-
скому деформированию и затем (либо одновременно) опреде-
ленной термической обработке, что позволяет изменить ее свой-
ства в нужном направлении. Такие новые методы термической
обработки в значительной мере позволяют удовлетворить все
возрастающие требования, которые современная техника
предъявляет к сталям.
Термическая обработка сталей прошла долгий путь разви-
тия—от первых чисто интуитивных методов закалки леген-
дарных мечей до современных научно обоснованных техноло-
гических процессов. И этот путь еще далеко не завершен. Сегод-
ня совместные усилия ученых и инженеров направлены на то,
чтобы в каждом конкретном случае использования состояние
стали было оптимальным. Это позволяет экономить материал
и повысить надежность конструкций.
Насколько прочна сталь?
Прочность стали вошла в поговорку. О человеке, который
обладает большой выдержкой, хорошо переносит нервные на-
пряжения, говорят: у него «стальные нервы». Сталь действи-
тельно принадлежит к числу очень прочных металлических ма-
териалов. Ее прочность и вязкость обусловлены химическим
составом и способом термообработки. И если когда-то рим-
ским легионерам приходилось время от времени покидать поле
сражения, чтобы выправить погнувшиеся мечи, то повинно
в этом было именно качество стали: либо слишком низкое со-
держание в ней углерода, либо неудовлетворительная термиче-
ская обработка (меч был совсем не закален или закален плохо).
Хорошая, правильно закаленная сталь в те времена была ред-
костью, оружие и инструмент из такой стали ценились очень до-
рого, и вряд ли простой легионер мог позволить себе меч из зна-
менитой кельтской стали, изготовленный в провинции Норикум
(на территории теперешней Австрии).
В древнем мире и в средние века железо и сталь употребля-
ли для изготовления оружия и инструментов. Эти материалы
оказались превосходными не только для мечей и доспехов, но
и для топоров, ножей, лемехов плугов, однако почти не находи-
ли применения в строительных и прочих конструкциях. Так про-
должалось вплоть до начала промышленной революции, вы-
звавшей быстрое развитие машиностроения. Тогда из черных
ванию и полировке клинка, вы-
травливанию надписей и узоров,
золочению или серебрению эфе-
са.
Дошедшие до нас толедские
клинки воплощают в себе нако-
пленный столетиями опыт полу-
чения и обработки высококаче-
ственной стали. Сегодня их
изготовление уже не составляет
тайны; технологические при-
емы, эмпирически найденные
древними оружейниками, полу-
чили свое научное объяснение
и обоснование.
Элементарные ячейки кристалличе-
ской решетки a-железа и мартенси-
та: кубическая гранецентрирован-
ная ячейка a-железа, построенная из
атомов железа (а); элементарная
ячейка мартенсита; черными точка-
ми показаны возможные места рас-
положения атомов углерода (б).
97
7-430
В результате длительного отжига
при температуре около 723° С це-
ментит, который залегал в перли-
те в виде пластинок, а в заэвтек-
тической стали (т. е. содержащей бо-
лее 0,8% углерода)—также в виде
сетки, приобретает округленную
форму; это так называемый глобу-
лярный цементит (х 300).
Кузнец—наш современник
Кузнец во все времена самым
тесным образом соприкасался
с металлом. Через клещи и мо-
лот он ощущал, как реагирует
на удары горячая сталь. Тесную
связь с металлом сохранил и со-
временный кузнец, хотя поль-
зуется он не ручным, а механи-
ческим молотом. Хороший куз-
нец «чувствует», как лучше
обрабатывать заготовку: мно-
гими слабыми ударами или со-
средоточив всю энергию молота
в нескольких сильных ударах.
Опыт, который приобретает
кузнец в повседневном «обще-
нии» с металлом, иного характе-
ра, чем опыт инженера или уче-
ного, но ои не менее ценен, когда
требуется разработать новый
технологический процесс ковки.
Убедительным примером тому
может служить работа Влади-
мира Арцюка—кузнеца сева-
стопольского завода, выпускаю-
щего портовые и плавучие
краны.
Со своим 6-тонным молотом
Арцюк решает самые разно-
образные технологические зада-
чи. Однажды ему пришлось ко-
вать новую немагнитную сталь.
металлов стали делать не только детали машин. Для мостов, ко-
раблей и многих других сооружений железо и сталь тоже оказа-
лись более подходящими, чем дерево или камень. Очень быстро
сталь заняла первое место среди конструкционных материалов.
Вместе с бетоном и стеклом она является символом современ-
ной архитектуры. О многосторонних достоинствах стали как
конструкционного материала убедительно свидетельствуют по-
строенные из нее здания и сооружения, к тому же и сделанные
при помощи стальных инструментов и орудий.
Сталь обрабатывают стальными инструментами: резцами,
сверлами, фрезами. Для обработки ее давлением (ковки, штам-
повки, прокатки) тоже служат стальные инструменты: штампы,
прокатные валки и т. п. Разумеется, сталь, из которой изгото-
вляют инструмент, должна обладать иными свойствами, чем
сталь, предназначенная для сооружения мостов. Поэтому стали
в зависимости от их назначения разделяются на две большие
группы: инструментальные и конструкционные. От инструмен-
тальной стали требуется в первую очередь высокая твердость
и хорошее сопротивление износу, иначе инструмент будет иметь
недостаточную стойкость, и рабочим, подобно римским легио-
нерам, придется часто прерывать работу, чтобы заточить или
заменить инструмент.
К конструкционной стали предъявляются иные требования.
Она должна быть прочной, чтобы выдерживать заданные на-
грузки, и вязкой, чтобы при превышении расчетной нагрузки де-
таль ломалась или трескалась не сразу, а только после некото-
рой пластической деформации. Чтобы правильно рассчитать
размеры детали или строительного элемента, конструктор, вы-
бирая марку стали, должен основываться на ее характеристиках,
важнейшей из которых является предел прочности на растяже-
ние.
Было бы идеально, если бы сталь в реальных конструкциях
всегда проявляла такую же прочность, как при лабораторных
испытаниях. В действительности дело обстоит далеко не так, и
в этом инженерам не раз приходилось убеждаться на собствен-
ном печальном опыте. Первые сомнения возникли 30—40 лет
назад. Фермы железнодорожных и автодорожных мостов, сва-
ренные из высококачественной стали, ломались за одну ночь,
хотя нагрузки были значительно меньше допустимой расчетной
величины. При этом мост не обнаруживал никаких деформаций,
излом носил хрупкий характер: сталь разрушалась подобно
стеклу, без предварительной пластической деформации. Вначале
такие случаи казались специалистам загадочными, но вскоре
выяснилось, что на прочность сварных конструкций оказывают
существенное влияние условия окружающей среды. При низких
температурах многие стали теряют вязкость, причем у неко-
торых из них эта критическая температура перехода от вязкого
состояния к хрупкому лежит немного ниже или даже выше 0° С.
Когда же к воздействию холода добавляется еще неблагоприят-
ное распределение остаточных напряжений, обусловленных
сварными швами, то хрупкие трещины возникают особенно бы-
стро. До сих пор хрупкое разрушение остается главной причи-
ной самых опасных аварий сварных конструкций из стали.
За последние полвека благодаря усилиям металлургов и ме-
талловедов удалось значительно повысить прочность конструк-
ционных сталей. В конце двадцатых годов вместо самой
распространенной тогда углеродистой стали Ст 52, прочность
которой составляла около 37 кг/мм2 (370 Н/мм2), для сварных
98
В большинстве случаев мы без колебаний полагаемся на прочность стали,
и только изредка, например находясь в вагончике подвесной дороги, задаем се-
бе вопрос: а собственно говоря, насколько же прочна сталь?
конструкций начали применять сталь прочностью 52 кг/мм2.
Это позволило значительно уменьшить вес конструкций и рас-
ход материала. Постепенно в промышленную практику вошли
конструкционные стали, имеющие прочность 60, а затем
и 75 кг/мм2 Но чем выше прочность стали, тем жестче нужно
соблюдать технологические правила и режимы при ее получе-
нии и переработке. К тому же повышенную прочность новых
конструкционных сталей не всегда удается использовать пол-
ностью. В реальных сварных конструкциях, подверженных дина-
Мосты принадлежат к числу наиболее внушительных сооружений из стали.
Этот изящный стальной мост соединяет берега Дуная в Братиславе.
Несмотря на точное соблюде-
ние установленных в лаборато-
рии параметров ковки, заготов-
ки все время получались
с трещинами. Сталь оказалась
очень капризной—она не выно-
сила сильных ударов и много-
кратных нагревов. Арцюк начал
экспериментировать, меняя тем-
пературу подогрева, продолжи-
тельность ковки, силу ударов,
пытаясь таким образом устано-
вить оптимальные условия про-
цесса. И действительно, за ко-
роткое время ему удалось найти
новую технологию, которая
позволила получать каче-
ственные поковки из высоколе-
гированной стали.
Эта история не представляет
собой ничего необычного.
Чтобы убедиться в этом, доста-
точно просмотреть списки изоб-
ретателей. Многие из них, как
и Владимир Арцюк,—рабочие.
Их огромный опыт и практиче-
ские знания составляют один из
необходимых творческих эле-
ментов дальнейшего развития
производственных процессов.
Шведские шторы
Металлургическая промыш-
ленность Швеции невелика по
масштабам, но шведская сталь
издавна пользуется заслужен-
ной славой. В немецком языке
существует выражение „hinter
schwedische Gardinen" (в букваль-
ном переводе: за шведскими
шторами), котброе означает—
за решеткой, т. е. в тюрьме.
В столь необычной форме про-
явилось признание заслуг швед-
ских сталеваров. Такую решетку
очень трудно было перепилить,
а если ее делали из специальной
двухслойной стали, то и совсем
невозможно. В этом случае
прутья решетки имели сердцеви-
ну из высоколегированной ста-
ли, которая была окружена
слоем обычной стали. Материал
сердцевины представлял собой
сталь, содержащую 10—14%
марганца и свыше 1% углерода.
7*
99
Такой! материал обладает инте-
ресной особенностью. В исход-
ном состоянии он довольно мяг-
кий, йо если его подвергать
местной холодной деформации,
например ударять молотком, то
в месте удара он упрочняется
и становится тем тверже, чем
больше деформация. Когда за-
ключенный пытался перепилить
такую решетку напильником
или ножовкой, то сначала дело
шло легко и быстро, но как
только разрез доходил до серд-
цевины, начинались трудности.
Пытаясь ускорить работу, за-
ключений сильно нажимал на
инструмент, но при этом силь-
нее проявлялся и эффект холод-
ного упрочнения. Перепилить
прут так и не удавалось, как бы
ни был хорош инструмент. При
обработке резанием эта сталь
поддается только инструменту
из твердых сплавов. Конечно,
основная область применения
такой стали—отнюдь не тю-
ремные решетки. Из нее изгото-
вляют детали машин, которые
при эксплуатации должны обла-
дать особенно высокой износо-
стойкостью: крестовины рель-
совых пересечений, плиты мо-
лотковых дробилок для измель-
чения твердых горных пород,
траки танковых гусениц
и многое другое. Необходимое
условие правильного примене-
ния такой стали состоит в том,
что при работе детали должна
создаваться местная пластиче-
ская деформация. Только тогда
может полностью проявиться
способность стали к холодному
упрочнению, которую впервые
почти сто лет назад описал ан-
глийский металлург Р.А. Гад-
филд (1858—1940) (его именем
часто и называют эту сталь).
Однако было бы совершенно не-
правильно изготовить из нее,
например, сопло пескоструйной
установки, потому что в усло-
виях абразивного износа стой-
кость стали Гадфилда еще мень-
ше, чем обычной углеродистой
стали.
мическим нагрузкам, эти стали ведут себя лучше обычных, но не
в такой мере, как этого можно было бы ожидать, судя по разни-
це в значениях их прочности на растяжение.
Особенно высокой прочности достигает сталь в специальной
холоднотянутой проволоке—до 400 кг/мм2. Это означает, что
такая проволока с поперечным сечением всего 1 мм2 может вы-
держать вес пя/ги человек.
Широко известное здание нынешнего московского ГУМа построено в
1889—1893 гг. по проекту архитектора Померанцева. Стальная конструкция
его крыши весит 834 т.
100
В самолете- и ракетостроении требуются сверхпрочные стали (прочностью
порядка 200 кг/мм2), которые к тому же должны обладать и достаточной вяз-
костью, т.е. способностью пластически деформироваться перед разрушением.
Это достигается путем специальной термомеханической обработки (аусформин-
га) легированных термически улучшенных сталей. Максимальная прочность та-
ких ковких (деформируемых) сталей в настоящее время достигает 300 кг/мм2
(3000 Н/мм2).
Сталь, которая не ржавеет
За период 1890—1925 гг. во всем мире было произведено почти 2 млрд, т же-
леза и стали. За то же время коррозия уничтожила около трети этого количе-
ства: приблизительно 800 млн. т металла было принесено в жертву «рыжему
дьяволу»—превратилось в ржавчину. Можно ли избежать таких потерь? Наука
ведет непрекращающуюся войну с коррозией и немало преуспела в этом.
В принципе возможны два пути борьбы с ржавлением стали. Первый путь—за-
щищать поверхность металла от прямого воздействия на нее агрессивной внеш-
ней среды. Ежегодно в мире затрачиваются огромные средства на антикорро-
зионные лакокрасочные покрытия стальных сооружений и деталей машин. Еще
эффективнее защищают сталь металлические или пластмассовые покрытия, но
они и обходятся дороже. Второй путь—уже в процессе выплавки добавлять
в сталь вещества (легирующие элементы), которые повышают ее стойкость
к коррозии.
В начале XX в. специалисты обнаружили, что сталь, полученная пудлин-
говым способом, втрое дольше сопротивляется коррозии, чем бессемеровская
или томасовская сталь, разлитая в изложницы в жидком состоянии. Тогда для
Пластмассовые покрытия защищают металл от коррозии. Покрытие этих полуфабрикатов из ста-
ли предохраняет их не только от ржавления на воздухе, но и от воздействия всех агрессивных газов
и жидкостей, к которым пластмасса устойчива.
101
строительных целей начали из конвертерной стали приготавливать «искусствен-
ную сварочную сталь». Это был первый металлургический способ получения
стали, стойкой к атмосферной коррозии. В 30-е годы выяснилось, что сталь с по-
вышенным содержанием фосфора и меди ржавеет иначе, чем сталь с низким со-
держанием этих элементов. На поверхности деталей из обычной стали с тече-
нием времени нарастает слой, состоящий преимущественно из соединений
железа с кислородом и водородом; этот слой имеет рыхлую структуру, через ко-
торую легко проникает воздух и влага, и слабо связан с основным металлом.
А при повышенном содержании в стали фосфора и меди продукты коррозий
образуют на поверхности изделия плотный и прочный слой, который защищает
нижележащий металл от дальнейшего агрессивного воздействия атмосферы. За-
метим, что, когда в данном случае говорят о повышенном содержании фосфора
и меди, имеют в виду буквально «гомеопатические дозы». Например, в ГДР про-
изводят коррозионно-стойкую (на воздухе) углеродистую сталь, содержащую не
менее 0,3% меди и 0,06% фосфора. В качестве аналогии вспомним, например,
таблетки аскорбиновой кислоты, которые люди принимают от простуды,—в
них количество витамина С тоже измеряется не килограммами, как вес человека,
а всего лишь миллиграммами. Так и стали требуются ничтожные добавки,
чтобы ее стойкость к атмосферной коррозии значительно возросла. Строение
защитного слоя на такой коррозионно-стойкой стали еще недостаточно выясне-
но. Предполагается, в частности, что соединения фосфора и меди образуют
в слое обычной ржавчины периодические плотные прослойки и тем самым суще-
ственно замедляют атмосферную коррозию.
Однако для полной защиты от коррозии необходимы более эффективные
и соответственно более дорогостоящие средства (хотя и в этом случае понятие
«абсолютная защита от коррозии» условно—речь идет о том, что сталь долго
не ржавеет лишь в определенных условиях, например на воздухе). Вероятно,
каждый из нас когда-нибудь, держа в руках вилку или инструмент с многообе-
щающим клеймом «Нерж, сталь», задавался вопросом: чем же отличаются эти
изделия от тех, которые приходится постоянно чистить или слегка смазывать,
чтобы они оставались блестящими? В первую очередь нержавеющие стали от-
личаются высоким содержанием (уже не в гомеопатических дозах) легирующего
элемента хрома.
Чтобы сделать сталь нечувствительной к воздействию атмосферного возду-
ха, в нее добавляют 12—15% хрома. Механизм защитного действия хрома мож-
но упрощенно представить следующим образом. Атомы хрома, находящиеся на
поверхности, быстро вступают в реакцию с кислородом воздуха и образуют
слой окисных соединений, плотный и прочно связанный с поверхностью, ко-
торый изолирует нижележащий металл от атмосферного воздуха. Этот слой
имеет настолько малую толщину, что его нельзя заметить невооруженным гла-
зом, поэтому поверхность изделия из нержавеющей стали сохраняет металличе-
ский блеск. В зависимости от содержания углерода высокохромистые нержа-
веющие стали можно разделить на три класса, которые различаются
характером структуры. При содержании хрома около 16% и углерода до 0,1%
сталь не претерпевает превращений при нагреве и охлаждении, т. е. ферритная
структура сохраняется во всем интервале температур—от комнатной до точки
плавления. Такие стали называют ферритными. Если уменьшить содержание
хрома и увеличить содержание углерода, то при нагреве или охлаждении насту-
пает частичное превращение—такую сталь относят к полуферритному классу.
При еще большем содержании углерода структура стали в процессе нагрева или
охлаждения претерпевает полное термическое превращение; эти хромистые ста-
ли способны к закалке и принадлежат к перлитно-мартенситному классу. Ста-
лям каждого из этих трех классов присущи свои преимущества и недостатки,
они требуют различных способов термической обработки, и их коррозионная
стойкость сильно зависит от структурного состояния.
Если к сплаву добавить хром и никель, то получится аустенитная сталь. Са-
мая известная и распространенная сталь этого класса содержит 18% хрома
и 8—10% никеля. Аустенитные хромоникелевые стали закаливают при темпера-
102
Для многих крупных предприятий
химической промышленности (как
и для этого завода в австрийском
городе Швехат) требуются металли-
ческие материалы, особенно устой-
чивые к коррозии. Как правило, это
высоколегированные стали, ко-
торые не ржавеют на воздухе и не
поддаются коррозии в различных
газах и жидкостях.
Высокой стойкостью к коррозии от-
личаются стали с большим содер-
жанием хрома и никеля. Их структу-
ра целиком состоит из кристаллов
одного типа —аустенита. Спе-
циальными методами травления ау-
стенитным зернам на металлогра-
фическом шлифе можно придать
различную окраску ( х 200).
туре 1000—1100° С. После такой термической обработки они
приобретают полностью аустенитную структуру и особенно вы-
сокую коррозионную стойкость.
• Кстати, высоколегированные хромистые и хромоникелевые
стали правильнее было бы именовать коррозионно-стойкими,
а не нержавеющими. Ржавчина—это только одна из форм кор-
розии, а такие стали устойчивы и к действию многих кислот. Ес-
ли кислоту налить в сосуд из обыкновенной стали, то он вскоре
разрушится. Высоколегированная коррозионно-стойкая, или
кислотоупорная, сталь ведет себя совсем иначе. Такая сталь ши-
роко применяется в химическом производстве. Из нее изгото-
вляют реакционные сосуды, резервуары, трубопроводы, армату-
ру. Вообще, современную химическую промышленность трудно
представить без таких сталей.
Чугунный Будда
В Китае гораздо раньше, чем
в Европе, научились выплавлять
жидкий чугун и отливать его
в формы. Предание гласит, что
в VII в. н. э. некий монах Чен Гун
должен был отлить гигантскую
фигуру Будды высотой около
20 м. Он приступил к работе
103
двадцатилетним юношей
и двадцать лет подготавливал
первую отливку, но она не уда-
лась. Сорокалетний мастер
опять принялся за работу, а до-
стигнув шестидесяти лет, пред-
принял вторую попытку отлить
статую. Но счастье снова ему
изменило. Когда же в третий раз
подготовка подошла к концу
и оставалось только залить фор-
му, восьмидесятилетний старец
бросился в расплавленный ме-
талл, чтобы умилостивить небе-
са. Боги благосклонно приняли
такую жертву, и статуя получи-
лась безупречной. К сожалению,
до нас не дошло ни одной фи-
гуры Будды подобных разме-
ров. Но если судить по другим
крупным отливкам древних ки-
тайских мастеров, то нужно при-
знать, что легенда несколько
преувеличивает труды монаха
Чен Гуна (как, впрочем, и поло-
жено легенде). Несомненно, фи-
гуру таких размеров нельзя бы-
ло отлить целиком, а только по
частям. Однако это ни в коей
мере не умаляет заслуг древних
литейщиков, а скорее, наоборот,
свидетельствует о высоком
уровне литейной технологии
в те далекие времена.
Бронза и чугун в Древнем Китае слу-
жили излюбленными материалами
для литья монументальных фигур.
Однако для многих применений этого оказывается недоста-
точно. Металлурги разрабатывают новые стали, способные ра-
ботать в экстремальных условиях. Если деталь из обыкновенной
стали при высоких температурах и под воздействием агрессив-
ного газа или жидкости разрушается очень быстро, то, изгото-
вленная из жаростойкой или окалиностойкой стали, она может
в таких условиях безотказно работать в течение многих часов.
Испытание на жаростойкость заключается в том, что стальные
образцы выдерживают на воздухе при заданной высокой темпе-
ратуре в течение 120 ч, несколько раз подвергая их охлаждению.
При этом потеря металла не должна превышать 1 г с 1 м2 по-
верхности за час. Важнейшими легирующими элементами
в подобных сталях наряду с хромом служат алюминий
и кремний.
Отлиты в формы
С тех пор как древние сыродутные печи, постепенно увеличи-
ваясь в размерах, превратились в домны, металлурги отказа-
лись от прежнего прямого способа получения железа и стали из
руды. Из продукта доменной плавки—расплавленного чугуна
с большим содержанием углерода—сталь можно получить
только путем повторной плавки и очистки. Но оказалось, что
чугун можно и непосредственно заливать в формы, благодаря
чему он тоже стал важным конструкционным материалом.
Именно из чугуна, а не из стали был сооружен первый металли-
ческий мост (через реку Северн в Англии в 1779 г.). Техническим
шедевром Лондонской всемирной выставки 1851 года был
«Кристалл-палас»—гигантское даже по теперешним предста-
влениям здание из чугуна и стекла длиной 554 м и высотой 42 м.
Его 2300 чугунных балок имели общий вес 3500 т (а стальные
элементы—только 550 т). До сих пор на старых вокзалах мож-
но увидеть чугунные колонны и балки. Но по мере технического
прогресса чугун находил и другие области применения, в пер-
вую очередь в машиностроении, где во многих случаях он ока-
зался выгоднее прочих конструкционных материалов.
Чем же отличается чугун от стали? Прежде всего он содер-
жит гораздо больше углерода (2—4%), тогда как в конструк-
ционных сталях содержание углерода измеряется десятыми до-
лями процента. Если в стали углерод химически связан
с железом и присутствует в виде карбида железа (цементита), то
в чугуне углерод находится в своей элементарной форме—в ви-
де графитных включений. Структура чугуна состоит из зерен же-
леза (феррит) и пластинок графита, крупных или мелких, ко-
торые распределены в так называемой металлической матрице,
т. е. массе основного металла. Незначительная доля углерода и
в чугуне может быть связана с железом в цементите; в этом слу-
чае матрица состоит из феррита и перлита, но форма и распре-
деление графита остаются здесь такими же, как в ферритной
матрице.
Графитные пластинки нарушают связность металлической
матрицы в чугуне. Они ослабляют поперечное сечение детали
или образца (потому что графит способен выдерживать только
сжимающие, но не растягивающие нагрузки) и способствуют
локальной концентрации напряжений при растягивающей на-
грузке.
В силу этого неблагоприятного обстоятельства чугун,
несмотря на большее содержание углерода, способен выдержи-
104
вать меньшую растягивающую нагрузку, чем сталь. Под сжи-
мающей нагрузкой чугун ведет себя лучше, так как графитные
пластинки в поперечном сечении образца или детали восприни-
мают на себя соответствующую часть напряжений сжатия.
Чтобы улучшить прочность чугуна, следует либо воздей-
ствовать на его металлическую матрицу (подобно тому, как это
делают со сталью), либо добиваться того, чтобы графитные
включения присутствовали в нем в виде шариков, а не пласти-
нок. Оба эти способа можно использовать и одновременно.
Чугун с шаровидным (сфероидальным, глобулярным) графи-
том представляет собой современный конструкционный мате-
Задолго до того как в Европе позна-
комились с чугуном, китайские ме-
таллурги получали из него крупные
отливки. Этот лев высотой 6 м
стоит в саду древнего буддийского
монастыря.
Первый в мире чугунный мост был
построен в 1779 г. через реку Северн
в Англии. Он соединил между собой
города Колбрукдейл и Вросли. Та-
кой характерный стиль чугунных
мостов сохранился до середины
XIX в, когда для сооружения мостов
начали применять сталь.
105
Благодаря форме и распределению
графитных включений серый чугун
способен хорошо демпфировать ко-
лебания, поэтому он служит превос-
ходным материалом для фундамен-
тов и станин в машиностроении.
В обычном сером чугуне графит за-
легает в виде пластинок и нитей,
пронизывающих массу основного
металла (х 300).
Серый чугун с шаровидными вклю-
чениями графита обладает больши-
ми прочностью на растяжение (его
так и называют: высокопрочный чу-
гун) и вязкостью, чем обычный
серый чугун, содержащий графит
в виде пластинок. Шарики графита
равномерно распределены в струк-
туре; у показанного на фотографии
серого чугуна прочность особенно
высока благодаря ферритовой обо-
лочке (белая) вокруг графитных
включений (х 300).
риал, в котором сочетаются важные достоинства чугуна
и стали: с одной стороны, он имеет хорошие литейные свойства,
а с другой—его прочность на растяжение достигает примерно
такого же уровня, как у стали. То же количество шаровидного
графита занимает гораздо меньшую площадь в поперечном се-
чении, чем пластинчатого; кроме того, опасность концентрации
напряжений на таком графите значительно уменьшается.
Как же добиться, чтобы графит в чугуне выделялся в виде
шариков, а не пластинок?
Для этого расплавленный чугун обрабатывают (модифици-
руют) церием или магнием. В результате условия на границах
раздела между расплавом и выпадающим из него при охлажде-
нии графитом изменяются таким образом, что графитные вклю-
чения приобретают округлую форму.
Как и углеродистая сталь, нелегированный чугун содержит
кремний и марганец. Кремний способствует выделению графи-
та, поэтому в чугуне содержание последнего составляет 2—3%.
Марганец оказывает обратное действие: чугун, в котором много
марганца, затвердевает белым, т.е. углерод в нем связан в це-
ментите (термины «белый» и «серый» характеризуют внешний
вид поверхности излома—графит придает излому серый цвет).
Литейный чугун, как правило, содержит больше кремния
и меньше марганца, чем передельный доменный чугун, предназ-
наченный для производства стали.
Но выделение графита (графитизация) в чугуне существенно
зависит и от условий затвердевания. При быстром затвердева-
нии образуется преимущественно цементит, при медленном—
графит. Технолог-литейщик должен тщательно учитывать это
обстоятельство, потому что стенки отливки часто имеют раз-
ную толщину и поэтому в них создаются разные условия затвер-
девания. В песчаных формах тепло отводится медленнее, чем
в металлических (кокилях); соответственно и условия затверде-
вания в этих случаях различны.
Текучесть расплавленного чугуна в большой степени зависит
от содержания в нем фосфора и серы. Фосфор делает расплав
более текучим, и тогда чугун хорошо заполняет внутренность
формы, включая ее мелкие изгибы. Поэтому для художествен-
ного литья чаще всего используют чугун с повышенным содер-
жанием фосфора. Наличие серы в чугуне, напротив, нежелатель-
но, поскольку она не только увеличивает вязкость расплавлен-
На этом металлографическом шли-
фе, окрашенном путем специально-
го травления, шарики графита вы-
глядят как декоративные элементы
на картине. Отчетливо видно их вее-
рообразное строение.
106
ного чугуна, но и ухудшает свойства отливок. Правда, чугун не так чувствителен
к сере, как сталь, потому что в нем всегда имеется достаточно марганца, связы-
вающего серу.
Важными преимуществами чугуна по сравнению со сталью являются его от-
носительно низкая температура плавления (приблизительно на 100° С ниже, чем
у стали), превосходные литейные качества, а также некоторые специфические
эксплуатационные свойства. Среди последних следует отметить лучшую, чем
у углеродистых сталей, стойкость к износу и коррозии, но прежде всего способ-
ность демпфировать (т. е. ослаблять) механические колебания. По этой причине
чугун широко используется для изготовления станин, стоек и несущих конструк-
ций вращающихся машин, которые должны работать без вибрации. Наряду
с конструкционным литейным чугуном находят применение и другие чугуны
специального назначения. Безграфитный отбеленный чугун, получаемый путем
соответствующего легирования при определенных условиях затвердевания,
обладает очень высокой износостойкостью. Из него делают, например, валки
для сталепрокатных станов.
Ковкий чугун получают путем длительного отжига отливок из отбеленного
чугуна. При этом свободный углерод частично выгорает (происходит обезугле-
роживающий отжиг) либо связанный углерод выделяется из распадающегося
цементита и остается внутри отливки в виде хлопьев или чешуек (углерод отжи-
га). Типичное применение ковких чугунов—изделия небольшого веса, например
водопроводные или газовые тройники, муфты, краны. Следует заметить, что на-
звание «ковкий чугун» условно, оно отражает только некоторое свойство чугу-
нов этого класса, а именно большую пластичность. Изделия из этих чугунов по-
лучают литьем, а не ковкой.
Наконец, необходимо упомянуть и стальное фасонное литье (фасонным
литьем называют процесс изготовления деталей путем отливки в формы в отли-
чие от разливки стали на слитки в изложницы). Возможность отливать сталь
в формы появилась тогда, когда металлурги научились ее плавить. Отливки по-
лучают как из углеродистых, так и из многих легированных сталей. Особенно
велико значение такой технологии для тех легированных сталей, которые с тру-
дом поддаются горячей и холодной обработке давлением.
Литейные сплавы железа составляют важную промышленную группу мате-
риалов. Правда, с развитием техники на смену литью для изготовления кон-
струкций в ряде случаев приходят новые решения, в частности штамповка, свар-
ка и т.д. Но без сомнения чугунное и стальное литье сохранит свое прочное
место в технике и в будущем.
Легче, чем сталь, -
легкие металлы
Сталь—превосходный, в некоторых случаях почти идеальный металличе-
ский материал, но он имеет один существенный недостаток: детали и конструк-
ции, сделанные даже из высокопрочной стали, тяжелы. Во многих отраслях тех-
ники, в первую очередь в самолетостроении, необходимы столь же прочные, но
более легкие материалы. Если бы построить самолет только из стали, то он ока-
зался бы слишком тяжелым и смог бы нести гораздо Меньше пассажиров и по-
лезного груза, чем современные самолеты, изготовленные преимущественно из
легких металлов.
Легкими металлами в отличие от стали и других тяжелых металлических ма-
териалов принято считать все металлы и сплавы, плотность которых составляет
меньше половины плотности железа, т. е. не превышает 3,5 г/см3. Это щелочные,
щелочноземельные и редкоземельные металлы (они располагаются в левой
верхней части таблицы Менделеева). Из них широкое применение в качестве
конструкционных материалов находят алюминий (плотность 2,7 г/см3), а также
еще более легкий магний (плотность 1,74 г/см3). Легируя эти металлы другими
элементами, получают множество различных алюминиевых и магниевых спла-
вов. В последние десятилетия внимание инженеров все больше привлекает еще
один легкий металл—бериллий. Он немного тяжелее магния (плотность
1,84 г/см3), но его сплавы отличаются высокой прочностью и другими важными
техническими свойствами. Правда, эти сплавы гораздо дороже и поэтому при-
меняются только для специальных целей.
Титан имеет плотность 4,5 г/см3 и по определению уже не принадлежит
к легким металлам, но его нельзя назвать и тяжелым. Примерно с 50-х годов ти-
тан тоже вошел в число промышленных конструкционных материалов.
А как обстоит дело с другими легкими металлами? Ведь среди них есть и та-
кие, которые легче воды, например литий, натрий и калий. (Автомобиль из лития
мог бы поднять один человек.) Это действительно были бы идеальные конструк-
ционные материалы, если бы не их чрезвычайно высокая химическая активность.
Они быстро вступают во взаимодействие с кислородом, причем реакция проте-
кает очень бурно, а соприкасаясь с водой, создают настоящий фейерверк: дым,
огонь, шипение. Для технических конструкций из всех легких металлов при-
годны только алюминий, магний, бериллий и титан, а также сплавы на их осно-
ве. Некоторые отрасли техники вообще не в состоянии обходиться без таких ма-
териалов. Трудно себе представить, например, современную авиацию без
алюминия. Титан и бериллий приобрели важное значение в космической техни-
ке, они необходимы также при создании высотных (стратосферных) самолетов
и ракет.
108
Рассмотрим сначала «традиционные» легкие металлы—
алюминий и магний. Хотя они известны уже не первое столетие
и мы повседневно встречаемся с ними, ученые и инженеры до
сих пор обнаруживают их новые удивительные особенности.
Алюминий—металл из глины
Алюминий, который когда-то называли «серебром из
глины», сегодня входит в число важнейших технических мате-
риалов. По своему содержанию в земной коре (7,5%) он также
является одним из самых распространенных металлов.
Исходным сырьем для получения алюминия служит боксит.
Эта похожая на глину повода получила свое название от мест-
ности Ле-Бо на юге Франции, где было обнаружено первое ее
месторождение. Боксит наполовину или больше состоит из оки-
сидлюминия (глинозема), связанной с водой. Кроме того, он со-
держит примеси, главным образом кремнезем, а также окислы
железа и титана. На глиноземном заводе из боксита сначала хи-
мическим путем выделяют примеси, а затем в больших печах
для обжига удаляют воду. Обожженный (кальцинированный)
глинозем в виде сухого- белого порошка (почти чистой окиси
алюминия А12О3) поступает в дальнейшую переработку на алю-
миниевый завод. Здесь его вместе с криолитом (Na3AlF6) нагре-
вают до 900—1000° С и расплавленную смесь подвергают элек-
тролизу. В результате электролиза выделяется металлический
алюминий. Чтобы получить тонну алюминия, требуется затра-
тить 13000—14000 кВт-ч электроэнергии, стоимость которой
К числу крупнейших потребителей
легких металлов принадлежит авиа-
ционная промышленность. Если для
обычных самолетов важнейшими
конструкционными материалами
служат алюминиевые сплавы, то
для строительства сверхзвуковых
самолетов все шире применяются
высокопрочные титановые сплавы.
109
Как появился алюминий
Одна весьма сомнительная ле-
генда рассказывает, что од-
нажды к римскому императору
Тиберию (42 г. до н.э.—37 г.
н. э.) пришел человек с металли-
ческой, небьющейся чашей. Ма-
териал чаши якобы был получен
из глинозема (Д12О3) и, следова-
тельно, должен был предста-
влять собой алюминий. Опа-
саясь, что такой металл из
глины может обесценить золото
и серебро, Тиберий на всякий
случай приказал отрубить чело-
веку голову. Разумеется, этому
рассказу трудно поверить: само-
родный алюминий в природе не
встречается, а во времена Рим-
ской империи не могло быть
технических средств, которые
позволили бы извлечь алюми-
ний из его соединений. Окись
алюминия в отличие от окиси
железа невозможно восстано-
вить при помощи древесного
угля. Только в 1825 г. датчанину
Гансу Христиану Эрстеду, а
в 1827 г. немцу Фридриху Вёлеру
удалось получить в лаборато-
рии первые граммы алюминия \
Кусок алюминия весом в не-
сколько килограммов широкая
публика впервые увидела на Па-
рижской всемирной выставке
1855 г. К тому времени Сен-
Клер Девиль во Франции уже
получал алюминий в техниче-
ских масштабах, но только
очень дорогостоящим химиче-
ским способом (путем восстано-
вления натрием из сплава хло-
ридов), от которого впослед-
ствии отказались. В отличие от
своего легендарного предше-
ственника Девиль пользовался
особым покровительством им-
ператора Наполеона III. Изящ-
но гравированная погремушка
для новорожденного принца
стала первым «изделием ширпо-
треба» из алюминия. Наполеон
III намеревался даже снарядить
1 Первую попытку получить ме-
таллический алюминий предпринял
в 1807 г. англичанин X. Дэви.—
Прим перев.
составляет значительную долю себестоимости алюминия. Пер-
вичный алюминий, получаемый в электролизерах, имеет чисто-
ту 99,3—99,9%. Основными примесями в нем являются кремний
и железо, в меньших количествах содержатся также титан, медь
и цинк. Путем повторного электролиза в расплаве получают
алюминий высокой чистоты (99,99% и выше).
Алюминий представляет собой блестящий серебристо-белый
металл с плотностью 2,7 г/см3 и точкой плавления 660° С, ко-
торый хорошо проводит тепло и электрический ток. Его кри-
сталлическая структура может быть представлена как трехмер-
ное сочетание кубических гранецентрированных элементарных
ячеек. Замечательная особенность алюминия состоит в том, что
на воздухе его поверхность быстро покрывается тонкой, но
очень плотной, прочной и твердой пленкой окиси, чем и объяс-
няется его высокая коррозионная стойкость. Эту окисную плен-
ку можно еще усилить химическими и электрохимическими ме-
тодами. Прочностные свойства прокатанного и отожженного до
мягкого состояния алюминия характеризуются следующими ве-
Автоклав Смеситель
Разбавитель
Электролизер
Путь алюминия от боксита до металла.
НО
Для получения и очистки алюминия используют процесс электролиза расплава.
личинами: предел текучести 20—30 Н/мм2, предел прочнос-
ти на разрыв 70—100 Н/мм2, твердость по Бринеллю
150—250 Н/мм2, удлинение при разрыве 30—50% и сужение
80—95%.
Эти свойства алюминия, особенно прочность, можно значи-
тельно повысить путем легирования различными элементами,
важнейшими из которых являются кремний, медь, магний, цинк
и марганец. Для легирования используют также железо, титан,
хром и реже—свинец, бор, кадмий, висмут, цирконий. Суще-
ственно различаются между собой деформируемые и литейные
алюминиевые сплавы. Деформируемые сплавы легко поддают-
ся обработке давлением и предназначены для прокатки, ковки,
прессования. Литейные сплавы отличаются жидкотекучестью,
своих гвардейцев алюминиевы-
ми кирасами, но цена оказалась
непомерно высокой. Во время
Парижской выставки 1 кг алю-
миния стоил 1000 марок, т.е. в
5 раз дороже серебра. Правда,
цена алюминия довольно бы-
стро снижалась, но в 1884 г. она
еще составляла около 100 марок
за 1кг. Только после изобрете-
ния электролитического процес-
са алюминий по своей стоимо-
сти сравнялся с обычными ме-
таллами.
К этому изобретению в 1886 г.
независимо друг от друга при-
шли П. Эру во Франции
и Ч. Холл в США. С того мо-
мента производство алюминия
расширялось очень быстро и со-
ответственно столь же быстро
падала цена: уже в 1897 г. 1кг
алюминия стоил всего 2,5 мар-
ки.
Семь достоинств алюминия
Известное ныне столь широкое
применение алюминия и его
сплавов определяется семью его
отличительными свойствами:
1) легок, масса алюминиевой
детали составляет лишь треть
массы стальной детали таких же
размеров;
2) устойчив к коррозии на
воздухе, а также в среде многих
газов и жидкостей;
3) обладает высокой отража-
тельной способностью и благо-
даря своему блеску имеет деко-
ративный вид;
4) алюминиевые сплавы по
прочности не уступают обыкно-
венным конструкционным ста-
лям;
5) отличается относительно
высокой упругостью и не стано-
вится хрупким при низких тем-
пературах;
6) хорошо поддается обра-
ботке резанием и давлением—
его можно раскатать в фольгу
толщиной 0,01 мм и меньше;
7) проводит электрический
ток и тепло лучше, чем все дру-
III
гие обычные металлы (за исклю-
чением меди).
Алюминий широко приме-
няется в строительстве и архи-
тектуре. В большинстве промы-
шленно развитых стран на эти
цели расходуется 20% запасов
алюминия. Авиация, железнодо-
рожный и автомобильный
транспорт потребляют 25%,
а электротехника—около 15%.
В последнее время быстро воз-
растает расход алюминия на из-
готовление тары и упаковки—
сегодня он уже достиг 10—15%.
Увеличивается значение алюми-
ния и в производстве товаров
широкого потребления: по
оценкам, его доля здесь также
составляет 10—15%. В связи
с этим быстро растет и абсо-
лютный объем производства
и потребления алюминия. На-
пример, в автомобилестроении
на каждую легковую машину се-
рийной модели приходится
в среднем 50 кг алюминия. По-
добные тенденции можно на-
блюдать и в других отраслях
промышленности. Алюминий
и его сплавы способны удовле-
творить многочисленные и все
возрастающие потребности со-
временной техники, они позво-
ляют снижать вес самых разно-
образных конструкций.
Микрошлиф, приготовленный на
разрезе литого алюминиевого
образца. Крупные кристаллиты рос-
ли со дна и с боковых граней в на-
правлении поверхности ( х 300).
хорошо заполняют форму, мало чувствительны к литейным
трещинам; их используют для фасонного литья.
Способность алюминия образовывать твердые растворы
с легирующими элементами невелика; иначе говоря, другие ме-
таллы слабо растворяются в алюминии в твердом состоянии.
Растворимость в алюминии кремния, меди, магния и цинка воз-
растает в той последовательности, в какой они здесь перечис-
лены. С понижением температуры их растворимость умень-
шается: при 100° С для меди и кремния она практически равна
нулю, а для цинка составляет 4%. Во многих двойных и много-
компонентных сплавах алюминия образуются преимуществен-
но хрупкие и твердые интерметаллические соединения, напри-
мер А12Си в сплавах алюминий—медь, Al3Fe в сплавах
алюминий—железо, Mg2Si и MgZn2 в соответствующих много-
компонентных сплавах и т.д. Большинство двойных сплавов
алюминия имеет диаграмму состояния с эвтектикой и двумя
областями твердых растворов. С точки зрения применения
в технике представляет интерес только левая часть диаграммы
состояния—от 100% А1 до эвтектического состава или немного
дальше.
Металловедение алюминия и его сплавов сегодня составляет
обширную и глубоко разработанную область знаний, однако
ученые продолжают обнаруживать здесь все новые интересные
факты. При практическом использовании металлических мате-
риалов, как правило, особенно важно выяснить следующие
вопросы:
1. Удовлетворяют ли поставленным требованиям свойства
материала, например его прочность и коррозионная стойкость?
2. Как придать материалу нужную форму, т. е. каким спосо-
бом его можно обрабатывать или перерабатывать?
Ответы на эти вопросы зависят от внутреннего строения ме-
талла или сплава. Металловедение раскрывает взаимосвязь
между внутренним строением и свойствами металлических
материалов.
Например, по диаграмме состояния можно судить о ли-
тейных свойствах сплавов алюминий—кремний. Алюминий
и кремний образуют между собой простую эвтектическую си-
стему, в которой эвтектическая точка соответствует составу
с 11,7% Si. Применяемые в технике сплавы содержат до 20%
кремния.
Наилучшими литейными свойствами обладают сплавы алю-
миний—кремний, по составу близкие к эвтектическому. Но
первые отливки из таких сплавов, названных силуминами, ока-
зались неудовлетворительными по микроструктуре и механиче-
ским свойствам. Кристаллы кремния залегали в эвтектике в ви-
де крупных игл и пластинок, и прочность сплавов составляла
лишь 100—120 Н/мм2, а относительное удлинение при разрыве
3—5%. Только путем специальной обработки (модифицирова-
ния) расплава натрием удалось получить мелкозернистую эвтек-
тику. В результате прочность сплавов возросла более чем
вдвое—до 240—280 Н/мм2, а удлинение—до 15%. Если такой
сплав1 AlSil3, содержащий около 13% кремния, отлить в песча-
ную форму, то после модифицирования его структура, несмотря
на заэвтектический состав, будет представлять собой мелкозер-
нистую эвтектику, в которой залегают отдельные доэвтектиче-
ские дендриты твердого а-раствора.
1 Приблизительно соответствует отечественному литейному алюминие-
вому сплаву АЛ 2.—Прим, перев.
112
Микрошлиф на образце литейного
алюминиевого сплава (AlCuMgFe).
В структуре видны преимуществен-
но дендритные кристаллы твердого
раствора (х 50).
Чистый алюминий очень хорошо
отражает тепловое излучение. Из
тонкой алюминиевой фольги,
в частности, изготовляют экраны,
которые защищают чувствитель-
ную измерительную аппаратуру от
воздействия тепла, излучаемого те-
лом человека.
Деформируемые алюминиевые сплавы делятся на сплавы
с естественной твердостью, т.е. не поддающиеся упрочнению
путем термической обработки, и термически упрочняемые
сплавы. Первая группа сплавов содержит меньше легирующих
элементов и применяется вместо чистого алюминия в тех слу-
чаях, когда его прочность недостаточна. Прочность таких спла-
вов повышается в результате легирования магнием в количестве
0,5—5%, а также марганцем в количестве до 1,2%. Листы из этих
алюминиевых сплавов получают с прокатного стана в полутвер-
дом или твердом состоянии. При этом прочность материала
увеличивают еще путем холодной обработки давлением (такое
упрочнение называют наклепом или нагартовкой). Например,
деформируемый алюминиевый сплав AlMg3 (содержит около
3% Mg) в отожженном, мягком состоянии имеет прочность на
Микрошлиф, приготовленный на
образце эвтектического сплава алю-
миний—кремний. Структура со-
стоит из модифицированной мелко-
зернистой эвтектики ( х 200).
8-430
113
На фотографии показан в стадии
монтажа каркас дирижабля LZ-129,
который в 1937 г. сгорел при посад-
ке в Лейкхерсте (США) после своего
тридцать седьмого трансатлантиче-
ского рейса. Самые большие дири-
жабли имели корпуса диаметром
41,2 м и длиной 245,2 м. Быть мо-
жет, время таких воздушных гиган-
тов безвозвратно прошло.
Каркас дирижаблей жесткой систе-
мы изготовляли из алюминиевых
сплавов в виде профилей, полу-
ченных путем прессования и частич-
но путем непрерывной разливки.
Чаще всего использовали сплавы
типа дуралюмина (алюминий—
медь—магний).
Нерадивый лаборант
По сравнению со сталью
чистый алюминий не особенно
прочен, но прочность его возра-
стает при легировании другими
элементами. Ее можно еще бо-
лее повысить путем холодного
деформирования. В этом со-
стоит один из способов упрочне-
ния алюминиевых материалов.
Вместе с тем давно известно,
что прочность углеродистой
стали можно увеличить путем ее
нагрева до высокой темпера-
гуры и последующего охлажде-
ния в воде, т. е. при помощи так
называемой закалки. Естествен-
но было попытаться сделать не-
что подобное с алюминием. За
эту задачу взялся в 1906 г. бер-
линский металлург Альфред
Вильм (1869—1937). Он исследо-
вал алюминиевый сплав, ко-
торый позднее стал известен во
разрыв 180 Н/мм2 и удлинение 15%, в полутвердом состоянии
230 Н/мм2 и 8% и в твердом состоянии 260 Н/мм2 и 3% соответ-
ственно. Как видно из этих данных, вследствие холодной дефор-
мации прочность сплава возрастает, но удлинение, т. е. пластич-
ность, снижается.
Другой путь повышения прочности алюминиевых сплавов
состоит в термической обработке, при которой прочность воз-
растает в результате дисперсионного твердения («старения») по-
сле закалки. Первый и наиболее известный сплав этого типа—
дуралюмин (AlCuMg), в котором упрочняющее действие
оказывает медь. Алюминий в твердом состоянии способен рас-
творять определенное количество меди, причем ее раствори-
мость достигает максимума при температуре 548° С. Твердый
раствор при этой температуре может содержать до 5,7% меди.
С понижением температуры растворимость меди быстро умень-
шается: при 200° С она составляет только 0,2%, а при комнатной
температуре еще меньше.
Структура алюминиевого сплава с 4% меди в равновесных
условиях состоит из кристаллов твердого раствора, содержащих
лишь очень немного меди, и кристаллов интерметаллического
соединения А12Си. Прочность такого сплава невелика (около
140 Н/мм2). Термическое упрочнение его осуществляют в три
последовательных этапа. На первом этапе сплав нагревают до
такой температуры, при которой достигается область макси-
мальной растворимости меди. При этом интерметаллическое
соединение растворяется и образуется сплав, состоящий из
114
однородных кристаллов твердого раствора со статистически
равномерно распределенными атомами меди. На втором этапе
выдержанную при этой температуре деталь или заготовку зака-
ливают, т.е. быстро охлаждают,—чаще всего в воде; для отли-
вок используют более «мягкую» закалочную среду, например
подогретое масло, чтобы избежать слишком больших оста-
точных термических напряжений. В результате закалки фикси-
руется структурное состояние сплава, достигнутое при высокой
температуре. Атомы меди остаются в пересыщенном
(переохлажденном) твердом растворе, и из него при столь бы-
стром охлаждении не выделяется интерметаллическое соедине-
ние А12Си.
На третьем этапе закаленный сплав выдерживают при ком-
натной температуре (естественное старение) или при повышен-
ной—приблизительно при 170° С (искусственное старение).
В процессе выдержки распределение атомов меди в твердом
растворе изменяется, переходя из статистически равномерного
в некоторое упорядоченное: атомы меди концентрируются
в определенных зонах кристаллов твердого раствора. При есте-
ственном старении такие зоны полностью или частично коге-
рентны, т.е. сохраняют пространственное кристаллографиче-
ское соответствие с кристаллической решеткой алюминия. При
искусственном старении в кристаллах твердого раствора тоже
можно наблюдать зоны, обогащенные медью, но здесь возни-
кают и некогерентные выделения. Такие обогащенные медью
плоские выделения толщиной в несколько атомных слоев полу-
чили по имени их открывателя общее название зон Гинье-Пре-
стона (сокращенно ГП-зон). Подобные выделения, возникаю-
щие в твердом растворе в процессе выдержки после закалки,
препятствуют скольжению дислокаций при деформировании,
и, чтобы преодолеть их действие, требуется затратить больше
энергии или приложить большее усилие. Это означает не что
иное, как повышение прочности сплава. Прочность на разрыв
у естественно состаренного дуралюмина составляет около
400 Н/мм2, т. е. почти вдвое больше, чем у отожженного (или за-
каленного) сплава. При этом состаренный сплав сохраняет при-
мерно ту же пластичность, величина которой оценивается отно-
сительным удлинением при разрыве, равным 12—14%.
всем мире как дуралюмин. Это
сплав алюминия с 4,5% меди,
0,5—1,0% магния и 0,5% марган-
ца. В своих многочисленных экс-
периментах Вильм нагревал
сплавы подобного состава по-
чти до начала плавления и затем
закаливал их в воде. Но про-
чность не увеличивалась. Од-
нажды Вильм в очередной раз
поручил своему лаборанту ис-
пытать образцы после такой
термической обработки. Но де-
ло было в субботу, стояла пре-
красная погода, и лаборант
предпочел отложить испытания
до следующей недели. В поне-
дельник же оказалось, что
образцы, пролежав двое суток
при комнатной температуре,
приобрели необычайно высо-
кую прочность. Вильм сделал
правильный вывод, что дуралю-
мин с течением времени после
закалки упрочняется. Такой про-
цесс назвали старением или, бо-
лее строго, дисперсионным
упрочнением (ибо он обусло-
влен выделением мелкодис-
персных и твердых фаз). Позд-
нее были разработаны и другие
сплавы, которые в результате
старения приобретают еще бо-
лее высокую прочность.
Открытие Вильма привело
к широкому использованию ду-
ралюмина в самолетостроении,
так как упрочненный таким
образом дуралюмин обладал
наилучшей удельной проч-
ностью (т.е. максимальным от-
ношением прочности к плотно-
сти) по сравнению со всеми
другими известными в то время
металлическими материалами.
Алюминий защищает сталь от кор-
розии. Стальная лента движется со
скоростью 1—3 м/с через специаль-
ную установку, где на нее путем на-
пыления наносится алюминий.
115
Для некоторых целей применяются специальные алюминиевые сплавы. На-
пример, поршни двигателей внутреннего сгорания, движущиеся в цилиндрах
с высокими скоростями и ускорениями, должны иметь как можно меньшую мас-
су, поэтому их следует делать из легкого материала с высокой прочностью. Ма-
териал должен быть также износостойким. Чтобы цилиндр двигателя не пере-
гревался, материал поршня должен хорошо отводить тепло, выделяющееся при
сгорании газовой смеси. Кроме того, тепловое расширение сплава должно быть
невелико, иначе нагретый поршень будет заедать или придется увеличить зазор
между поршнем и цилиндром, что приведет к ухудшению работы двигателя.
Трудно представить себе, чтобы один и тот же сплав мог удовлетворить всем
этим жестким и разнородным требованиям. Однако металловедам и металлур-
гам путем сложного легирования удалось создать нужные алюминиевые
сплавыВ их состав входят кремний, никель, медь, а иногда также хром или ко-
бальт. Структура таких поршневых сплавов состоит из кристаллов различных
типов, в том числе интерметаллических соединений Cu2NiAl7, Mg2Si и др. Эти
твердые мелкие кристаллы, залегающие в относительно мягкой основной массе,
обеспечивают высокую износостойкость и другие качества материала. По-
добные легкие сплавы с успехом применяются и для подшипников.
За сто лет алюминий прошел большой путь—от редкого ювелирного метал-
ла до современного широко распространенного и необходимого в технике мате-
риала, второго по значению после железа. Но это еще далеко не предел. Во всем
мире ученые и инженеры продолжают разрабатывать и совершенствовать алю-
миниевые сплавы, и перед этим «серебром из глины» открываются все новые
области применения.
Магнии легче алюминия
Легкий металл магний можно назвать «младшим братом» алюминия. По
распространенности в земной коре он занимает среди металлов третье место по-
сле алюминия и железа. Однако далеко не все соединения магния могут быть ис-
пользованы как исходное сырье для промышленного производства металла.
Широко распространены в природе силикаты и сульфаты магния, но они с боль-
шим трудом поддаются химической переработке; гораздо легче перерабатывать
минеральное сырье, содержащее окислы магния, например карбонатные породы
доломит и магнезит. Однако чаще всего для промышленного получения магния
используют природные вещества, содержащие его хлориды, особенно встречаю-
щуюся в калийных месторождениях двойную соль магния—карналлит
(MgCl2*KCl*6H2O). В некоторых странах магний добывают из морской воды.
После сложных операций обогащения получают обожженный хлорид магния, из
которого затем путем электролиза его расплава извлекают металлический маг-
ний. Такой процесс, как и аналогичный процесс производства алюминия, тре-
бует очень большого расхода электроэнергии. Для получения магния с успехом
применяют и термические (пирометаллургические) методы, хотя в этом случае
магний оказывается еще дороже, чем при электролитическом его производстве.
Благодаря совершенствованию технологии и оборудования себестоимость маг-
ния, получаемого термическими методами, удается постепенно снижать, и эти
методы приобретают все большее значение.
Полученный в результате дополнительных процессов рафинирования очи-
щенный магний представляет собой белый серебристый металл с точкой плавле-
ния 650° С. По плотности (1,74 г/см3) это самый легкий из технических металлов.
По своей структуре магний относится к металлам с гексагональной кристалли-
ческой решеткой. На воздухе поверхность магния, как и алюминия, быстро по-
крывается окисной пленкой.
1 В СССР для автомобильных поршней, головок цилиндров и подобных деталей разрабо-
тан специальный многокомпонентный силумин АЛ 17В.—Прим, персе.
116
Чистый магний не используют в качестве конструкционного
материала, потому что его прочностные свойства невысоки.
Прочность на растяжение в литом состоянии составляет всего
80—120 Н/мм, а относительное удлинение при разрыве 4—6%.
Магний образует сплавы со многими металлами. Две важ-
нейшие группы из них составляют сплавы магний—алюми-
ний—цинк и магний—церий с малыми добавками тория или
циркония.
Если вначале использовали преимущественно литейные маг-
ниевые сплавы, то за последние два десятилетия все большую
роль начинают играть деформируемые сплавы. Хорошие меха-
нические свойства сплавы приобретают при содержании в них
3—7% алюминия и 0,5—1% цинка. Например, магниевый сплав
MgA16Zn имеет предел прочности на растяжение
260—290 Н/мм2 и удлинение 6—10%. Литейные сплавы этой
группы содержат 6—10% алюминия и 1 — 3% цинка. Их проч-
ность ниже, чем у деформируемых сплавов. Например, ли-
тейный магниевый сплав MgA17Znl имеет прочность на растя-
жение 160—200 Н/мм2 при относительном удлинении 2—6%.
Добавка циркония в магний и его сплавы способствует
образованию более мелкого зерна, что значительно улучшает
механические свойства сплавов. Церий и торий повышают жа-
ропрочность и горячую твердость сплавов. Такое сложное леги-
рование позволило применять магний в тех областях техники,
где прежде он был непригоден. Если образец из сплава магний—
алюминий—цинк, нагретый до 150° С, удлиняется на 0,1% за
1000 ч уже при напряжении 10 Н/мм2, то у жаропрочных маг-
ниевых сплавов такая деформация наступает только при нагруз-
ке в шесть раз большей.
Некоторые магниевые сплавы обладают такой структурой,
что способны, подобно алюминиевым сплавам, к упрочнению
в процессе старения.
Магний—горючий металл. Он воспламеняется при темпе-
ратуре 550—600* С и быстро сгорает ослепительно ярким пла-
менем, при этом образуется окись магния в виде густого белого
дыма. Еще не так давно фотографы использовали для вспышки
магниевый порошок (теперь же на смену ему пришла лампа-
вспышка).
Огнеопасность магния и его сплавов способствовала возник-
новению определенного предубеждения против технического
применения этих материалов. Однако эту опасность нетрудно
полностью предотвратить, соблюдая простые меры предосто-
рожности. При литье расплавленные магниевые сплавы закры-
вают слоем солей или используют защитный сернистый газ.
При обработке магния резанием, если технологический процесс
ведется неправильно, может загореться мелкая стружка, а при
сухом шлифовании образующаяся мелкая магниевая пыль
в смеси с воздухом взрывается. Горящий магний ни в коем слу-
чае нельзя тушить водой—только песком или специальными
средствами. Компактные детали или отходы магния в виде
крупных кусков совершенно безопасны в пожарном отношении.
Существенное достоинство магниевых сплавов состоит
в том, что они хорошо обрабатываются резанием. При одина-
ковых скоростях резания магний требует примерно вдвое мень-
шего усилия, чем латунь, и в шесть раз меньшего, чем сталь.
В начале раздела мы назвали магний «младшим братом»
алюминия. При этом мы имели в виду в первую очередь то, что
магний и его сплавы применяются гораздо реже, чем алюминий.
Вначале было слабительное
К юго-востоку от Лондона ле-
жит курортный городок Эпсом,
известный своими ипподромом
и минеральными источниками.
В воде этих источников содер-
жится «эпсомская соль», кото-
рая действует как слабительное,
притом необыкновенно мягкое
и надежное. В 1695 г. один алхи-
мик в поисках философского
камня выпаривал эпсомскую
минеральную воду и получил
в осадке эту соль (правда, мы не
знаем, испытал ли он на себе ее
целебное действие). Позже он
обнаружил ту же соль в воде
многих других минеральных ис-
точников и за горький вкус на-
звал ее просто «горькой солью».
Это был гидратированный (т.е.
содержащий воду в кристаллах)
сульфат магния MgSO4-7H2O.
Другая магниевая соль, а имен-
но основной карбонат магния,
тоже в начале XVIII в. нашла
применение в медицине. Свое
название magnesia alba («белая
магнезия») она получила от ан-
тичного города Магнезия (ны-
не— Маниза в Турции). Англий-
ский химик Хэмфри Дэви
(1778—1829) предположил, что
это соединение представляет со-
бой окисел металла, который он
и назвал магнием. Правда, «бе-
лая магнезия» оказалась не
окислом, но это действительно
было соединение металла. Кто
же впервые получил металличе-
ский магний? Достоверно уста-
новлено, что Дэви в 1808 г. при-
готовил магниевую амальгаму,
т.е. сплав магния с ртутью, но
нам не известно, удалось ли ему
извлечь магний из амальгамы.
Принято считать, что первые
граммы чистого магния удалось
получить французскому химику
Бюсси в 1829 г. Лишь много поз-
же, на Лондонской всемирной
выставке 1862 г., было предста-
влено большее количество этого
нового металла. Если алюми-
ний в свое время привлек всеоб-
щий интерес как «чудесный ме-
117
талл», то появление магния, еще
более легкого и во многом сход-
ного с алюминием, не вызвало
особого шума. К сожалению,
в нашем столетии человечество
получило печальную возмож-
ность познакомиться с другими
свойствами этого металла. Маг-
ний и его сплавы стали широко
применять в зажигательных
бомбах, и в годы второй миро-
вой войны миллионы таких
бомб были сброшены на города
воюющих стран. Затем появи-
лось новое средство массовою
уничтожения — напалмовые
бомбы с оболочкой из маг-
ниевых сплавов,—которое ста-
ло символом жестокости и бес-
человечности войны.
Потомок греческих богов
Г реческие мифы повествуют
о поколении титанов—детей
Урана (неба) и Геи (земли). Де-
сять лет шла жестокая борьба
между титанами и богами
Олимпа. Боги во главе с Зевсом
одержали победу, и титаны бы-
ли низвергнуты в бездонную
подземную пропасть Тартар.
В 1795 г. немецкий химик
М. Клапрот (1743—1817), изу-
чая минерал рутил, выделил из
него неизвестный металл, ко-
торый окрестил титаном. Кла-
прот установил, что это тот же
элемент, который четырьмя го-
дами раньше англичанин
В. Мак-Грегор обнаружил в тя-
желом песке прибрежного по-
селка Менакан. В дальнейшем
оказалось, что титан присут-
ствует во многих минералах. По
распространенности в природе
этот элемент занимает среди ме-
таллов четвертое место (после
алюминия, железа и магния);
в земной коре он составляет
0,6%, т.е. втрое больше, чем
медь, цинк, никель, ванадий,
хром и марганец вместе взятые.
Вырабатывают титан преиму-
щественно из минералов рутила
и ильменита.
Но преимущества этого металла дают основание утверждать,
что в будущем он найдет широкое применение во многих облас-
тях техники, причем не только как легирующая добавка, сред-
ство для восстановления и очистки металлов или для целей ка-
тодной защиты других металлов от коррозии, но и как основной
компонент конструкционных сплавов.
Титан против стали?
Титан—металл нашего времени. Его применение постоянно
расширяется, и для многих целей он более перспективен, чем
любые другие металлы. В конце 60-х годов годовое производ-
ство титана в США и Японии—двух ведущих в этой области
странах капиталистического мира—составляло соответственно
20000 и 10000 г, сегодня оно перешло рубеж 100000 т. Совет-
ский Союз производит титана больше, чем все остальные
страны вместе взятые.
Такой быстрый рост обусловлен возникновением и разви-
тием новых отраслей промышленности и техники, в первую оче-
редь космической, которая потребовала новых конструк-
ционных материалов, обладающих высокими качествами.
Много трудностей пришлось преодолеть на пути создания
технически современной и экономически рентабельной техноло-
гии производства титана. Традиционные металлургические про-
цессы, такие как восстановление окислов металла углеродом
(применяемые при производстве железа) или электролиз распла-
вов (при помощи которого получают алюминий и магний), не
подходят для титана. Сегодня наиболее распространен метод
Кролля. Он состоит в следующем: концентрат, полученный при
переработке титановой руды, подвергают хлорированию, в ре-
зультате чего титан переходит в соединение с хлором (четырех-
хлористый титан). Этот промежуточный продукт нагревают
в замкнутой реторте в среде инертного газа вместе с распла-
вленным магнием. Магний, отнимая у титана хлор (образуя хло-
ристый магний), оставляет титан свободным, но не в форме ком-
пактного металла, а в виде пористой массы (губки), сидьно
загрязненной хлористым магнием и частично избыточным ме-
таллическим магнием. Путем дальнейших сложных процессов
рафинирования и переплава из этой титановой губки получают
чистый титан.
Титан принадлежит к тугоплавким металлам—он перехо-
дит из твердого состояния в жидкое только при температуре
около 1690° С. При комнатной температуре титан относится
к металлам с гексагональной пространственной решеткой, но
при температуре около 880 + 20° С происходит изменение в про-
странственном расположении атомов, и при дальнейшем нагре-
ве вплоть до точки плавления титан сохраняет кубическую
объемно-центрированную решетку.
Прочность технического титана зависит от степени его чи-
стоты и близка к прочности обычных конструкционных сталей.
По своей коррозионной стойкости титан превосходит даже вы-
соколегированные коррозионно-стойкие стали. Если такие ста-
ли в растворе, состоящем из двух частей соляной кислоты
и одной части азотной кислоты, за год растворяются на глубину
10 мм, то титан за то же время—только на 0,005 мм. Благодаря
столь необычной стойкости титан служит превосходным мате-
риалом для оболочек и облицовок резервуаров, в которых хра-
118
нятся кислоты. В химическом машиностроении титан приме-
няют всюду, где коррозия может привести к значительным
повреждениям или аварии.
Титан можно легировать различными элементами. Неко-
торые из них стабилизируют a-состояние, т. е. структуру с гекса-
гональной решеткой, другие—P-состояние, имеющее кубиче-
скую решетку. Соответственно различают сплавы а, Р и а 4- р.
Основными легирующими элементами в таких сплавах являют-
ся алюминий, олово, ванадий, хром, молибден, кобальт и неко-
торые другие.
Сплавы титана с алюминием и оловом отличаются высокой
жаропрочностью. Например, у сплава TiA15Sn2,5 при комнат-
ной температуре предел прочности на растяжение достигает
1000 Н/мм2 (т.е. вдвое выше, чем у углеродистой или низко-
легированной конструктивной стали), но и при температуре
400° С этот сплав сохраняет достаточно высокую прочность—
600 Н/мм2. Правда, величина высокотемпературной проч-
ности снижается, если нагрузка действует продолжительное
время.
Из группы а + [3-сплавов весьма распространен сплав
TiA16V4 (Ti 4- 6%А14- 4%V), предел прочности которого дости-
гает 1000 Н/мм , что сочетается также с высокой жаропроч-
ностью. Основное назначение этого сплава—крупные поковки.
Наибольшую прочность—до 1700 Н/мм2 (т.е. вчетверо вы-
ше, чем у обыкновенной конструкционной стали)—имеют
некоторые специальные титановые сплавы, например
TiV13CrllA14(Ti 4- 13%V 4- 11%Сг4- 4%А1). Коррозионно-стой-
кий сплав титана с 30% молибдена в некоторых агрессивных
средах ведет себя лучше, чем чистый титан.
Итак, важная роль титана в современной технике обусловле-
на не только его чрезвычайно высокой прочностью, но и стой-
костью при повышенных температурах и в коррозионных сре-
дах. В технике будущего титан, несомненно, займет еще более
значительное место. Методы его получения и легирования бу-
дут совершенствоваться, и, вероятно, недалеко то время, когда
на дороги выйдет автомобиль с кузовом из высокопрочного, не
поддающегося коррозии титанового сплава. Такой кузов будет
вдвое легче, чем изготовленный из листовой стали.
Почти 90% выплавляемого в мире титана потребляют авиа-
ция, космическая и ракетная техника. В современных боевых
Однако с момента открытия
титана до его получения в чи-
стом виде прошло больше ста
лет. Только в нашем веке (1910 г.)
американскому химику М. Хан-
теру удалось получить не-
сколько граммов металличе-
ского титана (описанный Кла-
протом «металлический осадок»
представлял собой окисел этого
металла). Производить чистый
титан в компактном виде очень
трудно, так как титановая губка
склонна поглощать газы, жадно
соединяется с азотом и углеро-
дом, а загрязненный примесями
титан становится хрупким
и ломким. Поэтому он долгое
время не вызывал интереса у ин-
женеров и считался беспо-
лезным металлом. Подобно
своим мифологическим тезкам,
титан отличался «своенравием»
и упорно сопротивлялся всем
попыткам приручить его. Толь-
ко после того, как была разрабо-
тана промышленная технология
получения чистого титана, нача-
ли выявляться его замеча-
тельные качества. Сегодня ти-
тан и его сплавы успешно
соперничают с высоколегиро-
ванными сталями, а по неко-
торым свойствам далеко их пре-
восходят.
Трубы этого теплообменного аппа-
рата с общей рабочей поверхностью
83 м2 выполнены из чистого титана,
днища цилиндра (трубны? доски)—
из листовой котельной стали, плаки-
рованной титаном.
119
В научном приборостроении преци-
зионные детали, работающие
с большими нагрузками, изгото-
вляют из сплавов тяжелых цветных
металлов. На фотографии показана
аппаратура фирмы «Цейс» (ГДР),
установленная в планетарии.
и транспортных самолетах наиболее ответственные, сильно на-
груженные детали делают из титановых сплавов. Уже сегодня
на постройку одного сверхзвукового самолёта идет от 4 до 25 т
титана. Крупнейшим потребителем титана является химическая
промышленность. Здесь тоже оказались незаменимы замеча-
тельные прочностные и антикоррозионные свойства титана.
Для узкоспециальных целей разработаны особые титановые
сплавы. Всемирную известность получил протез тазобедренно-
го сустава человека, созданный советским профессором Кон-
стантином Сивашом (и названный его именем) из сплава титана
с кобальтом. Как показывают оценки, искусственный сустав из
такого материала мог бы безотказно служить 140 лет.
Тяжелые цветные металлы
на службе у человека
В наше время железо и его сплавы, т. е. стали и чугуны, бесспорно являются
основными техническими материалами. Алюминиевые сплавы прочно зани-
мают второе место среди конструкционных материалов. Далеко позади сле-
дуют магний и титан. Однако, как показывает таблица Менделеева, в природе
существует еще более семидесяти металлов. Можно полагать, что в ближайшее
время ни один из них по масштабам производства и применения не сравнится
с железом и алюминием, но тем не менее почти все металлы уже так или иначе
вносят свой вклад в технический прогресс. Это в полной мере относится не толь-
ко к тем тяжелым металлам, которые человек уже давно знает и использует
(медь, олово, свинец, цинк, никель), но и к тем, которые лишь недавно заинтере-
совали ученых и инженеров, например цирконий, тантал и др. Значение новых
металлических материалов в электронике и современном машиностроении
определяется в первую очередь их особыми качествами, без которых здесь труд-
но обойтись. В ряде новых отраслей техники, таких как ядерная или космиче-
ская, «особые металлы» вообще незаменимы.
В данной главе мы познакомим читателя с некоторыми тяжелыми цветными
металлами. Сначала остановимся на старых добрых знакомых человека, ко-
торые уже столетиями, а то и тысячелетиями верно служат ему. Затем рассмо-
трим металлы, большинство из которых также очень давно известно, но не в ка-
честве технических материалов, а как драгоценные металлы. И в заключение
обратимся к тем особым металлам, которые вошли в технику лишь в последние
десятилетия.
Обыкновенные металлы
Из тяжелых цветных металлов в технике чаще всего используются медь, сви-
нец, цинк, олово и никель. С каждым годом в мире производят все бЪлыпе этих
металлов: так, годовое производство меди с начала XX в. выросло в десять раз.
Но потребности растут еще быстрее, и некоторых металлов уже явно не хватает.
Суровая экономическая необходимость заставляет собирать и пускать в дело
металлолом, непрерывно совершенствовать методы обогащения и металлурги-
ческой переработки, что дает возможность рентабельно добывать металлы из
все более бедных руд. Приходится строго следить, чтобы тяжелые цветные ме-
таллы применялись только там, где их особые свойства, безусловно, необхо-
димы и где их нельзя заменить другими материалами.
Л И1Л
121
Конвертер
Рафинировочная печь
Электролизные ванны
Путь меди от руды до металла (получение меди из сульфидных руд).
Медь—один из немногих действительно цветных металлов1: в зависимости
от степени чистоты и состояния поверхности ее цвет изменяется от светло-розо-
вого до красного. За год в мире производят 3—5 млн. т меди. Согласно оценкам,
мировые запасы меди в тех рудах, которые технически и экономически при-
годны для добычи и переработки существующими ныне способами, составляют
около 100 млн. т. Следовательно, уже через несколько десятков лет эти запасы
иссякнут. Открытие новых месторождений и совершенствование методов добы-
чи может лишь на какое-то более или менее продолжительное время отодвинуть
этот момент. Поэтому единственный выход состоит в том, чтобы возможно ши-
ре использовать металлолом и другие отходы промышленности, содержащие
медь. Уже после второй мировой войны в крупнейших промышленно развитых
странах из отходов получали больше меди, чем выплавляли ее из руд, а сегодня >
относительная доля вторичной меди значительно возросла. Для современной
техники наиболее важны некоторые особые свойства меди: высокая электро-
и теплопроводность, а также прочность, вязкость, хорошая коррозионная стой-
кость. Физические свойства меди тесно связаны с ее кристаллической структу-
рой. Медь относится к металлам, структура которых характеризуется кубиче-
ской гранецентрированной пространственной решеткой. Она плавится при
температуре 1083* С.
Около половины всего годового производства чистой металлической меди (с
большей или меньшей степенью чистоты) идет на изготовление проводов, кабе-
лей, шин и прочих токопроводящих изделий электротехнической промышленно-
сти. Максимально достигнутая сегодня проводимость меди составляет
60,1 м/Ом-мм2. Это означает, что медный провод сечением 1 мм2 и длиной
1 В литературе на русском языке (а также на болгарском и сербско-хорватском) технические
металлы принято делить на черные (металлы на основе железа, т.е. сталь и чугун) и цветные
(остальные). Соответственно и металлургия разделяется на две подотрасли: черную и цветную.Та-
кое разделение сохранилось с тех времен, когда в технике применялись только сплавы железа и ме-
ди. Теперь же в группу цветных входят многие металлы, которые по цвету мало отличаются от же-
леза. В большинстве других языков эти группы металлов и соответствующие отрасли металлургии
называют «железными» и «нежелезными».—Прим, перев.
122
В медеплавильном конвертере на
первой стадии продувки железо из
штейна (продукт предварительной
плавки рудного концентрата, содер-
жащий 25—40% меди) переходит
в шлак, на второй—сульфид меди
превращается в черновую медь.
Путем электролиза получают медь
высокой чистоты с очень хорошей
электропроводностью. Медь выде-
ляется на катоде, а в так называе-
мом анодном шламе остаются мы-
шьяк, сурьма, висмут, селен и сера,
а также золото, серебро и другие
примесные металлы.
9*
123
60,1 м обладает электрическим сопротивлением 1 Ом. Провода того же сечения
из серебра, алюминия и железа имеют такое сопротивление при длине 63, 38
и 10 м соответственно. По электропроводности медь лишь на 5% уступает сере-
бру, оставляя далеко позади все остальные металлы. Поэтому медь незаменима
в электротехнике, так как электроэнергию необходимо передавать с возможно
меньшими потерями. Любые примеси в меди, даже серебро, ухудшают ее элек-
тропроводность, причем ухудшение тем значительнее, чем дальше (по горизон-
тали) примесный элемент отстоит от меди в периодической таблице Менделе-
ева.
Предел прочности ов чистой меди в отожженном состоянии составляет
200—240 Н/мм2 при относительном удлинении около 40%. В результате холод-
ной деформации (наклепа) медь сильно упрочняется, и в зависимости от степени
наклепа ее прочность возрастает до 380 Н/мм2, а удлинение падает до 8—10%.
В отличие от электропроводности прочность и коррозионную стойкость меди
можно значительно улучшить путем легирования. Важнейшими легирующими
элементами в медных сплавах служат цинк, олово, алюминий и никель. Медные
сплавы, как и сплавы большинства других цветных металлов, делятся на дефор-
мируемые, которые используются в производстве полуфабрикатов (листов, по-
лос, профилей, проволоки и т.п.), и литейные, применяемые для изделий, ко-
торые получают путем литья в песчаные или металлические формы (кокили),
а также методами непрерывной разливки и центробежного литья.
Сплавы меди с цинком носят общее название «латунь». Специальные марки
латуни содержат и другие легирующие элементы. Если предел прочности при
растяжении латуни марки Л60 (60% меди и 40% цинка) в кованом состоянии сос-
тавляет 350—400 Н/мм2, то у специальных латуней прочность может достигать
800 Н/мм2, т.е. она вдвое выше, чем у обыкновенной углеродистой стали. С уве-
личением содержания цинка примерно до 15% сплав сохраняет красный цвет ме-
Не все сорта чистой меди свободны от кислорода. На микрошлифе образца из кислородной меди
(т.е. содержащей свыше 0,4% кислорода) видна структура, состоящая из первичных дендритов
Си2О, заключенных в эвтектической основной массе.
124
Медные сплавы широко приме-
няются в химическом машинострое-
нии. Трубы этого теплообменника,
предназначенного для нефтеперера-
батывающей промышленности, из-
готовлены из специальной латуни
CuZn28Sn, а днище (трубные до-
ски)—из латуни CuZn4O (40% Zn,
0,8% Sn), которую раньше называли
«мунц-металл» по имени ее изобре-
тателя, английского металлурга
Дж. Мунца.
Медь, обладающая отличной элек-
тропроводностью,—важнейший ме-
таллический материал в электротех-
нике. Из нее делают обмотки элек-
тродвигателей.
Микрошлиф образца из а-бронзы
CuSn6 ( х 150) в рекристаллизован-
ном состоянии, ее структура состоит
только из кристаллов твердого рас-
твора. Параллельные полосы, за-
метные в некоторых зернах, связаны
с образованием двойников.
Латунь очень хорошо поддается обработке давлением, поэтому детали из нее часто изготовляют
методом глубокой вытяжки.
ди, приблизительно при 15% цинка сплав приобретает характерный желтый цвет
латуни, затем цвет его меняется на светло-золотистый и, наконец, снова перехо-
дит в красноватый, что обусловлено появлением в структуре сплава наряду с фа-
зой а-латуни новой кристаллической фазы 0-латуни. Латунь очень хорошо под-
дается обработке резанием. Раньше ее широко использовали в художественных
ремеслах и для изготовления научных приборов. Известны, например, велико-
лепные художественные изделия нюрнбергских мастеров начала XVI в.
Сегодня латунь используют как конструкционный материал там, где тре-
буются высокая прочность и коррозионная стойкость: в трубопроводной армату-
126
Судовой винт (диаметр 4,5 м, вес
88 т) из алюминиевой бронзы.
ре, в химическом машиностроении и особенно в судостроении.
Обрабатываемость латуни можно улучшить с помощью леги-
рующих добавок: например, добавка свинца значительно улуч-
шает обрабатываемость резанием. При резании свинцо-
вистых латуней образуется короткая, ломкая стружка, что об-
легчает обработку изделия на автоматических станках.
Бронзы—это собирательное название другой большой
группы медных сплавов. Простейшие из них—оловянистые
бронзы, известные еще с бронзового века. Они, как и другие
сплавы, делятся на литейные (содержат 10—20% олова) и дефор-
мируемые (1—8% олова). Когда-то бронзы получали названия
в зависимости от их назначения: колокольная (20—30% олова),
зеркальная (30—35%), монетная (4—10%), пушечная (8—18%).
В наше время бронзы различают по их химическому составу.
В зависимости от содержания легирующих элементов и состоя-
ния обработки прочность бронз меняется примерно в пределах
200—750 Н/мм2. У бериллиевой бронзы, которая способна
упрочняться в результате старения, предел прочности достигает
1350 Н/мм2. Благодаря своим высоким механическим свой-
ствам, коррозионной стойкости и хорошей обрабатываемости
бронзы находят самое разнообразное применение. Из них де-
лают трубопроводную арматуру, обшивку и конструктивные
детали судов, элементы химических аппаратов и установок
и т.д. Бронзы обладают также благоприятными антифрик-
ционными свойствами и поэтому широко используются в под-
шипниках скольжения и зубчатых передачах.
Алюминиевые бронзы, содержащие около 8% алюминия, от-
личаются стойкостью к коррозии и окислению, сохраняют вы-
сокую прочность при повышенных температурах, хорошо со-
противляются износу. Из них изготовляют конденсаторные
трубы и детали химических аппаратов, высокотемпературную
арматуру, а также подшипники скольжения, работающие в усло-
виях абразивного износа и ударных нагрузок.
Болезни меди и олова
Тяжелые металлы медь и олово
при определенных условиях
окружающей среды могут «за-
болеть», причем совсем разны-
ми болезнями: медь страдает
«водородной болезнью», оло-
во—«оловянной чумой». Но
и тот, и другой пораженный ме-
талл становится непригодным
для употребления.
Водородная болезнь пора-
жает такую медь, в которой при-
сутствует кислород, распреде-
ленный в металле в виде мель-
чайших частиц закиси меди.
Если медь отжигать в атмосфе-
ре, содержащей водород, то по-
следний проникает в глубь ме-
талла и вступает в химическую
реакцию с кислородом закиси
меди:
2Н + Си2О -♦ 2Cu + H2O,
образуя водяной пар.
Но если очень маленькие
атомы водорода способны поч-
ти беспрепятственно диффунди-
ровать через металл, то гораздо
более крупные молекулы воды
не могут этого сделать: они
остаются в толще меди, накап-
127
ливаясь в ее мельчайших порах.
Водяной пар в этих порах посте-
пенно достигает очень высокого
давления и образует пузырьки,
а при охлаждении металла или
последующей холодной дефор-
мации возникают трещины по
границам зерен. Медь становит-
ся хрупкой. Водородная болезнь
не угрожает меди, если в ней нет
кислорода либо если весь кисло-
род химически связан с такими
элементами, окислы которых не
распадаются под действием во-
дорода, например с фосфором
или литием. Водородная бо-
лезнь может возникнуть и в зоне
шва при сварке меди водо-
родным или ацетиленовым пла-
менем.
Совсем иную «клиническую
картину» имеет оловянная чума.
Если оловянные изделия долго
находятся при низких темпера-
турах (это не раз, например, слу-
чалось в суровые зимы с труба-
ми церковных органов), то белое
металлическое Р-олово превра-
щается в неметаллическое серое
а-олово. Превращение на-
чинается в отдельных точках
и распространяется пятнами.
Серое олово представляет собой
аморфный порошок и занимает
гораздо больший объем, поэто-
му пораженные участки разру-
шаются под малейшей нагруз-
кой, и даже снова путем нагрева
превращая серое олово в белое,
мы не можем восстановить пре-
жний вид испорченного изделия.
Но если вовремя устранить все
зародыши a-фазы, т. е. «пре-
дупредить инфекцию», то олово
может оставаться здоровым до
температуры не —13,2° С (тем-
пература начала фазового пре-
вращения Р -> а), а приблизи-
тельно до — 30° С, когда металл
начинает быстро рассыпаться.
Вероятно, именно такие жесто-
кие морозы настигли армию
Наполеона, отступавшую из
России зимой 1812 г.,—тогда
у французских солдат стали от-
валиваться форменные пуго-
вицы, сделанные из олова.
Сплав меди с 20% никеля и 15% цинка получил название «ней-
зильбер» (по-немецки—«новое серебро»), и по виду он дей-
ствительно очень похож на серебро. Этот сплав применяется
для изготовления не только столовых приборов и посуды, но
и пружин, мембран и других деталей в приборостроении.
В заключение нашей короткой экскурсии в область медных
сплавов следует заметить, что в технике они и поныне занимают
большое и важное место, однако в машиностроении их «лучшие
времена» прошли. Здесь на смену им приходят другие мате-
риалы: высоколегированные стали, пластмассы и т. д. В настоя-
щее время дефицитные медные сплавы стремятся использовать
только в тех случаях, когда их особые свойства помогают до-
стичь существенных технических и экономических преимуществ.
Другой важнейший тяжелый металл, который тоже приме-
няется главным образом в чистом виде,—свинец. Он известен
с древнейших времен, но существенное значение в технике при-
обрел только с развитием производства серной кислоты. Этот
металл имеет голубовато-белый, а чаще тускло-серый цвет. Он
мягок, обладает низкой прочностью и плавится уже при 327,4° С.
Ежегодно в мире производится 3—4 млн. т свинца. Около
половины этого количества идет на изготовление аккумулято-
ров и кабелей, а треть его потребляет химическое аппарато-
строение. Остальной свинец используется для разных целей,
в частности для легирования сплавов и производства химиче-
ских соединений. Одно из главных достоинств свинца—его вы-
сокая коррозионная стойкость. На воздухе и в различных агрес-
сивных средах на поверхности свинцовых деталей образуются
плотные и прочно сцепленные с основным металлом пленки из
соединений свинца, возникших в результате коррозии. Такие
пленки хорошо защищают основной металл, если продукты
коррозии не растворяются (или очень мало растворяются)
в агрессивной среде. Поэтому, кстати, совершенно необосно-
ванны страхи по поводу использования свинцовых труб в город-
ской водопроводной сети. Действительно, свинец, попадая в ор-
ганизм человека, может вызвать отравление. Но водопр'оводная
питьевая вода, согласно стандартам, всегда обладает опреде-
ленной степенью жесткости, т. е. содержит соединения кальция,
которые на свинцовой поверхности образуют нерастворимую
в воде защитную пленку из карбоната или сульфата свинца.
Только родниковая вода, богатая кислородом и углекислотой,
способна в какой-то степени растворять свинец, и поэтому, если
пустить ее по свинцовому трубопроводу, то она могла бы приве-
сти к свинцовому отравлению.
Крупным потребителем свинца является кабельная промыш-
ленность. Бесшовная свинцовая оболочка прекрасно защищает
кабель, проложенный под землей или по морскому дну, и вместе
с тем не препятствует намотке или прокладке кабеля, поскольку
свинец очень пластичен. Из свинца изготовляют аппараты, ре-
зервуары и трубопроводы для серной кислоты. При взаимодей-
ствии с серной кислотой на поверхности свинца образуется
(правда, только в определенном диапазоне концентраций и тем-
ператур) плотная пленка сульфата, которая и защищает его от
кислоты. Из-за малой прочности свинца детали химической ап-
паратуры, как правило, не целиком изготовляют из него, а де-
лают из других материалов, на которые наносят однородное
свинцовое покрытие. Чтобы покрыть сталь свинцом, на нее сна-
чала необходимо нанести промежуточный слой из другого ме-
талла, так как железо и свинец не сплавляются между собой.
128
В качестве такого металла чаще всего используют олово, которое хорошо спла-
вляется как с железом, так и со свинцом. Однако гомогенное свинцевание—
весьма дорогой и трудоемкий технологический процесс, поэтому довольно ча-
сто стальные резервуары просто облицовывают свинцовыми листами.
Для легирования свинца используют главным образом сурьму и олово.
Сурьма, которую вводят в сплав в количестве 0,5—13%, повышает твердость
свинца; такие сплавы получили название «гартблей» (по-немецки—«твердый
свинец») или просто «гарт». Из свинцовых сплавов с добавками сурьмы и олова
делают подшипники скольжения и отливают типографский шрифт. Подшипни-
ки представляют собой ответственные узлы машин, которые работают под зна-
чительными нагрузками. В качестве материала для вкладышей подшипников хо-
рошо зарекомендовали себя свинцовые сплавы «баббиты» (названные так
в честь их изобретателя). Структуру таких сплавов составляют твердые иголь-
чатые частицы, залегающие в мягкой основе. Частицы служат каркасом и обес-
печивают сопротивление износу, а мягкая основа действует как дополнительная
смазка. Инородные твердые частицы, которые попадают в смазочное масло, на-
пример, в результате стирания стальных деталей, обволакиваются мягкой осно-
вой баббита и не причиняют вреда подшипнику.
Для отливки типографского шрифта используют различные сплавы свинца;
они обладают не только необходимой твердостью и прочностью, но и хороши-
ми литейными свойствами—последние определяются температурой плавления
и жидкотекучестью металла. Наиболее распространенный свинцовый сплав для
наборно-отливных машин содержит 11% сурьмы и 4% цинка.
Заканчивая наше знакомство со свинцом, напомним, что в античные времена
и в период раннего средневековья были известны круглые свинцовые стержень-
ки, которыми, как и современными графитовыми, можно было чертить линии,
хотя вряд ли они годились для письма. Предшественники современных каранда-
шей появились в XII в., они назывались серебряными (silberstift), но состояли из
смеси олова и свинца. Такими карандашами пользовались и художники, напри-
мер Ганс Гольбейн старший.
Гарт—общее название сплавов
свинца с сурьмой, содержащих от
0,5 до 13% сурьмы. Типографские
наборы отливают из сплавов, ко-
торые помимо этого содержат так-
же олово и иногда медь.
129
Горячее цинкование стальных дета-
лей производят путем, кратковре-
менного погружения их в распла-
вленный цинк. Поверхность стали
покрывается плотным, прочно сце-
пленным с ней слоем цинка.
«Крик» металла
Если согнуть кусок олова, мож-
но отчетливо услышать харак-
терный хруст или скрип. Олово
принадлежит к тем металлам,
которые при деформировании
способны образовывать кри-
сталлические двойники. Это оз-
начает, что под действием внеш-
ней силы некоторые довольно
большие (в микроскопическом
масштабе) участки кристалличе-
ской решетки скачкообразно
переходят в положение, зеркаль-
но симметричное по отношению
к первоначальному. Образова-
ние таких двойников повышает
способность металла к пласти-
ческой деформации. В отличие
от других металлов, способных
к двойникованию, олово в про-
цессе зарождения двойников из-
дает хрустящий звук1.
Сегодня уже известно, что
многие процессы внутри метал-
ла протекают не столь бесшум-
но, как считалось ранее. Зву-
ковые импульсы возникают при
элементарных актах пластиче-
ского деформирования, при
образовании и росте трещин.
Правда, в большинстве случаев
частота этих звуков лежит выше
границы чувствительности чело-
веческого уха—в области
16 кГц. Анализ звукового излу-
чения (акустической эмиссии)
металлов является в наши дни
одним из новых методов нераз-
рушающих испытаний материа-
лов, который позволяет обнару-
живать скрытые в них дефекты
1 Процесс двойникования сопро-
вождается заметными звуковыми
эффектами и при деформировании
сплавов вольфрама с рением.—
Прим. ред.
Следующий тяжелый цветной металл—цинк; он служит
главным образом для защиты от коррозии стальных изделий.
Цинк относится к металлам с гексагональной кристаллической
решеткой, вследствие чего деформация скольжением происхо-
дит в нем только по базисной плоскости элементарной ячейки;
поэтому при комнатной температуре цинк довольно хрупок.
При более высоких температурах цинк легче поддается дефор-
мации, плавится он при 419,5° С. По объему мирового производ-
ства (около 5 млн. т в год) цинк занимает среди цветных метал-
лов третье место после алюминия и меди.
Цинк устойчив к коррозии на воздухе и в воде (с раство-
ренным в ней воздухом) благодаря образованию на его поверх-
ности плотных и прочно сцепленных слоев карбоната цинка
(соль основного характера). Для защиты от коррозии на
стальные изделия различными способами наносят цинковые по-
крытия. Например, при горячем цинковании подлежащее обра-
ботке изделие погружают в расплавленный цинк. При диффу-
зионном цинковании (так называемой шерардизации) мелкие
стальные детали, например гвозди, винты, скобяные приборы,
загружают вместе с тонким цинковым порошком и песком
в медленно вращающийся барабан и выдерживают при темпе-
ратуре до 400° С. Широко используют и гальваническое цинко-
вание стальных деталей. Оно обладает рядом преимуществ: во-
первых, при этом толщину слоя можно точно регулировать
в зависимости от назначения детали; во-вторых, между цин-
ковым защитным покрытием и основным металлом не обра-
зуется никаких хрупких промежуточных слоев из сплавов, и, на-
конец, в этом случае отпадает необходимость в нагреве. Все
130
названные методы цинкования позволяют получать цинковые
покрытия толщиной 0,02—ОД мм.
Цинковые сплавы, используемые для литья под давлением,
содержат добавки алюминия, меди и магния. Они обладают от-
личными литейными свойствами и позволяют получать тонко-
стенные прецизионные отливки сложной конфигурации.
Цинковый сплав с 22% алюминия обладает чрезвычайно ин-
тересным свойством—сверхпластичностью. Под растягиваю-
щей нагрузкой этот сплав способен удлиняться на 1000%, т.е.
в 20—50 раз больше, чем обычные металлические материалы.
Листы из такого цинково-алюминиевого сплава приобретают
сверхпластичное состояние при температуре 260—270° С и не-
обычайно легко поддаются операциям формообразования. При
комнатной температуре прочность сплава достигает 300 Н/мм2,
и не исключено, что когда-нибудь такой сплав будут применять
для кузовов автомобилей.
Около четверти всего производимого в мире цинка расхо-
дуется на легирование других металлов, преимущественно лату-
ней и иных медных сплавов.
Олово—древний металл, который по сей день сохраняет
большое значение, хотя области его применения теперь совер-
шенно иные. В бронзовом веке олово вместе с медью служило
важнейшим металлическим материалом. Оловянной посудой
пользовались повсюду и в средневековье, и даже в прошлом сто-
летии. С развитием консервной промышленности олово нашло
новое важное применение—многие миллиарды консервных ба-
нок делают из белой жести, т. е. из луженой (покрытой оловом)
тонколистовой стали. Сегодня для этой цели употребляют по-
чти половину мирового производства олова. При нормальных
температурах олово способно чрезвычайно долго противо-
стоять коррозии на воздухе и в воде. С течением времени по-
верхность этого металла утрачивает блеск, и на ней образуется
плотный и прочный окисный слой, который предохраняет изде-
лие от дальнейшей коррозии. Олово принадлежит к самым лег-
коплавким тяжелым металлам—его точка плавления составля-
ет всего 232° С. Олово нетоксично и не влияет на вкус пищевых
продуктов. Поэтому вполне закономерен путь, пройденный
этим металлом от посуды и кубков до консервных банок. К со-
жалению, запасы олова на земле невелики и его приходится упо-
треблять очень экономно. Ежегодно в мире производят лишь
около четверти миллиона тонн олова.
и процессы деформации. Чув-
ствительные приборы регистри-
руют неслышимые для человека
звуковые импульсы, преобра-
зуют их в электрические сиг-
налы и производят дальнейшую
электронную обработку послед-
них. Эти методы используются
в очень широком диапазо-
не частот: приблизительно
50 кГц—1,5 МГц.
Анализ звукового излучения
материалов—очень молодой
метод, но он уже блестяще заре-
комендовал себя на практике,
особенно в обнаружении дефек-
тов, возникающих в стенках кру-
пных резервуаров и трубопрово-
дов при испытаниях под давлени-
ем. Акустические датчики, прило-
женные в определенных местах
к резервуару, очень точно реги-
стрируют момент, когда давле-
ние достигает критической вели-
чины, что позволяет вовремя
прекратить испытание и устра-
нить выявленный дефект. Не
будь таких датчиков, давление
могло бы превысить критиче-
скую величину и наступило бы
разрушение резервуара. Подоб-
ный метод нашел применение
и в ядерной энергетике для кон-
троля состояния баков высокого
давления в ядерных реакторах.
Правда, здесь возникают допол-
нительные трудности, свя-
занные с шумовым фоном, вы-
сокими температурами и радиа-
цией. Однако эти трудности
удается преодолеть, и в настоя-
щее время метод анализа звуко-
вого излучения считается на-
илучшим для текущего контро-
ля резервуаров высокого давле-
ния в ядерных реакторах,
к надежности которых предъя-
вляются чрезвычайно высокие
требования.
Микрошлиф, приготовленный на
образце недеформированного олова
(х 20).
131
Экономический шпионаж
и белая жесть
В эпоху феодализма получила
развитие экономическая поли-
тика, известная в истории под
названием «меркантилизм» (от
французского mercantile: тор-
говый, купеческий). Цель этой
политики состояла в экономиче-
ском укреплении государства.
А поскольку государство в те
времена олицетворял собой го-
сударь (вспомним выражение,
приписываемое французскому
королю Людовику XIV: «Госу-
дарство—это я»), такая полити-
ка означала усиление абсолют-
ной власти и могущества коро-
лей, князей и прочих монархов.
Тогда же возникло понятие тор-
гового баланса государства.
Феодальные владыки, увеличи-
вая вывоз товаров, стремились
получить как можно больше де-
нег и драгоценных металлов,
чтобы покрыть возрастающие
расходы на атрибуты роскош-
ной жизни—своей и своего дво-
ра. Для этого пользовались раз-
ными способами: приглашали
специалистов из других стран,
чтобы создать у себя мануфак-
туры, производящие товары «на
экспорт», или посылали за гра-
ницу своих «разведчиков»,
чтобы разузнать там секреты
технологии производства.
Одним из таких «разведчи-
ков» был Эндрю Яррантон, ко-
торый считается основополож-
ником английской политической
экономии. В 1665 г. он получил
задание разведать место и тех-
нологию изготовления белой
жести в Саксонском княжестве.
В саксонских Рудных горах бе-
лую жесть делали уже с 1536 г.
Листовая прокатка тогда была
неизвестна и сырые листы обра-
батывали на ковочных машинах
с приводом от водяного колеса.
Из такой черной жести затем пу-
тем лужения приготовляли бе-
лую жесть отличного качества.
В этой области Саксонскому
княжеству принадлежала моно-
полия. Основным покупателем
Оловянные покрытия наносят не только на сталь, но и на чу-
гун, медь и медные сплавы. Этот безупречный в гигиеническом
отношении и стойкий к коррозии слой получают различными
способами, чаще всего погружая изделие в расплав олова или
гальваническим путем. Толщина оловянного покрытия на луже-
ной с обеих сторон белой жести составляет около 0,002 мм с ка-
ждой стороны; следовательно, на 1 м2 белой жести расходуется
приблизительно 30 г олова. Из оловянных сплавов практиче-
ское применение нашли только мягкие припои; все остальные
сплавы, содержащие олово, имеют в своей основе другой ме-
талл. Широко распространенные оловянно-свинцовые припои
содержат 25 —70% олова.
Наконец, обратимся еще к одному металлу, который завер-
шает собой ряд традиционных, давно известных тяжелых метал-
лов. В средние века саксонские горняки пытались получать медь
из красно-бурого гравия, считая его медной рудой. Но все попы-
тки были тщетны. Тогда они решили, что их дурачит злой
горный дух по имени Никель, и присвоили этому минералу пре-
небрежительное название «купферникель» (буквально—«злой
дух меди»). В память об этой древней истории шведский химик
и минералог А. Кронштедт назвал никелем металл, открытый
им в 1751 г.
Никель—вязкий металл с сильным блеском. По своей струк-
туре он относится к металлам с кубической гранецентрирован-
ной решеткой. Никель плавится при температуре 1455° С. Как
и железо, его можно ковать, прокатывать и вытягивать в прово-
локу. Предел прочности никеля при растяжении составляет
400—700 Н/мм2. Он устойчив к коррозии в воде, в том числе
морской, в щелочах, растворах солей и многих органических
кислотах. Никель можно легировать различными элементами.
Обладая такими достоинствами, этот металл мог бы стать
в технике серьезным конкурентом железу, но, к сожалению,
в природе он встречается гораздо реже. Мировое производство
никеля составляет около полумиллиона тонн в год, т. е. в тысячу
раз меньше, чем производство стали. Половина этого количе-
ства никеля идет на легирование сталей—в сталеплавильном
производстве он является одним из важнейших легирующих
элементов. Никель повышает вязкость и прочность низколеги-
рованных сталей и коррозионную стойкость и жаропрочность
высоколегированных сталей.
В последнее время особенно возросло техническое значение
никелевых сплавов. Сплавы железа с никелем применялись еще
тогда, когда никель, по существу, не был известен—именно та-
кой сплав, содержащий до 10% никеля, представляет собой ме-
теоритное железо. Из медно-никелевых сплавов чеканили мо-
неты во II тысячелетии до н.э. Древнекитайский металл
«пафонг» был не чем иным, как сплавом меди с цинком и нике-
лем, и только в начале XIX в. примерно такой же сплав начали
делать в Германии под названием «нейзильбер». Но лишь го-
раздо позже никелевые сплавы нашли широкое применение
в технике. Прежде всего здесь следует отметить сплавы никеля
с медью, которые легко поддаются горячей и холодной обра-
ботке давлением, обладают достаточной прочностью, особенно
при повышенных температурах, хорошо сопротивляются изно-
су и коррозии, имеют высокое электросопротивление, причем
оно лишь незначительно изменяется с температурой.
Никель и медь полностью смешиваются между собой как
в жидком, так и в твердом состоянии, образуя непрерывный (по
132
белой жести была Англия. Хотя
англичане располагали лучшей
железной рудой и хорошим оло-
вом, делать белую жесть они не
умели. И Англия не хотела боль-
ше мириться с таким положе-
нием. В опубликованном в 1681 г.
трактате «Способы укрепле-
ния Англии на море и на суше»
Яррантон так писал о своей
«творческой командировке»:
«Мне предоставили достаточ-
ную сумму денег, чтобы покрыть
расходы на путешествие туда,
где делают листы белой жести.
Оттуда я должен был привезти
искусство ее изготовления».
«Путешествие» прошло ус-
пешно, и приготовленная по
указаниям Яррантона белая
жесть, по мнению лондонских
знатоков, оказалась гораздо
лучше, чем привезенная из Сак-
сонии. Но все же производство
белой жести в Англии продвига-
лось очень медленно. Только
в начале XVIII в., когда за боль-
шие посулы удалось привезти
в Англию опытных металлур-
гов, дело сдвинулось с мертвой
точки. И поскольку в Англии
для изготовления листовой ста-
ли применялись более произво-
дительные прокатные станы, эта
страна вскоре стала крупней-
шим изготовителем и экспорте-
ром белой жести.
Это не космическая ракета,
а фотоэлектронный умножитель.
Такие устройства широко приме-
няются в ядерной физике, например,
для счета частиц в пузырьковых ка-
мерах. Отдельные детали фотоум-
ножителя изготовлены из раз-
личных металлических материалов,
таких как никель и его сплавы, же-
лезная проволока в медной оболоч-
ке, легкие сплавы. На катод путем
напыления нанесен сплав из сурьмы,
калия, натрия и цезия.
133
составу) ряд твердых растворов. Все свойства медно-никелевых сплавов плавно
изменяются в зависимости от относительного содержания в них этих металлов,
причем кривые таких изменений, как правило, имеют ярко выраженные макси-
мумы и минимумы. Чистый никель при температурах ниже 353° С ферромагни-
тен. Эта точка Кюри равномерно снижается с увеличением содержания меди.
При комнатной температуре ферромагнетизм сохраняется только у сплавов, со-
держащих больше 66% никеля.
Добавляя другие элементы, можно значительно улучшить обрабатывае-
мость и эксплуатационные свойства медно-никелевых сплавов. Например,
сплавы с 30—50% никеля широко применяются в электрических резисторах. Жа-
ропрочные и коррозионно-стойкие сплавы, содержащие больше 50% никеля, из-
вестны под общим названием «монель-металл». Когда-то так назвали «есте-
ственный» сплав, который непосредственно выплавляли из некоторых
канадских руд.
Добавка хрома придает никелю стойкость в агрессивной окислительной сре-
де. Нихромы, т. е. сплавы никель—хром и никель—хром—железо, хорошо заре-
комендовали себя как материалы для нагревательных элементов. Необычайно
жаропрочные «суперсплавы» на основе никеля наряду с хромом, молибденом
и железом содержат также вольфрам, титан и алюминий. Они способны к дис-
персионному упрочнению в результате термической обработки, предел прочно-
сти этих сплавов превышает 1000 Н/мм2; весьма высока и их жаропрочность
в температурном интервале 800—1000° С. Такие сплавы представляют собой
превосходный материал для лопаток турбин реактивных двигателей.
Из чистого никеля и никелевых сплавов изготовлены внутренние детали
электронных ламп. Для некоторых специальных целей применяются сплавы ни-
келя, обладающие особыми магнитными свойствами или заданным коэффи-
циентом теплового расширения.
Никель—один из самых распространенных материалов для антикорро-
зионных и декоративных покрытий. Чаще всего никелевые покрытия наносят
гальваническим путем. Около 20% мирового производства никеля идет на галь-
ваническое никелирование изделий из других металлов.
Благодаря столь разностороннему применению никель играет заметную
роль в технике. Есть основания полагать, что в будущем значение никеля еще бо-
лее возрастет.
Люди называют их «благородными»
Когда заходит речь о благородных металлах, большинству из нас приходят
на ум серебро, золото и платина. Но кроме них существуют еще пять менее из-
вестных благородных металлов. Они носят общее название платиновых, потому
что вместе с платиной входят в восьмую группу периодической системы Менде-
леева (к этой группе относятся также железо, никель и кобальт), тогда как сере-
бро и золото (вместе с медью) включены в первую дополнительную группу.
Платиновые металлы—это рутений, родий, палладий, осмий и иридий.
Названием «благородных» все эти металлы обязаны своему «аристократиче-
скому характеру»: они гораздо реже, чем остальные металлы, вступают в хими-
ческие реакции и образуют соединения с другими элементами. По этой причине
они (в том числе и серебро) встречаются в природе почти исключительно в само-
родном, т. е. более или менее чистом, виде. Однако это не означает, что благо-
родные металлы в принципе неспособны к химическим реакциям и, следователь-
но, абсолютно не поддаются коррозии. Например, серебро корродирует в газах,
содержащих серу, и поверхность серебряных предметов покрывается корич-
невым или черным слоем сульфида серебра даже при ничтожном содержании
в воздухе сернистых соединений. Золото тоже не так устойчиво, как обычно ду-
мают. Его сильно разъедают хлор и бром, а в смеси (в пропорции 3 :1) концентри-
рованных соляной и азотной кислот (так называемой царской водке) раство-
ряются и золото, и платина. Если платиновые металлы нагревать на воздухе,
134
они образуют летучие окислы. Тем не менее они по праву носят название «бла-
городных», так как остаются стойкими в очень жестких условиях. Наряду с вели-
колепной коррозионной стойкостью эти металлы обладают и другими достоин-
ствами, которые делают их незаменимыми для специальных технических целей;
сюда, в частности, относятся непревзойденная электропроводность серебра, хо-
рошие механические свойства платиновых сплавов, сохраняющиеся и при высо-
ких температурах, а также специфические свойства, особенно ценные при изгото-
влении электрических контактов.
Наиболее часто встречается самый дешевый из благородных металлов—се-
ребро. В чистом виде это белый, очень пластичный металл. Грамм серебра мож-
но вытянуть в проволоку длиной почти 2 км. Серебро плавится при 960,5° С. Его
легируют многими металлами—чаще всего медью и кадмием, а также оловом,
ртутью, золотом, платиной и другими платиновыми металлами.
С тех пор как люди узнали серебро, они пользуются им как мерой стоимости.
В Китае, Эфиопии, Афганистане и Иране вплоть до 30-х годов были в ходу сере-
бряные деньги. В древней Руси деньгами служили бруски из серебра. Если товар
стоил дешевле целого бруска, последний рубили на куски, отсюда и пошло наз-
вание денежной единицы—«рубль».
Ежегодно в мире производится меньше 10000 т серебра. В настоящее время
его больше всего добывают в Мексике, США и Канаде.
Для технического применения некоторые свойства серебра имеют особое
значение. Электрические контакты, срабатывающие бесчисленное количество
раз, должны состоять из материала, который хорошо проводит ток и способен
выдержать многочисленные включения-выключения. Помимо чистого сере-
бра—его наносят на контактные поверхности гальваническим способом или пу-
тем плакирования—для таких контактов используют также сплавы серебра
с кадмием и палладием, из которых изготавливают самые ответственные кон-
такты. Недавно были разработаны сплавы серебро—окись кадмия. Их полу-
чают из сплавов серебра с кадмием методом «внутреннего окисления», путем
отжига на воздухе или в кислородной среде. При этом кислород проникает
в глубь металла и там реагирует с более активным (по сравнению с серебром)
кадмием. Образующиеся мельчайшие частицы окиси кадмия, равномерно рас-
пределенные в структуре металла, значительно повышают его прочность.
Серебро обладает еще одной замечательной особенностью—бактери-
цидным действием. Оно убивает болезнетворных и гнилостных бактерий. По-
этому вполне можно поверить древнему историку, писавшему, что во время
Серебро встречается в природе в ви-
де самородного металла. Это при-
чудливое «растение» (серебро на
кальците) найдено в шахте вблизи
Фрейберга.
135
Металлы, особенно золото, человек с незапамятных времен использует для украшений. Эти брон-
зовые спиральные браслеты с львиными головами, покрытые золотой фольгой, имеют длину
5,5 см, ширину 1,5 см и диаметр 7,6 см. Они найдены в скифском кургане (IV в. до н. э.).
похода Александра Македонского в Индию (IV в до н. э.) офицеры его армии
меньше страдали от желудочно-кишечных заболеваний, чем рядовые воины.
Они ели и пили то же самое, но из серебряной, а не из оловянной посуды. Сере-
бро стерилизует воду, даже когда содержится в количестве миллиардных долей
грамма на литр. По этой причине серебро довольно широко применяют для по-
крытия трубопроводов, арматуры и резервуаров в молочной; пивоваренной
и других отраслях пищевой промышленности.
Серебро и его сплавы с их высокой коррозионной стойкостью используют
для изготовления особенно ответственных специальных элементов в химиче-
ской аппаратуре и оборудовании. Например, серебряные тигли пригодны для
расплавления солей или щелочей, которые оказывают разрушающее воздей-
ствие на большинство других металлов. Превосходными качествами обладают
и серебряные припои: они дают прочное паяное соединение, хорошо проводя-
щее тепло и электрический ток.
Значение серебра в технике непрерывно растет. Можно полагать, что суще-
ствующие ныне пропорции в потреблении серебра (большая доля его идет на
монеты и ювелирные изделия1 в будущем значительно изменятся в пользу тех-
нических применений.
Самый известный и прославленный из благородных металлов—золото. Ни-
какой другой металл не стоил людям столько пота, слез и крови, как золото. Ра-
ди него обманывали и убивали, плели интриги и развязывали войны, жестоко уг-
нетали и истребляли целые народы. Желтый металл привлекал человека на всех
1 Существенная доля добываемого сегодня серебра расходуется на приготовление фотографи-
ческих эмульсий (кино- и фотопленок, фотопластинок, фотобумаги).—Прим. ред.
136
Золотые сплавы приобретают все
большее значение в технике, особен-
но в электронной промышленности.
На микрофотографии сплава золота
с 31,5% галлия видна эвтектическая
структура между интерметалличе-
скими фазами AuGa и AuGa2
(хЗОО).
Микроструктура сплава золота с 6%
кремния в литом состоянии напоми-
нает старинный индейский орна-
мент ( х 500).
этапах истории, он и до сего времени не утратил своей притяга-
тельной силы, не говоря уже о том, что в мире золото служит
всеобщим эквивалентом товарной стоимости. Почему? Это не
так легко объяснить. Пару столетий назад этот металл в технике
был абсолютно бесполезен. Делать из золота оружие или ин-
струмент не имеет смысла—оно слишком мягкое. Да и в наше
время техническое применение золота ограничено немногочис-
ленными и сугубо специальными случаями; например, его ис-
пользуют на советских космических аппаратах как материал для
уплотнений.
За долгую историю человечества добыто всего около
50000 т золота, и большая часть его благополучно хранится
в сейфах. Из того золота, которое ежегодно добывают в совре-
менном мире, 50% идет на чеканку монет, 20% на ювелирные из-
Золото как лекарство
Золото, которое люди так почи-
тают и ценят, должно быть по-
лезно и для здоровья—подоб-
ное мнение было широко рас-
пространено еще двести лет
назад. В августе 1791 г. в немец-
ком «Металлургическом журна-
ле» со ссылкой на Берхааве
10-430
137
(1668—1738) описывалось дей-
ствие (скорее бездействие) зо-
лотых микстур и пилюль. Ав-
торы рассказали историю
о некоем владетельном князе,
который каждый день про-
глатывал изрядное количество
золота, считая, что оно способ-
ствует пищеварению и оказы-
' вает укрепляющее действие.
Кункель фон Левенштерн
(1638—1703) весьма необычным,
но очень убедительным спосо-
бом доказал князю, что золото
нерастворимо в «со^ах челове-
ческого тела» и поэтому беспре-
пятственно выводится из орга-
низма. Левенштерн велел со-
брать экскременты князя и из-
влек из них золото, а затем
сделал из него большую пугови-
цу, которую пришил себе на
платье. На вопрос удивленного
князя, что означает такая боль-
шая пуговица, Левенштерн отве-
тил: «Я ношу здесь ваше здо-
ровье».
Но это было давно. А в наше
время в медицине находят при-
менение некоторые искус-
ственные изотопы золота, пре-
имущественно с массовым чис-
лом 198 и 199. Оба они радиоак-
тивны и испускают альфа-
и гамма-излучение. Эти изо-
топы в виде игл, нитей или
мелкого порошка используют
для лечения злокачественных за-
болеваний крови.
делия, столько же потребляет стоматология, а на долю техники
остается только 10%.
В одном золото абсолютно превосходит все другие ме-
таллы: оно как ни один из них поддается пластическому дефор-
мированию. Из одного грамма золота можно вытянуть прово-
локу длиной 3 км, а золотую фольгу удается сделать такой
тонкой, что она становится почти прозрачной на просвет и вы-
глядит голубой или зеленоватой. Золото плавится при 1063° С.
Оно принадлежит к самым тяжелым металлам: 1 см3 золота
имеет массу 19,32 г. Важнейшими легирующими элементами
в золотых сплавах служат медь и серебро, в качестве добавок
применяют также никель и платиновые металлы.
В электротехнике чистое золото используют для покрытий
контактов, а сплавы золота с никелем или серебром—как мате-
риал для самих контактов. Из сплава золота, содержащего до
50% платины (иногда еще 0,5% родия), делают фильеры для про-
изводства химических волокон. Другие сплавы золота находят
применение в лабораторной технике; например, для изготовле-
ния тиглей, кювет и катодных сеток вместо чистой платины ис-
пользуют сплав серебро—золото—платина.
Значение золота и его сплавов в технике продолжает расти,
однако титулом «царя металлов» оно пользуется не за какие-то
особые выдающиеся технические качества. В первую очередь
это особое положение золота обусловлено его ролью в мировой
валютной системе и ювелирном деле.
Платина встречается реже золота и в наши дни ценится го-
раздо дороже его. Но было время, когда платина стоила деше-
вле серебра. Когда испанские завоеватели начали в больших ко-
личествах привозить платину из Южной Америки, ювелиры
стали использовать новый металл для подделки золота. Они че-
канили монеты из сплавов золота с платиной, которые вслед-
ствие большой плотности платины—она даже немного тяжелее
золота (1 см3 платины имеет массу 21,45 г)—были такого же ве-
са, как и настоящие золотые. Чтобы положить конец этому мо-
шенничеству, чиновники испанского казначейства просто утопи-
ли в море весь запас платины, которую им удалось
конфисковать. Через сотни лет платину снова начали использо-
вать для монет, но теперь уже потому, что она стала существен-
но дороже золота. В России, которая до 1914 г. давала 95% ми-
рового производства платины, в период 1828—1845 гт. чеканили
Схематическое расположение ато-
мов в кристалле при образовании
двойников.
платиновые монеты—так называемые белые дукаты с номина-
лом три, шесть и двенадцать серебряных рублей. Трехрублевый
платиновый дукат имел массу 10,35332 г. Сегодня Советский
Союз занимает ведущее место среди стран, добывающих
платину.
Платина—серовато-белый блестящий, мягкий и хорошо де-
формируемый металл. Ее температура плавления (1773,3° С) бо-
лее чем на 200° выше, чем у железа. Химическая стойкость пла-
тины очень высока: кислоты на нее не действуют (за
исключением царской водки), с кислородом она не реагирует да-
же при нагреве. Поэтому платина служит материалом для лабо-
раторной аппаратуры, работающей в самых тяжелых условиях.
Так, платина абсолютно устойчива в расплавленном стекле, и из
нее делают плавильные тигли для варки оптического стекла,
требования к чистоте которого особенно высоки. Платиновые
фильеры применяются в производстве стеклянного волокна.
В электротехнике платина и ее сплавы также чрезвычайно ценят-
ся как материалы, которые обеспечивают высокую надежность
и точность срабатывания различных переключающих
устройств.
Для легирования платины используют преимущественно ее
«ближайших родственников»—платиновые металлы (палладий,
родий, рутений, осмий и иридий). Платинородиевые сплавы от-
личаются прочностью и стойкостью при высоких температурах.
Платиноиридиевые сплавы приняты в качестве материала для
международных эталонов массы и длины, потому что обладают
наиболее подходящими для этой цели химическими и физиче-
скими свойствами. Парижские первичные эталоны метра и ки-
лограмма, как и их копии, находящиеся в различных странах, со-
стоят из сплава платины с 10% иридия. Из подобных сплавов,
прочных и химически стойких, изготовляют также канюли
и другие элементы медицинского инструментария.
Платиновые металлы редко применяются в чистом виде.
Иридий по химической стойкости превосходит платину и при
комнатной температуре слабо растворяется даже в царской вод-
ке. Из иридия изготовляют тигли для специальных целей, но
этот металл очень тверд и с трудом поддается деформирова-
нию. Его плотность составляет 22,42 г/см3, по плотности он за-
нимает второе место среди металлов. Самый тяжелый ме-
талл—осмий; его плотность равна 22,48 г/см3, по твердости
и прочности он подобен иридию. В природе существует сплав
этих двух металлов, называемый «осмирид», из которого пре-
жде делали наконечники для перьев авторучек. Теперь для этой
цели используют сплавы осмий—никель и осмий—вольфрам—
кобальт. Палладий служит главным образом как легирующий
металл при получении серебряных, золотых и платиновых спла-
вов. В чистрм виде он слишком активно насыщается газами; на-
пример, при комнатной температуре палладий способен погло-
щать водород в 800-кратном объеме.
Родий, как и палладий, служит преимущественно для легиро-
вания платиновых сплавов. Из родиевой ленты изготовляют
электронагреватели с рабочей температурой до 1800° С.
Рутений также почти не применяется в чистом виде. В неко-
торых сплавах им иногда заменяют осмий.
Благородные металлы находят самые разнообразные приме-
нения в современной технике, но по сравнению с другими техни-
ческими металлами их количественная доля очень невелика, по-
скольку они слишком дороги.
От фунта к единице СИ
В свое время Агрикола, как
и многие другие до и после него,
жаловался на трудности, свя-
занные с измерениями. Каждый
феодал в своих владениях про-
извольно устанавливал меры,
стремясь таким способом полу-
чить с подданных больше по-
датей натурой и деньгами. К то-
му же величина одной и той же
единицы измерения нередко ме-
нялась в зависимости от того,
что именно ею измеряли. Так,
в Венеции были приняты три
разных фунта. Тяжелыми фунта-
ми венецианцы отвешивали све-
жее мясо, некоторые другие про-
дукты и металлы (исключение
составляли золото, серебро и из-
делия из них, а также жемчуг,
которые измеряли так назы-
ваемыми золотыми или сере-
бряными горошинами). Легкий
фунт служил для взвешивания
изюма, некоторых фруктов, кра-
сок, пряностей и т.д. Аптекари
же отмеряли медикаменты ме-
дицинскими фунтами. Подобная
неразбериха встречалась повсю-
ду. Любое государство, пусть
даже крошечное, имело свои соб-
ственные единицы измерения.
Лишь во второй половине
XIX в. получила общее призна-
ние метрическая система мер,
разработанная во Франции
и вначале только там действо-
вавшая. Затем в 1875 г. 17 госу-
дарств подписали в Париже
«Международную метрическую
конвенцию». За последние сто
лет усилиями ученых и инжене-
ров единицы измерения посте-
пенно все более уточнялись. Но
научно-технический прогресс
настоятельно требовал созда-
ния единой международной сис-
темы. Такая Международная си-
стема единиц была принята
в 1954 г. на X Генеральной кон-
ференции по мерам и весам, а на
следующей конференции в 1960г.
этой системе присвоили со-
кращенное наименование СИ
(SI—System International).
В ГДР система СИ введена
ю*
139
Таблица 4
Пересчет в единицы СИ
Стари единица Единица СИ Соотношение
Тонна (т)1 Килограмм (кг) 1 Т = 103 КГ
Килограмм-сила (кгс) Ньютон (Н) 1 КГС = 9,81 Н
Техническая атмосфера Паскаль (Па) 1 ат = 9,81 КМ Па
Калория (кал) Джоуль (Дж) 1 кал = 4,19 Дж
1 Тонна временно допускается.
в 1968 г. в виде официальной
«Таблицы основных единиц»1.
Правда, до 1 января 1981 г. раз-
решено пользоваться некоторы-
ми старыми единицами, но по
истечении этого срока будут до-
пускаться только единицы СИ.
Последовательное примене-
ние системы СИ позволит в мак-
симальной степени упростить
все расчеты. Она устранит пута-
ницу с различными единицами
«физической» и «технической»
систем, которые господствовали
еще в 50-х годах, что безусловно
облегчит и международные свя-
зи в области йауки, техники
и торговли.
Система СИ базируется на
Иридий, очень редкий металл, из-
влекают из мансфельдских ме-
дистых сланцев (ГДР). Сплав ири-
дия с сурьмой (антимонид иридия)
применяется как полупронодни-
ковый материал. На микрофотогра-
фии этого сплава видна структура,
возникшая в результате двойнико-
вания.
пяти основных единицах:
Длина
Масса
Сила тока
Температура
Сила света
—метр (м)
—килограмм (кг)
—ампер (А)
—кельвин (К)
—кандела (кд)
Все другие единицы СИ мож-
но получить как производные,
выразив их через основные еди-
ницы при помощи соответ-
ствующих физических уравне-
ний. Дополнительными едини-
цами СИ являются радиан
и стерадиан, в которых изме-
ряют соответственно плоские
и пространственные углы.
В данной книге мы, как прави-
ло, употребляли единицы СИ.
Чтобы пересчитать их в старые
единицы, более привычные для
читателей зрелого возраста,
можно воспользоваться табли-
цей.
Эталон метра представляет собой стержень из сплава платины с 10% иридия.
Международный эталон метра был отлит в Париже 13 мая 1874 г. Сегодня для
определения единицы длины «метр» используют длину световой волны.
1 В СССР с 1 января 1963 г. дей-
ствует ГОСТ 9867-61 «Единицы фи-
зических величин», в основе которо-
го лежит система СИ.—Прим, перев.
140
Об особых металлах
В четвертой, пятой и шестой дополнительных группах перио-
дической системы элементов места между титаном и вольфра-
мом занимают цирконий, гафний, тантал и ниобий. Они раз-
личны по свойствам и применению; объединяет их лишь то, что
все они только в последние десятилетия привлекли к себе
внимание.
Самый легкий из этих металлов—цирконий. Его открыли
(М. Клапрот) еще в 1789 г., но только в XX в. цирконий удалось
получить в чистом виде методом хлорирования (каким полу-
чают и титан). Более чистый цирконий можно получить мето-
дом иодирования, в котором иодид циркония разлагается на на-
гретой до высокой температуры циркониевой проволоке. Метод
иодирования используют и для производства других чистых
металлов.
По внешнему виду цирконий похож на сталь. Он устойчив
к соляной, азотной, серной и фосфорной кислотам и в этом от-
ношении превосходит титан и высоколегированные стали.
Плотность циркония равна 6,49 г/см3 (несколько меньше, чем
у железа), а температура плавления составляет 1852° С. По про-
чности он не уступает конструкционным сталям. Уже благодаря
этим качествам цирконий представляет определенный интерес
для техники, но он обладает и некоторыми особыми свойства-
ми. Из циркония, например, делают оболочки топливных эле-
ментов для ядерных реакторов. В такую оболочку, чаще всего
имеющую форму тонкой трубы, заключено ядерное топливо,
и она отделяет его от охладителя (теплоносителя). В реакторах
с водяным охлаждением трубу обтекает вода при температуре
200—300° С под высоким давлением. В подобных условиях ма-
териал оболочки должен быть не только устойчив к коррозии
и механическим нагрузкам, но и не нарушать нейтронный ба-
ланс реактора. Поэтому в оболочке не должно быть таких при-
месных атомов, которые сильно поглощают нейтроны. Цирко-
ний и некоторые его сплавы лучше всего удовлетворяют
комплексным требованиям, предъявляемым к конструкционным
материалам ядерных реакторов. Здесь особенно важна высокая
чистота циркония и его сплавов—в первую очередь отсутствие
в них гафния. Однако в природе этот металл сопутствует цирко-
нию, и, чтобы разделить их, требуются сложные процессы
очистки.
Цирконий является также очень эффективным легирующим
элементом для сталей и легких металлов. Сталям он придает
лучшую вязкость, уменьшая их охрупчивание при низких темпе-
ратурах. Цирконий повышает прочность и отчасти кбррозион-
ную стойкость алюминиевых и магниевых сплавов.
Гафний, постоянный спутник циркония, по химическому по-
ведению очень с ним сходен, и эти металлы трудно разделить.
Существование гафния предсказал Д. И. Менделеев, а просла-
вленный датский физик Нильс Бор установил некоторые свой-
ства тогда еще не открытого элемента. Двум сотрудникам Бо-
ра—венгерскому химику Д. Хевеши и голландскому физику
Д. Костеру—в 1923 г. удалось обнаружить гафний методом рент-
геноспектрального анализа. Свое наименование гафний полу-
чил от латинского названия датской столицы Копенгагена.
Гафний принадлежит к тугоплавким металлам, его темпера-
тура плавления составляет 1975° С. В технике это пока еще
новый материал. Интересно, что гафний и цирконий, столь по-
Почему мы иногда
сидим 'в темноте
Как только наступают сумерки,
мы включаем электрическое ос-
вещение. Это удобно, давно при-
вычно и не вызывает у нас
особых раздумий. И лишь когда
лампочка перегорает, мы обра-
щаем на нее внимание и в зави-
симости от ситуации и настрое-
ния разражаемся обвинитель-
ной речью в адрес электролам-
повой промышленности или
просто с досадой замечаем, что
в доме опять нет ни одной за-
пасной лампочки. Тогда мы на-
чинаем внимательно изучать ис-
порченную лампочку, питая
смутную (и чаще всего обманчи-
вую) надежду, что она еще мо-
жет снова загореться.
Внутри стеклянного баллона
мы видим систему, отдельные
части которой—также сте-
клянные—называются тарелоч-
ка, штабик и штенгель. Через
штенгель при изготовлении
лампы откачивали воздух. Для
подвода тока в стекло впаяны
кусочки проволоки. Раньше она
была платиновой, а теперь—
железоникелевая в медной обо-
лочке. Нить накала предста-
вляет собой двойную спираль из
вольфрамовой проволоки, а ее
держатели изготовлены из мо-
либденовой проволоки. На-
ружный резьбовой цоколь
лампы делают из мягкой листо-
вой латуни или другого подоб-
ного материала. Каждая деталь
лампы имеет свое специальное
назначение, которому должен
соответствовать применяемый
материал.
Для спиральной нити накала
лучше всего подходит воль-
фрам, так как ее температура
превышает 2000° С. Многие ме-
таллы при такой температуре
плавятся или даже испаряются,
вольфрам же выдерживает ее
много сотен часов, но и у воль-
фрамовой спирали срок службы
не безграничен. В любой лампе,
будь она вакуумная или напол-
141
ненная газом, неизбежно остает-
ся ничтожное количество кисло-
рода и водяного пара. На раска-
ленной вольфрамовой нити пар
разлагается на водород и кисло-
род. Свободный кислород со-
единяется с вольфрамом, обра-
зуя летучий окисел, который
осаждается на холодной вну-
тренней поверхности баллона.
Здесь условия таковы, что водо-
род восстанавливает вольфрам
из окисла, отнимая у него кисло-
род и снова образуя водяной
пар. Молекулы пара опять до-
стигают раскаленной вольфра-
мовой нити, разлагаются на ней,
весь процесс повторяется. В ре-
зультате вольфрам атом за ато-
мом переносится со спирали на
внутреннюю поверхность стен-
ки баллона.
Постепенно вольфрамовая
нить становится все тоньше,
а стеклянный баллон покры-
вается изнутри темным нале-
том. Лампа светит слабее. Нако-
нец, когда вольфрамовая нить
становится слишком тонкой,
она не выдерживает нагрузки
и рвется. Мы остаемся в темно-
те и начинаем искать новую
лампу.
хожие по многим своим свойствам, в ядерных реакторах выпол-
няют противоположные функции. Если цирконий практически
прозрачен для нейтронов, то гафний представляет для них почти
непреодолимое препятствие. Поэтому гафний используется как
замедлитель быстрых и поглотитель тепловых (т. е. медленных)
нейтронов.
Другие два сходных между собой металла—тантал и нио-
бий—в основном применяются в качестве легирующих приса-
док к специальным сталям. Они еще более тугоплавки: у танта-
ла температура плавления достигает 3000° С, у ниобия она
составляет 2415° С. Оба металла обладают высокой проч-
ностью и очень устойчивы в химически агрессивных средах. Ве-
роятно, большинству читателей тантал и ниобий мало известны,
но для специальных целей эти металлы применяются уже более
40 лет. Тантал давно используют в химической промышленно-
сти (например, в теплообменниках), для изготовления фильер,
в качестве конструкционного материала в электронике. Чистый
тантал—один из немногих металлов, которые хорошо «ужи-
ваются» с биологическими тканями. Он не вступает с ними ни
в какие реакции, не вызывает раздражения в мышцах или костях
и т. д. Поэтому для скрепления костей и мягких тканей хирурги
пользуются танталовыми пластинками, проволокой, винтами,
стержнями и скобами. По коррозионной стойкости ниобий не-
сколько уступает танталу, но превосходит его по многим дру-
гим качествам. Кубический сантиметр ниобия при комнатной
температуре способен, словно губка, впитать в себя почти литр
водорода. Эту способность ниобий сохраняет и при высоких
температурах, поэтому он служит хорошим геттером (т. е. по-
глотителем газов). Рядом полезных свойств обладают и неко-
торые соединения ниобия; например, его сверхтвердый карбид
сейчас все шире используют как материал для режущего инстру-
мента. Наконец, определенные физические свойства ниобия от-
крывают перед ним широкие перспективы в качестве конструк-
ционного материала в ядерной технике.
Главными потребителями двух других тугоплавких метал-
лов—вольфрама и молибдена—являются металлурги;
80—90% этих металлов расходуется на легирование сталей,
К материалу для полного протеза
тазобедренного сустава предъ-
являются очень высокие требова-
ния. Наряду с титановыми сплавами
здесь особенно хордшо зарекомен-
довал себя сплав кобальта с 30%
хрома и 5—7% молибдена. Для су-
ставной чашки используется полиэ-
тилен.
142
а также никелевых и медных сплавов. Но и в чистом виде оба
эти металла находят применение для некоторых специальных
технических целей.
Вольфрам—самый тугоплавкий из всех металлов, его тем-
пература плавления составляет 3410° С. По прочности он пре-
восходит лучшие стали. Холоднотянутая вольфрамовая прово-
лока выдерживает растягивающую нагрузку 4000 Н/мм2 и даже
в отожженном состоянии сохраняет прочность выше
1000 Н/мм2. Из вольфрама делают нити накала в осветительных
и электронных лампах, нагревательные элементы электро-
печей, неплавящиеся электроды для сварки в среде защитного
газа.
Молибден уступает вольфраму как по температуре плавле-
ния (2620° С), так и по прочности, но тем не менее его предел
прочности в холоднотянутом состоянии выглядит внушительно
по сравнению с аналогичным показателем для сталей. Молиб-
ден применяется для некоторых специальных целей, в частности
для изготовления подвесок анодов и катодов в электронных
лампах, а также электронагревательных спиралей. Из молибде-
на делают некоторые специальные резервуары и трубопроводы
для химической промышленности.
Металлы в будущем
Если кто-то думает, что время металлов подходит к концу и что в будущем
их место займут другие материалы, в первую очередь пластмассы, то он опреде-
ленно заблуждается. Действительно, неметаллические материалы приобретают
все большее значение, и их производство растет быстрыми темпами: по ежегод-
ному производству пластмассы уже опережают все цветные металлы, а в бли-
жайшем будущем (если считать по объему, а не по весу) оставят позади и сталь.
Однако цифры ежегодного прироста производства стали, алюминия и других
металлов однозначно свидетельствуют о том, что металлам еще суждена долгая
жизнь. Неметаллические материалы и металлы взаимно дополняют друг друга.
Материалы с новыми свойствами
В многоцветной палитре металлических материалов сталь еще долго будет
занимать самое видное место. Однако сейчас все активнее входят в жизнь новые
сплавы с совершенно особыми свойствами. Наряду с высокой прочностью,
упругостью и другими превосходными механическими свойствами новые
сплавы обладают, например, сверхпроводимостью или сверхпластичностью.
Эти материалы уже не укладываются в рамки наших традиционных представле-
ний—они характерны скорее для техники будущего. Разумеется, и в будущем
конструкторы потребуют от металлических материалов прочности, коррозион-
ной стойкости, хорошей обрабатываемости и т. д., и металлурги будут неустанно
разрабатывать все более прочные, стойкие к коррозии и лучше обрабатываемые
сплавы. Но сегодня этим уже ни в коей мере не ограничиваются замыслы ученых
и потребности инженеров. Сейчас в материаловедении возникло новое напра-
вление, оно состоит в том, чтобы придать материалам совершенно не свой-
ственные им качества. Например, предпринимаются попытки получить метал-
лические сплавы, прозрачные для света, или создать металлические материалы,
у которых свойства меняются в зависимости от условий нагружения. Даже весь-
ма осторожно сформулированные ведущими металлургами и металловедами
представления о будущих сплавах порой не менее поражают воображение, чем
вымыслы писателей-фантастов. Однако эти представления основаны на глубо-
ком научном анализе.
В поисках новых решений исследователи наталкиваются на открытия, сде-
ланные столетиями раньше, когда их никто еще не мог оценить по достоинству.
Многие из этих «старых» открытий приобрели новое значение после того, как
удалось перейти от научных экспериментов к техническому и хозяйственному
144
использованию материалов. Но для этого наука и техника дол-
жны были достигнуть соответствующего уровня развития.
Нередко к одной и той же цели ведут разные, на первый
взгляд даже противоположные пути. Типичный пример—пои-
ски путей повышения прочности металлических материалов.
Несколько упрощая картину, можно сказать, что одни ученые
с этой целью выращивают почти идеальные металлические кри-
сталлы, свободные от дефектов или, во всяком случае, содержа-
щие их возможно меньше, другие же, напротив, стремятся уве-
личить плотность дефектов в кристаллической решетке металла.
Непосвященному может показаться, что представители этих
двух научных направлений должны вести между собой неприми-
римую войну. Но на самом деле они работают мирно и дружно,
потому что оба направления имеют одну и ту же научную осно-
ву—теорию дислокаций.
Именно дислокации, т. е. определенные дефекты кристалли-
ческой решетки, способные перемещаться под действием сил,
являются в металле носителями пластичности. Без дислокаций
пластическая деформация невозможна или наступает только
при напряжении, приблизительно в тысячу раз большем того,
которое требуется при наличии свободных дислокаций. Следо-
вательно, чтобы повысить прочность (т.е. сопротивление пла-
стической деформации), нужно либо уменьшать количество дис-
локаций вообще, что и делают одни исследователи, либо
попытаться закрепить имеющиеся в металле свободные дислока-
ции, тем самым отняв у них функцию носителей пластично-
сти,—этим занимаются другие.
Чтобы понять, как происходит закрепление дислокаций, сле-
дует исходить из того, что дислокации, взаимодействуя друг
с другом, зацепляются и теряют способность двигаться, оста-
ваясь неподвижными даже при возрастании нагрузки. Таким
образом, вводя в кристаллическую решетку инородные атомы
либо подвергая металл определенной термической обработке
(или же используя оба способа совместно), можно закрепить
свободные дислокации атомами примесей и их скоплениями
и улучшить прочностные свойства металла.
Новый «прямой путь»
В ближайшие десятилетия развитие технологии материалов,
по-вцдимому, приведет к радикальным изменениям как в про-
цессах получения металлов, так и в изготовлении из них полуфа-
брикатов, т.е. листов, полос, профилей, труб.
Очевидно, в производстве стали на смену обычному сегодня
технологическому процессу с использованием чугуна в качестве
промежуточного продукта придет прямой процесс получения
стали из руды. Основную роль будут играть полностью автома-
тизированные сталеплавильные заводы с линиями непрерывной
разливки и прокатки. Вместе с тем получат развитие и принци-
пиально новые технологические процессы, а именно наряду
с производством тонких стальных профилей электролитическим
путем непосредственно из железной руды станет возможным
и получение готовых деталей методами электролиза, электро-
фореза и конденсации.
Ограниченность земных ресурсов уже сейчас заставляет че-
ловечество обратиться к огромным запасам металлов в миро-
вом океане. К началу нового тысячелетия важнейшее, если не ре-
От стремянки Иакова
к небесному лифту
В Ветхом завете (первой из двух
частей Библии) описан довольно
извилистый жизненный путь
Иакова—сына Исаака. Од-
нажды Иаков увидел во сне
лестницу-стремянку, стоящую
на земле и уходящую верхним
концом в облака; она служила
для «сообщения» между землей
и небом.
Если теперь вместо библей-
ских «исходных данных» взять
высоту стационарной орбиты—
36000 км (находясь на такой
орбите, космическая станция
остается постоянно над одной
точкой земной поверхности)
и заменить стремянку Иакова
лифтом—потому что космо-
навты едва ли смогли бы под-
няться, пешком по столь высо-
кой лестнице,—то в подобном
проекте решающую роль дол-
жен был бы играть вопрос о ма-
териале для канатов лифта. Со-
гласно расчетам советского уче-
ного Е. Р. Арзуманова, этот ма-
териал должен обладать не
такой уж невероятной про-
чностью—всего 17 000 Н/мм2,
чтобы можно было говорить
о «небесном лифте»; правда, при
этом материал должен иметь
плотность не больше, чем у во-
ды, т. е. он должен быть пример-
но в 3 раза легче алюминия.
Удастся ли когда-нибудь по-
лучить подобные материалы?
Специалисты полагают, что
в 2000 г. будут созданы мате-
риалы на основе железа с пре-
делом прочности до 9000 Н/мм2.
Это в 20 раз больше, чем у из-
вестных сегодня высокопрочных
сталей. Подобной прочности,
как предполагают, удастся до-
биться и для некоторых цветных
металлов, например титановых
и бериллиевых сплавов. Однако
это еще далеко от абсолютного
предела прочности, которого
могут достигать нитевидные
монокристаллы («усы»).
Какие же возможны дальней-
шие пути увеличения прочно-
145
ста? Металлы отличаются
очень плотной упаковкой ато-
мов в кристаллической решетке.
Если бы удалось расположить
подобным образом атомы неме-
таллов, то соответствующие
кристаллы обладали бы невоо-
бразимой прочностью. Совет-
ский ученый А. В. Степанов
рассчитал некоторые физичес-
кие свойства таких гипотети-
ческих кристаллов с плотней-
шей упаковкой: углерод в
плотноупакованном состоянии
должен иметь прочность по-
рядка 400000 Н/мм2, а азот—
2800000 Н/мм2! Конечно,
это лишь теоретические ве-
личины, которые еще долго
останутся недостижимыми. Но
они позволяют нам судить
о перспективах техники, в свете
которых «небесный лифт» уже
не выглядит чистой фантазией.
Впрочем, подъемные устройства
подобного рода уже сегодня со-
ставляют предмет исследования
нескольких групп советских
и американских ученых. И все же
пока, чтобы представить себе
материал, который в тысячи раз
прочнее лучших современных
конструкционных сталей и к то-
му же сохраняет свою про-
чность и в условиях космическо-
го холода, и при температурах
свыше 10000° С, нужно обла-
дать силой воображения и фан-
тазией Жюля Верна.
Разумеется, не следует ду-
мать, что через несколько десят-
ков лет мы будем иметь дело
только со сверхпрочными мате-
риалами. Они будут составлять
лишь малую долю среди раз-
нообразных конструкционных
материалов. Глубже изучив про-
цессы, приводящие к разруше-
нию и повреждению металлов,
мы научимся управлять ими,
и тогда конструкторы смогут
использовать при более высоких
нагрузках и традиционные мате-
риалы. При этом неразрушаю-
щие методы испытаний обеспе-
чат текущий контроль всех кри-
тических участков металличе-
ских конструкций.
шающее, значение приобретет добыча руд со дна морей
и океанов—сначала на континентальном шельфе, потом и
с больших глубин,—а также получение некоторых металлов из
морской воды. Наряду с новыми высокопроизводительными
способами переработки металлических отходов и лома широкое
применение найдут совершенно новые металлургические про-
цессы. К ним, в частности, относится бактериальная металлур-
гия, которая уже сегодня достигла определенных успехов. В пе-
чати сообщалось, что в одном из микробиологических
институтов Академии наук СССР разработан способ получения
меди из сульфидных руд с помощью бактерий, усваивающих се-
ру. Есть все основания надеяться, что микробиологическими ме-
тодами удастся извлекать и другие металлы—из бедных руд,
отходов металлургического производства и остатков («хво-
стов») на обогатительных фабриках. Не исключено, что когда-
нибудь начнут ремонтировать детали машин методом бакте-
риальной «сварки».
Металлы в космосе
Освоение космоса открывает и перед металлургами новые
технологические возможности. В невесомости резко меняются,
например, процессы течения жидкостей или теплопереноса.
В отсутствие гравитации особенно отчетлииво проявляется дей-
ствие молекулярных сил адгезии, когезии и поверхностного на-
тяжения, значительную роль начинают играть капиллярные эф-
фекты. Благодаря этому в космосе можно использовать
совершенно новые способы получения и переработки металли-
ческих и неметаллических материалов.
Для плавки здесь не требуется тигель, потому что расплав
под действием поверхностного натяжения принимает шароо-
бразную форму и свободно повисает в пространстве. Как пока-
зали советские и американские космические эксперименты, рас-
плавленная медь в космосе за 3 с образует шар диаметром
10 см. Металл не загрязняется примесями, которые на земле
переходят в него из стенок тигля. С помощью электрических
и магнитных полей свободно парящему расплаву можно при-
дать нужную форму—таким образом родилась новая техноло-
гия формообразования металлических деталей. Разные рас-
плавы, сильно отличающиеся по плотности, идеально смеши-
ваются между собой и после этого не расслаиваются—на земле
это неизбежно происходит под действием силы тяжести. Можно
даже смешивать расплавы с газами. Газ, действуя подобно
дрожжам в тесте, равномерно распределяется в расплавленном
металле, который после затвердевания приобретает вид метал-
лической губки с замкнутыми ячейками. Материал, содержащий
по весу 87% газа и 13% стали, плавает в воде как пробка. Такие
вспененные металлы открывают путь для новых конструк-
тивных решений в судостроении и авиации да и в самой косми-
ческой технике.
Электронная промышленность из года в год требует все
больше полупроводниковых материалов, притом все лучшего
качества. В недалеком будущем эти материалы чрезвычайно вы-
сокой чистоты с идеально равномерно распределенными приме-
сями (разумеется, только нужными) будут получать на орби-
тальных производственных станциях. По оценкам специали-
стов, в 2000 г. космические лаборатории дадут более 300 т такой
146
Монокристалл германия. Герма-
ний—один из важнейших полу-
проводниковых материалов.
Это- не фантастический пейзаж
какой-то далекой планеты,
а рельеф травления на поверхно-
сти германия ( х 200).
продукции. Насколько это важно для электроники, можно су-
дить хотя бы по тому факту, что уже сегодня на одном полупро-
водниковом кристалле размещают около 750 тыс. диодов, тран-
зисторов, сопротивлений и конденсаторов.
Металлургия завтрашнего дня
Мы говорим здесь не о далеких перспективах космической
металлургии. Об этом свидетельствует, например, тот факт, что
в рамках программы «Союз—Аполлон» в июле 1975 г. было
проведено 26 экспериментов по 10 темам, связанным с техноло-
гией материалов. В научно-исследовательских институтах раз-
работаны планы практического освоения внеземной металлур-
гии и металлообработки, и нам пора привыкать к мысли, что
это не утопия, а реальная технология завтрашнего дня.
Автомобиль моей мечты
Автомобиль—вещь полезная
и красивая, он облегчает и укра-
шает нашу жизнь. Но, к сожале-
нию, это не всегда так. В боль-
шом городе не проходит и часа
без пресловутых «дорожно-
транспортных происшествий»,
а тому, кто попал в аварию, ни-
как не позавидуешь, даже если
он отделался испугом. От одно-
го лишь вида пробитого капота
или вдавленной крыши кузова
начинает неприятно сосать
под ложечкой. Каждый во-
дитель, вспомнив такой момент,
подсознательно сбавляет ско-
рость и еще внимательнее сле-
дит за дорожными знаками.
И все равно никто не застрахо-
ван от мелких повреждений, ка-
кие случаются, например, на тес-
ной стоянке или в узких воротах
гаража (у всех гаражей ворота
почему-то слишком узкие!). Как
было' бы хорошо, если бы на
следующий день отвратитель-
ная вмятина на крыле или двер-
це исчезла сама собой, не причи-
няя владельцу машины тяжких
забот, связанных с ремонтом.
А ведь нечто подобное уже воз-
можно.
Существует сплав никеля с ти-
таном, обладающий одним по-
чти фантастическим свой-
ством—своего рода памятью.
Если куску этого сплава в нагре-
том состоянии придать опреде-
ленную форму, охладить, а по-
том как угодно смять или
согнуть, то при повторном на-
греве до некоторой минималь-
ной температуры он снова при-
мет первоначальную форму, ка-
кую имел после горячей дефор-
мации. Предполагают, что при
помощи дополнительных леги-
рующих элементов температу-
ру, при которой будет протекать
этот удивительный и пока еще
неясный процесс восстановле-
ния формы, можно снизить по-
чти до комнатной.
Когда ученые выяснят при-
чины и механизм этого явления,
147
появится возможность разра-
батывать специальные кон-
струкционные материалы с по-
добными свойствами. Тогда из-
готовленный из такого материа-
ла бампер, погнутый при столк-
новении, за ночь примет свою
первоначальную форму—вла-
дельцу машины достаточно бу-
дет просто включить в гараже
отопление.
Но и на земле технология металлов ищет новые пути: напри-
мер, как получить сплав, не добавляя в металл легирующих эле-
ментов. Достижения атомной физики позволяют получать
сплавы в процессе ядерных превращений. Чтобы добиться
нужных свойств металлических материалов, металлурги рас-
считывают на ЭВМ их микроструктуру. Наряду со сплавами
в традиционном смысле все большее практическое значение
приобретают так называемые композиционные материалы.
Алюминиевые и титановые сплавы, армированные волокнами
из неметаллов, превосходят по прочности не только обыкно-
венные, но и сверхпрочные стали; специалисты полагают, что
лет через сорок они станут важнейшими материалами крупной
промышленности. По мнению многих ученых, такое же место на
рубеже III тысячелетия займут материалы, приготовленные ме-
тодами порошковой металлургии.
Развитие материалов протекает в русле общего технического
прогресса и в соответствии с закономерностями развития обще-
ства. Любой прогноз, если он касается не только теоретических
возможностей, но и практического применения, всегда должен
учитывать уровень развития общества. При социализме, где
критерием и целью прогресса является благо людей, а не макси-
мальная прибыль, наука и техника делают богаче и прекраснее
жизнь общества в целом и каждого его члена в отдельности.
Рекомендуемая литература
1. Венецкий С. И. Рассказы о металлах.— М.: Металлургия, 1978.
2. Гинер П.Г. Тайны огненной страны.—Днепропетровск: Промшь. 1972.
3. Мезенин Н.А. Занимательно о железе.— М.: Металлургия, 1972.
4. Пекшин И. С. Покорение железа.— М.: Металлургия, 1964.
5. Савицкий Е.М., Клячко В. С. Металлы космической эры.— М.: Советская •,
Россия, 1972
6. Степанов И. С. Редкие металлы и технический прогресс.— М.: Металлургия,
1964.
7. Ферсман А.Е. Занимательная геохимия.— М.: Детгиз, 1954.
8. Фролов В. А., Юдкевич Р.В. Металлы будущего.— М.: Советская Россия,
1960.
Предметно - именной указатель
Агрикола Георгий (Георг Бауэр) 26,
27-29, 30
Алхимия 24, 25
Альберт Вильгельм 80
Алюминий 77, 108, 109-116
бронзы 127
сплавы 111-116, 131, 148
Амальгама 23, 117
Анализ звукового излучения метал-
лов 130-131
Аносов П. П. 60
Астон-железо 33
Атом
строение 45-46
размеры 45
Аустенит 91, 93
Аусформинг (специальная термоме-
ханическая обработка) 101
Аюи Рене-Жюст 50
Белая жесть 84-85, 131, 132, 133
Бергман Олаф 50
Бериллий 108
бронзы 127
Берцелиус Й.Я. 24
Бессемер Генри 34, 39
Бессемеровский процесс 34, 35
Благородные металлы 43, 45,
134-140
Бор Нильс 45, 141
Бронзы 14, 15, 19, 23, 26, 27, 127
бронзовый век 14
Вакуумная металлургия 39, 40
Вёлер Август 77, 110
Видманштетт Алоис, фон 59, 60
«Внутреннее окисление» 135
Водородная болезнь 127-128
Вольфрам 44, 141, 142-143.
Вспененные металлы 146
Высоколегированная (марганцевая)
сталь 89, 99
Гелий 43, 69
Гальванический 'элемент 80-81
Гальванотехника 85-86
Гафний 141, 142
Гебер (Джабир ибн-Хайян) 25
Германий 147
Гомогенное свинцевание 128-129
Горячее цинкование 130
График 104-106
Гюйгенс Христиан 50
Дамасская сталь 16, 17
Дендриты 50-51
Дерби Абрахам 31
Дефекты кристаллической решетки
53
Деформирование (и деформация)
72-78
Диаграмма напряжение — дефор-
мация 76
Дислокации 53, 54, 73-75, 76-77, 78,
145
Доменный процесс 31, 37, 38
Друде Пауль 59
Дуралюмин 114, 115
Дэви Хэмфри 81-82, ПО, 117
Железо 44, 87-107
кристаллическая решетка 88-89,
93, 97
карбид железа 90, 91
-углерод, диаграмма состояния
91, 94
Железный век 15-21
Закалка 93-97
Затвердевание 63-66
Зеркальная бронза 127
Золото 10-12, 66, 67-68, 134,
136-138
сплавы 66, 73-74
Зоммерфельд Арнольд 46
Износков А. А. 36
Инструментальные стали 89, 98
Ионная связь 49, 50
Иридий 134, 139, 140
Каменно-медный век 12
Карат 66
Кислородно-конверторный способ
(ЛД-процесс) 37, 39
Клапрот М. 118, 141
Книппинг Пауль 51
Ковалентная связь 49
Колокольная бронза 127
Конструкционные стали 89, 95,
98-99
Коррозионно-стойкие стали
101-103
Коррозионное растрескивание под
напряжением 84
Коррозия 79-85
химическая 79-80
электрохимическая 79, 80, 82
Корт Генри 31
Костер Д. 141
Кричный (сыродутный) горн 29-31
Кричный передел 31
Кролля метод 118
Кузнецов Н. Н. 36
Кузнечный мех 18
Кюри точка 89
Латунь 23, 124-127
Лауэ Макс 51
Легирование 66
Легкие металлы 108-120
Ледебур Альфред 91, 93
Ледебурит 91
Литейная сталь 107
Литейный чугун 106-107
Локальный (гальванический) эле-
мент 82
Ломоносов М. В. 43-44
Лужение 131
Магний 108, 116-118
сплавы 117-118
соли 117-118
Мартен Пьер 36
Мартеновский процесс 36
Мартенсит 93, 97
Медь 12, 67-68, 122-128
сплавы 69, 124-128, 132, 134
Межкристаллитная коррозия 84
Межмолекулярная связь 49, 50
Мейер Лотар 43, 44, 47
Менделеев Д.И. 44, 46-47, 48, 141
Металлическая связь 49, 50, 59
Металлический водород 59
Металлическое состояние 58-62
Металлография 54-57, 59-60
Метеоритное железо 15, 16, 17, 59
Модуль упругости 76
Мозговой А. И. 39
Молибден 141, 142-143
Монель-металл 80
Монетная бронза 127
Нейзильбер (новое серебро) 128,
132
Нержавеющая сталь 102
Никель 132-134
сплавы 68, 128, 132-133
-титановые сплавы 147-148
Ниобий 141, 142
Нормальный электронный потен-
циал 82
Окалиностойкая сталь 104
Олово 14, 129, 131-132
оловянная чума 127-128
Оптический микроскоп 54-57
Осмий 134, 139
Отпуск 93-97
Палладий 134, 139
Парацельс 25, 29
Паули Вольфганг 46
Пергамский водопровод 15
Переходные металлы 47
Периодическая система 43, 44-48
Перлит 90-91, 94, 98
Пйри Р.Э. 17
Плавление 63-66
Плазма 61-62
Пластическая деформация 72, 74,
75, 76, 78
Пластичность 72-78
Платина 134, 138-139
сплавы 139
Платиновые металлы 134, 139
Ползучесть 16-Т1
Полупроводники 61-62, 146-147
Предел прочности на разрыв 76
Предел текучести 76
Принцип Паули 46, 60
Промышленная революция 97
Пространственная решетка 51; 53
Прочность 72-78
Пудлингование 31-33
Пушечная бронза 127
Рентген В. К. 51-52
Реомюр Р.А. 59
Родий 134, 139
Ртуть 43, 69
Рутений 134, 139
Сварочное железо 33
Сверхпроводимость 59
Свинец 22, 63-64, 65 70, 76, 128-129
Серебро 44, 134, 135-136
сплавы 135, 136
как валюта 135
Сименсы, братья Вильгельм и Фри-
дрих 35
Сквозная коррозия 84
Сплавы 66-71
Сталь 31-39, 89-107
фасонное литье 107
Стено Николаус (Нильс Стенсен)
50
«Суперсплавы»
сверхпластичность 144
Сурьма 22, 49, 70, 129
Тантал 141, 142
Твердые растворы 68-69
внедрения 68
замещения 68
Температура плавления 68, 69, 83
Теплота плавления 65, 83
Термическое улучшение 96, 97
Титан 108, 109, 118
сплавы 119, 148
Томас Сидней Джилкрист 34
Томасовский процесс 35
Томсен Х.Ю. 13
Углеродистые стали 89, 90, 98
Упрочнение 72, 74, 77, 80
Упругость 44, 72-78
Усталостное разрушение
кривые Вёлера 77-78
Ферми Энрико 59
Феррит 90, 93, 94
Флогистон 44 45
Фридрих Вальтер 51
Фуггер Якоб 27
Хантсмен Бенджамен 32, 33
Хевеши Д. 141
Хенкель И.Ф. 23
Хромоникелевые стали 102-103
Цементит 90-91, 93, 94, 98
Цинк 130-131
сплавы 124-127, 131
Цирконий 141, 142
Чернов Д.К. 93
Чугун 31, 34, 91, 94, 104-107
с шаровидным графитом 105-106
Эвтектика 70
Эвтектические сплавы 69, 70
Эксплуатационный предел вынос-
ливости 78
Электролиз расплава ПО, 111
Электронный газ 49, 59-60, 62
Электронный микроскоп 54-57
Элементарная ячейка (простран-
ственной решетки) 51, 53
Энергетические зоны 60-62
Оглавление
От редактора русского перевода 5
От автора 7
Металлы вчера и сегодня 9
Что такое металлы? 43
О поведении металлов 63
Железо и сталь 87
Легче, чем сталь,—легкие металлы 108
Тяжелые цветные металлы на службе
у человека 121
Металлы в будущем 144
Рекомендуемая литература 149
М. Беккерт
МИР МЕТАЛЛОВ
ИБ № 2095
Научный редактор А.Н. Кондрашова
Мл. научи, ред. М.А. Харузнна
Художник А.М. Ясинский
Худож. редактор Л.Е. Безрученкоа
Технический редактор Л. П. Бирюкова
Корректор В. С. Соколов
Сдано в набор 1109.79.
Подписано к печати 30.0480.
Формат 84 х 108*/1«.
Бумага офсетнаа № 1
Гарнитура тайма Печать офсет.
Объем 4,75 бум. л. Усл. печ. л. 15.96
Уч.-изд л. 14,95 Изд. № 12/0551
Тираж 150000 экз. Зак. 430 Цена 1 р. 70 к.
ИЗДАТЕЛЬСТВО «МИР»
Москва, 1-й Рижский пер, 2.
Можайский полиграфкомбинат Союэполнграф-
прома при Государственном комитете СССР по
делам издательств, полиграфии и книжной Top-
говли.
г. Можайск, ул. Мира, 93.