Author: Голдовская Л.Ф.
Tags: общая экология биоценология гидробиология биогеография общая биохимия химия окружающая среда
ISBN: 5-03-003649-0
Year: 2005
Text
Белгородский государственный университет (БелГУ) - право-
приемник учительского института, открытого в 1876 г. За последние
35 лет университет превратился в один из крупнейших вузов России и
в 1996 г. приобрел с татус классического университета.
На 15 факультетах университета обучаются около 19,5 тыс. студен-
тов из России и зарубежных стран по 50 специальностям педагогиче-
ского и общеуниверситетского профиля и по 12 направлениям
четырехлетней программы подготовки бакалавров наук. В Бе «ГУ
открыт единственный в России социально-геологический факультет.
На 71 кафедре и в 20 научных центрах и лабораториях БелГУ про-
водятся фундаментальные и прикладные научные исследования по
36 направлениям. Создаются бизнес-инкубатор и технопарк, где ио
разработанной в БелГУ оригинальной технологии вырабатываются и
реализуются реагенты для гальванопокрытий, косметики, синтеза ле-
карственных веществ, анализа медпрепаратов и витами-
нов; пищевые и кормовые добавки для выведения пато-
генных веществ, бактерий и вирусов из организма чело-
века и животных и другие технологии.
Адрес университета: Россия, 308015, г. Белгород,
ул. Победы, 85.
Те/: (0722) 30-12-11. Факс: (0722) 30-10-12.
Web: http:/www.bsu.cdu.ru Email: lnfo@bsu.edu.ru
БелГУ
УЧЕБНИКИ И УЧЕБНЫЕ ПОСОБИЯ
ДЛЯ СТУДЕНТОВ ВЫСШИХ УЧЕБНЫХ ЗАВЕДЕНИЙ
Л. Ф. Голдовская
ХИМИЯ
ОКРУЖАЮЩЕЙ СРЕДЫ
>
I
I
I
Допущено Министерством образования Российской Федерации
в качестве учебника для студентов высших учебных заведений,
обучающихся по специальности «Охрана окружающей среды и
рациональное использование природных ресурсов»
направления подготовки дипломированных специалистов
«Защита окружающей среды»
МОСКВА «МИР» 2005
УДК 574
ББК 28.072я73
Г 60
Рецензенты д-р хим. наук, проф. В В Тарасов, заведующий кафедрой
промышленной экологии РХТУ им. Д И Менделеева; д-р хим. паук, проф
М. Ю. Плетнев, заведующий кафедрой органической химии Белгородского
государственного университета; д-р техн. наук., проф. Н. А. Шаповалов, заве-
дующий кафедрой физической и коллоидной химии Белгородского техноло-
гического университета им В. Г Шухова; канд. пед. наук, проф Н М. Анти-
пова, кафедра ботаники и методики преподавания биологии Белгородского
государственного университета.
Голдовская Л. Ф
ГбО Химия окружающей среды Учебник для вузов. — М. Мир, 2005 —
296 с. ил.
ISBN 5-03-003649-0
В учебнике, посвященном экологической химии, рациональному использова
нию природных ресурсов, охране окружающей среды (в том числе инженерным
методам защиты и обеспечению безопасности жизнедеятельности), приведена
всесторонняя классификация загрязняющих Веществ и рассмотрено их воздей-
ствие на живые организмы. Дана экологическая оценка различных промыш-
ленных производств, проанализированы пути решения экологических проблем.
В учебнике содержатся экологические задачи, практические работы, задания иссле-
довательского характера для лабораторных и полевых условий. Глобальные эколо-
гические проблемы рассмотрены на примере одного из российских регионов.
Для студентов химических, биологических и экологических специальностей
вузов, а также для учителей и учащихся профильных химико-биологических и
экологических классов.
УДК 574
ББК 28 072я73
ISBN 5-03-003649-0
© Издательство «Мир», 2005
Посвящается моей матери,
Кузнецовой Анне Петровне,
подарившей мне жизнь и вместе с ней
любовь к Земле и людям.
ПРЕДИСЛОВИЕ
Что побудило меня написать эту книгу? Прежде всего прихо-
дящее с годами восприятие жизни как уникального бесценного
явления, жизни во всех ее проявлениях — это и утренняя заря, и
восход солнца, и тол^бое небо над нашей планетой Земля. и пес-
ня жаворонка высоко над пшеничным полем, и порхающая над
цветочным лугом бабочка, и тихий шелест листьев в грибном
лесу, и журчание ручейка, и жизнь людей как составная часть
живой природы. Человек счастлив только в согласии со своей со-
вестью, в мире с другими людьми, в гармонии с окружающей сре-
дой. И как нужно всем нам беречь это единство с окружающей сре-
дой, разумно использовать природные ресурсы, охранять приро-
ду от загрязнения! Экологическая обстановка в нашей стране и
во всем мире требуег безотлагательных мер. Воспитание эколо-
гически грамотного молодого поколения должно быть одним из
приоритетных направлений государственной экологической по-
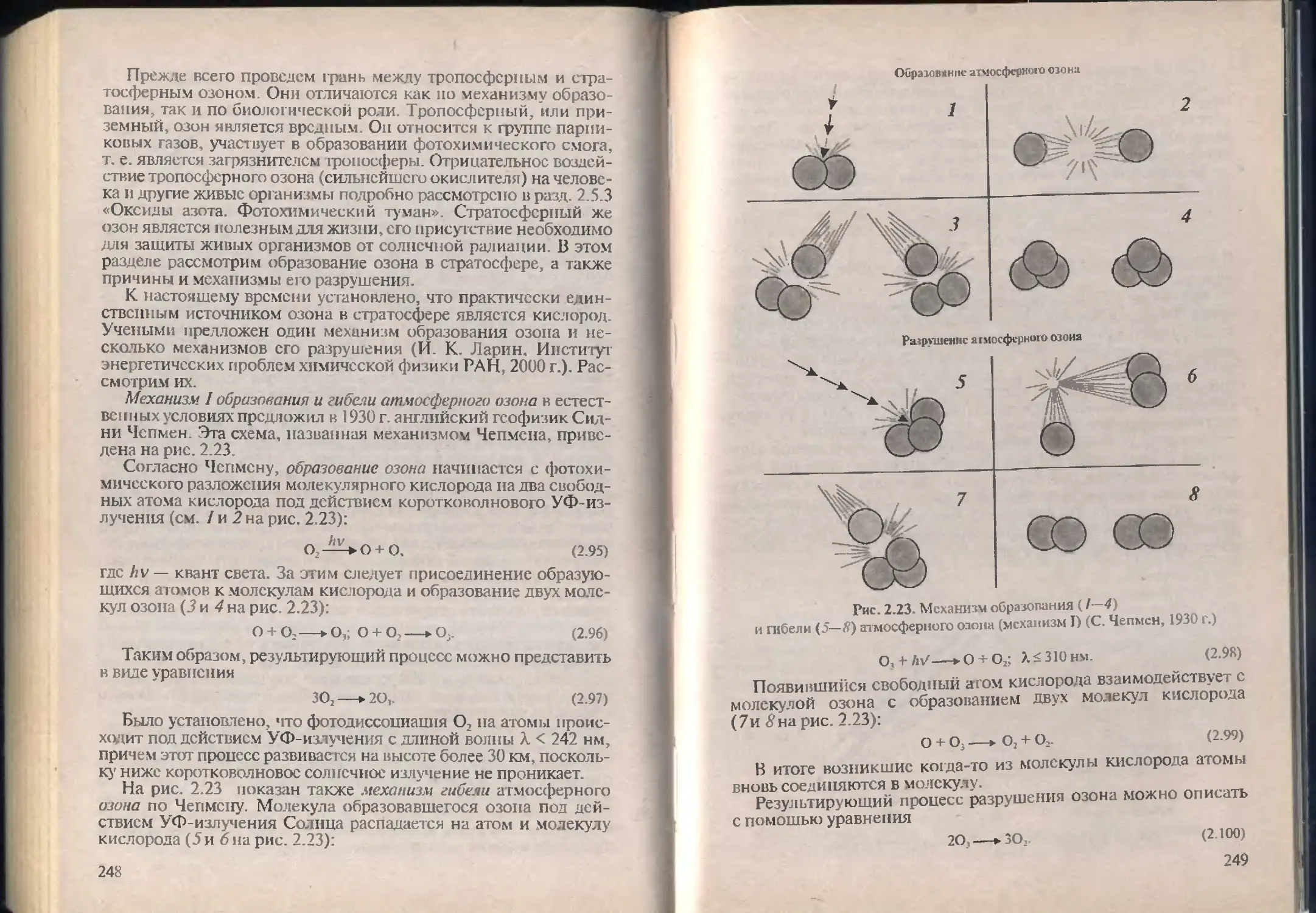
литики.
Педагог по профессии и призванию, химик по специально-
сти, я стала экологом по велению времени, по призыву сердца.
В течение последних десяти лет областью моих научных ин гере-
сов стала экология и смежные с ней науки.
Опыт преподавания учебных дисциплин и спецкурсов по
проблемам химии окружающей среды (экологической химии)
на биолого-химическом факультете Белгородского государ-
ственного университета (БелГУ), а также курса эколопш в гим-
назии № 3 г. Белгорода для классов химико-биологического про-
филя лег в основу этого учебника.
Большинство существующих учебников и учебных пособий
относится к литеразуре по классической (биологической) эко-
логии, в данном же учебнике в основном изложены химические
аспекты экологии. В нем рассматривается не только роль химии
в возникновении неблагоприятных экологических ситуаций и
влияние химических промышленных продуктов на окружаю-
щую среду, но и значение химической науки и технологии в раз-
работке малоотходных и безотходных производств, методов
3
предотвращения подобных ситуаций. Уделено должное внима-
ние работе очистных сооружений, совершенствованию методов
очистки отходящих газов, сгонных вод, переработке бытовых и
промышленных отходов и другим химическим аспектам эколо-
гии. Экологические проблемы рассмотрены на примере ряда pc-
i-ионов планеты, в частности Цсшрального Черноземного регио-
на России и Белгородской области. Естественно, что при изучении
региональных экологоческих проблем надо учитывать изменяю-
щуюся экологическую обстановку. Экологическое образование
по своему содержанию должно быть конкретным, т. е. направ-
ленным на проблемы конкретного региона, но при этом, безу-
словно, должно давать знания по глобальным (мировым) эколо-
гическим проблемам.
Химия окружающей среды является обязательной дисципли-
ной для специальности «Охрана окружающей среды и рациональ-
ное использование природных ресурсов», по которой готовят
около 60 вузов России. Соответствующие разделы этого предме-
та преподаются и в рамках специальностей «Безопасность жиз-
недеятельности» и «Инженерная защита окружающей среды».
В полном объеме такое учебное издание должно содержать ин-
формацию по химии и экологии земной атмосферы, гидросфе-
ры, почвы, материалы о радиации и ядерной энергетике, атакже
изложение законодательных основ в области охраны окружаю-
щей среды.
Предлагаемый учебник по экологической химии по сути яв-
ляется первым и охватывает круг проблем, связанных с земной
атмосферой.
Во введении рассматриваются предмет экологии, краткая ис-
тория ее развития как науки, структура современной экологии,
ее различные научные направления, основные понятия и опре-
деления общей экологии
В главе 1 раскрыты цели и задачи экологической химии; рас-
смотрены виды загрязнений окружающей среды (физическое,
химическое, биологическое и др.), их источники; приведена
подробная и всесторонняя классификация химических веществ
по характеру воздействия на живые организмы; даны экологи-
ческие стандарты и нормативы; показана биологическая роль
макро- и микроэлементов, рассмотрен их круговорот в биосфере
с учетом антропогенного вмешательства. Особое внимание уде-
ляется классификации веществ по характеру их воздействия на
здоровье человека.
В главе 2 обобщен и систематизирован богатый литературный
материал по вопросам химии и экологии атмосферы, содержит-
ся информация о сгроении, химическом составе атмосферы и
биологической роли основных компонентов воздуха (азота, кис-
лорода, углекислого газа, водяных паров) Подробно рассматри-
4
ваются как источники загрязнения атмосферы (теплоэнергети-
ка, автотранспорт и различные отрасли промышленности), так и
химические процессы, которые лежат в основе этих производств
и сопровождаются поступлением в атмосферу загрязняющих ве-
ществ. Дается экологическая оценка данным производствам, и
рассматриваются пути решения экологических проблем.
Описывается поведение в атмосфере различных примесных га-
зов (оксидов углерода, серы и азота), являющихся основными
за1рязнитсля.ми воздуха. Дается обзор химических процессов,
протекающих в атмосфере с их участием.
Значительное место в книге занимает рассмотрение аэрозолей.
Подробно обсуждаются проблемы образования и трансформа-
ции аэрозолей в тропосфере и стратосфере в результате химичес-
ких и физико-химических процессов. Исследуются возможнос-
ти регионального и глобального распространения аэрозолей их
влияние на тепловое состояние атмосферы и климат.
В книге уделяется значительное внимание воздействию ос-
новных за1рязнитслсй воздуха на живые организмы. Обобщены
и систематизированы имеющиеся в литературе данные о влия-
нии на здоровье человека, на растения и животн ых оксидов угле-
рода, серы, азота, а также аэрозолей силикатных материалов и
тяжелых металлов (свинца, ртути, кадмия, цинка и меди) При-
водятся симптомы отравления человека этими веществами
На современном научном уровне обсуждаются глобальные
экологические проблемы атмосферы. Сопоставляются различ-
ные точки зрения по вопросам изменения климата с учетом со-
вместного действия парникового эффекта и истощения озона.
Приводятся некоторые прогнозы глобального потепления в XXI в.
Рассматриваются условия образования не только хорошо изучен-
ных кислотных дождей, но и малоизвестных щелочных осадков.
Излагаются существующие и возможные эколо<-ические послед-
ствия глобальных изменений и меры их предупреждения
Рассматриваются мероприятия по защите атмосферы от хи-
мического загрязнения, по очистке и обезвреживанию атмо-
сферных выбросов от токсичных веществ, созданию эффектив-
ных очистных сооружений на предприятиях. Описываются про-
цессы и аппараты очистки выбросов от пыли и газообразных
компонентов: пьшеосадительные камеры, циклоны, электрофильт-
ры, скрубберы, рукавные фильтры, абсорберы и адсорберы.
Третья глава содержи-i описание методик выполнения две-
надцати практических работ и заданий исследовательского ха-
рактера для полевой практики по теме «Атмосфера».
Основу книги наряду с литературными данными составили
опубликованные результаты моих научных исследований эколо-
гических проблем Белгородского региона, а также выполненных
под моим руководством исследовательских работ студентов био-
5
лого-химического факультета БелГУ и учащихся гимназии № 3
в научном обществе «Поиск». При изложении проблем перера-
ботки бытовых и промышленных отходов использована рисайк-
линговая концепция зацелующего кафедрой органической хи-
мии БелГУ, докт. хим. наук М Ю. Плетнева. Результаты пере-
численных работ нашли отражение как в теоретических разделах
данного пособия, так и в его практической части при описании
методик выполнения лабораторных работ, домашних заданий и
исследовательских работ.
Преподавание химии на двух факультетах БелГУ — биолого-
химическом и медицинском — помогло мне в определении раз-
личных форм влияния химического состава окружающей среды
на здоровье человека, что также нашло отражение в данной книге.
В исследовании экологического состояния атмосферного
воздуха, почвы, рек Северский Донец, Везелка, Нежеголь, Ко-
рень, Белгородского водохранилища, радиационного состояния
окружающей среды принимали участие студенты БелГУ Е. Бар-
калова (1993—1995); В Афанасьева, Г. Беляева (1994—1996);
Е Колесникова (1996—1997); Е. Сальтсвская (1996—1999);
М. Михайлова, С. Терентьева, Т. Орехова (1996—1999); А. Мази-
кин (1998—2000); Ю Асташе н ко (1996-2001) и др
Учащиеся гимназии № 3, изучающие данный курс экологии и
участвующие в исследовательской работе, стали победителями
всероссийских и международных олимпиад, конкурсов и выста-
вок, выступали с докладами на научных конференциях различ-
ного уровня, имеют публикации, и многие из них уже выбрали
профессии, связанные с экологией, химией и биологией. Так,
ученица 10-го класса Е. Никитина в 1996 г. стала бронзовым
призером Международной экологической олимпиады в Стамбу-
ле (Турция), отмечена Премией Президента России. В 1996 г.
ученица 11 -го класса Ю. Борзых стала лауреатом Российской от-
крытой конференции учащихся «Юность. Наука. Культура».
Выпускница этой школы Е. Сальтсвская, будучи студенткой
БелГУ (специальность «экология»), участвовала в работе (в ка-
честве соавтора доклада) Международных аэрозольных симпо-
зиумов (1AS-3, Москва, 1996; IAS-4, Санкт-Петербург, 1998),
трижды получила звание соросовского студента. Стала лауреа-
том Всероссийского конкурса юношеских исследовательских
работ и V Юношеских чтений им. В И. Вернадского (Москва,
1998) ученица 11-го класса Т Данькова. Благодаря этому и дру-
гим достижениям в области экологии уже на 1 -м курсе она стала
победителем конкурса Международной соросовской программы
образования в области точных наук (ISSEP). С. Трофимов —
дважды призер всероссийских олимпиад школьников по эколо-
гии (1998, 1999), лауреат V Юношеских чтений им. В. И Вер-
надского (Москва, 1998), лауреат Первой российской молодеж-
6
ной научной и инженерной выставки «Шаг в будущее», отмечен
сертификатом международной организации NACE, победитель
Национального соревнования молодых ученых Европейского
союза (Москва, 1999), призер XI Соревнования молодых ученых
Европейского союза в Тессалониках (Греция, сентябрь 1999).
С 1999 г. он студент Московского государственною техническо-
го университета им. Н. Э. Баумана (специальность «промыш-
ленная экология»). Ученицы 10-го класса белгородской гим-
назии № 3 В Гридчина и О. Луговая — лауреаты VII Всерос-
сийской научной конференции молодых исследователей «Шаг
в будушее» — получили диплом II степени (2000), они также лау-
реаты Всероссийскою конкурса «Первые шаги-2000», лауреаты
первой премии областного конкурса научных молодежных работ
«Молодежь Бел! ородской области» (2000). О. Луговая в 11-м клас-
се стала лауреатом VIII Всероссийской научной конференции
«Шаг в будущее» (Москва, 2001). Алексей Белых, будучи пяти-
классником, стал лауреатом Российской открытой конферен-
ции учащихся «Первые шаги в науку» (Обнинск, 2001), лауреа-
том Всероссийского конкурса научно-исследовательских работ
«Первые шаги» (Москва, 2001), награжден медалью Э. Галуа и
дипломом лауреата от Министерства образования Российской
Федерации. В последние годы он стал лауреатом Всероссийско-
го конкурса «Шаг в будущее, ЮНИОР» (Москва, 2002), победи-
телем этого же конкурса в 2003 г., ему вручены дипломы-серти-
фикаты международных организаций Intel (США, 2002) и Vitro
Biology (США, 2003).
Я благодарна своим ученикам за любовь к моему предмету.
Своими успехами в области экологии oim укрепили мою мысль
о необходимости написания данного учебника и помогли мне
сделать это. Надеюсь, что мой подрастающий внук Алеша откро-
ет для себя ценность этой науки и будет беречь окружающий
мир природы. Он уже помогал мне в работе над книгой своими
вопросами «Как9 Почему? Зачем?».
Мои коллег и—преподаватели экологии, химии и биологии —
постоянно подталкивали меня к созданию этой книги и давали
возможность на практике проверить подготовленный материал
при пении лекций в школьной и студенческой аудитории и при
обмене опытом на курсах повышения квалификации, различ-
ных семинарах и совещаниях. Я благодарна доценту кафедры
органической химии БелГУ, канд. техн, наук Владимиру Алек-
сандровичу Перистому за консультативную помощь ио вопро-
сам химического производства.
Выражаю признательность за компьютерный набор текста
книги Е. Н. Колесниковой А. М. Шамионовой, И. А. Белоус.
Учебник предназначен для студентов химических, экологи-
ческих и биологоческих специальностей вузов. Он может быть
7
использован как на факультативных занятиях, так и в качестве
специального курса для учебных заведений с медицинской и
сельскохозяйственной специализацией Полагаю, что книга по-
служит в качестве справочного пособия для учителей и учащихся
общеобразовательных учебных заведений разных видов — школ,
гимназий, лицеев (особенно для классов с углубленным изуче-
нием химии, биолбгии и экологии), а также колледжей. Пола-
гаю, что она может оказаться полезной и для практических ра-
ботников экологических служб, отделов охраны природы, про-
мышленной экологии. Надеюсь, что мой труд не останется
незамеченным и окажется достаточно интересным для широко-
го круга потенциальных читателей, дтя всех, кто озабочен эко-
логическим состоянием нашей среды обитания В книге можно
найти ответы на многие жизненно важные вопросы.
При обсуждении экологических проблем атмосферы, гидро-
сферы и почвы в любых конкретных областях и краях России
данная книга может быть использована как канва, по которой
легко воспроизводить конкретные картины экологической жиз-
ни любого региона.
Выражаю признательность рецензентам: заведующему ка-
федрой органической химии Белгородского государственного
университета, д-ру хим. наук Михаилу Юрьевичу Плетневу; про-
фессору кафедры ботаники и методики преподавания биологии
Белгородского государственного университета, канд. пед. наук
Наталье Митрофановне Антиповой; председателю УМК Мин-
образования РФ по специальности 320700 «Охрана окружаю-
щей среды и рациональное использование природных ресур-
сов», заведующему кафедрой промышленной экологии РХТУ
им. Д И. Менделеева, профессору Валерию Васильевичу Тара-
сову; заведующему кафедрой физической и коллоидной химии,
заместителю первого проректора по научной деятельности, на-
чальнику УНИР Белгородского государственного технологиче-
ского университета, д-ру техн, наук, профессору Николаю Афа-
насьевичу Шаповалову за полезные замечания и пожелания, ко-
торые мной с благодарностью приняты и учтены.
ВВЕДЕНИЕ
1. ЧТО ИЗУЧАЕТ ЭКОЛОГИЯ?
Вы начинаете изучать новую науку — экологию. Слово «эко-
логия» происходит от двух греческих слов: oikos — дом, жилище,
обиталище, местопребывание, убежище, родина и logos — поня-
тие, учение, наука. В дословном переводе экология — это наука
о доме, или наука о местообитании Иногда ее называют наукой
о собственном доме, о природном доме человека.
Термин «экология» ввел в научный обиход основоположник
экологии, известный немецкий зоолог и эволюционист Эрнст
Геккель (1834—1919). В своих трудах «Всеобщая морфология орга-
низмов» (1866) и «Естественная история миротворения» (1868)
он впервые дает следующее определение новой науки: «Под эко-
логией мы понимаем сумму знаний, относящихся к экономике
природы: изучение всей совокупности взаимоотношений жи-
вотного с окружающей его средой, как органической, так и не-
органической, и прежде всего — его дружественных или враж-
дебных отношений с теми животными и растениями, с которы-
ми он прямо или косвенно вступает в контакт. Одним словом,
экология — это изучение всех сложных взаимоотношений, кото-
рые Дарвин называет условиями, порождающими борьбу за су-
ществование». Таким образом, по Геккелю, экология — это наука
об отношениях организмов с окру-
жающей средой.
На русском языке слово «экология»
впервые, видимо, было упомянуто
в кратком изложении «Общей морфо-
логии» Э. Геккеля — небольшой книге,
вышедшей в 1868 г. под редакцией
И. И. Мечникова.
С развитием этой науки появились и
иные ее определения и дополнения.
Приведем некоторые из них. Извест-
ный французский эколог ПьерАгссс:
«Экология — наука не только естествен-
ная, она должна включать в себя и дру-
гие дисциплины, такие, например, как
право, экономика, социология и т. д.».
Н. Ф. Реймерс (известный отечсствен-
9
ный эколог) обозначил экологию как «научное направление, рас-
сматривающее некую значимую для центрального члена анализа
(субъекта, живого объекта) совокупность природных и отчасти
социальных (для человека) явлений и предметов с точки зрения
интересов этого центрального субъекта или живого объекта».
Первый президент экологического союза СССР (России) и один
из создателей Экологического фонда России Н. Ф. Реймере
(1931—1993) считал, что «экология в соврсмсн ном расширенном
понимании далеко вышла за рамки биологической праматери —
биоэкологии. Она превратилась в цикл знаний, по общест-
венному значению и внутреннему содержанию равный циклам
физико-математических, химико-биологических наук, наук
о Земле и общественных наук». Известный российский эколог
академик А. В Яблоков пишет: «Одни считают экологию частью
биологии, изучающей отношения организма и среды, другие —
комплексной наукой, исследующей среду обитания живых су-
ществ, включая человека, третьи — дисциплиной, изучающей
общие закономерности функционирования экосистем различ-
ного иерархического уровня, четвертые — общенаучной об-
ластью знания, рассматривающей любую совокупность предме-
тов и явлений с точки зрения какого-то центрального объекта
(как правило, живого или с участием живого). Этот перечень оп-
ределений неполный». В Советском энциклопедическом словаре
(1990) экология определяется как «...наука об отношениях расти-
тельных и животных организмов и образуемых ими сообществ
между собой и с окружающей средой...». Это определение явля-
ется наиболее распространенным.
Вопросы и задания
I От каких слов происходит слово «экология» и что оно означает в дословном пере-
воде? 2. Кто является основоположником экологии? 3. Что изучает экология? Дайте
определение.
2. КРАТКАЯ ИСТОРИЯ РАЗВИТИЯ ЭКОЛОГИИ
Как было отмечено выше, термин «экология» впервые введен
Э. Геккелем во второй половине XIX в., однако история возник-
новения экологии как науки корнями уходит в глубину веков.
По своей сути экологичными были уже труды античных филосо-
фов и первых ученых-естествоиспытателей Так. Аристотель
(384—322 п . до н. э.) описал поведение свыше 500 видов живот-
ных, его ученик ботаник Теофраст Эрезийский (371 —-280 гг. до
и. э.) изучал зависимость жизнедеятельности растений от почвы
и климата.
10
От периода Средних веков следов изучения природы сохра-
нилось меньше, однако Великие географические открытия в эпо-
ху Возрождения послужили основанием для систематизации
растений и животных. Основоположники систематики А. Цсзаль-
пин (1519—1603) и Д. Рей (1628—1705) описывали зависимость ви-
дов растений от условий произрастания и места обитания.
Русские естествоиспытатели и путешественники XV111 в.
Степан Петрович Крашенинников (1713—1755), Иван Ивано-
вич Лепехин (1740—1802), Петр Симон Паллас (1741 —1811) так-
же оставили нам описание климата, растительности и животно-
го мира в зависимости от географических условий. Французский
естествоиспытатель Жорж Бюффон (1707—1788) впервые стал
изучать влияние внешних условий (температуры, климата и ка-
чества пиши) на возможность превращения одного вида живот-
ных в другой. В это же время его соотечественник, автор первого
эволюционною учения, ботаник и зоолог Жан Батист Ламарк
(1744—1829) изучал влияние среды на организмы и впервые об-
ратил внимание на возможные катастрофические последствия
деятельности человека, которая может «сделать земной шар не-
пригодным для обитания».
Дальнейшему развитию экологического мышления способ-
ствовало появление в начале XIX в. биогеографии. Немецкий ес-
тествоиспытатель Александр Гумбольдт (1769—1859) в 1807 г.
сформулировал новое экологическое направление в географии
растений: в сходных зональных и вертикально-поясных геогра-
фических условиях у растений разных групп вырабатывается
одинаковый внешний облик. В середине XIX в. русский биолог-
эволюционист, профессор Московского университета Карл Фран-
цевич Рулье (1814—1858) разработал систему экологического ис-
следования животных — зообиологию. Особо следует отметить
работу великого английского ученого Чарльза Дарвина (1809—
1882) «Происхождение видов» (1859), в которой большое внима-
ние уделено адаптации (приспособлению) живых организмов и
взаимоотношениям их с окружающей средой. Э. Геккель отме-
чал, что одной из задач экологии является изучение всех тех взаи-
моотношений организмов, которые Ч. Дарвин обозначил как
борьбу за существование.
Всеобщее признание термин «экология» получил лишь к кон-
цу XIX в., а в 1870-х it . в экологии возникло новое направление.
В 1877 г. немецкий гидробиолог К. А. Мёбиус (1825—1908) обо-
сновал представление о биоценозе как об эволюционно сложив-
шемся закономерном сочетании организмов в определенных услови-
ях среды. По Мёбиусу, биоценозы, или природные сообщества,
обусловлены длительной историей приспособления видов друг
к другу и к сходной экологической обстановке. Учение о расти-
тельных сообществах обособилось в отдельную область ботани-
II
ческой экологии, получившую название фитоценологии, а затем
геоботаники. Основные положения этой науки были разработа-
ны позднее в трудах русских ученых-ботаников, лесовсдов —
Г. Ф. Морозова (1867-1920) и В. Н. Сукачева (1880-1967).
В развитии системного взгляда на различные природные яв-
ления большую роль сыграли исследования русского ученого,
почвоведа-географа Василия Васильевича Докучаева (1846—1903).
Как самостоятельная наука экология сформировалась к нача-
лу XX столетия. Оформились экологические школы гидробио-
логов, фитоценологов, ботаников и зоологов, в каждой из этих
школ получили развитее определенные грани экологической
пауки. К 1910 г. экология разделилась на аутэкологию — эколо-
гию особей и синэкологию — экологию сообществ. Период 1913—
1920 гт. связан с организацией экологических научных обществ,
основанием журналов. Экологию как науку начали преподавать
в университетах. Основы той экологии, которая изучается в на-
стоящее время, были заложены в 1920—1940 гг. Именно в это
время экология стала наукой, имеющей собственные объекты и ме-
тоды исследования, а также собственную концепцию. Слово
«концепция» (отлат. conceptio — понимание) и означает систему
взглядов, принципов, основных положений.
В 1930-х гг. оформилась новая область экологической нау-
ки — популяционная экология, основоположником которой явля-
ется английский ученый Ч. Элтон. В нашей стране в развитие
популяционной экологии внесли большой вклад С. А. Ссвср-
цов, С. С. Шварц, Н. П. Наумов, А. А. Уранов и др.
Параллельно развивались и такие области экологии, как эво-
люционная экология (М. С. Гиляров, С. С Шварц), палеоэкология
(И. С. Серебряков).
В начале 1940-х гг. в экологии возникли новые понятия. Еще
в 1935 г. английский ученый, ботаник-эколог А. Тенсли (1871—
1953) выдвинул и обосновал понятие «экосистема». Общепри-
нятого определения экосистемы не существует, но обычно счи-
тается, что экосистема — это совокупность разных обитающих
вместе организмов, а также физических и химических компонен-
тов среды, необходимых для их существования или являющихся
продуктами их жизнедеятельности При этом подразумевается,
что в экосистему наряду с неживыми компонентами входит набор
организмов, способных в своей совокупности осуществлять
полный круговорот углерода и других основных биогенных эле-
ментов (азота, фосфора и т. д.). Объединить в понятие «экосис-
тема» ее живые и неживые компоненты можно при условии, что
они находятся во взаимодействии. Именно это подчеркнул аме-
риканский ученый Р. Линдеман в 1942 г., определив экосистему
как «систему физико-химико-биологических процессов, проте-
кающих в пределах некоторой пространственно-временной еди-
12
ницы». Примерами отдельных экосистем являются: подушка
лишайников на стволе дерева, разрушающийся пень с его насе-
лением, луг, лес, озеро и т д.
В 1942 г. русский ученый академик В. Н. Сукачев ввел поня-
тие «биогеоценоз» (от греч. bios — жизнь, geo — Земля и kionys —
обший): «участок земной поверхности, где на известном протя-
жении биоценоз и отвечающие ему части атмосферы, литосферы,
гидросферы и педосферы остаются однородными и имеющими одно-
родный характер взаимодействия между ними и поэтому в совокуп-
ности образующими единый, внутренне обусловленный комплекс».
В этом определении «педосфера» — от греч. pedon — «почва». Гра-
ницы биогеоценозов В. Н. Сукачев считал совпадающими с гра-
ницами фитоценозов (от tpcs. phyton — растение).
«Экосистема» и «биогеоценоз» — близкие по сути понятия,
но если первое служит для обозначения систем, обеспечивающих
круговорот любого ранга, то «биогеоценоз» — понятие террито-
риальное, относимое к таким участкам суши, которые заняты
определенными единицами растительного покрова — фитоце-
нозами. В настоящее время эти понятия являются определяю-
щими для экологии как науки.
Следует отмстить особую роль в истории экологии крупней-
шего естествоиспытателя и мыслителя XX в., великого русского
ученого Владимира Ивановича Вернадского (1863—1945), кото-
рый создал учение о биосфере (области существования живого ве-
щества), закономерностях ее существования, устойчивости и
развития. Основы этого учения впервые были изложены им
в книге «Биосфера», а позднее и в других работах.
Биосфера — глобальная экосистема, функционирование которой
основано на экологических законах обеспечения баланса вещества и
энергии. Сам термин «биосфера» предло-
жил французский биолог Ж. Б. Ламарк
еще в начале XIX в. для обозначения сово-
купности всех живых существ, населяю-
щих Землю. Его «биосфера» существовала
отдельно от атмосферы, гидросферы и ли-
тосферы. В. И. Вернадский обозначил
этим словом иное. По Вернадскому, живое
неразрывно связано с окружающей его сре-
дой, оно объединяется с ней в сложную сис-
тему, в этот комплекс входит и человек. От
деятельности человека зависит сохран-
ность равновесия биосферы. В. И. Вернад-
ский намного опередил свою эпоху глу-
боким проникновением в основные зако-
номерности развития окружающего нас
мира. Еще в ранних статьях он первым из
В. И. Вернадский
13
ученых приводил доказательства геологическою по своим мас-
штабам хозяйственного воздействия человека на вес природные
процессы и предупреждал о неизбежности возникновения эко-
логических проблем, остроту которых мы ощутили в последние
десятилетия.
В 1944 г. В. И. Вернадский вводит новое понятие «ноосфера»
в статье «Несколько слов о ноосфере»: «Биосфера XX столетия
превращается в ноосферу, создаваемую прежде всего ростом
науки, научного понимания и основанного на ней социального
труда человека». Слово «ноосфера» буквально означает «мысля-
щая оболочка», т. с. сфера разума. По Вернадскому, ноосфера —
это новый этап развития биосферы, преобразуемой разумом и тру-
дом человека, и воздействуя на природу, человек как «гомо сапи-
енс фабер» (разумно производящий) должен просчитывать воз-
можные последствия.
В ] 940— 1950-е п. экология прсвра щается в точную науку бла-
годаря развитию количественных методов исследования. Эти
методы дают основы для математического моделирования, дела-
ют возможным научный прогноз. Появилась возможность про-
изводить расчеты энергетического баланса экологических сис-
тем, предельной продуктивности биоценозов в конкретных
условиях среды. Энергетический подход в оценках биосистем
активно развивали американские экологи Г. Одум и Ю. Одум
и другие ученые.
Методы количественного анализа позволили ученым, рабо-
тавшим с 1964 г. по Международной биологической программе
(МБП), подсчитать максимальную биологическую продуктив-
ность всей нашей планеты и максимально возможные нормы
изъятия продукции для нужд растущего населения Земли. Со
всей остротой встал вопрос о предотвращении возможных нару-
шений биологического равновесия в масштабах всей планеты.
Проблема охраны природы, разумного использования ее бо-
гатств на основе экологических законов — одна из важнейших
задач человечества.
В 1968 г. в Париже на межправительственной конференции
ЮНЕСКО по рациональному использованию и охране ресурсов
биосферы была принята международная программа исследова-
ний «Человек и биосфера». В том же году в Италии основана
международная научная (неправительственная) организация «Рим-
ский клуб», цель которой — разработка стратегии по решению
многих глобальных проблем, в том числе и экологических.
В 1974 г. в Гааге (Нидерланды) прошел I Международный конг-
ресс экологов, основано Международное общество экологов
(ИНТ — ЭКОЛ). В 1988 г. в Женеве (Швейцария) создана благо-
творительная организация — Центр «За наше общее будущее».
Центр содействует общественности и организациям всего мира
14
в усилиях, направленных на устойчивое развитие В 1992 г.
в Рио-де-Жанейро (Бразилия) состоялась конференция Органи-
зации Объединенных Наций по окружающей среде и развитию,
на которой представителями 179 государств принята «Повестка
дня на XXI век» и другие документы. На конференции был сде-
лан вывод о необходимости перехода человечества на путь ус-
тойчивого (поддерживаемого) развития, при этом выработанная
стратегия устойчивого развития в самом широком смысле на-
правлена на достижение гармонии в отношениях между людьми,
между обществом и природой.
В 1992 г. в России принят Закон об охране окружающей при-
родной среды а в 1996 г. издан Указ Президента РФ «О концеп-
ции перехода Российской Федерации к устойчивому развитию».
В связи с этим следует отметить важность экологического обра-
зования и большой вклад в его развитие, который внесли отечест-
вышые ученые И. Н. Пономарева, Н М. Чернова, И Т. Сураве-
гина, Е. А. Криксунов, В. В. Пасечник, Д И. Трайтак.
Завершая данный раздел, можно выделить в истории развития
концепции экологии пять основных этапов, первый из mix —
период чисто биологического исследования связей отдельных
организмов между собой и с окружающей средой; с середины
1920-хгт. начался второй этап, когда термин «экология» стали
применять к исследованию сообществ организмов; к 1950-м гг.
в науку введены понятия «экосистема» и «биогеоценоз», кото-
рые являются определяющими для экологии как науки (тре-
тий этап); в 1970-е гг. объектом пристального изучения стала
глобальная экосистема — биосфера (четвертый этап); и на-
конец, пятый этап начался с признания ответственности чело-
века (общества) за судьбу всей биосферы.
Вопросы и задания
1- Когда началась история экологии как науки? Назовите первых учепых-сстеетво-
испытателсй. 2. Кто из ученых ввел представление о биоценозе? Дайте определение это-
го понятия. 3. Когда экология сформировалась в самостоятельную науку? 4. Когда
в экологии возникли понятия «экосистема» и «биогеоценоз»? Дайте определения. На-
зовите ученых, которые ввели эти понятия. 5. Какова роль великого русского ученого
В. И. Вернадского в истории экологии? 6. Что такое биосфера и ноосфера? 7. Когда
было основано Международное общество экологов (ИНТ—ЭКОЛ)? 8. Когда н где
состоялась конференция ООН по окружающей среде и развитию? Что такое устойчивое
развитие? 9. Дайте характеристику основных этапов развития концепции экологии.
3. СТРУКТУРА СОВРЕМЕННОЙ ЭКОЛОГИИ
В течение длительного времени экология существовала как
часть биологии и изучала взаимоотношения живых организмов
15
со средой обитания. В рамках биологии она развивалась практи-
чески на протяжении ста лет — до 60—70-х гг XX в Роль челове-
ка в экологических системах недооценивалась, считалось, что
его взаимоотношения со средой подчиняются не биологичес-
ким, а социальным закономерностям.
В настоящее время термин «экология» претерпел существен-
ные изменения. Экология стала учитывать огромное влияние
деятельности человека на окружающую среду, в результате ко-
торой возникают проблемы не только сохранения равновесия
в природе, но и выживания человечества на планете, о чем пре-
дупреждал В И Вернадский
Одпо из важнейших условий обеспечения выживаемости чело-
вечества — это выработка правильного взгляда на взаимоотноше-
ния с живой природой. Мировосприятие через антропоцентризм
(человек в центре природы, он главный) чревато опасностями для
выживания, надо формировать новое мировоззрение — био-
центризм, в центре которого находится сам феномен жизни
Живая природа — вот главное достояние нашей планеты Земля,
и тол ько за счет живой эн ергии природы может существовать че-
ловеческое общество. Она удовлетворяет наши потребности
в продуктах питания, обеспечивает чистоту воздуха и природной
воды, смягчает климат и т. д. Человечество — только часть жи-
вой природы, оно не существует вне ее и подчиняется фунда-
ментальным биологическим законам.
При этом надо избегать и другой крайности, не сужать содержа-
ние экологии до взаимоотношений человеческого общества
с природной средой или до состояния среды, окружающей челове-
ка. Современная экология — это разветвленная система знаний.
В центре научной экологии находятся именно живые системы.
Экология изучает их на уровне организмов, популяций, сообществ
и экосистем, охватывает все уровни организации жизни. Все отде-
лы биологии как науки о жизни вносят свой вклад в дальнейшее
углубление этих знаний. Развитию экологических знаний способ-
ствуют все науки о среде — это физика, химия, науки о Земле,
включая географию, океанологию, метеорологию и др. Они в ос-
новном дают оценку' антропогенных изменений среды. Гумани-
тарные и социальные науки также вносят свой вклад в экологию,
они рассматривают отношение общества к природной среде, его
заботу о жизни настоящих и будущих поколений.
Таким образом, в настоящее время экология представляет со-
бой разветвленную систему наук.
Автор «Экологического манифеста» Н Ф Реймерс в своей
работе «Надежды на выживание человечества. Концептуальная
экология» (М., 1992) предложил следующую классификацию
биологической экологии по иерархическим уровням биотических
систем.
16
1. Эндоэкология, молекулярная экология (в том числе генетиче-
ская связь всего живого); морфологическая экология (экология
клеток и тканей); физиологическая экология (экология индивида).
2. Экзоэкология
— аутэкология (экология особей и организмов как представи-
телей вида);
— демэкология (экология малых групп);
— популяционная экология-,
— специоэкология (экология вида, или эйдэкология);
— синэкология (экология сообществ);
— биоценология (экология биоценозов);
— биогеоценология (учение об экосистемах);
— биосферология (учение о биосфере);
— экосферология (глобальная экология).
По этой терминологии глобальная экология выходит за рам-
ки биосферы и, изучая всю экосферу планеты как космического
тела, комплексно исследует влияние на биосферу антропоген-
ных, космических, геофизических и других воздействий.
Большинство ученых и авторов учебников в биологической
(общей), или классической, экологии чаще всего выделяют аут-
экологию (экологию особей, или организмов), демэкологию (эко-
логию популяций), синэкологию (экологию сообществ, учение об
экосистемах).
По систематическим категориям организмов биоэкологию под-
разделяют на экологию микроорганизмов, грибов, растений, жи-
вотных, человека и т. п.
При этом подразумевается биологический подход к биосфере
и составляющим ее экосистемам. Он может быть иным — гсо-
1рафическим, химическим и т. д. В изучении экосистем можно
выделить географическую, или ландшафтную, экологию, которую
называют также геоэкологией. Существует и экологическая гео-
графия — учение о географическом распространении экосистем.
Экология микрокосмоса исследует и создает замкнутые системы
жизнеобеспечения космических кораблей. Иногда ее называют
космической экологией.
По среде жизни, экологическим компонентам, а также регионам
можно выделить экологию суши (далее по ландшафтам, экосисте-
мам ит. д.), континентальных (пресных и соленых) водоемов, эколо-
гию моря, Крайнего Севера, высокогорий, леса, степи, почв, сельхозуго-
дий, города, может быть выделена архитектурная экология и т. д.
По методам исследований различают химическую, биохимиче-
скую, биогеохимическую и другие аналогичные экологические
дисциплины.
С точки зрения фактора времени различаю!' историческую и
эволюционную экологию (дополнительно археоэкологию и палео-
экологию).
17
Довольно четко выделяются прикладные области экологии:
промысловая, сельскохозяйственная (агроэкология) и промышлен-
ная (инженерная). Промышленная экология исследует воздей-
ствие предприятий на окружающую их среду. К прикладным об-
ластям экологии относятся также созология (от разговорного
англ, sos — спасите!) — охрана природы и средология — охрана
окружающей человека среды. По Реймерсу, термин «прикладная
экология» включаеттакже эколого-экономические дисциплины
и медицинскую экологию.
Необходимо различать экологию человека и социальную эколо-
гию. Экология человека как индивидуума изучает его связи
с окружающей средой, зависимость здоровья от состояния при-
родной и социальной среды. Социальная экология, рассматри-
вающая социальный ряд — личность, семью и т. д., изучает взаи-
модействие общества с природной средой, систему «природа-
общество» на разных уровнях — локальном, региональном,
глобальном. Возможно и разграничение их по особенностям
среды жизни: в экологии человека преобладают природные фак-
торы, а в социальной — социально-экономические.
К социальной экологии тесно примыкает экология культуры.
Все накопленное человечеством богатство нс исчерпывается
чисто материальными ценностями. Оно включает и образы го-
родов, парков, и библиотеки, музеи, картины. Дчя каждого па-
рода или его социального слоя весь материальный культурный
мир специфичен. Это создает предпосылки для развития этно-
экологии, которая включает в себя и отношение этносов к при-
родным ресурсам. Близка к этноэкологии экология народонаселе-
ния. Если этноэкология рассматривает этнос в ходе длительного
исторического процесса, то экология народонаселения приме-
нима к более короткому интервалу времени. Примером является
период перехода от сельского к городскому образу жизни в тече-
ние одного-двух поколений.
Самые общие экологические проблемы включают в общую
экологию, а их часть — в математическую, или теоретическую,
экологию
На рис. 1 представлена структура современной экологии по
А. В. Яблокову. Алексей Владимирович Яблоков — известный
русский эколог, он вместе с Н. Ф. Реймерсом является автором
первого в нашей стране «Словаря терминов и понятий, связан-
ных с охраной живой природы» (М.: Наука, 1982).
Возникают все новые отрасли экологии и научные направле-
ния. В настоящее время насчитывается примерно 50нераеноцен-
ных по объему отраслей экологии, из которых одни более разви-
ты, другие — менее.
Современная экология — это универсальная, быстро разви-
вающаяся, интегративная, комплексная наука (Интеграция оз-
18
Палеоэколог ня
Экология животных
Экология растений
Экология
МЯКрООргЛНПЛМОВ
Экология грибов
Экология и медицина
Экология и культура
Экология и мораль
Экология и npaiso
Экологическое
обраиигание
Эколог ическос
прогпозирование
Экология
и экономика
Экология
И 11ОЛИ1ИКЯ
Историческая
экология
Архсоэкология
Экология человека
Эковогия юрода
(урбОЭКОЛОГ ИЯ)
Экология тундр Лесная
и арктических пустынь экология Экология степей
Сельскохозяйственная
экология (агроэкология)
Экология пустынь
Экология гор
Экология островов
Экология
континентальных вод
Экология
морских побережий
и эстуариев
Экология оксана (моря)
Космическая экология
► Экология атмосферы
Экология гидросферы
Экология литосферы
Экология почв
Радиационная эколог ия
Химическая экология
Ландшафтная экология
Глобальная экология
Рекреационная экология
Промысловая эколог ия
Инженерная
(промышленная)
экология
Рис. 1. Структура современной экологии (по А В. Яблокову)
начает процесс сближения и связи различных наук.) Современная
экология рассматривает широкий круг вопросов, она давно выш-
ла за рамки биологии и тесно связана с длинным рядом смежных
наук, в числе которых география, физика, геология, метеороло-
гия, химия, медицина и т д. Современную экологию необходи-
мо рассматривать не столько как самостоятельную науку, сколь-
ко как мировоззрение, которое объединяет все сферы деятель-
ности людей, естественные, технические, гуманитарные науки.
Экологический аспект в настоящее время играет все большую
роль при решении любых практических задач. Методы экологии
позволяют предсказывать последствия хозяйственной деятель-
ности человека, давать рекомендации, как развивать сельское
хозяйство и промышленность, не истощая природных ресурсов
и не разрушая природных сообществ. Экология дает человеку
новые знания об окружающей среде, является ориентиром при
разработке новых технологий и определяет нравственное пове-
дение по отношению к природе, помогает осознать, что от со-
стояния окружающей среды зависят здоровье и качество жизни
самого человека.
19
В призыве Конференции ООН по окружающей среде и разви-
тию (1992 г.), обращенном ко всем государствам и правительствам,
сформулирована первоочередная задача обеспечения просвещения
по вопросам развития и сохранения окружающей среды.
Вопросы и задания
I. Дайте пояснение понятиям «антропоцентризм» и «бноцентризм». 2. Какой вклад
в развита: экологии внося естественные, гуманитарные и социальные науки? 3. Что
изучает биологическая, или классическая, экология? Назовите ее основные научные
Hai равления. 4. Что изучают аутэколо! ия, демэколошя и синэкология? 5. Укажите раз-
деление экологии ио следующим критериям’ систематическим категориям организмов;
среде жизни; методам исследований; фактору времени. 6. Назовите прикладные облас-
ти экологии. 7. В чем различие экологии человека и социальной экологии? 8. Каково
значение экологических знаний?
Глава 1
ПРЕДМЕТ И ОСНОВНЫЕ ПОНЯТИЯ
ЭКОЛОГИЧЕСКОЙ ХИМИИ
При грамотном, творческом и
добросовестном использовании до-
стижений химия является вели-
чайшей производительной и интел-
лектуальной силой общества.
Академик Ю. Д. Третьяков
1.1. ХИМИЧЕСКАЯ ЭКОЛОГИЯ
И ЭКОЛОГИЧЕСКАЯ ХИМИЯ
Одним из научных направлений и отраслей современной эко-
логии является химическая экология. Близка к ней по содержа-
нию экологическая химия. Рассмотрим различие этих наук.
С 1950-х гг. отмечается быстрое изменение материального со-
става окружающей среды, что связано с возрастающим техно-
генным воздействием, с быстрым развитием промышленности,
транспорта, химизации сельского хозяйства, а также с интенсив-
ной урбанизацией (ростом и развитием городов). Растущие
объемы промышленного производства, распространение про-
мышленных химических продуктов по всему миру и тенденции
к их рассеянию приводят к появлению в заметных концентраци-
ях химических реагентов вдали от места их производства или по-
требления. Отмечено изменение химического состава биосфе-
ры, что ухудшает условия существования животных, растений и
человека. К настоящему времени возникла необходимость более
глубокого изучения химических продуктов и материалов, вы-
пускаемых промышленностью, чтобы по-новому взглянуть на тс
химические процессы, которые протекают в природных средах
(атмосфере, гидросфере и литосфере). В условиях возрастающих
масштабов человеческой деятельности необходимо знание хими-
ческих механизмов взаимодействия между человеком, средой оби-
тания и отдельными экосистемами. Так возникают химическая
экология и экологическая химия. Биологический аспект такого
взаимодействия находится в ведении химической экологии как
21
науки о химических взаимодействиях между живыми организмами
или между живой и неживой природой. Химический аспект каса-
ется в основном качественного и количественного состава хи-
мических загрязнений и их превращений в окружающей среде.
Эти вопросы находятся в компетенции экологической химии.
Экологическая химия — это наука о химических процессах и взаи-
модействиях в окружающей среде, а также о последствиях таких
взаимодействий. Эти процессы определяют состав и свойства
объектов окружающей среды.
Термины «химическая экология» и «экологическая химия»
подчеркивают взаимосвязь химии и экологии. Экология, возник-
шая как наука о взаимоотношениях живых организмов и их со-
обществ между собой и со средой обитания, трансформирова-
лась в науку о структуре природы. Химия как наука о веществах и
их взаимных превращениях описывает состав и свойства компо-
нентов природы на атом но-молекулярном уровне. Обе эти дис-
циплины, взаимно дополняя одна другую, должны создать науч-
ные основы природопользования и охраны природы, способ-
ствовать оптимизации взаимодействия человека с природой.
Экологическая химия — это химия окружающей среды. Такое
краткое определение экологической химии дает известный уче-
ный Дж Бокрис. автор фундаментального труда «Химия окру-
жающей среды». Эта наука дает представление о химических
процессах, протекающих в окружающей среде под влиянием ант-
ропогенной деятельности, о воздействии загря- няющих веществ
на состояние среды, включая флору, фауну и человека. Экологи-
ческую химию можно также определить как науку, изучающую хи-
мические основы экологических явлений и проблем. Экологическая
химия тесно связана с другими областями знаний: биологией,
медициной, физикой, метеорологией, науками о Земле, сель-
скохозяйственной химией, почвоведением и др Экологическая
химия является комплексным научным направлением, тесно
связанным с перечисленными направлениями
Цель экологической химии состоит в изучении изменений
химического состава окружающей среды и прогнозировании
возможных экологических последствий таких изменений.
Экологическая химия дает экологическую оценку химиче-
ских веществ преимущественно на примере промышленных
продуктов. Но в последние годы при изучении этих вопросов
стало ясно, что природные вещества могут оказывать на биосфе-
ру такое же, а иногда и большее воздействие, чем антропоген-
ные. Природные вещества ни в коей мере нельзя считать всегда
экологически безопасными.
Сравним результаты изменений окружающей среды, вызван-
ные деятельностью человека и естественными причинами. Со-
поставление проведем по трем критериям: количественному по-
22
казателю, скорости и токсичности. Изменения природной сре-
ды в масштабах планеты, вызванные антропогенным вмешатель-
ством, количественно незначительны по сравнению с естест-
венными изменениями. Только в отдельных районах Земли за-
грязнения могут достигать порядка нескольких процентов и
более Однако естественные изменения в природной среде про-
исходят столь медленно, что для всего живого на Земле сохраня-
ется возможность генетически приспособиться к изменениям
окружающей среды. Антропогенное же вмешательство проявля-
ется весьма быстро и не оставляет шансов на это приспособле-
ние, особенно для высших организмов Например, обогащение
земной атмосферы кислородом от 1 до 21 % продолжалось от 1 до
1,5 млрд лет, что составляет примерно 0 004% в 200—300 тыс. лет,
тогда как в результате человеческой деятельности содержание
СО, в воздухе возросло на те же 0 004% в течение нескольких
последних десятилетий. Третья особенность антропо! еииого
воздействия на природу состоит в том, что при этом образуются
высокотоксичные для всего живого продукты. Возникновение
токсичных зшрязнсиий может быть связано как с накоплением
природных веществ (например, тяжелых металлов — свинца,
хрома, кадмия и др ), так и с получением новых веществ (пести-
цидов и др.) В любом случае важно раннее распознавание влия-
ния промышленных химических продуктов и продуктов превра-
щения природных соединений на окружающую срезу
Односторонний взгляд па химию как на единственную причи-
ну нарушения экологического равновесия в природе и виновницу
экологических бед неправомочен и в корне неверен. Современ-
ный человек уже не сможет обойтись без многих химических ма-
териалов и продуктов химической промышленности. Но главное
в том, что химическая наука и химическая промышленность по-
могают решать экологические проблемы, разрабатывая новые ме-
тоды очистки отходящих газов и сточных вод, предлагая эффек-
тивные способы переработки промышленных и бытовых отходов
в новую полезную продукцию, внедряя малоотходные, безотход-
ные, экологически безвредные технологические процессы (эко-
технологии). Для использования таких процессов необходимо
знать свойства химических продуктов, уметь прогнозировать по-
ведение химических веществ в окружающей среде и предвидеть
вредное воздействие на биосферу (экотоксикология). Эго нужно
для того, чтобы 'заблаговременно принимать необходимые защит-
ные меры, например заменять вещества безвредными для окружа-
ющей среды продуктами. Нужно разрабатывать критерии отбора
таких веществ.
Можно сформулировать три основные задачи экологиче-
ской химии, от решения которых зависит сохранение среды
обитания.
23
1. Разработка энерго- и ресурсосберегающих технологий, све-
дение к минимуму выбросов в атмосферу и гидросферу. Это
достигается комплексным использованием сырья, внедрением
безотходных производств, водооборотных схем, заменой отдель-
ных стадий процессов экологически более чистыми процессами
и т. д.
2. Повышение эффективности очистки выбрасываемых в ат-
мосферу газов и сбрасываемых в водоем сточных вод от наиболее
вредных веществ.
3. Оценка воздействия на окружающую среду загрязняющих
веществ и прогнозирование их дальнейшего поведения, распро-
странения и превращения в другие вещества под влиянием фак-
торов среды.
Вопросы и задания
1. Чем обусловлено возникновение экологической химии как науки? 2. Что изучает
экологическая химия? Охарактеризуйте предмет этой науки. 3. В чем отличие химиче-
ской экологии от экологической химии? 4. Сравните изменения окружающей среды,
вызпашшс деятельностью человека и естественными причинами. 5. Какие задачи ре-
шает экологическая химия?
1.2. ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ
Экологическая химия, как и любая другая отрасль научных
знаний, имеет свой словарь терминов, понятий и определений.
Рассмотрим наиболее важные из них и те, которые использова-
ны в данной книге.
Одним из наиболее часто употребляемых понятий является
«загрязнение». Чаше всего под термином «загрязнение» понимают
многочисленные и разнообразные воздействия, которые так или
иначе разрушают естественную среду. Загрязнение означает
влияние всех токсичных веществ, которые человек выбрасывает
в экосферу Экосфера — это совокупность свойств планеты Зем-
ля, которые создают условия для развития жизни на Земле. За-
грязнением могут быть и малоопасные, безвредные для живых
существ соединения, воздействующие на окружающую среду
лишь в большой концентрации, например углекислый газ, со-
держание которого в атмосфере увеличивается в результате сжи-
гания топлива.
Н. Ф Реймерс определяет «загрязнение» окружающей среды
как «привнесение в среду или возникновение в ней новых,
обычно не характерных для нее физических, химических, ин-
формационных или биологических факторов, или превышение
естественного среднего уровня содержания данных факторов
24
в среде, приводящее к негативным последствиям». «Загрязне-
ние» можно определить и как поступление любых веществ или
материалов в неположенное место. Будучи полезными в одном
месте, они вызывают загрязнение, когда выбрасываются или по-
ступают туда, где никому нс нужны и могут нанести ущерб окру-
жающей среде или здоровью человека. Иначе говоря, «загрязне-
ние» — это все то, что появляется не в том месте, нс в то время и
нс в том количестве, как естественно для природы, т е. все то,
чго выводит природу из состояния равновесия.
Ф. Рамад в книге «Основы прикладной экологии» (1981) при-
водит определение из доклада официальной комиссии Белого
дома (США): «Загрязнение есть неблагоприятное изменение
окружающей среды, которое целиком или частично является ре-
зультатом человеческой деятельности, прямо или косвенно ме-
няет распределение приходящей энергии, уровни радиации, фи-
зико-химические свойства окружающей среды и условия су-
ществования живых существ. Эти изменения могут влиять на
человека прямо или через сельскохозяйственные ресурсы, через
воду или другие биологические продукты (вещества). Они также
могут воздействовать на человека, ухудшая физические свой-
ства предметов, находящихся в его собственности, условия от-
дыха на природе и обезображивая се саму».
Трудно дать простое определение загрязнению, так как оно
включает много факторов, связанных с самыми разными источ-
никами. Можно принять такое определение загрязнения. Под
загрязнением окружающей среди понимается поступление в при-
родную среду любых твердых, газообразных или жидких веществ,
микроорганизмов или энергии (тепловой, электромагнитной, ради-
ационной, звуковой) в количествах, вызывающих изменение соста-
ва и свойств компонентов природы, оказывающих вредное воздей-
ствие на человека, флору и фауну (Скурлатов Ю, И ., Дука Г Г., Ми-
зигиА., 1994).
Загрязнение окружающей среды может возникать вследствие
естественных причте, землетрясений, вулканической деятельно-
сти, лесных пожаров, биологического самозагрязнения водоемов
(их «цветения»), постоянно идущей эрозии, а также эрозии, вы-
званной бурями и наводнениями. Ярким примером природного
краткосрочного изменения состава окружающей среды является
деятельность вулканов, когда в атмосферу поступают тысячи
тонн различных веществ. Типичные вулканические газы содер-
жат (об.%): водяного пара — 79%, СО, — 12%, SO2 — 7%, N2 —
1% и в сумме (СО + H2S + НС1 + СН4 + Аг) — 1%.
Обычно под загрязнением имеют в виду антропогенные за-
грязнения, т. с. загрязнения окружающей среды в результате хо-
зяйственной деятельности человека. О масштабах антропоген-
25
кого воздействия на биосферу можно судить по данным, пред-
ставленным в табл. 1.1.
Таблица /. /
Масштабы антропогенного Воздействия па биосферу
(по Ю. И. Скурлатову, Г. Г. Дуке, А. Мизити, 1994)
Извлечение из биосферы в год Поступление в биосферу в год
Ископаемые — 100 млрд т Металлы — 800 млн т Химические вещества — 100 тыс. наименований Синтетические материалы — 60 млн т Минеральные удобрения — 500 млн т Пестициды — 5 млн т Железо — 50 млн т Жидкий сток — 500 млрд м3 Твердый сток — 17,4 млрд т СО,— 20 млрд т SO2— 150 млн т
Виды загрязнений многообразны и связаны с деятельностью
человека, например:
• выбросы вредных веществ в атмосферу (твердых частиц
пыли, дыма, золы, сажи; газообразных веществ — сернистого
газа SO2, оксидов азота NO,, углекислого газа СО2, угарного газа
СО, углеводородов С,Н, и др.);
• попадание в природные воды сточных вод бол ьшихживот-
новодческих комплексов, промышленных и бытовых сточных
вод, содержащих различные неорганические и органические ве-
щества и микроорганизмы;
• за1рязненис водной среды и почвы нефтепродуктами, ми-
неральными солями, тяжелыми металлами (Hg, Cd, Pb, Си, Zn
и др.), СПАВ (синтетическими поверхностно-активными ве-
ществами, например моющими средствами);
• широкое применение пестицидов — химических средств
защиты сельскохозяйственных растений от вредителей, болез-
ней и сорняков (хлорпроизводных углеводородов, фосфорорга-
нических и других веществ);
• засорен не ландшафтов мусором и твердыми отходами про-
изводства и потребления (остатками исходного сырья, побочны-
ми продуктами, металлоломом, резиной, пластмассой, стеклом,
тарой, бумагой и т. п.);
• повышение уровня ионизирующей радиации, источником
которой являются радиоактивные вещества (например, U-235,
Th-232, Sr-90, Cs-137 и др.), в результате самопроизвольного
превращения которых могут возникать а- и р-частицы, нейтро-
ны, у-лучи, оказывающие сильное воздействие на человека, вы-
зывая генетические изменения;
26
• накопление тепла в атмосфере и гидросфере, ведущее к из-
менению климата и другим последствиям;
• усиление звуковых и электромашитных воздействий, су-
щественно влияющих на жизнедеятельность человека и животных.
Из существующих вариантов классификации загрязнения окру-
жающей среды —
• по природе загрязнителей (физическое, химическое, био-
логическое и т. и.);
• по состоянию загрязняющего вещества (газ, жидкость,
твердые отходы и,т/д.);
• по стойкости загрязнения в естественной среде (разрушае-
мое и неразлагаемос);
• но виду или качеству природной среды, где распространя-
ется загрязнение (атмосфера, гидросфера, литосфера и т. н.);
• по медицинским показаниям, способу поражения челове-
ческого организма (через пищу, при кожных контактах, приды-
хании и т. д.) —
ни один не является полным, поскольку в реальных условиях
живые организмы подвергаются воздействию не одного, а не-
скольких загрязнителей, и воздействия одного и того же ве-
щества могут быть качественно различными, и проникать оно
в организм может нс одним, а несколькими способами. Напри-
мер, ртуть, оказавшись в почве, затем попадает в атмосферу,
в воду и далее — в растения и животные, т. е. вместе с раститель-
ной и животной пищей ртуть проникает в желудок человека,
а при дыхании — в легкие.
Рассмотрим подробнее одну из часто используемых класси-
фикаций, в которой виды загрязнений распределяют по характе-
ру их влияния на экосистемы:
1) изменение химического состава окружающей среды за счет
поступления чуждых естественным экосистемам веществ (отхо-
дов различных производств, инсектицидов, бытовых стоков
и др.) — химическое загрязнение-,
2) изменение физических характеристик окружающей среды
(теплового баланса, уровня освещенности, шума, радиационно-
го фона, интенсивности электромагнитного излучения и др.) —
физическое загрязнение",
изменение биологического разнообразия, состава и функцио-
нирования популяций живых организмов (результат нерегули-
руемого отлова, отстрела животных, браконьерства, истребле-
ния отдельных видов организмов); развитие болезнетворных
бактерий и вирусов, гельминтов, простейших, нарушение био-
ценозов из-за неумелого внедрения новых видов организмов —
биологическое загрязнение",
4) изменение природных ландшафтов и экосистем в процессе
природопользования, вызывающее отрицательные экологичс-
27
скис последствия и приносящее эсгстический вред (грубая урба-
низация, осушение болот, вырубка лесов, распашка степей, эро-
зия почв, мелиоративные работы, создание искусственных водо-
емов и др.).
Вопросы и задания
1. Дайте определение понятия «загрязнение». 2. Приведите примеры, характеризую-
щие масштабы антропогенного воздействия ня биосферу. 3. Какие вилы загрязнений эко-
систем вы знаете? 4.11ривсдитс наиболее часто встречающуюся классификацию эагряэнс-
1Шй. 5. В чем различие химического и физического загрязнений окружающей среды?
1.3. ХИМИЧЕСКИЕ ЗАГРЯЗНЯЮЩИЕ ВЕЩЕСТВА,
ИХ ИСТОЧНИКИ И РАСПРОСТРАНЕНИЕ В БИОСФЕРЕ
Одним из основных факторов неблагоприятного антропоген-
ного воздействия на окружающую среду является ес химическое
загрязнение. Этому виду загрязнения подвержены все среды
обитания (водная, наземно-воздушная, почва) и сами живые
организмы. В природную среду все в больших количествах попа-
дают газообразные, жидкие и твердые отходы промышленного,
сельскохозяйственного и бытового происхождения, ухудшая ус-
ловия существования растений, животных и человека.
По оценке Всемирной организации здравоохранения (ВОЗ),
из более чем 6 млн известных химических веществ практически
используется до 500 тыс. соединений. Из них около 40 тыс. ве-
ществ обладают вредными для человека свойствами, а 12 тыс.
являются токсичными (ядовитыми). Ассортимент химических
веществ ежегодно возрастает на 5%.
Как следует из табл. 1.1, ежегодно в биосферу поступает до
100 тысяч различных химических веществ, из них 60 млн т
синтетических материалов, 500 млн т минеральных удобрений,
5 млн т пестицидов, 50 млн т железа и, кроме этого, масса других
жидких и газообразных веществ В результате сжигания топлива
в атмосферу ежегодно поступает более 20 млрд т углекислого
газа и более 700 млн т паре- и газообразных соединений и твер-
дых частиц. При сжигании низких сортов угля и мазута в атмо-
сферу за год выделяется 150 млн т сернистого газа.
Химические вещества, загрязняющие среду обитания, назы-
ваются поллютанты (от лат. pollutio — марание); синоним — за-
грязнители Веществами-загрязнителями можно назвать такие
вещества, которые попадают в биосферу в процессе деятельности
человека, нарушают баланс веществ экосистемы, делают среду
обитания менее благоприятной.
В экологической химии важно определять источники загряз-
няющих веществ и закономерности распределения их в биосфере.
28
Источники химических загрязняющих веществ разнообраз-
ны. К основным источникам загрязнения относятся транспорт,
тепловая и атомная энергетика, промышленное и сельскохозяй-
ственное производство, коммунальное хозяйство городов. При-
ведем некоторую информацию но данным источникам загряз-
нения. Автотранспорт — основной источник загрязнения атмо-
сферы: увеличение численности мирового парка автомашин
приводит к загрязнению атмосферы монооксидом углерода СО,
оксидами азота NOX, углеводородами С,НУ, диоксидом серы SO,,
тяжелыми металлами (преимущественно свинцом), в неболь-
ших количествах альдегидами, сажей, бенз[о|пирсном и др.
В состав выхлопных газов автотранспорта входит более 200 ком-
понентов.
Возрастание морских перевозок вызывает загрязнение морей
и океанов нефтью и нефтепродуктами. В процессе работы тепло-
вых электростанций происходит загрязнение воздуха оксидами
углерода и серы, образуются также огромные количества твер-
дых отходов (шлаков, золы). Атомные электростанции (АЭС)
служат источником радиоактивного загрязнения биосферы.
Промышленными источниками химического загрязнения
окружающей среды являются горнодобывающая, металлурги-
ческая, металлообрабатывающая, химическая, нефтедобываю-
щая, нефтеперерабатывающая, целлюлозно-бумажная, дерево- >
обрабатывающая и пищевая отрасли промышленности. Все они
за»рязняют биосферу твердыми отходами, газовыми выбросами
и сточными водами, содержащими самые разные неорганиче-
ские и органические вещества: металлы, неметаллы, оксиды,
кислоты, щелочи, соли, углеводороды, альдегиды, карбоновые
кислоты, спирты, фенол, бензол, толуол, ацетон и др. Широкое
применение в сельском хозяйстве удобрений — минеральных
(азогных, фосфорных, калийных) и органических (отходов жи-
вотноводства) — приводит к зафязнению почвы, водоемов и
сельскохозяйст венной продукции биогенными элементами (N, В К)
и патогенными микроорганизмами. Ненормированное приме-
нение в земледелии пестицидов (химических средств зашиты
растений) приводит к появлению ядохимикатов в атмосфере,
почве и природных водах. Установлено, например, что в гидро-
сферу поступило 25% пестицида ДДТ (дихлордифен илтрихлор-
этана), запрещенного в настоящее время к употреблению. В про-
изводстве пестицидов используют более 700 химических веществ.
Значительным источником загрязнения являются комму-
нально-бытовые сточные воды больших городов, которые очи-
щаются не полностью, т. е. сбрасываются в природные воды
в загрязненном виде. Объем сточных вод в мире достигает по-
рядка 450 км3 в гол В городскую канализацию поступают также
сточные воды промышленных предприятий, энергетики, транс-
29
порта (промышленные стоки) и поверхностный сток, т. с. дож-
девые и снеговые воды.
Коммунальное хозяйство городов дает также большое коли-
чество твердых бытовых отходов (ТБО), содержащих макулату-
ру, металлы, пластмассу, стекло, текстиль, пищевые отходы и др.
Ежегодно в России образуется около 130 млн м’ ТБО.
Таким образом, источников загрязнения много, и большин-
ство из них поставляет в биосферу не одно, а нсскол ько десятков
загрязняющих веществ. На рис. I 1 представлены основные ис-
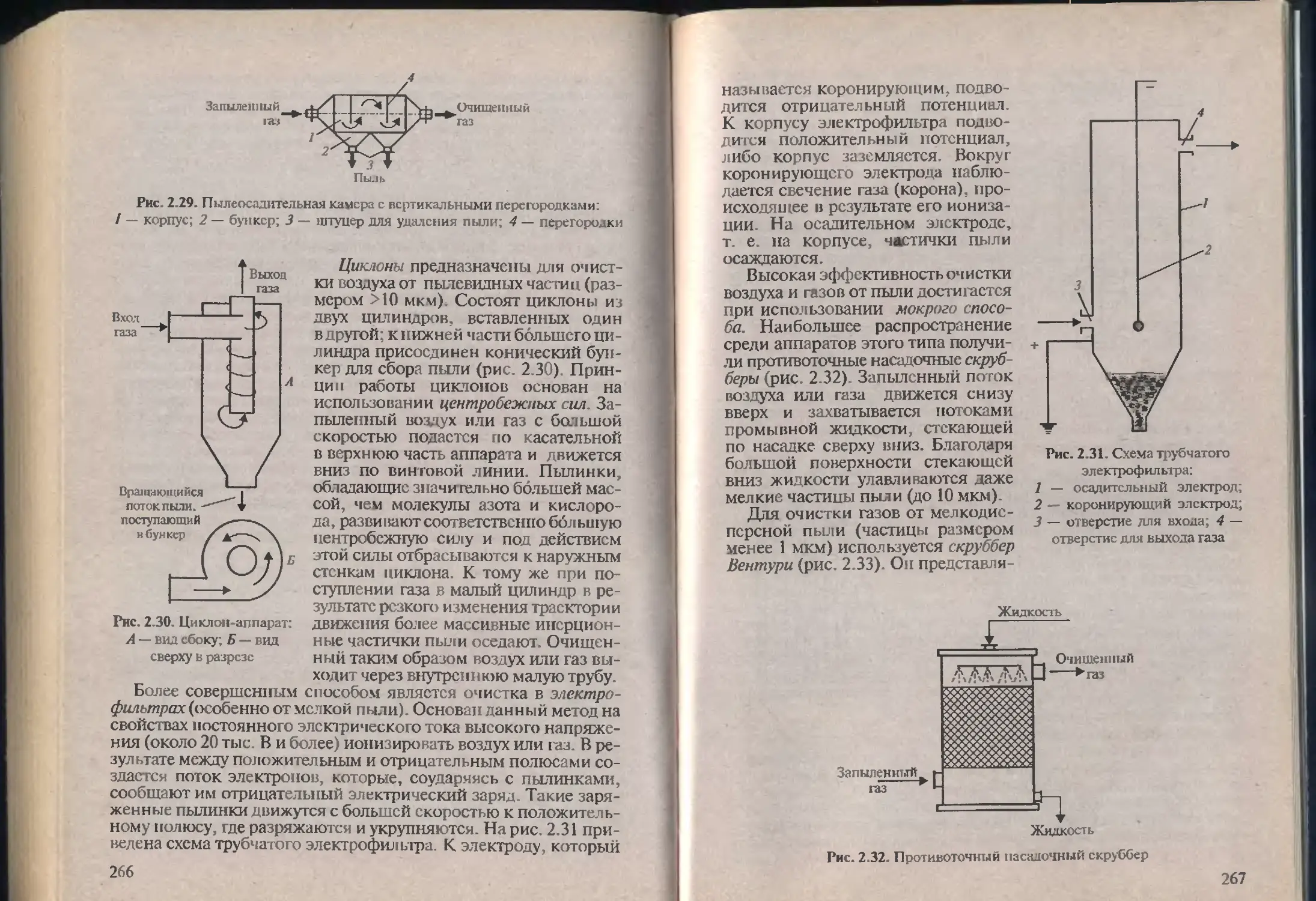
точники загрязнения биосферы.
Химические загрязняюшие вещества перемещаются в био-
сфере. Попав первоначально от источника в одну из природных
Рис. 1.1 Основные источники загрязнения биосферы:
1) металлургическая промышленность: элсктросталснлавильный цех; 2) атом-
ная энергетика: Белоярская АЭС; 3) нефтеперерабатывающая Промышлен-
ность: Кременчугский НПЗ; 4) сельскохозяйственное производство; 5) хими-
ческая промышленность: Белореченский химический завод; 6) горнодобы-
вающая промышленность; 7) коммунальное хозяйство: городская свалка;
Я) теплоэнергетика Новосибирскэнерго; 9) автотранспорт
30
сред, они постепенно загрязняют и другие среды (воздух, воду,
почву). Например, применение избыточных количеств азотных
удобрений (нитратов) приводит к загрязнению почвы, потом
подземных и поверхностных вод. Из почвы нитраты попадают
в растения, далее — в организм животных и, наконец, с продук-
тами питания и водой — в организм человека, вызывая заболева-
ние — нитратную метгемоглобинемию.
Распределение загрязняющих веществ в биосфере происхо-
ди! неравномерно. В разных природных средах они распростра-
няются с разной скоростью, а следовательно, и на разные рас-
стояния. В наибольшей степени рассеяние загрязняющих ве-
ществ происходит в атмосфере.
Загрязнения биосферы подразделяются на локальные, регио-
нальные и глобальные. Локальное загрязнение — это загрязнение
окружающей среды в конкретной местности в ограниченных про-
странственно-временных масштабах. Такие загрязнения обычно
наблюдаются вокруг промышленных предприятий, городов,
рудников, животноводческих комплексов. Химический состав
таких загрязнений определяется в основном их источником. На-
пример, локальное за1рязнепис почвы свинцом наблюдается
вдоль автотрасс с интенсивным движением. Около крупных жи-
вотноводческих комплексов поверхностные воды и почва могут
быть загрязнены ионами аммония. Локальное загрязнение бывает
техническое, или эксплуатационное, наблюдаемое при нормаль-
ной работе предприятия, и аварийное, вызванное резким и не-
ожиданным нарушением работы предприятия, связанным с вы-
бросом в биосферу большого количества вредных веществ.
Техническое загрязнение, как правило, остается локальным. Ава-
рийное загрязнение нередко переходит в региональное, а в катаст-
рофических случаях — в глобальное. Примером катастрофичс-
ского загрязнения окружающей среды явилась авария на Чер-
нобыльской АЭС в 1986 г. Повышение уровня радиации было
зарегистрировано тогда практически по всему земному’ шару.
Региональное загрязнение формируется на основе локальных за-
грязнений при увеличении их количества или пространственно-
временных масштабов. Региональное загрязнение проявляется
в пределах значительных территорий (региона), но не охватыва-
ет всю планету. Причиной региональною загрязнения является
поступление загрязняющих веществ в биосферу в течение дли-
тельного времени, и особенно если эти вещества поступают
в подвижные компоненты биосферы — в атмосферу и природ-
ные воды.
Переход локальных загрязнений в региональные может быть
связан с расширением территорий юродов, которые постепенно
превращаются в гигантские мегаполисы с многомиллионным
населением. Так, в США на Атлантическом побережье страны
31
сформировался огромный урбанизированный район площадью
около 150 тыс. км2 и населением более 40 млн человек (слив-
шиеся агломерации городов Бостона, Нью-Йорка, Филадель-
фии, Балтимора и Вашингтона). Атмосферные выбросы пред-
приятий большого города переносятся па большие территории,
создавая региональное за1рязнсние.
Примером регионального загрязнения может служить загряз-
нение природных вод нефтью и нефтепродуктами на обширных
акваториях Мексиканского или Персидского заливов. Площади
нефтяных пятен после аварий достигают нескольких тысяч
квадратных километров. В Узбекистане и Молдавии отмечались
региональные загрязнения почвенного покрова пестицидами.
Глобальное загрязнение — это загрязнение, которое нарушает ес-
тественные физико-химические, биологические показатели биосферы
в целом и обнаруживается практически в любой точке нашей плане-
ты. Как правило, глобальные загрязнения переносятся атмосфер-
ными потоками на большие расстояния от места своего возникно-
вспия. Основными загрязняющими веществами атмосферы явля-
ются оксиды у!лсрода, серы и азота (СО, SO2, NO,), углеводороды
(CjHJ и взвешенные частицы (пыль, дым). К глобальным загрязне-
ниям биосферы следует отнести и радиоактивные выпадения.
Вопросы и задания
1. Какие вещества называются «загрявнителями»? 2. Приведите примеры химиче-
ских загрязняющих веществ и их поступлений в биосферу. 3. Норис. 1.1 охарактеризуй-
те основные источники загрязнений. 4. Какие загрязнения называются локальными,
региональными, глобальными? При выше примеры.
1.4. КЛАССИФИКАЦИЯ ВЕЩЕСТВ
ПО ХАРАКТЕРУ ВОЗДЕЙСТВИЯ
НА ЖИВЫЕ ОРГАНИЗМЫ
Все присутствующие в биосфере химические вещества как
природного, так и антропогенного происхождения составляют
хемосферу.
В экологической химии нет единой классификации веществ.
Их подразделение можно производить по разным признакам.
С экологической точки зрения важно знать нс только источники
химических веществ и их распространение в биосфере, по и об-
ласти применения, поведение химических продуктов в окру-
жающей среде, биологические последствия их воздействия.
В разделе 1.3 рассмотрена классификация загрязняющих хи-
мических веществ по источникам возникновения (промышлен-
ные, зрапспортные, сельскохозяйственные, коммунально-бы-
товые) и по пространственному распределению (локальные, рс-
32
гиональные, глобальные). Загрязняющие вещества классифици-
руют также по областям применения и характеру воздействия.
С этой точки зрения можно выделить несколько важных групп.
Биоциды — это вещества, действие которых направлено против
живых существ. К ним относятся инсектициды (для уничтоже-
ния насекомых), фунгициды (для борьбы с фитопатогенными
грибами и бактериями), гербициды (для уничтожения сорняков)
и др., имеющие общее название пестициды. Они являются зна-
чимыми для окружающей среды, так как применяются длитель-
ное время. Другую группу' составляют добавки к пищевым продук-
там и косметическим средствам. Они имеютбольн ое значение, так
как непосредственно используются человеком. Третью группу
химических продуктов составляют удобрения, моющие средства и
растворители для химической чистки, которые также важны, по-
скольку применяются широко и в больших количествах.
Другая классификация веществ подразделяет их на природные
и нс свойственные окружающей среде вещества — ксенобиотики
(от греч. xenos — чужой и bios — жизн ь) Ксенобиотиками называ-
ются вещества, чуждые живым организмам по своей структуре и
биологическим свойствам и получающиеся в результате хими-
ческого синтеза. К ним относится, например, запрещенный в
настоящее время к употреблению пестицид ДДТ (дихлордифе-
нилтрихлорэтан), имеющий следующую структурную формулу и
химическое название:
2.2.2-трнхл«р-1,1 -Г1ис(л-хлорфе1шл)31а11
В экологической химии различают также экзогенные вещест-
ва и экотокенканты. Экзогенные вещества (от греч. ехо — снару-
жи и genesis — происхождение) — это вещества, появление кото-
рых связано с деятельностью человека, т. е. термин подчеркивает
нсприродное происхождение вещества. Экотоксиканты (от
греч. oikos — дом и toxikon — яд) — это ядовитые вещества антро-
погенного происхождения Имеются также суперэкотоксиканты
(отлат. super— сверху, над) — это вещества, обладающие в малых
дозах мощным токсическим действием полифункиионального
характера. К ним относятся диоксины, дибсизофураны, бензан-
трацены, микотоксины; нитрозоамины, нафтиламины и др.
Ниже приведены формулы веществ, представляющие эти клас-
сы соединений:
2,3,7,8-тетрвии1ирдибснзодиокснн
дибенэофурап
В-пафтиламин
Более подробно о диоксинах и нитрозоаминах см. на с. 37, где
приводятся сведения о мутагенности и канцерогенности.
Особую группу химических продуктов составляют радиоак-
тивные вещества, сильное биологическое действие которых выз-
вано их ионизирующим излучением.
Все вещества хемосферы можно условно разделить на четы-
ре группы. Первую группу составляют безвредные для чело-
века вещества, например кислород, азот, хлорид натрия, гидро-
карбонат натрия и др Ко в т о р о й группе относятся вещества,
действующие на человека опосредованно, делая менее благо-
приятной среду его обитания. Это парниковые газы (СО2, СН4
и др ), вызывающие потепление климата; фторхлорпроизвод-
ные углеводородов (фреоны), вызывающие разрушение защит-
ного озонового слоя Земли ит. д. Ктретьей группе принад-
лежат токсиканты, которые оказывают прямое действие па
человека, отравляя его, например сероводород, ртуть, соедине-
ния мышьяка и т. д. Ч с т в е р т у ю группу составляют вещества
неопределенного характера, о биологическом действии кото-
рых нет достаточных сведений. Проводя такое разделение ве-
ществ, надо помнить, что одно и то же вещество, взятое в ма-
лых количествах, является безвредным и даже необходимым
человеку, как, например, поваренная соль (хлорид натрия),
а в больших количествах оно же оказывает вредное действие на
организм человека
Предлагается также подразделять все вещества (в зависимо-
сти от их воздействия на живые организмы) на пять типов (Боб-
ков А. С., 1997).
1. Необходимые для организма вещества (при недостатке их
в организме возникают функциональные нарушения, которые
устраняются при введении в организм этих веществ).
2. Стимуляторы (стимулирующие обменные процессы) —
в качестве таких веществ могут выступать как необходимые, так
и нс необходимые для организма в данное время вещества
3. Терапевтические агенты — вещества, способствующие лик-
видации появляющихся заболеваний.
4. Инертные вещества, т. е. безвредные вещества, не оказы-
вающие какого-либо воздействия на организм.
34
5. Токсичные вещества, причиняющие вред организму, иногда
необратимый, что ведет к функциональным нарушениям, де-
формациям, летальному исходу.
На рис. 1.2 показано, каков может быть биологический ответ
организма на увеличение концентрации любого из веществ, по-
ступающих извне.
Рис. 1.2. Биологический ответ организма в зависимости от концентрации
необходимого (сплошная кривая) и токсичного (штриховая кривая) вещества.
Взаимное расположение двух кривых относительно шкалы
концентраций условное
Каждое вещество имеет спою собственную специфическую
кривую в координатах «биологический ответ — концентра-
ция». Как видно из хода кривых, даже необходимые вещества
(А) могут стать токсичными при избыточном их потреблении,
например в случае ограничения усвояемости других необходи-
мых веществ. Организм поддерживает концентрацию веществ
в оптимальном интервале посредством комплекса физиологи-
ческих процессов.
Все вредные вещества по степени их воздействия на организм
человека разделены на четыре класса опасности В основу класси-
фикации положены показатели, характеризующие степень опас-
ности веществ в зависимое ги от их токсичности, кумулятивности,
способности вызывать отдаленные побочные явления.
35
Приведем эту классификацию с примерами неорганических
и органических веществ, загрязняющих водоемы хозяйственно-
питьевого и культурно-бытового назначения:
I класс — чрезвычайно опасные вещества (ртуть, бериллий,
фосфор; бенз|а]пирен, тетраэтилсвинец, диэтилртуть, пента-
хлорбифенил и др.);
II класс — высокоопасные вещества (кадмий, мышьяк, свинец,
барий, бром, алюминий, бор, цианиды, роданиды, нитриты; ди-
фенил (фепилбензол), алкиланилин, ампициллин, бензилпени-
циллин, винилхлорид, формальдегид, анилин, циклогексан, пи-
ридин, бензол, метанол и др.);
III класс — опасные вещества (хром, ванадий, железо, медь,
цинк, сульфиды, аммиак, нитраты; дифениламин, белково-ви-
таминный концентрат (БВК), бензин, стирол, бутилен, этилен,
ацетон и др.);
IV класс — умеренно опасные вещества (фосфат кальция, хло-
риды, сульфаты; метилмеркаптан, фенол, гексахлорэтан, керо-
син, нафталин, толуол, олефинсульфонаты, карбоновые кисло-
ты, алкил сульфонаты, нефть и др.).
В 2001 г. Министерством природных ресурсов РФ утвержде-
ны «Критерии отнесения опасных отходов к классу опасности
для окружающей природной среды». По этому документу класс
опасности отходов устанавливается по степени возможного вред-
ного воздействия на окружающую природную среду (ОПС) при
непосредственном или опосредованном воздействии опасного
отхода на нее:
1-й класс — чрезвычайно опасные отходы, обладающие очень
высокой степенью вредного воздействия на ОПС; критерием от-
несения отхода к 1-му классу является необратимое нарушение
экологической системы (период восстановления отсутствует);
2-й класс — высокоопасные отходы, обладающие высокой сте-
пенью воздействия на ОПС (вызывают сильное нарушение эко-
логической системы: период восстановления — не менее 30 лет
после полного устранения источника вредного воздействия);
3-й класс — умеренно опасные отходы, обладающие средней
степенью вредного воздействия на ОПС (вызывают нарушения
экологической системы: период восстановления — не менее
10 лет после снижения вредного воздействия от существующего
источника);
4-й класс — малоопасные отходы, обладающие низкой сте-
пенью вредного воздействия на ОПС (вызывают нарушения
экологической системы: период самовосстановления — не ме-
нее 3 лет);
5-й класс — практически не опасные отходы, обладающие
очень низкой степенью вредного воздействия на ОПС (практи-
чески не нарушают экосистему).
36
Отнесение отходов к классу опасности для ОПС может осуще-
ствлял ься расчетным или экспериментальным методами. В случае
отнесения производителями с помощью расчетного метода како-
го-либо отхода, например, к 5-му классу опасности необходимо
подт верждение этого расчета экспериментальным методом.
Экспериментальный метод основан на биотестировании вод-
ной вытяжки отходов. С этой целью необходимо использовать не
менее двух тсст-объектов из разных систематических групп (даф-
нии и инфузории, цериодафнии и бактерии или водоросли и т. п.).
Для природных сред обычным является одновременное при-
сутствие нескольких вредных веществ, т. е. имеет место совмест-
ное (комбинированное) их действие на живые организмы В за-
висимости от характера развивающихся при этом процессов со-
вместное действие вредных веществ может проявляться как:
• синергизм — одно вещество усиливает действие другого ве-
щества;
• аддитивность — действия веществ суммируются;
• антагонизм — одно вещество ослабляет действие другого.
Воздействие загрязняющих веществ на живой организм мо-
жет быть трех типов: цитотоксическое, тератогенное и генети-
ческое
В основе цитотоксического действия лежит изменение про-
ницаемости клеточных мембран, нарушение функциональных
свойств ферментативных систем клеток. Тератогенное воздей-
ствие связано с нарушением действия генов без влияния на на-
следственные структуры клетки и организма. Соответственно
вещества, вызывающие такие изменения, называются терато-
генными (вызывающими уродства, от греч. terratos — чудовище)
В основе генетического воздействия лежит изменение темпа му-
тагенеза организма. Мутация (от лат. mutatio — изменение, пе-
ремена) — это естественно возникающие (спонтанные) или вы-
зываемые искусственно (химическими веществами, радиацией и
другими факторами) изменения генотипа. Генотип — это сово-
купность всех генов организма, наследственная основа организ-
ма. Ген (греч. genos — род, происхождение) — единица генетиче-
ской информации, представляет собой определенный участок
молекулы ДНК (дезоксирибонуклеиновой кислоты) у высших
оргенизмов и РНК (рибонуклеиновой кислоты) у вирусов. Любой
физический агент (фактор), вызывающий мутацию, называется
мутаген. Действие химических мутагенов (этиленимина, нитро-
зометилмочевины) сходно с действием радиоактивного излуче-
ния. В обоих случаях воздействию подвержен наиболее радиочув-
ствительный компонент клетки — ядро, в частности хромосомы.
Мутация связана с изменением числа и структуры хромосом.
Наиболее опасными для человека являются такие вещества,
которые обладают свойством мутагенного и канцерогенного воз-
37
действия. Канцероген — вещество или физический агент, способ-
ствующим развитию злокачественных новообразований (раковых
заболеваний) или их возшткновению. Канцерогенное действие
проявляется по двухступенчатому механизму: генотоксической
инициации и эпигенетического иромотирования. Инициаторы
в процессе взаимодействия с ДН К вызывают необратимые сома-
тические мутации, причем достаточно малой дозы вещества и од-
нократного введения. Предположительно, для этого воздействия
не существует пороговых значений концентрации, ниже которых
оно нс проявляется. Вещество промотор само по себе нс канцеро-
генное, но усиливает действие инициатора, а его собственное воз-
действие на организм в течение некоторого времени является об-
ратимым. Промотору требуется более длительное время воздей-
ствия на организм, чтобы он вызвал появление раковой опухоли.
Канцерогенез провоцируется многими химическими загряз-
нителями окружающей среды. К ним относятся:
• полициклические углеводороды, образующие донорно-ак-
цепторные комплексы с пуриновыми основаниями ДНК и РНК;
• алкилнитрозоамины, алкилирующие белки;
• ароматические амины (косвенно), образующие канцеро-
генноактивные продукты трансформации (гидроксиламины,
аминобензолы);
• аминоазосоединения (косвенно), образующие N-окси-
или N-оксимстиловые производные, которые взаимодействуют
с метиониновыми остатками белков.
Потенциальными канцерогенами считаются около 25 тысяч
веществ В табл. 1.2 даны примеры инициаторов и промоторов
канцерогенеза.
На основании опытов с животными доказано, что фенобарби-
тал, ДДТ (дихлордифснилтрихлорэтан). ТХДД (тетрахлордибен-
зодиоксин), ПХБ (полихлорированные бифенилы) и хлороформ
являются промоторами канцерогенеза. Мутагенным действием
обладают поликонденсировапные ароматические углеводороды
(ПЛУ, например бспзЫпирен), нитроароматические соединения
и многие пестициды. Нитриты также способствуют мутациям.
Ниже приведены формулы указанных в табл. 1.2 веществ и
пояснения к ним.
а. Бспз[о]пирен (С20Н12) присутствует в выхлопных газах авто-
мобилей:
б. Общая формула нитрозососдинений R— N=Q где —N=O —
нитрозогруппа; R — алифатический или ароматический ради-
кал Формула N-нитрозоаминов
38
Таблица 1.2
Примеры инициаторов и промоторов канцерогенеза
(по Ф. Корте, 1997)
Инициаторы Промоторы
Химич ПАУ N -Ни грозо-N - нитро- N-мсгил-гуанидин Димсгилнитрозоамин Диэтиднитрозоамин N-Нитрозо-N - мстилмочеви на Уретан 1,2-Димстилгидразин Биологические свеч Канцерогенный Экспозиция перед воздействием промотора Достаточно однократного введения Влияние необратимо и аддитивно Не существует определенной пороговой концентрации Мутагенное действие некие соединения Кротоновое масло Фенобарбитал ДДТ, ПХБ тхдд Хлороформ Сахарин (под вопросом) Цикламат iemea химических соединений Сам по себе не канцерогенный Действие проявляется после появления инициатора Необходимо длительное воздействие Вначале действие обратимо и псаддитивно Пороговая концентрация, вероятно, зависит от времени воздействия дозы Мутагенное действие отсутствует
R
N--N =О
Они обладают канцерогенными и мутагенными свойствами,
раздражают кожу, применяются для производства красителей,
лекарственных средств, в качестве компонентов ракетных
топлив. Далее приведены формулы некоторых нитрозосоедине-
ний и нитрозоаминов, указанных в табл. 1.2:
н
п,с^_
N N —= О
н.с""''
----N—
Н,С----N-=C
~'""N---N«---О
I 4(1
II
N-HKiposo-N-iiMTpo-N-Menci гуанидин,
производное гуанидина (иминомочеиипы):
HN = C
"Nil,
лимепшнитрозоямин
39
II
Н,С.^
N---------N = O
H,C]''""
Лиэтилнитроэоамл1!
----N-----О
О—=C
----------------CH,
I
H
N-nnTporso-N-мстилмочевииа
в. Уретан(ы) (карбаматы) — это производные карбаминовой
кислоты:
NH, — с
^1Н
Они применяются в производстве лекарственных средств и гер-
бицидов. Этилкарбамат — уретан, имеющий формулу
NH.----С^_
^-о------C.1I,
г. Формула 1,2-диметилгидразина:
Н,С----N------N------СН,
I I
н п
д. Кротононос масло содержит смолообразное вещество не-
изученного состава, являющееся причиной его токсичности.
По-видимому, аналогичное вещество находится в составе масла
семян молочая.
е. Фенобарбитал (синоним — люминал) — успокаивающее,
снотворное средство; его химическое название д-этил-5-фсиил-
барбитуровая кислота, формула:
ж. Сгрукгурная формула ДДТ приведена на с. 33.
з. ПХБ — эго полихлорированные бифенилы, к ним относит-
ся, например, 2,4'-дихлорбифенил:
40
Cl
CI
и. ТХДД (тетрахлордибснзо-?7-диоксин) относится к группе
полихлорированных дибензо-п-диоксинов (ПХДД) — хлориро-
ванных циклических ароматических эфиров, в которых два бен-
зольных кольца с различной степенью хлорирования связаны
между собой атомами кислорода в ор/ло-положении:
Диоксины образуются как побочные продукты химических
процессов в ряде производств (например, металлургическая,
целлюлозно-бумажная отрасли промышленного производства),
в ходе сжигания отходов, в мусоросжигательных печах, а также
при пожарах. Наиболее токсичным является изомер 2,3,7,8-ТХДД,
структурная формула которого приведена на с. 33 при рассмот-
рении суперэкотоксикантов. Он обладает явно выраженным
действием, промотирующим образование опухолей, хотя не
инициирует их появление. ПХДД оказывают тератогенное и от-
равляющее действия на зародыши. Смертность эмбрионов не-
которых видов животных проявляется при очень низких кон-
центрациях 2,3,7,8-ТХДД.
к. Хлороформ (грихлормстан СНС13) имеет формулу
л. Сахарин — это имид о-сульфобснзойпой кислоты:
м. Цикламаты — это соли цикламовой (циклогексилсульфа-
мовой) кислоты C6HnNHSO3H:
41
jL I
11,с< у.н N----s^—он
C
Hl
Они производились в США как малокалорийные сладкие
агенты, ио обладают канцерогенными свойствами, поэтому в на-
стоящее время запрещены к применению.
Существует тесная связь между хи м ической структурой и ток-
сически м действием веществ:
• в гомологическом ряду сила наркотического воздействия
возрастает с увеличением числа атомов углерода в молекуле —
правило Ричардсона (это правило верно для большой группы уг-
леводородов, кроме углеводородов ароматического ряда);
• согласно правилу разветвленных цепей наркотическое
действие ослабевает с разветвлением цепи углеродных атомов;
• замыкание цепи углеродных атомов усиливает ингаляци-
онное действие вещества;
• биологическая активность вещества возрастает с увеличе-
нием не предельности соединения;
• введение в молекулу групп ОН и О приводит к усилению
наркотического действия веществ;
• введение в молекулу галогенов может привести к усиле-
нию как наркотического, так и общетоксического действия;
• соединения, имеющие в молекуле группы NO, или NH-,,
оказывают нейротропное действие, являются кровяными ядами,
вызывают дегенеративное изменение некоторых органов.
Возможны различные способы поступления токсичных ве-
ществ в организм человека: в процессе дыхания (ингаляцион-
ный), через желудочно-кишечный тракт (перорально), через
кожу и слизистые оболочки.
Под воздействием токсичных веществ на организм могут
возникать острые и хронические отравления. Острые отравле-
ния характеризуются кратковременностью действия относи-
тельно больших количеств вредных веществ и ярким типичным
проявлением либо непосредственно в момент воздействия,
либо через сравнительно небольшой (обычно в несколько ча-
сов) скрытый (латентный) период. Такие отравления чаще все-
го происходят в результате крупных производственных аварий.
Хронические отравления развиваются постепенно, при длитель-
ном воздействии токсичных веществ в относительно неболь-
ших количествах.
Отравление одним и тем же веществом при остром и хрони-
ческом воздействии на организм проявляется по-разному. На-
42
пример, бензол С6Н6 при острой интоксикации вызывает пре-
имущественно поражение нервной системы, а при хроническом
отравлении наблюдается в основном изменение кроветворной
системы.
Большинство ядов может вызывать как острое, так и хрони-
ческое отравление, но существуют и такие, которые вызывают
преимущественно либо острые (синильная кислота HCN), либо
хронические (свинец, марганец) отравления. Существуют также
подострые интоксикации, протекающие более медленно по срав-
нению с острыми отравлениями и имеющие затяжное течение.
Механизм токсического воздействия химических ве-
ществ может быть следующим:
• инактивиронаиие каталитических ферментных систем;
• стимулирование структурных, функциональных и биохи-
мических изменений в генетическом аппарате клеток;
• инициирование не санкционированных организмом сте-
хиометрических превращений в молекулах;
• интенсификация образования злокачественных опухолей.
В качестве итога можно дать классификацию токсичных ве-
ществ по времени воздействия на живые организмы и по форме
проявления эффекта (см рис. 1.3).
Рис. 1.3. Классификация токсичных веществ по времени воздействия
на биологические объекты и по форме проявления эффекта
43
Рассматривая действие веществ па живые организмы, необ-
ходимо учитывать, что эти вещества могут претерпевать транс-
формацию (превращения) под действием абиотических и биоти-
ческих факторов среды: абиотические (ши физико-химические) —
это факторы неживой природы (солнечный свет, температура,
влажность, кислотно-основные свойства, радиация и др.), тогда
как биотические — факторы живой природы (влияние живых
организмов друг на друга и на среду). Трансформация веществ
возможна в результате 1) химических превращений под действи-
ем абиотических факторов и 2) биохимических превращений
внутри живых организмов (биотрансформация, или метаболизм).
Метаболизм (от греч. metahole — превращение) — совокуп-
ность процессов биохимических превращений веществ и энер-
гии в живых организмах (синоним — обмен веществ). В результа-
те биотрансформации токсичных веществ в большинстве случа-
ев образуются менее токсичные продукты (метаболиты), более
растворимые и легко выводимые из организма. В некоторых слу-
чаях токсичность метаболитов оказывается выше, чем попавших
в организм веществ — примерами служат бензол, метанол, фтор-
карбоновые кислоты. Метаболизм промышленных ядов возмо-
жен за счет реакций окисления, восстановления, гидролитиче-
ского расщепления, метилирования, ацилирования и др.
Рассмотрим примеры биотрансформации веществ в разных
живых организмах (Тели гченко М. М., Остроумов С. А., 1990).
Пример 1. Взаимодействие диэтилам ина с нитритами в среде
желудочного сока у млекопитающих с образованием канцероге-
на диэтилпитрозоамина:
с,н, с,н,
NH + NO,----- N--N — О - ОН-
I I
с,н, с,н,
Пример 2. Детоксикация бензойной кислоты у птиц путем ре-
акции связывания бензойной кислоты с аминокислотой — ор-
нитином (продукт выводится с экскрементами):
44
Пример 3. Биодеградация дихлордифенил грихлорэтана (ДДТ)
некоторыми членистоногими в дихлордифениддихлорэтсн (ДДЕ) —
тоже токсичное вещество. При этом происходит дегидрохлори-
рование — одновременное отщепление по одному атому водоро-
да и хлора и образование двойной связи
CCI, СО,
ДДТ ДДЕ
1,1.1 -тр|ЕХЛор-2.2-<*ис(и-хлорфсниЛ)эт;1н 1,1 -дихлор-2,2-бис(я-хлорфепил)этеи
В реакции в примере 1 в результате биотрансформации в же-
лудке млекопитающего образуется канцерогенное вещество.
Пример 2 показывает, что в организме могут происходить про-
цессы детоксикации вещества, которые либо уменьшают, либо
устраняют полностью токсическое действие химического веще-
ства. Детоксикация — эго биотические превращения химическо-
го вещества в соединения с меньшей токсичностью. Механизмы
детоксикации могут быть разные. Вот некоторые из mix:
• превращение токсичных компонентов в менее токсичную
форму (например, при попадании в организм ионов тяжелых
металлов Cd2+, Hg-+, Pb2+ и др. реакцией печени и почек являет-
ся увеличение синтеза мсталлотионинов — белков, которые проч-
но связывают эти ионы, тем самым не давая им в дальнейшем
конкурировать с необходимыми для жизнедеятельности ионами
Fe2+, Со2+, Mg2+ за места связывания в ферментах);
• перенос металла кровью в другие ткани, где он будет иммо-
билизован (например, ионы свинца РЬ2~, иммобилизованные
в костях более чем на 90% от своего количества в организме, оста-
ются токсичными лишь за счет остальных 10%, распределенных
в других тканях организма);
• образование нерастворимых солевых комплексов в кишеч-
ном тракге.
В примере 3 описана биодеградация ДДТ в Д ДЕ. Лабораторны-
ми исследованиями установлено, что возможно разложение ДДТ
бактериями Pseudomonas aeruginosa, оно протекает через множе-
ство последовательных и параллельных реакций с образованием
в конечном итоге фумаровой и ацетоуксусной кислот, которые
вступают в основной обмен веществ:
ацетоуксусная кислота
45
Однако в природных условиях это превращение осуще-
ствить очень трудно. Подобные процессы расщепления проис-
ходят также и организмах животных и растений, в обоих случа-
ях конечными продуктами являются конъюгаты, т. е. продукты
конъюгации (от лат. conjugalio — соединение) — связывания
вредных веществ с веществами, содержащимися в тканях Орга-
ПИЗ.МОН.
Постороппис вещества могут оказаться очень устойчивыми
в окружающей среде даже в том случае, если существуют при-
родные ферменты, способные расщеплять их. Существуют ксе-
нобиотики, которые вообще не подвергаются биотрансфор-
мации или очень медленно разлагаются в природе (так назы-
ваемые высокоперсистентные). Такие вещества, как, например,
атомы металлов, в принципе не могут разрушаться.
Образующиеся в организме продукты превращения остаются
в окружающей среде и после их вывода из организма или после
его гибели и разложения, а также после включения в цепь пита-
ния. Цепь питания (пищевая цепь, цепь трофическая) — ряд ви-
дов или их групп, каждое предыдущее звено в котором служит
пищей для следующего. Например, запрещенный к примене-
нию ДДТ до сих нор обнаруживают в жире тюленей и у пингви-
нов Антарктиды.
Продукты биотрансформации разлагаются далее либо абиоти-
чески, либо в других организмах До топ» момента, когда они пол-
ностью разложатся до СО2 и других продуктов минерализации
или низкомолекулярных полупродуктов, вступающих в природ-
ный круговорот углерода, эти химические вещества следует рас-
сматривать как посторонние и вредные для окружающей среды.
Вопросы и задания
I. Какие вещества называются биоцидами, ксенобиотиками? Приведите примеры.
2. Что такое экзогенные вещества, экотоксиканты и супсрэкотоксиканты? Приведите
примеры супсрэкотоксикаптов. 3. Назовите пять типов ьещест н по характеру их воздей-
ствия на живые организмы. 4. В каком случае необходимое вещество может стать ток-
сичным? Что такое биологический ответ организма? Поясните рисунком. 5. Дайте клас-
сификацию вредных веществ по степени их опасности для человека и приведите приме-
ры. 6. Ч го такое аддитивность, синергизм и антагонизм вредных веществ? 7. Раскройте
понятия цитотоксического, тераютенното и генетического воздействия веществ на жи-
вой организм. 8. Дайте определение понятиям «мутаген», «канцероген». 9 Что такое
инициаторы и промоторы канцерогенеза? Приведите примеры. 10. Какие вещества на-
зываются диоксинами и каково их действие на человека? Н. Какая существует связь
между химической структурой и токсическим действием веществ? 12. Охарактеризуйте
по рис. 1.3 классификацию токсичных веществ по времени воздействия на биологиче-
ские объекты и по форме проявления эффекта. 13. Что такое биотрацсформзция ве-
ществ? Приведите примеры биотрансформации ь разных живых организмах. 14.Что та-
кое детоксикация веществ? Назовите некоторые механизмы детоксикации.
46
1.5. ЭКОЛОГИЧЕСКИЕ СТАНДАРТЫ И НОРМАТИВЫ
Живые организмы способны без вреда для себя переносить
присутствие определенных количеств загрязняющих веществ.
Такое их содержание, ниже которого болезненные реакции не
наблюдаю гея, называется пороговым уровнем При больших ко-
личествах наступают последствия для здоровья, которые зависят
как от концентрации вещества, гак и от длительности его воз-
действия (экспозиции). При короткой экспозиции переноси-
мыми являются более высокие уровни загрязнителей, т. е. при
кратком воздействии загрязняющих веществ пороговые значе-
ния могут быть выше, а при более длительном воздействии —
ниже. Исключение составляют вещества, способные к биоакку-
муляции, и радиоактивные вещества. У радиоактивных веществ,
по мнению исследователей, пороговый уровень нулевой. Это озна-
чает, что любое, даже самое краткосрочное их воздействие мо-
жет причинить вред организму. У соединений, способных к био-
аккумуляции, пороговые уровни очень низкие. Явление биоак-
кумуляции заключается в накоплении живыми организмами
химических веществ, загрязняющих среду обитания. Поскольку
объем поедаемой пищи за длительное время значительно превы-
шает массу потребителя, а загрязняющие вещества не во всех
случаях полностью выводятся из организма, то на каждом следую-
щем этапе экологической пирамиды (трофической цепи) создастся
многократно более высокая концентрация стойких зафязнитс-
лей. В рыбе, например, концентрация ртути может быть в I000 раз
выше, чем в водоеме, из которого она выловлена. Человек, яв-
ляющийся конечным звеном пищевой цепи и питающийся та-
кой рыбой, аккумулирует в своем организме ртуть в очень высо-
ких концентрациях, что может послужить причиной летального
исхода (рис. 1.4).
В течение длительного времени в организме возможно на-
копление малых, кажущихся безвредными доз загрязняющего
Рис. 1.4. Биологическое накопление токсикантов в пищевых цепях
47
вещества. Спустя некоторое время в организме создается ток-
сичная его концентрация, которая представляет опасность для
здоровья В общем случае под дозой подразумевается произведе-
ние концентрации (уровня) на экспозицию. При ингаляционных
отравлениях дозу определяют как произведение С • t, где С —
концентрация паров или аэрозоля (мг/м*); t — время вдыхания
(мин). При поражении другими путями (через желудочно-ки-
шечный тракт, кожу, внутривенно, внутримышечно и пр.) доза
оценивается массой химического вещества (mi) на 1 кг живой
массы организма.
Различают:
— срсднссмсртсльные (летальные) дозы:
a) LCt^ — при ингаляционном отравлении;
б) LDyj (ЛД50) — при отравлении другими путями;
— пороговые дозы:
a) PCt10 — при ингаляционном отравлении;
б) PDI0 (ПД|П) — при отравлении другими путями.
Цифра в индексе показывает вероятность гибели организмов:
для смертельных доз — 50%, для пороговых (появление призна-
ков отравления) — 10%.
Для сохранения качества окружающей среды требуется стро-
гое нормирование поступления в биосферу токсичных веществ.
Необходимо знать тс предельные их уровни, при которых воз-
можна нормальная жизнедеятельность организмов.
Экологическое нормирование проводится с целью ограничить
антропогенные воздействия, оптимизировать все виды взаимо-
действия человека с природой. Экологическое нормирование
предусматривает:
• учет многообразия путей загрязнения и самоочищения
элементов биосферы при оценке последствий антропогенного
воздействия;
• выявление «критических» компонентов биосферы, наибо-
лее чувствительных к антропогенному' воздействию;
• развитие научного подхода к нормированию воздействий
на природные экосистемы.
Основным критерием при определении допустимой экологи-
ческой нагрузки является отсутствие снижения продуктивно-
сти, стабильности и разнообразия экосистемы.
При нормировании антропогенных воздействий большое
значение имеет выбор приоритетных факторов, в данном случае
загрязнителей окружающей среды. Эта приоритетность опреде-
ляет характер и срочность мероприятий по борьбе с негативны-
ми последствиями и но их предотвращению.
Основной величиной экологического нормирования содер-
жания вредных веществ в природной среде является предельно
допустимая концентрация. ПДК — это такое содержание вредно-
48
го вещества в окружающей среде, которое при постоянном кон-
такте или при воздействии за определенный промежуток време-
ни практически не влияет на здоровье человека и не вызывает
неблагоприятных последствий у его потомства.
При определении ПДК учитывается не только влияние за-
грязняющего вещества на здоровье человека, но и его воздей-
ствие на животных, растения, микроор1днизмы, а также па при-
родные сообщества в целом. Таким образом, высшим показате-
лем является экологическая предельно допустимая концентрация
вещества — пороговая концентрация, превышение которой при-
водит к отрицательным последствиям для экосистемы в целом.
ПДК является важнейшим экологическим стандартом, нор-
мативом качества окружающей среды. ПДК загрязняющих ве-
ществ устанавливаются в законодательном порядке или реко-
мендуются компетентными учреждениями, органами здраво-
охранения для воздуха, воды, почвы, для пищевых продуктов и
кормов. В настоящее время установлены ПДК большого коли-
чества вредных веществ для воздушной среды и водной среды,
а сравнительно недавно начаты исследования по разработке
ПДК загрязняющих веществ для почвы.
Наряду с величиной экологической ПДК важной характерис-
тикой экосистемы является ее ассимиляционная емкость в отно-
шении данного загрязняющего вещества (ЗВ) или суммы ве-
ществ. Ассимиляционная емкость объекта окружающей среды —
это максимальное количество ЗВ, которое может быть за единицу
времени накоплено, разрушено, трансформировано или выведено за
пределы экосистемы в результате процессов самоочищения без на-
рушения ее нормального функционирования.
Следует отметить, что соблюдение ПДК не гарантирует со-
хранения качества среды надостаточно высоком уровне, потому
что отдаленные последствия влияния веществ и их взаимодей-
ствия между собой (синергизм) еще недостаточно изучены, как
и эф(}>скты биоаккумуляции и повышения токсичности загряз-
нителей при переходе с одного грофичсского уровня на другой.
На основе ПДК разрабатываются научно-технические нор-
мативы: предельно допустимый выброс (ПДВ) вредного вещества
в атмосферу и предельно допустимый сброс (ПДС) в водный бас-
сейн. Эти нормативы устанавливаются для разовых выбросов и
сбросов. ПДВ и ПДС определяются индивидуально для каждого
источника загрязнения с таким расчетом, чтобы совокупное
воздействие на окружающую среду всех источников в данном
районе не приводило к превышению ПДК.
При выработке этих нормативов требуется учет большого
числа факторов, таких как гидрометеорологические условия,
рельеф, распределение в пространстве и времени, учет подвер-
женных воздействию организмов, чувствительность этих орга-
49
пизмов к воздействиям и т. д. Изучение этих факторов проводят
соответствующие экологические службы.
Количество и мощность источников загрязнения может из-
меняться по мерс развития производства в данном районе, по-
этом}' нормативы ПДВ и ПДС периодически пересматриваются.
В некоторых случаях, когда предприятие не может уложиться
в установленные нормативы, ему могут быть установлены так
называемые временно согласованные выбросы (ВСВ), которые до-
пускают загрязнение окружающей среды сверх нормы в течение
строго определенного времени. Это время отводится для проведе-
ния природоохранных мероприятий, необходимых для снижения
выбросов. Для радиоактивного загрязнения и других вредных фи-
зических воздейст вий (шум, электромагнитные излучения и др.)
устанавливаются временно допустимые уровни (ВДУ).
Важнейший экологический стандарт — ПДК — подразделяют
на несколько видов Д'1я санитарной оценки воздушной среды ис-
пользуют следующие виды предельно допустимых концентра-
ций: ИДК,, — предельно допустимая концентрация вредного ве-
щества в воздухе рабочей зоны (производственного помещения),
выражаемая в мг/м3. Эта концентрация нс должна вызывать у ра-
ботающих при ежедневном вдыхании в течение 8 ч за все время
рабочего стажа каких-либо заболеваний или отклонений от нор-
мы в состоянии здоровья, которые могли бы быть обнаружены
современными методами исследования непосредственно во вре-
мя работы или в отдаленные сроки. Рабочей зоной считается
пространство высотой до 2 м над уровнем пола или площадки,
на которой расположены места постоянного или временного
пребывания работающих. Можно выделить еще предельно допус-
тимую концентрацию вредного вещества на территории промыш-
ленного предприятия (на площадке предприятия) — ПДК,,,, (обыч-
но принимается ПДК„п = 0,3 ПДКРД.
Для химических веществ, на которые ПДК не установлены,
временно устанавливают ориентировочно безопасные уровни воз-
действия (ОБУВ) и оговаривают условия их применения в каж-
дом отдельном случае. ОБУВ должны пересматриваться через
каждые два года с учетом накопленных данных о здоровье рабо-
тающих или заменяться ПДК. Помимо этого, для санитарной
оценки воздушной среды можег использоваться показатель
ВДКр, — временно допустимая концентрация химического ве-
щества в воздухе рабочей зоны (временный отраслевой норма-
тив на 2—3 года). Применяют также ОДКр , — ориентировочно до-
пустимую концентрацию химического вещества в воздухе рабо-
чей зоны.
Для населенных пунктов существуют количественно другие
нормативы. Во-первых, устанавливается ПДК,, п — предельно до-
пустимая концентрация вредного вещества в атмосферном воздухе
50
населенного пункта. Кроме того, в воздухе населенных мест
определяют два значения ПДК — среднесуточное и максималь-
ное разовое.
ПДК", — максимальная разовая концентрация вредного ве-
щества в воздухе населенных мест (мг/м3), которая не должна
вызывать рефлекторных реакций в организме человека (ощуще-
ния запаха, световой чувствительности глаз и др.) при кратков-
ременном воздействии за1"рязнителя (в течение 20 мин);
ПДКс с — среднесуточная предельно допустимая концентрация
вредного вещества и воздухе населенных мест (мг/м3). Эта кон-
цен граиия не должна оказывать вредного воздействия (обще-
токсического, канцерогенного и др.) в условиях неопределенно
долгого круглосуточного вдыхания (усреднение проводится за
период 24 ч).
При установлении ПДКР, и ПДКнп учитывается различный
характер воздействия вещества на человека в условиях произ-
водства и в населенном месте. При определении воздействия ве-
щества в рабочей зоне находятся практически здоровые, взрос-
лые люди, и время воздействия ограничено протяженностью ра-
бочего дня и рабочим стажем. При определении же ПДК|1П учету
подлежат иные факторы, принимается во внимание, что вещест-
во воздействует круглосуточно и в течение всей жизни на всех
людей (взрослых и детей, здоровых и больных). Поэтому для од-
ного и того же загрязнителя ПДКр3 в десятки и даже сотни раз
выше, чем ПДКНЛ1. В табл. 1.3 это различие показано на примере
двух веществ.
Из данных табл. 1.3 следует, что для оксида серы(IV) допус-
кается более высокая концентрация по сравнению с оксидом
азота(ГУ).
Схематично классификация ПДК вредных веществ в воздуш-
ной среде показана на рис. 1 5
1*ис. 1.5. Классификация ПДК вредных веществ в воздухе
51
Таблица 1.3
Различие ИДК (мг/м3) веществ в условиях производства
и в населенном пункте
Вещество 1ШКрл В воздухе населенных пунктов
плк„ плк„.р
Диоксид серы SO. 10 0,05 0,500
Диоксид азота NO. 2 0,04 0,085
Для воды также установлены стандарты и нормативы, основ-
ным из которых является ПДКв — предельно допустимая концен-
трация вещества в воде (выражается в миллиграммах вещества
на 1 л воды, мг/л). По назначению различают водоемы хозяйст-
венно-питьевые, культурно-бытовые, рыбохозяйственные. К каж-
дой категории объектов водопользовашгя предъявляются свои
требования Для водных объектов, кроме ПДКП, важным являет-
ся такой норматив, как лимитирующий показатель вредности
(ЛПВ), который отражает приоритетность требований к качест-
ву воды. В водных объектах хозяйственно-питьевого и культур-
но-бытового назначения важны санитарно-токсикологический
(c.-т.), общесанитарный (общ.) и органолептический (орг.) ЛИВ'
Для рыбохозяйственных водоемов вредные вещества объединя-
ют в группы по следующим ЛПВ токсикологическому, органо-
лептическому, рыбохозяйственному и обшесани гарному. В вод-
ных объектах разных категорий ПДК одного и того же вещества
имеют' различные значения. Например, для хозяйственно-питье-
вой воды ПДК, но нефти составляет 0.3 мг/л, а для рыбохозяй-
ственных водоемов ПДКп по нефти снижается до 0,05 мг/л,
так как мясо рыбы, обитающей в воде, загрязненной нефтью,
обладает резким запахом, кроме того, нефть весьма токсична для
икры, личинок и мальков
Установление ПДК загрязняющих веществ в почве представляет
трудности по нескольким причинам. С одной стороны, почва —
среда, гораздо менее подвижная, чем вода и воздух, и аккумуля-
ция химических веществ может происходить в течение длитель-
ного времени. С другой стороны, активная микробиологическая
жизнь почвы способствует трансформации поступающих ве-
ществ, их деградации и миграции. ПДК загрязняющих веществ
в почвах определяются с учетом не только химической природы
и токсичности загрязняющих веществ, но особенностей самих
почв. Почвы по своему химическому составу и свойствам могут
сильно различаться, и для них невозможно установить унифи-
цированные уровни ПДК.
1 Такие сокращенные варианты записи (c.-т., общ., орг.) используют в спе-
циальной литсрат уре.
52
Например, накопление тяжелых металлов в почве зависит от
ее поглотительной способности, кислотно-основных свойств и
содержания гумуса, поэтому для ряда тяжелых металлов уста-
новлены ориентировочно допустимые концентрации (ОДК), ко-
торые используются вместо ПДК. ОДК, каки ПДК, выражаются
в миллиграммах вредного вещества на 1 кг воздушно-сухой поч-
вы (мг/кг). Для пестицидов вводят ОДК, но для быстро разлагае-
мых пестицидов легче установить ПДК. В табл. 1.4 приведены
ПДК и ОДК некоторых химических веществ в почве.
Таблица 1.4
ПДК и ОДК химических веществ в почве
Вещество ПДК, мг/кг ОДК, мг/кг
Карбофос Хлорофос Бромофос Г сксахяорбензол 0.5 0,5 0,20 0,03
Таким образом, для определения качества окружающей сре-
ды служат экологические стандарты и нормативы.
Вопросы и задания
1 Дайте определения понятий «пороговый уровень», «экспозиция», «доза». 2- Что
такое биоаккумуляция? Приведите пример. 3. Кяк определяется доза а) при ингаляци-
онном отравлении; б) при отравлении через желудочно-кишечный тракт, кожу и т. д.?
4. Что означают ЛД», ПД,0? 5. Какие задачи решает экологическое нормирование?
6. Назовите важнейший экологический стандарт качества природной среды. Что озна-
чают ПДК, ПДУ. ПД В, ПДС? 7. Дайте классификацию ПДК вредных веществ в воздухе.
В чем различие 1ШК,,. ПДК.,, ПДК,,,. ЦДКМ г, ПДК„? Приведите примеры. 8, Что озна-
чают ВДК„ „ ОДКр,? 9. В каких единицах выражается ПДК вредных веществ в воде? Что
такое ЛПВ? 10 Какие лимитирующие показатели вредности используются в водных
объектах хозяйственно-питьевого и культурно-бытового назначения? 11 Приведите
пример, показывающий рахтичия значении ПДК. для водоемов хозяйственно-питьево-
го и рыбохозяйственного водопользования. 12- В чем трудность установления ПДК за-
рязняющих веществ в почве? В каких случаях устанавливают ОДК? Приведите при-
меры.
1.6. ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ БИОСФЕРЫ
В предыдущих разделах мы рассмотрели многие вещества, их
естественные и техногенные источники, классификацию ве-
ществ по характеру воздействия на живые организмы.
Как известно, любое вещество состоит из химических эле-
ментов, которые по своему распространению и роли в биосфере
в значительной степени отличаются один от другого.
53
Химический состав Земли, законы распространения и рас-
пределения химических элементов, пути их миграции и превра-
щения в условиях Земли изучает наука геохимия. В создание и
развитие геохимии как науки большой вклад внесли американ-
ский исследователь Ф. У Кларк (1847—1931) и русские ученые
В. И. Вернадский (1863-1945) и A. L. Ферсман (1883-1945).
Раздел геохимии, изучающий химические процессы в земной
коре с участием живых организмов, называют биогеохимией. Часгь
земной оболочки, занятую растительными и животными орга-
низмами, называют биосферой. Ее верхняя граница (тропосфера)
находится па высоте 12—15 км, а нижняя (литосфера) — на глу-
бине до 5 км. Биосфера включает в себя нижнюю часть атмоефе-
ры (тропосферу), всю гидросферу и верхнюю часть литосферы.
Около 90 элементов существует в природе, остальные получе-
ны искусственно, с помощью ядерных реакций. Распростра-
ненность химических элементов в природе различна, их сред-
нее содержание оценивается кларками1. Сравнительно неболь-
шое число элементов составляет земную кору. Около 50% массы
земной коры приходится на кислород, более 25% — на кремний
Основную массу земной коры (99,8%) составляют 18 элемен-
тов — кислород, кремний, алюминий, железо, кальций, натрий,
калий, магний, водород, титан, углерод, хлор, фосфор, сера,
азот, марганец, фтор, барий. На долю всех остальных элементов
приходится лишь 0,2%. Организм человека содержит около 70 эле-
ментов.
Согласно учению В. И. Вернадского активное участие в пере-
распределении химических элементов в земной коре принима-
ют живые организмы (живое вещество). Минералы, природные
химические вещества образуются в биосфере в различных коли-
чествах благодаря деятельности живых организмов.
Примером геохимической роли живого вещества является
кальциевая функция, характерная для всех организмов, имею-
щих кальций-фосфатный (карбонатный) скелет. Концентрируя
кальций в своих телах, живые организмы энергично извлекают
его из окружающей среды. Другой пример геохимической роли
живого вещества — образование железных руд в результате дея-
тельности микроорганизмов.
Предположение В. И. Вернадского о сходстве химического
состава земной коры и живых организмов получает подтвержде-
ние. Исследования химического состава земной коры, почвы,
’ В 1889 г. Ф У. Кларк рассчитал и составил таблицу среднего содержания
в земной коре 50 наиболее распространенных элементов. Академик Л Е Фер-
сман предложил частоту встречаемости элементов в природе называть «клар-
ком» Позднее, в 1925—1930 гг., академик В. И Вернадский уточнил значения
для многих элементов.
54
морской воды, растений, животных и человека показали, что
в живых организмах, в том числе и у человека, можно обнару-
жить почти все те же элементы, которые есть в земной коре и
морской воде (табл. 1.5).
Таблица 1.5
Содержание химических элеменюв (масс.%) в земной коре,
почвах, морской воде, растениях, животных (по А. II. Виноградову)
Элемент Земная кора Почвы Морская вода Растения Животные
О 49.4 49,0 85,82 70,0 62.4
Si 27,6 33,0 5-10 5 0,15 МО’
Al 7,45 7,12 1-10— 0,02 1-ю-’
Fe 5,0 3,8 5-10- 0,02 0,01
С 0,15 2.0 0,002 18 21
Ст 3,5 1,37 0,04 0,3 1,9
К 2.5 1,36 0,038 0,3 0.27
Na 2,6 0,63 1,06 0,02 0,1
Mg 2,0 0.6 0.14 0,07 0,03
Ti 0,6 0,46 1-Ю-7 1-ю-7 1-10 1-10—
N 0,02 0,1 МО- 0,3 3,1
11 1,0 — 10,72 10 9,7
Р 0.08 0,08 5-10— 0.07 0,95
S 0,05 0,05 0.09 0,05 0,16
Мп 0,09 0.085 4-10 7 1 IOJ 1 10 ’
7.г 0,04 0,62 — 5-10- —
Sr 0,04 0,03 МО- 1-ю— 1-10—
Ва 0.04 0,04 5-10 6 1-10— МО-
Се 0,02 0,02 1-ю— — МО—
Сг 0,02 0,019 — 5-10 4 1-10 ’
F 0,027 0,02 1-10— 110-’ МО5— 1-ю—
V 0,03 0,01 5 10- 1-10— 1-10—
С1 0,048 0,01 1,89 МО- 0.08
Rb 0,03 5-10-’ 210- 5 10— 1-10’
Zn 5 10— 5 10 5-10— 3 io— 1 10—
Ni 1102 510 ’ 3-Ю-7 5-10— 1-10—
Си но-2 210-’ 2 10 4 2 10 4 1 10 4
Со 410-’ 1 10— 1-10— 2-10-’ 1-10——1-10—
и 6,510 ’ 310-’ 1,5 10 5 1 10 ’ 110-4
РЬ 1,5 10 4 5-10 4 5-10- 1-10— 1-10—
в 3 10— 510— 5-10 4 1-10— 110-’
1 3-10-’ 5 10 4 1 io- 1-10— 1-10 ’-МО-
Мо 1.5-10-2 зчо-^ 1-10 7 2 10— 1-10——1-10 ’
As 5 10— 410 4 1,5-10— 310-’ М0-—110-
Вг 1,5 10 4 2-Ю— 7-10— — 110-
Cd 510— 5-10— 1 10 6 1 ю—
П1 1-10-* 6-10 4 4-10- 6-ю— 1-10-7
55
Таблица L5 (продолжение)
Элемент Земная кора Почвы Морская вода Растения Животные
W —- no-4 — — —
и 210-4 1-.10-* 2-10-’ — МО 8
Se 6-10-’ МО-6 4-Ю-7 1 10-’ —
Bi 1,7-10-* 2-10 8 210-* — 2-Ю-6
Hg 7-10"* но-4 3-10-’ МО-7 М0-6-М0-7
Ag МО"’ — но-’ —
Au 5-10-' 4-10-!“ — МО-7
Ra 2-10"10 8-10-" МО-14 МО-'4 МО1-’
Из данных табл. 1.5 следует, что большую долю веществ жи-
вых организмов составляют элементы, ко торые имеют довольно
высокую распространенность в земной коре. Например, содер-
жание кислорода в земной коре составляе т49%, в организме жи-
вотных и человека — 62%. Это показывает и рис. 1.6
Однако эта закономерность соблюдается не всегда. Так, в зем-
ной коре содержится много кремния (27,6%), а в живых организ-
мах, особенно в животных, его мало: в растениях — 0,15%, в жи-
вотных— 1 • 10-5% (табл. 1.5). Аналогично алюминий в больших
количествах содержится в земной коре (7,45%) и в очень незна-
чительных — в живых организмах В растениях алюминия содер-
жится 0,02%, в животных — 1 • 10-5%.
Непропорциональное содержание элементов в организме и
среде связано с тем, что на усвоение элементов влияет раствори-
мость их природных соединений в воде. Природные соединения
кремния (SiO,) и алюминия (А12О3) практически нерастворимы
в воде, поэтому они и не усваиваются живыми организмами. Об-
ратная картина наблюдается, например, для углерода, который
в незначительных количествах содержится в земной коре, а но
содержанию в живых организмах занимает второе (после кисло-
рода) место. Увеличенное содержание элемента в организме по
сравнению с окружающей средой называется биологическим кон-
центрированием элемента.
Процесс эволюции от неорганических веществ к биооргани-
ческим, основанный на использовании тех или иных химиче-
ских элементов для создания биосистем, подчинен законам ес-
тественного отбора. В итоге этого отбора основу живых систем
образуют только шесть элементов — С, Н, О, N, Р, S — получив-
ших название органогенов На долю этих элементов в организме
приходится 97,4%. Характерное для органогенов образование
водорастворимых соединений и способствует их концентриро-
ванию в живых организмах.
В разнос время многие ученые пытались классифицировать
химические элементы, находящиеся в живых организмах. В со-
ответствии с классификацией, предложенной В. И. Вернадским,
56
Рис. 1.6. Содержание химических элементов в земной коре
(см. цифры наружного ряда) и в организме человека (приведены данные
только для макроэлементов)
элементы, составляющие живые организмы, подразделяются
в зависимости от их среднего содержания (масс.%) на макро- и
микроэлементы.
Макроэлементы — это элементы, содержание которых в орга-
низме выше 10-2%. К ним относятся О (62), С (21), Н (10), N (3),
57
Са (2), Р (1), К (0,23), S (0,16), С1 (0.1), Na (0,08), Mg (0,027)
В скобках указана массовая доля элемента (масс.%).
На рис. 1.6 приведено содержание макроэлементов в организ-
ме человека. Обычно к ним относят 11 элементов (они указаны
на рисунке), в свою очередь они подразделяются на две группы,
из которых одна объединяет основные макроэлементы. Из ос-
новных макроэлементов (их шесть) — С, Н, О, N, Р, S — построе-
ны биомолскулы клетки: белки, нуклеиновые кислоты, липиды,
углеводы. Остальные пять макроэлементов — Са, Mg, Na, К, Cl —
составляют вторую группу.
Микроэлементы — это элементы, содержание которых в орга-
низме находится в пределах от 10~J% и ниже. К ним относятся I,
Си, As, F, Вг, Sr, Ва, Со и др. Иногда выделяют ультрамикроэле-
менты — это элементы, содержание которых в организме ниже
1-10 5% К ним относятся Hg, Au, U, Th, Ка и др. В настоящее
время их объединяют в одну группу с микроэлементами.
Однако данная классификация нс отражает биологической
роли и физиологического значения того или иного элемента.
Известный биохимик и биогеохимик В. В. Ковальский (1899—
1984), исходя из значимости элементов для жизнедеятельности,
разделил их на три группы.
1. Жизненно необходимые (незаменимые) элементы — посто-
янно содержатся в организме человека, входят в состав фермен-
тов, гормонов и витаминов; это Н, О, Са, N, К, Р, Na, S, Mg, Cl,
С, I, Мп, Си, Со, Fe, Zn, Мо, V Дефицит этих элементов приво-
дит к нарушению нормальной жизнедеятельности человека.
2. Постоянные примесные элементы — элементы, которые
всегда содержатся в организме животных и человека, — Ga, Sb,
Sr, Вг, F Вс, Li, Si, Sn, Cs, Al, Ba, Ge, As, Rb, Pb, Ra, Bi, Cd, Cr, Ni,
Ti, Ag, Th, Hg, U, Sc; но их биологическая роль мало изучена или
неизвестна.
3. Примесные элементы — это обнаруженные в организме че-
ловека и животных Sc, TI, In, La, Pr, Sm, W Rc, Tb и др. Данные об
их количестве отсутствуют, их биологическая роль нс выяснена.
Элементы, необходимые для построения и жизнедеятельно-
сти различных клеток и организмов, называют биогенными эле-
ментами. Точно перечислить все биогенные элементы в настоя-
щее время еще невозможно из-за сложности определения очень
низких концентраций микроэлементов и установления их био-
логических функций. Для 24 элементов биогснность установле-
на надежно. Эго элементы 1-ой и некоторые элементы 2-ой груп-
пы по В. В. Ковальскому. Остальные элементы, кроме биоген-
ных называют второстепенными элементами.
Подводя итог сказанному выше, отметим, что примерно 50 эле-
ментов встречаются в природе в существенных количествах, из
них примерно поровну составляют- биогенные и второстепенные
58
элементы. Биогенные элементы разделяют па макро- и микро-
элементы, к макроэлементам относят 11 элементов, а из 14 мик-
роэлементов роль одних для жизни человека доказана (Си, Мп,
Fc, Zn, Mo, F, I, Sc), а роль других вероятна (Cr, Ni, V, Sn, As, Si).
Главный критерий, по которому различают макро- и микро-
элементы, — это потребность организма вэлсменте, выражаемая
в мг/кг массы или мг/сутки. Ежедневная потребность человека
в макроэлементах составляет примерно 100 мг/сут., а необходимое
количество микроэлементов не превышает нескольких мг/сут.
Есть и другие различия между макро- и микроэлементами.
Первые (преимущественно С, Н, О, N, S, Р) представлены
в организме в основном органическими веществами, вторые
входят в состав неорганических или комплексных соединений.
Отклонения в содержании макроэлементов не вызывают серьез-
ных нарушений в жизнедеятельности организма, в то время как
даже незначительные изменения в количестве микроэлементов
приводят к заболеваниям.
Необходимо знать, что невозможно провести четкого разде-
ления биогенных элементов на макро- и микроэлементы и что,
по данным разных источников, оно нс всегда совпадает для раз-
ных групп организмов (человека, животных и растений). В рас-
тениях к макроэлементам относят такие, которых содержится
довольно много (от нескольких процентов до сотых долей про-
цента сухого вещества). Содержание микроэлементов в растени-
ях составляет тысячные и стотысячные доли процента (В, Мп,
Mo, Си, Zn, Со, V и др.). Например, если натрий нс столь сущест-
вен для растений, как для животных, то бор, напротив, имеет
большое значение в жизнедеятельности растений, гак как он не-
обходим для азотистого обмена. При недостатке бора в почве
клубеньковые бактерии перестают фиксировать азот и питаются _
за счет растений.
Органы человека по-разному концентрируют в себе различ-
ные химические элементы, т. е. распределение химических эле-
ментов между разными органами и тканями человека оказывает-
ся неравномерным. Данные по распределению (топографии) не-
которых макро- и микроэлементов в организме человека
представлены на рис. 1.7.
Десять металлов, жизненно необходимых для живого орга-
низма, получили название металлы жизни — это Са, К, Na, Mg,
Fe, Zn, Си, Мп, Мо, Со (расположены в порядке уменьшения их
содержания). Некоторые макроэлементы (Mg, Са) и большин-
ство микроэлементов содержатся в организме в виде комплексов
с лигандами — аминокислотами, белками, нуклеиновыми кис-
лотами гормонами, витаминами и т. д. Так, ион Fe2+ в качестве
комнлексообразователя входит в состав гемоглобина, Со2" —
в витамин В|2, Mg2+ — в хлорофилл.
59
Подовые железы
Zn, Br
Волосы
Al, As, V
Скелетная
мускулатура
Li, Mg, К
Дентин и эмаль зубов
Са, Mg. F
Зубная ткань
Са, Р
Мышцы
Li, Mg, К
Костная ткань
Na, Са, Mg, К, Р
Ге, Na, Li, Са, К
Печень
Li, Se, Mo Zn,
Си Mg, К, Си
Мозг
Na, Mg, К
Гипофиз
Zn, Вг. Мп, Ст
Глазная жидкость
Na
Сетчатка глаз
Ва
Щитонцдная железа
I, Zn, Вг
Сердце
Легкие
IJ, Na
Поджелудочная железа
Mg
Почки
Li, Sc, Са, Na, Mg, К,
Mo Cd. Hg
Спинно-мозговая
жидкость
Na
Пищеварительные соки
Na
Рис. 1.7. Концентрирование некоторых химических элементов в органах,
тканях и биожидкостях человека
Биологическая роль химических элементов в организме чело-
века разнообразна. Главная функция макроэлементов — это по-
строение тканей, поддержание постоянства осмотического дав-
ления, ионного и кислотно-основного состава. Микроэлементы
участвуют в обмене веществ, процессах размножения, тканевом
дыхании, обезвреживании токсичных веществ, влияют на про-
цессы кроветворения, окисления—восстановления, проницае-
мость сосудов и тканей.
Необходимо знать, что для организма вреден нс только недо-
статок, но и избыток биогенных элементов, так как при этом на-
рушается химический гомеостаз1. Например, избыток цинксо-
держащих компонентов пиши вызывает угнетение активности
железосодержащих ферментов (проявляется антагонизм Zn и
1 Гомеостаз (от i-рсч. homoios — подобный, одинаковый; stasis — состоя-
ние) — относительное динамическое постоянство состава и свойств внутрен-
ней среды и устойчивость основных физиологических функций организма.
В применении к биоценозам — сохранение постоянства видового состава и
числа особей.
60
Fc). На рис. 1.8 показана кривая зависимости реакции организ-
ма от концентрации веществ в пище. Элементы считаются ток-
сичными, если попадание их в организм приводит к тяжелой па-
тологии. К такому ряду токсичных элементов относятся, напри-
мер, Hg, Cd, Pb и др Данные элементы в организме человека и
животных находятся в качестве примесных.
Рис. 1.8. Характер изменения реакции организма
в зависимости от концентрации веществ в пите
Наряду с заболеваниями, вызванными загрязнением окру-
жающей среды, существуют заболевания, связанные с аномаль-
ным содержанием некоторых элементов в почве, водоемах той
или иной географической зоны. Такие заболевания называются
эндемическими. Например, в Белгородской области обнаружено
много железа (особенно в районах добычи и переработки желез-
ной руды), избыток кальция вследствие распространения место-
рождений мела. Растворимыми солями кальция обусловлена до-
вольно высокая жесткость белгородской воды. Этот фактор спо-
собствует распространению мочекаменной болезни, тогда как
дефицит йода в белгородской воде приводит к заболеванию щи-
товидной железы.
Вопросы и задания
1. Что можно сказать о соответствии содержания химических элементов в организ-
ме человека, в земной коре и морской воде? 2. Что такое биологическое концентриро-
вание элементов? Приведите примеры по табл. 1.5ирис. 1.6.3. Из перечисленных ниже
элементов, содержащихся в организме человека, выбрать а) биогенные; 6) примесные;
61
в) макроэлементы; г) микроэлементы; С N. Са. Hg, Cd, Q Н, Mg, S. 7,n. Fc, Na, K, Cu,
Cl, Мц P, I- 4. Назоните отличительные особенности макро- и микроэлементов. 5. По
рис. 1.7 дайте характеристику louoipacpjtH элементом воргапитме человека. 6. Норме. L8
охарактеризуйте зависимость реакции opieHHiMa от концентрации веществ в пище.
7. Как называются заболевания, вызванные аномальным схыержанием некоторых эле-
ментов в воде, почве? Какие аномалии существуют в вашей области?
1.7. ЕСТЕСТВЕННЫЕ БИОГЕОХИМИЧЕСКИЕ ЦИКЛЫ
И ИХ АНТРОПОГЕННЫЕ ИЗМЕНЕНИЯ
Химические элементы в биосфере циркулируют, т. е. совер-
шают круговорот. В таких циклических процессах происходит
обмен химическими элементами между различными компонен-
тами биосферы. Из внешней среды химические элементы посту-
пают в тела живых организмов, в которых претерпевают пре-
вращение в сложные соединения, и затем возвращаются в почву,
воду, атмосферу либо в виде продуктов жизнедеятельности, либо
в виде полностью отмерших организмов.
Круговорот биогенных элементов (углерода, кислорода, азота,
серы, фосфора и др.) в биосфере представляет собой переход их
из неживых (абиотических) компонентов'в живые (биотиче-
ские) компоненты и обратно за счет множества химических и
биохимических превращений Элементы могут многократно
циркулировать между организмами и окружающей средой Цир-
куляция биогенных элементов обычно сопровождается их пере-
ходом из одних химических веществ в другие. Круговые движе-
ния химических элементов называются биогеохимическими цик-
лами («био» относится к живым организмам, а «гео» — к почве,
воздуху, воде на земной поверхности). Термин «биогеохимиче-
ский цикл» ввел В И. Вернадский. С круговоротом химических
элементов тесно связан круговорот веществ, например кругово-
рот воды в природе (гидрологический цикл), который известен вам
из курса географии
Способность обеспечивать крутоворот элементов (и веществ)
является важным свойством биосферы. С ним связана неисчер-
паемость отдельных химических элементов и их соединений.
Например, при отсутствии круговорота углерода за короткое
время был бы исчерпан этот основной «строительный материал»
всего живого, способный образовывать связи углерод—углерод
и создавать тем самым огромное число органических соедине-
ний. Именно благодаря круговоротам обеспечивается непре-
рывность процессов в биосфере
Своей деятельностью человек нарушает естественный баланс
круговорота элементов в биосфере. Рассмотрим круговороты
важнейших биогриных элементов и воздействие на них антропо-
генных факторов
62
Круговорот углерода (рис. 1.9) Углерод в атмосфере содер-
жится в основном в виде углекислого газа С02(0,03 об.%). Масса
углерода, содержащегося в атмосфере в виде СО2, составляет
около 600 млрд т, что примерно в 2 раза больше массы углерода
в живых организмах. Круговорот углерода в биосфере начинает-
ся с поглощения атмосферного СО2 зелеными растениями (и не-
которыми микроорганизмами) в 'процессе фотосинтеза. При
этом из углекислого газа и воды образуются углеводы (в первую
очередь глюкоза) и кислород, который выделяется в атмосферу':
лСО2 +лН2О
спет
хлорофилл
СЛЛ+лОЛ;
углеводы
(1-1)
СО, + Н,о----* /* С6Н . А + О,Т.
1 - хлорофилл ‘ u *
ГЛЮКмои
(1.2)
Круговорот
углерода в природе
Вулканическая
деятельность
Воздействие человека
Лесные пожары
Органическое
вещество почв
Органическое
вещество животных
Органическое
вешеетво зеленых
растений
Промышленное
сжигание топлива
Отопление жнзых
домов и предприятий
Выхлопные газы
автотранспорта
Известняки,
доломиты
Вырубка лесов (косвенно
увеличивает СО, за счет
уменьшения фотосинтеза)
Океан
Н,СО,
Производство
элекгроэнерпш (ТЭС)
Разрушение почвенною
_____покрова______
СО,
натмосфере
Обжиг известняка
«Захоронение»
(«уход в । еологию»)
Частичное высвобождение СО. человеком
Рис. 1.9. Схема круговорота уг.дерода.
1 — фотосинтез; 2—дыхание; 3 — разложение; 4—растворение: 5— осаждение
Большинство растений и животных потребляют кислород
при дыхании, выделяя при этом СО2 как конечный продукт об-
мена. Углерод в виде органического вещества из растений посту-
1 Новая концепция фотосинтеза рассмотрена в разд. 2.3 «Биологическая
роль воздуха».
63
паст в пищевые цепи животных В экосистеме углерод переме-
щается с одного трофического уровня на другой до тех пор, пока
не возвратится в атмосферу в результате дыхания или пока орга-
низмы, в которых он содержится, не погибнут. Мертвые расте-
ния и животные разлагаются микроорганизмами почвы, в ре-
зультате углерод этих растений и животных окисляется до СО, и
возвращается в атмосферу. Естественными источниками по-
ступления углекислого газа в атмосферу являются также извер-
жения вулканов и лесные пожары.
Углекислый газ атмосферы не только потребляется зелеными
растениями при фотосинтезе, но и растворяется в океанах. Оксан
содержит углекислого газа в 50 раз больше, чем атмосфера. При
растворении СО2 в воде образуется непрочная угольная кислота,
которая может разлагаться с выделением углекислого газа:
со, I-11,0 Н,СО,. (1.3)
Угольная кислота диссоциирует на гидро карбонат- и карбонат-
ионы:
Н;С03Д=>НСО, +Н’; (1.4)
НСО31=>СО,2- + 1Г. (1.5)
Эти ионы реагируют с кальцием и магнием, попадающими в во-
ду' вследствие выветривания пород. При взаимодействии ионов
кальция с карбонат-ионами образуется нерастворимый карбо-
нат кальция — известняк:
Са^ + со,2- —» СаСО,. (1.6)
При совместном взаимодействии ионов кальция и магния
с карбонат-ионами образуется доломит СаСО, - MgCO3. Благо-
даря этим реакциям, сопровождающимся выпадением карбона-
тов в осадок, происходит дальнейшее растворение СО, в воде.
При этом может происходить частичное превращение нераство-
римого карбоната в растворимый гидрокарбонат:
СаСО, + СО; + 11 ;О Са(НСО,),. (1.7)
На поверхности водоема раствор согревается, и из него вновь выпа-
дает СаСО3 и выделяется СО,, т. е происходит обратная реакция.
Таким образом океаны поддерживают концентрацию СО,
в атмосфере на постоянном уровне, играя роль своеобразного
буфера. Именно этот механизм до появления интенсивной тех-
ногенной деятельности человека обеспечивал относительное
постоянство содержания СО2 в атмосфере Земли.
Небольшая часть углерода, по выражению В. И. Вернадского,
«ускользает» от круговорота (прежде всего в бескислородной
среде) и «уходит в геологию», образуя захоронения в литосфере
в качестве торфа, угля, горючих сланцев, нефти, или концентри-
руется в донных отложениях оксана в виде известняка и доломи-
64
та. Этот углерод в последнее столетие в значительной степени
высвобождается человеком, использующим указанные вещества
в качестве энергетических, строительных и других ресурсов.
До того времени как человечество начало сжигать ископаемое
топливо, скорости поступления углекислого газа в атмосферу и
его удаления из цикла были примерно равны. Техногенная дея-
тельность человека нарушила естественный баланс круговорота
углерода. Сжигание топлива происходит в промышленных произ-
водствах, в тепловых электростанциях (ТЭС), при отоплении жи-
лых домов и предприятий, при горении нефтепродуктов в двига-
телях внутреннего сгорания и т. д. За последние 150 лет коли-
чество сжигаемого топлива увеличивается ежегодно примерно на
4,3%. В результате ежегодно в атмосферу выбрасывается около
6 млрд т СО,. Отрицательным экологическим последствием интен-
сивного сжигания топлива является увеличение в атмосфере ядо-
витого угарного газа СО.
Увеличению содержания СО, в атмосфере способствует также
интенсивное сведение лесов, особенно тропических, с целью
расширения ссльскохозяйствсшшх земель и увеличения произ-
водства изделий из древесины. Сельскохозяйственные культуры
потребляют в 10—20 раз меньше СО, на единицу площади по-
верхности, чем тропические деревья. Наконец, фактором влия-
ния человека на круговорот углерода можно назвать его воздей-
ствие на почву в процессе сельскохозяйственного производства
(разрушение почвенного покрова, выделения с полей, культива-
ция). Итогом деятельности человека на планете стал неуклон-
ный рост содержания СО2 в атмосфере Земли, начиная с 50-х гг.
XX в. Глобальное экологическое последствие этого — парнико-
вый эффект (см. разд. 2.6 1).
Таким образом складывается биогеохимический цикл (БГХЦ),
или круговорот, углерода — одного из наиболее важных биоген-
ных элементов (органогенов), входящих в состав всех живых
организмов.
В настоящее время представление В И Вернадского о биогео-
химических циклах как основе организованности биосферы
углублено и расширено до представления о технобиогеохими-
ческих циклах (ТБГХЦ) как основе организованности экосферы
и анзропосфсры в целом. Вовлечение того или иного химиче-
ского элемента в процессы ТБГХЦ зависит от многих факторов:
химических свойств элемента (в частности, растворимости об-
разуемых им соединений), его земного кларка (среднего содер-
жания в земной коре); роли элемента в ТБГХ-процессах (био-
фильносги — необходимости участия этого элемента в построе-
нии живого организма, технофильносги — включения элемента
в производственные процессы, геохимической активности), со-
отношения биологического, техногенного и геологического цик-
65
лов этого элемента. Баланс элемента в конкретной экосистеме
может быть как положительным (пртирсссивная аккумуляция),
так и отрицательным (прогрессивное рассеяние).
На рис. 1.10 представлен тсхнобиогеохимический цикл свин-
ца, нс являющегося жизненно необходимым элементом а, на-
против, относящегося к труппе тяжелых токсичных металлов.
Свинец ингибирует ферментативные реакции, вступая в хими-
ческое взаимодействие с белками и осаждая их. Присутствие по-
вышенных концентраций свинца в воздухе, воле и продуктах
питания представляет угрозу для здоровья человека.
В природных условиях свинец находится в основном в земной
коре, он входит в состав более 200 минералов, из них промышлен-
Рис 1.10. Тсхнобиогеохимичсский цикл свинца в окружающей среде
(по Л. С. Бобкову, 1997):
/ — затрязнение воды в трубах, изготовленных из свинца; 2 — употребление
людьми загрязненной питьевой воды; 3 - проникновение свинца в воду из
земной коры; 4 — горнодобывающие процессы; 5 — производство чушкового
свинца; б-поглощение свинца корневой системой растений; 7 - загрязнение
воздуха п процессе выплавки свинца; 8— употребление в пищу растений, со-
держащих свинец; 9— осаждение свинца из воздуха; 10— загрязнение воздуха
свинцом в процессе работы автомобильных двигателей; 11 — употребление
животными в пишу загрязненной растительности; 12 — животные, употреб-
ляемые в пищу человеком; 13 — поглощение детьми свинца, содержащегося
в красках: 14 — попадание свинцовой глазури в пищевые продукты
66
нос значение имеют только гри галенит PbS англезит PbSO.. и
церуссит РЬСО3 Из земной коры свинец может попадать в под-
земные воды, а при выветривании горных пород — в атмосферу и
поверхностные воды. Добыча, переработка и выплавка этого ме-
талла сопровождаются рассеиванием свинца в биосфере, причем
часто в более активной миграционно-способной форме, чем его
природные соединения. Показатель технофильности свинца
очень высокий и уступает лишь углероду, хлору и золоту. Мировое
производсгво свинца составляет "34 мл н т в год и постоянно возрас-
тает, причем выбросы свинца в атмосферу достигают 4,3 млнт в
год, и его антропогенное поступление значительно превышает
природное. При сжигании нефти и бензина в окружающую среду
поступает нс менее 50% всего антропогенного свинца, что является
важной составляющей вТБГХЦ элемента.
Районы, в которых концентрация химических элементов (со-
единений) в силу природных причин оказывается выше или ниже
оптимального уровня, называют, по А П. Виноградову (1895—
1975), биогеохимическими провинциями. Этот известный русский
ученый-геохимик ввел данное понятие в науку. Формирование
биогеохимических провинций обусловлено особенностями поч-
вообразуюших пород, почвообразовательного процесса, а также
присутствием рудных аномалии. При загрязнении биосферы про-
исходит образование техногенных аномалий, в которых содержа-
ние химических элементов превышает в 10 и более раз так назы-
ваемое фоновое (или среднестатистическое содержание в неза-
§эязненных ландшафтах). Потоки элементов в их ТБГХ11 играю!
ольшую роль в возникновении как зон повышенной концент-
рации тех или иных веществ, так и зон обеднения, т. с. в образо-
вании различных геохимических провинций. Происходят су-
щественное перераспределение вещества на земной поверхно-
сти, дифференциация в пространстве элементов экосферы. На
техногенные геохимические аномалии указывал еще известный
геохймик А. И. Перельман, подразделяя их на зри типа: 1) гло-
бальные, охватывающие весь земной шар; 2) региональные, охва-
тывающие части материка, страны, области; 3) локальные, радиу-
сом до нескольких десятков километров и связанные с опреде-
ленным источником загрязнения.
Вопросы и задания
1. Что представляет собой круговорот биогенных элементов? !. Что такое биогеохи-
мический ним (БГХЦ)?3 По рис. 1.9 охарактеризуйте а) два механизма удаления угле-
кислот газа из атмосферы; б) природные источники поступления СО, в атмосферу;
в) антропогенные источники поступления углекислого газа в атмосферу. 4. Назовите
основные факторы воздействия человека на круговорот углерода и экологические по-
следствия этого воздействия 5 Что такое ТБГХЦ? Пояснение дайте па примере свин-
ца. 6. От каких факторов зависит вовлечение химического элемента в процессы ТБГХЦ?
7. Что такое биофильность и технофилыюсть элемента? 8. Что такое «биогеохимиче-
ские провинции» и «техногенные геохимические аномалии»?
Глава 2
АТМОСФЕРА
Земная газовая оболочка, наш
воздух, есть создание жизни.
Академик В. И. Вернадский
2.1. СТРОЕНИЕ АТМОСФЕРЫ
Словами «воздух» и «атмосфера» обычно называют газовую
оболочку, окружающую Землю. Общая масса воздуха составляет
5,13-1015 т. Земная атмосфера подразделяется на слои в соответ-
ствии с их температурой (рис. 2.1).
Самый ближний к поверхности Земли слой называется тро-
посферой. Высота се меняется в зависимости от местонахожде-
ния на Земле: над экватором она составляет 16—18 км, а нал по-
люсами — 8—10 км. В слое тропосферы в основном и происходят
все те явления, которые называют «погодой». Именно в этой час-
ти атмосферы образуются все осадки в виде дождей, формируют-
ся облака почти всех видов и возникает подавляющее число раз-
Рис 2 1. Строение атмосферы Земли
68
новидностсй гроз и штормов. По мере увеличения высоты тем-
пература в тропосфере понижается Выше тропосферы распола-
гается стратосфера. В стратосфере температура сначала сохра-
няется постоянной, но с определенного уровня начинает повы-
шаться с высотой. В стратосфере сконцентрирована основная
часть атмосферного озона, который и вызывает повышение тем-
пературы, так как поглощает ультрафиолетовые лучи Солнца.
В наиболее высоких концентрациях озон находится на высоте
25—30 км. Па высоте более 50 км от поверхности Земли начинает-
ся мезосфера — зона, где температура опять понижается. На высо-
те более 80 км расположена термосфера, не имеющая определен-
ной верхней границы. В этой зоне температура с высотой вновь
возрастает На высоте выше 400 км находится экзосфера.
По мере удаления от поверхности Земли воздух становится
вес разреженнее, атмосферное давление снижается, 90% массы
атмосферы сосредоточено в пределах 16 км над земной поверх-
ностью Затруднение дыхания высоко в горах связано с умень-
шением содержания кислорода во вдыхаемом воздухе. В тропо-
сфере су щест вутот различные формы жизн и. Ниж! пою часть тро-
посферы относят к биосфере. В контакте с тропосферой ведут
свою жизнь обитатели суши.
Вопросы и задания
1. На какие слои делится атмосфера Земли? Назовите нысхлу этих слоев. 2. Как из-
меняется температура атмос<|>еры с высотой? 3. В какой части атмосферы происходит
накопление озона: а) тропосфере; б) стратосфере; в) мезосфере? Какую часть атмосфе-
ры ОТНОСЯТ К биос<|>ере?
2.2. ХИМИЧЕСКИЙ СОСТАВ АТМОСФЕРЫ
Химический состав чистого сухого воздуха указан в табл. 2.1,
в которой приведены как концентрации газов, так и их общая
масса в атмосфере1.
Из табл. 2.1 следует, что воздух в основном состоит из азота N2
(78,08 об.%), кислорода О2 (20,95 об.%), значительно меньшего
количества инертного газа аргона Аг (0,93 об.%) и еще меньше-
го — углекислого газа СО, (0,03 об.%). Помимо этих постоянных
компонентов воздуха, важным компонентом является также во-
дяной пар, содержание которого меняется от 0 об.% в сухом воз-
духе до ~4 об.% во влажном воздухе. Основная масса водяных
паров содержится в нижних слоях (до 6 км) атмосферы, в стра-
тосфере они (фактически отсутствуют.
1 Концентрация газов (млн-1) означает число частиц газа на Г IO0 частиц
воздуха; ее международное обозначение — ppm.
69
Состав воздуха
Таблица 2.1
Газ Формула Кон ich грация Общая масса в атмосфере. 10’ т
Азот N, 78.084 об.% 3 900 000
Кислород о, 20,948 об.% 1 200 000
Аргон Аг 0,934 об.% 67 000
Оксид утлерода(ГУ) СО, 0,032 o6.% 2600
Водяной пар 11,6 Нс учитывается 14 000
Неон Nc 18,18 млн.-1 65
Криптон Кг 1,14 млн.-1 17
Метан СН, 2,00 млн.-1 4
Гелий Нс 5,24 млн.-1 4
Озон легом о, < 0,07 млн.-1
Озон зимой о5 < 0.02 млн.-1 3
Ксенон Хе 0,087 млн.-1 2
Оксид азота(1) N2O 0,50 млн.-1 2
Оксид углерода(П) СО Следы 0,6
Водород Н, 0,5млн.-1 0.2
Аммиак NH3 Следы 0,02
Оксид азота(ТУ) NO, < 0.02 млн.-1 0,013
Оксид азота(П) NO Следы 0,005
Оксид ccpu(IV) SO, < 1млн.-1 0,002
Сероводород H,S Следы 0,001
Все остальные имеющиеся в атмосфере газы содержатся лишь
в следовых количествах, составляющих в сумме 0,02 об.%. Коли-
чество инертных газов (неона, гелия, криптона, ксенона) в воз-
духе колеблется от тысячных до миллионных долей процента.
В атмосферном воздухе содержится также незначительное коли-
чество водорода.
Примесями атмосферного воздуха природного происхожде-
ния, образующимися в результате химических и биологических
процессов, являются такие газообразные вещества, как аммиак,
оксиды азота, метан, сероводород и др. Гниение органических
веществ способствует поступлению в воздух сероводорода, ам-
миака. В результате брожения углеродистых веществ выделяется
метан. Оксиды азота в небольших количествах образуются во
время грозы при взаимодействии азота с кислородом.
Атмосферный воздух служит источником для получения та-
ких промышленных 1азов, как аргон, диоксид углерода, азот и
кислород. Гелий и водород в настоящее время получают из при-
родного газа, жидких углеводородов и угля, т. е. ресурсов, кото-
рым угрожает возможное истощение. Потребность в резервах
кислорода в атмосфере намного больше из-за естественных и
искусственных процессов сгорания.
70
Время жизни следовых газов в атмосфере колеблется от не-
скольких суток до 100 лет. Гак, в ряду О3, СО, СН4, Н2, N,O время
жизни возрастает.
Пыневыс частицы от промышленных и природных источни-
ков также оказываются весьма существенным компонентом воз-
духа хотя обычно они присутствуют в относительно небольших
количествах. Природными источниками пыли являются дей-
ствующие вулканы, ветровая эрозия почв, биологические про-
цессы (пыльца растений), лесные пожары, выносы с поверхно-
стей морей и океанов, а также космическая пыль (поступление
веществ из космического пространства).
В воздухе содержатся также микроорганизмы (бактерии, ви-
русы, плесневые грибки и др.). Патогенные микроорганизмы
среди них встречаются редко и в ничтожных количествах, одна-
ко в воздухе закрытых помещений могут обнаруживаться возбу-
дители инфекций.
Вопросы и задания
1. Назовите основные постоянные компоненты воздуха и их концентрацию
в атмосфере (в объемных процентах). 2. В каких слоях атмосферы находятся водя-
ные нары? Назовите пределы колебания их содержания. 3. Охарактеризуйте следо-
вые газы атмосферы и их происхождение. 4. Назовите природные источники пыли
в воздухе.
2.3. БИОЛОГИЧЕСКАЯ РОЛЬ ВОЗДУХА
Наличие воздуха — это первое жизненно необходимое усло-
вие существования человека в окружающей среде. Вдыхаемый
воздух доставляет в организм кислород, а выдыхаемый выводит
из организма все газообразные продукты обмена. От качества
воздуха зависит здоровье человека. Максимальное количество
воздуха, проходящего через легкие человека за сутки, составляет
11 520 л, или соответственно 480 л/ч. В пересчете на кислород
получается, что человек потребляет ~ 100 л О2 за 1 ч.
Кислород (Oj) с биологической точки зрения является важ-
ной составной частью воздуха. Без него жизнь на Земле невоз-
можна, он необходим для дыхания растений, животных и чело-
века. В больших количествах кислород расходуется в процессах
окисления и горения. Одновременно происходят и обратные
процессы, восстанавливающие нормальное содержание кисло-
рода в атмосферном воздухе. Важнейший из этих процессов —
фотосинтез (см. реакцию (1.1)), осуществляемый зелеными рас-
тениями на свету (в присутствии хлорофилла). Исходными ве-
ществами для него служат углекислый газ и вода:
71
лСО2 + лН2О
солнечный свсг^
хлорофилл
СЛз.0, + пО2.
Растеши, поглощая углекислый газ, расщепляющего, усваивая
углерод для синтеза органических веществ. Освобождающийся
кислород выделяется в атмосферу. За счет жизнедеятельности
растений ежегодно в атмосферу выделяется ~0р • 1012 трлн т кис-
лорода.
В 1995 г. Г. Г. Комиссаров (Институт химической физики
им Н. Н. Семенова РАН) предложил принципиально новую кон-
цепцию (|ютосинтеза, которую подробно изложил и обосновал
в книге «Фотосинтез: физико-химический подход» (2003). Со-
гласноэтой концепции источником кислорода и элементного во-
дорода при фотосинтезе служит не вода (Н2О), а перокси,!! водоро-
да (Н,О2) экзо- и эндогенного происхождения; для процесса не-
обходима нс только световая, но и тепловая энергия, при этом
происходит локальный разогрев хлоропласта.
В ходе фотосинтеза протекает несколько тысяч реакций.
Несмотря на комплексность процесса фотосинтеза, его можно
разделить на две основные стадии — световую, для протека-
ния которой необходимо непосредственное действие света, и
темновую, которая следует за световой. На первой, световой,
стадии происходит, как принято считать, фоторазложение
воды с образованием молекулярного кислорода, который вы-
деляется в атмосферу:
и2о-----► [Н] + о2.
хлорофилл t
Эта схематичная запись выражает сущность фотосинтеза. Обра-
зовавшийся водород [111 вступает затем в темновой цикл фикса-
ции углекислого газа, который заканчивается образованием уг-
леводов, условно обозначаемых {СН,О}:
[Н| + СО2 .ФСР™9Н|Ь1>. {СН2О}.
Эта сталия включает большое число ферментативных реакций.
С учетом всего сказанного выше суммарное уравнение фото-
синтеза обычно записывают в виде:
СО2 + 11,0 Растс||ИЯ ► {СН;О} + о2.
По новой концепции первую (световую) стадию фотосинтеза
следует записать так:
Н,О; Н,О2---► [HJ + О,.
1 хлорофилл 2
В природе нет чистой воды, в ней всегда присутствует примесь пе-
роксида водорода. В хлоропласте на каждую молекулу хлорофил-
72
ла приходится одна молекула Н2О2. Пероксид водорода — нор-
мальный метаболит любой аэробной клетки. В физиологических
концентрациях Н2О2 нс только не токсичен, но и необходим для
нормальной жизнедеятельности клетки. Он активно участвует
во многих регуляторных процессах растительной клетки. В по-
следние годы появились сообщения, что Н2О2 является эффек-
тивным лечебным средством.
Переход кислорода из атмосферного воздуха в кровь и из крови
в ткани зависит от парциального давления. На уровне моря пар-
циальное давление кислорода в воздухе равно ~21 кПа (160 мм
рт. ст.), при снижении ею до 18,5 кПа (140 мм рт. ст.) у человека
появляются первые признаки гипоксии (кислородною голода-
ния). Снижение парциального давления кислорода до 6,5—
8 кПа (50—60 мм рт. ст.) опасно для жизни. Такое явление быва-
ет в горах при подъеме человека на высоту (высотная, или гор-
ная, болезнь).
Азот (N2) является инертным разбавителем кислорода атмо-
сферы. В чистом кислороде жизнь невозможна. Азот играет важ-
ную роль в биосфере. В виде органических соединений он содер-
жится во всех организмах, входит в состав белков и нуклеиновых
кислот, т. с. относится к жизненно важным элементам. Боль-
шинство организмов не способно усваивать свободный азот (N2)
из воздуха. В растения азот поступает из почвы с неорганически-
ми веществами — солями аммония и нитратами. Животные усваи-
вают органически связанный азот при потреблении раститель-
ной или животной пищи.
Вовлечение атмосферного азота (N ) в биологический круго-
ворот начинается с азотфиксации — образования аммиака, а по-
том и других соединений азота (нитритов и нитратов) в результа-
те деятельности почвенных и водных азотфиксирующих микро-
организмов:
атмосферный азот N, —► аммиак NH- —► нитриты NO, —► нитрагы NO,-.
В природных условиях свободный азот фиксируют сине-зеле-
ные водоросли, а также азотбактерии, живущие в клубеньках на
корнях ольхи, облепихи, белой акации, бобовых растений (соя,
люцерна, горох, фасоль, клевер, земляные орехи). Процесс пре-
вращения азотсодержащих веществ в форму, пригодную для
усвоения высшими растениями, называется нитрификацией.
Аммиак образуется нс только при фиксации атмосферного
азота, но и выделяется также в процессе экскреции и разложе-
ния растительных и животных организмов. В результате деятель-
ности бактерий из него впоследствии образуются сначала нит-
риты, а потом нитраты.
Небиологическим путем химически связанный азот образу-
ется при электрических разрядах в атмосфере, а также при высо-
ких температурах (выхлопные газы, выбросы промышленных
предприятий):
N2 + O,—»2NO; (2.1)
2NO + О, —♦ 2 NO,. (2.2)
Оксид азота(ТУ) при взаимодействии с водой может образовы-
вать азотную кислоту:
3NO, Н2О —► NO + 2HNO,, (2.3)
которая впоследствии дает нитраты.
Б биосфере происходит и обратный процесс: разрушение
почвенными и водными бактериями нитратов до нитритов, ам-
миака и молекулярного азота, возвращающегося в атмосферу,
т. е. процесс денитрификации. Бактсрии-дсиитрификаторы рас-
пространены в почвах и водах с малым содержанием кисло-
рода.
Колебания концентрации N2 в природе незначительны.
Содержание углекислого газа (COJ в атмосфере составляет
более 2 • 1012 т. Он участвует в круговороте углерода (см. рис. 1.9).
Атмосферный воздух непрерывно пополняется углекислым
зом в результате жизнедеятельности живых организмов, процес-
сов горения, брожения, извержения вулканов и т. д. В то же са-
мое время СО2 постоянно удаляется из атмосферы, так как усваи-
вается зелеными растениями в процессе фотосинтеза. Таким
образом, углекислый газ играет важную роль в природе, являясь
источником углерода при синтезе органических веществ расте-
ниями и природным сырьем для пополнения атмосферы кисло-
родом.
Диоксид углерода — физиологический возбудится вдыхатель-
ного центра. При его концентрации 0,5% отмечается увеличение
легочной вентиляции. При более высоких концентрациях угле-
кислый газ оказывает наркотическое действие и вызывает асфик-
сию (удушье). Такое повышение концентрации может наблю-
даться только в закрытых помещениях. Уменьшение концентра-
ции СО2 в воздухе неопасно для жизни, так как необходимое
парциальное давление СО2 в крови обеспечивается за счет жиз-
недеятельности организма.
Углекислый газ играет большую роль в поглощении инфра-
красного (ИК) излучения Земли и способствует уменьшению
охлаждения ее поверхности. Увеличение содержания СО2 в ат-
мосфере за счет антропогенного фактора может вызвать по-
тепление климата (об этой проблеме см. подробнее в разд. 2.6
«Глобальные экологические проблемы атмосферы»).
Озон (Oj), содержащийся в воздухе, имеет важное биологи-
ческое значение Он поглощает солнечное излучение с длиной
волны менее 290 нм, защищая все живое от его губительного
74
действия. Выраженное действие озона на организм человека
проявляется при его концентрации выше 0,02 мг/м-.
Кроме указанных в табл. 2.1 инертных газов (аргона, неона,
гелия, криптона, ксенона) обычно обнаруживается также радио-
активный инертный газ радон, выделяющийся из почвы. Одна-
ко концентрация его очень мала (6 10 |К%), поэтому он не мо-
жет оказать существенного неблагоприятного действия на чело-
века.
Водяные пары, содержащиеся в атмосферном воздухе, защи-
щают поверхность Земли от чрезмерною охлаждения вследствие
утечки тепла в космическое пространство, являются источни-
ком атмосферных осадков, обеспечивают развитие растительно-
сти, дают начало поверхностным и грунтовым водам.
Количество воды в воздухе определяет ею влажность. Высо-
кая влажность действует неблагоприятно на человека: при высо-
кой температуре она способствуе т перегреванию организма, при
низкой температуре ускоряет переохлаждение организма, так
как теплопроводность воды во много раз выше, чем теплопро-
водность воздуха.
Умеренное повышение концентрации легких отрицательных
аэроионов является благоприятным фактором, имеющим обще-
оздоровительное значение В городах воздух менее ионизиро-
ван, чем в сельских районах.
Изложенные данные показывают, что атмосферный воздух
имеет очень важное значение для создания нормальных условий
жизни на пашей планете.
Вопросы и задания
1. Какова основная биологическая функция кислорода воздуха? Сколько литров
кислорода необходимо в сутки одному человеку для дыхания? 2. Почему азот является
жизненно важным элементом? 3. Способны ли живые организмы усваивать свободный
азот из воздуха? 4. Что такое азотфиксация и как оня осуществляется? 5. Что называется
нитрификацией и денитрификацией? 6. Назовите небиологический путь образования
химически связанного азота. 7. Каком роль углекислого газа в природе? 8. Какое фи-
зиологическое действие на человека оказывает избыток СО, в воздухе? 9. В чем заклю-
чается биологическое значение озона? 10. Какова роль водяных паров в природе?
11. Какое денег вне па человека оказывает влажность воздуха?
2.4. ИСТОЧНИКИ ЗАГРЯЗНЕНИЯ
АТМОСФЕРЫ
Вы уже знаете, что природный химический состав воздуха
в естественных условиях изменяется очень незначительно. Од-
нако в результате хозяйственной и производственной деятель-
ности человека может происходить существенное изменение со-
75
става атмосферы. Особенно изменяется концентрация второсте-
пенных газовых примесей (диоксида серы SO2, оксидов азота
NO и МО3, монооксида углерода СО, метана СН4 и др.). Увели-
чивается также концентрация твердых взвешенных час гиц Про-
исходит загрязнение атмосферного воздуха. Оно особенно про-
является в больших городах и промышленных центрах. Были
случаи, когда люди теряли сознание вследствие отравления угар-
ным газом (СО), попадая в районы интенсивного автомоби льно-
го движения. В результате сильного загрязнения воздуха цент-
ральные районы некоторых городов абсолютно непригодны для
жилья.
К загрязнителям воздуха относятся вещества, присутствую-
щие в атмосфере в концентрациях, которые могут оказывать не-
благоприятное воздействие па человека и окружающую среду.
Большинство таких веществ, как диоксид серы, оксиды азота и
другие, обычно присутствуют в атмосфере в низких {фоновых},
не представляющих опасности концентрациях. Они образуются
как в результате природных процессов, так и из антропогенных
источников. Доля природных источтптков этих веществ значи-
тельно больше антропогенных. В табл. 2.1 (см. с. 70) были приве-
дены фоновые концентрации газов, встречающихся в естест-
ве иных условиях, измеренные в незагрязненных районах. Таким
образом, к загрязнителям воздуха следует относить вещества
в высоких (но сравнению с фоновыми значениями) концентра-
циях, которые возникают в результате химических и биологи-
ческих процессов, используемых человеком
В проблеме антропогенного (техногенного) изменения ок-
ружающей среды загрязнение атмосферы занимает особое мес-
то. Во-первых, это обусловлено тем, что увеличение концент-
рации некоторых газов, зачастую второстепенных, приводит к
глобальным экологическим последствиям, как то: кислотные
дожди (SO2, NO, NO2), разрушение озонового слоя (фреоны),
парниковый эффект (СОг, СН4, фреоны, N2O). Во-вторых, из-
за высокой скорости движения воздушных масс выбросы вред-
ных веществ могут переноситься в течение короткого времени
на расстояния в сотни и тысячи километров. Это приводит к
глобальному за«рязнснию других компонентов биосферы: по-
верхностных вод, почв, растительности. Кроме того, содержа-
ние в атмосфере различных веществ, в том числе токсичных,
приводит к непосредственному быстрому попаданию их при
дыхании в организм человека и к последующему накоплению
в нем, ведь в суп ки через легкие человека проходит 11,5 м3 воз-
духа.
Конечно, в атмосфере происходят фотохимические процес-
сы, с помощью которых перерабатываются загрязняющие вещест-
ва и восстанавливается баланс. Однако за период с начала XX в.
76
человек выбросил в атмосферу такое количество за1рязнителей,
что они уже нарушили природные процессы и равновесие в био-
сфере.
Каковы же основные антропогенные источники загрязнения
атмосферного воздуха?
Это прежде всего производство энергии, автотранспорт, чер-
ная и цветная металлургия, химическая и нефтехимическая про-
мышленность, предприятия по производству строительных ма-
териалов.
Вопросы и задания
1. Концентрация каких веществ в атмосфере может существенно изменяться в ре-
зультате хозяйственной и производственной деятельности человека? 2. Что такое «фо-
новые концентрации газов в атмос<[>ере»? 3. При кяких концентрациях вещество можно
относить к загрязнителям воздуха? 4. Почему загрязнение атмос<|>еры занимает особое
место в проблеме антропогенного изменения окружающей среды? 5. Назовите основ-
ные источники загрязнения атмосферной) воздуха.
2.4.1. Теплоэнергетика
Процессы сгорания топлива используются для обогрева и
приготовления пищи в быту и для получения электроэнергии
в промышленности.
Тепловые электростанции (ТЭС), любые промышленные и
коммунальные предприятия, работа которых связана со сжига-
нием топлива, относятся к теплоэнергетике. Эти производства
являются одним из основных источников техногенного загряз-
нения воздушной среды. На долю ТЭС приходится около 25%
всех вредных выбросов. По состоянию на 1988 г. доля ТЭС в ми-
ровом производстве электроэнергии составляла 65% (Чалый Г. В.
Энергетика и экология. 1991).
На тепловых электростанциях в качестве топлива используют
уголь, мазут, природный газ, реже — нефть, горючие сланцы.
Есть электростанции, работающие на мест ном топливе — торфе,
как, например, Шатурская ТЭС в Московской области.
Принцип работы типичной тепловой электростанции состо-
ит в следующем: топливо сжигают в топках паровых котлов, и
его химическая энергия превращается в тепловую энергию пара.
Иными словами, тепло, выделяющееся при сжигании топлива,
используется для нагревания воды и получения пара. В паровой
турбине энергия пара переходит в механическую, которая затем
в турбогенераторе превращается в электрическую. Отработан-
ный пар вновь превращается в воду в конденсаторе, через кото-
рый пропускается холодная вода. В процессе конденсации пара
охлаждающая вода нагревается. Эта вода либо сбрасывается
77
в водоем, откуда она забирается, либо пропускается через спе-
циальные системы — градирни — для охлаждения и повторного
использования в конденсаторе (рис. 2.2). Вода, образовавшаяся
из сконденсированного пара, возвращается в котел. Описанный
цикл повторяется.
Рис. 2.2. Красноярская ТЭС.
Слева и справа от трубы расположены градирни
Таков же принцип работы и атомных электростанций (АЭС),
использующих ядерное топливо.
Коэффициент полезного действия (КПД) обычной ТЭС (ти-
па ГРЭС) составляет 37—39%, т. с. около 40%. Это означает, что
ТЭС теряет 60 усл. ед. тепла на каждые 40 ед., преобразованных
в электрическую энергию. В декабре 2000 г. на северо-западе па-
шей страны построили ТЭС, работающую на природном газе,
КПД которой 52%. Это ТЭС XXI века.
Для работы ТЭС требуются большие количества топлива и
воды, к чистоте последней предъявляются высокие требования.
Эти электростанции обычно строят недалеко от рек или вблизи
других больших водоемов. Так, ГРЭС мощностью 2 млн кВт
ежесуточно сжигает 17 800 т угля и 2500 т мазута, потребляет
150000 м3 воды. На охлаждение ежесуточно расходуется более
7 млн м3 воды, и при этом происходит тепловое загрязнение во-
доема-охладителя.
На электростанциях применяют два типа охладителей. В устрой-
ствах первого типа холодная вода, поступающая из внешнего ре-
зервуара, используется для конденсации пара, а затем перебра-
сывается в нагретом состоянии в тот же резервуар, откуда за-
биралась холодная вода. Такой тин называется охлаждением
с открытым циклом. В устройствах второго типа, называемых
охлаждением с замкнутым циклом, тепло, полученное охлаждаю-
щей водой, рассеивается в атмосфере при помощи градирен (ба-
78
шеи, в которых вода охлаждается путем разбрызгивания). Гра-
дирни имеют большие размеры по сравнению с окружающими
строениями, они бывают видны за несколько километров.
Тепловое загрязнение воды происходит в случае использования
охлаждения открытого типа. Каковы могут быть экологические
последствия теплового загрязнения для водных организмов? Во-
первых, отмечаются случаи гибели рыбы, хотя это и сравнитель-
но редкое явление. Во-вторых, температура может влиять на
репродуктивные функции водных организмов. Например, взрос-
лые особи форели способны выживать в те плои воде, но размно-
жаться они не будут. Под влиянием повышения температуры от-
мечается более раннее появление некоторых насекомых, кото-
рые затем погибают, так как в это время года им не хватает пиши,
а это значит, что позже будет не хватать пищи тем, кто питается
этими насекомыми, и т. д.
В поведении рыб под воздействием теплового шока могут
происходить изменения, позволяющие хищникам легко хватать
их. Кроме того, рыбы, подвергшиеся тепловому шоку, будут бо-
лее чувствительными к болезням. В отдаленной перспективе не-
которые из перечисленных эффектов способны оказаться столь
же губительными для популяции, как и непосредственная ги-
бель от перегрева воды.
Температура может оказать воздействие на структуру всего
водного сообщества. Приток избыточного тепла упрощает вод-
ные экосистемы, число различных видов уменьшается Наибо-
лее опасные тепловые воздействия на экосистемы оказывают
электростанции, расположенные в более теплых климатических
областях, поскольку организмы попадают в температурные усло-
вия, близкие к их верхнему температурному пределу выжи-
вания.
Чтобы избежатьтеплового загрязнения водоемов, применяют
охлаждение с замкнутым циклом, при котором значительная
часть «бросового» тепла охлаждающей воды передается в атмо-
сферу. Для этой цели используют пруды-охладители, охладитель-
ные каналы и охлаждающие башни (градирни) Однако следует
учитывать, что градирни должны иметь высоту, превышающую
глубину долины, вблизи которой они расположены, в против-
ном случае над долиной будет постоянно висеть туман, создавая
в окрестностях условия для непрерывного смога.
Для электростанций, расположенных в холодных регионах
мира, на берегу холодных морей или вблизи холодных эстуариев
крупных рек, не обязательны охлаждающие сооружения, сели
сбросы теплых вод не нарушают экологического равновесия
в природных водоемах.
Один из путей повышения эффективности производства
электроэнергии состоит в утилизации тепловых отходов, т. е.
79
тепла, получающегося при сжигании топлива, но не способного
превратиться в электрическую энергию. Отработанный пар ис-
пользуется для отопления, его транспортируют по подземным
трубопроводам в жилые дома, учреждения и на предприятия для
обогревания их зимой Такие сооружения называются тепло-
электроцентралями (ТЭЦ).
Другим способом повышения эффективности производства
электроэнергии является комбинированный цикл, в котором
объединяются газовая турбина и обычная система котел/паро-
вая турбина. Газовая турбина вращается не паром, а потоком га-
зов — продуктов сгорания керосина или природного газа. Третий
метол — использование магнитогидродинамической установки
(МГД-генератора), опытный образен которой был впервые со-
здан в нашей стране. Последние электростанции могут иметь
КПД до 60% и будут меньше загрязнять окружающую среду.
Экологические проблемы тепловых электростанций не огра-
ничиваются только тепловым загрязнением. Болес существенно
зафязнсиис атмосферы газообразными продуктами сгорания
топлива и твердыми отходами.
Основные элементы топлива — углерод и водород, в меныпих
количествах присутствуют сера и азот. В топливе могут бы ть со-
единения и других элементов, например металлов (сульфиды и
оксиды)
Количество серосодержащих соединений в топливе зависит
как от его типа, так и от места его добычи. Содержание серы
в нефти и угле может изменяться от долей процента до 6%. Сред-
нее содержание серы в углях, идущих на получение электроэнер-
гии, составляет 2,5%. Содержание серы в сырой нефти меньше,
чем в угле, и нс превышает 1%. Нефть, используемая для отоп-
ления домов, содержит сравнительно низкое количество ссрьг
в среднем около 0,25%. При перегонке нефти большая часть
серы переходит в мазут. В нем может содержаться от 0,5 до 5,0%
серы, хотя посредством дополнительных процедур перегонки
содержание серы в мазуте можно еще уменьшить. Мазут приме-
няется для отопления жилых домов, школ, больниц и в качестве
топлива на ТЭС из-за сравнительно низкой цены и малого со-
держания серы В отличие от утля и нефти природный газ прак-
тически нс содержит серы. С этой точки зрения газ — эколо-
гически чистое топливо. Однако в случае использования газа
природе наносится вред при прокладке тысячекилометровых га-
зовых трубопроводов, особенно в северных регионах, где сосре-
доточены основные месторождения газа. Природный газ перед
использованием обычно очищают от возможных соединений
серы, чтобы предотвратить коррозию трубопроводов.
В нефти сера практически полностью входит в состав органи-
ческих соединений (так называемая органическая сера). В угле
80
половина серы органическая, другая половина — неорганиче-
ская, распределенная в виде мелких кристаллов пирита (FeS,),
сульфатов Fe,(SO4)3, MgSO.t! CaSO4 и других соединений.
При сгорании топлива содержащиеся в нем углерод и водород
образуют соответствующие оксиды, что можно изобразить урав-
нениями:
С + О, —> СО, + Q; (2.4)
2Н + '/Д —* НО + у (2.5)
Если количества кислорода недостаточно для полного окисле-
ния углерода, то протекает реакция
с + '/А—>со+р, (2.6)
либо часть образующегося СО2 вступает в реакцию с углеродом,
образуя монооксид углерода:
С + СО,—»2СО-0 (2.7)
Таким образом, в условиях недостатка кислорода может выде-
ляться большее количество СО. Кроме того, по сравнению
с полным сгоранием уменьшается количество выделяющейся
теплоты (О).
При сжигании нефти в топочных устройствах образуется от 12
до 15% СО,. В оптимальных условиях сжигания выход СО со-
ставляет менее 2% от выхода СО2, т. с. менее 0,024—0,030%.
Все процессы сгорания углеродного топлива служат источни-
ками поступления в атмосферу углекислого газа, который до не-
давнего времени не считался загрязняющим веществом. Полага-
ли, что образующийся при сгорании углекислый газ усваивается
растениями при фотосинтезе. Однако концентрация СО, в ат-
мосфере неуклонно растет, и в промышленных районах превы-
шение достигает 10% по сравнению с отдаленными районами.
В связи с этим вызывает опасение строительство мощных ГРЭС
вокруг Красноярска (проект КАТЭК). Каждая из восьми ГРЭС
будет выбрасывать в атмосферу до 40 млн т СО,. Скорость расхо-
дования кислорода превысит скорость его поступления за счет
фотосинтеза. Это приведет к снижению концентрации О2 в воз-
духе с одновременным увеличением концентрации СО2 в при-
земном слое, а следовазслыю. и к кислородному голоданию и
изменению климата региона. О других последствиях увеличения
концентрации СО, в атмосфере («парниковый эффект», «эффект
пустыни») см. разд. 2.6.
При неполном сгорании нефти или угля летучие органиче-
ские соединения удаляются, образуя один из компонентов ды-
ма, что особенно характерно для небольших печей. В больших
печах летучие соединения, обладающие высокой горючестью,
воспламеняются от излучения горячих стенок печи и сгорают
полностью до СО2 и Н,О.
81
Сера и азот, входящие в состав угля и нефти, также сгорают
с образованием оксидов. При сгорании серы обычно образуется
сернистый газ:
S + O,—>SO3. (2.8)
В меньшей степени в пламени протекает дальнейшее окисление:
so2 + О —► SO, (2.9)
либо
SO, - '/,0, —► SO, + Q (2-!°)
В составе оксидов, образующихся в обычном пламени, при-
сутствует лишь около 1 % S03. Хотя ссрпый ангидрид S03 стаби-
лен при низких температурах, скорость его образования в отсут-
ствие катализаторов незначительна. При температурах, харак-
терных для пламени, более устойчив сернистый газ S02.
В процессе горения выделяется также монооксид азота NO.
Источником его образования частично служит азот, содержа-
щийся в топливе, при сгорании которого окисляется 18—80%
азота. Монооксид азота образуется и в результате реакции взаи-
модействия атмосферных кислорода и азота в пламени и в при-
легающих к нему слоях. Происходящую реакцию можно пред-
ставить так:
N, + O2—>2NO — Q.
Попадая в атмосферу, монооксид азота медленно превращается
в диоксид путем сложных фотохимических реакций В упрощен-
ном виде они сводятся к реакции
NO + '/A—► NO,.
При горении газа или нефти, нс содержащей серы и азота,
оксиды азота образуются лишь в результате реакций с участием
атмосферного азота. Если количество оксидов серы в продуктах
сгорания зависит только от содержания серы в топливе, то кон-
центрация оксидов азота в большей степени определяется спо-
собом сжигания топлива и температурой пламени.
Таким образом, в состав отходящих газов теплоэнергетики вхо-
дят СО2, СО, Н2О (пар), SO2 (реже SO3), NO, NO, и другие ве-
щества, поступление которых в воздушную среду наносит боль-
шой вред всем компонентам биосферы.
Образование твердых частиц (дыма) при горении зависит от
содержания твердых негорючих материалов в топливе и от пол-
ноты сгорания углерода. В дымах котельных, работающих с пе-
регрузкой (при неполном сгорании в них топлива), присутству-
ют несгорсвшие частицы углерода и неорганические вещества.
82
Обычно в аппаратах, работающих на нефти и газе, образуется
мало дыма. Наоборот, в печах, работающих на угле, особенно
при его распылении, выделяется значительное количество дыма.
Частицы, выбрасываемые в атмосферу при сжигании угля на
ТЭС, называются летучей золой.
В печах старой конструкции, когда уголь сжигали на колос-
никовых решетках, выделение дыма значительно уменьшалось,
поскольку большая часть золы нс попадала в дымоход, а соби-
ралась в зольной ямс. Сжигание топлива в стационарных сис-
темах производится в камерах, где обеспечивается стабильное
пламя и достаточное время для протекания реакций окисле-
ния. Поэтому основными загрязни гелями воздуха являются
оксиды азота, оксиды серы и частицы дыма. В настоящее время
разработаны и широко внедряются способы улавливания час-
тиц дыма. Извлечение же оксидов азота и серы пока разработа -
но недостаточно.
Теплоэнергетика является также источником крупнотоннаж-
ных твердых отходов, в числе которых «хвосты» углеобогащения,
золы и шлаки. Состав отходов углеобогатительных фабрик пред-
ставлен в табл. 2.2.
Таблица 2.2
Отходы углеобогатительных фабрик
Компонент Со, ержапие, масс.% Компонент Содержание масс.%
SiO, 55-60 СаО 0,5-1,0
А1?6, 22-26 К.О + Na,О 4,0-4,5
Fe.O, 5-12 С 5
Отходы посту! ают в отвалы, загрязняя почвенный покров,
пылят, «дымят» и тем самым резко ухудшают состояние атмо-
сферы. Одним из видов обогащения угля является технологи-
ческий процесс по уменьшению содержания в топливе серы.
При этом в большом количестве образуется твердый отход ти-
па колчедана, содержащий 42—46% S и 5—8% С. Только
в Подмосковном угольном бассейне его количество превышает
60 млн т.
Золы и шлаки тепловых электростанций представляют собой
многокомпонентные системы, в состав которых входят оксиды
кремния, алюминия, железа, щелочноземельных металлов и др.
Ежегодное их образование составляет около 70 млн т, a оте-
пень использования невелика — всего 1—2%. На терри гории
каждой ГРЭС КАТЭК будут формироваться ежегодно отвалы из
-1,5 млн т золы и шлаков, содержащих до 25 элементов, в том
числе Zn, Мп, Sr, Ti, Ва и др. Эти металлы, проникая из шлаков
в подземные воды, загрязнят их.
83
ГРЭС мощностью 2 млн кВт за год выбрасывает в атмосферу
~43 тыс. т золы, 220 тыс. т SO2,36—40 тыс. т оксидов азота. Через
высокие трубы вредные вещества выбрасываются в атмосферу на
многие десятки и сотни километров. В летучей золе тепловых
электростанций, работающих на угле, в небольших количествах
содержатся также токсичные элементы: мышьяк (As) и селен
(Sc).
В последние годы получены данные, что ТЭС, работающие на
угле, как и АЭС, могут давать радиационное загрязнение окру-
жающей среды. В летучей золе ТЭС обнаруживают радиоактив-
ные элементы и продукты их распада. Причина в том, что обыч-
ный уголь содержит радиоакт ивный изотоп углерода С-14, при-
меси калия-40, урана-238, тория-232 и продукты их распада. При
работе ТЭС эти радионуклиды вместе с летучей золой и другими
продуктами сгорания поступают в приземный слой атмосферы,
почву и водоемы. Количество выброшенных в атмосферу радио-
нуклидов зависит от зольности угля и эффск I ивности очистных
фильтров сжигающих устройств. ТЭЦ различного типа выбра-
сывают в атмосферу от 1 до 20% общего количества образующей-
Рис. 2.3. Белгородская ТЭЦ
ся золы.
Таким образом, теплоэнергетика может быть причиной теп-
лового (термального) загрязнения окружающей среды, источни-
ком большого количества загрязняющих веществ, в том числе
твердых частиц, углекислого газа, оксидов серы и оксидов азота,
и даже источником радиационного загрязнения.
В заключение дадим краткую химико-экологическую харак-
теристику теплоэнергетики Белгородской области. В области
действуют' две ТЭЦ: Белгород-
ская и Губкинская. В состав Бел-
городской ТЭЦ, находящейся в по-
роде Белгороде, входят две ко-
тельные- «Южная» и «Западная».
На станции и котельных исполь-
зуют два вида топлива: природ-
ный газ и мазут как резервный
вид топлива. В состав Губкин-
ской ТЭЦ, расположенной в го-
роде Губкине, входит одна ото-
пительная котельная «Журав-
лики». На станции в качестве
топлива применяют природный
газ и уголь, на котельной — при-
родный газ и мазут. В 1989 г. на
Губкинской ТЭЦ создана уста-
новка по очистке дымовых газов
от оксидов серы.
84
Сравнение видов топлива, применяемых на Белгородской и
Губкинской ТЭЦ, показывает, что экологически менее бдагопри-
ятна Губкинская ТЭЦ, так как она наряду с природным газом и
мазутом использует уголь. А уголь, согласно имеющимся данным,
экологически более опасное топливо, так как даст больше отхо-
дов, в том числе сернистого газа, дыма, золы и шлаков.
В докладе Госкомэкологии Белгородской области сообщает-
ся, что предприятиями топливно-энергетического комплекса
в 1999 г. выброшено в атмосферный воздух 1,7 тыс. т загрязняю-
щих веществ, что на 0.3 тыс. т, или на 14%, меньше, чем в преды-
дущем году. По сравнению с 1994 г загрязняющие выбросы со-
кратились на 0,9 тыс. т, или на 34%. На предприятиях электро-
энергетики улавливается и обезвреживается 98,5% твердых
загрязняющих веществ, газообразных — только 0,4%.
Белгородская ТЭЦ расположена на правом берегу' р. Север-
ский Донец (приток Дона) Градирни (охлаждающие башни) на
ТЭЦ отсутствуют. Отработанные теплые воды сбрасываются
в небольшой охлаждающий пруд имеющий непосредственный
выход в реку. Зона реки в пределах 1 км от тепловой электро
станции (вниз по течению) имеет температуру воды на 5—6 °C
ниже, чем в месте сброса теплых вод, что можно считать небла-
гоприятным фактором для миграции водных организмов, чув-
ствительных к таким перепадам температур.
Речная вода имеет практически нейтральную или слабоще-
лочную реакцию (pH 6,9—8) и в этом отношении нс представля-
ет опасности для водных организмов. Атмосферные осадки
в районе ТЭЦ имеют локальный кислотный характер (pH 5,3—
6,8), обусловленный в основном азотной кислотой, что свиде-
тельствует о выбросах кислотообразующих оксидов, преиму-
щественно N1OX (NO и NO,) Белгородская ТЭЦ практически не
Рис. 2.4. Белгородская ТЭЦ
(производственные помещения)
85
загрязняет атмосферу твердыми веществами Масса осаждаю-
щихся из воздуха твердых веществ в зоне ТЭЦ сое гавляет за месяц
3,0—4,5 г/м2, в то время как в загрязненных районах города она
составляет 21—30 г/м2 (район цементного завода и главная авто-
магистраль города — проспект Богдана Хмсльницого).
Вопросы и задания
1 Какие виды топлива находят более широкое применение н теплоэнергетике?
2. Чем обусловлено тепловое загрязнение окружающей среды при работе ТЭС и каконы
его экологические последствия? 3. Как избежать теплового загрязнения? Что такое гра-
дирни? 4. Какие газы поступают в атмосферу при сгорании топлива? Напишите уравне-
ния реакций их образования. S Объясните прнсугоние твердых частиц в отходящих
дымовых газах теплоэнергетики 6. Что представляют собой твердые отходы углеобога-
щения, шлаки и золы? Как они влияют на экологическое состояние окружающей сре-
ды? 7. Почему ТЭС могут быть источником радиационного загрязнения биосферы?
Задача
Сколько тонн сернистого газа, являющегося одним из основных загрязнителей ат-
мосферы. образуется при сгорании на ТЭС 1 млн т угля, содержащего 2.5% S?
2.4.2. Автотранспорт
Наряду со стационарными источниками вредных выбросов
в атмосферу (тепловые электростанции, заводские котельные
и т. д.) в крупных городах в загрязнении воздуха возрастает роль
автотранспорта, на долю которого в некоторых юродах прихо-
дится до 75% всею объема выбросов.
Рис. 2.5. Автомагистраль (г. Москва)
86
В отличие от стационарных систем в двигателях внутреннего
сгорания продолжительность горения значительно меньше (до-
ли секунды). При этом холодные стенки камеры сгорания в ав-
томобиле не дают возможности топливу сгорать полностью.
В результате образуются и выбрасываются в атмосферу продук-
ты неполного сгорания, увеличивая количество углеводородов и
угарного газа (табл. 2.3).
Таблица 2.3
Сраппительная оценка выбросов продуктов сгорания
стационарными источниками и автотранспортом (млн т/год)
Продукты сгорания Источник продуктов сгорания
автомобили ТЭС, заводы и т. д.
Оксид углерода(П) 59,7 5,2
Углеводороды и другие 10,9 6.4
органические вещества Оксиды азота 5,5 6,5
Серосодержащие соединения 1,0 22,4
Макрочастицы 1,0 9,8
Топливо для двигателей внутреннего сгорания (бензин, ди-
зельное топливо) состоит в основном из углеводородов пара-
финов, циклопарафинов, ароматических. Бензин представляет
собой смесь углеводородов разного строения фракций С4—С12
(~300 соединений). Дизельное топливо состоит из углеводоро-
дов с более высокой молекулярной массой. При полном сгора-
нии топлива образуются углекислый газ, вода, выделяется теп-
лота. Например, для октана реакция горения имеет вид
2C5Hif + 250,—► 16СО. + 18Н2О + Q. (2.11)
Двигатель внутреннего сгорания представляет собой пульси-
рующий химический реактор, предназначегшыи для преобразо-
вания тепловой энергии химической реакции в механическую.
Отработанные газы автомобильных двигателей содержат более
200 веществ, большинство из которых токсичны Основными
компонентами выхлопных газов автомобилей являются N2, О2,
Н2О, СО . СО, оксиды серы (преимущественно SO2), оксиды азо-
та*(NO, N02), углеводороды, альдегиды, сажа, бенз[а]пирсн.
На долю автотранспорта приходится 70—90% пудового вы-
броса в атмосферу СО, 40—45% оксидов азота и 30—40% углево-
дородов. Химический состав выхлопных газов зависит от типа
двигателя, режима его работы и качества используемого топли-
ва. Например, в выбросах карбюраторного двигателя содержи т-
ся больше оксида углерода и несгорсвших углеводородов, одна-
ко меньше оксидов азота и сажи, чем в выбросах дизельного дви-
гателя. Выхлопы дизельного двигателя имеют характерные дым
87
и запах. Неприя тный запах, сопровождающий работу двигателя
этого типа, обусловлен наличием оксидов азота и окисленных
органических соединений.
Характер вождения автомобиля также влияет на состав вы-
хлопов. Наихудший режим по выбросу оксида азота соответс тву-
ет повышенной и средней скорости, в то время как холостой ход
и снижение скорости приводят к высоким выбросам углеводо-
родов и оксида углерода. Количество SO, в выхлопных газах за-
висит от содержания серы в топливе
Полициклические ароматические углеводороды, входящие
в состав газов автомобильных выхлопов, обладают канцероген-
ными свойствами, поэтому необходим строгий контроль за их
содержанием. К ним относится бенз[а]пирсн, структурная фор-
мула которого приведена в разд. 1.4 (см. с. 32). Образование
подобных углеводородов нс связано непосредственно с содержа-
нием ароматических углеводородов в горючем. Большее влия-
ние на количество этих углеводородов в выхлопных газах оказы-
вает не вид горючего, а характеристика двигателя, потребление
торючего и режим работы. Считают, что выбросы дизельного
топлива содержат больше канцерогенных всшсств.
Роль автомобильного транспорта в загрязнении атмосферы
обусловлена не только абсолютной массой выбросов. Большое
значение имеет то, что выхлопные газы поступают непосред-
ственно в приземный слой атмосферы, где скорость ветра незна-
чительна и газы плохо рассеиваются в отличие от выбросов
предприятий через высокие заводские трубы. Кроме того, ос-
новную массу выхлопа составляют тяжелые газы, что также пре-
пятствует их рассеиванию.
С начала 1930-х гт. к большинству бензинов стали добавлять
тетраэтилсвинец РЬ(С,Н5)4 или тетраметилсвинсц РЬ(С113)4. Эти
добавки увеличивают октановое число и действуют в качестве
антидетонатора, т. е. предотвращают взрывное сгорание бензи-
на. Октановое число служит количественной характеристикой
детонационной стойкости бензина (см. подробнее в учебнике
органической химии для 10 класса). В 1921 г. была обнаружена
способность тетраэтилсвинца подавлять детонацию бензина и
повышать мощность и экономичность двигателей внутреннего
сгорания. Тетраэтилсвинец РЬ(С2Н5)4 представляет собой бес-
цветную летучую, очень ядовитую жидкость На 1 л бензина до-
бавляется 0.8 см3, или 0,6—0,9 г, этого вещества. До 75% свинца,
содержащегося в бензине, выделяется в воздух с выхлопными
газами автомобилей. Потребление РЬ(С,Н5)4 быстро росло, авто-
мобильные, авиационные и судовые двигатели выбрасывали
токсичный свинец в атмосферу вес в больших количествах. По-
скольку в антидстонаиионной жидкости содержится и дибром-
мстан, после сгорания топлива свинец может находиться в возлу-
88
хс в виде твердых и газообразных бромистых соединений. На
70—80% автомобильный свинец представлен частицами диамет-
ром меньше 1 мкм Эти частицы образуют аэрозоли.
При сгорании 1 л горючего в воздух попадает от 200 до 500 мг
свинца. В течение года автомобиль может выбрасывать около
1 кг этого металла. С увеличением числа автомобилей опасность
свинцового загрязнения атмосферы возрастает. При содержа-
нии I г свинца в 2 л бензина и при плотности движения 1000 ав-
томашин в час на каждом километре дороги с выхлопами еже-
часно выносится 30—40 г свинца.
Загрязнение атмосферы города свинцом происходит в основ-
ном (на 90%) от выхлопных газов автомобилей. Воздух некото-
рых городов содержит в 20 раз больше свинца, чем воздух в сель-
ской местности, и и 2000 раз больше, чем над открытым морем
Твердые частицы выхлопов, содержащие свинец, в зависимо-
сти от размера либо оседают в непосредственной близости от
магистрали, либо захватываются воздушными массами и затем
выпадают с атмосферными осадками. Установлено, что время
пребывания мелких частиц соединений свинца в атмосфере со-
ставляет 1—4 недели. Соединения свинца оседают преимущест-
венно па почву и растительность, а затем включаются в пищевые
цепи животных и человека. Свинец — кумулятивный яд (от лат.
cumulattio — скопление), он постепенно накапливается в организме
человека, поскольку скорость его естественного выведения
очень низка. Аккумуляция свинца растениями зависит от их ви-
довых особенностей.
Многие исследователи стран Западной Европы, Америки,
Японии, Австралии, России находили свинец вблизи дорог
в значительных количествах. Например, японские ученые обна-
ружили, что вдоль автомагистралей их страны тянутся полосы
почвы, зараженной свинцом. Содержание металла у дороги со-
ставляло в среднем 19 мг на 1 кг почвы, а на расстоянии 20 м и
дальше — 3 мг/кг. В одном месте рядом с шоссе было обнаруже-
но очень большое количество свинца — 109 мг/кг. В придорож-
ной растительности содержание этого металла также было повы-
шено. Ученые Германии установили, что трава около шоссе со-
держит от 35 до 50 мг свинца в 1 кг сухой массы, в то время как
в чистой траве, удаленной от дорог, — 2—3 мг.
Повышенное содержание свинца в овощах и фруктах, выра-
щенных вблизи автострад, а также в молоке коров, которым
скармливалась загрязненная трава, представляет опасность для
здоровья человека. Однако главная опасность — это свинец, рас-
сеянный в воздухе. В 1 м’ воздуха городов Западной Европы со-
держится в среднем 1—3 (до 10) мкг, в США — 5 мкг свинца. Со-
единения этого металла через легкие поступают в кровь челове-
ка В 100 см’ крови обычно содержится If —35 мкг свинца Под
89
влиянием загрязненного воздуха содержание этого металла в кро-
ви поднимается до 80 мкг и выше этого верхнего порога концен-
трации. Считают, что явные признаки свинцового отравления —
анемия, постоянные головные боли, мышечная боль — появля-
ются при указанной концентрации, иными словами, при содер-
жании свинца в крови 0,8 млн-1 (0,8 ppm).
Приближение концентрации свинца в атмосфере к опасной
черте заставило многие страны пойти на уменьшение содержа-
ния тетраэтилсвинца в бензине. В США в 1974 г. было решено
постепенно прекратить добавление соединений свинца в бен-
зин. Другой причиной такого решения было отравление свин-
цом каталитических преобразователей, применяемых для дожи-
гания углеводородов и монооксида углерода, оставшихся в вы-
хлопных газах.
Каталитические преобразователи окисляют несгоревшие угле-
водороды до углекислого газа и воды и преобразуют оксиды азо-
та в газообразный азот. Однако несколько меньшая цена этили-
рованного бензина (с добавлением тетраэтилсвинца) привлекает
покупателей. Чтобы предупредить незаконные заправки и выход
из строя каталитических преобразователей, в США в 1986 г.
было установлено максимально допустимое содержание свинца
в горючем в количестве 0,006 г/л. По мнению специалистов, это-
го количества свинца достаточно для обеспечения нормальной
работы автомобильного двигателя
В настоящее время в некоторых странах (Японии и др.) ис-
пользование этилированного бензина запрещено. В Москве и
ряде других городов России применение этилированного бензи-
на также запрещено. Добавки соединений свинца сейчас уже нс
столь необходимы. Небольшое удорожание процесса перегонки
позволяет получить горючее с нужными антидетонапионными
свойствами, так что добавление соединений свинца в бензин
становится необязательным Для дальнейшего снижения выбро-
сов вредных веществ от автотранспорта в атмосферу необходимо
продолжить работу по установке каталитических преобразовате-
лей, называемых также каталитическими нейтрализаторами.
Дадим оценку загрязнения атмосферы автомобильным транс-
портом в Белгородской области. В 1998 г. доля выбросов загряз-
няющих веществ от автотранспорта в целом по области состав-
ляла 71,0%, в 1999 г. — 74,5%, для Белгорода эти показатели со-
ответственно были 65% и 83,2%. Автомобильный парк в облает
продолжает расти. По состоянию на 1 января 2000 г. автопарк Бел-
городской области насчитывал около 330 тыс. ед. различных ви-
дов автотранспорта (легковых, грузовых автомобилей, автобу-
сов, мотоциклов и г. н.). Принимаются меры по защите атмо-
сферного воздуха от выхлопов автотранспорта. Так, в 1996 г.
областной думой принят закон «Об охране атмосферного возду-
90
ха от загрязнения выбросами двигателей автомобильного транс-
порта на территории Белгородской области». В 1998 г. но ласть
поступал только неэтилированный бензин, т. с. не содержащий
тетраэтилсвинца.
В целях усиления контроля и исполнения вышеуказанного
закона в г. Белгороде в 1999 г. создано и работает государствен-
ное унитарное предприятие «Эко-автоцентр» с филиалами по
Белгородской области. Его функции состоят в проведении конт-
рольно-диагностических работ, выдаче «талонов токсичности»
и «карточек дымности», подтверждающих соответствие норма-
тивам выбросов вредных веществ транспортом.
Вопросы и задания
1. Дайте сравнительную оценку продуктов сгорания стационарных источников и
актспрансиорта. 2. Назовите основные вещества, содержащиеся в выхлопных iajax
автомобилей. 3. От каких <|>актор<>в зависит химический состав выхлопных газов? Оха-
рактеризуйте различие выбросов карбюраторного и дизельного двигателей. 4. Когда и
с какой целью стали добавлять в бензин тетраэтилсвинец? 5. Приведите примеры, ха-
рактеризующие загрязнение воздуха, почвы и растений свинцом от выхлопных газов
автомобилей. 6. При какой концентрации свинца в крови наблюдаются явные Призна-
ки свинцового отравления? 7. К кие меры принимают для уменьшения загрязнения ат-
мосферы автомобильными выхлопами?
Задачи
I. Какое коли* сс во свинца попадет в окружающую среду' с выхлопными газами ав-
томобиля при сгорании 6 л бензина, содержащего 0,6 г/л тетраэтилсвинца, считая, что
75% свинца выделяется в воздух с выхлопными газами? 2. Вычислите массу свинца в 5 л
крови гсловска при достижении пороговой концентрации этого металла. Пеобхо. имыс
справочные данные см. в тексте.
2.4.3. Горно-добывающая
и металлургическая промышленность
Горно-добывающая (горная) промышленность — это комплекс
отраслей по добыче и первичной переработке полезных иско-
паемых. Выделяют следующие основные группы юрной про-
мышленности: топливную, рудодобывающую, промышленность
неметаллических ископаемых и горно-химическую
Металлургическая промышленность (металлургия) охватыва-
ет подготовку и обогащение добытых руд, процесс получения
металлов из подготовленного сырья, очистку (рафинирование)
металлов, производство металлических сплавов и прокатку.
В со тветствии с подразделением металлов и исходных руд
различают металлургию черных металлов (железо и его сплавы
с углеродом и другими элементами, т. е. сталь, чугун, ферроспла-
вы) и цветных (все остальные металлы и их сплавы).
91
Черная и цветная металлургия и горно-добывающая про-
мышленность являются интенсивными источниками загрязне-
ния атмосферы отходящими газами и твердыми выбросами
Среди всех отраслей промышленности России по выбросам
вредных веществ в атмосферу цветная металлургия занимает
второе, а черная металлургия — третье место. По сбросу загряз-
ненных сточных вод черная металлургия находится на четвертом
месте, а цветная — на седьмом. По количеству образующихся
токсичных отходов на первом месте стоит цветная металлургия,
на втором — черная, которая лидирует по объему используемых
токсичных отходов производства.
В черной металлургии в 2000 г. выбросы вредных вещес тв в ат-
мосферу в целом составили 2396 тыс. т( 108,8% к уровню 1999 г.),
в том числе (тыс. т) твердых веществ — 357,6, диоксида серы —
234,7, монооксида углерода — 1635, монооксида азота — 148,3.
Сброс загрязненных сточных вод в поверхностные водоемы по
сравнению с 1999 г. вырос на 8,2% и достиг 761,1 млн м3 В отрас-
ли за год образовалось 31 941,7 тыс. т токсичных отходов, из ко-
торых использовано и полностью обезврежено 22 480,1 тыс. т.
В основе производства черных металлов лежат реакции вос-
становления природных оксидов железа (магнитного железняка
Fe,O4, красного железняка Рс2О3, бурого железняка Fe2O3 Н2О)
мопооксидом углерода (СО) и углем (коксом).
При сгорании кокса образуется диоксид углерода (углекис-
лый газ):
С + о, = СО,,
который, проходя через раскаленный кокс, превращается в мо-
нооксид углерода:
СО2 + с = 2СО.
Монооксид углерода постепенно восстанавливает руду. Реакция
идет в несколько стадий при разной температуре (см. подробнее
в учебниках неорганической химии и в специальной литературе
по производству чугуна и стали):
FcjO4 + СО = 3FeO + СО2; (2.12)
FcO + СО = Fe + СО? (2.13)
В восстановлении оксидов железа участвует и углерод кокса:
FcO + С = Fc + СО. (2.14)
Добыча и обработка руды сопровождаются загрязнением воз-
духа. При подготовке сырья, за^узке руды и кокса в доменную
печь образуется большое количество пыли Сам доменный про-
цесс также является источником загрязнения воздуха из-за содер-
жания токсичного оксида углерода(Ц) в отходящем колошниковом
газе. Отходящие газы представляют собой ценное топливо, кото-
92
рое очищают и используют на металлургических комбинатах, но
из-за большого объема устаревших основных фондов металлур-
гия продолжает загрязнять окружающую среду.
В процессе получения стали в конвертерах для поддержания
реакции используется чистый кислород. Этот процесс сопро-
вождается интенсивным выделением дымовых газов, которые не-
обходимо очишать перед выбросом в атмосферу. Конвертерные
газы, как и доменный колошниковый газ, отличаются высоким
содержанием монооксида углерода, который на большинстве
современных заводов утилизируется. Железные руды содержат
соединения серы, поэтому в отходящих газах предприятий чер-
ной металлургии содержится сернистый газ, хотя имеется опыт
очистки отходящих газов от SO2.
При загрузке коксовых печей также возможно загрязнение
воздуха. В данном производстве это пыль, выделения пара и
мелких частиц охлаждаемого кокса. Кроме того, в воздух выде-
ляются газы, которые могуг содержать сульфиды, меркаптаны1 и
другие химические вещества с неприятным запахом. Общая
формула меркаптанов R—S—Н, где R — углеводородный ра-
дикал.
Любое металлургическое производство, как правило, являет-
ся тем промышленным центром, вокруг которого вырастают
крупные населенные пункты с высокой плотностью населения.
Проблема атмосферного загрязнения в таких местностях всегда
неизбежна, экологическая вредност ь предприятий металлургии,
как правило, усугубляется большим объемом производства. До-
менное производство, коксохимический и агломерационный
процесс наносят существенный ущерб окружающей среде. Чер-
ная металлургия по степени негативного воздействия на био-
сферу разделяет ведущее место с теплоэнергетикой. Однако
выбросы металлургических предприятий имеют высокую темпе-
ратуру (300—400 °C, а иногда до 800 °C) и могут быть использова-
ны как теплоносители.
Загрязнение воздуха от предприятий черной металлургии в за-
висимости от силы ветра может распространяться на расстояние
15—25 км. Дополнительными источниками загрязнения атмо-
сферы служат рудные дворы, бункерные эстакады, узлы агломе-
рационного производства и переработки шлаков. Например,
выброс SO2 в агломерационном процессе составляет около 190 г
на 1 т руды, а в отходящих газах мартеновских печей, работаю-
щих на кислородном дутье, содержится до 60 кг СО и до 3 кг SO2
в расчете на 1 т готовой продукции.
1 Меркаптаны — часто употребляемое в экологической литературе назва-
ние класса веществ, имеющих обшсс название «тиолы» — сернистые аналоги
спиртов.
93
Рис. 2.6. Медные слитки
(ОАО «Уралэлектромедь»)
В цветной металлургии глав-
ную опасность представляют вы-
бросы соединений высокоток-
сичных металлов, таких как медь,
свинец, ртуть, кадмий, цинк, а
также большое количество об-
жиговых газов, содержащих со-
единения серы (преимущест-
венно SO2), фтор и его произ-
водные.
В табл. 2.4 представлены дан-
ные о выбросе некоторых метал-
лов в цветной металлургии.
Таблица 2.4
Выброс химических элементов в атмосфер}
при производстве цветных металлов, кг/т металла
Элемент Про известно
медмо-никелевое шшко-кадмиевое свинцовое
Мышьяк 3,0 0,591 0,363
Кадмий 0,2 0,5 0,005
Медь 2,5 0,14 0,072
Ртуть 0,042 0,002
Никель 9.0 — 0,085
Свинец 3,09 2,54 G,36
Цинк 0,845 15,72 0,11
Наиболее опасны из этих элементов мышьяк и ртуть, мышья-
ка содержится больше в выбросах модно-никелевого производ-
ства, а ртути — в выбросах цинко-кадмиевого производства.
Обжиг и переработка сульфидных руд мели, свинца и цинка
сопряжены с интенсивными поступлениями SO2 в атмосферу.
Цветная металлургия — это второй после теплоэнергетики за-
грязнитель биосферы сернистым газом
Важнейшими минералами, входящими в состав медных руд,
являются халькозин, или медный блеск, Cu2S; халькопирит, или
медный колчедан, CuFeS2, малахит (CllOH)2CO3. Процесс полу-
чения меди из медного блеска упрощенно можно описать сле-
дующими уравнениями:
2Ci>,S + 30, = 2Cu,0 + 2SOjT; (2.15)
2Cu,O + Cu,S = 6Cu + SO,T. (2 16)
В процессе выплавки меди концентрация SO2 в отходящих га-
зах составляет па разных стадиях 2—8%. И меются производства,
на которых в выбросах газов в атмосферу содержится около 4—
94
10% SO2, т. e количество, достаточное для организации произ-
водства серной кислоты.
Свинец и цинк чаще всего получают из сульфидных минера-
лов галенита (PbS) и цинковой обманки (ZnS), которые обычно
в природном сырье присутствуют вместе Отходящие газы этого
производства содержат до 6% SO2, их используют, когда это воз-
можно, для производства серной кислоты. В этом случае главной
проблемой является содержание в газах, выходящих из обжиго-
вых печей, оксида мышьяка (As2O3), хлороводорода, фтороводо-
рода и других примесей, относящихся к каталитическим ядам.
Они мешают протеканию стадии каталитического окисления
в производстве серной кислоты:
катализатор
2SO2 - О.. * 2SO,,
их необходимо удалять из газового потока вместе с примесями
твердых частиц.
С производством цветных металлов и сплавов, а также с галь-
ваническим производством связаны возможные поступления
в окружающую среду таких элемен гов, как Se, As, Sb, Си, Ag, Sr,
Zn Cd, Hg, Al, Sn, Pb, Bi, Mo, W, Ni.
Твердыми отходами черной и цветной металлургии являются
шлаки, которые в виде пыли из отвалов попадают в атмосферу,
особенно в ветреную погоду. Наряду с основными компонента-
ми металлургических шлаков, в числе которых SiO2, CaQ А1,О;,
MgQ Fe2O3, FeO, MnQ SO, (табл. 2.5), шлаки содержат также
тяжелые металлы, мышьяк, сурьму и другие примеси.
Таблица 2.5
Химический состав металлургических шлаков,
среднее содержание (no Н С. Торочсшникову)
Вид шлака Основные компоненты, %
SiO; AI.O, СаО MgO Ге,О, ЬеО МпО SO,
Доменный 38 9,5 42 5 3,5 0,5 0,9 1.6 2,3
Мартеновский 23,5 4 39 11,5 3 8,5 7,5 0,4
Цветной металлургии 37,5 8 17 4,5 1,5 27.5 0,25 1,25
Производство чугуна и стали в нашей стране ежегодно сопро-
вождается образованием более 70 млн т металлургических шла-
ков, из которых используется только половина.
Выплавка цветных металлов в мире значительно меньше, чем
черных, однако выход шлаков на 1 т цветного металла больше,
чем на 1 т черного металла. В отвальных шлаках цветной метал-
лургии зачастую содержание ценных компонентов оказывается
выше, чем в добываемых природных рудах. Так, по некоторым
оценкам в отвалах шлаков на медеплавильных заводах содер-
95
жится более 27 млн т Fe, 335 тыс. т Си и 2 млн т Zn В шлаковых
отвалах свинцовых заводов содержится до 3 млн т Fc, более
900 тыс. т Zn, 150 тыс т ВЬ, 70 тыс. т Си. Подобные шлаки необ-
ходимо перерабатывать с целью извлечения ценных металлов.
При этом одновременно можно решать и экономические, и эко-
логические задачи, предотвращая загрязнение окружающей
среды тяжелыми металлами.
Рассмотрим некоторые нуги решения экологических проблем
в металлургии. Основное направление экологизации металлур-
гического и многих других производств — комплексное исполь-
зование природного сырья, совершенствование технологии, со-
здание малоотходных и безотходных производств.
• Одним из примеров таких процессов в черной металлургии
может служить бескоксовый, бездоменный метод получения железа
непосредственным восстановлением железорудных концент-
ратов водородом или конвертированным природным газом Из
технологической цепи устраняются стадии, ответственные за за-
грязнение окружающей среды: доменный передел, производство
кокса и агломерата. Эго позволяет практически полностью ис-
ключить вредные выбросы в атмосферу, уменьшить потребность
в воде, сократить количество образующихся сточных вод.
По этой схеме мелкораздробленный железный концентрат, сме-
шанный с водой, перекачивают с месторождения па металлурги-
ческий завод по 1рубам в виде пульпы с помощью насосов. Вода
после отделения в специальных отстойниках возвращается в водо-
оборот. Во вращающихся барабанах руду смешивают со склеиваю-
щими (связующими) веществами и получают гранулированный
продукт — окатыши. При 1рануляции в окатыши добавляют очень
небольшое количество извести. Окатыши поступаю! в шахтную
печь, где происходи г восстановление оксидов железа. Процесс осу-
шест нлястся при 1 000— 1100 ‘С, в результате i юлучают губчатое же-
лезо, содержащее до 85% Fe. Данный продукт направляют на элек-
тродуговой переплав для получения высококачественной стали
Такая технология производства стали обеспечивает резкое сниже-
ние выбросов SO,, пыли и других вредных веществ Шлаки и другие
твердые О1Х0ДЫ практически не образуются.
Предприятием с такой технологией является ОАО «Осколь-
ский электрометаллургический комбинат» (ОАО «ОЭМК»), на-
ходящийся в Белгородской области (г. Старый Оскол).
• В производстве стали технологически целесообразно при-
менение электропечей и конвертеров, которые к тому же экологи-
чески более чистые, чем мартеновские печи. При этом удельные
выбросы пыли снижаются в 8 раз, оксидов азота — в 10 раз.
Использование топливно-кислородной продувки конвертеров
уменьшает вынос пыли в 10—12 раз по сравнению с верхней кис-
лородной продувкой.
96
• Использование плазменных процессов в производстве стали.
В металлургическом плавильном агрегате и зону высокотемпе-
ратурной электрической дуги вдувают инертный газ (обычно ар-
гон), который, нагреваясь до температуры 30 000 К, образует
поток плазмы — нагретого до высокой температуры частично
ионизированного газа. Осуществление металлургических про-
цессов при столь высоких температурах позволяет получать ме-
таллы высокого качества практически без отходов
Лаборатория плазменной металлургии была создана в 1962 г.
в Институте металлур! ии и материаловедения (в настоящее вре-
мя это ИМЕТ им. А" А. Байкова РАН). Ес первым руководителем
был Н Н Рыкалип, потом Ю. В Цветков. Были изучены усло-
вия генерации низкотемпературной плазмы, разработаны осно-
вы процессов получения и образования неорганических мате-
риалов с применением низкотемпературной плазмы.
Плазменная металлур!ия — сравнительно новое, развиваю-
щееся научно-техническое направление. Плазменные процессы
в составе энергометаллургического комплекса (ЭМК) — это ме-
таллургия будущего. Согласно развиваемой концепции ради-
кальное решение технологических, экологических и энергети-
ческих проблем должно обеспечить объединение производства
электроэнергии и химико-металлургических производств в рам-
ках единого энерготсхнологического комплекса.
Термическая плазма может быть применена как на стадии по-
лучения высококачественного синтез-газа, так и в собственно
металлургическом производстве. Синтез-газ, получаемый гази-
фикацией низкосортного топлива и биомассы, используют для
производства электрической и тепловой энергии, а также в каче-
стве восстановителя в металлургическом производстве. При ис-
пользовании плазменных источников тепл ты температуру ра-
бочей среды можно изменять от 3000 до 25 000 С Плазменно-
дуговые аппараты (плазмотроны) используют для нагрева
металлошихты, рудного сырья, переплавления заготовок, при
резке и термической обработке металлоизделий. Плазмоструй-
ные плазмотроны применяют для приготовления восстанови-
тельных газов, нанесения покрытий, получения металлических
порошков.
• Использование твердых отходов черной металлургии Ос-
новными отходами черной металлургии являются вскрышные
породы, образуемые при добыче железной руды, доменные и
сталеплавильные шлаки. Важно найти применение нерудным
породам железорудных месторождений. Это актуально, в част-
ности, дня Белгородской области, где открытым способом ве-
дется добыча железной руды в районе крупнейшего месторож-
дения — Курской магнитной аномалии (КМА). Вместе с желез-
ной рудой добывается много нерудных попутных пород. Их
97
можно использовать и уже используют для производства стро-
ительных материалов (цемента, извести, щебня и др.). Напри-
мер, вскрышные сланцы и глины используют для производства
керамзита; отсев дроблении сланцев и «хвосты» мокрой магнит-
ной сепарации горно-обогатительных комбинатов (ГОКов) —
для производства силикатного кирпича (при этом снижается
расход извести и песка).
Шлаки и золы — побочные продукты черной и цветной ме-
таллургии — хорошее сырье для производства стройматериалов.
Их используют в качестве добавок при производстве цемента,
бетона, дорожных плит, золошлакового щебня, вяжущих мате-
риалов (гипсовых и известковых) и т. д.
• Переработка шлаков цветной металлургии с целью полу-
чении из них ценных металлов и других полезных продуктов.
Примером может служить восстановление шлаковых расплавов
в электропечах смесью кокса и известняка, которое идет в соот-
ветствии со схемой
2(МсО • SiO,) + 2СаС0, + С —► 2Ме + ЗСО, + 2(СаО SiOJ. (2.17)
Образующийся силикат кальция CaSiO3 — прекрасное сыр!>е
дли производства строительных материалов. По этой технологии
работают заводы, например, по переработке медных шлаков ста-
рых отвалов. После извлечении цветных металлов целесообраз-
но перерабатывать шлаки в песок и щебень, которые можно ис-
пользовать в строительстве дорог и др.
• Комплексное использование руд. Большинство металличе-
ских руд имеет сложный состав. Например, при производстве
титана на основе ильменита FeTiO, последний спекают с кок-
сом, в результате чего образуются чугун Fe(C), TiO2, СО2:
2FeTiO, + ЗС —> 2Fc(C) + 21iO2 + СО,. (2.18)
Далее процесс продолжается в соответствии со следующей схемой:
TiO, + С + 2С12 —> "ПО* + СО2; (2.19)
TiCl4 + 2Mg —*• 2MgClj + Ti (2.20)
Образующийся MgCl2 подвергают электролизу, при этом по-
лучаются Mg и С12, которые возвращают в производство:
МёС12эдс^Т0К>Ме + С12.
Таким образом из ильменита получают титан, образующийся
низкосортный чугун реализуют в виде скрапа.
Другим примером комплексного использования руды и со-
здания безотходной технологии является получение из пирита
(FeS2) серной кислоты (уравнения реакций приведены в учебни-
ках по неорганической химии). Пирит наряду с FcS2 содержит
примеси соединений цветных металлов — меди, цинка, свинца
98
и др При организации безотходного производства эти металлы
удастся выделить. Образующийся при обжиге пирита Ге2О3,
можно использовать в производстве красок и цемента.
• Замена в цветной металлургии пирометаллургических про-
цессов гидрометаллургическими. Следует пояснить, что если в со-
ответствии с подразделением металлов и исходных руд различа-
ют металлургию черных и цветных металлов, то в зависимости си-
вида энергии, используемой при основных процессах, различа-
ют пирометаллургию и гидрометаллургию. В пирометаллургии
металлы и сплавы получают и рафинируют при сжигании топли-
ва, в процессе экзотермических реакций, электроплавки, элект-
ролиза расплавов, термической диссоциации или дистилляции
(восстановление металлов в газообразном состоянии с последу-
ющей конденсацией) и др. В гидрометаллургии металлы получа-
ют из руд путем выщелачивания и выделения из водных раство-
ров без нагрева до высокой температуры. Главным экологиче-
ским преимуществом гидрометаллургических процессов является
отсутствие токсичных газовых выбросов в атмосферу Они ос-
нованы на сорбции (поглощении) и экстракции (извлечении).
Методы сорбционной технологии используются в производстве
металлов — U, Au, Ni, Со, Си, Мц W и др., экстракционная тех-
нология — для переработки концентратов Си—Zn, Си—Ni, раз-
деления Со и Ni, получения золота высокой чистоты и т. д. При-
менение этих методов способствует созданию безотходной тех-
нологии при высоком экономическом эффекте.
• Повышение радиационной безопасности на предприятиях ме-
таллургического комплекса. Это направление разработано в соот-
ветствии с «Комплексом мер по развитию металлургической про-
мышленности Российской Федерации на период до 2010 года»,
одобренного распоряжением Правительства РФ № 1228р от
05.09.2002 г В металлургической промышленности концентри-
руется значительное количество радиоактивных веществ: добы-
вается и перерабатывается сырье с повышенным содержанием
радионуклидов, функционируют десятки тысяч радиоизотоп-
ных приборов и устройств, переплавляются десятки миллионов
Тонн металлолома, поступающего из разных отраслей народного
хозяйства, в том числе с предприятий атомной промышленно-
сти, оборонного и нефтегазового комплексов. За последнее де-
сятилетие XX в. (1991—2000) число радиационных инцидентов
на металлурги чески х предприятиях превысило 300. В шлаках,
металле, металлоотходах могут быть такие радионуклиды, как
U-235, U-238, Pu-239, Sr-90, Сс-144, Со-60, Ni-бЗ, Мп-54, Ag-110,
Fe-55 Zn-65, Cs-134, Cs-137.
C 2001 г. головной организацией по радиационной безопас-
ности металлургического производства и представителем Мин-
промнауки в международных организациях по этим вопросам
99
является Центральный научно-исследовательский институт чер-
ной металлургии им. И. П. Бардина (ЦНИИчсрметим. И. П. Бар-
дина). Уровень выпускаемой в институте аппаратуры радиаци-
онного контроля — один из самых высоких в мире, и она эффек-
тивно используется как на отечественных, так и на зарубежных
металлолерсрабатываюших и металлургических заводах.
• Устранение или снижение выбросов в атмосферу сернистого
газа. На долю цветной металлургии приходится 20% общего
объема выбросов SO2. Образующийся сернистый газ можно улав-
ливать и использоват ь для производства серной кислоты. Так, на-
пример, если при получении 1 т меди улавливать весь сернистый
газ, то можно получить примерно 10 т серной кислоты.
Богата железной рудой Белгородская область. Добыча руды
является основой развивающейся горно-добывающией и метал-
лургической промышленности края. По данным за последние
годы от предприятий черной металлургии в атмосферу в течение
1999 г. поступило 48,4 тыс. т загрязняющих веществ, т. с. по
сравнению с 1994 г. выбросы возросли на 3,2 тыс. т, или на 7,2%.
Выбросы предприятий металлургического комплекса и горно-
добывающей промышленности составляют 56,3% от общих вы-
бросов по области. Самыми крупными зафязнителями воздуха
являются ОАО «Оскольский электрометаллургический комби-
ната, ОАО «Лебединский горно-обогатительный комбинат» и
ОАО «Стойленский горно-обогатительный комбинат». Очисти-
тельными сооружениями предприятий металлургической игор-
но-добывающей промышленности улавливаются и обезврежи-
ваются на 90% твердые вещества, тогда как газообразные выбро-
сы очистке практически пс подвергаются.
Рассмотрим более подробно добычу и переработку железной
руды на Стойленском и Лебединском горно-обогатительных
комбинатах и выплавку стали на Оскольском электрометаллур-
гическом комбинате.
Стойленское месторождение богатых железных руд и желе-
зистых кварцитов, открытое в 1931 г., расположено в центральной
части северо-восточной полосы Курской магнитной аномалии. ОАО
«Стойленский горно-обогатительный комбинат» возник и развива-
ется на сырьевой базе этого месторождения. Строительство желе-
зорудного карьера началось в 1961 г., в 1968 г. сдан в эксплуата-
цию карьер по добыче богатой руды мощностью 2 млн т в год,
bi юследствии доведенной до 4,6 млн т в год. В 1976 г. начато стро-
ительство Стойленского ГОКа по добыче и обогащению бедных
железных руд (железистых кварцитов). Запасы их в контуре карь-
ера до отметки 250 м составляют 2 млрд-334 млн т. При отработке
этих запасов карьер будет иметь размеры 4200 х 3000 м по низу,
наибольшая глубина состави т 470 м. Объем вскрышных пород
при этом составит 1 млрд 300 млн м5. В 1983 г. введен в эксплуа-
100
тацию первый комплекс по производству 1,7 млн т в год железо-
рудного концентрата. В 1999 г. комбинат произвел более 9 млн т
железорудного концентрата. В 2000—2001 гг. планировалось до-
вести объем производства концентрата до 10 млн т в год. Увели-
чивая объемы производства, ОАО «Стойленский ГОК» решает и
экологические задачи. Вводятся в строй производства ко пере-
работке вскрышных пород. На предприятиях ГОКа производят-
ся строительный щебень, сыромолотый мел, керамзитовый гра-
вий и керамзитовый песок, тонкодисперспый мел, железобетон-
ные плиты для перекрытий, фундаментные блоки и товарный
бетон
Кратко рассмотрим технологию производства железорудного
концентрата из железной руды. Схематически это выглядит так.
1 Проводят вскрышные работы, чтобы удалить верхние оса-
дочные породы и обнажить залежи руды. Далее проводят взрыв-
ные работы, т. е. руду в карьере подрывают.
2. Измельчают руду последовательно в мельницах крупного,
среднего и, наконец, мелкого дробления.
3. Окончательную обработку руды — измельчение до порош-
кообразного состояния и обогащение — ведут в мельницах обо-
гатительной фабрики Для обогащения используются магнит-
ные свойства железа: богатые железом частицы улавливаются
магнитами, а легкая пустая порода смывается водой.
Аналогично процесс осуществляется и на ОАО «Лебединский
горно-обогатительный комбинат (ОАО «ЛГОК»), который стоит
в ряду самых крупных и известных горно-добывающих пред-
приятий мира. Его продукция — железорудные концентрат и ока-
тыши ~ служит сырьем для производства лучших сортов проката
и для получения стали на многих ведущих сталеплавильных пред-
приятиях России СНГ, Восточной Европы и Ближнего Востока.
Ежегодно ОАО «ЛГОК» перерабатывает 45,5 млн т сырой руды,
производит 18,5 млн т железорудного концентрата и 8,9 млн т ока-
тышей. На ГОКе получают концентрат высокого качества, при-
годный для производства металлизованных брикетов и окаты-
шей. Отличительная особенность технологии переработки желе-
зистых кварцитов на комбинате состоит в использовании метода
полного самоизмельчения руды, позволяющего исключить опе-
рации традиционного среднего и мелкого дробления. Конечный
размер измельченного продукта составляет 44 мкм К 2003 г. на
Лебединском ГОКе освоена проектная мощность по выпуску го-
рячебрикетированного железа (1 млн т брикетов в год).
ОАО «Оскольский электрометаллургический комбинат» (цех
окомкования комбината) производит окисленные окатыши из же-
лезорудного ко1шен1рата ОАО «ЛГОК». Концентрат в виде пуль-
пы (смесь с водой) транспортируется на ОЭМК по пульпопрово-
ду на расстояние 26^5 км, затем вода отделяется, а из руды с до-
101
банлением связующих веществ получают окатыши. Окатыши
обжигают на конвейерной машине, после чего окисленные ока-
тыши (рис. 2.7) имеют размер 5—20 мм, содержание железа в них
не менее 67%, кремнезема — не более 3,36%.
Из цеха окомкования окисленные окатыши поступают по
транспортерам в шахтные печи цеха металлизации Здесь из
окисленных окатышей получают металлизованные окатыши
после обработки их по технологии Мидрекс нагретым восстано-
вительным (конверсионным) газом, полученным из природно-
го газа в процессе его конверсии. Мсталлизованные окатыши
(рис. 2.8) имеют средний размер 5—20 мм, отличаются высоким
содержанием железа (87,3%), низким содержанием серы, фос-
фора и цветных металлов, а также незначительной способ-
ностью к вторичному окислению при увлажнении.
Из цеха металлизации окатыши по транспортерам поступают
в электросталеплавильный цех, где в электроду го вых печах из них
выплавляют сталь (рис. 2.9). Жидкий металл разливается на
установках непрерывной разливки стали. ОАО «ОЭМК» выпус-
кает 180 марок углеродистой, низколегированной и легирован-
ной стали. Марки стали, выплавляемые на ОАО «ОЭМК», име-
ют дополнительную маркировку ПВ (прямое восстановление).
В 2003 г. ОАО «ОЭМК» активно выходит на рынок с высоко-
качественным прокатом с термомеханической обработкой, об-
точкой и шлифовкой из стали прямого восстановления (ПВ)
блаюдаря вводу в эксплуатацию стана 350.
При строительстве данного комбината была задействована
новая стратегия природоохранной деятельности, направленная
на внедрение технологий, уменьшаю-
щих или полностью исключающих
вредное воздействие предприятия на
окружающую среду. Комбинат распо-
ложен на расстоянии 22 км от г. Ста-
рый Оскол.
Рис. 2.7. Окислсп-
ныс окатыши
Рис. 2.8. Металли-
зованныс окатыши
Рис. 2.9. Электро дуговая
сталеплавильная печь
(ОЭМК)
J02
Экологические особенности ОАО «ОЭМК» следующие.
• Исключение из технологического цикла таких производств,
как коксовое, агломерационное и доменное. Это позволило умень-
шить выбросы в атмосферу сернистых соединений, оксидов азо-
та и углерода, углеводородов.
• Эксплуатируются отечественные и импортные электрофшьт-
ры, тканевые рукавные и карманные фильтры, скрубберы, трубы
Вентури, циклоны.
• Выбросы вредных веществ осуществляются через высотные
трубы (120—150 м), что способствует их рассеиванию до кон-
центраций, не превышающих допустимые
• Вокруг комбината организована двухкилометровая санитар-
но-защитная зона, па границе которой концентрации соедине-
ний азота, серы, пыли, оксидов углерода составляют 0,3—0,7 ПДК
для воздуха населенных мест.
• Действует рациональная схема водоснабжения, которая пре-
дусматривает использование воды в оборотных циклах. Разделе-
ние промышленной, хозбытовой и ливневой канализаций по-
зволяет исключить СМСШС1П1С стоков.
Вопросы и задания
1. Какие вещества — загрязнители атмосферы могут содержаться в отходящих газах
предприятий черной металлургии? 2. Назоните наиболее опасные металлы в выбросах
предприятий цветной металлургии. 3. По выбросу какого газа цветная металлургия
занимает второе место после теплоэнергетики? 4. Как можно решить экологическую
проблему предотвращения загрязнения атмосферы сернистым газом? 5. Назовите ос-
новные компоненты металлургических шлаков (доменных мартеновских и цветной
металлургии). 6. В каком производстве (черных или цветных металлов) выход шлаков
больше? 7 Назовите основные пути экологизации производства черных металлов.
8. Как в цветной металлургии можно компзексно решать экономические и экологиче-
ские задачи предотвращения загрязнения окружающей среды?
Задача
В воздухе городской среды концентрация наиболее токсичных металлов ртути и
кадмия составляет соответственно 0,0016 и 0,025 мкг/м’. В течение суток через легкие
человека проходит около 11,5 м3 воздуха. Рассчитайте, сколько граммов Hg и Cd посту-
пает за сутки в организм человека с вдыхаемым воздухом.
2.4.4. Нефтеперерабатывающая
и нефтехимическая промышленность
Нефть помимо углеводородов, общая формула которых СХНГ
содержит серосодержащие органические и неорганические со-
единения, железо, ванадий, а также соли щелочных и щелочно-
земельных металлов, образующие при сгорании золу. Сера в СО-
ЮЗ
ставе неф-i и разных месторождений обнаруживается либо в виде
простого вещества, либо в виде соединений: сероводорода, мер-
каптанов (тиолов), сульфидов, дисульфидов, полисульфидов и
др. Приведем формулы некоторых меркаптанов, например:
сп,---sh сн,------сн,---sh
метаптиол этангмол
(мстилмсркзпган) (угилмеркзггган)
Содержание сернистых соединений в сырой нефти составля-
ет от 0,1% (в бакинской и грозненской нефти) до 4,5% и более
(в башкирской и волжской нефти). В странах СНГ примерно
65—69% добываемой неф ти относится к сернистым (содержание
общей серы до 1,9%) и высокосернистым (содержание общей
серы выше 2,0%) ее разновидностям. Зольность нефти невелика,
составляет не более 0,1%. (Для сравнения: зольность угля со-
ставляет 1 % и более.)
В настоящее время в мире ежегодно добывается более 4 млрд т
сырой нефти, при добыче, транспортировке и переработке которой
потери составляют около 50 млн т сырой нефти и нефтепродуктов.
Загрязнение атмосферного воздуха происходит уже при до-
быче нефти, до се поступления на не^ггеисрсрабатывающие за-
воды (НПЗ). Одним из крупнейших на территории СНГ являет-
ся Каспийское месторождение нефти (рис. 2.10).
На нефтепромыслах главной причиной загрязнения воздуха
является выброс попутных газов нефти, в которых содержание
свободного сероводорода может достигать 2%.
Выбросы попутных газов происходят при бурении в период
освоения нефтяных месторождений, а также при аварийных
ситуациях. В типовой схеме подготовки нефти к переработке
предусмотрены отделение от нефти газа и его утилизация. По-
Рис. 2 10. Нефтяные вышки в Каспийском море (г. Баку)
104
путные газы нефти являются цепным сырьем для производства
син тетического каучука и резинотехнических изделий, полиэти-
лена, поливинилхлорида, этилового спирта и т. д. Путем абсорб-
ции моноэтаноламином из попутных газов нефти выделяется
сероводород, который служит сырьем для получения высокока-
чественной мелкодисперсной серы и серной кислоты. При сжи-
гании сероводорода в условиях недостатка кислорода воздуха
образуется сера:
2H,S + 02 —>2S + 211,0, (2.22)
а при избытке кислорода — сернистый газ:
2H,S + 30, -—»2SO,T + 2НД (2.23)
который далее перерабатывается в серную кислоту по типовой
схеме контактною производства H2SO4. Это, безусловно, комп-
лексный метод использования природных ресурсов, но он не
везде еще применяется.
Существуют нефтепромыслы, па которых попутные газы неф-
ти сжигают на факельных установках, загрязняя атмосферный
воздух СО,, СО, сажей и особенно сернистым газом SO2 — см.
реакцию (2.23).
Еще более значимым источником зафязнепия атмосферного
воздуха являются нефтеперерабатывающие заводы. В табл. 2.6
представлены данные о масштабах ежегодных выбросов в атмо-
сферу CxHr H,S, СО, S02 нефтеперерабатывающим предприя-
тием.
В процессе нефтепереработки (прямая гонка нефти, переработ-
ка мазута, крекинг, риформинг, коксование, гидроочистка, окис-
ление битума) большинство серосодержащих соединений пре-
вращается в сернистый газ. Он обнаруживается вокруг нефтепере-
рабатывающих и нефтехимических заводов в радиусе 8—12 км.
Отрицательное влияние выбросов SO2na нефтеперерабатываю-
щем заводе мощностью 12 млн т в год может проявляться на рас-
стоянии до 20 км от предприятия. Из общего количества сернис-
того газа, выделяемого в атмосферу Земли, около 40% приходит-
ся на долю нефтепродуктов.
Масштабы поступления в атмосферу сероводорода не столь
велики, как сернистого газа. Однако H2S присутствует в выбро-
сах НПЗ даже в том случае, если сернистая нефть, поступающая
на переработку, и нс содержит свободного сероводорода. Он об-
разуется в процессе термической переработки (первичная пере-
гонка, термический крекинг). Сероводород обнаруживается на
расстоянии до 5—10 км от источника выброса. Однако, как было
показано выше, на большинстве НПЗ образующийся сероводо-
род утилизируется путем превращения его в серу или серную
кислоту (см. реакции (2.22), (2.23)).
105
Таблица 2.6
Выброс в атмосферу газов нефтеперерабатывающим заводом
(по А. С. Бобкову и др., 1997)
Загрязняющее вещество Выброс в атмосферу, тыс. т/год
минуя очистные сооружения после очистки
Углеводороды 190 0,520
Сероводород 0,64 0,002
Оксид углсрода(11) 219 0,600
Оксид ссры( IV) 115 0,310
В общем балансе веществ, загрязняющих атмосферный воз-
дух, соединения серы занимают значительное место, причем не-
которые из них, в частности H2S и SO2, могут рассматриваться
как универсальные зафязнитсли. Сернистый газ наиболее зна-
чим в загрязнении воздуха по массивности выбросов (с учетом
сгорания топлива и всех промышленных выбросов), повсемест-
ности его распространения и неблагоприятному влиянию на че-
ловека.
В процессе добычи нефти загрязнение воздуха меркаптанами
практически не наблюдается. Однако источником выделения
в атмосферу меркаптанов может служить производство по пере-
работке сернистых щелочных сточных вод нефтеперерабаты-
вающего завода. При упаривании таких щелочных вод в воздух
может выделяться значительное количество сероводорода, ме-
тил- и этилмеркаптанов и других соединений.
Сероводород и меркаптаны обычно удаляют из легких сортов
топлива (бензин, керосин, легкое дизельное топливо и др.), так
как они могут вызывать коррозию двигателей.
Загрязнение атмосферы мелкими частицами сажи происхо-
дит при нарушении режима горения факелов, используемых для
предотвращения внезапных выбросов газообразных углеводоро-
дов. Кроме этой), твердые частицы поступают в атмосферный
воздух в процессе каталитического крекинга, в особенности при
регенерации катализатора. Уменьшающиеся в размерах в ре-
зультате многократного использования частицы катализатора
выносятся с потоком газа.
Следует также учитывать, что может происходить утечка уг-
леводородов из щелей в клапанах и трубопроводах, в реакторах и
резервуарах для хранения нефтепродуктов. При правильном про-
ведении процессов переработки нефти эти потери можно сде-
лать минимальными.
По сравнению с нефтеперерабатывающими предприятиями
нефтехимические производства выбрасывают в атмосферу са-
мые разнообразные вещества, среди которых можно выделить
предельные, непредельные и ароматические углеводороды, ал-
килпитрил, ацетонифил, дихлорэтсн, хлорэтен, метанол, орга-
106
нические кислоты и ангидриды, оксиды серы, азота, углерода,
сероводород и сероуглерод. Наиболее опасная обстановка воз-
никает на нефтехимических заводах в аварийных ситуациях.
Например, катастрофа на нефтехимическом заводе в г. Бхопал
(Индия) в 1984 г. привела к гибели 5 тыс. человек и серьезному
нарушению здоровья (потеря зрения, психические расстройства
и другие заболевания) у более чем 200 тыс жителей в результате
выброса и распространения газового облака, содержащего метил-
изоцианат.
В последние годы уделяется большое внимание совершен-
ствованию технологии добычи и переработки нефти с целью
уменьшения отрицательных последствий для атмосферного воз-
духа и всей биосферы.
В Белгородской области нефтеперерабатывающих и нефтехи-
мических производств нет. Однако источниками загрязнения
биосферы нефтепродуктами (бензином, мазутом и др ) могуг
быть нефтебаза и автозаправочные с танции (АЗС).
Вопросы и задания
1. Какие вещества содержит сырая нефть? 2. Назовите основные сернистые сиеди*
пения в составе сырой нс<]>ти и их суммарное содержание в нефти различных месторож-
дений. 3. Что является главной причиной загрязнения атмосферного воздуха на нефте-
промыслах? Какие меры защиты принимают при этом? 4. Охарактеризуйте выбросы
в атмосферу нефтеперерабатывающих заводов. 5. Как осуществляется утилизами я серо-
водорода? 6. Что такое тиолы (меркаптаны) и какое производство янлисгся источником
их выделения в атмосферу? 7. Назовите причины и источники поступления в атмос<|>ерУ
твердых частиц в процессе добычи и переработки нефти. 8. Какие вещества выбрасыва-
ются в атмосферу нефтехимическими производствами?
Задачи
1 Используя данные, приведенные в этом разделе, вычислите, сколько процентов
составляют потери нефти при ее добыче, транспортировке и переработке. 2. Мировой
выброс SO2 составляет 147 млн т в год. Из общего количества сернистого газа, выделяе-
мого в атмосферу Земли, около 40% приходится не долю нефтепродуктов. Сколько тонн
это составляет? 3. На нефтеперерабатывающем заводе мощностью 12 млн т выбросы
SO, составляют 219 тыс. г в год. Вычислите, сколько тонн SO, образуется при перера-
ботке 1 т сырой нефти.
2.4.5. Химическая промышленность
Предприятия химической промышленности являются источ-
никами самых разнообразных по химическому составу выбросов
в атмосферу Одно из таких предприятий — ОАО «Сумыхимпром»
(рис. 2.11). Перечислить все вещества, производимые химической
промышленностью, невозможно. Рассмотрим только основные
107
Рис. 2.11. Химическая
промышленное'! ь. Цех
по производству диоксида титана
(ОАО Сумыхимпром»)
химические производства и их
вредные выбросы в атмосферу.
К важнейшим производствам
химической промышленности от-
носятся производства кислот, ще-
лочей, аммиака, минеральных
удобрений, водорода, хлора, ла-
ков, красок, полимеров, искус-
ственных и синтетических воло-
кон и др.
В табл. 2.7 перечислены неко-
торые химические производства
и характерные для них выбросы
в атмосферу.
Загрязнение атмосферы соеди-
нениями серы (SO,, SO,, H2SO4,
H,S, CS2, меркаптанами) проис-
ходит при производстве серной
кислоты, фосфорных удобрений (суперфосфата), некоторых
сложных удобрений (аммофоса, нитрофоски), капролактама,
карбофоса искусстве! пых волокон, бумаги, целлюлозы и др.
«Поставщиками» соединений азота (NO, NO,, NH3, HNO2,
HNOj и др.) в атмосферу являются предприятия по производству
аммиака, азотной кислоты, азотных удобрений (аммиачной во-
ды, калийной селитры, натриевой селитры, аммиачной селитры,
сульфата аммония, карбамида), сложных удобрений (аммофо-
са), соды (аммиачно-хлоридным способом), серной кислоты
(питрозным методом). Соединения азота поступают в атмосфе-
ру также в производстве органических веществ: щавелевой кис-
лоты, капролактама, анилиновых красителей, вискозы, фото-
пленки, целлулоида и др.
Хлор и его соединения поступают в атмосферу при производ-
стве соляной кислоты, хлорида кальция, хлорной извести, соды,
хлора и едкого натра (электролизом водного раствора .хлорида
натрия), поливинилхлоридной смолы, тетрахлорэтилена, орга-
нических красителей, пестицидов, уксусной кислоты и др.
Загрязнение атмосферы фтором и его соединениями происхо-
дит при производстве фосфорных удобрений (суперфосфата),
некоторых сложных удобрений, эмалей, алюминия и др.
Химическая промышленность является источником самых
разнообразных выбросов в атмосферу, содержащих как неорга-
нические, так и органические вещест ва. В качестве примера рас-
смотрим коксохимическое производство. Какие загрязняющие
вещества образуются в этом производстве? Какие меры прини-
маются для зашиты окружающей среды?
Сущность коксохимического производства заключается в сле-
дующем. Коксующиеся угли нагревают в коксовых батареях при
108
Таблица 2.7
Вредные выбросы в атмосферу основных химических производств
Продукт произволе™ Загряз:1яющие оешсстна
Азотная кислота NO, NO2, NH3
Серная кислота:
нитрозным методом NO, NO,, SO2. SO-, H,SO4, Fc2O3
(пыль)
контактным ме тодом SO,, SO3. H,SO4, FcjO3 (пыль)
Соляная кислота HC1, Cl2
Фосфор и фосфорная кислота P,O5, H,PO4, HF, фосфогинс (пыль)
Аммиак NHj, CO
Сода NH3
Электролиз водного раствора NaCl Clj, NaOH
Хлорная известь Cl,, СаС12 (пыль)
Водород методом конверсии СО и СН4 CO
Продукты коксохимического CO, CO,, фенол, нафталин, бензол
производства и его производные
Карбамид (мочевина) NH3, СО (NH,),CO (пыль)
Аммиачная селитра СО, NH3. HNOj. NH4NO3 (пыль)
Суперфосфат H,SO4, HF, пыль суперфосфата
Сложные удобрения NQ NOj, NH3, Н1-; H,SO4, P,O„
HNO3, пыль удобрении
Карбофос SO,. P,O5, H,S, пыль карбофоса
Бумага и целлюлоза HjS. меркаптаны, дым,
выделяющийся при сжигании коры
и опилок
11оливинилхлорид!гая смола Hg, HgCl,, NH,
Щавелевая кислота NO, NO,. C,H2O4 (пыль)
Уксусная кислота CH3COH, CH3COOH
Тетрахлорэтилен HC1, Cl,
Метанол CH3OH CO
Капролактам NO, NO,, SO,. H.S, CO
Ацетон СН3СОН, (CH,)jCO
Искусственные волокна H.S, cs.
Синтетический каучук Стирол, толуол, ацетон, изопрен
Лаки и краски с,н,
температуре порядка 1000 °C, при этом образуется твердый по-
ристый материал — кокс, применяемый в качестве топлива и
восстановителя при выплавке чугуна. При коксовании наря-
ду с коксом образуется прямой коксовый газ, содержащий более
300 различных веществ, многие из которых относятся к вредным
и могут за1рязнять воздушный бассейн — эго СО, Н2, CS2, NH3,
H3S, циановодород, бензол, толуол, ксилол, фенол", пиридин,
антрацен и др. В период загрузки и выгрузки коксовых батарей,
при нарушениях герметичности камер и других отклонениях
в режиме их работы атмосфера загрязняется пылью и сложной
109
смссыо перечисленных летучих соединений. Установлено, что
некоторые из этих веществ обладают канцероген ным действием.
На коксохимических предприятиях предусмотрены химические
цеха по переработке прямого коксового газа. 11ри промывании
его водой улавливают аммиак и аммонийные соли Непогло-
шенпый аммиак улавливают серной кислотой с образованием
сульфата аммония, который применяется в качестве азотного
удобрении. Бензол, толуол и ксилол поглощают соляровым мас-
лом, потом отгоняют и разделяют на индивидуальные компо-
ненты. Каменноугольная смола, которая оседает при промыва-
нии аммиака водой, используется для выделения фенола путем
обработки раствором едкого натра. Образующийся при этом фе-
нолят натрия извлекается водой, при дальнейшем добавлении
серной кислоты образуется исходный фенол. Пиридин C5HSN
переходит в водную фазу при обработке смолы серной кислотой,
так как сернокислый пиридин растворим в воде. Нафталин вы-
деляют путем кристаллизации Оставшиеся Н2, СО и частично
СН4 называются оборотным коксовым газом. Они используются в
качестве горючего для обогрева коксовых батарей.
Таким образом, почти все побочные продукты коксования
находят полезное применение, и одновременно решаются эко-
логические задачи защиты атмосферного воздуха от загрязнения
вредными веществами
В Белгородской области к химической промышленности от-
носится ряд предприятий, находящихся в городе Шебекино:
ООО «Завод моющих средств», АО «Гея» (выпускает поверхност-
но-активные вещества) и др. В Белгороде есть крупные пред-
приятия, производства которых основаны на проведении хими-
ческих и физико-химических процессов, но они относятся не
к химической, а к медицинской (ОАО «Белвитамины») или пи-
щевой (ЗАО «Цитробсл» — завод лимонной кислоты) промыш-
ленности. К химической промышленности относятся такие бел-
городские предприятия, как ОАО «Бслпласг» (производство
пластмасс), ЗАО «КВИЛ» (производство лаков и красок) Пред-
приятие ОАО «Луч» является электрохимическим производ-
ством, использующим процессы электролиза для гальваносте-
гии (никелировании, цинкования меднения и т. п.).
Суммарные выбросы за1рязняющих веществ от предприятий
химической и медицинской промышленности в Белгородской об-
ласти в 1999 г. составили 1,4 тыс. т, ч т о на 0,1 тыс, т меньше, чем
в 1998 г. По сравнению с 1994 г. они снизились на 1,7 тыс. т.
В общем объеме загрязняющих веществ по области доля пред-
приятий химии и медицины составляет всего лишь 1,7%. Однако
следует иметь в виду, что это в основном токсичные газообраз-
ные или жидкие летучие вещества: хлористый водород НС1, се-
роводород H,S, аммиак NH3, хлор С12, гексан С61114, этилацстат
ПО
CHjCOOCI-L. диэтиловый эфир С2Н5—О—С,Н5, метиловый
спирт СН3ОН, серная кислота H2SO4 и др. На предприятиях этой
отрасли достигнута относительно высокая степень очистки вы-
бросов от вредных газообразных соединений — 35,6%.
Вопросы и задания
1. Назоните предприятия, загрязняющие атмос<|кру соединениями серы. 2. Какие
производства являются поставщиками соединений азота в атмосферный воздух? 3. При
произведет не каких веществ в атмосферу поступают хлор и его соединения? 4. Назовите
вещества, которые содержит прямой коксовый газ. 5. Что такое оборотный коксовый
газ? 6. Как решаются экологические проблемы в коксохимическом производстве?
Задача
Антропогенные источники ежегодно выделяют в окружающую среду до 60 млн т
оксидов азота, причем на долю химической промышленности приходится около 5%,
а на долю энергетики и транспорта — около 95%. Вычислите, сколько тонн оксидов азо-
та выделяют в юд предприятия химической промышленности и сколько тонн — пред-
приятия энергетики и транспорта.
2.4.6. Промышленность строительных материалов
К строительным материалам относится большая группа не-
рудных полезных ископаемых, применяемых или в естествен-
ном состоянии, или после механической и термической обра-
ботки. Это строительные камни, песок, гравий, шебень, извест-
няк, мел, мрамор, nine, глина и др. Кроме тою, строительными
материалами являются разнообразные продукты промышленно-
го производства: вяжущие вещества — цемент, известь и др.; бе-
тон, железобетон, шлакобетон, силикатный кирпич, стекло,
стекловолокно, красный кирпич, асбестоцементные изделия,
шифер, теплоизоляционные материалы, канализационные тру-
бы, облицовочные плиты и т. д
Промышленность строительных материалов (далее везде «строй-
материалов») традиционно относится к числу существенных ис-
точников загрязнения окружающей среды, в частности атмо-
сферы.
Загрязнение атмосферы происходит при добыче полезных ис-
копаемых открытым — наиболее дешевым — способом. Промыш-
ленность стройматериалов использует ежегодно более 2 млрд т
минерального сырья Запыленность воздуха и ухудшение жиз-
ненных условий возрастают за счет выветривания горных пород,
складированных в отвалы. Эги отвалы нс только сокращают
плошадь сельскохозяйственных земель, по и являются источни-
ками различных загрязняющих веществ, которые развеиваются
111
Рис. 2.12. Белгородский цементный завод
(вращающиеся печи обжша сырьсного шлама и получения клинкера)
ветрами, повышая запыленность атмосферы, действуя угнетаю-
ще на растительность прилегающих территорий.
Процессы подготовки сырья, его дробления, фракциониро-
вания и хранения связаны с загрязнением окружающей среды.
Для предприятий характерно обилие транспортных средств, со-
здающих шум, выделяющих копоть и газы, вредные для человека
и природы.
Технологическая схема производства стройматериалов вклю-
чает добычу, доставку, измельчение, смешивание компонен-
тов, последующие прессование, сушку, обжиг, упаковку юто-
вой продукции. При этом почти па всех этапах выделяется
пыль. Широкое использование порошковых компонентов услож-
няет задачи обеспыливания. Источником пыли являются от-
крытые склады нерудного минерального сырья (песка, гравия,
шебня и др.) Пыль строительных материалов очень разнооб-
разна по составу, физико-химическим и механическим свой-
ствам, чем и обусловлено ее отрицательное действие на окружаю-
щую среду' и различные органы человека (об этом подробнее
см. в разд. 2.5.4).
С выделением большого количества пыли связано производ-
ство цемента (важнейшего вяжущего материала) и других вяжу-
щих материалов (извести, гипсовых и магнезиальных вяжущих).
Портландцемент (один из лучших видов цемента) получают
обжигом мелко измельченной смеси известняка и глины, при
спекании этой смеси образуется плотный клинкер, который за-
тем размалывают в тонкий порошок. Между глиной и известня-
ком происходят сложные химические реакции. Упрощенно их
112
можно представить как обезвоживание каолинита, разложение
известняка и образование силиката кальция:
А1,О3 • 2SiO, • 2Н2О НаГреВаНИе».Л1гО, 2SiO3 + 2Н.ОТ; (2.24)
WaHHekCaO + coJ; (225)
СаО + SiO, на|рсвание» caSiO3. (2.26)
Основные компоненты цемента — CaQ SiO2, AUO3.
Негашеную известь, в основном состоящую из СаО, получают
в промышленности обжигом известняка по реакции (2.25).
При взаимодействии СаО с водой получают гашеную известь'.
СаО + Н2О = Са(ОН)2 + Q (2.27)
Смесь гашеной извести с цементом, водой и песком применяют
в строительстве.
В производстве цемента запыленность воздуха в рабочей зоне
может достигать 100—120 мг/м3, при производстве извести —
70—80 мг/м3. ПДК цемента в воздухе рабочей зоны составляет
6 мг/м3. В окружающей среде запыленность воздуха значительно
ниже, чем в рабочей зоне. В районе цементного завода она ко-
леблется от десятых долей миллиграмма до нескольких милли-
граммов на 1 м3 воздуха. Главными источниками пыли и газов на
таких заводах являются цеха обжига и помола. В цехах подготов-
ки сырья сильно пылят дробилки и сушильные барабаны для из-
вестняка и глины. В воздухе рабочей зоны сушильных барабанов
и сырьевых мельниц иногда содержится несколько десятков
граммов пыли в 1 м3.
Пыль цементных заводов и карьеров по добыче известняка и
глины может быть источником загрязнения окружающей среды
сопутствующими тяжелыми металлами Влияние предприятия
распространяется на несколько километров. По данным иссле-
дований, около карьера цементного завода содержание Сг, Sr, Ti,
Pb в листьях тополя в 2—2,5 раза выше по сравнению с «фоном».
Вторая зона с повышенным содержанием этих металлов может
наблюдаться на расстоянии в несколько километров в том на-
правлении, куда дуют ветры. Это необходимо учитывать при
планировании строительства жилого массива. Предприятия, яв-
ляющиеся источниками загрязнения воздушной среды, должны
отделяться от жилой застройки санитарно-защитными зонами
(СЗЗ). Эти предприятия не должны располагаться с наветренной
стороны для ветров преобладающего направления по отноше-
нию к застройке жилья.
В производстве гипса ввиду больших потерь сырья запылен-
ность в рабочей зоне очень велика, и атмосферный воздух за-
грязняется в радиусе 1—1,5 км. Жженый гипс, или ааебастр
113
(CaSO4)2 • ll2O, получают при нагревании до 150—180°С природ-
ного гипса CaSO4 - 2Н2О
2(CaSO4 2Н,О) Р-епан>1$ (CaSO,)2 11,0 + ЗН2ОТ. (2,28)
Алебастр в смеси с известью, песком и водой применяют
в качестве штукатурки, а в медицине его используют для наложе-
ния гипсовых повязок.
В производстве глиняного (красного) кирпича и силикатного
(белого) кирпича, строительной керамики запыленность произ-
водственных помещений достигает 6—10 мг/м’. ПДК глины
в воздухе рабочей зоны составляет 6 мг/м1. При изготовлении
красного кирпича глину смешивают с песком и водой, формуют
в кирпич-сырец, который далее сушат и обжигают. Глины, бо-
гатые Fc,O3, после обжига окрашиваются в бурые и красные
цвета. Глину, сильно «загрязненную» оксидом железа(Ш) и
песком, называют формовочной землей. Такую глину преиму-
щественно используют для изготовления кирпича и черепицы
Силикатный кирпич изготовляют путем нагревания в автокла-
вах при температуре 180 С смеси гашеной извести Са(ОН)2
с песком SiO2.
Весьма опасна пыль кварца (SiO2), образующаяся при произ-
водстве стекла и изделий из него Сырьем для производства
обычного оконного стекла служат кварцевый песок SiO2, сода
Na,CO3 и известняк СаСО3. Эти вещества тщательно перемеши-
вают и нагревают при температуре 1500 °C:
Na2CO3 + SiO, ” ГР683™ » Na,SiO3 + СО,?; (2.29)
CaCOj + SiO2 —> CaSiOj + СО2Т. (2.30)
Образовавшиеся силикаты натрия и кальция сплавляют с пес-
ком, который беруг в избытке. Примерный состав такого стекла
можно выразить формулой Na2O - СаО • 6SiO2. При изготовле-
нии стекла иного назначения (химического), кварцевого, хрус-
тального используют и другое сырье: поташ К2СО3, оксид свин-
ца(11) РЬО и др Из стекла делают стекловолокно и ткани, при-
меняемые в качестве тепло- и электроизоляторов.
Особую экологическую опасность представляет пыль, выде-
ляющаяся при добыче асбеста, изготовлении и обработке асбес-
тоцементных изделий. Асбест — это природный минера.'! с крис-
таллами в форме тонких волокон Он относится к волокнистым
силикатам. Состав хризен ил-асбеста можно выразить химиче-
ской формулой Mg6(OH)s[Si.O10] (иногда приводится формула
асбеста — 3MgO • 2SiO2- 2Н2О). Асбест негорюч, его используют
в качестве теплоизоляционного и огнеупорного материала для
обкладки труб парового отопления, в потолочных перекрытиях,
114
для звукоизоляции общественных зданий. Fro даже использова-
ли для покрытия гладильных досок, в некоторых красках и кро-
вельйых материалах. В 1960-х гг. было обнаружено, что асбесто-
вая пыль обладает канцерогенным действием.
Существенным источником зазрязнения воздуха являются
асфальтобетонные заводы. Па этом производстве образуется мно-
го пыли, дымят сжигаемое топливо и горячий битум.
Обильное выделение пыли наблюдается при изготовлении
древесно-стружечных и древесно-волокнистых плит (ДСП и ДВП).
Древесная пыль огнеопасна и взрывоопасна.
В качестве покрытия пола используют линолеум — полимер-
ный органический материал на основе поливинилхлорида (ПВХ),
в который добавляют- фталаты в качестве пластификат ора в ко-
личестве до 40 мае.%. Фталаты (соли и сложные эфиры фталевой
кислоты) используют для этой цели и в других пластмассах, хотя
и меньшем объеме, чем в ПВХ. Кроме того, их использую г при
изготовлении растворителей, смазок, в производстве бумаги, в
парфюмерии (в дезодорантах), при изготовлении пестицидов,
лаков и красок. Фталаты относятся к веществам, распространен-
ным повсеместно, их находят в почве, воде и воздухе. Фталаты
могут встречаться и в продуктах питания с искусственной упа-
ковкой. Источником распространения этих веществ в окружаю-
щей среде служат потери их в производстве, происходящая со
временем диффузия из пластмасс, а также улетучивание при
сжигании пластмасс.
Формула сложных эфиров фталевой кислоты такова:
ПВХ и сополимеры винилхлорида составляют примерно 75%
рынка полимеров. Покрытие пола, производимое в Германии,
состоит на 28—50% из ПВХ 25—60% — из наполнителя, 10—20% —
пластификатора, 1—5% — пигмента и 1—2% — смазки и стаби-
лизатора.
Установлено отрицательное влияние фталатов на живые орга-
низмы При действии фталатов на растения наблюдаются хлоро-
зы, при которых бледнеет зеленая окраска листьев. Вредное воз-
действие на растения может оказывать эмиссия фталатов из пле-
ночных материалов теплиц. Исследования животных показали,
что в большей степени фталаты концентрируются в печени и
легких При длительном воздействии в больших дозах наиболее
распространенный ди-2-этилгсксилфтадат оказывает на живот-
ных мутагенное, канцерогенное и тератогенное действие. Для
115
человека установлено, что фталаты вызывают воспалительные
процессы слизистых оболочек, раздражения кожи, слабость,
чувство беспокойства Максимально допустимая эмиссионная
концентрация для фталатов установлена равной 10 мг/м3.
Перечисленные примеры применения неорганических и ор-
ганических веществ дают нам представление о том, какой вклад
промышленность стройматериалов вносит в загрязнение окру-
жающей среды.
В заключение необходимо от мстить, что строительная индуст-
рия является одной из немногих отраслей промышленности,
в которой можно использовать в качестве исходного материала
попутно добываемые породы и образуемые отходы многих про-
изводств, например отходы ТЭС, металлургической, химиче-
ской и других отраслей промышленности Выше, в разд. 2.4.3
были приведены примеры использования вскрышных пород же-
лезорудных месторождений, а также шлаков и золы черной и
цветной металлургии в качестве сырья для получения стройма-
териалов.
Строительная индустрия использует отходы и других отрас-
лей промышленности. Например, отходы углеобогащения при-
меняются в производстве легких бетонов; фосфогипс (отход
производства фосфорной кислоты) — в производстве потолоч-
ных плит, цемента; отходы целлюлозно-бумажной промышлен-
ности — в качестве добавок при изготовлении керамзита, арбо-
лита; отходы деревообрабатывающей промышленности — для
изготовления ДВП, ДСП и арболитовых изделий и т. д. Про-
мышленность стройматериалов использует и вторичные ресур-
сы, например:
• бой стекла — для производства стекловолокна;
• отходы по грсбления полимерных материалов — для произ-
водства линолеумной плитки,
• макулатуру — для производства мягкой кровли (рубероид,
толь);
• резиновую крошку из вышедших из употребления авто-
шин — для производства гидроизоляционных материалов и т. д.
Переход строительной индустрии на новую сырьевую базу —
использование нетрадиционного сырья (попутно добываемых
пород и отходов) — дает существенный эколого-экономический
эффект: позволяет экономить природное сырье, охранять пло-
дородные земли и решать экологические задачи охраны окружаю-
щей среды.
В Белгородской области строительная индустрия — это разви-
тая отрасль промышленности, имеющая богатую сырьевую ба-
зу, — месторождения мела, известняка, глины, кремнезема и
других полезных ископаемых. Среди предприятий строительно-
го комплекса основными загрязнителями атмосферы являются
116
АО «Оскодцемент» (г. Старый Оскол), «Белгородский цемент»
(г. Белгород), «U 1ебскинский меловой завод» (г. Шсбекино),
«Стройматериалы» (г. Белгород). К этой отрасли промышленно-
сти относятся такие белгородские предприятия (АО), как «Бел-
городасбестоцсмснт», «ЖБИ-4» (завод железобетонных изде-
лий), «ЖБК-1» (завод железобетонных конструкций) и ряд
предприятий в области, использующих как минеральное сырье,
так и вскрышные породы и отходы других производств.
Масса выбросов зшрязняющих веществ от предприятий строи-
тельного комплекса в 1999 г. составила 17,9 тыс. т, что на 1,4 тыс. т,
или на 8,4%, больше, чем в 1998 г. По сравнению с 1994 г. выбро-
сы увеличились на 0,4 тыс. т, или на 2,1%. На долю выбросов
предприятий строительного комплекса приходится 20,9% от об-
щих выбросов загрязняющих веществ в области.
Строительные материалы производят не только предприятия
данного комплекса, но и другие в частности ОАО «Оскольский
электрометаллургический комбинат», на котором действуют
мощности по производству силикатного и керамического кир-
пича, санитарно-керамических изделий и облицовочной кера-
мической плитки.
На предприятиях строительного комплекса осуществлен ряд
воздухоохранных мероприятий. Так, в 1999 г. на цементных за-
водах Белгорода и Старого Оскола капитально отремонтирова-
ны электрофильтры, позволившие снизить выбросы на 240 т
в год. Предприятия по производству строительных материалов
оснащены оборудованием для улавливания и утилизации пыли
в количестве 44 т в год. Однако уровень очистки и утилизации
газообразующих веществ еще недостаточен, и в этой сфере тре-
буются дальнейшие вложения предприятий.
Вопросы и задания
I. Какие виды минерального сырья относятся к строительным материалам? Приве-
дите примеры. 2. Какие продукты промышленного производства являются строитель-
ными материалами? 3. Назовите основной загрязни гель атмосферы, который выделяется
почти на всех этапах производства стройматериалов. Поясните на примерах 4. Приведи-
те примеры запыленности воздуха и производстве цемента, извести, гипса, кирпиче,
стекла. 5. Какое производство может быть источником загрязнения атмосферы тяже-
лыми металлами? 6. Почему опасна для человека асбестовая пыль? 7. Какие вещества
используются в производстве линолеума и почему они опасны для жиных организмов?
8 В чем состоит эколого-экономический эффект использования нетрадиционного
сырья в стройиндустрии? 9. Приведите примеры использования в производстве строй-
материалов отходов других производств.
Задачи
1. Выбросы цементной пыли от Новороссийского цементного завода в начале 1990-х гг.
состаачяли 3—4 мг/м3 С вводом в действие эффективных иылеочистных установок
117
выбросы сократились более чем в 10 раз. Дайте экологическую оценку запыленное! и
в долях ПДК, 2. В воздухе производственных помещений кирпичного зашма запылен-
ность превысила предельно допустимую концентрацию в 1,5 раза. Определите концен-
трацию пыли в воздухе.
2.5. ВОЗДЕЙСТВИЕ ОСНОВНЫХ ЗАГРЯЗНИТЕЛЕЙ
ВОЗДУХА НА ЖИВЫЕ ОРГАНИЗМЫ
На основании данных об источниках загрязнения воздушной
среды, приведенных в разд. 2.4, можно выделить следующие ос-
новные загрязнители атмосферы: оксиды углерода СО и СО2,
оксиды серы SO2 и SOj, оксиды азота NO и NO2, углеводороды и
продукты их окисления, тяжелые металлы, твердые взвешенные
частицы (пыль, дым). Выясним их влияние на объекты окружа-
ющей среды и в первую очередь на живые организмы.
2.5.1. Оксиды углерода
Оксид углерода(И) — СО. Этот газ, называемый также «моно-
оксидом углерода» или «угарным газом», относится к основным
загрязнителям воздуха. В незагрязненном воздухе содержание
СО невелико и составляет всего 0,05—0,1 млн-1, но по массе его
больше, чем таких загрязнителей, как NO. NO-,, SO2. Содержание
СО в атмосфере составляет 6 • 10s т.
Небольшие количества СО природного происхождения обра-
зуются в результате вулканической деятельности и окисления
метана в атмосфере Последняя реакция имеет многостадийный
характер и протекает с участием тро тосферного озона О, и ради-
калов ОН Упрощенно процесс образования СО из метана мож-
но представить уравнением
2СН. + 30,—► 2СО + 4КО. (2.31)
Антропогенными источниками монооксида углерода явля-
ются автотранспорт, промышленные печи и котельные (из-за
неполною сгорания топлива). Среднее время пребывания СО
в атмосфере составляет примерно 6 месяцев.
• СО — бесцветный, нс имеющий запаха газ, поэтому его труд-
но обнаружить органами чувств. Он вдыхается вместе с воздухом
или табачным дымом и, поступая в кровь, конкурирует с кисло-
родом за молекулы гемоглобина. Гемоглобин представляет со-
бой железосодержащий белок, присутствующий в эритроцитах
крови и переносящий кислород из легких к клеткам тканей орга-
низма, а углекислый газ — из клеток организма обратно в легкие.
Эта нормальная картина переноса нарушается, когда во вдыхае-
118
мом воздухе присутствует СО. Молекулы оксида углсрода(ТТ)
присоединяются к гемоглобину в 210 раз легче, чем кислород.
Чем больше оксида углерода(П) содержится в воздухе, тем боль-
ше гемоглобина, прочно связанного с ним и по этой причине нс
способного переносить кислород. Гемоглобин, соединившийся
с СО, называется карбоксигемоглобином, или карбонилгемогло-
бином:
НЬ + СО <=♦ HbCQ (2.32)
тогда как гемоглобин, связанный с кислородом, называется ок-
сигемоглобином. Его образование можно отобразить уравнением
НЬ + О, ♦=* НЬО,. (2.33)
В присутствии СО происходит вытеснение кислорода из нестой-
кого комплекса оксигемоглобина и образование карбоксигемо-
глобина
Hb0,+ C0S=T>HbCO + O,. (2.34)
Одним из источников СО является сам человек, организм ко-
торого производит и выделяет во внешнюю среду (с выдыхае-
мым воздухом) за сутки около 10 мл СО. Это так называемый
эндогенный оксид углерода(П), который образуется в процессах
кроветворения.
В атмосфере с большим содержанием оксида углерода(П)
возможно наступление смерти от удушья {асфиксии). Ткани тела
умирают от кислородного голодания. По этой причине СО при
повышенных концентрациях представляет смертельно опасный
яд (см с 122).
Отравление угарным газом может произойч и не только в про-
изводственных условиях, но и в быту. В зданиях с печным отоп-
лением при недостатке кислорола воздуха происходит неполное
сгорание топлива, и вместо СО2 (углекислого газа) образуется
угарный газ по одной из двух приведенных ранее реакций (см.
уравнения (2.6) и (2.7)).
Таким образом, если преждевременно (до полного сгорания
топлива) закрыть заслонку печи, то доступ кислорода воздуха
к месту горения углеродсодержашего топлива прекратится и
начнутся реакции:
нагревание
2С + О2----!------* 2CQ
„ л нагревание
С + СО,-----------* 2СО.
Большое количество угарного газа образуется при пожарах в за-
крытых помещениях.
Подвср! ает себя опасности и курильщик Даже у слабого ку-
рильщика 3% гемоглобина уже связано только из-за курения. Это
равноценно нахождению в течение 8—10 ч в помещении, где кон-
центрация СО составляет 20 мг/м\ Такой уровень концентрации
119
бывает па улицах больших юродов. Содержание карбоксигемо-
глобина в крови человека, выкуривающего пачку сигарет в день,
составляет в среднем 4,7%. У среднего курильщика до 6% гемо-
глобина его крови теряет способность доставлять кислород к тка-
ням. Это соответствует содержанию оксида углерода(П) в воздухе
45 мг/м3. У страстных курильщиков содержание карбоксигемо-
глобина в крови порой достигает 10— 15%. Дым от сигареты может
содержать до 4% оксида углерода(ТТ). Следует знать, чго вредное
воздействие от СО (угарного газа) получает не только сам куриль-
щик, но и люди, находящиеся с гшм в одном помещении.
Вдыхание воздуха с повышешгым содержанием СО приводит к
увеличению доли карбоксигемоглобина нс сразу, а постепенно —
в течение нескольких часов. При уменьшении содержания СО
в воздухе кровь также нормализуется лишь через несколько часов.
В табл. 2.8 показано, как изменяется доля карбоксигемогло-
бина в крови человека при увеличении концентрации СО в воз-
духе I юслс 8—10 ч вдыхания. Этот уровень карбоксигемоглобина
считается равновесным значением, т. е. более длительное вдыха-
ние СО при данной концентрации уже не приведет к увеличе-
нию доли карбоксигемоглобина в крови.
Таблица 2.8
Влияние концентрации СО в воздухе на содержание
карбоксигемоглобина в крови (по П Ревеллю, Ч. Ревеллю, 1995)
Содержание СО, мг/ы3 Доля карбоксигемоглобина в крови. %
0 0.4
5 1.0
10 1,6
20 2,9
30 4,1
40 5,4
45 6,0
50 6,6
60 7,8
Следует знать, что даже при вдыхании незагрязненного воз-
духа у некурящих людей в крови содержится 0,3—0,5% кар-
боксигемоглобина. Эта небольшая концентрация создается
вследствие образования в организме человека небольшого ко-
личества СО в процессе нормального метаболизма, а также
вследствие наличия СО в незначительном количестве даже
в неза1рязнснном воздухе.
В США в 1970-е гг. стандартом качества воздуха было уста-
новлено содержание СО в атмосфере 10 мг/м , усредненное за
восьмичасовой период. Этот уровень не должен превышаться
более одного раза в год. Значит, даже слабый курильщик создаст
120
себе концентрацию оксида углерода(П), в два раза превышаю-
щую предельно допустимый уровень.
В России предельно допустимая концентрация СО в атмосфер-
ном воздухе насеченных мест составляет: максимальная разо-
вая — 5 мг/м3, среднесуточная — 3 мг/м3. ПДК оксида углсро-
да(П) для рабочих с 8-часовым рабочим днем составляет 50 млн 1
(0,05 г/кг). В Германии установлена также максимальная эмис-
сионная концентрация СО — 50 млн-1 (50 см’/м3) Для сравне-
ния скажем, что внутри помещений где СО образуется в резуль-
тате неполного сгорания топлива в печах и курения, его концен-
трация может доходить до 50 млн-1. Вдыхаемый при курении
дым содержит примерно 400 млн-* СО. В незагрязненном же ат-
мосферном воздухе, как было отмечено в начале этого раздела,
содержится всего 0,1 млн-1 СО Концентра щя СО на городских
транспортных магистралях часто достигает 50 млн-1, а в «пробках»
может повышаться до 140 млн-1. При работе двигателя внутреннего
сгорания на холостом ходу выхлопные газы могут содержать 1,0—
1,5 об.% СО Поэтому у людей, работающих или живущих около
автомагистралей с высокой плотностью транспортного движе-
ния, содержание НЬ • СО в крови значительно более высокое по
сравнению с остальным населением.
На горожанина-курильщика, особенно в закрытых помещени-
ях, приходится двойная нагрузка — э го действие СО образующе-
гося в результате выброса промышленными предприятиями и
транспортом, с одной стороны, а также действие СО, содержаще-
гося в табачном дыме, — с другой. У промышленных рабочих-
курильщиков в крови обнаружено в среднем 5% НЬ СО, / неку-
рящих рабочих содержание НЬ СО не превышало 1,5%. Для
уменьшения большой загазованности юродов рекомендуется
создавать зеленые пешеходные зоны.
У людей с повышенным содержанием НЬ • СО в крови наблю-
даются следующие клинические симптомы. Во-первых, сниже-
ние способности к восприятию звуковых сигналов Это наблю-
дается при содержании карбоксигемоглобина в крови в пределах
2,5—5% от общего гемоглобина. Во-вторых, отмечаются нару-
шения процессов мышления. Ослабевает способность различать
увеличение яркости света, когда доля карбоксигемоглобина не
превышает даже 3%. На скоростных автострадах концентрация
СО может подниматься до 60 мг/м3, что вызывает повышение
доли карбоксигемоглобина почти до 8%. При этом серьезно на-
рушаются навыки вождения автомобиля, ослабевают реакции на
появление стоп-сигналов и на скорость идущего впереди автомо-
биля, следствием чего могут быть аварии на дорогах. Высокие ло-
кальные концентрации СО, даже кратковременные, причиной
которых в больших городах является в основном автотранспорт,
представляют собой так называемые экологические ловушки.
121
В табл. 2.9 указаны признаки отравления угарным газом при
более высоком (по сравнению с рассмотренными) содержании
НЬ • СО в крови (10—60%).
Таблица 2.9
Признаки отравления угарным газом при высоком содержании
карбоксигемоглобина в крови (по Г. Фелленбергу, 1997)
Концентрация СО в воздухе Содержание НЬ-СО в крови, % Клинические СИМПТОМЫ
млн 1 об. %
60 0,006 10 Ослабление зрения, легкая головная боль
130 0,013 20 Боли в голове и теле, утомляемость, временная потеря сознания
200 0,02 30 Потеря сознания, паралич, нарушение дыхания и жизнедеятельности
660 0,066 50 Полная потеря сознания, паралич, прекращение дыхания
750 0,075 60 В течение 1 ч наступает летальный исход
Из табл. 2.9 видно, что при концентрации угарного газа
0,006 об.% доля карбоксигемоглобина в крови составляет 10%, и
при этом уже появляется легкая головная боль. Концентрации
0,066 об.% в атмосфере достаточно для того, чтобы связать поло-
вину гемоглобина, что грозит полной потерей сознания, а при
концентрации СО 0,075 об % уже 60% гемоглобина связывается
в карбоксигемоглобин, и при вдыхании такого воздуха в течение
часа наступает смерть. Концентрация СО 1 об.% смертельна
в течение нескольких минут.
Так как реакция взаимодействия оксигемоглобина с угарным
газом обратима, повышение в дыхательной системе человека
парциального давления О2 будет ускорять диссоциацию карбок-
сигемоглобина и выделение СО из организма, и равновесие (см.
реакцию (2 34)) смещается влево по принципу Ле Шателье:
НЬО, + СО <=» НЬСО + Oj.
Поэтому человека, получившего отравление угарным газом, на-
до поместить на свежий воздух, увеличить доступ кислорода.
В настоящее время имеются лечебные препараты, которые
используют при отравлении оксидом углерода(П). Например,
введение восстановленного железа резко ускоряет удаление СО
из организма. Это основано на высоком химическом сродстве
СО к двухвалентному железу и на способности СО выступать
в качестве лиганда в различных комплексных соединениях.
122
Скорость связывания гемоглобина с угарным газом зависит
нс только от концентрации СО в воздухе, но и от интенсивности
обмена веществ в организме человека, в том числе и от частоты
дыхания. Время насыщения гемоглобина оксидом углерода(П)
зависит от физической нагрузки. Например, в состоянии покоя
при объеме поступающего в легкие воздуха 10 л/мин с содержа-
нием 0,1 об.% СО насыщение достигается через 6 ч, при тяжелой
работе и интенсивности дыхания 30 л/мин оно достигается уже
менее чем через 2 ч (рис. 2.13).
Оксид углсрода(П) опасен не только в высоких концентраци-
ях, но и в низких Он может быть причиной сердечных приступов.
Исследования, проведенные с людьми, страдающими стенокар-
дией, показали, что даже при уровне карбоксигемоглобина
в крови 2% состояние больных стенокардией ухудшается, а при
содержании его в количестве 3% приступы стенокардии начина-
ются быстрее и происходят дольше обычного. Причина заклю-
чается в том, чго оксид углерода(П) уменьшает перенос кислоро-
да к тканям, а ткань, которая особенно чувствительна к недо-
статку кислорода, — это миокард (сердечная мышца).
Итак, монооксид углерода представляет опасность для чело-
века прежде всего потому, что может связываться с гемоглоби-
Рнс. 2.13. Насыщение гемоглобина оксидом углсрода(И)
при различной физической нагрузке;
1 — тяжелая работа (интенсивность дыхания 30 л/мин); 2 — легкая работа
(20 л/мин); 3 — покой (10 л/мин)
123
ном. Но он опасен также и тем, что участвует в образовании смо-
га (дыма и тумана). Кроме того, СО может образовывать с метал-
лами высокотоксичныс соединения — карбонилы. Например,
пентакарбонил железа Ье(СО)5 и тетракарбонил никеля Ni(CO)4
представляют собой летучие весьма ядовитые жидкости.
В обшем случае растения реагируют на меньшие концентра-
ции газообразных за»рязнителсй, чем животные. Оксид утлеро-
да(11) составляет исключение, он приносит вред растениям при
значительно больших концентрациях, чем при действии на жи-
вотных. По сравнению с другими газами, загрязняющими воз-
дух, СО в меньшей степени участвует в метаболизме растений.
Ежегодно доля выбросов СО от антропогенных источников
возрастает на 20—30%. Однако суммарная концентрация его
в атмосфере увеличивается медленно, так как в природе проис-
ходят процессы связывания СО путем как окисления в СО2, так
и диффузии в стратосферу с последующим превращением в СО2.
Накоплению СО в атмосфере препятствуют высшие растения,
водоросли и особенно микроорганизмы почвы. Высшие расте-
ния могут связывать СО с помощью аминокислот ы серина, воз-
можно также окисление СО в СО, Отсюда очевидна роль зеле-
ных насаждений в очистке воздуха городов. В почве некоторые
микроорганизмы также либо частично переводят СО в органи-
ческие соединения, либо окисляют его в СО2. Поэтому почва иг-
рает особую роль в поглощении СО из атмосферы.
Таким образом, благодаря способности природы к самоочи-
щению концентрация моноксида углерода возрастает, но нс
столь значительно, и происходит обезвреживание воздуха. Но
эта способность природы небсз!ранична.
Оксид углерода(ГУ) — СО, В отличие от мопооксида углерода
содержание СО2, называемого также «диоксидом углерода» или
«углекислым тазом», в атмосферном воздухе значительно боль-
ше и составляет -2,6 • 1012 т. В природе СО2 находится в состоя-
нии постоянного круговорота (см., например, рис. 1.9). В этом
круговороте происходят процессы противоположной направ-
ленности: с одной стороны, выделение СО, в атмосферу, с дру-
гой — фиксация его из атмосферы при фотосинтезе и др.
Увеличение количества сжигаемого природного топлива с раз-
витием индустриализации многих стран, особенно в течение по-
следних 100—200 лет, привело к заметному повышению содер-
жания СО2 в атмосфере. Если в 1750 г. концен грация СО2 состав-
ляла 280 млн ', то к настоящему времени она повысилась до
330—340 млн'1 и составляет 0,03 об.%. Обшес промышленное
выделение СО2 в атмосферу достигает 30 млрд т/год. Попавший
в атмосферу СО2 находится в ней в среднем 2—4 года, и за это
время он распространяется повсеместно по всей земной поверх-
ности.
124
Влияние СО2 проявляется прежде всего в его способности по-
глощать инфракрасные лучи, вызывать так называемый парни-
ковый эффект, т. е потепление климата на Земле. Эти глобаль-
ные последствия увеличения концентрации углекислого газа
в атмосфере подробнее рассмотрены в разд. 2.6, здесь же приво-
дятся сведения о воздействии СО2 на человека и о роли углекис-
лого газа в жизни растений.
Кислород составляет 50—85% массы тканей растений и жи-
вотных, является самым распространенным элементом на Зем-
ле, играет роль окислителя. При участии кислорода совершается
один из важнейших процессов — дыхание, а далее он служит как
источник энергии живых организмов, которая выделяется при
окислении углеводов, жиров и белков. В число продуктов окис-
ления входит СО2. Таким образом, человек потребляет кислород
и выделяет углекислый газ. В спокойном состоянии через легкие
человека за сутки проходит 10—11 тыс. л воздуха, при физиче-
ских нагрузках и повышении температуры воздуха потребность
в кислороде может возрасти в 3—5 раз.
Диоксид углерода постоянно образуется в тканях организма
в процессе обмена веществ и играет важную роль в регуляции
дыхания и кровообращения. Например, окисление глюкозы со-
провождается образованием углекислого газа, воды и выделени-
ем большого количества теплоты:
С6Н12О6 + 6О2 = 6СО2 + 611,0 + 2800 кДж/моль. (2.35)
Диоксид углерода является физиологическим возбудителем
дыхательного центра. При концентрации СО, 0,5 об.% и выше
отмечается увеличение легочной вентиляции, при более высоких
концентрациях СО2 оказывает наркотическое действие и вызы-
вает асфиксию. Уменьшение концентрации СО, в атмосферном
воздухе неопасно, так как необходимое парциальное давление
СО2 в крови обеспечивается за счет жизнедеятельности самою
организма. В жилых помещениях содержание СО2 не должно пре-
вышать®,1%. Большие концентрации СО2 (свыше 10%) вызыва-
ют сильный ацидоз — снижение pH крови (повышение ее кис-
лотности), бурную одышку и паралич дыхательного центра, т. е.
оказывают токсическое действие на человека.
Главная буферная система плазмы крови (Н,СО3 — НСО3“)
обеспечивает поддержание кислотно-основного гомеостаза, по-
стоянного значения pH крови порядка 7,4 (слабощелочная среда).
Как известно, при дыхании живых организмов СО2 выделяет-
ся, а при фотосинтезе растениями СО2 поглощается с образова-
нием в них углеводов, в частности глюкозы (C6Hl2Ot), и выделе-
нием кислорода (см уравнение реакции (1.1)).
Таким образом, зеленые растения очищают атмосферу от уг-
лекислого газа, который загрязняет воздух и является основным
125
продуктом сгорания углсродсодержащих веществ. И если боль-
шинство других атмосферных газов поглощается растениями без
переработки, то СО2 благодаря процессам фотосинтеза в расте-
ниях включается в процессы метаболизма, что особенно важно,
так как создаются условия для дальнейшего его поглощения.
Принято считать, что наибольшую роль в поглощении СО2
в природе играют леса, именно леса помогают поддерживать ба-
ланс СО2 в атмосфере Земли. Однако исследования последних
лет показывают большую роль болот в этом процессе (подробнее
см. разд. 2.6.1).
Фотосинтез в клетках древесных растений осуществляется
в широком диапазоне температур окружающей среды — от нуля
до 40 °C и выше. У большинства видов растений умеренной зоны
интенсивность фотосинтеза возрастает с повышением темпера-
туры и достигает максимального значения при 20—25 °C. Вод-
ный дефицит листа сильно подавляет процесс фотосинтеза.
Существенное влияние на ход фотосинтеза оказывает концент-
рация углекислого газа в атмосфере (0,03—0,04%). С увеличением
концентрации СО2 в атмосфере его ассимиляция возрастает.
Загрязнение окружающей среды подавляет ассимиляцион-
ную способность листа. Поэтому фотосинтез можно считать са-
мым чувствительным индикатором состояния среды произрас-
тания. Вокруг цементных заводов до мезофилла’ листа доходит
всего лишь 50% световою потока. Фотосинтез снижается под
влиянием химических препаратов, вызывающих хлороз, побуре-
ние листьев или листопад.
Исследования ученых показали, что максимальной интен-
сивностью фотосинтеза и дыхания обладают представители ши-
роколиственных пород (вяз гладкий, клен остролистный, липа
мелколистная, дуб черешчатый), а минимальной — хвойные.
Полученные данные свидетельствуют также о снижении в целом
интенсивности фотосинтеза и увеличении дыхания древесных и
кустарниковых растений в условиях города по сравнению с при-
городным парком. Обусловлено это химическим загрязнением
городской среды.
Вопросы и задания
1. Какая функция гемоглобина крови нарушается при вдыхании оксида утлеро-
да(П)? Объясните происходящие явления. 2. В каких случаях может произойти отравле-
1 .Мезофилл (от гр. mesos — средний и phyllon — лист) — основная ткань
листьев растении, состоящая из живых клеток, содержащих хлорофилл — зе-
леный пигмент растений, от присутствия которого зависит окраска листьев,
побегов. Биологическая роль хлорофилла (от гр. chloros — зеленый, phyllon —
лист), заключается в поглощении энергии солнечного спета и трансформации
се в химическую энергию органических веществ, образующихся в процессе
фотосинтеза.
126
нис угарным газом в быту? 3. Какой опасности подвергает себя курильщик? 4. Какие
нормативы установлены на содержание монооксида углерода в воздухе в нашей стране
и за рубежом? 5. Может ли оксид углсрода(П) стать причиной аварий на автодорогах?
Оз нет мо 1 и пируйте. 6. Назовите признаки отравления угарным газом при разном содер-
жании СО н воздухе и карбоксигемоглобина в крови. 7. От каких факторов зависит на-
сыщение гемоглобина оксидом утлерода(Н)? 8. Почему при возрастающей антропоген-
ной нагрузке концентрация СО в атмосфере возрастает незначительно? 9 Приведите
примеры влияния СО, на природу и человека. 10. Назовите экологический норматив на
содержание углекислого газа в жзиых помещениях. 11. В чем состоит экологическая
роль фотосинтеза и от каких факторов зависит этот процесс?
Задачи
I. При обследовании двух ipynn рабочих, выполняющих ремонтные работы на го-
родских улицах А и Б, были отмечены следующие симптомы: у рабочих группы А —
сшгжение способности воспринимать звуковые сигналы и различать увеличение ярко-
сти света; у рабочих группы Б — нарушение навыков вождения автомобиля, ослабление
реакции па появление стоп-сигналов и на скорость едущего впереди автомобиля. Ис-
пользуя данные табл. 2.8, вычислите, во сколько раз были превышена ПДК угарного
газа на улицах А и Б этого города? 2. Используя графики приведенные на рис. 2.13,
определите, какую долю (в об.Я) составит содержание карбоксигемоглобина в крови
при вдыхании в течение I ч воздуха с концентрацией СО в нем 0,1 об.% при выполнении
а) тяжелой работы, б) легкой работы, а также в) в состоянии покоя. Какие нарушения
здоровья при этом будут наблюдаться? (См. табл. 2.9.) 3. Растения с листовой поверхно-
стью в 1 дм2 усваивают за 1 ч из атмосферною воздуха около 50 мг СО,, а из воздуха,
содержащего до 5% углекислого газа, — ПО мг. Какая масса гмокозы ассимилируется за
I ч в первом и во втором случаях? Какой объем кислорода выделяется при этом в воздух?
Для решения задачи составьте уравнение фотосинтеза тюкозы.
2.5.2. Оксиды серы
Оксид ccpw(IV) — SO2. Этот газ, называемый также диокси-
дом серы, сернистым газом или сернистым ангидридом, отно-
сится к числу основных зафязнителей атмосферы. Его концент-
рация в воздухе около 1 млн-1, а общее количество в атмосфере
составляет 2 106 т.
Диоксид серы попадает в атмосферу как естественным путем,
так и в результате антропогенной деятельности. К природным
источникам SO2 в первую очередь относятся действующие вул-
каны, лесные пожары, морская пена и микробиологические
превращения серосодержащих соединений. Диоксид серы ант-
ропогенного происхождения образуется при сжигании топлива
(на ТЭС, заводах, фабриках, для обогревания помещений, в дви-
гателях внутреннего сгорания), в металлургических производ-
ствах (при выплавке меди, свинца, цинка из сульфидных руд),
в производстве серной кислоты и при переработке нефти Про-
изводство тепловой и электрической энергии является основным
антропогенным источником SO-,. Например, в США в 1983 г. око-
127
ло 90% всех антропогенных выбросов SO2 приходилось на сер-
нистый газ от сжигания топлива в тепловых электростанциях.
В ФРГ в 1986 г. более половины (62,6%) выбросов SO, давали
электростанции. Общее количество SO, антропогенного проис-
хождения в развитых промышленных странах превышает коли-
чество природного SO2 в 20—30 раз.
Поведение и реакции в атмосфере. Продолжительность жизни
соединений серы в атмосфере колеблется от нескольких часов до
20 суток. Время пребывания SO2 в атмосфере в среднем исчисля-
ется двумя неделями. Этот промежуток времени слишком мал,
чтобы газ мог распространиться в глобальном (земном) масшта-
бе. Поэтому проблема загрязнения атмосферы сернистым газом
возникает в первую очередь в высок развитых промышленных
странах и у их ближайших соседей. Например, исследованиями
ученых г. Белгорода (1991—1996) установлено, что выпадения
соединений серы, а также азота на территории Белгородской об-
ласти обусловлены не только собственными источниками, но и
влиянием соседних областей (Курской, Воронежской), а частич-
но и других государств (Украины, Белоруссии, Польши, Герма-
нии, Чехии и Румынии).
Многие страны Европы по отношению к проблеме загрязне-
ния атмосферы SO2 условно можно разделить на «экспортирую-
щие» и «импортирующие» серу. Имеется в виду вынос и поступ-
ление серы через воздушные границы. Так, например, с террито-
рий Дании, Нидерландов, Бельгии, Великобритании, Германии
и Франции выбросов сернистого газа к странам-соседям боль-
ше, чем встречные поступления SO2 от соседей к ним. В то же
время Норвегия, Швеция, Финляндия, Австрия и Швейцария,
наоборот, больше получают серы от соседних государств, чем
выпускают через собственные фаницы.
В атмосфере сернист ый газ претерпевает ряд химических пре-
вращений, важнейшие из которых — окисление и образование
кислот. Эги реакции необходимо рассмотреть, так как опасность
дня природы представляет не только сам сернистый газ, но и
продукты его превращения в атмосфере (SO3, H2SO3, H2SO4 и
сульфаты).
Естественные и антропогенные процессы окисления и горе-
ния веществ, содержащих серу, дают в основном сернистый газ
SO2. Доля же другого оксида серы — триоксида (SO3 серного ан-
гидрида) — очень незначительна. Например, в процессе пер-
воначального горения топлива до SO3 окисляется менее 3%
серы, а основная часть серы превращается в сернистый газ, кото-
рый поступает в атмосферу. Здесь SO2 постепенно окисляется
кислородом воздуха до SO3 (см. уравнение реакции (2.10)).
Этому окислению способствуют оксиды и соли металлов
(в основном Fe и Мп), содсржашисся в воздухе в виде пыли и
128
играющие роль катализаторов, а также солнечный свет (фотохи-
мическое окисление). Возможно окисление SO2 и озоном:
SO2 + О., so3 + О2. (2.36)
Образовавшийся оксид ccpbi(VI) сразу же реагирует с водя-
ным паром, образуя серную кислоту:
SO, + Н2О —► H2SO4, (2.37)
которая присутствует в воздухе в виде легкого тумана, состояще-
го из крошечных капель.
Для тропосферы установлено также образование серной кис-
лоты в результате реакции SO2 с радикалом ОН'. Этот процесс
происходит следующим образом Под действием света атмо-
сферный озон разлагается:
о^о, +о (2.38)
Возбужденный кислород с атмосферными парами воды может
образовать радикалы ОН":
О+Н,о—► ОН +ОН-. (2.39)
Исключительно реакционноспособные радикалы ОН' дают с SO2
серную кислоту:
SO, + 20Н —► H2SO4. (2.40)
Сернистый газ может также вступать в реакцию с парами
воды, например в облаках, образуя сернистую кислоту, которая
далее подвергается диссоциации:
SO2 + Н2О *=► H,SO, *=> Н* + HSO3- 21Г + SO?-. (2.41)
Эта слабая, неустойчивая кислота, в свою очередь, постепен-
но реагирует- с кислородом воздуха, образуя серную кислоту:
21IjS0, + О, —> 2H2SO«. (2.42)
До серной кислоты сернистая кислота может окисляться также
озоном
II SO, + О, —► SO?- + Н* + О2 (2.43)
и пероксидом водорода
HSO,- + H2Oj- ► SO/- +Н‘+ Н ,0. (2 44)
Таким образом, серная кислота в воздухе образуется двумя
путями. В сухом воздухе образуется главным образом SO, и за-
тем H2SO4, а при высокой влажности сначала образуется H2SO3.
которая потом окисляется до H2SO4.
При сжигании угля наряду с оксидами серы образуются также
оксиды кальция и железа. При сгорании нефти их образуется
значительно меньше. Далее оксиды этих металлов вступают
129
в реакцию с атмосферной серной кислотой с образованием твер-
дых частиц сульфатов кальция и железа(П) и (Ш):
СаО -г Н,$О4 —> CaSO4 + Н,О; (2.45)
1еО + H2SO4 —» FcSO, + Н.О; (2.46)
FcjOj + 3H,SO4 —► le2(SO4)3 + 3H2Q (2.47)
Если в атмосфере содержится аммиак, то серная кислота
вступаете ним во взаимодействие с образованием гидросульфа-
та и сульфата аммония:
N Н, + Н ,50. —► NH4HSO4; (2.48)
NH4HSO4 + N H,—» (NH4),SO4. (2.49)
Перечисленные превращения SO3 в атмосфере представлены
на рис. 2.14.
Содержание частиц сульфатов и капель серной кислоты в воз-
духе городов может достигать от 5 до 20%. Исследования показа-
ли, что большая часть диоксида серы превращается в серную кис-
лоту и сульфаты в течение нескольких суток после его выброса
в атмосферу. За это время ветер може т отнести эти загрязнения на
сотни километров от места выброса. Замеры показали, что сернис-
тый газ и образующиеся в облаках кислоты могут переноситься
мощными потоками воздуха на расстояние до 1500 км.
Во время переноса диоксид серы SO2 и образуемые им кислоты
могут быть нейтрализованы только в том случае, если в воздухе
Рис. 2.14. Химические превращения сернистого газа в атмосфере
130
находится пыль, содержащая гидроксиды щелочных и щелочно-
земельных металлов. В регионах, где производится добыча и об-
жиг мела, известняка (СаСОЛ, вполне вероятно образование
гидроксида кальция Са(ОН)2. Например, па предприятиях строи-
тельной индустрии г. Белгорода (ОАО «Стройматериалы» и др.)
известь получают обжигом мела (см. реакцию (2.25)):
.. ,_нагревание
СаСО,------—♦ СаО + СО,.
Образующийся при этом оксид кальция частично поступает в
виде выбросов в атмосферу, где соединяется с парами воды при
их конденсации (т. с. с дождем или мокрым снегом), и при этом
образуется гидроксид кальция (см. реакцию (2.27)):
СаО + Н.О--► Са(ОН),.
В свою очередь, гидроксил кальция в атмос(}>ере взаимодей-
ствует с SO2, SO,, H2SO3, H2SO4 с образованием соответствсшю
сульфитов и сульфатов кальция:
SO., + Са(ОН), —► CaSO3 + Ц2О, (2.50)
SO, + Са(ОН)2 > Си SO, + Н,О: (2.51)
ILSO, + Са(ОН), —► CaSO, + 2Н,О; (2.52)
H,SO. + Са(ОН), ► CaS04 + 2Н?О. (2.53)
Однако в результате нейтрализации лишь небольшая доля
SO2 удаляется из атмосферы, да и подобная нейтрализация про-
исходит далеко не во всех регионах. Атмосфера очищается от SO2
и других кислотных газов главным образом при вымывании их
дождем или снегом, а также при их «сухом» осаждении, т е.
в виде самого газа или газа, адсорбированного на мельчайших
частицах пыли. В странах Европы 2/3 всех осадков серы принято
относить к сухой части, при этом считают, что остальная часть
вымывается из атмосферы вместе с дождями и снегом.
Сухая часть загрязнений обычно выпадает в непосредствен-
ной близости от источника выброса либо на незначительном
удалении от него. При длительном переносе воздухом в основ-
ном выпадает связанная водой часть выбросов. Гребни гор и на-
ветренная сторона возвышенностей в большей степени под-
вергаются действию осадков в виде дождей, чем подветренная
сторона Лесами с их большой и разветвленной поверхностью
удерживается больше выбросов, чем лугами и пашнями. С де-
ревьев сухая часть выбросов в основном уносится с водой, и на
листьях, хвойных иглах и в трещинах коры остается меньшая
часть загрязнений.
Влажную (мокрую) часть выбросов обычно называют кислот-
ными дождями. Кислотными выбросами в атмосферу наряду
с 5О2являются НО, Н F и NO2. Выбросы HCI и НЕ носят локаль-
131
ный характер. Источником HCI в атмосфере являются произ-
водства эмалей, фарфора, сжигание отходов и установки для пи-
ролиза, а источником HF — производство алюминия, стеколь-
ное производсгво. Диоксид азота по сравнению с НС1 и HF игра-
ет значительно большую роль в возникновении кислотных
дождей, которые имеют глобальные последствия. Образование
кислотных дождей и их действие на окружающую среду подроб-
нее рассмотрено в разд. 2.6.
Важно рассмотреть еще одно явление, связанное с выбросами
SO в атмосферу, — образование смога
Поступление SO2 в атмосферу и превращение его в серную
кислоту в значительной степени происходит в условиях влажных
атлантических ветров, особенно в зимний отопительный сезон
(при сжигании большого количества твердого серосодержащего
топлива) Эти процессы получили известность в середине XX в.,
когда в результате мощных дымовых выбросов, содержащих час-
тицы дыма и SO2, в Лондоне возник густой туман (pea soup),
в котором происходило медленное образование аэрозоля серной
кислоты Эта смесь получила название «смог» (от англ, smoke —
дым и fog — туман). Лондонский смог, начавшийся 5 декабря
1952 г., за 3—4 суюк погубил более 4 тыс. человек. Английские
специалисты определили, что в этом смоге содержалось не-
сколько сотен тонн дыма и сернистого газа. Была зафиксирова-
на прямая, непосредственная связь между концентрацией в воз-
духе этих веществ и смертностью населения.
Несколькими годами ранее, утром 26 октября 1948 г., г. Доно-
ру (США, штат Пенсильвания) также окугал густой туман Это
была такая густая смесь тумана с дымом и копотью, что из нее
началось выпадение сажи Сажа покрыла слоем дома, тротуары
и мостовые, на которых оставались отчетливые следы пешеходов
и автомобильных шин Двое суток видимость была настолько
плохой, что жители с трудом находили дорогу домой. Вскоре
врачей начали осаждать кашляющие и задыхающиеся пациенты,
которые жаловались на нехватку' воздуха для дыхания, насморк,
резь в глазах, боль в горле и тошноту. В течение следующих четы-
рех суток, пока сильный дождь не смыл этот опасный покров,
заболело 5910 человек из 14 тысяч жителей города. Двадцать че-
ловек умерло. Погибло также много собак, кошек и канареек.
В 1963 г. смог (густой туман с копотью и дымом), опустив-
шийся на Нью-Йорк, привел к CMCpin более 400 человек.
Зимой воздух в Анкаре (столице Турции) самый грязный
в мире, при этом источником загрязнения атмосферы являются
не автомашины и заводы, которых в городе немного, а дым ото-
пительных печей, которыми пользуется население частных мно-
гоквартирных домов. Город, расположенный в центре Анато-
лийского плоскогорья, окружен с трех сторон горами. Другими
132
словами, Анкара оказалась ловушкой для смога — с раннего угра
се покрывает «одеяло» густого черного дыма, смешанного с ту-
маном. В солнечную погоду, если на окраине города светит солн-
це, то в центре города видимость снижается настолько, что во-
дители автомашин вынуждены включать фары. Жители цент-
ральных районов столицы Турции не видят солнца неделями.
Домашние хозяйки сушат белье в помещении, потому что если
вывесить его на улице, оно немедленно станет грязным. Такое
загрязнение атмосферы сказывается и на состоянии дыхатель-
ной системы человека. Например, если за 10 лет, с 1965 по 1975 г.,
население Анкары выросло только в 2 раза, то число заболева-
ний раком легких увеличилось в 10 раз, хроническим бронхи-
том — в 11 раз.
В один из январских дней 1972 г. снег на улице южных райо-
нов Норвегии был черным, и, как показали химические анали-
зы, это было вызвано выпадением частиц сажи, перенесенных
воздушными потоками из промышленного Рура (область Герма-
нии). Промышленные предприятия Западной Европы ежегодно
выбрасывают в атмосферу громадное количество SO2 Перене-
сенный господствующими потоками воздуха в Скандинавию, он
выпадает в виде кислотных осадков, соединяясь с парами воды,
образует серную кислоту.
Для земель Северный Рейн—Вестфалия важным фактором
образования смога являегся угольная пыль.
Ученые считают, что ежегодно тысячи смертельных случаев
в городах всего мира связаны с за1рязнением воздуха. Смог на-
блюдается лишь в осенне-зимнее время (с октября по февраль).
В настоящее время ото метеорологическое явление называют
смогом лондонского типа, так как именно в Лондоне образование
смога происходило особенно часто и интенсивно Главным дей-
ствующим компонентом смога является сернистый газ в сочета-
нии с аэрозолем серной кислоты. При вдыхании такой смеси
сернистый газ достигает легочных альвеол (пронизанных сетью
капилляров тканей легких) и, являясь сильным раздражителем
дыхательных путей, вызывает воспалительные процессы и рост
заболеваний со смертельным исходом.
В смоге помимо SO2 может присутствовать и ряд других ве-
ществ, образующихся при сгорании топлива и содержащихся
в выхлопных газах автотранспорта, — это СО, NO, (NO и Ь1О2),
углеводороды. Так, еще в 1930-е гг. над Лос-Анджелесом стали
наблюдать аналогичные явления и в теплое время года — летом и
в жаркие дни ранней осенью. Этот смог отличается от лондон-
ского, и его называют лос-анджелесским или фотохимическим
туманом, так как для его возникновения необходим солнечный
свет, вызывающий сложные фотохимические превращения
в смеси углеводородов и оксидов азота автомобильных выбро-
133
сов. Возникновение этого смога и его действие на живые орга-
низмы подробно рассмотрено в разд. 2.5.3.
Воздействие на человека и животных. Диоксид серы — газ
с резким удушливым запахом, весьма ядовит. На человека SO2
действует прежде всего как раздражитель слизистой оболочки ды-
хательных путей, вызывая сильный кашель. У взрослых здоро-
вых людей эти симптомы появляются только при концентраци-
ях 5 млн 1 (13 мг/м3). В течение короткого времени воздействия
SO2 человек может выдержать и десятикратную концентрацию,
значительно сложнее обстоит дело с людьми, обладающими
повышенной чувствительностью к SO>. Эту группу составляет
-10% населения; у людей этой группы уже кратковременное воз-
действие SO2 при концентрации 1,3 мг/м3 вызывает спазмы ды-
хательных путей, и требуется немедленное медицинское вмеша-
тельство Таким же образом реагируют на загрязнение атмо-
сферы сернистым газом и больные астмой.
Считают, что физиологическое воздействие SO2 на организм
человека в первую очередь связано с образованием H2SO3 на
влажной слизистой бронхов. Аналогичным образом проявляет-
ся воздействие и аэрозолей серной кислоты. В тяжелых случаях
может возникнуть отек легких. При длительном воздействии
сернистого газа пропадает чувствительность к запахам и вкусам.
В организме человека H2SO2 окисляется в H2SO4 и выводится через
ночки, водородный показатель мочи при этом понижается — уве-
личивается кислотность (нормальным является интервал 4,8—7,5).
Диоксид серы опасен для здоровья людей, страдающих забо-
леваниями дыхательных путей. Установлена прямая зависи-
мость между концентрацией SO2 в воздухе и частотой заболева-
ний населения хроническим бронхитом-.
у=14,5х—1,3, (2.54)
где у — число человек, заболевших бронхитом, %; х — концент-
рация SO2 в воздухе, мг/м3.
Из приведенной зависимости следует, что при концентрации
SO2 в воздухе 0,5 мг/м3 заболеваемость бронхитом составит око-
ло6%, при концентрации 1,0 мг/м'заболеваемость возрастает до
13,2%, при 5 мг/м3 — до 71,2%, а при концентрации 6.8 мг/м1
почти все население заболеет бронхитом. Эп и прогнозы совпа-
дают с результатами исследований, проведенных в Германии и
других европейских странах
По данным исследований американских ученых, даже в райо-
не, где средняя годовая концентрация оксидов серы составляла
всего 0,1 мг/м3, количество заболеваний бронхитом заметно воз-
росло.
Высокое содержание оксидов серы в воздухе непосредствен-
но влияет и на увеличение заболеваемости людей, и на рост
смертности. Во всех случаях катасгрофического за1рязнения ат-
134
мосферы в Нью-Йорке, Осаке и Лондоне исследователи отмеча-
ли увеличение смертности вслед за периодами высоких концент-
раций оксидов серы в воздухе этих городов.
Порой трудно определить вред, нанесенный организму не-
посредственным действием диоксида серы, так как он присут-
ствует в воздухе наряду с другими веществами, опасными для
здоровья. Например, трудно разделить степени воздействия на
человека оксидов серы и пылевых частиц, поскольку обычно
действие этих видов загрязнений совместное и одновременное.
По статистике, при повышенной концентрации пыли токсичес-
кое действие SO2 проявляется значительно сильнее, чем в возду-
хе, свободном от пыли. После нескольких трагедий в Лондоне,
связанных с образованием смога, было установлено, что при
комбинированном воздействии пыли и SO2 смертность превы-
сила обычное среднее значение. При совместном воздействии
пыли и SO2 возрастает опасность заболевания хроническим
бронхитом. Синергизм совместного действия пыли и диоксида серы
объясняют адсорбцией молекул SO2 на мельчайших частицах
пыли, которые могут проникать в чувствительные альвеолы лег-
ких. На пылевых частицах SO2 проникает глубже в легкие, т. е.
воспалительные процессы нс ограничиваются слизистой обо-
лочкой бронхов.
Диоксид серы часто действует совместно с оксидами азота
NO,. Эта комбинация сше значительнее увеличивает число забо-
леваний дыхательных путей. С загрязнением воздуха связано
распространение в наши дни и такого заболевания, как воспале-
ние гортани {псевдокруп).
Диоксид серы вызывает не только затруднение дыхания, но
дает и дополнительный эффект. В экспериментах на крысах по-
казано, что этот газ оказывается коканцерогеном. В присутствии
бсиз(а]пирсна сернистый газ увеличивает частоту появления ра-
ковых опухолей. В настоящее время нет достаточных данных,
чтобы считать SO2 канцерогеном или коканцерогеном для чело-
века, но подозрения на этот счет имеются. Для высших живот-
ных SO2 также является раздражителем дыхательных путей, од-
нако систематических наблюдений по этому' поводу значитель-
но меньше.
Исходя из влияния SO2 на здоровье человека, устанавливают
экологические нормативы на его содержание в воздухе. В США
стандарты качества воздуха (1971 г.) устанавливают среднесуточную
концешрацию оксидов серы {суточный стандарт) — 0,365 мг/м3,
причем этол уровень нс должен превышаться более одного раза
в год. Годичный стандарт, т. е. усредненное значение за год, со-
ставляет 0,080 мг/м5. Для сравнения приведем концентрацию
SO2 в воздухе некоторых населенных пунктов. В сельской мест-
ности фоновая концентрация близка к 0,0005 мг/м5, однако кон-
135
цен грация в городах в 50—100 раз выше В Чикаго, например,
в 1954 г. концентрация оксидов серы составляла 0,470 мг/м3, что
почти в 1000 раз выше фоновой. После установления стандартов
качества воздуха и принятия необходимых мер по уменьшению
выбросов оксидов серы в атмосферу концентрация этих газов
значительно снизилась. Во время лондонского смога 1952 г. кон-
центрация оксидов серы в воздухе достигла 4 мг/м3, что более
чем в 10 раз выше суточного стандарта. В Анкаре в январе 1982 г.
в течение нескольких дней содержание оксидов серы в воздухе
достигало 2,8 мг/м3.
В России предельно допустимая концентрация SO2 составляет:
максимальная разовая — 0,5 мг/м3, среднесуточная — 0,05 мг/м3.
Действие SO, на растения. Сернистый газ токсичен нс только
для человека, но и для растении, причем их чувствительность
к вредному воздействию SO2 проявляется при меньших его кон-
цен грациях, чем у животных. Много работ посвящено исследо-
ванию влияния SO2 на состояние растительного мира.
В воздействии различных атмосферных загрязнителей на расте-
ния есть много общего В табл. 2.10 показаны последствия атмо-
сферного загрязнения на разных уровнях организации экосистемы.
Видна взаимосвязь между влиянием на клеточном уровне и реак-
циями всего растения или даже расгигелыюго сообщества в целом.
Процесс воздействия начинается с поступления загрязнителя
в клетку. Происходит уменьшение активности ферментов, нару-
шение естественных реакций обмена веществ, изменение струк-
туры органелл. Все это в конце концов приводит к гибели клет ки.
Достигнув определенного уровня, нарушения функции кле-
ток могут отразиться на следующем, более высоком уровне орга-
низации. Происходит изменение ассимиляции, дыхания или
транспирации, наблюдается задержка роста и развития, в осо-
бенности листьев. Повреждение на уровне клетки внешне может
проявляться в форме хлороза (от греч. chldras — зеленовато-жел-
тый, бледный) — побледнения листа, вызванного потерей хло-
рофилла, или некроза — его омертвения.
Воздействие токсикантов на отдельные органы может приво-
дить к увеличению чувствительности растения к климатическим
фак торам и патогенам или непосредственно к подавлению роста
и ухудшению качества. Эти изменения, так же как изменения
в характере межвидовой борьбы, вызывают трансформацию ви-
дов и уменьшение их численности в растительном покрове.
Воздействие атмосферных загрязнителей на экосистемы про-
является в нарушении биогеохимических циклов, уменьшении
способности экосистем к саморегуляции. Накопление загрязни-
телей в кормовых растениях может представлять опасность для
животных и человека. При сильном загрязнении атмосферы мо-
гут возникнуть зоны, лишенные растительности.
136
Таблица 2.10
Классификация действия атмосферных загрязнителей на растения
(no Р. Гудериану, 1979 г.)
Клетка
Поглощение
загрязнителя
Изменение кле-
точной среды
Действие
на ферменты
и метаболиты
Изменения кле-
точных органелл
И метаболизма
Нарушение путей
обмена веществ
Изменения клеток
Разрушение
и гибель клеток
Ткань или орган
Поглощение или
осаждение
загрязнителя
Изменение асси-
миляции, дыхания
или транспирации
Изменения в росте
и развитии
Хлороз, некроз
Гибель или отми-
рание органов
растений
| Организм
Поглощение или
осаждение
вагрязнитсля
Изменение роста
Повышение
восприимчивости
к биотическим
и абиотическим
факторам
Снижение про-
дуктивное г и
И качества урожая
Гибель растений
Экосистема
Накопление за-
грязнителя в рас-
тениях и других
компонентах эко-
системы, таких как
почва, поверхност-
ные и грунтовые
воды
Вредность хтя
потребителей
как результат
накопления
Изменения видо-
вого состава, шкже
связанные со сдви-
гами в межвидовой
борьбе
Нарушение биогео-
химических циклов
Нарушение ста-
бильности и умень-
шение способности
к саморегуляции
Распад древост оев
и ассоциаций
Расширение ли-
шенных раститель-
ности зон (опусто-
шение)
Сернистый газ относится к числу наиболее распространенных
загрязнителей атмосферы. Поэтому подробно рассмотрим воз-
действие именно этого загрязнителя на растения.
Еще в XVII в., составляя отчет для Карла II, Дж. Ивлин указы-
вал, что посадки деревьев будут способствовать уменьшению
загрязнения воздуха в Лондоне. Как показали дальнейшие ис-
следования, совет ученого был разумным.
В последние 10—20 лет выполнены многочисленные экспе-
рименты с целью определения скорости поглощения SO2 для
листьев ряда растений в лабораторных и полевых условиях.
Установлено, что, например, трава может существенно пони-
зить концентрацию SO2 в загрязненном воздухе.
137
Поглощение SO, растениями сопряжено с нарушением их
жизнедеятельности, в частности процесса фотосинтеза и неко-
торых других энергетических процессов. Так, при воздействии
диоксида серы в разных концентрациях и с разной экспозицией
(временем воздействия) наблюдали следующие изменения:
• 0,3 млн 1 (0,3 ч) — уменьшение фиксации углекислого газа;
• 0,1 млн-1 (24 ч) — увеличение открытия устьиц;
• 0,1 млн-1 (1350 ч) — повреждение листьев.
Поглощение растениями газообразных зафязнитслсй связано
с растворимостью газов в водной пленке на поверхности мезофиль-
ных клеток1. Растворение газов обычно течет за собой ионизацию,
поэтому в процессах метаболизма растений могут участвовать так-
же ионы. При поглощении SO, в клетках образуется сернистая кис-
лота, которая диссоциирует на ионы HSO3- и SO,2-.
Небольшие дозы SO, вызывают открытие устьица листа, при
высоких дозах, напротив, происходит их закрыт ие. Считают, что
при низких дозах поглощения преобладают процессы превраще-
ния сернистого газа в ссроорганичсские соединения и SO, не
действует на ферменты. При более высоких концентрациях SO2
процесс его превращения в органических соединениях протека-
ет неполно. В этом случае концентрирование неорганической
серы в растении может вызвать ингибирование ферментов.
Высокие концентрации и длительное воздействие SO2 вызыва-
ют серьезные повреждения растений и наносят им ущерб. Термин
«повреждение» включает все реакции растения, обусловленные
загрязнением атмосферы: обратимые изменения метаболизма,
уменьшение интенсивности фотосинтеза, некроз листьев, преж-
девременный листопад или подавление роста. Термин «ущерб»
включает все последствия, снижающие хозяйственную ценность
или направленное использование растений. Их хозяйственная
ценность определяется экономическими, экологическими и эс-
тетическими факторами (рис. 2.15).
Исследования по влиянию концентрации SO, и времени его
воздействия показали, что повреждение растений в большей сте-
пени зависит от концентрации, чем от времени. Возрастание си-
лы воздействия с увеличением концентрации SO2 зависит нс от
повышения абсолютного количества поглощенного загрязните-
ля, а от высокой скорости поглощения. Если в единицу времени
поглощается мало диоксида серы, то он может успеть окислить-
ся и в определенных пределах подвергнуться восстановлению
и нейтрализации без появления повреждений растения. Токсич-
ность значительно уменьшается при окислении сульфита в сульфат.
При разной скорости поглощения загрязнителей появляются
разные симптомы повреждения. Быстрое проникновение боль-
1 См. сноску на стр. 126.
138
Рис. 2.15. Действие загрязни гелей воздуха
на хозяйственную ценность растений
шого количества загрязнителя и лист вызывает разрушение ме-
зофилла и возникновение некроза листа. Продолжительное дей-
ствие низких концентраций токсического агента, как правило,
сопровождается появлением хлороза листьев.
Главную опасность для растительности представляет хрони-
ческое воздействие низких концентраций SO,, распространяю-
щихся на очень больших территориях Кратковременное воздей-
ствие высоких концентраций встречается нечасто.
Физиологическое действие SO, на растения имеет сложный мс-
ханизм. Упрощенно его можно представить следующим обра-
зом Диоксид серы действует непосредственно на листья расте-
ний. В клетках за счет воды образуется сернистая кислота H,SO3,
которая диссоциирует с образованием пиросульфит-ионов Н$О3_.
Далее в результате ряда биохимических превращений происхо-
дят поражение мембран хлоропластов и обесцвечивание хлоро-
филла. Под влиянием SO, листья желтеют, причем пожелтение
происходит в первую очередь в областях между прожилками лис-
та. На них появляются полоски желтоватого или коричневато-
красного цвета. Наряду с разрушением мембран и обесцвечивани-
ем красящих веществ листьев ион HSO3_ нарушает деятельность
ряда ферментов, понижая их активность. При наличии значи-
тельных повреждений перенос веществ между мембранами нару-
шается, в результате чего проявляются некрозы листьев, т. е. отми-
рание целых участков циста. Возможно, что действие SO2 является
причиной уменьшения морозостойкости почек деревьев.
139
Токсическое действие S03 сильнее проявляется в темноте,
чем на свету. Это связано с тем, что на свету HSO, в хлороплас-
тах превращается в органически связанные группы SH ', кото-
рые являются сгроительным компонентом аминокислот. В ре-
зультате SO,, концентрация которого сначала была близка к ток-
сической, в какой-то степени оказывается даже полезным для
растительного организма.
Видимым симптомам повреждения могут предшествовать
различные реакции на уровне клеток и органов, которые клас-
сифицируются как скрытые повреждения. Это понятие в основ-
ном включает функциональное повреждение растения под воз-
действием загрязнителя воздуха без видимых проявлений этого
воздействия. Загрязнитель может вызывать торможение роста,
уменьшение урожая без видимых морфологических изменений.
Например, у однолетних растений, подвергшихся воздействию
SO,, было отмечено значительное снижение урожая, в то время
как другие симптомы повреждения были выражены слабо. Пос-
ле контакта Loliumрегеппе (плевел многолетний, или райграс па-
стбишный, английский) с воздухом, содержащим SO, в концен-
трации 0,2 мг/м’, в течение 6 мес. отмечалось замедление роста
на 52% по сравнению с контрольными растениями. Это было
связано с ослаблением кущения, уменьшением образования но-
вых листьев и их ранним старением. Эти примеры показывают,
что возможно снижение ожидаемой ценности растительности
даже при отсутствии видимых симптомов повреждения.
Хорошо заметный некроз листьев, постепенно усиливающий-
ся по мерс приближения к источнику, служит гарантией выявле-
ния действия загрязнителя и мерилом степени повреждения.
Однако при долгосрочных действиях низких концентраций за-
грязнителя столь очевидных реакций не наблюдается. В таких
случаях увеличивается возможность скрытых повреждений.
Свободные от зафязнителей временные периоды, в течение ко-
торых может происходить восстановление нарушений в расте-
ниях, сравнительно редки. Поэтому в экологическом отноше-
нии долгосрочное воздействие низких концентраций является
более опасным по сравнению с кратковременным действием вы-
соких концентраций загрязнителя воздуха.
Снижение урожая и подавление роста растений — вот конеч-
ный результат цепной реакции, начавшейся с проникновением
загрязнителя в растительную клетку.
В табл. 2.11 приведены данные о степени повреждения ело-
вых насаждений в Германии в 1970-е гг. под воздействием SO2.
Незначительные повреждения отмечаются при средней концент-
рации SO2 0,025 мг/м’ воздуха, а сильные повреждения — при
концентрации 0,05 мг/м’. Гибель деревьев всех возрастных
групп происходила при концентрации 0,07—0,09 мг/м’.
140
Таблица 2. И
Зависимость степени повреждения еловых насаждений
от концентрации SO2 п воздухе и содержания серы в хвое
(по Р. Гудериану, 1979)
Степень повреждения Средняя концентрация SO,, мг/м5 Среднее содержание серы в хвое, %
в течение годя в период роста во время зимы
Без видимых повреждений 0.015 0,005 0,030 0,1
Слабое повреждение, некоторое снижение ассимиляции 0,025-0,035 0,01-0,02 0,05-0,06 0,135
Среднее повреждение, 0,03-0,04 0,02-0,03 0,05-0,07 0,165
значительное снижение ассимиляции, отдельные случаи гибели деревьев Сильное повреждение. значительное снижение ассимиляции, изреженность 0,05-0,07 0,02—0,05 0,07-0,09 0,240
древостоя вследствие гибели деревьев Гибель деревьев всех возрастных групп 0,07-0,09 0,04-0,07 0,1-0,2 0,320
Сильные повреждения сосновых насаждений по сравнению
с еловыми наблюдаются при более высоких концентрациях SO2 —
порядка 0,18 мг/м3 воздуха. Устойчивые виды растений повреж-
даются только при концентрации SO, 2 мг/м3.
Если SO2 действует на растения в сочетании с другими атмо-
сферными загрязнителями, то преобладают аддитивные или си-
нергетические эффекты Например, у таких pacrci шй, как кочан-
ная капуста, цветная капуста и томаты, аддитивный эффект про-
является при комбинированном воздействии SO2 и озона.
Существование четкого синергизма обнаружено при одновре-
менном поглощении SO и НС1 растениями (овсом, клевером
луговым и шпинатом) Ослабление повреждающего действия
токсикантов (антагонизм) наблюдается очень редко. Например,
при добавлении SO, отмечается снижение фитотоксичности
смеси озона и продуктов сжигания бензина. Число совместно
встречающихся биологически активных загрязнителей все вре-
мя возрастает. В крупных городах велика плотность промыш-
ленных предприятий, являющихся источниками самых разных
атмосферных загрязнителей. В целом опасность повреждения
растительности при одновременном присутствии нескольких
токсикантов в атмосфере возрастает.
Как известно, сера является жизненно важным, незамени-
мым элементом растительных организмов Она находится в рас-
141
тениях в органической (составная часть белков) и неорганиче-
ской формах, обеспечивает нормальный рост растений Из всех
органов растений наиболее богаты серой листья. Содержание
органически связанной серы колеблется от 0,06% в хвое до 0.7%
в листьях некоторых крестоцветных. Не связанная в органичес-
ких соединениях сера присутствует в растениях в форме сульфа-
та. В зависимости от поглощения из почвы и воздуха се количе-
ство в растении в сульфатной форме может значительно превы-
шать количество органической серы. При этом если содержание
органической серы увеличивается незначительно или остается
постоянным, то избыток серы в форме сульфата, который являет-
ся резервом серы, отлагается прежде всего в клеточных вакуолях.
Высшие растения поглощают серу через корни, главным об-
разом также в форме сульфатов. Дополнительным источником
серы может служить SO , ассимилированный из воздуха. Расте-
ния хлопчатника способны поглощать из воздуха до 50% всей
содержащейся в них серы. Изучение дефицитных но сере расте-
ний подсолнечника, кукурузы и табака показали, что поступаю-
щий из воздуха SO, может служить основным источником серы
и обеспечивать их нормальный рост. Поступившая из воздуха
сера была обнаружена в растениях в виде тех же соединений, что
и сера из почвы, хотя и оказалась менее эффективной физиоло-
гически. Тем не менее положительное влияние поглощения SO2 из
воздуха можно наблюдать лишь на почвах, бедных доступной серой.
Растения на таких почвах выдерживают более высокие концент-
рации SO2 в воздухе.
Из общего выброса SO2 существенная часть серы попадает
в почву с осадками. В загрязненных районах осадки могут содер-
жать значительно больше серы, чем осадки непромышленных
районов, что может привести к закислению почв. Ежегодное по-
ступление серы из осадков колеблется от 5 до 250 кг на гектар
в зависимости от исходного количества SO2. Содержание погло-
щенной серы в еловом древостое в три раза превышает ее по-
ступление в буковый древостой или ее задержание на безлесной
местности. Обща?! поверхность елового дерева очень велика за
счет хвои и большого количества отмершей древесины. В осо-
бенности после осадков большие количества SO2 адсорбируются
на поверхностных водных пленках. Этим обусловловлен значи-
тельный эффект отфильтровывания воздуха еловыми насажде-
ниями.
Сравнение влияния на растения газообразных SO2, НС1 и HF
показывает, что HF значительно более опасен, чем SO,. По фи-
тотоксичности НО и SO2 различаются мало, при этом для расте-
ний значение имеет нс только неодинаковая токсичность этих
газов, но и степень их поглощения: фторидов накапливается
в 8,5 раза больше, чем серы, а хлоридов — в 2,5 раза больше.
142
Растения обладают малой способностью к детоксикации по-
глощенных загрязнителей. Это связано с недостатком продол-
жительных периодов, свободных от загрязнителей, а также с на-
коплением загрязнений в растениях и почве.
Исключительная чувствительность растений и их специфи-
ческие реакции на конкретные загрязнители используются для
конфоля загрязнения воздуха, установления предельно допус-
тимых концентраций загрязнителей, разработки мер защиты
растительности.
Критерии качества (чистоты) воздуха представляют собой ко-
личественные взаимосвязи между степенью загрязнения воздуха
и реакциями человека, животных, растений и материалов. Ука-
занные взаимоотношения доза—реакция служат научной осно-
вой законодательства в области экологических стандартов Рас-
тения особенно чувствительны к существующим загрязнителям
воздуха, и взаимоотношения доза—реакция, определенные для
растений, составляют основу для выработки стандартов содер-
жания SO2 в воздухе.
При определении стандартов руководствуются нс только пред-
отвращением отрицательных последствий загрязнения воздуха,
но и техническими возможностями. Таким образом, стандарты
являются чем-то средним между научно установленной необхо-
димостью определенного качества воздуха и техническими и
экономическими возможностями уменьшения выбросов. В раз-
ных странах действуют разные стандарты, и со временем они пе-
ресматриваются. Приведем некоторые из них. Например, в ФРГ
в 1974 г. были приняты следующие стандарты для защиты расти-
тельности от действия SO2:
• 0,14 мг SO2/m3 воздуха — для долговременных воздей-
ствий;
• 0,40 мг SO2/m3 воздуха — для кратковременных воздей-
ствий.
В США приняты более жесткие первичные и вторичные стан-
дарты. Первичные стандарты определяются защитой челове-
чества от вредного воздействия загрязнений. Вторичные стан-
дарты предусматривают соответствующую защиту раститель-
ности на основе наиболее чувствительной по отношению к SO2
грутшы растений.
Первичные стандарты SO2:
• 0,08 мг SO2 /м3 воздуха (0,03 млн-1) — средняя годовая кон-
центрация;
• 0,365 мг SOj/m3 воздуха (0,14 млн-1) — максимальная сред-
няя 24-часовая концентрация, превышение которой допускает-
ся только один раз в год.
Вторичные стандарты SO2:
• 0,06 мг SO2 /м3 воздуха (0,02 млн ’) — средняя годовая кон-
центрация;
143
• 0,260 mi SO2 /м воздуха (0,10 млн-1) — максимальная сред-
няя 24-часовая концентрация превышение которой допускает-
ся только один раз в год;
• 1,3 мг/м3 воздуха (0,5 млн-1) — максимальная средняя трех-
часовая концыгграция, превышение которой допускается толь-
ко один раз в год.
Растения нс только чувствительны к загрязнителям воздуха,
но и проявляют специфические реакции и могут быть использо-
ваны в качестве биологических индикаторов для выявления и
оценки влияния атмосферных загрязнителей. На разные по хи-
мическому составу зафязнители растения отвечают соответ-
ствующими реакциями, т. е. индикаторные растения могут быть
пригодны для выявления отдельных загрязнителей воздуха,
а также для контроля за состоянием воздуха. Путем использова-
ния высших и низших индикаторных растений удается обнару-
жить SO2, HF и НС1 даже в тех местах, где одновременно присут-
ствует несколько загрязнителей. Например, в качестве индика-
торных растений на фториды можно использовать злаковые
травы, листовую капусту и гладиолусы. Наряду с высшими рас-
тениями эпифитныс организмы, такие как лишайники, очень
подходят в качестве индикаторов действия за!рязнителя Вы-
бросы SO, от металлургических заводов являются причиной ис-
чезновения некоторых листоватых лишайников и общего умень-
шения популяции лишайников. При средней концентрации SO2
0,23 мг/м воздуха исследовавшийся лишайник Hypogymnia phy-
sodes, широко распространенный на территории Европы, пол-
ностью вымирал за 29 суток Установлена зависимость между
степенью повреждения естественной лишайниковой флоры и
концентрацией SO2 в атмосфере. Обнаружена большая чувстви-
тельность Hypogymnia physodes к SO2, HF и НС1. Опыты показы-
вают, что кратковременное воздействие (до 5—7 суток) высоких
концентраций SO2 (1,9 мг/м3 воздуха), по-видимому, менее опас-
но для листоватого лишайника Hypogymnia physodes, чем для не-
которых высших растений (Acer platanoides — клен плагановид-
ный, Trifolium repens — клевер ползучий, Chrysanthemun leuc. —
хризантема белая, из группы грунтовых многолетних хризантем,
Picea ahies — ель обыкновенная) Некроз у высших растений по-
является раньше, чем можно было обнаружить какие-либо при-
знаки реакции у слоевища лишайника. Вместе с тем долговре-
менное воздействие (свыше 15—17 суток) низких концентраций
вызывает более продолжительные заболевания у лишайников,
чем у высших растений (Vilis vinifera — виноград культурный,
Picea ahies — ель обыкновенная, Pinusstrobus — сосна Всймуто-
ва) Отсюда следует, что llypogymnia physodes является хорошим
индикатором для регистрации низких концентраций загрязпи-
144
телей в атмосфере. Величины накопления загрязнителей у ли-
шайников и высших растений довольно близки. Например, ско-
росгь накопления серы у лишайников была близка к скорости
накопления этого загрязнителя у клубники и сосны Веймутова.
Поглощение загрязнителя у лишайников больше зависит от вре-
мени воздействия, чем от концентрации.
«Лишайниковые пустыни» в больших городах и промышлен
ных районах и уменьшение разнообразия видов лишайниковых
популяций в менее загрязненных областях свидетельствуют об
очень большой чувствительности этих организмов к атмосфер-
ным загрязнителям.
В сельском хозяйстве, садоводстве и лесоводстве необходимо
учитывать специфическую видовую устойчивость растений
к действию атмосферных загрязнителей (см табл. 2.12) Культи-
вирование устойчивых видов и сортов является одним из основ-
ных мероприятий по снижению действия атмосферных загрязни-
телей на растительные сообщества.
Таблица 2.12
Степень опасности для отдельных групп растений
при хроническом воздействии SO,
Виды растений (Степень опасности*1
Сельскохозяйственные культуры
Злаковые, включая кукурузу
Бобовые (клевер, люцерна)
Крестоцветные, подсолнечник
Картофель
Спекла и капуста
Кормовые растения (для зеленого корма, сена и силоса)
Виды зерновых злаков и злаковых гран
Кормовые бобовые, включая клепероподобпыс кормовые
растения
Крестоцветные и подсолнечник
Виды листовой и кормовой капусты
Овощи
Крестоцветные
Бобовые
Зонтичные
Маревые
Тыквенные
Сложноцветные
Пасленовые
Лилейные
Луга и пастбища
Злаковые
Клсвсроподобные растения
145
Таблица 2.12 (продолжение)
Виды растений Степень опасности”
Плодовые
Семечковые плоды -г + + +
Косточковые плоды Ягоды (кроме клубники), грецкий орех + + 4* 4- 4* 4- 4-
Лещина + + +
Виноград Клубника 4-4-4- +
Леса и лесные культуры
Пихта, ель, сосна Веймугова Сосна австрийская, туя, тисс, кипарисовик, + + + + +
можжевельник, лиственные деревья + + +
Декоративные растения
Лилейные, касатиковые, амарилисовые Лютиковые, розовые + + 4-
Мотыльковые Гераниевые 4-4-4- +
Аралиевые 4-
Гвоздичные + +
Вересковые Сложноцветные + +
” Раз личают следующие степени опасности: очень слабая (+), слабая (++)
средняя ( Н-1), сильная (++++) и очень сильная (+++++)
11ри распределении по группам по степени опасности учиты-
вается снижение продуктивности растений, уменьшение коли-
чества и качества урожая.
Как показано в табл. 2 12, существует различная степень
опасности от постоянного воздействия сернистого газа в разно-
образных случаях практики землепользования. Весьма чувстви-
тел ьны к S02 фруктовые деревья, такие как яблони, груши, а так-
же хвойные (пихта, ель, сосна). Большую опасность представля-
ет сернистый газ для ягодных культур и грецкого ореха. Нс
рекомендуется разведение семечковых плодовых кул ь гур в райо-
нах загрязнения атмосферы сернистым газом. Хлопчатник, лю-
церна и ячмень весьма чувствительны к SO2. К числу относи-
тельно устойчивых против SO2 культур относятся подсолнечник,
картофель, свекла, капуста, тыква. Из декоративных растений
наиболее чувствительны к SO, мотыльковые, более устойчивы
представители аралиевых, вересковых, сложноцветных семейств.
Под влиянием SO2 может происходить сильное подкисление
почв. Для снижения кислотности и поддержания pH (водород-
ною показателя) в оптимальных для растений пределах необхо-
димодостаточное количество кальция. Кроме того, он повыша-
ет устойчивость растений к SO, и НЕ У определенных растений
146
оптимальная обеспеченность азотным питанием снижает погло-
щение этих загрязнителей. Калий также увеличивает устойчи-
вость растений, уменьшает степень повреждения растений, осо-
бенно в случае воздействия SO,.
К другим мероприятиям по снижению действия загрязните-
лей относятся подрезка с целью омоложения процессов роста
вегетативных и генеративных органов, посадка защитных рядов
устойчивых растений перед чувствительными культурами.
Воздействие SO2 на металлы, строительные, отделочные и другие
материалы Сернистый газ в гораздо большей степени, чем другие
газообразные загрязнители (СО, СО,, О3, оксиды азота), действу-
ет разрушающе на строительные материалы, металлы, отделоч-
ные материалы внутри помещений, на ткани, бума!у, кожу ит. д.
В присутствии SO, ускоряется атмосферная коррозия железа и
его сплавов, а также цинка, меди и алюминия. Протекание этого
процесса обеспечивает влажная атмосфера. В сухом воздухе ме-
таллы практически не подвергаются действию сернистого газа.
В промышленных районах с более высокой концентрацией
SO2 коррозия железа и стали наблюдается в большей степени,
чем в сельских районах.
Основными продуктами электрохимической коррозии желе-
за в гонкой пленке воды на поверхности металла (в отсутствие
SO,) являются Fe(OH),, FcO(OH), Ге3О4 и др. (см. учебники по
общей и неорганической химии).
Содержащийся в атмосфере SO, растворяется во влажной
пленке на поверхности металла, при этом образуется сернистая
кислота, которая окисляется в серную кислоту. На поверхности
железных изделий образуется корка гшроскопичного FcSO4,
толщина которой все время увеличивается:
Fc + H,SO4 —»l’eS04 + Н2. (2.55)
Гигроскопичные соли поглощают воду даже из ненасыщенного
влагой воздуха. Таким образом, влажные пленки на поверхности
металла представляют опасность даже в относительно сухой мест-
ности.
Сульфат железа в водном растворе в результате гидролиза
2feSO4 + 2Н,О ♦=₽ (FcOH),SO4 + H,SO4 (2.56)
показывает кислу ю реакцию, что допол н итеяыю усиливает дей-
ствие кислоты на металл. Растворенный сульфат железа(П)
окисляется на воздухе с образованием основной соли сульфата
железа(Ш), являющейся составной частью ржавчины:
2FeSO4 + Н,О + >/,О2 - ► 2Fe(OH)SO4. (2.57)
Считают, что одной из причин ускорения электрохимиче-
ской коррозии железа в присутствии SO, является образование
раствора FcSO4, который служит проводником ионов.
147
Аналогичным образом объясняется ускорение атмосферной
коррозии Zn, Си и Л1 под действием сернистого газа. Оно обуслов-
лено образованием ZnSO4, CuSO4 6Cu(OH)2 и A12(SO4)3 I <sH,O со-
ответственно. Однако следует заметить, что для меди и алюми-
ния поглощение сернистого газа наблюдается в меньшей степе-
ни, чем для железа и цинка.
Большой ущерб от коррозии претерпевает старинная бронза.
На поверхности бронзы образуется слой патины сине-зеленого
цвета, состоящей из карбонатов и сульфатов, а иногда и хлори-
дов. На патине обычно отлагаются слои пыли и копоти. Эта кор-
ка удерживает воду, в которой непрерывно растворяются кисло-
тообразующие газы, в том числе SO2. Получившаяся оболочка,
содержащая кислоту', разъедает металл, переводя его в виде ионов
в раствор. При таком коррозионном процессе поверхность
бронзовых изделий и скульптур теряет свою первоначальную
форму и разрушается.
Под действием SO, и особенно образующейся из него серной
кислоты происходит разрушение не только металлов, но и строе-
ний с известковой кладкой, памятников зодчества, произведе-
ний искусства, изделий из мрамора, известняка (СаСО3), ошту-
катуренных поверхностей, стекол, бетона и других строительных
материалов. В большей степени эти разрушения связаны с дей-
ствием кислотных дождей, т. е. кислот, образующихся не на
влажной поверхности материалов, а непосредственно в атмо-
сферном воздухе, что рассмотрено в разд. 2.6.2
Сорбция сернистого газа происходит не только на внешней
поверхности строительных конструкций, но и внутри помеще-
ний. Наиболее эффективными абсорбентами диоксида серы яв-
ляются естественные ткани (обивка из хлопка, шерстяной ткани
и кожи) и эмульсионные краски.
В большинстве случаев считают, что концентрация газов
внутри помещения меньше, чем вис помещения. Например, для
SO2 она меньше в пять раз. Период полувыведения этого газа
(время, в течение которого концентрация газа снижается на
50%) составляет 40—60 мин. Однако в помещениях при работе
неисправных газовых горелок, газовых обогревателей и каминов
содержание SO, и СО может оказаться более высоким, чем вне
помещений.
Исследования, проведенные с СО, NO„ О3 и SO2, показали,
что действие сернистого газа на материалы, находящиеся внутри
помещения, наиболее вредное. Неокрашенные каменная и бе-
тонная кладки, известковый раствор и кирпич поглощают SO2
с образованием сульфатов. Особенно пагубно образование суль-
фатов для материалов, содержащих СаСО3, так как объем 1 моль
CaSO. больше, чем объем 1 моль СаСО3, т. е. в материале возни-
кает механическое напряжение, что ведет к появлению трещин.
148
Особое значение такое явление имеет для старинных зданий, где
серьезной проблемой стало разрушение фресок.
Ог воздействия SO2 разрушаются и многие органические ма-
териалы — бумага, ткани, кожа, резина и красители. Бумага, тка-
ни и кожа образованы гидрофильными веществами, которые на-
капливают воду между волокнами. При растворении SO2b порах
образуется сернистая кислота, которая может окисляться в сер-
ную при каталитическом воздействии тяжелых металлов, содер-
жащихся в следовых количествах в перечисленных материалах.
Кислоты постепенно гидролизуют макромолекулы, главным об-
разом целлюлозы и белков, в результате чего эти материалы ста-
новятся хрупкими.
Хлопковые, вискозные и нейлоновые ткани разрушаются при
низких концентрациях SO2. Они теряют свою механическую
прочность. Действие SO2 особенно опасно для изделий из бума-
। и (книг, документов и т. п.). Аналогичное воздействие испыты-
вают и изделия из кожи. Как восстановитель S02 может вызвать
обесцвечивание красителей, что приводит к выцветанию раз-
личных тканей.
Существует несколько способов уменьшения вреда, наноси-
мого материалам сернистым газом. Наиболее простым и доступ-
ным является кондиционирование воздуха помещения, в про-
цессе которого вентилируемый воздух пропускается через фильт-
ры или скрубберы. Принцип их работы рассмотрен в разд. 2.7
«Защита атмосферы от химического загрязнения». Наиболее
цепные старинные книги, ткани и кожу необходимо хранить
в помещениях или витринах, заполненных отфильтрованным
воздухом. Для предохранения книг и документов от разрушения
нужно использовать более устойчивые к действию SO2 бумагу и
переплет.
Вопросы и задания
1.1 (азовитс природные и антропогенные источники сернистого газа. 2. Какое про-
изводство является основным антропогенным источником SO2? 3. Учитывая время
жизни соединений серы, оцените возможности их распространения в атмосфере. При-
ведите примеры. 4. Напишите уравнения химических превращений SO, в атмосфере.
5. В каком случае может происходить нейтрализация диоксида серы и образуемых им
кислот в атмосфере? Назовите и другие естественные пути очищения атмосферного
воздуха от SO,. 6. Что такое смог «лошонскси о типа»? Приведите примеры экологиче-
ских последствий его образовании в разных странах мира. 7. Охарактеризуйте физиоло-
гическое воздействие SO, на человека и животных. 8. Объясните причины синергети-
ческого эффекта пыли и диоксида серы на здоровье человека. 9. Назовите экологиче-
ские стандарты на содержание SO, в атмосфере. 10. По табл. 2.10 охарактеризуйте
воздействие атмосферных загрязнителей на растения: а) клеточный уровень; б) отдель-
ные органы; в) растение в целом; г) растительное сообщество. 11. Каково влияние SO2
на биохимические процессы в растениях? 12. Что включают в себя понятия повреждения
растений и ущерб от воздействия атмосферных загрязнителей? 13. Охарактеризуйте симп-
149
темы понрсждсния растений при действии сернистого raja- Что такое хлороз и некроз?
14. Какие виды древесных растений наиболее чувствительны к действию SO2? 15. При-
ведите примеры аддитивного синергетического и антагонистического эффекта при со-
вместном действии на растения SO, и других атмосферных загрязнителей. 16. Каким
образом высокая чувствительность растений учитывается прн установлении ПДК сер-
нистого газа в воздухе? 17. Что такое биологические индикаторы? Приведите примеры
использования индикаторных растений. 18 Приведите примеры различной чувстви-
тельности сельскохозяйственных растений к воздействию SO,. 19. Назовите ряд меро-
приятий но снижению действия атмосферных загрязнителей в сельскохозяйственной
практике и десовоястве. 20. Объясните ускорение атмосферной коррозии железа, цин-
ка, меди и алюминия под действием сернистого газа. 21. Какие строительные конструк-
ции разрушаются под действием SO2 и образующейся из него серной кислоты? 22. По-
чему опасно образование сульфатов для строительных материалов, содержащих СаСО/?
23. Объясните причины разрушающего дейст вия сернистого газа на ткани, бумшу, ко-
жу и красители.
Задачи
I. Электростанция сжигает за сутки 1000 т угля, содержащего 3% серы. Допустим,
что 10% образующегося при сжигании угля сернистого газа окисляется в серный ангид-
рид, который превращается в серную кислоту. Расположенный рядом завод по обжигу
известняка ежесуточно выбрасывает в атмосферу ло 50 кг оксида кальция, который реа-
гирует с атмосферной влагой. Написать уравнения всех упомянутых реакций и после
вычисления ответить на вопрос: достаточно ли образующегося в атмосфере гидроксида
кальция для нейтрализации серной кислоты, образующейся в результате работы дан-
ной ТЭС? 2. Используя прнведешюе в данном разделеураннснис. рассчитайте, сколько
процентов населения заболеет хроническим бронхитом при концентрации SO, в возду-
хе 1,3 мг/м1. Как реагируют на эту концентрацию люди, обладающие повышенной чув-
ствительное! ью к действию сернистого газа и больные астмой? 3. Наблюдалось ли пре-
вышение среднесуточной предельно допустимой концентрации сернистого газа и во
сколько раз а) около медеплавильного завода с концентрацией SO, в атмосфере 0,15 мг/м’;
б) в районе тепловой злектростанции (С(SO,) = 0,20 мг/м *); в) на автотрассе (C(SO,) =
•* 0,05 мг/м3)? Какие отклонения в здоровье могут наблюдаться у .падей, живущих
в этих районах? Будут ли отмечаться повреждения сосновых и еловых деревьев, если
средняя концентрация SO, в течение года будет составлять указанные значения? Для
ответа на последний вопрос используйте данные, приведенные в табл. 2.11 ин поясне-
ниях к ней.
2.5.3. Оксиды азота. Фотохимический туман
Естественные и антропогенные источники. Оксиды азота (NO и
NO2), как и SO2, относя гея к основным загрязнителям атмосферы.
Они вызывают как локальные, так и глобальные изменения в окру-
жающей среде. Концентрация этих газов в чистом воздухе невели-
ка. Для NO2 она составляет менее 0,02 млн-1, или 2 • 1(Ноб.%. Мо-
нооксид азота NO присутствует в воздухе лишь в следовых коли-
чествах. Масса указанных газов в атмосфере соответственно
составляет 0,013 Ю9 г и 0,005 109т. Монооксид NO и диоксид
NO, азота в экологической литературе часто обозначают общей
150
формулой NOX. В несколько большем количестве по сравнению
с NO и NO? в воздухе содержится оксид диазота N,O. Его кон-
центрация равна 0,5 млн-1 (5 10-5 об.%), а масса — 2 - 109т.
Естественными источниками оксидов азота в атмосфере явля-
ются лесные пожары, |розовые разряды, при которых образуется
монооксид NO, окисляющийся затем в диоксид NO2:
N2 + О, ±=> 2NQ 2NO + О, —> 2NO,.
Оксиды азота, образующиеся в процессах микробиологической
денитрификации в почве, также выделяются в атмосферу:
NO,-—> NO,-—♦ NO—* N2O—>N,.
Основное количество оксида диазота N,O выделяют азотсодер-
жащие соединения почв, N2O образуется также в процессах сжи-
гания биомассы и при использовании азотных удобрений. В про-
цессе ферментации силоса может выделят вся в очень небольших
количествах диоксид азота NO2. Природные источники дают до
770 млн т NO, в год (в пересчете на NO2).
Основным антропогенным источником оксидов азота (NO и
NO2) являются процессы высокотемпературного сгорания раз-
личных видов топлива (природного газа, угля, бензина, мазута)
на тепловых электростанциях, промышленных установках и
в автомобильных двигателях. Примерно 90% всех выбросов ок-
сидов азота в атмосферу связаны с сжиганием топлива, в процес-
се которого протекают реакции двух типов: 1) реакция между О2
воздуха и азотом, содержащимся в топливе, 2) реакция между О2
воздуха и азотом, содержащимся в воздухе. Ответственность за
поступление оксидов азота в атмосферу несут и некоторые отрас-
ли химической промышленности, в частности производители
азотной кислоты («лисьи хвосты» над трубами), серной кислоты
нитрозным методом, взрывчатых веществ. Поступление оксидов
азота происходит и в других процессах нитрования, и при очист-
ке металлов азотной кислотой, а также при ядерных взрывах. На
долю химической промышленности приходится около 5% выбросов
NOr Антропогенные источники выделяют до 60 млн т оксидов
азота в год (в пересчете на NO,).
В большинстве развитых стран главным антропогенным ис-
точником оксидов азота остается автомобильный транспорт, на
его долю в среднем приходится 40—50% выбросов. На рис. 2.16
показана роль различных антропогенных источников в эмиссии
оксидов азота в атмосферу.
В отличие от сернистого газа основное количество оксидов
азота в атмосфере имеет природное происхождение. Па долю
антропогенных источников приходится только около 10% об-
щей эмиссии NO. NO,, N,O, в то время как около 90% SO2 в ат-
мосфере является продуктом человеческой деятельности.
151
Рис. 2.16. Доля ангропогенных источников
в поступлении оксидов азота в атмосферу:
1 — автотранспорт; 2 — ТЭС; 3 — сжигание топлива в промышленности;
4 — все прочие источники
Поведение и реакции в атмосфере. Диоксид азота NO, сохраня-
ется в атмосфере лишь несколько суток, считается, что средняя
продолжительность жизни в атмосфере соединений азота со-
ставляет -4 сут.
Доля осаждений по сравнению с эмиссией (выбросами, по-
ступлениями в атмосферу) для соединений азота еще более не-
значительна, чем для соединений серы. Это объясняется тем,
что оксиды азота, вступая в разнообразные химические реакции,
дольше остаются в атмосфере и переносятся на более значитель-
ные расстояния от источника, чем соединения серы. Например,
на территории Белгородской области осаждение соединений
азота в большей степени, чем соединений серы, обусловлено
внешними поступлениями от соседних областей и государств —
доля каких поступлений составляет 75% от общих поступлений
азота, которые за период 1985—1995 гг. составили в среднем
7 тыс. т N в год. Какие же химические превращения происходят
с оксидами азота в атмосфере?
Первоначально образующийся мопооксид азота NO окисля-
ется в диоксид NO, кислородом воздуха (см. реакцию (2.2)):
2NO + О2 —► 2NO,
или озоном:
NO + О, —> NO; + О,. (2.58)
В образовании NO, могут принимать участие и свободные ра-
дикалы, в частности гидропероксид-радикал НОО':
НОО' + NO—> NO; + НО’. (2.59)
Рассмотрим некоторые источники озона и псроксид-радика-
лов, необходимых для окисления NO в NO2.
152
Источником тропосферного озона в незначительной степени
является и стра тосфера, но в основном он зарождается в тропо-
сфере, причем схема процесса резко отличае тся от образования
стратосферного озона.
На начальных стадиях процесса решающую роль ш-рает СО:
СО + ОН —► И’ + СО,; (2.60)
Н + О, + М—>НООЧ-М, (2.61)
где М — частицы, участвующие в столкновениях, но не вступаю-
щие в реакции, например N2. Образующийся при этом радикал
НОО' окисляет NO до NO, (см. уравнение (2.59)).
Ночью NO2 стабилен. Днем под влиянием солнечного света
(область длин волн менее 430 нм) NO2 расщепляется на NO и О
(фотолиз):
NO2-^>NO+O. (2.62)
Этот активный атомарный кислород при взаимодействии
с молекулярным кислородом может образовывать озон, при
этом требуется присутствие инертных частиц М
О + О, + М —♦ О3 + М. (2.63)
Образующийся таким образом в тропосфере озон окисляет NO
до NO, (см. уравнение (2.58)).
NOj может участвовать и в ряде других реакций. В присут-
ствии пыли, содержащей карбонаты щелочных и щелочнозе-
мельных металлов, происходит образование соответствующих
нитритов и нитратов:
2NO, + Na2COj + НгО —> NaNO, + NaNO, + Н,СО,; (2.64)
4NO; + 2CaCOj 2Н2О —♦ Ca(NO,), + Ca(NO,), + 2Н,СО,. (2.65)
Образующиеся соли менее токсичны, чем NO2.
Во влажном воздухе диоксид азота вступает в реакцию с Н2О
с образованием азотистой и азотной кислот:
2NO, +11,0 —» HNO, + HNO,. (2.66)
Данную реакцию можно рассматривать как вариант дальнейше-
го ослабления токсичности, гак как при этом ослабляется окис-
лительная активность NO,. Образующаяся азотистая кислота
при больших концентрациях может оказывать мутагенное дей-
ствие. Однако UNO, в атмосфере в больших количествах нс об-
разуется, гак как она неустойчива
В незначительной степени NO, может реагировать с радика-
лами ОН-, возникающими при фотолизе воды ультрафиолето-
вым светом, с образованием азотной кислоты:
NO, + ОН —* HNO-. (2.67)
153
Азотистая и особенно азотная кислоты вносят свой вклад
в образование кислотных дождей.
Оксид диазота (N2O), также содержащийся в атмосфере, под
действием солнечного излучения может превращаться в моно-
оксид азота NO. Последний после ряда превращений также вно-
сит свой вклад в проблему кислотных дождей:
2N2O 2NO + N,; (2.68)
2NO + O,—».2NOj;
2NO, + Н2О—►HNO,+ HNOj. (2.69)
В зависимости от высоты нахождения в атмосфере N2Q как и
NO2, может выполнять различную функцию: либо разрушать
озон, либо спасать его. Кроме того, N2O проявляет себя как пар-
никовый газ. Подробнее это обсуждается в разделе «Глобальные
экологические проблемы».
Азотная кислота в атмосфере, реагируя с различными вещест-
вами, образует нитраты, которые затем выпадают на землю с осад-
ками в виде минеральных аэрозолей. Одной из таких реакций
является взаимодействие с аммиаком:
HNO, + NHj —> NHtNO-. (2.70)
В водном растворе аммиак имеет щелочную реакцию, вслед-
ствие чего может частично нейтрализовать атмосферные кис-
лотные осадки. Важнейшими источниками атмосферного ам-
миака, являющегося продуктом разрушения органических ве-
ществ, служат почва, моча животных, а также производство и
внесение в почву азотных удобрений.
На рис. 2.17 представлены перечисленные превращения окси-
дов азота с указанием их основных антропогенных источников.
Фотохимический смог. Оксиды азота играют большую роль
в возникновении фотохимического смога, называемого также
фотохимическим туманом. Этот смог был впервые обнаружен
в 1944 г. над Лос-Анджелесом (США), наиболее часто наблюдал-
ся там в последующие годы, поэтому его называют смогом лос-
инджелесского типа.
В смоге лондонского типа, который мы рассмотрели в преды-
дущем разделе (2.5.2), практически не образуется каких-либо
новых веществ, а его токсичность полностью зависит от исход-
ных загрязнителей. Возникает он в результате сжигания боль-
ших количеств топлива. В смоге лос-анджелесского типа в ре-
зультате реакций, протекающих под действием солнечного света
в смеси углеводородов и оксидов азота, образуются новые веще-
ства, значительно превышающие по своей токсичности исход-
ные атмосферные загрязнения. Лос-Анджелесский смог пред-
ставляет собой сухой туман с влажностью около 70%. Фотохими-
ческий туман образуется при значительно меньших выбросах
154
Взаимодействие с ОН"
Рис. 2.17. Химические превращения оксидов азота в атмосфере
(без учета образования фотохимического смога)
в атмосферу по сравнению с лондонским смогом, и для него бо-
лее характерна желто-зеленая или сизая сухая дымка, а нс
сплошной туман.
Основной причиной фотохимического тумана являются выхлопные
газы автомобилей. На каждом километре пути легковой автомобиль
в среднем выделяет около 10 г оксида азота(П). В Лос-Анджелесе
еще в 1970-е гг. было более 4 млн автомобилей, в воздух поступало
около 1000 тэтого газа в сутки. Явно выражешштй фотохимический
туман наблюдается в этом городе более 70 дней в году.
Рассмотрим уравнения химических реакций, приводящих
к образованию смога лос-анджелесского типа. В ясные дни сол-
нечная радиация вызывает расщепление молекул диоксида азота
с образованием монооксида азота и атомарного кислорода (см.
реакцию (2.62)):
NOj^E^NO + O.
Атомарный кислород с молекулярным кислородом воздуха
даст озон (см. уравнение реакции (2.63)). В слоях воздуха, близ-
ких к поверхности земли, озон вновь быстро реагирует с NO,
окисляя его до диоксид^! азота, сам при этом снова превращается
в молекулярный кислород:
155
O3 + NO—► (),+ NO;. (2.71)
Далее диоксид азота снова разлагается на NO и О (см. уравне-
ние (2.62)). Такдолжны идти реакции в отсутствие углеводородов.
Концентрации оксидов азота не достигают опасного уровня. Эти
процессы обратимы. Заметного накопления озона не происходит.
Но в присутствии углеводородов (CVH3.) монооксид азота реа-
гирует с ними. Результаты этого взаимодействия с экологиче-
ской точки зрения очень опасны. Во-первых, образуются очень
агрессивные и вредные органические соединения — пероксиацил-
нитраты (ПАН). Во-вторых, монооксид азота таким образом
связывается, остается меньше возможности для протекания ре-
акции его взаимодействия с озоном (см. уравнение (2.71)). Так
происходит накопление озона.
Озон, вступая в реакцию с угле водородами, тоже образует
вредные соединения — альдегиды. В фотохимическом смоге
присутствует также монооксид углерода СО — продукт неполно-
го сгорания бензина.
Таким образом, в смоге лос-анджелесского типа помимо пер-
вичных (исходных) загрязнителей (оксидов азота и углеводоро-
дов), образуются вторичные загрязнители озон, ПАН, альдегиды.
Приведем уравнения некоторых реакций, которые могут про-
текать при возникновении фотохимического смога. Озон реа-
гирует с олефинами, в частности с проленом, с образованием
альдегидов. В данном случае получается этаналь:
Н,С---СН---СН2 + О,—► Н,С---СН------О + НСО- + НО-. (2.72)
пропен этаналь
Далее этаналь на свету взаимодействует с атомарным кисло-
родом с образованием радикалов:
Н3С----С= О+О СВСТ» Н3С-----С = О + НО . (2.73)
н
Органические радикалы в присутствии кислорода воздуха порож-
дают радикалы пероксидов:
Н,С---С----О + О2---^HjC----С----О (2.74)
О----О-
Пероксорадикалы могут реагировать с NO,. Из образующих-
ся при этом соединений наиболее известен пероксоапетилнит-
рат (CH3COO,NO,), концентрация которого в смоге может до-
стигать 50 млрд-1 (5-10-6 %):
н3с---j'==O + NO-’ —* HjO---С----° (27S)
о—о- 1---о—NO,.
пероксоацетилнитрат
156
Поскольку это вещество легко вступает в реакцию взаимо-
действия с различными органическими веществами, например
ферментами, оно чрезвычайно токсично для человека и других
живых организмов.
Диоксид азота, озон, ПАН и альдегиды называются фотохи-
мическими загрязнителями воздуха, или фотохимическими окис-
лителями, поскольку они образуются в ходе реакций, возбуж-
денных солнечным светом. Все они токсичны и способны окис-
лять различные вещества, которые не может окисли ть кислород
воздуха.
Из фотохимических окислителей в наибольшем количестве об-
разуется озон. Он наиболее опасен. В крупных американских го-
родах концентрация озона достигает 2—3 мг/м’ и выше, что
в 100—200 раз больше, чем в чистом природном воздухе. Столь
высокие концентрации, конечно, бывают нечасто, однако и бо-
лее низкие его концентрации тоже оказывают вредное воздей-
ствие. Даже при слабом смоге с концентрацией озона 0,2 мг/м’
появляется неприятный запах. Американский стандарт качества
воздуха устанавливает предельно допустимое содержание озона
0,24 мг/м’.
Скорость образования озона зависит от освещенности, и по-
этому его концентрация изменяется в течение суток и в течение
года. Кроме того, концентрация озона изменяется по мере уда-
ления от источника выбросов оксидов азота. На последнее об-
стоятельство влияет также направление ветра. Поясним эти по-
ложения.
Уменьшение концентрации озона ночью объясняется прежде
всего прекращением его фотохимического синтеза (в отсутствие
солнечного света), а также продолжающимся участием его в окис-
лении NO в NO, В гористых местностях это изменение кон-
центрации выражено в меньшей степени, так как в чистом гор-
ном воздухе практически отсутствует NO, на окисление которого
мог бы расходоваться озон.
С увеличением солнечной освещенности, с рассвета и до по-
лудня, концентрация озона возрастает. В утренние «часы пик»
(примерно с 6 до 8 ч) с увеличением потока автомобилей возрас-
тает концентрация NO, который попадает в атмосферу с выхлоп-
ными газами. Потом содержание монооксида азота в воздухе
уменьшается. Параллельно с этим уменьшением возрастает до
максимума концентрация диоксида азота. Далее по мерс умень-
шения содержания NO2 растет концентрация озона. Через неко-
торое время, уже во второй половине дня, содержание озона
в воздухе также начинает уменьшаться.
Годовые изменения образования озона складываются из су-
точных изменений и дают максимальное значение в периоды
высокой солнечной активности. В районах с умеренным клима-
157
том при характерной циклонной активности количество фото-
химически образовавшегося озона в различные годы может зна-
чительно колебаться.
Теперь рассмотрим, как изменяется соотношение концентра-
ций оксидов азота и озона при удалении от источников выбро-
сов NO, т. е. от больших городов и промышленных центров. По
мерс переноса выбросов концентрация NO резко падает вслед-
ствие окисления его в NO;. Концентрация NO2 при этом меняет-
ся менее резко, так как убыль NO2 связана главным образом
с естественными процессами. Концентрация озона также очень
сильно уменьшается вследствие реакции взаимодействия его
с NO Однако на большом удалении от источников выбросов
в так называемых районах чистого воздуха (в горных районах)
можно наблюдать сравнительно высокие концентрации О3. Это
связано с фотохимическими превращениями NO2 в озон на
большой высоте, в то время как вблизи поверхности оставшийся
О, реагирует с остатками NO. В связи с этим концентрация озона
в горных районах может быть больше, чем в центральной части
города.
Только при максимуме выбросов и в отсутствие ветра или при
обратном cixj направлении в воздухе больших городов могут наб-
людаться высокие концентрации озона — до 0,3—0,4 мг/м3.
Образование фотохимического смога, наблюдаемого в Лос-
Анджелесе, зафиксировано и в других городах мира с интенсив-
ным автомобильным движением. Так, 18 июня 1970 г. Токио был
окутан густой молочной дымкой. Стояла страшная жара при
полном безветрии. В этот день примерно 6 тыс. человек обрати-
лись к врачам с жалобами на головную боль и тошноту, у них
«горели» глаза, ноги перестали слушаться.
Состав смога зависит от его происхождения. Жители пере-
полненных автотранспортом городов юга Европы (Афины, Мад-
рид) и Калифорнии (Лос-Анджелес) в солнечные летние дни
страдают от смога лос-анджелесского типа, для которого харак-
терно присутствие оксидов азота, озона, ал ьдепздов, ПАН и дру-
гих псроксидных соединений. В городах средней Европы и Ве-
ликобритании наблюдается смог лондонского типа в осенний и
зимний периоды, в нем преобладают SO2, H2SO., и копоть. Кро-
ме этих типичных видов смога возможно образование аномалий
промежуточного состава при разных погодных условиях.
Фотохимический смог усиливает коррозию металлов, разру-
шение строительных сооружений, резины и других материалов.
Например, в Белгороде в безветренный летний дш <ь над круп-
ной автомагистралью города (проспект Б. Хмельницкого) мож-
но наблюдать молочную дымку — это фотохимический смог.
Воздействие оксидов азота, озона и других фотохимических
окислителей па человека. Оксид азота(1) (оксид диазота) N2O, об-
158
разуюшийся главным образом естественным путем, безвреден
для человека. Он представляет собой бесцветный газ со слабым
запахом и сладковатым вкусом. Вдыхание небольших количеств
]\ ,О приводит к притуплению болевой чувствительности, вслед-
ствие чего этот газ иногда в смеси с кислородом применяют для
наркоза. В малых количествах N2O вызывает чувство опьянения
(отсюда название «веселящий газ»). Вдыхание чистого N2O быс-
тро вызывает наркотическое состояние и удушье.
Оксид азота NO и диоксид азота NO2 в атмосфере встречают-
ся вместе, поэтому чаще всего оценивакхг их совместное воздей-
ствие на организм человека. Только вблизи от источника выбро-
сов отмечается высокая концентрация NO. При сгорании топли-
ва в автомобилях и в тепловых электростанциях примерно 90%
оксидов азота образуется в форме монооксида азота. Оставшие-
ся 10% приходятся на диоксид азо«а. Однако входе химических
реакций значительная часть NO превращается в NO2 — гораздо
более опасное соединение.
Монооксид азота NO представляет собой бесцветный газ. Он
не раздражает дыхательные пути, и поэтому человек может его
не почувствовать. При вдыхании NO, как и СО, связывается с ге-
моглобином. При этом образуется нестойкое нитрозосоедине-
ние, которое быстро переходи т в метгемоглобин, при этом Fe2+
переходит в Ге3’. Ион Fc3+ не может обратимо связывать О2 и та-
ким образом выходит из процесса переноса кислорода. Концент-
рация метгемоглобина в крови 60—70% считается летальной. Но
такое предельное значение может возникнуть только в закрытых
помещениях, на открытом воздухе это невозможно.
По мере удаления от источника выброса все большее количест-
во NO превращается в NO, — бурый, обладающий характерным
неприятным запахом газ. Диоксид азота сильно раздражает сли-
зистые оболочки дыхательных путей. Вдыхание ядовитых паров
NO, может привести к серьезному отравлению.
Диоксид азота вызывает сенсорные, функциональные и па-
тологические эффекты. Рассмотрим некоторые из них.
К сенсорным эффектам можно отнести обонятельные и зри-
тельные ответы организма на воздействие NO,. Даже при малых
концентрациях, составляющих всего 0,23 мг/м5, человек ощуща-
ет присутствие этого газа. Эта концентрация является порогом
обнаружения NO2. Однако способность обнаруживать диоксид
азота пропадает после 10 мин вдыхания, но при этом люди жалу-
ются па чувство сухости и першения в горле. Хотя и эти ощуще-
ния исчезают при продолжительном воздействии газа в кон-
центрации, в 15 раз превышающей порог обнаружения. Таким
образом, NO2 ослабляет обоняние.
Диоксид азота не только возлействуез на обоняние, но и ослаб-
ляет ночное зрение — способность глаз адаптироваться к тем ноте.
159
Этот эффект наблюдается при концентрации О, И мг/м3 что
ниже ворога обнаружения.
Функциональным эффектом, вызываемым диоксидом азота,
является повышенное сопротивление дыхательных путей. Ины-
ми словами, NO, вызывает увеличение усилий, затрачиваемых
на дыхание. Эта реакция наблюдалась у здоровых людей ври
концентрации NO2 всего 0,056 мг/м3, что в четыре раза ниже по-
рога обнаружения. Люди с хроническими заболеваниями легких
испытывают затрудненность дыхания уже при концентрации
0,038 мг/м3.
Патологические эффекты проявляются в том, что NO, делает
человека более восприимчивым к патогенам, вызывающим бо-
лезни дыхательных путей. У людей, подвергшихся воздействию
высоких концентраций диоксида азота, чаще наблюдаются катар
верхних дыхательных путей, бронхиты, круп и воспаление легких.
Диоксид азота сам по себе может быть причиной заболеваний
дыхательных путей. Попадая в организм человека, NO2 при кон-
такте с влагой образует азотистую и азотную кислоты, которые
разъедают стенки альвеол легких. При этом стенки альвеол и
кровеносных капилляров становятся настолько проницаемыми,
что пропускают сыворотку крови в полость легких. В этой жид-
кости растворяется вдыхаемый воздух, образуя пену, препят-
ствующую дальнейшему газообмену. Возникает о/иек легких, ко-
торый может привести к смерти.
Длительное воздействие оксидов азота вызывает расширение
клеток в корешках бронхов (тонких разветвлениях воздушных пу-
тей альвеол), ухудшение сопротивляемости легких к бактериям,
а также расширение альвеол.
Некоторые исследователи считают, что в районах с более вы-
соким содержанием в атмосфере диоксида азота наблюдается
повышенная смертность от сердечных и раковых заболеваний.
Люди, страдающие хроническими заболеваниями дыхатель-
ных путей (эмфиземой легких, астмой) и сердечно-сосудистыми
болезнями, могут быть более чувствительными к прямым воз-
действиям NO, У них легче развиваются осложнения (напри-
мер. воспаление легких) при кратковременных респираторных
инфекциях Полагают, что около 10—15% населения США стра-
дает хроническим и респираторными заболеваниями Исходя из
этого, в США установлен стандарт на содержание NO, на уров-
не, предохраняющем население от респираторных инфекций
Среднегодовой стандарт качества воздуха в США предусматрива-
ет концентрацию NO, 0,1 мг/м3. Her данных на допустимое со-
держание NO2 в небольшие промежутки времени (например,
среднесуточную концентрацию).
В Германии принята максимально допустимая эмиссионная
концентрация (МЭК) NO2 — 9 мг/м3. МЭК показывает, какая
160
концентрация вещества выбрасывается той или иной установ-
кой или другим источником в воздух. Измерение концентрации
выбросов производится непосредственно в потоке газов. Но сле-
дует знать, что диоксид азота представляет собой опасность для
здоровья человека, даже если его концентрация в воздухе мень-
ше МЭК, особенно при длительном действии.
В России установлены следующие экологические стандарты на
содержание оксидов азота в атмосферном воздухе населенных
мест: для NO, максимальная разовая предельно допустимая кон-
центрация (ПДК^р) составляет 0,085 мг/м3, а среднесуточная
предельно допустимая концентрация (ПДК..) — 0,040 мг/м3; для
NO ПДК„Р= 0,400 мг/м3, ПДК. = 0,060 мг/м
Действие озона на организм человека подобно действию диок-
сида азота. Озон прежде всего опасен тем, что может вызвать тя-
желый отек легких. Это наблюдается при концентрации О3 выше
0,2 мг/м3. Указанная концентрация принята в Германии за МЭК.
При концентрации озона около 0,2 мг/м3 наблюдаются уста-
лость, головная боль, резь в глазах и раздражение слизистых оболо-
чек. Поэтому в городах, где существует опасность образования
смога, концентрацию озона 0,3—0,4 мг/м3 следует считать пре-
дельной. Обычно в промышленных районах Германии средняя
концентрация О3ввоздухс влетпий периоде хтгавляст-0,03мг/м3.
Кроме того, О, нарушает движение мерцательных волосков
в бронхах, которые должны выводить чужеродные вещества из
бронхов вместе с мокротой. Систематическое вдыхание озона
приводит к накоплению в легких чужеродных веществ, что по-
тенциально увеличивает опасность заболевания раком, так как кан-
церогенные вещества задерживаются в легких дольше обычного.
Стандар т качества воздуха в США устанавливает допустимую
концентрацию О, 0,24 мг/м3. Это значение не должно превы-
шаться более одного раза в год. Однако ученые считают, что дан-
ный уровень соответствует более высокому содержанию фото-
химических окислителей в воздухе, так как доля О3составляет
только 75% от полной массы окислителей в воздухе. Они отме-
чают, что число приступов у больных астмой возрастало при
концентрации озона 0,3—0,5 мг/м3, что всего лишь на 25% выше
стандарта. Поэтому стандарт, по мнению американских ученых,
должен предусматривать более низкое содержание озона.
К началу 1980-х гг. 144 млн граждан США проживали в районах,
в которых содержание озона превышало допустимый уровень.
Наиболее остро проблема озона стоит в Южной Калифорнии.
В России предельно допустимая концентрация озона состав-
ляет: максимальная разовая — 0,160 мг/м3, среднесуточная —
0,030 мг/м3.
Сильными фотохимическими окислителями являются пе-
роксоацилнитраты (ПАП) — крайне неприятные для человека
161
вещества Они раздражают слизистую оболочку глаз и органы
дыхания. Лица с хроническими легочными заболеваниями осо-
бенно подвержены влиянию фотохимических окислителей.
Воспалительные процессы в глазах (конъюнктивит) — одно
из серьезнейших последствий фотохимического загрязнения
воздуха. Раздражение глаз может наблюдаться даже при невысо-
ком содержании фотохимических окислителей — 0,2 мг/м3, что
меньше установлен ного стандарта.
В специальных экспериментах было установлено влияние
фотохт ических окислителей на организм животных. В присут-
ствии окислителей в воздухе мыши оказывались более воспри-
имчивыми к бактериальным инфекциям; эритроциты и клетки
сердечной мышцы деформировались. Трехмесячное воздействие
озоном в концентрации около 0,11 мг/м3 приводило к снижению
веса крыс и нарушению биохимии физиологических процессов
у них. У хомячков при кратковременных воздействиях низких
концентраций окислителей обнаруживались повреждения хро-
мосом лейкоцитов.
Рассмотрев отдельно влияние оксидов азота и озона, оха-
рактеризуем в целом воздействие фотохимического смога на
организм человека и животных. При фотохимическом тумане,
как и при лондонском смоге, появляется неприятный запах,
резко ухудшается видимость, что созде ст опасность аварийных
ситуаций на дорогах. У людей воспаляются глаза, слизистые
оболочки носа и горла, отмечаются симптомы удушья, обо-
стрение легочных и различных хронических заболеваний. Фо-
тохимический туман отрицательно действует на нервно-психи-
ческую систему, вызывает обострение бронхиальной астмы.
Сохранение смоговой ситуации в течение длительного времени
приводит к повышению уровня заболеваемости и смертности
среди населения. Особенно сильно смог влияет на детей и по-
жилых людей. Погибают и домашние животные, главным обра-
зом собаки и птицы.
Подводя итог рассмотрению воздействия на человека газооб-
разных загрязнителей воздуха (оксидов углерода СО и СО,, серы
SO2 и SO3. азота NO и NO2, а также озона О, и других фотохими-
ческих окислителей), можно отметить, что наиболее чувстви-
тельными к загрязнению воздуха являются люди, страдающие
хроническими заболеваниями дыхательных путей, а также сер-
дечно-сосудистой системы. Для этой категории населения за-
грязнение воздуха особенно опасно. Больные стенокардией наи-
более восприимчивы к действию монооксида углерода СО. На
людей, страдающих эмфиземой легких и астмой, особо вредное
влияние оказывает диоксид серы SO2. Дети, у которых частота
дыхания выше, чем у взрослых, в ряде случаев имеют повышен-
ную чувствительность к загрязнению воздуха.
162
Воздействие фотохимических окислителей на растения. Разру-
шающее воздействие фотохимических окислителей на растения
было обнаружено раньше, чем подтверждено их влияние на здо-
ровье людей.
Оксиды азота NOX могут воздействовать на растения тремя
путями: прямым контактом с растениями, через образующиеся
в воздухе кислотные осадки и косвенно — путем фотохимиче-
ского образования таких окислителей, как О3 и ПАН.
Прямое воздействие NOxHa растения определяется визуально
по пожелтению или побурению листьев и игл, происходящему
в результате окисления хлорофилла. Окисление жирных кислот
в растениях, происходящее одновременно с окислением хлоро-
филла, приводит, кроме того, к разрушению мембран и некрозу.
Образующаяся при этом в клетках азотистая кислота HNO2 ока-
зывает мутагенное действие.
Отрицательное биологическое воздействие NOX на растения
проявляется в обесцвечивании листьев, увядании цветков, пре-
кращении плодоношения и роста. Такое действие объясняется
образованием кислот при растворении оксидов азота в межкле-
точной и внутриклеточной жидкостях.
Ботаники считают, что первоначальные симптомы поврежде-
ния растений оксидами азота проявляются в беспорядочном
распространении обесцвечивающих пятен серо-зеленого оттен-
ка. Эти пятна постепенно грубеют, высыхают и становятся белы-
ми. Оксиды азота токсичны при концентрации 3 млн-1. Для
сравнения: сернистый гае вызывает поражение растений при
большей концентрации (5 млн-1).
Нарушения роста растений при воздействии NO,наблюдают-
ся при концентрациях 0,35 мг/м3 и выше. Это значение является
предельной концентрацией. Опасность повреждения раститель-
ности диоксидом азота существует только в больших городах и
промышленных районах, где средняя концентрация NO, состав-
ляет 0,2—0,3 мг/м3.
Растения более устойчивы (по сравнению с человеком) к воз-
действию чистого NO2. Это объясняется особенностями усвое-
ния NO,, который восстанавливается в хлоропластах и в качест-
ве NH2-rpynnbi входит в аминокислоты. При концентрации
0,17—0,18 мг/м3 оксиды а юта используются растениями в ка-
честве удобрений. Эта способность к метаболизирован и ю NOX
человеку не присуща.
Разрушительное действие NO, на растения усиливается
в присутствии диоксида серы SO2. Это подтверждено на опытах
со следующими породами деревьев: тополь черный, береза пла-
кучая, ольха белая, лила мелколистная. Эти газы обладают си-
нергизмом, и в атмосфере они часто присутствуют вместе. В то
время как действие одного NO2 многие растения переносят
163
в концентрации до 0,35 мг/м3, в присутствии SO, такое же коли-
чество NO2 может причинить им ущерб.
Озон и пероксоацилнитраты (ПАН) — сильные окислители.
Они оказывают влияние на метаболизм, рост и энергетические
процессы в растениях, ингибируя многие ферментативные реак-
ции, например синтез гликолипидов, полисахаридов стенок
клетки, целлюлозы и др. О, и ПАН влияют на фотосинтез, вызы-
вая уменьшение фиксации СО2 и уменьшение количества хлоро-
филла, подавляют и другие энергонроцессы
Озон значительно токсичнее оксидов азота при действии на рас-
тения. Для них он токсичен в концентрации ,2 млн-1. На верх-
ней стороне листьев появляется белая или коричневая крапча-
тость.
Чувствительные виды растений уже после часовой обработки
озоном при концентрации 0,05—0,1 мг/м3 проявляют признаки
угнетения. Озон также изменяет структуру клеточных мембран.
Появляется серебристая пятнистость листьев. При воздействии
озона окисляются пигменты и листья обесцвечиваются. На глян-
цевом слое кожицы листьев и игл появляются трещины, и он ста-
новится хрупким. В фсщинах могут, например, прорастать
грибные споры, проникающие затем вглубь листа и разрушаю-
щие его Этот инфекционный процесс является одной из причин
гибели лесов.
При окислительных процессах в клетке растений может вы-
деляться этилен С2НЧ, вызывающий опадание листьев и игл.
Результатом воздействия высоких концентраций озона явля-
ется штриховая исчерченностъ листьев. Впервые на это обратили
внимание в Лос-Анджелесе в 1940-х гг., когда обнаружили на
листьях растений небольшие темные пятна, наподобие штрихов
Установлено, что озон влияет на цитрусовые, приводит
к чрезмерно раннему созреванию плодов и опаданию их до до-
стижения нормальных размеров.
Специальное исследование, проведенное с четырьмя видами
сельскохозяйственных растений (соя, кукуруза, пшеница и зем-
ляной орех), показало, что загрязнение воздуха озоном приводит
к потере урожая.
Таким образом, признаки повреждений, вызванных NO2 и
О3, визуально диагностируются. Однако следует учитывать, что
в естественных условиях, в том числе и в городах, эти загрязни-
тели действуют на растения не по отдельности, а комплексно
в сложной смеси с другими, поэтому индикацию воздействия
провести трудно.
О совместном действии О3 и SO2 известно следующее. В не-
больших концентрациях оба газа действуют явно синергетиче-
ски, и угнетение роста растений, вызванное озоном, усиливает-
ся в присутствии сернистого газа. 11ри высоких концентрациях,
164
наоборот, в присутствии SO2 действие О3 ослабляется. Можно
предположить, что при этом озон превращает большую часть об-
разовавшейся в клетке сернистой кислоты в серную кислоту, об-
(адающую меньшим фитотоксическим действием.
ПАН становится физиологически активным только при осве-
щении. Фотолитически он распадается на NO2 и пероксоацетил-
радикал (СН3СО2О‘), который, окисляя, разрушает пигменты
фо тосинтеза и другие вещества в клетке.
Многие растения повреждаются при концентрации окис-
лителей 0,08—0,16 мг/м3, что ниже предельной концентрации
(0,24 мг/м3), установленной в США для человека. А наиболее
чувствительные растения, как мы отметили выше, повреждают-
ся уже при концентрации 0,05 мг/м3 — это значение является
критическим.
Исследования, проведенные в Германии, показали, что сред-
негодовые концентрации, как правило, ниже этого критического
порога, однако в отдельные дни могут наблюдаться концентра-
ционные пики, намного превышающие это значение. В зависи-
мости от числа пиков в течение года для растений устанавлива-
ются более или менее продолжительные периоды отдыха. За это
время растение может справиться с токсическим действием
либо, наоборот, четче зафиксируется его поражение.
В заключение следует отметить, что фотохимический смог,
компонентами которого являются оксиды азота, углеводороды,
озон, ПАН и альдегиды, повреждает растения. От смога особен-
но страдают салатные культуры, бобы, свекла, злаки, виноград,
декоративные насаждения. Сначала на листьях образуется вод-
ное набухание. Через некоторое время нижние поверхности
листьев приобретают серебристый или бронзовый оттенок, а верх-
ние становятся пятнистыми, с белыми налетами. Затем насту па-
ют быстрое увядание и гибель листьев.
Поведение оксидов азота и озона внутри помещений. Наиболь-
шая концентрация газообразных загрязнителей наблюдается
в городских районах, поэтому изучение поведения таких загряз-
нителей в замкнутых объемах имеет большое значение.
Было проведено исследование концентрации газов внутри и
вне помещений. Оказалось что для NQ> и других оксидов азота
эти концентрации равны. Происходит диффузия этих газов в по-
мещение и одновременно осаждение их на поверхности внутри
помещения, благодаря этому они удаляются из воздуха. Оксиды
азота эффективно удаляются с помощью активированного угля.
Период полувыведения (время, в течение которого концент-
рация газа снижается на 50%) для NOT из жилого помещения со-
ставляет 6 мин.
Для О3 концентрация внутри помещения в 1,6 раза меньше,
чем вне помещения. Период его полувыведсния из рабочего по-
165
мешения составляет 11 мин. При увеличении относительной
влажности воздуха скорость удаления озона из газовой фазы
возрастает. Применение фильтров из активированного у1ля
в системах кондиционирования воздуха очень эффективно для
уменьшения концентрации озона в воздухе, используемом для
вентиляции зданий.
Оксиды азота не оказывают какого-либо существенного дей-
ствия на неорганические вещества внутренних поверхностей по-
мещений. Присутствие NO, внутри помещений в течение дли-
тельного времени может привести к обесцвечиванию красок.
Озон разрушает некоторые органические полимеры и влияет на
краски, способные окисляться.
Вопросы и задания
1 Назовите основные природные и антропогешпле источники оксидов азота в ат-
мосфере. 2. Дайте сравнительный анализ поступлений оксидов азота и сернистого газа
от природных и антропогенных источников. 3. Рассмотрите на рис. 2.17 схему химиче-
ских превращений оксидов азом и напишите соответствующие этим превращениям
уравнения реакций 4. Напишите уравнения химических реакций приводящих к обра-
юнанию смога дос-анджслссского т ипа. Почему его также называют Цитохимическим
смогом? 5. Назови ге химический состав фотохимического смога. Какие вещества смога
относятся к фотохимическим окислителям, или фотохимическим загрязнителям, воз-
духа? 6. Как и почему изменяется соотношение концентраций оксидов азота и озона
при удалении от источника выбросов NO? 7. В чем состоит различие смогов лос-апджс-
лесското и лондонского типов? 8. Каково физиологическое действие N,O и NO иа орга-
низм человека? 9. В чем заключаются сенсорные, функциональные и патологические
эЦхфекты от воздействия NO, на организм человека? При каких концентрациях диокси-
да азота они наблюдаются? 10. Вероятность каких заболеваний возрастает при воздей-
ствии NO, на человека? 11. Какие экологические стандарты на содержание NO, установ-
лены в России и других странах? 12. Каково влияние О, на здоровье человека? 13. При
каких концентрациях озона нанимается а) усталость, головная боль, раздражен ие сли-
зистых оболочек; б) конъюнктивит; в) отск легких; г) возрастание числа приступов
у больных астмой? 14. Охарактеризуйте воздействие фотохимического смога на орга-
низм человека. 15. Какое влияние оказывают О, и ПАН на биохимические процессы
в растениях? 16. По каким признакам можно провести визуальную диагностику по-
вреждения растений фотохимическими окислителями: а) диоксидом азота; б) озоном?
Какой из этих фотохимических окислителей токсичнее для растений? 17. Почему рас-
тения более устойчивы по сравнению с человеком к воздействию NO,? 18. Как изменя-
ются воздействия NO, и О, на растения в присутствии 50,? 19. Какое влияние оказыва-
ет (фотохимический смог на строительные материалы?
Задачи
1 Антропогенные источники выделяют в атмосферу до 60 хин т оксидов азота в i од
(в пересчете на NO,). Используя рис. 2.16, вычислите, сколько тонн составит эмиссия
оксидов азота от а) автотранспорта; б) тепловых электростанций; в) сжигания топлива
в промышленности; г) всех прочих источников? Сколько тонн оксидов азота «поставля-
ет» в атмосферу химическая промышленность? Для последнего расчета используйте
166
цифры, приведенные в данном разделе. 2. В промышленных районах и городах иногда
наблюдается концентрация NO: 0.4—0.8 .мг/м', при образовании фотохимического
смога — 1 мг/м’. Во сколько раз эти значения превышают порог обнаружения NO..
ПДК«., и 1ШКс_? Какие сенсорные и функциональные эффекты наблюдаются при воз-
действии таких концентраций NO. на человека? 3. На автотрассе крупного города В
полдень концентрация О, составила 0,3 МГ/М5. Во сколько раз это значение превысило
прелечьнодопустимую кониешраиию для человека и критический порог для растений?
Какие нарушения здоровья может вызвать загрязните воздуха озоном в такой кон-
центрации?
2.5.4. Аэрозоли
Природные и антропогенные источники аэрозолей. Помимо га-
зообразных веществ, в воздухе присутствуют твердые и жидкие
частицы. Это еще одно серьезное загрязнение атмосферы.
Частицы, находящиеся в воздухе во взвешенном состоянии,
образуют различные аэрозоли (от греч. аег — воздух и лат. solu-
Ио — раствор). Аэрозоли — это дисперсные системы с газообразной
дисперсионной средой. По агрегатному состоянию и размерам
частиц дисперсной фазы аэрозоли делят на туманы — системы
с жидкой дисперсной фазой в виде капель размером 0,1 —10 мкм,
пыли — системы с твердыми частицами размером более 10 мкм и
дымы — системы, размеры твердых частиц в которых находятся
в пределах 0,001—10 мкм. Если туманы — это капли жидкости
в воздухе, то дымы и пыли — твердые частицы в воздухе. Одно-
временное образование тумана и дыма, как мы уже знаем, при-
водит к такому экологически неблагоприятному явлению, как
смог (см. разд. 2.5.2 и 2.5.3).
Пыли и дымы содержат твердые частицы самой разнообраз-
ной формы. Упрощенно данные частицы можно представить
в виде сфер с радиусом в пределах от 0,001 до 100 мкм. Наиболее
многочисленны частицы аэрозолей с радиусом 0,1—1 мкм.
Частицы аэрозолей либо попадают в атмосферу с земной по-
верхности в готовом виде, либо образуются непосредственно
в атмосфере в результате химических реакций.
Рассмотрим происхождение различных видов аэрозолей.
Жидкая вода находится в атмосфере главным образом в виде об-
лаков, дождя, тумана и дымки. В частицах дымки вода присут-
ствует в виде тонкой пленки жидкос ти на твердой поверхности.
Каждая капелька влаги, возникающая при конденсации водя-
ных паров, содержит не только растворенные атмосферные га-
зы, но и растворенные твердые неорганические и органические
загрязнители атмосферы. Капли атмосферной влаги представля-
ют собой как бы микрорсактор, в котором могут происходить
всевозможные химические превращения. В табл. 2.13 приведены
свойства частиц атмосферной влаги.
167
Свойства частиц атмосферной влаги
(по Ю. И. Скурлатову, 1994)
Таблица 2.13
Форма атмос<|1срной влаги Размер частиц, мкм Массовое содержание поды, г/м’ РП Содержание металла, моль/л
Fe Мп
Дождь 200—2000 0,1-1 4-5 10-8-10-5 10-»-10-«
Облака 10 0,1-3 3-6 10-’-10~* 10 ’-10-5
Туман 10 0,02-0,2 2-6 10-*-10-» 10 ’—ю-5
Дымка 0,03-0,3 ЦН-Ю-» 1-8 10^-10-’ 10-’-ЦГ*
Оксиды железа и марганца являются потенциальными ка-
тализаторами окислительно-восстановительных превращений
и атмосферной влаге.
Большая концен трация ядер конденсации (посторонних час-
тиц) в атмосфере над юродом приводит к повышенной облачно-
сти, увеличению частоты выпадения осадков и увеличению ко-
личества туманов. Повторяемость туманов в городах на 10—20%
выше, чем на открытой местности.
Помимо частиц воды, в атмосфере возможно появление час-
тиц других жидкостей, т. е. возникновение туманов иной хими-
ческой природы. В атмосферном воздухе в виде взвеси могут на-
ходиться такие жидкие вещества, как, например, образующиеся
при неполном сгорании бензина и дизельного топлива жидкие
углеводороды и производные углеводородов, которые улетучи-
ваются в воздух. В результате фотохимических реакций между
оксидами азога и углеводородами образуются новые жидкие
органические соединения, которые рассеиваются в воздухе
в виде мельчайших капелек. Эти реакции были рассмотрены
в разд. 2.5.3 (например, реакции (2.72)—(2.74)).
В загрязнении атмосферы большую роль играют пыли и
дымы, твердые частицы которых очень разнообразны и по хими-
ческому составу, и по происхождению. Естественными источни-
ками твердых частиц являются вулканы при их извержении; ме-
теориты, сгорающие в слоях атмосферы; горные породы (части-
цы, образующиеся при выветривании этих пород); причиной
образования частиц могут быть ветровая эрозия почв, пыльные
бури, лесные пожары, морские штормы, цветочная пыльца. Ан-
тропогенными источниками твердых частиц являются открытые
разработки угля и других полезных ископаемых, а кроме того
к образованию твердых частиц в атмосфере приводят: сжигание
топлива на ТЭС, ТЭЦ. в котельных промышленных предприя-
тий и в автомобилях; обогащение и обработка руд; выплавка
и обработка металлов (резание, сверление); производство це-
мента, асбеста, кирпича и других строительных материалов; раз-
личные процессы обработки материалов в силикатной промыш-
168
ценности (дробление, размалывание); производство и примене-
ние удобрений и пестицидов; сжигание мусора и отходов: ядер-
ные взрывы и др. Несмотря на такое разнообразие ан гропоген-
ных источников, считается, что больше половины твердых час-
тиц имеют естественное происхождение, хотя очень трудно
разделить антропогенное и природное происхождения аэрозоля.
Например, во время аварии на Чернобыльской атомной элект-
ростанции в 1986 г. в окружающую среду, в том числе в атмосфе-
ру, попали радиоактивные частицы Cs-137, Sr-90, Pu-239, U-235
и др., из которых многие осели на почву, лес. Это было загрязне-
ние антропогенного характера, явившееся результатом техно-
генной катастрофы. При лесных пожарах, ветровой эрозии почв
(естественные процессы) происходит распространение радиоак-
тивных аэрозолей на сотни и даже тысячи километров в другие
регионы. Такое явление произошло в сентябре 1992 г. во время
пыльной бури, зародившейся па Балканах, охватившей север-
ную часть Украины, Брянскую область России, юго-восточную
часть Белоруссии (радиационно загрязненные территории). Были
исследованы траектории переноса воздушных масс на высоте
1,5 км из районов Киева и Гомеля, которые привели к 100-крат-
ному повышению концентрации Cs-137 в Вильнюсе (Литва).
В перечисленных выше естественных и антропогенных про-
цессах образуются твердые частицы разного химического соста-
ва. Например, большое количество твердых частиц получается
при сжигании угля — это частицы золы (CaSiO,), сажи (С), окси-
дов металлов (CaO, FcO, Fc2O3). В глобальном (земном) масшта-
бе твердые частицы в атмосфере имеют в основном минеральное
происхождение, но в отдельных районах состав их меняется в за-
висимости от источников образования, и могут преобладать си-
ликаты, карбонаты, сульфаты щелочных и щелочноземельных
металлов, тяжелые металлы, углеводороды, сажа и даже споры
растений.
Например, в атмосфере города Белгорода (в зоне предприятий
строительного комплекса) в 1996—1998 гг. были обнаружены
аэрозольные частицы размером 0,5—70 мкм. Среди них преобла-
дали минеральные асимметричной формы частицы кальцита
CaCOj, кварца SiO2, кальцита с примесью магнезита Ca(Mg)CO3.
Присутствовали также аэрозольные частицы, образованные в ре-
зультате высокотемпературных процессов. Для них характерны
полиэлсментность состава и сферическая форма. Такие частицы
состоят из многих элементов — Si, Са, Mg, Al, Fe, К, Ba, Na, S, P,
Pb, Cu, Zn и др.
Приведем примеры образования аэрозолей непосредственно
в атмосфере в результате химических реакций Многие аэро-
зольные частицы образуются из газов, например SO2, или из ут-
лсводородов. Как известно, сернистый газ — один из основных
169
загрязнителей воздуха. В атмосфере происходит его окисление
с образованием тумана серной кислоты (см. уравнения реакций
(2.36), (2.37)). Это может быть фотохимическое или каталити-
ческое окисление. Последнее связано с присутствием соответ-
ствующего катализатора (ионов тяжелых металлов) и достигает
высокого уровня только в зафязненном воздухе. Даже в отсут-
ствие света диоксид серы окисляется в воздухе при наличии не-
которых оксидов металлов (алюминия, кальция и железа).
Из многочисленных органических соединений, попадающих
в атмосферу, наибольшую склонность к образованию аэрозолей
проявляют терпены — ненасыщенные углеводороды состава
(С511.з)„, содержащиеся главным образом в растениях. Так, наб-
людаемая над хвойными лесами в летнее время голубоватая
дымка представляет собой аэрозоль, возникающий в результате
фотохимического окисления терпенов.
Число аэрозольных частиц в воздухе сильно варьирует в зави-
симости от местности. В нижней зропосфсре на высоте менее
2 км, в сельских районах их концентрация составляет ~104 час-
тиц в I см3 воздуха, а над загрязненными большими городами —
> 105 частиц в 1 см3 воздуха. Фоновый уровень, соответствующий
чистому воздуху, нс подверженному влиянию локальных источ-
ников аэрозолей, характеризуется концентрацией 200—500 час-
тиц в 1 см3.
Трансформация аэрозольных частиц в атмосфере. Частицы
в атмосфере претерпевают изменения. Во-первых, под действи-
ем силы тяжести они могут осаждаться. Кроме того, находясь
в состоянии броуновского движения в воздушной массе, части-
цы сталкиваются и коагулируют (соединяются между собой),
т. е. размеры их увеличиваются, а количество уменьшается. Они
также взаимодействуют с газообразными примесями с образо-
ванием новых аэрозольных частиц иного химического состава.
В любом случае первоначальное состояние частиц постояшю
изменяется. Рассмотрим поведение аэрозольных частиц в атмо-
сфере.
Характерное свойство аэрозолей связано со склонностью час-
тиц дисперсной фазы к седиментации (оседанию под действием
силы тяжести). Из закона Стокса для сипы трения F^ — бтщги
следует, что постоянная скорость седиментации (и) сфериче-
ской частицы пропорциональна квадрату ее радиуса (г), разно-
сти плотностей частицы (р) и среды (р0), обратно пропорцио-
нальна вязкости среды (ц):
2g(p - Ро)г
и —--------.
9П • (276)
Для описания седиментации частиц несферической формы
в уравнение Стокса вводят дополнительные множители, напри-
мер фактор формы.
170
Применимость закона Стокса ограничивается дисперсностью
частиц. Большие частицы (более 100 мкм) могут двигаться уско-
ренно, и тогда для определения скорости их движения урав-
нение (2.76) неприменимо. Малые частицы (менее 0,1 мкм)
осаждаются очень медленно, на это осаждение влияют внешние
воздействия. В аэрозолях закон Стокса удовлетворительно опи-
сывает движение частиц с радиусом более 5 мкм.
От скорости осаждения аэрозольных частиц зависит продол-
жительность их пребывания в атмосфере. В целом эта величина
колеблется от нескольких суток до нескольких недель, составляя
в среднем около одной недели. Наиболее мелкие частицы могут
оставаться в атмосфере во взвешенном состоянии более года.
Время жизни капель невелико — от нескольких минут в случае
больших дождевых капель и примерно до одного часа дня капель
облаков. Время жизни частиц смога размером < 1 мкм достигает
недели.
Практически можно считать, что осаждаются лишь частицы
размером >1 мкм, а для меньших частиц скорость осаждения
слишком мала, тогда как частицы размером >10 мкм оседают
быстро. При этом если частицы размером от 5 до 1 мкм образуют
сравнительно устойчивые системы медленно осаждающихся ча-
стиц, то частицы <1 мкм ведут себя подобно газам.
Путем осаждения из атмосферы удаляется около 20% частиц,
главным образом в результате промывания атмосферы осадками
и образования туманов. Этот процесс очищения влияет на время
пребывания частиц в атмосфере. Те частицы, которые но своему
поведению сходны с частицами газов (диаметр 1 мкм и меньше),
в значительно меньшей степени подвержены действию атмо-
сферных осадков, время их пребывания в нижних слоях атмо-
сферы составляет 10—20 суток. Этого времени бывает достаточ-
но для распространения частиц по всему полушарию (хемисфе-
рс). Однако перемещение из Северного полушария в Южное за
20 суток нс представляется возможным, поскольку экваториаль-
ная зона низкого давления вокруг Земли значительно затрудняет
обмен воздушными массами между двумя полушариями.
Если частицы достигают верхних слоев тропосферы, то они
могут проникнуть в стратосферу с помощью горизонтальных
воздушных потоков между тропосферой и стратосферой. При вул-
канических извержениях частицы золы и пыли могут подниматься
па высоту до 20 км и выше. Продолжительность существования
аэрозольных частиц в стратосфере составляет 1—3 года.
Время пребывания частиц в атмосфере и, следовательно, их
распространение по земной поверхности зависят не только от
размеров частиц и их плотности, но и от скорости ве тров, а так-
же от того, на какую высоту частицы были занесены первона-
чально. Крупные частицы обычно оседают в течение нескольких
171
часов или суток, тем не менее они могут переноситься на сотни
километров, если вначале оказались надостаточно большой вы-
соте Так например, пыль пустыни Сахара можно обнаружить
на юге США, в Центральной и Латинской Америке. Средняя
плотность частиц этой пыли, имеющих в поперечнике 12 мкм и
больше, равна 2,5 г/см3. Ежегодная масса атмосферной пыли,
выносимой из Сахары, составляет 100—400 Мт, при этом пыль
частично осаждается в сухом виде, частично прибивается к земле
дождями
Приведем некоторые примеры, показывающие, какая масса
пыли осаждается из атмосферы на единицу площади Земли. Так,
в ФРГ в 1965 г осаждение ныли в сутки составляло 460 мг/м2,
в 1975 г. — 240, в 1985 г — 160. Исследования, проведенные
в г. Белгороде (Россия) в 1996 г., показали, что масса осаждаю-
щихся из воздуха твердых веществ в разных районах города ко-
лебалась от 3,2 до 32,5 г/м2 за месяц, что соответствует среднесу-
точной массе от 106 до 1080 мг/м2. Наиболее загрязнена твердыми
частицами атмосфера над проспектом Богдана Хмельницкого —
главной автотранспортной магистралью, которая пересекает го-
род с севера на юг. Здесь осаждается крупная дорожная пыль и
производственная пыль близлежащих предприятий. Достаточно
высока степень загрязнения воздуха и вблизи предприятий стро-
ительной индустрии, которые выбрасывают много силикатной,
известковой, цементной и другой пыли.
Атмосферные аэрозоли, накапливающиеся над городом и про-
мышлешгыми зонами, имеют не только локальное, но и регио-
нальное значение. Сначала они образуют сгущения над первона-
чальными источниками, но при сильном движении воздушных
масс эти загрязнения могут разноситься в подветренную сторону.
В экологическом отношении очень важно знать и прогнози-
ровать возможный атмосферный перенос образующихся аэро-
золей на более или менее далекие расстояния. Зная размер час-
тиц аэрозолей в районе предприятий строительного комплекса
г Белгорода, можно сделать следующий прогноз их переноса
в атмосфере В северо-восточной части города, в зоне комбина-
та «Стройматериалы», большинство аэрозольных частиц име-
ют размеры >10 мкм, а именно 40, 60 и 70 мкм, т. е. являются
быстро осаждающимися. Это в основном минеральные части-
, цы кальцита СаСО3 и кварца SiO2. Их распространение в атмос-
фере носит преимущественно локальный характер. Обнаружены
здесь и многокомпонентные пепловые частицы диаметром 4 мкм,
образующиеся в результате высокотемпературных процессов.
Возможен их атмосферный перенос в региональном масштабе.
Атмосферные частицы в западной части города, имеющие раз-
меры 8, 5 и 1,6 мкм, переносятся уже на большие расстояния и
могут давать региональное загрязнение В этой части города на-
172
холятся комбинат асбестоцементных изделий, завод железобетон-
ных изделий, цементный завод и другие предприятия. Большин-
ство (65%) аэрозольных частиц в данной промышленной зоне
имеет размер 1 мкм и менее, время их пребывания в нижних сло-
ях атмосферы может достигать 20 суток.
Следовательно, наблюдаемое изменение атмосферы не огра-
ничится городской чертой, а будет распространяться далее —
в региональном и даже глобальном масштабах. Обычно время
полного перемешивания в пределах полушария составляет от 0,5
до 3 месяцев, а перемешивание воздушных масс между полуша-
риями длится примерно год.
В областях с умеренным климатом интенсивность поступле-
ний аэрозолей в атмосферу заметно зависит от времен года. Их
образование по естественным причинам достигает максимума
в жаркие летние месяцы, а выделение частиц антропогенного
происхождения над городами и густонаселенными районами
максимально в отопительный зимний период. Главной причиной
возникновения аэрозолей в последнем случае являются продук-
ты, образующиеся при работе промышленных и бытовых ко-
тельных.
Область распространения аэрозолей, образующихся в закры-
тых помещениях, имеет четко ограниченный местный характер.
При отсутствии вентиляции и вытяжных усгройств концент-
рация загрязнения может достичь такой величины, что станет
опасной для человеческого организма. Это особенно характерно
для загрязнений, вызывающих аллергию.
Из сказанного выше следует, что устойчивость аэрозолей
определяется многими факторами и прежде всего размером час-
тиц. Естественное разрушение аэрозолей происходит либо в ре-
зультате седиментации, либо в результате коагуляции. Грубодис-
персныс аэрозоли (с крупными частицами) неустойчивы в связи
с большой скоростью седиментации, которая преобладает над
броуновским движением; такие аэрозоли переносятся в воздухе
преимущественно ветром. Высоколиспсрсные аэрозоли (с малыми
частицами) могут быть неустойчивы вследствие частых столкно-
вений частиц друг с другом. В таких аэрозолях преобладает бро-
уновское движение. Основной механизм разрушения — коагу-
ляция и оседание в результате диффузии. Более устойчивые аэро-
золи содержат частицы размером 0,1 —100 мкм.
Удаление аэрозолей в процессе слипания частиц (сухого и
мокрого — с атмосферными осадками) происходит в основном
за счет осаждения, которое являегся одним из основных путей
самоочищения атмосферы.
Трансформация аэрозольных частиц в атмосфере заключает-
ся не только в коагуляции и седиментации, но и в изменении
химического состава. Многие газообразные примеси moi ут реа-
173
гироватъ с аэрозольными частицами, например аммиак с 112SO.,
пары азотной кислоты с NaCl, озон с частицами органических ве-
ществ и т. д.
При наличии в атмосфере аммиака аэрозоль ссриой кислоты
превращается в сульфат аммония (см. реакции (2.48), (2.49)):
2NH,+ HSO,—► (NH^SO*.
В загрязненной атмосфере в 1 м3 воздуха может находиться до
нескольких микрограммов аммиака и столько же сульфата. Эта
реакция протекает быстро. Столкновение молекул NH-с капля-
ми H2SO4, содержащейся в смоге или тумане, приводит к образо-
ванию соли Сульфат аммония является важным компонентом
атмосферных аэрозолей.
В атмосфере может происходить образование сульфатов ще-
лочных металлов. Например, при взаимодействии частиц NaCl
с каплями H2SO4 образуется сульфат натрия.
2NaCl + H2SO _> Na,SO, + 2НС1.
Содержание NaCl в 1 м3 атмосферы может достигать несколь-
ких миллиграммов. В результате этой реакции в воздухе наряду
с сульфатом натрия образуется свободная соляная кислота.
Аналогично может взаимодействовать аэрозоль H,SO4c кар-
бонатами, поднимающимися с поверхности Земли.
СаСО, + H2SO4 —> CaSO„ + Н2О + СО,Т. (2.78)
Так образуется сульфат кальция. Тропосферные аэрозоли серной
кислоты moi ут сохраняться в атмосфере только несколько суток.
Потом они либо выпадают в осадки вместе с дождями, либо пре-
вращаются в твердые частицы сульфатов.
Возможно образование в атмосфере и нитратов. Если диок-
сид азота NO2 и аэрозоль NaCl присутствуют во влажном возду-
хе, то реакция между ними приводит к образованию частиц
NaNO3 и газообразного НС1. На первой стадии процесса получа-
ется азотная кислота (см. реакцию (2.3)):
3NO, + Н,О —> 2HNO, + NQ
На второй стадии проз екает адсорбция паров азотной кислоты су-
хими частицами NaCl, далее они взаимодействуют друг с другом
HNOj + NaCl —» NaNOj + НС1 (2.79)
с образованием нитрата натрия. Хлороводород улетучивается ли-
бо в процессе испарения капли, либо после него.
Такие изменения происходят с аэрозолями в атмосфере.
Аэрозольные частицы в стратосфере. Существование аэрозо-
лей в стратосфере было установлено в 1960—1970-е гг. с по-
мощью ракетной техники и путем использования лучей прожек-
тора или лазерного зондирования атмосферы с помощью спс-
174
циальных оптических локаторов (лидаров). Максимальная кон-
центрация аэрозольных частиц наблюдается во влажных слоях
атмосферы, преимущественно на высоте 18—20 км над Землей.
После извержения вулканов масса пыли в стратосфере сильно
увеличивается, потом она постепенно, в течение нескольких лет,
уменьшается. Ядра некоторых частиц могут иметь космическое
происхождение. Стратосферные частицы можно разделить на две
группы, отличающиеся размером. Первую группу составляют
частицы с радиусом 0 < R < 1 мкм, их концентрация может со-
ставлять от 1 до 103 частиц в 1 см3 воздуха. Вторую ipynny состав-
ляют частицы с R> 1 мкм, их концентрация в стратосфере 0,01—
0,07 частиц в 1 см3.
Стратосфера характеризуется практически полным отсутствием
облаков и термической стабильностью. Это способствует относи-
тельной стабильности и большей продолжительности жизни за-
грязняющих веществ в стратосфере по сравнению с зропосфе-
рой. Если пребывание их в тропосфере ограничивается периоломв
несколько суток или недель, то в стратосфере оно может составлять
несколько лет (чаше всего 1—3 года). Например, время пребывания
в стратосфере радиоактивных продуктов, попавших туда в резуль-
тате ядерных взрывов, составляет 2 года Концентрация частиц
в стратос 1>ерс может быть в 10—100 раз выше, чем в тропосфере.
Стратосферные частицы состоят главным образом из сульфа-
тов. Основным компонентом аэрозолей является сульфат аммо-
ния (NH4)2SO4 Среднюю концентрацию [SO42 ) можно принять
равной 0,1 мг/м3 воздуха. Стратосферные частицы образуются из
газообразного SO2, попадающего на эту высоту' при извержении
вулканов и окисляющегося здесь до SO3. Последний при взаимо-
действии с парами воды образует серную кислоту H2SO.,. Обра-
зующиеся частицы предста«1ляют собой капли радиусом от 0,1 до
нескольких микрометров. Как было отмечено выше, концентра-
ция водяных паров в сгратосфере очень мала, поэтому процесс
образования капель H2SO4 протекает в незначительной степени.
Однако присутст вующие в стратосфере твердые мелкие частицы
играют роль ядер конденсации и способствуют этому процессу.
За последние 20 лет содержание сернокислотных аэрозолей в стра-
тосфере ежегодно увеличивается примерно на 9%. В течение не-
скольких лет пребывания в стратосфере частицы аэрозолей мо-
гут подвер!аться коагуляции и седиментации.
Влияние аэрозолей на тепловое состояние атмосферы и климат.
Опасным экологическим последствием увеличения количества
аэрозолей является уменьшение прозрачности атмосферы, се по-
мутнение. Так, аэрозольная мутность атмосферы в Москве на
20% больше, чем в пригороде, а в отдельные месяцы разница до-
стигает 40%. Осенью по сравнению с летом воздух становится
более прозрачным, это связано с увеличением повторяемости и
175
продолжительности атмосферных осадков, способствующих вы-
мыванию аэрозолей.
Уменьшение прозрачности атмосферы в городах приводит
к снижению поступления прямой солнечной радиации на 18—20%.
Зимой в Санкт-Петербурге потеря солнечной радиации достига-
ет даже 50%.
Загрязненной атмосферой особенно интенсивно поглощается
коротковолновое ультрафиолетовое излучение, в результате отме-
чают «покраснение» солнечной радиации. Для человека и растений
такое изменение спектрального состава неблагоприятно, посколь-
ку ослабляется наиболее активное в биологическом отношении из-
лучение. В Москве человек получает на 13% меньше биол отчески
активной УФ-радиации по сравнению с сельской местностью
Аэрозоли ослабляют солнечное излучение в результате раз-
личных оптических явлении: рассеяния, отражения и поглоще-
ния лучей. Это в первую очередь зависит от размера частиц.
Частицы диаметром >1 мкм в значительной степени поглощают
инфракрасные лучи, в результате чего воздушные слои, содержа-
щие подобные частицы, надеваются, а нижние соответственно
остаются более холодными. Частицы темного цвета, например
сажи, сильнее всего поглощают видимый свет и инфракрасные
лучи. Это приводит к охлаждению земной поверхности. Тенден-
ция к снижению температуры Земли была обнаружена 35—40 лет
назад. Проз ивоположная теория «парникового эффекта» возник-
ла гораздо раньше. Эти две тенденции в конечном итоге определя-
ют тепловое состояние атмосферы Земли.
Частицы диаметром <1мкм незначительно поглощают инф-
ракрасное излучение. Эти частицы способствуют рассеянию све-
та в видимой области спектра. Но при диаметре < 0,4 мкм (т. с.
меньше длины волны видимого света) они не оказывают замет-
ного влияния на рассеяние света, хотя могут поглощать ультра-
фиолетовые лучи.
В настоящее время плотность аэрозолей в тропосфере тако-
ва, что она при водит к понижению температуры земной поверхно-
сти приблизительно на 1,5 °C.
Увеличение количества аэрозолей в стратосфере, например
после сильного извержения вулкана, сопровождается повыше-
нием температуры на несколько градусов и загрязнсшюй ниж-
ней части стратосферы. Но это не вызывает заметных климати-
ческих изменений на Земле. Температура нижних слоев тропо-
сферы при этом понижается всего на несколько десятых градуса.
Большая концентрация ядер конденсации в атмосфере над
городом приводит к повышенной облачности и увеличению часто-
ты выпадения осадков. Например, повторяемость осадков для
Москвы на 30—40% выше, чем в ее окрестностях.
Продолжительные туманы могут быть вызваны высоким содер-
жанием аэрозольных частиц в воздухе. Повторяемость туманов
176
в городах на 10—20% выше, чем на от крытой местности. Именно
с туманами и смогами связаны наиболее опасные случаи загряз-
нения в городах.
Вследствие загрязнения атмосферы и повышенной облачно-
сти происходит уменьшение освещенности. В целом показатели
солнечной есгсственной освещенности в городах на 10—20% ниже,
чем в пригороде.
Влияние аэрозолей на здоровье человека. Аэрозоли могут на-
нести значительный ущерб человеческому организму. Их воз-
действие па здоровье человека может быть как прямым, так и
косвенным.
Как было сказано в предыдущем разделе, аэрозоли ослабляют
поток солнечных лучей, уменьшают поступление на земную по-
верхность биологически активного УФ-излучения. Это излуче-
ние необходимо Д1я поддержания нормальной температуры че-
ловеческого тела и для образования витамина D3. Недостаток
это! о витамина в организме негативно влияет на формирование
костей — возникает заболевание, которое иазвается «рахит». В Рур-
ской области (Германия) в районах с сильно запыленной атмо-
сферой процент заболевания новорожденных рахитом был в два
раза больше, чем в сельской местности. Кроме того, УФ-излуче-
ние уничтожает микроорганизмы и оказывает сюрилизуюшее
действие. Уменьшение доли УФ-лучей в пыльной атмосфере
больших городов повышает вероятность инфекционных бактери-
альных заболеваний. Повышение вероятности заболевания рахи-
том и инфекционными заболеваниями — это косвенное воздей-
ствие аэрозолей на здоровье человека.
Прямое воздействие аэрозольных частиц проявляется в воз-
никновении ряда специфических заболеваний дыхательных пу-
тей. Частота респираторных инфекций, таких как катары верх-
них дыхательных путей и бронхит возрастает при увеличении
содержания твердых частиц в воздухе. Повышенное число этих
заболеваний отмечалось при средней концентрации твердых час-
тиц в воздухе в течение года более 100 мкг/м-’. Поэтому средней
стандартной концентрацией в течение года для твердых частиц
в большинстве стран считается 50—75 мкг/м3. Если твердые час-
тицы присутствуют в воздухе вместе с оксидами серы, то их воз-
действие на здоровье людей становится более опасным (вспом-
ните лондонский смог), так как течение уже имеющихся легоч-
ных и сердечных заболеваний осложняется.
Создают проблемы со здоровьем у людей и частицы сульфа-
тов, которые образуются в атмосфере В состав сульфатных час-
тиц входят капельки серной кислоты, а также сульфаты аммо-
ния, кальция, магния, железа и других металлов. Сульфатные
чаепшы имеют минимальные размеры среди частиц, загрязняю-
щих воздух в городах, и потому легко проникают в легкие.
Вследствие своих .малых размеров эти частицы дольше, чем час-
177
типы больших размеров, остаются взвешенными в воздухе, пе-
реносясь на большие расстояния, измеряемые сотнями кило-
метров. Значительная часть сульфатов в воздухе обязана своим
появлением выбросам тепловых электростанций. Считают, что
вредное воздействие на здоровье людей начинает проявляться
при содержании сульфатов в воздухе в количестве 10 мкг/м3
(среднесуточное значение). Дожди обычно быстро вымывают
сульфаты, уменьшая тем самым их концентрацию в воздухе.
Некоторые твердые частицы, зафязняющие воздух, не толь-
ко повышают число респираторных заболеваний, но и могут вы-
зывать развитие злокачественных опухолей. Эго является одной
из причин того, что горожане чаще болеют раком легких, чем
сельские жители. Канцерогенами являются полициклические
ароматические углеводы, в частности бспз[а]пирсн, содержащийся
в выхлопных газах автомобилей. Эти соединения могут быть в воз-
духе как в свободном виде, гак и связанными с частицами сажи.
Повышенный риск заболевания раком легких есть у работни-
ков, имеющих дело с асбестом. Вдыхание многих видов произ-
водственной пыли считается серьезной угрозой здоровью. У ра-
бочих угольных шахт это приводит к угольной пигментации лег-
ких («черная болезнь»). Рабочие в хлопковой промышленности
могут получить «коричневую болезнь» легких в результате вды-
хания хлопковой пыли. Рабочие урановых рудников подверже-
ны повышенному риску заболеть раком легких от вдыхания ра-
диоактивной урановой пыли.
Производственная пыль вызывает профессиональные забо-
левания легких, в первую очередь пневмокониозы (от греч. рпеи-
топ — легкие, konia — пыль). Здесь речь идет об изменении
тканей легких в результате вдыхания пыли в течение ряда лет.
В зависимости от химического состава аэрозольных частиц раз-
личают следующие виды пневмокониозов: силикоз, силикато-
зы, асбестоз, сидероз, антракоз, алюминоз, апатитоз, пневмоко-
ниозы от воздействия органических веществ и др. Аэрозоли, со-
держащие частицы оксида кремния(1У) (кремнезема, кварца),
вызывают заболевание легких — силикоз, в случае силикатов
в аэрозолях — силикатоз, асбеста — асбестоз1, железных руд или
железного лома — сидероз, у гл я — антракоз и т. д. Действие аэрозо-
ля зависит не только от его химического состава, но и от концент-
рации в воздухе, дисперсности (размеров частиц), формы пыли-
нок, их твердости. Рассмотрим некоторые виды пневмокониозов.
Силикоз вызывается кварцевой пылью, частицы которой име-
ют диаметр около 3 мкм. Для силикоза характерна одышка, боли
в грудной клетке, кашель. Пыль диоксида кремния относится
к числу наиболее опасных видов пыли. Содержание SiO2 в той
' Асбестоз является одним из наиболее опасных и распространенных ни-
див силикатоза.
178
или иной смешанной пыли часто определяет степень ее агрес-
сивности по отношению к организму В развитии фиброза ле-
гочной ткани большое значение имеет дисперсность вдыхаемой
пыли. Наиболее опасна для организма мелкодисперсная пыль
(диаметр частиц от 2 до 5 мкм). Такие пылевые частицы находят-
ся во взвешенном состоянии во вдыхаемом воздухе и проникают
в более глубокие отделы дыхательных путей.
Развитие силикатоза происходит под действием и других си-
ликатов, например талька, нефелина. Симптомы силикатоза:
прогрессирующая одышка, кашель, боли в грудной клетке, об-
щая слабость, недомогание.
Подробнее рассмотрим заболевание асбестоз, которое имеет
далеко идущие последствия и проявляется порой у рабочих
спуст я 20—30 лет после кон такта с веществом. Асбестом называ-
ют группу природных минералов — гидросиликатов, важней-
шим из которых является хризотил-асбест МеДОН)к [Si-O10].
Асбестоз вызывается иглами асбеста длиной более 5 мкм и
толщиной более 3 мкм. Эти частицы проникают в легкие, оста-
ются в альвеолах, обрастая дендритами. Присутствие волокон
асбеста в легких затрудняет дыхание. Ткань вокруг волокон
уплотняется, и прерывается процесс перехода кислорода в кровь.
В процессирующей стадии болезни большие скопления узелков
в тканях препятствуют газообмену в легких. Асбестовые иглы
в конечном итоге приводил' к микроповреждениям тканей лег-
ких, облетая в них доступ чужеродных веществ. Таким образом,
в развитии асбестоза играет роль нс только химическое воздей-
ствие пыли, но и механическое повреждение ле1 очной ткани ас-
бестовыми волокнами Частицы этого волокнистого материала
могут иметь размеры 10—12 мкм и более. У больных с ярко выра-
женным асбестозом наблюдаются тяжелые нарушения здоровья:
колющие боли в груди, сильный кашель, головная боль, повышен-
ная утомляемость, общая слабость. При асбестозе бывают также
и желудочные расстройства. Часто наблюдаются серо-землистый
цвет лица и цианоз (синюшность) губ.
Как асбестоз, так и силикоз в первую очередь связаны с про-
фессиональной деятельностью человека и возникают у рабочих
в результате многолетнего вдыхания тонкой пыли. Однако ас-
бестоз обычно не проявляется раньше чем через 20 лет после на-
чала работы человека с асбестом.
Асбест обладает кан цероген 11ым дейс гвисм и может вызы вать
рак легкого. Даже кратковременное воздействие асбеста может при -
вести к заболеванию раком спустя 20—40 лет. Асбест вызывает
редкую форму рака — мезотелиому. Большинство связанных
с асбестом болезней встречается у людей, непосредственно рабо-
тавших с асбестом, даже если они работали с ним всего несколько
педель. Существует угроза заболеть раком даже у детей или жен ра-
бочих, если асбест был занесен в дом на рабочей одежде.
179
Где же используется асбест? Так как он негорюч, его широ-
ко применяют в производстве теплоизоляционных и огнестой-
ких материалов. Асбест используют для обкладки труб парово-
го отопления, в одежде пожарных, в жаростойких рукавицах, для
футеровки печей и для топочных воздуховодов. Он используется
в материале плитки для погодков и пола, его включают в смолу и
цемент для кровельных работ, в шифер (в смеси с цементом),
в тормозные накладки для автомобилей. Раньше асбест исполь-
зовался даже для покрытия гладильных досок. Старые половые
плитки и линолеум нс следует очищать шкуркой из-за опасно-
сти освобождения асбестовых волокон. Потолочные покрытия
со временем могут «шелушиться», рассеивая асбестовые волокна
в воздух. В связи с этим США в 1986 г. был издан закон, по кото-
рому все школы должны быть проверены на асбестовое покры-
тие и в случае его обнаружения очищены от его следов.
Небольшие количества асбестовых волокон присутствуют
в воздухе крупных городов. Это, по-видимому, связано в основ-
ном с сооружением или сносом зданий с асбестосодержащими
конструкциями. При механическом воздействии материалы на
основе асбеста способны расщепляться на гибкиетонкис волок-
на, которые являются опасным компонентом запыленной ат-
мосфсры. Волокна находят также в воздухе тех мест, где асбест
добывают, размалывают или превращают в различные продукты.
Необходимо по возможности предотвращать попадание ас-
беста в воздух, воду и пищу. Для большинства изделий из асбеста
имеются равноценные заменители. Главным исключением оста-
ются накчадки для тормозов и муфт сцепления в тяжелых грузо-
вых автомашинах.
Не следует применять асбест для внутренней отделки жилых
зданий и детских учреждений.
Доказано, что заболевания легких среди тех, кто работает
с асбестом, преобладают у курильщиков. Другими словами, ку-
рение и загрязнение воздуха асбестом обладают синергическим
эффектом. Этот эффект можно объяснить тем, что микропо-
вреждения тканей легкого от воздействия асбестовых игл облег-
чают доступ канцерогенных веществ табака в поврежденные
клетки. Кроме того, у курильщиков происходит подавление ра-
боты крохотных ресничек клеток, выстилающих проходы в легкие
и обычно удаляющих из mix чужеродные частицы. Следователь-
но, в организме курильщиков такого рода частицы (в том числе
асбеста) остаются гораздо дольше, чем у некурящих. К тому же
твердые частицы несут на себе в адсорбированном состоянии дру-
гие зафязнитсли.
Для пыли и других веществ, представляющих канцерогенную
опасность, в Германии введено понятие «технически допустимая
концентрация» (ТДК), т. е. концеп грация вредного вещества, кото-
рая возникает на рабочем месте после применения всех доступных
180
средств для его устранения. Значение ТДК для мелкой асбестовой
ныли составляет около 0,05 мг, или около 106 волокон в 1 м3воздуха.
Предельно допустимые концентрации (ПДК) пыли в воздухе за-
висят от степени ес опасности для здоровья человека. Они раз-
личны в зависимости от видов пыли. В табл. 2.14 приведены
ПДК пыли некоторых вешеств в воздухе населенных мест.
Из данных табл. 2.14 следует, что ПДК пыли в воздухе насе-
ленных пунктов должна составлять: максимальная разовая — не
более 0,5 мг/ м3, среднесуточная — не более 0,15 мг/м3.
Воздействие металлической ныли на человека и животных. Одним
из опасных видов пыли является металлическая пыль, особенно
пыль тяжелых металлов. Рассмотрим ее воздействие подробнее.
Таблица 2.14
ПДК’* пыли различных веществ
в атмосферном воздухе населенных мест, мг/м’
Наименование вещества пдк,.р ПДКС ОБУВ0
Пыль абразивная (корунд белый, монокорунд) Пыль асбеетосодсржашая, количество хризотил-аебеста до 10% (по асбесту) Пыль бумаги, древесная пыль Пыль выбросов табачных фабрик 8- 10-* 0,06G* 4- 10-“ 0,040 0,100
(с содержанием никотина до 2,7%, в пересчете на никотин) То же (с содержанием никотина до 1,5% и смолистых веществ до 16%) Пыль зерновая 0,500 0,150 0,030
Пыль латуни (в пересчете на медь) Пыль меховая (шерстяная, пуховая) Пыль неорганическая: 20—70% SiO, (шамот, цемент и др.) 0,300 0,100 0,003 0,030
гипсового вяжущего из фосфогипса с цементом SiO2 <20% (доломит и др.) 0,500 0,150 0,500
S1O, >70% (динас и др.) 0,150 0,050 0,020 0,100 0,060 0.040
Пыль «пемолюкса» Пыль поливинилхлорида Пыль полиметаллическая спинцово-цинкового производства (содержит до 1% РЬ) Пыль стекловолокна и стеклопластика Пыль фенолоформаладегидной смолы резол ьного типа Пыль хлопковая 0,200 0,0001 0,050
” В индексе: м.р — максимальная разовая; с.с — среднесуточная; ОБУВ —
ориентировочно безопасные уровни воздействия.
« Волокон в 1 мл воздуха.
181
К тяжелым металлам (ТМ) относят более 40 химических эле-
ментов периодической системы Менделеева с относительными
атомными массами выше 50. Тяжелыми металлами называют
также элементы, которые имеют плотность более 7—8 тыс. кг/м1
(7—8 г/см’) (кроме благородных и редких). И хотя оба определе-
ния условны и перечни ТМ по этим двум признакам не совпада-
ют, термин «тяжелые металлы» прочно вошел в экологическую
литературу. К числу гяжслых металлов относят хром (Сг), марга-
нец (Мп), железо (Fe), кобальт (Со), никель (Ni), медь (Си), цинк
(Zn), галлий (Ga), германий (Ge), молибден (Мо) кадмий (Cd),
олово (Sn), сурьму (Sb), теллур (Тс), вольфрам (W), ртуть (11g),
таллий (Т1), свинец (РЬ), висмут (Bi). Иногда в экологической
литеразуре к ТМ относят мышьяк, который является неметал-
лом, но проявляет некоторые металлические свойства, в частно-
сти имеет металлический блеск.
Металлы попадают в воздух с дымом плавильных печей при
производстве, например, стали и цветных металлов, а также рас-
сеиваются вместе с золой и доменными шлаками. Как правило,
руды помимо главного металла содержат многочисленные при-
меси, которые не улавливаются и уходят вместе с дымом в атмо-
сферу. Например, цинковые руды содержат примеси индия и кад-
мия. Доменные газы уносят в атмосферу не только железо, но и
медь, свинец, мышьяк и другие металлы. Из 1 т пыли, выбрасы-
ваемой в атмосферу при плавке медных руд, можно получить до-
полнительно до 100 кг меди и немногим меньше свинца и цинка.
Твердые аэрозоли металлов образуются также при сжигании угля,
нефти, торфа и других горючих ископаемых. Металлическая пыль
поступает в атмосферу при проведении различных процессов об-
работки металлов (резание, сверление, шлифование и т. д.). При-
месь некоторых металлов присутствует в цементном сырье и вы-
деляется в воздухе при его обжиге. В результате антропогенной
деятельности в атмосферу поступает в несколько раз больше Au,
Cd, Pb, Sn, Sc, Те и других металлов, чем из природных источни-
ков В итоге всех этих процессов биос<|>ера постепенно насыщает-
ся металлами, находящимися в состоянии рассеяния.
В Белгородской области антропогенными источниками за-
грязнения атмосферы металлами являются открытые карьеры по
добыче железной руды, ОАО «Лебединский ГОК» и ОАО «Стой-
ленский ГОК», ОАО «Оскольский электрометаллургический
комбинат» (ОАО «ОЭМК»), машиностроительные и металлооб-
рабатывающие предприятия, гальванические цеха электрохими-
ческих производств (в городе Белгороде это заводы «Белэнерго-
маш», «Завод металлоконструкций», «Фрез», «Электроконтакт»,
«Сокол», «Промэлектроника» и др.). Источниками некоторых
металлов в атмосфере могут быть предприятия теплоэнергетики,
182
цементное производство (АО «Белгородский цемент», «Оскол-
цемент»).
Если воздействие кварца и асбеста является в основном ре-
зультатом механического повреждения ткани, то мельчайшие
частицы металлов или ионы металлов, попадая в кровь, вызыва-
ют образование токсичных продуктов биохимических реакций
в клетках.
Рассмотрим воздействие на организм человека и животных
некоторых тяжелых металлов, а также их источники. Главными
металлами-загрязнителями являются свинец, ртуть и кадмий.
Свинец, относи гея к числу металлов, наиболее распространен-
ных в окружающей среде и опасных для живых организмов. Со-
держание свинца в земной коре составляет 1,5 - 10~3%. В природе
свинец встречается в основном в виде галенита PbS. Из сульфид-
ных пород под воздействием атмосферных процессов он может
попадать в окружающую среду.
На Земле встречаются зоны с положительной геохимической
аномалией свинца, например па Оркнейских и Шетландских
островах.
Антропогенное поступление свинца в атмосферу гораздо боль-
ше природного. Еще сравнительно недавно (в начале 1990-х гг.)
основным источником свинца был тетраэтилсвинец, используе-
мый в моторном топливе в качестве антидетонационной добавки.
С продуктами сгорания бензина поступало до 70% общего коли-
чества выбросов свинца. В связи с принятыми мерами по отказу
от использования этилированного бензина доля этого источни-
ка ж>лжна постепенно уменьшаться, хотя данный процесс за-
медлен постоянным увеличением числа автомобилей. В Белго-
родскую область, например, в 1998 г. поступал только нсэтили-
рованный бензин.
Свинец может поступать в окружающую среду при добыче
свинцовых руд и выплавке из них свинца Производство и при-
менение аккумуляторных батарей, свинцовых покрытий кабе-
лей сравнительно мало влияют на загрязнение воздуха, если их
большая часть идет на вторичную переработку. Источником за-
грязнения атмосферы свинцом служат продукты сжигания твер-
дых отходов, утля и нефти. Свинец содержится в красках, служа-
щих антикоррозионным покрытием (РЬ3О4). В течение длитель-
ного времени свинцовый сурик РЬХО. (вещество ярко-красного
цвета) широко использовался в качестве пигмента в масляных
красках, применявшихся при окраске домов. Эти дома еще со-
хранились, и отслаивающаяся со стен старая краска в виде пыли
попадает в атмосферу. Этот процесс усиливается при разруше-
нии домов в процессе их сноса. Основной карбонат свинца(П)
РЬ;(ОН)2(СО3), раньше широко применялся для изготовления
183
белой масляной краски, известной под названием «свинцовые
белила». В настоящее время применяют более безопасные крас-
ки, и свинцовые белила заменены диоксидом ти гана TiO2 (тита-
новыми белилами). Для приготовления красно-коричневой крас-
ки используют железный сурик Fc2O3, встречающийся в природе
в виде красного железняка. Источником свинца может быть оцин-
кованная посуда (в цинке возможна примесь свинца), глазурь
керамической посуды (в ней также возможна примесь свинца),
свинцовое стекло (хрусталь), особенно при потреблении кислых
блюд и напитков, так как в кислой среде свинец растворяется и в
виде растворимых солей переходит в организм.
Так, есть все оснавания полагать, что упадок Римской импе-
рии в определенной степени был связан со свинцовой интокси-
кацией римлян. В Древнем Риме были свинцовые водопроводные
трубы. Кроме того, у римской элиты было принято покрывать
внутреннюю поверхность бронзовой посуды тонким слоем свин-
ца —для устранения неприятного, «плебейского» привкуса мели.
Химические анализы, выполненные учеными-археологами, по-
казали высокое содержание свинца в костях скелетов в богатых за-
хоронениях, принадлежащих представителям высшего класса рим-
ского общества.
Ряд современных производственных процессов, в которых
применяют продукты, содержащие свинец, также вносит вклад в
загрязнение окружающей среды свинцом.
Из перечисленных источников свинец поступает во все ком-
поненты биосферы: атмосферу, природные воды, почву, расте-
ния, животных и далее с продуктами питания в организм чело-
века. Свидетельством роста накопления свинца в атмосфере
является увеличение его концентрации во льдах Гренландии, со-
ответствующее периоду промышленной революции в XIX в и
в большей степени с середины XX в. в связи с возрастающим
числом автомобилей.
Свинец, расссятптый в воздухе, представляет наибольшую
опасность для здоровья человека. Концен грация свинца в атмо-
сфере городов может достигать 10 мкг/м3. При усреднении за ме-
сяц содержание свинца в городском воздухе составляет 5 мкг/м3.
В дожде и снеге порой присутствует до 300 мг/л свинца. Городская
пыль иногда содержит около 1% свинца При вдыхании эти час-
тицы попадают в легкие. Через легкие свинец поступает в кровь
человека. Содержание РЬ в крови современного человека в 100 раз
превышает его содержание в крови первобытною человека.
Свинец и его соединения относятся к ядам, действующим
преимущественно на нервно-сосудистую систему и непосред-
ственно на кровь.
Токсическое действие свинца связано с его способностью за-
мещать кальций в костях и нервных волокнах Свинец дспони-
184
руется в основном в скелете (до 90%) в форме труднораствори-
мого фосфата:
ЗРЬ2’ + 2РОЛ = РЬ.(РО4)2. (2.80)
Отравление человека свинцом проявляется нсспецифичсски-
ми симптомами'. вначале повышенная возбудимость и бессонни-
ца, позже утомляемость и депрессия. Более поздние симптомы
заключаются в расстройстве функции нервной системы и в по-
ражении головного мозга. Древнеримская элита при использо-
вании свинцовой посуды получала постепешгую и непрерывную
интоксикацию в течение жизни нескольких поколений. В ре-
зультате снижалась их энергия, работоспособность, исчезали
предприимчивость, азарт, настойчивость. Иные качества стано-
вились характерными для тех, кто правил государством, — быст-
рая утомляемость, вялость, безразличие, бездействие.
В медицине известны случаи свинцовых отравлений, которые
происходят на металлургических предприятиях. Это тяжелею забо-
левание организма, сопровождающееся поражением центральной
и вегетативной нервной системы, нарушением обмена веществ.
Свинец действует на ткани гладких мышц и па моторную
нервную систему, управляющую двигательной активностью, вы-
зывает параличи, головные боли, головокружение, увеличение
внутричерепного давления. Установлена связь гипертонии с вы-
соким уровнем содержания свинца в крови. Высокую заболевае-
мость рассеянным склерозом в некоторых регионах связывают
с большим содержанием свинца в красноцветных песчаниках.
Свинец — кумулятивный яд, иными словами, он постепенно
накапливается в организме человека, поскольку скорость его сс-
тествспного выведения очень низка. Присутствующий в атмо-
сфере свинец непрерывно добавляется к тому количеству, ко-
торое уже содержится в пашем организме. Свинец уменьшает
скорость образования эритроцитов в костном мозге, он также
блокирует синтез гемоглобина.
Как показывают проведенные исследования на животных,
свинец способен вызывать рак у крыс. Полагают, что подобные
данные могут быть распространены и на человека (преиму-
щественно это относится к раку почек, желудка, кишечника).
Присутствие свинца в продуктах питания влияет па развитие
кариеса. Свинец, как и другие тяжелые металлы (Hg, Cd), отри-
цательно влияет на реакцию глазной сетчатки, вызывает ухудше-
ние сумеречного зрения.
Особенно опасно воздействие свинца на маленьких детей,
оно вызывает умственную отсталость и хроническое заболева-
ние мозга. Сильное загрязнение воздуха городов свинцом отри-
цательно сражается на интеллектуальном развитии детей. Они
более чувствительны к отравлению свинцом по сравнению со
185
взрослыми, поскольку у маленьких детей пороговый уровень
свинца, при котором проявляются признаки свинцового отрав-
ления, составляет половину уровня для взрослых. Годовалый
ребенок в городе вдыхает и поглотает из воздуха почти столько
же свинца, сколько он получает и поглощает его из пищи.
Отравление свинцом у ребенка поначалу проявляется многи-
ми симптомами, включая потерю аппетита, непослушание, по-
терю интереса к играм. Развитие заболевания характеризуется
постоянными запорами, рвотой, припадками и обмороками.
Свинцовое отравление может даже закончиться смертью. В слу-
чаях средней тяжести отравления дети оказываются умственно
отсталыми. Даже при содержании свинца ниже порогового
уровня происходит ослабление способности к учебе.
Установлено, что органические соединения свинца более ток-
сичны, чем неорганические. Определение степени отравления
свинцом можно проводить по ai ализу крови, а также мочи или
волос. Признаки заболевания наблюдаются при содержании
свинца 1 мкг/мл в крови или соответственно 0,1 мкг/мл в моче.
Предельно допустимая концентрация свинца в в< з ухе насе-
ленных мест составляет: максимальная разовая — 0,001 мг/м3,
среднесуточная — 0,0003 мг/м3. Для тетраэтилсвинца макси-
мальная разовая ПДК составляет 0,0001 мг/м3, а среднесуточ-
ная — 4 • 10-5 мг/м3.
Ртуть. Кроме свинца наиболее полно по сравнению с другими
металлами изучена токсичность ртути для человека и животных.
Много исследований было проведено после 1953 г., когда открыли
«болезнь Минамата», по названию залива Минамата в Японии.
Люди, живущие здесь, умирали от отравления ртутью. Они упо-
требляли в пищу морскую рыбу и моллюски, содержащие ртуть.
Последняя попадала в залив со сточными водами предприятия,
расположенного на берегу залива.
Ртуть мало распространена в земной коре (~1 • 10-5%). Она
встречается главным образом в сульфидных осадках в виде кино-
вари HgS. Существуют природные источники загрязнения окру-
жающей среды ртутью, связанные с процессами выветривания
горных пород, а также с деятельностью земных и подводных вул-
канов. В вулканических районах наблюдаются ртутные геохими-
ческие аномалии, в частности такая аномалия обнаружена на
Гавайях: бывают периоды, когда концентрация ртути там превы-
шает 20 мкг/м3 воздуха. В атмосферу поступает как парообразная
Sryrb, так и металлическая — в форме частиц диаметром мспсе
,3 мкм.
Следует отметить, что хотя основную роль в загрязнении ок-
ружающей среды ртутью играют природные источники, доля
ртути, попадающей в окружающую среду в результате деятельно-
сти человека, постоянно возрастает. К антропогенным источни-
186
кам ртути относятся электрохимическое производство хлора и
щелочи, вышедшие из употребления люминесцентные лампы
дневного света, применяемые в медицинской практике (для ле-
чения воспалительных процессов) ртутно-кварцевые лампы,
манометры, термометры, краски, производство пестицидов, цел-
люлозно-бумажное производство, электронная промышленность,
фармацевтические препараты, некоторые полимерные материа-
лы. Ртугь выделяется в атмосферу при сжигании ископаемого
топлива (угля и особенно нефти). В бурых утлях относительно
мало ртути, больше ее содержится в антрацитах. Среднее содер-
жание ртути в угле составляет Концентрация ртути в не-
фти и нефтепродуктах еще выше и составляет 2 I (Н—2 • 10~3%.
При сжигании угля в золе остается 10% Hg, остальное перехо-
дит в парообразное состояние и поступает в атмосферу в виде
выбросов через трубы. Техногенным источником атмосферной
ртути является цементное производство. Обжиг известняка и
глинистых сланцев всдегся при весьма высокой температуре —
до 1500 °C. Этого достаточно, чтобы ртуть, в рассеянных коли-
чествах присутствующая в осадочных породах, перешла в атмо-
сферу. Ртутные пары выделяются в воздух также при переработ-
ке полиметаллических руд — при производстве Pb, Zn, Си
В атмосфере ртуть адсорбируется частицами пыли, при этом ее
содержание относительно веса пылинок иногда бывает 1 : 1.
Хотя в основном ртуть содержится в гидросфере, ее присут-
ствие в атмосфере также является серьезной экологической
проблемой. Природное содержание ртути в атмосфере составляет
примерно 0,003—0,009 мкг/м3, однако в районах добычи сульфид-
ных руд ее содержание возрастает на несколько порядков. Так,
в воздухе над рудником в Аризоне содержалось 20 мкг/м ртути.
Антропогенный вклад ртути составляет —1/3 всех поступле-
ний этого металла в атмосферу. Из атмосферы ртуть выпадает на
поверхность суши, затем с поверхностным стоком она поступает
в водоемы, где и концентрируется в основном в донных отложе-
ниях.
В воде ртуть взаимодействует с органическими веществами и
с помощью анаэробных организмов переходит в токсичные ве-
щества метилртугь (CH3Hg)+ и диметилртуть СН3—Hg—СН3.
Так как метилртугь растворима, она быстро проникает в орга-
низмы, живущие в водной среде, и далее по пищевой цепи попа-
дает в организм человека.
Помимо ртути, алкилированию под действием бактерий спо-
собны подвергаться многие металлы и неметаллы: Pb, Sn, Cd, Tl,
As, Se и др. В алкилированной форме металлы проявляют более
выраженное токсическое действие, чем в ионной форме, уже
в ничтожных количествах оказывая вредное и даже губительное
воздействие на живые организмы.
187
Метилртуть особенно опасна, так как она быстро переходит
из крови в мозговую ткань, разрушая мозжечок и кору головного
мозга. Клинические симптомы такого поражения — оцепене-
ние, потеря ориентирования в пространстве, частичная потеря
зрения. Симптомы ртутного отравления проявляются нс сразу.
Так как головной мозг содержит избыток клеток, выполняющих
какую-либо определенную функцию, то клинические симптомы
обычно нс проявляются до тех пор, пока эта избыточность нс
исчезнет. Другим неприятным последствием отравления метил-
ртугью является проникновение ртути в плаценту и накопление
ее в плоде, причем мать не испытывает болезненных ощущений.
Метилртуть токсична и для животных. ВIIIвеци и раствор мс-
тилртути применяли для протравы посевного зерна с целью ли-
квидации плесневого грибка. Это повлекло за собой массовое
отравление зерноядных птиц, а также хищников, которые пита-
лись этими п тицами. У хищных птиц концентрация ртути в орга-
низме была в несколько раз выше, чем у зерноядных. Значит, ртуть
способна к биоаккумуляции.
Ртуть оказывает вредное воздействие на почки, органы пище-
варения, центральную нервную систему, сердце человека, резко
снижает кровяное давление. При остром отравлении наблюда-
ются вспышки психического возбуждения с возможными гал-
люцинациями, которые сменяются упадком сил. Признаками
острого отравления являются усталость, дрожание рук, помутне-
ние рассудка (отсутствие ясности мышления), тошнота.
Острое ртутное отравление, получившее в Японии название
«болезнь Минамата», сопровождалось следующими симптома-
ми. У людей, съевших отравленную рыбу, быстро ухудшались
зрение и слух, расстраивалась координация движений, конвуль-
сии и судорога сводили мышцы, нарушалась речь, появлялись
серьезные психические отклонения. Наиболее тяжелые случаи
заканчивались полной слепотой, параличом, безумием, смертью.
Проверка показала, что концентрация ртути в рыбах залива Мина-
матадостигала 50 мг/кг веса рыбы. В 1953г. более 100 человек забо-
лели этой страшной нервной болезнью, из них 50 умерли, в этот
период подвергались интоксикации ртутью внутриутробные
младенцы, еще нс появившиеся на свет. Родившись, несчастные
дети росли медленно и были умственно отсталыми. От этой бо-
лезни страдали не только люди, но и домашние животные — за
три года в районе этого залива погибло до половины всех кошек.
Позднее острые ртутные отравления были отмечены и в дру-
гих районах Японии, а также в Швеции В озерах Швеции кон-
центрация ртути (попадала в озера с отходами целлюлозно-бу-
мажного производства) была ниже, чем в заливе Минамата, око-
ло 10 мг/кг веса рыбы, поэтому опасных отравлений и смертей
в Швеции не было. В связи с отравлением людей, птиц и рыбы
в Швеции в 1966—1967 гг. было запрещено применение прспа-
188
ратон, содержащих ртуть, в сельском хозяйстве (ртутьсодержа-
щих пестицидов) и целлюлозно-бумажной промышленности.
Достаточно большое количество ртути попадает в воздух, ког-
да разбиваются стеклянные ртутные термометры. Такие термо-
метры широко используются как в химических лабораториях,
так и в медицине. По данным для США, ежегодно в окружаю-
щую среду из разбитых медицинских термометров выделяется
60 т ртути. Необходимо помнить, что ртуть — весьма токсичный
металл, поэтому требуется соблюдать меры осторожности при
обращении с термометрами. Ртуть, пролитую из разбитого тер-
мометра, необходимо немедленно собрать одним из доступных
методов (с помощью резиновой груши или ватного тампона,
смазанного любым жиром или кремом, а также с применением
порошка серы), затем поместить в небьющийся, герметично за-
крывающийся сосуд с 10%-ом раствором КМпО«, подкислен-
ным соляной кислотой, или с 20%-ом раствором FcCl3. Реакти-
вы, используемые для этой цели, называются демеркуризаторами.
После этого ртуть можно эвакуировать в специально отведенное
место (полигон) для токсичных отходов. Но лучше собранную ме-
таллическую ртуть сдать в специальную лабораторию. В г. Белго-
роде в декабре 1997 г. при Государственном комитете по охране
окружающей природной среды Белгородской области была орга-
низована лаборатория по утилизации ртутьсодержащих ламп и
приборов. Собранную ртуть ни в косм случае нельзя выбрасы-
вать в канализационную систему. Жидкий металл будет- испа-
ряться, загрязняя воздух в помещении. Пары металлической
ртути вызывают тяжелые отравления. Ртуть может адсорбиро-
ваться неокрашенным деревом, меловой побелкой (СаСОр, ков-
ровыми покрытиями и другими ворсистыми, мягкими тканями.
Так возникает опасность хронического отравления ртутью лю-
дей, живущих или работающих в этом помещении.
Клиническая проверка ртутного отравления основана на опре-
делении содержания ртути в крови. Симптомы ртутного отравле-
ния наступают при се содержании в крови (0,2—0,6) 10~*%.
Среднесуточная предельно допустимая концентрация металли-
ческой ртути в воздухе населенных мест — 0,0003мг/м3. Для боль-
шинства соединений ртути (в пересчете на чистую ртуть) ПДКС С
имеет такое же значение (0,0003мг/м3).
Кадмий — третий метдлл-загрязнитель, представляющий серь-
езную опасность для человека и животных. Он, так же как свинец
и ртуть, встречается в основном в сульфидных породах, т. е. отно-
сится кхалькофильным элементам. По своим свойствам Cd очень
сходен с Zn, является его постоянным спутником в природных со-
единениях. Кадмий получают из цинковых пород, однако его со-
держание в земной коре примерно в 700 раз меньше, чем цинка, и
составляет всего 1,3 10“ %. Zn, Cd и Hg — это сходные по хими-
ческим свойствам элементы (составляют одну подгруппу в Пе-
189
риодичсской системе), однако они сильно различаются по био-
логической роли. Если Zn — жизненно необходимый элемент и
только в сравнительно больших концентрациях обладает ток-
сичностью, то Cd и Hg — примесные токсичные элементы.
В результате атмосферных процессов кадмий, как и другие
элементы, попадает в воздух и водоемы. Природный уровень
кадмия в воздухе составляет около 0,002 мкг/м}, однако районы
предприятий по выплавке цинка и кадмия характеризуются бо-
лее высокими концентрациями кадмия — свыше 0,3 мкг/м3.
Ежегодное производство кадмия в мире по оценкам разных ав-
торов, составляет 15—20 тыс. т. При добыче, обогащении и вы-
плавке этого металла происходит значительное зафязненис им
воздуха. Повышенное содержание кадмия отмечалось в листьях
деревьев, травах, лишайниках, мхах и почвах на расстоянии бо-
лее 12—13 км от плавильного завода, а в некоторых случаях и на
расстоянии 25 км по направлению ветра. Почти такое же коли-
чество кадмия, как при выплавке, попадает в атмосферу в ре-
зультате сжигания или переработки изделий, содержащих Cd.
Так, выделение кадмия в атмосферу происходит при сжигании
каменного угля и в меньшей степени — нефти. Кадмий содер-
жится в мазуте и дизельном топливе, которые используются
в сельскохозяйственной технике и автотранспорте. Есть и другие
антропогенные источники загрязнения окружающей среды кад-
мием. Металлический кадмий входит в состав различных спла-
вов, применяемых в машино- и приборостроении, используется
при изготовлении трамвайных и троллейбусных проводов,
в медных и серебряных контактах, автоматических огнетушите-
лях, типографических изделиях, свинцово-оловянных припоях
и др. Он присутствует в изделиях, содержащих цинк. Кадмий
йожет выделяться также при травлении меди, свинца, так как он
присутствует в них в виде примеси. Кадмий используется при
изготовлении электрических батарей, щелочных аккумуляторов
(никель-кадмиевых, серебряно-кадмиевых), стабилизаторов;
применяется в гальванических процессах (кадмирование), про-
изводстве красок и цветных стекол (CdS — желтая краска) и не-
которых пластмасс. В пластмассы кадмий добавляется дчя проч-
ности и в составе красителей. Следует учитывать, что при сжига-
нии мусора, содержащего изделия из таких пластмасс, кадмий
попадает в атмосферу. Кадмиевые стержни применяются
в ядерных реакторах. Он содержится в виде незначительной
примеси в фосфорных удобрениях (суперфосфате), входит
в состав противогрибковых ядохимикатов (фунгицидов), из ко-
торых попадает в сельскохозяйственные растения и далее,
с продуктами питания, в организм человека. Аналогичным пу-
тем кадмий попадает в табак. В сигарете может содержаться до
1—2 мкг Cd, причем 25% этого количества остается в организ-
ме, создавая серьезную опасность для здоровья курильщиков.
190
так как кадмий гораздо легче абсорбируется при вдыхании, чем
при проглатывании.
Антропогенный выброс кадмия в атмосферу (7 тыс. т/год) на-
много превышает поступление его из природных источников
(850 т/год) В результате действия антропогенных и естествен-
ных источников происходит накопление аэрозоля кадмия вбли-
зи земной поверхности.
Дождь может содержать до 50 мкг/л Cd. Ежедневно с пищей и
воздухом при дыхании в организм взрослого человека может по-
ступить около 50 мкг Cd, из них ~2 мкг задерживается, осталь-
ное выводится. В организм у заядлых курильщиков дополни-
тельно попадает 1—4 мкг кадмия. Если цинк является активато-
ром многих биохимических процессов в организме человека, то
кадмий, как и ртуть, оказывает ингибирующее действие на мно-
гие ферменты и в результате тормозит процессы с их участием.
Хотя концентрация кадмия в окружающей среде не столь вели-
ка, как, например, свинца, этот металл обладает способностью
накапливаться в организме. При систематическом поглощении
в течение нескольких лет его котгцентрация в организме человека
превысит исходную в несколько раз. Если в среднем человек на-
капливает около 30 мг кадмия, то из них 33% накапливаются
в почках, 14% — в печени, 2% — в легких, 0,3% — в поджелудоч-
ной железе, остальное — в других тканях. Связываясь с металло-
тионином, кадмий в виде белкового комплекса накапливается
в наибольшей степени в коре надпочечников. При хроническом
отравлении кадмием в моче появляется белок; это является при-
чиной образования камней в почках. Период полувыведсния по-
глощенного кадмия, связанного с мсталлотионином, составляет
около 35 лет для маленьких детей и около 12 лет для людей зрелого
возраста. Таким образом, одним из отрицательных последствий на-
копления кадмия является тяжелое поражение почек.
Установлено влияние содержания кадмия и цинка в почках
на кровяное давление у людей. Кадмий способен повышать кро-
вяное давление. Видимо, не случайно в Японии, где кадмиевое
загрязнение среды очень велико, отмечается относительно боль-
ше инсультов, чем в других странах.
Наряду с накоплением в почках кадмий, подобно кальцию, от-
кладывается в костях, образуя фосфат кадмия Cd3(POi)2. Одно-
временно вымываются из костей ионы Са2+, что сопровождается
болезненным усыханием скелета. Это специфическое костное за-
болевание впервые было открыто в Японии и получило название
«итай-итай». Появление данной болезни связано с загрязнением
окружающей среды от горнодобывающего комплекса, а также
с загрязнением воды на рисовых полях кадмием, который вхо-
дил в состав фунгицидов. Распространенность этой болезни
в Японии обусловлена сше и тем, что кадмий накапливается
в рыбах и некоторых морских животных, продукты из которых
191
являются важной частью питания населения этой страны. Этот
недуг выражается в нарушениях различных функций организма,
в необычайной хрупкости и ломкости костей, в результате чего
даже глубокий вдох может явиться причиной перелома ребра.
Кадмий размякает кости. От болезни «итай-итай» в Японии по-
гибло уже несколько сотен человек.
Наряду с воздействием на костную систему систематическое
отравление кадмием приводит к появлению на зубах желтовато-
го налета (это CdS — «кадмиевая кайма»), патологическому из-
менению слизистой оболочки носоглотки, к снижению числа
эритроцитов.
Опасность кадмия для человека и животных заключается еще
и в его канцерогенности. Опыты с крысами показали возмож-
ность возникновения рака легких под действием аэрозолей
CdCl,, следовательно, существует опасность канцерогенного воз-
действия биологически активных ионов кадмия и на человека.
Против кадмия выдвинуты серьезные обвинения, так как отмеча-
ется связь между его содержанием в питьевой воде и смертностью
от рака. Считают, что с кадмием могут быть связаны все формы
рака. В этом его отличие от других тяжелых металлов, которые
обычно «специализируются» на определенном виде рака.
Среднесуточная 11ДК соединений кадмия (в пересчете на кад-
мий) составляет 0,0003мг/м3.
Таким образом, мы рассмотрели источники и влияние на орга-
низм человека главных мсталлов-загрязниюлей (Pb, Hg, Cd), ко-
торые являются примесными элементами.
Теперь кратко рассмотрим антропогенные источники и влия-
ние на здоровье человека избыточных количеств таких, металлов,
которые являются жизненно необходимыми, постоянно содержат-
ся в организме и шрают определенную биологическую роль.
К таким металлам, в частности, относил ся цинк и медь.
Цинк. Содержание цинка в земной коре составляет ~1 • 10'2%.
Вместе с кадмием он встречается в основном в сульфидных по-
родах. Главные природные соединения цинка — это цинковая
обманка ZnS и смитсонит (галмей благородный) ZnCOj. В ре-
зультате атмосферных процессов цинк попадает в атмосферу и
гидросферу. Цинк и кадмий ведут себя одинаково в геохимиче-
ских и промышленных процессах, и источники загрязнения эти-
ми элементами почти одни и те же. Основным антропогенным
источником загрязнения атмосферы являются производства по
добыче цинковой руды, ее обогащению и выплавке металла.
Цинк используют во многих отраслях промышленности, но глав-
ное применение он находит в гальванических покрытиях, кото-
рые наносятся на железные и стальные изделия (цинкование), и
в производстве сплавов с алюминием, медью и магнием.
Цинк и его сплавы применяются в машиностроении, элект-
ротехнической промышленности. Заводы по выплавке цинка и
192
его сплавов и гальванические заводы — наиболее серьезные ис-
точники загрязнения окружающей среды цинком. Значительная
часть цинка расходуется для изготовления гальванических эле-
ментов (марганцево-цинковых и др.), применяемых в качестве
источников электропитания установок связи, различных изме-
рительных приборов, карманных фонарей, а также в производ-
стве аккумуляторов (серебряно-цинковых). Оксид цинка ис-
пользуется для изготовления белой масляной краски (цинковые
белила) и в качестве наполнителя резины. Соли цинка ZnCk и
ZnCl2 • 2NH4C1 применяются для травления металлов, при пай-
ке и сварке металлов. Сульфид цинка ZnS примени ют в качестве
люминофора при изготовлении экранов телевизоров.
Цинк является жизненно важным элементом и по степени
своей необходимости для живых организмов относится к метал-
лам жизни. Он входит в состав более 40 металлоферментов, ко-
торые катализируют гидролиз пептидов, белков, некоторых
эфиров и альдегидов. Цинк входит в состав гормона инсулина,
который влияет на содержание сахара в крови Этот элемент со-
держится в организме человека в количестве 10,8 ммоль (для
сравнения: Cd — 0,6 ммоль, Hg — 0,18 ммоль). Он концентриру-
ется в мышцах, печени, поджелудочной железе, некоторых дру-
гих органах.
Но, несмотря на свою важную биологическую роль, цинк, как
и всякий элемент, при поступлении в организм в избыточном
количестве оказывает отрицательное воздействие на здоровье
человека, становится токсичным. В больших количествах (—150 mi
для взрослого человека) он вызывает рвоту.
В целом цинк оказывает обшетоксичсское, раздражающее,
канцерогенное действие, вызывает сладкий вкус во рту, сухость
в горле, тошноту, рвоту, кашель, раздражение кожи, слизистых
оболочек, бессонницу, снижение массы тела, ослабление памя-
ти, малокровие, кровоизлияние, отек легких.
Для соединений цинка (в пересчете на цинк) установлены средне-
суточные предельно допустимые концентрации. В частности, ПДК
составляют (мг/м3 воздуха): для ацетата — 0,005; нитрата — 0,003;
карбоната — 0,020; оксида — 0,050; сульфата — 0,008. Для других
соединений (в пересчете на цинк) определены следующие ориен-
тировочные безопасные уровни воздействия (ОБУВ): для хлорида
и монофосфата — 0,005; для сульфида — 0,010 мг/м-’воздуха.
Медь. Содержание меди в земной коре примерно такое же,
каки цинка (0,01%). Медь тоже относится к хал ькофильным ме-
таллам; се обнаруживают в сульфидных осадках вместе с Pb, Cd,
Zn. Основное количество (80%) мели выплавляют из суль-
фидных руд (медный блеск Cu,S, медный колчедан CuFeS,). Ос-
новные примеси при выплавке меди — Fc, Zn, Со. За1рязненис
атмосферы медью происходит прежде всего при добыче руды, се
обогащении и выплавке металла. Медь может переноситься на
193
большие расстояния с воздухом и водой. Так, например, аномаль-
ное содержание мели было обнаружено в почве и растениях на
расстоянии более 8 км от плавильного завода. Медь используют
для изготовления электрических проводов и кабелей, котлов и пе-
регонных кубов, для гальванических покрытий (меднение). Ши-
рокое применение в машиностроительной промышленности,
электротехнике и других производствах находят сплавы меди
с Zn, Ni, Sn, Al, Fe, Мп, Be (латунь, бронза, мельхиор, нейзиль-
бер). Названные производства могут служить источниками за-
грязнения окружающей среды медью и сопутствующими пере-
численными выше металлами. Медь вносят в почву с микроудоб-
рениями. Из солей меди, например таких, как (СиОИ)2СО3
(малахит), Си(СН,СОО)2 Н,0 и других, вырабатывают боль-
шое число разнообразных по цвету минеральных красок: зеле-
ных. синих, коричневых, фиолетовых и черных. Все соли меди
ядовиты. Некоторые из них применяются в качестве пестици-
дов. Например, раствор медного купороса CuSO. • 5Н,0 исполь-
зуют для опрыскивания растений и протравления зерна перед
посевом, чтобы уничтожить споры вредных грибков. Смешан-
ный ацетат-арсенит мсди(П) Си(СН ;СОО), Си(ЛдО3)2 приме-
няют под названием «парижская зелень» для уничтожения вре-
дителей растений. Содержащаяся в пестицидах медь усваива-
ется сельскохозяйственными растениями и далее поступает
в организмы животных и человека.
Медь, как и цинк, является необходимым микроэлементом
растительных и животных организмов. По значимости она отно-
сится к металлам жизни. В организме человека медь содержится
в меньшем количестве, чем цинк (около 1,1 ммоль). В основ-
ном она концентрируется в печени головном мозге и крови.
В настоящее время известны около 25 медьсодержащих белков
и ферментов, роль которых — активировать многие процессы,
в том числе окисление органических веществ. Медь вместе с же-
лезом участвует в кроветворении. При дефиците меди в организ-
ме нарушается обмен железа между плазмой крови и эритроци-
тами, это может привести к разрушению эритроцитов. В опытах
на животных показано, что недостаток меди приводит к тяже-
лым отклонениям в обмене веществ: медная анемия (или так
называемая «лизуха»), экзотическая атаксия (нарушение коор-
динации движений) и др. Для лечения таких животных доста-
точно введения растворимых солей меди в рацион питания. По-
требность человека в меди (2—3 мг в сугки) может полностью
обеспечиваться потребляемой пищей.
Избыток меди отрицательно сказывается на здоровье челове-
ка. Известна болезнь Коновалова—Вильсона, связанная с избы-
точным количеством меди в организме. При этом избыток меди
откладывается в мозговой ткани, коже, печени, поджелудочной
железе и миокарде. Считается, что этот избыток накапливается
194
из-за того, что нарушен синтез церулоплазмина — медьсодержа-
щего белка, который присутствует в плазме крови млекопитаю-
щих. Выполняя чранспортную "функцию, церулоплазмин peiy-
лируст баланс меди и обеспечивает выведение се избытка из
организма.
В больших концентрациях растворимые соли меди токсичны.
Так, например, сульфат меди (медный купорос) массой до 2 г
вызывает сильное отравление с возможным смертельным исхо-
дом. Токсичное действие меди объясняется тем, что медь обра-
зуете белками нерастворимые бионеорганические комплексы —
альбуминаты, т. с. свертывает белки. Ионы меди образукл проч-
ную связь с аминным азотом и с группой SH-бслков, что приво-
дит к инактивации ферментов.
Нстпрямыхдоказагсльствтому, что медь обладает канцероген-
ным действием, хотя рак легких среди медников распространен.
В целом можно отметить, что медь оказывает обшстоксичсское,
раздражаю!цес, мутагенное действие, вызывает головную боль, го-
ловокружение, слабость, боли в мышцах, нарушение функции пе-
чени, почек, раздражает слизистые оболочки, кожу глаз, вызывает
изъязвления и перфорацию носовой перегородки, "изъязвление ро-
говицы глаза, расстройство нервной системы, сладкий вкус во рту,
Iювышение температуры до 38—39 °C, «медную лихорадку».
Дли соединений меди (в пересчете на медь) установлены средне-
суточные предельно допустимые концентрации. В частности, ПДК
составляют (мг/м3 воздуха): для сульфата, сульфида и хлорида
меди(П) — 0,001; для оксида мсди(П) и хлорида меди(Т) — 0,002.
В 1996—1998 гг. в г. Белгороде было проведено определение
некоторых тяжелых металлов в дождевой воде методом атомно-
абсорбционной спектрометрии. Медь обнаружена не была; сви-
нец и кадмий присутствовали в атмосферных осадках только
в западной, промышленной части города, где находятся пред-
приятия по производству цемента, асбестоцементных изделий,
железобетонных конструкций, авторемонтный завод и др. Кон-
центрация свинца составляла 35 мкг/л, кадмия — всего 2 мкг/л.
Однако цинк был обнаружен во всех пяти пробах, взятых в раз-
ных точках города. Его концентрация варьировала в пределах
20—490 мкг на 1 л дождевой воды и была максимальной в запад-
ной части города.
Болес детальное исследование атмосферных осадков в райо-
не предприятий стройиндустрии г. Белгорода (комбинат «Строй-
материалы» в северо-восточной части города и ряд вышепере-
численных предприятий в западной части города) позволило
установить полиэлементность состава аэрозольных частиц,
осаждаемых дождем. В них присутствовали многие металлы,
в том числе и тяжелые, редкие и рассеянные — Са, Mg, Al, Ее, К,
Ba, Na, Sb, Ti, Mo, Pb, Cu, Zn, Se, Gd, La, наряду с неметаллами —
Si, C, S, P, As.
195
Пыль и аллергические заболевания. Пыль различного химиче-
ского состава и разного происхождения может вызывать у людей
аллергию. Аллергия (allergia от 1реч. alios — другой и ergon — дей-
ствие) — это повышенная чувствительность организма человека
к воздействию некоторых факторов окружающей среды (химиче-
ских веществ, микроорганизмов и продуктов их жизнедеятельно-
сти, пищевых продуктов и др.), называемых аллергенами. Аллергия
приводит к развитию аллергических болезней, среди которых осо-
бенно часто встречаются бронхиальная астма, ноллинозы (на-
сморк, конъюнктивит и др.), крапивница, контактные дерматиты.
Аллергические заболевания известны с древних времен. Ешс
Гиппократ (V—IV вв. до н. э.) описал случаи непереносимости
некоторых пищевых продуктов, приводящей к желудочным рас-
стройствам и крапивнице, а Гален (П в. н. э.) сообщил о насмор-
ке, возникающем от запаха розы. В XIX в. была описана сенная
лихорадка и доказано, что сс причиной является вдыхание пыль-
цы растений. Термин «аллергия» был предложен в 1906 г. авст-
рийским педиатром Пирке для обозначения необычной, изме-
ненной реакции некоторых детей на введение им с лечебной
целью противодифтерийной сыворотки.
Широкое распространение аллергии связано со множеством
причин, среди которых загрязнение окружающей среды выхлоп-
ными газами, выбросы отходов промышленного производства;
увеличивающееся применение антибиотиков и других лекар-
ственных средств; развитие химической промышленности, в ре-
зультате чего появилось большое количество синтетических ма-
териалов, красителей, моющих средств и других веществ, мно-
гие из которых являются аллергенами Аллергены бывают-.
• неинфекционного происхождения (бытовая пыль, шерсть
животных, лекарственные средства и другие химические вещест-
ва и растительные пищевые продукты);
• инфекционного происхождения (бактерии, вирусы, грибки и
продукты их жизнедеятельности)
Специалисты различают биологические, лекарственные, бы-
товые, пыльцевые, пищевые и промышленные аллергены
Промышленными аллергенами могут быть скипидар, минераль-
ные масла, никель, хром, мышьяк, деготь, дубильные вещества,
красители, лаки, инсектициды, фунгициды, бакелит, формалин,
мочевина, эпоксидные смолы, детергенты, аминобензолы, про-
изводные хинолина, хлорбензола и многие другие вещества. Ал-
лергенами могут быть стиральные порошки, красители для во-
лос, бровей и ресниц, парфюмерные средства.
В ответ на внедрение в живой организм аллергена возникают
аллергические реакции. На первой сталии отмечается повышен-
ная чувствительность к впервые попавшему в организм аллер-
гену — сенсибилизация. Происходит это в результате выработки
196
антител, образующихся в ответ на введение только данного
аллергена, или появления лимфоцитов, способных взаимодей-
ствовать с данным аллергеном. Если к моменту их возникнове-
ния аллерген удален из организма, никаких болезненных прояв-
лений нс наблюдается. При повторном воздействии аллерген со-
единяется с образовавшимися антителами или лимфоцитами.
С этого момента происходит ряд биохимических процессов с вы-
делением гистамина и друз их медиаторов. На последней стадии
наступает повреждение клеток, тканей, органо».
Профессиональные аллергические болезни развиваются при
производственном контакте с промышленными аллергенами,
поступающими в атмосферу в виде аэрозоля. При ингаляцион-
ном поступлении аллергена в организм развиваются аллергиче-
ские заболевания органов дыхания (бронхиальная астма, рини-
ты и др.), при попадании его через кожу — дерматиты, экзема
и др. В условиях производства нередко наблюдается одновре-
менное действие аллергенов на кожу и респираторный тракт, что
вызывает поражение органовдыхания и кожи.
В табл. 2.15 перечислены некоторые виды пыли, оказывающие
аллергическое действие.
Таблица 2.15
Некоторые виды пыли, вызывающие аллергию
Группа а.ыер|еноь Примеры аллергенов
Биологические Бактерии Вирусы Грибки
Лекарственные Пенициллин Хинин
Бытовые Пыль ковров, одежды, постельного белья Частички домашних насекомых, клсшн Волосы, шерсть, перхоть животных Перья птиц Препараты бытовой химии (порошкообразные моющие средства) Сухой корм для аквариумных рыбок — рачок дафния
Пыльцевые Пыльца некоторых растений, особенно пыльца амброзии
Пищевые Кофе Какао Мука
Промышленные Металлы (платина, ванадий, бериллий, никель, хром,
(производственные) кобальт, ртуть) Древесная пыль Искусственные смолы Пестициды Белково-витаминныс концентраты — продукты биохи- мических заводов
197
Влияние пыли на растения. Содержащаяся в воздухе пыль
(кварцевая, известковая, цементная, асбестовая, угольная, ме-
таллическая и т. д.) может оседать на листья и стебли растений.
Например, вблизи источника выброса поверхностью листьев
может удерживаться около 30% от общего количества осевших
тяжелых металлов. В низинах и с наветренной стороны это коли-
чество может возрастать до 60%.
Пыль удерживается на растениях тем прочнее, чем гуще во-
лоски (трихомы) на поверхности листа. Гигроскопическая пыль
может высасывать из листьев воду через эпидермис и таким об-
разом понижать степень гидратации цитоплазмы, необходимую
для нормального обмена веществ. Это приводит к усыханию
листьев. Пыль, содержащая известь, как, например, выбросы
цементных заводов, образуе г на поверхности листа с водой твер-
дую корку Са(ОН)2 или ЗСаО SiO2. Такая корка закрывает все
норы и нарушает газообмен, необходимый для нормального пи-
тания растения и процесса фотосинтеза.
Негигроскопическая пыль влияет также и на процесс фото-
синтеза. Как известно, для фотосинтеза необходим солнечный
свет определенной длины волны. Отложения ныли на растениях
сильно отражают солнечный свет в спектральной области 400—
750 нм и тем самым препятствуют нормальному осуществлению
фотосинтеза.
Поглощая инфракрасное излучение, пыль способствует пере-
греву листьев. Таким образом, во время летней жары нормаль-
ный водный режим в листьях может быть нарушен, и перегрев
приведет к снижению активности ферментов фотосинтеза.
Белый налет на листьях — признак угнетения и усыхания тра-
вянистых растений — можно наблюдать, например, в лесу близ
предприятия «Стройматериалы» (ООПТ урочище «Городской лес»),
а также в районе цементного завода г. Белгорода.
Во время дождей происходит частичное освобождение расте-
ний от осевшей ныли
Роль аэрозолей в процессах разрушения металлов и силикатных
материалов. Мы уже знаем, что присутствующий в воздухе сер-
нистый газ, реагируя с атмосферной влагой, образует непрочную
сернистую кислоту' H2SO3(cm. реакцию (2.41)):
SO. + Н.О^тН + HSOj-► 21V I SO,2-,
которая под каталитическим воздействием тяжелых металлов
либо при взаимодействии с радикалами ОН , озоном О3 или пе-
роксидом водорода Н2О, превращается в серную кислоту 112SO4:
SO2 + 2ОН —»H,SO4:
SO,-Г о,—►SO1 + O2;
SO, + Н2О —» H,SO4;
198
HSO,- + О,—► SO,2 + H‘ + О,;
nso3- + Н2О, —► SO?- + 1Г + н,о.
Подробно эти реакции были рассмотрены в разд. 2.5.2 (см. ре-
акции (2.36), (2.37), (2.40), (2.43), (2.44)).
Образующаяся серная кислота, как известно, может разру-
шать металлы, карбонатные и силикатные материалы
Одновременное присутствие в атмосфере частиц пыли и аэрозо-
ля серной кислоты в значительной степени усиливает коррозию
металлов и силикатных покрытий. Сернокислотные аэрозоли
отлагаются на поверхности металлов, стекла, каменной обли-
цовки зданий. На всех открытых поверхностях образуются тон-
чайшие налеты сульфатов. Пыль также образует отложения на
поверхности этих материалов. Некоторые вещества пыли обла-
дают гигроскопическими свойствами. К ним относятся, в част-
ности, сульфаты и хлориды, что удерживает влагу. Во влажной
пленке пыли кислотные газы (SO, и 11С1) растворяются, что уси-
ливает коррозию. Серная кислота, удержанная осадками ныли,
также способствует усилению коррозии металлов, известковых
и силикатных материалов по сравнению с коррозией в атмосфе-
ре в отсутствие аэрозолей.
Вопросы и задания
1. Дайте определение понятиям: пыль, дым, туман. 2. Назовите ecrecTneiniuc и ант-
ропогенные источники твердых частиц в атмосфере. 3. Возможно ли возникновение ра-
(иоактивных аэрозолей в районах, удаленных па сотни километров от источника вы-
броса? Дайте обоснованный ответ. 4. Какие но химическому составу аэрозоли преобла-
дают в зоне предприятий строи тельного комплекса города Белгорода? 5. Какие
изменения могут происходить с аэрозольными частицами в ат мосфере? 6. Каково время
пребывания частиц в атмос<|тере и от каких фак торов оно зависит? 7. Зная размер аэро-
зольных частиц в городе Белгороде, составьте прогноз их возможного переноса в атмо-
сфере. 8. Назовите пугн самоочищения атмосферы от взвешенных частиц. 9, Какие хи-
мические реакции с аэрозолями могут происходить в атмосфере? Приведите примеры.
10. В чем состоят особенности поведения стратосферных частиц и каков их химический
состав? 11. Какие изменения кл нмата наблюдаются при увеличении количества аэрозо-
лей, особенно в городах? 12. Что является причиной повышения вероятности заболева-
ния рахитом и инфекционными болезнями? 13- Что такое пневмокониозы и каковы
причины их возникновения? 14. Охарактеризуйте наиболее распространенные виды
пневмокониозов. Какие симптомы характерны для а) силикоза; б) асбестоза? 15. В чем
специфика воздейст иия асбеста на организм человека? Назовите возможные источники
поступления асбестовых волокон в атмосферу, я том числе в вашем городе, поселке и т. п.
16. Что такое тяжелые металлы? Какие из перечисленных метал зов можно отнести
к тяжелым: Cr. Mg, Hg, Ге. Cd, Zn. Al, Са, Cu. Pb? Выделите среди них три главных ме-
тэлла-загрязнитсля атмосферы. 17. Назовите основные источники загрязнения атмо-
сферы металлами, в том числе в Белгородской области (городе, районе, где вы живете).
Болес подробно рассмотрите источники загрязнения такими металлами, какРЬ, Hg, Cd.
Zn, Си. 18. Какой металл вызвал упадок Римской империи и почему? 19. Какие металлы
способны замешать Са в костях? 20. Отравление каким металлом вызывает а) умсгвен-
199
ную отсталость, особенно детей и подростков; б) «болезнь Минамата»: в) «болезнь
итай-итай»; г) болезнь Коновалова—Вильсона? Каков характер проявления этих болез-
ней? 21. Какие меры предосторожности следует соблюдать при использовании ртутных
термометров? Чгозакое демеркуризагоры? 22. В чем заключаете» принципиальное био-
логическое отличие Zn и Си от Pb, Hg, Cd? Какое воздействие оказьнинот избыточные
количества цинка и меди на организм человека? 23 Какие из указанных металлов (РЬ,
Hg, Cd, Zn, Си) облапают канцерогенным действием? 24. Что такое a.Liepin» и каковы
причины ее возникновения? 25 Приведите примеры биолотческих, лекарственных,
бытовых, пыльцевых, пищевых и промышленных аллергенов. 26. Объясните причины
нарушения процесса фотосинтеза в растениях при оседании на них пыли. 27. Как мож-
но объяснить усиление сернокислотной коррозии материалов в присутствии пыли?
Задачи
I. Медиципское обследовашге рабочего завода по выплавке свинца показало, что
концентрация свинца в его крови составляет 1,2 мкг/мл. Рассчитайте, какой концент-
рации свинца в моче это соответствует. Могут ли при этом быть обнаружены признаки
заболевания? Если да, то какие? 2. В сигарете содержится 1,4 мкт кадмия, 25% этого
количества остается в организме курильщика. Вычислите, сколько микрограммов кад-
мия остается ежедневно в организме человека при выкуривании 20 сигарет. Какие нару-
шения здоровья может вызвать увеличение концентрации кадмия в организме? 3. Было
установлено, что содержание свинца в беиз>ше составляет 0,03 г/л. Учитывая, что 75%
свинца, содержащегося в бензине, выделяется в воздух с выхлопными газами, рассчи-
тайте, сколько граммов свинца выделит в атмосферу один автомобиль при использова-
нии 100 л бензина. 4. Среднее содержание ртути в резных сортах угля составляет 1 млн-1
(I часть ртути на I млн частей угля). При сжигании угля на тепловых электростанциях
в золе остается 10% ртутя. остальная ртуть улетучивается (переходит н парообразное со-
стояние). Рассчитайте, сколько килограммов ргуги ежегодно выбрасывает ТЭС через
дымовые трубы при сжигании 2500тугля. 5. Дети ходили в школу мимо свалки асбесто-
вых отходов и любили скатываться с асбестовой «горки». Кроме того, в этом районе
сносили старые дома, в которых применялся асбест, и школьники здесь часто играли.
Химический анализ воздуха показал, что концентрация асбестовой пыли составляла
0,05 мг/м5. Превышало ли это значение предельно допустимую концентрацию (ПДК) и
во сколько раз? Какие отдаленные последствия для здоровья детей возможны? 6- Иссле-
дования, проведенные в г. Белгороде в 1996 г., показали, что .масса осаждающихся из
воздуха твердых веществ за месяц составила: в районе витаминного комбината — 7.5 г/м2,
в районе цементного завода — 21.4 г/м2. Рассчитайте, какая масса твердых веществ
осаждается в этих районах на I м2 земли за год. Сделайте вывод, в каком районе го-
рода атмосфера является более запыленной и во сколько раз. Какие заболевания
вызывает повышенная запыленность воздуха и как она влияет иа фютосинтсз рас-
тений?
2.6. ГЛОБАЛЬНЫЕ
ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ АТМОСФЕРЫ
Увеличение концентрации некоторых веществ в атмосфере
Земли сопряжено с далеко идущими последствиями Возможно
возникновение экологических проблем мирового значения.
К таким глобальным экологическим проблемам относятся пар-
никовый эффект, разрушение озоновою слоя, кислотные осадки.
200
2.6.1. Парниковый эффект
(глобальное потепление)
История глобального потепления. Гипотеза о возможном из-
менении климата при увеличении концентрации углекислого
газа возникла давно — на рубеже XIX—XX вв. Уже около 100 лет
ведутся регулярные наблюдения за климатом на Земле. Швед-
ский физикохимик, лауреат Нобелевской премии Сванте Арре-
ниус исследовал физическую природу парникового эффекта
и некоторые свойства газов, сохраняющих тепло в атмосфере.
В 1908 г. в своей книге «Образование миров» он писал: «Если бы
содержание угольной кислоты (СО, — при», авт.) в воздухе
удвоилось, то температура земной поверхности повысилась бы
на 4 °C». Но фактических и точных измерений содержания СО2
в атмосфере было сравнительно немного вплоть до первою
Международного геофизическою года (1957 г.). С этого времени
стали проводиться систематические измерения в различных ре-
гионах мира, и эти измерения в течение ряда лет показали, что
концентрация углекислого газа в воздухе возрастает.
По Климатическим условиям 80-е гг. XX в. были жаркими,
что дало повод ученым заявить, что «парниковый эффект» уже
ощутим. В 80-х it. наблюдались засухи, наводнения, ураганы как
следствие потепления климата. Последующие 1990-е гг. тоже
были очень жаркими
В 1988 г. Организацией Объединенных Наций была создана
Межправительственная группа экспертов по проблемам изме-
нения климата (IPCC), в которую вошли 300 ведущих ученых-
климатологов мира.
На международной встрече в Торонто (Канада) в 1988 г. уче-
ные и политики обсуждали пути возможного уменьшения вы-
бросов углекислого газа.
Сорок девять ученых — лауреатов Нобелевской премии —
в 1990 г. заявили, что «глобальное потепление является наиболее
серьезной экологической угрозой XXI столетия, и только при-
нимая меры уже сейчас, мы можем быть уверены, что грядущие
поколения не столкнутся с этой угрозой».
Независимая международная экологическая организация
«Гринпис» в 1990 г. издала доклад «Глобальное потепление» (на
русском языке книга опубликована в 1993 г. в изд-ве МГУ) До-
клад написан ведущими учеными в области энергетики из США,
Великобритании, Швеции, Бразилии и Индии.
На Конференции ООН по окружающей среде и развитию
в Рио-де-Жанейро в 1992 г. была принята Конвенция об измене-
нии климата. В ней говорится о необходимости объединения
международных усилий с целью предотвращения неблагоприят-
ных последствий потепления климата.
201
В 1997 г. в Киото (Япония) состоялась Третья конференция
ООН по изменению климата, на которой представители пра-
вительств 171 страны подписали соглашение (Протокол Кио-
то). 11о этому документу всем странам необходимо сократить
выбросы парниковых газов, обеспечивающих потепление
климата.
22—23 ноября 2000 г. в Гааге (Голландия) прошла климати-
ческая конференция, организованная ООН и Всемирной орга-
низацией здравоохранения, на которой рассматривалась проб-
лема парникового эффекта. Поданным, приведенным в докладе
на этой конкуренции Л. Карнауховым (Институт биофизики клет-
ки Российской академии паук, г. Пущино), из-за увеличения
концентрации СО, в атмосфере через 100—200 лет неминуема
парниковая катастрофа. Температура дос тигнет нескольких со-
тен градусов, и жизнь на планете исчезнет.
Что должно сделать человечество, чтобы этого не произошло?
Возможные варианты рассмотрены далее, в подразделе «Пути ре-
шения проблемы глобального потепления климата» (см. с. 218).
Природа парникового эффекта. Парниковые газы. Профессив-
ное человечество и в первую очередь ученые и политики уделяют
большое внимание проблеме глобального потепления климата.
Рассмотрим теперь, почему это явление называется «парнико-
вым эффектом», какова его природа.
Представим себе застекленный парник (цветочную оранже-
рею или теплицу), который нагревается па солнце. Нагрев вы-
зван тем, что световая энергия, проникающая внутрь парника
через стекло, поглощается и превращается при этом в тепловую,
г. е. в инфракрасное (ИК) излучение, которое не может пройти
через стекло наружу. Таким образом, тепло как бы улавливается,
и температура в парнике повышается.
Аналогично надевается атмосфера Земли. Солнечное излу-
чение падает на Землю. Большая его часть проникает сквозь ат-
мосферу и, поглощаясь, нагревает поверхпос1ный слой Земли.
Землей испускается невидимое инфракрасное излучение, в ре-
зультате чего Земля охлаждается. Однако часть этого излучения
поглощается парниковыми газами в атмосфере, которые шрают
роль «одеяла», удерживающего тепло (см. рис. 2.18).
Чем выше концентрация этих газов, тем заметнее парнико-
вый эффект
Парниковые газы — это газы, создающие в атмосфере экран, за-
держивающий инфракрасные лучи, которые в результате нагрева-
ют поверхность Земли и нижний слой атмосферы. Многие из этих
газов почти на всем протяжении истории Земли присутствовали
в атмосфере в незначительном количестве. К наиболее значи-
мым из-за количества природным парниковым газам относятся
пары воды Н2О. Следующим в ряду парниковых газов стоит уг-
202
Рис. 2.18* Парниковый эффект
лекислый газ СО2. В отсутствие СО, температура поверхности
Земли была бы примерно на 33 °C ниже, чем в настоящее вре-
мя, т. е. условия для жизни животных и растений были бы
крайне нсблагоприяз ними Углекислый газ попадает в атмос-
феру как естественным, так и искусственным путем (см. разд.
2.5.1). Следовательно, необходимо делать различие между ес-
тественным парниковым эффектом и антропогенным, уси-
ленным парниковым эффектом. Далее будут рассматриваться
проблемы парникового эффекта, вызванные деятельностью
человека
В настоящее время основными парниковыми газами являются
углекислый газ СО,, метан СН4, хлорфторуглероды (фреоны) и ок-
сид азота(\) N,Q По докладу специалистов «Гринпис» доля влия-
ния основных парниковых газов на глобальное потепление дли-
тельное время составляла: СО, — 55% (0,5%), фреонов и род-
ственных им газов — 24% (4%), СН4 — 15% (0,9 ), N,O — 6%
(0,8%) (в скобках указан уровень среднегодового прироста этих
газов). Тропосферный озон О3 тоже относится к парниковым
газам, по его трудно оценить количественно. Возникает он в тро-
посфере в результате химических реакций под действием сол-
нечного света между углеводородами и оксидами азот а, образо-
вавшимися при сжигании ископаемого топлива (подробнее это
обсуждалось в разд. 2.5.3).
К 2000 г. доля влияния этих основных парниковых газов на
глобальное потепление изменилась. Табл. 2.16 составлена на
основе данных, опубликованных в журнале «Химия в России»
(2000, № 8) по материалам статьи американского ученого Кеви-
на Гурни. По сравнению с 1990 г. возросла доля углекислого газа
203
с 55 до 64% и метана — с 15 до 20%, уменьшилась доля фреонов
(в связи с их запретом) с 24 до 10%, на прежнем уровне осталась
доля N2O (6 %) (табл. 2.16).
Таблица 2.16
Основные парниковые газы, их источники и доля влияния
на глобальное потепление (данные 2000 г.)
Газ Оснонныс источники Доля влияния на глобальное потепление, %
Углекислый газ СО2 Производство, транспортировка и сжигание ископаемого топлива (86%) Сведение тропических лесов и сжигание биомассы (12%) Остальные И очники (2%) 64
Метан СН, Утечка природного газа Производство топлива Жизнедеятельпосп. животных (пищеварительная ферментация) Рисовые плантации Сведение лесов 20
Хлорфгоруг- □1сроды(фрсо- ны) и родст- венные газы Холодильная промышленность (хладагенты) Производство аэрозольных упаковок Системы кондиционирования воздуха Производство пенопласта 10
Оксид азота(1) NjO Применение азотных удобрений Сжигание биомассы Сжигание ископаемого топлива 6
Антропогенный парниковый эффект на 57% обусловлен до-
бычей и потреблением энергии, на 9% — исчезновением лесов, на
14% — сельскохозяйственной деятельностью и на 20% — осталь-
ным промышленным производством, нс связанным с энергетиче-
ским циклом (втом числе и производством фреонов) (см. рис. 2.18).
Дадим некоторые пояснения по поводу источников парнико-
вых газов и их влияния на потепление климата.
Исходная причина накопления теплоулавливающих газов
в атмосфере связана с промышленностью, которая использует
в качестве источника энергии ископаемое топливо. Начиная
с 1860-х гг. отмечается рост потребления ископаемого топлива,
соответственно увеличивается концентрация СО2 в атмосфере.
Сжигание ископаемого топлива — основной источник углекис-
лого газа (86%). Уголь является наиболее углеродоемким топли-
вом, за ним следуют нефть и природный газ. Это означает, что
при сгорании угля эмиссия (выпуск) углерода на единицу топли-
ва будет больше, чем при сгорании нефти и природного газа.
204
Рис. 2.19. Вклад в развитие парникового эффекта по видам
хозяйственной деятельности (данные по докладу «Гринпис», 1993 г.):
7 — производство и использование энергии; 2— сельское хозяйство; 3— про-
мышленность, в том числе производство и использование фреонов; 4 — вы-
рубка лесов
а соответственно больше и выброс СО, (при условии полного
сгорания угля). Ежегодный выброс углерода в виде СО2 в 1990 г.
составил 5,6—5,7 млрд т. Одна треть углекислого газа в атмосфе-
ре Европы связана с работой автомобилей.
Вырубка лесов также способствует переходу СО2 в атмосферу.
Это происходит в процессе как сжигания деревьев, так и посте-
пенного разрушения и гниогия древесины, остающейся на мес-
тах лесозаготовок (при этом происходит выделение СО, и СН4,
причем последний является продуктом анаэробного разложе-
ния). Количество углерода, поступившего в атмосферу в виде
СО, за счет сведения лесов, по данным за 1990 г., оценивается
в 1,5—3,0 млрд т ежегодно. Эти источники дают 12% поступле-
ний углекислого газа в атмосферу.
Источником СО, в атмосфере является также процесс гниения
органических веществ в почве, особенно в лесных экосистемах.
На долю остальных источников, включая производство цемен-
та или окисление монооксида углерода СО, приходится 2% СО2.
Углекислый газ считается основным парниковым газом. Его
влияние на глобальное потепление в последнее десятилетие XX в.
разными учеными оценивается в 55—64% (оценка 64% макси-
мальная). ‘
Вторым парниковым газом по значимости, т. с. по влиянию
на глобальное потепление, является метан СН4, происхождение
которого в атмосфере имеет как природную, так и антропоген-
ную историю. Природный газ (метан) имеет не только самостоя-
тельные месторождения; он часто сопутствует нефтяным место-
рождениям, поэтому имеет название «попутный природный
газ». При добыче и зрапспортировке СН4 попадает в атмосферу
(утечка природного газа). Источником метана в атмосфере слу-
205
жат также болота. Болота всей планеты ежегодно выделяют око-
ло 115 млн т СН,.
Рисоводство — еще один источник поступлений СН, в атмо-
сферу. Современные плантации риса ежегодно производят око-
ло 110 млн г СН4, что составляет примерно 20% всех его антропо-
генных выбросов.
Метан является продуктом жизнедеятельности, он выделяет-
ся при пищеварительной ферментации (например, у скота). Вы-
деляется СН, и при силосовании (например, в процессе заготов-
ки и хранения измельченной кукурузной массы в прессованном
виде).
При сведении лесов древесина, остающаяся в местах лесоза-
готовок, разлагается в анаэробных условиях с выделением мета-
на. Метан образуется и при так называемом метановом броже-
нии растительных остатков («болотный газ»).
Примерно 20% глобального потепления обусловлено присут-
ствием метана в атмосфере.
В образовании парникового эффекта молекула СН4 в 21 раз
более эффективна, чем СО2 (Химия в России, 2000, № 8). Издан-
ных «Гринпис» за 1993 г. по сравнительной оценке влияния СН4
и СО, следует, что по степени влияния на глобальное потепле-
ние за период в 20 лет метан в 63 раза превосходит углекислый
газ, по выполненному расчету эффект глобального потепления
от каждого 1 кг СП. за этот период в 63 раза больше, чем от каж-
дого 1 кг СО,.
В основном СН4 удаляется из атмосферы путем реакции
с гидроксил-радикалом (ОН")- Имеются некоторые доказатель-
ства, что СН4 и другие загрязнители атмосферы привели к сокра-
щению концентрации ОН' Примерно 30% роста концентрации
СН, в атмосфере объясняется способностью атмосферы к его
поглощению.
Большой вклад в развитие парникового эффекта вносят га-
логенуглеводороды. Они содержат углерод и один или более ато-
мов галогенов (фтора и хлора). К ним относятся такие вещества,
как С1СНЪ CI,CH2, C11C1F2, CFCIj, CF2C1, и др. Сточки зрения
глобального потепления наибольшее значение имеют хлорфтор-
углероды (ХФУ). Международное обозначение этих соедине-
ний — CFC, они известны также под названием «фреоны». Наи-
большее значение из них имеют CFC-11 и CFC-12. Хотя ХФУ
присутствуют в атмосфере в крайне незначительных количе-
ствах, однако являются весьма активными парниковыми газами,
работающими па парниковый эффект в тысячи раз активнее,
чем СО,. Фреоны не только сильные поглотители тепла, они
также вызывают разрушение озонового слоя Земли.
Производство фреонов началось сравнительно недавно —
всего за несколько лег до Второй мировой войны. Синтезирова-
206
ни фреоны в 1930-х гг., а с копна 1950-х гг. их широко применяют
в промышленном производстве. За короткое время концентрация
их в атмосфере достигла 0,3 млрд'. В начале 1990-х гг. содержа-
ние фреонов в атмосфере ежегодно увеличивалось на 5—10%.
Фреоны используются в холодильной промышленности (в ка-
честве хладагентов), в производстве аэрозольных упаковок. Они
применяются в системах кондиционирования воздуха. Напри-
мер, в США фреон-12 применяется в автомобильных кондицио-
нерах Хладагенты, содержащиеся в рефрижераторах и конди-
ционерах, обычно выпускаются в воздух во время ремонта этих
агрегатов или по окончании срока их службы. Хлорфторуглено-
дородныс растворители используются для очистки электронных
плат. Фреоны применяют также в производстве пенопласта, од-
норазовых пластиковых стаканчиков.
На фреоны приходится около 10% глобального потепления,
но концентрация этих соединений в атмосфере в настоящее вре-
мя сокращается в результате международного запрета на их про-
изводство и потребление Ученые стали искать вешества-замс-
пители фреонов. Началось производство альтернативных аэро-
зольных распылителей. Разрабатываются способы рекуперации,
очистки и повторного использования хладагентов в холодиль-
ных камерах и кондиционерах, создаются альтернативные раст-
ворители для очистки электронных плат.
В качестве заменителей фреонов стали использовать гидро-
хлорфгоруглероды (ИСЬС) и гидрофторуглсроды (11FC). Хотя
они уменьшают толщину озонового слоя не столь значительно,
как фреоны, однако являются сильнодействующими парниковы-
ми газами, т е проблему парникового эффекта они не решают.
Даже если повсюду применение ХФУ будет запрещено, исто-
щение озонового слоя будет продолжаться из-за долгого вре-
мени жизни фреонов в атмосфере. Измерения концентрации
HCFC и HFC показывают ее рост в атмосфере. Если их
концентрация будет продолжать увеличиваться, эти вещества
могут также оказать значительное влияние на глобальное по-
тепление в будущем
Менее значимым парниковым газом по его влиянию на гло-
бальное потепление является N2O. Как и СО2, оксид азота(1) —
естественный компонент атмосферы, но присутствует он в ней
в значительно меньшем количестве. К антропогенным источни-
кам этого парникового газа относятся хозяйства, использующие
азотные удобрения, сжигающие биомассы, а также механизмы,
в которых ископаемое топливо используется в двигателях внут-
реннего сгорания (см. подробнее разд. 2.5.3). На долю N2O при-
ходится около 6% глобального потепления.
Признаки парникового эффекта в XX в. Климатическая систе-
ма планеты находилась в равновесии, когда поглощенное сол-
207
нечное излучение уравновешивалось тепловым излучением Зем-
ли. Это было до технической революции, которая вызвала значи-
тельное увеличение выбросов антропогенных парниковых газов.
Систематические наблюдения за климатом и содержанием
в атмосфере парниковых газов дают основание для прогноза
к увеличению их концепзрации и повышению средней темпера-
туры на планете.
По оценке ученых, за 100 с лишним лет с начала индустриаль-
ной эпохи произошло 25%-ое повышение концентрации углекис-
лого газа, доля которого в парниковом эффекте наибольшая.
При этом отмечается, что содержание СО, в атмосфере непре-
рывно возрастает — на 0,5% в год.
Данные о температуре воздуха, собранные за последнее сто-
летие, показывают, что увеличение глобальных температур ко-
леблется в пределах от 0,3 до 0,6 °C, и можно принять, что увели-
чение средней глобальной температуры в XX в. составило при-
мерно 0,5 °C. Наблюдаемое потепление климата можно связать
с парниковым эффектом. Физическое проявление парникового
эффекта уже не вызывает сомнений. В XX в. отмечены следую-
щие ею признаки:
• жара и засуха, которые затронули Северную Америку и
другие регионы планеты в 1980-е гг.;
• увеличение расстояния до зоны вечной мерзлоты на Аляс-
ке и в канадской Арктике;
• повышение средней температуры озер в Канаде;
• уменьшение годовой максимальной протяженности лед-
никового покрова в Антарктике и Арктике;
• убывание количества айсбергов на севере Европы и в дру-
гих районах мира;
• необычные климатические явления в последние годы
XX в. — ураган Хьюго, наводнения в Африке и Индии, бури
в Европе;
• уменьшение толщины льда в Арктике и Антарктике: на-
пример, толщина льда в районе севернее Гренландии уменьши-
лась с 6,7 м в 1976 г. до 4,5 м в 1987 г.
Все это привело Межправительственную комиссию по изме-
нению климата (1РСС) к выводу о явном антропогенном воздейст-
вии на глобальный климат на планете.
Возможно, что потепление вызвано не только парниковым
эффектом, но и естественной изменчивостью климата. Тем не
менее для специалистов ясно, что, создавая своей дея цельностью
антропогенные выбросы в атмосферу газов, поглошаюших
ИК-излучение, человечество способствует потеплению климата.
Прогноз глобального потепления на XXI в. и возможные эколо-
гические последствия Изучением дальнейшего повышения срсд-
непланетной температуры Земли, прогнозом ее на XXI в. зани-
208
маются многие ученые, специалисты научных институтов, меж-
дународных организаций, группы экспертов на уровне прави-
тельств. Для оценки возможного изменения климата разрабаты-
ваются компьютерные модели будущего климата, или модели
глобальной циркуляции (МГЦ).
Рассмоприм некоторые из этих прогнозов, сопоставим раз-
ные точки зрения.
В последнем десятилетии XX в. среди ученых бытовали две
крайние точки зрения на ожидаемое потепление в XXI в. Точку
зрения одних можно сформулировать как «пет никаких осно-
ваний для беспокойства», тогда как другие предрекают «конец
света» и в связи с этим предполагают изменение температуры
к 2100 г.: от сравнительно умеренного повышения на 0,5 °C
в наши дни до катастрофического потепления на 5 °C и выше
еще до конца XXI в. Повышение на 5 °C может быть названо
катастрофическим, так как оно соответствует уровню потепле-
ния, имевшему место в период жизни на Земле между 15 тыс. и
5 тыс. лет назад и ознаменовавшему собой переход от послед-
него едникового периода к современной межледниковой эпо-
хе. Модели МГЦ дают эту верхнюю оценку, т. е. прогнозируют
максимальное потепление даже более чем на 5 °C. Прогнозы
аналитиков из международной организации «Гринпис» (1990 г.),
не совпадая с этими двумя точками зрения, соответствуют про-
межуточным данным. Ученые IPCC дают более оптимистиче-
скую оценку. По их расчетам, к 2100 г. произойдет повышение
температуры на 3 °C при том условии, что рост выбросов пар-
никовых газов будет таким же, как в наше время. Но даже при
такой, более благоприятной оценке IPCC скорость изменения
температуры составит 0,3 °C за десятилетие. Большинство уче-
ных считает, что в течение XXI в. вполне вероятно повышение
глобальной температуры на 1 °C или около того. Но даже это,
казалось бы, незначительное повышение температуры может
оказаться опасным для некоторых видов растений и животных,
обитающих вблизи горных вершин.
В начале 1990-х гг. появились также прогнозы потепления
при удвоении содержания СО,. Многие ученые и компьютерные
модели предсказывают повышение средней глобальной темпе-
ратуры на 1,5—4,5 °C при «эффективном удвоении» количества
СО2 по сравнению с его уровням i в доиндустриальную эпоху.
«Эффективное удвоение» означает усиление в два раза парнико-
вого эффекта. Это может произойти к 2030—2050-м гг., если вы-
бросы парниковых газов будут продолжаться на современном
уровне.Количество парниковых газов в атмосфере станет таким,
что по теплопоглощающей способности они в два раза превзой-
дут СО,, содержавшийся в атмосфере в середине XIX в. Вспом-
ним прогноз гениального С. Аррениуса, который в начале XX в.
209
высказал предположение о повышении температуры на 4 °C при
удвоении содержания угольной кислоты.
В конце 2000 г. американский ученый Кевин Гурни привел
несколько иные цифры (его статья опубликована в журнале «Хи-
мия в России», № 8 за 2000 г.) По его мнению, рост средней тем-
пературы может составить от 1,0 до 3,5 °C при удвоении первона-
чальной (до промышленной революции) концентрации СО2.
Если сохранятся нынешние тенденции, это может произойти
примерно к 2100 г., причем температура может повыситься не-
равномерно — до 10 °C в полярных регионах и, возможно, не из-
менится вообще в экваториальном поясе.
По прогнозам ученых, удвоение содержания СО, в атмосфере
приведет нс только к повышению глобальной температуры на
1,5—4,5 °C (по другим оценкам на 1,0—3,5 °C), но и к другим
климатическим изменениям, а также к нарушениям во всех зем-
ных экосистемах, к истощению биоты гибели или сокращению
лесов, обеднению фауны, снижению урожайности сельскохо-
зяйственных культур, дефициту продуктов питания, миграции и
болезням людей. Рассмотрим наиболее важные из возможных
климатических изменений.
• Увеличение осадков, особенно в средних и высоких широ-
тах в зимний период.
• Уменьшение поверхности морского льда и снежного по-
крова.
• Потепление полярных зим.
• Подъем среднего уровня Мирового океана (на 10—30 см —
произойдет к 2030 г. и на 30— 100 см — к концу XXI в. вследствие
нагрева и таяния ледников). В случае таяния Антарктического
ледникового щита глобальный уровень моря поднимется более
чем на 5 м. В течение XXI в. это, вероятнее всего, нс произойдет.
• Повышение уровня моря вызовет крупномасштабные на-
воднения (например, во многих северных регионах России), за-
топление прибрежных зон, ведущее к загрязнению систем водо-
снабжения, засолению пресноводных прибрежных акваторий,
перемещению человеческих поселений Повышение уровня мо-
ря на 1 м затопит 15% площади Египта и 14% урожайной земли
Бангладеш
• Понижение влагосодержания почвы в летний период во
внутри континентальных областях средних широт (летнее иссу-
шение континентов), вызванное более ранним окончанием тая-
ния снегов и периодов дождей.
• Понижение влажности почвы в некоторых регионах при-
ведет к их опустыниванию (например, в Африке).
• Распространение засухи от 5% в 1990-е гг. до 50% к 2050-м гг.
вызовет ухудшение обеспечения населения продовольствием,
особенно в густонаселенных регионах мира (Северная Африка,
210
Южная Америка, западные арабские страны, Юго-Восточная
Азия, Индийский полуостров, Мексика, Центральная Америка,
юго-западные территории США, часть Восточной Бразилии и дру-
гие зоны).
• Потери урожая зерновых культур в некоторых областях
Земли (в Южной Европе, на юге США, в Западной Австралии).
• Потепление на 0,1—1,0 °C за 10-летний период и засуха
ограничат распространение лесов и приведут к замене 100—
200 млн га леса степными зонами. Произойдет сокращение тер-
риторий, занятых лесами
• Такое смещение географических зон растительности приве-
дет к сокращению территорий, пригодных для жизни животных,
т с произойдет обеднение земной фауны. Могут погибнуть не
только отдельные виды животных, но исчезнуть целые генотипы.
• Произойдет значительное сокращение видового многооб-
разия растений и животных.
• Появятся новые виды, для которых эти условия более бла-
гоприятны. Среди растений это сорняки, среди животных —
вредители и паразиты садов и жилищ. Расширятся возможности
распространения вредных насекомых и микробов — возбудите-
лей болезней — за пределы зропической зоны на субтропиче-
скую и даже среднюю полосу с разрушительными последствия-
ми для местных сельскохозяйственных культур.
• Миграция людей из районов наводнения, засухи, обедне-
ния флоры и фауны приведет к распространению эпидемий
в лагерях и поселениях для беженцев.
• Распространение болезней, характерных для жаркой зоны
(малярия, шистосомоз, лихорадка денге, японский энцефалит),
в сторону северных широт; это может привести к заболеваемости
большего числа людей.
Наиболее сильному негативному воздействию подвергнутся
жители крупных урбанизированных районов.
Обратная связь «средаепланетная температура — концентрация
парниковых газов». В результате повышения среднепланетной
температуры может произойти дальнейшее увеличение концент-
рации СО2 и других парниковых газов уже за счет природных ис-
точников. Это так называемые положительные обратные связи.
Рассмотрим наиболее существенные из них.
• Повышение температуры вод Мирового океана будет при-
водить к понижению растворимости СО,. Излишек СО, будет
поступать в атмосферу. Океаны являются гигантским резервуа-
ром для СО2, поскольку они содержат СО, в 50—60 раз больше,
чем атмосфера, и в 20 раз больше, чем биосфера. Этот источник
СО2 представляет большую опасность.
• Еше большее количество связанного СО, содержится в зем-
ной коре в виде карбонатсодержащих пород (почти в 50 000 раз
211
больше, чем в атмосфере). Разложение карбонатов в результате
повышения температуры Земли из-за подземных ядерных взры-
вов и других факторов может привести к выделению огромных
количеств СО2 в атмосферу.
• Можно ожидать увеличения выделения метана на высоких
широтах в результате прогревания и увлажнения почвы, оттаи-
вания грунтов в тундре, так как залитые водой почвы могут про-
изводить в 100 раз больше СН4, чем сухие.
• В зоне вечной мерзлоты имеется избыток замороженного
органического вещества, способного разлагаться при повыше-
нии температуры с выделением СН4.
• Повышение температуры придонных вод Мирового окса-
на может привести к разложению мстан-гидратных комплексов
(кристаллических комплексов молекул метана и воды). Они
чаще встречаются ближе к поверхности осадочных пород, на дне
или вблизи него. Прогревание воды может привести к разложе-
нию этих комплексов и поступлению в атмосферу значительных
количеств СН4 и СО2 (в результате окисления метана бактерия-
ми и непосредственного окисления в верхних слоях атмосферы).
• Метан-гидратные комплексы встречаются и в зоне вечной
мерзлоты. Они залегают ниже слоя вечной мерзлоты и в далеких
от берегов зонах Арктики. Температурная волна от нагретой по-
верхности будет проникать в землю очень медленно, поэтому
это влияние будет незначительным в течение нескольких деся-
тилетий. Однако наличие трещин вызывает эпизодические вы-
бросы СП4 уже в настоящее время.
• При повышении температуры атмосферы возрастает ско-
рость испарения морской воды, следовательно, увеличивается ко-
личество водяных паров, которые являются парниковым газом.
• Повышение температуры, вызванное парниковым эффек-
том, с одной стороны, может увеличить темпы фотосинтеза (т. е.
усилить поглощение углекислого газа), но, с другой стороны,
способствует интенсификации противоположных процессов —
дыхания, окисления, гниения растений, что приводит к увели-
чению концентрации СО2 По мнению большинства ученых,
увеличение выделения СО2 происходит быстрее, чем фотосин-
тез. При глобальном потеплении пострадают леса, приток СО2
в атмосферу увеличится.
Таким образом, глобальное потепление в большинстве случа-
ев будет вызывать увеличение концен трации парниковых газов
(СО2, СН4, водяных паров), что, в свою очередь, ускорит рост
срсдпспланетной температуры на Земле.
Оптимистический и реалистический прогнозы последствий гло-
бального потепления для человеческой цивилизации. Специалис-
ты лаборатории биофизики биоценозов Института биофизики
клетки (ИБК) Российской академии наук рассмотрели несколь-
212
ко сценариев развития парникового эффекта при условии про-
должающегося сжигания углеводородного топлива (угля, нефти,
газа идр.) (доклад Л. Карнаухова, 2000 г,). При этом учитывались
процессы, происходящие в живой и неживой природе в услови-
ях Земли. По этим данным биологических механизмов удаления
СО, из атмосферы явно недостаточно по сравнению с его техно-
генным выбросом, который в 50 раз превосходит биологически
связанный СО2 (с учетом поглощения СО, при фотосинтезе и
обратного выделения его в процессах дыхания, окисления, гние-
ния и т. д.).
Была проанализирована роль различных биоценозов в долго-
временном извлечении СО, из атмосферы. Оказалось, что роль
биоценозов лесов в этом процессе крайне мала. Это объясняется
тем, что практически весь связанный благодаря фотосинтезу уг-
лерод возвращается в атмосферу в виде СО2 вследствие процес-
сов дыхания, гниения отмирающих листьев и древесины, а так-
же лесных пожаров. Этот вывод поколебал распространенное
мнение, что «лес — это легкие планеты».
Для долговременного извлечения СО, из атмосферы необхо-
димо, чтобы значительная часть связанного в результате процес-
сов фотосинтеза углерода оказывалась недоступной для процес-
сов окисления. Такие условия существуют только в биоценозах
болот и тропических морей.
В биоценозе болота отмирающая растительность попадает
в стоячую воду с низким содержанием кислорода и накапливает-
ся там, практически не разлагаясь (частичное анаэробное разло-
жение с образованием СН4 не меняет общей картины). Частично
разложившиеся остатки растений превращаются в торф, а затем
в бурый и каменный уголь. В настоящее время общая площадь
болот на Земле сократилась почти в два раза и продолжает сокра-
щаться в результате их осушения. Соответственно уменьшается
количество извлекаемого из атмосферы СО2.
В биоценозах тропических морей растворенный СО, исполь-
зуется в качестве «строительного материала» при образовании
известковых раковин и чехлов. Практически все карбонаты (из-
вестняки, доломиты, мел, мрамор и т. д.) имеют биогенное проис-
хождение. Важную роль в этом отношении играют коралловые
полипы и планктон (всего около 80 видов). Имеются сведения
о гибели коралловых рифов. А в результате сброса гербицидов и
пестицидов в Мировой океан может пострадать фораминиферо-
вый планктон. В результате уменьшится связывание СО,, изъ-
ятие его из океанической воды.
По мнению Л. Карнаухова, «парниковый эффект» способен
изменятыемпературу планеты на несколько сотен градусов. На-
пример, средне планетная температура Венеры при параметрах
атмосферы, аналогичных земным, должна была бы быть всего на
213
50 °C выше, чем на Земле. Однако срсдпспланстная температура
Венеры составляет почти 500 °C за счет сильного парникового
эффекта.
Повышение среднепланетной температуры Земли даже па 50 °C
имело бы катастрофические последствия для человеческой ци-
вилизации, явилось бы «парниковой катастрофой». Повышение
температуры на 150 °C, по-видимому, сделало бы невозможным
существование жизни на Земле.
Ученые из Института биофизики клетки предложили следую-
щую количественную оценку влияния концентрации парнико-
вых газов на среднепланетную температуру Земли:
(2.81)
где Л7(со,) — повышение темпера гуры поверхности планеты зи счет
парникового эффекта: р — коэффициент пропорциональности,
имеющий размерность температуры Р-0.8-(———)= 37’Си за-
Ср-Л/со
висящий оттаких универсальных параметров, как Л/С0[ — моляр-
ная масса парникового газа, С{. — изобарная теплоемкость ат-
мосферы, /<о — универсальная газовая постоянная, Т — темпера-
тура планеты, лишенной парникового эффекта (для Земли и
Венеры коэффициенты Р примерно равны и составляют 37 ’С);
Ссо, — концентрация парниковых газов у поверхности планеты;
Ссо, — концентрация парниковых газов, при которой атмосфера
поглощает половину длинноволнового (инфракрасного) излу-
чения поверхности планеты.
Расчетные значения парникового эффекта (8 °C) не всегда со-
впадают с реально наблюдаемым повышением среднепланетной
температуры на Земле (1—2 °C) Существуют два объяснения
причины этого Во-первых, Мировой океан играет роль гигант-
ского теплового буфера, стабилизирующего температуру Земли
Во-вторых, наряду с парниковым эффектом, повышающим тем-
пературу, происходит накопление аэрозольных частиц в верхних
слоях атмосферы, которые понижают температуру. Особенно
ощутимо это может быть во время наземных ядерных испыта-
ний, которые приводят к поступлению сажи в верхние слои
атмосферы. Во время ядерной войны может наступить значи-
тельное падение среднепланетной температуры Земли, так
называемая «ядерная зима». Об этом предупреждал академик
Н 11 Моисеев.
Эти две причины (тепловая инерция Мирового океана и
аэрозольное загрязнение верхних слоев атмосферы), но мнению
ученых из ИБК не могут существенно изменить прогноз парни-
ковой катастрофы, по способны только несколько отдалить вре-
мя ее наступления.
214
На основе имеющихся данных о техногенном поступлении
СО, в атмосферу ученые Института биофизики клетки (А. Карнау-
хов и др ) дают два прогноза глобального потепления (табл. 2.17).
Таблица 2.17
Опгимистический и реалистический сценарий парниковой катастрофы
(по А. Карнаухову, 2000)
Вариант Сценарии развития мировой энергетики Критическая стадия парниковой катастрофы А/=50 ‘С
1 Оптимистический сценарий', техногенный выброс СО, останется постоянным (первое удвоение концентрации СО, произойдет через 100 лет) 300 лет
2 Реалистический сценарий: техногенный выброс СО2 будет расти теми же темпами, что и се- годня (удвоение концентрации СО, будет происходить каждые 50 лет) 100 лет
Первый сценарий — оптимистический — предполагает, что
техногенный выброс СО, в атмосферу со временем не увеличит-
ся, т. е. будет оставаться на современном уровне. По этому вари-
анту человеческая цивилизация просуществует 300 лет.
Второй сценарий — реалистический — предполагает, что по-
ступление СО2 в атмосферу будет расти с той же скоростью, что и
в настоящее время (при такой скорости роста техногешгый вы-
брос СО2 удваивается каждые 50 лет). В таком случае время су-
ществования человеческой цивилизации составит всего 100 лет.
Самым худшим был бы третий — «пессимистический?* — сце-
нарий, предполагающий ускорение техногенного выброса СО2.
Увеличения скорости техногешюго выброса СО2 допускать нельзя,
таккакэто граничите самоуничтожением. Человечество должно
срочно выработать меры снижения выбросов углекислого газа и
других парниковых газов.
Ученые прогнозируют возможность наступления «леднико-
вого периода» на севере Евразии и Америки. Как ни парадок-
сально, но это также является следствием глобального повыше-
ния температуры на Земле Это произойдет, если плотность вод
пресного, но холодного (в результате таяния Гренландского лед-
ника) Лабрадорского течения станет меньше плотности соленых
вод теплого течения Гольфстрим. Лабрадорское течение подни-
мется на поверхность, перекрывая путь Гольфстриму на север.
В результате нарушится меридиональный перенос тепла между
тропическими и полярными областями. На севере Евразии и
Америки температура понизится, а в экваториальной части воз-
растет. Наиболее вероятным наступление «ледникового псрио-
215
ла» представляется через 25—100 лет — в момент массового тая-
ния Гренландского ледника.
Одним из следствий наступления нового «ледникового пе-
риода» будет резкий рост сжигания угля, нефти и газа для ото-
пления жилищ, что может только ускорить начало терминаль-
ной стадии парниковой катастрофы.
Пути решения проблемы глобального потепления климата. Уче-
ные и политики всего мира, озабоченные проблемой парнико-
вого эффекта и его возможными последствиями, предлагают ряд
мер по борьбе с глобальным потеплением климата. Приведем
наиболее часто выдвигаемые предложения.
1. Для стабилизации парниковых газов на уровнях, устано-
вившихся к концу XX в., необходимо снижать объемы выбросов:
СО, — на 50—80%, СН-— на 10—20%, фреонов — на 75—100%,
N.O - на 80-85%.
2. Так как более половины выбросов парниковых газов свя-
зано с производством энергии, необходимо сокращать произ-
водство и потребление энергии, повышать эффективность энер-
гетики, использовать энергосберегающие технологии. Мировое
сообщество должно перейти к энергосберегающему будущему.
Развитые страны не должны экспортировать устаревшие энерго-
емкие технологии в страны третьего мира.
3. Сокращать потребление ископаемого топлива в качестве
источника энергии, стремиться к полному отказу от сжигания
ископаемых органических веществ, являющихся основным ис-
точником углекислого газа.
4. Вместо угля целесообразнее использовать природный газ.
так как он при сгорании даст меньше углекислого газа на единицу
производства энергии. Однако при этом надо избегать антропоген-
ных выбросов метана и его потерь при транспортировке, ведь метан
представляет собой более сильный парниковый газ, чем СО2.
5. Рекомендовать для использования углеводородное топли-
во, получаемое из растительных остатков и бытовых отходов пу-
тем их анаэробного разложения (биогаз).
6. Широко использовать возобновляемые источники энер-
гии (энергию Солнца, ветра, гидроэнергию, геотермальную
энергию).
7. Сокращать численность автомобилей, совершенствовать
действующие модели, внедрять более экономичные двигатели,
повышать их коэффициент полезного действия, использовать
в автомобилях вместо жидких нефтепродуктов более экологич-
ные виды топлива (водород, метан, смесь пропана и бутана).
В 2001 г. в Швейцарии создан автомобиль, работающий на мета-
не, образующемся при разложении пищевых отходов.
8. Прекратить уничтожение лесных массивов и восстановить
их, где это возможно, и таким образом увеличить поглощение
216
углекислого газа. Такие методы прямого удаления СО2 из атмо-
сферы называются «углеродным секвестром».
9. По возможности нс производить осушения болот, так как
биоценозам болот принадлежит большая роль (по сравнению
с биоценозами лесов) в долговременном извлечении СО2 из ат-
мосферы.
10. Ограничить или полностью исключить производство
фреонов и аналогичных им веществ (гидрофторуглсродов).
11. Развитие сельского хозяйства вести но технологиям,
уменьшающим образование парниковых газов.
12. Повсеместно ввести «углеродный налог» (на выбросы угле-
родсодержащих соединении). Принцип «загрязняющий платит»
в некоторых странах был введен в начале 70-х гг. XX столетия.
В табл. 2.18 показано, к какому понижению температуры мо-
гут привести некоторые из названных выше мероприятий по
уменьшению эмиссии парниковых газов.
Таблица 2.18
Мероприятия по снижению эмиссии парниковых газов
и понижению среднегодовой температуры (из доклада «Гринпис», 1993)
Вариант стратег ии Среднее понижение темпера |уры. °C
Запрещение выпуска фреонов 0,52
Прекращение сведения лесов 0,20
Восстановление лесов на площади 500—1000 млн га 0.20
Замена нефти и угля газом 0,28
Консервация энергии 0,45
Итого 1.65
Угроза парниковой катастрофы требует объединения усилий
всего человечества. В первую очередь это относится к промыш-
ленно развитым странам, и особую ответственность несут руко-
водители государств. Как было отмечено в начале этого раздела,
в 1997 г. в Киото (Япония) состоялась Третья конференция ООН
по изменению климата. В результате был принят Протокол Кио-
то, требующий сокращения выбросов парниковых газов к 2008—
2012 I г. на 5% по сравнению с 1990 г. Но вот в начале 2001 г. пре-
зидент США Джордж Буш объявил, что не поддерживает Киси -
ский протокол и намерен выйти из него, так как протокол
подписан прежней администрацией. Американцы добиваются
приобрел синя квот на вредные выбросы утех стран, которые не
дотягивают до установленного им уровня. Такая позиция безот-
ветственна, ведь на долю США в настоящее время приходится
около 25% всего мирового объема выброса углекислого газа.
Осознать опасность парниковой катастрофы должны не толь-
ко руководители государств, но и все граждане мира.
217
Действия гражданина Земли, обеспокоенного опасностью парни-
кового эффекта:
• Заменить в доме лампы накаливания па экономичные
флуоресцентные лампы.
• Улучшить теплоизоляцию всего дома и в частности котла
для подофева воды.
• Покупать наиболее эффективные нагреватели воздуха и
прочее бытовое электрооборудование.
• Выбирать из бытового мусора все, что может пригодиться
для вторичной переработки, и сдава ть это приемщикам вторич-
ного сырья.
• Отказаться от престижных больших машин, больше пользо-
ваться общественным транспортом.
• Предпочитать продукты сельского хозяйства, полученные
с помощью привычных способов, продуктам интенсивного вы-
ращивания.
• Увеличивать долю растительной пищи в рационе питания.
• Проявлять активность в объединениях, поддерживая спрос
на продукцию компаний, работающих на предотвращение гло-
бального потепления.
• Использовать все возможност и для распространения зна-
ний об опасности парникового эффекта среди других людей.
Начинать надо с собственного дома, сделав все возможное
для эффективного использования энергии в бытовых системах.
Для этого надо улучшать теплоизоляцию крыши, стен, окон.
Хорошо изолированный дом позволяет в течение длительного
отопительного сезона экономить много топлива, а значит, спо-
собствует сокращению выбросов углекислого газа.
Важно также вовремя заменять бытовое оборудование, у ко-
торого заканчивается срок эксплуатации. Главная черта старого
механизма — большой расход энергии. Общество потребителей
должно добиваться, чтобы маркировка товара содержала данные
по его экономичности.
Вопрос о выброшенной бумаге или лишней упаковке также
очень важен, поскольку бумажный мусор может скапливаться
в количествах, достаточных для начала процесса выделения ме-
тана (на влажных свалках). Таким образом, способствовать вто-
ричной переработке многих материалов (в том числе бумажного
мусора) — значит снижать концентрацию одного из важнейших
парниковых газов (СН;).
Предпочитая сельскохозяйственные продукты, полученные
с использованием натуральных органических удобрений, про-
дуктам, выращенным на полях, обработанных минеральными
(азотными) удобрениями, мы способствуем уменьшению вы-
бросов оксидов азота, которые возникают па предприятиях ту-
ковой промышленности (производства минеральных удобре-
218
ний). Потребление растительной пищи при сокращении потреб-
ления мяса сокращает выделение метана из силосных ям.
Покупка автомобиля должна быть продиктована не мнимы-
ми представлениями о престижности, а жизненной или произ-
водственной необходимостью. Надо помнить, что 1 л бензина,
сгорая в двигателе БМВ или другой «престижной машины», до-
бавляет 2,5 кг СО, в атмосферу Каждый владелец легкового
автомобиля вносит свой вклад в развитие парникового эффекта.
Каждый гражданин должен вырабатывать в себе черты ново! о
образажизни, помогающего уменьшить угрозу парникового эф-
фекта.
Публикации писем с обращением к конкретным лицам и
организациям, от которых зависит принятие решений, — это
тоже большая сила.
Вопросы и задания
1. Кто из ученых и когда первым исследовал физическую природу парникового эф-
фекта и предположил, что при увеличении концситряции углекислого газа в атмосфере
произойдет повышение температуры? 2. Где и когда была принята Конвенция об изме-
нении климата и подписан Протокол Киото? О чем эти документы? 3. Объясните при-
роду парникового эффекта. 4. Назовите основные парниковые газы и ихисточники. Ка-
кова доля их влияния на глобальное потепление? 5. Сравните углекислый газ, метан и
фреоны по способности воздействия на потепление климата. 6. На сколько градусов
повысилась средняя глобальная земператц>а нашей планеты в XX в.? Назовите призна-
ки парникового эффекта в XX в. 7. Сравните точки зрения разных ученых о возможном
повышении температуры в XXI в 8. Назовите возможные экологические последствия
удвоения содержания СО, в атмосфере. 9. Какое влияние окажет повышение средне-
планетной температуры Земли на концентрацию СО,, СМ, и водяных паров? Приве-
дите примеры так называемых «положительных обратных связей». 10. Сравните роль
биоценозов лесов, болот и тропических морей в извлечении СО,из атмосферы. 11. Что
такое «оптимистический» и «реалистический» прогнозы парниковой катастрофы для
человеческой цивилизации? 12. Назовите основные пути решении проблемы глобаль-
ного потепления климата. 13. Что вы можете сделать, чтобы уменьшить опасность пар-
никового эффекта?
Задачи
1 Электростанция, работающая на угле, выделяет па каждый гигаватт-час выраба-
тываемой энср| ии 964 т СО, (с учетом добычи топлива, строительства и эксплуатации),
на нефти — 726,2 т СО,, на природном iaae — в 1.5 раза меньше, чем на нефти,
а выбросы СО, при строитсяьсi ве солнечно-тепловой электростанции в 134 раза мень-
ше, чем для работающей па газе. Рассчитайте, сколько тонн СО, выделяет электростан-
ция, использующая энергию Солнца. Сделайте вывод, какая из указашндх электростан-
ций вносит больший «вклад» в развитие глобального потепления климата поданному
парниковому газу. Для сведения: 1 гигаватт (Шт) = 1 млрд Вт. 2. Для «дровяной» тепло-
элсктрос!акции мощностью I млрд Вт-ч были использованы специальные быстрорас-
тущие деревья, которые поглотили из атмосферы в процессе <|мэтоси1псза 1509,1 т СО,.
В период строительства этой электростанции в атмосферу поступило 2.9 т СО,, я в псри-
219
од эксплуатации выделилось 1346.3 т СО:. Каким будет результирующее влияние ука-
занной электростанции на парниковый эффект: положительным или отрицательным?
Сделайте вывод на основе вычислений. 3. В развитие парникового эффекта большой
вклад вносят хлорфторуглсроды (фреоны), мировое производство которых к 1990 г. со-
ставляло 43*1615 т. Объем производства этих веществ в США составлял 380 000 т.
Вычислите, какая доля (в %) мирового производства фреонов приходилась на США
в 1990-е гг.? В домашних холодильниках используется 3800 г фреонов, в автомобильных
кондиционерах — 54 100 т. Сколько процентов это составляет от общего объема произ-
водства этих веществ в США?
2.6.2. Кислотные осадки
Водородный показатель — характеристика кислотности. Как
известно из курса химии, при диссоциации кислот образуются
ионы водорода Н+, присутствие которых обусловливает кислую
реакцию растворов кислот. Щелочи диссоциируют в водном
растворе с образованием гидроксид-ионов ОН . Вода — слабый
электролит, при сс диссоциации образуется одинаковое коли-
чество ионов Н+ и ОН-:
Н,ОЧ=^НЧ-ОН . (2.82)
В чистой воде реакция нейтральная. Установлено, что произведе-
ние концентраций ионов Н и ОН есть величина постоянная:
|Н‘) • [ОН ] = 10 “ (2.83)
Количественной характеристикой кислотно-основных свойств
растворов является водородный показатель (pH) — отрицатель-
ный десятичный логарифм концентрации ионов водорода:
рН = — (2.84)
В нейтральной среде [Н+] = [ОН-], поэтому [Н+] = 10-7 и pH = 7.
В кислой среде [Н ] > [ОН ], поэтому [Н+] > 10-7 и pH < 7. В ще-
лочной среде [Н+] < [ОН |, поэтому [H*j < 10-7 и pH > 7. Таким
образом, дистиллированная вода характеризуется значением
pH = 7. Чем больше в растворе концентрация ионов Н+, тем
меньшее значение имеет pH и тем более кислым является раст-
вор. Например, если в растворе концентрация ионов Н+ состав-
ляет 0,01 моль/л, то pH = 2 (pH = —lg(l • 10 ’)), если же концент-
рация ионов Н+ равна 0,1 моль/л, то pH = 1 (pH = —lg(l • 10-1)).
Эти примеры показывают, что уменьшение значения pH на еди-
ницу означает увеличение концентрации ионов водорода в 10 раз.
Уменьшение pH на 2 ед. соответствует увеличению концентра-
ции Н+ в 100 раз.
Причины образования кислотных осадков. Дождевая вода, об-
разующаяся при конденсации водяного пара, теоретически долж-
на иметь нейтральную реакцию, однако в действительности
даже самый чистый дождь нс имеет значение pH = 7. Ведь
220
в атмосфере всегда присутствует углекислый газ (постоянный
компонент воздуха), который при взаимодействии с атмосфер-
ной водой образует угольную кислоту (см. реакцию (1.3)):
СО, + Н .о *=► НСО, Н‘ + НСО3- 21Г + СО,'-.
I Тоэтому дождевая вода имеет слабокислую реакцию (pH = 5,6).
Кислотным же называется дождь, pH которого < 5,6. Термин
«кислотный дождь» впервые висл английский химик Роберт Ан-
гус Смит в 1882 г. в своей книге «Воздух и дождь: начало хими-
ческой климатологии». А. Смиту' удалось выявить зависимость
между уровнем аагрязнения воздуха над Манчес тером и кислот-
ностью осадков.
Образование кислотного дождя обусловлено выбросами в ат-
мосферу кислотных оксидов, преимущественно SO2 и NO,, естест-
венные и техногенные источники которых подробно рассмотре-
ны в разд. 2 5.2 и 2.5.3. К основным антропогенным источникам
этих газов относятся тепловые электростанции, промышленные
котельные, автотранспорт, технологические агрегаты металлур-
гической, химической и других отраслей промышленности.
Поступающий в атмосферу сернистый газ окисляется кисло-
родом воздуха в серный ангидрид (см. реакцию (2.10)):
__ катализатор
2SO, + О, —-----2SO,.
Происходит эта необычная для природы реакция в присут-
ствии пылеобразных частиц оксидов металлов, выступающих
в роли катализаторов, или под действием солнечного света.
Образующийся серный ангидрид растворяется в капельках
влаги с образованием серной кислоты, выпадающей далее с ат-
мосферными осадками на Землю в виде кислотного дождя (см.
реакцию (2.37)):
SO.+ Н.0__► H;S04.
Так образуется в атмосфере серная кислота, являющаяся пер-
вой причиной выпадения кислотных осадков.
Вторая причина образования кислотных осадков связана
с азотной кислотой, образующейся в атмосфере из оксидов азота
(см. реакции (2.2) и (2.66)):
2NO + O-—>2NO,;
2NO. + Н,О —> HNO, + HNO,.
Азотистая кислота HNO2 может окисляться в азотную, т. е. сум-
марное уравнение происходящего процесса:
4NO, + 2Н,О + О,—►4HNO, (2.85)
В нашей стране установлены следующие предельно допусти-
мые концентрации кислот в атмосферном воздухе населенных
221
мест: для HNO3 ПДК = 0.400 мг/м', ПДК,С = 0,150 мг/м3, для
H2SO4 ПДК*,, = 0.300 мг/м3, ПДК„ = 0,100 мг/м3.
Роль серной и азотной кислот в образовании кислотных дож-
дей неодинакова в различных регионах мира. Из всего коли-
чества кислот, выпавших с дождями на северо-востоке США и
в Центральной Европе, в среднем -/3 приходится на серную кис-
лоту и ’/3 — па азотную. Это соотношение может, однако, не-
сколько изменяться в зависимости от конкретного места или ре-
гиона. Например, на западном побережье США, в Калифорнии,
кислотность дождей обусловлена на 57% азотной кислотой, а на
43% — серной, это связано с большими выбросами оксидов азо-
та автомобилями в южных районах Калифорнии. В некоторых
регионах мира определенную долю кислотности осадков состав-
ляют хлороводород и фтороводород.
Хотя термин «кислотный дождь» возник более 100 лет назад,
проблеме кислотных дождей стали уделять внимание сравни-
тельно недавно. Раньше всех с этой эколо! ической проблемой
столкнулись в Скандинавских странах (1950-е гг.). Затем эта
проблема заявила о себе на северо-востоке США, юго-востоке
Канады, далее — в северной Европе, на Тайване и в Японии.
В 1970-е гг стали явно обнаруживаться экологические послед-
ствия кислотныхдождей. Так, 10 апреля 1974 г. в небольшом шот-
ландском городке Питлохри выпал кислотный дождь с pH = 2,4.
Предметом серьезного обсуждения проблема кислотныхдож-
дей стала на XXVTTI Генеральной ассамблее Международного
союза по теоретической и прикладной химии (ИЮГТАК), кото-
рая состоялась в Мадриде в 1975 г. Кислотными следует назы-
вать осадки не только в виде дождя, но и любые осадки (туманы,
снег, 1рад), кислотность которых выше нормальной. К ним так-
же относят так называемые кислотные отложения — выпадение
из атмосферы сухих кислотных частиц. Кислоты могут выпадать
из атмосферы и без воды — сами по себе или с частицами пыли.
Такие сухие кислотные отложения могут накапливаться на по-
верхности растений, а при смачивании небольшим количеством
влаги, например при выпадении росы, давать сильные кислоты.
Следовательно, к кислотным осадкам надо относить и кислот-
ную росу. Таким образом, к кислотным осадкам относятся
кислотный дождь, кислотный снег, кислотный град, кислотный
туман, сухие кислотные осадки (кислотные отложения), кислот-
ная роса.
Водородный показатель кислотных осадков зависит от коли-
чества в атмосфере и кислот, и воды, в которой они растворены.
Сильные дожди обычно .менее кислотные, так как воды в них от-
носительно больше, чем в умеренном или слабом дожде. У тума-
нов и росы кислотность выше, чем у дождей, поскольку здесь
кислоты растворены в значительно меньшем количестве влага.
У них уровень кислотности иногда в 100 раз выше (или значение
pH на 2 ед. меньше), чем у дождя. Вода, образующая облака, мо-
жет быть более кислой, чем дождь.
Кислотные осадки выпадают в большинстве промышленных
районов мира. Они особенно распространены в странах Скан-
динавии (Швеция, Норвегия, Финляндия), Европы, на северо-
востоке и западном побережье США и Канады. В указанных
районах Северной Америки, а также почти над всей Европой pH
дождя и снега обычно составляет около 4,5. В пределах этих ре-
гионов бывают осадки с pH = 4,0. Вода, образующая облака,
в отдельных случаях имеет pH = 3,5 и даже ниже. Туман в районе
Лос-Анджелеса обычно имеет pH = 2,5—3. В промышленных зо-
нах и крупных городах осадки, как правило, в 10—1000 раз кис-
лее нормальных. Отмечались даже случаи выпадения осадков
с pH = 1,5, т. е. в 10 000 раз более кислотные по сравнению с так
называемым чистым дождем, pH которого должен составлять 5,6
(см. стр. 221).
Кислотные дожди «не признают» границ между государства-
ми и народами. Великобритания и Северная Европа «экспорти-
руют» кислотные дожди в Швецию и Норвегию. США и Канада
также «обмениваются» своими кислотными дождями, однако
США в большей степени ответственны за эти дожди, так как
выбрасывают в атмосферу гораздо большее количество оксидов
серы, а преобладающие ветры над восточными промышленно
развитыми штагами США направлены в сторону Канады.
Исследователи считают, что более 50% кислотных осадков,
выпадающих над восточной частью США и Канады, объясняют-
ся работой угольных электростанций, которые дают около 75%
всех выбросов SO,. С целью рассеивания загрязняющих веществ
в более высоких слоях атмосферы и уменьшения загрязнения
приземного воздуха на некоторых ТЭС произвели замену обыч-
ных труб на более высокие — 300-метровыс. Но оказалось, что
эта мера, решая только местные проблемы, создает более широ-
комасштабные, приводя к усиленному превращению диоксида
серы и оксидов азота в кислоты и к их распространению на сот-
ни километров от источника, особенно по направлению ветра.
Другие пути решения проблемы кислотных дождей рассмотрены
в конце разд. 2.6.2.
Влияние кислотных осадков на живые организмы, строительные
материалы и памятники культуры. Водные экосистемы. Наи-
более заметное влияние кислотные осадки оказывают на обита-
телей водоемов. В 1950-е гг. рыбаки отметили резкое сокраще-
ние популяции рыб во многих озерах Швеции, Норвегии, про-
винции Онтарио (Канада) и гор Адирондак (шт. Нью-Йорк).
Шведские ученые первыми объяснили этот факт повышенной
кислотностью воды в результате выпадения кислотных осадков.
223
В Швеции и Норвегии рыба погибла примерно в 6500 озерах
и семи реках. В канадской провинции Онтарио около 1200 озер
в 1990-е гт. были «.мертвы». В горах Адирондак более 200 озер ли-
шены рыбы, причем но многих из них выжило лишь несколько
видов бактерий. Исследования, проведенные в 1975 г., показали,
что всегда 50% этих высокогорных озер имели pH < 5.
Каким же образом повышенная кисло тность воды действует
на сокращение численности рыб? В пресноводных озерах, ручь-
ях и прудах вода обычно имеет pH = 6—7, и живые организмы
в этих водоемах адаптированы именно к этому уровню кислот-
ности. Значение pH водной среды чрезвычайно важно, посколь-
ку от него зависит деятельность ферментов, гормонов, регулирую-
щих метаболизм, рост и развитие организмов. Взрослая рыба
менее чувствительна к изменению pH среды, чем молодь, так как
метаболизм поддерживает внутренний pH на должном уровне,
а кожа обеспечивает более или менее надежную защиту от нару-
шений. Ученые считают, что сокращение численности рыб про-
исходит в основном не из-за гибели взрослой рыбы, а из-за того,
что кислые воды не позволяют рыбе нормально размножаться.
Самки могут оказаться не способны выметывать икру в кислой
воде. Но если даже они и отложили икру, то из-за повышения
кислотности воды либо она гибнет, либо погибнут мальки. При
изменении реакции воды всего лишь на одну единицу pH,
т. е. при увеличении кислотности в 10 раз по сравнению с опти-
мальной, мальки в большинстве случаев испытывают серьезный
стресс и часто погибают. В результате в водоемах с кислой водой
встречается нс молодь, а только взрослые особи.
Подкисление водоемов усиливается в период таяния снегов,
когда вес накопившиеся за зиму в почве кислотные осадки вы-
мываются талыми водами в водоемы. По времени это совпадает
с началом нереста у рыб. Таким образом, вымеченная икра ока-
зывается в кислой воде и погибает. Наряду с рыбой в кислой сре-
де быстро погибают и другие водные организмы либо из-за пря-
мого воздействия ионов Н+, либо из-за невозможности размно-
жения.
Уменьшение pH среды по-разному влияет па жизнеспособ-
ность различных организмов. При значении pH = 6 гибнут рако-
образные, улитки, моллюски, при pH < 5,8—5,9 — лосось/фо-
рель, плотва, а также некоторые восприимчивые к кислотному
загрязнению насекомые, фито- и зоопланктон При рН=5,7 и
ниже гибнут сиг и хариус. Окунь и щука выдерживают подкисле-
ние водоемов до pH = 5,1, а угорь и голец — до pH = 4,6—4,7. Из
приведенных примеров видно, как по-разному влияет кислот-
ность на вилы рыб, лишь немногие выживают при pH < 4,5, при
этом важно отмстить, что даже при вымирании самых чувстви-
тельных видов наступает нарушение водных экосистем. При pH
224
меньше 4,5 бурно развиваются кислотолюбивые мхи, грибы и
нитчатые водоросли, развивается белый мох сфагнум (в обыч-
ных условиях — обитатель суши), водоем начинает заболачи-
ваться. При таком понижении pH в озерах вымирают микроор-
ганизмы, развиваются анаэробные (бескислородные) процессы
с выделением метана и сероводорода.
Кислотные осадки оказывают на рыб нс только прямое воз-
действие, но и косвенное — за счет вымывания алюминия и тя-
желых металлов из почвы и донных отложений. Под действием
кислот эти металлы переходят из нерастворимых соединений
в растворимые, становятся доступными для живых организмов,
поглощаются ими, производя токсическое действие Алюми-
ний, попадая в водоемы, вызь вает аномалии развития и гибель
эмбрионов рыбы, повреждает жаберный аппарат рыб. Ионы
алюминия и марганца могут вызвать угнетение роста растений и
водорослей, сокращение или полное исчезновение популяций
рыб, в частности семги.
Отмечая пагубное действие кислотных осадков на водные
экосистемы, следует добавить, что не все озера одинаково чув-
ствительны к ним. Чувствительность озер к кислотным дождям
определяется химическим составом подстилающих пород и поч-
вы на водоразделах и берегах. Если в них присутствует известняк
(осадочная порода, состоящая из карбоната кальция), то такие
озера «сопротивляются» закислению воды, поскольку карбона-
ты нейтрализуют кислоту:
CaCOj + 2Н‘ —► Са:' + СО2 + Н,О. (2.86)
Карбонат кальция играет роль буфера, поддерживает посто-
янным значение pH. Аналогичное действие производит и карбо-
нат магния MgCO3. Однако возможности любого буфера ограни-
чены. Известняк, например, расходуется, реагируя с кислотами,
т. е. его буферная емкость уменьшается. Если она будет исчерпа-
на, то дополнительные ионы водорода останутся в растворе и
произойдет соответствующее понижение pH среды. При исто-
щении буферной емкости добавление даже небольшого коли-
чества кислот вызовет резкое уменьшение pH.
Если водозаборные бассейны озер сложены гранитами (или
гнейсами) с низкой буферной емкостью, как в горах Адирондак,
то такие озера чувствительны к кислотным осадкам. Последние
вызывают сильное подкисление их воды. Обширные территории
Северной Америки, особенно в Канаде, сильно страдают от кис-
лотных осадков, так как сложены гранитными породами
Таким образом, экологические последствия для разных рек и
озер на планете, получающих одинаковое количество кислотных
осадков, не одинаковы. Так, Белгородская область богата место-
рождениями мела (карбоната кальция). В зоне меловой системы
225
находятся водозаборные бассейны почти всех рек области (Се-
верский Донец, Оскол, Ворскла, Нежсголь, Псел, Пена, Короча,
Валуй и др ). На рис. 2.20 представлена геологическая кар га-схе-
ма Белгородской области, на которой отмечены меловые систе-
мы. Так как породы осадочного происхождения состоят из кар-
боната кальция, они обладают большой буферной емкостью и,
следовательно, могут защищать белгородские реки и пруды от
кислотных осадков. Иными словами, возможные кислотные осад-
ки не должны вызывать сильного снижения pH воды этих рек,
а потому отрицательные экологические последствия для данных
водных экосистем будут незначительными. Химический состав
атмосферных осадков в г. Белгороде приведен на с гр. 238.
Рис. 2.20. Геологическая карта-схема Белгородской области
(Г Н Григорьев, 1996)
Продолжая разговор о кислотных осадках, следует заметить,
что действие их не ограничивается гибелью непосредственных
обитателей водоемов, а сказывается и на других животных, яв-
ляющихся следующими звеньями пишевой цепи. Гибель рыбы и
других вод н ых обитателей вызывает уменьшение численности жи-
вотных, пищевые цепи которых начинаются в водных экосистемах.
По мере сокращения численности рыбы будет уменьшаться и
численность пи тающихся рыбой птиц и животных, таких как бе-
логоловый орлан, гагара, скопа, а также норка и выдра. Напри-
мер, в горах Адирондак (север США), где в озерах уже не оста-
лось рыбы, практически исчезли гагары и другая водоплаваю-
226
щая дичь; резко сократились популяции птиц, питающихся на
секомыми, личинки которых развиваются в воде; уменьшилась
численность енотов.
Численность лягушек, жаб и тритонов также сокращается по
причине тех же кислотных осадков, так как многие из этих видов
размножаются во временных водоемах, возникающих в период
весенних дождей, т е. образованных только дождевой водой,
кислотность которой выше, чем у вод естественных (природных)
водоемов.
Почва и растения. Нстолько водные экосистемы чувстви-
тельны к кислотным дождях!. Почвенные и наземные экосисте-
мы, в частности растения, также страдают от их воздействия.
Как и водоемы, почвы по-разному реагируют на кислотные
осадки. Почвы, возникшие на осадочных породах, например
карбонатных минералах, и почвы, богатые органическими ве-
ществами (гумусом), способны нейтрализовать кислотные дож-
ди. К таким можно отнести почвы Центрального Черноземья,
в частности почвы Белгородской области, где чернозем занимает
около 77% площади земельных угодий. Основными свойствами
черноземов являются богатство гумусом и элементами питания
(N, Р, К и др.) растений, отсутствие в поч не легкорастворимых со-
лей и наличие в профиле карбонатов, а также благоприятные
физические свойства.
Почвы, образованные на гранитах и ытсйсах, практически не
растворимых в воде, очень чувствительны к кислотным осадкам
и легко становятся закисленными. Например, 70—80% земель
в восточной части США имеют почвы, чувствительные к закис-
лению. Из таких почв кислотные дожди легко выщелачивают
небольшое количество минеральных питательных веществ, тем
самым уменьшая их плодородие и как результат отрицательно
воздействуя на растения.
Рассмотрим подробнее три основных пути воздействия кис-
лотных осадков на растения.
1. Непосредственное воздействие (прямой контакт) с растени-
ем. Кислоты нарушают поверхность растений, в частности за-
щитный восковой покров листьев, делая растения более уязви-
мыми для вредных насекомых, грибов и других патогенных орга-
низмов. Через такие поврежденные листья испаряется больше
влаги, что может вызвать нарушение жизнедеятельности расте-
ний, особенно во время засухи Кислотные осадки, стекая по рас-
тениям, вымывают из листьев биогенные элементы, особенно
если поверхность листьев повреждена. Специальные лаборатор-
ные опыты показали, что иголки у сосны достигали лишь поло-
вины нормальной длины, а урожай помидоров заметно снижал-
ся, когда их поливали водой, кислотность которой соответство-
вала pH кислотного дождя (4,5).
227
2. Вытеснение ионов биогенных элементов из почвы (выщела-
чивание биогенов). Кислотные осадки вымывают ионы биоген-
ных элементов из почвы. Частички гумуса и глины обычно заря-
жены отрицательно и удерживают такие положительные биоген-
ные ионы, как К+, NH.+, Са2+. При просачивании через почву
нейтрального водного раствора эти ионы удерживаются части-
цами почвы и не вымываются. Однако при поступлении в почву
кислотного дождя биогенные ионы вытесняются ионами Н\
Кроме того, при низких значениях pH понижается активность
азотфиксаторов, что еще больше приводит к уменьшению со-
держания биогенов.
Дефицит биогенов, возникающий в результате вымывания
их из листьев и вытеснения из почвы, вызывает замедление ро-
ста растений, снижает их сопротивляемость болезням и вреди-
телям.
3. Перевод токсичных металлов из нерастворимых соединений
в растворимые (мобил изация алюминия и других элементов). При
рассмотрении водных экосистем было отмечено, что алюминий и
тяжелые металлы под действием кислот, содержащихся в атмо-
сферных осадках, переходят из нерастворимых форм в раствори-
мые. Алюминий широко распространен в земной коре, присут-
ствует в значительных количествах во многих горных породах и
почвенных минералах (слюда белая К2О - ЗА12О3 • 6SiO2 • 2Н,О;
полевой шпат, или ортоклаз, К2О • А12О} • 6SiO2). Из кристаллов
кварца (SiO2), полевого шпата и слюды состоят горные породы —
граниты и гнейсы. Алюминий входит в состав всех глинистых почв.
Основу различных глин составляет каолин А12О3 - 2SiO2 - 2Н2О
При повышении кислотности происходит растворение соедине-
ний алюминия, переход алюминия в раствор. Этот процесс на-
зывается мобилизацией алюминия. Образующиеся соединения
обладают токсичностью для корневой системы, они разрушают
корневые волоски, которые в конечном итоге отмирают При
повреждении волосков нарушается процесс питания растении.
Особенно опасен алюминий при невысоком соотношении в поч-
ве Са : А1 (т. е. при малом содержании кальция). Например,
в Белгородской области есть месторождения глины, так что не
исключается образование растворимых соединений алюминия
при повышении кислотности почвы. Однако присутствие зна-
чительного количества карбопата кальция в белгородских поч-
вах должно снижать эффект воздействия токсичного алюми-
ния.
Тяжелые металлы, например свинец и ртуть, тоже могут перехо-
дить в растворимые соединения при подкислении среды. Кроме
того, тяжелые металлы и повышенная кислотность обладают си-
нергическим действием на растения, т. е действие одного из этих
двух факторов усиливается действием другого.
228
С повышением кислотности почвы и образованием раствори-
мых форм токсичных металлов активность микроорганизмов
резко снижается. В почве содержатся различные микроорганиз-
мы: бактерии, 1рибы, вирусы и др. Большинство из них перера-
батывает лесную подстилку, улучшает структуру почвы, перево-
дит органические соединения в усвояемые формы. Снижение
активности микроорганизмов приводит к ухудшению качества
почвы, что отрицательно сказывается на жизнедеятельности ра-
стений.
Итак, рассмотрены пути воздействия кислотных осадков на
растения. В результате действия даже одного из названных фак-
торов происходит деградация или гибель дикорастущих расте-
ний, снижается продуктивность сельскохозяйственных расте-
ний. В первую очередь погибают некоторые лишайники, кото-
рые считаются «индикаторами» чистого воздуха. Кислотные
осадки влияют также на кустарниковую и древесную раститель-
ность. Они вызывают массовые заболевания лесов, особенно
хвойных, составляющих основную часть лесных площадей Рос-
сии, Европы и Северной Америки. Кислотные дожди омертвля-
ют леса. Леса высыхают, развивается суховершинность деревьев
на больших площадях. Чаще всего страдают ель, сосна, пихта,
потому что смена хвои происходит реже, чем смена листьев, и
хвоя накапливает больше веществ-загрязнителей за один и тот
же период времени.
Например, наблюдения за лесами в Баварии (Германия) по-
казали, что у ели красной — вида, который наиболее чувствите-
лен к повреждениям, — наблюдаются пожелтение и раннее опа-
дание хвои, которое, начинаясь с вершины дерева, постепенно
распространяется книзу. Процесс, кроме тото, развивается по
направлению к стволу, т. е. хвоя начинает опадать с самых кон-
цов ветвей, и ветки опускаются вниз. В Англии из-за кислотных
дождей гибнет до 60% хвойных лесов, в Германии — до 50%.
Действию кислотных дождей подвергаются не только хвойные
породы деревьев, но и лиственные (бук, граб, дуб, береза, ряби-
на, платан).
Примером деградации лесов и другой растительности в Рос-
сии является территория около г. Норильска, медеплавильные
заводы которого выбрасывают в атмосферу большое количество
сернистого газа. В результате выпадения сернокислотных дож-
дей погибла древесная растительность в радиусе 50 км от центра
города, на больших площадях исчезли лишайники.
В 1980-е гг. отмечались повреждения лесов и даже их табель
по всей Европе. К 1990 г. в Северной Европе от кислотных дож-
дей пострадало около 50% лесов. Эти явления охватили лесные
массивы Германии, Чехословакии, Польши, Австрии. Швейца-
рии, Швеции, Голландии, Румынии, Великобритании, Югосла-
229
вии. Например, отмечено, что у слей в Швеции хвоя удержива-
ется лишь в течение одного года, тогда как у здоровых молодых
деревьев она сменяется каждые три года. Буки в некоторых райо-
нах Швеции и Германии теряют листву уже в августе, причем
листья опадают, когда они еще зеленые. В Германии поврежде-
ния деревьев были отмечены на 50% площади лесов, и это явле-
ние получило название Waldsterben (буквально — «умирающие
леса»). В этой стране можно встретить плакат с надписью: «Лес
умирает сегодня. Мы умрем завтра». Ведь каждый вид расте-
ний — это часть определенной экосистемы, поэтому заболева-
ние лесов ведет к дальнейшей гибели целой экологической це-
почки. В конечном итоге это отрицательно скажется на здоровье
человека.
Аналогичные повреждения деревьев обнаружены на северо-
востоке и западе США, где выпадают кислотные дожди. В лесах
отмечается быстрая гибель красных слей. Происходит также за-
медление роста деревьев, что выражается в уменьшении толщи-
ны годичных колец на срезе ствола или в уменьшении ежегодно-
го прироста. Другими словами, налицо признаки снижения про-
дуктивности леса.
Разрушение лесной экосистемы ведет к эрозии почвы, засо-
рению водоемов, наводнениям, уменьшению запасов воды, ги-
бели диких животных. Изменяется видовой состав лесной рас-
тительности. Погибшие деревья будут замешены ацидофильны-
ми видами (т. е. «любящими кислотность»), состав которых
очень ограничен. В основном это мхи, папоротники и другие
низкорослые растения, не представляющие экономической цен-
ности.
Из-за кислотности дождей страдают нс только леса, но и сель-
скохозяйственные культуры. В них также разрушается хлоро-
филл, затрудняется процесс фотосинтеза, изменяется обмен ве-
ществ. У растений повреждаются покровные ткани, нарушаются
рост и развитие, уменьшается сопротивляемость болезням и
вредителям, снижается урожайность. Например, по данным для
Донбасса снижение урожайности зерновых достигает 27%, гречи-
хи — 25%, капусты — 12%, кукурузы — 43% по причине воздей-
ствия SO2, выделяющегося при самовозгорании угольных отвалов
(терриконов), и образующейся в атмосфере серной кислоты.
Строительные материалы и памятники культуры. Воздействию
кислотных осадков подвержены строительные конструкции из
мрамора и известняка, химическая формула которых СаСО3.
Эти материалы широко используются для оформления фасадов
зданий и сооружения памятников. Если при строительстве ис-
пользована гашеная известь, то при взаимодействии с угле-
кислым газом атмосферы она также превращается в карбонат
кальция:
230
Са(ОН), + СО. —> CaCOj + Н2О. (2.87)
При действии на эти минералы кислотных дождей содержа-
щиеся в них сильные кислоты (азотная и серная) растворяют
карбонат кальция (см реакцию (2.86)):
СаСО, + 21Г —♦ Са*’ + СО, + Н,О.
В результате архитектурные сооружения и скульптуры из этих
пород разрушаются. Памятники и здания, простоявшие сотни и
даже тысячи лет с небольшими внешними изменениями, за по-
следние три десятилетия подверглись разрушительному дей-
ствию кислотных дождей. Muonic из каменных памятников по-
теряли свой внешний вид, а некоторые и вовсе рассыпались.
Кислотные осадки составляют угрозу существованию многих
памятников Древней Греции и Рима из мрамора и известняка.
Такая же судьба грозит и Тадж-Махалу — шедевру индийской
архитектуры периода Великих Моголов, Вестминстерскому аб-
батству в Лондоне, собору Св. Павла в Римс, статуям на соборе
Св Иоанна в Голландии, Королевскому дворцу в Амстердаме и
др. Угрожает гибель от кислотных дождей памятнику русского
классицизма Казанскому собору Мраморному дворцу' и Алек-
сандро-Невской лавре в Санкт-Петербурге. Высокая влажность
воздуха в некоторых из этих городов, в частности в Санкт-Пе-
тербурге, способствует превращению в ат.мос(]>ере газообразных
оксидов серы и азота в соответствующие кислоты (серную и
азотную), которые и производят свое разрушительное действие.
В Европе существует опасность утраты более 100 тысяч цен-
нейших памятников средневекового готического искусства.
К их числу относятся витражи соборов и церквей в Германии
(г. Кельн, архитектурные памятники XI—XVII вв., в том числе
известный Кельнский собор; г. Эрфурт, архитектурные памят-
ники XII—XV вв.), Франции (г. Шартр, готический собор Нотр-
Дам XII—XIII вв., церкви и другие архитектурные памятники
X—XVH вв.), Великобритании (г. Кентербери, соборы XI—XVI вв.),
Швейцарии (г. Берн, архитектурные памятники XV—XVIII вв.).
Замечательные памятники мировой культуры, каковыми явля-
ются витражи церквей в российских городах Санкт-Петербурге,
Москве, Новгороде, Пскове и других, также испытывают губи-
тельное воздействие кислотных дождей.
Повышенная кислотность осадков вызывает коррозию ме-
таллических конструкций зданий, мостов, плотин, линий элект-
ропередач.
Человек. На человека кислотные дожди действуют в основ-
ном опосредованно, т. е. через рассмотренные выше экосистемы
рек, озер, лесов, сельскохозяйственных угодий и т. д. Отрица-
тельное воздейст вие кислотных дождей на человека проявляется
прежде всего через ухудшение качества жизни. Наносимый раз-
231
личным экосистемам экономический, экологический и эстетиче-
ский ущерб приносит вред и человеку.
Примером экономического ущерба является исчезновение
рыбы в некоторых озерах, реках и прудах. Особенно значитель-
ный экономический ущерб отмечается при исчезновении цен-
ных промысловых рыб в регионах, где рыба является основным
продуктом питания и предметом торговли Исчезновение цен-
ных пород деревьев, замена их низкорослыми растениями также
приводит к экономическому ущербу.
Выше было отмечено, что подкисление водоемов вызывает
загрязнение их ионами алюминия и тяжелых металлов. Может
произойти загрязнение этими металлами как поверхностных,
так и грунтовых вод, являющихся источниками питьевой воды.
Употребление загрязненной воды окажет влияние на здоровье
человека. Было установлено, что алюминий способен вызывать
болезнь Альцгеймера, разновидность преждевременного старе-
ния. Ионы таких тяжелых металлов, как ртуть, свинец, кадмий,
цинк, из водоемов попадают в рыбу, а далее по пищевой цепи
в организм человека, вызывая тяжелейшие отравления. Ртуть,
содержащаяся в природных водоемах, может под влиянием кис-
лой среды превратиться в ядовитую метилртуть. Рыбы будут
накапливать это соединение ртути в своих тканях Ртуть — силь-
но токсичное вещество для человека, поэтому при потребле-
нии такой рыбы происходит его отравление ртутью (см об этом
в разд. 2.5 4 — болезнь «Минамата»). Ионы тяжелых металлов
могут поступать в организм человека нс только при употребле-
нии рыбы, но и через недостаточно очищенную питьевую воду.
Назовем еще одно косвенное воздействие кислотных дождей
на организм человека. Если повышается кислотность воды водо-
хранилищ, откуда ведется водозабор для городской водопровод-
ной сети, то в подаваемой воде могут растворяться токсичные
металлы самих водопроводных труб и пробок. Таким образом,
например, в питьевую воду может поступать свинец, который
раньше использовали при строительстве водопроводных систем.
С такой водой токсичные металлы могут попадать в организм чело-
века. Не менее важно и то, что деградирующие леса, гибнущие озе-
ра, разрушающиеся памятники культуры — это большие эстетиче-
ские потери для человечества, а также фактор негативного воздей-
ствия на эмоционально-психологическое состояние людей.
Меры защиты биосферы от кислотных осадков. Кислотные
дожди, как было отмечено, наносят значительный ущерб всем
объектам окружающей среды. Поэтому данная проблема весьма
актуальна и требует объединения усилий всех стран.
Прежде всего необходимы меры, позволяющие резко снизить
выбросы в атмосферу сернистого газа и оксидов азота, так как
именно они являются причиной образования кислотных дож-
232
дсй. Для уменьшения газообразных выбросов необходимо со-
вершенствовать технологический процесс по принципу безот-
ходного производства, разрабатывать систему эффективных
очистных сооружений, а это определяется уровнем развития на-
уки и техники, которые должны быть приоритетными в государ-
ственной политике.
В первую очередь надо резко снизить выбросы в атмосферу
сернистого газа так как серная кислота примерно на 70% обуслов-
ливает кислотность дождей, выпадающих на больших расстоя-
ниях от места выбросов.
Одним из путей уменьшения содержания SO2 в выбросах яв-
ляется обессеривание топлива Уголь можно очишать от серы ме-
тодом промывки водой. Дчя этого уголь необходимо предвари-
тельно измельчить, просеять через сито, а затем промыть водой.
При этом сера отделяется от частиц угля в результате седимента-
ции пирита FeS2 вследствие его относительно большой плотно-
сти. Эта мера позволяет удалить из угля 25—50% содержащейся
в нем серы, однако полного отделения серы от угля таким мето-
дом достичь не удается.
Нефть и нефтепродукты можно гидрировать при высоких
температурах и под большим давлением в присутствии катализа-
тора, при этом сера переходит в H2S. При охлаждении реакцион-
ной смеси сероводород остается в i азовой фазе, т. е. может быть
отделен от топлива.
Природный газ обычно не содержит серы. Если же в нем при-
сутствует сероводород, то его можно удалять методом промывки
водой, в которой сероводород растворяется
Уменьшения выбросов сернистого газа можно достичь заме-
ной угля низкосернистыми нефтью и природным газом. Например,
на Белгородской ТЭЦ и входящих в се состав двух котельных
(«Южной» и «Западной») используют природный газ и мазут,
а на Губкинской ТЭЦ (в Белгородской области) — природный
газ и уголь, на ее отопительной котельной — природный газ и
мазут. Из сравнения видов топлива, применяемых на Белгород-
ской и Губкинской ТЭЦ, следует, что вероятность образования
кислотных дождей больше в районе Губкинской ТЭЦ, так как
наряду с природным газом и мазутом на ней используется и
уголь, содержащий, как правило, больше серы.
Используемые на практике способы обессеривания не по-
зволяют полностью удалить из топлива серу Кроме того, при
сгорании топлива из азота воздуха получаются сшс и оксиды
азота, т. е. образующиеся газы необходимо подвергать очистке.
Таких методов очистки газов предложено достаточно много в за-
висимости от вида топлива. Они значительно различаются по
эффективности. Рассмотрим кратко химические основы неко-
торых из них.
233
1. Аммиачный метод скрубберной (мокрой) очистки. Поэтому
метолу к поточному газу добавляют аммиак. В установке для
промывки газа (скруббере1) SO,, NH3 и вода превращаются
в сульфат аммония:
4NH3 + 2SO, + 2Н,О + О, —> 2(N1L)3SO*. (2.88)
Образующийся сульфат аммония можно использовать в качест-
ве удобрения.
2. Известковый метод скрубберной (мокрой) очистки. Газ,
предварительно очищенный от пыли, посту! 1ает в скруббер с из-
вестковым молоком:
SO, + Са(ОН), + Н,О —► CaSO, + 211,0.
(2.89)
изпестковос
молоко
Образующийся в скруббере CaSO, в дальнейшем под воздей-
ствием SO2, Са(ОН)2 и кислорода воздуха переходит в сульфат
кальция через промежуточную реакцию образования гидросуль-
фита кальция:
SO, + CaSO, + Н2О —> Са( HSO,)(2.90)
Ca(HSO.)2 + Са(ОН), + О,—> 2CaSO4 + 2Н,О (2.91)
Этот метод скрубберной (мокрой) очистки топочных газов по-
зволяет снизить содержание серы в отходящих газах на 95%.
3. Сульфитный метод мокрой очистки. В отличие от предыду-
щего метода газ пропускают не через известковый раствор, а че-
рез нагретый раствор сульфита кальция. При этом образуется
соответствующий гидросульфит (см. реакцию (2.90)). После
охлаждения из раствора пиросульфита можно вновь выделить
SO2 и использовать его для производства серной кислоты Кроме
того, из гидросульфита и Са(ОН)2 при окислении воздухом мож-
но получить сульфат кальция, как в предыдущем методе (см. ре-
акцию (2.91)).
Вместе с SO2 в раствор сульфита переходят галогены и следы
тяжелых металлов. После удаления SO2 раствор сульфита можно
использовать повторно до тех пор, пока он не обогатится доста-
точно загрязнениями. Оксиды азота в этом методе не отделяются.
4. Известняковый метод сухой очистки Измельченный уголь
перемешивается с пылью известняка (СаСО3), и эта смесь пода-
ется в камеру сгорания. После сжигания из известняка, сернис-
того газа и кислорода воздуха образуется сульфат кальция:
2СаСО, + 2SO, + О, —» 2CaSO. + 2СО,. (2.92)
1 Устройство скрубберов и других газо- и пылсочистных установок рас-
смотрено в разд. 2.7.
234
Вместо известняка можно использовать негашеную известь СаО
2СаО + 2$О, + О,—► 2CaSO4. (2.93)
Этот метод требует небольших затрат, технически прост, однако
недостаточно эффективен так как позволяет связывать только
50% SO2 топочных газов. Полученный сульфат кальция загряз-
нен золой, это затрудняет его использование.
5. Сухой метод очистки отходящих газов при сжигании топли-
ва в «кипящем слое». Смесь угля и известняковой пыли, как и
в методе 4, подается в камеру сгорания. За счет' энергии подогре-
того воздуха, одновременно подаваемого снизу камеры, смесь
находится во взвешенном состоянии, т. е. весь процесс сгорания
протекает в «кипящем слое». При этом происходят те же хими-
ческие реакции, что и в предыдущем методе 4. Преимущество
этого метода состоит в том, что принцип «кипящего слоя» по-
зволяет вести сжигание при температуре 800—900 С При этом
на 50% сокращается процесс образования оксидов азота в отличие
от методов, которые проводятся при температуре выше 1000 °C
Данный мстодявляется высокоэффективным, он позволяет уда-
лять из отходящих газов до 90% серы. Чрезвычайно интенсивное
перемешивание угля и известняковой пыли дает возможность
наряду с серой отделять и галогены.
6. Адсорбционный метод с применением активированного угля
или кокса Для улавливания SO2, содержащегося в отходящих га-
зах горения топлива и некоторых металлургических произ-
водств, можно использовать углеродные пористые вещества (ак-
тивированный уголь или кокс). При этом адсорбируются сер-
нистый газ, галогены и тяжелые металлы. После исчерпания
адсорбционной емкости активированный кокс перемешивают
с горячим песком для извлечения SO2 и галогенов Кокс после
десорбции вновь используют для очистки газов. Сернист ый газ
можно в дальнейшем использовать для производства серной
кислоты и других химических синтезов
7. Получение из сернистого газа серы. Из SO2 отходящих газов
можно получать и серу (простое вещество), для чего к отходя-
щим газам в стехиометрическом отношении к SO2требуется до-
бавить сероводород При этом SO2 восстанавливается с образо-
ванием серы:
2H,S + SO2 —» 3S + 2Н2О. (2.94)
Бывают ли щелочные осадки? Да, бывают, однако они не
столь распространены, как кислотные осадки, малоизвестны,
а их влияние па объекты окружающей среды практически не
исследовано. Тем не менее их’ рассмотрение заслуживает вни-
мания
Мониторинг кислотно-основных свойств атмосферных осад-
ков, проводимый автором этой книги с 1994 г., показал, что
235
в г. Белгороде преобладают щелочные осадки Это подтверждается
исследованиями и других белгородских ученых (Л. Л. Новых,
С И Свергузова).
В табл. 2.19 указаны средние значения pH атмосферных осад-
ков (дождя и снега) в г. Белгороде за 1994—1996 гг. Из шести
контролируемых точек города в четырех осадки были щелочны-
ми: в районах цементного завода, комбината стройматериалов,
Белгородского государственного университета и нарка Победы.
В центре города осадки почти нейтральные. Кислотными были
осадки только в районе витаминного комбината, который ис-
пользует кислоты в своем производстве.
Таблица 2.19
Средние значения pH атмосферных осадков в городе Белгороде (1994—1996 гг.)
Место отбора пробы pH
АО «Бслвитамины» 5,25
Ул. Красина (центр города) 6,99
Ул. Студенческая (Белгородский государственный университет) 7,43
Проспект Богдана Хмельницкою (парк Победы) 8,34
АО «Стройматериалы» 8,82
АО «Белцсмснт» 10,62
За указанный трехлетний период наблюдений осадки с ще-
лочной реакцией составили 50%, практически нейтральной —
33% кислой — 17%.
Происхождение щелочных осадков можно объяснить следую-
щим образом. В качестве сырья предприятия стройиндустрии
города Белгорода (комбинат стройматериалов, цементный завод
и др.) используют мел, добываемый в карьере в непосредствен-
ной близости от предприятия. Обжиг мела сопровождается об-
разованием оксида кальция (по реакции (2.25)), который по-
ступает в атмосферу при недостаточно эффективной работе
пылеочистных сооружений:
СаСО3—»СаО+ СО,.
В атмосфере оксид кальция соединятся с водяными парами
(см. реакцию (2.27)) при их конденсации, с дождем или мокрым
снегом, образуя при этом гидроксид кальция
СаО + Н2О —► Са(ОН)„
который и создает щелочную реакцию атмосферных осадков.
В дальнейшем возможно взаимодействие гидроксида кальция
с углекислым газом и водой с образованием карбоната и гидро-
карбоната кальция:
Са(О11)2 + СО,—» CaCOjJ- + Н,О;
СаСО3 + СО2 + Н,О - + Са(НСОз),.
236
Химический анализ дождевой воды показал, что в ней в не-
значительном количестве присутствуют сульфат- и нитрат-ионы
(порядка 0,2 мг/л). Как известно, причиной кислотного характе-
ра осадков являются серная и азотная кислоты. В то же время
наблюдается большое содержание катионов кальция (5—8 мг/л)
и гидрокарбонат-ионов, содержание, которых в районе пред-
приятий строительного комплекса в 1,5—2 раза больше, чем в дру-
гих районах города, и составляет 18—24 мг/л. Это показывает,
что в образовании локальных щелочных осадков главную роль
играет карбонатно-кальциевая система и происходящие в ней
процессы, о чем было сказано выше.
Щелочные осадки оказывают влияние на растения. Об этом
свидетельствуют паши наблюдения за состоянием растительно-
го покрова в лесу на Меловой горе, расположенной на расстоя-
нии 300—500 м от предприятия «Стройматериалы». Ныне этот
массив называется особо охраняемой природной территорией
«Городской лес» (ООПТ «Городской лес») В этом районе с ще-
лочными осадками и большим количеством осаждаемой из воз-
духа пыли, преимущественно состоящей из СаСО3, СаО и Са(ОН)2,
отмечаются изменения в фенотипическом строении растений.
Наблюдаются следы «ожогов» на листовых пластинках, белый
налет на листьях и угнетенное состояние травянистых расте-
ний
Однако следует отметить одну положительную экологиче-
скую роль образующегося в атмосфере гидроксида кальция. Ин-
тересным представляется следующее наблюдение. Замечено,
что плодовые деревья (яблони, груши, абрикосы), растущие
в непосредственной близости от АО «Стройматериалы», в зна-
чительно меньшей степени подвержены болезням. Это отмеча-
ется на всей улице, расположенной параллельно предприятию и
имеющей протяженность с северо-запада на юго-восток около
3 км, как и само предприятие «Стройматериалы». Аналогичное
явление отмечается и вблизи цементного завода. По всей види-
мости, проявляются бактерицидные свойства гидроксида каль-
ция, ведь недаром применяемую для этих целей бордосскую
жидкость получаю т путем смешивания раствора медного купоро-
са CuSO4 • 511,0 с известковым молоком, т. е. раствором Са(ОН),.
Побелку деревьев также выполняют гашеной известью. Таким
образом, около предприятий стройиндустрии происходит как
бы «опрыскивание» деревьев раствором гидроксида кальция.
Исследования, проведенные в последующие годы (1997—
2001), показали нивелирование (выравнивание) кислотно-ос-
новных свойств осадков в различных зонах города. В районе
предприятий стройиндустрии осадки стали менее щелочными,
а в районе витаминного комбината — менее кислыми. Это видно
из следующих данных
237
Кислотно-основные свойства атмосферных осадков
в районе промышленных предприятий г. Белгорода
(средние значения pH осадков за 2000—2001 гт )
Предприятие АО «БелАЦИ» АО «Бел- цемент» АО ♦Строй- материалы* ♦Бслэнсрго- маш» АО«Белви та.мины»
pH осадков 7,84 8,58 7,76 7,38 6,02
Подобное изменение pH осадков можно объяснить более эф-
фективной работой пылсочистительных и газоочистительных
сооружений, а для некоторых предприятий, в частности для
АО «Белвитамины», — уменьшением объемов производства.
Таким образом, наряду с распространенными представления-
ми о глобальном характере кислотных дождей, их негативном
влиянии на природу в г. Белгороде установлено преобладание
щелочных осадков, обусловленных природными и антропоген-
ными факторами, выявлен характер их влияния на растения.
Возникновение щелочных осадков возможно и в других регио-
нах, где происходят выбросы шелочеобразующих веществ.
Вопросы и задания
I. Какая величина является количественной характеристикой кислотно-основных
свойств атмосферных осадков? 2. Можно ли считать кислотным дождь, pH которого
имеет значение а) 10,2; б) 6,3; в) 5,3? 3. Напишите уравнения реакций образования
серной и азотной кислот в атмосфере. 4. Покажите по карте Европы и Америки зоны
преимущественного выпадения кислотных дождей. Выбросами каких оксидов они
вызваны? 5 Кислотность каких осадков выше: дождя или тумана, и почему? 6. Какое
воздействие кислая вода оказывает на обитателей водных экосистем? 7. Каким обра-
зом химический состав подстилающих пород влияет на чувствительность водоемов
к кислотным дождям? 8. Какие почвы способны нейтрализовать кислотные осадки?
9. Каков механизм выщелачивания биогенов из почвы? 10. Каковы последствия мо-
билизации алюминия для растений? 11. Назовите, какие из указанных растений более
чувствительны к кислотным осадкам и почему; а) ель; б) сосна; в) береза? 12. Как из-
меняется видовой состав лесной растительности при действии кислотных осадков
в течение длительного времени? 13. Каков хи мизм воздействия кислотных осадков на
карбонатные строительные материалы? Напишите уравнения реакций. Приведите
примеры разрушения памятников культуры. 14. Приведите примеры опосредованно-
го воздействия кислотных осадков на человека. 15. Какие мероприятия можно пред-
ложить для защиты биосферы от кислотных осадков? 16. Что такое «обессеривание
топлива» и решает ли оно проблему кислотных дождей? 17. Напишите уравнения хи-
мических реакций, лежащих в основе процесса очистки отходящих газов с целью пре-
дупреждения образования кислотных осадков. 18. Какие химические производства
обусловливают щелочной характер осадков? Объясните локальный характер щелоч-
ных осадков в г. Белгороде. 19 Предложите нс менее двух методов сухой и мокрой
очистки отходящих газов от кислотообразующих оксидов. Какие из этих методов мо-
гут одновременно применяться для очистки от сернистого газа и от оксидов азота?
Сравните их по эффективности.
238
Задачи
1. Рассчи гайтс концентрацию ионов И' в пробах дождевой воды, взятых для иссле-
дования в 1996 г. в различных промышленных зонах города Белгорода: а) АО «Бслиита-
мины» — pH 5; б) АО «Стройматериалы» — pH 8 Во сколько раз концентрация ионов
водорода в первой пробе больше (или меньше), чем во второй? Какой раствор является
кислым? 2. Концентрация ионов Н* в пробе воды, полеченной при таянии снега, со-
бранного около крупной автомагистрали, составила КГ6 моль/л, а в другой пробе, со-
бранной около цементного завода, — 10-5 моль/л. Рассчитайте pH обеих проб снега и
сделайте вывод, можно ли их отнести к кислотным осадкам. 3. Рассчитай те, сколько
извести (кг) потребуется для нейтрализации 15 кг SO,, содержащегося в отходящих га-
зах. если очистку проводить известковым методом в скруббере. Предотвращает ли это
образование сернокислотных дождей?
2.6.3. Разрушение озонового слоя
История озоновой проблемы. Озоновый слой (озоносфера) рас-
полагается в стратосфере приполярных широт на высоте 10 км от
поверхности Земли и на высоте до 50 км вблизи экватора. Мак-
симальная концентрация озона О, (около 5 млн-1) отмечается на
высоте 20—25 км, где его содержание составляет ~5 молекул
О3 на 106 молекул воздуха. В слое озоносфсры озон находится
в очень разреженном состоянии. Если бы можно было собрать
весь озон, содержащийся в атмосфере, у поверхности Земли при
давлении 101,3 кПа и температуре 20 С, то толщина этого слоя
составила бы около 3 мм. Его называют озоновым щитом Земли,
так как он защищает все живое на Земле от жесткого ультрафио-
летового излучения Солнца.
Проблема разрушения или, точнее, истощения озонового слоя
возникла в начале 1970-х гг. Было высказано несколько гипотез,
согласно которым некоторые вещества — продукты деятельно-
сти человека — достигнув стратосферы, могут вызывать разло-
жение озона.
В 1970 г. немецкий ученый Пауль Кругцсн предположил, что
причиной разрушения озона является N2O — оксид диазота, ко-
торый в атмосфере превращается в NO — оксид азота(П). По-
следний непосредственно участвует в каталитической реакции
разрушения озона. В следующем 1971 г. химик из Калифорнийс-
кого университета в Беркли (США) Гарольд Джонстон высказал
мысль, что оксиды азота, содержащиеся в выбросах реактивных
двигателей сверхзвуковых самолетов, могут вызывать уменьше-
ние количества озона в стратосфере. В декабре 1973 г. химики из
Калифорнийского университет в Ирвине (США) Шервуд Роу-
ленд и Марио Молина высказали мнение, что хлорфторуглерод-
ные соединения (ХФУ) могут постепенно достигать стратосфе-
ры и разрушать озоновый щи г. В июне 1974 г. статья об их откры-
тии была опубликована в журнале «Nature» («Природа»),
239
В 1977 i. в рамках Программы ООН по окружающей среде
(ЮНЕП) проведена Первая международная конференция по
проблеме истощения озона.
С 1982 г. группой английских исследователей под руковод-
ством Джо Фармана из Кембриджа установлен факт уменьше-
ния содержания озона над Антарктидой В 1984 г. приборы их
наземных станций мониторинга (на антарктической станции
Халли-Бей) показали снижение содержания озона на 40% за пе-
риод около 30 дней (с сентября по октябрь).
В 1985 г. была опубликована историческая статья, объявив-
шая о появлении в Южном полушарии озоновой «дыры» Фото-
снимки, сделанные из космоса, показали наличие над Антарк-
тидой огромной «дыры», равной по площади территории США.
Под «дырой» не следует понимать то, что и данной области со-
всем нет озона. Отмечено лишь сильное утончение его слоя.
В том же 1985 г. участники международных переговоров в Ве-
не подписывают Венскую конвенцию об охране озонового слоя,
призывающую страшл к проведению дополнительных исследо-
ваний и обмену информацией по сокращению озонового слоя.
СССР присоединился к Венской конвенции в 1986 г.
В 1986 г. тринадцать американских ученых совершают На-
циональную озоновую экспедицию в Антарктиду, результаты
которой позволяют заключить, что потеря озона в этом районе,
вероятно, вызвана химическими веществами. Однако в то время
некоторые ученые объясняли уменьшение озона нс химически-
ми, а климатическими или динамическими процессами (движе-
нием масс воздуха).
В 1987 г. 150 американских ученых совершают вторую экспе-
дицию в Антарктиду, в результате которой сделан вывод о том,
что первопричиной сокращения озонового слоя являются хлор-
содержащие химические соединения. В октябре 1987 г. озоновая
«дыра» над Антарктидой стала больше, чем в 1985 г. Дефицит
озона уже составлял почти 50%.
Следующим шагом после Венской конференции стало под-
писание 16 сентября 1987 г. Монреальского протокола по ве-
ществам, разрушающим озоновый слой Это международное
соглашение усганавливаст графики поэтапного сокращения
производства и использования озоноразрушающих веществ
(ОРВ). Страны-участницы согласились заморозить производ-
ство и потребление ХФУ к 1990 г. на уровне 1986 г., провести
20%-ос сокращение к 1 января 1994 г. и следующее 30%-ое —
к 1 января 1999 г. В 1987 г. Монреальский протокол (МП) под-
писали 36 стран, к июню 1995 г. — почти 150 стран, а на юби-
лейной встрече в Монреале в сентябре 1997 г. таких стран было
уже 163. СССР подписал Монреальский протокол в 1988 г.
240
День принятия Монреальского протокола — 16сентября — по
инициативе ЮНЕП с 1995 г. объявлен ООН Международным
днем защиты озонового слоя.
После открытия озоновой «дыры» над Антарктидой (1985 г.)
исследования по содержанию озона продолжались. Они прово-
дились нс только в Южном, по и в Северном полушарии. В 1988 г.
появилось сообщение, что нал Северным полушарием за период
1968—1986 гг обнаружены потери от 1,7 до 3% озонового слоя.
Установлено наличие озоновой «дыры» и над Арктикой, однако
меньшей по размерам, чем над Антарктидой.
В 1989—1992 гг. проведено несколько международных экспе-
диций по исследованию озоновою слоя над Арктикой, в кото-
рых активное участие принимали ученые нашей страны. Выяв-
ленные озоновые «мини-дыры» особенно часто появлялись нал
европейским сектором Арктики и севером Европы и Атланти-
ческого оксана. Однако в отличие от Антарктиды эти «мини-
дыры» были менее интенсивными, меньше по плошали и сме-
щались на значительные расстояния за нсдолгое время своего
существования. Это объясняется тем, что зимний полярный
вихрь слабо устойчив и в отличие от антарктического обменива-
ется массами воздуха со стратосферой соседних широт, откуда
приходит более теплый и богатый озоном воздух. Однако аркти-
ческие «мини-дыры» мс гут вызывать более серьезные послед-
ствия в густонаселенной Северной Европе, чем более сильная
озоновая дыра в пустынной Антарктиде.
Встречи сторон Монреальского протокола на правитель-
ственном уровне происходят ежегодно. На таких встречах при-
нимаются новые поправки к МП, все более ограничивающие
производство и использование озоноразрушаюших веществ.
Так, в июне 1990 г. в Лондоне представителями 92 государств
(в том числе и нашей страны) подписано дополнение к МП,
предусматривающее полное прекращение производства ХФУ
к 2000 г. Этот документ называют Лондонским протоколом.
В 1997 г. на очередной встрече в Монреале была достигнута дого-
воренность о необходимости лицензирования экспортно-им-
портных операций с озоноразрушаюшими веществами (ОРВ).
Озоновая проблема обсуждалась и на Конференции ООН по
окружающей среде и развитию, состоявшейся в июне 1992 г.
в Рио-де-Жанейро (Бразилия) с участием глав государств и пред-
ставителей из 179 стран мира. В документах конференции отме-
чено. что «озоновый слой в стратосфере планеты продолжает
уменьшаться из-за выбросов в атмосферу хлорфторуглеродов и
других веществ, содержащих химически активные соединения
хлора и брома... Необходимо разработать безопасные замените-
ли этих химических веществ и проследить за тем, чтобы они
были доступны как развитым, гак и развивающимся странам».
241
Ежегодно наша планета Земля теряет около 0,5% озонового
слоя. За последние 10—15 лет его содержание уменьшилось при-
мерно на 7%, и отмечается нарастающая интенсивность этого
процесса. Наибольшие потери стратосферного озона раньше
приходились на каждую антарктическую весну (октябрь), но
сейчас и в северных широтах исчезает около 10% озона зимой и
весной и около 5% летом и осенью В первой половине 1997 г.
возникла громадная по своим масштабам озоновая «дыра» пло-
щадью ~30 млн км2 над всей Арктикой, включая север Европы,
Канады, Гренландию, Балтийское море, северные области Си-
бири вплоть до Урала и Байкала. Среднемесячное уменьшение
озона весной достигало здесь 30—40% Над Южным полушари-
ем за 5 лет (1993—1998) «дыра» увеличилась в два раза, достигнув
площади 22 млн км2. Полученные данные полностью подтверж-
дают теорию химического разрушения озонового слоя.
В 1996 г. ученые Шервуд Роуленд, Марио Молина из Кали-
форнийского университета в США и Пауль Крутцсн из Инс-
титута химии им Макса Планка в Германии были удостоены
Нобелевской премии за установление причин снижения кон-
центрации стратосферного озона. Они смогли доказать, что ос-
новными разрушителями озона являются атомы хлора или бро-
ма, отделившиеся от молекул галогенированных углеводородов
под действием солнечной радиации.
Методы измерения содержания озона. Каким же образом уче-
ные определяют содержание озона в стратосфере?
Систематические измерения содержания озона в атмосфере
начались в Англии и Швейцарии в 1926 г. Позднее начала фор-
мироваться мировая озонометрическая сеть, а в 1960-е гг она
появилась и в нашей стране. К концу 1990-х гг. в мире уже на-
считывалось около 120 озонометрических станций, из них около
40 — на территории России.
В первые годы измерение озона осуществляли преимущест-
венно с помощью наземных спектрофотометров Добсона. Этот
старейший разработанный Дж. М. Б. Добсоном инструмент стал
использоваться с 1931 г. метеорологами для слежения за движе-
нием воздушных масс и измерении содержания озона Принцип
данного метода состоит в определении доли ультрафиолетового
излучения Солнца, достигающего поверхности Земли. Посколь-
ку Оз поглощает ультрафиолетовые лучи, уменьшение его коли-
чества соответствует усилению ультрафиолетового облучения
земной поверхности. Точность этого прибора при благоприят-
ных метеоусловиях составляет 1—3%. Этим методом, например,
пользовались английские исследователи под руководством Джо
Фармана в 1980-е it. на британской антарктической станции
Халли-Бей. В России широко используются фильтровые озоно-
метры.
242
Вертикальное распределение концентрации озона исследуют
с помощью озонозондов, поднимаемых на аэростатах до высоты
20—35 км
Глобальное распределение озона изучают также с помощью
приборов, установленных на искусственных спутниках Земли,
например на американских серии «Нимбус» или российских се-
рии «Метеор». Так, группа исследователей Дональда Хита из
Годдардовского центра космических полетов НАСА использо-
вала спутник «Нимбус-7». Цветные слайды, полученные ими
с помощью компьютеров в 1979-1983 гг., показали наличие над
Антарктидой озоновой «дыры», о которой заявила английская
группа Джо Фармана только в 1985 г.
В России проводятся систематические наблюдения за общим
содержанием озона (ОСО) сетью наземных озонометрических
станций, атакже путем измерений прибором ТОМС со спутника
«Метеор-3».
В последнее десятилетие ушедшего века измерения содержа-
ния озона проводились с помощью российских стратосферных
самолетов, ранее используемых в военных целях. В их числе
М-17, созданный под руководством генерального конструктора
В. М. Мясищева, и его модификация М-55, разработанная
Экспериментальным машиностроительным заводом (ЭМЗ) им.
В М. Мясищева Эти летательные аппараты представляют собой
выдающиеся образцы мировой авиационной техники. Уже
в 1990 г. самолетом М-17 «Экологический интернационал» про-
ведены первые исследования состояния атмосферы с целью
определения содержания в ней озона. Эта работа проводилась
в рамках проекта «Глобальный резерв озона», организаторами
которою были объединение «Ноосфера», ЭМЗ им. В. М. Мяси-
щева и Московская патриархия Самолет М-55 также получил
новое назначение и название «Геофизика». В переоборудовании
самолета принимали участие ученые Центральной аэрологиче-
ской обсерватории Росгидромета и Института космических ис-
следований Российской академии наук (РАН) В 1994 г. комис-
сия по научно-техническому сотрудничеству между Российской
Федерацией и Итальянской Республикой одобрила междуна-
родный проект создания на базе советского высотного самолета-
разведчика М-55 летающей лаборатории для проведения всесто-
роннего мониторинга атмосферы Земли, в частности страто-
сферного озона. В декабре 1996 г. — январе 1997 г. состоялась
первая международная научная экспедиция по изучению озоно-
вого слоя в Арктике с помощью самолета-лаборатории М-55
«Геофизика». Создание подобной летающей лаборатории — это
вклад России в выполнение сс обязательств по Венской конвен-
ции и Монреальскому протоколу.
Мониторинг озона как в верхних слоях атмосферы, так и
в приземном слое в нашей стране осуществляет Росгидромет и
243
в первую очередь его ведущие институты — Центральная аэроло-
гическая обсерватория (ЦАО), Главная геофизическая обсервато-
рия и Институт прикладной геофизикии им. академика Е К Фе-
дорова.
Проблемой озонового слоя занимаются также многие науч-
но-исследовательские институты РАН, например Институт кос-
мических исследований, Физический институт, Институт хими-
ческой физики, Институт физики Земли.
Состояние озонового слоя в мире и над Россией. Исследования,
проведенные в Антарктике с помощью американских спутников
«Нимбус-7» и российских «Метсор-3», показали уменьшение
общего содержания озона в районе 60—90° ю. ш. за 20 лет (1979—
1999). На рис. 2.21 приводится содержание озона О3 (в единицах
Добсона, ДЕ), 1 ДЕ = 0,01 мм толщины слоя, который получает-
ся, если сжать весь озон, содержащийся в атмосфере, до давле-
ния 101,3 КПа (760 мм рт. ст.) при температуре 0 С. Тогда обра-
зующийся слой озона в 3 мм (нормальное значение) будет соот-
ветствовать 300 ДЕ. Все данные получены за период с середины
сентября по начало октября. Изданных следует, что минималь-
ное количество озона, почти такое же, как в 1995 г., наблюдалось
в 1999 г.
На рис. 2.22 показано истощение озонового слоя за период
1988—1997 гг. Приводятся данные о глобальном тренде, полу-
244
Рис. 2.22. Истощение озонового слоя за период с 1988 по 1997 г.
ченном усреднением значений за семь месяцев каждого года —
с апреля по октябрь. Установлены колебания в содержании озо-
на, усредненный тренд составляет около 13%. Пунктирная ли-
ния показывает общую тенденцию истощения озона.
Мониторинг содержания озона, проводимый в нашей стране,
позволяет дать следующую характерист ику озонового слоя над
территорией России в последнее десятилетие XX в.
Если в 1970—1980 гг. снижение общего содсржашы страто-
сферного озона (ОСО) над Россией происходило эпизодически,
то в 1990-х it. озоновые «дыры» над обширными регионами Рос-
сии зимой стали носить устойчивый характер.
С декабря 1992 г. по апрель 1993 г. над территорией СНГ зна-
чения ОСО были ниже климатических норм на 5—20%. Наи-
большие среднемесячные отклонения в декабре составляли 10—
12% севернее 50° с. ш. Понижение ОСО достигало 20% над Вос-
точной Сибирью в январе и над севером европейской части
в феврале 199 г. В марте — апреле этого же года наиболее низ-
кие значения ОСО отмечены на северных широтах (от 60° и
выше). В период с мая по сентябрь над территорией СНГ значе-
ния ОСО были ниже нормы на 5—15%. В октябре — ноябре ОСО
было близко к норме. В декабре 1993 г. над всей территорией
России ОСО было пониженным. Таким образом, в период с де-
кабря 1992 г. по сентябрь 1993 г. для средних и высоких широт
территории СНГ, как и для всего Северного полушария, были
характерны пониженные значения ОСО
Зимой 1993—1994 гг. нс было тюль обширных и сильных от-
рицательных отклонений ОСО, как зимой 1992—1993 гг., однако
в зимне-весенний сезон 1994—1995 гг. опять отмечены значи-
тельные отрицательные отклонения в содержании озона.
245
До середины 1990-х г. общее содержание озона над Сканди-
навией и северо-западом России в январе было обычно ниже,
чем над северо-востоком Сибири и Камчаткой, па 20—25%. Од-
нако в последние годы снижение ОСО стало наблюдаться и над
другими областями России. Так, в январе 1995 г. отмечено сни-
жение ОСО над Западно-Сибирской равниной и Среднесибир-
ским плоскогорьем на 15—20%, в то время как над северо-запа-
дом России ОСО было ниже нормы только на 10—15%.
В 1996 г. (в период с января по апрель) над большей частью
контролируемой территории России наблюдались пониженные
среднемесячные значения ОСО. С мая по июль незначительные
понижения отмечались только в отдельных районах. В августе
значения ОСО приблизились к климатическим нормам, а в сен-
тябре в отдельных регионах оказались несколько выше средних
многолетних значений. К декабрю 1996 г. значения ОСО снова
понизились. В целом за 1996 г. ОСО было несколько ниже нор-
мы над европейской территорией России и Уралом, устойчиво
ниже нормы — над Западной и Восточной Сибирью, а также над
Дальним Востоком. Над Якутией озоновый слой был минима-
лен, и жители республики подвергались сильному ультрафиоле-
товому облучению.
Весной 1996 г. было зарегистрировано уменьшение озонового
слоя до 30% над Республикой Коми, Архангельской и Киров-
ской областями РФ, что, по мнению некоторых специалистов,
связано с воздействием выбросов при запусках искусственных
спутников Земли с космодрома Плесецк, находящегося в Архан-
гельской области.
С января по май 1997 г. значения ОСО были ниже нормы на
5—30% преимущественно над Сибирью и Дальним Востоком,
в особенности над их северными районами. С июня по ноябрь
среднемесячные значения ОСО над всей контролируемой тер-
риторией были близки к норме. В декабре значения ОСО также
были близки к норме, исключая северо-западную часть европей-
ской территории России (ЕТР) и Балтии, где дефицит озона пре-
вышал 20%.
Следует отмстить, ч го уже не первый год выделяется весна
с аномально низкими значениями ОСО в марте и апреле над
Восточной Сибирью. Аномалия 1997 г. была самой значитель-
ной как по длительности, так и по размерам затрагиваемой тер-
ритории и дефициту озона (—30%) за все время наблюдений. Эта
аномалия над восточной территорией страны явилась отражени-
ем необычно низкого содержания озона в циркумполярном вих-
ре весной 1997 г., когда в Арктике наблюдалось близкое подобие
озоновой «дыры» в Антарктике. «Дыра» над Арктикой и значи-
тельной частью Восточной Сибири имела диаметр ~3 тыс. км.
Таким образом, наиболее неблагоприятными с точки зрения по-
246
вышениядоз УФ-Б (биологически опасной) радиации в 1997 г.
были Восточная Сибирь и северо-запад ЕТР.
В 1998 г в отличие от ряда предыдущих лет общее содержание
озона над территорией Российской Федерации характеризова-
лось значениями, близкими к средним многолетним. Только в от-
дельные периоды наблюдался некоторый дефицит озона (5—25%),
преимущественно над Якутском, Архангельском, Владивосто-
ком, Сибирью, Дальним Востоком, Северным Уралом, ЕТР.
В другие месяцы наблюдались повышенные значения ОСО над
этими же районами. В ноябре ОСО практически над всей терри-
торией России было выше средних многолетних. В целом за 1998 г.
ОСО над Россией было близко к «нормам» 70-х гг. и даже не-
сколько их превышало. Неблагоприятных по ОСО зон на тер-
ритории нашей страны нс было.
Наблюдаемое поведение озона над терри торией России зи-
мой — весной 1997—1998 гг. можно объяснить естественными и
антропоген пыми факторами. Среди естественных прич и н мож-
но назвать влияние изменений солнечной и вулканической ак-
тивности, динамики атмосферы, флуктуаций температуры. Дол-
говременные изменения содержания озона связаны с солнечной
активностью, которая имеет 11-летний цикл. Например, макси-
мум солнечной активности отмечен в 1979 г. Кроме того, наблю-
даются изменения содержания озона с более коротким перио-
дом — 26 месяцев. К антропогенным факторам относятся
выбросы парниковых газов и озоноразрушающих веществ, со-
держащих хлор. Это приводит к потеплению тропосферы и по-
холоданию стратосферы. Рост антропогенного хлора в страто-
сфере вызывает понижение уровня глобального ОСО. Другое
антропогенное воздействие — повышение содержания парнико-
вых газов — с одной стороны, должно приводить к некоторому
уменьшению скорости разрушения озона при понижении тем-
пературы стратосферы; с другой стороны, при этом может уве-
личиться скорость разрушения озона в результате активации
хлора в гетерогенных реакциях на сульфатном аэрозоле и поляр-
ных стратосферных облаках. Совокупность всех этих факторов
в конечном итоге влияет на содержание озона.
В 1999 г., как и в 1998 г., средние значения общего содер-
жания озона над всей территорией России оказались близки
к средним многолетним.
В целом с 1979 г. наблюдается понижение глобального среднего-
дового ОСО со скоростью примерно 2,5% за десятилетие.
Механизм образования и разрушения озона. Изучив историю
озоновой проблемы и географию озоновых «дыр», перейдем
к рассмотрению физико-химических аспектов этой проблемы.
Еще раз убедимся, что экология — интегративная наука. Выяс-
ним, какие химические реакции лежат в основе образования и
разрушения озона в стратосфере
247
Прежде всего проведем грань между тропосферным и стра-
тосферным озоном. Они отличаются как по механизму образо-
вания, так и по биологической роли. Тропосферный, или при-
земный, озон является вредным. Он относится к группе парни-
ковых газов, участвует в образовании фотохимического смога,
т. е является загрязнителем гропосферы. Отрицательное воздей-
ствие тропосферного озона (сильнейшего окислителя) на челове-
ка и другие живые организмы подробно рассмотрено в разд. 2.5.3
«Оксиды азота. Фотохимический туман». Стратосферный же
озон является полезным для жизни, его присутствие необходимо
для защиты живых организмов от солнечной радиации. В этом
разделе рассмотрим образование озона в стратосфере, а также
при тины и механизмы его разрушения.
К настоящему времени установлено, что практически един-
ственным источником озона в стратосфере является кислород.
Учеными предложен один механизм образования озона и не-
сколько механизмов его разрушения (И К Ларин, Институт
энергетических проблем химической физики РАН, 2000 г.). Рас-
смотрим их.
Механизм I образования и гибели атмосферного озона в естест-
венных условиях предложил в 1930 г. английский геофизик Сид-
ни Чепмен Эта схема, названная механизмом Чепмена, приве-
дена на рис. 2.23.
Согласно Чепмену, образование озона начинается с фотохи-
мического разложения молекулярного кислорода на два свобод-
ных атома кислорода под действием коротковолнового УФ-из-
лучения (см. / и 2 на рис. 2.23):
О, -^->0 + 0, (2.95)
где Av — квант света. За этим следует присоединение образую-
щихся атомов к молекулам кислорода и образование двух моле-
кул озона {3 и 4 на рис 2.23):
О + О, » О,; О + О, —► О-. (2.96)
Таким образом, результирующий процесс можно представить
в виде уравнения
30,—►го,. (2.97)
Было установлено, что фотодиссоциация О2 на атомы проис-
ходит под действием У'Ф-излучения с длиной волны А. < 242 нм,
причем этот процесс развивается на высоте более 30 км, посколь-
ку ниже коротковолновое солнечное излучение не проникает
На рис. 2.23 показан также механизм гибели атмосферного
озона по Чепмену. Молекула образовавшегося озона под дей-
ствием УФ-излучения Солнца распадается на атом и молекулу
кислорода (5 и 6 на рис. 2.23):
248
Образование атмосферного ою на
Рис. 2.23. Механизм образования (1—4)
и гибели (5— 8) атмосферного озона (механизм I) (С. Чепмен, 1930 г.)
О,+ /п'—>0 + О2; Х<310нм. (2.98)
Появившийся свободный атом кислорода взаимодействует с
молекулой озона с образованием двух молекул кислорода
(7и £на рис. 2.23):
О + О, —♦ О2 + О,. (2.99)
В итоге возникшие когда-то из молекулы кислорода атомы
вновь соединяются в молекулу.
Результирующий процесс разрушения озона можно описать
с помощью уравнения
20,—>30, (2.100)
249
Сумма реакций образования и разложения озона приводит
к нулевому циклу В отсутствие антропогенных загрязнителей
система кислород — озон находится в равновесии, которому со-
ответствуют определенные концентрации этих газов. Погло-
щенный солнечный свет переходит в теплоту, что и объясняет
повышение температуры в стратосфере.
Механизм II гибели атмосферного озона заключается в разви-
тии следующих реакций:
Oj + O3—»-2О+2О2; (2.101)
О + О—► О2. (2.102)
В последнем случае реагируют нс молекулы озона, а атомы кис-
лорода.
Механизм III гибели атмосферного озона сводится к следую-
щему. Атомы кислорода и молекулы озона образуют в атмосфере
жестко связанную систему частиц, называемую нечетным кисло-
родом, в которой атомы О и молекулы О, формально неразличи-
мы. Действительно, как это показано на рис. 2.24, до момента
гибели озона, который на высоте 30 км живет 0,6 года, происхо-
дят быстрые взаимные превращения между О3 и О, в которых
частицы нечетного кислорода Ох = О3 + О сохраняются.
На рис. 2.24 показано, что время жизни молекулярного кис-
лорода О2 составляет 600 лет. Образующийся из него под дей-
ствием солнечного света атомарный кислород О практически
мгновенно (за доли секунды) соединяется с О, с образованием
молекулы озона О3. Разложение О3 на атом и молекулу кислоро-
да под действием УФ-излучсния обозначено на рисунке проти-
воположно направленной стрелкой.
Времена процессов относятся к высоте 30 км
О, н О образуют н атмосфере систему частиц нечеток,
кислорода: Ох = О, + О
Рис. 2 24 Механизм III табели атмосферного озона
250
Механизм IV гибели атмосферного озона описывается сле-
дующей (см. реакцию (2.99)) основной реакцией гибели частиц ОЛ:
О, + О—»2Ог.
Действие всех других антропогенных и естествен пых соеди-
нений вызывает ускорение этой реакции.
Механизм V гибели атмосферного озона описывает процесс
ускорения реакции типа (2.99).
Ускорение связано с появлением более быстрых параллельных
путей основной реакции гибели нечетного кислорода:
(X + О —> 2О2
+ X ► ХО + О, где X « ОН, NO, С1, Вг и др. (2.103)
Процессы с участием частиц X протекаю! по цепному механиз-
му. В результате один атом хлора, появившийся в стратосфере,
может уничтожить сотни тысяч молекул озона.
Механизм VI гибели атмосферного озона отражает стадии раз-
вития этого процесса по цепному механизму.
1. Образование химически активных частиц X, ведущих цепь
(ОН, NO, С1, Вт).
2. Стадии продолжения цепи:
Х + О,—»ХО + О,; а)
ХО + О—»Х + Ог. б)
Результирующая реакция: О, + 0—>2О2. (2.104)
Активными частицами X, вызывающими цепную реакцию
разрушения озона, являются гидроксильные радикалы ОН ’, мо-
лекулы оксида азота(П) NO, атомы хлора и брома. Они вступают
в химическое взаимодействие с О}. образуя высокорсакшюн-
носпособное промежуточное соединение ХО, которое вступает
во взаимодействие с атомом кислорода. При этом образуется
конечный продукт реакции — молекулярный кислород О2. Из
приведенных реакций видно, что активные частицы ускоряют
процесс, а сами к концу' его остаются химически неизменными,
следовательно, они являются катализаторами процесса разру-
шения озона.
3 Может произойти гибель химически активных частиц X,
переход их в неактивное состояние, в другие соединения Это
будет обрыв цепи. Отношение скорости продолжения цепи
к скорости гибели частиц X определяет число разрушенных мо-
лекул озона.
Озоноразрушающие вещества. К числу основных озоноразру-
шающих веществ (ОРВ) относятся:
• хлорфторуглероды (ХФУ, международное обозначение
CFC — chlorofluorocarbon), такие как фтортрихлормстан CFC13
251
(ХФУ-11, или CFC-11), дифтордихлорметан CF2C12 (ХФУ-12,
или CFC-12) и др.;
• фторхлорбромуглероды, иначе называемые галонами, та-
кие как дифторхлорброммстап CF2ClBr (галон-1211) и трифтор-
бромметан CF,Br (галон-1301);
• гидрохлорфторуглсроды (ГХФУ, международное обозна-
чение — HCFC), в них нс все атомы водорода замешены галоге-
нами (например, дифторхлорметан CHC1FJ;
• метит бромид СН3Вг, мстилхлороформ СН3СС13 (МХФ) и
четыреххлористый углерод СО, (ЧХУ).
Из перечисленных веществ главными виновниками разрушения
озона являются ХФУ и галоны. Дадим краткую характеристику
этим веществам, назовем области их применения. Хлорфторуг-
лсроды (ХФУ) имеют и другие названия: хлорфтормстапы, хла-
доны, фреоны. Они относительно химически инертны (нсрсак-
ционноспособны), негорючи, малотоксичны, просты в произ-
водстве и хранении, очень летучи, практически нерастворимы
в воде и хорошо растворимы в органических растворителях. Бо-
лее того, являясь газами при комнатной температур : они сжи-
жаются при небольшом давлении с выделением тепла, а испаря-
ясь, вновь его поглощают и охлаждаются. Благодаря этим свой-
ствам ХФУ широко используются в технике.
• Первоначально ХФУ стали использовать как хладагенты
в холодильниках и кондиционерах воздуха. Поскольку эти изде-
лия ломаются и в конце срока эксплуатации выбрасываются, со-
держащиеся в них ХФУ попадают в атмосферу.
• Другая область применения — ХФУ как пропелленты (рас-
пылители) в аэрозольных упаковках различного назначения.
• Следующая важнейшая область их применения — произ-
водство пористых пластмасс (пенопластов). ХФУ растворяют
в жидких пластмассах при повышенном давлении (они хорошо
растворимы в органических веществах). Когда давление пони-
жают, они вспенивают пластмассу, так как растворимость их
уменьшается, и при этом улетучиваются в атмосферу.
Галоны уже в середине 1940-х гг. стали применяться как эф-
фективные средства пожаротушения. Галон-1301 и сейчас ши-
роко используется пожарными службами многих стран.
В России к концу XX столетия сложилась следующая структу-
ра использования озоноразрушаюших веществ (ОРВ) по секто-
рам потребления, связанным с промышленным производством
(рис. 2.25): 7 — аэрозольные упаковки — 46%; 2— холодильная
техника (бытового, торгового и промышленного назначения) и
кондиционеры — 27%; 3 — средства пожаротушения — 14%; 4—
пенопласты — 11%; 5 — растворители — 2%.
В свое время разработка ХФУ определяла новую ступень аме-
риканской промышленности. Хлорфторуглеродные соединения
252
501
Рис. 2.25. Диаграмма распределения озоноразрушающих веществ
по секторам потребления в России
открыл в 1928 г химик корпорации «Дюпон» Томас Мидгли. Он
знал, что компания «Дженерал-Моторс» работает над усовер-
шенствованием холодильных агрегатов. В то время в качестве
хладагентов использовали аммиак NH, или сернистый газ SO2,
которые имели серьезные недостатки' например, аммиак огне-
опасен, а сернистый газ токсичен. Токсичным можно считать и
хлористый метил СН3С1, использовавшийся до фреонов в ка-
честве хладагента. Новый хладагент должен был быть нетоксич-
ным, неогнеопасным и устойчивым. Томас Мидгли нашел такие
соединения, он назвал их фторуглеродами, так как они содержа-
ли углерод и один или несколько атомов галогенов (фтор, хлор,
бром, йод). Позднее их стали называть хлорфторуглеродами
(ХФУ), поскольку в состав химикатов, используемых в аэро-
зольных упаковках, вошли главным образом хлор и фтор.
Чтобы продемонстрировать неогнеопасносгьи нетоксичность
этого нового класса химических соединений, Т. Мидгли даже
вдыхал их и выдыхал на свечу Только в 1970-х гг. было установле-
но, что вдыхание ХФУ даст наркотический эффект. Использование
аэрозольных баллончиков с пропеллентами из ХФУ представляет
опасность для здоровья людей В больших концентрациях ХФУ
могут вызывать остановку сердца, а в мал ых дозах — нарушен ие его
ритма. Вдыхание содержи мою аэрозольных баллончиков оказыва-
ет отрицательное воздействие на ле! кие. Хлорфторуглеродные
соединения, предложенные Т Мидгли, получили торговое на-
звание «фреоны» (от лат. frigor — холод), и оно стало торговой
маркой корпорации «Дюпон».
Во время Второй мировой войны в качестве пропеллента ин-
сектицидов использовали оксид углерода(ГУ) СО,. Так называе-
мые «противоклопиныс бомбы» (банки) открыли практику ис-
пользования химикатов в аэрозольных баллончиках. В 1947 г. на
рынке аэрозолей главным товаром были инсектициды. Позднее
253
аэрозольные баллончики стали использоваться и для других ви-
дов продукции.
В 1950-х гг. в качестве пропеллентов стали широко приме-
няться фреон-И и фреон-12, которые, как йотом выяснилось,
оказались и наиболее опасными для озона. Эти фреоны позво-
ляли производить тонкое распыление, они были устойчивы и не
вступали в реакции с содержимым баллончика.
В 1974 г. пропелленты из ХФУ использовали в 300 видах аэро-
зольных упаковок, применявшихся для косметических товаров,
парфюмерии, дезодорантов, средств для мытья окон, освежите-
лей воздуха, инсектицидов, смазок, средств для очистки от смаз-
ки, упаковки для продуктов, различных средств по уходу за авто-
мобилем, ветеринарных препаратов. Ежегодное производство
ХФУ во всем мире к 1974 г. составило почти I млн т.
Примером «легкомысленного» использования ХФУ амери-
канцы считали изготовление упаковок из пенопластов для хра-
нения горячих гамбургеров компании «Макдоналдс». Начиная
с 1976 г. эти упаковки из пенопласта стали вытеснять картонные,
при этом также руководствовались экологическими соображе-
ниями, считая, что пенопласт меньше воздействует на окружаю-
щую среду, чем картон — в смысле потребления природного сы-
рья, воды и энергии на сю производство. Тогда еще вопрос раз-
рушения озона нс стоял так остро, но уже в 1987 г. «биг-мак» стал
своего рола символом загрязнения среды хлорфторуглеродами.
Хотя использование ХФУ в производстве упаковок продоволь-
ствия составляло менее 1% общего его потребления в США, про-
водимая кампания против использования ХФУ в продуктовых
упаковках способствовала повышению общественного сознания
в отношении угрозы озоновому слою.
Каким же образом эти вещества распространяются в атмо-
сфере и разрушают озоновый слой?
Высокая химическая устойчивость фреонов и плохая раство-
римость их в воде (они не вымываются дождем) позволяют этим
веществам высоко подниматься в атмосфере. Оказавшись вбли-
зи поверхности Земли, фреоны беспрепятственно проходят тро-
посферу, т. с. первые 10—15 км воздушного пространства, и ока-
зываются в стратосфере, где сосредоточено 90% атмосферного
озона Путь в стратосферу непрямой, поскольку фреоны, как и
все другие соединения, могут попасть в с гратосферу с поверхно-
сти Земли только с тропическими конвективными потоками. До
тропиков вещества переносятся приблизительно месяц. Движе-
ние вверх по тропосфере до высоты 10—15 км за счет конвекции
занимает несколько суток, иногда несколько часов. Но чтобы
оказаться на высоте 35 км, веществам требуется 15 лет. Отсюда
следует, что влияние на озоновый слой могут оказать только та-
кие вещества, время жизни которых в атмосфере превышает не-
254
сколько десятков лет. Именно такими веществами являются
фреоны. Время их жизни составляет 50 и более лет. По оценкам
Роуленда и Молины, хлорфторуглеродам нужно от 50 до 100 лет,
чтобы накопиться в стратосфере.
На рис 2.26 представлено изменение концентрации О, с вы-
сотой п О количестве озона судим по его давлению (см. на оси
абсцисс — Р, мПа), пик содержания озона соответствует высоте
20—25 км. Здесь же приведена схема разрушения озона фреона-
ми. Из аэрозольного баллончика фтортрихлорметан CFC1}
(CFC-11) поднимается в стратосферу. На высоте более 30 км
фреон разрушается солнечным УФ-излученисм с образованием
атомов хлора, которые посредством ценных реакции разрушают
стратосферный озон.
Рис. 2.26. Изменение по высоте концентрации озона
(выражено через его парциальное давление):
7 — фреоны высвобождаются человеком; 2 — фреоны разрушаются только
в стратосфере; 3 — атом хлора разрушает озон; 4 — более тонкий озоновый
слой пропускает больше УФ-излучсния; 5 — увеличенное количество УФ
опасно для живых организмов
Более детально механизм разрушения озона под действием
фреонов показан на рис. 2.27.
255
Рис. 2.27. Механизм гибели озона в результате действия фреонов:
1 — УФ-излучение «ударяет» в молекулу СС131‘; 2— в результате происходит от-
рыв атома хлора; 3— атом хлора сталкивается с молекулой озона; 4 — при стол-
кновении образуется монооксид хлора и высвобождается молекула кислорода;
5— свободный атом кислорода может сталкиваться с moiюоксидом хлора; 6—
при столкновении два атома кислорода образуют молекулу кислорода, а атом
хлора высвобождается, т. е. может дальше разрушать озон
Отрыв атома хлора от молекул ХФУ (CCI3F и CCI2F2) под дей-
ствием УФ-излучения можно показать в виде следующих урав-
нений:
CCl.F^ CCIjF- + СГ, (2.105)
CC12F2^UcCIF, + СГ. (2.106)
При этом образуются реакционноспособные радикалы. На CCIjF
активно действует излучение с длиной волны меньше 230 нм,
а на CCljFj — с длиной волны меньше 220 нм.
Итак, еще раз остановимся па экологических последствиях
разрушения озонового слоя, который защищает все живое на Зем-
ле от жесткого ультрафиолетового излучения Солнца. Защитная
256
роль озонового слоя объясняется тем, что озон поглощает ко-
ротковолновое солнечное УФ-излучение совершенно в том же
диапазоне длин волн, что и молекулы живых клеток. В результа-
те биологически опасное УФ-излучение поглощается в атмо-
сфере, не достигая поверхности Земли
Солнечное излучение с длиной волны меньше 200 нм хорошо
поглощается молекулами кислорода, поэтому такое излучение
не распространяется даже до нижних слоев стратосферы. Излу-
чение с длиной волны от 200 до 320 нм поглощается озоном,
а больше 320 нм — уже доходит до поверхности Земли.
В ходе эволюции Земли живые существа смогли выйти из мо-
рей (также поглощающих УФ-излучение) на сушу только тогда,
когда над Землей возникла первая озоновая оболочка. Расти-
тельность на суше появилась лишь чуть более 400 млн лет тому
назад, когда содержание кислорода составило примерно 0,5,
а озона — 0,7 современного уровня, что оказалось достаточным,
чтобы защитить живые клетки от коротковолнового солнечного
излучения. До этого момента жизнь развивалась исключительно
в водной среде, которая и обеспечивала соответствующую защиту
вместо озонового слоя. Таким образом, стратосферный озоно-
вый слой следует рассматривать как необходимое условие суще-
ствования на суше всего живого.
В 1970-х гг. было установлено, что озоновый слой истощает-
ся, следовательно, он перестает в полной мере выполнять свою
защитную функцию Уменьшение содержания озона позволяет
большему количеству УФ-лучей достигать поверхности Земли,
что является вредным для живых организмов. Рассмотрим воз-
можные экологические последствия разрушения озонового слоя.
Потеря озона в стратосфере с одновременным увеличением
его в тропосфере может привести к изменению климата. Разру-
шение озона вызывает снижение температуры в стратосфере и
разогревание тропосфе ы, так как все большее количество УФ-лу-
чей проникает в нее. Вспомним также, что О, относится к пар-
никовым газам и его образование в тропосфере происходит при
загрязнении ее оксидами азота и углеводородами (см. разд.
2.5.3), что ведет к повышению температуры. Кроме того, хлор-
фторуглсроды, являясь парниковыми газами, также поглощают
ИК-излучение и тем самым участвуют в создании парникового
эффекта (см. разд. 2.6.1). Таким образом, перераспределение
озона между тропосферой и стратосферой будет сопровождаться
климатическими изменениями.
Усиление УФ-облучсния оказывает вредное воздействие на
здоровье человека. Имеется много данных о связи солнечного
света и рака кожи. Известно, что даже при небольшом повыше-
нии дозы УФ-облучепия у человека появляются ожоги на коже.
Солнечная радиация способствует также старению кожи. Усилс-
257
ние УФ-облучения вызывает увеличение заболеваемости раком
кожи. За последнее десятилетие XX в. частота таких заболеваний
у жителей США и Европы возросла в несколько раз. Это связано
нс только с увеличением доли УФ-облучения, но и с изменением
образа жизни людей, которые стали больше времени проводить
на солнце.
Частота образования двух наиболее часю встречающихся форм
рака кожи, а именно базальноклеточной и плоскоклеточной
карциномы, особенно тесно связана с действием УФ-Б (т е. дей-
ствием световых волн с длиной волны 290—320 нм). Люди со
светлой кожей гораздо больше предрасположены к заболеванию
этими формами, так как пигменты в темной коже способствуют
задержке УФ-лучей. Однако у жителей тропических стран, боль-
шинство из которых имеет темную кожу, рак встречается чаще.
Это, видимо, объясняется тем, что они подвергаются более силь-
ному и более длительному УФ-облучению. Заболевания этими
формами рака на юге встречаются в 2,5 раза чаще, чем на севере.
Рак кожи, вызванный ультрафиолетом, в большинстве случаев
излечим. Базальноклеточный и плоскоклеточный рак редко ме-
тастазирует в другие области тела.
Ученые полагают, что уменьшение озонового слоя на 1 % при-
водит к 2%-му усилению УФ-радиации и к 2—5%-му увеличе-
нию числа случаев рака кожи.
Третий тип рака кожи — меланома — менее распространен, и
он не гак тесно связан с воздействием солнечного света. Тем не
менее частота меланомы на юге на 75% выше, чем на севере.
Ультрафиолетовые лучи оказывают также вредное действие
на глаза, в том числе на роговую оболочку', приводя к катарак-
там и старческому ослаблению зрения.
Биологическое действие УФ-радиации обусловлено высокой
чувствительностью нуклеиновых кислот, которые могут разру-
шаться, что приводит к гибели клеток или возникновению мута-
ций. Сильное УФ-облучсние способно повредить молекулы ДНК
(дезоксирибонуклеиновой кислоты) — основного хромосомно-
го материала, передающего генетическую информацию.
Воздействие УФ-излучсния на живую клетку преимущест-
венно связано именно с повреждением ДНК. Нуклеиновые кис-
лоты, образующие молекулы ДНК, поглощают УФ-излученис
гораздо сильнее, чем молекулы белков, образующих клетку.
Максимум поглощения УФ-излучения (254 нм) для озонового
слоя очень близок к таковому для ДНК (260 нм)
Наиболее эффективно УФ-излучение поглощается цикличе-
скими структурами азотистых оснований, соединяющих в ДНК
группировки сахара (дезоксирибозы) и фосфорной кислоты.
При поглощении кванта света (Av) происходит разрыв двойной
связи в тимине с образованием двух свободных валентностей
258
(рис. 2.28). Если вблизи от этого места то же самое происходит и
в соседней спирали, то они могут замкнуться, что ведет к потере
генетического кода клетки, задержке роста и делении и в конце
концов к ее гибели.
Схема фотообразования димеров тимина
Рис. 2.28. Ключевая реакция механизма воздействия
УФ-излучения на ДНК (по И К. Ларину, 2001)
УФ-облученис вызывает ослабление иммунной системы чело-
века. Полагают, что заболевания типа герпеса и фонической ли-
хорадки вызваны УФ-облучением. Изменение в иммунной сис-
теме может повлиять на число случаен некоторых инфекцион-
ных заболеваний.
Возросшее УФ-излучснис оказывает вредное воздействие на
растения и животных. Облучение ультрафиолетом приводит
к уменьшению площади поверхности листьев, высоты растений
и интенсивности фотосинтеза. Различные сельскохозяйствен-
ные растения неодинаково реагируют на усиление УФ-облуче-
ния. Испытания на злаках показали, что у 2/3 из них снижается
урожайность. Разрушение озонового слоя на 1% уменьшает уро-
жайность соевых бобов на 1%. УФ-облучение ухудшает качество
семян и понижает сопротивляемость вида к вредителям и болез-
ням, оно влияет также на глубину укоренения растений и спо-
собствует тому, что сорняки отнимают у культурных растений
воду и питательные вещества Менее изучено влияние УФ-об-
лучепия на развитие дикорастущих наземных сообществ расте-
ний, дающих миру примерно 90% первичной (растительной)
продукции.
Усиление УФ-облучения нанесет вред обитателям водных
экосистем. Эксперименты показали, что облучение вредно для
мальков рыб и другой водоплавающей молоди и тем самым су-
щественно влияет на пищевую цепь водоемов.
Одноклеточные и микроорганизмы подвержены опасности
в большей степени, чем крупные живые организмы, потому что
УФ-облучение проникает только в поверхностные слои клеток.
Так, 5%-ое увеличение УФ-радиации может наполовину сокра-
тить время жизни некоторых микроорганизмов.
259
В период весенних потерь озона в Антарктике ученые изучали
влияние УФ-облучения на морские микроорганизмы. Было уста-
новлено, что с возрастанием УФ-облучсния падает продуктив-
ность фитопланктона — микроскопических растений, которые
являются начальным звеном в пищевых цепях оксана.
Согласно полученным оценкам 25%-ая потеря озона может
вызвать 35%-ое уменьшение количества фитопланктона. Такой
эффект будет иметь катастрофические последствия для мирово-
го рыболовства.
Хотя УФ-излучение проникает вглубь океана только на не-
сколько метров, но это тот самый слой, где живет большая часть
морских микроорганизмов. Небольшие плавучие растения и
животные очень чувствительны к УФ-радиации, они же являют-
ся основой большинства пищевых цепей в океане. Вот почему
увеличение УФ-излучения может нанести значительный ущерб
многим живым организмам океана.
Результатом разрушения озонового слоя может быть наруше-
ние равновесия не только в водных, но и в наземных экосисте-
мах. Известно, что у одних живых организмов механизмы защи-
ты от УФ-излучения развиты лучше, чем у других. Поэтому мо-
жет произойти уменьшение численности одних популяций и
увеличение других.
В заключение следует отметать, что УФ-облучение оказывает
воздействие и ни строительные материалы Усиление ультрафио-
лета приводит к более быстрому выцветанию красок и растрес-
киванию полимерных материалов, на восстановление которых
потребуются дополнительные финансовые расходы. А это уже
экономический ущерб.
Меры защиты озонового слоя. Итак, разрушение озоновою
слоя грозит изменением климата, вредным воздействием на здо-
ровье человека (рак кожи, катаракта, нарушение иммунной сис-
темы, возрастание опасности инфекционных заболеваний),
а также негативно влияет на многие растения и животных (паде-
ние урожайности сельскохозяйственных культур, гибель неко-
торых микроорганизмов) и даже на строительные материалы.
Как же спасти, защитить озоновый слой Земли, чтобы избе-
жать таких экологических последствий?
Еще в 1970-е гг. американские ученые Ш. Роуленд и М. Мо-
лина ставили вопрос перед промышленниками и политиками об
отказе от производства и применения ХФУ в тех случаях, где это
не продиктовано особой необходимостью.
В 1978 г. в США было запрещено использование ХФУ в аэро-
зольных баллончиках. Так был сделан первый шаг к избавлению
человечества от этих химических соединений — главных винов-
ников разрушения озона. К такому решению пришли еще и по-
тому, что использование пропеллентов из ХФУ связано с опре-
260
деленной опасностью для здоровья людей. Стало известно, что
в больших концентрациях ХФУ могут вызывать остановку серд-
ца, а в малых дозах, как предполагали, — нарушение ритма его
работы. При вдыхании содержимого баллончиков хлорфторуг-
лсрод действует и на легкие. Кроме того, была показана неэко-
номичность аэрозольных упаковок. В баллончике содержится от
50 до 90% пропеллента и лишь небольшое количество активного
вещества. Потребителям было рекомендовано подыскать замену
этим изделиям:
• вместо напыляемого крема для бритья пользоваться мыль-
ной палочкой или электробритвой;
• вместо аэрозольных дезодорантов пользоваться дезодо-
рантами с шариком, палочкой или пудрой;
• вместо баллончиков с краской пользоваться кисточками;
• вместо распылителя инсектицидов пользоваться распыли-
телем на сжатом воздухе или опрыскивателем с ручным насосом.
В 1977 г. был изобретен новый клапан, получивший название
«аквазоль», который работает на смеси воды и газа бутана С4Ы10
в качестве пропеллента (без ХФУ).
Труднее было найти замену хлорфторуглсродам в кондицио-
нерах и холодильниках. В промышленности хлорфторуглеродов
в 1980-е гг. начались серьезные поиски их заменителей. Требо-
валось заменить три основных вещества: ХФУ-11, используе-
мый в производстве пенопластов и в холодильниках; ХФУ-12,
применяемый в холодильниках, кондиционерах и при изготов-
лении пенопластов; ХФУ-113 — растворитель для электронной
промышленности. С этой целью были предложены химические
соединения, известные под названиями фреон-123 и фреон-134а.
В отличие от фреона-11 и фрсона-12 эти заменители должны
разлагаться в тропосфере, нс достигая озонового слоя.
Одновременно с поисками альтернативных веществ идет по-
этапное сокращение производства и использования озонораз-
рушающих веществ согласно Венской конвенции (ВК) и Мон-
реальскому протоколу (МП) и дополнениям к МП. Для разви-
вающихся стран вывод из производства и потребления ОРВ
может быть осуществлен в более поздние сроки, чем в развитых
странах. Например, если для развитых стран срок вывода из
производства ХФУ, четыреххлористого углерода (ЧХУ) и метил-
хлороформа (МХФ) — 1 января 1996 г., то для развивающихся
стран — 1 января 2006 г.
На момент подписания ВК и МП Советский Союз характери-
зовался как промышленно развитая страна. После распада
СССР, в 1991 г. Россия получила статус государства с переход-
ной экономикой, и в 1996 г. ей была предоставлена помощь
в виде гранта от Глобального экологического фонда (ГЭФ) для
поэтапного сокращения производства озоноразрушающих ве-
261
ществ. Россия к моменту принятая МП (1987 г.) находилась
в числе крупнейших мировых производителей и потребителей
главных ОРВ. Пик их производства пришелся на 1990 г. и со-
ставлял тогда 20% от мирового уровня производства. К 1996 г.
в России объем производства ОРВ снизился в 10 раз по сравне-
нию с 1990 г., производство фреонов — более чем в шесть раз,
галонов — почти в 20 раз. В 1996 г. полностью прекращено про-
изводство метилхлороформа СН3СС13.
На ряде крупнейших в мире предприятий перешли на ис-
пользование альтернативных озонобезопасных веществ. Уже
более 80% производимых в мире аэрозолей используют углево-
дородные пропелленты (УВП) типа пропана или бутана С 1994 г.
на эту' технологию перешли и ряд предприя тий в России, в част-
ности крупнейший завод аэрозольных упаковок в Казани. Угле-
водороды стали эффективной заменой ХФУ при производстве
вспененных теплоизолирующих материалов. В настоящее время
достаточно широкое распространение в качестве вспенивателя
получил циклопентан С5НЮ. Его свойства аналогичны свой-
ствам ХФУ-11 и R-134a.
В холодильной технике внедрение озонобезопасных веществ
сопровождается наибольшими трудностями. Используемые в ка-
честве хладагентов вещества можно подразделить на следующие
группы:
• хлорфторуглероды (ХФУ), которые должны быть выведе-
ны в 1996 г.. - R-l 1, R-12 (или ХФУ-11, ХФУ-12) и др.;
• гидрохлорфторуглсроды (ГХФУ), вывод которых из по-
требления планируется к 2030 г., — R-21, R-22 (иначе ГХФУ-21,
ГХФУ-22) и др.;
• вещества, не содержащие атомов хлора и брома, — фторуг-
лероды, гидрофторуглероды (ГФУ), углеводороды и др. — R-134,
R-134a, R-717 (аммиак), R-290 (пропан), R-600 («-бутан); у них
нулевой потенциал озоноразрушения.
Идеального во всех отношениях заменителя ХФУ в качестве
хладагентов нет. Ряд европейских фирм сделали ставку на изобу-
тан — его потенциал озоноразрушения (ОРП) равен нулю, а по-
тенциал глобального потепления (ПГП) — всего 3, т. е. в 3 раза
превышает ПГП углекислого газа. Ряд английских фирм, а также
красноярский завод «Бирюса» используют пропан-бутановые
смеси. Основной недостаток этих хладагентов— их пожаро-
опасность. Многие производители холодильной техники в США,
Японии и других странах (в том числе и корпорация «Дюпон»)
перешли на хладагент R-134a — это ГФУ. Его ОРП равен нулю,
однако он является парниковым газом, и его ПГП равен 3300.
Однако ряд исследований свидетельствуют о незначительном
влиянии ГХФУ и ГФУ на парниковый эффект. Хладагент R- 134а
используется в отечественном холодильнике «Стинол» (от на-
262
звания «сталь новолипецкая»), выпускаемом ОЛО «Новолипец-
кий металлургический комбинат».
Разработка экологически безопасных хладагентов продол-
жается. У новых хладагентов С-1 и С-ЮМ ОРП равен 0 и 0,03,
а ПГП — 0,015 и 1200 соответственно.
Защита озонового слоя заключается нс только в разработке
новых озонобезопасных хладагентов, но и в регенерации ХФУ и
галонов, собранных из вышедшего из употребления оборудова-
ния. Это позволяет снижать производство ОРВ вплоть до полного
его прекращения в соответствии с Монреальским протоколом.
Однако даже при полном соблюдении всеми странами су-
ществующих международных соглашений по ограничению ис-
пользования ОРВ сезонные изменения содержания О, могут на-
блюдаться еще несколько десятилетий за счет накопившихся
в стратосфере галогенсодержащих соединений, выделяющих
атомы хлора и брома.
Вопросы и задания
1. В каком слое атмос<|>сры Земли находится озоновый слой? На какой высоте кон-
центрация озона максимальна? 2. Когда возникла проблема истощения озонового
слоя? Какие ученые первыми предположили, что причиной разрушения озона являют-
ся химические вещества — продукты деятельности человека? 3. Что такое озоновые
«дыры» и когда они были обнаружены нал Антарктидой и Арктикой? 4. Какие важные
международные документы по охране озонового слоя и сокращению производства озо-
норазрушаюших веществ были подписаны в 1985и 1987 гг.?Почему 16 сентября приня-
то считать Международным лием защиты озонового слоя? 5. Какие методы и приборы
используются для определения содержания озона в атмосфере? Какое практическое
применение в России нашли бывшие самолеты-разведчики? 6. По рис. 2.21 и 2.22 оха-
рактеризуйте тенденции в изменении содержания озона в последние 20 лет XX в.
7. С какой скоростью происходит понижение глобального среднегодового общего со-
держания стратосферного озона (ОСО)? 8. В каких регионах России чаще отмечалось
понижение содержания озона в последнее 10-лстис XX в.? 9. Какие естественные и ан г-
ропогенные факторы влияют на содержание озона в стратос<]>ере? 10. Чем различается
тропосферный и стратосферный озон? Почему тропосферный озон является вредным
газом, а страгосферный — полезным? 11. Охарактеризуйте по рис. 2.23 механизм обра-
зования стратосферного озона. Напишите соответсгвующис уравнения реакций. 12. Сколько
механизмов разрушения озона вы знаете* Охарактеризуйте механизмы гибели озона,
которые втексте раздела обозначены как I и II. Чем они различаются? Нанншите соот-
ветствующие уравнения реакций. 13. Охарактсризуй|е развитие представлений о гибе-
ли озона на основе механизмов III, IV, V и VI. Напишите соответствующие уравнения
реакций. 14. Назовите основные озоноразрушаюшие вещества (ОРВ). 15. Лайте хими-
ческую характеристику хлорфторуглеродам (ХФУ) и фгорхлорбромутлсродам (гало-
нам). Назовите области их применении. 16. В каких промышленных производствах Рос-
сии используются ОРВ? Для ответа на данный вопрос см. рис. 2.25. 17. Расскажше ис-
торию применения ХФУ в США (в качестве хладагентов, пропеллентов в аэрозольных
баллончиках и в производстве упаковок из пенопласта). Почему ХФУ называют также
фреонами? 18. Охарактеризуйте особенности распространения фреонов в атмосфере
Земли (скорость распространения, время жизни). 19. Используя рис. 2.26 и 2.27, оха-
263
растеризуйте механизм гибели озона н результате действия фреонов. 20. Какова эколо-
гическая роль озонового слоя Земли и чем она обусловлена? 21. Какое влияние оказы-
вает разрушение озонового слоя и усиление УФ-излучения на а) изменение климата;
6) здоровье человека; в) растения и животных? 22. Обьясните механизм воздействия
УФ-излучсния на живую клетку. Для ответа на «опрос используйте также рис. 2.28.
23. Назовите основные мероприятия по защите озонового слоя. 24. Какие альтернатив-
ные вещества предлагаются в качестве пропеллентов, хладагентов и вспенивателей вмес-
то ХФУ9 25 Какие индивидуальные меры защиты от избытка УФ-излучения вы можете
использовать?
2.7. ЗАЩИТА АТМОСФЕРЫ
ОТ ХИМИЧЕСКОГО ЗАГРЯЗНЕНИЯ
Наилучшим способом защиты атмосферы и биосферы в це-
лом является, конечно, совершенствование промышленных про-
изводств с целью создания безотходных или малоотходных тех-
нологий, при которых вредные вещества практически не должны
поступать в окружающую среду. Однако большинство промыш-
ленных производств пока сше использует открытые технологи-
ческие процессы, связанные с выбросом в атмосферу твердых час-
тиц и отходящих газов. Необходимо строгое ограничение выбро-
сов, а в перспективе — их полное исключение.
Комплекс мер с целью защиты атмосферы от за!рязнения
включает: совершенствование технологии производства для сни-
жения выбросов; сокращение наиболее вредных производств;
создание санитарно-зашитных зон около предприятий; рассея-
ние химических соединений в атмосфере; создание более эф-
фективных очистных сооружений на предприятиях; рациональ-
ную планировку зеленых насажден ий, обладающих пылеулавли-
вающей и газопоглотительной способностью.
Санитарными нормами проектирования промышленных
предприятий установлено, что предприятия, являющиеся ис-
точником выделения в окружающую среду вредных и неприятно
пахнущих вешеств или источниками ионизирующих излучений,
должны быть отделены от жилой застройки санитарно-защит-
ными зонами (СЗЗ). Санитарно-защитной зоной следует считать
пространство между промышленной площадкой, на границе ко-
торой концентрации вредных веществ не должны превышать
0,3 ПДК,,, (для воздуха рабочей зоны), и границей, на которой
обеспечивается соблюдение ПДК вредных веществ в атмосфер-
ном воздухе населенных пунктов (ПДК^ п). Границы СЗЗ при од-
ном источнике выброса устанавливают непосредственно от это-
го источника; при группе источников, сводящихся в одну точку
(центр их группирования), — от этой точки (центра). Промыш-
ленные предприятия подразделяюг на пять классов в зависимо-
сти от их опасности для окружающей среды по санитарно-гигис-
264
ническим критериям. Наиболее опасен I класс, наименее опа-
сен — V. Каждому классу предприятий соответствует своя сани-
тарпо-защитнгш зона: для предприятий класса I — 1000 м, клас-
са П — 500 м, класса Ill — 300 м, класса IV — 100 м и класса V —
50 м. СЗЗ предприятий при необходимости может быть увеличе-
на по решению соответствующих федеральных органов, но не
более чем в три раза.
Как правило, на каждом предприятии для отвода газов и уда-
ления пыли используют трубы высотой 200—350 м. Применение
высоких труб позволяет распределять загрязняющие вещества
на большие расстояния от точки выброса и, следовательно, раз-
бавлять выброс в большем объеме атмосферного воздуха, сни-
жая тем самым их концентрацию. Так. из трубы высотой 200 м
лылегазовые потоки расходятся на 20 км, а из трубы выстой
250 м — на 75 км. Рассеяние вредных веществ позволяет снизить
их концентрацию в непосредственной близости от источника
выброса, однако загрязнение распространяется на большие рас-
стояния и вместо локального загрязнения может наблюдаться ре-
гиональное, хотя и с меньшей концентрацией вредных веществ.
Таким образом, рассеяние вредных веществ в атмосфере нс
является эффективным средством ее защиты от загрязнений.
Основное внимание при проектировании промышленных пред-
приятий или реконструкпиидействующихдолжноуделяться как
можно более полной очистке и обезвреживанию атмосферных
выбросов от токсичных веществ, созданию эффективных очист-
ных сооружений. Рассмотрим процессы пылеочистки и очистку
выбросов от газообразных компонентов.
Аппараты для очистки воздуха и газов от пыли подразделяются
на следующие типы.
1. ^Механические обеспыливающие устройства, в которых
пыль отделяется под действием гравитационных, инерционных
или центробежных сил.
2. Электрофильтры, в которых осаждение пыли осуществля-
ется за счет ионизации газа и сообщения электрического заряда
пылинкам.
3. Гидравлические аппараты, в которых твердые частицы
улавливаются жидкостью (мокрый способ).
4. Пористые фильтры, удерживающие тонкодисперсную пыль.
Пылеосадительные камеры, являясь простейшими аппаратами
механического способа очистки отходящих газов, применяются
для освобождения газов от грубодисперсной пыли (размер час-
тиц 500—50 мкм) и обеспечивают степень очистки 40—50%.
Способ очистки в данных аппаратах основан на действии грави-
тационных сил. При движении потока воздуха или газа между
перегородками его скорость снижается, и частицы пыли оседают
(рис. 2.29).
265
4
~ Очищенный
газ
Рис. 2.29. Пылеосадительная камера с вертикальными перегородками:
/ — корпус; 2 — бункер; 3 — штуцер для удаления пыли; 4 — перегородки
Рис. 2.30. Циклон-аппарат:
А — вид сбоку; Б — вид
Циклоны предназначены для очист-
ки воздуха от пылевидных частиц (раз-
мером >10 мкм). Состоят циклоны из
двух цилиндров, вставленных один
в другой; к нижней части большего ци-
линдра присоединен конический бун-
кер для сбора пыли (рис. 2.30). Прин-
цип работы циклонов основан на
использовании центробежных сил За-
пыленный воздух или газ с большой
скоростью подастся по касательной
в верхнюю часть аппарата и движется
вниз по винтовой линии. Пылинки,
обладающие значительно большей мас-
сой, чем молекулы азота и кислоро-
да, развивают соответственно большую
центробежную силу и под действием
этой силы отбрасываются к наружным
стенкам циклона. К тому же при по-
ступлении газа в малый цилиндр в ре-
зультате резкого изменения траектории
движения более массивные инерцион-
ные частички пыли оседают. Очищен-
сверху в разрезе ный таким образом воздух или газ вы-
ходит через внутреннюю малую трубу
Более совершенным способом является очистка в электро-
фильтрах (особенно от мелкой пыли). Основан данный метод на
свойствах постоянного электрического тока высокого напряже-
ния (около 20 тыс В и более) ионизировать воздух или газ. В ре-
зультате между положительным и отрицательным полюсами со-
здастся поток электронов, которые, соударяясь с пылинками,
сообщают им отрицательный электрический заряд. Такие заря-
женные пылинки движутся с большей скоростью к положитель-
ному полюсу, где разряжаются и укрупняются. На рис. 2.31 при-
ведена схема трубчатого электрофилыра. К электроду, который
266
называется коронирующим, подво-
дится отрицательный потенциал
К корпусу электрофильтра подво-
дится положительный потенциал,
либо корпус заземляется. Вокруг
корон ирующего электрода наблю-
дается свечение газа (корона), про-
исходящее и результате его иониза-
ции. На осадительном электроде,
т. е. на корпусе, частички пыли
осаждаются.
Высокая эффективность очистки
воздуха и газов от пыли достигается
при использовании мокрого спосо-
ба. Наибольшее распространение
среди аппаратов этого типа получи-
ли противоточные насадочные скруб-
беры (рис 2 32) Запыленный поток
воздуха или газа движется снизу
вверх и захватывается потоками
промывной жидкости стекающей
по насадке сверху вниз. Благодаря
большой поверхности стекающей
вниз жидкости улавливаются даже
мелкие частицы пыли (до 10 мкм).
Для очистки газов от мелкодис-
персной пыли (частицы размером
менее 1 мкм) используется скруббер
Вентури (рис. 2.33). Он представля-
Рис. 2.31. Схема трубчатого
электрофил ыра:
1 — осадительный электрод;
2 — коронирующий электрод;
3 — отверстие для входа; 4 —
отверстие для выхода газа
Рис. 2.32 Противоточный насадочный скруббер
267
Запыленный
Очищенный
газ’
Шлам
Рис. 2.33. Скруббер Вентури
ет собой трубу с плавным сужени-
ем на входе газа и плавным рас-
ширением на выходе. В наиболее
узкую часть трубы Вентури — гор-
ловину — с помошыо форсунок
подводится жидкость, а запылен-
ный воздух или газ проходит сквозь
горловину с большой скоростью,
распыляя жидкость, которая дис-
пергируется до мельчайших капе-
лек, так как скорость газа в гор-
ловине может достигать 120 м/с.
В результате степень очистки по-
тока воздуха иди газа от пыли мо-
жет достигать 95—99%.
Одним из способов очистки га-
зов от пыли является их фильтра-
ция через пористые перегородки.
Этот способ обеспечивает более
высокую степень очистки, чем су-
хое или мокрое пылеулавливание.
со встроенным пылеуловителем
Суть метода заключается в том,
что поглощенные частицы пер-
вых порций загрязненного по-
тока накапливаются в объеме
фильтрующего материала или
образуют пылевой слой на его
поверхности, что является для
вновь поступающих частиц до-
полнительным фильтрующим ма-
териалом и повышает эффек-
тивность очистки. Однако газо-
проницаемость фильтра посте-
пенно снижается, и периодиче-
ски необходима его регенерация
(восстановление первоначальной
фильтрующей способности).
В промышленности исполь-
зуют два вида фильтров: ткане-
вые и зернистые. Наибольшее
распространение получили тка-
невые рукавные фильтры, состоя-
щие из ряда тканевых рукавов,
которые укреплены в металли-
Рис. 2.34. Рукавный фильтр:
/ — корпус; 2 — рукава; 3 — дрос-
сель; 4— пыль; 5—затвор; б— шпек
268
ческом кожухе (рис. 2.34). Газ, поступая и нижнюю часть аппара-
та, проходит сквозь ткань рукавов, а пыль осаждается на поверх-
ности ткани и в ее порах, откуда сс периодически удаляют. Ру-
кавные фильтры способны задерживать пылевые частицы раз-
мером от 1—2 мкм и выше.
Преимуществом зернистых фильтров является их способ-
ность работать в агрессивных средах и при высоких температу-
рах, выдерживать большие механические нагрузки и перепады
давления. В них в качестве фильтрующих материалов использу-
ют песок, гальку, шлаки, кокс, трафит, древесные опилки.
Часто задачу пылеулавливания удается решить только при ис-
пользовании двух и более последовательно работающих ступе-
ней очистки газов (воздуха). На первой ступени очистки в таком
случае отделяются наиболее крупные фракции пыли, а на сле-
дующей ступени — более мелкие и т. д.
Газоочистка — это процессы очистки газов (воздуха) от газо-
образных химических примесей, содержащихся в очищаемом
газовом (воздушном) потоке.
Для очистки отходящих газов от газообразных примесей наи-
более часто используют три вида процессов.
1. Поглощение газов при их промывке жидкостями — абсорб-
ция (объемная сорбция).
2. Поглощение газов твердыми телами — адсорбция (поверх-
ностная сорбция).
3. Окислительно-восстановительные процессы (высокотем-
пературные и каталитические), в результате которых образуются
новые, экологически менее опасные вещества.
В химических и металлургических производствах наиболее
распространен первый из перечисленных — метод абсорбции.
Для удаления газов можно использовать воду, минеральные мас-
ла и расплавы. Однако чаще всего используют водные растворы
веществ, которые вступают в химическое взаимодействие с по-
глощаемым газом (метод хемосорбции). Так, например, для по-
глощения аммиака применяют разбавленные растворы серной
кислоты. Реакция между поглощаемым веществом (сорбатом) и
поглотителем (сорбентом) описывается уравнением, которое
представляет собой сумму уравнений (2.48) и (2.49):
2NH} + ll,so4 —> (NII4),SO,.
Аппараты, в которых осуществляются процессы газоочистки,
называются абсорберы.
Второй метод газоочистки — адсорбционный — основан на
поглощении паров или газов твердыми пористыми материала-
ми — адсорбентами. Наиболее часто применяют следующие ви-
ды адсорбентов: активированные (активные) угли, силикагели,
цеолиты, иониты. Для очистки газов по этому методу исполь-
?69
зуют массообменные аппараты — адсорберы. На рис. 2.35 изобра-
жен адсорбер полочного типа с неподвижными слоями адсор-
бента. Он представляет собой цилиндрическую вертикальную
(или горизонтальную) емкость, заполненную слоем адсорбента.
Рис. 2.35. Адсорбер полочного типа
с неподвижными слоями адсорбента:
/— корпус; 2— слой адсорбента
Третий метод газоочистки основан на проведении процес-
сов окисления и восстановления. Процессы окисления проводят
при повышенных температурах. При этом используют прямое и
каталитическое сжигание газообразных отходов. Например,
этот метод используют для очистки газовых выбросов, образую-
щихся в производстве вискозы (в небольших количествах в них
содержатся сероводород H2S и сероуглерод CS,). Наряду с окис-
лительными процессами для обезвреживания газовых выбросов
применяют и восстановительные процессы. Так, для удаления
монооксида азота NO из газовых потоков рекомендуется его тер-
мическое разложение в плазмотроне в присугствии различных
восстановителей (Н2, природный газ, кокс и др.)
Примеры окислительно-восстановительных процессов, при-
меняемых в газоочистке, были даны в разд. 2.6.3 «Кислотные
осадки» (Меры защиты атмосферы от кислотных осадков).
270
Применяемые методы газоочистки позволяют улучшить эко-
логическую обстановку, но не решают экологических проблем
предприятия полностью. В 1970—1980-е гг. система газоочист-
ки, как правило, создавалась уже для работающих производств,
экологические задачи зачастую решались после разработки тех-
нологии производства. Безусловно, более эффективный и рацио-
нальный путь — это разработка безотходных или малоотходных
технологических процессов, которые изначально обеспечива-
ют защиту окружающей среды, а не требуют создания дорого-
стоящих систем газоочистки. Выбор конкретной технологии
производства из нескольких предложенных вариантов должен
быть целесообразен для решения как химико-технологических,
так и экологических задач. Поясним это на конкретном приме-
ре. В производстве анионных поверхностно-активных веществ
(ПАВ), таких как алкисульфаты, алкибснзолсульфонаты, суль-
фоэтоксилаты и олсфинсульфопаты, применяемых для получе-
ния синтетических моющих средств (СМС) и для других целей,
основным технологическим процессом является сульфирование
гидрофобного органического сырья газообразным триоксидом
серы (SO3), разбавленным инертными газами или воздухом.
В процессе сульфирования образуется большое количество газо-
вых выбросов, содержащих SO3 и летучие органические вещест-
ва. Поэтому такая технология требует создания громоздкой сис-
темы газоочистки, при которой газовые выбросы очищаются
в поглотительных башнях раствором щелочи (NaOH), затем сер-
ной кислотой, далее остатки SO, (H2SO4) улавливаются извест-
ковым молоком (Са(ОН)2). В 1980 г. было предложено другое
инженерное решение технологического процесса: прямоточная
схема в каскаде аппаратов, которая дает снижение выбросовток-
сичных веществ в несколько раз (Перистый В. А., авт. свид-во
№ 747-856). Экологичность предложенной технологии основана
на низкой летучести сульфированного продукта (сульфомассы)
и на се способности хорошо поглощать триоксид серы. Однако и
до настоящего времени используются неэкологичные техноло-
гии сульфирования органических веществ в производстве ПАВ.
Вопросы и задания
1. Какие мероприятия нужно проводить с целью зашиты атмосферы отхимического
загрязнения? 2. Что такое санитарно-защитная зона (СЗЗ)? Какой должна быть СЗЗ для
предприятий разного класса опасности? 3. Как зависит распределение загрязняющих
веществ в атмосфере от высоты трубы? 4. Назовите четыре основных типааппаратов для
очистки от пыли отходящих газов. 5. Охарактеризуйте принцип работы пьыеосадитсль-
ной камеры, циклона, элскгрофильтра, скруббера и рукавного фильтра. 6. Какие про-
цессы используют для очистки отходящих газов от газообразных примесей? 7. В чем
сущность методов абсорбции и адсорбции? 8 Приведите примеры применения процес-
сов окисления и восстановления, используемых в газоочистке.
271
Задачи
1. Для очистки отходящих газов от SO. по методу скрубберной (мокрой) очистки
используют водный растъорчаммиака. В установке для промывки газа (скруббере) сер-
нистый газ. аммиаки вода превращаются в сульфат аммония, который можно исполь-
зовать в качестве удобрения. Напишите уравнение соответствующей реакции и рассчи-
тайте, сколько аммиака потребуется для поглощения 10 кг сернистого га». 2. Для очист-
ки дымовых газов от оксидов азота применяют раствор карбоната натрия, который
peai ируст с оксидами Ниже приведены схемы этих реакций:
NO + NO, + Na,CO3-----> NaNO, + СО,;
NO, + Na,CO,--► NaNO, + NaNOj + CO..
Расставьте коэффиниипы в этих уравнениях реакций и вычислите массу карбонам на-
трия. необходимого для извлечения 500 кг диоксида азота. 3. Одним из способов очистки
коксовых газон от оксида азота( 11) является использование метана в качестве восстано-
вителя:
4NO + СН4™изатоР>2К_+ +
Какой объем метана расходуется за 6 ч при ен> взаимодействии с оксидом азота(П) на
установке по очистке kokcoboio ia-за производительностью 100 тыс. м’/ч, если коксо-
вый газ содержит 8 мл NO в I м3?
Глава 3
ПРАКТИЧЕСКИЕ РАБОТЫ
ПО ТЕМЕ «АТМОСФЕРА»
3.1. МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Из числа предлагаемых ниже работ преподаватель может вы-
бирать тс или иные, исходя из наличия реактивов и оборудова-
ния, а также учитывая уровень подготовленности обучающихся.
Некоторые работы, например 4 (вариант 2), 6. 7, 8, можно про-
водить в учебное время (на практических занятиях), а работы 1,
2, 3, 4 (вариант 1) — на полевой практике. Работа 5 более слож-
ная, чем перечисленные выше; определение концентрации пы-
ли с помощью аспиратора фебует навыков, с этим методом
можно ознакомиться па промышленном предприятии, совер-
шив туда экскурсию. Работа II «Парниковый эффект» может
быть выполнена либо в учебное время на практическом занятии,
либо как домашнее задание. Используя методики, приведенные
в работах 9, 10, 12, можно проводить исследования экологиче-
ского состояния атмосферы в течение длительного времени, т. с.
осуществлять мониторинг содержания твердых веществ и кис-
лотно-основных свойств осадков, выявлять тенденции, делать
прогноз.
3.2. СОДЕРЖАНИЕ ПРАКТИЧЕСКИХ РАБОТ
Работа 1. Определение концентрации
паров бензина в воздухе
Оборудование: газоанализатор УГ-2.
Концентрацию газов и паров в воздухе можно определять при
помощи прибора-газоанализатора УГ-2.
Принцип работы газоанализатора основан на просасывай и и
воздуха, содержащего вредные пары (газы), через индикаторную
фубку воздухозаборным устройством. Образование окрашенного
столбика в индикаторной трубке происходит вследствие реакции,
протекающей между анализируемым паром (газом) и реактивом
273
наполнителя индикаторной трубки. При этом происходит образо-
вание продукта, по цвету отличающегося от исходного вещества.
Концентрация анализируемого газа в воздухе пропорциональна
длине окрашенного столбика индикаторного порошка в трубке.
Сравнивая длину окрашенного столбика с градуировочной
шкалой, определяют концентрацию в мг/м3. Градуировочная
шкала имеется для каждого пара (газа).
Перед анализом воздуха производится подготовка индика-
торной трубки. Предварительно трубки Промывают хромовой
смесью и водой и сушат при 120—130 °C. Высушенные трубки
хранятся в эксикаторе над серной кислотой.
Вставляют в трубку стержень, а с противоположного конца —
гигроскопический ватный тампон, который проталкивают
штырьком до упора со стержнем. При этом толщина тампона не
должна превышать 2,5 мм. Через воронку засыпают индикатор-
ный порошок. Постукиванием по стенке трубки стержнем до-
стигается уплотнение столбика порошка, после чего сверху стол-
бика укладывают такой же тампон из i игроскопической ваты.
Постукиванием еще раз уплотняют столбик порошка и, под-
жимая стержнем тампон, устраняют просвет между столбиком и
тампоном.
При неплотно заполненной трубке длина окрашенного стол-
бика увеличится, и границы его будут размытыми (нечеткими).
Правильность наполнения индикаторных трубок контролирует-
ся временем защелкивания штока воздухозаборного устройства.
Так, при прососе анализируемого воздуха объемом 300 мл про-
должитсл ьность хода штока до защелкивания должна составлять
примерно 3,5 мин. Если время защелкивания меньше, то стол-
бик порошка уплотнен слабо, и наоборот.
Подготовленные индикаторные трубки Необходимо гермети-
зировать заглушками. Оставшийся индикаторный порошок за-
паивается.
Анализ воздуха проводят следующим образом. Патрон проду-
вают исследуемым воздухом. Для этого отводят фиксатор возду-
хозаборного устройства и вставляют шток в направляющую
втулку так, чтобы наконечник фиксатора скользил по канавке
штока, над которой указан объем просасываемого воздуха 300 мл.
Давлением руки на головку штока сжимают сильфон до тех пор,
пока наконечник фиксатора не совпадет с верхним углублением
на канавке штока. Снимают заглушку с узкого конца патрона и
присоединяют его к резиновой трубке воздухозаборного устрой-
ства; снимают заглушку с широкого конца патрона и вводят по-
следний в испытуемую воздушную среду'. Надавливая на головку
штока, другой рукой отводят фиксатор. Как только начал дви-
гаться шток, фиксатор отпускают. В это время исследуемый воз-
дух просасывается через патрон. По истечении нескольких се-
274
кунд наконечник фиксатора войдет в нижнее углубление канав-
ки штока (слышен щелчок), и движение штока прекратится. Та-
кую продувку проводят один раз и патрон снимают.
Индикаторную трубку освобождают от герметизирующих за-
глушек и проверяют уплотнение порошка индикаторной трубки
путем постукивания стержнем о сгонки трубки. Если при этом
между столбиками порошка и ватным там помом образуется про-
свет, его устраняют нажатием стержня на тампон
Сжимают сильфон (как описано выше), чтобы обеспечить
последующее просасыванис воздуха объемом 300 мл. Резиновую
трубку воздухозаборного устройства соединяют с любым кон-
цом индикаторной трубки, друтой ее конец соединяют с фильт-
рующим патроном.
Надавливая одной рукой на головку штока, друтой отводят
фиксатор. Как только шток начал двигаться, отпускают фикса-
тор и засекают время В это время происходит просасывание ис-
следуемого воздуха через патрон и индикаторную трубку. Когда
наконечник фиксатора войдет в нижнее углубление канавки
штока, слышен щелчок. При этом продолжительность хода што-
ка должна составлять примерно 3,5 мин, что зависит от плотно-
сти набивки индикаторной трубки. После защелкивания проса-
сывание воздуха еше продолжается вследствие остаточного ва-
куума в сильфоне Поэтому общее время просасывания воздуха
составляет 5 мин.
По окончании анализа патрон освобождают от индикаторной
трубки и закрывают заглушками.
Концентрацию исследуемого газа в воздухе определяют по
измерительной шкале. Цифра на шкале, совпадающая с верхним
концом окрашенного столбика порошка, указывает концентра-
цию газа (пара) в мг/м3.
Работа 2. Экспресс-метод
определения углекислого газа в воздухе
I метод. Принцип метода: реакция углекислого газа с раство-
ром кальцинированной соды.
Оборудование: шприц на 100 мл
Реактивы: 1) кальцинированная сода (0,005%-ый раствор);
2) фенолфталеин (1%-ый раствор).
Ход определения: в шприц объемом 100 мл набирают 20 мл
0,005%-го раствора соды с фенолфталеином, имеющего розовую
окраску, а затем засасывают 80 мл воздуха и встряхивают в тече-
ние 1 мин. Если нс произошло обесцвечивания раствора, воздух
из шприца осторожно выжимают, оставив в нем раствор, вновь
набирают порцию воздуха и встряхивают еше 1 мин Эту опера-
275
пию повторяют 3—4 раза, после чего добавляют воздух неболь-
шими порциями по 10—20 мл, каждый раз встряхивая содержи-
мое 1 мин до обесцвечивания раствора. Подсчитав общий объем
воздуха, прошедшего через шприц, определяют концентрацию
СО, в воздухе поданным, приведенным в табл. 3.1.
Таблица 3.1
Содержание СО, в воздухе в зависимое ги о г объема воздуха,
обесцвечивающего 20 мл 0,005%-го раствора соды
Объем воздуха, мл Концентрация СО,, % Объем воздуха, мл Концентрация СО;, % Объем ноздухз, мл Концентрация СО,. %
80 3,2 330 1.16 410 0,84
160 2,08 340 1.12 420 0,80
200 1,82 350 1,08 430 0,76
240 1,56 360 1,04 440 0,70
260 1,44 370 1,00 450 0,66
280 1.36 380 0,96 460 0,60
300 1,28 390 0,92 470 0.56
320 1,20 400 0,88 480 0.52
п метод. Принцип метода: определение основано на нейтра-
лизации слабоаммнамного раствора углекислым газом в присут-
ствии индикатора фенолфталеина. В дальнейшем проводится
сравнительное исследование изучаемого воздуха и воздуха от-
крытой атмосферыj где содержание СО2 держится на уровне
0,04% в городе и 0,03% в сельской местности.
Оборудование: I) пробирки; 2) шприц на 20 мл.
Реактивы: 1) аммиак (25%-ый раствор); 2) фенолфталеин
(1%-ый раствор); 3) поглотительный раствор (к 500 мл дис-
тиллированной воды добавляют 0,04 мл раствора аммиака и
1—2 капли 1%-го фенолфталеина).
Ход определения: в пробирку наливают 10 мл поглотительного
раствора и закрывают резиновой пробкой, ко горую заранее про-
калывают иглой от шприца. Сначала исследование проводят
с воздухом открытой атмосферы. Для этого воздух забирают
шприцем до отметки 20 мл и под давлением вводят через иглу
в пробирку с аммиачным раствором. Не отпуская поршня, про-
бирку энергично взбалтывают для поглощения СО, из воздуха.
Эти манипуляции проводят до полного обесцвечивания погло-
тительного раствора. Записываю!, сколько раз (число шприцев)
пришлось вводить воздух из шприца в пробирку, чтобы раствор
обесцветился.
После этого пробирку освобождают от использованною раст-
вора, ополаскивают дистиллированной водой, заполняют све-
жим поглотительным раствором (10 мл) и точно так же проводят
определение с_исследусмы.м воздухом. Снова отмечают (записы-
276
вают) число шприцев, использованных на обесцвечивание раст-
вора. Как правило, во втором случае для нейтрализации аммиач-
ного раствора требуется меньшее число шприцев воздуха.
Концентрацию оксида углерода(1У) в воздухе определяют по
формуле:
где п — число шприцев воздуха открытой атмосферы; nt — число
шприцев исследуемого воздуха.
Работа 3. Оценка чистоты атмосферного воздуха
по величине автотранспортной нагрузки
Известно, что основные источники загрязнения атмосферно-
го воздуха — это предприятия тепловой энергетики, промыш-
ленные предприятия и автомобильный транспорт, причем в го-
родских условиях последний является наиболее мощным загряз-
нителем атмосферы. В выхлопных газах двигателей содержится
более 200 веществ. Наибольшую долю загрязнений атмосферы
составляют оксиды углерода и азота, углеводороды, сернистые
соединения, сажа.
Загрязнение воздуха отработанными газами автомобилей ха-
рактеризуется значительной неравномерностью в пространстве
и во времени. Поэтому очень важен оперативный и детальный
учет интенсивности и структуры транспортных потоков, особен-
но в городах и крупных населенных пунктах.
Санитарные требования по уровню загрязнения допускают
поток транспорта в жилой зоне интенсивностью не более 200 ав-
томобилей в час.
Для учета автомобильных потоков в микрорайоне составляет-
ся схема всех улиц, по которым разрешено движение транспор-
та. Затем выбирается несколько улиц с незначительным, сред-
ним и интенсивным движением автомашин.
Ниже предлагаются два несложных метода учета автотранс-
портной нагрузки.
1 метцд. Суть этого метода заключается в том, что на каждой
выбранной улице намечаются один или несколько пунктов наб-
людений. Желательно, чтобы они располагались вдали от пере-
крестков и остановок транспорта, были удобны и (что особенно
важно) безопасны дпя наблюдателей. На каждом пункте должны
работать два наблюдателя: один учитывает машины, идущие из
центра па окраину, другой — из окраинных районов в сторону
центра. Каждую проехавшую мимо автомашину наблюдатель от-
мечает точкой в соответствующей графе учетной таблицы, при
этом целесообразно вести отдельный учет легковых автомоби-
277
лей, грузовых машин, автобусов, тракторов и мотоциклов (трол-
лейбусы, особо не влияющие на загрязнение атмосферы, можно
не учитывать). Смена наблюдателей на пунктах должна прово-
диться нс реже, чем через 1—1,5 ч.
На одних и тех же пунктах возможно проведение разнообраз-
ных наблюдений:
• в разнос время дня (суточные изменения);
• в разные дни недели, но в одно и то же время (недельные
изменения);
• в разные сезоны года, но в одни и те же дни (сезонная ди-
намика движения транспорта).
По данным учетных таблиц можно строить графики суточной
и недельной динамики движения транспорта на конкретной
улице, сравнивать'транспортные потоки в центр и из центра го-
рода, сопоставлять интенсивность движения на оживленной ма-
гистрали, возле своего учебного заведения, на улице вблизи свое-
го дома и т. д.
При построении графика на горизонтальной оси (оси абс-
цисс) откладывается время (в часах — для суточной динамики
или в днях — для длительного периода наблюдений), а на верти-
кальной (оси ординат) — суммарная интенсивность транспорт-
ного потока. Такие графики легко сравнивать между собой.
П метод. Оценку воздействия автомобильного транспорта на
воздушную среду достаточно крупного города можно провести
также следующим методом. На уровне простейшей модели этот
метод предполагает, что общий грузовой поток в городе пропор-
ционален пассажирскому потоку, перевозимому общественным
транспортом, т. е. пассажирский поток можно считать своеоб-
разным индикатором зафязнсиия воздуха за счет автотранспор-
та. В рамках такой модели общая нагрузка (77) на атмосферу на
исследуемом участке (без учета транстородского грузопотока,
рельефа местности и перекрестков) определяется:
77= 1(4 Л = /. /> +4 / + ... + (,/„
где п — число маршрутов городского автотранспорта на иссле-
дуемом участке; 7, — длина трассы, проходимой транспортом
/-маршрута внутри участка;/ — частота следования /-маршрута.
Следует отметить, что 77 — это некая условная величина, при
расчете которой размерности 7; и/нс и грают существенной роли
и выбираются произвольно.
При проведении экологического мониторинга чистота ат-
мосферного воздуха по величине автотранспортной нагрузки
может быть оценена по любому из описанных методов. Однако
второй .метод дает только качественную картину распределения
интенсивности выбросов загрязняющих веществ автотранспор-
278
том в разных районах внутри одного города. Поэтому в целях
единообразия и получения информации, значимой для данного
микрорайона, следует придерживаться ряда рекомендаций:
• пользоваться первым методом как наиболее универсаль-
ным (хотя и более грудоемким) и позволяющим проводить срав-
нения автотранспортной нагрузки в разных районах города;
• выбрать не менее двух постов наблюдений (с незначитель-
ным и наиболее интенсивным движением транспорта), на кото-
рых будет проводиться ежегодное изучение автотранспортного
потока;
• измерение проводить в одни и тс же сроки: ежедневные
(например, с 14 до 15 ч) наблюдения в весенний (например, 16—
31 марта) и осенний (15—30 сентября) периоды;
• в сводную таблицу экопаспорта микрорайона проставлять
среднюю за период наблюдений интенсивность транспортного
потока (автомобилей/час).
Работа 4. Определение запыленности воздуха
Вариант 1. Оборудование: 1) фильтры; 2) воронки; 3) весы.
Запыленность воздуха определяют путем сбора листьев с де-
ревьев возле дорога и в удалении от нее С одинаковой листовой
поверхности смывают пыль, фильтруют и взвешивают массу
осадка после сушки.
Полученный результат дает количество пыли.
Сразу же после смыва пыли подсчитывают число обмытых
листьев (Л,), срывают 5 листочков, лучше разных по размеру,
протирают их от воды и обводят каждый лист на бумаге. Затем
вырезают по контуру и взвешивают вырезанные проекции листа
(A/J. Из той же бумаги вырезают квадрат 10 х 10 см и взвешивают
его (Л/2). Рассчитывают поверхность обмыгых листьев по формуле:
После этого можно определить, сколько пыли осаждается на
1 м2 поверхности листвы. Далее, зная точное время накопления
пыли (от момента последнего дождя до исследований), можно
подсчитать скорость осаждения пыли за сутки.
Вариант 2. Оборудование: 1) миллипоровый фильтр; 2) насос-
пробоотборник; 3) стекла размером 5 х 7,5 см; 4) микроскоп.
Ход эксперимента
1. Надеть полевой миллипоровый фильтр на входное отверс-
тие насоса-пробоотборника.
2. В течение 15 мин прокачать воздух лаборатории через фильтр.
3. С помощью данной насадки вывести новый фильтр за ок-
но и снова прокачать воздух в течение 15 мин.
279
4. Осторожно положить фильтры на стекла размером 5 х 7,5 см.
Рассмотреть фильтры под микроскопом при 100-кратном увели-
чении. Подсчитать число частиц в квадрате сетки.
5. Рассчитать среднее число частиц в квадрате, умножить его
на число квадратов, таким образом получится число частиц на
площади 9 см2, т. с. на фильтрующей поверхности.
6. Определить:
а) сколько частиц находится на площади 9 см2;
б) сколько частиц содержится в 1 м3 воздуха;
в) измерить диаметр минимум 20-ти любых частиц.
7. Вычислить долю (в процентах):
а) крупной пыли (10 мкм);
б) мелкой пыли (1—10 мкм);
в) аэрозолей (1 мкм).
8. От ветить на вопросы:
а) что понимают под зафязнением воздуха;
б) каков экономический ущерб от загрязнения воздуха;
в) что такое фотохимический смог;
г) каким образом дыхательная система человека удаляет час-
тицы размером более 10 мкм менее 10 мкм;
д) загрязнен ли воздух вашей местности;
с) за!рязнен ли воздух вашей лаборатории;
ж) чем различаются пробы воздуха, взятые в лаборатории и на
улице;
з) какова причина кислотных дождей;
и) намного ли снижается загрязнение воздуха благодаря при-
менению каталитических преобразователей в автомобилях?
Работа 5. Определение
содержания пыли в воздухе
Оборудование: 1) аналитические весы; 2) филыр АФА, 3) ал-
лонж металлический или пластмассовый; 4) электрический ас-
пиратор.
Содержание пыли в воздухе определяется по весу се в едини-
це объема и выражается в мг/м3 (гравиметрический метод) и по
числу пылинок в 1 см3 (счетный метод).
Гравиметрический метод основан на улавливании пыли из из-
вестного объема воздуха на предварительно взвешенном фильт-
ре и последующем взвешивании фильтра с пылью на аналити-
ческих весах. В качестве фильтрующего материала используют
специальные ткани или вату (стеклянную или хлопчатобу-
мажную), закладываемые в специальные трубки (аллонжи). ко-
торые могут быть стеклянными, пластмассовыми или метал-
лическими.
280
В последнее время наибольшее распространение получили
фильтры ЛФА из ткани ФПП-15. Эти фильтры обладают рядом
пенных качеств: высокой эффективностью пылеулавливания,
малым сопротивлением току аспирируемого воздуха, стойкостью
к химическим агрессивным средам, отсутствием необходимости
высушивания фильтров до и после аспирации (за исключением
случаев отбора проб в условиях высокой влажности, когда после
аспирации филыр необходимо высушить). Эти филыры могут
быть использованы для последующего определения степени
дисперсности и морфологии пылевых частиц после их просвет-
ления в органических растворителях.
Для фильтра АФЛ обычно используют металлические или
пластмассовые аллонжи в виде воронок, в широкой части кото-
рых при помощи гайки укрепляется фильтр (рис. 3.1).
Рис. 3.1. Кассеты и аллонжи для отбора проб воздуха на фильтры:
1 — филыры из ткани ФПП; 2 — пластмассовый аллонж с фильтром; 3— ме-
таллический аллонж; 4— корпус кассеты; 5— прокладки
Для отбора проб воздуха с целью определения содержания
в нем пыли используют аспираторы.
Электрические аспираторы, предназначенные для отбора
воздуха на участках производства, где имеется подводка элект-
рическою тока, состоят из воздуходувки, электромотора и рео-
метров. На передней панели аспиратора расположены колодка
для присоединения к прибору шнура, тумблер для включения и
выключения аппарата, ручки вентилей для регулировки скоро-
сти отбора проб, штуцеры для присоединения резиновых трубок
к аллонжам, реометры, предохранительный клапан для предот-
вращения перегрузок электродвигателя при отборе проб воздуха
с малыми скоростями, гнездо предохранителя, клемма для за-
земления аппарата (рис. 3.2).
281
Рис. 3.2. Электрический аспиратор для отбора проб воздуха;
/ — колодка для присоединения шнура к прибору; 2 — тумблер для включе-
ния; 3 — гнездо предохранителя; 4 — предохранительный клапан; 5 — ручки
вентилей для регулировки скорости аспирации; 6 — реометры; 7— клемма за-
земления; 8— штуцеры для присоединения трубок к аллонжам
Порядок работы с аспиратором следующий: после заземления
аппарата и подключения к сети предохранительный клапан мо-
жетбыть установлен в одно из двух положений. В первом положе-
нии вентили реометров открывают до отказа. Присоединив рези-
новые трубки с аллонжами к штуцерам реометров, регулируют
скорость просасывания воздуха. Если последняя окажется недо-
статочной, предохранительный клапан должен быть установлен
во второе положение. Отсчет скороеi и прохождения воздуха по
шкалам производят по верхнему краю поплавка реометров.
При отсутствии подвода электрического тока, а также на
взрывоопасных производствах для отбора проб воздуха может
быть использован эжекторный аспиратор АЭРА.
Время аспирации воздуха при определении его запыленности
устанавливают опытным пугем, исходя из уровня запыленности.
Для получения достаточно четких результатов необходимо, что-
бы привес фильтра составил не менее 3—5 мг. При большой за-
пыленности это достигается аспирацией 120—200 л воздуха при
скорости 10 л/мин. При незначительном содержании пыли при-
ходится протягивать значительно больший объем (до 0,5 м’), что
удлиняет время отбора проб. В случае использования фильтров
из ткани ФПП минимальный привес должен быть нс менее 1 мг,
максимальный — не более 25—50 мг.
282
Вычисление запыленности воздуха ведут следующим обра-
зом. Из массы фильтра после взятия пробы (Q) вычитают его
начальную массу (ft), т. е. определяют увеличение массы
фильтра (ДО).
Объем протянутого при аспирации воздуха приводится к нор-
мальным условиям по объединенному газовому закону:
К 273 в г; • 273 - в
И> - (273 -ь /) 1,01 -10s Па ,1ЛИ (273 + г) 760 мм рт. ст.’
где Vx — объем аспирированного воздуха, л; t — температура воз-
духа в помещении, °C; В— барометрическое давление в помеще-
ниях, где производится отбор пробы воздуха, Па или мм. рт. ст.
Массовая концентрация пыли рассчитывается по формуле:
д(2-юоо , ,
X ----V}--МГ/М ,
где 1000 — результат пересчета объема Ко (1 л = 10 3 м3).
Работа 6. Определение
дисперсного состава пыли
Оборудование: 1) фильтр из ткани ФПП-15; 2) предметное стек-
ло; 3) микроскоп; 4) водяная баня.
Реактив: ацетон.
После взвешивания с целью определения пыли в воздухе
фильтр из ткани ФПП-15 помещают на предметное стекло и
просветляют в парах ацет она (в вытяжном шкафу с соблюдением
мер противопожарной безопасности). Для этого предметное
стекло подносят к горловине колбы с ацетоном, подогреваемой
па водяной бане. Ткань фильтра быстро просветляется и тонким
прозрачным слоем плотно пристает к стеклу, фиксируя на нем
пылевые частицы.
Предметное стекло с просветленным фильтром помешают
на столик микроскопа Микроскопирование пыли ведут при
большом увеличении. Предварительно определяют цену деле-
ния окулярного микрометра, вставленного в окуляр микроско-
па. Для этого на оптический столик микроскопа помещают
объектив-микрометр и, найдя его при малом увеличении, уста-
навливают в цен грс поля зрения. Затем при большом увеличе-
нии совмещают линии объектива микрометра с линиями оку-
лярного микрометра (рис. 3.3) и, подсчитав число делений оку-
лярного микрометра до момента совпадения их с линиями
объектива-микрометра, определяют цену деления окулярного
микрометра.
Например, по рис. 3.3 видно, что при данных оптических усло-
виях 100 делений окулярного микрометра совпадают с 35-ю де-
283
2
Рис 3.3. Измерения цены деления
окулярной микрометрической линейки:
1 — окулярная микрометрическая линейка; 2 — объектив-микрометр
лениями объектива-микрометра (цена деления: 10 мкм). Следо-
вательно, одно деление окулярного микрометра равно
10 - 35 / 100 = 3,5 мкм.
После этого объектив-микрометр снимают с предметного
столика, а на его место устанавливают изучаемый препарат. Пе-
ремещая препарат в разных направлениях, подсчитывают не ме-
нее 100 пылевых частиц, определяя их размеры при помощи оку-
лярного микрометра и занося значения в таблицу Одновре-
менно дается описание морфологии пылевых частиц. При этом
отмечают их конфигурацию, характер краев и т. д. Изучение
морфологии пылевых частиц позволяет судить о составе пыли
(минеральная, растительная и др) и о возможных особенностях
ее воздействия на организм.
Работа 7. Определение
диоксида серы в лаборатории
Оборудование: 1) поглотительные склянки (поглотители); 2) со-
суд с тубусом (аспиратор); 3) резиновые трубки
Реактивы: 1) йод (0,0001 %-ый раствор йода); 2) крахмал
(0,3%-ый раствор).
Принцип метода — восстановление йода сернистым газом до
йодоводорода:
1, ь Н2О + SO, = SOj 4- 2HI.
284
Ход определения. В поглотитель (рис. 3.4) наливают поглоти-
тельный раствор объемом I мл, состоящий из смеси 0,0001 %-го
раствора йода с I—2 каплями 0,3%-го крахмала. В градуиро-
вочный сосуд с тубусом (снабженный нижним сливом) залива-
ютводуи собирают установку, показанную на рис. 3.4. Откры-
вают кран нижнего слива и со скоростью 10 мл/мин сливают
воду. При такой скорости можно легко сосчитать проходящие
через поглотительный раствор пузырьки газа. В результате это-
го создается разрежение и происходит присасывание воздуха.
Опыт проводят до исчезновения окраски поглотительного ра-
створа.
Рис. 3.4. Аспирационное устройство
Объем прошедшего через поглотитель воздуха можно опреде-
лить по объему вытекающей из аспиратора воды.
Концентрацию диоксида серы в воздухе определяют по табл. 3.2.
Таблица 3.2
Концентрация диоксиды серы
в зависимости от объема воздуха,
обесцвечивающего поглотительный раствор
Объем воздуха, мл Концентрация сернистого газа, мг/м’ Объем ноздуха, мл Концентрация сернистою газа, мг/м3
10 320 100 32
20 160 но 29
30 107 120 27
40 80 130 24
50 64 140 22
60 53 150 20
70 46 200 16
80 40 250 12
90 35 300 10
285
Работа 8. Определение хлора в лаборатории
1. Индикация с помощью индикаторной трубки. Оборудование:
1) индикаторная трубка; 2) аспиратор
Реактивы: 1) раствор реактва№ 1; 2) индикаторный порошок.
Приготовление реактивов:
а) раствор реактива № 7: берут 30 г бромида калия и 1 г карбо-
ната калия, растворяют в 100 мл дистиллированной воды и
добавляют 0,1 г флуоресцеина, предварительно растворенного
в 1 мл 10%-го раствора гидроксида калия;
б) индикаторный порошок', навеску силикагеля обрабатывают
раствором реактива № 1 из расчета 1,2 мл на 1 г силикагеля и
сушат в сушильном шкафу 30 мин.
При протягивании воздуха, содержащего хлор, через индика-
торную трубку с силикагелем, пропитанным раствором реактива
№ 1, образуется окрашенный в красный цвет слой, высота кото-
рого пропорциональна концентрации хлора.
Чувствительность метода — 0,002 мг/л. Мешают вещества,
вытесняющие бром из бромидов.
Ход определения: через индикаторную трубку, заполненную
приготовленным порошком, протягивают с помощью аспирато-
ра 300 см3 воздуха. Появление красной окраски свидетельствует
о содержании хлора — 0,002 мг/л.
2. Индикация с помощью индикаторной бумаги. Оборудование:
полоски фильтровальной бумаги.
Реактивы: раствор реактива № 2.
Приготовление реактива № 2:30 г бромида калия, 2 г карбоната
калия, 10 мл глицерина растворяют в 250 мл воды, к раствору
добавляют 0,2 г раствора флуоресцеина, растворенного в 2 мл
10%-го раствора КОН или NaOH. Полученным раствором про-
питывают полоски фильтровальной бумаги и высушивают в по-
мещении с чистым воздухом (окислители мешают определению).
Индикаторная бумага на основе флуоресцеина с бромидом
калия при контакте с хлором из желтой превращается в красную.
При концентрации 0,03 мг/л хлора розовое окрашивание появ-
ляется уже через несколько секунд.
3. Илдикация с помощью йодокрахмальной бумаги. Оборудова-
ние: полоски фильтровальной бумаги.
Реактивы: раствор индикатора (0,2%-ый раствор крахмала);
5%-ый раствор KI.
Приготовление раствора индикатора: полоски фильтроваль-
ной бумаги пропитывают смесью 5%-го раствора йодида калия и
0,2%-го раствора крахмала с последующим высуш иванием на воз-
духе Цвет приготовленных полосок бумаги должен бы i ь белым.
Реакция основана на вытеснении хлором йода из йодида ка-
лия и появлении синей окраски (или черной) при взаимодей-
ствии выделившегося йода с крахмалом.
При конце нтрации хлора 0,0014 мг/л окраска появляется че-
рез 10 мин. Бром, оксиды азота и другие окислители мешают опре-
делению.
Работа 9. Определение общей массы
растворимых и нерастворимых твердых веществ
в атмосферных осадках
Оборудование: 1) стеклянная или пластиковая посуда с пло-
щадью отверстия нс менее 50 см2; 2) химический стакан; 3) мер-
ный цилиндр; 4) сушильный шкаф; 5) аналитические весы.
Правила сбора осадков. Для сбора атмосферных осадков (дож-
дя и снега) используют чистую стеклянную или пластиковую по-
суду с площадью отверстия не менее 50 см2. Для быстрого сбора
осадков желательно применять посуду большего диаметра (на-
пример, стеклянный кристаллизатор) Посуду ставят на высоте
не менее 2 м под открытым небом на срок 2—4 недели. По исте-
чении этого срока пробы осадков собирают и по возможности
в гот же день исследуют в лаборатории.
Ход определения- Для определения твердых веществ использу-
ют метод выпаривания собранного количества осадков с после-
дующим взвешиванием полученного сухого остатка. Для этого
берут чистый сухой стакан и взвешивают его на аналитических
весах с точностью до десятитысячных долей грамма. Помещают
в него 100 мл исследуемой пробы атмосферных осадков, которые
далее выпаривают в сушильном шкафу при температуре 100—
110 С По разности масс стакана с полученным сухим остатком
и пустого стакана вычисляют массу твердых веществ в анализи-
руемой пробе:
m.^»= nv СОСТЫКОЫ ст*
Затем вычисляют массу твердых веществ, выпадающих на 1 м
поверхности Земли за месяц.
Работа 10. Определение массы
нерастворимых веществ в атмосферных осадках
Оборудование: 1) фильтры; 2) воронка; 3) коническая колба;
4) мерный цилиндр; 5) сушильный шкаф; 6) аналитические весы.
Реактивы: дистиллированная вода.
Ход определения: 100 мл атмосферных осадков отфильтровы-
вают через предварительно взвешенный чистый сухой фильтр.
Фильтр с полученным твердым осадком высушивают в сушиль-
ном шкафу при температуре 40—50 °C до постоянной массы. По
2S7
разности масс фильтра с сухим осадком и чистого фильтра вы-
числяют массу нерастворимых твердых веществ в исследуемой
пробе:
mHCJWCT К-В С ОСЧЯСПЧ ^ЧИСТОГО фнлыри '
Для получения достоверных результатов выполняют парал-
лельно холостой опыт. Для этого через предварительно взвешен-
ный сухой чистый фильтр отфильтровывают 100 мл дистиллиро-
ванной воды. Затем высушивают фильтр в сушильном шкафу
при температуре 40—50 °C и взвешивают его. Операцию высу-
шивания и взвешивания повторяют до постоянной массы, как и
с атмосферными осадками. Теоретически масса фильтра не долж-
на измениться (дистиллированная вода не содержит твердых ве-
ществ). Если разность масс тем не менее фиксируется, то эту по-
грешность учитывают при определении массы нерастворимых
веществ в исследуемых осадках.
Работа 11. Парниковый эффект
Оборудование: 1) прозрачная пластмассовая коробка или аква-
риум с крышкой; 2) пульверизатор; 3) термометр с подставкой;
4) электрическая лампа; 5) темный трунт; 6) светлый грунт.
Ход эксперимента.
1. Насыпать на дно прозрачной пластмассовой коробки или
аквариума темный грунт (песок или почву) слоем 2—3 см.
2. Увлажнить песок или почву с помощью пульверизатора.
3. Сделать из картона подставку для термометра.
4. Вкопать ее в грунт и установить на нее термометр шариком
вверх. Закрыть сосуд крышкой.
5. Установить лампу над сосудом на расстоянии 20—30 см та-
ким образом, чтобы свет падал на шарик термометра.
6. Выключив лампу, выждать, пока температура не сравняет-
ся с комнатной. Отметить эту температуру в журнале для наблю-
дений.
7. Оставив крышку на сосуде, включить лампу и записывать
температуру каждую минуту в течение 20 мин (термометр дол-
жен быть расположен так, чтобы можно было легко снимать его
показания через стенку сосуда)
8. Выключив лампу, выждать, пока температура не сравняет-
ся с комнатной. Снова увлажнить грунт и повторить опыт, сняв
крышку с сосуда.
9. Построить график, отложив по оси ординат температуру,
а по оси абсцисс — время.
10. Снова проделать ту же работу, заменив темный грунт
светлым.
Результаты оформить в виде табл. 3.3.
288
Таблица 3.3
Время, мин
Температура, 'С
без крышки
с крышкой
Ответить на вопросы.
1. Почему температура повышается, когда коробка закрыта
крышкой?
2. Сравнить этот процесс с парниковым эффектом Земли.
3. Различаются ли температурные кривые для темного и свет-
лого грунта?
4. Влияет ли на температуру воздуха увеличение облачности?
5. Как повлияет существенное повышение средней темпера-
туры на планете Земля на очертания суши?
Работа 12. Определение кислотно-основных свойств
атмосферных осадков
Оборудование: 1) иономер или pH-метр (с пофешностью из-
мерения не более 0,05 pH); 2) электрод стеклянный ЭСЛ-43-07
или аналогичный для измерения активности ионов водорода;
3) электрод сравнения хлорсерсбряный насыщенный образцо-
вый 2-го разряда по ГОС Г 17792 или аналогичный: 4) термометр
лабораторный с диапазоном измерений температуры 10—50 °C
с ценой деления ГС; 5) посуда мерная лабораторная 2-го клас-
са точности; 6) стаканы химические вместимостью 50 и 100 мл;
7) фильтры.
Реактивы-1) калий мористый, х. ч. или ч. д. а.; 2) стандарт-
титры (фиксаналы) для приготовления образцовых буферных
растворов; 3) вода дистиллированная.
Суть метода заключается в измерении разности потенциалов
селективного стеклянного электрода и хлорссребряного элект-
рода сравнения. Указанная разность потенциалов зависит от
концентрации (активности) ионов водорода в анализируемой
пробе воды.
Ход определения. Измерение pH следует проводить после от-
бора пробы. В соответствии с ИСО (TSO) 5667/3-85(2) макси-
мальное рекомендуемое время хранения пробы до начала анали-
за в лаборатории — 6 ч.
В связи с тем, что электрод сравнения заполнен насыщенным
раствором хлористого калия, измерять pH в общем объеме про-
бы нс рекомендуется во избежание загрязнения ее хлоридами.
289
Настройку pH-метра (иономера) проводят ежедневно по ин-
струкции, прилагаемой к прибору, потрем буферным растворам
с pH 4,01; 6,86; 9,18. Буферные растворы — это растворы с посто-
янным значением pH, их готовят из стандарг-титров.
Электродную пару помешают в анализируемую пробу воды.
Показания прибора считывают после прекращения дрейфа
стрелки измерительного прибора. Во время работы настройку
прибора проверяют по буферному раствору с pH 6,86. Если пока-
зания прибора при этом отклоняются от номинального значе-
ния pH более чем на 0,04 единицы, настройку по буферным
растворам покоряют. После каждого измерения электроды об-
мывают дистиллированной водой и промокают остатки воды
с их поверхности чистой фильтровальной бумагой.
По результатам измерений pH дождевой воды или талой сне-
говой воды делают вывод, какую реакцию имеют осадки в дан-
ном микрорайоне: кислую (pH < 7), нейтральную (pH = 7) или ще-
лочную (pH > 7) Кислотными можно называть осадки с pH < 5,6
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Алексеев С. В Экология. Наука и область образования: Методические ре-
комендации. — СПб.: Университет педагогического мастерства, 1994.
Большой энциклопедический словарь: Политехнический. — М Большая
российская энциклопедия, 2000.
Боровский Е. Э. Озоновый щит нэд Россией // http://archivc. Iseptewpcr.ru/
him/1998/по 34.1itm.
Вронский В. А. Экология: Оюварь-справочник. — Ростов-на-Дону. Феникс,
1999
Глобальное изменение климата Научный взгляд на проблему / Под ред.
Центра экологического здоровья. Пер. с англ. — М.: Социально-экологичес-
кий союз, 1998.
Глобальное потепление: Доклад «Гринпис* / Под ред. Дж. Лшгетта. Пер.
с англ — М Изд-во МГУ, 1993.
Голдовская Л. Ф.. Перистый В. А., Салыпевская Е. В Исследование состоя-
ния атмосферных осадков в г. Белгороде // Аэрозоли. 1998. Т. 4f. № 2. — М.;
Будапешт. С. 48.
Голдовская Л. Ф. Учебная и исследовательская работа школьников и сту-
дентов по экологии Белгородского края // Материалы научно-практической
конференции, посвященной 270-лстию Белгородской губернии. — Белгород:
Изд-во БелГУ, 1997. С. 35.
Голдовская Л. Ф., Салыпевская Е. В Дисперсный состав аэрозольных час-
тиц в районе предприятий стройиндустрии города Белгорода // Материмы V
Международной открытой межвузовской научно-практической конференции
«Региональные проблемы прикладной экологии». — Белгород: Изд-во БелГУ,
1998.С. 20
290
Goldovskaya E. E, Peristy К A. Saltcvskaya E. V., Shevtshenko V. P. Study of the
element composition of aerosols of the Belgorod town //Aerosols. 1998. 4e №. 5. —
Moscow; Budapest. P. 208.
Голдовская JI Ф., Перистый В. А., Плетнев M Ю К проблеме химического
загрязнения окружающей среды. Выход один: сделать экономику экологич-
ной // Экология человека. 2000. № 3. С. 70.
Голдовская Л. Ф., Заморозова Г И Преемственность исследовательской ра-
боты на этапах школа—вуз // Материалы региональной научно-практической
конференции «Преемственность в образовании: опыт, проблемы, перспекти-
вы». — Белгород: Изд-во БелГУ, 2000. С. 220.
Голдовская Л. Ф., Перистый В. А. Вопросы экологии и научно-технический
прогресс в условиях рыночной экономики // Материалы межвузовской науч-
но-практической конференции «Экология в теории и практике». Ч. 2. — Бел-
город: Изд-во БГПИ им. М. С. Озьминского, 1993. С. 34.
Голдовская Л Ф, Перистый В А., Скачкова Е. Г.. Трубицын М А. Роль поле-
вой практики по химии в экологическом образовании студентов // Тезисы
докладов Третьей межрегиональной экологической конференции «Проблемы
экологии в практике педагогического образования и в производстве». Ч. 2. —
Белгород: Изд-во БГПУ им. М. С. Ольминского, 1994. С. 18
ГолдовскаяЛ Ф., Перистый В. А., Пальчикова Л. Ф. Экологическое образо-
вание учащихся девятых классов химико-биологического профиля // Тезисы
докладов Третьей межрегиональной экологической конференции «Проблемы
экологии в практике педагогического образования и в производстве». Ч. 3. —
Белгород: Изд-во БГПУ им. М. С. Ольминского, 1994. С. 20.
Голдовская Л Ф., Перистый В. А. О программе экспериментального курса
экологии для 9-х классов химико-биологического профиля // Тезисы докла-
дов Четвертой открытой региональной конференции «Экологические и гене-
тические аспекты флоры и фауны Центральной России». — Белгород: Изд-во
БелГУ. 1996. С. 89.
Григорьев А. А. Города и окружающая среда (космические исследования).
М., 1982.
Гудериан Р. Загрязнение воздушной среды / Пер. с англ. — М Мир, 1979.
Гурни К Парниковый эффект и глобальное потепление // Химия в России.
2000. №8. С. 18.
Зайков Г. Е., Маслов С. А , Рубайло В. Л Кислотные дожди и окружающая
среда. — М.: Химия, 1991.
Запарин В В. История черной металлургии Урала. 90-е годы XX в. — М.
Наука, 2003.
Институту металлургии и материаловедения им. А. А. Байкова 60 лег:
Сборник научных грудов//Отв ред. Н. П. Лякишев — М. ЭЛИЗ, 1998.
И. П. Бардин и металлургическая наука: Сборник научных трудов. — М.:
Металлургиздат, 2003.
Карнаухов А. Парниковая ка i астрофа // http://ww*.pcrepletru/tcx(/kamauhov
l.html [ENGI.TSHHAUT<")][KO1-8RHWINDOWS} JDOSJI1SO-8859].
Карташев А Г Введение в экологию: Учебное пособие. — Томск: Водолей,
1998.
Комиссаров Г. Г. Фотосинтез: физико-химический подход. — М_: Едитори-
ал УРСС, 2003.
291
Критерии отнесения опасных отходов к классу опасности для окружаю-
щей природной среды. Утверждены приказом МПР России от 15 июня 2001 г.
№ 5l 1. — М., 2001.
Ларин И. К. Современное состояние исследований озонового слоя Земли //
hnp://www/ozoncprotect ton.nj/ozone4/slide(X)01 .htm.
Лозановская И. Н., ОрловД. С., Садовникова Л. К. Экология и охрана био-
сферы при химическом загрязнении. — М.: Высшая школа. 1998.
Малая медицинская энциклопедия: В 6 г. / АМН СССР. Гл. рсд. В. И. По-
кровский. — М.: Советская энциклопедия, 1991.
Мамедов 11 М., Суравегина И. Г. Экология. — М. Школа-Пресс, 1996.
Мирошников А. Б., Петина В. И. Влияние внешних и внутренних источни-
ков загрязнения атмосферы на территорию Белгородской области При транс-
граничном переносе загрязняющих веществ // Материалы международной
научно-практической конференции «Юг России в прошлом и настоящем: ис-
тория, экономика, культура». — Белгород: Изд-во БелГУ, 1998. С. 171.
Морозов В. Г., Фетисов Ю. К. Молекулярная физика. — М.: МИРАЭ, 1999.
На пути к устойчивому развитию России // Бюлл. Центра экологической
политики России. 1999. №7(11).
Небел Б. Наука об окружающей среде: Как устроен мир: В 2 т. Т. 1. Пер.
с англ. — М.: Мир, 1993.
Небел Б. Наука об окружающей среде: Как устроен мир: В 2 т. Т. 2. Пер.
с англ. — М.: Мир, 1993.
Новых Л. Л. и др. Проблемы кислотных осадков на территории Белгород-
ской области // Тезисы докладов Третьей межрегиональной экологической
конференции «Проблемы экологии в практике педагогического образования
и в производстве». Ч I. — Белгород: Изд-во Б1 НИ им. М. С. Ольминского
1994. С. 31.
Нормативные данные по предельно допустимым уровням загрязнения вред-
ными веществами объектов окружающей среды: Справочный материал. —
СПб.: Научно-технический центр«АМЕКОС» АО НИИ «Буревестник», 1993.
Обухов А. М. Контроль чистоты воздушного океана. — М . 1982.
Общая химия. Биофизическая химия. Химия биогенных элементов / Под.
рсд. Ю. А. Ершова. — М.: Высшая школа, 1993.
Охрана труда и экологическая безопасность в химической промышленно-
сти: Учебник для вузов / А. С. Бобков, А. А. Блинов, И. А. Роздан. Е. И. Хаба-
рова. — М.: Химия, 1997.
Панов Б. С. О проблеме защиты озонового слоя Земли // http://www.mine.
dgtu.donclsk.una/fm/cco891/5 html.
Перечень и коды веществ, загрязняющих атмосферный воздух. — СПб.:
Петербург — XXI век, 2000.
Перистый В. А., Голдовская Л. ф. Вопросы экологии в преподавании курса
химической технологии // Материалы межвузовской научно-практической
конференции «Экология в теории и практике». Ч. 11. — Белгород: Изд-во
БГПИ им М. С. Ольминского, 1993. С. 36.
Перистый В. А., Голдовская Л. Ф Экологические аспекты изучения соедине-
ний серы в курсах неорганической химии и химической технологии // Тезисы
докладов 111 .Межрегиональной экологической конференции «Проблемы эко-
логии в практике педагогического образования и в производстве». Ч. 2. — Бел-
город: Изд-во БГПУ им. М. С. Ольминского, 1994. С. 60.
292
Пивоваров Ю. И. Руководство к забора горным занят иям по гигиене и осно-
вам экологии человека — М.: ИКАР, 1998.
Пиментел Дж., Ку нрав) Дж. Возможности химии сегодня и завтра / Пер.
с англ. — М.: Мир, 1992.
Повестка дня на XXI век и другие документы конференции в Рио-де-Жа-
нейро / Составитель Майкл Кшинг. — Женева: Центр «За паше общее буду-
щее», 1993.
Ревелль 11., Ревелль Ч. Среда нашего обитания В 4 кн Кп. 2. Загрязнение
воды и воздуха / Пер. с англ. — М.: Мир. 19.95.
Ревелль П., Ревелль Ч. Среда нашего обитания: В 4 кн. Кн. 3. Энергетиче-
ские проблемы человечества / Пер. с англ. — М_: Мир, 1995.
Ревелль П., Ревелль Ч. Среда нашего обитания: В 4 кн. Кн. 4 Здоровье и
среда, в которой мы живем / Пер. с англ. — М.: Мир, 1995.
Реймерс Н. Ф., Я&оковА В. Словарь терминов и попя гий, связанных с охра-
ной живой природы. — М.: Наука. 1982.
Роун Ш Озоновый кризис. Пятпадцатилстняя эволюция неожиданной
глобальной опасности / Пер. с англ. — М.: Мир, 1993.
Скурлатов Ю. И. Дука Г Г., Мазити А. Введение в экологическую хи-
мию. — М.: Высшая школа, 1994.
Соколов Р. С. Химическая тсхнолш ия: В 2 т. Т. 1. — М.: Гуманитарный из-
дательский центр ВЛАДОС. 2000.
Саловьянов А. А. Озоновый кризис и Монреальский протокол // http://www
eco)og.spb.ru/Conimittec/AASolovyanov/Ozonc20.hUTi.
Состояние окружающей природной среды Белгородской области в 1995,
1996, 1997, 1998.1999.2000 it. — Белгород; Государственный комитет по охра-
не окружающей среды Белгородской области. 1996—2001.
Справочник: Химия. 2-е изд. / Пер. с нем. — М.: Химия, 2000.
Фелленберг Г. Загрязнение природной среды. Введение в экологическую
химию / Пер. с нем. — М.: Мир, 1997.
Фролов А. К. Окружающая среда крупного города и жизнь растений в нем. —
СПб.: Паука. 1998.
Фролов Ю. Г. Курс коллоидной химии. Поверхностные явления и дисперс-
ные системы. — М.: Химия, 1982.
Химия и общество / Пер. с англ. — М.: Мир, 1995.
Химия окружающей среды / Пер. с англ. Под рсд. А. П. Цыганкова. — М.:
Химия, 1982.
Химия: Большой энциклопедический словарь / Гл. ред. И. Л. Кнунянц. — М.:
БРЭ, 1998.
Чернова Н. М.. Былова А. М. Экология. — М.: Просвещение. 1988.
Щукин Е. Д., Перцов А В., Амелина Е. А. Коллоидная химия. — М : Изд-во
МГУ, 1982.
Экологическая химия / Пер. с нем. Под ред. Ф Корте. — М.: Мир. 1997.
Экологические проблемы России / Под ред. ?\. В. Яблокова, В. М. Захаро-
ва. — М.: Центр эколошческой политики России, 1999.
Эколошя родного края / Нод рсд. Т. Я. Ашнхминой. — Киров: Вятка, 1996.
Экология России: Хрестоматия / Сост. В Н Кузнецов. — М.: АО «МДС»,
1996.
.Экое//Официальный вестник Госкомэкологии России. 1999 № 1—2.
ОГЛАВЛЕНИЕ
Предисловие......................................................3
Введение....................................................... 9
1. Что изучает экология?......................................9
2. Краткая история развития экологии........................ 10
3. Структура современной экологии............................15
Глава 1. Предмет и основные понятия экологической химии..........21
1.1. Химическая экология и экологическая химия...............21
1.2. Загрязнение окружающей среды............................24
1.3. Химические загрязняющие вещества, их источники
и распространение в биосфере................................. 28
1 4 Классификация веществ по характеру воздействия
на живые организмы..........................................32
1.5. Экологические стандарты и нормативы.....................47
1.6. Химические элементы биосферы............................53
1.7. Естественные биогеохимические циклы и их антропогенные
изменения................................................. 62
Г л а в а 2. Атмосфера..........................................68
2.1. Строение атмосферы......................................68
2.2. Химический состав атмосферы..,..........................69
2.3. Биологическая роль воздуха..............................71
2.4 Источники загрязнения атмосферы..........................75
2.4.1. Теплоэнергетика...................................77
2.4.2. Автотранспорт.....................................86
2.4.3. Горно-добывающая и металлургическая промышленность... 91
2.4.4. Нефтеперерабатывающая и нефтехимическая
промышленность..........................................103
1.4.5. Химическая промышленность....................... 107
2.4.6. Промышленность строительных материалов...........111
2.5. Воздействие основных загрязнителей воздуха па живые
организмы............................................... 118
2.5.1. Оксиды углерода............................... 118
2.5.2. Оксиды серы................................. 127
2.5.3. Оксиды азота. Фотохимический туман ............ 150
2.5.4. Аэрозоли....................................... 167
294
2.6. Глобальные экологические проблемы атмосферы...........200
2.6.1. Парниковый эффект (глобальное потепление).......201
2.6.2. Кислотные осадки................................220
2.6.3. Разрушение озонового слоя .................... - 239
2.7. Зашита атмосферы от химического загрязнения.......... 264
Г л а в а 3. Практические работы по теме «Атмосфера»...........273
3.1. Методические указания..................................273
3.2. Содержание практических работ.........................273
Работа 1. Определение концентрации паров бензина в воздухе... 273
Работа 2. Экспресс-метод определения углекислого газа
в воздухе.............................................275
Работа 3. Оценка чистоты атмосферного воздуха по величине
автотранспортной нагрузки.....................---.....277
Работа 4. Определение запыленности воздуха........... 279
Работа 5. Определение содержания пыли в воздухе........280
Работа 6. Определение дисперсного состава пыли.........283
Работа 7. Определение диоксида серы в лаборатории......284
Работа 8. Определение хлора в лаборатории..............286
Работа 9. Определение общей массы растворимых
и нерастворимых твердых веществ в атмосферных
осадках...............................................287
Работа 10-Определение массы нерастворимых веществ
в атмосферных осадках................................. 287
Работа 11. Парниковый эффект....................-......288
Работа 12. Определение кислотно-основных свойств
атмосферных осадков.................................-.289
Библиографический список .....................................290
Учебное издание
Голдовская Лидия Федотовна
ХИМИЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Учебник для вузов
Зав. редакцией капа, хим наук Т. И. Почкаева
Ведущий редактор Л. А. Левченкова
Художник// М. Иванов
Корректор Г. И. Синяева
Компьютерная верстка А. А. Чаяновой
Подписано в печать 10.12.04. Формат 60x84’/,е. Бумага офсетная.
Гарнитура «Ньютон». Печать офсетная. Бум. л 9,25. Псч. л 18,50.
Изд. № 15/10063. Тираж 1500. Заказ № 1’160
Издательство «Мир»
Министерства культуры и массовых коммуникаций РФ.
107996, ГСП-6, Москва, 1-й Рижский пер., д. 2
Отпечатано с готовых диапозитивов
в ФГУП ИПК «Южный Урал»
460000, г. Оренбург, пер. Свободина, 4