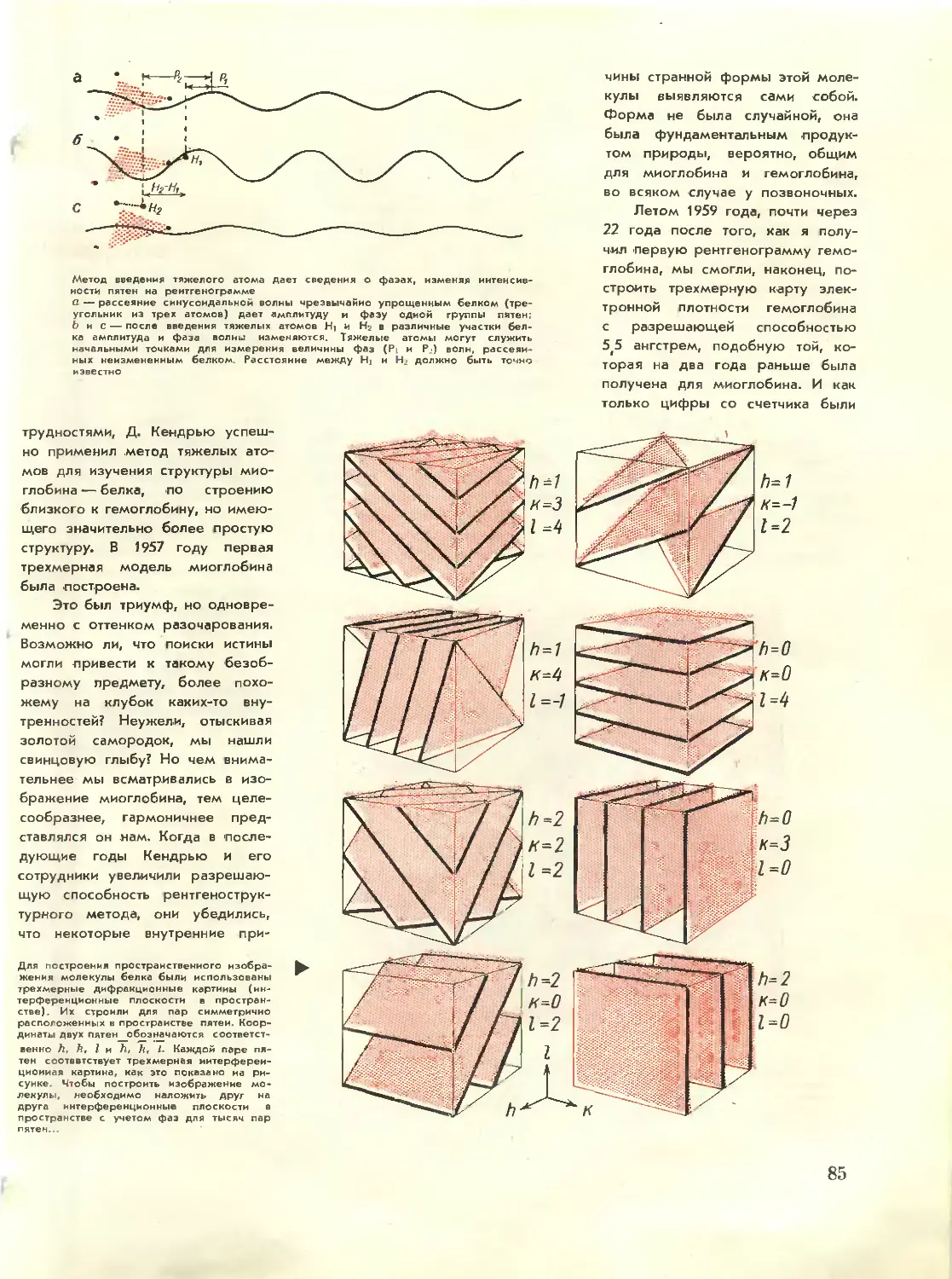
Text
ЭСШЧ/IUFI
(В
Z
С
ш
I
а
2
i 1Q65
В этом номере: Q. "^v*-*
ОС
Самое необыкновенное вещество— ц
обыкновенная вода р
Что такое жажда? 2
Рассказ о яде, который стал лекарством Q
т
Продолжаем спор о творчестве у
Митчел Уилсон о «резиновом человеке» 2*
Фантастика X
номере:
И. В. ПЕТРЯНОВ. Самое необыкновенное вещество . . 2
Э. О. ЛЕОНИДОВ. Вода и серебро: факты и
предостережения 13
Г. С. МОРГУНОВА. Вода, которую мы пьем . . . . ! 15
Л. И. ЭЛЬПИНЕР. Нужна пресная вода! 17
Ю. ДРУГОВ, И. ЕФИМОВ. Вода — жизнь 19
П. А. ПРОСЕЦКИЙ, Жажда — что это такое? 20
Почему человечеству будет нужна тяжелая вода? . . 22
Семь способов обеззараживания воды 24
Л. ГУМИЛЕВСКИЙ. Зинин (главы из повести) 28
Б. Г. ГИНЗБУРГ. С анилина началась промышленность
органического синтеза 34
В. Н. ЛИСИЦЫН. Реакция, вошедшая в историю науки 36
И. Е. КИСИК Кураре 38
А. И. КИТАЙГОРОДСКИЙ. Пути и цели 44
Еще одна тайна вырвана у природы 49
Б. А. КРЕНЦЕЛЬ, В. Н. ПАВЛОВ. Полимеры от «А» до «Я» 50
Краткая энциклопедия синтетических материалов ... 54
Г. Л. СЛОНИМСКИЙ. Старые материалы и новые
направления науки 60
Митчел Уилсон об ученых и изобретателях 62
Б. И. КАЗАКОВ. Молибден 66
Ф. ХОЙЛ. Черное облако (глава из повести) .... 74
М. Ф. ПЕРУТЦ. Молекула гемоглобина . 80
«Цели не столь химерические» 89
Хотите подготовиться к экзаменам получше? .... 90
Ю. С. МУСАБЕКОВ. Русский химик-самоучка
Ю. ШИШИНА. В новом измерении . . . -
92
95
На обложке:
2-я страница —фотоэтюд А. Лидова
3-я страница —рисунки 3. Яворского
До 3
1965
НАУЧНО-ПОПУЛЯРНЫЙ
ЖУРНАЛ
АКАДЕМИИ НАУК СССР
самое
необыкновенное
вещество
.о
I. ЧТО ТАКОЕ ВОДА!
Такой вопрос может показаться не
только странным, но и немного
невежливым. Кто же этого может не знать?
Всякий знает, что вода — это соединение
водорода и кислорода. Ее всем известная
формула-
ТО
Разберемся, прежде всего, в этой
формуле.
Сколько существует
различных водородов!
В природе существуют три различных
водорода — три изотопа. Самый легкий —
Н1. Химики часто называют его протием.
2
Член-корреспондент АН СССР
И. В. ПЕ7РЯНОВ
J
Водород в «обычной» воде почти нацело
состоит из протия. Кроме него во всякой
воде есть тяжелый водород — дейтерий Н2,
его чаще обозначают символом D.
Дейтерия в воде очень мало. На каждые
6700 атомов протия в среднем приходится
только один атом дейтерия. Не следует
думать, что это так уж мало. В природе часто
малые причины вызывают большие
последствия. Кроме протия и дейтерия,
существует еще сверхтяжелый водород Н3. Его
обычно называют тритием и обозначают
символом Т. Тритий радиоактивен, период
его полураспада немного больше 12 лет.
Он непрерывно образуется в стратосфере
под действием космического излучения.
Количество трития на нашей Земле
исчезающее мало — меньше одного килограмма
на всем земном шаре; но, несмотря на это,
его можно обнаружить в любой капле
воды.
Недавно ученые заподозрили, что
возможно существование четвертого изотопа
Н4 и даже пятого Н5. Они тоже должны
быть радиоактивны.
Сколько существует
различных кислородов!
В природе найдены три различных
изотопа кислорода. Больше всего легкого
кислорода О16, значительно меньше тяжелого
О18 и совсем мало кислорода О17. В
кислороде воздуха, которым мы дышим, на
каждые десять атомов О17 приходится 55
атомов О18 и более 26 000 атомов изотопа О16.
Физики создали в ускорителях и
реакторах еще четыре радиоактивных изотопа
кислорода: О14, О15, О19 и О20. Все они
живут очень недолго и через несколько
минут распадаются.
Сколько может быть
различных вод!
Если подсчитать все возможные
соединения с общей формулой Н20, то
окажется, что всего могут существовать сорок
две разные воды. Из них тридцать одна
вода будет радиоактивной, но и
стабильных устойчивых вод будет тоже немало —
девять:
Н2016, Н20", H2Oig, HDO16, HDO*7,
HDO18, D2016, D2017, D2018.
Если же подтвердится сообщение о том,
что существуют еще два сверхтяжелых
изотопа водорода Н4 и Н5, то будут
возможны уже сто пять типов молекул воды.
Где бы в мире ни зачерпнуть стакан
воды, в нем всегда окажется смесь
молекул, неодинаковых по изотопному составу.
Конечно, вероятность образования молекул
с разным изотопным составом далеко не
одинакова. Молекулы с двумя или сразу с
тремя редко встречающимися изотопными
атомами будут так редки и их будет так
мало, что, по мнению физи'ков, такие воды
пока можно не принимать во внимание.
3
Что такое
обыкновенная вода!
Такой воды в мире нет. Нигде нет
обыкновенной воды. Она всегда
необыкновенная. Даже по изотопному составу вода в
природе всегда различна. Он зависит от
истории воды — от того, что с ней
происходило в бесконечном многообразии ее
круговорота в природе.
При испарении вода обогащается про-
тием, и вода дождя поэтому отлична от
воды из озера. Вода из реки не похожа на
морскую воду. В закрытых озерах вода
содержит больше дейтерия, чем вода
горных ручьев. В каждом источнике свой
изотопный состав воды.
Когда зимой замерзает вода в озере,
изотопный состав льда меняется: в нем
уменьшилось содержание тяжелого
водорода, но зато повысилось количество тяжелого
кислорода. Поэтому вода из растаявшего
льда уже отличается от той воды, которая
замерзла. Если воду разложить, а потом
сжечь добытый из нее водород, то
получится снова вода, но совсем другая,
потому что в воздухе изотопный состав
кислорода отличается от среднего изотопного
состава кислорода воды. (Но зато, в
отличие от воды, изотопный состав воздуха
один и тот же на всем земном шаре.) Вода
в природе вечно меняется...
Что такое
легкая вода!
Это та самая вода, формулу которой
знают все школьники — Н2О16. Но такой
воды в природе нет. Ее с огромным
трудом приготовили ученые для точного
измерения свойств воды, в первую очередь для
измерения ее плотности. Пока такая вода
существует только в нескольких
крупнейших лабораториях мира, где изучают
свойства различных изотопных соединений.
Что такое
тяжелая вода!
И этой воды в природе нет. Строго
говоря, нужно было бы называть «тяжелой»
воду, состоящую только из одних тяжелых
изотопов водорода и кислорода — воду
D2O18. Но такой воды нет даже в
лабораториях. Она еще никому не нужна и
незачем ее готовить.
В науке и ядерной технике принято
условно называть «тяжелой водой»
тяжеловодородную воду. Она содержит только
дейтерий, в ней совсем нет обычного лег- \
кого изотопа водорода. Изотопный состав
кислорода в этой воде соответствует
обычному составу кислорода воздуха.
Бывает ли полутяжелая вода?
Полутяжелой водой можно назвать воду с
молекулами HDO. Она есть во всякой природной
воде, но получить ее в чистом виде
невозможно, потому что в воде всегда
протекают реакции изотопного обмена. Атомы
изотопов водорода очень подвижны и
непрерывно переходят из одной молекулы в
другую. Приготовить воду, средний состав
которой будет соответствовать формуле
полутяжелой воды, нетрудно. Но, в
действительности, благодаря реакции обмена
2HD0 ^ Н20 + D20
она будет представлять собой смесь
молекул с разным изотопным составом: НгО,
HDO, D20.
Что такое
«нулевая» вода!
Нулевая вода состоит из чистого
легкого водорода и кислорода воздуха. Эту воду
физико-химики выбрали в качестве
эталона: у нее очень постоянный состав. Ее не
так уж трудно получать и с ней удобно
сравнивать воду неизвестного состава:
определив разницу в плотности, легко найти
содержание дейтерия.
Кроме всех перечисленных вод, еще
существует тяжелокислородная вода — НгО18.
Получить ее из природной воды очень
сложно и трудно. Эту воду в чистом виде
еще, пожалуй, никто не сумел
приготовить. Но тяжелокислородная вода очень
нужна для исследования многих
биологических и химических процессов, поэтому
довольно концентрированные растворы
этой воды в воде обычной получают
теперь на заводах.
Существует ли
радиоактивная вода!
Да. Тритиевую воду получают
искусственным путем, в атомных реакторах. Из-за
сильной радиоактивности эта вода очень
опасна и нужна пока только для научных
целей.
4
Много ли разных вод
содержится в воде!
Смотря в какой. В той, что льется из
водопроводного крана, куда она пришла из
реки, тяжелой воды D2016 около 150 г на
тонну, а тяжелокислородной (Н2017 и Н2018
вместе) почти 1800 г на тонну воды. В воде
из Тихого океана тяжелой воды почти 165 г
на тонну. В тонне льда одного из больших
ледников Кавказа тяжелой воды на 7 г
больше, чем в речной воде, а
тяжелокислородной воды столько же. Но, зато в воде
ручейков, бегущих по этому леднику,
D2016 оказалось меньше на 7 г, а Н2Ь18 —
на 23 г больше, чем в речной.
Тритиевая вода Т2016 выпадает на
землю вместе с осадками, но очень мало,
всего лишь 1 г на миллион миллионов тонн
дождевой воды. В океанской воде ее еще
меньше.
В чем же различие
между легкой, природной
и тяжелой водами!
Ответ на этот вопрос будет зависеть от
того, кому он задан. Каждый из нас не
сомневается, что с водой-то он знаком хорошо.
Если показать нам три стакана с обычной,
тяжелой и легкой водой, то каждый даст
совершенно четкий и определенный ответ:
во всех трех сосудах — простая чистая
вода. Она одинаково прозрачна и
бесцветна. Ни на вкус, ни на запах нельзя найти
разницу между содержимым трех
стаканов. И это будет верно. Это все — вода.
Химик ответит почти так же: между
ними нет почти никакой разницы. Все
химические свойства трех вод почти
неразличимы: в каждой из них натрий будет
одинаково выделять водород, каждая будет
одинаково разлагаться при электролизе, все их
химические свойства будут почти
совпадать. Это и понятно: ведь химический
состав вещества в трех стаканах одинаков. Это
вода.
Физик не согласится. Он укажет на
заметную разницу в их физических
свойствах: и кипят и замерзают они при
различных температурах, плотность у них разная,
а упругость их пара тоже немного
различна. Правда, все эти различия малы.
Изменения в изотопном составе очень мало
влияют на физические свойства вещества.
Биолог, пожалуй, станет втупик — для
него вопрос о различии между водами с
разным изотопным составом еще не
решен. Еще совсем недавно считали, что в
тяжелой воде живые существа не могут
жить. Ее даже мертвой водой называли. Но
оказалось, что если очень медленно,
постепенно заменять в воде, где живут
некоторые микроорганизмы, протий на
дейтерий, то можно их приучить к тяжелой воде,
и они будут в ней неплохо жить и
развиваться. А обычная вода станет для них
вредной.
Кому нужна
тяжелая вода!
Всему человечеству. Мы уже подходим
к порогу, за которым появится совершенно
реальная угроза: ресурсов химического
топлива — нефти, газа, угля хватит очень
не надолго. И все надежды связаны с
будущим термоядерной энергетики.
Ее топливо — это тяжелая вода. Для
рассказа о ней нужна отдельная большая
статья. По всей вероятности, в ее конце
стоял бы вопрос — на сколько времени
хватит человечеству энергии, скрытой в воде?
И ответ на него: при таком росте
энергетики, которой мы в состоянии предвидеть,
не менее чем на миллиард лет.
II. СВОЙСТВА ВОДЫ
Почему вода — вода!
Этот вопрос совсем не так неразумен,,
как может показаться. В самом деле,
разве вода — это только та бесцветная
жидкость, что налита в стакан?
Океан, покрывающий почти всю нашу
планету, всю нашу чудесную Землю, в
котором миллионы лет назад зародилась
жизнь — это вода. Тучи, облака, туманы,
несущие влагу всему живому на земной
поверхности,— это тоже вода. Бескрайние
ледяные пустыни полярных областей,
снеговые покровы, застилающие почти
половину планеты — и это вода. _
Прекрасно, невоспроизводимо
бесконечное многообразие красок солнечного
заката, его золотых и багряных переливов,
торжественны и нежны краски небосвода
при восходе солнца... Это обычная и всегда
5
необыкновенная симфония цвета. обязана
рассеянию и поглощению солнечного
спектра водяными парами в атмосфере. Этот
великий художник природы — вода.
Великие горные цепи сложены
гигантскими толщами сотен различных горных
пород, и многие из них созданы
величайшим строителем природы — водой.
Непрерывно изменяется облик Земли. На месте,
где возвышались высочайшие горы,
расстилаются бескрайние равнины... Их создает
великий преобразователь — вода.
Безгранично многообразие жизни. Она
всюду на нашей планете. Но только там,
где есть вода.
Почему же одно из бесчисленных
химических соединений с простой и ничем не
примечательной формулой, состоящее из
двух обычных для мироздания элементов,
с молекулой всего из трех атомов —
простая окись водорода, самая обычная
вода,— почему она играет такую роль в
природе? Чем объясняется эта
исключительная роль воды?
Среди необозримого множества
веществ вода с ее физико-химическими
свойствами занимает совершенно особое,
исключительное место. И это надо понимать
буквально. Почти все физико-химические
свойства воды — исключение в природе.
Она действительно самое удивительное
вещество на свете. Она удивительна не
только многообразием изотопных форм
молекулы и не только надеждами, которые
связаны с ней, как с источником энергии
будущего. Она удивительна своими самыми
обычными свойствами.
Как построена
одна молекула воды!
Это известно очень точно. Она
построена вот так:
Хорошо изучено и измерено взаимное
расположение ядер атомов водорода и
кислорода и расстояние между ними.
Оказалось, что вместе с электронными
оболочками атомов, молекулу воды, если на
нее взглянуть с<сбоку», можно было бы
изобразить так:
:^Ш
А если взглянуть «сверху» со стороны
атома кислорода, то так:
Значит взаимное расположение зарядов
в молекуле воды можно изобразить в виде |
тетраэдра.
При таком строении взаимное
притяжение молекул воды необычайно сильно:
каждая молекула воды может образовать
четыре одинаковых «водородных» связи с
другими молекулами воды.
6
Все молекулы воды с любым изотопным
составом построены совершенно
одинаково.
А молекула льда? Никаких особых
молекул льда нет. В куске гГЬда молекулы
соединены так, что каждая из них связана
и окружена четырьмя другими
молекулами. Это очень рыхлая структура, в которой
остается много свободного объема.
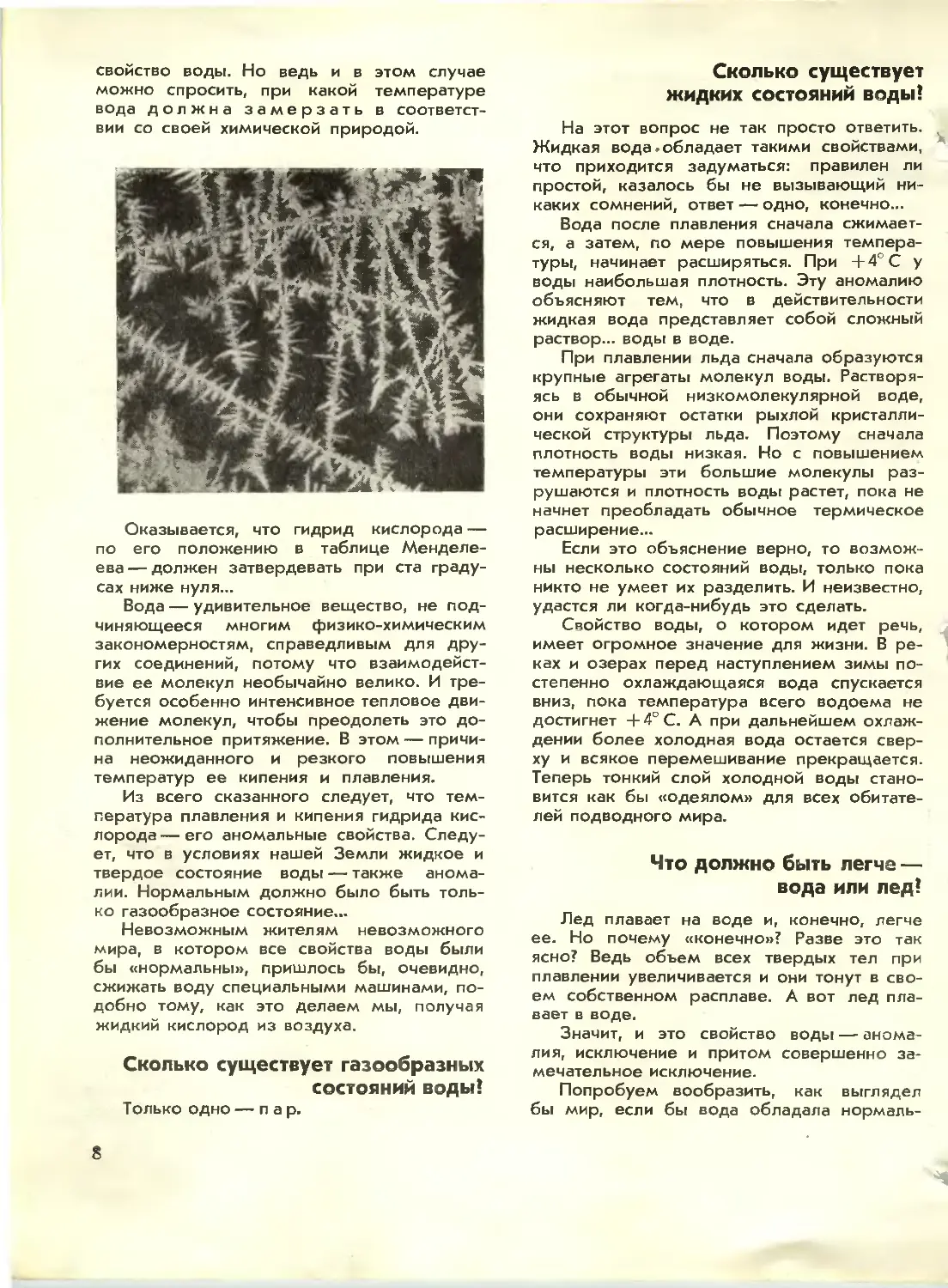
Правильное кристаллическое строение льда
выражается в изяществе снежинок и в
красоте морозных узоров на замерзших
оконных стеклах.
Как расположены
молекулы воды в воде?
К сожалению, этот очень важный
вопрос изучен далеко не достаточно.
Строение молекул в жидкой воде очень сложно.
Когда лед плавится, его сетчатая структура
частично сохраняется в образующейся
воде. Молекулы в талой воде состоят из
многих простых молекул — это агрегаты,
сохраняющие свойства льда. При
повышении температуры часть агрегатов
распадается, их размеры становятся меньше.
Взаимное притяжение ведет к тому, что
средняя величина сложной молекулы воды
в жидкой воде значительно больше, чем
размеры одной молекулы воды. Такое
необычайное молекулярное строение
обусловливает необычные физико-химические
свойства воды.
При какой температуре
вода должна кипеть?
Этот вопрос, вероятно, покажется
странным. Вода кипит при ста градусах,— это
знает каждый. Больше того, всем известно,
что именно температура кипения воды
выбрана в качестве опорной точки
температурной шкалы и условно обозначена 100° С.
Однако вопрос поставлен иначе: при
какой температуре вода должна кипеть?
Ведь температуры кипения различных
веществ не случайны. Они зависят от
положения элементов в периодической системе.
Чем меньше атомный номер элемента,
чем меньше его атомный вес, тем ниже
температура кипения его соединений. Вода
по химическому составу может быть
названа гидридом кислорода. НгТе, НгБе и H2S —
химические аналоги воды. Если проследить
за температурами их кипения и
сопоставить, как изменяются температуры кипения
гидридов в других группах периодической
системы, то можно довольно точно
определить температуру кипения любого гидрида,
так же как и любого другого соединения.
Сам Менделеев таким способом
предсказал свойства химических соединений еще
не открытых элементов.
Если определить температуру кипения
гидрида кислорода по положению
кислорода в периодической таблице, то окажется,
что вода должна кипеть при восьмидесяти
градусах ниже нуля... Значит, вода кипит
приблизительно на сто восемьдесят
градусов выше, чем должна кипеть.
Температура кипения, наиболее обычное свойство
воды, оказывается необычайным и
удивительным.
Можно представить себе; что если бы
наша вода потеряла вдруг способность
образовывать сложные, ассоциированные
молекулы, то она, вероятно, кипела бы при
той температуре, какая ей положена в
соответствии с периодическим законом.
Океаны закипели бы, на Земле не осталось ни
одной капли воды, а на небе никогда
больше не появилось ни одного облачка...
При какой температуре
вода замерзает!
И этот вопрос может вызвать
недоумение. Каждый знает, что вода замерзает при
нуле градусов. Это вторая опорная точка
термометра, фиксирующая самое обычное
7
свойство воды. Но ведь и в этом случае
можно спросить, при какой температуре
вода должна замерзать в
соответствии со своей химической природой.
Оказывается, что гидрид кислорода —
по его положению в таблице
Менделеева— должен затвердевать при ста
градусах ниже нуля...
Вода — удивительное вещество, не
подчиняющееся многим физико-химическим
закономерностям, справедливым для
других соединений, потому что
взаимодействие ее молекул необычайно велико. И
требуется особенно интенсивное тепловое
движение молекул, чтобы преодолеть это
дополнительное притяжение. В этом —
причина неожиданного и резкого повышения
температур ее кипения и плавления.
Из всего сказанного следует, что
температура плавления и кипения гидрида
кислорода — его аномальные свойства.
Следует, что в условиях нашей Земли жидкое и
твердое состояние воды — также
аномалии. Нормальным должно было быть
только газообразное состояние-
Невозможным жителям невозможного
мира, в котором все свойства воды были
бы «нормальны», пришлось бы, очевидно,
сжижать воду специальными машинами,
подобно тому, как это делаем мы, получая
жидкий кислород из воздуха.
Сколько существует газообразных
состояний воды?
Только одно — пар.
8
Сколько существует
жидких состояний воды?
На этот вопрос не так просто ответить.
Жидкая вода «обладает такими свойствами,
что приходится задуматься: правилен ли
простой, казалось бы не вызывающий
никаких сомнений, ответ — одно, конечно...
Вода после плавления сначала
сжимается, а затем, по мере повышения
температуры, начинает расширяться. При + 4° С у
воды наибольшая плотность. Эту аномалию
объясняют тем, что в действительности
жидкая вода представляет собой сложный
раствор... воды в воде.
При плавлении льда сначала образуются
крупные агрегаты молекул воды.
Растворяясь в обычной низкомолекулярной воде,
они сохраняют остатки рыхлой
кристаллической структуры льда. Поэтому сначала
плотность воды низкая. Но с повышением
температуры эти большие молекулы
разрушаются и плотность воды растет, пока не
начнет преобладать обычное термическое
расширение...
Если это объяснение верно, то
возможны несколько состояний воды, только пока
никто не умеет их разделить. И неизвестно,
удастся ли когда-нибудь это сделать.
Свойство воды, о котором идет речь,
имеет огромное значение для жизни. В
реках и озерах перед наступлением зимы
постепенно охлаждающаяся вода спускается
вниз, пока температура всего водоема не
достигнет +4° С. А при дальнейшем
охлаждении более холодная вода остается
сверху и всякое перемешивание прекращается.
Теперь тонкий слой холодной воды
становится как бы «одеялом» для всех
обитателей подводного мира.
Что должно быть легче —
вода или лед?
Лед плавает на воде и, конечно, легче
ее. Но почему «конечно»? Разве это так
ясно? Ведь объем всех твердых тел при
плавлении увеличивается и они тонут в
своем собственном расплаве. А вот лед
плавает в воде.
Значит, и это свойство воды —
аномалия, исключение и притом совершенно
замечательное исключение.
Попробуем вообразить, как выглядел
бы мир, если бы вода обладала нормаль-
ными свойствами и лед, как и полагается
любому нормальному веществу, был
плотнее жидкой воды. Зимой намерзающий
сверху лед тонул бы, непрерывно
опускаясь на дно водоема. Летом лед,
защищенный толщей холодной воды, не мог бы
растаять. Постепенно все озера, пруды,
реки, ручьи промерзли бы нацело,
превратившись в гигантские ледяные глыбы.
Наконец, промерзли бы моря, а за ними и
океаны. Наш цветущий мир стал бы сплошной
ледяной пустыней, кое-где покрытой
тонким слоем талой воды...
Сколько существует
льдов!
В природе, на нашей Земле — один,
обычный лед, самый прекрасный из
минералов. Никакие алмазы не могут
сравниться блеском и красотой со снежинками,
искрящимися на солнце. Льдом — голубовато-
зеленым камнем сложены горы, им покрыт
целый материк. Лед — горная порода с
необычными свойствами. Он твердый, но
течет как жидкость, и существуют огромные
ледяные реки, медленно стекающие с
высоких гор. Лед изменчив — он непрерывно
исчезает и образуется вновь. Лед
необычайно прочен и долговечен — десятки
тысячелетий хранит он в себе без изменений
тела мамонтов, случайно погибших в
ледниковых трещинах.
Но кроме этого льда в лабораториях
открыты еще по крайней мере шесть
различных, не менее удивительных льдов,
которых нет в природе. Они существуют
только при очень высоких давлениях.
Обычный лед сохраняется до давления
в 2115 атмосфер, но при этом давлении
плавится при —22° С. Когда давление
превышает 2115 ат, образуется плотный лед —
лед III. Он тяжелее воды и тонет в ней.
Если понизить температуру и довести
давление до 3000 ат, то получится еще более
плотный лед II. Давление сверх 5000 ат
превращает лед в лед V — его можно
нагреть почти до 0° С, и он не растает. При
давлении около 20 000 ат появляется
лед VI. Это буквально горячий лед — он
выдерживает, не плавясь, температуру
+ 80° С. Лед VII, обнаруженный при
давлении 40 000 ат, можно, пожалуй, назвать
раскаленным льдом. Это самый плотный и
тугоплавкий из известных льдов. Он
плавится только при 175 градусах выше нуля.
9
Некоторые ученые подозревают, что
существует еще неустойчивый лед IV,
быстро переходящий в лед V.
Наверно, человек сумеет в будущем
найти еще не один вид льда...
Что нужно,
чтобы лед растаял!
Очень много тепла. Больше, чем для
плавления такого же количества других
веществ (кроме нескольких металлов).
Исключительно большое значение скрытой
теплоты плавления — 80 калорий на грамм льда —
также аномальное свойство воды.
При замерзании воды такое же
количество тепла выделяется снова. Когда
появляется лед, когда выпадает снег, они
отдают тепло, которое подогревает землю и
воздух. Они противостоят холоду и
смягчают переход к суровой зиме. Именно бла-
10
годаря этому замечательному свойству
воды на нашей планете существуют осень
и весна.
Сколько тепла нужно,
чтобы нагреть воду!
Очень много. Больше, чем для
нагревания равного количества любого другого
вещества. Чтобы нагреть грамм воды на один
градус, необходима одна калория. Это
больше чем вдвое превышает
теплоемкость любого химического соединения.
И эта особенность воды имеет очень
большое значение не только при варке обеда
на кухне.
Вода — это великий распределитель
тепла на Земле. Нагретая Солнцем у экватора,
она переносит тепло в мировом Океане
гигантскими потоками морских течений в
далекие полярные области, где жизнь
возможна только благодаря этой удивительной
особенности воды.
Чтобы разделить молекулы воды,
чтобы превратить ее в пар, нужно очень много
энергии — нет ни одного вещества, у
которого скрытая теплота испарения была бы
больше, чем у воды. Вода — лучший
теплоноситель.
Вода — гигантский движитель:
подсчитано, что Солнце испаряет на Земле за одну
минуту миллиард тонн воды, и каждую
минуту миллиард тонн водяного пара
вместе с восходящими потоками нагретого
воздуха поднимается в верхние слои
атмосферы. Каждый грамм этого пара уносит с
собой 537 калорий солнечной энергии...
Эта энергия неминуемо должна
выделиться снова — превращаясь в облака,
отдавая тепло и нагревая воздух, водяной
пар каждую минуту отдает атмосфере
Земли чудовищно огромное количество
энергии:
2,2-1018 джоулей.
Чтобы выработать эту энергию за то же
время, понадобилось бы сорок миллионов
электростанций мощностью по миллиону
киловатт каждая...
Это та энергия, которая переносит
сотни миллиардов тонн воды по воздуху. Это
энергия ветров, бурь, ураганов и штормов.
Один ураган выделяет энергию,
эквивалентную тридцати тысячам атомных бомб.
Почему в море
вода соленая!
Это, пожалуй, одно из самых важных
следствий одного из самых удивительных
свойств воды. В ее молекуле центры
положительных и отрицательных зарядов
сильно смещены один относительно другого.
Поэтому вода обладает исключительно
высоким, аномальным значением
диэлектрической проницаемости.
Для воды 6 = 80, а для воздуха и
вакуума е = 1. Это значит, что два любых
разноименных заряда взаимно притягиваются друг
к другу в воде с силой в 80 раз меньшей,
чем в воздухе, так как по закону Кулона
Qi-Q2
Все межмолекулярные связи,
определяющие прочность всех тел, зависят от
взаимодействия между положительными
зарядами атомных ядер и отрицательными
зарядами электронов. На поверхности тела,
погруженного в воду, силы, действующие
между молекулами или атомами,
ослабевают под влиянием воды почти в сотни
раз.
И если оставшейся прочности связи
между молекулами недостаточно, чтобы
противостоять тепловому движению, то
молекулы или атомы начинают отрываться от
поверхности тела. Оно начинает
растворяться— либо распадаясь на отдельные
молекулы, как сахар в стакане чая, либо на
заряженные ионы, как поваренная соль.
Именно благодаря аномально высокой
диэлектрической проницаемости вода —
один из сильнейших растворителей.
Медленно и неотвратимо она разрушает даже
граниты.
Ручьи, речки и реки сносят растворенные
водой примеси в океан. Вода из океана
испаряется и вновь возвращается на землю,
чтобы снова и снова продолжать свою
вечную работу. А растворенные соли остаются
в морях и океанах.
Если бы вода не обладала
удивительным свойством — необычайно высокой
диэлектрической проницаемостью — море не
было бы соленым. Но это некому было бы
заметить — не было бы на Земле жизни.
Распадаются ли
в воде на ионы
ее собственные
молекулы!
Да, распадаются.
Молекулы воды очень
прочны, но все же очень
большая их часть
диссоциирует:
н2о = н+ + он-.
Из каждого миллиарда
молекул воды при
обычной температуре
диссоциированы всего две
молекулы.
Свободный протон
Н+ — ядро атома
водорода,— конечно, не может
существовать в водной
среде: он немедленно
присоединяется к
молекуле воды и образует ион
гидроксония НзО+.
Существует ли
чистая вода?
Если быть строгим и
точным в ответах, то
придется сказать, что нет —
чистой воды пока никто
не видал и не держал
в руках.
В воде всегда
растворены, наверное, сотни, а
может быть и тысячи
различных соединений почти
всех элементов
периодической системы. В ней
взвешены мельчайшие
нерастворимые частицы
пыли.
Много ученых
работает над решением трудной
проблемы получения абсолютно чистой
воды. Но пока еще получить такую воду не
удалось никому.
Это и понятно: налитая в сосуд вода
растворяет стекло, соприкасаясь с любым
газом она растворяет газ...
Очень тщательно очищенная вода
приобретает совершенно необычные свойства:
ее можно перегреть на десятки градусов
выше точки кипения — она не закипит, ее
можно очень сильно переохладить — она
не замерзнет.
12
Какую форму
имеет вода!
И этот вопрос поставлен совершенно
правильно. Вода обладает собственной
формой, как и любая другая жидкость. Ее
форма — шар. Утверждение учебников,
будто вода принимает форму сосуда, а
собственной не имеет — неверно. Ее
собственная форма на Земле обычно искажена
силой тяжести.
В том, что жидкости свойственна форма
шара, легко убедиться, поместив ее в
состояние невесомости. Это возможно и на
Земле: сфотографируйте падающую каплю
или хороший мыльный пузырь. И в том, и в
другом случае действие силы тяжести
исключено, и вода принимает свою
собственную форму.
Может ли вода
течь вверх!
Да, может. Это происходит всегда и
повсеместно. Сама поднимается вода вверх
в почве, смачивая всю толщу земли от
уровня грунтовых вод. Сама поднимается
вода вверх по капиллярам сосудов дерева.
Сама движется вода вверх в порах
промокательной бумаги или в волокнах
полотенца. В очень тонких трубках вода может
подняться на высоту нескольких метров...
Это объясняется еще одной
замечательной особенностью воды — ее
исключительно большим поверхностным натяжением.
Силы межмолекулярного притяжения
действуют на молекулу жидкости на ее
поверхности только в одну сторону, а у воды это
взаимодействие аномально велико.
Поэтому каждая молекула втягивается с
поверхности внутрь жидкости. Возникает сила,
стягивающая поверхность. У воды она
особенно велика: поверхностное натяжение
составляет 72 дины на сантиметр.
Эта сила и придает мыльному пузырю,
падающей капле и любому количеству
жидкости в условиях невесомости форму шара.
Она поддерживает бегающих по
поверхности пруда жуков, лапки которых водой
не смачиваются. Она поднимает воду в
почве, а стенки тонких пор и отверстий в
ней, наоборот, хорошо смачиваются водой.
Вряд ли вообще было бы возможно
земледелие, если бы вода не обладала этой
особенностью.
Все ли уже известно
о воде!
Совсем немного лет назад химики были
уверены, что состав воды им хорошо
известен. Но, однажды, одному
исследователю пришлось измерить плотность остатка
воды после электролиза. Плотность
оказалась на несколько стотысячных долей выше
нормальной...
В науке нет ничего незначительного. Эта
В серебряном сосуде вода не
портится, купели в церкви
•сделаны из -серебра, персидский
царь Кир возил воду на войне в
• серебряных чанах — таков набор
общеизвестных в наше время
аргументов в пользу «серебряной
чоды». Но автору известен слу-
ай, когда вполне современный
.молодой батюшка прибежал к
врачам советоваться — предстояло
крестить собственное чадо...
Усомнился!
Не мнительный ли
перестраховщик батюшка?
Ответ на этот вопрос интерес-
.но поискать в научной литературе.
ВОДА И СЕРЕБРО:
ФАКТЫ И ПРЕДОСТЕРЕЖЕНИЯ
В конце прошлого века
швейцарский ботаник Карл Негели
впервые описал действие слабых
растворов серебра на клетки
пресноводных водорослей. Он назвал
это явление олигодинамией.
(«Олигос» — следы, «динамис» —
действие. Действие «следов»,
крайне малых количеств).
Четкой теории процесса
построить не удалось, и долгое
время серебру приписывали даже
некую «неведомую силу». В
начале нашего столетия в Западной
Европе (Австрия, Германия)
появились публикации, авторы
которых утверждали, что
бактерицидное (губительное для бактерий)
действие серебра сказывалось
даже через воздушную
прослойку между ним и зараженной
поверхностью. Работа советского
исследователя В. Д. Славина в
1936 году опровергла э"-о чудо:
13
ничтожная разница потребовала
объяснения. И в результате стало постепенно
выясняться многое из того, о чем рассказано
в этой статье.
А началось все с простого измерения
самой обычной, будничной и неинтересной
величины — плотность воды была измерена
точнее на лишний десятичный знак...
Каждое новое, более точное измерение,
каждый новый верный расчет не только
повышает уверенность в знании и надежности
уже добытого и известного, но и
раздвигает границы неведомого и еще
непознанного, прокладывает к ним новые пути.
Нет предела человеческому разуму, нет
предела его возможностям; и то, что мы
теперь так много знаем о природе и
свойствах поистине самого необыкновенного в
мире вещества — о воде, открывает еще
большие возможности. Кто может сказать,
что еще будет узнано, что открыто
нового, еще более необычайного? Умейте
только видеть и удивляться.
Вода, как и все в мире, неисчерпаема.
Рассказ о самом обыкновенном и в то же время самом необыкновенном
веществе, который вы только что прочпи, предназначался автором — в несколько
расширенном виде — совсем для другого издания, готовящегося сейчас к печати. Его редакция
любезно разрешила нашему журналу, предназначенному в общем-то для взрослых,
напечатать эту статью.
Речь идет о «Детской энциклопедии», первое десятитомное издание которой
разошлось несколько лет назад почти полумиллионным тиражом и получило большое
международное признание — переведено и переводится во многих странах Европы, Азии
и Америки.
В настоящее время Академия педагогических наук РСФСР и издательство
«Просвещение» работают над вторым — расширенным изданием «Детской энциклопедии»
в двенадцати томах. Третий том — он называется «Вещество и энергия» — посвящен
физике и химии.
«Детская энциклопедия» — не только десять или двенадцать детских книжек. Это
популярное справочное издание, в котором и взрослые <— как нетрудно видеть на
примере рассказа о воде И. В. Петрянова — могут почерпнуть немало интересного.
Пожелаем же «Детской энциклопедии» большого успеха у юных читателей, у их
родителей и учителей.
дело было в неверной трактовке
контрольных опытов.
•В работах, посвященных
действию растворов серебра
удивителен полнейший разнобой. Одни
установили, что для бактерий
губительны только -ничтожные
количества серебра в зараженной
воде. Другие убедительными
опытами показали, что количества
эти должны быть вовсе не такими
ничтожными. Это миллиграммы
или десятые доли миллиграмма
в литре. Одни наблюдают эффект
через 10 минут. Другие видят, что
бактерии гибнут только через
несколько часов...
Кто же прав? Правы,
очевидно, все. Так в науке не бывает?
Увы, бывает, когда условия
опытов неодинаковы. В последние
'годы стало ясно, что одна и та же
доза серебра ведет себя в
отношении бактерий по-разному в
различной по химическому
составу воде. Если в воде больше
хлоридов, то серебро действует
хуже. Чем больше бактерий (на-
fipnMepf в сильно загрязненной
колодезной воде), тем слабее
действие серебра. Оказывается,
не все равно, какое серебро
ввести в воду. Ведь можно
электролитическим путем ввести в
воду ионы чистого серебра, можно
растворить азотнокислое серебро,
можно, наконец, использовать
коллоидные соединения. И
сравнение убедительно показывает,
что разные препараты действуют
неодинаково...
Многие ошибки прошлых
исследований объясняются и тем,
что стенки сосудов в которых
ученые изучали растворы,
понемногу «серебрились»,
сорбировали на себе серебро. И его
концентрация в следующем опыте
увеличивалась без ведома
экспериментаторов, потому что они...
не меняли лабораторную посуду
14
после каждого опыта. И вообще,
как это ни покажется странным,
точная методика аналитического
определения серебра в воде
появилась только в последние годы.
Ее применение позволяет теперь
судить о предмете исследования
гораздо четче.
Изменилась со временем и
бактериологическая оценка
опытов. Раньше исследователь
«пускал» в 1 литр воды 100 000
бактерий (например, кишечной
палочки), действовал той или другой
концентрацией серебра и
получал, например, такой результат
гибели бактерий: 99%. Казалось
6bif прекрасный эффект. Однако
сейчас в СССР государственный
стандарт на качество питьевой
воды допускает, чтобы в 1 литре
находилось не более трех
кишечных палочек. И результат
прежнего опыта выглядит
неутешительно, лотому что 1 %
оставшихся в живых бактерий — это
1000 штук в литре, в 333 раза
больше нормы...
Но вернемся к нашему
батюшке-перестраховщику. Что же
происходит со «святой водой», что
происходит в купелях? Происходят
вполне объяснимые вещи.
Действительно, если в литр чистой
воды ввести сотые доли
миллиграмма серебра, то (при условии
ее хранения в закупоренном
сосуде) микробы в ней we
развиваются. Но «не дай бог» они туда
попадут — и «святые свойства»
воды исчезнут: убить микробов
в уже зараженной ими воде
можно только большими дозами
серебра, Кстати, когда врачи
поинтересовались
бактериологическим загрязнением «святой» воды
в церковной утвари, результаты
оказались плачевными — рост
бактерий наблюдался во многих
пробах.
С Другой CTOpOHblf МОЖНО
предполагать, что церковники
иногда фабрикуют «святую воду»
именно с помощью увеличенных
доз серебра (растворяя
азотнокислое серебро или даже
прибегая к электролитической
диссоциации).
Тут возникает вопрос —
безвредны ли повышенные
концентрации серебра?
Специальные исследования в
этой области пока
немногочисленны. Но и сейчас санитарные
законы в некоторых странах
ограничили допустимые
количества серебра в воде весьма
малыми величинами. Например, в
США введена предельно
допустимая концентрация серебра в
шить ев ой воде 0,05 мг/л. Это
гораздо меньшее содержание серебра,
чем потребовалось бы для
обеззараживания воды! У нас
применение растворов серебра внутрь
для лечебных целей даже
запрещено Министерством
здравоохранения Украинской ССР.
Разумеется, серебряная
"посуда и столовое серебро полностью
безвредны (и, кроме того,
красивы!), так что в этом отношении
•никаких опасений возникать не
должно. Но ведь дело совсем не
только в тюсуде! Сейчас кое-кто
увлекся «самодеятельным»
получением серебряной воды электро-
|>щ ители городов давно привык-
*"■*' ли к централизованным
водопроводам и прозрачную, чистую
воду из-под крана принимают как
должное. И нам -не приходится
литическим путем.
Распространилось мнение о ее целебных
свойствах...
Хочу еще раз предупредить
каждого читателя: введение в
организм значительных количеств
серебра не безвредно! Только
врач# выбирая метод лечения,
может сопоставить вероятный его
эффект с возможным шобочным
действием препарата. Врач и
только врач!
Если в воде содержится
серебро в дозе, убивающей
бактерии, то употребление такой воды
для питья может причинить вред
здоровью.
Так что волновался батюшка
в общем-то не зря...
Э. О. ЛЕОНИДОВ
ВОДА, КОТОРУЮ
МЫ ПЬЕМ
задумываться над тем, что
гарантированная безвредность
водопроводной воды — это результат
работы сложного комплекса
сооружений результат обширной
системы научных работ в области
гигиены воды.
Биологическая роль воды
общеизвестна. Две трети
человеческого организма составляет
вода. 83,3% воды содержится
в мозге человека, 79,3%—в
крови. 76% —в мышцах, 22% —в
15
костях. Водный голод в течение
3—4 дней приводит организм к
гибели (тогда как без пищи
человек может жить гораздо дольше)
Очевидно, что качество, состав
воды также играют большую
эоль, определяя ее биологиче-
Гкую полноценность и
безвредность.
Научные взгляды в этом
отношении прошли долгую
эволюцию, начиная с Гиппократа, Ветру-
вия и других древних философов,
отличавших «здоровую» воду от
«нездоровой» по чисто внешним
признакам — запахуf цвету,
мутности, вкусу. Современная наука
о питьевой воде чрезвычайно
многообразна. В ней можно
выделить несколько основных
направлений. Одно из них связано
с изучением веществ <и живых
организмов, придающих воде
вредные, болезнетворные
свойства. Другое, наоборот, изучает
вещества, «придающие воде
биологически 'полезные свойства.
Третье «вправление — это
исследования в области превращения
вод различных источников в
питьевые.
Связь между
распространением некоторых заболеваний и
условиями снабжения водой была
замечена людьми очень давно.
Но только в 1888 г. на VI
Международном гигиеническом
конгрессе в Вене было признано
доказанным, что заразные болезни
распространяются питьевой водой.
Холерные и брюшнотифозные
эпидемии, потрясавшие Европу в
конце прошлого и начале нашего
столетия, убедительно
подтвердили этот вывод, но человечество
оплатило доказательство этой
истины ценой многих .и многих
тысяч жизней. Последняя широко
распространившаяся эпидемия
(пандемия) холеры началась в
1900 году в Индии. Паломники
занесли ее в Мекку откуда она
распространилась по Египту и,
унеся более 30 000 жертв,
перебросилась в Европу и Азию.
Лишь в 1924—1926 гг. эпидемия
закончилась на Дальнем Востоке.
В наше время перечень
заразных болезней, передаваемых
через воду, включает паратифы,
дизентерию, инфекционный
вирусный гелатит (болезнь Боткина),
туляремию, бруцеллез, лихорадку Ку.
Некоторые «исследования
указывают на возможность заражения
через воду туберкулезом и
полиомиелитом.
Откуда же попадают в воду
микробы —возбудители
инфекций? Прежде всего с
выделениями больных людей и животных.
При изучении водных эпидемий
чаще всего обнаруживалось, что
в источники водоснабжения пола-
дали бытовые сточные воды.
Немало сил ученых было потрачено
на установление эталона
бактериальной безвредности воды.
Чтобы обнаружить в воде
бактерии —возбудителей
инфекционных болезней, требуются сложные
и тонкие лабораторные
исследования. Для повседневного
контроля эти методы не годятся. Нужно
было найти косвенные признаки.
Сейчас для этой цели используют
микроорганизм, постоянно
выделяемый человеком — кишечную
палочку. Чем больше кишечных
палочек находится в водной
среде, тем больше вероятность, что
одновременно в «ей находятся и
болезнетворные микробы.
Советскими гигиенистами (научная
школа проф. С. Н. Черкинского)
доказано, что гарантировать
безвредность воды можно только
в том случае, когда число
кишечных палочек в одном литре не
превышает трех. Сама кишечная
палочка в воде безвредна, но она
гораздо устойчивее к
воздействию губительных для бактерий
веществ, чем возбудители
инфекций. Специальные исследования
показали, что, если после
обеззараживания в 1 л воды осталось
не более 3 кишечных палочек то
опасные микробы наверняка
погибли. Этим критерием и
пользуются сейчас в практике
водоснабжения при охране источников
от загрязнения и при
обеззараживании воды перед <подачей ее в
водопроводы.
Другая (проблема — это
химические примеси, которые есть во
всякой воде. Еще в середине
прошлого века было замечено,
что в одном из швейцарских
кантонов часто встречаются люди
необычной внешности. Глаза их
выпучены, подбородок переходит
в большой зоб; люди очень
возбудимы, нервны. Болезнь
получила название эндемического зоба.
В поисках ее причин врачи
пришли к выводу: зоб появляется
при ненормально низком
содержании йода в продуктах питания,
воде и воздухе. Препараты йода
стали применять как лекарство,
и это значительно уменьшило
число заболеваний эндемическим
зобом.
Чрезвычайно важно для
здоровья строго определенное
количество фтора в литьевой воде.
При его содержании свыше 1,5 мг
на 1 литр поражается зубная
эмаль, а в тяжелых случаях и
многие кости. Заболевание это
получило название флюороза.
Однако и слишком малые
количества фтора в воде (менее 1,0 мг
на литр) также приводят к
разрушению зубов — к ка'риесу.
Наилучшая концентрация фтора в
воде — 1 миллиграмм на литр.
В районах, где источники бедны
фтором воду специально
фторируют.
Некоторые химические
примеси содержатся в воде в очень
малых с житейской точки зрения
количествах, но небольшое
увеличение их концентрации уже
наносит вред здоровью. Чтобы
убедиться в этом понадобились
длительные многолетние наблюдения
за людьми в самых разных
районах мира, понадобились
специальные длительные опыты .на
животных. Постепенно возникло целое
учение о предельно допустимых
16
концентрациях различных веществ
в питьевой воде. Проведенные
исследования заставляют сейчас
ограничивать в воде количества
целого ряда химических веществ—
свинца, мышьяка, селена, хрома,
кадмия, цианидов.
Очень важен для человека —
особенно, для субъективного
отношения к литьевой воде — ее
минеральный состав. Но только в
последние годы начали
.появляться детальные научные
исследования по этому вопросу. Сложность
его решения состоит в том, что
вкусовые ощущения у разных
людей весьма различны, и в то
же время способность человека
^приспосабливаться к действию
слабых раздражителей очень
велика. Потребовались наблюдения
над тысячами людей| чтобы
прийти *< определенным выводам.
С максимально допустимыми
концентрациями хлоридов,
сульфатов магния м железа, других
солей, определяющих «жесткость»
воды, сейчас многое ясно. А
нижние пределы? До какой степени
может быть бедна солями вода,
чтобы оставаться пригодной для
питья?
Прежде всего, вода, бедная
минеральными солями, безвкусна.
В (переводе на язык физиологии
с<безвкуеность» воды означает,
что она «не раздражает вкусовые
окончания нервов во рту. Человек
не чувствует утоления жаждь^
если льет такую воду. Но вода,
в которой мало минеральных
солей, может вызывать не только
неудовольствие человека, но м
ллохо влиять на состояние его
здоровья.
Опыты, проведенные на
животных, (наблюдения за людьми
показали, что организму далеко
не безразличен солевой состав
воды. При употреблении
маломинерализованных вод {с соленостью
меньше 50 мг/я) животные
отставали в весе. А .если количество
соответствующего элемента,
например, кальция, одновременно
уменьшалось «и в пище то
начинались заболевания костей,
мышц, кровеносной системы,,
Каким же должен быть
солевой состав воды? Полного ответа
на этот вопрос еще нет. Слишком
многообразны воды,
употребляемые человеком в различных
районах Земли. Очень многое зависит
и от -питания.
Еще много предстоит сделать,
чтобы в учении о биологической
полноценности воды не осталось
«белых пятен».
Г. С. МОРГУНОВА
На производство одной тонны
стали расходуется 350 м*
воды, на один кирпич — и то уходит
250 литров. В жилых кварталах
города каждый день на одного
человека нужно больше 400
литров воды... Современный
океанский корабль берет с собой в
плаванье несколько сот тонн пресной
воды...
К сожалению, запасы пресных
вод, пригодных для
использования человеком, не настолько ве-
НУЖНА
ПРЕСНАЯ ВОДА!
лики, чтобы подобные подсчеты
были бессмысленны. На нашей
Земле 97f57% воды находится в
океане, 2,14%—в горных
ледниках и полярных льдах, 0,29%
составляют воды суши, 0,0005% —
вода в атмосфере- Для
снабжения водой мы используем те
самые 0,29% ■— в основном реки м
озера. А расход воды
увеличивается с каждым годом. Только
в Советском Союзе, например, в
1928 году водопроводы подавали
811 000 ж3 воды в сутки. А в
1958 годуг через 30 лет — уже
21 000 000 м\ в 25 раз больше.
Таковы законы развития городов,
промышленности, культуры — они
непосредственно связаны с
увеличением потребности в воде.
А освоение новых районов! Как
часто тормозится оно отсутствием
или 'нехваткой л ре он ой воды!
Все острее становится
-проблема изыскания новых
источников. В поисках воды мы
обращаемся к .недрам Земли, но и там
часто встречаем засолоненные
воды. Да и вообще количество
подземных вод не так уж велико.
...Более 1000 миллионов
кубических 'километров -воды
содержат моря и океаны. Но
практически -использовать эту воду
можно только шосле
превращения ее в пресную. Почти на
каждом морском судне есть
опреснитель — -постоянный источник
пресной воды для котлов, а в
случае необходимости — -и для питья.
Но судовые опреснители дают
всего несколько тонн воды в
сутки. А энергии расходуют много.
Для опреснения вод на суше
нужны в сотни тысяч раз более
мощные установки, и притом
гораздо более экономичные.
2 «Химия и жизнь»), № 3
17
Нужно сказать, что способов
опреснения морской воды уже
■предложено много. Их можно
разделить на две группы.
Первая— это 'изменение агрегатного
состояния воды (жидкость, лед,
пар). Вторая — действие
химических, электрохимических >и даже
биологических факторов без
изменения агрегатного состояния
воды.
Выпаривание соленой воды
ее перегонка — самый
неэкономичный метод. Существуют, лрав-
да, (некоторые
усовершенствования. Если выпаривать воду .под
вакуумом, то она кипит уже 'при
30—50° С. Если нагретую до 50—
70° С соленую воду тонким слоем
подавать на вращающийся с
большой скоростью барабан, то под
действием центробежных сил
испарение 1И отделение воды от
растворенных в «ей солей пойдет
быстрее. Это так (называемые
роторные испарители. Для южных
районов, где можно использовать
солнечную энергию,
спроектированы гелиоопреснители.
Параболическим зеркалом
концентрируют лучи, нагревая небольшой
объем воды до температуры
испарения. Производительность
такой установки — до 70 000 мг
воды в год.
Опреснять воду можно и
вымораживанием. При медленном
замерзании соленой воды
сначала образуются кристаллы
пресного льда 'игольчатой формы.
Они располагаются вертикально,
и рассол, замерзающий при
более низкой температуре, стекает
между ними образуя отдельный
слой. Чтобы добыть пресную
воду, лед послойно оттаивают в
порядке, обратном замерзанию.
Способ этот, казалось бы
простой, тоже неэкономичен и
сложен. Много энергии необходимо
для получения холода, сложны и
дороги устройства для отделения
рассола.
Очень интересна вторая
группа методов опреснения. В
электрохимическом обессоливании
воды -использовано явление
направленного движения ионов
растворенных солей в электрическом
поле. Положительно заряженные
катионы, как известно, движутся
к катоду, отрицательно
заряженные анионы — к аноду. На пути
движения ионов устанавливают
полупроницаемые мембраны,
которые делят установку -на
отдельные камеры. С одной стороны
каждая камера ограничена
положительно заряженной анионопро-
ницаемой диафрагмой( с другой —
такой же, но отрицательно
заряженной, т. е. катионопрон-ицае-
мой диафрагмой.
В одной из крайних камер
находится анод, в другой — катод.
Под действием постоянного тока
ионы «расходятся» в
противоположные стороны. Обратный путь
им отрезан заряженными
диафрагмами —и вода в камерах
постепенно освобождается от
солей, становится пресной.
К числу химических методов
опреснения относится
монообменный: соленую воду пропускают
через фильтры с ионообменными
смолами. Энергию расходуют
только насосы. Можно даже
регулировать степень опреснения. Но
опреснять этим способом морскую
воду не удается—в ней
слишком много солей.
Интересны попытки «применить
для опреснения воды
биологические процессы. Оказалось,
например, что некоторые морские
водоросли на свету поглощают
растворенные соли, а в темноте
выделяют 'ИХ. В каскаде освещенных
бассейнов такие водоросли будут
частично опреснять 'проточную
соленую воду. А «восстанавливать»
их можно в темных бассейнах.
Огромные перспективы
открывает использование атомной
энергии. Идея способа связана
с совмещением в одном
комплексе атомной электростанции и
испарительных устройств. При
мощности станции в 200 000 киловатт
можно вырабатывать
одновременно 200 000 ж3 пресной воды в
сутки.
Мы знаем, что 'полностью
лишенная солей «совершенно
пресная» вода для питья непригодна.
Но природная вода проходит
длительный процесс формирования
солевого состава в нем участвуют
многие химические элементы и
некоторые газы. В результате в
природной воде оказываются
растворенными вещества, в обычном
состоянии малорастворимые
{например, бикарбонат кальция).
Не придется ли человеку
моделировать процесс
«формирования» воды в природе? Или идти
в обход? Естественно, сразу же
возникает мысль о частичном
опреснении морской воды.
Испарительные установки таких
возможностей не дают. А, например,
электродиализ
(электрохимическое обессоливание) уже не так
бесперспективен.
Морская вода содержит
около 35 г различных солей в литре.
А в литре обычной воды солей
около 1,5 г. Но есть соли,
которых в морской воде даже
меньше, чем в питьевой пресной.
Может быть наука найдет
пути частичного опреснения
соленых вод и «исправления» их
состава. Может быть, когда-нибудь
мы научимся «изготовлять» воду
для питья лучше, чем это делает
природа. Для научной фантазии
врача здесь большой простор.
Опресненная вода не обязательно
будет 'просто питьевой. В
субтропиках и тропиках, где человеку
почти все время хочется пить,
а воды не хватает, может
появиться задача централизованного
снабжения водой целебного
состава, облегчающей тяготы
жаркого климата. И можно думать,
что эти решения не столь
отдаленны- Тем более, что
использование атомной энергии открывает
перспективы опреснения больших
количеств морской воды.
Кандидат медицинских наук
Л. И. ЭЛЬПИНЕР
18
/
В 1955 году в СССР (А. Г. Па-
сынским) и в США (С. Л.
Миллером) были поставлены
интереснейшие опыты. Электрический
разряд напряжением 60 000 вольт
пропускали через смесь паров
воды, аммиака, метана и
водорода. Эта смесь должна была
имитировать атмосферу
«безжизненной» Земли. Через неделю после
начала высоковольтной «грозы»
в сосуде были обнаружены
аминокислоты — те основные
«кирпичи», из которых состоит белковая
молекула... Эти эксперименты —
подтверждение гипотезы
академика А. И. Опарина о
возможности образования сложных
органических компонентов живого
организма из «простых химических
соединений.
Вода — необходимый
компонент синтеза аминокислот и,
кроме того, та среда, «питательный
бульон», в котором возникли и
развились ^первые живые
существа.
Но «прежде чем появилась
жизнь^ должна была появиться и
сама вода. Как это произошло?
«Геологическая» гипотеза
происхождения воды отвечает так:
земная кора и вода образовались
почти одновременно. Внутри
раскаленного тела — будущей
Земли — происходили бурные
реакции. Наряду с другими
соединениями, их результатом была и
вода... При остывании шланеты
она поднялась из <недр на
поверхность и образовала гидросферу —
мировой океан.
ВОДА—ЖИЗНЬ
Очень долго Земля была
безжизненной.
Но вода все больше
становилась сложнейшей химической
лабораторией, где встречались и
вступали в реакции
разнообразные неорганические соединения,
попадавшие в океан из земной
коры -и атмосферы. Гигантские
извержения выбрасывали из недр
в атмосферу, насыщенную парами
воды, раскаленный газ. Углерод
карбидов соединялся с
водородом воды. И однажды возникла
первая молекула углеводорода...
В горячей воде мирового
океана сложные органические
вещества смешивались и, поглощая
азот и атмосферный аммиак,
образовывали еще более крупные м
сложные молекулы. Появилась
и первая белковая молекула... Но
от простейших белков до живого
организма было еще очень, очень
далеко!
В «первичном бульоне» — в
водном растворе белков —
химические превращения были
хаотическими. Различные белки
смешивались, образуя коацерваты —
капельки 'полужидких коллоидов.
Эти капли поглощали другие
6enKHf в них .происходили
реакции— коацерват распадался... Или
наоборот — рос! Капельки росли,
делились, снова росли и снова
делились...
Сохранялись только те,
которые оказались наиболее
приспособленными к окружающей среде.
Начался естественный отбор. На
какой-то его стадии возникли
сначала очень простые, а затем и
более сложные ферменты,
первые 'биокатализаторы. Процесс
роста 'И дробления коацерватов
стал более направленным.
Появились «апельки белка, которые
росли 1И делились, уже сохраняя
свои свойства. И хотя они еще не
имели клеточного строения, они
были близки к вирусам...
(Возникла жизнь...
Но не будь воды — все эти
превращения стали бы
невозможны. Жизнь зародилась в воде,
развилась в воде, вода — ее
растворитель -и среда. Она является
«матрицей» жизни — эти слова
принадлежат крупнейшему
современному биохимику лауреату
Нобелевской премии Альберту
Сцент-Дьердьи.
Природа добилась просто
поразительной «организации» в
построении живого организма.
И не (последняя роль в «ней
принадлежит воде. В чем же она
заключается? Сцент-Дьердьл пишет:
■«Я mo-прежнему убежден в
том? что нельзя говорить о
белках, .нуклеиновых кислотах или
нуклеопротеидах .и о воде так,
как если бы это были две
различные системы. Они образуют
единую систему, которую нельзя
разделить на компоненты без
разрушения ее сущности... Биология
забыла о воде, подобно тому как
может позабыть о ней
глубоководная рыба».
И в самом деле — на воду
смотрели как на более или менее
н ейтраль ную среду,
заполняющую пространство между
структурными элементами в клетке. Но
ведь «живое» — это система из
воды и органического вещества,
единая, связанная, неразделимая.
Вода—неотъемлемая часть
живой природы.
— — Ю. ДРУГОВ
— И. ЕФИМОВ
?* 19
что это
такое?
■■шиадяяими
Кандидат медицинских наук
П. А. ПРОСЕЦНИЙ
Солнце висит над самой головой. До
палубы и поручней трапа нельзя
дотронуться. Порывистый суховей с
африканского берега, проносясь над кораблем
обжигает кожу. Губы трескаются,
пересыхает во рту. Мы выпиваем по 5—6
литров воды в день...
Через несколько дней становится, как
будто, легче — наступает адаптация,
организм приспособился к тропической жаре.
Многие матросы, голые по пояс,
безбоязненно работают на палубе. И только
бывалые моряки не снимают рубах. Временами
они обливают друг друга водой, даже не
раздеваясь, и продолжают свое дело.
Испаряясь, вода охлаждает тело, значит
меньше нужно потеть,— значит экономится
вода в организме.
Вышли в Индийский океан. Температура
снизилась с 36 до 30° по Цельсию, только
воздух стал более влажным, немного
труднее стало дышать.
А на следующий день случилось
несчастье. В полдень на палубе молодой
матрос получил тепловой удар.
В дело пришлось пускать лобелии и
камфару, лед и холодную воду из шланга.
Малейшее промедление могло бы стоить
парню жизни.
...Пострадавший неподвижно лежит на
кушетке, виновато смотрит на капитана и
пытается оправдываться. Он спортсмен...
И вообще не какой-нибудь слабосильный.
В Красном море дольше всех был голым
на палубе и меньше всех пил воды. А тут
в океане произошла какая-то ерунда.
Он не знал, что с повышением
влажности воздуха даже при 28—30 градусах
человек может потерять сознание потому,
что в воздухе, насыщенном влагой, пот
почти не испаряется с поверхности кожи и
тело не охлаждается. А выделяется пот
очень интенсивно, организм может за час
потерять больше литра воды. Если
организм теряет 5—10% содержащейся в нем
жидкости, наступают тяжелые расстройства.
При потере 15—20 % воды неизбежна
смерть...
Обмен веществ в организме возможен
только в том случае, когда продукты
обмена растворены. Основной растворитель
для них — вода. Все жизненно важные
процессы идут в организме в водных
растворах. Когда воды в организме становится
меньше, чем требуется, во многих органах
возникают сигналы об этом. Импульсы идут
от слизистой оболочки желудка и полости
рта, от почек и внутренних оболочек
кровеносных сосудов. В определенной области
коры головного мозга, получившей
название «питьевого центра», все эти нервные
импульсы «собираются». Раздражение
«питьевого центра» (даже механическое
или электрическое) вызывает жажду.
Часто желание пить не соответствует
фактической потребности организма в
воде. Такая жажда называется условно-
рефлекторной. Она возникает в тех
случаях, когда организм попадает в условия,
ранее вызывавшие жажду. Водного
дефицита — недостатка воды в организме —
может еще не быть, а жажда уже
появляется — действует условный рефлекс.
Чувство жажды возникает также из-за
высыхания слизистой оболочки рта. Здесь
достаточно смочить ее — прополоскать рот —
и пить уже не хочется.
Организм саморегулирует водный
обмен — при нехватке влаги одновременно с
«включением» механизмов жажды
уменьшается выделение мочи. При насыщении
клеток тела водой происходит обратный
процесс. Существует особый
антидиуретический гормон задней доли гипофиза,
который управляет соотношением между водой
и веществами, растворенными в моче.
Количество и концентрация мочи зависят от
поступления в кровь этого гормона.
21
—■/УЛЕЛ
Среднесуточная
потребность в воде человека,
находящегося в обычных для
себя условиях, составляет
2,5 литра. Основной
источник влаги — вода, которую
мы пьем, и жидкая пища.
Но немного воды образуется
в самом организме при
окислении ряда веществ A00 г
жира дают 107 г воды; 100 г
крахмала — 55 г воды; 100 г
белка — 41 г воды).
Выделение пота — по наблюдениям за
моряками в тропиках — может достигать
6—8 литров, а в ряде случаев и 10 литров
в сутки.
Было бы неправильно думать, что пот —
это только вода. Вместе с ней организм
теряет соли натрия, калия, кальция, фосфора
и хлора, а также многие водорастворимые
витамины (С, РР, витамины группы В). При
этом происходит нарушение щелочно-кис-
лотного равновесия, нарушается углеводный,
жировой и белковый обмен.
Утоление жажды —
сложная и еще не вполне
решенная проблема. Одни
исследователи считают, что воду
нужно пить без ограничения
до полного утоления
жажды, другие рекомендуют
воздерживаться от
обильного питья.
В условиях высокой
температуры при интенсивном
выделении пота в организм
должна вводиться не только
вода, но и другие необходимые вещества.
В рецептуру «тропического сиропа», с
успехом испробованного нашими моряками,
входят, кроме сахара, таннин,
водорастворимые витамины (С, группы В, Р и РР),
лимонная кислота, соли калия, кальция и
другие.
Кисловато-сладкий терпкий напиток
хорошо утоляет жажду и восполняет
теряемые с потом вещества. Его можно
употреблять и в горячих цехах, и в летних
туристических походах и при восхождении на горы.
ПОЧЕМУ ЧЕЛОВЕЧЕСТВУ
БУДЕТ НУЖНА
ТЯЖЕЛАЯ ВОДА
Ответить на этот вопрос
можно только языком цифр и
формул.
Вот значения очень точно
измеренных масс изотопных атомов
водорода:
Протий .
Дейтерий
Тритий .
I
,7»
М=1,007 825
М=2,014102
М=3,016049
Между легкими атомами, в
том числе между атомами
дейтерия, возможна ядерная реакция.
iDS + iDs^m^ + iT3
К такой реакции неприменим
закон сохранения веса, каким
представляла его старая химия:
2x2,014102^=1,007 825+3,016049
Разница в массах^ «недостача»
равна 0,00433 грамма. Это
означает, что при реакции между
двумя грамм-атомами тяжелого
водорода можно тюлучить,
согласно уравнению Эйнштейна
Е = Am-с2, энергию:
0,00433 х C,0-10l0J=3,9xl0i8 эрг.
Эта величина эквивалентна
энергии, получаемой в «аше
время от сжигания в топках 13,5 тонн
первосортного угля.
Итак: полвагона угля или два
грамм-атома дейтерия, «которые
содержатся в одной
грамм-молекуле тяжелой воды. А тяжелая
вода есть в любой природной
в оде, один атом д ейтери я на
22
6700 атомов протия.
Следовательно, простой воды потребуется:
6700 X 18 = 120 500 грамм или
1120 литров.
Иначе говоря, один литс
обычной воды может дать больше
энергии, чем 100 кг хорошего
угля... Не перейдем к трудностям,
которые будут лучше всего
понятны тоже на примере простого
расчета.
Чтобы два атома могли
вступить в ядерную реакцию, их ядра
должны столкнуться, т. е.
сблизиться до расстояния, на котором
начинают действовать межъядер-
лые силы — примерно до Ю-12 см.
Найдем энергию, необходимую
для того, чтобы преодолеть их
взаимное отталкивание. Из
закона Кулона следует, что
«потенциальная энергия двух ядер,
сблизившихся на расстояние
10~12 см, должна быть равна
Zi-Z2D,8-10-10J _
Ю2
= 2,3-10-7-Z!-Z2 эрг,
если между собой сталкиваются
элементы с атомными номерами
Z\ и Zz.
Представить себе, мала илк
•не очень мала эта энергия,
неспециалисту затруднительно.
Гораздо легче понять, с какой
скоростью должны сталкиваться
атомы чтобы преодолеть
потенциальную энергию
электростатического отталкивания. Они
должны обладать большей или по
крайней мере равной
кинетической энергией.
На языке формул это
означает:
-1-/nu = 2,3.10-7.Z1-Z2 эрг.
Массу одного атома tn можно
выразить через атомный вес,
зная, сколько атомов содержится
в грамм-атоме:
6,02 -Ю23"
После этого уже можно
вычислять скорость vt с которой
должны столкнуться атомы, чтобы
могла начаться ядерная реакция.
Из двух предыдущих формул
получим:
г А
У дейтерия атомный номер Z =
= 1- Масса изотопа А = 2. Значит,
v = 5f3-108-0,50S = 3,8-108 см/сек.
Скорость атомов должна быть
равна 3800 километров в секунду.
Средняя скорость теплового
движения атомов дейтерия три
комнатной температуре B93° К)
равна всего 1,9 км/сек.
Кинетическая энергия молекул возрастает
пропорционально абсолютной
температуре -или, что то же
самое, «пропорционально квадрату
скорости. Следовательно, чтобы
средняя скорость молекул
дейтерия была достаточной для
реакции между ядрами, .нужно нагреть
тяжелый водород до температуры:
1,92
^= 1,1-109градусов0).
Итак, сталкиваться и
реагировать между собой могут только
ядра дейтерия, «нагретые» до
температуры более миллиарда
градусов. Так формулируется
цифрами трудность, которую мы
обсуждаем.
Быть может, тяжелую воду
можно чем-нибудь 'Заменить?
Ничем. Тяжелая вода, как источник
тяжелого водорода для
термоядерных реакций с целью
получения энергии, -по-видимому,
«незаменима. Это следует из того что
необходимая для начала реакции
температура чрезвычайно сильно,
как легко увидеть, вернувшись
к нашим формулам, возрастает
по мере увеличения атомного
номера элемента Z. Часть дейтерия
можно было бы заменить на
тритий, но этого изотопа в природе
почти нет.
Возможно ли (Преодолеть эти
трудности? Вероятно, да.
Во-первых, для того, чтобы началась
реакция, не .нужно весь водород
нагревать до такой немыслимо
чудовищной температуры.
Достаточно, если хотя бы отдельные
атомы будут обладать нужной
энергией., Во всяком газе при
любой температуре есть частицы
с разными скоростями, от очень
малых до очень больших»
Благодаря этому реакция между
атомами дейтерия будет идти с
достаточной скоростью даже и при
температуре в несколько раз
меньшей, чем 109 градусов,, Это
намного облегчает задачу.,
Во-вторых, существует так
называемый туннельный эффект,
благодаря которому всегда есть
некоторая вероятность, что
реакция между ядрами все же может
•произойти, даже если -их
кинетическая энергия будет несколько
ниже, чем необходимо для
преодоления электростатического
отталкивания.
Поэтому для начала
термоядерного процесса между ядрами
тяжелого водорода будет
достаточна температура «всего»
только в 300 миллионов градусов.
Если же вести реакцию между
дейтерием и тритием, то будет
достаточно w 40 миллионов
градусов.
Нужен <не взрыв, а
управляемая реакция. Нужна
термоядерная «топка» с температурой в
сотню миллионов градусов. И хотя
в природе нет и не может быть
материала, способного выдержать
такую температуру, физики
нащупывают путь—первыми на него
ступили советские ученые — к
созданию термоядерного реактора.
Ведутся опыты: «стенками»
камеры могут быть мощные
электромагнитные «поля.
Сколько «понадобится
времени, чтобы термоядерная энерге-
тика# настоящая «гидроэнергетика
будущего» стала из фантазии
физиков реальностью — этого
сегодня не знает никто. Но ведь и
электричество казалось когда-то
(кстати, -не так давно —
каких-нибудь двести лет, назад,—
-величина, ничтожная в -истории
человечества!) забавным явлением — -и
ничем больше...
23
СЕМЬ СПОСОБОВ
Кандидат
медицинских наук
Л. И. ЭЛЬПИНЕР
ХЛОРИРОВАНИЕ
Один из наиболее распространенных методов
обеззараживания. При введении в воду хлора
образуется хлорноватистая кислота |С12 + Н20 -> НОС1 Н
+ HCI), которая диссоциирует по уравнению HOCI ->■
Н+ + IOCIJ-. Ион ОС1- определяет окислительную
и бактерицидную активность хлора. Последнюю
связывают также и с действием HOCI на микрофлору.
Воду хлорируют как чистым хлором, так и его
соединениями (хлорная известь, гипохлорит кальция,
хлорамин).
ОБРАБОТКА УЛЬТРАФИОЛЕТОВЫМИ
ЛУЧАМИ
Способ основан на способности лучей
ультрафиолетовой части светового спектра с длиной волны
254—257 миллимикрон вызывать гибель бактерий
в результате действия фотохимически активных
фотонов. Источником излучения служат специальные
лампы, в которых электрический разряд происходит
в парах ртути или в смеси ртутных паров с аргоном.
Бактерицидные ультрафиолетовые лампы
располагают над поверхностью тонкого слоя воды или
погружают в камеру с проточной водой.
24
ОБЕЗЗАРАЖИВАНИЯ ВОДЫ
ОЗОНИРОВАНИЕ
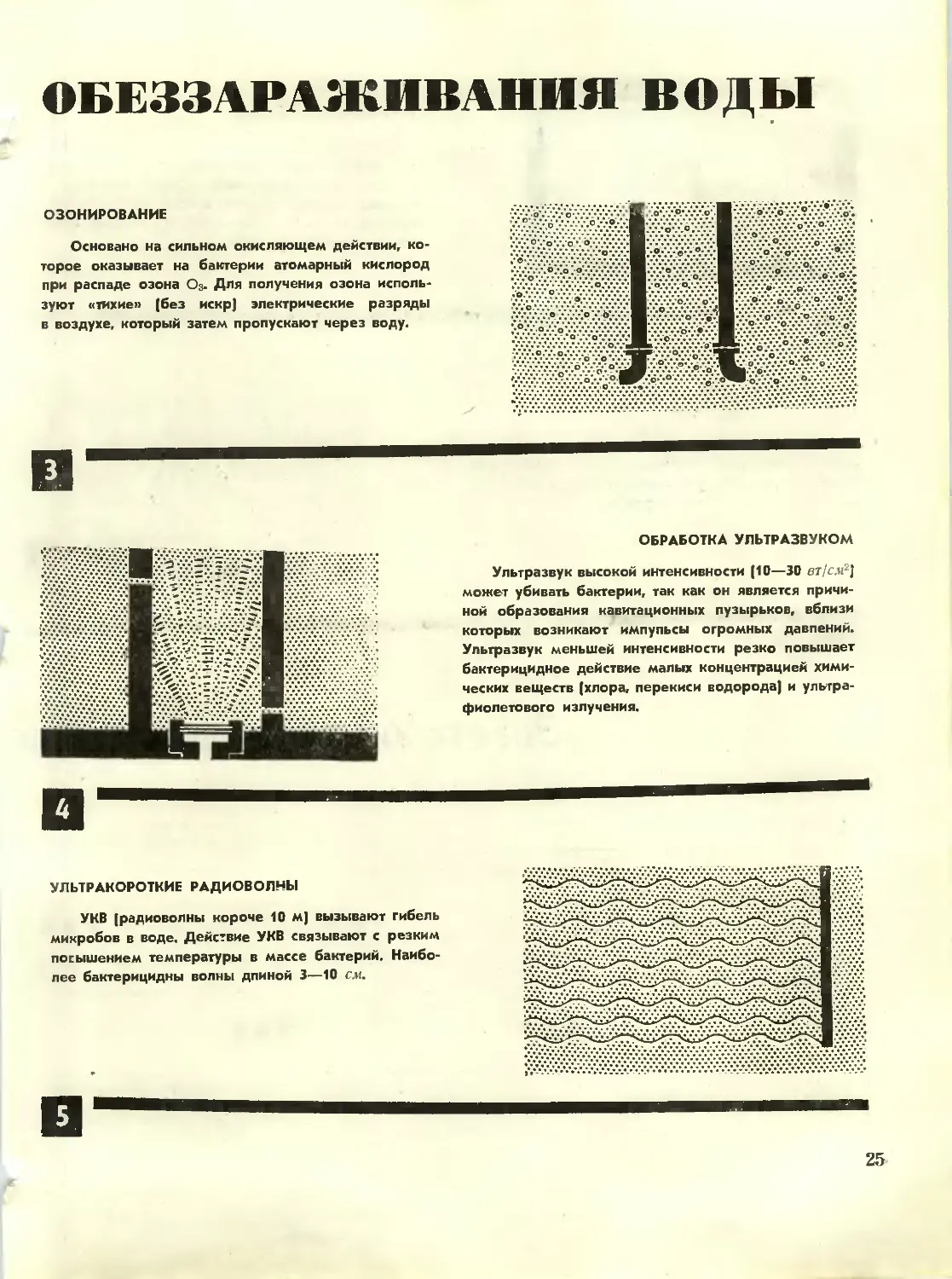
Основано на сильном окисляющем действии,
которое оказывает на бактерии атомарный кислород
при распаде озона 03. Для получения озона
используют «тихие» (без искр) электрические разряды
в воздухе, который затем пропускают через воду.
:ву:->:::::г::-::-л-:-:-:1
^XXiXpVov.v.vXvl
y;.::::\:::\:::wo; ■
:v/X?x^/B"xX;?x^v>?.>v.>^o^
1хРв1хШЩШ#
ОБРАБОТКА УЛЬТРАЗВУКОМ
Ультразвук высокой интенсивности A0—30 вт!см\
может убивать бактерии, так как он является
причиной образования кавитационных пузырьков, вблизи
которых возникают импульсы огромных давлений.
Ультразвук меньшей интенсивности резко повышает
бактерицидное действие малых концентрацией
химических веществ (хлора, перекиси водорода) и
ультрафиолетового излучения.
УЛЬТРАКОРОТКИЕ РАДИОВОЛНЫ
УКВ (радиоволны короче 10 м) вызывают гибель
микробов в воде. Действие УКВ связывают с резким
посышением температуры в массе бактерий.
Наиболее бактерицидны волны длиной 3—10 см.
РЕНТГЕНОВСКОЕ
И ГАММА-ОБЛУЧЕНИЕ
Мощными источниками гамма-лучей и
рентгеновых лучей можно обеззараживать воду. Бактерии
погибают как под действием самого излучения, так
и вследствие образования в воде химически
активных радикалов. Это еще один путь мирного
использования атомной энергии.
ОБЕЗЗАРАЖИВАНИЕ
ПЕРЕКИСЬЮ ВОДОРОДА
Перекись водорода в присутствии катализатора
выделяет атомарный кислород, окислительное
действие которого убивает бактерии. Метод
обеззараживания основан на этом эффекте.
wo. vX»v.v>
XvV'.\Ov/v**
V/X*X\vxXv.°xvx vX'^'w*/. ьх.х<^х*х/л*х^х//Х\\\*
^•^X•*■*•0^^•X^^вv/.(>/Xv;v^^^•X■X•X•X•X^•X•X/////••*^'•■•
v?-;Xvx*xX'?X\\\v:-x^
■\vXP.v;X\* XX-Vo.v.vV"
C-ftX^w^v^^rTOMrir.uSil!!"
Знаете ли вы, что..
Океан растворяет газы атмосферы и
переносит их на большие расстояния,
выступая наряду с ветрами в роли
регулятора состава воздуха.
Чтобы пересчитать число молекул в
1 см3 воды, миллиард человек должны
трудиться, отсчитывая каждый по одной
молекуле в секунду около миллиона лет.
Струя воды, вытекающая из сопла со
скоростью 100 м/сек, упруга как сталь. Ее
нельзя разрубить даже саблей — клинок
отскакивает от струи воды.
Вычислено, что ежегодно на дно
океана оседает около 2300 млн. т солей,
главным образом СаС03.
Взрослая береза извлекает корнями из
почвы и испаряет с поверхности листьев
до 70 ведер воды за сутки.
Содержание солей в океане в среднем
3,5%, в Средиземном море — 3,9%, в
Балтийском— 0,5°,,,, в Черном— !,8( ).
В Азовском море — самом богатом в
мире водоеме — вылавливается почти
столько же рыбы, сколько в Средиземном
море, которое по площади в 63 раза
больше Азовского.
Дно океана — еще неразведанное
хранилище полезных ископаемых. По расчетам
геологов, запасы руд на дне океана
составляют примерно 1,5 • !012 т. Это руды
никеля, меди, марганца н других металлов.
Обычное стекло растворяется в воде.
Точнейшие аналитические весы показывают,
что вместе со стаканом горячего чая вы
можете выпить около одной
десятитысячной грамма стекла.
26
Гигантское подземное озеро объемом
263 млн. м3 открыто в Целинном крае.
Подземная пресная вода отличается
хорошим качеством. Всего на территории
Казахстана известны 17 крупных
подземных озер. В 1962 году воду здесь
получали из 5000 скважин глубиной от 200 до
800 м.
Есть реки с соленой водой, например
река Солянка, протекающая на Крайнем
Севере СССР. Считают, что соль попадает
в реку с грунтовыми водами,
просачивающимися через соляные отложения.
Если бы моря и океаны испарились,
го их дно покрылось бы слоем соли
толщиной 60 м. Чтобы морская вода стала
пресной, ее нужно разбавить в 70 раз.
Самый высокий айсберг видели возле
острова Диско (Гренландия): его высота
достигала 149 м.
Й
В океане углекислого газа
приблизительно в 8 раз больше, чем в атмосфере.
Верблюд может терять влагу в
количестве до 7з от своего веса без всякого
ущерба для здоровья. Известен опыт, в
котором верблюд весом 450 кг поел* недели
работы в пустыне потерял в весе около
100 кг. После этого он вылил сразу 103 л
воды н «привел» свой вес в норму.
На крайнем севере Швеции пришла в
негодность бетонная плотина
гидроэлектростанции Суорва. Для ее ремонта избрали
дешевый, но рискованный способ. Бетонное
г ел о плотины покрыли синтетической
оболочкой на основе эпоксидной смолы и
неопрена. Этот непрочный «чехол» заклеил
трещины в бетоне и защищает плотину от
воды, снега, льда и ветра.
В Алжире есть озеро, наполненное
чернилами, которыми можно писать на
бумаге. Дело в том, что в озеро впадают
две небольшие речки: воды одной из них
богаты солями железа, другой — гуминовы-
ми веществами. В результате получается
раствор, подобный искусственным чернилам.
ЛИТЕРАТУРНЫЕ СТРАНИЦЫ
Лев ГУМИЛЕВСКИЙ
Философский факультет по новому уставу
делился на два отделения — собственно
философское и физико-математическое. Второе отделение
состояло в свою очередь из разрядов собственно
математического и естественных наук. На первом
курсе для обоих разрядов химию читал Клаус.
На старших курсах должен был читать
аналитическую и техническую химию Зинин. Он
предпочел для чтения лекций математический разряд,
так что натуралисты его не слушали.
Не трудно понять выбор Николая
Николаевича. Сам математик, он считал математиков
вообще более подготовленными и развитыми
слушателями. Натуралистам последнего курса он
решил читать только химию животных тел. Впрочем
студентам одного разряда не запрещалось
посещать другой. После первых же лекций нового
профессора многие натуралисты стали ходить
слушать его в математический разряд.
«Лекции его,— вспоминает А. М. Бутлеров,
один из первых учеников Зинина,— пользовались
громкой репутацией, и действительно, всякий,
слышавший его как профессора или как ученого,
делающего сообщение о своих исследованиях,
знает, каким замечательным лектором был Зинин:
его живая, образная речь всегда ярко рисовала
в воображении слушателей все, им излагаемое.
Высокий, как бы слегка крикливый тон,
чрезвычайно отчетливая дикция, удивительное умение
показать рельефно важные стороны предмета —
все увлекало слушателей, постоянно будило их
внимание... Он говорил обыкновенно стоя и с на-
Окончание. Начало публикации глав из повести см. в № 1
и 2.
IN
чала до конца держал слушателей под обаянием
своей речи».
Конечно, Николай Николаевич не
ограничивался чтением лекций. Он вел занятия в
лаборатории со студентами, давал темы и следил за их
выполнением, но предоставлял каждому искать
свой собственный путь.
Исключительная привязанность студентов к
Зинину объяснялась и любовным отношением
самого профессора к молодежи. Среди молодежи
это был старший веселый товарищ, и в его
лабораторию постоянно стекались студенты. Он
обращался со студентами как с равными, мог
выбранить, «даже поколотить виноватого», но не мог
никогда никому отказать в помощи или защите.
Главное же, что было необыкновенно в этом
профессоре, это то, что каждый, по
свидетельству Бутлерова, «после разговора с Зининым
уходил, так сказать, наэлектризованным, преданным
своему делу более, чем когда-либо».
Обычно утром, до обеда, Николай
Николаевич занимался своими исследованиями и читат
лекции. Органическим анализам отводились
особые, послеобеденные часы. В таких случаях с утра
служитель приготовлял печи и запас углей.
Жаровни с углями заменяли нынешние газовые
горелки и были непременным оборудованием
химических лабораторий. Отобедав пораньше,
профессор с учениками часа в три дня принимался за
«сожигание».
Так коротко назывался трудный и сложный
процесс органического элементарного анализа
путем сжигания вещества и количественного
определения продуктов сгорания. Зинин любил и
уважал науку, он прививал то же отношение к ней
и своим ученикам. Но они обязаны были ему и
знакомством с литературой. Он первый открывал
им в цитатах и декламациях достоинства
«Фауста* Гете и «Разбойников» Шиллера, красоту
Пушкина и юмор Гоголя.
Об этой особенности занятий Зинина с
благодарностью вспоминают все его ученики.
В той же лаборатории, где не было ни газа,
ни водопровода, ни вытяжных шкафов, ни
специальной посуды, Зинин вел и свои
исследования, задавшись обширной целью — изучить
действие сероводорода на органические вещества.
В самом начале этих исследований он
встретил интереснейший случай этого действия на ни-
тропроизводные углеводородов, получив
вещество, названное им «бензидамом». Это была
маслянистая, бесцветная жидкость, которая
постепенно бурела на воздухе. Рассматривая свой
«беизидам», Николай Николаевич увидел, что по
внешним свойствам он напоминает «анилин»,
который ему показывал в своей академической
лаборатории в Петербурге два года назад Юлий
Федорович Фрицше.
Тогда Николай Николаевич спросил его:
— Чем вы сейчас занимаетесь?
Фрицше вынул из стакана, стоявшего на
столе, пробирку с прозрачной, бесцветной
маслообразной жидкостью на дне и, показывая ее на
свет, сказал:
— Это то, что я назвал в своем последнем
сообщении анилином — по арабскому слову
«аниль» — сииий. Так португальцы называют
индиго. Я выделил органическое основание
красящего вещества индиго. Я получил его действием
едкого калия на природное индиго... Что вы от
меня хотите,— воскликнул он, возвращая
пробирку в стакан.— Я работаю что могу, я собираю
факты. Теорий я не понимаю...
— Из фактов строится наука,— напомнил
Николай Николаевич.— Без накопления фактов
невозможны теории...
Вынув пробку из пробирки, он ощутил
слабый, но характерный запах. Осторожно
поворачивая пробирку перед глазами, Зинин рассмотрел
жидкость на свету и, опуская на место, повторил:
— Без накопления фактов невозможны
никакие теории. Не вы один не понимаете нынешних
теорий — они плохо понимаются потому, что
неверны, не соответствуют тем самым фактам,
которые и вы и я собираем!
— А что, если это действительно анилин?!—
все с большим и большим волнением спрашивал
теперь себя Зинин.
Волнение его не трудно понять.
То было время когда развитие
производительных сил, потребности промышленности
ставили перед органической химией задачу
искусственного приготовления органических веществ. До
того органическая химия главным образом
анализировала, исследовала вещества растительного
и животного происхождения, но ничего не
синтезировала, ничего не приготовляла в лабораторном
и тем более заводском масштабе. Неорганическая
же химия в это время имела уже ряд блестящих
достижений по синтезу веществ.
Считалось, что подобный период должен
наступить и для органической химии. Однако
органические вещества повсюду получали только
путем переработки растительных и животных
продуктов. Предполагалось, что органические
вещества образуются лишь в живых организмах,
образуются под влиянием таинственной «жизненной
силы» и не могут приготовляться искусственным
путем.
Открытие Велера, получившего в 1828 году
путем синтеза из неорганических веществ такой
типичный продукт жизнедеятельности организма,
как мочевина, нанесло первый удар
идеалистическому представлению о «жизненной силе».
Энгельс писал по этому поводу:
«Благодаря получению неорганическим путем
таких химических соединений, которые до того
времени порождались только в живом организме,
было доказано, что законы химии имеют ту же
силу для органических тел, как и для
неорганических...».
Открытие Вёлера свидетельствовало, что
органические вещества можно получать
искусственным путем, и синтез анилина нанес бы второй
могучий удар по «жизненной силе», по витализму.
Николай Николаевич описал свой «бензидам»,
метод его получения и направил свое сообщение
об этом в Петербургскую Академию наук, а
тщательно упакованный флакончик с «бензидамом»
одновременно послал Фрицше.
Ознакомившись со статьей Зинина и с его
флаконом, Фрицше заявил, что вещество,
полученное казанским профессором синтетически и
названное им «бензидамом», было не что иное, как
анилин, который он, Фрицше, выделил путем
разложения натурального инднго.
Фрицше полагал, что найденный Зининым
способ искусственного получения азотистых
органических оснований открывает перспективу
искусственного получения сложных азотистых
оснований стрихнина, хинина и других алкалоидов,
содержащихся в растениях н оказывающих
удивительное действие на человеческий организм.
29
«Описание некоторых новых органических
оснований, полученных действием сероводорода на
соединения углеводородов с азотноватой
кислотой», напечатанное в «Бюллетенях Петербургской
Академии наук» в том же 1842 году, произвело
огромное впечатление на научный мир, хотя
никто еще не мог предвидеть, как часто и с каким
успехом «реакция Зинина» будет применяться при
синтезе самых разнообразных органических
веществ. Тем более никто не думал о том, что
синтез анилина окажется первым звеном в цепи
открытий, которые приведут к созданию
промышленности органической химии.
После сообщения Зинина, перепечатанного
химическими журналами всего мира, многие
ученые начали работать иад практическим
использованием реакции, получившей имя Зинина. Один
из них — Гофман, работавший в Гиссене в одно
время с Зининым, позже писал о его реакции.
«В то время во всяком случае, нельзя было и
предвидеть, какая громадная будущность
предстояла изящному методу... Никто бы не мог тогда
и подумать о том, как часто и с каким большим
успехом этот капитальный процесс будет
применяться при изучении бесконечных органических
веществ. Никто бы не мог представить себе и во
сне, что новому методу амидирования суждено
будет послужить основою могучей заводской
промышленности, которая, в свою очередь, даст
совершенно неожиданный и плодотворный толчок
науке. Но что дело шло здесь о химической
реакции, которой предстояла необыкновенно широкая
будущность, это мы почувствовали тогда же.
Когда же ко всему применение реакции Зинина
в толуоловом ряду вскоре показало со всей
очевидностью легкость и надежность производства
при этом процессе и богатый выход продукта,—
никто уже не сомневался, что наш коллега
сделал открытие, которое выпадает на долю только
немногим счастливцам...».
Николаю Николаевичу суждено было
оказаться еще и тем из немногих счастливцев, кому
удается при жизни своей быть свидетелем
грандиозного развития своих идей, собственными
глазами видеть великие плоды своего труда.
Химики всех стран на основе открытия
Зинина создали огромную отрасль промышленность,
превратив анилин — бесцветную жидкость — в
красители самых разнообразных цветов и
оттенков. А применение реакции Зинина в других
химических рядах повлекло за собой много новых
открытий.
С реакции Зинина началось развитие
синтетической промышленности органической химии,
достигшей теперь колоссальных размеров.
КОЛЫБЕЛЬ РУССКОЙ ХИМИИ
Круг умственной деятельности того
времени был вне правительства,
совершенно отсталого, и вне народа,
молчавшего в отчужденности,— он
был в книге, в аудитории, в
теоретическом споре и в учебном кабинете.
ГЕРЦЕН
Еще не утих шум, поднятый историческим
синтезом анилина, осуществленным в химической
лаборатории Казанского университета, как взоры
всего ученого мира вновь обратились к самому
восточному университету Европы: всего лишь
через два года после открытия Зинина другой
казанский химик, профессор Клаус, предъявил
научной общественности результаты исследований
нового, открытого им элемента.
Желая приготовить главнейшие соединения
платиновых металлов для химического кабинета
университета, Клаус в 1841 году добыл два
фунта отходов платиновой руды и подверг их
тщательному анализу, чтобы извлечь некоторое
количество нужного ему дорогого металла.
В самом начале работы исследователь был
удивлен богатством этих платиновых отходов: он
извлек из них не только платину, но и другие
элементы — иридий, родий, осмий и палладий. Еще
больше заинтересовала его оставшаяся сверх того
смесь различных металлов, в которой, как он
предполагал, находился еще какой-то новый,
неизвестный науке элемент.
Бесплодность попыток дерптского профессора
Озанна обнаружить этот элемент не остановила
Карла Карловича. Он не только выделил его, но
и благородно оставил за ним название заранее
данное Озанном,— рутений.
Три года посвятил Клаус выделению нового
элемента из платиновых остатков в чистом виде
и дальнейшему изучению его свойств и отношений
к другим элементам. Изо дня в день наблюдал
за работой соседа по лаборатории Николай
Николаевич Зинин и преклонялся перед его
экспериментаторским талантом.
В открытии Клауса не играли никакой роли
случай, удача, счастье, без чего в те времена не
обходился ии один рассказ об открытиях, об
изобретениях.
Ведь и синтез анилина, казалось всем, был
счастливой случайностью. Задавшись мыслью
изучить действие сероводорода на органические
вещества, Николай Николаевич о синтезе анилина
не думал и задачей своей его не ставил. Клаус,
наоборот, действовал целеустремленно, поставив
целью выделить неизвестный металл, присутствие
30
Рисунок
Л. Хайлова
которого в смеси он подозревал. Тут все дело
было в искусстве экспериментатора. Работая с
ничтожно малыми количествами вещества, Клаус
прибегал к тончайшим приемам, изощренной
технике. Пожалуй, проба на язык, ужасавшая Зини-
на, только и могла соответствовать приемам и
тщательности, с какой вел свои исследования
Карл Карлович.
Никогда еще трагическая борьба
человеческого ума с природой, с неповоротливостью
собственных мыслей, с неуклюжестью собственных рук не
представала Николаю Николаевичу с такой
ясностью, как в этом труде Клауса. До того как был
установлен периодический закон Менделеева,
открытие нового элемента могло быть лишь
результатом исключительной наблюдательности исследе-
31
вателя, его аналитического таланта и
невероятного трудолюбия, сопряженного с терпением и
настойчивостью. Карл Карлович справился со своей
задачей блестящим образом. Ему удалось
определить с большой точностью атомный вес нового
элемента и дать превосходное по точности
описание его отношения к различным химическим
веществам. Описание Клауса совпадает с
нынешним, сделанным в современных лабораторных
условиях.
Весь этот труд, «продолжительный и даже
вредный для здоровья», как замечает Клаус, был
выполнен им в три года. 13 сентября 1844 года
Петербургской Академии наук было доложено об
открытии Клаусом рутения; в том же году в
Казани вышла его брошюра «Химическое
исследование остатков уральской платиновой руды и
нового металла рутения».
Сообщение об открытии нового элемента
отметила печать всего мира.
Знаменитый шведский химик Якоб Берцелиус
писал Карлу Карловичу в январе 1845 года:
«Примите мои искренние поздравления с
превосходными открытиями и изящной их
обработкой: благодаря им Ваше имя будет неизгладимо
начертано в истории химии. В наше время очень
принято, если кому-либо удалось сделать
настоящее открытие, вести себя так, как будто вовсе
не нужно упоминать о прежних работах и
указаниях по тому же вопросу, в надежде, что ему
не придется делить честь открытия с каким-либо
предшественником. Это — плохое обыкновение, и
тем более плохое, что преследуемая им цель все
же через некоторое время ускользает. Вы
поступили совсем иначе. Вы упомянули о заслугах
Озанна и выдвинули их, причем даже сохранили
предложенное им название. Это — такой
благородный и честный поступок, что Вы навсегда
вызвали во мие самое искреннее, глубокое почтение
и сердечную симпатию, и я не сомневаюсь, что у
всех друзей доброго и справедливого это
встретит такой же отклик. Я взял на себя смелость
представить извлечение из Вашей статьи
Академии иаук, которая напечатает его в своем отчете
об этом заседании. С глубочайшим уважением
имею честь оставаться.
Преданный Вам Як. Берцелиус».
Карл Карлович показал письмо Зинину.
— А вознаградит ли Озанна ваш
благородный поступок за горькую его ошибку? — прочтя
письмо, грустно сказал Николай Николаевич и
подумал о том, как много говорят люди о муках
любви и ревности и как мало знают они о
трагедиях науки, о счастье ее побед и о горестях
поражений.
Несмотря на возраставшую популярность
Казанского университета и мировую известность
его химической лаборатории, число студентов, на
памяти Зинина, возросло не более как вдвое.
Дворянство, которому были все двери открыты,
стремилось в военную службу и предпочитало
специальные учебные заведения. Чиновники для
получения чинов по службе проходили нарочно для
того созданные особые, упрощенные курсы.
Обеспеченные родители предпочитали частные
пансионы, где их детей обучали кроме наук хорошим
манерам и благовоспитанности. Стипендиаты
должны были потом отбывать государственную
службу, как повинность.
Студенты в сущности ничем не были
заинтересованы, поступая в университет, если судьба не
наградила их идеальным стремлением к самой
науке, что встречалось не часто. Бескорыстное
влечение к чистому познанию, ради него самого,
пробуждалось постепенно в стенах самого
университета на скамьях аудиторий под влиянием
учителей. Таким учителем в полном и благородном
смысле слова для Зинина был Лобачевский;
таким учителем стал сам Зинин для множества
молодых людей, прошедших через Казанский
университет за те шесть лет, когда Николай
Николаевич учил и действовал в его стенах.
«Не. одни официальные слушатели и ученики
Зииина были его учениками на деле,—
свидетельствует Бутлеров.— Свою глубокую бескорыстную
любовь и преданность всякому знанию он умел
вселять во всех, имевших случай быть с ним в
общении,— а общение это было обширно, так как
глубокий живой оригинальный ум Зинина,
соединенный с необыкновенной беспритязательностью
и приветливостью в обращении, всюду влек к
нему молодежь, преданную науке. Это делало
Николая Николаевича центром, около которого
группировались не одни химики, но и те, которые
интересовались физиологией, сравнительной
анатомией, зоологией и проч. К нему же зачастую шли
за советом и врачи. Необыкновенная память,
огромная начитанность всегда делали Николая
Николаевича и тут драгоценным руководителем и
наставником».
Даже будучи технологом лишь по должности,
Николай Николаевич воспитал технолога по
призванию, ставшего главою русских химиков-техио-
логов. Это был Модест Яковлевич Киттары, один
из первых учеников Зинииа. По окончании курса
по разряду естественных наук Киттары взял
должность лаборанта, чтобы оставаться возле
учителя. Как натуралист, он готовился к
получению степени магистра зоологии. Работая над
диссертацией по анатомии осетровых рыб, он
постоянно обращался за советзми к Николаю Нико
лаевичу, который руководил раньше его
химическими занятиями лад сероцианистыми
соединениями. Диссертация тто этой теме доставила Киттары
степень кандидата и золотую медаль. Теперь тот
же профессор химии оказался и руководителем
в совсем другой области естествознания!
Киттары пользовался советами Зинина и потом,
занимаясь докторской диссертацией, посвященной
анатомии фаланги.
Разговоры на разнообразнейшие темы
происходили между делом, на ходу, чаще всего, когда
Николай Николаевич усаживался за свои
исследования, а Киттары, как лаборант, помогал ему
в работе.
Понимая обширное значение своей реакции,
Зинин продолжал расширять ее приложение,
перейдя от мононитрозамещенных углеводородов к
динит.розамещенным телам и к нитробензойной
кислоте. Продолжая итти тем же путем, он начал
вовлекать в круг исследования безкислородные
азотистые тела, а Киттары действием азотной
кислоты обрабатывал крахмал для получения из него
«ксилоидина>.
Организационная работа Киттары в
лаборатории, необыкновенная изобретательность в
постановке заданных химических процессов привели
Николая Николаевича к убеждению, что в лице
лаборанта он имеет прирожденного технолога.
Энциклопедические познания Зинина во всех
областях естествознания помогали ему видеть или,
по крайней мере, догадываться, где лучше всего
для дела и счастливее для себя приложит руки
ученик.
Киттары указал Николаю Николаевичу иа
сообщение о том, что Гофман, выделив бензол из
каменноугольной смолы, организует заводское
производство бензола. Дешевое сырье открывало
широкие перспективы для реакции Зинина, для
производства анилина.
— До какой поры мы все свое будем
отдавать в руки немцев?— гневно воскликнул учитель,
глядя в большие, почти круглые глаза своего
ученика,— у нас нет технологов, а пока их не будет,
все, что мы ни сделаем в наших лабораториях,
будет уходить на сторону, немцам, на пользу
иностранцам... И вот ты, прирожденный технолог,
делаешь диссертацию по зоологии, а я же тебе и
помогаю! Вздуть нас обоих следует!
Насильственно возвращенный в Казань,
Николай Николаевич считал дни и годы, которые
должен здесь отбывать. Точно издеваясь над
невольником, Мусин-Пушкин в 1-845 году перешел
попечителем в Петербург. Управляющим же
Казанским учебным округом был временно назначен
Лобачевский, и будь у Николая Николаевича
преемник по кафедре, он, кажется, и минуты не
оставался бы в безрадостной Казани.
Выбор Николая Николаевича, павший на
Киттары, оказался более, чем удачным. Киттары
в двадцать лет кончил университет, в двадцать
два был магистром, в двадцать три начал читать
технологию, заместив Зинина.
С перемещением его на кафедру технологии,
которая была его истинным призванием,
популярность Киттары вышла далеко за пределы
университета. Приобретенный в короткое время
авторитет в делах техники, «практическая расторопность
■и находчивость» составили ему славу не только
в Казани, где он руководил «Казанской
выставкой сельских произведений» и организовал
стеариновое производство, получившее впоследствии
огромное развитие, но сделали его популярным и
в кругах приволжских промышленников, которые
постоянно обращались к нему как к советчику.
Николай Николаевич читал химию
математикам, но химическую лабораторию его наполняли
главным образом, естественники и медики. Осенью
1844 года в университет поступили два брата
Бекетовых — Николай и Андрей Николаевичи, сын
профессора Вагнера — Николай Петрович и
быстро сдружившийся с ними Александр Михайлович
Бутлеров. Первым появился у Николая
Николаевича иа занятиях Бутлеров.
Как естественник, Бутлеров обязан был
слушать химию только у Клауса, но он акуратно
посещал и лекции Зинииа по технической химии.
В лаборатории он находился под руководством
Клауса, но пользовался советами Зинина. С
одинаковым интересом готовил он препараты сурьмы
по указанию Клауса и делал перегонку
«драконовой крови» по совету Зинииа.
Вспоминая о своих первых шагах в научных
занятиях, Бутлеров писал:
«Шестнадцатилетний студент-новичок, я в то
время, естественно, увлекался наружной стороной
химических явлений и с особенным интересом
любовался красивыми красными пластинками
азобензола, желтой игольчатой кристаллизацией азо-
ксибензола и блестящими серебристыми
чешуйками бензидина. Николай Николаевич обратил на
меня внимание и скоро познакомил меня с ходом
своих работ и с различными телами бензойного и
нафталинного рядов, с которыми он работал
прежде».
Зорко следивший за каждым своим
слушателем, за каждым вновь появляющимся в аудитории
или лаборатории студентом, Николай Николаевич
в наивном ученическом восхищении юноши
цветом и кристаллами веществ увидел душевную его
заинтересованность. Она обещала вырасти в
«Химия и жизнь», № Ч
33
страсть исследователя. Однако, когда Бутлеров
спросил Зинииа после первого же посещения,
можно ли ему заниматься в лаборатории,
Николай Николаевич отвечал небрежно и ие очень
приветливо:
— Ну конечно! Места на всех хватит, была
бы охота.
Опытный педагог терпеть не мог выхваливать
свой предмет, свою лабораторию перед другими.
Он не уговаривал студентов любить химию, и не
просто химию, а именно техническую химию.
Скоро студента, пришедшего из чужого
разряда, Зинин стал предпочитать своим.
Постепенно он знакомил Бутлерова с собственными
своими работами и с веществами, с которыми работал
прежде.
Не ограничиваясь собственными
исследованиями, Николай Николаевич интересовался всем
тем, что делали другие. Нередко он занимался
проверкой и повторением чужих опытов. Поручая
их ученикам, он большую часть опыта успевал,
однако, проделать собственными руками. Так
вместе с учителем приготовил Бутлеров ряд уже
довольно многочисленных после открытия Вёлера
производных мочевой кислоты. Таким же
порядком ои приготовлял производные иидиго, добывал
яблочную, галловую, муравьиную, щавелевую и
другие кислоты.
Наконец, под руководством учителя проделал
Бутлеров и знаменитую реакцию Зинииа.
«При этих разнообразных опытах,—
вспоминает Бутлеров,— ученику приходилось
волей-неволей знакомиться с различными отделами
органической химии, и это знакомство напрашивалось
само собой, облекаясь, так сказать, в плоть и
кровь, лотому что вещества из того или другого
отдела в -натуре проходили перед глазами. А не-
прилежиым быть не приходилось, когда
работалось вместе, заодно с профессором. Какой живой
интерес к делу вселялся таким образом в
учащегося видно из того, что, не довольствуясь опытами
в университетской лаборатории, я завел у себя и
домашнее приготовление кой-каких препаратов.
С торжеством бывало случалось приносить в
лабораторию образцы домашнего производства:
кофеина, изатина, аллоксантина и проч., нередко
навлекая на себя их приготовлением упреки
живших в одном доме со мной. Так умели наши
наставники, и Николай Николаевич в особенности,
возбуждать и поддерживать в учащихся научный
интерес».
Нужно отдать справедливость и самому
ученику. В Бутлерове было что-то, заставляющее л
других лекторов, обращаясь к аудитории,
смотреть именно на него. Располагала его готовность
слушать. У него никогда ие появлялось красноты
иа скулах от духоты и внутреннего напряжения;
его голубые глаза не теряли своего блеска к
концу лекции; ои не пересаживался на скамье, чтобы
устроиться поудобнее; ясно было, что ои не чув-
С АНИЛИНА
НАЧАЛАСЬ ПРОМЫШЛЕННОСТЬ
ОРГАНИЧЕСКОГО СИНТЕЗА
Синтез органических
соединений относится, несомненно, к
числу важнейших технических
достижений человечества — он
позволил создать новый мир
веществ, далеко простирающийся
за пределы -созданного природой.
Задача искусственного
получения органических соединений,
особенно красителей и
лекарственных веществ, 'извлекаемых в
большинстве случаев из
растений, была выдвинута жизнью в
середине прошлого столетия.
Особое место среди этих
веществ принадлежит анилину.
Анилин — простейший
ароматический амин СбНб—NH2
(химическое название — фен ил амин, ами-
нобензол). В чистом виде он
представляет собою почти
бесцветную маслообразную жидкость со
своеобразным запахом. Он
тяжелее воды, в которой плохо
растворяется, поэтому его называют
также анилиновым маслом.
Впервые анилин был получен
в 1В26 г. О. Унфердорбеном при
перегонке натурального индиго с
известью и назван «кристалли-
ном». В 1834 г. Ф. Рунге выделил
его из каменноугольной смолы и
назвал «цианол». В 1840 г. русский
академик Ю. Фщ Фрицше получил
это соединение, нагревая индиго
с раствором едкого кали, и назвал
его анилином.,
В 1842 г. Н. Н. Зинин впервые
получил такое же вещество
синтетически, восстанавливая
нитробензол сернистым аммонием.
В 1843 г. А. В. Гофман уста-
34
ствует утомления в плечах, сухости в горле,
желания встать и уйти. Это был хорошо
воспитанный юноша в прямом смысле слова. Он был
приветлив, услужлив, внимателен, вежлив. Он не
просто уживался с людьми — он не мог жить без
людей.
В природе и в жизни его влекло к себе все
веселое, волнующее и волнующееся, яркое и живое.
Он был необычайно подвижен, успевал посещать
аудитории математического разряда почти так же
аккуратно, как и своего.
Особую симпатию учителя Бутлеров завоевал
тем, что выделялся среди сверстников физической
силой и ловкостью. Он был тяжеловат и неуклюж,
но в физических упражнениях и акробатике мало
кто мог с ним 'Соперничать. Стоило побывать в
Казани какому-нибудь силачу или жонглеру, как
через несколько дней Бутлеров уже показывал
друзьям те же самые упражнения и приемы.
Николай Николаевич в перерывах занятий не прочь
был полюбоваться и сам этими упражнениями.
Под руководством Зинина и Клауса
Бутлеров вполне овладел искусством тонкого
эксперимента, заразился от них глубокой любовью к
химическим исследованиям, но системы
теоретических представлений от своих учителей он получить
не мог, так как сами руководители Бутлерова не
сходились в теоретических взглядах. Клаус был
горячим поклонником и последователем Берцелиу-
са. Он доказывал -справедливость его воззрений и
в пятидесятых годах, когда электрохимическая
теория уже всеми была оставлена. Наоборот, Зи-
иин склонен был принять воззрения французских
химиков Лорана и Жерара.
Французские химики Огюст Лоран и Шарль
Жерар выступили против дуалистической теории
Берцелиуса с новой, так называемой «унитарной»
теорией, согласно которой все органические
соединения получаются замещением водородных
атомов в основных углер о до- водородных ядрах
другими элементами, например хлором, бромом,
иодом, азотом и т. д. Положив свою теорию ядер
в основу классификации органических соединений,
Лоран тровел резкое различие между молекулой,
атомом и эквивалентом: молекулой он назвал
мельчайшее количество вешества, нужное для
образования соединения; атомом — мельчайшее
количество элемента, встречающееся в сложных
телах; эквивалентом — равнозначные массы
аналогичных веществ.
Николай Николаевич был осторожен в
выборе теоретических представлений, в изобилии
распространявшихся в то время, противоречащих
одно другому. Он не спешил внедрять ту или
другую теорию в сознание учеников, пока ие
установился один общий взгляд на существо все еще
темных химических процессов.
Быть может, это был наиболее правильный
путь, ведущий к самостоятельным суждениям, к
выработке собственных воззрений.
Инженер Б. Г. ГИНЗБУРГ
новил идентичность всех
перечисленных соединений.
В дальнейшем Н. Н. Зинин
распространил свои исследования
на другие ароматические нитро-
производные и показал общность
открытой им реакции
восстановления ароматических нитросоеди-
нений в аминосоединения.
История использования
успехов химической (науки в
промышленности знает .много примеров,
когда вновь открытые реакции,
представляющие большой
теоретический интерес, в течение
долгого времени не находили
никакого практического применения. Так
было .и с реакцией Зинина. Ее
стали 'применять в
промышленности (в несколько видоизмененном
А. Бешеном виде) только через
15 лет, сначала в Германии и
других странах. В России
производство анилина было начато после
1900 г. на заводе, построенном
около Кинешмы (теперь
Заволжский завод -имени Фрунзе).
Президент немецкого
Химического общества, один из
основателей анилинокрасочной
промышленности в Германии А. В,
Гофман, так охарактеризовал
значение реакции, открытой К Н.
Зиминым:
«Если бы Зинин не сделал
ничего более, кроме «превращения
нитробензола в анилин, то и
тогда его имя осталось бы
записанным золотыми буквами в истории
химии». Открытие Зинина дало
начало промышленности
синтетических красителей.
В конце Х!Х века возникли
другие отрасли промышленности
органического синтеза,
использующие промежуточные продукты
анилинокрасочного
производства — фармацевтическая,
взрывчатых веществ, душистых веществ.
Анилин можно с полным
правом назвать веществом-первенцом
промышленности органического
синтеза.
3* 35
Теоретические достижения химии того
времени мало могли дать Бутлерову, а в дальнейшей
своей научной деятельности он был бы стесне i
теоретическими представлениями, почерпнутыми
из университетских лекций. Не связанный же, как
многие из его современников, косным, привычным
мышлением, на котором были основаны
химические теории -старого времени, Бутлеров стал
творцом новой теории, лежащей в основе современной
органической химии.
Также другой ученик Зинина, Николай
Николаевич Бекетов, никогда не добывал ни одного
нового факта, ради самого факта, чем занималась
тогда преимущественно органическая химия.
Стараясь проникнуть в сущность «химического
сродства», Бекетов первым пришел к выводу, что
наиболее прочно соединяются между собой те
вещества, которые обладают наибольшею близостью
«паев», или атомов. Таким образом, первая мысль
о зависимости силы сродства элементов от их
атомного веса была высказана как раз химиком,
свободным от путанных представлений
предшествовавших теоретиков.
В научной деятельности и Бутлерова и
Бекетова видно мышление химиков-философов, и этой
особенностью они были обязаны влиянию -своего
учителя. Оно было столь властным, что вслед за
учителем, покинувшим Казань, последовали в
Петербург и его ученики.
Как солнце планетами, Зинин был окружен
своими учениками до последнего дня жизни. Не
только непосредственными учениками, но и
учениками учеников не был забыт в Казани Николай
Николаевич Зинин. В 1900 году, уже после смерти
Зинина и Бутлерова, ученики Бутлерова
профессора химии А. М. Зайцев и В. В. Марковников
подняли в Совете университета вопрос об
установке бюстов Зинина и Бутлерова в аудитории
химической лаборатории. Указывалась при этом
особая заслуга их, «дающаяся в удел только
немногим избранным»,—создание казанской школы
химиков.
«Эта беспримерная в нашем отечестве
заслуга,—писал А. М. Зайцев,-по крайней мере по
отношению к нашей специальности, составившая
славу тех лабораторий, которые имели счастье
находиться под их руководством, дает нам полное
право называть Зинина и Бутлерова отцами
русской химии. С гордостью мы должны сказать, что
эта школа возникла и организовалась на почве
нашего родного университета, и нужно также
заметить, что и вне казанской службы Зинина и
Бутлерова духовная связь с ними этой школы
никогда не прекращалась: все нужды и все успехи
нашей химической лаборатории всегда находили
в их сердцах благодарный отклик...».
Успехи русской химии в самом восточном
тогда научном центре страны выдвинули
Казанский университет в центр общественного
внимания и положили начало его исторической
известности, как «колыбели русской химии».
Окончательно мировую известность
утвердили за Казанским университетом Бутлеров и его
ближайшие ученики.
РЕАКЦИЯ,
ВОШЕДШАЯ
В ИСТОРИЮ НАУКИ
Кандидат
химических наук
В. Н. ЛИСИЦЫН
В первой половине XIX века
органическая химия только
начинала самостоятельное
существование. В области синтеза
органических веществ делались только
первые шаги.
Опубликованная в 1842 г.
работа профессора Казанского
университета Н. Н.
Зимина—превращение 1-нитронафталина и
нитробензола под действием
сернистого аммония в соответствующие
аминосоединения 1-нафтиламин и
анилин (или «н афт ал идам» и «бенз-
идам», как они были названы
Н. Н. Зининым) внесла
неоценимый вклад в развитие
органической химии.
N02 NHt N02 NH,
I III
\/\f
l/\S \/
\/
К Н. Зинин, понимая значение
открытой им реакции,
распространил ее и на другие нитро- и
динитросоединения. В 1844 г.
появилось сообщение о получении
нафтилендиамина и м-фенилен-
диамина из соответствующих ди-
нитросоединений. В 1845 г.
описано получение м-аминобензойной
кислоты и другие интересные
превращения замещенных бензола.
Так, три действии спиртовой
щелочи на нитробензол Н. Н. Зинин
впервые получ-ил азоксибензол.
Восстановление азоксибензола
позволило получить гидразобен-
зол, который под действием
кислот перегруппировывается в бен-
зидин D,4'-диам-инобифенил).
Эти работы показали общ-
зв
ность открытой Н. Н. Зини'ным
реакции получения ароматических
аминов путем восстановления нит-
росоединений. С тех лор эта
реакция вошла в историю химии
как «реакции Зимина». Следует
отметить, что это открытие было
сделано в то время, когда еще не
существовало даже классической
теории строения органических
соединений.
В те годы еще нельзя было
предвидеть, как часто и как
успешно будет применяться
реакция Зинина при синтезе самых
разнообразных органических
веществ. И, конечно, никто не
думал, что эта реакция, открытая в
Казани, станет первым звеном в
цепи открытий, которые
приведут к созданию современной
промышленности органического
синтеза. Но вскоре новые работы
химиков наглядно показали величие
открытия Зинина.
В 1858 г. Грисс открыл
реакцию диазотирования —
превращения первичных ароматических
аминов. Благодаря способности
диазосоединений к реакции азо-
сочетания был создан
многочисленный класс синтетических
красителей — азокрэсителей. Большая
реакционная способность
диазосоединений дала возможность
замещать диазогруппу атомами
водорода и галогенов, циан-, окси-,
алкокси-, ароксигруппами и др.
Это привело к получению
многочисленных новых органических
соединений.
Открытие Зинина выдвинуло
молодую в то время русскую
химическую науку на передовое
место. Уже вскоре ученым стало
ясно, какую роль в органической
хими и будут играть амин осоеди-
нения ароматического ряда
благодаря их реакционной
способности и возможностям превращения
в соединения других классов.
Ароматические амины стали
практически доступны благодаря
работам Зинина. В дальнейшем
научная мысль работала над
совершенствованием реакции Зинина,
над восстановлением нитросоеди-
нений с помощью различных
агентов и катализаторов. Появились
методы восстановления нитросое-
динений металлами в кислой
среде, железом в среде электролита,
металлами в щелочной среде,
водородом в жидкой и газовой
фазах в присутствии катализатора,
метод электрохимического
восстановления и т. д.
Общий способ восстановления
ароматических нитросоединений
до аминов, предложенный
Н. Н. Зиминым, часто
оказывается самым лучшем для
лабораторных экспериментов и в наше
время. Вряд ли найдется химическая
лаборатория, где бы не
применялось восстановление
ароматических нитросоединений до аминов.
Особенно важен метод
Зинина (с применением сульфидов)
для ступенчатого
восстановления — для случая, когда из
имеющихся в соединении нескольких
митрогрупп надо восстановить
только одну:
/V-NO, /W*Hf
Y V
N02 N02
Синтез первичных
ароматических аминов, осуществленный
Н. Н. Зининым, определил
направление развития органической
химии и вызвал к жизни анилино-
красочную 'промышленность, а
затем — .промышленность
взрывчатых веществ, фармацевтических
препаратов, ускорителей
вулканизации каучука и т. д.
Ароматические амины и их
замещенные занимают
исключительно важное место среди
промежуточных продуктов. Нет
почти ни одного класса красителей,
в синтезе которых не
использовались бы амины. Аммносоединения
необходимы как исходный
материал для синтеза
фармацевтических препаратов (сульфамидных,
фенацетина и других). Некоторые
амины находят применение в
синтезе промежуточных -продуктов
для полимеров (фенилизоцианат,
толуилендиизоцианаты и др.).
Говоря о большом научном
значении реакции Николая
Николаевича Зинина, мы с полным
правом можем назвать его
основателем самостоятельного
направления в химии. Ученик Н. Н. Зинина,
основатель теории химического
строения органических соединений
Александр Михайлович Бутлеров
говорил о своем учителе: «С его
научной и педагогической
деятельностью соединено возникновение
русской химической школы; ему
обязана русская химия по
преимуществу своим вступлением в
самостоятельную жизнь; его труды
впервые заставили ученых
Западной Европы отвести русской химии
почетное место,,. Именем Зинина
по справедливости гордится
русская наука».
НОВОСТИ ОТОВСЮДУ
ФОТОГРАФИРОВАНИЕ
ЖИВОЙ
КЛЕТКИ
В Принстонском университете (США)
сфотографирована «в собственных лучах»
живая клетка — представитель простейших
морских одноклеточных, вызывающих
свечение океана. Для фотографирования было
использовано специальное устройство,
которое усиливало свет, излучаемый
клеткой, в 500 тысяч раз. (Подобные
усилительные устройства применяются в
астрономии для фотографирования звезд.)
ОПЫТЫ ПОЛУЧЕНИЯ
БЕЛКА ИЗ НЕФТИ
ПРОДОЛЖАЮТСЯ
Журнал «Chemikal and Engineering
News» A964, № 3) сообщал, что в Лавере
(Франция) иа полупромышленных
нефтехимических установках налажено
непрерывное получение из нефти
микробиологическим путем белкового вещества.
Подкормка для бактерий должна содержать
азотистые соединения, фосфаты, калий и
магний. Кроме того, необходимо наличие в
ферментаторе железа, цинка, меди,
марганца (в количествах, содержащихся в
обычной воде). Аналогичные исследования
ведет также фирма «Эссо» (США), в
исследовательском центре которой был
получен иа опытной установке продукт,
содержащий 10 важнейших аминокислот и
витамины (в наибольших концентрациях —
группы В).
НОВЫЙ ИСКУССТВЕННЫЙ
МАТЕРИАЛ — ДЕВКОН
В США запатентован материал «дев-
кон» (пластичный металл), состоящий из
80% стального или алюминиевого порошка
и 20% связующей пластмассы. Материал
легко поддается механической обработке
обычными средствами, отличается хорошей
износостойкостью и стойкостью против
воздействия химических веществ, смазочных
масел, растворителей. Девкон в ьиде
пасты или жидкости заливается в форму и
После добавки активатора твердеет в
течение нескольких часов. Этот материал
может служить для восстановления
изношенных деталей, изготовления шаблонов,
форм, моделей.
37
.4dt* * ^^
Кандидат медицинских наук
И. Е. КИСИН
ВЕЩЕСТВО ИЗ ЛЕГЕНД
Лекарства, о которых пойдет речь,
появились в практике врача всего десять-пят-
надцать лет назад. Сейчас без них не
обходится почти ни одна трудная и долгая
хирургическая операция, они стали одним из
самых необходимых средств в арсенале
современной медицины. Но история этих
лекарств —как это нередко бывало со
многими целебными препаратами — началась
на много веков раньше.
Среди многих легенд об открытой ими
удивительной заокеанской стране спутники
Христофора Колумба привезли рассказ о
страшном яде, известном местному
населению, о яде, поражающем наповал и
человека и зверя — кураре. С тех пор
европейцам пришлось наслышаться еще немало
удивительных историй о смертоносном
веществе, наблюдать самим его действие и
даже испытать его на себе.
Южноамериканские индейцы
использовали кураре при исполнении религиозных
обрядов, на охоте и на войне. Обычно они
смазывали ядом наконечники боевых стрел.
«...Индеец, не говоря ни слова, схватил
свой сарбакан (духовое ружье) и
прокрался кустарниками к дереву. Там он
несколько минут оставался в неподвижности,
затем, вложив стрелу в сарбакан, поднял это
оружие, поднес его к губам, держа один
конец близ самого рта, что требовало
немалой сноровки, так как трубка была очень
длинна. Затем, набрав побольше воздуха в
легкие, он дунул в трубу... Леон, затаив
дыхание, не сводил глаз с тапира. Бедное
животное продолжало пастись, не
подозревая об опасности. Вдруг оно вздрогнуло,
прекратило есть, потом снова принялось
рвать корни, но уже более вяло, затем еще
раз остановилось, зашаталось и с громким
плеском упало на дно. Кураре оказало свое
действие: тапир был мертв».— Так описы-
38
X
<
CQ
U
<
ас
ш
О
3
го
и
и
Рисунок В. Щапова
вал Майн Рид сцену индейской охоты в
романе «Изгнанники в лесу».
Кураре очень долго было окружено
ореолом таинственности. Секрет его
приготовления ревниво оберегался индейцами,
и только постепенно на основе легенд,
преданий и по рассказам отдельных
путешественников, сумевших завоевать доверие
местного населения, удалось раскрыть этот
секрет.
По обычаю, яд приготовляли старейшие
женщины племени. На костре, в большом
котле, варились корни ядовитых растений
вместе со смолянистыми соками, змеиным
ядом, головами муравьев, хвостами
скорпионов. Яд признавался годным только в
том случае, если от вдыхания паров хотя бы
одна из варивших его старух теряла
сознание или погибала. Если же женщины
чувствовали себя хорошо, кураре считали
негодным, а его приготовителей жестоко
наказывали.
Индейцы хранили яд в бамбуковых
трубках, выдолбленных изнутри тыквах или
маленьких глиняных горшочках. Кураре,
чем-то напоминающее смолу, легко и
прочно прилипало к наконечникам стрел.
Индейцы справедливо считали эти стрелы
страшнее любого оружия.
После долгих и настойчивых поисков
европейцам удалось установить, что
основным смертоносным началом туземного яда
являются соки южноамериканских
растений—стрихнос и хондодендрон.
Но сам механизм действия яда на
живой организм оставался загадкой в течение
столетий. Ее пытались решить многие
естествоиспытатели. Постепенно кураре
превращалось в объект многочисленных научных
исследований. Заманчиво было не только
понять причину его силы, но и найти
противоядие. А позднее появилась мысль
использовать его даже в лечебных целях.
ПОДСТУПЫ
К ЗАГАДКЕ
Со временем природа действия яда
начинала все же проясняться. Поворотным
пунктом послужило, пожалуй, одно
случайное наблюдение. Ослица, раненная
отравленной стрелой, была спасена энергичным
вдуванием воздуха в ее легкие.
Напрашивался вывод: смерть от кураре наступает
из-за остановки дыхания. Значит, яд
должен парализовать дыхательные мышцы.
Позднее выяснилось, что кураре вначале
парализует мышцы головы, шеи, туловища,
дыхательная же мускулатура поражается
в последнюю очередь.
Исследователей заинтересовал вопрос о
природе этого паралича. На что действует
яд? На нервные центры, расположенные в
головном или спинном мозгу, на нервы, ко-
39
торые идут от этих центров к мышцам, или
непосредственно на мышцы? Крупный
ученый прошлого века К. Бернар провел
серию опытов. Он перевязывал у лягушки
артерию, снабжающую кровью заднюю
лапку, и вводил ей кураре. Через несколько
минут у лягушки оказывались
парализованными все мышцы за исключением
перевязанной лапки. Попасть сюда вместе с
кровью яд не мог, но ведь в нервные
центры, управляющие лапкой, он проникал
беспрепятственно! К. Бернар сделал вывод, что
паралич, вызываемый кураре, не связан с
действием на центральную нервную
систему.
Далее опыты велись на изолированной
мышце лягушки и относящемся к ней нерве.
В обычных условиях раздражение нерва
электрическим током вызывает сокращение
мышцы. Исследователь опускал в раствор
кураре нерв и вновь раздражал его
электрическим током. Мышца продолжала
сокращаться.
Затем и саму мышцу погружали в
ядовитый раствор. После этого она переставала
реагировать на раздражение нерва, но, тем
не менее, сокращалась, если на нее
непосредственно действовали электрическим
током. Так родилось предположение, что
кураре действует не на нерв и не на мышцу,
а на место их соединения.
Дальнейшее выяснение механизма
действия кураре оказалось связанным с
открытием ацетилхолина,— вещества, которое
играет роль посредника в передаче
возбуждения от нерва к мышце и другим органам.
Ацетилхолин оказался эфиром аминоспирта
холина и уксусной кислоты:
И °«;снз
H3CC0-ClfeCH2-N(CH3
NCH3
Выяснилось, что каждый импульс
возбуждения (биоток), поступающий по нерву к
мышце, вызывает выделение из нервного
окончания ацетилхолина, под действием
которого мышечное волокно возбуждается и
начинает сокращаться.
Определение роли ацетилхолина в
передаче возбуждения, факт, сам по себе
выдающийся в науке о живом
организме,—показало, что ключ к решению загадки кураре
таится во взаимодействии именно двух
веществ: самого яда и переносчика нервного
импульса. Наибольшее внимание
привлекали два факта. Прежде всего отравление
никак не сказывалось на выделении
нервными окончаниями ацетилхолина.
Следовательно, кураре не вызывало их паралича.
Кроме того, оказалось, что кураре
прекращает реакцию мышцы не только на
электрическое раздражение, но и на
действие ацетилхолина. Из этого был сделан
вывод, что в мышцах существуют
определенные биохимические системы, которые
при взаимодействии с ними ацетилхолина
вызывают возбуждение мышечных волокон.
Секрет кураре как раз и таился в его
свойстве как-то блокировать эти системы и
лишать их способности реагировать с ацетил-
холином.
Разгадать этот секрет до конца могла
помочь только расшифровка химического
строения яда.
КУРАРЕ
ПОДДАЕТСЯ
РАСШИФРОВКЕ
Установление химического строения
кураре оказалось чрезвычайно сложным
делом. В течение почти семидесяти лет
продолжались попытки выяснить его
химическую природу и, наконец, в 1935 г. ученому
Кингу удалось решить задачу. Из
бразильского музея он получил образец яда,
упакованный в бамбуковую трубку. Такой яд
назывался трубочным кураре и
изготовлялся, главным образом, из растений вида
хондодендрон. Исследования Кинга
начались с того, что из кураре было выделено
чистое кристаллическое вещество,
обладавшее всеми свойствами яда. Это вещество
получило название тубокурарина.
Затем перед ученым встала задача
установить элементы, из которых состоит
молекула тубокурарина. Тубокурарин
нагревали— при этом он разрушался — и его
остатки подвергали действию различных
химических реактивов, которые словно лакмусовая
бумажка помогали выявлять присутствие
того или иного элемента. Чтобы выяснить,
например, входит ли в исследуемое
соединение азот, разрушенный тубокурарин
сплавляли с металлическим натрием. Если
40
азот действительно присутствовал, тут он
должен был перейти в цианистый калий.
Добавка соли железа превращает
цианистый калий в соединение синего цвета —
берлинскую лазурь. В ходе опытов
содержимое пробирки на самом деле
окрашивалось в синий цвет. Химический анализ
подтвердил присутствие азота в молекуле
тубокурарина. Подобным же путем установили,
что в состав таинственного яда входят еще
три элемента: углерод, водород и кислород.
Следующая задача химиков сводилась
к определению точного количества атомов
каждого элемента в составе одной
молекулы тубокурарина. Методы аналитической
химии позволили справиться с этой задачей
сравнительно легко и быстро. Последовала
серия опытов и расчетов — и на листе
бумаги впервые возникла формула: C38H46N2O8.
Однако, самое главное было впереди.
Эмпирической формулы далеко не
достаточно, чтобы судить о природе какого бы то
ни было органического соединения. Нужно
было еще выяснить строение вещества,
установить характер связей, существующих
между всеми 94 атомами тубокурарина.
Сложнейший процесс выяснения
структуры вещества можно сравнить с
расшифровкой рукописи на неизвестном языке.
Одна загадка сменяет тут другую.
Достаточно взглянуть на структурную формулу
тубокурарина, чтобы представить трудность
задачи, которая была решена учеными:
В состав молекулы тубокурарина
входят два атома азота, соединенные каждый
с четырьмя углеродными атомами. Атом
азота в такой молекулярной конструкции
носит название четвертичного. Именно на
четвертичные атомы и обратили внимание
химики, изучавшие строение тубокурарина.
Это было связано с установлением одной
важной закономерности общего характера,
которая относится к веществам, близким к
естественным продуктам обмена.
Среди фармакологических препаратов,
напоминающих по строению природные
биохимические агенты, есть два типа
соединений: одни сходны по действию с этими
агентами, другие обладают как раз
обратным (антагонистическим) действием.
Обычно у антагонистов структура схожа с
естественным биохимическим веществом, но
вместе с тем она отличается иногда
значительно большей сложностью. Как говорят
в этих случаях фармакологи, какая-то часть
молекулы антагониста «утяжелена» по
сравнению с природным веществом.
«Утяжеление» может возникнуть из-за
присутствия сложных циклических структур.
Исходя из этой закономерности,
естественно было сравнить строение
тубокурарина и ацетилхолина. При первом же
взгляде на структурные формулы обоих веществ,
обращает на себя внимание присутствие и
в молекуле ацетилхолина и в молекуле
тубокурарина четвертичного атома азота.
Это сходство послужило одним из
оснований для создания теории о конкурентном
типе действия кураре.
Согласно этой теории тубокурарин,
благодаря некоторому сходству с ацетилхоли-
ном, вступает в реакцию с теми же
биохимическими системами, с которыми
взаимодействует ацетилхолин при передаче
нервного импульса. Однако из-за разницы в
объеме молекул тубокурарин не может
вызвать нормального физиологического
процесса, он лишь связывает реактивные био
химические системы, а значит препятствует
их взаимодействию с ацетилхолином.
Таким образом, между ацетилхолином и тубо-
курарином возникает настоящая
конкуренция, и при достаточной концентрации
антагонист-кураре вытесняет из реакции своего
конкурента — ацетилхолин.
Кураре можно образно сравнить с
поддельным ключом, который застрял в
замочной скважине. Он похож на настоящий ключ
и поэтому вошел в отверстие. Однако
открыть им дверь нельзя, так как он не
соответствует механизму замка. Замок оказался
«блокированным». Также блокирует
функцию нервно-мышечного соединения и
кураре.
41
ЯД СТАНОВИТСЯ
ЛЕКАРСТВОМ
Четыре века действие кураре было
известно европейцам. Постепенно
раскрывались все секреты легендарного яда. И в
какой-то момент закономерно встал вопрос:
а нельзя ли обратить на благо человеку
страшные свойства этого вещества?
Поле деятельности для кураре
отыскалось быстро. В хирургической практике —
при долгих и трудных операциях — врачу
необходимо полностью расслабить мышцы
больного. Обычно для этого прибегают к
помощи наркотиков, например, эфира. Но
наркотики требуются при этом в очень
больших дозах, а с дозой растет и их вредное
влияние на организм. Как же ограничить
применение наркотических средств и вместе
с тем добиваться полного расслабления
мышечных тканей. Вот тут и вспомнили о
кураре.
Было решено соединить действие
наркотических средств и тубокурарина,
очищенные препараты которого уже были
получены к тому времени. Провели серию
экспериментов на животных, а затем эту необычную
комбинацию стали использовать и при
операциях на людях. Успех превзошел все
ожидания. Тубокурарин не только
расслаблял мышцы больного, но и усиливал
действие наркотических средств. Это позволило
в два-три раза уменьшить дозы эфира,
а значит, стало значительно слабее вредное
действие наркотика на организм.
Достигнутый успех широко раскрыл для
тубокурарина двери операционных всего мира. И вот
уже 15—20 лет это лекарство занимает
важное место в арсенале врачей.
Широкие возможности применения
кураре в хирургии побудили фармакологов
начать интенсивные поиски новых средств
такого же типа. Как мы знаем, химическое
строение тубокурарина было к тому
времени точно установлено, и ученые решили
попытаться «упростить» сложную молекулу
этого вещества. Удалось синтезировать
большое количество соединений, структура
которых напоминала строение
тубокурарина, но была значительно проще. Эти
вещества содержали четвертичные атомы азота,
соединенные между собой циклическими
цепями из углеродных атомов.
Свойства новых веществ тщательно
исследовались, и, наконец, было обнаружено,
что группа соединений, представляющая
собой эфиры холина с фенолами, наделена
курареподобными свойствами. А одно
вещество этой группы — пиролаксон — лишь
незначительно уступало тубокурарину по
силе действия. Так в клиниках появился
первый синтетический заменитель кураре.
Дальнейший процесс совершенствования
курареподобных веществ пошел
значительно быстрее. Был создан препарат диплацин,
который выгодно отличался от
тубокурарина большей широтой терапевтического
действия. Это значит, что разница между
смертельной дозой, вызывающей остановку
дыхания, и дозой, просто расслабляющей
организм, была у него больше, чем у кураре.
Это значительно облегчило работу хирурга,
которому в обращении с тубокурарином
приходилось соблюдать большую осторожность.
Действие другого синтетического
препарата — парамиона — оказалось еще более
сильным, чем у тубокурарина. Были
открыты курареподобные свойства у полимети-
ленбисаммонийных соединений. Эти
вещества в отличие от тубокурарина не содержат
в своей молекуле циклических комплексов.
Но в них, как и в тубокурарине, есть два
четвертичных атома азота, соединенных
цепочкой из мегиленовых групп.
Исследователи заметили, что с
увеличением числа метиленовых групп между
атомами азота возрастает и сила действия
42
синтезируемых соединений. Максимум ку-
рареподобного действия оказался у
вещества с десятью метиленовыми группами в
цепи между атомами азота. Активность
соединений с большей длиной цепочки
начинает убывать. Чем это вызывается?
При десяти углеродных атомах в цепи
расстояние между четвертичными атомами
азота составляет 13—15 А (А равен 0,1
миллимикрона). Интересно, что в молекуле ту-
бокурарина оно приблизительно такое же.
Можно предполагать, что максимум
активности у соединения с десятью углеродными
атомами объясняется тем, что
пространственное расположение атомов азота в
молекуле вещества больше всего соответствует
расположению атомов в системах живого
организма, с которыми оно взаимодействует.
Вещество с цепочкой из десяти
углеродных атомов между четвертичными атомами
азота получило название декаметоний. Оно
оказалось в 5 раз сильнее тубокурарина.
Поиски курареподобных веществ
продолжались. Некоторые исследователи
решили взять за образец структуру ацетилхоли-
на. Этот путь оказался весьма
плодотворным. Вскоре был получен очень активный
препарат — дитилин, который состоит из
двух молекул ацетилхолина, соединенных
между собой кислотными концами.
Интересно, что в молекуле дитилина так же, как
и в молекуле декаметония, между двумя
четвертичными атомами азота находится
такая же цепочка. И для этого ряда
соединений оказался верным принцип: максимум
активности — у веществ с расстоянием 13 —
15 А между атомами азота.
Дитилин оказался кратковременно
действующим препаратом. Его эффект
наблюдается 4—7 минут, в то время как действие
других средств длится от двадцати до
сорока. Эта особенность дитилина объясняется
тем, что из-за большого сходства с ацетил-
холином он быстро разрушается холинэсте-
разой — тем же ферментом, что разрушает
и ацетилхолин. Вместе с тем дитилин
оказался и наименее токсичным из всех
известных курареподобных средств.
Поиски средств, расслабляющих
мышечную систему, не прекращаются. И есть все
основания ожидать, что еще не раз
вещества, построенные по образу и подобию
одного из сильнейших ядов природы,
придут на помощь врачу в его борьбе за жизнь
человека.
но-
ТО
-СМИ НО-
то
H2C-CH2-0-^-0-CHrCHs
-смн
Диплецин. Он выгодно
отличается от тубокурарина
большей широтой терапевтического
действия
Молекулы полиметиленбисаммонийных
соединений в отличие от курарина не
содержат циклических комплексов
сн,он-
ОН'СН,
сн3;й-(сн2)п-й(сн3
СНз СНз
cMjr ^г2\ онсн:
ch37N-ch2-ch2-o7c-ch2-ch2-c-o-ch2-ch2-n(ch
си' Шгт^Ап1 чсн,
43
МОЛОДЕЖЬ — УЧЕБА — ТВОРЧЕСТВО
За многие тысячи лет
эволюции природа воспитала в
человеке стремление создавать
самые разные вещи — строить
дома, делать топоры и мотыги,
прокладывать дороги. Тот, в ком
силен этот инстинкт,
унаследованный от далекого лохматого
прародителя, насаживавшего камень
с дыркой на подходящую палку
и выдалбливавшего уютную
пещеру из трех комнат со всеми
удобствами в скале, расположенной в
живописном районе на берегу,
становится изобретателем,
инженером, агрономом. Если же
вдобавок у такого человека нет
желания ограничиваться
повторением дел своих предшественников,
если он хочет строить дома
нового типа, создавать такие орудия,
каких еще ни у кого не было, и
получать такие урожаи, которые
еще никому не снились, то он
вступает в передовой отряд
строителей цивилизации.
Много качеств должен
объединять в себе человек,
играющий заметную роль в этом
движении мира к интересной и
комфортабельной жизни. Нужно
знать достигнутые на этом пути
успехи и разочаровывающие
тупики. Необходима превосходная
память, способная вобрать все
факты, имеющие прямое и косвенное
отношение к делу. А упорство и
настойчивость? Многие сотни
материалов перепробовал Эдисон,
пока нашел подходящую нить
накала электрической лампочки.
Непременное и страстное
желание увидеть плоды своей
.работы свойственно людям этого
стиля. Нет им покоя до тех пор, пока
миллионы людей не ощутят пользу
от их дел. Но при этом они
должны уметь не только работать, но
и доказать свою правоту.
В конечном счете лучшее
берет всегда (скажем для осторож-
■ш
вещ
Доктор
физико-математических наук
А. И. КИТАЙГОРОДСКИЙ
ности, почти всегда) верх. Таков
закон жизни. Но сколько сил и
нервов стоит это тем, у кого
единственная цель — бескорыстно
помочь людям жить легче и лучше.
Бескорыстно? Да, конечно. Хотите
убедиться в этом? Предложите
деньги за то, чтобы человек
отказался от доведения своего дела до
конца. Ничего не выйдет — отступ-
пиков не бывает. Я знал и знаю
много таких бескорыстных людей.
И всегда восхищался их
темпераментным служением своему делу.
На пути к цели много
разочарований, но зато сколько радости при
успехе! Общественное
признание—это щедрая расплата за все
волнения и тревоги, за труд без
счета часов и дней, за
беззаветную преданность делу. Для очень
многих слово «наука» связано
только с подобной деятельностью.
Так долгое время думал и я.
В доме моего отца, посвятившего
свою жизнь созданию новых
материалов, знания оценивались с
позиции практической полезности.
Надо учиться, надо быть
образованным, чтобы делать новые
машины, чтобы создавать сам>ю
прочную сталь, чтобы
придумывать самые быстрые самолеты.
Мальчишек часто спрашивают,
кем они хотят быть? Спрашивали
и меня, и я всегда отвечал, не
задумываясь:
— Буду заниматься наукой.
— Какой же?
— Еще не знаю, но буду
искать способы строить дома из
стекла или займусь
усовершенствованием электрических машин.
Лишь позднее я узнал, что в
слово «наука» многие вкладывают
совсем другой смысл.
Глава из книги «Физика — моя
профессия», выходящей в издательстве
«Молодая гвардия» (печатается с
небольшими сокращениями).
44
Лет четырнадцати я начал
.регулярно ходить в Румянцевскую
библиотеку (старое здание
теперешней Ленинской), где проводил
время за чтением. Сначала читал
то, что связано со школой.
На уроке по географии
учительница рассказывала про
Индию. Хорошо. Значит, надо
почитать что-нибудь про индусских
факиров и про нравы раджей.
На уроке литературы шел
разговор о декабристах. Тоже
интересно: выпишем мемуары Якуш-
кина.
Но скоро выбор книг стал
диктоваться не школой, а
курилкой библиотеки. Приходится
признаться, что я уже покуривал в
этом возрасте. Курилка была
клубом библиотеки, откуда, я
подозреваю, многие посетители и не
выходили в читальный зал. Там
было всегда шумно, мальчишки
кричали и спорили. Спорили
жарко, неистово, перепрыгивая с
одной темы на другую. Спорили обо
всем: о Дарвине и о религии, о
гипнозе и самовнушении, об
отношении Блока к Белинскому и
театральных постановках
Мейерхольда.
Я не жалею теперь, что рано
начал курить. Песещение
курилки — одно из лучших моих
воспоминаний, и если преувеличение
сказать, что там я получил свое
образование, то уж во всяком
случае верно, что эти нескончаемые
споры в основном заставляли
прочитать книги, которые иначе
остались бы мне не известными.
Одним из непременных
посетителей курилки был молодой
человек, которого, кажется, звали
Валерий. Гладкие длинные
волосы, истощенное лицо, глубоко
запавшие темные глаза. Он курил
самые дешевые папиросы и
никогда не ходил в буфет. Денег у
него, видимо, не было... Запомнил я
его не из-за колоритной
внешности, а за горячие речи, в
особенности на темы о призвании
человека. Классификация человеческих
стремлений по степени их
важности казалась Валерию
самоочевидной, и впервые от него я услышал
понимание науки, совсем
отличное от моих домашних
представлений.
— Утилитаризм есть выдумка
буржуазного общества,— говорил
он, попыхивая папиросой.— Это
Френсис Бэкон изволил заявить,
что стремление к познанию
никому не нужно, если оно не связано
с практической пользой.— Я так и
вижу,— продолжал он,— пузатого
лавочника, наставляющего своего
сына: «кому нужна поэзия,
картины или пустые знания о числе
звезд во вселенной? Только
нескольким сотням чудаков — таких,
как ты. Зато все люди хотят есть,
нуждаются в одежде и мечтают о
теплом и уютном доме. Помогай
им в этом, и ты добьешся
уважения, почета и достатка...».
Валерий передохнул немного.
— Казалось бы, каждому
интеллигентному человеку должна
быть противна эта откровенная
мещанская проповедь... Противно
слушать Бэкона, что поэзия если
и нужна, то лишь как отдых
после трудов, а абстрактные знания
полезны лишь потому, что их
вскоре удастся превратить в дешевую
колбасу... Нет, только наука и
искусство, лишенные практической
направленности, обожествляют
человека, возносят его над
животными.
— Не говори глупостей!—
кричали ему.— Голодному
человеку не до чистого искусства, и
размерами атома он не станет
интересоваться. Сначала надо
накормить людей, а потом уже думать
об их душе.
Но в защиту Бэкона редко
кто выступал. С Валерием
соглашались... в принципе. Просто
считали его заботы и волнения
несвоевременными.
— В общем,— говорили ему,—
общество не мешает тебе
заниматься искусством или чистой
наукой. Но не жди за это горячей
признательности от сегодняшнего
мира, в котором для миллионое
людей еще недостает хлеба и
башмаков. Вот наступит золотой век...
Как-то, когда мы были с
Валерием вдвоем, я робко спросил у
него:
— Какие же цели у науки,
если это не создание полезных
вещей?
— Цель науки — открытие
новых фактов и связей между
явлениями,— последовал
незамедлительный ответ.— Привести
примеры?
Я кивнул головой.
— Хорошо. Вот тебе примеры
из разных областей. Физик нашел,
что электропроводность меди
падает с увеличением температуры
Нашел впервые. Найден новый
факт—наука стала богаче.
Исследователь австралийской фауны
нашел новый вид муравьев. Это
другой пример бесспорного
завоевания науки. Историк после
просмотра большого числа
оригинальных документов установил, что в
кругах немецкого мещанства
великая французская революция была
встречена неприязнью,— вот тебе
третий пример.
— Ив этом цель науки?—
удивился я.
— Нет. Установление новых,
доселе не известных фактов —
лишь фундамент науки. На долю
же более способных, я бы сказал,
более зрячих исследователей
приходится работа по постройке
верхних этажей здания науки. На
основе фактов они ищут обобщения
и устанавливают связи между
явлениями, то есть открывают
закономерности.
— Я понимаю. Но скажите,
Валерий, если человек ищет пути
для улучшения качества стали,
разве он не занимается наукой?
— Я бы для такой работы
подыскал другое слово,— отвечал
он в раздумье.— Конечно, и здесь
зачастую открывается много ново-
45
го и интересного, но оно не
является самоцелью.
— Вы что же, к такой
деятельности относитесь с меньшим
уважением?— Все во мне
протестовало, я становился на защиту
своего отца. Но обороняться не
пришлось.
— Да бог с тобой!—отвечал
он спокойно.— Превосходная,
благороднейшая деятельность. Но
доказывать ее необходимость — это
ломиться в открытую дверь. А вот
то, что бескорыстное стремление
к познанию заслуживает не
меньшего уважения,— вот этого очень
многие не понимают.
И уже тогда мне стало ясно,
что в слово «наука» многие
вкладывают совсем разное
содержание.
Когда говорят, что этот
человек — ученый или что этот
человек занимается наукой,— имеют в
виду лишь одно: он обладает
определенными знаниями и
использует их в работе. Оставим за
наукой этот широкий смысл, а чтобы
не было недоразумений, разделим
научную деятельность людей на
три области: прикладные науки,
гуманитарные науки и
естествознание.
Любое исследование в
области прикладных наук направлено
к практической цели. Создание
новой технологии производства,
усовершенствование существующей,
создание новых материалов,
введение в обиход более быстрых и
более удобных путей сообщения,
увеличение урожайности почвы,
создание новых медикаментов —
эти задачи повседневно решаются
технической физикой, технической
механикой, химической
технологией, агрономией, медициной
и т. д.
Направление .развития
прикладных наук довольно очевидно.
Оно диктуется практическими
нуждами человечества, нуждами
страны. Не хватает запасов
энергии, значит, надо искать новые
источники энергии — создается
атомная промышленность. Мало
шерсти, она дорога и не во всем
удовлетворяет современным
требованиям — создается
промышленность синтетического волокна.
И так всегда!
Мир вещей окружает
человека. Как подчинить их себе и
заставить работать наилучшим
образом? На эти вопросы отвечают
прикладные науки.
Почему же вещи ведут себя
так, а не иначе, как
взаимосвязаны события в мире вещей, как
устроен окружающий нас мир? На
эти вопросы отвечают
естественные науки. Понимание природы
является их конечной целью.
Деление на естественные и
прикладные науки — это не
деление по областям знания. Физики,
занимающиеся изучением законов
рассеяния элементарных частиц;
химики, исследующие
закономерности разрыва химических связей;
биологи, рассматривающие в
электронный микроскоп строение
хвостика бактериофага,— всех этих
деятелей мы зачисляем в один
отряд. Физик, конструирующий
ядерный реактор; химик, улучшающий
свойства полиэтилена;
биолог-селекционер, выводящий новую
породу животных, попадают при
нашем делении в одну армию.
Не искусственно ли это
деление? Разве не проще считать всех
физиков — физиками, а всех
химиков— химиками? Нет, нет и нет!
Не только не проще, это ведет к
заблуждениям.
Деление по областям знания
сохраняется в значительной мере
среди исследователей,
занимающихся прикладной наукой. Но
наша тема — естествознание. И мы
не разберемся в основных
тенденциях его развития, если по
старинке будем строить заборы,
отделяющие физиков от химиков и
биологов.
Характерная особенность
последних десятилетий как раз и
состоит в отрицании границ между
отдельными главами
естествознания. Изучение химических
реакций, биологических процессов и
явлений неживого мира
осуществляется одними методами и
исходит из общих теоретических
позиций.
Что же предста вляет собой
отдельное исследование в области-
естествознания?
Пояснить это я собираюсь на
примере своей узкой профессии.
Несколько слов о том, как я ее
выбрал.
Твердо я знал одно: хочу
заниматься наукой. Но какой?
Постепенно приходили
решении, сначала негативные...
Пожалуй, первой была отброшена честь
заниматься техникой. Не потому^
что мне казались ее задачи
малопривлекательными. Совсем нет?
А просто потому, что я
почувствовал склонность к спокойному
аналитическому размышлению.
Логические скачки в исследованиях,
неизбежные в прикладных науках с
их лихорадочным стремлением к
конечной цели, были мне не по
вкусу. Не нашел я в себе и
желания сразу видеть зримый
результат своих трудов. Найденная
новая идея казалась более ценной,.
чем построенный прибор.
Довольно быстро отказался я
и от мысли посвятить себя
гуманитарным наукам.
Биология дней моей юности
представлялась беспорядочным
скопищем фактов. Казалось, что
нет здесь возможности для
строгого анализа, безнадежны поиски
общих законов, которым
подчиняется жизнь живых существ
(сейчас я жалею, что мне так
казалось; на наших глазах биология
превращается в точную науку).
Чистая математика также не
прельщала. Схема действий,
которая мне нравилась больше всего,—
это анализ фактов, поиски общих
закономерностей и проверка их на
опыте. А все это могла дать
только физика! Физика должна стать
моей профессией.
46
Выбор характера
деятельности, конечно, не был случайным,
он отвечал моим склонностям.
А вот выбор узкой профессии был
делом случая. Вышло так, что еще
за два года до окончания
университета я начал работать в
лаборатории. Занимался я той областью
физики, которая называется рент-
геноструктурным анализом
кристаллов.
Тогда научная работа была не
в чести, да и зарплату научные
работники получали много
меньшую, чем инженеры. Мои
приятели, а среди них было больше
всего посвятивших себя технике,
смотрели на меня несколько свысока.
Каждый из них мог отчетливо
сформулировать цели своей
работы. Один занимался
усовершенствованием электровозов, другой
работал над улучшением
гирокомпасов, третий конструировал
самолеты.
Они с увлечением
рассказывали о своей работе, окружающие
легко понимали их цели и охотно
слушали. Разумеется, и мне
хотелось поделиться своими успехами.
Как-то в кругу друзей я сообщил
о первом законченном мною
экспериментальном исследовании.
— Понимаете, я нашел
расстояния между атомами в
молекуле аминоуксусной кислоты.
Сразу же последовал вопрос:
— А зачем это нужно?
— То есть, как это зачем? Эти
расстояния были до сих пор не
известны.
— Ну и что же? Кому нужны
такие данные?
Я не сумел тогда толком
ответить. Приятели меня засмеяли, и
я обиженно умолк.
Казалось бы, простой
вопрос — зачем это нужно?— в
отношении естественно-научного
исследования совсем не прост, и
ответ на него требует длинного
отступления.
Определив расстояния между
атомами в молекуле
аминоуксусной кислоты, я решил задачу
своей узкой специальности. Как я
уже говорил, она называется рент-
геноструктурный анализ
кристаллов. Это совсем небольшой
участок научного фронта. Тем не
менее, исследованием структуры
кристаллов рентгеновскими лучами
занимается во всем мире не один
десяток тысяч исследователей. Их
цель — усовершенствовать методы
эксперимента и расчета, с тем,
чтобы такие исследования проводить
наиболее точно и быстро, а также
изучить структуру как можно
большего числа веществ во всех
тех случаях, когда заранее не
ясно, какова она. Решению этих
задач подчинено развитие рентге-
ноструктурного анализа
кристаллов. Так же точно и любая другая
научная специальность является
деятельностью, развивающейся
согласно своим целям.
Никто из членов научного
содружества физиков и химиков,
изучающих структуру кристаллов,
не сомневается в том, что нужно
совершенствовать методы расчета
и эксперимента в области рентге-
ноструктурного анализа, что
нужно определять неизвестные
структуры кристаллов. Не сомневаются
в этом и исследователи,
работающие в других областях науки.
Для чего же нужно это
делать? Правильный ответ здесь
только тот, который давал мой
библиотечный собеседник,;— это
нужно делать для TorOi чтобы
выяснить не известные науке факты.
Почти во всех без исключения
случаях вновь выясненные факты
(как бы ничтожны они ни были),
новые точки зрения (на сколь
угодно скромные явления) не
останутся под спудом. Через год
или через десятилетия они
понадобятся другому исследователю.
Научная эстафета, переданная,
может быть, через десятки
научных работ разных авторов,
доберется до крупного открытия или
свершения.
Можно напомнить, что без
знания структуры графита не
удалось бы рассчитать атомный
реактор. А не совершенствуя
расчетных методов рентгеноструктурно-
го анализа, не удалось бы
выяснить структуру гена, а значит и
подойти к уяснению природы
наследственности.
Таким образом, деятельность
отряда научных работников,
занимающихся рентгеноструктурным
анализом кристаллов, становится
необходимым элементом
существенных успехов всей науки.
Наш пример был совершенно
произвольным. Можно было бы
проследить такое же участие в
больших достижениях науки и
техники любых других разделов
естествознания: инфракрасной
спектроскопии или калориметрии;
учения о люминесценции или об
адсорбции; математической теории
«Фурье-преобразований» или
теории относительности. И эти
разделы науки, как и вся наука в
целом, решают свои собственные
задачи. Однако каждое научное
исследование, принесшее с собой
что-то новое, незаметно и
непредвиденно, может быть, через
множество посредников окажется
включенным в большое и важное
открытие.
Итог, к которому я хотел
подвести читателя, несложен: фронт
естественных наук непрерывен и
широк, в движении его участвуют
сотни тысяч исследователей.
Каждый из них способствует этому
продвижению, если устанавливает
в своей работе новые факты.
Хорошо. Но какова цель всего
естествознания? Я уже сказал —
познавать мир, находить новое.
А зачем?
Фритьоф Нансен на такой
вопрос ответил следующим образом:
«История человечества — это
непрерывное стремление от
темноты к ясности. Поэтому не имеет
смысла обсуждать цели
познания — человек желает знать, и
когда у него прекратится это
желание, он перестанет быть
человеком».
47
Стремление человека к
познанию не нуждается в объяснении,
потому что это стремление к
радостям жизни.
Научное творчество, одно из
наиболее бескорыстных деяний,
принадлежит к числу самых
великолепных человеческих
переживаний. Это знают все лица, близкие
к науке, к ее успехам — большим
и малым. Можно найти много
красочных признаний этих радостей.
Вот, например, часто приводимая
цитата из сочинений Птоломея.
«Я знаю, что я смертен и
создан ненадолго. Но когда я
исследую звездные множества, мои
ноги уже не покоятся на Земле, я
стою .рядом с Зевсом, вкушаю
пищу богов и ощущаю себя
богом».
И действительно, понимание
природы, овладение ее тайнами,
умение предсказать явление во
всех деталях наполняют
человека чувством огромной гордости,
способствуют самоутверждению.
Ничто более, чем научное
познание, не способствует низвержению
бога. Человек, знающий
природу, сам чувствует себя ее
творцом, ощущает себя всесильным
и не нуждается в духовной
опоре.
Итак, не приходится
объяснять, зачем человек познает
природу. Но остается ответить на
другой важный вопрос. Имеет ли
советский естествоиспытатель
моральное право заниматься своей
наукой в современном мире, пока
еще разделенном на два лагеря,
мире, весьма далеком от
совершенства, мире, в котором еще
столько миллионов голодных и
несчастных людей?
Не обязан ли он отложить
свои занятия до эпохи
коммунизма, а знания и способности
обратить на служение практике
сегодняшнего дня?
Нет, работник «чистой» науки
может не мучиться угрызениями
совести.
Развитие фронта
естествознания в огромной степени
ускоряет приближение человечества к
полному достатку, так как
неминуемо приводит к техническим
революциям. Поэтому в широкой
деятельности исследователей
заинтересованы не только они сами, но
и советское общество.
НОВОСТИ ОТОВСЮДУ1
За рубежом синтезирован и введен в
терапевтическую практику новый диуретик
тиабутазид — сосудорасширяющее и
мочегонное средство, назначаемое при спазме
сосудов, стенокардии, гипертонии,
атеросклерозе и циррозе печени. Лекарство
принимают внутрь, по 10—15 миллиграмм
в день, 3—4 раза в неделю. Тиабутазид —
производное гипотиазида, его диуретин е-
кое действие сильнее. Одновременно он
вызывает у больных заметное снижение
веса. Новый препарат проверен
экспериментально и клинически в
Медико-фармацевтическом институте (Бухарест).
После синтеза в 1962 г. устойчивого
вещества — тетрафторксенона
продолжаются попытки получить соединения и
других инертных газов. Уже получены
химические соединения радона и криптона.
Исследуются возможности синтеза
соединений гелия с использованием
радиоактивного распада трития и лития-6.
Предполагают, что возможно образование молекул
дифторгелия при бомбардировке фтора
альфа-частицами — ядрами гелия.
Прозрачный светостойкий и
теплостойкий акриловый пластик для оптических
линз, работающих в устройствах с
ультрафиолетовым облучением, выпущен фирмой
«Бейкер Кемикл» (США).
Пластик не размягчается при
температурах до 120° С.
При облучении ультрафиолетовыми
лучами в течение 2400 часов при
температуре 82е С пожелтение материала
примерно в полтора раза меньше, чем в случаях
обычных акриловых смол.
Фирма «Нейшнл» (США) разработала
новый технологический процесс — «наль-
кои». Он состоит в том, что отдельные
микроскопические волоконца или частицы
заключаются в пленочную оболочку из
полиэтилена или другого полиолефина. В
качестве наполнителя были успешно
испытаны целлюлозное, стеклянное и асбестовое
волокна, минеральная шерсть,
металлические порошки, соли, сажа. Опытные партии
листового материала иа основе
стекловолокна с прокладкой из фольги изготовлены
на стандартных бумагоделательных
машинах. Листы обладают низкой звуко-, тепло-
и электропроводностью. По прочности они
близки к листовой холоднокатаной стали
и алюминию (при значительно меньшей
плотности). Новый листовой материал
должен найти применение в автомобильной и
авиационной промышленности.
В Англии выпущены так называемые
бета-светильники, ие требующие внешних
источников энергии. Светильник
представляет собой герметический стеклянный
сосуд любой формы и размера, внутренняя
поверхность которого покрывается слоем
фосфора. Сосуд наполнен тритием,
излучающим электроны низких энергий.
Эксперименты и предварительные расчеты
показали, что срок службы тритиевых
светильников может достигать 20 лет. Как и в
телевизионной аппаратуре, внешняя
радиация отсутствует, поскольку энергия
излучений мала и поглощается стеклянными
48
НОВОСТИ ОТОВСЮДУ
стенками сосуда. Бета-светильники можно
применять в качестве световых указателей
на самолетах и судах, в системах
сигнализации, для подсветки шкал приборов и
для освещения в шахтах. Естественно,
такой источник свата может работать и под
водой, в масле и т. п. Сейчас
изготовляются светильники в виде трубок длиной от
2 мм до 50 см.
КВАНТОВЫЕ
ГЕНЕРАТОРЫ
В МЕТЕОРОЛОГИИ
Сотрудники Стенфордского
научно-исследовательского института (США)
пытаются использовать лазеры для
предсказания погоды. Суть метода — упавпнвание
сигналов, отраженных далекими
предметами — в данном случае мелкнмн частицами,
в верхних слоях атмосферы.
Исследователи надеются использовать особенности
рассеяния узкого светового луча лазера
для изучения природы миражей,
турбулентных потоков в атмосфере, физических
характеристик облаков и туманов.
СТЕКЛО
ХАМЕЛЕОН
Создано стекло, которое темнеет на
свету и вновь делается прозрачным,
когда освещение спабеет.
Явление фотохромиэма — изменения
окраски под действием света хорошо
известно и изучено. Наиболее простой
пример вещества-хамелеона — эмупьсня
фотопленки- Содержащиеся в ней кристаллы
хлорида, бромида или нодида серебра
под действием света разлагаются и
создают изображение из частиц металлического
серебра, которое закрепляется при
дальнейшей обработке.
А теперь разработали процесс, при
котором мельчайшие кристаллы гапогени-
дов серебра осаждаются в силикатном
стекле во время его охлаждения и
закалки. Под действием света и
ультрафиолетовых пучей эти кристаллы за
несколько секунд превращаются в металлическое
геребро, н стекло темнеет. Мнкроскопиче-
:ки малые размеры кристаллов и то, что
5ни «закованы» в химически инертном.
твердом стекле, мешает этим цветовым
центрам перейти в стабильные частицы
серебра. Как только действие света
прекращается, гало ген иды восстанавливаются
вновь в течение нескольких минут или
часов, и стекло становится совершенно
прозрачным.
Ученые считают, что такие стекла
должны найти применение в качестве
«световых клапанов» оптических систем и в
запоминающих устройствах приборов. Из
них можно будет изготавливать и
ветровые стекла автомобилей.
ДЛЯ ТЕХ,
КТО В ПУТИ
В Канаде разработан слоистый
материал, из которого можно буквально за
несколько минут соорудить теплую н прочную
палатку илн небольшой домик. Основой
будущего сооружения служат одни или не-
скопько пакетов, заполненных
порошкообразной смесью, состоящей в, основном, из
эпоксидной смолы. По обе стороны
пакета укреплены пиротехнические слои.
Достаточно поджечь их с помощью
обыкновенной спички, как начинает выделяться
тепло, необходимое для вспучивания
эпоксидной смолы. Деталь палатки или весь
ее купол толщиной в десять сантиметров
вырастает буквально на глазах.
ЕЩЕ
ОДНО СВОЙСТВО
МАТЕРИАЛА
Как сообщала газета «Тайме», в Англии
создан новый научный центр по
исследованиям сверхчистых материалов. Одна из
главных задач исследований — создание
материалов, поглощающих сигналы
радиолокационных устройств...
МИНИАТЮРНЫЕ
ОСВЕТИТЕЛЬНЫЕ
ЛАМПЫ
Английская фирма «Шеррантн»
объявила, что в ближайшее время выпустит в
продажу миниатюрные полупроводниковые
осветительные лампы без ннтей
накаливания и стеклянных колб. Источником света
служит крупника фосфида галлия —
полупроводника, заделываемого в прозрачный
пластмассовый цилиндр длиной I мм и
диаметром 0,75 мм. Такая «лампа» дает при
включении тока красный свет. К.п.д.
такого источника света весьма низок — 0,1%,
но это компенсируется его миниатюрностью
н исключительно высокой скоростью
накаливания (менее одной микросекунды).
Новые лампы смогут найтн применение в
различных радиоэлектронных приборах.
ЕЩЕ ОДНА ТАЙНА
ВЫРВАНА У ПРИРОДЫ...
В мартовскомт номере журнала +Сайнс*
опубликовано сообщение группы американских ученых, воз-
гла вляемых известным биохимиком Р. У. Холли*
Ученые пишут, что им удалось расшифровать
последовательность чередования структурных элементов
(нуклеотидов) в одной из нуклеиновых кислот.
Работа Р. У. Холли и его сотрудников имеет
важнейшее значение для химии и биологии,
открывает путь к искусственному синтезу биологически
активных нуклеиновых кислот.
В одном из ближайших номеров нашего
журнала будет напечатана статья профессора Я. М.
Варшавского об этом интереснейшем научном открытии-
НОВОСТИ ОТОВСЮДУ
«Химия и жизнь», № 3
49
ПОЛИМЕРЫ
В одной из наших газет недавно
появилось сообщение: «Тридцать две минуты не
билось сердце... не хватало одной
перегородки. Сердце было трехкамерное. За
тридцать две минуты врач выкроил из белой
синтетической ткани перегородку и вшил ее
в сердце».
Это интересное, но в общем-то рядовое
в наше время, сообщение глубоко
символично. Оно иллюстрирует тот факт, что
синтетические полимерные материалы
проникли сейчас в самые потайные уголки
человеческой жизни, науки и культуры.
Считают, что изобретателем первого
синтетического материала был американец
Джон Хайатт. Однажды он порезал палец и
решил замазать ранку коллодием. Схватив
банку, он обнаружил, что весь жидкий
коллодий в ней превратился в твердую пленку.
Тут то и осенила его счастливая мысль: он
соединил коллодий — иначе говоря
нитроцеллюлозу— с камфарой и назвал новый
материал целлулоидом. Целлулоид годился
лишь на изготовление воротничков и мелких
безделушек, но главное было в другом.
Первый синтетический материал стал ступенью
прогресса в культуре человечества и
началом эпохи искусственных материалов.
Через 13 лет после изготовления первой
пластмассы появилось первое искусственное
волокно. Но еще 300 лет назад известный
английский физик Роберт Гук писал: «Я
часто думаю, что возможно, по-видимому,
найти пути искусственно получить клейкую
су аналогично тому, как она образуемся
шелковичного червя». Искусств
шелк — вискоза — был^зготовлен из то
же Cbi
целлюл
Закон
ханике
получили
надежду
готовый
пластмасса,— и
изобретательность
щий важный шаг
шаг связан с ф<
?Ции
fO Кб?
sa гражд:
Сити на «скл
эриал и п
лько в mi
"ОЛИ
ы почти
помЦш» свою
сделалщРедую-*
ании полимеров. Этот
ормальдегидной
смолой, первым полимером — подлинным
детищем человека, изготовленным без
использования материалов растительного
происхождения, каким является, например,
целлюлоза. Фенопласты получили широкое
распространение, дожили до наших дней и,
видимо, не скоро еще их отправят «на
пенсию».
Первый день нового года следовало бы
отмечать как праздник Советской Химии,
ибо 1 января 1928 года в СССР родился
первый в мире синтетический каучук. Его
создатель — русский ученый Сергей
Васильевич Лебедев — химик-поэт (по словам
известной художницы и жены ученого
А. П. Остроумовой-Лебедевой), человек
необычайной научной интуиции. Возглавляемая
им инициативная группа из восьми человек
на общественных началах, работая по
вечерам и по выходным, сумела всего лишь за
полтора года решить сложнейшую задачу.
Получение синтетического каучука было
ответом на требование «века моторов» — дать
шины для автомобилей молодой Советской
республики, не имеющей природного
каучука.
В середине 30-х годов нашего столетия
начинается подлинная история жизни
синтетического волокна. Американский химик
Карозерс синтезировал на основе бензола
образец полимера нового типа —
полиамидного, получившего назван,(*^нейлон. Вскоре
были получены первые
и — нейлона и его
ка из той же семьи >
— капро>
эр
>ты ст|
чествен
капрона и а'
явилось нов
чальник с
оно наз
А не
волокон
^синтетических
йшего родст-
полиалдмдных
амде.н
равлении пр
ряженная р
шей ст|$а)(Ы
получ
пластмасс.
но в те же
и в ряде ла-
ультате этой
тонн высо-
золокон —
Англии
потерплен — родона-
ных волокон. У нас
А.
нали о новом типе
Это — полиолефины,
50
Профессор Б. А. КРЕНЦЕЛЬ, В. Н. ПАВЛОВ
в первую очередь полиэтилен и
полипропилен. Полимеры вышли на передний план
науки и промышленности.
Примерно до 1925 г. синтетические
материалы были всего лишь неполноценными
заменителями традиционных природных
материалов — металла, дерева, шелковых и
хлопчатобумажных тканей. Однако с самого
своего рождения искусственные полимеры
соединили в себе некоторые преимущества
веществ природных. Уже фенопласты
отличались легкостью дерева, но были прочнее
и проще его в обработке. Стало ясно, что
качества эти можно улучшить, а несложную
технологию получения синтетических
материалов легче поставить на индустриальные
рельсы, чем резко увеличить производство
металла или усовершенствовать обработку
дерева. Но как это сделать?
Тщательное изучение строения
природного и синтетического каучука показало
исключительно важное значение
микроструктуры полимерной цепи. Так, при
полимеризации бутадиена НгС = СН—СН = СН2
возможно образование 1,4 цис- и 1,4
транс-полибутадиена. В первом случае получается
высокоэластичный материал, а во втором —
твердая, неэластичная пластмасса. На
практике часто образуется смесь из цис- и
трансизомеров, между тем как природному
каучуку свойственно регулярное строение цепи,
т. е. составление ее из звеньев только
одного изомера.
На примере синтетических каучуков
выявилась необходимость познания самых
сокровенных тайн молекул.
С другой стороны — на пути создания
новых материалов с совершенными
свойствами возникали проблемы разработки
сложнейшего оборудования и новых
катализаторов, сравнимых по своей эффективности
с природными катализаторами —
ферментами.
С успехами в решении этих проблем
были связаны дальнейшие успехи в создании
новых материалов. Так, твердый полиэтилен,
синтезированный незадолго до начала
второй мировой войны почти одновременно в
Ленинграде и в Лондоне, удалось получить,
лишь применив высокое давление—около
1500 атмосфер.
Полиэтилен оказался прекрасным
диэлектриком, его применили для изоляции
высокочастотных кабелей, в том числе и
подводных. Нужда в таком материале, особенно в
годы второй мировой войны, была очень
большой, и поэтому производство
полиэтилена, несмотря на сложность технологии и
трудности военного времени, было освоено
в нескольких странах.
Вслед за полиэтиленом был получен
полипропилен. Синтез под высоким
давлением полиэтилена — родоначальника семьи
полиолефинов — считался крупным
достижением химии. Казалось бы, получение
второго члена этой семьи — уже рядовое
событие. Однако первые образцы твердого
полипропилена стали ошеломляющей
сенсацией. Дело в том, что до тех пор из пропилена
умели получать только жидкие полимеры с
низким молекулярным весом. Новое
открытие стало возможным лишь после создания
лауреатами Нобелевской премии Карлом
Циглером и Джулио Натта в 1954—1955
годах принципиально нового типа
катализаторов полимеризации — металлоорганиче-
ских комплексов. С помощью этих
катализаторов твердый полипропилен, который
ранее невозможно было получить ни при
каких условиях, Джулио Натта получил при
комнатной температуре и обычном
давлении. К тому же полипропилен обладал сте-
реорегулярным строением, поэтому метод
4* 51
Натта назвали стереоспецифической
полимеризацией. Но это не все. У полипропилена,
так же как и у полиамидов, оказалась
отличная волокнообразующая способность.
Полипропиленовое волокно не уступает по
прочности лучшим капроновым волокнам.
Возможности прогресса в создании
«мягких» методов полимеризации безграничны.
Вот интересное сообщение из Японии.
«Если кусок алюминиевой фольги,
погруженный в толуольный раствор аллилхлорида,
проткнуть иголкой, то на поверхности
фольги немедленно появляется красное пятно, из
которого в виде пустотелого стебля нздшыа
ет расти светло-желтый полимерны
дукт. Скорость роста стебля прй)мёр^о
3 см/сек. Если на фольге нанести царап
ножом^^появляется Красная линия, из к
торой UHhe тонкой пластинк^*Цастет пол
мер».
Этот
войти в с
школьни
продукт
красив
*ю занимательных
Jb. А тот Ф#йк^*^
:тет из опомрРьенной
авторам работы осн^даание счита
процесс горазд^
гический рост,
Гше моделирует биоло-
|е известные до сих пор
модельные систе* '
Мы уже упоминали о трудностях
получения бутадиеновых каучуков. После того,
как удалось осуществить полимеризацию
бутадиена направленно и получить
эластичный полибутадиеновый полимер, в составе
которого до 98% 1,4 цис-полибутадиена,
попытались создать полный аналог природного
каучука, образованного из молекул другого
мономера — изопрена. Однако, когда поли-
изопреновый каучук был получен, стало
ясно, что слепое копирование природы —
не лучший путь для создания каучуков или,
как их еще называют, эластомеров.
Оказалось, что хотя бутадиеновый каучук и
уступает природному и синтетическому изопре-
новым каучукам по прочности, он
превосходит их по износоустойчивости. Значит, для
создания наилучших материалов необходимо
искать метод, позволяющий объединять
преимущества отдельных полимеров.
Эта задача стала разрешимой в
результате развития теории и практики привитой
полимеризации и блок-сополимеризации —
методов, похожих на гибридизацию в
биологии.
Привитая полимеризация состоит в том,
что в полимерной цепи основного вещества
создают такие группы, которые способны
затем реагировать с мономером другого типа.
Получаемый «гибрид» можно изобразить
схематически тан.
—А— А—А—А—А—А—А—А—А—
I I I
Б Б Ь
Блок-сополимеры отличаются тем, что
сомономер Б входит ужел состав цепи:
—А—А—А
но получать
о с неожидан-
рифщдученые одной
или к каучуку
зультага чего каучук
но новое свойство —
опасные излучения
е того, у нового
весло сопротивление
Описанные здесь достижения химии
привели к тому, что полимеры во многом
сравнялись по свойствам или превзошли
традиционные материалы. В числе непобежденных
долго оставались конструкционные
материалы — сталь и железобетон. Однако по
аналогии с железобетоном возникла идея
создания армированных пластиков и, в первую
очередь, стеклопластиков.
Почему именно хрупкое стекло
привлекло внимание ученых? Дело в том, что
вытянутое в тонкую нить оно меняет свои
качества. Стеклянное волокно отличается
наиболее высоким пределом прочности при
растяжении (до 250 кГ/мм2, в то время как
нейлоновое — 50,4 кГ/мм2), хорошим модулем
упругости B000—7000 кГ/мм2, а у нейлона —
400) и малой теплопроводностью.
Стеклопластики в 4,5 раза легче стали и в 1,5 раза
легче дюралюминия, но по прочности они
превосходят цветные металлы и спорят с
некоторыми марками стали.
Зарубежная печать сообщает, что
стеклопластики используются в самых
ответственных конструкциях: из них делают
покрытия межконтинентальных ракет и
космических кораблей. Во время полета в ат-
52
которс
темпер
туре anfl
Замеч
из углерс
мосфере оболочка ракеты разогревается до
температуры в несколько тысяч градусов.
Конечно, пластмассовый кожух при этом
сгорает, но медленно, слоями. И успевает, таким
образом, защитить корпус ракеты на самом
опасном участке полета.
Космонавтика требовала все новых и
новых материалов — более легких, чем
алюминий, более прочных и стойких в условиях
тысячеградусных температур, чем гранит.
Новые материалы искали повсюду — даже в
таких местах, где, казалось, искать их было
совсем уж бессмысленно. Там, где хранится
хлопок или вата, грозная надпись
предупреждает — «огнеопасно». И тем не^СёНее
именно из хлопка — как сообщила
иностранная печать — удалось получить волокло,
це боится л*
эы — 3000
^иний п_
имее*
в то же в&емя сохран
полимеры из котор
из него можно изп
разнообразные>4Ч5долия
Есть MHorob€tto|o6oB получения такого
волокна. Наибоад^перспективный и
широко применяемый — нагревание в
определенных условиях некоторых полимерных,
например вискозных, волокон до высоких
температур. Тысячелетняя история человечества
подтверждала тот факт, что любое
органическое вещество, т. е. вещество,
построенное в основном из атомов углерода и
водорода,— разрушается уже при температуре
двести—триста градусов. И все же
уникальное по своей термостабильности волокно
было приготовлено из чисто органического
материала.
Весь процесс образования графитового
волокна из вискозного можно выразить
следующей схемой:
(CsHi0O6)n —f (СзбН50)п -^jjj£* (C28H)„
гине космическс
1ри такой темпер
|ЩаетсяЦ]г1ар.
кно состоит на^зщ£/о
оп л ав коя^ташитази
ipflgfltjiJl ГИРKQJgfr?
лученс^А значитл"Ч
вискозное
волокно
углеродное
волокно
графитовое
волокно
Пластмасса, изготовленная на основе
графитового волокна и фенольных смол,
успешно выдержала кратковременные
испытания в струе воздуха, нагретого до 10000
градусов и несущегося с ураганной
скоростью— 760 м/сек.'
Однако наилучшей термостабильности
ожидают все же от неуглеродных,
неорганических полимеров. А они—повсюду:
кирпич и фарфор, стекло и кварц. Правда, почти
все природные неорганические полимеры
страдают одним трудноисправимым
дефектом— хрупкостью. Вот почему химия
неорганических полимеров развивается довольно
медленно. Но трудно еще не значит —
невозможно. И в природе встречаются, хотя
и редко, гибкие неорганические нити.
Пример тому — асбестовое волокно.
Неорганические поли^Шрь! можно
синтезировать в принципе of помощью реакций
нее типов, что и oprafttdti
взаимодействии пятихл
с хлори*?ТУм аммоние
гоиь
полимеры
синте^ировс
м
:ла,
дукты
Химия
лимеров
первые ш
том, чт<
няются^в Д
стомер!
олы.
и. Главнс
ганичес!
иные
ские. Например,
истого^рсфо-
тер-
сфонитрила.
термостойкие
ые неплавкие
лх неортунических по-
трудояг делает лишь
причина трудностей в
'В молекулы не соеди-
Они охотнее пере-
страиваг&гй в небольшие по размерам
кристаллы. Поэтому, как считает академик
В. А. Каргин, не следует точно копировать в
неорганических полимерах известную
структуру большинства органических полимеров.
Несомненно, что труднее всего
соединить в одном материале жаростойкость
неорганического полимера с эластичностью
резины. Поэтому успехов в создании
термостабильных каучуков еще меньше. Для
увеличения стойкости органических полимеров
при высоких температурах нужно научиться
увеличивать прочность химических связей в
полимере. Обычные нетермостойкие каучу-
ки — это полиуглеводороды, их главная цепь
состоит из связей С—С и С—Н. Можно,
например, хотя бы частично заменить атомы
водорода в каучуке на атомы фтора, тогда
в полимере возникает более прочная, чем
С—Н, связь С—F.
Фторкаучуки получают на основе
сополимеров фторолефинов, фторированных
полиэфиров, фторполимеров с гетероатома-
ми в цепи, фторсиликонов и других
соединений.
Фторкаучуки отличаются меньшей
гибкостью и более высокой термостойкостью,
они могут работать при температуре до 300
53
градусов. Однако малая гибкость
ничивает области их использования,
lo смелее^ переходить от п;
на основе Л—С связи к
Материалов,^*"основурй угл
годился
1й элем<
^ет быть
in
ДЪлгое время НШИГо «п
чески означало jy диэлектри!
ко, появил^ьмКлимеры с y^i
тивлением^иЯф 108 ом-см,
Элемент мс
*м углерод:
ы, . напр|
т. Связь
аздо
И мер
терь,
>ным сопро-
проводимость
которых к rcwry же возрастаете
повышением температуры. Такие полимеры
принадлежат уже к классу полупроводников. В
первую очередь полупроводниковыми
свойствами отличаются полимеры с системой
сопряженных связей. Простейший из них —
полиацетилен, получающийся при полимериза-
меров объясняет-
ов сопряженных
собны
связям. А ведь
жения электронов
металлы. Одна-
', необходим пере-
акромолекулы к
о стало возмож-
рлжны преодолеть неко-
ский барьер, называемый
актив ЩШ* проводимости. В ряде
случаев именно ^он ограничивает
проводимость полимеров.
Полимеры с сопряженными связями
можно получать как обычными в полимерной
химии приемами, так и из
полимеров-изоляторов, отщепляя, например, хлористый во-
ции ацетилена
СН—.
Особенность этих
свойствами я-электр<
войных £рвязей; я-эл<
"вдвигаться по т
вободойчпере
ются прталод!
ере, кцо
101 одно
ля тоТ*^г чтобы
ектроны
нергети
ПЛАСТМАССЫ
КРАТКАЯ ЭНЦИКЛОПЕДИ1
АМИНОПЛАСТЫ
Пластмассы -на основе карба-
мидных смол с различными
наполнителями.
Карбамидные смолы
—продукты конденсации мочевины, мела-
мина или анилина с
формальдегидом.
Мочевину получают из
аммиака и углекислого газа, меламин —
из цианамида кальция и аммиака,
«анилин— из нитробензола.
Аминопласты производятся
промышленностью с 1929 года. На
их основе получают клеи, лаки,
эмали, пенолласты, различные
технические изделия и предметы
широкого потребления.
иониты
Синтетические ионообменные
смолы.
Содержат активные группы,
способные обменивать ионы с
раствором, куда погружен ио-
нит.
Для ионитов характерна
способность поглощать ионы и
регенерировать (восстанавливать свой
исходный состав); химическая
стойкость к воде и растворам
электролитов; механическая
прочность. Применяются для очистки
и опреснения воды, выделения
металлов и радиоактивных
элементов из руд, очистки
дубителей и т. д.
МИПОРА
Пенопласт на основе мо-
чевино-формальдегидной смолы
[—NHCONHCH2—]п-
Тепло- и звукоизолятор.,
Устойчив к коррозии, но
недостаточно стоек к воде.
Легче пробки в 10 раз.
Негорюч,
Применяется для
звукоизоляции зрительных залов и жилых
зданий.,
54
дород от поливинилхлорида. Химики
научились получать полимеры с сопря
связями, электропроводность кото
няется в широких пределах, от б
метадвдм до близко^^к диэлектрикам
И
ковы7
билы-icj
мостов
женньн
т. е.
>есен тот
CBonCTBaj
гь по/
' связей
ни вдвое в
чтс^полупрово^
£опутств€р и терме
кости обычных пс
которые из
ясняется высок
ров с с
[OTI
'ред.
ров. БО(
только сам
ер-
ря-
г редисов,
термост^
того,
отивосто-
ят деиствиюсвъхсаких температур, но и
помогают выст&^-ьЛфугим полимерам.
Стабилизирующие свойства сопряженных систем
сейчас интенсивно изучаются.
Полимеры с сопряженными связями
обладают и крайне интересными химическими
свойствами. Они, например, оказываются
эффективными ката
к знать, быть мож!
ких полимеров будут с
ы, моделирующие фер
Полим^ртн, которые
мим ценным ci
рь приврет
тва, a y° Ъ>
са^т^раз
кормертеняя
нятия. [Например,
рами окисления,
енно с помощью
даны кахализато*
але обладали
ством — легко-
амые .неожидан-
к тому, что они
ые отрасли про-
ологию и при-
швейная и тек-
нность со временем, ве-
по-иному, поскольку
во вытесняются клеем
и неткаными материалами. Однако с
помощью клея можно не только «сшить» костюм,
но и построить дом. На основе эпоксидных
смол получен клей, который вытеснит
привычные способы соединения конструкций —
заклепки, болты, сварку.
-ibie к
1недрян:
изводст
вычные
стилы
роят
игла
[промыш.
Кдут наз,
<ь наст
зяйшы
1НТЕТИЧЕСКИХ МАТЕРИАЛОВ
ОРГАНИЧЕСКОЕ СТЕКЛО
СНз
I
—СН2—С—
I
СООСНз _\п
Полиметилметакрилат —
полимер метилового эфира метакри-
ловой кислоты., Известен под
названием «плексиглас». Сырьем
служат ацетон и синильная кислота.
Незаменимый материал в
строительстве, авиационной и
автомобильной промышленности,
часовом деле, медицине, быту и т., д.
ПЕНОПОЛИУРЕТАНЫ
Эластичные (поролоны) и
жесткие. Стойки к действию
кипящей воды, масел, бензина,
солей, спирта. Разрушаются
минеральными кислотами и
щелочами.
Поролоны сфаботают» при
температурах от—25° до +110° С,
не изменяя эластичности. Жесткие
пенополиуретаны применяются в
самолето- и судостроении;
поролоны — для упаковки, изоляции
труб, холодильников, в качестве
обивочных и прокладочных
материалов, для сидений, подошв
обуви, бытовых принадлежностей
(губки, матрацы и т. п.)
ПЕНТОН
Хлорированный полиэфир
СН2С1
I
-С—СН20-
— сн2
ч
СН2С1
Исходным сырьем служит
многоатомный спирт пентаэритрит.
Полимер выдерживает
нагревание до 285° С, легко
обрабатывается., Отличается абсолютной
водостойкостью и высокой
химической стойкостью (боится только
азотной и дымящей серной
кислот). Из него изготовляют трубы,
клапаны, вентили, детали
подшипников.
55
Все чаще высказывают мысль, что
главным строительным материалом будущего
будет воздух. Новой «профессией» во^здух
обязан полимерам. Во Всесоюзном /аучУо-
исследовательском институте железКетсрта
воздух уже использовали на равных frplfeax
с бето*1Т!&|- К еще не затвердевшему бетой^
добавляют синтетическую смету, а зат^м^
следуюишй «стропильный компонент»,
воздух, фоЪу^«гя^гвг под давлен иемлС&р-
ла способствует образован им^Г^^ювЦнившх
пузыреи^оздуха. Пол^м£*с*гтеы#ий и про>
ный по^Ьтый бетон.Ь^гтакогол]б£тона два
годахазад на одно/Л^из московсврзаводов
наладили выпу^^квружных стенных блоков
для девяти-дв»г^дтзатиэтажных домов.
Подлинный TripfeBopoT начали полимеры
в медицине. Пластмассовые челюсти,
суставы, сосуды уже никого не удивляют. Из
пластмассы удалось сконструировать очень
сложное по «архитектуре» среднее ухо.
Недавно появилось сообщение, что изготовле-
едусмотренная
чи поместили в
ьтры, задер-
знки^к^овека
\ftff «Неделя»
татах приме-
цинского клея
на «деталь» организма
природой: американск!
полимерные сетк1
гвающие опасные для
эмбы. В(к&нце прошлоп
рщи^м^оо успешных ре:
4иа акр и л агоч —
тя соединения Koqrvi.
Полимеры изменя!
ни я лекарствшгд^втся совм<
тимое — и^готовл йтягодежд^
собы примене-
1ть несовмес-
которая одно-
временноЛЕлужит медикаментом.
•солько jt)&j в текстильных инсти-
|ы и ЛёйЬграда и в Институте
Гой химии АН Латвийской ССР
ведутся работы по получению различных
видов бактерицидного активного волокна:
летилана, диолана и иодана.
Бактерицидно-активные вещества введены в структуру
волокна, благодаря чему они сохраняются
ПЛАСТОБЕТОН
Композиция минеральных
наполнителей (песок, щебень,
шлаки, керамзит и т. д.), пропитанных
фурфурол-ацетоновой смолой
(мономер ФА).
Пластобетон обладает высокой
водонепроницаемостью, стоек к
бензину, маслу и разбавленным
щелочами и кислотам.
Теплостоек до 200° С, не
боится огня.
Армируется металлом,
камышом, асбестом.. Его применяют
для изготовления труб, шахтной
крепи, тюбингов, газгольдеров,
хранилищ агрессивных
жидкостей.
ПОЛИВИНИЛХЛОРИД
[—СН2—CHCI—]п
Производится с 1930 года. Сырьем
служат ацетилен, хлористый
водород или этилен и хлор.
В зависимости от добавок
может быть жестким или эпастич-
ным.
Полимер практически
негорюч, тверд, стоек к кислотам и
солям, прочен, упруг.
Недостатками являются низкая
теплостойкость (выдерживает нагревание
до +60° С), хрулкость при
температурах ниже 0°*
Применяется для изготовления
труб, футеровочных плит,
технических деталей, крупногабаритных
изделий (ванны, раковины и т. д.).
Поддается сварке.
ПОЛИВИНИЛОВЫЙ СПИРТ
—СН2—СН—"
I
он
Получают действием метилового
спирта на поливинил ацетат.
Основные свойства: растворим
в воде и абсолютно стоек к
действию углеводородов и масел.
Хорошо пластифицируется и
дает гибкие, прочные изделия,
устойчивые к нагреванию до
120° С
Служит для получения пленок,
клеев, волокна, стойких
эмульгаторов. Используется также при
изготовлении некоторых
лекарственных препаратов.
56
очень долго. Утверждают, что мясо,
завернутое в такую ткань, можно хранить
несколько дней при комнатной температуре, несща-
саясь его порчи.
Присоединение к полимеру лек^
увеличивает срок его действия (пол^
препятсЛ^т выводу л^к^рства из орган
ма), а k^/да меняет /^го сво^С^ва; HanPHL'ji^::
н^ловый^пйиэт превращает обыко^^
ивное средство jipo*
мер, полна
неженный fto
тив склере
Некотуэ&ые облает!
ров совсем уж нео
предложили приме!
почвы для сел!
те14Ц4 поли7
1ны. Во^Франции<
гь пластмасЩ^вместо
хозяйства. Автор
назвал свое изобретение пластопоникой по
аналогии с гидроГтсГникой. Сообщают также,
что специальная маска из синтетической
пленки, через которую свободно проникает
растворенный в воде кислород, позволяет
длительное время находиться под водой;
уже проведены успешные опыты с
животными. f^\
Соединяя кривой экспериментальные
на графике и экстраггалируя ее в не-
Ьдованную область, мо>ЮфбеЛ<спе-
ента сдей^гь интересны^ в|г1оЗг Вос-
гауе^#л^этим методом>^ проэкстра-
%f& достижения современной поли-
ной Ч#вуки на иеско!лькд десятилетий
г ед. >^ ^у^^Щ,
Очевидиц, иЬр^ные изме^геуия
произойдут прежде^ се го в^легкой гтромышленно-
сти, здесьп/рлная победа синтетики над при-
родным^ЛЯЦериаламИьЧэсобенно близка.
Но «~^ тажелой промышленности
произойдут радикальные изменения. Не
исключено, что в ближайшие десятилетия
полимеры будут самым серьезным образом
соперничать с металлами. Особенно это
относится к армированным пластикам и
неорганическим термостабильным полимерам.
ПОЛИКАРБОНАТЫ
Полиэфиры угольной кислоты
[_0-Q>-R_<Q>_OCO-]?i
получают из двухатомных
фенолов и фосгена. В
промышленность применяется поликарбонат на
основе дифенилолпропана,
синтезируемого из фенола и ацетона.
За границей известен под
названием «лексан». Это бесцветный
прозрачный твердый полимер, с
высокими диэлектрическими
свойствами.,
Выдерживает температуру от
—100° до +135° С, действие
кислот и окислителей., Детали из
поликарбонатов в ряде случаев
применяются вместо бронзовых.
ПОЛИСТИРОЛ
Полимер стирола
Г— СН—СН2—"
Jn
Исходным сырьем служат бензол
и этилен.
Полистирол отличается
прозрачностью, легкостью,
водостойкостью, превосходными диалект-
трическими свойствами,
химической стойкостью.
Применяется для получения
пенопластов, небьющихся стекол,
деталей электротехнических
аппаратов, изоляторов.
Недостатки — хрупкость и
низкая теплостойкость.
ПОЛИФОРМАЛЬДЕГИД
[~СН20-]п
Продукт полимеризации
формальдегида, который получают
окислением метана или
метилового спирта. В США выпускается с
1956 г. под названием «дельрин».
Полимер прочен, хороший
диэлектрик. Стоек к действию воды,
органическим растворителям и
маслам, к нагреванию до +170°,
легко обрабатывается.
Применяется для изготовления
шестерен, подшипников, бытовых
изделий, высокопрочной пленки и
волокон.
О J
Производство пластмасс, вероятно, догонит
производство металлов, и в конце концов
добыча металлов, по всей верс}£9р!£сти,
сократится. Уже в ближайшее пятш|
ровое производство пластмасс
17 млн. тонн, а всех^цветных металл^ —
18 м|ЙЙ|онн; но есл&^читать по объему>
милл^Лнов кубо*1_^
1к цветные метадцй! —
ОказыЕ
плас
ров, в
лишь
1956 гоЖГ объем
мире Лиастмасс 6i
цветн№Гметаллов
Но количеством*- это не все.^Ке важнее
качество. Нвт^мрлЩр, полиэтиленовые трубы,
которые приЛдятана смену железным,
избавят от множества хлопот, вызванных
необходимостью защищать железо от коррозии,
от мороза и т. д. Да и прокладывать
металлические трубы дорого и неудобно, в то
время как полиэтилен/*Шйе можно просто
разматывать с больших кадушек, как кабель,
ромный интерес п^^мггавляют работы,
язанные с изучением пдародны^ролиме-
ов, с исследованием во
за в л^родэатории. Эти
^^ ie ин
об
Р:
"еров,
ки со
5ир<
^егуляр]
тоят из
ные пол
в котор
распо.
аминш.
И
рвать сад
Ученые
Ь[Х ПОЛНА
эы
их син-
оты позволят
сные «патенты»
уже получения
нья которых со-
ведь природ-
ят из цепочек,
строгохюпределенным образом
Ьено бол^е двадцати различных
эт! jamam
ательно слепо модели-
_ е не ос
ровать природу. Не исключено, что в
будущем появятся принципиально новые схемы
синтеза. Уже сейчас часто применяют радиа-
ционно-химический синтез. Этот метод
позволяет породнить, казалось бы, самые не-
ЛОЛИЭТИЛЕН
'[—СН2—СН2—]п продукт
полимеризации этилена. Отличается
химической инертностью, прочностью,
легкостью, хорошими
диэлектрическими свойствами.
До последних лет полиэтилен
производили под высоким
давлением A200 ат). В 1954 г. в ФРГ
Диглером создан метод получения
полиэтилена при обычном
давлении с помощью металлоорганиче-
ских катализаторов. Полиэтилен,
синтезируемый таким способом,
отличается большой
регулярностью структуры и поэтому
повышенными прочностью и
температурой плавления. Применяется для
производства оболочек кабелей,
труб, пленки, волокна, деталей
машин, бытовых изделий.
СТЕКЛОПЛАСТИКИ
Полимеры (феноло-формаль-
дегидные м эпоксидные смолы,
полиэфиры, кремнийорганические
полимеры, каучуковые
композиции), армированные
стекловолокном или стеклотканью.
Стеклопластики отличаются исключительной
прочностью. Они намного легче
металлов, стойки к действию воды,
химических веществ,
электрического тока.
В качестве нового
конструкционного материала используют
во всех областях техники.
Стеклопластики начинают применять для
изготовления кузовов шахтных
вагонеток и автомобилей, корпусов
лодок и катеров, элементов жилых
и промышленных зданий и т. д.
ФТОРОПЛАСТ-4
«Тефлон» в США, «флюон» в
Англии—полимер тетрафторэти-
лена [—CF2—CF2—]п
Химической стойкостью
превосходит все природные in
синтетические материалы, в том числе
золото и платину. «Работает» при
нагревании до +250с С, не
становится хрупким даже при
температуре жидкого воздуха.
Применяется для изготовления
уплотняющих деталей, изделий
электро- и радиотехнической
промышленности, химически стойкой
аппаратуры, самосмазывающихся
подшипников, пленки.
58
похожие материалы. На симпозиуме по
радиационной химии в ноябре 1964 года были
доклады об успехах «гибридизации» РППД"" ,
ческих полимеров (виниловых, пол^
полистирола) с минеральными веи^ест
силикагелем, сажей,
предусмо
&в, но ря^
по?
^исью циркония.
гь все возможно^
1НципиЛЪнр новых!
|сь в поЛГедяэе вр^Мя,
Кые смег^
тключено, 4TJ
/с проводи^
быть может, когда-нибудь то кои!
вода и кабели,
внутри полим
типичный про*
П£€
элучить п^
:твами,
дие про-
j выглядеть так: полимер
ричем первый из них —
ик, а второй — наш
старый знакомый диэлектрик.
Академик Н. Н. Семенов недавно писал:
«Живой организм состоит в основном из
биополимеров — белк
лот... следует пытатьс!
u-ie полимеры, облад?
^>йствами материалов, но\
экуцярны^г^ашйн, cnocoj
*е*скую энерги*
^ическую (подоб
?кт»«ч
Если,
Ншь..пас
возможн
сы сами
нов, cq
будь */yj
Го
зпример
ГО ЁГ
Угнут игр^
£щсг*сь пс
иСКОГО
ТЫ СИНТ€
уклеиновых кис-
дать синтетиче-
е уже не только
свойс^^ми мо-
Ъразо-
посредствен-
о мышцам) и в
и трос сейчас
ого крана, то,
имерные тро-
ь роль подъемных кра-
действием какого-ни-
ента.
^^ еских материалов
необъятны!^! уже сегодня можно,
перефразируя крылатые слова М. В. Ломоносова, с
полным правом утверждать:
«Глубоко проникают полимеры в дела
человеческие».
ФЕНОПЛАСТЫ
Пластические массы на основе
феноло-формальдегидных смол
с наполнителями (древесная мука,
кварц, асбест, стекловолокно и
т.д.).
Меняя состав смолы и
наполнителя, получают разные типы
фенопластов. На этой странице
журнала приведены краткие сведения
о некоторых из них.
АНТЕГМИТ
Химически стойкий,
теплопроводный антифрикционный
материал на основе порошка графита.
Применяется для изготовления
теплообменников труб, арматуры
для химических предприятий.
ГЕТИНАКС
Фенопласт на основе
бумажных листов. Широко применяется
в электротехнической
промышленности.
Текстолит
Ткань, пропитанная феноло-
формальдегидной смолой. Из нее
делают бесшумные шестерни,
подшипники, пропеллеры, гребные
винты.
ФАОЛИТ
Фенопласт с асбестовым
наполнителем. Используется для
изготовления химически стойких
труб, фасонных деталей,
разнообразной арматуры.
СТАРЫЕ МАТЕРИАЛЫ
И
НОВЫЕ НАПРАВЛЕНИЯ
НАУКИ
Доктор химических наук
Г. Л. СЛОНИМСКИЙ
О полимерах часто говорят и пишут как о
новых материалах. Но на самом деле полимерные
материалы совсем не новы...
Из природных полимеров — целлюлозы и
лигнина— в основном состоит дерево. Из полимерных
молекул состоят волокна, переплетение которых
образует кожу животного. Клеющее вещество,
соединяющее эти волокна воедино—тоже полимер-
Натуральный шелк, овечья шерсть и хлопковое
волокно состоят из полимеров. К полимерам
относятся 'натуральный каучук, мягкие и твердые
природные смолы (гуттаперча, янтарь, шеллак),
естественные клеющие вещества (например, казеин и
разнообразные камеди, в частности, гуммиарабик).
Таким образом, полимерные материалы всех
типов (твердые, эластичные, пластич«ые/ волокнистые,
пленочные) известны людям с -незапамятных времен
и широко используются.
Новое — это промышленный синтез не
существующих в природе полимеров и создание на их
основе самых разнообразных твердых материалов,
синтетических каучуков и текстильных волокон, пленок,
лаков, клеев и так далее.
Синтезированы вещества, свойства которых
лучше, чем у природных. Синтезированы и необычные
материалы с такими комбинациями физических и
химических свойств, которые не встречаются в
природе.
Например, несуществующий в природе
политетрафторэтилен, известный под названием «тефлон»,
обладает необычайно высокой химической
стойкостью, сохраняет свои механические свойства до
значительно более высоких температур, чем
природные органические полимеры, обладает
превосходными диэлектрическими и антифрикционными
свойствами.
К другой большой группе синтетических
полимерных материалов — полиорганосилоксанов
принадлежи^ в частности, великолепный по
теплостойкости каучук — полидиметилсилоксан. В последнее
время эту группу веществ удалось значительно
расширить, включая в состав полимерных молекул
атомы таких элементов, как титан, бор, алюминий. И все
полиэлементоорганосилоксаны необычны по своим
свойствам.
Синтезированы полимерные полупроводники,
созданы углеводородные полимеры, длительно
выдерживающие температуру красного каления, м
многие другие. Естественно, возникла необходимость
изучить основные физические свойства новых
материалов.
Уже более 100 лет было известно, что
природные полимеры обладают многими необычными
качествами. Но только в последние десятилетия
появилась острая потребность в точном знании основных
законов, управляющих механическим поведением и,
физическими свойствами полимерных веществ. Для
создания автомобильных шин из синтетического кау-1
чука нужно было «изучить законы деформации рези-|
ны при длительных и периодических нагрузках.
А чтобы повысить стабильность работы радиотехни-i
ческих систем оказалось необходимым исследовать
медленные процессы упругого 'Последействия, раз--
вивающиеся в изоляторных пластинах конденсаторов.
Исследования, начатые в 1937 году в Советском
Союзе, а затем быстро развитые у нас и за рубе-
60
жом, оказались исключительно интересными.
Выяснилось, что тело из полимерного материала может
быть одновременно твердым и жидким — в
зависимости от того, быстро или медленно действовали
деформирующие его силы. Оказалось что многие
полимеры, в первую очередь каучуки, обладают в
широком интервале температур такой высокой
эластичностью, какая не встречается чи у каких других
*» Щругбети, мю^мдоффшению механического даНр1Ц»г
"J#*i&
мне деформации £
-т
пределах идеально yi
Ъ*туфцтдгпь ynjrfyrecnH есть «Цв^ше^но лосгошрная величина,
с*ц*Ф^ от дефСрмацрн и^ш >а^рж*}ния, при вторых его измеряет,
нн^е^якюепьнооги п>рвь1»аиия те/Ц.в напряженном состоянии.'
ZJ**: .'./' > - ■• '.'•.--
материалов. Упругие деформации эластичных и
твердых полимерных материалов не подчиняются
закону Гука, а текучесть жидких полимеров (например,
расплавов и растворов) не повинуется закону
вязкости Ньютона. Полимер, который при медленном
механическом воздействии на него течет, казалось бы,
можно охарактеризовать коэффициентом вязкости.
Однако тот же полимер при
быстром воздействии ведет себя уже
как упругое тело, и для его
характеристики нужно определять
модуль упругости...
На протяжении многих лет
исследователи не учитывали этих
особенностей. Результаты,
полученные в лаборатории, использовали
для производственных расчетов.
Естественно, это приводило к
серьезным ошибкам и даже к
авариям. Полимер, который считали
твердым после лабораторных
испытаний на удар (быстрое воздействие), тек под
действием длительной нагрузки в условиях эксплуатации.
\Л, наоборот, резина, которую считали эластичной
при низких температурах (на основании опытов с
медленным растяжением на динамометре),
оказывалась при тех же температурах твердой и даже
хрупкой при ударе шины о землю во время посадки
самолета. Таким образом, методы теории
сопротивления материалов, основанные на использовании
закона Гука, оказались непригодными для расчета
изделий из тзердых или эластичных синтетических
материалов. А для расчета процессов переработки
расплавленных полимеров точно так же нельзя было
применить методы гидродинамики вязкой
жидкости, основанные на законе вязкости Ньютона.
В связи с этим, в последние годы возникли
новые области науки — структурная механика
полимеров, инженерная механика полимеров. В основе этих
новых научных направлений лежат «накопленные
химиками и физико-химиками знания об особенностях
строения огромных молекул полимеров, об
особенностях их взаимной укладки в так
называемые надмолекулярные
структуры в массивных
полимерных телах, о связях между
химическим строением больших
молекул, надмолекулярной структурой
и механическими свойствами
полимерных тел.
Об этих очень новых и
важных исследованиях еще будет,
несомненно, много написано в журнале «Химия и
Жизнь». В области изучения свойств полимеров
сплетаются в одно целое такие, казалось бы,
разные области знания, как химия и механика, не
говоря уже о физике и биологии. Другая
интереснейшая особенность науки о полимерах —
оригинальное созмещение чисто качественных закономер-
лрроге
ностеи со строго количественными зависимостями.
«Инструментом» для этого служат многие казалось
бы, весьма абстрактные разделы математики.
Химическое производство, создав и продолжая
создавать все новые и новые синтетические
материалы, дало толчок к развитию
ряда смежных наук.
«Обратное» воздействие этих наук на
химию помогает создавать
полимеры с нужными нам
ценными свойствами. Так химия,
в содружестве с другими
науками, преобразует нашу жизнь.
Митчел Уилсон об ученых
и изобретателях
Когда в 1938 году знаменитый ученый
Энрико Ферми выехал из Рима в Стокгольм
на торжественную церемонию вручения
Нобелевской премии, присужденной ему за
исследования взаимодействия нейтронов с
атомными ядрами, он знал, что не скоро
вернется в свою родную Италию, которой
правили в то время Муссолини и
чернорубашечники. Ферми эмигрировал в Америку.
Именно здесь, в лаборатории
ученого-антифашиста, словно по чудовищной иронии судьбы,
зародилось ядро сспроекта Манхэттен»,
завершившегося созданием оружия массового
уничтожения — атомной бомбы,
Но в первые годы работы Ферми в США
об атомной бомбе всерьез еще никто не
думал— сама возможность ее создания
оспаривалась многими ведущими физиками.
И Ферми на первых порах продолжал свои
чисто теоретические исследования в
области нейтронной физики, начатые им в Риме.
В это время и появился впервые в его
лаборатории никому не известный молодой
ассистент Митчел Уилсон.
Уилсон взялся за решение сложных
научных проблем с таким же рвением, как и
остальные сотрудники лаборатории. Но у
него были и другие интересы, не имевшие
прямого отношения к проблеме захвата
нейтронов ядрами. Его влекли к себе
судьбы и переживания этих людей, посвятивших
свою жизнь познанию неведомого, история
науки и ее творцов. Позже он писал:
«Просто чтобы отдохнуть, я иногда покидал свою
лабораторию и шел в физическую
библиотеку университета, где выбирал наугад
какие-нибудь древние протоколы заседаний
Королевского общества и читал
какой-нибудь забытый научный доклад
двухсотлетней давности».
Постепенно перед молодым ученым
вырисовывалась захватывающая картина той
драмы идей, которая всегда лежала в
основе научного прогресса.
ЧАРЛЬЗ ГУДИЙР
Соль, сыр, суп*
чернила — все §м то!
История открытия Чарльзо\*
Гудийром вулканизации резины —
одна из самых запутанных и
непостижимых историй в Америке.
Этот человек не "имел права на
успех. Он не обладал нужными
знаниями и подготовкой. Он
сталкивался с трудностями, перед
которыми спасовал бы любой другой.
Часто он даже не знал, чего
добивался.
Изыскания завели Гудийра в
дремучую чащу органической
химии, и он шел вперед наивно и
беспечно, как Гензель и Гретель
шли через лес к колдунье.
Органическая химия была в то время еще
в пеленках. Никто не знал о
резине или «резиновой» химии больше
Гудийра, а он ровным счетом
ничего не знал. Гудийр просто
верил в свою счастливую звезду.
Б 1735 году экспедиция
французских астрономов нашла в
Перу дерево, выделявшее особый
сок, или смолу, которая была
бесцветной в свеем естественном
состоянии и обладала свойством за
твердевать в лучах солнца.
Туземцы изготовляли из смо
лы различные предметы: обувь
посуду и т. д. Французы привезл!
это вещество домой и познакоми
ли Европу с эластичной резиной
которая на первых порах вызвал*
интерес лишь как диковинка
Джозеф Пристли в письме к дру
гу сообщал, что он пользуется ек
для стирания ошибок в рукописи
62
А спустя полтора десятка лет Митчел
Уилсон — уже известный писатель —
закончил работу над книгой «Американские
ученые и изобретатели», посвященной истории
науки и техники в США. Русский перевод
этой книги недавно выпущен в свет
издательством «Знание».
Среди героев очерков Уилсона —
патриарх американской науки Бенджамен
Франклин и строитель первых пароходов Роберт
Фултон; Джозеф Генри, вошедший в
историю науки как человек, открывший
самоиндукцию, и Грэхем Белл, создатель телефона;
знаменитый изобретатель Томас Эдисон и
известный лишь немногим своим
соотечественникам замечательный физик Уиллард
Гиббс... Здесь и подвижники, посвящавшие
свои открытия человечеству, и дельцы,
пытавшиеся совместить служение науке и
бизнесу.
Уилсон воссоздает и тот общий
исторический фон, на котором возникали
открытия; он рассказывает об экономических
предпосылках, вызывавших к жизни
изобретения, и о связанных с ними переменах в
экономике и жизни, вызывавших, в свою
очередь, новые изобретения.
Но главное в книге — это портреты
людей. Уилсон, сам в прошлом научный
работник, прекрасно чувствует и передает
атмосферу творческого поиска, трудный путь
научного познания. В предисловии к первому
изданию книги он писал: «Эта книга — плод
сотрудничества двух моих профессий и
компромисс между ними...».
Уилсон правдиво показывает одну из
отличительных черт развития науки и техники
в США. Американские ученые и
изобретатели были чаще всего
практиками-экспериментаторами. К таким
исследователям-эмпирикам относился и Чарльз Гудийр —
изобретатель способа вулканизации резины,
благодаря которому каучук из занятной, но
бесполезной диковинки превратился в
важнейший материал современной техники. Уилсон
писал, что если бы ему довелось
познакомиться с Гудийром, то он пришел бы в
ярость: «Подумать только — чтобы человек,
совершенно не приспособленный для этого,
ухитрился преодолеть столько трудностей и
добиться успеха! Этот человек
представляется мне похожим на Чаплина персонажем
рассказа, трагического и в то же время
неотразимо смешного».
Мы публикуем в сокращенном виде
очерк о Чарльзе Гудийре из книги Уилсона
«Американские ученые и изобретатели»
(перевод В. Рамзеса).
Первая фабрика резины была
открыта в Вене в 1811 году.
К 1820 году французы научились
изготовлять подтяжки и подвязки
из резиновых нитей, сплетенных с
хлопком. В Англии Макинтош
придумал класть тонкий слой
резины между двумя кусками
материи и делать непромокаемые
пальто, которые под зимним дождем
становились твердыми, как броня;
летом же их приходилось хранить
в прохладном подвале. Примерно
в то же время один морской
капитан завез в Соединенные Штаты
пятьсот пар жесткой индейской
обуви. Ее стали носить в
дождливую погоду поверх обычных
башмаков. Эта резиновая обувь была
очень неуклюжей, но, тем не
менее, пользовалась большим
спросом у американцев.
Внезапная популярность
резины в Соединенных Штатах
послужила причиной бума 1830 года
Житель Бостона Э. М. Чаффи
искал вещество, которое улучшило
бы качество кожи. Он приступил
к опытам, смешав фунт сырой
резины с тремя квартами скипидара.
Затем прибавил сажи для
придания смеси цвета и блеска.
Каландровая машина, которую он сам
сконструировал, наносила тонкий
слой этой смеси на материю.
В 1833 году вместе с несколькими
коллегами он основал компанию
«Роксберри Индйа Раббер» с
основным капиталом в 30 тысяч
долларов.
В 1835 году он получил
патенты на свою смесительную машин>
и каландр.
Дело имело феноменальный
успех. Через два года капитал
компании увеличился почти до
500 тысяч долларов. Чаффи
изготовлял крыши для хижин и
фургонов, головные уборы, обувь,
одежду.
На второе лето резиновая
одежда, головные уборы и крыши
фургонов превратились в жидкое
месиво и издавали такой отврати-
6?
тельный запах, что их
приходилось зарывать в землю. К концу
1836 года людям, причастным к
делу, стало совершенно ясно, что
резиновая промышленность
обречена на гибель, но широкая
публика еще не знала, что потери
акционеров резиновых фирм
составляли уже 2 миллиона долларов.
Незадолго до этого Чарльз
Гудийр вошел в магазин «Рок-
сберри компани» в Нью-Йорке.
Сделав покупки, он вышел из
магазина, не помышляя, что отныне
его преследует по пятам тень его
будущего.
Гудийр приобрел в магазине
резиновый спасательный круг.
Ему казалось, что он может
усовершенствовать клапан, через
который в круг накачивается
воздух. Он и не подозревал, что в
усовершенствовании прежде всего
нуждается материал, из которого
изготовлен круг, а не отдельные
его части. Через три недели он
сконструировал клапан,
работавший во много раз лучше старого.
Когда Гудийр пришел со своим
изобретением в контору «Роксбеп-
ри Раббер», агент компании
сказал, что, если он хочет
разбогатеть, пусть изобретает способ
усовершенствовать резину. Гудийру
следовало бы заткнуть уши и
удрать прочь, но он не удрал, а
лринял этот совет всерьез.
Чарльз Гудийр родился в
Нью-Хэвене (штат Коннектикут)
в декабре 1800 года. Когда ему
исполнился двадцать один год, он
стал компаньоном процветающей
фирмы скобяных изделий «А.
Гудийр и сыновья». Фирма
просуществовала до 1836 года, когда
крах банков вынудил Гудийра
закрыть предприятие. Еще до того,
как это произошло, Чарльз решил
расстаться с обреченным бизнесом
и посвятить жизнь
изобретательству. Но для своей деятельности
он избрал отрасль
промышленности, которая приближалась к
банкротству так же стремительно,
как и фирма «А. Гудийр и
сыновья».
Он считал резину
разновидностью кожи и часто говорил о
том, что необходимо «вылечить»
резину, сведя таким образом
практически неразрешимую
проблему к чему-то довольно
обыденному.
По своей наивности, Гудийр
полагал, что сможет решить эту
проблему в несколько месяцев. Он
писал: «Я был в блаженном
неведении относительно трудностей,
которые мне предстояло
преодолеть. Но вскоре я убедился, что
эксперименты с эластичной смолой
потребуют смены зимы и лета, то
есть, по меньшей мере, двенадцати
месяцев, а то и больше, пока я
смогу с уверенностью сказать, что
изделия не развалятся...».
ГУДИЙРА
ВЫСМЕИВАЮТ
И СЧИТАЮТ
СУМАСШЕДШИМ
Гудийр начал опыты с
бразильской эластичной смолой,
изготовляя дома тонкие пленки при
помощи скалки для теста. Он
смешивал сырую смолу с любым
попадавшимся под руку веществом:
солью, перцем, сахаром, песком,
касторовым маслом, даже с
супом,— следуя великолепному
логическому заключению, что, рано
или поздно, он перепробует все,
что есть на земле, и наконец
наткнется на удачное сочетание.
Житель Нью-Хэвена Ральф Стил
одолжил Гудийру денег, и" тот
открыл на них лавку. На полках
красовались сотни пар галош. Но
в первый же жаркий день они
растаяли и превратились в дурно
пахнущее месиво.
До сих пор Гудийр
использовал в качестве основы смесь,
предложенную Макинтошем:
эластичную смолу в скипидаре. Ему
пришло в голову, что липкость этой
смеси объясняется присутствием
скипидара. Он купил партию
резиновой смолы и задумал целую
серию опытов. Но не успел он к ннм
приступить, как один из его
подручных куском резины заклеил
дырку на брюках. Поджидая,
пока резина затвердеет, он присел.
Подоспевшему Гудийру пришлось
отрезать человека от брюк....
Гудийр закрыл свою лавку и
занялся опытами, смешивая с
резиновой смолой множество
веществ: орешник, сыр, чернила —
и все это никуда не годилось, за
исключением магнезии. Когда он
смешал фунт магнезии с фунтом
резиновой смолы, то получился
материал белее резиновой смолы,
гибкий и прочный, как кожа. Он
изготовил из него обложки для
книг, чехлы для роялей, показал
публике, получил горячее
одобрение, смеялся от радости — и через
месяц убедился, что его вновь
постигла полная неудача. Тогда он
продал дом, отвез жену и детей в
деревню, а сам поехал в Нью-
Йорк в поисках поддержки и
финансовой помощи. В Нью-Йорке
он встретил двух друзей. Один
уступил ему комнату на Голд-
стрит под лабораторию. Второй
друг, аптекарь, согласился
отпускать ему в кредит любые
химикалии, которые могли
понадобиться.
В то время Гудийр думал, что
его рецепт с магнезией можно еще
как-то усовершенствовать. Он
кипятил смесь смолы и магнезии в
водном растворе негашеной
извести и получал пласты резины,
которая была гораздо глаже и
прочнее прежней.
Газеты восхваляли его как
человека, спасшего резиновую
промышленность. Но через три
недели Гудийр обнаружил, что
одной капли самой слабой
кислоты — даже яблочного сока — было
достаточно, чтобы нейтрализовать
негашеную известь и разрушить
материал.
На следующем этапе поисков
Гудийр отказался от магнезии.
«Чистая негашеная известь — вот
в чем решение вопроса»,— думал
он. Но чистая негашеная известь .
64
не была решением вопроса — она
разрушала резиновую смолу.
Гудийру нравилось
расписывать цветными узорами изделия
из полученных им материалов;
однажды он попробовал применить
бронзовую краску. Но бронзовый
цвет не понравился, и он снял
краску царской водкой. Капля
кислоты, попавшая на резину, так
обесцветила материал, что Гудийр
сразу выбросил образец. Вид
выгоревшего пятна не выходил из
его головы, и спустя несколько
дней он отыскал заброшенную
галошу... На том месте, куда попала
капля кислоты, исчезла так
мучившая Гудийра липкость.
Царская водка, которую
применял Гудийр, была не чем иным,
как азотной кислотой с некоторой
примесью серной кислоты.
Гудийр так слабо разбирался в
химии, что ему казалось, будто ои
имеет дело с чистой азотной
кислотой. Он подверг несколько
пластов резины обработке парами
кислотной смеси. Результат
превосходил все его предыдущие
достижения, и он обратился за
патентом. Он арендовал старую
резиновую фабрику в Стейтен-Ай-
ленде, открыл магазин на Бродвее
и готовился приступить к
широкому производству, как вдруг
разразился второй экономический
кризис, разоривший покровителей
Гудийра. В течение всего двух
месяцев Гудийр снова впал в
совершенную нищету.
К этому времени Гудийр уже
фактически изобрел процесс
изготовления тонкой резиновой
пленки, коммерческое применение
которой было вполне возможным.
Но финансовый крах поверг его
в такое отчаяние, что он не был
в состоянии оценить достннутые
им результаты. Его семья
переехала к нему в Нью-Йорк, и чтобы
прокормить детей н жену,
Гудийру пришлось заложить последние
остатки своего имущества. Гудийр
часто совсем ослабевал от голода.
В то время в целях рекламы он
сделал себе костюм из резиновой
материи и надевал его, куда бы
ни отправлялся. Кто-то спросил
однажды, как можно разыскать
Гуднйра. Ему ответили: «Если вы
увидите человека в резиновом
пальто, резиновых ботинках,
резиновом цилиндре и с резиновым
кошельком в кармане, а в
резиновом кошельке ни одного цента, то
можете не сомневаться — это
Гудийр».
В сентябре этого же 1837 года
Гудийр снова поехал в Роксберри,
где еще сохранилась первая
резиновая фабрика, влачившая
жалкое существование. Чаффи,
первый создатель производства
резины в стране, не терял веры в
удивительные свойства нового
материала. Он взял Гудийра на работу
и разрешил ему проводить на
фабрике эксперименты, применяя
свое «кислотное лечение резины».
Гудийр делал обувь и материю
такого хорошего качества, что их
покупали даже те, кто раньше
вздрагивал при одном упоминании
резины. Его немедленно засыпали
просьбами о продаже лицензий, и
Гудийр заработал что-то около
5 тысяч долларов. Он смог
перевезти в Роксберри семью. К нему
снова вернулась удача.
Заказ правительства
Соединенных Штатов на сто пятьдесят
почтовых сумок из резины
увенчал его успех. Гудийр изготовил
сумки н вывесил их в лавке для
всеобщего обозрения.
После напряженной работы
Гудийр решил уехать вместе с
семьей на отдых. В течение его
двухнедельного отсутствия стояла
знойная погода. Когда Гудийр
вернулся, он понял, что фортуна
снова покинула его: сто пятьдесят
почтовых сумок растаяли на жаре.
Поверхность сумок уцелела, и это
доказывало, что сверху резина
действительно была «вылечена»,
■но внутренние слои ткани, до
которых не добрались пары
кислоты, стали такими же липкими.
Контракт с правительством был
ликвидирован; покупатели стали
возвращать и другие товары.
К концу лета он снова очутился в
нищете.
Накануне этого нового
провала Гудийр взял в помощники На-
таниела М. Хейворда, мастера с
фабрики Роксберри. Хейворд
также придумал свой способ «изле:
чения» резины, который
заключался в следующем: эластичная
смола смешивалась с истолченной
серой, затем смесь высушивалась
на солнце. Он назвал этот способ
«соляризацией». Идея
соляризации пришла к Хейворду во сне.
К удивлению Гудийра, резина
Хейворда обладала теми же
качествами, что и та, которую делал
он сам.
Он и не догадывался, что по
существу это была та же самая
резина, так как и в том и в
другом способе применялась сера. Но
теперь Гудийр уже так
бедствовал, что временами не знал, как
найти крышу над головой и кусок
хлеба для семьи.
«В течение четырех лет я
тщетно пытался улучшить мате-
териал, который до сих пор
разорял всех, кто когда-либо
занимался его производством. Многие
полагали, что человек, упорно
продолжавший заниматься этим
гиблым делом, заслуживал те
невзгоды, которые на него
обрушивались, и не имел права на
сострадание». Тем не менее Гудийр
продолжал работу.
В КОНЦЕ КОНЦОВ
ГУДИЙР
НАТЫКАЕТСЯ
НА УДАЧУ
У Гудийра был в Воберне
шурин, к которому он и переехал
с семьей на правах бедного
родственника. Именно в ту зиму
Гудийр открыл способ, известный
теперь под названием
«вулканизация».
«Я был поражен, заметив, что
образец резины, случайно
оставленный у нагретой печки, обуглил-
5 «Химия и жизнь», № 3
65
Mo
95,95
1
13
18
8
ЭЛЕМЕНТ № 421
Б. И. КАЗАНОВ
Глядя на современный карандаш, можно
подумать, что это изделие века техники —
XIX столетия. На самом же деле
материалами, которые оставляют мажущий след,
люди пользовались очень давно. Давно
научились заключать сердечник из такого
материала в оболочку. Как и в наше время,
для письма пользовались графитом. Но,
кроме графита, нередко в горах попадались
и другие минералы, очень на него похожие.
Они тоже были мягкими, имели
серо-стальной блеск и чешуйчатое строение. Считали,
что все они представляют собой
разновидности одного и того же материала. Его
называли «молибдена».
Этим же словом греки называли свинец
и сернистый свинец (минерал галенит),
который также оставляет темно-серый след
на твердой поверхности.
Подошло XVIII столетие — век, когда
было открыто существование многих до
того времени не известных металлов.
Минерал, из которого делали
карандаши, попал в лабораторию шведского химика
Карла Вильгельма Шееле. Со
свойственным ему энтузиазмом Шееле занялся
исследованием. Прежде всего он стал пробовать
на новом материале действие крепких
кислот. В концентрированной азотной кислоте
минерал растворился, но при этом в колбе
ся, словно кожа. Я попробовал
обратить внимание
присутствующих на это замечательное
явление..., так как обычно эластичная
смола таяла при высокой
температуре, но никто, кроме меня, не
видел ничего примечательного в
том, что обуглился кусочек
резины... Однако я сделал вывод, что
если бы удалось в нужный момент
приостановить процесс
обугливания, это избавило бы смесь от
липкости. После дальнейших
опытов, проведенных при высокой
температуре, я убедился, что мой
вывод верен... и, что необычайно
важно,— по краям обуглившегося
участка образовывалась полоска
избежавшей обугливания и
совершенно „излеченной" резины».
Гудийр сумел заметить эту
тоненькую полоску всего в
несколько миллиметров шириной н
догадаться, что это «исцеленная»
резина. Вот почему вполне
оправданы сказанные им впоследствии
слова: «Я признаю, что мои
открытия не являлись итогом
научного химического исследования,
но в то же время не могу
согласиться, что они были лишь, как
говорится, чистой случайностью.
Я утверждаю, что мои открытия
явились результатом
настойчивости и наблюдательности».
Вот как описывала первые
испытания нового материала дочь
Гудийра: «Я случайно увидела,
что отец держит у огня
маленький кусочек резины, и заметила,
что в этот день он был
необычайно взволнован каким-то
открытием. Он вышел из дома и прибил
кусок гвоздем к стеие. Стояли
сильные холода. На следующее
66
выпал белый осадок. Шееле установил, что
в растворе образовалась серная кислота,
а осадок представляет собой «особую белую
землю». Поскольку «земля» эта обладала
кислыми свойствами, он назвал ее
молибденовой кислотой — кислотой из минерала
«молибдена». Высушив остаток, Шееле
прокалил его и получил ангидрид.
В то время химики еще не имели
четкого представления о том, что ангидрид
(«кислота минус вода»)—это соединение
элемента с кислородом. Однако
собственный опыт подсказывал ученому: чтобы
выделить элемент из ангидрида, надо
прокалить его с чистым углем. Но для этого
у Шееле не было подходящей печи.
И он попросил другого шведского химика
П. Гьёльма сделать этот опыт. Гьёльм
охотно согласился.
Лишенный чувства зависти, беззаветно
преданный науке, Шееле с волнением ждал
результатов. И когда опыты завершились
получением неизвестного металла, Шееле
написал Гьёльму: «Радуюсь, что мы теперь
обладаем новым металлом — молибденом».
Так новый металл получил имя,
присвоенное ранее свинцу, от которого он так
сильно отличается. Это было в 1790 году.
Полученный металл не был чистым —
в нем содержалось много углерода, потому
что Гьёльм прокаливал его с углем. Уже
после смерти обоих первооткрывателей
нового металла их знаменитый
соотечественник Берцелиус стал восстанавливать
молибденовый ангидрид не углем, а водородом
и таким образом получил чистый молибден.
Он же подробно изучил состав и свойства
«особой белой земли» Шееле и определил
атомный вес молибдена.
Молибден занял свое место в семье
металлов.
помощь
ЗЕМЛЕДЕЛЬЦАМ
Новый металл и его соединения
заинтересовали химиков XIX столетия, особенно
благодаря разнообразию окрасок, которые
они давали. Чистый молибден при
длительном хранении совершенно не изменялся —
он прекрасно противостоял действию
воздуха и влаги. Однако при нагревании он
легко соединялся с кислородом, и
получалось порошкообразное желтоватое
вещество,, которое после охлаждения
становилось белым,— трехокись молибдена. При
нагревании до 500° С молибден целиком
переходил в это соединение. При этом
выделялось большое количество тепла и
начиналось * саморазогревание. Подсчитали,
что одним граммом сгоревшего таким
образом молибдена можно нагреть до кипения
около семнадцати литров воды. Но кого мог
интересовать металл, который при
небольшом нагреве теряет все свои металлические
свойства?
Минерал, в котором впервые был
обнаружен новый металл, тоже легко окислялся
на воздухе, превращаясь в молибденовый
ангидрид. В 1848 году русский химик
Генрих Васильевич Струве вместе со шведом
Л. Сванбергом занялись изучением свойств
утро отец принес этот кусочек в
дом и торжествующе поднял его
над головой. Резина была такой
же гибкой как и раньше».
За первым испытанием
последовала целая серия других,
которые Гудийр проводил при помощи
каминов, костров и печей для
обжигания кирпича, стремясь точно
установить необходимую дозу
тепла. Соседи считали Гудийра
славным, но безнадежно помешанным
человеком.
Вскоре одна французская
фирма предложила ему весьма
соблазнительную сумму за
исключительное право на
использование во Франции его способа
обработки резины парами азотной
кислоты.
Несмотря на то, что он был
по уши в долгах, а семья
перебивалась на картофеле и диких
кореньях, Гудийр ответил
французской фирме, что не может принять
ее предложения, так как в
настоящее время разрабатывает более
совершенный способ. Его друзья
не сомневались, что он
окончательно спятил. Однако зимой
1841 года к Гудийру стали
стекаться деньги. Новый материал
обладал отличными качествами,
и Гудийра засыпали
предложениями о покупке патента.
Вулканизация резины
послужила толчком для развития
электропромышленности, так как
резина — прекрасный изоляционный
материал. Окрыленный успехом,
Гудийр стал тратить больше, чем
зарабатывал. Он умер в 1860
году, оставив после себя двести
тысяч долларов долгу, но друзья
уже не считали его сумасшедшим.
5* 67
молибденовой кислоты и ее ангидрида. Они
растворили ангидрид в концентрированном
растворе аммиака (который известен всем
нам под названием нашатырного спирта)
и к полученному раствору прилили винного
спирта. Из раствора выделилась канарееч-
но-желтая соль — молибдат аммония.
Этой соли суждено было сыграть
большую роль в аналитической химии.
В те годы возникла наука о
плодородии — агрохимия. Специальные фабрики
стали вырабатывать удобрения,
содержащие азот и фосфор. И сразу понадобилось
научиться точно контролировать
содержание нужных элементов. Интересовало это и
владельцев фабрик, интересовало и
сельских хозяев: потребители удобрений могли
опасаться обмана со стороны дельцов. А
полученный Струве и Сванбергом молибдат
аммония оказался прекрасным реактивом
на фосфор, полностью осаждающим его из
растворов, дающим возможность
определить его содержание в любых продуктах —
туках, руде, металле.
Реактив оказался настолько хорошим,
что и теперь его используют во всех
лабораториях, определяя содержание фосфора.
Молибдат аммония нашел и другое
применение. Оказалось, что он губительно
действует на микроорганизмы. Его стали
использовать в качестве
дезинфицирующего вещества, обрабатывая им в небольших
количествах обивку мебели в театрах,
клубах, публичных библиотеках, чтобы
продлить срок службы этой мебели.
СОПЕРНИК
ИНДИГО
С древних времен во всем мире
славилась стойкая синяя краска из тропического
растения — индиго. Стоила она очень
дорого.
В XIX веке, когда стала бурно
развиваться промышленность красителей,
химики нашли новое применение молибдену.
Раствор молибденовой кислоты в серной
кислоте с добавлением винного спирта дал
синюю жидкость, которую стали
использовать для окраски шелковых тканей. Шелк
и хлопчатобумажные ткани, пропитанные
крепким раствором молибдата аммония,
высушенные и затем протянутые через
раствор восстановителя (хлористого олова),
окрашивались в небесно-голубой или синий
цвет. Кислые растворы солей молибденовой
кислоты под действием восстановителей
приобретают синий цвет. Такая краска
называется молибденовой синью или
минеральным индиго. Было составлено много
рецептов для окрашивания тканей
молибденовыми солями не только в синий, но и
в красный, желтый, черный, бурый цвета.
Окрашивали этими солями шерсть, мех,
кожу, дерево и резину. Использовали
молибденовые соединения и для приготовления
лаков, и для окраски керамических изделий.
Например, фарфор окрашивается в голубой
цвет молибдатом натрия, а в желтый —- все
тем же молибдатом аммония. Очень
ценится оранжевая краска из молибдата и
хромата свинца.
А сернистый молибден, из которого в
давние времена делали карандаши, стали
добавлять к глине, окрашивая керамиче-
кие изделия при обжиге в желтый или
красный цвет (в зависимости от количества
молибденита).
ВТОРЖЕНИЕ
В МЕТАЛЛУРГИЮ
Очень долго молибден использовали
только как краситель и для приготовления
реактивов. Только в самом конце XIX века
его стали применять в металлургии. На Пу-
тиловском заводе в 1885 году выплавили
сталь, в которой содержалось 0,52%
углерода и 3,72% молибдена. Сталь эту
подвергли многочисленным исследованиям и
проверкам. Оказалось, что свойства ее почти
такие же, как и вольфрамовой стали,
главным образом — большая твердость,
необходимая режущим инструментам. Причем
добавка в сталь 0,3% молибдена
увеличивает ее твердость в такой же степени, как
добавка 1% вольфрама. Молибден влияет
и на качество чугуна — благодаря
уменьшению зерен повышается его прочность и
износоустойчивость, что особенно заметно,
когда детали работают при высоких
температурах.
В 1900 году на Всемирной
промышленной выставке в Париже была представлена
Байтом и Тейлором сталь, содержащая мо- |
либден и обладающая замечательным
свойством — резцы из нее закаливались в
процессе работы.
В 1890 году был разработан процесс
выплавки ферромолибдена — сплава
железа и молибдена с большим содержанием
последнего. Добавляя в плавку определен-
68
ные количества этого сплава, начали
выплавлять специальные сорта стали.
Молибден наряду с хромом, никелем и кобальтом
стали широко использовать для
легирования, для придания металлу специальных
свойств. Можно уверенно сказать, что
легирующие металлы оказали немалое
влияние на технический прогресс начала XX
века, способствовали появлению новых
технологических процессов, рождению новых
машин.
Тем временем приближалась первая
мировая война. Военные ведомства
европейских держав требовали от
промышленности крепкой брони для кораблей и
укреплений, особо прочной стали для
пушек. Орудийные стволы стали изготовлять
из хромомолибденовых и никельмолибдено-
вых сталей, отличающихся высоким
пределом упругости и в то же время
поддающихся токарной обработке с высокой степенью
точности. Из хромомолибденовой стали
начали изготовлять бронебойные снаряды,
судовые валы и другие важные детали.
Фирма «Винчестер» применила эту сталь
для изготовления стволов и ствольных
коробок винтовок.
Появлялось все больше тяжелых
моторов. Для них нужны были крупные
шариковые и роликовые подшипники,
выдерживающие большую нагрузку. И для этой
цели подошли хромомолибденовые и ни-
кельмолибденовые стали.
В наше время, когда ежегодно добывают
из недр Земли миллионы тонн
молибденовых руд, 90% всего молибдена поглощает
черная металлургия.
МОЛИБДЕН
В АВИАЦИИ
Когда самолеты перестали делать из
дерева и парусины, понадобились не
только мощные моторы и легкие металлические
листы обшивки. Понадобился жесткий
каркас фюзеляжа из труб.
Сначала трубы из углеродистой стали
удовлетворяли требованиям авиации. Но
самолеты увеличивались в размерах,
появились самолеты-гиганты. Чтобы не
увеличивать их и без того большого веса,
потребовались трубы большого диаметра, но с
малой толщиной стенки. Трубы из хромова-
надиевой стали не выдерживали протяжку
до нужного размера и рвались, а в местах
сварки отпускались и теряли прочность.
Выйти из этого тупика удалось с
помощью хромомолибденовой стали. Трубы из
нее хорошо .протягивались, прекрасно
сваривались и, что главное, в тонких сечениях
не отпускались при сварке, а
самозакаливались на воздухе. А количество
молибдена в стали, из которой их протягивают,
было совершенно ничтожным — всего 0,15—
0,30%.
ПОРОШКОВАЯ
МЕТАЛЛУРГИЯ
Даже после того, как молибден стал
играть важную роль в сталелитейной
промышленности, он долгое время не находил
применения в чистом виде, потому что
получался не в виде литой массы, а в
порошке, хотя это и металлический порошок. Вся
трудность заключалась в том, что
молибден — тугоплавкий металл (температура
плавления 2622° С). Такую температуру не
выдерживает обычная футеровка печей, и
выплавить молибден, как и другие
тугоплавкие металлы (вольфрам, тантал, осмий,
рений), долгое время не представлялось
возможным. Молибден к тому же при
сравнительно небольшом нагреве активно
соединяется с кислородом воздуха и переходит
в трехокись молибдена. Выплавленный в
графитовом тигле, молибден оказался
монолитным, но хрупким, потому что
.поглощал углерод непосредственно из материала
тигля, и при этом образовывался карбид
молибдена.
Получить чистый пластический металл
не удавалось. Русским химиком Николаем
Николаевичем Бекетовым был разработан
в 1890 году способ получения ковкого
вольфрама, но всей проблемы это не разрешало.
Только в 1907 году удалось, наконец,
получить молибденовую проволоку. Химик
Вердассер использовал для этого обходный
путь. Металлический порошкообразный
молибден он смешивал с клейкими
органическими веществами (например, с сахаром)
и продавливал полученную массу через
отверстие матрицы. Получалась клейкая
нить. Поместив эту нить в атмосферу
водорода, чтобы не допустить окисления
молибдена, Вердассер пропускал через нее
электрический ток. Нить нагревалась,
органическое вещество испарялось из нес, металл
плавился, и получалась молибденовая
проволока. Этот так называемый метод шпри-
69
цевания был еще несовершенен и явно
недостаточен для промышленных нужд.
Однако этим методом была получена
проволока не только из молибдена, но также из
других тугоплавких металлов, в том числе
из вольфрама.
В 1910 году Джеймс Кулидж взял
патент на получение тугоплавких металлов
способом металлокерамики. По этому
методу сначала получали металлический
порошок (так, как это делал еще Берцелиус).
Затем добавляли к нему раствор глицерина
в спирте и из этой массы прессовали шта-
бики. Молибденовый порошок тоньше, чем
вольфрамовый, поэтому прессованные
брикеты из него получаются более прочными.
Их спекают в печи при температуре 1100—
1200° С в течение 2—3 часов. После этого
через брикеты пропускают постоянный ток
низкого напряжения. Они разогреваются и
свариваются — получается компактная
монолитная масса молибдена высокой
чистоты.
Способ металлокерамики — порошковой
металлургии завоевал всеобщее признание
и в наше время имеет самое широкое
распространение.
ЭЛЕКТРИЧЕСКОЕ
ОСВЕЩЕНИЕ И РАДИОТЕХНИКА
Нити накаливания в электрических
лампочках вытягивают из вольфрама,
превосходящего по тугоплавкости все другие
металлы и дающего наибольшую светоотдачу.
Но если впаять вольфрамовую нить в
стеклянный стерженек в центре лампочки, то
он вскоре треснет в результате теплового
расширения нити.
Когда исследовали физические свойства
молибдена, то обнаружили, что у него
ничтожно малый коэффициент теплового
расширения. При нагреве от 25 до 500° С
размеры молибденовой детали увеличатся
всего на 0,0000055 первоначальной
величины. И даже при нагреве до 1200° С
молибден практически почти не расширяется.
Поэтому вольфрамовую нить накаливания
стали подвешивать на молибденовых
крючках, впаянных в стекло. В дальнейшем
молибден сыграл еще большую роль в
электровакуумной технике. К вакуумным
приборам электрический ток подводится
через молибденовые прутки, впаянные в
специальное стекло, имеющее одинаковый
с молибденом коэффициент теплового
расширения (поэтому только это стекло и
носит название молибденового).
В двадцатые годы нашего века радио ^
стало всеобщим увлечением и
потребностью. Началась форменная радиогорячка.
Радиоприемники тех лет были
обычно безламповыми—детекторными. Лучшую
слышимость подбирали, пробуя в разных
местах контакт между стальным тонким
щупом — контактной пружиной и
кристаллом... все того же самого
распространенного молибденового минерала —
молибденового блеска (он же молибденит, он же
сернистый молибден) — того самого, который
в древности использовали вместо грифеля.
Металлический молибден служит в
радиоприемниках и в наше время. Он хорошо
прокатывается в тонкие листы толщиной
0,1—0,2 миллиметра, выдерживает сильный
нагрев и потому оказался хорошим
материалом для анодов радиоламп.
И ДРУГИЕ ОБЛАСТИ
ПРИМЕНЕНИЯ
Сплав из молибдена с вольфрамом в
паре с вольфрамом можно использовать
для измерения температур до 2900° С в
восстановительной атмосфере. Молибденовая
проволока может служить обмоткой в
высокотемпературных (до 2200° С) печах
(однако для этого необходима неокисляющая
среда).
Используется в технике и вредное в
ряде случаев свойство молибдена
окисляться при высокой температуре. Молибден
применяют для очистки благородных газов
от примеси кислорода. Неон или аргон
пропускают над нагретой до 600—900° С
поверхностью молибдена, и она жадно
поглощает кислород.
Тугоплавкий, ковкий, не тускнеющий,
обладающий приятным цветом молибден
получил признание у ювелиров как
заменитель драгоценной платины. Молибден и
соли молибденовой кислоты используют в
различных химических процессах в качестве
катализатора. В кожевенной
промышленности соединения молибдена добавляют к
дубильному раствору... А молибденовый блеск,
который раньше не отличали от графита,
в наше время и применяют вместо графита,
как высокотемпературную смазку (по
кристаллической структуре этот минерал
действительно подобен графиту).
70
МЕСТОРОЖДЕНИЯ
МОЛИБДЕНА
В земной коре содержится около 0,001%
молибдена,— как полагают, несколько
меньше, чем вольфрама, кобальта, олова, но
значительно больше, чем таких известных
с древности элементов, как мышьяк,
сурьма, ртуть, серебро, золото.
Концентрации молибдена в рудах
невелики— при содержании 1% РУДа уже
считается богатой. Насчитывается 15 молибде-
носодержащих минералов, наиболее
известны 4: сернистый молибден (молибденит,
молибденовый блеск), вульфенит —
свинцовая соль молибденовой кислоты, повел-
лит — кальциевая соль молибденовой
кислоты и молибдит— («молибденовая охра») —
соединение окислов молибдена и железа.
Наиболее важен молибденит. Из руды,
содержащей этот минерал, получают
ферромолибден, а его уже добавляют к стали в
качестве легирующей добавки.
Добыча молибденовых руд началась
лишь в 80-х годах XIX столетия. До первой
мировой войны молибден добывали в
промышленных масштабах только в Австралии
и Норвегии (всего несколько десятков
тонн). Во время войны — к 1918 г.—
мировое производство молибдена достигло 800 т.
Намного увеличился объем добычи в
Норвегии, началась разработка молибденовых
руд в Канаде и США. Залежи вульфенита
нашли в Испании, строились рудники в
Манчжурии и в Корее, Австралия начала
добывать молибден не только на материке,
но и на островах Новая Зеландия и
Тасмания.
В 1916 году началась разработка
богатых молибденовых руд массива Клаймакс,
в американском штате Колорадо. Во время
войны молибден стали добывать Швеция,
Перу, Чили.
Но вскоре после окончания первой
мировой войны спрос на молибден резко
сократился, цены упали, и добыча почти
прекратилась. Только к 1923 году
воевавшие государства израсходовали
накопленные запасы, и добыча молибдена опять
пошла в гору.
Перед второй мировой войной
капиталистические страны добывали в год 15—■
17 тысяч тонн молибдена, а в 1943 г.—
30 тыс. т в рудных концентратах. После
войны производство молибдена несколько
упало и составляло в 1952 г. 22 тыс. г, а в
1956 г. снова выросло до 30 тыс. т. Из
капиталистических стран больше всего
молибдена добывают в США (до 90%). К числу
поставщиков этого металла принадлежат
также Чили, Мексика, Канада, отчасти
Норвегия и Финляндия.
Почти монопольное положение Америки
в торговле молибденом изменилось только
в послевоенные годы. Социалистические
страны располагают сейчас собственными
месторождениями и полностью
обеспечивают этим ценным металлом свою
промышленность.
СОВЕТСКИЙ
МОЛИБДЕН
В России молибден начали добывать в
начале XX века в Забайкалье, на Чикой-
ском руднике, попавшем в концессию
иностранной фирме. Молибденовую руду
концессионеры отправляли за границу, а в
Россию молибден ввозили из Германии.
Когда началась первая мировая война,
импорт из Германии прекратился. Добыча
молибдена на Чикойском руднике
увеличилась до... одного пуда A6 кг)
молибденового концентрата в день. Значительная часть
молибденового концентрата из Чикоя
поступала в распоряжение
фармацевтического общества Феррейна в Москве, которое
налаживало у себя производство молибда-
та аммония, необходимого для определения
фосфора в удобрениях. Продукции Чикоя
явно не хватало, и молибденовым сырьем
стала служить австралийская руда,
которую доставляли во Владивосток морским
путем. Вскоре концессионеры закрыли Чи-
койский рудник, и добыча молибдена в
Забайкалье прекратилась до 1926 года.
Советское государство заинтересовалось
редкими металлами с первых месяцев
своего существования. Уже в 1917 году в городе
Богородске под Москвой на заводе
«Электросплав» начались опыты по выплавке
молибдена. Гражданская война, борьба с
контрреволюцией приостановили эти
работы, но уже в 1921 году при химическом
отделе ВСНХ был организован отдел новых
производств во главе с В. Н. Глебовой. По
ее инициативе создали «Бюро редких
элементов» (Бюрель), которое заинтересова-
71
лось прежде всего получением
металлических вольфрама и молибдена из
отечественных руд. Первые работы были начаты в
лаборатории неорганической химии
Московского университета под руководством
профессора И. А. Каблукова и В. И. Спицина
(ныне академика).
Россия становилась на путь
электрификации, Россию нужно было прежде всего
осветить. И в 1922 году понадобились нити
накаливания и подвески для них из
собственных вольфрама и молибдена. Тогда
при Московском кабельном заводе
открылась специальная вольфрамовая
лаборатория, в которой несколько энтузиастов —
сотрудников «Бюреля» после долгих
поисков (заимствовать опыт было неоткуда)
наладили производство вольфрамовых
нитей накаливания. А в 1928 году удалось
начать выпуск молибденовой проволоки.
В 1931 году Московский электрозавод
выпустил уже 70 миллионов метров
вольфрамовой проволоки и 20 миллионов
молибденовой.
В те же годы возобновилась добыча
молибденовых руд в Забайкалье. А вслед за
тем геологи открыли много месторождений
молибдена в Сибири, Казахстане, на
Кавказе и в других районах Советского Союза.
Еще в 1926 году академик А. Е.
Ферсман на основе анализа распространенности
руд предложил выделить
«монголо-охотский металлический пояс», который
характеризуется залеганием руд олова,
вольфрама, молибдена и других металлов. В
пределах СССР в этот пояс входит все южное
и восточное Забайкалье, Приамурье и
побережье Охотского моря.
МОЛИБДЕН В ЖИВЫХ
ОРГАНИЗМАХ
Многие элементы —бор, марганец, цинк
и другие — находятся в обычных почвах в
ничтожно малых количествах, но тем не
менее существенно влияют на развитие
растений и животных. К этим так называемым
микроэлементам относится и молибден.
Современными методами исследования
молибден обнаружили в зеленой массе
растений (около 1 мг на килограмм сухого
вещества). Много оказалось его в горохе и
бобах. Нашли молибден и в различных
органах животных организмов, до 2 мг на
1 кг сухого вещества у беспозвоночных и
около 0,3 мг на килограмм^-у
позвоночных. Это не могло быть случайностью —
стало ясно, что молибден играет
определенную роль в обмене веществ. Однако
существо дела долгое время оставалось
совершенно непонятным.
Вначале в одном опытном хозяйстве в
Повой Зеландии было замечено, что
добавление в почву ничтожных количеств
молибденовых солей увеличивает урожай
люцерны на 30%. 50—60 граммов молибденовой
соли на кислых почвах стали заменять
тонну извести, без которой раньше удобрение
суперфосфатом не оказывало никакого
действия. В той же Новой Зеландии фермеры
долгое время покупали почему-то только
низкосортный известняк, который хотя и
был дешевле, но извести содержал много
меньше. Объяснить это простым
недомыслием было трудно—фермеры явно знали
свои поля и разницу в качестве дорогого и
дешевого известняка. Когда же один из
химиков предпринял тщательное
исследование, то оказалось, что в низкосортном
известняке содержатся ничтожные примеси
молибденовых солей. Но их было
достаточно, чтобы увеличивать урожай клевера и
люцерны. Малые количества молибдена
усиливают активность клубеньковых
бактерий на корнях бобовых растений — гороха,
фасоли, сои, клевера, люцерны, благодаря
чему они лучше усваивают азот и быстрее
растут. Есть и другие растения,
небезразличные к молибдену, например, донник
лекарственный (астрагал) накапливает в
своих тканях молибден в количествах в 100 раз
больших, чем другие растения.
Но в дальнейшем выяснилось, что не на
всех почвах молибден проявляет свое
полезное действие. На красноземах и
буроземах, в которых содержатся соли железа,
его действие не сказывается. Обнаружилась
и «оборотная сторона медали» — избыток
молибдена в растениях пагубно сказывался
на животных. В Англии, в округе Сомерсет,
в течение многих лет наблюдалось тяжелое
заболевание скота — у животных портилась
шерсть, расстраивалось пищеварение,
нередко болезнь заканчивалась падежом.
Анализ почвы и растений на пастбищах
этого округа показал, что содержание
молибдена там в три с лишним раза больше
обычного. Заболевание животных получило
название молибденозиса, а человек заболе-
72
вает при избытке молибдена далеко не
новой болезнью — подагрой.
Науку о влиянии на организм
химической среды, об участии различных
элементов в обмене веществ начал создавать
академик Владимир Иванович Вернадский.
Ученик Вернадского академик Александр
Павлович Виноградов установил биогеохи-
мнческие провинции—территории, в
которых почвы обогащены тем или иным
элементом. Наше Закавказье выделяется как
молибденовая провинция — здесь почвы так
же обогащены молибденом, как и в округе
Сомерсет в Англии. Но заболевание скота,
обычное в Сомерсете, в Закавказье не
встречается. Было предположение, что
причина заболевания заключается не в
избытке молибдена, что в этом ученые ошиблись.
В конце концов исследователи убедились в
правильности первой версии. А разница
объясняется тем, что в почвах Закавказья
много железа, меди и серы, которые в
определенных соотношениях с молибденом
снимают его токсическое действие.
Только в последние годы роль
молибдена в организме животных и человека
становится яснее. Установлено, что молибден
входит в состав важного фермента — ксан-
тиноксидазы. Если в пище мало молибдена,
то этот фермент образуется в
недостаточном количестве, и организм болезненно
реагирует на его нехватку.
Если же молибдена в пище больше, чем
нужно, то обмен веществ тоже нарушается.
Ксантиноксидаза ускоряет азотистый обмен
в организме, в частности пуриновый обмен.
В результате распада пуринов образуется
мочевая кислота. Если этой кислоты
слишком много, то почки не успевают выводить
ее из организма, тогда в суставах, в
мышечных сухожилиях скапливаются
растворенные в этой кислоте соли. Суставы начинают
болеть, развивается подагра.
Молибден служит человеку. Он не
потеряет своего значения и в будущем, когда
пушечные стволы и корабельная броня
будут забыты человечеством, когда свойства
любого металла станут служить только
нуждам человека, мира, свободного труда.
ерное
ФАНТАСТИКА |
ф. ХОЙЛ
Блако
Раздавшийся из громкоговорителя голос был
встречен дружным хохотом, так как это был
голос садовника Джо. Лестер, естественно, не имел
возможности снабдить голос интонациями, все
слова произносились одинаково и следовали одио
за другим через равные интервалы; только между
фразами были небольшие паузы. Облако говорило
слегка картавя, в несколько медлительной
манере жителя Запада и неописуемо комично
коверкало некоторые слова. Отныне Облако именовалось
не иначе, как «Джо».
В первом сообщении содержалось
приблизительно следующее:
— Ваша первая передача была для меня
неожиданностью, ибо крайне необычно было
обнаружить животных с техническими знаниями на
планетах — телах с весьма неблагоприятными
условиями для жизни.
На вопрос, почему он так считает» Джо
ответил:
— По двум весьма простым причинам. Живя
на поверхности твердого тела, вы испытываете
воздействие значительной силы тяжести. Это
резко ограничивает размеры, до которых могут
вырасти ваши животные, и следовательно,
возможности вашей нервной деятельности. Это приводит
к тому, что вам необходимо иметь систему
мускулов для того, чтобы двигаться, и защитную
броню для предохранения от резких ударов,—
например, череп необходим вам для защиты
вашего мозга. Лишний вес мускулов и брони еще
больлге сужает возможности вашей нервной дея-
Окончанне. Начало публикации отрывков из повести см.
в № 1 и 2. Повесть готовится к печати в издательстве
«Знание».
тельиости. Самые крупные ваши животные
состояли по существу в основном из костей и
мускулов и имели очень маленький мозг. Как я
говорил, причиной этого является сильное
гравитационное поле, в котором вы живете. Вообще,
наличие разумной жизни можно было ожидать лишь
в рассеянной газовой среде, а не на планетах.
Второй неблагоприятный фактор — острый
недостаток у вас основных химических продуктов.
Для синтеза химических веществ в больших
масштабах необходим свет от какой-нибудь звезды.
А ваша планета поглощает лишь ничтожную
часть солнечного света. В данный момент я сам
как раз синтезирую нужные мне химические
вещества, причем в количестве, примерно в
10 000 000 000 раз большем, чем их синтезируется
на всей поверхности вашей планеты. Недостаток
у вас химических продуктов приводит к
необходимости ожесточенной борьбы за существование,
а в таких условиях первым проблескам разума
трудно выдержать конкуренцию с крепкими
костями и сильными мускулами. Конечно, если
разуму удается достаточно развиться, то дальнейшая
конкуренция с чисто физической силой
становится легче, однако первые шаги чрезвычайно
трудны — настолько, что достигнутый вами уровень
является большой редкостью среди планетных
форм жизни.
— Вот это удар для энтузиастов космических
путешествий,— сказал Марлоу.— Спросите его,
Гарри, чему мы обязаны появлением у нас на
Земле разумной жизни?
Вопрос был задан и через некоторое время
пришел ответ:
— Вероятно, стечению нескольких
обстоятельств, среди которых я выделил бы, как наи-
74
более важный, тот факт, что около 50 миллионов
лет назад на Земле развился совершенно новый
тип растений — то, что вы называете травой.
Появление этого растения вызвало коренную
перестройку всего животного мира, так как траву, в
отличие от всех других растений, можно щипать
прямо с Земли. По мере того как трава
распространялась по всей Земле, те животные, которые
могли извлечь пользу из этой особенности,
выживали и развивались. Остальные виды
приходили в упадок или вымирали. По-видимому, это
была главная перемена, благодаря которой разум
впервые утвердился на вашей планете.
— В вашем способе связи имеется целый ряд
весьма необыкновенных особенностей, которые
сделали расшифровку ваших сообщений довольно
трудным делом,— продолжало Облако.—
Особенно странно для меня то, что символы, которые вы
употребляете для связи, не имеют
непосредственного отношения к деятельности вашего мозга.
— Тут, мне кажется, нам следует ему кое-
что сказать,— заметил Кингсли.
— Ну, конечно. Я вообще не понимаю, как
это вы могли так долго сидеть спокойно, Крис,—
вставила Энн Хэлси.
Кингсли изложил свои идеи относительно
связи на постоянном и переменном токе и
спросил, действительно ли функционирование самого
Джо основано на переменном токе. Джо
подтвердил это и продолжал:
— Но необычно не только это. Самое
удивительное в вас —^ большое сходство между
отдельными индивидуумами. Это позволяет вам
пользоваться очень грубым способом связи. Вы
обозначаете свои психические состояния метками. Гнев,
головная боль, смущение, счастье, меланхолия —
все это ваши метки. Если А хочет сказать Б, что
он страдает от головной боли, он не пытается
описать, какие нарушения имеют место в его
нервной системе. Вместо этого он пользуется меткой.
Он говорит: «У меня болит голова». Когда Б
слышит это, он берет метку «головная боль» и
представляет себе, что это значит в соответствии
со своим собственным опытом. Таким образом, А
может сообщить Б о своем недомогании, даже
если ни тот ни другой не имеют ни малейшего
представления о том, что такое в
действительности головная боль. Такой весьма своеобразный
способ связи возможен, конечно, только межчу
почти идентичными индивидуумами...
— Насколько я понял, вы имеете в виду
следующее,— сказал Кингсли.— Если бы
существовали два абсолютно тождественных индивидуума,
то им вообще не нужно было бы никакой связи,
так как каждый автоматически знал бы
переживания другого. Для связи же между очень
разными индивидуумами требуется гораздо более
сложная система.
— Именно это я пытался объяснить. Теперь
вам ясно, почему мне было трудно
расшифровывать ваш язык. Это язык, удобный для почти
одинаковых индивидуумов, тогда как вы и я очень
сильно отличаемся друг от друга, гораздо сильнее,
чем вы, вероятно, представляете. К счастью, ваше
психическое устройство оказалось довольно
простым. Как только я до некоторой степени в нем
разобрался, расшифровка стала возможной.
— Но есть все-таки между нами что-нибудь
общее в функциях нервной системы? Можете вы,
например, испытывать что-нибудь
соответствующее нашей головной боли?— спросил Мак-Нейл.
— Вообще говоря, у меня, так же как у вас,
могут быть ощущения приятного и неприятного.
Но эти ощущения должны быть у любого
существа, обладающего чем-то вроде нервной системы.
Неприятные ощущения возникают при внезапном
разрыве связей, а это может случиться со мной,
так же как и с вами. Счастье — это
динамическое состояние, когда нервные связи
устанавливаются, а не разрываются, и это может случиться
со мной, как и с вами. Однако, несмотря на это,
я думаю, что мои субъективные переживания
совершенно отличны от ваших, за исключением
одного— как и вы, я стремлюсь избегать
неприятных ощущений, а приятные ощущения, наоборот,
желательны.
Более конкретно, вашу головную боль
вызывает недостаточное кровоснабжение,' в результате
чего нарушается точность электрических
импульсов в мозгу. Я испытываю нечто весьма похожее
на головную боль, если в мою нервную систему
попадают радиоактивные вещества. Это вызывает
электрические разряды, как в ваших счетчиках
Гейгера. Разряды нарушают синхронность
процессов в нервной системе и производят крайне
неприятные субъективные ощущения.
Теперь я хочу выяснить совершенно другой
вопрос. Меня заинтересовало то, что вы
называете «искусством». Литературу я могу понять,
как искусство выражения словами идей и
эмоций.
Изобразительные искусства очевидным
образом связаны с вашим восприятием мира. Но я
совершенно не представляю, что такое музыка. Мое
невежество в этом отношении едва ли
удивительно, так как, насколько я понимаю, вы никогда не
передавали музыки. Нельзя ли восполнить этот
пробел?
— Ну, Энн, вам представляется возможность
отличиться,— сказал Кингсли.— И какая возмож-
ность! Ни один музыкант никогда еще не играл
для такой аудитории!
— Что же мне сыграть?
— Как насчет той вещи Бетховена, которую
вы играли вчера вечером?
— Опус 106? Пожалуй, слишком сильно для
начинающего.
— Давайте, Энн! Задайте работы старине
Джо, - подбодрил Барнет.
— Не обязательно играть, Энн, если вам не
хочется. Вчера я записал вас на магнитофон,—
сказал Лестер.
— Ну, и как получилось?
— С технической точки зрения мы сделали
все, что возможно. Если вы были довольны своим
исполнением, то мы можем начать передачу хоть
сейчас, если хотите.
—■ Пожалуй, будет лучше, если вы
передадите запись. Это звучит смешно, но мне кажется, я
бы очень волновалась, если бы играла для этого
существа, чем бы оно ни было.
— Ну, что за глупости! Старина Джо не
кусается.
— Может быть, и не кусается, но я все-таки
предпочитаю запись.
Запись передали. После этого пришло
сообщение:
— Очень интересно. Пожалуйста, повторите
первую часть со скоростью, увеличенной на
тридцать процентов.
После того, как это было сделано, следующее
сообщение гласило:
— Так лучше. Очень хорошо. Я намерен
поразмыслить об этом. До свиданья.
— Боже мой, вы прикончили его, Энн!—
воскликнул Марлоу.
— Но я не понимаю, как музыка может
нравиться Джо. В конечном счете музыка — это звук,
а как было выяснено, для Джо не существует
звуков,— удивился Паркинсон.
— С этим я не согласен, сказал Мак-Нейл.—
Хотя с первого взгляда кажется, что наше
восприятие музыки неотделимо от звуков, на самом
деле это совсем разные вещи. Наш мозг
воспринимает не что иное, как электрические сигналы,
идущие от ушей. В данном случае звук
используется просто как удобное средство для
возбуждения 'В мозгу определенных электрических
импульсов. Больше того, многие данные ооказывают,
что музыкальные ритмы отражают главные
электрические ритмы нашего мозга.
— Это очень интересно, Джон!— воскликнул
Кингсли.— Выходит, что музыка -самым
непосредственным образом выражает деятельность нашего
мозга.
— Нет, это, пожалуй, чересчур сильно. Я бы
сказал, что музыка — наилучшее отражение
мировых проиессо'в большого масштаба. Но речь
дает более полное представление о тонкой
мозговой активности.
Споры продолжались до глубокой ночи. Все
сказанное Облаком подверглось детальному
обсуждению. Пожалуй, самое поразительное
замечание сделала Энн Хэле и.
— В первой части сонаты си бемоль мажор
есть пометка, требующая совершенно
фантастического темпа, который не под силу ни одному
нормальному .пианисту и, конечно, совершенно
недостижим для меня. Вы обратили внимание на эту
просьбу увеличить скорость? Мне стало просто не
по себе, хотя, возможно, это было лишь странное
совпадение.
На этом этапе развития событий всем уже
стало ясно, что следует передать политическим
властям информацию о действительной природе
Облака. Правительства разных стран опять
налаживали работу радиопередатчиков. Было
обнаружено, что если передавать вертикально вверх
трехсантиметровые волны, ионизация атмосферы
может поддерживаться на уровне, удобном для
связи на десятисантиметровых волнах.
Нортоистоу снова стал мировым центром связи.
Никто особенно не радовался тому, что
приходится огласить сведения, касающиеся Облака.
Каждый чувствовал, что связь с Облаком выйдет
из-под контроля Нортонстоу. А ученые еще
многое хотели бы узнать. Кингсли был категорически
против передачи информации политикам, но на
сей раз ему пришлось подчиниться большинству,
считавшему, что, как это ни печально, хранить
секрет больше нельзя.
Лестер записывал на пленку все разговоры
с Облаком, и теперь они были переданы по радио
на десятисантиметровых волнах. Однако все до
единого правительства не питали никаких
сомнений относительно сохранения секретности.
Большинство людей так никогда и -не узнало о
существовании жизни в Облаке, тем более, что в
дальнейшем события приняли такой оборот, что
секретность стала совершенно необходимой.
В тот момент ни одно правительство не
располагало односантиметровым передатчиком и
приемником подходящей конструкции.
Следовательно, связь с Облаком, по крайней мере
времечко, должна была осуществляться из Нортонстоу.
Специалисты в США указывали, однако, что связь
иа десятисантиметровых волнах с Нортоистоу, и
76
дальше на волне в один сантиметр позволит
правительствам США и других стран установить
контакт с Облаком. Было решено, что Нор-
гонстоу станет центром не только для передачи
информации по всей Земле, но и для связи с
Облаком.
Обитатели Нортонстоу разделились на два
примерно равных лагеря. Те, кто поддерживав
Кингсли и Лестера, считали, что надо открыто
отвергнуть план политиков и послать к чертям
правительства. Остальные, во главе с Марлоу и
Пэркинсоном, доказывали, что такое открытое
неповиновение ничего не даст, так как политики
могут в случае необходимости добиться своего
силой. За 'несколько часов до очередной передачи
от Облака между двумя группами разгорелся
жаркий спор. Дело кончилось компромиссом:
было решено, что по техническим причинам Нор-
тонстоу не сможет принимать никаких передач на
десятисантиметровых волнах. Правительства
смогут слышать Облако, но не разговаривать с ним.
Итак, критический момент наступил. В этот
день сильные мира сего слушали Облако, но не
могли отвечать.
Мак-Нейл обратился к Облаку:
— Нам было бы интересно узнать, чем
отличается от нашего ваш способ размножения.
— Размножение — то есть появление нового
индивидуума — происходит у нас совершенно
иначе. Видите ли, если бы не несчастные случаи или
непреодолимое желание уничтожить себя — такое
случается с нами иногда, как и с вами — я мог бы
жить бесконечно. Следовательно, в отличие от
вас, для меня не существует необходимости
породить какой-нибудь новый индивидуум, который
остался бы после моек смерти.
— Сколько же вам сейчас лет? i
— Несколько больше пятисот миллионов.
— И ваше рождение было, так же как
возникновение жизни на Земле, следствием какой-то
самопроизвольной химической реакции?
— Нет. Путешествуя по Галактике, мы
подыскиваем подходящие скопления вещества — обта-
ка, которые можно заселить. Мы делаем это
примерно так же, как вы сажаете черенки от деревьев.
Если бы я, например, обнаружил подходящее
облако, еще не наделенное жизнью, я снабдил бы
его сравнительно простой «нервной системой».
Я посадил бы туда то же, из чего сделан я сам.
часть себя самого. Это позволяет избежать тех
многочисленных опасностей, с которыми
сталкивается самопроизвольно возникающая жизнь.
Возьмем хотя бы такой пример. Как я уже
раньше объяснял, в мою нервную систему не должны
ни в коем случае попадать радиоактивные
вещества. Для этого у меня есть специальный весьма
сложно устроенный электромагнитный экран,
который препятствует доступу любого
радиоактивного газа к моим нервным центрам — иначе
говоря, к моему мозгу. Стоит только этому экрану
испортиться, как я почувствую сильнейшую боль
и вскоре погибну. Выход из строя экрана — один
из возможных несчастных случаев, о которых я
только что говорил. Суть этого примера в том,
что мы можем снабдить своих «потомков» как
экранами, так и разумом для управления ими,
тогда как практически невероятно, чтобы такие
экраны могли появиться в ходе
самопроизвольного развития жизни.
— 'Но ведь это должно было случиться,
когда появился первый из вашего рода,— возразил
Мак-Нейл.
— Я не согласен с тем, что вообще когда-
либо существовал «первый»,— ответило Облако.
Мак-Нейл не понял этого замечания, но
Кингсли и Марлоу переглянулись, как бы говоря:
Юго, вон куда он гнет! Что бы сказали,
сторонники теории „взрывающейся вселенной"?»
— Обеспечив своих «потомков» такими
защитными средствами,— продолжало Облако,— мы
предоставляем им в остальном развиваться по
своему усмотрению. Здесь я должен пояснить
важное различие между нами и вами. Число
клеток в вашем мозге почти не изменяется с
момента рождения. Поэтому ваше развитие заключается
в том, что вы учитесь использовать наилучшим
образом мозг определенной емкости. В нашем
случае дело обстоит совершенно иначе. Мы можем
увеличивать свой мозг сколько угодно. При этом,
конечно, можно удалять или заменять
изношенные или испорченные части. Наше развитие
заключается, таким образом, и в развитии самого
мозга, и в том, что мы учимся использовать его
наилучшим образом для решения возникающих
перед нами проблем. Теперь вам должно быть
ясно, что наши «дети» начинают со сравнительно
простого устройства мозга; по мере того как мы
взрослеем, наш мозг становится все больше и
сложнее.
— Не могли ли бы вы описать так, чтобы нам
было понятно, как делаются новые части вашего
мозга?— спросил Мак-Нейл.
- - Думаю, что могу. Во-первых, я
изготовляю нужные сложные молекулы из химического
сырья, запасы которого у меня всегда под рукой.
Затем молекулы укладываются соответствующим
образом на поверхности твердого тела, образуя
«нервную структуру*- Материал твердого тела вы-
77
Рисунок В. Щапова
бирается такой, чтобы температура его плавления
не была слишком низкой — лед, например, не
подходит в данном случае — и чтобы он был
хорошим электрическим изолятором. Поверхность тела
также должна быть хорошо подготовлена, чтобы
прочно удержать на себе нервную структуру —
мозговое вещество, как вы бы сказали.
Конечно, самое трудное — конструирование
этой нервной структуры. Надо добиться, чтобы
новый мозг действовал как единое целое при
выполнении определенной задачи. Необходимо
также, чтобы этот новый узел не начинал работать
самопроизвольно, а ждал соответствующих
сигналов от остальных частей моего мозга. Новая
часть мозга может получать такие сигналы по
многим каналам. Точно так же выход новой части
имеет много связей со старой частью мозга. В
результате работа нового мозга может
контролироваться, и он включается в общую нервную сеть.
— У меня есть еще два вопроса,—сказал
Мак-Нейл.—Как вы перезаряжаете энергией
ваши нервные элементы? У человека для этого есгь
система кровообращения. Есть ли у вас что-либо
подобное этой системе?
Последовал ответ:
— Размер меняется в зависимости от того,
для какой цели служит данный элемент. Твердое
тело, на котором он строится, может быть от од-
ного-двух до нескольких сот метров размером.
Да, у меня есть нечто, подобное системе
кровообращения. Доставка нужных веществ
осуществляется потоком газа, который постоянно омывает
нервные элементы. Однако этот поток приводится
в движение не сердцем, а электромагнитным
насосом. Таким образом, этот насос имеет
неорганическую природу, поэтому при насаждении
нового очага жизни «родитель» обязательно
обеспечивает своего «потомка» таким насосом. Идущий от
иасоса газ захватывает питательные вещества,
затем проходит вблизи нервных элементов, которые
поглощают различные нужные для работы моего
мозга молекулы. Отработанные продукты
деятельности организма выделяются в этот же поток газа
и затем фильтруются в органе, подобном вашим
почкам. Поток очищенного газа поступает опять
в электромагнитный насос.
Чрезвычайно важно, что мое сердце, почки
и кровь имеют неорганическую природу. В
случае, если они перестают работать, ничего
страшного не происходит. Если мое «сердце»
отказывает, я просто переключаюсь на запасное, которое
держу всегда наготове. Если выходят из строя
мои «почки», я не умираю, как ваш композитор
Моцарт. Я опять-таки перехожу иа запасные
«почки». Возобновлять свою кровь я также могу
практически неограниченно.
Вскоре после этого Джо умолк.
— Самое потрясающее — то, насколько
общими оказываются принципиальные основы
жизни,— заявил Мак-Нейл.— Детали, конечно,
невероятно различны: газ вместо крови,
электромагнитное сердце и почки и так далее. Но общая
структура организма почти одинакова.
— И то, как он достраивает свой мозг, по-
моему, имеет что-то общее с программированием
для вычислительных машин,— сказал Лестер.—
Вы обратили внимание, Крис? Это было очень
похоже на составление новой подпрограммы.
— Я думаю, такое сходство не случайно.
Я как-то слышал, что коленный состав мухи очень
похож по своей конструкции на человеческий.
Почему? Да потому, что существует, видимо, только
одна хорошая конструкция коленного сустава.
Точно так же существуют какие-то единые
принципы, в соответствии с которыми может быть
построено разумное существо.
— Но почему вы думаете, что эти принципы
едины?—спросил Мак-Нейл у Кингсли.
— Мне трудно это объяснить, потому что это
78
уж очень похоже на выражение религиозного
чувства. Мы знаем, что Вселенная построена в
соответствии с некоторыми основными законами
природы, которые постигает или пытается постичь
наша наука. Мы склонны несколько зазнаваться,
когда, обозревая свои успехи в этой области, мы
говорим, что Вселенная построена логично с
нашей точки зрения. Это значит ставить телегу
впереди лошади. Не Вселенная построена логично с
нашей точки зрения; это мы, и наша логика,
развились в соответствии с логикой Вселенной.
Таким образом, можно сказать, что разумная жизнь
есть нечто, отражающее самую суть строения
Вселенной. Это относится и к нам и к Джо. Вот
почему у нас оказывается так много общего, вот
почему в разговоре у нас обнаруживается нечто
вроде общих интересов, несмотря на столь
гигантское различие в деталях нашего строения. Ибо в
основных чертах как мы, так и Джо построены
по принципам, которые следуют из общего
устройства Вселенной.
— Эти ублюдки-политики все еще пытаются
пробиться. Проклятье, пойду выключу
лампочки,— сказал Лестер.
Он направился к панели с лампочками,
вспышки которых извещали о поступлении
разнообразных сообщений. Минуту спустя он вернулся
на свое место, сотрясаясь от хохота.
— Это просто великолепно!— еле выдавил он
из себя.— Я забыл прекратить трансляцию
нашего разговора на десятисантиметровых волнах. Они
слышали все, что мы говорили — все наши
уговоры, насчет «технических причин» и все
остальное. Сейчас они, конечно, в ярости. Теперь, по-
моему, каша заварилась.
Никто, казалось, не знал, что делать.
Наконец, Кингсли подошел к пульту. Он переключил
несколько тумблеров и сказал в микрофон:
— Нортонстоу. Говорит Кингсли. Если есть
какие-либо сообщения, передавайте.
В динамике послышался раздраженный
голос:
— А, наконец-то Нортонстоу. Мы уже три
часа пытаемся с вами связаться.
— .Кто это говорит?
— Громер, министр обороны США. Должен
вам сообщить, что вы говорите с весьма
рассерженным человеком, мистер Киигсли. Я жду
объяснений вашего возмутительного поведения
сегодня.
— В таком случае, боюсь, что вам придется
еще подождать. Даю вам тридцать секунд, и если
за это время ваши высказывания не станут
убедительнее, я отключаюсь опять.
Голос стал спокойнее, но более угрожающим:
— Мистер Кингсли, я уже наслышан о
вашем невыносимом характере, <но сам сталкиваюсь
с этим в первый раз. К вашему сведению, я
намерен принять меры, чтобы это был и последний
раз. Это не угроза. Я просто сообщаю вам со всей
ответственностью, что очень скоро вы будете
удалены из Нортонстоу. Вопрос о том, куда вы
будете удалены, я предоставляю вашему собственному
воображению.
— Я хотел бы отметить, мистер Громер, что
в своих планах относительно меня, вы не учли
одного очень важного обстоятельства.
— Какого именно, смею спросить?
— Что в моей власти вообще уничтожить
весь американский материк. Если вы
сомневаетесь в правдивости моих слов, спросите своих
астрономов, что случилось с Луной вечером
седьмого августа. Вам следовало бы также принять во
внимание, что мне потребуется значительно
меньше пяти минут, чтобы привести в исполнение эту
угрозу.
Кингсли переключил несколько тумблеров, и
лампочки на контрольной панели погасли. Map-
лоу был бледен; на лбу и над верхней губой у
него выступили капельки пота.
— Это вы сделали нехорошо, Крис; нет,
нехорошо,— сказал он.
Кингсли смутился.
— Извините, Джофф. У меня совершенно
вылетело из головы, что вы американец. Еще раз
прошу прощенья за это, но имейте в виду, что я
ответил бы то же самое и Лондону, и Москве и
вообще кому угодно.
Марлоу покачал головой.
— Вы неправильно меня поняли, Крис. Я
возражал не потому, что Америка — моя страна.
В любом случае я прекрасно понимаю, что вы
просто запугиваете его. Меня беспокоит, что
такие угрозы могут иметь чертовски опасные
последствия.
— Чепуха. Не стоит делать из мухи слона.
Газеты приучили вас думать, что политики —
важные персоны, и вы никак не можете от этого
отвыкнуть. Они, вероятно, понимают, что я
пытаюсь их запугать, но пока остается хоть какая-
то вероятность, что я могу осуществить свою
угрозу, они не пустят в ход политику сильной
руки. Вот увидите.
Однако прав был Марлоу, а не Кингсли. Это
показали дальнейшие события.
Перевод с английского
проф. Д. Л. ФРАНК-КА МЕИЕЦКОГО
79
jq
X
ш
3"
>|
X
JQ
X
эе
ш
ш
о.
М
X
с?
о.
О
<
о.
О
ш
<
с;
МОЛЕКУЛ
На протяжении более ста лет биохимики многих стран мира посвящали свои
усипия выяснению природы белков. Много сделали в этой области и русские ученые,
среди которых почетное место занимают такие исследователи, как И. М. Сеченов,
М. В. Ненцкий и другие.
В настоящее время в результате применения точнейших методов исследования,
и в первую очередь — рентгеноструктурного анализа, стало возможным определить
пространственное расположение атомов в молекуле гемоглобина — важнейшего
пигмента, ведающего снабжением организма кислородом. Американский биохимик
лауреат Нобелевской премии М. Ф. Перутц — один из пионеров изучения
пространственной структуры этого бепка. Благодаря исследованиям М. Ф. Перутца и группы его
сотрудников стала известна структура молекулы гемоглобина, прояснились многие
процессы, происходящие в кровеносных сосудах живого организма.
О том, насколько была сложна и трудна эта работа, можно составить
впечатление по высказыванию английского физика У.-Л. Брэгга: «При изучении
кристаллического гемоглобина пошади исследователям пришлось замерить 28 тысяч рефлексов,
а при их обработке, дпя построения полного трехмерного патерсоновского синтеза,
число слагаемых во всех грех суммах составило 1,21 X Ю10. Несмотря на большое
количество вычиспитепьных и механических усовершенствований, сокращающих эту
работу, промер 28 тысяч рефпексов и вычиспение всех тройных сумм дпя одного
кристалла гемоглобина потребовали четырех лет. Когда эта работа планировалась,
не быпо никаких гарантий, что ее резупьтаты оправдают впоженные усипия,— но,
к счастью, эти опасения не оправдались».
Описанию этих работ и посвяшена предлагаемая статья из журнала «Scientific
American».
Доктор биологических наук П. А. КОРЖУЕВ
В 1937 году я избрал темой
сво'его исследования
рентгенографический анализ гемоглобина —
белка крови, переносящего
кислород. К счастью, рецензенты моей
докторской диссертации (я был
тфгда аспирантом Кембриджского
университета) не требовали
определения его структуры, 1иначе я
рисковал бы оставаться
аспирантом в течение... двадцати трех лет.
Проблема определения места
каждого атома в этой гигантской
молекуле и до сих пор еще не
решена окончательно, но
структура ее уже расшифрована
достаточно детально, чтобы дать
представление о запутанном
трехмерном строении каждой из
четырех составляющих ее
аминокислотных цепей и расположении
четырех пигментных групп —
пунктов присоединения
кислорода.
Каждая из четырех цепей
гемоглобина напоминает по
форме цепочку миоглобина —
мышечного белка, переносчика
кислорода. Сопоставление структур
этих двух белков позволяет с
помощью физических методов
достаточно точно определить, где
располагается каждый
аминокислотный остаток в гемоглобине по
отношению к изгибам и
поворотам его цепей. Однако с помощью
одних лишь физических методов
нельзя установить, какая из
двадцати различных аминокислот
занимает данное место. Это
достигается химическим анализом.
Суммарные результаты этих
двух различных методов
исследования позволяют представить
себе общую четкую картину
строения молекулы гемоглобина.
По своей функции
гемоглобин не является кислородным
резервуаром типа молекулярного
легкого. Две из четырех цепочек
в молекуле меняют свое
положение в пространстве, так что
просвет между ними сужается с
присоединением к гемоглобину
кислорода и расширяется после его
отщепления. Данные о том, что
химическая активность
гемоглобина и других белков связана с
изменениями в их структуре, были
известны и раньше, но нами
впервые продемонстрирована природа
этих изменений. Они позволили
считать молекулу гемоглобина как
80
ЕМОГЛОБИНА
М. Ф. ПЕРУТЦ
бы дышащей. Но казалось
парадоксальным, что расширение
молекулы происходит при
отсутствии кислорода, а не тогда, когда
он связан с гемоглобином.
За два года до моего
'Поступления в аспирантуру профессор
Джон Бернал и Дороти Кроуфут-
Хотчкин получили первые рентге-
нодифракционные картины
кристаллов белка и установили, что
белковые молекулы, (несмотря на
большие размерь^ имеют
высокоорганизованную структуру. В то
время это открытие 'вызвало'
сенсацию, так как к белкам еще
всюду относились как к
коллоидам с неопределенной
структурой. В конце тридцатых годов
значение нуклеиновых кислот еще
предстояло открыть; в
соответствии с тем, чему я учился,
«секрет жизни» казался мне
заключенным в структуре белков. Из
всех методов, доступных физике
и химии, лишь рентгенокристал-
лография давала единственный
шанс, правда, довольно слабый,
определить эту структуру...
Когда я избрал темой
диссертации рентгенографический
анализ гемоглобина, мои друзья-
студвнты смотрели на меня с
сочувственной улыбкой. Ведь
наиболее сложным из органических
Модель молекулы гемоглобина,
сконструированная в результате реитгено
дифракционных исследований. Вид сверху
(верхний рисунок) и сбоку (нижний рисунок).
Рисунки сделаны с модели, построенной
М- Ф. Перутцом и его сотрудниками.
Блоки неправильной формы показывают
электронную плотность на различных
уровнях молекулы гемоглобина. Молекула
состоит из четырех субъединиц: двух
идентичных альфа- (светлые блоки) и бета-
цепей ({темные блоки). Буквами N на
верхнем рисунке обозначены концевые
аминогруппы альфа-цепей; буквами С —
концевые карбоксильные группы. В
складках каждой цепи «упрятан» цветной диск.
Это — гем, железосодержащая структура,
соединяющаяся с кислородом.
6 «Химия и жизнь», № 3
81
веществ, структура которых
определялась тогда
рентгенографическим методом, был краситель
фталоцианин, молекула которого
содержит 5В атомов. Как же я
мог надеяться определить
положение каждого из тысяч атомов
в молекуле гемоглобина?
ФУНКЦИЯ
ГЕМОГЛОБИНА
Гемоглобин — основной
компонент красных кровяных
шариков {эритроцитов), переносящих
■по артериям кислород от легких
к тканям, способствующий
переносу углекислого газа по венам
обратно к легким. Один
эритроцит содержит около 280
миллионов молекул гемоглобина.
Каждая молекула в 64 с половиной
тысячи раз тяжелее атома
водорода и состоит примерно из
10 тысяч атомов водорода,
углерода, азота, кислорода и серы
плюс четыре атома железа,
которые в данном случае более
важны, чем все остальные. Каждый
атом железа расположен в
центре группы aTOMOBf образующих
пигмент, называемый гемом,
который придает крови ее красный
цвет -и .регулирует ее способность
соединяться с кислородом.
Каждый гем окружен одной из
четырех аминокислотных цепей,
которые вместе составляют белковую
часть молекулы — глобин. Четыре
цепи глобина состоят из двух
одинаковых пар, так называемых
альфа- и бета-цепей. Все четыре
цепи вместе содержат 574
аминокислотных остатка.
В отсутствие переносчика
кислорода 1 литр артериальной
крови может растворить и перенести
не более 3 миллилитров
кислорода. Гемоглобин повышает эту
способность в 70 раз. Без него
большие животные не смогли бы
получать достаточного для своего
существования количества
кислорода. Кроме того, более 90
процентов транспортируемой углекис-
Рентгенодифракционный снимок, полученный от одного кристалла
гемоглобина, который вращался во время съемки. Электроны,
сгруппированные вокруг центров атомов в кристалле, рассеивают
падающие иа него рентгеновские лучи, образуя симметрично
расположенные пятна. Пятиа, находящиеся на равных расстояниях
от центра и противоположные друг другу, имеют одинаковую
плотность
лоты переносится по венам
благодаря гемоглобину.
Каждый из четырех атомов
железа в молекуле гемоглобина
может связать одну молекулу {то
есть два атома) кислорода. Эта
реакция обратима — в том
смысле, что кислород забирается там,
где его много (в легких) и
освобождается там, где в нем
ощущается потребность {в тканях).
Она сопровождается изменением
цвета: гемоглобин, содержащий
кислород известный как окси-
гемоглобин, окрашивает
артериальную кровь в алый цвет;
восстановленный, или
освобожденный от кислорода, гемоглобин
придает венозной крови
.пурпурный оттенок. В данном случае
термин «восстановленный» для
бескислородной формы
гемоглобина неудачен, потому что слово
«восстановленный» означает для
химика, что атом или группа
атомов присоединяют электроны. На
самом же деле атомы железа
как в восстановленном, так и в
окисленном гемоглобине имеют
одинаковое число электронов и
находятся в виде двухвалентных
или «ферро»-ионов.
Они окисляются до
трехвалентных, или «ферри»-ионов, при
определенных болезнях крови и
действии некоторых ядов. В этом
случае гемоглобин приобретает
бурую окраску и в такой форме
известен как метгемоглобин, или
ферригемоглобин.
«Ферро»-ионы железа
обладают способностью связывать
молекулярный кислород только при
условии, если гем соединен
с глобином. Сам по себе гем не
связывает кислорода; эта реакция
становится возможной лишь в
специфической химической среде,
создаваемой глобином. В
сочетании же с другими белками,
такими как ферменты пероксидаза и
каталаза, тот же гем может обна-
82
суживать совершенно другие
химические свойства.
Однако функция глобина этим
не ограничивается. Благодаря ему
происходит физиологически
выгодное взаимодействие четырех
атомов железа внутри каждой
молекулы. Соединение любых трех
атомов железа с кислородом
ускоряет присоединение
кислорода к четвертому; точно так же
освобождение кислорода тремя
атомами заставляет четвертый
атом быстрее освободиться от
своего кислорода.
Я уже упоминал, что
гемоглобин играет также важную роль
в переносе углекислого газа от
тканей к легким. Этот газ не
переносится атомами железа, и только
часть его связывается
непосредственно с глобином; наибольшее
его количество поглощается
эритроцитами и жидкостью крови —
в форме бикарбоната.
Исчезновение кислотной группы у каждой
молекулы гемоглобина, отдающей
кислород, облегчает перенос
бикарбоната. Когда гемоглобин
вновь захватывает кислород из
легких эти кислотные группы
опять образуются, начиная ряд
химических реакций,
стимулирующих освобождение углекислого
газа из тканей. Напротив,
присутствие бикарбоната и молочной
кислоты в тканях ускоряет
освобождение кислорода.
Дыхание кажется нам таким
простым; но, однако, это
элементарное проявление жизни
осуществляется благодаря
взаимодействию многих видов атомов
в гигантской молекуле
колоссальной сложности. Выяснение
структуры молекулы открыло бы нам
не только ее внешний в-ид, но и
функцию.
ПРИНЦИП
РЕНТГЕНОГРАФИЧЕСКОГО
АНАЛИЗА
Рентгеноструктурный анализ
белков иногда считается
труднодоступным разделом науки,
понятным только специалистам, но
идеи, лежащие в основе этой
работы, настолько просты, что
многие физики находят их просто
скучными. Кристаллы
гемоглобина и других белков содержат
много воды и, подобно всем
живым тканям, теряют
регулярность своей структуры при
высушивании. Чтобы сохранить эту
регулярность во время
рентгенографического анализа, кристаллы
помещают в маленькие
стеклянные капилляры, где они остаются
влажными. На один кристалл
направляют узкий пучок
рентгеновых лучей одной длины волны.
Если кристалл неподвижен, то на
фотопленке, находящейся сзади
него, будут зафиксированы пятна,
ложащиеся эллипсами; если же
кристалл вращать в
определенном направлении, то эти «пятна
возникают в узлах правильной ре-
шетки^ зависящей от
расположения молекул в кристалле. Каждое
пятно имеет характерную
«интенсивность, зависящую от
расположения атомов внутри молекулы.
Пятна, расположенные
симметрично, но по разные стороны от
центра рентгенограммы, имеют
одинаковую степень интенсивности.
Для расшифровки
рентгенограмм был изготовлен простой
оптический прибор, имеющий экран
с двумя отверстиями в точках, где
находятся симметричные пятна.
Интерференционные полосы,
полученные при дифракции света
через эти два отверстия,
показаны ниже на рисунке.
ФАЗОВАЯ
ПРОБЛЕМА
Изображение атомной струн*
туры кристалла получают двумя
путями: поочередным печатанием
всех интерференционных картин
на один и тот же кадр или
наложением всех интерференционных
картин и получением общего
отпечатка на одном кадре. При
этом возникает неизбежная
трудность. Для того чтобы
изображение не искажалось, каждая
группа пятен на рентгенограмме
должна быть расположена
правильно по отношению к
некоторой произвольно выбранной
общей начальной точке.
Расстояние максимума волны от
начальной точки называется фазой.
Накладывая (интерференционны©
картины, можно получить
почти любую картину структуры при
• ••••••••••
• ••••••••••
5 4 3 2 10 12
К
•апшшш
uvmm
Рентгенографическое изображение можно объяснить с помощью
специального оптического устройства для получения интерференционных картин
пятен иа рентгенограмме (рисунок справа). Каждая пара симметрично
расположенных пятеи дает характерные для них интерференционные полосы.
Таким образом, пятна, обозначенные 2,2 и 2,2, дают полосы, обозначенные
2,2. Двухмерное изображение атомной структуры кристалла может быть
получено, если все интерференционные картины будут одновременно
напечатаны на одном и том же листе фотобумаги. Но для этого раньше нужно
решить фазовую проблему (см. ниже).
6* 83
соответствующем произвольном
выборе фаз. Сама по себе
рентгенографическая картина дает нам
только амплитуды, но не фазы
волн полученных от каждой пары
пятен. Это значит, что половина
информации для получения
изображения отсутствует.
Вследствие этой
недостаточности информации
дифракционная картина кристаллов
уподобляется шифру без ключа.
Проводя годы в попытках измерить
интенсивность нескольких тысяч
пятен в дифракционных
рентгенограммах гемоглобина, я
«испытывал танталовы муки, находясь в
положении исследователя,
окруженного «абором таблиц,
исписанных неизвестными письменами.
В течение некоторого времени
У.-Л. Брэгг и я без особого
успеха пытались разработать метод
расшифровки фаз. Окончательное
решение пришло в 1953 году,
когда я открыл, что метод,
(найденный для более простых
структур, может быть также
использован для белков.
Суть этого метода в том что
молекулу вещества несколько
видоизменяют путем введения в нее
тяжелых атомов — таких как
атомы ртути,— для определения их
положения в структуре молекулы.
Присутствие тяжелого атома
вызывает заметные изменения в
дифракционной картине и дает
возможность шолучить большую
информацию о фазах. По разнице
амплитуд волн, соответствующих
отражению белка с тяжелым
атомом и без него, для каждой
группы волн можно определить
расстояние гребня волны от тяжелого
атома для каждой
интерференционной полосы. Таким образом,
благодаря тяжелому атому,
определяющему общую начальную
точку, представляется возможность
измерить величину фазы, как
показано на рисунке (стр. 85, слева),
где тяжелый атом обозначен Hi.
Но эксперимент еще не говорит
нам, в каком направлении
измеряется фаза....
На том же рисунке показано,
что если тяжелый атом Нг ввести
в молекуле в другое положение,
чем Hi, то он уменьшает
амплитуду волны, рассеиваемой белком.
Степень этого уменьшения
позволяет измерить расстояние
гребня волны от Нг- Можно видеть,
что этот гребень должен быть
впереди Н^ другими словами,
расстояние его от Hi не может
совпадать с расстоянием от Нг.
Окончательный ответ зависит от
знания длины и направления
линии, соединяющей Нг и Hj. Эти
величины возможно рассчитать
математически.
Метод тяжелых атомов
можно применить для .изучения
гемоглобина, присоединяя атом ртути
к атомам серы аминокислоты
цистеина. Он оправдывает себя,
однако, только в том случае, если
такое присоединение не
изменяет структуру молекул
гемоглобина и порядок ее расположения
в кристалле. Когда я впервые
попытался применить фазовый
метод, то не был уверен, что мне
удастся полностью удовлетворить
этим строгим требованиям. И
когда я проводил первую
рентгенографию меркурированного
(связанного с атомом ртути)
гемоглобина, настроение у меня
колебалось между надеждами на
немедленный успех и мрачными
предчувствиями провала. Когда же
дифракционные пятна оказались
точно в том положении, что и в
немеркурированном белке, лишь
с несколько иной
интенсивностью— то есть именно так, как
я надеялся,— я ворвался в
комнату Брэгга в радостном
возбуждении, уверенный, что скоро уже
будет определена структура и
гемоглобина, и многих других
белков. Брэгг разделил мою
радость; ии один из нас тогда не
предвидел тех огромных
технических трудностей, которые
встанут на нашем пути в
последующие пять лет.
РЕШЕНИЕ
ПРОБЛЕМЫ
* СТРУКТУРЫ
Решив, по крайней мере в
принципе, фазовую проблему, мы
задались целью построить
структурное изображение молекулы
гемоглобина на основе наших
рентгенографических данных.
Количество пятен на
рентгенограммах белковых кристаллов
доходит до десятков тысяч.
Чтобы правильно определить фазу
каждого пятна и его
интенсивность, нужно было сделать
несколько точных измерений. Затем
в результаты надо внести
поправки на различные геометрические
факторы и использовать их для
построения изображения,
накладывая десятки тысяч волн. В
окончательном расчете приходилось
складывать или вычитать десятки
миллионов чисел. До появления
счетно-вычислительных устройств
такая работа была бы совершенно
невозможной.
В то время как я сражался
с разного рода техническими
О' 90 та" 2/и-
Ш ШШШ/.
I
L_ Фазовая проблема возникает вследствие того, что пятна на рентгенограмме
не указывают, какие фазы должны иметь все интерференционные картины
по отношению к произвольно выбранной общей начальной точке. На этом
рисунке четыре идентичные интерференционные картины имеют разные
фазы относительно начальной точки в левом верхнем углу. Фаза означает
расстояние гребня волны от начальной точки, измеренное в градусах.
Длина одной волны — 360 градусов
84
Метод введения тяжелого атома дает сведения о фазах, изменяя
интенсивности пятен на рентгенограмме
а — рассеяние синусоидальной волны чрезвычайно упрощенным белком
(треугольник из трех атомов) дает амплитуду и фазу одной группы пятен;
Ь и с — после введения тяжелых атомов Н| и Кг в различные участки
белка амплитуда и фаза волны изменяются. Тяжелые атомы могут служить
начальными точками для измерения величины фаз (Pi и Р_.) волн,
рассеянных неизмененным белком. Расстояние между Hi и И2 должно быть точно
известно
трудностями, Д. Кендрью
успешно применил метод тяжелых
атомов для изучения структуры мио-
глобина — белка, по строению
близкого к гемоглобину, но
имеющего значительно более простую
структуру. В 1957 году первая
трехмерная модель миоглобина
была лостроена.
Это был триумф, но
одновременно с оттенком разочарования.
Возможно ли, что поиски истины
могли лривести к такому
безобразному предмету, более
похожему на клубок каких-то
внутренностей? Неужели, отыскивая
золотой самородок, мы нашли
свинцовую глыбу? Но чем
внимательнее мы всматривались в
изображение миоглобина, тем
целесообразнее, гармоничнее
представлялся он лам. Когда в
последующие годы Кендрью и его
сотрудники увеличили
разрешающую способность рентгенострук-
турного метода, они убедились,
что некоторые внутренние при-
Для построения пространственного
изображения молекулы белка были использованы
трехмерные дифракционные картины
(интерференционные плоскости в
пространстве). Их строили для пар симметрично
расположенных в пространстве пятен.
Координаты двух пятен обозначаются
соответственно h, h, I и h, h, i. Каждой паре
пятен соответствует трехмерная
интерференционная картина, как это показано иа
рисунке. Чтобы построить изображение
молекулы, необходимо наложить Друг на
друга интерференционные плоскости в
пространстве с учетом фаз для тысяч пар
пятен...
чины странной формы этой
молекулы выявляются сами гобой.
Форма не была случайной, она
была фундаментальным
продуктом природы, вероятно, общим
для миоглобина и гемоглобина,
во всяком случае у позвоночных.
Летом 1959 года, почти через
22 года после того, как я
получил первую рентгенограмму
гемоглобина, мы смогли, наконец,
построить трехмерную карту
электронной плотности гемоглобина
с разрешающей способностью
5f5 ангстрем, подобную той,
которая на два года раньше была
получена для миоглобина. И как
только цифры со счетчика были
Гг^З^П
85
перенесены на контурную карту,
мы убедились в том, что каждая
из четырех цепей гемоглобина по
форме очень напоминает
единственную цепь миоглобина. Бета-
цепь и /лиоглобин были вообще
идентичны, а альфа-цепь
отличалась от них лишь более коротким
поперечником одной маленькой
петли.
Миоглобин был экстрагирован
Кендрью из мышц кашалота.
Гемоглобин был получен из крови
лошадей. Позднейшие
исследования показали, что миоглобин
тюленя и лошади, гемоглобин
человека и коровы имеют сходное
строение.
На первый взгляд случайная,
беспорядочная складчатость цепи
оказалась целесообразной,
удобной для удержания гема в
положении, облегчающем ему
перенос кислорода. Гем лежит в
складке цепи так, что только две его
кислотные группы находятся на
(поверхности молекулы и могут
вступать в контакт с окружающей
молекулу водой. Атомы железа
в геме связаны с атомами азота
аминокислоты гистидина.
Через некоторое время я
построил модели альфа- .и
бета-цепей гемоглобина и убедился в
том, что они соответствуют
атомной картине, как и цепь
миоглобина. Если две белковые цепи
похожи по внешнему виду, то
можно надеяться, что и состав их
окажется также сходным. На
языке химии белка это означает, что
20 различных видов аминокислот
в миоглобине и гемоглобине всех
позвоночных содержатся
приблизительно в одинаковой пропорции
и порядок их расположения тоже
примерно одинаков. Чтобы
установить справедливость этого
утверждения, мы проделали
множество химических анализов.
Но совершенно неожиданным
оказалось то, что белки с почти
одинаковой структурой и
функцией резко различаются
последовательностью своих аминокислот.
Какой же механизм
заставлял различные цепи складываться
одним и тем же образом?
ВОЗМОЖНЫЙ
МЕХАНИЗМ
СКЛАДЫВАНИЯ
Что придает какой-то одной
конфигурации большую
стабильность, чем всем другим?
Единственное объяснение, к которому
мы можем пока обратиться,
касается распределения так
называемых полярных и неполярных
аминокислот между поверхностью
'И глубокими слоями молекулы.
Некоторые аминокислоты,
такие как глютаминовая кислота и
лизин, .имеют боковые группы
атомов с положительным или
отрицательным зарядом, которые
активно взаимодействуют с
окружающими молекулами воды.
Боковые группы таких аминокислот,
как глютамин или тирозин, в
конечном счете электронейтральны,,
однако содержат атомы азота
.или кислорода, у которых
разноименные заряды достаточно
велики, чтобы образовать диполь.
Они тоже притягивают воду, но
не так активно, как заряженные
группы. Это притяжение
происходит благодаря образованию
разноименных зарядов в самой
молекуле воды, что делает ее,
в свою очередь, диполярной.
Соединяясь с электрически
заряженными группами или любыми
другими диполями, водные молекулы
уменьшают до минимума
напряженность электрического поля
вокруг этих групп и
стабилизируют всю структуру в результате
снижения количества так
называемой свободной энергии.
Боковые группы других
аминокислот, таких как лейцин и фе-
нилаланин, содержат только
углеродные и водородные атомы.
Будучи электронейтральными и
Молакулэ миоглобина в том виде, в котором она впервые была сконструирована
Д. Кеидрью и его сотрудниками в 1957 г. Она имела этот весьма отталкивающий вид,
напоминающий внутренности. Нолбасовидные сплетения отражают ход аминокислотной
цепи в молекуле. Темное, дисковидное образование (расположенное здесь ие совсем
правильно) представляет собой гем. Более детальное и точное изображение миоглобина
в другой проекции даио иа стр. 88
86
Цепи гемоглобина, альфа-цепь — слева
и бета-цепь — справа, выведенные из
модели, построенной автором и его
сотрудниками. Прерывистые линии
показывают ход центральной цепи.
Частично виден гем (цветной диск),
прикрытый моделью
лишь слабо диполярными, эти
группы отталкивают воду
подобно воску. Причина этого
отталкивания странна и загадочна.
Группы, которые называются
углеводородными, имеют тенденцию
приводить хаотичность молекул
водь» в строгий порядок, такой,
как в кристалле льда. Это
упорядочение уменьшает стабильность
системы. Физики в таких случаях
говорят об уменьшении энтропии,
которая служит мерой
беспорядка в системе. Таким образом,
сила, заставляющая боковые
группы «отворачиваться» от воды >и
соединяться друг с другом,— это
анархическое сопротивление
молекул воды тому
упорядочивающему влиянию, которое
оказывают <на них эти группы.
Наши модели показывают,
что боковые группы, обладающие
наибольшим зарядом 1или
степенью диполярности,
располагаются на поверхности молекулы,
взаимодействуя с водой.
Неполярные группы либо заключены
внутри молекулы, либо таким
образом вклиниваются в ее
углубление, что не могут
контактировать с водой. Говоря физическим
языком, боковые группы
распределяются так, чтобы по
возможности уменьшить свободную
энергию <и увеличить энтропию в
молекулах белка и окружающей
воды...
Сейчас еще преждевременно
говорить о том, существует ли
единственное объяснение той
силы, которая из всех возможных
конфигураций белковой цепи
избирательно стабилизирует только
одну. Известно, что ло крайней
мере одна аминокислота
вследствие своей изломанной
конфигурации, нарушает плавность цепи,
заставляя ее образовывать угол
в том месте, где она находится.
Цепи в гемоглобине и миоглоби-
не у всех видов имеют несколько
углов, «но только в одном из них,
а именно в 36 положении в бета-
цепи .гемоглобина <и в 37— в мио-
глобине, всегда присутствует
пролин. Во всех других углах
его присутствие необязательно
и определяется видом
животного.
Так как последовательность
аминокислот в белках определить
легче, чем их пространственную
структуру, то задача облегчилась
бы, если бы мы могли вывести
эту структуру, зная
аминокислотную последовательность. В
принципе, вероятно, чтобы добиться
этого, достаточно знать
межатомные силы и -путь, по которому эти
атомы группируются. На деле же
проблема эта чрезвычайно
усложняется тем, что существует
огромное количество (путей, по которым
может идти [закручивание
длинной белковой цепи.
СОЕДИНЕНИЕ
ЧЕТЫРЕХ ЦЕПЕЙ
Если гемоглобин состоит из
четырех одинаковых цепей, то
кристаллограф может nafleflTbCflf
что они лежат по углам
правильного тетраэдра.
В результате этого
образуется почти сферическая молекула
размером 64 X 55 X 50 ангстрем.
Кажется удивительным, что
четыре предмета такой неправильной
формы могут так точно подходить
один к другому. Но если
механизм складывания белковой части
молекулы удалось предсказать,
то положение гемов в молекуле
оксигемоглобина оказалось
довольно неожиданным. Исходя из
их химического взаимодействия,
априорно можно было бы
предполагать, что они расположены
рядом. В действительности же
оказалось, что каждый гем лежит
на поверхности молекулы как бы
в отдельном «пакете», «не
подозревая» о существовании своих
партнеров. Отсюда видно, что
одно из наиболее важных
физиологических свойств гемоглобина
не может быть объяснено только
его структурой.
В 1937 году Ф. Гурвиц нашел
ключ к молекулярному
объяснению физиологического действия
гемоглобина. Он поставил
кристаллы оксигемоглобина, имею-
87
Бета-цепь (слева) и миоглобин (справа). Цветными кружками обозначены пролиновые остатки, на долю
которых приходится 10со всех аминокислот; их положение часто совпадает с изломами цепи. Кружки
обозначающие Hg, показывают места, где атомы ртути могут быть присоединены к атомам серы
О Кислород
ф Азот
) ф Углерод
о о Водород
Излом молекулы гемоглобина, наблюдающийся там, где остаток аминокислоты пролина (цветной)
расположен между двумя сегментами спирали в бета-цепи; изображен только скелет цепи. Все атомы водорода
и боковые ветви аминокислот, за исключением пролина, удалены
88
щие форму игл, в холодильник.
Когда через несколько «едель он
достал эту взвесь, то увидел, что
кислород был поглощен
бактериями и вместо красных 1игл
появились фиолетовые
гексагональные пластинки — кристаллы
восстановленного гемоглобина. Во
время исследования этих
кристаллов под микроскопом, между
-предметным и покровным
стеклами проник кислород, вызывая на
глазах распад фиолетовых
пластинок и образование красных
игл оксигемоглобина. Это
превращение убедило Гурвица в том,
что реакция гемоглобина с
кислородом должна сопровождаться
изменением структуры молекулы
гемоглобина. Эти наблюдения и
загадка структуры оксигемоглобина
настолько заинтересовали меня,
что я предложил аспирантке
Хилари Мюрхед попробовать
применить метод рентгеноструктурного
анализа с низкой разрешающей
способностью для изучения
структуры восстановленной формы
гемоглобина.
Мюрхед успешно решила эту
сложную задачу. Сделанные ею
карты электронной плотности
показали нам два вида структурных
изменений: изменение в
складчатости одной цепи и нарушение
взаимного расположения цепей.
Группа ученых в
Кембриджском университете доказала, что
это изменение в окисленной
форме гемоглобина происходило
после того, как три из четыре*
атомов железа соединялись с кис*
лородом. Это в несколько сот раз
ускоряло связывание четвертого
атома железа с кислородом...
Атомный механизм
перемещения бета-цепей пока еще не
выяснен. Наш рентгеноструктур-
ный анализ еще не достиг
разрешающей способности,
необходимой для их рассмотрения, и мне
кажется, что до тех пор, пока мы
не получим структур
восстановленного гемоглобина и
оксигемоглобина на атомном уровне, мы
не сможем до конца разобраться
в этом загадочном явлении.
Сокращенный перевод
с английского М. КАНДРОРА
«...Мы познакомились с
сахаром как веществом химически-
сложным, состоящим из трех
элементов;, сернистая ртуть
(киноварь) и сернистое железо
представляют химически-сложные
вещества, заключающие по две
элементарные составные части...
Но что же такое
элементарные вещества? Элементарны ли,
однородны ли они действительно,
по самой сущности своей, или все
дело заключается в неизвестности
тех условий, при которых эти так
называемые элементы могли бы,
в свою очередь, быть разложены?
Вопрос этот остается без ответа.
Весьма возможно, что многие из
наших элементов окажутся со
временем веществами химически
сложными, но если они и сложны,
то все-таки смело можно утверж-
х
<
X
ш
О
X
г
и
и
<
с;
X
ш
с;
и
<
X
«ЦЕЛИ НЕ СТОЛЬ
ХИМЕРИ
Еще в конце прошлого века многим ученым казалось,
что слово «атом» следует понимать буквально («атом» — по-
гречески «неделимый»), что за атомами навсегда сохранится
привилегия при любых обстоятельствах оставаться
неизменными.
Знаменитый английский физик Максвелл писал: «Каковы
бы ни были катастрофы в небесных пространствах, в
отдаленном будущем, или в настоящее время, каковы бы ни были
разрушения старых миров и рождение из их обломков новых,
атомы, из которых построены эти миры — основные камни
мироздания — не изменяются ни в своих размерах, ни в
своих свойствах. Сегодня, как и в момент творческого акта, они
совершенны в числе, мере и весе». Он же говорил: «...теория,
с которой мы до такой степени освоились, известная под
названием эволюционной теории, не может быть применима
к атомам».
Однако многим современникам Максвелла казалось
странным, что в развивающемся, эволюционирующем мире
могут существовать неизменные кирпичи мироздания.
Странным казалось и то, что химические элементы ничем не
связаны друг с другом, в то время как естествознание выявляет
все новые и новые доказательства единства мира. Одним из
таких ученых был создатель теории строения органических
соединений Александр Михайлович Бутлеров.
В 1877 году в журнале «Свет» была напечатана его статья
«Химические явления», в которой А. М. Бутлеров делился с
читателем мыслями о природе атомов и элементов.
Мы .публикуем отрывки из этой статьи-
«ЦЕЛИ НЕ СТОЛЬ
ХИМЕРИЧЕСКИЕ...»
89
дать, что сложность эта — другого,
так сказать, высшего порядка, чем
сложность веществ, известных
ныне за химически-сложные. Те
влияния, л од которыми более или
менее легко обнаруживается эта
обыкновенная сложность -и
происходят разложения, «не действуют
на элементы, не выделяют из них
разнородных составных частей.
Оставаясь строго ъ л редел ах
факта, наука зовет элементами те
вещества, которые не могли быть
до сих пор разложены никакими
известными нам средствами...
Точное знание
останавливается здесь на факте, но это не
значит, чтобы его представители
должны были отказываться от
всякой попытки предполагать,
догадываться. Без предположений,
руководящих в исследовании,
немыслим стройный прогресс в
собирании фактического материала,
но беда, когда -исследователь
перестает замечать границу между
своими предположениями и
фактом и принимает предположение
за реальную истину, или — что
еще хуже — в угоду своим
предположениям не замечает фактов.
Так, законны и небесполезны
догадки о натуре элементов, лишь
бы помнить при этом, что
вращаемся в-не области фактического
знания. В области догадок —
перевес на стороне того, что
большинство наших элементов
сложно. Трудно думать, чтобы для
разнообразия вещества в природе
нужно было так много элементов,
когда везде и всюду мы видим —
и видим тем яснее, чем глубже
проникают наши знания,— что
•бесконечное разнообразие
явлений сводится к малому числу
причин. Притом мы знаем
фактически, что из сравнительно малого
числа элементов может возникать
почти бесконечное разнообразие
химически-сложных тел. Далее,
между различными элементами
мы находим некоторые взаимные
отношения, напоминающие то,
что наблюдается над сложными
ХОТИТЕ
В этом номере журнала мы
предлагаем вам попробовать
ответить на несколько вопросов.
И не спешите заглядывать в
ответ — представьте себе, что
экзамен уже начался...
Материалы подготовлены
кандидатом химических
наук
С. И- ДРАКИНЫМ
1. Какое неорганическое соединение при
обычной температуре не является ни газом, ни
жидкостью, ни твердым веществом?
2. Каким образом, не прибегая к действию
реактивов, из медного купороса и воды можно получить
серную кислоту?
химическими веществами. Все это
делает предположение о
сложности наших нынешних элементов
далеко не невероятным, а
алхимики, стремясь превращать одни
металлы в другие, быть может,
преследовали цели не столь
химерические, как это думают часто...
Знаменитый французский
астроном Франсуа Араго сказал, что
тому недостает благоразумия, кто
вне области чистой математики
говорит о невозможности чего-
либо. Нельзя не преклониться
перед поучительной верностью этих
слов! Но этого мало; такое
отрицание не только неправильно, но
и вредно: отрицание тем хуже —
заключает тот же ученый — что
оно не ведет ни к наблюдению,
ни к опыту...
(Выше) было сказано, что
элементами зовутся вещества,
которые до сих пор не удалось
разложить, но что химическая
сложность некоторых иэ них (хотя и
сложность особого -порядка) не
невероятна. Это .значит, что
атомы некоторых элементов в
сущности, быть может, способны
подвергнуться химическому делению,
т. е. они не суть действительные
атомы, неделимые по своей
природе, .но неделимы только
доступными нам средствами, -и
сохраняются лишь в тех химических
процессах, которые известны ныне,
но могут быть 'разделены в новых
процессах, которые будут
открыты впоследствии. Такое строгое
отношение к понятию об атоме
вполне отвечает духу точной
.науки и действительному значению
научных теорий».
<ю
ПОДГОТОВИТЬСЯ К ЭКЗАМЕНАМ
ПОЛУЧШЕ?
3. Как, -не прибегая к действию реактивов, из
соединения AICI3-6H2O приготовить соляную кисло-
ту?
4. Что произойдет с алюминиевой кастрюлей,
если в ней долго кипятить раствор соды?
5. Растворимость одной из неорганических солей
серебра в воде исключительно велика: 557 г соли на
100 г воды (при 25е). Кроме того, эта соль хорошо
растворима в бензоле и толуоле. Какая эта соль?
6. Каким образом из азота можно получить
аммиак, не прибегая к использованию высокой
температуры, давления или электрических разрядов?
7. Имеется смесь кислорода и закиси азота N2C.
Как химическим способом из этой смеси выделить
N20?
8. Если в раствор йодида калия ввести хлор, то
выделится свободный йод (что сразу же
обнаруживается ло окраске раствора). Но при дальнейшем
насыщении раствора хлором окраска исчезает. Что
при этом происходит?
9. Какие два химических элемента -названы в
честь одной и той же страны?
10. Какой металл, кроме золота, имеет желтый
цвет?
11. Как из сернокислого бария получить
хлористый барий?
ОТВЕТЫ
К вопросу 1.
Кремневая кислота, представляющая собой
студенистый осадок — гель.
К вопросу 2.
При электролизе раствора CuS04 на катоде
выделится медь, а в растворе образуется серная
кислота.
К вопросу 3.
При нагревании соли происходит реакция:
г
2А1С13-6Н20 > 6j HCI + 3|Н20 + А12Оа
Соль гидролизуется; в остатке останется AUO3;
«ели сконденсировать выделившиеся пары, то
получится соляная кислота.
К вопросу 4.
В растворе сода гидролизуется:
ГЧа2С03 -; 2Н20 ^_2NaOH + Н2С03
i
tco2 + н2о
Алюминий будет реагировать со щелочью:
2AI + 2NaOH + 6Н20^> 2Na [AI (ОИL] + 3| Н2.
Алюминиевая кастрюля будет разрушаться с
выделением водорода и углекислого газа.
К вопросу 5.
Перхлорат серебра АдСЮ4.
К вопросу 6.
Литий при обычной температуре реагирует
с азотом, образуя нитрид:
6Li + N2-*2LisN
Нитрид лития разлагается водой с
образованием аммиака:
Li3;N + ЗН [ОН -* NH3 + 3UOH.
• ,
К вопросу 7.
Нужно добавить к смеси окись азота NO,
Произойдет реакция:
2N0 + 02=2N02.
Закись азота с NO реагировать не будет.
Полученную двуокись аэота можно удалить, пропуская
газовую смесь через раствор щелочи.
К вопросу 8.
Происходит окисление йода до йодноватой
кислоты:
J2 + 5С12 + 6Н20 -^ 10HCI Н 2Н J03.
Кислота растворяется в воде.
К вопросу 9.
Галлий и франций (Галлия — старинное
название Франции).
К вопросу 10.
Цезий.
К вопросу 11.
Прокалив BaS04 с углем, можно получить
сульфид:
BaS04 + 4C -* BaS + 41CO
На сульфид действуют соляной кислотой:
BaS + 2НС1 -^ BaCI2 + |H2S
91
РУССКИЙ
ХИМИК-
САМОУЧКА
РРИИ'ЧШ !■<!.!Udl J.
Юноша был схвачен за
«колдовство», его посадили в сарай и
приставили сторожей. Когда
стемнело, он написал фосфором на
стене сарая: «Не робей, Семен».
Сторожа, испугавшись ярко
светившейся в темноте дьявольской
надписи, разбежались. Наутро он
явился к своей «хозяйке» —
юноша был крепостным помещицы
Скульской. Он рассказал о ночном
приключении и упросил отправить
его в Петербург учиться.
Так началось вступление в
науку выходца из крепостных,
уроженца Ярославской губернии
Семена Прокофьевича Власова.
Его современники писали, что
Власов — гений, которого по
справедливости можно назвать
вторым Ломоносовым. Это, конечно,
преувеличение. Но несомненно,
Власов был исключительно
одаренным человеком, он много и
настойчиво трудился и достиг
выдающихся результатов в
различных отраслях науки — в химии,
химической технологии,
электрохимии, физике, прикладной
механике. Начиная с раннего детства
до преждевременной смерти — он
умер 32 лет —Власов упорно
боролся за элементарные
человеческие права и признание своих
научных и технических новшеств,
преодолевая косность и суеверия
окружающих.
С. П. Власов родился в
1789 году в Любимсксм уезде
Ярославской губернии, в семье
крепостного крестьянина. Отец
обучал его грамоте, желая сделать
священником. Но мальчика
больше занимали движение солнца по
небосводу, радуга, падающие
звезды, ветер и буря. Молодой пастух
наблюдал за поведением птиц и
других обитателей леса, строил
свои еще наивные гипотезы,
размышлял, пытался даже
экспериментировать. Вызывая камнем
брызги водяных капелек и
наблюдая при этом радугу, он
самостоятельно (и в общем довольно
правильно) объяснил ее
преломлением света во влажном воздухе.
Он приносил в деревню
светящиеся пни, изучал причины свечения.
Однажды попытался уверить
односельчан в небожественном
происхождении грома и молнии. За
увлечение посторонними делами
Семена нередко жестоко
наказывали.
Наконец мальчика
заподозрили в том, что он общается с
дьяволом. От греха подальше,
решили отослать его в Петербург и
пристроить к какому-нибудь делу.
В столице Семен был отдан в
услужение торговцу вином,
закоренелому суеверу. Но и здесь его
неудержимо впекли наблюдения
и опыты. Он вызывал
электрические явления, натирая шерстяным
лоскутом смолу, которой запеча-
тывали горлышки винных
бутылок.
Один студент обратил
внимание на любознательного мальчика.
Он порекомендовал ему книгу по
физике. Семен отдал за нее в
книжной лавке все свои
сбережения и вскоре выучил книгу
наизусть.
Как-то виноторговец застал
Власова за тайным чтением
физики. Книга была отнята и
сожжена в печи, а Семен высечеи.
Такое обхождение сделало из
Власова еще более ревностного
приверженца науки, но заставило его
быть более скрытным. Постепенно
он приобрел несколько новых
книг, среди которых были
классические произведения —
«Гальванические опыты» В. Петрова,
«Химия» Жакена и другие.
За несколько лет Власов
самостоятельно приобрел
основательные познания в физике и
химии. К несчастью, хозяин
обнаружил и отобрал книги.
Взбешенный, он отослал Семена обратно
в деревню.
Здесь его встретили
враждебно. С большим трудом удалось
Власову получить позволение
снова отправиться в столицу. Теперь
он устроился прислуживать в
трактире. Проработал там не-
нившись. Его молодую жен>
Скульская оставила у себя, в
«залог».
На этот раз он открыл в
столице небольшую мыловаренную
мастерскую, где готовил, кроме
разных сортов мыла, помады и
сколько лет, каждую свободную
минуту отдавал естествознанию.
Свои грошовые сбережения
Власов расходовал на химикаты,
инструменты и книги. Но и здесь он
вскоре прослыл колдуном. Семена
решили отдать в рекруты. По
указу помещицы Скульской его
сковали, привезли в деревню и
посадили в сарай. Напрасно он
пытался доказать свою невиновность,
его не слушали. Тогда-то он и
воспользовался привезенным из
Петербурга куском фосфора.
Все-таки Власов получил у
Скульской, которую напугали
разговоры о нечистой силе,
разрешение в третий раз поехать в
Петербург, но предварительно же-
Рисунки М. Лисогорского
душистые составы, а на досуге
занимался опытами по чистой
химии. Тогда, поняв хитрость
Власова, его задумали снова отправить,
заковав, в деревню.
Но Власов вовремя
ликвидировал свое небольшое заведение
и скрылся под защиту фабриканта
Грейсона, который, заметив
необыкновенные способности
юноши, взял его к себе на фабрику.
Власову была поручена
лаборатория — верх мечтаний. Молодой
ученый способствовал
усовершенствованию производства у
Грейсона. Он снизил температуру
переплавки металла при помощи
добавления плавней; от него
исходила идея замены свинцовых пуль
93
чугунными, за что Грейсон
получил от царского правительства
щедрую награду. Но вскоре по
невыясненной причине Грейсон
отказал Власову от места.
Весной 1810 года, когда
Александр I прогуливался по
Фонтанке, Власов обратился к нему с
прошением — принять его в число
казенных воспитанников Медико-
хирургической академии, чтобы
«усовершенствоваться в химии и
физике». Александр I
распорядился проэкзаменовать Власова.
Подвергнутый испытаниям
перед конференцией академии,
Власов обнаружил глубокие знания
по химии и физике. Он
представил модель изобретенной им
гидростатической машины, которая
могла поднимать воду на
несколько саженей и предназначалась
для орошения. Несмотря на
возражения одного из академиков,
остальные профессора
единодушно засвидетельствовали, что
академия в лице Власова
приобретает очень полезного сотрудника.
Было напечатано ходатайство
министра перед государем об
освобождении Власова из крепостных.
На запрос генерал-губернатора
помещица Скульская ответила,
что она готова отпустить Власова
на свободу, но ввиду своего
«посредственного состояния» хотела
бы получить за него и за его
жену 5 тысяч рублей. Тогда
царь приказал бесплатно
освободить Власова, а Скульской выдать
зачетную рекрутскую квитанцию.
Указ об освобождении Семена
Прокофьевича и Афимьи
Федоровны Власовых из крепостных
был подписан царем 14 сентября
1811 года.
Вскоре Власова зачислили в
воспитанники
Медико-хирургической академии по
фармацевтической части. Академик-химик
А. И. Шерер поручил ему
должность лаборанта. Власов стал
учиться и одновременно работал в
лаборатории.
За последнее десятилетие
своей жизни (I8II—1821 гг.) он
сделал ряд замечательных
открытий и усовершенствований.
Так, в докладе 1815 года
Власов сообщает медицинскому
совету о разработанном им новом
способе получения серной кислоты в
деревянных камерах, пропитанных
серой (вместо свинцовых камер);
после испытаний академика
Рихтера метод Власова был одобрен
советом; далее он
усовершенствовал метод получения азотной
кислоты; предложил специальный
состав, быстро тушивший пож а-
ры; состав для реставрации
старых, потемневших картин. Из
отходов монетного двора он очень
дешевым способом изготовлял
красную краску.
Усовершенствовал метод извлечения из сандала
краски бакан; разработал способ
получения лазури, по качеству
превосходящей ввозимую из
Германии краску, причем
отечественная лазурь получалась вдвое
дешевле. Из отходов производства
монет Власов изготовлял хорошие
чернила, ваксу.
Власов одним из первых
вслед за англичанином Дэви
получил электролитическим методом,
улучшенным им, металлические
калий и натрий и подробно
изучил их свойства. Изучал он и
взаимодействие металлических
щелочей с водой; в этих опытах ему
помогала жена.
Он изобрел новый способ
дешевого получения спирта,
который продал П. П. Свиньину. В не
известном ранее письме
Власова Свиньину от 22 декабря
1816 года мы читаем: «По елику
Вы сами изволили говорить, что
покупаете секрет единственно для
интереса, могущего произойти
для Вас от оного, а не для того,
чтобы опубликовать оный для
славы своей, то Вы ничего не
теряете, если честь изобретения
предоставите мне самому, оставив
при себе все привилегии, какими
Правительство может позволить
пользоваться изобретателю.
Основываясь на сем, прошу Вас
покорнейше принять такое условие,
чтобы я мог известить правительство
об открытии моем нового способа
выгонки вина и просить в награду
за оное позволения, чтобы одному
мне токмо производить его в
действо столько то лет.
Позволение же сие обязуюсь передать
по причине моих недостатков
единственно Вам».
Свои работы по физико-химии
гальванических элементов Власов
публиковал в журнале
«Соревнователь просвещения», который
издавался в те годы. В области
электрохимии и электротехники он
был учеником и последователем
знаменитого В. В. Петрова.
Напомним, что в то время в учении
об электричестве взгляду Вольта
о решающей роли контакта
металлов в возникновении тока
противостояло мнение, что
электричество возникает в результате
химических реакций. Власов правильно
отрицал постоянное
существование в природе «электрической
жидкости». Он писал, что
электричество образуется в результате
химических процессов. Путем
рекомбинации вольтовых пар
Власов пришел к гальванической паре
в форме, общепринятой в наше
время. «Гальванический прибор»
Власова — это не «вольтов столб»
и не «гальваническая батарея
Петрова», а нормально собранная
батарея элементов. Кроме меди и
цинка Власов изучал
гальванические элементы с железом, чугуном,
свинцом и другими металлами; иа
электролитов он испытывал
растворы гидрата аммония, гидратов
окиси кальция и бария,хлористого
натрия, растворы различных
кислот. Ему принадлежит
конструкция оригинального
гальванического элемента с цинковым
электродом, свернутым в спираль.
Спустя несколько лет этот опыт был
повторен американцем Р. Харом.
Результаты
электрохимических исследований Власова
докладывались публично, а также печа-
94
В НОВОМ ИЗМЕРЕНИИ
— Я счастлив, что я
вирусолог,— сказал мне недавно один
знакомый.— Ведь мы работаем на
переднем крае науки!
Ощущение ответственности,
«нужности» разделяют с ним
сейчас многие биологи. Все жадно
впитывают свежий ветер
открытий, с гордостью сознавая себя
участниками и современниками
одной из величайших научных
революций.
«События в этом мире уже нельзя описывать
языком классической химии».
Альберт СЦЕНТ-ДЬЕРДЬИ
Среди ее лидеров следует
назвать лауреата Нобелевской
премии Альберта Сцент-Дьердьи,
создателя совсем еще юной
науки — субмолекулярной
биологии.
Небольшая книга
Сцент-Дьердьи «Введение в
субмолекулярную биологию» (Москва,
издательство «Наука», 1964)—лодлин-
ная драгоценность для биолога и
врача. Основную ее идею
сформулировал в предисловии к книге
ее переводчик профессор Л. А.
Тумерман:
«Уже много лет является
Сцент-Дьердьи провозвестником
мысли о том, что понимание
биологической функции немыслимо
без перехода в новое
„измерение", в мир субмолекулярных и
супрамолекулярных электронных
явлений, управляемых не
законами классической, а законами
квантовой физики».
К чему говорить о
субмолекулярной биологии, если
молекулярная биология
находится в полном расцвете! —
предупреждает вопрос
читателя автор в начале книги. И
отвечает: Нет оснований ставить
тались в двух журналах. Они
были известны и за рубежом.
Английский физик профессор
В. Аллен слушал лекцию Власова
в Петербурге и, вернувшись к себе
на родину, переписывался с
Власовым. Публикуемые в журнале
«Соревнователь просвещения»
труды Власова долгое время
оставались неизвестными историкам
науки, так как этот журнал после
восстания декабристов был
запретен и изъят из библиотек.
Из других многочисленных
работ Власова упомянем его
конструкцию деревянной паровой
машины, в которой из металла был
сделан только котел; она стоила в
25 раз дешевле, чем обычные
металлические. Власов
усовершенствовал шахтерский фонарь,
использовав в качестве материала
слюду; подробно рассмотрел
преимущества и недостатки различных
громоотводов, создав здесь целую
систему взглядов. Он предложил
лучшие конструкции
громоотводов, в которых железо
комбинировалось с медью и углем.
Научная деятельность
Власова получила высокую оценку в
журналах «Соревнователь
просвещения», «Отечественные записки»,
«Новый магазин естественной
истории, физики, химии и сведений
экономических», «Архив истории
труда в России» и
«Электричество».
Жизнь С. П. Власова
оборвалась рано. Он скончался в
расцвете сил в результате отравления
при очередных химических
исследованиях. Это произошло 27
августа 1821 года в Петербурге.
В знак уважения к памяти
выдающегося русского ученого, бывшего
крепостного, прожившего такую
трудную, но плодотворную жизнь,
его провожали в последний путь
крупнейшие ученые России.
Доктор химических наук
Ю. С МУСАБЕКОВ
95
под сомнение эти успехи. Но
все же, если не дать себя
ослепить и посмотреть на
биохимию глазами, привыкшими
к тьме, то становятся ясными
огромные пробелы в наших
знаниях. Дальше он продол-*
жает:
...Современная биохимия
по-прежнему пользуется
языком букв и черточек, а
отсюда следует, что эта науна
развивается все в том же
молекулярном измерении, в каком
она развивалась при своем
зарождении в прошлом веке. Но
с тех пор породившая ее наука
химия, сливаясь все больше
с физикой и математикой,
перешла в новое измерение,
в субмолекулярное, в
субатомное электронное
измерение. События в этом мире уже
нельзя описывать языком
классической химии, а его
законами служат законы квантовой,
или волновой, механики. В
свете этой новой науки атом уже
не представляет собой
неделимую единицу, а состоит из
ядра, окруженного
электронными облаками
разнообразных и фантастических форм.
По-видимому, более тонкие
явления жизни заключаются в
изменении формы и
перераспределении таких облаков.
Итак, стремление заполнить
огромные -пробелы в знаниях и
поиски совершенно новых
подходов для объяснений сложнейших
явлений жизни — вот, что
послужило фундаментом для
основания субмолекулярной, или кванто-
вомеханической, биологии.
Материалом же для строительства
здания новой науки служат основные
достижения целого ряда
физических наук.
Сцент-Дьердьи в этой книге,
как, впрочем, и в предыдущей
работе «Биоэнергетика» (перевод
ее был издан Государственным
издательством
физико-математической литературы в 1961 году),
делает смелую попытку
осмыслить роль в биологии квантово-
механических 'процессов:
переходов между электронными
уровнями различных типов, резонансной
миграции электронов, миграции
делокализованных электронов.
Доказывая, что биология
(подвластна законам физики, Сцент-
Дьердьи не скрывает всей
сложности «взаимоотношений» между
нею и физикой:
Биолог зависит от
суждения физиков, но вместе с тем
он должен быть очень
осторожен, когда ему говорят, что то
или иное событие невероятно.
Если бы я всегда соглашался
с вердиктом физиков, то мне
пришлось бы бросить это
направление моих исследований.
Я счастлив, что не сделал
этого... С тех пор, как я начал
работать в моем теперешнем
направлении, все кажется мне
более красочным,— признается
семидесятилетний ученый,— и
я с большим нетерпением, чем
когда бы то ни было прежде,
спешу по утрам в свою
лабораторию.
Личным примером он
старается увлечь биологов,
вступающих в неизведанную, очень
сложную область науки, ободрить их,
а своими рассуждениями —
убедить, что этот путь исследований
один из наиболее верных и
перспективных:
Жизнь управляется
именно электронами, то есть
энергией, которую отдельными
порциями отдают эти электрон bF
при своем спуске с высокого
уровня, куда они были
подняты фотонами. Но электроны,
движущиеся по замкнутому
пути,— это слабый
электрический ток. Следовательно,
жизнью движут небольшие
электрические токи,
поддерживаемые солнечным светом.
Автор не навязывает
читателю своих мыслей в качестве
окончательного приговора. Он
заставляет согласиться с ним с помощью
логичных и изящных
доказательств.
Несмотря на научную
строгость изложения, Сцент-Дьердьи
нельзя упрекнуть в сухости,
академизме. Нас вводит в область
проблем квантовомеханической
биологии человек страстный,
бесконечно преданный научному
прогрессу. Он применяет все
допустимые «'приемы обольщения»,
чтобы увлечь того, кто способен
увлечься, ходом своей мысли.
Книга Сцент-Дьердьи
пронизана духом подлинно научной
мысли, чуждой всему застывшему,
неподвижному. Прочтите ее*
Ю. Шишина
Редакционная коллегия:
Главный редактор И. В. Летрянов-Соколов
П. Ф. Баденков, В. И. Гольданский, Н. М. Жаворонков, С. В. Кафтанов, Л. И. Мазур, Б. Д. Мельник,
М. И. Рохлин (зам. главного редактора), П. А. Ребиндер, С. С. Скороходов, Б. И. Степанов, А. С. Хохлов,
М. Б. Черненко (зам. главного редактора), Н. М. Эмануэль
Оформление А. И. Гангалюки
Тех. редактор О. Беккер
Адрес редакции: Москва В-333, Ленинский проспект, 61/1. Телефон АВ 7-72-64
Подписано к печати 14/V—1965 г.
Печ. л. 10,08 Уч.-изд. л. 11,0
Т. 06764
Бум. л. 3
Формат бумаги В4 X 10BVi6
Тиоаж 20000 Зак. 2192
2-я типография издательства «Наука», Москва, Шубинский пер., 10
ш
G=2
f он
: 1
: - С -
)
ОИ :
1
"С- :
• 4
F- - т. А.
Цена »0 коп.
с
и
©
I
ч
в
S
Одна из цепей
молекулы
пигмента
КРОВИ —
ГЕМОГЛОБИНА
ВЫГЛЯДИТ ТАК:
Много
ли
РАЗНЫХ
вод
СОДЕРЖИТСЯ
В ВОДЕ!
Читайте в следующем
номере журнала:
Как устроены
локаторы
гремучей змеи
и летучей мыши
•
Инженеры
изучают
ПАТЕНТЫ
ЖИВОЙ
ПРИРОДЫ
Читайте
в следующем
номере журнала:
Растение
просит
помощи
Издательство «Наука»