Author: Лякишев Н.П.
Tags: металлургия металловедение физика инженерия инженерное дело издательство машиностроение
ISBN: 5-217-01569-1
Year: 1996
Text
справочник
диаграммы
состояния
двойных
металлических
систем
Справочник в трех томах
Редакционый совет:
акад. РАН Н.П. Лякишев
(главный редактор издания),
акад. РАН О А Банных
(зам. гл. ред.),
д-р техн, наук ЛЛ. Рохлин
(зам. гл. ред.),
канд. техн, наук С.П. Алисова,
канд. техн, наук Н.Р. Бочвар,
канд. хим. наук П.Б. Будберг,
канд. техн, наук Т.В. Добаткина,
канд. техн, наук Е.В. Лысова,
д-р техн, наук В.П. Полякова,
д-р техн, наук К.Б. Поварова,
д-р техн, наук МА Тылкина,
д-р хим. наук Л.Е. Шелимова,
д-р техн, наук Е.Н. Шефтель
МОСКВА
МАШИНОСТРОЕНИЕ
1997
ДИАГРАММЫ ' у
СОСТОЯНИЯ_____/
двойных
металлических
систем
том 2______________
Под общей редакцией
академика РАН Н.П. Лякишева
МОСКВА
МАШИНОСТРОЕНИЕ
1997
УДК 669.017.11
ББК 34.2
Д 44
Издание осуществлено при поддержке
Российского фонда фундаментальных
исследований по проекту 96-03-46024
Диаграммы состояния двойных металлических систем:
Д44 Справочник: В 3 т.: Т.2 / Под общ. ред. Н.П. Лякишева. — М.:
Машиностроение, 1997. — 1024 с., ил.
ISBN 5-217-01569-1
Приведены критически рассмотренные и обобщенные сведения о диаграм-
мах состояния двойных металлических систем, знание которых необходимо для
выбора и разработки промышленных металлических материалов, технологии
их производства и практического использования. Содержатся сведения об
образующихся в системах соединениях и их кристаллических структурах,
типах и температурах фазовых превращений, взаимных растворимостях
компонентов друг в друге и изменении их с температурой.
Справочник предназначен для инженерно-технических работников научно-
исследовательских институтов и промышленных предприятий металлургии,
машиностроения и других отраслей промышленности, а также для профессор-
ско-преподавательского состава и студентов высших учебных заведений.
ББК 34.2
ISBN 5-217-01569-1 (Т.2) © Н.П. Лякишев, О.А. Банных,
ISBN 5-217-01567-5 Л.Л. Рохлин и др., 1997
© Издательство ’’Машиностроение”, 1997
ПРЕДИСЛОВИЕ
Второй том справочника ’’Диаграммы состояния двойных металли-
ческих систем” включает в себя описания двойных равновесных
диаграмм состояния металлов от калифорния (Cf) до лютеция (Lu),
составленные на основании оценки и обобщения имеющихся в лите-
ратуре сведений.
В соответствии с принятой формой описания диаграмм состояния
при характеристике кристаллических решеток, образующихся в
системах интерметаллических фаз, указывается символ Пирсона,
широко применяемый для этой цели в последнее время, но не ис-
пользованный в ранее вышедших на русском языке справочниках по
двойным диаграммам состояния металлических систем М.Хансена и
К.Андерко, Р.П. Эллиота, Ф.А. Шайка и А.Е. Вола. Символ Пирсона
состоит из трех частей: первая, строчная буква характеризует синго-
нию решетки, вторая, прописная буква характеризует решетку по
классификации Бравэ и последующие цифры — число атомов в
элементарной ячейке, так что дается достаточно полное качественное
описание кристаллического типа. Например, cF24 означает: кубичес-
кая гранецентрированная решетка с 24 атомами в элементарной
ячейке. В приведенной ниже таблице указаны возможные типы
решеток Бравэ и их обозначение в символах Пирсона согласно
справочнику Пирсон У. ’’Кристаллохимия и физика металлов и
сплавов”.
При описании кристаллических структур также использовали
следующие обозначения: ОЦК — объемно центрированная кубическая
структура, ГЦК — гранецентрированная кубическая структура, ГПУ
— гексагональная плотноупакованная структура, ДГПУ — двойная
гексагональная плотноупакованная структура.
Следует обратить внимание на ряд обозначений, введенных в
текст справочника:
6
Предисловие
Таблица. Типы кристаллических решеток в символах Пирсона
Символ Пирсона Система Символ решетки
аР Триклинная (анортическая) Р
тР Моноклинная Р
тС Моноклинная базоцентрированная С
' оР Ромбическая Р
оС Ромбическая базоцентрированная С
oF Ромбическая гранецентрированная F
ol Ромбическая объемно центрированная I
tP Тетрагональная Р
tl Тетрагональная объемно центрированная I
hP Гексагональная Р
hR Ромбоэдрическая R
cP Кубическая R
cF Кубическая гранецентрированная F
cl Кубическая объемно центрированная I
Ограниченные твердые растворы на основе чистых компонентов,
аллотропических форм чистых компонентов или соединений обозна-
чаются соответствующими символами и заключаются в круглые
скобки, например (Mg), (0Zr), (Pd3Sm).
Неограниченные твердые растворы между двумя компонентами
обозначаются символами соответствующих компонентов и заключа-
ются в круглые скобки, например (бСе, 0Y), (Ag, Au),
Если чистый компонент или соединение существуют в двух моди-
фикациях, то высокотемпературная модификация обозначается
греческой буквой 0 или ВТ:
0Zr, pPaSm или Ni3Sn (ВТ),
а низкотемпературная — а или НТ:
aZr, aPdSm или Ni3Sn (НТ).
Если чистый компонент или соединение существует в трех моди-
фикациях, то высокотемпературная, среднетемпературная и низко-
температурная модификации обозначаются соответственно гречески-
ми буквами у, Р, “ или ВТ, СТ, НТ, например ySm, 0Sm, aSm или
Bi2Pt (ВТ), Bi2Pt (СТ), Bi2Pt (НТ).
Предисловие
7
Было признано целесообразным указать на диаграммах состояния
принятые в настоящее время наиболее достоверные значения темпе-
ратур плавления и температур полиморфных превращений чистых
металлов. Значения этих температур указаны по Бюллетеню фазо-
вых диаграмм сплавов [В1]. ' ’
При изложении материалов в настоящем справочнике для указа-
ния повторяющихся ссылок на литературу, используемую во многих
описаниях диаграмм состояния, применены следующие сокращения:
X — Хансен М., Андерко К. Структуры двойных сплавов. М.:
Металлургиздат, 1962. Т.2. 1188 с.
Э — Эллиот Р.П. Структуры двойных сплавов. М.: Металлур-
гия, 1970. Т.1. 456 с., Т.2. 472 с.
Ш — Шанк Ф.А. Структуры двойных сплавов. М.: Металлур-
гия, 1973. 760 с.
М — Massalski Т.В. Binary АПоу Phase Diagrams, American
Society for Metals. Ohio: Metals Park, 1986, 1987. V. 1,2.
2224 p.
М2 — второе издание M.
P — Pearson W.B. A Handbook of Lattice Spacings and Structu-
res of Metals and Alloys. Oxford-London-Edinburgh-New-
York-Toronto-Sydney-Paris-Braunschweig: Pergamon Press,
1967. 1448 p.
V-C — Villars P., Calvert L.D. Pearson’s Handbook of Crystallo-
graphic Data for Intermetallic Phases. Ohio Metals Park,
1985. V. 1, 2, 3.
V-C2 — Второе издание V-C.
Bl — Bull. Alloy Phase Diagrams. 1986. V. 7. № 6. P. 601—602.
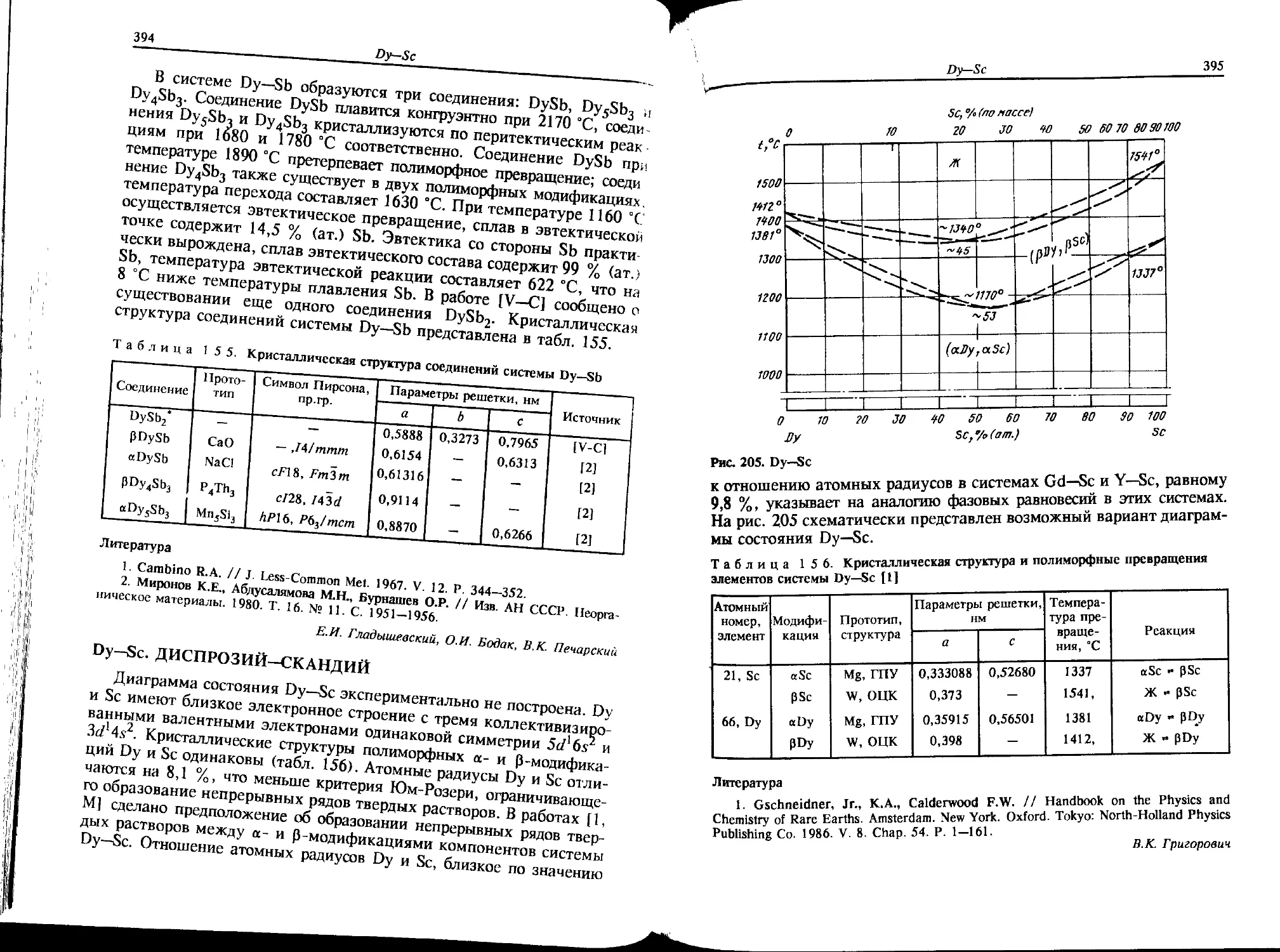
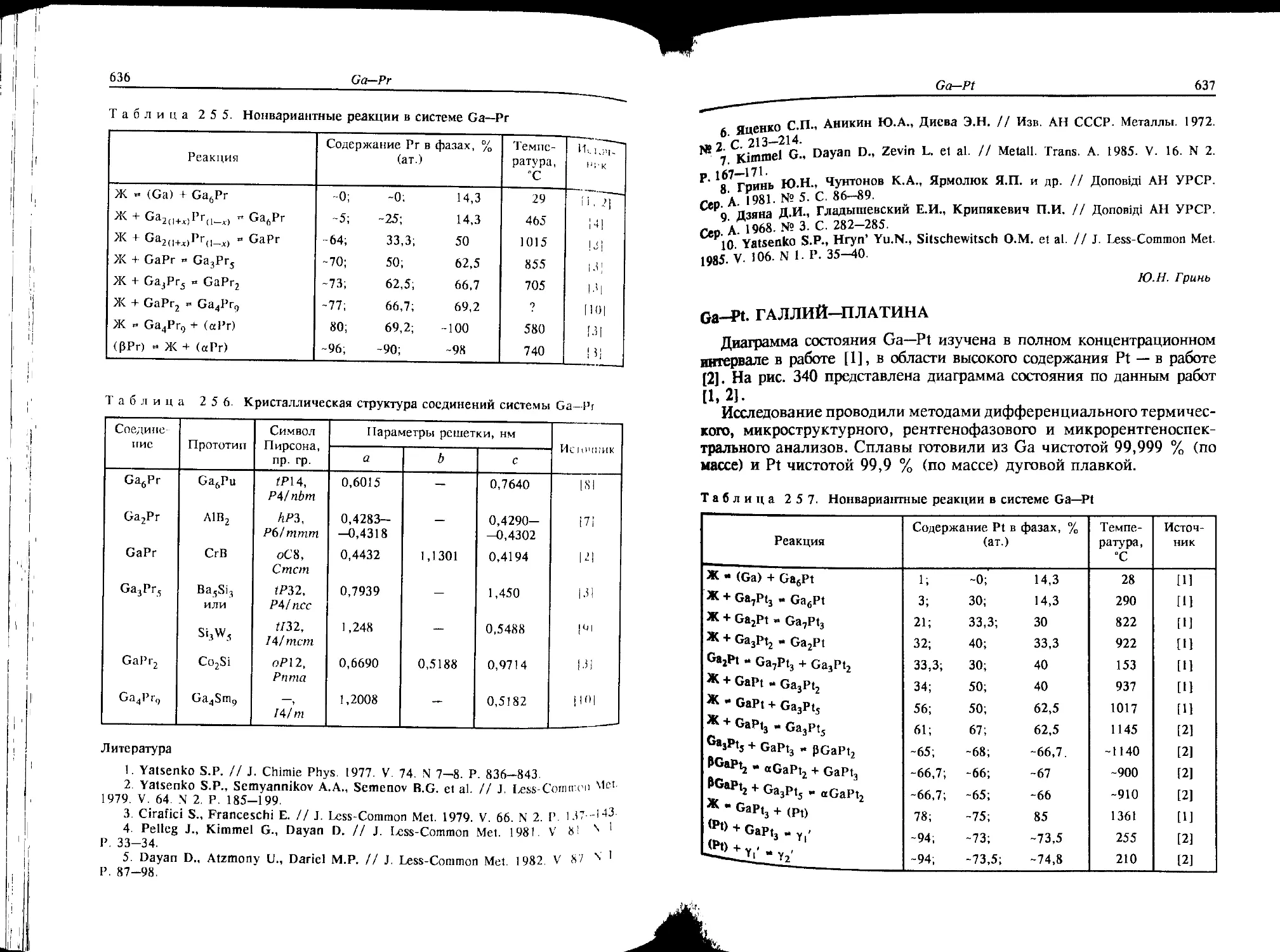
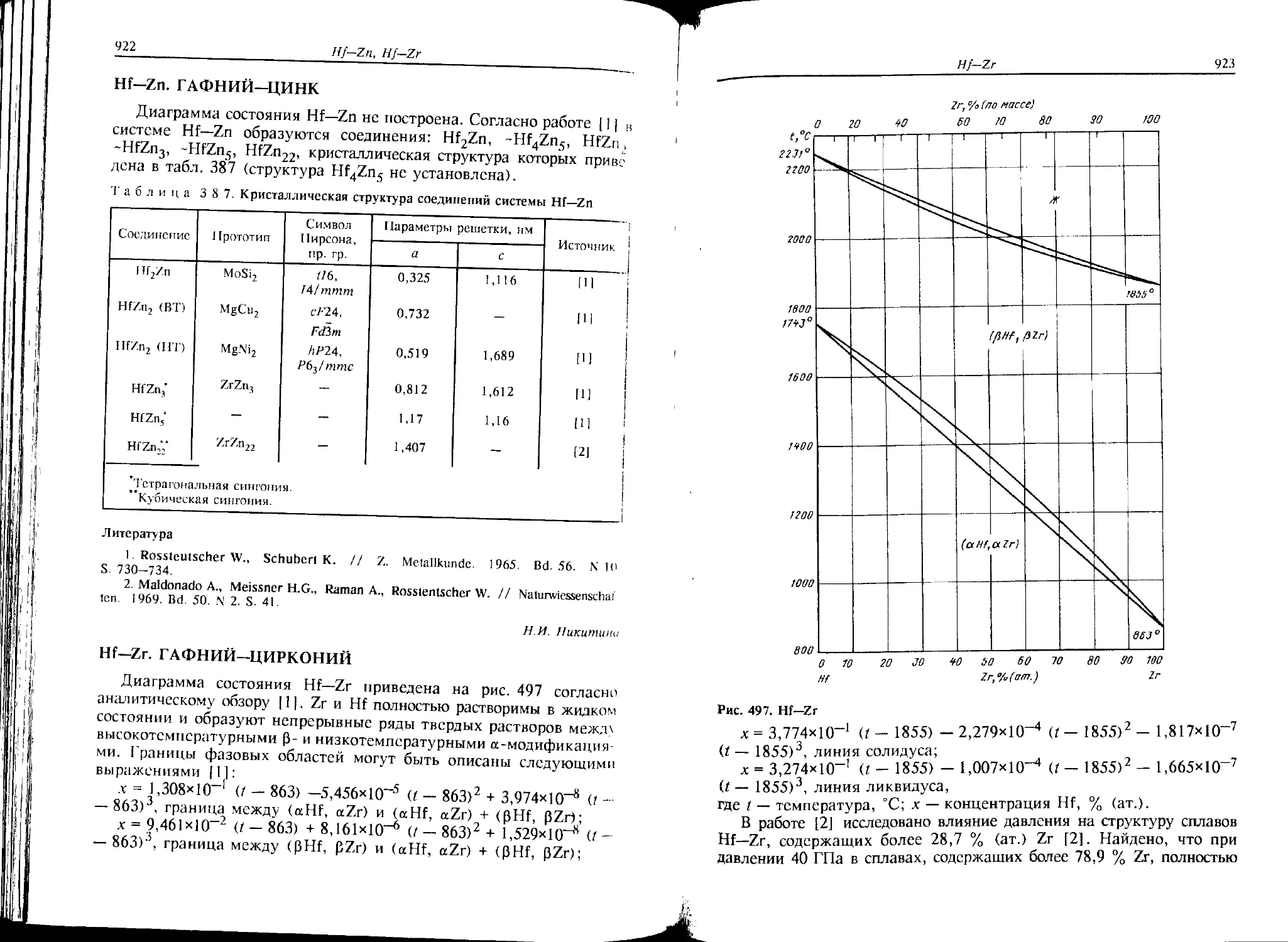
Cf—Мо. КАЛИФОРНИЙ-МОЛИБДЕН
Согласно сведениям, приведенным в справочнике [М], Cf и Мо
имеют незначительную растворимость друг в друге в твердом состоя-
нии. Соединений в системе не образуется.
Л.Л. Рохлин
О—Мо. ХЛОР—МОЛИБДЕН
Наиболее полно данные о соединениях в системе О—Мо обобщены
в работе [1], где представлены температуры их плавления или разло-
жения (рис. 1). В системе синтезированы пять хлоридов Мо.
Соединение МоС16 стабильно в атмосфере С12 при температуре
20 °C [2].
Соединение MoCL существует в двух модификациях: низкотемпе-
ратурной МоС15 (НТ) при температуре 98 ±2 °C и высокотемпера-
турной МоС15 (ВТ), которая плавится при 197±3 °C. Соединения
МоС15 и МоС14 образуют эвтектику при температуре 183±3 °C
[3, 4,5].
Соединение МоС14 также имеет две модификации, плавится по
перитектической реакции при 277±10 °C. Температура его полимор-
фного превращения -241 °C [6, 7].
Соединение 0МоС13 разлагается при давлении хлора, равном
0,1 МПа, и температуре на несколько градусов выше температуры
плавления МоС14. Соединение аМоСН имеет близкий к 0МоС13
состав, разлагается при температуре 650±10 °C и давлении 0,1 МПа
[1, 6, 9].
Соединение МоС12 (Мо3С112) разлагается на (Мо) и (С12) при
температуре 950±10 °C и давлении 0,1 МПа [6].
Кристаллическая структура соединений приведена в табл. 1.
Cl—Mo
9
Cl, % fпо массе)
Cl, a/o(am.)
Cl
Рис. 1. Cl—Mo {p - 0,1 МПа)
Таблица 1. Кристаллическая структура соединений системы С1—Мо
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а b с
МоС16 WC16 ЛК35, - — — — [2]
МоС15 (НТ) NbClj — иЗЦ 1,781! 0,60796 Р - 95, 7±1° [3]
МоС15 (ВТ) — — — — — [3, 4]
₽МоС14 (ВТ) — -, Р31с 0,6085 — 1,1674 16]
10
Cl-Re
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а b с
аМоС14 (НТ) NbCl — 1,23 0,64 0,84 Р == 134° [81
PMoCl3 — -, СИ с 0,6115 0,9814 1,1906 Р - 91“ [6]
аМоС13 — —, С2/т 0,6065— 0,6092 0,9745— 0,9760 0,7275— 0,7250 Р - 124+124,6° [1, 6, 9, 10]
МоС12 — —, ВЬат 1,11249 1,1280 1,4067 [6J
Литература
I. Brewer L., Lamoreaux R.H. // Atomic Energy Review. Special Issue N 7 Molibde-
num: Physico-Chemical Properties of its Compounds and Alloys. Vienna: International
Atomic Energy Agency, 1980. P. 195—356.
2. Mercer M. // Chem Commun. 1967. N 3. P. 119—121.
3. Sands D.E., Zalkin A. // Acta Crystallogr. 1959. V. 12. P. 723.
4. Дробот Д.В., Сапранова E.A. // Журнал неорганической химии. 1974. Вып. 19.
С. 228-231.
5. Коршунов В.Г., Нирша В.М. // Журнал неорганической химии. 1969. Т. 14.
С. 1656-1658.
6. Schafer Н., Sonnering H.-G., Tillack J. et al. // Z. Anorg. All. Chem. 1967. Bd.
353. S. 281-310.
7. Westlan A.D., Uzelac V. // Inorg. Chim. Acta. 1977. V. 23. P. L37-L39.
8. Kepert D.L., Mandyczewsky R. // Inorg. Chem. 1968. V. 7. P. 2091.
9. Oppermann H., StOver G. // Z. Anorg. All. Chem. 1972. V. 387. S. 218-229.
10. Schnering H.G., Woehrle H. // Naturwissenschaften. 1963. Bd. 50. S. 91.
КБ. Поварова
Cl-Re. ХЛОР-РЕНИЙ
Сведения о взаимодействии Cl с Re обобщены в работах [1—3].
При воздействии С1 на металлический Re при температуре 500 °C
образуется ReCl5 — твердое кристаллическое вещество коричневого
цвета, которое плавится при 260 °C и кипит при 330 С°. При нагреве
в присутствии кислорода образуются оксохлориды (ReOCl и ReOCl4).
При нагреве без доступа кислорода ReCl$ диссоциирует с образовани-
ем ReCl3, который также получают восстановлением ReCL водородом
или его разложением в токе азота при температуре 375 °C. Соедине-
ние ReCl3 кристаллизуется в гексагональной системе, температура
плавления составляет -727 °C. Двойные соединения Re с С1 другой
валентности либо неустойчивы, либо их существование находится под
сомнением.
Cl—Те, Cm—Cr
11
Литература
1. Друце И. Рений: Пер. с англ. / Под ред. А.В. Лапицкого. М.: Иностранная
литература, 1951. 115 с.
2. Лебедев К.Б. Рений. М.: Металлургиздат, 1963. 207 с.
3. Борисова Л.В., Ермаков А.Н. Аналитическая химия рения. М.: Наука, 1974.
317 с.
М. А. Тылкина
С1—Те. ХЛОР-ТЕЛЛУР
В работе [1] предположено существование в системе С1—Те соеди-
нения С1Те с неизвестной кристаллической структурой.
Литература
1. Petrov E.S. // Abh. Akad. Wiss. Math. — naturwiss. Techn. 1977. N 2.
P. 223-237.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Cm—Cr. КЮРИЙ—ХРОМ
Диаграмма состояния Cm—Cr рассчитана теоретически в работе
[1]. Результаты расчета в предположении, что Ст и Сг незначитель-
но растворяются друг в друге, представлены на рис. 2. Предположи-
12
Cm-О
тельно строение диаграммы аналогично строению других диаграмм
состояния сплавов актинидов с Сг.
Литература
1. Venkatraman М., Neumann J.P., Peterson D.E. // Bull. Alloy Phase Diagrams.
1985. V. 6. N 5. P. 416-417.
Л.Л. Рохлин
Cm—О. КЮРИЙ-КИСЛОРОД
В системе образуются три оксида: Ст2О3, СтО2 и Ст70ц [1—3].
Соединение Ст2О3 известно в трех модификациях. Низкотемпера-
турная модификация (НТ) существует при температуре ниже 800 °C.
В интервале температур 800—1300 °C стабильна среднетемпературная
модификация (СТ). При температуре выше 1500 °C существует
высокотемпературная модификация (ВТ).
Низкотемпературная модификация гомогенна при составе СтО„,
где х = 1,52+1,64.
Кристаллическая структура соединений приведена в табл. 2.
Таблица 2. Кристаллическая структура соединений системы Ст—О
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Cm2O3 Mn2O3 с/80, 7йЗ 1,0922- — —
1,0996 [1]
1,101 —- [2]
1,100 — — [3]
Cm2O3(CT)’ — —“ 1,4276 0,3656 0,8913 U1
Cm2O3(BT) La2O3 hP5, 0,3845 •— 0,6092 [1]
Р3т1 0,380 — 0,600 [2]
CmO2 CaF2 cFi 2, 0,5372 — [3]
Fm3m 0,5357 — [1]
Cm7On — — 0,6677 — — [1]
’Моноклинная сингония, p - 100,39°. **Триклинная сингония, a - 99,52°.
Литература
1. Mosley W.C. // J. Inorg. Nuclear Chem. 1972. V. 34. N 3. P. 539-555.
2. Wallmann J.C. // J. Inorg. Nuclear Chem. 1964. V. 26. N 12. P. 2053-2057.
3. Asprey L.B., Ellinger F.H., Fried S., Zachariasen W.H. // J. Amer. Chem. Soc.
1955. V. 77. N 6. P. 1707-1708.
Ю.Б. Кузьма
Co—Сг
13
Co—Сг. КОБАЛЬТ—ХРОМ
Диаграмма состояния Со—Сг (рис. 3) исследована рядом авторов
[1—3, X, Э]. Согласно последним исследованиям, в системе образу-
ется одна промежуточная фаза о (С^Со?) и твердые растворы на
основе кобальта (еСо) и (аСо) и хрома (Сг).
Рис. 3. Со—Сг
Нонвариантные равновесия в системе приведены в табл. 3.
Растворимость Со в (Сг) приведена ниже:
Температура, °C........ 1395 -1250
Растворимость Со, % (ат.) . . 46,8 -30
Источник............... [3] 11, 2]
-700
-12
[1, 2]
14
Co—Сг
Растворимость Сг в (аСо) приведена ниже:
1395 1260 990 965
39,9 43,3 38 36,3
[3] [3] 13] 14]
Таблица 3. Нонвариантные равновесия в системе Со—Сг
Температура, °C...........
Растворимость Сг, % (ат.) . .
Источник .................
Реакция Содержание Сг в фазах, % (ат.) Температура, °C Источник
Ж ₽ (а Со) + (Сг) 46,5; 39,9; 53,2 1395 [1]
43,8; - 1395 [3]
45,5; -; - 1400 [4]
(Сг) * а* 1260-1270 [1-3]
(Сг) * а + (аСо) 52,4; -54; 43,3 -1260 [1]
““l ““ 1255 [4]
(аСо) + а •* (еСо) 967 [1]
38,1; -54; -40 -965 [3]
-44; -; - 990 [4]
Фаза с имеет интервал гомогенности протяженностью -53—68% (ат.) Сг [1—3].
Введение Сг повышает температуру полиморфного превращения
а Со и еСо и снижает температуру перехода Со из ферро- в пара-
магнитное состояние с -1125 °C для 100 % (ат.) Со до 720—740 °C
и -500 °C для сплавов с 7—10 до 12—15 % (ат.) Сг соответственно
[1, 5]. Богатые Со сплавы претерпевают мартенситное превра-
щение [X].
На основании данных термического анализа, измерения твердости
и удельного электросопротивления в работе [4] сообщается об обра-
зовании областей упорядочения в богатых Сг твердых растворах на
основе Со: Со3Сг (ар при 620 °C, Со2Сг (а2) при 640 °C и Со3Сг2
при 625 °C, между которыми протекают эвтектоидные превращения
при температурах 605 и 615 °C и содержаниях 28,35 и 42,5 % /ат.)
Сг соответственно.
Фаза о (53—68 % (ат.) Сг) имеет тетрагональную структуру типа
(pU), символ Пирсона /РЗО, пр.гр. Р^/тпт, а = 0,8740,883 нм,
с = 0,4540,457 нм [5—7]. При температуре 1280—1300 °C сплав
с 64 % (ат.) Сг имеет ОЦК решетку (Сг), а = 0,2933±0,0001 нм [1].
В работе [7] указывается на наличие упорядочения в фазе
а [7].
В работах [5, 8] сообщается об образовании высокотемпературной
фазы S в богатых Сг сплавах, которая распадается на (Сг) и фазу о
Со—Си
15
по эвтектоидной реакции при 1260 °C [8]. Фаза б имеет кубическую
структуру типа А15 (W3O), а = 0,455*0,457 нм [5]. В работе [X]
приведен вариант диаграммы состояния с образованием б-фазы в
системе. В более поздних и детальных исследованиях [1—3], прове-
денных на сплавах более высокой чистоты, ее существование не
подтверждено.
Литература
1. Allibert С., Bernard С., Valignat N., Domber М. // J. Less-Common Met. 1978.
V. 59. N 2. P. 211-228.
2. Driole J., Allibert C., Bonnier E. // Metall. 1979. V. 33. N 5. P. 471—474.
3. Hasebe Mitsuhiko, Oikawa Kei, Nishizawa Taiji // J. Japan Inst. Metals. 1982.
V. 46. N 6. P. 577-583.
4. Григорьев A.T., Ю-Пу E., Соколовская EM. // Журнал неорганической химии.
1961. Т.6. № 7. С. 1616-1621.
5. Jukawa N., Hida М., Imura Т. et al. // Metall. Trans. 1972. V. 3. N 4.
P. 887—895.
6. Dickins C.J., Douglas A.M., Taylor W.H. // J. Iron Steel Inst. (London) 1951.
V. 167. P. 27; // Acta Crystallogr. 1956. V. 9. P. 297-303.
7. Kasper J.S., Decker B.F., Belangar J.R. 11 J. Appl. Phys. 1951. V. 22.
P. 361-362.
8. Elsez A.E., Westerman A.B., Manning G.K. // Trans. AIME. 1949. V. 180.
P. 579- 602; V. 185. P. 298-300.
К.Б. Поварова
Co—Си. КОБАЛЬТ—МЕДЬ
Диаграмма состояния Со—Си приведена на рис. 4 согласно работе
[1], в которой обобщены экспериментальные и термодинамические
данные различных исследователей. Система Со—Си является диаг-
раммой перитектического типа. В твердом состоянии имеет место
эвтектоидное превращение [3]. Указанные реакции приведены в
табл. 4.
Таблица 4. Нонвариантные реакции в системе Со—Си [3]
Реакция Содержание Си в фазах, % (ат.) Температура, °C
Ж + («Со) - (Си) 94,9; 12,6; 91,6; 1112
(«Со) - (еСо) + (Си) 0,1; 0,04; 99,96 421
Ретроградный характер линии солидуса со стороны Со был уста-
новлен в работе [3]. Максимальная растворимость Си в (аСо) дости-
гается при температуре 1367 °C и составляет 19,7 % (ат.) [3].
Растворимость в интервале температур 1100—900 °C приведи а в
табл. 5.
16
Co—Си
CO
Си, % (am.)
Си
Рис. 4. Со—Си
Таблица 5. Растворимость Со и Си в твердом состоянии
Температу- ра, “С Растворимость, % (ат.)
Си в (Со) Со в (Си)
[31 [4] [5] [3] [5]
1100 12,3 — 13,0 8,0 13
1080 И 10,5 13,0 7,3 7,6
1050 9,4 8,7 — 6,3 —
1040 — — 10,5 — 6,2
1030 6,9 6,8 9,2 4,6 4,8
950 5,6 — 7,3 3,5 3,8
900 4,7 — 4,8 2,8 2,9
В сплавах системы Со—Си в результате сильного переохлаждения
(на 100 °C и более) появляется область несмешиваемости в жидком
состоянии, которая почти симметрична относительно оси составов.
При эквиатомном составе критическая точка смешения лежит на
90 °C ниже кривой ликвидуса [6].
В работах [7—10] приведены расчеты диаграммы Со—Си, резуль-
таты которых согласуются с экспериментальными данными.
Co—Dy
17
Литература
1. Nishizawa T., Ishida K. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 2.
P. 161-165.
2. Григорьев A.T., Пантелеймонов Л.А., Витинг Л.М., Куприна В.В. // Журнал
неорганической химии. 1956. Т.1. № 5. С. 1064—1066.
3. Hasebe М., Nishizawa Т. // Calphad. 1980. V. 4. N 2. Р. 83—100.
4. Bruni F.J., Christian J.W. // Mater. Sci. Eng. 1972. V. 9. N 4. P. 241-242.
5. Old C.F., Haworth C.W. // J. Inst. Met. 1966. V. 94. N 8. P. 303-304.
6. Nakagawa Y. // Acta Metall. 1958. V. 6. N 11. P. 704-711.
7. Kaufman L. // Calphad. 1978. V. 2. P. 117-146.
8. Lee Y.M., Russei K.C., Aaronson HJ. // Ser. Metal. 1981. ¥.15. N 7. P. 723-726.
9. Кузнецов Г.М., Федоров B.H., Токарчук И.Н. 11 Изв. вузов Цветная метал-
лургия. 1983. № 4. С. 78—81.
10. Taskinen Р. // Z. Metallkundc. 1982. Bd. 73. N 7. S. 445—450.
H.P. Бочвар
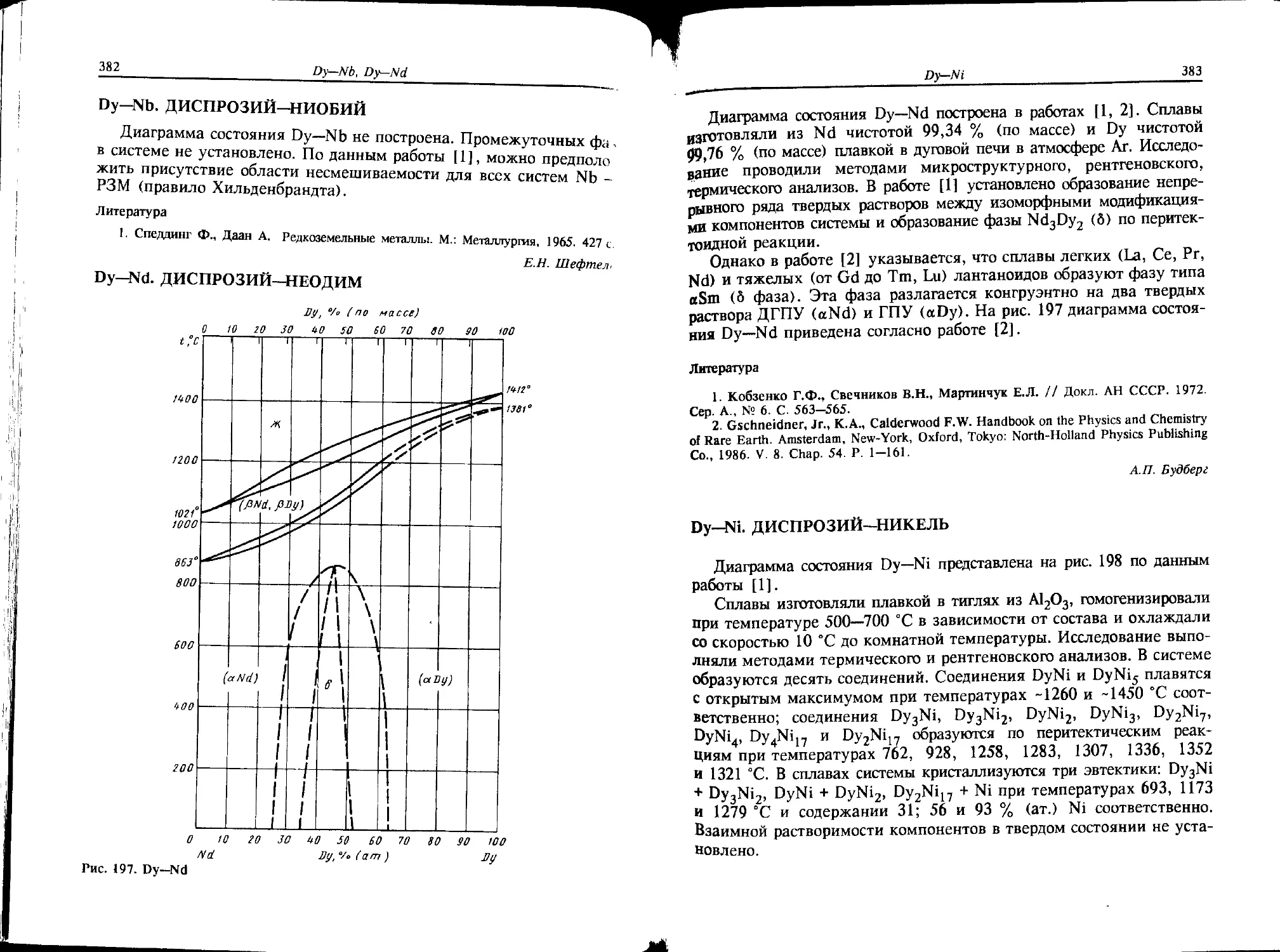
Со—Dy. КОБАЛЬТ—ДИСПРОЗИЙ
Диаграмма состояния Со—Dy (рис. 5) в полном интервале концен-
траций изучена и подробно описана в работе [1]. Сплавы синтезиро-
вали в дуговой печи в атмосфере Аг и гомогенизировали в эвакуиро-
ванных кварцевых ампулах. Для получения сплавов использовали Со
чистотой 99,98 % (по массе) и Dy чистотой 99,82 % (по массе).
Исследование выполнено с помощью микроскопического, рентгено-
структурного и дифференциального термического анализов.
В работе [1] подтверждено существование семи известных ранее
соединений [2]. Формулы для трех из них несколько отличаются
друг от друга. Вместо CogDy, Co5Dy и Co2Dy3 обнаружены Co17Dy2,
Со5 2Dy и CoDyx.
Дополнительно найдено соединение Co3Dy4, структура которого
исследована в работе [3]. Состав соединения CoDyх уточнен в работе
[4], он описывается формулой Co7Dy12.
Три соединения образуются из расплава: Co17Dy2 (1390 °C),
Co3Dy (1370 °C) и Co7Dy12 (765 °C), все остальные фазы — по
перитектическим реакциям:
Ж + Co17Dy2 « Со5 2Dy при 1350 °C;
Ж + Со3Ьу ** Co7Dy2 при 1350 °C;
Ж + Co3Dy « Co2Dy при 1275 °C;
Ж + (aDy) CoDy3 при 875 °C.
Соединение Со5 2Dy существует в узком интервале температур
(1360—ИЗО °C). ’ В системе кристаллизуются четыре эвтектики:
CoDy3 + Co7Dy12 при 755 °C;
Co7Dy12 + Co2Dy при 745 °C;
Co7Dy2 + Со5 2Dy при 1345 °C;
Co17Dy2 + (aCo) при 1365 °C.
IS
Co—Dy
Взаимная растворимость компонентов в твердом состоянии практи-
чески отсутствует.
Кристаллическая структура всех известных соединений наиболее
полно описана в работе [5] (табл. 6). Как видно из таблицы, для
соединения Co17Dy2 установлено два типа кристаллической
структуры.
Со-Er
19
Таблица 6. Кристаллическая структура соединений системы Со-45у (5]
Соединение Прототип Символ Пирсо- на, пр.гр. Параметры решетки, нм.
a b c
Col7Dy2 Th2Nin ЛР38, Р63/ (ттс) 0,8356 — 0,8113
CO|7Dy2 Th2Zn)7 АЛ19, R3m 0,8346 — 1,2180
С°5,2ПУ CaCu5 hP6, Р6/(ттт) 0,4923 — 0,3983
Co7Dy2 Co7Er2 hR\&, 0,4992 — 3,613
R3m
Co3Dy Ni3Pu —. 0,4995 — 2,436
R3m
Co2Dy Cu2Mg cF24, 0,7188 — —
Fd3m
Co3Dy4 Co3Ho4 hP22, Pf>3/m 1,1448 — 0,3994
Co7Dy)2 Co7Ho12 mP38, P2jc 0,836 1,125 1,392
CoDy3 Fe3C oP\b, Pnma 0,6965 0,9341 0,6233
'p - 138,8”.
Литература
1. Buschow K.H.J. // Phillips Res. Rep. 1971. V. 26. N 1. P. 49—64.
2. Wood J.D., Conard G.P. // Rare Earth Research. Conf. II. New York. 1964.
P. 209-217.
3. Lemaire R., Schweizer J., Makinthos J. // Acta Crystallogr. B. 1969. V. 25. N 4.
P. 710-713.
4. Adams W., Moreau J.M., Parthe E. et al. // Acta Crystallogr. B. 1976. V. 32. N 9.
P. 2697-2699.
5. Гладышевский Е.И., Бодак 0.11. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О. И. Бодак, В. К. Печарский
Со—Ег. КОБАЛЬТ—ЭРБИЙ
Диаграмма состояния Со—Ег (рис. 6) в полном интервале концен-
траций изучена и подробно описана в работах [1,2] с учетом резуль-
татов работы [3], в которой формула соединения, содержащего около
67 % (ат.) Ег, имеет вид Со7Ег12 (вместо СоЕгх или СоЕг2). Сплавы
20
Co—Er
синтезировали в дуговой печи в атмосфере Аг й гомогенизировали в
эвакуированных кварцевых ампулах с использованием Со чистотой
99,98 % (по массе) и Ег чистотой 99,82 % (по массе). Исследование
выполнено методами микроскопического, рентгеноструктурного и
дифференциального термического анализов.
Рис. 6. Со—Ег
В системе установлено восемь соединений. Три соединения обра-
зуются из расплава: Со^Ег (1359 °C), Со3Ег (1380 °C) и Со7Ег12
(810 °C), все остальные фазы — по перитектическим реакциям:
Ж + (аСо) * Со17Ег2 при 1345 °C;
Ж + Со3Ег * Со7Ег2 при 1345 °C;
Ж + Со3Ег - Со2Ег при 1355 °C;
Ж + (Ег) СоЕг3 при 900 °C.
Со-Er
21
Соединение Со6Ег существует в узком интервале температур
(1355-1150 °C).
Фаза Со3Ег4 образуется по перитектоидной реакции Со7Ег12 +
+ Со2Ег * Со3Ег4 при температуре -740 °C.
Взаимная растворимость компонентов в твердом состоянии прак-
тически отсутствует.
В системе кристаллизуются четыре эвтектики: СоЕг3 + Со7Ег,2
при 800 °C; Со7Ег12 + Со2Ег при 795 °C; Со7Ег2 + Со6Ег при 1330 °C;
Со17Ег2 + Со6Ег при 1335 °C.
Кристаллическая структура всех известных соединений системы
Со—Ег представлена в табл. 7 согласно работам [2, 3, 4].
Таблица 7- Кристаллическая структура соединений системы Со—Ег
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм
a b c
С0|7Ег2 Th2Ni[7 АР38, Р63/ттс 0,8310 — 0,8113
Со6Ег CaCu5 hP6, Pf>! ттт 0,4870 — 0,4002
Со7Ег2 Co7Er2 AR18, 0,4960 — 3,5467
R3m
Со3Ег Ni3Pu 0,4072 — 2,4179
R3m
Со3Ег4 Со3Но4 hP22, P63lm 1,132 — 0,3967
Со2Ег Cu2Mg cF24, 0,7148 — —
Fd3m
Со7Ег12 Со7НО|2 P38, P2{/c 0,830 1,116 1,182
СоЕг3 Fe3C OP16, Pnma 0,6902 0,9191 0,6189
*₽ - 138,7”.
Литература
1. Buschow K.H.J. // Phillips Res. Rep. 1971. V. 26. N 1. P. 49-64.
2. Buschow K.H.J. // Z. Metallkunde. 1966. Bd. 57- N 10. S. 728-737.
3. Adams W., Moreau J.M., Parthe E. etal. // Acta Crystallogr. B. 1976. V. 32. N 9.
P. 2697-2699.
4. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
22
Co-Fe
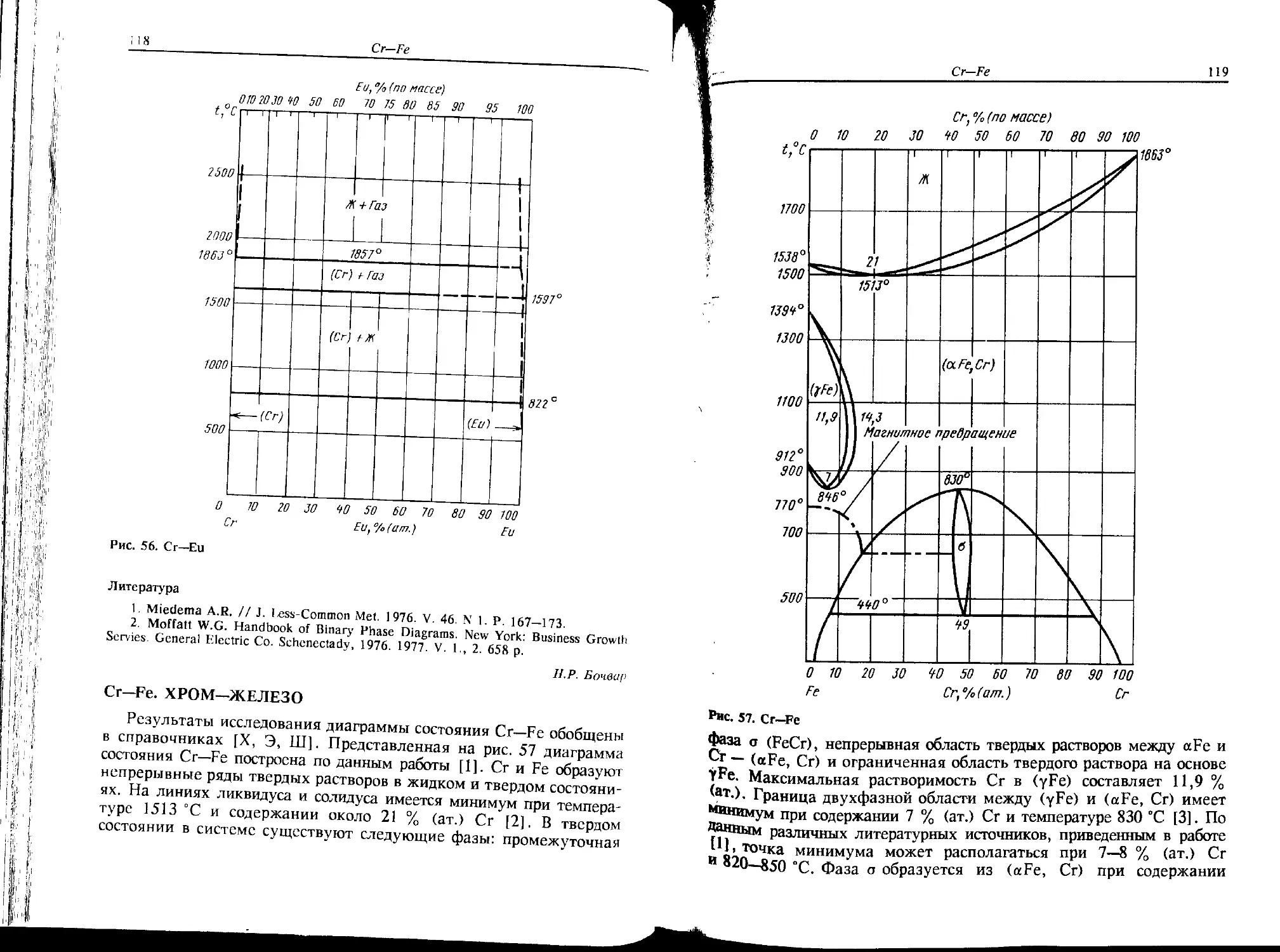
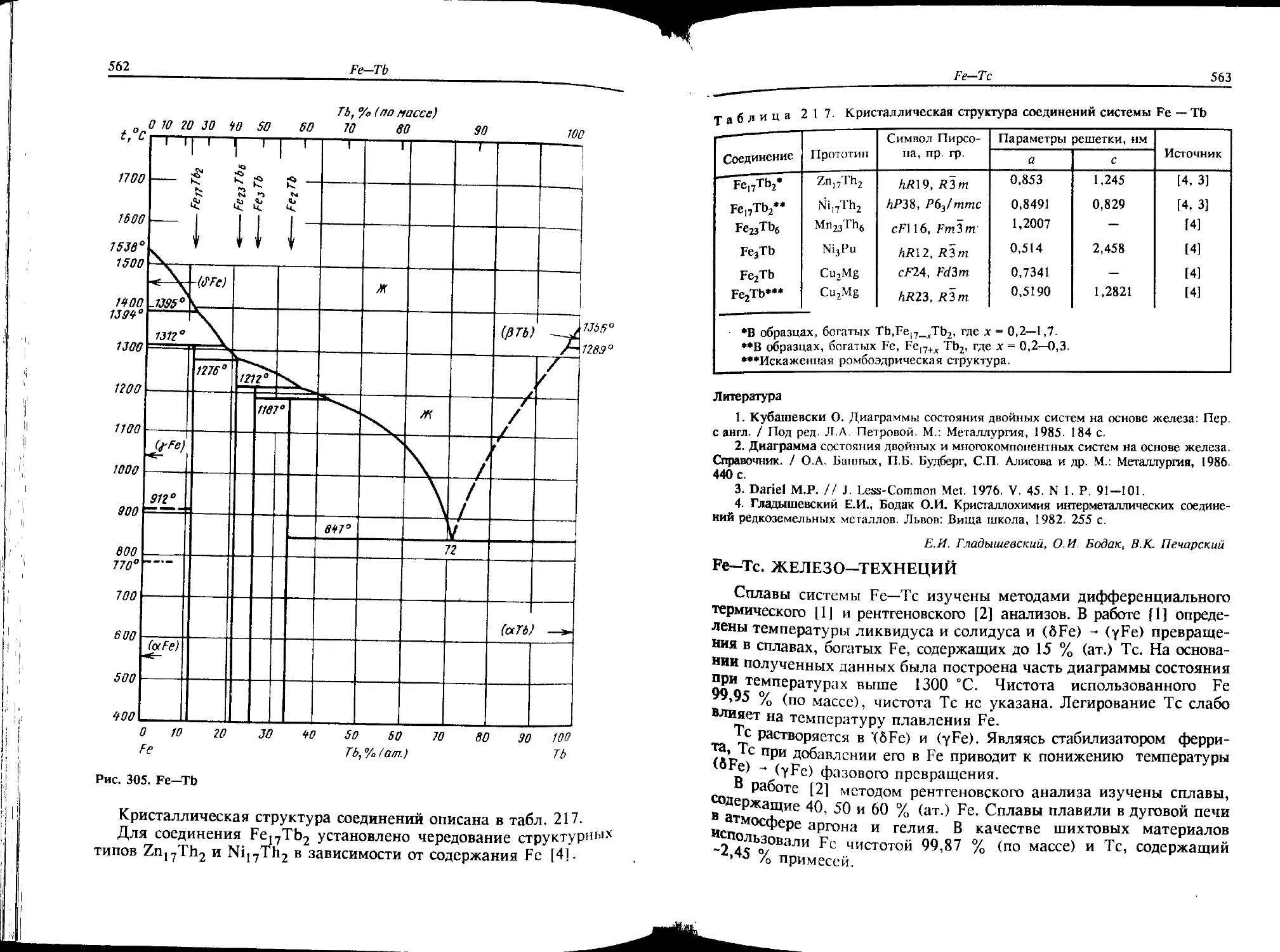
Co-Fe. КОБАЛЬТ—ЖЕЛЕЗО
В связи с большой технической важностью этой системы (магнит-
ные сплавы, некоторые сорта специальных сталей и др.) она исследо-
валась многократно. Приведенный на рис. 7 вариант диаграммы
состояния основан на данных двух специализированных справочных
изданий [1, 2] и обзорной статьи [3]. Приведенные в них результаты
хорошо согласуются друг с другом.
Со, "Л (по массе)
Рис. 7. Со—Fe
Промежуточные фазы в системе отсутствуют. При температуре
1494 °C происходит перитектическое превращение Ж + (aFe) « (yFe).
Между (yFe) и высокотемпературной модификацией (аСо) образует-
ся непрерывный ряд твердых растворов (yFe, аСо); кривые ликви-
Co—Go.
23
дус—солидус имеют минимум при температуре 1475 °C, и содержании
65 % (ат.) Со.
Растворимость Со в (aFe) также весьма велика. Кривые превраще-
ния (aFe) * (yFe, аСо) имеют максимум при содержании 45 % (ат.)
Со и температуре 985 °C [2, 3] или -970 °C [1]. При понижении
температуры происходит упорядочение по типу CsCl за счет перехода
второго рода (максимум температуры упорядочения соответствует
733 °C при концентрации 48 % (ат.) Со). Фаза упорядочения обозна-
чена FeCo. Скептицизм в отношении этой фазы, выраженный в
работе [2], представляется неоправданным. Сведения о других упоря-
доченных фазах, упоминаемые в работах [1—3], не подтвердились.
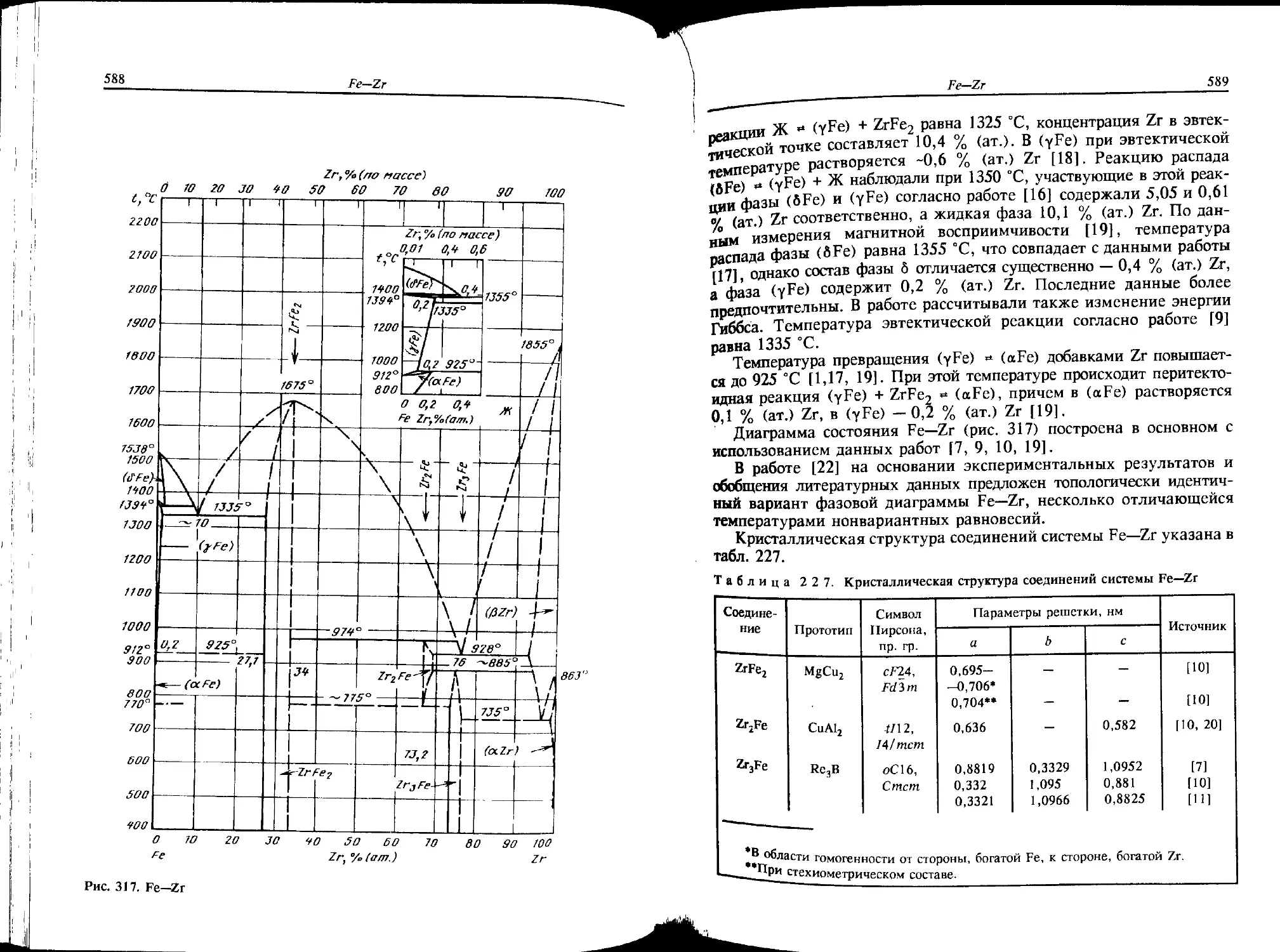
Некоторое сомнение вызывают границы (aFe) и (yFe, аСо) в области
• концентраций 70—90 % (ат.) Со. В работе [3] указывается на более
узкую двухфазную область, но эти данные считаются менее надеж-
ными.
Пересечение линий точек Кюри (TJ с границами твердых раство-
ров происходит при содержании 15 % (ат.) Со и 69 % (ат.) Со.
Что касается равновесий при переходе от (еСо) к (аСо) их изуче-
ние затруднено из-за низкой температуры перехода и малого разли-
чия энергии Гиббса превращающихся фаз. Кроме (еСо) и (аСо) в
этой области составов сплавов наблюдалась фаза т) с четырехслойной
гексагональной плотноупакованной структурой типа La, считающая-
ся, однако, метастабильной [3].
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.с
англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
2. Диаграммы состояния двойных и многокомпонентных систем на основе железа.
/ О.А. Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с.
3. Nishizawa Т„ Ishida К. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3.
P. 250—259.
B.H. Кузнецов
Co—Ga. КОБАЛЬТ—ГАЛЛИЙ
Исследование диаграммы состояния и кристаллических структур,
образующихся в системе Со—Ga, посвящен ряд работ [X, Э, Ш,
1—6]. Диаграмма состояния системы во всем интервале концентраций
построена в работе [4] и представлена на рис. 8. Авторами работы
[5] приведен еще один ее вариант, в основном подтверждающий
данные работы [4]. В работе [3] диаграмма состояния, построенная
в интервале концентраций 20—70 % (ат.) Ga, также в основном
согласуется с данными работы [4].
Сплавы синтезировали в индукционной печи в тиглях из оксида
алюминия в атмосфере чистого Аг, отжигали в эвакуированных
24
Co—Ga
Рис. 8. Co—Ga
кварцевых ампулах при 400—600 °C 1 месяц, при 600—800 °C 15
суток и при 1000 °C 4 суток. Для получения сплавов использовали
'gi Ga чистотой 99,99 % (по массе) и Со чистотой 99,99 % (по массе).
'' Исследование выполняли методами микроскопического, рентгеновско-
1 го фазового и структурного, микрорентгеноспектрального и термичес-
кого анализов.
В системе Со—Ga образуются два соединения — CoGa и CoGa3,
оба по перитектическим реакциям:
Ж + Со - CoGa при 1210 °C;
Ж + CoGa * CoGa3 при 855 °C.
фаза CoGa имеет довольно значительную область гомогенности, а
' фаза CoGa3 — узкую область гомогенности и образуется при практи-
чески идеальном стехиометрическом составе и постоянном содержа-
нии обоих компонентов.
Все три известных в литературе варианта диаграммы состояния
рассматриваемой системы отличаются между собой в основном по
ширине области гомогенности эквиатомного соединения. Она, по
данным разных работ, такова: 30—63 [4], 36,3—59,8 [5] и 35—53 %
(ат.) Ga [6]. Другое отличие состоит в интерпретации фазовых
равновесий богатой Со области. В работе [4] не учтен полиморфизм
Со. Авторы работы [5] считают, что Ga стабилизирует высокотемпе-
ратурную модификацию Со при охлаждении до комнатной темпера-
туры. В работе [6] указывается, что добавки Со лишь несколько
понижают температуру его полиморфного превращения.
Растворимость Ga в твердом Со при различных температурах
приведена ниже.
Температура, °C......... 1210 1100 800 700 600
Растворимость Ga, % (ат.) ... 19 18,5 16,3 14,5 14
Данные по кристаллическим структурам в системе Со—Ga пред-
ставлены в табл. 8.
Таблица 8. Кристаллическая структура соединений системы Со—Ga
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а с
CoGa3 CoGa Irln3 CsCl Р4п2 сР2, РтЗт 0,626 0,2862 (9)— -0,2882 (9) 0,648 [6] [2]
С увеличением концентрации Ga параметр кубической решетки
CoGa увеличивается по кривой с максимумом: от 0,2875 нм при
34,4 % (ат.) Ga до максимального значения 0,2882(9) нм при 50,0 %
<ат.) Ga и затем снижается до 0,2852(9) нм при 57,8 % (ат.) Ga [2].
26
Co—Gd
Литература
1. Ommen A.H., Waegemaekers A.A.H.J., Moleman A.C. et al. // Acta Metall. 1981.
V. 29. N 1. P. 123-133.
2. Henig E.-T., Lukas H.-L., Petrov E. // Z. Metallkunde 1982. Bd. 73. N 2.
S. 87-91.
3. Wunsch K.M., Watchel E. // Z. Metallkunde. 1982. Bd. 73. N 5. S. 311-315.
4. Feschotte R., Eggimann D. // J. Less-Common Met. 1979. V. 63. N 1. P. 15—30.
5. Lu Xuesjian, Liang Ying-Kui, Zhang Dao-Fan. // Acta. Rhys. Sin. 1980. V. 29.
N 5. P. 557-565.
6. Schubert K., Lukas H.G., Meizner H.-G. et al. // Z. Metallkunde. 1959. Bd. 50.
N 9. S. 534-540.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Со—Gd. КОБАЛЬТ—ГАДОЛИНИЙ
Диаграмма состояния Со—Gd в полном интервале концентраций
изучена и подробно описана в работах [1—5]. Результаты этих работ
отличаются как по количеству установленных двойных соединений,
так и по их составам и температурам образования.
Представленная на рис. 9 диаграмма состояния приведена в основ-
ном по данным работы [5].
Сплавы синтезировали в высокочастотной печи в корундовых
тиглях, а затем переплавляли в дуговой печи в атмосфере Аг и
гомогенизировали в эвакуированных кварцевых ампулах. Для полу-
чения сплавов использовали Со чистотой 99,90 % (по массе) и Gd
чистотой 98,4 % (по массе). Исследования выполняли с помощью
микроскопического, рентгеноструктурного и дифференциального
термического анализов.
В системе Со—Gd образуется восемь соединений.
Представленная на рис. 9 диаграмма состояния скорректирована
в соответствии с данными работ [2, 6,7], согласно которым соедине-
ния Co5Gd и Co17Gd2 имеют области гомогенности [2, 7], а соедине-
ние при концентрации около 37 % Со имеет формулу Co7Gd12 [6].
Кроме того, согласно работам [2, 7] соединение CocGd распадается
на соединения Co7Gd2 и Co17Gd2 и соединение Co17Gd2 претерпевает
полиморфное превращение. На полиморфизм соединения Co17Gd2
указывалось также в работах [9, 10]. В работах [5, 8] указывалось,
что соединение Co7Gd2 также претерпевает полиморфное превраще-
ние.
В работе [11], в отличие от работы [5], установлено образование
только семи соединений, причем конгруэнтно плавящемуся соедине-
нию при 1370 °C приписана формула Co17Gd3. Как видно из диаг-
раммы состояния (рис. 9), из расплава при 1385 °C образуется соеди-
нение Co17Gd,. Все остальные фазы образуются по перитектическим
реакциям (таол. 9).
Co—Gd
27
Рис. 9. Со-Gd
28
Co—Gd
Взаимная растворимость компонентов в твердом состоянии прак-
тически отсутствует.
В системе кристаллизуются две эвтектики [5]: Co7Gd12 + Co3Gd4
при 650 °C; CoI7Gd2 + (аСо) при 1365 °C. По данным работы [11]
также образуются две эвтектики: CoGd3 + Co3Gd4 содержит 35,8 %
(ат.) Со и плавится при 645 °C; Co]7Gd2 + (аСо) содержит 92,5 %
(ат.) Со и плавится при 1341 °C.
Фазы Co5Gd и Co17Gd3 [11] при высоких температурах имеют
переменный состав, который описывают стехиометрические формулы
Co5,6-5,4Gd и Со16 8_17 0Gd2.
Таблица 9. Нонвариантные реакции в системе Co—Gd
Реакция Температура, °C Источник
Ж + Co17Gd2 « Co5Gd 1355 [5]
Ж + Co5Gd » Co7Gd2 1300 1295 [5] [П]
Ж + Co7Gd2 * Co3Gd 1275 1277 [5] [Hl
Ж + Co3Gd » Co2Gd 1115 1116 [5] (HI
Ж + Co2Gd « Co3Gd4 665 670 [5] [111
Ж + CoGd3 CojGdjj 660 [5]
Ж + (aGd) - CoGd3 780 [5]
Согласно работе [2] область гомогенности соединения Co^Gd
при температуре 1200 °C находится в пределах составов Со4 gGd—
С°5 65^^’ а область гомогенности соединения Co17Gd2 при темпера-
туре 1200 °C составляет -1,2 % (ат.). Температура полиморфного
превращения Coi7Gd2 находится приблизительно в интервале темпе-
ратур 1175—1200 °C. Температура эвтектоидного распада Co5Gd на
Co7Gd2 и Co17Gd2 составляет 775 °C [2].
Кристаллическая структура соединений представлена в табл. 10.
Таблица 10. Кристаллическая структура соединений системы Со—Gd [12]
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм
a b с
Col7Gd2 (ВТ) Th2NiJ7 hP3&, Р(>3/mmc 0,8364 — 0,8141
Col7Gd2 (HT) Th2Zni7 hR19, R3m 0,8367 — 1,2186
Co—Gd
29
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм
a b c
Co5Dy CaCu5 hP6, Pf>l ттт 0,4973 — 0,3969
Co7Gd2 (ВТ) Co7Er2 /1R18, 0,5022 — 3,624
R3m
Co7Gd2 (НТ) Ni7Ce2 АР36, Р63/ттс 0,5022 — 2,419
Co3Gd Ni3Pu 0,5039 — 2,4522
R3m
Co2Gd Cu2Mg cF24, 0,72561 — —
Fd3m
Co3Gd4 Co3Ho4 hP22, P63/m 1,161 — 0,4048
COj Gd12 Co7HO|2 mP38, P2jc 0,841 1,139 1,402
CoGd3 Fe3C 0PI6, Pnma 0,705 0,954 0,632
*P = 138,8°.
Литература
1. Lihl F., Ehold J.R., Kirchmayer H.R. et al. // Acta Phys. Aus. 1969. V. 30. N 1—2.
P. 164-175.
2. Buschow K.HJ., Broeder F.J. // J. Less-Common Met. 1973. V. 33. N 2.
P. 191-195.
3. Novy V.F., Vickery R.C., Kleber E.V. 11 Trans. AIME. 1961. V. 221. N 3.
P. 588-590.
4. Савицкий E.M., Терехова В.Ф., Буров И.В. // Журнал неорганической химии.
1962. Т.7. № 11. С. 2571—2574.
5. Buschow K.HJ., Goot A.S. // J. Less-Common Met. 1969. V. 17. N 3.
P. 249-255.
6. Adams W., Moreau J.M., Parth6 E. et al. // Acta Crystallogr. B. 1976. V. 32. N 9.
P. 2697-2699.
7. Broeder F.J., Buschow K.HJ. // J. Less-Common Met. 1972. V. 29. N 1. P. 65-71.
8. Buschow K.HJ. // Acta Crystallogr. 1966. V. 21. N 4. P. 1389-1392.
9. Destertag W., Strnat K. // Acta Crystallogr. 1966. V. 21. N 4. P. 560-565.
10. Bouchet G., Laforest J., Lemaire R. et al. // C.R. Acad. Sci Paris. 1966. V. b262.
N 9. P. 1227-1230.
11. Ge Weiging, Wu Changheng, Zhuang Yuzhi // Proc. 6th Nat. Symp. Phase Diagr.
Shenyang. Nov. 20-24, 1990. Shenyang. 1990. P. 90-92.
12. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических
соединений редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
30
Co—Ge
Co-Ge. КОБАЛЬТ—ГЕРМАНИЙ
Диаграмма состояния Со—Ge в полном интервале концентраций
изучена в работе [11 и представлена на рис. 10. Сплавы синтезирова-
ли в дуговой печи в атмосфере Аг и гомогенизировали в эвакуирован-
ных кварцевых ампулах. Для получения сплавов использовали Со и
Ge, % (па пассе)
Рис. 10. Со—Ge
Co—Cr€
31
Ge чистотой 99,99 % (по массе). Исследования выполняли с помо-
щью микроскопического, рентгеноструктурного и дифференциального
термического анализов.
Из шести обнаруженных в системе Со—Ge соединений одно
CorGej образуется с открытым максимумом при температуре
1210 °C, остальные образуются по перитектическим реакциям:
Ж + CoGe « CoGe2 при 832 “С;
CoGe, + CoGe * Co5Ge7 при 806 °C;
Ж + Co5Ge3 * CoGe при 985 “С;
Co5Ge3 + (аСо) - Co5Ge2 при 636 °C;
Ж + (аСо) « Co4Ge при 1123 °C.
Соединение Co5Ge2 существует в интервале температур 382—636 °C,
ниже указанной границы оно перитектоидно распадается.
Соединение Co4Ge имеет еще более узкие температурные границы
существования (оно эвтектоидно распадается уже при 1105 °C).
Две фазы Co5Ge3 и CoGe обладают небольшими областями гомо-
генности, которые включают в себя составы с идеальной стехио-
метрией. Эвтектика (Ge) + CoGe2 кристаллизуется при 817 °C, а
эвтектоид Co5Ge3 + Co4Ge образуется при 1105 °C.
Заметной растворимости Со в Ge не обнаружено. Растворимость
Ge в Со в интервале температур от комнатной и до 1100 °C практи-
чески не зависит от температуры и составляет около 18 % (ат.) Ge.
Кристаллическая структура соединений приведена в табл. 11.
Таблица 11. Кристаллическая структура соединений системы Со—Ge [1—4]
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм
а b С
CoGe2 CoGe2 Стеа 1,0822 0,5661 0,5661
Co5Ge7 Co^Gc^ tI24, 14тт 0,7641 — 0,5814
CoGe (*') FeSi сР8, P2J 0,4637 — —
CoGe (*2) CoGe тС16, С2/т 1,1648 0,3807 0,4945
COjGCg Ni2In hP6, Р63/ттс 0,3940 — 0,5018
_ *3 C05G ^2 — — 0,4060(3) — 0,5900(1)
1 При давлении 7,7 ГПа и температурах 500—1350 °C ’2Р - 101,103°. 3 Гексагональная сингония [1]. [2].
Структура соединения Co4Ge не известна.
32
Со-Н
Литература
1. Dayar A., Feschotte Р. // J. Less-Common Met. 1980. V. 72. N 1. P. 51—70.
2. Bhan S., Schubert К. 11 L. Metallkunde. 1960. Bd. 52. N 6. S. 327-339.
3. Larchev V.I., Popova S.V. // J. Less-Common Met. 1982. V. 87. N 1. P. 53—57.
4. Lecoq P. // Ann. Chim (Rome). 1963. V. 8. P. 85—116.
Е.И. Гладышевский, OH. Бодак, В. К. Печорский
Со—Н. КОБАЛЬТ—ВОДОРОД
Растворимость Н в (аСо) при 100—1492 °C подчиняется закону:
Igx = 0,51gp - 2,89 - 1680/Т (Ц;
Igx = 0,51gp - 3,08 - 1370/Т [2],
где х — концентрация Н, % (ат.); р — давление, Па; Т — темпера-
тура, К.
Значительно больше Н растворяется в жидком Со при 1492—
1700 °C.
Igx = 0,51gp - 2,27 - 2140/71 [1];
Igx = 0,51gp - 2,50 - 1670/7° [2].
Гидриды Со : СоН и СоН2 разлагаются при нагреве выше 150 и
45 °C соответственно.
Рис. 11. Со-Н
Co—Hf
33
В работах [3—6] обобщены известные данные о взаимодействии Со
с Н, что позволило построить высокотемпературный участок диаграм-
мы состояния Со—Н при Рн^ = 50 МПа (рис. 11). Водород понижает
температуру плавления и повышает точку полиморфизма Со, в
соответствии с чем диаграмма включает газоэвтектическос и газопе-
ритектоидное равновесия.
Растворимость Н в (гСо) меньше, чем в (аСо). При полиморфном
превращении (аСо) (еСо) растворимость Н в Со уменьшается
примерно в 2 раза [6].
Литература
1. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с немецк. / Под ред.
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
2. Fromm Е., Jenn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324—326.
3. Шаповалов В.И., Сердюк Н.П. // Доповод УРСР. 1979. № 2. С. 151—154.
4. Шаповалов В.И., Сердюк Н.П. // Журнал физической химии. 1979. Т. 53.
№ 9. С. 2187-2191.
5. Шаповалов В.И., Сердюк Н.П. // Изв. вузов. Черная металлургия. 1980. № 12.
С. 13-17-
6. Шаповалов В.И., Бойко Л.В. // Изв. вузов. Черная металлургия. 1984. № 8.
С. 122-125.
В. И. Шаповалов
Co—Hf. КОБАЛЬТ—ГАФНИЙ
Диаграмма состояния Co—Hf изучена в работах [1—4]. В работе
[5] окончательно установлены структуры соединений и уточнено
строение области, богатой Со. Все эти данные обобщены в работе [6]
и представлены на рис. 12.
В системе образуется шесть соединений.
Соединение Hf2Co образуется по перитектической реакции (Ж +
+ HfCo * Hf2Co) при температуре 1315 °C. Состав соединения сме-
щен от идеального в сторону Hf.
Соединение HfCo конгруэнтно плавится при 1640 °C. Область
гомогенности ее невелика.
Фаза Лавеса HfCo2 существует в значительном интервале концен-
траций, конгруэнтно плавится при 1670 °C.
Вблизи состава HfCo4 согласно работе [5] существуют два
соединения: Hf2Co7 и Hf6Co23, образующиеся по перитектическим
реакциям.
Кроме того, в небольшом интервале температур существует соеди-
нение HfCo7 [2].
Кристаллическая структура соединений приведена в табл. 12.
2 Зак. 2144
34
Co—Hf
Co, в/о (по массе)
Рис. 12. Co—Hf
Таблица 12. Кристаллическая структура соединений системы Hf—Со
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм Источник
а b С
Hf2Co Ti2Ni cF96, Fd3m 1,207* — — 15]
HfCo CsCl сР2, РтЗт 0,3164 — — 15]
HfCo2 MgCu2 cF24, Fd3m 0,6932— -0,6839 — — [6]
Hf2Co7 Zr2Ni7 тСЗб, СИ т 0,4444 0,8191 1,214 [5]
Со-Но
35
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм Источник
а Ь с
Hf6Co23 Th6Mn23 сП 16, РтЗт 1,1502 — — [5]
HfCo7 HfCo7 tP32, РМ ттт 0,7070 — — [5]
*При концентрации 33 % (ат.) Hf.
Литература
1. Свечников В.Н., Кочержинский Ю.М., Пан В.М. / / Вопросы металлургии и
металловедения: Сб. статей. Киев: АН УРСР, 1962. № 16. С. 220—223.
2. Свечников В.Н., Шурин А.К., Дмитриева Г.П. и др. // Диаграммы состояния
металлических систем. М.: Наука. 1968. С. 153—156.
3. Свечников В.Н., Шурин А.К., Дмитриева Г.П. и др. // Изв. АН СССР. Метал-
лы. 1969. № 1. С. 214-218.
4. Кочержинский Ю.М., Маркив В.Я., Петьков В.В. // Изв. АН СССР. Металлы.
1973. № 1. С. 189-195.
5. Buschow K.H.J., Wernick J.H., Chin G.Y. // J. Less-Common Met. 1978. V. 59.
P. 61—67-
6. Kubaschewski-von Goldbeck O. // Atomic Energy Review. Special Issue N 8
Hafnium: Physico-Chemical Properties of its Compounds and Alloys. Vienna: International
Atomic Energy Agency. 1981. P. 57—118.
B.H. Кузнецов
Co—Но. КОБАЛЬТ—ГОЛЬМИЙ
Диаграмма состояния Со—Но в полном интервале концентраций
изучена в работах [1,2] и представлена на рис. 13.
Сплавы синтезировали в дуговой печи в атмосфере Аг и гомогени-
зировали в эвакуированных кварцевых ампулах. Для получения
сплавов использовали Со чистотой 99,98 % (по массе) и Ег чистотой
99,82 % (по массе). Исследование выполнено методами микроскопи-
ческого, рентгеноструктурного и дифференциального термического
анализов.
В системе образуются восемь соединений. Три соединения образу-
ются из расплава: Со17Но2 (1370 °C), Со3Но (1390 °C) и Со7Но12
(795 °C), четыре соединения — по перитектическим реакциям:
Ж + Со17Но2 « Со5 5Но при 1355 °C;
Ж + Со3Но Со7Но2 при 1365 °C;
Ж + Со3Но - Со2Но при 1330 °C;
Ж + (Но) СоНо3 при 895 °C.
Соединение Cos sHo существует в узком интервале температур
1355—Ц50 °C.
2*
36
Co—Hf
Ho Co, a/o (am.) Co
Рис. 13. Co—Ho
Фаза Co3Ho4 образуется по перетектоидной реакции
Co7Ho12 + Co2Ho «* Co3Ho4 при 755 °C.
Взаимная растворимость компонентов в твердом состоянии прак-
тически отсутствует.
В системе кристаллизуются четыре эвтектики: СоНо3 + Со7Но, 2
при 770 °C; Со7Но12 + Со2Но при 775 °C; Со7Но? + Сое сНо при
1340 °C; Со17Но2 + (аСо) при 1345 °C.
Кристаллическая структура всех известных соединений системы
Со—Но по данным работ [2, 3] приведена в табл. 13.
Co—In
37
Таблица 13. Кристаллическая структура соединений системы Со—Но
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм
a b c
Со, 7Но2 Th2Nil7 ЛР38, РЬ3/ттс 0,8320 — 0,8113
Со5,5Но CaCu5 hP6, Р6/ттт 0,4881 — 0,4006
Со7Но2 Co7Gd2 hR\b, 0,4977 — 3,610
R3m
Со3Но Ni3Pu — 0,4981 — 2,429
R3m
Со2Но Cu2Mg cF24, 0,71738 — —
Fd3m
Со3Но4 Co3Ho4 hP22, P63/m 1,140 — 0,3980
Со7 Но|2 Co7Hol2 mP38, P2x/c 0,8327 1,1191 1,3871
СоНо3 Fe3C OP16, Pnma 0,6920 0,9293 0,6213
*₽ = 138,8°.
Литература
1. Buschow K.HJ., Goot A.S. // J. Less-Common Met. 1969. V. 19. N 3. P. 153—158.
2. Buschow K.H.J. // Phillips Res. Rep. 1971. V. 26. N 1. P. 49—64.
3. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Со—In. КОБАЛЬТ—ИНДИЙ
Диаграмма состояния Со—In (рис. 14) приведена в работе [1]
согласно данным работы [2]. Сплавы синтезировали как методом
порошковой металлургии, так и плавкой в защитной атмосфере
путем введения Со в жидкий In при температуре 300—600 °C. Исход-
ными материалами служили порошок In чистотой 99,99 % (по массе)
или компактный In чистотой 99,999 % (по массе); порошок Со
чистотой 99,99 % (по массе) или электролитический Со чистотой
99,74 % (по массе). Сплавы отжигали в эвакуированных кварце-
вых ампулах. Исследование выполнено с помощью микроскопи-
ческого, рентгеноструктурного и дифференциального термического
анализов.
38
Co—In
Co in, % (am.) in
Рис. 14. Co—In
При температуре 1286 °C реализуется монотектическая реакция,
состав монотектической точки отнесен к -23 % (ат.) In. При темпе-
ратурах 550 и 490 °C осуществляются перитектические превращения,
результатом чего является образование соединений Со1ц2 и Со1п3.
При температуре 156 °C происходит вырожденная эвтектическая
реакция Ж « Coln3 + (In). В работе [3] установлено образование
соединений Co3In2, Coin при температуре 200—250 °C, которые на
равновесную диаграмму (см. рис. 14) не нанесены.
Кристаллическая структура соединений Со1п2 и Со1п3 приведена
в табл. 14.
Таблица 14. Кристаллическая структура соединений системы Со-4п
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм Источник
а b с
Со1п2 CuMg2 о/48, Eddd 0,9402 0,5282 1,7846 [4]
Со1п3 CoGa3 Р4п2 0,6829 — 0,7094 [5]
Литература
1. Okamoto Н. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 2. P. 137—139.
2. Schobel J.D., Stadelmaier H.H. // Z. Metallkunde. 1970. Bd. 61. N 5. S. 342-343.
3. Хлапова A.X. // Физика редких элементов. M.: Изд-во АН СССР, 1954. Т. 1.
С. 115-120.
Co—Ir
39
4. Stadelmaier H.H., Manaktala H.K. // Acta Crystallogr. B. 1975. V. 31. N 2.
P. 374-378.
5. Катрич M.B., Матушенко H.H., Титов Ю.Г. // Кристаллография. 1977. Т. 22.
№ 1. С. 188-190.
П.Б. Будберг
Со—1г. КОБАЛЬТ—ИРИДИЙ
Диаграмма состояния Со—1г приведена на рис. 15 по данным работ
[1, 2]. Кривые ликвидус—солидус построены приближенно по данным
работы [1]. По данным работы [2] при температуре -900 °C в облас-
ти концентрации 20—30 % (ат.) 1г твердый раствор (аСо, 1г) упоря-
дочивается с образованием фазы со структурой Mg3Cd, а в области
концентраций 70—80 % (ат.) 1г при температуре 1300 °C образует
фазу, имеющую структуру Cu3Au. Вблизи состава сплава с 50 %
(ат.) 1г упорядочение согласно этим данным отсутствует [2].
40
Co—К, Co—Lu
Литература
1. Koster W., Horn E. // Z. Metallkunde. 1952. Bd. 43. S. 444-449.
2. Бернард В.Б., Куприна B.B. // Вестник Моск. гос. ун-та. Сер. Химия. 1986.
Т. 27. № 1. С. 56-59.
В.Н. Кузнецов
Со—К. КОБАЛЬТ—КАЛИЙ
В работе [1] установлено, что Со не растворяется в жидком К
вплоть до температуры его кипения (750 °C) при атмосферном давле-
нии.
По данным работы [2] присутствие 0,25 % К повышает темпера-
туры полиморфного превращения Со при нагреве от 422 до 477 °C и
понижает при охлаждении от 422 до 342 °C. Дальнейшее повышение
содержания К не влияет на температуру превращения Со.
Литература
1. Willhelm С. И Mater. Design. Eng. 1963. V. 58. N 6. P. 97-98.
2. Hashimoto V. // Nippon Kinzoku Gakkat Shi. 1938. V. 2. N 3. P. 67—69.
Л.Л. Зусман
Co—La. КОБАЛЬТ—ЛАНТАН
Система Co—La исследована многократно [1—9]. Диаграмма
состояния Со—La построена во всем интервале концентраций по
результатам микроструктурного, рентгеновского и дифференциаль-
ного термического анализов. Диаграмма приведена на рис. 16 по дан-
ным работы [1]. Состав фазы Co3La4 указан по работе [9]. Со и La
неограничено растворимы друг в друге в жидком состоянии.
При кристаллизации в системе образуется шесть промежуточных
фаз, из которых соединение CoLa3 плавится конгруэнтно при 545 °C
[1, 2] или 540 °C [9]. Соединения Co3La4 (или CoLax [1], или
Со1 7La2 [3, 4]), Co3La2, Co7La2, Co5La и Co13La образуются по
перитектическим реакциям. Соединение Co7La2 существует в двух
модификациях [Г]. По данным работ [М, 3], в системе образуется
соединение Co19La5 предположительно при температуре 868 °C. В
системе существуют две эвтектики [1—9].
Растворимость La в Со при температуре 1000 °C составляет менее
0,05 % (ат.).
Данные по нонвариантным реакциям и температурам образования
фаз в системе Со—La приведены в табл. 15, а по кристаллическим
характеристикам соединений системы — в табл. 16.
Co—La
41
Co, °/o (no массе}
Рис. 16. Co—La
42
Co—La
Таблица 15. Нонвариантные реакции в системе Со—La
Реакция Температура, °C Источник
Ж + (аСо) » Co13La 1185 (И
1275 [3]
Ж + CO|3La » Co5La 1212 [9]
1090 (И
1124 [3]
1120110 [9]
Ж + CojLa >* Co7La2 800 [1]
843 [3]
842 [9]
Ж + Co7La2 •* Co3La2 695 [11
727 [3]
720±5 [91
5K “Ь Co3La2 ** 570 [1]
596 [31
585±5 191
ж* (pLa) + CoLa3 520 [Ц
530 [9]
Ж** ” CoLa3 + Co3La4 500 [1]
518 [9]
‘При концентрации 20 [1] или 21,5 % (ат.) Со [9].
"При концентрации 31 [1] или 31,4 % (ат.) Со [9]
Таблица 16. Кристаллическая структура соединений системы Со—La
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм Источник
a b c
Co13La NaZn13 CF112, Fm3m 1,1344 — — [1]
Co5La CaCu5 hP6, 0,5100 — 0,3968 [1]
aCo7La2 Ce2Ni7 /1РЗ6, РЬ^/ттс 0,5101 — 2,4511 [1, 6]
pCo7La2 Co7Er2 /iR18, R3m 0,511 — 3,669 [11
CO|9La3 Co19Ce5 hR24, R3m 0,5127 — 0,4874 [3]
Co3La2 oC20, Cmca 1,034 0,4886 0,7811 [11
Co—Li
43
«Соединение 1 Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм Источник
а b с
\ CoLa’ — — 0,5981 — — [1]
Co17La2 Nd2Col(7 ЛР37, Pf^/mmc 0,489 — 0,431 [3, 4]
Co3La4 Zr4Al3 t/16, iMmmm 0,6063 — 0,9775 [5]
CoLa3 Fe3C oPXL Pnma 0,7277 0,7279 1,0020 1,0088 0,6575 0,6578 [1, 7] [8]
’Кубическая сингония.
Литература
1. Buschow K.H.J., Velge W.A.J. П J. Less-Common Met. 1967. V. 13. N 1.
P. 11-17.
2. Buschow K.H.J. // Phillips Res. Rep. 1971. V. 26. N 1. P. 49-64.
3. Ray A.E. // Cobalt. 1974. V. 1. P. 13-20.
4. Parthe E., Moreau J.M. // J. Less-Common Met. 1977. V. 53. N 1. P. 1—24.
5. Singh P.P., Raman A. // Mater. Res. Bull. 1968. V. 3. N 10. P. 843—844.
6. Buschow K.H.J. // Acta Crystallogr. B. 1970. V. 26. N 10. P. 1389—1392.
7. Buschow van der Goot A.S. // J. Less-Common Met. 1969. V. 18. N 3.
P. 309-311.
8. Cromer D.T., Larson A.C. // Acta Crystallogr. 1961. V. 14. N 12. P. 1226—1228.
9. Wu Chang-heng, Zhuang Yu-Zhi, Tiu Zi-mei, Guan Ziao-hua. // Proc. 5’th Nat.
Symp. Phase Diagr. Wuhan. Nov. 18—21. 1988. Wuhan. 1988. P. 33—39.
M.A. Тылкина, В.П. Полякова
Co—Li. КОБАЛЬТ—ЛИТИЙ
Co и Li полностью не смешиваются в жидком и твердом состоя-
нии. Согласно экспериментальным данным работы [1] и теоретичес-
ким расчетам, проведенным в работе [2], растворимость чистого Li
в Со в интервале температур 400—1100 °C находится в пределах
(10‘8—10'2) % (ат.) соответственно.
Литература
1. Бескоровайный Н.М., Иолтуховский А.Г. Конструкционные материалы и
жидкометаллические теплоносители. М.: Энергоатомиздат, 1983. 168 с.
2. Кузин А.Н., Люблинский И.Е., Бескоровайный Н.М. // Расчеты и эксперимен-
тальные методы построения диаграмм состояния: Сб. статей. М.: Наука, 1985.
С. 113-118.
Л. Л. Зусман
44
Co—Lu, Co—Mg
Co-Lu. КОБАЛЬТ—ЛЮТЕЦИЙ
Диаграмма состояния Со—Lu не построена. В работах [III, 1]
приведены сведения только о составах и структуре некоторых двой-
ных соединений. Данные по кристаллическим структурам всех извес-
тных соединений системы Со—Lu обобщены в работе [1] и приведены
в табл. 17.
Таблица 17. Кристаллическая структура соединений системы Со—Lu
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм
a b c
Co3Lu Ni3Pu ~“l R3m 0,4955 — 2,4101
Co2Lu Cu2Mg cF24, Fd3m 0,7122 — —
Co3Lu4 Co3Ho4 hP22, Рб^/т 1,121 — 0,392
CoLu3 Fe3C oP16, Pnma 0,687 0,903 0,614
Co17Lu2 Th2Ni17 hP3S, Pfhjmmc 0,8247 — 0,8093
Co7Lu2 Co7Er2 hRW, R3m 0,4946 — 3,598
Литература
1. Е.И. Гладышевский, О.И. Бодак. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Со—Mg. КОБАЛЬТ-МАГНИЙ
Первоначальные исследования системы Со—Mg были противоречи-
вы [X]. Более поздние исследования [1,2] показали их ошибочность.
Представленная на рис. 17 диаграмма состояния приведена по наибо-
лее полным данным, опубликованным в работе [2]. В системе образу-
ется одно соединение MgCo2, относящееся к фазам Лавеса. Образова-
ние соединения происходит при охлаждении расплава по перитекти-
ческой реакции при температуре 970 °C. Со стороны Со в системе
предполагаются превращения, связанные с полиморфным превраще-
нием (еСо) (аСо) при температуре 422 °C и переходом от состоя-
ния ферромагнетизма к парамагнитному состоянию при температуре
1121 °C.
Co—Mg
45
Рис. 17. Co—Mg
Co стороны Mg в системе имеет место эвтектическое превра-
щение при температуре 635 °C и содержании 1,9 % (ат.) [4,5 % (по
массе)] Со.
Результаты измерения параметров кристаллических решеток (Mg)
и (Со) свидетельствовали об отсутствии существенной растворимости
компонентов друг в друге в твердом состоянии [2].
Кристаллическая решетка фазы MgCo2 типа MgNi2 (символ
Пирсона ЙР24, пр.гр. Рб3/ш/ис) с параметрами а = 0,486 нм, с =
• 0,792 нм [1]. Значения параметров решетки MgCo2, по данным
работы [2], колебались в пределах: а = 0,4847 +0,4900 нм, с =
= 0,7926+0,7986 нм, с/а = 1,629 + 1,638.
Литература
1. Stadelmaier Н.Н., Yun T.S. // Z. Metallkunde. 1961. Bd. 52. N 7. S. 477^80.
2. Smith J.F., Smith M.J. // Trans. ASM. 1964. V. 57. N 1. P. 337-345.
Л.Л. Рохлин
46
Со—Мп
Co—Мп. КОБАЛЬТ—МАРГАНЕЦ /
Обобщенная диаграмма состояния Со—Мп (рис. 18) приведена по
данным аналитического обзора как наиболее достоверный вариант
[1]. В системе наблюдаются два перитектических равновесия: Ж +
+ (аСо) « (рМп) при температуре 1161 °C и Ж + (8Мп) (PMn) при
температуре -1185 °C [1] (1160 и 1190 °C соответственно, по данным
работы [2]). Кобальт снижает температуру полиморфного превраще-
ния (рМп) (аМп) и повышает температуру перехода (рМп) в
(уМп). Марганец, в свою очередь, снижает температуру полимор-
фных превращений Со.
Мп Со,°/о(ат.) СО
Рис. 18. Со—Мп
Двухфазная область (аСо) + (рМп) при температуре перитектики
расположена при содержании -59—62 % (ат.) Мп. При понижении
температуры эта область смещается в сторону Со. При температуре
545 °C по перитектоидной реакции в системе образуется соединение
МпСо, фаза а со структурой типа aCrFe, символ Пирсона (РЗО, пр.гр.
[1, 2].
В работах [3, 4] диаграмму состояния Со—Мп строили расчетным
путем. Расчетный вариант диаграммы был проверен эксперименталь-
но [4] с использованием метода диффузионных пар.
Co—Mo
47
Литература
\ 1. Ishida K., Nishizawa T. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 2.
ft 125-137.
j 2. Tsioplakis K., GOdeske T. // Z. Metallkunde. 1971. Bd. 62. N 9. S. 680—681.
I 3. Kaufman L. // Calphad. 1978. V. 2. N 2. P. 117-146.
I 4. Hasebe M., Oikawa K., Nishizawa T. // J. Japan Inst. Metals. 1982. V. 46. N 6.
РЛ577—583.
А. Л. Татаркина
СоНИо. КОБАЛЬТММОЛИБДЕН
Фазовые равновесия в системе Со—Мо исследовали, обобщали и
уточняли неоднократно [X, Э, Ш, 1—5]. Наиболее достоверной
можно считать диаграмму состояния Со—Мо (рис. 19), построенную
на основе анализа экспериментальных результатов в работе [4].
Мо Со, % (ат.) Со
Рис. 19. Со—Мо
В системе установлено существование четырех промежуточных
Фаз: Мо3Со2 (а), Мо6Со7 (ц), МоСо, (к), Мо2Со9 (0) — и граничных
твердых растворов на основе Мо и Со. Отмечается сильная темпера-
турная зависимость взаимной растворимости исходных компонен-
48
Co—Mo
тов. Растворимость Co в (Mo) равна 11,5 % (ат.) при температуре!
1620 °C и 1,5 % (ат.) при температуре 1300 °C [2, 3], растворимость
Мо в (аСо) — 19,5 % (ат.) при 1300 °C и 17,5 % (ат.) при 1200 °C
[3]. Согласно работе [5] растворимость Мо в (аСо) при различных
температурах составляет: [
Температура, ;
°C......... 1200 1100 1000 950 900 850 800 75Q
Растворимость /
Мо, % (ат.) . . 16,2 13,5 11,4 9,15 6,83 1,85 0,83 0,^6
Максимальная растворимость Мо в (еСо) не превышает 9 % (ат.)
[2]. Молибден повышает температуру е а перехода в Со. Наиболее
вероятно, что твердый раствор на основе еСо образуется по перитек-
тоидной реакции (аСо) + МоСо3 при температуре 700±150 °C [4, 6]
или 980±60 °C [X].
Фаза о (Мо3Со2) образуется по перитектической реакции Ж +
+ (Мо) при температуре 1620 °C [2], существует в интервале концен-
траций 36—37 % (ат.) Со при температуре 1510 °C [2] или 36—40 %
(ат.) Со при температуре 1200 °C [3] и эвтектоидно распадается при
температуре 1000±100 °C [3] или 1250 °C [2].
Фаза р. (Мо6Со7) образуется по перитектической реакции Ж +
+ Мо3Со2 при температуре -1510 С° [2]. Область гомогенности 51,5—
58,5 % (ат.) Со [3] или 50,5—54,5 % (ат.) Со [2] расположена в
интервале температур 1300— 800 °C [3].
Фазы МоСо3 (к) и Мо2Со9 (0) образуются в результате перитек-
тоидных реакций в твердом состоянии при температурах 1025 и
1200 °C соответственно [2]. Фаза к гомогенна в интервале концен-
траций 15—16,5 % (ат.) Со [3], 22,6—23 % (ат.) Мо при температуре
950-900 °C [5].
Фаза 0 эвтектоидно распадается на МоСо3 и а Со при температуре
1018 °C [2].
Кобальт уменьшает параметр решетки а Мо до 0,3136 нм при
содержании 8 % (ат.) Со [2]. Параметр решетки а ГЦК твердого
раствора (аСо) возрастает от 0,354 до 0,361 нм при 17 % (ат.)
Мо [5]. Параметры гексагональной решетки (еСо) увеличивают-
ся до а = 0,2507 нм; с = 0,4070 нм при содержании 8—10 % (ат.)
Мо [6].
Кристаллическая структура соединений системы приведена в
табл. 18.
Следует отметить, что область диаграммы, включающая а е
переход, в твердых растворах на основе Со требует детального рас-
смотрения.
Co—N
49
а б л и ц a 18. Кристаллическая структура соединений системы Со—Мо
«аза (сое- динение) Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а С
а 1МО3СО2) — £Р6, Р4г/ттт 0,92841 0,92287— 0,9221 0,48736 0,48269— 0,4814 При концентрации Со, % (ат.): 37 [2] 40 [7]
р. (Мо6Со7) Fe7W6 AR13, R3m 0,4675 0,4762 0,4767 0,4725 2,57 2,5615 2,565 2,542 При концентрации Со, % (ат.): 50,8 [2] 46,15 [8] а - 30,80° [7] а = 30,883° [9]
к (М0С03) Ni3Sn hP8, Pf>}/mmc 0,5133 0,5130 0,412 0,4128 При концентрации Со, % (ат.): 76 [2] 90-92 [6]
0 (Мо2Со9) Mg hP2, Pf>3/mmc 0,25988 0,42124 При концентрации 82 % (ат.) Со и температуре 1100 °C [2]
Литература
1. Sykes W.P., Graff H.F. // Trans. ASM. 1935. V. 23. P. 249-283.
2. Quinn T.J., Hume-Rothery W. // J. Less-Common Met. 1963. V. 5. N 4.
P. 314-324.
3. Huijwegen C.P., Rieck G.D. // J. Less-Common Met. 1974. V. 34. N 2.
P. 309-314.
4. Brewer L., Lamoreaux R.H. // Atomic Energy Review, Special Issue N 7 Molibde-
num: Physico-Chemical Properties of its Compounds and Alloys. Vienna: International
Atomic Energy Agency, 1980. P. 195—356-
5. Takayama T., Wey Myeong Yong, Nichizawa T. // Trans. Japan Inst. Metals. 1981.
V. 22. N 5. P. 315-325.
6. Bibring H., Graf R., Hebd C.R. // Compt. Rend. Acad. Sci. Paris. 1961- V. 252.
N 26. P. 4160-4162.
7- Forsyth J.B., D’Alte Da Veiga L.M. // Acta Crystallogr. 1963. V. 16. N 6-
P. 509-512.
8- Forsyth J.B., D’Alte Da Veiga L.M. // Acta Crystallogr. 1962. V. 15. N 6.
P- 543-546.
9. Henglein E., Kohsok H. // Revue de Metallurgie. 1949. V. 46. P. 569.
КБ. Поварова
Co—N. КОБАЛЬТ—АЗОТ
Азот практически нерастворим в (Со) при температуре 1600 °C
[1]. По данным работы [2] растворимость N в (аСо) при температуре
600 °C составляет 0,6 % (по массе) [2,5 % (ат.)]. Рентгеновским
исследованием азотированного в NH3 порошка Со при температуре
50
Co-Na
------------------------------------------------------------
380 °C установлено существование двух нитридов Co3N [7,34 % (по
массе) N] и Co2N [10,7 % (по массе) N] [2]. /
Нитрид Co3N стабилен в интервале концентраций 7,7—8 % (по
массе) N и имеет гексагональную решетку из металлических атомов:
а = 0,2663 нм, с = 0,4260 нм, с!а 1,637 [при 7,7 % (по массе) 1,4].
Нитрид Co2N изоструктурный Со2С, имеет ромбически искаженную
гексагональную упаковку с параметрами а = 0,2848 нм, Й =
= 0,4636 нм, с = 0,4339 нм. (
При электронно-графическом изучении нитридов Со в тонких
пленках обнаружены также еще три нитрида Co,N, Co_N и
Co4N [3].
Литература
1. Busch Т., Dodd R.A. // Trans. АШЕ. 1960. V. 218. Р. 488-490.
2. Yuza R„ Sachsze W. // Z. Anorg. All. Chem. 1945. Bd. 253. N 1-2. S. 95-108.
3. Terao N. 11 Met. Sci. Rev. Met. 1960. V. 57. P. 96-100.
Г.П. Жмурко
Co—Na. КОБАЛЬТ-НАТРИЙ
В работе [1] проведен теоретический расчет линии ликвидус при
температурах от 350 до -800 °C в системе Со—Na, результаты кото-
рого представлены на рис. 20.
Рис. 20. Кривая растворимости Со в жидком Na
Литература
1. Кузин А.Н., Люблинский И.Е., Бескоровайный Н.М. // Расчеты и экспери-
ментальные методы построения диаграмм состояния: Сб. статей. М.: Наука, 1985.
С. 113-118.
Л.Л. Зусман
Co—Nb
51
Co—Nb. КОБАЛЬТ—НИОБИЙ
\ Диаграмма состояния, приведенная на рис. 21, построена на
основании данных, полученных в работах [1, 2], которые на учас-
в
Исследования [1] выполнены во всем интервале концентраций на
сплавах, приготовленных в вакуумной дуговой печи в атмосфере
гелия высокой чистоты из Nb чистотой 99,9 % (по массе) и Со
электролитического чистотой 99,9 % (по массе). Сплавы подвергали
гомогенизирующему отжигу в вакуумной печи и вакуумированных
кварцевых ампулах.
52
Со-Nb
Исследования проводили методами микроструктурного, рентгенов-
ского, дифференциального термического, локального микрорентгено-
спектрального анализов, а также измерением твердости и микротвер-
дости, а для сплавов, богатых Со, измерением магнитной восприим-
чивости.
Система характеризуется наличием граничных твердых растворов
(Nb), (аСо) и (еСо) и пяти интерметаллических соединений: NbCo
(р), Ар NbCo2 (А2), NbCo, (А3), Nb2Co7 (%).
Два из них, NbCo и NbCo2, образуются конгруэнтно при темпера-
турах 1480 и 1520 °C и имеют области гомогенности [44—51 % (ат.)
Со] и [66—73 (ат.) Со] соответственно.
Фаза А[ образуется по перитектической реакции Ж + NbCo2 А]
при температуре 1420 °C, а при 1200 °C распадается по эвтектоидной
реакции А, NbCo + NbCo2. По данным работы [3] А] легко переох-
лаждается до комнатной температуры при скорости охлаждения
2,5—3 °С/с и более.
Соединение NbCo3 образуется по перитектической реакции Ж +
+ NbCo2 NbCo3 при температуре 1240 °C и существует до темпера-
туры 1000 °C, при которой эвтектоидно распадается по реакции
NbCo3 ** NbCo2 + Nb2Co7. Область гомогенности соединения NbCo3
если и существует, то ее протяженность не превышает 1 % (ат.) [1].
Соединение Nb2Co7 образуется по перитектоидной реакции
(аСо) + NbCo3 ** Nb2Co7 при температуре 1050 °C, имеет узкую
область гомогенности 77—79 % (ат.) Со.
Растворимость Со в (Nb) снижается с уменьшением температуры
и составляет 5 % (ат.) при 1370 °C [3], 4 % (ат.) — при 1150 и
600 °C [1].
Растворимость Nb в (Со) равна 4 % (ат.) при температуре
1100 °C и 1 % (ат.) при температуре 800 °C [1].
В системе протекают три эвтектические реакции: Ж (Nb) +
+ NbCo при 1370 °C, Ж * NbCo + Aj при 1370 °C, Ж * NbCo3 +
+ (а Со) при 1210 °C.
Данные по кристаллической структуре приведены в табл. 19.
Таблица 19. Кристаллическая структура соединений системы Со—Nb
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм Источник
а С
NbCo (ц.) W6Fe7 hRl 3, 0,4928* 2,63* [4]
R3m
MgZn2 hPl2, Р63/ттс 0,4834± ±0,0002 0,4835 0,4832 0,7853± ±0,0004 0,7860 0,7864 [5] [4] [И '
Со-Nd
53
\ Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм Источник
а С
\ NbCo2 (А2> NbCo, (А3) *При концентра MgCu2 MgNi2 щии 46 % сЛ24, Fd3m hP24, (ат.) Со. 0,6788 0,4735 1,5456 [1, 2J [И
Структурный тип соединения Nb2Co7 (%) не установлен.
Литература
1. Баталева С.К., Куприна В.В., Маркив В.Я. и др. // Вестник Моск. гос. ун-та.
Сер. Химия. 1970. № 4.'С. 432-437.
2. Баталева С.К., Куприна В.В., Маркив В.Я. // Труды Моск. веч. металлург,
ин-та. 1972. № 12. С. 467-469.
3. Шурин А.К., Дмитриева Г.И. // Вопросы физики металлов и металловедения:
Сб. статей. Киев: АН УССР. 1964. Т. 18. С. 175-177.
4. Raman А. // Trans. Met. Soc. AIME. 1966. V. 236. N 4. P. 561—565.
5. Кузьма Ю.Б., Шурин A.K., Дмитриева Г.И., Гладышевский Е.И. // Донов1д1
АН УРСР. 1964. № 5. С. 600-603.
Е.Н. Шефтель
Со—Nd. КОБАЛЬТ—НЕОДИМ
Диаграмма состояния Со—Nd исследована во всем интервале
концентраций [1, 2] методами дифференциального термического,
рентгеноструктурного и микроструктурного анализов и приведена на
рис. 22 по (Ml.
Сплавы выплавляли в дуговой печи из Со чистотой 99,9 % (по
массе) и Nd чистотой 99,07 % (по массе). В системе Со—Nd при
кристаллизации образуются десять промежуточных фаз. Взаимная
растворимость компонентов в твердом состоянии практически отсут-
ствует [1].
Соединение CoNd3 образуется конгруэнтно при температуре
646 °C. Остальные промежуточные фазы образуются по перитекти-
ческим реакциям: Co17Nd2 (1301 °C), Co^Nd (1266 °C), Co19Nd5
(И66 °C), Co7Nd2 (1161 °C); Co3Nd (1105 °C), Co2Nd (965 °C),
Co3Nd2 (640 °C); Co17Nd2 (599 °C), Co3Nd7 (596 °C) [MJ. Предпо-
ложительно соединения Co7Nd2 и Co3Nd2 существуют в двух моди-
фикациях. Температура полиморфного перехода Co3Nd2 — 583 °C.
В системе протекают две эвтектические реакции:
Ж « (Nd) + CoNd3 при 625 °C и 80 % (ат.) Nd;
Ж « Co3Nd7 + Coj 7Nd2 при 560 °C и 64 % (ат.) Nd.
54
Со-Nd
Рис. 22. Со—Nd
В литературе указывается также на вероятность существо-
вания соединений Co2Nd5 [3], Co3Nd4, СоиМс124, Co4Nd, Co29Nd7,
Co13Nd3 [4].
Данные работы [5], полученные на основе дифференциального
термического, рентгеновского, микрорентгеноспектрального анализов,
в интервале концентраций 50—100 % (ат.) Со подтверждают сущес-
твование семи промежуточных фаз. Однако по данным работы [5]
соединение Co17Nd2 плавится конгруэнтно при температуре 1390 °C
и образует эвтектику Ж (аСо) + CoI7Nd2 при температуре 1306 °C
и содержании 93 % (ат.) Со. Соединения Co5Nd, Co19Nd5, Co7Nd2,
Co3Nd, Co2Nd, CoNd3 образуются по перитектическим реакциям при
температурах 1266, 1152, 1116, 1110, 1050 и 650 °C соответственно.
Кристаллическая структура известных промежуточных фаз в
системе Со—Nd приведена в табл. 20.
Таблица 2 0. Кристаллическая структура соединений системы Со—Nd
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b С
CoNd3 Fe3C ОР16, Рпта 0,7107 0,9750 0,6386 [1, 6, 7]
Со-Nd
55
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
CojNd/ Mn5C2 wtC28, С2/с 1,637 0,643 0,708 [31
Co3Nd7 Fe3Th7 КР20, Pf>3mc 0,9888 — 0,5937 [1, 4]
CO| 7 Ndj — 0,4795 — 0,408 [Ц
P63/mmc 0,479 — 0,407 [7]
Co3Nd4 Zr4Al3 hPl, Р6 0,5583 — 0,958 [4]
aCo3Nd2 La2Ni3 оС8, Стеа 0,4963 1,0006 0,7569 [1]
Co2Nd MgCu2 cF24, Fdlm 0,7300 0,727 — — [8, 9] [III, 10]
Co3Nd PuNi3 АР13, Rim 0,5067 0,5073 — 2,476 2,474 [11] [12]
Co7Nd2 (ВТ) Co7Gd2 hR13, Rim 0,5059 — 3,643 [13, 14]
Co7Nd2 (HT) Ni7Ce2 AP36, P63/mmc 0,5063 — 2,445 [13]
C0|9Nd5 Col9Ce5 hR24, R3m 0,5054 — 4,866 [1]
,Co5Nd CaCu5 hP6, 0,5026 — 0,3975 [Э]
P& mmm 0,5031 — 0,3977 [15-17]
Col7Nd2 Th2Zn|7 AR 19, Rim 0,8428 — 1,2243 [17, 18]
.. C°i|Nd24 . ’P = 96,7°. Гексагон ^'^24^'^! 1 тльная сингс hP70, P63mc 1НИЯ. 0,9596 2,179 [4]
Литература
* Ray А.Е. Ц Cobalt. 1974. N 1. Р. 13-20.
2. Buschow K.H.J. Ц Phillips Res. Rep. 1970. V. 26. N 1. P. 49-64.
4- Moreau J.-M., Paccard D. // Acta Crystallogr. B. 1976. V. 32. N 6. P. 1654-1657.
< PP<’ Raman A- 11 Mater. Res. Bull. 1968. V. 3. N 10. P. 843-854.
‘ Changheng W., Yuzhi Z., Xirnei T., Xiaohua G. // Proc. 6th Nat. Symp. Phase
Br’ Shenyang. Nov. 20-24. 1990. Shenyang. 1990. P. 93-94.
56
Co-Ni
6. Buschow К.H.J., Goot A.S. // J. Less-Common Met. 1969. V. 18. N 3.
P. 309-311.
7. Parthfe E., Moreau J.-M. // J. Less-Common Met. 1974. V. 53. N 1. P. 1—24.
8. Haszko S.E. // Trans. ASM. 1960. V. 219. N 5. P. 958.
9. Ross J.W., Crangle J. 11 Phys. Rev. 1964. V. 133. P. 509A-510A.
10. Harris I.R., Mansey R.C., Raynor G.V. // J. Less-Common Met. 1965. V. 9. N 4.
P. 270-280.
11. Khan Y. // Acta Crystallogr. B. 1974. V. 30. N 6. P. 1533-1537.
12. Ostertag W. // Trans. AIME. 1967. V. 239. N 6. P. 690-693.
13. Buschow K.H.J. // Acta Crystallogr. B. 1970. V. 26. N 10. P. 1389-1392.
14. Khan Y., Feldman D. // Z. Metallkund. 1973. Bd. 64. N 12. S. 853-854.
15. Hallwell A. // J. Less-Common Met. 1959. V. 1. P. 343—347.
16. Duright A.E. 11 Trans. ASM. 1961. V. 53. P. 479-500.
17. Khan Y. 11 Acta Crystallogr. B. 1973. V. 29. N 11. P. 2502-2507.
18. Ostertag W., Strnak K. // Acta Crystallogr. 1960. V. 21. N 4. P. 560—565.
B.Z7. Полякова
Co-Ni. КОБАЛЬТ—НИКЕЛЬ
Диаграмма состояния Со—Ni (рис. 23) построена по данным работ
[1, М]. Кобальт и никель неограниченно растворимы друг в друге,
образуя непрерывный ряд твердых растворов. Температуры ликвиду-
са и солидуса отличаются всего на йесколько градусов, поэтому
кривые ликвидуса и солидуса сливаются в одну линию. При исследо-
вании влияния Ni на а Со * еСо превращение было показано, что с
увеличением содержания Ni возрастает гистерезис этого бездиффузи-
онного превращения. По результатам измерения плотности и магнит-
ных свойств сплавов установлено, что сплавы, содержащие 22—32 %
(ат.) Ni, двухфазны и состоят из (аСо) + (еСо) [X]. По данным
работы 11] концентрация Ni на границе перехода (аСо) - (аСо) +
+ (еСо) при различных температурах приведена ниже:
Температура, °C............ 475 450 400 350 250
Концентрация Ni, % (ат.) .... 0 13 24,5 34 50
Максимальная растворимость Ni в (еСо), по данным этой работы,
не превышает 5 % (ат.).
Анализируемые экспериментальные данные не являются полно-
стью достоверными и требуют уточнения. Высказанное в работе [2]
предположение об образовании сверхструктуры CoNi3 до сих пор не
имеет прямых экспериментальных подтверждений. По мнению
авторов работы [3] аномалии, связываемые со сверхструктурой,
могут быть объяснены образованием ближнего упорядочения.
Одномерно разупрочненная структура, образующаяся при (мар-
тенситном) превращении в богатых Со сплавах, метастабильна и
контролируется наряду с электронной структурой диффузионной
подвижностью компонентов; истинные равновесия в этой области
изучены плохо [4].
Рис. 23. Co-Ni
Литература
1- Lihl F. Ц Z. Metallkunde. 1955. Bd. 46. S. 434-441.
2. Taylor A. // J. Inst. Met. 1950. V. 77- P. 585-594.
3- Gupta K.P. // Scr. Metal. 1971. V. 5. N 4. P. 329-332.
4. Устинов А.И., Гаевский Ю.Ф., Рудь А.Д. и др. // Металлофизика. 1986. Т. 8.
№ 4. С. 112-114.
В. П. Полякова
58
Co-О
Со-0. КОБАЛЬТ—КИСЛОРОД
Полностью диаграмма состояния Со—О не построена. На рис. 24
приведена богатая Со часть диаграммы состояния от 0 до 3,5 %
(ат.) О [X].
СО 0,°/о(ат.)
Рис. 24. Со—О
Температура эвтектической реакции 1451 °C и концентрация
кислорода в эвтектике 0,84 % (ат.) требуют уточнения. Раство-
римость О в жидком Со по данным работ [Ш] ниже: И [Э] приведена
Температура, °C Растворимость О, % (по массе): 1700 1650 1600 1550
[Ш] 0,52 0,38 0,28 0,20
[Э] — 0,28 0,24 0,19
В системе существуют три оксида СоО, Со304 и Со2О3 [X, Э, Ш].
Установлено, что при температуре выше 1000 °C в системе существу-
ет только одно соединение СоО. Температура плавления СоО состав-
ляет 1810 °C [Ш|. Область его гомогенности 50—51,7 % (ат.) О [Э].
Соединение Со3О4 имеет область гомогенности, равную 56,7—58,5 %
(ат.) О. При температуре 900 °C Со304 разлагается с образованием
Co—Os
59
Co 01 о? [51,7 % (ат.) О] [Э]. Соединение Co203 стабильно при
температуре ниже 300 °C.
Кристаллическая структура оксидов приведена в табл. 21.
Таблица 2 1. Кристаллическая структура соединений системы Со—О
Соединение Прототип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источник
а с
СоО ZnS ЛР4, РбуШС cF8, F43m 0,32 0,45 0,52 [ПТ] [Ш]
Со3О4 Al2MgO4 cF56, Fd3m 0,809 — [X]
Структура соединения Со2О3 неизвестна.
B.IJ. Полякова
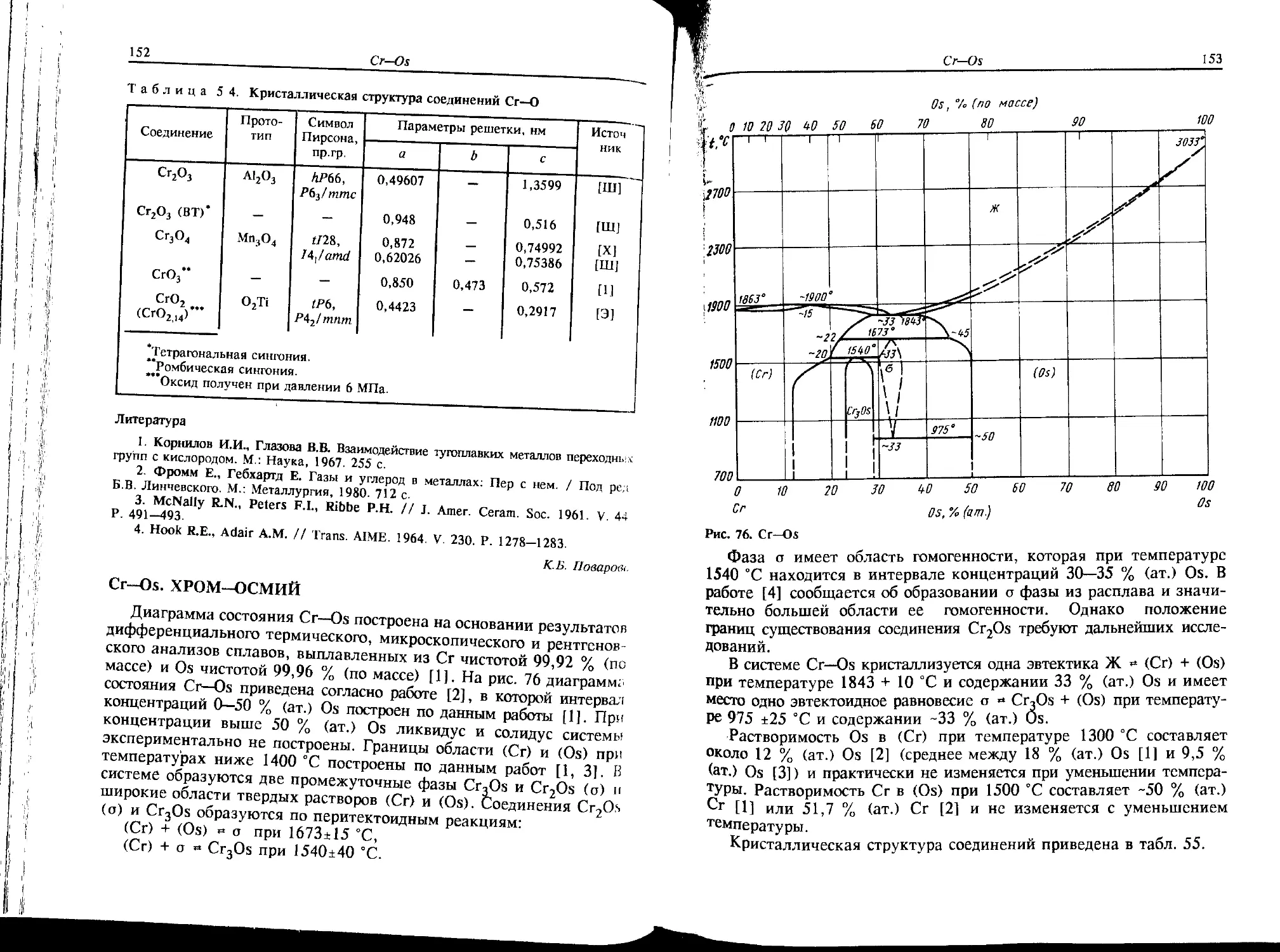
Со—Os. КОБАЛЬТ—ОСМИЙ
Экспериментальных данных по системе Со—Os очень мало. Пред-
полагаемая диаграмма состояния системы Со—Os построена по дан-
ным рентгеноструктурного и микроструктурного анализов, приведен-
ным в работе [1]. Установлено, что (еСо) и Os образуют непрерыв-
ный ряд твердых растворов (рис. 25). Значения параметров кристал-
лической ГПУ решетки сплавов лежат на прямой, соединяющей
Со Os, °/о (am.) QS
Рис. 25. Co-Os
60
Co—Pb
значения параметров решетки исходных компонентов. Металлографи-
ческий анализ сплавов в интервале концентраций 30—73 % (ат.) Os
после отжига позволяет предположить широкую область существова-
ния твердых растворов. Магнитным анализом сплавов определены
кривые превращения при температуре до 1200 °C. Диаграмма состоя-
ния Со—Os требует детального изучения.
Литература
1. KOster W., Horn Е. // Z. Metallkunde. 1952. Bd. 43. N 12. S. 444-449.
В П. Полякова
Co—Pb. КОБАЛЬТ—СВИНЕЦ
Информация о взаимодействии Со с РЬ приведена в работах [X,
Э, Ш]. Диаграмма состояния Со—РЬ, исследованная методами терми-
ческого анализа, химическим анализом закаленных сплавов и по
данным микроструктурного анализа, представлена на рис. 26 [1,2].
РЬ, °/о ( по массе)
Рис. 26. Со—РЬ
Кобальт и свинец практически не растворяются друг в друге в
твердом состоянии (растворимость РЬ в (Со) составляет примерно
1,2- 10'3 % (по массе) [3]) и почти во всем диапазоне концентраций
не смешиваются в жидком состоянии.
Co—Pd
61
Температура, °C . . .
J Растворимость Со:
% (по массе) . . .
Согласно работе [1] температура эвтектики лишь на -0,5 °C ниже
1 точки плавления РЬ, а температура монотектической реакции Ж *
(аСо) + Ж2 равна 1490 °C (т.е. на 5 °C ниже температуры плавле-
ния чистого Со) [2].
Растворимость Со в
ниже:
жидком Pb по данным работ [1,2] приведена
800 900 1000 1100 1200 1300 1500 1550
0,01 0,02 0,03 0,06 0,10 0,20 0,24 0,33
0,05 0,10 0,16 0,23 0,40 0,70 0,84 1,15
йХ Литература
* 1. Stevenson D.A., Wulf J. // Trans. AIME. 1961. V. 221. P. 271-275.
•i ' 2. Schenck H., Frohberg M.G. // Z. Erzberg. Metallhiittenwesen. 1962.
S. 512—513.
3. Tammann G., Oelsen W. // Z. Anorg. All. Chem. 1930. Bd. 186. S. 279—280.
Л. Л. Зусман
Bd. 15.
Co—Pd. КОБАЛЬТ—ПАЛЛАДИЙ
Информация о взаимодействии Со с Pd приведена в работах [X,
Э]. Диаграмма состояния представлена на рис. 27 [X, Э, 1]. Область
ликвидус—солидус в этой системе изучена довольно давно [X].
Упорядочение в твердых растворах обнаружено и изучено методом
электронной дифракции в работе [1] на образцах, приготовленных
прокаткой сплавов, полученных в плазменной печи, и совместным
осаждением паров компонентов на поверхность NaCl при температу-
ре 320-350 °C.
В системе обнаружены две упорядоченные фазы CoPd и CoPd3.
Фаза CoPd существует, по-видимому, в узком интервале концентра-
ций вблизи идеального состава (получить однофазные образцы не
удалось). Фаза CoPd3 обладает значительной областью гомогенности.
Температура разупорядоче^ия фазы CoPd выше 850 °C, а фазы
CoPd3 — 830 °C (максимальная температура разупорядочения соот-
ветствует составу с 80 % (ат.) Pd) [1] .
Предположительно в области концентраций 80—90 % (по массе)
Pd может происходить дальнейшее упорядочение и образование более
сложных сверхструктур.
В работе [2] обнаружена фаза Co3Pd, но использованный метод
(изучение потенциалов электрохимического растворения сплавов в
кислоте) и способ приготовления образцов (совместное химическое
осаждение из водных растворов солей) вызывают сомнение в том, что
полученные данные относятся к равновесной диаграмме состояния.
62
Co—Pd
Pd, % (no массе)
Рис. 27. Co—Pd
На рис. 27 указано также положение температур Кюри (маг-
нитные превращения) для Со—Pd сплавов: ферромагнетизм сохраня-
ется при концентрации до 99,0 % (ат.) Pd (температура Кюри
равна 7 К) [Э].
Кристаллическая структура соединений приведена в табл. 22.
Co-Pr
63
Таблица 22. Кристаллическая структура соединений системы Co—Pd
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а с
CoPd CuAu tP4, Р4/ ттт 0,4048 0,4106 0,3928 0,3888 В образцах Со + CoPd В образцах CoPd + + CoPd3
CoPd3 Cu3Au сР4, РтЗт 0,3820 — —
Литература
1. Matsuo Y. // J. Phys. Soc. Japan. 1972. V. 32. N 4. P. 972-978.
2. Mallat T., Petro J., Marczis L. // J/. Electroanal. Chem. Interfac. Electrochem.
1986. V. 208. N 1. P. 169-173.
B.H. Кузнецов
Co—Рг. КОБАЛЬТ-ПРАЗЕОДИМ
Диаграмма состояния Co—Рг в полном интервале концентраций
изучена, подробно описана в работах [1—3] и приведена на рис. 28.
Сплавы синтезировали в дуговой печи в атмосфере Аг и гомогени-
зировали в эвакуированных кварцевых ампулах, используя Со чисто-
той 99,9 % (по массе) и Рг чистотой 99,75 % (по массе). Исследова-
ние выполнено с помощью дифференциального термического, рентге-
ноструктурного и микроскопического анализов.
Согласно диаграмме состояния в системе Со—Рг образуется девять
двойных соединений. Только наиболее богатое Рг соединение СоРг3
образуется из расплава при температуре 588 °C. Все остальные
соединения образуются по перитектическим реакциям [1—3].
В работе [4] установлено существование восьми соединений,
причем только два из них отличаются по типу образования и
составу от полученных в работах [1—3]. Так, два соединения СоРг3
и п плавятся конгруэнтно при 580 и -1354 °C соответственно.
е шесть соединений образуются по перитектическим реак-
Остальны
По данным работ [1—3] в системе кристаллизуются две эвтектики,
по данным работы [4] — три эвтектики.
астворимость Рг в Со в твердом состоянии незначительна (при
вературе 1000 °с °на £°’03 % (ат,)Ь
Работам Л[1^|ПРИВеДеНЫ нонваРиантные Реакции в системе согласно
64
Co—Pr
Рис. 28. Co—Pr
Co—Pr
65
W блица 23. Нонвариантные реакции в системе Со—Рг
Температура, °C
Реакция [1-3] [4]
5к + (аСо) я Со|7Рг2 1271 —
Ж * СО]7рГ2 — 1354
Ж + СО|7Рг2 » Со5Рг 1229 1231±3
Ж + Со5Рг я Со|9Рг5 1125 1130±3
Ж + Со|9Рг5 я Со7Рг2 1118 1120±3
Ж + Со7Рг2 * Со3Рг 1057 1065±3
Ж + Со3Рг - Со2Рг 931 930±5
Ж + Со2Рг « Со, 7Рг2 598 —
Ж + СоРг3 « Со3Рг7 558 —
Ж + Со2Рг » Со3Рг4 — 588±2
Ж* я (аРг) + СоРг3 570 570±2
Ж « Со3Рг7 + Со, 7Рг2 541 —
Ж" я Со3Рг + Со3Рг7 — 533±3
Ж“‘ я СоРг2 + (аСо) — 1296
*При концентрации 19,5 % (ат.) Со.
**При концентрации 34,0 % (ат.) Со.
***При концентрации 93,0 % (ат.) Со.
Данные по кристаллической структуре соединений в системе
Со—Рг обобщены в работе [5] и приведены в табл. 24.
Таблица 2 4. Кристаллическая структура соединений системы Со—Рг
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
СО|7Рг2 Zn17Th2 АЛ 19, «Зли 0,8436 — 1,2276
Со5Рг Cu5Ca АР6, Рб/ттт 0,5032 — 0,3992
Со,9Рг5 Со19Се5 hP24, R3m 0,5053 — 4,871
3 Зак. 2144
66
Co—Pr
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
Со7Рг2 (ВТ) С°7^г2 AR18, • tJR3m 0,5060 — 3,643 ~
Со7Рг2 (НТ) Ni7Ce2 hP36 P63/mmc 0,5058 —- 2,4470
Со3Рг Ni3Pu R3m 0,5066 — 2,477
Со2Рг Cu2Mg cF24, Fdim 0,7306 — —
Со, 7рГ2 Coh7Nd2 P63/mmc 0,479 — 0,407
СоРг3 CFe3 OP16, Pntna 0,713 0,982 0,442
Со5Рг2‘ *Р - 96,8“. C2Mn5 mC28, C2/c 1,654 0,6480 0,710 i
Соединение Со7Рг2 существует в двух полиморфных модификаци-
ях: гексагональной и ромбической [5]. В работе [6] указано на
существование соединения Со2Рг5.
В работе [4] сообщается о неустойчивости фазы Со5Рг. Она при
температуре <850 °C претерпевает частичный распад по спинодально-
му механизму.
Структура соединения Со3Рг7 неизвестна.
Литература
1. Ray А.Е. // Cobalt. 1974. V. 1. Р. 13-20.
2. Buschow K.H.J. // Phillips Res. Rep. 1971. V. 26. N 1. P. 49-64.
3. Ray A.E., Bierman A.T., Harmer R.S. et al. // Cobalt. 1973. V. 4. N 4
P. 103-106.
4. Changheng W., Yuzhi Z., Ximei T„ Xiaohua G. // Proc. 6th Nat. Symp. Phase
Diagr. Shenyang. Nov. 20—24. 1990. Shenyang. 1990. P. 87—89.
5. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
6. Moreau J.-M., Paccard D. // Acta Crystallogr. В. 1976. V. 32. N 6. P. 1654— 1657
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский, М.А. Тылкии><
Со-Pt
67
Ca-pt. КОБАЛЬТ—ПЛАТИНА
Информация о взаимодействии Со с Pt приведена в работах [X,
Щ]. Диаграмма состояния Со—Pt построена по данным работ [X, 1,
2] и представлена на рис. 29. Компоненты этой системы образуют
Непрерывный ряд твердых растворов. На кривых ликвидус—солидус
Показано наличие минимума, который находится при температуре
1465 °C. Кривые ликвидус и солидус, по всей вероятности, очень
близки друг к другу.
Со Pt, % (am.) Pt
р«с. 29. Co-Pt
3*
68
Co—Pu
В системе образуются две упорядоченные фазы CoPt с простой
тетрагональной решеткой и CoPt3 с ГЦК решеткой [X, Ш, 1]. Грани-
цы упорядоченных фаз тщательно исследованы с помощью рентгенов-
ского и нейтронографического методов [2]. Полученные данные
хорошо согласуются с результатами, показанными на рис. 29. В
работе [2] также выполнен теоретический анализ упорядочения в
этой системе с учетом ’’химических” и магнитных взаимодействий
атомов.
Кристаллическая структура соединений приведена в табл. 25.
Таблица 2 5. Кристаллическая структура соединений системы Со—Pt [X, 1]
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм
а С
CoPt CoPt3 CuAu Cu3Au £Р4, Р4/ттт сР4, РтЗт 0,2677 0,3831 0,368^
Литература
1. Berg Н„ Cohen M.J. // Metal. Trans. 1972. V. 3. N 12. P. 1797-1799.
2. Инден Г. // Диаграммы фаз в сплавах: Пер. с англ. // Под ред. А.Я. Беленько-
го. М.: Мир. 1986. С. 114-127.
В. Н. Кузнецов
Со—Pu. КОБАЛЬТ—ПЛУТОНИЙ
Информация о взаимодействии Со и Рц приведена в работах [X,
Э, Ш]. Диаграмма состояния системы Со—Pu построена в работах [1,
2]. Результаты обоих исследований хорошо совпадают.
На рис. 30 представлена диаграмма состояния, построенная по
результатам термического, микроструктурного, рентгеноструктурного
и дилатометрического анализов 11].
В системе образуются шесть соединений: Co17Pu2, Co3Pu, Со2Ри,
CoPu2, СоРи3 и CoPur, из которых только одно Со2Ри плавится
конгруэнтно при -1300 °C. Соединения Co17Pu2, Co3Pu, СоРи2 и
СоРи3 образуются по перитектическим реакциям при температурах
1210, 1230, 605 и 442 °C соответственно, а соединение СоРи6 образу-
ется по перитектоидной реакции при температуре 395 °C.
В системе кристаллизуется две эвтектики: Coj7Pu2 + Co3Pu при
температуре 1170 °C и CoPu3 + (бРи) при температуре 405 °C и
содержании 88 % (ат.) Pu.
Соединения СоРи3 и СоРи2 обладают небольшой областью гомо-
генности.
*
Co—Pu
69
По данным работы [3], на рис. 30 (верхний угол) представлена
часть диаграммы состояния в области, богатой Pu, которая характе-
ризует равновесие между фазами й, й' и е.
70
Кристаллическая структура соединений приведена в табл. 26
[1—6]. Для соединения Со3Ри указаны три типа структур, относя-
щихся к триклинной, гексагональной и ромбической сингониям.
Таблица 2 6. Кристаллическая структура соединений системы Со—Ри
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
СоРиД — — 1,0475 (5) — 0,5340 (5) Ш
СоРи3 Re3B оС16, Стет 0,3475 (4) 1,0976 (10) 0,9220 (8) [1, 4, 6]
СоРи2*2 — — 0,7803— 0,7732 — 0,3606 (5)— 0,3654 (5) [1]
Со2Ри MgCu2 cF24, Fd^m 0,7095 (5) 0,7075 (5) — — [1] [5]
Со3Ри*3 — — 0,8635 (10) — — 11]
Со3Ри*2 — — 0,5003 — 2,442 (6) [Ц
Со3Ри’4 — — 1,413 0,493 0,993 [1]
сопРи;2 — — 0,8327 (5) — 0,8107 (5) [X, 1]
’Тетрагональная сингония.
*2Гексагональная сингония.
*3Триклинная сингония, а - 33,66°.
*4Ромбическая сингония.
Литература
1. Poole D.M. // Plutonium. London: Claver-Hume Press Ltd. 1961. P. 267—280.
2. Schonfeld F.W. // The Metal Plutonium. Chicago: University of Chicago Press.
1961. P. 240-254.
3. Elliott R.O., Larson A.C. // The Metal Plutonium. Chicago: University of Chicago
Press. 1961. P. 265-280.
4. Schonfeld F.W. // The Metallurgy and Fuels, Progress in Nuclear Energy. Ser. V.
V. 2. New York: Pergomon Press, 1959. P. 579—599.
5. Runnals O.J. // Can. J. Chem. 1956. V. 34. P. 133-145.
6. Larson A.C., Cromer D.T., Roof R.B. // Acta Crystallogr. 1963. V. 16.
P. 835-836.
M.A. Тылкина, А.Л. Татаркина, E.M. Соколовская
Co—Re. КОБАЛЬТ—РЕНИЙ
Диаграммы состояния Со—Re, построенные в работах [1, 2] во
всем интервале концентраций, в основном совпадают. Сплавы иссле-
довали методами рентгеноструктурного, микроструктурного, терми-
ческого и магнитного анализов [1]. В работе [2] использовали эти же
методы, а также рентгеноспектральный анализ, определение твердое-
Co—Re
71
Re, % (no массе)
Рис. 31. Co—Re
ти и электросопротивления. Сплавы приготовляли в дуговой печи в
атмосфере гелия. Гомогенизирующий отжиг проводили в вакууме при
1300 °C в течение 200 ч; а закалку сплавов — от 800 и 1000 °C после
выдержки 1000 и 750 ч соответственно в эвакуированных ампулах.
Исходные металлы: монокристаллический Re и электролитический
Со чистотой 99,99 % (по массе).
Диаграмма состояния системы (рис. 31) — перитектического типа
[2]. Соединений не обнаружено. Установлен непрерывный ряд твер-
дых растворов с ГПУ решеткой между (еСо) и (Re). Область твердых
растворов в (аСо) невелика и обладает ГЦК решеткой. Двухфазная
область (аСо) + (еСо, Re) находится при температурах выше темпе-
ратуры полиморфного превращения Со (422 °C) и ниже температуры
перитектики (-1550 °C). При температуре 1550 °C граница раствори-
мости Re в (аСо) проходит около 15 % (ат.), в (еСо) — около 25 %
(ат.) Re. Рений линейно понижает точку Кюри, граница ферромаг-
нитной области лежит при 10 % (ат.) Re.
Литература
1. Kdster W., Horn Е. // Z. Metallkunde. 1952. Bd. 43. N 2. S. 144.
2. Иютина И.А., Куприна В.В., Соколовская Е.М. и др. // Исследование и
применение рения: Сб. статей. М.: Наука, 1975. С. 54—56.
М.А. Тылкина
72
Со-Rh
Co—Rh. КОБАЛЬТ—РОДИЙ
Равновесная диаграмма состояния системы Со—Rh не изучена.
Гипотетическая диаграмма состояния по данным работ [1,2] пред-
ставлена на рис. 32. Rh и (аСо) образуют непрерывный ряд твердых
растворов. Поскольку отжиг при 1400 °C приводит к частичному
оплавлению сплавов, содержащих 57,2 % (ат.) и 75,2 % (ат.) Rh,
можно предположить наличие минимума на кривых ликви-
дус-солидус.
Рис. 32. Со—Rh
Положение линий начала мартенситных превращений (аСо) -
- (еСо) и (еСо) - (аСо) изучено в области концентраций до 50 %
(ат.) Rh. Кривые получены методами магнитного и дилатометричес-
кого анализов.
Литература
1. KOster W., Horn Е. // Z. Metallkunde. 1952. Bd. 43. S. 444-449.
2. Благородные металлы: Справочник / Под ред. Е.М. Савицкого. М.: Металлур-
гия, 1984. 592 с.
В.Н. Кузнецов
Co—Ru, Co~—S
73
Co—Ru. КОБАЛЬТ—РУТЕНИЙ
Диаграмма состояния Со—Ru, приведенная на рис. 33, построена
по данным работ [X, 1]. Положение равновесных фазовых границ
известно лишь при температурах между 1000 и 1200 °C, при более
низких температурах кривые указывают начало и конец мартенсит-
ного перехода е « а, а при более высоких являются ’’гипотетически-
ми”. Перитектическая реакция протекает при температуре -1450 °C.
Рентгенографическим методом установлена непрерывная раствори-
мость между (еСо) и Ru. Поскольку сплавы, содержащие 9 и 12 %
(ат.) Ru, частично оплавлялись при 1400 °C, на кривых ликвидус—со-
лидус твердого раствора (аСо), по-видимому, имеется минимум.
Рис. 33. Со—Ru
Литература
I. Kflster W„ Horn Е. И L. Metallkunde. 1952. 1952. Bd. 43. S. 444-449.
B.H. Кузнецов
Со—S. КОБАЛЬТ—СЕРА
На рис. 34 приведена диаграмма состояния Со—S при давлении
0,1 МПа, построенная в работе [11 на основании результатов соб-
ственного экспериментального исследования и обобщения литератур-
ных данных. В работе [1] для приготовления сплавов был использо-
74
Co—S
Рис. 34. Co—S
ван электролитический Co, содержащий -0,5 % Ni и <0,3 % других
примесей, а для контрольных сплавов — Со высокой чистоты, содер-
жащий <0,0007 % примесей; S чистотой >99,99 %. Исследование
проводили методами термического, металлографического, рентге-
новского и химического анализов сплавов, закаленных от 930, 850,
780, 600 и 200 °C. В системе установлено существование пяти соеди-
нений.
Соединение Co4S3±x имеет область гомогенности 42,2—44,2 %
(ат.) S при температуре 845 °C и 42,5—43,8 % (ат.) S при температу-
ре 805 °C; эта фаза может существовать только при высоких темпе-
ратурах и закалкой не фиксируется; ее структура неизвестна.
Соединение CogS8 не имеет области гомогенности; оно имеет
структуру собственного типа (символ Пирсона cF68, пр.гр. Fm3m) с
параметром решетки а - 0,9927±0,0001 нм [X].
Соединение pCoS1+x в области концентраций 50,9—51,6 % (ат.) S
при температуре 600 °C имеет структуру типа NiAs (В8) с парамет-
Co—Sb
75
рами a - 0,3374 нм и с = 0,5187 нм при насыщении Со и а =
= 0,3368 нм и с = 0,5170 нм при насыщении S. Эта фаза непрерывно
переходит в фазу р' CoS1+x, которая существует в области концен-
трации 51,6— 54,0 % (ат.) S при температуре 600 °C. Она является
сверхструктурной по отношению к NiAs и имеет утроенные парамет-
ры решетки.
Соединение Co3S4 имеет гранецентрированную кубическую
структуру типа шпинели (тип Co3S4) с параметром решетки а =
= 0,9477 нм; область гомогенности отсутствует.
Соединение CoS2 также не имеет заметной области гомогенности;
ее структура типа FeS2 (С2), а = 0,55343±0,00001 нм.
В обзоре [Э] указывается на возможность существования фазы
Co2S3 со структурой шпинели с кобальтовыми вакансиями (параметр
решетки а = 0,944 нм), которая однако получена лишь химическим
путем.
Литература
1. Кузнецов В.Г., Соколова М.А., Палкина К.К., Попова З.В. // Изв. АН СССР.
Неорганические материалы. 1965. Т. 1. № 5. С. 675—689.
Л. С. Гузей
Со—Sb. КОБАЛЬТ—СУРЬМА
Система Со—Sb исследована в полном интервале концентраций
методами дифференциального термического, рентгеноструктурного и
микроструктурного анализов, измерения свойств [X, Э, 1]. Наиболее
достоверная диаграмма состояния Со—Sb (рис. 35) построена на
основе анализа литературных данных [2].
Система Со—Sb представляет собой сложную систему с тремя
промежуточными фазами: р (CoSb), у (CoSb2) и 6 (CoSb3). Соедине-
ние CoSb плавится конгруэнтно при температуре -1202 °C й имеет
область гомогенности 48—51 % (ат.) Sb [2]. По перитектическим
реакциям образуются соединения CoSb2 и CoSb3 при температурах
931 и 876 °C соответственно. Фаза CoSb2 существует в двух модифи-
кациях и имеет область гомогенности 64—67 % (ат.) Sb. Температура
полиморфного перехода в соединении CoSb2 -377 °C [2]. В ‘более
ранних работах [1] указывается значение температуры полиморфно-
го перехода CoSb2 420—435 °C.
В системе наблюдаются два эвтектических равновесия [2]:
Ж * (аСо) + CoSb при 1113 °C и 25,5 % (ат.) Sb;
Ж * (Sb) + CoSb3 при 623 °C и -96 % (ат.) Sb.
По данным работы [1] температуры эвтектических равновесий -1080
и 620 °C соответственно.
76
Со-Sb
Co Sb,°/o(am.) Sb
Рис. 35. Co—Sb
Максимальная растворимость Sb в (Co) составляет -2,5 % (ат.)
при температуре эвтектики [3] (-7 % (ат.) по данным работы [1]).
Кобальт практически нерастворим в (Sb).
Кристаллическая структура промежуточных фаз приведена в
табл. 27.
Таблица 27. Кристаллическая структура соединений системы Со—Sb [3]
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм
а b с
CoSb NiAs ЛР4, Р63/ ттс 0,3916— 0,3871 — 0,5191- 0,5193
CoSb2 (у) FeS2 оР6, Ртпт 0,5596 0,6373 0,3370
CoSb2 (у')* CoSb2 тР 12, Р2,/с 0,652 0,638 0,655
CoSb3 CoAs3 с/32, 0,9036 — —
1тЗ
*р - 118,2°.
Co—Sc
71
Литература
V Chen T., Mikkelsen S.C., Charion G.B. // J. Crystal Growth. 1978. V. 43. N 1.
P. 5V-12.
j. Ishida K., Nishizawa T. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 3.
p. 243-248.
Е.И. Гладышевский, О. И. Бодак, В. К. Печорский
Со—Sc. КОБАЛЬТ—СКАНДИЙ
О существовании в системе Со—Sc соединений Co2Sc, CoSc и
CoSc2 сообщается в работах [Э, Ш]. Диаграмма состояния системы
во всем интервале концентраций (кроме кривой ликвидуса в интерва-
ле концентраций 80—100 % (ат.) Sc) построена в работе [1]. Иссле-
78
Co—Sc
дование проведено методами рентгенографического, микроструктур-
ного, микрорентгеноспектрального и дифференциального термическо-
го анализов. Исходные металлы: Sc чистотой 99,84 % (по массе) и Со
чистотой 99,9 % (по массе). На рис. 36 приведена диаграмма состоя-
ния по данным работы [1]. Кривая ликвидуса в области, богатой Sc,
построена гипотетически.
В системе образуются четыре соединения. Два соединения Co2Sc
и CoSc2 плавятся конгруэнтно при температурах 1520 и 840 °C
соответственно. Область гомогенности соединения Co2Sc расположена
от 31 до 36 % (ат.) Sc и практически не зависит от температуры.
Соединения CoSc и CoSc3 образуются по перитектическим реакци-
ям при 1050 и 870 °C соответственно. Состав соединения CoSc не-
сколько смещен от стехиометрического в сторону Sc (содержание Sc
равно 52 % (ат.)).
В системе протекают три эвтектических превращения:
Ж * (аСо) + Co2Sc при 1140 °C,
Ж CoSc + CoSc2 при 820 °C,
Ж * CoSc2 + CoSc3 при 780 °C.
Взаимная растворимость Со и Sc не превышает 1 % (ат.).
Данные по кристаллической структуре соединений приведены в
табл. 28.
Таблица 2 8. Кристаллическая структура соединений системы Со—Sc [1]
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а b с
Co2Sc MgCu2 cF24, Fdim 0,690 0,692 — — При концентрации Sc, % (ат.): 31 36
CoSc CsCl сР2, Pm3m 0,3154 — — При концентрации 52 % (ат.) Sc
CoSc2 CuA12 tin, /4/mcm 0,6342 — 0,5643 —
CoSc3* PuBr3 — 0,337 0,995 0,537 —
Ромбическая сингония.
Литература
1. Маркив В.Я., Гавриленко И.С., Петьков В.В., Белявина Н.Н. // Металлофизи-
ка. 1978. Вып. 73. С. 39-45.
М.А. Тылкина, В.Н. Кузнецов
C&—-Se
79
Со-Se. КОБАЛЬТ—СЕЛЕН
1 Информация о взаимодействии Со с Se приведена в работах [X,
Э,;Ш, 1—4]. Диаграмма состояния Со—Se (рис. 37) построена по
обобщенным данным работы [X] с учетом данных [Э, Ш, 1—3].
В системе установлено образование трех фаз: Co9Se8, CoSe (у) и
Со8е2.,Фаза Co9Se8 [44,4 % (ат.) Se] обладает очень узкой областью
гомогенности, образуется по перитектоидной реакции, температура
которой точно не установлена и предполагается 400—600 °C [1]. Фаза
Co9Se8 имеет ГЦК решетку с параметром а = 1,0431 нм [1].
«о
Со-Si
Фаза CoSe (у) обладает областью гомогенности 50,4—57,8 % (ат.)
Se при температуре 600 °C и 51,2—56,8 % (ат.) Se при температуре
400 °C. Внутри области гомогенности этой фазы имеет место непре-
рывный переход от гексагональной структуры У] типа NiAs (а =
= 0,36294 нм, с = 0,53006 нм) к моноклинной структуре у2, сущест-
вующей при содержании Se более 54,9 % (ат.); для состава с 56,8 %
(ат.) Se параметры ячейки: а = 0,61372 нм, b = 0,35673 нм, с =
= 0,51976 нм, 0 = 91,22°.
Фаза CoSe2 образуется по перитектической реакции при темпера-
туре -960 °C, имеет узкую область гомогенности; структуру типа
FeS2, а = 0,58588 нм для стехиометрического состава и 0,58611 нм
для CoSej д.
В работе [4] приведена р—Т-диаграмма в интервале температур
700—1100 °C и давлений Se от 1,33*10"4 до 1,33*1О6 Па.
Литература
1. Bohm F. // Acta Chem. Scand. 1955. V. 9. P. 1510-1522.
2. Дудкин Л.Д., Вайданич В.И. 11 Физика твердого тела. 1960. Т. 2. С. 1526—
1532.
3. Егог N.G., Wagner J.B., Jr. 11 keto. Metall. 1963. V. 11. P. 1339-1345.
4. Yusutoshi N., Kenzo I. // J. Japan Inst. Metals. 1971. V. 35. N 11. P. 1031—1034.
Л.С. Гузей
Co—Si. КОБАЛЬТ—КРЕМНИЙ
Диаграмма состояния системы Со—Si (рис. 38) построена на
основании данных работ [X, 1—3].
Характер фазовых равновесий в системе требует дополнительных
исследований. Наиболее достоверным можно считать образование
соединений CoSi2, CoSi, Co2Si конгруэнтно при температурах -1326,
1460 и 1332 °C [X, 1—3]. В литературе имеются неоднозначные
данные о существовании соединения Co3Si [X, Ш, 4]. Согласно
работе [X] соединение Co3Si образуется по перитектической реак-
ции при температуре 1212 °C и эвтектоидно распадается при
температуре 1170 °C. По данным работ [Ш, 5], фаза Co3Si выпадает
из пересыщенного твердого раствора (аСо) при температурах ниже
570 °C.
Растворимость Со в (Si) весьма мала: при температуре 1200 °C
она составляет 1016 см-3 (ретроградный максимум) [1, 2]. Раствори-
мость Si в (Со) требует уточнения.
Кристаллическая структура промежуточных фаз приведена в
табл. 29.
Со-Si
81
Рис. 38. Со—Si
Таблица 29. Кристаллическая структура соединений системы Со—Si
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
CoSi2 CaF2 cF12, Fm3m 0,53676 0,5367 •— — IX]
CoSi FeSi cP8, p2)3 0,44445 — — [II
Co2Si Co2Si oP12, Pnma 0,7109 0,4918 0,3738 [X, 1]
Co^Si Ni3Sn hP8, P63/ me — — — [5]
82
Co—Sm
Литература
1. Гельд П.В., Сидоренко Ф. А. Силициды переходных металлов четвертог
периода. М.: Металлургия, 1971. 584 с.
2. Самсонов Г.В., Дворина Л.А., Рудь Б.М. Силициды. М.: Металлургия, 197'»
271 с.
3. Kaufman L. // Calphad. 1979. V. 3. N 1. Р. 45-76.
4. Roomgaart J.V., Garpad F.M. // Acta Metall. 1972. V. 20. N 4. P. 472—476.
5. KOster W., Warlimont T., Godecke T. 11 г. Metallkunde. 1973. Bd. 64. N 6
S. 399.
B.H. Кузнецов
Co—Sm. КОБАЛЬТ—САМАРИЙ
Диаграмма состояния Co—Sm (рис. 39) в полном интервале кон-
центраций изучена и подробно описана в работах [1, 2].
Сплавы синтезировали в корундовых тиглях в высокочастотной
печи в атмосфере Аг, а затем переплавляли в дуговой печи и гомоге-
низировали в эвакуированных кварцевых ампулах, используя Со
чистотой 99,90 % (по массе) и Sm чистотой 97,7 % (по массе).
Исследование выполняли с помощью дифференциального термическо-
го, рентгеноструктурного и микроскопического анализов. Основыва-
ясь на экспериментальных данных работ [1, 2], в работе [3] диаг-
рамма Co—Sm была построена расчетным путем. Учитывая разброс
экспериментальных данных, авторы работы [3] отмечают довольно
хорошее соответствие полученных результатов.
В системе Co—Sm образуется семь двойных соединений: Coi7Sm2,
Co5Sm, Co7Sm2, Co3Sm, Co2Sm, Co4Sm9 и CoSm3. Только два из них
Co17Sm2 и CoSm3 образуются из расплава при температурах 1335 и
700 °C соответственно [1, 2]. Все остальные соединения образуются
по перитектическим реакциям:
Ж + Co17Sm2 * Co5Sm при 1320 °C [1, 2], 1309 °C [3];
Ж + Co5Sm w Co7Sm2 при 1240 °C [1, 2], 1215 °C [3];
Ж + Co7Sm2 - Co3Sm при 1200 °C [1, 2], 1182 °C [3];
Ж + Co3Sm - Co2Sm при 1075 °C [1, 2], 1046 °C [3];
Ж + CoSm3 - Co4Sm9 при 610 °C [1, 2], 585 °C [3].
В работе [4] указано на существование еще одного соединения в
системе Co—Sm Co19Sm5, которое образуется по перитектической
реакции Ж + Co5Sm * Co19Sm5 при температуре 1260 °C и распадает-
ся по эвтектоидной реакции Co19Sm5 * Co7Sm2 + Co5Sm при темпера-
туре несколько ниже 1200 °C.
В системе протекают три эвтектические реакции:
Ж * (аСо) + Co17Sm2 при 1325 °C [1], 1356 °C [3];
Ж * Co2Sm + Co4Sm9 при 600 °C [1], 585 °C [3];
Ж * Co3Sm + (aSm) при 630 °C [1], 634 °C [3].
Co—Sm
83
рис. 39. Co—Sm
84
Co—Sm
Соединения Co7Sm2 [5—7], Co5Sm [4], Co19Sm5 [4], Co17Sm [l,8f
существуют в двух модификациях. Соединения Co5Sm [1, 2, 7, 9—12|
и Co17Sm2 [1, 2, 7, 9, 10] при высоких температурах имеют неболь-
шие области гомогенности. Согласно работам [4, 7] в пределах этих
областей существуют структуры с упорядочением.
В соответствии с работами [11, 13, 14] фаза Co5Sm стабильна при
нагреве только до 600—750 °C, однако в работе [15] распад этого
соединения не подтвержден. В работе [9] на основании металлогра-
фического исследования указывается, что максимальная раствори-
мость Sm в фазе Co^Sm наблюдается при температуре 1200 °C (при
этом состав соединения соответствует формуле Co48Sm). При темпе-
ратуре выше 1237 °C растворимость Sm значительно уменьшается
так, что перитектическое превращение при температуре 1320 °C
происходит в точке, соответствующей составу Co56Sm. В работе [12]
определены границы области гомогенности соединения Co5Sm в
интервале температур 1200—800 °C, причем растворимость Sm в
Co5Sm увеличивается при понижении температуры (в отличии от
[9]) и составляет 0,098—0,118 % (ат.) при температуре 800 °C.
Взаимная растворимость компонентов в твердом состоянии прак-
тически отсутствует.
Кристаллические характеристики соединений в системе Со—Sm
обобщены в работе [16] и приведены в табл. 30.
Таблица 3 0. Кристаллическая структура соединений системы Со—Sm [16]
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм
а Ь с
Col7_xSm2 Cu7Tb ЛР8, Р6/ттт 0,4856 — 0,4081
Co17Sm2 (ВТ) Ni17Th2 ЛР38, Р63/ттс 0,8384 — 0,8159
Co17Sm2 (НТ) Zn17Th2 hRl9, R3m 0,8402 — 1,2231
Co3Sm Cu5Ca hPf>, Рб/ттт 0,4997 — 0,3974
Co5_xSm Cu3Ca hP6, Р6/ттт 0,5004 — 0,3974
Co5+xSm (x = 0,2-0,6) Cu7Tb hP8, Р(ь!ттт 0,4967 — 0,4001
Co19Sm5 (HT) Co19Sm5 Р63/ттс 0,50312 — 3,2265
CO19S11I5 (ВТ) Co)9Ce5 hR24, R3m 0,50314 — 4,8402
Co—Sm
85
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм
а Ь С
"~Co7Sm2 (НТ) Со7Ег2 ЛА18, 0,5045 — 3,6486
Co7Sm2 (ВТ) R3m /1РЗ6, Р63/ ттс 0,5043 — 2,4312
Co3Sm Ni3Pu R3m 0,5053 — 2,461
Co2Sm Cu2Mg cF24, Fd3m 0,7260 — —
С02 Sm5 C2Mn3 тС28, С2/с 1,6282 0,6392 0,7061
CoSm3 *Р - 96,61”. CFe оР\Ь, Рпта 0,7090 0,9625 0,6342
Литература
1. Buschow K.HJ., Goot A.S. // J. Less-Common Met. 1968. V. 14. N 3.
P. 323-r328.
2. Uhl F„ Ehold J.R., Kirchmaver H.R. et al. // Acta Phys. Aus. 1969. V. 30. N 1-2.
P. 164-175.
3. Schneider G., Henig E.-Th., Lukas H.L., Petzow G. //J. Less-Common Met. 1985.
V. 110. N 1-2. P. 159-170.
4. Khan Y. // Z. Metallkunde. 1974. Bd. 65. N 7. S. 489-497.
5. Buschow K.HJ. // Acta Crystallogr. B. 1970. V. 26. N 10. P. 1389-1392.
6. Buschow K.HJ. // Phillips Res. Rep. 1971. V. 26. N 4. P. 49-64.
7. Khan Y. 11 Acta Crystallogr. B. 1974. V. 30. N 4. P. 861-864.
8. Khan Y., Mueller B. // J. Less-Common Met. 1973. V. 32. № 1. P. 39—45.
9. Buschow K.HJ., Broeder FJ.A. // J. Less-Common Met. 1973. V. 33. N 2.
P. 191-195.
Ю. Williams K.L., Bartlett R.W., Jorgensen P.J. // J. Less-Common Met. 1974. V. 37.
Nl.P. 174-176.
И. Мегат Л.М., Макарова Г.М., Солина Л.В. и др. // Физика металлов и метал-
ловедение. 1975. Т. 39. № 2. С. 295-301.
12. Лившиц Б.Г., Лилиев А.С., Менушенков В.П. и др. // Изв. АН СССР.
Металлы. 1982. № 4. С. 113-116.
13. Broeder F.J.A., Buschow K.HJ. 11 J. Less-Common Met. 1972. V. 29. N 1.
P. 65-71.
14. Ray A.E. // Cobalt. 1974. V. 1. P. 13-20.
15. Meyer L.F., Alibert C.H., Castanet R. // J. Less-Common Met. 1987. V. 127. N 2.
243-250.
Дин^ Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических сое-
ений редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
86
Co— Sn
Co—Sn. КОБАЛЬТ—ОЛОВО
Диаграмма состояния Со—Sn, приведенная на рис. 40, построена
по данным работы [1J с учетом данных работ [2, 3J. Исследование
проводили методами термического, рентгенографического и микро-
структурного анализов, а также измерением микротвердости [1]. Для
получения сплавов использовали Со и Sn чистотой 99,99 и 99,999 %
(по массе) соответственно. В системе подтверждено существование
трех промежуточных фаз Co3Sn2 (у), CoSn и CoSn2. Фаза у плавится
конгруэнтно при -1230 °C (в работе [X] приводится -1170 °C), а две
другие фазы образуются по перитектическим реакциям [1]:
“Ж + у * CoSn при 947 °C (936±9 °C [X]);
Ж + CoSn ₽ CoSn2 при 568 °C (525+10 °C [X]).
Фазы у и CoSn имеют небольшие области гомогенности протяжен-
ностью -1 % (ат.) для у и -3—4 % (ат.) для CoSn при температурах
ниже 400 °C. Фаза у существует в двух модификациях, температура
перехода составляет -500 °C [2] или 547 °C [3]. В системе кристал-
лизуются две эвтектики при температуре 1180 °C и содержании
~24 % Sn [1] и при температуре -229 °C и содержании -99 % (ат.)
Sn [XI.
Кристаллическая структура соединений приведена в табл. 31.
Таблица 31 Кристаллическая структура соединений системы Со—Sn
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм , Источник
а С
у (ВТ) NiAs ИР4, Р63/ттс 0,4111*’ 0,5183*' [X]
0,4104*2 0,5171 *2 [X]
У (НТ)’3 NiAs hP4, 1,639 0,5208 [X]
Р63/ттс 1,6445 0,5179 [1]
CoSn’4 PtTl — 0,5279 0,4259 [X]
0,5278 0,4258 [1]
CoSn2 CuA12 tl\2, 14/тст 0,6361 0,5452 IX, 1]
При температуре 850 °C со стороны Со.
*2Г1ри температуре 950 °C со стороны Sn.
’’Упорядоченная решетка.
*4Гексагональная сингония.
В работе [1] указано, что закалкой из жидкого состояния сплавов,
содержащих до 5 % (ат.) Sn, можно получить метастабильный
однофазный твердый раствор на основе Со. Данные о влиянии Sn на
полиморфное и магнитное превращение Со требуют дальнейшего
уточнения.
Co—Sn
87
рис, 40. Co—Sn
G
88
Co-Та
Литература
1. Пантелеймонов Л.А., Портнова Г.Ф., Нестерова О.П. // Вестник Моск, гос
ун-та. Сер. Химия. 1971. Т. 12. № 1. С. 117-119.
2. Asanuma M.J. И Phys. Soc. Japan. 1962. V. 17. Р. 300-306.
3. Schmid Н. 11 Cobalt. 1960. V . 7 . N 1. P. 26-32.
B.ll. Полякова.
Co—Та. КОБАЛЬТ—ТАНТАЛ
Диаграмма состояния сплавов Со—Та изучалась неоднократно [X,
Э, Ш, 1—3]. Первый ориентировочный вариант диаграммы состояния
предложен в работе [1] на основании данных микроструктурного и
рентгеновского анализов закаленных от 1300 °C образцов, богатых
Рис. 41. Со—Та
Та,% (по массе)
Со—Т а
89
Та, и от 1000 °C образцов, содержащих более 80 % Со. В системе
обнаружена растворимость компонентов друг в друге и семь проме-
жуточных фаз. Предполагается, что Та повышает температуру
полиморфного превращения Со.
И,. Более поздние исследования [2—3], проведенные методами диффе-
ренциального термического, микроструктурного и рентгеновского
анализов, позволили уточнить фазовые равновесия в системе. Диаг-
рамма состояния Со—Та (рис. 41) построена по совокупности данных
работ [2, 3]. В системе подтверждено образование шести промежу-
точных фаз, из которых ТаСо (р) и ТаСо2 (Л2) образуются непосред-
ственно из расплава конгруэнтно при температурах 1700 °C [3] и
1650 °C [2] соответственно. Фаза А3 и Та2Со образуются по псритек-
тическим реакциям:
V Ж + Л2 ** А3 при 1450 °C [2];
1 Ж + (Та) « Та2Со при 1800 °C [3].
®' По данным работы [2], фазы Aj и Та2Со7 (к) образуются по
ж перитектоидным реакциям:
ж И + ^2 ** ПРИ 1540 °C;
| (аСо) + А3 к при 950 °C.
ij’;' Фаза А[ существует в узком интервале температур и при температуре
ИЗО °C эвтектоидно распадается. Фазы Л2, А3 и р обладают заметны-
ми областями гомогенности. Область существования фазы р соответ-
ствует 44—56 % (ат.) Та, фазы Л2 — 64—70,5 % (ат.) Со и фазы А3 —
72—73,5 % (ат.) Со [2—3]. Предполагается существование метаста-
бильной фазы ТаСо3 в интервале температур 1000—950 °C [2].
В системе наблюдаются эвтектические взаимодействия:
Ж * Та2Со + р при 1670 °C и 58 % (ат.) Та [3];
Ж ** р + А2 при 1560 °C и -43 % (ат.) Та [2];
Ж ** (аСо) + А3 при 1280 °C и 8 % (ат.) Та [2].
Максимальная растворимость Со в (Та) составляет 20 % (ат.), а
при 500 °C — 2 % (ат.) [2]. Границы твердых растворов Та в (аСо)
и (еСо) требуют уточнения, как и влияние Та на температуру поли-
морфного превращения Со.
Кристаллическая структура промежуточных фаз приведена в
табл. 32.
Таблица 3 2. Кристаллическая структура соединений системы Со—Та
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм Источник
а с
Та2Со СпА12 tl\2, /4/ mcm 0,6115 0,6140 0,4972 0,4858 [1] [3]
90
Со-Tb
Соединение Прототип Символ Нир- сона, пр.гр. Параметры решетки, нм Источник
а С
ТаСо (ц) W6Fe7 ЛЯ 13, 0,4928 2,644 [11
R3 т 0,4947 2,657 [1]
0,4900 2,642 [И
А, MgZn2 hP\2, 0,4838 0,7835 [2|
РЬу/ттс 0,4836 0,786 [1]
0,4797 0,7827 [1]
^•2 MgCu2 cF24, 0,6807 — [2|
Fd3m 0,6701 —
Л3 MgNi2 hP24, 0,4747- 0,1547- [2]
Р63/ттс 0,4730 1,543
аТаСо, AuCu3 сР4, 0,3647 1,5 11]
РтЗт
К — — 0,9389 1,555 [2]
'Гексагональная сингония.
Литература
1 Raman А. // Metall. 1967. В. 21. N 9. S. 900-903.
2. Петьков B.B., Кочержинский Ю.А., Маркив В.Я. // Металлофизика. 1972
Выи. 41. С. 93-97.
3. Бернард В.Б., Юрченко Л.А., Бодак О.И., Куприна В.В. // Вестник Моск, roi
ун-та. Сер. Химия. 1976. Т. 17. № 2. С. 208-212.
В.П. Полякова
Со—ТЬ. КОБАЛЬТ—ТЕРБИЙ
Диаграмма состояния Со—ТЬ не построена. В литературе (Э, Ш.
1| приведены сведения только о составах и структуре некоторых
двойных соединений. Кристаллическая структура всех известных
соединений системы Со—ТЬ наиболее полно описана в работе |1) и
приведена в табл. 33.
Т а б л ина 33. Кристаллическая структура соединений системы Со—ТЬ
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм
а b с
С О [ у IЬ2 N i |7Th2 ЛР38, Р63/ттс 0,8347 — 0,8127
Со । у 1 Ь2 Znl7Th2 ЛЯ 19, РЗт 0,8347 — 1,2186
CosTb Cu5Ca hPb, Р6/ттт 0,4946 — 0,3980
Со—Тс, Co-Те
91
к Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм
a b c
Г Со7ТЬ2 Со7Ег2 KR1 8, 0,5003 — 0,3980
R3m
1 СоТЬ Ni3Pu —, 0,5019 — 2,442
R3m
I Со2ТЬ Cu2Mg cF24, 0,7209 — —
Fd3m
Со3ТЬ4 CO3HO4 hP22, P63/m 1,1514 — 0,4007
I Со7ТЬ1*2 Со7По12 mP3K, P2jc 0,839 1,132 1,397
| СоТЬ3 CFe3 oP\b, Pnma 0,6985 0,9380 0,6250
f *₽= 138,8°.
Идите ратура
1. Гладышевский Е.И., Бодак О.И. // Кристаллохимия интерметаллических со-
К'единений редкоземельных металлов. Львов: Виш,а школа. 1982. 255 с.
S Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Л
Со—Тс. КОБАЛЬТ—ТЕХНЕЦИЙ
В работе [1] исследованы сплавы системы Со—Тс в интервале
концентраций 14,3—75 % (ат.) Со, отожженные в течение семи дней
при температуре 1050 °C. Установлено, что все сплавы обладают
структурой твердого раствора с ГПУ решеткой. Соединений в
системе не обнаружено. Авторы работы [ 1 ] предполагают, что диаг-
рамма состояния этой системы будет подобна диаграмме состояния
Со—Re.
Литература
1. Darby J.B., Norton J.Y. and Downey 1.М. //J. Less-Common Met. 1963. B. 5. N 5.
P. 397-402.
M.A. Тылкина
Co-Те. КОБАЛЬТ—ТЕЛЛУР
Информация о взаимодействии Со с Те приведена в работах [X,
'’> Ш]. На рис. 42 представлена диаграмма состояния СоТе, постро-
енная на основании обобщения данных работ [X, Э, 1—3]. В работе
I'M для получения сплавов использовали Те чистотой 99,999 % (по
массе) и Со химически чистый.
92
Co-Те
Те, °/о (по массе)
Рис. 42. Со—Те
В системе образуются две фазы: у и СоТе2. Максимум температу-
ры плавления фазы у приходится на состав сплава с 54,5 % (ат.) Те
и соответствует 1012±2 °C. Эвтектика образуется при 43 % (ат.) Те
и температуре 977±3 °C. Резкий подъем линии ликвидус от эвтек-
тической точки указывает на возможность существования области
несмешиваемости в жидком состоянии.
Фаза у имеет довольно широкую область гомогенности — 54,5—
65,4 % (ат.) Те. По данным зависимости энтальпии от состава этой
фазе приписывается формула Со3Те4 (57 % (ат.) Те) [1], а по
максимуму температуры плавления — формула Со5Те6 [3]. Эта фаза
обладает решеткой типа NiAs (символ Пирсона ЛР4, пр.гр. РЬ^ттс)
с параметрами а - 0,38937 нм и с = 0,53763 нм при содержании
Со-Th
93
54,55 % (ат.) Те и а = 0,38017 нм, с = 0,54994 нм при содержании
64,29 % (ат.) Те.
Фаза СоТе2 имеет узкую область гомогенности (66,8—67,8 % (ат.)
Те) и образуется по перитектической реакции при температуре
749 °C. Ее структура относится к типу FeS2 (символ Пирсона оРб,
пр.гр. Рппт), при стехиометрическом составе параметры решетки а =
= 0,63185 нм, 5 = 0,53189 нм, с = 0,38970 нм [2]. Растворимость Те
в Со в твердом состоянии невелика и не превышает 0,25 % (по
массе).
Литература
1. Дудкин Л.Д., Дюльдина К.А. // Журнал неорганической химии. 1959. Т. 4.
№ 10. С. 2313-2319.
2. HaraldsenJ., Gronvold F., Hurlem Т. 11 Z. Anorg. All. Chem. 1956. Bd. 283. N 1.
S. 143-146.
3. Tschirner H.-U., Garlipp B., Rentsch R. // Z. Metallkunde. 1986. Bd. 77. N 12.
S. 811-814.
Л.С. Гузей
Co—Th. КОБАЛЬТ—ТОРИЙ
Взаимодействие Co c Th рассмотрено в работах [X, Э]. Диаграмма
состояния Со—Th, представленная на рис. 43, построена по данным
работ (1, 2] в интервале температур от 800 °C до температур плавле-
ния сплавов.
В системе Со—Th существуют пять соединений: Th7Co3, ThCo,
Th2Co)7, ThCo5 и Th2Co7.
Существование первых четырех соединений установлено также в
более ранних работах [X].
Соединения Th7Co3, ThCo, TI1C05 и Th2Co17 плавятся конгруэн-
тно при температурах 1188, 1137, 1437 и 1462 °C соответственно.
Соединение Th2Co7 образуется по перитектической реакции Ж +
+ ThCo5 ** Th2Co7 при температуре 1125 °C. Авторам работы [3],
установившим наличие двух модификаций соединения Th2Co7, не
удалось определить температуру перехода aTh2Co7 в 0Th2Co7, так
как обе модификации существовали в образцах одновременно.
Соединение ThCo5 имеет область гомогенности -4 % (ат.) Со при
температуре 1300°С и ~2 % (ат.) Со — при температуре 1000 °C [2].
В системе наблюдается пять эвтектических реакций:
Ж * («Th) + Th7Co3 при 1100 °C;
Ж - Th7Co3 + ThCo при 1037 °C;
Ж « ThCo + Th2Co7 при 975 °C;
Ж * ThCo5 + Th2Co17 при 1300 °C;
Ж « Th2Co17 + (аСо) при 1387 °C.
Составы эвтектических точек точно не установлены.
94
Co-Те
Co, % (no массе)
Рис. 43. Со-Th
Данные по кристаллической структуре соединений приведены в
табл. 34.
Таблица 3 4. Кристаллическая структура соединений системы Со—Th
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Th7Co3 — Р63 тс 0,9892 (3) — 0,6207 (2) И!
ThCo СгВ оС8, Стет 0,3776 (2) 1,0877 (5) 0,4153 (2) [1]
ос Ce2Ni7 hP3f>, РС^ттс 0,5030 — 2,462 [3]
Со-Ti
95
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
^₽Th2Co7 Ег2Со7 АА18, R3m 0,503 — 3,691 [3]
ThCo5 СаСи5 hPf>, Р6/ттт 0,5005 — 0,3987 [Э]
Th2CO|7 Th2Zn17 KR19, R3m 0,8438 — 1,2254 [4]
«Литература
Ж 1. Thomson J.R. // J. Uss-Common Met. 1966. V. 10. P. 432-434.
В 2. Thomson J.R. // J. Uss-Common Met. 1972. V. 28. P. 182-185.
Ж 3. Buschow K.H.J., van der Goot A.S. //J. Uss-Common Met. 1971. V. 23.
fp. 399-402.
Ж 4. Johnson Q„ Smith G.S., Wood D.S. // Acta Crystallogr. B. 1969. V. 25. P. 464.
Г.П. Жмурко
' Co—Ti. КОБАЛЬТ—ТИТАН
Перечень работ по исследованию взаимодействия Со с Ti, выпол-
; ненных до середины 60-х годов, имеется в справочной литературе [X,
Э, Ш]. На рис. 44 приведен обобщенный вариант диаграммы состоя-
ния Со—Ti, учитывающий материалы работ [1—3]. В сплавах систе-
мы образуется пять интерметаллических соединений, из которых
только одно TiCo плавится с открытым максимумом при 1325 °C.
Остальные соединения Ti2Co, TiCo2 (с), TiCo2 (Ji), TiCo3 кристалли-
зуются по перитектическим реакциям при температуре 1058, 1235,
1210, 1190 °C соответственно. Кроме перитектик в сплаве кристалли-
зуются две эвтектики: ((3Ti) + Ti2Co при температуре 1020 °C и
TiCo2 (Л) + TiCo3 при температуре 1184 °C. Твердый раствор на
основе соединения TiCo3 (фаза у) имеет упорядоченную структуру
типа AuCu3. При увеличении содержания Ti параметр решетки а
твердого раствора возрастает от 0,3604 до 0,3613 [Э]. Следует отме-
тить, что при понижении температуры содержание Ti в фазе у
возрастает.
Вблизи состава, отвечающего соединению TiCo2, существуют две
фазы TiCo2 (А) и TiCo2 (с), первая из них имеет кристаллическую
структуру типа MgNi2 с параметрами решетки а = 0,4372 нм, с =
* 1,5427 нм, вторая — MgCu2 с параметром а = 0,6716 нм. Фаза на
основе соединения TiCo обладает довольно широкой областью гомо-
генности, которая при температуре 600 °C простирается от 48,5 до
% (ат.) Со [4]. Кристаллическая структура TiCo — кубическая
типа CsCl, а = 0,2965+0,3002 нм.
96
Со-Ti
Рис. 44. Co—Ti
Фаза Ti2Co относится к структурному типу TiNu, а = 1,130 нм.
Область гомогенности Ti2Co не установлена. Кобальт понижает
температуру полиморфного превращения Ti до 685 °C, максимальная
растворимость Со в (£Ti) -14,5 % (ат.), растворимость в (aTi) 1,5 %
(ат.) при температуре 685 °C. В твердом растворе (аСо) растворяется
-11 % (ат.) Ti при температуре 900 °C и -13,5 % (ат.) Ti при
температуре 1100 °C.
Литература
1. Петьков В.В., Киреев М.В. // Металлофизика. 1971. Вып. 33. С. 107—115.
2. Uhrenius В., Forsen К. // Z. Metallkunde. 1983. Bd. 74. N 9. S. 610-615.
3. Takayama T., Wey Myeong J„ Nishizawa T. // J. Japan Inst. Metals. 1981. V. 45
N 4. P. 341-346.
4. Van der Straten Bastin G.F., van Loo F.J.J., Rieck G.D. // Z. Metallkunde
1976. Bd. 67. N 3. S. 152-157.
77.fi. Будберг
Co—II, Co—Tm, Co—U
97
Ico-Tl. КОБАЛЬТ—ТАЛЛИЙ
ж Диаграмма состояния Со—Т1 не построена. В расплавленном Т1
«при температуре 900 °C растворяется до 0,86 % (ат.) Со в виде
м порошка. Растворение такого количества Со понижает температуру
Жплавления Т1 на 6 °C. Структура сплава с 0,75 % (ат.) Со состоит из
©первичных кристаллов Т1 и эвтектики; при несколько большем
«содержании Со образуются два несмешивающихся слоя [X].
№. Г.П. Жмурко
®Co-Tm. КОБАЛЬТ—ТУЛЛИЙ
I Диаграмма состояния Co—Tm не исследована. В литературе [Э,
* Ш, 1] приведены сведения о составах и структуре некоторых двой-
I ных соединений. Кристаллическая структура известных соединений
системы Co—Tm приведена в табл. 35.
Таблица 3 5. Кристаллическая структура соединений системы Co—Tm [1]
Соединение 11рототип Символ Пирсона, пр.гр. Параметры решетки, нм
a С
Со17Тт2 Ni17Th2 /1Р38, Р63/ттс 0,8298 0,8131
Со5Тт Cu5Ca hP6, Р6/ттт 0,4863 0,4017
Со7Тт2 coyGe^ hRl8, R3m 0,4965 3,605
Со3Тт Ni3Pu —, Rm3 0,4968 2,416
Со2Тт Cu2Mg cF24, Fd3m 0,71952 —
Со3Тт4 Co3Ho4 hP22, P63/m 1,1290 0,3952
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Со—U. КОБАЛЬТ—УРАН
Первоначально в системе Со—U обнаружено три интерметалличес-
ких соединения CoU6, CoU, Co2U [XI. В более поздних работах в
области, богатой Со, установлено существование еще трех соедине-
ний Co3U, Co4U и CoHU2 [Э]. Последний вариант диаграммы состо-
яния Со—U приведен на рис. 45.
4 Зак. 2144
98
Co~U
CO Ut°/<r (a/п.) U
Рис. 45. Co—U
Соединения Co2U, Co4U и Coj]U2 плавятся конгруэнтно при 1170,
1120 и ИЗО °C. Соединения Co2U имеет значительную область
гомогенности. Соединения CoU6 и CoU образуются по перитектичес-
ким реакциям при 830 и 815 °C, соединение Co3U устойчиво при
температуре до 830 °C. В системе существуют четыре эвтектических
равновесия:
Ж « CoU6 + CoU при 740 °C;
Ж « Co2U + Co4U при 1090 °C;
Ж * Co4U + CoHU2 при 1095 °C;
Ж * ConU2 + (аСо) при 1120 °C.
В сплавах, богатых U, предполагают наличие эвтектоидных
превращений (yU) и (PU) весьма ограниченных концентраций.
Соединение CoU6 имеет ОЦ тетрагональную решетку изотипную
MnUg (символ Пирсона //28, пр.гр. 14/mcni), параметры решетки а~
= 1,036±0,002 нм, с = 0,521 ±0,002 нм [X], соединение CoU — ОЦК
структуру, а = 0,63557 ±0,00004 нм [X], соединение Co2U — структу-
ру типа Cu2Mg (символ Пирсона cF24, пр.гр. Fd3m), а - 0,6929—
0,7000 нм [X, Ш]. Структура соединений Co3U, Co4U и CoHU2 нс
установлена.
Г.П. Жмур'^
Co-V
99
Co—V. КОБАЛЬТ—ВАНАДИЙ
На рис. 46 приведена диаграмма состояния Со—V по данным
работы [X] с учетом результатов последующих исследований [Э, Ш,
1]. В сплавах системы существуют три интерметаллических соедине-
ния Co3V, CoV, CoV3. Первое из этих соединений образуется в
результате перекристаллизации твердого раствора (аСо) при темпе-
ратуре 1071 °C. Соединение CoV образуется по перитектической
реакции при температуре 1422 °C, а соединение CoV3 — по перитек-
тоидной реакции при температуре -1026 °C. Соединение CoV (а)
обладает широкой областью гомогенности, которая при комнатной
Температуре простирается от 45,6 до 72 % (ат.) V. При температуре
'•Я242 °C кристаллизуется эвтектика (аСо) + а. При температуре
И026 °C и содержании 34,2 % (ат.) V (аСо) распадается по эвтекто-
ждной реакции на смесь Co3V + а.
ж И, % (по массе)
I 0 10 20 30 40 50 Б0 70 80 90 100
О 10 20 30 00 50 50 70 80 90 100
Со °/о (ат ) /
Рис. 46. Co-V
Максимальная растворимость V в Со достигает 35,2 % (ат.) при
т«мпературе 1242 °C, которая снижается до 9,1 % (ат.) при комнат-
ой температуре. В (V) растворяется до 22,4 % (ат.) Со при темпера-
УРе 1422 °C, при комнатной температуре —7,0 % (ат.).
4*
100
Co—W
Соединение CoV3 имеет кубическую решетку типа Сг3О с пара
метром а = 0,4681 нм [Ш]; соединение CoV тетрагональную структу-
ру с параметрами решетки а - 0,6246 нм и с = 0,9104 нм, соеди-
нение Co3V — упорядоченную гексагональную структуру, близкую
к типу AuCu3 (символ Пирсона сР4, пр.гр. РтЗт) с 24 атома-
ми, приходящимися на элементарную ячейку, а = 0,5032 нм,
с = 1,227 нм [3].
Литература
1. Aoki loshihira, Obi loshihira, Konjatsu Hiroshi // Z. Metallkunde. 1979. Bd. 70
N 7. S. 436-440.
П.Б. Будберг
Co—W. КОБАЛЬТ—ВОЛЬФРАМ
Диаграмма состояния (рис. 47) представлена по данным работ [X,
Э, 1]. В системе образуются две промежуточные фазы Co3W, Co7W6
и твердые растворы на основе W и Со:(аСо) и (еСо). Фаза Co7W(.
образуется по перитектической реакции из расплава и (W) при
температуре 1689 °C, интервал гомогенности 43,3—48,5 % (ат.) W
[1]. Между («Со) и Co7W6 образуется эвтектика при температуре
1471 °C и содержании -21 % (ат.) W. Соединение Co3W гомогенно
в интервале концентраций 22,9 и 25,3 % (ат.) W и образуется по
перитектоидной реакции при взаимодействии (аСо) и Co7W6 при
температуре 1093 °C [1]. На линиях ликвидус—солидус (аСо) имеет-
ся максимум при температуре 1505 °C и содержании 10 % (ат.) W.
Растворимость W в расплаве при температуре перитектики составляет
32 % (ат.) W. Растворимость W в (аСо) при эвтектической темпера-
туре равна 17,5 % (ат.), при температуре 1093 °C — 13,0 % (ат.), а
при температуре 865 °C — 4,0 % (ат.). Растворимость W в (еСо) при
температурах 1100, 1050, 1000, 900, 800, 700 и 350 °C составляет 13;
8; 6; 3,6; 2,2; 1,5 и -1 % (ат.) соответственно.
По данным работы [1] температура превращения (аСо) * (гСо)
в сплавах с W близка к температуре превращения для чистого Со и
составляет 422 °C. Этот участок диаграммы состояния нуждается в
уточнении. В сплавах, содержащих <8 % (ат.) W, наблюдается
мартенситное превращение а - е'. Введение W понижает температу-
ру магнитного превращения с 1121 °C для Со до 865 °C для сплава
(аСо) с 4 % (ат.) W. Растворимость Со в (W) составляет 0,9 % (ат.)
при температуре перитектики.
Соединение Co7W6 имеет гексагональную структуру типа Fe7W6
(символ Пирсона АТ? 13, пр.гр. RЗиг), а = 0,4732 нм, с = 2,653 нм со
стороны Со и а = 0,4761 нм, с = 2,572 нм со стороны W [2].
Co-W
101
Рис. 47. Co—W
Соединение Co3W обладает структурой типа Ni3Sn (символ Пирсо-
на ЛР8, пр.гр. Pbijmmc}, а = 0,513 нм, с = 0,413 нм [2].
В работах [3, 4] проведен термодинамический расчет сплавов
системы Co—W. В первой из указанных работ показано, что раство-
римость Со в (W) при перитектической температуре составляет -2 %
(ат,), во второй рассчитано влияние W на снижение температуры
Кюри (аСо).
Литература
1 Nagender Naidu S.V., Sriramamurty А.М., Rama Rao // J. Alloy Phase Diagrams.
1986. V. 2. N 1. P. 43-52.
2. Magneli A., Wetgren A. // Z. Anorg. All. Chem. 1938. Bd. 238. S. 268—272.
3. Gabriel A., Lukas H.L., Allbert C.H., Ansara Y. // Z. Metallkunde. 1985. Bd. 76.
N 9- S. 589—595.
4. Guillerment A.F. // Z. Metallkunde. 1988. Bd. 79. N 10. S. 638—642.
К.Б. Поварова
102
Co-Y
Co—Y. КОБАЛЬТ—ИТТРИЙ
Исследованию диаграммы состояния Со—Y посвящен ряд работ |Э,
1—4]. На рис. 48 представлен обобщенный вариант диаграммы состо-
яния согласно работе [5]. Сплавы синтезировали из металлов со
следующим содержанием основного компонента: Со — 99,98 % (по
массе), Y — 99,76 % (по массе).
Рис. 48. Co-Y
Исследование выполнено методами микроструктурного, рентгенов-
ского анализов, измерением ЭДС. В сплавах системы Со—Y сущес-
твует девять интерметаллических соединений, из которых лишь одно
Co17Y2 плавится с открытым максимумом при 1370 °C. Все остальные
образуются по перитектическим реакциям:
Co—Y
103
Ж + Co17Y2 ** Co5Y при 1350 °C;
Ж + Co5Y - Co7Y2 при 1340 °C;
Ж + Co7Y2 * Co3Y при 1330 °C;
Ж'+ Co3Y - Co2Y Юри 1160 °C;
i Ж* Co2Y = Co3Y2 при 780 °C;
; Co3Y2 * Co7Y9 при 735 °C;
Ж + Co7Yg « Co5Y8 при 725 °C;
Ж + (aY) * CoY3 при 880 °C.
В системе кристаллизуются две эвтектики: (aCo) + Co17Y2 при
температуре 1330 °C и Co5Y8 + CoY3 при температуре 715 °C. Взаим-
ная растворимость компонентов в твердом состоянии практически
отсутствует.
Сведения о кристаллических структурах и составах всех обнару-
женных соединений суммированы в табл. 36 и, кроме упомянутых
выше работ, систематизированы в работе [6].
Таблица 36. Кристаллическая структура соединений системы Со—Y [6]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
CO|7Y2 Ni17Th2 ЛР38, Pbjmmc 0,8355 — 0,8128
Co5Y Cu5Ca hP6, P6/mmm 0,4928 — 0,3992
Co7Y2 Co7Er2 hR18, R3m 0,5002 — 3,621
Co3Y Ni3Pu R3m 0,5016 — 2,433
Co2Y Cu2Mg cF24, Fd3m 0,7217 — —
Co7Y9 Co3Ho4 hP22, P63/m 1,1529 — 0,4041
Co5Y8* Co5Yg mP 52, P2jc 0,7058 0,7286 2,4277
CoY3 _ *₽ - 102,11°. Fe3C OP16, Pnma 0,7026 0,9454 0,6290
^я’ература
1- Buschow K.H.J. // Phillips Res. Rep. 1971. V. 26. N 1. P. 49-64.
2. Pelleg J., Carlson O.N. // J. Less-Common Met. 1965. V. 9. N 4. P. 281-288.
3 Ray A.E. // Cobalt. 1974. V. 1. P. 13-20.
104 Co-Yb
4. Grover A.K., Colbs B.R., Sarkissian B.V. et al. // J. Less-Common Met. 1982
V. 86. N 1. P. 29-36.
5. Subramanian P.R., Smith J.F. // Metall Trans. A. 1985. V. 16. P. 1195-1201.
6. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Co-Yb. КОБАЛЬТ—ИТТЕРБИЙ
Диаграмма состояния Со—Yb не исследована. В литературе [Ш,
1] содержатся сведения о составах и структуре некоторых двойных
соединений (табл. 37). В справочнике [М] приведен один из возмож-
ных вариантов диаграммы состояния этой системы (рис. 49). Проте-
кание монотектической реакции предполагается при температуре
1310 °C. При температуре 819 °C кристаллизуется вырожденная
эвтектика Co2Yb + (yYb).
Кристаллическая структура соединений приведена в табл. 37.
Рис. 49. Со—Yb
Co—Zn
105
Таблица 3 7. Кристаллическая структура соединений системы Со—Yb [1]
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм
а С
CO|7Yb2 Ni17Th2 /гР38, Р famine 0,8309 0,8096
Co3Yb Ni3Pu R3m 0,4952 2,419
Co2Yb Cu2Mg cFU, F<T3m 0,706 —
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Co—Zn. КОБАЛЬТ—ЦИНК
Диаграмма состояния Co—Zn, построенная на основании анализа
данных термического, микроструктурного, рентгеновского анализов
и измерения температурной зависимости магнитной восприимчивос-
ти, приведена на рис. 50 согласно работе IX].
В системе существуют промежуточные фазы: 0 и 015 у, Yi и Уг»
Все фазы имеют области гомогенности, которые с понижением темпе-
ратуры сужаются. В работе [1] изучены сплавы системы при содер-
жании Zn до 60 % (ат.) и температурах >800 °C. Полностью подтвер-
ждены сведения о характере взаимодействия Со с Zn, приведенные
на рис. 50.
Максимальная растворимость Zn в (аСо) определена по измене-
нию параметра кристаллической решетки а, который для (аСо) воз-
растает от 0,3542 до 0,3642 нм при содержании 37,5 % (ат.) Zn [2].
Влияние Zn на температуру полиморфного превращения Со требует
уточнения. При температуре 300 °C растворимость Zn в (еСо) дости-
гает 2,5 % (ат.).
Растворимость Со в (Zn), по-видимому, очень мала и при темпе-
ратуре 400 °C составляет -0,01 % (ат.) и несколько уменьшается при
понижении температуры. Со стороны Zn наблюдается вырожденная
эвтектика, температура плавления которой на несколько долей
гРадуса ниже температуры плавления Zn.
Фаза 0, по-видимому, обладает ОЦК структурой, фаза 0( — ОЦК
структурой типа 0Mg, а = 0,6314 нм со стороны Со и а = 0,6369 нм
со стороны Zn. Фаза у изотипна у латуни, а = 0,8908 нм при содер-
жании 76,2 % (ат.) Zn и а = 0,8985 нм при содержании 84,7 % (ат.)
106
Co—Zn
Рис. 50. Co-Zn
Co—Zr
107
Zn; фаза у, имеет структуру искаженной у-латуни. Фаза у2 (CoZn13)
обладает моноклинной структурой (две формульные единицы на
элементарную ячейку), а = 1,3306-4),0033 нм; b = 0,7535±0,0002 нм,
с = 0,4992+0,0012 нм, р = 126°47'±15' [2].
Литература
1. Budurov S., Wassiiew G. // Z. Metallkunde. 1973. Bd. 67. N 3. S. 170—172.
2. Brown P.J. // Acta Crystallogr. 1962. V. 15. P. 608—612.
В.П. Полякова
Co-Zr. КОБАЛЬТ—ЦИРКОНИЙ
Диаграмма состояния Со—Zr приведена на рис. 51 по данным
работы [1]. Сплавы, приготовленные дуговой плавкой в среде очи-
щенного Не из иодидного Zr чистотой 99,9 % (по массе) и электро-
литического Со чистотой 99,9 % (по массе), исследовали методами
термического, микроструктурного, рентгеновского, локального рентге-
носпектрального анализов, измерения твердости, микротвердости и
магнитной восприимчивости. Сплавы отжигали в интервале темпера-
тур 1150—600 °C, длительность отжига составляла 1000—3500 ч при
каждой температуре. Взаимодействие Zn и Со характеризуется
образованием шести соединений — Zr2Con, Zr6Co23, ZrCo2, ZrCo,
Zr2Co, Zr3Co. Соединения ZrCo2 (X2), ZrCo и Zr2Co плавятся конгру-
энтно при 1560, 1370 и 1090 °C соответственно, a Zr2Con, Zr6Co23
и Zr3Co образуются по перитектическим реакциям:
Ж + Zr6Co23 * Zr2Con при 1270 °C;
Ж + ZrCo2 * Zr6Co23 при 1350 °C;
Ж + (pZr) Zr3Co при 980 °C.
В системе протекают эвтектические реакции:
Ж « (аСо) + Zr2CoH при 1240 °C и 10 % (ат.) Zr;
Ж * Л2 + ZrCo при 1260 °C и 46 % (ат.) Zr;
Ж ZrCo + Zr2Co при 1040 °C и 64 % (ат.) Zr;
Ж * Zr2Co + Zr3Co при 940 °C и 70 % (ат.) Zr.
Область гомогенности ZrCo2(A2) имеет протяженность 25—34 %
(ат.) Zr, Zr3Co — 74—76 % (ат.) Zr, остальные соединения заметных
областей гомогенности не имеют.
В работе [2] для области гомогенности ZrCo2 даются пределы
27,8-33,3 % (ат.) Zr.
В работе [3] соединение Zr3Co обнаружено не было, а соединению
Zr6Co23 отвечала фаза ZrCo4. В последующих исследованиях подтвер-
ждено существование стабильных фаз Zr3Co [4, 5], Zr2Co, ZrCo2 и
ZigCo23 [41 и не подтверждено существование фазы ZrCo4 [5]. В
работе [3] подробно исследованы, фазовые превращения твердых
108
Co—Zr
Рис. 51. Co—Zr
Co—Zr
109
растворов на основе Zr. Максимальная растворимость Со в (0Zr) при
температуре 980 °C составляет 3,37 % (ат.) Со. Кобальт понижает
температуру р * а превращения Zr. При температуре 833 °C [3]
происходит эвтектоидный распад (pZr). Эвтектоидная точка располо-
жена при 97,54 % (ат.) Zr. Растворимость Со в (aZr) составляет
0,16—0,31 % (ат.), растворимость Zr в (аСо) —0,32 % (ат.).
В системе Co—Zr при исследовании аморфных сплавов обнаружен
ряд метастабильных фаз. Сведения о кристаллических структурах
стабильных и метастабильных фаз приведены в табл. 38.
Таблица 38. Кристаллическая структура соединения системы Co—Zr
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а Ь С
Стабильные соединения
Zr2 Соц — — — — — [6]
^гб^°23 Th6Mn23 сЯ16, Fm3m 1,1516 1,148 — — [6] [4]
ZrCo2 MgCu2 cF24, Fd3m 0,687—0,696** 0,6867-0,6950 — — [1] [4]
ZrCo CsCl сР2, РтЗт 0,3196 0,3181—0,3198 — — [3] [4]
Zr2Co CuAl2 (/12, 14/тст 0,6366 0,6375 — 0,5514 0,5446 [3] [4]
Zr3Co BRe3 оС\Ь, Стет Метастаб; 0,327 0,3290 альные соедини 1,084 1,0879 тия 0,895 0,8859 [И [4]
aZr4Co wZr — 0,5038 — 0,3126 [4, 7]
0Zr4Co** — — 0,3281 0,3553 0,6864 [4]
Zr3Co2 Структу При koi Ромби1 >a неизвестн тцентрации 1еская синго а. 25—34 % (а НИЯ. 0,861 т.) Zr. 0,344 1,203 [4]
110
Cr—Cs
Следует отметить, что образованию стабильной фазы Zr2Co с
тетрагональной структурой типа CuA12 (pZr2Co) при кристаллизации
аморфных сплавов предшествовало появление фазы Zr2Co с кубичес-
кой структурой типа Ti2Ni (aZr2Co), при дальнейшем нагреве проис-
ходило структурное превращение фазы типа Ti2Ni в фазу типа
СиА12. Согласно работе [8] метастабильная фаза Zr2Co с кубической
структурой типа Е93 появляется при кристаллизации аморфных
сплавов, содержащих <0,2 % (ат.) О.
Калометрическим методом определены энтальпии образования
соединений: Zr2Co — 33000+2000 Дж-моль’1 (1290 К); ZrCo —
42200+1000 Дж-моль’1 (1512 К); ZrCo2 — 41000+1600 Дж-моль 1
(1708 К); ZrCo4 - 29800+1500 Дж - моль’1 (1596 К) [9J.
Литература
I. Баталева С.К., Куприна В.В., Бурнашева В.В. и др. // Вестник Моск. гос.
ун-та. Сер. Химия. 1970. Т. И. № 5. С. 557-561.
2. Nishizawa Т„ Ishida К. // Bull. Alloy Phase Diagrams. 1983. V. 4. N 4.
P. 387-390.
3. Pechin W.H., Williams D.E., Larsen W.L. // Trans. ASM. 1964. V. 47
p. 464-473.
4. Buschow K.H.J. 11 J. I^ess-Common Met. 1982. V. 85. N 2. P. 221—231.
5. Matkovic T., Kesin-Racan M., Matkovic P. // Metallurgija. 1986. V. 25. N 3.
P. 87-91.
6. Кузьма Ю.Б., Маркив В.Я., Ворошилов Ю.В., Сколоздра Р.В. // Изв АН
СССР. Неорганические материалы. 1966. Т. 2. № 2. С. 259—263.
7. Vincze I., van der Woude F., Buschow K.HJ //J. Non—Cryst. Solids. 1983. V. 54.
N 1-2. P. 101-106.
8. Altounian Z., Batallea E., Strom-Olsen J.O., Walter J.L. // J. Appl. Phys. 1987.
V. 61. N 1. P. 149-153.
9. Gachon J.C., Hertz J. // Calphad. 1983. V. 7. N 1. P. 1-12.
Л.А. Третьяченко
Cr—Cs. ХРОМ—ЦЕЗИЙ
На основании данных о строении и свойствах исходных компонен-
тов построена гипотетическая диаграмма состояния Cr—Cs (рис. 52)
11], предполагающая практически полное отсутствие взаимной
растворимости компонентов в жидком и твердом состояниях, Раство-
римость Сг в жидком Cs составляет около 10"3 % (ат.) при темпера-
туре -977 °C, при этом содержание кислорода в Cs равно ~10'2 %
(ат.).
Cr—Cs
111
Cr Cs,7o(am.) Cs
Phc. 52. Cr—Cs (p - 0.1 МПа)
Литература
p Venkatraman M., Neumann J.P. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 4.
Л.Л. Зусман
112
С г—Си
Сг—Си. ХРОМ—МЕДЬ
Диаграмма состояния Сг—Си исследована неоднократно. Получен-
ные результаты подтверждают наличие эвтектического равновесия в
системе и существование двух твердых растворов на основе Си и Сг.
Однако характер фазовых равновесий в высокотемпературной области
при концентрациях 0—55 % (ат.) Си является предметом многочис-
ленных дискуссий. В основном обсуждается вопрос о наличии или
отсутствии области несмешиваемости в жидком состоянии. В обзоре
[1] авторы анализируют ранние экспериментальные данные работ [2,
3] о существовании монотектики при температуре 1467 °C в интерва-
ле концентраций 5,0—53 % (ат.) Си и связывают это с низкой чисто-
той исходных материалов. Основываясь на термодинамических
расчетах [4] и определении активности жидкости [5], авторы работы
[1] описывают диаграмму состояния Сг—Си как эвтектическую
систему с отсутствием несмешиваемости в жидком состоянии и очень
пологим ликвидусом в области средних составов. Об отсутствии
несмешиваемости сообщается также в работе [6].
Рис. S3. Сг—Си
Си, 7> (ат.)
Cr—Cu
ИЗ
Выполненное впоследствии экспериментальное исследование [7]
во всем интервале концентраций методами дифференциального
термического и металлографического анализов позволило установить,
что в сплавах, содержащих от 4 до 45 % (ат.) Си, имеет место
монотектическое равновесие при температуре 1767±8 °C и концен-
трации 18,8 % (ат.) Си (рис. 53). Содержание примесей в исследо-
ванных сплавах не превышает % (по массе): Fe, Ni, Si — 0,001;
Мп — 0,01; О — 0,002; N — 0,0005; С — 0,005. Область расслоения
двух жидкостей Ж] и Ж2 простирается от 18,8 до 45 % (ат.) Си в
узком интервале температур, верхняя граница которого нс превыше
ет 1900 °C. Результаты термодинамического исследования сплавов
данной системы, приведенные в работах [8—10], также свидетель-
ствуют о наличии области несмешиваемости в жидком состоянии.
Полученные результаты не противоречат данным по активности,
указанным в работе [5], где подтверждается существование двухфаз-
ной области Ж + (Сг) в интервале концентраций 42—97 % (ат.) Сг
при температуре 1550 °C. Температура эвтектической реакции Ж *
** (Си) + (Сг), равная 1076,6 °C, и концентрация Си в эвтекти-
ке, составляющая 98,44 % (ат.), приняты на рис. 53 по данным
работы [11]
Растворимость Си в (Сг) определена в работе [4] при двух темпе-
ратурах, а в работе [7] — при трех температурах методом рентгенов-
ской дифракции при анализе кристаллов Сг, селективно выделенных
из сплава после изотермической выдержки. Эти данные приведены
в табл. 39.
Таблица 3 9 Растворимость Си в (Сг)
Температура, °C Растворимость Си, % (ат.) Источник
1700 0,35±0,04 [7]
1600 0,27±0,03 [7]
1500 0,22±0,03 17]
1300 0,16 [4]
__ 1150 0,085 [4]
Результаты растворимости Сг в (Си) проанализированы в работе
П] и некоторые из них [11—13] приведены в табл. 40.
Исследования были проведены методом металлографического
анализа, а также рентгеновского анализа [12] и измерением электро-
сопротивления [11]. В качестве исходных материалов были использо-
ваны Си чистотой 99,99 [11, 12]; 99,96 [13] % (по массе) и Сг
чистотой 99 [11]; 99,7 [12]; 99,8 [13] % (по массе).
114
Cr—Cu
Таблица 4 0. Растворимость Сг в (Си)
Температура, °C Растворимость Сг, % (ат.) Источник Температура, °C Растворимость Сг, % (ат.) Источник
1070 0,76 [12] 900 0,21 0,23 [И] [13]
1050 0,73 [И] 840 0,12 0,15 [12] [13]
1030 0,54 [12] 800 0,16 [13]
1000 0,49 [И] 700 0,1 [14]
980 0,48 [12] 600 0,09 [13]
950 0,31 [И] 400 0,024 [13]
910 0,27 [12]
Максимальная растворимость при температуре 1076,6 °C составля-
ет 0,89 % (ат.) Сг [11].
Согласно работе [1] растворимость Сг в (Си) может быть описана
уравнением х = 24840 ехр (—114880/ЛГ), где х — в % (ат.) Сг.
В работе [14] приведены сведения о влиянии различных скоростей
охлаждения сплавов на содержание Сг в (Си) и эвтектике.
Литература
1. Chakrabarti B.J., Laughlin D.E. И Bull. Alloy Phase Diagrams. 1984. V. 5. N 1.
P. 59—68.
2. Hindrichs G. // Z. Anorg. All. Chem. 1908. Bd. 59. S. 420-423.
3. Siedschlag E. // Z. Anorg. All. Chem. 1923. Bd. 131. S. 173-178.
4. Кузнецов Г.М., Федоров B.H., Роднянская А.Л. // Изв. вузов. Цветная метал-
лургия. 1977. № 3. С. 84—86.
5. Timberg L., Toguri J.M. // J. Chem. Thermodyn. 1982. V. 14. P. 193-199.
6. Кузнецов Г.М., Федоров B.H., Токарчук И.Н. // Изв. вузов. Цветная металлур-
гия. 1983. № 4. С. 78-81.
7. Леонов М.П., Бочвар Н.Р., Иванченко В.Г. // Доклады АН СССР. 1986.
Т. 220. № 4. С. 888-890.
8. Kaufman L. // Calphad. 1978. V. 2. Р. 117-146.
9. Белоусов А.А., Нечепуренко А.С. // Кинетика обменных взаимодействий и
термодинамические свойства металлургических расплавов: Сб. статей. Свердловск:
1983. С. 33-40.
10. Katsutoshi О., Seiji N., Toshio О. // Trans. Japan. Inst. Metals. 1984. V. 25.
N 11. P. 810-814.
11. Doi T. // J. Inst. Met. 1957. V. 21. N 5. P. 337-340.
12. Захаров M.B., Осинцев O.E. // Изв. вузов. Цветная металлургия. 1967. № 5
С. 152-155.
13. Дриц М.Е., Рохлин Л.Л., Бочвар Н.Р. и др. // Изв. вузов. Цветная металлур-
гия. 1975. № 2. С. 122-125.
14. Волошко И.А., Розенберг В.М. // Изв. АН СССР. Металлы. 1987. № 1.
С. 196-198.
Н.Р. Бочвар, К.Б. Поварова
Cr-Dy
115
Cr-Dy. ХРОМ-ДИСПРОЗИЙ
Диаграмма состояния Сг—Dy построена на основании данных
работ [1, 2] и приведена на рис. 54. В работе [1] использованы Сг
чистотой 99,98 % (по массе) и Dy чистотой 99,3 % (по массе).
Исследование выполнено методами дифференциального термического,
металлографического и рентгеноструктурного анализов. Промежуточ-
ных фаз в системе не обнаружено. Система характеризуется наличи-
ем области несмешиваемости в жидком состоянии. Монотектйческая
реакция имеет место при температуре 1795 °C и содержании 0,95 %
(ат.) Dy [1]. Эвтектика между твердыми растворами (Сг) и (Dy)
образуется при температуре 1190 °C и содержании 76,4 % (ат.) Dy
[2]. В работе [1] температура эвтектики определена .равной 1170 °C.
Рис. 54. Cr-Dy
Максимальная растворимость Dy в (Сг), полученная экстраполяцией
[1], составляет 0,6 % (ат.). При температурах 1700 и 1600 °C в (Сг)
Растворяется 0,2 и 0,12 % (ат.) Dy [1], а при 1260 °C — 0,065 %
(ат.) Dy [2]. В (Dy) растворяется менее 0,62 % (ат.) Сг [2]. Термо-
116
Cr-Er
динамический расчет диаграммы, проведенный в работе [3], подтвер-
дил характер взаимодействия элементов в системе Сг—Dy. Однако
температура эвтектической реакции на 100—150 °C выше экспери-
ментально установленной.
Литература
1. Свечников В.Н., Кобзенко Г.Ф., Иванченко В.И. // Металлофизика. 1975.
Вып. 59. С. 77-83.
2. Copeland М., Kato Н. // Physics and Problems of Reactor Control Rods. Vienna.
International Atomic Energy Agency, 1964. P. 295—317.
3. Свечников B.H., Иванченко В.Г., Кобзенко Г.Ф. // Диаграммы состояния
металлических систем. Термодинамические расчеты и экспериментальные методы. М.:
Наука, 1981. С. 85-90.
К. Б. Поварова, Н.Р. Бочвар
Сг—Ег. ХРОМ-ЭРБИЙ
Диаграмма состояния Сг—Ег построена по данным работ [1,2] и
приведена на рис. 55. Исследование выполнено методами дифферен-
циального термического, металлографического и рентгеноструктурно-
го анализов. В работе [1] использованы Сг чистотой 99,98 % (по
Рис. 55. Сг—Ег
Ег, % (по массе)
С г—Ей
117
массе) и Ег чистотой 99,0 % (по массе). Система характеризуется
наличием области несмешиваемости в жидком состоянии. Промежу-
точные фазы не образуются. Монотектическая реакция протекает при
температуре 1775 °C и содержании 1,1 % (ат.) Ег [1]. Эвтектика
между твердыми растворами (Сг) и (Ег) образуется при температуре
1210 °C и содержании 75,9 % (ат.) Ег [2]. В работе [1] температура
эвтектики определена равной 1220 °C.
Растворимость Ег в (Сг) при монотектической температуре,
полученная экстраполяцией, составляет 0,65 % (ат.), при температу-
рах 1700 и 1600 °C равна 0,18 и 0,08 % (ат.) соответственно [11.
Согласно данным работы [2] при температуре 1260 °C в (Сг) раство-
ряется менее 0,1 % (ат.) Ег, а растворимость Сг в (Ег) составляет
менее 0,1 % (ат.). Термодинамический расчет диаграммы, проведен-
ный в работе [3], подтвердил характер взаимодействия элементов в
системе Сг—Ег. Однако температуры нонвариантных реакций и
концентрации критических точек значительно отличаются от экспе-
риментально установленных.
Литература
1. Свечников В.Н., Кобзенко Г. Ф„ Иванченко В.Г. // Металлофизика. 1975.
Вып. 59. С. 77-83.
2. Copeland М., Kato Н. // Physics and Material Problems of Reactor Control Rods.
Vienna: International Atomic Energy Agency, 1964. P. 295—317.
3. Иванченко В.Г., Кобзенко Г.Ф., Свечников В.H. // Металлофизика. 1979.
N 75. С. 98-102.
К. Б. Поварова, Н.Р. Бочвар
Сг—Ен. ХРОМ—ЕВРОПИЙ
Диаграмма состояния Сг—Ей экспериментально не построена.
Однако в работе [1] на основании термодинамического расчета
показано, что в системе Сг—Ей стабильные соединения не образуются
и система Сг—Ей подобна системе Nb—Ей. На основании указанных
данных в работе [2] предложена гипотетическая диаграмма Сг—Ей
(рис. 56) и сообщается об отсутствии взаимной растворимости компо-
нентов в жидком и твердом состояниях.
1 18
Cr-Fe
Рис. 56. Cr-Eu
Литература
1. Miedema A.R. //J. I>ess-Common Met. 1976. V. 46. N 1. P. 167—173.
2. Moffatt W.G. Handbook of Binary Phase Diagrams. New York: Business Growth
Servies. General Electric Co. Schenectady, 1976. 1977. V. 1., 2. 658 p.
H.P. Бочвар
Cr—Fe. ХРОМ—ЖЕЛЕЗО
Результаты исследования диаграммы состояния Cr—Fe обобщены
в справочниках [X, Э, Ш]. Представленная на рис. 57 диаграмма
состояния Cr—Fe построена по данным работы [1]. Сг и Fe образуют
непрерывные ряды твердых растворов в жидком и твердом состояни-
ях. На линиях ликвидуса и солидуса имеется минимум при темпера-
туре 1513 °C и содержании около 21 % (ат.) Сг [2]. В твердом
состоянии в системе существуют следующие фазы: промежуточная
Cr-Fe
119
Рис. 57. Cr-Fe
Фаза a (FeCr), непрерывная область твердых растворов между aFe и
у* ~ (aFe, Сг) и ограниченная область твердого раствора на основе
yFe. Максимальная растворимость Сг в (yFe) составляет 11,9 %
(ат.). Граница двухфазной области между (yFe) и (aFe, Сг) имеет
••иимум при содержании 7 % (ат.) Сг и температуре 830 °C [3]. По
Данным различных литературных источников, приведенным в работе
и в'>Т0ЧКа минимУма может располагаться при 7—8 % (ат.) Сг
8^0—850 °C. Фаза а образуется из (aFe, Сг) при содержании
120
Cr—Ga
48—49 % (ат.) Cr и температуре ниже 815—830 °C и распадается при
температуре 440—520 °C по эвтектоидной реакции на два твердых
раствора, богатых Fe и Сг. На рис. 57 температура эвтектоидной
реакции и концентрация Сг в эвтектоиде приведены по данным
работы [1]. Интервал гомогенности фазы а, по данным различных
исследователей, колеблется в пределах 42—51 % (ат.) Cr [1, 4]. Фаза
а имеет структуру типа 0U (символ Пирсона (РЗО, пр.гр. P^/mrim),
Параметры решетки имеют следующие значения: а = 0,8794—
0,881 нм, с = 0,4552—0,458 нм [41. Диаграмма состояния Сг—Fe часто
используется при различных термодинамических расчетах, в качестве
примера можно сослаться на работы [5, 6].
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
с англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
2. Schurmann Е., Brauckmann J. // Arch. Eisenhiittenwes. 1977. Bd. 48. N 1
S. 3-7.
3. Poyet P., Guiraldeng P., Hoehmann J. 11 Mem. Sci. Rev. Met. 1972. V. 69. N 11
P. 775-783.
4. Yukawa N., Hida M., Imura T. et al. Metall. Trans. 1972. V. 3. N 4. P. 887—895.
5. Lin J.C., Chuang Y.Y., Hsieh K.C., Chang Y.A. // Calphad. 1987. V. 11. N 1
P. 57-72.
6. Andersson J.O., Sudman В. И Calphad. 1987. V. 11. N 1. P. 83-92.
К.Б. Поварова
Cr-Ga. ХРОМ-ГАЛЛИЙ
Диаграмма состояния Cr—Ga (рис. 58) построена по данным работ
[1, 2]. В системе образуются четыре соединения: Cr3Ga, CrGa,
Cr5Ga6, CrGa4. Все указанные соединения образуются по перитекти-
ческим реакциям. Содержание Ga в богатом Сг соединении по дан-
ным работы [1] составляет 23 % (ат.), что не отвечает стехиометри-
ческому составу Cr3Ga, поэтому действительная формула соединения
будет отличаться от приведенной. Соединение Cr3Ga претерпевает
полиморфное превращение при температуре 1100 °C: 0Cr3Ga ”
aCr3Ga [1]. Нонвариантные реакции приведены в табл. 41.
Таблица 41. Нонвариантные реакции в системе Cr—Ga
Реакция Содержание Ga в фазах, % ,(ат.) Температура, °C Источник
Ж + (Cr) « pCr3Ga -33; 16; -23 -1620 [1]
Ж + aCr3Ga « CrGa 83; -23; 50 880 860 [1] [2]
Ж + CrGa » Cr5Ga6 92,5; 50; 56,6 775 750 [1J [2J
Cr—Ga
121
Реакция Содержание Ga н фазах, % (ат.) Температура, °C Источник
Ж + Cr5Ga6 • CrGa4 97,5; 56,6, -77 700 710 HI [2]
* CrGa4 + (Ga) -100; -77; -100 -29,5 [11
CrGa •* «Cr3Ga + Cr5Ga6 50; 23; -56,6 760 Hl
— — *— -680 [2]
Рис» 58. Сг—Ga
Кристаллохимические характеристики соединений в системе
Сг-—Ga приведены в табл. 42.
Таблица 4 2. Кристаллическая структура соединений системы Cr—Ga
Соединение Прототип Символ Пирсо- на, пр.гр. Параметр решетки а, нм Угол а° Источник
Cr3Ga Cr3Si сР8, РтЗт 0,464 0,4645 (4) — [21 [31
CrGa Cr5Alx hR26, R3m 0,901 89,2 [21
CrGa4 PtHg4 сЛО, /432 0,564 — [2]
I. IJ
I
if! 122 Cr-Gd
I Литература
I 1. Bornand J.D., Feschotte P. // Z. Metallkunde. 1972. Bd. 29. N 1. S. 81-91.
я 2. Maissner H.G., Schubert K. // Z. Metallkunde. 1965. Bd. 56. N 8. S. 523—530.
I 3. Wood E.A., Compton W.B., Mattias B.T. // Acta Crystallogr. 1958. V. 11. N 9.
11 P. 604-606.
I КБ. Поварова
i | Cr-Gd. ХРОМ-ГАДОЛИНИЙ
I* Диаграмма состояния Cr—Gd приведена на рис. 59 по данным
' работ [1, 2]. Исследование проведено методами дифференциального
I 4 термического, микроструктурного и рентгеновского анализов. В
Г качестве исходных материалов в работе [1] использованы Сг и Gd
чистотой 99,98 и 99,6 % (по массе), а в работе [2] — Сг и Gd чисто-
той 99,7 и 99,5 % (по массе) соответственно. Система Сг—Gd харак-
] 1 1р1 теризуется наличием области несмешиваемости в жидком состоянии,
t В сплавах, содержащих до ~64 % (ат.) Gd, протекает монотектичес-
I 'п кая реакция при температуре 1830 °C [2]. Согласно работе [1]
Рис. 59. Cr—Gd
Cr—Ge
123
Я Температура реакции равна 1820 °C, а содержание Gd в монотектике
^составляет 0,7 % (ат.). Эвтектика между твердыми растворами (Сг)
В И (aGd) кристаллизуется при температуре 1170 °C и содержании
ж 88,8 % (ат.) Gd [2], температура эвтектической реакции согласно
« работе [1] составляет 1150 °C. Максимальная растворимость Gd в
ж (Сг), полученная экстраполяцией, равна 0,42 % (ат.). При темпера-
li турах 1700 и 1600 °C в (Сг) растворяется 0,16 и 0,08 % (ат.) Gd [1J,
!' а при 1160 °C — менее 0,03 % (ат.) [2]. В работе [3[ проведен
' термодинамический расчет диаграммы состояния Cr—Gd и подтвер-
жден характер взаимодействия компонентов. Однако температуры
нонвариантных равновесий и концентрации критических точек
значительно отличаются от экспериментальных данных.
Литература
1. Свечников В.Н., Кобзенко Г.Ф., Иванченко В.Г. // Металлофизика. 1975.
Вып. 59. С. 77-83.
2. Copeland M.I., Armontrout С.Е., Kato Н. // Rept. Investing. Bur. Mines. U.S. Dept
Interior. 1964. N 6503. 9 p.
J 3. Иванченко В.Г., Кобзенко Г.Ф., Свечников B.H. // Металлофизика. 1979.
< Вып. 75. С. 98-102.
’’ К.Б. Поварова, Н.Р. Бочвар
Cr—Ge. ХРОМ-ГЕРМАНИЙ
Диаграмма состояния Cr—Ge обобщена в работе [1] на основании
различных исследований и построена на рис. 60, в основном по
: результатам работы [2]. В системе установлено пять промежуточных
фаз: Cr3Ge, Cr5Ge3, CrnGe8, CrGe, СгцСе19, причем все фазы
образуются по перитектическим реакциям. Данные работ [3, 4] о
конгруэнтном плавлении Cr3Ge и Cr5Ge3 не подтвердились. Также
не подтвердились результаты работы [5] о протекании в системе
монотектической реакции при температуре 1564 °C. Соединение
Ci\Ge3 претерпевает полиморфное превращение при 1002 °C:
pCr5Ge3 * aCr5Ge3. Соединения Cr3Ge и Cr5Ge3 имеют области
гомогенности, протяженность которых приведена в табл. 43.
Таблица 4 3. Границы существования соединений Cr3Ge и Cr5Ge3
Соединение Область гомогенности, % (ат.) Ge Температура, °C Источник
Cr3Ge 20,5-25,1 — [2]
21,82-26,36 1250 [3]
21,78-24,7 700 [4]
37,41-38,2 — [2]
__ Cr5Ge3 35,45-37,27 — [3]
124
Cr—Ge
Рис. 60. Cr—Ge
Нонвариантные реакции, имеющие место в системе Cr—Ge, приве-
дены в табл. 44.
Растворимость Ge в (Сг) при перитектической температуре состав-
ляет 11 % (ат.) [2]. Это значение можно считать средним между
значениями, приведенными в работах [4, 5] и составляющими 8—9
и 13 % (ат.) Ge соответственно, а значение ~5 % (ат.) Ge, указан-
ное в работе [3], занижено. При температурах 1525, 1420, 1300 и
1100 °C растворимость Ge в (Сг) составляет 11, 9, 7 и 5 % (ат.)
соответственно [5]. Данные по растворимости Ge в (Сг) при более
низких температурах хорошо согласуются между собой, раствори-
мость составляет менее 4 % (ат.) при 700—750 °C. Растворимость Сг
в (Ge) составляет <0,3 % (ат.) при 895 °C [2].
Кристаллохимические характеристики соединений приведены в
табл. 45.
Таблица 4 4. Нонвариантные реакции в системе Cr—Ge
Реакция Содержание Ge в фазах, % (ат.) Температура, “С Источник
Ж + (Сг) ₽ Cr3Ge 29; 11; 25 1564 [2]
— — — 1410 [5]
Ж + Cr3Ge * pCr5Ge3 47; 26,36; 37,5 1262 (21
Cr—Ge
125
Г Реакция Содержание Ge в фазах, % (ат.) Температура, °C Источник
— — — 1250 [3]
— — — 1245 [6]
Ж + ₽Cr5Ge3 - СгиСе8 53; 38,2; 42,1 1170 [2]
— — — 1160 [31
Ж + CrHGe8 « CrGe 68; 42,1; 50 998 [2, 7]
— — — 1025 [3]
— — — 995 [6]
Ж + CrGe « СгцСе19 78; 50; 63,34 928 [2]
— — — 955 [3]
— — — 925 [61
Ж •* Cr„Ge19 + (Ge) 85; 63,34; 99,7 895 [И
77 — — 865 [4J
Таблица 4 5. Кристаллическая структура соединений системы Cr—Ge
Соединение Прото- тип Символ Пирсо- на, пр.гр. Параметры решетки, нм Ис- точ- ник
а Ь С
Cr3Ge Cr3Si сР8, РтЗп 0,4631 — — [8]
“Cr5Ge3 W3Si3 (732, 14/тст 0,9410 (7) — 0,4783 (5) [8]
СгцСе8 — —, Рпат 1,3171 1,5775 0,4939 [9]
CrGe FeSi сР8, Р2{3 — — — [8]
CrnGel5> Mil] ]S1)9 tP\20, Р4п2 0,579 (1) — 5,187 (30) [8]
Ромбическая сингония.
Литература
1- Gokhale А.В., Abbaschian G.J. // Bull. Alloy Phase Diagrams. 1986. V. 7. N 5.
p- 477-485.
2. Godat D., Feschotte P. 11 J. Less-Common Met. 1980. V. 72. N 1. P. 7—22.
3. Загряжский В.Л., Штольц A.K., Гельд H.B., Кузьменко Н.В. // Порошковая
металлургия, 1966. № 8. С. 55—60.
4. Rawal В., Gupta К.Р. // J. Less-Common Met. 1972. V. 27. Р. 65—72.
5. Кобзенко Г.Ф. // Металлофизика. 1968. Вып. 22. С. 73—84.
126
Cr-H, Cr-Hf
6. Калишевич Г.И., Загряжский В.Л., Щипанова А.В. и др. // Журнал физичес-
кой химии. 1969. Т. 43. № 1. С. 246—248.
7. Kawasumu I., Konishi S., Kubota M., Sakata M. // Japan. Appl. Phys. 1978
V. 17. N 12. P. 2173-2174.
8. Kolenda M., Stoch J„ Szytula A. // J. Magntsm. Mater. 1980. V. 20. P. 99—106.
9. Ysrailoff P., Vollenkle H., Wittmann A. // Monatsh. Chem 1974. Bd. 105. N 6
S. 1387-1401.
К.Б. Поварова
Cr-H. ХРОМ-ВОДОРОД
Растворимость H в Cr в зависимости от давления и температуры
может быть описана уравнениями:
1g х = 0,5xlg р - 3,59 - 1330/7’ при 500-700 °C [1],
1g х = 0,5xlg р - 1,99 - 3000/Т при 730-1130 °C [1],
1g х = 0,5xlg р - 2,26 - 2730/Т при 700-1350 °C [2],
где х — концентрация Н, % (ат.); р — давление, МПа; Т — темпера-
тура, К.
В жидком Сг при температуре 1903 °C и давлении 0,1 МПа со-
гласно данным работы [1] растворяется около 0,33 % (ат.) Н. Высо-
котемпературные исследования [2] показали, что Н понижает темпе-
ратуру плавления Сг, при этом наблюдается газоэвтектическое
равновесие. Минимальная растворимость Н в Сг имеет место при
-500 °C, ниже этой температуры процесс поглощения газа идет
экзотермически.
Литература
1. Фромм Е., Гебхардт Е. Газы и углерод в металлах. Пер. с нем. / Под ред. Б.В.
Линчевского. М.: Металлургия, 1980. 712 с.
2. Шаповалов В.И., Сердюк Н.П., Долженков В.И. // Допов1д1 АН УРСР. 1981.
С. 88-90.
В.И. Шаповалов
Cr-Hf. ХРОМ-ГАФНИЙ
Диаграмма состояния Cr—Hf приведена на рис. 61 по данным
работы [1], в которой проведен полный обзор этой системы. Ликви-
дус и солидус системы построены в основном по данным работ [2—4].
В системе обнаружена одна промежуточная фаза Cr2Hf, которая
плавится конгруэнтно при температуре, находящейся в пределах
1813—1873 °C по данным работ [2—6]. На рис. 61 значение темпера-
туры образования соединения Cr2Hf принято согласно работе [1].
По данным работ [1, 3, 4] соединение Cr2Hf имеет две модифи-
кации: высокотемпературную (ВТ) м низкотемпературную (НТ),
температура полиморфного превращения составляет 1335 °C [1]. По
данным работ [5, 6] соединение Cr2Hf имеет три модификации:
Cr-Hf
127
Hf, ОА (no массе)
61. Cr-Hf
помимо вышеуказанных ВТ и НТ еще и среднетемпературную (СТ).
Температура превращения Cr,Hf (ВТ) »* Cr2Hf (СТ) составляет
SI350 °C для сплавов, богатых Hf, и 1420 °C для сплавов, богатых Сг
[5]. Согласно работе [6] эти температуры соответственно равны 1490
Си 1540 °C. Температура превращения Cr2Hf (СТ) •» Cr2Hf (НТ)
соответствует 1200 °C [5] или 1300 °C [б].
а б л и ц а 4 6. Нонвариантные реакции в системе Cr—Hf
— Реакция Содержание Hf в фазах, % (ат.) Температура, °C Источник
Мр > Ж - <Cr) + Cr2Hf -13; -0; 33,3 1665 * 30 (1]
1 -12; -0; 32 1642 »10 12}
-14; -0; 33,5 1662*15 [31
-13; <2; -33; 1693*15 [4]
Ж * Cr2Hf +(₽Hf) -70; -35; -84 1500 * 20 [1)
-73,4; -34; - 1392*10 12]
128
Cr-Hf
Реакция Содержание Hf в фазах, % (ат.) Температура, °C Источник j
~69; -33,5; -84 1492+5 [3]
-59; -36, -87 1512+8 14]
(рно « Cr2Hf + (aHf) -88; -35; >98 1370+20 П)
91,5; -34; >98 1302+10 [2]
-88; 33,5 >98,5 1392 [3] 1
-88,5; -35,5; >98 1357 +15 14] 1
Таблица 4 7. Кристаллическая структура соединений системы Cr—Hf
Соединение Прото- тип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
Cr2Hf (ВТ) MgZn2 API 2, РЬ3!ттс 0,507 (2) 0,823 (2) [1]
Cr2Hf (СТ) MgNi2 МПА. Рв3/ттс 0,5047 1,632 [51
Cr2Hf (НТ) Cu2Mg cF24, Fd3m 0,715 (2) — [1]
На рис. 61 температуры превращений приведены по данным работы
[5]. В системе кристаллизуются две эвтектики и имеет место одно
эвтектоидное превращение (табл. 46).
Растворимость Hf в (Сг) менее 0,3 % (ат.) [3]; согласно работе
[2] в интервале температур 1000—1500 °C она меняется от 0,05 де
0,1 % (ат.) Hf. Кристаллическая структура соединения Cr2Hf приве-
дена в табл. 47.
Литература
1. Venkatraman М., Neumann J.P. // Bull. Alloy Phase Diagrams. 1986. V. 7 N (>
P. 570-573.
2. Свечников И.Р., Шурин A.K., Дмитриева Г.П. // Фазовые превращения в
металлах и сплавах: Сб. статей. Киев: Наукова думка, 1965. С. 159—162.
3. Carlson O.N., Alexander D.G. // J. Less-Common Met. 1968. V. 15. P. 361—370
4. Rudy E., Windisch S.F. //J. Less-Common Met. 1968. V. 15. P. 13—27.
5. Минаева C.A., Будберг П.Б. // Фазовые равновесия в металлах и сплавах: Сб
статей. М.: Наука, 1981. С. 179—185.
6. Кочержинский Ю.А., Маркив В.Я., Петьков В.Б. // Изв. Ан СССР. Металлы
1973. № 1. С. 189-195.
КБ. Поварены
Cr-Hg
129
Cr-Hg. ХРОМ—РТУТЬ
Диаграмма состояния Cr—Hg не построена. В работе [1] на осно-
вании имеющихся данных по растворимости Сг в жидкой Hg предло-
жена рассчитанная диаграмма, которая характеризуется практически
полной несмешиваемостью Сг и Hg в жидком и твердом состояниях
(рис. 62). Согласно данным работы [2] растворимость Сг в Hg при
температурах 500 и 750 °C может быть описана уравнением
lgx = 8,70 - 930/7,
где х — концентрация Сг, % (ат.); Т — температура, К.
Hj,°/0(no массе)
Рис. 62. Cr-Hg (р - 0,1 МПа)
Путем экстраполяции получен предел растворимости Сг в Hg при
температуре 25 °C, равный 10’24 % (ат.). Экспериментальные значе-
ния растворимости Сг в Hg при различных температурах, указанные
в справочниках [X, Ш], приведены ниже.
Температура, °C................. 18 30 500 550 600
Растворимость Сг, % (ат.)....... 3,1x10" 4х10'7 6,8х10'5 8х10~5 6,5><10'4
Литература
1. Venkatraman М., Neumann J.P. // Bull. Alloy Phase Diagrams. 1990. V. 10. N 2
P. 157-159.
5 Зак. 2144
HP. Бочвар
130
Cr—Ho
Сг—Но. ХРОМ-ГОЛЬМИЙ
Диаграмма состояния Сг—Но построена по данным работ [1, 2|
(рис. 63). Исследование проведено методами дифференциально ,,
термического, металлографического и рентгеноструктурного анализе!!
с использованием Сг и Но чистотой 99,98 и 99,8 % (по массе) соот
ветственно. Система характеризуется наличием области несмешива-
емости в жидком состоянии протяженностью от 1 до -45 % (ат.) Но.
Монотектическая реакция имеет место при 1780 °C [2]. Промежуточ
ные фазы не образуются. Эвтектика между твердыми растворами
(Сг) и (Но) образуется при температуре 1190 °C и содержании
-82—83 % (ат.) Но. Приведенная в работе [1] эвтектоидная реакция
при 1090 °C связывается с наличием полиморфизма Но. Однако Нс
не имеет полиморфного превращения в твердом состоянии [3, 4]. Как
указывается в работе [4], полиморфное превращение Но, так же как
и Ег, Тгп и Lu, реализуется только в жидком состоянии. Поэтому на
рис. 63 приведен возможный вариант строения системы в сплавах
богатых Но, связанный с превращением при температуре 1090 °C.
Растворимость Но в (Сг) при температурах 1700, 1600, 1400 и
900 °C составляет 0,21; 0,1; 0,065 и <0,065 % (ат.) соответственно
[2]. Согласно работе [3] в (Сг) при температуре 1260 °C растворяет-
л
г
t Cr-In 131
•(г""''————
cg <0,07 % (ат.) Но. Максимальная растворимость Но в (Сг), полу-
денная экстраполяцией, составляет 0,62 % (ат.) [1].
1 В работе [5] проведен термодинамический расчет диаграммы
состояния Сг—Но и подтвержден характер взаимодействия компо-
нентов, однако температуры нонвариантных реакций и концентрации
критических точек отличаются от экспериментальных.
Литература
, 1. Свечников В.Н., Кобзенко, Г.Ф., Иванченко В.Г. // Доповцц АН УРСР. 1972.
Сер. А. № 4. С. 376-378.
2. Свечников В.Н., Кобзенко Г.Ф., Иванченко В.Г. // Металлофизика. 1975.
Вып. 59. С. 77-83.
3. Gschneidner, Jr., К.А., Calderwood F.W. 11 Handbook on the Physics and Chemi-
stry of-Rare Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Phisics Publi-
shing. 1986. V. 8. P. 1-161.
4. Григорович B.K., Григорович K.B. И Строение и свойства металлических и
шлаковых расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск:
ЧПИ. 1990. Т. 2. Ч. 2. С. 250-252.
5. Иванченко В.Г., Кобзенко Г.Ф., Свечников В.Н. // Металлофизика. 1979.
Вып. 75. С. 98-102.
К.Е. Поварова, Н.Р. Бочвар
Сг—In. ХРОМ-ИНДИЙ
Диаграмма состояния Сг—In не построена. В работе [1] указано,
что в сплавах с 50 и 75 % (ат.) In при 1500 и 1620 °C металлографи-
ческим и рентгеновским анализами было обнаружено отсутствие
сплавления. На основании этого сделано заключение о наличии в
системе области несмешиваемости, что было подтверждено термоди-
намическим расчетом в работе [2]. Согласно данным работы [3] в
системе должно существовать четыре соединения: Crln2, Сг1п3, Сг21п
и СгЛп. Первые два идентифицированы в работах [4, 5]. Соедине-
ние Сг1п2 имеет тетрагональную структуру с параметрами решетки
л “ 0,468 нм, с = 0,444 нм [4]. Соединение Сг1п3 имеет структуру
типа Си (символ Пирсона cF4, пр. гр. Fm3m), параметр решетки
а - 0,469 нм [5].
Литература
1. Dasarathy С. Naturwissenschaft. 1968. Bd. 55. N 4. Р. 179.
2. Dasarathy С. // Trans. AIME. 1969. V. 245. N 9. P. 2015-2019.
3- Савицкий E.M., Грибуля В.Б. // Доклады АН СССР. 1970. Т. 190. С. 1147.
4. Raman A., Schubert К. // Metallkunde. 1965. Bd. 51. N 1. S. 44—52.
5. Schubert К., Raman A., Rossteutscher W. // Naturwissenschaft. 1964. Bd. 51.
8 506-507.
КБ. Поварова
5*
132
Cr-Ir
Cr—Ir. ХРОМ—ИРИДИЙ
Диаграмма состояния Сг—1г исследована в работах [1—3], резуль-
таты которых согласуются между собой. На рис. 64 приведена диаг-
рамма состояния по данным работы [4], в которой обобщены сведе-
ния по этой системе. В системе образуются две промежуточные фазы
е и р и имеются широкие области двух твердых растворов (1г) и (Сг).
Фазы е и р образуются по перитектическим реакциям [1]:
Ж + (1г) « е при 2200 +50 °C и -30 % (ат.) Сг,
Ж + е * р при 1750 + 10 °C и 74-75 % (ат.) Сг.
Сг, °/<> (па массе)
Рис. 64. Сг—1г
Фаза е имеет область гомогенности, которая существует в преде-
лах концентраций -32—68 % (ат.) Сг при 1750 °C и -32—60 % (ат.)
Сг при 1100 °C [1]. Согласно работе [2] интервал гомогенности фазы
е составляет 31,5—58 % (ат.) Сг. Фаза р также имеет область гомо
генности протяженностью -72—83 % (ат.) Сг [1]. В работе [2|
указаны границы области фазы Р 72,5—78,5 % (ат.) Сг. В системе
кристаллизуется эвтектика между фазой р и (Сг) при температуре
1680 + 10 °C и содержании -85 % (ат.) Сг. Максимальная раствори-
мость Сг в (1г) достигает 27 % (ат.) и мало меняется с изменением
температуры [1]. Растворимость 1г в (Сг) при температурах 1680 и
1100 °C составляет 12—13 и -6 % (ат.) соответственно [1], а при
температуре 900 °C — 2,5 % (ат.) по данным работы [2].
Cr-K
133
В, Фаза e имеет гексагональную плотноупакованную структуру с
яараметрами решетки а = 0,2691—0,2661 нм; с - 0,428 (6) — 0,427
Ж) нм для сплавов, содержащих 30—63 % (ат.) Сг [1]. Фаза Р имеет
Структуру типа Cr2Si (символ Пирсона сР8, пр. гр. РтЗп); параметр
|£шетки а для сплавов в интервале концентраций 73—82 % (ат.) Сг,
докаленных от 1400 °C, составляет 0,4689—0,4859 нм соответственно
[1]. В сплавах с содержанием Сг более 16 % (ат.), отожженных при
600-700 °С в течение нескольких дней, и в сплавах с 23—28 % (ат.)
Сг, быстро охлажденных после дуговой вакуумной плавки, установ-
лено образование упорядоченной фазы у' со структурой типа Cu3Au
(символ Пирсона сР4, пр. гр. РтЗт).
Литература
1. Waterstrat R.M., Manusz^wski R.C. // J. Less-Common Met. 1973. V. 32.
P. 79—89.
2. Raub E., Mahler W. // Z. Metallkunde. 1955. Bd. 46. S. 210-215.
3. Khapton A.G. // J. Inst. Met. 1958. V. 87. P. 28-32.
4. Venkatraman M„ Neumann J.P. 11 Bull. Alloy Phase Diagrams. 1990. V. 11. N 1.
P. 5-8.
К.Б. Поварова
Cr-K. ХРОМ-КАЛИЙ
134
Cr—La
На основании данных о строении и свойствах исходных компонен-
тов построена гипотетическая диаграмма состояния [1], предполага-
ющая практически полное отсутствие взаимной растворимости ком-
понентов в жидком и твердом состоянии (рис. 65). На основании дан-
ных о растворимости Сг в К, который является аналогом Li и Na,
высказано предположение, что в жидком К при температуре 800 °C
растворяется 10“3 % (ат.) Сг.
Литература
1. Venkatraman М., Neumann J.P. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 4.
P. 398.
Л.Л. Зусман
Cr—La. ХРОМ-ЛАНТАН
Cr Ll,7ofem) La
Рис. 66. Cr—La
Cr-Li
135
Ш Диаграмма состояния Cr—La (рис. 66) простроена по данным работ
Ж, 2]. Исследование проведено методами дифференциального терми-
ческого, металлографического, рентгеноструктурного анализов, а
^же> применен термодинамический расчет с использованием моде-
субррцулярных растворов. Материалами для исследования служи-
дц СпдгДа чистотой 99,5 и 99 % (по массе) соответственно. Система
характеризуется наличием широкой области несмешиваемости в
жидком состоянии. Монотектическая реакция протекает при темпера-
туре 1830 °C и содержании -0,9 % (ат.) La [1]. В работе [3] темпе-
ратура монотектики определена равной 1710 °C при содержании
4,0 % (ат.) La. Эвтектическая реакция Ж * (Cr) + (PLa) протекает
при температуре 865 °C и содержании 96,6 % (ат.) La [2]. При этом
температура реакции определена экспериментально, а состав эвтек-
тики приведен согласно расчету. В работе [4] температура эвтектики
определена равной также 865 °C, а в работе [3]-900 °C. В системе
имеет место эвтектоидное равновесие при -730 °C [4], в работе [3]
эта температура определена более низкой (705 °C).
Растворимость La в (Сг) при различных температурах приведена
ниже [1].
Температура, °C................. 1680 1600
Растворимость La, % (ат.)....... 0,2 0,13
1400
0,08
1200
0,03
Экстраполяцией полученных значений до пересечения с монотекти-
ческой горизонталью определена максимальная растворимость La в
(Сг), равная 0,65 % (ат.).
Литература
1. Свечников В.Н., Кобзенко Г.Ф., Киреев М.В., Иванченко В.Г. // Доновцц
АН УРСР. 1973. Сер. А. № 2. С. 167-171.
2. Свечников В.Н., Иванченко В.Г., Кобзенко Г.Ф. // Диаграммы состояния
металлических систем. Термодинамические расчеты и экспериментальные методы: Сб.
статей. М.: Наука, 1981. С. 85-90.
3. Савицкий Е.М., Терехова В.Ф., Холопов А.В. // Журнал неорганической
химии. 1960. Т. 5. № 3. С. 754-755.
4. Гшнейднер К. Сплавы редкоземельных металлов: Пер. с англ. / Под ред.
Е.М. Савицкого. М.: Мир, 1965. 427 с.
К. Б. Поварова, Н.Р. Бочвар
Cr-Li. ХРОМ-ЛИТИЙ
Диаграмма состояния Cr—Li не построена [1]. Имеются сведения,
Что Сг и Li практически не смешиваются ни в жидком, ни в твердом
состояниях, однако некоторые данные по растворимости Сг в жидком
Li приведены в справочниках [X, Э, Ш]. При этом имеется большое
Расхождение в полученных значениях растворимости:
136
Cr—Lu
Температура, °C............... 1200 1000 900 800 700
Растворимость Cr, % (ат.).... 0,55 0,16 0,06 0,0012 0,02 0,0069 0,000 м
Источник..................... [2] [2] [2] [3] [2] [3] [3)
Различие в растворимости Сг в жидком Li может быть связано с
разной степенью чистоты исследовавшихся металлов. По данным
работы [2] Li содержал более 0,1 % (ат.) О, а по данным работы
[3] - ~10~3 % (ат.) N.
Литература
1. Venkatraman М., Neumann J.P. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 4
P. 399-400.
2. Бескоровайный H.M., Яковлев Е.И. Il Металлургия и металловедение чисты к
металлов: Сб. статей. М.: Наука, 1960. Вып. 2. С. 189—206.-
3. Leavenworth H.W., Cleary R.E. // Acta Metall. 1961. V. 9. P. 519—520.
КБ. Поваров,;
Cr—Lu. ХРОМ-ЛЮТЕЦИЙ
Экспериментальная диаграмма Cr—Lu построена в работе [1]. Сг
образует с Lu эвтектику при температуре 1250 °C и содержании
-69—70 % (ат.) Lu (рис. 67); расслоение в жидком состоянии и
промежуточные фазы отсутствуют [1], Проведенный в работе (21
Cr—Mg, Cr—Mn
137
^термодинамический расчет диаграммы с использованием моделей
^убрегулярных растворов показал хорошее соответствие расчетных и
экспериментальных данных. Растворимость Сг в Lu при эвтектичес-
кой температуре меньше 0,12 % (ат.) и уменьшается с понижением
температуры.
Литература
1. Свечников В.Н., Кобзенко Г.Ф., Иванченко В.Г. // Структура фаз, фазовые
превращения и диаграммы состояния металлических систем: Сб. статей. М.: Наука,
1974. С. 194-198.
2. Свечников В.Н., Иванченко В.Г., Кобзенко Г.Ф. // Диаграммы состояния
металлических систем. Термодинамические расчеты и экспериментальные методы. Сб.
статей. М.: Наука. 1981. С. 85—90.
К. Б. Поварова
Cr—Mg. ХРОМ-МАГНИЙ
Диаграмма состояния Cr—Mg не построена. В работе [1] проведен
анализ некоторых исследований, посвященных приготовлению спла-
вов системы Cr—Mg при взаимодействии Mg с Сг2О3. Отмечается, что
существование соединений CrMg, Cr2Mg3, CrMg3 и CrMg4, о которых
сообщено в работе [X], сомнительно, так как не подтверждено иссле-
дованиями кристаллической структуры.
Литература
1. Venkatraman М., Neumann J.P. // Bull. Alloy Phase Diagrams. 1985. V. 6. N 4.
P. 335.
К.Б. Поварова
Cr—Mn. ХРОМ-МАРГАНЕЦ
Диаграмма состояния Cr—Mn (рис. 68) построена преимуществен-
но по данным работ [1—4]. При этом богатый Мп участок диаграммы
построен по данным работы [4], в которой эта область исследована
методом высокотемпературной металлографии. В системе существуют
Две промежуточные фазы а(СгМп2) и о(СгМп3), а также твердые
растворы (Сг) и различных модификаций Мп: (аМп), (рМп), (уМп)
и (5Мп). Фазы а и а претерпевают полиморфные превращения. Фаза
а существует в двух модификациях: высокотемпературной а' и
низкотемпературной а". Интервал гомогенности обеих фаз состав-
ляет 60,2—65,3 % (ат.) Мп. Температура полиморфного превраще-
ния ниже 600 °C [3]. Фаза а существует в трех модификациях:
высокотемпературной о, среднетемпературной о' и низкотемператур-
ной а". Область гомогенности фазы о находится в пределах
концентраций 72,8—78 % (ат.) Мп, фаз а' и а" — в пределах кон-
1
центраций 75—79 % (ат.) Мп [1]. Температура полиморфного пре
вращения о' * о" составляет 800 °C [3J. Реакции образования фа?
и другие нонвариантные реакции, имеющие место в системе, привс
дены в табл. 48.
Растворимость Мп в (Сг) при различных температурах согласие
работам [1—3J приведена ниже (однако надежность определения
растворимости при температурах ниже 900 °C невелика из-за низкой
скорости протекания диффузионных процессов):
Температура, °C.................... 1321 1000 600 500 <400
Растворимость Мп, % (ат.).......... 71,4 69 -31 -28 -7
Кристаллическая структура отдельных фаз приведена в табл. 49.
Большая скорость охлаждения (107 — 10° °C/с) дает возможность
стабилизировать метастабильные фазы в сплавах с высоким содержа
нием Мп [8]. Одна из этих фаз (5Мп, Сг) представляет собой непре-
рывный ряд твердых растворов между бМп и Сг, другая (у'Мп)
является фазой уМп с тетрагонально искаженной решеткой. Фаза
(5Мп, Сг) имеет ОЦК структуру, параметр решетки а для сплавов
с 72 и 82 % (ат.) Мп составляет 0,2917 и 0,2935 нм соответственно
Cr—Mg, Cr—Mn
139
Цй], Параметры решетки фазы (у'Мп): а = 0,2863 нм, с = 0,3637 нм
Жпгсг сплава с 84 % (ат,) Мл и а = 0,2668 нм, с = 0,3597 нм для сплава
Ж 99,6 % (ат.) Мп [8].
ж а б л и ц а 4 8. Нонвариантные реакции в системе С г—Мп
Реакция Содержание Мп в фа- Темпе- ратура, °C Источник
зах, % (ат.)
Ж + (Сг) - а 81; 71,4; 72,8 1312 [И
Ж + а а (бМп) 89; 77; -85 1278 [4]
а' + (рМп) » («Мп) 79,0; 94,0; 91,0 900 (4]
(Сг) + а' » а' 54,0; 75,0; 62,5 926 [1]
cr * (Cr) + о' 74,0; 69,0; 75,0 999 [Ц
в + (уМп) •» а' 78; 93,5; 79,0 1006 (1]
(ЙМп) « а + (уМп) 85,0; 78,0; 93,0 1020 [4J
(уМп) ₽ а’ + (0Мп) 94,0; 79,0; 98,0 -1000 [41
Таблица 4 9. Кристаллическая структура соединений системы Сг—Мл
Фаза Прототип Символ Пирсона, пр. гр. Параметры решет- ки, НМ Примечание
а С
(Сг) «Сг с!2, 1тЗт 0,2889 — При концен- трации Мп, % (ат.): 40 [1]
а', а" «Мп с/58, 143 т — — - [2, 3)
а', а" oCrFe tP30, Р4г/тпт 0,8860 0,8862 0,8868 0,4590 0,4549 0,4601 75 [6] 77 [7] 83 [31
(РМп) РМп сР20, Р4,32 0,6303 — 92,7 [1]
(аМп) «Мп с/58, 143 т 0,8906 — 92,3 [1]
Литература
1. Carfile S.J., Christian J.W., Hume-Rothery W. // J. Inst Met. 1949. V. ?6.
P. 169—194.
2. Pearson W.B., Christian J.W., Hume-Rothery W. // Nature. 1951. V. 167. P. 110.
3. Wachtel E„ Bartlett C. // Z. Metallkunde. 1964. Bd. 55. S. 29-36.
4. Lugscheider E., Ettmayer P. // Monatsh. Chem. 1971. V. 102. P. 1234—1244.
5. Venkatraman M., Neumann J.P. It Bull. Alloy Phase Diagrams. 1986. V. 7. N 5.
P. 457-462.
6. Stuwe H.P. // Trans. AIME. 1959. V. 215. P. 408-411.
7- Gupta K.P., Rajan N.S., Beck P.A. // Trans. AIME. 1960. V. 218. P. 617-624.
8. Гудзенко B.H., Полесова А.Ф. // Изв. АН СССР. Металлы. 1975. № 5.
С 153- 156.
К. Б. Поварова
140
С г—Mo
Cr-Мо. ХРОМ-МОЛИБДЕН
Диаграмма состояния Сг—Мо приведена на рис. 69 согласно работе
[ 1 ], в которой при построении линий ликвидуса и солидуса исполь-
зованы данные работ [2—5]. Система характеризуется наличием
областей непрерывных растворов в жидком и твердом состояниях.
Минимум на кривых ликвидуса и солидуса по совокупности данных
определен при температуре 1820 + 30 °C и содержании -12,5 % (ат.)
Мо. Существование расслоения при температуре ниже 880 °C было
рассчитано на основании термодинамических данных в работе [6].
Однако прямых экспериментальных подтверждений расслоения в
твердых растворах пока не найдено, возможно, из-за низкой скорости
развития диффузионных процессов при этих температурах [1].
Рис. 69. Сг—Мо Сг Мо,°/ч(ат.) Мо
При исследовании сплавов системы Сг—Мо методом диффузион-
ных пар при температурах 1000—1600 °C были обнаружены фазы с
гексагональной структурой в интервале концентраций 20—55 % (ат.)
V
С г—Mo
141
Mo и тетрагональной структурой в интервале концентраций 35—50 %
(ат.) Мо [7—9]. Поскольку эти фазы никогда не встречаются в литых
Сплавах, в работе [1] высказано мнение, что их появление связано
с загрязнением примесями внедрения, в частности кислородом.
Непрерывный твердый раствор (Сг, Мо) имеет структуру типа W
(символ Пирсона сП, пр. гр. 7m 3 m). Значения параметра а кристал-
лической решетки (Сг, Мо) при комнатной температуре, измеренные
на образцах, закаленных от 800—1200 °C, хорошо согласуются между
собой (табл. 50).
Таблица 5 0. Параметр решетки а твердого раствора (Сг, Мо)
Концентрация Мо, % (ат.) Параметр решетки а, нм Источ- ник Концентра- ция Мо, % (ат.) Параметр решетки а, нм Источ- ник
5 0,2900 14] 0,2954 [12]
0,2899 [12] 30 0,2976 [Ю]
10 0,2918 [Ю] 0,2980 [12]
0,2917 [П] 40 0,3007 [Ю]
0,2908 [4] 0,3008 [П]
0,2913 [12] 60 0,3060 [10]
20 0,2943 [10] 0,3072 [12]
0,2946 [И] 83 0,3109 [Ю]
0,2950 [4] 0,3108 [4]
Литература
1. Venkatraman М., Neumann J.P. 7/ Bull. Alloy Phase Diagrams. 1987. V. 8. N 3.
P. 216-220.
2. Putman J.W., Potter R.D., Grant NJ. 11 Trans. ASM. 1951. V. 43. P. 824-852.
3. Bloom D.S., Grant N.J. // Trans AIME. 1954. V. 200. P. 261-268.
4. Свечников B.H., Кобзенко Г.Ф. // Доклады АН СССР. 1964. Т. 155. № 3.
С. 611-614.
5. Кочержинский Ю.А., Василенко В.И. / / Изв. АН СССР. Металлы. 1979. № 4.
С. 205-207.
6. Raufmann L., Nesor Н. // Annual Rev. Mater. Sci. 1973. V. 3. P. 1—30.
7. Аржаный П.М., Волкова P.M. // Журнал неорганической химии. 1963. № 8.
С. 354—355.
8. Прокошкин Д.А., Сидунова О.И. // Изв. вузов. Машиностроение. 1966. № 7.
С- 116-119.
9. Арзамасова А.М., Пименова Л.А. // Физико-химия и механика материалов.
*977. Т. 13. № 4. С. 119-121.
КБ. Поварова
142
Cr-N
Cr—N. ХРОМ-АЗОТ
Данные о взаимодействии Сг с N обобщены в работе [1]. Диаг-
рамма состояния Cr—N, исследованная при давлении 98,1 кПа мето
дами дифференциального термического и металлографического
анализов в работе [2] и скорректированная с учетом термодинами
ческих свойств фаз [1], приведена на рис. 70. В интервале концен-
траций 0—40 % (ат.) N диаграмма построена экспериментально [2].
в области составов с большим содержанием N диаграмма построена
теоретически с учетом литературных данных. Сплавы Cr с N получа-
ли насыщением расплава Сг с чистотой 99,98 % (по массе), высоко-
чистым азотом при различном парциальном давлении в процессе
дуговой плавки. При парциальном давлении N, равном 300 кПа,
концентрация N в расплаве составляла 16,9 % (ат.).
У, % (по массе)
Рис. 70. Cr-N
Cr-N
143
к На диаграмме отмечено об- разование трех нитридов: Cr^N, CrN и CrN2. Нитрид Cr2N обра- -зуеггся из расплава по газопе- ритектической реакции при 4740 °C: Ж + Газ * Cr2N [2]. Таблица 51. Растворимость N в (Сг) [6—8]
Температу- ра, °C Растворимость N, % (ат.)
[6] [7] [8]
1000 0,104 0,01 0,075
Температура разложения моно- 1100 0,204 0,045 0,18
нитрида CrN по газоперитекто- идной реакции CrN ** Cr2N + 1200 0,364 0,16 0,39
+ Газ установлена равной 1300 0,60 0,49 0,77
1049 °C [3]. Температура раз- 1400 0,94 1,29 1,39
ложения нитрида CrN2 не опре- 1640 2,25 4,46 4,36
делена. Соединение Cr2N имеет область гомогенности -27,3—33,6 % (ат.) N [2]. Согласно расчету,
проведенному в работе [4], область гомогенности Cr2N составляет
23,3—32,8 % (ат.) N при температуре 1000 °C. Соединение CrN по
расчетам работы [4] имеет узкую область гомогенности <0,37 % (ат.)
N. Границы существования CrN смещаются от -49,5 % (ат.) N при
температуре разложения до 49,9 % (ат.) N при 900 °C.
В системе протекает эвтектическая реакция Ж * (Сг) + Cr2N при
температуре 1640 °C и содержании 13,4 % (ат.) N. Предельная
растворимость N в (Сг) при температуре плавления эвтектики нахо-
дится в пределах 5,35—6 % (ат.) [1]. Растворимость N в (Сг) может
быть выражена уравнением Igx - 4,43 — 7250/Т в интервале 1320—
800 °C и Igx = 1,62 — 4130/Г в интервале температур 900—400 °C [5],
где х — концентрация N, % (ат.); Т — температура, К. В зависи-
мости от температуры и давления растворимость выражается следую-
щим уравнением: Igx = 0,5 1g р + 0,1 — 1410/7 [5], где р — давление,
Па. В табл. 51 представлены результаты расчетов растворимости N
в (Сг) в интервале температур 1000—1400 °C и данные, полученные
экстраполяцией, для максимальной растворимости при эвтектической
температуре.
Наиболее достоверными, как указано в работе [1], следует счи-
тать результаты, полученные в работе [8] с применением высокочув-
ствительного метода термогравиметрического анализа в сочетании с
прецизионным измерением парциального давления N.
Нитрид Cr2N имеет гексагональную структуру, параметры решет-
ки: д = 0,4759 нм, с = 0,4438 нм для состава CrN0 42 и а = 0,4805 нм,
с в 0,4479 для состава CrN0 49 [1]. Нитрид CrN согласно работе [9]
имеет структуру типа NaCl (символ Пирсона с/8, пр. гр. С/иЗщ) с
параметром решетки а = 0,4138—0,4139 нм. В работе [1] приводится
значение а = 0,4149 нм.
144
Cr— Na, Cr—Nb
Литература
1. Иванченко В.Г., Мельниченко Т.В. // Металлофизика, 1991. Т. 13. № ?
С. 23-30.
2. Свечников В.Н., Кобзенко Г.Ф., Иванченко В.Г., Мартынчук Э.Л. II Диаграм
мы состояния металлических систем: Сб. статей. М.: Наука, 1971. С. 135—138.
3. Mills Т. И J. Less-Common Met. 1970. V. 22. N 4. Р. 373-381.
4. Mills Т, И J. Less-Common Met. 1972. V. 26. N 2. P. 223-234.
5. Фромм E., Гебхардт E. Газы и углерод в металлах: Пер. с нем. / Под рс.:
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
6. Seybolt A.U., Oriani R.A. И Trans. AIME. 1956. V. 206. Р. 558-562.
7. Томилин И.А., Савостьянова Н.А. // Заводская лаборатория. 1962. № 28.
С. 959-961.
8. Mills Т. И J. Less-Common Met. 1971. V. 23. N 4. Р. 317.
9. Пинскер З.Г., Абросимова Л.Н, // Кристаллография. 1958. Т. 3. С. 281—287
Н.Р. Бочвар
Cr—Na. ХРОМ-НАТРИЙ
В работе [1] предложена гипотетическая диаграмма состояний
системы Cr—Na, предполагающая практически полное отсутствие вза-
имной растворимости компонентов в жидком и твердом состояниях.
Литература
1. Venkatraman М„ Neumann J.P. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 4.
p. 400-401.
К.Б. Поварова
Сг—Nb. ХРОМ—НИОБИЙ
Диаграмма состояния Cr—Nb (рис. 71) построена в работе [1] на
основании анализа исследований, проведенных в работах [2—5].
Ликвидус построен преимущественно по данным работы [3]. В систе-
ме образуются одна промежуточная фаза Cr2Nb и твердые растворы
(Сг) и (Nb). Соединение Cr2Nb плавится конгруэнтно и имеет широ-
кую область гомогенности -30—39 % (ат.) Nb. Температура плавле-
ния Cr2Nb, по различным данным, составляет: 1683 + 10 [8], 1713
[7], 1773 [3], 1723+5 |4], 1733 [6], 1770+50 [1]. Соединение Cr2N'b
имеет две аллотропические модификации. Температура перехода
между высокотемпературной (ВТ) и низкотемпературной (НТ)
формами увеличивается от 1585 до 1625 °C для богатых Сг и Nb
сплавов соответственно [4].
В системе кристаллизуются две эвтектики: Ж «* (Cr) + Cr2Nb и
Ж ** Cr2Nb + (Nb). Температура и состав эвтектик по различным
данным приведены в табл. 52.
Cr—Nb
145
Cr Nb, tf/o (am.) Nb
Рис. 71. Cr-Nb
Растворимость Nb в (Cr) составляет ~6 % (ат.) при эвтектической
температуре и ~1 % (ат.) при 1000 °C. Растворимость Сг в (Nb) при
эвтектической температуре равна -15 % (ат.) и снижается до
~2— 3 % (ат.) при 1000 °C [1]. Кристаллическая структура Cr2Nb
приведена в табл. 53.
Таблица 5 2. Температура и состав эвтектик в системе Cr—Nb
Эвтектика (Cr) + Cr2Nb Эвтектика Cr2Nb + (Nb) Источник
Температура, “С Содержание Nb, % (ат.) Температура, °C Содержание Nb, % (ат.)
1602 21-22 1662 39 [81
1662 20,1 1713 48,9 [2]
1620 -12 1602 -53 [3]
1642 19,3 1662 49 [4]
1640 20,0 1660 50 [5]
162Q+4Q -12 1650+50 -50 [1]
146
Cr—Nd
Таблица 5 3. Кристаллическая структура соединения Cr2Nb
Соединение Прототип Символ Пирсо- на, пр.гр. Параметр ре- шетки а, нм Источник
Cr?Nb (ВТ) MgZn2 ЛР12, Р63/ттс — Hl
Cr2Nb (НТ) MgCu2 cF24, Fd3tn 0,697-0,702’ [1, 3, 9]
В области гомогенности.
Литература
1. Venkatraman М., Neumann J.P. // Bull. Alloy Phase Diagrams. 1986. V. 7. N ?
P. 462-466.
2. Еременко B.H., Зудилова Г.В., Гаевская Л.A. 11 Металловедение и термически
обработка металлов. 1958. № 1. С. 11—16.
3. Goldschmidt H.J., Brand J.A. 11 J. Less-Common Met. 1961. N 3. P. 44—61.
4. Пан B.M. // Физика металлов и металловедение. 1961. Т. 12. № 3. С. 455-А5"
5. Свечников В.Н., Пан В.М. // Исследование по жаропрочным сплавам: С.-
статей. М.. Наука. 1962. Вып. 6. С. 47—56.
6. Корнилов И.И., Шахова К.И., Будберг П.Б., Недумов Н.А. // Доклады A J
СССР. 1963. Т. 149 Вып. 6. С. 1340-1342.
7. Elliot R.P., Rostoker W. II Trans. ASM. 1958. V. 50. P. 617-633.
8. Елютин В.П.. Функе В.Ф. // Изв. АН СССР. Отделение технических нал :
Металлургия и топливо. 1956. Вып. 3. С. 68—76.
9. Захарова М.И., Прокошкип Д.А. // Изв. АН СССР. Отделение технически
наук. Металлургия и топливо. 1961. Вып. 4. С. 56—57.
КБ. Повара, i
Cr—Nd. ХРОМ—НЕОДИМ
Диаграмма состояния Cr—Nd построена в работе [1] на основании
результатов дифференциального термического, металлографическою
и рентгеновского анализов с использованием Сг и Nd чистотой 99,‘Т-
и 99,4 % (ат.) соответственно. В работе [2| проведен термодинамг
чсский расчет этой же диаграммы с использованием моделей идеал!
ных растворов. Данные работ [1,2] отражены на рис. 72, на которо л
приведена диаграмма состояния Cr—Nd. Система характеризуете.!
наличием области несмешиваемости в жидком состоянии. Промеж>
точные фазы не образуются. В твердом состоянии присутствую;
только твердые растворы (Сг) и (Nd). Монотектическая реакци >
протекает при температуре 1810 °C и содержании 1,65 % (ат.) Nti
Эвтектическая реакция имеет место при температуре 965 °C и со
держании 96,9 % (ат.) Nd, при этом состав эвтектики определи!
расчетным путем в работе [2]. Помимо указанных равновесий в
системе существует эвтектоидное равновесие при 835 °C, связанно,
с полиморфизмом Nd. Растворимость Nd в (Сг) при различив '
температурах приведена ниже по данным работ [3, 4].
Cr—Nd
147
Cr Nd, °/« lam.) Nd
₽ис. 72. Сг-Nd
Температура, °C.............. 1790 1750 1700 1600 1400 1000 . 450
Растворимость Nd, % (ат)..... 0,88 0,5-0,6 0,5-0,45 0,37 0,24 0,16 <0,006
Экстраполяцией указанных значений до пересечения с монотекти-
ческой горизонталью получена максимальная растворимость Nd в
'Сг), равная 1,1 % (ат.).
Литература
!1 Саечников В.Н., Кобзенко Г.Ф., Мартинчук Е.Д., Иванченко В.Г. // Допов!д1
*** УСРС. 1969. Сер. А. № 1. С. 61-64.
148
Cr-Ni
2. Свечников B.H., Иванченко В.Г., Кобзенко Г.Ф. // Диаграммы состояния
металлических систем. Термодинамические расчеты и экспериментальные методы: (
статей. М.: Наука, 1981. С. 85—90.
3. Кобзенко Г.Ф., Холодов А.Г., Иванченко В.Г. и др. // Доповщ! АН УРС р
1970. Сер. A. N И. С. 1045-1048.
4. Кобзенко Г.Ф., Холодов А.Г., Иванченко В.Г. и др. // Диаграммы состояния
металлических систем: Сб. статей. М.: Наука, 1971. С. 177—180.
К.Б. Поварова, Н.Р. Бочвар
Cr-Ni. ХРОМ-НИКЕЛЬ
Результаты исследования взаимодействия Cr с Ni собраны в
справочниках [X, Э, III]. Диаграмма состояния Cr—Ni (рис. 73;
построена в работе [1] на основании обобщения данных работ
[2—10]. Ликвидус и солидус системы построены по данным работ [2.
3], кривые солидуса твердых растворов (Сг) и (Ni) — по данным
работ [2—4]. В системе существует промежуточная фаза Ni2 Сг,
которая образуется в твердом состоянии. Эвтектика между (Ni) и
(Сг) кристаллизуется при температуре 1345 °C и содержании 56 %
(ат.) Сг. Растворимость Ni в (Сг) составляет -32 % (ат.) при эвтек-
тической температуре, -10 % (ат.) — при 1000 °C и -2 % (ат.) —
при 500 °C. Растворимость Сг в (Ni) равна -50 % (ат.) при эвтекти-
ческой температуре и -36 % (ат.) — при 700 °C. Упорядочение,
сг, °/о (по массе)
Рис. 73. Cr-Ni
Cr—Np
149
«имеющее место в сплавах около состава Ni2Cr, исследовано в работах
ж [5—8]. Установлено, что для стехиометрического состава Ni2Cr
^температура упорядочения составляет 590 °C. Соединение Ni2Cr
имеет интервал гомогенности 25—36 % (ат.) Сг. Структура Ni2Cr
.^относится к типу MoPt2 (символ Пирсона о/6, пр.гр. Immm). Пара-
метры решетки сверхструктуры по отношению к параметрам решетки
i'pNi (а0) составляют а = а0/2, b = Зац/2, с = а0 [10].
Имеются сведения о двух метастабильных фазах [ 1 ]. Одна фаза
находится вблизи состава сплава с 70 % (ат.) Сг, имеет структуру
типа oCrFe (символ Пирсона /РЗО, пр.гр. P42/mnm) и параметры
Урешетки а = 0,8825 нм, с = 0,4598 нм. Вторая фаза находится при
'’/составе сплава, содержащего свыше 70 % (ат.) Сг. Она обнаружена
в пленках, полученных напылением в вакууме, и имеет структуру
/ типа Cr3Si (символ Пирсона сР8, пр.гр. РгиЗп); параметр решетки
а - 0,458 нм.
Литература
1. Nash Р. // Bull. Alloy Phase Diagrams. 1986. V. 7. N 5. P. 887—895.
2. Jenkins C.H.M., Bucknall E.H., Austin C.R., Mellor G.A. //J. Iron Steel Inst.
London. 1937. V. 136. P. 187-220.
3. Свечников В.П., Пан B.M. // Научные работы Института металлофизики
АН УССР: Сб. статей. Киев: АН УССР, 1962. Вып. 15. С. 164-178.
4. Karamazin L. // Mater. Sci. Eng. 1982. V. 54. P. 247—256.
5. Багарятипский И.А., Тяпкин И.Д. // Доклады АН СССР. 1958. Т. 3. Вып. 5.
С. 1025-1028.
6. Sudramanian K.R., Gupta К.Р. // Trans. Indian Inst. Met. 1983. V. 36. N 3.
P. 163-167.
7. Винтайкин E.3., Иткин В.П., Могутнов B.M. // Физика металлов и металлове-
дение. 1972. Т. 33. Вып. 4. С. 846-848.
8. Simpsom М.А., Smith T.F. // Aust. J. Phys. 1982. V. 35. P. 307-319.
9. Taunt R.J., Ralph B. // Surf. Sci. 1975. V. 47. P. 569-582.
К.Б. Поварова
Cr—Np. ХРОМ-НЕПТУНИЙ
Диаграмма состояния Cr—Np экспериментально не построена. На
рис. 74 приведен вариант диаграммы, который рассчитан в работе
[1]. Авторы работы [1] предположили, что Сг и Np подобно другим
системам Сг с актинидами образуют простую эвтектическую систему
с небольшой растворимостью в твердом состоянии. Согласно расчету
эвтектика кристаллизуется при температуре -503 °C и содержании
~83 ат. % Np. Предполагаются нонвариантные равновесия при
температурах 576 и 280 °C, связанные с полиморфизмом Np. Харак-
тер этих равновесий нс установлен.
150
Cr—O
Np, % (no массе)
Рис. 74. Cr—Np
Литература
1. Venkatraman M., Neumann J.P., Peterson D.E. // Bull. Alloy Phase Diagrams
1985. V. 6. N 5. P. 418—419.
ТВ. Добаткини
Cr-O. ХРОМ-КИСЛОРОД
Результаты исследования взаимодействия Сг с О обобщены в
работах [1, 2]. Диаграмма состояния Сг—О (рис. 75) построена в
работе [X]. При температурах выше 1800 °C имеет место расслоение
в жидком состоянии и интервале концентраций -2—48 % (ат.) О.
Наиболее стабильный оксид Сг2О3 начинает разлагаться ниже своей
температуры плавления, поэтому его температуру плавления трудно
точно определить. Она составляет 2330 °C (на воздухе) или 2315 °C
(в азоте) [3].
При температурах ниже 1600 °C Сг2О, находится в равновесии с
твердым раствором (Сг). В справочнике [Ш] высказано предположе-
ние о наличии у Сг2О3 высокотемпературной тетрагональной моди-
фикации.
Сг—О
151
I
t Высокотемпературная
/фаза Cr3O4 стабильна
При температурах выше
1600° С. Она образует эв-
тектику с (Сг) при темпе-
ратуре -1660 °C и содер-
жании -52 % (ат.) О. В
работе [Ш] высказано
мнение, что эта фаза
стабилизируется примеся-
ми Fe и не является двой-
ной фазой. Поэтому на
диаграмме состояния
Сг—О она нанесена штри-
ховой линией, и необхо-
димо дальнейшее исследо-
вание этого участка сис-
темы на более чистых
Рис. 75. Сг—О
материалах.
Температура плавления СгО3 (170—198 °C) зависит от степени
разложения в твердом состоянии. По данным ряда исследований,
приведенным в работе [1], разложение СгО3 до Сг2О3 может идти по
нескольким схемам по мере повышения температуры: при 265 °C
образуется Сг5О,5, который при 360 °C переходит в Сг5О12 и далее
при 410 °C — в Сг2О3; или СгО3 переходит последовательно в СпОо,
Сг2О5, СгО2 и Сг2О3. По данным работы [4} при температуре 380 °C
в системе существует нонвариантное равновесие между СгО2, Сг2О5
й Сг2Оч. Оксид СгО2 стабилен при парциальном давлении О более
~Ю МПа. Нестабильный оксид Сг3О образуется при восстановлении
Сг2О3 при 1500 °C другим металлом (Ti, Zr, V) или при окислении
Сг паром в присутствии большого количества Н при 600 °C. Раство-
римость О в (Сг) приведена ниже по данным работы [1].
Температура, “С................. 1500 1400 1300 1200 1100
Растворимость О, % (ат.)....... 0,043 0,023 0,011 0,005 0,0025
В работе [2] для температурной зависимости растворимости О в
(Сг) предлагается выражение Igx = 3,09 — 7900/7, где х — атом-
ная доля О. Это уравнение реализуется в интервале температур
1Ю0—1500 °C.
Кристаллическая структура соединений Сг—О приведена в
табл. 54.
152
Cr—Os
Таблица 54. Кристаллическая структура соединений Сг—О
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источ НИК
а b С
Сг2О3 А12О3 ЛР66, Р63/ ттс 0,49607 — 1,3599 [III]
Сг2О3 (ВТ)* — — 0,948 — 0,516 [Ш]
Сг3О4 Мп3О4 (728, HJamd 0,872 0,62026 — 0,74992 0,75386 [XI [П1]
СгО3“ — — 0,850 0,473 0,572 [1]
Сг02 (CrO2J4) O2Ti ГР6, Pb-Jmnm 0,4423 — 0,2917 [Э]
‘Тетрагональная сингония.
Ромбическая сингония.
Оксид получен при давлении 6 МПа.
Литература
1. Корнилов И.И., Глазова В. В. Взаимодействие тугоплавких металлов переходных
групп с кислородом. М.: Наука, 1967. 255 с.
2. Фромм Е., Гебхартд Е. Газы и углерод в металлах: Пер с нем. / Под pe;i
Б.В. Линчевского. М.: Металлургия, 1980. 712 с-
3. McNally R.N., Peters F.I., Ribbe Р.Н. // J. Amer. Ceram. Soc. 1961. V. 44
P. 491—493.
4. Hook R.E., Adair A.M. // Trans. AIME. 1964. V. 230. P. 1278-1283.
К.Б. Поварове
Cr—Os. ХРОМ—ОСМИЙ
Диаграмма состояния Cr—Os построена на основании результатов
дифференциального термического, микроскопического и рентгенов-
ского анализов сплавов, выплавленных из Сг чистотой 99,92 % (по
массе) и Os чистотой 99,96 % (по массе) [1]. На рис. 76 диаграмм:'
состояния Cr—Os приведена согласно работе [2], в которой интервал
концентраций 0—50 % (ат.) Os построен по данным работы [1]. При
концентрации выше 50 % (ат.) Os ликвидус и солидус системы
экспериментально не построены. Границы области (Сг) и (Os) при
температурах ниже 1400 °C построены по данным работ [1, 3]. В
системе образуются две промежуточные фазы Cr30s и Cr2Os (а) п
широкие области твердых растворов (Сг) и (Os). Соединения Cr2Os
(а) и Cr30s образуются по перитектоидным реакциям:
(Cr) + (Os) * о при 1673±15 °C,
(Сг) + о « Cr3Os при 1540±40 °C.
Рис. 76. Сг-Os
Фаза о имеет область гомогенности, которая при температуре
1540 °C находится в интервале концентраций 30—35 % (ат.) Os. В
работе [4] сообщается об образовании о фазы из расплава и значи-
тельно большей области ее гомогенности. Однако положение
границ существования соединения Cr2Os требуют дальнейших иссле-
дований.
В системе Cr—Os кристаллизуется одна эвтектика Ж. * (Cr) + (Os)
при температуре 1843 + 10 °C и содержании 33 % (ат.) Os и имеет
место одно эвтектоидное равновесие о Cr,Os + (Os) при температу-
ре 975 ±25 °C и содержании ~33 % (ат.) Os.
Растворимость Os в (Сг) при температуре 1300 °C составляет
около 12 % (ат.) Os [2] (среднее между 18 % (ат.) Os [1] и 9,5 %
(ат.) Os [3]) и практически не изменяется при уменьшении темпера-
туры. Растворимость Сг в (Os) при 1500 °C составляет -50 % (ат.)
[1] или 51,7 % (ат.) Сг [2] и не изменяется с уменьшением
температуры.
Кристаллическая структура соединений приведена в табл. 55.
154
Cr—P
Таблица 55. Кристаллическая структура соединений системы Cr—Os
Соединение Прототип Символ Пирсо- на, пр.гр Параметры решетки, нм Источни*
а С
Cr20s CrFe IP30, P42/mnm 0,9107 0,904 0,4696 0,460 [51 [6]
Cr3Os Cr3Si сР8, РтЗп 0,4684 0,46779 (2) — [1] [7]
Литература
1. Свечников В.Н., Дмитриева Г.В., Кобзенко Г.Ф., Шурин А.К. // Доклады А ,
СССР. 1964. Т. 158. № 3. С. 668-670.
2. Venkatraman М., Neumann J.P. // Bull Alloy Phase Diagrams. 1990. V. 11. N .
P. 8-11.
3. Raub E. 11 Ъ. Metallkunde. 1957. Bd. 48. S. 53-56.
4. Савицкий E.M., Полякова В.П., Горина Н.Б., Рошан Н.Р. Металловедени
платиновых металлов. М.: Металлургия, 1975. 423 с.
5. Watersrtrat R.M., Kasper J.S. // Trans. AIME. 1957. V. 209. P. 872-873.
6. Knapton A.G. // J. Inst. Met. 1958/1959. V. 87. P. 28-32.
7. Nevitt M.V. // Trans. AIME. 1958. V. 212. P.350-355.
К.Б. Повара
Сг-Р. ХРОМ-ФОСФОР
Полностью диаграмма Cr—P экспериментально не построен*
Обзор данных различных исследований системы Cr—Р проведен ;•
работе [1], результатом которого явилась приведенная на рис. 7
диаграмма. Область концентраций до 30 % (ат.) Р построена и >
данным работы [2] на основании результатов термического и микрос
труктурного анализов. Исследования в области большего содержании
Р затруднено из-за высокого давления паров Р, поэтому в области
концентраций 40—100 % (ат.) Р на диаграмме указано только поло
жение соединений, обнаруженных в сплавах системы Cr—Р. В работ
[11 указывается, что в системе образуется семь соединений: Сг3Р.
Сг2Р, Сг12Р7, СгР, Сг2Р3, СгР2, СгРд. Однако существование Сг2Р;
является сомнительным. Все указанные фазы были в основном синтг
зированы путем взаимодействия порошка Cr с Р в запаянных кварце
вых ампулах при высоких температурах.
Соединение CrjP образуется по перитектической реакции при
температуре -1510 °C [2]. Соединение Сг2Р плавится конгруэнтно
при температуре -1640 °C и имеет две модификации, высокотемпе
ратурную Сг2Р (ВТ) и низкотемпературную Сг2Р (НТ), температур;
перехода не установлена. Характер образования остальных соедине
ний, показанных на рис. 77, не определен. Имеются сведения, что
Cr-P 155
соединение СгР плавится при температуре между 850 и 1000 °C [4].
Существование соединения СгР4 было определено в работе [5] и
установлено, что оно стабильно при давлении -100 МПа и темпера-
туре 1000 °C.
В системе кристаллизуется эвтектика при температуре -1370 °C
и содержании -13 % (ат.) Р по реакции Ж *• (Сг) + (Сг3Р) [2].
Кристаллическая структура соединений приведена в табл. 56.
Таблица 5 6. Кристаллическая структура соединений системы Cr—Р
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм Источ- ник
а b с
Сг3Р W cJ2< 1тЗт 0,9185 — — [б]
0,9186 — — (71
СггР (ВТ) Fe2P hP9, Р62т -0,63 — -0,33 (И
Сг2₽ (НТ) — оР18, Рттт 0,6332 1,0339 0,3299 П1
<-Г>2Г*7 Анти- Th7S12 hP2Q, Р^/т 0,8981 — 0,3313 (8)
СгР МпР оРй, Рпта 0,5367 0,3122 0,6017 [91
156
Cr-Pb
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм Источ НИК
а b С
СгР2‘ OsGe2 mC12, CUm 0,8213 0,3034 0,7098 [11
СгР4“ МоР4 тС20, С2/с 0,51914 0,07600 0,57712 [1]
‘fl - 119, 47°.
* P - 110, 65”.
Литература
1. Venkatraman M„ Neumann J.P. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 5
P. 430-434.
2. Vogel R„ Kasten G.V. // Arch. Eisenhuttenw. 1939. Bd. 12. S. 383—391.
3. Ripley R.L. ///J. Less-Common Met. 1962. V. 4. P. 496—503.
4. Faller F.E., Biltz W. // Z. Anorg. All. Chem. 1941. Bd. 248. S. 209-228.
5. Jeitschko W., Donahue P.C. // Acta Crystallogr. B. 1973. V. B29. P. 783-787
6. Rundqvist S. // Acta Chem. Scand. 1962. V. 16. N I P. 1—19.
7. Lundstrom T. // Acta chem. Scand 1962. V. 16. N 1. P. 149—154.
8. Chun H.K., Carpenter G.B. 11 Acta Crystallogr. B. 1979. V. B35. P. 30—33.
9. Selte K„ Hjersing H., Kjekshus A. et. al. // Acta Chem. Scand. A. 1975. V. 29
N 7. P. 695-698.
HP. Бочвар
Cr-Pb. ХРОМ-СВИНЕЦ
Ориентировочная диаграмма состояния Cr—Pb приведена в работе
[1] и показана на рис. 78. Диаграмма характеризуется отсутствием
промежуточных фаз и существованием несмешиваемости в жидком
состоянии. Однако температура монотектической реакции 1470 °C,
приведенная на рис. 78 по справочнику [X], является заниженной,
из-за использования Сг низкой чистоты (температура плавления С г
приводится равной 1550 °C, что на 300 °C ниже истинной). Тип
нонвариантной реакции при температуре -327 °C не установлен.
Растворимость Сг в жидком РЬ в интервале температур 900—1200 °C
(чистота Сг и РЬ составляла 99,96 и 99,9 % (по массе) соответствен-
но) приведена ниже по данным работы [2]:
Температура, °C.............. 1210 1098 1060 1014 992 908
Растворимость Сг, % (ат.).... 0,63 0,24 0,18 0,16 0,08 0,04
Данные работы [2] могут быть выражены уравнением Igx =
= 4,30 — 6720/Т, где х — концентрация Сг, % (ат.); Т — температу-
ра, К.
Cr~Pd
157
Экстраполяцией полученных значений растворимости до монотек-
тической температуры установлена максимальная растворимость Сг,
соответствующая ~3 % (ат.). В справочнике [Ш] сообщается значе-
ние растворимости Сг в жидком РЬ при температуре 600 °C, равное
-5x10-4 % (ат.).
Литература
1- Venkatraman М„ Neumann J.P. // Bull Alloy Phase Diagrams. 1988. V. 9. N 2.
P- 155-157.
2. Alden T., Stevenson D.A., Wulff J. // Trans. AIME. 1958. V.212. P. 15-17.
КБ. Поварова
Cr-Pd. ХРОМ-ПАЛЛАДИЙ
Диаграмма состояния Cr—Pd (рис. 79) построена в работе [1]
После обобщения данных различных исследователей 12—4]. Система
исследована методами термического, рентгеновского, микро рентген не-
йтрального и металлографического анализов. Хотя Сг содержал
которое количество О [2, 3], но присутствие О не влияло на
158
Cr—Pd
Cr Pd, ’А (am) Pd
Рис. 79. Cr—Pd
результаты построения фазовой диаграммы. Кривые ликвидус—соли
дус в богатых Сг сплавах построены по данным работы [3], а в
области концентраций 50—100 % (ат.) Pd — по данным работы [21.
Система Cr—Pd характеризуется полной смешиваемостью в жидком
состоянии и наличием областей твердых растворов (Pd) и (Сг). В
твердом состоянии образуются два соединения CrPd и Cr2Pd3. Соеди-
нение CrPd образуется при перитектоидной реакции (Cr) + (Pd) “
CrPd при температуре 57От 10 °C и имеет узкий интервал гомогенное
ти от 50 до 52 % (ат.) Pd [3, 5]. По данным работы [5] в сплавах с
55—57 % (ат.) Pd в процессе отжига при температурах ниже 500 °C
появляется упорядоченная фаза состава Cr2Pd3. Предполагается, что
она образуется по перитектоидной реакции при 505т10 °C. В системе
кристаллизуется эвтектика (Cr) + (Pd) при температуре 1315 °C и
содержании 44 % (ат.) Pd.
Растворимость Сг в (Pd) достигает -50 % (ат.) при эвтекти
ческой температуре, максимальная растворимость Pd в (Сг) нс
превышает ~1 % (ат.) Pd fl]. При температурах 1200, 1000, 800 °C
растворимость Pd в (Сг) составляет 0,5т0,1, 1,ЗтО,5 и 0,7тО, 1 %
(ат.) [4].
Кристаллическая структура соединений приведена в табл. 57.
Cr—Pr
159
j в б л и ц a 5 7- Кристаллическая структура соединений системы Cr—Pd
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а с
CrPd AuCu tP2, Рл/ ттт 0,274 (3) 0,380 (1) При концентрации 43-54 % (ат.) Pd. Закалка от 460 °C [3]
Cr2Pd3 AuCu3 сР4, РтЗт 0,385 (2) — При концентрации 60-67 % (ат.) Pd [5]
(Pd) Си cF4, Fm3m 0,3858 — При концентрации 60 % (ат.) Pd. Закал- ка от 1000 °C [2]
0,3856 — При концентрации 63,5 % (ат.) Pd. За- калка от 1000 °C [3]
0,3870 — При концентрации 81,5 % (ат.) Pd. За- калка от 1000 °C [3]
0,3886 — При концентрации 85 % (ат.) Pd. Закал- ка от 1000 °C [2]
Литература
1. Venkatraman М., Neumann J.P. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 1.
P. 11-15.
2. Grube G., Knabe R. 11 I. Electrochem. 1936. V. 421. S. 793-804.
3. Raub E., Mahler W. // Z. Metallkunde. 1954. Bd. 45. S. 648-650.
4. Waterstrat R.M. //J. Less-Common Met. 1981. V. 80. N 1. P. 31—36.
5. Raub E., Gohle R„ Roschel E. // Z. Metallkunde. 1967. Bd. 58. N 8. S. 567-568.
КБ. Поварова
Cr-Рг. ХРОМ—ПРАЗЕОДИМ
Диаграмма состояния Cr—Pr построена в работе [1] на основании
Результатов дифференциального термического, металлографического
и Рентгеновского анализов. В качестве исходных материалов исполь-
зовали Сг и Рг чистотой 99,98 и 98, 94 % (по массе) соответственно.
В работе [2] проведен термодинамический расчет диаграммы с ис-
пользованием моделей идеальных растворов и определен состав
эвтектической точки. Приведенная на рис. 80 диаграмма Сг—Рг по-
строена с учетом данных работ [1, 2]. Система характеризуется
существованием области несмешиваемости в жидком состоянии и
ОтсУтствием промежуточных фаз. Монотектическая реакция имеет
160
Cr—Pr
Рис. 80. Cr—Рг
место при температуре 1800 °C и содержании 1,25 % (ат.) Рг. В
связи с полиморфизмом Рг в системе протекает эвтектоидная реакция
при температуре 770 °C. Растворимость Рг в (Сг), исследованная в
работах [3, 4], приведена ниже:
Температура, °C......................
Растворимость Рг, % (ат.)............
1780 1750 1700 1600 1000
0,65 0,5 0,37 0,26 0,12
Экстраполируя полученные значения до пересечения с монотект1
ческой горизонталью, в работе [3] была определена максимальн о
растворимость Рг в (Сг), равная 0,9 % (ат.).
г Cr—Pt 161
$*—“
Литература
1. Свечников В.Н., Кобзенко Г.Ф., Кашевская О.М., Иванченко В.Г. // Доповщ!
4ц УРСР. 1969. Сер. A. N 8. С. 748-751.
2. Свечников В.Н., Иванченко В.Г., Кобзенко Г.Ф. // Диаграммы состояния
'((йеталлических систем. Термодинамические расчеты и экспериментальные методы: Сб.
^статей. М.: Наука, 1981. С. 85—90.
3. Кобзенко Г.Ф., Холодов А.Г., Иванченко В.Г. и др. // Допов1д1 АН УРСР.
>1970. Сер. А. № 11. С. 1045-1048.
ь 4. Кобзенко Г.Ф., Холодов А.Г., Иванченко В.Г. и др. // Диаграммы состояния
и!1еталлических систем: Сб. статей. М.: Наука, 1971. С. 177—180.
Н.Р. Бочвар, К.Б. Поварова
Cr—Pt. ХРОМ—ПЛАТИНА
Результаты исследования диаграммы состояния Сг—Pt приведены
в работах [X, Ш, 1—3] и обобщены в работе [4]. Фазовая диаграмма,
приведенная на рис. 81 по данным работы [4], основана на данных
работ [1, 2], в которых исследование проведено методами рентгенов-
ского, металлографического, микрорентгеноспектрального анализов
и электронной микроскопии. В работе [1] использовали Сг и Pt
чистотой 99,999 и 99,9 % (по массе) соответственно. Главными
неметаллическими примесями были Н и О, содержание которых
Pt, °/о (по массе)
Рис. 81. Cr—Pt
6 Зак. 2144
162
Cr-Pt
составляло 0,03 и 0,7 % (по массе) соответственно. Однако в работе
[1] показано, что высокое содержание О не оказывает какого-либо
значительного влияния на строение фазовой диаграммы.
Система Cr—Pt характеризуется наличием трех упорядоченных
интерметаллических фаз Cr3Pt, CrPt, CrPt3 й широких областей
твердых растворов (Pt) и (Сг).
На кривых ликвидуса и солидуса в области концентраций -80 /
(ат.) Pt наблюдается максимум, температура которого составляет
1790 °C [1].
В работе [2] указывается на конгруэнтное плавление соединения
Cr3Pt (рис. 81), в отличие от данных работы [1], в которой сообща-
ется об образовании Cr3Pt по синтектической реакции. Это предпола-
гает образование области несмешиваемости в интервале концентра-
ций 10—30 % (ат.) Pt. Однако согласно расчету, проведенному в
работе [3], это маловероятно. Как указывается в работе [4], об-
ласть концентраций 10—30 % (ат.) Pt требует дальнейшего исследо-
вания.
Соединение Cr3Pt имеет область гомогенности, протяженное .> п
которой при температуре -1000 °C составляет от -17 до -23 % (ат.)
Pt [1].
Упорядоченная фаза CrPt3 образуется из неупорядоченного твер -
дого раствора (Pt) при температуре ниже 1200 °C. Она существует в
широкой области концентраций от -34 до -85 % (ат.) Pt. Макси
мальная точка перехода порядок беспорядок имеет место при
температуре -ИЗО °C и содержании -67 % (ат.) Pt [4].
Соединение CrPt было установлено рентгенографически по изме-
нению типа структуры (от Л12 к £10), которое происходит при увели-
чении концентрации Ст в области соединения CrPt3. Кроме того,
соединение CrPt и существование двухфазной области CrPt3 + CrPt
наблюдали в тонких пленках при температурах ниже 600 °C при
содержании 52—74 % (ат.) Pt [4].
В системе Cr—Pt кристаллизуется эвтектика и имеет место одни
эвтектоидное равновесие. Указанные нонвариантные реакции привс
дены в табл. 58 [4].
Таблица 58. Нонвариантные реакции в системе Cr-Pt
Реакция Содержание Pt в фазах, % (ат.) Температура,
Ж > Сг3Р1 + (Pt) -24; -20; -29 1530
Ж ₽ (Cr) + Cr3Pt -13; -10; -17 1500
(Pt) » Cr3Pt + CrPt3 -34; -23; — 970
Cr—Pu
163
Границы твердых растворов (Сг) и (Pt) на рис. 81 приведены по
данным работы [1]. Растворимость Pt в (Сг), по данным работы [2]
павна 2,5 % (ат.) при 900 °C, что хорошо согласуется с данными
заботы [4]. Область существования (Pt) при 1530 °C простирается от
^29 Д° ЮО % (ат.) Pt. Кристаллическая структура соединений
приведена в табл. 59.
Таблица 5 9. Кристаллическая структура соединений системы Сг—Pt
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а с
Cr3Pt Cr3Si сРЪ, РтЗт 0,4684 При концентра- ции Pt, % (ат.): ~17 [1]
СгРЦ AuCu3 сР4, РтЗт 0,4708 0,4711 0,3800 -23(1] 20 [2] 35 [1]
CrPt Au Си tP2, 0,3804 0,3841 0,3879 0,3894 0,3902 0,3822 0,3811 40,5 [1] 60,4 (1] 76,7 [2] 86,5 [2] 90,2 [1] 51,5 (в тонких
Р4/ттт пленках) [4]
Литература
1. Waterstrat R.M. // Met. Trans. 1973. V. 4. N 6. P. 1585-1592.
2. Raub E„ Mahler W. // Z Metallkunde. 1955. Bd. 46. S. 210-215.
3. De Boer F.R., Boom R., Miedema A.R. // Physica. 1982. V. 113B. P. 18-41.
4. Venkatraman M„ Neumann J.P. // Bull Alloy Phase Diagrams. 1990. V. 11. N 1.
P. 16-21.
Н.Р. Бочвар
Cr—Pu. ХРОМ—ПЛУТОНИЙ
Данные различных исследований взаимодействия Ст и Ри хорошо
^ласуются между собой и показывают, что в системе Cr—Pu отсут-
СтвУЮт промежуточные фазы и она представляет собой систему
эвтектического типа. Эвтектика образуется по реакции Ж « (Сг) +
+ (еРц) при температуре 620 °C и содержании Сг менее 1 % (ат.).
'-г практически не растворяется в Ри и поэтому не влияет на темпе-
ратуры аллотропических превращений Ри. Диаграмма состояния
'-r"-Pu приведена на рис. 82 по данным работы [1].
6*
164
Cr-Rb
Литература
1. Venkatraman М„ Neumann J.P. // Bull, alloy Phase Diagrams. 1984. V. 5. N 4.
P. 402.
КБ. Поварова
Литература
1. Venkatraman М., Neumann J.P., Petersen D.E. // Bull. Alloy Phase Diagrams
1985. V. 6. N 5. P. 425-429.
К. Б. Поварова
Cr-Rb. ХРОМ-РУБИДИЙ
Экспериментально диаграмма состояния Cr—Rb не построена. В
работе [1] предложена гипотетическая диаграмма (рис. 83), предпо-
лагающая практически полное отсутствие взаимодействия компонен-
тов в жидком и твердом состояниях. В этой же работе приводится
растворимость Сг в жидком Rb при температурах от 700 до 900 °C,
которая составляет порядка 10"3 % (ат.). При этом содержание
кислорода в расплаве 5*10“2 % (ат.).
Cr—Re. ХРОМ—РЕНИЙ
Диаграмма состояния Cr—Re (рис. 84) построена в работе [1] на
основании результатов исследований, приведенных в областях кон-
центраций 20—100 % (ат.) Re [2] и 0—20 % (ат.) Re [3]. В системе
образуется одна промежуточная фаза о (на основе Cr2Re3) и широ-
кие области твердых растворов (Сг) и (Re). Фаза о имеет большую
область гомогенности, протяженность которой, по данным различных
работ, составляет в % (ат.) Re: 58—63 [1], 57—65 [2], 59—67 [3].
Реакции, соответствующие образованию фаз о и (Сг), приведены
в табл. 60 [1].
В работе [3] обнаружено фазовое превращение в богатых Сг
сплавах при температурах ниже 300 °C. Однако по мнению авторов
Работы [1] это превращение связано с протеканием магнитных
Превращений.
166
C r—Re
fie, % (по массе)
Рис. 84. Сг-Re
Максимальная растворимость Сг в (Re) составляет около 25 %
(ат.) и снижается до -10 % (ат.) при 1500 °C [2]. Растворимость Re
в (Сг) при температуре 1500 °C составляет около 36 % (ат.) [2].
Параметр кристаллической решетки (Сг) (тип W, символ Пирсона
сГ2, пр.гр. 1тЗт) меняется линейно от значения 0,2885 нм для Сг
до 0,2968 нм для сплава с 38 % (ат.) Re [4]. Фаза а имеет структуру
типа oCrFe (символ Пирсона /РЗО, пр.гр. Р^/тпт). Усреднен-
ные параметры решетки этой фазы равны а == 0,928 (4) нм, с ~
= 0,483 (3) нм [1]. Согласно работе [4] параметры решетки увели
чиваются от а = 0,932 нм и с = 0,481 нм для состава, богатого Сг, до
а - 0,932 нм и с = 0,485 нм для состава, богатого Re.
Таблица 6 0. Нонвариантные реакции в системе Cr—Re
Реакция Содержание Re в фазах, % (ат.) Температура, °C
Ж + (Re) «* а -48; -75; -63 2354
Ж + а « (Сг) -40; 58; -50 2284
Cr-Rfi
167
Щература
У 1 Venkatraman М., Neumann J.P. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 2.
i 105-Ю7.
2 Савицкий E.M., Тылкина M.A., Поварова К.Б. // Журнал неогранической
LjaMH. 1959. Т. 4. № 8. С- 873-874. ... ...
J. Лариков Л.Н., Бакланова Л.М., Барабаш О.М. // Доклады АН УРСР. 1977.
Lp. А. № 3. С. 258-260.
4. Mucheim J., Muller J. // Phys. Kondens. Mater. 1964. N 2. S. 377—396.
А. Л. Поварова
Cr—Rh. ХРОМ-РОДИЙ
Диаграмма состояния Cr—Rh (рис. 85) построена в работе [1] по
данным исследования [2]. В работе [2] использованы методы рентге-
ноструктурного, рентгеновского и микрорентгеноспектрального
анализов. Исследование проведено на сплавах, выплавленных в
Cr Rh,°/o (ат.) Rh
рис. 85. Cr—Rh
Система характеризуется образованием двух промежуточных
Фаз Cr3Rh и е и широкими областями твердых растворов (Сг) и
(Rh). Соединение Cr3Rh образуется в твердом состоянии по перитек-
тоидной реакции, а фаза е — по перитектической реакции. Фаза е
Cr-Ru
169
имеет широкую область гомогенности 32—80 % (ат.) Rh, соединение
Cr3Rh — узкую область гомогенности 22—23 % (ат.) Rh. В системе
кристаллизуется одна эвтектика. Нонвариантные реакции, протекаю-
щие в системе, приведены в табл. 61 [1].
Максимальная растворимость Rh в (Сг) составляет ~20 % (ат.)
при эвтектической температуре и снижается до -5,5 % (ат.) при
900 °C [2]. Максимальная растворимость Сг в (Rh) составляет -31 °/
(ат.) и уменьшается с понижением температуры.
Кристаллическая структура фаз в системе Cr—Rh
табл. 62 [1].
Таблица 61. Нонвариантные
приведен? в
Реакции в системе Cr-Rh
-69;
-34;
-20;
-66
-22,5
-32
-60;
-19;
~27;
Реакция
Ж + (Rh)
(Сг) + е
CraRh
Ж ” (Сг) +
Содержание Rh
Температура, °c
1700
1265
1475
Cr—1
Таблица 6 2. Кристаллическая структура соединений
!-----------1----------->--------------
Фаза | Прототип 1 Символ Пирсо 1 на, пр.гр. / Параметры решетки, 1 Примечание
I а нм / с
При концен-
(Сг) W . ' с72, 1тЗп 1 0,2885 трациях Rh, % (ат.):
Cr3Rh / Cr3Si | РтЗп 1 1 0,2909 0,4556 1 — 1 0 % 10,3 [3]
Е 1 Mg j 1 0,4660 -23 [4]
'^с’2, Щттс 1 0,2665 0,2663 1 0,2668 0,2665 1 0,4270 1 ' 0,4260 / 0,4249 1 0,4251 0,4263 | -23 [5] . 39 [3] 40 [2] 50 [4]
0,2667 / 50 [3]
0,2687 1 0,4286 I 50 [2]
?h) 1 Си I СР4, С'тЗт 1 0,2682 I 0,2695 I 0,3781 / 0,4277 / 0,4308 1 70 [3] 1 70 [2J 1 80 [2] 1
0,3792 1 90 [3] 1
94,2 [3]
$йература
1. Venkatraman М., Neumann J.P. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 2.
007-109.
2. Waterstrat R.M., Manuszewski R.C. // J. Less-Common Met. 1973. V. 32.
p .’331—343.
J. Raub. E„ Mahler W. 11 Z. Metallkunde. 1955. Bd. 46. S. 210-215.
*4. Greenfield P., Beck P.A. // Ttans. AIME. 1956. V. 206. P. 265-276.
5. Nevitt M.V. // Trans. AIME. 1958. V. 121. P. 350-355.
К Б. Поварова
Cr—Ru. ХРОМ-РУТЕНИЙ
Диаграмма состояния Cr—Ru обобщена в работе [1] на основа-
нии сопоставления вариантов диаграммы по данным работ [2—7]. В
этих работах имеются существенные разногласия относительно
количества и стабильности промежуточных фаз, а также характера
реакций. На рис. 86 диаграмма состояния Cr—Ru приведена по
данным работы [1].
Ku, °/о (по массе)
Ru, °/о (ат)
Ru
Сг
Рис. 86. Cr-Ru
Система характеризуется образованием в твердом состоянии
по перитектоидным реакциям фазы о (на основе соединения Cr2Ru)
и фазы Cr3Ru. Фаза Cr3Ru существует в узком температурном
интервале. Протяженность области гомогенности составляет около
170
Cr—Ru.
2 % (ат.) Ru по результатам большинства исследований. Однако
состав этой фазы требует уточнения. В работах [2, 3, 5] содержание
Ru в фазе Cr3Ru указано равным 25 % (ат.), в работе [4] — около
31,5 (ат.).
Фаза а также имеет небольшую область гомогенности, которая
согласно данным работ [2—6] простирается от 32 т2 до 36 т2 % (ат >
Ru. В табл. 63 приведены реакции образования фаз, а также эвтск; и -
ческая и эвтектоидные реакции, имеющие место в системе Cr—Ru,
Таблица 6 3. Нонвариантные реакции в системе Cr—Ru [1]
Реакция Содержание Ru в фазах, % (ат.) Температура, Т
Ж » (Cr) + (Ru) -37; -32; -48 1610
(Cr) + (Ru) - а -32; -48; -33 1580
а «« Cr3Ru + (Ru) -33; -25; -50 -800
(Cr) + а «* Cr3Ru -23; -32; -25 -1000
Cr3Ru «* (Cr) + (Ru) -25; 18; -51 -750
Твердый раствор Ru в Ст существует в широком интервале кон
центраций. Растворимость Ru уменьшается с понижением температ\
ры от ~32 % (ат.) при эвтектической температуре до ~23 % (ат/
при 1000 °C и далее до -18 % (ат.) при 500—800 °C [3, 4].
Твердый раствор Сг в Ru существует в широком интервале кон
центраций. Максимальная растворимость достигает 52 % (ат.) Сг при
1580—1610 °C, мало меняется с понижением температуры до -800 °C,
при -500 °C растворимость Сг в (Ru) не превышает -42 % (ат.).
Точность определения границ твердых растворов составляет тЗ %
(ат.) Ru [11].
Кристаллическая структура фаз приведена в табл. 64.
Таблица 6 4. Кристаллическая структура соединений системы Cr—Ru
Соедине' ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Примеча- ние
а С
Cr3Ru Cr3Si сР8, РтЗп 0,4683 [5, 6]
О aCrFe tP30, Р42/тпт 0,906 (4)' 0,90635 0,470 (4)’ 0,47430 [4, 6] [8]
При концентрации 34,2 % (ат.) Ru.
OS
171
Литература
1. Venkatraman M., Neumann J.P. // Bull. Alloy Phase Diagrams. 1987. V, 8. N 2.
«'P. 109-112.
2. Савицкий E.M., Терехова В.Ф., Бирун H.A. // Журнал неорганической химии.
* 1961- Т. 6. № 8. С. 1960-1962.
. 3. Шурин А.К., Дмитриева Г.П. // Сборник научных трудов Ин га металлофи-
зики. 1964. Вып. 18. С. 170-174.
4. Waterstrat R.M. // J. Less-Common Met. 1981. V. 80. Р. 31—36.
5. Raub Е., Mahler W. П Z. Metallkunde. 1955. Bd. 46. S. 210-215.
6. Wopersnow W., Raub Ch.J. // Metall. 1979. Bd. 33. N 12. S. 1261—1265.
7. Greenfield P., Beck P.A. // Trans AIME. 1956. V. 206. P. 265-276.
8. De Veiga L.M., Costa M.M.R.R., de Almeida M.J.M. et all // Acta Crystallogr. B.
1980. N 36. P. 1750-1757.
K'./r. Поварова
Cr-S. ХРОМ—СЕРА
Результаты исследования взаимодействия Cr с S приведены в
справочниках [X, Э, Ш]. Фазовые равновесия в богатой S части
диаграммы состояния и высокотемпературные реакции сульфидов Сг
сложны и нуждаются в уточнении. Диаграмма состояния Сг—S в
интервале концентраций 40—70 % (ат.) S построена в работе [1] на
основании обобщения данных ряда работ [2—6]. Исследование прово-
дили методами термического, микроскопического и химического
анализов [2], а также методом высокотемпературного рентгеновского
анализа сплавов, синтезированных при 1300 °C из Сг и S чистотой
99,999 % (ат.) [3]. В работах [2—7] определено влияние давления
паров S на положение фазовых равновесий, в том числе в присут-
ствии жидкой фазы [8], а также исследована кристаллическая струк-
тура синтезированных фаз [9, 10]. На рис. 87 приведена диаграмма
состояния Cr—S по справочнику [X] в области концентраций 0—40 %
(ат.) S и по работе [1] в области концентраций 40—70 % (ат.) S.
Система характеризуется наличием области несмешиваемости в
жидком состоянии и образованием ряда сульфидов Сг. При темпера-
туре монотектики 1550 °C расслоение расплава наблюдается в интер-
вале концентраций 3,5—38,1 % (ат.) S. В системе высокотемператур-
ная фаза Cr,_xS образуется из расплава при -1650 °C: представляет
собой неупорядоченный твердый раствор, который упорядочивается
при -550 °C и распадается по двум эвтектоидным реакциям:
Crj_xS (I) « Cfj o3S + Cr7S8 при -300 °C;
Cr^S (II) * СгХ + Cr5S6 при -310 °C.
Соединение Cfj_xS участвует в двух эвтектических реакциях и
образует эвтектику с (Сг) при температуре 1350 °C и содержании
43,9 % (ат.) S и с (S) при температуре -1300 °C и содержании
-66 % (ат.) S [1,8].
172
Cr—S
Рис. 87. Cr—S
Остальные шесть соединений образуются по перитектоидным
реакциям, приведенным ниже:
(Cr) + Cfj^S » Crj 03S при 600 °C [1];
Cr} S (I) + Cfi S’(II) * Cr7S8 при -320 °C [1];
Cr^S + Cr3S4 « Cr5S6 при -325 °C [1];
Cr^S + Cr0 7S и Cr3S4 при -940 °C [9];
Crj S + (S) CrQ7S при -1200 °C [3];
Cr0 7S + (S) « Cr2S3 при -1100 °C [1].
Соединения Cr(_yS, Cr7S8, Cr3S4 и Cr2S3 имеют области гомоген
ности, интервал существования которых приведен ниже.
Соединение...........................
S, % (ат.)...........................
Cr,_xS Cr7Sg Cr3S4 Cr2S3
50,5—58,5 53,2-53,5 55,3-56,8 59,9-60.0
Источник.........................
[1,81 [1] [9] [1]
Растворимость S в (Си) при температуре 1200 °C не превышает
12x10-6 % (ат.) при отношении давления H9S к давлению Н7 равном
-24x10"^ [4].
Кристаллическая структура соединений приведена в табл. 65.
Cr—S
173
и 6 л и ц a 6 5. Кристаллическая структура соединений системы Cr—S
Сочи- нение Сингония Параметры решетки, нм Примечание
а b с
Cr, 03S Моноклинная 0,3826 0,5913 0,6089 Р = 101,6’ [9]
Cr7Sg Гексагональная с произвольно распределенны- ми вакансиями 0,3464(1) 0,3459(2) — 0,5163 0,5761(3) При концентрации 53,2 % (ат.) S [9] При концентрации 53,3 % (ат.) S [9]
Cr5S6 Гексагональная с упорядочен- ным располо- жением вакан- сий 0,5982(2) 1,1509(3) [9]
Cr3S4 Моноклинная 0,5973(3) 0,4332(2) 1,1361(6) При концентрации 55,9 % (ar.) S. Р - 91,15° [9]
0 5960(3) 0,3427(2) 1,1253(6) При концентрации 56,8 % (ат.) S. р = 91,63’ [93
Cr07S Гексагональная 0,5939(2) — 1,1192(3) Для богатых Сг сплавов
0,5943(2) — 1,1171(3) Для богатых S спла- вов
Cr2S3 Ромбоэдричес- кая 0,5937(2) — 1,6698(5) При концентрации 59,8 % (ат.) S [9]
0,5939(4) — 1,6651(1) При концентрации 60 % (ат.) S [9]
СГ1-aS Гексагональная 0,345 0,576 При температуре выше 570 °C и кон- центрации 52,4— 54,5 % (ат.) S (X, Э]
Литература
1. Petrie A., Jacob К.В. // Trans. ASM. 1985. V. 16А. N 4. Р. 503-510.
2. Vogel R., Reinbach R. // Arch. Eisenhuttenwes. 1938. Bd. U.S. 457—482.
3. Rau H.K, // J. Uss-Common Met. 1977. V. 55. P. 205-211.
4. Groliere R., Barbouth N. // Met. Sci. Rev. Met. 1976. V. 73. N I. P. 71-76.
5. Hager J.P., Elliot J.F. // Trans. AIME. 1967. V. 239. P.5I3.
6. Le Brusq H„ Delamaire J.P. // Rev. Int. Ilautes Temp. Refracr. 1974. V. 11.
p 193.
7. Igaki K., Ohashi N., Makami M, // J. Phys. Sos. Jpn. 1971. V. 31. P. 1424.
8. El Goresy A., Kullekud G. // Carnegie Inst. Washington Yearb. 1969. P. 182.
9. Jellinger F. // Acta Crystallogr. 1957. V. 10. P. 620—628.
Ю, Pompa T.J.A., Van Brugger C.F. // J. Inogr. Nucl. Chem. 1969. V. 31. P. 73.
К. Б. Поварова
174
Cr—Sb
Сг-Sb. ХРОМ-СУРЬМА
Диаграмма состояния Сг—Sb (рис. 88) построена в работе [ 1 j На
основании обобщения данных исследований [2—4]. Ликвидус системы
приведен по данным работы [2], в которой исследование было прове-
дено методами термического и микроструктурного анализов. Так как
в работе [2] был использован Сг недостаточно высокой чистоты —
98,97 % (по массе) с температурой плавления 1553 °C (вместо
1863 °C), кривая ликвидуса в области концентраций 0—30 % (ат.) Sb
была скорректирована в соответствии с истинной температурой плав-
ления Сг.
В системе образуются две промежуточные фазы CrSb и CrSb2.
Соединение CrSb плавится конгруэнтно при 1113 °C и имеет неболь-
шой интервал гомогенности. CrSb2 образуется по перитектической
реакции. Температура образования CrSb2 (718 °C) принята согласно
данным работ [3, 4] и определена методами калориметрического
дифференциального термического и высокотемпературного рентгенов-
ского анализов. Реакция образования соединения CrSb2 и эвтектичес-
кие реакции, протекающие в системе, приведены согласно работе [1]
в табл. 66.
Cr—Sb
175
Ьблица 6 6. Нонвариантные реакции в системе Cr-Sb
Г7 Реакция Содержание Sb в фазе, % (ат.) Температура, °C
ИК + CrSb » CrSb2 -89; 50; 66,7 718тЗ
ЕЖ - (Cr) + CrSb -42; -5; -47 1102
Sk - CRSb2 + (Sb) 95,5; 66,7; -100 620*0,5
Таблица 67. Кристаллическая структура соединений системы Cr—Sb
Соеди- нение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а b С
CrSb NiAs АР4, При концентрации
P63/mmc S, % (ат.):
0,4137 — 0,5462 48 [5J
0,4123 — 0,5470 50 [5]
0,4122 — 0,5464 50 [6]
CrSb2 FeS2 оРб, Рппт 0,60275 0,68738 0,32715 [71
Растворимость Sb в (Сг) составляет ~5 % (ат.) при температуре
1050 °C. В (Sb) Ст практически не растворяется [2].
Кристаллическая структура соединений приведена в табл. 67.
В работе [1] сообщается о возможности образования в сплавах,
содержащих 88—94 % (ат.) Sb, метастабильной фазы Сг0 г8Ь0 9 при
быстрой скорости охлаждения. Эта фаза имеет простую кубическую
структуру типа аРо (символ Пирсона сР\, пр.гр. Pm3m), параметр
решетки 0,3074 нм.
Литература
1. Venkatraman ML, Neumann J.P. // Bull. Allov Phase Diagrams. 1990. V. 11.4 5.
P. 435-440.
2. Williams R.S. // Z. Anorg. AU. Chem. 1907. V. 55. S. 1-33.
3. Alles A., Falk B., Westrum E.F., Gronvold F. // J. Chem. Thermodyn. 1978. V. 10.
P. 103-116.
4. Kjekshus A., Peterzens P.G., Rakke T., Andersen A.F. // Acta Chem. Scand. A.
1979. V. 33. P. 469—480.
5. Kjekshus A„ Walsets K.P. // Acta Chem. Scand. 1969. V. 23. N 8.
P- 2621-2630.
6. Reimers W., Hellner E., Treutmann W., Heger G. //J. Phvs. C. 1982. V. 15.
P- 3597-3615.
7. Holseth H., Kjekshus A., Andersen A.F. // Actya Chem. Scand. 1970 V 24 N 9.
₽ 3309-3316.
И.Р. Бочвар
176
Cr—Sc
Сг-Sc. ХРОМ-СКАНДИЙ
Диаграмма состояния Cr—Sc (рис. 89) построена на основании
результатов термического, микроструктурного, рентгеновского анали-
зов и измерения твердости в работе [ 1 ]. Сплавы выплавляли в дуго-
вой печи в атмосфере Аг из Сг чистотой 99,98 % (по массе) и Sc
чистотой 99,97 % (по массе). Промежуточные фазы в системе отсут-
ствуют. Между твердыми растворами (Сг) и (Sc) образуется эвтекти-
ка при температуре 1090 °C и содержании 60—65 % (ат.) Sc. (г
понижает температуру полиморфного превращения Sc до температу-
ры эвтектоидного превращения 990 °C. Растворимость Сг в (aSc) при
990 °C составляет 0,4 % (ат.), в (pSc) при 1090 °C — 2 % (ат ).
Растворимость Sc в (Сг) составляет менее 0,1% (ат.) [Э]. В работе
[2] проведен расчет диаграммы с использованием моделей субрегу-
лярных растворов. Показано хорошее соответствие эксперимента,! е
ным данным.
Sc,°/o(no массе)
Рис. 89. Cr—Sc
Литература
1. Свечников В.Н., Кобзенко Г.Ф., Иванченко В.Г. // Доповцр УРСР. 1972
Серия А. № 3. С. 266—268.
2. Свечников В.Н., Иванченко В.Г., Кобзенко Г.Ф. // Диаграммы состояния
металлических систем. Термодинамические расчеты и экспериментальные методы: Сб.
статей. М.: Наука, 1981. С. 85—90.
КБ. Поварова
Cr—Se
177
j£r-Se. ХРОМ-СЕЛЕН
tt результаты исследования взаимодействия Cr с Se приведены в
Ждравочниках [X, Э, Ш]. Участок диаграммы Cr—Se (рис. 90) постро-
4вн. в интервале концентраций -35—100 % (ат.) Se на основании
Данных дифференциального термического, металлографического,
рентгеновского анализов и измерения твердости в работе [ 1 ]. Сплавы
ролучали твердофазным синтезом или сплавлением Сг и Se чистотой
’09,99 % (по массе). В интервале концентраций -50—60 % (ат.) Se
из расплава конгруэнтно образуется соединение, представляю-
5е, °/о (по массе)
Рис. 90. Cr—Sc
Щее собой неупорядоченный твердый раствор на основе соединения
Cr^Se. Температура плавления его находится между температура-
ми -1550 и -1500 °C, которые соответствуют граничным составам
CrSe и Cr2Se3 [2, 3]. При понижении температуры происходит
Распад неупорядоченного твердого раствора с образованием при 305,
911 и 811 °C упорядоченных фаз CrSe, Cr3Se4 и Cr2Se3 соответ-
ственно. Соединение CrSe образуется по перитектоидной реакции из
Ст^дХе и твердого раствора (Сг). Соединения Cr3Sc4 и Cr2Sc3 образу-
ется конгруэнтно. В системе протекают две эвтектические и две
эвтектоидные реакции:
178
C r—Sc
Ж * Cr)_xSe + (Сг) при 1450 °C;
Ж * Cr2Se3 + (Se) при -221 °C;
Crj xSe * CrSe + CroSe^ при -300 °C;
Cr! xSe « Cr3Se4 + Cr2Se3 при -800 °C.
Все указанные соединения имеют области гомогенности, пр,
женность которых приведена ниже:
Соединение........................... CrSe Cr3Se4 Cr Л. .
Se, % (ат.).......................... 49,5-53,5 56-58,4 54,5-58 59,2- .2
Источник............................. [1, X] [1] [X] [1.
В справочнике [Ш] сообщается о соединении Cr7Se8 с монок. ин-
ной решеткой (пр.гр. Пт). В работе [4] указано на образов.!дне
соединения Cr68Se с тетрагональной решеткой. На основании дан пях
об аномальном ходе магнитных и электрических свойств CrSe вы а-
зано предположение о наличии в CrSe полиморфного преврапс ия
при 305 °C [Ш].
Кристаллическая структура соединений приведена в табл. 68
Таблица 6 8. Кристаллическая структура соединений системы Cr—Se
Соединение Прототип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источ> /к
а b с
Cr^Se** 1 2 NiAs АР4, Pf>Jmmc — — —
CrSe NiAs hPX, Р63/ттс 0,3674 0,5959 [11
0,371 — 0,603 (3!
Cr3Se4 — —, 12т 0,6299 0,3607 1,173 15!
Cr2Se3 — -, R3 0,62533 —- 1,7316 [Uli
Cr2Se3’4 5 — — 0,3605 — 0,5774 [1!
'Неупорядоченная структура.
’^Моноклинная сингония, 0 - 91, 86°.
*3Ромбоэдрическая сингония, приводятся параметры гексагональной ячейки
Гексагональная сингония.
Литература
1. Бабицына А.А., Черницына М.А., Калинников В.Т. // Журнал неорганичен 1,1
химии. 1975. Т. 20. № 12. С. 3357-3362.
2. Оболончик В.А. Селениды. М.: Металлургия, 1972. 296 с.
3. Barraclough К.С., Meyer А. // J. Cryst. Growth. 1973. V. 20. Р. 212.
4 Corliss L.M., Elliott N„ Hastings J.M., Sass R.L. // Phys. Rev. 1961. V 1 1
P. 1402.
5. Chevreton M., Bertaut F. // Compt. Rend. 1961. V. 253. P. 145—147.
КБ. Лова Г •'
Cr—Si
179
Сг-Si. ХРОМ- КРЕМНИЙ
Обобщенный вариант диаграммы состояния Cr—Si представлен в
работе [1] и показан на рис. 91. При построении диаграммы были
использованы экспериментальные данные работ [2—5]. В системе
^образуются четыре соединения Cr3Si, Cr5Si3, CrSi, CrSi2, а также
твердые растворы (Сг) и (Si). Соединения Cr3Si, Cr5Si3 и CrSi2
плавятся конгруэнтно, a CrSi образуется по перитектической реак-
' ции. В более ранних работах указывается, что соединение CrSi пла-
вится конгруэнтно [2, 3], a Cr3Si и Cr3Si2 (40 % (ат.) Si) образуют-
Cr Si, % (ат )
рис. 91. Cr—Si
ся по перитектическим реакциям [1]. Эти данные не подтвердились
в последующих работах. Соединение Cr5Si3 претерпевает полимор-
фное превращение при 1505т20 °C [4] и имеет две модификации
«Cr5Si3 (низкотемпературная) и 0Cr5Si3 (высокотемпературная).
Уединения Cr3Si, Cr5Si3 и CrSi2 имеют области гомогенности,
протяженность которых приведена ниже:
180
Cr—Si
Cr—Si
181
Соединение............................
Si, % (ат.)............................
Температура, °C........................
Источник...............................
Cr3Si u Cr ^Si ц CrSi2
22,5-26,4 36-41 66,67-66,99
1700-1660 1413 —
[4-6] [1-6] [1]
В системе кристаллизуются четыре эвтектики. Реакции образова
ния соединений и эвтектические реакции приведены в табл. 69.
Кристаллическая структура соединений приведена в табл. 70.
Таблица 6 9. Нонвариантные реакции в системе Cr—Si
Реакция Содержание Si в фазах, % (ат.) Температу- ра, °C Источник
Ж » Cr3Si — 25 — 1770 [1]
1725 [3]
1781 [5]
Ж - pCr5Si3 — 37,5 — 1637 [1,3]
1680*20 [4]
1732 [5]
Ж + aCr5Si3 - CrSi 51 41 50 1413 [1]
51 37,5 50 1413*5 [3]
53 — 50 1485 [5]
Ж » CrS2 — 66,67 — 1588 [3] i
1490*20 [4] |
1486 [5]
Ж - (Cr) + Cr3Si 15 9,5 22,5 1705 [1]
9,2 2,3 25 1550 [2]
13 10 15 1550 [3]
15 9 24 1705*5 [4]
13,78 10,69 22,49 1700*10 [5]
Ж » Cr3Si + pCr5Si3 35 26,4 38 1660 [1]
34,25 29,85 37,5 1680*10 [5]
35 26 37,5 1650*10 [4]
33,50 32 35 1510 12]
Реакция Содержание Si в фазах, % (ат.) Температу- ра, °C' Источник
Ж - CrSi + CrSi2 56 50 66,67 1390*10 [1, 4]
60 50 66,67 1425 [2]
58,25 52 64,5 1431 [3]
57,33 50 66,67 1455*10 [5]
Ж - CrSi2 + (Si) 82 66,99 -100 1305 [1]
84,20 66,67 100 1331 [2]
85 72 100 1314 13]
87 66,67 100 1305*10 [4]
85,22 66,67 100 1335 [5]
Таблица 7 0. Кристаллическая структура соединений Cr—Si
Соедине- ние Прототип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источники
а с
Cr3Si Cr3Si сР8, РтЗп 0,45580 (2) — [7]
a Cr5Si3 W5Cr3 (/38, iMmcm 0,9170 0,4636 [8, 9]
CrSi FeSi сР8, Р2Х3 0,4620 — [1]
CrSi2 CrSi2 hP9, Р6222 0,4428 0,6363 [1]
Литература
1. Gokhale А.В., Abbaschan G.J. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 5.
P. 474-484.
2. Kieffer R., Benesovsky F„ Schroth H. // Z. Metallkunde. 1953. Bd. 44.
S. 437-442.
3. Goldschmidt H.J., Brond J.A. // J. Less-Common Met. 1961. V. 3. P. 34—43.
4. Chang Y.A. 11 Trans A1ME. 1968. V. 242. P. 1509-1515.
5. Kocherzhinsky Ya.A. // Therm. Anal. Proc. 3-rd. ICTA. Davos. 1971. V. 1.
P. 549—559.
6. Wurker W„ Roy K., Heese J. // Mater. Res. Bull. 1974. V. 9. P. 971-978.
7. Jurisch M., Behr G. // Acta Phys. Acad. Hung. 1979. V. 47. N 1-3. P. 201—207.
8. Parthe E., Newethy H., Schmid H. 11 Monatsch. Chem. 1955. Bd. 60. S. 385-386.
9. Dauben C.H., Templeton D.H., Myers C.E. // J. Phys. Chem. 1956. V. 60.
P 443-445.
К.Б. Поварова
182
Cr—Sm
Cr—Sn
183
Cr—Sm. ХРОМ-САМАРИЙ
Диаграмма состояния Cr—Sm построена в работе [1] на основании
результатов термического, металлографического и рентгеновского
анализов с использованием Сг и Sm чистотой 99,98 и >99 % (по
массе) соответственно. В работе [2] был проведен термодинамический
расчет диаграммы с помощью моделей субрегулярных растворов. Был
уточнен состав эвтектики и показано хорошее соответствие расчет-
ных и экспериментальных данных. Диаграмма состояния Cr—Sm,
показанная на рис. 92, построена по результатам этих двух работ.
Система характеризуется областью несмешиваемости в жидком
состоянии и отсутствием промежуточных фаз. Монотектическая
реакция протекает при температуре 1810 °C и содержании 2 % (ат.)
Sm. Эвтектическая реакция имеет место при температуре 1035 °C и
содержании 97,7 % (ат.) Sm. Эвтектоидные равновесия связаны
с полиморфизмом Sm. Максимальная растворимость Сг в (Sm)
не превышает 0,35 % (ат.), растворимость Sm в (Сг) составляет
<0,35 % (ат.) [1].
Рис. 92. Cr—Sm
Литература
1. Свечников B.H., Кобзенко Г.Ф., Иванченко В.Г. // Доклады АН СССР. 1973.
Т. 213. № 5. С. 1062-1064.
2. Свечников В.Н., Иванченко В.Г., Кобзенко Г.Ф. // Диаграммы состояния
металлических систем. Термодинамические расчеты и экспериментальные методы: Сб.
статей. М.: Наука, 1981. С. 85—90.
H.P. Бочвар
Cr-Sn. ХРОМ-ОЛОВО
Данные о взаимодействии Cr с Sn приведены в справочниках [X,
Э, Ш]. Диаграмма состояния Cr—-Sn (рис. 93) построена в работе [1]
на основании результатов дифференциального термического анализа.
Образцы выплавляли в корундовых тиглях из Sn чистотой 99,9995 %
Рис. 93. Cr—Sn
Cr
Sn
Sn ,°/o(a m.)
184
С г—Та
(по массе) и электролитического Сг. Для сплавов в интервале кон
центраций 22,8—55,5 % (ат.) Sn выше температуры монотектическои
реакции 1374 °C имеет место несмешиваемость в жидком состоянии
Критическая точка кривой расслаивания расположена при температу
ре 1485 °C и содержании 39,5 % (ат.) Sn. При температуре 230 °(
кристаллизуется эвтектика. Промежуточные фазы в системе отсу т
ствуют. Растворимость Сг в жидком Sn при различных температурах
приведена ниже [ 1, 2] :
Температура, °C.............. 1300 1100 1000 800
Растворимость Сг, % (ат.).... -25 -10 -6,5 -1,7
В работе [3] приведены данные о получении методом амальгами
рования метастабильного соединения Cr2Sn3, которое при отжиге в
вакууме при температуре 435 т5 °C необратимо распадается. Соединс
ние Cr2Sn3 имеет сложную кристаллическую структуру.
Литература
1. Predel В., Sandig Н. // Z. Metallkunde. 1969. Bd. 60. N 3. S. 208-214.
2. Stevenson D.A., Wulff J. 11 Trans. AIME. 1961. V. 221. P. 271-275.
3. Hollan L., Lecocq P., Michel A. // Compt. Rend. 1964. V. 258. P. 3309—3310
К.Б. Поваров!
Cr—Та. ХРОМ—ТАНТАЛ
Диаграмма состояния Сг—Та, приведенная на рис. 94, построена
по результатам исследований [1—7], проанализированных и обоб-
щенных в работе [8]. В системе образуются промежуточная фаза
Сг2Та и твердые растворы (Сг) и (Та). В работе [2] нашли еще одно
соединение Сг3Та, которое образуется по перитектической реакции
при температуре 1825 °C, однако в других работах не подтверждено
существование этого соединения, и на рис. 94 оно не показано.
Соединение Сг2Та плавится конгруэнтно, имеет две модификации
высокотемпературную (ВТ) и низкотемпературную (НТ), которая
образуется по перитектоидной реакции. Температура плавления
соединения Сг2Та (ВТ), по данным различных исследований, приве
дена ниже:
Температура, °C....................... 2015 2020 2040
Источник.............................. [9] [1,6] [3]
Интервал гомогенности Сг2Та (ВТ) составляет 30—38 % (ат.) Та,
а Сг2Та (НТ) — 33—36 % (ат.) Та. В системе кристаллизуются две
эвтектики и имеет место одно эвтектоидное равновесие. Нонвариан-
тные реакции приведены в табл. 71.
Cr—Ta
185
Рис. 94. Cr—Ta
Растворимость Та в (Сг) приведена ниже:
Температура, "С......................
Растворимость Та, % (ат.)............
Источник.............................
1760 1600 1400 1200
-4 2,4 -0,9 0,3-0,5
[1, 2] [5, 6] [5, 61 [5, 6]
Растворимость Сг в (Та) при эвтектической температуре 1965 °C
достигает ~27 % (ат.) и снижается с понижением температуры до
значений ~13; ~8,8 и 5,5 % (ат.) при 1600, 1400 и 1200 °C соответ-
ственно (5, 6].
Кристаллическая структура соединений приведена в табл. 72.
Таблица 7 1. Нонвариантные реакции в системе Сг—Та
Реакция Содержание Та в фазах, % (ат.) Темпера- тура, °C Источ- ник
Ж - (Cr) + Cr2Ta(J3T) -13; -4; -30 1760 181
10,5; - - 1760 1П
13; 1760 [2]
13; - 1700 13, 5]
186
С г—Та
Реакция Содержание Та в фазах, % (ат.) Темпера- тура, °C Истом ! ник ;
Ж - Cr2Ta(BT) + (Та) 50т4; -38; -73 1965 г20 [1, 2, 5. ' 8]
Cr2Ta(BT) + (Та) « Cr2Ta(HT) -35; -84; -36 1695 181
Cr2Ta(BT) - (Cr) + Cr2Ta(HT) ~31,5; -3; -33 1660 [8]
Таблица 7 2. Кристаллическая структура соединений системы Сг—Та
Соедине- ние Прото- тип Символ Пир- сона, пр.гр. Параметры решет- ки, нм Примечание (
а С
Сг2Та(ВТ) MgZn2 API 2, Р63/ ттс 0,491 0,805 В богатой Сг облас- j ти [1]
0,498 0,816 В богатой Та облас- ти [ 1 ]
0,494 0,810 [4, 9] ;
Сг2Та(НТ) MgCu2 cF24, Fd3m 0,697(3) — [4] >
0,694 — В богатой Сг облас- ти 12]
0,700 — В богатой Та облас- ти [2]
Сг2Та3 MgNi2 hP24, Рв^/ттс 0,4963 1,626 [2]
Литература
1. Rudy Е. // Techn. Rep. AFML TR 65-2. 1969. N 3. P. 137-141.
2. Кочержинский Ю.А., Петьков B.B., Шишкин Е.А. // Металлофизика. 1973
№ 46. С. 75-80.
3. Kubaschewski О., Speidel Н. // J. Inst. Met. 1948—1949. V. 75. Р. 417—430.
4. Duwez Р., Martens Н. // Trans. AIME. 1952. V. 194. Р. 72-747
5 Григорьев А.Т., Гусева Л.Н., Соколовская Е.М., Максимова М.В. // Журна.
неорганической химии. 1959. Т. 4. № 9. С. 984.
6. Auld J.H., Ryan N.E. // J. Less-Common Met. 1961. V. 3. P. 221-225.
7. Gebhardt E., Rexer J, // Z. Metallkunde. 1967. Bd. 58. S. 611-616.
8. Venkatraman M., Neumann J.P. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 2
P. 112-116.
9. Elliott R.P., Rostoker W. // Trans. ASM. 1958. V. 50. P. 617-633.
КБ. Поваром
Cr-Tb
187
Cr—Tb. ХРОМ—ТЕРБИЙ
Диаграмма состояния Cr—ТЬ построена по данным микрострук-
турного, рентгеновского, термического анализов и измерений твер-
дости сплавов, выплавленных в дуговой печи из Сг и ТЬ чистотой
; 99,98 и 99,7 % (по массе) соответственно [1,2] (рис. 95). Система
характеризуется наличием области несмешиваемости в жидком
! состоянии. Монотектическая реакция протекает при температуре
1800 °C и содержании 0,9 % (ат.) ТЬ [2]. Промежуточные фазы в
системе отсутствуют. Эвтектика кристаллизуется при температуре
1165 °C и содержании ~86 % (ат.) ТЬ. Сг понижает температуру
полиморфного превращения ТЬ до температуры эвтектоидной реак-
ции 1045 °C при содержании ~94 % (ат.) ТЬ [1]. Растворимость ТЬ
I в (Сг) при температуре монотектики получена экстраполяцией и
S составляет 0,48 % (ат.). Растворимость при других температурах
, приведена ниже:
Температура, °C...........................
Растворимость ТЬ, % (ат.).................
1700 1600 1400
0,20 0,12 0,10
Термодинамический расчет диаграммы, проведенный в работе [3],
подтвердил характер взаимодействия компонентов в системе Сг—ТЬ.
рис. 95. Сг-ть
188
С г—Тс
Литература
1. Свечников В.Н., Кобзенко Г.Ф.,
№ 33. С. 93-95.
2. Свечников В.Н., Кобзенко Г.Ф.,
№ 59. С. 77-83.
3, Иванченко В.Г.. Кобзенко Г.Ф..
№ 75. С. 98-102.
Сг—Тс. ХРОМ-ТЕХНЕЦИЙ
Иванченко В.Г. // Металлофизика. 1 97 |
Иванченко В.Г. // Металлофизика. 197
Свечников В.Н. // Металлофизика. 19',<>
К. Б. Поваро, -.:
Экспериментально диаграмма состояния Сг—Тс не построен;!
Гипотетический вариант диаграммы приведен на рис. 96 согласно
работе [1]. При этом авторы исходили из предположения, что диаг-
рамма Сг—Тс должна быть подобна диаграмме Cr—Re.
Рис. 96. Сг—Тс
Известно соединение СгТс2 (о фаза), которое найдено в сплавах,
содержащих 60 и 75 % (ат.) Тс [2]. Это соединение имеет структур
типа CrFc (символ Пирсона (РЗО, пр.гр. тпт), параметры ре
шетки для сплава с 60 % (ат.) Тс составляют а = 0,9217 нм, с -
= 0,4803 нм, а для сплава с 75 % (ат.) Тс — а = 0,9290 нм, с
= 0,4803 нм.
Литература
1 . Venkatraman М., Neumann J.P. // Bull. Alloy Phase Diagrams. 1986. V. 7. 6
P. 573-574.
2 Derby J.B., Lam J.R., Lam D.J. et. al. 11 J. Less-Common Met 1962. V. 4
P. 558-563.
КБ. Поваров.'
Cr-Те. ХРОМ-ТЕЛЛУР
О взаимодействии Сг с Те сообщается в справочниках [X, Э,
III]. Диаграмма состояния Сг—Те, построенная в работе [1] в
интервале концентраций 25—100 % (ат.) Те по данным дифферен-
циального термического и рентгеновского анализов, приведена на
рис. 97. Исходными материалами служили Сг и Те чистотой 99,997
и 99,99 % (по массе) соответственно, образцы запаивались в вакуу-
мированные кварцевые тигли. Диаграмма состояния имеет сложное
строение. В области концентраций 52,5—61,5 % (ат.) Те существует
четыре соединения Сг1хТе, Сг3Те4, Сг5Те8 и Сг2Те3. Кроме того,
при концентрациях свыше 70 % (ат.) Те предполагается существова-
ние еще двух соединений СгТе3 и Сг3Те7.
Те, ’А (по массе)
Рис. 97. Сг—Те
Соединение Сг, хТе имеет область гомогенности, которая при
температуре 952 °C простирается от 51,3 до 53,4 % (ат.) Те. Соеди-
нение Сг3Те4 существует в двух модификациях. Высокотемператур-
ная модификация рСг3Те4 имеет широкую область гомогенности,
которая при температуре 952 °C простирается от 53,5 до 59,3 % (ат.)
190
Cr-Те
Те. При температуре 635 тЗ °C высокотемпературная модификация
переходит в низкотемпературную модификацию аСг3Те4, которая
стабильна в интервале 56,4 и 59,2 % (ат.) Те. Соединение Cr5Tefj
существует также в двух модификациях: моноклинной (рСг5Те8) и
тригональной (аСг5Те8). При стехиометрическом составе 61,54 %
(ат.) Те рСг5Те8 стабильна при низкой температуре. Закалка от
-800 °C приводит к образованию модификации аСг5Те8, которая
при низкой температуре содержит несколько большее количество
Тс — 62 % (ат.). Соединение СгТе3 образуется по перитектической
реакции при температуре 480тЗ °C, а соединение Сг3Те7 — по пери
тектоидной реакции при температуре 461 т2 °C и содержании 70 %
(ат.) Те.
В системе Сг—Те существует область несмешиваемости в жид-
ком состоянии и протекают две эвтектические реакции со сторо
ны Сг и со стороны Те. Температура монотектической реакции
составляет 1215т4 °C, состав монотектической точки лежит при
-47,5 % (ат.) Те.
Эвтектические реакции приведены ниже:
Ж * (Сг) + Сг(.хТе при 1181 °C и -10 % (ат.) Те;
Ж « СгТе3 + (Те) при 445 т! °C и -100 % (ат.) Те.
Характер превращений в твердом состоянии в области концентра-
ций 52,5—61,5 % (ат.) Те при высоких температурах точно не уста-
новлен. Предполагается два варианта строения этой части системы.
По первой версии все фазы, находящиеся в этой области концентра-
ций, переходят в высокотемпературную фазу, обозначенную как у'
(см. вставку 1 на рис. 97), которая плавится конгруэнтно при темпе-
ратуре 1292т5 °C и содержании 55 % (ат.) Те. В твердом состоянии
по кривой с максимумом вблизи температуры 1352 °C у' фаза пере-
ходит в высокотемпературную модификацию рСг3Те4 или рСг5Те8,
обозначенную как у на вставке 1 (см. рис. 97). В этом случае реак-
ция при температуре 1204т2 °C будет соответствовать кататектичес-
кой реакции у' * Ж + Сг1д.Те. По другой версии превращение при
1204 °C связано с переходами второго рода, когда фаза Cr1<vTe с
гексагональной структурой переходит в фазу с моноклинной структу-
рой, обозначенной у на вставке 2 (см. рис. 97). При этом фазой с
моноклинной структурой может быть рСг3Те4 или рСг5Те8. Между
фазами Сг1хТе и рСг3Те4 не было обнаружено двухфазной области,
тогда как между рСг3Тс4 и рСг5Те8 имеется узкая двухфазная
область.
Кристаллическая структура соединений по данным работы [1]
приведена в табл. 73.
Сг—Те
191
Таблица 7 3. Кристаллическая структура соединений системы Сг—Те
Примечание При концентрации 52,5 % (ат.) Те, Закалка от 1152 °C При концентрации 53,4 % (ат.) Те. Закалка от 1152 °C При концентрации 55,4 % (ат.) Те. Закалка от 802 °C. Р - 90,72 (2) ° При концентрации 57,5 % (ат.) Те. Закалка от 802 °C. Р - 91,10 (3)’ При концентрации 59,2 % (ат.) Те. Закалка от 402 °C. Р - 90,83 (3)° При концентрации 60 % (ат.) Те. Закалка от 402 °C При концентрации 59,6 % (ат.) Те. Закалка от 802 °C. Р - 90,46 (3)° При концентрации 61,5 % (ат.) Те. Закалка от 402 °C. Р - 90,36 (3)° При концентрации 62,0 % (ат.) Те. Закалка от 402 °C |р - 118,4°
| Параметры решетки, нм | 0,6261 (3) 0,6247(2) 1,2400(4) 1,2318(4) S о гч сч 1,2062(3) 1,2115(3) 1,1994(3) 1,2002(4) in < нм
о 1 1 0,3968(1) 0,3930(1) о© сь m о 1 0,7838(2) 0,7836(2) 1 гч гч •и»
а 0,4020(3) 0,4007(2) 0,6908(2) 0,6866(2) F—< гч □о о 0,6811(1) 1,3614(4) 1,3530(3) 0,7810(4) □0 0© о
Символ Пирсо- на, пр.гр. g g а, 5 тС 14, С2/т |сп o' гч g G Г |<П а, Г гТ а, Г
Прототип з Z 1А tn и и? и оо и 1 1 Моноклинная сингония.
Соединение 0J и оГ ь СП и сп и оо Н «о и б а аГ Н и
192
Cr-Th
Cr-Ti
193
Литература
1. Ipser H., Komarek K., Klepp K.O. // J. Uss-Common Met. 1983. V. 92 N >
P. 265-282.
H.P. Бочвар, К.Б. Поваров.,
Cr-Th. ХРОМ—ТОРИЙ
На основании обобщения литературных данных в работе [ 11
предлагается вариант диаграммы, показанной на рис. 98. Эвтектик,
между (Сг) и (Th) образуется при температуре 1235 °C и содержание
-75 % (ат.) Th. Природа нонвариантного равновесия при 1360 °C нг
установлена. Расчет диаграммы состояния Cr—Th с использованием
модели идеальных растворов для описания жидкой фазы показал, чте
эвтектическая температура должна составлять 994 °C, а концентра
ция Th в эвтектике — 53 % (ат.) Th [1]. Взаимная растворимость
компонентов в твердом состоянии незначительна [X, 1].
Литература
1. Venkatraman М., Neumann J.P. // Bull. Alloy Phase Diagrams. 1985. V. 6. \
P. 423-425.
К.Б. Повар
Cr—Ti. ХРОМ—ТИТАН
Диаграмма состояния Cr—Ti проанализирована и построена на
основании результатов исследований [1—6] в работе [5]. Диаграмма
приведена в справочнике [М] и воспроизведена на рис. 99. В жидком
состоянии Сг и Ti неограничено растворимы друг в друге. При пони-
жении температуры сплавы кристаллизуются с образованием непре-
рывного ряда твердых растворов (0Ti, Сг). На кривых солидуса и
ликвидуса существует минимум при температуре 1410 °C и содер-
жании 44 % (ат.) Ст. Основные превращения имеют место в твердом
состоянии. Вблизи состава TiCr2 образуются промежуточные фазы со
структурой фаз Лавеса. Высокотемпературная модификация yTiCr2
образуется конгруэнтно из (0Ti, Ст) при 1370 °C. При температурах
ниже 1270—1275 °C эта модификация переходит в среднетемператур-
ную модификацию pTiCr2. Интервал гомогенности фазы pTiCr2
составляет 64—66 % (ат.) Сг при температуре 1220 °C. Низкотемпе-
ратурная модификация aTiCr2 образуется по перитектоидной реак-
ции из pTiCr2 и (pTi, Ст) при температуре -1220 °C и имеет интер-
вал гомогенности в пределах 63—65 % (ат.) Ст.
В системе протекают две эвтектоидные реакции распада твердого
раствора (pTi, Сг) и соединения pTiCr2:
Ti Grt °/о (am ) С г
рис. 99. Cr-Ti
7
Зак. 2144
194
Cr-Ti
(PTi, Cr) - (aTi) + aTiCr2 при 667т10 °C и 13,5т0,5 % (ат.) Сг:
РТ1Сг2 - aTiCr2 + (pTi, Сг) при -800 °C.
Согласно расчету, проведенному в работе [7], эвтектоид (aTi) +
+ aTiCr2 содержит 7,3 % (ат.) Сг и образуется при 737 °C. Согласно
расчету, проведенному в работе [8], в системе протекает еще одна
эвтектоидная реакция при 390 °C: aTiCr2 « (aTi) + (pTi, Сг), Кроме
того, авторы работы [8] предположили существование области несме-
шиваемости в твердом состоянии, при этом максимальная темпера-
тура расслаивания составила 708 °C.
Растворимость Сг в (aTi) приведена ниже [9]:
Температура, °C................. -670 650 500 450
Растворимость Сг, % (ат.)....... 0,42-0,56 0,4-0,6 0,3—0,5 0,2—0,5
По расчетным данным работы 17] растворимость Сг в (aTi) при
температуре 737 °C составляет 0,23 % (ат.). Результаты измерения
электросопротивления, приведенные в работе [10], указывают на
ретроградный характер кривой растворимости Сг в (aTi): при 720 °C
растворимость составляет 0,336 % (ат.), а при 675 °C — 0,304 %
(ат.). Растворимость Ti в (Сг) составляет -15,5; 8 и 4 % (ат.) при
1300, 1200 и 1000 °C соответственно [4, 5].
Кристаллическая структура стабильных фаз приведена в табл. 74.
Таблица 74. Кристаллическая структура фаз системы Cr—Ti
Фаза Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Примеча- ние
a с
yTiCr2 MgNi2 ЛР24, Pf>3/mmc — — [5]
PTiCr2 MgZn2 hP\2, P63/mmc 0,4932 0,7961 [П]
aTiCr2 MgCu2 cF24, Fd3m 0,6943 0,691 [21
При кон- центрации Сг, % (ат.):
Р (Ti, Cr) W cI2, Jm3m 0,3233 — Ю [5]
0,3197 — 20 [5]
0,3156 — 30 [5]
0,3118 — 40 [5]
0,3096 — 45 [5]
0,2980 — 80 [5]
0,2913 — 90 [5]
Cr—Гт
195
При закалке в богатых Ti сплавах образуются метастабильныс
фазы: мартенсит (а') с плотноупакованной гексагональной структу-
рой (в сплавах с 3,7—9,7 % (ат.) Сг) и фаза ш (в сплавах с 3—10 %
(ат.) Сг) [13]. При этом фаза со сохраняется в структуре сплавов и
после низкотемпературного старения при 300 “С [14]. Фаза со имеет
гексагональную структуру (пр.гр. P3ml), а = 0,4616 нм, с =
да 0,2827 нм [13]. Параметры решетки фазы а' в зависимости от
содержания Сг приведены ниже [5]:
Сг, % (ат.)..........................................
а, нм.................................................
с, нм................................................
0,5 1,1 3,0 4,8 5,1
0,2943 0,2942 0,2939 0,2936 0,293
0,4673 0.4662 0,4628 0,4596 0,465
Литература
1. Cuff F.B., Grant N.J., Floe C.F. // Trans. AIME. 1952. V. 194. P. 848-853.
2. Duwes P„ Taylor J.L. // Trans. ASM. 1952. V. 44. P. 495-513.
3. Levinger B.W. // Trans AIME. 1953. V. 197. P. 196.
4. Свечников B.H., Кочержинский Ю.А., Кобзенко Г.Ф., Пан B.M. // Металло-
физика. 1974. № 52. С. 3—10.
5. Murray J.L. 11 Bull. Alloy Phase Diagrams. 1981. V. 2. N 2. P. 174—181.
6. Минаева C.A., Будберг П.Б., Гавзе А.П. // Изв. АН СССР. Металлы, 1971.
№ 4. С. 205-209.
7. Repiska L., Lfvrin А. // Kovove Mater. 1985. V. 23. N 6. P. 664—675.
8. Молоканов B.B., Будберг П.Б., Алисова С.П. // Доклады АН СССР. 1975.
Т. 223. № 5. С. 1184-1186.
9. Михеев В.С., Алексашин В.С. // Физика металлов и металловедение. 1962.
Т. 14. № 2. С. 231-236.
10. Faudot F., Bigot J. // Titanium: Sci. and Technol. Proc. 5th Int. Conf. Munich.:
Oberwisel. Sept 10—14. 1984. V. 3. P. 1445—1449.
11. Farrar P.A., Margolin H. // Trans. AIME. 1963. V. 227. N 6. P. 1342-1345.
12. Hickman B.S. 11 Trans. AIME. 1969. V. 245. N 6. P. 1329-1335.
13. Ikawa H., Shin S., Morikawa M. // Yosetsu Gakkai-Shi. 1972. V. 41. N 4.
P. 394—102.
14 Багаряцкий Ю.А., Носова Г.И, // Кристаллография. 1958. Т. 3. № 1.
С. 17-28.
В.П. Полякова
Сг—Тт. ХРОМ-ТУЛИЙ
Диаграмма состояния Cr—Тт построена в работе [1] по данным
металлографического, рентгеновского и дифференциального терми-
ческого анализов. Сплавы выплавлены в дуговой печи в атмосфере
очищенного Аг из Сг и Тт чистотой 99,98 и 99,7 % (по массе)
соответственно. Система характеризуется наличием области несме-
шиваемости в жидком состоянии и отсутствием промежуточных фаз.
Расслоение в жидкости наблюдается для сплавов, содержащих от ~7
до 25 % (ат.) Тт при температуре выше температуры монотектики,
которая составляет 1750т50 °C. При температуре -1230 °C и содер-
7*
196
Cr-Tm
Cr Tm,°/«(arn) Тт
Рис. 100. Cr-Tm
жании -71 % (ат.) Тт в системе кристаллизуется эвтектика. Расчет-
ная диаграмма, приведенная в работе [2] с использованием данных
по теплоте смешения элементов в жидком состоянии, указывает на
смещение области расслаивания в сторону увеличения содержания
Тт. На рис. 100 приведена диаграмма состояния Cr—Тт с учетом
данных работ [ 1, 2].
Растворимость Тт в (Сг) при 1260 °C составляет более 0,01 и
менее 0,03 % (ат.) [Ш].
Литература
1. Свечников В.Н., Кобзенко Г.Ф., Иванченко В.Г. // Структура фаз, фазовые
превращения и диаграммы состояния металлических систем: Сб. статей. М.: Наука,
1974. С. 194-198.
2. Иванченко В.Г., Кобзенко Г.Ф., Свечников В.Н. // Металлофизика. 1979
№ 75. С. 98-102.
К. Б. Поварова
Cr—U
197
Cr—U. ХРОМ-УРАН
Диаграмма состояния Cr—U (рис. 101) построена в работе [1] на
основании обобщения результатов исследований, проведенных в
работах [2—4] методами металлографического, рентгеновского и
термического анализов. Чистота исходных материалов в этих работах
составляла 99,99 и <99,77 % (по массе) для Сг и U соответственно.
Система характеризуется эвтектическим взаимодействием Cr с yU и
протеканием эвтектоидных реакций. Нонвариантные реакции приве-
дены в табл. 75 [1].
и //„(по массе)
Таблица 7 5. Нонвариантные реакции в системе Cr—U
Реакция Содержание U в фазах, % (ат.) Температура, °C
Ж « (Cr) + (YU) 81; -100; 96 860
(yU) « (Cr) + (0U) 98,4; -100; 99 738
(pU) “ (Cr) + (a(J) 99,1; -100; -99,8 630
198
Cr-V
Растворимость Cr в (yU) при эвтектической температуре составляем
-4 % (ат.) [1J, в (QU) при температуре эвтектоидного превращения
----1 % (ат.) [3|, в (aU) — менее 0,1 % (ат.) [3]. Растворимость I
в (Сг) ничтожно мала [1].
Литература
1. Venkatraman М., Neumann J.P. // Bull. Alloy Phase Diagrams. 1985. V. 6. \ 5
P. 425-429.
2. Daane A.H., Wilson A.S. // Trans. AIME. 1955. V. 203. P. 1213-1220.
3. Бадаева T.A., Кузнецова Р.И. // Строение и свойства сплавов урана, тория,
циркония: Сб. статей. М.: Госатомиздат, 1963. С. 87—91.
4. Provow D.M., Fisher R.W. // J. Less-Common Met. 1964. V. 6. P. 313—321.
К.Б. Поварова
Cr-V. ХРОМ-ВАНАДИЙ
Cr и V образуют непрерывный ряд твердых растворов (V, Сг) с
объемно центрированной кубической структурой. Параметр (а)
кристаллической решетки твердого раствора (Cr, V) изменяется со
слабым отклонением от правила Вегарда [ 1 ]. Промежуточные фазы
в системе не обнаружены. Данные различных исследований о поло-
жении линий ликвидуса и солидуса существенно различаются. Это
связано с использованием исходных материалов различной степени
Рис. 102. Cr-V
Cr~W
199
чистоты и трудностями введения поправок на испарение Сг при
измерении температур плавления. Наиболее близкие значения темпе-
ратур ликвидуса и солидуса были получены в работах [1, 2], где для
определения температур использован метод высокотемпературного
дифференциального термического анализа. Авторы работ [1, 2]
установили положение линий ликвидуса и солидуса без наличия
минимума. В работе [3] был сделан расчет диаграммы состояния
Cr—V в приближении регулярных растворов и определено, что кри-
вые ликвидуса и солидуса имеют минимум при температуре 1819 °C
и содержании 55 % (ат.) Сг. В обзоре, проведенном в работе [4],
были учтены все имеющиеся данные по системе Cr—V и указано на
существование минимума при температуре 1768 °C и содержании
70 % (ат.) Сг (рис. 102).
Литература
1. Rudy Е. // Air Fore Materials Laboratory. Ohio: Wright Patterson. AFB, 1969. Part
V. P. 116-117.
2. Кочержинский Ю.А., Василенко В.И. // Изв. АН СССР. Металлы. 1985. № 2.
С. 188-189.
3. Молоканов В.В., Чернов Д.В., Будберг П.Б. // Журнал физической химии.
1977. Т. 51. Вып. 8. С. 2022-2025.
4. Smith J.F., Bailey D.M., Carlson O.N. // Bull. Alloy Phase Diagrams. 1982. V. 2.
N 4. P. 469-473.
В.П. Полякова
Cr-W. ХРОМ-ВОЛЬФРАМ
рис. 103. Cr—W Cr Wf'/.fa/n.) W
200
Cr-Y
Диаграмма состояния Cr—W приведена на рис. 103 по обзору [ i;,
в котором в основном были использованы данные работ [2—4]. Со-
образуют с W при кристаллизации непрерывный ряд твердых раство
ров (Cr, W), который при температуре ниже 1677 °C и содержании
50 % (ат.) W распадается на два твердых раствора (Сг) и (W/
Двухфазная область (Cr) + (W) при температуре 500 °C простирается
от -5 до 95 % (ат.) W. В системе предполагается образование проме-
жуточной фазы при 75 % (ат.) W, состав, область существования и
характер образования которой требуют уточнения [1].
Параметр а объемно центрированной кубической решетки твердо
го раствора (Cr, W) увеличивается от W к Сг с небольшим положи -
тельным отклонением от закона Вегарда при концентрации 30—75 %
(ат.) W.
Литература
1. Nagender S.V., Sriramamurthy А.М., Rama Rao P. // Bull. Alloy Phase Diagrams
1984. V. 5. N 3. P. 289-292.
2. Greenway H.T. // J. Inst. Met. 1951-1952. V. 80. P. 589-592.
3. Margaria T., Allibert C., Ansara I., Driole J. // High Temp.-High Pressures. 1976
V. 8. P. 451—459.
4. Den Broeder F.J.A. // Acta Metall. 1972. V. 20. P. 319-332.
КБ. Поварова
Cr- Y, % (a/п.) Y
Рис. 104. Cr-Y
Cr-Yb
201
I Фазовые равновесия в системе Cr—Y изучались неоднократно, и
Ьх анализ проведен в обзорах [1, 2]. Согласуясь между собой в
Отношении отсутствия в системе Cr—Y промежуточных фаз и нали-
йия незначительной взаимной растворяемости компонентов в твердом
состоянии, данные различных исследований расходятся в определении
общего характера строения системы. Так, согласно работе [3] Сг и
Y полностью смешиваются в жидком состоянии и образуют эвтектику
при кристаллизации. В работах [4, 5 и др.] указывается на существо-
вание области несмешиваемости в жидком состоянии. По данным
работы [4] область несмешиваемости имеет место в интервале кон-
центраций 9,4—58 % (ат.) Y. Температура монотектической реакции
составляет 1760±25 °C [4], или 1780 °C [5]. Эвтектическая реакция
протекает при температуре 1330т25 °C и содержании ~80 % (ат.) Y
[4]. На рис. 104 диаграмма Cr—Y приведена согласно работе [4].
Термодинамический расчет, проведенный в работе [6], подтвердил
характер взаимодействия компонентов, показанный на рис. 104.
Растворимость Y в (Сг) при различных температурах определена
в работе [5] и приведена ниже:
Температура, °C.................... 1780 1700 1600 1400 1200
Растворимость Y, % (ат.)........... 0,44 0,23 0,17 0,14 0,06
Растворимость Сг в (Y) практически отсутствует [2].
Литература
1. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М.:
Наука, 1976. Т. 3. 816 с.
2. Venkatraman М., Neumann J.P. // Bull. Alloy Phase Diagrams. 1985. V. 6. N 5.
P. 429-431.
3. Taylor A., Hickman W.M., Doyle N.J. //J. Ixss-Common Met. V. 9. P. 214—217.
4. Терехова В.Ф., Савицкий E.M. Металловедение редкоземельных металлов. М.:
Наука, 1975. 260 с.
5. Свечников В.Н., Кобзенко Г.Ф., Киреев М.Б., Иванченко В.Г. // Доповад АН
УРСР. 1973. Сер. А. № 2. С. 167-171.
6. Иванченко В.Г., Кобзенко Г.Ф., Свечников В.Н. // Металлофизика. 1979.
№ 75. С. 98-102.
В. П. Полякова
Cr-Yb. ХРОМ—ИТТЕРБИЙ
Диаграмма состояния Cr—Yb (рис. 105) построена по результатам
дифференциального термического, микроструктурного анализов и
измерения микротвердости фаз в работе [1]. В качестве исходных
материалов были использованы Сг чистотой 99,98 % (по массе) и Yb
чистотой >99 % (по массе). В системе наблюдается практически
полная несмешиваемость в жидком и твердом состояниях, что обус-
202
Cr—Zn
Cr Yb,°/O(am.) Yb
Рис. 105. Cr—Yb
ловлено особенностями электронного строения двухвалентного Yb
близкого по своим свойствам к щелочно-земельным металлам. Yb
практически не влияет на изменение температуры плавления Сг. В
работе [2] указывается на получение сплава Сг с 0,3 % (по массе)
Yb методом дуговой плавки.
Литература
1. Свечников В.Н., Кобзенко Г.Ф., Иванченко В.Г. // Доклады АН СССР. 1973
Т. 213. № 5. С. 1062-1064.
2. Вол А.Е., Каган И.К. Строение и свойства двойных металлических систем. М
Наука, 1976. Т. 3. 816 с.
В. П. Полякова
Cr—Zn. ХРОМ-ЦИНК
Полностью диаграмма состояния Cr—Zn не исследована. Участок
диаграммы до 7 % (ат.) Сг приведен на рис. 106 по данным работ
[1—3]. В исследованной части системы идентифицирована одна фаза
6, которая образуется по перитектической реакции при температуре
464 °C и имеет узкий интервал гомогенности -5—6,2 % (ат.) Сг. На
рис. 106 интервал гомогенности фазы 6 не показан. Между фазой и
твердым раствором (Zn) образуется эвтектика при температуре
415 °C и содержании -0,3 % (ат.) Сг.
In Cr, °/o (am.)
Рис. 106, Cr—Zn
В работе [4] сообщается о еще одной фазе у в системе Cr—Zn,
которая обнаружена в сплаве с 7—8 % (ат.) Сг, однако ввиду низкой
чистоты исходного Сг, содержащего 1,5 % (по массе) Fe, существова-
ние этой фазы ставится под сомнение.
Растворимость Сг в (Zn) составляет 0,04 % (ат.) при эвтекти-
ческой температуре [1, 2]; 0,025 и 0,013 % (ат.) — при 375 и 350 “С
соответственно [2]. Растворимость Сг в жидком Zn равна —1,6 %
(ат.) при 464 °C [5]. Рентгеновским анализом образцов, получен-
ных электролитическим осаждением Сг на жидкий цинково-амаль-
гамный электрод с последующей дистилляцией Hg при 360—380 °C,
установлена растворимость Zn в (Сг) при температуре 250 °C, равная
25,5 % (ат.).
В работе [7] Q фазе приписывают формулу CrZn17 (288 атомов на
элементарную ячейку). По данным работы [4] фаза 0 имеет гексаго-
нальную структуру, а = 1,395 нм.
Литература
J. Hanemann G. // Z. Metallkunde. 1940. Bd. 32. S. 91—92.
2. Heumann T. // Z. Metallkunde. 1948. Bd. 39. S. 45-52.
3. Harding A.R., Raynor G.V. // J. Inst. Met. 1951—1952. V. 80. P. 436—439.
4. Lihl F„ Jenitschek J. // Z. Metallkunde. 1954. Bd. 45. S. 686—689.
204
Cr-Zr
5. Добрев P., Димова В., Георгиев И. // Материаловедение и технология Иг ’
Т. 5. С. 40—43.
6. Hollan L., Lecocq Р., Michel А. // Compt. Rend. 1964. V. 258. Р. 3309—331 <<
7. Hartmann Н., Hefmann W., Muller D. 11 Abh. Braunschw. Wiss. Ges. 1955 Bd >
S. 100-106.
К.Б. Повара n
Cr-Zr. ХРОМ—ЦИРКОНИЙ
Фазовые равновесия в системе Cr—Zr изучались многими иссле-
дователями и были обобщены в работе (1], при этом в основном
использованы данные работ [2—7] (рис. 107). Система Cr—Zr
представляет собой диаграмму эвтектического типа с одной промежу-
точной фазой ZrCr2. Соединение ZrCr2 плавится конгруэнтно при
1673 °C, имеет область гомогенности в интервале концентрации
-64—65 % (ат.) Сг и существует в трех модификациях. При темп;'
ратуре -1622 °C высокотемпературная модификация yZrCr2 перехо
дит в среднетемпературную модификацию pZrCr2, причем характер
этого перехода требует уточнения. Температура перехода pZrCr ?
Сг, % (по массе)
Рис. 107. Cr-Zr
Cr-Zr
205
ja»* aZrCr2 (низкотемпературная модификация) изменяется по кривой
максимумом в зависимости от состава. Максимальная температура
Перехода составляет -1592 °C при содержании 67 % (ат.) Сг [1]. В
Системе кристаллизуются две эвтектики, имеют место две эвтектоид-
ные реакции и одна каталектическая реакция. Нонвариантные реак-
щи приведены в табл. 76 [1].
Максимальная растворимость Сг в (pZr) составляет около 8 %
ат.) при температуре 1332 °C и снижается до 1,65 % (ат.) при
эвтектоидной температуре. Максимальная растворимость Сг в (aZr)
lie превышает 0,49 % (ат.) [1]. Кристаллическая структура соедине-
ний приведена в табл. 77.
; Закалкой могут быть получены метастбильные фазы: мартенсит
а' с гексагональной плотноупакованной структурой в сплавах с
<3,3 % (ат.) Cr [1, 8] и фаза со в сплавах с большим содержанием
Сг с гексагональной структурой, а = 0,502 нм, с = 0,312 нм [8].
Также могут быть получены аморфные сплавы с содержанием Сг
-30 % (ат.).
Таблица 7 6. Нонвариантные реакции в системе Cr—Zr
Реакция Содержание Cr в фазах, % (ат.) Температура, °C
Ж - (₽Zr) + aZrCr2 -22; ~8; -64 1332
Ж - aZrCr2 + (Cr) -82; -69; -0,6 1592
(₽Zr) - (aZr) + aZrCr2 1,65; -0,49; -64 836
pZrCr2 в aZrCr2 + (Cr) -69; -69; -0,6 1532
pZrCr2 •* Ж + aZrCr2 -64; -42; -65 1562
Таблица 7 7. Кристаллическая структура соединений системы Cr—Zr
Соеди- нение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а с
При концентра- ции Сг, % (ат.):
yZrCr2 MgZn2 hP\2, Р63/ттс 0,5079 0,8262 66,5 [X]
0,5089 0,8269 66,4 [3]
0,5100 0,8305 67 [4]
0,5107 0,8290 66,47 [7}
PZrCr2 MgNi2 hP24, Р6А/ттс 0,5100 1,612 При концентра- ции Сг, % (ат.), 67 [4]
206
Cs—Си, Cs—Fe
Соеди- нение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Примеча),'),
а с
aZrCr2 MgCu2 cF24, Fdlm 0,7207 0,7218— 0,7194 0,7211 — При конценгру. ции Сг, % <аг . [XI 64-69 [4j 66,47 [7]
Литература
1. Arias D„ Abriata J.P. // Bull. Alloy Phase Diagrams. 1986. V. 7. X 1
P. 237-243.
2. Будберг П.Б., Алисова С.П., Мусаев P.C. 11 Изв. АН СССР. Металлы. 1%8.
№ 3. C. 222-223.
3. Свечников B.H., Спектор А.Ц. // Изв. АН СССР. Металлы. 1971. № 4. С. 20’.
4. Петьков В.В., Прима С.Б., Третьяченко Л.А., Кочержинский Ю.А. // Металло-
физика. 1973. № 46. С. 80.
5. Rumball W.M., Elder F.G. И J. Less-Common Met. 1969. V. 19. N 4. P. 345-358
6. Rumball W.M. // J. Less-Common Met. 1974. V. 38. N 2-3. P. 233-237.
7 Imoto H., Sasaki M., Saito T., Sasaku Y. // Bull. Chem. Soc. Jap. 1980. V. : 1
P. 1584-1590.
8. Keys L.H., Johnson G., Nalin A.S. // J. Nucl. Mater. 1976. V. 59. P. 137.
9. Tenhover M., Johnson W.L. // Phys. Rev. B. Condens. Mater. 1983. V ?'
P. 1610.
К.Б. Uoeapoi, f
Cs—Си. ЦЕЗИЙ-МЕДЬ
Диаграмма состояния Cs—Си не построена. Исходя из соотноше
ния атомных радиусов Си и Cs следует ожидать их предельно малок
растворимости в твердом состоянии и практически полной несмеши-
ваемости в жидком состоянии. Образование соединений в системе н.
установлено [1].
Литература
1. Kienast G., Verma J. // Z. Anorg. All. Chem. 1961. Bd. 310. Nl.S. 143-169.
H.P. Бочва;'
Cs—Fe. ЦЕЗИЙ-ЖЕЛЕЗО
Cs и Fe полностью не смешиваются в жидком и твердом состояни-
ях [X].
Л. Л. Зусмаь
CS’^jQ
207
Cs—Ga. ЦЕЗИЙ-ГАЛЛИЙ
Исследования по диаграмме состояния Cs—Ga обобщены в работе
[1], в которой подробно проанализированы все имеющиеся работы
[2—7] и предложен вариант диаграммы, приведенный на рис. 108.
, В работах [3—5] использованы методы дифференциального терми-
ческого и рентгенографического анализов, а также прямой калори-
метрии с применением материалов Ga чистотой 99,999 % (по массе)
и Cs чистотой 99,9 % (по массе). Установлено, что Cs и Ga в жид-
ком состоянии не смешиваются в интервале концентрации -25—98 %
(ат.) Cs [5]. Температура монотектической реакции соответствует
гемйературе 625 °C [1].
В системе установлены три соединения Ga7Cs, Ga3Cs, Ga8Cs5.
Соединение Ga7Cs, описанное впервые в работах [3, 4] как
Ga^Cs, образуется по перитектической реакции при температуре
426 °C [3, 4].
Соединение Ga3Cs, установленное в работе [6], образуется по
перитектической реакции [1]. Температура его образования, взятая
равной 600т2 °C, определена в работе [5]. В работе [6] предполагает-
ся, что это соединение имеет область гомогенности 25—42 % (ат.) Cs.
208
Cs—Ge
Соединение Ga^Cs5 точно не установлено. В работе [4] указано,
что соединение, образующееся при взаимодействии двух жидкостей,
имеет формулу Ga2Cs, которая впоследствии не была подтвер-
ждена [71.
Кристаллическая структура соединений приведена в табл. 78.
Таблица 78. Кристаллическая структура соединений системы Cs—Ga
Соедине- ние Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм Примечание j
а Ь С
Ga7Cs — AR16, R3m 0,6620 — 2,9045 [61 ! I
При концен- | грации Cs, i (ат.): .’
Ga3Cs Ga3Rb /724, /4 ml 0,6400 — 1,5314 40 [6] ;
0,639(1) — 1,5287(1) 42 [6] j
Ga8Cs5 — — 0,564 0,984 0,590 33,3 [4] 1
Литература
1. Pelton A.D., Larose S. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 4
P. 340-343.
2. Thummel R., Klemm W. // Z. Anorg. All. Chem. 1970. Bd. 376. N 1. S. 44-63
3. Яценко С.П., Чунтонов K.A., Алямовскнй С.И., Диева Э.Н. // Общие законе
мерности в строении диаграмм состояния металлических систем: Сб. статей. М.: Наска
1973. С. 55-59.
4. Яценко С.П., Чунтонов К.А. // Изв. АН СССР. Металлы. 1973. № 6
С. 182-187.
5. Бушманов В.Д., Яценко С.П. // Изв. АН СССР. Металлы. 1981. № 5
С. 202-204.
6. Van Vucht J.H.N. // J. Less-Common Met. 1985. V. 108. NLP. 163—175.
7. Chuntonov K.A., Mclekhov L.Z., Kuznetsov A.N. et al. // J. Less-Common Met
1982. V. 83. P. 143-153.
It.II. Полякова
Cs—Ge. ЦЕЗИЙ—ГЕРМАНИЙ
Сплавы системы Cs—Ge исследованы методами дифференциально-
го термического, рентгенографического анализов в работах [1, 2|.
а также методами термомагнитного анализа и направленного затвер-
девания в работе [11.
Диаграмма состояния Cs—Ge (рис. 109) приведена на основе
анализа экспериментальных работ [1, 2]. Система характеризуется
образованием широкой области несмешиваемости в жидком состоя-
нии, простирающейся от ~50 до -100 % (ат.) Cs. Монотектичсская
Cs—Ge
209
Cs (am.) Ke
Рис. 109. Cs—Ge
температура составляет 661 тЗ °C, критическая температура купола
расслаивания находится около 830 °C [2].
В интервале концентраций 0—50 % (ат.) Cs в системе конгруэнтно
образуются две промежуточные фазы CsGe и CsGe4 при температу-
рах 820 и 990 °C соответственно [1]. В системе установлено два
эвтектических равновесия [1]:
Ж * (Ge) + CsGe4 при 735 °C и -94 % (ат.) Ge;
Ж * CsGe4 + CsGe при 650 °C и -63 % (ат.) Ge.
Эквиатомное соединение GeCs относится к кубической сингонии
(32 формульные единицы на элементарную ячейку, пр.гр. Р43п),
параметр решетки а = 1,367 нм [3]. Соединение CsGe4 также отно-
сится к кубической сингонии (пр.гр. РтЗп), параметр решетки а =
= 0,658 нм [4].
Литература
1. Дриц М.Е., Потемкин В.Ф., Зусман Л.Л. // Изв. АН СССР. Неорганические
материалы. 1982. Т. 18. № 7. С. 1148-1150.
2. Орлов А.Н., Чунтонов К.А., Мелехов Л.З., Семянников А.А. // Изв. АН СССР.
Металлы. 1987. № 6. С. 172-173.
3. Busmann Е. // Z. Anorg. All. Chem. 1961. Bd. 313. N 1. S. 90—106.
4. Дриц M.E., Зусман Л.Л., Потемкин В.Ф., Сизов Р.А. // Изв. АН СССР.
Металлы. 1987. № 4. С. 185-187.
В. П. Полякова
210
Cs—JI, Cs-Hf
Cs—H. ЦЕЗИЙ-ВОДОРОД
Взаимодействие Cs с H исследовано сравнительно мало. При
химическом взаимодействии Н с жидким или газообразным Cs обра-
зуется твердый гидрид CsH со структурой типа NaCl (символ Пирсо
на cF$, пр.гр. Fm3m), параметр решетки а которого составляв
0,6389 нм [Э, Ш] или 0,6376 нм [1]. Соединение CsH наименее,
устойчиво из гидридов щелочных металлов. Упругость диссоциации
CsH в интервале температур 240—440 °C приведена ниже:
Температу- 245,5 266 289 308 349,5 377,5 440
ра, °C....
Давление, ЗДхЮ-4 9,0х10~4 2,6хЮ"3 5,8*10_3 2,6х10~2 6,8хЮ-2 1,0*10~!
На........
Эмпирическое выражение упругости диссоциации имеет вид
1g (/7X133,32) = —3475,5/7° + 7,50 [1], где р — давление, Па; Т -
температура, К. Измерена растворимость Н в жидком Cs в интервале
температур 230—400 °C. Зависимости концентрации насыщенич
раствора Н в Cs и давления Н над насыщенным раствором от темпе
ратуры могут быть описаны уравнениями [2]:
1g (хх 104) = 3,46 - 900/7°;
1g (рх133,32) = 4,88 - 1800/Т,
где х — концентрация Н, % (по массе); р — давление, Па; Т -
температура. К.
Литература
1. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967- 74 с.
2. Арнольдов М.Н., Богданов Ю.Б., Ивановский М.М., Морозов В.А. // Изв А!!
СССР. Металлы. 1976. № 4. С. 30-32.
13. IT. Поляков
Cs-Hf. ЦЕЗИЙ-ГАФНИЙ
Экспериментально диаграмма состояния Cs—Hf не построена. Не
аналогии с известными системами Hf, Ti и Zr со щелочными метал
лами следует ожидать, что Cs и Hf не взаимодействуют друг с другом
ни в жидком, ни в твердом состояниях. Предполагаемая диаграмм,
состояния Cs—Hf приведена на рис. ПО [1].
Cs-Hg
21 1
Hf
Cs
Рис. 110. Cs-Hf
Литература
1. Balt C.W. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 1. P. 43—44.
В.П. Полякова
Cs-Hg. ЦЕЗИЙ-РТУТЬ
Диаграмма состояния Cs—Hg изучена методами дифференциально-
го термического анализа и измерения магнитных свойств сплавов и
приведена на рис. 111 по справочнику [X].
В системе Cs—Hg предполагается существование шести химичес-
ких соединений. Из них три соединения CsHg2, CsHg4 и CsHg6
плавятся конгруэнтно при температурах соответственно 208, 164 и
158 °C, причем CsHg6 имеет некоторый интервал гомогенности.
Соединения CsHg, Cs3Hg4 и CsHg12 образуются по перитектическим
реакциям при температурах -130, 171 и —12 °C соответственно. В
системе наблюдаются четыре эвтектические реакции:
Ж * (Cs) + CsHg при 16 °C и 2 % (ат.) Hg;
Ж * aCsHg2 + CsHg4 при 140 °C и 75,8 % (ат.) Hg;
Ж * CsHg4 + CsHg5 при 152 °C и 82 % (ат.) Hg;
Ж CsHgI2 + (Hg) при —46 °C и 98 % (ат.) Hg.
212
Cs—In
Рис. 111. Cs—Hg
Установлено, что растворимость Cs в Hg при температуре 18 (
составляет 6,48 % (ат.) [Э].
Кристаллическая структура промежуточных фаз не установлена
Л. Л- Зус.-»
Cs—In. ЦЕЗИЙ-ИНДИЙ
Диаграмма состояния Cs—In изучена методами дифференциалы»’
го термического, рентгеновского и магнетохимического анализов ’
работах [1, 2J и приведена на рис. 112 поданным работы [1]. Уст а
новлено, что в системе существует широкая область несмешиваемсс
ти в жидком состоянии протяженностью от -10 до -60 % (ат.) In
Монотектическая температура равна 570 °C, а максимальная темь
ратура купола расслаивания находится около 730 °C.
В системе установлено образование двух промежуточных фаз i!
2]. Соединение Csln4, содержащее 79,9 % (ат.) In, образуется
перитектической реакции при температуре 482 °C [1, 2]. Соединение
Cs2In3, содержащее 59,9т0,6 % (ат.) In, образуется также по пери
тектической реакции при температуре 570 °C [ 1 ]. В работе *' i
вместо соединения Cs2In3 указано соединение Cs5In8, которое пл -
Cs !n, °C* lam.) In
Рис. 112. Cs—In
вится конгруэнтно при 569 °C. Отмечается, что со стороны Cs и In
кристаллизуются эвтектики при температурах, близких к темпера-
турам плавления чистых компонентов. Растворимость Cs и In друг в
друге в твердом состоянии практически отсутствует. Кристаллическая
структура соединений и параметры их решеток приведены в работе
[1]. Структура Csln4 определена как тетрагональная с параметрами
решетки а = 0,7089 нм; с - 0,6693 нм, структура Cs2In3 определена
ромбической с параметрами решетки а - 0,6805 нм, b - 0,6965 нм,
с = 1,640 нм. Исследования, проведенные на монокристаллах соеди-
нений, позволили авторам работы |3| уточнить формулу и кристал-
лическую структуру наиболее богатого In соединения как Csln3 типа
RbGa3 (символ Пирсона //24, пр. гр. /4m2) с шестью формульными
единицами в элементарной ячейке и параметрами решетки а =
а 0,7047 нм, с = 1,6803 нм. Авторы работы |4j считают, что структу-
ра соединения Cs2In3 относится к пространственной группе /4m2 и
имеет четыре формульных единицы в элементарной ячейке, парамет-
ры решетки: а = 0,6910 (3) нм, с = 1,6612 (7) нм.
Литература
1. Chuntonov К.A., Melekhov L.Z., Kuznetsov A.N. et al, // J. Less-Common Met.
1982. V. 83. X 2. P. 143-153.
2. Thummcl R., Klemm W. // Z. Anorg. All. Chem. 1970. V. 376. X 1. S. 44—63.
214
Cs-K
3. Chuntonov K.A., Yatsenko S.P., Hryn Yu.N. etal. // J. Less-Common Met. 19^4
V. 99. N 1. P. 15-21.
4. Yatsenko S.P., Chuntonov K.A., Orlov A.N. et al. // J. Tess-Common Met. 19S5
V. 108. N 2. P. 339-343.
В.П. Поляков,/
Cs-K. ЦЕЗИЙ—КАЛИЙ
Диаграмма состояния Cs—К, приведенная на рис. 113, построена
в работе [11. Исследование проведено методами дифференциального
термического анализа. Сплавы выплавляли с использованием Ч
чистотой 99,97 % (по массе) и Cs чистотой 99,9 % (по массе) в
специальных стеклянных контейнерах в атмосфере Аг. Cs и К по-
лностью смешиваются между собой в жидком и твердом состояниях:.
На кривых ликвидуса и солидуса при температуре —38,05 °C и
концентрации 50,0 % (ат.) К наблюдается минимум. Согласно работ?
[2] при температуре —88 °C образуется соединение CsK2 с гексаго
нальной решеткой, параметры решетки а = 0,932 нм, с = 1,180 им
при —97 °C. При температуре —37 °C симметрия решетки сохраняем
ся, но ее параметры уменьшаются до а = 0,911 нм, с = 1,086 нм. Хотм
в работе [3] установлено существование соединения K7Cs6, однако
в более поздней работе [4] эти данные не подтвердились. В работе
И-? К, °/о ( а /п ) К
Рис. 113. Cs-K
Cs-Li 215
' [5] рассмотрены результаты расчета диаграммы состояния Cs—К для
давления 1 ГПа. По данным расчета, Cs и К полностью смешиваются
в твердом состоянии при любых температурах.
Литература
1. Goates J.R., Ott J.B., Hall Н.Т. // J. Chem. Eng. Data. 1971. V. 16. № 1.
P. 83-85.
2. Schueli U., Steinberg V., Sverbilova T., Voronel A. // J. Phys. Chem Solid. 1981.
V. 42. N 1. P. 16-22.
3. Simon A., Brumer W., Hillenkotter B., Kullmann H.J. // J. Anorg. All. Chem.
,1976. Bd. 417. P. 253-257.
4. Steinberg V., Sverbilova T., Voronel A. //J. Phys. Chem. Solid. 1981. V. 42. N 1.
P. 23-27.
' 5. Soma T., Hosaka K., Kagaya H.-M. // Phys. Status Solidi. 1986. V. 137. N 2.
Kill—KI 14.
В.П. Полякова
Cs-Li. ЦЕЗИЙ-ЛИТИЙ
Методом дифференциального термического анализа установлено,
что Cs и Li не смешиваются ни в жидком, ни в твердом состояниях
[1]. В работе [2] построена диаграмма состояния Cs—Li (рис. 114) и
отмечается небольшая растворимость Cs в жидком Li. Расчет раство-
Cs Li. , °/о (от.) L L
Рис. 114. Cs-Li (р - 0,1 МПа)
216
Cs—Mg
римости проведен rto уравнению Igx = 4,43 — 6594/7, где х — концом
трация Cs, % (ат.); Т — температура, К. Результаты расчета и
эксперимента приведены ниже:
Температура, “С........... 1093 1038 82 760 181
Растворимость Cs, % (ат.):
экспериментальная..... 0,336—0,704 0,159—0,2 0,174—0,179 0,007—0,018
расчетная................ 0,403 0,253 0,151 0,011 10'1
Литература
1. Tanigawa S., Doyama М. // Phys. Status Solidi. (b). 1973. V. 60. N 1. K35-K36
2. Bale C.W. // Bull. Alloy Phase Diagrams. 1989. V. 10. N 3. P. 232-233.
В.П. Полякова
Cs—Mg. ЦЕЗИЙ—МАГНИЙ
Диаграмма состояния Cs—Mg (рис. 115) изучена методами диффс
ренциального термического и рентгеновского анализов в работе [II.
Сплавы Cs с Mg получены в железных тиглях в среде Аг. Диаграмма
состояния Cs—Mg характеризуется широкой областью несмешивае
мости в жидком состоянии. Температура монотектики очень близка
Рис. 115. Cs—Mg
I
Cs—Mo, Cs—N, Cs—Na
217
к температуре плавления Mg. Растворимость Mg в жидком Cs при
монотектической температуре составляет -1,6 % (ат.) и снижается
до -0,08 % (ат.) при эвтектической температуре. Растворимость Cs
в (Mg) по данным расчета, проведенного в работе [2], составляет
-0,2 % (ат.) при монотектической температуре.
Литература
1. Klemm W., Kunze D. // Systems of Alkali and Alkaline Earth Metals. Proc. Int.
Symp. on Alkali Metals. London: Chem. Soc. Special Publ., 1967. N 22. P. 3—22.
2. Pelton A.D. // Bull. Alloy Phase. Diagrams. 1985. V. 6. N 1. P. 37—39.
Л.Л. Зусман
Cs—Mo. ЦЕЗИЙ—МОЛИБДЕН
На основании сопоставления экспериментальных данных и термо-
динамических свойств в работе [1] сделан вывод, что растворимость
Cs в (Мо) при температуре <1372 °C определяется количеством
дефектов в Мо. Растворимость Мо в жидком Cs связана с присутстви-
ем примесей С, N и О [1]. Рассчитано, что растворимость Мо в
жидком Cs возрастает от 8* 10"16 (ат. долей) при 680 °C до 4x10'9 (ат.
долей) при 1372 °C [1].
Литература
1. Brewer L., Lamoreaux R.H. // Atomic Energy Review. Special Issue N 7: Molibde-
num: Physico-Chemical Properties of its Compounds and Alloy. Vienna: International Atomic
Energy Agency, 1980. P. 195—356.
К.Б. Поварова
Cs-N. ЦЕЗИЙ-АЗОТ
Диаграмма состояния Cs—N не построена. Предполагается, что
растворимость N в жидком Cs незначительна [1]. Установлено
существование двух соединений: нитрида Cs3N и азида CsN3 [Э].
Соединение CsN3 получено нагревом CsN в струе азота. Этот нитрид
плавится при 326 °C и разлагается при 390 °C. Соединение CsN3
получено действием NH3 на С2СО3, его температура плавления
равна 314 °C. Азид имеет тетрагональную структуру, параметры
решетки а = 0,646 нм, с = 0,798 нм [Ш].
Литература
1. Barker M.G. // Handbook of Thermodynamic and Transport Properties of Alkali
Metals. Oxford: Blackwell Scientific Publications, 1985. P. 897—899.
Л.Л. Зусман
218
Cs—Nb
Cs—Na. ЦЕЗИЙ-НАТРИЙ
Диаграмма состояния Cs—Na, исследованная методами терми-
ческого и рентгеновского анализов в работах [1, 2], приведена на
рис. 116. Сплавы выплавляли из Cs и Na в вакууме в никелевых
тиглях. Чистота обоих металлов составляла 99,9 % (по массе) [1|.
В системе установлено существование соединения Na2Cs, которое
образуется по перитектической реакции при температуре —7,9 °C.
При температуре —31,83 °C кристаллизуется эвтектика (Cs) + Na2Cs.
Эвтектическая точка расположена при концентрации 20,9 % (ат.)
Na. Взаимная растворимость Cs и Na в твердом состоянии очень
мала. Так, при 23 °C в (Na) растворяется -1,5- 10‘5 % (ат.) Cs [3|.
Литература
1. Ott J.B., Goates J.R., Oyler D.E. И Trans, l-araday Soc. 1971. V. 67. \ 1
P 31-34.
2. Simon A., Ebbinghaus G. // Z. \aturforsch. B. 1972. Bd. 29. S. 616-618.
3. Александров Б.Н., Далакова H.B. // Изв. АН СССР. Металлы. 1982. V' :
С. 133-140.
Cs—О
219
Cs—Nb. ЦЕЗИЙ-НИОБИЙ
В работе [11 указано, что Cs и Nb не смешиваются ни в жидком,
ни в твердом состояниях. Приведенная на рис. 117 диаграмма состоя-
ния Cs—Nb построена в справочнике [М]. В работе [2J рассчитана
энтальпия возможного взаимодействия жидких Cs и Nb, которая
оказалась равной +364 кДж/моль.
С s N b , а/о (arrr ) NЬ
Рис. 117. Cs—Nb (р = 0,1 МПа)
Литература
1. Savitskii Е.М., Efimov Yu.V. // Plansecber. Pulvermetall. 1969. V. 17. P. 103—109.
2. Niessen A.K., de Boer F.R. Boom K„ et al. // Calphad. 1983. N 1. P. 51—70.
Cs—О. ЦЕЗИЙ-КИСЛОРОД 7 '
Взаимодействие Cs с О происходит на воздухе при комнатной
температуре с выделением значительного количества теплоты. Изуче-
ние этого процесса методами термического и рентгеновского анализов
с использованием тщательно очищенного Cs и спектрально чистого
О позволило построить диаграмму состояния Cs—О, приведенную на
Рис. 118 |Э]. В системе установлено четыре соединения: Cs7O, Cs4O,
Cs?O2, CsjO. Соединение Cs7O плавится конгруэнтно при 3 °C и
образует эвтектики с (Cs) при температуре —2 °C и содержании
220
Cs—O
Рис. 118. Cs—О
9,2 % (ат.) О и с Cs4O при температуре —8 °C и содержании 16,4 %
(ат.) О. Три других соединения Cs4O, Cs7O2 и Cs3O образуются п:
перитектическим реакциям при 10, 50 и 170 °C соответственно
Кроме указанных соединений в справочнике [UIJ приведены еще три
соединения, более богатые О: Cs2O3, CsO2, CsO3*Cs2O2. Установлю
но, что два последних соединения плавятся конгруэнтно при -432 г
-590 °C соответственно. Растворимость О в жидком Cs можно рас
считать по уравнению [1] Igx = 1,6188 — 114,8/7°, где х — концентра
ция О, % (ат.); Т — температура, К. В твердом состоянии в (C.v
растворяется незначительное количество О. Кристаллическая струк
тура соединений приведена в табл. 79.
Таблица 7 9. Кристаллическая структура соединений системы Cs—О
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм < ИсТОЧНИУ ।
а Ь С
Cs2O Анти-С<1С12 —, R3m 0,4256 — 1,899 [Э] j
CsO3- Cs2O2* — —, Immm 0,4322 0,7517 0,6430 [Ш] )
CsO2 СаС2 tI6, I4/mmm 0,445 — 0.728 [Ш] 1
Ромбическая сингония. J
Cs—O
221
Литература
1. Knights C.F., Phillips В.А. П J. Nucl. Mat. 1979. V. 84. P. 196-204.
Л.Л. Зусман
Cs—Pb. ЦЕЗИЙ—СВИНЕЦ
Диаграмма состояния Cs—Pb изучена методами дифференциально-
го термического и калориметрического анализов в работах [1, 2] и
приведена на рис. 119. Сплавы Cs с РЬ получали в среде Аг в герме-
тичных ампулах из тантала [1] или коррозионно-стойкой стали [2],
используя Cs чистотой 99,99 % (по массе) и РЬ чистотой 99,999 %
(по массе). В обоих исследованиях [1,2] установлено существование
четырех соединений: CsPb, Cs4Pb5, CsPb2, CsPb,. Из них эквиатом-
ное соединение плавится конгруэнтно при 653 °C, остальные образу-
ются по перитектическим реакциям: Cs4Pl\ при температуре 592 °C,
CsPb2 — при 560 °C, CsPb3 — при 345 °C. В системе кристаллизуются
две эвтектики по реакциям:
Ж * (Pb) + CsPb3 при 313 °C и 10 % (ат.) Cs,
Ж * CsPb + (Cs) при 26 °C и -100 % (ат.) Cs.
Характер кривых ликвидуса в сплавах, богатых Cs, указывает на
возможное расслоение расплавов и протекание монотектической
реакции. Однако отсутствие области несмешиваемости в жидком
состоянии было убедительно показано измерением электросопротив-
ления сплавов, проведенным в работе [3J.
Эквиатомное соединение CsPb имеет структуру типа NaCl (сим-
вол Пирсона /764, пр.гр. I4iacd), параметры решетки а = 1,226 нм,
с = 1,999 нм [3].
Рис. 119. Cs—РЬ
222
Cs—Pr, Cs-Rb
Литература
1 Зусман Л.Л. // Физике механические и теплофизические свойства металлов
Сб. статей. М.: Наука, 1976. С. 103—105.
2. Meijer J.A., Vinke G.J.B., van der Lugt W. //J. Phys. Forch.: Met. Phys. 1986
V. 16. N 7. P. 845-851.
3. Hewaidy I.F., Busmann E„ Klemm W. // Z. Anorg. All. Chem 1964. Bd. 328
S. 283-293.
Л.Л. Зусман
Cs—Pr. ЦЕЗИЙ—ПРАЗЕОДИМ
Диаграмма состояния Cs—Pr не построена. Экспериментально
установлено, что Cs и Рг не взаимодействуют друг с другом в жид
ком состоянии [ 1 ].
Литература
1. Griffin R.B., Gschneidner, Jr., К.А. // Met. Trans. 1971. V. 2. N9
P. 2517-2524.
Л.Л. Зусман
Cs—Rb. ЦЕЗИЙ-РУБИДИЙ
Диаграмма состояния Cs—Rb изучена в работе [1] методом диф-
ференциального термического анализа и приведена на рис. 120.
Сплавы Cs с Rb получали из компонентов чистотой 99,99 % (по
массе) в никелевых тиглях в среде Ar [1], либо в стеклянных ампу
лах в вакууме [2]. Установлено, что Cs и Rb полностью смешивают-
ся в жидком и твердом состояниях. Кривые ликвидуса и солидуса
имеют минимум при температуре 9,7 °C и содержании Rb 47 % (ат.).
Согласно термодинамическим расчетам, приведенным в работе [31,
при низких температурах (—230 ----250 °C) в системе существует
область несмешиваемости компонентов, при этом положение бино-
дальной кривой в значительной степени определяется давлением.
Рис. 120. Cs-Rb Cs Rb' °/о !ат
Cs-S
223
Литература
1. Goates J.R., Ott J.B., Delawarde E. // Trans. Faraday Soc. 1971. V. 67. N 8.
p. 1612-1616.
2. Аджемян Р.Ц., Рейхардт A.A., Кудрявцев Л.А. // Работы по термодинамике и
кинетике химических процессов: Сб. статей. Л.: 1976. С. 3—5.
3. Soma Т„ Hosaka К., Kagaya Н.-М. // Phys. Status Solidi. В. 1986. V. 137. N 2.
КН1-К114.
Cs—S. ЦЕЗИЙ-СЕРА
Л.Л. Зусман
Методом прямого синтеза из компонентов при нагреве получен
полисульфид цезия CsS6, который имеет триклинную структуру,
пр.гр. Р1, параметры решетки а = 1,153 нм, b = 0,918 нм, с =
= 0,467 нм, а = 89,2°, р = 95,2°, у = 95,13° [Э]. На рис. 121 представ-
лена часть диаграммы состояния Cs—S, заимствованная из справочни-
Рис. 121. Cs-S
ка [MJ. Согласно этой диаграмме в интервале концентраций
50-75 % (ат.) S образуется пять сульфидов. Сульфиды Cs2S2, Cs2S5
и Cs2S6 плавятся конгруэнтно при -460, 212 и 186 °C соответственно.
Сульфиды Sc2S3 и Cs2S4 образуются по перитектическим реакциям
при 206 и 160 °C соответственно. В исследованной части системы
кристаллизуются три эвтектики при температурах 151, 186 и 173 °C.
Л.Л. Зусман
224
Cs-Sb
Cs-Sb. ЦЕЗИЙ-СУРЬМА
Диаграмма состояния Cs—Sb (рис. 122) построена по данным
дифференциального термического и рентгеновского анализов, а также
по результатам измерения термоэлектродвижущей силы и электросо
противления сплавов [1, 2]. Синтез сплавов проводили в глубоком
вакууме после последовательного напыления компонентов на подо
гретую подложку [1, 2]. В системе обнаружено семь соединений
Четыре из них Cs3Sb, Cs5Sb4, CsSb и Cs3Sb7 плавятся конгруэнтн-.,
при температурах 725, 560, 580 и 493 °C соответственно. Три соеди-
нения Cs5Sb2, Cs2Sb и CsSb2 образуются по перитектическим реак
циям. Однако вследствие сложности получения и исследовании
сплавов фазовое строение области составов между 25 и 50 % (ат.) Sb
определено недостаточно точно. Это касается, например, структуры
и температуры образования соединения Cs5Sb2. Тепловой эффект,
обнаруженный при температуре 352 °C, возможно, является резуль-
татом полиморфного превращения в этой фазе. При температуре
487 °C, очевидно, происходит перитектическая реакция образована
Sb, (по массе)
Рис. 122. Cs-Sb
Cs—Se
225
соединения Cs2Sb, а при температуре 459 °C, скорее всего, образует-
ся эвтектическая смесь Cs2Sb и Cs5Sb4, хотя в работе |2] при иссле-
довании тонких пленок обнаружено появление соединения Cs3Sb2.
Практически во всех исследованиях системы Cs—Sb, в основном на
тонких пленках, указывается на существование соединений CsSb и
Cs3Sb, в большинстве работ были обнаружены соединения Cs2Sb и
Cs3Sb2.
Соединение Cs3Sb имеет небольшую область гомогенности между
22,5 и 25,0 % (ат.) Sb [4]. Соединение Cs3Sb7 претерпевает поли-
морфное превращение при температуре 339 °C. В системе кристалли-
зуется пять эвтектик. Нонвариантные реакции в системе Cs—Sb
приведены ниже:
Ж + Cs3Sb - Cs5Sb2 при 575 °C;
Ж + Cs5Sb2 * Cs2Sb при 487 °C;
Ж + Cs3Sb7 * CsSb2 при 427 °C;
Ж * (Cs) + Cs3Sb при 27 °C;
Ж ~ Cs2Sb + Cs5Sb4 при 459 °C;
Ж ~ Cs5Sb4 + CsSb при 553 °C;
Ж - CsSb + CsSb2 при 404 °C;
Ж * Cs3Sb7 + (Sb) при 473 °C.
Растворимость Cs в (Sb) и Sb в (Cs) практически отсутствует.
Соединение Cs3Sb имеет структуру типа NaTl (символ Пирсона
сС16, пр.гр. Fd3m), параметр решетки а = 0,914...0,919 нм [Э|.
Соединение CsSb имеет структуру типа NaP (символ Пирсона аР16,
пр.гр. Р2}2(1Х), параметры решетки а = 0,7576 нм, b = 0,7345 нм, с =
= 1,3278 нм |3|.
Литература
1. Kansky Е. // Thin Solid films. 1976. V. 34. N I. P. 139—144.
2. Miyake K. // J. Appl. Phys. 1960. V. 31. N 1. P. 76-81.
3. Schnering H.G., Haule W., Krogull G. // Z. Xaturforsch. B. 1979. Bd. 34. N 12.
S. 1678-1685.
Л.Л. Зусман
Cs—Se. ЦЕЗИЙ-СЕЛЕН
Диаграмма состояния Cs—Sc не построена. В этой системе уста-
новлено существование соединения Cs2Se, которое устойчиво до
температуры 660 °C. Это соединение синтезировано из компонентов:
Cs чистотой 99,98 % (по массе) и Se чистотой 99,999 % (по массе)
в жидком NH3 при температуре 300 °C и давлении 0,2 ГПа. Соедине-
ние Cs2Sc имеет орторомбическую структуру (пр.гр. Fdd2) с восемью
атомами в элементарной ячейке, параметры решетки а = 1,175 нм,
Ь = 1,649 нм, с = 0,6775 нм 111.
8 Зак. 2144
226
Cs—Si, Cs—Sn
Литература
I. Bottcher P. // J. less-Common Met. 1980. V. 76. N 1—2. P. 271—277.
Л.Л. Зус.уц, i
Cs—Si. ЦЕЗИЙ-КРЕМНИЙ
Диаграмма состояния Cs—Si не построена. В работе [1] указывай
ся на возможность существования эвтектики по составу, близкой
Si с температурой плавления 1360 °C. Сплавы Cs с Si получены -
герметичных танталовых тиглях с внутренней вставкой из поликрп
таллического фианита в среде Аг. В работе [2] сообщается о соедин
нии CsSi. Его кристаллическая структура относится к типу КС,-
(символ Пирсона сРб4, пр.гр. Р43п) с параметром решетки а =
= 1,350 нм. Известно также соединение CsSi8, которое образуется н
результате разложения CsSi в высоком вакууме при температур-
500 “С 13|.
Литература
1. Дриц М.Е., Зусман Л.Л., Камардинкин А.Н. и др. // Доклады АН СССР. 19-,
1. 266. \'о 3. С. 649-651.
2. Busmann Е. // Naturwissenschaften. 1960. Bd. 47. S. 82.
3. Schafer R„ Klemm W. // Z. Anorg. All. Chem. 1961. Bd. 312. S. 214-220.
Л.Л. 3yix..
Cs—Sn. ЦЕЗИЙ-ОЛОВО
Диаграмма состояния Cs—Sn (рис. 123) построена в работах 11, '
по данным термического, рентгеновского и нсйтронографическщ о
анализов. Сплавы Cs с Sn получили в герметизированных тиглях )
молибдена в среде Аг, используя Cs чистотой 99,99 % (по массе! и
Sn полупроводниковой чистоты. В жидком состоянии в сплава .
содержащих от 13 до 39 % (ат.) Sn, наблюдается расслоение жидкой
фазы. Температура монотектической реакции составляет 605 °C. Из
установленных в системе пяти соединений (Cs2Sn, CsSn, Cs?Sn,-
CsSn2 и CsSn4) лишь Cs2Sn3 плавится конгруэнтно при темпера г\ ре
930 °C. Три соединения CsSn4, CsSn2 и CsSn образуются по перин
тическим реакциям при температурах 580, 875 и 630 °C соотв. >
ствснно. Соединение Cs2Sn образуются по перитектоидной рсакн-п
при 565 °C. Со стороны Sn и со стороны Cs кристаллизуются эвтеь hi
ки при температурах, близких температурам плавления чисн<>4
компонентов.
Соединение CsSn имеет структуру типа NaPb (символ Нири -'-1
//64, пр. гр. 14]/czcyZ), параметры решетки а = 1,219 нм, с = 1,987 юл
|3|. Соединение Cs2Sn3 имеет тетрагональную структуру (пр i'
P4/nwc или Р4сс), параметры решетки а = 0,760 нм, с = 1,368 нм • '1'-
Cs—Sr
227
Рис. 123. Cs-^Sn
Литература
1- Дриц М.Е., Фридман А.С., Зусман Л.Л., Кусиков В.А. // Фазовые равновесия
в металлических сплавах: Сб. статей. М.: Наука, 1981. С. 176—178.
2. Мелехов Л.З., Яценко С.П., Чунтонов К.А., Гринь Ю.Н. // Изв. АН СССР.
Металлы, 1987. № 2. С. 201-203.
3. Hewaidy I.F., Busmann Е., Klemm W. // Z. Anorg. All. Chem. 1964. Bd. 181.
S. 283-293-
4. Дриц M.E., Фридман A.C., Зусман Л.Л. и др. //VI Всесоюзная конференция
по химии и технологии редких и щелочных элементов: Сб. статей. М.. Наука, 1983.
С. 85-86.
Л.Л. Зусман
Cs—Sr. ЦЕЗИЙ-СТРОНЦИЙ
Cs и Sr не смешиваются друг с другом в жидком и твердом .состоя-
ниях [1, 2]. Энтальпия возможного взаимодействия жидких Cs и Sr
по расчету, проведенному в работе [3], равна 46 кДж/моль, что
характеризует несмешиваемость в жидком состоянии.
8*
228
Cs-Те
Литература
1. Klemm W., Kunze D. / Systems of Alkali and Alkaline Earth Metals. I’roi- ;.
Symp. on Alkali Metals. London: Chem. Soc. Special Publ., 1967- N 2. P. 3—22.
2. Pelton A.D. // Bull. Alloy Phase Diagrams. 1985. V. 6. N 1. P. 39.
3. Niesson A.K., de Boer F.R., Boom R., de Chantel P.F. et. al. // Calphad i'is, >
V. 7. N I. P. 51-70.
Л.Л. Зу<. ,
Cs—Те. ЦЕЗИЙ-ТЕЛЛУР
Диаграмма состояния системы, построенная по результатам терм,,
ческого и рентгеновского анализов, а также измерения магнитных
свойств сплавов, представлена на рис. 124 [1—3]. Сплавы Cs с I ?
получали из компонентов в откаченных пирексовых ампулах или
тиглях из А12О3, используя Cs чистотой 99,99 % (по массе) и полу
проводниковый Те [1, 2].
Рис. 124. Cs—Те
Cs—Ti
229
В системе образуются семь соединений, два из которых Cs2Te
И Cs2Te3 плавятся конгруэнтно при температурах 821 [1] (или
810±Ю ° С [2]) и 395 °C соответственно. Остальные соединения
Cs3Te2, Cs5Te4, CsTe, Cs2Te5 и CsTe5 образуются по перитектичес-
ким реакциям:
Ж + Cs2Te ~ Cs3Te2 при 660 °C;
Ж + Cs3Te2 * Cs5Te4 при 465 °C;
Ж + Cs5Te4 ~ CsTe при 408 °C;
Ж + Cs2Te3 * Cs2Te5 при 235 °C;
Ж + (Те) ** CsTe5 при 263 °C.
Следует отметить, что авторы работы [4] вместо состава, отвеча-
ющего формуле CsTe5, указывают на состав, отвечающий формуле
CsTe4.
В системе протекают три эвтектические реакции:
Ж * (Cs) + Cs2Te при 27 “С и -0 % (ат.) Те;
Ж * CsTe + Cs2Te3 при 358 °C и 55 % (ат.) Те;
Ж * Cs2Te5 + CsTe5 при 215 °C и 78 % (ат.) Те.
Кристаллическая структура установлена лишь для двух соеди-
нений. Соединение Cs2Te3 имеет структуру типа K2S3 (символ
Пирсона оС20, пр. гр. Стс2), параметры решетки а = 0,8666 нм, b =
в 1,2065 нм, с = 0,8680 нм [4]. Соединение Cs5Te4 обладает
моноклинной структурой (пр. гр. Р2(/с), параметры решетки а =
= 0,7857 нм, b = 0,7286 нм, с = 1,4155 нм, 0 = 93,83° [4].
Литература
1. Чунтонов К.А., Кузнецов А.Н., Федоров В.М., Яценко С.П. // Изв. АН СССР.
Неорганические материалы. 1982. Т. 18. № 7. С. 1108—1112.
2. Adamson M.G., Leighty Y.E. // J. Nucl. Mater. 1983. V. 114. N 2, 3. P. 327-329.
3. BOttcher P. // J. Less-Common Met. 1980. V. 70. N 2. P. 263-271.
4. BSttcher P„ Kreetschmann V. 11 Z. Anorg. All. Chem. 1985. Bd. 523. S. 145-152.
Л.Л. Зусман
Cs—Ti. ЦЕЗИЙ—ТИТАН
Исходя из положения элементов в Периодической системе и
различия в их физико-химических характеристиках и электронной
структуре атомов, можно полагать, что Cs и Ti практически не
Должны взаимодействовать друг с другом. В работе [1] рассчитали
энтальпию возможного взаимодействия жидкого Cs с жидким Ti,
которая оказалась равной 280 кДж/моль. На рис. 125 приведен вари-
ант диаграммы состояния Cs—Ti [2]. Взаимодействие между Cs и aTi
Практически полностью отсутствует.
230
Cs—7/
Литература
1. Niesson A,К., de Boer F.R., Boom R. et al. // Calphad.' 1983. V. 7. N ’
P. 51-70.
2. Bale C.W. // Bull. Alloy Phase Diagrams. 1989. V. 10. N 2. P. 132-133.
Cs—TI. ЦЕЗИЙ-ТАЛЛИЙ
П.Б. Bydbcf
Диаграмма состояния Cs—Т1 построена в работе [1] по данным
дифференциального термического и рентгеновского анализов, а также
измерения плотности атомных объемов сплавов. Сплавы Cs с Ti
получали из компонентов в среде инертного газа, в тиглях из танта
ла. Исходными материалами являлись Cs, восстановленный кальцием
из хлорида и очищенный от примесей дистилляцией в высоком
вакууме, и Т1 чистотой 99 % (по массе). Авторы работы [1] устано
вили существование трех соединений, из которых одно Cs5T17 пла
вится конгруэнтно, а два других Cs4TI7 и CsTl3 образуются по пери
тектическим реакциям. В системе кристаллизуются две эвтектики
Однако приведенная в работе [2] диаграмма состояния Cs—Т1 отлича-
ется от построенной в работе [1] наличием области несмешиваемое! »
в жидком состоянии в интервале концентрацией от -15—20 до 50
Cs-Tl
231
Рис. 126. Cs-Tl (p - 0,1 МПа)
(ат.) TI (рис. 126). Установлено также, что соединение Cs5Tl7 пла-
вится конгруэнтно при температуре 408 °C и имеет две модифика-
ции. Температура перехода fJCs5Tl7 aCs^T^ составляет 294 °C.
Нонвариантные реакции приведены в табл. 80 [2].
Взаимная растворимость компонентов в твердом состоянии прак-
тически отсутствует.
Таблица 8 0. Нонвариантные реакции в системе Cs—Т1
Реакция Концентрация TI в фазах, % (ат.) Температура, °C
Ж - Ж, + pCs5Tl7 50; -17; 58,5 355
Ж + pCs5Tl7 Cs4Tl7 72; 58,5; 63,7 350
Ж + Cs4TI7 - CsTl3 78; 63,7; 75 310
Ж - CsTl3 + (PTI) -90; 75; -100 235
Ж » (Cs) + aCs5Tl7 — — 58,5 28,39
Литература •
1. Thummel R., Klemm W. // Z. Anorg. All. Chem. 1970. Bd. 376. Nl.S. 44-93.
2. Moffatt W.G. Handbook of Binary Phase Diagrams. New-York: Business Growth
Services. General Electric Co. Shenectady, 1976. 1977. V. 1,2. 658 p.
Н.Р. Бочвар
232
Cs-V, Cs—Y
Cs—V. ЦЕЗИЙ-ВАНАДИЙ
Исходя из положения элементов в Периодической системе и
различия в их физико-химических характеристиках и электронной
структуре атомов, можно полагать, что Cs и V практически н,
должны взаимодействовать друг с другом. В работе [1] рассчитала
энтальпию возможного взаимодействия жидких Cs и V, которая
оказалась равной 269 кДж/моль. На рис. 127 приведен вариант диаг-
раммы состояния Cs—V, заимствованный из справочника [М]. Взаи
модействие между Cs и V в твердом состоянии практически отсут-
ствует.
V, °/о (по массе)
Рис. 127. Cs-V
Литература
1. Niesson А.К., de Boer F.R., Boom R. et. al. // Calphad. 1983. V. 7. N I
P. 51-70.
П.Б. Будберс
Cs-Y. ЦЕЗИЙ—ИТТРИЙ
Данные о взаимодействии Cs и Y в литературе отсутствуют
Энтальпия возможного взаимодействия жидких Cs и Y рассчитана г
работе [1J и равна 189 кДж/моль, что характеризует практически
полное отсутствие смешиваемости в жидком состоянии.
Cs—Zn, Cs~Zr
233
Литература
1. Niesson A.K., de Boer F.R., Boom R. et al. // Calphad. 1983. V. 7. N 1.
p. 51-70.
П.Б. Буббе p г
Cs—Zn. ЦЕЗИЙ-ЦИНК
Диаграмма состояния системы Cs—Zn не исследована. Согласно
данным работы [1] жидкие сплавы этой системы склонны к рас-
слоению. В работе [2] рассчитали возможную энтальпию смеше-
ния двух компонентов в жидком состоянии, она оказалась равной
42 кДж/моль. Положительная энтальпия смешения свидетельствует
об отсутствии химического взаимодействия между двумя жидкими
фазами.
Литература
1. Pelton A.D. /7 Bull. Alloy Phase Diagrams. 1987. V. 8. N 5. P. 484.
2. Niesson A.K., de Boer F.R., Boom R. et al. // Calphand. 1983. V. 7. N 1.
P. 51-70.
П.Б. Будберг
Cs-Zr. ЦЕЗИЙ-ЦИРКОНИЙ
На рис. 128 представлена диаграмма состояния Cs—Zr по данным
работы [11, построенная в предположении, что взаимная раствори-
мость компонентов в этой системе незначительная и температуры
234
Си—Dy
нонвариантных равновесий практически совпадают с температурами
аллотропических превращений в чистых компонентах. В работе 121
рассчитана энтальпия возможного взаимодействия жидких Cs и Zr,
которая равна 282 кДж/моль.
Растворимость Zr в жидком Cs после выдержки в течение
100 ч при температуре 1260 °C в герметичных тиглях не превышает
0,0015 % (ат.) [1]/
Литература
1. Bale C.W. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 1. P. 44-45.
2. Niesson A.K., de Boer F.R., Bootn R. et al. // Calphad. 1983. V. 7. N 1
P. 51-70.
П.Б. Будберс
Cu-Dy. МЕДЬ—ДИСПРОЗИЙ
Диаграмма состояния Си—Dy в интервале концентраций 0—80 °/,
(ат.) Dy приведена на рис. 129 поданным работы [1]. Предположи-
тельное строение в области концентраций 80—100 % (ат.) Dy приве-
ду, % (по массе)
Рис. 129. Cu-Dy
Си—Dy 235
Дено по данным работы [2]. Исследование [1] проведено методами
дифференциального термического, рентгеновского и микроструктур-
ного анализов с использованием Си высокой чистоты 99,999 % (по
массе) и Dy чистотой 99,9 % (по массе).
В системе Си—Dy по данным работы [1] образуются шесть соеди-
нений, три из которых Cu9Dy2 [18,18 % (ат.) Dy], Cu2Dy [33,3 %
(ат.) Dy], CuDy [50,0 % (ат.) Dy] плавятся конгруэнтно при темпе-
ратурах (970±5) °C, (890±5) °C и (955±5) °C соответственно. Соеди-
нения Cu7Dy [12,5 % (ат.) Dy], Cu5Dy [16,67 % (ат.) Dy] и Cu7Dy2
[22,22 % (ат.) Dy] образуются по перитектическим реакциям:
Ж + Cu5Dy « Cu7Dy при (860±5) °C,
Ж + Cu9Dy2 a Cu5Dy при (965±5) °C,
Ж + Cu9Dy2 a Cu7Dy2 при (905±5) °C.
При этом соединение Cu5Dy имеет полиморфное превращение при
температуре -930 °C, а соединения Cu7Dy и Cu7Dy2 существуют
только при высоких температурах. Соединение Cu?Dy распадается по
эвтектоидной реакции при температуре 755 °C: Cu7Dy a Cu5Dy +
+ (Си) [1, 3], а соединение Cu7Dy2 — по кататектической реакции:
Cu7Dy2 а Ж + Cu9Dy2 при 855 °C и содержании в жидкой фазе
-28,7 % (ат.) Dy.
В системе кристаллизуются четыре эвтектики по реакциям:
Ж а (Си) + Cu7Dy при (855+5) °C и 10,0 % (ат.) Dy;
Ж a CugDy2 + Cu2Dy при (845±5) °C и 29,0 % (ат.) Dy;
Ж a Cu2Dy + CuDy при (840+5) °C и 39,5 % (ат.) Dy;
Ж a CuDy + (|JDy) при (790±5) °C и 70,0 % (ат.) Dy.
В отличие от результатов работы [1] в работе [4] обнаружено
только четыре соединения, одно из которых Cu5Dy плавится конгру-
энтно при 970 °C, а три других Cu7Dy, Cu2Dy и CuDy образуются по
перитектическим реакциям при температурах соответственно 890,
885 и 840 °C. Согласно данным работы [4] соединение Cu7Dy сущес-
твует в узкой температурной области и распадается по эвтектоидной
реакции при 848 °C, а две эвтектики (Си) + Cu^Dy и CuDy + (aDy)
кристаллизуются при температурах 880 и 808 с и содержании Dy
~7,4 и -74,1 % (ат.) соответственно. Авторы работы [2] отмечают,
Что по аналогии строения систем Си с другими лантаноидами *(Gd,
Ег и Y) предпочтение следует отдать данным работы [ 1 ].
Растворимость Dy в (Си) практически отсутствует [1,4] и равна
0,12—0,17 % (ат.) при эвтектической температуре [5]. Раствори-
мость Си в (Dy) <11,862 % (ат.) при эвтектической температуре и
<0,510 % (ат.) при 25 °C [1].
Кристаллическая структура соединений приведена в табл. 81.
Структура соединения Cu7Dy2 не установлена.
236
Си—Er
Таблица 8 1. Кристаллическая структура соединений системы Си- п,
Соединение Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм 1 и
а b с
Cu7Dy TbCu7 /1Р6, РЬ/ттт 0,4932 — 0,4156 131 ’
pCu5Dy CaCu5 hPf>, Р6/ттт — — — !-'1
aCu5Dy AuBe5 cF2A, F43m 0,7022 — — 11 i
0,7047 — — L:!
0,7027 — — !(!
Cu0Dy2* — — 0,4999 (5) — 1,394 (3) '1 1
Cu2Dy CeCu2 о/12, Imma 0,4303 0,6802 0,7282 ! ! 1
0,4300 (5) 0,6792 (5) 0,7300 <51 Ci
CuDy CsCI cPl, РтЗт 0,3455 — — 1' 1
0,3461 — — LS:
Тетрагональная сингония.
Литература
1. Franceschi Е. // J. less-Common Met. 1982. V. 87. N 2. Р 249—256.
2. Subramanian P.R., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1988. V '> 3a.
P. 331-337.
3. Buschow van der Goot A.S. 11 Acta'Crystallogr. B. 1971. V 27 8 8.
P. 1085-1088.
4. Cheng J.X. //Acta Phys. Sin. 1982. V. 31. № 6. P. 807-809.
5. Бочвар H.P., Лысова E.B. // Редкие металлы в цветных сплавах: Сб. cia
Наука, 1975. С. 12-18.
6. Buschow van der Goot A.S., Birkhan J. //J. Less-Common Mei i',r|9
V. 19. P. 433-436.
7. Storm A.R., Benson K.E. // Acta Crystallogr. 1963. V. 16. P. 701—702
8. Baenziger N.C., Moriarty J.L. // Acta Crystallogr. 1961. V. 14. P 948—95>.
///’. -P'
Си—Er. МЕДЬ—ЭРБИЙ
Диаграмма состояния Си—Ег исследована в работе |1| методами
дифференциального термического, металлографического и pchi'cih'h-
ского анализов, сплавы изготовляли в дуговой печи в атмосфер.
с использованием Си чистотой 99,99 % (по массе) и Ег чине"'1’
99,9 % (по массе).
Си-Er
237
Рис. 130. Си—Er
Система Си—Ег характеризуется наличием пяти соединений. Сое-
динения CuyEr, Cu2Er и CuEr плавятся конгруэнтно при темпера-
турах 1010, 935 и 1055 °C соответственно, а соединения Cu5Er и
Си Ег образуются по перитектическим реакциям при температурах
1005 и 940 °C.
По аналогии с характером образования фаз в системах Си с Gd,
Dy и Yb авторы работы [2] приписывают соединениям СиуЕг и СихЕг
стехиометрический состав Cu9Er2 и СиуЕг2 соответственно.
На рис. 130 диаграмма состояния Си—Ег приведена по данным
Работы [1] с указанием состава соединений в области около 20,0 %
'ат.) Ег по данным работы [2]. Нонвариантные равновесия, имеющие
Место в системе, указаны в табл. 82.
Растворимость Си и (Ег) мала и составляет <0,52 % (ат.) [0,2 %
(по массе)! Си [Э].
Кристаллическая структура соединений приведена в табл. 83.
238
Си—Ей
Таблица 8 2. Нонвариантные реакции в системе Си—Ег
Реакция Содержание Er в фазах, % (ат.) Температура, “С Источник
Ж + Cu9Er2 и Cu5Er -16,2 -18,2 16,67 1005 (И
Ж + Cu9Er2 ” Cu7Er2 -27,2 -18,2 -22,2 940 П1
Ж » (Си) + Cu5Er 9,5 -0 16,67 895 [11
Ж » Cu7Er2 + Cu2Er 30,0 -22,2 33,33 885 [1]
Ж - Cu2Er + CuEr -38,5 33,33 50,0 905 И!
Ж « CuEr + (Er) 69,5 50,0 -100,0 880 [1]
76,5 50,0 -100,0 860 [Э]
71,8 50,0 -100,0 845 [Э]
Таблица 83. Кристаллическая структура соединений системы Си—Ег
Соеди- нение Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм Источник
а b С
Cu5Er AuBes cF24, /43ет 0,7003 — — [3]
Cu2Er CeCu2 о/12, Imma 0,4275 (5) 0,6726 (5) 0,7285 (5) [1,4]
CuEr CsCl сП, РтЗт 0,3431 — — [Ш, 1, 2| 1
Литература
1. Buschow K.H.J. // Phillips Res. Rept. 1970. V. 25. N 4. P. 227-230.
2. Subramanian P.R., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1988. V. 9. N 3a
P. 337-342.
3. Buschow K.H.J, van der Goot A.S., Birkhan J. // J. Less-Common Met. 196(i
V. 19. P. 433-436.
4. Storm A.R., Bensom K.E. // Acta Crystallogr. 1963. V. 16. P. 701—702.
//.P. Бочви;
Cu-Eu. МЕДЬ—ЕВРОПИЙ
Диаграмма состояния Си—Ей приведена на рис. 131 по данным
работы [1] с корректировкой температур плавления Си и Ей согласно
работе [2]. Исследование проведено методами дифференциального
термического, рентгеновского и металлографического анализов. Для
приготовления сплавов использовали Си чистотой 99,999 % (по
массе) и Ей чистотой 99 % (по массе).
Си—Ей
239
Рис. 131. Си—Ей
В системе установлено четыре соединения, одно из которых Cu5Eu
образуется конгруэнтно при температуре 847 °C, а другие образуются
по перитектическим реакциям.
Нонвариантные равновесия, имеющие место в системе, указаны
в табл. 84.
Таблица 84. Нонвариантные реакции в системе Си—Eu [ 11
Реакция Содержание Ей в фазах, % (ат.) Температура, °C
Ж + Си5Еи •* Си2Еи -41,0; 16,7; 33,3; 597 ±5
Ж + Си2Еи » СиЕи -51,0; 33,3; 50,0; 53715
+ СиЕи * СиЕи2 -73,3; 50,0; 66,7; -44215
Ж « (Си) + Си5Еи -13,0; -0; 16,7; 842
ж " СиЕи2 + (Ей) 74,0; 66,7; 100,0; 437
240
Си-Fe
Содержание Ей в жидкой фазе (табл. 84) получено авторами
работы [2] интерполяцией экспериментальных данных работы [1).
Растворимость Си в (Ей) незначительная и составляет мене.
0,5 % (ат.) Си. Растворимость Ей в (Си) также очень мала.
Кристаллическая структура соединений приведена в табл. 85.
Таблица 85. Кристаллическая структура соединений системы Си—Ей
Соеди- нение Про- тотип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
Cu5Eu CaCu5 hP6, P6/mmm 0,5160 (4) — 0,4081 (3) [1]
Cu2Eu CeCu2 oil 2, Imma 0,4434 (3) 0,7234 (6) 0,7539 (6) Hl
0,445 (1) 0,725 (1) 0,754 (1) [3]
CuEu FeB oP8, Pnma 0,7976 (5) 0,4407 (2) 0,6054 (3) [1. 4]
CuEu2 CuCa2 oP12, Pnma 0,640 (1) 0,421 (1) 1,508 (2) [1] ;
Литература
1. Costa G.A., Franceschi Е.А., Tawansi А. // J. Less-Common Met. 1985. V. 10»
N 1. P. 175-182.
2. Subramanian P.R., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1988. V. 9. N .?,
P. 342-346.
3. Storm A.R., Benson K.E. // Acta Crystallogr. 1963. V. 16. P. 701-702.
4. Buschow K.H.J., Van Vucht J.H.N., Van der Hoogenhof W.W. // J. Less-Commo
Met. 1980. V. 75. P. 17-22.
H.P. Бочв^г
Cu—Fe. МЕДЬ—ЖЕЛЕЗО
Диаграмма состояния Си—Fe (рис. 132) построена в работе [11 по
данным калориметрического анализа и термодинамического расчета
Для получения сплавов использовали Fe чистотой 99,96 % (по массе'
и Си чистотой 99,98 % (по массе). Приведенные результаты согласу-
ются с данными работ [2, 3], в которых определены температур ;
ликвидуса и солидуса системы методом термического анализа, и
данными работы [4] по определению границ растворимости в твердом
состоянии. Температуры плавления Си и Fe, а также температур1!
полиморфных превращений в Fe скорректированы согласно существ)
ющему стандарту.
В системе Си—Fe установлено наличие двух перитектических о
одного эвтектоидного равновесия, которые указаны в табл. 86.
В сплавах системы Си—Fe в результате сильного переохлажден и •<
(степень переохлаждения 100 °C и выше) появляется область несме-
шиваемости в жидком состоянии [5]. Критическая температу ра
Си-Fe
241
Рис. 132. Cu-Fc
смешения лежит на 20 °C ниже температуры ликвидуса при эквиа-
томном составе.
Определение растворимости Fe в Си в твердом состоянии и по-
строение границ (Си)-твердого раствора проведено в работах [6—8]
Методами металлографического [6], рентгеновского [7] и микрорен-
тгеноспектрального [8] анализов. Растворимость Fe в (Си) при
температурах 1025. 900, 800 и 700 °C по данным работы [7] состав-
ляет 2,84; 1,7; 1,02; 0,57 % (ат.) Fe соответственно, а по данным
Работы [8] при температурах 1050, 890, 800, 700 и 650 °C — 2,94;
1,30; 0,73; 0,37 и 0,24 % (ат.) Fe соответственно.
242
Cu—Fe
Таблица 86. Нонвариантные реакции в системе Cu—Fe
Реакция Содержание Fe в фазах, % (ат.) Температура, '(
Ж + (6Fe) ₽ (yFe) 89,7; 93,2; 92,6 1480
Ж + (yFe) ₽ (Си) 2,8; 92,0; 4,0 1094
(yFe) ₽ (aFe) + (Си) 97,9 98,6 1,3 850
Растворимость Си в (dFe) определена в работах [1, 2], в (yFe) -
в работах [1, 4, 8] и в (aFe) — в работах [8—11] методами металле’-
рафического [4], рентгеновского [10], микрорентгеноспектральном
[4, 8], химического [9] анализов, измерения термоэлектродвижущеи
силы [4], магнитной проницаемости и электропроводности [1]. Хе ,
кривой солидуса со стороны Fe в системе Cu—Fe свидетельствует >
наличии ретроградного солидуса [1, 4].
Растворимость Си в (yFe) при температурах 1470, 1370, 1270.
1200 и 1100 °C составляет 10,0; 12,0; 10,0; 8,5; 8,0 % (ат.) [4] и при
температурах 1050, 1010, 970, 925 °C 6,52; 5,25; 4,43 и 3,68 % (ат
Си соответственно [8].
Растворимость Си в (aFe) по данным работы [8] приведена ниже:
Температура, °C........................
Растворимость Си, % (ат.).............
900 847 820 790 720 690
0,21 1,71 1,45 1,21 0,61 0.43
По данным работы [9] растворимость Си в (aFe) определсп.,
равной:
Температура, °C.......................... 841 801 759 728 693
Растворимость Си, % (ат.)................ 1,79 1,22 0,86 0,61 0.4-
Согласно работе [10] значения растворимости Си в (а 1\
следующие:
Температура, °C................................
Растворимость Си, % (ат.)......................
900 800 700 600
0,38 0,33 0,24 0,13
А согласно работе 11 ] растворимость Си в (aFe) составляет:
Температура, “С ............................ 865 845 760 695
Растворимость Си, % (ат.)................... 1,89 1,41 0,79 0,41
В работе [12] кривую ограниченной растворимости Си в (aFe> <•
твердом состоянии рассчитывали с использованием модели регуляр
ных растворов и литературных данных по термодинамическим свои
ствам компонентов, также рентгеновского анализа, просвечивающей
электронной микроскопии и измерения микротвердости. Значение
CUr-^jQ.
243
растворимости при температурах 825, 785, 765 и 700 °C составляют
1,4; 1,0; 0,6 и 0,4 % (ат.) Си соответственно.
! Параметр решетки я для твердого раствора на основе меди (Си)
приведен в работе [7]: для сплава, содержащего 2,39 % (ат.) Fe а =
= 36092 нм.
Параметр решетки (aFe) при содержании 0,38 % (ат.) Си а =
= 0,28682 нм [10].
В работах [13—20] диаграмма состояния Cu—Fe построена расчет-
ными методами.
Литература
1. Oelsen W., Schumann Е., Florin С. // Arch. Eisenhiittenwes. 1961. Bd. 32. N 10.
S. 719-728.
2. Hellawell A., Hume-Rothery W. // Phylos. Trans. Roy. Soc. London. 1957.
V. 249A. N 968. P. 417-459.
3. Hume-Rotherv W., Bucklv R.A. // J. Iron Steel. London. 1964. V. 202.
P. 531-533.
4. Бочвар А.А., Екатова A.C., Панченко E.B. и др. 11 Доклады АН СССР. 1967.
Т. 174. № 4. С. 863-864.
5. Nakagawa Y. И Acta Metall. 1958. V. 6. N 11. Р. 764-771.
6. Hanson D., Ford G.W. // J. Inst. Met. 1924. V. 32. P. 335-361.
7. Anderson A.G.H., Kingsbury A.W. // Trans. AIME. 1993. V. 152. P. 38—47.
8. Salje G., Feller-Kniepmeier M. // Z. Metallkunde. 1978. Bd. 69. N 3.
S. 167-169.
9. Wriedt H.A., Darker L.S. // Trans. AIME. I960. V. 218. N 1. P. 30-36.
10. Abrahamson E.P., Loputa S.L. // I’rans. AIME. 1966. V. 236. N 1. P. 76—78.
11. Querkshi A.H. 11 Z. Metallkunde. 1961. Bd. 52. S. 799-813.
12. Chen L.H., Chin T.S., Hung M.P. // J. Appl. Phys. 1988. V. 64. N 10. Pt. 2.
P. 5962-5964.
13. Harvig H„ Kirchner G., Hiller! M. // Metall. Trans. 1972. V. 3. N 1.
p 329—332.
'14. Kaufman L. 11 Calphad. 1978. V. 2. N 2. P. 117-146.
15. Smith J.H., Bailev D.M. // CS Dep. Commer. Nat. Bur. Stand. Spec. Publ. 1978.
N 496/2. P. 1027—1046.
16. Kubaschewski O., Smith J.H., Bailev D.M. // Z. Metallkunde. 1977. Bd. 68. N 7.
S. 495-499.
17. Uhrenius B. // Calphad. 1980. V. 4. N 3. P. 193-200.
18. Васильев M.B. // Журнал физической химии. 1983. T. 57. № 10.
С. 2413-2417.
19. Кузнецов Г.М., Федоров В.Н., Токарчук И.Н. // Изв. вузов. Цветная ме1ал-
лургия. 1983. № 4. С. 78-81.
20. Chuang Y.—Y., Schmid R„ Chang A. // Metall. Trans 1984. V. 15A. N 7—12.
P. 1921-1930.
~ „ If.P. Бочвар
Cu—Ga. МЕДЬ—ГАЛЛИИ
Диаграмма состояния системы Си—Ga приведена на рис. 133 по
совокупности данных работ [1—5]. Кривая ликвидуса твердого рас-
твора на основе Си принята по данным работы [1]; кривые солидуса
И растворимости Ga в (Си) приведены по данным работы [2], область
Концентраций 18—32 % (ат.) Ga в интервале температур 600—900 °C
244
Cu—Ga
Ga, % (по массе)
показана по данным исследования [3]; в области концентрации
13—23 % (ат.) Ga при температурах ниже 600 °C границы фазовых
областей проведены по данным работы [4]; в области концентрации
30—100 % (ат.) Ga — по данным работы [5]. Исследования проводи-
ли методами термического [1, 3—5], металлографического [2—
рентгеновского [5, 6], дилатометрического [4] анализов с использо
ванием Си чистотой 99,99 % (по массе) и Ga чистотой 99,95 % (но
массе).
В системе Cu—Ga при температурах 915, 836, 485, 468 и 254 ‘С
протекают перитектические реакции образования промежуточных
фаз 0, у, Y2’ Y3’ ® по соответствующим реакциям: Ж + (Си) * 0, Ж t
+ 0 y> Ж + Yi 11 Y2’ Ж + Y2 11 Уз* Ж + Y3 ** 6 [3, 5]. Другие фазы
£', Yj(Cu9Ga4) образуются в твердом состоянии. Фаза I образуется
по перитектоидной реакции (Си) + 0 £ при температуре 620 °C |4]
При температуре около 322 °C и ниже в области концентраций
21—23 % (ат.) Ga стабилизируется фаза [4]. В более ранней
работе [3] указывалось на существование в этой области составов
двух превращений, образования фазы 5' по перитектоидной реакции
при температуре 480 °C [(Си) + £ ” £'] и эвтектоидного распада
фазы при температуре 475 °C (£ <=* £' + у). По данным работы [31
фаза £ стабильна в интервале температур 616—480 °C, при темпера
туре ниже 480 °C стабильна фаза.
Cu—Ga
245
г Данные работы [4] были подтверждены результатами работы [6].
На кривых температурной зависимости модуля упругости и электро-
| проводности для сплавов с 22 и 23 % (ат.) Ga имеющиеся перегибы
р при температуре 340 °C указывали, по мнению авторов, на наличие
( процесса упорядочение — разупорядочение и отсутствие какого-либо
| превращения при температуре 480 °C.
Фаза Yi образуется в результате превращения у ** Yi в интервале
s температур 645—490 °C в зависимости от содержания Ga, когда
< неупорядоченная фаза у переходит в упорядоченную фазу Yp Фазы
Yj, у2 и уз являются тремя модификациями фазы у.
В системе Cu—Ga имеют место одно эвтектическое и одно эвтекто-
; идное равновесия. Эвтектика кристаллизуется при температуре
29,75 °C [М] по реакции Ж ** 0 + (Ga), причем эвтектическая точка
; близка по составу к чистому Ga. Эвтектоидное равновесие наблюда-
ется при температуре 616 °C: Р £ + у. Эвтектоидный распад фазы
Р подробно описан в работе [7]. Механизм ’’массивного” превраще-
, ния фазы р обсуждается в работах [8—10].
Значения растворимости Ga в (Си) согласно работе [1 ] приведе-
ны ниже:
Температура, "С........... 914 900 800 700 620 600 500 400 300
' Растворимость Ga, % (ат.). 16,4 16,65 18,0 19,1 19,7 19,6 19,45 19,25 18,8
Растворимость Ga в (Си), по данным работы [2] приведена ниже:
Температура, °C....... 914 900 800 700 620 600 500 400 300 200
Растворимость
Ga, % (ат.)........... 16,2 16,55 18,2 19,4 20,25 20,2 19,7 19,35 19,0 18,6
Кристаллическая структура соединений системы Cu—Ga приведена
в табл. 87.
Параметр решетки (Си) по мере легирования Ga увеличивается
и при 20 % (ат.) Ga составляет а = 0,3691 нм [14].
Таблица 8 7. Кристаллическая структура соединений системы Cu—Ga
Соедине- ние Прототип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источник
а С
₽*' W с/2, JmЗт 0,29611 — [П, 12]
е Mg hP2, РЬ^/ттс 0,29005 0,42413 [12]
0,2599 0,4237 [13]
0,25992 0,42442- [14]
0,26013 0,42435
0,2597- 0,4233- [15]
0,2626 0,4280
246
Си—Ga
Соедине- ние Прототип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источник
а С
Г2 MgjCd — — — [Г2|
Y*3 — — — — 15, 12]
Yi’’ Cu9A14 сР52, Р4 3т 0,8747 — 112]
Y2M — — 0,87035 — [5, 12|
Y,’’ — — 0,8635 — [5, 12[
O’4 CuGa2 — 0.2836 0,5843 [5, 12|
’’Электронное соединение 3/2, параметры решетки указаны при содержании -23 % (ат.) Ga. ^Упорядоченная модификация фазы р 1161. По данным работы [17] решетке фазы Е/ не упорядочивается после длительных отжигов при температурах 200 и по;с. *лФаза у состава Cu9Ga4 [30,77 % (ат.) Ga] является электронным соедине- нием 21/13 ]5, 18]. Четыре фазы у, у,, у2, у3 имеют кубическую сингонию и весьма незначительно различаются по структуре. Число атомов на ячейку измен-,। егся от 52 (у,) до 47 (у3) [5, 12]. Параметры решетки для у2 указаны при содср жании 36 % (ат.) Ga, для у3 — ври 42, 64 % (ат.) Ga. 4Тетрагональная сингония.
Литература
1. Hume-Rothery W., Mabbott G.W., Channel-Evans R.M. // Phil. Trans. Roy. S.»
London. 1934. V. 233A. P. 1-97.
2. Owen E.A., Rowlands V.W. // J. Inst. Met. 1940. V. 66. N 10. P. 361—378.
3. Hume-Rothery W., Raynor G.V. // J. Inst. Met. 1937. V. 61. P. 205-222.
4. Kittl J.E., Massalski T.B. // J. Inst. Met. 1965. V. 93. P. 182-188.
5. Betterson J.O., Hume-Rothery W. // J. Inst. Met. 1952. V. 80. N 8. P. 459—4н8
6. Lang W. // Z. Metallkunde. 1958. Bd. 49. N 8. S. 424-425.
7. Spencer C.W., Mack D.J. // J. Inst. Met. 1956. V. 84. N 12. P. 461-466.
8. Kittl J.E., Rodriguez С. 11 Acta Metall. 1969. V. 17. N 5. P. 925-928.
9. Gaketti J.C., Bertorello H.R., Kittl J.E. // Acta Metall. 1982. V. 30. \
P. 813-819.
10. Мирзаев Д.А., Счастливцев B.M., Карзунов C.E. и др. // Физика металле1 >'
металловедение. 1985. Г. 59. № 3. С. 566—571.
11. Hume-Rothery W., Raynor G.V., Reynolds P.W. et. al. // J Inst. Met. 194.)
V. 66. N 7. P. 209-239.
12. Гринь Ю.Н., Гладышевский P.E. Галлиды. M.: Металлургия. 1989. 30^ с
13. Zintl Е„ Treusch О. // Z. Phys. Chem. 1936. Bd. 34. S. 225-237.
14. Massalski T.B., Cockayne В. 11 Acta Metall. 1959. V. 7. N 12. P. 762-768
15. Burkhard W., Schubert K. // Z. Metallkunde. 1959. Bd. 50. N 8. S. 442-452
16. Hume-Rothery W.. Reynolds P.W., Raynor G.V. // J. Inst. Met. 1940. V. 66 \ '
P. 191-207.
17. Kittl J.E.. Massalski T.B. // J. Appl. Phys. 1962. V. 3. P. 242-243.
18. Hume-Rothery W.. Beterson J.O., Revnolds P.W. // J Inst. Met. 1952. V 8;i
№ 11. P. 609-616
HP.
Cu-Gd
247
I Cu-Gd. МЕДЬ—ГАДО ЛИНИЙ
Г Диаграмма состояния Си—Gd приведена на рис. 134 по данным
^работы [1]. Исследование проведено с использованием Си чистотой
W9,999 % (по массе) и Gd чистотой 99,95 % (по массе) методами
^дифференциального термического, рентгеновского и металлографи-
ческого анализов [2].
I Gd, °/° (по массе)
I, о 10 20 30 6-0 50 60 70______80_______90______ (00
t°c\—।—п—।—п---1---1----1 I"
0 10 20 30 GO 50 60 70 80 90 (00
Си Gd, % (am.) Gd
*MC. 134. Cu-Gd
В системе существуют шесть соединений, три из которых CupGd2,
Cu,Gd, CuGd плавятся конгруэнтно при температурах 930, 860 и
830 °C, а три других Cu6Gd, Cu5Gd и Cu7Gd2 образуются по пери-
тектическим реакциям. При этом соединение Cu5Gd имеет большую
область гомогенности и претерпевает превращение высокотемператур-
Вой модификации 0Cu5Gd в низкотемпературную aCu5Gd. Согласно
Данным работы [2] это превращение происходит вблизи температуры
«60 °C. Однако авторы работы [1] принимают температуру поли-
морфного превращения около 870 °C (см. вставку на рис. 134), по
аналогии с другими Cu-лантаноидными системами и на основании
248
Си-Gd
работы [3], где указано, что aCu5Gd существует при всех темпера гу-
рах ниже перитектической. Соединение Cu7Gd2 существует в узкой
температурной области 870—825 °C. В работе [3] сообщается о соеди-
нении Cu7Gd, которое существует при высоких температурах й
распадается при 700 °C и ниже на (Си) и Cu6Gd. Авторы работы > 1 j
также не исключают возможности образования Cu7Gd. При рентге-
новском исследовании сплавов вблизи состава Cu7Gd ими была
обнаружена фаза родственная по типу фазе Cu5Gd. Так как сущес-
твование Cu7Gd возможно, на рис. 134 эта фаза показала
штриховой линией.
Нонвариантные реакции, имеющие место в системе, указаны в
табл. 88.
Максимальная растворимость Си в (£Gd) составляет около 15 %
(ат.), а в (aGd) — около 2 % (ат.) [2]. Растворимость Gd в (Си)
незначительна.
Кристаллическая структура соединений приведена в табл. 89.
В противоположность данным работы [2] в работе [6] указываете я
на образование четырех соединений в системе Си—Gd, одно из кото-
рых Cu5Gd плавится конгруэнтно при температуре 932 °C, а осталь-
ные CuzGd, Cu2Gd и CuGd — инконгруэнтно при температурах 875,
870 и 759 °C соответственно. Две эвтектики (|3Gd) + CuGd и Cu^Gd +
+ (Си) кристаллизуются соответственно при температурах 668 и
875 °C. Однако авторы работы [1] отдают предпочтение данны й
работы [2] в связи с аналогичным строением системы Си—Gd другим
Cu-лантаноидным системам.
Таблица 8 8. Нонвариантные реакции в системе Си—Gd [2]
Реакция Содержание Gd в фазах, % (ат.) Температура, °C
Ж + Cu5Gd ₽ Cu6Gd -9,8; -16; 14,29 865
Ж + Cu9Gd2 ₽ Cu5Gd -15,8; 18,18; 16,67 925
Ж + Cu9Gd2 * Cu7Gd2 — 18,18; 22,3 870
Cu7Gd2 " Ж + Cu9Gd2 22,3; — 18,18 825
Ж » (Cu) + Cu6Gd 9,5; -0; 14,29 860
Ж ₽ Cu9Gd2 + Cu2Gd 29; 18,18; 33,33 820
Ж ₽ Cu2Gd + CuGd 43,5; 33,33; 50 770
Ж ** CuGd + (pGd) 70; 50; -85 675
(PGd) » (aGd) + CuGd -89,5; -98; 50,0 630 J
Си—Ge
249
Таблица 89. Кристаллическая структура соединений системы Си—Gd
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм Источник
а b С
^Cu7Gd’ — — 0,4951 — 0,4171 13)
Cu6Gd Cu6Ce оР28, Рпта 0,8315 0,5983 0,9949 [1, 4]
pCu5Gd Cu5Ca hP6, Рб/ттт 0,5018 — 0,4118 111
0,5036 (5) — 0,4142 11, 2]
aCu5Gd AuBe5 cF24, F43m 0,706 — — [3]
Cu9Gd2‘* — — 0,500 — 1,390 [2]
Cu2Gd CeCu2 о/12, Imma 0,4333 0,6888 0,7375 [1]
0,4328 0,6878 0,7343 [2]
0,4320 0,6858 0,7330 [51
CuGd CsCl сР2, РтЗт 0,3501 — — [1, 2J
Гексагональная сингония [3].
Тетрагональная сингония [2].
Литература
1. Subramanian P.R., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1988. V. 9. N 3a.
P. 347-354.
2. Carnasciali M.M., Ciraficu S., Franceschi E. // J. Less-Common Met. 1983. V. 92.
N 1. P. 143-147.
3. Buschow K.H.J., van der Goot A.S. // Acta Crystallogr. B. 1971. V. 27. N 6.
P. 1085-1088.
4. Buschow K.H.J. van der Goot A.S. //J. I-ess-Common Met. 1970. V. 20.
P. 309-313.
5. Storm A.R., Benson K.E. // Acta Crystallogr. 1963. V. 16. P. 701-702.
6. Cheng J.-X., Ceng Z.-M. // Acta Phys. Sin. 1983. V. 32. N 11. P. 1443-1448.
E.B. Лысова
Cu—Ge. МЕДЬ—ГЕРМАНИЙ
На рис. 135 приведена диаграмма состояния Си—Ge согласно
работам [1—3] в области концентраций 0—22 % (ат.) Gc и согласно
работе [4] в области концентраций 22—100 % (ат.) Ge.
Диаграмма построена по результатам термического, металлогра-
фического и химического анализов с использованием Си чистотой
99,99 % (по массе) и Gc чистотой 99,9995 % (по массе).
В системе кристаллизуются следующие фазы: (Си), C(Cu5Ge), £],
c(Cu3Gc), т| и (Ge). Фаза плавится конгруэнтно при температуре
747 °C и содержании 23,5 % (ат.) Gc [4]. Она стабильна в области
250
Cu—
концентраций 23,0—23,8 % (ат.) Ge и в интервале температур 74'.’—
549,5 °C. В работе [51 содержание Ge в фазе Ej указано равном
24,1 % (ат.). Фазы С и г) образуются по перитектическим реакциям,
а фаза е — по перитектоидной реакции. Область существования фл>ы
С довольно значительная, и ее границы в зависимости от температу-
ры установлены в работе [2]. Значения концентрации Gc на гранте
области фазы С с областью (Си) + С приведены ниже:
Температура, °C............ 800 750 700 600 580 400 .; ”
Концентрация Ge, % (ат.)... 12,5 12,2 12 11,8 11,6 11,5 11 ♦
Концентрация Ge на границе области фазы С с областью Ж ‘
составляет 14 и 17,5 % (ат.) при температурах 800 и 750 °C. ез
границе с областью { + е, — 18,4; 18,2 % (ат.) при 700 и 600 °( а
на границе с областью С + с — 17,9; 17,4 и 16,9 % (ат.) при 500.
и 300 °C соответственно.
Область фазы ц расположена при концентрациях Ge 26,05; 1;
26,25 и 26.65 % (ат.), соответствующих температурам 698, 636, '
и 644 °C. Фаза е имеет область гомогенности 23,1—25,1 % (ат.) <
Си—Ge
251
Нонвариантные реакции, проходящие в системе, указаны в
। табл. 90.
Растворимость Ge в (Си) при различных температурах по данным
i металлографического анализа работы [2] приведена ниже:
I Температура, °C............... 800 700 600 500 400 300
Растворимость Ge, % (ат.)...... 11,6 11,0 10,6 10,2 10 9,75
Растворимость Ge в (Си) по данным рентгеновского анализа,
полученная авторами работы [3], следующая:
Температура, °C....................... 821 800 700 600 500 400 300200
Растворимость Ge, % (ат.)............ 11,4 11,3 10,9 10,4 10,1 9,6 9,2 8,7
Растворимость Си в Ge по результатам многих работ, обобщенных
(в работе [6], незначительна и составляет 8,5- 10“5 % (ат.) при
температуре 900 °C.
Т а б л и ц а 9 0. Нонвариантные реакции в системе Си—Ge
Реакция Содержание Си в фазах, % (ат.) Температура, °C
Ж + (Си) » < 17,5; 12; 12,8 824
Ж + е, » 1] 30,3; 23,75; 26,05 698
е, + т; >* е 23,8; 26,1; 24,8 636
е, » е + С 23,1; 23,1; 18,2 549,5
В •* е + (Ge) 26,25; 25,1; -100 614
Ж « С + е, 21,95; 18,3; 23 743,5
Ж •* р + (Ge) 36,5; 26,65; -100 644
Таблица 9 1. Кристаллическая структура соединений системы Си—Ge
Соеди- нение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а ь С
<’ Mg АР2, Р63/ ттс 0,25845- 0,26035 0,4225— 0,04223 В интервале кон- центраций 12,3— 17,62 % (ат.) Gt [6, 7]
ei W с!2, 1тЗт 0,417 — 0,500 При концентрации 23,2 % (ат.) Ge [5]
е PCu3Ti оР8, Рттп 0,529 0,455 0,420 [6]
9 w с!2, 1тЗт — — — [5]
Электронное соединение на основе Cu5Ge с электронной концентрацией 3/2.
252
Си-Н
Кристаллическая структура соединений приведена в табл. 91.
Параметр решетки (Си) меняется от 0,36149 для чистой Си дч
0,36451 нм при содержании 9,25 % (ат.) Ge [8].
Литература
1 Hume-Rothery W., Mabbot C.W., Channel-Evans К.М. 11 Phil. Trans. Roy Si
London. 1934. V. 233A. P. 1-97.
2. Hume-Rothery W., Raynor G.V., Reynolds P.W., Packer H.K. // J. Inst. M.;
1940. V. 66. № 7. P. 209-239.
3. Owen E.A., Rowlands V.W. // J. Inst. Met. 1940. V. 66. P. 361-375.
4. Reynolds J., Hume-Rotherv W. // J. Inst. Met 1956—1957. V. 85. \ ;
P. 119-127.
5. Schubert K., Brandauer G. // Z. Metallkunde. 1952. Bd. 43. N 7. S. 262-268
6. Olesinski R.W., Abbaschian G.J. // Bull. Alloy Phase Diagrams. 1986. V. 7. N .
P. 28-35.
7. Massalski T.B., Cockayne B. // Acta Metall. 1959. V. 7. N 12. P. 762—769.
8. Pal S.K., Halder S.K., Sen Gupta S.P. // Acta Crystallogr. A. 1978. V. 3-',
P. 140-142.
E.B. Лысов
Cu-H. МЕДЬ—ВОДОРОД
Диаграмма состояния Си—Н не построена. Информация о взаимо
действии Си с Н приводится в справочниках [X, Э, Ш], где в основ
ном рассматривается растворимость Н в Си. По данным работ [X, 11
установлено существование гидрида Си (СиН), который получен при
проведении специальных химических реакций. В работе [1] показа
но, что СиН неустойчив даже при комнатной температуре.
Рис. 136. Си—Н
Высокотемпературны и
участок диаграммы состоя
ния Си—Н (рис. 136) при
давлениях до 50 МПа бы.1
впервые построен авторами
работ [2, 3]. Показано, что I!
понижает температуру пла
вления Си, обнаружено газе
эвтектическое равновесие пр:1
температуре 1072 °C.
Растворимость Н в Си в
твердом и жидком состояния?:
растет с повышением темпера
туры и может быть описан '<
соответственно следующими
уравнениями:
по данным работы [4]
Си-Hf
253
1g X = 0,5 lg p - 2,65 - 2560/7(500-1083 °C);
lg x = 0,5 1g p - 1,35 - 2270/7(1088-1550 °C);
по данным работы [5]
Ig x = 0,5 lg p - 2,77 - 2426/7(500-1083 °C);
Ig x = 0,5 lg p - 2,35 - 2250/7(1100-1550 °C),
где x — концентрация H, % (ат.); 7 — температура, К; р — давле-
ние, Па.
Атомы Си в решетке СиН составляют гексагональную плотную
упаковку с параметрами решетки а = 0,289 (3) нм, с = 0,463 (5) нм
[X].
Литература
1. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
2. Шаповалов В.И., Сердюк Н.П. И Изв. вузов. Цветная металлургия. 1980. № 2.
С. 90-93.
3. Шаповалов В.И., Сердюк Н.П. // Изв. вузов. Цветная металлургия. 1982. № 1.
С. 69-73.
4. Фромм Е. Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред.
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
5. Fromm Е., Jehn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324—326.
В.И. Шаповалов
Cu—Hf. МЕДЬ—ГАФНИЙ
Диаграмма состояния Си—Hf обобщена авторами работы [1] и
приведена на рис. 137 на основании данных работы [2] в области
концентраций 0—20 % (ат.) Hf, работы [3] в области концентраций
20—67 % (ат.) Hf и данных работы [4] в области концентраций
67—100 % (ат.) Hf. При построении ликвидуса авторами работы [1]
использованы также термодинамические расчеты, а стехиометричес-
кие составы соединений в области концентраций 20—45 % (ат.) Hf
приняты по уточненным данным работ [5—7] .Так, состав соединения
Cu51Hf14 принят по данным работ [5, 6] (в работе [3] это соединение
идентифицировано как Cu3Hf, а в работе [2] — как Cu4Hf). Состав
соединения Cu8Hf3 определен в работе [7], а состав соединения
Cu10Hf7 приведен по данным работы [5] (в работе [3] это соедине-
ние описано как Cu3Hf2).
Исследование проведено методами дифференциального термичес-
кого, металлографического и рентгеновского анализов, а также
высокотемпературной металлографии в работе [4] и электронной
микроскопии в работе [2]. В работах использована высокочистая Си,
а также Hf чистотой 99,93 % (по массе) по данным работы [3] или
с примесями 1,5 % (по массе) Zr и 0,02 % (по массе) О2 в работе
[4], или с 3 % (по массе) Zr по данным работы [5]. Однако отмеча-
ется, что влияние Zr несущественно.
254
Cu-Hf
Hf, °/o (по массе)
Си Hf, (am.) Hf
Рис. 137. Cu-Hf
В системе установлено пять соединений, три из которых Cu51HfN
CujgHfy и CuHf2 плавятся конгруэнтно при температурах -1115.
-1025 и 1310 °C соответственно, а два соединения Cu5Hf и Cu8Hf,
образуются по перитектическим реакциям. В системе кристаллизуют
ся четыре эвтектики. В работе [4] установлено существова'ние ката
тектической реакции при температуре 1540 °C с участием (pHf) ь
сплавах, богатых Hf.
Нонвариантные реакции, имеющие место в системе, указаны в
табл. 92.
Растворимость Hf в (Си) определена в работах [3, 9—11]. Ниже
приведены данные по растворимости Hf в (Си) при различных темпе
ратурах по работам [9, 11].
Температура, "С.............. 1050 1000 970 965 900 800 700 600
Растворимость Hf, % (ат.) по дан-
ным работ:
[9].......................... 0,13 0,24 - 0,31 0,15 0,09 0,06 0,03
[Н].......................... 0,15 0,29 0,34 - 0,19 0,10 0,06 0,04
Cu-Hf
255
Максимальная растворимость Hf в (Си) была принята авторами
работы [1] равной 0,4 % (ат.) при температуре 988 °C путем экстра-
поляции данных работы [11].
Растворимость Си в (Hf) определена в работе [4] и составляет при
температурах 1295 и 1540 °C -0,3 и 0,9 % (ат.) соответственно.
Максимальная растворимость Си в (ftHf) при температуре 1540 °C
равна ~4,3 % (ат.) [1].
Кристаллическая структура соединений приведена в табл. 93.
Данные по структуре фазы Cu5Hf отсутствуют.
Таблица 9 2. Нонвариантные реакции в системе Си—Hf
Реакция Содержание Hf в фазах, % (ат.) Температура, °C
Ж + Cu5lHf|4 ” Cu5Hf -12,6; 21,54; 16,66 1055
Ж + Cu5JHf14 ₽ CugHf3 -33,0; 21,54; 27,27 990
Ж » (Cu) + Cu5Hf 7,75; 99,6; 16,66 988
Ж и Cu8Hf3 + Cu10Hf7 -38,6; 27,27; 41,18 970
Ж - Cul0Hf7 + CuHf2 -43,6; 41,18; 66,67 980
Ж « CuHf2 + (aHf) -73,2; 66,67; -99,7 1295±10
(₽Hf) » Ж + (aHf) -95,7; — -99,1 1540
Та блица 93. Кристаллическая структура соединений системы Си—Hf
Соеди- нение Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм Источник
а b С
CusiHf14 Ag51Gdl4 АР68, Рб/т 1,1180 1,11794 — 0,8235 0,82457 [6J [7]
Cu8Hf3 CugHf3 оР44, Рпта 0,78113 0,99490 0,81014 [7]
Cu10Hf7 Ni10Zr7 oCfti, Abai 0,92654 0,92376 1,25872 [7]
CuHf2 MoSi2 tlb, M/mmm 0,31695 0,31643 — 1,11333 1,11530 112] [13]
Литература
1. Subramanian P.R., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1988. V. 9. N 1.
P. 51-56.
2. Perry A.J. // Mater. Sci. Eng. 1974. V. 13. P. 57-62.
3. Маркин Б.Я., Петьков B.B., Стороженко Д.И. и др. // Изв. АН СССР. Металлы.
1974. № 2. С. 209-213.
4. Pieraggi В., Dabosi F., Armand М. // J. Nucl. Mater. 1974. V. 52. N 2.
P. 336-338.
256
Си-Hg
5. Bsenko L. // J. Less-Common Met. 1975. V. 40. P. 365—366.
6. Gabatnuler J.P., White P., Parthe E. // Acta Crystallogr. B. 1975. V. h
P. 608-610.
7. Bsenko L. // Acta Crystallogr. B. 1976. V. 32. P. 2220—2224.
8. Reinback R. // Z. Metallkunde. I960. Bd. 51. S. 292-294.
9. Saarivirta M.J. // Met. Industry. 1963. V. 103. P. 685-688.
10. Watanabe R. // J. Japan Inst. Metals. 1966. V. 30. № 8. P. 754.
11. Watanabe R. // Trans. Nat. Reseach Inst. Metals. (Jap.). 1967. V. 9 Ni
P. 13-19.
12. Nevitt M.V., Downey J.M. // Trans. AIME. 1962. V. 224. P. 195-196.
13. Van Essen R.M., Buschow K.HJ. // J. Less-Common Met. 1979. V. 64
P. 277-284.
Н.Р. Бонену
Cu—Hg. МЕДЬ—РТУТЬ
На рис. 138 приведена диаграмма состояния Си—Hg по дан
ным работы [1], авторы которой обобщили в основном данные работ
[2, 3].
Рис. 138. Си—Hg
Диаграмма состояния системы Си—Hg построена в работе 12] по
результатам дифференциального термического и рентгеновской-'
анализов. В работе использовали электролитическую Си в порошю
и Hg высокой чистоты, сплавы изготовляли в кварцевых ампулах. В
11
Си-Но
257
системе наблюдается широкая область несмешиваемости в жидком
^стоянии в интервале концентраций от 15 до 90 % (ат.) Hg. Крити-
ческая точка на кривой несмешиваемости расположена около темпе-
ратуры 810 °C и при концентрации 50—55 % (ат.) Hg.
Монотектическая реакция Ж + Ж, + (Си) протекает при темпера-
туре 660 °C. Температура и характер нонвариантного превращения
(эвтектический или перитектический) со стороны Hg не определены.
По данным работы [2] в системе образуется только одно соедине-
ние Cu7Hg6 по перитектической реакции Ж + (Си) ₽ Cu7Hg6 при
температуре 128+2 °C. В более ранних работах [X], данные которых
противоречивы, приводятся другие формулы соединений.
Кривая растворимости Hg в (Си) приводится в работе [2]. При
монотектической температуре в (Си) растворяется 5 % (ат.) Hg, при
600, 500, 400, 300 и 200 °C — 4; 3; 1,5; 1,0 и 0,6 % (ат.) Hg соответ-
ственно.
Растворимость Си в жидкой Hg в интервале температур 550—20 °C
изменяется от 3,60 до 0,006 % (ат.) согласно работе [3]. Раствори-
мость Си в (Hg) при температуре 25 °C составляет 0,01 % (ат.) по
данным работы [41.
Соединение Cu7Hg6 имеет ромбоэдрическую сингонию (пр.гр.
R3m) с параметром решетки а = 0,94024 нм, а = 90,425° согласно
работе [2].
Литература
1. Chakrabarti D.J., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1985. V. 6. N 6.
P. 522-527.
2. Lugscheider E„ Jangg G. // Z. Metallkunde. 1971. Bd. 62. N 7. S. 548—551.
3. Jangg G., Palmann H. // Z. Metallkunde. 1963. Bd. 54. S. 364-369.
4. Spengler H. // Metall. 1958. Bd. 12. S. 105-113.
E.B. Лысова
Си—Но. МЕДЬ—ГОЛЬМИЙ
При экспериментальных исследованиях системы Си—Но установ-
лена температура эвтектической реакции в богатой Си области,
которая равна 864 °C согласно работе [11. В работе [2] изучена
растворимость Но в Си в интервале температур 500—1000 °C и уста-
новлено, что максимальная растворимость Но в Си при эвтекти-
ческой температуре составляет -0,02 % (ат.) или 0,06 % (по массе)
и практически нс меняется при уменьшении температуры.
Имеются также данные о кристаллических структурах трех соеди-
нений Cu5Ho, Си2Но и СиНо, причем соединение Си2Но может
иметь как гексагональную структуру по данным работы [31, так и
кубическую структуру согласно работе [4]. На основании приведен-
9 Зак 2144
258
Си-Но
ных выше данных и по аналогии с другими Си-лантаноидными
системами авторы работы [5] заключили, что Си5Но имеет
модификации: высокотемпературную 0Си5Но и низкотемпетарурн, ю
аСи^Но. Температура перехода аСи5Но * рСи5Но составляет окою
970 *С. Кроме того, авторами работы [5] предположено существо» i-
ние еще двух соединений Си7Но2 и Си9Но2 по подобию с экспср
ментально построенными системами Си—Gd, Си—Dy и Си—Ег.
Предполагаемая диаграмма состояния Си—Но приведена ' >
рис. 139 по данным работы [5]. Следует отметить, что температ> ры
плавления соединений, температуры нонвариантных реакции и
составы эвтектики в богатых Си и Но участках приняты по анало
с другими Си-лантаноидными системами. Границы фазовых облас"
в работе [5] рассчитаны на основании определенных термодинам
ческих параметров.
Кристаллическая структура соединений системы представлен^ •*’
табл. 94.
Си—In
259
таблица 9 4. Кристаллическая структура соединений системы Си—Но
у— — “ 1 “ Соединение Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм Источ- ник
а b С
рСи5Но СаСи5 АР6, Рб/ттт 0,4960 — 0,4016 [3]
аСи5Но AuBe5 cF24, F43m 0,7016 — — [4]
Си2Но CeCu2 о/12, Imma 0,6759 0,7280 0,4280 [6]
СиНо CsCl сР2, РтЗт 0,3446 — — [7, 8]
Литература
1. Wunderlin WJ., Beaudry B.J., Daane А.Н. // Trans. AWE. 1965. V. 223. P. 436.
2. Wunderlin W.J., Beaudry B.J., Daane A.H. // Trans. AIME. 1963. V. 227- N 6.
P. 1302-1305.
3. Dwight A.E. // Trans. ASM. 1961. V. 53- P. 479-500.
4. Buschow K.H.J., van der Goot A.S., Birkhan J. // J. Less-Common Met. 1969.
V. 19. P. 433—436.
5. Subramanian P.R., Laughlin D.E.// Bull. Alloy Phase Diagrams. 1988. V. 9- N 3a.
P. 355-358.
6. Storm A.R., Benson R.E. // Acta Crystallogr. 1963. V. 16. P. 701—702.
7. Chao C.C., Luo H.L., Duwez P. // J. Appl. Phys. 1964. V. 35. P. 257—258.
8. landelli A., Palenzona A. // J. Less-Common Met. 1965. V. 9. P. 1—6.
H.P. Бочвар
Cu—In. МЕДЬ—ИНДИЙ
Диаграмма состояния Си—In [1] приведена на рис. 140. В работе
[1] ликвидус системы построен по данным работы [2], однако в
области концентраций 25,5—34,4 % (ат.) In учитывались также
данные работы [3]. Солидус твердого раствора (Си) построен по
данным работы [4], линия сольвуса (Си) приведена по данным
работы [5]. Область существования фазы р приведена согласно
работе [6]. Превращения в твердом состоянии в области концентра-
ций 25—35 % (ат.) In приведены по данным работ [3, 7], а строение
сплавов при содержании 33—39 % (ат.) In — по данным работы [7]
(см. вставку).
В системе установлено существование семи фаз: (Си), (In), Р, т),
Y> 6, Сиц1п9.
Согласно работе [1] фаза у плавится конгруэнтно при температу-
ре 684 °C и содержании -29,35 % (ат.) In. Эти обобщенные значения
температуры плавления и концентрации In основаны на данных,
полученных в работе [2] [685 °C и 29,1 % (ат.) In] и в работе [3]
[682,3 °C и 29,56 % (ат.) In]. Фаза у имеет широкую область гомо-
генности в интервале концентраций'27,7—31,3 % (ат.) In [3].
9*
260
Си—In
In, % (no массе)
О 10 20 JO 50 50 60 70 80 90 Wf
t,°C-----1—П-------П------r~]---I—------1—--------Г~1------П------------1----------—
0 10 20 30 4Z7 50 60 70 80 90 WO
Ou 7/7, % (am) ?n
Рис. 140. Cu—In
Фаза S образуется в твердом состоянии при переходе у ** д при
содержании 29,5 % (ат.) In и температуре 631 °C [2] или 30,15
(ат.) In и 630 °C [3]. Область гомогенности фазы 6 находится в
интервале концентраций 28,9—30,6 % (ат.) In.
Фазы р, ц и Cujjln9 образуются по перитектическим реакциям
Фаза р существует только при высоких температурах и имеет область
гомогенности в интервале концентраций 18,05—24,5 % (ат.) In.
Фаза ц имеет область гомогенности в интервале концентрат, ь
-33—38 % (ат.) In. В этой области согласно работе [7] обнаружена
несколько модификаций фазы ц. Высокотемпературная модификаци!
фазы г) (Cu2_xIn), устойчивая до температуры 440 °C, при охлажд-
нии последовательно превращается в фазу А, устойчивую в интерв
ле температур 480—350 °C и гомогенную в области концентраций
35,5—37,8 % (ат.) In, затем в фазу А', устойчивую в интерва '
температур 450—300 °C и гомогенную в области концентраций 35,4-
37,8 % (ат.) In, и затем в фазу В при температуре ниже 389 °C »
области концентраций 35,6—37,2 % (ат.) In. В этой же облас >
Си—In
261
концентраций -33—38 % (ат.) In существует фаза С, образующаяся
по перитектоидной реакции при температуре 350 °C, гомогенная в
области концентраций 34,1—35,2 % (ат.) In при температуре 200 °C.
Согласно работе [1] при температуре 310 °C образуется фаза
Cubing. В более ранней работе [2] при этой же температуре предпо-
лагали образование фазы ср, устойчивой до комнатной температуры.
Однако в работе [8] не подтверждено существование фазы ср. По
данным работ [8, 9], фаза Сии1п9 существует при температурах
выше 157 °C.
Проходящие в системе нонвариантные превращения указаны в
табл. 95.
По данным работы [4], солидус (Си) при температурах 1054, 989,
973, 906, 852, 789 и 719 °C проходит соответственно через концен-
трации In — 0,34; 1,06; 2,72; 3,93; 6,30; 7,91 и 9,18 % (ат.). При
перитектической температуре растворимость In в (Си) составляет
9,35 % (ат.). Согласно работе [1] растворимость In в (Си) при пери-
тектической температуре 710 °C равна 10,06 % (ат.), а при эвтекто-
идной температуре 574 °C — 10,9 % (ат.).
Таблица 95. Нонвариантные реакции в системе Си—In [1]
Реакция Содержание In в фазах, % (ат.) Температура, °C
Ж + (Си) - р -21,0; 10,05; 18,05 710
Ж+у-г; -35,4; 31,3; -33 667
Ж + А' •* Спц1п9 93; 37,8; 45 310
Ж . р + у 25,65; 24,5; 27,7 678
Ж В + (In) 98,4; -36,7; -100 153
р - (Си) + 5 20,15; 10,9; 29,05 574
Y ₽ Р + 6 27,7; 21,85; 28,9 616
Y * 6 + Г] 31,3; 30,6; 33,4 614
й + В ₽ С 30,6; 35,51; 34,9 350
Си, 1п9 - В + (Ж) 45; 36,7; -98,3 -157
Растворимость In в (Си), определенная в работе [10], составляет
10,85 % (ат.) при температуре эвтектоидного распада и 1,15 % (ат.)
при температуре 262 °C.
Кристаллическая структура соединений приведена в табл. 96.
Наряду с данными, имеющимися в табл. 96, для фазы у в работе [1]
предположительно приводится прототип 1пМп3 (символ Пирсона
С-Р52, пр. гр. Р4 3ли). Фаза 6 по данным работы [3] имеет тетраго-
нальную искаженную решетку у латуни с параметрами а = 0,899 нм,
262
Си—In
с = 0,916 нм; по данным работы [16] фаза 6 является сверхструкт
рой типа NiAl. В работе [17] на рентгенограммах фазы й был
одновременно обнаружены линии сверхструктуры типа NiAl и лиж>
тетрагональной структуры. Для фазы q в работе [1] указан так*
прототип Ni2In (символ Пирсона ЛР6, пр. гр. P63//nmc). Данные
параметре решетки (Си) приведены в работах [2, 5, 10]. При соде;
жании 10,5 % (ат.) In а - 0,37120 нм [5].
Таблица 9 6. Кристаллическая структура соединений системы Си—In
Соеди- нение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а Ь С
р* W cl 12, 1тЗт 0,3014 — — При концентрации 20,5 % (ат.) In. Закалка от 650 °C [1, 2]
У** Си5/.пй cl52, 143т 0,92503 — — При концентрации 29,6 % (ат.) In. Закалка от 650 °C [3J
б Cu7In3 аР40, pl 1,0071 0,9131 0,6724 При концентрации 30 % (ат.) In. а - 90,22°, Р - 82,84°, у - 106,81° [11, 121
п NiAs АР4, Р63/ ттс 0,4289 — 0,5263 При концентрации 36 % (ат.) In. За- калка от 500 °C |7, 13]
А'*’ — — 2,1375 0,7405 0,5218 При концентрации 37 % (ат.) In и температуре 440 “С [7]
А' — — 3,4194 0,7395 0,5262 При температуре 350 °C [7]
CuHIn9 AuCu wC20, СИ т 1,2814 0,4354 0,7363 При температуре 280 °C, р - 54,49’ [9]
Электронное соединение на основе Cu3In с электронной концентрацией 3/2 [14Ц “Электронное соединение на основе Cu9In4 с электронной концентрацией 21/13 [15]. Ромбическая сингония с 55 атомами в элементарной ячейке.
Си—I г
263
Дитература
! 1. Subramanian P.R., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1989. V. 10. № 5.
p. 554—568.
2. Weibke F., Eggers H. // Z. Anorg. All. Chem. 1934. Bd. 220. S. 273-292.
. 3. Reynolds J., Wiseman W.A., Hume-Rothery W.B. // J. Inst. Met. 1951—1952.
V. 80. N 12. Р. 637-640.
4/Mischik T., Hehenkamp T. // Z. Metallkunde. 1987. Bd. 78. N 5. S. 358-361.
5. Jones R.O., Owen E.A. // J. Inst. Met. 1954. V. 82. N 9. P. 445-448.
6. Hume-Rothery W.B., Raynor G.V., Reynolds P.W., Packer H.K. //J. Inst. Met.
1940. V. 66. N 7. P. 209-239.
7. Jain K.C., Ellner M., Schubert K. // Z. Metallkunde. 1972. Bd. 63. N 8.
S. 456—461.
8. Wallbrecht P.C., Blachnik R., Mills K.C. // Thermochim. Acta. 1981. V. 48.
P. 69-82.
9. Rajasekharan T.P., Schubert K. // Z. Metallkunde. 1981. Bd. 72. S. 275—278.
10. Owen E.A., O'Donnel R.A.E. // J. Inst. Met. 1953. V. 81. N 1. P. 479—480
11. Vrolijk J.W.G.A., Wolff L.R. // J. Cryst. Growth. 1980. V. 48. P. 85-92.
12. KOster A.S., Wolff L.R., Visser G.J. // Acta Crystallogr. B. 1980. V. 36.
P. 3094-3096.
13. Макаров E.C. // Изв. АН СССР. Отдел химических наук. 1943. № 4. С. 264.
14. Hume-Rothery W.B., Reynolds P.W., Raynor G.V. // J. Inst. Met. 1940. V. 66.
N 6. P. 191-202.
15. Hume-Rothery W.B., Betterson J.O., Reynolds J. // J. Inst. Met. 1952. V. 80.
N 12. P. 609-616.
16. Hellner E., Laves F. // Z. Naturforsch. 1947. N 2a. S. 177—183.
17. Corderoy D.J.H., Heneycomb R.W.K. // J. Inst. Met. 1964. V. 92. N 1.
P. 65-69.
H P. Бочвар
Cu-Ir. МЕДЬ—ИРИДИЙ
Диаграмма состояния Си—Ir (рис. 141) построена по данным
работы 11] при температурах выше 1138 °C на основании термодина-
мического расчета, а ниже 1200 °C — по данным экспериментальной
работы [2].
В работе [2] применены методы дифференциального термическо-
го, микроструктурного и рентгеновского анализов и использованы
электролитическая Си и 1г высокой частоты.
Диаграмма состояния системы является простой диаграммой
перитектического типа без промежуточных фаз. Единственное нонва-
риантное перитектическое равновесие Ж + (1г) (Си) наблюдается
при температуре 1138 ±5 °C. При этом концентрация 1г в жидкой
фазе, (Си) и (1г) составляет -4, -8 и -97 % (ат.) соответствен-
но |2].
Растворимость 1г в (Си) по результатам рентгеновского анализа
приведена ниже [21:
264
Си—К
Рис. 141. Си—1г
Температура, °C..........................
Растворимость 1г, % (ат.)................
1138 1020 860 700
-8 6,5 5,5 3,1
Растворимость Си в (1г) следующая [2]:
Температура, °C.......................... 1600 1400
Растворимость Си, % (ат.)................ 7,3 5,1
1200 1090 800
3,2 3,0 1,4
Литература
1. Raub Е., ROschel Е. // Z. Metallkunde. 1969. Bd. 60. N 2. S. 142-144.
2. Chakrabarti D.J., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1987. V. 8 N ?
P. 132-136; 195-196.
В.П. Поляков»
Cu-K. МЕДЬ—КАЛИЙ
Диаграмма состояния системы Си—К не построена. Образование
интерметаллических соединений в системе не установлено [1, 21-
Исходя из соотношения атомных радиусов Си и К, а также данные
о растворимости Си в (Na), которая составляет при температур'
плавления менее 1 % (ат.), в системе Си—К следует ожидать пре
дельно малую взаимную растворимость Си и К в твердом состояний
и практически полную несмешиваемость в жидком состоянии [2].
Си—La
265
Литература
1. Kienast G., Verma J. // Z. Anorg. All. Chem. 1961. Bd. 310. S. 143—169.
2. Pelton A.D. // Bull. Alloy Phase Diagrams. 1986. V 7. N 3. P. 231.
Л.Л. Зусман
Cu—La. МЕДЬ—ЛАНТАН
Диаграмма состояния Си—La исследована авторами работы [1] во
всей области концентраций и авторами работы [2] в области содер-
жания La до 33,3 % (ат.). В работе [2] использованы методы диффе-
ренциального термического, микрорентгеноспектрального, рентгенов-
ского анализов и растровой электронной микроскопии. В качестве
исходных материалов использовали Си чистотой 99,99 % (по массе)
и La чистотой 99,5 % (по массе). Сплавы выплавлены в тиглях из
борида азота. В работе [1] использованы методы дифференциального
термического, рентгеновского и металлографического анализов.
Сплавы выплавляли из Си чистотой 99,999 % (по массе) и La чисто-
той 99,9 % (по массе) в тиглях из Мо. На рис. 142 приведена диаг-
рамма состояния Си—La согласно работе [3], в которой суммированы
в основном данные работ [1, 2, 4].
La ,°/о (по массе)
Рис. 142. Си—La
266
Си-La
В работе [1] в системе Си—La найдены соединения Cu6ba, CuJ41
Cu2La и Cuba, а в работе [2] найдено два соединения — X [7,5
(ат.) La[ и Cu4ba. Из указанных выше в системе Си—La ик )И
соединений два соединения Cu6La и Cu2ba плавятся конгруэнтно , ;11
температурах 920 °C (2] (или 905 °C [1]) и 830 °C соответстве;
Соединение Cu6La имеет полиморфное превращение при темпера; )с
-227 °C [3]. Соединения Cu5ba, Cu4ba, Cuba и X образуются
перитектическим реакциям. Соединение X существует в узкой тем; -
ратурной области и распадается по эвтектоидной реакции X ((др +
+ Cu6ba, температура которой точно не установлена (между 850 и
800 °C) [2, 3[. Авторы работы [2] предположительно считают, что
соединение X может соответствовать соединению Cu13ba. Однако в
работе [51 соединение Cu13ba было обнаружено только в сплав? - .
полученных со сверхбыстрой скоростью охлаждения, поэтому сое ля
нсние X отнесено авторами работ [2, 61 к метастабильным сое?? ,
нениям.
Нонвариантные равновесия, проходящие в системе, указаны ?
табл. 97.
Кристаллическая структура соединений приведена в табл. 98.
Таблица 97. Нонвариантные реакции в системе Си—La
Реакция Содержание La в фазах, % (ат.) Температура, “С Источив
Ж + pCu6La « СиДл -22; -14.5 16,7 800 805 [2, 3| И. 4]
Ж + Cu5La я Cu4La — 16,4; 20 743 (21
Ж + Cu2La » Cuba -60; 33,3; 50 525 (1, 4]
Ж 4 (Си) « X — -0; 7,5 873 |2|
Ж » (Си) + [)Си61,а -9, -0; 14,3 864 865 [2, 5| 11, 4|
Ж = Си41л + Си,1л 25,5; 20; 33,3 735 |2|
Ж = CuLa + PU -71; 50; -100 475 IL 4]
Т а 5 л и ц а 9 8. Кристаллическая структура соединений системы Си—La
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
pCu6La СеСи6 о/’28, Рпта 0,8164 0,8165 0,5187 0,5148 0,0231 1,023 121 И, 7|
аСиД-а* — — — — — 131
Си—Li
267
^Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а Ь С
j Cu5La 8 СаСи5 /1Р6, Рб/ттт 0,5189 0,5186 — 0,4107 0,4110 11] [8]
Cu4La — tI90, !4т2 0,8904 — 1,9210 (21
Cu2La А1В2 hP3, Рб/ттт 0,4342 0,4345 — 0,3817 0,3819 (2] П1
CuLa FeB оР8, Рпта 0,7543 0,4616 0,5724 [1]
’Моноклинная сингония, появляющаяся при температуре ниже -227 °C.
Литература
1. Cirafici S., Palensona A. // J. Less-Common Met. 1977- V. 53. N 2. P. 199—203.
2. Meyer-Liautaud F., Allibert C.H., Moreau J.M. //J. Less-Common Met. 1985.
V. ПО. P. 81-90.
3. Okamoto H. // J. Phase Equilibria. 1991. V. 12. № 4. P. 504—505.
4. Chakrabarti D.J., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1981. V. 2. N 3.
P. 302-305.
5. Bloch J.M., Shaltiel D., Davidov D. // J. Less-Common Met. 1981. V. 79.
P. 323-327
6. Subramanian P.R., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1988. V. 9. N 3a.
P. 316-321.
7. Vogel R., Neumann T. // Z. Metallkunde. 1943. Bd. 35. S. 29—42.
8. Pasture! A., Liautaud F., Colinet C., Allibert C.H. // J. Less-Common Met. 1984.
V. 96. P. 93-97.
E.B. Лысова
Cu—Li. МЕДЬ—ЛИТИЙ
Диаграмма состояния Си—Li (рис. 143) построена в работе [1] на
основании данных работ [2, 3]. При этом кривая ликвидуса взята из
работы [2], а кривая солидуса из работы [3] по данным термического
[3], рентгеновского [3] и металлографического [2, 3] анализов. В
системе наблюдается эвтектическое равновесие Ж »* (Си) + (01Л при
температуре, близкой к температуре плавления Li, и отсутствие
промежуточных фаз. Как сообщается в работе [1], пологий ход
кривой ликвидуса может указывать на наличие области несмешивае-
мости в жидком состоянии. На основании использования термодина-
мических данных в работе [1] рассчитана метастабильная кривая
начала расслаивания в жидком состоянии (на диаграмме эта кривая
показана штриховой линией).
268
Си—Lu
Си Li, 7°(ат.) Li
Рис. 143. Си—Li
Растворимость Li в (Си) по данным работы [3] составляет при
эвтектической температуре ~20 % (ат.).
Растворимость Си в жидком Li, рассчитанная в работе [1], состав-
ляет 0,3; 0,04 и 0,01 % (ат.) при температурах 400, 250 и 180,6 °C
соответственно. Параметр решетки (Си) а - 0,3645 нм при 20 % (ат.)
Li [3].
Литература
1. Pelton A.D. И Bull. Alloy Phase Diagrams. 1986. V. 7. N 2. P. 142-144.
2. Pastorello S. // Gazz. Chim. ital. 1930. V. 60. P. 988-992.
3. Klemm W., Valavsek B. // Z. Anorg. All. Chem. 1958. Bd. 286. S. 184-187.
E.B. Лысова
Cu—Lu. МЕДЬ—ЛЮТЕЦИЙ
Диаграмма состояния системы Си—Lu экспериментально не по-
строена. Имеются сведения о существовании трех соединений —
Cu5Lu [1], Cu2Lu [2] и CuLu [Э]. Однако в работе [3] представлена
схематичная равновесная диаграмма состояния Си—Lu (рис. 144)
Температуры плавления указанных выше известных и предполагае-
мых соединений Cu9Lu2? и Cu7Lu2? и температуры эвтектик уставов-
лены экстраполяцией соответствующих данных Си-лантаноидных
систем, для которых экспериментальные фазовые диаграммы извес-
тны. Границы фазовых областей построены с использованием рассчи-
танных термодинамических параметров. Температуры плавления
конгруэнтно плавящихся соединений CugLu2?, Cu2Lu, CuLu согласно
работе [3J получены равными 1040, 1000 и 1200 °C соответственно.
Предполагаемые нонвариантные равновесия в системе Си—Lu указа-
ны в табл. 99.
Кристаллическая структура соединений указана в табл. 100.
Таблица 9 9 Нонвариантные реакции в системе Си—Lu
Реакция Содержание Lu в фазах, % (ar.) Температура, °C
Ж + Cu9Lu2? •* Cu5Lu ~Н,8; 18,18; 16,67 995
Ж + Cu9Lu2? » Cu7Lu2? — 18,18; 22,2 -1000
Cu7Lu2? •* Ж + Cu9Lu2? 22,2; — 18,18 -960
270
Си—Mg
Реакция Содержание Lu в фазах, % (ат.) Температура, t
Ж * (Си) + Cu5Lu 8; -0; 16,67 920
Ж ’ Cu9Lu2? + Cu2Lu -30,7; 18,18; 33,33 910
Ж 1 Cu2Lu + CuLu -34,5; 33,33, 50 985
Ж ’ CuLu + (Lu) 67; 60; -100 1025
Таблица 100. Кристаллическая структура соединений системы Си—Lu
Соеди- нение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм Источник
а Ь С
Cu5Lu AuBe5 сГ24, F43m 0,6970 — — [11
Cu2Lu CeCu2 о/12, Imma 0,4245 0,6627 0,7220 12)
CuLu CsCl сР2, РтЗт 0,3390 — — [Э]
Cu23Lufi’ ThsMn2J сГНб, РтЗт 1,20 — —
’Соединение получено при давлении 7,7 ГПа и на диаграмме (рис. 144) не
указано.
Литература
1. landelli A., Palenzona А. // J. Less-Common. 1971. V. 25. Р. 333—335.
2. Storm A.R., Benson К.Е. И Acta Crystallogr. 1963. V. 16. Р. 701-702.
3. Subramanian P.R., Laughlin D.E. 11 Bull. Alloy Phase Diagrams. 1988. V. 9. \
P. 358-361.
4. Tsvyashchenko A.V. //J. Less-Common Met. 1984 V. 99. P. L9—Lil.
Cu—Mg. МЕДЬ—МАГНИЙ
Диаграмма состояния Си—Mg (рис. 145) построена в работе [1] il
основе обобщения данных работ [2, 3]. Для исследования использова
ны Си чистотой 99,99 % (по массе) 12, 3] и Mg, чистотой 99,99
(по массе) [2] или 99,98 % (по массе) [3]; применены метод!'
металлографического, дифференциального термического, рентгенов
ского |2, 3] и микрорентгеноспектрального анализов [3].
В системе Си—Mg существуют два соединения Mg2Cu и MgCu2.
которые плавятся конгруэнтно: Mg2Cu при температуре 568 °C |2.
3], a MgCu2 при температурах 797 °C [1], либо 819 °C [2], либ<
793 °C [3]. Соединение MgCu2 имеет область гомогенности, макси
мальная протяженность которой составляет 64,7—69 % (ат.) Си.
I
I В системе кристаллизуются три эвтектики (табл. 101).
Растворимость Си в (Mg) приведена ниже:
Температура, °C....... 600 500 485 480 480 470-460 400 300 25
Растворимость Си, %
f (ат.).................. 0,1 0,22 0,23 0,211 0,012 0,011 0,115 0,077 0,007
Источник................ 14] [4] [4] 15] 12) [2] [5] [5] [2]
Таблица 101. Нонвариантные реакции в системе Си—Mg
Реакция Содержание Си в фазах, % (ат.) Температура, °C Источник
Ж » (Mg) + Mg2Cu 14,5; 0,013; 33,3 485 [2]
Ж » Mg2Cu + MgCu2 42; 33,3; 64,68 552±2 [1-3]
Ж * MgCu2 + (Cu) 76,9 68,99; 93,07 725 ±3 [2, 3]
272
Си—Mg
Таблица 10 2. Кристаллическая структура соединений системы Си—Mg
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм • Примечание
а Ь с
Mg2Cu CuMg2 oF48, Fddd 0,5284 0,907 1,825 17]
MgCu2 Cu2Mg cF24, Fd3m 0,7064 — — [8]
0,7030— 0,7044 — — При температур,- 300 °C для обла,: ти гомогенности [3]
0,7025— 0,7082 — — При температура 544 °C для обла,. ти гомогенности [3]
Однако авторы работы [1] считают данные работ [2, 4] по ра<
творимости Си в (Mg) завышенными.
Растворимость Mg в (Си) следующая:
Температура, °C........ 725 722 700 700 600 600 500 500 400 ЗС<
Растворимость Mg, %
(ат.).................. 6,93 6,69 7,48 6,55 5,79 5.53 5,53 4,45 3,33 2,.
Источник............... [3] [2] (6] [2] [6] [2J [2] [6] [6) |6;
Кристаллическая структура соединений указана в табл. 102.
Рассчитанная в работе [9] диаграмма состояния Си—Mg хорошо
совпадает с диаграммой, полученной экспериментально fl].
Литература
1. Nayeb-Hashemi А.А., Clark J.B. // Bull. Alloy Phase Diagrams. 1984, V. 5. N !
P. 36-43.
2. Jones W.S.D. // J. Inst. Met. 1931. V. 46. P. 395-419.
3. Bagnoud P„ Feschottc P. // L. Metallkunde. 1978. Bd. 69. N 2. S. 114-120.
4. Yue A.S. // Phys. Chem. Proc. Metallurg. Metallurg. Soc. Conf. New-York: AIM1
1961. P. 613-614.
5. Степанов Н.И., Корнилов И.И. // Изв. ин-та физико-химического анализ.,
1935. Т. 7. С. 89-98.
6. Рогельберг И.Л. // Труды ин-та Гипроцветметобработка. М.: ГИПРОПМО
1957. Вып. 16. С. 82-89.
7. Schubert К., Anderko К. // Z. Metallkunde. 1951. Bd. 42. S. 321-325.
8. Chatterjee G.P., Mukherjee J.R., Som K.C.J. // J. Mines. Metals. Fuels (India1
1963. V. 11. N 1. P. 12-14.
9. Coughanowr C.A., Ansara J., Luoma R. et al. // Z. Metallkunde. 1991. Bd 82
N 7. S. 574-581.
Е.Е. Лысов,-
Си—Мп
273
(ju—Мп. МЕДЬ—МАРГАНЕЦ
^Диаграмма состояния Си—Мп (рис. 146) построена по данным
работ [1, 2] в интервале концентраций 0—30 % (ат.) Мп и по дан-
ным работ [3, 4] в области сплавов, богатых Мп. В работе [1] ис-
поАзованы электролитические Си и Мп, в работе [2] — катодная Си
чистотой 99,99 % (по массе) и электролитический Мп чистотой
99,98 % (по массе). Исследование проведено методами термического,
металлографического и рентгеновского анализов [1, 3, 4], измерения
твердости и электрических свойств [1], микрорентгеноспектрального
анализа и методом закалок из твердо-жидкого состояния [2]. В
работе [2] построены только кривые ликвидуса и солидуса. В работе
[5] кривые ликвидуса и солидуса приведены на основании результа-
тов измерения ЭДС. Температуры ликвидуса и солидуса сплавов с
содержанием Мп до ~30 % (ат.), полученные по данным работ [1,
Рис. 146. Си—Мп
274
Си—Мп
2, 5], хорошо согласуются между собой. Ликвидус системы Си—Мч
имеет минимум. Согласно обзору [X] точка минимума находится пр
содержании 38,4 % (ат.) Мп или около этого состава и температур
870+5 °C, согласно работам [3, 4] — при содержании -37 % (ат.) Мч
и той же температуре. При температуре 1098 °C имеет место кат;;
тектическое равновесие (бМп) [87,5 % (ат.) Мп] Ж[76 % (аг,
Мп] + (уМп)[88,2 % (ат.) Мп] [3].
Превращения в твердом состоянии связаны с процессами упоряде
чения в сплавах до 30 % (ат.) Мп и с аллотропическими модификл
циями Мп. В системе в твердом состоянии имеет место непрерывны.!
переход от гранецентрированной кубической решетки твердого par -
твора на основе меди (Си) к гранецентрированной кубической решет-
ке (уМп) [6]. Твердый раствор, обозначенный (Си, уМп), упорядс
чивается при температуре 400 °C и содержании ~16 % (ат.) Мч
(МпСи5) и при температуре 450 °C и содержании -25 % (ат.) Мн
(MnCu3) [1].
Границы существования твердого раствора (Си, уМп), определен
ные в работе [4], соответствуют 93,5; 85; 67; 37; 30 % (ат.) Мп при
температурах 900, 800, 700, 600, 500 °C соответственно. При темш
ратуре 727 °C в твердом состоянии протекает либо эвтектоидная
либо перитектоидная реакция, связанная с превращением РМп
«Мп. Концентрация Мп, соответствующая положению грани t
существования твердого раствора при различных температура^
приведена ниже согласно данным работы [4]:
Температура, °C....................... 900 800 700 600 500
Концентрация Мп:
% (ат.).......................... 94,93 86,76 70,14 40,45 33,14
% (по массе)...................... 93,5 85 67 37 30
Растворимость Си в (аМп) и (рМп) если имеется, то очень незнл
чительная. Как отмечается в ряде работ [6—8], в системе Си—Ми <
твердом состоянии может образовываться метастабильная фаза, пре.
ставляющая собой твердый раствор на основе уМп с тетрагонально •
решеткой. В работе [9] проведен расчет диаграммы состояния Си—Mi
на основании использования имеющихся в литературе эксперимси
тальных диаграмм и термодинамических данных в сочетании .
параметрами стабильности для исходных компонентов. Показано, чы?
положение точки минимума на кривой ликвидуса сдвинуто в сторон'
большей концентрации Мп - на 10 % (ат.).
Литература
1. Соколовская Е.М., Григорьев А.Т., Смирнова Е.М. // Журнал неорганически .
химии. № 7. С. 2636—2638.
2. Schiirmann Е., Schulz Н. // Z. Metallkunde. 1971. Bd. 62. N 10. S. 758-762.
Си-Mo 275
\ 3. Hellawell A., Hume-Rothery W. // Philos. Trans. Roy. Soc. London. 1957.
у\249А. N 968. P. 417-459.
\ 4. Dean R.S., Long J.R., Gaham T.E. et al. // Trans. ASM. 1945. V. 34. P. 443-463.
15. Hajra J.P. // Scr. Met. 1979. V. 13. N 13. P. 173-175.
’|6. Basinski Z.S., Christian W. // J. Inst. Met. 1951-1952. V. 80. N 12. P. 659-666.
7. Винтайкин E.3., Удовенко B.A., Дмитриев B.T. и др. // Проблемы металловеде-
ния и физики металлов: Сб. статей. М.: Металлургия, 1976. С. 48—54.
8. Vitek J.M., Warlimont Н. // Metal. Sci. 1976. V. 10. N 1. P. 7-13.
9. Kaufman L. // Calphad. 1978. V. 2. N 2. P. 117-146.
E.B. Лысова
Си—Mo. МЕДЬ—МОЛИБДЕН
Диаграмма состояния Си—Мо экспериментально не построена.
Согласно обзорам [X, Э] Си и Мо не смешиваются в жидком и
твердом состоянии, а взаимная растворимость компонентов при
температуре 900 °C чрезвычайно мала [1]. В работе [2] диаграмма
состояния Си—Мо (рис. 147) построена в основном с учетом данных
работы [3], которые получены исключительно расчетным методом с
использованием термодинамических параметров. В системе согласно
работам [2, 3] имеют место монотектическое и эвтектическое равно-
весия (табл. 103).
рис. 147. Си—Мо
276
Cu-N
При температуре 2585 °C наблюдается также равновесие г;> - +
+ Ж * Ж,.
Растворимость Мо в (Си), полученная методом электромагнитной
индукции в работе [4], составляет 1,91 и 2,50 % (ат.) при темпера-
турах 1900 и 2100 °C соответственно.
Растворимость Си в (Мо), определенная в работе [5] методами
металлографического, рентгеновского анализов и измерения электгм-
сопротивления, равна ~2,3 % (ат.) при температуре 950 °C.
Однако авторы работы [2] отдают предпочтение расчетным дан-
ным работы [3] по растворимости Мо в (Си) и Си в (Мо).
Таблица 103. Нонвариантные реакции в системе Си—Мо
Реакция Содержание Мо в фазах, % (ат.) Температура,
Ж ₽ (Мо) + Ж, 89,5; 98,4; 11,8 2515±100
Ж » (Си) + (Мо) 0,067; 0,061; 99,937 1083±0,1
Литература
1. Linde J.O. // Ann. Phys. Leipzig. 1932. V. 15. Р. 219—247.
2. Subramanian P.R., Laughlin D.E. // Bull. Allov Phase Diagrams. 1990. V. 11. \ 2
P. 169-172.
3. Brewer L., Lamoreaux R.H. // Atomic Energy Review. Special Issul № 7. Molyb '
num: Physico-chemical Properties of its compounds and alloys. Vienna: International Atomic
Energy Agency, 1980. P. 195—356.
4. Driole J., Allibert C„ Bonnier E. 11 Metall. 1979. Bd. 33. N 5. S. 471-474.
5. Башкин М.Л., Савин A.B., Туманов Б.И. и др. // Изв. АН СССР. Отделе, >е
технических наук. Металлургия и топливо. 1961. N? 4. С. 111—114.
K.R. Поварова, Е.В.
Cu-N. МЕДЬ—АЗОТ
Диаграмма состояния Си—N не построена. N не растворяется в
твердой и жидкой Си до температуры 1400 °C [1]. Нитриды меди
Cu3N [6,85 % (по массе) NJ и CuN3 [39,81 % (по массе) N1 получе-
ны взаимодействием аммиака с оксидами Си [2].
Нитрид меди CuN3 имеет кубическую решетку типа }
(символ Пирсона сР4, пр. гр. РтЗт) с параметром решетки и "
= 0,3814 нм [3].
Литература
1. ROntgen Р„ MOllcrF. И Metallwirtschaft. 1934. Bd. 13. S. 31—83, 97-100.
2. Вол А.Е. Строение и свойства двойных металлических систем. М.: Физмат '
1959. Т. 1. 756 с.
3. Juza R. И Z. Anorg. All. Chem. 1941. Bd. 248. S. 118-120.
Н.Р.
Си—Na
277
^u—Na. МЕДЬ—НАТРИЙ
Диаграмма состояния Си—Na нс построена. В обзоре IX] имеется
указание об отсутствии соединений Си с Na. На рис. 148 приведена
предположительная диаграмма состояния Си—Na согласно работе [1].
Авторы предполагают, что в системе Си—Na возможно существо-
вание области несмешиваемости в жидком состоянии с температурой
монотектического равновесия -1084 °C, близкой к температуре
плавления Си.
Рис. 148. Си—Na
В работе 111 обобщены литературные данные по растворимости Си
в жидком Na в интервале температур 225—725 °C. Согласно им рас-
творимость Си в жидком Na составляет 5,9- 10“6 % (ат.) при темпе-
ратуре 225 °C и 9,8 • 10~3 % (ат.) при температуре 725 °C. При
экстраполяции кривой растворимости к точке плавления Na (97,8 °C)
и Си (1084,87 °C)' значения растворимости Си в Na составляют
3,7- Ю'8 и 0,07 % (ат.) соответственно.
Растворимость Na в (Си) нс определялась; однако она до-
лжна быть незначительной вследствие большой разницы в атомных
Радиусах.
Литература
1. Pelton A.D. И Bull. Alloy Phase Diagrams. 1986. V. 7. N 1. P. 25-27.
E.U. Лысова
278
Cu—Nb
Cu—Nb. МЕДЬ—НИОБИЙ
Сведения о типе диаграммы состояния Cu-Nb противоречива
Одни исследователи находят в системе равновесие перитектическою
типа и расслоение в жидком состоянии [1, 2]. Другие авторы счита-
ют, что в системе имеют место равновесие эвтектического типа г
пологая кривая ликвидуса [3, 4], а появление несмешиваемости в
жидком состоянии объясняют сильным влиянием загрязнения Nb
примесями, особенно О [4]. В работах [5, 6] приведены данные с
наличии в системе равновесия перитектического типа и пологой
кривой ликвидуса.
Диаграмма состояния Cu—Nb (рис. 149) построена в работе [11 по
результатам дифференциального термического, рентгеновского анали
зов, измерения микротвердости. В работе использованы Си чистотой
99,996 % (по массе) и Nb электронно-лучевого переплава чистото;’
99,8 % (по массе).
Си-Nd
279
В системе в твердом состоянии установлено наличие двух твердых
растворов на основе компонентов — (Си) и (Nb). Соединения в систе-
ме отсутствуют.
При температуре 1095 °C протекает перитектическая реакция
ЯЦ + (Nb) « (Си), при этом содержание Nb в жидкой фазе составля-
ет -0,14 % (ат.). Монотектическая реакция Ж! « Ж2 + (Nb) проте-
кает при температуре 1675±5 °C [1] или 1550 °C [2]. Монотектичес-
кая точка соответствует содержанию -33 % (ат.) Nb. Растворимость
Nb в (Си) приведена ниже:
Температура, °C.................... 1100 1080 1095 1000 1000 800 20
растворимость Nb:
% (ат.)....................... 1,66 0,1 -0,4 0,45 0,2 0,15 0,14
% (по массе)................. -1,14 0,07 -0,28 0,31 -0,14 0,10 0,096
Источник........................... 12] (3] [1] [2] [1} [1] 12]
Растворимость Си в (Nb) в интервале температур 800—1000 °C
составляет 0,58—0,73 % (ат.), а при температуре 1675 °C — 0,9 %
(ат.) [1]. По данным работы [5] при температуре перитектики она
равна ~2 % (ат.), по данным работы [3] при температуре 1080 °C —
-1,2 % (ат.).
Литература
1. Терехов Г.И., Александрова Л.Н. // Изв. АН СССР. Металлы. 1984. № 4.
С. 210-213.
2. Попов И.А., Ширяева Н.В. // Журнал неорганической химии. 1961. Т. 6.
Вып. 10. С. 2334-2340.
3. Петренко В.Т., Тихоновский М.А., Бердник А.П. и др. // Вопросы атомной
науки и техники. Серия: Общая ядерная физика. 1979. № 9. С. 20—24.
4. Chakrabarti D.J., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1982. V. 2. N 4.
P. 455-460.
5. Allibert C., Driole J., Bonnier E. // Compt. Rend. Acad. Sci. 1969. V. 268 C. N 18.
P. 1579-1581.
6. Kaufman L. // Calphad. 1978. V. 2. N 2. P. 117-146.
H.P. Бочвар
Cu—Nd. МЕДЬ—НЕОДИМ
Диаграмма состояния Си—Nd приведена на рис. 150 согласно
^работе [1] с корректировкой температур плавления исходных компо-
нентов и температуры полиморфного превращения Nd согласно
работе [2]. Исследование проведено методами дифференциального
термического, металлографического и рентгеновского анализов. В
Качестве исходных материалов использовали Си чистотой 99,999 %
(по массе) и Nd чистотой 99,9 % (по массе). В работе [21 обобщены
Экспериментальные данные работ [1, 3, 4J, но предпочтение в основ-
ном отдано данным работы (1 ]. Авторами работы [5] по результатам
280
Си-Nd
Рис. 150. Си—Nd
дифференциального термического и рентгеновского анализов построе-
на часть диаграммы состояния Си—Nd в интервале концентрации
0—33,3 % (ат.) Nd. В изученной области составов найдены те ж.
соединения, что и в работе [1].
В системе образуется шесть соединений, два из которых Cu^No
и Cu2Nd плавятся конгруэнтно при температурах 910 и 840 Ч
соответственно [1, 2]. Температуры плавления соединений Cu6Nd и
Cu2Nd по данным работ [3—5] отличаются от приведенных выше ь
составляют 917, 830 °C [3], 962, 843 °C [4] и 930, 830 °C [5] сосп
ветственно. Остальные соединения Cu5Nd, Cu4Nd, Cu7Nd2 и CuNn
образуются по перитектическим реакциям [1, 2]. Соединение Cu5N<:
имеет область гомогенности. Соединение Cu7Nd2 согласно работав
[1,2] существует только в узкой температурной области 825—785 °C.
Си-Nd
281
Оно не было получено при температуре 20—25 °C ни после закалки
с высокой температуры, ни после отжига. Соединение Cu7Nd2 распа-
дается при температуре 785±5 °C [1]. Существование соединения
Cu7Nd2 не подтверждено в работах [3, 4], хотя авторы работы [4]
указывают на присутствие термических эффектов при температурах
830 и 785 °C. Однако в работе [5] сообщается, что в системе Си—Nd
при температуре 790 °C образуется эвтектика Cu7Nd2 + Cu2Nd, что
предполагает существование соединения Cu7Nd2 вплоть до комнатной
температуры. Такая разноречивость данных требует дальнейших
уточнений в этой части диаграммы.
Нонвариантные равновесия, проходящие в системе, указаны в
табл. 104.
Растворимость Nd в (Си) и Си в (Nd) незначительна.
Кристаллическая структура соединений приведена в табл. 105.
Таблица 10 4. Нонвариантные реакции в системе Си—Nd
Реакция Содержание Nd в фазах, % (ат.) Температура, °C Источник
Ж + Cu6Nd » CujNd 19,8 14,3 16,7 870 [2]
20,5 14,3 16,7 870±5 [1]
19 14,3 16,7 916 13]
20,9 14,3 16,7 847 [4]
— 14,3 16,7 882 [5]
Ж + Cu5Nd ₽ Cu4Nd 21,9 16,7 20 845 [2]
23,0 16,7 20 845±5 [11
23,0 16,7 20 853 [3]
25,3 16,7 20 829 [41
— 16,7 20 870 [51
Ж + Cu4Nd ₽ Cu7Nd2 — 20 22,2 825±5 [1, 2]
— 20 22,2 840 [51
Ж + Cu2Nd ₽ CuNd 51,5 33,3 50 675±5 [1, 2]
60 33,3 50 602 [31
— 33,3 50 691 [4]
Ж ₽ (Си) + Cu6Nd 9 0 14,3 865 [2]
10 0 14,3 865±5 [11
9 0 14,3 874 [3]
282
Си-Nd
Реакция Содержание Nd в фазах, % (ат.) Температура, °C Источник
8 0 14,3 868 14]
— 0 14,3 680 [5]
Ж - Cu4Nd + Cu2Nd 27 20 33,3 770±5 [1, 2]
26 20 33,3 760 [3]
28 20 33,3 785 [4]
Ж «* CuNd + (aNd) 70 50 100 520±5 [1, 2]
67 50 100 478 13]
(₽Nd) - Ж + (aNd) 100 90 100 830 [1J
-100 <91,5 -100 <863 [2]
100 81,6 100 780 [3]
Таблица 10 5. Кристаллическая структура соединений системы Си—Nd
Соеди- нение Прото- тип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источник
а b С
Cu6Nd CeCu6 оР28, Рпта 0,8092 0,5062 1,0105 [6]
0,8064 0,5058 1,0113 [1]
0,7952 0,5044 1,0203 [4]
CusNd CaCu5 hPb, РЬ/ттт 0,5101 — 0,4108 [И
0,5097 — 0,4112 [4]
0,5110 — 0,4104 [7]
Cu4Nd’ CeCu4 оР20, Рппт 0,450 0,806 0,915 (2]
Cu2Nd CeCu2 о/12, Imma 0,4387 0,7059 0,7420 [8]
0,4387 0,7001 0,7418 [1]
0,4384 0,7096 0,7417 [4]
CuNd FeB оРЪ, Рпта 0,7279 0,4514 0,5634 [1]
0,7302 0,4569 0,5578 [4]
Согласно работе [1] соединение Cu4Nd имеет кубическую сингонию с пара-
метром решетки а - 0,527 нм.
Структура соединения Cu7Nd2 не установлена.
Си-Ni
283
Литература
1. Carnasciali М.М., Costa G.A., Franceschi E. // J. Less-Common Met. 1983. V. 92.
N 1. P. 97-103.
2. Subramanian P.R., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1988. V. 9. N 3a.
p. 362—369.
3. Cheng C.S., Nong L.—Q. // Acta Phys. Sinica. 1983. V. 32. N 11. P. 1449—1454.
4. Laks C., Pelleg J., Zevin L. // J. Less-Common Met. 1984. V. 102. N 1. P. 23—28.
5. Gu Han-Shen, Song Jia-ging // Proc. 5th Nat. Symp. Phase Diagr. Wuhan.
Nov. 18-21. 1988. Dig. Wuhan, 1988. P. 17-20.
6. Buschow van der Goot A.S. // J. Less-Common Met. 1970. V. 20. N 4.
P. 309-310.
7. Buschow van der Goot A.S. // Acta Crystallogr. 1971. V. 27. N 6.
p. 1085-1088.
8. Storm A.R„ Benson K.E. // Acta Crystallogr. 1963. V. 16. N 7 P- 701—702.
HP. Бочвар
Cu—Ni. МЕДЬ—НИКЕЛЬ
Диаграмма состояния Си—Ni приведена на рис. 151 с учетом
данных работ [1—3], полученных в разных температурных интерва-
лах. Исследование [1] проведено в интервале температур 1000—
1500 °C с использованием катодной Си чистотой 99,99 % (по массе)
и электролитического Ni чистотой 99,95 % (по массе) методом
микрорентгеноспектрального анализа образцов, закаленных из твер-
до-жидкого состояния. Результаты работы хорошо совпадают с дан-
ными работ [4—6], полученными методами термического [4, 6],
металлографического [5] и микрорентгеноспектрального [6] анализов
в области концентраций 0—100 % (ат.) Ni [4]; 0—21 % (ат.) Ni [5]
и 72—100 % (ат.) Ni [6]. Согласно данным работ [1, 4-4>] диаграмма
состояния Си—Ni характеризуется образованием в процессе кристал-
лизации непрерывного ряда твердых растворов (Си, Ni) с гранецен-
трированной кубической структурой. В работе [2] по данным спек-
трального анализа установлено равновесие Ж « Газ с азеотропным
минимумом при температуре 2500 °C и концентрации -50—60 %
(ат.) Ni; указывается на наличие области расслоения на две фазы
(газообразный и жидкий растворы разного состава) при концентрации
60—100 % (ат.) Ni. В интервале концентраций 0—60 % (ат.) Ni
область расслоения настолько узка, что практически вырождается в
прямую линию.
В работе [3] на основании расчета, проведенного по термодинами-
ческим константам, приведена граница расслаивания твердого раство-
ра и критическая точка несмешиваемости, соответствующая концен-
трации 69,7 % (ат.) и температуре 342 °C [3].
В работах [7, 8] рассчитаны положения кривых ликвидуса и
солидуса системы Си—Ni.
284
Си-Ni
Рис. 151. Си—Ni
Литература
1. Schiirmann Е., Schulz Е. // Z. Metallkunde. 1971. Bd. 62. N 10. S. 758-762.
2. Палатник Л.С., Левченко А.А., Богданова А.Ф., Терлецкий B.E. // Физика
металлов и металловедение. 1958. Т. 6. № 3. С. 540—544.
3. Kaufman L. // Calphad. 1978. V. 2. N 2. Р. 117-146.
4. Feest Е.А., Doherty R.D. // J. Inst. Met. 1971. V. 99. N 3. P. 102-103.
5. Bastow B.D., Kirkwood D.H. // J. Inst. Met. 1971. V. 99. N 9. P. 277-283.
6. SchUrmann E., Prinz B. // Z. Metallkunde. 1974. Bd. 65. N 8. S. 535-539.
7- Pascoe G., Mackowiak J. // J. Inst. Met. 1970. V. 98. N 8. P. 253-256.
8. Tarby S.K., Bowker J.C., Stockdale W.L. // J. Inst. Met. 1972. V. 100. N 12
P. 374-375.
E.B. Лысови
Си—О
285
Си-0. МЕДЬ-КИСЛОРОД
Диаграмма состояния Си—О приведена на рис. 152 по обобщенным
данным работы [ 1 ], в которой использованы экспериментальные
результаты работ [2—5]. На рис. 152 указаны также изобары, соот-
ветствующие давлению О2 в 10, 104 и 105 Па. В системе существуют
три фазы: (Си), Си2О и СиО, что Подтверждается данными по изме-
рению магнитной восприимчивости и рентгеновским анализом [4],
при этом соединения Си2О и СиО не имеют областей гомогенности.
Соединение Си2О плавится конгруэнтно при температуре 1225±5 °C
[2—5] или 1229 °C [1]. Согласно работе [2] соединение СиО плавит-
ся инконгруэнтно при температуре 1122 <5 °C, когда давление О
составляет 0,1 МПа. В работе [1] указывается, что соединение СиО
плавится конгруэнтно при температуре 1230 °C при давлении О2,
равном 2,45 МПа. В системе имеется область несмешиваемости.
Критическая точка монотектического купола соответствует темпера-
туре 1345 °C и содержанию 21,5 % (ат.) О.
Рис. 152. Си—о
Нонвариантные реакции, проходящие в системе при различном
давлении О2, указаны в табл. 106.
Растворимость О в жидкой Си2О возрастает с увеличением давле-
ния О, как показано ниже [5]:
Давление О, КПа.......................... 3,55 20,3 43,56
Растворимость О, % (ат.)................. 36,2 37,86 38,67
286
Си—О
Таблица 10 6. Нонвариантные реакции в системе Си—О
Реакция Содержание О в фа- Темпе- ратура, °C Примечание
зах , % (ат.)
Ж ** Ж, + Си2О 31; 9,57; 33,3 1223 При давлении О2, МПа: 11,75- 10'5 [1]
— — — 1216±5 0,1 [2]
Ж «* (Си) + Си2О 1,73; 0,03; 33,3 1066 27- 10’7 [1, 3]
Ж « Си2О + СиО 39; 33,3; 50 1091 6- 10'2 (1]
Расчетным путем на основании измерения электросопротивления
в работе [6] установлена растворимость О в (Си) при различных
температурах:
Температура, °C..............................
Растворимость О, % (ат.).....................
900 800 735 678
0,013 0,012 0,009 0,008
Кристаллическая структура соединений указана в табл. 107.
Таблица 107. Кристаллическая структура соединений системы Си—О
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а b С
Си2О (куприт) СиО (тенорит) Си2О -CrS сР6, РпЗт тСЪ, СИ с 0,4250 (5) 0,4684 0,3425 0,5129 11, 7] При темпера- туре 26 °C, Р - 99,48° IX, 1]
Литература
1. Neumann J.P., Zhong Т., Chang Y.A. 11 Bull. Alloy Phase Diagrams. 1984. V. 5
N 2. P. 136-140.
2. Gerlach J., Osterwald J., Stichel W. // Z. Metallkunde. 1968. Bd. 59. N 7
S. 576-579.
3. Kuxmann U., Kurre K. // Erzmetall. 1968. Bd. 21. S. 199—209.
4. Osterwald J. 11 Z. Metallkunde. 1968. Bd. 59. N 7. S. 573-576.
5. Osterwald J., Sadat-Darbandi // Metall. 1976. Bd. 30. S. 1057-1058.
6. Bigelow L.K., Cherg J.H. // Metall. Trans. 1976. V. 7. B. N 4. P. 661-669.
7. Пинскер З.Г., Иманов P.M. // Кристаллография. 1964 № 9. С. 413—415.
HP. Бочвар
Си—Os, Си—Р
287
Cu-Os. МЕДЬ—ОСМИЙ
Диаграмма состояния Си—Os не построена. В работе [1] на осно-
вании измерения электросопротивления богатых Си сплавов указано,
что растворимость Os в (Си) чрезвычайно мала.
Литература
1. Linde J.O. // Ann. Phys. Leinzig. 1932. Bd. 15. S. 231.
E.B. Лысова
Cu—P. МЕДЬ—ФОСФОР
На рис. 153 приведена диаграмма состояния Cu-Р, построенная
по данным работы [1] в интервале концентраций 0—25 % (ат.) Р и
по данным работы [2] в интервале концентраций 25—100 % (ат.) Р.
Исследование проведено методами дифференциального термического,
металлографического и рентгеновского анализов. В системе уста-
новлено существование двух соединений СщР и СиР2, плавящихся
конгруэнтно при температурах 1022 и 891 °C соответственно. Соеди-
нение СщР имеет область гомогенности, которая распространяется
от 25 до 31 % (ат.) Р при температуре 833 °C и до 27,5 % (ат.) Р
при температуре 700 °C. В области частной диаграммы CuP2—Р
Р, % (по массе)
Рис. 153. Си-4»
288
Си-Pb
авторы работы [2] построили кривую ликвидуса на основе уравнения
Т-891 =-202,34 [2,61 (х - 0,67)2] - 274,1 [2,61 (х - 0,67)4|. г,’1г
х — концентрация Р, % (ат.); Т — температура, К, и предположи.;и
существование вырожденной эвтектики со стороны Р. Эвтектически:'
реакции, протекающие в системе Си—Р, указаны в табл. 108.
Таблица 108. Нонвариантные реакции в системе Си—Р
Реакция Содержание Р в фазах, % (ат.) Температура.
Ж * (Си) + Си3Р 15,7; 3,4; 25 714
Ж * Си3Р + СиР2 49; 25; 66,7 833
Ж » СиР2 + (Р) — 66,7; -100 '590
Растворимость Р в (Си) по данным измерения параметров решет-
ки в работе [3] приведена ниже:
Температура, °C............................ 700 600 500 400 300
Растворимость Р, °/о (ат.)................. 3,4 2,8 2,2 1,7 !.?
Более низкие значения растворимости Р в (Си) приведены в
работе [4] по данным металлографического анализа:
Температура, °C.................................
Растворимость Р, % (ат.)........................
714 600 400 2«0
2,3 1,6 1,2 <1 ”
Соединение Си3Р имеет гексагональную структуру типа AsCu.
(символ Пирсона ЛР24, пр. гр. Р3с1) и параметры решетки и -
= 0,695 нм, с = 0,712 нм [3, 5].
Литература
1. Lindlief W.E. // Metals and Alloys. 1933. V. 4. P. 85-87.
2. Угай Я.А., Пшестанчик B.P., Гуков О.Я., Анохин В.З. // Изв. АН ССС
Неорганические материалы. 1972. Т. 8. № 6. С. 1015—1018.
3. Mertz J.C., Matnewson С.Н. // Trans. AIME. 1937. V. 124. Р. 59—77
4. Hanson D., Archbutt S.L., Ford G.W. // J. Inst. Met. 1930. V. 43. P. 54—55
5. Haraldsen H. // Z. Anorg. All. Chem. 1939. Bd. 240. S. 337-354.
E.B. Jibice
Cu-Pb. МЕДЬ—СВИНЕЦ
Обобщенная диаграмма состояния Си—Pb по данным различны .
исследователей приведена в справочнике [XJ. Диаграмма состоянп
построена (рис. 154) по результатам дифференциального термине:
кого анализа [1J, которые хорошо согласуются с результатами мш
роскопичсского анализа [2] и химического анализа проб, взятых и >
Cu—Pb
289
Рис. 154. Cu-Pb
расплавов [3]. Система Cu—Pb характеризуется наличием монотекти-
ческого и эвтектического равновесий и двух твердых растворов (Си)
и (РЬ). Область несмешиваемости при монотектической температуре
(954—955 °C [1], 955±5 °C [2]), простирается от 15,3 до 65,3 % (ат.)
Pb [1] или 15,7—63,8 % (ат.) РЬ [2]. Критическая точка на кривой
расслаивания лежит при температуре 990 °C и содержании 34,3 %
(ат.) Pb [1] или 1002 °C и 35,5 % (ат.) РЬ [3]. Эвтектическая точка
расположена при содержании -99,82 % (ат.) РЬ и температуре
326 °C [4J.
Растворимость Си в жидком РЬ определена в работе [4] в интер-
вале температур от эвтектической до монотектической и подтвер-
ждена в работе [3]. Полученная кривая растворимости пересекает
монотектическую горизонталь около 67 % (ат.) РЬ.
Растворимость РЬ в (Си) при температуре 600 °C, определенная
на основании микроскопического и рентгеновского анализов, не
превышает 0,09 % (ат.) [5].
Растворимость Си в (РЬ) не превышает 0,023 % (ат.) [X]. В
работе [6] приведены обобщенная диаграмма Cu—Pb и кривые ликви-
дуса, рассчитанные с использованием термодинамических данных.
Ю Зак. 2144
290
Cu—Pd
Литература
1. Seith W., Johren H., Wagner J. 11 Z. Metallkunde. 1955. Bd. 46. S. 773—Тт-,
2. Pelzel E. // Metall. 1956. Bd. 10. N 21-22. S. 1023-1028.
3. SchOrmann E., Kaune A. // Z. Metallkunde. 1965. Bd. 56. S. 453—461.
4. Kleppa O.Y., Weil J.A. // J. Am. Chem. Soc. 1951. V. 73. P. 4848-4850
5. Raub E., Engel A. // Z Metallkunde. 1946. Bd. 37- S. 76-81.
6. Chakrabarti D.J., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1984. V 5 '.5
P. 503-510.
H P.
Cu—Pd. МЕДЬ—ПАЛЛАДИЙ
Диаграмма состояния Си—Pd, построенная по результатам терми-
ческого и рентгеновского анализов [1] с использованием высокое ис-
той бескислородной Си и Pd, дегазированного в вакууме, подтвер-
ждается данными работы [2], в которой авторы использовали ме i од
дифракционной электронной микроскопии. Диаграмма состояния
Си—Pd характеризуется образованием при кристаллизации непрерыв-
ного ряда твердых растворов (Си, Pd), в твердом состоянии им ст
место образование упорядоченных структур. Имеется много рабо: в
которых исследовано упорядочение, существующее в области стехио-
Рис. 155. Си—Pd
Cu~Pd
291
метрических составов соединения Cu3Pd при температуре 508 °C с
‘’образованием фаз а\ а" (1), а" (2) и соединение CuPd при темпера-
туре около 598 °C с образованием фазы 0 [1—7].
В подробных обзорах системы [5, 6] принят вариант диаграммы
состояния (рис. 155), основанный на признании наблюдающегося в
системе эвтектоидного равновесия, указанного в работе [3] между
фазами а" (2) и 0 при температуре -400 °C. Кроме того, учтены
данные работ [4, 5] о имеющих место двух перитектоидных равнове-
сиях (см. вставку на рис. 155) (Си, Pd) + а' « а" (1) при темпе-
ратуре 495 °C и (Си, Pd) + а" (1) * а" (2) при температуре 475 °C
с образованием одномерных длиннопериодных сверхструктурных
фаз в областях фаз а" (1) и а" (2) [4, 5, 7]. Область фазы а' сущес-
твует в пределах концентрации Pd -7,6—-22 % (ат.), область фазы
л" (1) — в пределах -18—-27 % (ат.), а область фазы а" (2) — в
пределах -27—30 % (ат.). Фаза 0 имеет протяженность от -36 до
,-47 % (ат.) Pd.
Кристаллическая структура фаз приведена в табл. 109.
Таблица 109. Кристаллическая структура фаз системы Cu—Pd
Фаза Прототип Символ Пирсона, пр,гр. Параметры решетки, нм Примечание
а с
При содержании Pd, % (ат.) [1,6]:
а' AuCu3 сР4, РтЗт 0,3646 — 10
0,3672 — 18
а" (1) Cu3Pd tP28, Р4тт 0,3703 0,3655 При содержании 25 % (ат.) Pd, отжиг при темпе- ратуре 300 “С [6, 8, 9] ’
а" (2) — — 0,3710 0,3682 При содержании 28,5 % (ат.) Pd [6, Ю]
₽ CsCl сР2, РтЗпг 0,2965 '—• При содержании 40 % (ат.) Pd [1, 6]
(Си, Pd) Си cF4, Fm3m 0,3626 При содержании Pd % (ат.): 3 |6]
0,3781 — 55 (1, 6]
0,3862 — 88 [6]
10*
292
Си—Pm
Литература
1. Jones F.W., Sykes С. // J. Inst. Met. 1939. V. 65. P. 419-433.
2. Stocks G.M., Winter H. // Electron. Struct. Complex Syst.: Proc. NATO Adv Siudy
Inst. Ghent. 12-23 July. 1982. New-York. London, 1984. P. 463-579.
3. Jaumot F.E., Sawatzky A. // Acta Metall. 1956. V. 4. N 2. P. 118—144.
4. Soutter A., Colson A., Hertz J. // Mem. Sci. Metall. 1971- V. 68. \ ч
P. 575-593.
5. Huang P., Menon S., de Fontaine D. // J. Phase Equilibria. 1991. V. 12. \
P. 3-5.
6. Subramanian P.R., Laughlin D.E. // J. Phase Equilibria. 1991. V. 12 N ?
P. 231-243.
7. Cedel G., de Fontaine D., Drcysse H. et al // Acta Met. Mater. 1990. V. 38. N ! j
P. 2299-2308.
8. Watanabe D., Hirabayashi M., Ogawa S. // Acta Crystallogr. 1955. V 8
P. 510-512.
9. Schubert K., Kiefer B., Wilkens M„ Haufler R. // Z. Metallkunde. 1955. Bd. ль
S. 692-715.
10. Hirabayashi M., Ogawa S. // J. Phys. Soc. Japan. 1956. V. 12. N 3. P. 259—271
E.B. JJbict’eu
Cu—Pm. МЕДЬ—ПРОМЕТИЙ
Равновесная диаграмма состояния системы Си—Pm эксперимен-
тально не построена, и нет данных о соединениях в этой системе.
Однако авторы работы [1] предложили рассчитанный вариант дин -
Си Pm, (ат) Рт
Рис. 156. Си—Pm
Cu—Po, Cu—Pr
293
раммы состояния Си—Pm (рис. 156). Существование соединений
Cu6Pm’ Cu5Pm, Cu4Pm, Cu7Pm2, Cu2Pm и CuPm, температуры
плавления этих соединений и температуры эвтектических реакций
были предположены по аналогии с соединениями в экспериментально
установленных системах Си—Се, Си—Nd, Си—Рг и Си—Sm. Получен-
ные результаты в комбинации с термодинамическим моделированием
позволили авторам работы [1J построить схематичную Си—Pm фазо-
вую диаграмму. Кристаллические структуры и параметры решеток
были рассчитаны на основе систематического изменения кристаллог-
рафических данных (табл. ПО).
Таблица 110. Кристаллическая структура соединений системы Си—Pm [1]
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм
a b c
Cu6Pm CeCu6 оР28, Pnma 0,807 0,506 1,008
Cu5Pm CeCu5 hPf>, 0,509 — 0,410
Cu4Pm CeCu4 oP20, Pnnm 0,446 0,803 0,910
Cu2Pm CeCu2 oil 2, Imma 0,437 0,696 0,740
CuPm FeB oP&, Pnma 0,722 0,454 0,553
Литература
1. Subramanian P.R., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1988. V. 9. N 3a.
P. 369-371.
H. P. Бочвар
Cu-Po. МЕДЬ—ПОЛОНИЙ
В системе Cu—Po предположительно имеется по крайней мере
одно соединение, однако подтверждение этому рентгеноструктурным
анализом получено не было [Э].
Н.Р. Бочвар
Си—Рг. МЕДЬ-ПРАЗЕОДИМ
Авторы работы [1] предложили вариант диаграммы состояния
Cu—Pr (рис. 157) в основном на базе диаграммы из работы [2] с
некоторыми уточнениями температур плавления и состава богатых
Си эвтектик, а также предположения о существовании соединения
Cu5Pr в соответствии с другими Cu-лантаноидными системами.
В системе установлено пять соединений, два из которых Cu6Pr и
Си2Рг плавятся конгруэнтно при температурах 962 и 841 °C соответ-
294
Cu-Pr
Си Рг, % (am.) ?r
Рис. 157. Си—Рг
ственно [2]. Другие соединения образуются по перитектическим
реакциям (табл. 111).
Растворимость Си в (Рг) и Рг в (Си) очень незначительна, что
следует из фазовой диаграммы, приведенной в обзоре [X].
Кристаллическая структура соединений приведена в табл. 112.
Таблица 111. Нонвариантные реакции в системе Си—Рг
Реакция Содержание Рг в фазах, % (ат.) Температура, “С Источник
Ж + CusPr •* Cu5Pr -24,4; 14,3; 16,7 837 И!
Ж + Cu5Pr ₽ Cu4Pr -25,1; 16,7; 20 824 [1, 2]
Ж + Cu2Pr - CuPr -61,3; 33,3; 50 563 [2]
Ж ₽ (Си) + Си6Рг -7,5; -0; -14,3 870 [1, 2]
Ж ₽ Си4Рг + Си2Рг -27; 20; 33,3 770 И, 2]
Ж ₽ СиРг + (аРг) 68; 50; -100 472 [2]
(|}Рг) ₽ Ж + (аРг) -100; -85; -100 795 [И
Си-Pt
295
Таблица 112. Кристаллическая структура соединений системы Си—Рг
?Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источ- НИК
a b c
~~ Cu6Pr* CeCu6 oP28, Pnma 0,8101 0,5081 1,0140 [3]
CujPr CaCu5 hP6, Pf>/mmm 0,5122 — 0,4109 14]
. Cu4Pr CeCu4 oP20, Pnnm 0,454 0,808 0,922 15]
Cu2Pr CeCu2 о/12, Imma 0,4400 0,7024 0,7435 16]
CuPr FeB oP8, Pnma 0,7343 0,4584 0,5604 HI
*В работе [7] подтверждена структура типа СеСи6 при проведении рентгенов-
ского анализа на порошках литых сплавов, однако не исключается возможность
структуры типа Th2Ni,7 (символ Пирсона hP38, пр. гр. Р(>3/ттс)
Литература
1. Subramanian P.R., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1988. V. 9. N 3a.
P. 372—377.
2. Canneri C. // Metallurgia italiana. 1934. V. 26. P. 869—871.
3. Buschow K.H.J., van der Goot A.S. 11 J. I^ss-Common Met. 1970. V. 20.
P. 309-313.
4. Dwight A.E. 11 Trans. ASM. 1961. V. 53. P. 479—500.
5. Pop J., Rus E., CoIdea M., Pop O. // Phys. Status Solidi. 1979. V. 54A.
P. 365-368.
6. Storm A.R., Benson K.E. // Acta Crystallogr. 1963. V. 16. P, 701—702.
7. Лейтус Г.М., Боева О.А., Жаворонкова K.H. и др. // Изв. АН СССР Неорга-
нические материалы. 1991. Т. 27. № 4. С. 721—724.
Н.Р. Бочвар
Си—Pt. МЕДЬ—ПЛАТИНА
Исследования сплавов Си—Pt проанализированы и суммированы
в справочнике [X] (рис. 158). Ликвидус системы исследован при
концентрации до 43 % (ат.) Pt [1], а превращения в твердом состо-
янии — во всей области концентраций методами термического анали-
за [2|, измерения электросопротивления [2, 3] и электродвижущих
сил [4].
Сплавы Си—Pt при кристаллизации образуют непрерывный ряд
твердых растворов. В твердом состоянии образуются упорядоченные
структуры в широком интервале концентраций при температурах
ниже -645 и 812 °C. Согласно работе [31 наивысшая степень упоря-
дочения достигается при 22,5; 50; 72,5 и 86 % (ат.) Pt, что соответ-
ствует упорядоченным структурам соединений Cu3Pt, CuPt, CuPt3 и
CuPt7. В сплавах области упорядоченного раствора соединения CuPt
обнаружено существование двухфазных областей, включающих
совместное присутствие упорядоченной и неупорядоченной структур.
296
Си-Pt
Рис. 158. Cu-Pt
В работе [Ш] указывается, что двухфазные области имеют место при
концентрациях 42,5—47,5 и 49,8—50 % (ат.) Pt.
Кристаллическая структура соединений приведена в табл. ИЗ.
Существование упорядоченной структуры соединения CuPt7 нс
было точно доказано рентгенографическим исследованием [3]. Сведе-
ния о параметре решеток разупорядоченных твердых растворов
приведены в работе [Ш].
Таблица 113. Кристаллическая структура соединений системы Си—Pt
Соединение Прототип Символ Пирсона, пр.гр. Параметры решет- ки, нм Примечание
Cu3Pt AuCu3 сР4, РтЗт — [X]
CuPt‘ — — 0,788 р - 91° [П]
CuPt3 Си cFA, Fm3m 0,3849 При содержании 72,5 % (ат.) Pt |П]
Тригональная сингония.
Си—Ри
297
Литература
1. Darinckel F. // Z. Anorg. All. Chem. 1907. Bd. 54. S. 335—338.
2. Курнаков H.C., Не.милов B.A. // Журнал неорганической химии. 1933. Т. 210.
С- 1—12.
3. Schneider A., Esch V. // Z. Elektrochem. 1944. Bd. 50. S. 290—301.
4. Weibke H., Matthes H. // Z. Elektrochem. 1941. Bd. 47. S. 421—432.
E.B. Лысова
Cu—Pu. МЕДЬ—ПЛУТОНИЙ
Диаграмма состояния системы Си—Pu построена в работе [1].
Позднее авторами работы [2] были уточнены температуры фазовых
превращений, однако общий характер строения системы сохранился.
На рис. 159 диаграмма состояния Си—Pu приведена по данным
работы [2J, но температуры полиморфных превращений Pu скоррек-
тированы в соответствии с установленными стандартами.
Система характеризуется наличием четырех соединений, два из
которых плавятся конгруэнтно: Cu17Pu4 при температуре 1000 °C
либо при 954 °C [1], а соединение Cu2Pu при температуре -900 °C
[2] или 865 °C [11. Два других соединения Cu6Pu и Cu4Pu образуют-
ся по перитектическим реакциям. Однако авторы работы [1] в отли-
чие от авторов работы [2] указывают, что ближайшие к Си соедине-
ние, плавящееся инконгруэнтно при температуре 926 °C, имеет
формулу CU]]Pu6 вместо Cu6Pu.
Имеющиеся в системе перитектические и эвтектические равнове-
сия указаны в табл. 114.
Таблица 114. Нонвариантные реакции в системе Си—Pu
Реакция Содержание Ри в фазах, % (ат.) Температура, °C Источник
Ж + CU|7Pu4 * Cu6Pu - 19,04; 14,38 -950 [1, 2]
Ж + Cul7Pu4 ° Cu4Pu - 19,04; 20 -960 [2]
Ж « (Си) + Си6Ри 9,5; -0; 14,38 885 [2]
9,0; -0; 14,38 881 [11
Ж " Си4Ри + Си2Ри 30; 20; 33,3 870 [2]
29,5; 20; 33,3 849 [Ц
Ж ₽ Си2Ри + (вРи) 93,5 33,3; -97 625 [2]
94; 33,3; 94 625 [1]
298
Си—Ри
Рис. 159. Си—Ри
Таблица 115. Кристаллическая структура соединений системы Си—Ри
Соеди- нение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источ НИК
а b с
Cu6Pu CeCu6 оР28, Рпта 0,8050 (3) 0,5025 (3) 1,0059 (6) 12]
Cu2Pu Се Си 2 о/12, fmma — — — ]Ш]
В твердом состоянии имеют место пять нонвариантных равновс
сий, связанных с полиморфизмом Ри. Характер этих равновесии
(эвтектоидный или перитектоидный) нс установлен.
Растворимость Ри в (Си) не определялась. Максимальная раство
римость Си в (еРи) составляет около 3 % (ат.) [1, 2].
Кристаллическая структура соединений приведена в табл. 115.
Cu—Rb, Си—Re, Cu—Rh
299
Литература
1. Rhinehammer T.B., Elter D.E, Jones // Plutonium. 1960. London: Cleaver-Hume
press Ltd., 1961. P. 289-300.
2. Кугайцев В.И., Чеботарев H.T., Андрианов M.A. и др. // Атомная энергия.
1967- Т- 23. Вып. 6. С. 511—519.
Е.В. Лысова
Си—Rb. МЕДЬ—РУБИДИЙ
Диаграмма состояния Си—Rb не построена, и образование интер-
металлических соединений в системе не установлено [1]. Исходя из
соотношения атомнйх радиусов Си и Rb, следует ожидать их взаим-
ную растворимость в твердом состоянии предельно малой. Исходя из
данных по растворимости Си в жидком Na, составляющей при темпе-
ратуре плавления Си менее 1 % (ат.), и учитывая, что раствори-
мость при переходе от Li к Сз уменьшается, следует ожидать практи-
чески полную несмешиваемость Си и Rb в жидком состоянии.
Литература
1. Kieast G., Verta J. // Z. Anorg. All. Chem. 1961. Bd. 310. S. 143—169.
Л.Л. Зусман
Cu—Re. МЕДЬ—РЕНИЙ
Диаграмма состояния Си—Re не построена. В работе [1] установ-
лена несмешиваемость Си с Re в жидком и твердом состояниях во
всем интервале концентраций. В работе [2] показано, что раствори-
мость Re в (Си) не превышает (1—2)10"'* % (по массе).
Литература
1. Holland-Nell V., Sauerwald F. // Z. Anorg. All. Chem. 1954. Bd. 276. N 3—4.
S. 155-158.
2. Knook B., Star W.M., van der Rongen H.S.M., van der Berg G.J. // Physica.
1964. V. 30. N 6. P. 1124-1130.
M.A. TАлкина
Cu—Rh. МЕДЬ—РОДИЙ
Авторы работы [1] построили диаграмму состояния системы
Cu—Rh (рис. 160) с использованием в основном данных работы [2].
В работе [2] для исследования применены методы металлографичес-
кого и рентгеновского анализов и использованы электролитическая
Си и Rh чистотой 99,9 % (по массе). Между Си и Rh образуется при
300
Си-Rh
Рис. 160. Си—Rh
кристаллизации непрерывный ряд твердых растворов, который при
понижении температуры до 1150 °C при содержании 60 % (ат.) Rh
расслаивается на два твердых раствора (Си) и (Rh). При температуре
1000 °C область расслоения существует в интервале концентраций
35—75 % (ат.) Rh, при 800 °C — в интервале 25—90 % (ат.) Rh и при
600 °C — в интервале 23—93 % (ат.) Rh. Рентгеновские данные
работы [3] по измерению параметров решеток показали, что границы
твердых растворов (Си, Rh) при температурах 600—800 °C лежат при
концентрациях 9,2 и 81,5 % (ат.) Rh.
В более ранней работе [4] указывается, что система Си—Rh явля-
ется диаграммой перитектического типа с ограниченной раствори-
мостью компонентов в твердом состоянии и наличием упорядоченных
фаз при 50, 75 и возможно 25 % (ат.) Rh. Однако в работе [2] эти
данные не подтвердились. В работе [3] методом быстрой закалки
получен непрерывный ряд метастабильных твердых растворов, что
говорит в пользу диаграммы, предложенной авторами работы [2].
Литература
1. Chakrabarti D.J., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1982. V. 2. N 4
P. 460-462.
2. Raub C.J., ROschel E., Menzel D„ Gadhof M. // Metall. 1971. Bd. 25. N 7.
S. 761-762.
Cu—Ru, Cu—S
301
3. Luo H.J., Duwer P. // J. Less-Common Met. 1964. V. 6. P. 248—249.
4. Звягинцев О.Б., Бруновский Б.К. 11 Известия сектора платины института по
изучению платины и других благородных металлов. М.: Изд-во АН СССР, 1935. Т. 12.
С- 37-66.
Н.Р. Бочвар
Cu-Ru. МЕДЬ—РУТЕНИЙ
Диаграмма состояния Cu—Ru исследована в работе [1] на основа-
нии расчета эмпирических критериев, описывающих взаимодействие
металла в жидком состоянии, и экспериментальных исследований
сплавов методами металлографического, термического анализов и
измерения микротвердости. Си и Ru не смешиваются в жидком
состоянии; взаимная их растворимость в твердом состоянии отсут-
ствует.
Литература
1. Янсон И.Э. // Материалы конференции молодых ученых химического факуль-
тета Моск. гос. ун-та. Москва 25—28 мая. 1985. Ч. 1. М., 1985. С. 129—132. Ден. в
ВИНИТИ 5.12.85. № 8373-В.
Н.Р. Бочвар
Cu-S. МЕДЬ—СЕРА
Несмотря на многочисленные исследования системы Cu—S, она до
настоящего времени еще полностью не изучена, так как данные
рентгеновских исследований о числе фаз и об их кристаллической
структуре не всегда согласуются с имеющимися вариантами диаграм-
мы состояния. Диаграммы состояния, приведенные в справочниках
[X, Э], в дальнейшем неоднократно изменялись и уточнялись. Диаг-
рамма состояния Cu—S (рис. 161, а) построена по совокупности работ
[1—3J, низкотемпературная часть диаграммы [содержание 33—37 %
(ат.) S] приведена на рис. 161, б по данным работы [4]. Данные о
диаграмме состояния системы Cu—S [до 40 % (ат.) S] согласно
работе [5] хорошо согласуются с данными, приведенными на рис. 161
[1—3]. В системе Cu—S кроме соединений Cu2S и CuS существуют
соединения Cuj 96S, Cu7S4 и Cu9S5. Из них соединения Cu2S, Cuj 96S
и Cu9S5 обладают несколькими полиморфными модификациями:
соединения Cu2S и Cuj 96S триморфны, а соединение Cu9S5 —
Диморфно [6].
Соединение Cu2S плавится конгруэнтно при температуре 1130 °C
[X] и имеет область гомогенности. Существование широкой одно-
фазной области при высоких температурах установлено, исходя из
предположения авторов работы [6], что обычно наблюдаемая фаза
Cu2 XS находится между фазами Cu2S, Cu1 96S и Cu9S5. Область
302
Cu-S
S,(по массе)
a)
Рис. 161. Cu-S
гомогенности соединения Cu2S уменьшается с температурой, и при
70 °C и содержании 35,65 % (ат.) S соединение Cu9S5 (дигениг»,
обозначенное на рис. 161, б как фаза 1, эвтектоидно распадается с
образованием фаз 5 (Cuj 96S) и 4 (Cu7S4). Фазы (см. рис. 161, б) 2
(ковеллин) и 3 (’’остающийся голубым” ковеллин) являются модифи-
кациями соединения CuS, фаза 5 (джарлеит), фаза 6 (гексагональный
халькозин) и фаза 7 (халькозин) — модификациями соединения
Cu2S.
В табл. 116 приведены нонвариантные реакции, имеющие место
между названными фазами 1—7, как по данным работы [4] (рис. 161.
б), так и для сравнения по данным работ [7, 8]. В работах [7, 81
имеется отличие в характере и температурах фазовых превращении,
например, в образовании фазы 5.
Соединение CuS образуется по перитектической реакции про
температуре 507 °C: Ж + Cu2S * CuS.
В системе имеют место две монотектические реакции при темпе
ратурах 1104 и 812 °C. Со стороны Си максимум области несмешива-
емости в жидком состоянии имеет место при температуре 1510 °C и
концентрации -16 % (ат.) S [3]. Указанные на диаграмме концен
Cu-S 303
грации жидких фаз, участвующих в моиотектическом равновесии со
стороны Си (2,62 и 32,69 % (ат.) S согласно работе [3]), а также
концентрация эвтектической точки со стороны Си (1,47 % (ат.) S и
температура эвтектики 1067 °C по данным работы [3]) находятся
в хорошем соответствии с данными, приводимыми ранее в справоч-
нике [X].
таблица 116. Нонвариантные реакции в системе Си—S при концентрации
$ рг -33 до 37,5 % (ат.)
Реакция Содержание S в фазах, % (ат.) Темпе- ратура, °C Источ- ник
1*5 + 4 —; — 70 [41
35,65*0,03; 34,0810,02; 36,3610,04 72±3 17, 8]
(Си) + 1-6 -0; 33,344; 33,340 435 (1, 4, 8]
(Си) + 6-7 — — — 103 [4]
-0; 33,310,02; -33,3310,02 103,515 [7. 8]
1 + 7-5 83 14]
1 + 6-5 35,29±0,03; 33,4710,05; 33,9910,02 93 И, 7, 8)
6-7+1 93 14]
1 + 3-4 7613 14]
36,1710,02; 5012; 36,3610,04 7513 [7, 8]
1+2-3 —; 157 [4]
Растворимость S в Си незначительна. Она указана в табл. 117
согласно работам [Э].
Кристаллическая структура соединений приведена в табл. 118.
Кроме сульфидов, указанных в табл. 118, известны также сульфиды
Си с гексагональной сингонией: Cu39S28 (минерал снионковит) с
параметрами а = 2,2962 нм, с = 4,1429 нм и Cu9S8 (минерал яровит)
с параметрами а - 0,3800 нм, с - 6,726 нм [17].
Таблица 117. Растворимость S в Си
Температура, °C Растворимость S в очень чистой Си (99,999 %) Растворимость S в бескислород - ной Си
% (ат.) % (по массе) % (ат.) % (по массе)
1000 0,0140 0,0070 0,0170 0,0085
900 0,0052 0,0026 0,0092 0,0046
800 0,0018 0,0009 0,0046 0,0023
700 0,0006 0,0003 0,0022 0,0011
_ 600— 0,0002 0,0001 0,0008 0,0004
304
Cu—S
Таблица 118. Кристаллическая структура соединений системы Cu—S
Соединение Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм Примечание
а Ь С
Cu2S (гексаго- нальный халь- козин) Cu2S АРб, Pfhjmmc 0,3981 — 0,8761 При температ-, ре 470-103 °C [Э]
Cu2S (халько- зин) Cu2S тР1Ы, P2Jc 1,5246 1,1884 1,3494 При темпера г, ре ниже 103 "С Р = 116,35 [9;
Cu2S*' — — 0,5735 (10) — — При температ) ре выше 470 С [6]
Си, 96S 2 (джарлеит) — — 0,5707 — — При темперап ре выше 100 [Э]
^ui,96^ 3 (джарлеит) — —, Ртпт 2,692 1,571 1,356 При темпера i v ре ниже 83 °C ПО]
^ul,96^ (джарлеит) — - Р2х1п 2,6897 1,5745 1,3465 При темпера!.' ре ниже 83 °C, состав Cu3,Sl6 Р - 90,13° [10!
CugS*5 (дигенит) — — 0,5570 (3) 0,5551 (3) — — При темпера i v ре ниже 78 °C. состав Cu4 g?S, состав Си, 76S 16, Э] '
Cu9S*2 (дигенит) — — 0,5610 (6) — — При темпера г ре 300 °C (6, Ji
Си9-А (дигенит) Cu9_aS —, РтЗт 0,5567 — — При температ ) ре выше 73 С [Ш]
Cu7S4 (ВТ) (анилит) Cu9Sb5 cFM, Fm3m 0,5556 — — При темпера I > ре выше 37 'С. состав Си, 75S ПИ
Cu7S4 (НТ) (анилит) Hf3Cug оР44, Pnma 0,7887 0,7826 1,108 11ри темпера i v ре 37 °C [Hi
0,789 0,784 1,101 [12]
Cu—S
305
Соединение Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм Примечание
а Ь с
CuS’6 (ковеллин) *'Гексагона *2Гранецен *3Ромбичес *4Моноклиг *5Гранецен *6Согласно структурой тиг а - 0,5387 нм. CuS льная си! грироваш кая синго 1ная синп трирован! работе [1 a ZnS (а API 2, Pbjmmc тгония. чая кубическая ния. эния. чая кубическая 6] для соедин чмвол Пирсона 0,375 0,3794 0,3796 сингония сингония ения Си cF8, пр. со свер? S извеш гр. F4m) 1,623 1,6332 1,6382 [Структуре на модис и параме [X] [Э] Давление 0,1 МПа [13] )Й. эикация со тром решетки
Сведения о метастабильных фазах Cu2S, Cuj %S, Cu9S5 приведены
в табл. 119.
Таблица 119. Кристаллическая структура метастабильных соединений
Системы Cu—S
Соедине- ние Прото- тип Символ Пирсо- на, пр.гр. Параметры решет- ки, нм Примечание
а С
Cu2S Cu2S (Pl 2, Р432,2 0,3996 1,1287 При давлении 80 МПа [Ш]
Cu2S*' — 0,8016 2,2536 [V - С]
Cu2S’2 — —, Fm3m 0,5387 — [16]
Си, 96S — Р432,2 0,4008 1,1268 При температуре 100—470 °C [Э]
Cu9-xS5 (промежу- точный дигенит) — —, РЗт 0,383 4,688 [14]
CuS2’3 FeS2 (пирит) РаЗ (?) 0,57891 При температуре 250-750 °C и давлении 2-6,5 ГПа [14, 15]
306 ___________ Cu-Sb
Соедине- ние Прото- тип Символ Пирсо- на, пр.гр. Параметры решет- ки, НМ Примечание
а с
CuS (ко- веллин) CuS /ьР12, Р63/ттс 0,3729 1,6111 При давлении 3,3 ГПа [13]
''Тетрагональная сингония.
*2Кубическая сингония.
*3Согласно работе (14) CuS2 может иметь ромбическую сингонию.
I
Литература
1. Roseboom Е.Н. // Econ. Geolog. 1966. V. 61. N 4. Р. 641-672.
2. Rau Н. И J. Phys. Chem. Solids. 1974. V. 35. N 10. P. 1415-1424.
3. Moulki M., Osterwald J. // Z. Metallkunde. 1979. Bd. 70. N 12. S. 808-810.
4. Burton P.B. // Econ. Geolog. 1973. V. 68. N 3. P. 455-463.
5. Бурылев Б.П., Федорова H.H., Цемехман Л.Ш. // Журнал неорганически
химии. 1974. Т. 19. Вып. 8. С. 2283-2285.
6. Djurle S. // Acta Chem. Scand. 1958. V. 12. P. 1415-1426.
7. Potter R.W., II. // Econ. Geolog. 1977. V. 72. N 8. P. 1524-1542.
8. Chakrabarti D.J., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1982. V. 2. N '
P. 254-271.
9. Evans H.T. // Z. Kristallogr. 1979. Bd. 150. N 1-2. S. 29^-320.
10. Takeda H., Donnay Roseboom E.H. et al. // Z. Kristallogr. 1967. Bd. 12
N 3-4. S. 404-413.
11. Gronvold F., Westrum E.F. // Amer. Mineral. 1980. V 65. N 5—6. P. 574—57
12. Koto K., Marimoto N. // Acta Crystallogr. B. 1970. V. 26. N 5. P. 915—924.
13. Takeuchi Y., Kudoh Y., Sato G. // Z. Kristallogr. 1985. Bd. 173. N I-'
S. 119-128.
14. Воган Д., Кренг Дж. Химия сульфидных металлов. М.: Мир, 1981. 575
15. King Н.Е., Prewitt С.Т. // Am Mineral. 1979. V. 64. N 7. P. 1265-1271.
16. Казинец M.M. // Кристаллография. 1969. Т. 14- Вып. 4. С. 704—706.
17. Goble R.J. // Canad. Mineral. 1980. V. 18. N 4. P. 511-518.
с.
Ю.Б. Кузьма, E.B. ЛыСО‘Л<
Cu-Sb. МЕДЬ—СУРЬМА
Изучению взаимодействия Си и Sb посвящено более 50 публик.
ций. Достаточно полный обзор их дан в справочнике IX]. В даль-
нейшем были проведены дополнительные исследования диаграмм •
состояния Си—Sb [Э, Ш, 1—3], но в общем ее основное строен. .'
осталось такое же, какое указано в справочнике [X].
Представленная на рис. 162 диаграмма состояния Си—Sb привел
на по данным работы [X] с некоторыми дополнениями в облаем!
образования фазы в' согласно работе [2].
В системе образуются шесть промежуточных фаз: р, которой пр1'
писывается формула Cu3Sb, а также Cu2Sb, е, е', т], к. Фазе Р
307
Cu-Sb
соответствует максимум на диаграмме состояния при температуре
684 °C и содержании -30 % (ат.) Sb (28,6 % (ат.) Sb [4, Э]). Фаза
Р имеет широкую область гомогенности: от 19,4 до 30,8 % (ат.) Sb.
При температуре 435 °C фаза р эвтектоидно распадается на фазу к
и Cu2Sb. Фаза Cu2Sb образуется по перитектической реакции из
жидкости, содержащей 46 % (ат.) Sb, и фазы Р при температуре
586 °C и устойчива до комнатной температуры. Она имеет узкую
область гомогенности, не более 0,6 % (ат.) [Э, 5]. Фаза ц образуется
по перитектоидной реакции при взаимодействии твердого раствора на
основе Си и фазы Р при температуре 488 °C и эвтектоидно распадает-
ся при температуре -400 °C на (Си) и фазу в. Фаза в образуется по
перитектоидной реакции при температуре 462 °C из т] и р и устойчи-
Ва до комнатной температуры. Фаза к образуется перитектоидно при
температуре -450 °C из фаз е и р и распадается эвтектоидно при
температуре 360 °C на фазу в' и Cu2Sb [2]. Фаза в' образуется
перитектоидно из фаз емки распадается эвтектоидно на фазы в и
Cu2Sb. Температурный диапазон существования фазы б приблизи-
тельно 260-390 °C.
308
Си-Sb
В системе имеют место два эвтектических превращения Ж «
* (Си) + р при температуре 645 °C и содержании 19,0 % (ат.) Sb
и Ж ** Cu2Sb + (Sb) при температуре 526 °C и содержании 62,3 f
(ат.) Sb.
Растворимость Sb в (Си) представлена в справочнике [X] к.и
наиболее достоверная при обобщении ряда исследований. Последую-
щие исследования, результаты которых опубликованы в справочнике
[Э], подтверждают данные, приведенные на диаграмме состояния
Си—Sb (рис. 162) по работе [X]. Растворимость Sb в (Си) при отдель-
ных температурах согласно справочнику [Э] указана ниже:
Температура, °C..................... 600 550 500 450 400 360 340 25ч
Растворимость Sb, % (ат.)........... 5,795,745,695,44 4,61 3,43 3,02 1,35
Растворимость Си в (Sb) незначительна. По различным оценкам
она составляет 0,5 % (ат.) при температуре 400 °C, 0,2 % (ат.) —
при температуре 526 °C и 0,1 % (ат.) — при комнатной температуре
[X]. Измерения параметров кристаллической решетки и электричес-
ких свойств показало практически отсутствие растворимости Си
в (Sb), а измерение магнитных свойств — растворимость 1,4 %
(ат.) [X].
Сведения о кристаллической структуре фаз, образующихся в
системе, представлены в табл. 120.
Таблица 12 0. Кристаллическая структура фаз системы Си—Sb
Фаза Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм Примечав»
а Ь с
Р BiF3 сП6, РтЗт 0,601 При содержа, нии 25 % (<Т: Sb и темпера туре 475 °C [X]
п Mg hP2, Pfyjmmc 0,271 (0) 0,436 (6) При содержа нии 5,4 % (ат.) Sb и ii-v пературе 480 °C IX, 3i
е — — 0,272 (0) — 0,431 При содержа нии 19 % < а ’ Sb [3]
Е — РЗ 0,992 (0) — 0,432 (0) При содерж.. нии 21,5 % (ат.) Sb [21
Си—Sc
309
фаза Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм Примечание
а b С
к Cu3Ti оР&, Рттп 0,550 (5) 0,476 (0) 0,435 (3) При содержа- нии 24 % (ат.) Sb [2]
CujSb CujSb tP6. Р4/птт 0,4000 (6) — 0,6103 (9) В области го- могенности
0,4001 (2) — 0,6104 (3) [Ш, 5]
‘Гексагональная сингония.
Литература
1. Hehenkamp Т., Kossak R. // Z. Metallkunde. 1983. Bd. 74. N 4. S. 195—198.
2. Giinzel E., Schubert K. // Z. Metallkunde. 1958. Bd. 49. N 3. S. 124-133.
3. Schubert K.. Ilschner M. // Z. Metallkunde. 1954. Bd. 45. N 6. S. 366—370.
4. Вегер A.A., Герасимова Я.И. 11 Научные доклады высшей школы. Химия и
химическая технология. 1959. № 1. С. 16—18.
5. Pearson W.B. // Canad. J. Phys. 1964. V. 42. P. 519-525.
Л.Л. Рохлин
Cu—Sc. МЕДЬ—СКАНДИЙ
Обобщенная диаграмма состояния системы Си—Sc (рис. 163)
приведена в работе [1] на основании экспериментальных данных
работ [2, 3] и собственных термодинамических расчетов. В системе
образуются три соединения: Cu4Sc, Cu2Sc и CuSc. Соединение Cu4Sc
Плавится конгруэнтно при температуре 925 °C по данным работы [2]
или при температуре 975 °C по данным работы [3], причем в работе
[3] указано также на существование области гомогенности соедине-
ния Cu4Sc от 19 до 23 % (ат.) Sc. Соединение Cu2Sc по данным
работы [2] образуется по перитектической реакции Ж + CuSc *
Cu2Sc при температуре 890 °C, в то время как данные работы [3]
Указывают на конгруэнтное плавление соединения Cu2Sc при темпе-
ратуре 990 °C. Данные работы [3] признаны в работе [1] более
вероятными по аналогии с подобными соединениями Cu2Nd, Cu2Dy,
Cu,Gd. Соединение CuSc плавится конгруэнтно при температуре
1125 °C [2, 3].
Эвтектические превращения, имеющие место в системе Си—Sc,
Указаны в табл. 121.
Из-за отсутствия экспериментальных данных для кривых ликви-
Дуса, ограничивающих области Ж + Cu2Sc и Ж + (Sc), эти фазовые
’Тани цы были рассчитаны из термодинамических параметров [1].
310
Си-Sc
Максимальная растворимость компонентов составляет около 0,5 %
(ат.) Sc в (Си) и <1,0 % (ат.) Си в (aSc) [2]. По данном работы |3]
растворимость Си в (Sc) при температуре 800 °C равна -1,5 % (ат.).
При температуре 1337 °C имеет место полиморфное превращение
(aSc) * (pSc).
Таблица 121. Нонвариантные реакции в системе Си—Sc
Реакция Содержание Sc в фазах, % (ат.) Температура, "С ИСТОЧ!:
Ж - (Си) + Cu4Sc -13; -0,5; 20 865 121
-11; - 20 860 131
Ж в Cu4Sc + Cu2Sc -30; 20; 33.5 875 [2:
-32; 20; 33,5 870 (31
Ж в Cu2Sc + CuSc -36,5; 33,3; 50 890 [П
-39; 33,3; 50 890 [3'1
Ж в CuSc + (aSc) -71; 50; -99 875 [?;
-70; 50; -99 900 [31
Си-Se
311
| Кристаллическая структура соединений приведена в табл 122.
I Кристаллическая структура и параметры решетки соединения
By^Sc не установлены.
Д б л и ц а 12 2. Кристаллическая структура соединений системы Си—Sc
г Соединение Прото- тип Символ Пирсона, пр.гр. Параметры ре- шетки, нм Примечание
а с
Cu2Sc MoSi2 tI6, 14/ттт 0,3290 0,8388 (4]
CuSc CsCl сР2, РтЗт 0,3256 — При использовании Sc чистотой 99,95 % (по массе) [5]
0,3240 — При использовании Sc чистотой 98,2 % (по массе) [6]
Лжгература
. 1. Subramanian P.R., Laughlin D.E. // Bull. Alloy. Phase Diagrams. 1988. VOX 3a.
F, 378-382.
2. Наумкин О.П., Терехова В.Ф., Савицкий E.M. 11 Редкоземельные металлы и
СПЛвы: Сб. статей. М.: Наука, 1971. С. 28—34.
ч 3. Маркив В.Я., Гавриленко И.С.. Петьков В.В., Белявина В.Н. // Металлофизи-
< 1978. № 73. С. 39-45.
J 4. Dwight А.Е., Downey J.W., Conner R.A. // Acta Crystallogr. 1967. V. 22.
I 745-747.
V 5. Alfred A.T. // Trans. AIME. 1962. V. 224. P. 1082-1083.
‘ 6. Крипякевич П.И., Протасов B.C., Кузьма Ю.Б. // Доклады АН УРСР. 1964.
И|2. С. 212-215.
' . Е.В. Лысова
?U-Se. МЕДЬ—СЕЛЕН
\ Представленная в справочнике [X] диаграмма состояния Си—Se
Жраничена содержанием Se от 0 до 40 % (ат.) , на ней показана
д№отектическая реакция при температуре 1107 °C, эвтектическое
|РСвращение Ж «* (Си) + Cu2Se при температуре 1063 °C и содержа-
ли Se в эвтектической точке ~1,8 % (ат.), а также конгруэнтное
уРазование при 1120 °C соединения Cu2Se. В дальнейшем тот же
|Wtok диаграммы исследован в работе [1], и полученные результа-
У^орошо согласуются с данными справочника [X]. В полном кон-
2'Итрационном интервале диаграмма состояния Си—Se была построе-
У в работе [2] по результатам дифференциального термического,
^Иттеновского и микроструктурного анализов, измерения микротвер-
312
Cu—Se
Си Se,%(am.) Se
Рис. 164. Cu—Se
дости. Исходные компоненты в работе [21 были особо чистыми В
работах [3, 4] в области, богатой Se, эта диаграмма состояния бы ла
дополнена сведениями об образовании соединения CuSe2 в отличие
от работы [2], где это соединение не было обнаружено. В основном
строение диаграммы в разных работах совпадает, однако наблюда-
ется различие в температурах нонвариантных и полиморфных пре-
вращений, а также в числе модификаций некоторых соединений. На
рис. 164 диаграмма состояния Си—Sc приведена согласно работе 131,
в которой обобщены экспериментальные данные работ [X, 2, 5, б).
В системе существуют четыре соединения: Cu2Se, Cu3Se2, CuS: и
CuSe2. Соединение Cu2Se плавится конгруэнтно при температуре
ИЗО °C [2, 31, 1120 °C [XJ, 1144 °C [4]. Полиморфное превращение
этого соединения имеет место при температуре 123± 15 °C соглас
данным работы [3], либо оно начинается при 162 °C согласно данным
работы [2, 41. Область гомогенности соединения Cu2Se расположс ’;1
в интервале концентраций 33,3—36,6 % (ат.) Se [21, а по данным
работы [3] области гомогенности на основе соединений aCu2_rSe
pCu2_A.Se находятся в пределах -33,3—33,8 и 33,3—36,4 % (ат.) Se'
соответственно. При увеличении содержания Se соединение pCu2 .St’
Cu—Se
313
становится устойчивым при комнатной температуре. Методами изме-
нения термоэлектродвижущей силы [7], дилатометрическим [8] и
высокотемпературной рентгенографии [9] уточнены границы фазо-
вых областей соединения Cu2_xSe.
Двухфазная область а + Р соединения Cu2_xSe (2,01 2—% >
> 1,82) при нагреве расположена в интервале температур 130—141 °C
[Ю], либо -135 —142 °C для Cu2_xSe (2,00 > 2 - х > 1,72) [7].
Соединения Cu3Se2, CuSe и CuSe2 образуются по перитектическим
реакциям при температурах 112 °C [3] (или 175 [2], или 135 [4]),
377 [3] (или 400 [2], или 382 [4]), 332 [3] (или 342 °C [4]) соответ-
ственно. Соединение CuSe имеет две модификации: aCuSe при темпе-
ратуре ниже 80 °C и pCuSe при температуре выше 80 °C согласно
данным работ [2, 4]. Однако в работе [3] указаны три модификации
соединения CuSe, существующие при температурах: ниже 51 °C
(aCuSe), в интервале 51—120 °C (PCuSe) и выше 120 °C (yCuSe).
В табл. 123 приведены нонвариантные реакции в системе Cu—Se
по данным различных исследований.
Таблица 123. Нонвариантные реакции в системе Cu-4Se
Реакция Содержание Se в фазах, % (ат.) Температура, °C Источник
Ж ₽ Ж, + ₽Cu2.JSe —; —; -33,3 1100 [2, 3]
—; —; -33,3 1107 {4]
Ж » (Си) + pCu2_xSe -1,8; ~0; -33,3 1063 13}
—; -33,3 1060 [4]
pCu2_xSe + >К3 -52,5; -36,5; — 523 [3]
— -35,6; — 523 14]
-35,6; — 540 [2]
Ж в CuSe2 + (Sc) или —; 66,7; -100 218 [3, 4]
Ж + CuSe2 в (Se) 66,7 -100 221 13, 4]
₽Cu2_xSe + (Си) в aCu2 xSe -33,3; -0; -33,3; 123±15 [3]
-33,3; -0; -33,3 162 12, 4]
^Cu2.xSe + PCuSe в Cu3Se2 -36,5; 50, 40 112 131
-35,6; 50; 40 135 14]
-35,6, 50; 40 175 [2]
Ж + pCu2.xSe в yCuSe -36,5; 50 377 13]
314
Cu—Se
Реакция Содержание Se в фазах, % (ат.) Температура, °C Источник
-35,6; 50 382 [4]
-35,6; 50 400 [2]
Ж -I и yCuSe e CuSe2 50; 66,7 332 [3|
-; 50; 66,7 342 [4]
Растворимость Se в Си при температуре 675 °C составляет 0,002
(ат.) и увеличивается до 0,0092 % (ат.) при температуре 900 °C [! i
Кристаллическая структура соединений системы Си—Se приводе
в табл. 124.
Для aCu2_xSe приведены также сведения о существованг
тетрагональной сингонии с параметрами решетки а = 0,6808 нм, .
= 0,0103 нм [17], либо а = 1,1712 нм, с = 1,1864 нм [18] , а также
ромбической сингонии с параметрами решетки а = 0, 4118 нм,
= 0,7032 нм, с = 2,0381 нм [V - С].
Таблица 12 4. Кристаллическая структура соединений системы Си—Se
Соединение Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм Примечать
а b с
pCu7.xSe (берцелианит) CaF2 с/'12, Fm/Sm. 0,585 — — При составе Cu2Se |12]
0,5765 — — Си, 8Se 112]
0,5768 — — Си, 7iSe [10]
aCu^Se’1 — — 1,4087 2,0381 0,4145 3 = 90,35° При темпера i ре ниже 123 <
Cu3Se2 (умангит) Си tPIO, P42fm 0,64024 — 0,42786 [12]
0,6406 — 0,4270 ИЗ]
aCuSe (клокманит) CuSe АР26, Р63/ттс 0,394 — 1,725 При темпера> ре ниже 44 < |Х] или пиан 51 “С [3]
0,3939 — 1,725 'Го же 114!
Cu—Se
315
Соединение Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм Примечание
a b c
pCuSe*2 — — 0,3948 0,6958 1,7239 В интервале температур 50— 120 “С [V —С]
yCuSe*3 — —, P63/mmc — — — В интервале температур 120-377 °C [3]
CuSe2 FeS2 oP6, Pnnm 0,5106 0,6292 0,3812 [15]
0,30226 0,61957 0,37468 Данные получе- ны методом нейтронографии [16]
’Моноклинная сингония.
*гРомбическая сингония.
*3Гексагональная сингония.
Методом электронографии установлено также соединение
Cu6Se4 5, которое обладает структурой собственного типа (пр. гр.
R3m) с параметрами решетки а = 0,414 нм, с = 1,015 нм [19]. Сое-
динение этого состава между соединениями Cu3Se2 и CuSe при
построении диаграммы, однако, не установлено.
Соединение CuSe2 согласно данным работы [12] имеет структуру
типа FeS2 (пирит) (пр. гр. РаЗ) с параметром решетки а = 0,6116 нм.
Литература
1. Бурылев Б.П., Федорова Н.Н., Цемехман Л.Ш. // Журнал неорганической
химии. 1974. Т. 19. Вып. 8. С. 2283-2285.
2. Бабицына А.А., Емельянов Т.А., Черницына М.А. и др. // Журнал неоргани-
ческой химии. 1975. Т. 20. Вып. 11. С. 3093-3096.
3. Chakrabarti D.J., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1981. V. 2. N 3.
₽ 305-315.
4. Зломанов В.П., Новоселова A.B. p-T-x диаграммы состояния систем металл—ха-
лькоген. М.: Наука, 1987. 208 с.
5. Heyding R.D. // Canad. J. Chem. 1966. V. 44. N 10. P. 1233-1236.
6. Murray R.M., Heyding R.D. // Canad. J. Chem. 1975. V. 53. N 6. P. 873-887.
7. Конев B.H., Циглизян П.Н., Фоменков C.A. и др. 11 Изв. АН СССР. Неоргани-
ческие материалы. 1980. Т. 16. № 10. С. 1750-1752.
8. Vucic Z., Horvatic V., Milaf О. 11 Solid Stale lonies. 1984. V. 13. N 2.
p 127-133.
9. Бигвава А.Д., Кунчулин Э.Д., Коробков Б.К. и др. // Изв. АН СССР. Неорга-
нические материалы. 1985. Т. 21. № 10. С. 1793-1795.
10. Tonejc А. // J. Mater. Sci. 1980. V. 15. N 12. Р.3080-3094.
Н. Taylor P.L., van Wagoner D.L., Pitt C.H. // Metall. Trans. 1976. V. 7B. N 1.
p 103-106.
316
Си—Si
12. Heyding R.P., Murray R.M. // Canad. J. Chem. 1976. V. 54. N 5. P. 841
13. Morimoto M., Kato K. // Science. 1966. V. 152. № 3. P. 345—347-
14. Effenberger H., Pertlik F. // Ncues Jahrb. Mineral. Monatsh. 1981.
S. 197-205.
15. Gattow G. // Z. Anorg. All. Chem. 1965. Bd. 340. N 5-6. S. 312-318.
16. Kjekshus A., Rakke T., Andersen A.F. // Acta Chem. Scand. 1974. V. 28Л X ;
P. 996-1000.
17. Асадов Ю.Г., Джабриалова Г.А., Насеров В.И. 11 Изв. АН СССР. Неорга,
ческие материалы. 1972. Т. 8. № 6. С. 1144—1146.
18. Миколайчук А.Г., Когут А.И. // Кристаллография. 1974. Т. 19. Выь
С. 342-345.
19. Гасимов В.А., Агаев К.А. // Азербайджанский химический журнал. W ,
№ 2. С. 107-109.
Ю.Б. Кузьма, Е.В. Лыс- .и
Cu-Si. МЕДЬ—КРЕМНИЙ
Диаграмма состояния Си—Si (рис. 165) построена авторами работ ,।
[1] на основании данных работ |Х, 1—7]. Область диаграммы, вкл -
чающая составы сплавов, содержащих от 0 до 14,552 % (ат.) S>,
приведена по данным работ [2, 5]. Область диаграммы от 14,552 ,;о
36,128 % (ат.) Si построена согласно работе [3], однако строен г
сплавов при содержании 20,089—21,853 % (ат.) Si взято по данш ч
работы [4], а при содержании 21,853—28,534 % (ат.) Si — по дач-
ным работы [6]. Часть диаграммы состояния в области конце;
траций 36,128—100 % (ат.) Si построена по данным справочнн-л
[X] при использовании Си чистотой 99,91 % (по массе) и Si чистс
той 98,12 % (по массе). Диаграмма Си—Si была исследована мете.г
ми термического, металлографического [2—5], рентгеновского [6. 1
и дилатометрического [4] анализов, измерением электросопротив.и
ния [4] и методом авторадиографии [8].
В системе Си—Si только фаза т| плавится конгруэнтно при темп.,
ратуре 859 °C и содержании 24,083 % (ат.) Si. Остальные фа.м
образуются либо по перитектическим реакциям — р, б, либо и >
перитектоидным реакциям — К, у и е. Все эти фазы обладают ра
личными областями гомогенности.
Область существования фазы р находится в узком температурное
интервале между 852 и 785 °C [5].
Область существования фазы б охватывает интервал температ . !
824—710 °C, а при температуре 710 °C она претерпевает эвтектоп,.-
ный распад на фазы у и £ [3,4].
Фаза р имеет две низкотемпературные полиморфные модифика
ции г)' и г)" [4, 5].
При температурах 620 и 570 °C протекают перитектоидные пр
вращения с образованием фаз p' и р", а при температурах 558
467 °C протекают эвтектоидные превращения фаз р и р'.
Cu-Si
317
Рис. 165. Cu-Si
Область гомогенности фазы К находится в интервале температур
842—552 °C. При температуре 552 °C [5| или 557 °C [7, 8] фаза К
распадается на (Си) и у по эвтектоидной реакции.
Фаза у стабильна от температуры образования 729 °C [5] вплоть
до комнатной температуры.
Фаза г существует в очень узкой концентрационной области
21,2—21,3 % (ат.) Si и стабильна от температуры 800 °C вплоть до
комнатной [4].
Нонвариантные превращения, проходящие в системе Cu--Si,
указаны в табл. 125.
Границы существования (Си)-твердого раствора построены по
результатам металлографического [2, 5] и рентгеновского [7] анали-
зов, причем данные этих двух методов отличаются незначительно —
на 0,1 %. Растворимость Si в (Си) максимальна при температуре
перитектоидного превращения 842 °C и составляет 11,25 % (ат.) [5].
Растворимость Си в (Si) ничтожно мала, она приведена ниже по
Данным работы |8]:
318
Си-Si
Температура, °C........... 1300 1200 1000 800 500
Растворимость Си, % (ат.). . 2,8- 10'3 2,0- 10‘3 5,5- 10'4 8,5- 10’5 5,3- 10'•
Кристаллическая структура фаз представлена в табл. 126.
В работе [13] указывается, что фаза 6 имеет кубическую синю-
нию с параметром решетки а - 0,8506 нм. В работе [9] предполагает-
ся, что фаза б имеет искаженную решетку у-латуни.
Таблица 125 Нонвариантные реакции в системе Си—Si
Реакция Содержание Si в фазах, % (ат.) Температура, °C Источник
Ж + (Си) - р 16; 11,15; 14,2 852 151
К + 6 16; 14,3, 17,6 785 15]
Ж + fl * 5 18,1; 17,2; 17,6 824 13]
6 » у + е 18,2; 17,6; 21,2 710 [3, 4]
Ж ° 6 + т] 19,9; 19,6; 22,2 820 [3]
Ж » 1] + (Si) 30,1; 24,9; 100 802 [3]
е + г] « г]' 21,3; 23,4; 23,2 620 [4, 6]
е + г)' - ц " 21,3; 23,4; 23,3 570 [4, 6]
г] «* г]' + (Si) 25,3; 25,2; 100 558 [61
р' в р" + (Si) 24,9; 24,9; 100 467 [6]
(Си) + Р » К 11,25; 14,4; 12,45 842 [5]
К » (Си) + у 11,05; 9,95; 17,15 552 [5]
К + б » у 14,5; 17,65; 17,1 729 [5]
б + Л в 6 19,4; 23,5; 21,2 800 [4]
Таблица 126. Кристаллическая структура фаз системы Си—Si
Фаза Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм Примечание
а b с
К Mg КР2, Р6$/ттс 0,25543 — 0,41762 При содержании 11,8 % (ат.) Si ]1, 5, 9]
0,25563 — 0,41741 При содержании 14,6 % (ат.) Si [3J
Р’1 W с12, 1т2>т 0,2854 — — При содержании 14,9 % (ат.) Si [IO]
У РМп сР20, Р4,32 0,6198 — — [1, 101
Си-Si
319
ti
I Фаза Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм Примечание
а b с
3*2 — — 0,8815 — 0,7903 Ill]
. e*3 — — 0,9694 — — [9]
0,95 — — НИ
В*4 — R3m 0,247 — — а - 109,74" [1, 12]
п’*4 — -, яз 0,472 — — а - 95,72" [1, 12]
— — 0,7676 0,700 0,2194 [1, 12]
‘'Электронное соединение с электронной концентрацией 3/2. ‘2Тетрагональная сингония [1]. Электронное соединение с электронной кон- центрацией 21/13 {13]. "Кубическая сингония. *4Ромбоэдрическая сингония. *5Ромбическая сингония.
Параметр решетки (Си) возрастает с увеличением содержания Si
от а = 0,3607 нм (для чистой Си) до а = 0,3615 нм при содержании
10 % (ат.) Si [5, 91.
Рассчитанная диаграмма состояния Си—Si приведена в работе
(14], а сведения о метастабильной диаграмме — в работе [1].
Литература
1. Olesinski R.W., Abbaschian G.J. // Bull. Alloy Phase Diagrams. 1986. V. 7. N 2.
P. 170-178.
2. Smith C.S. H J. Inst. Met. 1928. V. 40. № 2. P. 359-370.
3. Smith C.S. // Trans. AIME. 1929. V. 83. P. 413-439.
4. Lokibe K. // Kinzoku no Kenkyu. 1931. V. 8. N 8. P. 433—456. J. Inst. Metals.
1931. V. 47. № 3. P. 651.
5. Smith C.S. 11 Trans. AIME. 1940. V. 137. P. 313-329.
6. Mima G., Hasegawa M. // Tech. Rept. Osaka. Univ. 1960. V. 10. P. 157—169.
7. Andersen A.G.H. H Trans. AIME. 1940. V. 137. P. 334-350.
8. Struthers J.DJ. // J. Appl. Phys. 1956. V. 27. P. 1560.
9. Arrhenius S., Westgren A. // Z. Phys. Chem. 1931. Bd. 14 B. S. 66—79.
10. Isawa T. 11 J. Japan. Inst. Metals. 1938. V. 2. P. 400-409.
11. Mukherjee K.P., Bandyopadhyaya J., Gupta K.P. // Trans. AIME. 1969. V. 245.
P. 2335-2338.
12. Solberg J.K. // Acta Crystalllogr. A. 1978. V. 34. P. 684-698.
13. Hume-Rothery W., Betterson J.O., Reynolds J. // J. Inst. Met. 1951—1952. V. 80.
P. 609-616.
14. ZUdecke D. // Calphad. 1987- V. 11. N 2. P. 135-142.
Е В. Лысова
320
Си— Sm
Cu-Sm. МЕДЬ—САМАРИЙ
Диаграмма состояния Си—Sm исследована неоднократно, одн>ко
полученные данные противоречивы.
В работе [1] указывается на образование пяти соединений, два
которых Cu6Sm и Cu2Sm плавятся конгруэнтно при температурах 0 4
и 860 °C соответственно. Три других соединения Cu5Sm, Cu4Sru и
CuSm образуются по перитектическим реакциям при температурах
927, 880 и 735 °C соответственно. В системе кристаллизуются > р,,
эвтектики:
Ж « (Си) + Cu6Sm при 882 °C и 9 % (ат.) Sm;
Ж * Cu.Sm + Cu2Sm при 818 °C и 28 % (ат.) Sm;
Ж ** CuSm + (aSm) при 597 °C и 71 % (ат.) Sm.
По данным работ [3, 4], в системе Си—Sm в отличие от рабе гы
[1] существуют четыре соединения Cu6Sm, Cu2Sm, CuSm и CusSm
[3] или Cu4Sm [4]. Причем в работе [2] отмечается, что соединение
CuSm плавится конгруэнтно при температуре 790 °C. Температур!,!
образования Cu6Sm и Cu2Sm составляют 975 и 865 °C по данным
Рис. 166. Си—Sm
Cu—Sm
321
паботы [2] или 970 и 860 °C — по данным работы [3]. Температуры
эвтектических реакций кристаллизации (Си) + Cu6Sm; Cu^Sm (или
Си Sm) + Cu2Sm и CuSm + (aSm) соответственно равны 890, 810 и
575 °C по данным работы [2] или 900, 820 и 570 °C — по данным
паботы [3]. В работе [2] установлена также эвтектика Cu2Sm +
+ CuSm при температуре 720 °C.
В работе [4] помимо указанных соединений найдено еще два
соединения Cu3Sm и Cu2Sm, первое из которых образуется по пери-
тектической реакции, а второе кристаллизуется из расплава. В
других работах существование таких соединений не подтверждается.
Авторы работы [5] обобщили имеющиеся различные эксперимен-
тальные данные и привели их в соответствие с данными по другим
Cu-лантаноидным системам; Предлагаемая диаграмма состояния
Cu—Sm приведена на рис. 166 по данным работы [5]. По сравнению
с диаграммой, построенной в работе [1], в представленную диаграм-
му внесены следующие поправки.
В области концентраций 10—25 % (ат.) Sm ликвидус сдвинут к
более низким температурам, и температуры плавления соединений
Cu6Sm (900 °C), Cu5Sm (830 °C) и эвтектики (Си) + Cu6Sm (860 °C)
имеют более низкие значения в соответствии с систематическим
уменьшением температур плавления в ряду от La к Sm. Кроме того,
предполагается существование эвтектики Cu2Sm + CuSm при темпе-
ратуре 720 °C и содержании 44,4 % (ат.) Sm и конгруэнтное плавле-
ние соединения CuSm (735 °C), в соответствии с данными работы
[2], но при более низкой температуре. Предполагается также по
аналогии с другими Cu-лантаноидными системами существование
соединения Cu7Sm2, образующегося по перитектической реакции и
стабильного в узкой температурной области. В богатых Sm сплавах
предполагаются превращения вследствие наличия трех модификаций
Sm: (aSm) « (0Sm) при температуре 734 °C при нагреве (и 727 °C
при охлаждении), (0Sm) * (ySm) при температуре 922 °C.
В твердом состоянии Sm и Си практически не растворяются друг
в друге [2]. Однако в работе [3] растворимость Sm в (Си) оценивает-
ся как 0,47 % (ат.), а в работе [4J растворимость Sm в (Си) при
комнатной температуре принята равной 2 % (ат.).
Кристаллическая структура соединений представлена в табл. 127.
Авторами работы [12] подтверждена структура типа СеСи6 и
'-'еСи5 для соединений Cu6Sm и Cu5Sm соответственно. Однако для
соединения Cu6Sm в работе [12] не исключается возможность отнесе-
ния его структуры к типу Th2Ni17 (символ Пирсона АР38, пр. гр.
ръ$/ттт). Согласно работе [4| соединение Cu4Sm имеет гексаго-
нальную сингонию с параметрами решетки а = 0,519 нм, с =
" 0,415 нм. По данным работы [4] соединение Cu2Sm имеет гексаго-
11 Зак. 2144
322
Си—Sm
нальную сингонию (пр. гр. РЬ/ттт) с параметрами решетки г ,
= 0,438 нм; с = 0,382 нм. Однако согласно работе [5] данные рабо ;i
[10] (см. табл. 127) предпочтительнее, так как сингония типа Се(
существует почти во всех Cu-лантаноидных системах. Авторы рабо , ы
[13] указывают, что соединение CuSm имеет ромбическую структх ?
типа FeB (символ Пирсона оР8, пр. гр. Рпта) с параметрами реш
ки а = 0,724 нм; b = 0,421 нм; с = 0,617 нм.
Таблица 12 7. Кристаллическая структура соединений системы Си—Sm
Соеди- нение Прото- тип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источим
а Ь С
Cu6Sm CeCu6 оР28, Pnma 0,8080 0,5092 1,0210 RI
0,8120 0,5100 1,0130 [6]
0,8060 0,5034 1,0049 [71
CiijSm CdCu5 hP6, Р6/ттт 0,5074 — 0,4099 [8]
0,5071 — 0,4151 [21
0,5074 — 0,4098 [9[
0,507 — 0,412 [6|
Cu4Sm CeCu4 oP20, Pnnm 0,442 0,801 0,901 !9[
CujSm CeCu2 o/12, Imma 0,4360 (5) 0,6925 (5) 0,7375 (5> ПО!
CuSm CsCl cP2, РтЗт 0,354 — — 14]
0,3528 — — [111
Литература
1. Kuhn К., Perry A.J. // Met. Sci. 1975. V. 9. N 7. P. 339-341.
2. Торчинова P.C., Терехова В.Ф., Савицкий Е.М. // Редкоземельные мега >
сплавы и соединения: Сб. статей. М.: Наука, 1973. С. 166 -168.
3. Голубков Л.А., Шибанова Н.М., Саксонов Ю.Г. и др. // Изв. АН С<1
Металлы. 1977. № 6. С. 180-184.
4 Алиев О.М. // Исследования в области неорганической и физической химг
Сб. статей. Баку: Элм, 1977. С. 200—205.
5. Subramanian P.R., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1988. V. 9 \
P. 382-389.
6. Рустамов П.Г., Алиев O.M., Гуссейнов Г.Г., Алиджанов М.А. // Те,>
докладов Всесоюзной конференции по кристаллохимии интерметаллических соел<ч
ний. Львов: ЛГУ, 1984. С. 112.
7. Buschow K.HJ., van der Goot A.S. //J. Less-Common Met. 1970. V ! '
P. 309-313.
8. Haszko S.E. // Trans. AIME. 1960. V. 218. P. 763.
Cu—Sn
323
o. Rus E., CoIdea M„ Pop J. // Philos. Mag. 1981. V. 44B. N 3. P. 405—411.
10- Storm A.R., Benson K.E. П Acta Crystallogr. 1963. V. 16. P. 701—702.
Ц. Chao C.C., Luo H.L,, Duwez P. // J. Appl. Phys. 1964. V. 35. P. 257—258.
12. Лейтус Г.М., Боева О.А., Жаворонкова K.H. и др. // Изв. АН СССР. Неорга-
нические материалы. 1991. Т. 27- № 4. С. 721—724.
яИ 13- Walline R.E., Wallance W.E. // J. Chem. Phys. 1965. V. 42. N 2. P. 604—607.
H.P. Бочвар
Cu—Sn. МЕДЬ—ОЛОВО
Результаты исследования сплавов системы Cu—Sn суммированы в
работах [X, 1] и приведены на рис. 167. Более поздние исследования
касались определения границы растворимости твердого раствора на
основе Си [2], положения ликвидуса и солидуса в области (Си) [3],
исследования кристаллической структуры отдельных фаз [4—7].
Р«С. 167. Cu—Sn
11*
324
Cu—Sn
В системе Cu—Sn существуют восемь фаз (Си), р, у, 6(Cu31Sn >
£, E(Cu3Sn), г), (Sn). Три фазы р, у и р образуются по перитектич.
ким реакциям при температурах 798, 755 и 415 °C соответствен! п.
Остальные три фазы е, Е, и б образуются в результате превращен.<й
в твердом состоянии. При этом фаза е образуется при температ\ f>с
676 °C из фазы у по реакции у ** е, а фазы £ и б образуются ; о
перитектоидным реакциям при температурах 640 и 590 °C соотв. j-
ствснно.
Фаза (Си) кристаллизуется из жидкости в интервале темпера-
тур 1084,87—798 °C при содержании до 15 % (ат.) Sn по лин, и
ликвидуса. По данным работы [3] ликвидус в интервале меж..у
температурой плавления Си и температурой перитектического пре-
вращения при 798 °C несколько сдвинут в область более высоких
температур.
Фаза (Sn) кристаллизуется из жидкости в узком интерг,-
ле температур 232—227 °C и концентрационной области 1,3
(ат.) Си.
Фаза р существует при высоких температурах в интервале 798—
586 °C в узкой концентрационной области (наибольшая протяжен-
ность ее составляет ~3 % (ат.) при температуре 755 °C). При темпе
ратуре 586 °C фаза Р претерпевает эвтектоидный распад на фа ы
(Си) и у.
Фаза у имеет довольно значительную область гомогенности i
существует в интервале температур 755—520 °C. При температуре
640 °C фаза у претерпевает превращение по кататектической реак-
ции на фазу в и Ж. При температуре 520 °C фаза у распадается но
эвтектоидной реакции.
Фаза е существует в интервале температур от 676 °C ,о
комнатной и имеет небольшую область гомогенности, наиболь-
шая ширина которой составляет 1,5 % (ат.) при температ\ пе
640 °C.
Фаза Е существует в узкой концентрационной области в интервал
температур 640—582 °C и при температуре 582 °C претерпев? '
эвтектоидный распад на фазы е и б.
Фаза б имеет также узкую область гомогенности в интерва
температур 590—350 °C и при температуре 350 °C распадается ;>’
эвтектоидной реакции на фазы (Си) и е.
Фаза г) существует в узкой области составов и в интерна
температур 189—186 °C происходит ее упорядочение с образов.'
нием фазы т/ при 186 °C со стороны Sn и при 189 °C со сто; -
ны Си.
Происходящие в системе нонвариантные равновесия указаны ”
табл. 128.
Си—Sn
325
Кривая растворимости Sn в (Си) имеет ретроградный харак-
тер- Данные по растворимости Sn в (Си) приведены ниже согласно
работе 12]:
700 550 400 320 250
температура, °C. .
растворимость Sn:
% (ат.)..........
% (по массе).
8,7 9,1 7,7 7,3 5,7
15,10 15,80 13,50 12,80 10,10
Растворимость Си в (Sn) очень мала и составляет при эвтектиче-
ской температуре 227 °C 0,01 % (ат.) или 0,006 % (по массе) [8].
Таблица 12 8. Нонвариантные реакции в системе Cu—Sn
Реакция Содержание Sn в фазах, % (ат.) Температура, "С
Ж + (Си) - р 15,5; 7,7 13,1 798
Ж+₽М 19,1; ~16,5; -17 755
Ж + Е ” Т| 86,7; 24,9; 43,5 415
Ж - П + (Sn) 98,7; 45,5; >99,9 227
₽ ₽ (Си) + у 14,9; 9,1; 15,4 586
у ₽ е + Ж 27,9; 25,9; 43,1 640
Y •• (Си) + S 16,5; 9,1; 20,4 520
Y + е * £ 21,8; 24,5; 22,5 640
? •• е + 5 21,7; 20,8; 24,5 582
в ° (Си) + е 20,5; 6,2; 24,5 350
Кристаллическая структура фаз приведена в табл. 129.
Параметр решетки (Си) определен в работе [2] для сплава с
6,6 % (ат.) Sn. Он увеличивается от 0,3672 нм при температуре
150-250 °C до 0,3707 нм при 550-700 °C.
Обзор по метастабильным фазам проведен в работе [1].
Таблица 129 Кристаллическая структура фаз системы Cu—Sn
Фаза Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм Примечание
а Ь с
Р W с/2, Jm3m 0,2981— 0,2991 — — В интервале кон- центраций 15,2— 17,2 % (ат.) Sn 19]
326
Cu—Sn
Фаза Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм Примечание
a b c
У BiF3 cF16, Fm3m 0,6116 (6) — При температуре 700 °C и содержа нии 25 % (ат.) Si, [X, 10]
0,60605— 0,61176 При температуре 710 °C в интерва ле концентраций 16,6-25,0 % (аз .• Sn [1]
б’* 1 Си4|8пц с/'416, F43m 1,7980 — — [1]
е2 Cu10Sn3 hP2f>, P63/m 0,7330 — 0,78640 [6]
е Cu3Sn oC8, Стоп 0,5529 4,7750 0,4323 [7]
*3 П NiAs hP4, Pf>3/mmc 0,4192 (2) — 0,5037 (2) [5]
л*4 — — — — — [1]
'Электронное соединение с электронной концентрацией 21/13. Согласно дан i
ным работы [4] структура фазы 5 кубическая и относится к структурному типу I
у-латуни (Cu5Zng) (символ Пирсона с/52, пр. гр. /43т) с параметром решетки а !
= 1,79505 (3) нм. I
* 2Фаза I является сверхструктурой, основанной на £AgZn [6]. !
* 3Для фазы р в работе [5] определена также гексагональная структура типа i
NiAl с параметрами решетки а = 2,0870 (2) нм, с - 2,5081 (2) нм. i
* 4Гексагональная сингония. Фаза г]' является сверхструктурой,'основанной на |
структуре типа NiAs. j
Литература
1. Saunders N., Miodownik A.P. // Bull. Alloy Phase Diagrams. 1990. V. 11- N J
P. 273-287.
2. Токсентова P.K., Биимбетов H., Черноусова К.Т., Пресняков А.А. // Свойст .
цветных металлов и сплавов: Труды ин-та ядерной физики АН КазССР. Алма-Акг
АН КазССР, 1970. Т. 2. С. 103-106.
3. Bastow B.D., Kirkwood D.H. 11 J. Inst. Met. 1971. V. 99. N 9. P. 277-283.
4. KnOdler H. 11 Metall. 1964. Bd. 18. S. 1172-1177.
5. Gangulee A., Das G.C., Bever M.B. // Metall. Trans. 1973. V. 4. P. 2063—206.'’
6. Brandon J.K., Pearson W.B., Tozer D.J.N. // Acta Crystallogr. B. 1975. V 3i
P. 774-779.
7. Watanabe Y., Fujinaga Y., Iwasaki H. // Acta Crystallogr. B. 1983. V. 3i;
P. 306-311.
8. Homer C.H., Plummer H. 11 J. Inst. Met. 1939. V. 64. P. 169-200.
9. Исаичев И. // Журнал теоретической физики. 1939. Т. 9. С. 1286—1292.
10. KnOder Н. И Acta Crystallogr. 1957. V. 10. Р. 86-87.
Н.Р. Боч,">
Си—Sr
327
Си—Sr. МЕДЬ—СТРОНЦИЙ
Диаграмма состояния Си—Sr приведена на рис. 168 из работы [1],
авторы которой использовали в основном данные работы [2]. Система
Си—Sr исследовалась методами термического и рентгеновского анали-
зов при использовании Sr чистотой 99,8 % (по массе) и Си чистотой
99,999 % (по массе) [1]. Сплавы плавили В атмосфере Аг, используя
железные тигли для составов, содержащих свыше 52 % (ат.) Sr и
молибденовые тигли для составов, богатых Си.
Си Sr, -/• (am.) Sr
Рис. 168. Си—Sr
В системе Си—Sr существует два соединения Cu5Sr и CuSr, кото-
рые образуются по перитектическим реакциям при температурах 845
и 586 °C соответственно.
Нонвариантные превращения, проходящие в системе Си—Sr,
Указаны в табл. 130.
В работе [1] указывается также на возможность протекания
перитектического Ж + (pSr) ** (aSr), либо кататектического (PSr) ««
** Ж + (aSr) равновесия с участием pSr и aSr при температуре
-555 °C.
328
Си—Та
Таблица 13 0. Нонвариантные реакции в системе Си—Sr
Реакция Содержание Sr в фазах, % (ат.) Температура, Ч
Ж + (Си) ₽ CujSr 17,3; -0; 16,7 845
Ж + Cu5Sr " CuSr 52,1; 16,7; 50 586
Ж •* CuSr + aSr 79,5; 50; -100 507
Cu5Sr » (Си) + CuSr 16,7; ~0; 50 ~28
Взаимная растворимость Си и Sr в твердом состоянии отсутствус i
Кристаллическая структура соединений указана в табл. 131.
В работе [11 приведены рассчитанные кривые ликвидуса, которы
оказались в хорошем соответствии с экспериментальными кривыми
полученными в работе [2].
Таблица 131. Кристаллическая структура соединений системы Си—Sr
Соеди- нение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а с
Cu5Sr CaCu5 АР6, Рб/ттс 0,5261 (2) 0,4058 (2) [1. 2]
CuSr BaCu hP8 (?), Рб^ттс 0,4341 1,538 [1, 3]
0,4346 1,3566 [2]
Литература
1. Chakrabarty D.J., Laughlin D.E, // Bull. Alloy Phase Diagrams. 1984. V. 5. N 4
P. 391-396.
2. Bruzzone G. // J. I.ess-Common Met. 1971. V. 25. N 4. P. 361—366.
3. Fornasini M.L., Merlo F. // Acta Crystallogr. B. 1980. V. 36. P. 1288-1291.
Е В. Лысова
Си—Та. МЕДЬ—ТАНТАЛ
Диаграмма состояния Си—Та не построена. В работе [1] пытались
получить сплавы Си с Та путем плавки в дуговой печи или спекани
ем смеси порошков Си и Та при температуре 1000 °C в течение
3 сут.
Рентгенограммы полученных материалов содержали линии, соот-
ветствующие объемно центрированной решетке Та и гранецен
трированной решетке Си. Новых соединений в системе не обнару
жено [1].
Cu~Tb
329
В работе {2} сообщается об очень ограниченной взаимной раство-
римости элементов. В работе {3} указывается, что в жидкой Си при
температуре 1200 °C растворяется около 0,009 % (ат.) Та.
Литература
1. Elliott R.P. // Armour Research Foundation. Chicago. Techn. Report 1. OSR. Techn.
Note OSR-TN-247. 1954. № 8. P. 23.
2. Kieffer R., Nowotny H. // Metall. 1963. Bd. 17. S. 669-677.
3. Smith C.J. // Trans. AIME. 1959. V. 215. P. 905-909.
Е В. Лысова
Cu-Tb. МЕДЬ—ТЕРБИЙ
Диаграмма состояния Си—Tb экспериментально не построена.
Имеются сведения об образовании четырех соединений: Cu7Tb,
Cu5Tb, Cu2Tb и CuTb [Э, Ш, 2].
Авторы работы U] установили температуры плавления известных
соединений путем интерполяции соответствующих данных для других
Cu-лантаноидных систем, для которых имелись экспериментальные
Tb, 7о (ат.)
Рис. 169. Cu-Tb
330
Си-Tb
фазовые диаграммы. Сочетая полученные данные с термодинами к .
кими параметрами, авторы работы [1] предложили схематично
диаграмму, приведенную на рис. 169.
Помимо указанных соединений предполагается существов 1н ; >
соединений Cu9Tb2 и Cu7Tb2 по аналогии с системами Си—Сл
Си—Dy и Си—Ег. Три соединения Cu9Tb2, Cu2Tb и CuTb плавятсt
конгруэнтно при температурах 950, 870 и 900 °C соответственно
Соединение Cu5Tb образуется по перитектической реакции: Ж +
Cu9Tb2 * * pCu^Tb при температуре 940 °C и концентрации ТЬ в
жидкой фазе -14,8 % (ат.). Соединение Cu5Tb имеет полиморфное
превращение aCu5Tb * pCu5Tb при температуре 895 °C. Соединение
Cu7Tb предположительно может образоваться в интервале темпера
тур 800— 700 °C; оно разлагается на (Си) и aCu5Tb. Соединенье
Cu7Tb2 предположительно существует в высокотемпературной облас-
ти в узком интервале температур -890—850 °C и разлагается на К
и Cu9Tb2.
Кристаллическая структура соединений приведена в табл. 132
Таблица 13 2. Кристаллическая структура соединений системы Си—ТЬ
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b С
pCu5Tb CaCu5 hPb, РЫттс 0,503 — 0,409 [2]
aCu$Tb AuBe5 cF24, F43m 0,7041 — — [3]
Cu7Tb2* — — 0,4942 — 0,4164 [2]
Cu2Tb CeCu2 ol 12, Imma 0,4310 0,6825 0,7320 [41
CuTb CsCl cP2, Pm 3 m 0,348 — — (51
Гексагональная сингония.
Литература
1. Subramanian P.R., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1988. V. 9. N 3
P. 390-394
2. Buschow K.H.J., van der Goot A.S. // Acta Crystallogr. B. 1971. V. 27 X
P. 1085-1088.
3 Buschow K.H.J., van der Goot A.S., Birkhan 3. II J. Less-Common. Met 19tA
V. 19. P. 433-436.
4. Storm A.R., Benson K.E. // Acta Crystallogr. V. 16. P. 701—702.
5 Chao C.C.. Luo H.J., Duwez P. // J. Appl. Phys. 1964. V. 35. P 257-258
HP. Боне
Си—Тс, Си—Те
331
qj—Тс. МЕДЬ—ТЕХНЕЦИЙ
Диаграмма состояния Си—Тс не построена. Исследование сплавов
системы Си—Тс, полученных различными способами и прошедших
соответствующую термическую обработку, методами металлографии,
атомно-эмиссионной спектрометрии и радиометрического анализа,
показало, что Тс, подобно Re, не взаимодействует с Си ни в твердом,
ни в жидком состояниях [1].
Литература
1. Буков К.Г., Титова Т.К., Федотов Л.П. // Изв. АН СССР. Металлы. 1990. № 5.
С. 203-205.
Е.В. Лысова
Си—Те. МЕДЬ—ТЕЛЛУР
Сведения об исследовании диаграммы состояния Си—Те в полном
или узком интервале концентраций и температур собраны в справоч-
никах [X, Э, Ш]. Диаграмма состояния во всем интервале кон-
центраций приведена в справочнике [X] и показана на рис. 170.
332
Си—Те
Она характеризуется наличием соединений Cu2Te, Си4Те3 и Си Г
Соединение Си2Те плавится конгруэнтно при температур
1125 °C [X]. Соединения Си4Те3 и СиТе образуются по перитест.
ческим реакциям Ж + Cu2Te * Си4Те3 при температуре 630 С i
Ж + + Си4Те3 ** СиТе при температуре 365—367 °C, т.е. при тс<
температуре, которая ранее считалась температурой полиморфной
превращения Си4Те3.
Наряду с указанными фазами, образование которых считает;
достаточно надежно установленным, предполагается образование еш
одной фазы X [X]. Фаза X предположительно образуется по перитсу
тической реакции при температуре 727 °C. Состав этой фазы лежи
вблизи концентрации 36—37,5 % (ат.) Те. В работе [2] для это;
соединения указана формула Си5Те3.
Фаза Си2Те имеет область гомогенности, которая при температур.
400 °C расположена при содержании 33,3—34,2 % (ат.) Те [3].
Авторами работы [1] установлено, что соединение Си2_ЛТе прете;
певает четыре фазовых превращения: при температурах 172, 32;
(или 305 °C при х = 0,10), 360 °C и в интервале температур от 56'1
(х = 0,02) до 425 °C (х = 0,16). При температурах -275 °C и 260 Т
превращение наблюдается только в интервале составов 0 < х < 0,0;
и 0,12 < х < 0,20 соответственно. Результаты этой работы
общем подтверждают диаграмму, представленную в справочни
ке [X].
Авторами работы [4] изучена часть диаграммы состояния в облас
ти сплавов, близких к составу соединения Си2Те. Они пришли к
выводу, что ее строение в этой части значительно сложнее, чем
указано на диаграмме, приведенной в справочнике [X].
Соединение Си4Те3 также имеет область гомогенности ~1 % (ат л
а именно от 41,65 % (ат.) Те (состав Си7Те5) до -42,78 % (ат.) Ъ
(состав Си4Те3). Соединение Си4 хТе3 согласно данным работы |5|
испытывает превращение при температуре, близкой к 367 °C.
Диаграмма состояния Си—Те характеризуется также тем, что в
жидком состоянии имеется область несмешиваемости при концентра
ции от -4,3 до -30 % (ат.) Те и монотектической температуре
1051 °C. При температуре лишь на один градус ниже монотектичес
кой имеет место эвтектическое превращение Ж * (Си) + Си2Те при
концентрации Те в эвтектической точке 30,1 % (ат.) [X].
В работе 16] приведена уточненная (с привлечением термодина
мических расчетов) часть диаграммы состояния Си—Те в области
концентраций 0—40 % (ат.) Те и в интервале температур 1000
1400 °C. Согласно этой работе протяженность области несмеши
ваемости в жидком состоянии при монотектической температуре: о;
-2,5 до -28 % (ат.) Те и содержание Те в эвтектике соответствуй>
Си—Те
333
28 % (ат.) Те. При температуре 340 °C и концентрации 71 %
(ат.) Те наблюдается еще одно эвтектическое равновесие Ж *
„СиТе + (Те).
На основании измерений электропроводности определены следую-
щие значения растворимости Те в (Си); при температуре 800 °C —
-0,0037 % (ат.), 700 °С-0,0007 % (ат.) и -600 °С-0,00015 % (ат.)
[6, X].
Сведения о кристаллических структурах соединений, обнару-
женных и расшифрованных различными исследователями, противо-
речивы.
В табл. 133 приведены сведения о кристаллической структуре
соединений, указанных на приведенной диаграмме состояния.
Таблица 133. Кристаллическая структура соединений системы Си—Те
Соединение Прото- тип Символ Пир- сона, пр.гр. Параметры решетки, нм Примечание
а b С
Си2Те (ВТ)*1 — 0,611 — — При темпера- туре выше 560 °C [5)
Си2Те (СТ) hPf>, P6/mmn 0,4246 0,7289 Предположи- тельно для промежуточно- го интервала температур 360—305 °C [7, V-C]
Си2Те (НТ)*2 — — 1,245— 1,254 2,156— 2,171 При комнатной температуре и содержании 33,3 % (ат.) Те [21
Си4Те3*3 или Си7Те5 (риккардит) — — 0,3978 — 0,6122 12}
СиТе СиТе оРА, Pmmn 0,3156 0,4078 0,6834 12]
0,310 0,402 7,686 [6, V-CJ
''Кубическая сингония. *2Гексагональная сингония. Предполагается наличие сверхструктуры с утро- енными осями а и с {21. 3Тетрагональная сингония.
334
Си—Те
Сведения об остальных соединениях, полученных при различных
условиях в системе Си—Те, собраны в табл. 134 по данным работы
[V-CJ. Приведенные в табл. 134 формулы соединений в ряде случ,.св
отличаются от представленных на диаграмме. Соединение Си Ге
согласно представленной диаграмме не образуется. Соединение с
формулой Си3Те2, по-видимому, соответствует соединению Cu4'ie3
на диаграмме, а соединение с формулой Си13Те7 — соединению
Си2Те на диаграмме, Си7Те4 — фазе X на диаграмме.
Таблица 13 4. Кристаллическая структура соединений системы
Си—Те [V-C]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
CuTe2 FeS2 Pai 0,06600 — —
Cu3Te2 (ВТ) Cu3Te2 cF2&, F43m 0,6032 — —
Cu3Te2 (HT) Cu3Te2 oPf>, Pmmn 0,3991 0,3965 1,221 i.
*-изТе2 — — 2,023 — 4,191
Cu3Te2*2 — — 0,40032 — 1,2220
Cul3Te7*2 — — 1,0186 1,0308 0,4234
Cu13Te7 2 — — 0,7319 2,2236 3,6458
Cul3Te7*’ — — 0,8378 — 1,0877
Cii|3Te7 3 — — 0,873 1,460 0,7199
Cu7Te5 Cu7Te5 hP12, P3m\ 0,837 — 2,16
Cu,Te4 Cu7Te4 hP22, P3ml 0,828 — 0,722
Cu, xTex (x = 0,33) Cu2Te hP6, 0,4180 — 0,7236
'Гексагональная сингония *2Ромбическая сингония. *3Моноклинная сингония р = 90,33”.
Литература
1. Guastavino F., Luquest Н.„ Bougnot J. // Mater. Res. Bull. 1973. V. 8. \ ’*>
P. 935-942.
2. Patzak J. // Z. Metallkunde. 1956. Bd. 47- N 6. S. 418-420.
3. Lovenz G., Wagner C. // J. Chem. Phys. 1957. V. 26. P. 1607-1608.
4. Mijatami S., Mori S., Yanagihara M. // J. Phys. Soc. Japan. 1979. V. 47. \ •
P. 1152—1158.
5. Anderko K., Schubert K. // Z. Metallkunde. 1954. Bd. 45. S. 371-378.
6. Бурылев Б.П., Федорова Н.Н., Цемехман Л.Ш. // Журнал неорганической
даши. 1974. Т. 10. № 8. С. 2283-2285.
7. Smart J.S., Smith А.А. // Trans. AIME. 1943. V. 152. Р. 103-117.
' g. Nowotny Р. // Z. Metallkunde. 1946. Bd. 37. S. 40-^2.
Е.И. Гладышевский, О.И. Бодак, В.К. Нечарский
Cu-Th. МЕДЬ—ТОРИЙ
По диаграмме состояния Си—Th получены различающиеся между
дабой экспериментальные данные [X, Э, 1]. Представленная на
рис. 171 диаграмма состояния построена по данным работы [2], в
которой наиболее тщательно проведены исследования в интервале
Iконцентраций 0—70 % (ат.) Тп и, по данным обзора [1], в интервале
;концентраций 70—100 % (ат.) Th. Авторы работы [2] использовали
Си чистотой 99,999 % (по массе) и Th чистотой 99,97 % (по массе).
’Сплавы выплавляли в дуговой печи в атмосфере Аг на медном водо-
. охлаждаемом поддоне. Исследование проводили методами дифферен-
'диального термического, металлографического и рентгеновского
; анализов. Авторы работы [1] использовали литературные данные по
; фазовым равновесиям и термодинамические свойства компонентов и
! промежуточных фаз и рассчитали кривую ликвидуса. В этой работе
обобщены результаты всех предыдущих исследований по системе
Си—Th. Система характеризуется наличием четырех соединений
Th, °/о (по массе)
Рис. 171. Си—Th
336
Си-Th
Cu6Th, Cu3 6Th, Cu2Th и CuTh2, которые плавятся конгруэнтно ;
температурах 1055, 1015 и 1007 °C соответственно. В системе отм( ч;ь
ется пять эвтектических равновесий, указанных в табл. 135.
Таблица 135. Эвтектические реакции в системе
Реакция Содержание Th в фазах, % (ат.) Температуре, <
Ж » (Си) + Cu6Th 7±1 -100 14,29 935
Ж •* Cu6Th + Си3 6Th 18±0,5 14,29 21,74 1020
Ж «* Си3 6Th + Cu2Th 26±0,5 21,74 33,3 980
Ж ₽ Cu2Th + CuTh2 49±0,5 33,3 66,7 880
Ж « CuTh2 + (aTh) 70±0,5 66,7 -100 1000
При температуре -1360 °C имеет место кататектическое (0Th'
* Ж + (aTh) (или перитектическое Ж + (0Th) « (aTh) равновесие с
участием фаз (aTh) и (0Th).
Растворимость Th в (Си) незначительная и составляет при тем:. -
ратуре 946 °C менее 0,1 % (ат.) [3].
Кристаллическая структура соединений приведена в табл. 136
Таблица 13 6. Кристаллическая структура соединений системы Си—Th
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
Cu6Th CeCu6 oP28, Puma 0,81103 0,50817 1,01046 12]
GaAg36 —, Р6/ m 1,1812 — 0,8844 [4]
Cu2Th A1B2 hP3, РЫmmm 0,4383 — 0,3496 12]
CuTh2 CuA12 tl\1, IM man 0,730 — 0,580 [2]
Литература
1. Chakrabartv D.J., Laughlin D.E., Peterson D.E. // Bull. Alloy Phase Diagram
1986. V. 7. N 1. P. 36-43.
2. Schitz R.J., Stevens E.R., Carlson O.N. // J. Less-Common Met. 1971. V. 25. “s
P. 175-185.
3. Raub E., Engel M. // Z. Elektrochem. 1943. Bd. 49. S. 487—493.
4. Bailey D.M. // J. less Common Met. 1973. V. 30. P. 164-166.
E.B. Лысо
; Cu—Ti. МЕДЬ—ТИТАН
Диаграмма состояния Cu—Ti исследовалась многократно, однако
до настоящего времени нет единого мнения относительно состава и
характера образования промежуточных фаз. Подробно о существую-
щих противоречиях изложено в обзоре [Ш].
Рис. 172. Cu—Ti
На рис. 172 приведена диаграмма Cu—Ti, построенная соглас-
но работам [1, 2] (на вставке рисунка — по данным работы [3])
по результатам термического, металлографического, рентгеновско-
го анализов и измерения микротвердости. Система характеризует-
ся образованием шести соединений, два из которых плавятся кон-
груэнтно: CuTi2 (у> при температуре 1010+5 °C и CuTi (6) при
338
Си-Ti
984±5 °C. Четыре других соединения — Cu4Ti (С), Cu2Ti (A), Cu31
(0) и Cu4Ti3 (е) — образуются по перитектическим реакциям.
Соединения А и 0 существуют в узком температурном интерес.
880—865 °C — фаза А и 890—800 °C — фаза 0 и распадаются по эвт
тоидным реакциям. Соединения (, е, б и у имеют незначительна...
области гомогенности в интервале концентраций Ti 20—22; 42—<
50—52 и 67,7—70 % (ат.) соответственно.
Проходящие в системе нонвариантные превращения с участи
названных выше соединений приведены в табл. 137.
Таблица 137. Нонвариантные реакции в системе Си—Ti (1, 2]
Реакция Содержание Ti в фазах, % (ат.) Температурь,
Ж + (Си) » Cu4Ti (О 8; 20; 892±3
Ж + Cu3Ti2 (0) » Cu2Ti (Л) 40; 33,3 880
Ж в Cu4Ti3 (g) « Cu3Ti2 (0) -42; 40 890±4
Ж + CuTi (О « Cu4Ti3 (г) 50; 42,85 929 ±4
Ж Cu4Ti (<) + Cu7Ti (А.) 27; -22; 33,3 875
Ж •» CuTi (б) т CuTi2 (у) 57; -52; 66,7 960
Ж « CuTi2 (Y) + 0Ti 69; -67,7; -87 1003
Cu2Ti (А.) « Cu4Ti If) + + Cu3 Ii2 (0) 33,3; -22; 40 865
Cu3Ti2 (0) « Cii4Ti (O + + Cu4Ti3 (e) 40; -22; -42 800
(₽Ti)* ” Cul’i2 (y) + (eTi) 94,25; -70; 98,87 800
Согласно работам [4, 5] температура эвтектоидного превращения (pit) р.п- 776 и 798 °C, а содержание Ti в эвтектоидной точке 93 и 94,5 % (ат.) cooruei ственно.
В отличие от данных работ (1, 2]. авторы работы [3] обнаружь
существование еще одного соединения Cu7Ti3, которое плави с
конгруэнтно при температуре 905 °C, а при температуре 865 °C ра
падастся по эвтектоидной реакции на Cu7Ti2 и Cu3Ti2 (см. встав'
на рис. 173). По данным работы [3] соединение Cu2Ti также плавк1
ся конгруэнтно при температуре 908 °C, в то время как в работах ,;
6J указывается на перитектический характер его образования
В литературе имеются расхождения в отношении состава и теме
ратуры образования соединения, богатого Си. В работах [3, 6, 7 - '*
указывается на существование соединения Cu7Ti2, состав котор-
Cu—Ti
339
лежит между 21,9 и 22,4 % (ат.) Ti при температуре 800 °C [9].
В работах [1, 2, 10, 11] говорится о соединении Cu4Ti, причем в
исследовании [1] предполагается, что стехиометрический состав
данного соединения соответствует данной формуле при температуре
600 °C и формуле CuI5Ti4 при более высоких температурах, область
гомогенности его при температуре 800 °C простирается от 20,7 до
21,5 % (ат.) Ti. Температура перитектической реакции образования
Cu4Ti соответствует 870 °C [11]. По данным работ [12—15], ближай-
шее к Си соединение имеет формулу Cu3Ti.
Растворимость Ti в (Си) по различным данным приведена в
табл. 138.
Таблица 13.8. Растворимость Ti в (Си)
Температура, °C Растворимость Ti, % (ат.)
[13] [16] [17] [6] [18] [11]
1000 — 3,0 — — — —
950 4,5 7,0 — — — —
900 6,7 —• — — — —
870 9,6 — — 7,3 7,3 —
850 7,9 6,8 6,5 5,2 — 7,3
800 5,6 4,7 5,5 3,9 3,9 4,3
700 3,3 2,4 3,2 2,0 2,0 2,5
600 2.5 1,1 1,25 1,1 1,0 0,8±0,1
500 2,0 — 0,53 0,6 0,7 —
400 1,6 — -0,20 0,26 0,27 0,3±0,1
300 1,5 — -0,13 0,2 —- —
Растворимость Си в (Ti) определена в работах [4, 5, 19,
20], Растворимость Си в (Ti) по данным работ [19, 20] приведе-
на ниже:
Температура, °C.........
Растворимость Си, % (ат.)
Источник................
800 775 600 475 400
1,13 1,3 0,95 0,03 0,83
[19] [20] [19] [20] [19]
Кристаллическая структура соединений указана в табл. 139.
340
Си-Ti
Таблица 139. Кристаллическая структура соединений системы Си—Ti
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Истомин,
a b c
Cu4Ti (ВТ) ZrAu4 —, Pnma 0,453 0,435 1,27 HU
Cu4Ti (HT) MoN14 —, IMm 0,60 — 0,365 UH
Cu2Ti VAu2 oC 12, Amm2 0,4397 0,7988 0,4456 [2]
0,432 0,797 0,449 [21
Cu3Ti* — — 0,3133 — 1,405 [2]
0,313 — 1,395 [2Ц
Cu4Ti3 Cu4Ti3 til 4, 14/tnmm 0,3130 — L994 [2, ?1|
CuTi CuTi tP4, P4nmm 0,3125 — 0,5915 [2
CuTi2 MoSi2 — 0,2941 — 1,079 [2!
‘Тетрагональная сингония. 1 i
Литература
1. Еременко В.Н., Буянов Ю.И., Прима С.Б. // Порошковая металлургия, 19м
№ 6. С. 77-87.
2. Еременко В.Н., Буянов Ю.И., Панченко Н.М. // Порошковая металлурги-
1970. № 5. С. 73-78.
3. Zwicker U., Kalsch Е„ Nishimura Т. u.a. // Metall. 1966. Bd. 20. N < <
S. 1252-1255.
4. MacQuillan A.D. // J. Inst. Met. 1951. V. 79. P. 73.
5. Joukainen A., Grant N.J., Floe C.F. 11 Trans. AIME. 1952. V. 194. P. 766.
6. Zwicker U. // Z. Metallkunde. 1962. Bd. 53. N 11. S. 709-714.
7. Nevit M.V. // U.S. Atomic Energy Comm. ANL 6330. I960. P. 164.
8. Ence E„ Margolin H. 11 Trans. AIME. 1961. V. 221. P. 320.
9. Van Loo Bastin G.F., Leenen A.J. // J. Less-Common Met. 1978 V 5"
P. 111.
10. Raub E., Walter P., Engel M. 111. Metallkunde. 1952. Bd. 43. S. 112-118
11. Brun J.Y., Hamar-Thibault S.J., Allibert C.H. // Z. Metallkunde. 1983. Bd 7-J
N 8. S. 525-529.
12. Karlsson N. // J. Inst. Met. 1951. V. 79. P. 391-405.
13. Вигдорович B.H., Крестовников A.H., Мальцев M.B. 11 Изв. АН СССР. О где
технических наук. 1958. № 2. С. 145—148.
14. Giessen В.С., Szymanski D.S. // J. Appl. Cryst. 1971. V. 4. P. 257.
15. Tahir A., Asia T., Ideed K.M. // Fizika (SFRY). 1987- V. 19. N 2. P. 185-1'»''
16. Saarivirta M.J., Cannon H.S. // Metal. Progr. 1959. V. 76. N 2. P. 81—84.
17- Калинин К.П., Спиридонова M.3. // Труды ин-та Гипроцветметобработка М
ГипроЦМО, 1960. № 18. С. 46-57.
18. Nagata К., Nishikava S. // Report Inst. Ind. Soc. Un. Tokyo. 1981. V. 29. »8 4
P. 189.
Cu-Tl
341
В'. 19. Борискина Н.Г., Мясникова К.П. // Титан и его сплавы: Сб. Статей. М.:
Г|1аука, 1962. № 7. С. 61-67.
20. Vigier G., Pelletier J.M., Merlin J. // J. Less-Common Met. 1979. V. 64. N 2.
175-183.
Л 21. Schubert K. // Z. Metallkunde. 1965. Bd. 56. N 3. S. 197-199.
< H.P. Бочвар
s Cu—TI. МЕДЬ—ТАЛЛИЙ
На рис. 173 приведена диаграмма состояния Си—Т1, построенная
авторами работы 11] по данным работ [2, 3] в температурном интер-
. вале 1300—800 °C и по данным работ [4, 5] при температурах ниже
800 °C на основании результатов дифференциального термического,
микроскопического и калориметрического анализов при использова-
нии Си чистотой 99,995 % (по массе) и Т1 чистотой 99,999 % (по
массе) [3]. Система характеризуется наличием области несмешивае-
мости в жидком состоянии, которая охватывает интервал концентра-
ций 14,5—83 % (ат.) Т1 при монотектической температуре [2, 3].
' Критическая точка кривой расслаивания расположена при температу-
Т1°/о(по массе)
рнс. 173. Cu-Tl
342
Си—Тт
ре -1250 °C и содержании -50 % (ат.) Т1 [3]. Монотектичсч <ая
реакция протекает при температуре 968 °C: Ж [ 14,5 % (ат.) Т ] «
Ж2 [83 % (ат.) Т1] + (Си) [3]. Температура эвтектической реак-
ции Ж = (Си) + (Т1) определена в работе [4] как 300—303 °C и 0
работе [21 — 293 °C. Согласно термодинамическим расчетам, прове-
денным в работе [1], температура эвтектики принята равной 302 с.
Состав жидкости в эвтектической точке установлен при конце!
ции 99,95 % (ат.) Т1 путем экстраполяции кривой ликвиду •; к
эвтектической горизонтали [5].
Растворимость Т1 в (Си), определенная в работе [3] по данным
металлографического и рентгеновского (в скобках) анализов, приве-
дена ниже:
Температура, °C....................... 1050 1000 950
Растворимость Т1, % (ат.).......... 0,16 (0,13) 0,27 (0,28) 0,27 (0,23i
Температура, °C.................. 900 800 700 600
Растворимость Т1, % (ат.).......... 0,24 (0,17) 0,09 (0,10) 0,05 <0,03 (Ол • ‘
Литература
1. Chakrabarty D.J., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1984. V. 5 ' 1
P. 156-160.
2. Seith W., Jones H., Wagner J. // Z. Metallkunde. 1955. Bd. 46. X I
S. 773-779.
3. Predel B., Sandig H. // Mater. Set. Eng. 1969. V.4.N1.P. 49-57.
4. Doerinckel F. 11 7.. Anorg. All. Chem. 1906. Bd. 48. S. 185-188.
5. Kleppa O.J. //J. Amer. Chem. Soc. 1952. V. 74. P. 6047—6051.
E.B. Льк - . л
Cu—Tm. МЕДЬ—ТУЛИЙ
Диаграмма состояния Си—Tm экспериментально не построе. <
Растворимость Тт в (Си) исследована в работе [1] методами мет;: т-
лографического анализа и измерения электросопротивления и тв< р-
дости. В качестве исходных материалов при этом использованы i а
чистотой 99,99 % (по массе) и Тт чистотой 99,98 % (по мае;
Растворимость Тт в (Си) составляет 0,05—0,07 % (ат.) при эвтп
тической температуре.
Кроме того, имеются сведения о существовании трех соединений.
Cu5Tm [2[, Cu2Tm [3] и CuTm [4]. Авторы работы [5] представь, ы
схематичную диаграмму состояния Си—Тт (рис. 174). Темпера^ рл
плавления 1000 °C для Си5Тт, 960 °C для Си2Тт и 1100 °C J "
CuTm были установлены экстраполяцией соответствующих данвь4
для других Cu-лантаноидных систем, для которых фазовые диагра'
Си—Тт
343
Си Тт,*/, (ат.) Тт
Рис. 174. Си—Тт
мы были уже известны. Границы фазовых областей построены с
учетом экстраполированных температур нонвариантных равновесий
и термодинамических параметров. Кроме экспериментально установ-
ленных соединений предполагается образование соединений Cu9Tm2
м Cu7Tm2 с температурами плавления -1020 и -960 °C соответствен-
но по аналогии с подобными Cu-лантаноидными системами.
Кристаллическая структура соединений указана в табл. 140.
Таблица 14 0. Кристаллическая структура соединений системы Си—Тт
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Си5Тт AuBes cF24, F43m 0,6991 — — [2]
Си2Тт CeCu2 ol 12, Imma 0,4266 0,6697 0,7247 (3]
CuTm CsCl сР2, РтЗт 0,34145 — — 14]
344
Cu-V
Литература
1. Бочвар Н.Р., Лысова Е.В. // Редкие металлы в цветных сплавах: Сб. статей м
Наука, 1975. С. 12-16.
2. Buschow van der Goot A.S., Birkhan J. // J. Less-Common Met. 9
V. 19. P. 433-436.
3. Storm A.R., Benson K.E. // Acta Crystallogr. 1963. V. 16. P. 701-702.
4. Chao С.С., Luo H.L., Duwez P. 11 J. Appl. Phys. 1964. V. 35. P. 257-258.
5. Subramanian. P.R., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1988. V. 9. \ ы
P. 395-398.
H.B.
Cu-V. МЕДЬ—УРАН
Диаграмма состояния Си—U приведена на рис. 175 по данным
термического, металлографического и рентгеновского анализов
[1]. Сплавы для исследования готовили из электролитической
Си и U путем плавления в тиглях из окиси Zr и Be. Система Си- U
характеризуется наличием области несмешиваемости в жидком
состоянии. Монотектическая реакция протекает при температур
1080 °C:
Ж[~95 % (ат.) U] = TKj [-22,5 % (ат.) U] + (YU).
Рис. 175. Си-U
Cu-V
345
В системе Си—U обнаружено соединение Cu5U, которое образуется
по перитектической реакции Ж + (yU) * Cu5U при температуре
1052 °C. Существование соединений Cu5U подтверждено в работе [2].
Со стороны Си в системе проходит эвтектическое равновесие Ж »
(Си) + Cu5U при температуре 950 °C и концентрации U в эвтекти-
ческой точке 8 % (ат.).
В твердом состоянии имеют место два нонвариантных превраще-
ния, связанных с полиморфизмом U, температуры которых оказались
близкими к температурам соответствующих полиморфных превраще-
ний U.
Растворимость элементов друг в друге в твердом состоянии не
изучена. Соединение Cu5U имеет структуру типа АиВе5 (символ
Пирсона сЛ24, пр. гр. F43m) [П], близкую к типу MgCu2 [X] (сим-
вол Пирсона сЕ24, пр. гр. Fd3m) с параметром а - 0,7033+0,7038 нм
[2] или а - 0,7021 нм [П]. По данным работы [3], состав и параметр
решетки соединения Cu5U, образующегося в опытах с диффузионны-
ми парами, отклоняются от равновесных.
Литература
1. Wilhelm Н.А., Carlson O.N. 11 Trans. ASM. 1950. V. 42. P. 1311-1325.
2. Baenziger N.S., Rundle R.E., Snow A.J. et. al. // Acta Crystallogr. 1950. V. 3.
P. 34-40.
3. Adda Y. 11 C. R. Acad. Sci. Paris. 1960. V. 250. P. 115-117.
E.B. Лысова
Си—V. МЕДЬ—ВАНАДИЙ
Диаграмма состояния Си—V во всей области концентраций иссле-
довалась в работах [1—41 методами металлографического, термичес-
кого, рентгеновского анализов. В работе [4] использовался также
метод электромагнитной сепарации и микрорентгеноспектральный
анализ. Чистота исходных материалов составляла 99,99 % (по массе)
Си и 99,8 % (по массе) V. На рис. 176 приведена диаграмма состоя-
ния Си—V, построенная по экспериментальным данным работ [1—3].
Система характеризуется отсутствием соединений и широкой об-
ластью несмешиваемости в жидком состоянии, которая простирается
от 4 до 86,4 % (ат.) V при температуре монотектического равновесия
1530+15 °C. Используя экспериментально полученные термодинами-
ческие данные, авторы работы [4] построили диаграмму состояния
Си—V путем теоретического расчета. Полученная ими температура
монотектического равновесия 1778 °C значительно выше, чем указан-
ная на диаграмме см. рис. 177 по данным работ [1—3]. Протяжен-
ность области несмешиваемости при температуре монотектического
346
Си-Г
Си V
Рис. 176. Си—V
равновесия, рассчитанная в работе [4], составляет -18—80 % (л 1
V, что существенно меньше интервала протяженности, эксперимен-
тально установленного авторами работ [2, 3]. Кривая расслоени.:
как показали результаты расчета [3], имеет максимум при приблизи
тельно эквиатомном составе и температуре около 2580 °C. Согласие
расчету в работе [4] максимум кривой расслоения расположен при
температуре около 1955 °C при той же концентрации.
Помимо монотектической реакции Ж « Ж( + (V) в системе пре
температуре 1120±5 °C происходит перитектическая реакция Ж
+ (V) ** (Си) при концентрации V в жидкой фазе 0,4 % (ат.).
Максимальная растворимость V в (Си) при температуре 1120 (
составляет 0,8 % (ат.) и снижается до 0,1 % (ат.) при темпер.»
туре 20 °C. Авторы работы [51, используя метод электросети
тивления, получили значительно меньшие величины, указании
ниже:
Температура, С.................... 1000 900 800 700 600 50(»
Растворимость V, % (ат.).......... 0,114 0,075 0,04 0,017 0,008 0,00»
Cu-W
347
Максимальная растворимость Си в (V) при температуре 1530 °C —
g °/ (ат.)- Результаты по определению содержания Си и V в твердой
жидкой фазах при различных температурах, полученные методом
электромагнитной сепарации в работе [4], приведены в табл. 141.
Таблица 141. Содержание Си и V в твердой и жидкой фазах [4]
"Температура, °C Си, % (ат.) V, % (ат.)
Твердая фаза Жидкая фаза Твердая фаза Жидкая фаза
"" 1175 3 99,34 97 0,66
1260 3,5 98,7 96,5 1,29
1400 4,3 97,33 95,7 2,67
1440 4,4 — 95,6 —
1500 4,8 95,37 95,2 4,63
1530 4,9 94,58 95,1 5,42
1600 5,9 93,5 94,1 6,5
В работе [6] приведена диаграмма состояния Си—V при использо-
вании данных работ [1—4]. Для эвтектического и монотектического
равновесий в работе [6] приведены температуры 1085 и 1778 С
соответственно.
Литература
1. Савицкий Е.М., Дуйсемалиев У.К. // Вестник АН Каз. ССР. 1962. №5.
С. 55-60.
2. Савицкий Е.М., Барон В.В., Дуйсемалиев У.К., Ефимов Ю.В. // Вестник АН
Каз. ССР. 1964. № 7. С. 38-74.
3. Ефимов Ю.В. // Изв. АН СССР. Металлы. 1967. № 6. С. 163—167.
4. Allibert С., Oriole J. // J. Less-Common Met. 1977. V. 51. Р. 25—33.
5. Eicke Н., Hahlbohm H.D. 11 г. Metallkunde. 1964. Bd. 55. S. 524-528.
6. Smith J.F., Carlson O.N. 11 Bull. Alloy Phase Diagrams. 1981. V. 2. N 3.
P. 348-351.
H.P. Бочвар
Cu—W. МЕДЬ—ВОЛЬФРАМ
Си и W не взаимодействуют ни в твердом, ни в жидком состояни-
ях [X. 1].
Литература
1- SchrOter К. // Z. Metallkunde. 1931. Bd. 31. S. 197-
К.Б. Поварова
348
Cu-Y
Cu—Y. МЕДЬ—ИТТРИЙ
Диаграмма состояния системы Си—Y исследовалась в работ . .
fl—З]. В работе [1] диаграмма состояния Си—Y построена по дани -
металлографического и рентгеновского анализов и определен.,
температур начала плавления сплавов. При этом использована (. ч
чистотой 99,99 % (по массе) и Y чистотой 99 % (по массе). Соглап .>
работе [1] в системе образуются четыре соединения, три из которь
Cu4Y, Cu2Y, CuY плавятся конгруэнтно при температурах 985+1 ,
935±15 и 935 + 15° соответственно. Одно соединение Cu6Y образует,,
по перитектической реакции при температуре 930 °C. В работе j.
также установлено наличие в системе Си—Y четырех указанна
соединений, нов противоположность данным работы [1] соединена
Cu4Y образуется инконгруэнтно по синтектической реакции Ж] 1
+ Ж2 = Cu4Y при температуре 912 °C. Температура плавления други
соединений Cu6Y, Cu2Y и CuY соответственно равны 892, 895 и
952 °C.
Рис. 177. Cu-Y
В работе [4] указывается, что в системе Си—Y в области концсн
траций, богатой Си, существует соединение Cu7Y, которое поел
низкотемпературного отжига разлагается на Cu5Y и (Си). Это сосди
некие не принималось во внимание при построении диаграмм-
состояния в работах [1—3].
Cu-Y
349
Диаграмма состояния Си—Y, приведенная на рис. 177, построена
авторами обзорной работы [3], где учтены данные работ [1, 2] о
существовании четырех соединений Cu6Y, Cu4Y, Cu2Y и CuY. В
работе [3] на диаграмме также приводится соединение Cu7Y2, ста-
бильное от температуры образования до комнатной температуры, в
отличие от аналогичных соединений в системах Си—Dy, Си—ТЬ и
Си—Gd, существующих в узком температурном интервале.
Согласно работе [3] три соединения Cu4Y, Cu2Y и CuY плавятся
конгруэнтно при температурах 975±5, 935+15, 935±15° соответствен-
но. Два других соединения Cu6Y и Cu7Y2 образуются по перитекти-
ческим реакциям при температурах 910±5 и 920±5 °C. Соединение
Cu«:Y имеет область гомогенности в интервале концентрации -12,5—
14,3 % (ат.) [3]. В работе [1] область гомогенности соединение Cu6Y
не обнаружена. Соединение Cu4Y обладает областью гомогенности в
интервале концентраций 18,2—20 % (ат.) Y [1, 3].
Нонвариантные превращения, проходящие в системе Си—Y,
указаны в табл. 142.
Таблица 14 2. Нонвариантные реакции в системе Си—Y
Реакция Содержание в фазах, % (ат.) Температура, °C Источник
Ж + Cu4Y - Cu6Y — 18; 14,3 910±5 [3]
12,5; 20; 14,3 930 IU
Ж + Cu4Y - Cu7Y2 — -20; 22,2 920 ±5 [3]
Ж - (Си) + Cu6Y 9,3; s0,04; s 14,3 860 [3]
9,3; <1; 14,3 890±10 in
Ж - Cu7Y2 + Cu2Y 28; 22,2; 33,3 84О±15 [3]
Ж « Cu2Y + CuY 42; 33,3; 50 830±15 [1, 3]
Ж » CuY + (aY) 67; 50; 299,9 770 [3]
67; 50; >99,9 760 [11
(₽Y) - Ж + (aY) г99,9 -97,5; г 99,9 1470 [3]
Растворимость Y в (Си) и Си в (Y) составляет менее 1 % (ат.) [2J.
Кристаллическая структура соединений приведена в табл. 143.
Соединение Cu5Y согласно работе [4] имеет гексагональную
решетку типа СаСи5 (символ Пирсона ЛР6, пр. гр. Рь/ (ттт)),
параметры решетки для быстроохлажденного сплава: а = 0,5005 нм,
с = 0,4097 нм. В этой работе не подтверждено существование соеди-
нения Cu4Y. Соединение Cu7Y имеет также гексагональную решетку
с параметрами а = 0,4940 нм и с = 0,4157 нм 14].
350
Си-Yb
Таблица 143. Кристаллическая структура соединений системы Си—Y
Соеди- нение Прото- тип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источник
а b с
CuY CsCl сР2, РтЗт 0,3479 — — 15)
Cu2Y CeCu2 о/12, Imma 0,4305 (5) 0,6800 (5) 0,7315 (5) [6]
0,4308 (3) 0,6891 (8) 0,7303 (7) [7]
Cu4Y CaCu5? hP6, Р6/ттт? 0,4994 — 0,4113 [71
Cu6Y* — — 0,683 — 0,407 [81
Гексагональная сингония.
Литература
1. Domagala R.F., Raysch J.J., Levinson D.W. // Trans. ASM. 1961. V 5 -
P. 137-155.
2. Спеддинг Ф., Дааи A. // Редкоземельные металлы. M.: Металлургия. 196е
С. 282-284.
3. Chakrabarty D.J., Laughlin D.E. 11 Bull. Alloy Phase Diagrams. 1981. V. 2. X j
P. 315-319.
4. Buschow van der Goot A.S. // Acta Crystallogr. B. 1971. V. 27. N <>
P. 1085-1088.
5. Bruzzone G., Ruggiero A.F. // Atti Accad. Naz. Line. Rend. C. Sci. Fiz. Mat. \
1962. V. 33. P. 312-314.
6. Storm A.R., Benson K.E. // Acta Crystallogr. 1963. V. 16. N 7. P. 701—702.
7. Kejriwal P.K., Ryda E. // Acta Crystallogr. 1963. V. 16. N 8’. P. 853.
8. Гшнейднер К.А. Сплавы редкоземельных металлов: Пер. с англ. / Под. рел
Е.М. Савицкого. М.: Мир, 1965. 427 с.
Е.В. Лысо».
Си—Yb. МЕДЬ—ИТТЕРБИЙ
Диаграмма состояния Си—Yb приведена на рис. 178 по данным
работы [1] с корректировкой температур плавления исходных метал-
лов и температуры полиморфного превращения (yYb) - (pYb)
795 °C по работе [2]. Исследование было проведено с использованием
электронно-рафинированной Си чистотой 99,999 % (по массе) и \ b
чистотой 99,9 % (по массе) методами дифференциального термичес
кого, рентгеновского и магнитного анализов. Сплавы выплавляли ь
дуговой печи в атмосфере Аг.
В системе Си—Yb обнаружено существование пяти соединений
одно из которых Cu9Yb2 плавится конгруэнтно при температуре
937 °C, а другие Cu5Yb, Cu7Yb2, Cu2Yb и CuYb образуются по
перитектическим реакциям.
Си-Yb
351
Yb, */• (no массе)
>ec. 178. Cu-Yb
Нонвариантные превращения, проходящие в системе Си—Yb,
/ указаны в табл. 144.
Г Растворимость Yb в (Си) исследована в работе (31 методами
£ металлографического анализа и измерения электросопротивления.
При эвтектической температуре растворимость составляет 0,018—
0,026 % (ат.) Yb.
| Кристаллическая структура соединений указана в табл. 145.
Р Структура соединений Cu9Yb2 и Cu7Yb2 не установлена. Однако в
е' работе [1] сообщается, что основой структуры Cu9Yb2 является
тетрагональная ячейка с ориентировочными параметрами решетки
I а ® 0,496; с = 1,384 нм.
352
Си-Zn
Авторы работы [5] сообщают о соединении Cu23Yb6 с кубичсо
структурой (а= 1,203 нм), образованной только при высоком дар.,
нии (7,7 ГПа).
Таблица 14 4. Нонвариантные реакции в системе Си—Yb
Реакция Содержание Yb в фазах, % (ат.) Температура.
Ж + Cu9Yb2 ₽ Cu5Yb -12; 18,2, 16,7 879
Ж + Cu9Yb2 - Cu7Yb2 30; 18,2; 22,2 825
Ж + Cu7Yb2 ₽ Cu2Yb -37,5; 22,2; 33,3 757
Ж + Cu2Yb - CuYb -50,5 33,3; 50 628
Ж » Cu5Yb + (Cu) 10; 16,7; -0 859
Ж ₽ CuYb + («Yb) 73,5, 50; -100 472
Таблица 145. Кристаллическая структура соединений системы Си—Yb
Соеди- нение Прото- тип Символ Пирсо- на, пр.гр. Параметры решетки, нм Источит t
a b c
Cu5Yb CaCuj hP6, Pf>/mmm 0,4994 — 0,4126
Cu2Yb CeCu2 o/12, Imma 0,4291 0,6899 0,7386 [11
0,428 (1) 0,676 (1) 0,740 (1) [4|
CuYb FeB oP8, Pnma 0,7568 0,4260 0,5771 IH
Литература
1. landelli A., Palenzona А. // J. Less-Common Met. 1971. V. 25. N 3. Р. 333—3'.
2. Subramanian P.R., Laughlin D.E. // Bull. Alloy Phase Diagrams. 1988. V. 9. N 1
P. 398-403.
3. Бочвар H.P., Лысова E.B. /1 Редкие металлы в цветных сплавах: Сб. статей '<
Наука, 1975. С. 12—16.
4. Storm A.R., Benson К.Е. // Acta Crystallogr. 1963. V. 16. N 7. P. 701-702
5. Tsvyashchenko A.V. // J. Less-Common Met. 1984. V. 99. P. L9—Lil.
E.B. Лыс ' -
Cu-Zn. МЕДЬ—ЦИНК
Диаграмма состояния Си—Zn исследовалась подробно во вес
концентрационном интервале, и результаты работ обобщены в спр-
вочнике [X]. На рис. 179 приведена диаграмма состояния Си—Zu
основном по данным работ [1—3] с учетом данных работ [4—7|
области твердого раствора (Си), фаз у и Р'. Исследования проведен•
методами термического, металлографического и рентгеновски
анализов.
Cu—Zn
353
Рис. 179. Cu—Zn
В системе Cu—Zn существуют шесть фаз. Фаза (Си) кристаллизу-
ется из жидкости в интервале температур от температуры затверде-
вания Си до 902 °C и при концентрациях до 36,8 % (ат.) Zn.
В твердом состоянии в области (Си) установлены превращения,
указывающие на образование соединения с формулой Cu3Zn, сущес-
твующее в двух модификациях: и а2 [4].
Фазы р, у, б, е, (Zn) образуются по перитектическим реакциям.
Область фазы р ограничена областью концентраций 36,1 % (ат.)
Zn при температуре 902 °C, 56,5 % (ат.) Zn при 834 °C; 48,2 % (ат.)
Zn при 468 °C и 44,8 % (ат.) Zn при 454 °C. В интервале температур
454—468 °C происходит упорядочение фазы Р: р р'. В работе [5]
показано, что фаза Р' распадается по эвтектоидной реакции р' »
•2 Зак. 2144
354
Cu—Zn
~ (Cu) + у'" (НТ) при температуре -255 °C. По данным работы Д;
эвтектоидный распад фазы 0' происходит при температуре вы, ,
100 °C.
Фаза у имеет широкую область гомогенности, и максимально
протяженность ее при температуре 558 °C составляет 13 % Дат.). г;0
данным работы [61, фаза у существует в четырех модификациях i0
температур 250—280 °C стабильна фаза у'", выше 280 °C устойчивf
фаза у", которая при температурах 550—650 °C переходит в фаз\
выше 700 °C существует высокотемпературная модификация у.
Фаза 6 существует в узком температурном 700—558 °C и кон ши
трационном интервалах и при температуре 558 °C претерпев,*.
распад 6 •* у" + е.
Область е фазы находится в пределах концентраций 78 % (;5 , *
Zn при температуре 597 °C и 87,5 % (ат.) Zn при температ.
423 °C. Фаза е стабильна до комнатной температуры.
Перитектические реакции образования фаз 0, у, б, е и (?ч;
приведены в табл. 146.
Таблица 146. Перитектические реакции в системе Си—Zn
Реакция Содержание Zn в фазах, % (ат.) Температура, (
Ж + (Си) - р 36,8; 31,9; 36,1 902
Ж + Р w у 59,1; 56,5; 59 834
Ж + у ₽ 6 79,55; 69,2; 72,4 700
Ж + 6 « е 88; 76; 78 597
Ж + е ₽ (Zn) 98,3; 87,5; 97,3 423
Растворимость Zn в (Си) сначала увеличивается от 31,9 % (аг.1
при температуре 920 °C до 38,3 % (ат.) при температуре 454 °C [9;
а затем понижается и составляет 34,5 % (ат.) при температур.
150 °C и 29 % (ат.) при 0 °C [7]. Данные метал лографическо;
[9—11J, рентгеновских [7, 8, И] и электронно-микроскопически
111 ] исследований хорошо совпадают.
Растворимость Си в (Zn) приведена ниже [13]:
Температура, °C................... 400 350 300 250 200 150 95
Растворимость Си, % (ат.)........ 2,61 2,14 1,62 1,23 0,95 0,60 0,4(1
Кристаллическая структура фаз указана в табл. 147.
Параметр решетки (Си) при содержании 5 % (ат.) Zn состав.т-
ет 0,3620 нм [16], а при увеличении содержания Zn от 11,41 л
33,56 % (ат.) изменяется в пределах 0,36327—0,36898 нм соотвс*
ственно [7].
Cu—Zn
355
Таблица 147. Кристаллическая структура фаз системы Cu—Zn
фаза Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Примечание
а Ь с
p ‘ W с/2, Im 3 m — — — [7]
P' CsCl сР2, РтЗт 0,29558- -0,29582 — — При концен- трации 48,23 - 49,3 % <ат.) Zn }7}
у (ВТ)*1 у-латунь (CujZng) cl52, 743т 0,886 — — При содержа- нии 38,3 % (ат.) Zn [X, П, 14]
v'*2 — — — — — [6]
— — 0,8888 — — [6]
у" (HT)*4 — — 0,512 0,366 0,529 16]
8’5 0,300 — — При темпера- туре 600 °C и концентрации 74,5 % (ат.) Zn [14]
e’3 Mg hP2 Р63/ттс 0,2731 (4) — 0,4284 (3) При концен- трации 81,5 % (ат.) Zn [15}
**Фаза у построена на основе стехиометрического состава Cu5Zng с соотноше- нием числа валентных электронов к числу атомов 21:13 [X, П, 14}. *2Кубическая сингония. *3Кубическая сингония с элементарной ячейкой, содержащей 52 атома. *4Ромбическая сингония. *3Кубическая сингония. - _ _ - . - . - . - .. - —
Литература
1. Jitsuka D. И Z. Metallkunde. 1927. Bd. 19. S. 396-403.
2. Ruer R., Kremers K. // Z. Anorg. All. Chem. 1929. Bd. 184. S. 193-231.
3. Schramm J. // Metallwirtschaft. 1935. Bd. 14. S. 995-1001.
4. Григорьев A.T., Соколовская E.M., Пятницкий B.H. // Журнал неорганической
химии. 1957. Т. 2. № 7. С. 1546-1551.
5. Shinoda G., Amano Y. // Trans. Japan Inst. Metals. 1960. V. 1. P. 54—57.
6. Мелихов В.Д., Косымбекова K.K., Полякова Т.П. и др. // Физика металлов и
металловедение. 1963. Т. 16. Вып. 5. С. 700—702.
7. Rao S.S., Anantharaman T.R. 11 Z. Metallkunde. 1969- Bd. 60. N 4. S. 312—315.
8. Massalski T.B., Kittl J.E. //J. Inst. Austral. Inst. Metals. 1963. V. 8. P. 91—97.
9. Genders R„ Bailey G.L. // J. Inst. Met. 1925. V. 33. P. 213-221.
12*
356
Cu—Zr
10. Hume-Rothery W., Mubbot G.W., Channel-Evans K.M. 11 Philos. Trans ,v
Soc. London. 1934. V. 233. A. P. 74.
11. Erez G. 11 J. Inst. Met. 1962. V. 90. N 10. P. 403.
12. Hofmann W., Fahrenhorst G. // Z. Metallkunde. 1950. Bd. 41. N 2. S. 460—'.- >
13. Hume-Rothery W., Betterton J.O., Reynolds J. //J. Inst. Met. 1951—1952. V >)
N 11. P. 609-616.
14. Schubert K., Wall E. // Z. Metallkunde. 1949. Bd. 40. N 10. S. 383-385.
15. Moeller K. // Z. Metallkunde. 1943. Bd. 35. N 1. S. 27-28.
16. Гуляев А.П., Трусова А.Ф. 11 Журнал технической физики. 1950. T -
Вып. 1. С. 66-78.
Н.Р. Бо'к<! п
Cu—Zr. МЕДЬ—ЦИРКОНИЙ
Диаграмма состояния Си—Zr, приведенная в справочнике [X], в
основном по данным работы [1], в дальнейшем претерпела значь
тельные изменения. Были уточнены составы и температуры образов/
ния ранее установленных фаз и найдены новые соединения. Однако
до настоящего времени окончательный вариант диаграммы не отра
ботан. Основные различия связаны с идентифицированием первых
трех соединений со стороны Си. Авторы работы [2, 3] методам,,
дифференциального термического анализа, электронной микроскопии
[2] и микрорентгеновского анализа [3] установили, что одно из них
плавится конгруэнтно, а два других образуются по перитектическим
реакциям. Согласно работам [2, 4], соединение, плавящееся конгру
энтно, имеет формулу Cu4Zr (или Cu3Zr [1]), тогда как в работе |3;
приведена формула Cu7Zr2, а в работе [5] — Cu3 6Zr. Однако авторы
работы [6] для этого соединения устанавливают формулу Cu51Zr14.
которая была подтверждена в работах [7, 8]. Богатое Си соединение
образующееся по перитектической реакции, на основании данных
электронной микроскопии определено как Cu4Zr [9], Cu9Zr2 [3, 5,
8] или Cu5Zr [2, 4]. В работе [10] на основании рентгеновско
го анализа богатому Си соединению приписана формула Cu5Zr
а в работе [II] также рентгеновским анализом установлена
формула Cu9Zr2, которая принята в работе [8].
Следующему инконгруэнтно плавящемуся соединению авторы
работ [2, 3] приписывают формулу Cu5Zr2, однако авторы работ [17,
12] для этого соединения устанавливают формулу Cu8Zr3, которая
также приведена в обобщенной работе [8]. Уточнены формулы в
других соединений. В работе [13] установлено соединение Cu10Zr7
(вместо Cu3Zr2 [1]), также показано, что соединение CuZr стабильно
только при температуре выше 712±5 °C, а при температурах ниже
712±5 °C разлагается по эвтектоидной реакции на Cu10Zr7 и CuZr,
Фаза CuZr2 имеет две модификации. Переход CuZr2 (ВТ) ** CuZi
(НТ) осуществляется при температуре -927 °C [7].
Си—2 г
357
В работе [7] исследованы сплавы в интервале концентраций
25—70 % (ат.) Zr методами дифференциального термического, рен-
тгеновского и микрорентгеноспектрального анализов. В качестве
исходных компонентов использованы Си чистотой 99,99 % (по массе)
и Zr чистотой 99,95 % (по массе). Сплавы готовили дуговым пере-
плавом в атмосфере Аг, отжигали в эвакуированных кварцевых
ампулах при температурах 977—527 °C в течение 100 ч. Авторы
сообщают о четырех новых фазах: Cu24Zr13, CuZr1+z, Cu5Zr8 и Cu2Zr.
Фаза Cu2Zr содержит 33 % (ат.) Zr и существует в интервале темпе-
ратур -950—877 °C. Фаза Cu24Zrjq содержит 35 % (ат.) Zr и сущес-
твует в интервале температур -985—895 °C. При этом фазы Cu2Zr,
Cu24Zr]3 и CuZr1+z могут быть зафиксированы в образцах только
после закалки из жидкого состояния, но не сохраняются после закал-
ки из твердого состояния. Фаза Cu5Zr8 может быть зафиксирована
после закалки с любой температуры внутри ее стабильной области.
358
Си-Zr
Представленная на рис. 180 диаграмма состояния Си—Zr привел
на по данным работы [7] в интервале концентраций 25—70 % (ат
Zr, по данным работы [3], в интервале концентраций 0—25 % (ат
Zr, при этом формулы соединений приняты согласно работе [7]. А
интервале концентраций 70—100 % (ат.) Zr диаграмма построена п
данным работы [1]. Авторы работы [8] ставят под сомнениеданны.
работы [7], считая, что при проведении эксперимента в работе [7
не было достигнуто равновесие и сплавы были загрязнены примесям;
Si и О. На вставке рис. 182 показано строение части системы Си—Z
в интервале концентраций 25—70 % (ат.) Zr согласно работе [8].
Реакции образования соединений по данным различных рабо:
приведены в табл. 148, а эвтектические и эвтектоидные превращение
указаны в табл. 149.
Таблица 148. Реакции образования соединений в системе Си—Zr
Реакция Содержание Zr в фазах, % (ат.) Температура, ”C Источник
Ж + Cu51Zr14 * Cu5Zr 10,7; 22,22; 18,18 1010 [3]
—• 21,54; 16,6 1014 [И]
Ж ₽ Cu51Zr14 25; — 1110 [1]
—; 20; — 1113 12]
—; 22,2; — 1104 [3]
21,54; — 1115 [11]
Ж + Cu51Zr14 « CugZr3 30,81; 25; 28,4 1070 ID
36; 22,2, 28,4 975 13J
-32,5; 21,54; 27,27 -1025 [7]
"Ь ** ₽ Cu2Zr 27,27; 35,1; 33,33 -950 [7]
Ж + CugZr3 <« Cu24Zr(3 -35,2; 28,4; 35,1 -985 [7]
Ж ₽ Cu[0Zr7 40; — 895 [1]
41,18; — -925 17]
Ж - CuZr или ' 1 50; — 935 11]
Ж + CuZrl+z ₽ CuZr 51,5; — -935 17]
Ж + Cu5Zr8 ₽ CuZrl+z ♦ 60,8; -56,5 — 17]
Ж + CuZr2 « Cu5Zrg 66,7; 60,8 — [7]
Ж <* CuZr2 50,0; — 1000 ID
—; 51,1; — -1010 17]
Cu~Zr
359
Таблица 14 9. Эвтектические и эвтектоидные реакции в системе Си—Zr
Реакция Содержание Zr в фазах, % (ат.) Темпера- тура, °C Источник
"ж* (Си) + Cu5Zr 8,2; — 967 [3]
и ’ ч; - 8,25; — 971 [2]
9,0; ""“г — 965 [1]
Ж И Cu24Zrl3 + Cu10Zr7 35,5; -35,1; 41,18 904 [7]
Ж * CU|0Zr7 + CuZr -47,5; 41,18; 51,5 890 [7]
Ж * CuZr2 (ВТ) + (pZr) 72; 66,67; 94,7 995 [1]
CiigZr3 e CUjlZr14 + Cu10Zr7 27,27; 21,54; 41,18 612 [7]
Cu2Zr - Cu8Zr3 + Cu10Zr7 33,3; 27,27; 41,18 -877 17]
CujjZfh e Cu2Zr + Cu|0Zr7 35,1; 33,3; 41,18 -895 [7]
CuZr •* CU|0Zr7 + Cu5Zrg 51,5; 41,18; 61,52; 712 [7]
Cu5Zrs •* CU|0Zr7 + CuZr2 61,52; 41,18; 66,7 -697 [7]
CuZr1+z •* CuZr + Cu5Zr8 (z - 0,3) -56,51; 51,5; 61,52 -927 [7]
PZr » CuZr2 (HT) + (aZr) 97,7; 66,7; -99,7 822±10 Ц]
Растворимость Zr в (Си) приведена в табл. 150, по данным работ
[9, 14-17].
Растворимость Си в (Zr) приведена ниже:
Температура, °C....................................
Растворимость Си, % (ат.)..........................
Источник...........................................
995 960 925 890 850
5,3 5,25 4,67 3,94 2,79
11] [18] [18] [18] [18]
Данные по кристаллической структуре соединений указаны в
табл. 151.
Таблица 15 0. Растворимость Zr в (Си)
Температура, °C Zr, % (ат.)
(91 [14] [15] 116] [17]
Эвтектическая 0,118 0,167 0,105 0,077 —
950 — 0,125 0,084 — —
900 — 0,077 0,064 0,059 —
850 — 0,049 0,051 — 0,100
800 — — 0,032 0,042 0,042
700 — — 0,014 — —
600 — — 0,007 0,021 0,031
360
Cu—Zr
Таблица 151. Кристаллическая структура соединений системы Cu—Zr
Соединение Прототип Символ Пир- сона, пр.гр. Параметры решетки, нм Исте> НИК
a b c
Cu5Zr AuBe3 c/24, F43/n 0,687 — — 171
— — 0,6856 — 0,6882 [И!
Cu51Zr14 Gd14Ag51 ЛР65, P6/m 1,125 — 0,8275 [6|
CugZr3 CugHf3 oP44, Pnma 0,78693 0,81547 0,99848 I12J
Cu24Zrl3 — — 1,118 (9) 0,7911 (7) 0,6459 (9) (7|
Cu)0Zr7 Ni10Zr7 oC68, clca 1,26729 0,93163 0,93466 [19]
CuZr CsCl cP2, РтЗт 0,3260 — — [13|
CuZr1+2, где z»0,3 Cu cF4, РтЗт 0,412 — — [7]
Cu5Zrg’* — — 0,5672 (5) 0,7874 (2) 1,123 (8) [7]
CuZr2 (HT)*“ — — 1,592 (4) — 1,132 (8) [7]
CuZr2 (ВТ) MoSi2 tI6, 14/mmm 0,32204 ( 4) — 1,11832 (6) 120]
0,3242 (6) — 1,127 (2) [7]
Тетрагональная сверкструктура, производная от структуры типа ЛиВе5.
Ромбическая сингония.
Тетрагональная сингония.
Литература
1. Lundin С.Е., McPherson D.J., Hansen М. // Trans. AIME. 1953. V. 197
P. 273-279.
2. Perry A.J., Hugi W. 11 J. Inst. Met. 1972. V. 100. N 12. P. 378-380.
3. Кузнецов Г.М., Федоров B.H., Роднянская А.Л. и др. // Изв. вузов. Цветная
металлургия. 1978. № 6. 91—94.
4. Hillmann G., Hofmann W. // Z. Metallkunde. 1965. Bd. 56. N 5. S. 279-286.
5. Vitek J.M. // Z. Metallkunde. 1976. Bd. 67. N 8. S. 559-564.
6. Gabathuler J.P., White P., Parthe E. // Acta Crystallogr. B. 1975. V. 31. N 2
P. 608—610.
7. Kneller E., Khan V., Gorres U. 11 Z. Metallkunde. 1986. Bd. 77. N 1. P. 43-48.
8. Arias D„ Abriata J.P. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 5
P. 452—459.
9. Donachie M.J. // J. Inst. Met. 1964. V. 92. N 6. P. 180.
10. Lou M.Y.-W., Grant N.J. // Met. Trans. 1984. V. 15A. N 7. P. 1491-1493.
D-Fe
361
11. Glimois J.L., Forey P., Fcron J.L. //J. Less-Common Met. 1985. V. 113. N 2.
p. 213-224.
12. Bsenko L. // Acta Crystallogr. B. 1976. V. 32. P. 2220—2224.
! 13. Carvalho E.M., Harris J.R. // J. Mater. Sci. 1980. V. 15. P. 1224.
14. Showak W. 11 Trans. AIME. 1962. V. 224. N 6. P. 1297-1298.
15. Saarivirta M.J. // Trans. AIME. 1960. V. 218. P. 431-437.
16. Zwicker U. // Metall.1962. Bd. 16. N 5. S. 409-412.
17. Корольков A.M., Лысова E.B. // Структуры и свойства легких сплавов: Сб.
статей. М.: Наука, 1971. С. 17-20.
18. Douglass D.L., Morgana R.E. // Trans. AIME. 1955. V. 215. N 6. P. 869-870.
19. Bsenko L. // J. Less-Common Met. 1975. V. 40. P. 365—366.
20. Nevitt M. 11 Trans. AIME. 1962. V. 224. P. 195-196.
H.P. Бочвар
D-Fe. ДЕЙТЕРИЙ-ЖЕЛЕЗО
Растворимость D в Fe в зависимости от температуры исследовали
в работах [1, 2]. В работе [3] на основе теоретических предпосылок
проведен расчет растворимости D в yFe. Расчетные значения не-
сколько занижены по сравнению с экспериментальными, однако они
были также использованы при построении кривой растворимости в
работе [4]. На рис. 181 приведена часть диаграммы состояния систе-
мы Fe—D [4, М] при давлении 0,1 МПа. Зависимость растворимости
D в aFe от давления подчиняется закону Сивертса: х = Кр1, где
Fe D,%(arn.)
Рис. 181. D-Fe
362
D—Nb
Рис. 182. D—Nb
К — константа; р — давление D, МПа. При температуре полиморфна
го перехода aFe yFe (912 °C) растворимость D резко возраст;
ст. В области aFe она может быть представлена уравнением Ig.t -
= —1376/Г — 0,633, где х — концентрация Z), % (ат.), Т — темпера
тура, К. Растворимость D в yFe выражается уравнением Igx
= —1377/7° — 0,51 [4]. Для определения растворимости D в 6Fe так»
с большой достоверностью может быть использовано уравнение дл •>
растворимости D в aFe [4].
Литература
1. Sieverts A., Zapf G., Moritz Н. // Z. Phys. Chem. 1938. V. 183. S. 19.
2. Heumann Th., Primas D. // Z. Naturforsch. A. 1966. Bd. 21. S- 260—269.
3. Демин В.Б., Выходец В.Б., Гелвд П.В. и др. // Изв. АН СССР. Металлы. 1972
№ 2. С. 201-203.
4. Кубашевски О. Диаграммы состояния систем на основе железа: Пер. с англ
Под ред. Л.А. Петровой. М.: Металлургия. 1985. 184 с.
Л.Л. Рохлич
D—Nb. ДЕЙТЕРИЙ-НИОБИЙ
Исследование системы
D—Nb выполнено в работах
[1—31. При исследовании
использован Nb в виде про
волоки чистотой 99,983 ?/
(по массе), обезуглерожен
ный в атмосфере О2 при
температуре 1800 °C, при
давлении 1,33- 10'^ МПа
и отожженный в вакууме
(р > 1,33- 10‘14 МПа) при
2100 °C. Насыщение Nb
дейтерием в сплавах с
содержанием D, равным
4,8—49,3 % (ат.) проведено
при температуре 600 °C и
равновесном давлении газа
[2]. На рис. 182 приведена
часть диаграммы состояния
системы D—Nb, по данным
работы [3], как результа!
резистометрических исследований сплавов в интервале концентраций
0,1—40 % (ат.) D. Согласно работе [2J критическая точка бинодали
при которой твердый раствор на основе Nb распадается на два твер
дых раствора а и а', расположена при ~25 % (ат.) D и температуре
177 °C.
D-Та
363
Литература
1 Westlake D.G., Ocker S.T. // A. Met. Trans. 1975. A. 6. N 2. P. 399-402.
2. Bauer H.C., Tretkowski J., VOlke J. u.a. // Z. Phys. 1977. Bd. 28. S. 255-258.
3. Kinichirou D.F., Yen C.H., Masayoshi T. // J. Jap. Inst. Met. 1979. V. 4'3. N 7.
p. 611—617.
E.H. Шефтель
D—Та. ДЕЙТЕРИЙ-ТАНТАЛ
В работе [1] приведен вариант диаграммы состояния D—Та
(рис. 183) в интервале температур —40—100 °C. Исследование выпо-
лнено методом термического анализа. В системе существуют два
соединения: фаза е, образующаяся конгруэнтно при температуре
65 °C и при температуре -15 °C распадающаяся по эвтектоидной
реакции е * (D) + TaD(0), и соединение TaD(p), кристаллизующееся
по перитектоидной реакции при температуре 60 °C. Указано также,
что при температурах 70 и 65 °C конгруэнтно образуются еще два
соединения: фазы Сиу; состав этих фаз не установлен.
Литература
1. Condon J.B., Schober Т., Lasser R. // J. Nucl. Mater. 1990. V. 170. P. 24-30.
С.П. Алисова
365
364
D—Zr
D-V. ДЕЙТЕРИЙ-ВАНАДИЙ
В работе [1] фольгу V чистотой 99,8 % (по массе) и толщиной
0,2 мм дегазировали в вакууме при температуре 900 и затем п; ,<
температуре 600 °C рафинировали водородом. Насыщение металла о
проводили при 600 °C. D получали разложением TiD2. Таким обра
зом, удалось синтезировать сплавы с максимальным содержанием i
до VD0 77. Исследование проводили методами термического, рентгс
невского и нейтронографического анализов, измерением теплоемко,
ти в интервале температур —140—200 °C. Кроме неупорядоченной
твердого раствора D в V в сплавах системы V—D образуются четыре
фазы с упорядоченным расположением атомов; фаза (3 — сверхструк
тура VD при температуре ниже 133,5 °C; фаза у — сверхструктур..
V4D3 при температуре ниже —122 °C, фаза б — сверхструктура VD]
при температуре ниже —32 °C, а также С фаза.
В работе [2] с учетом данных работ [1, 3, 4] построена диаграмма
состояния системы V—D, приведенная на рис. 184. При температуре
—39 °C образуется фаза С по реакции (V) + б * С, при температуре
—62 °C эта фаза распадается по эвтектоидной реакции на смесь р +
\ + б. При температуре —56 °C и содержании ~75 % (ат.) D осущес-
| твляется эвтектоидное превращение (V) « р + <.
। фаза Р имеет тетрагональную структуру (пр. гр. С tn или lA^amd,
параметры сверхструктуры А = 2а0, С - с0. Фаза у обладает ОЦК
решеткой (пр. гр. Рп2, параметры свсрхструктуры А = С = ^2а0 ,
В » 2д0). Фаза б имеет ОЦК структуру (пр. гр. Рппп, параметры
сверхструктуры А = В = j3aQ , С = а0).
В работе [5] исследовали влияние давления на растворимость D
В V при температурах от 20 до 80 °C. В области низких концентра-
ций значения растворимости D в V подчиняются закону Сивертса.
Сведения, подтверждающие данные предыдущих исследований диаг-
раммы состояния V—D, полученные методом измерения парциальных
давлений и электросопротивления, содержатся в работе [6]. Авторы
работы [3] пос роили зависимость Igx — 1/Т, где х — предельная
растворимость D в V, % (ат.), Т — температура, К [7].
Литература
1. Asano Н., Hirabayashi М. // Phys. Status Solidi (а). 1973. V. 15. NI.
Р. 267-279.
2. Pesch W., Schober T., Wenzl H. 11 Scr. Metall. 1982. V. 16. N 3. P. 307-312.
3. Schober T. // Scr. Metall. 1978. V. 12. N 6. P. 549-554.
4. Papathanassopouios K., Wenzl H. // J. Phys F. Met. Phys., 1982. V. 1. N 7.
P. 1389-1381.
5. Papathanassopouios K., Wenzl H. // J. Phys. F. Met. Phys. 1982. V. 12. N 7.
P. 1369-1381.
6. Kinichirou D.F., Huang Yen C.H. Masayoshi T. // J.Jap. Inst. Met 1979. V. 43.
N 7. P. 611-617.
7. Flanagan T.B., Schober T., Wenzl H. // Acta Metall. 1985. V. 33. N 4.
P. 685-691.
77.5. Будберг
D—Zr. ДЕЙТЕРИЙ-ЦИРКОНИЙ
Диаграмма состояния D—Zr полностью не построена, часть диаг-
раммы состояния D—Zr со стороны Zr приведена на рис. 185 [1]. В
системе D—Zr существуют твердые растворы на основе aZr и pZr,
фазы б и е на основе ZrD2 [ 1, 2]. В системе найдена также фаза у
на основе ZrD, однако авторы работы [2] полагают, что этот дейте-
Рид является метастабильной фазой (согласно работе [3] фаза у
считается равновесной). Дейтериды получены насыщением химичес-
ки чистого металлического Zr газообразным D при 900 °C в тече-
ние 4 ч с последующим медленным охлаждением до 700 °C или
Методом самораспространяющегося высокотемпературного синтеза
14]). D понижает температуру Р « а превращения Zr до температуры
550 °C [1].
366
D-Zr
Рис. 185. D—Zr
Границы области PZr + 6 определены экспериментально по изотер
мам давления в интервале температур 600—800 °C. Экстраполяцией
границ между pZr и pZr + 6 областями и между pZr + 6 и 6 областя
ми до температуры эвтектоидной реакции pZr * aZr + 5 определен
состав эвтектоида -42—43 % (ат.) D и граница эвтектоидной гори-
зонтали (по D) -56 % (ат.) D.
Растворимость D в aZr подчиняется закону Сивертса [5, 6] в
интервале температур 500—800 °C и давлений 1,33(10° — 10‘6) МПа
и выражается уравнением Igx = 0,51g/? — 0,17 + 3300/Г, а в интервале
давлений 1,33(10'11 — 10'Э МПа и температур 450—750 °C завися-
Dy—Er
367
остью Igx e 0,51gp + 0,219 + 2690/T [5], где x — концентрация D,
у(ат.), p — давление, МПа, T — температура, К. В результате
/^общения литературных данных предложено уравнение раствори-
°ости D в aZr Igx = 0,51gp — 3,26 + 3010/7' (уравнение применимо до
М< 8 9 % (ат.) D при 447—797 °C [7]). Давление диссоциации дейте-
пилов Zr° измерено для соотношений D:Zr = 0,02-1,80 в интервале
давлений (5,32—133) 10 4 МПа и температур 352—560 °C [8].
фаза б (ZrD2) относится к кубической сингонии (пр. гр. О$ —
Fmim, а - 0,476 нм для ZrDj 79 при 20 °C [2]). Фаза e(ZrD2) имеет
гранецентрированную тетрагональную структуру, пр. гр. lA/mtnm
параметры решетки для состава ZrDj «2 составляют: а = 0,488, с =
-0,455 нм при 20 °C, для состава ZrDt 96 а = 0,4939 нм, с =
- 0,4473 нм при 20 °C [2].
С повышением температуры степень тетрагональное™ решетки
ZrD2 уменьшается от da = 0,934 при 597 °C до с/а — 0,948 при
650 °C [2]. С увеличением давления отношение с/а уменьшается
линейно от 0,904 при атмосферном давлении до 0,884 при р = 10 ГПа
(для ZrDt эд) [9]. Дейтерид y(ZrD) имеет гранецентрированную
тетрагональную структуру, пр. гр. Р42/и. Для ZrD — метастабильной
фазы, присутствующей в образце состава ZrDj 82 совместно с фазами
е и б [2], параметр решетки а = 0,4586 нм, с - 0,4848 нм.
Литература
1. Singh К.Р., Parr J.G. // Trans. Faraday Soc. 1963. V. 59. N 10. P. 2256-2259.
2. Петрунин В.Ф., Глазков В.П., Савин В.И. и др. // Физика металлов и металло-
ведение. 1978. Т. 46. № 1. С. 206-209.
3. Солодинин А.М., Бойко Е.Б., Андриевский Р.А. // Изв. АН СССР. Металлы.
1978. № 1. С. 198-203.
4. Петрунин В.Ф., Долуханян С.К., Земляное М.Г. и др. // Физика твердого тела.
1981. Т. 23. № 7. С. 1926-193В.
5. Nagasaka М., Yamashima Т. // J. Less-Common Met. 1976. V. 45. N 1. Р. 53—62.
6. Ricca F. // J. Phys. Chem. 1967. V. 71. N 11. P. 3632-3637.
7. Fromm E., Jehn H. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324-325.
8. Morton J.R., Stark D.S. // Trans. Faraday Soc. 1960. V. 56. N 3. P. 351-356.
9. Glazkov V.P., Irodova A.V., Somenkov V.A. // J. Less-Common Met. 1987. V. 129.
N 1-2. P. 165-170
Л.А. Третьяченко
Dy—Er. ДИСПРОЗИЙ—ЭРБИЙ
На рис. 186 изображена диаграмма состояния Dy—Ег.
Сплавы синтезировали в дуговой печи в атмосфере Аг из компо-
нентов высокой чистоты, суммарное содержание примесей в которых
не превышало 0,01 % (по массе). Слитки прокатывали в холодном
состоянии на листы, полировали поверхность и отжигали в вакууме
при 550 °C в течение 20 ч завернутыми в фольгу из Та. Исследо-
368
Dy—Fe
By Fr^/afam.) Er
Рис. 186. Dy—Er
вание выполняли методами термического, рентгеновского и микром
труктурного анализов [1]. Температура начала плавления сплавов
линейно возрастает с увеличением содержания Ег. Одновременно
повышается температура полиморфного превращения Dy от 1381 д•>
1466 °C при содержании 50 % (ат.) Ег. В твердом состоянии Dy и Е;
при температурах менее 1381 °C неограниченно растворимы друг я
друге.
Список литературы
1. Spedding F.H., Sanden В., Beaudry В J. //J, Less-Common Met. 1973, V. 31. X
P. 1-13.
А.П. Будбер
Dy—Fe. ДИСПРОЗИЙ-ЖЕЛЕЗО
Диаграмма состояния Dy—Fe по данным работы [1] приведена н.«
рис. 187. Сплавы изготовляли из Dy чистотой 99,9 % (по массе) и Ге
чистотой 99,999 % (по массе). В системе образуются четыре соединс
ния: Fe17Dy2, Fc3Dy, Fe23Dy6 и Fe2Dy. Соединения Fe17Dy2 и Fe3Dv
плавятся с открытым максимумом при 1375 и 1305 °C соответствен
но, соединения Fe23Dy6 и Fe2Dy образуются по перитектические
реакциям при 1290 и 1270 °C соответственно. В сплавах система
кристаллизуются три эвтектики: yFe + Fe17Dy2, Fe23Dy6 + Fe3Dy ।
Fe2Dy + aDy при 1360, 1285 и 890 °C соответственно. Заметное
Dy—Fe
369
Рис. 187. Dy—Fe
растворимости компонентов системы в соединениях не обнаружено.
Соединение Fe23Dy6 имеет кристаллическую структуру изомор-
фную Th6Mn23 (пр. гр. Fm3m), а = 1,206 нм [2]. Соединение Fe2Dy
обладает решеткой типа MgCu2 (символ Пирсона с/24, пр. гр. Fd3m,
а ® 0,732 нм). Решетка Fe3Dy изоморфна PuNi3 (пр. гр. R3m, а =
= 0,5116 нм, с = 2,4555 нм). Гексагональную решетку типа Th2Ni17
(пр. гр. РбЛттс) имеет соединение Fe17Dy2, а = 0,8453 нм, с =
в 0,8287 нм.
Литература
1 Goot A.S., Buschow K.H.-J. // J. Less-Common Met. 1971. V. 21. N 2.
P 151-157.
2 Крипякевич П.И., Франкевич Д.П. // Кристаллография. 1965. Т. 10. № 4.
560.
А. П. Будберг
370
Dy—Ga
Dy—Ga. ДИСПРОЗИЙ-ГАЛЛИЙ
Диаграмма состояния системы Dy—Ga представлена на рис.
Сплавы синтезировали плавкой в герметически закрытых ти< . ix
из Та. Исходными компонентами служили Dy чистотой 99,9 % io
массе) и Ga Чистотой 99,999 % (по массе) fl). Сплавы отжигали в
герметических условиях в течение 400 ч при температурах, близ; |Х
к температурам перитектических реакций. Исследование проводниц
методами термического, микроструктурного анализов, измеренном
микротвердости. В системе образуются четыре соединения: Оу5С.ц,
DyGa, DyGa2 и DyGa3, из которых DyGa2 плавится конгруэнтно ири
1330 °C, остальные кристаллизуются по перитектическим реакциям
Dy—H 371
при 1210, 1280 и 800 °C соответственно. В сплавах системы при
940 "С образуется эвтектика Dy + Dy5Ga3, в которой содержится
20 % (ат.) Ga. Взаимная растворимость компонентов друг в друге не
установлена.
Соединение Dy5Ga3 имеет кристаллическую решетку типа Сг5В3
(символ Пирсона /732, пр. гр. 14/(тст), а = 0,7629 нм, с - 1,402 нм).
Соединение DyGa обладает решеткой типа СгВ (символ Пирсона
оС$, пр. гр. Стет, а - 0,4307 нм, b = 1,0894 нм, с = 0,4059 нм).
Соединение DyGa2 имеет кристаллическую решетку типа А1В2 (сим-
вол Пирсона hP3, пр. гр. Рб/ттт, а = 0,4206, с - 0,411 нм).
Литература
1. Yatsenko S.P., Semyannikov А.А., Semenov B.G., Chuntonov К.А. // J. Less-
Common Met. 1979. V. 64. N 2. P. 185-194.
А.П. Будберг
Dy—H. ДИСПРОЗИЙ-ВОДОРОД
Диаграмма состояния Dy—H не построена. В системе установлено
существование двух гидридов: DyH2 и DyH3. Соединение DyH2 имеет
кубическую структуру с параметром решетки а = 0,3201 нм, а соеди-
нение DyH3 — гексагональную структуру типа Ni3As (пр. гр. Р3с1,
уп
Dy-Hg
а = 0,367 нм, с = 0,660 нм, [Э] или а = 0,6369 нм, с = 0,661
[Ш]). Температурная зависимость давления диссоциации D\H-,
может быть представлена зависимостями Igp = 13,28 — 12120/7’ j j f
или Igp = 12,38 — 10980/Г [2]. Соединение DyH2 гомогенно в интер-
вале концентраций 65,8—67,4 % (ат.). Граница области гомогенно:• и
DyH3 со стороны Dy при температурах 200—300 °C соответствх Ст
72,6 % (ат.) Н. Температурная зависимость растворимости Н в Dy
может быть представлена уравнением Igx = —3,25 + 4100/Г, где л --
концентрация Н, % (ат.), Т — температура, К, для интервала темпе-
ратур 560—980 °C (рис. 189).
Литература
1. Фромм Е., Гебхардт Е. // Газы и углерод в металлах: Пер. с нем. / Под ред.
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
2. Mcguillan A.D. // J. Less-Common Met. 1976. V. 49. Р. 431—438.
В. И. Шаповал в
Dy-Hg. ДИСПРОЗИЙ-РТУТЬ
На рис. 190 изображена диаграмма состояния Dy—Hg.
Сплавы синтезировали в тиглях из Та в атмосфере инертного газа.
Исследование проводили методами термического и рентгеновского
Dy—Но
373
^ализов [1]. В системе образуются три соединения: DyHg3, DyHg2
И DyHg, которые диссоциируют при температурах 500, 550 и 610 °C
Соответственно. В сплавах ряда других редкоземельных металлов
(РЗМ) с Hg существует еще одно соединение типа (P3M)Hg4, в
сплавах с Hg это соединение не было установлено.
Литература
' 1. Kirchmayr H.R., Lugscheider W. // Z. Metallkunde. 1966. Bd. 57. N 10.
S. 725-728.
А.П. Будберг
Dy—Но. ДИСПРОЗИЙ-ГОЛЬМИЙ
Особенности взаимодействия Dy и Но исследовали в работах [1,
2]. По данным работы [ 1 ], в системе Dy—Но наблюдаются непрерыв-
ные ряды твердых растворов как на основе низкотемпературной
модификации с гексагональной плотноупакованной структурой, так
и на основе высокотемпературной модификации со структурой объем-
но центрированного куба. В работе [2] установлено образование
непрерывного ряда твердых растворов с объемно центрированной
кубической структурой и показано, что температура начала плавле-
Р«с. 191. Dy—Но
374
Dy—In
ния Dy при добавлении к нему Но непрерывно возрастает. Такж;
возрастает и температура полиморфного превращения Dy от 1381 до
1458 °C при 75 % содержании (ат.) Но. В работе [2] исходили и-
соображений, что Но мономорфный металл. Диаграмма плавкости
системы Dy—Н (рис. 191 [2]) позволяет предположить перитектиче
скую кристаллизацию с точкой превращения вблизи 75 % (ат.
Но, отвечающей составу, в котором пересекаются кривые начала г
конца кристаллизации сплавов системы. Характер превращений 1
системе согласно работе [2] подтверждают данные расчета, проведен
ного в работе [3].
Литература
1. Маркова И.А., Терехова В.Ф., Савицкий Е.М. // Изв. АН СССР. Металль
1970. № 6. С. 170-175.
2. Spedding F.H., Sanden В., Beaudry B.J. // J. Less-Common Met. 1973. V. 31. N 1
P. 1-13.
3. Shiflet G.J., Lee L.K., Aaronson H.I. // Calphad. 1979. V. 3. P. 129.
А.П. Будберг
Dy—In. ДИСПРОЗИЙ—ИНДИЙ
Диаграмма состояния системы Dy—In приведена на рис. 192.
Сплавы изготовляли из Dy чистотой 99,9 % (по массе) и In чисто
той 99,999 % (по массе). Сплавы гомогенизировали при 800 °C i
течение 450 ч и закаливали в воде [1, 2]. Исследование выполнено
методами термического, микроструктурного и рентгеновскогЬ анали
зов. В системе образуются пять соединений. Фазы Dy2In, Dyln,
Dy3In5 и Dyln3 плавятся конгруэнтно при 1260, 1300, 1140 и 1150 °C
соответственно. Соединение Dy5In3 образуется по перитектической
реакции при температуре -1220 °C. В сплавах системы кристаллизу
ются две эвтектики 0Dy + Dy2In, Dy3Inc + Dyln3 при одинаковой
температуре 1100 °C. При температуре 1000 °C 0Dy, содержащий
-16 % (ат.) In, претерпевает эвтектоидное превращение PDy
* a Dy + Dy2In. При температуре 1000 °C в aDy растворяется 8 %
(ат.) In. Очевидно, в сплавах, богатых In, при 160 °C протекает вы-
рожденное перитектическое превращение.
Фаза Dy2In имеет кристаллическую структуру типа Ni2In (символ
Пирсона hP6 пр. гр. Рб^/tntnc, а = 0,5343 нм, с = 0,6677 нм). Фаза
Dy5In3 имеет структуру типа W5Si3 (символ Пирсона /732, пр. гр.
14/тст, а = 1,212 нм, с = 0,596 нм). Фаза Dyln обладает структурой
типа CsCl (символ Пирсона сР2, пр. гр. Pm Зиг, а = 0,3791 нм). Фаза
Dyln3 имеет структуру типа AuCu3 (символ Пирсона сР4 пр. гр
Pm 3 m, а = 0,4573 нм).
Dy—In
375
Рис. 192. Dy—In
Литература
1. Кувандыков O.K., Шакаров X.O., Яценко С.П. и др. // Доклады АН УЗССР.
1981. № 2. С. 28-30.
2. Yatsenko S.P., Semyannikov А.А., Shakarov H.J., Fedorova E.G. // J. Less-
Common Met. 1983. V. 90. № 1. P. 95-108.
А.П. Будберг
376
Dy—Ir, Dy—La
Dy—Ir. ДИСПРОЗИЙ-ИРИДИЙ
Диаграмма состояния Dy—Ir не построена. Согласно работам [Э
Ш] в системе существует соединение Dylr2 со структурой тип;;
MgCu2 (символ Пирсона с/,’24, пр. гр. Fd3m, а = 0,7517 нм).
А.П. Будбер,-
Dy—La. ДИСПРОЗИЙ-ЛАНТАН
Фазовая диаграмма состояния La—Dy экспериментально не постро-
ена [1, М]. На рис. 193 представлен гипотетический вариант диаг-
раммы состояния системы La—Dy, предполагающий образование
непрерывных ряде? твердых растворов между высокотемпературными
Dy—Lu
377
модификациями компонентов и эвтектоидную реакцию при темпера-
туре -850 °C (yLa, PDy) pDy + a (Dy, La). При температуре
-735 °C и содержании -30 % (ат.) Dy образуется промежуточная
фаза (б) со структурой типа aSm (символ Пирсона KR3, пр. гр. R3m).
В работе [2] исследована кристаллическая структура и измерены
параметры решетки семи сплавов системы La—Dy при температуре
20 °C. Сплавы предварительно были отожжены пои температуре
200 °C в течение 14 дней. Установлено, что область фазы a La распо-
ложена в интервале концентраций 0—21 % (ат.) Dy; в интервале
21—38 % (ат.) Dy существует фаза со структурой aSm. Зависимость
параметров решетки сплавов от состава имеет отрицательное откло-
нение от закона Вегарда в области фазы a Dy и положительное откло-
нение в области фазы a La, что свидетельствует об отклонении рас-
творов от идеальных.
Литература
1. Gschneidner, Jr., К.А., Calderwood F.W. Handbook on the Physics and Chemistry
of Rare Earths. Amsterdam New-York. Oxford. Tokyo: North-Holland Physics Publishing
Co., 1986. V. 8. Chap. 54. P. 1-161.
2. Krizek H., Taylor K.N.R. //J. Less-Common Met 1974 V 38 P. 263—265.
U.K. Григорович
Dy-Lu. ДИСПРОЗИЙ-ЛЮТЕЦИЙ
Диаграмма состояния Dy—Lu экспериментально не построена [1,
М]. Dy и Lu в металлическом состоянии имеют идентичное электрон-
ное строение 5d'6s2, одинаковую кристаллическую структуру типа
Mg (символ Пирсона hP2, пр. гр. Р^/ттс} с близкими параметрами
решетки и атомными радиусами, отличающимися всего на 2,25 %.
В табл. 152 приведена кристаллическая структура Dy и Lu.
Таблица 15 2. Кристаллическая структура и полиморфные превращения
элементов системы Dy—Lu
Атом- ный номер, элемент Моди- фика- ция Прото- тип, струк- тура Параметры ре- шетки, нм Темпе- ратура превра- щении, “С Реакция Источ- ник
а С
66, Dy aDy Mg, ГПУ 0,35915 0,5650 1381 aDy •* pDy [I]
PDy W, ОЦК 0,398 — Mi? в Dy - Ж [1]
71, Lu — Mg, ГНУ 0,35052 0,55494 1663 Lu ₽ ^К.рр|у [2]
1790 Ж »ЖоцК [2]
378
Dy—Lu
Рис. 194. Dy—Lu
Можно предположить, что Dy и Lu образуют непрерывный ря <
почти идеальных твердых растворов с малым отклонением от закон:;
Вегарда кривой зависимости параметров решетки от состава сплавов
Lu в твердом состоянии при высоких температурах вблизи температу
ры плавления не испытывает полиморфного превращения, но имес
соответствующее изменение ближнего порядка в жидком состоянии
при температуре 1790 °C [2]. Учитывая близость растворов к идеаль
ным, построено схематическое изображение диаграммы состояния
Dy—Lu (рис. 194). Характерным является слияние ликвидуса и
солидуса практически в одну общую прямую с узким интервалом
двухфазной области между ними. В другую прямую сливаются линии
сольвуса и ликвуса. Перитектическая точка расположена при темпе
ратуре 1455 °C и содержании 18 % (ат.) Lu.
Литература
1. Gschneidner, Jr., К.А., Calderwood F.W. Handbook on the Physics and Chemist:
of Rare Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publishing
Co., 1986. V. 8. Chap. 54. P. 1-161.
2. Григорович В.К., Григорович К.В. // Строение и свойства металлические
шлаковых расплавов: Тезисы докладов на VII Всероссийской конференции. Челябинск
ЧПИ, 1990. Т. 2. Ч. 2. С. 250-252.
В. К. Григорова
Dy—Mg
379
py—Mg. ДИСПРОЗИЙ-МАГНИЙ
В системе Dy—Mg (рис. 195) методом рентгеновского анализа
установлены четыре соединения: MgDy, Mg2Dy, Mg3Dy и Mg24Dy5
[1—4]. В работе [5] существование соединения Mg3Dy не было под-
тверждено. В работе [1] фазовые превращения в сплавах системы
были изучены лишь со стороны Dy, в работах [6, 7] — со стороны
Mg. В системе осуществляется перитектическое превращение при
температуре 857 °C и эвтектоидное превращение при температуре
706 °C.
Рис. 195. Dy—Mg
Растворимость Mg в a Dy при эвтектоидной температуре составля-
ет 13,5 (ат.) %. С понижением температуры растворимость Mg в aDy
снижается и при 350 °C составляет около 2,7 % (ат.) [8]. Со стороны
Mg в системе имеет место эвтектическое превращение при темпера-
туре 561 °C. Растворимость Dy в твердом Mg при отдельных темпера-
турах составляет 4,83 % (ат.) при 561 °C, 4,65 % (ат.) при 540 °C,
4,18 % (ат.) при 500 °C, 3,13 % (ат.) при 400 °C, 2,37 % (ат.) при
300 °C и 1,67 % (ат.) при 200 °C.
380
Dy—Мп
Соединение MgDy имеет кубическую структуру типа CsCl (симе- i
Пирсона сР2, пр. гр. РтЗт, а = 0,3786 нм, [1], а = 0,3784 нм [<).,
а = 0,3767 нм [3], а соединение Mg2Dy — гексагональную структур,
типа MgZn2 (символ Пирсона ЛР12, пр. гр. Pb-Jmmc, а = 0,602 н\
с = 0,976 нм [3]). Фаза Mg3Dy обладает кубической структурен
типа Fe3Al (или BiF3>, а = 0,7267 нм [3]. Соединение Mg24D .
имеет кубическую структуру типа Ti^Re24 (упорядоченная ре-
шетка типа аМп, символ Пирсона с/58, пр. гр. /43т, а
= 1,124 нм [4]).
Литература
1. Miller А.Е., Daane А.Н. // Trans. AIME. 1964. V. 230. N 4. P. 568-572.
2. Крипякевич П.И., Евдокименко В.И., Гладышевский ЕИ. // Кристаллографе.
1964. Т. 9. № 3. С. 410-411.
3. Kripiakewysch P.I., Evdokimenko V.I. // Z. Anorg. All. Chem. 1967. Bd. 35
N 1/2. S. 104-112.
4. Крипякевич П.1, Евдокименко B.I. // Допов1д1 АН УРСР. 1962. № 1
С. 1610-1011.
5. Buschow K.H.J. // J. Less-Common Met. 1976. V. 44. N 1. P. 301—306.
6. Рохлин Л.Л., Деева Л.П. // Технология легких сплавов. 1976. № 12. С. 83—8-’
7. Рохлин Л.Л. Магниевые сплавы, содержащие редкоземельные металлы. М
Наука, 1980. 192 с.
8. Joseph R.R., Gschneidner К.А. // Trans. AIME. 1965. V. 233. N 1
P. 2063-2069.
9. landelli A., Palenzona A. // J. Less-Common Met. 1965. V. 9. NI. P. 1—6.
Л.Л. Рохли •
Dy—Мп. ДИСПРОЗИЙ-МАРГАНЕЦ
Диаграмма состояния Dy—Мп изображена на рис. 196 по данны..
работы [1]. Сплавы исследовали методами рентгеновской
термического анализов. В сплавах системы Dy—Мп по псритектичс;
ким реакциям образуются соединения DyMn2, Dy6Mn23 и DyMn, .
при температурах 930, 1035 и 1075 °C соответственно. Пр>
температуре 855 °C кристаллизуется эвтектика Dy + DyMn2, эвтектн
ческая точка расположена при содержании 12 % (по массе) Mi-
Растворимость Dy в Мп не превышает 1 % (по массе) при темпера
туре 100 °C. Dy понижает температуру полиморфного превращена
6Мп до 1120 °C.
Соединение DyMn2 обладает кубической решеткой типа MgCu
(символ Пирсона cF24, пр. гр. Fd3m), соединение Dy6Mn23 имее<
решетку типа 77г6Мп23, а соединение DyMn12 — тетрагональную
структуру типа ThMn[2-
Dy Мп, °/o (по массе) Мп
Рис. 196. Dy—Мп
Литература
1. Kirchmayr H.R., Lugscheider W. // Z. Metallkunde. 1967. Bd. 58. N 3.
S. 185—188.
П.Б. Будберг
Dy-Mo. ДИСПРОЗИЙ—МОЛИБДЕН
По данным работы [Э], в системе Dy—Мо соединений не образует-
ся. Термодинамические расчеты, проведенные в работе [1], позволи-
ли предположить существование эвтектики при температуре 1377 °C
и содержании 2 ±0,5 % (ат.) Мо и взаимную растворимость компо-
нентов в интервале температур 827—1117 °C.
Литература
1. Brewer L., Lamoreaux R.H. // Atomic Energy Review. Special Issue № 7 Molibde-
num: Physico-Chemical Properties its Compounds and Alloys. Vienna: International Atomic
Energy. 1980. P. 195-356.
К. Б. Поварова
382
Dy—Nb, Dy—Nd
Dy—Nb. ДИСПРОЗИЙ—НИОБИЙ
Диаграмма состояния Dy—Nb не построена. Промежуточных фа,
в системе не установлено. По данным работы [1], можно предполо
жить присутствие области несмешиваемости для всех систем Nb -
РЗМ (правило Хильденбрандта).
Литература
1. Спеллинг Ф., Даан А. Редкоземельные металлы. М.: Металлургия, 1965. 427 с
Е.И. Шефте.л,
Dy—Nd. ДИСПРОЗИЙ—НЕОДИМ
Рис. 197. Dy—Nd
Dy-Ni
383
Диаграмма состояния Dy—Nd построена в работах [1, 2]. Сплавы
изготовляли из Nd чистотой 99,34 % (по массе) и Dy чистотой
99,76 % (по массе) плавкой в дуговой печи в атмосфере Аг. Исследо-
вание проводили методами микроструктурного, рентгеновского,
термического анализов. В работе [1] установлено образование непре-
рывного ряда твердых растворов между изоморфными модификация-
ми компонентов системы и образование фазы Nd3Dy2 (S) по перитек-
тоидной реакции.
Однако в работе [2] указывается, что сплавы легких (La, Се, Рг,
Nd) и тяжелых (от Gd до Tm, Lu) лантаноидов образуют фазу типа
aSm (б фаза). Эта фаза разлагается конгруэнтно на два твердых
раствора ДГПУ (aNd) и ГПУ (aDy). На рис. 197 диаграмма состоя-
ния Dy—Nd приведена согласно работе [2].
Литература
1. Кобзенко Г.Ф., Свечников В.Н., Мартинчук Е.Л. // Докл. АН СССР. 1972.
Сер. А., № 6. С. 563-565.
2. Gschneidner, Jr., К.A., Calderwood F.W. Handbook on the Physics and Chemistry
of Rare Earth. Amsterdam, New-York, Oxford, Tokyo: North-Holland Physics Publishing
Co., 1986. V. 8. Chap. 54. P. 1-161.
А. П. Будберг
Dy-Ni. ДИСПРОЗИЙ-НИКЕЛЬ
Диаграмма состояния Dy-Ni представлена на рис. 198 по данным
работы [1].
Сплавы изготовляли плавкой в тиглях из А12О3, гомогенизировали
при температуре 500—700 °C в зависимости от состава и охлаждали
со скоростью 10 °C до комнатной температуры. Исследование выпо-
лняли методами термического и рентгеновского анализов. В системе
образуются десять соединений. Соединения DyNi и DyNi5 плавятся
с открытым максимумом при температурах -1260 и -1450 °C соот-
ветственно; соединения Dy3Ni, Dy3Ni2, DyNi2, DyNi3, Dy2Ni7,
DyNi4, Dy4Ni17 и Dy2Ni17 образуются по перитектическим реак-
циям при температурах 762, 928, 1258, 1283, 1307, 1336, 1352
и 1321 °C. В сплавах системы кристаллизуются три эвтектики: Dy3Ni
+ Dy3Ni2, DyNi + DyNi2, Dy2Ni17 + Ni при температурах 693, 1173
и 1279 °C и содержании 31; 56 и 93 % (ат.) Ni соответственно.
Взаимной растворимости компонентов в твердом состоянии не уста-
новлено.
384
Dy—Pb
Рис. 198. Dy—Ni
Литература
1. Zheng J.X., Wang C.Z. // Acta Phys. Sin. (Chin. J. Phys). 1982. I\ <
P. 668-673.
A.IJ. Будбе,’
Dy—Pb. ДИСПРОЗИЙ-СВИНЕЦ
Диаграмма состояния Dy—Pb приведена на рис. 199. Сплавь
изготовляли в тиглях из Та, герметически заваренных в атмосфере
Аг и затем помещенных в вакуумную печь. Расплав гомогенизиров..
ли в течение 1 ч. Исходными компонентами служили РЬ чистотеи
99,999 % (по массе), Dy с содержанием, % (по массе): 0,04С<’.
0,02Но; 0,02Gd; 0,00650; 0,01Tb; 0,004А1 и 0,005Mg. Исследованье
выполняли методами микроструктурного, рентгеновского и терме
ческого анализов [ 1 ].
В системе установлено образование пяти соединений. Соединен ь-.
Dy5Pb3 плавится с открытым максимумом при 1695 °C; соединения
Dy—Pb
385
Рис. 199. Dy-Pb
Dy5Pb4, DyPb, DyPb2 и DyPb3 образуются по перитектическим
реакциям при температурах 1555, 1445, 955 и 880 °C соответственно.
Соединение DyPb, очевидно, при температуре ИЗО °C распадается
по кататектической реакции DyPb ' Dy5Pb4 + Ж. В системе Dy—Pb
кристаллизуются две эвтектики: Dy + Dy5Pb3 при температуре
1200 °C и содержании 13,3 % (ат.) РЬ и DyPb3 + РЬ при темпера-
туре 326 °C. РЬ снижает температуру полиморфного превращения Dy
от 1381 до 1360 °C, при этой температуре протекает реакция (3Dy »*
а aDy + Ж.
13 Зак. 2144
386
Dy-Pd
Соединение Dy5Pb-» кристаллизуется в гексагональной структуре
типа MncSi3 (символ Пирсона hPld, пр. гр. РЬ3/тст, а = 0,8962 нм,
с » 0,6567 нм). Соединение Dy5Pb4 обладает, очевидно, тетрагональ-
ной решеткой с параметрами а - с = 0,8127 нм, b = 1:538 нм. Соеди
нение DyPb кристаллизуется с образованием кубической структуры
типа АуСи3 (символ Пирсона сР4, пр. гр. РтЗт, а = 0,4806 йм).
Литература
1. McMaster O.D., O'Keefe T.Y., Gschneidner, Jr., K.A. // Trans. AIME. 1968
V. 242. N 5. P. 936-939.
А. П. Будберг
Dy-Pd. ДИСПРОЗИЙ-ПАЛЛАДИЙ
Диаграмма состояния Dy—Pd представлена на рис. 200 по данным
работы [1].
Сплавы системы Dy—Pd изготовляли в дуговой печи в атмосфере
Аг чистотой 99,98 % (по массе) с использованием геттера и отжигали
перед закалкой в вакуумной трубчатой печи при различных темпе-
ратурах. Исходными компонентами служили Pd чистотой 99,9 % (по
массе), Dy переплавленный с содержанием других редкоземельных
Dy Pd, 7° (am.) Pd
Рис. 200. Dy—Pd
Dy—Pr
387
металлов -0,1 % (по массе) и 0,1 % (по массе) Та, 0,02 % (по
массе) Со. Исследование выполняли методами микроструктурного,
рентгеновского и термического анализов.
В системе образуются семь соединений. Соединения Dy5Pd2,
PyPd, Py4Pd5, DyPd5 плавятся конгруэнтно при температурах
895, -1450, -1400 и -1710 °C соответственно; соединения Dy3Pd2,
ОУ2?^3 и DyPd2 образуются по перитектическим реакциям при
температурах 950, 1245 и 1295 °C соответственно. В интервале
температур 798—770 °C соединение DyPd претерпевает полиморфное
превращение. Область гомогенности соединения DyPd находится в
пределах 1—1,5 % (ат.). Область гомогенности соединения DyPd5 при
температуре 1217 °C составляет -4 % (ат.), несколько сужаясь при
понижении температуры.
В сплавах системы Dy-Pd кристаллизуются пять эвтектик:
(Dy) + Dy5Pd2, Dy5Pd2 + Dy3Pd2, DyPd + Dy4Pdr, Dy2Pd3 + DyPd2,
DyPd5 + Pd при температурах 863, 880, 1365, 1225, 1217 °C
и содержании 23,5; -31; -53; -63; -85 % (ат.) Pd соответ-
ственно. Растворимость Dy в Pd при температуре 1217 °C
достигает -12,3 % (ат.). Заметной растворимости Pd в Dy не
наблюдается.
Соединение DyPd3 обладает кубической решеткой типа AuCu3
(символ Пирсона сР4, пр. гр. РтЗт, а - 0,4076 нм). Соединение
DyPd имеет кубическую решетку типа CsCl (символ Пирсона сР2,
пр. гр. РтЗт, а = 0,4486 нм). Структура типа Si2U3 (символ Пирсо-
на tPIO пр. гр. P4ltnbm, а = 0,7762 нм, с = 0,3893 нм) наблюдается
у соединения Dy2Pd3. Структурой собственного типа обладает соеди-
нение Dy5Pd2 (а = 0,958 нм, с = 1,356 нм).
Литература
1. Loeblich О., Kaub Е. // J. Less-Common Met. 1973. V. 30. N 1. Р. 47—62.
А.П. Будберг
Dy—Pr. ДИСПРОЗИЙ-ПРАЗЕОДИМ
Диаграмма состояния Dy—Pr не построена. Рг и Dy имеют иден-
тичное электронное строение с тремя валентными электронами
Sd16s2, близкие плотно упакованные гексагональные структуры
(ДГПУ и ГПУ) при низких температурах и одинаковую объемно цен-
трированную структуру при высоких температурах, близкие значе-
ния параметров решеток, а также атомные радиусы, отличающиеся
лишь на 3 %. В табл. 153 приведены кристаллохимические данные
Рг и Dy.
13*
Л
388
Dy—Pr
By, “/<, fam.) Pg
Рис. 201. Dy—Pr
Таблица 15 3. Кристаллическая структура и полиморфные превращения
элементов системы Рг—Dy
Атомный номер, элемент Модифи- кация Прототип, структура Параметры решетки, нм Темпера- тура пре- враще- ния, °C Реакция
а с
59, Рг аРг La, ДГПУ 0,36721 1,18326 795 аРг * РРг
рРг W, ОЦК 0,413 — 931 Ж - РРг
66, Dy a Dy Mg, ГПУ 0,35915 0,56501 1381 aDy * РОу
pDy W, ОЦК 0,398 — 1412 Ж - PDy
Dy—Pm
389
На основании работ [1, M] сделано предположение об образова-
нии непрерывных рядов твердых растворов между компонентами со
структурами высоко- и низкотемпературных модификаций этих
элементов, а также о существовании упорядоченной фазы со структу-
рой типа aSm (6 фаза) (символ Пирсона hR3, пр. гр. R3m). На
рис. 201 схематически представлен возможный вариант диаграммы
состояния системы Dy—Pr. Превращение в твердом состоянии, веро-
ятно, осуществляется при температуре -735 °C, область гомогенности
фазы со структурой aSm расположена приблизительно в интервале
концентраций 40—70 % (ат.) Dy. Вследствие небольшого отличия в
величине атомных радиусов Dy и Рг линии ликвидуса и солидуса,
равно как и сольвуса, немного отклоняются от прямой.
Литература
1. Gschneidner, Jr., К.A., Calderwood F.W. // Handbook on the Physics and
Chemistry of Rare Earths. Amsterdam. New-York. Oxford. Tokyo: North-Holland Physics
Publishing Co. 1986. V. 8. Chap. 54. P. 1-161.
B.K. Григорович
Dy-Pm. ДИСПРОЗИЙ—ПРОМЕТИЙ
Диаграмма состояния Dy—Pm экспериментально не построена.
Dy и Pm достаточно близко расположены в Периодической
системе в ряду лантаноидов и имеют идентичное электронное строе-
ние с тремя коллективизированными валентными электронами
5с?16s2, сходные кристаллические плотные гексагональные струк-
туры и одинаковые кубические структуры высоко- и низкотемпера-
турных модификаций этих элементов с близкими значениями пара-
метров решеток и атомными радиусами, отличающимися всего на
2,1 %. Согласно работам fl, М] можно предположить образование
непрерывных рядов твердых растворов, почти идеальных при высоких
температурах.
На рис. 202 схематически представлена диаграмма состояния
Pm—Dy. При температуре ниже -750 °C из твердого раствора на
основе низкотемпературных модификаций компонентов образуется
упорядоченная плотноупакованная ромбоэдрическая фаза (б) типа
aSm (символ Пирсона hR3, пр. гр. R3m). Диаграмма плавкости
ограничена практически прямыми линиями. Концентрационная
область существования фазы со структурой aSm занимает интервал
в пределах 40—50 % (ат.) Dy.
390
Dy-Re
Рис. 202. Dy—Pm
Литература
1. Gschnetdner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
try of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publi-
shing Co. 1986. V. 8. Chap. 54. P. 1—161.
В. К. Григорович
Dy-Re. ДИСПРОЗИЙ—РЕНИЙ
Диаграмма состояния Dy—Re не построена.
Согласно справочнику [III] в системе Dy—Re образуется соедине-
ние DyRe2 с гексагональной структурой типа MgZn2 (символ Пирсона
ЛР24, пр.гр. Pb^lmmc^ а** 0,5391 нм, с = 0,8804 нм). В работах
Dy—S
391
[1, 2] исследованы сплавы во всем интервале концентраций методами
цщкроструктурного и рентгеновского анализов; сплавы приготовлены
р- дуговой печи в атмосфере очищенного Не с использованием Re
чистотой 99,98 % (по массе) и Dy чистотой 99,5 % (по массе),
растворимость Dy в Re в твердом состоянии менее 1 % (ат.).
Литература
1. Савицкий Е.М., Хамидов О.А. // Изв. АН СССР. Неорганические материалы.
1965- Т. 1. № 11. С. 1873-1877.
2. Хамидов О. А., Савицкий Е.М. // Диаграммы состояния металлических систем.
Сб. статей. М.. Наука. 1968. С. 178—184.
М.А. Тылкина
Dy-5. ДИСПРОЗИЙ-СЕРА
По данным работ [1, 2] на рис. 203 приведен вариант диаграммы
состояния Dy—S в интервале концентраций 50—60 % (ат.) S, ограни-
ченном фазами DyS и Dy2S3. Исследование проведено методами мик-
роструктурного, рентгеновского и термического анализов. Согласно
работе [3] область гомогенности моносульфида DyS расположена в
интервале составов DyS075_100. Соединение Dy5S7 плавится
S, % (по массе)
₽ис. 203. Dy—S
392
Dy-S
конгруэнтно при 1850 °C. Соединение Dy2S3 существует в трех
модификациях: а, ₽и у. По данным работы [3], при температурах
ниже 950 °C стабильно соединение aDy2S3, в интервале температур
950—1470 °C — pDy2S3 и при температурах от 1470 °C до температх
ры плавления существует yDy2S3. Кристаллическая структура соеди-
нений приведена в табл. 154.
Таблица 15 4. Кристаллическая структура соединений системы Dy—S
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а Ь с
DyS NaCl cES, БтЗт 0,5490 — — [Э]
0,5456 —
0,5591
ОУ5$7* — —, с2/т 1,284 0,381 1,161 [Э]
1,2785 0,3813 1,1565 !Ш]
aDy2S3 aLa2S3 оР20, Рпта 0,7279 0,3878 1,5136 [4]
0,7307 0,3890 1,523 [3]
0Dy2S3 — —, Р2,/т 1,757 0,402 1,017 [Э]
1,7456 0,4022 1,0183 [4]
yDy2S3 Th3P4 с/2Ь, /43d 0,8292 — — [Э]
0,8303 — — [5]
DyS2.x EuS2 tP24 0,7808 — — [6]
Р4г/п 0,7697 — 0,7861 [Э]
Моноклинная сингония, 0 = 74° [Э], В - 104,85 [Ш].
Моноклинная сингония, 0 » 81,17” [Э], 0 = 98, 67” [4].
Литература
1. Васильева Н.Г., Миронов К.Е., Соколов В.В. и др. // Тугоплавкие соединения
редкоземельных металлов: Сб. статей. Новосибирск: Наука, 1979- С. 183—186.
2. Васильева Н.Г., Соколов В.В., Миронов К.Е. и др. // Изв. АН СССР. Неорга
нические материалы, 1980. Т. 16. № 3. С. 418—421.
3. Ярембаш Е.И., Елисеев А.А. Халькогениды редкоземельных металлов. М :
Наука, 1975. 258 с.
4. Sleight A.W., Premitt С.Т. // Inor. Chem. 1968. V. 7- N 11. P. 2232-2237.
5. Гризик A.A., Елисеев A.A., Толстова В.А. и др. // Журнал неорганической
химии. 1972. Т. 17. Вып. 1. С. 11-15.
6. Webb A.W., Hall Н.Т. // Inor. Chem. 1970. V. 9. N 5. P. 1088-1087.
Ю.Б. Кузьма
Dy—Sb
393
py-Sb. ДИСПРОЗИЙ-СУРЬМА
Диаграмма состояния Dy—Sb исследована в работах [1, 2]. На
рис. 204 приведена диаграмма состояния системы по данным работы
[2]. Сплавы синтезировали в кварцевых ампулах в вакууме (исполь-
зован Ti геттер) ступенчатым нагревом до 600 °C с последующим
отжигом при 1100—1200 °C в течение 500 ч. В качестве исходных
материалов использовали дисциллат Dy и Sb чистотой 99,999 % (по
массе). Исследование выполнено методами термического, рентгенов-
ского и микроструктурного анализов.
Рис. 204. Dy—Sb
394
Dy—Sc
В системе Dy—Sb образуются три соединения: DySb, Dy5Sb3 и
Dy4Sb3. Соединение DySb плавится конгруэнтно при 2170 °C, соеди
нения Dy5Sb3 и Dy4Sb3 кристаллизуются по перитектическим реак
циям при 1680 и 1780 °C соответственно. Соединение DySb при
температуре 1890 °C претерпевает полиморфное превращение; соеди
некие Dy4Sb3 также существует в двух полиморфных модификациях,
температура перехода составляет 1630 °C. При температуре 1160 °C
осуществляется эвтектическое превращение, сплав в эвтектической
точке содержит 14,5 % (ат.) Sb. Эвтектика со стороны Sb практи-
чески вырождена, сплав эвтектического состава содержит 99 % (ат.)
Sb, температура эвтектической реакции составляет 622 °C, что на
8 °C ниже температуры плавления Sb. В работе [V—С] сообщено о
существовании еще одного соединения DySb2. Кристаллическая
структура соединений системы Dy—Sb представлена в табл. 155.
Таблица 155. Кристаллическая структура соединений системы Dy—Sb
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
DySb2* — — 0,5888 0,3273 0,7965 [V-C]
PDySb CaO — ,14/mmtn 0,6154 — 0,6313 [2]
a DySb NaCl cF\%, Fm3m 0,61316 — — [2]
PDy4Sb3 P«Th3 c/28, /43 d 0,9114 — — [2]
aDy5Sb3 Mn5Si3 hP16, PS^/mcm 0,8870 — 0,6266 [2]
Литература
1. Cambino R.A. // J. Less-Common Met. 1967. V. 12. P. 344—352.
2. Миронов K.E., Абдусалямова M.H., Бурнашев O.P. // Изв. АН СССР. Неорга-
ническое материалы. 1980. Т. 16. № 11. С. 1951—1956.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Dy—Sc. ДИСПРОЗИЙ-СКАНДИЙ
Диаграмма состояния Dy—Sc экспериментально не построена. Dy
и Sc имеют близкое электронное строение с тремя коллективизиро-
ванными валентными электронами одинаковой симметрии 5dl6s2 и
3d14s2. Кристаллические структуры полиморфных а- и р-модифика-
ций Dy и Sc одинаковы (табл. 156). Атомные радиусы Dy и Sc отли-
чаются на 8,1 %, что меньше критерия Юм-Розери, ограничивающе-
го образование непрерывных рядов твердых растворов. В работах [1,
М] сделано предположение об образовании непрерывных рядов твер-
дых растворов между а- и р-модификациями компонентов системы
Dy—Sc. Отношение атомных радиусов Dy и Sc, близкое по значению
Dy—Sc
395
JJy Scam.) Sc
Рис. 205. Dy—Sc
к отношению атомных радиусов в системах Gd—Sc и Y—Sc, равному
9,8 %, указывает на аналогию фазовых равновесий в этих системах.
На рис. 205 схематически представлен возможный вариант диаграм-
мы состояния Dy—Sc.
Таблица 15 6. Кристаллическая структура и полиморфные превращения
элементов системы Dy—Sc [1]
Атомный номер, элемент Модифи- кация Прототип, структура Параметры решетки, нм Темпера- тура пре- враще- ния, °C Реакция
а с
21, Sc a Sc Mg, ГПУ 0,333088 0,52680 1337 aSc * pSc
PSc W, ОЦК 0,373 — 1541, Ж * PSc
66, Dy a Dy Mg, ГПУ 0,35915 0,56501 1381 «Dy и pDy
pDy W, ОЦК 0,398 — 1412, Ж - pDy
Литература
1. Gschneidner, Jr., К.А., Calderwood F.W. // Handbook on the Physics and
Chemistry of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics
Publishing Co. 1986. V. 8. Chap. 54. P. 1-161.
U.K. Григорович.
1
396
Dy—Si, Dy—Sm
Dy—Si. ДИСПРОЗИЙ-КРЕМНИЙ
Диаграмма состояния Dy—Si не построена. В работе [1] сплавы
синтезировали путем отжига в вакууме контактирующих пластин Si
вырезанных из монокристалла, и фольги Dy. Для получения сплавов
использовали Dy в виде фольги толщиной 110±5 мкм, содержащий
примеси в количестве 0,099 % (по массе). В справочниках [Э, Ш]
сообщается об образовании четырех соединений в системе Dy—Si:
Dy5Si3, DySi, Dy3Si5 и Dy2Si3. В сплавах, богатых Dy, кристаллизу-
ется эвтектика при температуре 1145 °C [Э] (1160 °C [Ш], 1195 °C
[1]) и содержании 84,8—89,4 % (ат.) Si [Э] (83 % (ат.) Si [1].
Растворимость Si в Dy в твердом состоянии составляет менее 0,58 %
(ат.) [31 (менее 1,2 % (ат.) [Ш]). Установлено, что соединение DySi
находится в равновесии с соединением Dy5Si3 и фазой, содержащей
60 % (ат.) Si (примерный состав Dy2Si3). В табл. 157 приведена
кристаллическая структура соединений.
Таблица 157- Кристаллическая структура соединений системы Dy—Si
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
a b c
DySi FeB oP8, Pnma 0,787 0,380 0,565 [Ш]
Dy2Si3 A1B2 hP3, PStmmm 0,383 — 0,411 [Ш]
Dy3Si5 CdSt2 — 0,404 0,394 1,344 [Ш]
0,403 0,394 1,333 [Э]
Dy5Si3 Mn5Si3 hPlf>, Pf^/mcm — — — 1Ш]
Литература
1. Лозовский В.Н., Колесниченко А.И. // Изв. АН СССР. Неорганические
материалы. 1981. Т. 17- № 3. С. 545—555.
А. II. Будберг
Dy—Sm. ДИСПРОЗИЙ-САМАРИЙ
Диаграмма состояния Dy—Sm экспериментально не построена [ 1,
М]. Dy и Sm близко расположены в Периодической системе, имеют
идентичное электронное строение с тремя валентными электронами
5с/1б52, одинаковые кристаллические структуры полиморфных моди-
фикаций, близкие значения параметров решетки [1]; атомные радиу-
сы отличаются всего на 1,7 %. В табл. 158 приведены кристаллохи-
мические данные Dy и Sm.
Dy—Sm
397
Оу, "/о (т массе)
Рис. 206. Dy—Sm
Сделано предположение, что Dy и Sm образуют непрерывные
ряды твердых растворов между ySm и 0Dy.
На рис. 206 представлена схематически диаграмма состояния
системы Sm—Dy. Линии ликвидуса и солидуса представляют собой
практически прямые линии. Также в прямую сливаются две линии
сольвуса. На основе ромбоэдрической модификации aSm при темпе-
ратурах ниже 734 °C образуется область твердых растворов, распро-
страняющаяся при комнатной температуре до концентраций 22—28 %
(ат.) Dy.
398
Ру—Та
Таблица 158. Кристаллическая структура и полиморфные превращения
элементов системы Dy—Sm
Атомар- ный но- мер, эле- мент Моди- фика- ция Прототип, структура Параметры решет- ки, нм Темпе- ратура превра- щения, °C Реакция
a с
62, Sm aSm — 0,3690 2,6207 734 aSm » pSm ”,
pSm Mg, ГПУ 0,36630 0,58448 922 PSm иySm
ySm W, ОЦК 0,410 — 1074 Ж » YSm
66, Dy a Dy Mg, ГПУ 0,35915 0,56501 1381 a Dy «* pDy
PDy W, ОЦК 0,398 — 1412 Ж » PDy
Литература
1. Gschneidner, Jr., К.А., Calderwood F.W. // Handbook on the Physics and Chetn.s-
try of Rare Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Pubb-
shing Co. 1968. V. 8. Chap. 59. P. 1-161.
B.K. Григоров" /
Dy-Ta. ДИСПРОЗИЙ—ТАНТАЛ
Для изучения особенностей взаимодействия Dy с Та Dy помещали
в тигли из Та, которые заваривали и нагревали в вакуумной индук-
ционной печи в течение 1 ч при температурах выше температуры
плавления Dy, равной 1412 °C, и сбрасывали в водоохлаждаем к и
Dy—Tb
399
бедный приемник [1]. Установлено, что этого времени было доста-
Хцно для достижения равновесия. Содержание Та в закаленных
: д1Лавах определяли химическим анализом, что отвечало его концен-
; урапии на кривой ликвидус. Исследование проводили методом диф-
ференциального термического анализа с относительной погрешностью
10,5—1,0 %. На рис. 207 показана часть диаграммы состояния системы
’ру—Та. Кривая ограниченной растворимости Та в жидком Dy в
?интервале температур 1615—1830 °C можно описать уравнением igx =
—6,6446- 10‘3/Т + 0,9729, где х — атомная доля Та в жидком Dy,
{.Г — температура, К. Парциальная молярная теплота растворения Та
'в жидком Dy равна ДЯ = 132,3 кДж/моль. Температура нонвариан-
тной реакции составляет 1408±9 °C, эвтектика содержит 0,19±0,06%
(ат.) Та.
Литература
1. Dennison D.H., Tschetter MJ., Gcshneidner, Jr., K.A. // J. Less-Common Met.
1965. V. 10. N 2. P. 109-115.
А.П. Будберг
Dy—Tb. ДИСПРОЗИЙ-ТЕРБИЙ
Диаграмма состояния Dy—Tb экспериментально не построена [ 1,
М]. Dy и ТЬ расположены в Периодической системе рядом, имеют
идентичное электронное строение с тремя коллективизированными
валентными электронами 5 с?16s2 в металлическом состоянии, одина-
ковые кристаллические структуры с очень близкими параметрами
решеток [1, 2], атомные радиусы Dy и ТЬ отличаются всего на
0,5 %. В табл. 159 приведены кристаллохимические данные Dy и ТЬ.
Таблица 15 9. Кристаллическая структура и полиморфные превращения
Элементов системы Dy—Tb [ 1 ]
Атомный номер, Элемент Модифи- кация Прототип, структура Параметры решетки, нм Темпера- тура пре- враще- ния, °C Реакция
а С
68, ТЬ аТЬ Mg, ГПУ 0,36055 0,56966 1289 аТЬ»РТЬ
рть W, ОЦК 0,402 — 1356 ж - рть
66, Dy U Dy Mg, ГПУ 0,35915 0,56501 1381 «Dy * pDy
PDy W, ОЦК 0,398 — 1412 Ж ₽ pDy
Сделано предположение об образовании непрерывного ряда твер-
дых растворов между высоко- и низкотемпературными модификация-
ми Dy и ТЬ. В работах [1,2] показано, что параметры а-твердых
400
Dy-Tb
Рис. 208. Dy-Tb
растворов в зависимости от состава меняются линейно, что соответ-
ствует правилу Вегарда. На рис. 208 схематически представлена
диаграмма состояния системы Tb—Dy, аналогичная экспериментально
построенным диаграммам Gd—ТЬ и Gd—Dy [2].
Литература
1. Сирота Н.Н., Семиренко В.В. // Изв. АН СССР. Металлы. 1976. № 6.
С. 209-211.
2. Gschneidner, Jr., К.А., Calderwood F.W. // Handbook on the Physics and
Chemistry of Rare Earths. Amsterdam, New York, Oxford, Tokyo-’ North-Holland Physics
Publishing Co. 1986. V. 8. Chap. 54. P. 1-161.
U.K. Григорович
Dy—Те 401
тоу—Те. ДИСПРОЗИЙ-ТЕЛЛУР
В работе [1] методами термического и рентгеновского анали-
зов построена диаграмма состояния системы Dy—Те, приведенная на
рис. 209. Сплавы синтезировали в эвакуированных кварцевых ампу-
лах с использованием Dy, содержащего в качестве примесей не более
О 3 % (по массе) и Те с содержанием примесей не более 0,01 % (по
массе). В системе обнаружено шесть соединений. Соединения Dy Те
Те, % (по массе)
Рис. 209. Dy—Те
и Dy^Te4 плавятся конгруэнтно при температурах 1850 и 1570 °C,
соответственно; соединения Dy2Te3, Dy4Te7, Dy4Te9 и Оу4Тец
кристаллизуются по перитектическим реакциям при температурах
1510, 1230, 920, 855 °C соответственно. При температурах 1385, 1540
и ~450 °C осуществляются эвтектические превращения; эвтектики
пРи 1385 и -450 °C практически вырождены, так же как и перитек-
тИческая реакция образования соединения Dy2Te3. В табл. 160
приведены кристаллические структуры соединений.
402
Dy—Th
Dy—Tm
403
Т а б л и ц а 1 6 0. Кристаллические структуры соединений системы Dy-Te
Соединение Прото- тип Символ Пирсона, пр.гр. ^Параметры решетки, нм Источник
a b c
DyTe NaCl cF8, Fm3m 0,6077 — — И]
0,6092 — — [2]
0,6075 — O]
Dy3Te4 Sc2S3 0F8O, Fddd 1,232 0,854 2,617 [1]
Dy2Te3 Sc2S3 oF80, Fddd 1,22 0,8645 2,585 [1]
Dy4Te7 Fe2As — 0,4274 — 0,8917 [1]
Dy4Te9 0,429 — 0,891 [3]
Nd2Te5 oC28, Ctncm 0,4301 0,4301 4,32 fl]
ОуДе,, NdTe3 oC 16, Ctncm 0,4298 0,4298 2,542 HI
Литература
1. Абрикосов H.X., Зинченко К.А., Елисеев А. А. II Ичп ait сс'Г"в и
кие материалы. 1970. Т. 6. № 4. С. 720—725 3 СССР НеоРганичес
2. Bnraer LH, // J. Inorg Nucl. Chem. 1960. V. 15. P. 199-201.
3. Pardo M.P., Flahaut L. 11 Compt. Rend. 1963. V. 256. P. 953—955.
Н.И. Никитина
Dy—Th. ДИСПРОЗИЙ-ТОРИЙ
\ По данным работ [1, M], на рис. 210 представлена диаграмма
состояния системы Dy—Th. Установлено образование непрерывного
ряда твердых растворов между высокотемпературными модификация-
ми Th и Dy. В сплавах, богатых Dy, при содержании -90 % (ат.) Dy
осуществляется эвтектоидный распад твердого раствора (₽Th, PDy)
на a Th + а Dy. При температуре -1460 °C и содержании -22 % (ат.)
Dy наблюдается максимум превращения (PTh, PDy) =* a Th. Раствори-
мость Dy в Th при 20 °C составляет 35 % (ат.) и возрастает до 57 %
(ат.) при температуре эвтектоидной реакции.
Литература
1. Бадаева Т.А., Кузнецова Р.И. // Изв. АН СССР. Металлы. 1969. № 5. С.
156-163.
А. П. Будберг
Dy—Tm. ДИСПРОЗИЙ-ТУЛИЙ
Диаграмма состояния Dy—Tm экспериментально не построена [1,
М]. Dy и Тт близко расположены в Периодической системе и имеют
идентичное электронное строение с тремя валентными электронами
5d*6s2, одинаковую кристаллическую структуру типа Mg с близкими
Тт, % (по массе)
0 10 20 30 W 50 60 70 80 90 100
Рис. 211. Dy—Tm Тт°/0(ат.) Тт
404
Dy—W
параметрами решетки (1] и атомными радиусами, отличающимися
всего лишь на 1,6 %. В табл. 161 приведены кристаллохимические
данные Dy и Тш.
Таблица 161. Кристаллическая структура и полиморфные превращения
элементов системы Dy—Тт
Атомный номер, элемент Моди- фика- ция Прото- тип, структура Параметры ре- шетки, нм Темпе- ратура превра- щения, °C Реакция Источ- ник
а С
66, Dy aDy Mg, ГПУ 0,35915 0,56501 1381 aDy •* PDy [1]
₽Dy W, ОЦК 0,398 — 1412 Ж * PDy [1]
69, Тт — Mg, ГПУ 0,35375 0,55540 1545 Ж •* aTm [1]
1655 Жгпу 11 жоцк [2]
Сделано предположение, что Dy и Тт образуют непрерывные
ряды твердых растворов при высоких температурах. На рис. 211
схематически представлен вариант диаграммы состояния системы
Dy—Тт. Тт при высоких температурах в твердом состоянии не
имеет полиморфного превращения [1, М], однако, как показано в
работе [2], изменение ближнего порядка при температуре 1655 °C
объясняет существование на диаграмме (рис. 211) штриховой линии,
разделяющей области расплавов с ГПУ и ОЦК структурами. При
температуре 1442 °C и содержании 25 % (ат.) Тт имеет место пери-
тектическое превращение, которое на рис. 211 изображено в виде
точки, поскольку кривые ликвидуса, солидуса и сольвуса практичес-
ки сливаются.
Литература
1. Gschneidner, Jr., К.A., Calderwood F.W. // Handbook on the Physics and
Chemistry of Rare Earth. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics
Publishing Co. 1986. V. 8. Chap. 54. P. 1-161.
2. Григорович B.K., Григорович K.B. 11 Строение и свойства металлических и
шлаковых расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск:
ЧНИ, 1990. Т. 2. Ч. 2.
В. К. Григорович
Dy—W. ДИСПРОЗИЙ-ВОЛЬФРАМ
Диаграмма состояния Dy—W не построена. Как следует из работ
[ 1, 2], промежуточных фаз в системе не установлено. Раствори-
мость W чистотой 99,9 % (по массе) в Dy, содержащем, % (по
массе): 0,04N, 0,0020, 0,006Mg, 0,003А1, 0,007Si, О,ЗСа, 0,02Fe,
0,03Ni при температурах 1603, 1790, 1812, 1999 и 2077 °C, состав-
Dy-Y
405
дяет соответственно 0,148 % (ат.); 0,290 % (ат.); 0,424 % (ат.);
0,452 % (ат.); 0,713 % (ат.) и может быть представлена зависи-
мостью Igx = —5,971- 10 3Г 1 + 0,360, где х — атомная доля W в
жидком Dy, Т — температура, К. Рассчитанная по этому уравнению
растворимость W в Dy при температуре его плавления 1412 °C со-
ставляет 0,065 % (ат.) [3].
Литература
1. Baenziger N.C., Moriarty J.L. // Acta Crystallog. 1961. V. 14. P. 948—950.
2. Elliott R.P. // Rare Earths III. Proceeding of the Forth Conference. New York:
Gordon and Breach. 1965. P. 215—245.
3. Dennison D.H., Tschetter M.J., Gschneidner, Jr., K.A. // J. Less-Common Met.
1966. V. 11. N 6. P. 423-435.
К. Б. Поварова
Dy—Y. ДИСПРОЗИЙ-ИТТРИЙ
Диаграмма состояния Dy—Y приведена на рис. 212 по данным
работы [1]. Сплавы выплавляли в дуговой печи в атмосфере Не и
отжигали в вакуумной печи при температуре 850 °C в течение 70 ч.
Исследование проводили микроструктурным анализом, температуру
Рис. 212. Dy-Y
406
Dy—Zr
солидус определяли оптическим пирометром по появлению первой
капли жидкости. Электросопротивление определяли на проволоч-
ных образцах, полученных холодной прокаткой с промежуточ-
ными отжигами продолжительностью 20—30 мин. Исходными
материалами служили дисциллированный Dy чистотой 99,6—99,7 %
(по массе) и дисциллированный Y чистотой 99,6—99,7 % (ио
массе) [1].
Установлено образование непрерывного ряда твердых растворив
между изоморфными модификациями металлов, отвечающими струк-
туре типа W (символ Пирсона с12, пр. гр. 1тЗт) — высокотемпера-
турная модификация и структуре типа Mg (символ Пирсона hP2, пр.
гр. Рб^/ттс) — низкотемпературная модификация. Отмечается, что
все исследованные сплавы отличаются высокой пластичностью и
стойкостью против окисления на воздухе при комнатной темпе-
ратуре.
Литература
1. Маркова И.А., Терехова В.Ф., Савицкий Е.М. // Изв. АН СССР. Неорганичес-
кие материалы. 1967. Т. 3. № 2. С. 392-394.
А. П. Будберг
Dy—Zr. ДИСПРОЗИЙ-ЦИРКОНИЙ
Диаграмма состояния Dy—Zr приведена на рис. 213 по данным
работы [Э]. Эвтектика aDy + pZr плавится при температуре 1280 С
и содержит 43,3 % (ат.) Zr. Растворимость Dy в PZr при эвтектичес-
кой температуре составляет 80,6 % (ат.), растворимость Zr в aDy
находится в интервале концентраций 8,6—10,2 % (ат.). Dy повышает
температуру а * р превращения Zr от 863 до 890 °C — температуры
перитектоидной реакции pZr + aDy »» aZr. При закалке из жидкою
состояния со скоростью 106-108 К/с растворимость Zr в aDy увели-
чивается до -58 % (ат.) [1, 2]. Предположительно существование
кататектической реакции pDy Ж + aDy (см. рис. 215).
Dy—Zr
407
Zr, “/о (no массе)
Рис. 213. Dy—Zr
Литература
1. Wang R. // Metall. Trans. 1972. V. 3. N 5. P. 1213-1221.
2. Wang R., Kim B. // Metall. Trans. 1974. V. 5. N 9. P. 1973-1977.
Л.А. Третьяченко
II
408
Er—Fe
Er—Fe
409
Er—Fe. ЭРБИЙ-ЖЕЛЕЗО
Система Er—Fe исследована в работах [1—8] методами микрос-
труктурного, рентгеновского, термического анализов, измерением
твердости, микротвердости и электросопротивления. На рис. 214
приведена диаграмма состояния системы Er—Fe по данным работы
[2]. В качестве шихтовых материалов использовали Ег чистотой
99,9 % (по массе) и Fe чистотой 99,98 % (по массе). Сплавы изго-
товляли в дуговой печи в инертной среде. В системе установлено
существование пяти соединений. Соединение ErFe3 плавится конгру-
энтно при температуре 1380 °C, соединения ErFe,, ErAFe0,, ErFec и
Er2Fei7 образуются по перитектическим реакциям при температурах
1355, 1345, 1345, 1350 °C соответственно. При температурах 895 и
1310 °C кристаллизуются эвтектики (Er) + ErFe2 и Er6Fe23 + ErFe5.
При температуре 1285 °C осуществляется эвтектоидный распад
соединения ErFe5 по реакции ErFe^ * Er6Fe23 + Er2Fe]7.
Fe и Ег незначительно растворимы друг в друге. Растворимость Ег
в aFe при температуре 300 °C составляет 0,3—0,4 % (по массе)
согласно работе [2] или 0,005 % (по массе) по данным работы [1].
Растворимость Fe в Ег при температуре эвтектики 895 °C равна
0,1 % (по массе), по данным работы [2], а, по данным работы [1],
при температуре 900 °C она составляет 0,03 % (по массе). В работе
[2] указано, что легирование Fe Ег незначительно повышает темпе-
ратуру превращения а * у и практически не влияет на температуру
полиморфного превращения у * 6. В табл. 162 приведена кристалли-
ческая структура соединений.
Таблица 162. Кристаллическая структура соединений системы Er—Fe
Соединение Прототип Символ Пирсона, пр.гр. Параметры ре- шетки, нм Источник
a С
ErFe2 MgCu2 cF24, Fd3m 0,7273 — [Э]
ErFe3 PuNi3 — 0,5096 2,448 [1]
ЕгбРе23 Th6Mn23 cFl 16, Fm3m 1,201 — [6]
Er2Fel7 Th2Ni17 AP38, P63! mmc 0,8423 0,8284 [7]
Литература
1. Meyer А. // J. Less-Common Met. 1969. V. 18. N 1. Р. 41—48.
2. Колесниченко В.Е., Терехова В.Ф., Савицкий Е.М. // Изв. АН СССР. Неорга-
нические материалы, 1971. Т. 7. № 3. С. 495—497.
3. Савицкий Е.М., Терехова В.Ф., Наумкин О.П. // Цветные металлы. 1960. № 1.
С. 43-48.
4. Wernick J.H., Geller S. // Trans. AIME. 1960. V. 18. N 5. P. 866-868.
5. Dwight A.E. // Trans. ASM. 1961. V. 53. P. 479-500.
6. Крипякевич П.И., Франкевич Д.П. // Кристаллография. 1965. Т. 10. Вып. 4.
С. 560.
7. Buschow K.H.J. // J. Less-Common Met. 1966. V. 11. N 2. P. 204-208.
8. Koon N.C., Schindler A.J., Carter F.L. // Physics Letters A. 1971. V. 37- N 5.
P. 413-414.
A./7. Будберг
Рис. 214. Er—Fe
410
Er—Ga
Ег-Ga. ЭРБИЙ-ГАЛЛИЙ
Диаграмма состояния Er—Ga представлена на рис. 215 по данным
работы [1]. Сплавы синтезировали из чистых компонентов в гермети-
чески закрытых тиглях. Исходными материалами служили Ег чисто
той 99,9 % (по массе) и Ga чистотой 99,999 % (по массе). Исследо-
вание выполняли методами термического, рентгеновского анализов
и измерением микротвердости. В системе образуются пять соедине-
ний, три из которых Er5Ga3, ErGa и Er^Gaj плавятся с открытым
максимумом при температурах 1320, 1340 и 1300 °C соответственно,
Рис. 215. Er—Ga
Er—Gd
411
а два ErGa2 и ErGa3 образуются по перитектическим реакциям при
температурах 1280 и 960 °C соответственно.
При температуре 1040 °C и содержании 20 % (ат.) Ga кристалли-
зуется эвтектика (Er) + Er5Ga3, при температуре 1290 °C и содержа-
нии 47 % (ат.) Ga протекает эвтектическая реакция Ж * Er5Ga3 +
+ ErGa, при температуре 1250 °C и содержании 57 % (ат.) Ga крис-
таллизуется эвтектика ErGa + Er2Ga3. Кристаллическая структура
соединений приведена в табл. 163.
Таблица 16 3. Кристаллическая структура соединений системы Er—Ga [1]
Соедине- ние Прототип. Символ Пирсона, пр. гр. Параметры решетки, нм
а b с
Er3Ga3 Mn5Si3 API 6, Pbijmcm. 0,8482 — 0,6358
ErGa CrB оС8, Стет 0,4258 1,0719 0,4016
ErGa2 A1B2 hP3, Pf>/mmm 0,4180 — 0,4016
ErGa3 AuCu3 сР4, РтЗт 0,424 — —
Литература
1. Yatsenko S.P., Semyannikov А.А., Semenov B.G., Chuntonov К. A. //J. Less-
Common Met. 1979. V. 64. N 2. P. 185-199.
А.П. Будберг
Er-Gd. ЭРБИЙ-ГАДОЛИНИЙ
Рис. 216. Er-Gd
412
Er—Ge
В работе [1] предложен вариант диаграммы состояния Ег—G'!
(рис. 216). Для приготовления сплавов использовали Gd и Ег чисто
той 99,9 % (по массе). Вид диаграммы плавкости предполагает
перитектический характер превращения образования твердого pai -
твора на основе высокотемпературной модификации pGd. Состав
сплава (aGd, Ег), принимающего участие в реакции, содержит 75 %
(ат.) Ег.
Литература
1. Gschneidner, Jr., К.A., Calderwood F.W. // Handbook on the Physics and Chcmb,
try of Rare Earths. Amsterdam, New-York, Tokyo: North-Holland Physics Publishing Co
1986. V. 8. Chap. 54. P. 1-161.
А.П. Будберг
Er—Ge. ЭРБИЙ-ГЕРМАНИЙ
Ge, °/<> (по массе)
Рис. 217. Er—Ge
Er—Ge
413
Диаграмма состояния Er—Ge изучена в работах [ 1, 2]. Сплавы
изготовляли в дуговой печи в среде очищенного Аг и гомогенизирова-
ли также в среде Аг в контейнерах из танталовой жести при темпера-
туре 1200 °C в течение 100 ч и при температуре 750 °C в течение
400 ч. Исследование выполняли методами термического, микрос-
труктурного, рентгеновского анализов, измерением плотности. На
рис. 217 приведена диаграмма состояния Er—Ge по данным работы
[2]. В системе образуется восемь соединений. Соединение Er5Ge3
плавится с открытым максимумом при 1950 °C, соединения Er5Ge4,
ErnGe10, ErGe, ErGej 5, ErGe2, ErGe3.x кристаллизуются по пери-
тектическим реакциям при температурах 1875, 1720, 1451, 1409,
1037, 890 °C соответственно. Соединение ЕгиСе5 образуется по
перитектоидной реакции ErGe + ErGej 5 ЕгцСес при температуре
1387 °C. Соединение ErGe! 5 при температуре 943 °C претерпевает
полиморфное превращение,’ а соединение ErGe2 существует в трех
полиморфных модификациях: температура а * 0 превращения состав-
ляет 907 °C, 0 ** у превращения 932 °C. В системе Er—Ge осущес-
твляются два эвтектических превращения: Ж « (Er) + Er5Ge3 при
температуре 1322 °C и содержании 12 % (ат.) Ge и Ж =* ErGe3_x +
+ (Ge) при температуре 877 °C и содержании 86 % (ат.) Ge. Взаим-
ная растворимость Ег и Ge в твердом состоянии менее 1 % (ат.).
Области гомогенности на основе соединений не превышают 1 % (ат.).
Кристаллическая структура соединений приведена в табл. 164.
Таблица 16 4. Кристаллическая структура соединений системы Er—Ge [2]
Соедине- ние Прототип Символ Пирсона, np. гр. Параметры решетки, нм
a b c
Er3Ge3 Mn5Si3 ЛР16, Pf>3/mcm 0,835 — 0,627
Er5Ge4 Sm5Ge4 oP36, Pnma 0,754 1,449 0,757
Eij|Ge|0 НоцСв|0 tI84, 1,076 — 1,609
ErGe CrB 0C8, Cmcm 0,419 1,056 0,390
pErGe, 5 A1B2 hP3, Pb/mmm 0,389 — 0,409
ErGe3.x YGe3'5 — 2,088 0,399 0,388
Кристаллическая структура Er4Ge5, aErGe] 5 и трех модификаций
соединения ErGe2 не установлена.
Литература
Еременко В.Н., Буянов Ю.И., Обушенко И.М. и др. // Физико-химические
свойства сплавов рения: Сб. статей. М.: Наука, 1979. С. 27—32.
г сп Еременко В.Н., Обушенко И.М. // Изв. вузов. Цветная металлургия. 1981. № 3.
59—62.
А. П. Будберг
414
Er~H
Er—H. ЭРБИЙ-ВОДОРОД
Диаграмма состояния системы Er—Н схематически представлена
на рис. 218 по данным работы [1]. В системе образуются соединения
ЕгН2 и ЕгН3. Соединение ЕгЩ при температуре 383 °C и давлении
0,1 МПа разлагается, а гидрид ЕгН, устойчив до температуры 750 °C.
Теплота образования соединений ЕгН2 и ЕгН3 составляет соответ-
ственно —230 и —83 кДж/моль. Температурная зависимость давления
диссоциации соединения ЕгН2 описывается выражением Igp^ ~
- 12,69 — 11500/Т. Область гомогенности соединения ЕгН2 при
температурах 200—300 °C составляет примерно 4 % (ат.) в интервале
концентраций 66—70 % (ат.) Н.
Рис. 218. Er—Н
Ег Н,°/о(ат.)
Er—Hf
415
Соединение ЕгН2 имеет кристаллическую структуру типа CaF2
(символ Пирсона cF12, пр. гр. Fm3m, а = 0,5126 нм). Структу-
ра соединения ЕгН3 относится к типу Na3As, а => 0,3621 нм, с =
® 0,6526 нм.
Литература
1. Lundin С. // Trans. AIME. 1968. V. 242. N 5. Р. 903-907.
В. И. Шаповалов
Er-Hf. ЭРБИЙ-ГАФНИЙ
Диаграмма состояния Er—Hf приведена на рис. 219 по данным
работы [1]. Сплавы изготовляли плавкой в дуговой печи в атмосфере
Не. Исходными материалами служили иодидный Hf и Ег, дисцилли-
рованный в вакууме. Исследование было выполнено методами мик-
роструктурного, рентгеновского и термического анализов, а также
измерением твердости и микротвердости.
Er Hf
Рис. 219. Er—Hf
416
Er-Hg
При температуре 1447 °C и содержании 27 % (ат.) Hf осущес-
твляется эвтектическая кристаллизация. Растворимость Hf в Ег при
эвтектической температуре составляет -3 % (ат.) и уменьшается до
—1,5 % (ат.) при температуре 600 °C. Растворимость Ег в Hf при
эвтектической температуре равна 7 % (ат.) и 2,5 % (ат.) при темпе-
ратуре 600 °C.
Литература
1. Колесниченко В.Е., Терехова В.Ф., Савицкий Е.М. / / Редкоземельные металлы
и сплавы. Сб. статей. М.: Наука, 1971. С. 46—50.
Л.77. Будбер,-
Er—Hg. ЭРБИЙ—РТУТЬ
Диаграмма состояния Er—Hg схематически представлена на
рис. 220. Сплавы изготовляли в тиглях из Та в атмосфере Аг. Исход-
ными компонентами служили Hg чистотой 99 % (по массе) и Ег с
суммарным содержанием примесей ~1 % (по массе). Исследование
выполняли методами рентгеновского и термического анализов.
//у Ег, % (ат-) Ег
Рис. 220. Er—Hg
Er-Но
417
В системе образуются три соединения: ErHg3, ErHg2 и ErHg, темпе-
ратуры кристаллизации которых по перитектическим реакциям соот-
ветственно равны 430, 520 и 570 °C. Растворимость Ег в жидкой Hg
при нормальном давлении и температуре 150 °C составляет -0,1 %
(ат.). Растворимость Hg в Ег не установлена.
Литература
1. Kirchmayz H.R., Zugscheider W. // Z. Metallkunde. 1966. Bd. 57 N 10.
S. 725-728.
А.П. Будберг
Er-Но. ЭРБИЙ—ГОЛЬМИЙ
Но и Ег расположены рядом в Периодической системе, имеют
идентичное электронное строение с тремя валентными электронами
5rZ* 6s2, одинаковые кристаллические структуры типа Mg (символ
Пирсона hP2, пр. гр. Pb^/тст) и очень близкие значения параметров
решеток: а = 0,35778 нм и 0,35592 нм для Но и Ег соответственно.
Атомные радиусы Но и Ег отличаются всего лишь на 0,5 %. Исследо-
вание выполнено в работе [1] методами микроструктурного, рентге-
новского и термического анализов.
Но Ег,%(ат.) Ег
Рис. 221. Ег—Но
14 Зак. 2144
418
Er—Jn
Изменение параметров решеток Но и Ег указывает на линейную
зависимость, подчиняющуюся закону Вегарда. В работах [1—2] уста-
новлено, что Но и Ег мономорфные металлы, В работе [3] указано
на существование ближнего порядка в жидком состоянии у Но при
температуре 1485 °C и у Ег при температуре 1555 °C. На рис. 221
схематически приведена диаграмма состояния системы Но—Ег, пря-
мая сплошная линия отвечает ликвидусу-солидусу системы, штри-
ховая линия является концентрационной границей ближнего порядка
в жидкости.
Литература
1. Spedding F.H., Sanden В., Beaudry В J. //J. Less-Common Met. 1973. V. 31. N 1
P. 1-13.
2. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis
try of Rare Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publi
shing Co. 1986. V. 8. Chap. 54. P. 1-161.
3. Григорович B.K., Григорович K.B. // Строение и свойства металлических и
шлаковых расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск:
ЧПИ, 1990. Т. II. Ч. II. С. 250—252.
В.К. Григорович
Er—In. ЭРБИЙ—ИНДИЙ
Диаграмма состояния Er—In приведена на рис. 229 по данным
работы [1]. Сплавы, изготовленные из In чистотой 99,9 % (по массе)
и Ег чистотой 99,999 % (по массе), исследовали методом термичес-
кого анализа в атмосфере Не в герметичных тиглях из Та и мето-
дом рентгеновского анализа после отжига образцов при высоких
температурах в течение 400 ч в герметичных заваренных тиглях
из Та.
В системе установлено пять соединений: Ег51п3, Ег31п5, Ег1п3,
Ег21п и Erin. Соединения Ег51п3, ЕгДп5 и Erln3 плавятся с откры-
тым максимумом при 1270, 1070 и 1090 °C соответственно. Соедине-
ния Ег21п и Erin образуются по перитектическим реакциям при
температурах 1230 и 1220 °C соответственно. При температурах
1140, 1060, 1050 °C и содержании 23 % (ат.) In, 57 % (ат.) In и
65 % (ат.) In осуществляются эвтектические превращения. Штрихо-
вой линией при 1040 °C показано полиморфное превращение у соеди-
нения Ег21п.
Соединение Ег21п имеет кристаллическую структуру типа
Ni2In (символ Пирсона hP6, пр. гр. Рб^/ттс, а = 0,5296 нм, с =
= 0,6644 нм). Соединение ErNi3 имеет структуру типа AuCu3 (символ
Пирсона сР4, пр. гр. РтЗт, а - 0,4553 нм).
Er—La
419
Er In.’L (am.) In
Рис. 222. Er—In
Литература
1- Yatsenko S.P., Semyannikov A.A., Shakarov H.O., Fedorova E.C. // J. Less-
Common Met. 1983. V. 90. P. 95-108.
А.П. Будберг
Er—La. ЭРБИЙ-ЛАНТАН
Диаграмма состояния Er—La (рис. 223), построенная на основании
°бобщения и анализа литературных данных по особенностям взаимо-
действия редкоземельных металлов в двойных системах, приведена
схематически в работе [1].
14*
420
Er—Lu
Рис. 223. Er—La
Литература
1. Gschneidner, Jr., K.A. // J. Less-Common Met. 1985. V. 144. NIP. 29—42.
П.Б. Будберг
Er—Lu. ЭРБИЙ-ЛЮТЕЦИЙ
Диаграмма состояния Er—Lu экспериментально не построена. Er
и Lu имеют идентичное электронное строение с тремя валентными
электронами 5а?16s2, одинаковые кристаллические структуры типа Mg
(символ Пирсона hP'l, пр. гр. Рб^/ттс), близкие по значению пара-
Er—Lu
421
Er Lu,°/0(am.) Lu
Рис. 224. Er—Lu
метры решеток: a = 0,35592 нм для Ег и a = 0,35052 нм для Lu [1].
Атомные радиусы Ег и Lu отличаются всего на 1,25 %.
Сделано предположение об образовании между Ег и Lu непрерыв-
ных рядов идеальных твердых растворов. Линии ликвидуса-солидуса
должны сливаться в одну линию. У Ег и Lu-мономорфных металлов
[2, 3] вблизи температуры плавления наблюдается изменение ближ-
него порядка ЖГПу « Жоцк в жидком состоянии при температурах
1555 °C (Ег) и 1790 °C (Lu) [4]. На рис. 224 схематически представ-
лена диаграмма состояния Ег—Lu. Штриховая линия (линия ликвиду-
са) отделяет область жидкости с ближним порядком.
Литература
1. Spedding F.H., Sanden В., Beaudry B.J. 11 J. Less-Common Met. 1973. V. 31. N 1.
P- 1-13.
2. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and Chemis-
“У of Rare Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publi-
shing Co. 1986. V. 8. Chap. 54. P. 1-161.
3. Gschneidner, Jr., K.A., Daane A.H. 11 Handbook on the Physics and Chemistry of
Hare Earths. Amsterdam. New York. Oxford. Tokyo: Elsevier Scince Publ., 1988. V. 11.
C-hap. 78. P. 409-464.
4. Григорович В.К., Григорович К.В. // Строение и свойства металлических и
шлаковых расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск:
ЧПИ 1990. Т. II. Ч. II. С. 250-252.
В.К. Григорович.
422
Er—Mg
Er—Mg. ЭРБИЙ-МАГНИЙ
Диаграмма состояния Er—Mg приведена на рис. 225 согласно
справочнику [М]. На основании рентгеновских исследований в систе-
ме Er—Mg установлено образование трех соединений [1—3]. Соедине
ния Mg24Er5, Mg2Er и MgEr образуются по перитектическим реакци-
ям, температура которых точно не установлена, кроме температуры
822 “С, отвечающей реакции Ж + ”pEn” « MgEr кристаллизации
соединения MgEr. При температуре 699 °C предположительно проис-
ходит эвтектоидный распад (ЗЕг. При температуре 584 °C и содержа-
нии 13,7 % (ат.) Ег в интервале концентраций 6,9—18 % (ат.) Ег
осуществляется эвтектическая реакция Ж « (Mg) + Mg^Er^ Крис
таллическая структура соединений приведена в табл. 165.
Y Ег, % (по массе)
' 0 20 4050 £0 10 80 SO 95 100
I’I’I 1 “Г- 1 Г" Г1 1 1573° 'Я
ж х / / 7 / ’ / /
/ t / /
' 822- 5°__t )’/ 1 / /
650° 5 • —. >— —• — 69975 — г I (Ег)
(М^5~9 73,7 \ 3
1 «!? Uj ii \
5? 5
10 20 30 40 50 60 70 80 90 100
Мд Ег,%(ат) Ег
Рис. 225. Er—Mg
Таблица 165. Кристаллическая структура соединений системы Er—Mg
Соединение Прототип Символ Пирсона, пр.гр. Параметры решет- ки, НМ Источник
а С
MgEr CsCl сР2, РтЗт 0,3737 — [4]
0,3756 — [3]
0,3758 — [2]
Er—Мп
423
Соединение Прототип Символ Пирсона, пр.гр. Параметры решет- ки, нм Источник
а с
W2Er MgZn2 ЙР12, Pbjmmc 0,600 0,970 [М]
Th5Re24 — 1,224 — [4]
c.q-j
Литература
i. Крипякевич П.И., Евдокименко В.И., Гладышевский Е.И. // Кристаллография.
1964. Т. 9. № 3. С. 410—411.
2. Krypiakewytsch P.L, Evdokimenko V.I. // Z. Anorg. All. Chem. 1967. Bd. 355.
N j- S, 104-112.
3. landelli A., Palenzona A. // J. Less-Common Met. 1965. V. 9. N 1. P. 1—6.
4. Miller A.E., Daane A.H. // Trans. AIME, 1964. V. 230. N 4. P. 568-572.
5. Рохлин Л.Л., Никитина Н.И., Золина З.К. // Металловедение и термическая
обработка металлов. 1978. № 7. С. 15—18.
6. Рохлин Л.Л. Магниевые сплавы, содержащие редкоземельные металлы. М.:
Наука, 1980. 192 с.
Л.Л. Рохлин
Er-Мп. ЭРБИЙ—МАРГАНЕЦ
Диаграмма состояния Ег—Мп представлена на рис. 226 по данным
работы [1]. Сплавы исследовали методами термического и рентге-
новского анализов. В системе образуются три соединения: ЕгМп2,
Ег6Мп23 и ЕгМп12, кристаллизующиеся по перитектическим реакци-
424
Er—Mo, Er—Nd
ям при температурах 990, 1115 и 1210 °C соответственно. При темпе-
ратуре 940 °C и содержании 27,3 % (ат.) Мп осуществляется эвтек-
тическая реакция Ж ** (Ег) + ЕгМп2.
Соединение ЕгМп2 обладает структурой типа MgZn2 (символ
Пирсона ЛР12, пр. гр. Pfs^/mmc). Соединение Ег6Мп23 имеет структу-
ру типа Th6Mn23 (символ Пирсона сР116, пр. гр. Fmbrn), соединение
ЕгМп12 — структуру типа ThMn12 (символ Пирсона ГГ26, пр. гр.
14/ттт).
Литература
1. Kirchmayr H.R., Lygscheider W. // Z. Metallkunde. 1967. Bd. 58. N 3.
S. 185-188.
П.Б. Буд бе p г
Er—Mo. ЭРБИЙ-МОЛИБДЕН
Диаграмма состояния Ег—Mo не построена. В работе [1] на осно-
вании термодинамических расчетов показано, что в системе Ег—Мо
можно ожидать существование области несмешиваемости с темпера-
турой монотектической реакции 2467+30 °C; сплав, отвечающий
монотектической точке, содержит 9+3 % (ат.) Ег. Концентрацион-
ная протяженность монотектической горизонтали занимает интервал
0,5 — 59+7 % (ат.) Ег. Взаимная растворимость компонентов при
температурах 727—1127 °C, видимо, не должна превышать сотых
долей процента.
Литература
1. Brewer L., Lamoreaux R.H. // Atomic Energy Review. Special Issue N 7 Molibde-
num: Physico-Chemical Properties of its Compounds and Alloys. Vienna: International
Atomic Energy Agency. 1980. P. 195—356.
К Б. Поварова
Er—Nb. ЭРБИЙ—НИОБИЙ
Диаграмма состояния Er—Nb не построена. Система характеризу-
ется существованием области несмешиваемости в жидком состоянии.
В справочниках [Э, Ш] также указано, что при температуре, близ-
кой к температуре плавления Nb, равной 2469 °C, протекает моно-
тектическая реакция, а при температуре, близкой к температуре
плавления Ег (1529 °C) — эвтектическая реакция.
Е.Н. Шефтель
Er—Nd
425
Er—Nd. ЭРБИЙ-НЕОДИМ
Диаграмма состояния Er—Nd представлена на рис. 227 по данным
работы [1], в которой были использованы экспериментальные данные
работы [2]. Сплавы изготовлены в дуговой печи в атмосфере Аг и
отжигали при температурах 550 и 800 °C в течение 3000 и 1000 ч
соответственно. В качестве шихтовых материалов использовали Nd
чистотой 99,4 % (по массе) и Ег чистотой более 99,7 % (по массе).
Исследование проводили методами микроструктурного, рентгеновско-
го и термического анализов [2]. Предполагается образование высоко-
температурной модификации Nd по перитектической реакции при
температуре -1200 °C и содержании -50 % (ат.) Ег. Фаза S типа
aSm образуется из твердого раствора (Er, aNd) при температуре
900±15 °C.
Er Nd, % (ат) Nd
Рис. 227. Er—Nd
Литература
1. Gschneidner, Jr., К.A., Calderwood F.W. // Bull. Alloy Phase Diagrams. 1982.
v- 3. N 3. P. 350—351.
2. Кобзенко Г.Ф., Мартинчук E.A., Моисеева И.В. // Доклады АН УРСР. 1972.
Сер. А. № 4. С. 374-376.
А.П. Будберг
426
Er—Ni
Er—Ni. ЭРБИЙ-НИКЕЛЬ
Диаграмма состояния Er—Ni приведена на рис. 228 по данным
работы fl]. Сплавы изготовляли плавкой в дуговой печи в атмосфе-
ре Аг, образцы отжигали в вакууме при 1000 °C от 24 ч до 26 суток,
а также при 900 и 700 °C по три недели, после чего закаливали в
воде. Исходными компонентами служили Ег чистотой 99,9 % (по
массе) и Ni чистотой 99,96 % (по массе). Исследование выполняли
методами микроструктурного, рентгеновского и термического анали-
зов, измерением магнитных свойств.
Ni, % (по массе)
Рис. 228. Er—Ni
Ег—О
427
В системе существуют восемь соединений. Соединения ErNi и
ErNi5 плавятся конгруэнтно при 1100 и 1380 °C; Er3Ni, Er5Ni3,
ErNi2, ErNi3 и Er2Ni17 образуются по перитектическим реакциям при
температурах 845, 800, 1255, 1320 и 1315 °C соответственно. Соеди-
нение Er2Ni7 кристаллизуется по перитектоидной реакции при
температуре 1275 °C ErNi3 + ErNi5 « Er2Ni7. При температурах 765,
1025 и 1280 °C осуществляются эвтектические реакции Ж « Er3Ni +
+ Er5Ni3, Ж » ErNi + ErNi2 и Ж » Er2Ni17 + (Ni) соответственно.
Растворимость компонентов в твердом состоянии незначительна.
В табл. 166 приведена кристаллическая структура соединений [1].
Таблица 16 6. Кристаллическая структура соединений системы Er—Ni
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
Er3Ni Fe3C <?P16, Pnma 0,6804 0,943 1,065
ErNi FeB oPH, Pnma 0,6977 0,411 0,5448
ErNi2 MgCu2 cF24, Fd3m 0,7125 — —
ErNi3 PuNi3 — 0,4491 — 2,425
Er2Ni7 Gd2Co7 ЛЯ18, R3m 0,4904 — 3,606
ErNi5 CaZn5 hP6, P6mm 0,4854 — 0,3964
ErjNi|7 Th2Ni|7 ЛР38, P63/mmc 0,8287 — 0,8017
Литература
1. Buschow K.H.J. // J. Less-Common Met. 1968. V. 16. N 1. Р. 45—63.
С. П. Алисова
Ег—О. ЭРБИЙ—КИСЛОРОД
В справочнике [Э] приведены результаты изучения фазовых
равновесий в системе Ег—О, представленные на рис. 229. Исследова-
ние проведено микроструктурным, рентгеновским и термическим
анализами. В равновесии с Ег находится соединение Ег2О3, образую-
щееся, видимо, из расплава. По данным рентгеновского анализа
сплава с 1,32 % (ат.) О при температуре 1000 °C установлено обра-
зование кристаллической структуры с гранецентрированной кубичес-
кой решеткой и параметром а = 0,4778 нм. На этом основании сдела-
но предположение о существовании моноокисла ЕгО и возможной
реализации практически вырожденного эвтектического превращения
Ж ** ЕгО + (Ег) вблизи температуры плавления Ег, равной 1529 °C,
хотя данные микроструктурного анализа сплава с 50 % (ат.) О не
подтверждают существование ЕгО.
428
Er-Pd
Er 0, °/o (am.)
Рис. 229. Er—О
Растворимость О в Er при комнатной температуре менее 0,31 %
(ат.), а при температуре 1000 °C менее 2,1 % (ат.). Соединение
Ег2О3 имеет объемно центрированную решетку типа Мп2О3 (символ
Пирсона с/80, пр. гр. lai, а = 1,0547 + 1,0550 нм) и не претерпевает
полиморфного превращения в интервале температур 25—1300 °C.
В работе [Э] указано, что после закалки от 1200 °C и давлении
3 МПа образуется полиморфная модификация соединения Ег2О3 с
моноклинной структурой.
С. П. Алисова
Er—Pd. ЭРБИЙ-ПАЛЛАДИЙ
Диаграмма состояния Er—Pd (рис. 230) построена по эксперимен-
тальным результатам работы [1], дополненным данными термодина-
мического расчета, полученными в работе [2]. Сплавы выплавляли
в дуговой печи в атмосфере Аг с использованием геттера из Zr и
отжигали перед закалкой в воде при различных температурах.
В качестве исходных материалов использовали Pd чистотой 99,9 %
(по массе) и переплавленный Ег с содержанием остальных редкозе-
мельных металлов в количестве ~0,1 % (по массе) и -0,1 %
Er-Pd
429
Рис. 230. Er-Pd
(по массе) Та. Исследование было выполнено методами микрострук-
турного, рентгеновского и термического анализов.
Соединения Er5Pd2, ErPd, Er3Pd4 (Er4Pd5 LU> и ErPd3 образу-
ются конгруэнтно при температурах 940, 1540, 1450 и 1710 °C,
соответственно. Соединения Er3Pd2, Er2Pd3, Er10Pd21 (ErPd2 [1])
образуются по перитектическим реакциям при температурах 991,
1323, 1325 °C. Соединение ErPd7 образуется также по перитектичес-
кой реакции и нанесено на диаграмму (см. рис. 230) по данным
работы [3]. Соединение ErPd имеет область гомогенности 1—1,5 %
(ат.), а в интервале температур 565—548 °C претерпевает полимор-
фное превращение. Соединение Er2Pd3 также существует в двух
модификациях, температура структурного перехода составляет
1150 °C. Соединение ErPd3 имеет достаточно широкую область гомо-
генности, равную ~5 % (ат.), в интервале концентраций 75—79,5 %
(ат.) PJ. При температурах 915, 923, 1430, 1295 и 1280 °C и содер-
жании 26,5; 31,5; 53,5; 63,5; 86,0 % (ат.) Pd осуществляется эвтек-
тическая кристаллизация. Растворимость Ег в Pd при эвтектической
температуре 1280 °C составляет 13 % (ат.). В табл. 167 приведена
кристаллическая структура соединений.
430
Er—Pm
Кристаллическая структура обеих модификаций соединения
Er2Pd3 не установлена; также не расшифрована низкотемпературная
модификация aErPd; данных о кристаллической структуре соедине-
ния ErPd7 нет.
Таблица 167. Кристаллическая структура соединений системы Er—Pd
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а С
Er5Pd2 Dy5Pd2 t/49, 741 /а 0,944 1,336 [1]
Er3Pd2 Si2U3 tPIO, P4/mbm — — [2]
PErPd CsCl сР2, РтЗт 0,3455 — [1, 2]
Er3Pd4 Pu3Pd4 hR14, R3 — — [2]
®Г10Рс^21 — тс24, с2/т — — Г2]
ErPd3 AuCu3 сР4, РтЗт 0,4064 — [1, 21
Литература
1. Loeblich О., Raub Е. // J. Less-Common Met. 1971. V. 30. N 1. Р. 47—62.
2. Okamoto Н. И J. Phase Equilibria. 1991. V. 12. N 1. Р. 116-117.
3. Sakamoto Y., Takao K., Takede S., Takede T. // J. Less-Common Met. 1989.
V. 152. P. 127-138.
С.П. Алисова
Er—Pm. ЭРБИЙ—ПРОМЕТИЙ
Диаграмма состояния Pm—Ег экспериментально не построена, Ег
и Рш имеют идентичное электронное строение с тремя коллективи-
зированными электронами 5Л6$2. Атомные радиусы Ег и Pm отлича-
ются всего на 3 % [1]. Кристаллические характеристики Ег и Pm
приведены в табл. 168.
На рис. 231 приведен вариант гипотетической диаграммы состоя-
ния системы Pm—Ег, предполагающий образование непрерывных
рядов твердых растворов с гексагональной структурой. По данным
работы [2], указывающей на существование ближнего порядка
Жгпу ** ЖоцкЕг при температуре 1555 °C нанесена прямая, соеди-
няющая эту температуру с температурой а 0 превращения Pm
(890 °C). Пересечение этой прямой с линией, соединяющей темпера-
туры плавления Pm (1042 °C) и Ег (1529 °C), определяет температу-
Pm Er,°/a(am) Er
Рис. 231. Er—Pm
Ру перитектической горизонтали, равную 1450 °C; при этой темпера-
туре состав (рРт, Ег) содержит ~84 % (ат.) Ег. При температуре
ниже 750 °C по данным работы [1] существует промежуточная фаза
S со структурой типа aSm (символ Пирсона, Л/?3, пр. гр. Злп>.
432
Er—Po, Er—Pr
Таблица 16 8. Кристаллическая структура и полиморфные превращения
элементов системы Pm—Ег [ 11
Атомный номер, элемент Модифи- кация Прототип, структура Параметры решетки Темпера ту- ра превра- щения, °C Реакция
а С
61, Pm аРт La, ДГПУ 0,365 1,165 890 аРт « РРт
рРт W, ОЦК — — 1042 Ж » ЗРт
68, Ег — Mg, ГПУ 0,35592 0,55850 1555 ЖГПу • Жоцк
1529 Ж •* Ег
Литература
1. Gschneidner, Jr., К.A., Calderwood F.W. / / Handbook on the Physics and Chemis-
try of Rare Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publi-
shing Co., 1986. V. 8. Chap. 54. P. 1-161.
2. Григорович B.K., Григорович K.B. // Строение и свойства металлических и
шлаковых расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск:
ЧПИ, 1990. Т. 2. Ч. 2. С. 250-252.
В.К. Григорович
Ег—Ро. ЭРБИЙ-ПОЛОНИЙ
Диаграмма состояния Ег—Ро не построена. В работе [Ш] сооб-
щается о синтезе сплава системы Ег—Ро при соотношении атомов
Ро:Ег = 0,7:2 и температуре его плавления ~1490±50 °C.
Л. Б. Будберг
Ег-Pi. ЭРБИЙ—ПРАЗЕОДИМ
Диаграмма состояния Ег—Рг экспериментально не построена. Рг
и Ег имеют идентичное электронное строение с тремя коллективизи-
рованными валентными электронами 5dl6s2, близкие по симметрии
плотные гексагональные структуры и мало отличающиеся (всего на
4,0 %) атомные радиусы [1]. В табл. 169 приведены кристаллические
данные элементов системы Рг—Ег.
На рис. 232 показана гипотетическая диаграмма состояния систе-
мы Рг—Ег. Сделано предположение об образовании широкой области
непрерывных рядов твердых растворов с гексагональной структурой.
В работе [2] установлено изменение ближнего порядка в жидком Ег
при температуре 1555 °C. Высказано соображение, что пересечение
двух прямых, соединяющих температуры плавления Рг и Ег и темпе-
Er—Pr
433
Рис. 232. Er-Pr
ратуры их превращений аРг рРг и Жгпу * ^^огтк’ определяет
температуру перитектической горизонтали при 1440 °C с точкой
превращения при содержании -85 % (ат.) Ег. При температуре
ниже -750 °C должна образовываться 3 фаза со структурой типа
“Sm (символ Пирсона hR3, пр. гр. R3m) при концентрации 30—50 %
(ат.) Ег.
434
Er—Pt
Таблица 16 9. Кристаллическая структура и полиморфные превращения
элементов системы Рг—Ег
Атомный номер, элемент Моди- фикация Прототип, структура Параметры решетки, нм Температура превра- щения, °C Реакция Источник
а С
59, Рг аРг La, ДГПУ 0,36721 1,18326 795 аРг « рРг [1]
рРг W, ОПК 0,413 — 931 Ж » рРг [1]
68, Ег — Mg, ГПУ 0,35592 0,55850 1529 Ж * Ег [11
1555 Ж ГПУ а Жоцк [21
Литература
1. Gschneidner, Jr., К. A., Calderwood F.W. / / Handbook on the Physics and Chemis-
try of Rare Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publi-
shing Co., 1986. V. 8. Chap. 54. P. 1-161.
2. Григорович B.K., Григорович K.B. // Строение и свойства металлических и
шлаковых расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск-
ЧПИ, 1990. Т. 2. Ч. 2. С. 250-252.
В.К. Григорович
Er—Pt. ЭРБИЙ—ПЛАТИНА
Диаграмма состояния Er—Pt приведена на рис. 233.
Сплавы синтезировали в дуговой печи и отжигали при температу-
рах 1200 и 900 “С по 200 ч. Исследование проводили методами
микроструктурного, термического и рентгеновского анализов. Исход-
ными материалами служили Pt чистотой 99,91 % (по массе) и дис-
тиллированный Ег чистотой 99,9 % (по массе) [1].
Таблица 170. Кристаллическая структура соединений системы Er—Pt
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
ErPt3 AuCu3 cP4, РтЗт 0,40528 — —
ErPt2 MgCu2 cF24, Fd3m 0,757 — —
ErPt FeB oPS, Pnma 0,6904 0,4453 0,65512
ErPt5 CaCu5 hP6, Pb/mmm 0,526 — 0,444
Er—Pt
435
Рис. 233. Er—Pt
В системе образуются семь соединений, из которых ErPt и ЕгРь
плавятся с открытым максимумом при температурах 1660 и 1840 °C
соответственно. Соединения Er9Pt, Er2Pt, Er^Pt^, ErPt2, ErPt5 крис-
таллизуются по перитектическим реакциям при температурах 1160,
1445, 1630, 1740, 1690 °C соответственно. Эвтектики (Er) + EfnPt,
ErxPt + ErPt2, ErPt5 + (Pt) кристаллизуются при 20, ~62, -91 %
(ат.) Pt при температурах 1045, 1610, 1540 °C соответственно.
Растворимость Pt в Ег не превышает 0,1 % (ат.) при температуре
1000 °C, в Pt растворяется -0,5 % (ат.) Ег.
Кристаллическая структура соединений приведена в табл. 170.
436
Er—Pu, Er—Re
rJ
, ii
।
'i
1,1
ij
' .1
'il
J
: il
W
j'
Литература
1. Колесниченко B.E., Терехова В.Ф., Савицкий Е.М. /1 Диаграммы состояния
металлических систем: Сб. статей. М.: Наука, 1974. С. 174—176.
А.П. Будберг
Er—Pu. ЭРБИЙ-ПЛУТОНИЙ
Диаграмма состояния Ег—Pu не построена. В справочнике [III]
сообщается, что добавка 5 % (ат.) Ег повышает температуру плавле-
ния Pu до 645 °C. Максимальная растворимость Pu в Ег достигает
-20 % (ат.), а Ег в Pu ~2—3 % (ат.). Сделано предположение о
существовании реакции Ж + (Ег) •* (ePu) [Ш].
В.Н. Кузнецов
Ег—Re. ЭРБИЙ-РЕНИЙ
Ле, '/• (по массе')
Рис. 234. Ег—ЙС "A (am.) Re
Er-Rh
437
Диаграмма состояния Ег—Re приведена на рис. 234 по данным
работы [1]. Исследование проводили микроструктурным, рентгенов-
ским, термическим анализами, измерением твердости, микротвер-
дости, удельного электросопротивления, абсолютной термо-ЭДС.
В качестве исходных материалов использовали Re чистотой 99,98 %
(по массе), дистиллированный Ег чистотой 99,5 % (по массе). Спла-
вы изготовляли в дуговой печи в атмосфере очищенного Не. Отжиг
сплавов с содержанием Re до 60 % (ат.) проводили в двойных эваку-
ированных кварцевых ампулах при температуре 950 °C в течение
300 ч с последующей закалкой, а богатые Re сплавы отжигали в
вакууме при температуре 1200 °C в течение 200 ч.
В системе Er—Re образуется соединение ErRe2 по перитектической
реакции Ж + (Re) * ErRe2 при температуре 2500 °C. При температу-
ре 1440 °C осуществляется эвтектическая кристаллизация Ж * (Ег) +
+ ErRe2, сплав эвтектического состава содержит -3 % (ат.) Re. Рас-
творимость Re в Ег не превышает 1 % (ат.), растворимость Ег в
Re менее 0,3 % (ат.). Соединение ErRe2 имеет кристаллическую
структуру типа MgZn2 (символ Пирсона ЛР12, пр. гр. РЪ^/ттс, а =
= 0,5363 нм, с = 0,8758 нм [1], а = 0,5381 нм, с = 0,8788 нм [Ш]).
Литература
1. Савицкий Е.М., Хамидов О.А. // Изв. АН СССР. Неорганические материалы,
1967. Т. 3. № 4. С. 649—655.
М.А. Тылкина
Er-Rh. ЭРБИЙ—РОДИЙ
Диаграмма состояния Er—Rh приведена на рис. 235 по данным
работы [1]. Исследование проводили методами микроструктурного,
рентгеновского и термического анализов. В качестве исходных мате-
риалов использовали Rh в порошке чистотой 99,92 % (по массе) и Ег
чистотой 99,9 % (по массе).
В системе образуются восемь соединений, из которых ErRh, ErRh2
и ErRh5 плавятся с открытым максимумом при температуре выше
1400 °C, a Er3Rh, Er7Rh3, Er5Rh3 (a), Er5Rh3 (0), Er3Rh2 образуются
по перитектическим реакциям при температурах 1080, 1110, 1175,
1250, 1300 °C соответственно. Соединение Er5Rh3 имеет область
гомогенности в концентрационном интервале 36—38 % (ат.) Rh.
Температурный интервал полиморфного превращения соединения
Er^Rh3 составляет 1175—950 °C. При температуре -1450 °C соедине-
ние ErRh^ распадается по эвтектоидной реакции ErRh5 * ErRh2 +
+ (Rh).
В системе Er—Rh осуществляются четыре эвтектических превра-
щения: Ж * (Er) + Er3Rh (1020 °C, -8 % (ат.) Rh), Ж = ErRh +
+ ErRh2 (1240 °C, 60 % (ат.) Rh), Ж * ErRh2 + ErRh5 (> 1400 °C,
80 % (ат.) Rh) и Ж * ErRh5 + (Rh) (>1400 °C, 90 % (ат.) Rh).
438
Er-Rh
Rh, % (no массе)
Рис. 235. Ег-Rh
Кристаллическая структура соединений приведена в табл. 171.
Таблица 171. Кристаллическая структура соединений системы Er—Rh
Соеди- нение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а Ь с
F,r3Rh Fe3C оР\6, Pnma 0,7075 0,9335 0,6128 [2]
Er7Rh3 Th7Fe3 hPIO, Р63тс 0,9643 — 0,6070 12]
0Er5Rh3 Mn5Si3 hP\6, Pf^/mcm 0,8084 — 0,6306 12]
Er3Rh2 Y3Rh2 — 1,109 — 2,488 [2]
ErRh CsCl сР1, РтЗт 0,3372— 0,3375 — — 13}
ErRh2 MgCu2 cF24, Fd3m 0,7465— 0,7414 — — [3]
ErRh5 Ca^n^ — 0,5118 — 0,4292 [3]
Литература
1. Ghassem Н., Raman А. // Metall. Trans. 1973. V. 4. N 3. Р. 745—748.
2. Moreau J.-M., Paccard D., Parthe E. // Acta Crystallog. B. 1976. V. 32
P. 1767-1771.
3. Parthe E„ Moreau J.-M. // J. Less-Common Met. 1977. V. 53. N 1. P. 1-24.
А.П. Будберг
Er-S, Er—Sb
439
Er-S- ЭРБИЙ-СЕРА
Диаграмма состояния Er—S не построена. Кристаллическая струк-
тура сульфидов, указанных в работах [1, 2], приведена в табл. 172.
Таблица 17 2. Кристаллическая структура соединений системы Er—S
Соеди- нение Прототип Символ Пирсона, пр.гр. Параметры решетки Источник
a b c P°
ErS NaCl cF8, 0,5432 — — — [3]
РтЗт 0,5430 — — II]
0,5392 — — — Hl
Er5S7 y5s7 c2/m 1,2671 0,3775 1,1480 104,75 [III]
8Er2S3 Ho2S3 P2Jm 1,7404 0,3978 1,0092 98,67 [3]
yEr2S3 Th3P4 o/28, 743d 0,8244 — — — 14]
Er2S3* Sb2S3 oP20, Pnma 1,0526 0,3824 1,0374 — [У-С]
ErS2_x EuS2 P4^n 0,7636 0,7811 — — 15]
Ers;:x — — 0,7745 — — — 15]
•Получено при давлении 1 ГПа. ••Получено при давлении 4—7 ГПа, кубическая сингония.
Литература
1- Ярембаш Е.И., Елисеев А.А. Халькогениды редкоземельных металлов. М.:
Наука, 1975. 258 с.
2. Самсонов Г.В., Дроздова С.В. Сульфиды. М.: Металлургия. 1972 304 с.
3. Sleight A.W., Prewitt С.Т. // Inorg. Chem. 1968. V. 7. N И. P. 2232-2237
4. Eatough H.L., Webb W., Hall N.T. // Inorg. Chem. 1969. V. 8. N 10.
₽. 2069-2073.
1О.Б. Кузьма
Er-Sb. ЭРБИЙ-СУРЬМА
Диаграмма состояния Er—Sb не построена. В работе [V-C] приве-
дены данные о кристаллической структуре двух соединений системы
Ег—Sb (табл. 173).
440
Er—Sc
Таблица 17 3. Кристаллическая структура соединений системы Er—Sb
Соединение Прототип Символ Пирсона, пр.гр. Парамехры решетки, нм
а b с
ErSb2* — —• 0,5866 0,5259 0,7926
ErSb NaCl сЕ8, ЕтЗт 0,61089 — —
*Ромбичсская сингония.
С.П. Алисова
Er—Sc. ЭРБИЙ-СКАНДИЙ
На рис. 236 приведена диаграмма состояния системы Er—Sc.
построенная в работе [3] по данным работ [1, 2].
Сплавы системы Er—Sc исследовали в работах [1, 2] методами
термического, рентгеновского, микроструктурного анализов, измере
нием твердости, микротвердости и плотности.
Рис. 236. Ег—Sc
В качестве исходных материалов использовали Sc чистотой 98,16
% (по массе) и Ег чистотой 99,35 % (по массе). При температуре
1470 °C (1450+10 °C 11,2]) и содержании ~50 % (ат.) Sc кристалли-
зуется эвтектика Er + pSc.
Er—Se
441
Чистый Sc (при 1337 °C [3] (1350 °C [1,2]) и сплавы системы,
богатые Sc, в интервале температур 1470—1337 °C претерпевают
полиморфное превращение роцк * агпу.
। Литература
1. Наумкин О.П., Терехова В.Ф., Савицкий Е.М. // Журнал неорганической
; химии. 1964. Т. 9. № 10. С. 2497-2498.
2. Савицкий Е.М., Терехова В.Ф., Буров И.В. и др. И Изв. АН СССР. Неоргани-
ческие материалы. 1965. Т. 1. № 10. С. 1648-1659.
' 3. Gschneidner, Jr., К.А., Calderwood F.W. // Bull. Alloy Phase Diagrams. 1983. V.
,4. N 1. P. 75-76.
, С.П. Алисова
Ег-SE. ЭРБИЙ-СЕЛЕН
Диаграмма состояния Er—Se приведена на рис. 237 по данным
работы [Ш]. В системе существуют четыре соединения ErSe, Er3Se4,
Er2Se3 и ErSe2. Соединения ErSe и Er3Se4 плавятся конгруэнтно при
температурах 1750 и 1490 °C; соединения Er2Se3 и Er3Se4 образуют
непрерывный ряд твердых растворов. Соединение ErSe2 кристаллизу-
ется по перитектической реакции при температуре 1100 °C и при
температуре 890 °C претерпевает полиморфное превращение. При
температурах 1305, 1420 и 220 °C кристаллизуются эвтектики
Е? Se, % (am.) Se
Рис- 237. Er—Se
442
Er—Sm
(Er) + ErSe, ErSe + Er3Se4 и ErSe2 + (Se); при температуре 220 °C
эвтектика вырождена. В табл. 174 приведена кристаллическая струк-
тура соединений.
Таблица 17 4. Кристаллическая структура соединений системы Er—Se
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источ- ник
a b с
ErSe NaCl cF8, Fm3m 0,5662 0,5656 — —• [Э] [1]
Er3Se4—Er2Se3* Sc2S3 oFSO, Fddd 1,138 0,809 2,42 ЦП]
Er3Se4** CaIIo2S4 — 0,690 0,799 — —. [1] [2]
Er2Se3 Th3P4 c/28, 143d 0,8581 — — [3]
Er2Se3*** Sc2S3 oF80, Fddd 1,1357 0,8093 2,4186 [4]
ErSe2(BT) — Immm 0,4061 0,5571 1,316 [5]
ErSe2(HT) — Cmma 1,622 1,580 1,180 [5]
ErSe2 SbCu2 tP6, Р4/nmm 0,396 0,3973 — 0,810 0,8197 [3] [V—С]
*Проиндицирована как промежуточная фаза в указанном интервале **а - 33,7’11], а - 60,08“ [2]. составов.
***Получено отжигом при 600 °C в течение 24 ч и 800 “С в течение 120 ч.
Литература
1. Flahaut J., Lepeltieau С. // Bull. Soc. Chim. France. 1968. V. I N 1. P. 47—50.
2. Guittard M., Flahaut J. // Compt. Rend. Acad. Sci. Paris Ser. C. 1967. V. 264. N 7.
P. 1951-1954.
3. Eatough N.L., Hall H.T. 11 Inorg. Chem. 1970. V. 9. N 2. P. 417-421.
4 Haase D.J., Steinfink H., Weise EJ. 11 Inorg. Chem. 1965. V. 4. N 3. P. 538-541
Ю.Б. Кузьма
Er—Sm. ЭРБИЙ-САМАРИЙ
Диаграмма состояния Er—Sm экспериментально не построена. Sm
и Ег имеют идентичное электронное строение 5dl6s2, одинаковые
кристаллические структуры с близкими параметрами решеток. Атом-
ные радиусы Sm и Ег отличаются на 2,7 %. Данные о кристалличес-
кой структуре элементов приведены в табл. 175.
Er—Sm
443
Таблица 17 5. Кристаллическая структура и полиморфные превращения
элементов системы Sm—Ег
Атом- ный номер, элемент Моди- фика- ция Прототип, структура Параметры решет- ки, нм Темпе- ратура превра- щения, °C Реакция Источ- ник
а с
62, Sm aSm aSm, — 0,36290 2,6207 734 aSmwpSm [1]
pSm Mg, ГПУ 0,36630 0,58448 922 pSm^ySm [И
ySm W, ОЦК 0,410 — 1074 ySm*X [1]
68, Ег —. Mg, ГПУ 0,35592 0,5585 1529 Ж-Er [1]
— —• 1555 ЖГПУ**ЖОЦК [2]
Ег, °/« (по массе)
Рис. 238. Er—Sm
444
Er—Sn
На рис. 238 представлена гипотетически диаграмма состояния
Sm—Ег, характеризующаяся образованием непрерывных рядов твер-
дых растворов на основе Sm и Ег. При температурах ниже 734 °C
существует область твердых растворов со структурой aSm при кон-
центрации от 0 до 18—23 % (ат.) Ег. В работе [2] указано на сущес-
твование у Ег ближнего порядка Жгпу * Жоцк при температуре
1555 °C. Пересечение двух прямых, соединяющих температуру
плавления Sm с температурой плавления Ег и температуру превра-
щения aSm pSm с температурой превращения ЖП1у •* Ж011^, опре-
деляет температуру перитектической горизонтали при 1450 Т и -85
% (ат.) Ег.
Литература
1. Gschneidner, Jr„ К.А., Calderwood F.W. // Handbook on the Physics and
Chemistry of Rare Earths. Amsterdam. New-York. Oxford. Tokyo; North-Holland Physics
Publishing Co., 1986. V. 8. Chap. 54. P. 1—161.
2. Григорович B.K., Григорович K.B. // Строение и свойства металлических и
шлаковых расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск:
ЧПИ, 1990. Г. 2. Ч. 2. С. 250-252.
В. К. Григорович
Er—Sn. ЭРБИЙ-ОЛОВО
Диаграмма состояния Er—Sn приведена на рис. 239 согласно [М]
по данным работ [Э, 1]. Исследование проводили методами микрос-
труктурного, рентгеновского и термического анализа. В работе [1]
использовали Sn и Ег высокой чистоты. Образцы отжигали в вакууме
Рис. 239. Er—Sn
Ег—Та
445
при 1250 °C в течение 2 ч. При температуре 1230 °C и содержании
-17,2 % (ат.) Sn протекает эвтектическая реакция Ж * (Er) + Er2Sn.
Предположительно соединение Er2Sn плавится конгруэнтно. Раство-
римость Sn в Ег при эвтектической температуре не превышает 1,4 %
(ат.). Соединение ErSn3 плавится с открытым максимумом при
1090 °С [1]. Эвтектика, образующаяся по реакции Ж * ErSn3 + (Sn),
носит вырожденный характер. Растворимость Ег в жидком Sn можно
рассчитать по уравнению Igx = (А - В/ТУ ±Дг, где х — атомная доля
Ег в насыщенном расплаве Sn, находящемся в равновесии с ErSn3, А
и В — статистические коэффициенты, Т — температура, К, № —
доверительный интервал. Растворимость Ег в жидком Sn при темпе-
ратуре 700 °C составляет 3,12±0,84 % (ат.).
Литература
1. Кулагина Н.Е., Баянов А.П., Кулагин Н.М. // Изв. АН СССР. Металлы. 1985.
№ 3. С. 211-216.
А.П, Будберг
Ег—Та. ЭРБИЙ-ТАНТАЛ
Диаграмма состояния Ег—Та (рис. 240) построена в работе [1] по
данным работы [2]. Исследование в работе [2] проводили методами
термического и химического анализов. В качестве исходных материа-
лов использовали Ег с содержанием примесей в количестве 0,135 %
Ег Та,°/о(агп.)
рис. 240. Ег—Та
446
Er-Tb
(по массе) и Та чистотой 99,9 % (по массе). Сплавы выплавляли в
заваренных тиглях из Та в вакуумной индукционной печи при
температурах выше температуры плавления Ег, затем образцы
сбрасывали в водоохлаждаемый приемник. На основании химического
анализа закаленных сплавов была определена растворимость Та в
жидком Ег при температурах 1530, 1605, 1656, 1751, 1773 °C, кото-
рая составила 0,51 % (ат.), 0,71 % (ат.), 0,82 % (ат.), 1,13 % (ат.),
1,24 % (ат.) соответственно. Линия ликвидус построена в области
температур 1530—1773 °C в интервале концентраций 0,51—1,24 %
(ат.) Та. Существование эвтектики установлено при температуре
1490 °C и содержании 0,44 % (ат.) Та.
Литература
1. Moffatt W.G. Handbook of Binary Phase Diagrams. New-York: Bisiness Growth
Services. General Electric Co. Schenectady. 1981. V. 2. 384 P.
2. Dennison D.H., Tschetter M.J., Gschneidner, Jr., K.A. // J. Less-Comtnon Met.
1966. V. 10. N 2. P. 108-115.
T.B. Добаткина
Er—Tb. ЭРБИЙ—ТЕРБИЙ
Диаграмма состояния Er—ТЬ приведена на рис. 241 по данным
работы [1], результаты которой хорошо согласуются с данными
расчета в работе [2]. Исследование в работе [1] проводили мето-
дами микроструктурного, рентгеновского и термического анализов.
ТЬ, % (по mere)
Рис. 241. Ег—ТЬ
Er-Те
447
В качестве исходных материалов использовали Ег чистотой 99,88 %
(по массе) и ТЬ чистотой 99,97 % (по массе). В системе установлено
образование непрерывных рядов твердых растворов с гексагональной
плотноупакованной структурой. Температура полиморфного превра-
щения ТЬ повышается от 1289 до 1464 °C с увеличением содержания
Ег в сплавах до 66 % (ат.).
Литература
1. Spedding F.H., Sandeen В., Beaudry B.J. // J. Less-Common Met. 1973. V. 31.
N 1. P. 1-13.
2. Shiflet G.J., Lee J.K., Aaronson H.I. // Calphad. 1979. V. 3. N 2. P. 129-137.
А.П. Будберг
Er - Те. ЭРБИЙ-ТЕЛЛУР
Диаграмма состояния Er — Те приведена на рис. 242 по данным
работы [1]. Исследование проводили методами микроструктурного,
рентгеновского и термического анализов. Сплавы изготовляли в
эвакуированных кварцевых ампулах с использованием Ег чистотой
99,9 % (ат.) и Те чистотой 99,99 % (ат.).
Er Те
Рис. 242. Ег—Те
448
Er—Th
В системе образуются три соединения ЕгТе, Ег2Те3 и ЕгТе3.
Соединения ЕгТе и Ег2Те3 кристаллизуются непосредственно из
расплава при температурах 1525 и 1460 °C. Характер взаимодей-
ствия между ними не установлен. Соединение ЕгТе образуется
по перитектической реакции Ж + Ег2Тс3 ЕгТе3 при температуре
575 °C. В системе Ег—Те при температуре 1270 °C и содержании
13 % (ат.) Те происходит эвтектическое превращение. Также
эвтектическая реакция видимо наблюдается в области сплавов,
богатых Те.
В табл. 176 приведена кристаллическая структура соединений.
Таблица 176. Кристаллическая структура соединений системы Ег—Те
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а Ь С
ЕгТе NaCl cF8, Fmlm 0,6021 — — [2]
0,6063 — — [3]
Ег2Те3* — — 1,2096 0,8553 2,5695 И)
Ег2Те3 — — 1,213 0,857 2,573 [4]
ЕгТе3* — — 0,431 2,531 0,431 [И
*Ромбическая сингония.
Литература
1. Haase D.J., Steinfink., Weiss E.G. // Inorg. Chem. 1965. N 4. P. 541—543.
2. Bruzzone G. // At1i Accad. Naz. Line. Rend. C. Sci. Fi. Mat. Nat. 1961. V. 31
P. 260-264.
3. Brixner L.H. // J. Inorg. Chem. 1960. V. 15. N 1-2. P. 199-201.
4. Flahaut J., Pomange L., Quittard M, et. al // Compt. Rend. Acad. Sci. Paris. 1963
V. 257. P. 1530-1533.
НИ. Никитина
Er—Th. ЭРБИЙ—ТОРИЙ
Диаграмма состояния Th—Ег была построена в работах [ 1, 21.
Сплавы системы Th—Ег исследовали методами микроструктурного,
рентгеновского, термического анализов, измерением твердости.
Исходными материалами служили компактный и порошкообразный
Th чистотой 99,5 % (по массе) и Ег чистотой 99,585 % (по массе).
Сплавы были получены во всем интервале концентраций прямым
сплавлением исходных металлов в дуговой печи в атмосфере хими
чески чистого Аг.
Er—Th
449
Th Er,°/o (am) Er
Рис. 243. Er—Th
Установлено образование широкой области твердых растворов
между высокотемпературной модификацией Th и Ег.
При температуре 1550 °C и содержании -12 % (ат.) Ег наблюда-
ется превращение aTh * (pTh, Ег). В работе [3] максимум превраще-
ния указан при концентрации 2,5 % (ат.) Ег. По данным работы [1J
при температуре -1400 °C осуществляется перитектоидное превраще-
ние (aTh) + (PTh, Er) aЕг. Однако по данным работы [4] Ег не
имеет полиморфного превращения, что исключает вероятность ука-
занной реакции. На рис. 243 приведен возможный вариант диаграм-
мы состояния Er—Th, который предполагает образование твердого
раствора (PTh, Ег) по перитектической реакции и образование
Эвтектоида между (aTh) и (Ег) при -1400 °C.
15 Зак. 2144
450
Er—Ti
Литература
1. Бадаева Т.А., Кузнецова Р.И. // Изв. АН СССР. Металлы. 1969. № 5. С.
156-163.
2. Бадаева Т.А., Кузнецова Р.И. / / Физико-химия сплавов и тугоплавких соеди-
нений с торием и ураном. М.. Наука, 1968. С. 11—15.
3- Uy J.C., Burr А.А. // J. Less-Common Met. 1966. V. 11. N 3. P. 149—156.
4. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and
Chemistre of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland. Physics
Publishing Co. 1986. V. 8. Chap. 54. P. 1-161.
T.B. Добаткина
Ег-Ti. ЭРБИЙ-ТИТАН
Результаты исследования системы Er—Ti приведены в работах [Э,
Ш, М]. Диаграмма состояния Er—Ti представлена на рис. 244 по
данным работы [М]. При температуре 1320 °C и содержании 74 %
(ат.) Ег происходит эвтектическое превращение Ж * (Er) + (0Ti).
При температуре 890 °C протекает перитектоидная реакция (PTi) +
+ (Ег) ** (aTi), вызванная полиморфным превращением Ti.
Максимальная растворимость Ti в Ег в твердом состоянии при
эвтектической температуре составляет ~3,4 % (ат.) [Э]. По данным
работы [1] растворимость Ег в Ti в твердом состоянии менее 1,5 %
(ат.).
Рис. 244. Er—Ti
Er—Tm
451
Литература
1. Савицкий Е.М., Терехова В.Ф., Наумкин О.И. // Изв. вузов. Цветная метал-
лургия. 1960. № 1. С. 43-48.
П. Б. Будберг
Er—Tm. ЭРБИЙ-ТУЛИЙ
Диаграмма состояния Er—Tm экспериментально не построена. Ег
' и Тт имеют идентичное электронное строение 5rf]6s2, одинаковые
кристаллические структуры типа Mg (символ Пирсона, hP2 пр.гр.
Pf^/mmc) с близкими значениями параметров решетки, равными а =
== 0,35592 нм, с - 0,55850 нм для Ег и а = 0,35375 нм, с = 0,55540 нм
для Тт [1]. Атомные радиусы Ег и Тт отличаются лишь на 0,6 %.
Рис. 245. Ег—Тт
На рис. 245 представлена гипотетическая диаграмма состояния
Er—Tm, характеризующаяся образованием непрерывных рядов твер-
дых растворов между компонентами системы. Штриховой линией
проведена граница области с ближним порядком в жидком состоянии
по данным работы [2]; температура перехода Жоцк ** Жгпу состав-
ляет 1555 и 1655 °C для Ег и Тт соответственно.
15*
452
Er-У
Литература
1. Gschneidner, Jr., К.A., Calderwood F.W. // Handbook on the Physics and
Chemistry of Rare Earths. Amsterdam. New-York. Oxford. Tokyo: North-Holland Physics
Publishing Co., 1986. V. 8. Chap. 54. P. 1—161.
2. Григорович B.K., Григорович K.B. // Строение и свойства металлических и
шлаковых расплавов: Сб. статей. Челябинск: ЧПИ, 1990. Т. 2. Ч. 2. С. 250—252.
В. К. Григорович
Ег—V. ЭРБИЙ—ВАНАДИЙ
Диаграмма состояния Er—V приведена на рис. 246 по данным
работы [Э]. Исследования проводили методами термического, рентге-
новского и микроструктурного анализов. Установлено монотектичес-
кое превращение при температуре 1900 °C (1870 °C [1]). Жидкость,
богатая Ег, при монотектической температуре содержит 26,7—36,7 %
(ат.) V. Концентрационный интервал протяженности монотекти-
ческой горизонтали при температуре 1870 °C составляет 11,4—99,9 %
(ат.) V согласно работе [1]. Эвтектическое превращение Ж ** (Ег) +
+ (V) наблюдается при температуре 1495 °C [Э] (1450 °C [Ш],
1529 °C [1]). Эвтектика содержит 9,2 % (ат.) V [Э] (7,8 % (ат.) V
[Ш], 4,3 % (ат.) V [1]).
Рис. 246. Er—V
Er-W, Er-Y
453
Взаимная растворимость компонентов в системе предельно мала;
максимальная растворимость V в Ег в твердом состоянии не превы-
шает 0,65 % (ат.) [Ш]. Растворимость V в Ег при эвтектической
температуре 1529 °C, по данным работы [1], составляет 0,43 % (ат.).
Литература
1. Smith J.F., Lee K.J., Martin D.M. // Calphad. 1988. V. 12. N 1. P. 89-96.
' Н.П. Абрукина
Er—W. ЭРБИЙ-ВОЛЬФРАМ
Диаграмма состояния Er—W не построена. В работе [1] изучали
растворимость W в Ег. При исследовании использовали W чистотой
99,9 % (по массе) и Ег, содержащий 0,004 % (ат.) С, 0,013 % (ат.)
N, 0,003 % (ат.) О, 0,04 % (ат.) F, 0,02 % (ат.) Mg, 0,005 % (ат.)
Si, 0,02 % (ат.) Са, 0,01 % (ат.) Сг, 0,02 % (ат.) Fe. Растворимость
W в Ег может быть выражена уравнением 1пх = -8,724 • 10'3Т-1 +
+ 1,779, где х — атомная доля W в жидком Er, Т — температура, К.
Температурная зависимость растворимости W в Ег приведена ниже:
Температура, °C.............. 1522 1604 1747 1781 1922 2030
Растворимость W, % (ат.)..... 0,082 0,126 0,318 0,382 0,492 1,095
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner, Jr., K.A. 11 J. Less-Common Met.
1966. V. 11. N 6. P. 423-435.
К.Б. Поварова
Er-Y. ЭРБИЙ-ИТТРИЙ
Диаграмма состояния Er—Y приведена на рис. 247 по данным
работы [1], как результат исследований [1, 2]. Исследования прово-
дили методами микроструктурного, рентгеновского и термического
анализов. В качестве шихтовых материалов использовали Ег чисто-
той 99,98 % (ат.) и Y чистотой 99,68 % (ат.). Установлено, что
Добавка Ег к Y, как и добавка Y к Ег, приводит к снижению темпе-
ратуры плавления чистых компонентов. Солидус системы имеет
минимум при температуре 1507 °C и содержании Y 47 % (ат.).
Чистый Y, как и сплавы с содержанием более 47 % (ат.) Y, претер-
певают полиморфное превращение, связанное с изменением типа
структуры; 0Y имеет объемно центрированную структуру, твердый
раствор (Er, аУ) — гексагональную плотноупакованную структуру;
температура этого превращения возрастает от 1478 до 1507 °C с
Увеличением в сплавах содержания Ег.
454
Er—Zr
Y, % (no массе)
Рис. 247. Er—Y
Литература
1. Spedding F.H., Sanden B. Beaudry BJ. // J. Less-Common Met. 1973. V. 31. N 1.
P. 1-13.
2. Маркова И.А., Терехова В.Ф., Савицкий E.M. // Журнал неорганической
химии. 1964. Т. 9. № 8. С. 2034-2036.
А. П. Будберг
Er—Zr. ЭРБИЙ—ЦИРКОНИЙ
Диаграмма состояния Er—Zr приведена на рис. 248 по данным
работы [Ш]. Исследование проводили методами микроструктурного,
рентгеновского и термического анализов. При температуре 1300 °C
и содержании 34,1 % (ат.) Zr (при 1450 °C и -37,9 % (ат.) Zr [Э])
кристаллизуется эвтектика Ж (Er) + PZr. Растворимость Zr
в Ег при эвтектической температуре составляет 20 % (ат.) [Ш]
(-27,3 % (ат.) [Э]). Установлено, что Ег повышает температуру а
« р превращения Zr. Согласно работе [Ш] перитектоидная реакция
(Er) + pZr ** aZr протекает при температуре -1030 °C, а раствори-
мость Ег в aZr при температуре перитектоидной реакции составляет
-13,5 % (ат.). Поданным работы [Э] температура перитектоидной
реакции равна -925 °C, а содержание Ег в pZr и aZr составляет -1,1
и -2,8 % (ат.) соответственно.
При быстрой закалке из расплава со скоростью 107 °C/с образуют-
ся метастабильные твердые растворы (а') с гексагональной плотноу-
пакованной структурой во всем интервале концентраций системы
Er—Zr, как показано в работах [1, 2].
Eu—Ga
455
fr ZrfMafn.) Zr
Рис. 248. Er—Zr
Литература
1. Wand R. // Metall Trans. 1972. V. 3. N 5. P. 1213-1221.
2. Wand R., Kim J.B. // Metall Trans. 1974. V. 5. N 9. P. 1973-1977.
Л.А. Третьяченко
Eu—Ga. ЕВРОПИЙ-ГАЛЛИЙ
Диаграмма состояния Eu—Ga приведена на рис. 249 по данным
работы [1]. Сплавы синтезировали в герметичных тиглях из Та. В
качестве шихтовых материалов использовали Ga чистотой 99,999 %
(по массе) и Ей чистотой 99,9 % (по массе). Исследование проводили
методами термического, микроструктурного и рентгеновского анали-
зов. В системе существуют шесть соединений Eu5Ga3, EuGa, Eu2Ga3,
456
Eu.—Ga
Eu Ga, % (am.) Ga
Рис. 249. Eu—Ga
EuGa2, Eu2Ga5 и EuGa4. Соединение EuGa2 плавится с открытым
максимумом, соединения Eu5Ga3, EuGa, Eu2Ga3, Eu2Ga5, EuGa4
образуются по перитектическим реакциям при температурах 607,
660, 790, 1015, 970 °C соответственно. В работе [2] уточнен состав
соединения Eu2Ga5 с указанием стехиометрического состава Eu3Ga8.
При температуре 495 °C кристаллизуется эвтектика (Ей) +
+ Eu5Ga3. Эвтектическая реакция со стороны Ga вырождена. Взаим-
ная растворимость компонентов в твердом состоянии практически
отсутствует.
В табл. 177 приведена кристаллическая структура соединений.
Eu—Ge
457
Таблица 177. Кристаллическая структура соединений системы Eu—Ga
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источник
а b с
Eu2Ga5* — Fm3m 0,4408 0,4375 2,5856 [2]
(Eu3Ga8) — Атт2 1,533 0,4577 1,1018 [3]
EuGa4 ВаА14 tno, 74/ттт 0,442 — 1,075 [1]
EuGa2 aib2 АРЗ, Р6/ттт 0,4345 — 0,4520 [Н
♦Ромбическая структура собственного типа.
Литература
1. Yatsenko S.P., Semyannikov A. A., Semenov B.G. et al. //J. Less-Common Met.
1979. V. 64. N 2. P. 185-199.
2. Mooij D.B., Buschow K.H.J. //J. Less-Common Met. 1985. V. 109. N 1. P.
117-122.
3. Grin Ju.N., Yatsenko S.P., Fedorova E.G. et al. // J. Less-Common Met. 1987. V.
136. P. 55—60.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Eu—Ge. ЕВРОПИЙ—ГЕРМАНИЙ
Диаграмма состояния Eu—Ge приведена на рис. 250 по данным
работы [1] на основе экспериментальных данных работы [2], в
которой исследование сплавов системы выполнено методами микрос-
труктурного, рентгеновского и термического анализов. В качестве
исходных материалов использовали Ей чистотой 99,81 % (по массе)
и Ge чистотой 99,99 % (по массе). Сплавы выплавляли в дуговой
печи в инертной среде и отжигали в наполненных Не кварцевых
ампулах при температуре 630 °C в течение 260 ч или при температу-
ре 950 °C в течение 100 ч.
В системе существует пять соединений: EuqGe, EuGe, EuGe2,
Eu2Ge3 и Eu3Ge5. Соединения Eu3Ge, EuGe, EuGe2 плавятся конгру-
этно при 1215, 1220 °C и 1030 °C соответственно; соединение Eu2Ge3
образуется по перитектоидной реакции EuGe + Eu3Ge5 * Eu2Ge3 при
температуре 916 °C, соединение Eu3Ge5 кристаллизуется по перитек-
тической реакции при температуре -1011 °C и распадается по
эвтектоидной реакции aEu3Ge5 ** Eu2Ge3 + aEuGe2 при температуре
755 °C. Соединение Eu3Ge5 претерпевает при температуре 870 °C по-
лиморфное превращение, кристаллическая структура высокотемпера-
турной модификации (0Eu3Ge5) не расшифрована, кристаллическая
458
Eu—Ge
структура низкотемпературной модификации (aEu3Ge5) гексагональ-
ная [1]. Соединение EuGe2 также существует в двух структурных
формах (температура перехода 810 °C): кристаллическая структура
высокотемпературной модификации (pEuGe2) не определена, низко-
температурная модификация (aEuGe2) имеет гексагональную струк-
туру. Все соединения имеют постоянный состав.
Взаимная растворимость компонентов в твердом состоянии прак-
тически отсутствует. Растворимость Ей в Ge при температуре 723 °C
не превышает 0,9 % (по массе). По данным работ [1, 3, 4], соедине-
ние EuGe имеет кристаллическую структуру типа GrB (символ
Пирсона оС8, пр. гр. Стет, а = 0,4722 нм, b = 1,125 нм, с =
= 0,4109 нм). Низкотемпературная модификация соединения aEuGe,
имеет структуру типа Cdl2 (символ Пирсона hP3, пр. гр. Р3т\, а =
= 0,4102 нм, с - 0,4995 нм) согласно работам [1, 2, 5].
Литература
1. Gokhale А.В., Abbaschian G.J. 11 J. Phase Equilibria. 1991. V. 12. N. 4. P. 490
2. Еременко B.H., Обушенко И.М., Буянов Ю.И. и др. // Диаграммы состояния
тугоплавких систем: Сб. статей. Киев: Институт проблем материаловедения, 1980. С.
163-171.
Eu—H, Eu-Hf
459
3. Гладышевский Е.И., Угрин Н.С. // Доповщ! АН УРСР. 1965. № 10. С. 1326—
1329.
4. МеПо F. Fornasini M.L. // J. Less-Common Met. 1967. V. 13. N 6. P. 603—610.
5. Гладышевский Е.И. // Доповод АН УРСР. 1964. № 2. С. 209—212.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Eu—Н. ЕВРОПИЙ-ВОДОРОД
Диаграмма состояния Eu—Н не построена.
В справочнике [X] указано на образование соединения ЕиН2 с
ромбической структурой типа SrH2 и параметрами решетки а = 0,621
нм, b = 0,377 нм; с = 0,716 нм.
В.И. Шаповалов
Eu-Hf. ЕВРОПИЙ—ГАФНИЙ
Hf, а/о (по naccei
Рис- 251. Eu-Hf
460
Eu—Hg, Ей—In.
Диаграмма состояния Eu—Hf гипотетически представлена на рис
251 по данным работы [1]. Сплавы получали нагревом смеси компо
нентов в герметичных контейнерах из Мо. Установлена раствори
мость Hf в Ей и Ей в Hf в интервале температур 850—1600 °C:
Температура, °C.....................
Растворимость, % (ат.):
Hf.................................
Eu..............................
850 1200 1450 1600
1,66 0,68 0,65 0,71
0,025 0,026 0,034 0,025
Литература
1. Савицкий Е.М., Драбей В.Г., Бакаринова В.И. И Атомная энергия. 1971. Т. 30.
Вып. 4. С. 390.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Eu—Hg. ЕВРОПИЙ-РТУТЬ
Диаграмма состояния Eu—Hg не построена. В справочнике [Ш]
сообщено об образовании соединений EuHg2, EuHg3, EuHg5, EuHg10,
Eu3Hg2. В табл. 178 приведена кристаллическая структура четырех
соединений в системе Eu—Hg [1].
Таблица 178. Кристаллическая структура соединений системы Eu—Hg [ 1J
Соединение Прототип Символ Пир- сона, пр. гр. Параметры решетки, нм
а С
EuHg CsCl сР2, РтЗт 0,3880 —
EuHg2 A1B2 hP3, Рб/ттт 0,4970 0,3705
EuHg3 Mg3Cd РЬ^ттс 0,6794 0,5074
Eu14Hg51 Gd14Ag51 /Щ68, РЬ/т 1,357 0,974
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Eu—In. ЕВРОПИЙ-ИНДИЙ
Диаграмма состояния Eu—In (рис. 252) построена в работе [1] по
данным экспериментальных исследований [2, 3] во всем интервале
концентраций. Исследование проводили методами микроструктур-
ного, рентгеновского и термического анализов. Исходными матери-
алами служили In чистотой 99,999 % (по массе) и Ей чистотой
99,8 % (по массе).
Eu.—In
461
Рис. 252. Eu-In
В системе образуются четыре соединения: Eu2In, Euln, Euln2 и
Euln4. Соединения Euln и Euln2 плавятся конгруэнтно при темпера-
турах 920 и 980 °C соответственно; соединения Eu2In и Euln4 образу-
ются по перитектическим реакциям при температурах 710 °C (реак-
ция вырождена) и 450 °C соответственно. Соединение Eu2In имеет
полиморфное превращение при температуре 660 °C. При температу-
рах 620 °C и 156 °C происходят эвтектические превращения Ж »*
* (Eu) + Eu2In и Ж Euln4 + (In) (реакция вырождена). Кристалли-
ческая структура определена только для соединения Euln2. Соедине-
ние Euln2 имеет кристаллическую структуру типа Са1п2 (символ
Пирсона ЙР6, пр. гр. Р^/ттс, а = 0,496 нм, с = 0,785 нм [1]).
Литература
1. Okamoto Н. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 2. P. 140—143.
2. Яценко С.П., Золотарев B.M., Федорова ЕГ. // Изв. АН СССР. Металлы. 1983.
№ 2. С. 207-209.
3. Yatsenko S.P., Semyannikov А.А., Sharkov Н.О. et al. // J. Less-Common Met.
1983. V. 90. N 1. P. 95-108.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
462
Eu—Ir, Eu—La
Eu—Ir. ЕВРОПИЙ-ИРИДИЙ
Диаграмма состояния Eu—Ir экспериментально не построена.
В работе [Э( при изучении магнитных свойств установлено существо-
вание соединения Eulr2 со структурой типа MgCu2 (символ Пирсона
cF24, пр. гр. Fd3m). В работе [Ш] подтверждено образование
соединения Eulr2 типа NgCu2, указан параметр решетки, равный а -
= 0,7566 нм.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Eu—La. ЕВРОПИЙ-ЛАНТАН
Диаграмма состояния Eu—La (рис. 253) построена в работе [1] в
основном по данным работы [2]. Установлено существование области
несмешиваемости в жидком состоянии. Купол области несмешивае-
мости расположен при содержании 59 % (ат.) La и температуре
962 °C, точка монотектики содержит 80 % (ат.) La. Максимальная
растворимость La в Ей составляет 5 % (ат.), растворимость Ей в
La — 18 % (ат.). Температура у * Р превращения La, равная 865 °C,
снижается до 789 °C при 10 % (ат.) Ей.
La,’/’ (по массе)
Ей La,°/e(atn) La
Рис. 253. Eu—La
Eu—Mg
463
Литература
1. Okamoto Н. // J. Phase Equilibria. 1991. V. 12. N 1. P. 118.
2. Spenger S., Renz I., Bach H. // J. Less-Common Met. 1976. V. 161. P. 109—113.
С.П. Алисова
gu_Mg. европий-магний
Диаграмма состояния Eu—Mg приведена на рис. 254 по данным
работы [1] с учетом результатов работы [2] в области сплавов,
богатых Mg. В системе установлено образование четырех соединений:
Eu2Mg, Eu2Mg17, EuMg, EuMg5. Соединения Eu2Mg и Eu2Mg17 обра-
зуются конгруэнтно при температурах 719 и 591 “С, соединения
EuMg и EuMg5 кристаллизуются по перитектическим реакциям при
температурах 463 и 573 “С (реакция вырождена) соответственно. При
температурах 449, 569 и 562 °C [2] (571 °C [1]) происходят эвтекти-
ческие реакции Ж ** (Eu) + EuMg, Ж »» EuMg5 + Eu2Mg17, Ж «*
» Eu2Mg17 + (Mg) соответственно. Растворимость Eu в Mg предельно
мала и при эвтектической температуре 562 °C составляет 4,8 х
х 10~5 % (ат.).
Кристаллическая структура соединений приведена в табл. 179.
Рис. 254. Eu—Mg
464
Ей—Мп
Таблица 179. Кристаллическая структура соединений системы Eu—Mg
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм 1 Источник
a С
EuMg CsCl cP2, РтЗт 0,4102 — [3]
EuMg2 MgZn2 API 2, P63/mmc 0,6279 0,620 1,0308 1,035 [3] [4]
EuMgj EuMg5 P63/mmc — — [М]
Eu2Mg17 Th2Mn17 — 1,049 1,0468 1,033 1,0374 [2] [1]
Литература
1. Muhlpfordt W., Klemm W. // J. Less-Common Met. 1969. V. 17. N 1. S. 127-129.
2. Рохлин Л.Л. Магниевые сплавы, содержащие редкоземельные металлы. М.:
Наука, 1980. 192 с.
3. Klemm W., Kock Н., Muhlpfordt W. 11 Angem. Chem. 1964. B. 76. N 20. S. 862
4- Крипякевич П. I., Евдокименко В. I., Залуцкий I.I. // Доповщ! АН УРСР
1964. № 5. С. 766-767.
5. Крипякевич П.1., Евдокименко B.I. // В1спик Львовского Университету. Сер.
х!м!чна. 1969. № 11. С. 3—7.
Л.Л. Рохлин
Ей—Мп. ЕВРОПИЙ—МАРГАНЕЦ
Диаграмма состояния Ей—Мп экспериментально не построена.
В работе [1] сплавы Ей с Мп изготовляли в герметичных тиглях из
Мо или W при температуре 2000 °C в высокочастотной печи и после
отжига при 800 °C в течение 500 ч закаливали в воде. Установлено
расслаивание в жидком состоянии. Нижние слои сплавов являются
твердым раствором на основе а Мп с параметром решетки а = 0,899
нм (параметр решетки а чистого Мп составляет 0,891 нм). Проведен-
ный расчет рентгенограммы порошка сплава состава EuMn28 в работе
Г1] не позволяет утверждать образование соединения указанной
стехиометрии.
В работе [2] авторами высказано предположение, что система
Ей—Мп может быть отнесена к диаграммам состояния редкоземель-
ных металлов с Мп, характеризующихся образованием широких
областей несмешиваемости в жидком состоянии и отсутствием
интерметаллических соединений, подобно системам Мп с La, Се,
Рг, Yb.
1 Eu—N, Eu-Nb, Eu—Nl 465
й Литература
да 1. Франкевич Д.П., Заречнюк О.С. // Изв. АН СССР. Металлы. 1973. № 1. С.
Ж 196
j 2. Савицкий Е.М., Терехова В.Ф. Металловедение редкоземельных металлов. М.:
Наука, 1975. 179 с.
. С.II. Алисова
j Eu-N. ЕВРОПИЙ-АЗОТ
? Диаграмма состояния Eu—N экспериментально не построена.
Согласно работам (Э, 1] в системе существует соединение EuN со
структурой типа NaCl (символ Пирсона сЕ8, пр. гр. FmЗт, а --
= 0,5014 нм [Э] или а = 0,5017 нм [1]).
Литература
1. Jacobs Н„ Fink U. И Z. Anorg. All. Chem. 1978. Bd. 438. N 1. S. 151-159.
Ю.Б. Кузьма
Eu-Nb. ЕВРОПИЙ-НИОБИЙ
Диаграмма состояния Eu—Nb экспериментально не построена. В
справочнике [М] высказано предположение об образовании ограни-
ченной растворимости компонентов в твердой и жидкой фазах.
Соединений в системе не установлено.
Е.Н. Шефтель
Eu-Ni. ЕВРОПИЙ—НИКЕЛЬ
рис. 255. Eu-Ni
Ей. % (по пассе)
466
Eu-0
Диаграмма состояния Eu—Ni экспериментально построена со
стороны Ni и приведена на рис. 255 по данным работы [М]. Соеди-
нение Ni5Eu плавится конгруэнтно при -1440 °C, соединение Ni17Euz
образуется по перитектической реакции, соединение Ni3Eu существ-.,
ет в сплавах с содержанием Ей более -17 % (ат.), а также в смеси
с соединением NicEu. Растворимость Ей в Ni при эвтектической
температуре -1200 °C не превышает 0,3 % (ат.).
Соединение Ni,7Eu2 имеет кристаллическую структуру типа
Ni]7Th2 (пр. гр. Рб3/ттс, а = 0,836 нм, с = 0,809 нм), соединение
NijEu — структуру типа Си5Са (символ Пирсона АР6, пр. гр.
РЬ/ттт, а - 0,4911 нм, с « 0,3965 нм) [1—4].
Литература
1. Крипякевич П.1., Гладышевский E.I. // Доповщ! АН УРСР. 1966. № 66. С
769-771.
2. Терехова В.Ф., Савицкий Е.М., Торчинова Р.С. // Диаграммы состояния
металлических систем: Сб. статей. М.: Наука, 1968. С. 200—206.
3. Терехова В.Ф., Крипякевич П.И., Франкевич Д.П. и др. // Изв. АН СССР.
Металлы. 1967- № 1. С. 205-207.
4. Palenzona А. // Atti Accad. Naz. Line. Rend. C. Sci. Fiz. Mat. Nat. 1967. N 4. P.
504-509.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Ей—О. ЕВРОПИЙ-КИСЛОРОД
Рис. 256. Ей—О
Диаграмма состояния
Ей—О (рис. 256) построена в
работе [1] в области концен-
траций О — 60 % (ат.) О. В
системе установлено образо
вание трех соединений ЕиО,
Еи3О4 и Еи2О3, нанесенных
на диаграмму. Соедине-
ние ЕиО кристаллизуется
по газоперитектической ре-
акции при температуре
-1520 °C, соединения Еи3О4
и Еи?О3 плавятся конгруэн
тно. Превращения Ж «* Газ +
+ Еи3О4 и Газ * Ж + ЕиО
имеют газоэвтектический
характер. В табл. 180 при-
ведена кристаллическая
структура соединений.
Еи-Р
467
'Таблица 180. Кристаллическая структура соединений системы Ей—О
Соединение Прото- тип Символ Пирсона, пр.гр. Параметры решетки, нм Источ- ник
a b c
~~ ЕиО NaCl cF8, Fm3m 0,51439 — — [Э]
ЕиО1,99-1,08 NaCl cF8, Fm3m 0,5146— 0,5139 — — [3]
Еи3О4 CaFe2O4 O.P28, Pnma 1,0085 0,3502 1,2054 14]
Еи2О3(ВТ)* Sm2O3 mC30, CUm 1,4105 0,36021 0,8808 [5]
Еи2О3(НТ) Mn2O3 c7'80, 7a3 1,0869 — — [Ш]
ЕиО2“ PbFCl РЫптт 0,390 — 0,663 [2]
Fu „ГК **♦ ьи16и21 — — 1,9713 4,956 0,5652 [Э]
•Р = 100°.
**Соединеиие установлено электронографически.
“•Соединение имеет ромбическую структуру, получено нагревом в вакууме
при 1100 °C соединения ЕиО [Э].
Литература
1. McCarthy G.J.. White W.B. // J. Less-Common Met. 1970. V. 22. N 4. P. 409-417.
2. Имамов P.M., Рагимли H.A., Семилетов С.A. // Кристаллография. 1974. Т. 19.
Вып. 4. С. 751-753.
3. Игнатьева Н.И. // Синтез и свойства соединений редкоземельных металлов: Сб.
Статей. Свердловск: АН СССР. Уральский научный центр. 1982, С. 36—41.
4. Ray R.C. И Acta Crystallogr. 1966. V. 20. N 6. Р. 716-723.
5. Yakel H.L. // Acta Crystallogr. B. 1979. V. 35. N 4. P. 564-569.
Ю.Б. Кузьма
Eu—P. ЕВРОПИЙ-ФОСФОР
Диаграмма состояния Eu—P экспериментально не построена.
Имеются сведения о существовании фосфидов: Eu2P [1], Еи3Р2 [2],
Еи4Р3 и EuP0 91 [1], ЕиР [Ш], Еи3Р4 [3], EuPi 82 [1], ЕиР2 [4],
ЁиР2 75 [1], ЕиР3 [5], Еи4Р5 [1], ЕиР7 [6]. В работе [1] соединения
Eu4Pj и Eu4P5 получены химическим путем и не исключено, что они
окажутся идентичными по структуре с фосфидами состава, близкого
к составам Еи3Р2 [2] и Еи3Р4 [3], для которых структура расшифро-
вана.
468
Еи—Р
В работе [7] определена температура плавления соединений Еи3Р2
(1300 °C), ЕиР (2200 °C), ЕиР2 (840 °C), температура плавления
Еи3Р4 равна 950 °C согласно работе [3]. В работе [8] установлено,
что при нагреве соединение ЕиР7 разлагается в следующей последо-
вательности: при 480 °C оно переходит в ЕиР3 (ВТ), которое при
573 °C переходит в ЕиР2, а затем при 706 °C в Eu3P4; Еи3Р4 при
793 °C переходит в ЕиР. В работе [2] показано, что температура
Кюри для соединения Еи3Р2 равна 25 К. В табл. 181 приведена
кристаллическая структура соединений.
Таблица 181. Кристаллическая структура соединений системы Eu—Р
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм Источ- НИК
а ь с
Eu3P2 Ba3P2 /43<У 0,9026 — — [2]
EuP NaCl сЕ8, Fm3m 0,5755 — — [Ш]
Eu3P4 Eu3P4 Fd'dl 1,4050 1,7085 0,5735 [3]
EuP3(BT)* AuAs3 cl/m 0,9068 0,7222 0,5598 15)
EuP3(HT) SrP3 mC32, C2/m — — — [51
*p - 113 ,15°.
Литература
1. Миронов К.Е., Брыгалина Г.П., Икорский В.Н. // Сплавы редкоземельных
металлов с особыми физико-химическими свойствами: Сб. статей. М.: Наука, 1975- С
121-123.
2. Hulliger F. Vogt О. // Solid State Commun. 1970. V. 8. P. 771-772.
3. Schnering H.G., Wittmann M., Sommer D. // Z. Anorg. All. Chem. 1984. Bd. 510
N 3. P. 61-71.
4. Миронов K.E., Брыгалина Г.П. 11 Редкоземельные металлы, сплавы и соедине -
ния: Сб. статей. М.: Наука, 1973. С. 305—308.
5. Schnering HG., Wichelhaus W., Wittmann M. // Reps. 5-th Intern. Conf. Solid
Compounds of Transition Elements. Uppsala. 1976. Rep. 11. P. 68.
6. Schnering H.G., Wittmann M. 11 7,. Naturforsch. 1980. Bd. 35. N 7. S. 824-830
7. Миронов K.E., Брыгалина Г.П. 11 Изв. АН СССР. Неорганические материалы
1974. Т. 10. № 5. С 920-922.
8. Schmettow W., Mensing Ch., Schnering H.G. // Reps. 6-th Intern. Conf. Therm
Anal. Bayrenth. July 6—12, 1980. S. 124.
Ю.Б. Кузьма
Eu—Pb
469
Eu—PB. ЕВРОПИЙ-СВИНЕЦ
Диаграмма состояния Eu—Pb приведена на рис. 257 по данным
работы Г1 ]. Сплавы изготовляли и отжигали в тиглях из Та в атмос-
фере инертного газа. В качестве шихтовых материалов использовали
РЬ чистотой 99,99 % (по массе) и дисциллированный Ей чистотой
99,92 % (по массе). Исследование проводили методами микрострук-
турного, рентгеновского и термического анализов.
рис. 257. Ей—РЬ
470
Eu~Pd
В системе образуются четыре соединения: Eu2Pb, EuPb, EuPb3
плавятся конгруэнтно при 1250, 1080 и 788 °C соответственно,
EurPb, кристаллизуется при температуре 1145 °C по реакции
Еи’рЛ Ж « Eu.Pb,.
Соединение EuPb в температурном интервале 857—870 °C претер-
певает полиморфное превращение. При температурах 770, 1031, 717
и 328 °C осуществляется эвтектическая кристаллизация по реакциям
Ж * (Eu) + Eu2Pb, Ж * Eu5Pb3 + EuPb, Ж * EuPb + EuPb3, Ж -
* EuPb3 + (РЬ). При температуре 328 °C эвтектика практически вы-
рождена. Взаимная растворимость компонентов в системе Ей—РЬ
незначительна. Кристаллическая структура соединений представлена
в табл. 182.
Таблица 18 2. Кристаллическая структура соединений системы Ей—РЬ [2]
Соединение Прототип Символ Пирсона, пр.гр. ,1,1 Параметры решетки, нм
a b c
EuPbj AuCu3 cP 4, РтЗт 0,4915 —
EuPb AuCu tP2, PM mmm 0,5227 — 0,4586
Eu5Pb3 W5Si3 tI32, IM mcm 1,3184 — 0,6214
Eu2Pb PbCl2 oPl2, Pnma 0,787 0,510 1,003
Литература
1. McMasters O.D., Gchneidner, Jr., К.А. // J. Less-Common Met. 1967. V. 13. N 2
P. 193-199.
2. Гладышевский Е.И., Бодак О.И. Кристаллография интерметаллических соеди
нений редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарскии
Eu—Pd. ЕВРОПИЙ-ПАЛЛАДИЙ
Диаграмма состояния Eu—Pd приведена на рис. 258 по данным
работы [1]. Сплавы выплавляли в дуговой печи в атмосфере Аг.
В качестве шихтовых материалов использовали Ей чистотой 99,5 %
(по массе) и Pd чистотой 99,9 % (по массе). Исследование проводили
методами микроструктурного, рентгеновского и термического анали-
зов. Термический анализ выполняли в контейнерах из Мо на прессо-
ванных образцах из смеси стружки Ей и порошка Pd. Во избежание
взаимодействия с материалом контейнера сплавы с содержанием Pd
более 75 % (ат.) подвергали термическому анализу в тиглях из
оксида А1.
Eu—Pd
471
Ptl, % t no косое)
Рис. 258. Eu—Pd
В системе обнаружено шесть соединений: Eu<Pd2, Eu3Pd2, EuPd,
EuPd2, EuPd3, EuPd5. Соединения Eu^Pd2 и EuPd3 плавятся конгру-
энтно при температурах 810 и 1425 'С; соединения Eu5Pd2, EuPd,
EuPd2 и EuPdj кристаллизуются по перитектическим реакциям при
температурах 610, 855, 1330 и 1105 °C соответственно. При темпера-
турах 545, 775 и 1080 °C происходит соответственно эвтектическая
кристаллизация. Соединение EuPd2 .обладает полиморфизмом, темпе-
472
Еи—Ро, Ей—Pt
ратура превращения не определена. Также не расшифрована крис-
таллическая структура соединения EuPd5. Кристаллическая структу-
ра остальных соединений системы приведена в табл. 183.
Таблица 183. Кристаллическая структура соединений системы Eu—Pd [2]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
EuPd3 АиСи3 cP4, РтЗт 0,4101 — —
EuPd2 MgZn2 hP\2, P63/mmc 0,4081 — 0,7761
EuPd2 MgCu2 cF24, Fd3m 0,7763 — —
EuPd CrB oC8, Ctncm 0,4097 1,1121 0,4447
EujPd2 Er3Ni2 hRl5, R3 0,9204 — 1,7384
Eu5Pd2* *₽ - 97,2 Mn5C2 5°. mC28, C2/c 1,7299 0,6985 0,7919
Литература
1. landelli A., Palenzona А. // J. Less-Common Met. 1974. V. 38. N 1. Р. 1—7.
2. Гладышевский Е.И.. Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Eu-Ро. ЕВРОПИЙ-ПОЛОНИЙ
Диаграмма состояния Eu-Ро экспериментально не построена.
По данным работы [Ш] при изучении взаимодействия паров Ро с
твердым Ей установлено соединение Еи4Ро3.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарскш
Eu—Pt. ЕВРОПИЙ-ПЛАТИНА
Диаграмма состояния Eu—Pt приведена на рис. 259 по данным
работы [1]. Порошок Pt и стружку Ей нагревали в контейнере из Та
в атмосфере Аг до 900—1000 °C, затем образцы спекали при темпера-
туре 1500 °C в контейнерах из Мо, после чего переплавляли в дуго-
вой печи в инертной среде. Исследование проводили методами мик-
Eu—Pt
473
Ей Pt,"л (am.} Pt
Рис. 259. Eu—Pt
роструктурного, рентгеновского и термического анализов. Измерена
магнитная восприимчивость сплавов в интервале температур -173 *
* 827 “С. В системе существует семь соединений ~Eu9Pt, Eu5Pt2,
pU3^2> Eu5Pt4, EuPt2, Eu2Pt7, EuPtj. Соединения ~EugPt, Eu5Pt2,
Eu3pb и Eu5Pt4 образуются по перитектическим реакциям при
температурах 660, 770, 950 и 1055 °C соответственно; условия обра-
зования соединений EuPt2, Eu2Pt7 и ЕиРц не указаны. Предполагают
существование области гомогенности соединения EuPt2 в интервале
концентраций 65—74 % (ат.) Pt. Кристаллическая структура соедине-
ний приведена в табл. 184.
474
Еи—Ри, Ей—Re
Таблица 18 4. Кристаллическая структура соединений системы Eu—Pt
Соединение Прото- тип Символ Пирсо- на, пр. гр- Параметры решетки, нм Источ- НИК
a b c
EuPt5* — — 0,5305 0,9100 2,6366 [2]
Eu2Pt7 Cl2Ni7 Р63/пипс 0,5304 — 2,687 12,M]
EuPt2 MgCu2 CF2A, Fd3m 0,7731 — — [2]
Eu5Pt4 Sm5Ge4 оРЗб, Pnma 0,7703 1,5217 0,7982 [MJ
Eu3Pt2 Er3Ni2 hR\5, R3 0,9063 — 1,7270 [2]
Eu5Pi2** MnjC2 mC28, C2/c 1,6776 0,6877 0,7843 [2]
~Eu9Pt*** — — 0,5857 — — [2]
EuPt3 ♦Ромбическ **P - 97,24 ***Кубичес MgCu2 .ая сингонр кая сингон cF24, Fd3m 1Я. ИЯ. 0,7705 [2]
Литература
1. landelli A., Palenzona А. // J. Less-Common Met. 1981. N 2. Р. 71—82.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Eu—Pu. ЕВРОПИЙ-ПЛУТОНИЙ
Диаграмма состояния системы Eu—Pu не построена. В справочнике
[III] высказано предположение об образовании области несмеши-
ваемости в жидком состоянии.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Eu—Re. ЕВРОПИЙ-РЕНИЙ
Диаграмма состояния Eu—Re не построена. Согласно работе [Э]
методом рентгеноструктурного анализа сплава, полученного спекани-
ем компонентов в присутствии жидкой фазы, в системе обнаружено
соединение с гексагональной структурой типа MgZn2 (символ Пирсо-
на ЛР12 пр. гр. P63/mmc, а = 0,5316 нм, с - 0,8742 нм).
М. А. Тылкина
Eu—S
475
Eu—S- ЕВРОПИЙ-СЕРА
Ориентировочная диаграмма состояния Eu—S co стороны S приве-
дена на рис. 260 по данным работы [1]. Соединение EuS плавится
конгруэнтно при -2250 °C согласно работе [2] и имеет область гомо-
генности от EuS0 15 до EuS. Соединение Eu3S4 образуется при взаи-
модействии EuS с парами S, соединение Eu2S3 8] — при взаимодей-
ствии Eu3S4 с парами S [11. Соединение yEu3S4 существует в интер-
вале составов Eu3S4-Eu2S3 по данным работы [3] и кристаллизуется
по перитектической реакции при -2150 °C [2]. В работе [3] сообще-
но о полиморфизме этого соединения. В табл. 185 приведена кристал-
лическая структура соединений.
5, °/а (ат.) S
Рис. 260. Eu—S
476
Eu—Sb
Таблица 185. Кристаллическая структура соединений системы Eu—S
Соединение Прото- тип Символ Пирсо- на, пр. гр. Параметры решетки, нм Источ- НИК
а b с
EuS NaCl cF8, Fm3m 0,5970 0,509708 — — [Э] [2]
yEu3S4* Th3P4 с/28, 743d 0,8537 0,85366 — — О] [2]
(l LtijSj Pnma 0,7186 0,3794 1,5373 [3]
Ец2^3,8| Eu2$3,81 Р4г/п ИЛИ Р4/шпт 0,7871 — 0,8041 [4]
*Методом нейтронографии монокристалла соединения Eu3S4 установлено, что
при температуре ниже -88 °C происходит ромбоэдрическое искажение куби-
ческой структуры [5].
Литература
1. Ananth K.R., Gielisse P.J., Rockett T.J. //Mater. Res. Bull. 1974. V. 9. N 9. P.
1167-1171.
2. Елисеев A.A., Садовская O.A., Нгуен Ван Тям // Изв. АН СССР. Неорганичес-
кие материалы. 1974. Т. 10. № 12. С. 2134-2139.
3. Ярембаш Е.И,, Елисеев А.А. Халькогениды редкоземельных элементов. М.:
Наука, 1975. 258 с.
4. Елисеев А.А., Толстова В.А., Кузьмичева Г.М. // Журнал неорганической
химии. 1978. Т. 23: Вып. 12. С. 3137-3180.
5. Wiskelhaus W., Simon A., Stevens К. et al. // Philos. Mag. В. 1982. V. 46. N 2.
Part 2. P. 115-121.
Ю.Б. Кузьма
Eu—Sb. ЕВРОПИЙ-СУРЬМА
Диаграмма состояния Eu—Sb не исследована. В литературе име-
ются сведения о трех интерметаллических соединениях, кристал-
лические структуры которых приведены в табл. 186 [V-C].
Таблица 18 6. Кристаллическая структура соединений системы Eu—Sb
Соединение Прото- тип Символ Пирсо- на, пр. ГР- Параметры решетки, нм Источ- НИК
а b С
EuSb2* CaSb2 тРв, Р2}/т 0,4768 0,4299 0,8970 [V—С]
Eu2Sb3** Sr2Sb3 тР 40, Р2,/с 0,6570 1,2760 1,5028 [V—С]
Eu—Sc, Eu—Se
477
Соединение Прото- тип Символ Пирсо- на, пр. гр. Параметры решетки, нм Источ- НИК
а Ь с
EunSb|0 НоцСвю «84, 14/nvnm 1,2325 — 1,8024 [V—С]
Eu5Sb3*** Анти- y3s5 — 1,29826 1,00033 0,86325 [1]
♦a - 103,01°.
**Угол не указан.
•••Ромбическая сингония.
Литература
1. Яценко С.П., Федорова Е.Г. Редкоземельные элементы. Взаимодействие с р-
металлами. М.: Наука, 1990. 280 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Eu—Sc. ЕВРОПИЙ-СКАНДИЙ
Согласно работе [М] термодинамический анализ К.А. Гшнейднера
и Ф.У, Кальдервуда, основанный на учете разницы в энергии между
двухвалентным и трехвалентным Ей, дает возможность предполагать,
что в системе Eu—Sc не существуют стабильные фазы.
Л.Л. Рохлин
Eu—Se. ЕВРОПИЙ-СЕЛЕН
Диаграмма состояния Eu—Se приведена на рис. 261. Характер
взаимодействия между соединениями EuSe и Eu2Se3 не установлен,
Однако по результатам рентгеновского анализа между этими соедине-
ниями образуются непрерывные ряды твердых растворов. Соединение
Eu4Se? образуется по перитектической реакции Ж + Eu2Se3 Eu4Se7
[1]. Сведения о кристаллической структуре соединений системы
Eu—Se приведены в табл. 187.
Таблица 187. Кристаллическая структура соединений системы Eu—Se
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b С
EuSe NaCl cF8, 0,6185 — — [Э]
Fm3m 0,6197 — — [Ш]
Eu2Se3 Sc2Se3 0F8Q, Fddd 1,239 0,876 2,628 [1,2]
478
Eu—Si
Рис. 261. Eu-^Se
Кристаллическая решетка Eu2Se3 может рассматриваться как
упорядоченная решетка EuSe. Поэтому между обоими соединениями
возможно образование непрерывного ряда твердых растворов.
Литература
1. Ярембаш Е.И., Елисеев А.А. Халькогениды редкоземельных элементов. М.
Наука. 1975. 258 с.
2. Елисеев А.А., Садовская О.А., Нгуен Ван Тям // Изв. АН СССР. Неорганичес-
кие материалы. 1975. Т. И. № 3. С. 424—427.
Ю.Б. Кузьма
Eu—Si. ЕВРОПИЙ-КРЕМНИЙ
Диаграмма состояния Eu—Si не исследована. Соединение EuSi2 при
температуре 150 °C претерпевает полиморфное превращение, выше
этой температуры соединение имеет тетрагональную решетку типа
ThSi2, ниже — очевидно, ромбически искаженную тетрагональную
типа GdSi2 [Э, 1]. Известно также соединение EuSi [Ш], структура
которого подробно исследована в работе [2].
Eu—Sm, Eu—Sn
479
Таблица 18 8. Кристаллическая структура соединений системы Eu—Si [1]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а Ь с
EuSi2 aThSi2 7Z12, Hjamd 0,429 1,366
EuSi2 aGdSi2 0112, Imma —“
EuSi CrB оС8, Стет 0,472 1,115 0,399
По данным работы [1] в сплавах системы Eu—Si возможно обра-
зование четырех интерметаллических соединений. Сведения о трех
из них суммированы в табл. 188. Структура соединения ~Eu3Si не
установлена.
Литература
1. Гладышевский Е.И. Кристаллохимия силицидов и германидов. М.: Металлургия,
1971. 296 с.
2. Гладышевский Е.И., Крипякевич П.И. // Журнал структурной химии. 1964.
Т. 5. № 6. С. 853-859.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Eu—Sm. ЕВРОПИЙ-САМАРИЙ
Добавка 0,2 % (ат.) Ей понижает температуру плавления Sm на
20 °C, но не влияет на температуру а Р полиморфного превращения
последнего [Э].
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Eu—Sn. ЕВРОПИЙ-ОЛОВО
Диаграмма состояния Eu—Sn не исследована. В литературе есть
сведения об образовании в этой системе двух интерметаллических
соединений, сведения о которых представлены в табл. 189.
Таблица 18 9. Кристаллическая структура соединений системы
Eu—Sn [V-C]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а Ь С
EuSn EuSn3 CrB AuCu3 оС8, Стет сР4, РтЗгп 0,4976 0,47443 1,190 0,4456
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
480
Ей—Та, Ей—Те
Ей—Та. ЕВРОПИЙ-ТАНТАЛ
Диаграмма состояния Ей—Та не исследована. В работе [1] приве-
дены результаты определения растворимости Та в жидком Ен. Образ-
цы заваривали в толстостенные тигли из Та и отжигали в индукци-
онной печи в вакууме при 1674—1872 °C. После отжига в течение
1 ч образцы охлаждали в медном водоохлаждаемом приемнике,
температуру контролировали пирометром с точностью 1—2 %.
В исследованном интервале температур растворимость Та в жид-
ком Ен составляет 0,0271—0,0502 % (ат.) и может быть описана
уравнением: Igx = А/Т + В, где х — атомная доля Та в жидком Ен, А
и В — константы: А = -5,404 • 10'3, В = -0,799, Т — температура, К.
Растворимость Та в жидком Ей при его температуре плавления
(822 °C) по этому уравнению составляет 0,00018 % (ат.).
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner, Jr., К. A. //J. Less-Common Met
1966. V. 11. N 6. P. 423-435.
E.ff. Гладышевский, О.И. Бодак, В.К. Печарский
Ей—Те. ЕВРОПИЙ-ТЕЛЛУР
Сплавы системы Ей—Те синтезировали в эвакуированных квар-
цевых ампулах с использованием Ей чистотой 99,05 % и Те чистотой
99,99 % и исследовали методами термического и рентгеновского
анализов [1]. Диаграмма состояния Ен—Те приведена на рис. 262 по
данным работы [1].
В системе образуется четыре соединения: EuTe, Eu3Te4, Еи4Те7
и Еи3Те7. Соединение EuTe плавится конгруэнтно при 1525 °C.
Соединения Еи4Те7 и Еи3Те7 образуются по перитектическим реак-
циям соответственно при температурах 520 °C и 430-°C. Относитель-
но образования соединения Еи3Те4 имеются неясности. В представ-
ленной в работе [1] диаграмме состояния Ей—Те предполагается, что
между EuTe и Еи3Те4 образуется непрерывный ряд твердых раство-
ров. Это твердые растворы с кубической кристаллической решеткой
типа NaCl, характерной для EuTe. С другой стороны, для Еи3Те4
характерна другая кристаллическая решетка — предположительно
ромбическая. Кроме того, на основании рентгеновских исследова-
ний высказывается предположение, что твердый раствор с решеткой
типа NaCl образуется только в некотором интервале высоких
температур.
В сплавах системы кристаллизуется две эвтектики: (Ей) +
+ EuTe при температуре 780 °C и Еи3Те7 + (Те) при температуре
410 °C.
Ей—Те
481
Рис. 262. Ей—Те
Кристаллическая решетка EuTe типа NaCl (сРЪ, пр. гр. РтЗтУс
а = 0,659 нм [1], а = 0,66 нм или 0,6603 нм [Ш]. Соединение Еи3Те4
имеет предположительно ромбическую решетку.
Высказывается также предположение об образовании в системе
соединения ЕиТе3 с такой же решеткой, как и у LaTe3 [Ш].
Литература
1- Садовская О.А., Ярембаш Е.И. // Изв. АН СССР. Неорганические материалы.
1970. Т. 6. № 7. С. 1252-1256.
Н.И. Никитина
• О Зак. 2144
482
Eu—Th, Eu-Ti, Eu-Tl
Eu—Th. ЕВРОПИЙ-ТОРИЙ
Отдельные исследования сплавов Eu с Th показали незначитель-
ную растворимость первого во втором, что связывают с инертностью
химического взаимодействия, обусловленного стабильной электро
иной конфигурацией — 4f оболочки РЗМ [1].
Литература
1. Гшнейднер К.А. Сплавы редкоземельных металлов: Пер. с англ. / Под ред. Е М.
Савицкого. М.: Мир. 1965. 426 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарскии
Eu-Ti. ЕВРОПИЙ-ТИТАН
Согласно сообщению [1] сплавы системы Eu—Ti трудно синтези-
ровать из-за высокого давления паров Ей. По данным химического,
рентгеновского, спектрального и микроструктурного анализов сплава,
спеченного в присутствии жидкой фазы при 1150 °C, сделан вывод об
отсутствии интерметаллических соединений. Ей незначительно
растворяется в Ti при этой же температуре [Э].
Литература
1. Гшнейднер К.А. Сплавы редкоземельных металлов: Пер. с англ. / Под ред. Е.М.
Савицкого. М.: Мир, 1965. 426 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарскии
Eu-Tl. ЕВРОПИЙ-ТАЛЛИЙ
Диаграмма состояния Eu—Т1 не исследована. Имеются сведе
ния [V-C] относительно образования соединений в этой системе
(табл. 190). О существовании соединения ЕиТ12 сообщается в
работе [Ш].
Таблица 19 0. Кристаллическая структура соединений системы
Eu-Tl [V-C]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a С
EuTl CsCl cP2, РтЗт 0,3970 —
EuT12 Caln2 hP6, Pf^/mmc 0,5035 0,7964
EuTl3 AuCu3 cP4, РтЗт 0,4718 —
SnNi3 hP8, Pb^/mmc 0,7018 0,5313
Е.И. Гладышевский, О.И. Бодак, В.К Печарскш,
Eu—U, Eu-V
483
Eu—U. ЕВРОПИЙ-УРАН
Сведения по определению взаимной растворимости компонентов
системы Eu—U приведены в работе [Э]. Металлы между собой не
образуют интерметаллических соединений и мало растворимы друг
в ДРУге как в жидком, так и в твердом состояниях. Так раство-
римость Ей в жидком U составляет 0,3 % (ат.) при 1250 °C и
0,23 % (ат.) при 1150 °C, растворимость U в Ей при 1250 °C —
0,32 % (ат.) и практически не изменяется при охлаждении расплава
до 1000 °C [Э].
Е.И. Гладышевский, О.И. Бодак, В.К. Печарскии
Eu-V. ЕВРОПИЙ-ВАНАДИЙ
Диаграмма состояния Eu—V экспериментально не исследована.
В работе [1] был проведен термодинамический расчет системы с ис-
пользованием модели регулярных растворов. Результаты расчета
484
Eu—W
представлены на рис. 263. Предполагается кристаллизация вырожден-
ной эвтектики (Eu) + (V) при температуре, практически совпадаю-
щей с температурой плавления Ей, а при температуре 1597 °C проте-
кание нонвариантной реакции с участием газовой фазы, в результате
которой образуется жидкая фаза на основе Ей.
Литература
1. Smith J.F., Lee K.J. // Bull. Alloy Phase Diagrams. 1986. V. 8. N 3. P. 221-224
291-292.
П.Б. Будбере
Eu—W. ЕВРОПИЙ-ВОЛЬФРАМ
Согласно работе [1], растворимость W чистотой 99,9 % (по массе)
в Ей чистотой 99,93 % (по массе) при температурах 1480, 1612, 1698
и 1820 °C составляет в % (ат.): 0,0017, 0,0019, 0,0016 и 0,0009
соответственно. Эти результаты, однако, вызывают сомнение, так как
Рис. 264. Eu—W
Eu—Y, Eu—Yb
485
относятся к температурам, превышающим температуру кипения Ей
при давлении 0,1 МПа (1597 °C). При температуре плавления Ей,
равной 822 °C, в нем растворяется < 0,001 % (ат.) W [1]. Термо-
динамические расчеты свидетельствуют об отсутствии промежуточ-
ных соединений в системе [2]. Данные о взаимодействии Eu с W
обобщены в работе [3], в которой построена диаграмма, приведенная
на рис. 264.
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner, Jr., K.A. // J. Less-Common Met.
1966. V. 11. N 6. P. 423-435.
2. Miedema A.R // J. Less-Common Met. 1976. V. 46. N 1. P. 167—183.
3. Pandian S., Nagender Naidu S.V., Rama Rao P. // J. Alloy Phase Diagrams. 1988.
V. 4. N 2. P. 73—116.
КБ. Поварова
Eu—Y. ЕВРОПИЙ-ИТТРИЙ
Диаграмма состояния в Eu—Y не построена. Термодинамический
анализ, учитывающий валентность Ей, дал основание предполагать,
что в системе не существует стабильных соединений [М].
Л.Л. Рохлин
Eu—Yb. ЕВРОПИЙ—ИТТЕРБИЙ
486
Eu—Zn, Eu—Zr
Диаграмма состояния Eu—Yb (рис. 265) построена по результатам
дифференциального термического, рентгеновского и микроскопи-
ческого анализов [1]. При исследовании использовали Ей и ТЬ
чистотой по металлическим примесям 99,9 % (по массе). Взаимодей-
ствие Ей и Yb характеризуется неограниченной растворимостью в
жидком состоянии. В твердом состоянии имеет место непрерывный
ряд твердых растворов с ОЦК решеткой между Ей и высокотемпера-
турной модификацией Yb. На основе низкотемпературной модифика-
ции Yb с ГЦК решеткой образуются ограниченные твердые растворы.
Литература
1. Козлов В.Г., Станолевич Г.П., Кулифеев В.К. // Химия и металлургия редких
металлов: Тр. Моск, ин-та стали и сплавов. М.: Металлургия, 1979. С. 99—101.
Л.Л. Рохлин
Eu—Zn. ЕВРОПИЙ-ЦИНК
Диаграмма состояния Eu—Zn не исследована. Имеются сведения
[Ш, V-C, 1] (табл. 191) об образовании в сплавах системы соедине-
ний.
Таблица 191. Кристаллическая структура соединений системы Eu—Zn
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
EuZn CsCl cP2, РтЗт 0,3812 — —
EuZn2 CeCu2 o/12, Imma 0,4728 0,7650 0,7655
EuZn3 CaCu3 hP6, P6/mmm 0,5454 — 0,4285
EuZnM BaCdlt tI4%, 14}!amd 1,0719 — 0,6873
EuZn13 NaZn13 cFH2, Fm 3 c 1,2216 — —
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982, 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Eu—Zr. ЕВРОПИЙ-ЦИРКОНИЙ
Экспериментальные данные о взаимодействии Zr и Ей отсутству-
ют. Согласно термодинамическим расчетам [ 1 ] в системе не образу-
ются устойчивые соединения. В справочнике [2] приведен обобщен-
Eu—Zr
487
ный вариант диаграммы состояния системы Eu—Zr (рис. 266). Пред-
полагается, что при нормальном давлении и высоких температурах
в равновесии с 0Zr и его расплавом сосуществуют расплав на основе
Ей или газообразная фаза на его основе, поскольку температура
плавления Zr выше температуры кипения Ей.
Литература
1- Miedema A.R. // J. Less-Common Met. 1976. V. 46. N 1. P. 167-183.
2. Moffatt W.G. Handbook of Binary Phase Diagrams. New York: Business Growth
Services. General Electric Co. Schenectady, 1976. 1977. V. 1,2. 658 p.
JI. А. Третьячгнко
488
F—Ru, Fe—Ga
F—Ru. ФТОР-РУТЕНИЙ
Диаграмма состояния F—Ru не построена. В работе [1] сообщается
о существовании соединений RuF5 и RuF6 с температурами плавле-
ния 87 и 54 °C, соответственно. В твердом состоянии образуются
фазы RuF3 и RuF4.
Литература
1. Термические константы веществ: Справочник / Под ред. В.П. Глушко и др у,
ВИНИТИ, 1972. Вып. 6. Ч. 1. 343 с.
С.П. Алисова
Fe—Ga. ЖЕЛЕЗО-ГАЛЛИЙ
Сведения об исследовании структур, составах и характере пре-
вращений в системе Fe—Ga собраны в работах [X, Э, Ш, 1, 2j.
Обобщенный вариант диаграммы состояния Fe—Ga во всем интервале
концентраций приведен на рис. 267 по данным работы [1]. Замкну-
тая область раствора Ga в (yFe) существует в интервале температур
912—1394 °C, при максимальном содержании 2,8 % (ат.) Ga при
температуре 1140 °C. Гораздо более протяженной является область
существования твердого раствора Ga в (aFe). Область твердого рас-
твора существует как в разупорядоченном состоянии (структура типа
А2, прототип W, символ Пирсона с/2, пр. гр. 1тЗт), так и в упоря-
доченных (at — тип В2 прототип CsCl, символ Пирсона сР2, пр. гр.
РтЗт и а( тип В2') состояниях. Максимальная растворимость Ga
в (aFe) равна 35,1 % (ат.) при температуре перитектической реак-
ции: Ж + (aFe) * at равной 1037 °C. При температуре 950 °C и
содержании 31,1 % (ат.) Ga по перитектоидной реакции (aFe) + aj
a( образуется вторая упорядоченная фаза [2].
На рис. 267 образование фаз а( и а, представлено не как резуль-
тат перитектической (при 1037 °C) и перитектоидной (при 950 °C)
реакций, а как следствие реакции упорядочения второго порядка
(aFe)(A2) aj(B2) и aj(B2) * a^ (В2') [1].
Установлено образование четырех соединений. При температуре
680 °C конгруэнтно образуется соединение Fe3Ga, существующее в
двух модификациях: Pi (низкотемпературная) и Р2 (высокотемпера-
турная). Полиморфное превращение Р, р2 происходит в интервале
температур 605—619 °C. По вырожденной перитектоидной реакции
при температуре 674 °C образуется фаза а2, которая существует при
температурах до 588 °C, а затем эвтектоидно распадается на твердый
раствор (aFe) и Fe3Ga (0 j). При температуре 625 °C фаза aj эвтекто-
идно распадается на р2 и низкотемпературную модификацию Fc6Ga5-
Fe—Ga
489
Рис. 267. Fe—Ga
^единение ^e6^a5 образуется перитектоидно при температуре
оО С из твердого раствора otj и соединения Fe3Ga4 и претерпевает
полиморфное превращение, температура которого со стороны Ga
составляет 778 °C. Соединения Fe3Ga4 и FeGa3 образуются по пери-
тектическим реакциям при температурах 906 и 824 °C. Раствори-
°сть Fe в Ga в твердом состоянии незначительна.
кристаллическая структура соединений приведена в табл. 192.
490
Fe—Ga
Таблица 19 2. Кристаллическая структура соединений системы Fe—Ga
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Ис ro’i- -ЧИК
a b c
Fe3Ga Irln3 ZP16, P42/mnm 0,6220 — 0,6580 131
FeGa3 CoGa3 ZP16, 0,6250 — 0,6580 [V-C]
P4n2
Fe3Ga4* — 1,260 — 0,551 [3,4]
Fe3Ga4** Fe3Ga4 mC42, C2/m 1,0091 0,7666 0,7866 [31
Fe6Ga5(BT) AlgCr5 ЛЯ26, R3m 1,2463 — 1,5577 [V-C]
Fe6Ga,***(HT) Fe6Ga5 mC44, C2/m 1,0058 0,7946 0,7747 [3i
Fe3Ga(p2) Ni3Sn hP&, P63/mmc 0,52184 — 0,42373 12)
Fe3Ga(pl) AuCu3 cP4, РтЗт 0,37109— 0,37114 — — [31
«1 CsCl cP2, РтЗт — — — [1, 4]
ai — cP16, Fm3m — — — [4j
«2 BiF3 cF16, Fm3m 0,5810— 0,5821 — — [V-C]
‘Тетрагональная сингония. * * P = 106,40°. * *• p - 109,20”.
Указанные в таблице для соединения Fe3Ga4 два типа кристалли-
ческих решеток представляют собой фактически одну и ту же решет-
ку, но выраженную различными пространственными группами J31 •
Для соединений в системе приводятся также другие формулы: Fc3Ga2
(решетка типа CsCl), Fe7Ga6 (решетка типа Al8Gr5) [3]. В работе
13] указывается на образование в системе соединения с гексагональ-
ной решеткой типа Mg3Cd. Однако в более позднем обзоре [4] соеди-
нение с такого типа решеткой отрицается.
Литература
1 . Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер
с англ. / Под ред. Л.А. Петровой. М.: Металлургия. 1985. 184 с.
2 . Диаграммы состояния двойных и многокомпонентных систем на основе
Fe—Gd
491
железа / О.А. Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986.
440 с.
3 Гринь Ю.А., Гладышевский Р.Е., Галлиды. М.: Металлургия, 1989. 304 с.
4 Okamoto Н. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 6. С. 576—581.'
Е.И. Гладышевский, О.И. Бодак, В.К. Печарскии
Fe-Gd. ЖЕЛЕЗО-ГАДОЛИНИЙ
Результаты исследования диаграммы состояния Fe—Gd изложены
в работах [X, Э, Ш, 1- 4]. На рис. 268 приведен обобщенный вариант
диаграммы согласно работе [2].
Система характеризуется наличием четырех соединений, которые
образуются по перитектическим реакциям, приведенным ниже.
Ж + (yFe) * FepGdo при 1335;
Ж + Fe17Gd2 * Fe23Gd6 при 1280;
Ж + Fe23Gd6 * FeaGd при 1155;
Ж + Fe3Gd * Fe2Gd при 1080.
Эвтектика Fe2Gd + (aGd), кристаллизующаяся при 845 °C, содер-
жит 70,0 % (ат.) Gd. Максимальная растворимость Fe в Gd менее
0,6 % (ат.).
Таблица 19 3. Кристаллическая структура соединений системы Fe—Gd [1]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
Fe,7Gd2 (НТ) Zn|7Th2 AA19, R3m 0,8540 — 1,2428
Fel7Gd2(BT) Nil7Th2 /1ЯЗ8, РЬ^/ттс 0,8496 — 0,8345
Fe23Gd6 M1I23 сЯ16, Fm3m 1,213 — —
Fe3Gd Ni3Pu hR12, R3m 0,5166 — 2,407
Fe3Gd Cu2Mg cF24, Fd3m 0,7394 — —
Кристаллическая структура соединений приведена табл. 193.
соединений, присутствующих на диаграмме и описанных в
Работах [1—3], в работе [V-C] сообщается о высокотемпературной
Модификации Fe17Gd2 и еще четырех фазах, для которых выполнен
ервый этап структурного анализа (установлены симметрия и пара-
мм-ры решетки): Fe^Gd (гексагональная сингония, а = 0,9848 нм,
• йм нм>, ^Gd (гексагональная сингония, а = 0,515 нм, с =
,664 нм), Fe7Gd2 (ромбическая сингония а = 0,571 йм, b =
492
Fe-Gd
Рис. 268. Fe-Gd
= 0,678 нм, с = 0,715 нм), Fe3Gd2 (кубическая сингония, а -
= 0,825 нм).
Приводимый в работе [1] для соединения Fe)7Gd2 тип решетки с
прототипом СаСи5 не следует принимать во внимание ввиду разли-
чия в формулах соединения и прототипа решетки. Следует так*'-
иметь в виду, что решетки типа Zn17Th2 и Ni17Th2, которые указаны
в табл. 193, являются производными от решетки типа CaCu5 [PI
Fe—Ge
493
ЛшератуРа
1 Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
й редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
^"х^Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
С 3 Диаграммы состояния двойных и многокомпонентных систем на основе железа
/ О А Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с.
4 Савицкий Е.М., Терехова В.Ф., Буров И.В. и др. // Журнал неорганической
химии. 1061. Т. 6. № 7. С. 1732-1734.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Fe-Ge. ЖЕЛЕЗО-ГЕРМАНИЙ
Диаграммы состояния Fe—Ge изучена многими исследователями
[X, Э, Ш]. Диаграмма состояния построена в полном интервале
концентраций и обобщена в работах [1,2] (рис. 269).
Исследования выполняли методами рентгеновского фазового и
структурного, дифференциального термического анализов.
Обнаружено существование областей твердых растворов на основе
yFe и aFe и шести соединений Fe3Ge (е), Fe32Ge2 (Р), Fe13Geg (ту),
FerGe^ (к), FeGe и FeGe2. Предельная растворимость Ge в yFe при
1150 °C равна 3,84 % (ат.). В (aFe) при этой температуре растворя-
ется до 13 % (ат.) Ge. При понижении температуры растворимость
Ge в (aFe) снижается до 10 % (ат.). В богатой Fe области системы,
ОЦК фаза (твердый раствор на основе aFe) существует в двух по-
лиморфных модификациях: неупорядоченной (aFe) и упорядоченной
(«р. Возникновение фазы aj связано с превращениями второго
порядка [1]. Растворимость Geeap интервале температур ИЗО—
900 °C падает, а затем, при дальнейшем понижении температуры,
вновь растет, достигая приблизительно 20 % (ат.) Ge при 400 °C.
Таблица 19 4. Нонвариантные реакции в системе Fe—Ge [1]
Реакция Содержание в фазах, % (ат.) Темпера- тура, °C
Fe3 2Ge2 + a, ₽ Fe3Ge 34,5; 20; 25 -1050
Ж + Fe3,2Ge2 - Fel3Geg 55; 41,5; 42,5 928
Fel3Geg н Fe3 2Ge2 + Fe^Ge^ -42,5; 40; -45 -525
Fei3Geg + FeGe2 * FeGe 43,5; 66,5; 50 748
Fei3Geg + FeGe •• Fe6Ge5 43; 50; 45 -600
Ж + Fel3Geg = FeGe2 69,5; 43,5; 66,5 840
ж » a, + Fe3 2Ge2 30; 22; 33,5 ИЗО
ж ₽ FeGe2 + (Ge) 75; 66,5, 100 838
ж - Fe3 2Ge2 37,5; 37,5; — 1170
Fe3Ge * tt, + Fe3 2Ge2 25; 19,5 36 400
494
Fe—Ge
Рис. 269. Fe—Ge
Имеющие место в системе нонвариантные реакции указаны в
табл. 194.
Соединение Fe3Ge(e) образуется по перитектоидной реакции и
существует в интервале температур -1050—400 °C. При понижении
температуры фаза е претерпевает полиморфное превращение при
700 °C. Соединение Fe3 2Ge2 (Р) образуется с открытым максимумом
при 1170 °C; область гомогенности фазы р при температуре И00 ~
находится в интервале концентрации 34—40 % (ат.). При дальней-
Fe-Ge
495
ем понижении температуры, область его гомогенности сначала
есколько возрастает, затем незначительно сужается вплоть до
чгемпературы 800 °C, после чего остается практически постоянной.
Соединение FeI3Ges (п) образуется в результате перитектической
оеакции и перитектоидно распадается. Область его существования
вначале расширяется, а затем сужается, достигая максимума при
748 °C. Соединения FeGe и FeGe2 характеризуются идеальной стехи-
ометрией и практически отсутствием области гомогенности [3].
Растворимость Fe в Ge ничтожно мала и при температуре 850 °C
не превышает 3,3 • 10"6 % (ат.).
Кристаллические структуры фаз, образующихся в системе Fe—Ge
приведены в табл. 195. Для соединения FeGe, согласно работе [3],
характерна только одна гексагональная модификация. В это же время
в работе [V-C] приводятся сведения о других типах кристаллической
решетки для этого соединения, которые также включены в таблицу.
Таблица 19 5. Кристаллическая структура соединений системы Fe—Ge
Соединение Прототип Символ Пирсона, пр. гр- Параметры решетки, нм Источник
а b с
FeGej CuAl2 ti 12, I4lmcm 0,5908 — 0,4957 [V-C]
FeGe FeSi cP8, 0,4700 — — [V-C]
P2t3
CoGe mC 16, CUm 1,1838 0,3937 0,4933* [V-C]
CoSn hP6, Pf>! mmm 0,4965 — 0,4054 [V-C]
Fe6Ge5 Fe6Ge5 mC44, C2/m 0,9965 0,7826 0,7801** IV-C]
Fe13Ge8 Fe13Ge8 hP22, Рб^/ттс 0,7976 — 0,4993 [4]
Fe3,2Ge2 Fe3 2Ge2 0,3998 — 0,5010 [4]
РЬъ1ттс
FejGe(BT) Ni3Sn hP8, Рб^/ттс 0,5162 — 0,4207 [V-C]
FejGe(HT) Cu3Au cP4, 0,3574 — — [V-C]
РтЗт
* ₽ ' 103,5°.
' P - 109 ,66°.
496
Fe-H
Литература
1. Кубашевки О. Диаграммы состояния двойных систем на основе железа пеп
англ. / Под ред. А.А. Петровой. М.: Металлургия, 1985. 184 с. Р' с
2. Диаграммы состояния двойных и многокомпонентных систем на основе желе
/ О.А. Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с За
3. Maier J., Wachtel Е. // Z. Metallkunde. 1972. Bd. 63. S. 411-418.
4. Malaman В., Steinmetz Y., Roques B. /7 J. Less-Common Met. 1980. V 7s v э
P. 155-176. 2
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Fe-H. ЖЕЛЕЗО—ВОДОРОД
Диаграмма состояния Fe—Н рассматривается в работах [1—6]
Установлено наличие в этой системе газоэвтектического, газопе-
ритектоидного и газоэвтектоидного равновесий при температурах
1532 °C (Ж * (SFe) + Н2), 1401 °C ((SFe) + Н2 * (yFe)), 909,3 °C
((yFe) * (aFe) + Н2) [1].
Области существования твердых растворов Fe узкие даже при
давлениях порядка 10 МПа, а сдвиг критических точек превращений
Fe под влиянием водорода сравнительно небольшой.
При давлении до 10 МПа растворимость Н во всех модификациях
Fe и расплаве подчиняется закону Сивертса и описывается соотноше-
ниями:
Igx = 0,51gp - 3,06 - 1460/7 для (aFe);
Igx = 0,51gp - 2,96 - 1330/7 для (yFe);
Igx = 0,51gp - 1,56 - 3810/7 для (6Fe);
Igx = 0,51gp - 2,50 - 1600/7,
где x — концентрация H, % (ат.); 7 — температура, К, р — давле-
ние, Па.
При давлении выше 10 МПа наблюдаются ощутимые отрицатель-
ные отклонения от закона Сивертса, связанные с процессами адсор-
бции и десорбции, происходящими при поглощении металлом Н [3].
Н способствует стабилизации
(yFe), что согласуется с дан-
ными работы [7]. В системе
Fe—Н при газоэвтектоидном
превращении (t = 909,3 С) на
границе между растущей и ис-
чезающей фазой образуется
сильно пересыщенная водородом
метастабильная зона (Н-слой),
перемещение которой приводит
к интенсивной самопроизволь-
ной (спонтанной) деформации
металла в твердом состоянии
[8].
Р, мпа
Рис. 270. Fe-H
Fe—Hf
497
Учитывая, что содержание Н в Fe является функцией его парци-
ального давления в газовой фазе, изображение диаграммы Fe—Н на
Плоскости является условным [1]. Истинную диаграмму следует
изображать объемно, в координатах р—Т—х (рис. 270). Такая диаг-
памма представляет собой систему поверхностей, исходящих из осей
температуры и давления и соединенных уступами, изобарические
сечения которых параллельны оси концентраций. Одновременно
поверхности этих уступов, связывающих концентрации Н в соответ-
ствующих фазах, имеют наклон к горизонтальной плоскости, резко
уменьшающийся при давлении Н более 20—25 МПа. В соответствии
с диаграммой состояния равновесие в системе Fe—Н возможно только
при таких комбинациях температуры и состава, которые соответству-
ют точкам на поверхности диаграммы.
В работе [9] обнаружен скачок растворимости Н в Fe при магнит-
ном превращении в точке Кюри.
Литература
• 1. Диаграммы состояния двойных и многокомпонентных систем на основе железа.
/ О.А. Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с.
2. Бунин К.П., Шаповалов В.И., Трофименко В.В. // Доклады АН УССР. 1976.
№ 3. С. 265-267.
3. Шаповалов В.И. // Изв. вузов. Черная металлургия. 1976. № 12. С. 92—96.
4. Шаповалов В.И. // Журнал физической химии. 1980. Т. 54. № 11. С. 2899—
2905.
5. Шаповалов В.И. Влияние водорода на структуру и свойства железоуглеродистых
сплавов. М.: Металлургия. 1982. 232 с.
6. Шаповалов В.И., Трофименко В.В. // Журнал физической химии. 1978. Т. 52.
№ 12. С. 3140-3142.
7. Шаповалов В.И., Трофименко В.В. // Доклады АН УСССР. 1977- № 1. С.
74—76.
ы. ?' Шаповалов В.И., Карпов В.Ю. // Физика металлов и металловедение. Т. 55.
№ 4. 1983. С. 805-811.
122_j Шаповалов В.И., Бойко Л.В. // Изв. вузов. Черная металлургия. 1984. № 8. С.
В.И. Шаповалов
pe-Hf. ЖЕЛЕЗО—ГАФНИЙ
в ЬаЛ^ЛЬТатЫ исслеДований диаграммы состояния Fe—Hf обобщены
DH^°OTax [1,2]. Сплавы изучали методами термического, дилатомет-
рИс 2?[°’ Рентгеновского и магнитного анализов. Представленная на
обиач 1 диагРамма приведена по данным работы [1]. Установлено
образ0®3*1”6 ДВУХ соединений: Hf2Fe и HfFe2. Соединение Hf2Fe
Цд?е Уется по перитектоидной реакции при 1260 °C, соединение
рИм 2 кР”^ал-чизуется из расплава при температуре 1820 °C. Раство-
(ат) [3| * в <аре) при температуре 1330 °C составляет -0,06 %
Работе [4] ЧТ° близко к значению < 0,1 % (ат.), приведенному в
498
Fe—Hf
Рис. 271. Fe—Hf
Кристаллическая структура соединений приведена в табл. 196.
Согласно работе [1] соединение HfFe2 может существовать и в
двух других модификациях с кристаллическими решетками, харак-
терными для двух других форм фаз Лавеса: типа MgCu2 и типа
MgNi2.
Таблица 19 6. Кристаллическая структура соединений системы Fe—Hf
Соединение Прототип Символ Пирсона, яр. гр. Параметры решетки, нм Источник
а с
Hf2Fe Ti2Ni сГ96, Fd3m 1,2055 1,20246 — [1’1 151
HfFe2 MgZn2 hPVL, Рб-Jmmc 0,49116— 0,49756 0,80013- 0,81288 П1
Fe-Hg 499
дитература
1 Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
англ / Под ред- Л-А. Петровой. М.: Металлургия, 1985. 184 с.
С 2 Диаграммы состояния двойных и многокомпонентных систем на основе железа.
/ О А. Банных, П.Б. Будберг, С П. Алисова и др. М.: Металлургия, 1986. 440 с.
' 3. Свечников В.Н., Шурин А.К. // Доклады АН СССР. 1961. Т. 139. № 4. С.
«95-899.
4. Reinbach R. // Z. Metallkunde. 1960. Bd. 51. N 5. S. 292-294.
5. Cekic B., Prelesnik., Koicki S. et al. //J. Less-Common Met. 1991. V. 171. N 1.
p. 9-15.
П.Б. Будберг
Fe-4ig. ЖЕЛЕЗО-РТУТЬ
Диаграмма состояния Fe—Hg не построена. Исследования давления
пара над амальгамами позволили сделать вывод, что в системе не
образуются стабильные соединения [1]. Опубликованные данные о
растворимости Fe в жидкой ртути существенно различаются [X, 1].
В работе [1] приводятся значения растворимости Fe в Hg, которые,
по-видимому, являются наиболее надежными. Эти значения пред-
ставлены на рис. 272.
272. Fe-Hg
Л*п*Р»тура
'•"i'Tte”.0: Диаграммы состояния двойных систем на основе железа: Пер.
°Д ред. А.А. Петровой. М.: Металлургия, 1985. 184 с.
JT*.
Л.Л. Рохлин
500
Fe-Но
Fe—Но. ЖЕЛЕЗО-ГОЛЬМИЙ
Сведения о сплавах системы Fe—Но приведены в работах [Э, |ц
V-C, 1—3]. Диаграмма состояния Fe—Но приведена на рис. 273 по
данным работы [2]. При этом, согласно работе [М], исключено
предположение о полиморфном превращении Но и связанной с этим
реакции.
Fe Но, °/о (ат.) Но
Рис. 273. Fe—Но
В системе Fe—Но образуются четыре соединения, два из которых
Fei-fHo, и Fe23Ho6 плавятся с открытыми максимумами при 1343 и
1332 °C соответственно, а два других Fe3Ho и Fe2Ho образуют! я по
перитектическим реакциям: Ж + Fe23Ho6 ** Fe3Ho (1293 °C) и Ж +
+ Fe3Ho Fe2Ho (1288 °C). При температурах 1338, 1285 и 875
Fe—ln.
501
держаниях 9,18 и 63,4 % (ат.) Но кристаллизуются эвтектики
7vFe) + Fe17Ho2, Fe17Ho2 + Fe23Ho6 и Fe2Ho + (Но). Взаимная
растворимость компонентов практически отсутствует.
Таблица
19 7. Кристаллическая структура соединений системы Fe—Но [1]
Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
Соединение a с
FE17HO2 Ni17Th2 /iP38, Р63/mmc 0,8438 0,8310
Fe^Ho^ Mn23Th6 cF116, Fm3m 1,2032 —
Fe3Ho Ni3Pu AA12, 0,5084 2,445
R3m
Fe2Ho Cu2Mg cF24, Ed3 m 0,7305 —
Кристаллические структуры соединений системы Fe—Но описаны
табл. 197. Кроме соединений, присутствующих на диаграмме, в
работах [Э, V-C] сообщается еще о двух фазах: Fe5Ho и Fe8Ho.
Первое соединение по составу близко к соединению Fe23Ho<r, но для
FesHo приводится другая кристаллическая решетка типа СаСп5 (ЛР6,
Пр. гр. РЬ/ттт). Второе соединение Fe8Ho близко по составу к
соединению Fe17Ho2.
Литература
^1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
нии редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
2* Кубашевски О. Диаграммы состояния двойных систем на основе железа. Пер.
/ Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
/ п а ^иагРаммы состояния двойных и многокомпонентных систем на основе железа
• • Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
р«-4п. ЖЕЛЕ30-41НДИЙ
^Диаграмма состояния Fe—In (рис. 274) построена по результатам
авР°стРуктурного, рентгеновского, электронно-микроскопического
“А В сплавах системы при температуре 1470 °C и содер-
ствук? % (ат.) In протекает монотектическая реакция, соответ-
Сл'ая Рвению жидкой фазы на два несмешивающихся жид-
Хоццен~Я' Область расслоения расположена в широком интервале
Расслоен,аЦИй от до 91 % (ат.) In. Критическая точка кривой
Ия расположена при температуре >2100 °C.
502
Fe—In.
При температуре -1320 °C и содержании 0,7 % (ат.) In протекает
кататектическая реакция: (6Fe) (yFe) + Ж, максимальная раство-
римость In в (5Fe) составляет 0,9 % (ат.). При температуре 920 °C
реализуется перитектическое превращение (yFe) + Ж « (aFe), макси-
мальная растворимость In в (aFe) равна 0,5 % (ат.). При комнатной
температуре в (aFe) растворяется <0,28 (ат.) In. При температуре
156 °C в сплавах системы кристаллизуется эвтектика Ж •* (aFe) +
+ (In). В более позднем обзоре [3] внесены некоторые уточнения в
концентрации и температуры критических точек диаграммы состоя-
ния, но общее ее строение осталось без изменений. Так, согласно
работе [3] критическая точка кривой расслаивания имеет место при
температуре -2857 °C и содержании -50 % (ат.) In. Концентрация
жидкой фазы со стороны In, участвующей в монотектической РеаК'
ции — 91,5 % (ат.) In. Температура кататектической реакции в
Fe—Ir
503
боте [3] указана равной 1350 °C, а концентрация In в (6Fe> и
?vFe) соответственно 0,5 и 0,8 % (ат.). Концентрация In в жидкой
Лазе участвующей в перитектической реакции, по данным работы
[3], составляет 99,6 % (ат.).
Литература
1 Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
С англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
2 Диаграммы состояния двойных и многокомпонентных систем на основе железа
/ О.А. Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с.
3 . Okamoto Н. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 2. P. 143—146.
С.П. Алисова
Fe—Ir. ЖЕЛЕЗО-ИРИДИЙ
Литературные данные о системе Fe—Ir приведены в работах [X,
Э, Ш] и обобщены в работах [1—3]. Fe и 1г неограниченно растворя-
ются друг в друге при высоких температурах. Ликвидус системы при
добавлении 1г к Fe повышается до перитектической температуры
275. Fe^r
504
Fe-K, Fe—Kr
1546 °C [2] (по данным работ [1—3] — 1538 °C). Координаты пери.
тектичсского равновесия оценены экспериментально: Ж (2,1 % (ат)
Ir) + (yFe, 1г) (0,3 % (ат.) 1г) ** (6Fe) (2,5 % (ат.) 1г) [2].
При понижении температуры конгруэнтно при температуре 625 °C
и содержании 38 % (ат.) 1г образуется промежуточная фаза е с
гексагональной плотноупакованной решеткой (символ Пирсона hP2
пр. гр. Рб3/ттс). При температуре 400 °C область гомогенности
фазы е находится в интервале концентраций 22—45 % (ат.) 1г.
Параметр решетки фазы е внутри области гомогенности возрастает
от а = 0,258 нм, с - 0,415 нм (со стороны Fe) до а = 0,265 нм, с =
= 0,429 нм (со стороны Ir) [Ш, 1]). При температуре 470 °C [3]
протекает эвтектоидное превращение (yFe, Ir) * (aFe) + е.
Приведенная на рис. 275 диаграмма состояния Fe—1г построена
расчетным методом с использованием литературных данных по
термодинамическим свойствам компонентов, жидкой и твердых а, у
и б фаз [2,4].
Литература
1. Диаграмма состояния двойных и многокомпонентных систем на основе железа.
/ О.А. Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986) 440 v
2 Swartzendruber L.J. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 1. P. 48—52.
3. Кубашевски О. Диаграммы состояния двойных систем на основе железа Нер.
с англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
4. Kuchai* L., Repiska L., Kemorova К. // Sb. Vfidekych Praci Vysok6 Skoly Btlrtske.
Ostrava. 1980. V. 26. P. 119-136.
А.Л. Татаркина, Т.П. Лобода
Fe-K. ЖЕЛЕЗО-КАЛИЙ
Диаграмма состояния Fe—К не построена. Имеются данные, что
сплавы системы Fe—К удалось приготовить, используя К и стружку
Fe; сплавы получали в бойлере и при нагреве Fe с солями К.
Сообщается [JII] о примерной растворимости Fe в жидком К в
интервале температур 670—1055 °C, подчиняющейся зависимости
Igx = 8,193 - 6166/71, где х — концентрация Fe 104, % (по массе);
Т — температура, К. Так, растворимость Fe в жидком К при 670 С
составляет 0,0031 % (ат.), при 760 °C — 0,0120 % (ат.), при 870 °C
- 0,0953 % (ат.), при 925 °C -0,0980 % (ат.).
П.Б. Будберг
Fe—Kr. ЖЕЛЕЗО-КРИПТОН
Диаграмма состояния Fe—Kr не построена. В работе [1] сообща-
ется, что Fe при температуре 1200—1500 °C не адсорбирует Кг, это
позволяет предполагать невозможность образования в этой системе
ни твердых растворов, ни промежуточных фаз.
Fe—La
505
ЛигератуРа
1 Вол А.Е. Строение и свойства двойных металлических систем. М.: Физматгиз,
1962-Т. 2. 984 с.
СП. Алисова
Fe-La. ЖЕЛЕЗО—ЛАНТАН
Сведения, полученные при изучении системы Fe—La, собраны в
справочниках [Э, Ш, 1, 2]. Обобщенная диаграмма состояния Fe—La,
приведенная на рис. 276, построена в работе [1] в основном по
результатам работы [3]. При температуре 780 °C и содержании
91 5 % (ат.) в системе кристаллизуется эвтектика (aFe) + (La).
506
Fe—Li, Fe—Lu
Нонвариантные превращения при 1400 °C (перитектическое) и
при 900 °C — (эвтектическое) связаны с полиморфизмом Fe. Раство-
римость La в Fe при температуре 1400 °C составляет 0,03 % (ат)
[4], при 900 °C менее 0,2 % (ат.) и при 780 °C менее 0,1 % ит)
[1]. Для системы характерен аномальный ход кривой ликвидуса с
горизонтальным участком в диапазоне 8—19 % (ат.) La. В работе ]1]
предполагается, что аномальный ход кривой ликвидуса на этом учас-
тке не связан с образованием области несмешиваемости.
Сообщения об образовании в системе двух соединений Fe3l.a и
Fe2La в большинстве работ не подтверждаются [1].
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа Пер.
с англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
2. Диаграммы состояния двойных и многокомпонентных систем на основе железа
/ О.А. Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с
3. Гшнейднер К.А. Сплавы редкоземельных металлов: Пер. с англ. / Под ред i-..М.
Савицкого. М.: Мир, 1965 . 427 с.
4. Kuchaf L., Reptskd L„ Kemorova L. et. al. // Sb. Vfidekych Praci Vysoke Skoly
Bdflske. Ostrava. 1980. V. 26. P. 119-136.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Fe—Li. ЖЕЛЕЗО—ЛИТИЙ
Диаграмма состояния Fe—Li не построена. В работах [X, Э, Ш]
приведены данные по растворимости Fe в Li в интервале температур
400—1200 °C при использовании Li чистотой 99,0—99,8 % (по массе).
Растворимость Fe в жидком Li, согласно наиболее предпочтительным
данным работ, в которых использовался Li чистотой 99,8 % (по
массе), приведена ниже [Э].
Температура, °C......... 1200 900 800 600 400
Растворимость Fe, % (ат.). . . 4,4-10’2 1,2-10’3 7- 10‘4 610'4 5-Ю 4
Li практически не растворим в твердом Fe [X].
С.П. Алисова
Fe—Lu. ЖЕЛЕЗО-ЛЮТЕЦИЙ
Фазовое строение сплавов системы Fe—Lu и их кристаллическая
структура приведены в работах [Э, Ш]. Диаграмма состояния Fe—l-k*
(рис. 277) построена в работе [1].
Сплавы Fe чистотой 99,98 % (по массе) и Lu чистотой 99,2 % (>10
массе) синтезировали в инертной атмосфере в дуговой печи. Богатые
Fe сплавы отжигали при 1000 °C в вакууме, а богатые Lu — в атмос*
фере очищенного Аг при 900 °C.
Fe—Lu
507
Исследования проводили методами рентгеновского фазового и
структурного, микроскопического и дифференциального термического
анализов.
В системе Fe—Lu образуется четыре соединения. Фаза Fe2Lu
Плавится с открытым максимумом при 1345 °C. Фазы Fe17Lu2,
£?23^u65 Fe3Lu кристаллизуются по перитектическим реакциям:
+ р T<YFe) e Fei7Lu2 <1320 °C), Ж + Fe3Lu « Fe23Lu6 (1290 °C) и Ж +
ejLu •* Fe3Lu (1310 °C). При температурах 1275 и 970 °C и содер-
реН^ях П и 75 % (ат.) Lu протекают эвтектические реакции Ж
il7^u2 + Fe23Lu6 и Ж •» Fe2Lu + (Lu) соответственно. Совместная
воримость компонентов практически отсутствует.
Ристаллическая структура соединений приведена в табл. 198 [2].
508
Fe—Mg
Таблица 198. Кристаллическая структура соединений
системы Fe—Lu [2]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки,
a c
Fe17Lu2 Zn^Thj W?19, R3m —
Fe^Lu Nil7Th2 hP38, 0,8387- 0,829z
х - 9,5 - 9,6 P63/mmc 0,8388 0,8287
Fe23Lu6 Mn23Th6 cFl 16, Fm3m 1,195 —
Fe3Lu Ni3Pu hRW, R3m — —
Fe2Lu Cu2Mg cF24, Fd3m 0,72170 -
Литература
1. Колесниченко В.Е., Терехова В.Ф., Савицкий Е.М. // Металловедение цветных
металлов и сплавов. Сб. статей. М.: Наука, 1972. С. 31—33.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических сое мне-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, ь.К.. Печарскии
Ид Fe, °/а (ат)
Рис. 278. Fe—Mg
Fe—Mn
509
Диаграмма состояния Fe—Mg не построена, хотя изучению осо-
бенностей взаимодействия этих элементов посвящен ряд работ [Э,
ПИ Отсутствие диаграммы состояния связано, по-видимому, со
сложностью получения сплавов для исследования из-за различия в
температурах плавления Mg и Fe [X]. Часть диаграммы состояния
рс Mg приведена на рис. 278 [М]. Установлено эвтектическое
равновесие при температуре 649 °C и концентрации Fe в эвтектике
8 • 10‘3 % (ат.).
В справочнике [X] концентрация Fe в эвтектике приводится от
6,5 ‘ Ю'3 до 13,0 • IO'3 % (ат.), и в справочнике [Э] — 2,6 х
х’10’3 % (ат.).
Максимальная растворимость Fe в Mg составляет 4,3 • 10 %
(ат.). Предположительно растворимость Mg в Fe возможна лишь при
высоком давлении и температуре не ниже 1000 °C, что согласуется
с данными работы [Ш], где сообщается о содержании -0,2 % (ат.)
Mg в Fe после плавки в присутствии Mg при температуре 1600 °C и
давлении 2,5 МПа.
С. П. Алисова
Fe—Mn. ЖЕЛЕЗО—МАРГАНЕЦ
Строение диаграммы состояния Fe—Мп дано в работах [X, Э,
Ш, 1,2]. На рис. 279 приведена диаграмма состояния по данным
работы [2].
Установлено, что в сплавах системы протекают два перитектичес-
ких превращения: Ж + (SFc) (yFe, у Мп) при температуре 1473 °C
и Ж + (дМп) * (yFe, уМп) при температуре 1232 °C. Линии ликвиду-
са и солидуса фазы (yFe, уМп) имеют точку минимума при концен-
трации 86 % (ат.) Мп. Практически в сплавах с той же концентра-
цией Мп (86,5 % (ат.)) при температуре 1155 °C конгруэнтно обра-
зуется из твердого раствора (yFe, уМп) твердый раствор (РМп),
имеющий значительную область гомогенности. Твердый раствор
~7Ал° РаспаДается по эвтектоидной реакции при температуре
w С на (yFe, уМп) + (аМп). В сплавах системы существует
прерывный ряд твердых растворов на основе (yFe, уМп). Изучение
^ияяия Мп на превращение (aFe) •* (yFe) методами микроструктур-
ной гл ₽ентгеновского анализов показало [X], что границы двухфаз-
в и Области (“Fe) + (yFe, уМп) при температуре 400 °C расположены
интервале концентраций 3,2-30 % (ат.).
ма»теСПЛаВах с ^~25 % (ат.) Мп существует метастабильная
^^нситная фаза е, распадающаяся на aFe + (yFe, уМп). В работе
3УетсяПРеДП°Лагают’ чт0 Фаза е является равновесной и обра-
п° перитектоидной реакции (aFe) + (yFe, уМп) е.
510
Fe—Mg
Метастабильная фаза е сплава с 18,5 % (ат.) Мп имеет ГПУ
решетку типа Mg с параметрами а = 0,2530 нм, с - 0,4079 нм [X].
По данным работы [Э], параметр решетки (aFe) увеличивается
с 0,28610 до 0,28702 нм при повышении содержания Мп в сплавах от
0 до 8,5 % (ат.). Параметр решетки фазы (yFe, уМп) при содержа
нии 13,19 и 50,43 % (ат.) Мп равен 0,35807 и 0,36237 нм, соответ-
ственно Г2].
Fe—Mo
511
Методами термического анализа, измерением твердости, микрот-
пдости, удельного электросопротивления, а также микроструктур-
и рентгеновскими анализами установлено [Ш], что непрерыв-
яый (yFe, уМп) твердый раствор претерпевает превращения. Сингу-
лярные точки на кривых состав — свойство указывают на образова-
ние соединения FeMn и, возможно, Fe2Mn.
расчет диаграммы состояния Fe—Мп по термодинамическим
свойствам отдельных сплавов этой системы показал ее хорошее
глиттяпенис с диаграммой, построенной по экспериментальным дан-
ным [3,4].
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
с англ- / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
2. Диаграммы состояния двойных и многокомпонентных систем на основе железа.
/ О.А. Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с.
3. Dew-Hughes D // Calphad. 1979. V. 3. Р. 175-203.
4. Kaufman L. // Calphad. 1978. V. 2. N 2. P. 117-146.
С.П. Алисова
Fe—Mo. ЖЕЛЕЗО-МОЛИБДЕН
Данные о взаимодействии Fe с Мо. приведены в эксперименталь-
ных работах [1—5] и обзорах [6—8], в которых были сделаны попыт-
ки построить диаграмму состояния расчетным методом по результа-
там металлографического, рентгеновского, термического анализов в
сочетании с термодинамическими данными (рис. 280).
В системе образуются четыре промежуточные фазы (о, ц, R, А) и
твердые растворы на основе Мо, (aFe) и (yFe).
Предельная растворимость Fe в (Мо) при температурах 1540 и
1235 °C составляет 22 (+2) и 6 (+1) % (ат.) [7]. По данным работы
[8] максимальная растворимость Fe в (Мо) имеет место при темпера-
туре 1611 °C и составляет 31,3 % (ат.), а при 1235° — 6,2 % (ат.),
'-оединение MoFe(a) образуется по перитектической реакции из (Мо)
и расплава при температуре 1540 °C и содержании 49±2 % (ат.) Fe
1<] (1611 °C и 53,6 % (ат.) Мо [8,9]) и распадается на (Мо) и фазу
U по эвтектоидной реакции при температуре 1235±20 °C и содержа-
®®44 % (ат.) Fe [7] (43,3 % (ат.) Fe [3,8]), интервал гомогенности
-Оставляет 44—58 % (ат.) Fe. Соединение MoooFe^CK) образуется по
в^И?£КоИческ°й реакции при температуре 1488 °C [7,8] и содержа-
. 02 % (ат.) Fe, распадается по эвтектоидной реакции на (aFe) и
Им3У Ц при температуре 1200±10 °C и содержании 65 % (ат.) Fe,
(атеГп°^ЛаСТЬ гомогенности> которая находится при (61—65)±1 %
аоУ ге [3, 7, 8]. Соединение Мо6Ёе7(ц) образуется по перитектоид-
Реакции при температуре 1370 °C и содержании 59 % (ат.) Fe,
512
Fe—Mo
Mo Fef/ofam.) Fe
Рис. 280. Fe—Mo
интервал гомогенности составляет (56—61) ±1 % (ат.) Fe [4]. Соеди-
нение MoFe2 (фаза Лавеса, А) образуется по перитектоидной реакции
при температуре 950±50 °C [7] или 977 °C [81, интервал гомогеннос-
ти составляет 66,3±0,2 % (ат.) Fe [1, 4, 7, 8]. Твердый раствор на
основе (yFe) стабилен в интервале концентраций 0—1,7 % (ат.) Мо.
Наиболее тщательное определение протяженности области (yFe) в
работе [5] дает максимальные значения 1,65 + 0,05 % (ат.) Мо для
границы (yFe) и (yFe) + (aFe) и 2,26±0,05 % (ат.) Мо для границы
(yFe) + (aFe) и (aFe) — при температуре 1137 °C. Растворимость Мо
в (aFe) составляет 23+2, 13±1 и 6+1 % (ат.) при температурах 1450,
1200 и 950 °C соответственно [3, 8, 10].
Параметр ОЦК решетки (Мо) меняется от 0,3147 нм для чистого
Мо до 0,3118 нм для сплава с 20 % (ат.) Fe [7, 8].
Кристаллическая структура соединений представлена в табл. 1
Fe—N
513
, и и a 1 9 9. Кристаллическая структура соединений системы Fe—Mo [7,8] д О JI И м
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а С
MoFe(o) aCrFe tP30, Р42/mnm 0,9218 0,4813
Mo6Fe7(p) Fe7W6 hR\3, R3m 0,4751 0,2568
MojgFe62(R) R(Co, Cr, Mo) AR53, R3 — —
MoFe2(l) MgZn2 ЛР12, P63/ mmc 0,4744 0,7725
Параметр решетки (а) ОЦК твердого раствора (aFe) для 100 %
Fe и сплавов с 2,4; 4,22; 11,0 и 12,55 % (ат.) Мо составляет 0,28665;
0,2875; 0,2815; 0,2901; 0,29098 нм соответственно [7,8].
Литература
1. Sinha А.К., Buckley R.A., Hume-Rothery W. // J. Iron Steel Inst. London. 1976.
V. 205. P. 191-195.
2. Alberry P.J., Haworth C.W. // Met. Sci. 1975. V. 9. P. 140.
3. Heijwegen C.P., Rieck G.D. //J. Less-Common Met. 1974. V. 37. P. 115—121.
4. Higgins J., Wilkes P. // Philos. Mag. 1972. V. 25. P. 599-623.
5. Kichner G., Harvig H., Uhrenius В. 11 Metal Trans. 1973. V. 4. P. 1059-1067.
6. Hawkins D.T., Hiltgren R. // Constitution of Binary Alloys. Metal Handbook. Ohio:
Am. Soc. Met., Metals Park. 1973. V. 8. P. 265-269.
7. Brewer L., Lamoreaux R.H. // Atomic Energy Rewiew. Special Issue N 7
Molybdenum: Physico-Chemical Properties of Its Compounds and Alloys. Vienna: Internatio-
nal Atomic Energy Agency, 1980. P. 244-249.
8. Fernandez A. // Bull. Alloy Phase Diagrams. 1982. V. 3. N 3. P. 359-367.
9. Ueshima Y., Ichise E., Mori T. // Testu to Hagane. (J. Iro. St. Inst. Jap.). 1979.
V- 65. N 11. P. 118-126.
К.Б. Поварова
Fe-N. ЖЕЛЕЗО—АЗОТ
Исследованию взаимодействия Fe с N посвящено значительное
^сло работ [1, 2]. Одной из первых работ, посвященных этому
была работа [3]. Представленная на рис. 281 диаграмма
ояния Fe—N построена по обзорам [1,2] и является метаста-
ильн°й, Fe с N образует нитриды Fe.Nly') Fe2N(O, фазу е и
РаствТа°ИЛЬНЫ” НИТРВД ^е1б^2 [1]) (азотистый мартенсит).
темп°РИМ0СТЬ в (“Fe), находящемся в равновесии с Fe4N(y') при
превЕРаТУРе SV® составляет 0,4 % (ат.). Эвтектоидная точка
Ращения (yFe) * (aFe) + Fe4N(y') расположена при содержании
17 Зак. 2144
514
Fe-N
Рис. 281. Fe-N
8,75 % (ат.). Другое эвтектоидное превращение е * (yFe) + Fe4N(y')
реализуется при температуре 650 °C и содержании 16,0 % (ат.) N.
Предельная растворимость N в (yFe) при этой температуре составля-
ет 10,5 % (ат.), в фазе у' — 19,1 % (ат.).
Фаза у' кристаллизуется из твердого раствора е при температуре
680±5 °C; ее протяженность при температуре 650 °C составляет
19,1—20 % (ат.). Соединение Fe2N кристаллизуется из твердого
раствора с при температуре 500 °C и содержании 33,3 % (аг.)-
Параметр решетки (а) фазы (yFe) при увеличении содержания N
Fe—Na, Fe—Nb
515
озрастает от 0,3637 нм при 0 % (ат.) N до 0,3546 нм при содержа-
нии 8,67 % (ат.) N. В узкой области гомогенности параметр решетки
а фазы у' изменяется от 0,3791 до 0,3801 нм.
фаза е имеет ГПУ решетку с упорядоченным расположением
атомов азота. С увеличением содержания N от 19,42 до 33,02 % (ат.)
параметры решетки изменяются от а = 0,2660 нм; с - 0,4343 нм до
а - 0,276 нм; с = 0,4420 нм; область гомогенности фазы е при темпе-
ратуре 20 °C расположена при концентрациях 26,0—33,2 % (ат.) N.
фаза Fe2N(O обладает ромбической структурой с параметрами
а “ 0,2764 нм; b = 0,64829 нм; с - 0,4425 нм.
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
с англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
2. Диаграммы состояния двойных и многокомпонентных систем на основе железа.
/ О.А. Банных, П.Б. Будберг, С П. Алисова и др. М.: Металлургия, 1986. 440 с.
3. Чижевский Н.П. // Изв. Томского технологического ин-та. 1913. Т. 31. № 3.
С. 1-91.
С.П. Алисова
Fe—Na. ЖЕЛЕЗО-НАТРИЙ
Диаграмма состояния Fe—Na не построена, так как в обычных
условиях их невозможно приготовить. Имеются сведения об опреде-
лении растворимости Fe в жидком Na, которая чрезвычайно мала
[1—3]. Согласно работе [3] растворимость Na в (aFe) может быть
представлена в виде зависимости Igx = -1137/Т”1 - 5,0 в интервале
температур (230—544 °C), где х — концентрация Na, % (ат.); Т —
температура, К. Растворимость Na в (aFe) при температуре 400 °C
составляет 2,05 • 10’7 % (ат.), при 500 °C - 3,4 • 10 7 % (ат.).
Литература
1. Корнилов И.И. Железные сплавы. М.. Изд-во АН СССР, 1951. Т. 2. 220 с.
I п ' Диаграммы состояния двойных и многокомпонентных систем на основе железа
* Банных, П Б’ БУдбеРг, С.П. Алисова и др. М.: Металлургия. 1986. 440 с.
с ям ^Убашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
гл. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
П.Б. Будберг
pe-Nb. ЖЕЛЕЗО-НИОБИЙ
эул^ННые По системе Fe—Nb приведены в работах [X, Э, Ш]. Ре-
аты П03Дних исследований диаграммы состояния Fe—Nb обоб-
Работах П-З]-
Работе пн ’ приведена диаграмма состояния Fe—Nb согласно
17» ** ’ основанная на данных работ [4,5].
516
Fe—Nb
Рис. 282. Fe—Nb
Соединение Fe2Nb(e), фаза Лавеса, плавится конгруэнтно при
1627 °C [3] (1625 °C [Ш] или при температуре 1630 до 1665 °C [11)
Область гомогенности е расположена при концентрациях 27—38 %
(ат.) Nb [3], 26-28 % (ат.) Nb [1], 28-36 % (ат.) Nb [2].
Предположительно соединение, близкое к эквиатомному составу
Fe2jNb19 или Fe7Nb6 (фаза ц), образуется конгруэнтно и имеет
узкую область гомогенности, расположенную при 47—49 % (ат.) Nb
[4], 50—52 % (ат.) Nb [5]. Структура фазы р изотипна структуре
W6Fe7 (гексагональная (ромбоэдрическая) решетка, а - 0,4929 нм,
с = 2,68 нм, с/а - 5,44 [4,5]).
Диаграмма Fe—Nb характеризуется наличием трех эвтектических
реакций:
Ж * (SFe) + Fe2Nb(e) при 1373 °C [3]; 1370 °C [Ш];
Ж * Fe2Nb(e) + -FeNb(p) при 1535 °C [3]; 1550 °C [1];
Ж (Nb) + -FeNb(pi) при 1400 °C [3]; 1665 °C [1].
Fe—Nb
517
Значительная неопределенность сохраняется в части диаграммы,
Лпатой Nb. Линия ликвидуса Nb на рис. 284 нанесена приблизитель-
о но в соответствии с экспериментально установленными точками
Ликвидуса [6]. Растворимость Fe в Nb при температуре 1300 °C
составляет 5±1 % (ат.), 7 % (ат.) [4]. По данным работы [4],
эвтектическая точка между фазой ц и (Nb) отнесена к 64 % (ат.)
Nb, что согласуется с данными работы [6].
При температуре 1210 °C [3], (1190 °C [2]) протекает эвтектоид-
ная реакция (6Fe) ** (yFe) + е, эвтектоид содержит 1,5 % (ат.) Nb.
Максимальная растворимость Nb в (yFe) равна 0,9—1 % (ат.). При
температуре 961 °C [3] протекает перитектоидная реакция (yFe) +
+ е (aFe) (при 960 °C [2]). Растворимость Nb в (aFe), по данным
работы [3], составляет 0,095; 0,115; 0,185 и 0,33 % (ат.) при 600,
700, 800 и 900 °C соответственно. При температуре перитектоидной
реакции 961 °C растворимость Nb в (aFe) равна 0,7 % (ат.) [3].
Характеристики кристаллических структур промежуточных фаз
приведены в табл. 200.
Таблица 20 0. Кристаллическая структура соединений системы Fe—Nb
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источ- ник
а с
Fe2Nb(e) MgZn, API 2, 0,4874 0,7992 [2]
Р63/ ттс 0,4811-0,4832 0,7857-0,7871 [Э]
0,48295 0,7877 1Ш]
0,484 0,794 [Ш]
FeNb(n) Fe7W6 АР13, 0,4929 0,268 [4,5]
R'i т
Существование фаз 6, т) [Э, Ш, 6] не подтвердилось в более
поздних работах. Показано, что фаза п существует только в присут-
ствии О или N.
Литература
с ан Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
2Л Д ^0Д РеД Л А’ Петровой. М.: Металлургия, 1985. 184 с.
/ О А ^?агРаммы состояния двойных и многокомпонентных систем на основе железа.
\ ' a»HbK, П.Б. Будберг, С П. Алисова и др. М.: Металлургия, 1986. 440 с.
248 «л Е” Swartzendruber L.L // Bull. Alloy Phase Diagrams. 1986. V. 7. N 3. P.
° ""**3 4.
Raman A. // prOc. Indian Acad. Sci. 1967. V. 65. P. 256-264-
6 p 7х-’ Jack K.H. 11 J. Less-Common Met. 1985. V. 114. P. 123-127.
• Goldschmidt H.L // J. iron Steel Inst. (London). 1960. N 194. P. 169-180.
E.H. Шефтель
518
Fe—Nd
Fe—Nd. ЖЕЛЕЗО-НЕОДИМ
Диаграмма состояния Fe—Nd построена методами ДТА, рентге-
новского и микроструктурного анализов [1]. Диаграмма состояния
[1] в общем подтверждена в более поздней работе [2], в которой
более подробно исследована ее часть со стороны Nd. В отличие от
более ранней работы [3], в работах [1,2] в системе достоверно
установлено существование только одного соединения Fe17Nd2,
которое образуется по перитектической реакции при температуре
1210 °C [1,2]. По данным работы [2], температура образования
соединения Fe17Nd2 (Fe7Nd) составляет 1185 °C. Найденное в работе
[3] соединение Fe2Nd, по мнению авторов работы [1], представляет
собой тройное соединение, стабилизированное О2 в результате терми-
ческих нагревов в плохом вакууме.
В более поздней работе [4] тщательно проведенными метода-
ми дифференциального термического и микроструктурного анализов
Рис. 283. Fe—Nd
Fe—Nd
519
было, однако, установлено образование еще одного соединения
Fe Nd5 по перитектической реакции при температуре между 770
и 7^5 °C. В остальном данные работы [4] согласуются с данны-
ми работ [1,2].
'{Представленная на рис. 283 диаграмма состояния Fe—Nd постро-
ена’&тгл'асн0 работе [1] с дополнением по данным работы [4] в части
образования соединения Fe17Nd5 и по данным работы [2] в области,
богатой Nd, с небольшой корректировкой на температуры плавления
и полиморфного превращения Nd.
Температура эвтектической реакции Ж ₽ Fe17Nd5 + (aNd) состав-
ляет 684 °C [1], 684,5 С [2]. По данным работы [3], эвтектическое
взаимодействие со стороны Nd протекает при температуре 640 °C и
содержании 75 % (ат.) Nd. Концентрация Nd в эвтектике 76,5 %
(ат.) на диаграмме указана по данным работы [2].
Растворимость Nd в (yFe), определенная методом рентгеноспек-
трального анализа диффузионных пар, уменьшается от 0,31 % (ат.)
при 1100 °C до 0,245 % (ат.) при 950 °C, а в (aFe) она составляет
0,31 % (ат.) при 880 °C и 0,29 % (ат.) при 860 °C [5]. Согласно
работе [6] растворимость Nd в (aFe) составляет -0,02 % (ат.).
Кристаллическая структура Fe17Nd2 — ромбоэдрическая типа
Th2Zn17 (ЯЯ79, пр. гр. R3m) с а = 0,859 нм, с = 1,245 нм [7].
В работе [8] в области концентраций около 25 % (ат.) Nd под-
тверждено образование соединения Fe17Nd5 с гексагональной крис-
таллической решеткой ЛР228, пр. гр. Рь^/тст с параметрами а =
-2,0214(8) нм, с= 1,2329(8) нм.
Литература
1. Schneider G., Henig Е.-Т., Petzow G., Stadelmaler H.H. // Z. Metallkunde. 1987.
Bd. 78. N 10. S. 694-696.
2. Faudot F., Harmelin M., Bigot J. // Scr. Metall. 1989. V. 23. N 5. P. 795-798.
3. Терехова В.Ф., Маслова Э.В., Савицкий E.M. // Изв. АН СССР. Металлы.
*965. № 3. С. 128-130.
4. Landgraf F.J.G., Schneider G.S., Villas-Boas V., Missel F.P. 11 J. Less-Common
Met. 1990. V. 163. N 1. P. 209-218.
, 5- L* Xingkang, Wang Zhigurn, Lin Guoquan, Zhang Weijing, Pan Shuning // Proc.
Nat. Symp. Phase Diagr., Shenyang, Nov. 20—24. 1990. Shenyang. 1990. P. 125—126.
’ Kuchaf L., Repiska L., Komorova L. et. al. // Sb. Vfidekych Praci Vysoke Skoly
°anske. Ostrava. 1980. V. 26. P. 119-136.
n_. ’ Крипякевич П.И., Терехова В.Ф., Заречнюк O.C., Буров И.В. /// Кристаллог-
Рафия. 1963. Т. 8. № 2. С. 268.
'Moreau J.M., Paccard L., Nozieres J.P. et. al. // J. Less-Common Met. 1990. V.
03 N 2. P. 245-251.
В.П. Полякова, Л.Л. Рохлин
520
Fe-Ni
Fe—Ni. ЖЕЛЕЗО-НИКЕЛЬ
Сплавы системы Fe—Ni исследованы во многих работах, строение
их в высокотемпературной части изучено хорошо, однако добиться
полной ясности в строении низкотемпературной части диаграммы
состояния не удалось из-за возникающих экспериментальных труд-
ностей. Анализ и обобщение экспериментальных результатов прове-
дено в работах [1—5]. При высоких температурах система Fe—Ni
(рис. 284) характеризуется существованием непрерывного ряда
Ni,*/» (по массе)
Рис. 284. Fe-Ni
Fe—Ni
521
вердых растворов между (yFe) и (Ni). Отмечается, что интервал
между температурами ликвидуса и солидуса составляет всего лишь
5—10 °C. Линии ликвидуса и солидуса плавно понижаются от пери-
тектической горизонтали при температуре 1513 °C [2] или 1511 °C
ГЗ 4] до минимального значения при температуре 1425 °C в интерва-
ле'концентраций 60—70 % (ат.) Ni [2] или 1436 °C при концентра-
ции 68 % (ат.) Ni [1], 1439 °C при концентрации 69 % (ат.) Ni
[3,4], затем повышаются до температуры плавления Ni.
Максимальная растворимость Ni в (<5Fe) при температуре перитек-
тики составляет -4,1 % (ат.) [2] или 4,2 % (ат.) [3,4]. На основе
анализа положения перитектики (6) + Ж (у) установлено содержа-
ние Ni в фазах: Ж — 5,5 % (ат.) [3,4] или 5,8 % (ат.) [2]; (у) —
4,8 % (ат.) [3,4] и 4,5 % (ат.) [2].
При понижении температуры имеет место образование промежу-
точных упорядоченных фаз, обладающих областью гомогенности:
FeNi3 со структурой типа AuCu3 (символ Пирсона сР4, пр. гр.
РтЗт), FeNi — типа AuCu (символ Пирсона tP2, пр. гр. РМттт),
Fe3Ni, структура которой до сих пор не установлена [2].
В низкотемпературной области на линии точек Кюри возникает
трикритическая точка (462 °C, 48 % (ат.) Ni), ниже которой проис-
ходит расслоение на парамагнитную (уп) и ферромагнитную (уф)
фазы (обе с неупорядоченным расположением атомов). При темпера-
туре 389 °C из-за этого возникает монотектоидная горизонталь [3,4].
При температуре 516 °C ферромагнитный твердый раствор (Уф)
упорядочивается, образуя фазу FeNi3 (максимум температуры упоря-
дочения смещен от идеального состава). При температуре 345 °C
происходит эвтектоидный распад (уф) 11 (aFe) + FeNi3 [3,4].
В обзоре [6] в общем приведен такой же вид диаграммы состояния
с той лишь разницей, что отсутствует трикритическая точка (462 °C,
48 % (ат.) Ni) и соответствующая ей монотектоидная горизонталь
при температуре 389 °C.
Литература
, Диаграммы состояния двойных и многокомпонентных систем на основе железа.
О.А. Банных, П.Б. Будберг, С П. Алисова и др. М.: Металлургия, 1986. 440 с. .
2. Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
ансл. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
3 Chuang Y.Y., Chang Y.A., Schmin R., Lin J.C. // Metal. Trans. A. 1986. V. 17.
N »• P. 1361-1372.
Chuang Y.Y., Hsien K.C., Chang Y.A. // Metal. Trans. A. 1986. V. 17. N 8. P.
1380.
s- Hertzman S., Sundman В. 11 Scand. J. Met. 1985. V. 14. N 1. P. 94-102.
N , ' S^artzendruber L.J., Itkin V.P., Alcock C.B. // J. Phase Equilibria. 1991. V. 12.
N 3. p. 288-312.
B.H. Кузнецов, В.П. Полякова
522
Fe—O
Fe—О. ЖЕЛЕЗО—КИСЛОРОД
Сплавам системы Fe—О посвящены многие исследования [X, ”,
Ш], их результаты обобщены в работах [1,2]. На рис. 285 приведена
диаграмма состояния Fe—О согласно работе [2].
В системе Fe—О установлено существование трех соединен и й:
вюстита (близко к FeO), магнетита (Fe3O4> и гематита (Fc2O3).
Рис. 285. Fe—О
Fe—O
523
Вюстит — соединение переменного состава, близкого к FeO, устой-
о при избытке кислорода. Вюстит образуется при температуре
U30—1435 °C по перитектической реакции Ж + Fe3O4 * FeO. Об-
ласть гомогенности этой фазы определена и подробно описана в
пяботах [X, Э, Ш]. По данным электрохимических измерений [Ш],
области гомогенности вюстита при различных температурах приведе-
ны ниже.
Температура, °C................
Содержание О, % (ат.)........
Температура, °C...... 700
1000 900 800
51,13-52,89 51,18-52,69 51,25-52,52
650 600 570
Содержание О, % (ат.) 51,34-52,44 51,36-52,30 51,43-51,84 51,60
Вюстит по эвтектоидной реакции распадается FeO (aFe) + Fe3O4
при температуре 560 °C; эвтектоидная точка расположена при содер-
жании 51,41 % (ат.) О.
Магнетит Fe3O4 (57,15 % (ат.) О) плавится с открытым максиму-
мом при 1600 °C. В сплавах, более богатых О, при температуре
1583 °C протекает реакция Ж * Fe3O4 + О2- ® равновесии с О2
магнетит находится при температуре до 1457 °C.
Гематит Fe2O3 образуется по реакции Fe3O4 + О2 * Fe2O3 при
температуре 1457 °C. Он существует в стабильной форме aFe2O3 и
метастабильных формах [Э, Р, 21.
В богатых Fe сплавах при высоких температурах наблюдается
область несмешиваемости; температура монотектики составляет
1523 °C; в монотектике содержится 0,56 % (ат.) О. При температуре
1371 °C кристаллизуется эвтектика Ж * (yFe) + FeO.
При повышении температуры растворимость О в жидком Fe
увеличивается [1]:
Температура, °C................ 1600 1700 1800 1850 1900
Растворимость О, % (ат.)....... 0,86 1,31 1,89 2,52 3,20
При монотектической температуре, по данным различных иссле-
дователей, растворимость О в (SFe) составляет 0,02—0,21 % (ат.)
HU, 3]. В (yFe) при температуре 1345 °C растворяется 0,01 % (ат.)
» а при 950 °C — < 0,02 % (ат.) О. В (aFe) растворимость О не
превышает 0,1 % (ат.) [X]. Данные по растворимости О в Fe требу-
")т уточнения. В работе [4] рассчитано равновесное давление О над
юститом. Кристаллическая структура соединений представлена в
524
Fe—Os
Таблица 201. Кристаллическая структура соединений системы Fe—О
Соединение Прототип Символ Пирсона, пр. гр. Параметры решет- ки, нм Примечани,-
a С
FeO NaCl cF8, Fm3m 0,43088 0,42800 — При 51,5 (ат.) () При 52,8 1 (аз ) О
Fe3O4 Al2MgO4 cF5f>, Fd3m 0,83940 — [Р1
aFe2O3 aAl2O3 hR\Q, R3c 0,54271 0,50345 1,3749 a = 55,263' [I IP]
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа Игр.
с англ. / Под ред. Л.А. Петровой. М.: Металлургия. 1985. 184 с.
2. Диаграммы состояния двойных и многокомпонентных систем на основе железа
/ О.А. Банных, П.Б. Будберг, С.П. Алисова и др. М/. Металлургия. 1986. 440 е
3. Kusano Alihito, Ito Koin, Sano Kokichi. // Trans. Iron Steel Inst. Jpn. 197f, V
10. N 2. P. 78-82.
4. Spencer P.Y., Kubaschewski О. 11 Calphad. 1978. V. 2. N 2. P. 147—167
С.П. Алисова
Fe—Os. ЖЕЛЕЗО-ОСМИЙ
Немногочисленные литературные данные о взаимодействии Fe и
Os приведены в работах [X, Э, Ш, 1—3].
Гипотетическая диаграмма Fe—Os (рис. 286) построена по данным
работ [2,4]. Os повышает температуру плавления Fe и температуру
его полиморфного перехода 5 - у- Перитектическая реакция Ж +
+ (yFe) * (6Fe) протекает при 1543 °C [2] или 1552±15 °C [3]. Тем-
пература перитектической реакции Ж + (Os) * (yFe) установлена
равной 1720 °C [3]. Такая же температура определена в работе |2] -
Максимальная растворимость Os в (6Fe) ~ 2,7 % (ат.) [1,2]. По
данным работы [5], растворимость Os в Fe при температуре 1543 С
не превышает 1,68 % (ат.). Протяженность области (SFe) + 'у! с>
составляет - 2,7 — 3,0 % (ат.) Os.
По аналогии с системой Fe—Ru в данной системе следует ожпдлть
большой растворимости Fe в Os [2]. Область (yFe) твердого распора
расширяется за счет (aFe). Температура эвтектоидного распада
(yFe) (aFe) + (Os) принимается равной -620 °C [3].
Fe—Os
525
Fe Os, °/o (am) Os
Рис. 286. Fe—Os
Литература
/ п^д ДиагРаммы состояния двойных и многокомпонентных систем на основе железа,
if к*НЬ1Х’ П'Б’ Будберг, С.П. Алисова. М.: Металлургия, 1986. 440 с.
с - J" Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
гл. / под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
р 396^|gtzendruber L.J., Sundman В. // Bull. Alloy Phase Diagrams. 1983. V. 4. N 4.
Server Moffatt W.G. The Handbook of Binary Phase Diagrams. New York: Business Growth
vicesl General Elektric Co. Schenectady, 1976. 1977. V. 1,2. 658 p.
L-> RepiskA L., KomorovA L. // Sb. Vfidekych Poraci Vysok6 Skoly
iKe Ostrava. 1980. V. 26. P. 119-136.
А.Л. Татаркина, Т.П. Лобода
526
Fe-P
Fe—P. ЖЕЛЕЗО-ФОСФОР
Особенности взаимодействия Fe с P рассмотрены в справочниках
[X, Э, Ш] и обобщены в работах [2,1]. Представленная на рис. 287
диаграмма построена по данным работы [1]. В сплавах системы Fc—Р
установлено образование пяти соединений: Fe3P, Fe2P и более бога-
тые Р соединения FeP, FeP2 и FeP4. Фосфор выклинивает фазу (yFe)
и стабилизирует твердый раствор на основе Fe. Соединение Fc}P
образуется по перитектической реакции при 1166 °C. Соединение
Р, 7° (по массе)
Рис. 287. Fe—Р
Fe—Pb
527
p плавится с открытым максимумом при 1370 °C. При температу-
^050 °C плавится равновесная эвтектика (aFe) + Fe3P, а при
^мпературе 930 °C метастабильная (aFe) + Fe2P эвтектика (при
быстром охлаждении). Максимальная растворимость Р в (aFe) состав-
4 52 % (ат.), а в (yFe) соответствует 0,55 % (ат.) Р при темпе-
ратуре 1150 °C, область (yFe) + (aFe) при этих условиях находится
в пределах 0,55—1,23 % (ат.) Р. Представленная в работе [2] диаг-
рамма состояния Fe—Р в основном построена по данным работы [1].
Кристаллическая структура фосфидов железа приведена в
табл. 202.
Таблица 20 2. Кристаллическая структура соединений системы Fe—Р
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b С
Fe3P Ni3P f/32, /4 0,9100— 0,9108 — 0,4455- 0,4460 [2]
Fe2P Fe2P hP9, Р62т 0,5864— 0,5867 — 0,3456— 0,3460 [2]
FeP MnP оР8, Рпа2} 0,5187— 0,5196 0,57909— 0,5794 0,3095— 0,3099 [Р, 2]
FeP2 FeS2 (марка- зит) оР6, Рппт 0,4971— 0,4985 0,5654— 0,5668 0,2719- 0,2731 [2]
FeP4* •p-1 01,48°. тРЗО, Р2!/с 0,4918 1,3670 0,7002 [2]
Литература
1- Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
с англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
2. Okamoto Н. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 4. P. 404-412.
СП. Алисова
pe—Pb. ЖЕЛЕЗО-СВИНЕЦ
Диаграмма состояния Fe—Pb характеризуется незначительной
воримостью компонентов в жидком и твердом состояниях [1,2].
ствуютеРНЫе сведения образовании соединений в системе отсут-
n Ра^Оте 1Ш] указано на протекание монотектической реакции
р температуре 1530 °C и концентрации 0,013 % (ат.) РЬ.
528
Fe—Pd
a) S)
Рис. 288. Fe—Pb
По данным работы [1], температура монотектики практически совпа-
дает с температурой плавления Fe, содержание РЬ в монотектике
составляет около 0,05 % (ат.). Растворимость РЬ в жидком Fe при
температуре 1550—1600 °C равна -0,07 % (ат.) [Э] (-0,05 % (ат.)
[Ш]). В работе [2] приводятся данные, согласно которым раствори-
мость РЬ в жидком Fe заметно выше и составляет 0,081—0,244 %
(ат.) в интервале температур 1550—1700 °C, увеличиваясь с повыше-
нием температуры. Растворимость РЬ в твердом Fe при монотекти-
ческой температуре равна 2,7 10’4 % (ат.), а растворимость Fe
в жидком РЬ при температуре 600 °C — 8,5 • 10'4 % (ат.) |Ш|.
В интервале температур 1302—1465 °C растворимость Fe в жидком РЬ
составляет 0,08—0,21 % (ат.). На рис. 288 приведены части диаграм-
мы состояния Fe—РЬ со стороны Fe (рис. 290, а) и РЬ (рис. 290, б) ио
данным работы [1J.
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа. Игр
с англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
2. Burton В. И J. Phase Equilibria. 1991. V. 12. N 2. Р. 200-202.
С.П. Алисова
Fe—Pd. ЖЕЛЕЗО—ПАЛЛАДИЙ
Диаграмма состояния Fe—Pd была построена впервые в работе 111 •
Позднее диаграмма состояния системы неоднократно уточня-
лась экспериментально и методами термодинамического расчета
[Э, Ш, 2-8].
Установлено, что Pd и Fe неограниченно растворимы в жидком
состоянии. При понижении температуры сплавы кристаллизуются с
Fe~Pd
529
Рис. 289. Fe—Pd
образованием непрерывного ряда твердых растворов аустенитного
класса (рис. 289). Линии ликвидуса и солидуса пересекаются в точке
минимума при температуре 1304 °C и концентрации 48 % (ат.) Pd
1310 °С И 50 °/о (ат,) Pd [8]-
до 147я*КИ Pd к Ре повышают температуру перехода (6Fe) 11 (yFe)
'Q С [Э] и температуру перитектики Ж + (SFe) (yFe, Pd).
ет э оС^ВОримость Pd в (6Fc) при температуре перитектики составля-
/о (ат.) [Э] или 3,7 % (ат.) [8] и 0,045 % (ат.) при темпера-
530
Fe—Pd
туре 1480 °C Гб]. В твердом состоянии (yFe, Pd) претерпевает пре-
вращения, связанные с полиморфизмом Fe и образованием соедине-
ний FePd (у t) и FePd3(y2).
Исследования, проведенные методами высокотемпературных
рентгеновского, магнитного и дилатометрического анализов, посо-
лили уточнить положение фазовых областей в системе при темпера-
туре ниже 950 °C [4,5]. Имеет место образование монотектоида при
температуре 815±20 °C. Растворимость Pd в (aFe) при температуре
монотектоида равна ~3,5 % (ат.). Критическая температура мо»ю-
тектоидного купола составляет -900 °C, монотектическая горизон-
таль простирается до 23 % (ат.) Pd [4].
Эвтектоид между (aFe) и упорядоченной фазой FePd наблюдается
при температуре 620 °C и содержании 43 % (ат.) Pd [4], что хорошо
согласуется с более ранними работами [3]. По данным работы !5],
температура эвтектоида равна 605±8 °C и содержание в нем Pd
составляет 46 % (ат.) (рис. 289).
В отличие от данных работы [3] в работах [4,5] показано, что
максимальная температура образования FePd3 (820±20 °C) выше
максимальной температуры образования FePd (790±20 °C). Обе
упорядоченные фазы образуют между собой эвтектоид при темпера-
туре 760±30 °C и содержании 61,5 % (ат.) Pd [4,5]. Двухфазная
область между соединениями FePd и FePd3 заключена в интервале
концентраций 60,2—62,6 % Pd [4].
Кристаллическая структура соединений приведена в табл. 203.
Таблица 203. Кристаллическая структура соединений системы Fe — Pd
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
FePd AuCu tP2, Р4/ттт 0,3860 0,3855 0,3730 0,372 [2! [41
FcPd3 AuCu3 сР4, РтЗт 0,3848— 0,3851 — [21
0,3853 [41 __
Литература
1. Grigoriew А.Т. // Z. Anorg. All. Chem. 1932. Bd. 209. S. 295-299.
2. Савицкий E.M., Полякова В.П., Тыл кина М.А. Сплавы палладия. М.: II.'vmi-
1967. 214 с.
3. Куприна В.В., Григорьев А.Т. // Журнал неорганической химии. 1959 1 4
№ 3. С. 655-661.
4. Raub Е., Beeskow Н., Loebich О. // Z. Metallkunde. 1963. В. 54 !()-
S. 549-552.
Fe—Pm
531
5. Kussmann A., Jessen K. // Z. Metallkunde. 1963. B. 54. N 9. S. 504—511.
6. Kuchaf L., Repiska L., KomorovS L. // Sb. Vedekych Praci Vysok6 Skoly Banske.
bstrava- 1980. V. 26. P. 119—136.
7. Mafsui Masaakt, Yamada Hajime, Adachi Kendo // J. Phys. Japan. 1980. V. 48.
f] ft. p. 2161—2162.
8. Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
с англ- / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
В.П. Полякова
Fe-Pm. ЖЕЛЕЗО—ПРОМЕТИЙ
Гипотетическая диаграмма состояния системы Fe—Pm построена
на основании положения о близости электронного строения и хими-
ческих свойств Pm с Nd и Рг и, следовательно, аналогичного этим
системам характера взаимодействия Pm с Fe [1]. Она представлена
на рис. 290 по данным работы [1] и скорректирована по температу-
рам плавления и температурам полиморфных превращений чистых
металлов. В системе предполагается образование двух интерметал-
лических соединений Fe17Pm2 и Fe2Pm и кристаллизация эвтектики
в области сплавов, богатых Pm. Соединения характеризуются
отсутствием областей гомогенности. Определена температура эвтек-
тического превращения — 680 °C и эвтектический состав — 73 %
(ат.) Pm.
Взаимная растворимость Fe и Pm очень мала.
532
Fe—Pr
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа- Г1е
с англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
Н.П. АбруКина
Fe—Pr. ЖЕЛЕЗО-ПРАЗЕОДИМ
Система Fe—Pr (рис. 291) приведена на основе аналитического
обзора [1] и работы [2].
В системе Fe—Pr по перитектической реакции при температуре
1108 °C образуется соединение Fe17Pr2. Обнаруженное в работе [3]
соединение Fe7Pr с гексагональной решеткой, по мнению авторов
работы [4], соответствует соединению Fe17Pr2. Указанное в работах
Рис. 291. Fe—Pr
Fe-Pt
533
fl 5] соединение Fe2Pr, как установили авторы работы [2], не явля-
йся стабильным. В работе [2] сплавы получали из металлов высокой
частоты в атмосфере Аг. Сплавы отжигали в откачанных до выского
вакуума и запаянных кварцевых трубках при температурах 600, 500
и 400 °C в течение длительного времени. Исследование проводили
методами дифференциального термического и рентгеновского анали-
зов и электронной дифракции. Помимо стабильного соединения
Fe Рг2 было установлено два метастабильных соединения Fe,Pr со
структурой типа MgZn2 (символ Пирсона АР12, пр. гр. РЬ^/ттс,
параметры решетки а = 0,526 нм, с = 0,862 нм) и Fe2Pr со структу-
рой типа MgCu2 (символ Пирсона сА24, пр. гр. Fd/im, параметр
решетки а = 0,676 нм). При переходе к стабильному состоянию
структурная перестройка проходит по схеме Fe2Pr (тип MgZn2) -
- Fe2Pr (тип MgCu2) - Fe1?Pr2.
При температуре 640+3 °C и содержании Рг кристаллизуется
эвтектика Ж * (аРг) + Fe17Pr2 [2]. Соединение Рг в эвтектике
составляет 79 % (ат.) [1].
Кристаллическая структура соединений приведена в табл. 204.
Таблица 20 4. Кристаллическая структура соединений системы Fe — Рг
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
Fel7Pr2 Th2Znp AR19, R3m 0,8582 0,858 1,2462 1,247 [4] [6]
Литература
1- Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
С англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
2. Бурханов Г.С., Илюшин А.С., Кольчугина Н.Б. и др. / Металлы. 1994. № 5.
С. 163-169.
3. Ray А.Е., Sternat К., Feldman D. // Rare Earth Research New-York: Cordon and
breach. Sciene Publishers Inc., 1964. P. 443-457.
J*- Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
и Редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
I „Диаграммы состояния двойных и многокомпонентных систем на основе железа.
л ^анных> П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с.
р Крипякевич П.И., Франкевич Д.П. // Кристаллография. 1965. Т. 10. № 4.
__ В.П. Полякова
e-Pt. ЖЕЛЕЗО—ПЛАТИНА
НЫ]?ИагРа™У состояния Fe—Pt исследовали неоднократно различ-
и методами физико-химического анализа [X, Э, Ш, 1—3].
ния РИС’ представлен обобщенный вариант диаграммы состоя-
согласно работе [1]. Сплавы Fe—Pt характеризуются очень узким
534
Fe-Pt
Рис. 292. Fe-Pt
интервалом кристаллизации. Pt повышает температуру переход?
(yFe) ** (6Fc) до 1519 °C (температуры перитектической реакции Ж-
+ (6Fe) * (yFe, Pt)) и снижает температуру перехода (aFe) ** !гс '
Перитектическая реакция Ж + (6Fe) ** (yFe, Pt) при температур^
1519 °C происходит при концентрациях Pt, % (ат.), в фазах: Ж
3,6, (6Fc) — 2,3 и (yFe, Pt) — 2,5. При увеличении концентрации
более 3,6 % (ат.) линия ликвидуса опускается до очень размыт
Fe-Pt
535
имума, температура которого почти совпадает с температурой
перитектической реакции^
Диаграмма состояния re—Pt относится к типу диаграмм с откры-
той у-фазовой областью. При понижении температуры в области
твердого раствора (yFe, Pt) образуются три упорядоченных фазы:
Fe Pt(Yi)> FePt(y2), FcPi3(y3). Граница фазы Fe3Pt установлена по
данным магнитных, дилатометрических и рентгеновских исследова-
ний. Область гомогенности Fe3Pt 19—33 % (ат.) Pt. Указывается на
существование стабильной области в интервале температур 600—
740 °C [1]. Предполагается, что между (aFe) и Fe3Pt происходит
эвтектоидная реакция при температуре -550 °C и содержании 15 %
(ат.) Pt [1]. Превращение фазы FePt из упорядоченного в разупоря-
доченное состояние исследовали в ряде работ. В обобщенном виде
результаты этих исследований приведены на рис. 292 по данным
работ [X, 1]. Гипотетическую максимальную температуру упорядоче-
ния -1300 °C определили по аналогии системы Fe—Pt с системой
Fe—Pd [1].
Методом высокотемпературного рентгеновского анализа исследова-
ли сплавы системы в области существования фазы FePt3. Максимум
(YFe, Pt) ** (Fe3Pt) превращения наблюдается при температуре
1350 °C [4]. В работе [5] подтверждено, что диаграмма состояния
Fe—Pt в области существования промежуточных фаз FePt и FcPt3
имеет эвтектоидный характер. Однако эвтектоидная температура
требует уточнения.
Кристаллическая структура соединений представлена в табл. 205.
Таблица 205. Кристаллическая структура соединений системы Fe — Pt [2J
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а С
Ре3РцУ1) Cu3Au сР4, Рт3 т — —
FePt(Y2) CuAu tP2, Р4/ттт 0,2719 0,3722
FePt3(y3) Cu3Au сР4, РтЗт — —
Литература
с янгл.^г?ШеВСКИ О' Диаграммы состояния двойных систем на основе железа: Пер.
2-Диаг°Д РЕД Петровой. М.: Металлургия, 1985. 184 с.
ОЧМвочник / ~Ь1.С0СТ0ЯНИя двойных и многокомпонентных систем на основе железа.
440 с. и ™- Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986.
Пл*Тииовь1х1^о” Е’М., Полякова В.П., Горина Н.Б., Рошан Н.Р. // Металловедение
4. Cranele М': Металлургия, 1975. 424 с.
5- Власов! Е JhrW JA' " PhU MaS 1962- v 7- p 207-212.
* 30. N[o 5 q 980 985П°Ж1,ИКОВа ТГ1‘ Физика металлов и металловедение. 1970.
А. Л. Татаркина, Е.М. Соколовская
536
Fe—Pu.
Fe—Pu. ЖЕЛЕЗО-ПЛУТОНИЙ
Диаграмма состояния Fe—Pu, по данным работ [Э, 1—4], вострое
на методами дифференциального термического, рентгеновского
микроструктурного и дилатометрического анализов во всем интервале
концентраций.
Диаграмма состояния Fe—Pu (рис. 293) приведена по данным
работ [Э, 1]. В системе образуются два интерметаллических соедине-
ния Fe2Pu и FePu6. Соединение Fe2Pu плавится конгруэнтно при
Ри, ’/<> {по f'acce)
Рис. 293. Fe—Pu
Fe—Pu
531
°C и существует в трех модификациях с температурами поли-
^гхЬных превращений около 1050 и 900 °C. Связанные с полимор-
превращениями Fe2Pu нонвариантные превращения в твердом
££тоянии при температурах 1020 и 760 °C фиксируются при дилато-
^мтоическом анализе [Ш]. Температура последнего, однако, ближе
М точке Кюри железа. Соединение FePu6 образуется по перитекти-
£е[кой реакции Ж + Fe2Pu * FePu6 при температуре 428 °C. Соеди-
нения не обладают заметными областями гомогенности. В сплавах
«гай системы кристаллизуется две эвтектики: Ж * (yFe) + Fe2Pu при
температуре 1165 °C и содержании 18 % (ат.) Pu; Ж ** (6Pu) + FePu6
при температуре 410 °C и содержании ~90 % (ат.) Pu.
Растворимость Pu в (aFe) при температурах 847—877 °C составля-
ет <0,02 % (ат.), в (yFe) при 977—1007 °C -0,05 % (ат.), а при
1297 °C ~1 % (ат.) [1].
Фазовые равновесия в сплавах на основе Pu отличаются большой
сложностью в связи с пятью полиморфными превращениями Pu.
Часть диаграммы со стороны Pu (вставка на рис. 295) скорректирова-
на в соответствии с температурой плавления и температурами поли-
морфного превращения Pu, принятыми по данным работы [В1].
Кристаллическая структура соединений приведена в табл. 206.
Таблица 20 6. Кристаллическая структура соединений системы Fe—Pu
Соедине- ние Прототип Символ Пирсо- на, пр. гр. Параметры решетки, нм Источник
а С
«Fe2Pu MgCu2 cF24, Fd3m 0,715-0,719 — [Э, Ш, 1]
yFe2Pu — — — — [1]
₽Fe2Pu MgNi2 ЙР24, Рбъ1тт.с 0,564 1,837 [1]
FePu6 MnU6 tI28, I4/mcm 1,0403 0,5347 [4]
1,041 0,5349 [Э]
1,0404 0,5355 [Э]
Литература
с англ У??шевски О- Диаграммы состояния двойных систем на основе железа: Пер.
2 'диП°Д Ред' ЛА. Петровой. М.: Металлургия, 1985. 184 с.
/ О.Д к ГРаммы состояния двойных и многокомпонентных систем на основе железа
3 м!Г’ Н Е’ Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с.
V. 86. ы а о Р,С’’ Heines H.R., Pearce J.H., Waldron М.В. // J. Inst. Met. 1957/58.
4. Бо P 166—171.
«ой кон^Р A A'’ Кон°беевский C.T., Кутайцев В.И. и др. // Труды II Международ-
Ученых. ^ренции по мирному использованию атомной энергии. Доклады советских
376—395 ' Ядерное горючее и реакторные материалы. М.: Атомиздат, 1959. С.
П.Б. Будберг
538
Fe—Re
Fe—Re. ЖЕЛЕЗО-РЕНИЙ
Диаграмма состояния Fe—Re (рис. 294) построена в работе i Н на
основании обобщения данных работ [2,3]. В работе [2] исследиваЛИ
сплавы с содержанием Re до 40 % (ат.) методом термического и
микроструктурного анализов при высоких температурах. В рабой 13]
исследования проводили методами микроструктурного, рентгенов-
ского и микрорентгеноспектрального анализов, измерения элскцххо-
противления сплавов Fe—Re во всем интервале концентраций в
литом, закаленном (800, 1000, 1500 °C) и гомогенизированном
состояниях.
Рис. 294. Fe—Re
Fe—Re
539
В системе установлено образование ограниченных твердых раство-
на основе исходных компонентов и четырех промежуточных фаз:
вере ReFe2, Re2Fe3, Rc3Fe2, из которых ReFe2 и Re3Fe2 образуются
твердом состоянии по перитектоидным реакциям при температурах
-1400 и 1600 °C соответственно и имеют сравнительно узкие области
гомогенности.
Так как высокотемпературный термический анализ в анализируе-
мых работах [2,3] не применялся, характер образования соединений
ReFe3 и Re2Fe3 и особенности их взаимодействия между собой и
твердым раствором (Re) при температурах выше 1800 °C не опреде-
лены. Вероятно, обе фазы образуются непосредственно из расплава,
что характерно для большинства изученных систем Re с переходны-
ми металлами. Установлено, что соединения ReFeq и Re2Fe3 сущес-
твуют в ограниченном интервале температур. Соединение ReFe3
распадается по эвтектоидной реакции при 1205 °C [2,3] и содержа-
нии 51,5 % (по массе) Re [1] или 52,8 % (по массе) [3]. Соединение
Re2Fe3 распадается при 850 °C и ~72 % (по массе) Re [3]. Область
гомогенности Re2Fe3 составляет -65—15 % Re (по массе). Соедине-
ние ReFe3 обладает очень широкой областью гомогенности -20—65 %
(по массе) (-5—40 % (ат.) Re), границы которой со стороны Re
требуют уточнения.
Сложный характер диаграммы состояния, прилегающей к Fe,
определяется полиморфизмом последнего. Отмечается образование
значительных гомогенных областей на основе 6Fe, уРе и “Fe [2]. Re
повышает температуру плавления Fe. Твердый раствор (6Fe) образу-
ется по перитектической реакции Ж + ReFe3 ** (6Fe) при темпе-
ратуре 15^0 °C [2]. Эвтектоидная реакция (6Fe) ** ReFe3 + (yFe)
протекает при температуре 1375 °C и содержании -8 % (ат.) [22 %
(по массе)] Re [2]. Твердый раствор (aFe) образуется по перитекто-
идной реакции (yFe) + ReFe2 * (aFe) при температуре 895 °C [2,3].
На кривых температур фазового перехода (yFe) ** (aFe) наблюдается
минимум при 800 °C и -10 % (ат.) (27 % (по массе)) Re [2]. Темпе-
ратура магнитного превращения падает до 680 °C для сплава с 12 %
(ат.) [30 % (по массе)] Re [2].
Т
____2й Ц а 2 0 7- Кристаллическая структура соединений системы Fe—Re
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a С
RezFe3 ри ГР.30, 0,902 0,469 14]
Re3Fe2 (фаза о) Р42/тпт 0,904 0,472 [2]
рМп сР20, Р4,32 0,643 — 151
540
Fe—Rh
Сведения о кристаллической структуре соединений приведены в
табл. 207.
В работе [6] сообщается о существовании в системе соединения
Re2Fe со структурой аМп (символ Пирсона с/58, пр. гр. 743ш> с
параметром а = 0,8978 [6], которое образуется при температурах
950—1200 °C и стабильно до 750 °C.
Литература
1. Савицкий Е.М., Тылкина М.А., Левин А.М. Сплавы рения в электронике м
Энергия. 1980. 216 с.
2. Eggers Н., Mitt K.W. // Eisenforschung. 1938. Bd. 20. S. 147-
3. Иютипа И.А. Исследование диаграмм состояния и некоторых физико-химичес-
ких свойств сплавов рения с элементами подгруппы железа: Автореф. дис. канд. хим.
наук. М. 1974. 26 с.
4. Копецкий Ч.В., Шехтман В.Ш., Агеев Н.В., Савицкий Е.М. // ДАН СССР
1959. Т. 125. № 1. С. 87-88.
5. Крипякевич П.И., Кузьма Ю.Б., Протасов В.С. // Рений. М.: Наука. 1 964
С. 180.
6. Агеев Н.В., Шехтман В.Ш. // ДАН СССР, 1962. Т. 143. № 5. С. 1091-1093.
М.А. Тын.ина
Fe—Rh. ЖЕЛЕЗО—РОДИЙ
В справочной литературе [X, Э, Ш, 1, 2] приведены эксперимен-
тальные данные и гипотетические варианты диаграммы состояния
системы Fe—Rh. На рис. 295 представлена диаграмма состояния
Fe—Rh, построенная на основе обобщения данных работы [31, в кото-
рой использованы литературный материал по фазовым равновесиям
и расчеты с использованием данных по термодинамическим сиой-
ствам компонентов, которые подвергали оптимизации. Поведение
жидкой фазы описывали моделью регулярных растворов с одним
параметром взаимодействия.
Система характеризуется непрерывным рядом твердых растворов
в области между yFe и Rh при высоких температурах и широкой
областью твердого раствора на основе aFe, который существует в
двух модификациях упорядоченной (а') и неупорядоченной (aFe).
Упорядоченная фаза а' имеет структуру типа CsCl (cP2, нр гр.
РтЗт). Она стабильна до температуры —1300 °C в средней области
концентраций и при -400 °C в области концентраций от -15 Д°
-52 % (ат.) Rh [2,3]. Параметр решетки фазы находится в пределах
0,2929-0,2993 нм [3].
Вблизи эквиатомного состава фаза а' претерпевает превращение
а' ** а", связанное с переходом сплавов из ферромагнитного в анти-
ферромагнитное состояние, которое сопровождается изменением
параметра решетки.
Fe—Rh
541
При температуре 1515 °C [2] или при 1521 ±4 °C [3] в системе
происходит перитектическая реакция (SFe) + Ж « (yFe, Rh). Добав-
ление Rh к Fe понижает температуру (aFe) * (yFe, Rh) превращения
до минимума, который достигается при температуре 625 °C и содер-
жании 20 % (ат.) Rh [1,2] или при 605 °C и -19 % (ат.) Rh [3].
Растворимость Rh в (SFe) требует уточнения. По данным работы [2],
максимальная растворимость Rh в (SFe) составляет -2,9 % (ат.), в
области (SFe) + (yFe, Rh) - -2,9-3,4 % (ат.). В работе [4] расчет-
ным путем определена растворимость Rh в (SFe) при температуре
*515 °C, равная -0,67 % (ат.).
Литература
/ q ’Диграммы состояния двойных и многокомпонентных систем на основе железа.
2 Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с.
с *ИГЛ /Ур?1певски О- Диаграммы состояния двойных систем на основе железа: Пер.
3 Sw г?Д Ред' Я-А- Петровой. М.: Металлургия, 1985. 184 с.
1 Kveh„endruber LJ- // Bull. Alloy Phase Diagrams. 1984. V. 5. N 5. P. 456-462.
Ostrava iao« Bepisk£ L., Komorova L. // Sb. Videkych Praci Vysoke Skoly Bdftske.
“• >W). V. 26. P. 119-136.
А.Л. Татаркина, Т.П. Лобода
542
Fe—Rn, Fe—Ru
Fe—Rn. ЖЕЛЕЗО-РАДОН
Диаграмма состояния Fe—Rn не построена.
Электролитическое Fe при температурах 1200—1300 °C нс адсор-
бирует Rn. На основании этого сделано предположение, что Fe и Rn
не образуют ни твердых растворов, ни соединений [Ш, 1].
Литература
1. Вол А.Е. Строение и свойства двойных металлических систем. М.: Фичмапш
1962. Т. 2. 984 с.
Т.В. ДоОаткина
Fe—Ru. ЖЕЛЕЗО-РУТЕНИЙ
Диаграмма состояния Fe—Ru (рис. 296) построена в соответствии
с результатами дифференциального термического, микроскопическо-
го, рентгеноструктурного и дилатометрического анализов [1,2].
Система характеризуется большой растворимостью Fe в Ru в твердом
состоянии. Твердые растворы на основе Fe (6Fe) и (yFe) образуются
по перитектическим реакциям при температурах 1539 и 1590 °C соот-
ветственно. Добавки Ru расширяют область твердого раствора (yFe)
за счет (aFe) [1]. При температуре -500 °C и содержании 9,3 %
(ат.) Ru [Э] или 9,5 % (ат.) Ru [1] (yFe) распадается на (aFe) +
+ (Ru).
Рис. 296. Fe—Ru
Fe—S
543
дитерагУР3
Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
1 /Под ред- Л.А. Петровой. М.: Металлургия, 1985. 184 с.
с *н^л’_ -аммы состояния двойных и многокомпонентных систем на основе железа:
/ о.А. Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986.
^ПрЯВОЧНИл.- /
44® с. ви Полякова
Ffr-S- ЖЕЛЕЗО-СЕРА
Сведения о диаграмме состояния Fe—S приведены в работах [X,
Э Ш, 1,2]. Обобщенный вариант диаграммы состояния Fe—S пред-
ставлен на рис. 297 по данным работы [1].
В сплавах системы Fe—S образуется два соединения: FeS и FeS2.
Соединение FeS обладает довольно широкой областью гомогенности,
кристаллизуется из расплава при 1188 °C с кристаллической решет-
кой типа NiAs. Для этого сульфида также характерны две низкотем-
пературные модификации с температурами перехода 315 и 138 °C
[1].
При температуре 1365 °C в сплавах системы протекает кататекти-
ческая реакция (6Fe) и (yFe) + Ж. Максимальная растворимость S
в (yFe) составляет 0,09 % (ат.). При 988 °C кристаллизуется эвтек-
тика (yFe) + FeS, эвтектическая точка расположена при 44,6 % (ат.)
S. При температуре 927 °C протекает перитектоидное превращение
(yFe) + FeS ** (aFe). Максимальная растворимость S в (aFe) составля-
ет 0,035 % (ат.). В работе [3] показано, что растворимость S в (aFe)
в функции температуры подчиняется зависимости Igx = 3800/Г +
+ 1,44, где х — концентрация S, % (по массе); Т — темпера-
тура, К.
Фаза FeS2 образуется по перитектической реакции при 743 °C.
Она существует в виде двух модификаций: кубического пирита (тип
и ромбического марказита (тип С18). Температура превращения
марказита в пирит 444,5 °C.
В интервале концентраций FeS—S имеет место расслаивание в
идком состоянии с монотектической реакцией при 1082 °C.
работе [4] была предпринята попытка на основании измерения
^Ругости паров S под расплавом Fe рассчитать изменение активнос-
, теплоты и энтропии смешения в зависимости от содержания S в
^аве; расчет провели для температуры 1400 °C.
Для _ЛУченные термодинамические параметры послужили основой
СЧета части диаграммы состояния системы Fe—S в интервале
КпиТ₽аЦИЙ °~50 % (ат ) S-
Р сталлическая структура сульфидов представлена в табл. 208.
544
Fe—S
Рис. 297. Fe—S
Fe-Sb
545
Т а б л и ц а Соединение 2 0 8 Кристаллическая структура соедиений системы Fe—S [Р]
Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а Ь С
FeS NiAs ЛР4, Р63/ттс 0,3449 — 0,5780
FeS2 (пирит) FeS2 сР12, РаЗ 0,54189 — —
FeS2 (марказит) FeS2 оРб, Рппт 0,4445 0,5425 0,3388
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
С англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
2. Диаграммы состояния двойных и многокомпонентных систем на основе железа.
/ О А. Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с.
3. Herrstein W.H., Beck F.H., Fontana М.С. // Trans. AIME. 1968. V. 242. N 6.
P. 1049-1056.
4. Schtlzmann E. 11 Giessereiforschung. 1972. Bd. 24. N 1. S. 14—16.
, С.П. Алисова
достаточно под-
представлена по
Fe-Sb. ЖЕЛЕЗО-СУРЬМА
Диаграмма состояния этой системы исследована
робно в работах [X, Э, Ш, 1—3]. На рис. 298 она
данным работы [2].
Фаза FeSb (Р) образуется конгруэнтно при температуре 1019 °C
и имеет широкую область гомогенности, простирающуюся при темпе-
ратуре 600 °C от 42,7 до 46,5 % (ат.) Sb [2J. В работе [1] границы
области гомогенности определены при 620 °C от 41,0—41,25 до 48,25—
% (ат‘> Sb, и при температуре 20 °C от 42,25—42,5 до 48,0—
25 % (ат.) Sb. При температуре 996 °C и содержании 34,6 % (ат.)
So кристаллизуется эвтектика (aFe) + FeSb. При температуре 738 °C
И (или 733 °C [1] ) по перитектической реакции Ж + FeSb * FeSb2
образуется соединение FeSb2, имеющее небольшую область гомоген-
. ^СТи % (ат.). При температуре 614 °C (625 °C [1]) и содержа-
и ~99,2 (ат.) Sb кристаллизуется эвтектика FeSb2 + (Sb).
70П аств°РИМ0СТЬ Sb в Fe при температурах 950, 900, 850, 800, 750,
3 37 65°’ 600 °С составляет соответственно 4,89; 4,19; 3,92; 3,70;
с’ ’ 3,08; 2,77 и 2,58 % (ат.). Растворимость Fe в Sb в твердом
Чеп °Янии предельно мала; линия ликвидуса со стороны Sb проходит
779 81СОНЦентрации 85; 82; 78’7; 76 ,7 % (ат.) Sb при температурах
^°19, 848 и 868 °C соответственно [2].
Ристаллическая структура соединений указана в табл. 209.
18 За*. 2144
546
Fe-Sb
Sb,°/o(no массе)
Рис. 298. Fe-Sb
Таблица 20 9. Кристаллическая структура соединений системы Fe—Sb IX J
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b С
FeSb NiAs ЛР4, 0,413 0,517
(P> Рб^/ттс 0,411 — 0,515
0,407 — 0,514
FeSb2 FeS2 оР6, 0,3195 0,5831 0,653
(марказит) Рппт 0,3204 0,583 0,655 _]
Fe—Sc
547
пцтератУРа
1 Пантелеймонов Л.А., Бадтиев Э.Б. М. // Деп. в ВИНИТИ, 1973 г. 10.07.73
№ г_шевски О. Диаграммы состояния двойных систем на основе железа: Пер.
/Под ред- ЛА. Петровой. М.: Металлургия, 1985. 184 с.
С аНаЛ Диаграммы состояния двойных и многокомпонентных систем па основе железа
/ О А Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с.
С.П. Алисова
Fe_Sc. ЖЕЛЕЗО-СКАНДИЙ
Результаты исследований системы Fe—Sc проанализированы в
работах [Э, Ш, 1—4]. Диаграмма состояния Fe—Sc приведена на
рис. 299 согласно работе [1], которая основана на результатах работы
[5], дополненных данными более поздних исследований.
Система характеризуется существованием двух соединений:
ScFe2 и Sc3Fe. Соединение ScFe2 — фаза Лавеса плавится конгру-
энтно при температуре -1600 °C, имеет узкую область гомогеннос-
ти и существует в трех модификациях Л2 и А3 со структурами
типа MgZn2, MgCu2 и MgNi2 [1—4]. При этом отмечается, что моди-
фикация Л2 существует в интервале температур 1295—1525 °C при
дефиците атомов Fe [3]. Соединение Sc^Fe образуется по пери-
тектоидной реакции при температуре -800 °C [1,5]. По данным
работы [4], наиболее богатое Sc соединение отвечает формуле
Fe6 и образуется по перитектоидной реакции при температуре
°C.
Между ScFe2 и исходными компонентами наблюдаются два
эвтектических взаимодействия: Ж ** (yFe) + ScFe2 при температу-
ре 1200 °C и концентрации -9 % (ат.) Sc |5]; Ж => ScFe2 + (0Sc) при
температуре 910 °C и концентрации 80 % (ат.) Sc [5]. В работе [3]
температура первой реакции определена 1280 °C, а второй — 975 °C.
Растворимость Sc в (aFe) и (yFe) не превышает 0,4 % (ат.) [1].
Растворимость Fe в aSc при температуре 700 °C составляет -0,8 %
(ат.) [5].
Кристаллическая структура соединений указана в табл. 210.
Т А б
_ о л и ца 2 1 0. Кристаллическая структура соединений системы Fe-^Sc
Соедине- ние Прототип Символ Пирсо- на, пр. гр. Параметры решетки, нм Источник
а С
MgZn2 API 2, РЬъ/ттс 0,4977 0,8146 [3]
MgCu2 cF24, Fd3m 0,7039 — [3]
ScFe2(A3) MgNi2 hP24, Р63/ттс 0,4974 1,629 [3]
^Sc29Fe6 Sc29Fe6 —, I m3 1,4361 — [4]
18*
548
Fe—Sc
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа Нср-
с англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
2. Диаграммы состояния двойных и многокомпонентных систем на основе железа.
/ О.А. Банных, II.Б. Будберг, СП. Алисова и др. М.: Металлургия, 1986. 440 <.
3. Бодак О.И., Котур Б.Я., Гавриленко И.С. и др. // Доклады АН УССР. Сер л
1978. № 4. С. 366-371.
4. Котур Б.Я., Бодак О.И., Андрусяк Р.И. и др. // Доклады АН УССР Сер !’•
1986. № 11. С. 29-32.
5 Наумкин О.П., Терехова В.Ф., Савицкий Е.М. // Изв. АН СССР Металлы.
1969. № 3. С. 161-165.
В.П. Поляков
Fe—Se
549
Fe—Se. ЖЕЛЕЗО—СЕЛЕН
Диаграмма состояния Fe—Se исследовалась в большом числе работ.
Р зультаты ранних исследований представлены в работах [X, Э, Ш].
п аботах [1,2] даются достаточно полные обобщения результатов
следований этой диаграммы. На рис. 300 приведена диаграмма
состояния Fe—Se согласно позднему и наиболее полному обзору [2].
Se, °/о (по массе)
Диаграмма состояния характеризуется двумя областями расслаива-
я 8 жидком состоянии: со стороны Fe и со стороны Se и образова-
ний ГК0ЛЬКИХ пРомежУточных Фаз в средней области концентра-
• Имеющие место в системе нонвариантные превращения пере-
пои еНЫ В та^л- 211. Фаза 6' образуется непосредственно из расплава
реакТемпеРатУРе 1075 °C, соединение FeSe2 — по перитектической
в сиогИИ ПРИ темпеРатУРе 585 °C. Остальные промежуточные фазы
сме образуются в результате превращений в твердом состоянии.
550
Fe—Se
Фаза у при понижении температуры распадается согласно принятой
в работе [21 диаграмме на две изоструктурные с ней фазы. При :лОм
за фазой, более богатой Se, оставлено обозначение у, а за фазой
более бедной Se, — обозначение у'. Предполагается образование
области несмешиваемости (у + у') с критической температурой
расслаивания около 390 °C. В результате упорядочения фазы у" при
содержании 52—53 % (ат.) Se и температуре -300 °C образуется
pFe7Se2, которая при 180 °C переходит в aFe7Se2.
Таблица 211. Нонвариантные реакции в системе Fe—Se [2J
Реакция Содержание Se в фазах, % (ат.) Se Темпера- тура, °C
Ж « (8Fe) + Ж2 1 0 38 1520
Ж » Ж3 + 8 73 99,98 57,5 790
Ж2 « 8' 52 52 — 1075
Ж + (SFe) * (yFe) 41 0 ? 1400
Ж ° (yFe) + 8' 45 9 48,5 960
8' *• (yFe) + 8 48,5 9 49,5 942
(aFe) + 6 *» р 0 51 49,2 457
5' д 52,8 52,8 — 1065
6 4- yz 52 49,2 >52 350
8' » Ж + 6 62 67 57 849
Ж + 6 » у 99,99 58 58,5 728
Ж + у » FeSe2 -100 61 66,7 585
Ж « FeSe2 + (Se) -100 66,7 -100 -221
В более раннем обзоре [1] принималось, что со стороны Fe моно-
тектическая реакция имеет место при температуре 961 °C, а не при
1520 °C, как сообщается в работе [2]. Соответственно в работе |1]
принималось, что со стороны Fe в системе имеет место эвтектическая
реакция Ж * (6Fe) + б' при 542 °C и концентрации 5,5 % (ат.) Se,
в то время как в работах [2[ эта реакция отсутствует и при темпера-
туре 942 °C имеет место реакция в твердом состоянии б' * (yFe) +
+ б. В работе [1], в отличие от работы [2], предполагается, что фаза
у не претерпевает распада с образованием двух изоструктурных фаз,
одна из которых фаза у'. Фаза у', согласно работе [1], предположи-
тельно образуется при более высоких температурах, чем указано в
работе [2]. В остальном оба варианта диаграммы состояния Fe—Sc.
по данным работ [1] и [2], согласуются между собой, имея лишь
небольшие различия в температурах нонвариантных превращений и
концентрациях особых точек.
Fe—Si
551
В табл. 212 приведены характеристики кристаллических структур
Промежуточных фаз.
блица 21 2. Кристаллическая структура соединений системы Fe—Se [2]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b с
5 РЬО (Р4, P4lnmm 0,377- -0,3829 — 0,5521— —0,5585
8 NiAs hP4, Р63/ттс 0,3548— -0,3701 — 0,5733— -0,5911
Y* — тС14, С2/т 0,6140— -0,6208 0,3493п- -0,3541 1,1118— -1,1290
Y'** — тС7, С2/т 0,624— -0,6269 0,3573— -0,3619 0,5768— —0,5864
0Fe7Se8 — hP45, Р3,21 0,721— -0,72613 — 1,760— -1,7675
«Fe1Se8*** — аРШ, 1,253 0,7236 2,354
FeSe2 FeSz (марказит) оР6, Рппт 0,47890— -0,4804 0,572— -0,5784 0,35755— —0,35834
* Р - 91,0-92,0. •• Р-91-90,98°. а - 89,8°, р - 89,4° Y - 90,0°.
Литература
1- Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
с англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
' 2. Okamoto Н. // J. Phase Equilibria. 1991. V. 12. N 3. Р. 383-389.
Л.Л. Рохлин
₽e-Si. ЖЕЛЕЗО-КРЕМНИЙ
Система Fe—Si изучена очень тщательно. Различным металло-
ведческим и кристаллохимическим вопросам, связанным с -ней,
посвящены более 70 работ [X, Э, Ш, 1, 2]. Диаграмма состояния
nuQ построена в полном интервале концентраций и приведена на
Рис. 301 согласно работам [1, 2].
сплавах системы обнаружено существование твердых растворов
Ре ср!ИЯ На основе (yFe) и (aFe), а также интерметаллических фаз
пЙ?<Р)’ Fe5Si3<n>, FeSi(e), FeSi2(HT) и FeSi2(BT). Предельная
1350В°гИМ°СТЬ & В при 1150 °C равна 3,84 % (ат.) [1], при
С — 0,88 % (ат.) [3]. В богатой Fe области системы твердый
552
Fe—Si
Si, % (по массе)
О 10 10 JO 40 50 60 70 80 90 700
Fe Si, % (am.) Si
Рис. 301. Fc—Si
раствор на основе (aFe) существует в трех полиморфных модифика-
циях: неупорядоченной (aFe) и упорядоченных (а, и а2). Фаза «1
претерпевает полиморфное превращение в интервале температур
965—1150 °C и концентраций 21—27 % (ат.) Si. В работе [4] указано
Fe—Si
553
вставку на рис. 301), что фаза а2 образуется по перитектической
акции Ж + (aFe) a2 при температуре 1302 °C. Высокотемпера-
Р6 ая модификация фазы a t образуется также по перитектической
1рякции Ж + a2 ** at (ВТ) при 1250 °C, а низкотемпературная моди-
^кацИЯ — по перитектоидной реакции a2 + aj(BT) * ocj(HT) при
1156 °C.
Соединения Fe2Si, FeSi и FeSi2 образуются конгруэнтно при
температурах 1212, 1410 и 1220 °C соответственно. Соединение Fe2Si
при температуре 1040 °C эвтектоидно распадается. С участием Fe2Si
кристаллизуются две эвтектики: at + Fe2Si (1200 °C) и Fe2Si + FeSi
(1203 °C). Содержание Si в эвтектиках 32 и 36 % (ат.) соответствен-
но. Соединение Fe5Si3 образуется по перитектоидной реакции при
температуре 1060 °C и эвтектоидно распадается при температуре
825 °C.
Соединение FeSi существует при содержании Si от 49 до 50,8 %
(ат.). Соединение FeSi2 (НТ) образуется по перитектоидной реакции
при температуре 982 °C и при постоянном содержании Si, равном
66,7 % (ат.). Высокотемпературная модификация FeSi2 (ВТ) сущес-
твует при дефиците атомов Fe, имеет область гомогенности, которая
сужается при понижении температуры, и при температуре 937 °C
эвтектоидно распадается на чистый Si и FeSi2 (НТ), участвует в двух
эвтектических равновесиях при температурах 1212 и 1207 °C.
При быстром охлаждении сплавов от температуры 1100 °C и выше
растворимость Fe в Si может достигать 4 % (ат.). При охлаждении
от более низких температур эта растворимость не обнаруживается.
В табл. 213 собраны сведения о структурах силицидов железа.
Таблица 213. Кристаллическая структура соединений системы Fe—Si
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b с
PeSi2(HT) FeSi2 oC48, Стеа 0,98792 0,77991 0,78388 [5]
peSi2(BT) FeSi2 tP3, P4/mmm 0,2683- -0,2698 — 0,5127- -0,5147 [51
FeSi FeSi cP8, P2,/3 0,44891 — — [Р1
Fe3Si3 Mn5Si3 hPl6, P63/mcm 0,6755 — 0,4717 [4]
«1 BiF3 cF16, Fm3m 0,5608 — — [V-C]
«2 CsCl cP2, РтЗт 0,281 — — [V-C]
554
Fe— Sm
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа Не
с англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с. р'
2. Диаграммы состояния двойных и многокомпонентных систем на основе железа
Справочник / О.А. Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия 1дял
440 с.
3. Kuchaf L., RepiskS L., Komorova L. et al- // Sb. Vfidekych Praci Vysoke Skolv
Bdnske. OstravA. 1980. V. 26. P. 119-136. y
4. KOster M. // Trans. Iron Steel Inst. Jap. 1974. V. 14. N 6. P. 387—394.
5. Гладышевский E.M. Кристаллохимия силицидов и германидов. М.: Мега пуп.
гия, 1971. 296 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Fe—Sm. ЖЕЛЕЗО-САМАРИЙ
Сведения об образовании в системе Fe—Sm интерметаллических
соединений приведены в работах [Э, Ш, 1—3]. Полная диаграмма
состояния построена в работе [2] в основном по данным работы [4]
(рис. 302), исследование в которой проводили методами рентге-
новского, микроскопического и дифференциального термического
анализов.
В системе Fe—Sm образуются три интерметаллические соединения
по перитектическим реакциям Ж + (yFe) ** Fe12Sm2 (1280 °C), Ж +
+ FeijSm2 * Fe3Sm (1010 °C) и Ж + Fe3Sm Fe2Sm (900 °C). При
720 °C и содержании 72,5 % (ат.) Sm кристаллизуется эвтектика.
При эвтектической температуре максимальная растворимость Fe в
Sm составляет 0,54 % (ат.), a Sm в Fe при 1280 °C — практически
отсутствует [5].
В работе [6] путем непосредственного сплавления компонентов
был получен сплав, в структуре которого рентгеновским методом
установлено присутствие соединения Fe5Sm. Образование этого
соединения не было подтверждено в работе [4].
Кристаллическая структура соединений описана в табл. 214.
Таблица 214. Кристаллическая структура соединений системы Fe—Sm
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Ис юн пик
a С
FC[ 7Sm2 Zn,? Th2 4R19, R3m 0,8570 1,2440 [1,21
Fe5Sm Cu3Ca hP6, Рб/inmm 0,496 0,415 161
Fe3Sm Ni3Pu hRl2, R3m 0,5187 2,4910 (1.21
Fe2Sm Cu2Mg cF24, Fd3m 0,7417 — [1.21
Fe—Sm
555
Рис. 302. Fe—Sm
Литература
Иий А»Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
2К’иЛ3еМелЬНЫХ металлов- Львов: Вища школа. 1982. 255 с.
с аипп 7г?щевски Диаграммы состояния двойных систем на основе железа: Пер.
3Л'_' *1°Д ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
/ О а Д?агРаммы состояния двойных и многокомпонентных систем на основе железа
х • Ьаиных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с.
puschow K.H.J. // J. l£ss-Common Met. 1971. V. 25. N 2. P. 131-134.
ВШЬо Rchar Г-’ Re pi ski L., KomorovS L. et al. // Sb. VCdekych Praci Vysok6 Skoly
TeM°«rava. 1980. V. 26. P. 119-136.
N l/o D ,s^u к-’ Cherry L.V., Wallace W.E. // J. Phys. Chem. Solid. 1960. V. 16.
/z- P. 123—130.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
556
Fe—Sn
Fe-Sn. ЖЕЛЕЗО-ОЛОВО
Изучению диаграммы состояния Fe—Sn посвящено большое число
работ, достаточно полный перечень которых можно найти в справоч-
ных руководствах [X, Э, Ш, 1].
Диаграмма состояния характеризуется широкой областью несме-
шиваемости в жидком состоянии и наличием нескольких промежу-
точных фаз. Диаграмма состояния Fe—Sn представлена на рис. 304
согласно работе [2] с учетом дополнительных сведений по температу-
рам монотектического превращения и концентрациям участвующих
в нем фаз, приведенных в работе [1]. Протекающая при температуре
ИЗО °C монотектическая реакция имеет вид Ж •* (aFe) + Ж2). Об-
ласть расслоения в жидком состоянии располагается в интервале
концентраций -32—69 % (ат.) Sn. Критическая температура кривой
Рис. 303. Fe-Sn
Fe—Sn
557
лоения 1630 °C. В сплавах системы существует пять интерметал-
^нческих соединений: Fe3Sn, Fe5Sn3, Fe3Sn2, FeSn, FeSn2. Первое из
эзанных соединений образуется по перитектоидной реакции при
°C остальные по перитектическим реакциям при температурах
910 806, 770 и 513 °C соответственно.
у В работе [3] изучали положение петли (yFe) твердого раствора в
сплавах системы Fe—Sn. Сплавы выплавляли в дуговой печи с нерас-
улдуемым вольфрамовым электродом, в качестве шихтовых материа-
лов использовали электролитическое железо чистотой 99,95 % и
олова чистотой 99,99 %. Исследование проводили методами рентге-
новского анализа. При температуре 1100 °C границы между (yFe) /
[(yFe) + (aFe)] и [(yFe) + (aFe)] / (aFe) расположены при концен-
трациях 0,71 и 1,29 % (ат.) Sn, что хорошо согласуется с расчетом
[4], согласно которому при 1100 °C эти концентрации соответственно
равны 0,75 и 1,34 % (ат.) Sn. При температурах выше 1225 °C
данные работы [4] по концентрациям Sn в (yFe) и (aFe) несколько
ниже экспериментальных, полученных в исследовании [3].
Растворимость Sn в (aFe), принятая в последнем обзоре [1],
является максимальной при температуре 900 °C — 9,2 % (ат.) и
уменьшается при понижении температуры, составляя 3,2 % (ат.) Sn
при 600 °C.
Растворимость Fe в жидком Sn при температурах 232, 300, 400,
500, 600, 700, 800, 900, 1000 и 1100 °C (монотектика) равна 0,0022;
0,0098 ; 0,052; 0,17; 0,46; 1,3; 3,2; 5,8; 8,2 и 17,5 % (ат.) соответ-
ственно [1].
В работах [5,6] исследованы различные участки диаграммы
состояния системы, результаты этих работ учтены в варианте приве-
денной диаграммы.
Кристаллическая структура промежуточных фаз указана в
табл. 215.
Таблица 215. Кристаллическая структура соединений системы Fe—Sn [Р]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b c
Fe3Sn Ni3Sn hP8, Pfs^/mmc 0,5458 — 0,4361
Fe3Sn2* — — 1,353 0,534 0,920
FeSn CoSn hP6, P6/mmm 0,5298 — 0,4446
FeSn2 A12Cu 1/12, 14/mcm 0,6533 — 0,5323
_*Моноклинная сингония, р - 103°.
558
Fe-Sr, Fe-T, Fe-Ta
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа цеп
с англ. / Под род. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
2. Treheux D., Guiraldend Р. // Scr. Metal. 1974. V. 8. N 4. P. 363-366.
3. Speight E.A. // Met. Sci. Journ. 1972. V. 6. N 3. P. 57—60.
4. Hillert M. // J. Iron Steel Inst. (London). 1967. V. 205. P. 539—541.
5. Shiraishi S.Y., Bell H.B. // Trans. Inst. Min. Metall. Sect. C. 1968. V T' \ f.
P. 104-105.
6. Алексанян O.T., Кузьмин P.H., Матвеева H.M. // Диаграммы состояния
металлических систем. Сб. статей. М: Наука, 1974. С. 148—151.
С.77. Аи/соаа
Fe-Sr. ЖЕЛЕЗО-СТРОНЦИЙ
Сведения о диаграмме состояния системы Fe—Sr отсутствуют.
Приготовление сплавов сопряжено с трудностями, так как температу-
ра кипения Sr ниже температуры плавления Fe [X]. В работе (1]
сообщается о способе приготовления сплавов из ртутной амальгамы
этих металлов, при котором ртуть удаляют испарением, а получен-
ную смесь сплавляют. Согласно сведениям, приводимым в работе
[X], Sr нс растворим в твердом железе.
Литература
1. Шапошников А.А., Суходский В.А. // Цветные металлы. 1932. N 1, С. 100
С.П. Алисова
Fe-T. ЖЕЛЕЗО-ТРИТИЙ
Теоретический расчет растворимости Т в yFe проведен в работе
fl]. Несмотря на то, что рассчитанные значения растворимости не-
сколько ниже экспериментальных, они вполне могут быть исполь-
зованы на практике [2]. Согласно работе [2] растворимость Т в > Fe
подчиняется зависимости Igx = —1400/7" — 0,52, где х — концентра-
ция Т, % (ат.); Т — температура, К. Тритий менее растворим в yFe,
чем дейтерий и водород.
Литература
1. Выходец В.Б., Демин В.Б., Гельд П.В. и др. // Изв. АН СССР Металлы 1971
№ 6. С. 71-77.
2. Кубашевски О. Диаграммы состояния двойных систем на основе железа. Пер.
с англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
Н.П. Лбрук-ииа
Fe-Ta. ЖЕЛЕЗО—ТАНТАЛ
Диаграмма состояния Fe—Та была неоднократно исследована
методами физико-химического анализа с применением металлов
высокой чистоты, кинематическими методами и рассчитана на ЭВМ
с использованием литературных данных по термодинамическим
Fe—Ta
559
Та, °/o (по массе]
свойствам сплавов [1—4]. Обобщенная диаграмма состояния приведе-
на на рис. 304 согласно наиболее полному обзору [4].
В системе образуются две промежуточные фазы: Fe2Ta — фаза
авеса и FeTa — фаза р [1, 2, 4]. Фаза Fe2Ta плавится конгруэнтно
°C и при температуре 1300 °C имеет область гомогенности
до 36 % (ат.) Та [4]. Фаза FeTa стабильна в интервале кон-
в’Рации 49—54 % (ат.) Та. В соответствии с большинством данных
цо ПЛавится конгруэнтно в интервале температур 1800—1900 °C [2].
^Данным работы [3], в системе Fe—Ta имеется, кроме названных,
—единение FeTa4 при содержании 80 % (ат.) Та. Однако в других
Р^ах оно не найдено [1, 2, 4].
560
Fe-Та
В области, богатой Fe, температура эвтектической реакции Ж »
** (6Fe) + Fe2Ta принята равной 1442 °C [4]. Эвтектическая тоцКа
расположена при концентрации 7,9 % (ат.) Та [1, 2, 4]. Раствори,
мость Та в (6Fe) при эвтектической температуре составляет 2,8 у
(ат.) [2] (в работе [4] принято 2,5 % (ат.) Та). При температуре
1215 °C и концентрации 1,38 % (ат.) Та протекает эвтектоидная
реакция (5Fe) * (yFe) + Fe2Ta [2]. Растворимость Та в (yFe) при
этой температуре составляет 0,86 % (ат.) [2, 5]. В работе [4) кон-
центрация эвтектоидной точки принята равной 1,4 % (ат.) Та, а
растворимость Та в (yFe) — 0,9 % (ат.).
При температуре 965 °C в системе имеет место перитектоидная
реакция (yFe) + Fe2Ta « (aFe) с концентрацией Та в (aFe) — 0,71 %
(ат.) и в (yFe) * 0,4 % (ат.) [2, 5]. В работе [4] для этой реакции
приняты концентрации Та в (aFe) —0,7 % (ат.) и в (yFe) —0,3 %
(ат.).
Часть диаграммы со стороны Та указана как гипотетическая на
основании экспериментальной работы [6].
Растворимость Та в (yFe) и (aFe) при отдельных температурах
приведена ниже:
Температура, °C. . . . 1200
Растворимость Та, %
(ат.)............... 0,8
Источник............ [5]
1150 1100 1050
0,68 0,57 0,49
[51 [51 [5]
1000 950 900 800 ~(Ю
0,44 0,34 0,28 0,185 0,17
[51 [5J [71 [71 !7|
Максимальная растворимость Fe в (Та) близка к 7 % (ат.) |4|.
В табл. 216 приведены характеристики кристаллических структур
соединений.
Таблица 216. Кристаллическая структура соединений системы Fe—Та
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Исючпик
а С
FezTa FeTa MgZn2 Fe7W6 hP\2, РЬ3/ттс hH13, R3m 0,481- —0,483 0,493 0,787- -0,784 2,71 [21 14J
Литература
1. Диаграммы состояния двойных и многокомпонентных систем на основе железа-
/ О.А. Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с
2. Кубашевски О. Диаграммы состояния двойных систем на основе железа: IU Р
с англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
3. Архангельская О.В., Куприна В.В., Полкопина О.Ф. // Диаграммы состояние
в материаловедении: Сб. статей. Киев: Наукова Думка, 1984. С. 106—111
Fe—Tb
561
4 swartzendruber L.J., Paul E. // Bull. Alloy Phase Diagrams. 1986. V. 7. N 3.
.£• ^^pischer W.A., Lorenz K„ Fabritius H., Schlegel D. // Arch. Eisenhiittenwes. 1970.
41. N 5. S. 489—498.
“ A Raman A. // Trans. Indian Inst. Met. 1966. V. 19. P. 202—205.
7.’ Abrahamson E.P., Lopata S.L. // Trans. AJME. 1966. V. 236. NIP. 76-87.
А.Л. Татаркина, Т.П. Лобода
ре—Tb. ЖЕЛЕЗО-ТЕРБИЙ
Сведения о диаграмме состояния Fe—Tb приведены в справочни-
ках [Ш, 1, 2]. Диаграмма состояния в полном интервале концентра
ций построена в работе [3].
Представленная на рис. 305 диаграмма состояния Fe—Tb воспро-
изведена согласно работе [1], в которой она была построена в основ-
ном по данным работы [3]. В исследовании [3] сплавы синтезировали
в инертной атмосфере в дуговой печи, отжигали в эвакуированных
кварцевых ампулах при различных температурах. При высокотемпе-
ратурном отжиге (свыше 1100 °C) ампулы заполняли аргоном, В
качестве исходных материалов использовали Fe чистотой 99,99 %
(по массе) и ТЬ чистотой 99,9 % (по массе).
Исследования проводили методами рентгеновского фазового и
структурного, микроскопического, дифференциального термического
и микрорентгеноспектрального анализов.
В системе Fe—Tb установлено четыре интерметаллические соеди-
нения, образующихся по перитектическим реакциям, указанным
ниже:
Ж + (yFe) * Fe17Tb2 при 1312 °C,
Ж + Fe17Tb2 11 Fe23Tb6 при 1276 °C,
Ж + Fe2iTb6 * Fe3Tb при 1212 °C,
Ж + Fe3Tb - Fe2Tb при 1187 °C.
При температуре 847 “С и концентрации 72 % (ат.) ТЬ в системе
протекает эвтектическая реакция Ж ** Fe2Tb + (аТЬ).
По аналогии с системой Fe—Ег в работе [3] было сделано пред-
положение, что соединение Fe2Tb имеет область гомогенности при
повышенных температурах, распространяющуюся в сторону Fe.
иДнако собственные измерения параметров решетки Fe2Tb, выпо-
лненные в работе [3], не подтвердили наличие области гомогенности
Уэтого соединения. Результаты термического анализа [3] показали,
Добавка ТЬ приводит к некоторому повышению температуры
(vF ^аа5еНИЯ - (yFe) и понижению температуры превращения
тип ' " ^^е). Добавка Fe практически не сказывается на темпера-
Ре полиморфного превращения ТЬ [3].
Дите ЭИмная Растворимость компонентов настолько мала, что нахо-
за пределами точности эксперимента [3].
562
Fe-Tb
Tb,
Tb
Рис. 305. Fe-Tb
Кристаллическая структура соединений описана в табл. 217.
Для соединения Fe17Tb2 установлено чередование структурных
типов Zn17Th2 и Ni17Th2 в зависимости от содержания Fe [4].
Fe—Tc
563
Таблица 2 17 Кристаллическая структура соединений системы Fe -ть
Символ Пирсо- Параметры решетки, нм
Соединение Прототип па, пр. гр. а С источник
^Fel7Tb2* Zn17Th2 hR19, R3m 0,853 1,245 [4, 3]
Fel7Tb2** Ni|7Th2 /1РЗ8, Р63/ттс 0,8491 0,829 [4, 3]
Fe^Tbj Mn23Th6 CF116, Fm3m 1,2007 — [4]
Fe3Tb Ni3Pu hRYl, R3m 0,514 2,458 [41
Fe2Tb Cu2Mg cF24, Fd3m 0,7341 — [4]
Fe2Tb*** •В образу **В образ! •**Искаж Cu2Mg ax, богатых д.ах, богатых енная ромбо hR13, R3m Tb,Fe17_ATb2, где л Fe, Fe17+x Tb2, где эдрическая струкг 0,5190 - 0,2-1,7. х - 0,2-0,3. фа. 1,2821 [41
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
с англ. / Под ред. Л.Л. Петровой. М.: Металлургия, 1985. 184 с.
2. Диаграмма состояния двойных и многокомпонентных систем на основе железа.
Справочник. / О.А. Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986.
440 с.
3. Dariei М.Р. // J. Less-Common Met. 1976. V. 45. N 1. Р. 91—101.
4. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Fe—Tc. ЖЕЛЕЗО-ТЕХНЕЦИЙ
Сплавы системы Fe—Tc изучены методами дифференциального
термического [1] и рентгеновского [2] анализов. В работе [1] опреде-
лены температуры ликвидуса и солидуса и (SFe) - (yFe) превраще-
Ния в сплавах, богатых Fe, содержащих до 15 % (ат.) Тс. На основа-
нии полученных данных была построена часть диаграммы состояния
при температурах выше 1300 °C. Чистота использованного Fe
99,95 % (по массе), чистота Тс не указана. Легирование Тс слабо
влияет на температуру плавления Fe.
Тс растворяется в '(SFe) и (yFe). Являясь стабилизатором ферри-
ГЛР С ПРИ Добавлении его в Fe приводит к понижению температуры
o' - (yFe) фазового превращения.
В работе [2] методом рентгеновского анализа изучены сплавы,
^Держащие 40, 50 и 60 % (ат.) Fe. Сплавы плавили в дуговой печи
иСппМ0СФеРе аРгона и гелия. В качестве шихтовых материалов
-2 4?Ьо/°Вали чистотой 99,87 % (по массе) и Тс, содержащий
’ О /о примесей.
564
Fe—Tc
Рис. 306. Fe—Тс
В исследованных сплавах обнаружена тетрагональная фаза о с
параметрами решетки: а = 0,9130±0,0005 нм, с = 0,4788±0,0005 нм,
с!а = 0,524 для сплава Тс с 40 % (ат.) Fe; а = 0,9077±0,0003 нм,
с = 0,4756+0,0003 нм для сплава Тс с 50 % (ат.) Fe; а - 0,90Ю±
±0,0001 нм, с - 0,4713+0,0001 нм для сплава Тс с 60 % (ат.) Fe.
С учетом всех имеющихся экспериментальных данных [1, 2] в
работе |3J приведена схема наиболее вероятного строения диаграммы
состояния системы Fe—Тс (рис. 306), в которой предполагается, что
фаза п образуется по перитектической реакции из Тс и жидкой фазы,
a (6Fe) — твердый раствор распадается по эвтектоидной реакции на
(yFe) и фазу о.
В работе [4] проведен термодинамический расчет ликвидуса и
солидуса диаграммы состояния Fe—Тс в области, богатой Fe, и опрО'
делена растворимость Тс в Fe при 1537 °C, которая составляет
1,05 % (ат.) Тс.
Fe—Te
5f>5
Литература
1. Buckley R.A., Hume-Rothery W. // J. Iron Steel Inst. (London). 1963. V. 201. N 2.
p. 121-124.
2. Darby J.B., Lam Norton LJ„ Downey J.W. //J. Less-Common Met. 1962. V.
4. N 6. P- 558-563.
3. Moffat W.G. Handbook of Binary Phase Diagrams. New York: Business Growth
Services. General Electric Co. Schenectady, 1976. 1977. V. 1,2. 658 p.
4. Kuchaf L., RepiskS L., KomarovA L., Baffyova Z. // Sb. VSdekych Praci Vysoke
Skoly BAftske. Ostrava. 1980. V. 26. P. 119—136.
T.B. Добаткина
Fe—Te. ЖЕЛЕЗО—ТЕЛЛУР
Диаграмма состояния Fe—Te (рис. 307) приведена по данным
исследования сплавов методами термического и рентгеновского
анализов [1]. Результаты более ранних работ были противоречивы
[2—5]. Авторы работы [1] для приготовления сплавов использовали
Fe чистотой 99,9 % и Те чистотой 99,99 %. Полученные данные [1]
566
Fe—Te
согласуются с результатами исследования [2] и более поздней работы
[9]. Подтверждено существование фаз Р, у, б, в [6] и высокотемпе-
ратурной фазы р' [71. Высокотемпературные фазы, обнаруженные
в работах [3, 4], в исследовании [11 найдены не были.
Фаза Р (~FeTc09) образуется, вероятно, по перитектоидной
реакции (aFe) + р' р при 844 °C, хотя авторы работы [1] допуска-
ют и эвтектоидный характер реакции при этой температуре. Эта
фаза стабильна до комнатной температуры.
Высокотемпературная фаза Р' образуется в результате перитекти-
ческой реакции Ж + (yFe) * Р' при температуре 914 °C. При темпе-
ратуре 800 °C фаза Р' распадается на смесь р + у.
Фаза у (FeTc; 2) существует в области температур 636—809 °C и
имеет узкую область гомогенности, а именно 54—55 % (ат.) Тс.
Фаза б образуется по перитектической реакции при температуре
812 °C, содержит 55,2 % (ат.) Те, стабильна при температуре до
565 °C.
Фаза 6' содержит 59,7—62,6 % (ат.) Те и существует в области
температур 766—519 °C [71.
Фаза s, находящаяся в равновесии с (Те) и отвечающая стехио-
метрическому составу FeTe2, образуется по перитектической реакции
Ж + б' => е при температуре 649 °C, что согласуется с данными работ
[2, 3, 101.
Кристаллическая структура фаз приведена в табл. 218.
Таблица 218. Кристаллическая структура соединений системы Fe—Тс
Сое ди нение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Примечание
а Ь с
р РЬО ZP4, Р4/птт 0,38215 — 0,62695 [Р]
0'* — — 0,4013 — 2,096 При температу- ре 835 °C (71
0,4030 — 2,109 При температу- ре 870 °C (71
8** — — 0,3846 0,6661 0,5641 [Р1
6'* — — 0,3816 — 0,5654 171
Е FeS2 ОР6, Рппт 0,626 0,525 0,383 [61
♦Гексагональная сингония.
♦♦Моноклинная сингония, 0 = 90,2°.
Fe-Th
567
Литература
r) 1 Ipser H., Komarek K.L., Mikler H. // Monatsh. Chem. 1974. Bd. 105. N 6. S.
*421*—1333.
2 Chiba S. // Phys. Soc. Jap. 1955. V. 10. N 10. P. 837-842.
3. Абрикосов H.X., Дюльдина К.А., Жданова B.B. // Халькогениды. 1970. Вып.
2 С. 98—114.
4 Liewellyn J.P.. Smith Т. И Proc. Phys. Soc. 1959. V. 74. N 1. P. 65-69.
5 Гейдерих В.А., Герасимова Я.И., Никольская А.В. // Доклады АН СССР. 1961
Т 137. № 6. С. 1399—1401.
6. Gronvold F., Haraldson Н., Vihovde J. И Acta Chem. Scand. 1954. V. 8. P. 1927-
1942.
7. Rost E., Webjornsen S. // Acta Chem. Scand. Ser. A. 1974. V. 28. N 3. P. 361 —
362.
8. Zeciejewicz J. // Acta Chem. Scand. 1963. V. 17. N 10. P. 2593—2599.
9. Mann G.E., Vlack Z.H. // Metall. Trans. B. 1977. V. 8. N 1. P. 53-59.
10. Дудкин Л.Д., Вайданович В.И. // Физика твердого тела. 1960. Т. 2. № 7. С.
1526-1532.
С.П. Алисова
Fe-Th. ЖЕЛЕЗО-ТОРИЙ
Сплавы системы Fe—Th изучены в работах [1—6 и др.]. Ппрп
ставленная на рис. 306 диаграмма состояния приведена согласно
обзору [7| с некоторыми дополнениями по данным работы [6]
Система характеризуется образованием пяти соединений: Fe)7Th
Fe5Th, Fe7Th2, Fe3Th и Fe3Th7, одно из которых (Fe17Th2) плавится
конгруэнтно, а остальные — по перитектическим реакциям. Соедине-
ние Fe7Th2 присутствует в двух модификациях, но условия перехода
от одной модификации к другой не определены [9]. В системе имеют
место два эвтектических превращения: при температуре 875 "С и
содержании 55 % (ат.) Th и при температуре 1412 °C и содержании
6 % (ат.) Th.
Кристаллическая структура соединений представлена в табл. 219.
Таблица 219 Кристаллическая структура соединений системы Fe—Th
Соединение 1 IpOIOTHIl Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а с
Fel7Ih2 1 112^'Fl АЛ 19, R3m 0,8565 1,2469 18]
Fe5Th CaCu5 hP6, Р5/ттт 0,513 0,402 |Р]
«Fe7Th2 Ce2\i7 hP3f>, Р6Л/ттс 0,5193 2,4785 PI
pFe7Th2 Gd ,Co7 hR\8, R3m 0,5194 3,719 |9|
Fe3Th Pti\’i3 АЛ 12, R3m 0,522 0,518 2,496 2,52 [Р, 7] f7!
Fe3Th7 Fe, Th7 hP20, Р6лтс 0,985— -0,982 0,615— -0,621 |Р. 71
Литература
1. Florio J.V., Rundle R.E., Snow A.I. // Acta Cristallog. 1952. V. 5. N 4 P 449-
457.
2. Florio J.V., Baenziger N.C., Rundle R.E. // Acta Cristallog. 1956. V. 9. N 4- p'
367-372.
3. Matthias H.T., Compton V.B., Corenzwit E. // Phys. Chem. Solids. 1961 V. 19.
N 1/2. P. 130-133.
4. Thompson J.R. // J. I^ss-Common Met. 1966. V. 10. N 6. P. 432—438
5. Smith J.F., Hansen D.A. // Acta Cristallog. 1965. V. 19. N 6. P. 1019-1028.
6. Laabs F.C., Noack M.A., Smith J.F. // J. Phase Equilibria. 1991. V. 12 \ 1 r
23-27' Hep.
7- Кубашевски О. Диаграммы состояния двойных систем на основе железа и
с англ. / Под рсд Л А. Петровой. М.: Металлургия, 1985. 184 с.
Fe-Ti
569
Г 8 Johnson Q., Smith G.S., Wood D.H. // Acta Crystallog. B. 1969. V. 25. N 3. P.
,4^4Van der Goot A.S. // J. Less-Common Met. 1971- V. 23. N 4. P.
.3$?'^ q ц Алисоваг j] j] рОхлин
Fe_Ti. ЖЕЛЕЗО—ТИТАН
. Систему Fe—Ti неоднократно исследовали методами термического,
микроструктурного и рентгеноструктурного анализов, измерения
зависимости изменения физических свойств от состава [X].
Установлено, что в системе образуются две промежуточных фазы
TiFe2 и TiFe, со стороны исходных компонентов наблюдаются пре-
вращения, связанные с полиморфными переходами Fe и Ti.
570
Fe-П
Диаграмма состояния Fe—Ti (рис. 309) построена в работе
[Э]. Она соответствует диаграмме состояния, приведенной в
работе [ 1 ].
Максимальная расторимость Ti в (aFe), по данным различных
авторов, составляет 8 % (ат.) [Э], 9 % (ат.) [2], 13,7 % (ат.) |3|
При понижении температуры растворимость Ti в (aFe) снижается до
2,9 % (ат.) при 500 °C [3]. Растворимость Ti в (yFe) достигает
максимума 0,76 % (ат.) при температуре 1100 °C [Э]. Это значение
хорошо согласуется с указанным в работе [X] и принятым в работе
[1] значением 1,1 % (ат.) Ti при максимальной ширине двухфазной
области (aFe) + (yFe), составляющей 0,58 % (ат.).
Соединение TcFe2 образуется конгруэнтно при температуре
1427 °C [Э] или 1530 °C [X], 1480 °C [3]. Соединение TiFe2 имеет
широкую область гомогенности (-8—10 % (ат.)). Между соединени-
ем TiFe2 и (aFe) наблюдается эвтектическое взаимодействие при
1289 °C и концентрации 16 % (ат.) Ti [Э] или при 1298 °C и 17,5 %
(ат.) Ti [3] (-1340 °C по [X]).
Соединение TiFe образуется по перитектической реакции,
имеет область гомогенности -3 % (ат.). По данным работы |3|,
TiFe образуется с открытым максимумом при температурах выше
-1500 °C.
Со стороны Ti в системе наблюдается эвтектическое взаимодей-
ствие при температуре 1085 °C и концентрации -71 % (ат.) Ti [Э].
По данным работы [31, температура эвтектики равна 1100 °C. Отме-
чается значительная растворимость Fe в (0Ti), равная -22 % (ат.).
Fe снижает температуру полиморфного превращения Ti и при
-590 °C [X, Э] или 585 °C [41 в системе наблюдается эвтектоидное
превращение.
Растворимость Fe в aTi приведена ниже по данным работы
[5]:
Температура, °C..........................
580 500 420 360
Растворимость Fe, % (ат.).................. 0,047 0,030 0,014 0,007
По данным работы [6], линия растворимости Fe в (aTi) носит регр°г'
радный характер и максимальная растворимость Fe в (aTi) наблюда-
ется при температуре 790 °C и составляет 0,057 % (ат.).
В справочнике [Э] указывается на образование в богатой Ti
области сплавов метастабильной фазы ы.
Кристаллическая структура соединений указана в табл. 220.
Fe-Tl
571
Таблица 2 2 0. Кристаллическая структура соединений системы Fe—Ti
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Примеча- ние
а с
TiFe2 MgZn2 КРП, Р63/ттс 0,477(4) 0,779(4) При кон- центрации 27,4 % (ат.) Ti [Э]
0,481(4) 0,785(0) При кон- центрации 37 % (ат.) Ti [Э]
0,4785 0,7799 [2]
TiFe CsCl сР2, РтЗт 0,297(6)- -0,299(1) — [Э]
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
С англ. / Под ред.Л.А. Петровой. М.: Металлургия, 1985. 184 с.
2. Speich G.R. // Trans. AIME. 1962. V. 224. N 4. P. 850-858.
3. Корнилов И.И., Борискина Н.Г. // Доклады АН СССР. 1956. Т. 108. № 6. С.
1083-1085.
4. Борискина Н.Г., Мясникова К.П. // Титан и его сплавы: Сб. статей. М.: АН
СССР. 1962. № 7. С. 61-67.
5. Stupel М.М., Bamberger М., Ron М. // J. Less-Common Met. 1986. V. 123. N 1/2.
P. 1-7.
6. Matyka J., Faudot F„ Bigot J. // Titanium 80. Sci. and Technol. Proc. 4 Int. Conf.
Kyoto. May 19-22. 1980. V. 4. New York. 1980. P. 2941-2947.
В.П. Полякова
Fe—TI. ЖЕЛЕЗО—ТАЛЛИЙ
Согласно работам [1,2] Fe и Т1 не взаимодействуют между собой,
м не менее при исследованиях, связанных с пайкой Fe, установле-
о, что при температуре 1120 °C жидкий Т1 при контакте с Fe диф-
фундирует в него [3].
Л’Н'ература
2 We2k Е” Tamman G- // Z. Anorg. All. Chem. 1907. Bd. 55- N 1. S. 58-62.
3 p ever F- // Arch. Eisenhuttenwes. 1929. Bd. 2. N 11. S. 739-746.
C. 238 2з“Мальский Л-Л-’ Петрунин И.Е. // Изв. АН СССР. Металлы. 1968. № 2.
Т.В. Добаткина
572
Fe-Тт
Fe—Tm. ЖЕЛЕЗО—ТУЛЛИЙ
Первые работы по изучению системы Fe—Тт касались поиска
двойных соединений [Э, Ш]. Диаграмма состояния Fe—Тт (рис. 310)
была построена в работе [1] на основании результатов, полученных
в работе [21. В работе [2] сплавы синтезировали в инертной атмос-
фере дуговой печи.
Тт, /о (по массе)
Рис. 310. Fe—Тт
Fe—Tm
573
В качестве исходных материалов использовали Fe чистотой
00 98 % <П° массе) и 1'т чистот°й 99,9 % (по массе). Исследования
поводили методами рентгеновского фазового и структурного, диффе-
^циального термического анализов.
В системе Fe—Tm установлено четыре интерметаллических соеди-
ения. Фаза Fe2Tm образуется с открытым максимумом при темпера-
Tvne 1300 °C. Соединения Fe17Tm2, Fe23Tm6 и Fe3Tm образуются по
пноитектическим реакциям: Ж + (yFe) « Fe17Tm2 (1300 °C), Ж +
+ Fe Tm * Fe23Tm6 (1270 °C) и Ж + Fe2Tm * Fe3Tm (1280 °C). При
температурах 1255 и 937 °C и содержаниях 16,5 и 73 % (ат.) Тт в
системе кристаллизуются эвтектики. Растворимость Тт в (yFe) при
температуре 1300 °C составляет ~0,1 % (ат.) [3].
Таблица 221- Кристаллическая структура соединений системы Fe—Тт
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а с
Fel7Tm2 Ni17Th2 АР38, Р63/ттс 0,8470- -0,8428 0,8285- -0,8289 [4]
Fe23Tm6 МпгзТЬб CF116, Fm3m 1,198 — [4]
Fe3Tm NijPu hRW, R3m — — [1]
Fe2Tm Cu2Mg cF2A, Fd3m 0,723 — [4]
Кристаллическая структура соединений описана в табл. 221 [1, 4].
В работе [5] приводятся сведения о том, что Fe17Tm2 имеет решетку
типа Th2Zn17. Однако параметры решетки для этого типа структуры
не приводятся и ее образование вызывает сомнение.
Литература
Метяп ^ОлеСниченко В.Е., Терехова В.Ф., Савицкий Е.М. // Металловедение цветных
2 KBg сплавов: Сб- статей. М.: Наука. 1972. С. 31-32.
с англ / 1?шевСки О- Диаграммы состояния двойных систем на основе железа: Нер.
3 К Ред- Л А. Петровой. М.: Металлургия, 1985. 184 с.
ВАйяка *?с*1а*‘ L., Repiskd L., Komorovd L. et al. // Sb. VSdekych Praci Vysok6 Skoly
4Гл aVal98?V-26Pll9~136
ний пр ааЬ1111евский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине--
5 81г°3^М^ЛЬН1,,х металлов- Львов: Вища школа, 1982. 255 с.
nat К., Hoffer G„ Ray А.Е. // I.E.E.E. Trans. Magn. 1966. V. 23. P. 489-494.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
574
Fe-U
Fe—U. ЖЕЛЕЗО—УРАН
Диаграмма состояния Fe—U построена по результатам микрос-
труктурного, дифференциального термического, рентгеновского | [
2] и дилатометрического анализов [2]. Установлено существование
двух соединений UFe2 и U^Fc. Соединение UFe2 плавится конгру.)Н_
тно при 1230 °C [1] или 1235 °C [2J, а соединение U6Fe — инкингру-
энтно при 805 °C [1] или 815 °C [2].
Fe, % (по массе)
Рис. 311. Fe-U
В системе образуются две эвтектики: (yFe) + UFe2 при температу-
ре 1055 [1] или 1080 °C [2] и концентрации 78 % (ат.) f с и
UFe2 + U6Fe при 725 °C и 34 % (ат.) Fe. При температуре 80э С
протекает перитектическая реакция Ж + (yU) * U6Fe. Растворимость
U в (6Fe) незначительна. Растворимость Fe в твердом U увеличива-
ется с температурой от 0,018 % (ат.) при 600 °C до 1,5 % (ат
при 805 °C.
Fe-U
575
Позднее было проведено более полное исследование диаграммы
достояния в области, богатой железом [3]. Сплавы, содержащие до
22,2 % <п0 массе) U плавили в вакуумной индукционной печи и
исследовали методами дифференциального термического, дилатомет-
рического и металлографического анализов. Для получения сплавов
использовали Fe спектральной чистоты, содержащее менее 10'3 %
металлических примесей, и наиболее чистый промышленный U. На
рис. 311 приведена диаграмма состояния, построенная согласно
работам [2, 3] с некоторой корректировкой по данным работы [8] со
стороны Fe. Температуры превращений 8 ° у и у ₽ а я Fe незначи-
тельно изменяются при легировании его U.
Кристаллическая структура соединений указана в табл. 222.
Таблица 22 2. Кристаллическая структура соединения системы Fe—U
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
UFe2 MgCu2 CF24, 0,704 — [1]
Fdbm 0,7050 — [2]
0,7061 — [5]
0,7051 — [6]
0,7045 — [7]
U6Fe MnU6 1728, 1,031 0,524 [Р]
14/тст 1,0289 0,5232 [8]
В работе [9] методом ЭДС определяли термодинамические свой-
ства сплавов Fe—U.
Литература
1. Grogan J.D. // J. Inst. Met. 1950. V. 77. Р. 577-580.
2. Gordon Р., Kaufmann A.R. // Trans. AIME. 1950. V. 188. P. 182-184.
3. Michand G.G. // Canad. Metall. Quart. 1966. V. 5 N 4. P. 355-365.
4. Baenziger N.C., Rundle R.E, Snow A.Y., Wilson A.S. // Acta Crystallog. 1950. V.
3. p. 34-46.
5- Kutz G., Jacobs A.Y. //J. Nucl. Mater. 1962. V. 5. N 3. P 338—340.
6. Brook G.B., Williams G.Y., Smith EM. // J. Inst. Met. 1954-1955. V. 83. N 6. P.
271-276.
Я K‘ 11 Acta Metall. 1953. V. 1. P. 720.
8 Kvfia w метан, ivoj. v. i. r. 720.
trji /Г??П1евски о. Диаграммы состояния двойных систем на основе железа: Пер.
v. диаграммы состояния двойных систем г
С ан?л- > Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
i<w?‘ Ле®еДСв В.А., Назаров Н.В., Пятков В.И. и др. // Изв. АН СССР. Металлы.
1*73. №2. с. 212-216.
С.П. Алисова
576
Fe-V
Fe—V. ЖЕЛЕЗО—ВАНАДИЙ
Диаграмма состояния Fe—V изучена достаточно подробно, наибо-
лее ранние исследования обобщены в работах [X, Э, Ш, 1]. Пред-
ставленная на рис. 312 диаграмма состояния Fe—V приведена По
последнему наиболее полному обзору [1].
/, "/» (по массе)
Рис. 312. Fe—V
При высоких температурах в сплавах этой системы существует
непрерывный ряд твердых растворов между (aFe) и V. Кривые лик-
видуса и солидуса имеют минимум при концентрации 31 % <ат.) »
и температуре 1468 °C.
По данным работы [2], в области эквиатомного состава в твсрд°м
состоянии обнаружена промежуточная фаза o(FeV). На диаграмме
показано, что эта фаза образуется в результате превращения ! гс-
Fe-V
577
V) >* о при температуре 1219 °C и концентрации 48 % (ат.) V. Об-
ее гомогенности простирается от 37 до 57 % (ат.) V при темпе-
ЛЭтуре 700 °C [3] и от 39 до 54,7 % (ат.) V при температуре 1075 °C
[4]-по данным работы [1], область гомогенности фазы о несколько
(^работах [5, 6] обнаружено, что выделению стабильной фазы о
(в результате старения твердого раствора (aFe, V) при 600 °C) пред-
шествует образование метастабильной упорядоченной фазы со струк-
турой CsCl. Упорядочение твердого раствора (aFe, V) в области
существования фазы о исследовано в работах [7, 8].
Соединение FeV изоструктурно фазе о в системе Fe—Cr ((РЗО, пр.
гр. P42/wnm), обладающей тетрагональной решеткой с 30 атомами
в элементарной ячейке [9, 10]. В работе [11] показано, что парамет-
ры решетки фазы о меняются от а = 0,8865 ±0,0004 нм и с = 0,4650±
±0,0007 нм в двухфазной области для сплава с 29,8 % (ат.) V до
а = 0,9015±0,0004 нм и с = 0,4642+0,0007 нм для сплава с 60 %
(ат.) V.
Влияние V на а у превращение Fe изучено в ряде работ. Мето-
дом термомагнитного анализа установлено, что максимальная шири-
на области гомогенности фазы (yFe) [0,4 % (ат.) V] наблюдается
при температуре 1150 °C. Двухфазная область (aFe) + (yFe) прости-
рается при этой температуре до 2 % (ат.) V [12]. Это же значение
принято в работе [1]. Эти результаты подтверждены в работе [13].
Согласно термодинамическим расчетам фаза о стабильна при
1219-1157 °C [14].
Литература
1. Кубашевски О. Диаграммы состояния двойных систем на основе железа: Пер.
С англ. / Под ред. Л.А. Петровой, М.: Металлургия, 1985. 184 с.
2. Wever F., Jellinghaus W. // Mitt. K.-W. - Inst. Eisenforschung. 1930. Bd. 12. S.
317-322.
3- Martens H., Duwez P. .// Trans. ASM. 1952. V. 44. P. 484-493.
Greenfild P., Besk P.A. // Trans. AIME. 1954. V. 200. P. 253-257.
Besk P.A., Darby J.R., Arora O.P. // Trans. AIME. 1956: V. 206. P. 148-149.
7 ek,lp T'W” Besk PA- 11 Trans' AIME' 1957 V- 209 P' 1269-1271.
A Chandross R.J., Shoemaker D.P. // J. Phys. Soc. Jap. 1962. V. 17. P. 16-19.
»• Datre M. // Comt. Rend. 1964. V. 259. P. 2640-2642.
04 ,Ver R’ JeUinghaus W. // Mitt. K.-W.-Inst. Eisenforschung. 1931. Bd. 13. S.
’3-109, 143-147.
*0- Andrews K.W. // Research. 1948. V. I P. 478^79.
12 p.an"eman RE-. Mariano A.N. // Trans. AIME. 1964. V. 230. P. 937-939.
1970 пи*5., er W.A., Lorenz K„ Fabritius H., Schlegel D. // Arch. Eisenhiittenwes.
13 £’41N 5 S- 489-498.
14 Г00" K ’ Krolik E- /1 Kovove Mater. 1973. V. 11. N 2. P. 93-97.
spencer P.J., Connseil J.F. // Z. Metallkunde. 1973. Bd. 64. N 9. S. 662-665.
19 2144 B.H. Кузнецов
4.
5.
6.
578
Fe-W
Fe—W. ЖЕЛЕЗО-ВОЛЬФРАМ
О взаимодействии Fe c W сообщается в справочниках [X, Э, IJJ ।
Диаграмма состояния (рис. 313) построена на основании исследова-
ний [1—5], результаты которых проанализированы в работе [6]. в
системе образуются три промежуточные фазы A(Fe2W), p(Fe7W6y
S(FeW) и твердые растворы (W), (aFe) и (yFe). На кривых ликвидуса
и солидуса (aFe) имеется минимум при температуре 1529 °C и
содержании 4,4 % (ат.) W [1, 2, 6]. При температуре 1548 С
IV, % (по массе)
О 2030 40 50 60 70 80 90 100
Г" । I “I— 1 Т
Ж
11, 42,1
20,6 - 1548°ft.
4,4. /14,3 40,5 1 1 I |
<f-(c<Fe) \l4.6 1190 0 ИГ
IIL... -(ГРе, -1060е 48.5^
1г г— — ’ 1 А
7 / L770. • • • • •
Магнить превраше /ое >ние
• 1 • 1 L.
—г- б,°с 1550 1540 1538 1530 1520 163 i W, °/o (по массе) 0 Ю 20 30
Г i
X
4
(a Fe)
7 < 7 е IV, °/B( n am.)
Д/е. Ms) 97,4
(И/
^50,7 \
1
1 (FeW) г 1 L_
1 Г 1
JL_ T -J.
О 10 20 30 40 50 60 70 80 90 100
Fe
IV, °/о (ат.)
Рис. 313. Fe—W
Fe-W
579
образуется (aFe) с концентрацией 14,3 % (ат.) W по перитекти-
ческой реакции из расплава, содержащего 11,2 % (ат.) W и
фазы ц [1, 6].
растворимость W в (aFe) с понижением температуры убывает от
14,3 % (ат.) при 1548 °C до 4,6 % (ат.) при 1190 °C [1—6]. При
температурах ниже 1000 °C растворимость W в (aFe) установлена
недостаточно точно, так как для установления равновесия в системе
необходимо длительное время выдержки [6]. W стабилизирует (aFe),
повышая температуру превращения (aFe) * (yFe) и понижая темпе-
ратуру превращения (yFe) * (6Fe), и приводит к появлению замкну-
той (yFe) области. Максимальная растворимость W в (yFe) составля-
ет 1,46 % (ат.), ширина области (aFe) + (yFe) -0,64 % (ат.) при
температуре 1140 °C [3].
Соединение Fe7W6 (фаза ц) образуется по перитектической реак-
ции из расплава с 20,6 % (ат.) W и (W) при температуре 1637 °C и
содержании 39,8 % (ат.) W [2] или при 42,1 % (ат.) W [6]. В ряде
ранних работ этому соединению была приписана формула Fe3W2,
соответствующая его химическому составу, тогда как формула Fe7W6
основывается на его кристаллической структуре. Соединение Fe7W6
имеет область гомогенности, протяженность которой составляет
39,1—40,5 % (ат.) W [1, 3] или 40,5—44,5 % (ат.) W [6]. По данным
работ [1—4], соединение Fe7W6 стабильно в широком интервале
температур вплоть до комнатной, однако исследование сплавов с
5—40 % (ат.) W, отожженных при 1000 °C в течение 2000 ч, показа-
ло, что в них присутствует только одно интерметаллическое соедине-
ние FeW — фаза б [6]. Температура эвтектоидного распада p(Fe7W6)
на (aFe) и б (FeW) - 1190 °C [7] (см. рис. 316).
О существовании фазы 5 сообщалось в одной из ранних работ [X]
и позднее было показано, что эта фаза образуется при температуре
1215 °C и содержании -50,78 % (ат.) W по перитектоидной реакции
из Fe7W6 и (W) [6, 7]. Интервал гомогенности составляет -48,5—
52,5 % (ат.) W.
Соединение Fe2W (фаза А) образуется по перитектоидной реакции
при температуре 1060 °C из (aFe) и фазы р. [2—4,7]. Эта фаза, как
Фаза ц, исчезает при длительных отжигах (2000 ч), при температуре
1000 °C, однако присутствует (наряду с фазой р.) в сплавах, получен-
ных в обычных условиях и не подвергающихся длительному низко-
температурному отжигу, в связи с чем она указана на всех вариантах
диаграмм состояния (отдельные точки на рис. 313).
,, Растворимость Fe в (W) 2,6 %
16?7 °C [2].
Кристаллическая структура промежуточных фаз приведена
и. 223.
19»
(ат.) при температуре
в
580
Fe-Y
Таблица 22 3. Кристаллическая структура соединений системы Fe—V, |&]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, им ‘
a b
Q)Fe2W MgZn2 hPX2, Р63/ттс 0,4737 — 0,7700
(H)Fe7W6 Fe7W6 hRX3, 0,4755* 2,583*
R3m 0,4771** — 2,596’-*
(6)FeW MoNi oP56, P2{2i2l 0,776*** 1,248*** 0,710*4*
*Для богатых Fe сплавов.
**Для богатых W сплавов.
***Для сплава с 50,7 % (ат.) W.
Литература
1. Sinha А.К., Hume-Rothery W. // J. Iron Steel Inst. 1967. V. 205. \ 11. P.
1145-1149.
2. Sykes W.P. // Trans. ASM. 1936. V. 24. P. 541-550.
3. Kirshner G., Harvig H., Uhrenius B. // Metall. Trans. 1973. V. 4. N 4. P. 1059—
1064.
4. Takayama T., Wey M.Y., Nishizawa T. // Trans. Japan Inst. Met. 1981. V. 22 X 5.
P. 315-325.
5. Swartzendruber L.J. // Bull. Alloy Phase Diagrams. 1982. V. 3. P. 161—165
6. Nagender Naidu S.V., Sriramamurthy A.M., Rama Rao P. // J. Allov Phase
Diagrams. 1986. V. 2. N 3. P. 176-188.
7. Raynor G.V., Rivlin V.G. // Int. Met. Review. 1983. V. 28. P. 122-129.
К.Б. Поварова
Fe-Y. ЖЕЛЕЗО—ИТТРИЙ
Результаты исследований системы Fe—Y собраны в работах |'Э, Ш,
1—3J. Представленная на рис. 314 диаграмма состояния Fe—Y приве-
дена согласно работам [2, 4].
В системе Fe—Y найдено четыре интерметаллические соединения:
Fe2Y, Fe3Y, Fe23Y6 и Fe)7Y2. Три последние фазы плавятся с откры-
тыми максимумами при 1335, 1300 и 1400 °C. Лишь одна (раза
образуется при температуре 1125 °C по перитектической реакции:
Ж + Fe3Y ** Fe2Y. Определены составы и температуры плавления
четырех эвтектик: (yFe) + Fe17Y2 (1350 °C, 8,2 % (ат.) Y); Fc]7Y2 +
+ Fe23Y6 (1280 °C, 12,9 % (ат.) Y); Fe23Y6 + Fe3Y (1250 °C, 23,7 %
(ат.) Y) и Fe2Y + (aY) (900 °C, 66,0 % (ат.) Y). Растворимость Y 0
Fe в твердом состоянии составляет менее 0,6 % (ат.).
Fe-Y
581
fe Y,ya(am.) Y
P>C- 314. Fe-Y
T » < Г " ° л и ц а 2 2 4. Кристаллическая структура соединений системы Fe—Y [1]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a с
Fe2Y . Fe3Y Fe23V6 Cu2Mg Ni3Pu Mn23Th6 cF24, Fd3m hRl2, R3m cFH6, Fm3m 0,7356 0,5133 1,212 2,460
582
Fe—Yb
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, 77м
а С
Fel7Y2(BT) FeI7Y2(IIT) Zn17Th2 Ni|7Th2 /гЛ19, R3m hP38, Р6г/ ттс 0,8510 0,8464 1,2384 0,8312
Кристаллографические данные всех соединений приведены в
табл. 224. В работах [V-C] дополнительно упоминается соединение
Fe5Y с решеткой типа СаСи5, которое на диаграмме отсутствует.
Соединение Fc17Y2 существует в двух модификациях: высокотемпе-
ратурной Fe17Y2(BT) и низкотемпературной Fe17Y2(HT).
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 225 с.
2. Кубашевски О. Диаграммы состояния двойных систем на основе железа. Пер.
с англ. / Под ред. Л.А. Петровой. М.: Металлургия, 1985. 184 с.
3. Диаграммы состояния двойных и многокомпонентных систем на основе железа.
/ О.А. Банных, П.Б. Будберг, С.П. Алисова и др. М.: Металлургия, 1986. 440 с
4. Dotnagala R.F., Rausch J.J., Levinson D.W. // Trans. ASM. 1961 V. 53 P.
137—155.
Е.И. Гладышевская, О.И. Бодак, В.К. Лечарский
Fe—Yb. ЖЕЛЕЗО—ИТТЕРБИЙ
Исследование системы Fe—Yb проводилось с целью установления
образования интерметаллических соединений [1,2]. Гипотетическая
диаграмма состояния (рис. 315) приведена в работе [2] и построена
на основании схематического описания фазовых равновесий, прове-
денного в работе [3].
Таблица 22 5. Кристаллическая структура соединений системы Fe—Yb
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
Fe17Yb2 Ni17Th2 АР38, Р63/ ттс 0,8408 0,8280 111
Fe23Yb6 Mn2JTh6 сАНб, Fm3m 1,1944 — 111
Fe2Yb Cu2Mg cF24, Fd3m 0,7239 — [V-CI
Fe—Yb
583
Система Fe—Yb характеризуется ограниченной областью несме-
шиваемости компонентов в жидком состоянии и существованием
йитерметаллидов Fe23Yb6 и Fe17Yb2. Температуры и реакции образо-
вания этих соединений не установлены. Монотектическое превраще-
"йе имеет место при температуре 1310 °C. Характер реакции, проте-
ающей при 1290 °C, не установлен [31.
в ^Ристаллические структуры соединений системы Fe—Yb описаны
В. Кр°ме фаз, присутствующих на диаграмме и описанных
•Р отах [1, 2], в работе [V-C] сообщается еще об одном интерме-
таллиде - Fe2Yb.
584
Fe—Zn.
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических спедИНе
ний редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
2. Кубашевски О. Диаграммы состояния двойных систем на основе железа, цеп
с англ. / Под редакцией Л.А. Петровой. М.: Металлургия. 1985. 184 с.
3. landelli A., Palenzona А. // Rev. Chim. Minerale. 1976. V. 13. Р. 55—60
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Fe—Zn. ЖЕЛЕЗО-ЦИНК
Изготовление сплавов этой системы затруднено. Однако система
Fe—Zn исследовалась неоднократно. Представленная на рис. 316
диаграмма построена по совокупности данных работ [1, 2]. Согласно
работе [1] построены линия ликвидуса до перитектического превра-
щения при 780 °C и часть диаграммы со стороны Fe, а согласно
Рис. 316. Fe—Zn
Fe—Zn
585
х е [2] — часть диаграммы со стороны Zn, включающая области
Р^—^твования промежуточных фаз. По данным работы [1] в (aFe)
Отворяется 46 % (по массе) Zn [42 % (ат.) Zn]. Растворимость Zn
(yFe) составляет около 8 % (по массе) [6,9 % (ат.)]. Подтвержде-
®о образование замкнутой области твердого раствора на основе (yFe)
Й*4]. Полученные в работе [1] результаты в основном согласуются
с ранее известными данными работ [X, Э, Ш].
Ближайшее к Fe соединение фаза Г образуется по перитектичес-
кой реакции при температуре 782 °C [X, 2] или 780 °C [1]. Фаза Г
обляпает областью гомогенности протяженностью 72—80 % (по массе)
Zn (68,7—77,4 % (ат.) Zn).
7. Богатая Zn часть диаграммы состояния исследовалась методами
микрорентгеноспектрального, микроскопического, рентгеновского,
. дифференциального термического анализов и измерения микротвер-
дости фаз [2,5—7]. Сложный способ приготовления образцов для
исследования подробно описан в работах [2, 5]. Промежуточные
фазы Sj и С образуются по перитектическим реакциям при темпера-
турах 667±3 °C и 531+10 °C, имеют области гомогенности протяжен-
ностью 88—93 % (по массе) Zn [86,2—91,9 % (ат.) Zn] и 95—96 %
(по массе) Zn [94—95,3 % (ат.) Zn] соответственно [2, 5, 6].
Температура сольвуса фазы Sj
приведена ниже [8]:
в зависимости от содержания Fe
Концентрация Fe, % (ат.). . . 9,24 10,29 10,94 11,63 12,67
% (по массе) 8,0 8,92 9,47 10,10 11,02
Температура, °C 558±1 595±3 604 ±6 621 ±1 653 ±1
Фаза Г1 образуется по перитектоидной реакции при температуре
550±10 °C [2]. Область гомогенности этой фазы находится в преде-
лах 81—85 % (по массе) Zn [78,4—82,8 % (ат.) Zn].
"Таблица 22 6. Кристаллическая структура соединений системы Fe—Zn
Соединение Прото- тип Символ Пирсона, пр. гр. Параметры решетки, нм Ис- точ- ник
а b С
U')Fe3Znl0 ’ Fe3Znl0 с!52, 1тЗт 0,899 — — [2]
<8))FeZn10* — hP550, Р63тс 1,2815-1,283 - 5,735 5,77 [7] [Р]
(OFeZn)3** CoZn,3 тС28, С2/т 1,0862 0,7608 0,5061 [5]
Г(»** 1,799(2) — — [2]
тел Число атомов в элементарной ячейке этого соединения указано приблизи- нРВДелах 547-563 [Р, 8]. ,**₽ * 100,53°. — Кубическая сингония.
586
Fe-Zr
Кристаллическая структура промежуточных фаз приведена
табл. 226.
Литература
1. Будуров С., Тончева С., Ковачев П., Русев К. // Материалознание и ге'но
логия. 1980. Т. 9. С. 101-109.
2. Gellings P.J., Gierman G., KOster D., Kuit J. // Z. Metallkunde. 1980. Bd 71
N 2. S. 70-75.
3. Ковачев П., Тончева С., Будуров С., Ненчев Н. // Материалознание и техно,-о
гия. 1984. Т. 13. С. 11-17.
4. Nishizawa Т., Hasebe М., Ко. М. // J. Iron. Steel Inst. Jap. 1981. V. 67 \ 14 p
2086-2097.
5. Gellings P.J. de Bree E.W., Gierman G. 11 Z. Metallkunde. 1979. Bd. 70. X 5 s
312-314,315-317.
6. Gellinds PJ., KOster D„ Kuit J., Frausen T. // Z. Metallkunde. 1980. Bd. 71 \ 3
S. 150-154.
7. Bastin G.F., Van Loo F.J.J., Rieck G.D. // Z. Metallkunde. 1976. Bd. 67 X 10
S. 694-697.
8. Jena A.K., LOhberg K. // Z. Metallkunde. 1982. Bd. 73. N 8. S. 157-521
RH Полякова
Fe—Zr. ЖЕЛЕЗО—ЦИРКОНИЙ
Исследование взаимодействия Fe с Zr начато еще в 1928 г. |Х|,
однако окончательно диаграмма состояния системы Fe—Zr не по-
строена до сих пор. Различные исследователи [1—22] сообщают об
образовании промежуточных фаз, число, стехиометрия и кристалли-
ческая структура которых не всегда совпадают. Для исследования,
как правило, были использованы материалы высокой чистоты —
иодидный цирконий, электролитическое или армко железо; сплавы
выплавляли в дуговой печи в атмосфере аргона, в индукционной
печи во взвешенном состоянии в атмосфере гелия, в электронно-
лучевой печи в вакууме. Исследования проводили методами микрос-
копического, рентгеновского фазового, дифференциального термичес-
кого анализов, а также измерением твердости, магнитного анализа,
Мессбауэровской спектроскопии и др.
Надежно установлено существование соединения ZrFe2, которое
плавится конгруэнтно при 1675 °C, имеет область гомогенности
протяженностью 27,7—34,3 % (ат.) Zr при температуре 1450 °C 111
и 27,1—34 % (ат.) Zr при температурах 700—500 °C [10] (рис. 317).
В работе [1] сообщается о соединении ZrFe3, относящемся к струк-
турному типу Ti6Mn23 [12], а в работе [3] — о соединении
^го,22^ео,78’ существующем при высоких температурах и являющемся
фазой Лавеса (тип MgNi2). Однако более поздними исследованиями
[10] образование фаз со структурой типов Th6Mn23 и MgNi2 в систе-
Fe—Zr
587
pc 2r не было подтверждено и высказано предположение, что
ение их является результатом загрязнения сплавов.
П° Соединение Zr2Fe впервые найдено авторами работы [2], подтвер-
ждено в исследованиях [4—7, 9, 10, 13, 14]. Оно образуется по пери-
тектической реакции Ж + ZrFe2 * Zr2Fe при 974 °C и существует в
гоаниченном интервале температур, претерпевая эвтектоидный
паспад по реакции Zr2Fe * ZrFe2 + Zr3Fe при температуре -775 °C
(пис. 317) [7, 9]. Для получения сплава Zr2Fe в однофазном состоя-
нии требуется длительный отжиг (100 ч при 900 °C), а для предот-
вращения его эвтектоидного распада необходима резкая закалка из
области существования соединения [10].
Стехиометрический состав наиболее богатого Zr соединения Zr3Fe
установлен в работе [5] (ранее наиболее богатым Zr соединением
полагали Zr.Fe [2, 13]), подтвержден в исследованиях [6—11, 14,
15]. Zr3Fe образуется по перитектоидной реакции Zr2Fe + (0Zr) *
и Zr3Fe при температуре -885 °C [6, 7, 9]. Граница области гомоген-
ности фазы на основе Zr3Fe со стороны Fe находится при содержа-
нии 73,2 % (ат.) Zr, со стороны Zr граница не установлена [10]
(рис. 317).
В богатых Zr сплавах происходит эвтектическая реакция Ж *»
(0Zr) + Zr2Fe. Согласно данным работ [7, 9] эвтектическая темпе-
ратура составляет 928 °C, эвтектическая концентрация — 76 % (ат.)
Zr (согласно более ранним данным эвтектическая температура равна
947±5 °C [2]). Растворимость Fe в (pZr) при эвтектической темпера-
туре определена равной 6,75 % (ат.) [Э] или 8,68 % (ат.) [2] и с
понижением температуры уменьшается.
Fe понижает температуру превращения (0Zr) (aZr). Твердый
раствор на основе (pZr) претерпевает эвтектоидный распад (0Zr) и
“ (aZr) + ZtoFe [5, 7, 9]. В различных работах приводят значения
эвтектоидной температуры, близкие к 735±5 °C [1, 7, 9] или к 795+
±5 °C [2, Ш]. В исследовании [9] найдено, что эвтектоидный распад
происходит в интервале температур вследствие присутствия примеси
кислорода в сплавах. Температура -735 °C принята в качестве
эвтектоидной температуры в системе Zr—Fe при 0 % О. Эвтектоид-
ная концентрация составляет 3,55 % (ат.) Fc [Э] или 4,02 %
(ат.) [2].
Растворимость Fe в (aZr) незначительна: -0,033 % (ат.) при
тектодиной температуре и при 700 °C -0,02 % (ат.) [Э]. По
Г12?ым Рентгеновского анализа и Мессбауэровской спектроскопии
on i Нлайдено’ чт0 в <«Zr) растворяется Fe, % (ат.): 0,024; 0,018;
ственн GO? ~ ПРИ темпеРатУРах» °^: 670, 600, 520, 400 соответ-
ПОнижает температуру плавления и температуру превращения
' ** (yFe). По данным работы [17], температура эвтектической
588
Fe—Zr
Рис. 317. Fe—Zr
Fe—Zr
589
кпии Ж * (yFe) + ZrFe2 равна 1325 °C, концентрация Zr в эвтек-
SefcKofi точке составляет 10,4 % (ат.). В (yFe) при эвтектической
температуре растворяется -0,6 % (ат.) Zr [18]. Реакцию распада
(fiFe) ** (yFe) + Ж наблюдали при 1350 °C, участвующие в этой реак-
ции фазы (SFe) и (yFe) согласно работе [16] содержали 5,05 и 0,61
у (ат.) Zr соответственно, а жидкая фаза 10,1 % (ат.) Zr. По дан-
ным измерения магнитной восприимчивости [19], температура
ояспада фазы (6Fe) равна 1355 °C, что совпадает с данными работы
[17], однако состав фазы 6 отличается существенно — 0,4 % (ат.) Zr,
а фаза (yFe) содержит 0,2 % (ат.) Zr. Последние данные более
предпочтительны. В работе рассчитывали также изменение энергии
Гиббса. Температура эвтектической реакции согласно работе [9]
равна 1335 °C.
Температура превращения (yFe) * (aFe) добавками Zr повышает-
ся до 925 °C [1,17, 19]. При этой температуре происходит перитекто-
идная реакция (yFe) + ZrFe2 ** (aFe), причем в (aFe) растворяется
0,1 % (ат.) Zr, в (yFe) -0,2 % (ат.) Zr [19].
Диаграмма состояния Fe—Zr (рис. 317) построена в основном с
использованием данных работ [7, 9, 10, 19].
В работе [22] на основании экспериментальных результатов и
обобщения литературных данных предложен топологически идентич-
ный вариант фазовой диаграммы Fe—Zr, несколько отличающейся
температурами нонвариантных равновесий.
Кристаллическая структура соединений системы Fe—Zr указана в
табл. 227.
Таблица 22 7. Кристаллическая структура соединений системы Fe—Zr
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь С
ZrFe2 MgCu2 CF24, Fd Зт 0,695- -0,706* 0,704** — [W] [Ю]
Zr-Fe CuA12 tl\2, 74/ тст 0,636 — 0,582 [10, 20]
Zr3Fe Re3B оС\Ь, Стет 0,8819 0,332 0,3329 1,095 1,0952 0,881 [7] НО]
0,3321 1,0966 0,8825 [И]
области гомогенности от стороны, богатой Fe, к стороне, богатой — Стехиометрическом составе. Zr.
590
Fe-Zr
Соединение Zr^Fe, о котором сообщали в работах [2, 4, 5. )3]
(структура его не была установлена), в последнее время рассматрива-
ют как метастабильную фазу, образование ее часто наблюдают при
отжиге аморфных сплавов Zr—Fe, получаемых путем закалки из
жидкого состояния [8, 21]. Для фазы, обозначенной pZr4Fe (содержа-
ние Fe около 20 % (ат.)), в работе [8] предлагают ромбическую
структуру с параметрами решетки а = 0,3283, Ь = 0,3553, с = 0.6867
нм. Согласно работе [21] эту ромбическую фазу можно представитъ
также как результат ромбического искажения тетрагональной решет-
ки типа CuAu2 и обозначать следует не 0Zr4Fe, a pZr3Fe.
При кристаллизации аморфных сплавов наблюдали также образо-
вание фазы Zr2Fe с кубической структурой типа Ti2Ni или W3Fe3C
(Е93) [8, 10, 14, 15, 21], которая возникала вследствие загрязнения
сплавов примесями внедрения (О, N).
Литература
1. Свечников В.Н., Пан В.М., Спектор А.Ц. // Журнал неорганической химии.
1963. Т. 8. № 9. С. 2118-2123.
2. Rhines F.N., Gould R.W. // Advan. X-Ray Anal., 1963. V. 6. P. 62-73.
3. Гусева Л.Н., Малахова T.O. // Металлофизика. 1973. Вып. 46. С. 111—113
4. Бабикова Ю.Ф., Филиппов В.П., Штань И.И. // Атомная энергия. 1972. 1 32
№ 6. С. 484—485.
5. Малахова Т.О. // Структура фаз, фазовые превращения и диаграммы состояния
металлических систем: Сб. статей. М.: Наука, 1974. С. 144—147-
6. Малахова Т.О. // Сплавы для атомной энергетики: Сб. статей. М.: Наука, 1974
С. 123-130.
7. Malachova Т.О., Alekseyeva Z.M. //J. Less-Common Met. 1981. V. 81 X 2.
P. 293-300.
8. Buschow K.H.J. Ц Ibid. 1981. 79. N 2. P. 243-253.
9 Малахова T.O., Кобылкин A.H. // Изв. АН СССР. Металлы. 1982. V 2
С. 205-209.
10. Aubertin F„ Gonser U., Campbell S.J., Wagner H.—G. // Z. Metallkunde 1 985.
Bd. 76. N 4. S. 237-244.
11. Matcovic T., Kesic—Racan M., Matcovic P. 11 Metalurgija. 1986. V. 25 X 3.
P 87-91.
12. Крипякевич П.И., Протасов B.C., Черкашин E.E. // Журнал неорганической
химии. 1965. Т. 10. № 1. С. 288-290.
13. Тарараева Е.М., Иванов О.С. // Строение и свойства сплавов для атомной
энергетики: Сб. статей. М.: Наука, 1973. С. 131—138.
14. Van Essen R.M., Buschow K.H.J. 11 J. Less-Common Met. 1979 V- ''4
P. 277-284.
15. Vincze L, Van der Woude F., Scott M.G. // Solid State Commun. 1981 V. <’
N7.P. 567-570.
16. Stupel M.M., Bumberger M„ Weiss B.Z. // Scr. Metall. 1985. V 19. x 6
P. 739-740.
17. Свечников B.H., Спектор А.Ц. // Доклады АН СССР 1962. Т. 143 X1 3
С. 613-615.
Ga—Gd
591
< 1g Свечников ®-н-’ Спектор А.Ц. // Вопросы физики металлов и металловедения.
,лхл Вып* 11* С* 30—35.
*19 Fischer W.A., Lorenz К., Fabritius Н„ Schlegel D. // Arch. Eisenhiittenwes.
1070 Bd 41- N 5. S. 489—498.
2q Кузьма Ю.Б., Маркив В.Я., Ворошилов Ю.В., Сколоздра Р.В. // Изв. АН
гССР Неорганические материалы. 1966. 2. № 2. С. 259—263.
^21 Vincze I., Van der Woude F., Buschow K.H.J. //J. Non-Cryst. Solids. 1983.
v 54 N 1-2. P.101-106.
V 22 Алексеева 3.M., Короткова H.B. // Изв. АН СССР. Металлы. 1989. № 4.
с 202-208.
Л-А. Третьяченко
Ga—Cd. ГАЛЛИЙ-ГАДОЛИНИЙ
Диаграмма состояния Ga—Gd построена в работе [1] (рис. 318) на
основе обобщения данных работ [2—4] в области составов со стороны
Gd и данных работ [5—7] в области составов со стороны Ga.
В системе существует пять промежуточных фаз: Ga6Gd, Ga2Gd,
GaGd, Ga2Gd3 и Ga3Gd5. Соединение Ga2Gd плавится конгруэнтно
при 1400 °C [2] и имеет широкую область гомогенности [-13 %
(ат.)], простирающуюся в сторону избытка Ga [5]. Этой фазе припи-
сывается формула Ga2(i + ^Gdj , где 0 < х < 0,33. По данным работ
16, 7], область гомогенности на основе Ga2Gd простирается от 22,0
до 33,3 % (ат.) Gd.
ба
^^e-Ga-Cd
Gd°/o(am.)
Gd
592
Ga—Gd
Соединения Ga6Gd, GaGd, Ga2Gd3, Ga3Gd5 образуются по пери-
тектическим реакциям. Нонвариантные реакции в системе G,:i— Gd
представлены в табл. 228.
Таблица 22 8. Нонвариантные реакции в системе Ga—Gd
Реакция Содержание Gd в Температу- ра, "С Источник
фазах, % (ат.)
Ж * (Ga) + Ga6Gd <0,1; 0; 14,3 29 1П '
Ж + Ga2Gd e Ga6Gd 0,4 22; 14,3 406 [1, 7]
Ж + Ga2Gd * GaGd 55; 33,3; 50 1195 1Н
Ж + GaGd * Ga2Gd3 61,5; 50; 60 1110 [И
Ж + Ga2Gd3 * Ga3Gd5 64; 60; 62,5 1090 [И
ж » Ga3Gd5 + (aGd) 80; 62,5; 100 850 [1]
ж + (aGd) ’ (pGd) -95; -100, <100 <1235 U1
Данные по кристаллической структуре промежуточных фаз систе-
мы Ga—Gd приведены в табл. 229.
Таблица 2 2 9. Кристаллическая структура соединений системы Ga—Gd
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a b c
Ga6Gd Ga6Pu tP\4, P4/nbm 0,5946 0,5945 — 0,7601 0,7571 [51 [81
Ga2Gd A1B2 hP3, Pf>/ mm 0,4223 0,4223- -0,4268 — 0,4137 0,4137- -0,4218 [2[ [51
GaGd CrB oC8, Cmcm 0,4343 0,4341 0,43372 1,1017 1,102 1,10316 0,4114 0,4066 0,41106 [21 [91 [Ю!
Ga2Gd3 Ga2Gd3 6/80, 14/mem 1,1666 — 1,5061 [HI
Ga3Gd5 Gr5B3 tI32, 14/mem 0,7726 0,7723 0,7742 — 1,4170 1,4226 1,416 fl 2[ [21 [13|
Литература
1. Palenzona A., Cirafici S. // Bull. Alloy Phase Diagr. 1990. V. 11. N I P. 67—72
2. Buschow K.H.J., Van der Hoogenhof W.W. 11 J. Less-Common Met. 1976. V 4^
N 2. P. 309-319.
3. Yatsenko S.P. // J. Chim. Phys. 1977. V. 74. N 7-8. P. 836-843.
4. Yatsenko S.P., Semyannikov A.A., Semenov B.G. et al. // J. Less-Common M 1
1979. V. 64. N 2. P. 185-199.
5. Pelleg J., Zevin L. // J. Less-Common Met. 1981. V. 77. N 2. P. 197—203.
Ga—Ge
593
6 Dayan D., Atzmony U., Dariel M.P. //J. Less-Common Met. 1982. V. 87. N 1.
G., Dayan D., Zevin L., Pelleg J. // Metall. Trans. A. 1985. V. 16. N 1—6.
P ^Pelleg J., Kimmel G., Dayan D. // J. Less-Common Met. 1981. V. 81. N 1.
^-Raenziger N.C., Moriarty J.L. // Acta Crystallogr. 1961. V. 14. N 9. P. 946—947.
10. Dwight A.E., Downey J.W., Conner, Jr., R.A. // Acta Crystallogr. 1967. V. 23.
W 5 P- 860—862.
'll. Yatsenko S.P., Hladyschewsky R.E., Sitschewitsch O.M. et al. // J. Less-Common
Met 1986. V. 115. N 1. P. 17-22.
12. Palenzona A., Franceschi E. // J. Ijcss-Common Met. 1968. V. 14. N 1. P. 47—53
13. Дзяна Д.1., Крипякевич П.1. // Допов1д1 АН УРСР. Сер. А. 1969. № 3. С.
247-250.
Л.Е. ПТелимова
Ga—Ge. ГАЛЛИЙ—ГЕРМАНИЙ
Диаграмма состояния Ga—Ge построена в работе [1] (рис. 319) на
основе обобщения и оптимизации данных рентгенофазового и метал-
лографического анализов [X, Э].
Кот СТОроны Ga в системе существует вырожденная эвтектика,
ческоЯ СОдержит 5 ’ Ю 3 % <ат-) Ge [Э]. По данным термодинами-
6 . iQ-з Расчета, положение эвтектической точки соответствует
Л (ат.) Ge, температура -29,77 °C.
594
Ga-H
Кривая растворимости Ga в Ge имеет ретроградный харакТео
По данным определения параметров решетки в функции от состава
максимальная растворимость Ga в Ge составляет 2,6 % (ат.) Ga при
температуре 780 °C [X]. Однако, по данным работы [Э], основанным
на спектрофотометрическом анализе и измерении электрофизических
свойств направленно выращенных кристаллов растворимость Ga в Ge
существенно ниже и составляет:
Температура, °C................ 900 800 650 400 300
Растворимость Ga, % (ат )...... 0,5 0,95 1,1 0,8 0,6
Максимальная растворимость Ga в Ge наблюдается при 650 "С.
Из данных рентгенографического исследования [2] следует, что
параметр решетки Ge (а = 0,56574 нм) линейно возрастает при
увеличении концентрации атомов Ga примерно на 0,00004 нм / %
(ат.).
Теплоты смешения жидких сплавов Ga—Ge определяли в широкой
области составов при температурах 1000 °C [3], 997 °C [4] и 967 °C
[5]. Экспериментальные результаты работ [3, 5] были оптимизи-
рованы в работе [1], в результате чего получено следующее уравне-
ние: Дт1пЯ = xGexGa(-2580 + 59,0xGa) Дж/моль, где xGe и xGa -
атомные доли компонентов.
Литература
1. Olesinski R.W., Abbaschian G.J. И Bull. Alloy Phase Diagr. 1.985. V. 6. N 3
P. 258-262.
2. Greiner E.S., Breidt P. // J. Metals. 1955. V. 7. N 1. P. 187-188.
3. Predel B., Stein D.W. // Z. Metallkunde. 1971. Bd. 62. N 6. P. 499-504.
4. Bergman C., Bros J.P., Laffitte M. 11 Termochim. Acta. 1971. V. 2. P. 259—263
5. Eslarni H., Miggianu Y.M., Gambino M., Bros J.P. // J. Less-Common Met. 1979
V. 64. N 1. P. 31-44.
Л.Е. Шелимова
Ga-H. ГАЛЛИЙ—ВОДОРОД
По данным работы {1], в системе образуется гидрид Са2Нб’
устойчивый от комнатной температуры до 130 °C. Его структура
неизвестна, температура плавления — 21,4 °C. Имеются также
сведения о соединении GaH3, разлагающемся при комнатной темпе-
ратуре [2].
Литература
1. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с
2. Фромм Е., Гебхардт Е. Газы и углерод в металлах. Пер. с нем. / Под ’
Линчевского. М.: Металлургия, 1980. 712 с.
В.И. И1а1и')ваЮв
Ga—Hf
595
Ga-Hf. ГАЛЛИЙ-ГАФНИЙ
Схематическая диаграмма состояния Ga—Hf, представленная на
, 320 предложена в работе [1]. Исследование проводили методами
£ш4ьеоенциального термического, микроструктурного и рентгенофа-
системе образуются семь соединений с
большинства из них выше 1300 °C. В
Предполагается, что в
температурами плавления
СИС^Ме имеются два эвтектических равновесия
Ж «* (Hf) + Hf5Ga3 180 % (ат.) Hf];
п/ * Hf5Ga3 + Hf5Ga4 [~55 % (ат.) Hf]
аРи температурах выше 1300 °C.
120П ^2Ga образуется предположительно при температуре выше
Ние G по перитектоидной реакции между (Hf) и Hf5Ga3. Соедине-
Те. Hf5^a3 плавится, по-видимому, с открытым максимумом при
ДаннСРаТУре > ISO® °G- ^a3a Hf5Ga4 также плавится конгруэнтно,
+ ее структуре нет. По перитектической реакции Ж +
CQ(yJ5Ga4 11 HfGa образуется соединение HfGa со структурой
n QHHOro типа. Фаза Hf2Ga3 образуется по реакции Ж + HfGa *
596
Ga—Hg
Соединение HfGa2 образуется по перитектоидной реакции
Hf2Ga3 + HfGa3 HfGa2 при -1100 °C и имеет структуру собствен-
ного типа. Фаза HfGa3, вероятно, образуется перитектически из
расплава и Hf2Ga3.
Кристаллографические характеристики соединений приведены в
табл. 230.
Таблица 23 0. Кристаллическая структура соединений системы Ga—Hf
Соедине- ние I IpoTOTHn Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a b c
Hf2Ga A12Cu tn 2, /4/mem 0,6686 — 0,5295 13]
Hf5Ga3 Si3Mn5 hP\6, Pb^/ mcm 0,7970 0,7962 — 0,5686 0,5676 [3] 14]
HfGa HfGa Pbcm 0,9171 0,8503 0,5648 12]
Hf2Ga3 Al3Zr2 oF4Q, Fdd2 0,5472 0,9402 1,3630 [3]
HfGa2 HfGa2 tl24, I4jamd 0,4046 — 2,5446 [3]
HfGa3 Al3Ti US, 14/mmm 0,3881 — 0,9032
Литература
1. POtzschke М„ Schubert К. И 7.. Metallkunde. 1962. Bd. 53. N 7. S. 474-488.
2. MapKiB В.Я., Белявша H.H. И Доповщ! АН УРСР. Сер. Б. 1986. № 4
С. 43—47.
3. Schubert К., Meissner Н,—G., POtzschke М. и.а. // Naturwissenschaften. 1962.
Bd. 49. N 3. S. 57-58.
4. Boiler H., Parthe E. // Monatsh. Chemie. 1963. Bd. 94. N 1. S. 225—226
Ю.Н. Гринь
Ga—Hg. ГАЛЛИЙ—РТУТЬ
Данные, полученные в ранних исследованиях системы Ga—Hg |Х]
о полной нерастворимости компонентов, в более поздних работах нс
были подтверждены. Диаграмма состояния (рис. 321) построена в
работе [1] методом дифференциального термического анализа с
использованием Ga чистотой 99,999 % (по массе) и дистиллирован-
ной ртути.
В системе протекает монотектическая реакция при 27,72 с.
Область несмешиваемости в жидком состоянии простирается от 4 Д°
98,5 % (ат.) Ga. Со стороны Hg имеется вырожденная эвтектика.
Ga-Но
597
Hg Gaf/Ham.) Ga
Рис. 321. Ga—Hg
Растворимость Ga в Hg, определенная потенциометрическим
методом и химическим анализом, равна 3,82 % (ат.) при температу-
ре 30 “С [Э].
Литература
L Predef В. И Т. Physik. Chemie. 1960. Bd. 24. N 3/4. S. 206-216.
Ю.Н. Гринь
Ga-Ho. ГАЛЛИЙ—ГОЛЬМИЙ
<^ема ^а—Но (рис. 322) исследована многократно методами
^^Реренциального термического, микроструктурного, рентгенофазо-
работ3^71*130® в Работах [1—3] и рентгеноструктурного анализа в
Или аХ 5] • Сплавы получали из компонентов дуговой плавкой
танталовых герметичных тиглях.
598 Ga—Ho
Ga,°/o(no пассе)
Рис. 322. Ga—Но
В системе найдено семь соединений, из которых GaHo и GibH0
плавятся конгруэнтно при 1280 °C и 1270 °C соответственно.
Нонвариантные реакции в системе Ga—Но представлены в
табл. 231.
Ga—Ho
599
Таблица 23 1. Нонвариантные реакции в системе Ga—Ho
Реакция Содержание Ga в фазах, % (ат.) Темпе- ратура, "С Источ- ник
X »• (Но) + Ga3Ho5 20; -0; 37,5 950 [1, 2]
Ж + GaHo •* Ga3Ho5 -37; 50; 37,5 1230 [1, 2]
Ж - GaHo + Ga2Ho 57; 50; 66,7 1210 [1, 2]
Ж + Ga2Ho * Ga3Ho -85; 66,7; 75 870 [1, 2]
Ж + Ga3Ho - Ga6Ho -98; 75; 85,7 312 [7]
Ж - (Ga) + Ga6Ho -100; -100; 85,7 -29,8 [1, 2]
При последующем детальном изучении отдельных фаз показано,
что Ga3Ho имеет пять модификаций, температурные интервалы
существования установлены лишь для двух: вблизи температуры
ликвидуса стабильна модификация со структурой типа Cu3Au, а при
низких температурах (250—600 °C) — модификация со структурой
типа Ni3Ti [6].
Согласно работе [7] соединение Ga6Ho образуется по перитекти-
ческой реакции при 312 °C. При температуре 600 °C найдены фазы
составов Ga5Ho3 [3] и Ga2Ho3 [5] (показаны на диаграмме штрихо-
вой линией). В работе [8] сообщается, что Ga3Ho5 имеет вторую
модификацию со структурой типа B3Gr5, стабильную при температу-
ре 600 °C.
Кристаллическая структура соединений представлена в табл. 232.
Таблица 23 2. Кристаллическая структура соединений системы Ga—Ho
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b С
Ga6Ho Ga^Pu tP4, P4nbm 0,5920 — 0,7540 17]
«Ga3Ho Ni3Ti hP16, Р63/ттс 0,6082 — 0,9417 [6]
PGa3Ho RhNi2Ta Pf^/mmc 0,6161 — 2,304 [6]
YGa3Ho Al3Ho hR20, R3m 0,6078 — 3,529 [6]
ftGa3Ho PA13PU hP24, Pb^/mmc 0,6084 — 1,4061 [9]
*Ga3Ho Cu3Au cP4, РтЗт 0,4227 0,4237 — — [1] [6]
600
Ga—I
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Исючник
а b с
Ga2Ho B2A1 АРЗ, Р6/ттт 0,4189 — 0,4063 1П
Ga5Ho3 Ga5Tm3 оР32, Рпта 1,1380 1,1347 0,9619 0,9630 0,6057 0,6046 I4| 13)
GaHo CrB оС8, Стет 0,4281 1,0805 0,4042 [1,2]
Ga2Ho3 Ga2Gd3 74/ тст 1,1489 — 1,470 15]
Ga3Ho5 (ВТ) Si3Mn5 h.Plf>, Р63/ тст 0,8571 — 0,6331 [I, 2]
Ga3Ho5 (HT) BjCr, 1132, 14/тст 0,7590 — 1,4001 181
Литература
1. Яценко С.П., Семянников А.А., Чунтонов К.А. // Изв. АН СССР. Металлы.
1978. № 3. С. 201-204.
2. Yatsenko S.P., Semyannikov А.А., Semenov B.G. et al. // J. Less-Common Met.
1979. V. 64. N 2. P. 185-199.
3. Марюв В.Я., Жушбвська Т.Г., Белявша H.M. // Допов1д1 АН УРСР. Сер А.
1981. № 3. С. 84-86.
4. Yatsenko S.P., Hladyschewsky E.I., Tschuntonow К.А. et al. // J. Less-Common
Met. 1983. V. 91. N 1. P. 21-32.
5. Yatsenko S.P., Hladyschewsky R.E., Sitschewitsch O.M. et al. // J. Less—Common
Met. 1986. V. 115. N 1. P. 17-22.
6. Cirafici F„ Francheschi E. 11 J. Less-Common Met. 1981. V. 77. N 2. P. 269-280.
7. Pelleg J., Kimmel G., Dayan D. // J. Less-Common Met. 1981. V. 81. N L
P. 33-34.
8. Hladyschewsky E.I., Yarmolyuk Ya.P., Hryn Yu.N. // Acta Crystallogr. A. 1985.
V. 40. N 5. P. 243.
9. Carnasciali M.M., Cirafici S., Francheschi E. // J. Less-Common Met. 1981 V 81
N 1. P. 115-116.
Ю.Н- l'pu*b
Ga—I. ГАЛЛИЙ-ЙОД
Диаграмма состояния Ga—I, представленная на рис. 323, построена
в работе [1]. В системе образуются три соединения: Gal, Gal2 и Gah-
Соединение Gal образуется синтектически при 269 °C, a Gal2 и С’3 з
плавятся конгруэнтно при 211 и 213 °C соответственно. При темпера-
турах выше 269 °C в области концентраций 2—64 % (ат.) I наблюда-
ется несмешиваемость компонентов в жидком состоянии. В системе
существуют четыре эвтектические равновесия:
Ga—In
601
Рис. 323. Ga—I
‘ Ж « Gal + Gal2 при 206 °C и -65 % (ат.) I;
. Ж * Gal2 + Gal3 при 159 °C и -69 % (ат.) I;
Ж Gal3 + (I) при 98 °C и -90 % (ат.) I,
Ж - (Ga) + Gal при <30 °C и 0 % (ат.) I.
Кристаллическая структура Gal3 ромбическая: пространственная
ФУПпа Стет , а = 1,829, b = 0,594, с = 0,609 нм [2].
Литература
!• Кулюкин В.Н., Петров Е.С. // Изв. Сибирского отделения АН СССР. 1969.
Вып. 5. № 12. С. 52-56.
мн ' 5mma Rundle R.E. 11 Proc, and Abstr. Amer. Crvst. Ass. Annual Meeting.
Milwaukee. 1958. P. 16.
Ю Н. Гринь
Ga-4n. ГАЛЛИЙ—ИНДИЙ
B Da6ntrPaMMa СОСтояния Ga—In, приведенная на рис. 324, построена
2—g6] Ш На основе обобщения и оптимизации данных работ [X,
А.
602
Ga—In
Диаграмма состояния является диаграммой эвтектического типа.
Положение эвтектической точки соответствует: 12,5 % (ат.> In
(15,9 °C) [2]; 16,5 % (ат.) In (15,7 °C) [X, 3]; 15,8 % (ат.) In
(15,8 °C) [4]; 13,2 % (ат.) In (15,2 °C) [5]; 13,8 % (ат.) In (15,3 С)
[6, 7J. Термодинамический расчет дает следующие координаты
эвтектической точки: 14,2 % (ат.) In и 15,8 °C [8]. На основе крити-
ческого анализа экспериментальных данных в работе [1] рекоменду-
ются координаты: 14,2 % (ат.) In и 15,3 °C.
Растворимость In в Ga составляет менее 0,3 % (ат.). Раствори-
мость Ga в In изучалась многими авторами [X, 1]. Сведения о значи-
тельной растворимости Ga в In [~18 % (ат.)] [X] не подтвердились
более поздними исследованиями ]3, 9]. Согласно работе [3] макси-
мальная растворимость Ga в In составляет 3,1 % (ат.) при эвтекти-
ческой температуре. Согласно данным работы ]9] растворимость Ga
в In при 120, 100 и 20 °C составляет 1,66; 1,82 и 1,1 % (ат.) соответ-
ственно. Кривая солидуса имеет ярко выраженный ретроградный
характер.
Имеются сведения о метастабильной диаграмме состояния
Gall—In, где Gall — метастабильная модификация, существунипая
при высоких давлениях [Ш]. Диаграмма состояния — эвтектического
типа с координатами эвтектической точки: — 28,3 °C и 6,3 % '
Ga—Ir
603
По данным работы [10], существует метастабильная фаза
’ тп с ромбической решеткой типа aU (символ Пирсона оС4, пр.
^^Стст) с параметрами: а = 0,2770 нм, b = 0,8183 нм, с = 0,3306
£ <-1« -о.
Литература
1 Anderson T.J., Ansara I. // J. Phase Equilibria. 1991. V. 12. N 1. P. 64—72.
2 Predel B., Stein D.W. //J. Less-Common Met. 1969. V. 18. N 1. P. 49—57.
Heubner U., Wincierz P. // Metall. 1966. Bd. 20. N 7. S. 703—707.
4. Яценко С.П., Кононенко В.И., Данилин В.И. и др. // Тр. Ин-та химии
уральского научного центра АН СССР. 1966. Вып. 12. С. 51—56.
5. Топчян Л.С., Захаров Д.М., Людвигов Р.Б. и др. // Журнал физической
химии. 1973. Т. 47. № 1. С- 273—274.
6. Кикнадзе Г.И., Деспири А.И., Захаров Д.М. и др. // Атомная энергия. 1965.
Т. 19. № 2. С. 178.
7. Захаров Д.М. // Журнал физической химии. 1975. Т. 49. № 9. С. 2208—2209.
8. Hayes F.H., Kubaschewski О. // J. Inst. Metals. 1969. V. 97. Р. 381-383.
9. Кузнецова С.К., Шкаликова К.И., Кузнецов Г.М. // Изв. АН СССР. Неоргани-
ческие материалы. 1975. Т. И. № 6. С. 1016—1019.
10. Szymanski D., Barrick J.C., Giessen В.С. // J. Solid State Chemistry. 1979. V. 30.
Nl.P. 55-59.
Ю.Н. Гринь
Ga—Ir. ГАЛЛИЙ—ИРИДИЙ
Диаграмма состояния Ga—Ir не построена. В литературе [1—5]
имеются сведения о существовании четырех интерметаллических
соединений, температура и характер образования которых не
указаны.
Кристаллографические характеристики соединений представлены
в табл. 233.
Таблица 23 3. Кристаллическая структура соединений Ga—Ir
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b с
Са,1г2 А19Со2 тР22, Р2}/с 0,6467 0,6409 0,8853 [1]
Ga3k CoGa3 tPlf>, Р4т2 0,640 — 0,659 [2, 3]
Gaslr3 Ga5Ir3 tP32, Р4п2 0,5823 — 1,420 [4, 5]
Galr CsCl сР2, 0,298 [Э]
РтЗт 0,3004 — —• [6]
604
Ga-K
Литература
1, Edshammar L.—E. // Acta Chim. Scandin. 1970. V. 24. N 4. P. 22—23
2. Schubert K., Breimer H., Gohle R. u. a. // Naturwissenschaften. 1958 Bd 45
N 15. S. 360-361.
3. Schubert K., Lukas H.L., Meissner H.~G. u. a. // Z. Metallkunde. 1959 Bd 5q
N 9. S. 534-540.
4. VOlenkle H., Wittman A., Nowotny H. // Monatsh. Chemie. 1966. Bd. 97 2
S. 506—516.
5. Holleck H., Nowotny H„ Benesowsky F. // Monatsh. Chemie. 1963. Bd. 94 \ 5
S. 841-843.
Ю.Н. Гринь
Ga-K. ГАЛЛИЙ-КАЛИЙ
Диаграмма состояния Ga—К, представленная на рис. 325, постро-
ена в работе [1] на основе обобщения экспериментальных данных |2,
3]. Диаграмма состояния не установлена окончательно вследствие
возможности окисления и испарения К. Установлено существование
соединений Ga13K3 и Ga3K, которые образуются по перитектическим
реакциям. В системе существует область несмешиваемости в жидком
состоянии, граница которой со стороны Ga не установлена с доста-
точной степенью точности, а со стороны К отвечает 99 % (ат.) К.
Ga К,°/в(ат.) К
Рис. 325. Ga-K
Ga-K
605
Существование соединения Ga8K5 точно не установлено. В работе
„ заключение о его образовании было сделано на основе данных
пмического анализа. Согласно данным работы [3] соединение в
ТС й области составов имеет формулу Ga2K. Рентгенографическое
^следование [4] не подтвердило существование соединения Ga8K5
и показало, что только два соединения — Ga13K3 и Ga3K образуются
системе Ga—К. На рис. 328 условно показано, что соединение,
близкое по составу к Ga8K5, образуется синтектически при темпера-
туре 620 С.
Нонвариантные реакции в системе Ga—К приведены в табл. 234.
В системе существуют две вырожденные эвтектики — со стороны
Ga и К.
Таблица 23 4. Нонвариантные реакции в системе Ga—К [1]
Реакция Содержание К в фазах, % (ат.) Темпе- ратура, °C
Ж - (Ga) + Gal3K3 -0; -0; 18,75 29,77
Ж + Ga3K и Ga)3K3 -5; 25; 18,75 5Ю±10
Ж + GagK5 - Ga3K ~21; 38,46; 25 -595
Ж| + Ж2 - GagK5 -38; >99,9; 38,46 -620
Ж2 * GagK5 + (К) -100; 38,47; -100 63,7
Данные по кристаллической структуре соединений системы Ga—К
приведены в табл. 235.
Существенная зависимость параметров решетки от состава, обна-
руженная в работе [7], указывает на наличие заметной области
гомогенности на основе соединения Ga3K.
Таблица 23 5. Кристаллическая структура соединений системы Ga—К
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
6а,3к3 Ga3K — оС128, Стет 0,6441 1,6143 2,8404 [5]
Ga3Rb Г/24, 0,6278 — 1,4799 14]
/4т2 0,6268 — 1,4782 [б]
Ga3K* Ga3K** — — 0,6271 — 1,481 [7]
— — 0,6126 — 1,480 [7]
*20 % (ат.) к.
(ат.) к.
606
Ga—I<a
Литература
1. Pelton A.D., Larose S. 11 Bull. Alloy Phase Diagr. 1990. V. 11. N 4. P. 343—34-7
2. Feschotte P. 11 Ann. Chim. (Paris). 1961. V. 6. P. 1029-1070.
3. Яценко С.П., Чунтонов К.A. // Изв. АН СССР. Металлы. 1973 V 6
С. 182-187.
4. Belin С., Ling R.G. // Compt. Rend. (Paris). 1982. V. 294. P. 1083-1086
5. Belin C. // Acta Crystallogr. 1980. В V. 36. N 6. P. 1339-1343.
6. Яценко С.П., Гладышевский Е.И., Чунтонов К.А. и др. // Кристаллшр.чбия
1983. Т. 28. № 4. С. 809-810. ’
7. Van Vucht J.H.N. // J. less-Common Met. 1985. V. 108. N 1. P. 163—175
Л.Е. llle su мова
Ga—La. ГАЛЛИЙ-ЛАНТАН
Диаграмма состояния Ga—La (рис. 326) построена в работе [ 1) на
основе обобщения данных термического, микроструктурного и рентге-
ноструктурного анализов [2—5]. В системе существуют пять проме-
жуточных фаз: Ga6La, Ga2La, GaLa, Ga3Lar и GaLa3, из которых
только Ga2La плавится конгруэнтно при 1450 °C [2, 3], а остальные
соединения образуются по перитектическим реакциям. Соединение
Ga2La имеет широкую область гомогенности, простирающуюся от 18
до 33,3 % (ат.) La [5]. В работе [6] предложена модель, основанная
на замещении атомов La парами атомов Ga, согласно которой дигал-
лиду лантана приписывается формула Ga2(1 + x)La(1 _ х).
Рис. 326. Ga—La
Ga—La
607
„ оаботе [71 сообщается об образовании соединения Ga4La вслсд-
ие упорядочения в Ga2(l + x)Lai . х. Соединение состава Ga4La с
СТ^ически деформированной структурой типа А1В2 найдено также
^работе (8] при температурах 400 и 600 °C.
* Нонвариантные реакции в системе Ga—La представлены в
табл. 236.
Таблица 23 6. Нонвариантные реакции в системе Ga—La
Реакция Содержание La в фазах, % (ат.) Темпе- ратура, °C Источ- ник
Ж * (Ga) + Ga6La <0,1; 0; 14,3 -29 [1]
Ж + Ga2La * Ga6La 0,5; 18; 14,3 477 [4, 51
Ж.+ Ga2La - GaLa 55,5; 33,3; 50 1010 Ш
Ж + GaLa - Ga3Las 70; 50; 62,5 825 [1]
Ж.+ Ga3La5 * GaLa3 79; 62,5; 75 615 [I]
Ж <* GaLa3 + (pLa) 80; 75; 100 550 [1]
Ж + (yLa) * (pLa) -94; -100; -100 <865 [1]
Кристаллическая структура соединений системы Ga—La пред-
ставлена в табл. 237.
Таблица 237. Кристаллическая структура соединений системы Ga—La
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b с
Ga6La Ga6Pu /Р14, 0,6094 — 0,7692 14]
P4/nbm 0,6101 — 0,7696 [9]
0,61041 — 0,77052 [Ю]
Ga4La — —. 0,434 0,757 0,441 [7]
Стет 0,4357 0,7540 0,4415 [8]
Ga2La aib2 hP3, 0,4320- — 0,4427- [6]
Р6/ттт -0,4352 — -0,4408
GaLa CrB оС8, 0,450 1,139 0,423 [И]
Стет 0,45226 1,15876 0,42559 [12]
0,4662 1,154 0,4181 [3]
Ga3La5 Cr5B3 /732, 0,8066 — 1,4733 [13]
14/тст 0,8056 — 1,468 [14]
GaLa3 AuCu3 сР4, 0,566 — — [3]
РтЗт
608
Ga—Li
Литература
1. Palenzona A., Cirafici S. 11 Bull. Alloy Phase Diagr. 1990. V. 11. N 1. p 7’—77
2. Yatsenko S.P. // J. Chimie Phys. 1977. V. 74. N 7-8. P. 836-843.
3. Yatsenko S.P., Semyannikov A.A., Semenov B.G., Chuntonov K.A. // j ]
Common Met. 1979. V. 64. N 2. P. 185-199.
4. Pelleg J., Kimmel G., Dayan D. // J. Less-Common Met. 1981. V 81 v 1
P. 33-44.
5. Dayan D., Atzmony U., Dariel M.P. //J. Less-Common Met. 1982. V 87 у 1
P. 87-98.
6. Kimmel G., Dayan D., Zevin L., Pelleg J. // Metall. Trans. A. 1985. V 16 \ i_a
P. 167-171.
7. Zevin L„ Pelleg J., Kimmel G., Dayan D. // Scripta Metall. 1984. V ig
P. 1257-1261.
8. Лапунова Р.Б., Гринь Ю.Н., Ярмолюк Я.П. 11 Изв. вузов. Цветная металлур-
гия. 1983. № 2. С. 116-118.
9. Гринь Ю.Н., Чунтонов К.А., Ярмолюк Я.П. та 1н // Доповда АН УРСР. Сер А
1981. № 5. С. 86-89.
10. Lu S.S., Xie S., Liang J. // Acta Phys. Sin. (China). 1982. V. 31. P. 1635—1641.
11. Parthe E., Hohnke D., Jeitschko W., Schob O. // Naturwissenschaften 1965
Bd. 52. N 7. S. 155.
12. Dwight A.E., Downey J.W., Conner Jr. R.A. 11 Acta Crystallogr. 1967. V. 23 N 5.
P. 860-862.
13. Palenzona A., Franceschi E. 11 J. Less-Common Met. 1968. V. 14. N 1. P. 47—53.
14. Дзяна Д.1., Крип’якевич ПЛ. // Доповщ! АН УРСР. Сер. А. 1969. № 3.
С. 247-250.
Л.Е. llle.iu.noea
Ga—Li. ГАЛЛИЙ-ЛИТИЙ
Диаграмма состояния Ga—Li, представленная на рис. 327, по-
строена в работе [1] на основе обобщения и оптимизации данных
[2-4].
В системе обнаружено шесть соединений, из которых только GaLi
плавится конгруэнтно при 730 °C по данным работы [2] и 740 °C по
данным работы [3]. Соединение GaLi имеет широкую область гомо-
генности, простирающуюся от 46 до 54 % (ат.) Li при 400 С по
данным [2] или от 45 до 56 % (ат.) Li по данным работы [5] при той
же температуре.
Соединению Ga14Li3 в работе [3] приписывалась формула Ga4Li,
однако более поздние рентгенографические исследования [6, 71 в
сочетании с химическим анализом показали, что соединение имеет
формулу Ga14Li3.
Существование соединения Ga4Li5 установлено авторами раооты
[8]. Предполагается, что Ga4Li5 разлагается по перитектоиДн0И
реакции, температура которой неизвестна.
Соединение Ga2Li3, которое также разлагается по пери гекто
идной реакции, имеет область гомогенности от 59,5 до 60,5 % (aT<
Li (415 °C) [5]. Соединение GaLi2 образуется по перитсктическо
Ga—Li
609
Li, °/o(rro массе)
реакции при 510 °C по данным [3] или при 515 °C по данным работы
[2] и имеет область гомогенности в пределах 66—67 % (ат.) Li
(415 °C) [5].
Нонвариантные реакции в системе Ga—Li представлены в
табл. 238.
Тай
о л и ц а 23 8. Нонвариантные реакции в системе Ga—Li
Реакция Содержание Li в фазах, % (ат.) Темпе- ратура, °C
Ж - (Ga) + Gal4Li3 -1,7; -0; 17,6 27,5±2
Ж + °a2Li . Gal4Li3 8; 33,3; 17,6 288±5
Ж + G®Li - Ga2Li -11; 46; 33,3 356±10
GaLi + Ga2Li3-Ga4L15 53; -59; 55,5 9
GaLi + GaLi2„Ga2Li3 56; 66,7; 60 477±10
* + GaLi - GaLi, 71,5; -58; 66,7 515±5
(Li) + GaLi2 97,5; -100, 66,7 1б7±1
Зак. 2144
610
Ga—Li
Данные по кристаллической структуре соединений системы Ga—Ц
представлены в табл. 239.
Таблица 23 9. Кристаллическая структура соединений системы Ga—Li
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник;
a b c
Ga14Li3 — hR5\, R3m 0,8441 0,8461 — 1,6793 1,6845 N
GaLi NaTl cF16, Fd3m 0,6150 0,6213 0,6207* 0,6220** 0,6238*** — — !3i |5] |2) 1?! [2!
Ga4Li5 — hR9, P3tn\ 0,4375 — 0,8257 181
Al2Li3 hR15, R3m 0,4367 — 1,3896 [01
GaLi2 — oCl2, Cmcm 0,4562 0,9542 0,4364 [9|
*50 % **51,8 ***53,8 (ат.) Li. % (ат.) Li. % (ат.) Li.
Параметр решетки GaLi растет линейно с увеличением содержа-
ния Li в пределах его области гомогенности (400 °C) [2].
Кристаллическая структура и точная формула соединения Ga2Li
не установлена.
Литература
1. Sangster J., Pelton A.D. // J. Phase Equilibria. 1991. V. 12. N 1. P. 33-j7
2. Thilmmel R„ Klemm W. // Z. Anorg. All. Chem. 1970. Bd. 376. N 1 S. 44--63.
3. Яценко С.П., Чунтонов К.А., Аляновский С.И., Диева Э.Н. // Изв. АН С( СР
Металлы. 1973. N 1. С. 185-188.
4. Яценко С.П., Салтыкова Е.А., Диев В.Н., Рыкова Л.Н. // Журнал физической
химии. 1973. Т. 47. № 9. С. 2417-2419.
5. Wen C.J., Huggins R.A. // J. Electrochem. Soc. 1981. V. 128. N 8. P. 163t>- -”41.
6. Belin C., Ling R.G. 11 J. Solid State Chem. 1982. V. 45. N 2. P. 290-292
7. StOhr J., Schafer H. 11 Rev. Chim. Min. 1982. Bd. 19. N 2. S. 122-127
8. StOhr J„ Schafer H. // Z. Anorg. All. Chem. 1981. Bd. 474. S. 221-225
9. Miiller W., StOhr J. // Z. Naturforsch. B. 1977. Bd. 32. N 6. S. 631-633
Л.Е.
Ga—Lu
611
Ga^Lu. ГАЛЛИЙ-ЛЮТЕЦИЙ
диаграмма состояния Ga—Lu (рис. 328) построена в работе [1]
-годами дифференциального термического, микроструктурного и
пентгенофазового анализов. Образцы получали из компонентов: Ga
Боготой не менее 99,9 % (по массе) и Lu чистотой не менее
20*
Ln}a/,(na массе)
612
Ga—Lu
99,71 % (по массе), дуговой плавкой или плавкой в запаянных
танталовых тиглях.
В системе установлено шесть соединений, из которых Ga-Lu
GaLu и Ga3Lu5 плавятся конгруэнтно при 1280, 1350 и 1420 °C. Фаза
Ga3Lu5 имеет область гомогенности протяженностью ~3 % (ат.) [2]
Таблица 24 0. Нонвариантные реакции в системе Ga—Lu [1J
Реакция Содержание Lu в фазах, % (ат.) Темперт vpa °C
Ж в (Ga) + Ga3Lu -0; -0; 25 -29.77
Ж + Ga2Lu Ga3Lu -17; 33,3; 25 930
Ж + Ga5Lu3 •* Ga2Lu -32,7; 37,5; 33,3 1170
Ж •* Ga5Lu3 + GaLu 43; 37,5; 50 1220
Ж •* GaLu + Ga3Lu5 53; 50; 57 1330
Ж Ga3Lu5 + (Lu) 80; 62,5; -100 1160
Соединение Ga2Lu3 было найдено в работах [3, 4] при 600 "С.
Температура реакции образования Ga2Lu3 точно не определена. Фазе
Ga5Lu3 ранее приписывали формулу Ga3Lu2. Формула Ga5Lu3 была
установлена при изучении кристаллической структуры [5, 6|.
Нонвариантные реакции представлены в табл. 240.
Кристаллическая структура соединений приведена в табл. 241.
Таблица 241. Кристаллическая структура соединений системы Ga—l.u
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
Ga3Lu Cu3Au СР4, РтЗт 0,4190 — — [7!
Ga2Lu Hg2K Imma 0,625 0,4185 0,8044 1«1
Ga5Lu3 Ga5Tm3 оР32, Рпта 1,124 0,9515 0,5960 |б|
GaLu CrB оС8, Стет 0,4217 0,42090 1,0532 1,05817 0,3995 0,40001 1’1 [41
Ga2Lu3 Ga2Gd3 /4/mem 1,1211 — 1,438 н;
Ga3Lus Si3Mn5 hP\f>, Р6}/ тст 0,8381 0,8382 — 0,6369 0,6347 111
Ga—Mg
613
Литература
Vatsenko S P . Semyannikov A. A., Semenov B.G. et al. //J. Less-Common Met.
*v АД. N 2. P.’185-199.
1^’, Palenzona A., Franceschi E. // J. Less-Common Met. 1968. V. 14. N 1. P. 47—53.
3 Hladyschewsky E.I., Yarmolyuk Ya.P„ Hryn’ Yu.N. // Acta Crystallogr. A. 1985.
v 40 SUppl- N 5. P. C 243.
V’ 4" Yatsenko S.P., Hladyschewsky E.I., Sitschewitsch O.M. et al. //J. Less-Common
Met 1986. V. 115. N 1. P. 17—22.
5 Сичевич O.M., Гладышевский P.E., Гринь Ю.Н. и др. // Диаграммы состояния
металлических систем: Тез. докл. на IV Всесоюзном совещании. М.: Наука. 1982.
г 99-100.
6 Yatsenko S.P., Hladyschewsky E.I., Tschuntonov К.А. et al. // L. Less-Common
Met. 1983. V. 91.N1.P. 21—32
7. Cirafici S., Francheschi E. // J. Less-Common Met. 1981. V. 77. N 2. P. 269—280.
8. Гладышевский Е.И., Гринь Ю.Н., Яценко С.П. и др. // Доповщ! АН УРСР.
Сер. А. 1980. № 6. С. 81-84.
9. Dwight А.Е., Downey J.W., Conner R.A. 11 Acta Crystallogr. 1967. V. 23. N 5. P.
860-862.
Ю.Н. Гринь
Ga—Mg. ГАЛЛИЙ—МАГНИЙ
Диаграмма состояния Ga—Mg приведена на рис. 329, в соответ-
ствии с работой [1], где она была исследована методами термическо-
го, рентгенофазового и микрорентгеноспектрального анализов. Ранее
в работе [2] были обобщены экспериментальные данные [X, 3—5], а
также проведен термодинамический анализ системы.
614
Ga-Mg
В системе образуются пять соединений: Ga2Mg5, GaMg2, GaMe
Ga2Mg и Ga5Mg2, из которых Ga2Mg5, GaMg и Ga2Mg плавятся,
данным работы [1], конгруэнтно при 470, 370 и -283 °C соответ-
ственно.
Ранее в работе [X] полагали, что GaMg образуется по перитекти-
ческой реакции Ж + GaMg2 GaMg при температуре 373 °C. Относи-
тельно характера образования соединения Ga2Mg также имеются
противоречивые данные: по данным работы [X], Ga2Mg образуется
по перитектической реакции Ж + GaMg •* Ga2Mg при температуре
285 °C, а, по данным работы [1], Ca2Mg плавится конгруэнтно при
-283 °C.
Согласно работе [1] все соединения, образующиеся в системе
Ga—Mg, имеют узкие области гомогенности — менее 0,1 % (ат.).
Данные работы [3] о наличии широкой области гомогенности на
основе соединения GaMg2 не подтвердились.
Таблица 24 2. Нонвариантные реакции в системе Ga—Mg
Реакция Содержание Ga в фазах, % (ат.) Темпе- ратура, “С Источник
Ж « (Mg) + Ga2Mg5 19,1; 3,1; 28,58 425 U, 3]
Ж + GiijMgj * GaMg2 -34; 28,58; 33,3 450 [1.3]
Ж - GaMg2 + GaMg -46; 33,3; 50 365 [1,3]
Ж •* GaMg + Ga2Mg -66,6; 50; 66,6 283 [1]
Ж + Ga2Mg - Ga5Mg2 -85; 66,6; 71,42 202 ш
Ж « (Ga) + Ga5Mg2 -100; -100; 71,42 29,75 !И
Таблица 24 3. Кристаллическая структура соединений системы Ga—Mg
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Исючник
а b С
Ga5Mg2 Ga5Mg2 Н28, /4/ттт 0,862(7) — 0,711(1) N
Ga2Mg Ga2Mg оР24, РЬат 0,680(2) 1,634(6) 0,411(1) [71
GaMg GaMg tI32, 1^!а 1,053 — 0,553 [81
GaMg2 GaMg2 hP\%, Р62с 0,7794 — 0,6893 [91
Ga2Mg5 Ga2Mg5 о728, Ibam 1,371 1,3708 0,702 0,7017 0,602 0,6020 [81 1101
Ga—Mn
615
Нонвариантные реакции в системе Ga—Mg представлены в
4абл. 242..
* Данные о кристаллической структуре соединении приведены в
ДитерДтуР3
1 Feschotte Р., Yvon К. // J. Less-Common Met. 1990. V. 158. N 1. Р. 89—97.
2 Nayeb—Hashemi A.A., Clark J.B. // Bull. Alloy Phase Diagrams. 1985. V. 6. N 5.
p 434—439.
' j predel B„ Stein D.W. // J. Less-Common Met. 1969. V. 18. N 3. P. 203—213.
4 Stahlin W. // J- Less-Common Met. 1973. V. 32. N 3. P. 395—397.
5 Eliner M., GOdecke T., Duddek G., Predel В. 11 Z. Anorg. All. Chem. 1980.
Bd- 463. N 1—2. S. 170—178.
6 . Smith G.S., Johnson Q., Wood D.H. // Acta Crystallogr. B. 1969. V. 25. N 3.
p 554__557.
7 , Smith G.S., Mucker K.F., Johnson Q. et al. // Acta Crystallogr. B. 1969. V. 25.
N 3. P. 549—553.
8 . Schubert K., Gauzzi F., Frank K. // Z. Metallkunde. 1963. Bd. 54. N 7.
S. 422—429.
9. Frank K., Schubert K. // J. Less-Common Met. 1970. V. 20. N 3. P. 215—221.
10. Schubert K., Frank K., Gohle R. u.a. 11 Naturwissenschaften. 1963. Bd. 50. N 2.
:S. 41.
JI. E. Шелимова
330, no-
чистотой
Ga-Mn. ГАЛЛИЙ—МАРГАНЕЦ
Диаграмма состояния Ga—Мп, представленная на рис.
строена в работе [1]. Образцы готовили из компонентов: Ga
99,9 и Мп чистотой 99,99 % (по массе) по данным работы [1]; Ga
чистотой 99,999 и Мп чистотой 99,9 % (по массе) по данным работ
[2j- 3], в алундовых тиглях и исследовали методами дифференциаль-
ного, термического, рентгеновского анализа и измерения магнитных
Свойств. Различия в числе промежуточных фаз в работе [1] ив более
Ранних работах [4, 5] наблюдаются в основном в области концентра-
ции 60—100 % (ат.) Мп.
о системе существуют пять промежуточных фаз: ы, <₽, к, Z
Л — низкотемпературная модификация Z) и е. Фаза (уМп) претерпе-
и ^эвтектоидное превращение при температуре 620 °C: (уМп) «*
vpMn) + Е. фаза Е образуется в результате твердофазного превра-
7ая пРн ~800 °C и имеет область гомогенности, простирающуюся
фаз/О,Д°73 °/о (ак) Mn I1! или от 70>5 75 % <ат-> Mn t2, 3].
темп * °бразуется по перитектической реакции Ж + (6Mn) * Z при
540-5по^Ре 830 °C и преиращается в фазу ц в интервале температур
nDcri W С. Фаза ц имеет область гомогенности, расположенную в
,Те °т 40 До 50 % (ат.) Мп. Фаза к получается в результа-
~500 °qTе?ТОиДн°й реакции между фазами ц и <р при температуре
• Фазы ь) и <р образуются по перитектическим реакциям при
616
Ga-Мп
410 и 522 °C. Состав фазы со описывается формулой Ga6Mn |5|,
Ga5 2Мп [6] или Ga5Mn(Ga9Mn2) [1].
Мп практически не растворяется в твердом Ga. В (аМп) растворя-
ется 1,95 % (ат.) Ga. Добавление Ga стабилизирует (QMn) и (уМп)
вплоть до комнатной температуры (область гомогенности (0Мп) про-
стирается от 80,8 до 91,4, а (уМп) от 55 до 63 % (ат.) Мп соответ-
ственно при комнатной температуре). Растворимость Ga в (бМп)
достигает -42 % (ат.) при температуре 830 °C.
Со стороны Ga наблюдается эвтектическое превращение Ж
« (Ga) + со при температуре 28,5 °C.
Ga—Mn
617
Кристаллографические характеристики промежуточных фаз
представлены в табл. 244.
j блица 24 4. Кристаллическая структура соединений системы Ga—Mn
Соединение Прото- тип Символ Пирсо- на, пр. гр. Параметры решетки, нм Источ- НИК
а Ь с
Ga52Mn(<i>) — Ссс2 или Ссст 0,8842 0,8974 0,9940 [6]
Ga7>7Mn2i3(<p) Hg4Ni 1432 0,5597 — — [1]
Оа5Мп2(к) Hg5Mn2 1Р14, P4/mbm 0,880 — 0,269 [Ш]
Ga6Mn7(X) AlgCr5 hR2f>, R3m 1,2588 — 1,6068 [5]
Ga^^Mn^gjte) Mg3Cd Р(^/ттс 0,536 — 0,432 [7]
В области существования (уМп), по данным работы [1], в зависи-
мости от температуры и состава существуют три области — у j, у2 и
Уз, различающиеся по кристаллической структуре. Фаза У] имеет
ГЦК решетку с параметром а = 0,8992 нм [62 % (ат.) Мп] [8]. Фаза
у2 имеет гранецентрированную тетрагональную решетку (простран-
ственная группа FA/rnmni) с параметрами а = 0,3810 нм, с = 0,3677
им [1], фаза у3, по данным работы [1] — упорядоченную гранецен-
трированную тетрагональную решетку типа CuAu I с параметрами
а ж 0,27475 нм, с = 0,36756 нм.
Литература
1. Lu Xue-Shan, Liang Jing-kui, Shi Ting-jun et al. 11 Acta Physica Sinica. 1980.
v. 29. N 4. P. 469—489.
в Ъ Masumoto H., Watanabe K., Mitera M. // Jap. J. Inst. Metals. 1978. V. 42. N 5.
P. 474-479.
3. Masumoto H., Watanabe K., Mitera M. // Trans. Jap. Inst. Metals. 1978. V. 19.
N 3. P. 138-145.
4- Wachtel E., Nier K.J. 11 Ъ. Metallkunde. 1965. Bd. 56. N 11. P. 779-789.
V Meissner H.-G., Schubert K., Anantharaman T.R. // Proc. Ind. Acad. Sci. 1965.
V-61-N6A. P. 340-367.
Girgis K., Schulz H. // Naturwissenschaften. 1971. Bd. 58. N 1. S. 95.
/• Kren E., Kadar G. // Solid State Commun. 1970. V. 8. N 20. P. 1653-1655.
Isuboya J., Sugihara M. // J. Phys. Soc. Japan. 1963. V. 18. N 7. P. 1096.
Ю.Н. Гринь
618
Ga—Mo
Ga—Mo. ГАЛЛИЙ-МОЛИБДЕН
Обобщенная диаграмма состояния Ga—Mo представлен?. На
рис. 331 по данным работы [1]. В системе образуются пять промежу-
точных фаз: Mo^Ga, MoGa, MoGa2, Mo6Ga3} и Mo8Ga4! 4]
Соединение Mo3Ga образуется по перитектической реакции Ж +
+ (Мо) « Mo3Ga при 1820±20 °C; MogGa41 — по перитектической
реакции Ж + Mo3Ga * Mo8Ga4 при 835±5 °C [4]. Остальные три
фазы разлагаются: Mo6Ga31 при температурах выше 695 °C, a MoGa
Рис. 331. Ga—Mo
Таблица 2 4 5. Кристаллическая структура соединений системы Ga—Mo
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм ЙС1С.Ч ник
а b С
Mo3Ga Cr3Si сР8, РтЗп 0,4944 — — М!
Mo6Ga31* — тР\Ы, P2f/c 0,9517 1,6067 1,6995 П
MogGa4| V8Ga41 hRM), R3 1,404 — 1,505 Ml
* р = 95,09°.
Ga—N, Ga—Na
619
Растворимость Ga в (Мо) составляет 1,75 % (ат.) при 1275 °C и
10 34 % <ат.) при 1700 °C. _
' Данные по кристаллической структуре промежуточных фаз систе-
<« Ga-Mo приведены в табл. 245.
М**
Литература
1 Brewer L., Lamoreaux R.H. // Atomic Energy Review. Special Issue N 7 Molybde-
Phvsico — Chemical Properties of its Compounds and Alloys. Vienna.: Intern. Atomic
Energy Agency, 1980. P- 249—251.
2 Yvon К. 11 Acta Crystallogr. B. 1974. V. 30. N 4. P. 853-856.
3 Yvon K. // Acta Crystallogr. B. 1975. V. 31. N 1. P. 117—120.
4 Bornand J.D., Siemens R.E., Oden L.L. // J. Less-Common Met. 1973. V. 30. N 2.
P. 205-209.
К Б. Поварова
Ga—N. ГАЛЛИЙ-АЗОТ
В системе Ga—N при взаимодействии Ga с NFL при температуре
1000 °C образуется мононитрид галлия GaN, сублимирующий при
температурах выше 800 °C без диссоциации [1]. GaN имеет структу-
ру типа вюртцита (символ Пирсона hP4, пр. гр. Р63/пс) с параметра-
ми а - 0,3182 нм, с = 0,5173 нм [Ш]. Сообщается о существовании
триазида Ga(N3)3 [Э].
Литература
1. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред.
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
Ю.Н. Гринь
Ga-Na. ГАЛЛИЙ—НАТРИЙ
Диаграмма состояния Ga—Na построена в работе [1] на основе
обобщения экспериментальных данных [X, Э, 2—4] и представлена
яа Рис. 332.
. В системе существуют два соединения: Ga4Na и Ga39Na22
''ja13Na7). Согласно диаграмме состояния [1] соединение Ga4Na
Плавится конгруэнтно при 499 °C, а при температуре 498 °C сущес-
^Увт эвтектика (Ga4Na + Ga39Na22), содержащая 20,5 % (ат.) Na.
как состав эвтектики в пределах точности эксперимента совпада-
зн 00Ставом о^Дннения Ga4Na, оно, возможно, плавится инконгру-
Сое °’ КЯК Это представлено на диаграмме состояния в работе [4].
^^ПИнение Ga39Na22 плавится конгруэнтно при 556 °C. Первона-
*° емУ приписывалась формула Ga8Na5 [X], однако детальный
. агиографический анализ [5] показал, что соединение имеет
*°^Улу Ga39Na22 или Ga13Na7 [6].
пни СИстеме наблюдается область несмешиваемости в жидком состоя-
» простирающаяся от 60 до 90 % (ат.) Na. Температура монотек-
620
Ga—Na
Ga—Nb
621
тической реакции отвечает 519 °C [1, 2]. Критическая температура,
согласно работе [2], соответствует 550 °C, однако некоторые авторы
полагают, что критическая точка может лежать ниже кривой ликви-
дуса [7].
Нонвариантные реакции в системе Ga—Na представлены в
табл. 246.
Кристаллическая структура соединений представлена в табл. 247.
Таблица 24 6. Нонвариантные реакции в системе Ga—Na [1]
Реакция Содержание Na в фазах, % (ат.) Температура С
Ж “ (Ga) + Ga4Na ~0; -0; 20 29,77
Ж » Ga4Na + Ga39Na22 20,5; 20; 36,1 498
Ж - Ga39Na22 + Ж2 -60; 36,1 -89,5 519
Ж - Ga39Na22 + (Na) -100; 36,1; -100 97,8 J
блица 24 7. Кристаллическая структура соединений системы Ga—Na
Соединение Прото- тип Символ Пирсона, пр. гр. Параметры решетки, нм Источ- НИК
а Ь С
~~ Ga4Na Al4Ba trio, 14/ттт 0,4223 0,4230 — 1,119 1,1272 [8] [9]
Ga)3Na7* — AR360, R3m 1,4965 — 3,893 [9]
Ga)3Na7** — оР240, Pnma 1,5625 1,4979 2,1678 [6]
Ga39Na22 — оР244, Pnma 1,5585 1,4948 2,1632 [5]
избытком Ga.
c
•Структура соответствует соединению, приготовленному
•♦Структура соответствует соединению, приготовленному с избытком Na.
Литература
1. Pelton A.D., Larose S. // Bull. Alloy Phase Diagr. 1990. V. 11. N 4. P- 347—353
2. Жакупов Ш.Р., Чунтонов К.А., Угодников Г.Г. и др. // Журнал физической
химии. 1980. Т. 54. № 4. С. 1023-1025.
3. Gambino М., Bros J.-P. // Thermochimica Acta. 1973. V. 6. N 1. Р. 129—136.
4. Itami T., Shimoji M., Meijer J. et al. // Physica. B. 1986. V. 142. P. 145—151.
5. Ling R.G., Belin C. // Acta Crystallogr. B. 1982. V. 38. N 4. P. 1101-1104.
6. Frank-Cordier U., Cordier G., Schafer H. // Z. Naturforsch. 1982. Bd. 37. N 2.
S. 127-135.
7. Fescotte P. // J. Less-Common Met. 1991. V. 175. N 1. P. L5—L6.
8. Bruzzone G. // Acta Crystallogr. B. 1969. V. 25. N 6. P. 1206-1207.
9. Frank-Cordier U., Cordier G., Schafer H. // Z. Naturforsch. B. 1982. Bd. 37.
S. 119-126.
JI.E. Шалимова
Ga-Nb. ГАЛЛИЙ—НИОБИЙ
Диаграмма состояния Ga—Nb построена на основании результатов
металлографического, рентгеновского, термического, микрорентгенос-
пектрального анализов и измерения твердости в области концентра-
ции от 0 до 60 % (ат.) Ga по данным работ [1, 2]; 60—100 % (ат.)
П° данным работы [3]. Линия солидуса построена по данным
Раиоты [4]. В обобщенном виде диаграмма состояния представлена
113 Рис. 333.
Nb^,CHCTeMe сУЩествУют пять соединений: Nb3Ga, Nb5Ga3, Nb5Ga4,
пои io^ H?bGa3« из КОТОРЫХ только Nb5Ga3 плавится конгруэнтно
Р 950 °C, остальные соединения образуются по перитектическим
Дням. Соединение Nb3Ga имеет область гомогенности [1, 2, 4,
» положение границ которой зависит от температуры. Предполага-
622
Ga-Nb
Hb Ga,Q/B(arn.) Ga
Рис. 333. Ga-Nb
ется наличие узкой области гомогенности у соединений Nb5Ga3 и
NbGa3.
Нонвариантные реакции в системе Ga—Nb представлены в
табл. 248.
Температуры нонвариантных реакций несколько различаются по
данным различных исследований [2—6].
Таблица 248. Нонвариантные реакции в системе Ga—Nb
Реакция Содержание Ga в фазах, % (ат.) Темпе- ратура, °C Иоочпик
Ж + (Nb) - Nb3Ga -27; 19; 25 1860 [1, 2)
Ж - Nb3Ga + Nb5Ga3 -31,5; 25; 37,5 1740 (1.2}
Ж + Nb5Ga3 « Nb5Ga4 -60; 37,5 44,4 1540 [1, 21
Ж + Nb5Ga4 - Nb4Ga5 -83; 44,4; 55,6 1300 |1, 2]
Ж + Nb4Ga5 - NbGa3 -90; 55,6; 75 1235 |3i
Ж. •* (Ga.) + NbGa3 -100; -100; 75 28 131
Ga-Nb
623
растворимость Ga в Nb составляет:
700 1200 1500 1600 1700 1800 1850
Температура, v растворимость Ga % (ат.). . . 1,3 2,5 7,7 11,3 12,0 15,8 19,0
Источник [1] [2] [1] (4] [2] [11
Кристаллическая структура фаз, существующих в системе Ga—Nb,
представлена в табл. 249.
Таблица 249. Кристаллическая структура соединений системы Ga—Nb
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
Й с
(Nb) W с/2, 7m3m 0,3295— -0,3289 — [21
NbjGa Cr3Ga cP8, РтЗп 0,5181- -0,5168 — [21
Nb3Ga3 W5Si3 t/32, I4(mcm 1,0306 1,028 1,032 0,5070 0,506 0,506 [2] [7] [3]
Nb5Ga4 Ca4Ti3 P63/mcm 0,7963 0,796 0,5411 0,545 [2] [7]
Nb4Ga3* — —— 0,838 1,708 [V—С]
, NbGa3 TiAl3 t/8, /4/mmm 0,379 0,874 [71
NbGa3 0,3803** 0,8731** [31
NbGa3 — 0,379*** 0,888*** [31
•Тетрагональная сингония. “80 % (ат.) Ga. _ “*73 % (aT.) Ga.
Литература
1 Ashby D.A., Rawlings R.D. // J. Less-Common Met. 1976. V. 50. N 1. P. 111-124.
p 24912Ma J’L" Flukiger R' Mu,ler J- 4 J Less-Common Met. 1977. V. 55. N 2.
Барон B.B., Мызенкова Л.Ф., Савицкий E.M. // Металловедение и металлофи-
4 рХиР°ВОДНИков' Сб- статей. М.: Наука, 1965. С. 86-88.
5 ли °lte sPitz E-L- /Z L Less-Common Met. 1974. V. 37. N 2. P. 233-246.
б’ n ° LL" Siemens RF- 11 L Less-Common Met. 1968. V. 14. N 1. P. 33-40.
Статей Латышева В.И. // Сверхпроводящие сплавы и соединения: Сб.
7 м • Наука> l972- С. 70—77.
• Meissner H.-G., Schubert К. // Z. Metallkunde. 1965. Bd. 56. N 7. S. 475-484.
EH. Шефтель
624
Ga—Nd
Ga—Nd. ГАЛЛИЙ-НЕОДИМ
Диаграмма состояния Ga—Nd построена в полном концентраци-
онном интервале в работах [1—4]. Область составов с высоким содер-
жанием Ga изучали в работах [5—7]. На рис. 334 представлен обоб-
щенный вариант диаграммы состояния Ga—Nd. Исследования прово-
дили методами дифференциального термического, рентгенофазового
Рис. 334. Ga—Nd
Ga—Nd
625
i кооструктурного и ретгеноструктурного анализов. Образцы полу-
яли из компонентов: Ga чистотой не менее 99,9 % (по массе) и Nd
^сдутой не менее 99,86 % (по массе), дуговой плавкой или плавкой
запаянных танталовых тиглях.
В системе образуется эвтектика Ga4Nd9 + (aNd) при температуре
651 ’С и содержании 80 % (ат.) Nd и вырожденная эвтектика со
стороны Ga при температуре 27 °C.
фаза Ga4Nd9, которой первоначально приписывали состав GaNd3,
образуется по перитектической реакции Ж + Ga3Nd5(GaNd2?) *
„ Ga4Nd9 при температуре 786 °C.
В более поздних работах при изучении тройных систем (Со,
ре) _ Ga — Nd [8] при температуре 400 °C в двойной системе
Ga—Nd были найдены фазы: GaNd2, Ga3 + xNd5 _ х и Ga2Nd3 (на
рис. 334 они показаны штриховыми линиями).
Соединения Ga3Nd5 и GaNd образуются по перитектическим
реакциям: Ж + GaNd Ga3Nd^ при 884 °C и Ж + Ga2(1+xj Nd|_x
•* GaNd при 905 °C соответственно.
Фаза Ga2<1 + x)Nd(1 _ х) плавится конгруэнтно при 1488 °C и имеет
область гомогенности, простирающуюся от 66,7 до 80 % [5] или до
78 % (ат.) Ga [6] и образующуюся за счет статистического замеще-
ния части атомов Nd парами атомов Ga [9].
Соединения Ga4Nd и Ga6Nd образуются по перитектическим
реакциям при 622 и 463 °C соответственно.
Кристаллическая структура соединений дана в табл. 250.
Таблица 25 0. Кристаллическая структура соединений системы Ga—Nd
Соединение Прото- тип Символ Пирсо- на, пр. гр. Параметры решетки, нм Источ- НИК
а b с
Ga6Nd Ga6Pu 7Р14, Р4/nbm 0,5991 — 0,7608 [10]
Ga2Nd B2A1 hP3, РЬ/ттт 0,4270— 0,4305 — 0,4270— 0,4283 [9]
GaNd CrB оСЗ, Стет 0,4421 1,122 0,4170 [2]
Ga2Nd3 Ga2Gd3 74/ тст 1,1915 — 1,534 [И]
Ga3 + xNdj Si3W5 t/32, 74/ тст 1,2227 — 0,5553 [12J
Ga3Nd5 B3Cr5 7732, 74/тст 0,7881 — 1,4395 [12]
Ga4Nd9 Ga4Smg 14/т 1,2001 — 0,5121 [13]
626
Ga-Ni
Литература
1. Yatsenko S.P. 11 J. Chim. Phys. 1977. V. 74. N 7-8. P. 836-843.
2. Yatsenko S.P., Semyannikov A.A., Semenov B.G. et al. // J. Less-Common m,,.
1979. V. 64. N 2. P. 185-199.
3. Яценко С.П., Семенов Б.Г., Чунтонов K.A. // Изв. АН СССР. Металлы 1977
№ 6. С. 185-187.
4. Мапогу К., Pelleg J., Grill А. // J. Less-Common Met. 1978. V 61 \ ?
Р. 293-299.
5. Dayan D., Atzmony U., Dariel M.P. //J. Less-Common Met. 1982. V 87 \ 2
P. 87-98.
6. Kimmel G., Dayan D., Grill A. et al. //J. Less-Common Met. 1980. V. 1
P. 133-140.
7. Pelleg J., Kimmel G., Dayan D. // J. Less-Common Met. 1981. V. 81 N 1
P. 33-34.
8. Лапунова P.B. Фазовые равновесия и кристаллические структуры в тронных
системах редкоземельных металл—железо—галлий: Автореф. дис. канд. хим наук.
Львов. 1989. 24 с.
9. Kimmel G., Dayan D., Zevin L. et al. // Metall. Trans. A. 1985. V. 16 \ 1-6
P. 167-171.
10. Гринь Ю.Н., Чунтонов K.A., Ярмолюк Я.П. и др. // Допошд! АН УРСР.
Сер. А. 1981. № 5. С. 86-89.
11. Yatsenko S.P., Hladyschewsky R.E., Sitschewitsch О.М. et al. // J. Ixss-C mmon
Met. 1986. V. 115. N 1. P. 17-22.
12. Гринь Ю.Н., Гладышевский P.E. Галлиды: Справочник. M.: Металлургия,
1989.304 с
13. Yatsenko S.P., HrytrYu.N., Sitschewitsch О.М. et al. // J. Less-Common Met.
1985. V. 106. NIP. 35-40.
Ю Н Гринь
Ga-Ni. ГАЛЛИЙ—НИКЕЛЬ
Диаграмма состояния Ga—Ni (рис. 335) построена в работе ! 11 на
основе результатов дифференциального термического, микрострук-
турного, рентгеновского анализов и измерения электросопротивления.
Образцы готовили из Ga и Ni чистотой 99,99 % (по массе) плавкой
в алундовых тиглях в атмосфере аргона.
В системе образуются семь соединений: Ga4Ni, Ga3Ni2, Ga4Ni3,
GaNi, Ga2Ni3, Ga3Ni5 и GaNi3, из которых только GaNi плавится
конгруэнтно при составе Ga36Ni64 и температуре 1220 °C . Об засть
гомогенности этой фазы простирается от 35,5 до 57 % (ат.) Ga при
950 °C.
Растворимость Ni в твердом Ga не найдена, растворимость Ga в
Ni составляет 24,3: 18,3 и 15,8 % (ат.) при температуре 1212, Ю0у
и 800 °C соответственно.
Нонвариантные реакции в системе Ga—Ni даны в табл. 25 < -
Кристаллическая структура соединений дана в табл. 252.
Термодинамические характеристики сплавов Ga—Ni изучены в
работах [4, 5].
Ga-Ni
627
ffa Hi, °/o (am.) Ni
**. 335. Ga-Ni
Tag
и 4 a 2 5 1. Нонвариантные реакции в системе Ga—Ni [1]
Реакция Содержание Ni в фазах, % (ат.) Темпе-
"ж ратура, °
* - <^а) + Ga4Ni ~0; ~0; 20 30,2
* + Ga3Ni2-Ga4Ni -4; 40; 20 363±2
* + GaNi-Ga3Ni2 28,5; 43; 40 950 ±2
^1 + <>аз№2-Са№ 45; 40; 42,8 542±1
628
Ga—Ni
Реакция Содержание Ni в фазах, % (ат.) Темпе- ратура,
GaNi + GaNi3 •> Ga2Ni3 64,5; 70; 60 94912
GcijNi^ + Gablij и Ga^Ni^ 64; 70; 62,5 741±1
Ж •* GaNi + GaNi3 70,5; -65; 75 120713
Ж + (Ni) ₽ GaNi3 73; 75,7; 75 121212
Таблица 25 2. Кристаллическая структура соединений системы Ga—Ni
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b с
Ga4Ni — 1тЗ т 0,8424 — — [И
GagNi2 Al3Ni2 hP5, P3ntl 0,4054 — 0,4882 HI
Ga^Nij СадМц сП 12, la 3d 1,1411 — — 12]
GaNi CsCl cPl, РтЗт 0,28955 0,2887 — — 131 IU
Ga2Ni3 AsNi hP4, Pf>3/mmc 0,3995 — 0,4980 HI
Ga9Ni|3* Ga9Ni|3 C2/m 1,3822 0,7894 0,8478 |2]
GtijNis Ga3Ni5 Cmmm 0,7510 0,6708 0,3753 [И
GaNi3 • p = 3. AuCu3 5,88°C. cP4, РтЗт 0,3585 И)
Литература
1. Feschotte Р., Eggimann Р.Е. // J. Less-Common Met. 1979. V. 63. N 1 Р 30.
2. Ellner М., Best K.J., Jacobi Н. et al. //J. Less-Common Met. 1969. V 19. N
P. 294-296.
3. Ho K., Quader M.A., Lin F. H Scr. Met. 1977. V. 11. N 12. P. 1159-1163
4. Katayama J., Igi Sh„ Kozuka Z. // J. Jap. Inst. Metals. 1974. V. 38 *
P. 332-338. 4
5. Predel B., Vogelbein W., Schallner U. // Thermochimica Acta. 1975. V. I 2
P. 367-375.
Ю.Н l>}uHb
Ga—О, Gd—0s
629
Ga_0. ГАЛЛИЙ-КИСЛОРОД
Диаграмма состояния Ga—О не построена. В системе существуют
ксидьг Ga2O3, GaO и Ga2O. Два последних соединения нестабильны
пои наличии влаги и нагреве [Ш]. В работе [Э] сообщается о сущес-
твовании пяти модификаций Ga2O3, из которых только 0Ga2O3
лабильна в интервале температур от комнатной до температуры
плавления 1725±15 °C [Э] или 1795±15 °C [Ш].
Кристаллическая структура 0Ga2O3 относится к моноклинной
сингонии (пр. гр. С2/т) с параметрами решетки а = 0,580 (1) нм,
Ъ я 0,304 (1) нм, с = 1,223 (2) м, 0 = 103°42' [Э]. Модификация
aGa2O3 имеет ромбоэдрическую решетку типа аА12О3 (символ Пирсо-
на Л/210, пр. гр. R3c) с параметрами а = 0,499 нм, с = 1,347 нм [Э].
Растворимость кислорода в Ga в интервале температур 115—
1125 °C изучена в работе [1J и выражается следующим уравнением:
Igx = -7380/Г + 4,264 (±0,03), где х — концентрая О, % (ат.); Т —
температура, К.
Литература
1. Alcock G.B., Jacob К.Т. И J. Less-Common Met. 1977. V. 53. N 2. Р. 211-222.
Ю.Н. Гринь
Ga—Os. ГАЛЛИЙ-ОСМИЙ
Диаграмма состояния Ga—Os не построена. Известно лишь одно
соединение aGa3Os, стабильное при нормальных условиях [1, 2].
Кристаллическая структура aGa3Os принадлежит к типу 1п31г (сим-
вол Пирсона ZP16, пр. гр. Р4л2) с параметрами а = 0,6475 нм, с =
“ 0,6734 нм.
При давлении 2,5—2,7 ГПа и температурах 450—800 °C получено
соединение Ga2Os со структурой типа Si2Ti (символ Пирсона оР24,
ПР> гр. Fddd), с параметрами а = 0,8242 нм, b = 0,4740 нм, с = 0,8747
им при 65 % (ат.) Ga. Ромбическая модификация 0Ga3Os с парамет-
рами решетки а = 0,566 нм, b = 0,563 нм, с = 1,536 нм синтезирована
ри давлении 6,5—7,7 ГПа и температурах 300—500 °C при содержа-
ли 73 % (ат.) Ga [3].
Литература
15. s ЗбО^бГ Bre*mer Gohle R. и. а. // Naturwissenschaftcn. 1958. Bd. 45. N
N Schubert K., Lukas H.L., Meissner H.—G. et al. // Z. Metallkunde. 1959. Bd. 50.
3y 534-540.
1982.\РОпова C.B., Фомичева Л.Н. // Изв. АН СССР. Неорганические материалы.
• I. 18. № 2. С. 251—255.
Ю.Н. Гринь
г
630
Ga—P, Ga-Pb
Ga—P. ГАЛЛИЙ-ФОСФОР
h
Диаграмма состояния Ga—P приведена на рис. 336 по данным [[Ц|
в области концентраций от 0 до 50 % (ат.) Р. В системе существует
одно соединение Ga—Р, плавящееся конгруэнтно при 1467 С При
Фосфид галлия имеет структуру типа сфалерита (символ Пирсона
сГ8, пр. гр. F43m) с параметром решетки а = 0,5436 нм [Ш] или а =
= 0,54505 нм [Э].
Ю.н. Гринь
Ga-Pb. ГАЛЛИЙ-СВИНЕЦ
Обобщение и оптимизация данных по фазовым равновесиям в
системе Ga—РЬ приведены в работе [1]. Диаграмма состояния, пред-
ставленная на рис. 337, построена по данным дифференциального
термического анализа в работах [2, 3]. В системе существует моно-
тектическое рановесие при температуре 313 °C, положение монотек-
Ga-Pb
631
тической точки отвечает 94,5 % (ат.) РЬ [2] или 95,8 % (ат.) [3].
В работе [1] получено расчетное значение температуры монотекти-
ческой реакции, равное 312,6 °C, при содержании 96,9 % (ат.) РЬ.
Область несмешиваемости в жидком состоянии простирается от 2,4
до 94,5 % (ат.) РЬ, критическая точка находится при температуре
606 °C и содержании ~50 % (ат.) РЬ.
Растворимость Ga в РЬ увеличивается от 0,06 % при НО °C до
0.5 % (ат.) при 311 °C [3J.
При закалке из жидкого состояния сплава с содержанием 92,95 %
'ат^ метастабильные фазы получены не были [4].
Энтальпии смешения жидких сплавов Ga—РЬ были измерены в
₽аооте [5] при температуре 327 °C во всем интервале концентраций.
Литература
I’ Ansara I., Ajersch F. И J. Phase Equilibria. 1991. V. 12. N 1. P. 73-76.
• Kredel B. // z. Metallkunde. 1959. Bd. 50. N 11. S. 663-667.
greenwood J.N. // J. Inst. Metals. 1958-1959. V. 87. N 3. P. 91-93.
p. 119g‘f^2081Va P‘K” Giessen BC’ Grant NJ' 11 Acta Me,allurS- 1968 v- 16- N 10
5‘ Predel B., stein D.W. // J. Less-Common Met. 1971. V. 24. N 2. P. 159-171.
Ю.Н. Гринь
632
Ga-Pd
Ga-Pd. ГАЛЛИЙ-ПАЛЛАДИЙ
Диаграмма состояния Ga—Pd изучена в полном концентрационно
интервале в работе [1], а в области концентраций 25—50 % (ат) да
— в работе [2]. Обобщенный вариант диаграммы состояния пред-
ставлен на рис. 338. 4
Pdr °/о (по массе)
Рис. 338. Ga-Pd
Ga-Pd
633
Исследование проводили методами дифференциального термичес-
микроструктурного и рентгенофазового анализов. Образцы
§длучали йз компонентов дуговой плавкой [1, 2].
В системе обнаружено девять промежуточных фаз, из кото-
пых GaPd, Ga4Pd5 и GaPd2 плавятся конгруэнтно при 1020, 1010 и
1310 °C соответственно. Соединение GaPd2 имеет максимальную
область гомогенности при температуре -1020 °C [26—36 % (ат.) Ga],
претерпевает эвтектоидный распад при 870 °C на Ga5Pd13 и (Pd).
Соединение Ga2Pd5 образуется в результате конгруэнтного твердо-
фазного превращения GaPd2 при 900 °C, а соединение Ga3Pd7 — по
перитектоидной реакции при температуре 700 °C.
Таблица 25 3. Нонвариантные реакции в системе Ga—Pd
Реакция Содержание Pd в фазах, % (ат.) Темпе- ратура, °C Источ- ник
Ж * (Ga) + GasPd ~0; -0; -17 -29,77 [1]
Ж + Ga7Pd3 * GasPd -4; 30: -17 200 11]
Ж + GaPd - Ga7Pd3 -17; 50; 30 460 11]
Ж * GaPd + Ga4Pd5 46,5; 50; 55,6 960 12]
Ga4Pd3 - GaPd + Ga3Pd3 55,6; 50; 62,5 920 [2]
Ж * Ga4Pd5 + Ga3Pd3 43; 55,6; 62,5 970 [2]
Ж + GaPd2 ° Ga3Pd3 -41,5; 66,7; 62,5 1020 [2]
GaPd2 + Ga2Pd5 >• Ga3Pd7 -68; -71; 70 700 [2]
GaPd2 + Ga2Pd5 - Ga5Pd13 ~74; -71; 72,2 -910 [2]
GaPd2 - Ga3Pd13 + (Pd) -74; 72,2; -83,5 870 [2]
Ж - GaPd2 + (Pd) 75,5; -74; -83 1020 [2]
Растворимость Pd в Ga не обнаружена, а растворимость Ga в Pd
Достигает -17 % (ат.) при температуре 1020 °C.
Нонвариантные реакции в системе Ga—Pd даны в табл. 253.
кристаллическая структура соединений представлена в табл. 254.
Л б
__ л и Ц а 2 5 4. Кристаллическая структура соединений системы Ga—Pd
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b С
Ga3Pd Ga3Pd (724, 14/тст 0,6448 — 1,0003 [3]
Ga7Pd3 Ir3Sn7 1тЗт 0,876 — — [2J
634
Ga—Pr
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Исн.члик
а b с
GaPd FeSi оР8, Р2|3 0,4890 — — И '
Ga4Pd5 CsCl сР2, 0,3040 — — И
РтЗт
Ga3Pd5 Ga3Rh5 оР 16, Pbam 1,051 0,542 0,403 1 ; 1
GaPd2 Co2Si оР12, Рпта 0,5493 0,4064 0,7814 i'l
GazPds Ga2Pd5 оР28, Рпта 0,5485 0,4083 1,8396 |2|
Ga5Pd13* — 2,358(6) 0,534(3) 0,405(9) 12!
♦Ромбическая сингония.
Литература
1. Schubert К., Lukas H.L., Meissner H.-G., Bhan S. // Z. Metallkunde. 1959.
Bd. 50. N 9. S. 534-540.
2. Khalaff K., Schubert K. // J. Less-Common Met. 1974. V. 37. N 1. P. 120—140.
3. Bhan S., Schubert К. 11 Trans. Ind. Inst. Metals. 1960. V. 13. N 222. P 333—336.
4. Schubert K., Pfisterer H. // Z. Metallkunde. 1950. Bd. 41. N 11. S. 433-441.
Ю H. Гринь
Ga—Pr. ГАЛЛИЙ-ПРАЗЕОДИМ
Диаграмма состояния Ga—Pr построена в полном концентрацион-
ном интервале в работах [ 1, 2], в области концентраций 0—50 %
(ат.) Ga изучена в работе [3] и в области с высоким содержани-
ем Ga — в работах [4,5]. Растворимость Рг в жидком Ga изуче-
на в работе [6]. Обобщенная диаграмма состояния представлена на
рис. 339.
Исследование проводили методами дифференциального термичес-
кого, микроструктурного и рентгенофазового анализов. Для пол\не-
ния сплавов использовали Ga чистотой не менее 99,9 % (но массе)
и Рг чистотой не менее 99,86 % (по массе).
В системе существует шесть промежуточных фаз, из которых
только Ga2(1 + Л)РГ1 _ х плавится конгруэнтно при 1470 “С. Эти Фаза
имеет область гомогенности, простирающуюся от 21 до 33,3 7 (аТ>
Рг [5], которая образуется в результате статистического замещения
части атомов Рг парами атомов Ga [7].
Ga—Pr
635
^онвариантные реакции в системе Ga—Pr даны в табл. 255.
стаиРИСТаллическая структура соединений системы Ga—Pr пред-
“влена в табл. 256.
636
Ga—Pr
Таблица 25 5. Нонвариантные реакции в системе Ga—Pr
Реакция Содержание Рг в фазах, % (ат.) Темпе- ратура, °C Ш’К
Ж >• (Ga) + Ga6Pr -0; -0; 14,3 29 Н.
Ж + Ga2(|+х)Pr( 1-x) ” Ga6Pr -5; -25; 14,3 465 HI
Ж + Ga2(l+x)Pr(l-x) " GaPr -64; 33,3; 50 1015 i JI
ж + GaPr » Ga3Pr5 -70; 50; 62,5 855 13!
ж + Ga3Pr5 в GaPr2 ~73; 62,5; 66,7 705 |3|
ж + GaPr2 в Ga4Pr9 -77; 66,7; 69,2 9 |П)|
ж « Ga4Pr9 + (aPr) 80; 69,2; -100 580 131
(0Рг) » Ж + (аРг) -96; -90; -98 740 11|
Таблица 2 5 6. Кристаллическая структура соединений системы Ga—Pr
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Исн'чпик
a b c
Ga6Pr Ga6Pu tPl4, Р4/nbm 0,6015 — 0,7640 181
Ga2Pr A1B2 hPl, Р6/mmm 0,4283— -0,4318 — 0,4290— -0,4302 171
GaPr CrB oC8, Cmcm 0,4432 1,1301 0,4194
Ga3Prs Ba5Si3 или tP32, Р4/ ncc 0,7939 — 1,450 Ml
Si3W5 f/32, I4/mcm 1,248 — 0,5488 P'l
GaPr2 Co2Si oP12, Pnma 0,6690 0,5188 0,9714 !3i
Ga4Pr9 Ga4Sm9 I4/m 1,2008 — 0,5182 110]
Литература
1. Yatsenko S.P. // J. Chimie Phys. 1977. V. 74. N 7-8. P. 836-843.
2. Yatsenko S.P., Semyannikov A.A., Semenov B.G. et al. // J. Less-Common Met
1979. V. 64. N 2. P. 185-199.
3. Cirafici S., Franceschi E. // J. Less-Common Met. 1979. V. 66. N 2. P. 137---i4J-
4. Pelleg J., Kimmel G., Dayan D. // J. Less-Common Met. 1981. V 81 41
P. 33-34.
5. Dayan D., Atzmony U., Dariel M.P. // J. Less-Common Met. 1982. V 8/ 4
P. 87-98.
Ga—Pt
637
„ ои«л СП., Аникин Ю.А., Диева Э.Н. // Изв. АН СССР. Металлы. 1972.
6.
^7 ^Kimniel g', Dayan D., Zevin L. et al. // Metall. Trans. A. 1985. V. 16. N 2.
P- ^"гпинь Ю.Н., Чунтонов K.A., Ярмолюк Я.П. и др. // Допов1д1 АН УРСР.
г._ А 1981- № 5. С. 86-89.
о Дзяна ДИ., Гладышевский Е.И., Крипякевич П.И. // Допов1д1 АН УРСР.
А 1968. № 3. С. 282-285.
*10 Yatsenko S.P., Hryn’ Yu.N., Sitscnewitsch O.M. et al. // J. Less-Common Met.
1985. V. Ю6. N 1. P. 35-40.
Ю.Н. Гринь
Ga—Pt. ГАЛЛИЙ-ПЛАТИНА
Диаграмма состояния Ga—Pt изучена в полном концентрационном
интервале в работе [1], в области высокого содержания Pt — в работе
[2]. На рис. 340 представлена диаграмма состояния по данным работ
[1, 2].
Исследование проводили методами дифференциального термичес-
кого, микроструктурного, рентгенофазового и микрорентгеноспек-
трального анализов. Сплавы готовили из Ga чистотой 99,999 % (по
массе) и Pt чистотой 99,9 % (по массе) дуговой плавкой.
Таблица 257. Нонвариантные реакции в системе Ga—Pt
Реакция Содержание Pt в (ат.) фазах, % Темпе- ратура, “С Источ- ник
Ж • (Ga) + Ga6Pt 1; -0; 14,3 28 [1]
Ж + Ga7Pt3 - GaePt 3; 30; 14,3 290 [1]
Ж + Ga2Pt » Ga7Pt3 21; 33,3; 30 822 [1]
Ж + Ga3Pt2 - Ga2Pt 32; 40; 33,3 922 [1]
Ga2Pt - Ga7Ptj + Ga3Pt2 33,3; 30; 40 153 [1]
Ж + GaPt - Ga3Pt2 34; 50; 40 937 [1]
* * GaPt + Ga3Pt5 56; 50; 62,5 1017 [1]
* + GaPt3 - Ga3Pt5 61; 67; 62,5 1145 [2]
G“jPt5 + GaPt3 - pGaPt2 -65; -68; -66,7. -1140 [2]
₽GaPt2 - «GaPt2 + GaPt3 ^G»Pt2 + Ga3Pt5₽aGapt2 -66,7; -66; -67 -900 [2]
-66,7; -65; -66 -910 [2]
* - GaPt3 + (pt) 78; -75; 85 1361 [1]
<Pt> + GaPt3-Y/ -94; -94; -73; -73,5; -73,5 -74,8 255 210 [2] [2]
638
Ga—Pt
Рис. 340. Ga—Pt
В системе существуют восемь соединений, из которых GaPi й
GaPt3 плавятся конгруэнтно при 1104 и 1374 °C. Остальные соедине-
ния образуются по перитектическим и перитектоидным реакциям-
Соединение GaPt3(y') имеет область гомогенности протяженностью
от 69 до 76 % (ат.) Pt (-910 °C) и вступает в твердофазное взаимо
действие с (Pt) с образованием фаз и у^. Соединение Са3Р*5
имеет область гомогенности протяженностью от 62 до 65,5 % (аТ-)
Ga—Pt
639
блица 25 8.
Кристаллическая структура соединений системы Ga—Pt
ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a b c
*Ga6Pt* — — 1,5978 1,2058 0,8884 [3]
GavPtj 1тЗт 0,809 — — [3]
Ga2Pt CaF2 cF\2, Fm3m 0,5923 — — [4]
Ga3Pt2 Al3Ni2 hP5, P3ml 0,422 — 0,517 [3]
GaPt FeSi cP8, P2t3 0,4910 — — 15]
Ga3Pt5 Ga3Ptj oC 16, Cmmm 0,8047 0,3956 0,7455 [3]
₽GaPt2 Ge3Rh5 oPlb, Pbam 1,0860 0,5484 0,3950 [4]
aGaPt2 aGaPt2 oP24, Pmma 1,6440 0,3922 0,5488 [4]
GaPt3(y‘) AuCu3 cP4, РтЗт 0,3892 — — [2]
Yj' SiU3 tl\b, 14! man 0,54920 — 0,78102 [2]
Y2' •Ромби GaPt3 ческая сингс tPlt>, Р4/mbm ЖИЯ. 0,54674 — 0,78916 [2]
Растворимость Pt в Ga не обнаружена, а растворимость Ga в Pt
Достигает -15 % (ат.) при температуре 1361 °C.
^Нонвариантные реакции в системе Ga—Pt представлены в
Кристаллическая структура соединений представлена в табл. 258.
Литература
2 2Uex р-’ Feschotte Р. // J. Less-Common Met. 1976. V. 46. N 1. Р. 101-116.
490. °Уа Y" Mish*ma Y., Suzuki T. // Z. Metallkunde. 1987- Bd. 78. N 7. S. 485-
4 Schubert K- // Z. Metallkunde. 1960. Bd. 51. N 6. S. 327-339.
IlfiO~1168 °Padhyay T-’ Khalaff K., Schubert K. // Metall. 1974 Bd. 28. N 12. S.
N 1. p^£Qr^,ava M.K., Gadala A.A., Schubert K. // J. Less-Common Met. 1975. V. 42.
Ю Н. Гринь
640
Ga—Pu
Ga—Pu. ГАЛЛИЙ—ПЛУТОНИЙ
В литературе существуют два варианта диаграммы сос1оЯНИя
системы Ga—Pu [1, 2J, построенной методами дифференциального
термического и рентгенофазового анализа. Различия между ними в
основном касаются области высокого содержания Ga. На рис. 341
Ра, "/о (по массе)
Рис. 341. Ga—Pu
Ga—Pu
641
ставлена диаграмма состояния согласно работе [1], данные
оой в основном согласуются с данными работы [3], где проведено
^общение литературных данных по фазовым равновесиям в системе
Ga—Ри- „ ,
В системе образуются двенадцать промежуточных фаз. Фаза
ГаРи получается в результате твердофазного взаимодействия
Га Ри< с фазой ц при температуре 675 “С и претерпевает полимор-
фное превращение при температуре 365 °C [1] или 363 °C [2].
Соединение Ga3Pu5 образуется в результате конгруэнтного твердо-
фазного превращения фазы ц при -780 °C. Фаза ц образуется по
перитектической реакции Ж + GaPu * ц при 920 °C, имеет область
гомогенности, простирающуюся от 60 до 82 % (ат.) Рц [1], и распа-
дается с понижением температуры согласно двум реакциям: ц *
ш(ePu) + GaPu3 (координаты эвтектоидной точки 655 °C, 82 % (ат.)
Ри) и и « GaqPuc + GaPu (координаты эвтектоидной точки 765 °C и
61 % (ат.) Ри).
Фаза GaPu получается по перитектической реакции Ж + Ga2Pu *
* GaPu при 970 °C и претерпевает полиморфное превращение при
570 °C., Соединение Ga2P'u плавится конгруэнтно при 1262 °C [1] или
1264 °C [2]. Соединение Ga3Pu2 образуется, вероятно, в резуль-
тате твердофазной реакции между Ga2Pu и GaPu при температуре
-720 °C. Соединения Ga3Pu, Ga3 7Pu, Ga4Pu, Ga6Pu и Ga15Pu2 обра-
зуются по перитектическим реакциям при температурах 1100, 475,
450, 375 и 60 °C соответственно. При этом Ga3Pu, Ga4Pu и Ga6Pu
претерпевают, вероятно, полиморфные превращения при температу-
рах 920, -80 и -75 °C соответственно. Ga3 7Pu распадается эвтекто-
идно при 120 °C.
Растворимость Ри в Ga не обнаружена, а растворимость Ga в SPu
и ePu достигает -12 % (ат.) при температуре 640 и 715 °C.
Кристаллическая структура соединений представлена в табл. 259.
Таблица 25 9. Кристаллическая структура соединений системы Ga—Pu
Соединение Прото- тип Символ Пирсона, пр. гр. Параметры решетки, нм Источ- НИК
а b с
Gal5Pu2* — — 0,6206 — 0,8332 [1]
Ga6Pu Ga6Pu ?Р14, Р4/nbm 0,5942 — 0,7617 [4]
Ga4Pu Al4u о/20, Imma 0,4380 0,6290 1,3673 [4]
Ga7Pu2* — — 0,4257 — 0,9695 Ш
21 2144
642
Ga-Rb
Соединение Прото- тип Символ Пирсона, пр. гр. Параметры решетки, нм Источ- ник
а b с
0Ga3Pu 0Ga3Pu /lR16, R3m 0,6178 — 2,8031
aGa3Pu Mg3Cd Р63/ ттс 0,6299 — 0,4513 U]
Ga2Pu b2ai ЬРЗ, РЫ ттт 0,4248— -0,4258 — 0,4107— -0,4139 11]
Ga3Pu2** — — 0,4378 — 0,3792 Н]
PGaPu In Г/2, 1М ттт 0,331 — 0,403 16]
ttGaPu aGaPu 14тт 0,6641 — -0,6666 0,8083— -0,7985 !&)
Ga3Pu3 Si3W5 /732, 74/ тст 1,1735 — 0,5511 12]
aGaPu3 SrPb3 Р4/ттт 0,4471 — 0,4590 |6|
0GaPu3 AuCu3 сР4, РтЗт 0,4507 — — !2]
П ‘Тетрагон; “Гсксагог гльная син! сальная сит 72,3 ония. гония. 0,7207— 0,7167 1П
Литература
1. Chebotarev N.T., Smotriskaya E.S., Andrianov M.A et al. // Plutonium 1975 and
Other Actinides. Proc, of 5th Int. Conf. Amsterdam. 1976. P. 37—45.
2. Ellinger F.H., Land C.C., Struebing V.O. // J. Nucl. Materials 1964. V 12. N 2.
P. 226-236.
3. Peterson D.E., Kassner M.E. // Bull. Alloy Phase Diagrams 1988. V. 9 N 3.
P. 261-267.
4. Ellinger F.H., Zachariasen W.U. 11 Acta Crystallogr. 1965. V. 16. N 2 F 281-
283.
5. Larson A.C., Cromer D.T., Roof R.B. // Acta Crystallogr. 1965. V. 18 N 2
P. 294-295.
6. Hoche id H„ Tanon A., Despres J. // J. Nucl. Materials. 1965. V. 15 N 3
P. 241-244.
Ю.Н /'PuHb
Ga-Rb. ГАЛЛИЙ—РУБИДИЙ
Диаграмма состояния Ga—Rb, представленная на рис. 342, по-
строена в работе [1] на основе обобщения экспериментальных дан-
ных [2—6].
Ga-Rb
643
Ga Rb,°/>(am.) Rb
Йис. 342. Ga-Rb
Существование двух соединений: Ga7Rb (ранеее приписывалась
формула Ga5Rb [3]) и Ga3Rb достаточно надежно установлено
рентгенографическими исследованиями [4—6]. Соединение Ga7Rb
образуется по перитектической реакции Ж + Ga3Rb * Ga7Rb при
температуре 354 °C. Соединение Ga3Rb также образуется по перитек-
тической реакции, предположительно при температуре 520 °C [2].
Возможно в системе образуется еще соединение Ga8Rb5[2], однако
его существование не подтверждено рентгенографически [6].
, В системе обнаружена область несмешиваемости в жидком состоя-
нии> простирающаяся от 30 до 99 % (ат.) Rb. Как со стороны Ga, так
и со стороны Rb существуют вырожденные эвтектики с температура-
ми плавления, практически совпадающими с температурами плавле-
Ия чистых компонентов.
в Диаграмма состояния Ga—Rb не установлена достаточно надежно
изи с возможностью окисления и испарения Rb.
ристаллическая структура соединений представлена в табл. 260.
[6] оединению Ga7Rb ранее приписывалась моноклинная структура
ПА .’йоднако данные работы [5] показывают, что соединение имеет
^боэдрическую решетку.
21*
644
Gct-Re
Таблица 260. Кристаллическая структура соединений системы Ga—яь
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм 1ОЧНИК
а b с
Ga7Rb — AR16, 0,6600 — 2,8563 'Я '
R3m
Ga3Rb Ga3Rb tI24, 0,6315 — 1,5000 16]
I4m2
Ga8Rb5?* (Ga2Rb) — — 0,610 1,113 0,616 13]
♦Ромбическая сингония.
Литература
1. Pelton A.D., Larose S. // Bull. Alloy Phase Diagrams. // 1990. V. 11. N 4. P
354-356.
2. Thiimmel R., Klemm W. // Z. Anorg. All. Chem. 1970. Bd. 376. N 1.. S 44-53.
3. Яценко С.П., Чунтонов K.A., Алямовский С.И. // Изв. АН СССР. Металлы.
1973. № 3. С. 233-235.
4. Belin С. // Acta Crystallogr. В. 1981. V. 37. N 11. Р. 2060-2062.
5. Van Vucht J.H.N. // J. Less-Common Met. 1985. V. 108. NLP. 163—175.
JI.E. lll:’iuMOea
Ga—Re. ГАЛЛИЙ-РЕНИЙ
Диаграмма состояния Ga—Re не построена. При атмосферном
давлении получить сплавы и соединения этих металлов не удалось.
Галлиды Re получены в условиях высокого давления (7,7 ГПа) и
температуры. При температуре 400 °C кристаллизуется фаза, близ-
кая по составу к фазе с формулой Ga3Re [77 % (ат.) Ga], с ромби-
ческой решеткой и параметрами: а = 0,5747, b = 0,5728, с - 1,559 нм.
При температуре выше 500 °C образуется соединение pGa3Re 'струк-
турный тип Ga3Co, символ Пирсона (Р16, пр. гр. Р4п2) с параметра-
ми решетки а = 0,6511 нм, с = 0,6790 нм [73 % (ат.) Ga]. При
температуре выше 800 °C получена фаза переменного состава с
содержанием Ga — 40—60 % (ат.), с гексагональной структурой и
параметрами а = 0,2823 нм, с = 0,4238 нм [40 % (ат.) Ga].
Литература
1. Попова С.В., Фомичева Л.Н. // Изв. АН СССР. Неорганические wait риалы
1982. Т. 18. № 2. С. 251-255.
Л/. А. .гылкина
Ga—Rh, Ga—Ru
645
ea_Rh. ГАЛЛИЙ-РОДИЙ
' диаграмма состояния Ga—Rh не построена. Имеются сведения о
ествовании четырех интерметаллических соединений, данные о
^металлической структуре которых приведены в табл. 261.
Таблица 2 6 1. Кристаллическая структура соединений системы Ga—Rh
Соедине- ние Прототип Символ Пирсо- на, пр. гр. Параметры решетки, нм Источ- НИК
а b с
Ga9Rh2 А19Со2 тР22, P2Jс 0,6448 0,6405 0,8829 [1]
Ga3Rh Ga3Co tP16, Р4п2 0,648(8) — 0,655(3) [2, Э]
Ga17Rh10 Ga17Rh)0 tP108, Р4с2 0,5813 — 4,746 [3, 4]
GaRh CsCl сР2, РтЗт 0,301 — — [Ш]
Литература
Д. Edshammar L.-E. // Acta Chim. Scand. 1970. V. 24, N 4. P. 22—23.
2. Schubert K., Lukas H.L., Meissner H.-G. et al. // Z. Metallkunde. 1959. Bd. 50.
N 9. S. 534-540.
3. VOllenkle H., Wittmann A., Novotny H. // Monatsh. Chemie. 1967. Bd. 98. N 1.
S. 176-183.
4. VOllenkle H„ Wittmann A., Nowotny H. // Monatsh. Chemie. 1966. Bd. 97. N 2.
S. 506-516.
Ю.Н. Гринь
Ga—Ru. ГАЛЛИЙ—РУТЕНИЙ
Диаграмма состояния Ga—Ru не построена. Имеются сведения о
существовании трех интерметаллических соединений, данные о
кристаллической структуре которых приведены в табл. 262.
Таблица 26 2. Кристаллическая структура соединений системы Ga—Ru
Соедине- ' ние Прототип Символ Пирсо- на, пр. гр. Параметры решетки, нм Источ- НИК
а b с
Ga3Ru Ga3Co (Р16, Р4п2 0,647 — 0,673 [Э]
Ga2Ru Si2Ti oF24, Fddd 0,8184 0,8184 0,4749 [1, Ш]
GaRu CsCl сР2, РтЗт 0,3010 — — [Ш]
Литература
1 Evers J- Oehlinger G. И Mat. Res. Bull. 1984. V. 19. N 9. P. 1177-1180.
Ю.Н, Гринь
646
Ga—S
Ga—S. ГАЛЛИЙ—СЕРА
Диаграмма состояния Ga—S в полном концентрационном интер-
вале не построена [X, Э, Ш]. На рис. 343 представлен участок
диаграммы состояния в области концентраций 0—60 % (ат.) s по
данным работы [1].
В системе образуется эвтектика GaS + Ga4S5 [930 °C 55 % <ат)
S] и вырожденная эвтектика со стороны Ga. Область несмешиваемос-
ти в жидком состоянии при температуре 933 °C простирается от -3
до 17 % (ат.) S, критическая точка не определена.
S, а/а ( по массе)
Рис. 343. Ga—S
Ga—5Л
647
Соединения GaS и Ga2S3 плавятся конгруэнтно при 1015 и
и ЯП °C соответственно. Предполагается, что соединение Ga2S3 имеет
lbw полиморфные модификации, температуры фазовых переходов
трчяоне установлены.
Соединения Ga^Sj и Ga2S образуются по перитектическим реак-
циям при 940 и 960 °C соответственно. Предполагается, что соедине-
ииеЬд485 имеет полиморфное превращение при -900 °C.
Растворимость S в Ga не обнаружена.
Кристаллографические данные о сульфидах Ga приведены в
табл. 263.
Таблица 26 3. Кристаллическая структура соединений системы Ga—S
Соединение Прото- тип Символ Пирсо- на, пр. гр. Параметры решетки, нм Источник
а b С
GaS*1 — — 0,357(8) — 1,54(7) [X]
«Ga2S3*2 SZn cF8, 0,517 — — [2]
(<550—600 °C) Г43т 0,5181 —• — (X]
pGajSj* (>550—600 °C) SZn ЛР4, Р63тс 0,3685 0,6028 [2]
yGa2S3*4 ИЛИ — — 0,6370 — 1,805 12]
yGa2S3*5 **Гексагонал! •^Сфалерит. *3Вюртцит. *4Сверхструк * Р-121,22 >ная синг тура на ( в ония. >азе вюртц 1,1140 ита. 0,6411 0,7038 13]
Литература
1- Рустамов П.Г., Мардахаев Б.Н., Сафаров М.Г. // Изв. АН СССР. Неорганичес-
кие материалы. 1967. Т. 3. № 3. С. 479—483.
».J2, Полупроводниковые халькогениды и сплавы на их основе / Н.Х. Абрикосов,
• Ьанкина, Л-B- Порецкая и др. М.: Наука, 1975. 220 с.
J- Goodyear J„ Steigmann G.A. 11 Acta Crystallogr. 1963. V. 16. N 10. P. 946-949.
Ю.Н. Гринь
Ga-Sb. ГАЛЛИЙ-СУРЬМА
ная^а Рис' 344 представлена диаграмма состояния Ga—Sb, построен-
TaJibHifa^OTe На основе обобщения и оптимизации эксперимен-
ых данных.
GavhCHCTeMe существует одно конгруэнтно плавящееся соединение —
OD с температурой плавления: 706 °C [X]; 712 °C [2]; 709,2 °C
648
Ga—Sb
Рис. 344. Ga—Sb
[3]; 711,7 °C [1] — и протекают две эвтектические реакции, темпе-
ратура которых дана в табл. 264.
Соединение GaSb имеет структуру типа сфалерита. Данные по
кристаллической структуре GaSb приведены в табл. 265.
Таблица 26 4. Эвтектические реакции в системе Ga—Sb
Реакции Содержание Sb в фазах, % (ат.) Темпе- ратура, °C Источник
Ж * (Ga) + GaSb -0; -0; 50 29,8 [X]
~0; -0; 50 29,5 [41
-0; -0; 50 29,5±0,3
-0; -0; 50 -29,77 Hi
Ж * GaSb + (Sb) 88,2; 50; -100 589,8±0,5 |Х|
87,0; 50; -100 583 [41
88,4; 50; -100 588,5±0,5 [31
88,2; 50; -100 589,3 [1!
Ga—Sc
649
Пои комнатной температуре и давлении 6—9 ГПа GaSb претерпе-
'i фазовое превращение в тетрагональную фазу pGaSb (структур-
* - тип pSn) [5]. На Р-Т-фазовой диаграмме имеется тройная точка
1К + GaSb + PGaSb при температуре 385 °C и давлении 5,65 ГПа [5].
* В работе [7] измерен параметр решетки GaSb в интервале темпе-
ратур 10—70 °C.
Таблица 26 5. Кристаллическая структура соединений системы Ga—Sb
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
GaSb ZnS cF8, 0,6105(6) — [X]
F43m 0,609614 — [6]
0,609593 — [7]
pGaSb pSn t!4, Ibjamd 0,5348 0,2973 [1]
Литература
1. Ngai T.L., Sharma R.C., Chang Y.A. // Bull. Alloy Phase Diagrams. 1988. V. 9.
N 5. P. 586-591.
2. Глазов B.M., Петров Д.А. // Изв. АН СССР. Отделение технических наук.
1958. № 4. С. 125-129.
3. Maglione М.Н., Potier А. // J. Chim. Phys. 1968. V. 65. Р. 1595—1598.
4. KOster W., Thoma В. // Z. Metallkunde. 1955. V. 46. N 4. P. 291—293.
5. Jayaraman A., Klement W., Kennedy G.C. // Phys. Rev. 1963. V. 130. N 2. P.
540-547.
6. Озолина Г.В., Аверкиева Г.К., Горюнова H.A. и др. // Кристаллография. 1963.
Т. 8. № 2. С. 272.
7. Straumanis М.Е., Kim C.D. // J. Appl. Phys. 1965. V. 36. N 12. P. 3822-3825.
Л.Е. Шелимова
Ga—Sc. ГАЛЛИЙ-СКАНДИЙ
L. Диаграмма состояния Ga—Sc представлена на рис. 345 в полном
концентрационном интервале по данным работы [1], а на вставке —
по данным работы [2]. Растворимость Sc в жидком Ga изучена в
Работе [3].
С данным работы [1], в системе образуются пять соединений:
азос, Ga2Sc, GaSc, Ga4Sc5, Ga3Sc5, из которых Ga2Sc и Ga3Sc5
явятся конгруэнтно при 1140 и 1430 °C соответственно.
онвариантные реакции в системе Ga—Sc приведены в табл. 266.
Ga «ОГласно Работе [2] в системе образуется еще одно соединение —
Gaf^r3’ К0Т0Р°е плавится конгруэнтно при ИЗО °C. Соединение
кой ’ П° данным работы [2], образуется в результате перитектичес-
Реакции Ж + Ga5Sc3 * Ga2Sc (см. вставку на рис. 345).
Р сталлическая структура соединений представлена в табл. 267.
650
Ga-Sc
* * * *
Рис. 345. Ga-Sc
Таблица 26 6. Нонвариантные реакции в системе Ga—Sc [1]
Реакция
e (Ga) + Ga3Sc
+ Ga2Sc <* Ga3Sc
•* Ga2Sc + GaSc
+ Ga4Sc5 ₽ GaSc
Содержание Sc в фазах, °/a Темпе paтуpa.
(ат.)
-0; -0; 25 JO
-10; 33,3; 25 1030
43; 33,3, 50 1070
-44; 55,6; 50 1 090
Ga—Se
651
реакция Содержание Sc в фазах, % (ат.) Темпе- ратура, °C
Ga3Sc5 - Ga4Sc3 -50; 62,5; 55,6 1230
I jK * (aSc) + Ga3Sc5 80; -100; 62,5 1060
Таблиц i 2 6 7. Кристаллическая структура соединений системы л a—Sc
Сое ди не- Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
ние а b с
Ga3Sc AuCu3 сР4, РтЗт 0,4095 0,4092 — — [1] [2]
Ga2Sc Hg2K о!12, Imma 0,6614 0,4140 0,7914 [4, 5]
GaSc BCr оСЬ, Стет 0,4023 1,0212 0,3894 [И
Ga3Sc3 Si3Mn3 hP16, Р631 тст 0,8067 — 0,6036 [1]
При давлении 0,77—7,7 ГПа и температуре 200—500 °C получена
модификация соединения Ga2Sc со структурой типа Si2Zr (символ
Пирсона оС 12, пр. гр. Сттт) с параметрами решетки: а = 1,331,
b 0,4098, с = 0,4242 нм [6].
Литература
1- Yatsenko S.P., Semyannikov A. A., Semenov B.G. et al. //J. Less-Common Met.
1979. V. 64. N 2. P. 185-199.
2. Маркие В.Я., Гавриленко И.С., Петьков В.В. и др. // Доклады АН УРСР. Сер.
А- 1977. № 2. с. 167-171.
3- Яценко С.П., Аникин Ю.А. // Изв. АН СССР. Металлы. 1970. № 4. С. 162—
167.
4. Гладишевский Э.1., Гринь Ю.Н., Яценко С.П. и др. // Доповвд АН УРСР. Сер.
А- 1980. № 6. С. 81-84.
8? ggБелявина Н.М., Маркин В.Я. II Допов1д1 АН УРСР. Сер. А. 1980. № 4. С.
u Попова С.В., Фомичева П.Н., Путро В.Г. // Изв. АН СССР. Неорганические
’ериалы. 1980. Т. 16. № 9. С. 1563-1567.
Ю.Н. Гринь
ГАЛЛИЙ-СЕЛЕН
^Диаграмма состояния Ga—Se, представленная на рис. 346, по-
рабоп^г? ИнтеРвале концентраций 0—60 % (ат.) Se по данным
йьпсг -PJ и в интервале концентраций 60—100 % (ат.) Se по дан-
м работы [2].
652
Ga—Se
Se, % (no массе)
Рис. 346. Ga—Se
В системе существует область несмешиваемости в жидком состоя
нии, которая простирается от 7 до 42 % (ат.) Se при температуре
915 °C [1]. Критическая точка находится при температуре -1000 С
и содержании ~22 % (ат.) Se. В системе имеются три эвтектичес-
ких равновесия: два из них вырождены (со стороны Ga и Se), а
третье протекает по реакции Ж GaSe + Ga2Se3 при 884 °C и 55 %
(ат.) Se.
В системе образуются два соединения — GaSe и Ga2Se3, плавящи-
еся конгруэнтно при 938 и 1005 °C соответственно. Существование
соединения Ga2Se [X] не было подтверждено.
Ga~Si
653
Соединение GaSe имеет гексагональную решетку с параметрами
» 0 3759 нм и с = 1,602 нм [1], pGa2Se3 — моноклинную решетку
дарамстрами а = Ь = 0,666 нм, с = 1,165 нм и р = 108,12 °, yGa2Se3
кубическую решетку типа сфалерита (символ Пирсона с/В, пр. гр.
43/п) с а- 0,5462 нм [2].
кература
! 1 Suzuki Н., Mori R. // Jap. J. Appl. Phys. 1974. V. 13. N 4. P. 417-423.
2. Mikkelsen, Jr., J.C. // J. Solid State Chem. 1981. V. 40. N 3. P. 312-317.
Ю.Н, Гринь
Ga—Si. ГАЛЛИЙ-КРЕМНИЙ
На рис. 347 представлена обобщенная диаграмма состояния Ga—Si,
рассчитанная в работе [1] на основании оптимизации эксперимен-
тов Си„СТеме имеется вырожденная эвтектика со стороны Ga, состав
туг>а^°И СОГласно работе [1] отвечает 99,994 % (ат.) Ga, а темпера-
•гра плавления -29,77 °C.
654 Ga—Sm
Растворимость Si в жидком Ga составляет 0,25 и 0,01 % (атл Пп
температурах 500 и 300 °C соотвественно [X]. Расстворимость gJ*И
Si, по данным работы [Э], составляет: в
Температура, °C........................ 805±10 982±10 10мщ0
Растворимость Ga, % (ат.).............. 0,03 0,052 0.064
Термодинамический расчет [2] дает более высокие значения
растворимости Ga в Si: -0,23 % (ат.) при -1170 °C (максимальная
растворимость) и -0,08 % (ат.) Ga при -800 °C.
В работе [3] с использованием модели квазирегулярных растворов
определен ликвидус в системе Ga—Si в области составов с малым
содержанием Si.
Литература
1. Olesinski R.W., Kanani N., Abbaschian G.J. // Bull. Alloy Phase Diagrams 1985
V. 6. N 4. P. 362-364.
2. Козловская B.M., Рубинштейн P.H. 11 Физика твердого тела. 1961. Т. 5 з
С. 3354-3362.
3. Кожитов Л.В., Николаев А.Г., Кузнецов Г.М. и др. // Журнал неорганической
химии. 1986. Т. 31. № 2. С. 444-447.
Ю.Н. Гринь
Ga-Sm. ГАЛЛИЙ-САМАРИЙ
Диаграмма состояния Ga—Sm построена в полном концентраци-
онном интервале в работах [1—3]. Область составов с высоким содер-
жанием Ga изучали в работах [4, 5], а растворимость Sm в жидком
Ga — в работе [6]. На рис. 348 представлен обобщенный вариант
диаграммы состояния.
Исследование проводили методами дифференциального термичес-
кого, рентгенофазового, микроструктурного и рентгеноструктурного
анализов. Образцы получали из Ga чистотой не менее 99,9 % <п0
массе) и Sm чистотой 99,86 % (по массе) дуговой плавкой или
плавкой в запаянных танталовых тиглях.
В системе образуются шесть соединений: Ga6Sm, Ga2Sm, GaSm,
Ga2Sm3, Ga3Sm5, Ga4Smg, из которых только одно соединение Ga2Sni
плавится конгруэнтно при 1390 °C, а остальные соединения образу-
ются по перитектическим реакциям. Фаза Ga2(1 + x)Smj . х имсет
широкую область гомогенности, простирающуюся от 24 до 33.3 /о
(ат.) Sm [5] и образующуюся за счет статистического замещения
части атомов Sm парами атомов Ga [7]. Фаза Ga2Sm3 найдена ®
работе [8] после отжига сплавов при 400 °C. Фазе Ga4Sm9 1’91 в
более ранних работах [1—3] приписывали формулу GaSm3.
Нонвариантные реакции в системе Ga—Sm даны в табл. 268.
Кристаллическая структура соединений приведена в табл. 269.
Ga—Sm
655
656
Ga—Sm
Таблица 26 8. Нонвариантные реакции в системе Ga—Sm
Реакция Содержание Sm в фазах, % (ат.) Темпе- ратура, °C Исюч Вик
Ж - (Ga) + Ga6Sm -0; -0; 14,3 -30 |2[ '
Ж + Ga2Sm » Ga6Sm -3; 24; 14,3 439 [4i
Ж + Ga2Sm » GaSm -52; 33,3; 50 1105 1'21
Ж + GaSm •* Ga3Sm5 -63, 50; 62,5 970 R!
Ж + Ga3Sm5 « Ga4Sm9 -70 62,5; 69 873 [2i
Ж В Ga4Sm9 + (aSm) 80; 69; -100 735 [21
Таблица 26 9. Кристаллическая структура соединений системы Ga—Sm
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a b c
Ga6Sm Ga6Pu 1.Р14, P4/nbm 0,5963 — 0,7608 14)
B2A1 hP3, P6/mmm 0,4238— -0,4274 — 0,4187- -0,4206 [71
GaSm BCr oC8, Cmcm 0,4162 1,1013 0,4095 [31
Ga2Sm3 Ga^Gdj 74/ man 1,1713 — 1,517 [81
Ga3Sm5 B3Cr5 1J32, 14/ ntcm 0,77796 — 1,428 [101
Ga4Sm9 Ga4Sm9 74/m 1,1940 — 0,5081 [9!
Литература
1. Yatsenko S.P. // J. Chemie Physique. 1977. V. 74. N 7-8. P. 836-843.
2. Yatsenko S.P., Semyannikov A.A., Semenov B.G. et al. // J. Less-Common v i
1979. V. 64. N 2. P. 185-199.
3. Яценко С.П., Семенов Б.Г., Чунтонов K.A. 11 Изв. АН СССР. Металлы I 9'7.
№ 6. C. 185-187.
4. Pelleg J., Kimmel G., Dayan D. // J. Less-Common Met. 1981. V. 81. N 1
33-34.
5. Dayan D., Atzmony U., Dariel M.P. // J. Less-Common Met. 1982. V. 87. N 1 *’
87-98.
6. Яценко С.П., Аникин Ю.А., Диева Э.Н. //Изв. АН СССР. Металлы. l '~ ’
№ 2. С. 213-214.
7. Kimmel G., Dayan D., Zevin L. et al. // Metal. Trans. A. 1985. V. 16. N 1—6 1’
167-171.
8. Yatsenko S.P., Hladyschewsky R.E., Sitschewitsch O.M. et al. // J. Less Common
Met. 1986. V. 115. N 1. P. 17-22.
Ga—Sn
657
i □ yatsenko S.P., Hryn’Yu. N., Sitschewitsch O.M. et al. // J. Less-Common Met.
1985- V- Ю6. N 1. P- 35—40.
I jo Palenzona A., Francheschi E. // J. Less-Common Met. 1986. V. 14. N 1.
1 47-53.
'I Ю.Н. Гринь
A-Sn. ГАЛЛИЙ-ОЛОВО
I Диаграмма состояния Ga—Sn, представленная на рис. 349, по-
строена в работах [1, Ш] на основе данных термического, рентгено-
фазового и дилатометрического анализов.
Рис. 349. Ga—Sn
Диаграмма состояния — эвтектического типа с температурой
плавления эвтектики: 20,6 °C [1], 20,5 °C [2], 20,4 °C [3]. Эвтек-
тической точке отвечает состав 8,5 % (ат.) Sn [1] или 7,9 % (ат.)
bn [3J.
Растворимость Sn в Ga составляет 0,017 % (ат.) [2] при темпера-
турах 20,5 °C, растворимость Ga в (Sn) — 7,1 % (ат.) (параметры
ле.??оТКи ^п) при этом уменьшаются: а от 0,5830 до 0,5786 нм, с от
и>4182 до 0,3168 нм) [1].
Диаграмма состояния Gall—Sn (Gall — метастабильная модифи-
^~НИя, устойчивая при высоком давлении) также эвтектического типа
°°Рдинаты эвтектической точки: -23,3 °C, 3,2 % (ат.) Sn] [3].
658
Ga—Sr
При закалке из жидкого состояния можно получить метастабиль-
ное соединение GaSn4 со структурой типа HgSn6 (пр. гр. РЬ/тпиЧ)
с параметрами: а = 0,3143, с = 0,2922 нм [4]. О других сплавах
Ga—Sn, закаленных из расплава, сообщается в работе [5].
Литература
1. Predel В. // J. Less-Common Met. 1964. V. 7. N 5. Р. 347—355.
2. Audit Ph., Epelboin I., Erny M. // Mem. Sci. Rev. Met. 1962. V. 59. N 3 p
233-239.
3. Delcroix S., Defrain A., Epelboin I. // J. Physique. 1963. V. 24. N I. P. 17—20.
4. Kane R.H., Giessen B., Grant N.J. // Acta Metall. 1966. V. 14. N 5. P. 605—609
5. Jones H. // Rep. Prog. Phys. 1973. V. 36. N 11. P. 1425-1497.
Ю.Н. Гр ;нь
Ga—Sr. ГАЛЛИЙ-СТРОНЦИЙ
Диаграмма состояния Ga—Sr (рис. 350) построена в работе [1J на
основе данных термического, микроструктурного и рентгеновского
анализов.
Рис. 350. Ga—Sr
Ga—Ta
659
V В системе образуются три соединения, из которых Ga2Sr плавится
конгруэнтно при 1045 °C, a Ga4Sr и GaSr образуются по перитекти-
ческим реакциям при 767 и 710 °C соответственно. При 503 °C
кристаллизуется эвтектика GaSr + (ocSr), а при ~29 °C — вырожден-
ная эвтектика (Ga) + Ga4Sr.
I Кристаллическая структура соединений представлена в табл. 270.
Таблица 27 0. Кристаллическая структура соединений системы Ga-^Sr
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
Ga4Sr А14Ва шо, 14/ттт 0,4430 1,071 [1]
Ga2Sr А1В2 hP3, Р6/ттт 0,4345 0,4344 0,4736 0,4732 [1] [Э]
GaSr AlSr сР64, Р2,/3 1,2484 — [2]
Литература
1. Bruzzone G.I. // Boll. Scient. Fac. Chim. Industr. Bologna. 1966. V. 24. N 4.
P. 113-132.
2. Fornasini M.L., Merlo F. Il Acta Crystallogr. 1976. V. 32. N 6. P. 1864—1867.
JLJ1. Зусман
Ga—Ta. ГАЛЛИЙ-ТАНТАЛ
Диаграмма состояния Ga—Ta не построена. Рентгенографически
установлено существование двух соединений: Ga2Ta и Ga3Ta5.
Образцы получали из компонентов ступенчатым нагревом в
алундовых тиглях в вакууме [1] либо дуговой плавкой [2].
Кристаллическая структура соединений дана в табл. 271.
В работе [1] отмечается, что на структуру соединений оказывают
влияние микропримсси неметаллов, например кислорода.
Найденные ранее фазы GaTa2, Ga3Ta [2], Ga3Ta5 со структурой
Типа В3Сгг [51, а также Ga->Ta4, Ga<rTa4 [4, 6, 7] не потверждсны в
Работе [1]
При давлении 7,7 ГПа были получены соединения: Ga3Ta5 со
структурой типа Si3W5 или Si3Mn5, Ga3Ta (структурный тип Al3Ti),
п.а5^аб (структурный тип Sn5Ti6) и Ga2Ta3 (структурный тип
Таблица 271. Кристаллическая структура соединений системы Ga—Та
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
Ga2Ta* — — 1,6297 1,1178 [1’Г~~
Ga3Ta5 Si3W5 t/32, 1,0187 0,5101 [1]
/4/тст 1,0208 0,5116 [2J
1,0180 0,5090 [31
1,020 0,510 [4]
*Тетрагональная сингония.
Литература
1. Brown P.W. // J. Less-Common Met. 1977. V. 52. N 1. P. 77—80.
2. Гладышевский E.M., Телегус B.C., Маркив В.Я. И Кристаллография 1963
Т. 8. № 6. С. 921-923.
3. Schubert К., Frank К., Gohle R. и.а. // Naturwissenschaften. 1963. Bd. 50. N 2.
S. 41.
4. Meissner H.-G., Schubert K. // Z. Metallkunde. 1965. Bd. 56. N 7. S. 475 -484.
5. Holleck H., Rieger W., Nowotny H. u.a. // Monatsh. Chemie. 1964. Bd. 95 N 2.
S. 552-557.
6. Holleck H., Nowotny H., Benesovsky F. // Monatsh. Chemie. 1963. Bd. 94. \ 5.
S. 841-843.
7. Havinga E.E., van Maaren M.H., Damsma H. // Phys. Rev. Letters. 1968. V 29A.
N 3. P. 109-110.
8. Попова C.B., Путро В.Г. // Изв. АН СССР. Неорганические материалы. Г. 15.
№ 7. С. 1210-1213.
Ю.Н. Гринь
Ga—ТЬ. ГАЛЛИЙ-ТЕРБИЙ
Диаграмма состояния Ga—ТЬ построена в полном концентраци-
онном интервале в работах [1, 2], а в области составов с высоким
содержанием Ga — в работах [3, 4]. Растворимость ТЬ в жидком Ga
изучена в работе [5]. На рис. 351 приведен обобщенный вариант
диаграммы состояния Ga—ТЬ. Исследование проводили методами
дифференциального термического, микроструктурного и рентгенов-
ского анализов. Образцы получали из Ga и ТЬ дуговой плавкой или
плавкой в танталовых герметичных тиглях.
В системе обнаружено существование семи соединений, из кото-
рых только Ga2Tb плавится конгруэнтно при 1380 °C. Соединение
Ga3Tb имеет две полиморфные модификации: высокотемпературнУ10
со структурой типа Cu3Au и низкотемпературную со структурой типа
Ni3Sn [5]. При температуре 600 °C найдены фазы Ga5Tb3 16] (пер'
воначально приписывалась формула Ga3Tb2) и Ga2Tb3 [71.
Ga—Tb
661
*>c. 351. Ga—Tb
табл°272РИаНТНЫе Реаки,ии в системе Ga—Tb представлены в
Кристаллическая структура соединений представлена в табл. 273.
662
Ga—Tb
Таблица 27 2. Нонвариантные реакции в системе Ga—ТЬ
Реакция Содержание ТЬ в фазах, % (ат.) Темпе- ратура, °C Источ- ник
Ж «« (Ga) + Ga6Tb -0; ~0; 14,3 -29 !>Г
Ж + aGa3Tb » Ga6Tb ~4; 25; 14,3 397 [4]
Ж + Ga2Tb 0Ga3Tb -17; 33,3; 25 1010 [1]
Ж + Ga2Tb GaTb "56; 33,3; 50 1210 [1]
Ж GaTb ₽ Ga3Tb5 -64; 50; 62,5 ИЗО HI
Ж Ga3Tb5 + (aTb) 80; 62,5; -100 880 [1]
Таблица 273. Кристаллическая структура соединений системы Ga—ТЬ
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
Ga6Tb Ga6Pu (Pl 4, PM mbm 0,5924 — 0,7546 [41
aGa3Tb Ni3Sn hP8, Р63/ ттс 0,6278 — 0,4507 [5]
₽Ga3Tb Cu3Au сР4, РтЗт 0,4285 — [5]
Ga2Tb B2A1 hP3, Р6/ттт 0,4209 — 0,4095 [8|
GajTb3 Ga5Tm3 оР32, Рпта 1,145 0,9666 0,6087 [6]
GaTb BCr оС8, Стет 0,43114 1,09394 0,40851 [9]
Ga2Tb3 Ga2Gd3 /4/тст 1,1604 — 1,4862 [71
Ga3Tb5 взСг5 tI32, IM тст 0,7681 — 1,4108 [101
Литература
1. Yatsenko S.P., Semyannikov A. A., Semenov B.G. et al. //J. Less-Common Met.
1979. V. 64. N 2. P. 185-199.
2. Yatsenko S.P. // J. Chim. Phys. 1977. V. 74. N 7-8. P. 836-843.
3. Dayan D., Atzmony U., Dariel M.P. //J. Less-Common Met. 1982. V. 87- N 1
87-98.
4. Pelleg J., Kimmel G., Dayan D. // J. Less-Common Met. 1981. V. 81. N 1 I’
33-34.
5. Cirafici F., Francheschi E. // J. less-Common Met. 1981. V. 'll. N 2. P. 269—780-
Ga—Te
663
6 Yatsenko S.P., Hladyschewsky E.I., Tschuntonow K.A. et al. // J. Less-Common
uet. 1983. V. 91. N 1. P. 21-32.
' 7 Yatsenko S.P., Hladyschewsky R.E., Sitschewitsch O.M. et al. // J. Less-Common
Met 1986. V. 115. N 1. P. 17-22.
8. Haszko S.E. // Trans. AIME. 1961. V. 221. N 1. P. 201-202.
- 9. Dwight A.E., Downey J.W., Conner R.A. // Acta Crystallogr. 1967. V. 23. N 5.
p. 860—862.
10. Palenzona A., Franceschi E. // J. Less-Common Met. 1968. V. 14. N 1.
p. 47-53.
Ю.Н. Гринь
Ga—Te. ГАЛЛИЙ-ТЕЛЛУР
Исследование системы проводили методами термического, рентге-
нофазового [X, Э, 1—7] и рентгеноструктурного анализов [5, 8], а
также рассчитывали, исходя из термодинамических параметров [9].
Диаграмма состояния Ga—Te приведена на рис. 352 по данным
работ [7, 9]. В системе образуются четыре соединения: GaTe,
Ga3Te4, Ga2Te3 и Ga2Te5, из которых GaTe и Ga2Te3 плавятся
конгруэнтно при 848 и 812 °C [7] соответственно. Найденное в
работе [1] соединение Ga3Te2 в более поздних работах не подтвер-
ждено.
В системе существует область несмешиваемости в жидком состоя-
нии, простирающаяся от 11,2 до 36,3 % (ат.) Те [9].
Нонвариантные реакции в системе Ga—Te даны в табл. 274.
Кристаллическая структура соединений представлена в табл. 275.
Таблица 27 4. Нонвариантные реакции в системе Ga—Te
Реакция Содержание Те в фазах, % (ат.) Темпе- ратура, °C Источ- ник
Ж1 - (Ga) + GaTe -0; -0; 50 29,8 [7]
Ж2 ’ Ж, + GaTe 36,3; 11,2; 50 746 [7, 9]
Ж *• GaTe + Ga3Te4 54,9, 50; 57,1 778 [7, 9]
Ж + Ga2Te3 ₽ Ga3Te4 -56; 60; 57,1 784 [7]
Ж + Ga2Te3 ₽ Ga2Te5 -80; 60; 71,4 488 [7]
— — — 495 [3]
GazTes ₽ Ga2Te3 + (Те) 71,4; 60; -100 400 17]
Ж “ (Те) + Ga2Te5 95; -100 71,4 436 (7]
— — — 440 (3]
664
Ga-Те
Рис. 352. Ga-Те
Таблица 27 5. Кристаллическая структура соединений системы Ga—Те
Соедине- ние I1рототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
GaTe* GaTe тС 24, С2/т 1,7404 1,0456 0,4077 [51
Ga3Te4~ — — 0,8278 — 0,6906 [7!
Ga2Tej — Fdlm 0,5909 — — [71
Ga2Te5 Ga2Te5 ГЛ 4, 14/т 0,7913 0,7917 — 0,6848 0,6869 [8] [7!
* Р = 104,43°.
♦♦Тригональная сингония.
Ga-Th.
665
Литература
1. Newman P.C., Brice J.C., Wright H.C. 11 Phil. Res. Report. 1961. V. 16. N 1. P.
41—50.
2. Wobst M. // Scripta Metall. 1971. V. 5. N 7- P. 583-586.
3. Alapini F., Guittard M., Julien-Pouzol M. et al. // Compt. Rend. Acad. Sci. Paris.
Ser. C. 1976. V. 282. P. 543—545.
4. Глазов B.M., Павлова Л.М. // Изв. АН СССР. Неорганические материалы.
1977. Т. 13. № 1. С. 184-188.
5. Alapini F., Flahaut J., Guittard M. et al. // J. Solid State Chem. 1979. V. 28. N 3.
p. 309—319.
6. Said H., Castanet R. II J. Less-Common Met. 1979. V. 68. N 2. P. 213—215.
7. Blachnik R., Irle E. // J. Less-Common Met. 1985. V. 113. N 1. P. LI—L3.
8. Joulien—Pouzol M., Jaulmes S., Alapini F. // Acta Crystallogr. B. 1977. V. 33.
N 7. P. 2270-2272.
9. Irle E., Gather B., Blachnik R. u.a. // Z. Metallkunde. 1987. Bd. 78. N 8. S.
535-543.
10. Jones H. 11 Rep. Prog Phys. 1973. V. 36. N 11. P. 1425-1497-
Ю. H. Гринь
Ga-Th. ГАЛЛИЙ-ТОРИЙ
Диаграмма состояния Ga—Th не построена. Установлено сущес-
твование четырех соединений: Ga2Th, GaTh, Ga2Th3 и GaTh2. В
работе [2] в образце состава Ga3Th наблюдали неизвестную фазу в
равновесии с Ga2Th, а в работе [1] сообщается о наличии одной или
двух неизвестных фаз в области составов между Ga2Th и Ga.
Кристаллическая структура соединений представлена в табл. 276.
Таблица 27 6. Кристаллическав структура соединений системы Ga—Th
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a b c
Ga2Th aSi2Th t/12, 0,4247 —— 1,4701 [И
Hjamd 0,4243 —“ 1,4690 [3]
GaTh AgSr оР\Ь, Pnma 1,6346 0,4136 0,6053 [1]
Ga2Th3 Si2U3 tPIO, PM mbm 0,8000 — 0,4224 Hl
GaTh2 CuA12 t/12, /4/mcm 0,7471 — 0,5933 [1]
^Ьпература
V A\₽a'enzona A., Fornasini M.L., Manfrinetti P. // J. I-css-Common Met. 1984.
• 2. P. L15-L18.
S. 1386^1390 H ’ Nowo,hv Benesovsky F. 11 Monatsh. Chem. 1964. Bd. 95. N 4—5.
3- Brown A. // Acta Crystallogr. 1961. V. 14. N 8. P. 860-865.
Ю Н. Гринь
666
Ga—Ti
Ga—Ti. ГАЛЛИЙ—ТИТАН
Диаграмма состояния Ga—Ti построена во всей области концен-
траций в [1, III ]. Согласно [1] в системе существуют восемь соеди-
нений: Ga3Ti, Ga2Ti, Ga3Ti2, GaTi, Ga4Ti5, Ga3Ti5, GaTi2 и Ga'Ii^,
из которых Ga4Ti5, Ga3Ti5 и GaTi2 плавятся конгруэнтно при темпе-
ратурах: -1230, -1425 и >1500 °C соответственно. Остальные соеди-
нения образуются по перитектическим или перитектоидным (Ga3Ti->)
реакциям.
В работе [2], где проведены оценка и обобщение эксперименталь-
ных данных по системе Ga—Ti, построенная в работах [1, Ш] диаг-
рамма состояния подвергнута сомнению в связи с возможным окисле-
нием и неравновесностью исследованных сплавов. На рис. 353 пред-
ставлен участок диаграммы состояния со стороны Ti, который соглас-
но работе [2| считается надежно установленным и согласуется с
данными работ |Х, Э]. Введение Ga в Ti приводит к повышению
температуры фазового превращения (f}Ti> * (aTi) вплоть до темпе-
ратуры 940 ± 10 °C, при которой происходит перитектоидная
реакция (0Ti) + GaTi3 >* (aTi). Соединение GaTi3 образуется по
Ga—Ti
667
‘перитектоидной реакции (₽Ti) + GaTi2 * GaTi3 при температуре
1030 ± 20 °C. Соединение GaTi2, вероятно, плавится конгруэнтно и
образует эвтектику с (PTi). Область твердого раствора (aTi) и соеди-
нение GaTij детально изучены рентгенографически в работах [3, 4].
В табл. 277 приведены данные по кристаллической структуре всех
соединений, обнаруженных в системе Ga—Ti, однако не все эти
соединения являются равновесными фазами.
Таблица 277 Кристаллическая структура соединений системы Ga—Ti
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
GaTi3 Ni3Sn 4Р8, Р63/ттс 0,57410 0,46350 [4]
GaTi2 Ni2In hP6, Р63/ ттс 0,4514 0,5501 [1]
Ga3Ti3 W5Si3 t/32, 74/ тст 1,0218 0,5054 [5]
Ga/Гц Ga4Ti5 hP\8, Р63/ тст 0,7861 0,5452 [5]
GaTi AuCu 1Р4, Р4/ттт 0,3967 0,3967 [5]
Ga3Ti2 Ga^Tij tPW, Р41т 0,6284 0,4010 [И
Ga,Tit ai5 n3 tP32, Р4/mbm 1,117 0,399 [6]
GiijTi Ga2Hf tI24, I4\/amd 0,3929 0,4061 15]
Ga3Ti Al3Ti t/8, 14/ттт 0,3789 0,8734 [5]
Литература
, 1- POtaschke М., Schubert К. // Z. Metallkunde. 1962. Bd. 53. N 7. S. 474-488.
* Murray J.L. 11 Bull. Alloy Phase Diagrams. 1985. V. 6. N 4. P. 327-330.
3- Белоусов O.K. 11 Изв. АН СССР. Металлы. 1976. № 4. С. 190-196.
* Белоусов O.K. Ц Изв. АН СССР. Металлы. 1978. № 1. С. 195-197.
Вн ' Seubert К., Meissner H.-G., POtzschke М. et al. 11 Naturwissenschaften. 1962.
1 S 57-58
L55U.L61iida R" Hashimoto s-’ Watanabe D. // Jap. J. Appl. Phys. 1982. V. 21. N 1. P.
Л.Е. Шелимова
668
Ga—Tl
Ga—TI. ГАЛЛИЙ-ТАЛЛИЙ
Диаграмма состояния Ga—Tl построена в работе fl] методом
дифференциального термического анализа и приведена на рис. 354
Хотя растворимость Ga в Т1 не определена, было установлено, что
температура полиморфного превращения в Т1 понижается от 230 д0
224 °C. Это указывает на наличие эвтектоидного распада, что отра-
жено предположительно на рис. 354.
Рис. 354. Ga—Tl
Область несмешиваемости в жидком состоянии простирается от 1,8
до 95,5 % (ат.) Т1, критическая точка находится при температуре
574 °C и содержании ~40 % (ат.) Т1. Монотектическая реакция
протекает при температуре 287 °C и концентрации 95,5 % (атЗ 1
Термодинамические характеристики жидких сплавов Ga-
изучены в работе [2].
Литература
1. Predel В. // Z. Metallkunde. 1959. Bd. 50. N 11. S. 663-667.
2. Predel В., Stein D.W. // J. Less-Common Met. 1971. V. 24. N 2. P. 159—17
fO.ll. i'PuHb
Ga-Тт
669
Ga-Tm- ГАЛЛИЙ-ТУЛИЙ
Систему Ga—Тт исследовали методами дифференциального
•епмического, микроструктурного и рентгеновского анализов [1—3].
Образцы получали из компонентов дуговой плавкой [4—6] или в
танталовых герметичных тиглях [1—3].
Диаграмма состояния построена в полном концентрационном
интервале в работах [1—3] и представлена в обобщенном виде на
рис. 355.
670
Ga—Tm
Таблица 2 7 8. Нонвариантные реакции в системе Ga—Tm
Реакция Содержание Tm в фазах, % (ат.) Темпе- ратура, “С И» 104- Ник
Ж (Ga) + Ga6Tm -0; -0; 14,3 -30 !И
Ж + Ga3Tm я Ga6Tm -3; 25; 14,3 <400 15]
Ж Ga2Tm » Ga3Tm -20; 33,3; 25 960 !Н
Ж Ga5Tm3 » Ga2Tm -32; 37,5; 33,3 1240 Н]
ж Ga5Tm3 + GaTm -43; 37,5; 50 1220 41
ж * GaTm + Ga3Tm5 54; 50; 62,5 1290 [11
ж я (Tm) + Ga3Tm5 80; -100; 62,5 1020 14
В системе существуют семь соединений, из которых Ga5Tm3,
GaTm и Ga3Tm5 плавятся конгруэнтно при 1280, 1320 и 1340 °C [1J.
Соединению Ga5Tm3 [4] в более ранних работах приписывали фор-
мулу Ga3Tm2. В работе (6] обнаружена новая фаза Ga2Tm3, сущес-
твующая при 600 °C.
Таблица 2 7 9 Кристаллическая структура соединений системы Ga—Tm
Соедине- ние I1рототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a b c
Ga6Tm Ga6Pu tP14, Р4/nbm 0,5850 — 0,7510 '51
Ga2Tm Hg2K Imma 0,6887 0,4201 0,8078 [7, 81
Ga5Tm3 Ga5Tm3 oP32, Pnma 1,1293 0,9561 0,6001 {41
GaTm BCr oCS, Cmcm 0,4245 1,0633 0,4017 131
Ga2Tm3 Ga2Gd3 74/mcm 1,124 — 1,447 161
Ga3Tm5 Si3Mn5 API 6, P63/mcm 0.8452 — 0,6320 131
Нонвариантные реакции в системе Ga—Tm даны в табл. 2/8.
Данные по кристаллической структуре соединений системы
Ga—Tm представлены в табл. 279.
Литература
1. Yatsenko S.P., Semyannikov А.А., Semenov B.G. et al. // J. Less-Common MeI
1979. V. 64. N 2. P. 185-199.
2. Yatsenko S.P. // J. Chim. Phys. 1977. V. 74. N 7-8. P. 836-843.
Ga-U
671
Яиенко С.П., Семянников А.А., Чунтонов К.А. // Изв. АН СССР. Металлы.
№3 С. 201-204.
J97B- > -_ nko s.p„ Hladyschewsky E.I., Tschuntonov К.А. et al. // J. Less-Common
1 io83. V. 91. N 1. P- 21—32.
*5 Pelleg J-, Kimmel G., Dayan D. // J. Less-Common Met. 1981. V. 81. N 1. P.
^^”x^Yatsenko S.P., Hladyschewsky R.E., Sitschewitsch O.M. et al. 11 J. Less-Common
uet 1986. V. 115. N 1. P. 17-22.
7 Гладишевский Э.И., Гринь Ю.Н., Яценко С.П. и др. // Доповцц АН УРСР.
Сео А. 1980. № 6. С. 81—84.
Lflscher Н., Girgis К., Fischer Р. // J. Less-Common Met. 1982. V. 83. N 1. P.
123-125.
ЮН. Гринь
Ga-U. ГАЛЛИЙ-УРАН
Диаграмма состояния системы Ga—U построена в работах [1,2]
по результатам термического, микроструктурного и рентгеновского
диализов и представлена на рис. 356.
Таблица 28 0. Нонвариантные реакции в системе Ga—U
Реакция Содержание U в фазах, % (ат.) Темпе- ратура, °C Источ- ник
Ж • (Gal + Ga3U -0, -0; 25 29,7 [1]
Ж + Ga2U * Ga3U -20; 33,3; 25 1250 [1]
Ж + Ga2U * Ga3U3 -58; 33,3; 37,5 1260 [1, 2]
Ж - (yU) + Ga3U3 78; -98,5; 37,5 1030 [1]
. (0U) + Ga3U3 -98,5; -99; 37,5 735 [1]
JPU) - (aU) + Ga3U3 ~98,5; >99; 37,5 660 [1]
т • <
J л и Д а 2 8 1. Кристаллическая структура соединения Ga—U
м*дине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь С
Ga,!) Cu3Au сР4, 0,42475 — — [X]
РтЗт 0,4249 [7]
Ga2u В2А1 НРЗ, 0,422 — 0,402 [8]
РЬ/ттт
Рй5Ри3 оС32, 0,9396 0,7575 0,9387 [2]
Стет 0,940 0,760 0,942 [7]
it
ьп
Ga—U
U,V. (ain.) и
Рис. 356. Ga—U
В системе образуются три соединения: Ga3U, Ga2U и Ga^l j- и3
которых Ga2U плавится конгруэнтно при 1355 °C, остальные сосди-
нения образуются по перитектическим реакциям. Соединение
претерпевает полиморфное превращение при температурах ниже
—173 °C [3, 4], низкотемпературная модификация обладает ром^1"
чески деформированной структурой типа А1В2 [3, 4]. Соединений
Ga5U3 [21 ранее приписывали формулу GaU [5] или Ga3U2 Ш
Ga-V
673
.... у0Нвариантные реакции в системе Ga—U даны в табл. 280.
Метастабильные сплавы с малым содержанием Ga, полученные
•йкалкой из расплава, изучали в работе [6].
- Кристаллическая структура соединений представлена в табл. 281.
датература
1. Buschow K.H.J. // J. Less-Common Met. 1973. V. 31. N 1. Р. 165-168.
2 Dayan D., Kimmel G., Dariel M.P. // J. Nud. Mater. 1985. V. 135. N 1. P. 40—45.
3. Andreev A.V., Belov K.P., Deriagin A.V. et al. // J. Phys. Collog. 1979. V. 40.
w C—4. P- 82—83.
4. Scechovsky V., Smetana Z„ Mehovsky A. // Phys. Status Solidi. (a). 1975. V. 28.
N ]. P. K37-K40.
5. Марков Е.Г., Левдик В.A. // Кристаллография. 1956. T. 1. N 6. С. 644—649.
6. Dayan D., Dariel D., Dapht M. // Actinides 85. Aix de Provence. 1985. P. 95.
7. Sternberk J., Ansorge V., Hrebik J. et al. 11 Crechoslov. J. Phys. 1971- V. B21.
N 9. P 969—977.
8. Misiuk A., Mulak J., Czopnik A. et al. // Bull. Acad. Palon. Sci., Chim. 1972.
V. 20. N 4. P. 337—341.
Ю.Н. Гринь
Ga-V. ГАЛЛИЙ-ВАНАДИЙ
В литературе существует пять вариантов диаграммы состояния
системы Ga—V [1—5]. В обобщенном варианте диаграммы состояния
(рис. 357) область высокого содержания V представлена согласно
работе [5], а область высокого содержания Ga — согласно работе
[4], участок, прилегающий к монотектике, дан согласно работе [3].
Исследование системы проводили методами дифференциального
термического, рентгенофазового и локального рентгеноспектрального
анализов, а также измерения плотности.
Таблица 282. Нонвариантные реакции в системе Ga—V
Реакция Содержание V в фазах, % (ат.) Темпе- ратура, °C Источ- ник
Ж - (Ga) + Ga4lVg ~0; -0; 16,3 29,7 [4]
Ж + Ga5V2 - Ga41Vg -1; 28,6; 16,3 495 [4]
Ж + Ga7V6 » Ga5V2 -8; 46,2; 28,6 1050 [4]
ж2 « Ж, + Ga7V6 '32; -9; 46,2 1085 [3]
Ж + (V) » Ga7V6 -41; -60; 46,2 1155 [6]
Ga7V6 - Ga5V2 + Ga5V6 46,2; 28,6; 54,5 1020 15]
(V) + Ga7V6 » Ga5V6 -62; 46,2; 54,5 1095 [3]
-!yL“ Ga5V6 + GaV3 -63; 54,5; 75 1075 15]
22 Зак. 2144
674
Ga—V
Рис. 357. Ga—V
В системе существуют пять промежуточных фаз. Фаза GaVj
образуется при температуре 1300 °C в результате конгруэнтного
твердофазного распада твердого раствора (V) и имеет область гомо-
генности в пределах 68—78 % (ат.) V в интервале температур 950"
1100 °C [5]. Соединение Ga5V6 образуется по перитектоидной РсаК
Ga—V
675
пои высоких температурах, по-видимому, имеет небольшую
5?Йсть гомогенности [1]. Фаза Ga7V6 образуется по перитектической
°^ia «и имеет небольшую область гомогенности и распадается
^ектоидно при 1020 °C на Ga5V6 и Ga5V2.
Таблица 2 8 3. Кристаллическая структура соединений системы Ga—V
Соединение Прототип Символ Пирсона, np. гр. Параметры решетки, нм Источник
а С
Ga41V g Ga41Vg ЛА49, R3 1,3938 1,4892 [7]
Ga^Yj Hg5Mn2 tPl4, P4/mbm 0,8968 0,2693 [5]
Ga7V6 ZngCu5 cI52, /43m 0,9197- -0,9182 — (81
Ga5V6 aZn5Ti6 hP22, Р63/ттс 0,846 0,8496 0,516 0,5174 [3] [5]
GaV3 SiCr3 cP8, Pm3n 0,4821 0,482 — [5] [3]
Растворимость V в Ga не обнаружена, а растворимость Ga в V
достигает -40 % (ат.) вблизи температуры 1155 °C [6].
Нонвариантные реакции в системе Ga—V даны в табл. 282.
Данные по кристаллической структуре соединений системы Ga—V
представлены в табл. 283.
Литература
1. Савицкий Е.М., Крипякевич П.И., Барон В.В. и др. // Журнал неорганической
ХМмии 1964. Т. 9. N 5. С. 1155-1157.
2- Meissner H.-G., Schubert К. // Z. Metallkunde. 1965. Bd. 56. N 7. S. 475—484.
« Meier R.G., Uzel Y„ Kandler K. // Z. Naturforsch. A. 1966. Bd. 21. N 5.
S. 531-540.
— Савицкий E.M., Крипякевич П.И., Барон В.В. и др. // Изв. АН СССР. Неорга-
«ич«:кие материалы. 1967. T.3.N1.C. 45-53.
Т По ?ЖИН Й.П., Воробьева Н.С., Кунаков Я.Н. и др. // Доклады АН СССР. 1968.
6<Л2 С 341-344.
7 JF- и Bull. Alloy Phase Diagr. 1981. V. 2. N 2. P. 23-27.
113—K’’ Petter M„ Pupp G. // Acta Crystallogr. B. 1975. V. 31. N 1.
1964 vU^1 Van, Bruning H.A.C.M., Donkersloot H.C. et al. // Phil. Res. Rep.
V- 19-N 5. P. 407-421.
12*
Ю.Н. Гринь
676
Ga-W, Ga—Y
Ga—W. ГАЛЛИЙ-ВОЛЬФРАМ
Диаграмма состояния Ga—W не построена. В обычных условиях
Ga не взаимодействует с W ни в жидком, ни в твердом состояния, по
крайней мере при нагреве до 800 °C. Спектральным анализом оста-
новлено, что при температуре 815 °C растворимость W в Ga составля-
ет 0,001—0,008 % (по массе).
В сплавах с 15—85 % (ат.) Ga, полученных при высоком давлении
(7,7 ГПа) при 300—1400 °C, обнаружены следующие фазы: при 400—
800 °C — твердый раствор на основе W с ОЦК решеткой и W,Ga5,
а в ряде случаев дополнительно неизвестная фаза с 79—84 % (ат.)
Ga; при температурах выше 800 °C образуется фаза с 53—61 % (ат.)
Ga (Wt _ tGa — W2Ga3). Все фазы метастабильны, разлагаются при
нагреве в вакууме при 100 °C в течение 5 ч.
Фаза W?Ga5 имеет решетку типа Mn2Hg5 (символ Пирсона //'14,
пр. гр. Р^/тЪт) с параметрами а = 0,8984 нм, с = 0,2674 нм для
сплава с содержанием 69 % (ат.) Ga. Фаза Wj _ xGa — W2Ga3 имеет
гексагональную плотноупакованную решетку с параметрами а =
= 0,3006 нм, с = 0,4738 нм для сплава с 60 % (ат.) Ga.
Литература
1. Вол А.Е. Строение и свойства двойных металлических систем. М.: Физмаггиз.
1962. Т. 2. 984 с.
2. Popova S.V., Fomitchcva L.N. // J. Less-Common Met. 1981. V. 77. .X l 1’
137-140.
K.H. /loedi'XMCl
Ga-Y. ГАЛЛИЙ-ИТТРИЙ
Диаграмма состояния Ga—Y построена в полном концентрацион-
ном интервале в работах 11—3]. Растворимость Y в жидком Ga
изучали в работе [4]. На рис. 358 приведен обобщенный вариант
диаграммы состояния системы Ga—Y.
Исследование проводили методами дифференциального термичес-
кого, микроструктурного и рентгеновского анализов [1—3]. Образны
получали из компонентов дуговой плавкой [4] либо плавкой в тан га
ловых герметичных тиглях [1—3].
В системе обнаружено шесть соединений: Ga6Y, Ga2Y, Ga5Y?
GaY, Ga2Y3 и Ga3Y5, из которых Ga2Y и GaY плавятся конгруэнню
при 1350 и 1385 °C [1] соответственно. Соединения Ga6Y и Ga3\s
образуются по перитектическим реакциям при температурах >300 Y
[5] и 1295 °C соответственно. Характер образования соединении
Ga5Y3 и Ga2Y3 не определен, они обнаружены при темпсрат\рс
600 °C [6, 7].
Ga—Y 677
Y, % (по массе)
эл В систсме найдены две эвтектики (aY) + Ga3Yc при 1015 °C и
20 % (ат.) Ga; Ga2Y + GaY при 1270 °C и 58 % (ат.) Ga и одна
вырожденная эвтектика со стороны Ga.
Данные по кристаллической структуре соединений системы Ga—Y
представлены в табл. 284.
Энтальпии образования соединений Ga2Y, GaY и Ga3Y5 определе-
Ы калориметрическим методом в работе [8].
678
Ga—Yb
Таблица 28 4. Кристаллическая структура соединений системы Ga—Y
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм "“"I Источник
a b c
Ga6Y Ga6Pu tP4, Р4/nbm 0,5947 — 0,7549 [5| ~~
Ga2Y B2A1 hP3, P6/mmm 0,4217 — 0,4111 [2]
Ga5Y Ga5Tm3 oP32, Ptima 1,145 0,9674 0,6098 [6]
GaY BCr oCb, Cmcm 0,4304 1,0868 0,4065 12]
Ga2Y3 G^Gdj 14/mcm 1,162 — 1,486 [7]
Ga3Y5 Si3Mn5 hP16, P63/ man 0,8567 — 0,6468 [2]
Литература
1. Yatzenko S.P., Semyannikov A.A., Semenov B.G. et al. // J. Less-Common Met.
1979. V. 64. N 2. P. 185-199.
2. Yatzenko S.P. // J. Chim. Phys. 1977. V. 74. N 7-8. P. 836-842.
3. Яценко С.П., Семянников A.A., Чунтонов K.A. // Тугоплавкие соединении
редкоземельных элементов. Сб. статей. Душанбе: Дониш, 1979. С. 311—313.
4. Яценко С.П., Аникин Ю.А., Диева Э.Н. // Изв. АН СССР. Металлы 1972
№ 2. С. 213-214.
5. Гринив О.И., Гринив Ш.О., Гринь Ю.Н. и др. // Допов1д1 АН УРСР Сер о
1985. N 5. С. 42-44.
6. Yatzenko S.P., Hladyschewsky E.I., Tschuntonov К. A. et al. //J. Less-Common
Met. 1983. V. 91. N 1. P. 21-32.
7. Yatzenko S.P., Hladyschewsky R.E., Sitschewitsch O.M. et al. // J. Less-Common
Met. 1986. V. 115. N 1. P. 17-22.
8. Merker P. // J. Less-Common Met. 1991. V. 169. N 2. P. L23—L24.
Ю.Н. Гриш,
Ga—Yb. ГАЛЛИЙ—ИТТЕРБИЙ
Диаграмма состояния Ga—Yb построена в полном концентраци-
онном интервале в двух вариантах: в работах [1—3] и в работе |4|,
различающихся по составу и характеру образования промежуточных
фаз. Область составов вблизи Ga исследовали в работе [5], а интср
вал концентраций 20—32 % (ат.) Yb — в работе [6].
На рис. 359 представлена диаграмма состояния Ga—Yb по данные
работы [6], построенная на основе обобщения и ревизии результатов
работы [4, 5], а также собственного рентгенографического исслс
дования. В системе обнаружено семь соединений: Ga6Yb, Ga4Yb.
Ga—Yb
Рис. 359. Ga-Yb
Ga3_xYb, GasYb3, Ga2Yb, GaYb и GaYb2, из которых Ga2Yb и GaYb
плавятся конгруэнтно при 1100 и 895 °C соответственно [4]. Фаза
Qa3_xYb образуется по перитектоидной реакции и имеет заметную
область гомогенности (0 < х < 0,36). Фаза Ga„Yb3 существует в
ограниченной области температур-----830—870 °C.
. Нонвариантные реакции в системе Ga—Yb даны в табл. 285.
Данные по кристаллической структуре соединений системы Ga—Yb
представлены в табл. 286.
680
Ga—Yb
Реакция Содержание Yb в фазах, % (ат.) Темпе- ратура, °C Исюп ник
Ж » (Ga) + Ga6Yb -0; -0; 14,3 27 14] ~~
Ж + Ga4Yb ° Ga6Yb -3,5; 20; 14,3 282 !5|
Ж + Ga2Yb ₽ Ga4Yb -17; 33,3; 20 755 I4j
Ga4Yb + Ga2Yb - Ga3. xYb 20, 33,3, -25 -740 {6i
Ж + Ga2Yb » Ga8Yb3 -20; 33,3; 27,3 -870 [6]
GagYb3 ₽ Ж + Ga2Yb 27,3; -20 33,3 -830 [6|
Ж ₽ Ga2Yb + GaYb -46, 33,3; 50 880 [41
Ж + GaYb - GaYb2 -67; 50; 66,7 650 [41
Ж ₽ GaYb2 + (<xYb) -80; 66,7; -100 605 4j
Таблица 28 6. Кристаллическая структура соединений системы Ga—Yb
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a b c
Ga6Yb Ga6Pu fP14, P4/nbm 0,5849 — 0,7601 [5]
Ga4Yb* Ga4Ca mlO, С2/m 0,6148 0,6106 0,6084 [61
Ga3. tYb — hP54-3, Pb/mmm 1,3025 — 0,8360 [6]
GagYb3 GagEu3 oI22, Immm 0,4225 0,4340 2,5665 [61
Ga2Yb Galn2 hPf>, P63/mmc 0,4455 — 0,7199 [41
GaYb AuCu tP4, Р4/mmm 0,483 — 0,384 [41
GaYb2 PbCl2 oP12, Pnma 0,7063 0,5050 0,9427 [4]
*Фаза Ga3.xYb кристаллизуется в сверхструктуру типа А1В2, сохраняющую пространственную группу Р6/ ттт с параметрами решетки а и с в 3 и 2 раза соответственно больше, чем параметры исходной структуры [6].
Ga—Zti 681
di Литература
ч 1 Yatzenko S.P., Semyannikov A.A., Semenov B.G. et al. // J. Less-Common Met.
11079 V. 64. N 2. P. 185-199.
r 2. Yatzenko S.P. // J. Chim. Phys. 1977- V. 74. N 7-8. P. 836-843.
3 Яценко С.П., Семянников A.A., Чунтонов K.A. // Изв. АН СССР. Металлы.
1978. № 1. С. 193-194.
4. Palenzona A., Cirafici S. // J. Less-Common Met. 1979. V. 63. N 1. P. 105—109.
5. Pelleg J., Kimmel G., Dayan D. 11 J. Less-Common Met. 1981. V. 81. N 1.
P. 33-44.
6. Cirafici S., Fornasini M.L. // J. Less-Common Met. 1990. V. 163. N 2. P. 331-338.
Ю Н. Гринь
Ga-Zn. ГАЛЛИЙ-ЦИНК
Диаграмма состояния Ga—Zn, представленная на рис. 360, по-
строена в работе [1] на основе обобщения данных термического
анализа и измерения электросопротивления сплавов [X, Э, 2—5].
Z/7, % (по пассе)
Рис. 360. Ga—Zn
Диаграмма состояния Ga—Zn — эвтектического типа, координаты
эвтектической точки, по данным различных исследований, состав-
ляют: 5,3 % (ат.) Zn, 25 °C [X]; 3,7 % (ат.) Zn, 25,4 °C [Э]; 3,7 %
'ат-) Zn, 25 °C [3, 4]. Согласно расчетным данным [1] состав эвтек-
Тики соответствует 3,87 % (ат.) Zn, температура плавления эвтекти-
ки 24,67 °C, что находится в хорошем согласии с экспериментальны-
682
Ga—Zr
ми данными ГЭ, 3, 4]. В работе [3] отмечалось, что положение
линии ликвидуса в системе Ga—Zn чувствительно к скорости
охлаждения при термическом анализе. При использовании скорости
охлаждения от 0,3 до 1,0 °С/мин линия ликвидуса сдвигается в
сторону более низких температур примерно на 12 °C.
Растворимость Ga в Zn определена на основе рентгенографическо-
го исследования [5]. Согласно работе [5] максимальная раствори-
мость Ga в Zn составляет 2,36 % (ат.) при температуре 260 °C. При
22 °C растворимость Ga в Zn равна 1,95 % (ат.). По данным работы
[Э], растворимость Zn в Ga, полученная путем измерения микрот-
вердости, составляет 0,8 % (ат.) при температуре 20 °C.
Термодинамические свойства жидких сплавов системы Ga—Zn
исследовали в работах [6—8] методом ЭДС во всей области составов
при температурах от 693 [7] до 1033 °C [8].
Литература
1. Dutkiewic J., Moser Z., Zabdyr L. et al. // Bull. Alloy Phase Diagrams. №i
V. 11. N 1. P. 77-82.
2. Valenti V., Fiorani M. // Gazz. Chim. Ital. 1955. V. 85. N 5-6. P. 620-635
3. Шураи П.Е., Данилин B.H., Стрывалин И.Т. и др. // Изв. АН СССР. Металлы
1974. № 5. С. 245.
4. Delcroix S., Detrain A., Epelboin I. // J. Phys. Rad. 1963. V. 24. N 1. P. 17—-2i>
5. Davis D.A. // J. Inst. Metals. 1965. V. 93. N 14. P. 515-516.
6. Genta V., Fiorani M„ Valenti V. // Gazz. Chim. Ital. 1955. V. 85. N 1—2 г
103-110.
7. Svirbley W.J., Read S.M. 11 J. Phys. Chem. 1962. V. 66. N 4. P. 658-662.
8. Рябов В.Г., Стрывалин И.Т. // Изв. АН СССР. Металлы. 1971. № 2. С. 78—81
Л.Е. Шелилш.’ '
Ga—Zr. ГАЛЛИЙ—ЦИРКОНИЙ
Диаграмма состояния Ga—Zr (рис. 361) построена в работе [1] пе
результатам термического, микроструктурного и рентгеновского
анализов. Сплавы, богатые Zr (до 6 % (ат.) Ga), исследовали в
работе [2].
Установлено существование девяти интерметаллических соедине
ний [1]. Температура образования соединений ZrGa, Zr5Ga4, Zr3Ga >
и Zr5Ga3 находится выше 1500 °C и точно не установлена. Соедине
ние Zr5Ga4 существует лишь при высоких температурах, при темпе
ратуре около 1400 °C претерпевает эвтектоидный распад с образова
нием ZrGa и Zr3Ga2. В работе [2] и ранее в работе [Э] наиболс.
богатому Zr соединению приписывали формулу Zr3Ga.
Нонвариантные реакции в системе Ga—Zr даны в табл. 287.
Максимальная растворимость Ga в pZr составляет 8 % (ат.). Ga
несколько снижает температуру 0Zr * aZr превращения.
Ga-Zr
683
Рис. 361. Ga-Zr
В работе [3] определена растворимость Zr в жидком Ga. Кривая
ликвидуса подчиняется зависимости Igx = 1,05 - 4220/7, где х —
концентрация Zr в расплаве, % (ат.); Т — температура, К. При
температурах 400 и 500 °C растворимость Zr в Ga равна 6,3 • 10‘4
и 4,0 • Ю'3 % (ат.) Zr соответственно.
Данные по кристаллической структуре соединений системы Ga—Zr
представлены в табл. 288.
684
Ga—Zr
Таблица 287. Нонвариантные реакции в системе Ga—Zr
Реакция Содержание Zr в фазах, % (ат.) Темпе- ратура, °C Источ- ник
Ж + ZrGa2 *=* ZrGa3 -19; 33,3; 25 1275 [1|
Ж + Zr2Ga3 * ZrGa2 -22; 40; 33,3 1300 IU ;
ZrGa2 + Zr2Ga3 * Zr3Ga3 33,3; 40, 62,5 9 (И
Ж + ZrGa «* Zr2Ga3 -38; 50; 40 1430 [1]
Zr5Ga4 ₽ ZrGa + Zr3Ga2 55,5; 50; 60 -1400 [11
(PZr) + Zr5Ga3 •* Zr2Ga -96; 62,5; 66,7 950 И)
Ж ₽ Zr3Ga3 + (PZr) 79; 62,5; -92 >1100 [21
(PZr) •* Zr2Ga + (aZr) 98,2; 66,7; 99,2 860 [2]
Таблица 288. Кристаллическая структура соединений системы Ga—Zr
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a b c
ZrGa3 ZrAl3 (Л 6, /4/ттт 0,3960 — 1,744 (U
ZrGa2 ZrGa2 оС 12, С ттт 1,289 0,3994 0,4123 HI
Zr3Gas Zr3Ga3 оСП, Стет 0,7111 0,8848 0,9084 [IJ
Zr2Ga3 Zr2Al3 oFM), F2dd 0,5497 0,9444 1,3755 [1]
a ZrGa BMo tllb, Ibjamd 0,3865 — 2,056 [11
Zr5Ga4 Ti5Ga4 НР)Я, P63/mcm 0,8350 — 0,5757 [11
Zr3Ga2 V3Si2 1P10, Р4/mbm 0,7349 — 0,3692 Hi
Zr5Ga3 Mn5Si3 hPlb, P63/mcm 0,8076 0,8020 — 0,5742 0,5678 [II [5]
Zr2Ga CuA12 tl\2, /4/mcm 0,6712 — 0,5443 [11 .....
Соединение ZrGa претерпевает превращение в твердом состоянии
Температура превращения и структура высокотемпературной фазы
нс установлены.
Gd-Ge
685
Литература
i 1 potzschke M„ Schubert K. // Z. Metallkunde. 1962. V. 53. N 7. S. 474—488.
L 2. Easton D.S., Betterton J.O. // Metall. Trans. 1970. V. 1. N 12. P 3295-3299.
к 3 Яценко С.П., Аникин Ю.А. // Физико-химическая механика материалов. 1970.
V 6. № 3. С. 57-62.
I 4. Schubert К., Meissner POtzschke М. u.a. // Naturwissenschaften. 1962. Bd.
Ь. N 3. S. 57.
1 5. Boiler H., Parthe E. // Monatsh. Chem. 1963. Bd. 94. N 1. S. 225—226.
I 6. Raman A., Schubert K. // Z. Metallkunde. 1965. Bd. 56. N 1. S. 40—43.
1 Л.А. Третьяченко
Gd-Ge. ГАДОЛИНИИ—ГЕРМАНИЙ
Диаграмму состояния Gd—Ge исследовали в работах [1,2] мето-
дами микроструктурного, термического и рентгенофазового анализов.
Олавы получали дуговой плавкой из Ge и Gd чистотой 99,99 % (по
массе) и 99,76 % (по массе) соответственно.
На рис. 362 представлена диаграмма состояния по данным работы
[2]. Эта диаграмма согласуется с приведенной в работе [3], где
проведено обобщение экспериментальных данных по фазовым равно-
весиям в системе Gd—Ge.
В системе образуются шесть соединений: Gd5Ge3, Gd5Ge4, GdGe,
Gd2Ge3, Gd3Ge5 и GdGe2 57, из которых только Gd5Ge3 плавится
конгруэнтно при 1790 °C. Йе обнаружен германид Gd||Ge10, о кото-
ром сообщалось в работе [4]. Соединение GdGe2 57 существует в
узком интервале температур 850—890 °C. Соединение Gd2Ge3 имеет
три полиморфные модификации. Фазовое превращение у « Р проис-
ходит при 1210—1070 °C (в зависимости от содержания Ge), а прира-
щение Р « а при 833 °C. Соединение Gd3Ge5 также претерпевает
фазовое превращение при температуре < 600 °C.
Таблица 28 9 Нонвариантные реакции в системе Gd—Ge [2]
Реакция Содержание Ge в фазах, % (ат.) Темпе- ратура, °C
ж - («Gd) + Gd5Ge3 И; -0; 37,5 1113
+ Gd5Ge3 - Gd,Ge4 46,5; 37,5; 44,5 1690
ж + Gd5Ge4 « GdGe -54; 44,4; 50 1570
ж + GdGe e yGd2Ge3 64; 50; 60 1415
“Gd2Ge3 + (Gc) » pGd3Ge5 61; -100; 62,5 808
Ж + PGd2Ge3 - GdGe2 7J -82; 61; 72 890
Ж ° (Ge) + GdGez 57 85; -100; -72 860
5dGe2,57 ° <Ge) + 0Gd2Ge3 72; -100; 61 850
686
Gd—Ge
Рис. 362, Gd—Ge
Таблица 29 0. Кристаллическая структура соединений системы Gd—Ge
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источн»
а b С
GdjGej Mn5Si3 hP\. 6, Р63/ тст 0,855 — 0,641 |2|
Gd5Ge4 SmjGe,! оРЗб, Рпта 0,775 1,476 0,775 !21
GdGe BCr оС8, Стет 0,434 1,078 0,397 1?!
Gd-H
687
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
aGd2Ge3 A1B2 hP3, РЬ/ттт 0,3972 — 0,4203 [2]
pGd3Ge5 aGdSi2 Imma 0,4103 0,4096 1,376 [3]
aGd}Ge5 aThSi2 1112, H\/amd 0,410 — 1,373 [21
GdGe2j57 — ¥Ge35 C222, 2,093 0,410 0,394 [2]
Нонвариантные реакции в системе Gd—Ge даны в табл. 289.
Данные по кристаллической структуре соединений системы
Gd—Ge представлены в табл. 290.
Литература
1. Еременко В.Н., Буянов Ю.И., Баталин В.Г. Физическая химия конденсирован-
ных фаз, сверхтвердых материалов и их границ раздела. Киев: Наукова думка, 1975.
С. 191-201.
2. Еременко В.Н., Баталин В.Г., Буянов Ю.И. // Порошковая металлургия, 1980.
№ 2. С. 40—45.
3. Gokhale А.В., Abbaschian G.J. // Bull. Alloy Phase Diagrams. 1989. V. 10. N 2.
P. 147-152.
4. Tharp A.G., Smith G.S., Johnson Q. // Acta Crystallogr. 1966. V. 20. N 4. P.
583—585.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Gd-4I. ГАДОЛИНИЙ—ВОДОРОД
Взаимодействие водорода с Gd (рис. 363) характерно для РЗМ
(Sm, Eu, Tb, Dy, Ho, Er, Tu, Yb, Lu) и отличается образованием
подрядов GdH2 и GdH3 [1, Э]. Соединение GdH2 имеет кубическую
структуру типа CaF2 (символ Пирсона cF12, пр. гр. Р'тЗт) с а =
* 0,530 нм. Соединение GdH3 кристаллизуется в гексагональной
структуре типа РиН3 (символ Пирсона hP24, пр. гр. Р3с1) с парамет-
рами а « 0,373 нм, с = 0,671 нм [Э]. Область (Gd) + GdH2 при
! ^емпературе 1000 °C расположена в интервале концентраций 36—
% (ат.) Н; при 900 °C - 33,5-58,0 % (ат.) Н; при 800 °C -
Z9~^2,5 % (ат.) Н; при 700 °C - 25-65 % (ат.) Н [Ш].
Давление диссоциации GdH2 в интервале температур 600—800 °C
^фажается уравнением Igp = 11,84 — 10250/Т, где р — давление, Па;
~~ температура, К. Близкие значения р получены в работах [2, 3].
688
Gd—Hg
H, % (по массе)
t°C
800
700
ООО
500
ООО
JOO
200
too
0 10 20 JO 40 50 60 70 00
Gd H, % (am.)
Рис. 363. Gd—H
Литература
1. Фромм E., Гебхардт E. Газы и углерод в металлах. Пер. с нем. / Под ред. Б.В
Линчевского. М.: Металлургия, 1980. 712 с.
2. McQuillan A.D. // J. Less-Common Met. 1976. V. 49. N 1/2. P. 431-438.
3. Daou J.N., Chineb M„ Lucasson P. // J. Less-Common Met. 1981. V. 79. N 1. Г.
65-74.
С.П. Алисова
Gd—Hg. ГАДОЛИНИЙ-РТУТЬ
Диаграмма состояния Gd—Hg (рис. 364) построена в работе 111
В системе обнаружены четыре соединения: GdHg4, GdHg3, GdHg2 и
GdHg. Соединения GdHg4 и GdHg3 образуются по перитектическим
реакциям при температурах 145 и 300 °C соответственно. Соединс
ния GdHg2 и GdHg образуются при температурах 515 и 615 °C со-
ответственно по реакциям: Hg (Газ) + GdHg ** GdHg2 и Hg (Газ) +
+ (aGd) GdHg.
В работе [2] уточнена стехиометрия соединения GdHg4 [ 1Г
согласно работе [2] этому соединению соответствует формула
Gdt ,Hg45.
Кристаллическая структура соединений приведена в табл. 291.
Gd-Hg
689
Hg Gd, °А> (от.) Gd
Рис. 364. Gd-Hg
Таблица 291. Кристаллическая структура соединений системы Gd—Hg
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
GdllH$45 Snij (Cd45 cF44H, F4 3m 2,1551 ’— [2]
GdHg3 CdMg3 hP8, Рд^/ттс 0,6591 0,4889 13)
GdHg2 CeCd2 hP3, P3ml 0,4853 0,3477 [4]
GdHg CsCl cP2, РтЗт 0,3672 — [Ш]
Литература
1- Kirchmayr H.R., Lugscheider W. // Z. Metallkunde. 1966. Bd. 57. N 10.
S. 725-731.
2- Merlo F., Fornasini M.Z. 11 J. Less-Common Met. 1979 V. 64. N 2. P. 221—231.
3. Palenzona A. // J. Less-Common Met. 1966. V. 10. N 4. P. 290—292.
4. landelli A., Palenzona A. // J. Less-Common Met. 1968. V. 15. N 3. P. 273—284.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
690
Gd—Ho
Gd—Но. ГАДОЛИНИЙ—ГОЛЬМИЙ
На рис. 365 приведена диаграмма состояния Gd—Ho по данным
работы [М]. Представленная диаграмма плавкости исключает поли-
морфизм Но и позволяет предположить возможность перитектичес-
кой реакции [1].
Gd Но, % (ат.) Но
Рис. 365. Gd—Ho
Литература
1. Spedding F.H., Sanden В., Beaudry BJ. // J. Less-Common Met. 1973. V. 31 '•
P. 1-13.
Е.И. Гладышевский, О.И. Бодак, В.К. Пенара <li
Gd—In
691
Gd-In- ГАДОЛИНИЙ—ИНДИЙ
ji Диаграмму состояния Gd—In исследовали в работах [1—3]. На
рис. 366 представлена диаграмма состояния согласно работе [3],
которая согласуется с обобщенной диаграммой, приведенной в
1бзоре [4].
I Исследование проводили методами дифференциального термичес-
ки), микроструктурного и рентгеновского анализов. Сплавы готови-
те. 366. Gd—in
692
Gd—Jn
ли индукционной плавкой из Gd и In чистотой 99,9 °/0 (по массе) и
99,99 % (по массе) соответственно.
В системе обнаружено пять соединений: Gd2In, Gd5In3, Gdhj.
Gd3In5 и Gdln3. Соединения Gd2In, Gdln, Gd3In5 и Gdln3 плавятся
конгруэнтно при 1170, 1260, 1160 и 1170 °C соответственно.
Таблица 29 2. Нонвариантные реакции в системе Gd—In [3]
Реакция Содержание In в фазах, % (ат.) Темпе- ратура, °C
Ж - (pGd) + Gd2In 19,5; 15; -32 1025
(PGd) (aGd) + Gd2In ~13; 6; -32 920
Ж ** Gd2In + Gdjlrij 36,5; ~34; -36,5 1125
Ж + Gdln Gd5In3 -37; ~45; 37,5 1150
Ж - Gdln + Gd3In5 56,5; -49; -61,5 1135
Ж * Gd3In5 + Gdln3 66; -63; 75 1120
Ж - Gdln3 + (In) >99,5; 75; -100 154
Нонвариантные реакции в системе Gd—In даны в табл. 292.
Данные по кристаллической структуре соединений представлены
в табл. 293.
Таблица 293. Кристаллическая структура соединений системы Gd—In
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
Gd2In Ni2In hP6, Р63/ттс 0,5414 — 0,6742 [3)
Gd5In3 W5Si3 tI32, IMmcm 1,2345 0,6065 [3]
Gdln CsCl сР2, РтЗт 0,3795 — — [3]
Gd3In5 Pu3Pd5 оС32, Стет 0,993 0,806 1,0345 [51
Gdln3 AuCu3 сР4, РтЗт 0,4609 — — [31
Литература
1. Zhuang Y„ Yuan S., Zheng J. // Acta Phys. Sin. (Chin. S. Pys.). 1982. V. 31. N !
P. 121-125.
2. Yatsenko S.P., Semyannikov A.A., Shakarov H.O. et al. 11 J. Less-Common M1'
1983. V. 90. N 1. P. 95-108.
Gd—Ir
693
I 3. Delfino S., Saccone A., Ferro R. // Z. Metallkunde. 1983. Bd. 74. N 10.
к 674—679.
j 4. Palenzona A., Cirafici S. // Bull. Alloy Phase Diagrams. 1989. V. 10. N 3.
j>. 234—239.
: 5. Delfino S., Saccone A., Mazzone D., Ferro R. 11 J. Less-Common Met. 1981. V. 81.
H l. Р. 45-53.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарскии
G&-JT. ГАДОЛИНИЙ-ИРИДИЙ
Диаграмма состояния Gd—Ir не построена. В работах [1—6] име-
ются сведения о существовании следующих соединений: Gd3Ir,
Gd<Ir2> Gd5Ir3, Gd3Ir2 и Gdlr2.
Кристаллическая структура соединений представлена в табл. 294.
Таблица 29 4. Кристаллическая структура соединений системы Gd—Ir [V-C]
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b с
Gd3Ir Fe3C ОР16, Pnma 0,7247 0,9448 0,6392
Gd5Ir2* Mn2C2 тС28, С2/с 1,5956 9,6493 0,7249
Gd5Ir3 Pu5Rh3 tP32, РМ псс 1,0977 — 0,6348
Gd3Ir2 Y3Rh2 ti 140, /4/ mcm 1,1311 — 2,528
Gdlr2 MgCu2 cF24, 0,7550 — —
Fd3m
* P - 96,9Г.
Литература
1- Le Roy J., Moreau J.M., Paccard D. et al. // Acta Crystallogr. B. 1979. V. 35. N 6.
P 1437-1439.
2. Le ROy Moreau J.1VL, Paccard D. et al. // Acta Crystallogr. A. 1978. V. 34. N 4.
3. Paccard D., Le Roy J., Moreau J.M. // Acta Crystallogr. B. 1979. V. 35. N 6.
“ 1315-1318.
4. Савицкий E.M., Полякова В.П., Горина H.E. // Редкоземельные металлы и
сплавы: Сб. статей. М.: Наука, 1971. С. 63-67.
5. Le Roy J., Moreau J.M., Paccard D. // J Less-Common Met. 1980. V. 76. N 2.
H 131-135.
6. Le Roy J., Paccard D., Moreau J.M. // J. Less-Common Met. 1980. V. 72. N I.
p П-15.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
694
Gd—La
Gd—La. ГАДОЛИНИЙ-ЛАНТАН
Диаграмму состояния Gd—La исследовали в работе [1]. Сведения
об этой системе суммированы в работе [Э]. В системе существует
непрерывный ряд твердых растворов между высокотемпературными
модификациями компонентов.
Рис. 367. Gd—La
Между низкотемпературными модификациями непрерывный ряд
твердых растворов, по данным работы [1, Э], не существует. Соглас-
но работе [Э] при температуре 1025 °C протекает перитектоидная
реакция (aGd) + (pLa) « (aLa), а при температуре -840 °C образу-
ется фаза б по реакции (aGd) + (aLa) » б. Фаза б имеет гексаго-
нальную структуру типа aSm (символ Пирсона АРЗ, пр. гр.
с параметрами а = 0,36623 нм, с = 2,6471 нм для сплава состава
^30^^70 •
На рис. 367 представлена компилятивная диаграмма состояния
согласно работе [2], отличающаяся от приведенной в работе [Э]. По
данным работы [2], непрерывный ряд твердых растворов существует
и между а модификациями Gd и La, а фаза б образуется в результа-
те упорядочения этого твердого раствора при температуре ниже
840 °C.
Gd—Lu
695
Литература
I i. Spedding F.H., Valletta R.M., Daane A.N. // Trans. ASM. 1962. V. 55. N 1. P.
1065—1068.
, 2. Gschneidner, Jr., K.A., Calderwood F.W. // Handbook on the Physics and
Chemistry of Rare Earth. Amsterdam. New-York. Oxford. Tokio: North-Holland. Physics.
Publishing, 1986. V. 8. Chapt. 54. P. 1-161.
Е.И. Гладышевский, О-И. Бодак, В.К. Печарский
Gd-L\i. ГАДОЛИНИЙ-ЛЮТЕЦИЙ
Диаграмма состояния Gd—Lu экспериментально не построена [1,
М]. Gd и Lu имеют в металлическом состоянии идентичное элек-
тронное строение с тремя валентными электронами Sd^bs2, одинако-
вую кристаллическую ГПУ структуру типа Mg с близкими парамет-
рами решетки [1] и атомными радиусами, отличающимися на 3,8 %.
Кристаллические характеристики элементов системы Gd—Lu пред-
ставлены в табл. 295.
Таблица 29 5. Кристаллическая структура и полиморфные
превращения элементов системы Gd—Lu
Атом- ный но- мер, элемент Моди- фика- ция Прототип, структура Параметры ре- шетки, нм Темпе- ратура превра- щения, °C Реакция Источ- ник
а С
64Gd aGd PGd Mg, ГПУ W, ОЦК 0,36336 0,57810 1313 1235 Ж - pGd aGd " - PGd [1] [1]
71Lu — Mg, ГПУ 0,35052 0,55494 1663 1790 Ж - Lu ЖГПу ” ** жоцк [1] [2]
Исследование электросопротивления четырех сплавов Gd—Lu и
Определение параметров решетки показало, что aGd и Lu образуют
непрерывный ряд твердых растворов с ГПУ структурой [3]. Парамет-
ры решетки ГПУ твердых растворов изменяются почти линейно от
'jd к Lu, показывая лишь небольшое отклонение от правила Вегарда,
положительное для а и отрицательное для с [1, 3].
Lu не имеет полиморфного превращения ГПУ ОЦК в твердом
состоянии вблизи температуры плавления [1, М], но испытывает
аналогичное изменение ближнего порядка в жидком состоянии при
температуре 1790 °C [2]. На основании этих данных и близости
Растворов к идеальным построена диаграмма состояния Gd—Lu
ч?нс. 368). Линии ликвидус—солидус и сольвус—ликвус близки к
рямым, но между ними существуют небольшие двухфазные области.
696
Gd—Lu
Lu^/o (no массе)
Рис. 368. Gd—Lu
Дистектическая точка отвечает 1450 °C и 37,5 % (ат.) Lu. Штрихо-
вая линия разделяет области ЖГПу и Жоцк ближнего порядка в
расплавах, содержащих более 37,5 % (ат.) Lu.
Литература
1. Gschneidner, Jr., К.A., Calderwood F.W. // Handbook on the Physics and Chemis-
try of Rare Earths. Amsterdam., N.-Y., Oxford, Tokio: North-Holland Publ. 1986. V
Chapt. 54. P. 1—161.
2. Григорович В.К., Григорович К.В. // Строение и свойства металлически' и
шлаковых расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск:
ЧПИ, 1990. Т. 2. Ч. 2. С. 250-252.
3. Smidt, Jr., F.A., Daane А.Н. И J. Phys. Chem. Solids. 1963. V. 24 3
P. 361-370.
B.K. Григорович
Gd-Mg 697
Gd-Mg. ГАДОЛИНИЙ-МАГНИЙ
Диаграмма состояния Gd—Mg впервые была построена в работе
(П-В более поздних работах [2—4] в основном был подтвержден ее
общий вид и уточнены отдельные элементы.
На рис. 369 приведена диаграмма состояния по данным работы
[4], где был проведен критический анализ всех предыдущих исследо-
ваний.
Рис. 369. Gd—Mg
в системе установлено существование четырех соединений:
Mg5Gd, Mg3Gd, Mg2Gd и MgGd. Все соединения образуются по
перитектическим реакциям при температурах 658, 720, 756 и 868 °C
Соответственно. Со стороны Mg кристаллизуется эвтектика (Mg) +
+ Mg5Gd [548 °C, 8,8 % (ат.) Gd]. При температуре 700 °C протека-
ет эвтектоидная реакция (pGd) * (aGd) + MgGd.
Растворимость Mg в aGd при температуре эвтектоидного превра-
щения равна 14,1 % (ат.), а при температуре 350 °C — 4
Растворимость Gd в твердом Mg составляет [2]:
Температура, °C............... 548 540 500 400
Растворимость Gd, % (ат.)..... 4,53 4,41 3,54 1,97
Кристаллическая структура соединений представлена в табл. 296.
% (ат.) [5].
300 200
0,98 0,61
698
Gd-Мп
Таблица 296. Кристаллическая структура соединений системы Gd—Mg
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
MgGd CsCl сР2, 0,3824 [6]
РтЗт 0,379 171
Mg2Gd MgCu2 cF24, 0,855 [7]
Fd3m 0,859 [8]
MgjGd BiF3 cF\6, 0,7326 [9]
РтЗт 0,731 [7|
0,735 [8]
Mg5Gd — 0,2234 [Ю|
F43nt
Литература
1. Савицкий Е.И., Терехова В.Ф., Буров И.В. и др. // Журнал неорганически:
химии. 1961. Т. 6. N 7. С. 1734-1737.
2. Рохлин Л.Л., Никитина Н.И. // Изв. Вузов. Цветная металлургия. 1977- X ’
С. 167-168.
3. Рохлин Л.Л., Никитина Н.И. // Легирование и обработка легких сплавов. < ч
статей. М.: Наука. 1981. С. 111—114.
4. Manfrinetti Р., Gschneidner К.А. // J. Less-Common Met. 1986. V. 123 N I - ’
P. 267-275.
5. Joseph R.R., Gschneidner K.A. 11 Trans. AIME. 1965. V. 233. N 12. P. 206. -
2069.
6. Miller A.E., Daane A.H. // Trans. AIME. 1964. V. 230. N 4. P. 568-572.
7. Крипякевич П.И., Терехова В.Ф., Заречнюк O.C. и др. // Кристаллографе !
1963. Т. 8. N 2. С. 268.
8. Крипякевич П.И., Евдокименко В.И. // Вопросы применения редкоземельнь х
металлов: Сб. статей. М.: Наука. 1964. С. 146—148.
9. Buschow K.H.J. // J. Less-Common Met. 1976. V. 44. N 1. P. 301-306.
10. Tanasini M.L., Manfrinetti P., Gschneidner K.A. // Acta Crystallogr. С. IVML.
V. 42. N 2. P. 138-142.
JI. JI. POX.'II,II
Gd—Mn. ГАДОЛИНИЙ—МАРГАНЕЦ
На рис. 370 приведена диаграмма состояния Gd—Мп, построен!:;: i
по данным дифференциального термического, рентгеновского и
микроструктурного анализов, а также измерения магнитной воспри-
имчивости [ILIJ. Сплавы получали дистилляцией Hg из амальгам
Gd—Mn—Hg.
В системе имеет место эвтектическое равновесие при температур'
830 °C и содержании 35,3 % (ат.) Мп. Обнаружено существовать
трех соединений: GdMn2, Gd6Mn23 и GdMn12, которые образуются
Gd—Mn
699
(jd (am.) Mn
Рис. 370. Gd-Mn
00 перитектическим реакциям при 950, 1050 и 1080 °C соответствен-
В работе [Ш] предполагается, что формула Gd6Mn23 отвечает
Истинной стехиометрии обнаруженного ранее соединения, которому
Приписывалась формула GdMn5 [Э].
Температура превращений SMn ** уМп и уМп >= 0Мп снижаются
До 1122 и 1085 °C соответственно при увеличении содержания Gd.
Приведенные данные подтверждены в работе [1].
Кристаллическая структура соединений приведена в табл. 297.
700
Gd-Мо
Таблица 29 7. Кристаллическая структура соединений системы Gd—Мп
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a с
GdMn2 MgCu2 cF24, Fd3m 0,7724 0,7801 — [Э] ЦП]
Gd6Mn23 Th6M23 cF\A6, Fm3m 1,2532 — [Ш]
GdMnl2 YMn|2 Н26, 14/mmm 0,864 0,479 [III]
Литература
1. Kirchmayr H.R., Lugscheider W. // Z. Metallkunde. 1967- Bd. 58. N 5 S.
185-188.
Н.И. Никитина
Gd—Mo. ГАДОЛИНИЙ—МОЛИБДЕН
Рис. 371. Gd—Mo
Gd—N
701
Диаграмма состояния Gd—Мо построена на основании данных
рентгеновского, микроструктурного и термического анализов сплавов,
приготовленных из Gd и Мо чистотой 99,95 % (по массе) [^..Диаг-
рамма согласуется с данными более ранних работ об отсутствии в
системе промежуточных фаз [2] и низкой [<0,1 % (по массе)]
растворимости Gd в Мо [Э, Ш].
На рис. 371 приведена диаграмма состояния Gd—Мо, построенная
в работе [3] на основе обобщения и термодинамической оптимизации
данных, которая хорошо согласуется с результатами работы [1]. В
системе обнаружена несмешиваемость в жидком состоянии в интерва-
ле концентраций 10—64 % (ат.) Gd, температура монотектической
реакции соответствует 2470± 15 °C. Введение Мо понижает темпера-
туру плавления Gd до 1305± 10 °C (эвтектическое превращение) и
полиморфного превращения Gd до 1225±10 °C (эвтектоидное пре-
вращение).
Растворимость Gd в Мо при температурах 2570 и 2510 °C равна
0,09 и 1,53 % (по массе) (солидус). В интервале температур 1600—
2400 °C растворимость Gd в Мо составляет:
Температура, °C........................ 2400 2200 2000 1800 1600
Растворимость Gd, % (по массе)......... 1,1 0,4 0,3 0,2 0,15
Литература
1. Ghuang Y., Li С., Chuang Н., Као L. // Acta Metall. Sin. (China). 1966. V. 9. P.
110-112.
2. Савицкий E.M., Барой B.B., Tao T.T. 11 Изв. АН СССР. Отделение технических
наук. Металлургия и топливо. 1962. № 1. С. 156—159.
3. Brewer L., Lamoreaux R.H. /1 Atomic Energy Rewiew. Special Issue N 7 Molyb-
denum: Physico — Chemical Properties of its Compounds and Alloys. Vienna. International
Atomic Energy Agency, 1980. P. 251-253.
КБ. Поварова
ГАДОЛИНИЙ—АЗОТ
В системе Gd—N существует соединение GdN с температурой
давления > 2500 °C с кубической структурой типа NaCl (символ
п л^Она с^’ ПР- ГР- -^шЗгп), с параметром решетки а, равным
Р>499 нм [X]; 0,4999 нм [Э] и 0,5086 нм [Ш].
Н.И. Никитина
702
Gd—Nb, Gd-Nd
Gd—Nb. ГАДОЛИНИЙ—НИОБИЙ
По данным работы [Ш] в системе наблюдается несмешиваемость
компонентов в жидком состоянии. Соединения в системе нс обпазт-
ются [Э]. ' -
Е.Н. Шеф1>1сль
Gd—Nd. ГАДОЛИНИЙ—НЕОДИМ
На рис. 372 представлена обобщенная диаграмма состояния
Gd—Nd по данным работы [М], учитывающая результаты более
ранних исследований [Ш].
Диаграмма характеризуется неограниченной взаимной раствори-
мостью как высокотемпературных, так и низкотемпературных моди-
фикаций компонентов. При температурах ниже 700 °C в твердом
состоянии образуется фаза 6, имеющая область гомогенности в
пределах -45—55 % (ат.) Nd и кристаллическую структуру типа aSm
(символ Пирсона hP3, пр. гр. R3m) с параметрами а = 0,3658 нм,
с = 2,6045 нм [1].
Gd-Ni
703
jlKieparypa
Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
Н^^едкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
ГАДОЛИНИЙ-НИКЕЛЬ
Диаграмму состояния Gd—Ni исследовали в работах [1—3] мето-
дами дифференциального термического и рентгеновского анализа с
использованием для приготовления сплавов Gd и Ni чистотой 99,9 и
#1, (по кассе)
**•”3. Gd—Ni
704
Gd—Ni
99,99 % (по массе) соответственно. На рис. 373 приведена диаграмм
состояния по данным работы [3].
В системе образуются восемь интерметаллических соединений, Из
которых GdNi5 и GdNi плавятся конгруэнтно при 1480 и 1280 °C
соответственно. Согласно данным структурных исследовании [4]
соединения Gd2Ni7 и GdNi3 существуют в двух полиморфны* моди.
фикациях, не отраженных на диаграмме состояния.
Таблица 29 8. Нонвариантные реакции в системе Gd—Ni [3]
Реакция Содержание Ni в фазах, % (ат.) ——— Темпе- ра! ура, С
Ж + (aGd) * Gd3Ni -31; -0; 25 "35
Ж и Gd3Ni + GdjNij 32; 25; 40 635
Ж + GdNi » Gd3Ni2 -33; 50; 40 690
Ж - GdNi + GdNi2 56, 50; 66,7 880
Ж + GdNi3 « GdNi2 -58; 75; 66,7 1010
Ж + Gd2Ni7 * GdNi3 -60; 77,8; 75 1110
Ж + GdNij * Gd2Ni7 -65; 83,3; 77,8 1 370
Ж + GdNis « Gd2Nil7 -94; 83,3; 89,5 1 285
Ж - Gd2Ni17 + (Ni) 95; 89,5; -100 1275
Таблица 29 9. Кристаллическая структура соединений системы Gd—Ni [4]
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b с
Gd3Ni Fe3C ОР16, Pnma 0,695 0,968 0,630
Gd3Ni2* — — 0,728 — 0.861
GdNi BCr оС8, Стет 0,3764 1,0329 0,4242
GdNi2 Cu2Mg cF24, Fd3m 0,72078 — —
pGdNi3 PuNi3 F3m 0,4987 — 2.448
aGdNi3 CeNi3 hP24, Р63/ ттс 0,4982 — 1,631
0Gd2Ni7 Gd2Co7 R3m 0,4954 — 3,627
Gd-O
705
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b с
Ce2Ni7 /гРЗб, Р63/ ттс 0,4937 — 2,418
; GdNi4** — — 0,535 — 0,583
GdNi5 CaCu5 hP6, Рб/ттт 0,4904 — 0,3967
Gd2Ni17 Th2Ni17 hP38, Р63/ ттс 0,843 — 0,804
•Тетрагональная сингония.
••Гексагональная сингония.
Нонвариантные равновесия в системе Gd — Ni приведены в
табл. 298.
Данные по кристаллической структуре соединений системы Gd —
Ni представлены в табл. 299.
Литература
1. Virkar A.V., Raman А. // J. Less-Common Met. 1969. V. 18. N 1. P. 59—66.
2. Buschow K.HJ., Goot A.S. 11 J. Less-Common Met. 1970. V. 22. N 3. P. 419-^28.
3. Pan Y., Zheng J., Li M., Yang H. // Acta Phys. Sin. (Chin. J. Phys ). 1986. V. 35.
N 5. P. 677-680.
4. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарскии
Gd-O. ГАДОЛИНИЙ—КИСЛОРОД
В системе Gd—О известны два соединения: Gd2O3 с температурой
ЯЛавления 2350±50 °C и GdO [Э]. Соединение Gd2O3 имеет три
ПОДификации [Э, Ш]. Согласно работе [1], превращение С-модифи-
КйЦии в В-модификацию происходит в интервале температур 1000—
°C, а по данным работы [2] — при 1225 °C. Данные по кристал-
лИческой структуре Gd2O3 представлены в табл. 300.
® 6 л и ц а 3 0 0. Кристаллическая структура соединений системы Gd—О
Соединение Прото- Символ Пирсона, пр. гр. Параметры решетки, нм Источ-
а b С
А Gd2o3‘ ® Gd2O3** Sm2O3 тСЗО, СИт 0,376 1,4061 1,397 0,3566 0,356 0,589 0,8760 0,925 [Э] [Э] [Ш]
Зак. 2144
706
Gd-Os, Gd—P
Соединение Прото- тип Символ Пирсона, пр. гр. Параметры решетки, нм Исто'' ник
а Ь с
С Gd2O3*** Мп2О3 с780, lai 1,0813 — [Ш] —
’Гексагональная сингония. * * р = 100,1“ [Э], р - 99,02" [Ш]. * ** t < 1250 °C.
Литература
1. Портной К.И., Фадеева В.И., Тимофеева Н.И. // Атомная энергия. 1963. N U
С. 559—562.
2. Warshaw J., Roy R. // J. Phys. Chem. 1964. V. 65. P. 2048-2051.
Н И. Никитина
Gd-Os. ГАДОЛИНИЙ-ОСМИЙ
Диаграмма состояния Gd—Os не построена. Имеются сведения о
существовании двух интерметаллических соединений: GdOs2 и
Gd3Os, образующихся в этой системе [1, V-CJ.
Данные по кристаллической структуре этих соединений приведены
в табл. 301.
Таблица 301. Кристаллическая структура соединений системы Gd—Os
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм 7 Источник
а Ь С
GdOs2 MgZn2 ЙР12, РЬЛ/ттс 0,5319 — 0,8838 [1, V-CI
Gd30s Fe3C ОР16, Рпта 0,7415 0,9217 0,6333 [1, V-C]
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедини
ний редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарс ^
Gd—P. ГАДОЛИНИЙ-ФОСФОР
В системе Gd—P существует соединение GdP с ГЦК решеткой
типа NaCl (символ Пирсона с/8, пр. гр. Fm3m), с параметром а =
= 0,5723 нм [Ш].
Н.И. Никити"‘.'
Gd—Pb
707
Gd-Pb. ГАДОЛИНИЙ-СВИНЕЦ
; Диаграмма состояния Gd—Pb построена в работе [1] и представ-
лена на рис. Образцы выплавляли в танталовых тиглях и иссле-
довали в литом состоянии методами микроструктурного, рентгенов-
Pb,a/o(am.)
Pb
Gd
Рис- 374. Gd—Pb
В системе существует шесть промежуточных фаз, из которых
Gd5Pb3 плавится конгруэнтно при 1670 “С. Остальные соединения
Образуются по перитектическим реакциям.
23*
708
Gd—Pd
Таблица 30 2. Нонвариантные реакции в системе Gd—Pb [1]
Реакция Содержание Pb в фазах, % (ат.) Темпе ратура, "С
(₽Gd) ₽ (aGd) + Ж -1; <1; -5 1212
Ж ₽ (aGd) + Gd5Pb3 14,5; -0; 37,5 1120
Ж + Gd5Pb3 ₽ Gd5Pb4 -45; -40; 44,4 1460
Ж + Gd5Pb4 ₽ Gd„Pbl0 -53; 44,4; 47,6 1225
Ж + GdnPbl0 н Gd6Pb7 -57; 47,6; 53,8 1160
Ж + Gd6Pb7 ₽ GdPb2 -68; 53,8; 66,7 1010
Ж + GdPb2 * GdPb3 -77; 66,7; 75 969
Ж ₽ (Pb) + GdPb3 -100; -100; 75 -328
Таблица 30 3. Кристаллическая структура соединений системы Gd—Pb [ 1 j
Соедине- ние Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а b С
GdPb3 AuCu3 сР4, РтЗт 0,48261 — —
Gd5Pb4 Sm5Ge4 оРЗб, Рпта 0,8176 1,564 0,8293
Gd5Pb3 Mn5Si3 hP\6, Р63/тст 0,9078 — 0,6644
Нонвариантные равновесия в системе Gd—РЬ представлены в
табл. 302.
Температура 1410 °C отвечает полиморфному превращению в
Gd5Pb4.
Данные по кристаллической структуре соединений системы
Gd—РЬ представлены в табл. 303.
Литература
1. Demel J.T., Gschneidner К.А. // J. Nucl. Mater. 1969. V. 29. N 1. Р. 111-120
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Gd—Pd. ГАДОЛИНИЙ-ПАЛЛАДИЙ
Диаграмма состояния Gd—Pd, представленная на рис. 375, по-
строена в работе [1] методами дифференциального термического и
микроструктурного анализа.
Сплавы выплавляли в дуговой печи в атмосфере Аг, использован
Pd чистотой 99,9 % (по массе) и Gd (переплавленный) с содержани-
ем остальных РЗМ -0,1 % (по массе).
Gd—Pd
709
Pd, % (па массе)
Рис. 375. Gd—Pd
В системе существуют семь интерметаллических соединений, из
которых GdPd, Gd4Pd5 и GdPd3 плавятся конгруэнтно при 1380,
-1355 и -1630 °C соответственно. Остальные соединения образуются
по перитектическим реакциям.
Нонвариантные реакции в системе Gd—Pd представлены в
табл. 304.
Соединения GdPd и GdPd3 имеют области гомогенности протя-
*енностью 1—1,5 % (ат.) и -6 % (ат.) (1128 °C) соответственно.
710
Gd—Pd
Соединение GdPd претерпевает полиморфное превращение в интер-
вале температур 1038—1005 °C, Gd4Pd5 — при 1305 °C. Соединение
Gd2Pd3 распадается эвтектоидно на Gd4Pd5 и GdPd? при ИЗО °C.
Растворимость Gd в Pd при 1128 °C составляет 12 % (ат.).
Данные по кристаллической структуре соединений системы
Gd—Pd представлены в табл. 305.
Таблица 30 4. Нонвариантные реакции в системе Gd—Pd [1]
Реакция Содержание Pd в фазах, % (ат.) Темпе ратура. °C
Ж + (PGd) - (aGd) -3; -1; -2 1290
Ж ₽ (aGd) + Gd5Pd2 -24; -0; 28,6 785
Ж + Gd3Pd2 « Gd5Pd2 -27; 40; 28,6 812
Ж + aGdPd * Gd3Pd2 -33; 50; 40 882
Ж ₽ pGdPd + PGd4Pd5 -53; -50; 56 1320
Ж + aGd4Pd5 ₽ Gd2Pd3 -63; 56; 60 1160
Ж ₽ Gd2Pd3 + GdPd2 -64; 60; 66,7 1152
Ж + GdPd3 - GdPd2 -65; 75; 66,7 1227
Ж ₽ GdPd3 + (Pd) -86; -77; 88 1128
Таблица 305. Кристаллическая структура соединений системы Gd—Pd 11 ]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а Ь с
Gd3Pd2 U3Si2 (РЮ, PM mbm 0,784 — 0,389
aGdPd CrB оС8, Стет 0,3736 1,055 0,4548
Gd3Pd4 Pu3Pd4 ER14, АЗ 1,3265 — 0,5738
GdPd2 MgCu2 сР24, Fd3m 0,7577 — —
GdPd3 AuCu3 сР4, РтЗт 0,40661 — —
Литература
1 Loebich О., Raub Е. // J. Less-Common Met. 1973. V. 30. N 1. Р. 47—62.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Gd—Pm
711
qd-Pm- ГАДОЛИНИЙ-ПРОМЕТИЙ
ч ;s Диаграмма состояния Gd—Pm экспериментально не построена [1,
до]. Однако Gd и Pm имеют близкие атомные номера и идентичное
электронное строение с тремя коллективизированными валентными
электронами 5d^bs2, одинаковые кристаллические ОЦК структуры
Р/Т7
Gd, °/> (am.) Gd
₽ис- 376. Gd—Pm
712
Gd—Po
Данные по кристаллической структуре Gd и Pm представлены в
табл. 306.
В связи с этим можно предположить, что Gd и Pm образуют
между собой непрерывные ряды твердых растворов аир. Вследствие
близости этих растворов к идеальным линии ликвидуса и солидуса
практически сливаются в прямую, соединяющую температуры плаВ-
ления Gd и Pm (рис. 376), с очень узкой двухфазной областью
между ними. В другую прямую сливаются линии полиморфного
превращения а « р. При температурах ниже -750 °C образуется
промежуточная упорядоченная фаза 6 со структурой типа aSm (по
аналогии с другими системами между легкими и тяжелыми лантани-
дами). Максимум области гомогенности этой фазы по аналогии с
системой Gd—Nd [1] должен лежать вблизи 50 % (ат.). Область
существования упорядоченной фазы типа aSm указана условно
штриховыми линиями.
Таблица 30 6. Кристаллическая структура и полиморфные
превращения элементов системы Gd—Pm [I ]
Атомный номер, элемент Моди- фика- ция Прототип, структура Параметры решет- ки, нм Темпера- тура пре- враще- ния, °C Реакция
а с
61Рш аРт La, ДГПУ 0,365 1,165 890 аРт ₽ ₽Рт
рРт W, ОЦК 0,410 — 1042 Ж - рРт
64Gd aGd Mg, ГПУ 0,36336 0,57810 1235 aGd ₽ pG..l
₽Gd W, ОЦК 0,405 — 1313 Ж - 0Gd
Литература
1. Gschneidner, Jr., К.A., Calderwood F.A. // Handbook on the Physics and
Chemistry of Rare Earths: Amsterdam. New-York. Oxford. Tokyo: North-Holland Phvstcs.
Publishing. Co., 1986. V. 8. Chap. 54. P. 1-161.
B.K. Григоро'глч
Gd—Po. ГАДОЛИНИЙ-ПОЛОНИЙ
Диаграмма состояния Gd—Po не построена. Сообщается об изуче-
нии взаимодействия паров Ро с массивным образцом Gd. Продукт
реакции, в котором соотношение Po : Gd =3:2, плавится при
1635+50 °C. С увеличением времени реакции отношение Gd : 1’°
уменьшалось. Это указывает на то, что продукты реакции не являют-
ся стабильными двойными фазами [Ш].
И.И. Никита’--1
Gd-Pr
713
Gd-_pr. ГАДОЛИНИЙ-ПРАЗЕОДИМ
ь ’ Диаграмма состояния Gd—Рг экспериментально не построена [1,
щ Однако Gd и Рг имеют довольно близкие атомные номера,
Дентинное электронное строение с тремя коллективизированными
рентными электронами 5dl6s2, близкие плотные гексагональные а
Модификации ДГПУ типа (аРг) и ГПУ типа (aGd) и одинаковые
$ЦК структуры высокотемпературных фаз р с близкими параметра-
₽Ис- 377. Gd-4>r
714
Gd—Pr
Данные по кристаллической структуре Gd и Рг приведены в
табл. 307.
На основании этого можно предположить, что Gd и Рг при высо-
ких температурах образуют непрерывные ряды р твердых растворов
а при более низких температурах — непрерывные ряды а твердых
растворов. При температурах ниже -750 °C образуется промежуточ-
ная фаза со структурой типа aSm, как и в других системах между
легкими и тяжелыми лантанидами. Вследствие близости строения й
атомных радиусов растворы Рг и Gd близки к идеальным, поэтому
на диаграмме состояния системы Gd—Рг (рис. 377) линии ликвидуса
и солидуса, так же как и линии сольвуса, почти сливаются в прямые,
соединяющие температуры плавления и превращения Рг и Gd с
узкими двухфазными областями между ними.
Таблица 307. Кристаллическая структура и полиморфные превращение
элементов системы Gd—Рг [1]
Атомный номер, элемент Моди- фика- ция Прототип, структура Параметры решет- ки, нм Темпера- тура пре- вращения, °C Реакция
а С
59, Рг «Рг 1л, ДГПУ 0,36721 1,18326 795 aPr ₽ рг;
рРг W, ОЦК 0,413 — 931 Ж » РРг
64, Gd aGd Mg, ГПУ 0,36336 0,57810 1235 aGd •* PGJ
PGd W, ОЦК 0,405 — 1313 Ж - pGu
Рентгеноструктурные исследования сплавов системы Gd—Рг [2, 3|
показали, что отожженные сплавы с содержанием до 50 % (ат.) Gd
имеют ДГПУ структуру, сплавы с содержанием 80—100 % (ат.) Gd
— ГПУ структуру, а сплавы с 58,5—70 % (ат.) Gd — структуру тина
aSm. Сплавы с содержанием 55 и 75 % (ат.) Gd были двухфазными.
На основании этих данных на диаграмме состояния изображена
область существования фазы 6 со структурой типа aSm.
Литература
1. Gschneidner, Jr., К.A., Calderwood F.W. // Handbook on the Physics
Chemistry of Rare Earths: Amsterdam. New-York. Oxford. Tokyo: North-Holland Pliysi'.s
Publishing. Co. 1986. V. 8. Chap. 54. P. 1—161.
2. Harris I.R., Koch C.C., Raynor G.V. // J. Less-Common Met. 1966. V. 11. Ni 6 11
436-454.
3. Tissot L„ Blaise A. 11 J. Appl. Phys. 1970. V. 41. N 3. P. 1180-1182.
B.K. Григоров''1
Gd—Pt
715
Lj-Pt. ГАДОЛИНИЙ-ПЛАТИНА
А Диаграмма состояния Gd—Pt построена в области концентраций
(И50 % (ат.) Gd в работе [1] по результатам дифференциального
«термического, микроструктурного и рентгеновского анализов, измере-
ния микротвердости, удельного электросопротивления и магнитной
Сплавы синтезировали методом дуговой плавки в атмосфере
°Чиц1енного Не с использованием в качестве исходных материалов Pt
Истотой 99,99 % (по массе) и Gd чистотой 99,98 % (по массе).
716
Gd—Pu
В системе в исследованном интервале существуют три соединения-
GdPt5, GdPt2 и GdPt, из которых два последние плавятся конгр\,)н^
тно при -2050 и >1650 °C соответственно. Соединение GdPt5 образу,
ется по перитектической реакции Ж + GdPt2 GdPt5 при 1650 С
Соединение GdPt2 имеет широкую область гомогенности, простираю-
щуюся от 21 до 34 % (ат.) Gd.
Максимальная растворимость Gd в Pt составляет менее 0.7
(ат.), при этом Gd понижает температуру ее плавления.
Таблица 30 8. Кристаллическая структура сединепий системы Gd—Pt i v -pj
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
a b (
Gd3Pt Fe3C OP16, Pnma 0,7125 0,9631 0,6460
Gd7Pt3 Th7Fe3 hP20, Pf>3mc 0,9977 — 0,62’5
Gd2Pt Co2Si oPl2, Pnma 0,7186 0,4813 0.8854
Gd5Pt3 Mn5Si3 API 6, РЬ3/тст 0,8479 — 0,6’75
GdPt FeB оРЪ, Pnma 0,7088 0,4502 0,55°0
GdPt2 MgCu2 cF24, Fdlm 0,7635- -0,7574 — —
GdPt5* — — 0,5289 0,9071 2,643
♦Ромбическая сингония.
Имеются сведения о существовании соединений Gd3Pt, Gd7Pt3,
Gd2Pt и Gd5Pt3 в области концентраций 50—100 % (ат.) Gd (V-C|.
Кристаллическая структура соединений системы Gd—Pt представлена
в табл. 308.
Литература
1. Воронова М.И., Полякова В.П., Савицкий Е.М. // Изв. АН СССР. Меча ‘ 11,1
1983. № 4. С. 176-179.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Gd—Pu. ГАДОЛИНИЙ—ПЛУТОНИЙ
Диаграмма состояния Gd—Pu изучена частично и представлена иа
рис. 379 по данным работы [1]. Исследование выполнено методам0
микроструктурного, рентгеновского, термического анализов, а также
измерением электропроводности и магнитных свойств. Gd снижает
Gd—Pu
717
Gd, °/s (fro массе)
Рис. 379. Gd—Pu
температуру плавления Pu и при температуре 600 °C, по-видимому,
протекает эвтектическая реакция Ж « (ePu) + (aGd). Gd повышает
температуру е » 6 полиморфного превращения Pu и при температуре
°C протекает перитектоидная реакция (ePu) + (aGd) (бРи).
При температуре -300 °C имеет место эвтектоидная реакция
(fiPu) а (yPu) + (aGd).
Максимальная растворимость Gd в ePu и бРи достигает ~20 %
(ат.), а Ри в aGd - ~10 % (ат.) (600 °C).
718
Gd-Re
Литература
1. Кутайцев В.И., Чеботарев Н.Т., Андрианов М.А. и др. // Атомная
1967. Т. 23. № 6. С. 511—519.
Е.И. Гладышевский, О.И. Бодак, В. К. Печирскии
Gd-Re. ГАДОЛИНИЙ-РЕНИЙ
Диаграмма состояния Gd—Re, представленная на рис. 380 по
данным работы [1], построена по результатам дифференциального
термического, рентгеновского, микроструктурного анализов, а такжс
измерения твердости, микротвердости, удельного электросопротив-
ления и коэффициента термоэлектродвижущей силы. Сплавы
синтезировали методом дуговой плавки в атмосфере очищенного Не
с использованием в качестве исходных компонентов Re чистотой
Рис. 380. Gd-Re
Gd-Rh
719
Lp 98 % (по массе) и дистиллированного Gd чистотой 99,5 % (по
кассе)•
\ В системе образуется одно соединение GdRe2 (фаза Лавеса)
«к перитектической реакции Ж + (Re) GdRe2 при температуре
WO °C. При температуре 1290 °C имеет место эвтектическая
Реакция Ж •* (PGd) + GdRe2, а при температуре -1225 “С — эвтекто-
Ндная реакция (pGd) * (aGd) + GdRe2.
, ..растворимость Re в Gd составляет менее 1 % (ат.), a Gd в Re —
^,4 % (ат.).
V... .Соединение GdRe2 имеет структуру типа MgZn2 (символ Пирсона
пр. гр. РЬ^/ттс) с параметрами а = 0,5412 нм, с = 0,8827 нм
доданным работы [1] и а = 0,5455 нм, с = 0,8841 нм по данным
работы [Ш].
Литература
1. Савицкий Е.М., Хамидов О.Х. // Изв. АН СССР. Неорганические материалы.
1967. Т. 3. № 4. С. 649—655.
М.А. Тылкина
Gd-Rh. ГАДОЛИНИЙ-РОДИЙ
Диаграмма состояния Gd—Rh (рис. 381) построена в работе [1] на
Основе данных дифференциального термического, микроструктурного
и рентгеновского анализов. Сплавы выплавляли методом дуговой
плавки в атмосфере Аг.
Таблица 30 9. Нонвариантные реакции в системе Gd—Rh [1]
Реакция Содержание Rh в фазах, % (ат.) Темпе- ратура, °C
Ж - (aGd) + Gd3Rh 18; ~0; 25; 920
Ж + Gd7Rh3 « Gd3Rh -22; 30; 25 960
Ж + Gd5Rh3 » Gd7Rh3 -28; 37,5; 30 1035
Ж + Gd3Rh2 в Gd5Rh3 —36; 40; 37,5 1110
Ж + Ga4Rh3 » Gd3Rh2 -38; 42,8; 40 1190
Gd3Rh2 в Gd5Rh3 + Gd4Rh3 40; 37,5; 42,8 1080
Ж + GdRh в Gd4Rh3 -43; 50; 42,8 1230
Ж в GdRh + GdRh2 -55; 50; 66,7 1395
Ж + GdRh2 в GdRh3 -78; 66,7; 75 1560
Ж в GdRh3 + GdRh5 -80; 75; 83,3 1460
GdRh5 в GdRh3 + (Rh) 83,3; 75; -100 1320
Ж в GdRh5 + (Rh) -87; 83,3; -100 1470
720
Gd-Rh
Gd
Rh, °/>(am.)
Rh
Рис. 381. Gd-Rh
В системе образуются девять соединений, из которых GdRh,
GdRh2 и GdRh5 плавятся конгруэнтно при температурах 1470, -1750
и 1560 °C соответственно. Остальные соединения образуются по
перитектическим реакциям.
Нонвариантные реакции в системе Gd—Rh даны в табл. 309.
Соединения Gd3Rh2 и GdRh5 распадаются эвтектоидно при -10SI)
и 1320 °C соответственно. Соединение Gd5Rh3 претерпевает поли-
морфное превращение при температуре -995 -----1010 °C.
Gd—Ru
721
блица 310. Кристаллическая структура соединений системы
£-Rh [V C]
Соединение Прототип Символ Пирсона, пр.гр. Параметры решетки, нм
а Ь с
' Gd3Rh Fe3C OP16, Pnma 0,7195 0,9540 0,6328
Gd7Rh3 Th7Fe3 hP20, P63mc 0,9854 — 0,6178
Gd5Rh3 MnsSi3 hP16, P63/mcm 0,8244 — 0,6455
Gd3Rh2 Y3Rh2 tn 40, 14/mcm 1,127 — 2,532
Gd5Rh4 Sm5Ge4 oP36, Pnma 0,7343 1,457 0,7527
GdRh CsCl cP2, РтЗт 0,34425 — —
GdRh2 MgCu2 cF24, Fd3m 0,7514 —
GdRh3 CeNi3 hP24, Р63/ттс 0,5235 — 1,740
GdRh5 CaCu5 hPf>, РЫ ттт 0,5168 — 0,4306
Данные по кристаллической структуре соединений системы
Gd—Rh представлены в табл. 310.
Литература
1- Loebich О., Raub Е. // J. Less-Common Met. 1976. V. 46. N 1. Р. 1—6.
Е.И. Гладышевский, О.И. Бодак, В.К. Печорский
Gd—Ru. ГАДОЛИНИЙ—РУТЕНИЙ
Диаграмма состояния Gd—Ru (рис. 382) построена в работе [J I на
основании данных дифференциального термического, микрострук-
турного и рентгеновского анализов.
Кроме известной фазы Лавеса GdRu2 [2, 3] обнаружены еще три
промежуточные фазы: Gd3Ru, Gd5Ru2 и Gd5Ru3. Соединения Gd5Ru2
и GdRu2 плавятся конгруэнтно при 1100 и 1700 °C соответственно.
С-оединения Gd3Ru и Gd5Ru3 образуются по перитектическим реак-
циям при 1055 и 1065 °C соответственно. В системе имеются три
эвтектических равновесия:
722
Gd-Ru
Рис. 382. Gd—Ru
Ж * (aGd) + Gd3Ru при 917 °C и -85 % (ат.) Gd,
Ж * Gd5Ru2 + Gd5Ru3 при 1015 °C и -70 % (ат.) Gd,
Ж * GdRu2 + (Ru) при -1600 °C и -20 % (ат.) Gd.
Полиморфизм фазы Лавсса, о котором сообщалось в работе U1-
в работе [1] не подтвержден. Данные по кристаллической структуре
соединений системы Gd—Ru представлены в табл. 311.
Gd—S
723
a б л и ц a 3 11. Кристаллическая структура соединений системы Gd—Ru
"ТоедИне- Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
3 ние а b с
GdjRu Fe3C оР16, Pnma 0,7310 №$50 0,6317 [4]
Gd5Ru2* Mn5C2 тС28, С2/с 1,5939 0,6391 0,7324 [4]
GdRu2 MgZn2 API 2, Р63/ ттс 0,5276 0,5274 0,5277(6) — 0,8904 0,8904 0,8886 [2] 15] [6]
GdRu2 MgCu2 cF24, Fd5m 0,756 — — [3]
♦ p - 97,05°
Литература
1. Loebich О., Raub Е. И J. Uss-Common Met. 1976. V. 46, N 1. Р. 7-15.
2. Dwight А.Е., Downey J.W., Conner R.A. // Trans. AIME. 1966. V. 236. N 10.
P. 1509—1510.
3. Крипякевич П.И., Терехова В.Ф., Заречнюк O.C., Буров И.В. / / Кристаллогра-
фия. 1963. Т. 7. № 2. С 268.
4. Palenzona А. // J. Uss-Common Met. 1979. V. 66. N 2. Р. 27—33.
5. Compton V.B., Matthias B.T. // Acta Crystallogr. 1959. V. 12. N 9. P. 651-654.
6. Cannon J.F., Robertson D.L., Hall H.T. // J. Uss-Common Met. 1972. V. 29. N 2.
P. 141-146.
В.П. Полякова
Gd—S. ГАДОЛИНИЙ-СЕРА
Диаграмма состояния Gd—S полностью не построена. Имеются
сведения о существовании четырех соединений: GdS, Gd2S3, Gd3S4
и GdS2 1Э]. Участок диаграммы состояния в области концентраций
ЭД—60 % (ат.) S, приведенный на рис. 383, построен в работах [1, 2].
Соединения GdS и Gd2S3 плавятся конгруэнтно при -2300 и 1850 °C
соответственно и образуют между собой эвтектику при температуре
1'50 °C и содержании 57,6 % (ат.) S.
Область гомогенности моносульфида Gd описывается формулой
р \О,75-1,о или -GdS0 71_j о ГЗ]. В области существования соединения
з2^з при низких температурах обнаружены четыре фазы: а, а1, а2,
а , Рентгенограммы которых подобны, однако отличаются интенсив-
ностями линий, на этом основании сделано предположение о фазовых
“Ревращениях в этой области [4]. Дисульфид Gd устойчив в области
составов GdS] 71 8 [3]. В работах |5, 6] сообщается о полиморфиз-
724
Gd-S
мс GdS2_x. Данные работы [7] о существовании соединения Gd3S4 с
гексагональной структурой требуют подтверждения.
Данные по кристаллической структуре соединений системы Gd—S
приведены в табл. 312.
Таблица 312. Кристаллическая структура соединений системы Gd—S
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a b c
GdS NaCl cF8, Fm3m 0,5574 0,5563 — — [81 |9J
aGd2$3 Ta2S3 oP20, Pnma 0,7334 0,3937 1,5200 |4|
yGd2S3 Th3P4 cI28, 14 3d 0,8387 — — 181
GdS2* — — 0,783 0,785 — 0,796 0,796 Pl [81
Gd-Sb
725
“Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b с
"GdS?* EuS2 ЛР24, Р42/п 0,7796 — 0,7961 [5]
GdS2*** — — 0,7882 — — 15]
♦Тетрагональная сингония. ♦♦Высокотемпературная модификация. ♦♦♦Низкотемпературная кубическая модификация.
Литература
1. Васильев И.Г., Миронов К.Е., Соколов В.В. и др. // Тугоплавкие соединения
редкоземельных металлов: Сб. статей. Новосибирск: Наука. 1979. С. 183—186.
2. Kamarzin A. A., Mironov К.Е., Sokolov V.V. et al. //J. Crystal Growth. 1981.
V. 52. N 2. P. 619-622.
3. Ярембаш Е.И., Елисеев A.A. Халькогениды редкоземельных элементов. М.:
Наука. 1975. 258 с.
4. Елисеев А.А., Гризик А.А., Толстова В.А. и др. // Журнал неорганической
химии. 1975. Т. 20. № 5. С. 1159-1162.
5. Webb A.W., Hall Н.Т. // Inorg. Chem. 1970. V. 9. N 5. P. 1084-1087.
6. Елисеев A.A., Толстова В.А., Кузьмичева Г.М. // Журнал неорганической
химии. 1978. Т. 23. № 12. С. 3171-3180.
7. Yaguchi К. // J. Phys. Soc. Japan. 1967. V. 22. N 4. P. 673-675.
8. Flahaut J., Guittard M., Loriers J., Partrie M. // Compt. Rend. 1957. V. 245.
N 25. P. 2291-2293.
Ю.Б. Кузьма
Gd-Sb. ГАДОЛИНИЙ—СУРЬМА
< Диаграмма состояния Gd—Sb (рис. 384) построена в работе [1] по
данным дифференциального термического, микроструктурного и
рентгеновского анализов, а также измерением микротвердости.
Сплавы готовили методом ’’ампульного” синтеза с использованием Sb
г чистотой 99,9999 % (по массе) и Gd, полученного двойной дистилля-
; Дней.
! Результаты работы [1| хорошо согласуются с данными более
'Ранней работы [2]. В системе существуют четыре соединения, из
I которых только GdSb плавится конгруэнтно при 2130 °C. GdSb
। существует в двух модификациях, температура полиморфного пре-
। вращения 1840 °C [11. Соединения Gd3Sb3, Gd4Sb3 и GdSb2 образу-
i 10тся по перитектическим реакциям при 1640, 1770 и 780 °C соответ-
J Ственно. В системе имеют место два эвтектических равновесия:
' Ж * («Gd) + Gd5Sb3 при 1120 °C и 13 % (ат.) Sb,
’ Ж « (GdSb2) + (Sb) при 624 °C и 99 % (ат.) Sb.
726
Gd-Sb
Sb,°/a(no массе)
Рис. 384. Gd—Sb
Таблица 313. Кристаллическая структура соединений системы Gd—Sb
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b с
Gd5Sbj Mn5Si3 API 6, Pb^/mcm 0,8974 — 0,6342 (И
Gd4Sb3 Анти- с/28, 0,9224 — [Н1|
Th3P4 /43d 0,9220 — — 1П
aGdSb NaCl cF8, Fm3m 0,6210 — — (П
GdSb2 SmSb2 оС24, Стеа 0,615 0,598 1,783 13!
Gd—Sc
727
Растворимость Sb в Gd невелика [~1 % (ат.)] [1]. Согласно
паботе [1] Sb снижает температуру фазового перехода aGd * pGd.
Данные по кристаллической структуре соединений системы Gd—Sb
представлены в табл. 313.
Литература
1 Abdusalyamova M.N., Burnashev O.R., Mironov K.Y. / J. Less-Common Met.
1986. V. 125. N 1-2. P. 1-6.
2. Gambino R.J. // J. Less-Common Met. 1967. V. 12. N 5. P. 344—352.
3. Абдусалямова M.H. // Журнал Всесоюзного химического общества им. Д.И.
Менделеева. 1981. Т. 26. № 6. С. 673-678.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Gd—Sc. ГАДОЛИНИЙ-СКАНДИЙ
Диаграмма состояния Gd—Sc (рис. 385) построена в работе [I]
по данным дифференциального термического и рентгеновского
анализов.
Sc, °/о (по массе)
Р»с. 385. C,d-Sc
728
Gd-Se
Сплавы, выплавленные в дуговой печи, гомогенизировали при
1100 °C. Порошки гомогенизированных сплавов для рентгеновского
анализа дополнительно отжигали в танталовых ампулах в атмосфе-
ре Не.
Система Gd—Sc характеризуется образованием непрерывного рцца
твердых растворов между низкотемпературными и высокотемпе-
ратурными модификациями компонентов.
Литература
1. Beaudry B.J., Daane А.Н. // J. Less-Common Met. 1964. V. 6. N 4. P. 322—325.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Gd-Se. ГАДОЛИНИЙ-СЕЛЕН
Диаграмма состояния Gd—Se (рис. 386) построена в работе |) ] в
области концентраций 0—60 % (ат.) Se по результатам визуально-
термического, рентгеновского, микроструктурного анализов, а также
измерения твердости и магнитных свойств.
Se, % (по пассе)
Рис. 386. Gd-Se
Gd-Se
729
' В качестве исходных материалов использовали Gd чистотой
ал 9 % (по массе) и Se высокой чистоты. При изготовлении сплавов
грсобое внимание уделяли их защите от окисления.
ъ В области концентраций 0—60 % (ат.) Se образуются два соедине-
ния: GdSe и GdnSe3, плавящиеся конгруэнтно при -2180 и -1700 °C
соответственно. Область гомогенности соединения GdSe простирается
ОТ:49,2 до 50,8 % (ат.) Se при 1550 °C. Границы области гомогеннос-
ти соединения Gd2Se3 [1] приведены ниже:
Температура, °C............................... 1300 1480 1550
Растворимость Se, % (ат.).................. 58,2—60 58,0—60 57,9—60
В системе в указанном интервале концентраций имеют место два
эвтектических равновесия: вырожденная эвтектика со стороны Gd и
эвтектика между GdSe и Gd2Sc3 с температурой плавления 1550 °C.
Таблица 314. Кристаллическая структура соединений системы Gd—Sc
ТЛТ. ’'Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь С
GdSe NaCl cF8, Fm3m 0,5772 0,5758 — — [2] [Э]
Gd3Se4? Th3P4 с/28, J43d 0,8717 — — [Э]
Gd3Se4? NiAs hP4, P63/mmc 0,472 — 0,756 [3]
Gd2Se3 (ВТ) Th3P4 cI2&, 14 3d 0,872 0,8718 0,8716* 0,8709** — — [Э] [Ш] [1] [1J
Gd2Se3 (НТ) Sb2S3 oP20, Pnma 1,118 0,405 1,098 [2]
GdSe2 ThSe2 Pnma 0,727 0,403 0,830 12]
(GdSe, g) LaSe2 — 0,815 — 0,836 [Э]
♦Параметр _ **Парамет ErSe2 решетки i p решетки Cmma три 1600 °C. при 1300 °C 1,647 1,608 1,206 [4]
В работах [Э, Ш, 2] сообщается о существовании, кроме GdSe и
Ud2Se?, соединений Gd3Se4 и GdSe2 (GdSej 8). Данные по кристалли-
еской структуре соединения GdSe2 противоречивы: имеются сведе-
730
Gd—Si
ния о принадлежности GdSe2 к тетрагональной или ромбической
сингонии. Согласно работе [2] соединение Gd2Se3 существует в u)Vx
модификациях.
Данные по кристаллической структуре соединений системы Gd—Se
представлены в табл. 314.
Литература
1. Pribylskii N.Yu., Vasilieva I.G., Gamidow R.S. // Mater. Res. Bull. 1982. \ 17
N 9. P. 1147-1153.
2. Ярембаш Е.И., Елисеев A.A. // Халькогениды редкоземельных элемент.; ц
Наука. 1975. 258 с.
3. Koichi Yaguchi // J. Phys. Soc. Japan. 1967. V. 22. N 2. P. 673—674.
4. Wang R.„ Steinfink H. // Inorg. Chem. 1967. V. 6. N 8. P. 1685-1691
A2. A. X . jb.yta
Gd—Si. ГАДОЛИНИЙ—КРЕМНИЙ
Диаграмма состояния Gd—Si полностью не построена. Имеются
сведения о существовании шести соединений: Gd5Si3, Gd5Si4, GdSi,
Gd5Si7, Gd3Si5 и GdSi2 [Э, Ш, 1, 2].
В работе [3] определена растворимость Si в жидком Gd. Установ-
лено, что Gd понижает температуру плавления Si. Температура
плавления эвтектики со стороны Si составляет 1140 °C [81 % ;:it.)
Si]. Ранее сообщалось о существовании в системе Gd—Si эвтектики
со стороны Gd при температуре 1070 °C [Ш]. Растворимость Si в Gd
составляет -1,1 % (ат.) [Ш]. Предполагается, что соединение GdsSi3
плавится конгруэнтно. Согласно работе [4] соединение GdSi2 плшшт-
ся конгруэнтно при 1540 °C.
Таблица 315. Кристаллическая структура соединений системы Gd—Si
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b с
Gd5Si3 Mn5Si3 API 6, Р63/ тст 0,8517 — 0,6404 [V С|
Gd5Si4 Sm5Ge4 оРЗб, Рпта 0,74738 1,47240 0,77362 [V ('!
GdSi FcB оР8, Рпта 0,800 0,385 0,573 [В!!
Gd^Sij A1B2 ЬРЗ, РЬ/ттт 0,3873 — 0,4183 [ V <. 1
Gd5Si5 ThSi2 ti 12, Ibjamd 0,410 — 1,361 |У и
GdSi2 GdSi2 0/12, Imma 0,409 0,401 1,344 [\ . i
Gd—Sm
731
Вк. 387. Gd—Si
На рис. 387 представлена ориентировочная диаграмма состояния
Gd-Si, основанная на данных работ [Э, Ш, 1—4].
Данные по кристаллической структуре соединений системы Gd—Si
представлены в табл. 315.
Литература
1- Матюшенко Н.Н. Кристаллические структуры двойных соединений М.: Метал-
лургия, 1969. 303 с.
' 2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
3. Лозовский В.М., Колесниченко А.И. // Изв. АН СССР. Неорганические
*“териалы. 1981. Т. 17. № 3. С. 554-555.
Самсонов Г.В., Виницкий И.М. Тугоплавкие соединения: М.: Металлургия,
‘*76. 558 с.
В.П. Полякова
Gd-Sm. ГАДОЛИНИЙ-САМАРИЙ
м 388 приведена диаграмма состояния Gd—Sm, построенная
_Рао°Те [1]. Согласно работе [1] в системе существуют непрерывные
твердых растворов между высокотемпературными (ySm и pGd)
(®“3котемпературными (pSm и aGd) модификациями Gd и Sm. На
ва«ии близости физико-химических параметров Gd и Sm сделано
732
Gd—Sm
Рис. 388. Gd—Sm
заключение, что образование идеальных твердых растворов приводит
к слиянию линий ликвидуса и солидуса и образованию прямолиней-
ного сольвуса. При понижении температуры происходит полиморфн°е
превращение pSm * aSm и образование твердого раствора на основс
Sm со стуктурой типа aSm.
Промежуточные фазы в системе не обнаружены [1, 2].
Gd—Sn
733
Параметры решетки твердого раствора со структурой типа Mg
Гсимвол Пирсона hP2, пр. гр. Pf^/mmc) изменяются от а =
10,36336 нм, с = 0,57810 нм для aGd до а = 0,3638 нм, с = 0,5779 нм
ддя’ сплава с содержанием 20 % (ат.) Sm. В области твердого раство-
па со структурой типа aSm (символ Пирсона ЛРЗ, пр. гр. 7?3т)
параметры решетки изменяются от а = 0,36290 нм, с = 2,6207 нм для
tfSm до a = 0,3615 нм, с = 2,610 нм для сплава с содержанием 20 %
(ат.) Gd [V-C].
Литература
1. Gschneidner, Jr., К.А., Calderwood F.W. // Handbook on Physics and Chemistry
of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publishing.
Co. 1986. V. 8. Chap. 54. P. 1-161.
2. Терехова В.Ф., Савицкий E.M., Торчинова P.C. // Диаграммы состояния
металлических систем: Сб. статей. М.: Наука, 1968. С. 200—206.
В.П. Полякова
Ga—Sn. ГАДОЛИНИЙ-ОЛОВО
Диаграмма состояния Gd—Sn полностью не построена. Диаграмма
состояния в области концентраций 0—25 % (ат.) Gd, приведенная на
рис. 389, построена в работе [1] по данным термического, микрос-
труктурного анализов, а также измерения микротвердости.
В системе существует
вырожденная эвтектика
со стороны Sn. Соедине-
ние GdSn3 плавится кон-
груэнтно при 1115±4 °C.
В работах [2—4, V-C]
указывается на сущес-
твование в системе
Gd—Sn, кроме соединения
GdSn3, промежуточных
Фаз: Gd5Sn3, Gd5Sn4,
GduSn10, GdSn2, Gd3Sn7
и GdSn2;5. Состав и ха-
рактер образования этих
Фаз нуждается в уточне-
нии.
Данные по кристалли-
чной структуре соедине-
нии системы Gd—Sn пред-
ъявлены в табл. 316.
Рис. 389. Gd—Sn
734
Gd-Та
Таблица 316. Кристаллическая структура соединений системы Gd—Sn
Соедине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а Ь с Источник
Gd3Sn3 Mn5Si3 API 6, P63/nicm 0,9032 0,9020 — 0,6595 0,6568 12J [4|
Gd5Sn4 Sm5Ge4 оРЗб, Pnma 0,8046 1,553 0,8193 1V-C |
GdiiStijO HO||Ge|0 /784, 74/ттт 1,167 — 1,715 [V-c:
GdSn2 ZrSi2 oC12, Стет 0,4428 1,6410 0,4322 14]
Gd3Sn7 Gd3Sn7 С ттт 0,44597 2,65163 0,43823 [V-CI
GdSn2 75 GdSn2 у*; А mm2 0,43552 0,44039 2,2044 [V-C]
GdSn3 AuCu сР4, РтЗт 0,4678 — — 14]
Литература
1. Кулагина Н.Г., Баянов А.П., Кулагин Н.М. // Изв. АН СССР. Металлы. 1985.
№ 3. С. 211-216.
2. Jeitschko W., Parthe Е. // Acta Crystallogr. 1967. V. 22. N 4. P. 551-555.
3. Сколоздра P.B., Аксельруд Л.Г., Печарский В.К., Корецкая О.Э. // Доклады
АН УССР. Сер. Б. 1986. № 12. С. 51-54.
4. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа. 1982. 253 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Gd—Та. ГАДОЛИНИЙ—ТАНТАЛ
Диаграмма состояния Gd—Та не построена. В работе [1] с по-
мощью ДТА изучена растворимость Та в жидком Gd в интервале
температур 1381—1772 °C. Образцы готовили индукционным на>'ре-
вом в запаянных танталовых тиглях с использованием Gd, получен-
ного металлотермическим восстановлением, и Та в прутке чистотой
>99,9 % (по массе).
Установлено, что в системе не существует промежуточных фаз. Со
стороны Gd имеется эвтектическое равновесие Ж * (PGd) + (Та) при
температуре 1311 ±5 °C и содержании 0,06+0,02 % (ат.) Та. При
температуре 1236+5 °C происходит эвтектоидная реакция (PGd) **
(aGd) + (Та). Растворимость Та в жидком Gd не превышает 0,4 %
(ат.) при температуре 1772 °C.
Gd—Tb, Gd—Tc
735
Литература
1 Dennison D.H., Tschetter M.J., Gschneidner K.A. 11 J. Less-Common Met. 1965.
Г10.№. P. Ю8-115.
у Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
£а-ТЬ. ГАДОЛИНИЙ-ТЕРБИЙ
1 Диаграмма состояния Gd—Tb, представленная на рис. 390, по-
строена в работе [1] по данным дифференциального термического,
Микроструктурного и рентгеновского анализов. Сплавы готовили в
дуговой печи с нерасходуемым W-электродом на медном поду с
Использованием Gd и ТЬ чистотой 98,5 и 99,0 % (по массе) соответ-
В системе образуются непрерывные ряды твердых растворов между
изоморфными модификациями. Не исключается возможность сущес-
твования минимума или максимума на кривых ликвидуса и солидуса,
ЧТО .характерно для непрерывных рядов твердых растворов между
редкоземельными металлами [Ш].
Литература
vД. Буров И.В., Терехова В.Ф., Савицкий Е.М. // Журнал неорганической химии.
Т 9. № 8. С. 2036-2038.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Gd-Tc. ГАДОЛИНИЙ-ТЕХНЕЦИЙ
Диаграмма состояния Gd—Tc не построена. В системе обнаружено
ОДйо соединение GdTc2 с гексагональной решеткой типа MgZn2
(символ Пирсона API2, пр. гр. РЬ^/ттс) с параметрами а =
*0,5397 нм, с = 0,8883 нм [1].
J^parypa
Darby J.B., Norton L.J., Downey J.W. // J. Less-Common Met. 1964. V. 6. N 2. P.
103—167
Н.И. Никитина
736
Gd-Те
Gd-Te. ГАДОЛИНИЙ-ТЕЛЛУР
Диаграмма состояния Gd — Те (рис. 391) построена в работе ц,
по данным термического и микроструктурного анализов, а екже
измерения электрофизических свойств. Сплавы синтезировали в
вакуумированных кварцевых ампулах. Gd и Те содержали соответ-
ственно 0,15 и 0,06 % (по массе) примесей.
Те, %, (по массе)
Рис. 391. Gd—Тс
В системе найдено семь соединений GdTe, Gd3Te4, Gd; Ге3,
Gd4Te7, GdTe2, Gd2Te5, GdTe3. Соединение GdTe плавится конгру-
энтно при 1825 °C. Соединения Gd3Te4, Gd4Te7, GdTe2, Gd2Te5 и
GdTe3 образуются по перитектическим реакциям при 1258, 1190,
1000, 920 и 835 °C соответственно. Авторы [1] указывают, что соеди-
нение Gd2Te3 также образуется по перитектической реакции при
-1215 °C, однако на рис. 391 эта реакция не показана. Обнаружена
область твердых растворов между соединениями Gd3Te4 и Gd, 1 е3-
Со стороны Gd существует эвтектика (PGd) + GdTe при темпера-
туре 1290 °C и содержании -3 % (ат.) Те. Со стороны Те имеется
вырожденная эвтектика (Те) + GdTe3. При температуре 1150 °C по-
видимому, протекает эвтектоидная реакция: (0Gd) ** (aGd) + Gd Ге,
однако характер взаимодействия Тс с aGd и 0Gd, как и раствор*1'
мость компонентов друг в друге, нуждаются в уточнении.
Gd—Th
737
1Л и ц a 3 17. Кристаллическая структура соединений системы Gd—Те
*жёдине- Прото- тип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b с
®ЗТе Я R5 ' NaCl сГ8, РтЗт 0,6139 0,614 — — [2] [Ш]
GdjTe4 Sb2s3 оР20, Рпта 0,428 1,183 1,206 [3]
ofidjTej Sb2S3 оР20, Рпта 0,429 1,175 1,198 [Ш]
.^Те2* — — 0,910 — 0,930 [Э]
Nd2Te5 оС28, Стет 0,4336 — 4,36 [4]
«(№ NdTe3 оС16, Стет 0,4326 — 2,558 [5]
ЩГ94?** ♦Тетраг ♦*Триго анальная с нальная ci ингония, тнгония, а == 25, 1,30 5°. [Э]
.(/Имеются сведения о существовании соединения GdTe4 [Э], кото-
рое не было обнаружено в работе [1].
Данные по кристаллической структуре соединений системы Gd —
Те представлены в табл. 317. Результаты определения кристалличес-
кий структуры GdTe противоречивы; по данным различных исследо-
вателей, GdTe имеет либо кубическую структуру типа NaCl, либо
моноклинную решетку [Э, Ш]. Данные о кубической структуре
GdTe являются более надежными.
Литература
1. Заргарян В.Ш., Абрикосов Н.Х. // Изв. АН СССР. Неорганические материалы.
1967. Т. 3. № 5. С. 769-776.
2. landelli А. // Atti Accad. Naz. Line. Rend. Sci. Fiz. Mat. Nat. 1960. V. 29. N 1.
P. 62-69.
3. Ярембаш Е.И., Елисеев А.А. Халькогениды редкоземельных элементов. M.:
Наука. 1975. 258 с.
4. Pardo M.R., Flahaut J. // Compt. Rend. Acad. Sci. (Paris). 1966. V. 263 C. N 18.
F- 1058-1060.
5. Pardo M.R., Gorochov O., Flahaut J., Domange L. // Compt. Rend. Acad. Sci
(Paris) 1965. V. 260. N 6. P. 1666-1669.
Н.И. Никитина
Gd-Th. ГАДОЛИНИЙ-ТОРИЙ
Диаграмма состояния Gd—Th (рис. 392) построена в работе [1] по
Данным дифференциального термического и микроструктурного
Диализов. В качестве исходных компонентов использовали Th чисто-
ли 99,5 % (по массе) и Gd с содержанием примесей Си, Са, Fe —
Д6 % (по массе) [2].
^4 Зак. 2144
738
Gd-Th
В системе образуются непрерывные ряды твердых растворов м*.аду
изоморфными высокотемпературными модификациями Th и Gd. При
1330 °C наблюдается перитектоидная реакция (0Th, pGd) + (aTli)
* (aGd). При содержании ~20 % (ат? Gd наблюдается максимум
кривой превращения aTh (pTh, PGd) [1, 3].
В работе [4] на основании изменения параметров решетки
установлена растворимость Gd в Th, составляющая -60 % (ат.» при
900 °C. Параметр решетки изменяется от а - 0,50749 нм для Тп до
а = 0,50693 нм в сплавах, содержащих 59,97 и 65,02 % (ат.) Gd.
Литература
I. Бадаева Т.А., Кузнецова Р.И. // Изв. АН СССР. Металлы. 1969. № 1
156-163.
2. Бадаева Т.А. Строение сплавов тория. М.: Наука, 1968. 178 с.
3. Бадаева Т.А., Кузнецова Р.И. // Физико-химия сплавов и тугоплавких счн ди-
нений с торием и ураном: Сб. статей. М.: Наука, 1968. С. 5—10.
4. Norman М„ Harris J.R., Raynor G.V. // J. Less-Common Met. 1966 V
P. 395-399.
В.П.
Gd-Ti
739
Gd—Ti. ГАДОЛИНИЙ-ТИТАН
Диаграмма состояния Gd—Ti является диаграммой эвтектического
ипа с температурой плавления эвтектики 1120±5 °C по данным
пяботы [1] и 1240+10 °C по данным работы [Э]. Растворимость Ti в
Gd
₽ЙС. 393. Gd-Ti
Ti,°/с (ат.)
Ti
1Ь Диаграмма состояния Gd—Ti (рис. 393) представлена по данным
1®боты [М] и построена на основании критического анализа работ по
Фазовым равновесиям в системе Gd—Ti. Представленная диаграмма
. состояния существенно отличается от приведенной в работе [1].
Согласно работе [М] в системе существует область расслаивания
Жидком состоянии в интервале концентраций 13—65 % (ат.) Ti.
Температура монотсктической реакции соответствует -1275 °C.
Эвтектическое'равновесие со стороны Gd имеет место при температу-
Ре 1240 °C и содержит И % (ат.) Ti. При температуре 1230 °C
Происходит эвтектоидная реакция (pGd) * (aGd) + (pTi). Со стороны
И протекает перитектоидная реакция (PTi) + (aGd) * (aTi) при
.Температуре 885 °C.
24*
740
Gd-Tl
Литература
1. Савицкий Е.М., Бурханов Г.С. // Журнал неорганической химии. 196? ] 7
№ 3. С. 699-701.
В.П. Нол111(ова
Gd-Tl. ГАДОЛИНИЙ-ТАЛЛИЙ
Диаграмма состояния Gd—Т1 (рис. 394) построена в работе [1] по
данным дифференциального термического, микроструктурною и
рентгеновского анализов. Сплавы получены плавкой в индукционной
печи в герметичных танталовых тиглях. В качестве исходных компо-
нентов использовали Gd и Т1 чистотой 99,9 и 99,99 % (ат.) соответ-
ственно.
В системе обнаружено пять соединений, из которых GdTl и GdTl3
плавятся конгруэнтно при 1270 и 990 °C соответственно. Остальные
соединения образуются по перитектическим реакциям.
Нонвариантные реакции в системе Gd—Т1 приведены в табл. 318.
П,°А(по массе)
Рис. 394. Gd-Tl
Gd-Tl
741
т блица 318. Нонвариантные реакции в системе Gd—Т1 [1]
Реакция — Содержание TI в фазах, % (ат.) Темпе- ратура, °C
(₽Gd) + aGd2Tl 23; -13; -33,3 920
(pGd) ** <«Gd) + aGd2Tl -12; ~5; -33,3 870
де + Gd5Tl3 »* pGd2Tl -28; 37,5; -33,3 1055
tJK + GdTl * Gd5Tl3 -36,5; -50; 37,5 1200
+ GdTl >* Gd3Tl5 -63; -50; 62,5 1050
jK - Gd3Tl5 + GdTl3 71,5; 62,5; 75 970
Ж - (pTi) + GdTl3 -100; -100; 75 303
, 1 ,
Таблица 3 19. Кристаллическая структура соединений системы Gd—Т1
'(^едине- ние Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a b c
Gd2Tl Ni2In hP6, Р6Э/mine 0,536- -0,542 0,5399 — 0,670- -0,680 0,6735 [1] [V-C]
GdsTl3 Mn5Si3 API 6, РЬ^/mcm 0,9042 — 0,6664 [2]
GdTl AuCuI tP4, Pl/mmm — — — [1]
GdTl CsCl cP2, Pm3m 0,37797 — — [3]
Gd3Tl5 Pu3Pd5 oC32, Cmcm 1,0035 0,8105 1,039 [V-C]
GdTl3 AuCu3 cP 4, Pm3m 0,4696 0,4694 — — [3] [1]
Растворимость Т1 в aGd и pGd и области гомогенности промежу-
точных фаз требуют уточнения.
Данные по кристаллической структуре соединений системы Gd—Т1
Приведены в табл. 319.
Литература
1. Delfino S., Saccone A., Ferro R. // Z. Metallkunde. 1983. Bd. 74. N 10. S.
674-679.
2. Franceschi E., Palenzona A. // J. Less-Common Met. 1969. V. 18. N 2. P. 93—98.
3. Baenziger N.C., Moriarty J.L. // Acta Crystallogr. 1961. V. 14. N 9. P. 948—950.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
742
Gd-Тт
Gd—Tm. ГАДОЛИНИЙ—ТУЛИЙ
Диаграмма состояния Gd—Tm экспериментально не построена
Однако Gd и Tm имеют идентичное электронное строение с тремя
коллективизированными электронами 5d[6s2 и одинаковую кристал-
лическую структуру с близкими параметрами решетки и атомныМи
радиусами [1]. Данные по кристаллической структуре Gd и Тщ
приведены в табл. 320.
Тт,7о(па массе)
Рис. 395. Gd—Тт
На основании изоэлектронности, изоструктурности, близости
атомных радиусов, отличающихся на 3,1 %, и близкого расположе-
ния в Периодической системе можно предположить, что Gd и ТШ
образуют непрерывные ряды идеальных растворов. Вследствие иде-
альности, как и в системе Gd—Ег, наблюдается слияние ликвиду-
са-солидуса в прямую линию и образование прямолинейного сольву-
са. Наклон прямой сольвуса определяется превращением ближнего
порядка в расплаве Тт при 1655 °C 12]. В системе Gd—Тт сущес-
твует перитектика при температуре 1396 °C и содержании 38 %
Тт (рис. 395).
Gd-U, Gd—V
743
блица 320. Кристаллическая структура и полиморфные
^вращения элементов системы Gd—Тт
^АИЗРИ-' 1Ме’нт Моди- фика- ция Прото- тип^ структу- ра Параметры решет- ки, НМ Темпера- тура, в , ^вра- щения, “С 11 Реакция Ис- точ- иик
а С
64Gd aGd Mg, ГПУ 0,36336 0,57810 1235 aGd - ₽Gd [1]
PGd W, ОЦК 1313 Ж * PGd [1]
69Tm Mg, ГПУ 0,35375 0,55040 1545 Ж о Tm [1]
1655 Ж ГПУ = жоцк [21
Литература
1. Gschneidner, Jr„ К.A., Eyring L.R. // Handbook on the Physics and Chemistry of
Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publishing. Co.,
1986. V. 8. P. 409—484.
2. Григорович B.K., Григорович K.B. // Строение и свойства металлических и
шлаковых расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск:
ЧПИ, 1990. Т. 2. Ч. 2. С. 250-252.
В.К. Григорович
Gd-U. ГАДОЛИНИЙ—УРАН
Диаграмма состояния Gd—U не построена. Gd и U не смешива-
ются в жидком состоянии. Растворимость Gd в жидком U при темпе-
ратурах 1250, 1200 и 1150 °C составляет 0,23; 0,15 и 0,11 % (ат.)
соответственно; растворимость Gd в aU — менее 0,08 % (ат.) |3j.
Е.И. Гладышевский, О.И. Водак, В.К. Печарский
G(U-V. ГАДОЛИНИЙ-ВАНАДИЙ
Диаграмма состояния Gd—V экспериментально нс построена.
Согласно работе [Э1 для системы характерна крайне ограниченная
Растворимость' компонентов друг в друге в жидком и твердом состо-
янии.
, В работе [1] рассчитаны температуры трех нонвариантных равно-
весий и составы участвующих в этих равновесиях фаз. Нонвариан-
1’Ные равновесия в системе Gd—V представлены в табл. 321.
744
Gd—Tm
Таблица 321. Нонвариантные реакции в системе Gd—V [1]
Реакция Содержание V в фазах, % (ат.) Темпе - ратура, °C
Ж, ₽ Ж2 + (V) 98,8; 8.7; 99,9 189о
Ж » (pGd) + (V) 1,8; 0,9; -100 1289
(₽Gd> <• (aGd) + (V) 0,5; 0,2; -100 1223
Литература
1. Smith J.F., Lee K.J., Martin D.M. // Calphad. 1988. V. 12. N 1. P. 89-96
В.Л- Полякова
Gd-W. ГАДОЛИНИЙ-ВОЛЬФРАМ
Диаграмма состояния системы Gd—W не построена. Соединения
в системе не обнаружены [1].
В работе [2] исследована растворимость W в жидком Gd. При
синтезе сплавов использованы W чистотой 99,9 % (по массе) и Gd
металлотермический.
Растворимость W в жидком Gd приведена ниже:
Температура, °C.......................... 1662 1708
Растворимость W
% (ат.)................................ 0,067 0,105
% (по массе)............................... 0,078 0,123
1868 1935
0,137 0,172
0,160 0,202
2022
0.225
0,264
Эта растворимость описывается уравнением
Igx = -6,345 • 103 Г1 + 0,127,
где х — атомная доля W в жидком Gd; Т — температура, К. Рассчи-
танная по этому уравнению растворимость W в жидком Gd при
температуре его плавления составляет 0,0133 % (ат.) [2].
Литература
1. Baenziger N.C., Moriarty J.L. // Acta Crystallogr. 1961. V. 14. N 9. P. 948—950
2. Dennison D.H., Tschetter M.J., Gschneidner, Jr., K.A. // J. Less-Common Met
1966. V. 11. N 6. P. 423-435.
К.Б. Повар:iea
Gd—Y. ГАДОЛИНИЙ-ИТТРИЙ
Диаграмма состояния системы Gd—Y приведена на рис. 396
данным работы [1]. Исследование выполнено методами термической,
рентгеновского и микроструктурного анализов.
Gd—Yb
745
Ы. 396. Gd—Y
В системе образуются непрерывные ряды твердых растворов
между высокотемпературными и низкотемпературными модификаци-
ям Gd и Y.
Литература
кч;1., Gschneidner, Jr., К.А., Calderwood F.W. // Handbook on the Physics and
Oleihlstry of Rare Earths. Amsterdam. New-York. Oxford. Tokyo: North-Holland Physics.
Publishing. Co., 1986. V. 8. P. 1-161.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
-l«fcYb- ГАДОЛИНИЙ-ИТТЕРБИЙ
Диаграмма состояния Gd—Yb, приведенная на рис. 397, построена
в работе [1] по данным дифференциального термического, микро-
структурного и рентгеновского анализов, а также на основе электро-
НОграфического и микрорентгеноспектрального исследования.
л... Сплавы выплавляли в индукционной печи в атмосфере Не в
танталовых тиглях. В качестве исходных материалов использовали
дистиллированные Gd и Yb.
Система Gd—Yb характеризуется расслаиванием в жидком состоя-
нии в интервале концентраций 49—71 % (ат.) Yb, температура
Монотектической реакции 1183 °C. Промежуточные фазы в системе
обнаружены. Твердый раствор на основе aGd образуется по реак-
ции (0Gd) « (aGd) + Ж при температуре 1161 °C. Согласно работе
й] (0Yb) образуется по перитектической реакции при 819 °C Ж +
746
Gd—Yb
Рис. 397. Gd—Yb
+ (aGd) ** (0Yb). При 780 °C происходит эвтектоидная реакция
(yYb) * (aGd) + (aYb).
Максимальная растворимость Yb в 0Gd составляет 21 % (:ч.).
Растворимость Yb в aGd приведена ниже:
Температура, °C ... 500 650 700 780 820 850 1000 И<>-
Растворимость
Yb, % (ат.)...... 6,5 10,4 11,8 14,0 14,6 15,8 17,0 19.0п0-5
Максимальная растворимость Gd в 0Yb и aYb составляет 2,3 и
1,4 % (ат.) соответственно.
Растворимость Gd в жидком Yb указана ниже:
Температура, °C ............... 850 900 950 1000 1050 1100 11
Растворимость Gd, % (ат)....... 1,6 2,2 3,0 5,1 5,8 8,1 1 ~
Gd—Zn
747
длтература
1 Beaundry B.J., Spedding F.H. // Metal. Trans. 1974. V. 5. N 7. P. 1631—1636.
В.П. Полякова
Gd—Zn. ГАДОЛИНИЙ-ЦИНК
Диаграмма состояния Gd—Zn не построена. В работах [Э, III]
сообщено, что GdZn имеет кубическую структуру типа CsCl. Кри-
сталлическая структура остальных соединений системы Gd—Zn
(табл. 322) приведена по данным работ [V-C]
Таблица 32 2. Кристаллическая структура соединений системы Gd—Zn
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
a b c
GdZn CsCl сР2, РтЗт 0,3602 — —
GdZn2 CeCu2 с/12, Imma 0,4513 0,7214 0,7606
GdZn3 YZn3 СР16, Рпта 0,6718 0,4439 1,0158
GdjZn,! U3ZnH Immm 0,4423 1,3063 0,8842
Gd6Zn23 Th6Mn23 cF\lf>, Fm3m 1,275 — —
Gd13Zn55 Gd13Zn55 Р(>3тс 1,4352 — 1,4218
GdZn5 CaCu5 hPf>, РЬ/ттт 0,5383 — 0,4215
!jGd3Zrl22 Pu3Zn22 Hl 00, J4l/amd 0,8831 — 2,1118
, Gd2Zn17 Th2Ni17 или /1РЗ8, P(>3/mmc 0,8987 — 0,8828
Nb2BC|7 hR19, R3m 0,8994 — 1,3169
GtlZni2 ThMn12 tI2f>, 74/mmm 0,8898 — 0,5210
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
748
Gd-Zr
Gd-Zr. ГАДОЛИНИЙ-ЦИРКОНИЙ
Диаграмму состояния Gd—Zr исследовали в работе 11], богатую
Gd часть исследовали дополнительно [2] (рис. 398). Сплавы готовил^
из йодистого Zr и Gd чистотой более 99 % (по массе) плавленном в
вакуумной дуговой печи. Исследование проводили методами микрос-
копического, термического и рентгеновского анализов.
Рис. 398. Gd-Zr
В системе Gd—Zr существует эвтектика Ж (aGd) + (0Zr) пр'1
температуре 1220 °C и содержании 30 % (ат.) Zr. Растворимость Zr
в aGd при эвтектической температуре составляет около 3,4 % аг.
{2], в 0Zr при той же температуре растворяется до 7 % (ат.) Gd 111
Добавки Gd повышают температуру превращения aZr * 0Zr, в Рс'
зультате чего перитектоидная реакция (0Zr) + (aGd) ** (aZr) проис-
ходит при температуре 890 °C. Растворимость Gd в Zr уменьшается
от 5 % (по массе) при 890 °C до 2—3 % (по массе) при 600 °C |21 •
Ge—H
749
При закалке сплавов Gd—Zr из жидкого состояния (скорость
хлаждения Ю7 °С/с) наблюдается образование метастабильных
ли^ьдых растворов на основе aZr при содержании Gd до 12 % (ат.),
ГДО основе aGd — при содержании Zr до 19 % (ат.) [4, 5].
|рййратура
1. Copeland M.I., Armantrout С.Е., Kato Н. U S. Bur. Mines. Rept. Invest. N 5850.
13 p.
2 Copeland M.I., Kato H. // Physics and Material Problems of Reactor Control Rods.
Vienna: IAEA. 1964. P. 295-317.
3. Chase M.W. // Bull. Alloy Phase Diagrams. 1983. V. 4. N 1. P. 124—125.
4^ Wang R. // Metall. Trans. 1972. V. 3. N 5. P. 1213-1221.
5. Wang R., Kim J.B. // Metall. Trans. 1974. V. 5. N 9. P. 1973-1977.
Л.А. Третьяченко
Ge—H. ГЕРМАНИЙ-ВОДОРОД
Известные литературные данные по взаимодействию этих элемен-
тов связаны в основном с технологическими особенностями получе-
ния чистого (полупроводникового) Ge. Однако имеющаяся информа-
ция довольно противоречива. Так, в работе [1] сообщается о возмож-
ности поглощения Ge значительных количеств Н. В то же время в
работе [2] приводятся данные о крайне малой растворимости Н в Ge.
Химическое взаимодействие Ge с Н приводит к образованию
соединений GeH4, Ge5H12, Ge4H|0, Ge3H8, Ge2H6, а также (GeH)A
и (СгеН)2_Л [Э].
Растворимость Н в жидком Ge в интервале температур 1500—
1700 °C описывается выражением [3]
Igx = 0,51g/? - 2,97 - 750/Т,
х — концентрация Н, % (ат.), р—давление, Па; Т — темпе-
ратура, К.
Литература
!• Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
R 2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред.
•В. Линчевского. М.: Металлургия: 1980. 712 с.
3- Fromm Е., Jehn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 323-325.
В.И. Шаповалов
750
Ge-Hf
Ge-Hf. ГЕРМАНИЙ-ГАФНИЙ
Диаграмма состояния Ge—Hf исследована в работах [1, 2J ренгге*
новским методом. Обнаружено шесть соединений. Соединения GcHl
GeHf2, Ge2Hf3, Ge4Hf5, GeHf и Ge2Hf образуются по перитектике
ским реакциям. При этом температура образования установлена
только для Ge2Hf и GeHf2, соответственно равная 1744 и 2026 С.
Соединение Ge3Hf5 плавится конгруэнтно при ~ 2220 °C. В системе
кристаллизуются две эвтектики и имеет место одна перитектоидная
реакция. Диаграмма состояния Ge—Hf приведена на рис. 399 по
данным работы [М]. Эвтектические реакции приведены ниже:
Рис. 399. Ge-Hf
Ж * Ge2Hf + (Ge) при ~ 930 °C и 98 % (ат.) Ge;
Ж * (0Hf) + GeHf3 при 1775 °C и 10 % (ат.) Ge.
При температуре 1745 °C протекает превращение, связанное с
полиморфизмом Hf : (0Hf) + GeHf3 (aHf). В табл. 323 дана инфор-
мация о кристаллической структуре двойных соединений системы
Ge-Hf [2,3].
Ge—Hg, Ge—Но
751
-г блица 323. Кристаллическая структура соединений системы Ge—Hf
т л uJ _____________
'^оединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
a с
GeHf3 iU\r Ti3P tP32, P42/n 0,656 0,525
’ GeHf2 IT' ' A12Cu tl\2, 14/тст 0,6587 0,537
* Ge3Hf5 Mn5Si3 АР16, Pfhjmcm 0,787 0,555
Ge2Hf3 U3Si2 tPIO, Р4/ mbm 0,708 0,359
~~ GeHf FeB oP8, Pnma — —
Ge2Hf Si2Zr oC 12, Cmcm — —
Ge4Hf5 Si4Zrs P4l2}2 — —
Литература
1. Nowotny Н., Braun Н., Benesovsky F. // Radex Rundsch. 1960. Bd. 16. S. 367—
372.
2. Nowotny H., Benesovsky F., Schob O. // Monatsh. Chem. 1960. Bd. 91. S. 270—
' 275.
. 3. Schubert K., Meissner H.G., Rossteutscher W. // Naturwissenschaften. 1964.
Bd. 51. S. 506-507.
С. П. Алисова
Ge—Hg. ГЕРМАНИЙ-РТУТЬ
Диаграмма состояния Ge—Hg не построена. В работе [X] сообщено
о растворимости Ge в жидкой Hg, которая становится заметной лишь
при температуре выше 250 °C и при температуре 300 °C достигает не
Менее 0,027 % (по массе).
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Ge-Ho. ГЕРМАНИЙ—ГОЛЬМИЙ
Диаграмма состояния Ge—Но (рис. 400) построена в работе [11.
Сплавы для исследования готовили в дуговой печи в инертной атмос-
фере из Ge чистоты 99,99 % (по массе) и Но чистоты 99,8 % (по
Массе). Исследование сплавов осуществляли методами дифференци-
ального термического, микроскопического, рентгеноструктурного
анализов и измерения плотности.
752
Ge-Но
Ge, °/o (по массе)
Рис. 400. Ge—Но
В системе обнаружено девять соединений, из которых только
Ge3Hoj плавится конгруэнтно при 1950 °C; реакции образования
остальных соединений приведены в табл. 324.
Ge—Но
753
Таблица 3 2 4. Нонвариантные реакции в системе Ge—Но
Реакция Содержание Ge в фа- зах, % (ат.) Температу- ра, °C
JjjV^Ge3Ho5 •* Ge4Ho5 37,5 43,8; 1860
Ж + Ge4Ho5 *" GejoHo,, —; 43,8; 47,9 1700
% + Gel0Ho, >* GeHo —; 47,9; 50 1475
Ж + GeHo ₽ Ge, 5Ho 53; 50; 60 1400
Ж + Ge, 5Но >* Ge, 7Ho 70; 60; 62,5 1210
Ж + Ge17Ho •* Ge, gHo 77; 62,5; 63,5 1000
Ж + Ge, gHo ** 7Ho 82; 63,5; 72,5 905
GeHo + Ge, 5 Ho e Ge5Ho4 50; 60; 54,9 1360
Ж - Ge3Ho5 + (Ho) 12; 36,7; -99,5 1250
Ж • Ge2>7Ho + (Ge) 86; 72,5; -99 880
Таблица 325. Кристаллическая структура соединений системы Ge—Но
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
a b c
Ge3Ho5 Si3Mn5 hPlf>, PCtJmcm 0,8391 — 0,6295
Ge4Ho5 Ge4Sm5 оРЗЬ, Pnma 0,7568 1,4569 0,7648
GeI0Ho,, Ge,0HO|| tI34, 14/ттт 1,0818 — 1,6247
GeHo BCr 0C8, Ctncm 0,4242 1,0612 0,3916
Ge5Ho4 — — — — —
«Ge, 5Ho Ge, 5Ho — 0,6783 0,8234 0,7864
PGe, 5Ho B2A1 ЙРЗ, PCt/mmm 0,3926 — 0,4113
«Ge, 7Ho — — — — —
PGe,7Ho aSi2Th Г/12, 74,/amd 0,4044 — 1,478
Ge, gHo Ge2Dy — 0,7810 0,798 1,478
_ Ge2 7Ho Ge3,5Y — 2,0722 0,3972 0,3898
754
Ge-In
Соединение Ge3Ho5 имеет небольшую область гомогенно^
Соединения Gej 5Но и Gej 7Но претерпевают полиморфные прсвра'
щсния соответственно при температурах 940 и 925 °C.
Растворимость Но в (Ge) при эвтектической температуре 880 р
составляет менее 1 % (ат.); растворимость Ge в (Но) при 1250 (
0,5 % (ат.).
Сведения о кристаллической структуре двойных соединений
системы Ge—Но [2] даны в табл. 325.
Литература
1. Еременко В.Н., Обушенко И.М., Буянов Ю.И. // Доклады АН УССР. Сео. д
1980. № 7. С. 91-95.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печар гкий
Ge-In. ГЕРМАНИЙ-ИНДИЙ
Сплавы системы Ge—In исследовались многократно [X, Э, Ш], По
расчету [Э] вырожденная эвтектика имеет место при температуре
156,29 °C и содержании 0,05 % (ат.) Ge. Диаграмма состояния Gc—In
представлена на рис. 401 [X].
In 6е,°/о(ат.) Бе
Рис. 401. Ge-In
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Ge—Irt Ge—К
755
ГЕРМАНИЙ-ИРИДИЙ
Диаграмма состояния Ge—Ir не построена. Однако в работах [X,
Bi фмеются сведения о взаимодействии этих элементов. В работе [1]
go^JnjeHO, что сплав 1г с 40 % (ат.) Ge имеет эвтектическую или
эвтектоидную структуру. В структуре сплавов 1г с 80 и 56 % (ат.) Ge
ЙЙбдЮдаются две фазы. Соединение Ge?Ir3 находится в равновесии
с Ge4Ir в сплаве с 80 % (ат.) Ge, a Ge7lr3 — в равновесии с Gelr в
сплаве с 56 % (ат.) Ge.
Сведения о кристаллической структуре известных двойных фаз
системы Ge—1г, по данным работы [V-C], приведены в табл. 326.
Т>я б л и ц а 3 2 6. Кристаллическая структура соединений системы Ge—1г
'Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а Ь с
< Gelr MnP оР8, Рпта 0,6281 0,5611 0,3490
Ge4Ir3 — — — — —
!<• G?5Ir4 Ge5Ir4 tP36, Р4с2 0,56123 — 1,8361
Ge7Ir3 Ge7Ir3 с74О, РтЗт 0,8735 — —
Ge4Ir Ge4Tr ЛР15, РЗ, 0,6215 — —
Литера-гура
1. Bhan S., Schubert К. // Z. Metallkunde. 1960. Bd. 51. S. 327-339.
Е.И. Гладышевский, О.И. Бодак, В .К. Печарский
бе—К. ГЕРМАНИЙ-КАЛИЙ
Диаграмма состояния Ge—К (рис. 402) построена в работе [1J с
помощью дифференциального термического анализа. Сплавы получе-
861 сплавлением Ge полупроводниковой чистоты и К чистотой 98,5 %
(по массе) в герметичных тиглях из Nb с внутренними вставками из
MjOg или полукристаллического фианита (ZrO2:Y2O3 = 3:1).
В системе обнаружено три соединения: Ge4K, GeK и GeK3, плавя-
Щиеся конгруэнтно соответственно при ИЗО, 1090 и 890 °C. Эвтекти-
ческие равновесия приведены в табл. 327.
756
Ge—К
Ge К, % (am.) К
Рис. 402. Ge—К
Таблица 327. Нонвариантные реакции в системе Ge—К
Реакции Содержание К в жидкой фазе, % (ат.) Температура, °C
Ж - (Ge) + Ge4K 5 920
Ж * Ge4K + GeK 35 740
Ж ₽ GeK + GeK3 62 575
Ж - GeK3 + К 100 -64 -
Ge—La
757
Соединение GeK имеет кубическую структуру (пр. гр. Р43т,
параметр решетки а = 1,28 нм [2]; соединение KGe4 также относится
к кубической сингонии (пр. гр. РтЗп, параметр решетки а =
« 0,644 нм) [3].
Литература
1 Дриц М.Е., Потемкин В.Ф., Зусман Л.Л. // Изв. АН СССР. Неорганические
материалы. 1982. Т. 18. № 7. С. 367-372.
2. Donald Е. // J. Electrochem. Soc. 1982. V. 129. N 7. Р. 1513-1515.
3. Потемкин В.Ф., Сизов Р.А., Зусман Л.Л., Дриц М.Е. // Изв. АН СССР. Метал-
лы. 1989. № 3. С. 197-199.
Л.Л. Зусман
Ge-La. ГЕРМАНИЙ-ЛАНТАН
Диаграмма состояния системы Ge—La (рис. 403) построена в
работе [1]. Сплавы готовили дуговой плавкой в среде чистого Аг,
используя Ge чистотой 99,99 % (по массе) и La чистотой 99,79 %
(по массе). Гомогенизирующий отжиг проводили в запаянных квар-
цевых ампулах, наполненных Не, или в печи ТГВ в среде Аг. Иссле-
Рис- 403. Ge-La
758
Ge—La
дование выполняли методами микроструктурного, дифференциально-
го термического, рентгенофазового и рентгеноструктурного анализов
В системе обнаружено шесть соединений, два из которых Ge3La'
и Ge2_xLa (х = 0,4) плавятся конгруэнтно соответственно при 1430
и 1500 °C. Соединения GeLa и Ge2_xLa имеют небольшие области
гомогенности, причем последнее соединение имеет две полиморфные
модификации. Нонвариантные реакции в системе Ge—La приведены
ниже:
Ж + Ge3La5 ** GeLa
Ж + Gc3La5 GeLa3
Ge3La5 + GeLa * Ge3La4
Ge3La4 + GeLa * Ge4La5
Ж GcLa3 + (pLa)
Ж pGe2_vLa + (Ge)
Ж ** GeLa + PGe2_xLa
PGc2_xLa + (Ge) ** aGe2_xLa
PGe2_xLa * aGc2_xLa + GeLa
при 1370 °C;
при 850 °C;
при 1325 °C;
при 1290 °C;
при 730 °C;
при 810 °C;
при 1340 °C;
при 445 °C;
при 420 °C.
Взаимная растворимость компонентов при эвтектической темпера-
туре составляет менее 2 % (ат.).
Сведения о кристаллической структуре двойных соединений
системы Ge—La [1,2] даны в табл. 328.
Таблица 3 2 8. Кристаллическая структура двойных соединений
системы Ge—La
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a b c
“ Ge2_ xLa aSi2Cd oZ12, Imma 0,4408 0,4299 1,4095 [И
pGe2_vI.a aSi2Th tl\2, I42/amd 0,4382 — 1,4396 II!
GeLa BFe oP8, Pnma 0,848 0,413 0,613 Hi
Ge4I^5 Ge4Sm5 oP36, Pnma 0,803 1,550 0,813 in
Ge3La4 Th3P4 cI28, 0,9349 — — Hi
Mid
Ge,La5 Si3Mns hP\f>, P f>3/mem 0,896 — 0,676 [21
GeLaj PTi5 IP32, P42/n 1,2739 — 0,6294 III
Ge—Li
159
М$Рат>ра
cki Еоеменко В.Н., Зиоиг Куок Ши, Буянов Ю.И. // Допов1д1 АН УРСР. Сер.
Йз? № 9 С 8!9-823
^*2 Грынив И.А., Печарский В.К., Ярмолюк Я.П. и др. // Кристаллография. 1987.
№ з. с. 781-782.
г’гЖ :;
'jfcPi'-'’ ’ .. ..
Ge^-Li. ГЕРМАНИИ-ЛИТИИ
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Экспериментальная диаграмма состояния Ge—Li построена в
интервале концентраций 0—4,5 % (ат.) Ge и 42—100 % (ат.) Ge в
работе [1]. В качестве исходных материалов были использованы Li
чистотой 99,8 % (по массе) и Ge чистотой 99,99 % (по массе).
Сплавы готовили в тиглях из Fe в атмосфере Аг и исследовали
методами дифференциального термического анализа, металлографии
и рентгеновской дифракции. В работе [2] синтезировано два соедине-
ния Li4„Gen и Li3nGen с температурами плавления 750 ± 10 и 800 +
± 10 °C соответственно и рассчитана линия ликвидуса. В работе |3]
предполагается существование соединений I^Gej (18,5 % (ат.) Ge),
Цдере4 (21 % (ат.) Ge), Li2Ge и неизвестного соединения в концен-
трационном интервале 21—25 % (ат.) Ge.
760
Ge—Lu
Диаграмма состояния Ge—Li (рис. 404) построена по данньщ
работы [1] с учетом сведений из работ [2, 3]. Соединение Li >Ge
плавится конгруэнтно [2], характер плавления другого соединения
не установлен. В системе установлено две эвтектики: при содержании
50 % (ат.) Ge и температуре 528 ± 10 °C [1] и на стороне Li с
температурой, близкой к точке плавления Li. В работе [5] сообщено
о двух новых соединениях Li7Ge2 [4] и 1лцСе6 [5]. Растворимость
Li в (Ge) при температуре 800 °C составляет 1,7- 10—2 % (ат.) [2].
Соединение Li22Ge5 имеет кубическую структуру типа Li22Pb5 с
параметром решетки а = 1,886 нм [31, соединение Li7Ge2 — ром-
бическую структуру (пр. гр. Сттт) с параметрами решетки а =
= 0,924 нм, b = 1,321 йм, с - 0,463 нм [4]. Соединение LiHGe6
обладает ромбической структурой (пр. гр. Стет) с параметр,(ми
решетки а - 0,438 нм, b = 2,455 нм, с = 1,064 нм [5].
Литература
1. Федоров П.И., Молочко В.А. // Изв. Ан СССР. Неорганические материалы.
1966. Т. 2. № 10. С. 1870-1871.
2. Pell Е.М. // J. Phys. Chem. Solids. 1957. V. 3. Р. 74-76.
3. Гладышевский Е.И., Олексеев Г.И., Крипякевич Р.И. // Кристаллография.
1964. № 9. С. 338-341.
4. Hopf V„ Muller W.. Schafer H. // Z. Naturforsch. 1972. Bd. 27. N 10. S. 1157—
1160.
5. Frank U., Muller W. // Z. Naturforsch. 1975. Bd. 30. N 3. S. 313-315.
JI. JI. 3 у сети
Ge-Lu. ГЕРМАНИЙ—ЛЮТЕЦИЙ
Диаграмма состояния Ge—Lu (рис. 405) построена в работе [ 11 по
данным дифференциального термического, микроскопического и
рентгеноструктурного анализов. Сплавы для исследования готовили
в дуговой печи в атмосфере Аг. Исходными материалами служили Lu
чистотой 99,71 % (по массе) и Ge чистотой 99,99 % (по массе).
В системе обнаружено шесть соединений. Соединение Gc3Lu5
плавится конгруэнтно при 2040 °C; соединение Ge5Lu4 образуется по
перитектоидной реакции, остальные — по перитектическим реакциям.
Нонвариантные реакции в системе Ge—Lu приведены ниже:
Ж + Gc3Lu5 ** Ge4Lu5 при 1940 °C;
Ж + Ge4Lu5 « Ge10LuH при 1720 °C;
Ж + Ge10Luu ** Ge2 Lu при 1330 °C;
Ж + Ge2_yLu ** Се2_хЪи при 1065 °C;
Ge10Luu + Gc2_yLu * Ge5Lu4 при 1310 °C;
Сс41дц ** Ge]0Lujj + Ge3Lu5 при 1660 °C;
Ж « Gc3Lu5 + (Lu) при 1400 °C;
Ж * Ge2_xLu + (Ge) при 860 °C.
Ge—Lu
761
405. Ge—Lu
H Oc
ц i Соединение Gej^Lu претерпевает полиморфное превращение при
1030 °C. Взаимная растворимость компонентов в твердом состоянии
^превышает 1 % (ат.).
0,- В табл. 329 приведены данные о кристаллической структуре
^единений системы Ge—Lu [1, 2].
Таблица 32 9. Кристаллическая структура соединений системы Ge—Lu
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b С
Ge3Lu5 Si3Mn5 ЙР16, Р63/ тст 0,824 — 0,617 [2]
Ge4Lu5 Ge4Sm5 оРЪЬ, Рпта 0,745 1,428 0,748 [2]
762
Ge—Mg
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
Gc10Lu,, Ge|0HoH Г/84, /4/ттт 1,063 — 1,578 [2]
Ge2_cI.u Si2Zr оС 12, Стет 0,3987 1,5558 0,3851 [2]
ttGe2_yLu — 0,6629 0,8069 0,7585 [1]
Литература
1. Еременко B.H., Мелешевич К.А., Буянов Ю.И. // Доклады АН УССР. Сер А
1987. № 5. С. 78-82.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вигца школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарс!.;,й
Ge—Mg. ГЕРМАНИЙ—МАГНИЙ
Ge—Мп
763
- Имеющиеся сведения о диаграмме состояния системы Ge—Mg
сррошо согласуются между собой [1]. Диаграмма состояния
[рис. 406) построена по данным работы [2] и дополнена в богатой Mg
области (более 90 % (по массе) Mg) данными работы [3].
В системе образуется одно промежуточное соединение — Mg2Ge,
плавящееся конгруэнтно при 1117 °C и образующее эвтектики с
исходными элементами. Эвтектика (Ge) + Mg2Ge имеет место при
температуре 697 °C и содержании 35,7 % (ат.) Mg, другая эвтектика
(Mg)+ Mg2Ge образуется при температуре 636 °C и содержании
1,15 % (ат.) Ge [3] или 1,2—1,5 % (ат.) Ge 11].
Взаимная растворимость компонентов незначительна. По данным
рентгеновского исследования, растворимость Ge в (Mg) при темпера-
туре 602 °C составляет 0,003 % (ат.) [1].
Соединение Mg2Ge имеет кубическую структуру типа CaF2 с
параметром решетки по данным различных работ, колеблющимся от
0,6370 до 0,6393 нм [1].
Литература
1. Nayeb-Hashemi A.A., Clark J.B., Olenski R.W., Abbaschian G.J. // Bull. Alloy
Phase Diagrams. 1984. V. 5. N 4. P. 359—365.
2. Geffken R„ Miller E. 11 Trans. AIME 1968. V. 242. N 11. P. 2323-2328.
3. Klemm W., Westlinning H. // Z. Anorg. All. Chem. 1941. Bd. 245. N 4.
S. 365-380.
Л.Л. Рохлин
Ge—Мп. ГЕРМАНИЙ-МАРГАНЕЦ
Диаграмма состояния Ge—Мп (рис. 407) представлена в обзорной
работе [1], в которой проанализировано 47 источников.
В системе установлено шесть соединений. Соединения Mn3 4Ge,
Mn5Ge2, Mn2Gc, Mn5Gc3 плавятся конгруэнтно при 930, 953, 965 и
966 °C соответственно. Соединение Mn3Gc2 образуется по перитекти-
ческой реакции, соединение Mn7Gc3 — по перитектоидной реакции,
однако относительно последнего соединения автор настоящего обзора
Разделяет мнение, изложенное в работах [2, 3J, о том, что оно,
скорее, является низкотемпературной модификацией фазы Mn5Ge2.
Реакции образования остальных соединений, а также эвтектические
равновесия, имеющие место в системе, приведены в табл. 330.
Максимальная растворимость Ge в 5 Мп составляет около 5 %
(ат.) при температуре перитектической реакции; максимальная рас-
творимость Ge в уМп не превышает 13 % (ат.); максимальная рас-
творимость Ge в рМп и аМп составляет соответственно -9 и -1,3 %
(ат.).
В табл. 331 приведены сведения о кристаллической структуре
Двойных соединений.
IM
Ge—Мп
0 fO ZO 30 90 50 60 10 во 90 100
Mn Ge,°/a(ani.) Ga
Рис. 407. Ge—Мп
Таблица 3 3 0. Нонвариантные реакции в системе Ge—Мп [1]
Реакции Содержание Ge в жидкой фазе, % (ат.) Темпера:' ра, °C
Ж + MnsGe3 •* Mn3Ge2 52; 38; 40 796
Ж ** (Ge) + Mn^GCj 57; -100; 40 720
Ж ₽ Mn5Ge3 + Mn2Ge 35,6; 37; 34 948
Ж •* GeMn + Mn5Ge2 30,5; 30,0; -32 935
Ж » Mn5Ge2 + Mn3 4Ge 24; 28; -23,5 912
Ж » (уМп) + Mn3 4Ge 22,4; 13,5; 22,5 918
Mn2Ge ₽ Mn5Ge3 + Mn5Ge2 33,4; -37; 29,5 790
Mn5Ge3 + Mn5Ge2 ₽ Mn7Ge3 -37; -29; 30 690
Mn5Ge2 » Mn3 4Ge + Mh7Ge3 28,6; 23,5; 30 620 ——1
Ge—Mo
765
Таблица 33 1. Кристаллическая структура двойных соединений
системы Ge—Мп
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b с
Mn5Ge3 Mn,Si3 АР16, 0,7188 — 0,5037 [4]
Pf^/mcm 0,7184 — 0,5053 [5]
MnuGeg Cr„Ge8 оР16, 1,322 1,583 0,509 [6]
(Mn3Ge2) Рпта
Mnj^GetBT) Ni3Sn hP8, Р6}/ттс 0,2668 — 0,43309 [4]
Mn34Ge(HT) Al3Ti tIS, /4/ттт 0,3803 — 0,3618 [4]
Mn5Ge2 — /гР128, 0,7186 — 1,30 [4]
Р3с1
*При концентрации 22,7 % (ат.) Ge.
Литература
1. Gokhale А.В., Abbaschian R. 11 Bull. Alloy Phase Diagrams. 1990. V. 11. N 5.
P. 460-468.
2. Zwicker U., Jahn E„ Schubert K, // Z. Metallkunde. 1949. Bd. 40. S. 433—436.
3. Laridjani M„ Bigare M., Guiner A. // Mem. Sci. Rev. Met. 1970. V. 76. N 10.
P. 675-679.
4. Ohoyama T. // J. Phys. Soc. Japan. 1961. V. 16. P. 1995—2002.
5. Castelliz L. // Z. Metallkunde. 1955. Bd. 46. N 3. S. 198-203.
6. Vollenkle H., Wittmann A., Nowotny H. // Monatsh. Chem. 1964. Bd. 95.
Spl544—1549.
J '
З.М. Алексеева
Ge-Mo. ГЕРМАНИЙ—МОЛИБДЕН
। Диаграмма состояния Ge—Mo (рис. 408) построена в работе [1 j по
Данным металлографического и рентгеновского анализов. Сплавы для
Исследования готовили из Ge и Мо чистотой 99,95 % (по массе).
> В системе обнаружено четыре соединения GeMo3, Ge3Mo5,
Ge23Mo13 [2J (в работе [1] оно обозначено как Ge3Mo2) и Ge2Mo,
Образующиеся по перитектическим реакциям соответственно при
1800, 1730, 1520 и < 1100 °C (или 1080+15 °C [3]). Реакции образо-
вания этих соединений и другие нонвариантные равновесия, имею-
°(Ие место в системе, приведены в табл. 332.
Соединение Ge23Mo13 имеет небольшую область гомогенности от
66 До 37 % (ат.) Мо.
766
Ge—Mo
Рис. 408. Ge-Mo
7’ а б л и ц a 3 3 2. Нонвариантные реакции в системе Ge—Мо [1]
Реакции Содержание Mo в фа- зах, % (ат.) Темпера гз ра, °C
Ж + (Мо) •* GcMOj 60; -95, 75 1800
Ж + GeMoj ₽ Ge3Mo5 50; 75; 62,5 1730
Ж + GejMoj »* Gc2jMoh 20; 62,5 36,1 1520
Ж к Ge23MoH •* Ge2Mo -5; 36,1; 33,3 1083
Ж (Ge) + Ge2Mo -; -; 33,3 935
Растворимость Мо в твердом Ge незначительна; растворимость Ge
в (Мо) при перитектической температуре (1800 °C) составляет нс
менее 5 % (ат.).
В табл. 333 сведена также информация о кристаллической струк-
туре двойных соединений [1, V-CJ.
Соединение pGe2Mo образуется при давлении выше 2,0 ГПа и
нагреве выше 1000 °C в течение 5 ч [6}. По другим сведениям |41
соединение pGc2Mo было получено путем быстрой закалки от 1350 С
сплава с 40 % (ат.) Мо при атмосферном давлении.
Ge—Mo
767
Таблица 33 3. Кристаллическая структура двойных соединений
системы Ge—Мо
Соединение Прототип Символ Пирсона, пр, гр. Параметры решетки, нм Источник
а b с
GeMo3 W3O оР32, РтЗп 0,49330 — — (И
Ge3Mo5 W5Si3 (732, РЬ^/тст 0,9837 — 0,4973 [1]
0,982 — 0,497 [4]
Ge23MoI3 Ge23Mo13 tP\M, 0,599 — 6,354 (2J
Р4п2
Ge2Mo PbCl2 оР 12, Рпта 0,6342(2) 0,3451(1) 0,8582(2) [5]
pGe2Mo — 14/ттт 0,3322(3) — 0,8219(3) [6]
В работе [7] установлено, что переход из аморфного состояния в
кристаллическое пленок сплавов Ge—Мо происходит при температуре
выше 3000 °C.
Термодинамические свойства сплавов системы Ge—Мо обобщены
i в работе [8].
п
Литература
. , l.StecherP., Benesovsky F„ Nowotny Н. // Monatsh. Chem. 1963. Bd. 94.
L 1154-1162.
] 2. Vflllenkle H., Wittmann A., Nowotny H. // Monatsh. Chem. 1964. Bd. 95.
p. 1544-1549.
3. Peavler R.J., Beck C.G. 11 J. Phys. Chem. 1959. V. 63. P. 2058-2059.
| 4. Searcy A.W., Pealver R.J. // J. Am. Chem. Soc. 1952. V. 74. P. 566—567.
I.. 5. Brown A. // Nature. 1965. V. 206. P. 502-503.
6. Агошков B.M., Горбатенков В.Д., Попова В.С., Фомичева Л.Н. // J. I>ess
Common Met. 1981. Т. 78. С. 235-243.
. 7. Bosnell J.R., Voisey U.C. // Thin Solid Films. 1970. V. 6. P. 161-166.
8. Olesinski R.W., Abbaschian G.J; // Bull. Alloy Phase Diagrams. 1987. V. 8. N 1.
P. 53-56.
КБ. Поварова
768
Ge—N, Ge—Na
Ge—N. ГЕРМАНИЙ—АЗОТ
Диаграмма состояния Ge—N не построена.
Достоверно установлено соединение Ge3N4, существующее в двух
полиморфных модификациях. При нагреве до 900 °C при атмосфер-
ном давлении Ge3N4 разлагается на элементы [1]. В работе |\’|
сообщено о существовании соединения Ge3N2. Методы получения и
свойства нитридов германия изложены в [2].
Обе модификации соединения Ge3N4 имеют гексагональную
структуру: aGe3N4 — типа aSi3N4 (символ Пирсона ЛР28, пр. гр.
Р31с, параметры решетки а = 0,8202(4) нм, с = 0,5941(3) нм>,
pGe3N4 — собственного типа (пр. гр. параметры решетки а =
= 0,8038(4) нм, с = 0,3074(2) нм) [3]. Данные о ромбической струк-
туре соединения Ge3N4, приведенные в работе [3], в более поздних
работах не подтверждены.
Литература
1. Лютая М.Д., Самсонов Г.В., Хохряков О.Т. // Журнал неорганической химии.
1964. Т. 9. С. 831-833.
2. Самсонов Г.В. Нитриды. Киев: Наукова думка, 1969. 380 с.
3. Ruddlesden S.N., Popper Р. // Acta Crystallog. 1958. V. 11. С. 465—468.
Ю.Б. Кузьма
Ge—Na. ГЕРМАНИЙ—НАТРИЙ
Рис. 409. Ge—Na
'Т Ge—Nb 769
Диаграмма состояния Ge—Na (рис. 409) построена в работе [1].
- Сплавы для исследования синтезировали в инертной атмосфере в
герметизированных ниобиевых тиглях с внутренними вставками из
, А^з или поликристалличсского фианита, в качестве исходных
Материалов служили Ge полупроводниковой чистоты и Na чистотой
99,8 % (по массе). Сплавы исследовали методом дифференциального
термического анализа.
В системе обнаружено два соединения GeNa и GeNa3, плавящиеся
конгруэнтно соответственно при 1160 и 820 °C. В работе [2]
\ обнаружено еще одно химическое соединение Ge4Na, показанное на
рис. 409 штриховой линией.
Соединение GeNa имеет моноклинную структуру (пр. гр. P2j/c,
параметры решетки а = 1,233 нм, b = 0,670 нм, с = 1,142 нм, 0 =
» 119,9 °) [31. Структура GeNa3 не определена. Соединение Ge4Na
имеет кубическую структуру (символ Пирсона сР8, пр. гр. РтЗп,
параметр решетки а = 0,640 нм).
. Литература
1. Дриц М.Е., Потемкин В.Ф., Зусман Л.Л. // Изв. АН СССР. Неорганические
материалы. 1982. Г. 18. № 7. С 1148-1150.
2. Потемкин В.Ф., Сизов Р.А., Зусман Л.Л., Дриц М.Е. // Изв. АН СССР.
' Металлы. 1989. № 3. С. 197-199.
3. Witte J„ Schnering H.G. П L. Anorg. All. Chem. 1964. Bd. 327. S. 260-273.
: Л.Л. Зусман
- Ge-Nb. ГЕРМАНИЙ-НИОБИЙ
J Диаграмма состояния Ge—Nb построена в широком интервале
£ концентраций в работах [1, 2]. Сплавы плавили в дуговой печи в
Ж атмосфере Аг, используя Nb чистотой 99,6 % (по массе) и Ge чисто-
w той 99,995 % (по массе) [1J; в работе [2] использовали порошкооб-
разный Nb чистотой 99,95 % (по массе) и спектрально-чистый Ge.
^Исследования сплавов выполняли методами микроструктурного,
1 рентгеновского и дифференциального термического анализов, в
©работе [2] использовали также микрорентгеноспектральный анализ
«и измерение твердости.
Б Диаграмма состояния Ge—Nb (рис. 410) характеризуется наличи-
Вем трех интерметаллических соединений, два из которых Nb5Ge3 и
wNbGe2 плавятся конгруэнтно соответственно при 2180 ± 10 °C [2]
Ж (или 2150 °C [1]) и 1680 °C [2]. Реакция образования соединения
кNb3Ge, а также эвтектические реакции, имеющие место в системе,
№ приведены в табл. 334.
1 25 Зак. 2144
no
Ge-Nb
Рис. 410. Ge—Nb
Таблица 33 4. Нонвариантные реакции в системе Ge—Nb
Реакция Содержание Ge в фа- Темпера г. ра, °C
зах , % (ат.)
Ж + (Nb) ₽ Nb3Ge 22; 11,5; 18 1900
Ж ₽ (Nb3Ge) + Nb5Ge3 27; 23; 38 1865
Ж •* (Nb5Ge3) + NbGe2 58; 43; 1580
Ж ₽ (NbGe2) + Ge -100; — — -930*
Температура эвтектики скорректирована в соответствии с температурой план
ления Ge, в работе [1] приводится значение 950 °C.
Растворимость Ge в Nb составляет 11,5 ± 1 % (ат.) при 1900 С
(при этом параметр решетки уменьшается от 0,3300 нм — чистый
Nb — до 0,3294 нм) и 4 ± 1 % (ат.) при 1000 °C [2]. Растворимость
Nb в Ge крайне мала [1]. Протяженность области гомогенности
соединения Nb3Ge изменяется с температурой следующим образом:
Температура, °C ................... 1865 1650 1600 1600
Содержание Ge, % (ат.) ............. 18 ± 0,5 - 23 ± 1 16-21 18-20 15-22
Источник .......................... (2] [1] [2] |31
Ge-Nb
771
При 1000 °C протяженность области гомогенности соединения
GeNb3 не превышает 1 % (ат.) [2]. В табл. 335 приведены сведения
о кристаллической структуре двойных соединений [2, 3, 4, 5].
Таблица 33 5. Кристаллическая структура двойных соединений
системы Ge—Nb
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Примечание
а С
GejNb CrSi2 ЛР9, 0,4966 0,6787 [2]
Р6222 0,4943 0,6778 [4]
При концен- трации Ge, % (ат.) [2]:
Ge3Nb5 W5Si3 t/32, 1,0165 0,5138 38
14/mcm 1,0127 0,5168 44
При концен- трации Ge,
% (ат.):
GeNb3 Cr3Si сРЪ, 0,5156 — 23 [2]
РтЗп 0,5172 — 18 Г2]
0,5177 15 [3]
0,5167 22 [3]
Ge2Nb3 Mn5Si3 hPlf>, Р63/тст 0,7774 0,5404 [5]
В работах [1, 2] указывается на существование еще одного интер-
металлического соединения Ge2Nb3 в системе Ge—Nb. В работе [5]
методом рентгеновского анализа исследованы образцы с 35—50 %
(ат.) Ge, полученные совместным напылением Nb (99,99 %) и Ge
(99,999 %) на подложку. Было предположено, что фаза Ge2Nb3 либо
метастабильна, либо стабилизируется примесями внедрения.
Литература
1. Пан В.М., Латышева В.И., Шишкин Е.А. // Металловедение, физико-химия
и металлофизика сверхпроводников: Сб. статей. М.: Наука, 1967. С. 157—160.
2. lorda J.L., Fliikiger R., Muller J. // J. Less-Common Met. 1978. V- 62. P. 25—37
3. Carpenter J.H. 11 J. Phys. Chem. 1963. V. 67. P. 2141-2144.
4. Brixher L.H. // J. Inorg. Nucl. Chem. 1963. V. 25. P. 257-260.
5. Kloska M., Haase E.L. 11 J. Less-Common Met. 1984. V. 99. N 2. P. 241-248.
E.H. Шефтель
25»
772
Ge—Nd
Ge—Nd. ГЕРМАНИЙ—НЕОДИМ
Диаграмма состояния Ge—Nd (рис. 411) построена в работе Ц]
Сплавы для исследования плавили в дуговой печи в инертной атмо-
сфере; гомогенизирующий отжиг проводили в запаянных кварцевых
ампулах, заполненных Не. Исследование выполняли методами диф-
ференциального термического, микроскопического и рентгенострук-
турного анализов. Чистота исходного Ge составляла 99,99 % (по
массе) и исходного Nd — 99,34 % (по массе).
Рис. 411. Ge—Nd
В системе обнаружено четыре соединения. Соединения Ge^Nd^- i’
Ge2_xNd плавятся конгруэнтно соответственно при 1580 и 1487 С-
Реакции образования остальных соединений, а также эвтектические
реакции и другие нонвариантные равновесия, имеющие место (’
системе, приведены в табл. 336 [1].
Ge—Nd
773
T а б л и Ц a 336. Нонвариантные реакции в системе Ge-Nd
- Реакция Содержание Ge в фа- зах, % (ат.) Температу- ра, °C
+ GejNdj >* Ge4Nd5 49; 37,5; 44,4 1490
ЯС + GiaNdj « GeNd 51,5; 44,4; 50 1397
ЯС * Ge3Nd5 + (aNd) 10; 37,5; <2 825
ЯС * Ge2_ANd + GeNd 52; 62,6; 50 1390
ЯС * Ge2_xNd + (Ge) 84; 62,6; <98 828
(pe) + ₽Ge2_zNd » aGe2_xNd -100; 62,6; 61 680
pGe2_xNd ₽ GeNd + aGe2_xNd 50; — 615
(0Nd) * («Nd) + Ж 7 858
Для всех германидов Nd обнаружены незначительные области
гомогенности, которые включают стехиометрические составы. Взаим-
ная растворимость компонентов при эвтектических температурах
составляет менее 2 % (ат.).
В табл. 337 приведены сведения о кристаллической структуре
двойных соединений [2].
Таблица 337. Кристаллическая структура двойных соединений
системы Ge—Nd
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b С
Ge3Nd5 Si3Mn5 API 6, Р63/ тст 0,875 — 0,655
Ge4Nd5 Ge4Sm5 оРЗв, Рпта 0,785 1,510 0,794
GeNd BCr оС8, Стет 0,442 1,097 0,404
PGe2_xNd aSi2Th tlt2, I4x/amd 0,423 1,415
aGe2_xNd aSi2Gd 0112, Imma 0,422 0,417 1,403
Литература
1. Еременко В.Н., Баталин В.Г., Буянов Ю.И. // Изв. АН СССР. Неорганические
Материалы. 1974. Т. 10. № 8. С. 1384-1388.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В. К. Печарский
774
Ge-Ni
Ge-Ni. ГЕРМАНИЙ-НИКЕЛЬ
Диаграмма состояния Ge—Ni исследовалась неоднократно [X, i
2]. На рис. 412 приведен обобщенный вариант диаграммы, построен-
ный в работе [3] на основании данных работ fl, 2, 4].
бе, % (по массе)
В системе обнаружено девять соединений. Соединения pNi3Ge и
eNi5Ge3 плавятся конгруэнтно соответственно при 1132 и 1185 С-
Эти соединения имеют большие области гомогенности. Соединение
|3Ni3Ge при всех температурах существует в концентрационном
интервале 22,5—25 % (ат.) Ge; область гомогенности соединения
Ge-Ni
715
Ej4i5Ge3 максимальна при 1050 °C (33,0—38,8 % (ат.) Ge). Соедине-
яйе eNi5Ge3 претерпевает полиморфное превращение.
реакции образования остальных соединений, а также эвтектиче-
реакции и другие нонвариантные равновесия, имеющие место
в системе, приведены в табл. 338.
Таблица 33 8. Нонвариантные реакции в системе Ge—Ni [3]
Реакция Содержание Ge в фа- зах, % (ат.) Температу- ра, °C
Ж + Ni3Ge2 ₽ NiGe 54,5; -45; 50 850
Ж + Ni19Ge12 Ni3Ge2 47; -41,5; -41,7 990
Ж + eNi5Ge3 ₽ Ni19Gel2 -45,5; 38,8; 39 1050
Ж +yNi3Ge >* SNi5Ge2 28,9; 25,6; 28 1102
Ж + ₽Ni3Ge ₽ yNi3Ge 27,3; -25; -25,6 1118
eNi5Ge + ₽Ni3Ge >* Ni2Ge 34,5; 25; 33,5 506
yNi3Ge ₽ pNi3Ge + 6Ni3Ge3 25,6; -25; 28 1082
dNi^Gez ** pNi^Gc + eNi^Ge^ 28; 25; 33,6 1045
Ni3Ge2 e Ni,9GC|2 + NiGe -39,6; -39,2; 50 515
eNi5Ge3 ₽ Ni19Ge,2 + e'Ni5Ge3 -37,7; -38; -37,5 394
NiI9Ge12 » NiGe + e'Ni5Ge3 -38,2; 50; -37,6 382
eNijGe3 •* Ni2Ge + e'Ni5Ge3 36,3; 33,5; 37 290
Ж - (Ni) + pNi3Ge 23; -16; -23,3 1124
Ж * dNi5Ge2 + cNi5Ge3 29; 28; 33,6 1099
Ж » NiGe + (Ge) 67; 50; -100 762
Соединения Ni2Ge и Ni19Ge12 имеют области гомогенности,
протяженности которых не установлены. Максимальная раствори-
мость Gc в (Ni) при температуре 1124 °C составляет 16 % (ат.).
Растворимость Ni в Ge незначительна.
В табл. 339 приведены данные по кристаллической структуре
соединений [V-C].
Таблица 33 9. Кристаллическая структура соединения системы Ge—Ni
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b с
NiGe MnP оР8, Рпта 0,5389 0,3438 0,5820
Ni3Ge2 NiAs hP4, Pf^/mmc 0,386 — 0,500
пь
Ge—О
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм ~
а Ь с
Ni,9Ge,', Ge,2Ni|9 тС 62, С2 1,1631 0,6715 1,0048 "
eNi5Ge3 NiAs /гР4, Pf>3/mmc 0,3955 — 0,5046
ezNi5Gej * Ge3Ni5 тС32, сг 1,1682 0,6737 0,6264
Ni2Ge SiCO2 оР\2, Рпта 0,5113 0,3830 0,7264
Ni,Ge*’* — С2/т 1,013 0,780 0,683
SNi5Ge2 Sb2Pd5 /1Р84, РЬ3! ттс 0,6827 — 1,2395
^Ц?Ое13 (yNi3Ge) NaTl eFib, Fd3m 0,57436 — —
PNijGe AuCu3 cP 4, РтЗт 0,3566 — —
* p = 90,0°. ’* p= 52,11°. *“ p = 90,4°.
Литература
1. Eliner М., GOdecke Т., Schubert К. /1 J. Less-Common Met. 1971. V. 24. x 1.
P. 23-40.
2. Dayyer A., Feschotte P. // J. Less-Common Met. 1980. V. 72. N 1. P. 51—70
3. Nash A., Nash P. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 3. P. 255-264
4. Ruttewit K„ Masing G. // Z. Metallkunde. 1940. Bd. 32. S. 51—61.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Ge-O. ГЕРМАНИЙ—КИСЛОРОД
Информация о взаимодействии Ge с О собрана в работах |Х, ’).
1Щ. Диаграмма состояния Ge—О в области составов Ge—GeO2
(рис. 413) построена в работе [1] и уточнена в работе [2]. Соедине-
ние GeO термодинамически нестабильно в твердом состоянии, соеди-
нение GeO2 имеет две модификации. Жидкий оксид GeO2 может
быть переохлажден, становясь стеклообразным. Путем измерение
абсорбции инфракрасных спектров в работе [3] определена раствори-
мость О в (Ge):
Температура, “С ......................
Растворимость О, 10~3 % (ат.) ........
940 900 800 750 700 6'1’
6,7 4,0 1,4 0,75 0,34 0,1*
Ge—Os
777
Рис. 413. Ge—О
Низкотемпературная модификация GeO2 имеет гексагональную
структуру типа а-кварца (символ Пирсона hJP9, пр. гр. Р3221), пара-
метры решетки а = 0,4987 нм, с = 0,5652 нм [Э]. Высокотемператур-
ная модификация GeO2 имеет тетрагональную структуру типа рутила
(символ Пирсона tP6, пр. гр. Р42/тпт), параметры решетки а =
“0,4395(3) нм, с = 2860(3) нм [4].
Литература
1. Candidus E.S., Thuomi D. // J. Chem. Phys. 1955. V. 23. P. 588.
2. Trumbore F.A., Thurmond C.E., Kowalchik M. // J Chem. Phys. 1956. V. 24.
₽ 1112.
3. Kaiser W„ Thurmond C.E. // J. Appl. Phys. 1961. V. 32. P. 115—118.
4. Bauer W.H. // Acta Crystallog. 1956. V. 9. P. 515-520.
Л.С. Гузей
Ge-Os. ГЕРМАНИЙ-ОСМИЙ
Диаграмма состояния Ge—Os не построена. В системе обнаружено
несколько промежуточных соединений [X, Э], но способ приготовле-
ния и чистота исходных материалов не указаны. Сплавы исследовали
рентгеновским методом, результаты приведены в табл. 340 [V-C].
778
Ge-P
Таблица 3 4 0. Кристаллическая структура соединений системы Ge—Os
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а Ь с
Ge30s2 — — 1,1511 — 0,9267
Ge30s2 Si3Ru2 оР40, Pbcn 1,1544 0,9281 0,5783
Ge20s* Ge2Os тС 12, С2/т 0,8995 0,3094 0,7685
’р - 119,16°.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарс^.щ
Ge-P. ГЕРМАНИЙ-ФОСФОР
Информация о взаимодействии Ge с Р приведена в работах [X,
III]. Диаграмма состояния Ge—Р (рис. 414) построена в работе |11.
Сплавы исследованы с помощью дифференциального термического
анализа.
Р,% (по пассе)
Рис. 414. Gc-P
В системе обнаружено одно соединение, образующееся по перитек
тической реакции при температуре 725 °C и содержании =63 % (ат.)
Р: Ж + Ge « GeP.
Ge—Pb
779
растворимость P в Ge составляет 0,10 % (ат.) при 900 °C, 0,14 %
(ат.) при 850 °C; 0,2 % при 800 °C; 0,39 % (ат.) при 700 °C; 0,45 %
(ат.) при 600 °C (максимум) и 0,38 % (ат.) при 500 °C [Ш].
Соединение GcP имеет структуру типа GaTe (символ Пирсона
znC24, пр. гр. С2/т), параметры решетки а = 1,514 нм, b =
-0,3638 нм, с = 0,991 нм, р = 101,1° [2].
В диапазоне давлений 1—5 ГПа и температур 600—1500 °C соеди-
нение GeP имеет искаженную структуру типа сфалерита (символ
Пирсона cF%, пр. гр. Г 4 Зт), с параметрами решетки а = 0,5581 нм,
с ₽ 0,5463 нм; получено также соединение GeP2 с параметром а =
- 0,5619 нм [3].
При высоких давлениях и температурах согласно работе [4] у GcP
обнаружена структура типа AsGe (символ Пирсона (/4, пр. гр.
/4mm), параметры решетки а = 0,3544 нм, с = 0,5581 нм); кроме
того, обнаружено два новых соединения с ромбоэдрической структу-
рой: GeP3 с параметрами решетки а = 0,7050 нм, с = 0,9932 нм и
GeP5 с параметрами а = 0,3467 нм, с = 1,004 нм.
Литература
1. Гончаров Е.Г., Соколов Л.И., Угай Я.А. // Журнал неорганической химии.
1975. Т. 20. № 9. С. 2453-2455.
2. Wadsten Т. // Acta Chern. Scand. 1967. V. 21. N 2. P. 593-594.
3. Ogusi D., Namikava R., Tanaka J. // J. Chem. Soc. Japan. Pure Chem. Sec. 1968.
V. 89. N 8. P. 746-752.
4. Donohue P.C., Young H.S. // J. Solid State Chem. 1970. V. 1. N 1. P. 143-149.
Ю.Б. Кузьма
Ge—Pb. ГЕРМАНИЙ-СВИНЕЦ
Информация о взаимодействии Ge с РЬ приведена в работах [X,
Э]. Обобщенная диаграмма состояния Ge—Pb (рис. 415) построена в
работе [1]; кривую ликвидуса рассчитывали в предположении модели
псевдорегулярных растворов. Диаграмма состояния демонстрирует
простую эвтектику с отсутствием взаимной растворимости компонен-
тов в твердом состоянии и неограниченной растворимостью в жидком
состоянии. Положение вырожденной эвтектической точки, по данным
Разных исследователей, меняется от 0,02 % (ат.) Ge согласно экспе-
рименту, проведенному в работе [2], до 0,07 % (ат.) Ge согласно
расчету; ее температура только на 0,1 °C (эксперимент [2]) или
0,4 °C (расчет) ниже температуры плавления РЬ.
780
Ge-Pd
Рис. 415. Ge-Pb
Литература
1. Olesinski R.W., Abbashian G.J. // Bull. Alloy Phase Diagrams. 1984. V. 5 \ 4.
P. 374-377.
2. Trumbore F.A. // Bell System Techn. J. 1960. V. 39. P. 205-233.
Е.И. Гладышевский, О.И. Бодак, Б.К. Печарский
Ge-Pd. ГЕРМАНИЙ-ПАЛЛАДИЙ
Диаграмма состояния Ge—Pd (рис. 416) построена в работе 111-
Сплавы синтезировали в кварцевых ампулах в атмосфере Аг, отжи-
гали при 1350 °C в течение 30 мин и закаливали в холодной воде. В
качестве исходных материалов использовали Ge и Pd чистотой не
менее 99,9 % (по массе) основного металла. Исследование выполняли
методами металлографического, термического и рентгеноструктурного
анализов.
В системе обнаружено пять соединений. Соединения GcPd2 и
GePd плавятся конгруэнтно соответственно при 1295 °C и 830 °C,
остальные образуются по перитектическим реакциям:
Ж + (Pd) « pGePd5 при 840 °C;
Ж + Ge2Pd5 * GcPd3(Ge9Pd25) при 970 °C;
Ж + GePd2 « Ge2Pd5 при 990 °C.
Ge—Pd
781
Рис. 416. Ge—Pd
В системе протекают три эвтектические реакции:
Ж aGePd5 + pGePd3 при 760 °C и -19 % (ат.) Ge;
Ж * GePd2 + GePd при 815 °C и -46 (ат.) Ge-
Ж « GePd + (Ge) при 725 °C и -64 % (ат. Ge.
Соединение GePd5 существует в двух модификациях.
Низкотемпературная модификация образуется при 800 °C по
Перитектической реакции (pGePd5) + Ж (aGePd5). Высокотемпера-
турная модификация при 775 °C распадается по эвтектоидной реак-
ции |JGePd5 (Pd) + (aGePd5). Соединение GePd3 также имеет две
Модификации; температура полиморфного перехода варьируется от
600 до 550 °C; высокотемпературная модификация обозначена как
782
Ge—Pr
Ge9Pd25. В табл. 341 приведены сведения о кристаллической структс-
ре соединений [V-CJ. Соединения Ge8Pd2( и Ge4Pd21 не отражены
на рис. 416. Структура соединения Ge2Pd5 неизвестна.
Таблица 341. Кристаллическая структура соединений системы Ge—Pd
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b с
GePd MnP оР8, Pnma 0,5782 0,3481 0,6259
GePd2 pf2 hP9, Р62т 0,6712 — 0,3408
Ge9Pd25 Ge9Pd25 КР34, РЗ 0,7351 — 1,0605
GegPd21 PtgAl2, tn 16, /4,/а 1,3067 — 1,0033
GePdj* AsPd5 тС24, С2 0,5509 0,7725 0,8375
Ge4Pd2l *P = 98,09 W сП 2, 1тЗт 0,3085 — —
Литература
1. Khalaff К., Schubert К. // Z. Metallkunde. 1974. Bd. 65. N 5. S. 379-382.
Е.И. Гладышевский, О.И. Бодак, Б.К. Печарски.;
Ge—Pr. ГЕРМАНИЙ—ПРАЗЕОДИМ
Сведения об образовании соединений в системе Ge—Pr приведены
в работах |Х, Э, Ш]. Диаграмма состояния Ge—Pr (рис. 417) постро
ена в работе [1] на основании результатов работы [2] с небольшой
корррсктировкой. Сплавы плавили в дуговой печи в инертной атмо
сфере. В качестве исходных материалов использовали Ge чистотой
99,99 % (мае.) и Рг чистотой 99,84 % (мае.). Гомогенизирующим
отжиг проводили в кварцевых ампулах, наполненных Не. Исследова-
ние выполняли методами дифференциального термического, микрос-
копического и рентгеноструктурного анализов (2].
В системе обнаружено восемь соединений. О семи соединениях
сообщается в работе [2] и об одном Ge2Pr — в работе [1]. При этом
область гомогенности Ge2Pr находится в пределах 66,44—66,86 %
(ат.) Ge, тогда как область гомогенности Ge2_xPr находится в предо-
Ge—Pr
783
Ge,°/o (no массе)
Рис. 417. Ge-Рг
лах 61—62,6 % (ат.) Ge. Соединения Gc3Pr5 и Ge2_xPr плавятся
конгруэнтно соответственно при 1490 и 1506 °C. Реакции образова-
ния остальных соединений, а также прочие нонвариантные равнове-
сия, имеющие место в системе, приведены в табл 342 [1]. Превра-
щение 0Ge2 „Рг * aGe? „Рг протекает в интервале температур
548-615 °C.
Таблица 342. Нонвариантные реакции в системе Ge—Pr
Реакция Содержание Ge в фа- зах, % (ат.) Температу- ра, “С
Ж + Ge3Pr5 » GePr3 15,37; 37,7; 25 800
Ж + Ge3Pr5 » Ge3Pr4 44,5; 37,7; 42,9 1465
Ж + Ge3Pr4 « Ge4Pr5 48,8; 42,9; 44,4 1430
Ж + Ge4Pr, •* GePr -50,2; 44,4; 50 1400
Ж + pGe2_xPr » GePr,_y 51,5; 61; 51,6 1360
Ж •• GePr3 + (aPr) 12; 25; 0 755
Ж ° GePf|_y + GePr 51,2; 51,6; 50 1320
Ж « pGe2_xPr + (Ge) 84,5; 62,6; -98,8 830
₽Ge2_(Pr + <Ge) - Ge2Pr 62,6; -100; 66,7 615
(РРг) = (aPr) + Ж -1,85; -0; 8,4 774
784
Ge—Pr
Растворимость Рг в Ge составляет ~2 % (ат.) при эвтектической
температуре и уменьшается до менее чем 0,5 % (ат.) при темпера-
туре 700 °C.
В табл 343 приведены сведения о кристаллической структуре
двойных соединений [3, 4].
Таблица 343. Кристаллическая структура соединений системы Ge—Рг
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
a b c
GePr3 Ti3P /Р32, P42/n 1,2422 — 0,6118
Ge3Pr5 Si3Mns API 6, Р6ъ/тст 0,8818 — 0,6686
Ge3Pr4 Th3P4 <728, 0,9153 —
I43d
Ge4Pr5 Ge4Sm5 оРЗб, Pnma 0,807 1,534 0,808
GePr BCr oC8, Cmcm 0,4468 1,1079 0,4041
GePr^, BFe oP8, Pnma 0,829 0,404 0,599
рСе2_лРг‘* aSi2Th tl\2, I4jamd 0,443 — 1,400
aGe2_xPr" aSi2Cd o/12, Imma 0,427 0,418 1,422
Ge2Pr aSi2Th 1/12, Ibjamd — — —
'При концентрации 51,6 % (ат.) Ge. При концентрациях 61—62,6 % (ат.) Ge.
Литература
1. Gokhale А.В., Munitz A., Abbaschian G.J. // Bull. Alloy Phase Diagrams. 1989
V. 10. N 3. P. 241-246.
2. Еременко B.H., Ши Зыонг Куок, Буянов Ю.И., Харькова А.М. // Изв. ЛИ
СССР. Неорганические материалы. 1975. Т. 11. № 1. С. 170—172.
3. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедип<
ний редкоземельных металлов. Львов: Виш,а школа, 1982. 255 с.
4. Гринив И.А., Печарский В.К., Ярмолюк Я.П. и др. // Кристаллография. 1987
Т. 32. № 3. С. 781-782.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарскиа
Ge—Pt
785
Ge—Pt. ГЕРМАНИЙ—ПЛАТИНА
Диаграмма состояния Ge—Pt (рис. 418) построена в работе [1].
Сплавы для исследования готовили в дуговой печи в атмосфере Аг из
Се чистотой 99,999 % (по массе) и Pt чистотой 99,9 % (по массе).
Исследования проводили методами металлографического, термиче-
ского и рентгеноструктурного анализов.
Се, % <по массе)
Рис. 418. Ge—Pt
В системе обнаружено шесть соединений. Соединения GePt и
GePt2 плавятся конгруэнтно при 1079 и 804 °C соответственно.
Остальные образуются по перитектическим реакциям (табл. 344).
Таблица 34 4. Нонвариантные реакции в системе Ge—Pt
Реакция Содержание Ge в фа- зах, % (ат.) Температу- ра, "С '
Ж + (Pt) ₽ GePt, 28,5; 93,4; 25 915
Ж » GePt3 + GePt2 30; 25; 33,3 725
Ж + Ge Pt = Ge2Pt3 —• 50; 40 820
Ж + GePt » Ge3Pt2 64; 50; 60 900
ж + Ge3Pt, = Ge2Pt 72,5; 60; 66,6 855
” (Ge) + Ge2Pt 78; -100; 66,6 802
Ge?Pt, + GePt? 36,5, 40; 33,3 792
786
Ge—Pu
Растворимость Pt в Ge пренебрежимо мала; максимальная раство-
римость Ge в Pt (6,6 % (ат.)) соответствует перитектической темпе-
ратуре. Область гомогенности GePt3 имеет протяженность 2,5
(ат.). В табл. 345 приведены сведения о кристаллической структуре
двойных соединений [V-C].
Таблица 345. Кристаллическая структура соединений
системы Ge—Pt [V-C]
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а Ь С
GejPt Ге2С оР6, Рппт 0,6185 0,5767 0,2908 ~
GCjP^ или Ge3Pt2 оР20, Рпта 1,6441 0,33771 0,62017
Ge3Pt2 оР40, Стет 0,6846 1,2236 0,7544
GePt MnP ОРЯ, Рпта 0,5719 0,3697 0,6087
Ge2Pt Ge2Pt3 оС20, Рпта 1,2240 0,7549 0,6854
GePt2 РГ'е2 hP9, Р62т 0,668 — 0,353
GePt3 или GePt3 тС16, С2т 0,7930 0,7767 0,5520
GePt3 ‘P - 135,2 SeTl 8°. £/16, 14/тст 0,5499 0,7933
Литература
1. Оуа У., Suzuki Т. // Z. Metallkunde. 1987. Bd. 78. N 4. S. 295-300.
Е.И. Гладышевский, О.И. Бодак, В.К. Пенаре1'.-’-
Ge—Pu. ГЕРМАНИЙ—ПЛУТОНИЙ
Диаграмма состояния Ge—Pu не построена. Имеется информация
о соединениях Ge2Pu, Ge3Pu, Ge3Pu2 [X], GePu3 и Ge2Pu3 |3i
Между (Ge) и Ge3Pu обнаружена эвтектика [Э]. Соединение Gc2Pu
имеет структуру типа ThSi2 с параметрами решетки а = 0,4102(2) нм
и с = 1,381(1) нм (на стороне Ge), соединение Ge3Pu2 — гексаго-
нальную структуру типа псевдо-А1В2 с параметрами а = 0,3975(2) им
и с = 0,4198(2) нм, соединение Ge3Pu — кубическую структуру тина
AuCu3 с параметрами а = 0,4223(1) нм [X].
ГК. Алексеем.
Ge—Rb
787
Gf^Rb. ГЕРМАНИЙ-РУБИДИЙ
Информация о взаимодействии Ge с Rb приведена в работах [X,
Ц1]. Диаграмма состояния Ge—Rb (рис. 419) построена в работе [1].
Сплавы для исследования приготовляли из Ge полупроводниковой
чистоты и Rb чистотой 99,9 % (по массе) в инертной среде в герме-
тичных тиглях из Nb с внутренним тиглем из высокочистого корунда
или поликристаллического фианита. Исследование выполняли мето-
дами термического, рентгеноструктурного, микроструктурного и ло-
кального рентгеноспектрального анализов.
Рис. 419. Ge—Rb
В системе имеется четыре соединения — Ge4 Rb, GeRb, Ge2Rb3 и
GeRb3 — с температурами конгруэнтного плавления 1110, 930, 960
и 705 °C соответственно. Эвтектические равновесия, имеющиеся в
системе, приведены ниже:
788
Ge—Re
Ж •* (Ge) + Ge4Rb при 890 °C;
Ж * Ge4Rb + GeRb при 740 °C;
Ж * GeRb + Ge2Rb3 при 855 °C;
Ж * Ge2Rb3 + GeRb3 при 540 °C;
Ж « GeRb3 + (Rb) при 39 °C.
Соединение GeRb имеет кубическую структуру с 32 формульными
группами в элементарной ячейке (пр. гр. Р43п, а = 1,319 нм) |2|.
Кристаллическая структура соединения Ge4Rb, определенная с
помощью нейтронной дифракции, также кубическая (пр. гр. РтЗп,
а = 0,650 нм) [3].
Литература
1. Дриц М.Е., Потемкин В.Ф., Зусман Л.Л. // Изв. Ан СССР. Неорганические
материалы. 1982. Т. 18. № 7. С. 1148—1150.
2. Busmann Е. // Z. Anorg. All. Chem. 1961. Bd. 313. S. 90-106.
3. Потемкин В.Ф., Сизов P.A., Зусман Л.Л., Дриц М.Е. // Изв. АН СССР
Металлы. 1989. № 3. С. 197—199.
Л.Л. Зусман
Ge-Re. ГЕРМАНИЙ—РЕНИЙ
Схематическая диаграмма состояния Ge—Re в интервале концен-
траций 0—50 % (ат.) Re построена в работе [1]. Соединение Ge2Re
образуется по перитектической реакции при 1132 °C из жидкости и
(Re), эвтектическая реакция Ж ** (Ge) + Ge2Re имеет место при
Ge
Рис. 420. Ge— Rc
температуре 930 °C. В ра-
боте [2] предпринято тща-
тельное рентгенографичес-
кое исследование, в резуль-
тате которого обнаружено
новое промежуточное соеди
нение Ge7Re3; соединение
же Ge2Re считается в этой
работе метастабильным, таг
что на рис. 420, представ-
ленном из работы [1], пока-
зано вместо него соединение
Ge7Re3.
Максимальная раствори-
мость Re в Ge имеет место
при эвтектической темпера-
туре и равна 3 % (ат.).
Соединение Ge2Re обла-
дает моноклинной структу
Ge-Rh
789
пой типа Ge2Os или As2Nb (а = 0,9205 нм, b = 0,3108 нм, с =
.0,8032 нм, р = 120,7°) [3]. Соединение Gc-,Re3 имеет ромбическую
структуру (пр. гр. Стет, а = 0,3227 нм, b = 0,9045 нм, с = 2,1956 нм,
2-4) [2].
Литература
1. Searcy A.W., McNeels R.A. // J. Am. Chem. Soc. 1956. V. 76. P. 5287-5289.
2. Siegrist T., Hulliger F. // J. Less-Common Met. 1983. V. 90. N 1. P. 143—151.
3. Larchev V.I., Popova S.V. // J. Less-Common Met. 1982. V. 84. P. 87—89.
M.A. Тылкина
Ge-Rh. ГЕРМАНИЙ-РОДИЙ
рис. 421. Ge-Rh
790
Ge—Re
Диаграмма состояния Ge—Rh (рис. 421) построена в работе [Э|.
В качестве исходных материалов использовали химически чистые Ge
и Rh, сплавы синтезировали в высокочастотной печи или в печи
сопротивления в кварцевых ампулах, заполненных Аг. Исследование
выполняли методами металлографического и рентгеноструктурного
анализов и измерения микротвердости и плотности.
Согласно диаграмме состояния в системе имеется четыре промежу-
точных соединения. Соединения GeRh и GeRh2 плавятся конгруэнтно
(температуры не указаны). Соединения Ge3Rh5 и Ge4Rh3 образуются
по перитектическим реакциям. В системе кристаллизуются три
эвтектики. Нонвариантные равновесия приведены ниже:
Ж + GeRh2 * Ge3Rh5;
Ж + GeRh « Ge4Rh3;
Ж ** GeRh2 + (Rh);
Ж ** Gc3Rh5 + GeRh;
Ж Ge4Rh3 + (Ge).
Температуры нонвариантных равновесий не указаны. Имеются
сведения о незначительной взаимной растворимости компонентов. В
табл. 346 приведены сведения о кристаллической структуре двойных
соединений [V-С]. Некоторые сведения о кристаллической структуре
приведены также в работе [X]. Структура соединения Ge4Rh3 неиз-
вестна.
Таблица 3 4 6. Кристаллическая структура соединений
системы Ge—Rh
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а Ь С
GeRh MnP оР8, Рпта 0,570 0,648 0,325
GeRh SiFe сР8, Р2,3 0,4862 — —
Ge(Rh5 Ge3Rh5 ОР16, РЬат 0,542 1,032 0,396
GeRh2 SiCo2 оР\2, Рпта 0,544 0,400 0,757
Е.И. Гладышевский, О.И. Бодак, В.К. Печарск'.ш
Ge—Ru
791
Ge—Ru. ГЕРМАНИЙ-РУТЕНИЙ
Диаграмма состояния Ge—Ru (рис. 422) построена по данным
работы [Ш]. Сплавы исследовали методами рентгеновского, метал-
лографического и термического анализов.
Рис. 422. Ge—Ru
В системе образуются два промежуточных соединения. Соединение
GeRu плавится конгруэнтно при 1475 °C, соединение Ge3Ru2 образу-
ется по перитектической реакции при 1460 °C. Нонвариантные
Равновесия, имеющие место в системе, приведены в табл. 347.
792
Ge—S
Таблица 347. Нонвариантные реакции в системе Ge—Ru
Реакция Содержание Ru в фа- зах, % (ат.) Температу- ра, °C
Ж + GeRu * Ge3Ru2 -40; 50; 40 1460 ~~
Ж ’ GeRu + (Ru) -59; 50; 0 1200
Ж (Ge) + Ge3Ru2 -100; 0; 40 937
В табл. 348 приведены сведения о кристаллической структуре
двойных соединений [V-C].
Таблица 34 8. Кристаллическая структура соединений системы Ge—Ru
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b С
GeRu SiFe сР8, Р2|3 0,4846 — —
Ge3Ru2 Si3Ru2 оР40, РЬсп 1,1436 0,9238 0,5716
Ge3Ru2 Sn3Ru2 tP20, Р4с2 0,5739 — 0,9952
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Ge-S. ГЕРМАНИЙ-СЕРА
Сведения о взаимодействии Ge с S приведены в работах [X, Э,
UIJ. Диаграмма состояния Ge—S (рис. 423) построена в работе !И-
Образцы для исследования готовили в вакуумированных кварцевых
ампулах сплавлением Ge (удельное электросопротивление около
1 Ом/см) с сульфидами Ge или с S чистотой 99,997 % (по массе).
Исследование проводили методами металлографического, термическо-
го и рентгеновского анализов. В противоположность более ранним
работам [Е] в системе обнаружено только два соединения, GeS и
GcS2, первое из которых претерпевает полиморфное превращение,
возможно, второго рода при 590 + 5 °C. Максимальная растворимость
5 в (Ge) не превышает ДО-5 (ат.) [Э].
Соединение GeS кристаллизуется в решетку ромбической синго-
нии с параметрами а = 0,430 нм, b = 1,044 нм, с = 0,363 нм. Соедине^
ние GeS2 также имеет ромбическую решетку, представляющую собой
сильно деформированную структуру типа восьмислойного Cdl2 с
параметрами а = 1,168 нм, Ь = 2,239 нм, с = 0,687 нм.
Ge—Sb
793
Рис. 423. Ge—S
Литература
1. Лю Цюнь-хуа, Пашинкин А.С., Новоселова А.В. // Доклады АН СССР. 1963.
Т; 155. № 6. С. 1335-1338.
\ ' Л. С. Гузей
Ge—Sb. ГЕРМАНИЙ-СУРЬМА
Сведения о взаимодействии Ge с Sb приведены в работах [X, Э,
Ш]. Диаграмма состояния Ge—Sb (рис. 424) построена в работе [1]
* На основе обобщения литературных данных. В системе установлено
, Эвтектическое равновесие между Ge и Sb, которое осуществляется
> Ври температуре 592 °C и содержании -85,5 % (ат.) Sb. Максималь-
ная растворимость Sb в Ge, зафиксированная при 800 °C, составляет
*>7хЮ~2 % (ат.) [2]; растворимость Ge в Sb незначительна. В работе
. 14] рассчитаны ликвидус и сольвус в приближении теории регуляр-
ных растворов; получено хорошее совпадение с данными экспе-
римента.
194
Ge—Sc
Литература
1. Olesinski R.W., Abbaschian G.J. // Bull Alloy Phase Giagrams. 1986. V. 7. \ 3
P 219-222, 303-304.
2. Trumbore F.A., Spitzer W.G., Logan R.A., Luke C.L. // J. Electrochem Soc. 1962
V. 109. P. 734-738.
3. Никитина Г.В., Романенко B.H., Ишутинова Л.Н. // Изв. АН СССР. Неоргани-
ческие материалы. 1971. Т. 7. № 1. С. 45—49.
Г.К. Алексеенко
Ge-Sc. ГЕРМАНИЙ-СКАНДИЙ
Диаграмма состояния Ge—Sc (рис. 425) построена по данным
работы [1] и только область существования предполагаемого равно-
весия при температуре 1355 °C приведена по данным работы [21.
Сплавы готовили в дуговой печи в среде чистого Аг из Sc чистотой
99,0 % (по массе) и Ge чистотой 99,99 % (по массе). Гомогенизиру-
ющий отжиг сплавов проводили в вакуумированных кварцевых
ампулах, заполненных Не, или в печи в среде Аг. Для предотвраще-
ния контакта образцов со стенками кварцевой ампулы или керами-
ческого тигля использовали контейнеры из Мо или Та.
Исследование выполняли методами микроструктурного, дифферен-
циального термического и рентгенофазового анализов.
Ge Sb, % (am) Sb
Рис. 424. Ge-Sc
Ge-Sc
795
бе, °/o (no массе)
Рис. 425. Ge-Sc
В соответствии с диаграммой состояния в системе образуется пять
промежуточных соединений. Соединение Ge3Sc5 плавится конгру-
энтно при 2065 °C. Перитектические реакции образования остальных
соединений приведены ниже.
Ж + Ge3Sc5 * Ge4Sc5 при 1870°С;
Ж + Ge4Sc5 * Ge10ScH при 1675 °C;
Ж + GeigScj 1 * GeSc при 1192 °C;
Ж + GeSc * Ge2Sc при 1116 °C.
В системе имеют место две нонвариантные эвтектические реакции:
Ж (aSc) + Ge3Sc5 при 1274 °C и 12 % (ат.) Ge;
Ж * (Ge) + Ge2Sc при 892 °C и 85 % (ат.) Ge.
При температуре 1355 °C протекает реакция, связанная с поли-
**орфином Sc : Ж + (PSc) ** (aSc).
796
Ge—Se
Взаимная растворимость при эвтектических температурах состав -
ляет менее 1 % (ат.) Sc в Ge и 1—2 % (ат.) Ge в Sc. Область гомо-
генности соединения Ge3Sc5 составляет 1 % (ат.). В табл. 349 приве-
дены сведения о кристаллической структуре соединений [V-CJ.
Таблица 3 4 9. Кристаллическая структура соединений системы Ge—Sc
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а Ь С
Ge2Sc Si2Zr оС 12, Стет 0,3888 1,4873 0,3793
GeSe BCr оС8, Стет 0,4007 1,006 0,3762
Gel0SC|i Ge10Holt /784, 74/ттт 1,012 — 1,554
Ge4Sc5 Ge4Sm5 оРЗб, Рпта 0,7269 1,3980 0,7152
Ge3Sc5 S*3^n5 hP\f>, Р63/ тст 0,7921 — 0,5881
Литература
1. Еременко В.Н., Обушенко И.М., Буянов Ю.М., Мелешевич К.А. // Доклады
АН УССР. Сер. А. 1981. № 4. С. 172-178.
2. Gokhale А.В., Abbaschian G.J. // Bull. Alloy Phase Diagrams. 1986. V. 7. N b
P. 540-543. 597-598.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Ge—Se. ГЕРМАНИЙ-СЕЛЕН
Сведения о строении диаграммы состояния Ge—Se, полученные
разными исследователями [Э, Ш, 1,2, 3], практически согласуются
между собой в отношении существования двух промежуточных
соединений (GeSe и GeSe2), конгруэнтного плавления GeSe2 при
740 °C и наличия полиморфизма у GeSe. Однако противоречивы
данные о характере образования последней фазы. По данным работы
[3], она образуется по перитектической реакции Ж + GeSe2 * GeSe
при 670 °C и претерпевает полиморфое превращение при температу
ре 670 °C. В работе [1] температура 670 °C дана как температур *
конгруэнтного плавления GeSe, а в работе [2] для той же практичес-
ки температуры (675 + 3 °C) приводится другая перитектическа'*
реакция Ж + (Ge) GeSe. В работе 11J указывается на две темпера-
туры 664 ± 3 °C со стороны Ge и 579 ± 3 °C со стороны GeSe2- Это
Ge-Se
797
i5f, % (по пассе)
Se Se, % (am.) Se
Рис. 426. Ge—Se
дает возможность написать реакцию перитектоидного образования
aGeSe как (Ge) + 0GeSe * aGeSe и реакцию эвтектоидного распада
0GeSe как 0GeSe « aGeSe + GeSe2 (рис. 426). Кроме того, приводится
температура еще одного превращения, равная 646 ± 3 °C. При темпе-
ратуре 905 + 3 °C и концентрации ~20 % (ат.) Se существует моно-
тектика. В рассмотренных работах были использованы практически
одинаковые материалы и методы исследования, так что причина
противоречий неясна. В работе [4] проведен обзор имеющихся дан-
ных по исследованию диаграммы Ge—Se и приводится другой вариант
Диаграммы при концентрациях до 70 % (ат.) Se, основанный на
Данных работы [5] (см. вставку на рис. 426).
798
«St
Соединение aGeSc кристаллизуется в решетку ромбической синг0,
нии с параметрами а = 0,4384(5) нм, b = 0,3832(5) нм, t =
= 1,082(2) нм [6]. Соединение pGeSe имеет структуру типа NaCl
(символ Пирсона cF8, пр. гр. Fm3m), параметр решетки ц =
= 0,5730(3) нм при температуре 651 ± 5 °C [4]. Соединение GeSe
обладает также решеткой ромбической сингонии (пр. гр. Рттп или
Ртп, а = 0,6953(1) нм, b = 1,2220(5) нм, с = 2,306(3) нм) [6]. По
данным работы [4], соединение GeSe2 имеет моноклинную структу-
ру, параметры решетки а = 0,7016(5) нм, b = 1,6796(8) нм, t =
= 1,1831(5) нм, р = 90,65(5)°.
Литература
1. Виноградова Г.З., Дембовский С.А., Сивкова Н.Б. //Журнал неорганической
химии. 1968. Т. 13. № 7. С. 2029.
2. Карбанов С.Г., Зломанов В.П., Новоселова А.В. // Вестник Московсн го
университета. Химия. 1968. № 3. С. 96—98.
3. Лю Цюнь-Хуа, Пашинкин А.С., Новоселова А.В. И Доклады АН СССР. 1962
Т. 146. № 5. С. 1092-1093.
4. Gokhale А.В., Abbaschian R. // Bull. Alloy Phase Diagrams. 1990. V. 11. X 3
P. 257-262.
5. Ipser H., Gambino M., Schuster W. 11 Monatsch. Chem. 1982. V. 113
P. 389-398.
6. Лю Цюнь-хуа, Пашкин A.C., Новоселова А.В. // Журнал неорганичен и
химии. 1962. Т. 2. № 9. С. 2159-2161.
Л.С. Гу.п и
Ge—Si. ГЕРМАНИЙ—КРЕМНИЙ
Сведения о взаимодействии между Ge и Si обобщены в работах
[X, Э, IIIJ. Диаграмма состояния Ge—Si (рис. 427) построена в работе
[1] с использованием методов термического и рентгеновского анали-
зов. Перед измерениями все сплавы были подвергнуты гомогенизации
в течение нескольких месяцев. Диаграмма состояния характеризуется
образованием непрерывного ряда твердых растворов. Никаких фазо-
вых превращений после отжига сплавов в течение нескольких меся
цев при 925, 715, 295 и 177 °C не обнаружено. Параметр решетки
плавно меняется при изменении состава и характеризуется средним
сжатием решетки на 0,0009 нм, т.е. немного меньше, чем на 0,2 %
во всем интервале концентраций. Отрицательное отклонение от-
правила Вегарда подтверждено в работе [2]: максимальное отклоне-
ние (около 0,00060—0,00069 нм или чуть более 0,1 %) наблюдали к
центральной части. Твердые растворы (Ge, Si) имеют разупорядо
ченную структуру типа алмаза, в которой атомы компонента, содср
жащегося в сплаве в меньшем количестве, вероятнее всего располо-
жены во второй координационной сфере. Этот вывод сделан на
основании изучения фононного спектра сплавов [3].
Ge~Si
799
Рис. 427. Ge—Si
В работе [4] описана техника получения монокристаллов сплавов
Ge—Si во всем интервале концентраций, основанная на кристаллиза-
ции из газовой фазы с использованием Si в качестве элемента-носи-
теля.
Работы [5, 6] посвящены расчетам ликвидуса и солидуса сплавов
системы, причем в первой из них использовали представление об
идеальном поведении компонентов в жидкой и твердых фазах, а во
второй — представление об электронной структуре и статистическую
механику при низких температурах и давлениях 0 и 3 ГПа. Совпаде-
ние экспериментальных и расчетных данных было удовлетвори-
тельным.
Литература
1- Stohr Н., Klemm W. // Z. Anorg. Alt. Chem. 1939. Bd. 241. S. 305—323-
2. Dismukes J.P., Ekstrom K., Paff R.J. // J. Phys. Chem. 1964. V. 68.
P. 3021-3027.
3. Logan R.A., Roweel J.M., Trumbore F.A. // Phys. Rev. 1964. V. 136.
p- 1751-1755.
4. Сандулова А.В. // Доклады АН СССР. 1962. Т. 143. С. 610—612.
5. Ojha V., Kuchar L. // Sb. Vederych Praci. Vysoke Skole Banske. Ostrava. 1986.
V- 32. N 10. P. 83-96.
6. Oteish A., Resta R. // Phys. Rev. B. Condens. Mater. 1988. V. 37- N 12.
p- 6983-6990.
М.И. Бычкова
800
Ge— Sm
Ge—Sm. ГЕРМАНИЙ—САМАРИЙ
Диаграмма состояния Ge—Sm (рис. 428) построена в работе |;)
Сплавы готовили в дуговой печи в атмосфере Аг из Sm чистотой
99,67 % (по массе) и Ge чистотой 99,99 % (по массе). Исследование
осуществляли методами микроструктурного, рентгенофазового и
дифференциального термического анализов.
Рис. 428. Ge—Sm
В системе обнаружено пять соединений. Соединение Ge3Sni5
плавится конгруэнтно при 1700 °C. Реакции образования остальные
соединений, а также эвтектические реакции, имеющие место в
системе, и реакции полиморфного превращения соединения Ge2_vS”!
приведены в табл. 350 [1].
Ge—Sm
801
T а б л и Ц а 35 0. Нонвариантные реакции в системе Ge—Sm
Реакция Содержание Ge в фа- зах, % (ат.) Температу- ра, °C
Ж + Ge3Sm5 •* Ge4Sm5 37,5; 44,4 1500
Ж + Ge4Sm5 ° GeSm 44,4; 50,0 1400
Ж + GeSm - yGe^m 50,0; 60 1355
X - (Ge) + pGe2_ySm 85; 0; 60 820
Ж * (PSm) + Ge3Sm5 И; 100; 37,5 890
(Ge) + PGe^Sm « Ge2_xSm 100; —; — 760
GeSm + yGe2_vSm - pGe2_ySm — >1085
или Ж + yGe2_ySm •* pGe2_ySm — <1085
GeSm + pGe2_ySm - aGe2_ySm — >745
или Ge2_ASm + pGe2_.Sm <* aGe2_ySm — <745
Соединение Gc2_ySm обозначают как Gej 56Sm104, основываясь на
предположении об образовании антидефектов атомов Sm, располо-
женных в позициях атомов Ge.
В табл. 351 приведены сведения о кристаллической структуре
соединений [1, V-C].
Таблица 351. Кристаллическая структура соединений системы Ge—Sm
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, им
а Ь с
Ge2Sm Si2Zr оС 12, Ibjamd 0,4183 — 1,3810
“Ge2_vSm B2Al hP3, РЬ/ттт 0,4005 — 0,4374
GeSm BCr оС8, Стет 0,4387 1,0890 0,3993
Ge4Sm5 Ge4Sm5 оРЗб, Рпта 0,775 1,494 0,785
Ge3Sm5 Si3Mn5 hPl6, Р6У/mcm 0,8653 — 0,6471
Литература
1- Еременко В.Н., Баталин В.Г., Буянов Ю.И. // Доповщ! АН УРСР. Сер. Б. 1977.
№5. С. 413-416.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
26 Зак. 2144
802
Ge—Sn
Ge—Sn. ГЕРМАНИЙ-ОЛОВО
Сведения о диаграмме состояния Ge—Sn приведены в работах [у
Э, Ш]. Обобщенная диаграмма состояния (рис. 429), построенная в
работе [1], представляет собой диаграмму простого эвтектического
типа; эвтектическая реакция имеет место при концентрации 99,74 <у
(ат.) Sn и при температуре на 0,78 °C ниже температуры плавления
Sn. Максимальная растворимость Sn в Ge [1,1 % (ат.)] наблюдается
при температуре 400 °C, при температуре 231 °C растворимость
уменьшается до менее 1 % (ат.). С помощью модели регулярных
растворов в работе [2] была рассчитана диаграмма состояния Ge—Sn.
Гипотетическая р—Т диаграмма предложена в работе [3].
Gc Sn, "/о (am.) Sn
Рис. 429. Ge—Sn
Литература
1. Olesinski R.W., Abbaschian G.J. // Bull. Alloy Phase Diagram. 1984. V. 5 '•>
P. 265-271.
2. Ansara L, Bros J.P., Gambino M. // Calphad. 1979. V. 3. N 3. P. 225-233
3. Smith R.W., Vnuk K. // Phase Transform. Solids. Symp., Maleme-Chania. Crc’.t’
June-July. 1983. New-York. 1984. P. 795-801.
Е.И. Гладышевский, О.И. Кодак, В.К. Печарский
Ge-Sr
803
Ge_^r. ГЕРМАНИЙ-СТРОНЦИЙ
Диаграмма состояния Ge—Sr (рис. 430) построена в работе [1].
н^паады изготовляли в дуговой печи в атмосфере Аг из порошкового
Нечистотой 99,999 % (по массе) и пруткового Sr чистотой 99,5 %
7п0 )иас£е). Исследование выполняли методами микроструктурного и
пентгсновского анализов.
Sr, "/я (по массе)
Р»С. 430. Ge-Sr
2б‘
804
Ge-Ta
В системе обнаружено три соединения. Соединение GeSr плавится
конгруэнтно при -1165 °C. Два других образуются по перитектичес-
ким реакциям. Эти и другие нонвариантные равновесия приведены
в табл. 352.
Таблица 35 2. Нонвариантные реакции в системе Ge—Sr
Реакция Содержание Sr в фа- зах, % (ат.) Температу pa, "С
Ж + GeSr •* Ge2Sr -; 50; 33,3 1015±7
Ж + GeSr - GeSr2 ; 50; 66,7 972±7
Ж - (Ge) + Ge2Sr 19,3; 0; 33,3 755±5
Ж - (pSr) + GeSr2 96,4; 100; 66,7 714±5
В табл. 353 приведены сведения о кристаллической структуре
соединений [V—С].
Таблица 353. Кристаллическая структура соединений системы Ge—Sr
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а Ь с
Ge2Sr Si2Ba оР24, Рпта 0,874 0,665 1,124
GeSr BCr оС8, Стет 0,4820 1,139 0,4167
Ge3Sr4 Ge3Sr4 Immm 1,338 0,484 1,852
GeSrs SiCo5 Рпта 0,813 0,520 0,958
Литература
1. Sharkey R.L. // J. Less-Common Met. 1970. V. 20. N 2. P. 113-119.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Ge—К. ГЕРМАНИЙ-ТАНТАЛ
Диаграмма состояния Ge—Та не построена. В работах [X, Э, Ш1
собрана информация о соединениях, обнаруженных в системе
(табл. 354).
Соединение GeTa2 имеет четыре модификации [4]. Соединение
Ge2Ta образуется по перитектической реакции при взаимодействии
богатой Ge жидкости и GeTa2 при температуре 1280 ± 20 °C. Раство-
римость Та в Ge, по данным работы [5], приведена ниже:
* Ge—'J'b 805
Императу pa, °C ................... 910 875 850 825 800 775
К^воримость Та, 10~3 % (ат.) ...... 45 147 79 43 15,8 7,9
Ж а блица 354. Кристаллическая структура соединений системы Ge—Та
(Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а с
G^Ta CrSi2 hP9, Р6222 0,4958 0,490(5) 0,6751 0,6738(5) [1] [2]
1 aGe3Ta5 Si3Ta3 — 0,6599 1,201 [3]
PGe3Ta5 — 14/тст 1,001 0,5150 [3]
или /42»1
j aGeTa3 Ti3P tP32, Р42/п 1,028 0,522 [Ш]
j f$GcTa3 Ni3P 74, (732 1,035 0,516 [Ш]
ЖДИтература
1. Wallbaum H.J. // Naturwissenschaften. 1944. Bd. 31. S. 76—77.
Й 2. Brixner L.H. // J. Inorg. Nucl. Chem. 1963. V. 25. P. 257-260.
3. Nowotny H., Searcy A.W., Du J.E. // Phys. Chem. 1956. V. 60. P. 677-678.
Il 4. Criscione J.M. // Diss. Purdue Univ. Lafayette. Diss. Abstr. 1954. V. 14. P. 1675.
| 5. Сандулова A.B., Хе Ю.-Л. // Доклады АН СССР. 1959. T. 128. C. 329-332.
w М.И. Бычкова
-Tb. ГЕРМАНИЙ-ТЕРБИЙ
№, Диаграмма состояния Ge—Tb (рис. 431) приведена по данным
Наботы [М2].
К Сведения о кристаллической структуре известных фаз системы
Кге—ТЬ, по данным работ [1, 2], приведены в табл. 355.
на б л и ц а 355. Кристаллическая структура соединений системы Ge—ТЬ
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а Ь с
Ge3Tb5 Si3Mn5 API 6, Р63/ тст 0,8495 — 0,6351
№’ Ge4Tb5 Ge4Sm5 оРЗб, Рпта 0,6138 1,6399 0,691
НК ^(oTb,, Се10НОц 7784, 74/ттт 1,089 — 1,649
й
806
Ge-Tb
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а Ь С
GeTb BCr оС8, Стет 0,4300 1,0717 0,3950 ~
Ge3Tbz ВгА1 НРЗ, Р6/ттт 0,395 — 0,416
Ge2Tb* — — 0,8001 0,8216 1,4940
Ромбическая сингония.
Tb,°/a (по массе)
Рис. 431. Ge-Tb
Литература
1. Sekizawa К. И J. Phys. Soc. Jap. 1966. V. 21. Р. 1137-1142.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарскии
L1'
| Ge—Те 807
<Ge—Те. ГЕРМАНИЙ—ТЕЛЛУР
>' " Диаграмма состояния Ge—Те (рис. 432) построена в работе [X] и
«уточнена в области образования соединения GeTe в работах [1, 2].
Соеди'нение GeTe плавится конгруэнтно при 724 °C [Э] и имеет
^состав 50,61 % (ат.) Те [2]. Соединение GeTe существует в трех
, (модификациях; высокотемпературная модификация yGeTe эвтекто-
|!йдно распадается при 356 °C на aGeTe + 0GeTe [1] (см. вставку на
KipHC^ 432). Две низкотемпературные модификации существуют в
одном и том же температурном интервале и разделены узкой двух-
фазной областью. В системе существует две эвтектики: (Ge) +
|;+ yGeTe при 723 °C и 49,85 % (ат.) Те [Э, 2] и 0GeTe + (Те) при
fi'382 °C и 85 % (ат.) Те [X, 1]. Растворимость Те в твердом (Ge) по
^результатам диффузионных экспериментов приведена ниже [3]:
Температура, °C ........................ 900 870 840 770
/ Растворимость Те, % (ат.) ........... 0,0012 0,010 0,014 0,0036
" Соединение 0GeTe имеет область гомогенности, протяженность
/которой 50,3—51,5 % (ат.) Те при температуре 430 °C.
₽ис. 432. Ge—Те
808
Ge—Th
yGeTe имеет кубическую структуру типа NaCl (символ Пирсона
C.F8, пр. гр. Fm3m), параметр решетки а = 0,601(0) нм при 460 °C со
стороны, богатой Ge; а = 0,599(0) нм при 390 °C со стороны, богатой
Те; а = 0,6020 нм при 600 °C для сплава с 50 % (ат.) Тс и ц а
= 0,5999 нм при 600 °C для сплава с 51 % (ат.) Те [2]. Соединение
aGeTe имеет тригонально искаженную структуру типа NaCl с пара-
метром решетки а = 0,5986 нм, а - 88,35°. В работе [4] определена
структура другой низкотемпературной модификации pGeTe с ром-
бической подъячейкой, имеющей параметры а = 1,176 нм, Ь =
= 0,415 нм, с = 0,436 нм; для получения параметров элементарной
ячейки этого соединения необходимо увеличить в 4 раза параметры
b и с подъячейки, в результате получаем соответственно 16,60 и
17,44 нм. В работе [М2] в более схематичной диаграмме состояния
в эвтектоидном распаде yGeTe и перитектоидном образовании pGeTe
при температуре 365 °C участвуют другие наборы фаз.
Литература
1. Абрикосов Н.Х., Карпинский О.Г., Шелимова Л.Е., Коржуев М.А. // Изв.
СССР. Неорганические материалы. 1977- Т. 13. № 12. С. 2160—2164.
2. Шелимова Л.Е., Абрикосов Н.Х., Жданова В.В. // Журнал неорганической
химии. 1965. Т. 10. № 5. С. 1200-1205.
3. Игнатков В.Д., Косенко В.Е. // Физика твердого тела. 1962. 7.4.
С. 1627-1631.
4. Карбанов С.Г., Зломанов В.П., Новоселова А.В. // Изв. АН СССР. Неоргани-
ческие материалы. 1969. Т. 5. № 7. С. 1171—1174.
Л.С. Тузей
Ge—Th. ГЕРМАНИЙ-ТОРИЙ
В работе [Ш] приведены две предположительные диаграммы
состояния Ge—Th, построенные в работах [1, 2]. В результате крити-
ческого анализа в качестве реальной диаграммы принята версия,
изложенная в работе [1] (рис. 433).
В системе образуются шесть промежуточных соединений, два из
которых, Th3Ge2, ThGe2, плавятся конгруэнтно соответственно при
-2000 и 1900 °C.
Реакции образования остальных соединений, а также эвтектичсс
кие реакции, имеющие место в системе, приведены ниже:
Ж + Th3Ge2 - Th2Ge при 1750 °C;
ж + Th3Ge2 * ThGe при 1700 °C;
ж + aThGe2 11 ^^1019^e2 при 1600 °C;
ж + aThGe2 * Th3Gcs, температура не установлена;
ж * Th2Ge + (pTh) при 1500 °C;
Ж W Th3Ge5 + ThGe при 1550 °C;
ж * Th09Ge 2 + (Ge) при <938,3 °C.
Рцс. 433. Ge—Th
Взаимная растворимость исходных компонентов не оценивалась. В
лабл. 356 приведены сведения о кристаллической структуре со-
единений; соединения ThGe] 5 и ThGe] 6 на диаграмме не приведены.
б лица 3 5 6. Кристаллическая структура соединений системы Ge—Th
У" Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
‘ ThGe2 ?г< ThGe2 оС12, Сттт 0,4223 1,6911 0,4052 [2]
Th3Ge5 A1B2 hP3, Р6/ ттт 0,4065 — 0,4202 [1]
ThGe, 5 — Рсс2 0,6989 0,8432 0,8136 [2]
ThGe16 — Fddd 0,59113 0,5889 1,4219 [2]
ThGe NaCl cF8, 0,60496 — —- [И
Fm Зт 0,6046 — — [21
ThQ 9Ge2 — — 0,4023 0,402 1,6642 1,6645 0,4160 0,409 [2] [И
810
Ge-Ti
I
I
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм 1,1 Ь’ЧНИк
а b с
Th3Ge2 U3Si2 /РЮ, Р4/тЬт 0,7951 0,7976 — 0,4194 0,4165
Th2Gc CuA12 /712, 24/тст 0,7414 — 0,6081 i'l
Ромбическая сингония.
Литература
1. Stecher P„ Benesovsky F., Nowotny H. // Monatsh. Chem., 1963. Bd. 94 nj 3
S. 549-564.
2. Brown A., Norneys J.J. // J. Less-Common Met. 1963. V. 5. N 4. P. 302 -313.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Ge-Ti. ГЕРМАНИЙ-ТИТАН
Сплавы системы Ge—Ti, содержащие 15—18 % (ат.) Ge, исследо-
ваны в работах [X, Э, 1, 2, 3]. Установлено существование соедине-
ния Ti5Ge3, определены пределы растворимости Ge в aTi и pTi;
менее 1 % (ат.) при 500 °C и до 4 % (ат.) при 900 °C. Максимальная
растворимость Ge в pTi составляет 9 % (ат.) при 1400 °C. По изме-
ренным температурам превращения aTi ** pTi в двухкомпонентных
сплавах сделан вывод о наличии перитектоидной реакции (PTi) +
+ Ti5Ge3 * (aTi), имеющей место при 897 ± 3 °C. По аналогии с
системой Ti—Si в работе [3] сделан вывод о возможности существова-
ния соединения Ti3Ge. Сообщено также о существовании соединений
TiGe2, TiGe и Ti6Ge5. Растворимость Ti в твердом (Ge), определен-
ная изотопным методом, составляет 1,8- НТ6 % (ат.) [LUJ.
На рис. 434 представлена диаграмма состояния Ge—Ti, построен-
ная в работе [М2], где критически обобщены изложенные выше
факты. Температура конгруэнтного плавления Ti5Ge3 определена
равной 1980 °C; реакции образования остальных соединений приведе-
ны ниже:
Ж + Ti5Ge3 - TLGe5 при 1650 °C;
Ж + Ti6Ge5 * TiGe2 при 1075 °C.
В системе протекают две эвтектические реакции:
Ж « Ti5Ge3 + (pTi) при 1325 °C и 14,9 % (ат.) Ge;
Ж * TiGe2 + (Ge) при 900 °C и 89 % (ат.) Ge.
При температуре 860 °C имеет место эвтектоидный распад Р Р* '
(PTi) « (aTi) + Ti5Ge3.
Ge-Ti
811
Ряс. 434. Ge—Ti
ч! В табл. 357 приведены сведения о кристаллической структуре
соединений [2].
Т«б лица 3 5 7. Кристаллическая структура соединений системы Ge—Ti
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a b c
TiGe2 TiSi2 о/24, Fddd 0,8594 0,5030 0,8864 [X]
Ti5Gej Mn5Si3 hPl6, Р63/mcm 0,7552 — 0,5234 [X]
TiGe TiSt 0P8, Pmm2 0,380(1) 0,522(4) 0,682 14]
TieGea NbfiSn5 Immm — — — [M]
С.
С.
Литература
Corner Н. // J. Inst Met. 1953. V. 81. Р. 421-523.
3 McQuillan М. // J. Inst. Met. 1955. V. 83. Р. 485-491.
168-4б9УСОВ 0 К'’ к°РниловИ;И- 11 Изв Ан СССР. Металлы. 1976. № 1.
1590^4595^ В ’ ^амсонов в-г- Журнал неорганической химии. 1957. Т. 4. № 7.
С.П. Алисова
812
Ge-Tl, Ge-Тт
Ge—TI. ГЕРМАНИЙ-ТАЛЛИЙ
Сплавы системы Ge—TI изучены методами термического и микро-
скопического анализов, измерения твердости и электросопротивления
[X, Э, 1, 2]. Диаграмма состояния Ge—Т1 (рис. 435) представляет
собой простую эвтектическую систему без промежуточных фаз
Эвтектическая точка (0,04 % (ат.) Ge) [Э] смещена к точке плавле-
ния Т1. В обзоре [2] собраны термодинамические данные сплавов
этой системы. Кривая ликвидуса согласно расчету [3] хорошо согла-
суется с экспериментальной кривой.
Ge Tl,%(arn.) Т1
Рис. 435. Ge-Tl
Литература
1. Савицкий Е.М., Барон В.В., Тылкина М.А. // Журнал неорганической химии
1958. Т. 3. № 3. С. 763-775.
2. Olesinski R.W., Abbaschian G.J. // Bull. Alloy Phase Diagrams. 1985. V. 6 N 2
P. 125-128.
3. Васильев M.B. // Журнал физической химии. 1985. T. 59. № 2. С. 313—317-
В.Н. Итякова
Ge—Тгп. ГЕРМАНИЙ—ТУЛИЙ
Диаграмма состояния Ge—Тт (рис. 436) построена в работе |М21-
В системе обнаружено восемь соединений, из которых Ge3Tm5 пла-
вится конгруэнтно. Реакции образования остальных соединении
приведены ниже:
Ge—Tm
813
Tin, % (no массе)
Ж + Ge3Tm5 * Ge4Tm5
Ж + Ge4Tm5 * Ое10Тти
Ge5Tm4 + Ое10Ттп * GeTm
Ж + GejoTmjj 11 Ge^Tm4
Ж + Ge5Tm4 * Gej 5Tm
Ж + Gcj 5Т1П «* PGe^ 8Tm
Ж + аСё| 8Tm »* Ge2TmQ 9
Ж + pGej 8Tm aGej 8Tm
при 1776 °C;
при 1720 °C;
при 1333 °C;
при 1374 °C;
при 1272 °C;
при 1040 °C;
при 885 °C;
при 1022 °C.
В системе протекают две эвтектические реакции:
Ж * Ge3Tm5 + (Tm) при 1342 °C и 86,5 % (ат.) Тт;
Ж « Ge2Tm0 9 + (Ge) при 870 °C и 15 % (ат.) Тт.
При 950 °C происходит эвтектоидный распад
PGelgTm * aGe1>8Tm + Gej 5Tm.
В табл. 358 приведены сведения о кристаллической структуре
Двойных соединений [1—4].
Ge-U
815
814
Ge-U
Таблица 35 8. Кристаллическая структура двойных соединений
системы Ge—Тт
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
TmGe* — — 1,072 — 1,601 HI
Tm2Ge3 А1В2 hP3, Рв/ттт 0,388 — 0,407 [2J
Tm5Ge3 Si3Mn5 hP16, Р6}/тст 0,831 — 0,623 [3]
Tm5Ge4 Sm5Ge4 оРЗб, Рпта 0,749 1,436 0,754 14]
Тетрагональная сингония.
Литература
1. Tharp A.G., Smith G.S., Jonson Q. // Acta Crystallog. 1966. V. 20. \ 2
P. 583-585.
2. Гладышевский Е.И. // Журнал структурной химии. 1964. Т. 5. V 4
С. 568-575.
3. Гладышевский Е.И. // Журнал структурной химии. 1964. Т. 5. \? ft.
С. 919-921.
4. Smith G.S., Tharp A.G., Jonson Q. // Acta Cryst. 1967. V. 22. N 6. P. 940-942
В.П. Полякова
Ge—U. ГЕРМАНИЙ-УРАН
Диаграмма состояния Ge—U (рис. 437) построена методами дела
тометрического, термического, микроскопического и рентгеновского
анализов [1]. В качестве исходных материалов использовали Ge
чистотой 99,99 % (по массе) и U чистотой 99,86 % (по массе).
В системе обнаружено пять соединений, из которых UGe3, UGe2
и UsGe3 плавятся конгруэнтно соответственно при -1475, -1450 и
1670 °C. Соединение U3Ge4 образуется по перитектической реакции
при 1440 °C, а соединение U7Ge — по перитектоидной реакции при
1035 °C. Формула соединения U7Ge требует уточнения. Эвтектичес-
кие реакции, протекающие в системе, приведены ниже:
Ж * (Ge) + UGe3 при 931 °C и -100 % (ат.) Ge;
Ж * UGe3 + UGe2 при 1430 °C и 31 % (ат.) Ge;
Ж * UGe2 + U3Ge4 при 1400 °C и -38 % (ат.) Ge;
Ж * U5Ge3 + (yU) при 1072 °C и -96 % (ат.) Ge.
В системе имеют место две эвтектоидные реакции:
(yU) U7Ge + (PU) при 770 °C;
(pU) * UGe + (aU) при 662 °C.
Ж Рис. 437. Ge-U
Максимальная растворимость Ge в (yU) составляет около 3 %
(ат.), a (PU) и (aU) — около 1 % (ат.). U в Ge практически не
растворим {1].
При исследовании упругости пара при температурах выше 2040 °C
[2] подтверждено существование соединений UGe3, UGe2 и U5Ge3 и
обнаружены соединения UGe и U3Ge5. Соединение U3Ge4 не обнару-
жено.
В табл. 359 приведены сведения о кристаллической структуре
двойных соединений.
816
Ge-V
Таблица 35 9. Кристаллическая структура двойных соединений
системы Ge—U
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Ис гочнчк
а b С
UGe3 AuCu3 сР4, 0,4206 — — [Х^
РтЗт 0,4205 — — [31
0,4196 — — [4|
UGcj ZrSi2 оС12, Стет 0,412 1,51 0,398 [31
UGe2 A1B2 hP3, Рб/ттс 0,3963 — 0,4128 [V-C1
U3Ge4‘ — — 0,587 0,988 0,898 [3]
U5Ge3 Mn5Si3 ЛР16, Р6У/тст 0,858 — 0,579 [31
’Ромбическая сингония.
Литература
1. Ляшенко В.С., Быков В.Н. // Атомная энергия. 1960. Т. 8. № 2. С. 146— '.48
2. Alcock С.В., Grieveson Р. // J. Inst. Met. 1961. V. 90. N 8. P. 304-310.
3. Макаров E.C., Быков В.Н, // Кристаллография. 1959. Т. 4. № 2. С. 183—185.
4. Brixner L.H, // J. Inorg. Nucl. Chem. 1963. V. 25. P. 783—787.
В.П. Полякова
Ge—V. ГЕРМАНИЙ—ВАНАДИЙ
Диаграмма состояния Ge—V (рис. 438) исследовалась двумя груп-
пами ученых [1, 2]. В работе [1] сплавы, приготовленные из моно-
кристаллического Ge и V, переплавленного электронным пучком и
имеющего чистоту 99,85 % (по массе), исследовали методами мик-
роструктурного, рентгеновского, термического анализов, измерением
микротвердости и температуры сверхпроводящего перехода.
В системе обнаружено четыре промежуточных соединения, два из
которых, V3Ge и V^Ges, плавятся конгруэнтно соответственно при
1690 ± 10 и -1930 °C, по данным работы [1], или 1920 и
1965 + 35 °C, по данным работы [2]. Эти соединения имеют узкие
области гомогенности протяженностью от 24 до 27 % (ат.) Ge при
температурах 1590—1620 °C для V3Ge и от 36,9 до 37,5 % (ат.) Ge
при температуре 1620 °C для V5Ge3. Соединение V3Ge при темпера'
туре плавления имеет стехиометрический состав, при температура4
ниже 800 °C его состав сдвинут в сторону более высоких содержании
V (24,5—24,9 ат. % Ge). При понижении температуры до —263 С
соединение V3Ge претерпевает мартенситное превращение с тетрад-
Ge-V
817
Вис. 438. Ge-V
сальным искажением решетки. Реакции образования остальных
соединений, а также эвтектические равновесия, имеющие место в
системе, приведены в табл. 360.
Таблица 360. Нонвариантные реакции в системе Ge—V
Реакции Содержание V в жидкой фазе, % (ат.) Температура, °C Источник
* + VsGe3 ₽ V^eg — 1575 [1]
+ Уц6е5 » V17Ge31 — 960 111
* » (Ge) + V17Ge31 -2 927 [1]
X - V5Ge3 + V3Ge -69 1620 fl]
» GeV3 + (V) 1760 f2]
-85 1590 [И
818
Ge— v
Ge—W 819
Растворимость Ge в (V) составляет менее 0,5 % (ат.) при темпе-
ратурах ниже 600 °C; 1 % (ат.) при 800 °C; 1,2 % (ат.) при 1200 q
и 3 % (ат.) при эвтектической температуре. Растворимость V в (Gej
мала.
В табл. 361 приведены сведения о кристаллической структуре
двойных соединений.
СССР.
АН (
и ДР- // Металлов
|ы АН УССР. 1958
1. Савицкий Е.М., Ефимов Ю.В., Айхлер К., Зволииский О.И., // Изв.
Металлы. 1974. № 3. С. 214-220.
2. Свечников В.Н., Кочержинский Ю.А., Кобзенко Г.С. г ~р. металлофизика.
1974. Вып. 52. С. 3-22.
3 Гладышевский Е.И., Кузьма Ю.В. // Доклады АН УССР. 1958. № |1
С. 1208-1211.
4. VOllenkle Н., Wittmann A., Nowotny Н. // Monatsh. Chem. Bd. 95. X 6
S. 1544-1547.
5. Hauser J.J. // Phys. Rev. Lett. 1965. V. 14. P. 422-423.
6. VOllenkle H., Preisinger A., Nowotny H. u.a. // Z. Kristallogr. 1967. Bd. 124.
N 1-2. S. 9-14.
М.И. Бычкова
ГЕРМАНИЙ-ВОЛЬФРАМ
j -Взаимодействие Ge c W изучено рядом исследователей в работах
'гХ Э, Ш, П- В системе образуется вырожденная эвтектика при
Рис. 439. Ge—W
В образцах, отожженных в вакуумированных кварцевых ампулах
в! течение 200—500 ч при температурах до 1000 °C, рентгеновским
методом идентифицированы выделения фазы, изоструктурной с
Mo2Ge3 и содержащей -40 % (ат.) W (62 % (по массе) W). Обнару-
женная фаза обозначена как W2Ge3 [1], предполагается, что она
образуется по перитектоидной реакции из (W) и (Ge).
Растворимость W в жидком Ge при температуре 1700 °C составля-
ет -6 % (ат.) [1J.
Литература
1. Поварова К.Б., Савицкий Е.М. // Диаграммы состояния металлических систем:
статей. М.: Наука, 1975. С. 95—98.
К.Б. Поварова
820
Ge-Y
Ge—Y. ГЕРМАНИЙ-ИТТРИЙ
Диаграмма состояния Ge—Y (рис. 440) построена в работе Ц]
методами дифференциального термического и микроскопического
анализов.
Ge, Vo (по массе)
Рис. 440. Ge-Y
В системе обнаружено восемь промежуточных фаз, из которых
Y5Ge3 образуется конгруэнтно при 1965 °C. Реакции образования ос-
тальных соединений приведены ниже:
Ж + Y5Ge3 « Y5Gc4 при 1945 °C;
Ж + Y5Ge4 * YnGe10 при 1900 °C;
Ж + Yj jGe10 YGe при 1730 °C;
Ж + YGe * pY2Ge3 при 1460 °C;
Ge-Y
821
ж + aY2Ge3 * YGe, 7 при 910 °C;
; , Ж + YGe, 7 « YGe2 при 880 °C;
' ’ Ж + YGe2’ * YGc3 5 при 860 °C.
В системе протекают две эвтектические реакции:
Ж 11 Y5Ge3 + (aY) при 1280 °C и 12 % (ат.) Ge;
Ж ** YGe3 5 + (Ge) при 820 °C и 88 % (ат.) Ge,
а также наблюдаются две эвтектоидных и одно катетектическое
превращения:
YGe3 5 (Ge) + YGe2 при 760 °C;
YGe2 (Ge) + YGe, 7 при 710 °C;
(PY) * (aY) + Ж ’ при 1460 °C.
Растворимость компонентов друг в друге требует уточнения. В
табл. 362 приведены сведения о кристаллической структуре двойных
соединений. Соединение Y2Ge3 претерпевает полиморфное превраще-
ние при 1430 °C.
Таблица 36 2. Кристаллическая структура соединений системы Ge—Y
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь С
Y5Ge3 MnsSi3 hP\f>, 0,8472 — 0,6348 [1]
P6i/ mcm 0,8471 — 0,6350 [2]
0,8458 — 0,6373 [3]
Y5Ge4 Sm5Ge4 оРЗЬ, Pnma 0,763 1,468 0,768 [4]
YuGe10 IIO|]Ge10 tI84, 74/ттт 1,086 1,638 [5]
YGe CrB oC8, 0,42698 1,0693 0,39398 [1]
Стет 0,4262 1,0694 0,3941 [6]
0,4259 1,067 0,3932 [71
Y2Ge3 aib2 hP3, 0,3938 — 0,4137 [И
(YGe,i5) P&ттт 0,3935 — 0,4139 [81
или
Реет 0,694 0,827 0,784 [11
, Y^El,7 ThSi2 Ц12, 0,4065 — 1,3683 [1J
I4x/amd 0,4060 — 1,3683 [8]
ИЛИ
Fddl" 0,5749 1,7246 1,3683 [1]
YGe-* — — 0,800 0,820 1,492 [1]
YGe* — — 2,084 0,4047 0,3909 [1]
С222, 2,084 0,4047 1,5636 [1]
Ромбическая сингония.
822
Ge-Yb
Литература
1. Schmidt F.A., McMasters O.D., Carlson O.N. // J. Less-Common Met. 1972. V >6
N 1. P. 53-70.
2. Parthe E. // Acta Crystallog. 1960. V. 13. N 10. P. 868-870.
3. Buschow Fast J.F. // Phys. Status Solidi. 1967. V. 21. N 2. P. 593—600.
4. Smith G.S., Tharp A.G., Jonson Q. // Acta Crystallog. 1967. V. 22 N c,
P. 940-942.
5. Tharp A.G., Smith G.S., Jonson Q. // Acta Crystallog. 1966. V. 20. \ ">
P. 583-585.
6. Schob O., Parthe E. 11 Acta Crystallog. 1965. V. 19. N 2. P. 214-215.
7. Buschow K.H.J., Fast J.F. // Phys. Status Solidi. 1966. V. 16. N 2. P. 467—473.
8. Schob O., Parthe E. // Monatsh. Chem. 1964. Bd. 95. S. 1466.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Ge-Yb. ГЕРМАНИЙ-ИТТЕРБИЙ
Диаграмма состояния Ge—Yb построена в работе [1] методами
дифференциального термического, микроскопического, химического
и рентгеновского анализов (рис. 441). В качестве исходных материа-
лов использовали монокристаллический Ge и Yb чистотой 99,8 % (по
массе).
Yb, 7° (по массе)
Ge Yb,%(am) Yb
Рис. 441. Ge—Yb
Ge-Zn
823
Система Ge—Yb характеризуется образованием широкой монотек-
.^ической области и двух промежуточных фаз, одна из которых,
Yb3Ge5_x, плавится конгруэнтно при 1080 °C. Соединение YbnGe10
образуется по перитектической реакции при 970 °C Ж + 0Yb3Ge5_x
* Ge10Ybjj. Монотектическая реакция Ж * Ж] + pYb3Ge5_x протека-
ет при температуре 1065 °C и концентрации 55 % (ат.) Ge. В систе-
ме наблюдается два эвтектических превращения:
Ж * aYb3Ge5_x + (Ge) при 735 °C и 79 % (ат.) Ge;
' Ж * pYb + YbuGcjQ при 818 °C и -100 % (ат.) Ge.
Соединение Yb3Ge5_v претерпевает при температуре 935 °C поли-
морфное превращение.
В табл. 363 приведены сведения о кристаллической структуре
Соединений.
C'V
Та блица 3 6 3. Кристаллическая структура соединений
Системы Ge—Yb Щ
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а С
aYb3Ge5 Th3Pd5 АР8, Р62т 0,6847 0,4076
Yb||Ge|0 ПОцСе)0 Г/84, 14/ттт 1,072 1,652
Yb5Ge3[O] Mn5Si3 API 6, Р63/ тст 0,8350 0,6407
^Структура высокотемпературной модификации 0Yb3Ge5 не установ-
'J-лена.
* Соединение Yb5Gc3, о котором сообщено в работе [V-C],
I; по данным работы [1], наблюдается только в присутствии
t кислорода.
jv; Литература
1. Еременко В.Н., Мелешевич К.А., Буянов Ю.И. // Доклады АН УССР. Сер. А.
1983. № 3. С. 84-89.
"А''1
Ж В.П. Полякова
i
Ж Ge-Zn. ГЕРМАНИЙ-ЦИНК
| Диаграмма состояния Ge—Zn (рис. 442), построенная по результа-
там дифференциального термического и микроскопического анализов
1 и, представляет собой простую эвтектическую систему без
Ж Промежуточных фаз. Эвтектическое равновесие Ж * (Ge) + (Zn)
824
Ge-Zr
Бе, °/o {no массе)
Рис. 442. Ge—Zn
протекает при температуре 394 °C и концентрации 5,5 % (ат.) Ge.
Взаимная растворимость компонентов в твердом состоянии чрезвы-
чайно мала.
Литература
1. Olesninski R.W., Abbaschian G.J. // Bull. Alloy Phase Diagrams. 1985. V. 6 X' 6.
P. 509.
В.П. По.'пи'Ова
Ge-Zr. ГЕРМАНИЙ-ЦИРКОНИЙ
Диаграмма состояния Ge—Zr (рис. 443) построена в работе [ 1! на
основании экспериментальных результатов термического и рентгенов-
ского анализов, проведенных в работах [2, 3].
В системе обнаружено пять промежуточных фаз, из которых
Zr5Gc3 плавится конгруэнтно при температуре -2330 °C. Реакции
образования остальных соединений, а также эвтектические реакции
и другие нонвариантные равновесия, имеющие место в системе,
приведены в табл. 364.
Ge-Zr
825
tyc. 443. Ge-Zr
б л и ц a 3 6 4. Нонвариантные реакции в системе Ge—Zr
Реакция Содержание Zr в жидкой фазе, % (ат.) Температура, °C Источник
£ + Zr5Ge3 » ZrGe — 2240 [11
* + Zr5Gc3 » Zr5Ge4 __ 9 [4J
+ Zr5Ge3 » Zr3Ge -83 1587 [11
Ж + ZrGe « ZrGe2 — 1522 [11
^."ZrjGe + (pZr) 90,5 1537 И!
" ZrGe2 + (Ge) 1,3 934 [1]
+ Zr3Ge » (aZr) — 896 [1]
826
Ge—Zr
Согласно работе (4| соединения Ge3Zr5 и Ge2Zr обладают заметном
областями гомогенности соответственно 36—39 % и 65—68 % (. т
Ge. Максимальная растворимость Ge в (PZr) составляет ~0,9 % (£Т>
при эвтектической температуре, максимальная растворимость Ge
(aZr) — 1 % (ат.) при перитектоидной температуре. Растворимся
Zr в (Ge) практически отсутствует. В табл. 365 приведена инфориа
ция о кристаллической структуре двойных соединений.
Таблица 3 6 5. Кристаллическая структура соединений системы Ge—Zr
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Исто'”
a b c
ZrGe2 ZrSi2 оС12, Стет 0,376 0,37893 0,381 1,497 1,4975 1,504 0.379 0,37606 0,377 12' 15! [61
ZrGe FeB оР8, Pnma 0,707(5) 0,390(4) 0,539(6) [?
Zr5Ge4 Zr5Si4 P4t2,2 0,7243 — 1,3162 [8;
Zr5Ge, Mn5Si3 hP16, PbJ mcm 0,7993 — 0,5597 |9!
Zr3Ge Ti3P tP32, P42/n 1,108 — 0,548 |1(:
При закалке из расплава с большой скоростью охлаждения в
сплавах при концентрациях 13—21 % (ат.) Ge образуется аморфная
фаза, при содержании 9—12 % (ат.) Ge — метастабильный твердый
раствор Ge в (pZr) со структурой ОЦК [11, 12].
Литература
1. Abriata J.P., Bolcich J.C., Arias D. // Bull. Alloy Phase Diagrams. 1986. V ? \ 1
P. 43-47.
2 Carlson O.N., Armstrong P.E., Wilhelm H.A. // Trans. ASM. 1956 ' 48
P. 843-854.
3. Smith J.F., Bailey D.M. // Acta Crystallog. 1957. V. 10. A 4. P. 341—342
4 Серопегип Ю.Д., Гузева И.А., Пантелеймонов Л.В. и др. Исследование > >
сипемы Zr—Gc // Моск. Гос. vn-т. М.: 1979. 10 с. Деп. в ВИНИТИ, № 3345- "9
5. Smith J.F., Bailey D.M. // Acta Crystallog. 1957. V. 10. N 4. P. 341-342
6 Rossteutscher W., Schubert K. /7 Z. Metallkunde. 1965. Bd. 56 4 1
S. 813-822.
7. Schubert K„ Meissner H.G., Raman A. u.a. // Naturwissenschaften. 1964 H i
N 12. S. 287.
8. Preifer H.U., Schubert K. // Z. Metallkunde. 1966. Bd. 57. N 12. S. 884- 588
9. Parthe E., Norton J. // Acta Crystallog. 1958. V. 11. N 1. P. 14—17.
10 Schubert K., Raman A., Rossteutscher W. // Naturwissenschaften. 1964 H 5 '
N 21. S. 506-507. ,
11. Inoue A., Takahashi Y., Tovola N. et al. 11 J. Mater. Sci. 1982. V. I7 4
P. 3299—3307. 4
12 Inoue A., Takahashi Y., Masumoto N. 11 J. Mater. Sci. 1983. V. 18. P 4.'9-^4
JI. A
JJ—Hf
827
jpJHf. ВОДОРОД—ГАФНИЙ
Диаграмма состояния Н—Hf (рис. 444) построена в работе [1]. К
ранее известным данным по строению низкотемпературной части
диаграммы добавлены вновь полученные сведения о влиянии водоро-
да ра полиморфное превращение Hf; при температуре -700 °C уста-
новлен эвтектоидный распад (pHf) на («Hf) + 6. В системе обнаруже-
но три гидрида: б, б' и е(ШН2). б гидрид с областью гомогенности
63—65 % (ат.) Н имеет дефектную структуру типа CaF2 [Э, 2] с
параметром решетки а = 0,7708 нм при 63 % (ат.) Н. Давление
диссоциации б фазы в интервале температур 600—900 °C можно
вычислить по уравнению 12]
lg (1,3 • 10’4р) = 10,38 - 6846/Г,
гдеp — давление, МПа; Т —температура, К.
Фаза 6' обладает псевдокубической дефектной структурой фазы
Превращается в фазу б при нагреве до 85—100 °C [Э]. Структура
Г314 е тетрагональная типа ZrH2 с параметрами решетки а =
828
H—Hg, H-Ho
= 0,4906(5) нм, с = 0,4362(5) нм (HfHj g3) и а = 0,4918(4) нм, <
= 0,4363(1) нм (HfH2) [3],
Растворимость Н в (aHf) подчиняется закону Сивертса и в интер
вале температуре 290—900 °C при давлении 0,1 МПа имеет вид
Igx = 0,51g/? - 2,74 + 1920/7" [4],
где х — концентрация Н, % (ат.); р — давление, Па; Т — темперап-
ра, К. Предельную растворимость Н в (aHf) в интервале температур
600—900 °C можно описать выражением
Igx = 2,3 - 1460/Т [4].
Литература
1. Okamoto Н. // J. Phase Equilibria. 1991. V. 12. N 1. Р. 120.
2. Фромм Е., Гебхард Е. Газы и углерод в металлах: Пер. с нем. / Под р, ,
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
3. Sidhu S.S. И J. Chem. Phys. 1954. V. 22. Р. 1062-1063.
4. Fromm Е., Jehn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324—32C;
В.П. Поляком)
H—Hg. ВОДОРОД-РТУТЬ
Диаграмма состояния H—Hg не построена. Согласно работе [ 11
водород не растворяется ни в жидкой, ни в твердой ртути. Довольно
сложные реакции могут привести к образованию гидридов HgH и
HgH2. Известно, что HgH2 стабилен при температурах ниже—125 С,
в то время как смесь HgH и HgH2 не стабильна при температуре
-78 °C [Ш].
Литература
1. ФроммЕ., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ре,.
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
В.И. Шаповалов
Н-Но. ВОДОРОД-ГОЛЬМИЙ
Диаграмма состояния Н—Но не построена. В работе [Ш] указы ва
ется на существование соединений НоН2 и НоН3. Соединение НоН2
обладает кубической структурой типа CaF2 (пр. гр. СтЗхи, а
= 0,5165нм), область гомогенности 66—69 % (ат.) Н [III]. Давление
диссоциации НоН2 выражается зависимостью [1]
Ig (1,3 -10“4/?) = 13,52 - 12110/7,
где р — давление Hg, МПа; Т — температура, К.
П—Ir, H~K
829
Соединение НоН3 имеет гексагональную структуру (пр. гр. Р3с1,
й » 0,6308 нм, с = 0,6560 нм) [Ш]. Нижняя граница однофазной
области НоН3 приходится на 72,6 % (ат.) Н [Ш].
Литература
1. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред.
р.В. Линчевского. М.: Металлургия, 1980. 712 с.
В.П. Полякова
Н—1г. ВОДОРОД-ИРИДИЙ
Диаграмма состояния Н—1г не построена. Согласно работе [1]
растворимость Н в твердом 1г в интервале температур 1400—1600 °C
описывается выражением
Igx = 0,51gp - 2,02 - 3847/Т,
где х — концентрация Н, % (ат.); р — давление, Па; Г — темпе-
ратура, К.
При использовании 1г чистотой 99,999 % растворимость Н в 1г
при давлении 0,1 МПа согласно работе [2] составляет:
Температура, °C ..................... 1581 1530 1521 1432 1393
Растворимость Н, 10~5 % (ат.)........ 2,23 1,79 1,63 1,46 1,30
В работе [3J изучено влияние давления (до 9 ГПа) и температуры
(300—400 °C) на растворимость Н в 1г. Экспериментальное значение
растворимости при давлении Н2 равном 9 ГПа и температуре 250 °C
(температура насыщения) составляет <0,005 % (ат.). Приуменьше-
нии давления до 0,1 МПа растворимость Н в 1г резко падает до
s5- 10-8 % (ат.).
Литература
1. Фромм Е„ Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред.
В-В. Линчевского. М.: Металлургия, 1980. 712 с.
2. McLellan R.B., Oates W.A. // Acta Metall. 1973. V. 21. N 3. P. 181-185.
3. Antonov V.E., Belash J.T., Malyshev V.Y. // Platinium Metals Rev. 1984. V. 28.
.N 4. P. 158-163.
В.П. Полякова
H-к. ВОДОРОД-КАЛИЙ
Диаграмма состояния H—К не построена. Водород начинает актив-
но взаимодействовать с калием при нагреве выше 200 °C. При этом
образуется гидрид КН, имеющий решетку типа NaCl (символ Пирсо-
на cF8, пр. гр. Fmbrn, а = 0,570 нм). Теплота образования составляет
830
H-La
около 61 кДж/моль. Согласно работе [1] зависимость давления
диссоциации от температуры в интервале температур 280—420 Q
имеет вид:
lg (1,3 • 10 4р) = 11,2 - 5850/Т,
где р — давление, МПа; Т — температура, К.
Подробное исследование поглощения Н жидким К предпринято R
работе [2J. Методом Сивертса на специально очищенном расплаве К
и Н была определена растворимость в интервале темпераю р
370—440 °C. Обнаружено влияние температуры на растворимость Н
в жидком К согласно выражению 1g х = 4,39—2930/Т при давлении
0,1 МПа, где х — концентрация Н, % (ат.); Т — температура, К.
Зависимость растворимости Н в жидком К от температуры и
давления в области температур 340—440 °C, полученная в работе |3|,
имеет вид 1g х = 0,5 1g р — 2,32, где х — концентрация Н, % (ат.м
р — давление, Па. В отличие от работы [2] в работе [3] не обнаруже-
но изменение содержания Н при изменении температуры расплав,!.
Литература
1. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
2 Арнольдов М.Н., Ивановский М.Н., Морозов В.А. и др. // Изв. АН СССР
Металлы. 1973. № 1. С. 74—77.
3. Fromm Е., Jehn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324-326.
В.И. Ulanoeaics
H—La. ВОДОРОД—ЛАНТАН
Диаграмма состояния Н—La (рис. 445) построена в интервале
температур 300—900 °C [1] методом термического анализа. Водород
повышает температуру плавления La. Предполагается существование
перитектического равновесия Ж + LaHx « (yLa) при температуре
-1200 °C [2]. Растворимость Н в (0La) подчиняется закону Сивергсз
и в интервале температур 630—780 "С может быть описана как
Igx = 0,51gp - 3,26 + 3525/Т,
где х — концентрация Н, % (ат.).; р — давление, Па; Т — темпераг -
ра, К. Максимальная растворимость Н в (pLa) составляет <12,5 %
(ат.) [3]. В системе обнаружено два гидрида LaH2 и LaH3, между
которыми существует непрерывный ряд твердых растворов aLaH, Г1
4]. Оба гидрида имеют кубическую структуру (пр. гр. Fm3m), а =
= 0,5661 нм [Э| или 0,5667 нм [X] для LaH2; а = 0,5620 нм ди
LaH2 78 и а = 0,5604 нм для LaH3 [Э].
H-La
831
**ис. 445. H-La
1 Низкотемпературная часть диаграммы состояния при —163 —
+127 °C и отношениях H/La = 2,0 - 2,9 исследована в работе [5].
Обнаружено превращение кубической фазы в две тетрагональные:
°Цна образуется при температуре 100 °C, вторая — при температуре
" 50 °C.
В работе [6] дается подробный аналитический обзор по системе
Н—La.
832
Il-Li
Литература
1. Peterson D.T., Straatmann J.A. // J. Phys. Chem. 1966. V. 70. N 9. P. 298n_
2984.
2. Bischof R. 11 J. Less-Common Met. 1985. V. 110. N 1-2. P. 99-106.
3. Fromm E., Jehn H. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324—326
4. Messer C. // J. Less-Common Met. 1977. V. 55. N 2. P. 231—242.
5. Boroch E., Conder K., Ru-Xiu Cai, Kaldis E. //J. Less-Common Met. 1989
V. 156. N 1-2. P. 259-271.
6. Khatamian D., Manchester F.D. // Bull. Alloy Phase Diagrams. 1990. V. 11.4 ]
P. 90-99.
B.IL Полякова
H—Li. ВОДОРОД—ЛИТИЙ
Система H—Li исследована сравнительно хорошо в области кон-
центраций 0—50 % (ат.) Н. Диаграмма состояния (рис. 446) построе-
на по результатам термического анализа и отражает основной харак-
тер взаимодействия этих элементов с образованием 1лН при темпера-
туре 688 + 1 °C и наличием монотектической изотермы при
685 ± 1 °C в области концентраций 13—49 % (ат.) Н [Э].
Li Н^/о (ат.)
Рис. 446. Н—Li
H—Lu
833
, Данные по растворимости Н в жидком Li в интервале температур
710—910 °C обобщены выражением [1]
Igx = 0,51g/? - 3,33 + 2685/Т,
jpe X — концентрация Н, % (ат.); р — давление, Па; Т — температу-
ра, к.
ПН имеет кубическую структуру типа NaCl (символ Пирсона cF8,
пр. гр. Fm3m), параметр решетки а = 0,4093 нм, в работе [Э] указа-
ны еще следующие значения а равные 0,409; 0,408; 0,40834 нм.
ПН широко используется в качестве аккумулятора водорода; при
взаимодействии с водой выделяет 2,800 м3/кг Н [2, 3]. Давление
пара при температуре плавления LiH составляет -0,08 МПа [Ш].
Литература
. I. Fromm Е., Jehn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324—326.
2. Галактионова H.A. Водород в металлах. M.: Металлургия, 1967. 303 с.
3. Андриевский Р.А. Материаловедение гидридов. М.: Металлургия, 1986. 129 с.
В.И. Шаповалов
Н—Lu. ВОДОРОД-ЛЮТЕЦИЙ
Характер взаимодействия в системе Н—Lu при температурах,
близких к точке плавления Lu, практически неизвестен. Имеются
данные о существовании двух соединений в системе: LuH2 и LuH3
[Ш]. Соединение LuH2 существует в области концентраций
65-68 ат. % Н и, по-видимому, имеет кубическую решетку типа
CaF2 (пр. гр. Fm3m, а = 0,5033 нм) [Ш]. Теплота образования LuH2
составляет 200 кДж/моль; температурная зависимость давления
^Диссоциации этого гидрида согласно работе [1] имеет вид 1g р =
- 12,225-10,7/Г, где р — давление, Па; Т — температура, К. Соеди-
нение LuH3 (-73,5 % (ат.) Н) имеет гексагональную структуру с
Параметрами решетки а = 0,3558 нм, с = 0,6443 нм или структуру
Нзотипную HoD3 с параметрами решетки а = 0,6163 нм, с =
*0,6443 нм [Ш]. Согласно работе [Э] LuH2 д обладает гексагональ-
ной структурой с параметрами решетки 'а = 0,357(3) нм, с =
* 0,643(4) нм.
Растворимость Н в (Lu) в работе [2] описана уравнением
Igx = 0,51g/? - 3,25 + 4106/Г,
ЖДе х — концентрация Н, % (ат.); р — давление, Па; Т — температу-
>Ра, К. Предельная растворимость Н в (Lu) в разных температурных
Интервалах определяется зависимостями [2]:
Зак. 2144
834
H-Mg
Igx = 1,4 - 25/TQ5 - 250 °C);
Igx = 1,99 - 347/7(250 - 350 °C);
Igx = 1,67 - 132/7(350 - 850 °C).
При исследовании твердого раствора Н в (Lu) методами электросо-
противления и рентгеноструктурного анализа уточнены границы
фазы и обнаружено существование двух ее модификаций а и а'.
Превращение ос' « а идет при нагреве в интервале температур
170—380 °C и сопровождается сильным (в 1,5 раза) изменением
электросопротивления и параметра решетки [3, 4].
Литература
1. McQuillan A.D. // J. Less-Common Met. 1976. V. 49. N 1-2. P. 431-438.
2. Fromm E., Jehn H. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324—326.
3. Daou J.N., Bonnet J.R. 11 Ber. Kernforschungsanlage Julich, Conf. 6. 1972 Bd. 1
S. 141-159.
4. Daou J.U., Chineb M„ Lucasson P. // J. Less-Common Met. 1981. V 79 N 1.
P. 65-71.
В.И. Шаповалов, В.П. Полякова
H-Mg. ВОДОРОД-МАГНИЙ
В работах [1,2] показано, что Н снижает температуру плавления
Mg до температуры 641 °C, при которой протекает газоэвтектическое
превращение. О газоперитектическом равновесии при температуре
-600 °C сообщено в работе [2]. В системе Н—Mg (рис. 447) установ-
лено образование по перитектической реакции соединения MgH2 с
тетрагональной структурой типа TiO2 (символ Пирсона (76, пр- гр.
Р42/тпт), параметры решетки а = 0,451 нм, с = 0,302 нм [3]. Рас-
творимость Н в твердом Mg ниже, чем в жидком. Согласно работе
[4] растворимость Н в твердом (Mg) имеет вид
Igx = 0,51gp - 2,48 - 1100/7,
где х — концентрация Н, % (ат.); р — давление, Па; Т — температу-
ра, К; растворимость Н в жидком Mg может быть рассчитана по
уравнению в интервале температур 700—800 °C
Igx = 0,51gp - 2,04 - 1400/7.
В интервале температур 650—1000 °C растворимость Н в жидком
увеличивается от 0,05 до 0,15 % (ат.).
Обзорная статья по системе Н—Mg приведена в работе [5].
H-Mg
835
Сердюк Н.П., Семик А.П. // Доклады АН УССР. 1981. № 6
Сердюк Н.П. // Изв. вузов. Цветная металлургия. 1982. № 1 •
₽мс. 447. H-Mg
Литература
_ Шаповалов В.И.,
£ ^2-105.
'*'2. Шаповалов В.И.,
С. 69—73
Вол А.Е. Строение и свойства двойных металлических систем. М.: Физматгиз,
*2 Т. 2. 984 с.
, 1’ Fromm Е., Jehn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324—326
p" . San-Martin A., Manchester F.D. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 5-
27»
В.И. Шаповалов
836
И-Мп
Н-Мп. ВОДОРОД—МАРГАНЕЦ
В работе [X] сообщено об экзотермическом типе поглощения
марганцем водорода при температурах ниже 500 °C и эндотермичес-
ком типе при температурах выше 500 °C. Температурная зависимость
растворимости Н в (аМп) в интервале 140—625 °C может быть описа-
на выражением
Igx = 0,51gp - 3,9 + 133/7 [1],
где х — концентрация Н, % (ат.); р — давление Па; 7 — темпера-
тура, К.
Рис. 448. Н-Мп
Н-Мо
837
В работе [2] не подтверждены эти данные, а сообщено, что рас-
«яовение Н в интервале температур 200—720 °C при давлении
МПа идет с поглощением теплоты:
IgA: = -0,461 - 590/Г.
растворимость Н в (рМп), (уМп) и (бМп) описывается соответствую-
щими уравнениями:
Igx = -0,635 - 276/Т;
Igx = -0,358 - 584/71;
Igx = 1,135 - 2766/7.
В работе [2] показано также, что Н значительно изменяет темпера-
туру плавления и полиморфных превращений Мп. Основываясь на
этих данных, построена диаграмма состояния системы Н—Мп
(рис. 448), включающая газоэвтектическое (1216 °C), газоперитекти-
ческое (1143 °C) и два эвтектоидных (1057 и 662 °C) равновесия.
В работе [1] приведены данные о растворимости Н в жидком Мп
в интервале температур 1350—1450 °C:
Igx = 0,51g/? - 2,4 - 1590/7".
Литература
1. Fromm Е., Jehn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324—326.
В.И. Шаповалов
H—Mo. ВОДОРОД—МОЛИБДЕН
Данные о взаимодействии Н с Мо обобщены в работах [X, Э, 1,
2, 3]. Исследования осуществлены в широком температурном интер-
вале (400—2300 °C) при давлениях до 10 МПа. Гидридов молибдена
Ве обнаружено. Растворимость Н в Мо не превышает 10—2 % (ат.)
при температуре 1600 °C [4]. Согласно работе [5] растворимость Н
® Мо подчиняется закону Сивертса при давлениях до 10 МПа, т.е.
Пропорциональна (р)1 , где р — давление водорода.
В работе [3] приведено уравнение, описывающее зависимость
Растворимости Н от давления и температуры:
1пх = -3.3007’1 + 1пТ - 14,6 + 1пр1/2 ± 0,3,
* — атомная доля Н; Т — температура, К; р — давление, Па.
аблюдается большой разброс экспериментальных значений,
°бенно вблизи температуры 800 °C [6, 7, 8, 9, 10].
'4
&
Ч
838
H—Na
Литература
1. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / щ.ц _
Б.В. Линчевского. М.: Металлургия, 1980. 712 с. Д'
2. Fromm Е„ Jehn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324—326
3. Brewer 1., Lamoreaux R.H. // Atomic Energy Review. Special Issue N 7. Molvbdenil
urn: Physico-Chemical Properties of Its Compounds and Alloys. Vienna: Internationa! Atomi
Energy Agency, 1980. P. 195-356. e
4. Oates W.A., McLellan R.B. // Scr. Metall. 1972. V. 6. P. 349-352.
5. Мазаев А.А., Аварбэ Р.Г., Вильк Ю.Н. 11 Изв. АН СССР. Металлы. 196 ) \с 4
С. 255—256.
6. Захаров А.П., Шарапов В.М. // Физико-химия и механика материалов 1971
Вып. 76. С. 54-58.
7. Sieverts A., Briining К. // Arch. Eisenhuttenwes. 1934. Bd. 7. S. 641—645
8. Hill M.L. // J. Metas. 1960. V. 12. P. 725-726.
9. Lange K.W., Schench H. // Z. Metallkunde. 1969. Bd. 60. S. 62-68.
10. Eguchi T., Morozumi S. // Nippon Kinzoku Gakkai Shi. 1974. V. 38. P 1019-
1025.
В.И. UI(i".',iea.ioe
H—Na. ВОДОРОД—НАТРИЙ
Полный обзор по системе Н—Na на основании 56 источников,
начиная с 1811 г. и включая обобщенную диаграмму состояния
(рис. 449), сделан в работе [1]. Диаграмма состояния системы Н—Na
характеризуется образованием гидрида эквиатомного состава NaH,
давление диссоциации которого, по данным работы [2], представля-
ется зависимостью
t,°c 700 500 300 100 Н, 7о (по массе) 7 7 2 3 0 5 6
i 1 1 1
/то с NaH
^0,00008 97,8 °
^-(Na)
0 10 20 30 00 50 60 Na Н, %(ain.)
Рис. 449. Н—Na
H-Nb
839
lg (1,3- 10V = 11,52 - 5070/7,
к it?
^-давление, МПа; T — температура, К. Теплота образования
-58 кДж/моль [3]. В работе [4] дается температура плав-
ления NaH, равная 638 ± 2 °C, при равновесном давлении
ЮДЗ МПа. Соединение NaH имеет кубическую структуру типа NaCl
^памвол Пирсона с78, пр. гр. Fm3m) с параметром решетки а =
. 0,488 нм [3].
Растворимость Н в жидком Na в интервале температур 110—
4^0 °C в работе [5J описывается выражением
~ *3 Igx = 0,51gp - 2,84 - 122/7,
8>0: ' - ••
тле х — концентрация Н, % (ат.); р — давление, Па; 7 — темпера-
тура, К.
(Предельная растворимость Н в жидком Na в интервале темпера-
Тур ЗОО—400 ° С подчиняется уравнению [5]
' Igx = 3,43 - 2880/7.
-4?Г Ч, &
Литература
1. San-Martin A., Manchester F.D. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 3.
К 287-294.
2. Фромм E., Гебхардт E. Газы и углерод в металлах: Пер. с нем. / Под ред.
Б.В. Линчевского. М.; Металлургия, 1980. 712 с.
3. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
4. Скуратов О. А., Павлов О.Н., Даникин В.И., Волков И.В. // Журнал неоргани-
ческой химии. 1976. Т. 21. С. 2910-2913.
5. Fromm Е., Jehn Н. // Bull. Alloy Phase Diagrams. 1984 V. 5. N 3. P. 324—326.
В.И. Шаповалов
H-Nb. ВОДОРОД—НИОБИЙ
Фазовые превращения в системе обсуждаются во многих работах
Э, Ш, 1—12]. Nb обладает большой способностью к поглощению
И растворяет практически до 50 % (ат.) Н при давлении 0,1 МПа.
Ри понижении температуры происходит образование большого
ела фаз. На рис. 450 приведен вариант диаграммы состояния
стемы Н—Nb согласно работе [12]. Указывается на образование
^ниадцати фаз. Фазы q, 9, е, L, О, ц, v,t у и р образуются по
Азоидным реакциям при содержании Н, равном 0,64; -0,66;
5^5 ~0,77; -0,81; 0,82; 0,83; 0,85; 0,90 и -0,95 % (по массе)
Q ?«, ^твенно. Фаза А образуется конгруэнтно Р й А при содержании
’ 4> (по массе) И.
840
H-Nb
Рис. 450. H-Nb
Твердый раствор (Nb) расслаивается при температурах ниже
200 °C на два твердых раствора а и а'. При концентрации 0,5 % (по
массе) Н и температуре 88 ± 1 °C, по данным работы 111, или
87,5 + 10 °C, по данным работы [3], образуется мототектоид а + Р-
В твердом состоянии протекает семь эвтектоидных превращении' п й
+ 0; 9 ° ® + Р Р ” £ + I; ). в L + О: р * О + v; О » I. + v; ' ?+
+ 5. Образование фаз е и £ установлено в работах [4—5) методом
просвечивающей микроскопии. В работах [7—9] установлено
существование кубической фазы у. В работе [10] приведено '.рав-
нение для расчета растворимости Н в (Nb) в интервале температур
-60 + -100 “С:
Igx = 2,58 - 598/Т,
где х — концентрация Н, % (ат.); Т — температура, К.
В работах ]4, 5] сообщается о превращении г р при понижении
температуры. В работе [5] оно оценивается как фазовый переход
второго рода (в интервале температур 0—66 °C), в работе |4| — Kt,K
II—Nd
841
«гупеячатый распад: г • n, ц • £ (температура перехода —66 °C) и
уЦ р (температура перехода —45 °C). Фазы а и а' имеют ОЦК
1_0уктуру, фаза ₽(NbH]_x) обладает ромбической структурой с
гюрядоченным расположением атомов Н в ’’тетрапорах”, фаза
a(NbH2) имеет ГЦ К структуру предположительно с нсупорядочен-
иЦМ расположением атомов Н в ’’тетрапорах” [5, 10].
Литература
1. Zaber Н., Peisl J. И J. Phys. F, Met. Phys. 1979. V. 9. N 7- P. 1461-1476.
2 Kobler U., Welter J.-M. // J. less-Common Met. 1982. V. 83. N 2. P. 225—236.
3 Lasser R., Bickmann K. // J. Nucl. Mater. 1985. V. 132. N 3. P. 244-248.
4. Pesch W., Schober T„ Wenzl H. // Scr. Metall. 1978. V. 12. P. 815.
5. Makenas B.J., Birnbaum H.K. // Acta Metall. 1982. V. 30. N 2. P. 469—482.
6. Pick M.A., Bausch R. //J. Phys. F, Met. Phys. 1976. V. 6. P. 1751.
7. Schober T., Linke U. // J. Less-Common Met. 1976. V. 44. P. 77.
8. Hwang Y.S., Torgeson D.R., Barnes R.G. // Scr. Metall. 1978. V. 12. P. 507.
9. Schober T. // Proc. 9th Int. Congr. Electr. Mier. Toronto. 1978. V. 1. P. 644.
10. Фромм E., Гебхардт E. Газы и углерод в металлах.: Пер. с нем. / Под ред.
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
11. Schober Т., Wenzl Н. // Phys. Status Solidi(a). 1976. V. 33. Р. 673.
12. Schober Т. // Metal-Hydrogen Phase Diagrams, Electron Structure and Properties
Hydrogen Metals. Proc. NATO Int. Symp. Richmond. 4—6 March. 1982. New York. 1983.
P. 1-19.
В.И. Шаповалов
H—Nd. ВОДОРОД—НЕОДИМ
Схематическая диаграмма состояния Н—Nd приведена на рис. 451
согласно работе [1]. Соединение NdH2 получено путем воздействия
Н на Nd в виде стружки при температуре 220—270 °C. Соединение
NdH2 имеет кубическую структуру типа CaF2 с параметром решетки
Д - 0,547 нм. Растворимость Н в Nd в интервале температур 300—
680 °C подчиняется зависимости [2]
Igx = 2,5 - 1265/7’,
Где х — концентрация Н, % (ат.); Т — температура, К.
> Давление диссоциации в системе Н—NdH2 в интервале температур
ООО— 800 °C описывается выражением [2]
lg (1,3- Ю 4р) = 9,37 - 9796/Т,
Р ~~ давление, МПа; Т — температура, К.
ц. -° Работе (1] сообщено, что Н повышает температуру плавления
и уменьшает температуру превращения aNd « £Nd. Установлена
и°Ласть несмешиваемости в области температур 1100 — -1500 °C. По
842
H-Nd
Рис. 451. H-Nd
перитектоидной реакции при 880 °C образуется фаза у, которая
участвует в эвтектоидной реакции (pNd) (aNd) + у при 814 С и
распадается на (aNd) и NdH2 при 680 °C. Эвтектоидная точка распо-
ложена при концентрации 22 % (ат.) Н. Сплавы, содержащие более
65 % (ат.) Н, не претерпевают превращения, находясь в области
гомогенности NdH2.
В работе [3] установлено существование гидрида NdH3 с ГПУ
решеткой с параметрами а = (0,385 ± 0,001) нм, с = (0,688 ±
+ 0,001) нм. Относительные молярные энтальпии и энтропии образо-
вания гидрида NdH3 соответственно равны —54,5 кДж/моль и
—129 Дж/моль Н2. В работах [4, 5] определены параметры решетки
соединения NdH3, значения которых совпадают со значениями,
приведенными в работе [3].
Литература
1. Peterson D„ Poskie T.J., Straatmann J. A. 11 J. Less-Common Met 1971. V -3
N 2. P. 177-183.
2. Фромм E., Гебхардт E. Газы и углерод в металлах: Пер. с нем. / Под Р-’-С
Б.В. Линчевского. М.,: Металлургия, 1980. 712 с. ,
3. Bischof R., Tellefsen M.,Kaldis Е. 11 J. Less-Common Met. 1985. V. 110 X
P. 99-106. . ,
4. Ohki Ch„ Uchida H„ Ko E. // J. Jap Inst. Metals. 1990. V. 54. N 2. P. 146—’- -
5. Mils M., Hadazi Z., Bixen M. // J. Less-Common Met. 1974. V 37 X
P. 331-335.
В И
H-Ni
843
ВОДОРОД-НИКЕЛЬ
\ растворимость H в твердом и жидком Ni, по данным работы [1],
и&жно записать в виде:
1g х - 0,5 lg р — 2,00 — 870/Г в интерв але температур
350-1400 °C;
1g х = 0,5 lg р — 2,48 —1176/7' в интервале температур
1500-1700 °C,
где х — концентрация Н, % (ат.); р — давление, Па; Т — темпера-
тура, К.
Рис. 452. H-Ni
Несколько отличаются уравнения растворимости Н в твердом Ni
в интервале температур 500—1350 °C, приведенные в работе [2]:
Igx = 0,51gp - 2,952 - 1109/7'.
В <
работе [3] построена высокотемпературная область диаграммы
с°стояния H-Ni (рис. 452) и указано на протекание газоэвтектичес-
Кого превращения при температуре вблизи 1400 °C. В обычных
844
H—Np
условиях гидриды Ni не синтезируются. Для этого нужны дибо
специальные химические реакции, либо очень высокое давление
водорода. Гидрид NiH (структура типа NaCl) получен химическим
путем и катодным насыщением. Он диссоциирует при температурах
от —30 °C до комИатной. Существование гидридов NiH2, NiH4 |Д] и
NiH3 дискутируется в работах [Ш, 5]. В области точки Кюри у N,
обнаружен скачок растворимости [6]. Полный обзор по системе Н—Ni
на основании 79 источников сделан в работе 17].
Литература
1. Fromm Е., Jehn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P 324—326
2. Шаповалов В.И., Сердюк Н.П. // Доклады АН УССР. 1979. № 2. С 151 — 154.
3. Шаповалов В.И., Сердюк Н.П. // Журнал физической химии. 1979 1 53
№ 9. С. 2187-2190.
4. Вол А.Е. Строение и свойства двойных металлических систем. М.: Физмапиз
1962. Т. 2. 984 с.
5. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. ! II, д ред.
В.В. Линчевского. М.: Металлургия, 1980. 712 с.
6. Шаповалов В.И., Бойко Л.В. // Изв. вузов. Черная металлургия. 19X4 8.
С. 122-125.
7. Wayman M.L., Weatherly G.C. // Bull. Alloy Phase Diagrams. 1989. V И) \ 5.
P. 569—580.
В.И. 111Ш1ЧШ№
H—Np. ВОДОРОД—НЕПТУНИЙ
Сведений о системе Н—Np очень мало [1, 2, Э]. При температу-
рах выше 60 °C металлический Np реагирует с газообразным И,
образуя гидриды NpH2 и NpH3 [1, 2]. Гидрид NpH2 имеет кубичес-
кую структуру типа CaF2; NpH3 кристаллизуется в гексагональную
структуру типа РиН3. Давление диссоциации NpH2 в интервале
температур 350—650 °C описывается выражением
Igp = 11,265 - 6126/Г,
где р — давление, Па; Т — температура, К.
В работе [Э] сообщается о возможности образования гидрида
NpH3fr_38, но эта информация из-за чрезвычайно высокого содержа-
ния Н представляется сомнительной.
Литература
1 Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967- 303 с
2 . Фромм Е., Гебхардт Т.Е. Газы и углерод в металлах: Пер. с нем. / I'0-1 1,с'
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
В.И
H-Os, H—Pa, H-Pb, Н-Pd
845
f_Os. ВОДОРОД—ОСМИЙ
Л Система H—Os практически не изучена в работах [X, Ш, 1]. Есть
«Адения, что компактный Os не поглощает Н, но тонкий порошок
хьЗутермически взаимодействует с газом. Существование гидридов не
нн&новлено даже при высоких давлениях (до 9 ГПа) и температурах
да400 °C [2].
Литература
1. Галактионова Е.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
2. Antonov V.E., Belash J.T., Malyshev V.Y. // Platinium Metals Rev. 1984. V. 28.
gf4. P. 158-163.
, В.И. Шаповалов
.6?.
Д-Ра. ВОДОРОД-ПРОТАКТИНИЙ
Ji*.
Система H—Pa изучена крайне ограниченно [X, Э, 1]. Надежно
^йгановлен факт образования гидрида РаН3, имеющего кубическую
фещетку, изоструктурную UH3, с параметром а = 0,6648 нм.
Литература
„с
'/ 1. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред.
в.В. Линчевского. М.: Металлургия, 1980. 712 с.
В.И. Шаповалов
Н-РЬ. ВОДОРОД-СВИНЕЦ
Y/Взаимодействие в системе Pb—N проявляется очень слабо [1, 2].
И практически нерастворим в твердом и жидком Pb [X]. Жидкий РЬ
йбглощает только 1,85- ПУ6 % (ат.) Н при температуре 600 °C и
Явлении 0,1 МПа [3]. В работе [1] сообщается о возможности
Получения соединения РЬН4 при электролизе H2SO4. Этот гидрид
неустойчив и разлагается уже при комнатной температуре.
Литература
1. Галактионова Н.А. Водород в металлах М.: Металлургия, 1967. 303 с.
2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред.
“•В. Линчевского. М.: Металлургия, 1980. 712 с.
3. Fromm Е., Jehn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324—326.
В.И. Шаповалов
Й-Pd. ВОДОРОД—ПАЛЛАДИЙ
Система Н—Pd изучалась неоднократно [X, Ш, Э, 1, 2], но
Полная диаграмма состояния ее не построена. Установлена широкая
~~ласть расслоения при низких температурах (рис. 453). Очень мало
едений получено о взаимодействии этих элементов вблизи темпера-
УРЫ плавления Pd.
846
H—Pd
Рис. 453. H—Pd
Поглощение Н палладием идет
активно уже при комнатной тем-
пературе. Причем абсорбция со-
провождается образованием фаз «
и р, имеющих решетку исходного
чистого металла. Эта важная осо-
бенность отличает Pd от всех ос-
тальных элементов [I]. Твердый
раствор а имеет ГЦК структуру с
параметром решетки, увеличиваю-
щимся от 0,3891 до 0,3894 нм при
увеличении содержания Н до
4,7 % (ат.) Н. Две фазы, аир
находятся в равновесии в интерва-
ле концентраций 4,7 — -39 %
(ат.) Н. Фаза р имеет кубическую
структуру сильно разупорядочен-
ного типа NaCl [2] с областью
гомогенности, в которой параметр
решетки изменяется от 0,4027 до
0,4070 нм. При температуре выше 300 °C или при давлении более
2 МПа Pd и PdH образуют непрерывный ряд твердых растворов. В
работе [Ш] предполагается образование PdH4 при температуре
—200 °C. Растворимость Н в Pd в температурном интервале
—20 + 150 °C может быть описана уравнением [3]
Igx = 0,51gp - 3,30 + 510/Г,
где х — концентрация Н, % (ат.); р — давление Н2, Па; Т — темпе-
ратура, К.
При более высоких температурах (150—980 °C) и концентрации
Н <3 % (ат.) растворимость Н в Pd описывается уравнением
Igx = 0,51gp - 2,97 + 375/Т.
Литература
1. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / 1Н'1
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
3. Fromm Е., Jehn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P 324-. -
В.И. Iilanow<’e
H~Po, H—Pr
847
_ро. ВОДОРОД-ПОЛОНИЙ
Сведений о системе Н—Ро очень мало [1, 2]. Известно, что при
Этическом взаимодействии этих элементов образуется гидрид РоН2,
^Р^тавляющий собой бесцветный радиоактивный газ и при комнат-
ОФЯ'температуре быстро разлагающийся на элементарные составляю-
тЙйе 11» 21.
j. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
3 ''1. Bagnall K.W. // Advan. Inorg. Chem. Radiochem. 1962. V. 4. N 2. P. 197—229.
В.И. Шаповалов
гн-pf. ВОДОРОД—ПРАЗЕОДИМ
Празеодим является гидридообразующим элементом, как и
другие РЗМ. На рис. 454 представлена диаграмма состояния Рг—Н,
Достроенная в работе [М]. Реакция Рг с Н начинается при темпера-
туре выше 300 °C; при этом металл чернеет и охрупчивается [X, Ш,
1, 2]. Гидриды празеодима имеют ГЦК решетку и широкую
^область гомогенности от РгН2 до РгН2 7. Давление диссоциации Н в
Интервале температур 600—800 °C описывается уравнением [2]
Н,°/о(ат.)
Рг
***C. 454. Н—Рг
848
H-Pt, Н-Ри
lg(l,3-10'4p) = 10,229 - 10446/Г,
где p — давление H, МПа; T — температура, К. Растворимость H в
Рг составляет -33 и 16,5 % (ат.) при температурах 850 и 650 “Q
соответственно [2].
В работе [3] указывается на существование перитектической
реакции Ж + РгНЛ * (рРг) при температуре 1250 °C и давлении
0,5 МПа. Другое превращение, природа которого не установлена
имеет место при 1060 °C.
В работе [4] сообщается о существовании гидрида РгН3 с гексаго-
нальной структурой, параметры решетки а= (0,389 ± 0,001) нм, с =
= (0,694 ± 0,001) нм.
Литература
I. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Ilei ред.
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
3. Bischof R., Tellefsen М„ Kaldis Е. // J. Less-Common Mel. 1985. V. 110 \ 1-2
Р. 99-106.
4. Ohki Ch., LJchida H., Ко Е. // J. Jap. Inst. Met. 1990. V. 54. N 2. P. 146—152.
В.И. Шапочное
Н-Pt. ВОДОРОД-ПЛАТИНА
Согласно работе [X] растворимость H в компактной Pt невелика:
Температура, °C ........... 409 827 1033 1136 1239 1342
Растворимость Н, 10-2 % (ат.) .. .0,12 0,18 0,41 0,70 1,07 1.64
Растворимость Н в Pt в интервале температур 300—1400 °C сомасно
работе [1] подчиняется зависимости
Igx = 0,51g (р-10) - 2,36 - 2404/Т,
где х — концентрация Н, % (ат.); р — давление, МПа; Т — темпера-
тура, К.
Литература
1. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / НPtJ
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
Л.Л. Р:
Н—Ри. ВОДОРОД-ПЛУТОНИЙ
Взаимодействие в системе Н—Ри изучено в работах [X, Э. 1- 2]
при температурах до 900 °C. Растворимость Н в жидком и тверда1
Ри довольно высока, при этом происходит выделение тепла.
видно из диаграммы состояния (рис. 455) [2], химическое взаимолеи-
Н—Ри
849
Рис. 455. Н—Ри
ствие приводит к образованию гидридов РиН2 (с кубической структу-
рой типа CaF2) и РиН3 (с гексагональной структурой). Оба гидрида
имеют довольно значительные области гомогенности. В системе Н—Ри
возможна эвтектическая реакция.
Давление диссоциации РиН2 в интервале температур 500—800 °C
согласно работе [2] имеет вид
Ig(l,3- 10'4р) = 10,00 - 8165/7°,
гАе р — давление, МПА; Т — температура, К.
Гидрид РиН2 может растворять до -7 % (ат.) Н, при этом пара-
метр решетки а уменьшается до 0,534 нм (РиН25). Гидрид РиН3
Имеет гексагональную структуру с параметрами решетки а =
^,378 нм, с = 0,676 нм.
850
H-Rb, H—Re, H-Rh
Литература
1. Галактионова H.A. Водород в металлах. М.; Металлургия, 1967. 303 с.
2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / пС)( .
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
В.И. Шаповалов
H-Rb. ВОДОРОД-РУБИДИЙ
Известно, что Rb гидридообразующий элемент [Э, 1], но R
реагирует с ним менее активно, чем с Li, Na или К. При этом обра-
зуется соединение RbH — белое кристаллическое вещество с решет-
кой типа NaCl, теплота образования которого около 50 кДж/моль, а
упругость диссоциации в интервале температур 280—480 °C зависит
от температуры следующим образом:
1g (1,3 • 10-4р> = 9,20 - 4533/7’,
где р — давление, МПа; Т — температура, К.
Соединение RbH начинает диссоциировать при температурах
выше 200 °C и разлагается, не достигая температуры плавления.
Литература
I. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
В.И. Шаповалов
H—Re. ВОДОРОД-РЕНИЙ
Сведения о системе H—Re очень ограниченны [X, Ш, 1. 2].
Вероятно, эти элементы не взаимодействуют в обычных условиях.
Тонкоизмсльченный Re поглощает Н [1], но это, по-видимому,
связано с адсорбцией, а не с растворением Н в кристаллической
решетке. Сведения о существовании гидрида ReH [3] требуют про-
верки.
Литература
I. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / П<’.т рел-
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
3 Сончина О.А. Редкие металлы. М.: Металлургиздат, 1955. 84 с.
В И. Шаповалов
H-Rh. ВОДОРОД-РОДИЙ
Сведений о взаимодействии в системе Н—Rh очень мало [X. Ш.
Э, 1, 2]. Согласно работе [3] Н образует с Rh разбавленный твер1ЫИ
раствор внедрения. Теплота растворения при этом составляет около
50 кДж/моль. Поглощение родием Н идет очень вяло и может быть
активизировано только специальными приемами [2]. Зависимое!
H—Ru
851
Растворимости H в кристаллическом Rh выражается формулой |4J в
Интервале температур 800—1600 °C:
Igx = 0,51gp - 3,12 - 1394/7,
^где х ~~ концентрация Н, % (ат.); р — давление, Па; Т — температу-
ра» К.
, взаимодействие между Н и Rh при высоких давлениях (до 9 ГПа)
^мпературах до 400 °C исследовано в работе [5].
-Литература
В ."'1. Галактионова Н.А. Водород в металлах: И.: Металлургия, 1967. 303 с.
н.. 2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред.
В В Линчевского. М.: Металлургия, 1980. 712 с.
3. McLellan R.B., Oates W.A. И Acta Metall. 1973. V. 21. N 3. P. 181-185.
4. Fromm E., Jehn H. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324—326.
5. Antonov V.E., Belash J.T., Malyshev V.Y. // Platinium Metals Rev. 1984. V. 28.
N 4. P. 158-163.
В.И. Шаповалов
H-Ru. ВОДОРОД—РУТЕНИЙ
Информация о системе Н—Ru очень ограниченна [X, III, 1, 2]. В
^Монолитном состоянии Ru эндотермически поглощает очень мало Н,
образуя твердый раствор внедрения. Концентрация Н в (Ru) в интер-
вале температур 1000—1500 °C может быть описана следующим
.Сражением [3]:
igx = 0,51g(p-10) - 2,87 - 2807/7,
W х — концентрация Н, % (ат.); р — давление, МПа; 7 — темпера-
*Ура, К.
Теплота растворения Н в Ru составляет ПО кДж/моль [4]. Сведе-
ний о существовании гидридов и влиянии Н на температуру плавле-
ния Ru нет.
В работе [5] приведены данные о растворимости Н в Ru при
• высоких давлениях (до 9 ГПа) и низких температурах (ниже 430 °C).
Литература
г/ .
,, *• Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
1 Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред.
’В‘ ЛИнчевского. М.: Металлургия, 1980. 712 с.
Fromm Е., Jehn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324—326.
f 4. McLellan R.B., Oates W.A.//Acta Met. 1973. V. 21. N 3. P. 181—185.
м . Ant°nov V.E., Belash J.T., Malyshev V.Y. // Platinium Metals Rev. 1984. V. 28.
%. N 4. p. 158-163.
,М, В.И. Шаповалов
852
H-Sb, H—Sc
H-Sb. ВОДОРОД-СУРЬМА
Водород практически нерастворим в жидкой и твердой сурьме [1]
Большинство информации о системе Н—Sb относится к гидриду
SbH3 — стибину. В обычных условиях это бесцветный очень ядовитый
газ, теплота образования которого составляет 144 кДж/моль. Он
легко разлагается при незначительном нагреве и может даже взры-
ваться при повышении температуры до 230 °C.
Литература
1. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
В.И. Шаповалов
Н—Sc. ВОДОРОД—СКАНДИЙ
Информация о системе Н—Sc весьма ограниченна [Э, 1, 2]. Скан-
дий легко взаимодействует с водородом, образуя соединение ScH2_
с кубической структурой, в которой атомы металла кристаллизуются
в ГЦК решетку с параметром а = 0,483 нм. В работе [3] сообщается,
что гексагональный (aSc) растворяет до 32—33 % (ат.) Н при комнат-
ной температуре. Смесь фаз (aSc) + ScH2_x существует в интервале
концентраций 35—57 % (ат.) Н (рис. 456).
8с И, °/о (ат.)
Рис. 456. Н—Sc
H—Si
853
\ Давление диссоциации ScH2_x в интервале температур 600—
1050 °C можно рассчитать по уравнению [1]
. п
' 1g (1,3-10 4р) = 10,48 - 10490/7,
fit '
р — давление, МПа; Т — температура, К.
растворимость Н в Sc в интервале температур 600—1050 °C до 5 %
(ат.) Н можно описать уравнением
Igx = 0,51gp - 2,59 + 4700/7,
где х — концентрация Н, % (ат.); р — давление, Па.
-,о Предельная растворимость Н в (aSc) в интервале температур 600—
1050 °C имеет вид
Igx = 1,7 - 132/7.
При высоких давлениях водорода (до 1,2 ГПа) удалось получить
тригидрид Sc [4], который оказался нестабильным в обычных
условиях.
Литература
1. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967- 303 с.
2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред.
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
3. Азарх З.М., фунин В.Н. // Кристаллография. 1965. Т. 10. № 7. С. 111—115.
4. Башкин И.О., Понятовский Е.Г., Кост М.Е. // Изв. АН СССР. Неорганические
материалы. 1978. Т. 14. № 9. С. 1615-1616.
В.И. Шаповалов
H-S1. ВОДОРОД-КРЕМНИЙ
v Кристаллический Si в обычных условиях не реагирует с Н [1,2].
Химической реакцией при действии НС1 на Mg2Si удалось получить
РЯД гидридов, называемых силанами: SiH4; Si2H6; Si3H8; Si4H10. Все
силаны обладают неприятным запахом и ядовиты. SiH4 и Si2H6 при
комнатной температуре газообразны; Si3H8 и Si4H]0 — жидкие.
В работе [3] приведена зависимость растворимости Н в жидком Si
’ Температуры:
Igx = -57800/7" + 2,0684.
854
H-Si
Рис. 457. H-Si
В твердом состоянии растворимость Н в Si в интервале температур
1250—1400 °C описывается уравнением 13]
Igx = -12700/Т + 5,31,
где х — концентрация Н, % (ат.); Т — температура, К.
При температурах ниже 1200 °C растворимость Н в Si составляет
менее 0,099- 10~3 % (ат.).
Диаграмма состояния системы Н—Si приведена на рис. 457
Литература
1. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967- 303 с.
2. ФроммЕ., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Hoi рЭД-
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
3. Костина Т.К., Баум Б.А., Курочкин К.Г. // Изв. АН СССР. Неорганические
материалы. 1970. Т. 6. № 1. С. 117—120.
В.И Шчг.оаалов
H~Sm
855
д-Srn. ВОДОРОД—САМАРИЙ
Самарий легко взаимодействует с Н2 при незначительном нагреве,
образу» как твердые растворы, так и гидриды (рис. 458) [1, 2].
Растворимость Н в (aSm) в интервале температур 500—600 °C
подчиняется зависимости [3]
Igx = 0,51gpH2 - 3,00 + 3685/Т,
да х _ концентрация Н, % (ат.); р — давление Н, Па; Т — темпера-
тура, К«
3m Н. (ат.)
Мс.’ 458. Н—Sm
В системе известно два гидрида: SmH2 и SmH3, первый из которых
имеет кубическую решетку типа CaF2 с параметром а = 0,3782 нм,
и^орой кристаллизуется в ГПУ структуру с параметрами решетки а =
* У.’3782 нм, с = 0,6779 нм [4] (аналогичные результаты получены
и Работах [5, 6]).
оп ^авление диссоциации SmH2 в интервале температур 600—800 °C
исывается выражением
lg (1,3 • 10 4р) = 11,4 - 11700/7" [2],
п
р давление, МПа; Т — температура, К.
856
H—Sn
В [6] сообщается об относительных молярных энтальпии и энтро-
пии образования гидрида SmH3, соответственно равными
—74,6 кДж/моль и —136 Дж/моль. Теплота образования SmH-, со-
ставляет 197 кДж/моль [Э]. В работе [7] установлена энтальпия
превращения SmH2 в SmH3 — 16,8 кДж/моль.
Литература
1. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
3. Fromm Е., Jehn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 32-1—326
4. Pebler A., Wallace W.E. // J. Phys. Chem. 1962. V. 66. P. 148.
5. Greis О., Knappe P., Muller H. // J. Solid State Chem. 1989. V. 39. P. 41).
6. Ohki Ch., Uchida H., Ko E. // J. Jap. Inst. Metals. 1990. V. 54. N 2. P. 146—152
7. Mitz M„ Hadazi Z., Bixon M. // J. Less-Common Met. 1974. V. 37 \ 3
P. 331-335.
В.И. Шаповалов
H—Sn. ВОДОРОД-ОЛОВО
Данных по системе H—Sn пока недостаточно даже для построения
хотя бы участка диаграммы состояния Н—Sn [1, 2]. При специально
проведенных химических реакциях [1] удалось получить гидрид
SnH4 (станнан). В обычных условиях это бесцветный очень ядовитый
газ. Температура плавления SnH4 составляет —150 °C, температура
кипения —52 °C. Считается, что атомная структура этого гидрида
подобна структуре металла. Теплота его образования составляет
-160 кДж/моль. Станнан очень неустойчив и разлагается при темпе-
ратуре 20 °C, а при температурах выше 160 °C его распад осущес-
твляется почти взрывообразно. Растворимость Н в (Sn) невысока
даже при значительном перегреве выше точки плавления [11 и в
интервале температур 1000—1300 °C описывается уравнением [2|
Igx = 0,51gp + 0,29 - 6540/Т,
где х — концентрация Н, % (ат.); р — давление, Па; Т — температУ'
ра, К.
Заметной растворимости Н в твердом (Sn) не обнаружено.
Литература
1. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 t
2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Н ’-' *
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
В.И. Шаповал06
H~Sr
857
^Г. ВОДОРОД—СТРОНЦИЙ
нь система H—Sr исследована достаточно полно [1, 2, X, Э, Ш]. На
1$Йс. 459 приведен фрагмент диаграммы состояния системы Н—Sr,
^Дробно проанализированный в работах [2, III]. Водород хорошо
растворим в обеих модификациях Sr и, кроме того, образует гидрид
SrH?- Давление диссоциации этого гидрида при температурах до
1000 °C можно описать уравнением (2]
; 459. H-Sr
858
И—Та
Теплота образования SrH2 составляет 176 кДж/моль. В интервале
температур 855—820 °C гидрид претерпевает полиморфное превращу
ние. Низкотемпературная модификация aSrH2 имеет ромбичи кую
структуру с параметрами решетки а = 0,6377 нм, b - 0,7358 нм. с =
= 0,3885 нм [X]. В работе [3] определен концентрационный ин1ервал
существования SrH2 при температуре 800 °C. Энтальпия растворения
газообразного Н в (aSr) составляет 120 кДж/моль, в (08п _
75 кДж/моль. Энтальпия образования aSrH2 составляет
180 кДж/моль, pSrH2 — 190 кДж/моль.
Литература
1. Галактионова К.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Ц.?, рСд
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
3. Petersen D.T., Nelson S.O. // J. Less-Common Met. 1980. V. 72. N 2. P. 25 i--256
В.И. IHatiuMLioa
H—Та. ВОДОРОД-ТАНТАЛ
Тантал активно экзотермически взаимодействует с Н [1, 2]. Рас-
творимость Н в (Та) в интервале температур 40—94 °C подчиняется
зависимости [3]
Igx = o,51gp - 3,56 + 1800/Г,
где х — концентрация Н, % (ат.); р — давление Н, Па; Т — темпера-
тура, К. Следует отметить значительные расхождения в определении
значений пределов растворимости Н в Та, приводимые в литера гуре,
на что справедливо указано в работе [1].
Сведения о фазах системы Н—Та противоречивы, что связано с
частичным или полным упорядочением фаз при низких темпера i \ рах
|4—7J. Наиболее надежными представляются результаты, полученные
в работе |6] и позволившие построить значительную часть дишрам-
мы состояния системы Н—Та; в этом исследовании использовали
монокристаллический Та чистотой 99,999 % (по массе). Болес 150
образцов исследовали методами дифференциального термического и
металлографического анализов. Точность определения концентрации
Н составляла +0,2 %. Диаграмма, приведенная на рис. 460, построе-
на в работе [8] на основании результатов исследования [6] и данных
работы [71 по магнитной восприимчивости. В системе при темпера-
туре 46,3 ± 0,3 °C образуется фаза 0 по перитектоидной реакции и3
г + (а'Та), эвтектоидный распад фазы (а'Та) на 0 + S происходит
при 45,3 + 0,3 °C; эвтектоидный распад фазы 6 на С + у протекает
при температурах —79 °C. В фазах (аТа) и (а'Та) металлические
H-Та
859
460. Н—Та
860
H-Tb
атомы образуют ОЦК структуру; фазы 0, б, £ и у предстаю лЮт
собой упорядоченные фазы внедрения, фаза е — частично упор;щ0.
ченная. Фазы б и С имеют моноклинную структуру. Параметру
решетки фазы б : а = 0,3390 нм, с == 0,3438, у = 90,5° при содержании
41,2 % (ат.) Н [8]. Фаза т] имеет псевдоромбическую структуру
Структура фаз у и 0 не установлена. Фазы 0 и е имеют ромбическую
структуру. Параметры решетки фазы 0 : а = 0,3359 нм, . =
= 0,3398 нм, у = 90,3° при содержании 33,3 % (ат.) Н. Параметры
решетки фазы е : а = 0,3368 нм, с = 0,3395 нм, у = 90,5° при содер-
жании 29,1 % (ат.) Н [8].
Литература
1. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред.
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
3. Fromm Е., Jehn Н. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 32л 326
4. Kobler U., Welter J.M. // J. Less-Common Met. 1982. V. 84. N 2. P. 225- 235,
5. Flanagan T.B., Schober T., Wenze H. // Acta Met. 1983. V. 31. N 4. P. 483 -487,
6. Schober T., Carl A. // Scr. Met. 1977. V. 11. N 5. P. 397-400.
7. Kobler U., Shober T. // J. Less-Common Met. 1978. V. 60. N 1. P. 101—107.
8. San-Martin A., Manchester F.D. // J. Phase Equilibria. 1991. V. 12 \ 3.
P. 332-370.
В.И. lllatii, Moe
H-Tb. ВОДОРОД—ТЕРБИЙ
Изменение растворимости Н в (аТЬ) в зависимости от температу-
ры и давления в интервале температур 560—980 °C можно описать
уравнением [1]
Igx = 0,51gp - 3,24 + 4046/7’,
где х — концентрация Н, % (ат.); р — давление, Па; Т — температу-
ра, К. В системе Н—ТЬ обнаружены гидриды кубический ТЫП с
решеткой типа CaF2 (символ Пирсона cF12, пр. гр. Fm3m) и пара-
метром решетки а - 0,522 нм и гексагональный ТЬН3 с пара мп рами
решетки а = 0,37 нм, с - 0,6658 нм [III]. Давление диссоциации
ТЬН2 в интервале температур 600—800 °C подчиняется уравнению
1g (1,3 -10 4р) = 10,28 - 11320/7°,
где р — давление, МПа [2]. Теплота образования этого пприДа
составляет -210 кДж/моль [3]. В этой же работе [3] дано выра-*с'
ние для давления диссоциации ТЬН2, которое несколько отличаете”
от приведенного в работе [2]:
lg(p-10) = (10,18 ± 0,09) - (10930 ± 120)/7°.
||Г2. Фромм ь.,
к к. Линчевского
В< a-
Jft»»Pe,ypa
j । pfomitt E., Jehn H. It Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324—326.
” Гебхардт E. Газы и углерод в металлах: Пер. с нем. / Под ред.
. М.: Металлургия, 1980. 712 с.
A.D. // J. Less-Common Met. 1976. V. 49. Р. 431-438.
В.И. Шаповалов
H^Th. ВОДОРОД-ТОРИЙ
Взаимодействие в системе Н—Th проявляется активно даже при
температуре 20 °C [1, X, Э, Ш]. Нагрев активизирует процесс, но
приводит к уменьшению равновесной растворимости Н в металле, так
кек процесс идет экзотермически. Температурная зависимость рас-
дрримости Н в (aTh) в интервале температур 200—800 °C описыва-
ется выражением
Г1
= 0,51g/) - 1,78 + 2090/Т [2],
адЬ х — концентрация Н, % (ат.); р — давление, Па; Т — темпера-
тура, К.
862
H-Ti
В системе обнаружено два гидрида (рис. 461): тетрагональный
ThH2 со структурой типа СаС2 (6 атомов в элементарной ячейку
(символ Пирсона /76, пр. гр. 14/ттт) с параметрами решетки а =
= 0,410 нм, с = 0,503 нм и Th4H]5, структура которого окончатель-
но не установлена (возможно, кубическая). Давление диссоциаццй
ThH2 в интервале температур 300—800 °C можно рассчита н, по
уравнению [2]
1g (1,3 • 10’4р) = 9,50 + 7650/Т,
где р — давление, МПа.
Энтальпия растворения Н в Th составляет 88 кДж/моль, энталь-
пия образования гидридов ThH2 и Th4H15 соответственно равна 143
и 67 кДж/моль.
Литература
1. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967- 303 с.
2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / По: ред.
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
3. Peterson Н.Т., Nelson S.O. // J. Less-Common Met. 1981. V. 80. N 2. P. 221-226.
В.И. Шапм./лов
H-Ti. ВОДОРОД—ТИТАН
Взаимодействие Ti с H2 при высоких температурах изучено в
работе [1]; установлено, что водород снижает температуру плавления
Ti; при 1532 °C происходит газоэвтектическое превращение:
Ж * (0Ti) + Н2.
Предложен новый вариант диаграммы состояния, включающий также
известные данные о взаимодействии Ti с Н при более низких темпе-
ратурах (рис. 462). Следует отметить, что условия протекания эвтек-
тоидного превращения при температуре 300 °C установлены доста-
точно надежно и подтверждены последними исследованиями |2]<
Максимальная растворимость Н в aTi составляет 6,7 % (ат.). Нри
взаимодействии Н с Ti, кроме образования насыщенных тверд*?4
растворов а, наблюдается также появление новой фазы TiHj,5-2,0
переменного состава, которая при температурах выше 37 °C имеет
кубическую структуру, по-видимому, типа CaF2 с параметром решет-
ки а = 0,444 нм, а при температурах ниже 37 °C — тетрагональную,
по-видимому, типа СаС2 с параметрами решетки а = 0,446 нм. с "
= 0,445 нм ЦП].
H-Ti
863
₽ИС. 462. н-Ti
Растворимость
*« 14].-
Н в Ti описывается следующими выражения-
lg х = Q 5 ig р _ 3,22 + 2550/Т при концентрациях Н < 7 % <ат.)
и в интервале температур 500—882 °C; .
1g х «0,5 lg р - 3,00 + 2730/Т при концентрациях Н < 2U /о ^тл
” в интервале температур 600—1227 С;
lg х = 0,5 lg р - 2,73 + 2380/Г при концентрациях Н < 2,4 А щтл
И в интервале температур 1675—2127 С,
^Ура? ^РНцентРация % (ат >; Р~ давление Н2,
Па; Т — темпе-
864
Н-П
Растворимость H в (aTi) в интервале температур 44—300 °C имеет
вид
1g (1,3 • 10’4р) = 2,6 - 1090/Т.
Давление диссоциации TiH2 при температурах ниже 300 °C можно
описать уравнением [5]
1g (р • 10) = 9,2 - 6900/Т;
в интервале температур 300—600 “С — уравнением
lg (1,3 • 10'4р) = 13,5 + 9500/Т,
где р — давление, МПа; Т — температура, К.
Давление диссоциации (pTi) в интервале температур 300—600 °C
описывается уравнением
1g (1,3 -10’4р) = 5,3 + 5000/Т [5].
Литература
1. Шаповалов В.И., Сердюк Н.П., Титков А.Л. // Изв. вузов. Цветная MCia.i ivp-
гия. 1983. № 6. С. 74-78.
2. Frame С., San-Martin A., Khatamian D., Manchester F.D. Il Proc. 10ih Int.
CODATA Conf., Ottava, 14-17 July, 1986. Amsterdam: 1987. P. 170-173.
3. San-Martin A., Manchester F.D., // Bull. Alloy Phase Diagrams. 1980. V 8 X I.
P. 30-40.
4. Fromm E., Jehn H. // Bull. Alloy Phase Diagrams. 1984. V. 5. N 3. P. 324—326.
5. Фромм E., Гебхардт E. Газы и углерод в металлах, Пер. с нем. / Нод ред
Б.В. Линчевского. М.: Металлургия, 1980. 712 с.
В.И. ШимлШ
Н—TLВОДОРОД-ТАЛЛИЙ
Водород не растворим в жидком и твердом TI [X, 1, 2]. При
взаимодействии атомарного Н с Т1 можно получить гидриды 11Н и
Т1Н3, свойства которых почти не изучены. Это нестабильные'
соединения, легко распадающиеся на элементы при нагрсвС
выше 200 °C.
Литература
1. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с
2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Не; !к-1'
Б.В. Линчевского. М.. Металлургия, 1980. 712 с.
В.И. IIIan<>MvW
H-Tm, H-U
865
Jjturm. ВОДОРОД-ТУЛИИ
Тулий — гидридообразующий элемент. В системе Н—Тт обнару-
жено ДВа гидрида: кубический ТтН1 94_2 02 (структурный тип,
вероятн°, CaF2) с параметром решетки а = 0’50894 (8) нм и гексаго-
gqflbHbrii с областью гомогенности 66,5—70,5 % (ат.) [Ill] и парамет-
решетки а = 0,35964(7) нм и с = 0,6493(2) нм [1]. Давление
диссоциации соединений зависит от температуры следующим
образом [2]:
lg(l,3-10’4p) = 10,82 - 11570/7,
ще р — давление Н2, МПа; Т — температура, К.
В работе [1] методами измерения равновесного давления при
сорбции и десорбции водорода тулием чистотой 99,9 % в интервале
температур 300—400 °C и рентгеновского анализа построена р—х
диаграмма состояния системы Н—Тт.
Литература
1. Miilier Н., Knappe Р. // J. Less-Common Met. 1982. V. 87. N 1. Р. 59-62.
2. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред.
S.B. Линчевского. М.: Металлургия. 1980. 712 с.
В.И. Шаповалов
Н—U. ВОДОРОД—УРАН
Диаграмме состояния Н—U (рис. 463), как одной из важнейших
Для понимания физико-химической природы актинидов, посвящено
большое число исследований, обзор которых приведен в работе [ 1 ].
В системе обнаружен гидрид UH3, имеющий две модификации.
Согласно обзору [X] равновесная концентрация Н в (aU) составляет
% (ат.) и мало меняется с температурой. Максимальная раство-
римость Н в (pU) составляет 0,2 % (ат.), в (yU) — 0,35 % (ат.). При
давлении U растворимость Н возрастает от 0,40 до 0,66 % (ат.) и
Достигает 0,71 % (ат.) при температуре 1250 °C.
Высокотемпературная модификация 0UH3 обладает примитивной
кубической решеткой типа HnU (символ Пирсона сР32, пр. гр.
. ^Зп) с параметром а = 0,66445 нм [X] или а = 0,6631 нм [Ш].
уЗкотемпературная модификация aUH3 получена взаимодействием
с Н при низкой температуре в криостате при различных давлениях
Ртного газа; отмечают ферромагнитную природу гидрида и его
+ 43б^°Н°СТЬ РаствоРять Н 1111]. Температура распада aUH3 ~ 430
Ла & С, очевидно, относится к пересыщенному ураном гидриду [X].
463 температура aUH3 * pUH3 превращения принята равной
Кристаллическая структура aUH3 кубическая типа Cr3Si
28 Зак. 2[44
866
И-V
(символ Пирсона сР8, пр.гр. РтЗп) с параметром решетки а =
= 0,4160 нм [Ш] или а = 0,416 нм [X] с восемью атомами в элемен-
тарной ячейке.
В работе [2] на основании имеющейся экспериментальной Г—х
диаграммы состояния была построена диаграмма состояния Н—U в
координатах р—Т—х при изменении давления до 8,3 МПа. В работе
[3] данные работы [21 получили подтверждение.
Литература
1. Chiotti Р. // Bull. Alloy Phase Diagrams. 1980. V. 1. N 2. P. 99—106.
2. Guinet Ph. //J. Nucl. Mater. 1968. V. 25. N 1. P. 24-37.
3. Northup Clyde J.M. // Plutonium and other Actinides. Proc. 5th Int. Conf., Baden-
Baden, 1975. Amsterdam. 1976. P. 109—114.
В.И.
H-V. ВОДОРОД—ВАНАДИЙ
Диаграмма состояния Н—V на протяжении последних 30 лет
привлекает пристальное внимание исследователей. Достаточно
полные обзоры более ранних работ по этой системе можно найти в
справочной литературе [X, Э, Ш].
H-V
867
H, 7» (ат.}
Рис. 464. Н—V
Наиболее обстоятельно эта система исследована в работе [1],
результаты которой получили подтверждение в более поздних публи-
кациях [2, 3]. Систему Н—V исследовали методом дифференциально-
го термического анализа с использованием весьма чистых исходных
компонентов. В системе установлен ряд превращений: образование
фаз в и р соответственно при 197 + 1 и 173 ± 1 °C (рис. 464), эвтек-
тоидный распад фазы е на а + Р при 164 ± 1 °C и перитектоидное
.образование фазы 6 из г) + е при —51 + 1 °C. Фаза ц является низко-
температурной модификацией фазы р и образуется по перитектоид-
вои реакции р + а « ц. Фаза С образуется по перитектоидной реакции
e + Y в С Фаза 6 (V3H2) имеет моноклинную структуру, символ
Пирсона лпС10 (4]. Фаза y(VH2) имеет структуру типа CaF2 (символ
Пирсона cF12, пр. гр. Fm3m) [4]. Растворение Н в (V) приводит к
Увеличению параметра решетки последнего. Фаза р (VH0 5) имеет
тетрагональную структуру, параметры решетки которой изменяются
^зависимости от состава; при содержании 31,5 % (ат.) Н а =
°>ЗОО2 нм, с = 0,3302 нм.
28*
868
H-W, H-Y
Литература
1. Schober T., Carl A. // Phys. Status Solidi(a). 1977. V. 43. N 2. P. 443~ч4Ч
2. Westlake D.G. // Seri. Met. 1977. V. 11. N 10. P. 887-888.
3. Pesch W., Schober T., Wenzl H. // Seri. Met. 1982. V. 16. N 3. P. 307--31 ->
4. Smith J.F., Peterson D.T. // Bull. Alloy Phase Diagrams. 1982. \' t \ ,
P. 55-60. 1
В.И. 1Пч'ъ-,виЛ0в
H-W. ВОДОРОД-ВОЛЬФРАМ
Данные о взаимодействии Н с W обобщены в работах (X. Щ]
Большинство исследователей отмечают, что W не образует гидридов
и нс поглощает Н при нагреве. В работе [1,2] приведены выражения
для изобарной растворимости Н в W в интервале давлений
0,1—10 МПа для двух температурных интервалов:
Igx = 0,51g/? - 3,62 - 1090/Т при 1600 - 2430 °C;
Igx = 0,5Igp - 2,40 - 4380/Т при 2430 - 3500 °C,
где х — концентрация Н, % (ат.); р — давление Н2, Па; Т — темпе-
ратура, К. Вычисленная по последнему уравнению растворимость Н
в W при температуре 3350 °C составляет 0,43 и 4,3 см3 Н в 100 г W
соответственно при давлении 0,1 и 10 МПа. В работе [3] приведено
уравнение, описывающее зависимость растворимости Н от давления
в интервале температур 900—1750 °C.
Igx = 0,51gp - 1,49 - 5250/Т.
Литература
1. Мазаев А.А., Аварбэ Р.Г., Вильк Ю.Н. // Изв. АН СССР. Металлы. 1968 № 6
С. 223-226.
2. Мазаев А.А., Аварбэ Р.Г., Вильк Ю.Н. // Журнал физической химии 1968
Т. 42, № 3. С. 641-643.
3. Frauenfelder R. // J. Vac. Sci. Techno!. 1969. V. 6. P. 388-397.
В.И.
H-Y. ВОДОРОД—ИТТРИЙ
На рис. 465 приведена диаграмма состояния Н—Y [1], широк0
представленная в литературе, наиболее удачно описывающая фазовое
состояние сплавов системы. Более поздние исследования, напР1,мСР
(2—4], не внесли существенного изменения в представления о
H-Y
869
H, % (no пассе)
Рис. 465. H-Y
Модействии Н с Y. В системе образуются гидриды: YH0 9_2 ( и
^2,8-3,0-
Растворимость Н в (aY) в интервале температур 900—1300 °C
можно описать уравнением
Igx = 0,51g/? - 2,0 + 4250/Т,
х — концентрация Н, % (ат.); р — давление, Па; Т — температу-
ра, К.
Предельная растворимость Н в Y в интервале температур 20—
... С имеет вид
Igx = 1,7 - 171/7’’.
’ ( Давление диссоциации YH2 в интервале температур 600—950 °C
^ожно рассчитать по уравнению [1J
A.'.q lg(l,3-10 4р) = 10,52 - 11870/Т,
Р ~~ Давление, МПа.
870
H-Yb, H—Zn
Гидрид УН2_Л имеет кубическую структуру типа CaF2 (символ
Пирсона cF\2, пр. гр. Fm3m) с параметром решетки а = 0,520! нм.
гидрид YH3_X имеет, по-видимому, гексагональную структуру типа
HoD3 (символ Пирсона ЛР24, пр. гр. Р3с1), с параметрами решетки
а = 0,636 нм, с = 0,6659 нм [Ш].
Литература
1. Фромм Е., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / 1(,»л ред
Б.В. Линчевского, М.: Металлургия, 1980. 712 с.
2. Tanse М., Eisher P.W., Watson J.S. // J. Less-Common Met. 1984. V 49 \ ।
P. 23-31.
3. Bonnet J.E., Juckum C., Lucasson A. // J. Phys, F, Met. Phys. 1982 V 12 4
P. 699-711.
4. Khatamian D., Manchester F.D. // Bull. Alloy Diagrams. 1988. V ') \ з
P. 252-260.
В.И. Шаповалов
H-Yb. ВОДОРОД—ИТТЕРБИЙ
Сведения о диаграмме состояния системы Н—Yb в литературе
отсутствуют. Установлен только факт образования двух гидридов:
YbH2, структурный тип SrH2, параметры решетки а = 0,5871 нм, Ь =
= 0,3561 нм, с = 0,679 нм и YbH3, структурный тип BiF3 (символ
Пирсона с/П6, пр.гр. Cm 3 m) параметр решетки а = 0,519 нм |Э].
Между этими гидридами имеется соответствующая двухфазная
область.
Характерно, что поглощение Н металлическим Yb приводит к
значительному (до 13,5 %) повышению его плотности.
Литература
1. Галактионова Н.А. Водород в металлах. М.. Металлургия, 1967 303 с
В.И. IHatux^KM
Н—Zn. ВОДОРОД-ЦИНК
Диаграмма состояния Н—Zn приведена на рис. 466.
Растворимость Н в твердом (Zn) в интервале температур 200^-
400 “С описывается выражением [1]
Igx = 0,5/g^ - 808/Т,
где х — концентрация Н, % (ат.); р — давление Н2, Па; Т — темпе-
ратура, К. В расплавленном Zn при температуре 516 °C и давлении
0,1 МПа растворяется около 1- 10“5 % (ат.) Н. Имеются сведения
о гидриде ZnH2, который при температуре ниже 90 °C разлагается в
H-Zr
871
f( % (по массе)
Вис. 466. Н—Zn
вакууме. Во влажном воздухе это соединение может разлагаться даже
при температуре 20 °C.
... Спектроскопически был обнаружен еще более неустойчивый
гидрид ZnH, свойства которого не изучены [2].
Литература
1. ФроммЕ., Гебхардт Е. Газы и углерод в металлах: Пер. с нем. / Под ред.
Линчевского. М.: Металлургия, 1980. 712 с.
2. Галактионова Н.А. Водород в металлах. М.: Металлургия, 1967. 303 с.
В. И. Шаповалов
H-Zr. ВОДОРОД-ЦИРКОНИЙ
Диаграмма состояния Н—Zr (рис. 467) представлена из обзора [1].
, Наиболее полно диаграмма состояния изучена в твердом состоянии
пРи концентрации до 50 % (ат.) Zr и представляет собой диаграмму
эвтектоидного типа. Предельная растворимость Н в (aZr) составляет
. % (ат ) и имеет место при температуре эвтектоидной реакции
эвтектоид содержит -37,5 % (ат.) Н. В интервале концентра-
ми 60—67 % (ат.) Н при температуре -200 °C существуют две
872
II—Zr
Zr
Рис. 467. H—Zr
гидридные фазы: 6 и e. Максимальное содержание Н в фазе S при
эвтектоидной температуре составляет 56,7 % (ат.); имеются сведе-
ния, что при высоких температурах в системе существует только
один гидрид 6(ZrH2). По данным рентгеновского анализа, фаза 6
существует при концентрации Н до 62,4 % (ат.), фаза е — до 63,2 %
(ат.). На основании микроструктурного исследования предполагается,
что тетрагональный гидрид е образуется при псевдомартенситном
превращении кубической фазы или путем двойникования [Э]. Одна-
ко предлагается и более сложный характер природы превращения б
« е. Высказано также предположение о существовании метастабиль-
ного тетрагонального гидрида на границе фазы 5 [Ш]. В исследова-
нии [2] показано, что при температуре 255 °C по перитектоидном
реакции aZr + ZrH2 « у в системе образуется гидрид у на основе
гидрида ZrH. Реакция образования фазы у протекает медленно.
Сведения о кристаллической структуре описанных выше гидридов
обобщены в табл. 366.
Растворимость Н в (aZr) при различных температурах приведена
ниже:
Температура, °C . . 840 800 750 700 650 600 560 530 500
Растворимость Н, %
(ат.) .......... 0,9 1,95 2,90 5,45 6,45 7,0 7,0 5.45 4’и
H-Zr
873
л и ц а 36 6. Кристаллическая характеристика гидридов системы Н—Zr
Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
Соединение а С
'в CaF2 сЛ2, 0,47783* — [Ш]
Fm3m 0,47803 0,478 [3] [4]
e ThH2 mf>, 74/mmm 0,4885” 0,488 0,505’” 0,497565 0,4582” 0,456 0,433*” 0,445095 [Ш] [Э] [Э] [5]
Y ZrH0J tPb, P42/n 0,460 0,45957 0,497 0,49686 [2] [6]
’При концентрации 61,4 % (ат.) H. **При концентрации 62,5 °/а (ат.) Н. ”’ Для ZrH2.
Растворимость H в (aZr) можно описать уравнением Арре-
ниуса
= 3,34-10’4 ехр(-32200RT),
Где х — растворимость Н, мг/кг; R — газовая постоянная,
Дж/(моль-К); Т — температура, К [4]. По данным работы [7],
растворимость Н в aZr подчиняется закону Сивертса. На основе
обобщения и статистической обработки литературных данных по
Фазовым равновесиям в системе Н—Zr построены границы фазовых
Областей между а + 0 и р на диаграмме состояния Н—Zr.
Днгература
и.' 1 • Zuzek Е„ Abriata J.P., San-Martin A., Manchester F.D. // Bull. Alloy Phase
‘Warns. 1990. V. 11. N 4. P. 385-395.
Mishra S., Sivaramakrishnan K.S., Asunadi M.K. // J. Nucl. Mater. 1972. V. 45.
*Э. Р. 235-244.
3- Barrciough K.J., Beever C.J. // J. Nucl Mat. 1970. V. 34. N 1. P. 125-134.
•Ki, Cann C.D., Atrens A. // J. Nucl. Mat. 1980. V. 88. N 1. P. 42-50.
p jj^Wpter C.P., Elliot R.O., Gschniedner K.H. // J. Chem. Phys. 1960. V. 33.
c ®eck R.L. // Trans. ASM. 1962. V. 55. P. 542-555.
z- Zuzek E. // Surface and Coat. Technol. 1986. V. 28. N 3-4. P. 323-338.
В.И. Шаповалов
874
Hf—In., Hf-Ir
Hf—In. ГАФНИЙ-ИНДИЙ
Диаграмма состояния Hf—In не построена. В системе обнару* I
два промежуточных соединения: Hf3In4, имеющее тетрагональ ।
структуру типа Ti3In4 (символ Пирсона ГР14, пр. гр. Р4/щл^/ j
метры решетки а = 1,023 нм, с = 0,3045 нм [1] и предположиТелЙ'
Hfln2, кристаллизующееся в тетрагональную структуру типа Аи^
(символ Пирсона tPA, пр. гр. РА/ттт, параметры решетки
= 0,436 нм, с - 0,451 нм [2]).
Растворимость Hf в жидком In в интервале температур 33^
967 °C подчиняется выражению
Igx = 1,60 - 2860/Т,
где х — концентрация Hf, % (ат.); Т — температура, К |3]. Эту
информацию и сведения об исходных компонентах можно найти в
обзорной работе [4].
Литература
I. Schubert К., Frank К., Gohle R. et. al. // Naturwissenschaften. 1Bd. 50
S. 41.
2. Raman A., Schubert K. // Z. Metallkunde. 1965. Bd. 56. N 1. S. 44-52.
3. Диева E.H. // Физико-химические исследования жидких металлов и сплавов:
Сб. статей. Свердловск: Уральский научный центр АН СССР, 1974. С. 105—110.
4. Okamoto Н. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 4. P. 412 412.
j .11 ЖмуР*°
Hf-Ir. ГАФНИЙ-ИРИДИЙ
Диаграмма состояния Hf—Ir (рис. 468) построена на основании
данных оптической пирометрии, дифференциального термического,
микроструктурного и рентгенофазового анализов [ 1, 2].
В системе Hf—1г достоверно установлено образование четыре*
промежуточных фаз, из которых Hflr и Hflr3 плавятся кон-РУэНТ1,°
при температурах 2410 и 2460 °C соответственно. Предполагается-
что оба соединения обладают областью гомогенности 2—5 %
нения Hf2Ir и Hf3Ir2 (Hf5Ir3) образуются по перитектическим
циям при температурах 1775 и 1970 °C соответственно. В работе I
сообщается о существовании соединений Hflr1+jf и Hf47Ir53. ^РиСТ а
лическая структура промежуточных фаз в системе Hf—1г прнвеД
в табл. 367 [Ш, 21.
468. Hf-Ir
Т * 6 л и ц а 3 6 7.
системы Hf-ir
Кристаллическая структура соединений
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b €
’ Hf,Ir Ti2Ni cF96, Fd3m 1,2352 — —
U.HtK — — 0,7868 1,692
It; да- ‘ и fc Mn5Sij API 6, Р63/тст 0,7943 0,5454
876
Hf-K
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b С
Hflr:
Hf47Ir5? NbRu — 0,4740 0,4680 0,3045
Hflrl+x NbRu — 0,421 0,416 0,368
Hflr3 AuCu3 сР4, РтЗт 0,3926— 0,3935 — —
Гексагональная сингония. Ромбическая сингония.
В системе Hf—Ir наблюдаются эвтектические реакции:
Ж ** ([JHf) + НГ21гпри 1470 °C и 18 % (ат.) 1г;
Ж « Hflr + Hflr3 при 2130 °C и 63 % (ат.) 1г;
Ж * Hflr3 + (1г) при 2290 °C и 88 % (ат.) 1г.
1г понижает температуру полиморфного превращения Hf. Темпе
ратура эвтектоидной реакции (PHf) ** (aHf) + Hf2Ir равна 1380 °C,
эвтектоидная точка расположена при концентрации -7,5 % (ат.) 1г.
Литература
1. Moffatt W.G. The Handbook of Binary Phase Diagrams. General Electric Co. New
York: Business Growth Servies. Schenectady, 1976. 1977. V. 1,2. 658 p.
2. Kubaschewski-von Goldbeck O. // Atomic Energy Review. Special. Issue N 8.
Hafnium: Physico-Chemical Properties of its Compounds and Alloys. Vienna: International
Atomic Energy Agency. 1981. P. 57—118.
Г.П. Жмурки
Hf-K. ГАФНИЙ-КАЛИЙ
Согласно работе [1] в системе Hf—К была предположена почти
полная несмешиваемость компонентов в жидком и твердом состояни-
ях (рис. 469). Этот вывод основан на аналогии системы Hf—К с
системами К—Ti, К—Zr и другими системами щелочных металлов с
металлами IVA группы. Газовая фаза, находящаяся в равновесии при
температуре 2000 °C и давлении 0,1 МПа с почти чистым pHf,
содержит -0,00005 % (ат.) Hf.
Hf-Li
877
Литература
I. Ball C.W. 11 Bull. Alloy Phase Diagrams. 1987. V. 8. N 1. P. 45-46.
Л. Л. Рохлин
Hf-Li. ГАФНИЙ-ЛИТИЙ
В работе [1] с использованием субрегулярной модели растворов
рассчитана линия ликвидус системы Hf—Li.
Литература
1. Кузин А.Н., Люблинский И.Е., Бескоровайный Н.М. // Расчетные и экспери-
ментальные методы построения диаграмм состояния: Сб. статей. М.: Наука, 1985.
С. 113-118.
В.П. Полякова
878
Hf-Мп
Hf—Мп. ГАФНИЙ-МАРГАНЕЦ
Сведения о диаграмме состояния Hf—Мп приведены в работах
[1—3]. Диаграмма состояния Hf—Мп (рис. 470) построена во всем
диапазоне концентраций в основном по [1].
Рис. 470. Hf—Мп
В системе установлено образование двух промежуточных фаз
HfMn2 и HfMn. Соединение HfMn2 плавится конгруэнтно при темпе-
ратуре 1690 °C. Область гомогенности этого соединения составляет
65—76 % (ат.) Мп при 1150 °C, 65,8—78,6 % (ат.) Мп [2| или
62—75 % (ат.) Мп [3] при 800 °C. Соединение HfMn образуется по
перитектоидной реакции (fSHf) + HfMn2 В * * 11 HfMn при 1250 °C [1!
Согласно |2| вместо HfMn образуется Hf3Mn2 по перитектической
Hf-Мо
879
реакции при 1300 °C. Кристаллическая структура промежуточных
фаз приведена в табл. 368.
Растворимость Мп в Hf в интервале температур 1150—800 °C
понижается от 2 до 0,79 % (ат.) [2].
Мп понижает температуру полиморфного превращения Hf, темпе-
ратура эвтектоидного превращения со стороны Hf составляет около
1150 °C [1] и 850 °C [2].
Таблица 368. Кристаллическая структура соединений системы Hf—Мп
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а с
HfMn2 HfMn MgZn2 Ti2Ni /гР12, Р63/ ттс CF96, Fd3m 0,5007- 0,4960 1,148 0,8236- 0,8147 [3] 12]
Литература
1. Свечников В.Н., Шурин А.К., Дмитриева Г.П., Алфинцева Р.А. // Диаграммы
состояния металлических систем: Сб. статей. М.: Наука, 1968. С. 153—156.
2. Шурин А.К., Дмитриева Г.П. // Допов1д1 АН УССР. 1969. Сер. А. № 1.
С. 67-69.
3. Свечников В.Н., Петьков В.В. // Металлофизика. 1976. № 64. С. 24—28.
Л.Л. Рохлин
Hf—Мо. ГАФНИЙ-МОЛИБДЕН
Диаграмма состояния Hf—Мо (рис. 471) построена в работе [1] на
основании анализа экспериментальных работ с учетом термодинами-
ческих характеристик системы. В системе существует только одна
промежуточная фаза HfMo2 — фаза Лавеса. Соединение HfMo2
образуется по перитектической реакции Ж + (Мо) « HfMo2 при
температуре 2170 ± 40 °C и существует в двух модификациях. Об-
ласть гомогенности HfMo2 простирается от -32 до 36—37,5 % (ат.)
Hf при температуре 1900 + 10 °C [2—3]. Температура полиморфного
превращения HfMo2 меняется от 1858 ± 15 °C для сплавов, богатых
Мо, до 1783 + 15 °C для сплавов, богатых Hf [1]. По данным работы
[4], в фазе существует обратное превращение при температуре
-900 °C. Кристаллическая структура промежуточных фаз в системе
Hf—Мо приведена в табл. 369.
А
880
Hf-Мо
Hf, °/o (по пассе)
Рис. 471. Hf—Мо
В работе [1] указывается, что поскольку на кривых ликви-
дус-солидус твердого раствора (Hf) имеется небольшой минимум, в
системе существует перитектическое превращение Ж + HfMo2
» (PHf) при температуре 1900 + 10 °C, хотя и в работах [2—4, 5J это
превращение интерпретируется как эвтектическое. Максимальная
растворимость Мо в (pHf) при температуре перитектики составляет
44 + 2 % (ат.) Мо. Минимум на кривых ликвидус—солидус наблюда-
ется при концентрации ~34 + 1 % (ат.) Мо и температуре на ~34 °C
ниже температуры перитектики [1]. Эвтектоидное превращение
(0Hf) » (aHf) + HfMo2 протекает при температуре 1200 + 35 °C и
концентрации 26,5 % (ат.) Мо.
Растворимость Мо в (aHf) может быть описана уравнением
х = -5,32-10 6Т + 7,30- 109Т 2,
где х — концентрация Мо, % (ат.); Т — температура, К. При темпе-
ратуре 480 °C она нс превышает 10~2 % (ат.) Мо [ 11.
Hf-N
881
Растворимость Hf в (Mo) может быть описана уравнением
1пх = -220071'1 + 0,6592 - 1,46610 3 + 4,205• 10'7Т2
и составляет при температуре перитектики -27 ± 1 % (ат.) [1].
расчетные данные хорошо согласуются с экспериментальными значе-
ниями.
Таблица 369. Кристаллическая структура соединений
системы Hf—Мо
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
HfMo2(BT) HfMo2(HT) MgNi2 MgCu2 ЛР24, Р63/ттс сА24, Fd3m 0,5345* 0,7545" 1,736’ [2, 6, 7] [2, 6, 7J
*При концентрации 33,16 % (ат.) Мо.
При концентрации 33,28 % (ат.) Мо.
Литература
1. Brewer L., Lamoreux R.H. // Atomic Energy Review Special Issue N 7- Molibdenum:
Physico-Chemical Properties of its Compounds and Alloys. Vienna: International Atomic
Energy Agency, 1980. P. 135—356.
2. Taylor A., Doyle N.J., Kagle B.J. //J. I^ess-Common Metals. 1961. V. 3. P. 265.
3. Garg S.P., Ackermann R.J. // Metal Trans. 1977. V. 8A. N 2. P. 239—244.
4. Алфинцева П.А., Шишкин E.A., Шурин А.К. // Фазовые превращения: Сб.
статей. Киев: Паукова думка, 1967- С. 129—132.
5. Еременко В.Н., Шабанова С.В., Великанова Т.Я. и др. // Металлофизика.
1974. Вып. 52. С. 94-98.
6. Rapp О. // J Tess-Common Met. 1970. V. 21. N 1. Р. 27—44.
7. Elliott R.P. // I'rans. ASM 1958. V. 50. P. 617-633; 1 961. V 53. P. 321-329.
КБ. Поварова
Hf—N. ГАФНИЙ-АЗОТ
Предполагаемая диаграмма состояния Hf—N (рис. 472) построена
со стороны Hf на основании анализа большинства известных экспери-
ментальных работ [1]. Данные о строении диаграммы со стороны N
отсутствуют.
882
Hf-N
Рис. 472. Hf-N
В исследованном интервале температур и концентраций в систем,
обнаружено три промежуточные фазы HfN, Hf3N2, Hf4N3 и области
твердых растворов на основе (aHf) и ((JHf).
Соединение HfN образуется конгруэнтно из расплава при темпе
ратурс 3387 °C и содержании 49 % (ат.) N и обладает областью
гомогенности 42,6—52,5 % (ат.) N при высоких температурах. Соеди
нения Hf4N3 и Hf3N2 образуются по перитектоидным реакциям
(aHf) + HfN * Hf4N3 и (aHf) + Hf4N3 « Hf3N2 при температур?’
-2300 и 1970 °C соответственно. Предполагается, что Hf4N3 распада
ется при температуре ниже 1500 °C. Кристаллическая структур
промежуточных фаз в системе Hf—N приведена в табл. 370.
N стабилизирует (aHf). Твердый раствор на основе (aHf) образ)
ется по перитектической реакции Ж + HfN (aHf) при температур'
2910 “С. Максимальная растворимость N в (aHf) при температур'
1700 °C составляет 29 % (ат.), при температуре перитектики — 27
(ат.). Предполагается, что со стороны Hf протекает эвтектическа
реакция Ж * (aHf) + ((JHf) при температуре 2190 °C.
Hf-Na
883
Таблица 37 0. Кристаллическая структура соединений системы Hf—N
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
a С
Hf3N2 — йЛб, R3m 0,3206 2,326 [2]
Hf4N3 v4c3 A.R8, R3m 0,3214 3,1122 [2]
HfN NaCI cF8, Fm3m 0,4524— 0,4515 — [31
Литература
1. Okamoto Н. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 2. P. 146—149.
2. Rudy E. 11 Metall. Trans. 1970. V. 1. N 5. P. 1249.
3. Rudy E. 11 Monatsh. Chem. 1961. V. 92. N 2. P. 415-441.
Н.П. Полякова
Hf—Na. ГАФНИЙ—НАТРИЙ
Предполагаемая диаграмма состояния Hf—Na (рис. 473) построена
на основе обобщения немногочисленных экспериментальных данных
по фазовым равновесиям в системе и предположения, что диаграмма
н/ Na
Рис. 473. Hf-Na
884
Hf-N
состояния Hf—Na аналогична диаграмме состояния Zr—Na. При
температуре 2000 °C и давлении 0,1 МПа газовая фаза находится в
равновесии почти с чистым (PHf) и содержит -0,00005 % (ат.) Hf
[1J.
В работе [2] рассчитана линия ликвидус системы Hf—Na с испол> -
зованием субрегулярной модели растворов.
Литература
1. Bale C.W. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 1. P. 46-47.
2. Кузин A.H., Люблинский И.Е., Бескоровайный H.M. // Расчеты и эксперимег
тальные методы построения диаграмм состояния: Сб. статей. М.: Наука. 198.'
С. 113-118.
В. П. Поляка-ч:
Hf—Nb. ГАФНИЙ-НИОБИЙ
Диаграмма состояния Hf—Nb (рис. 474) построена на основании
обобщающего обзора [1] экспериментальных и расчетных рабо:
[Ш, 2—5]. Исследования проводили методами измерения темпе
ратуры плавления, металлографического и рентгеноструктурного
анализов.
Рис. 474. Hf—Nb
Hf-Na
885
Система Hf—Nb характеризуется образованием непрерывных
.твердых растворов с ОЦК решеткой между высокотемпературной
модификацией <0Hf) и (Nb). Температурная кривая плавления спла-
вов в зависимости от состава проходит через минимум при концен-
трации 42 % (ат.) Nb и при температуре 2065 ± 10 °C [1] или
-25% (ат.) Nb и 2100 °C [2], или 32,5-55 % (ат.) Nb и
2080 ± 25 °C [3J. Параметры решетки твердых растворов (0Hf, Nb)
изменяются про-порционально содержанию Nb в сплаве в соответ-
ствии с правилом Вегарда [1, 41.
Относительно характера фазовых равновесий в твердом состоянии
в системе Hf—Nb до настоящего времени нет единого мнения [41.
Согласно работе [1] в системе наблюдается распад твердых растворов
(pHf, Nb) на две фазы (aHf) + (PHf, Nb). Максимальная раствори-
мость Nb в aHf составляет 4 % (ат.) [2—3] или -2 % (ат.) [3] при
температуре 1000 °C. Двухфазная область очень чувствительна к
загрязнению примесями внедрения [4].
В работах [5—6] указано на образование при низких температурах
гексагональной мстастабильной фазы со, ориентировочная область
которой ограничена на рис. 480 штриховой линией [1].
Литература
1. Okamoto Н. // J. Phase Equilibria. 1991. V. 12. N 2. Р. 211-214.
2. Siemend R.E., Babitzke H.R., Kato H. // U.S. Bur. Mines. Rept. Invest. 1964.
N 6492. 11 p.
3. Taylor A., Doyle N.J. // J. Iz'ss-Common Met. 1964. V. 7. N 1. P. 37—54.
4. Еременко B.H., Третьяченко Л.А. Тройные системы титана с переходными
металлами IV—VI групп. Киев: Наукова думка, 1987. С. 77—83.
5. Jackson W.A., Perkins A.J., Hehemann R.F. // Met. Trans. 1970. V. 1. N 7.
P. 2014-2016.
6. Carpenter R.W., Liu C.T., Mardon R.G. // Met. Trans. 1971. V. 2. NI.
P. 125-131.
E.H. Шефтель
Hf—Ni. ГАФНИЙ—НИКЕЛЬ
Диаграмма состояния Hf—Ni исследована методами металлографи-
ческого и рентгеновского анализов в работах [1—3], а также методом
термического анализа в работе [2]. По данным работы [1], в системе
Hf—Ni существует семь промежуточных фаз, из которых NiHf2, NiHf
и Ni7Hf2 плавятся конгруэнтно, a Ni10Hf7, Ni5Hf2, Ni5Hf обра-
зуются по перитектическим реакциям. Предполагается, что
соединение Ni^Hfg образуется по перитектоидной реакции и
эвтектоидно распадается при температуре 1150 ± 20 °C. По данным
работы [2] в системе было найдено новое соединение Ni3Hf, а реак-
886
Hf-Ni
Рис. 475. Hf—Ni
ция образования соединения Ni2Hf установлена как перитектическая
при 1200 °C. Вместо соединения Ni10Hf7 в работе [2] указано соеди-
нение Ni3Hf2.
В работе [3] подробно исследована часть диаграммы состояния
системы Hf—Ni в интервале концентраций 64—78 % (ат.) Ni. В
исследованном интервале концентраций была установлена новая фа>а
Ni7Hf3, которая стабильна в температурной области между
1250 ± 20 °C и 1016 ± 3 °C и разлагается по эвтектоидной реакции
на Ni10Hf7 и Ni3Hf. Ранее найденная в работе Ц] фаза Ni5lH/
описана как NiTjHfg. Она стабильна в температурной области межъ
1300 ±20 и 1175±10°Си разлагается эвтектоидно на Ni7Hf 5 и
Ni3Hf. Соединение Ni3Hf образуется по перитектической реакции
при температуре 1350 ± 20 °C и имеет полиморфное превращен '
при температуре ниже 1200 ± 10 °C. Отмечается, что между Ni3Hi
и богатой Hf фазой существует эвтектическое взаимодействие при
концентрации 65 % (ат.) Ni и температуре 1900 ± 10 °C.
Hf-Ni
887
В работе [4] проанализированы результаты работ [1—3] и постро-
ена обобщенная диаграмма состояния Hf—Ni. В работе [5] проведен
термодинамический расчет этой системы на основе эксперименталь-
ных данных работы [2] и построена оптимизированная диаграмма
Hf-Ni.
На рис. 475 приведен вариант диаграммы состояния Hf—Ni, по-
строенный с учетом данных аналитического обзора [4] и расчетных
данных [5]. Реакции образования соединений, эвтектические и
перитектоидные реакции, протекающие в системе Hf—Ni, приведены
в табл. 371.
Таблица 37 1. Моно- и нонвариантные реакции в системе Hf—Ni
Реакция Содержание Ni в фа- зах, % (ат.) Темпе- ратура, “С Источ- ник
(₽Hf) » Ж + (allf) 2; 4,4; 0,9 1250 [2]
Ж - («Hf) + NiHf2 14; 0,9; 66,7 1150 12]
18,24; 0,9; — 1154 [5]
Ж •* NiHf2 или —; 33,3; — 1196,32 [5]
Ж + Nillf ₽ NiHf2 17,5; 50, 66,7 1200 [1, 2, 4]
Ж » NiHf2 + NiHf 36,06; 33,3; 50 1196,0 15]
₽NiHf = «NiHf —; 50, — 1170 [4]
Ж + NiHf » Ni||llf9 59,5; 50; 55 1340 12]
58,18; —; — 1337,6 [5]
Ж + NinIIf9 ₽ NiI0Hf7 61; 55; 58,8 1290 12]
61,39; — 1293,1 15]
Ж т. Ni|0Hf7 + Ni7Hf3 63; 58,8; 70 1200 12]
62,4; — — 1198,3 [51
65; — 1190 [3]
Ж + Ni21Hfg » Ni7llfj 66,5; 72,4 70 1250 [3, 4]
Ni7Hf, » Ni10IIf7 + aNi3Hf 70; 58,8; 75 1016 13, 4]
Ni2lHfg ₽ Nli7Hf3 + aNi3Hf 72,4; 70; 75 1175 [3, 4]
Ж + Ni7Hf2 » Ni3Hf 71,4; 77,8; 75 1340 13, 4]
65,5; —; — 1300 (2]
₽Ni3Hf » aNi3Hf 75; — 1200 13]
888
Hf-Ni
Реакция Содержание Ni в фа- зах, % (ат.) Темпе- ратура, °C Источ- ник
Ж + Ni7Hf2 ₽ Ni5Hf 87; 77,8; 83,3 1240 [2]
86,4; -; - — [41
86,6; - 1225,7 [5]
Ж * Ni5Hf + (Ni) 88; 83,3; 99,0 1190 [2]
87,5; -; - — [41
87,63; -; 1190 [5]
Кристаллическая структура промежуточных фаз приведена в
табл. 372.
Таблица 372 Кристаллическая структура соединений
системы Hf—Ni
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b с
NiHf2 А12Си 1/12, 74/тст 0,6743 — 0,558 [41
NiHf CrB оС8, СтСт 0,3220 0,9820 0,412 [4]
Nij.Hf;1 — 14т 0,979 — 0,653 [4]
Ni10Hf7*2 — С2са 1,2275 0,9078 0,9126 [41
Ni7Hf3'3 — Р1 0,65138 0,65890 0,7627 [3]
Ni21Hfg*4 — Р1 0,64275 0,80007 0,85540 [31
PNijIIf ВаРЬ3 ЛА 12, АЗт 0,52787 — 1,92324 [31
aNi,Hf уТа(РЬ, Rh)3 КР ., Р63/ ттс 0,52822 — 2,13916 [3]
Ni5Hf AuBe5 cF24, Р43т 0,6683 — — [4]
. Ni7Hf2 1 Тетра ro *2Ромбич Ni7Zr2 шльная си зская сиигс ?иС36, С2/т чгония. НИЯ. [4]
* Триклинная сингония, а = 104,87°, р = 104,60°, у = 11 *4Моиоклинная сингония, Р = 68,14°. 2,71°.
Hf-0
889
Литература
1. Kirpatrick M.E., Larsen W.L. // Trans. ASM. 1961. V. 54. P. 580-590.
I 2. Свечников B.H., Шурин A.K., Дмитриева Г.П. 11 Изв. АН СССР. Металлы
1967. № 6. С. 176—179.
3. Bsenko L. // J. Less-Common Met. 1973. V. 63. N 2. P. 171—179.
4. Nash P., Nash A. // Bull. Alloy Phase Diagrams. 1983. V. 4. N 3. P. 250—253.
5. Kejun Z., Zhanpeng J. // J. Less-Common Met. 1990. V. 166. N 1. P. 21—27.
H.P. Бочвар, В.П. Полякова
Hf-O. ГАФНИЙ—КИСЛОРОД
Диаграмма состояния Hf—О (рис. 476) построена в интервале
концентраций 0—67 % (ат.) О по результатам металлографического
и рентгеновского анализов, измерения температуры начала плавле-
ния сплавов [1]. В исследованном интервале концентраций диа-
грамма характеризуется наличием перитектического превращения
Ж + (aHf) * (PHf) при температуре -2231 °C и эвтектического
превращения Ж •* (aHf) + HfO2 при концентрации 29 % (ат.) О и
температуре 2200 °C. Твердый раствор на основе (aHf) плавится
конгруэнтно при -2500 °C.
Оксид HfO2 плавится конгруэнтно при температуре -2810 °C. В
работах [Э, Ш1 приводятся температуры плавления НЮ2 от 2900 до
₽ис. 476. Hf-O
890
Hf—Os
2’15% °C. Оксид HfO2 существует предположительно в трех модифика-
циях, низкотемпературной моноклинной, среднетемпературнои
тетрагональной и высокотемпературной кубической. Переход и>
моноклинной в тетрагональную протекает при 1670 С. В работе [Э!
приводится значение 1700 °C, или 1554—1583 °C для оксида, содер
жащего примесь Zr 0,47 % (по массе), и 1672—1690 С для оксида,
свободного от примеси Zr [Ш]. Кубическая модификация HfO2 имсс;
тип CaF2 (символ Пирсона CF12, пр. гр. Fm3m), параметр решетки
а = 0,5125. Параметры решетки кристаллической структура
НЮ2(СТ): а = 0,514; с = 0,525 нм при 1920 + 20 °C [Э]. Оксид
НЮ2(НТ) (тип ZrO2, символ Пирсона mPt2, пр. гр. P2jc> имсс'
следующие параметры решетки: а = 0,511; b = 0,514; с - 0,528 нм.
0 = 99,72° при температуре 20 °C и а = 0,521; b - 0,515; с = 543 нм.
Р = 98,8° при температуре 1640 + 20 °C [Э].
Литература
1. Kubaschewski-von Goldbeck О. // Atomic Energy Review. Special Issue N *
Hafnium: Physico-Chemical Properties of its Compounds and Alloys. Vienna: Internationa:
Atomic Energy Agency, 1981. P. 57—118.
В.П. Полякова, H.P. Бочвар
Hf—Os. ГАФНИЙ-ОСМИЙ
Диаграмма состояния Hf—Os (рис. 477) построена во всем интер
вале концентраций по результатам микроструктурного, рснтгеновско
го и микрорентгеноспектрального анализов, измерения температуры
начала плавления сплавов [1]. В качестве исходных металлов ис
пользован иодидный Hf чистотой 99,9 % (по массе) и порошковый
s чистотой 99,9 % (по массе). Отмечается сложный характер диаг
раммы состояния системы Hf—Os.
В системе п°Дтвсрждено существование соединений HfOs2(X) и
Wf Обнаружено также еще три промежуточные фазы: Hf20s(rp
710s29(£) и фаза 0. Соединение HfOs2 плавится конгруэнтно при
гемпературе -2700 °C и имеет значительную область гомогенности
азы HfOs, Hf20s, Hf7IOs29, 0 образуются по перитектическим
Ж + Hf0s2 * HfOs (б) при 2520 ± 20 °C;
Ж + HfOs ₽ Hf2Os(n) при 2060 ± 20 °C;
Ж + Hf20s * Hf710s29(e) при 1880 ± 20 °C;
Ж + Hf710s29 - 6 при 1660 ± 20 °C.
т,ЛР?^аЛ^ИЧеСКая структура HfOs2, HfOs, Hf20s приведена t<
таол. 573. Структура Hf7IOs29 близка к структуре Hf2Os; однако
имметрия фаз е и 0 более низкая, чем кубическая. В системе Hf—Os
Hf—Os
891
Рис. 477. Hf—Os
образуются две эвтектики: (Os) + HfOs2 при температуре 2600 °C и
концентрации ~20 % (ат.) Hf; 0 + (pHf) при температуре 1580 °C и
концентрации ~80 % (ат.) Hf. Os снижает температуру полиморфно-
го превращения Hf: температура эвтектоидного превращения
(pHf) * (aHf) + 0 составляет 1225 + 25 °C.
Таблица 37 3. Кристаллическая структура соединений
системы Hf—Os
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
HfOs2 MgZn2 API 2, Р63/ ттс 0,5184 0,5200 0,8468 0,8492 [Э] [Э1
HfOs CsCl сР2, РтЗт 0,3239 — |Э]
Hf20s TizNi сР96, Fd3m 1,2278 — И]
Литература
1. Waterstrai R.M. // J. Less-Coramon Met. 1983. V. 95. N 2. P. 335—339.
В.П. Полякова
892
Hf-P, Hf—Pd
Hf-P. ГАФНИЙ-ФОСФОР
Диаграмма состояния Hf—P не построена. Имеются данные !
существовании фосфидов HfP и HfP2, кристаллическая структура
которых приведена в табл. 374.
Таблица 3 7 4. Кристаллическая структура соединений
системы Hf—Р [Ш]
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а Ь С
HfP TiP hP., 0,3650 — 1,237
HfP2 РЬС12 оР.., Ст 0,6467 0,8646 0,3497
В.П. Поляки,-.’
Hf—Pd. ГАФНИЙ-ПАЛЛАДИЙ
Диаграмма состояния Hf—Pd (рис. 478) построена по данным
дифференциального термического, металлографического и рентгене
структурного анализов [1]. При исследовании использовали иоди 1-
ный Hf и Pd чистотой 99,8 %.
В системе Hf—Pd обнаружено пять соединений, из которых HfPJ >
образуется непосредственно из расплава (конгруэнтно) при темпера-
туре 2075 °C и эвтектоидно распадается при температуре 1370 "С.
Соединения Hf2Pd, HfPd и HfPd3 образуются по перитектическим
реакциям при температурах 1415, 1610, 1965 + 10 °C соответственна.
Соединение Hf3Pd4 образуется по перитектоидной реакции при
температуре 1560 °C. Кристаллическая структура промежуточных
фаз системы Hf—Pd приведена в табл. 375. Структура HfPd и Hf3PJ.s
не установлена.
Таблица 3 7 5. Кристаллическая структура соединений
системы Hf—Pd
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
Hf2Pd MoSi2 f/6, /4/ттт 0,3251 0,325 1,105 1,1061 [И [Ш!
HfPd2 MoSi2 til 6, /4/ттт 0,3410 0,8635 [И
HfPd3 TiNi3 hP\6, Pftjmmc 0,5592 0,5595 0,916 0,9192 HJ [Э1
Hf—Pd
893
Hf
Pd, % (am,)
Рис. 478. Hf—Pd
В Pd растворяется до 22,5 % (ат.) Hf при [400 °C и 21,5 % при
800 °C. Твердый раствор на основе Pd образуется по перитектической
реакции (Pd) ** Ж + HfPd3 при температуре 1640 ± 10 °C. Раствори-
мость Pd в (pHf) не превышает 5 % (ат.), в (aHf) ~ 1 % (ат.). Pd
понижает температуру плавления и полиморфного превращения Hf.
Эвтектическое равновесие Ж » (0Hf) + Hf2Pd наблюдается при
температуре 1325 ± 10 °C и концентрации 27 % (ат.) Pd. Температу-
ра эвтектоидного превращения (pHf) (aHf) + Hf2Pd составляет
1180 ± 20 °C, эвтектоидный сплав содержит ~2,5 % (ат.) Pd.
По данным работы [2], в системе образуются только четыре фазы:
HfPd3, HfPd2, HfPd, Hf2Pd, из которых HfPd3 и HfPd образуются
конгруэнтно из расплава, а фаза HfPd2 существует при температурах
ниже 1000 °C.
Литература
1. Шурин А.К., Петьков В.В. И Изв. АН СССР. Металлы. 1972. № 2. С. 166-168.
2. Савицкий Е.М., Полякова В.П., Горина Н.Б., Рошан Н.Б. Металловедение
платиновых металлов. М.: Металлургия. 1975. 422 с.
В.И. Полякова
894
Hf—Pr
Hf-Pt
895
Hf—Рг. ГАФНИЙ-ПРАЗЕОДИМ
Диаграмма состояния Hf—Рг (рис. 479) построена в интервале
концентраций О—3 % (ат.) Hf по данным дифференциального терми-
ческого, микроструктурного и рентгеноструктурного анализов (1
Сплавы готовили в танталовых тиглях в атмосфере Не и выдержива-
ли при температуре, превышающей температуру плавления на
200—250 °C в течение 1 ч. При исследовании использовали Hf чисто
той 99,9 % (по массе); Рг чистотой 99,9 % (по массе).
Исследованная часть диаграммы состояния системы Hf—Рг харак
теризуется наличием вырожденного эвтектического равновесия при
температуре 930 °C и концентрации -0,026 % (ат.) Hf. Раствори
мость Hf в Рг практически отсутствует.
Литература
1. Griffin R.B., Gschneidner, Jr., К.А. // Metall. Trans. 1971- V. 2. N (>
P. 2517-2524.
Н.И. Гладышевский, О.И. Бодак, В.К. Печарскш<
ГАФНИЙ-ПЛАТИНА
Диаграмма состояния Hf—Pt построена по данным дифференци-
ддьного термического, рентгенофазового, микроструктурного и мик-
рррентгеноспектралъного анализов и приведена на рис. 480 с не-
большими изменениями согласно работе [1]. В работах [Э, Ш]
сообщается о существовании соединений PtHf2, PtHf, Pt]7Hf, Pt3Hf2
n* и* on finrarnft Pt Sum обнаружены также Фазы Pt4Hf
₽ис. 480. Hf-Pt
В системе Hf—Pt в работе (1] подтверждено существование соеди-
нений Pt3Hf, Pt3Hf2, Pt1+Hf, PtHf, PtHf2. Для соединения Pt1+Hf в
соответствии с его составом принята формула Pt, ] Hf9. Соединения
Pt5Hf и Pt4Hf обнаружены не были. Области существования всех
соединений сравнительно невелики. Соединения PtHf и Pt3Hf образу-
ются конгруэнтно при температурах 2100 и 2150 °C соответственно.
Фазы Pt2Hf и PtHf2 образуются по перитектическим реакциям: Ж +
896
Hf-Pt
+ Pt3Hf ** Pt2Hf при температуре 1960 °C и Ж + PtHf * PtHf2 при
температуре 1620 °C. Высокотемпературная фаза Pt2Hf образуется
при концентрации -67 % (ат.) Pt и существует в узком интервале
температур (- до 1630 °C). Соединения Pt3Hf2, PtnHf9 образуются
по перитектоидным реакциям при температурах 1670 и 1550 1С
соответственно. Соединение Pt3Hf2 эвтектоидно распадается при
температуре 1400 °C на Pt3Hf и PtnHf9.
В системе Hf—Pt наблюдаются две эвтектические реакции: Ж «
- Pt2Hf + PtHf при 1800 °СиЖ » PtHf2 + (pHf) при 1430 °C.
Твердый раствор на основе Pt образуется по перитектической
реакции (Pt) « Ж + Pt3Hf при температуре 1900 °C.
Кристаллическая структура промежуточных фаз в системе Hf—Pt
приведена в табл. 376.
Таблица 37 6. Кристаллическая структура соединений
системы Hf-Pt [Э, Ш, 5]
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b с
Pt3Hf TiNi3 /iP16, Р(>3/ттс 0,5636 — 0,9208
Pt2Hf CsCK?) сР2, РтЗт — — —
Pt3Hf2 MoSi2 ть, 14/ттт 0,343 — 0,873
Pt„Hf, CsCl сР2, РтЗт 0,3230 — —
PtHf CrB оСК, Стет 0,3345 1,0269 0,4288
PtHf2 Ti2Ni cF96, Fd3m 1,2461 — —
Литература
1. Конобас Ю.И. // Материалы конференции молодых ученых Химически,
факультета МГУ. М. 1985. ч. 1. С. 150-153.
2. Erdmann В., Keller С. // Inorg. Chem. Letters. 1971. V. 7. N 7. P. 675-683.
3. Helkombe C.E. // J. Less-Common Met. 1976. V. 44. N 2. P. 331-335.
4. Meschter P.I., Werrell W.L. // Met. Trans. 1977. V. 8A. N 3. P. 503-509.
5. Dwight A.E., Conner, Jr., R.A., Downey I.W. // Acta Crystallogr. 1965. V. 18. "s •
P. 835-839.
Г.П. Жму,-.
Hf-Ри
897
tff-Pu. ГАФНИЙ-ПЛУТОНИЙ
Диаграмма состояния Hf—Ри (рис. 481) построена во всем интер-
вал6 концентраций в работе [1]. Система характеризуется образова-
нием промежуточных фаз 0 и р и протеканием нескольких нонвари-
антных превращений в твердом состоянии, связанных с полиморфиз-
мом Hf и Ри. При кристаллизации из жидкой фазы сплавов, богатых
Ри, протекает перитектическое превращение при 765 °C. Фаза 0
образуется по перитектоидной реакции (SPu) + (aHf) * 0 при 340 °C.
29 Зак. 2144
898
Hf-Rb
Область гомогенности фазы 0 соответствует -4—10 % (ат.) Hf. ф;13а
р существует в ограниченном температурном и концентрационное
интервалах -200—300 °C и -3—4,5 % (ат.) Hf.
При температуре 520 °C происходит перитектоидное превращение
(гРц) + (aHf) * (бРи). Характер превращений в области Pu, согласно
работе [21, показан на вставке рис. 481.
Растворимость Hf в (ePu) изменяется от 11 % (ат.) при 765 ( ;ю
5,5 % (ат.) при 520 °C. Растворимость Hf в бРи изменяется от 7 уо
(ат.) при 520 °C до 3,5 % (ат.) при 290 °C — температуре эвтектоид-
ного распада бРи. Растворимость Pu в Hf составляет -10 % (ат.) при
1150 °C, с понижением температуры она уменьшается и составляет
менее 1 % при 500 °C [1].
Результаты работы [2] в общем согласуются с результатами
работы [1]. Различия между обеими работами в основном состоят в
определении температур нонвариантных превращений и концен г ра-
ций критических точек. Согласно работе [2] (см. вставку на
рис. 481) температура перитектического превращения, сопровождаю-
щегося образованием (ePu), составляет 749 °C, а концентрация Hf в
твердом растворе (ePu) — 6,5 % (ат.). Перитектоидная реакция
образования (бРи) протекает при температуре 502 °C и концентра-
ции 7 % (ат.) Hf. Температура перитектоидной реакции образования
фазы 0 составляет 341 °C, температура эвтектоидного распада (б Ни)
— 310 °C. Предполагается, что фаза р образуется перитектоидно при
температуре 270 °C и концентрации -3 % (ат.) Hf и устойчива при
температуре 20 °C.
Кристаллическая решетка фазы 0 аналогична решетке соединения
Pu6Zr. Она является ромбической с параметрами а = 1,0415 нм; А -
= 1,0428 нм; с = 1,1245 + 0,0005 нм [1]. Фаза р изоструктурна
аналогичной фазе в системе Pu—Zr.
Литература
1. Кутайцев В.И., Чеботарев Н.Т., Андрианов М.А. и др. // Атомная онергч;
1967. Т. 23. № 6. С. 511-519.
2. Ellinger F.H., Land С.С. И J. Nucl. Mater. 1968. V. 28. N 3. Р. 291-296.
Л.Л. Рм
Hf-Rb. ГАФНИЙ-РУБИДИЙ
В работе [1] было предположено, что система Hf—Rb по свое а
строению аналогична диаграммам Rb—Ti, Rb—Zr и другим систем.1'1
щелочных металлов с металлами IV А группы Периодической сип
мы элементов. Отсюда был сделан вывод, что в системе Hf—P-b
(рис. 482) имеет место почти полная несмешиваемость компонента
в жидком и твердом состояниях [1]. При температуре 2000 °C и
давлении 0,1 МПа газовая фаза, находящаяся в равновесии с почти
чистым pHf, содержит -0,00005 % (ат.) Hf.
Литература
1. Bale C.W. // Bull. Alloy Phase Diagrams. 1987. V. 8. N 1. P. 47-48.
Л.Л. Рохлин
Hf—Re. ГАФНИЙ-РЕНИЙ
Диаграмма состояния Hf—Re (рис. 483) построена по результатам
рентгеновского и микроструктурного анализов, измерения температу-
ры плавления и микротвердости фаз [1—3]. По данным работ [1—3],
в системе Hf—Re существуют соединения Hf5Re24, HfRe2, Hf~Re2,
образующиеся по перитектическим реакциям при температурах 2975,
2850, 2280 °C, соответственно. Эвтектическая реакция Ж ** (£Hf) +
+ Hf3Re2 протекает при температуре 2100 °C и концентрации
16,4—17,4 % (ат.) Re. Максимальная растворимость Hf в Re при
температуре 2975 °C составляет < 0,2 % и снижается до 0,1—0,05 %
Ири 1100 °C. Растворимость Re в (aHf) составляет менее 3 % (по
массе) при 1250 °C. Re стабилизирует (pHf) и снижает температуру
29»
900
Hf-Re
Рис. 482. Hf-Re
полиморфного превращения: эвтектоидный распад (PHf) протек.и)
при температуре 1300 °C.
В работе [4] было установлено образование в системе Hf—Re тро.
промежуточных фаз HfRe, HfRe2 и фазы % (82,5—89,5 % (ат.) Во
Фаза HfRe2 образуется непосредственно из расплава (конгруэнтно
при температуре -3160 °C и имеет область гомогенности 62—67,5
(ат.) Re. Фазы HfRe и % образуются по перитектическим реакцию
при температурах 2445 и 3085 + 15 °C [4J. В системе наблюдают о
две эвтектические реакции; Ж (PHf) + HfRe при температуре 184?>
± + 15 °C и концентрации 23,5 % (ат.) Re; Ж * (Re) + при темпе
ратуре 2930 + 15 °C и концентрации 91,5 % (ат.) Re. Максимальна'1
Hf-Rh
901
оастворимость Rc в (PHf) равна 12,5 % (ат.); эвтектоидное превра-
щение <pHf) ** (aHf) + HfRe протекает при температуре 1300 + 10 °C
И концентрации 12 % (ат.) Re. Максимальная растворимость Hf в
(Re) при эвтектической температуре составляет 3,5 % (ат.) [4].
Кристаллическая структура промежуточных фаз в системе Hf—Re,
до данным различных рентгенографических исследований, приведена
в табл. 377.
Таблица 377. Кристаллическая структура соединений
системы Hf—Re
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
Hf5Re24 или X аМп с/58, /43 т 0,9682— -0,9708 0,97126- -0,96605 — [1, 2] [4]
HfRe2 MgZn2 hPl2, P(yJ ттс 0,5248— -0,5235 0,5239 0,8592— -0,8569 0,8534 [1, 2] [4]
HfRe’ Тетрагон, 1льная сингош 1Я. 0,8906 1,3896 [4]
Литература
1. Савицкий Е.М., Тылкина М.А., Цыганова И.А. и др. // Журнал неорганичес-
кой химии. 1962. Т. 7. № 7. С. 1606-1610.
2. Гладышевский Е.И., Тылкина М.А., Савицкий Е.М. // Кристаллография. 1960.
Т. 5. № 6. С. 877-881.
3. Савицкий Е.М., Тылкина М.А., Левин А.М. Сплавы рения в электронике. М.:
Энергия, 1980. 215 с.
4. Taylor A., Kagle B.J., Dovle N.J.J. // J. Less-Common Met. 1963. V. 5. N 1.
P. 26-40.
М.Л. Тылкина
Hf—Rh. ГАФНИЙ—РОДИЙ
Диаграмма состояния Hf—Rh в области концентраций от 0 до
50 % (ат.) Rh (рис. 484) построена по данным дифференциального
термического анализа, измерения температур начала плавления
сплавов, металлографического и рентгенофазового анализов [1]. В
Исследуемой области концентраций подтверждено существование
Двух промежуточных фаз HfRh(S) и Hf2Rh(v). Фаза S кристаллизу-
ется конгруэнтно из расплава при температуре 2180 °C и при темпе-
902
Hf-Rh
Рис. 484. Hf-Rh
ратуре -600 °C претерпевает полиморфное превращение в твердей
состоянии. Фаза у образуется по перитектической реакции Ж + 6 •*
** у при температуре 1450 °C. Область гомогенности фазы у состав г;
ет не более 3 % (ат.) и смещена в сторону богатых Hf сплавов. Rh
понижает температуру плавления и полиморфного превращения Hf.
Эвтектическая реакция Ж ** (PHf) + у наблюдается при температур-'
1350 °C и концентрации 21 % (ат.) Rh. Эвтектоидный распад (fJHi-'
протекает при температуре 1315 °C и концентрации 8—9 % (ат.) Rh-
Максимальная растворимость Rh в (pHf) составляет -9,5 % (ат.)> в
(aHf) — менее 1 % (ат.).
Имеются данные о существовании в системе Hf—Rh со стороны Rh
соединений Hf2Rh3, Hf3Rh5, HfRh3 [Э, Ш]. Кристаллическая струк-
тура промежуточных фаз приведена в табл. 378.
I
Hf—Ru.
903
таблица 378. Кристаллическая структура соединений
сис«мы Hf-Rh [Ш]
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нМ
а b с
Ti2Ni cF96, Fd3m 1,230 — —
HfRh CsCl cP2, РтЗт 0,3227 — —
Hf46Rh5*4 — — 0,3268 — 0,3150
Hf45Rh5‘5 — — 0,312 0,341
Hf42Rh52 NbRu — 0,4392 0,4306 0,3470
Hf2Rh3 CuAu tP2, Р4/ттт 0,435 — 0,3451
HfRh3 Cu3Au cP 4, РтЗт 0,3912 — —
Тетрагональная сингония, искаженная структура CsCl.
Литература
1. Еременко В.Н., Штепа Т.Д., Великанова Т.Я. // Доклады АН УССР. 1985.
Серия А. № 10. С. 72-74.
Г.П. Жмурко
Hf—Ru. ГАФНИЙ-РУТЕНИЙ
Диаграмма состояния системы Hf—Ru (рис. 485) построена на
основании результатов измерения температуры плавления оптичес-
ким методом, металлографического и рентгеновского анализов [1, 2].
В системе установлено существование двух промежуточных фаз_ HfRu
и HfRu2. Соединение HfRu образуется из расплава конгруэнтно при
Температуре -2400 °C; соединение HfRu2 — по перитектической
реакции Ж + (Ru) HfRu2 при температуре -1910 °C. Кристалли-
ческая структура соединений приведена в табл. 379.
; В системе наблюдаются два эвтектических равновесия;
Ж ** (Ru) + HfRu2 при 1910 ± 25 °C и -18 % (ат.) Hf;
Ж - HfRu + (pHf) при 1710 ± 25 °C и -72,5 % (ат.) Hf.
904
Hf-Ru
Рис. 485. Hf-Ru
Ru понижает температуру полиморфного превращения Hf. Макс»
мальная растворимость Hf в (Ru) не превышает 5 % (ат.) при пери-
тектической температуре и снижается до 1,5 % при 1200 °C; макси-
мальная растворимость Ru в (0Hf) равна -10 % (ат.), в (aHf) -1 %.
Таблица 37 9. Кристаллическая структура соединений
системы Hf—Ru [1,2]
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а С
HfRu HfRu2 CsCl MgZ.n2 сР2, РтЗт hP\2, Pf>3/ттс 0,3215 0,5267 0,8723 i
Литература
1 Рошан Н.Р., Полякова В.П., Савицкий Е.М. // Диаграммы состояния метал.in
веских систем: Сб. статей. М.. Наука, 1971. С. 190—196.
2 . Савицкий Е.М., Полякова В.П., Горина Н.Б., Рошан Н.Р. Металловедение
платиновых металлов. М.: Металлургия, 1975. 287 с.
В.П. Поляков
Hf-S, Hf-Sb
905
jjf—S. ГАФНИЙ-СЕРА
Диаграмма состояния Hf—S не построена. В сплавах системы Hf—S
найдено несколько соединений, кристаллическая структура которых
приведена в табл. 380.
Таблица 38 0. Кристаллическая структура соединений
системы Hf—S [1—3]
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b С
~ Hf2S Анти- NbS2 hP.„ Р63/ттс 0,337 — 1,179
HfS* — — 0,33748 — 0,4351
Hf2S3* — — 0.3635 — 0,5839
HfS2 Cdl2 ЙРЗ, 0,3635 — 0,5837
Р3т1
HfS3" — — 0,508 0,51 0,358 0,3594 0,896 0,8992
’Гексагональная сингония. Моноклинная сингония, 0 = 98,4°, 0 = 98,16°
Литература
1. Franzen H.F., Graham J. // Z. Kristall. 1966. Bd. 123. S. 133.
2. McTaggart E.K., Wadsley A.D. // Australian J. Chem. 1958. V. 11. P. 445—457.
3. Harjldsen H., Kjekshus A., Rost E. et. al. // Acta Chem. Scand. 1963. V. 17.
P. 1283-1292.
Н.И. Никитина
Hf-Sb. ГАФНИЙ-СУРЬМА
Диаграмма состояния Hf—Sb не построена. В системе Hf—Sb
идентифицированы промежуточные фазы Hf3Sb, HfSb и HfSb2. HfSb2
существует в двух модификациях. Кристаллическая структура проме-
жуточных фаз в системе Hf—Sb приведена в табл. 381.
Таблица 381. Кристаллическая структура соединений
системы Hf—Sb ЦП]
Соединение 1 Грототип Символ Пирсона, пр. [р. Параметры решетки, нм
а b с
Hf3Sb Гс5Р — 1,123 — 0,565
HfSb FeSi сР8, P2t3 0,559 — —
Hf—Se, Hf-Si
907
Диаграмма состояния Hf—Sc (рис. 486) построена по результатам
дифференциального термического, микроструктурного и рентгено-
структурного анализов [1]. При исследовании использовали Hf
чистотой 98,9 % (по массе) и Sc чистотой 99,5 % (по массе).
Диаграмма состояния Hf—Sc характеризуется неограниченной
растворимостью компонентов в жидком и твердом состояниях между
обеими полиморфными модификациями компонентов. Между тверды-
ни растворами (а) и (Р) следует предполагать наличие двухфазной
области, в которой оба твердых раствора находятся совместно: (aHf,
aSc) + (PHf, PSc).
Литература
1. Наумкин О.П., Терехова В.Ф., Савицкий Е.М. // Изв. АН СССР. Неорганичес-
кие материалы. 1967. Т. 3. № 4. С. 711-713.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Hf—Se. ГАФНИЙ—СЕЛЕН
Диаграмма состояния Hf—Se нс построена. В сплавах системы
Hf—Se обнаружены соединения HfSe3, HfSe2, HfSe, Hf2Se3, Hf2Se,
кристаллическая структура некоторых приведена в табл. 382 [1—4].
Таблица 38 2. Кристаллическая структура соединений
системы Hf—Se
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b с
HfSe3‘ — — 0,5388 0,37216 0,9428
HfSe2 Cdl2 hP3, 0,3748 — 0,6159
Р3т1 0,3733 — 0,6146
Hf2Se Hf2S hP.., Р63/ттс 0,344 — 1,232
’Моноклинная сингония, 0 = 97,78°.
Литература
1. McTaggart F.K., Wadsley A.D. // Australian J. Chem. 1958. V. 11. P. 445—457.
2. Brattas L., Kjekshus A. // Acta Chem. Scand. 1972. V. 26. N 9. P. 3441—3449.
3. Greenway D.L., Nitsche R. // J. Physics Chem. Sol. 1965. V. 26. N 9.
P. 1445-1458.
4. Franzen H.F., Smeggil J., Conard B.R. // Mat. Res. Bull. 1967. V. 2. N 10.
P. 1087-1092.
Н.И. Никитина
Рис. 486. Hf—Sc
Hf-Si. ГАФНИЙ-КРЕМНИЙ
Диаграмма состояния Hf—Si приведена на рис. 487 по данным
аналитического обзора [1]. В системе Hf—Si наиболее достоверно
Установлено образование промежуточных фаз: Hf2Si, Hf3Si2, Hf5Si4,
HfSi и HfSi2, из которых Hf3Si2 образуется конгруэнтно при -2480 +
908
Hf-Si
Рис. 487. Hf-Si
± 20 °C. Соединения Hf2Si, Hf5Si4, HfSi и HfSi2 образуются no nep;?
тектическим реакциям при температурах 2083 + 12, 2320 + i?
2142 ± 15 и 1543 ± 8 °C и практически не имеют областей гомогст
ности [1]. Согласно работе (2] в системе Hf—Si, кроме указанные
фаз, по перитектической реакции при температуре выше 2400 <
образуется соединение Hf5Si3, которое распадается эвтектоидно при
температуре между 1500 и 1600 °C. Предполагается [2], что HfSi2 -
фаза переменного состава и смещена от стехиометрического состава
в сторону Hf. Кристаллическая структура промежуточных фаз при вс
дона в табл. 383.
Таблица 38 3. Кристаллическая структура соединений
системы Hf—Si
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник i J
a b c
Hf2Si A12Cu ti 12, 0,648 — 0,521 1Э1 i
/4/mcm 0,6457 — 0,5189 111 1
Hf5S.3 Mn5Si3 ЛР16. 0,7844 —. 0,54925 131 I
РЬ-J mcm 0,7890 — 0,5558 |9, 41 1
Hf3Si2 U3Si2 0,69887 — 0,36753 131 |
PM mbm 0,6999 — 0,3671 (5| J
Hf-Sn
909
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b С
Zr5Si4 /4,2,2 0,70397 — 1,2831 [3]
HfSi FeB оР8, Рпта 0,68897 0,6855 0,37724 0,3752 0,52235 0,5191 [3] [4]
HfSi2 ZrSi2 оС12, Стет 0,36724 1,4571 0,36414 [3]
В системе Hf—Si установлены два эвтектических взаимодействия:
Ж »* (PHf) + Hf2Si при концентрации 12 ± 1 % (ат.) Si и температу-
ре 1831 + 5 °C [1] или 2050 °C [2]; Ж HfSi2 + (Si) при 91,5 %
(ат.) Si и 1330 + 8 °C [1] или 1360 °C [2]. Si повышает температуру
превращения (aHf) * (PHf) до перитектоидной температуры 1770 °C
[1] или 1820 °C [2]. Растворимость Hf в (Si), Si в (aHf) практически
отсутствует [1], растворимость Si в pHf менее 1 % (ат.) [2].
Литература
1. Gokhale А.В., Abhaschian G.J. // Bull. Alloy Phase Diagrams. 1989. V. 10. N 4.
P. 390-393.
2. Шурин А.К., Тодоров П. // Металлофизика. 1971. Выл. 33. С. 100—102.
3. Карпинский О.Г., Евсеев Б.А. // Изв. АН СССР. Металлы. 1969. № 3.
С. 166-169.
4. Nowotny Н., Laube Е., Kieffer R., Benesovsky F. 11 Monatsh. Chem. 1958. Bd.
89. S. 701-707.
5. Schob O., Nowotny H., Benesovsky F. // Monatsh. Chem. 1961. Bd. 92.
S. 1218-1226.
В.П. Полякова
Hf-Sn. ГАФНИЙ-ОЛОВО
Диаграмма состояния Hf—Sn построена по данным дифференци-
ального термического, микроструктурного и рентгеноструктурного
анализов, измерения твердости и удельного электросопротивления
сплавов, микротвердости фаз и приведена на рис. 488 согласно анали-
тическому обзору [1]. Температуры плавления чистых металлов и
полиморфного превращения Hf приведены по данным работы [В11.
При исследовании использовали иодидный Hf чистотой 99,9 % и Sn
чистотой 99,99 % (по массе). Результаты работы [1] в области,
богатой Hf, хорошо согласуются с данными, приведенными в работе
[Ш]. Однако температуры нонвариантных превращений в работе [11
ниже, чем в работе [III].
В системе Hf—Sn установлено существование соединений Hf5Sn3,
Hf5Sn4, HfSn и HfSn2 [1—3]. Соединение Hf5Sn3 плавится конгруэн-
тно при 1735 °C [2] или выше [1]. Соединение HfSn2 образуется по
910
Hf-Sn
Рис. 488. Hf-Sn
перитектической реакции [1,2, Ш] при 1530 0 [2]. Характер образе
вания и интервал существования соединений Hf5Sn4 и HfSn требу,
уточнения. Кристаллическая структура промежуточных фаз в смете
ме Hf—Sn приведена в табл. 384.
Sn значительно снижает температуру плавления Hf: температу р.
эвтектической реакции Ж « (PHf) + Hf5Sn3 равна 1725 °C и концен
трация Sn в эвтектике -20,5 % (ат.) [2]. Sn снижает также темпере
туру полиморфного превращения Hf.
Отмечается большая растворимость Sn в (Hf): в (PHf) - 16 '
(ат.) [1J и в (aHf) ~ 14 % (ат.) при 1500 °C, 11,5 % при 1100 Ч
7,5 % при 800 °C [21.
Со стороны Sn имеет место вырожденная эвтектика при темпера
туре 230 °C.
Таблица 38 4. Кристаллическая структура соединений
системы Hf—Sn
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
Hf5Sn3 Mn5Sij hP\ 6, P63/mcm 0,8370— -0,842 0,5737- -0,5821 [1, 2[
Hf-Та
911
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
Hf5Sn4 Ti5Ga4 ЛР16, Pf^/mcm 0,874 0,871 0,592 0,589 [1] [3]
HfSn FeSi сР8, Р2,3 0,5594 — [1]
HfSn2 CrSi2 /гР9, Р6г22 0,5487 0,547 0,7625 0,760 [1] [1]
Литература
1. Okamoto Н. // J. Phase Equilibria. 1991. V. 12. N 4. P. 472—474.
2. Цыганова И.А., Тылкина M.A., Савицкий Е.М. // Изв. АН СССР. Металлы.
1971. № 3. С. 188-191.
3. Rosstenscher W., Schubert К. // Z. Metallkunde. 1965. Bd. 56. Nil. S. 813—822.
В.П. Полякова
Hf-Ta. ГАФНИЙ-ТАНТАЛ
В работах [1, 2] приведена уточненная диаграмма состояния
Hf—Та (рис. 489), первоначальный вариант которой был рассмотрен
в работе [Ш]. Диаграмма состояния построена на основании данных
Та , % (по массе)
Рис. 489. Hf-Ta
912
Hf—Tc
дифференциального термического, микроструктурного и дилатомет-
рического анализов, рентгеновских исследований при комнатной. (1
высоких температурах.
Сплавы Hf—Та кристаллизуются с образованием непрерывного
ряда твердых растворов. Кривые ликвидуса и солидуса построены с
помощью оптической пирометрии. Они проходят через пологий мини-
мум при температуре 2130 °C и концентрации 20,0 % (ат.) Та |2|.
Та снижает температуру полиморфного превращения Hf [1—Д.
Монотектоидная реакция протекает при 1083 °C и 40 ± 10 % (аг.)
Та [1, 2]. В работе [3] указывается температура 1020 °C и концен-
трация -17 % (ат.) Та. Вершина купола расслоения твердого раство-
ра на основе (PHf, Та) находится при 1140 °C [2] (или при 1670 С
и 35—40 % (ат.) Та [3]). Двухфазная область (0Hf) + (Та) при монс.-
тектоидной температуре расположена при концентрациях 40—81,1 ’<
(ат.) Та [2] или 17,5—91,2 % (ат.) Та [3]. Максимальная раствори-
мость Та в (aHf) при температуре 1083 °C составляет -6,7 % (аы
[21.
Литература
l. KrugM.P., Oden L.L., Romans Р.А. // Metall. Trans. A. 1975. V. 6. ?
P. 997-1002.
2. Krishnan R., Garg S.P., Krishnamurthy N. // J. Alloy Phase Diagrams. 1989. \ :
N 2. P. 117-124.
3. Свечников В.H., Шурин A.K., Дмитриева Г.П. // Металлофизика. 14M
Вып. 19. С 206-211.
В.П. Поляк :
Hf—Тс. ГАФНИЙ—ТЕХНЕЦИЙ
Диаграмма состояния Hf—Тс не построена. Рентгеновское исследо-
вание сплавов Hf—Тс показало, что в системе могут существова > >
соединения ~HfTc7, HfTc2 и HfTc, кристаллическая структур i
которых приведена в табл. 385 [1].
Таблица 3 8 5. Кристаллическая структура соединений системы Hf—Тс
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а С
HfTc7 а Мп с/58, /43т 0,9603 —
НП’с2 MgZn2 hP\2, Pbij ттс 0,5200 0,8616
HfTc CsCl сР2, РтЗт 0,3270 —
Hf-Те
913
Литература
I. Darby J.B., Lam D.J., Norton L.J., Downey J.W. // J. Less-Common Met. 1962.
V. 4. P. 558-563.
Н И. Никитина
Hf-Те. ГАФНИЙ-ТЕЛЛУР
Диаграмма состояния Hf—Те не построена. В сплавах системы
Hf—Те обнаружены промежуточные фазы, состав и кристаллическая
структура которых приведены в табл. 386 по данным работ [1—5]. В
области концентраций -58—70 % (ат.) Те предполагается существо-
вание фаз Hf2Tej [4] и Hfl+xTe2 (0,25 ±0,02 < х < -0,43) [5];
HfTe2_x (л = 0,0о1). Существование соединения HfTe [5] не было
подтверждено в работе [6].
Таблица 38 6 Кристаллическая структура соединений системы Hf—Те
Соединение Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
HfTe5 оС.., Стет 0,39743 1,4492 1,3730 [1]
HfTe3* тР.., Р2х/т 0,5879 0,39022 1,0056 12, 3]
Hf,T< — 0,3947 — 0,6635 [4]
HfTe- Р3«1 0,39492 — 0,66514 (6]
’p » 97,98°. Гексагональная сингония. Ромбоэдрическая сингония.
Литература
1. Furuseth S., Brattas L„ Kjekshus A. // Acta Chem. Scand. 1973. V. 27. N 7.
P. 2367-2374.
2. Brattas L., Kjekshus A. // Acta Chem. Scand. 1972. V. 26. N 9. P. 3441-3449.
3. Furuseth S., Brattas L„ Kjekshus A. // Acta Chem. Scand. 1975. V. 29. N 6.
P. 623-631.
4. McTaggart E.K., Wandslev A.D. // Australian J. Chem. 1958. V. 11. P. 445-447.
5. Brattas L„ Kjekshus A. // Acta Chem. Scand. 1971. V. 25. N 7. P. 2783-2785.
6. Smeggil J.G., Bartram S. // J. Solid State Chem. 1972. V. 5. N 3. P. 391-394.
Н.И. Никитина
914
Hf-Th
Hf—Th. ГАФНИЙ-ТОРИЙ
Диаграмма состояния Hf—Th (рис. 490) построена на основан!-и
данных термического и микроструктурного анализов и резистометрии
[1]. При исследовании использовали: губчатый Th и кристалличсс
кий Hf, основной примесью в которых был С в количестве 0,037 tl
0,03 % (по массе) соответственно.
Рис. 490. Hf-Th
В системе Hf—Th при температуре 1600 °C имеет место нонвари
антное равновесие кататектическбго типа (£Hf) « Ж + (aHf). Катя
тектичсская точка соответствует ~3 % (ат.) Th. Эвтектическая
реакция Ж « (0Th) + (aHf) протекает при 1450 °C и концентрации
31 % (ат.) Hf. Максимальная растворимость Hf в (pTh) при эвтекти
ческой температуре составляет -17,5 % (ат.), Th в (aHf) — 1,5
(ат.). При температуре 1295 °C и концентрации 11,3 % (ат.) Ш
имеет место еще одно нонвариантное превращение эвтектоидного
типа (0Th) (aTh) + (aHf). (aTh) и (aHf) при эвтектоидной темпе
ратуре содержат 6,5 % (ат.) Hf и 1,5 % (ат.) Th соответственно.
Литература
1. Gibson E.D., Loomic В.А., Carlson O.N. // Trans. ASM. 1958. V. 50. P. 348-34')
Г.И. TepeW'
Ц Hf—Ti. ГАФНИЙ—ТИТАН
й Диаграмма состояния Hf—Ti (рис. 491) построена на основании
№ данных дифференциального термического анализа, измерения темпе-
Ж ратуры плавления сплавов с помощью оптического пирометра и
I металлографического анализа [1—3]. В жидком и твердом состояниях
Рис. 491. Hf—Ti
Hf и Ti образуют ряды растворов. Согласно работе [2] температур-
}(. ный интервал области (aHf, aTi) + (0Hf, 0Ti) не превышает 10 °C.
По данным работы [3], температурные кривые, соответствующие
началу и концу полиморфного превращения (aHf, aTi) « (0Hf, 0Ti)
проходят через пологий минимум. В работе [4] построена диаграмма
состояния Hf—Ti расчетным путем по методу Кауфмана, которая
хорошо согласуется с экспериментально построенной диаграммой.
Литература
1. Тылкина М.А., Пекарев А,И., Савицкий Е.М. // Журнал неорганической
ХИМИИ. 1959. Т. 10. № 10. С. 2320-2322.
2. Imgram A.G., Williams D.N., Ogden H.R. // J. Less-Common Met. 1962. V. 4. N 3.
P. 217-225.
3. Руда Г.И., Корнилов И.И., Вавилова В.В. // Изв. АН СССР. Металлы. 1975.
№ 5. С.'203-206.
4. Kaufman L„ Tanner L. // Calphad. 1979. V. 3. A 2. P. 91-107.
Н.П. Полякова
916
Hf-U
Hf-U. ГАФНИЙ—УРАН
Диаграмма состояния Hf—U (рис. 492) построена на основании
данных термического, микроструктурного и рентгеноструктурного
анализов [1]. При исследовании использовали иодидный Hf и п
технической чистоты.
Рис. 492. Hf-U
Сплавы системы Hf—U, кристаллизуясь, образуют непрерывные
ряды твердых растворов между yU и pHf. При температуре 1125 С
в системе наблюдается монотектоидное превращение с монотектоид-
ной точкой при концентрации 55 % (ат.) Hf. Границы облачи
расслоения твердого раствора (yU, pHf) определены приблизительно,
купол расслоения соответствует -1200 °C. При температуре 733 <
протекает нонвариантная реакция эвтектоидного типа (yU, pH!)
1;1”| 917
и <pU) + (aHf). Растворимость Hf в (PU) при этой температуре со-
ставляет ~0,5 % (ат.). При температуре 676 °C предполагается
древращение перитектоидного типа, так как его температура выше
температуры превращения aU * PU. Растворимость U в (aHf) при
температуре 1425 °C достигает 2,3 % (ат.).
/ В работах [2, 3] приведены данные по расчету кривых ликвидуса,
'• солидуса и фазовых равновесий твердых растворов.
Литература
1. Peterson D.T., Beerntsen D.J. // Trans. ASM. 1960. V. 52. P. 763—780.
2. Chatterji D. // Metall. Trans. 1971. V. 2. N 10. P. 2939-2942.
3. Иванов O.C., Удовский А.Л. 11 Физико-химический анализ сплавов урана,
тория и циркония. М.: Наука, 1974. С. 91—103.
Г.И. Терехова
Hf—V. ГАФНИЙ-ВАНАДИЙ
Диаграмма состояния Hf—V (рис. 493) построена на основании
данных дифференциального термического, микроструктурного и
рентгеноструктурного анализов [1]. При исследовании использовали
V электронно-лучевой плавки и Hf с примесью Zr [0,44 % (по массе)].
₽ИС. 493. Hf—V
918
Hf-W
Установлено, что легирование V стабилизирует ((3Hf): эвтектоид-
ный распад протекает при концентрации 19 % (ат.) V и температуре
1190 + 25 °C. В системе обнаружена только фаза HfV2, которая
образуется конгруэнтно при температуре 1550 °C, и два эвтектичсс
ких превращения: Ж (0Hf) + HfV2 при 1456 °C и 43 % (ат.) V-
Ж * HfV2 + (V) при 1520 °C и 69 % (ат.) V.
Фаза HfV2 имеет незначительную область гомогенности [1;
Температура конгруэнтного плавления HfV2 равна 1550 °C [1] или
1580 °C [2]. Кристаллическая структура HfV2 типа MgCu2 (символ
Пирсона с/24, пр. гр. Fd3m, а = 0,738 нм [Ш] или а = 0,7400 нм
[Э]).
Литература
1. Rudy Е., Windisch Sr. // J. Less-Common Met. 1968. V. 15. N 1. P. 13-27.
2. Кочержинский Ю.А., Маркие В.Я., Петьков В.В. // Изв. АН СССР. Металла
1973. № 1. С. 189-195.
В.П. Поляков:’
Hf—W. ГАФНИЙ-ВОЛЬФРАМ
В работах [1—4J приведены варианты диаграммы состояния Hf—W.
Во всех вариантах диаграмма состояния имеет одинаковый вид,
однако температуры нонвариантных превращений и значения раствс
римости Hf в (W) и W в (Hf) различны. На рис. 494 приведена диа1
рамма состояния Hf—W согласно работе [5], построенная на основа
нии анализа данных работ [1—4].
В системе Hf—W образуется одна промежуточная фаза HfW2 по
перитектической реакции при температуре 2512 ± 18 °C. Температу
ра перитектической реакции равна 2540 [1], 2520 [2] или 2650 °C
|3]. Интервал гомогенности фазы HfW2 составляет ~2 % (ат.).
Соединение HfW2 образует с (0Hf) эвтектику при концентрации
-18 % (ат.) W и температуре 1949 °C (1980 [2] и 1930 °C [3]). Фаз.
HfW2 обладает структурой типа MgCu2 (символ Пирсона сТ24, пр. гр.
Fd3m, параметр решетки а = 0,7571—0,7599 нм [3], а =
= 0,7585—0,7593 нм [1, 7]). Твердый раствор (0Hf) распадается на
HfW2 и (aHf) по эвтектоидной реакции при концентрации 8 % (ат.!
W и температуре 1480 °C (1730 °C [1] и 1560 °C [3]). Растворимость
Hf в (W) приведена ниже:
Температура, °C ...........
Растворимость Hf, % (ат.) . , .
Источник ..................
2650
15±2
131
2540 2512
-6 9±2
И] [5|
2000 1500
1,7 Ы
[6] [6]
1400 800
-4 -3,5-4
[5] [3J
Hf-W
919
Hf fV, °/o (am.) W
Рис. 494. Hf-W
Растворимость W в (0Hf) составляет:
Температура, °C .................. 2010 1980 1930 1730 1560 1480
Растворимость W, % (ат.) ....... 13,5±1 11,5 13,5±1 -9 7±O,5 8tl
Источник ......................... [5] [1] [3] [1] [3] [5]
Растворимость W в (aHf) существенно ниже и составляет 0,9 %
(ат.) при температуре 1560 °C [3].
Литература
1. Braun Н., Rudy Е. // Z. Metallkunde. 1960. Bd. 51. S. 360-363.
2. Yeremenko V.N., Velikanova T.Ya., Artyukh L.V., Vischenevsky A.S. // Rev. Int.
Hautes Temp. Refract. 1975. V. 12. N 3. P. 209—213.
3. Giessen B.C., Rump I., Grant N.J. // Trans. AIME. 1962. V. 224. P. 60-64.
4. Ackermann R.J., Raub E.G. // High Temp. Sci. 1972. V. 4. N 4. P. 272-282.
5. Nagender S.V., Rama Rao P. // J. Alloy Phase Diagrams. 1987. V. 3. N 1.
P. 38-46.
6. Савицкий E.M., Поварова К.Б., Макаров П.В. Металловедение вольфрама. М.:
Металлургия, 1978. 223 с.
7. Rapp О. // J Less-Common Met. 1970. V. 21. Р. 27-44.
К. Б. Поварова
920
Hf-Y
Hf—Y. ГАФНИЙ-ИТТРИЙ
Диаграмма состояния Hf—Y (рис. 495) построена на основании
данных пирометрического и микроскопического анализов [Э]. При
исследовании использовали Hf чистотой 99,7 % и Y чистотой 98,3 %
(по массе).
Рис. 495. Hf-Y
Hf-Yb
921
Диаграмма состояния Hf—Y характеризуется неограниченной
растворимостью компонентов в жидком и ограниченной взаимной
растворимостью в твердом состоянии. Эвтектическое равновесие Ж *
* (aHf) + (aY) протекает при 1425 °C и 13 % (ат.) Hf. Растворимость
Y в (aHf) при температуре 1150 °C составляет 3 % (ат.), при 1425 °C
— 4,0 % (ат.). Растворимость Hf в (aY) при 1150 °C равна 0,5 %
(ат.), при 1425 °C — 2,0 % (ат.) (~1,0 % (ат.) [М]).
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Hf-Yb. ГАФНИЙ-ИТТЕРБИЙ
Согласно предполагаемому варианту диаграммы состояния Hf—Yb
(рис. 496) Hf и Yb имеют незначительную растворимость в жидком
состоянии и практически не растворяются в твердом состоянии.
Характер нонвариантных превращений не установлен [1].
Hf Yb,%(am) Yb
Рис. 496. Hf-Yb
Литература
1. Moffatt W.G. // Handbook of Binary Phase Diagrams. New York: Business Growth
Services. General Electric Co. Schenectady, 1981. V. 3. 385 p.
Т В. Добаткина
922
Hf—Zn, Hf—Zr
Hf—Zn. ГАФНИЙ-ЦИНК
Диаграмма состояния Hf—Zn не построена. Согласно работе [ 11 н
системе Hf—Zn образуются соединения: Hf2Zn, ~Hf4Zn5, HfZn,
~HfZn3, ~HfZn5, HfZn22, кристаллическая структура которых привс
дена в табл. 387 (структура Hf4Zn5 не установлена).
Таблица 3 8 7. Кристаллическая структура соединений системы Hf—Zn
Соединение 1 [рототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
Hf2Zn MoSi2 t!6, 14/ттт 0,325 1,116 [И
HfZn2 (ВТ) MgCu2 сТ-24, Fd/m 0,732 — И]
IIfZn2 (HT) MgNi2 hP24, Р63/ттс 0,519 1,689 [11
HfZn3' ZrZn3 — 0,812 1,612 111
HfZn5* — — 1,17 1,16 [11
HfZnT' ZrZn22 — 1,407 — [2]
Тетрагональная сингония.
Кубическая сингония.
Литература
1 Rossteutscher W., Schubert К. // Z. Metallkunde. 1965. Bd. 56. N IO
S. 730-734.
2. Maldonado A., Meissner H.G., Raman A., Rosstentscher W. // Naturwiessenschaf
ten. 1969. Bd. 50. N 2. S. 41.
НИ. Никитина
Hf—Zr. ГАФНИЙ—ЦИРКОНИЙ
Диаграмма состояния Hf—Zr приведена на рис. 497 согласно
аналитическому обзору [1]. Zr и Hf полностью растворимы в жидком
состоянии и образуют непрерывные ряды твердых растворов межд)
высокотемпературными 0- и низкотемпературными «-модификация-
ми. Границы фазовых областей могут быть описаны следующими
выражениями [1]:
х = 1 ,308x1g-* 1 О - 863) -5,456x10“5 (t - 863)2 + 3,974x1g-8 (,' -
— 863)3 *, граница между (aHf, aZr) и (aHf, aZr) + (0Hf, 0Zr);
x = 9,461x10-2 0 — 863) + 8Д61Х10-6 * O- 863)2 + 1,529x10"^ (t -
— 863)3, граница между (0Hf, 0Zr) и (aHf, aZr) + (0Hf, 0Zr);
Hf~Zr
923
Zr, °/o (no массе)
Hf Zr,%(am.) Zr
Рис. 497. Hf—Zr
x= 3,774x1g-1 (t- 1855) - 2,279x1g"4 it- 1855)2 - 1,817xlO~7
(Z — 1855)3, линия солидуса;
x = 3,274x10-’ (t - 1855) - 1,007x1g"4 (f - 1855)2 - l,665xl0"7
it — 1855)3, линия ликвидуса,
где t — температура, °C; x — концентрация Hf, % (ат.).
В работе [2] исследовано влияние давления на структуру сплавов
Hf—Zr, содержащих более 28,7 % (ат.) Zr [2]. Найдено, что при
Давлении 40 ГПа в сплавах, содержащих более 78,9 % Zr, полностью
924
Hg—Ho
происходит превращение (aHf, aZr) • « (<o — фаза с гексагоналы;.^
структурой, с/а = 0,622), при меньших содержаниях Zr превращсчнс
(aHf, aZr) - (0Hf, pZr) происходит частично.
Литература
I. Abriata J.P., Bolcich J.C., Peretti Н.А. // Bull. Alloy Phase. Diagrams. 1982. V
N 1. P. 29-34.
2. Ming Z„ Mangani M.H., Katahara K.W. // J. Appl. Phys. 1981. V. 52. N 3. P>
P. 1332-1335.
Л.А. Третьяче! !. ,
Hg-Ho. РТУТЬ-ГОЛЬМИЙ
Диаграмма состояния Hg—Ho не построена. В системе установлено
образование трех соединений: HoHg3, HoHg2, HoHg, кристалличес-
кая структура которых приведена в табл. 388. При нагреве соедине-
ния разлагаются по следующим реакциям:
Рис. 498. Hg-Ho
Hg—In
925
HoHg ₽ Газ + (Но)
HoHg2 « Газ + HoHg
HoHg3 Газ + HoHg2
при 600 °C;
при 550 °C;
при 470 °C [1].
На основании полученных результатов в работе [1] предложена
схематическая диаграмма состояния Hg—Ho (рис. 498). Раствори-
мость Но в жидкой Hg составляет 0,1 % (ат.) при температуре
150 °C и ~1 % (ат.) при температуре 450 °C. Растворимость Hg в Но
не обнаружена.
Таблица 388. Кристаллическая структура соединений системы Hg—Ho [2]
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а С
HoHg3 Mg3Cd hP.., Р63/ттс 0,6526 0,4872
HoHg2 А1В2 hP3, Р6/ттт 0,480 0,346
HoHg CsCl сР2, РтЗт 0,364 —
Литература
1. Rirchmayr H.R., Lugscheider W. // Z. Metallkunde. 1966. Bd. 57. N 10.
S. 725-728.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Hg—In. РТУТЬ-ИНДИЙ
Система Hg—In была исследована полностью или частично в
шести независимых работах методами дифференциального термичес-
кого, микроскопического и рентгеновского анализов, измерения
сверхпроводящих характеристик сплавов. Для проведения данных
работ были использованы максимально чистые исходные металлы
[Ш, 1—4]. Обобщенная диаграмма состояния Hg—In (рис. 499) по-
строена в работе [III]. В системе обнаружены соединения Hg6In
(фаза Р), Hg4In, Hg7In3(?), Hgln, Hglnlr
Богатая Hg фаза p плавится конгруэнтно при температуре —14,2
[1] или —13,2 [3], или —15 °C [4] и имеет широкую область гомо-
генности, простирающуюся от 2,5 до 19,1 % (ат.) In, и наиболее
точно отвечает формуле Hg6In. Соединение HgJn плавится по
перитектической реакции при —20,6 [Ш] или —20,7 [2], или —20,5
[3], или —21,5 °C [4J. Состав данной фазы требует уточнения.
926
Hg—In
ln.°/„ (no массе)
Рис. 499. Hg—In
Соединение Hg7In3 приведено на диаграмме условно на основании
данных термического анализа [3, 4, Ш]. В работах [1, 2] существо-
вание этого соединения не подтверждено. Соединение Hgln плавится
конгруэнтно при температуре —19,3 11], —18,5 [3], —18,6 °C [4]. По
мнению большинства исследователей, Hgln не имеет области гомо -
гснности; согласно [4] область гомогенности Hgln -2—4 % (ат.).
При концентрации 92,7 % (ат.) In и температуре 108 °C по
перитектической реакции образуется фаза Hglnn. При температуре
—31,0 °C область гомогенности фазы Hglnn составляет 78—91 % (ат. <
In, а при температуре —78 °C — 87—91 % (ат.) In [1]. В системе
установлены два эвтектических равновесия:
Ж « Hg4In + Hg7In3 при температуре —37,2 °C и концентрации
34,7 % (ат.) In;
Ж ₽ Hgln + Hglnn при температуре —31,0 °C и концентрации
61,5 % (ат.) In.
По данным работы [4], температура перитектической реакции, при
которой образуется Hglnn, составляет 105 °C, область гомогенности
Hg-Ir
927
Hglnn 84—92,5 % (ат.) In, эвтектические равновесия протекают при
температурах —37,5 и —31,5 °C соответственно.
Растворимость In в Hg при температуре перитектики —38,9 °C
равна ~0,1—0,3 % (ат.) [1] или < 0,5 % (ат.) [3]. Область твердого
раствора на основе In простирается до 6—7 % (ат.) Hg [1]. Парамет-
ры решетки (In) практически не зависят от состава.
Кристаллическая структура большинства промежуточных фаз не
индицирована. Известные кристаллографические параметры соедине-
ний Hg—In приведены в табл 389.
Таблица 389. Кристаллическая структура соединений системы Hg—In
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
Hg6In* — — — 0,521 [Ш]
Hg4In* — — 0,3484 — 0,3310 IV-C]
Hg4In yPu oF8, Fddd 0,3522 0,4849 1,0872 [V-C]
Hgln Hgln 0,3572 — 1,3168 IV-C1
Rim
Hgln“ — — 0,4675 0,4695 — — 14] IV-C]
Тетрагональная сингония. Кубическая сингония.
Литература
1. Coles B.R., Merriam M.F., Fisk Z. // J. Less-Common Met. 1963. V. 5. N 1.
P. 41-48.
2. Eggert G.L. // Trans. ASM. 1962. V. 55. N 2. P. 891-897.
3. Jangg G. // Z. Metallkunde. 1962. Bd. 53. N 9. S. 612-614.
4. Козин Л.Ф., Судаков B.A. // Изв. АН СССР. Металлы. 1970. №5. С. 197-201.
В.П. Полякова
Hg—1г. РТУТЬ—ИРИДИЙ
Диаграмма состояния Hg—1г не построена. Соединения Hg с 1г
Методом прямого растворения 1г в Hg при нагреве не были получены.
Растворимость 1г в Hg очень мала [1].
Литература
1. Jangg G., Dflrtbudak Т. // Z. Metallkunde. 1973. Bd. 64. N 10. S. 715-719.
В. П. Полякова
928
Hg-K
Hg—К. РТУТЬ—КАЛИЙ
Система Hg—К (рис. 500) исследована методами дифференциал!,
ного термического и рентгеновского анализа, измерением плотности
вязкости, магнитных и электрических свойств сплавов [X].
К, °/о (по массе)
Рис. 500. Hg—К
Нд К, У. (ат.) К
Установлена неограниченная смешиваемость Hg и К в жидком
состоянии. Растворимость К в жидкой Hg составляет [ 1 ]:
Температура, °C .......... 25 50 75 100 150 200
Растворимость К, % (ат.).. 2,3 4,5 9,6 11,5 14,6 23,7 32.
Взаимной растворимости в твердом состоянии у К и Hg не обнаружь
но. При затвердевании в сплавах системы Hg—К образуются соединс
ния: KHg, K5Hg7, KHg2, KHg2 7, KHg3, KHg4, KHg9, KHgn. Соеди
нения KHg и KHg2 плавятся конгруэнтно при температурах 180 а
270 °C. Фазы KHg9, KHg4, KHg3, KHg2 7 образуются по псритекть
чсским реакциям при температурах 70, 187, 195 и 219 “С. Предподн
гастся, что KHg3 имеет полиморфное превращение при температур
178 °C. Из-за отсутствия экспериментальных данных по условия4'
образования соединений KHgj ] и K5Hg7 диаграмма состояния постро
Hg-La
929
ена с допущениями, что оба соединения образуются по перитектичес-
ким реакциям при температурах ниже 70 и выше 219 °C соответ-
ственно. Кристаллическая структура промежуточных фаз в системе
Hg—К приведена в табл. 390.
Таблица 39 0. Кристаллическая структура соединений системы Hg—К
Соединение Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
KHg* оР8, Р1 0,659 0,676 0,706 12]
KsHg7 оР48, 0,999 1,923 0,825 [2]
РЬст 1,006 1,945 0,834 ]3]
KHg2 о720, 1т та 0,810 0,516 0,877 12]
KHgl! cP.., РтЗт 0,96455 — — [2]
*а “ 106°5';
Р = 10Г52';
у = 92Ч7'.
Литература
1. Козин Л.Ф. // Тр ин-та химических наук АН Каз. ССР. Алма-Ата. 1962. Т. 9.
С. 101.
2. Duwell E.J., Baenziger N.C. // Acta Crystallogr. 1955. V. 8. P. 705-716.
3. Duwell E.J., Baenziger N.C. 11 Acta Crystallogr. 1960. V. 13. P. 476-484.
Л.Л. Зусман
Hg-La. РТУТЬ—ЛАНТАН
Система Hg—La исследовалась в работах 11, 2]. По данным работы
[1], в системе при давлении 0,1 МПа установлено образование
"четырех соединений: LaHg4, LaHg3, LaHg2, LaHg, которые разлага-
:Ются по следующим реакциям: LaHg4 - LaHg3 + Ж при температуре
290 °C; LaHg3 - LaHg2 + Газ при температуре 440 °C; LaHg2 -
- LaHg + Газ при температуре 465 °C; LaHg - La + Газ при темпера-
туре 580 °C.
В работе [2] подтверждено существование этих соединений и
Указано на образование еще двух соединений, ~LaHg6 и -La2Hg9.
Исследование было проведено методами термического и рентгенов-
ского анализов. В качестве исходных материалов использовали La
Чистотой 99,6 % (по массе) и Hg чистотой 99,9 % (по массе). Спла-
вы были выплавлены в запаянных тиглях из Fe или Та. При этом
30 Зак. 2144
930
Hg—La
давление ртути над расплавом в запаянных тиглях увеличивало!,
при повышении температуры плавления сплавов.
На рис. 501 приведена схематическая диаграмма состояния Hg—1л
[2]. Взаимная растворимость компонентов в системе практическ и
отсутствует [1, 2]. Кристаллическая структура известных промеж}
точных фаз приведена в табл. 391.
931
if а б л и ц a 3 9 1. Кристаллическая структура соединений системы Hg—La
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
LaHg6‘ — — 0,9763 2,886 0,5004 [21
~La2Hg9 ZnJgGdl3 hP\ 42, P63mc 0,1567 — 1,548 [2. 3]
LaHg4 SmllCd45 с/-448, F43m 2,1977 — — 12, 3]
LaHg3 Ni3Sn ЙР8, Р63/ ттс 0,6822 0,6816 — 0,4960 0,4971 13] [2]
LaHg2 A1B2 hP3, Р6/ттт 0,4958 — 0,3640 [3]
LaHg Ромбиче CsCl гкая синго! сР2, РтЗт 1ИЯ. 0,3845 0,3864 — — [3] [2]
Литература
1. Kirchmayr H.R., Lugscheider W. // Z. Metallkunde. 1966. Bd. 57 N 10.
S. 725-728.
2. Bruzzone G., Merlo F. // J. I.ess-Common Met. 1976. V. 44. P. 259—265.
3. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печерский
Hg—Li. РТУТЬ-ЛИТИЙ
Диаграмма состояния Hg—Li (рис. 502) построена на основании
данных термического и рентгеновского анализов [X].
В системе установлено образование шести химических соедине-
ний, из которых LiHg и Li3Hg плавятся конгруэнтно при температу-
рах 595 и 375 °C соответственно. Соединение LiHg имеет область
гомогенности -38—62 % (ат.) Li. Соединения LiHg3, LiHg2, Li2Hg,
Li6Hg образуются по перитектическим реакциям при температурах
235—240, 339, 375 и 165 °C соответственно. Кристаллическая струк-
тура промежуточных фаз системы Hg—Li приведена в табл. 392.
В системе наблюдаются три эвтектические реакции:
Ж « (Hg) + LiHg3 при температуре —42 °C и концентрации
0,6 % (ат.) Li;
Ж ** Li2Hg + Li3Hg при температуре 371 °C и концентрации
-70 % (ат.) Li;
зо*
932
Hg-U
Ж (Li) + Li6Hg при температуре 161 °C и концентрат Ии
92,5 % (ат.) Li.
Рис. 502. Hg—Li
Таблица 3 9 2. Кристаллическая структура соединений системы Hg—Li
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм — Источник
а С
LiHg3 Ni3Sn ЛР8, P63/mmc 0,6253 0,4804 IU
LiHg CsCl сР2, РтЗт 0,3294 — 12]
Li3Hg BiF3 cF\ 6, Fm3m 0,6597 — щ :
. Растворимость Li в Hg при комнатной температуре составляет
1 12 % (ат.), растворимость Hg в Li при эвтектической температуре
—2,5 % (ат.).
Литература
1. Zintl Е., Schneidner А. // Z. Elektrochem. 1935. Bd. 41. S. 771—774.
2. Zintl E„ Braver G. 11 Z. Physik. Chem. 1933. Bd. 20. S. 245-271.
Л.Л. Зусман
Hg—Lu. РТУТЬ—ЛЮТЕЦИЙ
Диаграмма состояния Hg—Lu не построена. Имеются данные о
существовании соединений LuHg и LuHg3, кристаллическая структу-
ра которых приведена в табл. 393.
Таблица 39 3. Кристаллическая структура соединений системы Hg—Lu
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а Ь
LuHg LuHg3 CsCl MgjCd сР2, РтЗт hP, Р63/ттс 0,3607 0,6476 0,4851
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Hg—Mg. РТУТЬ—МАГНИЙ
Достаточно полный обзор исследований по диаграмме состояния
Hg—Mg (рис. 503) приведен в работе [X]. В системе образуются
шесть соединений, из которых MgHg, Mg5Hg3 и Mg2Hg плавятся
конгруэнтно при температурах 627, 562 и 580 °C соответственно.
Соединения MgHg2, MgcHg2, Mg3Hg образуются перитектически при
температурах 170, 519, 508 °C соответственно. Кристаллическая
структура известных промежуточных фаз приведена в табл. 394.
Со стороны Hg и Mg в системе наблюдаются эвтектические
реакции:
Ж * (Hg) + MgHg2 при —41 °C;
; Ж * Mg3Hg + (Mg) при 453 ± 5 °C и 82,5 % (ат.) Mg [36,4 %
(мае.) Mg].
934
Hg-Mg
Мд, a/<>(am.)
Рис. 503. Hg-Mg
Таблица 39 4. Кристаллическая структура соединений системы Hg—Mg [X]
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а с
MgHg2 MoSi2 tlb, /4/ттт 0,3838 0,8799
MgHg CsCl сР2, РтЗт 0,3449 —
MgsHgj Mn5Si3 hPlb, Р63/тст 0,8260 0,5931
Mg3Hg Na3As hP8, P63/mmc 0,4868 0,8656
Растворимость Mg в Hg, определенная различными методами, при
температурах, близких к комнатной, составила, % (ат.): 2,52—2,60
(химический анализ); 2,4 (измерения ЭДС); 2,5—2,74 (метод терми'
ческого анализа); 2,15 при 4 °C (измерения электропроводности)
Hg—Mn, Hg—Mo
935
растворимость Hg в твердом Mg, определенная микроскопическим
методом, составила -0,4 % (ат.), при эвтектической температуре и
-0,12 % (ат.) при температуре 400 °C [X].
Л.Л. Рохлин
Hg—Mn. РТУТЬ-МАРГАНЕЦ
Диаграмма состояния Hg—Mn не построена. В системе Hg—Mn
достоверно установлено существование двух промежуточных фаз
MnHg и Mn2Hg5. Соединение MnHg существует при температурах
< 265 °C. При высоких температурах MnHg обладает решеткой типа
CsCl (символ Пирсона сР2, пр. гр. РтЗт), параметр решетки а =
— 0,331 нм [X] или а = 0,3314 нм при температуре 18 °C [Ш]. При
понижении температуры решетка ОЦК переходит в тетрагональную
с параметрами а = 0,3288 нм; с = 0,3313 нм при температуре —180 °C
[Ш].
Фаза Mn2Hg5 образуется по перитектической реакции Ж +
+ MnHg Mn2Hg5 при температуре -75 °C [X]. Она имеет тетраго-
нальную структуру, аналогичную структуре Pd(NH3)4Cl2- Н2О и
Pt(NH3)Cl2- Н2О [X], уточненные параметры решетки которой а =
- 0,9758 нм, с = 0,2998 нм [Э]. В работе [1] предполагается образо-
вание в системе фазы MnHg4.
Растворимость Мп в жидкой Hg, определенная химическим анали-
зом фильтрованных равновесных расплавов, составляет:
Температура, °C .....................
Растворимость Мп:
% (ат.)..............................
% (по массе) ........................
100 200 300 400 500
0,1 0,35 1,4 3,6 6,29
0,03 0,1 0,4 1 2 [2].
Электрохимическим методом при температуре 15 °C определена
растворимость Мп в Hg, равная 4,6• 10“3 моль Мп на 1 л Hg [Ш];
растворимость Мп в Hg при комнатной температуре, измеренная
калориметрическим методом, равна 1,7- 10“3 % (по массе) [X].
Литература
1. Гавзе М.Н. Взаимодействие ртути с металлами и сплавами. М.: Наука, 1966.
158 с
. 2. Jangg G„ Palman Н. // Z. Metallkunde. 1963. Bd. 54. N 6. S. 364-369.
В. П. Полякова
Hg-Мо. РТУТЬ—МОЛИБДЕН
Диаграмма состояния Hg—Mo не построена. Растворимость Мо в
Hg при комнатной температуре определена равной 2- 10-5 % IX].
В работе [1] установлен предел растворимости Мо, не превышающий
0,001 г на 1 л Hg при 350 °C.
936
Hg—N, Hg—Na
Литература
1. Strachan J.H., Harris N.L. // J. Inst. Met. 1956-57. V. 85. P. 17-24.
К.Б. Иовирояц
Hg—N. РТУТЬ-АЗОТ
Диаграмма состояния Hg—N не построена. В работах [Э, ILIj
указывается на существование в системе соединений: HgN3, Hg3N,
Hg(N3)2. Соединение Hg(N3)2 имеет ромбическую решетку.
Л.Л. Рохлиц
Hg—Na. РТУТЬ—НАТРИЙ
Диаграмма состояния Hg—Na (рис. 504) построена на основании
данных термического и калориметрического анализов [X, 1].
В системе Hg—Na образуется семь соединений, из которых NaHg2
плавится конгруэнтно при 353 °C. Соединения NaHg4, Na7HgK,
Hg—Na 937
hlaHg, Na3Hg2, Na5Hg2, Na3Hg образуются по перитектическим
« реакциям при температурах 157, 223, -215, 121, 66 и 34 °C соответ-
^твенно. При температуре 180 °C фаза Na7Hg8 претерпевает поли-
Ж морфное превращение. Кристаллическая структура промежуточных
и фаз приведена в табл. 395.
^Таблица 3 9 5. Кристаллическая структура соединений системы Hg—Na
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а ь с
NaHg,*1 — — 0,615 — 0,970
NaHg2 А1В2 АРЗ, Р6/ттт 0,5029 — 0,3230
NaHg*2 NaHg оС 16, Стет 0,719 1,079 0,521
Na3Hg2‘3 Na3Hg2 tP20, P4-J тт 0,852 —‘ 0,780
Na5Hg2*4 — — 1,852 — —
Na5Hg:" 0,939 — 0,531
* 'Гексагональная сингония. *2Ромбическая сингония. ^Тетрагональная сингония. *4Ромбодрическая сингония, а = 29,38 Ь
В системе наблюдаются два нонвариантных эвтектических превра-
щения:
Ж * (Hg) + NaHg4 при —47,4 °C и 0,025 % (ат.) Na;
Ж * Na3Hg + (Na) при 21,4 °C и 85,2 % (ат.) Na.
Растворимость Na в Hg составляет 0,6 % (ат.) при —40 °C [2] и
5,4 % (ат.) при 25 °C [X]; в твердом Na при 23 °C растворяется
0,045 % (ат.) Hg [3].
Литература
1. Baley J., Biros L. // Collect. Czech. Comraun. 1978. V. 43. N 11. P. 2834—2838.
2. Александров Б.Н., Ломонос О.И. // Журнал физической химии. 1971. Т. 45.
№ 12. С. 3003-3006.
3. Александров Б.Н., Далакова Н.В. // Изв. АН ССР. Металлы. 1982. № 1.
С. 133-140.
Л.Л. Зусман
938
Hg—Nd
Hg—Nd. РТУТЬ—НЕОДИМ
Диаграмма состояния Hg—Nd (рис. 505) построена на основании
результатов дифференциального термического и рентгеноструктурно-
го анализов [1].
Рис. 505. Hg—Nd
В системе Hg—Nd установлено существование четырех промежу-
точных фаз, образующихся по реакциям:
NdHg « Газ + (Nd) при 665 °C; NdHg2 Газ + NdHg при 550 °C;
NdHg3 ~ Газ + NdHg2 при 410 °C; NdHg4 - Ж + NdHg3 при 265 °C.
, Hg—Ni
939
Кристаллическая структура промежуточных фаз системы Nd—Hg
приведена в табл. 396 [V-C, 2].
* растворимость Nd в жидкой Hg составляет 0,1 % (ат.) при 150 и
Z1 % (ат.) при 450 °C. Растворимость Hg в Nd нс обнаружена.
Таблица 39 6. Кристаллическая структура соединений системы Hg—Nd
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а С
NdHg4‘ — — 1,0867 —
NdHHg45 SmnCd45 CF448, 2,1716 —
F43w
NdHg3 Mg3Cd hP.., Р6Л/ ттс 0,6695 0,4929
NdHg2 A1B2 hP3, Р6/ттт 0,4899 0,3530
NdHg2 CeCd2 hP.., 0,4904 0,3520
P3ml
NdHg CsCl сР2, РтЗт 0,3780 —
Кубическая сингония.
Литература
1. Kirchmayr H.R., Lugscheider W. 11 7.. Metallkunde. 1966. Bd. 57. N 10.
S. 725-728.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Hg—Ni. РТУТЬ—НИКЕЛЬ
Диаграмма состояния Hg—Ni не построена. В системе Hg—Ni, по-
видимому, существует одно соединение NiHg4, образующееся по
перитектической реакции при температуре 280 [Э] или 225 °C [Ш,
1]. Оно имеет область гомогенности 20—25 % (ат.) Ni. Фаза NiHg4
обладает структурой изотипной PtHg4 (10 атомов в элементарной
ячейке), а = 0,6016 нм [X].
Растворимость Ni в жидкой Hg, определенная химическим анали-
зом фильтрованных насыщенных амальгам, составляет:
Температура, "С ......................
Растворимость Ni:
!0~' % (ат.) .....................
10~3 % (по массе) ................
550 500 450 400 350 300
29 22 19 15 7,5 7,5
8,5 7,1 5,6 4,3 2,3 2,3
940
Hg-0
Температура, °C 250 225 200 150 100 50
Растворимость Ni:
ИГ3 % (ат.) 4,5 2,1 1,7 0,85 0,37 0 !2
10 3 % (по массе) 1,3 0,62 0,50 0,25 0,11 0.036
На рис. 506 представлена часть линии ликвидуса системы Hg—\j
Перелом на кривой соответствует перитектической реакции с участи-
ем NiHg4.
Рис. 506. Hg—Ni
Литература
1. Гавзе М.Н. Взаимодействие ртути с металлами и сплавами. М.: Наука. 196о
158 с.
В.П. Поляков.
Hg-O. РТУТЬ—КИСЛОРОД
Диаграмма состояния Hg—О не построена. В аналитических обзо
рах [Э, Ш] приводятся сведения об образовании двух оксидов HgO
и HgO2- Оба оксида являются полиморфными: HgO имеет две моди-
фикации: гексагональную (а - 0,3577—0,3571; с = 0,8681—0,8667 нм>
и ромбическую, пр. гр. Рпта (а = 0,66120 нм; b = 0,55208; с =
= 0,35219 нм [Э] или а = 0,6612; b = 0,5520; с = 0,3521 нм, или а =
= 0,6592; b = 0,5504 нм; с = 0,3513 нм [Ш]).
Hg-Pb 941
Ж Соединение aHgO2 имеет кубическую решетку с а = 0,4736 нм;
IflHgO? ~ ромбическую (псевдотетрагональную) решетку, с парамет-
рами а = 0,6080 нм; b = 0,6010 нм; с = 0,4800 нм [Э].
р Л-Л. Рохлин
Hg-Pb. РТУТЬ—СВИНЕЦ
Диаграмма состояния Hg—РЬ (рис. 507) построена по данным
дифференциального термического, микроструктурного и рентгенов-
ского анализов [X, 1].
Рис. 507. Hg-Pb
Растворимость РЬ в жидкой Hg составляет -0,9 % (ат.) при 0 “С
и 1,26 % (ат.) при 15—18 °C и возрастает при дальнейшем повыше-
нии температуры [1]. Согласно измерениям электрохимического
потенциала амальгам растворимость РЬ при температуре 15 °C
составляет 1,3 % (ат.) [Ш]. Растворимость Hg в твердом (РЬ) доста-
942
Hg—Pd
точно велика, при температурах 93—95 °C она составляет ~24 °/,
(ат.). Предельная растворимость Hg в (РЬ), определенная методом
измерения температур перехода в сверхпроводящее состояние, равна
35-40 % (ат.) [1].
Точка замерзания Hg при содержании 0,015 % (ат.) РЬ снижается
лишь на 0,02° и при дальнейшем увеличении концентрации РЬ
повышается, что позволяет предполагать перитектическое равновесие
с участием соединения HgPb2 при температуре —37,6 °C.
Фаза HgPb2 имеет тетрагональную структуру с параметрами а •-
= 0,49615 нм; с = 0,44937 нм при концентрации 66,13 % (ат.) РЬ.
Литература
1. Гавзе М.Н. Взаимодействие ртути с металлами и сплавами. М.: Наука, 1966
158 с.
Р.П. Полякова
Hg—Pd. РТУТЬ—ПАЛЛАДИЙ
Диаграмма состояния Hg—Pd (рис. 508) построена в работе [1] по
данным термического и рентгеновского анализов, измерения давления
паров Hg [2]. Установлено, что в системе образуются три промежу-
точные фазы PdHg4, Pd2Hg5 и PdHg, из которых PdHg4 и Pd2Hgs
Рис. 508. Hg—Pd
Hg—Po, Hg—Pr
943
образуются по перитектическим реакциям при температурах 90 и
(238 °C соответственно. Температура и характер образования PdHg не
установлены. Кристаллическая структура промежуточных фаз PdHg
/и Pd2Hg5 приведена в табл. 397.
Таблица 39 7. Кристаллическая структура соединений системы Hg—Pd [2J
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а С
PdHg AuCu tP2, Р4/ттт 0,4285 0,3692
Pd2Hg5 Mn2Hg5 tP14, P4/mbm 0,9463 0,3031
ниже [21: 90 100
25 50
0,51 0,54 0,89 1,1
200 238 250 300
7,1 17 19 37
N 1. Р. 22-26.
150
3,1
Предполагается, что кристаллическая структура соединения
PdHg4 производная от структуры у-латуни [21.
Растворимость Hg в твердом Pd составляет -13,8 % (ат.). Раство-
римость Pd в жидкой Hg приведена
Температура, °C ......................
Растворимость Pd, 10~2 % (ат.) .......
Температура, °C ......................
Растворимость Pd, 10-2 % (ат.) .......
Литература
1. Guminski С. // Bull. Alloy Phase Diagrams. 1990. V. 11.
2. Jangg G„ Groll W. 11 Z. Metallkunde. 1965. Bd. 56. N 4. S. 232-234.
В.П. Полякова
Hg—Po. РТУТЬ-ПОЛОНИЙ
Диаграмма состояния Hg—Po не построена. Получено соединение
HgPo, которое имеет кристаллическую решетку типа NaCl (символ
Пирсона с/8, пр. гр. Fm3m, а = 0,6250 нм) [1].
Литература
1. Witteman W.G., Giorgi A.L., Vier D.T. 11 J. Phys. Chem. 1960 V. 64 N 4
P. 434-440.
Л.Л. Рохлин
Hg—Pr. РТУТЬ—ПРАЗЕОДИМ
Диаграмма состояния Hg—Pr (рис. 509) построена на основании
данных дифференциального термического, микроскопического и
рентгеноструктурного анализов при концентрациях Hg от 0 до 20 %
(ат.) [1, 2]. При исследовании использовали Hg чистотой 99,9 % и
Рг чистотой 99,0 % (по массе).
944
Hg-Pr
Рис. 509. Hg—Рг
Кристаллическая структура промежуточных фаз приведена а
табл. 398 [4].
Таблица 398. Кристаллическая структура соединений системы Hg—Рг
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм j
a c j
Pr„Hg45 SlTl^C^ cF448, F43m 2,1786 - 1 i
PrHg4‘ — — 1,0895 I - I
PrHg3 Mg3Cd hP, Pf^/mmc 0,6724 0,4937- ; 1 I
PrHg2 Л1В2 hP3, Pbtmmm 0,4918 0,3539 i I
PrHg Кубическая CsCl сингония. cP2, РтЗт 0,3799 — i l' __J
'WW1’
_______________________________ffg-Pt___________________ 945
По данным работы [1] в системе Hg—Рг со стороны Рг существует
эвтектическое равновесие Ж * (РРг) 4- PrHg при температуре 624 °C
и концентрации 20,3 % (ат.) Hg. При температуре 519 °C наблюда-
ется эвтектоидный распад ({ЗРг> * (аРг) 4- PrHg. Согласно работе [3]
промежуточные фазы при давлении 0,1 МПа разлагаются по реакци-
ям: PrHg « Газ 4- (Рг) при 570 °C; PtHg2 ₽ Газ 4- PrHg при 515 °C;
PrHg3 * Газ 4- PrHg2 при 440 °C; PrHg4 * PrHg3 4- Ж при 270 °C.
Растворимость Рг в Hg практически отсутствует [1]. Предельное
содержание Hg в твердом растворе на основе рРг составляет 14,6 %
(ат.), содержание Hg в (аРг) — 0,9 % (ат.) [2].
Литература
1. Griffin R.B., Gschneidner, Jr., К.А. // Met. Trans. 1971. V. 2. N 9. P. 2517—2524.
2. Gschneidner, Jr., K.A., Griffin R.B. // Met. Trans. 1971. V. 2. N 9. P. 2525—2531.
3. Kirchmayr H.R., Lugscheider W. // Z. Metallkunde. 1966. Bd. 57. N 10.
S. 725-728.
4. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов. Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Hg—Pt. РТУТЬ—ПЛАТИНА
Диаграмма состояния Hg—Pt (рис. 510) построена в работе [1] на
основании результатов дифференциального термического и рентгено-
структурного анализов, проведенных в работе [2].
В системе установлено существование трех промежуточных фаз:
PtHg4, PtHg2 и PtHg, образующихся с участием газовой фазы по
реакциям типа перитектических: PtHg * Газ 4- (Pt) при температуре
471 °C; PtHg2 ** Газ 4- PtHg при 436 °C; PtHg4 * Газ 4- PtHg2 при
424 °C. Фаза PtHg при температуре -250 °C распадается на (Pt) и
PtHg2 [1]. Кристаллическая структура соединений системы Hg—Pt
приведена в табл. 399.
Таблица 399. Кристаллическая структура соединений системы Hg—Pt
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а С
PtHg AuCu tP2, РА/ттт 0,4201 0,3825
PtHg2 PtHg2 tP3, Р4/ттт 0,4687 0,2913
PtHg4 PtHg4 Cl 10, /432 0,6186 —
946
Hg—Pu
Рис. 5JO. Hg-Pt
По данным рентгеновского анализа [X], растворимость (Hg) в
твердой (Pt) составляет 18,5 % (ат.). Растворимость Pt в жидкой Hg
увеличивается от 3,05—3,54- 10—’’ % (по массе) при температуре
101 °C до 8,80- 10-4 % при температуре 320 °C [1].
Литература
1. Guminski С. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 1. P. 26—32.
2. Jangg G., DOrtbudak T. // Z. Metallkunde. 1973. Bd. 64. N 10. S. 715-719
В.П. Dawi'
Hg—Pu. РТУТЬ—ПЛУТОНИЙ
Диаграмма состояния Hg—Pu (рис. 511) построена в интервал
концентраций 0—30 % (ат.) Pu [Э]. Эвтектическая реакция при
температуре, близкой к —39 °C, Ж * (Hg) + PuHg4 свидетельствует
о малой растворимости Pu в Hg, не превышающей 0,5 % (ат.), и
практически о полном отсутствии ее в твердом состоянии.
Растворимость Pu в жидкой Hg приведена ниже [Э]:
Температура, °C .......... 21 50 100 200 300 3-:
Растворимость Pu, % (ат.). 0,0131 0,0255 0,0625 0,190 0,496 0.501
Рис. 511. Hg—Pu
На основе рентгенографических исследований в системе Hg—Pu
установлено образование соединений PuHg4 и PuHg3 и предполагает-
ся существование соединения PuHg2. Структура PuHg4 объемно
центрированная псевдокубическая {а = 0,361 нм), структура PuHg3
типа UHg3 1Э].
Г. И. Терехов
Hg—Rb. РТУТЬ—РУБИДИЙ
Диаграмма состояния Hg—Rb (рис. 518) построена на основании
данных, приведенных в обзоре [X]. В системе образуются восемь
промежуточных фаз, из которых RbHg2 и Rb2Hg7 плавятся конгруэн-
тно при температурах 257 и 197 °C соответственно. Существование
соединения Rb5HgJ8 (21,74 % (ат.) Rb) является сомнительным, оно
нанесено на диаграмму в соответствии с результатами термичес-
кого анализа: на кривой охлаждения сплава с 22 % (ат.) Rb имелось
два пика: первый при температуре 197 °C, связанный с образова-
нием соединения Rb2Hg7, второй — при температуре 193 °C, связан-
ный с образованием соединения Rb5Hg18 по перитектической
реакции.
948
Hg—Re
О
2,15
0,92
19,5 25 26,4
2,80 3,15 3,31
1,21 1,37 1,43
Растворимость Rb в Hg приведена ниже:
Температура,°C................................
Растворимость Rb:
% (ат.) ..................................
% (по массе)..............................
Соединение RbHgn имеет структуру типа BaHgn, символ Пирсо-
на сРЗб, пр. гр. РтЗт, а = 0,9734 нм [1].
Литература
1. Duwell E.J., Baenziger N.C. // Acta Crystallogr. 1955. V. 8. N 11. P. 705—710
Л.Л. Рохли»
Hg—Re. РТУТЬ-РЕНИЙ
Диаграмма состояния Hg—Re не построена. В работе [1] сообщает-
ся об образовании амальгамы Re при электролизе водного раствора
перрената К с ртутным катодом. При нагреве до 300 °C в восстанови-
тельной атмосфере порошок Re нс взаимодействует с Hg [2].
Hg—Rh.
949
Литература
1. Hdlemann H. // Z. Anorg. All. Chem. 1931. Bd. 202. S. 277-291.
2. Heyne G., Moers K. // Z. Anorg. All. Chem. 1931. Bd. 196. S. 157-158.
M.A. Тылкина
Hg—Rh. РТУТЬ-РОДИЙ
Диаграмма состояния Hg—Rh (рис. 513) построена на основании
данных рентгеновского анализа и измерения давления паров Hg в
интервале температур 0—500 °C [1J. При исследовании использовали
Rh чистотой 99,9 % (по массе) и дистиллированную Hg.
Рис. 513. Hg—Rh
В системе обнаружены три промежуточные фазы, обладающие
узкой областью гомогенности. Фаза RhHg5 образуется с участием
газовой фазы по типу перитектической реакции при 560 °C, кристал-
лическая структура не расшифрована. Фазы Rhg4 63 и RhHg2 образу-
ются по перитектоидным реакциям при температурах 416 и 320 °C
соответственно. Кристаллическая структура RhHg2 аналогична
структуре PtHg2 (символ Пирсона tP3, пр.гр. р\!ттт^ а =
= 0,4551 нм; с = 0,299 нм).
Растворимость Hg в Rh незначительна. Растворимость Rh в Hg не
превышает 6- 10“5 % (по массе) при температуре 500 °C [2].
950
Hg—Ru, Hg—S
Литература
1. Jangg G., Kirchmayr H.R., Mathis H.B. // Z, Metallkunde. 1967. Bd. 58. N h;
S. 724-726.
2. Jangg G., Dortbudak T. // Z. Metallkunde. 1973. Bd. 64. N 10. S. 715—719.
В.П. Поляков/(
Hg—Ru. ртуть—Рутений
Диаграмма состояния Hg—Ru не построена. Известно, что соедине-
ния не были получены методом прямого растворения Ru в большом
количестве Hg при нагреве. Растворимость Ru в Hg составляет меню
10—5 (по массе), при температуре 500 °C [1].
Литература
1. Jangg G., Dortbudak Т. // Z. Metallkunde. 1973. Bd. 64. N 10. S. 715-719
В.П. Поляком
Hg-S. РТУТЬ—СЕРА
5, % (по массе)
Рис. 514. Hg-S
Hg—Sb________________ 95!
Диаграмма состояния Hg—S (рис. 514) построена на основании
результатов дифференциального термического и рентгеновского
анализов и определения термодинамических характеристик [1].
При исследовании использовали Hg и S чистотой 99,999 %
(по массе).
В системе Hg—S образуются две области несмешиваемости в
жидком состоянии, границы которых не установлены. Со стороны Hg
и S существуют вырожденные эвтектики. Растворимость Hg в жидкой
S составляет 0,4 % (ат.) при температуре 485 °C и 0,5 % (ат.) при
*520 °C [1]. Соединение HgS плавится конгруэнтно и претерпевает
два полиморфных превращения. Высокотемпературная модификация
HgS (гиперцинабарит) имеет гексагональную структуру (а =
= 0,701 нм; с = 1,413 нм) [1]. Модификация HgS, существующая в
интервале температур 481—315 °C (метацинабарит) обладает структу-
рой типа ZnS (сфалерит), символ Пирсона сГ8, пр. гр. F43w, а =
= 0,586 нм [X]. Низкотемпературная модификация HgS (киноварь)
имеет структуру собственного типа, символ Пирсона ЛР6, пр. гр.
Р3221, а = 0,416 нм, с = 0,953 нм [X], а = 0,4145 нм, с - 0,9496 нм
[2]; а = 0,41479—0,41624 нм, с - 0,9460 нм [1]. При повышении
давления до 21 ГПа структура киновари переходит в структуру типа
NaCl [3].
Литература
1. Potter П R.W., Barner H.L. // American Mineralogist. 1978. V. 63. N 10
P. 1143-1152.
2. Auvray P„ Genet F. // Bull. Soc. Fran. Miner. Crist. 1973. V. 96. N 2. P. 218-219.
3. Huang T.-L., Ruoff A.L. // Phys. Rev. B. Condens Matter. 1965. V. 31. N 9.
P. 5976-5983.
10.fi. Кузьма
Hg-Sb. РТУТЬ—СУРЬМА
Диаграмма состояния Hg—Sb (рис. 515) построена по данным
аналитического обзора 11], в основу которого положены результаты
работ [2, 3]. Система характеризуется полной нерастворимостью
компонентов в твердом состоянии. Растворимость Sb в Hg, по данным
полярографического и потенциометрического анализов, составляет
3,55- 10“4 % (ат.) [4|. Промежуточная фаза Hg3Sb2 получена
химическим методом [5]. Предполагается, что Hg3Sb2 метастабиль-
ное соединение [1J.
952
Hg—Sc
Sb,°/a (am.)
Рис. 515. Hg-Sb
Литература
1. Guminski C. // Bull. Alloy Phase Diagrams. 1990. V. 11. N 4. P. 317—320.
2. Jangg G., Lihl F., Legler E. // Z. Metallkunde. 1962. V. 53. S. 313-316.
3. Jangg G., Palman H. // Z. Metallkunde. 1963. V. 54. S. 364—369.
4. Sebreva A.I., Kozlovskii M.T. // Collect. Czech. Chem. Commun. 1960. V. 25
P. 3188-3194.
5. Угай Я.А., Гордин В.Л. // Журнал неорганической химии. 1962. Т. 7. № 3
С. 703-705.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Hg—Sc. РТУТЬ—СКАНДИЙ
Диаграмма состояния Hg—Sc не построена. Имеются сведения о
существовании в системе двух соединений ScHg3 и ScHg, структура
которых приведена в табл. 400 [1].
Таблица 4 0 0. Кристаллическая структура соединений системы Hg—Sc
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а С
ScHg3 Mg3Cd hP, Р63/ттс 0,6368 0,4761
ScHg CsCl сР2, РтЗт 0,348 —
Hg-Se
953
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, Б.К. Печарский
Hg-Se. РТУТЬ—СЕЛЕН
Диаграмма состояния Hg—Se (рис. 516) построена в интервале
концентраций 50—100 % Se на основании результатов дифференци-
ального термического, микроструктурного и рентгеновского анализов
[1, 2]. В работах [1,2] были использованы исходные материалы Hg
и Se высокой чистоты. В исследованном интервале концентраций
Рис. 516. Нд-Se
! обнаружено соединение HgSe, которое образует с Se при температуре
; 220 °C вырожденную эвтектику. При температуре 686 °C в системе
Наблюдается монотектическая реакция. Область расслаивания Ж, +
+ Ж2 при монотектической температуре расположена между -71 и
954
Hg—Si, Hg—Sm
85 % (ат.) Se. Границы монотектического купола не определены.
При температуре 650 °C в HgSe растворяется 1,11 % (ат.) Hg и
0,75 % (ат.) Se.
Соединение HgSe обладает кристаллической структурой типа ZnS
(сфалерита), символ Пирсона cF8, пр. гр. /’43m, а - 0,608 или
0,6074 нм [Э], а = 0,6082 - 0,6078 нм [1].
При давлениях 725—750 МПа получена модификация HgSe со
структурой типа HgS (киноварь), символ Пирсона ЛР6, пр. гр. /*3,21.
а = 0,432, с = 0,962 нм или а = 0,446, с = 0,917 нм [III].
Литература
1. Boctor N.Z., Kullerud G. И Solid State Chem. 1986. V. 62. N 2. P. 177-183.
2. Strauss A.J., Farrell L.B. 11 J. Inorg. Chem. 1962. V. 24. P. 1211-1213.
Ю.Б. Кузьма
Hg—Si. РТУТЬ—КРЕМНИЙ
Диаграмма состояния Hg—Si не построена. Взаимодействие Hg и
Si не обнаружено при температурах вплоть до точки кипения Hg [Х|
М.И. Бычкова-
Hg—Sm. РТУТЬ—САМАРИЙ
Диаграмма состояния Hg—Sm (рис. 517) построена на основании
данных дифференциального термического и рентгеноструктурного
анализа [1]. При исследовании использовали Hg чистотой 99,9 % и
Sm чистотой 99,0 % (по массе).
В системе образуются четыре химических соединения: SmHg4,
SmHg3, SmHg2 и SmHg, из которых только SmHg4 образуется по
перитектической реакции Ж + SmHg3 « SmHg4 при температуре
195 °C. Все последующие соединения образуются в результате взаи-
модействия газообразной Hg с SmHg2, SmHg и Sm при температурах
400, 530 и 630 °C соответственно.
Таблица 401. Кристаллическая структура соединений системы Hg—Sm
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а С
SmuIIg45 Sm||Cd45 с/'448, F43m 2,1651 —
SmIIg4 — С.. 1,0820 —
Smllg3 Mg3Cd hP.„ Pf^/mmc 0,6632 0,4909
Smllg2 Л1В2 hP3, Pf>/ттт 0,4853 0,3520
SmHg CsCl cP2, РтЗт 0,3744 —
Hg—Sm
955
Растворимость Sm в жидкой Hg составляет 0,1 % (ат.) при темпе-
ратуре 150 °C и -1 % (ат.) при температуре 450 °C; растворимость
Hg в Sm не обнаружена. Кристаллическая структура известных
промежуточных фаз по данным работ [2, V-С] приведена в табл. 401.
Литература
1. Kirchmayr H.R., Lugscheider W. // Z. Metallkunde. 1966. Bd. 57. N 10.
S. 725-728.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов. Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
956
Hg—Sn
Hg—Sn. РТУТЬ-ОЛОВО
Диаграмма состояния Hg—Sn (рис. 518) построена на основа-
нии обобщения данных дифференциального термического, мик-
роструктурного и рентгеновского анализов, приведенных в рабо
тах [X, Э, 1—5].
$п,°/°(па массе)
Рис. 518. Hg—Sn
В системе Hg—Sn установлено, что Hg почти не растворяется в
сером Sn(aSn) и менее 2 % Hg растворяется в белом Sn(PSn) [XI.
Область твердого раствора на основе Hg не более 1 % (ат.) [5]. По
данным работы [3], в области температур от —35,4 до 300 °C отмеча-
Hg-Sr
951
ется повышение растворимости Sn в жидкой Hg по сравнению с ранее
приведенными результатами.
В системе наблюдается существование четырех промежуточных
фаз: Р, y(HgSn12), 6 и HgSn4 [3—5], а не HgSn3, как указывалось
ранее в работах [X, Э]. Соединения 0, у и <5 образуются по перитек-
тическим реакциям при температурах 224, 214 и 95 °C соответствен-
но [X, 3—5] (см. рис. 524, вставка I). Фаза Р имеет переменный
состав с минимальным содержанием 96,5 % (ат.) Sn, существует в
узком интервале температур и эвтектоидно распадается при 198 °C
[X] или 197 °C [1]. Область гомогенности фазы у отвечает
88—94,5 % (ат.) Sn [X, 2] или 90—95 % (ат.) Sn [5]. Предполагает-
ся, что фаза у распадается при температуре —8,15 °C (или —7,5 °C
[Э]) и концентрации 92,6 % (ат.) Sn на 6 + (aSn) [4] (см. рис. 524,
вставка II). Область гомогенности фазы 6 отвечает концентрации
85—87 % (ат.) Sn [5]. Соединение HgSn4 образуется по перитекти-
ческой реакции Ж + 6 = HgSn4 при температуре —34,5 °C [5]. Фаза
Р имеет гексагональную решетку с параметрами а = 0,32415 нм; с =
= 0,30065 нм при содержании 96,5 % (ат.) Sn [X]. Решетка фазы у —
гексагональная с параметрами а = 0,3214 нм и с - 0,2995 нм при
концентрации 82,81 % (ат.) Sn [X] или а = 0,3204 нм и с =
= 0,2995 нм при концентрации 88 % (ат.) Sn и а = 0,3214 нм и с =
- 0,2995 нм при концентрации 94 % (ат.) Sn [1].
Литература
1. Taelor D.E., Burns C.L. // J. Res. Natl. Bur. Standards A. 1963. V. 67. N 1.
P. 55-70.
2. Гавзе M.H. Взаимодействие ртути с металлами и сплавами. М.: Наука, 1966.
158 с.
3. Petot E.G., Caillet М., Desre Р. // Comp. Rend. Acad. Sci., Paris, Ser. C. 1967.
V. 264. N 6. P. 490-493.
4. Ян-Шо-Сян Г.В., Семибратова H.M., Носек M.B. / / Труды института химичес-
ких наук. 1969. Т. 24. С. 120-127.
5. Smith R.W. // Canad. Metall. Quart. 1969. V. 8. N 2. P. 127-129.
В.II. Полякова
Hg-Sr. РТУТЬ-СТРОНЦИЙ
Диаграмма состояния Hg—Sr (рис. 519) построена на основании
данных дифференциального термического, металлографического и
рентгеновского анализов [1—2]. При исследовании использовали Hg
чистотой 99,99 % и Sr чистотой 99,8 % (по массе). Сплавы выплав-
ляли в запаянных железных тиглях.
В системе Hg—Sr существует десять соединений, из которых SrHg2
и SrHg образуются из расплава конгруэнтно при 772 и 850 °C соот-
958
Hg—Sr
Рис. 519. Hg—Sr
ветственно. Соединения SrHg13, SrHgj], Sr13Hg58, Sr14Hg51, SrHg3,
Sr3Hg2, Sr2Hg и Sr3Hg образуются по перитектическим реакциям при
температурах 62, 289, 427, 481, 512, 545, 478 и 458 °C соответствен
но. В системе наблюдаются три эвтектики: вырожденная эвтектика
(Hg) + SrHg13 при —39 °C; SrHg2 + SrHg при 40,5 % (ат.) Sr и
694 °C; Sr3Hg + aSr при 82 % (ат.) Sr и 442 °C. Кристалли
ческая структура известных промежуточных фаз приведена в
табл. 402.
Hg-Та, Hg-Tb
959
Таблица 40 2. Кристаллическая структура соединений системы Hg—Sr (1,2]
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b с
SrHg„ BaHg|l сРЗб, РтЗт 0,9510 — —
Srl3Hg58 Pul3Zn5g КР.., Р63/ттс 1,594 — 1,579
Srl4Hg51 Gd14Ag51 hP.., Рб/т 1,378 — 0,9880
SrHg3 SnNi3 ЬР8, Рб3/ттс 0,6906 — 0,5106
SrHg2 CeCu2 01.., Imma 0,4985 0,7754 0,8550
SrHg CsCl сР2, РтЗт 0,3955 — —
Sr3Hg2 U3Si2 tPIO, P4/mbm 0,8877 — 0,4556
Sr3Hg Fe3C оР16, Рпта 0,8523 1,108 0,7405
Литература
1. Bruzzone G., Merlo F. // J. Less-Common Met. 1974. V 35. N 1. P. 153-157.
2. Bruzzone G., Merlo F. // J. Less-Common Met. 1982. V. 85. N 2. P. 285—306.
Л.Л. Зусман
Hg—Та. РТУТЬ—ТАНТАЛ
Диаграмма состояния Hg—Та не построена. Попытки амальгиро-
вать Та оказались безуспешными. Никакого взаимодействия Hg и Та
не было обнаружено даже при высоких температурах [X].
М.И. Бычкова
Hg—ТЬ. РТУТЬ-ТЕРБИЙ
Диаграмма состояния Hg—ТЬ (рис. 520) построена на основании
Данных дифференциального термического и рентгеновского анализа
[1]. При исследовании использовали Hg чистотой 99,9 % (по массе)
и ТЬ чистотой 99,0 % (по массе).
В системе существуют четыре промежуточные фазы. Соединение
TbHg4 образуется по перитектической реакции Ж + TbHg, * TbHg4
при температуре -150 °C. Соединения TbHg3, TbHg2, TbHg образу-
ются в результате взаимодействия газообразной Hg с соединениями
TbHg2, TbHg и (аТЬ) соответственно. Кристаллическая структура
960
Hg-Tb
Hg Tb,%(am.) Tb
Рис. 520. Hg-Tb
известных промежуточных фаз системы Hg—Tb приведена в табл. 403
[V-C, 2J.
Растворимость ТЬ в жидкой Hg составляет 0,1 % (ат.) при темпе-
ратуре 150 °C и -1 % (ат.) при температуре 450 °C. Растворимость
Hg в ТЬ не обнаружена.
Таблица 4 0 3. Кристаллическая структура соединений системы
Hg-Tb [V-C, 2]
Соединение Прототип ' Символ Пирсона, пр. гр. Параметры решетки, нм
а С
TbHg3 MgjCd hP.., Р63/ттс 0,6565 0,4887
TbHg2 aib2 НРЗ, Р6/ ттт 0,4833 0,3487
TbHg2 CeCd2 hP.., P3ml 0,4833 0,3487
rbHg CsCl сР2, РтЗт 0,3678 —
Hg-Th
961
Литература
1. Kirchmayr H.R., Lugscheider W. // Z. Metallkunde. 1968. Bd. 59. N 4.
S. 296-297.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Hg-Th. РТУТЬ-ТОРИЙ
Диаграмма состояния Hg—Th (рис. 521) построена на основании
данных дифференциального термического, рентгеновского и резисто-
метрического анализов [ 1 ].
Рис. 521. Hg-Th
В системе установлено наличие двух соединений ThHg3 и ThHg,
характер образования которых не определен. Соединение ThHg
распадается по эвектоидной реакции при -400—600 °C, имеет гране-
центрированную кубическую решетку с параметром а = 0,480 нм.
Решетка соединения ThHg3 — гексагональная с параметрами а =
= 0,3361, с = 0,4905 нм. При температуре —32 °C в системе Hg—Th
существует нонвариантная реакция, очевидно, перитектического типа
Ж + ThHg3 11 (Hg). Растворимость Hg в Th практически отсутствует.
31 Зак. 2144
962
Hg-Ti
Растворимость Th в жидкой Hg, определенная химическим анализом
фильтрованных насыщенных амальгам, приведена ниже [2]:
Температура, °C ............. 400 350 300 200 150 100 20
Растворимость Th:
% (ат.).......................0,035 0,03 0,026 0,009 0,008 0,004 0,00 Н
% (по массе).............. 0,04 0,035 0,03 0,01 0,009 0,005 0,001 з
Литература
1 Domagala R.F., Elliott R.P., Rostoker W. // Trans. AIME. 1958. V 2i
P. 393-395.
2 . Jangg G., Palman H. 11 Ъ. Metallkunde. 1963. Bd. 54. S. 364—369.
Г.И. Тереком
Hg-Ti. РТУТЬ—ТИТАН
Диаграмма состояния Hg—Ti (рис. 522) построена в интервале
температур 0—600 °C на основании данных рентгеновского анализ,)
и измерения давления паров Hg над амальгамами [1].
В системе подтверждено существование соединений TiHg и Ti3H<.
При этом отмечено, что существует только одна модификация Ti3Hg,
Возможно, что низкотемпературная модификация Ti3Hg стабилизи
руется кислородом и представляет собой тройное соединение с'
структурой типа Cu3Au. В системе Hg—Ti существует еще одна фаза
с широкой областью гомогенности 52—63 % (ат.) Ti при тсмперат\ рг
300 °C. Эта фаза существует в двух модификациях, температур^
полиморфного перехода 300 °C. Отмечается, что область существен;!
ния высокотемпературной модификации этой фазы шире области
гомогенности низкотемпературной. В богатых Hg сплавах по перитск
тичсской реакции при 128 °C образуется новая фаза, состав которой
не установлен [1]. Кристаллическая структура промежуточных фаз
приведена в табл. 404.
Таблица 4 0 4. Кристаллическая структура соединений системы Hg—Ti
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
TiHg AuCu tP2, Р4/ттт 0,3009 0,4041 [1, 21
Ti3Hg Cu3Si cF.., Fd3m 0,51888 — [1, 2]
Ti3IIgO AuCu3 сР4, РтЗт 0,4166 — Hl
Hg—Tl
963
Рис. 522. Hg-Ti
Растворимость Ti в жидкой Hg, определенная химическим анали
зом фильтрованных насыщенных амальгам, приведена ниже [Ш]:
Температура, °C ..............550
Растворимость Ti:
10-3 % (ат.) ............. 21
10-4 % (по массе) ......... 50
500 400 300 200 100 20
17 8,4 3,4 1,2 0,17 0,017
40 20 8 3 0,4 0,04
Литература
1. Lugscheider Е., Jangg G. // Z. Metallkunde. 1973. V. 64. N 10. Р. 711—715.
2. Гавзе М.Н. Взаимодействие ртути с металлами и сплавами. М.: Наука, 1966.
158 с.
В.П. Полякова
Hg-Tl. РТУТЬ—ТАЛЛИЙ
Диаграмма состояния Hg—Т1 (рис. 523) построена на основании
данных дифференциального термического, рентгеновского анализа и
измерения электродвижущей силы [X, 1].
Растворимость Т1 в жидкой Hg высока и составляет при 0 °C
-18 %, при комнатной температуре -44 %, при 70 °C -50 % (ат.).
В системе Hg—Т1 найдено только одно соединение, соответствующее
31*
964
Hg—Tl
//у TI, % (am.) TI
Рис. 523. Hg—TI
формуле Hg5Tl2 (фаза a, 28,57 % (ат.) TI [X]) и имеющего перемен-
ный состав. При этом максимум на кривых плавления соответствует
28,6—29,1 % (ат.) Т1 при температуре 14,4—15 °C. Однако данные о
кристаллической структуре не позволяют утверждать, что эта фаза
имеет формулу Hg5Tl2. Фаза а обладает неупорядоченной решеткой
типа Си (символ Пирсона cFA, пр. гр. Fml>т), параметр решетки а
составляет 0,4673 нм при 29 % (ат.) Т1.
В твердом растворе на основе aTi растворяется до ~4 % (ат.) Hg.
Область гомогенности (рТ1) ограничена составами -84,6—90,35 %
(ат.) Т1 при комнатной температуре. Для (0Т1) приводятся следую-
щие значения параметра решетки: а = 0,3819 нм при 86 % (ат.) и а =
= 0,3827 нм при 90 % (ат.) Т1 [X].
В системе Hg—Т1 наблюдаются два эвтектических равновесия.
Ж ₽ (Hg) + а при —59 °C и 8,55 % (ат.) TI [X, 1] ;
Ж * a + (рТ1) при 0 или 0,6 °C и 40 % (ат.) TI [X, 1].
По данным работы [2], содержание Т1 в эвтектиках составляет 8,7
и 40,5 % Т1.
Hg-Тт, Hg-U
965
Изучено влияние давления до 5 ГПа на температуру ликвидуса
системы Hg—Tl и построена поверхность ликвидуса диаграммы
р—Т—х данной системы [3].
Литература
1. Ганзе М.Н. Взаимодействие рт\ти с металлами и сплавами. М.: Наука, 1966.
158 с.
2. Clayre Y., Rey J. 11 J. Less-Common Met. 1980. V. 70. N 1. P. 33-38.
3. Clark J.B., Thomas M.E., Richter P.W. // J. Less-Common Met. 1987. V. 132. N 2.
p. 181-194.
В.П. Полякова
Hg—Tm. РТУТЬ-ТУЛИЙ
Диаграмма состояния Hg—Tm не построена. Имеются сведения о
существовании в системе двух металлических соединений: Hg3Tm со
структурой типа Mg3Cd, пр. гр. РЬ^/ттс, а = 0,6491 нм; с =
= 0,4856 нм и HgTm типа CsCl, символ Пирсона сР2, пр. гр. РтЗт,
а = 0,3632 нм [1].
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Hg-U. РТУТЬ-УРАН
Диаграмма состояния при давлении 0,1 МПа Hg—U (рис. 524)
построена на основании результатов дифференциального термическо-
го и рентгеновского анализа fl].
В системе образуется три соединения UHg4, UHg3 и UHg2 при
взаимодействии газообразной Hg с UHg3, UHg2 и UHg при темпера-
турах 375, 406 и 482 °C соответственно. Образование соединения
UHg требует дальнейшего уточнения. Фаза UHg3 при температуре
ниже 70 °C распадается на UHg2 и UHg4. Предполагается, что струк-
тура соединения UHg4 характеризуется псевдокубической решеткой
с параметром а = 0,363 нм [X]. Соединению UHg3 предписывается
структура с гексагональной решеткой (два атома в элементарной
ячейке), а = 0,332—0,333 нм; с = 0,488—0,489 нм; UHg2 имеет струк-
туру типа А1В2, символ Пирсона hP3, пр. гр. РЫ ттт, а =
в 0,498-0,499 нм; с = 0,322-0,323 нм [X].
966
Hg-V
Рис. 524. Hg-U
Литература
l.LeeT.S., Chiotti P., Mason J.T. 11 J. Less-Common Met. 1979. V. 66. N 1
P. 33-40.
Г.И. Терехов
Hg-V. РТУТЬ—ВАНАДИЙ
Диаграмма состояния Hg—V не построена. Имеются данные о
растворимости V в жидкой Hg, которые приведены ниже:
Температура, °C ....................................
Растворимость V:
Ю^5 % (ат.) ....................................
10 5 % (по массе) ..............................
Источник ...........................................
Комнатная 538 638
— 1,6 5,9
5 0,4 1,5
IX] [Ш] [Ш]
По-видимому, значения растворимости V в Hg, приведенные в спра
вочнике [X], значительно завышены.
М.И. Бычкове
Hg-w, Hg-Y 967
Hg—w. РТУТЬ—ВОЛЬФРАМ
Диаграмма состояния Hg—W не построена. Имеются сведения, что
W не взаимодействует с Hg вплоть до температуры ее кипения и с
перегретыми парами Hg вплоть до температуры 1000 °C [X]. По
данным работы [ 1 ], растворимость W в жидкой Hg составляет
1- 10~5% (по массе).
Литература
1. Fleitman А.Н., Romano A.J., Klamut C.J. // Corrosion. 1966. V. 22. N5
P. 137-142.
К.Б. Поварова
Hg-Y. РТУТЬ-ИТТРИЙ
Диаграмма состояния Hg—Y (рис. 525) построена на основании
данных дифференциального термического и рентгеноструктурного
анализа во всем интервале концентраций [1]. Сплавы изготовляли
в танталовых тиглях в атмосфере Аг. В качестве исходных материа-
лов использовали Hg чистотой 99,9 % и Y чистотой 99,0 % (по
массе).
В системе Hg—Y установлено существование четырех промежуточ-
ных фаз YHg4, YHg3, YHg2 и YHg. Соединение YHg4 образуется по
перитектической реакции Ж + YHg3 »* YHg4 при 70 °C; соединения
YHg3, YHg2, YHg образуются в результате взаимодействия газообраз-
ной Hg с YHg2, YHg, Y при температурах 500, 530, 625 °C соответ-
ственно. Кристаллическая структура известных промежуточных фаз
системы Hg—Y приведена в табл. 405 [2, V-C].
Растворимость Y в жидкой Hg составляет 0,1 % (по массе) при
150 °C и -1 % (по массе) при 450 °C. Растворимость Hg в Y не
обнаружена [ 1 ].
Таблица 405. Кристаллическая структура соединений системы Hg—Y
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а С
YHg3 Mg3Cd hP.., Р63/ттс 0,6546 0,4871
YHg2 A1B2 hP3, Р6/ттт 0,4761 0,3529
YHg2 CeCd2 hP5, P3ml 0,4761 0,3529
YHg CsCl сР2, РтЗт 0,3682 —
968
H^Y
Hg Y^/^a/rr.) Y
Рис. 525. Hg—Y
Литература
1. Kirchmayr H.R., Lungscheider W. // Z. Metallkunde. 1966. Bd. 57. N 10-
S. 725-728.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вигца школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Hg—Yb
969
Hg—Yb. РТУТЬ—ИТТЕРБИЙ
Диаграмма состояния Hg—Yb (рис. 526) построена на основании
данных дифференциального термического и рентгеноструктурного
анализа fl]. При исследовании использовали Hg чистотой 99,9 % и
Yb чистотой 99,0 % (по массе).
Нд Yb,°A>(am.) Vb
Рис. 526. Hg—Yb
970
Hg—Zn
В системе установлено существование четырех промежуточных
фаз: YbHg4 (Yb14Hg51), YbHg3, YbHg2 и YbHg. Соединение YbHg.
образуется по перитектической реакции Ж + YbHg3 ** YbHg4 при
310 °C. Соединения YbHg3, YbHg2, YbHg образуются в результате
взаимодействия газообразной Hg с YbHg2, YbHg и (aYb) при темпе-
ратурах 370, 450 и 730 °C соответственно. Кристаллическая структу-
ра соединений приведена в табл. 406 [ 21.
Таблица 40 6. Кристаллическая структура соединений системы Hg—Yb
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а С
Yb14Hg51 Ag51Gdl4 HP.., Pf>/m 1,341 0,961
YbHg3 MgjCd hP... Pf>}/ mmc 0,6596 0,5021
YbIIg2 A1B2 hP3, P& mmm 0,4896 0,3534
YbHg . CsCl cP2, РтЗт 0,3735 —
Литература
1 Kirchmayr H.R., Lugscheider W. // Z. Metallkunde. 1968. Bd. 59. N4
S. 296-297.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Hg—Zn. РТУТЬ-ЦИНК
Диаграмма состояния Hg—Zn (рис. 527) построена на основании
ряда исследований, проведенных методами дифференциального
термического, микро- и рентгеноструктурного анализов, измерения
свойств жидких и твердых сплавов, и приведена по данным работы
[1]. Hg и Zn неограниченно растворимы в жидком состоянии. При
комнатной температуре (-20 “О растворимость Zn в Hg составляет
5,83 % (ат.). Значения растворимости Hg в твердом Zn, определен-
ные различными методами, сильно различаются и составляют по
данным микроскопического анализа 13 % (ат.), измерения ЭДС
0,5—1,5 %, измерения параметра решетки 0,08 % (ат.). Эвтектичес-
кая реакция Ж (Hg) + £ протекает при температуре —41,6 °C и
концентрации 1,7 % (ат.) Zn. Границы промежуточных фаз 0 и у
Hg—Zn
971
Рис. 527. Hg—Zn
определены методом измерения ЭДС сплавов, однако их соответствие
равновесным условиям сомнительно, так как при сравнительно
низких температурах реакций 42,9 и 20 °C вследствие малой скорос-
ти диффузии для достижения равновесия в системе требуются более
длительные выдержки. Кроме приведенных на диаграмме фаз Р и у
в системе Hg—Zn обнаружены соединения Hg2Zn3, HgZn2, HgZn3 или
Hg3Zn8, наличие которых, характер образования, точный состав и
положение в системе требуют дальнейшего уточнения.
Литература
1. Ганзе М.Н. Взаимодействие ртути с металлами и сплавами. М.: Наука, 1966.
158 с.
В.П. Полякова
Ho-in _______973
972 Hg—Zr, Но-In
Hg—Zr. РТУТЬ-ЦИРКОНИЙ
Диаграмма состояния Hg—Zr не построена. Методом измерения
давления пара и рентгеновским анализом амальгам подтверждено
существование в системе трех промежуточных фаз: ZrHg3, ZrHg.
Zr3Hg, которые имеют очень узкие области гомогенности и стабильны
в широком интервале температур [1]. При атмосферном давлении
температуры распада соединений составляют 405 ± 2 °C для ZrHg,
423 ± 2 °C для ZrHg и 560 + 5 °C для Zr3Hg. Zr в Hg незначительно
растворяется при повышенных температурах, Hg практически нерас-
творима в Zr. Кристаллическая структура промежуточных фаз приве
дена в табл. 407.
Таблица 407. Кристаллическая структура соединений системы Hg—Zr
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а с
ZrIIg3 АиСи3 сР4, РтЗт 0,43652 —
ZrHg AuCu tP2, Р4/ттт 0,315 0,417
Zr3Hg Cr3Si сР8, РтЗп 0,55583
Литература
1. Lugscheider Е., Jangg G. // Z. Metallkunde. 1973. Bd. 64. N 10. S. 711—715.
Л.А. Третьяченм
Но-In. ГОЛЬМИЙ-ИНДИЙ
Диаграмма состояния Но—In (рис. 528) построена методами диф
ференциального термического, микроскопического и рентгеновского
анализов [1]. При исследовании использовали Но чистотой 99,9 %,
In чистотой 99,999 % (по массе).
В системе образуется пять промежуточных фаз, из которых Но21п,
Holn, Но31п5 и Holn3 образуются из расплава конгруэнтно при
температурах 1240, 1270, 1100, 1110 °C соответственно. Соединение
Но51п3 образуется по перитектической реакции Ж + Holn ** Но51п3
при 1250 °C. Предполагается, что Но51п3 существует в двух модифи-
кациях.
В системе Но—In существует пять эвтектических равновесий:
Ж * ”рНо” + Но21п при ИЗО °C и 22 % (ат.) In;
Ж * Но21п + Но51п3 при 1230 °C и 37 % (ат.) In;
Рис. 528. Но—In
Ж ** Holn + Но31п5 при 1090 °C и 59 % (ат.) In;
Ж »* Ho3In5 + Но1п3 при 1080 °C и 66 % (ат.) In;
Ж Holn3 + (In) при -150 °C и -100 % In.
Кристаллическая структура промежуточных фаз в системе Но—In
приведена в табл. 408.
974
Ho—Jr
Таблица 40 8. Кристаллическая структура соединений системы Но—In < V-C)
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм ~~
а Ь С
Но21п Ni2In hP6, Р6}/ттс 0,5319 — О,6662~~~
Но51п3 Mn5In5 hP\f>, Pbyt тст 0,8939 — 0,6595
Но51п3 W5Si3 Н32, 14/тст 1,2092 — 0,6010
Holn CsCl сР2, РтЗт 0,3774 — —
Holn* — — 0,96 — 0,84
Ho3In5 Pu3Pd5 оС.., Стет 0,981 0,799 1,026
Holn3 Тетрагонг AuCu3 гльная сингон» сР4, РтЗт «я. 0,45725
В работе [1] отмечают превращение, связанное, по мнению авто
ров [1], с полиморфизмом Но. Однако так как данных о существова-
нии полиморфизма в Но нет [2], то характер обнаруженного превра-
щения требует уточнения. Один из возможных вариантов строени;1
системы в этой области показан на рис. 528 штриховыми линиями.
Литература
1. Yatsenko S.P., Semyannikov A.A., Shakarov Н.О. // J. Less-Common Met. 1983
V. 90. N 1. Р. 95-108.
2. Gschneidner, Jr., К.A., Calderwood F.W. // Handbook on the Physics and Chemi
ztry of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publi
shing Co., 1986. V. 8. P. 1-161.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Но-1г. ГОЛЬМИЙ-ИРИДИЙ
Диаграмма состояния Но—1г не построена. Имеются сведения
только о кристаллографических параметрах фаз, которые приведены
в табл. 409 по данным работ [V-C].
Ho—La
975
аблица 40 9. Кристаллическая структура соединений системы Но—1г
г Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а Ь с
4 Но31г Fe3C оР16, Рпта 0,7186 0,9139 0,6326
1 Но51г2* Мп5С2 тС.., С2/с 1,5497 0,6399 0,7169
Но51г3 Mn5Si3 hP\6, Р63/тст 0,8130 — 0,6318
Но51г3 Pu5Rh3 tP, Р4/псс 1,0822 — 0,6255
Но31г2 Y3Rh2 ti.., 14/тст 1,1132 — 2,492
Holr CsCl сР2, РтЗт 0,3383 —
Holr2 *р - 97,5° MgCu2 CF24, Fd3m 0,7503
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Но—La. ГОЛЬМИЙ-ЛАНТАН
Диаграмма состояния Но—La не построена. В металлическом
состоянии La и Но изоэлсктронны, обладают тремя коллективизиро-
ванными валентными 5dl6s2 электронами. Их плотные гексагональ-
ные структуры имеют близкие параметры, атомные радиусы отлича-
ются на 6,4 %. Благодаря близости электронного и кристаллического
строения и атомных радиусов между La и Но при высоких темпера-
турах образуются непрерывные ряды растворов, переходящие от
ДГПУ структуры a La к ГПУ структуре Но.
Большое различие температур плавления La (918 °C) и Но
(1474 °C) предопределяет перитектическую реакцию кристаллизации
их сплавов аналогично сплавам системы Nd—Ег. В приближении
Идеальных растворов линии, соединяющие температуры плавления
и превращения La и Но (имеется в виду, что Но претерпевает пре-
вращение в жидком состоянии Жгпу * Жфцк), пересекаются в пери-
тектической точке при температуре 1350 °C и 78 % (ат.) Но
(рис. 529) [1].
Структурные исследования сплавов системы Но—La при комнат-
ной температуре [2| показали, что в интервале концентраций
976
Ho—La
La Но, % (am) ни
Рис. 529. Но—La
40—55 % (ат.) Но сплавы обладают структурой типа aSm. Возникно-
вение куполообразной области существования фазы (б) со структурой
aSm при температурах ниже -735 °C приводит к разделению облас-
тей твердых растворов со структурой ДГПУ на основе aLa и ГПУ на
основе Но [1].
Литература
1. Григорович В.К., Григорович К.В. // Строение и свойства металлических и
шлаковых расплавов: Тезисы докл. на VII Всесоюзной конференции. Челябинск: ЧИП,
1990. Т. 2. Ч. 2. С. 250-252.
Ho—Lu
977
2. Gschneidner, Jr., К.А., Calderwood F.W. И Handbook on the Physics and Chemis-
try of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North Holland Physics Publi-
shing Co., 1986. V. 8. P. 1-161.
В. К. Григорович
Ho—Lu. ГОЛЬМИЙ-ЛЮТЕЦИЙ
| Диаграмма состояния Ho—Lu не построена. Но и Lu имеют иден-
тичное электронное строение с тремя валентными электронами
5с/16s2, одинаковую кристаллическую структуру типа Mg с близкими
параметрами решетки и атомными радиусами, отличающимися всею
лишь на 1,8 % [1]. На этом основании можно считать, что между Но
и Lu образуются непрерывные ряды идеальных твердых растворов со
структурой типа Mg; при этом линии ликвидуса и солидуса на диаг-
Но Lu,°/o (am.) Lu
Рис. 530. Но—Lu
978
Но-Mg
рамме состояния должны сливаться в одну прямую линию, соединяю
шую их температуры плавления. Но и Lu не испытывают полимор
фного превращения в твердом состоянии, но имеют изменение ближ-
него порядка в жидком состоянии ГПУ «ЮЦК при 1485 и 1790 С
соответственно [2]. Поскольку жидкие растворы Но и Lu также
идеальны, на диаграмме состояния (рис. 530) проведена прямая
линия ликвидуса, разделяющая области с Жгпу и Жоцк ближним
порядком [2].
Литература
1. Gschneidner, Jr., К.А., Calderwood F.W. // Handbook on the Physics and Chcmis
try of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Pubb-
shing Co. 1986. V. 8. Ch. 54. P. 1-161.
2. Григорович В.К., Григорович К.В. // Строение и свойства металлических- и
шлаковых расплавов: Тезисы докл. на VII Всесоюзной конференции. Челябинск: 4111'
1990. Т. 2. Ч. 2. С 250-252.
В.К. Григором;-/
Но—Mg. ГОЛЬМИЙ-МАГНИЙ
Диаграмма состояния Но—Mg (рис. 531) построена по данным
работ [1—3]. На основании рентгеновских исследований в системе
установлено образование трех промежуточных фаз: MgHo, Mg2Ho и
Mg24Hor [1, 4—6], кристаллическая структура которых приведен,- н
табл. 410. Соединение MgHo образуется по перитектической реакции
при 851 °C, состав перитектики не определен.
Таблица 410. Кристаллическая структура соединений системы Но—Mg
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источни*
а С
MgHo CsCl сР2, 0,3776 [11
РтЗт 0,3770 — [4]
0,3758 — [5]
Mg2Ho MgZrt2 КР\2, Рб^/ттс 0,601 0,976 [51
Mg24Ho5 ocMn с15%, 1,1233 — [5]
143т
Со стороны Но в системе наблюдается эвтектоидная реакция при
710 °C, которая объясняется авторами работы [1] полиморфизмов
Но. Согласно работе [7] Но не претерпевает полиморфного превр
щения. В связи с этим часть диаграммы состояния со стороны Ио
требует уточнения. Один из вариантов строения системы в этой чао а
показан штриховыми линиями.
Рис. 531. Но-Mg
Со стороны Mg эвтектическое превращение протекает при темпе-
ратуре 565 °C и концентрации 89,9 % (ат.) Mg. Растворимость Но в
твердом Mg составляет [2—3J:
Температура, °C 565 540 500 400 300 200
Растворимость Но.
% (ат.) 5,44 5,05 4,50 3,43 2,55 1,92
/о (по массе) 28,0 26,5 24,2 19,4 15,4 12,0
980
Ho-Мп
Ho—N
Литература
1. Miller А.Е., Daane A.Y. 11 Trans. AIME. 1964. V. 230. N 4. P. 568-572.
2. Рохлин Л.Л., Деева Л.П. 11 Изв. АН СССР. Металлы. 1978. № 5. С. 219-221
3. Рохлин Л.Л. Магниевые сплавы, содержащие редкоземельные металлы. \f
Наука, 1980. 192 с.
4. landelli A., Palenzona А. // J. Less-Common Met. 1965. V. 9. N 1. Р. 1—6.
5 Крипякевич П.И., Евдокименко В.И., Гладышевский Е.И. // Кристаллографии
1964. Т. 9. № 3. С. 410—411.
6. Krypiakewytsch P.I., Evdokimenko V.I. 11 L- Anorg. All. Chem. 1967. Bd. 355
N 1/2. S. 104-112.
7. Gschneidner, Jr., K.A., Calderwood F.W. // Handtwk on the Physics and Chemis-
try of Rare Earths. Amsterdam. New York. Oxford. Tokvo: North-Holland Physics Pubh
shing Co. 1986. V. 8. P. 1-161.
Л.Л. Рохлин
Ho-Mn. ГОЛЬМИЙ—МАРГАНЕЦ
Диаграмма состояния Но—Мп (рис. 532) построена методами
дифференциального термического и рентгеноструктурного анализа
[11 •
В системе существуют три промежуточные фазы, образующиеся
по перитектическим реакциям: Ж + (уМп) НоМп12 при температу-
ре 1085 °C; Ж + НоМп12 * Но6Мп23 при 1045 °C; Ж + Но6Мп23-
* НоМп2 при 965 °C. Для соединения Но6Мп2а в ранних работах [3.
Ш] дан состав НоМп5. По данным работы [2], соединение НоМгъ
существует в двух модификациях, но на диаграмме состояния это не
отображено. Кристаллическая структура промежуточных фаз привс
дена в табл. 411.
При температуре 875 °C и концентрации 27 % (ат.) Мп в системе
наблюдается эвтектическое равновесие: Ж * (Но) + НоМп2. Раство-
римость Мп в Но практически отсутствует. Мп растворяет не более
1 % (по массе) Но.
Таблица 41 1. Кристаллическая структура соединений в системе Но—Мп
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а С
НоМп2 MgZn2 API 2, Р63/ттс 0,5368 0,8764 12]
HoMn-j MgCu2 cF24, 0,757 — [Ш]
Fd3m 0,7592 — [2]
Но6Мп23 Th6Mn23 cF... 1,2324 — ЦП]
Fm3m 1,2331 — [2]
НоМп|2 ThMnl2 t/26, 14/ттт 0,8570 0,4747 [2]
Рис. 532. Но-Мп
Литература
1. Kirchmayr H.R., Lugscheider W. // Z. Metallkunde. 1967. V. 58. N 3.
P. 185-188.
2. Hladyschewskyi E.I., Krypiakewytsch Р.1., Bodak O.I. 11 Z. Anorg. All. Chem.
1966. Bd. 344. N 1/2. S. 95-101.
Е.И. Гладышевский, О И. Бодак, В.К. Печарский
Ho—N. ГОЛЬМИЙ-АЗОТ
Диаграмма состояния Но—N не построена. Известен нитрид HoN
с областью гомогенности HoN0 985 — HoN0 од, который находится в
равновесии с Но [11. Сообщается о нитриде Ho2N3 [21. Кристалли-
ческая структура нитридов приведена в табл. 412.
982
Но-Nb, Но-Nd
Таблица 412. Кристаллическая структура соединений системы Но—N
Соединение Прототип Символ Пирсо- на, пр. гр. Параметры ре- шетки, а, нм Источник
HoN NaCl с/8, Fm3m 0,4874 0,4877 [Э] ЦП|
Ho2N3 Mn2O3 с78О, 1аЗ 1,056 [2]
Литература
1. Brown R.C., Clark N.J. //J. Inorg Nucl. Chem. 1974. V. 36. N 11. P. 2507-2514
2. Kieffer R„ Ettmayer P„ Pajakoff S. // Monatsh. Chem. 1972. Bd. 103. N '
S. 1285-1298.
Ю.Б. Кузьм:!
Ho—Nb. ГОЛЬМИЙ-НИОБИЙ
Диаграмма состояния Ho—Nb не построена. По данным работы
[1], Но и Nb не смешиваются в жидком состоянии.
Литература
1. Савицкий Е.М., Барон В.В., Ефимов Ю.В. // Редкоземельные металлы и
сплавы. Сб. статей. М.: Наука, 1971. С. 81.
Е.Н. Шефте.и-
Но—Nd. ГОЛЬМИЙ—НЕОДИМ
Диаграмма системы Но—Nd экспериментально не построена. В
металлическом состоянии Но и Nd имеют идентичное электронное
строение с тремя коллективизированными валентными электронами
5г/16х2. Их низкотемпературные структуры имеют одинаковую сим
мстрию ДГПУ (aNd) и ГПУ (Но) с близкими параметрами решеток.
Атомные радиусы отличаются всего на 3,1 %.
Вследствие близкого электронного и кристаллического строения и
малого различия атомных радиусов Но и Nd должны образовывать
друг с другом почти идеальные растворы. На гипотетической диа!
рамме состояния Но—Nd (рис. 533), так же как в других системах
между легкими и тяжелыми лантонидами (Nd—Y, Nd—Ег и др.Г
должны наблюдаться при высоких температурах непрерывные ряды
растворов. В приближении идеальных растворов кривые ликвидуса и
солидуса должны сливаться в одну общую прямую, соединяющую их
температуры плавления. В другую прямую должны сливаться кривые
сольвуса, соединяющие температуру превращения aNd ** pNd
(863 °C) и температуру изменения ближнего порядка Жгпу ЖОцК
жидкого Но (1485 °C) [11. Пересечение этих прямых определяс!
перитектическую точку при температуре 1440 °C и концентрации
Но-Nd
983
Nd Ho,7«(am.) На
Рис. 533. Но—Nd
94 % (ат.) Но. Вследствие отклонения растворов от идеальных линии
ликвидуса, солидуса и сольвуса изображены в виде кривых с узкими
Двухфазными областями [1].
Рентгенографические и микроструктурные исследования сплавов
Но—Nd показали, что в aNd растворяется до 20 % Но, при этом
параметр решетки а изменяется с небольшим положительным откло-
нением от правила Всгарда. Отмечено существование фазы со струк-
турой aSm в интервале концентраций 25—40 % (ат.) Но [2J. В
соответствии с этим на диаграмме изображена куполообразная об-
ласть существования фазы типа aSm, обозначенная 6 на рис. 533.
984
Но-Ni
Литература
1. Григорович В.К., Григорович К.В, // Строение и свойства металлических и
шлаковых расплавов. Тезисы докл. на VII Всесоюзной конференции. Челябинск: ЧПИ
1990. Т. 2. Ч. 2. С. 250-252.
2. Gschneidner, Jr., K.F., Calderwood F.W. // Handbook on the Physics and Chemis
try of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland. Physics Publi
shing Co., 1986. V. 8. Ch. 54. P. 1-161.
B.K. Григорова
Ho—Ni. ГОЛЬМИЙ-НИКЕЛЬ
Диаграмма состояния Ho—Ni не построена. Имеются сведения об
образовании в системе ряда соедийений, кристаллическая структура
которых приведена в табл. 413 [1, V-C].
Таблица 413. Кристаллическая структура соединений системы Но—Ni
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
a b c
Ho3Ni Fe3C оР16, Рпта 0,683 0,954 0,625
Ho3Ni2 (ВТ) Er3Ni2 hP.., 0,852 — 1,575
R3
Ho3Ni2’ (НТ) Dy3Ni2 тС.., С2/т 1,330 0,365 0,951
HoNi CrB или ОСЬ, Стет 0,3707 1,0110 0,4198
FeB оР\6, Рпта 0,7022 0,414 0,5435
HoNi2 MgCu2 cF2A, 0,7138 — —
Fd3m
HoNi3 NbBe3 hR.., 0,4951 — 2,431
R3m
Ho2Ni7 Gd2Co7 hR.., 0,4921 — 3,609
R3m
HoNi5 CaCu5 hP6, P6/mmm 0,4872 — 0,3966
Ho2Ni17 Th2Nil7 hP... P63/mmc 0,828 — 0,8025
*0 = 105,6 °
Но—О
985
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Но—О. ГОЛЬМИЙ-КИСЛОРОД
Диаграмма состояния Но—О не построена. Имеются сведения о
соединении Но2О3, которое плавится при температуре 2350 °C [Ш].
При температуре 2200 °C [1] или 2190 °C [2] происходит полимор-
фное превращение. Сообщается также о гексагональной модификации
этого соединения (Н-форма) [3]. Методом электронографии обнару-
жена модификация с дефектной структурой типа CaF2, которая при
температурах выше 250 °C переходит в модификацию со структурой
типа Мп2О3 [4]. Закалкой от 1000 °C при давлении 2500 МПа зафик-
сирована моноклинная модификация Но2О3 [Ш]. Кристаллическая
структура соединения Но2О3 приведена в табл. 414.
Таблица 414. Кристаллическая структура соединения Но2О3
Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
Sm^Oj (ВТ) тс.., С2/т 1,390 0,3492 0,8592 [51
Mn2O3 (НТ) с/80, 1аЗ 1,06065 1,06080 — — [Э] [Ш]
La2O3 (Н-форма) hP.., P3ml 0,380 — 0,608 [3]
CaF2 сП 2, 0,518 — — [4]
ГтЗт
*0 - 99,98 °
Литература
1. Браун С.М. // Порошковая металлургия. 1970. № 6. С. 82—84.
2. Лопато Л.М., Шевченко А.В., Кущевский А.Е. // Изв. АН СССР. Неорганичес-
кие материалы. 1974. Т. 10. № 8. С. 1481—1487.
3. Gmelin Handbuch der Anorg. Chem. Berlin. 1974. N 39. Teil Cl. 436 s.
4. Кашаев А.А., Ущаповский Л.В., Ильин А.Г. // Кристаллография. 1975. Т. 20.
№ 1. С. 192-193.
5. Hoekstra H.R. // Inorg. Chem. 1966. V. 5. N 5. P. 754—755.
Ю.Б. Кузьма
986
Но-Os, Но-P, Ho—Pb
Ho—Os. ГОЛЬМИЙ-ОСМИЙ
Диаграмма состояния системы Но—Os не построена. Имеются
сведения о фазах, структура которых приведена в табл. 415.
Таблица 415. Кристаллическая структура соединений системы Но—Os
[Ш, V-C]
Соединение Прототип Символ Пирсона, пр. гр. Параметры рететки, нм
а b С
HoOs2 MgZn2 API 2, Р63/ттс 0,5295 — 0,8772
Ho3Os Fe3C ОР16, Рпта 0,7340 0,8985 0,6222
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Но-Р. ГОЛЬМИЙ-ФОСФОР
Диаграмма состояния Но—Р нс построена. Имеются данные о
соединениях НоР и НоР5 [1]. НоР обладает структурой типа NaCi
символ Пирсона cF8, пр. гр. Fm3m, а = 0,5626 нм [Ш]; в работе |2|
указывается на существование полиморфизма в этом соединении.
Литература
1. Schnering H.G., Wichelhaus W., Wittman M. 11 Reps. 5th Intern. Conf. Se i
Compounds of Transition Elements. Uppsala. 1976. Rep. 1168.
2. Fischer P., Furrer A., Kaldis E. et al. // Phys. Rev. B. Condens Matter. 198'
V. 31. N 1. P. 456-469.
Ю.Б. Kyet.-i.i
Ho—Pb. ГОЛЬМИЙ-СВИНЕЦ
Диаграмма состояния Ho—Pb не построена. Имеются данные о
соединениях, кристаллическая структура которых приведена н
табл. 416 [1].
Таблица 416 Кристаллическая структура соединений системы Но—РЬ
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b С
Но5РЬ3 Mn5Si3 АР16, Р63/тст 0,8915 — 0,6541
Но5РЬ4 Sm5Ge4 оР... Рпта 0,8095 1,541 0,8148
НоРЬ3 AuCu3 сР4, РтЗт 0,4800 — —
Ho—Pd
987
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Но—Pd. ГОЛЬМИЙ—ПАЛЛАДИЙ
Диаграмма состояния Но—Pd (рис. 534) приведена по аналитичес-
кому обзору [1]. В системе установлено существование восьми про-
межуточных фаз, из которых pHoPd, Ho3Pd4 и HoPd3 образуются из
расплава конгруэнтно при температурах 1480, -1430 и —1730 °C
соответственно. Фазы Ho5Pd2, Ho3Pd2, pHo2Pd3, Ho10Pd21 образуют-
ся по перитектическим реакциям при температурах 925, 970, 1281,
1313 °C соответственно. Предполагается, что соединение HoPd7
образуется по перитектоидной реакции в твердом состоянии. Соеди-
нения HoPd и HoPd3 обладают заметными областями гомогенности.
HoPd и Ho2Pd3 существуют в двух модификациях. Кристаллическая
структура фаз приведена в табл. 417.
988
Но-Pm
Таблица 417 Кристаллическая структура соединений в системе Но—Pd
fl, 2, V-C]
Соединение Прототип Символ Пирсона, np. гр. Параметры решетки, нм
а b с
Ho5Pd2 DyjPdi Г749, Z4,/a 0,945 — 1,3354
Ho3Pd2 U3Si2 tPIO, Р4/mbm 0,7718 — 0,3909
aHoPd FeB oP8, Pnma 0,7718 0,4242 0,5604
PHoPd CsCl cP2, РтЗт 0,3467 — —
Ho3Pd4 Pu3Pd4 Ml4, R3 1,3070 — 0,5677
H0|0Pd2| — mCl 24, C2/m — —- —
HoPd3 AuCu3 cP4, РтЗт 0,4069 —
В системе наблюдается четыре эвтектических равновесия:
Ж * (Но) + Ho5Pd2 при 900 °C и -24,5 % Pd;
Ж - pHoPd + Ho3Pd4 при 1398 °C и 53 % Pd;
Ж * pHo2Pd3 + Ho10Pd21 при 1270 °C и 62 % Pd;
Ж ** HoPd3 + (Pd) при 1255 °C и 86 % (ат.) Pd.
Растворимость Но в Pd достигает 12,5 % (ат.) при 1255 °C и
незначительно снижается при понижении температуры. Pd практи
чески не растворяется в Но.
Литература
1. Okamoto Н. // J. Phase Equlibria. 1991. V. 12. N 2. Р. 246-247.
2. Loebich О., Raub Е. 11 J. Less-Common Met. 1973. V. 30. N 1. P. 47-62.
Е.И. Гладышевский, О.И. Водак, В.К. Печарски.1
Но—Pm. ГОЛЬМИЙ-ПРОМЕТИЙ
Диаграмма состояния Но—Pm экспериментально не построена. Pm
и Но в металлическом состоянии изоэлектронны, имеют три коллек-
тивизированных валентных 5с/1бу2 электрона. Плотные гексагональ-
ные структуры ДГПУ аРт и ГПУ Но имеют близкие параметры
решеток. Атомные радиусы Но и Pm отличаются на 2,5 %. Близость
электронно-кристаллического строения и атомных радиусов предопре
деляет образование при высоких температурах твердых растворов
ДГПУ—ГПУ, переходящих друг в друга по механизму дефектов
упаковки. Система Но—Pm благодаря большому различию темпера-
тур плавления компонентов должна подобно системе Nd—Ег отно-
ситься к перитектическому типу. В приближении идеальных раство-
ров пересечение прямых линий, соединяющих температуры плавле-
ния (1042 и 1474 °C) и превращения (890 и 1485 °C) Pm и Но опре-
Ho—Pm
989
Рис. 535. Но—Рщп Но,°/-(ат.) Но
деляет перитектическую точку при температуре -1435 °C и концен-
трации 92 % (ат.) Но (рис. 535). При температуре ниже -735 °C
возникает промежуточная фаза, обозначенная б, типа aSm, разделя-
ющая ДГПУ твердые растворы на основе a Pm и ГПУ растворы на
основе Но ] 1 ]. Область фазы 6 отвечает приблизительно составам
сплавов с 20—30 % (ат.) Но [1].
Литература
1. Григорович В.К., Григорович К.В. // Строение и свойства металлических и
Шлаковых расплавов: Тезисы докл. на VI Всесоюзной конференции. Челябинск: ЧГШ,
1990. Г. 2. Ч. 2. С. 250—252.
В.К. Григорович
990
Ho—Po, Ho—Pr
Но—Ро. гольмий—полоний
Диаграмма состояния Но—Ро не построена. Сообщается о сущее
твовании соединений Но2Ро07, полученного взаимодействием паров
Но и Ро [Ш], и НоРо со структурой типа NaCl (символ Пирсона <г8,
пр. гр. Fm3m, а = 0,6200 нм) [V-C].
Е.И. Гладышевский, О.И. Бодак, В.К. Пенара-ши
Но—Рг. ГОЛЬМИЙ—ПРАЗЕОДИМ
Диаграмма состояния Но—Рг экспериментально не построена. Но
и Рг в металлическом состоянии изоэлсктронны. Они имеют три
валентных коллективизированных электрона 5dl6s2. Плотные гекса-
Ho—Pt
991
гональные структуры ДГПУ аРг и ГПУ Но имеют близкие параметры
решеток, атомные радиусы их различаются на 3,5 %. Вследствие
близости электронного и кристаллического строения, Но и Рг должны
образовывать при высоких температурах ряды плотных гексагональ-
ных твердых растворов, образующихся по перитектической реакции,
как в системе Er—Nd [1]. В приближении идеальных растворов
перитектическая точка отвечает -1400 °C и -85 % (ат.) Но [2]. При
температуре ниже -735 “С вблизи концентрации 40 % (ат.) Но
возникает промежуточная фаза 5 со структурой типа aSm (рис. 536).
Литература
1. Gschneidner, Jr., К.A., Calderwood F.W. // Handbook on the Physics and Chemis-
try of Rare Earths. Amsterdam. New York. Oxford. Tokyo: Physics Publising Co., 1986.
V. 8. Ch 54. P. 1-161.
2. Григорович B.K., Григорович К.В. // Строение и свойства металлических и
шлаковых расплавов: Тезисы докл. на VII Всесоюзной конференции. Челябинск: ЧПИ,
1990. Т. 2. Ч. 2. С. 250-252.
В.К. Григорович
Но—Pt. ГОЛЬМИЙ—ПЛАТИНА
Диаграмма состояния Но—Pt не изучена. Имеются данные о
существовании в системе девяти промежуточных фаз: Ho3Pt, Ho2Pt,
Ho5Pt3, Ho5Pt4, HoPt, Ho3Pt4, HoPt2, HoPt3 и Hot5, кристаллическая
структура которых приведена в табл. 418 по данным работ [Э, Ш 1].
Таблица4 1 8. Кристаллическая структура соединений системы Но—Pt
[1, Э, Ш]
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b С
Ho3Pt Fe3C оР16, Рпта 0,7019 0,9436 0,6394
Ho2Pt PbCl2 оР.., Рпта 0,7054 0,4722 0,8686
HOjPtj Mn5Si3 ЛР16, Р63/тст 0,8319 — 0,6191
Ho5Pt4 Sm5Ge4 оР.., Рпта 0,7435 1,4490 0,7512
HoPt FeB оРй, Рпта 0,6951 0,4470 0,5532
Ho3Pt4 Pu3Pd4 hRl4, R3 1,3061 — 0,5661
HoPt2 MgCu2 cF24, Fd3m 0,7586 — —
HoPt3 AuCu3 сР4, РтЗт 0,4063 — —
HoPt5 — о.., 0,5231 0,9091 2,649
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
992
Но—Ри, Но—Re, Ho—Rh
Но—Pu. ГОЛЬМИЙ-ПЛУТОНИЙ
Диаграмма состояния Но—Pu не построена. В результате исследо-
вания отдельных сплавов установлено, что предельная растворимость
Ри в твердом Но составляет -20 % (ат.), Но в Ри до 2—3 % (ат.)
Добавка Но к Ри до 5 % повышает температуру плавления последне-
го до 645 °C и позволяет зафиксировать закалкой ePu [Ш], что
позволяет предположить: богатые Ри сплавы кристаллизуются по
перитектической реакции
Ж + (Но) * (ePu)
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Но—Re. ГОЛЬМИЙ-РЕНИЙ
Диаграмма состояния Но—Re не построена. Сплавы системы
исследованы во всем интервале концентраций методами микрострук
турного и рентгеновского анализов [1, 2]. Показано, что в системе
Но—Re образуется только одно стабильное соединение HoRe2. Давос
фаза со структурой типа MgZn2 (символ Пирсона API2, пр. гр.
Р63/ттс, а = 0,5378 нм, с = 0,8785 нм [1, 2]).
Растворимость Но в Re < 1 % (ат.).
Предполагается, что по типу диаграмма состояния Но—Re будет
подобна диаграммам состояния систем Gd—Re и Y—Re.
Литература
1. Савицкий Е.М., Хамидов О.Х. // Изв. АН СССР. Неорганические материалы.
1965. Т. 1.N9 1.C. 1873-1877.
2. Хамидов О.Х., Савицкий Е.М. // Диаграммы состояния металлических систем.
Сб. статей. М.: Наука, 1968. С. 178—184.
М.А. Тылкина
Ho—Rh. ГОЛЬМИЙ—РОДИЙ
Диаграмма состояния Ho—Rh не построена. Имеются сведения
только о шести соединениях, кристаллографические параметры
которых приведены в табл. 419 по данным работ [1, Э, Ш1.
Таблица 419. Кристаллическая структура соединений системы Ho—Rh
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а Ь С
IIo3Rh Fe3C ОР16, Рпта 0,7119 0,9359 0,6265
Ho7Rh3 Th7Fe3 hP20, Pf^mc 0,9694 — 0,6098
Ho—Ru
993
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b с
Ho5Rh3 Mn5Si3 hPl 6, Pf>3/mcm 0,8100 — 0,6335
Ho3Rh2 Y3Rh2 п, /4/ тст 1,111 — 2,499
HoRh CsCl сР2, РтЗт 0,3387 — —
HoRh2 MgCu2 cF24, Fd3m 0,7426 — —
Литература
1. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вита школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Ho—Ru. ГОЛЬМИЙ—РУТЕНИЙ
Диаграмма состояния Ho—Ru не построена. Имеются данные о
существовании в системе трех промежуточных фаз HoRu2, Ho5Ru2
й Ho3Ru, кристаллическая структура которых приведена в табл. 420
по данным работы [ I ].
Таблица 42 0. Кристаллическая структура соединений системы Ho—Ru
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b С
HoRu2 MgZn2 hP\2, Pf>i/ ттс 0,5244 — 0,8810
Но5 Ru2’ Mn5C2 тС.., С2/с 1,5564 0,6251 0,7264
Ho3Ru Fe3C оР\Ь, Рпта 0,7277 0,9106 0,6235
*0 = 97,26".
Литература
1. Е.И. Гладышевский, О.И. Бодак. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
32 Зак. 2144
994
Ho—S, Но-Sb
Ho-S. ГОЛЬМИЙ-СЕРА
Диаграмма состояния системы Но—S не построена. Известно
несколько соединений в сплавах системы Но—S: HoS, Ho5S7, Ho2S3,
HoS167_1 72, кристаллическая структура которых приведена в
табл.’421.’
Таблица 421. Кристаллическая структура соединений системы Ho—S
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а Ь с
HoS NaCl сС8, 0,5465 — — 1Н
Fm3m 0,5457 — — 12]
Ho5S7* — — 1,2729 0,3796 1,1515 13]
HojSj" — — 1,75 0,4002 1,015 [4]
67 1>72 — — 0,766 — 0,784 {51
Моноклинная сингония, р “ 104,83°.
Моноклинная сингония, р - 99,4°.
Тетрагональная сингония
Литература
1. Bruzzone G. // Atti Accad. Naz. Line. Rend. C. Sci. Fiz. Mat. Nat. 1961. V. 30.
P. 208-213.
2. Guittard M. // Compt. Rend. 1965. V. 261. N 10. P. 2109-2112.
3. Adolphe C„ Guittard M„ Laruelle P. // Compt. Rend. 1964. V. 258. N 19.
P. 4773-4775.
4. White J.G., Yocom P.N., Lerner S. 11 Inorg. Chem. 1967. V. 6. P. 1872-1875.
5. King S.A., Tecotzky M. // Inorg. Chem. 1964. V. 3. N 2. P. 183-185.
Н И. Никитина
Ho—Sb. ГОЛЬМИЙ-СУРЬМА
Сплавы системы Но—Sb исследовали методами дифференциального
термического, микроскопического и рентгеновского анализов [1, 2].
Сплавы синтезировали из компонентов в запаянных ампулах с
использованием дистиллированного Но чистотой 99,8 % (по массе)
и Sb чистотой 99,999 % (по массе). Диаграмма состояния системы,
построенная по данным работ [1, 2], приведена на рис. 537.
Диаграмма состояния характеризуется наличием четырех интерме-
таллических соединений: Ho5Sb3, Ho4Sb3, HoSb и HoSb2. Соединение
HoSb плавится конгруэнтно при температуре 2160 °C. Соединения
Ho5Sb3, Ho4Sb3 и HoSb2 образуются по перитектическим реакциям
при температурах 1680, 1830 и 670 °C, соответственно. Соединения
Ho—Sb
995
Sb, "/о ( no массе)
Рис. 537. Но-Sb
Ho4Sb3 и HoSb существуют в двух модификациях. В системе образу-
ются две эвтектики: в сплавах, богатых Но, при температуре 1170 °C
и содержании 15 % (ат.) Sb и в сплавах, богатых Sb, при температу-
ре 624 °C и содержании Но менее 1 % (ат.).
Авторы работы [1] на основании данных термического анализа
установили со стороны Но наличие нонвариантного превращения при
1400 °C, связанного с полиморфным превращением Но при 1425 °C.
Наличие найденного превращения при 1400 °C вызывает сомнение
в связи с тем, что согласно работам [3, 4] в Но отсутствует полимор-
фное превращение в области температур, близких к его температуре
плавления.
32*
996
Ho—Sc
Сведения о кристаллической структуре соединений приведены
табл. 422.
Таблица 422. Кристаллическая структура соединений системы Но—Sb
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, им Источник
а с
Ho5Sb3 Mn5Si3 /гР16, 0,8847 0,6231 [1. 2] ~~
PbJ тст 0,885 0,6234 [5]
aHo4Sb3 Анти- с/28, 0,9071 П, 2]
^Рз 143d
aHoSb NaCl cF8, 0,613 — П, 21
Fm3m 0,6129 — 16]
0,613 — П1
0,61 — [8]
Литература
1. Abdusalyamova M.N., Burnashev O.R., Mironov К.Е. // J. Less-Common Met
1984. V. 102. N 1. P. L19-L22.
2. Abdusalyamova M.N., Burnashev O.R., Mironov K.E. // J. Less-Common Mei
1986. V. 125. P. 1-6.
3. Gschneidner, Jr., K.A. // J. Less-Common Met. 1985. V. 114. N 1. P. 29—42.
4. Spedding F.H., Sanden B., Beaudry B.J. // J. less-Common Met. 1973. V. 31 XI.
P. 1-13.
5. Rieger W., Parthe E. // Acta Crystallogr. 1968. V. 24. P. 456-458.
6. Brixner L.H. 11 J. Inorg. Nucl. Chem. 1960. V. 15. P. 199-201.
7. Bruzzone G. // Atti Accad. Naz. Line. Rend. C. Sci. Fiz. Mat. Nat. 1961. V. 30
P. 208-213.
8. Кузьмин P.H., Никитина C.B. // Кристаллография. 1963. № 8- С. 453—454.
И.И. Никитич:'
Но—Sc. ГОЛЬМИЙ-СКАНДИЙ
Экспериментально фазовая диаграмма Но—Sc не построена [ 11 •
Однако Sc и Но в металлическом состоянии почти изоэлектронны и
имеют три коллективизированных валентных электрона 3c/'4s2 и
5dl6s2, соответственно. Они имеют ГПУ структуру с близкими
параметрами а и с при температурах от —273 “С до высоких темпера
тур. Их атомные радиусы отличаются на 7,6 % и составляют 0,16406
и 0,17661 нм, соответственно. Сведения по кристаллическим структу-
рам элементов приведены в табл. 423.
Но-Sc
997
Но Sc, °/о (am) Sc
Рис. 538. Но—Sc
Таблица 423. Кристаллическая структура и полиморфные превращения
элементов системы Но—Sc
Атом- ный номер, элемент Моди- фикация Прото- тип, структура Параметры решет- ки, нм Темпе- ратура, °C Реакция Источник
а С
67, Но — Mg, ГПУ 0,35778 0,56178 1474 Ж ₽ Но [И
1485 «ОЦК ₽ЖГПУ [2]
21, Sc a Sc Mg, ГНУ 0,33088 0,52680 1312 aSc " pSc [1]
PSc W, ОЦК 0,373 — 1541 Ж » pSc
Вследствие близости электронного строения и изоструктурности
Но и Sc должны образовывать непрерывный ряд твердых растворов.
Действительно, экспериментально исследованные пять сплавов
системы Но—Sc имели ГПУ структуры, параметры я0, с0 которых
показали лишь небольшое положительное отклонение от прямых
Вегарда [1]. Благодаря небольшой разнице температур плавления
компонентов (67 °C) и значительному различию атомных радиусов
растворы Но и Sc существенно отклоняются от идеальных, и кривые
ликвидус—солидус должны значительно провисать, образуя эвтекти-
998
Но-Se
ческую систему (рис. 538). Область высокотемпературных О] [к
растворов в приближении идеальных растворов [2] простирается
приблизительно от 43 до 100 % (ат.) Sc. Фазовая диаграмма анало-
гична диаграмме системы Er—Sc.
Литература
1. Gschneidner, Jr. К. A., Calderwood F.W. 11 Handbook on the Physics and Chemis-
try of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Publi-
shing Co. 1986. V. 8. Chap. 5. P. 1—161.
2. Григорович B.JC., Григорович K.B. Строение и свойства металлических и
шлаковых расплавов: Сб. статей. Челябинск. ЧПИ, 1990. Т. 2. С. 250—252.
В. К. Гри
горович
Но—Se. ГОЛЬМИЙ-СЕЛЕН
В сплавах системы Но—Se обнаружено несколько соединений:
HoSe, Ho3Se4, HoSe2, Ho2Sc3 [1—4], данные по их кристаллической
структуре приведены в табл. 424.
Таблица 42 4. Кристаллическая структура соединений системы Но—Se
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b с
HoSe* — — 0,568 0,5687 — — П1 [21
Ho3Se4* — — 0,695 — 12]
HoSe2“’ ErSe2 — 1,637 1,592 1,194 13]
Ho2Se3 — oF128, Fddd 1,1380 0,8110 2,4279 14]
Кубическая сингония.
* Ромбоэдрическая сингония, а = 33,6°.
Ромбическая сингония.
Литература
1. Bruzzone G. // Atti Accad. Naz. Line. Rend. C. Sci. Fiz. Mat. Nat. 1961 V 30.
P. 208-212.
2. Guittard M„ Flahaut J. // Bull. Soc. Chim. Franc. 1968. N 12. P. 4759-4765-
3. Wang R., Steinfink H. // Inorg. Chem. 1967. V. 6. P. 1685—1692.
4. Range K.-J., Eglmeier Ch. // J. Less-Common Met. 1991. V. 171- N 1 Г
L.27-L.30.
Н.И. Никитина
Но-Si
999
Рис. 539. Но—Si
HO-Si- ГОЛЬМИЙ—КРЕМНИЙ
Сведения о диаграмме состояния Но—Si очень ограниченны. На
рис. 539 приведена линия ликвидуса
данным работы [11.
Синтез образцов осуществляли
отжигом контактируемых пластин
монокристального Si и фольги Но
в вакууме. Процесс вплавления Но
в Si контролировали визуально.
Образцы выдерживали 30 мин
при температуре контактного пла-
вления.
В качестве исходных компонентов
использовали Но чистотой 99,911 %
(по массе) и монокристаллический
Si, содержащий -4- 10“5 % В.
Со стороны Si обнаружена эвтек-
тика при температуре 1185 °C и
концентрации 73 % (ат.) Si.
В системе Но—Si образуются пять
соединений Ho5Si3, Ho5Si4, HoSi,
HoSi2__r HoSi2, структура которых
приведена в табл. 425 [2].
в системе со стороны Si по
Таблица 42 5. Кристаллическая структура соединений системы Ho-^Si
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
a b c
Ho5Si3 Mn5Si3 API 6, Pft^/mcm 0,834 — 0,622
Ho5Si4 Sm5Ge4 oP8(t, Pnma 0,7338 1,4449 0,7625
HoSi (НТ) CrB oC8, Cmcm 0,4228 1,0429 0,3801
HoSi (ВТ) FeB oP8, Pnma 0,781 0,379 0,563
HoSi,~t A1B2 hP3, P6/mmm 0,3816 — 0,4107
HoSi2 aGdSi2 оГ20, Imma 0,403 0,392 1,329
Литература
1. Лозовский В.Н., Колесниченко А.И. // Изв. АН СССР. Неорганические мате-
риалы. 1981. Т. 17. № 3. С. 554—555.
2. Гладышевский Е.И., Бодак О.И. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
1000
Ho—Sm
Ho—Sm. ГОЛЬМИЙ-САМАРИЙ
Экспериментально фазовая диаграмма Ho—Sm не построена [ 11.
Однако Sm и Но имеют в металлическом состоянии идентичное
электронное строение с тремя коллективизированными валентными
электронами Sd^s2, одинаковую плотную гексагональную структуру
типа Mg с близкими параметрами решетки и атомные радиусы,
отличающиеся всего на 2,15 %, и равные 0,18041 и 0,17661 нм.
Рис. 540. Ho—Sm
Ho—Sm
1001
Таблица 42 6. Кристаллическая структура и полиморфные превращения
элементов системы Ho—Sm
Атом- ный номер, элемент Моди- фикация Прото- тип, структура Параметры решет- ки, нм Темпе- ратура, °C Реакция Источник
a с
67, Но — Mg, ГПУ 0,35778 0,56178 1474 1485 Ж ” Но •'К-оцк ” ЖГПУ HI [2]
62, Sm aSm aSm, ромбичес- кая 0,36290 2,6207 734 aSm ₽ pSm [1]
pSm Mg, ГПУ 0,36630 0,58448 922 PSm -ySm [1]
ySm W, ОЦК 0,410 — 1074 Ж ” ySm [1]
Сведения по кристаллическим структурам элементов системы
приведены в табл. 426.
Можно предположить, что Но образует с pSm непрерывные ряды
ГПУ твердых растворов. Вследствие близости строения растворы
должны быть почти идеальными, поэтому линии ликвидуса—солидуса
и две линии сольвуса должны практически сливаться в две прямые
линии с узкими двухфазными областями между ними. Но вблизи
температуры плавления в отличие от большинства редкоземельных
металлов не имеет высокотемпературный ОЦК фазы [1], однако в
жидком состоянии при температуре 1485 °C он испытывает измене-
ние ближнего порядка Жгпу * Жоцк [2]. Это позволяет провести
прямую ликвидус—сольвус, соединяющую температуры превращений
Но при 1485 °C и Sm при 922 °C. Полученная таким образом диаг-
рамма состояния Ho—Sm относится к перитектическому типу с пери-
тектической точкой при температуре 1450 °C и концентрации 5 %
(ат.) Sm (рис. 540). Область ОЦК растворов на основе ySm простира-
ется от 5 до 100 % Sm. Сплавы, содержащие до 5 % Sm, плавятся,
сохраняя ГПУ ближний порядок, который при дальнейшем нагреве
сплавов переходит в ОЦК ближний порядок. В aSm растворяется до
19-25 % (ат.) Но.
Литература
1. Gschneidner, Jr., К.A., Calderwood F.W. // Handbook on the Physicsand Chemi-
stry of Rare Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publi-
shing Co., 1986. V. 8. Chap. 54. P. 1-161.
2. Григорович В.К., Григорович К.В. Строение и свойства металлических и
шлаковых расплавов: Сб. статей. Челябинск: ЧПИ, 1990. Т. 2. № 2. С. 250—252.
В. К. Григорович
1002
Ho—Sn, Ho-Та
Ho—Sn. гольмий-олово
По диаграмме состояния Но—Sn имеются ограниченные сведения,
касающиеся образования соединений: Ho5Sn3, Ho^Sn^, HoSn2.
HoSn3 [1]. Сведения по их кристаллической структуре приведены в
табл. 427 [1].
Таблица 4 2 7 Кристаллическая структура соединений системы Но—Sn
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм
а b С
Ho5Sn3 Mn5Si3 API 6, Р63/тст 0,8848 — 0,6461
H0],Sn|0 Ho, |Ge]0 tI84, 14/ттт 1,152 — 1,680
IIoSn2 ZrSi2 оС 12, Стет 0,4377 1,6185 0,4292
HoSn3 AuCu3 сР4, РтЗт 0,4653 —
Литература
1. Е.И. Гладышевский, О.И. Бодак. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
Е.И. Гладышевский, ОН. Бодак, В.К. Печарский
Но—Та. ГОЛЬМИЙ—ТАНТАЛ
Диаграмма состояния Но—Та исследована в ограниченной области
концентраций [ 1 ].
Сплавы изготовляли в индукционной печи в вакууме путем
нагрева Но выше его температуры плавления в толстостенных тиглях
1,00
о
0,20
1700
1600
1500
1000
Та, % (по массе)
0,70 0,60 0,80
I л г I I
1474°
3. - J 1468°
0,36
•*-(Нс )
1300
0 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00
Но
Та,“/о (ат.)
Рис. 541. Но-Та
Но-Tb
1003
из Та в течение 1 ч с последующим сбрасыванием в водоохлаждае-
мый медный приемник.
В качестве исходных компонентов использовали Но чистотой
99,93 % (по массе) и Та чистотой 99,9 % (по массе).
Температуру измеряли оптическим пирометром, содержание Та
в сплавах определяли с помощью химического анализа. Критические
точки сплавов определяли методом дифференциального термического
анализа.
На рис. 541 представлена часть диаграммы состояния от 0 до 1 %
(ат.) Та, приведенная в работе [М], на которой показана эвтектика,
образующаяся при концентрации 0,36 % (ат.) Та и температуре
1468 °C.
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner К.А. // J. Less-Common Met. 1965.
V. 10. N 2. P. 108-115.
A.C. Адамова
Ho—Tb. ГОЛЬМИЙ—ТЕРБИЙ
Диаграмма состояния Но—Tb (рис. 542) построена на основании
данных термического, рентгеноструктурного и металлографического
анализов [1]. Слитки выплавляли в дуговой печи в атмосфере Аг,
прокатывали в листы, которые отжигали 20 ч при температуре 550 °C
в вакууме.
Рис. 542. Но ГЬ ;•/, Но,‘А (ат) но
1004
Ho-Тс, Ho-Те
ТЬ и Но близко расположены в ряду лантанидов (65ТЬ и 67Но)
в металлическом состоянии имеют три коллективизированных
валентных электрона (5dl6s2), изоструктурны (имеют ГПУ решетки,).
Их атомные радиусы отличаются всего на 1 %. Поэтому ТЬ и
образуют почти идеальные твердые и жидкие растворы.
Значения параметров решеток а и с исследованных в работе (2 j
сплавов располагаются на прямой, соединяющей параметры решеток
ТЬ и Но. Это отвечает правилу Вегарда. Точки для ликвидуса и
солидуса различаются менее чем на 1,5 °C, и обе линии вследствие
идеальности растворов сливаются в прямую, соединяющую темпера-
туры плавления ТЬ и Но (рис. 542). В другую прямую, идущую под
большим наклоном, сливаются линии сольвуса. Обе прямые псресска
ются в точке при температуре 1462 °C и концентрации 10 % (атл
ТЬ, образуя вырожденную перитектику. Экстраполяция прямой
сольвуса в область жидкого состояния определяет узкую область
расплавов, имеющих ближний порядок Жгпу, над которой находится
область Жоцк с кластерами ОЦК типа. Температура 1485 °C отвеча-
ет превращению Жгпу ** ЖОцк [3].
Литература
1 Spedding F.H., Sanden В., Beaudry B.J. // J. Less-Common Met. 1973. V 3!
P. 1-13.
2. Сирота H.H., Семиренко B.B. // Изв. АН СССР. Металлы 1977. № 6. С. 167
3. Григорович В.К., Григорович К.В. Строение и свойства металлических и
шлаковых расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск
ЧПИ, 1990. Т. 2. № 2. С. 250-252.
В.К. Григорович
Ho-Тс. ГОЛЬМИЙ-ТЕХНЕЦИЙ
Диаграмма состояния Но—Тс не построена. Согласно данным,
приведенным в работе [Ш], единственное известное соединение
имеет формулу НоТс2 и структуру типа MgZn2 (символ Пирсона
ЙР12, пр. гр. РЬ^/ттс), а = 0,5353, с = 0,8813 нм.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарскии
Ho-Те. ГОЛЬМИЙ-ТЕЛЛУР
На рис. 543 приведена диаграмма состояния Но—Те fl]. Сплавы
готовили прямым синтезом из элементов в откачанных кварцевых
ампулах. Исследование проводили методами дифференциального
термического, рентгеновского и микроскопического анализов.
В сплавах системы обнаружено три соединения: НоТс, Но2Те5 и
НоТе3. Соединение НоТе плавится конгруэнтно при температуре
1370 °C и является фазой переменного состава, образуя односторон-
ние твердые растворы в интервале концентраций 50—55 % (ат.) Те.
Ho-Те
1005
Рис. 543. Ho-Те
Но Те, 7о (ат.) Те
Соединения Но2Те5 и НоТе3 образуются по перитектическим реакци-
ям соответственно при температурах 800 и 780 °C. В системе образу-
ются две эвтектики: Но + НоТе при температуре 1110 °C и концен-
трации 23 % (ат.) Те и НоТе3 + Те при температуре 445 °C. Послед-
няя температура скорректирована в сторону понижения на 10 °C в
соответствии с принятой температурой плавления Те.
Кристаллическая структура соединений приведена в табл. 428.
Таблица 428. Кристаллическая структура соединений системы Но—Те
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм Источник
а b с
НоТе \аС1 cF8, 0,6072 — — [2]
ТтЗ т 0,6049 — — 13,4]
Но2Те5 Na2Te5 — 0,4411 — 4,503 (1]
НоТе3* — — 0,4273 0,4273 2,487 (1]
‘Ромбическая сингония.
1006
Но-Th
Литература
1. Ярембаш Е.И., Вигилева Е.С., Елисеев А.А. и др. // Изв. АН СССР. Неоргани
ческие материалы. 1974. № 10. № 8. С. 1409—1413.
2. Brixner L.H., // J. Inorg. Nucl. Chem. 1960. V. 15. P. 199-201.
3. Bruzzone G. // Atti Accad. Naz. Line. Rend. C. Sci. Fiz. Mat. Nat. 1961. V ip
P. 208-213.
4. landelli A. // Rare Earth Researsch. New York: The McMillan Company, 1961
P. 135-141.
Н.И. Никитина
Ho—Th. ГОЛЬМИЙ-ТОРИЙ
Отрывочные сведения о строении системы Но—Th содержатся в
справочнике [Ш], наиболее полные результаты ее исследования с
построением диаграммы состояния приведены в работе [1].
Сплавы готовили плавлением Но чистотой 99,91 % (по массе) и
Th чистотой 99,5 % (по массе) в дуговой печи в атмосфере Аг.
Ho—Tl
1007
Отжиг сплавов проводили в кварцевых ампулах при 900 °C <24 ч) и
600 °C (168 ч) с последующим охлаждением с печью.
Для изучения сплавов применяли термический, микроскопический
и рентгеноструктурный анализ, а также метод твердости.
В системе надежно установлены линии ликвидуса и солидуса за
исключением части, примыкающей к Th и границы однофазного
раствора (aTh) с двухфазной областью (aTh) + (Но). Построенная
авторами работы [1] диаграмма состояния вызывает сомнение в ее
правильности в части, прилегающей к Но, так как при построении
диаграммы принималось во внимание полиморфное превращение Но.
По данным работы [2] полиморфное превращение в Но в твердом
состоянии не существует. Авторы работы [1] отмечают, что терми-
ческие эффекты в твердом состоянии проявляются недостаточно
четко.
Диаграмма состояния Но—Th, приведенная на рис. 544, построена
по данным работы [1] и исправлена в части, богатой Но с учетом
температуры плавления Но, равной 1474 °C (вместо 1461 °C) и
отсутствия полиморфного превращения.
В системе, по-видимому, наблюдаются перитектическое превраще-
ние при -1600 °C (pTh) + Ж * (Но) и эвтектическое превращение
при -1500 °C (0Th) (aTh) + (Но). Превращение (aTh) « (£Th)
имеет максимум при -1600 °C и содержании Но -35 % (ат.). Рас-
творимость Но в (aTh) при комнатной температуре составляет
около 55 % (ат.), а Th в (Но) при комнатной температуре —
незначительна.
Литература
1. Бадаева Т.А., Кузнецова Р.И. // Изв. АН СССР. Металлы. 1967. №6.
С. 187-192.
2. Gschneidner, Jr., К.A., Calderwood F.W. // Handbook on the Physics Chemistry
of Rare Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publishing
Co., 1986. V. 8. Chap. 54. P. 1-161.
A.C. Адамова
Ho—TI. ГОЛЬМИЙ-ТАЛЛИЙ
Имеются сведения об образовании в системе Но—Т1 нескольких
соединений: Но5Т13, НоТ1, Но3Т15, НоТ13.
Сведения о чистоте компонентов и методах приготовления сплавов
не сообщены.
Для исследования соединений использовался метод рентгенострук-
турного анализа. Данные по кристаллической структуре соединений
системы приведены в табл. 429 [1].
1008
Но—Тт
Таблица 42 9. Кристаллическая структура соединений системы Но—TI
Соединение Прототип Символ Пирсона, пр. гр. Параметры решетки, нм ~~
а b с
Но3Т13 Mn5Si3 hP\6, PfhJ тст 0,8883 — 0,6553
НоТ1 CsCl сР\1, РтЗт 0,3720 — —
Но3Т15 Pu3Pd5 оС32, Стет 0,993 0,804 1,031
НоТ13 AuCu3 сР4, РтЗт 0,4666 — —
Литература
1. Е.И, Гладышевский, О.И. Бодак. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов. Вища школа. 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Но-Tm. ГОЛЬМИЙ-ТУЛИЙ
Экспериментально фазовая диаграмма Но—Тт не построена (1 ].
Однако Тт и Но близко расположены в периодической системе,
имеют в металлическом состоянии идентичное электронное строение
с тремя коллективизированными валентными электронами 5с? 6s2,
одинаковую плотную гексагональную структуру типа Mg с очень
близкими параметрами решетки [1] и атомные радиусы, отличающи-
еся всего на 1,1 % (0,17661 и 0,17462 нм).
Сведения о кристаллической структуре элементов системы приве-
дены в табл. 430.
Таблица 43 0. Кристаллическая структура и полиморфные превращения
элементов системы Но—Тт
Атомный номер элемента Моди- фикация Прото- тип, структура Параметры решет- ки, нм Темпе- ратура, °C Реакция превращения Источник
а С
67, Но — Mg, ГПУ 0,35778 0,56178 1474 1485 Ж » Но ЖГПУ ₽ жоцк [1] [31
69, Тт — Mg, ГПУ 0,35375 0,55540 1545 1655 Ж - Тт ЖГПУ •* жоцк Ц] [3]
Но—Тт
1009
Тт,%(по массе)
Рис. 545. Но—Тт
Можно предположить, что Но и Тт образуют непрерывные ряды
идеальных твердых растворов с ГПУ структурой типа Mg. Линии
ликвидуса и солидуса на диаграмме Но-Tm (рис. 545) вследствие
идеальности растворов должны, так же как на экспериментально
построенной диаграмме Но—Ег [2], сливаться в одну прямую, соеди-
няющую их температуры плавления с очень узкой двухфазной
областью между ними.
Но и Тт не испытывают полиморфного превращения ГПУ * ОЦК
в твердом состоянии вблизи температуры плавления [М, 1], но
имеют изменение ближнего порядка в жидкости: Жгпу Жоцк при
1485 и 1655 °C соответственно [3]. Поскольку жидкие растворы Но
и Тт также идеальны, на диаграмме проведена прямая линия ликви-
дуса, разделяющая области с Жгпу и ЖОцК ближним порядком.
Литература
1. Gschneidner, Jr., К.A., Calderwood F.W. // Handbook on the Physics and Chemis-
try of Rare Earths. Amsterdam, New York, Oxford, Tokyo: North-Holland Physics Publi-
shing Co., 1986. V. 8. Chap. 54. P. 1-161.
2. Spedding F.H., Sandeen B., Beaudry B.J. 11 J. Less-Common Met. 1973. V. 31.
P. 1.
3. Григорович В.К., Григорович К.В. Строение и свойства металлических и
шлаковых расплавов: Тезисы докладов на VII Всесоюзной конференции. Челябинск.
ЧПИ, 1990. Т. 2. № 2. С. 250-252.
В.К. Григорович
1010
Ho—U, Ho—V
Но—и. ГОЛЬМИЙ-УРАН
Для взаимодействия Но и U характерна несмешиваемость в
жидком состоянии [Э]. В работе [Э] отмечено, что растворимость Но
в жидком U, по данным одной из работ, при температуре 1250 °C
равна 0,11 % (ат.), а при температуре 1150 °C — 0,36 % (атл. По
другой работе, растворимость Но в жидком U при температуре
1200 °C составляет 0,072 % (ат.), а растворимость Но в (aU) — менее
0,02 % (ат.).
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Но—V. ГОЛЬМИЙ-ВАНАДИЙ
Диаграмма состояния Но—V приведена на рис. 546 согласно работе
[М]. В работе [1] приведены данные о том, что все системы РЗМ—V,
кроме Sc, монотектического типа.
При температуре выше 1890 °C в системе существует область
несмешиваемости компонентов в жидком состоянии с содержанием
V от -15 до -98 % (ат.); обнаружены эвтектическая и монотектичес-
Ев К °/° (am) V
Рис. 546. Но—V
Ho—W, Ho-Y
1011
кая точки, имеющие координаты: 1405 °C и 8 % (ат.) V и 1890 °C и
-98 % (ат.) V- При температуре 1405 °C Но растворяет до 0,5 %
(ат.) V.
Двойных соединений нет.
дитература
1. Е.И. Гладышевский, О.И. Бодак. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа. 1982. 255 с.
А.С. Адамова
Ho—W. ГОЛЬМИЙ-ВОЛЬФРАМ
Диаграмма состояния Но—W не построена. Растворимость W
чистотой 99,9 % (по массе) в Но чистотой 99,8 % (по массе) приве-
дена ниже [ 1 ]:
Температура, °C ..............................1639 1785 1872 2050 2072
Растворимость W:
% (ат.)...................................... 0,249 0,589 0,517 1,798 2,221
% (по массе)............................. 0,278 0,656 0,576 2,000 2,459
Растворимость W в жидком Но при температуре его плавления
(1474 °C) составляет около 0,075 % (ат.).
Литература
1. Dennison D.H., Tschetter M.J., Gschneidner, Jr., K.A. 11 J. I,ess- Common Met.
1966. V. 11. N 6. P. 423-435.
К.Б. Поварова
Ho—Y. ГОЛЬМИЙ—ИТТРИЙ
Диаграмма состояния Но—Y построена в работе [1].
Сплавы синтезировали из дистиллированных Но чистотой 99,6 %
(по массе) и Y чистотой 99,6 % (по массе) в дуговой печи в атмос-
фере очищенного Не. При исследовании были использованы методы
рентгеновского, микроскопического и некоторых других анализов.
Было установлено, что линия солидуса в системе представляет
собой приблизительно прямую линию, соединяющую точки плавле-
ния Y и Но, а между низкотемпературными модификациями с гекса-
гональной решеткой образуется непрерывный ряд твердых растворов,
вторы работы [1] предполагали также образование непрерывных
твердых растворов между высокотемпературными ОЦК модификаци-
ями Но и Y.
с 9Огласно работе [2] в Но отсутствует полиморфное превращение
образованием высокотемпературной ОЦК фазы. Учитывая это,
Но)°РЫ ра^оты [3] предположили, что ОЦК твердый раствор (0Y,
является ограниченным и в системе имеет место перитектическое
1012
Но-Yb
Рис. 547. Но—Y
превращение Ж + (0Y, Но) * (aY, Но). По приблизительной оценки,
предельная концентрация (0Y, Но) равна 8,5 % (ат.) Y, температура
реакции -1480 °C [М].
Представленная на рис. 547 диаграмма состояния Но—Y построена
с учетом данных работ [1, 3, 4J. Двухфазные области Ж + (0Y, Но):
Ж + (aY, Но) и (0Y, Но) + (aY, Но) ввиду их узости представлены
как линии, а линия, соответствующая перитектическому превраще-
нию Ж + (0Y, Но) * (aY, Но), как точка (1480 °C).
Литература
1. Маркова И.А., Терехова В.Ф., Савицкий Е.М. // Изв. АН СССР. Неорганичес-
кие материалы. 1967- Т. 3. № 7. С- 392—394.
2. Spedding F.H., Sandeen В., Beaudry B.J. 11 J. Less-Common Met. 1973. V' 31
P. 1.
3. Gschneidner, Jr., K.A., Calderwood F.W. 11 Handbook on the Physics and Chemis
try of Rare Earths. Amsterdam. New York. Oxford. Tokyo: North-Holland Physics Pubh
shing Co., 1986. V. 8. Chap. 54. P. 1—161.
4. Gschneidner, Jr., K.A. //J. Less-Common Met. 1985. V. 114. N 1. P. 29—42.
Е.И. Гладышевский, О.И. Бодак, В.К. Пе-шрска '
Но—Yb. ГОЛЬМИЙ—ИТТЕРБИЙ
В работе [MJ сообщается, что в системе Но—Yb не образуются
соединения и, вероятно, имеет место несмешиваемость в жидком
состоянии.
Ho—Zn, Ho—Zr
1013
Ho-Zn. ГОЛЬМИЙ-ЦИНК
Сведения о диаграмме состояния Ho—Zn касаются лишь существо-
вания в этой системе соединений между Но и Zn.
Для исследования структуры этих соединений использовался метод
рентгеноструктурного анализа. Кристаллическая структура соедине-
ний приведена в табл. 431 [1].
Таблица 43 1. Кристаллическая структура соединений системы Ho—Zn
Соединение Прототип Символ Пирсона, ир. гр. Параметры решетки, нм
а b с
HoZn CsCl сР2, РтЗт 0,3547 — —
HoZn2 KHg2 Imma 0,4456 0,7039 0,7641
HoZn3 YZn3 оР1Ь, Рпта 0,6697 0,4366 1,0099
Ho6Zn23 Th6Mn23 с/Тб, ГтЗ т 1,265 — —
HO|3Zn5s Hol3Zn58 Р6Лтс 1,421 — 1,397
HoZn5 EuMg5 Р63/ттс 0,8866 — 0,9188
Ho2Zn]7 I h2 i j j /гР38, Р6}/ ттс 0,8963 — 0,8747
Ho2Zn17 I h2Zn|7 ЛЯ19, R3m 0,8956 — 1,3133
HoZn,2 ThMnI2 J126, 74/ ттт 0,8868 — 0,5195
Литература
1. Е.И. Гладышевский, О.И. Бодак. Кристаллохимия интерметаллических соедине-
ний редкоземельных металлов. Львов: Вища школа, 1982. 255 с.
Е.И. Гладышевский, О.И. Бодак, В.К. Печарский
Ho—Zr. ГОЛЬМИЙ-ЦИРКОНИЙ
Диаграмма состояния системы Ho—Zr экспериментально нс по-
строена. В работе [ 1 ] диаграмма Но—Zr построена в предположении
сходства ее с диаграммами других редкоземельных металлов с Zr. Но
повышает температуру полиморфного превращения Zr. При темпера-
туре перитектоидной реакции 905 °C в (aZr) растворяется -3,7 %
(ат.) Но, в (pZr) -1,1 % (ат.) Но [Э].
1014
Ио-Zr
В работе [2] исследование богатых Zr сплавов выполнено метода
ми измерения термического расширения, удельного электросопротив-
ления и температурного коэффициента электросопротивления. Со-
гласно работе [2] температура превращения фазы на основе Zr
повышается до -950 °C с увеличением содержания Но до -8,5
(ат.).
Диаграмма состояния системы Но—Zr на рис. 548 построена с
учетом предположения об эвтектическом характере этой системы
[11 и данных работы [2] о влиянии Но на температуру превращения
Рис. 548. Но—Zr
Ho—Zr
1015
Температура плавления Но и отсутствие полиморфного превраще-
ния в Но соответствует данным работы [3].
Точное определение координат перитектоидной реакции затрудня-
ло присутствие примесей в сплавах.
107
При резкой закалке из жидкого состояния (скорость охлаждения
°C/с), практически во всем интервале концентраций получен
непрерывный ряд метастабильных твердых растворов с ГПУ структу-
рой (а') [4, 5]. Параметры решетки фазы а' обнаруживают отрица-
тельное отклонение от правила Вегарда, наименьшее отклонение
наблюдалось при концентрации 58 % (ат.) Zr (наиболее нестабиль-
ная область).
Литература
1. Moffatt W.G. Handbook of Binary Phase Diagrams. New York: Business Growth
Services. General Electric Co. Schenactady, 1981. V. 3. 385 p.
2. landelli L„ Burr A. 11 J. AppL Physics. 1962. V. 33. N 9. P. 2689-2690.
3. Spedding F.H., Sandeen B., Beaudry B.J. // J. Less-Common Met. 1973. V. 31.
P. 1-13.
4. Wang R. 11 Met. Trans. 1972. V. 3. N 5. P. 1213-1221.
5. Wang R., Kim LB. // Ibid. 1974. V. 5. N 9. P. 1973-1977.
Л.А. Третьяченко
ОГЛАВЛЕНИЕ
Предисловие . . 5 Со—Sb. Кобальт—сурьма ... 75
Cf—Мо. Калифорний—молибден . . 8 Со—Sc. Кобальт—скандий . . . . ... 77
Cl—Мо. Хлор—молибден . . 8 Со—Se. Кобальт—селен 79
Cl—Re. Хлор—рений . 10 Со—Si. Кобальт—кремний . . . . . . 80
Cl-Те. Хлор—теллур . 11 Со—Sm. Кобальт—самарий . . . . ... 82
Cm—Сг. Кюрий—хром . . 11 Со—Sn. Кобальт—олово ... 86
Cm—О. Кюрий—кислород . 12 Со-Та. Кобальт—тантал ... 88
Co—Cr. Кобальт—хром . 13 Со—ТЬ. Кобальт—тербий . . . 9С
Co—Cu. Кобальт—медь . 15 Со-Тс. Кобальт—технеций . . . ... 91
Co-Dy. Кобальт—диспрозий . . . . . 17 Со—Те. Кобальт—теллур ... 91
Co—Er. Кобальт—эрбий . 19 Со—Th. Кобальт—торий ... 93
Co—Fe. Кобальт—железо . 22 Со—Ti. Кобальт—титан . . . 95
Co—Ga. Кобальт—галлий . 23 Со-Т1. Кобальт—таллий . . . 97
Co—Gd. Кобальт—гадолиний . . . . . 26 Со-Tm. Кобальт—тулий ... 9^
Co—Ge. Кобальт—германий . 30 Со—Li. Кобальт—уран ... 97
Co-H. Кобальт—водород . 32 Co-V. Кобальт—ванадий . . . . QO
Co—Hf. Кобальт—гафний . 33 Co—W. Кобальт—вольфрам . . . . . 100
Co—Ho. Кобальт—гольмий . 35 Co-Y. Кобальт—иттрий . . 102
Co—In. Кобальт—индий . 37 Co—Yb. Кобальт—иттербий . . . . . 104
Co-Ir. Кобальт—иридий . 39 Co-Zn. Кобальт—цинк . . 105
Co—K. Кобальт—калий . 40 Co—Zr. Кобальт—цирконий . . . . . 10.’
Co—La. Кобальт—лантан . 40 Cr—Cs. Хром—цезий ..11 0
Co—Li. Кобальт—литий . 43 Cr—Cu. Хром—медь . . 1 1 2
Co—Lu. Кобальт—лютеций . 44 Cr—Dy. Хром—диспрозий . . . . . . 115
Co—Mg. Кобальт—магний . 44 Cr—Er. Хром—эрбий . . 116
Co—Mn. Кобальт—марганец . 46 Cr—Eu. Хром—европий . . 117
Co-Mo. Кобальт—молибден . 47 Cr—Fe. Хром—железо . . 118
Co—N. Кобальт—азот . 49 Cr—Ga. Хром—галлий . . 1 20
Co-Na. Кобальт—натрий . 50 Cr—Gd. Хром—гадолиний . . . . . . 122
Co—Nb. Кобальт—ниобий . 51 Cr—Ge. Хром—германий . . 1 23
Co—Nd. Кобальт—неодим . 53 Cr—H. Хром—водород . . 1 26
Co-Ni. Кобальт—никель . 56 Cr—Hf. Хром—гафний . . 126
Co-O. Кобальт—кислород . 58 Cr—Hg. Хром—ртуть . . 129
Co—Os. Кобальт—осмий . 59 Cr-Ho. Хром—гольмий . . 130
Co-Pb. Кобальт—свинец . 60 Cr—In. Хром—индий . 131
Co—Pd. Кобальт—палладий . 61 Cr—Ir. Хром—иридий . . 13?
Co-Pr. Кобальт—празеодим . . . . . 63 Cr-K. Хром—калий . . 1 зз
Co-Pt. Кобальт—платина . 67 Cr—La. Хром—лантан . . 134
Co—Pu. Кобальт—плутоний . 68 Cr—Li. Хром—литий . . 135
Co—Re. Кобальт—рений . 70 Cr—Lu. Хром—лютеций . . 13’'
Co—Rh. Кобальт—родий . 72 Cr—Mg. Хром—магний . . 137
Co—Ru. Кобальт—рутений . 73 Cr-Mn. Хром—марганец . . 137
Co-S. Кобальт—сера . 73 Cr—Mo. Хром—молибден . . 140
зд Оглавление 1017
Cr-N. Хром—азот . . . 142 Cs—Мо. Цезий—молибден . . . . . 217
Cr—Na. Хром—натрий . . . 144 Cs-N. Цезий—азот . . . 217
Cr—Nb. Хром—ниобий ... 144 Cs—Na. Цезий—натрий . . . 218
ITcr-Nd. Хром—неодим . . . 146 Cs—Nb. Цезий—ниобий . . . 219
Я Cr—Ni. Хром—никель . . . 148 Cs—0. Цезий—кислород . . . 219
№ Cr-Np. Хром—нептуний . . . . . . . 149 Cs—Pb. Цезий—свинец ... 221
Ж Сг~° Хром—кислород . . . . ... 150 Cs-Pr. I [езий—празеодим . . . . 222
uE Cr—Os. Хром—осмий . . . 152 Cs—Rb. Цезий—рубидий . . . • . . . 222
ж Сг-Р Хром—фосфор . . . 154 Cs-S. Цезий—сера ... 223
и Сг—РЬ. Хром—свинец ... 156 Cs—Sb. Цезий—сурьма . . . 224
К Cr—Pd. Хром—палладий . . . . ... 157 Cs—Se. Цезий—селен ... 225
К Сг—Рг. Хром—празеодим . . . . . . 159 Cs—Si. Цезий—кремний . . . . . . . 226
R Cr-Pt. Хром—платина ... 161 Cs-Sn. Цезий—олово . . . 226
Ж' Сг—Ри. Хром—плутоний . . . . ... 163 Cs—Sr. Цезий—стронций . . ... 227
в Cr-Rb. Хром—рубидий . . . . ... 164 Cs—Те. Цезий—теллур . . . 228
IG ' Cr—Re. Хром—рений ... 165 Cs—Ti. Цезий—титан ... 229
Ё Cr—Rh. Хром—родий ... 167 Cs—TI. Цезий—таллий ... 230
Г-. Cr-Ru. Хром—рутений ... 169 Cs-V. Цезий—ванадий . . . . . . . 232
ft Cr—S. Хром—сера ... 171 Cs-Y. Цезий—иттрий ... 232
Й1 Cr—Sb. Хром—сурьма ... 174 Cs—Zn. Цезий—цинк ... 233
[ Cr—Sc. Хром—скандий ... 176 Cs—Zr. Цезий—цирконий . . . ... 233
Cr—Se. Хром—селен ... 177 Cu—Dy. Медь—диспрозий . . . . . 234
!' Cr—Si. Хром—кремний . . . . ... 179 Cu—Er. Медь—эрбий . . . 236
Cr—Sm. Хром—самарий . . . . ... 182 Cu—Eu. Медь—европий ... 238
Cr—Sn. Хром—олово ... 183 Cu—Fe Медь—железо . . . 240
Cr—Ta. Хром—тантал ... 184 Cu—Ga. Медь—галлий ... 243
> Cr—Tb. Хром—тербий ... 187 Cu—Gd. Медь—гадолиний . . ... 247
Cr-Tc. Хром—технеций . . . . ... 188 Cu—Ge. Медь—германий . . . ... 249
Cr—Те. Хром—теллур ... 189 Cu—H. Медь—водород .... . . . 252
[ Cr-Th. Хром—торий ... 192 Cu-Hf. Медь—гафний . . . . . . 253
1 Cr-Ti. Хром—титан ... 193 Cu—Hg. Медь—ртуть . . . 256
Cr—Tm. Хром—тулий ... 195 Cu—Ho. Медь—гольмий .... • . . 257
Cr-U. Хром—уран ... 197 Cu—In. Медь—индий . . 259
Cr-V. Хром—ванадий ... 198 Cu-Ir. Медь—иридий .... ... 263
Cr—W. Хром—вольфрам . . . . ... 199 Cu-K. Медь—калий • • . 264
Cr-Y. Хром—иттрий .... ... 200 Cu—La. Медь—лантан . . . 265
! Cr—Yb. Хром—иттербий . . . ... 201 Cu—Li. Мед1>—литий • . 267
Cr—Zn. Хром—цинк ... 202 Cu—Lu. Медь—лютеций . . .
‘ Cr-Zr. Хром—цирконий . . ... 204 Cu—Mg. Медь—магний ... 270
Cs—Cu. Цезий—медь ... 206 Cu—Mn. Медь—марганец . . . ... 273
Cs—Fe. Цезий—железо .... ... 206 Cu—Mo. Медь—молибден . . . 275
К Cs—Ga. Цезий—галлий .... ... 207 Cu—N. Медь—азот ... 276
1* Cs—Ge. Цезий—германий . . ... 208 Cu—Na. Медь—натрий . . 277
I Cs-H. Цезий—водород . . . ... 210 Cu—Nb. Медь—ниобий .... 278
f Cs—Hf. Цезий—гафний . . . ... 210 Cu—Nd. Медь—неодим • . 279
f Cs—Hg. Цезий—ртуть ... 211 Cu—Ni. Медь—никель • • . 283
I Cs—In. Цезий—индий .... ... 212 Cu—O- Медь—кислород . . . . 285
j Cs-K. Цезий—калий .... ... 214 Cu—Os. Медь—осмий • . 287
j Cs-Li. Цезий—литий .... ... 215 Cu—P Медь—фосфор .... • 287
| Cs—Mg. Цезий—магний .... ... 216 Cu-Pb. Медь—свинец • • 288
1018
Оглавление
Оглавление
1019
Cu—Pd. Медь—палладий......... 290
Си—Pm. Медь—прометий........292
Си—Ро. Медь—полоний......... 293
Си—Рг. Медь—празеодим ...... 293
Си—Pt. Медь—платина......... 295
Си—Pu. Медь—плутоний........ 297
Си—Rb. Медь—рубидий......... 299
Си—Re. Медь—рений .......... 299
Си—Rh. Медь—родий .......... 299
Cu—Ru. Медь—рутений......... 301
Cu-8S. Медь—сера............ 301
Си—Sb. Медь—сурьма.......... 306
Си—Sc. Медь—скандий......... 309
Си—Se. Медь—селен........... 311
Си—Si. Медь—кремний......... 316
Си—Sm. Медь—самарий......... 320
Cu—Sn. Медь—олово........... 323
Си—Sr. Медь—стронций.........327
Си—Та. Медь—тантал.......... 328
Си—ТЬ. Медь—тербий.......... 329
Си—Тс. Медь—технеций......... 331
Си—Те. Медь—теллур.......... 331
Си—Th. Медь—торий .......... 335
Cu—Ti. Медь—титан........... 337
Си—Т1. Медь—таллий.......... 341
Си—Тт. Медь—тулий ......... 342
Си—U. Медь—уран ........... 344
Си—V. Медь—ванадий......... 345
Си—W. Медь—вольфрам......... 347
Си—Y. Медь—иттрий.......... 348
Си—Yb. Медь—иттербий ....... 350
Cu—Zn. Медь—цинк............ 352
Си—Zr. Медь—цирконий......... 356
D—Fe. Дейтерий—железо ..... 361
D—Nb. Дейтерий—ниобий ..... 362
D—Та. Дейтерий—тантал....... 363
D—V. Дейтерий—ванадий...... 364
D—Zr. Дейтерий—цирконий . . . 365
Dy—Ег. Диспрозий—эрбий ..... 367
Dy—Fe. Диспрозий—железо...... 368
Dy—Ga. Диспрозий—галлий..... 370
Dy— Н Диспрозий—водород .... 371
Dy—Hg. Диспрозий—ртуть....... 372
Dy—Но. Диспрозий—гольмий .... 373
Dy—In. Диспрозий—индий ..... 374
Dy—1г. Диспрозий—иридий .... 376
Dy—La. Диспрозий—лантан...... 376
Dy—Lu. Диспрозий—лютеций . . . 377
Dy—Mg. Диспрозий—магний .... 379
Dy—Мп. Диспрозий—марганец . . . 380
Dy—Мо. Диспрозий—молибден . . ;
Dy—Nb. Диспрозий—ниобий ....
Dy—Nd. Диспрозий—неодим .... Зл /
Dy—Ni. Диспрозий—никель..... 3^3
Dy—РЬ. Диспрозий—свинец.......
Dy—Pd. Диспрозий—палладий . . . з^,
Dy—Pr. Диспрозий—празеодим . . ЗХ’
Dy—Pm. Диспрозий—прометий . . . 330
Dy—Re. Диспрозий—рений........р)
Dy—S. Диспрозий—сера ......З'г
Dy—Sb. Диспрозий—сурьма..... 3‘Н
Dy—Sc. Диспрозий—скандий .... J'U
Dy—Si. Диспрозий—кремний . . . Зил
Dy—Sm. Диспрозий—самарий .... 3%
Dy—Та. Диспрозий—тантал..... 398
Dy—Tb. Диспрозий—тербий..... 39')
Dy—Те. Диспрозий—теллур.....40!
Dy—Th. Диспрозий—торий . 41,-.’
Dy—Тт. Диспрозий—тулий .. 40.>
Dy—W Диспрозий—вольфрам . . . 404
Dy—Y. Диспрозий—иттрий..... 405
Dy—Zr. Диспрозий—цирконий . . . 40(>
Er—Fe. Эрбий—железо........ 408
Er—Ga. Эрбий—галлий........ 410
Er—Gd. Эрбий—гадолиний .....41 1
Er—Ge. Эрбий—германий.......4!.’
Er—Н. Эрбий—водород ...... 414
Er—Hf. Эрбий—гафний ........ 4! 4
Er—Hg. Эрбий—ртуть.......... 41 <
Ег—Но. Эрбий—гольмий........ 41 /
Er—In. Эрбий—индий ........ 418
Er—La. Эрбий—лантан........ 419
Er—Lu. Эрбий—лютеций ...... 420
Er—Mg. Эрбий—магний........ 422
Ег—Мп. Эрбий—марганец ..... 423
Ег—Мо. Эрбий—молибден....... 42-!
Er—Nb. Эрбий—ниобий........ 424
Er—Nd. Эрбий—неодим.........425
Er—Ni. Эрбий—никель........ 420
Ег—О. Эрбий—кислород ..... 427
Er—Pd. Эрбий—палладий....... 428
Er—Pm. Эрбий—прометий....... 43<>
Ег—Ро. Эрбий—полоний........ 432
Ег—Рг. Эрбий—празеодим .... 432
Er—Pt. Эрбий—платина........ 434
Er—Pu. Эрбий—плутоний....... 43<>
Er—Re. Эрбий—рений ....... 43(>
Er—Rh. Эрбий—родий ........ 43"
Er—S. Эрбий—сера.......... 439
Er—Sb. Эрбий—сурьма........ 439
Er—Sc. Эрбий—скандий . . 440 Eu-Y. Европий—иттрий . . . . . . 485
Er—Se. Эрбий—селен . . 441 Eu—Yb. Европий—иттербий . . . . . 485
Er—Sm. Эрбий—самарий . . 442 Eu-Zn. Европий—цинк . . 486
Er—Sn. Эрбий—олово . . 444 Eu-Zr. Европий—цирконий . . . . 486
Er-Та. Эрбий—тантал . . 445 F-Ru. Фтор—рутений . . 488
Er—Tb. Эрбий—тербий . . 446 Fe—Ga. Железо—галлий . . 488
Er—Те. Эрбий—теллур . . 447 Fe—Gd. Железо—гадолиний . . . . 491
Er—Th. Эрбий—торий . . 448 Fe—Ge. Железо—германий . . . . . 493
Er—Ti. Эрбий—титан . . 450 Fe-H. Железо—водород . . . . . . 496
Er—Tm. Эрбий—тулий . . 451 Fe—Hf. Железо—гафний . . 497
Er-V. Эрбий—ванадий . . 452 Fe—Hg. Железо—ртуть . . 499
Er—W. Эрбий—вольфрам . . . . . . 453 Fe—Ho. Железо—гольмий . . . . . . 500
Er-Y. Эрбий—иттрий . . 453 Fe-In. Железо—индий . . 501
Er-Zr. Эрбий—цирконий . . . . . . 454 Fe-Ir. Железо—иридий . . 503
Eu—Ga. Европий—галлий . . . . . . 455 Fe—K. Железо—калий . . 504
Eu—Ge. Европий—германий . . . . 457 Fe—Kr. Железо—криптон . • • . . 504
Eu-H. Европий—водород . . . . . . 459 Fe—La. Железо—лантан . . 505
Eu—Hf. Европий—гафний . . . . . . 459 Fe—Li. Железо—литий . . 506
Eu—Hg. Европий—ртуть . . 460 Fe—Lu. Железо—лютеций . . . . . . 506
Eu—In. Европий—индий . . 460 Fe—Mg. Железо—магний . . 508
Eu-Ir. Европий—иридий . . . . . . 462 Fe—Mn. Железо—марганец . . . . . 509
Eu—La. Европий—лантан . . . . . . 462 Fe—Mo. Железо—молибден . . . . . 511
Eu—Mg. Европий—магний . . . . . . 463 Fe—N. Железо—азот . . 513
Eu—Mn. Европий—марганец . . . . . 464 Fe—Na. Железо—натрий . . 515
Eu-N. Европий—азот . . 465 Fe—Nb. Железо—ниобий . . 515
Eu—Nb. Европий—ниобий . . . . . . 465 Fe—Nd. Железо—неодим . . 518
Eu—Ni. Европий—никель . . . . . . 465 Fe—Ni. Железо—никель . . 520
Eu—0. Европий—кислород . . . . . 466 Fe—0. Железо—кислород ’. . . . . 522
Eu-P. Европий—фосфор . . . . . . 467 Fe-Os. Железо—осмий . . 524
Eu-Pb. Европий-свинец . . . . . . 469 Fe-P. Железо—фосфор . . . . . . 526
Eu-Pd. Европий—палладий . . . . 470 Fe—Pb. Железо—свинец . . 527
Eu-Po. Европий—полоний . . . . . 472 Fe-Pd. Железо—палладий . . . . . 528
Eu—Pt. Европий—платина . . . . . 472 Fe—Pm. Железо—прометий . . . . . 531
Eu-Pu. Европий—плутоний . . . . 474 Fe—Pr. Железо—празеодим . . 532
Eu—Re. Европий—рений . . 474 Fe—Pt. Железо—платина . . . . . . 533
Eu—S. Европий—сера . . 475 Fe—Pu. Железо—плутоний . . . . . 536
Eu—Sb. Европий—сурьма . . . . . . 476 Fe—Re. Железо—рений . . 538
Eu—Sc. Европий—скандий . . . . . 477 Fe—Rh. Железо—родий . . 540
Eu—Se. Европий—селен . . 477 Fe—Rn. Железо—радон . . 542
Eu—Si. Европий—кремний . . . . . 478 Fe—Ru. Железо—рутений . . . . . . 542
Eu—Sm. Европий—самарий . . . . . 479 Fe—S. Железо—сера . . 543
Eu—Sn. Европий—олово . . 479 Fe—Sb. Железо—сурьма . . 545
Eu—Ta. Европий—тантал . . . . . . 480 Fe—Sc. Железо—скандий . . . . . . 547
Eu—Те. Европий—теллур . . . . . . 480 Fe-Se. Железо—селен . . 549
Eu—Th. Европий—торий . . 482 Fe-Si. Железо—кремний . . . . . . 551
Eu—Ti. Европий—титан . . 482 Fe—Sm. Железо—самарий . . . . . . 554
Eu—TI. Европий—таллий . . . . . . 482 Fe—Sn. Железо—олово . . 556
Eu—U. Европий—уран . . 483 Fe-Sr. Железо—стронций . . . 558
Eu—V. Европий—ванадий . . . . . 483 Fe-T. Железо—тритий . . 558
Eu—W. Европий—вольфрам . . . . 484 Fe-Ta. Железо—тантал ... . . 558
1020
Оглавление
Оглавление
1021
Fe—Tb. Железо—тербий......... 561
Fe—Tc. Железо—технеций ..... 563
Fe—Те. Железо—теллур......... 565
Fe—Th. Железо—торий......... 567
Fe—Ti. Железо—титан..........569
Fe—Т1. Железо—таллий.........571
Fe—Тт. Железо—туллий.........572
Fe—U. Железо—уран ..........574
Fe—V. Железо—ванадий........576
Fe—W. Железо—вольфрам.......578
Fe—Y. Железо—иттрий.........580
Fe—Yb. Железо—иттербий ..... 582
Fe—Zn. Железо—цинк ..........584
Fe—Zr. Железо—цирконий....... 586
Ga—Gd. Галлий—гадолиний.....591
Ga—Ge. Галлий—германий ......593
Ga—Н. Галлий—водород........594
Ga—Hf. Галлий—гафний......... 595
Ga—Hg. Галлий—ртуть ....... 586
Ga—Ho. Галлий—гольмий ......597
Ga—I. Галлий—йод .......... 600
Ga—In. Галлий—индий......... 601
Ga—1г. Галлий—иридий........ 603
Ga—К. Галлий—калий......... 604
Ga—La. Галлий—лантан ....... 606
Ga—Li. Галлий—литий......... 608
Ga—Lu. Галлий—лютеций........611
Ga—Mg. Галлий—магний........ 613
Ga—Mn. Галлий—марганец .... 615
Ga—Мо. Галлий—молибден .... 618
Ga—N. Галлий—азот ......... 619
Ga—Na. Галлий—натрий........ 619
Ga—Nb. Галлий—ниобий......... 621
Ga—Nd. Галлий—неодим........ 624
Ga—Ni. Галлий—никель........ 626
Ga—О. Галлий—кислород.......629
Ga—Os. Галлий—осмий......... 629
Ga—Р. Галлий—фосфор......... 630
Ga—РЬ. Галлий—свинец ....... 630
Ga—Pd. Галлий—палладий ..... 632
Ga—Рг. Галлий—празеодим...... 634
Ga—Pt. Галлий—платина ...... 637
Ga—Ри. Галлий—плутоний ..... 640
Ga—Rb. Галлий—рубидий ...... 642
Ga—Re. Галлий—рений......... 644
Ga—Rh. Галлий—родий.........645
Ga—Ru. Галлий—рутений .......645
Ga—S. Галлий—сера.......... 646
Ga—Sb. Галлий—сурьма ....... 647
Ga—Sc. Галлий—скандий ...... 649
Ga—Sc. Ga—Si. Галлий—селен Галлий—кремний .... 65 ] 6 Г,
Ga—Sm. Галлий—самарий ь.Ч
Ga—Sn. Галлий—олово 657
Ga—Sr. Галлий—стронций ... 058
Ga—Ta. Галлий—тантал 659
Ga—Tb. Галлий—тербий 660
Ga—Те. Галлий—теллур 6 03
Ga-Th. Галлий—торий 665
Ga—Ti. Галлий—титан 66р
Ga-Tl. Галлий—таллий 668
Ga—Tm. Галлий—тулий 669
Ga-U. Галлий—уран (Pl
Ga-V. Галлий—ванадий 67 3
Ga-W. Галлий—вольфрам 676
Ga-Y. Галлий—иттрий 676
Ga—Yb. Галлий—иттербий 67.s
Ga—Zn. Галлий—цинк 681
Ga—Zr. Галлий—цирконий
Gd—He. Гадолиний—германий . . . 685
Gd-H. Гадолиний—водород . . . t: 8 7
Gd—Hg. Гадолиний—ртуть
Gd—Ho. Гадолиний—гольмий .... 690
Gd-ln. Гадолиний—индий 6'1!
Gd-Ir. Гадолиний—иридий .... t>93
Gd—La. Гадолиний—лантан . . . 6'>4
Gd—Lu. Гадолиний—лютеций . . . 6‘Г~
Gd—Mg. Гадолиний—магний . . (.97
Gd—Mn. Гадолиний—марганец . . . 60S
Gd—Mo. Гадолиний—молибден . . 7.Ю
Gd—N. Гадолиний—азот 701
Gd—Nb. Гадолиний—ниобий . . 702
Gd—Nd. Гадолиний—неодим .... 702
Gd—Ni. Гадолиний—никель 703
Gd—O. Гадолиний—кислород . . . 705
Gd-Os. Гадолиний—осмий .... 706
Gd-P. Гадолиний—фосфор . . . 700
Gd-Pb. Гадолиний—свинец .... 7и7
Gd-Pd. Гадолиний—палладий . . 70S
Gd—Pm. Гадолиний—прометий . . 71 1
Gd-Po. Гадолиний—полоний . . . 712
Gd-Pr. Гадолиний—празеодим . 713
Gd-Pt. Гадолиний—платина . . 7 4
Gd—Pu. Гадолиний—плутоний . . 716
Gd—Re. Гадолиний—рений 7! S
Gd-Rh. Гадолиний—родий 71 9
Gd—Ru. Гадолиний—рутений . . 72'
Gd-S. Гадолиний—сера 723
Gd-Sb. Гадолиний—сурьма 725
Gd-Sc. Гадолиний-скандий ... 7?^
Gd—Se. Гадолиний—селен......728
Gd—Si. Гадолиний—кремний . . . 730
Gd—Sm- Гадолиний—самарий .... 731
Gd—Sn. Гадолиний—олово...... 733
Gd—Та. Гадолиний—тантал.....734
Gd—Tb. Гадолиний—тербий..... 735
Gd—Tc. Гадолиний—технеций . . . 735
Gd—Те. Гадолиний—теллур..... 736
Gd—Th. Гадолиний—торий ..........737
Gd—Ti. Гадолиний—титан...... 739
Gd—TI. Гадолиний—таллий..... 740
Gd—Тт. Гадолиний—тулий ........ 742
Gd—U. Гадолиний—уран ....... 743
Gd —V. Гадолиний—ванадий .... 743
Gd—W. Гадолиний—вольфрам . . . 744
Gd—Y. Гадолиний—иттрий....... 744
Gd—Yb. Гадолиний—иттербий . . . 745
Gd—Zn. Гадолиний—цинк........ 747
Gd—Zr. Гадолиний—цирконий ... 748
Ge—Н. Германий—водород.......749
Ge—Hf. Германий—гафний....... 750
Ge—Hg. Германий—ртуть ...... 751
Ge—Но. Германий—гольмий .... 751
Ge—In. Германий—индий........ 754
Ge—1г. Германий—иридий....... 755
Ge—К. Германий—калий.........755
Ge—La. Германий—лантан ..... 757
Ge—Li. Германий—литий........ 759
Ge—Lu. Германий—лютеций .... 760
Ge—Mg. Германий—магний ..... 762
Ge—Мп. Германий—марганец .... 763
Ge—Мо. Германий—молибден .... 765
Ge—N. Германий—азот .........768
Ge—Na. Германий—натрий ..... 768
Ge—Nb. Германий—ниобий ..... 769
Ge—Nd. Германий—неодим ......772
Ge—Ni. Германий—никель ..... 774
Ge—О. Германий—кислород .... 776
Ge—Os. Германий—осмий........ 777
Ge—Р. Германий—фосфор........778
Ge—Pb. Германий—свинец ......779
Ge—Pd. Германий—палладий .... 780
Ge—Pr. Германий—празеодим . . . 782
Ge—Pt. Германий—платина .... 785
Ge—Ри. Германий—плутоний .... 786
Ge—Rb. Германий—рубидий .... 787
Ge—Re. Германий—рений........ 788
Ge—Rh. Германий—родий........ 789
Ge—Ru. Германий—рутений .... 791
Ge—S. Германий—сера ........ 792
Ge—Sb. Германий—сурьма ......... 793
Ge—Sc. Германий—скандий .... 794
Ge—Se. Германий—селен .......... 796
Ge—Si. Германий—кремний .... 798
Ge—Sm. Германий—самарий .... 800
Ge—Sn. Германий—олово .......... 802
Ge—Sr. Германий—стронций .... 803
Ge—Та. Германий—тантал.... 804
Ge—ТЬ. Германий—тербий ......... 805
Ge—Те. Германий—теллур ......... 807
Ge—Th. Германий—торий .......... 808
Ge—Ti. Германий—титан .......... 810
Ge—Т1. Германий—таллий ......... 812
Ge—Тт. Германий—тулий..... 812
Ge—U. Германий—уран...... 814
Ge—V. Германий—ванадий .... 816
Ge—W. Германий—вольфрам ... 819
Ge—Y. Германий—иттрий ......... 820
Ge—Yb. Германий—иттербий .... 822
Ge—Zn. Германий—цинк...... 823
Ge—Zr. Германий—цирконий . . . 824
Н—Hf. Водород—гафний .......... 827
Н—Hg. Водород—ртуть...... 828
Н—Но. Водород—гольмий.... 828
Н—1г. Водород—иридий .......... 829
Н—К. Водород—калий ........... 829
Н—La. Водород—лантан..... 830
Н—Li. Водород—литий ........... 832
Н—Lu. Водород—лютеций ......... 833
Н—Mg. Водород—магний .......... 834
Н—Мп. Водород—марганец... 836
Н—Мо. Водород—молибден... 837
Н—Na. Водород—натрий .......... 838
Н—Nb. Водород—ниобий .......... 839
Н—Nd. Водород—неодим.....841
Н—Ni. Водород—никель..... 843
Н—Np. Водород—нептуний... 844
Н—Os. Водород—осмий ........... 845
Н—Ра. Водород—протактиний . . 845
Н—РЬ. Водород—свинец..... 845
Н—Pd. Водород—палладий...845
Н—Ро. Водород—полоний ......... 847
Н—Рг. Водород—празеодим .... 847
Н—Pt. Водород—платина.... 848
Н—Ри. Водород—плутоний... 848
Н—Rb. Водород—рубидий.... 850
Н—Re. Водород—рений ........... 850
Н—Rh. Водород—родий ........... 850
И—Ru. Водород—рутений.... 851
II—Sb. Водород—сурьма..... 852
1022
Оглавление
Н—Sc. Водород—скандий
Н—Si. Водород—кремний
И—Sm. Водород—самарий
Н—Sn. Водород—олово
Н—Sr Водород—стронций
Н—Та. Водород—тантал
н-ть. Водород—тербий
Н—Th. Водород—торий
H-Ti. Водород—титан
H-TI. Водород—таллий
Н—Tm. Водород—тулий
H-U. Водород—уран
1I-V. Водород—ванадий
H-W. Водород—вольфрам
Il-Y. Водород—иттрий
H-Yb. Водород—иттербий
H—Zn. Водород—цинк
H—Zr. Водород—цирконий . . .
Hf—In. Гафний—индий
Hf—Ir. Гафний—иридий
Hf-K. Гафний—калий
Hf-Li. Гафний—литий
Hf—Mn. Гафний—марганец
Hf—Mo Гафний—молибден
Hf-N Гафний—азот
Hf-Na. Гафний—натрий
Hf—Nb. Гафний—ниобий
Ilf—Ni. Гафний—никель
Hf-O. Гафний—кислород
Hf—Os. Гафний—осмий
Hf-P. Гафний—фосфор
Ilf—Pd. Гафний—палладий
Hf—Pr. Гафний—празеодим . . . .
Hf-Pt. Гафний—платина
Hf—Pu. Гафний—плутоний
I If—Rb. Гафний—рубидий
Hf—Re. Гафний—рений
Hf-Rh. Гафний—родий
Hf—Ru. Гафний—рутений
Hf-S. Гафний—сера
Hf-Sb. Гафний—сурьма
Hf—Sc. Гафний—скандий
Hf—Se. Гафний—селен
Hf-Si. Гафний—кремний
Hf-Sn. Гафний—олово
Hf-Га. Гафний—тантал
Hf—Tc. Гафний—технеций
Hf—Те. Гафний—теллур
Hf-Th. Гафний—торий
Hf—Ti. Гафний—титан
852
853
855
856
857
858
860
861
862
864
865
865
866
868
868
870
870
871
874
874
876
877
878
879
881
883
884
885
889
890
892
892
894
895
897
898
899
901
903
905
905
906
907
907
909
911
912
913
914
915
Hf—U. Гафний—уран .......... 9 к,
Hf—V. Гафний—ванадий........ 917
Hf—W. Гафний—вольфрам....... 91s
Hf—Y. Гафний—иттрий........ 92п
Hf—Yb. Гафний—иттербий ..... 921
Hf—Zn. Гафний—цинк ......... 922
Hf—Zr. Гафний—цирконий....... 92?
Hg—Но. Ртуть—гольмий ....... 924
Hg—In. Ртуть—индий.......... 925
Hg—1г. Ртуть—иридий......... 927
Hg—К. Ртуть—калий.......... 928
Hg—1л. Ртуть—лантан ........ 929
Hg—Li. Ртуть—литий.......... 93!
Hg—Lu. Ртуть—лютеций......... 933
Hg—Mg. Ртуть—магний ........ 933
Hg—Мп. Ртуть—марганец........ 935
Hg—Мо. Ртуть—молибден....... 935
Hg—N. Ртуть—азот ......... 93(>
Hg—Na. Ртуть—натрий ........ 939
Hg—Nd. Ртуть—неодим ........ 938
Hg—Ni. Ртуть—никель ........ 939
Hg—О. Ртуть—кислород........ 940
Hg—РЬ. Ртуть—свинец ........ 941
Hg—Pd. Ртуть—палладий........ 942
Hg—Po. Ртуть—полоний ....... 943
Hg—Pr. Ртуть—празеодим....... 943
Hg—Pt. Ртуть—платина ....... 945
Hg—Ри. Ртуть—плутоний....... 949
Hg—Rb. Ртуть—рубидий ........94"
Hg—Re. Ртуть—рений.......... 945
Hg—Rh. Ртуть—родий.......... 949
Hg—Ru. Ртуть—рутений ........950
Hg—S. Ртуть—сера .......... 950
Hg—Sb. Ртуть—сурьма ........ 951
Hg—Sc. Ртуть—скандий ....... 952
Hg—Sc. Ртуть—селен ......... 953
Hg—Si. Ртуть—кремний ....... 954
Hg—Sm. Ртут,.—самарий ....... 95 *
Hg—Sn. Ртуть—олово ......... 956
Hg—Sr. Ртуть—стронций....... 957
Hg—Та. Ртуть—тантал......... 959
Hg—Tb. Ртуть—тербий ........ 959
Hg—Th. Ртуть—торий ......... 961
Hg—Ti. Ртуть—титан ......... 962
Hg—TI. Ртуть—таллий ........ 963
Hg—Тт. Ртуть—тулий.......... 965
Hg—U. Ртуть—уран........... 965
Hg—V. Ртуть—ванадий ....... 966
Hg—W. Ртуть—вольфрам ...... 967
Hg—Y. Ртуть—иттрий..........967
Оглавление
1023
Hg—Yb. Ртуть—иттербий......969
Hg—Zn. Ртуть—цинк.......... 970
Hg—Zr. Ртуть—цирконий ..... 972
Но—In. Гольмий—индий....... 972
Но—1г. Гольмий—иридий...... 974
Но—La. Гольмий—лантан ..... 975
Но—Lu. Гольмий—лютеций..... 977
Но—Mg. Гольмий—магний...... 978
Но—Мп. Гольмий—марганец.... 980
Ho—N. Гольмий—азот ....... 981
Но—Nb. Гольмий—ниобий...... 982
Но—Nd. Гольмий—неодим......982
Но—Ni. Гольмий—никель ..... 984
Но—О. Гольмий—кислород.... 985
Но—Os. Гольмий—осмий....... 986
Но—Р. Гольмий—фосфор...... 986
Но—РЬ. Гольмий—свинец ......986
Но—Pd. Гольмий—палладий .... 987
Но—Pm. Гольмий—прометий .... 988
Но—Ро. Гольмий—полоний .... 990
Но—Рг. Гольмий—празеодим .... 990
Но—Pt. Гольмий—платина .... 991
Но—Ри. Гольмий—плутоний .... 992
Но—Re. Гольмий—рений....... 992
Но—Rh. Гольмий—родий.........992
Но—Ru. Гольмий—рутений ...... 993
Ho—S. Гольмий—сера........... 994
Но—Sb. Гольмий—сурьма ........994
Но—Sc. Гольмий—скандий ...... 996
Но—Se. Гольмий—селен ........ 998
Но—Si. Гольмий—кремний....... 999
Но—Sm. Гольмий-самарий .... 1000
Но—Sn. Гольмий—олово ....... 1002
Но—Та. Гольмий—тантал ...... 1002
Но—ТЬ. Гольмий—тербий ...... 1003
Но—Тс. Гольмий—технеций . . . 1004
Но—Те. Гольмий—теллур ...... 1004
Но—Th. Гольмий—торий......... 1006
Но—Т1. Гольмий—таллий ...... 1007
Но—Тт. Гольмий—тулий......... 1008
Но—U. Гольмий—уран........... 1010
Но—V. Гольмий—ванадий .... 1010
Но—W. Гольмий—вольфрам ... 1011
Но—Y. Гольмий—иттрий ....... 1011
Но—Yb. Гольмий—иттербий .... 1012
Ho—Zn. Гольмий—цинк......... 1013
Ho—Zr. Гольмий—цирконий ... 1013
СПРАВОЧНОЕ ИЗДАНИЕ
ДИАГРАММЫ СОСТОЯНИЯ двойных
МЕТАЛЛИЧЕСКИХ СИСТЕМ
Том 2
Редактор Н.Г. Сальникова
Художник В. Н. Погорелов
Художественный редактор Т.Н. Погорелова
Технический редактор О.В. Панкрашина
Корректоры А.П. Сизова, Л.Е. Сонюшкина
н/к
Лицензия ЛР № 080003 от 12.09.96.
Сдано в набор 06.01.97. Подписано в печать 21.08 97
Формат 60x88 1/16. Бумага офсетная. Гарнитура Таймс. Печать офсетная
Усл.неч.л. 63,21. Усл.кр.-отт. 63,21. Уч.-изд.л. 66,48
Тираж 1030 экз. Заказ 2444.
Ордена Трудового Красного Знамени издательство ’’Машиностроение”
107076, Москва, Стромынский пер., 4
Отпечатано в АООТ ”Политех-4”
129110, Москва, Б. Переяславская ул., 46,
с оригинал-макета, изготовленного в издательстве ’’Машиностроение”