Author: Конюхов Б.В.
Tags: общая генетика общая цитогенетика иммуногенетика эволюционное учение видообразование филогенез биология зоология генетические основы
Year: 1980
ИЗДАТЕЛЬСТВО «НАУКА»
ГЕНЕТИКА
РАЗВИТИЯ
ПОЗВОНОЧНЫХ
АКАДЕМИЯ НАУК СССР
ИНСТИТУТ ОБЩЕЙ ГЕНЕТИКИ
Б.В.КОНЮХОВ
ГЕНЕТИКА
РАЗВИТИЯ
ПОЗВОНОЧНЫХ
ИЗДАТЕЛЬСТВО «НАУКА»
МОСКВА 1980
УДК 575.113 596
Конюхов Б. В. Генетика развития позвоночных. М.: Наука,
1980.
В книге дается детальный обзор и теоретический анализ со-
временных достижений в изучении генетических основ разви-
тия человека и позвоночных животных. Рассмотрены особен-
ности действия генов в онтогенезе, в частности синхронность ак-
тивации аутосомных аллельных генов, случаи аллельного ис-
ключения, взаимодействие генных эффектов и плейотропия.
Специальные главы посвящены регуляции активности генов,
экспрессии генов в раннем развитии, генетическому контролю
процессов размножения и дифференцировки клеток, а также
морфогенеза. Обсуждаются молекулярные основы эмбриональ-
ной индукции и детерминации, клональная теория цитодиффе-
ренцировки и возникновения опухолей.
Рассчитана на генетиков и широкий круг биологов.
Ил. 59, табл. 10, библ. 946 казн
Ответственный редактор
чл.-корр. АН СССР Н. Г. ХРУЩОБ
Konyukhov В. V. Developmental genetics of vertebrates. Moscow;
Nauka, 1980.
A comprehensive analysis of the world literature relating
to the mechanisms of genetic control of human and vertebrate
animal development is given in the book. It contains much new
information concerning the specificity of gene action in ontoge-
nesis thus promoting our understanding genic regulation of
cell proliferation and differentiation as well as morphogenesis.
The molecular basis of embryonic induction and determination,
the clonal theory of cytodifferentiation, genetic programmed
cell death and the problem of aging are considered. The author
reports in detail his own experimental data on the mechanisms
of gene action during mammalian development.
The book will be useful reference for a wide range of
biologists and physicians.
„ 21003—068
К 055(02)—80 KH‘ 2’ © Издательство «Наука», 1980 г.
ВВЕДЕНИЕ
*
Развитие позвоночных начинается с оплодотворенной яйце-
клетки (зиготы), которая делится на две клетки, или бластомеры,
затем в результате их деления образуется 4 клетки и так далее,
пока не возникнет взрослый организм, состоящий из большого
числа клеток. Некоторые крупные млекопитающие состоят из
нескольких миллиардов клеток, что требует многочисленных
клеточных делений. Увеличение числа клеток сопровождается
возникновением существенных различий между ними, что обус-
ловлено их разной специализацией, или, как говорят, дифферен-
цировкой. Развитие организмов включает не только размноже-
ние и дифференцировку клеток, но также их перемещения, отми-
рание клеток на определенных стадиях онтогенеза и объедине-
ние (интеграцию) разных клеточных комплексов в ткани и
органы. Каждый из этих процессов (деление, движение, диффе-
ренцировка, интеграция и гибель клеток) является, конечно,
сложным и состоит из множества других процессов, в основе ко-
торых лежат простые химические реакции.
Еще до возникновения генетики как науки изучением меха-
низмов развития занимались эмбриологи, которыми уже в конце
прошлого века были получены убедительные факты о решающем
значении клеточных ядер в процессах онтогенеза. Так, в своих
исследованиях по гибридизации морских ежей Бовери [Boveri,
1893] поставил ряд опытов с целью выяснения вопроса, является
ли ядро единственным носителем наследственных свойств. Он
оплодотворял нормальные яйца и безъядерные фрагменты яиц
одного вида спермой другого вида. Образующиеся из оплодотво-
ренных безъядерных яиц так называемые мерогониальные (га-
плоидные) гибриды развивались в точном соответствии с отцов-
ским типом, а настоящие (диплоидные) гибриды образовывали
структуры промежуточного или гибридного характера. Эти опы-
ты ясно показали, что наследственные детерминанты, контроли-
рующие ход развития организма, содержатся в ядре, так как
мерогониальные гибриды получали от мужских половых клеток
(спермиев) в основном ядерный компонент.
После возникновения генетики в начале нашего столетия в
течение нескольких десятилетий генетика и эмбриология разви-
3
вались практически независимыми путями: генетики исследова-
ли проблему наследственной передачи признаков, а эмбриологи
анализировали закономерности онтогенеза, почти не привлекая
для этого понятий и данных генетики. Это было обусловлено
незрелостью генетики и, в частности, недостаточностью знаний
о гене и причинной цепи ген->-признак. Заметное объединение
генетики и эмбриологии, т. е. становление генетики развития как
науки, началось в 40—50-х годах, что совпадает с возникнове-
нием молекулярной биологии. Несмотря на «молодость», гене-
тикой развития получено много фактов, свидетельствующих о
том, что развитие организма находится под строгим генетиче-
ским контролем. Общий принцип такого контроля сейчас поня-
тен: различные стадии онтогенеза контролируются разными ге-
нами и в результате взаимодействия их продуктов происходит
возникновение структурных и функциональных особенностей
того или иного организма.
Немецкий биолог Геккер [Haecker, 1918] дал определение
феногенетики как науки, которая изучает возникновение призна-
ков взрослого организма, спускаясь ретроспективно до как мож-
но более ранних стадий их генетического контроля. Он указы-
вал, что основной задачей феногенетики является выяснение за-
путанных связей между признаками и лежащими в их основе
наследственными факторами. Гольдшмидт [Goldschmidt, 1938]
назвал такого рода исследования физиологической генетикой.
В настоящее время многие авторы относят работы, связанные с
изучением действия генов в онтогенезе, к разряду генетики раз-
вития. Некоторые исследователи, например Готлиб [Gottlieb,
1966], усматривают в данных терминах даже небольшие смысло-
вые различия. Однако следует признать, что все эти термины
выражают одно и то же понятие, а именно изучение механизмов
реализации наследственной информации в онтогенезе. Термин
«физиологическая генетика» для этих целей не подходит, так как
под ним сейчас понимают генетический контроль физиологиче-
ских процессов.
Реализация в онтогенезе генетической информации, записан-
ный чередованием нуклеотидов в ДНК зиготы, осуществляется в
результате непрерывных взаимовлияний ядра и цитоплазмы. Еще
в 1909 г. польский биолог Годлевский [Godlewski] в своей моно-
графии «Проблема наследственности в свете механики разви-
тия» обратил внимание, что в явлениях наследственности лежит
тесное взаимодействие ядра и цитоплазмы. Он полагал, что как
ядро, так и цитоплазма должны содержать определенные веще-
ства, регулирующие процессы развития. Н. К. Кольцов [1935] в
статье «Роль гена в физиологии развития» подчеркивал важную
роль обмена веществ между ядром и цитоплазмой в регуляции
активности генов в онтогенезе. В связи с этим он считал необ-
ходимым связать физиологию развития или, как ее раньше назы-
вали, механику развития с генетикой, цитологией и биохимией,
4
отмечая, что эти научные дисциплины поторопились отмеже-
ваться ДРУГ от ДРУга и пойти независимой дорогой. В течение
последних трех десятилетий со времени разработки методов
пересадки ядер соматических клеток в энуклеированные яйца
амфибий и гибридизации соматических клеток получено много
фактов, свидетельствующих о том, что активность генов в боль-
шой степени зависит от цитоплазмы. При этом экспрессия генов
может регулироваться на уровне транскрипции, в течение про-
цессинга и транспорта иРНК из ядра в цитоплазму, а также на
трансляционном и посттрансляционном уровнях (см. гл. 2).
В ходе развития происходит постоянное взаимодействие на-
следственных и экзогенных факторов. На формирование некото-
рых наследственно обусловленных так называемых количествен-
ных признаков, как, например, рост и вес тела, влияют условия
среды. Другие признаки, в частности цвет глаз, группы крови,
синтез определенных структурных белков и ферментов, опреде-
ляются исключительно генетически и не зависят от внешних
факторов. Влияние экзогенных факторов, а также сложные вза-
имодействия генных продуктов приводят к изменению экспрес-
сии генов, вследствие чего генные эффекты нередко сильно
варьируют, а в некоторых случаях даже совсем не проявляются.
Н. В. Тимофеев-Рессовский [1925] предложил понятия феноти-
пического проявления и выражения гена. Он указывал, что изу-
чение условий фенотипического проявления генов очень важно
для понимания явлений наследственности и должно быть одной
из основных проблем феногенетики. Отсутствие такого материа-
ла, по его мнению, не позволяло в то время связать менделизм
с механикой и физиологией развития, без чего нельзя создать
реального представления о природе гена и его действии в онто-
генезе. Несколько позднее понятия фенотипического проявления
и выражения гена стали использоваться в генетике под англий-
скими терминами пенетрантность и экспрессивность генов [Timo-
feef-Ressovsky, 1927].
Механизмы специфической активации генов в определенных
клеточных системах остаются пока неясными. Если иметь в виду,
что в течение индивидуального развития человека и других ви-
дов позвоночных функционируют более 100 тыс. генов, то можно
себе представить, насколько трудным является выяснение ме-
ханизмов генетического контроля такого сложного и многосту-
пенчатого процесса, каким является онтогенез. Даже при иссле-
довании роли генов в становлении какого-либо отдельного при-
знака мы сталкиваемся с большими трудностями, так как уже
давно известно, что развитие каждого признака контролируется
многими генами и представляет собой цепь последовательных
генных взаимодействий, проявляющихся в определенных усло-
виях среды [Рокицкий, 1929]. Анализ эффектов мутантных генов,
нарушающих отдельные этапы онтогенеза, позволяет исследо-
вать генетический контроль конкретных процессов развития.
5
Генетика человека и мыши изучена значительно лучше по
сравнению с другими видами позвоночных. Из 2735 исследован-
ных признаков человека для 1314 тип наследования четко уста-
новлен, а для 1421—является предположительным [McKusick,
1978]. Несмотря на то что у человека известно вдвое больше ге-
нов, чем у мыши, число локализованных на хромосомах мыши
локусов примерно в 1,5 раза больше.
В феногенетическом аспекте лучше других видов позвоноч-
ных изучена мышь, что обусловлено большой скоростью размно-
жения и удобствами содержания этих животных. Эмбриональ-
ный период развития мыши составляет 19—21 день, к 2—3 мес.
эти животные достигают половозрелости, и за год можно полу-
чить 3—4 поколения. Хорошо исследованы эмбриология [Rugh,
1968] и генетика мыши [Green, 1966а, 1975]: известно около 600
локусов, причем более 300 из них локализованы на хромосомах,
в результате чего составлены довольно подробные карты хромо-
сом.
Значительное число публикаций имеется по феногенетике
амфибий и курицы, что обусловлено доступностью этих объек-
тов для экспериментального анализа. Относительно неплохо из-
учено действие некоторых генов в онтогенезе человека [Hsia,
1968].
Многие данные свидетельствуют о большом сходстве эффек-
тов гомологичных генов у человека и различных видов позво-
ночных животных [Конюхов, 1969], что находится в полном со-
ответствии с законом гомологических рядов в наследственной из-
менчивости Н. И. Вавилова [Vavilov, 1922]. Согласно данному за-
кону, чем ближе располагаются виды друг к другу в своем эво-
люционном родстве, тем больше должно быть у них гомологич-
ных генов. Принимая во внимание большое сходство в строении,
развитии и функционировании тканей и органов у позвоночных,
в особенности у теплокровных, есть все основания считать, что
у них имеется много гомологичных локусов. У представителей
класса млекопитающих таких локусов должно быть еще больше.
Поэтому анализ действия генов у животных одного какого-либо
вида, например мыши, проливает свет на характер и механизмы
действия гомологичных генов как у других видов животных, так
и у человека.
Для анализа данных о действии генов в развитии большой
интерес представляют факты и интерпретации эмбриологов-экс-
периментаторов. С другой стороны, наследственное торможение
роста или даже полное выключение из развития зачатков опре-
деленных тканей или органов в результате действия мутантных
генов дает материал для понимания механизмов взаимодействия
различных тканевых закладок между собой. Следовательно, за-
дачи генетики развития и эмбриологии во многом сходны, и по-
лученные каждой из этих дисциплин факты проливают свет на
сложные механизмы онтогенеза высших организмов.
6
В президентской речи, посвященной открытию XI Междуна-
родного конгресса генетиков в Гааге, Хэдорн (Hadorn, 1965], из-
вестный своими блестящими исследованиями по феногенетике
дрозофилы, подчеркнул, что в течение ближайших нескольких
десятилетий генетика развития будет представлять одно из
центральных направлений генетической науки. Прошедшие после
данного конгресса полтора десятилетия подтвердили эти слова.
В докладе на открытии II съезда Всесоюзного общества гене-
тиков и селекционеров им. Н. И. Вавилова Б. Л. Астауров [1972,
с. 547] говорил: «Я твердо уверен, что именно решение проблем
осуществления наследственной информации в процессах индиви-
дуального развития, проблем генетики развития стало сейчас
направлением главного удара не только генетики, но и всей
современной общей биологии».
Создание с ранних этапов развития наиболее благоприятных
условий для лучшего проявления того или иного генотипа может
способствовать совершенствованию человека, а также повыше-
нию продуктивности сельскохозяйственных животных. Следова-
тельно, изучение реализации наследственной информации в он-
тогенезе представляет не только теоретический интерес для
понимания генетического контроля формирования организма, но
имеет также большое практическое значение. От накопления
сведений в этой области зависит возможность управления инди-
видуальным развитием.
Глава 1
ДЕЙСТВИЕ ГЕНА
*
Веществом, отвечающим за сохранение и передачу генетиче-
ской информации из поколения в поколение, является, как из-
вестно, дезоксирибонуклеиновая кислота (ДНК), которая обна-
ружена у животных организмов в хромосомах и митохондриях.
Митохондриальные гены в отличие от ядерных контролируют
лишь немногие признаки. Количество хромосомной ДНК в гап-
лоидной клетке человека — спермии или яйцеклетке — состав-
ляет 3 пг. Если вытянуть в одну нить эту ДНК, то длина такой
нити составит 0,9 м, а длина хромосомной ДНК зиготы— 1,8 м.
Количество информации в такой нити ДНК огромно, благодаря
чему из микроскопически малой зиготы (диаметром около
0,1 мм) возникает такой сложный организм, как человек.
Многие факты свидетельствуют в пользу модели строения
хромосом эукариотов, представленной одной двухцепочечной
нитью ДНК [Prescott, 1970; Збарский, 1971; Evans, 1973]. К эу-
кариотам относят все организмы, имеющие оформленное ядро,
к прокариотам — микробы и сине-зеленые водоросли. Основным
структурным элементом хромосом эукариотов являются хрома-
тиновые волокна, состоящие из ДНК и гистонов. Каждая хро-
матида представляет собой одно хроматиновое волокно, идущее
из конца в конец хроматиды и многократно сложеннее. Хрома-
тиновое волокно, в свою очередь, состоит из нуклеосом; каждая
нуклеосома — комплекс из восьми молекул гистонов (по две мо-
лекулы четырех основных гистонов Н2А, Н2В, НЗ и Н4), вокруг
которого обвивается нить ДНК протяженностью около 140 пар
нуклеотидов. Диаметр нуклеосомы — 83±23 А, среднее расстоя-
ние между нуклеосомами—140 А, межнуклеосомный отрезок
ДНК включает в среднем 60 пар нуклеотидов. Цепь нуклеосом
образует спираль второго порядка с диаметром 30—50 нм. Фор-
мирование толстых и коротких метафазных хромосом зависит от
спирализации тонких профазных хромосом, которые образуют
закономерно расположенные изгибы. В анафазе и телофазе ми-
тоза происходит диффузная деконденсация хроматина [Evans,
1977].
8
Исследования последних лет показали, что молекулярная ор-
ганизация генов эукариотов существенно отличается ст органи-
зации генов прокариотов. Если у прокариотов все гены пред;
ставляют собой непрерывную последовательность кодонов, обес-
печивающую кодирование колинеарной последовательности
аминокислот в соответствующей белковой молекуле, то у эука-
риотов многие гены являются мозаичными, они имеют вставки
неинформационной —«молчащей» —ДНК. Так, для гена 0-гло-
бина (гемоглобина) кролика вставка равна примерно 700 парам
оснований, а кодирующая часть гена составляет только 438 пар
оснований.’ В гене овальбумина курицы обнаружено 4 вставки
молчащей ДНК длиной до 7000 пар оснований. Такая структура
гена предполагает наличие механизма превращения первичного
транскрипта путем вырезания из него участков молчащей ДНК
в зрелую молекулу информационной РНК (иРНК), способную
к трансляции кода в рибосомах. Вставки молчащей ДНК, воз-
можно, не транскрибируются, а иРНК синтезируется отдельны-
ми кусками, которые в ходе процессинга объединяются [William-
son, 1977]. Вставки неинформационной ДНК в генах эукариотов
было предложено называть интронами, а функциональные участ-
ки ДНК — эксонами. Н. П. Дубинин [1978] считает более прием-
лемым участки кодонов обозначать как кодирующую ДНК, со-
До изменения
f иш-----м
А 8 С
После изменения
А С 8
2Г -ш-и—м—
А в С
j 1111 ttt tft 11
А В С С С
?ис’Три типа устойчивых изменений ДНК, влияющих на активность генов
Lno Gurdon, 1974]
^асток хромосомы содержит гены А, В, С. К типу / относятся изменения взаимного по-
ложения генов; // — изменения числа копий данного гена (амплификация); /// — каче-
ственные изменения в структуре самого гена. Изменение информации, закодированной в
генах, мутация (/), делеция (2) и постоянная инактивация (<?). Постоянная инактивация
гена не обязательно ведет к качественным изменениям в структуре гена, этот тип измене-
ни также включен в схему, поскольку результаты инактивации генов нельзя отличить
от их мутаций или делений в соматических клетках
9
кращенно кдДНК (cdDNA), молчащие участки — млДНК
(slDNA), а всю структуру таких гетерогенных систем — мозаич-
ной организацией гена.
Выделяют три основные категории изменений генома, которые
влияют на активность тех или иных генов: изменения взаимо-
расположения генов, их числа и информационного содержания
отдельных генов (рис. 1).
Для генов характерны две функции: точная репликация себя
в каждом поколении и детерминирование структуры рибонукле-
иновых кислот, необходимых для белкового синтеза. На хромо-
сомах происходит «переписывание» (транскрибирование) гене-
тической информации с ДНК на РНК, а в цитоплазме на иРНК
идет синтез полипептидных цепей, так называемый процесс
трансляции — перевод наследственной информации со структуры
иРНК в структуру белковой молекулы. При этом информация
кодируется несколько иным способом — последовательностью
аминокислот. Следовательно, декодирование генетической ин-
формации представляет двухфазный процесс: транскрипцию и
трансляцию. Посредством ферментов, которые являются белками
и катализируют соответствующие химические реакции, гены
влияют на синтез небелковых составных частей клетки, в частно-
сти углеводов и жиров. Ферменты необходимы также для синте-
за и репликации ДНК.
Действие гена является одной из основных проблем генетики
развития. Как реализуется ген в признак, из каких звеньев со-
стоит этот процесс, в какой клеточной системе ген действует и
где проявляются его вторичные эффекты, когда ген включается
в действие и как долго он активен — вот далеко не полный круг
вопросов, связанных с этой проблемой.
Первичным эффектом гена является РНК- Гены, обеспечи-
вающие продукцию больших количеств таких специальных ви-
дов РНК, как транспортные (т) и рибосомные (р), представлены
многочисленными копиями. Для синтеза определенных белков
иРНК, как правило, транскрибируются с уникальных последова-
тельностей нуклеотидов ДНК- Для синтеза рРНК и тРНК ис-
пользуется (в качестве матриц) менее 1% всей клеточной ДНК,
хотя они составляют в сумме около 98% РНК клетки [Watson,
1970]. У высших организмов основную массу иРНК цитоплазмы
составляют иРНК, имеющие «среднее» время жизни — период
их полураспада колеблется в пределах 2—24 ч; иРНК для тка-
неспецифических белков, таких, например, как глобины и кри-
сталлины, имеют более продолжительный срок жизни и могут
быть отнесены к «долгоживущим». К категории «короткоживу-
щих» иРНК, характеризующихся временем полураспада 20—
60 мин, относятся немногие иРНК, кодирующие синтез гистонов
и некоторых ферментов [см. Нейфах, Тимофеева, 1977].
Образование того или иного белка в ходе развития может
свидетельствовать об активации соответствующих структурных
10
енов Однако продукция белка часто зависит от регуляции его
г нтеза на различных посттранскрипционных уровнях. Данные
диетического анализа и использование методов избирательного
подавления синтеза РНК позволяют определить регуляцию син-
теза белка на уровне транскрипции.
Кодоминантный характер проявления генных эффектов
на биохимическом уровне
Мутантные рецессивные гены так же активны, как и их до-
минантные нормальные («дикие») аллели. Мутации чаще приво-
дят к изменению генного продукта, чем к его отсутствию. При
этом количество синтезируемого мутантного белка обычно такое
же, как и нормального. Большинство мутаций (70—75%) обус-
ловлено мононуклеотидными заменами, что приводит к замеще-
нию одной из аминокислот в полипептидной цепи, контролируе-
мой данным геном. Примерно в 2—6% случаев такого рода му-
таций происходит сдвиг места окончания синтеза полипептидной
цепи, вследствие чего образуется короткая или более длинная
полипептидная цепь, чем в норме [Hopkinson, 1972]. «Мутантные»
белки, как правило, не имеют нормальной функциональной ак-
тивности. Так, с помощью моновалентной антисыворотки против
антигемофилического глобулина — фактора VIII свертывающей
системы крови — показано, что в плазме больных гемофилией А
содержится такое же количество иммунопреципитирующего ма-
териала, как и у здоровых людей, т. е. количество мутантного
антигенофилического глобулина не отличается от нормы. Одна-
ко мутантный белок не обладает нормальной функциональной
активностью [Ratnoff, Jones, 1977].
Мутантные структурные и функциональные белки нередко
характеризуются нестабильностью, а ферменты — полной или
частичной неактивностью. Недостаточная активность того или
иного фермента является причиной возникновения более 140
наследственных болезней человека [McKusick, 1978]. При помо-
щи иммунологических методик установлено, что в эритроцитах
людей, больных галактоземией, присутствует неактивный фер-
мент галактозо-1-фосфатуридилтрансфераза, антигенные свой-
ства которого идентичны или очень сходны с активной молеку-
лой этого фермента, полученного из эритроцитов здоровых ин-
дивидов [Tedesco, Mellman, 1971]. В эритроцитах мышей с аката-
леземией содержится такое же количество белка каталазы, как
и в норме. Однако каталаза мутантов не обладает нормальной
ферментной активностью [Feinstein, 1970].
В настоящее время широко используется заместительная те-
рапия наследственных энзимопатий у человека путем введения
нормальных ферментов. В некоторых случаях данный метод ле-
чения оказывается неэффективным и иногда приводит к смер-
тельным исходам. Это связано с тем, что синтезируемый у боль-
11
ных неактивный аномальный белок в антигенном отношении от-
личается от нормального белка. Поэтому вводимый нормальный
белок распознается организмом больного как антигенно чуже-
родный материал. Мутантные белки по способности реагировать
с антисывороткой против соответствующего нормального белка
делятся на перекрестно реагирующие и перекрестно нереагирую-
щие. Заместительная терапия у больных с перекрестно нереаги-
рующими мутантными белками неэффективна и часто сопро-
вождается неблагоприятными последствиями. Высокая разре-
шающая способность иммунологических методов может быть
использована для уточнения молекулярного дефекта мутантно-
го белка. Боер и соавторы [Воуег е. а., 1973] изучили иммуноло-
гические свойства мутантных белков у больных с наследствен-
ными дефектами обмена веществ и обнаружили 190 перекрестно
реагирующих и 70 перекрестно нереагирующих мутантных бел-
ков. Исследование иммунологических свойств белкового про-
дукта мутантного гена Ьрн, обусловливающего ахондроплазию
у мыши, показало, что этот белок отличается в антигенном от-
ношении от белка, синтез которого контролируется соответст-
вующим нормальным аллелем данного локуса [Конюхов, Мали-
нина, Бугрилова и др., 1976].
В гетерозиготном состоянии уровень активности того или
иного фермента Обычно является промежуточным по отношению
к уровням активности данного фермента у нормального и гомо-
зиготного по этому мутантному гену индивидов. Так, у пациен-
тов с наследственным нарушением метаболизма холестерина
(болезнь Вольмана) активность лизосомной кислой липазы со-
ставляет лишь 10% от уровня активности этого фермента у нор-
мальных индивидов, а у гетерозигот — примерно 50% от нормы
[Cortner е. а., 1976].
Для белков сыворотки крови, в частности трансферринов и
гаптоглобинов, характерен такой же тип наследования, т. с.
каждый аллельный ген проявляет свои эффекты независимо от
того, находится ли он в гомо- или гетерозиготном состоянии
[Buettner-Janusch, 1970]. Нами было показано, что в экстрактах,
полученных из тканей 13-дневных эмбрионов мышей, гетерози-
готных по аутосомному рецессивному гену Ьрн, содержится вдвое
меньше продукта этого мутантного гена по сравнению с экст-
рактами из эмбрионов bpH/bpH такого же срока развития [Бугри-
лова, Конюхов, 1971]. У человека имеется более ста тысяч раз-
ных белков, и каждый индивид может быть гетерозиготен по
многим генам, контролирующим синтез редких и строго семей-
ных аномальных белков. Если для гетерозигот такие мутантные
белки, как правило, не причиняют серьезных беспокойств, то у
гомозигот они нередко являются причиной возникновения тя-
желых аномалий.
В тех случаях, когда имеются три или больше копий гена
вместо двух, как в норме, активность соответствующего фермен-
Г2
та оказывается повышенной. Исследование электрофоретических
вариантов глюкозофосфатизомеразы и НАДФ-изоцитратдегидро-
геназы в мышиных гетероплоидных клеточных линиях, содержа-
щих 3 или 4 копии хромосом с соответствующими генными локу-
сами, показало, что все добавочные аллели гиперплоидных хро-
мосом проявляются в равной степени [Farber, 1973]. А. Д. Тамар-
кина и соавторы [1977] исследовали активность цитоплазмати-
ческой супероксиддисмутазы-1 в эритроцитах двух групп людей:
у 17 больных с синдромом Дауна (трисомия 21) и 26 здоровых
индивидов. В группе больных активность фермента была в 1,56
раза выше по сравнению с нормой, что, очевидно, является ре-
зультатом увеличения дозы соответствующего структурного гена,
локализованного в 21-й хромосоме. У индивидов с трисомией по
12-й хромосоме активность лактатдегидрогеназы В и глицераль-
дегидфосфатдегидрогеназы, генные локусы которых локализова-
ны на этой хромосоме, увеличена в среднем в 1,5 раза по срав-
нению с нормой [Preto е. а., 1977].
Мутантные гены, контролирующие синтез аномальных гемо-
глобинов, так же, как и их нормальные аллели, проявляют свои
эффекты в гомо- и гетерозиготном состояниях, т. е. все эти гены
являются кодоминантными. Причем следует отметить, что ненор-
мальных (мутантных) полипептидных цепей гемоглобина обра-
зуется, очевидно, такое же количество, как и нормальных. Отме-
ченное некоторыми авторами уменьшение количества того или
иного мутантного гемоглобина по сравнению с нормальными
типами вероятнее всего обусловлено более ранней деградацией
ненормальных цепей, их дефектной сборкой или денатурацией
уже образованного тетрамера. Не имеется каких-либо достовер-
ных данных о нарушении транскрипции или трансляции в этих
случаях [White, 1972].
При талассемиях наблюдается частичное или полное отсут-
ствие а- или р-полипептидных цепей, что приводит к деструкции
эритроидных клеток и в конечном итоге — к анемии. В большин-
стве случаев исследованных талассемий установлена частичная
недостаточность или даже полное отсутствие иРНК для а- или
р-полипептидных цепей. а-Талассемии обусловлены делецией
соответствующих структурных генов, а отсутствие или уменьше-
ние количества иРНК при р-телассемиях может быть связано с
нарушением транскрипции или процессинга, вследствие чего
нРНК не выходит в цитоплазму. Имеющие измененную структу-
ру иРНК могут не вступать в соответствующие взаимодействия
£ Рибосомами или определенными цитоплазматическими вещест-
ами, в результате чего происходит их быстрая деградация [Ka-
ff1’ Koler, 1975; Nigon, Godet, 1976; Weatherall, Clegg, 1976].
причиной некоторых форм р-талассемий является нарушение
трансляции иРНК. Так, если добавить иРНК из эритроидных
семТ<*К пациентов> страдающих некоторыми формами р°-талас-
Ии> в бесклеточную систему, содержащую лишенный РНК
13
экстракт из нормальных клеток, то начинается синтез 0-поли-
пептидных цепей. Кроме того, синтез 0-полипептидных цепей в
эритроидных клетках таких больных начинается после перели-
вания им крови здоровых людей. Это указывает на то, что такие
заболевания обусловлены мутацией гена, контролирующего син-
тез фактора, необходимого для трансляции р-полипептидных це-
пей [Conconi, Senno, 1974]. Несмотря на отсутствие белкового
продукта, такого рода гены следует также причислить к разряду
активных, так как на них синтезируется РНК.
Пейджен [Paigen, 1970], заключая симпозиум по генетичес-
кому контролю метаболизма у млекопитающих, подчеркнул,
что сейчас твердо установлен кодоминантный характер действия
структурных генов: в период активности аутосомных генов у ге-
терозигот проявляются эффекты обоих аллелей.
Синхронность активации
аутосомных аллельных генов
Каждый ген вступает в действие на конкретной стадии раз-
вития. Для определения времени активации гена ретроспективно
исследуют (гистологически, цитологически или биохимически)
все более и более ранние стадии онтогенеза, пока не обнаружат
его первичное действие, влияющее на тот или иной процесс раз-
вития. Обычно генетики исследуют пару контрастирующих при-
знаков, контролируемых нормальным и мутантным аллелями.
Первичное отклонение развития от нормы, обусловленное му-
тантным геном, указывает на начало активности данного гена и
его нормального аллеля. Геккер [Наескег, 1918] назвал эту ста-
дию фенокритической, или фенокризом, и ее выявлению он при-
давал важное значение в феногенетических исследованиях. Оп-
ределение времени вступления гена в действие во многом зави-
сит от того, насколько используемые методики позволяют обна-
ружить ранние генные эффекты. Нередко имеются значительные
расхождения в данных разных авторов о начале функциониро-
вания того или иного гена, что обусловлено обычно использова-
нием неодинаковых по чувствительности методик. Холдейн [Hal-
dane, 1932] отмечал, что стадия появления признака и онтогене-
зе по необходимости является функцией нашего наблюдения.
Поэтому для определения начала времени действия генов необ-
ходимо использовать методы, позволяющие выявлять наиболее
ранние генные эффекты. Многочисленные факты свидетельст-
вуют о том, что активности нормальных и мутантных аллелей
совпадают по времени.
Была установлена более ранняя активация в эмбриогенезе
материнских аллелей по сравнению с отцовскими. Такого рода
данные были получены в основном на гибридных формах. В этих
случаях нельзя исключить, что оба аллеля функционируют, син-
тезируя соответствующие иРНК, но транслируется лишь иРНК
14
ОДНОГО из них [Корочкин, Беляева, 1972]. Райт и Шоу [Wright,
Shaw, 1970] считают, что различие во времени активации мате-
ринских и отцовских аутосомных аллельных генов скорее свой-
ственно межвидовым гибридам, а не индивидам одного и того же
вида.
Методом электрофореза в крахмальном геле было исследова-
но изменение активности глюкозофосфатизомеразы в ходе инди-
видуального развития гибридов Fi между близкородственными
видами луны-рыбы Lepomis gulosus и L. cyanellus (Centrarchi-
dae). Для реципрокных гибридов показано синхронное действие
двух аллелей локусов глюкозофосфатизомеразы А и В. Этидан-
ные подтверждают высказанное ранее предположение об отсут-
ствии ингибирования или асинхронности экспрессии аллелей у
гибридов между близкородственными видами [Champion, Whitt,
1976]. Изучение скорости синтеза иРНК у диплоидных и гапло-
идных зародышей вьюна показало, что у диплоидных зароды-
шей количество синтезированных иРНК на клетку вдвое больше,
чем у гаплоидных. Это указывает на функционирование обоих
родительских наборов хромосом на ранних стадиях развития рыб
[Kafiani, 1970].
В настоящее время не имеется прямых доказательств суще-
ствования временных различий дерепрессии материнских и от-
цовских аллелей. Наблюдаемая иногда асинхронность в выра-
жении контролируемых ими признаков обусловлена, по-видимо-
му, посттранскрипционной регуляцией. У гибридов лягушек от-
мечено более позднее появление отцовских форм некоторых
изоферментов по сравнению с материнскими, что обусловлено
высокой стабильностью белков материнского типа, синтезиро-
ванных в оогенезе [см. Корочкин, 1977].
Чёрч и Шульц [Church, Schultz, 1974] считают, что в отличие
от генома самки геном самца начинает дерепрессироваться у эмб-
риона мыши только на стадии бластоцисты. Авторы пришли к
такому заключению, исходя из данных других исследователей о
том, что партеногенетически активированные яйца мыши разви-
ваются до стадии бластоцисты и активность некоторых фермен-
тов самца проявляется позднее, чем соответствующих изофер-
ментов самки. Однако эти же авторы указывают, что эффекты
аутосомных генов t12 и Ау у мыши проявляются у гомозигот на
стадии морулы. Т. М. Хлебодарова и соавторы [1975] при помо-
щи высокочувствительной методики — иммуногистохимической
окраски по непрямому методу Кунса — показали, что отцовский
аллель локуса Pgd, контролирующий один из электрофоретиче-
ских вариантов 6-фосфоглюконатдегидрогеназы, активируется
У крысы в ходе первых делений дробления зиготы. Экспрессия
отцовского аллеля 0-глюкуронидазы происходит, очевидно, на
2- или 4-клеточной стадии [Wudl, Chapman, 1976], у 8-клеточного
зародыша мыши отмечена экспрессия отцовского аллеля глюко-
зофосфатизомеразы-! [Brinster, 1973], а у 8-клеточного эмбриона
15
крысы — отцовского аллеля 6-фосфоглюконатдегидрогеназы
[Серов, Познахиркина, Корочкин, 1975]. Аллели локуса, контро-
лирующего синтез субъединиц фермента S-формы НАДФ-зави-
симой малатдегидрогеназы, начинают функционировать синхрон-
но в эмбриогенезе мыши [Engel, Wolf, 1971]. Поэтому нельзя со-
гласиться с мнением Чёрча и Шульца [1974] о запаздывании у
эмбрионов млекопитающих дерепрессии отцовского генома по
сравнению с материнским. Следовательно, подавляющее боль-
шинство данных свидетельствует о синхронной активации (де-
репрессии) аутосомных аллельных генов в онтогенезе позвоноч-
ных.
Случаи аллельного исключения
А. А. Прокофьева-Бельговская [1946] впервые указала на
возможность различий в активности гомологичных аллелей у
дрозофилы. Она обнаружила эти различия между отцовской и
материнской хромосомами в слюнных железах у гомозиготных
и гетерозиготных особей по гену Sc8. Генетический контроль син-
теза полипептидных цепей иммуноглобулинов, по-видимому,
представляет наиболее достоверный случай исключения одного
из аллелей аутосомных структурных генов у позвоночных. Конт-
ролирующие синтез иммуноглобулинов гены являются кодоми-
нантными, так как у гетерозигот имеются продукты обоих роди-
тельских аллелей. Молекула иммуноглобулина состоит из 2 тя-
желых и 2 легких полипептидных цепей (Н- и L-цепи), синтез
которых контролируется двумя парами аутосомных несцеплен-
ных генов. Многие факты указывают, что в каждой зрелой лим-
фоидной (плазматической) клетке активен лишь один из ал-
лельных генов данных локусов [Fudenberg, Warner, 1970]. Одна-
ко в одном культивируемом in vitro лимфоците методом имму-
нофлуоресценции был показан синтез обоих тяжелых цепей мо-
лекулы иммуноглобулина. Блум и соавторы [Bloom е. а., 1971],
культивируя in vitro клоны лимфоцитов человека, установили,
что в каждой клетке синтезируются обе тяжелые цепи. Эти ав-
торы полагают, что в культивируемых in vitro клонах лимфоид-
ных клеток происходит дерепрессия нефункционирующего in
vivo аллеля. Имеются сообщения об аллельном исключении и
для других аутосомных генных локусов, в частности для Ess ло-
куса а-арилэстеразы кролика (Albers е. а., 1969].
Эти случаи аллельного исключения аутосомных генов, воз-
можно, связаны с дифференциальным проявлением генных эф-
фектов. Непроявление эффектов того или иного гена может за-
висеть от разных уровней посттранскрипционной регуляции ген-
ной экспрессии (см. гл. 2). Под истинно аллельным исключением
имеют в виду только те случаи, когда происходит инактивация
одного из аллелей с блоком процесса транскрипции соответст-
вующего участка ДНК. В этом отношении активность аллелей.
16
локализованных в Х-хромосомах, отличается от активности
аутосомных генов. Лайон [Lyon, 1961, 1968] высказала гипотезу
о том, что в клетках индивидов или особей женского пола у мле-
копитающих активна лишь одна Х-хромосома. Она установила,,
что у самок мышей XX, гетерозиготных по локализованным в
Х-хромосоме генам, контролирующим окраску шерсти, одни
участки шерсти имели окраску, свойственную отцу, а другие —
матери. У самок ХО такой мозаицизм отсутствовал. Эти данные
указывали на инактивацию одной из Х-хромосом у самок мле-
копитающих. Данные, полученные на культурах женских дипло-
идных клеток, подтвердили справедливость этой гипотезы. Для
каждого из трех изученных локусов Х-хромосомы человека была
установлено, что активен лишь один аллель [см. Krooth, Sell,
1970]. Возможно, что у особей женского пола инактивация генов
Х-хромосомы является неполной и не касается всех локусов [Du-
cos е. а., 1971]. Биохимические данные свидетельствую'; в пользу
того, что инактивирована по крайней мере большая часть Х-хро-
мосомы, так как обычно не удается обнаружить эффектов двух
генов, расположенных в Х-хромосоме на значительном расстоя-
нии друг от друга [Gartler е. а., 1972]. У некоторых видов наряду
с участками, активными только в одной Х-хромосоме, имеются
участки, которые инактивируются в обеих Х-хромосомах. Функ-
ция их не известна; возможно, они играют определенную роль в
эмбриогенезе [Lyon, 1970, 1972].
Инактивация генов в Х-хромосоме стабильна, неспособность
к транскрипции сохраняется в течение многих клеточных деле-
ний и даже в гетерокарионе не происходит активации генов в
инактивированной хромосоме. Так, если от женщины, имеющей
два электрофоретических варианта глюкозо-6-фосфатдегидроге-
назы — быстрый и медленный, которые контролируются разны-
ми аллелями соответствующего локуса в Х-хромосоме, выделить
клон клеток с быстрой фракцией фермента и такие клетки слить
с мышиными фибробластами, то в гетерокарионе проявляется
только быстрый вариант глюкозо-6-фосфатдегидрогеназы [Mi-
geon, 1972]. Известны примеры инактивации целого набора хро-
мосом, отдельных хромосом и части хромосом (гетерохромати-
зация). Однако об истинной инактивации отдельных генов в на-
стоящее время говорить трудно. Инактивация генов одной из
Х-хромосом приводит к тому, что количество продуктов, синтез
которых контролируется локализованными в Х-хромосоме гена-
ми, оказывается одинаковым у индивидов мужского и женского
пола. Это явление называют компенсацией дозы или дозовой
компенсацией генов [см. Гвоздев, 1970].
Мартин и соавторы [Martin е. а., 1978] исследовали актив-
ность нескольких аутосомных и Х-сцепленных ферментов в 4 ли-
ниях клеток, полученных из эмбриональных опухолей мыши.
Клетки одной из этих линий (тератокарцинома яичника) имели
обе Х-хромосомы, в остальных случаях кариотип был ХО. В пер-
17
вне дни культивирования in vitro ХХ-линия клеток обладала
двойной активностью Х-сцепленных ферментов по сравнению с
линиями клеток ХО, тогда как аутосомные продукты были оди-
наковы. Дифференцировка клеток наступала на 9-й день куль-
тивирования, при этом активность Х-сцепленных ферментов у
ХХ-линии клеток снижалась до уровня ХО, а большинство бел-
ков, синтез которых контролировался аутосомными генами,
оставались неизменными. Этот факт интерпретирован как инаю
тивация одной Х-хромосомы в процессе клеточной дифференци-
ровки.
Механизмы инактивации хромосом до сих пор изучены до-
вольно слабо. Предполагается, что каждая хромосома или ее
отдельные сегменты содержат локусы, ответственные за актив-
ность соответствующих участков [Lyon, 1974]. На мышах полу-
чены данные о неслучайном характере инактивации одной из
двух Х-хромосом [Drews е. а., 1974]. Авторы считают, что в одной
из Х-хромосом имеется рецептор, распознаваемый регуляторны-
ми молекулами, которые активируют гены этой хромосомы.
Инактивация одной из Х-хромосом у эмбрионов мыши проис-
ходит, очевидно, на стадии бластоцисты, когда зародыш имеет
примерно 50 клеток [Gardner, Lyon, 1971; Takagi, 1974]. При
этом отцовская Х-хромосома инактивируется в клетках презумп-
тивной энтодермы значительно чаще, чем материнская. В ходе
дальнейшего развития это приводит к тому, что в хорионе и
желточном мешке эмбрионов женского кариотипа наблюдается
избыток клеток с инактивированной отцовской Х-хромосомой
[Takagi е. а., 1978]. Изучение эритроцитарной фосфоглицеракт-
киназы-А в популяциях двух видов серых кенгуру показало, что
у самок Х-хромосома отцовского происхождения является неак-
тивной в ядерных эритробластах — предшественниках безъядер-
ных эритроцитов [Vande е. а., 1977]. У других видов млекопита-
ющих, в частности у самок мулов, имеет место случайная инак-
тивация родительских Х-хромосом в эритроидных клетках. При
помощи электрофореза в крахмальном геле исследовали спектр
глюкозо-6-фосфатдегидрогеназ эритроцитов у 74 мулов (42 сам-
ки и 32 самца) и у животных родительских видов: 35 ослов и
10 лошадей. Количественное проявление родительских аллелей
локуса глюкозо-6-фосфатдегидрогеназы, локализованного в
Х-хромосоме, варьировало в широких пределах у самок мулов:
от гемизиготного материнского до гемизиготного отцовского ал-
леля [Серов и др., 1977].
Следовательно, в настоящее время можно говорить об истин-
но аллельном исключении только в отношении генов, локализо-
ванных в Х-хромосомах. Непроявление экспрессии того или ино-
го аутосомного гена может зависеть от посттранскрипционной
регуляции.
18
Взаимодействие генов
Фенотип взрослого организма рассматривается сейчас не как
мозаика признаков, контролируемых отдельными генами, а как
общий продукт взаимодействия многих генов в онтогенезе. Сле-
довательно, генотип развивающегося организма представляет
собой эпигенетическую систему, или, как назвал его Уоддинг-
тон [Waddington, 1957], эпигенотип. Согласно Уоддингтону [1957],
эпигенотип забуферен таким образом, что развитие оказывается
«канализированным», т. е. имеет место жесткая направленность
развития по определенному пути, несмотря на различного рода
помехи, вызванные внешними условиями и генетической средой.
Термином гомеостаз развития обозначают по существу то же
явление, что и канализация развития. Различие этих понятий
заключается только в том, что термин канализация акцентирует
внимание на конечном продукте развития, а гомеостаз подчер-
кивает динамический аспект, который обеспечивается гомеоста-
тическими механизмами, возвращающими развитие на его нор-
мальный путь после различного рода отклонений.
Н. В. Тимофеев-Рессовский [1925] еще более 50 лет назад
писал, что связь генотипа и фенотипа не так проста, как это ка-
залось раньше, после первых менделистических работ, когда
склонны были видеть непосредственную связь определенного гена
с определенным признаком и представляли себе организм инте-
грированным из отдельных признаков. Н. В. Тимофеев-Рессов-
ский указывал, что генотип в процессе его проявления и разви-
тия действует как целостная система. При этом причинная зави-
симость фенотипа от генотипа у высших организмов является
сложной вследствие большой сложности эмбриогенеза, когда
различные развивающиеся части взаимодействуют друг с другом.
Этим автор, в частности, объяснял наблюдавшееся в его опытах
с дрозофилой неполное и нерегулярное проявление мутантного
гена radius incompletus, эффекты которого варьировали у особей
разных генотипов, т. е. на проявление данного гена большое
влияние оказывали другие гены. Таким образом, Тимофеев-Рес-
совский [1925] впервые экспериментально показал, что экспрес-
сия генов в онтогенезе может сильно варьировать в зависимости
от генетической среды.
Следует подчеркнуть, что взаимодействуют не сами гены, а
продукты одних генов с продуктами других генов на уровне хро-
мосом или чаще взаимодействуют продукты разных генов на
различных этапах реализации наследственной информации.
Продукт одного гена может выступать в качестве репрессора
или индуктора другого гена, а взаимодействие продуктов разных
генов между собой приводит в конечном итоге к усилению или
ослаблению экспрессии взаимодействующих генов. Следователь-
но, говоря о взаимодействии генов, необходимо иметь в виду,
что не сами гены взаимодействуют друг с другом, а вступают
19
iso взаимодействие, как правило, продукты генов, чаще всего
белки или вещества небелковой природы, синтез которых в ко-
нечном итоге находится под генным контролем. Прохождение
определенных этапов развития зависит от взаимодействия про-
дуктов многих генов и требует их точного количественного рав-
новесия. Изучение первичного эффекта того или иного гена (син-
тез определенной иРНК) провести крайне трудно, и поэтому
действие генов чаще оценивают по вторичным (синтез полипеп-
тпдных цепей) или даже более отдаленным эффектам, что да-
леко не всегда позволяет ответить на вопрос об уровне и меха-
низмах взаимодействия генов.
Различают аллельные и неаллельные взаимодействия генов.
Результатом взаимодействий аллельных генов являются доми-
нантно-рецессивные отношения и межаллельная комплементация.
К неаллельным взаимодействиям относятся все типы взаимо-
действий, наблюдающиеся между генами разных локусов. Как
уже отмечалось выше, не имеется принципиальных различий в
действии доминантных и рецессивных генов. Доминантность и
рецессивность определяются не особенностями действия соответ-
ствующих доминантного или рецессивного аллелей, а свойствами
контролируемых этими генами продуктов. Рецессивные гены так
же активны, как и их доминантные аллели; однако продукты
рецессивных генов отличаются от продуктов их доминантных
аллелей. В частности, ферменты теряют свою активность или
приобретают структурную нестабильность в результате превра-
щения доминантного (дикого) аллеля в мутантный рецессивный.
В. Г. Митрофанов [1977] справедливо отмечает, что понятие до-
минирования следует относить ко всей физиологической системе,
определяющей проявление признака в данных условиях, а не к
взаимодействию пары аллелей, так как доминантность и рецес-
сивность присущи признакам, а не генам. На белковом уровне,
как правило, нет ни доминантности, ни рецессивности в класси-
ческом понимании этих терминов. Однако доминирование и ре-
цессивность отчетливо наблюдаются на функциональном и мор-
фологическом уровнях.
Термины доминантный и рецессивный имеют смысл только в
отношении определенного признака или фенотипа. Так, серпо-
видно-клеточная болезнь у человека наследуется как рецессив-
ный признак; однако феномен серповидно-клеточности — харак-
терная деформация эритроцитов при соответствующей обработ-
ке in vitro — наследуется как доминантный признак, поскольку
он встречается у гетерозигот. Клинически дефекты ферментов у
человека обычно проявляются рецессивно, так как нормальный
аллель у гетерозигот обеспечивает половинное, но достаточное
количество фермента. Большинство выявленных к настоящему
времени нарушений обмена веществ наследуется по рецессивно-
му типу, хотя на биохимическом уровне мутантные аллели про-
являются кодоминантно. Это свидетельствует о том, что в норме
20
активность многих ферментов значительно превышает минималь-
ный уровень, необходимый для поддержания нормальной функ-
ции, т. е. имеет место как бы значительный «запас прочности»
[Harris, 1970b].
Если мутантный ген действует в клетках, гибель которых ге-
нетически запрограммирована (см. гл. 6), то одинарная доза му-
тантного гена обычно усиливает этот физиологически нормаль-
ный процесс. Так, при развитии хрусталика в центральных и глу-
боко расположенных кортикальных волокнах клеточные ядра
постепенно исчезают, т. е. происходит процесс денуклеации хру-
сталиковых волокон. В гомозиготном состоянии мутантный ген
dominant cataract-Fr обусловливает пикноз и деструкцию таких
ядер в развивающемся хрусталике эмбрионов мыши [Конюхов,
Колесова, 1976]. Как показали наши недавние исследования, у
гетерозигот не имеется четко выраженного пикноза ядер, а на-
блюдается только ускоренный процесс денуклеации, что в конеч-
ном итоге приводит так же, как и у гомозигот, к катаракте. Сле-
довательно, доминантный характер проявления эффектов му-
тантного гена может быть обусловлен его взаимодействием с
нормальными деструктивными процессами в ходе развития.
Действие небольших доз тератогенов подавляет гомеостати-
ческие механизмы развивающегося организма, вследствие чего у
гетерозигот нередко проявляются эффекты рецессивных генов.
Так, на мутантной линии мышей с анофтальмией показано, что
введение самкам на 7—9-й день беременности трипанового си-
него приводит к возникновению аномалий глаза у 35% гетерози-
гот. Трипановый синий в той же концентрации не вызывал ка-
ких-либо нарушений развития глаза у нормальных эмбрионов.
Тератогенное действие трипанового синего, очевидно, обусловле-
но вызываемой им у беременной мыши гипоксией вследствие
уменьшения числа эритроцитов и нарушения их функции [Barber,
1957; Beck, 1963]. Введение самкам мышей на 10-й день беремен-
ности 0,25 мг 5-фторурацила вызывало недоразвитие больше-
берцовой кости у гетерозиготных эмбрионов по гену luxoid или
luxate [Dagg, 1965], а также у гетерозиготных зародышей по ге-
ну Strong’s luxoid [Forsthoefel, 1972]. Недоразвитие большебер-
цовой кости является характерным признаком для гомозигот по
каждому из этих мутантных генов.
Хошино и соавторы [Hoshino е. а., 1972] значительно увеличи-
ли пенетрантность аутосомного рецессивного гена, обусловли-
вающего микрофтальмию у мыши. Они вводили 0,1 мл 1%-ного
раствора трипанового синего на 7-й день беременности гетерози-
готным самкам, которых скрещивали с самцами, гомозиготными
по этому гену. В контрольной группе от таких скрещиваний 30%
эмбрионов имели микрофтальмию, а в опытной — 50%. Локали-
зованный в Х-хромосоме мыши мутантный рецессивный ген sex-
linked anaemia (sla) обусловливает возникновение гипохромной
анемии у гемизиготных самцов (sla/Y) или гомозиготных самок:
21
(sla/sla). Гетерозиготные самки (sla/+) не имеют признаков ане-
мии на нормальной диете. Однако если их содержать на железо-
недостаточной диете, то у самок такого генотипа (sla/+) значи-
тельно быстрее появляется анемия, чем у нормальных животных.
Это указывает на проявление эффектов рецессивного гена sla в
одинарной дозе [Edwards е. а., 1972].
Экзогенные факторы могут усиливать также экспрессивность
доминантных генов. Введение на 8-й день беременности по 0,2 мл
1%-ного трипанового синего самкам мышей Т/+, спаренным с
самцами +/+, приводило к значительно большему укорочению
хвоста у родившихся мышей Т/+ по сравнению с контрольными
мышами этого же генотипа. Однако соотношение мышей гено-
типов Т/+ и +/+ в потомстве опытной группы сохранялось как
1 1 [Hamburgh е. а., 1970]. Введение актиномицина D самкам
мышей, гетерозиготным по гену Т, также приводило к усилению
эффектов одинарной дозы гена. Эмбрионы генотипа Т/+ имели
аномалии нервной системы и производных мезодермы, что явля-
ется характерным для гомозигот (Т/Т). Актиномицин D в такой
же дозе не нарушал развитие нормальных эмбрионов [Winfield,.
Bennett, 1971]. Следовательно, тератоген, подавляя гомеостати-
ческие механизмы, как бы увеличивал дозу гена Т до двойной.
У гетерозигот, после того как соответствующий локус теряет
активность, эффекты рецессивного аллеля могут исчезнуть в ре-
зультате действия гомеостатических механизмов. Нами было ус-
тановлено, что у мыши аутосомный рецессивный ген brachypo-
dism-H (Ьрн) проявляется в гетерозиготном состоянии в зачат-
ках бедренной и малоберцовой костей 13- и 14-суточных эмбрио-
нов. Локус Ьрн прекращает действие в зачатках пораженных
длинных костей конечностей к концу 14-х суток, а в течение 15-х
суток эмбрионального развития происходит нормализация де-
фектов, обусловленных одинарной дозой данного мутантного ге-
на [Бугрилова, Конюхов, 1971]. Результаты этой работы изложе-
ны ниже.
Измерение длины зачатков костей задних конечностей 13- и
14-суточных эмбрионов мышей показало, что зачатки бедренной
и малоберцовой костей эмбрионов Ьрн/+ достоверно меньше за-
чатков этих костей у эмбрионов нормального генотипа (+/+).
Причем различия между эмбрионами Ьрн/ + и +/+ выражены
сильнее для зачатков малоберцовой кости. По степени гипертро-
фии хрящевые клетки зачатка малоберцовой кости 13-суточных
эмбрионов Ьрн/+ занимают промежуточное положение между
зачатками этой кости эмбрионов +/+ и bpH/bpH. Прирост in situ
в длину бедренной и малоберцовой костей эмбрионов Ьрн/+ с
14-х по 15-е сутки выше, чем у эмбрионов + /+ (табл. 1).
Большая скорость роста зачатков костей 14-суточных эмбрио-
нов Ьрн/+ по сравнению с нормой приводит к нормализации их
размеров к концу 15-х суток эмбриогенеза. У 15-суточных эм-
брионов Ьрн/+ размеры и степень дифференцировки зачатков
22
Таблица 1. Прирост (в %) в длину зачатков бедренной и малоберцовой костей
эмбрионов мышей с 14-х по 15-е сутки развития
|Бугрилова, Конюхов, 1971]
Генотип эмбрионов Бедренная кость Малоберцовая кссть
X ±S- X р Х'± S- X р
Ьрн/+ +/+ 30,5+1,03(85) 25,6±0,90(95) <0,001 41,3+1,60(80) 29,3+1,20(92) <0,001
Примечание. В скобках — число измеренных зачатков костей.
Таблица 2. Прирост (в %) в длину зачатков бедренной и малоберцовой костей
эмбрионов мышей за 4 дня культивирования in vitro
{Бугрилова, Конюхов, 1971]
Возраст эмбрионов, сутки Генотип эмбрионов Бедренная кссть Малоберцовая кость
ХГ± S- X рк X ± S- * X р
13 ЬрН/+ +/+ 27,9±0,69(69) 36,7+1,03(45) <0,001 27,7±0,99(63) 40,99±1,49(39) <0,001
14 Ьрн/+ 15,74+0,75(40) >0,1 17,22±0,86(38) >0,1
+/+ 16,25±0,56(45) 16,92±0,97(40)
Примечание. В скобках — число культивируемых зачатков костей.
бедренной и малоберцовой костей уже не отличаются от нормы.
Следовательно, исчезновение эффектов мутантного гена Ьрн про-
исходит у 15-суточных гетерозиготных эмбрионов (рис. 2).
Скорость роста in vitro зачатков бедренной и малоберцовой
костей у 13-суточных эмбрионов Ьрн/+ меньше по сравнению со
скоростью роста этих костей у эмбрионов +/ + . Однако ско-
рость роста зачатков бедренной и малоберцовой костей 14-суточ-
ных эмбрионов Ьрн/+ не отличалась от нормы (табл. 2).
Изучение влияния экстрактов из 13-суточных эмбрионов
+ / + , Ьрн/ + и Ьрн/Ьрн на рост in vitro зачатков большеберцовых
костей эмбрионов 4-/+ такого же возраста показало, что экст-
ракты из тканей гетерозигот так же, как и гомозигот Ьрн/Ьри,
содержат ростингибирующий фактор. В первой серии опытов ис-
пользовали эмбриональные экстракты в концентрации 4 мг бел-
ка/мл культуральной среды. Прирост зачатков большеберцовых
костей за 4 дня культивирования составил 43,6±0,8; 26,4±0,74
и 20,3±0,69% в присутствии экстрактов из эмбрионов +/ + ,
Ьрн/+ и bpH/bpH соответственно (рис. 3). Эти данные показыва-
23
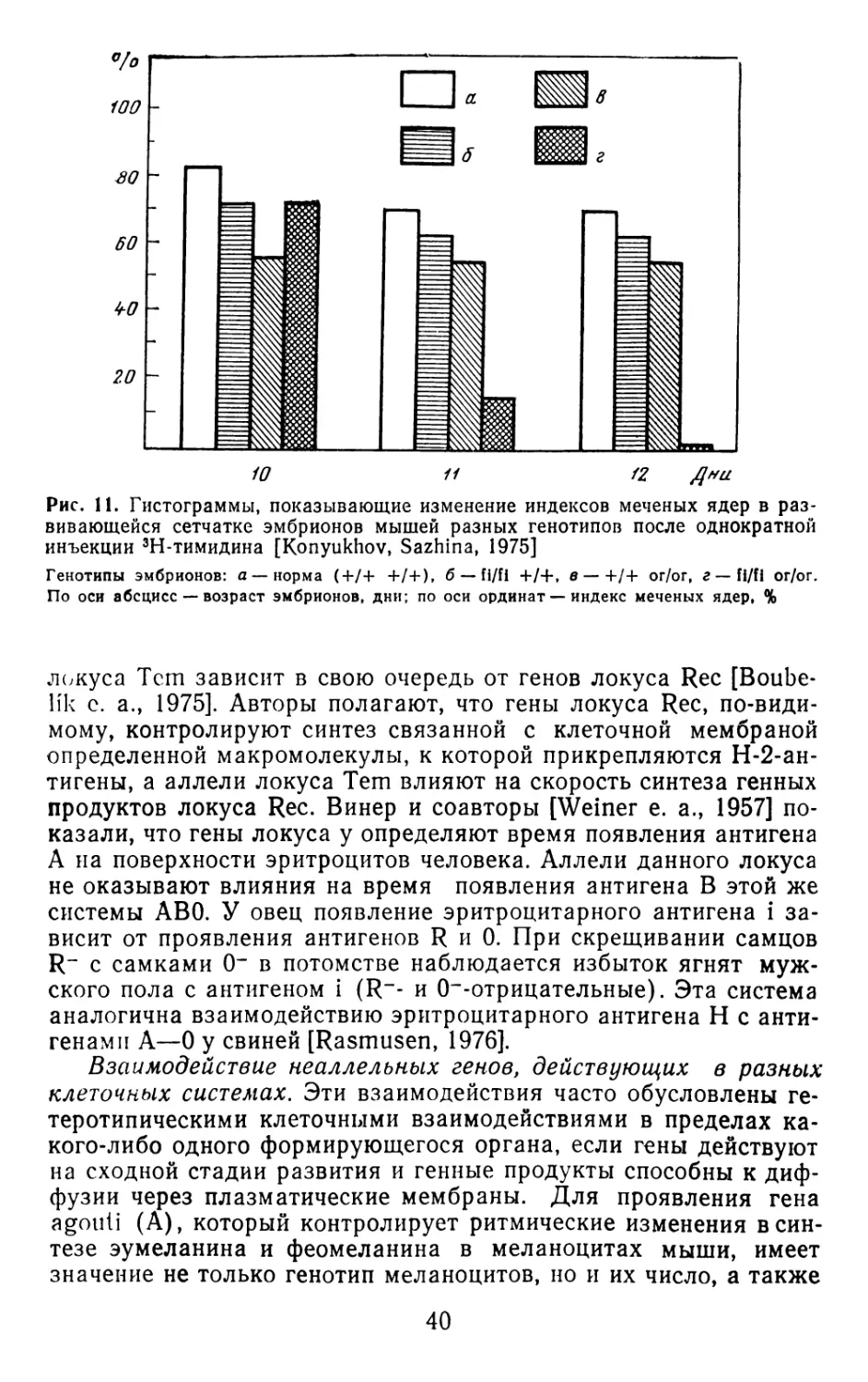
Рис. 2. Нормализация эффектов одинарной дозы аутосомного рецессивного
гена Ьрн в эмбриогенезе мыши, по данным Бугриловой, Конюхова [1971]
Генотипы эмбрионов: а-ь/+, б — Ьр^/ + . По оси абсцисс — возраст эмбрионов, дни;
по оси ординат — длина зачатков малоберцовых костей, мм
Рис. 3. Влияние экстрактов из тканей 13-суточных эмбрионов мышей разных
генотипов на рост in vitro зачатков нормальных косгей, по данным Бугрило-
вой, Конюхова [1971]
Генотипы эмбрионов: а F-/ + , б — Ьр^/+, в — Ьр^ /ЬрН По оси ординат — прирост (%)
зачатков большеберцовых костей 13-суточных эмбрионов +/+ за 4 дня культивирования
ют, что экстракт из эмбрионов bpH/bpH в концентрации 4 мг бел-
ка/мл значительно сильнее подавляет рост зачатков большебер-
цовых костей нормальных эмбрионов, чем экстракт из эмбрионов
Ьрн/+. Следовательно, экстракты из гетерозиготных эмбрионов
содержат меньше ростингибирующего фактора, чем экстракты
из эмбрионов bpH/bpH.
Во второй серии опытов использовали эмбриональные экст-
ракты в концентрации 2 мг белка/мл культуральной среды. Ско-
рость роста зачатков большеберцовых костей нормальных эм-
брионов в присутствии данной концентрации экстрактов из эм-
брионов + /+ была такой же, как при концентрации 4 мг/мл
культуральной среды. Прирост за 4 дня культивирования зачат-
ка большеберцовой кости эмбрионов +/+ в присутствии экст-
ракта из эмбрионов bpH/bpH в концентрации 2 мг/мл среды соста-
вил 27.3±0,86%, что соответствует величине прироста зачатка
данной кости в присутствии экстракта из эмбрионов Ьрн/+ при
концентрации в 2 раза большей (4 мг белка/мл культуральной
среды). Это указывает на то, что эмбриональный экстракт из
гетерозиготных эмбрионов содержит примерно вдвое меньше
ростингибирующего фактора по сравнению с экстрактом из эм-
брионов Ьрь/Ьрн.
Изучение эффектов гена Ьрн у гетерозигот позволило устано-
вить время прекращения его активности. Исследованиями на
эмбрионах, гомозиготных по этому гену, не удалось установить
24
время прекращения его действия в хрящевых клетках первично
пораженных костей (Konyukhov, Bugrilova, 1968]. Это связано с
т'ем, что in situ первичное поражение костей, очевидно, усилива-
ется действием циркулирующих в кровяном русле продуктов ге-
на Ьрн, что может пролонгировать эффекты последнего. Метод
культуры органа также не позволяет установить у гомозигот вре-
мя прекращения активности этого мутантного гена в хрящевых
клетках зачатков длинных костей вследствие сильного подавле-
ния их дифференцировки по сравнению с нормой. Так, если за-
чаток бедренной кости 13-суточных эмбрионов bpH/bpH растет in
vitro медленнее зачатка соответствующей кости нормальных эм-
брионов, то бедренная кость 14-суточных эмбрионов bpH/bptt
растет даже лучше. Это обусловлено тем, что зачатки костей эм-
брионов bpH/bpH данных сроков развития менее дифференциро-
ваны и обладают большей потенцией к росту по сравнению с за-
чатками нормальных эмбрионов. В отличие от гомозигот зачат-
ки костей 14-суточных эмбрионов Ьрн/+ дифференцированы при-
мерно так же, как и зачатки соответствующих костей эмбрионов
+/+, что позволяет проводить сравнения скорости роста зачат-
ков костей эмбрионов этих генотипов в культуре. Как было отме-
чено выше, скорость роста in vitro зачатков малоберцовой и бед-
ренной костей 14-суточных эмбрионов Ьры/ + не отличается от
скорости роста таких же зачатков костей эмбрионов +/+. Не
наблюдается также торможения роста зачатков пораженных ко-
стей у гетерозиготных эмбрионов in situ с 14 суток развития.
Локус Ьрн, очевидно, прекращает действие в хрящевых клетках
пораженных зачатков костей к концу 14-х суток эмбрионального
развития.
Эффекты гена Ьрн у гомозигот обнаруживаются в формирую-
щихся задних конечностях на 12-е сутки эмбриогенеза [Малини-
на, 1969]. Очевидно, ген вступает в действие в конце 11-х суток
эмбрионального развития. Этот период активации гена Ьрн отно-
сится к зачаткам бедренной и малоберцовой костей. Для костей
передних конечностей он несколько сдвинут на более ранние
стадии, а для костей стопы, наоборот, на более поздние стадии
эмбриогенеза, что обусловлено неодинаковой скоростью разви-
тия различных длинных костей конечностей. Относительно ко-
роткий период действия гена Ьрн (примерно 3 суток) обусловли-
вает тот факт, что эффекты одинарной дозы этого гена исчеза-
ют в течение поздних стадий развития. Следовательно, гомео-
статические механизмы компенсируют дефект, обусловленный
одной дозой гена Ьрн.
Многие факторы действуют в направлении поддержания го-
меостаза развития, и после прекращения активности локуса эф-
фекты его рецессивного аллеля могут исчезнуть, как это было
показано выше для эмбрионов мышей генотипа Ьрн/+ Поэтому
гетерозиготы по рецессивным генам не имеют заметных откло-
нений от нормы. Однако, зная период активности локуса и ис-
25
пользуя соответствующие методы исследования, можно опреде-
лить эффекты рецессивного аллеля даже у гетерозигот. Это об-
стоятельство важно учитывать при разработке методов опреде-
ления гетерозиготных носителей наследственных аномалий, что
имеет большое значение для проведения медико-генетических
консультаций.
Ряд рецессивных t-генов сложного Т-локуса у мыши усили-
вают эффекты мутантного доминантного Т-гена, хотя в гетерози-
готном состоянии t-гены (генотип t/+) не вызывают заметных
отклонений развития от нормы [Gluecksohn-Waelsch, Ericson,
1970; Bennett, 1975]. Эти данные свидетельствуют о том, что
t-аллели у гетерозигот активны, но их вредные эффекты не про-
являются в результате действия гомеостатических механизмов
развития. Таким образом, доминантно-рецессивные отношения
следует рассматривать в аспекте реализации эффектов аллель-
ных генов, а не в плане их активности.
Многие белки являются олигомерами, т. е. они состоят более
чем из одной полипептидной цепи, или мономера. Мономеры,
синтез которых контролируется разными аллелями, образуют
смешанные агрегаты, или «гибридные» белки. В настоящее вре-
мя обнаружено значительное число гибридных форм белков.
Гибридный белок встречается только у гетерозиготных особей.
Поскольку гетерозиготы получают один аллель от одного роди-
теля, а второй — от другого, такая молекулярная форма белка
может присутствовать только у особей, родители которых ее не
имели. Вообще любой фермент или неферментный белок, кото-
рый состоит из двух полипептидных цепей, может существовать
у гетерозигот в гибридной форме. В тех случаях, когда в гомо-
зиготном состоянии белок содержит более двух идентичных по-
липептидных цепей, картина образования гибридных молекул у
гетерозигот будет еще более сложной. Взаимодействие аллелей
на белковом уровне широко распространено у высших организ-
мов, в результате чего возникает полиморфизм белков, а при-
знаки часто детерминируются согласованным действием двух и
более генов. Характер наследования таких фенотипов не подчи-
няется правилам доминантности, рецессивности и кодоминант-
ности [Zimmermann, 1972].
Взаимодействие в цитоплазме продуктов разных мутантных
аллелей приводит иногда к нормализации фенотипа — феномен
межаллельной комплементации. Восстановление дикого (нор-
мального) фенотипа в результате межаллельной комплемента-
ции происходит через взаимодействие в цитоплазме различно из-
мененных полипептидных цепей, которые образуют гибридную
белковую молекулу [Fincham, 1966].
Гибридная белковая молекула в отличие от ферментов гомо-
зиготных особей обладает функциональной активностью в связи
с тем, что составляющие ее полипептидные цепи изменены в
разных участках (рис. 4).
26
в
Мутант S
Мутант &
г
Мутант А
Рис. 4. Схема межаллельной комплементации [Smith-Keary, 1975]
Три полусферы представляют собой трехмерные конфигурации субъединиц белковой мо-
лекулы, синтезируемые в норме (а) и двумя мутантами (б, в). Активный фермент обра-
зуется только в том случае, когда 2 субъединицы могут полимеризоваться; а — субъ-
единицы белковой молекулы могут полимеризоваться и образовать активный ферментный
комплекс; б — субъединицы не могут полимеризоваться и образовать активный фермент;
в —у мутанта трехмерная конфигурация субъединиц изменена несколько иначе, но субъ-
единицы все-таки не могут полимеризоваться и образовать активный фермент; г — в клет-
ке присутствуют оба мутантных аллельных гена и синтезируются 2 типа субъединиц,
которые могут полимеризоваться, в результате чего образуется фермент с пониженной ак-
тивностью. При этом только 50% пар субъединиц могут комплементировать друг с другом
У мыши известно 6 разных групп комплементации рецессив-
ных летальных генов сложного локуса Т [Gluecksohn-Waelsch,
Erickson, 1970; Bennett, 1975]. Например, у мышей генотипов
l°/t°, f/t1, t4/t4, t12/t12 наблюдаются серьезные нарушения развития
и гомозиготы погибают, как правило, на ранних стадиях эмбрио-
генеза. Эмбрионы генотипов f/t1, t°/t4, t°/t12, tVt4, V/t12 развива-
ются нормально, у мышей таких генотипов отмечена только сте-
рильность самцов. Как отмечалось выше, некоторые рецессивные
t-гены усиливают эффекты доминантного мутантного гена Т. Од-
нако аллель th7 ослабляет эффекты гена Т [Lyon, Meredith, 1964].
Лайон и Бихтол [Lyon, Bechtol, 1977] исследовали особенности
некоторых новых мутантных t-гаплотипов, возникающих из t6-
гаплотипа. В частности было показано, что фактор, обусловли-
вающий бесхвостный фенотип, при взаимодействии с мутантным
геном Т не рекомбинируется с этим геном, в то время как гомо-
зиготная летальность определяется фактором, находящимся
вблизи локуса tufted (tf). Обсуждая возможные механизмы воз-
27
никновения мутантных t-гаплотипов t*7, thl7, th20 и некоторых
других и их взаимодействие с генами других локусов, авторы
приходят к выводу, что дупликация или деления — вероятный
источник мутантных t-гаплотипов. Полученные в последнее
время данные указывают на то, что t-комплекс у мыши является
«супергеном» — большим сегментом хромосомы, включающим,
по-видимому, много генов, которые контролируют сходные функ-
ции раннего зародыша [Erickson е. а., 1978]. Поэтому не все из*
вестные группы комплементаций t-генов представляют собой ре-
зультат межаллелыюй комплементации, так как в этом случае
не исключена возможность взаимодействия генов разных локу-
сов.
Гены Miwh и mi локуса mi взаимодействуют по типу межал-
лельной комплементации. У мышей компаунда Miwb/mi наблю-
дается нормализация развития некоторых органов по сравнению
с мышами генотипов Miwh/Miwh и mi/mi. Объемы спинальных ган-
глиев у 14-дневных эмбрионов и новорожденных мышей, относи-
тельные веса и объемы надпочечников и размер глаза у 20-днев-
ных мышей этого компаунда не отличаются от нормы. У эмбрио-
нов и мышей mi/mi и Miwh/Miwh соответствующего возраста раз-
мер этих органов значительно меньше, чем в норме. Развитие
пигментного листка глаза у эмбрионов Miwh/mi нарушено в мень-
шей степени, чем у эмбрионов Miwh/Miwh и mi/mi. В результате
этого у мышей Miwh/mi сосудистая щель глаза закрывается, воз-
никает внутриглазное давление и не развивается микрофталь-
мия. Однако дефектный пигментный эпителий глаза не обеспе-
чивает нормального развития сетчатки на постэмбриональных
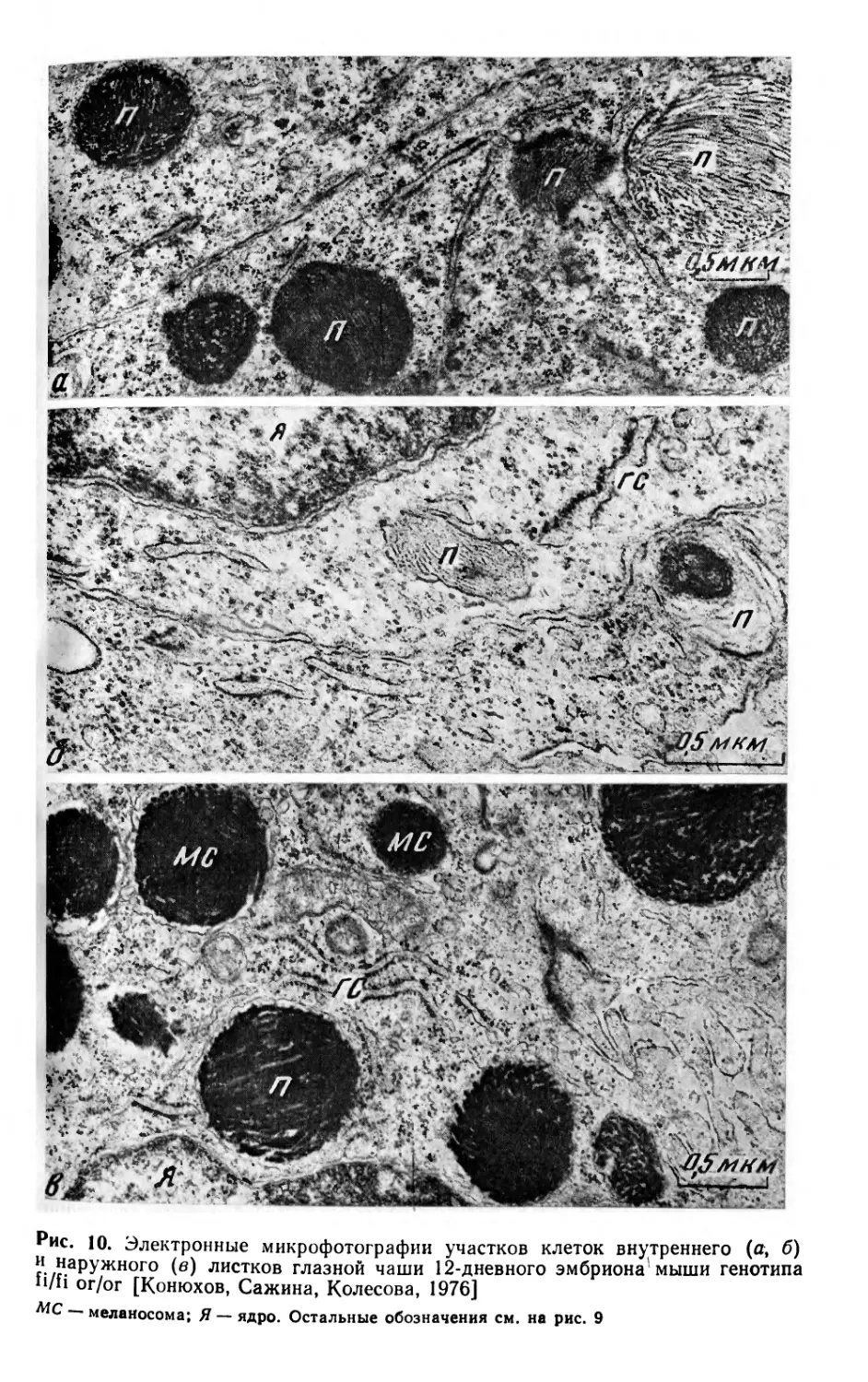
стадиях онтогенеза [Конюхов, Осипов, 1968].
На рис. 5 (см. вклейку) представлены сагиттальные срезы
глаза новорожденных мышей разного генотипа. Видно, что раз-
мер и строение глаза у мышей Miwh/mi почти такие же, как в
норме. У мышей mi/mi глаз сильно редуцирован и деформи-
рован (рис. 5, а), сетчатка складчатая и дифференцирована
слабее, чем в норме. Хрусталик неправильной формы с хаотиче-
ским расположением волокон. Радужина и цилиарное тело
слабо дифференцированы. Стекловидное тело отсутствует. Пиг-
ментный эпителий толстый, складчатый, по краям незакрывшей-
ся сосудистой щели (типичная колобома) и в дорсальной обла-
сти глаза представляет собой инвертированную сетчатку. У мы-
шей генотипа Miwh/Miwh глаз хотя и меньше поражен по сравне-
нию с глазом мышей mi/mi, но также неправильной формы и
меньшего размера, чем в норме. Сетчатка складчатая и частич-
но выворачивается через сосудистую щель наружу, где наблю-
даются участки инвертированной сетчатки (рис. 5, б).
Проведенный в последнее время в нашей лаборатории элек-
тронно-микроскопический анализ показал наличие в цитоплазме
клеток пигментного эпителия глаза 12- и 14-дневных эмбрионов
и новорожденных мышей Miwh/mi тирозиназной активности и не-
28
нормальных по своей структуре премеланосом. Хотя премелано-
сомы имеют высокую тирозиназную активность, меланин не син-
тезируется и вскоре после появления такие премеланосомы раз-
рушаются. У эмбрионов и новорожденных мышей, гомозиготных
по гену Miwh или mi, в клетках наружного листка глазной чаши
(аномальный пигментный эпителий) не было обнаружено тиро-
зиназной активности и премеланосом. Следовательно, у мышей
Miwh/mi имеет место некоторая нормализация развития пигмент-
ного эпителия глаза, хотя последний не достигает своей нор-
мальной дифференцировки.
Локус mi действует в клетках нервного гребня и его дерива-
тов. У эмбрионов мышей компаунда Miwh/mi происходит, очевид-
но, некоторая нормализация эктомезенхимы, в частности ее
ростингибирующих свойств. Это приводит к тому, что митотиче-
ская активность формирующегося пигментного эпителия глаза
у эмбрионов мышей Miwh/mi становится меньше, чем у эмбрионов
генотипов Miwh/Miwh и mi/mi, и дерепрессируются локусы, конт-
ролирующие пигментацию. Однако митотическая активность пиг-
ментного эпителия глаза у эмбрионов Miwh/mi остается все же
выше, чем в норме. Поэтому в клетках пигментного эпителия у
эмбрионов данного компаунда не образуются нормальные пре-
меланосомы и не происходит синтеза меланина, несмотря на ти-
розиназную активность в цитоплазме. Следовательно, частичное
восстановление нормальной структуры пигментного эпителия у
мышей Miwh/mi является результатом межклеточных взаимодей-
ствий — эктомезенхимы и пигментного эпителия. Таким обра-
зом, в результате межаллельной комплементации может наблю-
даться нормализация развития не только той клеточной системы,
в которой взаимодействуют продукты аллельных мутантных
генов, но также и других тканей, зависимых в своем форми-
ровании от первично генетически пораженной клеточной си-
стемы.
Холландер (Hollander, 1968] сообщил о комплементации алле-
лей Miwh и miW8 этого же локуса. У мышей генотипов Miwll/Miwh и
miw8/miws наблюдается микрофтальмия, а мыши Miwh/miwe име-
ют пигментированные глаза нормального размера. У мышей
Miwh/mi и Miwh/miws происходит, очевидно, нормализация гиб-
ридной белковой молекулы в клетках пораженного нервного
гребня и его дериватов, что и проявляется в ослаблении эффек-
тов этих мутантных генов.
Межаллельная комплементация мутантных генов отмечена
также для локуса р: гетерозиготы рв/р23 и рЬ8/р25 меньше пораже-
ны по сравнению с мышами генотипа р25/р25 [Wolfe, 1975]. Глюк-
сон-Уелш и соавторы [Gluecksohn-Waelsch е. а., 1974] провели
ксмплементационный анализ 6 летальных аллелей локуса albino
(с) у мыши. Множественность эффектов (биохимических и уль-
траструктурных) каждого мутантного гена и данные по межал-
лельной комплементации указывают на то, что эти летальные
29
аллели представляют собой различного размера перекрываю-
щие друг друга делении, захватывающие локус albino.
Генетическая комплементация наблюдается в гетерокарио-
нах, полученных при слиянии в культуре мутантных клеток от
индивидов, имеющих разные формы той или иной наследствен-
ной болезни. В кожных фибробластах больных пигментной ксе-
родермой репарация повреждений ДНК, вырезание пиримиди-
новых димеров, индуцированных ультрафиолетовыми лучами,
происходит значительно медленнее, чем в фибробластах от здо-
ровых людей. В гетерокарионах, образующихся при слиянии
фибробластов от индивидов, относящихся к разным семьям с
пигментной ксеродермой, нередко наблюдается нормальная
скорость репарации ДНК. Методом гибридизации мутантных
линий фибробластов установлено 5 групп комплементации пиг-
ментной ксеродермы [Kraemer е. а., 1975]. Эти данные показыва-
ют, что имеется 5 форм пигментной ксеродермы, которые контро-
лируются разными генами. Следовательно, по крайней мере 5
разных мутантных генов обусловливают нарушение репарации
ДНК в клетках человека. К сожалению, не выяснено, аллельны-
ми или неаллельными генами контролируются эти 5 форм пиг-
ментной ксеродермы, и поэтому не представляется возможным
детальное рассмотрение механизмов такой генетической компле-
ментации в гетерокарионах.
Если два ядра гетерокариона сливаются, образуя одно общее
ядро, то такую гибридную клетку называют синкарионом. Над-
лер и соавторы [Nadler е. а., 1970] описали межаллельную ком-
плементацию в синкарионах, возникших в результате слияния
фибробластов от разных пациентов с галакто.земией. При гибри-
дизации клеток китайского хомячка с лейкоцитами и фибробла-
стами нормальных людей в гибридных клетках был обнаружен
изофермент а-галактозидазы А с промежуточной электрофорети-
ческой подвижностью по отношению к таковой а-галактозидазы
А человека и китайского хомячка. Иммунологически было уста-
новлено, что этот изофермент является гетерополимером и со-
держит как человеческий компонент, так и компонент китайско-
го хомячка. В гибридах от слияния клеток китайского хомячка
и клеток от индивида с болезнью Фабри человеческая и гетеро-
полимерная а-галактозидазы А отсутствовали. Болезнь Фабри
обусловлена мутацией структурного гена а-галактозидазы А, в
результате чего не образуются иммунологически определяемые
п функциональные молекулы этого фермента а-галактозидазы А
[Hamers е. а., 1977].
Роман [Roman, 1956] предложил назвать аллели, обусловлен-
ные изменением одного и того же участка определенного локуса,
гомоаллелями, а аллели одного локуса, возникающие в резуль-
тате изменения его различных участков, — гетероаллелями. Для
различения гомо- и гетероаллелей используют тест межаллель-
ной комплементации: отсутствие рекомбинации генов и межал-
30
лельной комплементации указывает на то, что два исследуе-
мых аллеля являются идентичными, или гомоаллелями. Нали-
чие комплементации свидетельствует о том, что данные аллели
являются различными, т. е. гетероаллелями. Тест комплемента-
ции был использован, в частности, для анализа летальных генов
сложного Т-локуса у мыши. Отсутствие комплементационного
взаимодействия между t-генами рассматривалось как доказа-
тельство их идентичности [Dunn, Bennett, 1960]. Данн и соавторы
[Dunn е. а., 1962] утверждали, что наличие генетической компле-
ментации указывает на различие t-аллелей, несмотря на их
сходные эффекты. Однако, как указывалось выше, t-комплекс у
мыши, очевидно, включает многие локусы, контролирующие
сходные функции, и поэтому в этих исследованиях за межал-
лельную комплементацию могло быть принято отсутствие вза-
имодействия рецессивных генов, относящихся к разным локусам.
Таким образом, в результате межаллельной комплементации
может происходить нормализация мутантных фенотипов, что
имеет немаловажное значение в наследственной патологии чело-
века. Некоторые авторы объясняют явление гетерозиса межал-
лельной комплементацией. Гибридные ферменты, возникающие
в результате межаллельной комплементации, характеризуются
новыми биохимическими особенностями, отсутствующими у ро-
дителей. Гибридные белки образуются довольно часто. Финчем
[Fincham, 1966] подчеркивает, что если в какой-либо клетке син-
тезируются белки электрофоретически различимые и контроли-
руемые разными аллелями, то наряду с ними в данной клетке
образуется также и гибридный белок. Холдейн [Haldane, 1955]
одним из первых обратил на это внимание в своей биохимиче-
ской теории природы гетерозиса. Он считал, что два аллеля мо-
гут давать разные формы одного и того же фермента и в гиб-
ридном организме такие аллели обеспечивают обогащение био-
химических процессов, тем самым они создают ему лучшую воз-
можность существования в варьирующих условиях среды по
сравнению с гомозиготными родительскими формами.
Популяции человека так же, как и животных, в высокой сте-
пени генетически гетерогенны. Каждый индивид гетерозиготен
по многим генам, что выражается в широко распространенном
полиморфизме разнообразных признаков. Гетерозиготность уве-
личивает возможность синтеза различных полипептидов, из ко-
торых могут образовываться разные белки, обеспечивающие рас-
ширение нормы реакции или гетерозисный эффект.
Взаимодействия неаллельных генов классифицируют как мо-
дифицирующие влияния, полимерия, комплементарность и эпи-
стаз. Под модифицирующим действием понимают влияние ге-
нов-модификаторов на усиление или ослабление проявления при-
знака, контролируемого основным геном. Разделение генов на
два сорта — главных и модификаторов — зависит от того, ка-
кой признак выбран для изучения: одни и те же гены для одного-
31
признака будут главными, а для другого модифицирующими, и
наоборот. Следовательно, один и тот же ген может выступать в
разной роли (главного гена или гена-модификатора) по отноше-
нию к различным компонентам фенотипа. Полимерией называ-
ют взаимодействие многих генов, обладающих однозначным
действием, при становлении так называемых количественных
признаков (скорость роста, вес, размеры тела и т. д.). Если раз-
витие того или иного признака контролируется многими генами,
каждый из которых имеет небольшой эффект, и гены действуют
аддитивно, то говорят также о полигенном характере наследова-
ния. Не следует путать термин «полигенное наследование» с
мультифакториальным. Термин «мультифакториальный» ис-
пользуется для обозначения комбинированного действия ряда
наследственных и экзогенных факторов. В частности, расщепле-
ние нёба является результатом взаимодействия многих генов с
различными тератогенами в период эмбриогенеза, когда проис-
ходит срастание латеральных нёбных выступов друг с другом
[Fraser, 1976]. Этиология врожденных заболеваний сердца у че-
ловека также лучше всего объясняется мультифакториальной
наследственностью [Nora J. J., Nora А. Н., 1978].
Под комплементарностью (или дополнительностью) понима-
ют такие взаимодействия доминантных генов, когда взаимодей-
ствие их продуктов приводит к возникновению нового признака.
Выделение категории комплементарных генов в настоящее вре-
мя представляется малополезным, так как развитие высших ор-
ганизмов есть не что иное, как непрерывный процесс возникнове-
ния все новых и новых признаков, причем каждый ген отделен
от конечных компонентов фенотипа, на которые он влияет, до-
вольно значительным периодом онтогенеза. При этом практиче-
ски на каждом этапе развития белки, синтезированные под кон-
тролем одних генов, взаимодействуют с продуктами других ге-
нов, и такое непрерывное взаимодействие генных эффектов при-
водит к становлению сложных морфологических признаков
взрослого организма. Термином «эпистаз» обозначают подавле-
ние эффектов одного гена другим неаллельным ему геном, при-
чем ген, выступающий в качестве супрессора или ингибитора,
может быть как доминантным, так и рецессивным. Взаимодейст-
вие эффектов неаллельных генов может быть в одной или раз-
ных клеточных системах.
Взаимодействие неаллельных генов в одной клеточной систе-
ме. Во многих случаях сложные белки, состоящие из нескольких
субъединиц, контролируются генами двух или более локусов.
Эволюционные механизмы, включая дупликацию гена и после-
дующее дивергентное мутирование, приводят к тому, что локу-
>сы, контролирующие синтез субъединиц, расположены часто в
разных хромосомах. Разные субъединицы, объединяясь между
собой, образуют гетерополимерные белки. Так, в ходе разви-
тия человека образуется несколько типов гемоглобинов, синтез
32
Рис. 5. Нормализация строения глаза у мыши результате межаллельной
комплементации [Конюхов, Осипов, 1968]
Срезы через новорожденных генотипов: а — mi/ini,
г---h/ + (норма). Увел. Х.34
Рис. 7. Срезы через глаза 12-дневных эмбрионов мышей нормального (а)
и мутантного генотипов: +/-f-or/or (б), fi/fi + / + (в) и fi/fi or/с^г (г)
В результате взаимодействия генов ог и fi зачаток сетчатки у двойных гомозигот (г)
развивается по типу пигментного эпителия. Увел.: а — в — Х90, г XI30
V* Заказ 4731
Рис. 8. Срез через глаз 15-дневного
эмбриона мыши генотипа fi/fi ог/ог
[Конюхов, Сажина, Колесова, 1976]
хр хрусталик.
в — внутренний листок глазной чаши,
н наружный листок глазной чаши.
Увел. Х250
Рис. 9. Электронные микрофотогра-
фии участков клеток внутреннего (а)
и наружного (б) листков глазной ча-
ши 11-дневного эмбриона мыши гено-
типа fi/fi ог/ог [Конюхов, Сажина,
Колесова, 1976]
Стрелками показана
пости тирозиназы.
П — премеланосома;
М — митохондрия;
КГ — комплекс Гольджи;
ГС — гранулярная эндоплазматическая сеть
Рис. 10. Электронные микрофотографии участков клеток внутреннего (а, б)
и наружного (в) листков глазной чаши 12-дневного эмбриона мыши генотипа
H/fi ог/ог [Конюхов, Сажина, Колесова, 1976]
МС — мел а носом а; Я — ядро. Остальные обозначения см. на рис. 9
Рис. 12. Срезы через глаза 11-дневных эмбрионов мышей разных генотипов,
показывающие эпистаз гена mi над геном or [Konyukhov, Sazhina, 1966J
Генотипы: а — норма (+/+ +/+), б — ог/ог +/+, в----F/+ mi/mi, г — ог/ог mi/mi.
Увел. Х35
Рис. 13. Срезы через глаза новорожденных мышей разного генотипа
[Konyukhov, Sazhina, 1966]
Генотипы: а — норма (+/+ +/ + ), б — ог/ог +/+. в ь/ + mi/mi. г — ог/ог /mi.
У Двойных гомозигот (г) наблюдается частичное взаимное подавление эффектсв генов
ог и mi. Увел. х25
/8 Заказ № 4731
Рис. 13 (окончание)
Рис. 14. Срез через глаз новорожденной мыши генотипа fi/fi or/or mi/mi
Увел.- Х80
Локус
2 3 6
5 6
Генот и и
Лол ипептидная
цепь
Тип
гемоглобина
Рис. 6. Генетический контроль различных типов гемоглобина у человека
(по данным разных авторов)
которых контролируется 6 различными локусами (рис. 6). Причем
сначала дерепрессируются локусы для а-, и е-, затем для у-,
0- и б-полипептидных цепей (см. гл. 5, разд. «Синтез специфиче-
ских белков»).
Образование сложных белковых молекул — многоэтапный
процесс, поэтому возможность взаимодействия продуктов раз-
ных генов значительно возрастает. В некоторых случаях мута-
ция одного гена приводит к дефекту не одного, а сразу двух фер-
ментов, если у них имеется одна полипептидная цепь или если
один фермент активирует два других. Так, неактивная мутант-
ная форма энтерокиназы не активирует ни трипсин, ни (вторич-
но) химотрипсиноген, ни прокарбоксипептидазу, в результате
чего «выпадают» все протеолетические ферменты кишечника.
Неактивность фермента может приводить к подавлению субст-
ратом или его метаболитом других ферментных систем.
Взаимодействия неаллельных генов в одной клеточной систе-
ме в основном сводятся к тому, что одни гены подготавливают
условия для проявления эффектов других генов. Если какой-ли-
бо ген в результате мутации не производит необходимого про-
дукта, то действие других генов, участвующих в переработке
данного продукта, не проявляется. Мутантный ген albino (с) у
мыши и других млекопитающих нарушает активность тирозина-
зы. Вследствие этого меланин не образуется в пигментных клет-
ках и все гены, обусловливающие многообразие цветных вариа-
ций, не могут проявиться, так как отсутствует тот субстрат, на
который они действуют. Этим, в частности, объясняется явление
эпистаза, когда одни гены подавляют эффекты других неаллель-
ных генов. Следовательно, взаимодействие генов в одной клеточ-
ной системе происходит в тех случаях, когда контролируемые
генами продукты составляют одну цепь биохимических процес-
сов, необходимых для прохождения определенного этапа разви-
тия клетки.
Гены, активные в одной клеточной системе и имеющие сход-
ные фенотипические эффекты, могут действовать синергично,
2 Б. В. Конюхов 33
или аддитивно. Синергичный характер действия мутантных ге-
нов наблюдал Форстхофел [Forsthoefel, 1962] у мыши. У двойных
или тройных гетерозигот по генам, обусловливающим нарушение
развития скелета конечностей, он обнаружил недоразвитие или
полное отсутствие большеберцовой кости. Это свидетельствует о
том, что каждый из генов оказывал некоторое действие на фор-
мирование большеберцовой кости. Однако эффект каждого из
этих генов в одинарной дозе недостаточен, чтобы вызвать недо-
развитие данной кости. Аутосомный рецессивный ген siren (srn)
у мыши проявляет свои эффекты в одинарной дозе при взаимо-
действии с аутосомным доминантным геном Danforth’s short tail
(Sd). У мышей генотипа srn/ + Sd/+ в 46% наблюдали проявле-
ние эффектов гена srn [Hoornbeek, Adams, 1975]. Гены Sd и srn
обусловливают сходные нарушения развития скелета и мочепо-
ловой системы, поэтому и происходит взаимодействие их эффек-
тов. Описаны также другие случаи синергичного действия раз-
ных мутантных генов, нарушающих скелет [Griineberg, 1963], ге-
мопоэз [Russell е. а., 1968] и пигментацию шерсти [Silvers, 1963]
у мышей, а также пигментацию и структуру волос у морских сви-
нок [Wright, 1963].
Мутантные гены серебристо-голубой (р) и алеутской (а) ок-
раски шерсти у норок взаимодействуют аддитивно у двойных го-
мозигот, в результате чего возникает новый тип пигментации
(сапфировый), совмещающий в известной степени особенности,
присущие одинарным гомозиготам р/р +/+ и +/+ а/а. Размеры
меланосом крупнее по сравнению с нормой у норок генотипа
р/р + /+ в 1,5 раза, генотипа + / + а/а — в 40, а генотипа р/ра/а—
в 100 с лишним раз. У сапфировых норок (генотип р/р а/а) в
большей степени, чем у алеутских (+/ + а/а), возрастает вариа-
бельность как формы, так и размера меланосом, что, очевидно,
связано с нарушением их структуры. У сапфировых норок уже
в начале меланогенеза образуются громадные пигментные гра-
нулы. У алеутских норок на первых этапах меланогенеза проис-
ходит синтез почти нормальных по величине меланосом и обыч-
ный выброс их из клетки, а громадные пигментные гранулы об-
разуются лишь в конце меланогенеза [Зверева и др., 1976].
У мыши неаллельные аутосомные рецессивные гены reeler
(rl). staggerer (sg) и weaver (wv) обусловливают в гомозигот-
ном состоянии сходные аномалии развития мозжечка: уменьше-
ние его размеров и числа извилин, а также гипоплазию молеку-
лярного и наружного гранулярного слоев. У 7-дневных мышей
rl/rl wv/wv размеры мозжечка значительно меньше, молекуляр-
ный слой почти отсутствует, а наружный гранулярный слой
тоньше, чем у мышей rl/rl +/+ или +/+ wv/wv такого же воз-
раста. У 14-дневных двойных гомозигот наблюдается уменьше-
ние числа извилин мозжечка по сравнению с 7-дневными мышами
этого генотипа, что указывает на продолжение деструктивных
процессов в течение второй недели постнатального развития. Эти
34
данные свидетельствуют об аддитивном взаимодействии генов
г1 и wv у двойных гомозигот [Yoon, Coffey, 1975]. У мышей гено-
типа rl/rl sg/sg дефекты развития мозжечка выражены значи-
тельно сильнее по сравнению с одинарными гомозиготами, т. е.
гены г1 и sg также действуют аддитивно у двойных гомозигот.
В частности, у двойных гомозигот отмечено преждевременное ис-
чезновение наружного гранулярного слоя. Последний у мышей
rl/rl + / + или +/+ sg/sg существует примерно до 15-дневного
возраста, а у мышей rl/rl sg/sg он исчезает уже на 7—8-й день
после рождения, что является результатом аддитивного действия
обоих мутантных генов {Yoon, 1977а]. В то же время клетки Пур-
кинье у мышей rl/rl sg/sg морфологически очень сходны с тако-
выми мышей +/+ sg/sg как на 7-й, так и на 15-й дни постна-
тальной жизни. У животных обоих генотипов клетки Пуркинье
уменьшены в размерах, выглядят незрелыми и ядра их располо- в
жены эксцентрично. Это свидетельствует о том, что аномалии
клеток Пуркинье у мышей rl/rl sg/sg обусловлены только специ-
фическим действием гена sg {Yoon, 1977b]. Волокна Бергмана и
распределение эпителиальных клеток Гольджи изменены как у
одинарных гомозигот по генам г1 или sg, так и у мышей rl/rl
sg/sg. Однако аномалии волокон Бергмана у двойных гомозигот
отличаются от таковых у мышей rl/rl +/+ и +/+ sg/sg [Yoon,
1977с].
В наших исследованиях было показано, что у мышей, гомо-
зиготных по двум неаллельным мутантным рецессивным генам
fidget (fi) и ocular retardation (or), действующих в клетках за-
чатка сетчатки, развитие глаза нарушается значительно сильнее,
чем у одинарных гомозигот fi/fi +/+ или +/+ ог/ог. Гены fi и
ог у двойных гомозигот fi/fi ог/ог действуют синергично и подав-
ляют полностью митотическую активность клеток и рост внут-
реннего листка глазной чаши, т. е. зачатка сетчатки. Развитие
глаза у двойных гомозигот останавливается на стадии чаши, т. е.
вскоре после вступления в действие гена ог в клетках зачатка
сетчатки. Размеры глаз у зародышей поздних стадий эмбрио-
нального развития и новорожденных мышей fi/fi ог/ог почти та-
кие же, как у 11-дневных эмбрионов. Полость глазной чаши
12-дневных зародышей fi/fi ог/ог заполнена мезенхимными клет-
ками, сетчатка остается тонкой и недифференцированной
(рис. 7; см. вклейку). В пораженных глазах не происходит ин-
дукционного влияния сетчатки на хрусталик, вследствие чего
хрусталиковые волокна не образуются [Конюхов, Вахрушева,
Осипов, 1970].
Методом радиоавтографии с использованием эН-тимидина
было показано, что у 11-суточных эмбрионов fi/fi ог/ог имеет ме-
сто значительное уменьшение числа синтезирующих ДНК ядер
сетчатки по сравнению с нормальными зародышами и эмбриона-
ми, гомозиготными по одному из этих мутантных генов. В за-
чатке сетчатки 12-дневных эмбрионов fi/fi or/of почти полностью
35
2*
отсутствуют меченые ядра [Konyukhov, Sazhina, 1975]. Гены fi и
or действуют сходным образом: каждый из них в гомозиготном
состоянии значительно удлиняет пресинтетический период (GJ
митотического цикла в зачатке сетчатки, в результате чего и про-
исходит уменьшение скорости размножения клеток [Konyukhov,
Sazhina, 1971]. У эмбрионов мышей fi/fi ог/ог гены fi и ог дейст-
вуют синергично, очевидно, в пресинтетический период клеточно-
го цикла, нарушая биохимические процессы, подготавливающие
репликацию ДНК в зачатке сетчатки. Сильное ингибирование
роста сетчатки у эмбрионов fi/fi ог/ог приводит к изменению на-
правления ее развития, в результате чего внутренний листок
глазной чаши приобретает структурное сходство с пигментным
эпителием (рис. 8; см. вклейку).
Электронно-микроскопический анализ характера пигмента-
ции клеток внутреннего листка глазной чаши у эмбрионов мы-
шей fi/fi ог/ог показал, что дифференцировка клеток зачатка сет-
чатки у них происходит по типу пигментного эпителия [Конюхов,
Сажина, Колесова, 1976]. Результаты этой работы изложены
ниже.
Меланогенез исследовали в сетчатке и пигментном эпителии
9-, 10-, 11-, 12 и 15-дневных эмбрионов мышей генотипа fi/fi ог/ог.
В качестве контроля использовали нормальных эмбрионов того
же возраста (генотип +/+ +/+). У 10-дневных эмбрионов мы-
шей мутантного и нормального генотипов в цитоплазме клеток
внутреннего листка глазной чаши не удалось обнаружить преме-
ланосом и активности тирозиназы. Цитоплазма клеток форми-
рующегося пигментного эпителия содержит премеланосомы без
пигмента (ранние формы) и с различным числом гранул мелани-
на (средние и поздние формы). Активность тирозиназы наблю-
дается в премеланосомах, в окруженных мембраной пузырьках
(coated vesicles) и цистернах комплекса Гольджи. У 11-дневных
эмбрионов fi/fi ог/ог появляются первые признаки пигментации
внутреннего листка глазной чаши: в цитоплазме отдельных кле-
ток, главным образом в периферических частях зачатка сетчат-
ки, встречаются разные формы премеланосом. Все клетки пиг-
ментного листка имеют премеланосомы, причем их больше и они
имеют более высокую электронную плотность по сравнению с
премеланосомами зачатка сетчатки мутантных зародышей. Ак-
тивность тирозиназы наблюдается в премеланосомах, в окружен-
ных мембраной пузырьках и цистернах комплекса Гольджи.
В клетках пигментного эпителия активность тирозиназы выра-
жена сильнее, чем во внутреннем листке глазной чаши (рис. 9;
см. вклейку).
У 12-дневных эмбрионов генотипа fi/fi ог/ог по сравнению с
зародышами предыдущего срока развития во внутреннем листке
глазной чаши увеличивается число клеток, содержащих преме-
ланосомы. В периферических участках зачатка сетчатки возра-
стает число премеланосом и, в частности, форм с высокой элек-
36
тронной плотностью (рис. 10, о), а в клетках центральной части
содержатся главным образом непигментированные формы пре-
меланосом или премеланосомы с незначительным числом гранул
меланина (рис. 10, б). Активность тирозиназы наблюдается, так
же как и у эмбрионов более раннего возраста, в премеланосо-
мах, в окруженных мембраной пузырьках и цистернах комплек-
са Гольджи. Многие клетки пигментного эпителия зародышей
мутантного и нормального генотипов наряду с поздними форма-
ми премеланосом содержат также и меланосомы (рис. 10, в\ см.
вклейку).
У 15-дневных эмбрионов fi/fi ог/ог глаз представляет собой
чашу, внутренний и наружный листки которой состоят из одного
слоя клеток (см. рис. 8). Все клетки внутреннего листка пигмеи*
тированы и во многих чертах сходны с клетками пигментного
эпителия. В цитоплазме клеток сетчатки эмбрионов нормально-
го генотипа премеланосомы и тирозиназная активность отсутст-
вовали на всех изученных сроках развития. Меланогенез в пиг-
ментном эпителии у эмбрионов мутантного генотипа не отличал-
ся от такового у эмбрионов +/+ +/ + .
В культивируемых in vitro зачатках глаз без пигментного
эпителия 10- и 11-суточных эмбрионов мышей fi/fi ог/ог гены fi
и ог, так же как in vivo, взаимодействуют синергично. При куль-
тивировании зачатков глаз 11-суточных эмбрионов такое синер-
гичное действие наблюдается через 24 ч, а при культивировании
зачатков глаз 10-суточных эмбрионов — только после 72 ч куль-
тивирования in vitro. В клетках зачатка сетчатки 11-суточных
эмбрионов fi/fi ог/ог, очевидно, накапливаются продукты му-
тантных генов, и поэтому при культивировании этих зачатков
глаз сильное подавление митотической активности в развиваю-
щейся сетчатке наступает значительно быстрее, чем при культи-
вировании зачатков глаз 10-дневных эмбрионов данного геноти-
па [Конюхов, Уголькова, 1978].
Таким образом, синергичное взаимодействие мутантных ге-
нов fi и ог, обусловливающих сильное подавление клеточной
пролиферации внутреннего листка глазной чаши, приводит к из-
менению развития его клеток, которые дифференцируются, как и
клетки пигментного эпителия, с образованием специфических
структур — меланосом.
Мутантный ген fi действует также в клетках формирующейся
центральной нервной системы, подавляя размножение этих кле-
ток у гомозигот [Konyukhov, Vakhrusheva, 1969], что обусловлено
значительным увеличением Сгпериода клеточного цикла [Коню-
хов, Сажина, 1972]. В отличие от гена fi полудоминантный ген
splotch (Sp), наоборот, повышает скорость клеточной пролифе-
рации в формиругощейся центральной нервной системе, причем
это связано с уменьшением продолжительности S-периода мито-
тического цикла [Конюхов, Миронова, 1974]. Повышение скоро-
сти клеточной пролиферации в центральной нервной системе у
37
эмбрионов мышей Sp/Sp приводит к незакрытию у них нервной
трубки главным образом в пояснично-крестцовой области.
Мы считали интересным исследовать взаимодействие генов
Sp и fi, имеющих противоположно направленные эффекты.
С этой целью самок мышей Sp/+ +/+ скрещивали с самцами
+ /+ fi/fi, затем самок Sp/+ fi/ + скрещивали с самцами +/+
fi/fi в результате чего получали мышей Sp/+fi/fi, которых скре-
щивали между собой для получения эмбрионов генотипа Sp/Sp
fi/fi. Следует отметить, что с помощью многократных скрещива-
ний мутантные гены Sp и fi были введены в генотип мышей ин-
бредной линии CC57BR. В контроле скрещивали самок
Sp/-f- +/+, 47+ fi/fi или +/+ +/+ (инбредная линия
CC57BR) с самцами такого же генотипа. Самок вскрыва-
ли на 11- и 17-е сутки беременности, определяли число мест им-
плантаций, количество живых, мертвых и резорбированных эм-
брионов, а также число зародышей с открытой нервной трубкой.
При вскрытии мышей на 11-е сутки беременности у 26 самок
Sp/—Ь- + / + , скрещенных с самцами Sp/+ +/ + , было обнаруже-
но 16 эмбрионов Sp/Sp +/ + , что составило 11,8% от числа мест
имплантации, а у 21 самки Sp/+ fi/fi, скрещенной с самцом та-
кого же генотипа, был обнаружен только один эмбрион с откры-
той нервной трубкой, что составило 0,8%. У 18 самок Sp/4-fi/fi,
скрещенных с самцами такого же генотипа, на 17-е сутки бере-
менности было найдено лишь 2 эмбриона с открытой нервной
трубкой, что составляет 1,7% от числа мест имплантации. При
скрещивании самок Sp/+ +/+ с самцами Sp/+ +/+ число эм-
брионов с открытой нервной трубкой составило 14,4%.
Таким образом, при скрещивании мышей генотипа Sp/+ fi/fi
между собой наблюдается значительно меньше эмбрионов с от-
крытой нервной трубкой, чем при скрещивании самок Sp/+ +/+
с самцами такого же генотипа. Причем это различие не обуслов-
лено повышенной пре- или постимплантационной гибелью эм-
брионов генотипа Sp/Sp fi/fi [Конюхов, Миронова, 1979]. Эти дан-
ные свидетельствуют о том, что гены Sp и fi, каждый из которых
в гомозиготном состоянии вызывает нарушения центральной
нервной системы, при взаимодействии у двойных гомозигот
Sp/Sp fi/fi взаимно ослабляют эффекты, что приводит в боль-
шинстве случаев к нормальному закрытию нервной трубки.
Следовательно, гены, действующие в одной клеточной систе-
ме и имеющие противоположно направленные эффекты, могут
взаимно подавлять свою экспрессию. Такое взаимодействие му-
тантных генов с противоположными эффектами Киллер [Keeler,
1947} назвал реципрокным дефектным сбалансированием. Райт
[Wright S., 1963] наблюдал взаимное подавление эффектов неал-
лельных мутантных генов, нарушающих строение волос у мор-
ских свинок.
У человека также известны случаи ослабления эффектов двух
взаимодействующих неаллельных мутантных генов. В некоторых
38
родословных найдены в различных комбинациях шизофрения,
депрессия, невроз и эпилепсия. Изучение таких родословных по-
казало, что сочетание у одного индивида нескольких наследст-
венных нервных заболеваний дает атипичные формы как резуль-
тат состояния баланса между противоположными динамически-
ми эффектами. При этом симптомы заболеваний у пробанда
менее выражены и прогноз более благоприятный. Главные психо-
зы, по-видимому, эпистатичны по отношению к эпилепсии [Bra-
coni, 1976]. При одновременном сочетании у индивида а- и 0-та-
лассемий наблюдается уменьшение дисбаланса в содержании
отдельных глобиновых цепей, что приводит к ослаблению тяже-
сти клинической картины заболевания. Так, в семье греков-кип-
риотов, в которой было выявлено сочетание а- и 0-талассемий,
соотношение а к 0-цепям составляло 1 3, тогда как у гомозигот
по 0-талассемии оно равняется в среднем 10: 1. Следовательно,
одновременное наследование а- и 0-талассемий нормализует в
определенной степени дисбаланс глобиновых цепей [Bate, Hump-
hries, 1977].
Взаимодействие генов определяет время вступления в дейст-
вие гена или проявление его эффектов. Так, ген fi начинает дей-
ствовать в клетках зачатка сетчатки раньше гена ог и сдвигает
время вступления в действие гена or или проявление его эффек-
тов у двойных гомозигот fi/fi ог/ог на одни сутки позднее по
сравнению с одинарными гомозиготами ог/ог +/+ [Конюхов,
Вахрушева, Осипов, 1970]. Однократное введение 3Н-тимидина
самкам мышей в дозе 5 мкКи/г веса тела на 10, 11 или 12-й день
беременности показало, что индексы меченых ядер в сетчатке
10-дневных эмбрионов генотипов +/+ fi/fi и fi/fi ог/ог одинаковы
и выше, чем у эмбрионов ог/ог +/+. Однако индекс меченых
ядер в сетчатке 11-дневных эмбрионов fi/fi ог/ог значительно
меньше по сравнению с таковым у эмбрионов мышей, гомозигот-
ных по гену fi или и or, т. е. у одинарных гомозигот [Konyukhov,
Sazhina, 1975] (рис. 11, ср. г с б и в). Эти данные свидетельству-
ют об отсутствии экспрессии гена ог в зачатке сетчатки 10-днев-
ных эмбрионов fi/fi ог/ог. Запаздывание проявления эффектов
гена ог у двойных гомозигот по сравнению с одинарными гомо-
зиготами обусловлено тем, что в результате действия гена fi
клетки зачатка сетчатки у эмбрионов fi/fi ог/ог к моменту дере-
прессии гена ог у одинарных гомозигот проходят меньше деле-
ний и формирующаяся сетчатка оказывается менее зрелой.
В процессе дифференцировки эритроцитов у мыши время по-
явления антигенов, контролируемых аллелями основного локуса
гистосовместимости Н-2, зависит от влияния генов локуса Теш:
аллель Тета вызывает запаздывание проявления эффектов гена
Н-2Ь, а аллель Temb, наоборот, — более раннее проявление эф-
фектов гена Н-2а. Следовательно, на плазматических мембранах
эритроцитов контролируемые этими аллелями антигены появля-
ются позднее или несколько раньше. Причем действие аллелей
39
Рис. 11. Гистограммы, показывающие изменение индексов меченых ядер в раз-
вивающейся сетчатке эмбрионов мышей разных генотипов после однократной
инъекции 3Н-тимидина [Konyukhov, Sazhina, 1975]
Генотипы эмбрионов: а —норма (+/+ +/+), б — fi/fi +/+, в — +/+ ог/ог, г — fi/fi ог/ог.
По оси абсцисс — возраст эмбрионов, дни; по оси ординат — индекс меченых ядер, %
локуса Теш зависит в свою очередь от генов локуса Rec [Boube-
Ик с. а., 1975]. Авторы полагают, что гены локуса Rec, по-види-
мому, контролируют синтез связанной с клеточной мембраной
определенной макромолекулы, к которой прикрепляются Н-2-ан-
тигены, а аллели локуса Теш влияют на скорость синтеза генных
продуктов локуса Rec. Винер и соавторы [Weiner е. а., 1957] по-
казали, что гены локуса у определяют время появления антигена
А на поверхности эритроцитов человека. Аллели данного локуса
не оказывают влияния на время появления антигена В этой же
системы АВО. У овец появление эритроцитарного антигена i за-
висит от проявления антигенов R и 0. При скрещивании самцов
R- с самками 0“ в потомстве наблюдается избыток ягнят муж-
ского пола с антигеном i (R-- и (к-отрицательные). Эта система
аналогична взаимодействию эритроцитарного антигена Н с анти-
генами А—0 у свиней [Rasmusen, 1976].
Взаимодействие неаллельных генов, действующих в разных
клеточных системах. Эти взаимодействия часто обусловлены ге-
теротипическими клеточными взаимодействиями в пределах ка-
кого-либо одного формирующегося органа, если гены действуют
на сходной стадии развития и генные продукты способны к диф-
фузии через плазматические мембраны. Для проявления гена
agouti (А), который контролирует ритмические изменения в син-
тезе эумеланина и феомеланина в меланоцитах мыши, имеет
значение не только генотип меланоцитов, но и их число, а также
40
тип волосяного фолликула и генотип его клеток. Окружающие
волосяной фолликул клетки кожи также оказывают влияние на
характер выражения эффектов данного гена [Galbraith, 1969].
Мак-Ларен и Боумен [McLaren, Bowman, 1969] на химерных
мышах, полученных в результате агрегации клеток зародышей,
которые отличались друг от друга по 9 парам генов (контроли-
рующих, в частности, пигментацию, структуру волос, длину ушей
и хвоста, синтез изоцитратдегидрогеназы), показали, что эти ге-
ны оказывают локальное и нелокальное действие на фенотип.
Продукты деятельности «нелокальных» генов, очевидно, выделя-
ются из клеток, вследствие чего химерные структуры, состоящие
из мутантных и нормальных клеток, имеют нормальный фенотип.
Происходит своего рода «доминирование» на тканевом уровне.
Продукты «локальных» генов не выделяются из клеток, и поэто-
му мутантные клетки в химерных тканях сохраняют свойствен-
ный им фенотип даже в тех случаях, когда они контактируют с
нормальными клетками. Так, у химерных мышей rd/rd*->+/ +
зоны дегенерации фоторецепторов чередуются с участками нор-
мальной сетчатки. Следовательно, проявление мутантного гена
rd строго ограничено той клеточной популяцией, в которой этот
ген действует [Mintz, Sanyal, 1970].
В случаях нелокального действия гена у химер происходит
как бы выравнивание или перераспределение эффектов гена
между двумя клеточными популяциями. Мутантный ген short-
ear (se) у мыши уменьшает размеры ушей и костей скелета у го-
мозигот в результате подавления скорости размножения пред-
хрящевых клеток, т. е. скелетогенной мезенхимы [Green, 1968].
У химер se/se-<-> + /+ размеры наружного уха не отличаются от
нормы [McLaren, Bowman, 1969]. С другой стороны, у химер
se/se+-> + / + , так же как и у гетерозигот se/+, наблюдаются де-
фекты скелета, причем степень поражения костей у химерных
животных проявляется не у всех особей и варьирует сильнее по
сравнению с гетерозиготами [Griineberg, McLaren, 1972]. Мутант-
ный ген vestigial tail (vt) обусловливает у мыши аномалию хво-
ста, в частности, значительное уменьшение его размеров. У не-
которых химерных мышей vt/vL<->+/+, так же как у гетерозигот
vt/+, отмечены дефекты строения хвоста [McLaren, Bowman,
1969; McLaren, 1976а]. Следовательно, у таких химер, состоящих
из двух генетически разных клеточных популяций, одна из кото-
рых имеет мутантный ген в гомозиготном состоянии, конечные
эффекты гена могут проявляться примерно так же, как у гетеро-
зигот.
Химерные мыши W/+ С/С*->+/+ с/с имеют белую окраску
шерсти и рубиновые глаза. Гистологическое изучение тканей
этих мышей показало, что весь пигмент локализован в клетках
пигментного эпителия глаза, который представлен мозаикой со-
держащих и несодержащих меланин клеток. У мышей +/+
С/Сч-> + /-и с/с наблюдается интенсивная пигментация волос и
41
Таблица 3. Средние митотические индексы (в %) в сетчатках эмбрионов мышей
разных генотипов
[Konyukhov, Sazhina, 1966]
Топотип Возраст, сутки Генотип Возраст, сутки
10 11 12 13 10 11 12 1 *’
+/+ +/+ 2,82 2,80 2,84 2,74 +/+ mi/mi 2,75 2,79 2,64
ог/ог +/+ 1,36 1,63 1,53 1,43 ог/ог mi/mi — 2,78 1,97 1,93
Примечал и е. У 10-сутэч iwx эмбриэнов 4-/4. mi/mi и ог/ог mi/mi по пигментации глаза
еще невозможно отличить гомозигот по гену ml от нормальных зародышей.
мозаичное расположение пигментированных и непигментирован-
ных клеток в пигментном эпителии и сосудистой оболочке глаза.
Эти данные свидетельствуют о том, что пигментные клетки W/+
дифференцируются в волосяных фолликулах мышей генотипа
С/С, но не заселяют волосяные фолликулы у химерных мышей
W/+ С/С+->+/+ с/с в присутствии клеток генотипа +/+ с/с
[Gordon, 1977].
Гены, имеющие противоположно направленные эффекты, но
действующие в разных клеточных популяциях одного и того же
органа, могут ослаблять экспрессию друг друга. Мы наблюдали
в эмбриогенезе мыши взаимное ослабление эффектов генов ocu-
lar retardation (ог) и microphthalmia (mi) в результате межкле-
точных взаимодействий внутреннего и наружного листков глаз-
ной чаши. У одинарных гомозигот ог/ог +/+ ген ог начинает
действовать в клетках зачатка сетчатки уже на 10-е сутки эм-
бриогенеза, приводя к значительному снижению пролифератив-
ной активности этой ткани. Эффекты гена or не проявляются у
двойных гомозигот ог/ог mi/mi на ранних стадиях развития гла-
за. У 11-суточных эмбрионов ог/ог mi/mi. митотический индекс в
зачатке сетчатки такой же, как у эмбрионов +/+ +/+ и + /+
mi/mi. Только у 12-суточных эмбрионов ог/ог mi/mi впервые на-
блюдается уменьшение митотической активности клеток сетчат-
ки, обусловленное геном or (табл. 3). Строение глаза у 10- и 11-
суточных эмбрионов ог/ог mi/mi сходно со строением глаза эм-
брионов +/+ mi/mi (рис. 12 см. вклейку). Глаза новорожденных
ог/ог mi/mi имеют более правильную форму, чем у мышей +/ +
mi/mi, а по сравнению с глазами мышей ог/ог + /+ у них значи-
тельно лучше дифференцирована сетчатка (рис. 13; см. вклей-
ку). Следовательно, у двойных гомозигот строение глаза не-
сколько нормализуется по сравнению с одинарными гомозигота-
ми, хотя глаза остаются все-таки структурно ненормальными
[Konyukhov, Sazhina, 1966].
Запаздывание проявления эффектов гена ог у двойных гомо-
зигот ог/ог mi/mi на двое суток по сравнению с эмбрионами ог/ог
+ / + , очевидно, обусловлено переходом определенного вещества
из гиперплазированного наружного листка глазной чаши в пора-
42
женную геном or сетчатку, в которой отсутствует вещество, не-
обходимое для нормального размножения клеток. У двойных го-
мозигот на 10-е и 11-е сутки эмбриогенеза недостаток этого ве-
щества в сетчатке полностью компенсируется за счет перехода
его из ненормально утолщенной части пигментного листка, раз-
вивающейся по типу сетчатки. Аналогичным образом, по-види-
мому, взаимодействуют эффекты генов fi и mi. У эмбрионов мы-
шей, гомозиготных по этим неаллельным генам (двойных гомо-
зигот fi/fi mi/mi), эффекты гена fi проявляются лишь на самых
ранних стадиях формирования глаза, а начиная с 10-х суток бе-
ременности сильно гиперплазированный в результате действия
гена mi наружный листок глазной чаши полностью нормализует
развитие сетчатки, поражение которой обусловлено геном fi [Ко-
нюхов, Вахрушева, Осипов, 1971].
В последнее время в нашей лаборатории получены тройные
гомозиготы по генам fi, ог и mi — мыши генотипа fi/fi ог/ог mi/mi.
Изучение строения глаза показало, что у мышей fi/fi ог/ог mi/mi
в отличие от мышей fi/fi ог/ог +J+ зачаток сетчатки не разви-
вается по типу пигментного эпителия. Ни в одном случае у трой-
ных гомозигот мы не наблюдали пигментации внутреннего лист-
ка глазной чаши. У новорожденных мышей fi/fi ог/ог mi/mi глаза
деформированы, имеют типичную колобому и, как правило, ор-
битальную кисту. Сетчатка представлена общим ядерным слоем,
складчата, ганглиозные клетки не образуют четкого слоя, а раз-
бросаны по всему внутреннему ретикулярному слою, вследствие
чего последний выражен нечетко. Пигментный эпителий неравно-
мерно утолщен, местами складчат, и клетки его не содержат гра-
нул меланина. Стекловидное тело отсутствует, и хрусталик за-
нимает почти всю полость глаза. Хрусталик имеет неправильную
форму и признаки катарактальных изменений: волокна хаотично
расположены и частично лизированы, эпителий распространяет-
ся на задний полюс (рис. 14 см. вклейку).
Следовательно, строение глаза у тройных гомозигот (fi/fi
ог/ог mi/mi) в общих чертах сходно со строением глаза у мышей
+J+ +/+ mi/mi. Однако в отличие от последних у тройных го-
мозигот размеры глаза значительно меньше и наблюдается силь-
ное недоразвитие сетчатки, что обусловлено совместным дейст-
вием генов fi и ог. Образование орбитальной кисты у мышей
fi/fi or/or mi/mi обусловлено усиленным ростом наружного листка
глазной чаши (эффект гена mi) и сильным подавлением роста
сетчатки — синергичное действие генов fi и ог. Гиперплазиро-
ванный наружный листок глазной чаши стимулирует рост пора-
женной сетчатки, вследствие чего у мышей fi/fi ог/ог mi/mi сет-
чатка не развивается по типу пигментного эпителия, как это имеет
место у мышей генотипа fi/fi ог/ог +/+ Таким образом, взаимо-
действие генов, работающих в разных клеточных системах, мо-
жет приводить как к усилению, так и к ослаблению их эффектов.
Такие генные взаимодействия наблюдаются в гисто- и органо-
43
генезах, когда различные клеточные системы вступают в слож-
ные взаимоотношения друг с другом и анализ взаимодействия
генных эффектов проливает свет на механизмы дифференциров-
ки и морфогенеза.
Отсутствие взаимодействия неаллельных генов может указы-
вать на то, что данные гены работают в разных клеточных систе-
мах. Так, например, ген loop-tail (Lp) обусловливает в гомози-
готном состоянии незакрытие нервной трубки у эмбрионов мыши.
Это дало основание некоторым авторам полагать, что данный
ген первично нарушает развитие центральной нервной системы.
Однако полученные нами данные свидетельствуют о том, что
пролиферативная активность клеток нервной трубки у мутантов
не отличается от нормы. Кроме того, ген Lp не взаимодействует
у двойных гетерозигот с геном Sp, который действует в клетках
центральной нервной системы [Конюхов, Миронова, 1975]. Ген
Lp взаимодействует у двойных гетерозигот с геном Т или Fu, ко-
торые первично поражают хордомезодерму [Strong, Hollander,
1949]. Эти факты указывают на то, что ген Lp активен в клетках
хордомезодермы, а развитие центральной нервной системы у эм-
брионов Lp/Lp нарушается вторично. В табл. 4 суммированы
данные о взаимодействии мутантных генов, нарушающих разви-
тие глаза у мыши.
На заре развития генетики считали, кто каждый ген контро-
лирует определенный признак; позднее, когда стали известны
многочисленные случаи полигении, исследователи пришли к дру-
гому мнению — каждый компонент фенотипа является результа-
том взаимодействия генотипа как целого. Такая точка зрения
получила широкое распространение в литературе. Так, Э. Майр
[1974] в книге «Популяции, виды и эволюция» сформулировал
следующим образом взаимодействие генов: каждый признак ор-
ганизма подвержен влиянию всех генов, и каждый ген влияет на
все признаки. Именно такое взаимодействие обусловливает, по
мнению автора, функциональную интеграцию генотипа как це-
лого. Однако установленные в последние два десятилетия факты,
в частности на химерных мышах, свидетельствуют о том, что да-
леко не во всех случаях происходит взаимодействие генов. В ча-
стности, гены не взаимодействуют, если они активны в разных
клеточных клонах, из которых образуются различные органы,
например, такие, как глаз и конечность.
Плейотропия
Действие некоторых генов имеет строго локальный характер,
другие гены приводят к возникновению множественных эффек-
тов. Под плейотропией понимают влияние одного гена на не-
сколько признаков. Большинство генов у позвоночных имеет
множественные эффекты, в результате чего, используя медицин-
скую терминологию, можно сказать, что мутантные гены и обус-
44
Таблица 4. Взаимодействие мутантных генов, нарушающих развитие глаза у мыши
Генотип Сетчатка Пигментный эпителий
fi/fi +/+ +/+ +/+ ог/ог +/+ +/+ +/+ mi/mi +/ч—ь/+ Miwh/Mi4h +/+ +/+ Miwh/mi fi/fi +/+ mi/mi 4-/+ ог/ог mi/mi fi/fi ог/ог +/+ fi/fi ог/ог mi/mi Подавление роста начиная со стадии глазного пузыря Подавление роста начиная со стадии глазной чаши Нормальный рост Нормальный рост Нормальный рост Подавление роста на самых ранних стадиях формирования глаза Подавление роста после 11 дней эмбриогенеза Сильное подавление роста, развивается как пигментный эпителий Сильное подавление роста, но пигментация отсутствует Нормальное развитие Нормальное развитие Сильно повышенный рост, в дорсальной части глаза развивается как сетчатка, отсутствие пигментации Усиленный рост, образование складок, отсутствие пигментации Частичная нормализация развития: уменьшение скорос- ти роста по сравнению со ч скоростью роста у гомозигот, наличие дефектных меланосом и тирозиназы; синтез меланина отсутствует Усиленный рост, отсутствие пигментации Усиленный рост, отсутствие пигментации Нормальное развитие Усиленный рост, отсутствие пигментации
ловливают возникновение синдромов. Различают первичную
(мозаичную) и вторичную (относительную) плейотропии. По
мнению Хэдорна [Hadorn, 1961], возникновение первичной плейо-
тропии обусловлено, тем, что продукт одного и того же гена,
взаимодействуя с цитоплазмой различных клеточных систем, в
которых этот ген активен, может привести к возникновению раз-
ных эффектов. Несмотря на то что первичный эффект гена в раз-
ных клеточных системах одинаков — синтез специфического по-
липептида, взаимодействие последнего с продуктами других ге-
нов может привести к появлению плейотропии. Вторичная
плейотропия возникает в результате влияния продуктов первич-
ного действия гена в какой-либо одной или нескольких клеточ-
ных системах на развитие других тканей, в которых данный ген
не активен.
Хэдорн [Hadorn, 1961] назвал эффекты первичного действия
гена как в случае первичной, так и вторичной плейотропии ауто-
45
Рис. 15. Схема возникновения первичной
(Д) и вторичной (Б) плейотропии [На-
dorn, 1961]
Объяснения см. в тексте
фенами. Для обозначения
генных эффектов, появляю-
щихся в других зависимых
от аутофенов клеточных
системах, при вторичной
плейотропии он предложил
термин аллофены. На рис. 15
показано, что экспрессия
гена а может наблюдаться в
клетках I, II, IV и V типов,
а в клетках III типа этот
ген не активен. Возникнове-
ние вторичной плейотропии
обусловлено межклеточ<
ными взаимодействиями.
Например, ген Ь может
быть активен только в клет-
ках I типа, продукты дейст-
вия этого гена выходят из
клеток и оказывают влияние
на развитие клеток II, IV и
V типов, вследствие чего
появляются, согласно терминологии Хэдорна [Hadorn, 1961],
соответствующие аллофены гена Ь. Однако клетки III типа не
чувствительны к продуктам (аутофенам) этого гена.
Место действия гена. Действие многих генов характеризуется
тканеспецифичностью, что и лежит в основе генетического конт-
роля клеточной дифференцировки. Определение места действия
гена имеет важное значение для выяснения механизмов возник-
новения плейотропии. Место действия гена можно выявить в ре-
зультате экспериментальных исследований. Геккер [Наескег,
1918], указывая на важность обнаружения места действия гена в
феногенетических исследованиях, отмечал, что отклонения раз-
вития клеток от нормы на фенокритической фазе могут быть
обусловлены их автономными структурными или физико-химиче-
скими особенностями или нарушением развития и функции дру-
гих тканей, которые на первый взгляд как будто не принимают
участия в формировании исследуемого признака. Даже присут-
ствие фермента в клетке еще не доказывает, что он здесь синте-
зируется. Клеточную автономность в отношении синтеза фермен-
та можно установить с помощью методов трансплантации или
клеточных культур.
Для определения места действия генов используют следую-
щие методы исследования: парабиоз, трансплантацию тканей,
органов или клеток, получение химерных животных, культивиро-
вание in vitro тканей или клеток. Для определения места дейст-
вия генов у низших позвоночных животных широко используют
парабиоз. Этим методом было установлено, в частности, место
46
действия локуса immobile (im) у Xenopus laevis. В течение ран-
него периода эмбриогенеза мутанты im/im развиваются нормаль-
но. На стадиях 22—24 при механической стимуляции нормальные
зародыши отвечают сокращением шеи, а начиная со стадии 25
они способны к самостоятельным движениям. Мутантные заро-
дыши к таким сокращениям не способны, а при длительной сти-
муляции они медленно изгибаются под прямым углом. Глаза у
мутантов развиваются нормально, но способность их к движению
не возникает. Электронно-микроскопическое изучение гистогене-
за мышечной ткани показало, что у мутантов начиная с 33 стадии
наблюдается ненормальное взаиморасположение миофибрилл, а
на 45 стадии отмечена дегенерация актиномиозиновых нитей.
У парабионтов и химерных организмов обнаружено, что разви-
тие каждого парабионта и каждой части химерного организма
происходит в соответствии с генотипом исследуемой структуры,
причем аномалии затрагивают лишь клетки мезодермального
происхождения [Droin, Beauchemin, 1975].
Аутосомные рецессивные гены г и х у аксолотля (Ambystoma
mexicanum), имеющие сходные эффекты, в частности нарушение
формирования жабер и конечностей, обусловливают гибель го-
мозигот примерно на одной и той же стадии развития. В пара-
биозе с нормальными личинками не происходит нормализации
развития г/г и х/х особей: в их жабрах наблюдаются дегенера-
тивные изменения, передние конечности прекращают рост, не
образуя пальцев. Смерть мутантного партнера в результате рас-
ширения и разрывов сосудов вследствие застоя крови в них при-
водит к гибели нормального партнера. При трансплантации об-
ластей передних конечностей или жабер от г/г и х/х особей нор-
мальным личинкам возникали дефектные конечности и жабры,
соответствующие мутантному типу трансплантатов. Это указы-
вает, что данные гены действуют в клетках пораженных струк-
тур. Личинки, гомозиготные по обоим генам — двойные гомози-
готы (г/г х/х), четко отличаются от одинарных гомозигот (г/г
+/+ или +/+ х/х) сильно редуцированными размерами тела,
жабер и глаз, т. е. гены г и х действуют синергично у двойных
гомозигот [Humphrey, Chung, 1978].
Фенотипическая экспрессия мутантного аутосомного рецес-
сивного гена ар у Xenopus laevis выражается в рамках опреде-
ленного цикла: за периодом полного альбинизма следует кратко-
временный период пигментации, а затем наступает элиминация
сформированных меланосом. Личинки, как и взрослые животные
генотипа ар/ар, содержат единичные гранулы меланина в пиг-
ментном эпителии глаза. Дермальные меланофоры у мутантов
претерпевают сходные процессы возникновения и деструкции
пигментных гранул, как и клетки пигментного эпителия глаза.
Вероятно, в их основе лежат одни и те же регуляторные меха-
низмы, определяющие дифференцировку меланобластов на ста-
диях раннего эмбриогенеза. Данные по парабиозу между заро-
47
дышами +/+ и ар/ар показали, что общее кровообращение с го-
ловастиками нормального генотипа не приводит к нормализации
пигментации мутантов. У парабионтов процесс пигментации идет
по типу, характерному для каждого из партнеров парабиотиче-
ской пары [Хопёрская, Голубева, 1977]. С помощью пересадок
глазных пузырей между мутантными (ар/ар) и нормальными
(+/+) зародышами установлено, что синтез меланина в пиг-
ментном эпителии глаза мутантов восстанавливается до нор-
мального уровня, причем индукция меланинового синтеза воз-
можна только в очень узком интервале эмбриогенеза и осущест-
вляется энтомезодермальными тканями.
На зависимость синтеза меланина от влияния окружающих
тканей указывает, в частности, тот факт, что участки пигментно-
го эпителия, наиболее удаленные от энтомезодермальных орга-
нов, не содержали меланина и дифференцировались так же, как
у интактных мутантных особей. Эти данные свидетельствуют в
пользу предположения о том, что стимулирующее меланогенез
влияние исходит от энтомезодермальных тканей [Хопёрская,
1977]. Следовательно, ген ар у Xenopus laevis действует, по-види-
мому, в клетках энтомезодермальных тканей, а нарушения пиг-
ментации возникают вторично.
У мыши мутантные гены более 30 локусов нарушают разви-
тие волос [Green, 1966а]. С помощью разделения кожи эмбрионов
на эпидермис и дерму и трансплантации различных сочетаний
эпидермиса и дермы (от мутантных или нормальных зароды-
шей) в гистосовместимые реципиенты было установлено, что му*
тантные аутосомные рецессивные гены downless (dl), fuzzy (fz),
ichtyosis (ic) и depilated (dep) действуют в дифференцирующих
клетках эпидермиса мыши [Sofaer, 1973, 1974; Green е. а., 1974;
Mayer е. а., 1974, 1976].
Ген dl подавляет у гомозигот формирование волосяных фол-
ликулов, а гены fz, ic и dep влияют на строение волос, которые у
мышей fz/fz извитые и тоньше, а у мышей ic/ic тоньше и короче,
чем в норме. Так, кожу 14-дневных нормальных (+/+) и му-
тантных зародышей мышей генотипа fz/fz или ic/ic разделяли
трипсинизацией на дерму и эпидермис. Эти компоненты реком-
бинировали в различных сочетаниях: нормальный с нормальным
(дерма + /+ и эпидермис +/+), нормальный с мутантным (дер-
ма + /+ с эпидермисом fz/fz или ic/ic; дерма fz/fz или ic/ic с эпи-
дермисом +/ + ) или мутантный с мутантным (дерма fz/fz с эпи-
дермисом fz/fz; дерма ic/ic с эпидермисом ic/ic). Рекомбиниро-
ванные ткани импланировали в семенники взрослых гистосовме-
стимых мышей на 14 дней. Мутантные фенотипы возникали в тех
случаях, когда в рекомбинированных тканях присутствовал му-
тантный эпидермис [Green е. а., 1974: Мауег е. а., 1974].
Майер с соавторами [Мауег е. а., 1977] исследовали место дей-
ствия генов локуса crinkled (сг) путем комбинирования дермы и
эпидермиса кожи хвоста 15-дневных мышей генотипов сг/4- и
48
сг/сг и культивирования таких комбинированных участков кожи
в семенниках гистосовместимых животных. Поскольку мыши
сг/сг имеют голые хвосты, о месте действия гена судили по нали-
чию или отсутствию волос в трансплантате. В трансплантатах,
где были совмещены эпидермис сг/+ и дерма сг/ + , а также эпи-
дермис сг/+ и дерма сг/сг, волосы вырастали, в то время как в
случае комбинаций эпидермиса сг/сг и дермы сг/+, а также эпи-
дермиса сг/сг и дермы сг/сг волосы отсутствовали. На основании
этих данных был сделан вывод, что гены локуса сг, по край-
ней мере в коже хвоста, активны в клетках эпидермиса. С по-
мощью рекомбинации дермы и эпидермиса мутантных и
нормальных 14-дневных зародышей мыши установлено, что лока-
лизованный на Х-хромосоме локус tabby (Та) также действует в
эпидермисе, не влияя на развитие дермы [Mayer, Green, 1978].
Экспериментальный анализ развития эффектов некоторых
мутантных генов у мыши показал, что образование меланоблас-
тов из ганглиозной пластинки (нервного гребня), миграция и
дифференцировка их находятся под генетическим контролем.
Причем этот контроль осуществляется как в результате первич-
ного действия гена непосредственно в меланобластах, так и че-
рез влияние окружающих тканей на активность генов в мелано-
бластах. Нарушения образования меланобластов, их пролифе-
рации, миграции, выживания и дифференцировки приводят к
различным дефектам пигментации волос и кожи, в частности,
отсутствуют пигментации всего тела или его отдельных участков
[Mayer, 1970]. Опытами с рекомбинациями мутантных и нор-
мальных тканей и клеток (нервный гребень — кожа, дерма —
эпидермис, диссоциация — реагрегация) на различных стадиях
эмбриогенеза мыши было показано, что гены локуса steel (S1)
первично нарушают развитие кожи. При этом поражаются одно-
временно как дерма, так и эпидермис. Ген steel вступает в дейст-
вие ранее 13-го дня эмбриогенеза, а нарушение кожи наблюда-
ется у 18-дневных эмбрионов. Вероятный механизм действия гена
steel на меланогенез заключается в блокировании миграции ме-
ланобластов в мутантной ткани.
Гены dominant spotting (W) и piebald (s) действуют в мела-
нобластах, обусловливая их гибель в обычных условиях форми-
рования тканей, которые благоприятны для колонизации и раз-
вития нормальных меланобластов [Мауег, 1975]. Мыши, гомози-
готные по рецессивному ;гену extension, имеют желтую
окраску шерсти, обусловленную синтезом феомеланина в мела-
ноцитах волосяного фолликула. С помощью различных комбина-
ций нормальных и мутантных тканей (нервная трубка — кожа
или дерма — эпидермис кожи зародыша) показано, что гены
этого локуса действуют в меланоцитах. Причем синтез феомела-
нина меланоцитами осуществляется только в окружении клеток
волосяного фолликула [Lamoreux, Мауег, 1975; Poole, Silvers,
1976]. Используя методы дермально-эпидермальной рекомбина-
49
ции кожи зародышей мышей, различающихся по аллелям локуса
agouti (А), было установлено, что эпидермис, так же как и дер-
ма, играет важную роль в экспрессии генов этого локуса в мела-
ноцитах кожи [Poole, 1974].
Место действия гена можно установить с помощью экспери-
ментальных химер, полученных в результате агрегации бласто-
меров мутантных и нормальных животных. Таким образом Минц
[Mintz, 1964а, b] показала, что ген t12 у мыши является ранней
клеточной леталью, т. е. этот ген действует автономно в бласто-
мерах и приводит их к дегенерации. Минц и Сениал [Mintz, Sa-
nyal, 1970] установили, что ген retinal degeneration (rd), обус-
ловливающий дегенерацию фоторецепторов у гомозигот в пост-
натальный период [жизни, действует в самих фоторецепторных
клетках. Ген rd у мыши был первым мутантным геном, действу-
ющим в центральной нервной системе, место которого было уста-
новлено с помощью анализа экспериментальных химер. В сет-
чатке мышей rd/rd-<-> + / + участки с дегенерацией фоторецепто-
ров подстилаются клетками пигментного эпителия генотипа
+ /+ или rd/rd. Эти факты указывают, что ген rd действует в
фоторецепторах, а не в клетках пигментного эпителия. Дегенера-
ция сетчатки у крыс линии RCS (генотип rdy/rdy) отличается от
дегенерации сетчатки мышей. Муллен и Лавейл [Mullen, LaVail,
1976] исследовали процесс дегенерации фоторецепторов у химер-
ных крыс rdy/rdy-<-> + / +. Было показано, что сетчатка у таких
химер, так же как и у химерных мышей rd/rd^-> + / + , представ-
лена участками нормальных и дегенерировавших фоторецепто-
ров. Однако в отличие от мышей у химерных крыс участки сет-
чатки с дегенерирующими фоторецепторами всегда располага-
лись напротив мутантного пигментного эпителия генотипа
rdy/rdy. Следовательно, у крыс местом действия мутантного ге-
на rdy являются клетки пигментного эпителия глаза. Фоторецеп-
торы у крыс rdy/rdy дегенерируют вторично вследствие ненор-
мальной функции пигментного эпителия, который не фагоцити-
рует, как в норме, мембранный материал обламывающихся
старых апикальных дисков наружных сегментов палочек.
Мутантный аутосомный рецессивный ген ped в гомозиготном
состоянии обусловливает гибель почти всех клеток Пуркинье в
мозжечке мышей к 30-му дню жизни. Дегенерация клеток начи-
нается с 18-го дня после рождения. У мышей данного генотипа
наблюдаются также прогрессирующая дегенерация фоторецеп-
торных клеток сетчатки, нервных клеток обонятельной луковицы
и нарушения сперматогенеза, ведущие к бесплодию [Landis, Mul-
len, 1978]. Для определения места действия гена ped получали
химерных мышей с помощью агрегации 8-клеточных эмбрионов
генотипов ped/ped Gusb/Gusb и + / + Gush/Gush-Gusb- и Оизь-ал-
лели локуса, контролирующего синтез 0-глюкуронидазы, причем
гистохимически выявляются только эффекты Gusb. У химерных
особей нормальные клетки Пуркинье имели аллель Gusb, т. е.
50
клетки с геном Gusb дегенерировали, что указывает на место
действия локуса ped в клетках Пуркинье [Mullen, 1977]. Таким же
образом было показано, что ген rl не действует в клетках коры
головного мозга, а ненормальная локализация мутантных кле-
ток обусловлена изменением свойств других клеток [Mullen, 1975].
Формирование тканей и органов происходит при столь тесном
взаимодействии разных клеточных систем, что зачастую невоз-
можно сказать, что является первичным повреждением. Приме-
ром такой ситуации являются нервно-мышечные заболевания,
при которых неясно, обусловлено ли заболевание дефектом нерв-
ной клетки или мышечного волокна. Подход к решению этого
вопроса может быть достигнут созданием химер из двух зигот:
нормальной и мутантной по какому-либо нервно-мышечному за-
болеванию. Последующий анализ химерных особей и исследова-
ние культур тканей указывает на соответствие между определен-
ным генотипом и строением мышечного волокна, т. е. позволяет
определить локализацию первичного дефекта. В результате та-
кого рода исследований обнаружен первичный дефект у мышей
некоторых мутантных линий с нервно-мышечными заболева-
ниями.
С помощью культивирования in vitro скелетных мышечных
клеток 15—16-дневных эмбрионов мышей было установлено, что
аутосомный рецессивный ген muscular dysgenesis (mdg) дейст-
вует в мышечных клетках и, очевидно, первично нарушает обра-
зование плазматической мембраны [Bowden-Essien, 1972]. Опре-
делено также место действия других мутантных генов мыши:
dystrophia muscularis (в мышечных волокнах), dwarf (в передней
доле гипофиза), dominant spotting (в клетках гемопоэтической
ткани), а также генов, нарушающих развитие кожи, волос и пи-
гментации. Прогрессивная мышечная дегенерация у человека
обусловлена действием мутантного гена в мышечных волокнах
[см. Конюхов, Пашин, Гинтер, 1968].
Изучение транспорта железа у мышей mk/mk в петлях две-
надцатиперстной кишки in vitro показало, что причиной недоста-
точности железа в тканях этих животных является уменьшение
его абсорбции клетками слизистой оболочки кишечника [Ed-
wards, Hoke, 1972]. Методом культуры тканей было установлено,
что блок синтеза миелина у мышей двух мутантных линий dilute
lethal и waddler, характеризующихся недостаточной миелиниза-
цией, является внешним по отношению к нервным клеткам и их
аксонам. У гомозиготных мышей по этим мутантным генам на-
блюдается сильная недостаточность миелинизации мозжечковых
трактов. Однако последние миелинизируются in vitro так же,
как и ткань мозжечка от их нормальных сибсов [Hamburgh,
Bornstein, 1970].
Дифференцированные клетки продолжают синтезировать in
vitro тканеспецифические продукты, что указывает на актив-
ность соответствующих генов. Так, при культивировании клетки
51
хрусталика синтезируют кристаллины, клетки гипофиза — сома-
тотропный гормон и пролактин, клетки коры надпочечника —
стероиды, клетки паращитовидной железы — паратиреоидный
гормон, хондроциты — хондроитинсульфат и агколлаген, остео-
бласты— коллаген костного типа, эритробласты — гемоглобин,
мышечные клетки — миозин, лимфобласты — иммуноглобулины,
фибробласты — коллаген и хондроитинсульфат. В культурах
кожных фибробластов человека более 40 мутантных генов про-
являют свои биохимические эффекты, характеризующиеся нару-
шением углеводного, аминокислотного, липидного или нуклео-
тидного обмена вследствие недостаточности определенного фер-
мента [Сох, King, 1975].
С помощью культивирования клеток амниотической жидко*
сти удается обнаружить пораженных индивидов в конце 3-го мес
пренатального периода развития [Krooth, Sell, 1970]. Пренаталь*
ная диагностика возможна сейчас более чем для 100 моногенных
нарушений метаболизма человека, в частности для 11 мукополи-
сахаридозов, 12 болезней с нарушением углеводного обмена, 17
липидозов, 28 дефектов обмена аминокислот и 38 других болез-
ней [Rhine, 1976].
Место действия гена можно также определить с помощью ме-
тода радиоавтографии, в особенности если последний сочетается
с методом электронной микроскопии. Так, при помощи этих ме-
тодов было показано, что наследственная дегенерация фоторе-
цепторов у крыс первично обусловлена действием гена в клетках
пигментного эпителия. Меченные тритием аминокислоты (фе-
нилаланин и лейцин) вводили 11-дневным крысам с нормальным
зрением и наследственной дегенерацией сетчатки. Радиоактив-
ные белки синтезировались во внутренних сегментах и затем
перемещались в диски наружных сегментов палочек. У нормаль-
ных животных меченые диски наружных сегментов фагоцитиро-
вались клетками пигментного эпителия глаза через 8 дней после
инъекции аминокислот. У мутантов сборка и смещение дисков в
течение 3 дней не отличаются от нормы, но позднее слои меченых
дисков дезорганизуются, а их обломки собираются между на-
ружными сегментами палочек и пигментным эпителием. Следо-
вательно, у мутантных крыс пигментный эпителий глаза не мо-
жет выполнять нормальной фагоцитарной функции. В результате
этого между наружными члениками палочек и пигментным эпи-
телием образуется избыточное количество мембранного материа-
ла, что и является причиной дегенерации фоторецепторов [Вок,
Hall, 1971; La Vail е. а., 1972].
Механизмы возникновения первичной плейотропии. Мутации
активных во многих тканях генов должны приводить, как прави-
ло, к летальному исходу. Гены, контролирующие синтез жизнен-
но необходимых ферментов, активны во многих или даже во
всех клеточных системах. Эффекты таких генов одинаковы неза-
висимо от того, в каких клеточных системах они проявляются.
52
Следовательно, в данном случае не наблюдается строгой тка*
невой специфичности действия генов. Так, у больных людей с
острой перемежающейся порфирией наблюдается уменьшение
активности уропорфириноген-1-синтетазы в клетках печени, эри-
троцитах, лимфоцитах и культивируемых фибробластах кожи
[Sassa, Kappas, 1977], а мыши с акаталаземией имеют понижен-
ную активность каталазы в эритроцитах, печени, почках и лег-
ком [Feinstein, 1970].
У индивидов с синдромом Ниемана — Пика наблюдается не-
достаточная активность сфингомиелингидролазы, катализирую-
щей гидролиз сфигомиелина в фибробластах кожи, клетках пе-
чени, почек и костного мозга [Sloan е. а., 1969]. В культивируемых
лейкоцитах и кожных фибробластах от больных и гетерозигот-
ных носителей мутантных генов, обусловливающих мукополиса-
харидозы, отмечено избыточное накопление мукополисахаридов
[Foley е. а., 1969; Matalon, Dorfman, 1969]. Эти факты указывают
на то, что ферменты, участвующие в липидном и углеводном об-
мене, синтезируются во многих клеточных системах и мутации
контролирующих их генов могут быть причиной возникновения
первичной плейотропии.
Клинические симптомы такого наследственного заболевания,
как несовершенный остеогенез (хрупкость скелета, недостаток
зубов, истончение кожи, голубая окраска склер, глухота и раз-
болтанность суставов), обусловлены нарушением синтеза колла-
гена, незрелые волокна которого связаны лабильными межмоле-
кулярными связями [Fujii е. а., 1977].
Чунг и Бриггс [Chung, Briggs, 1975] провели эксперименталь-
ное изучение действия рецессивного летального гена 1 у аксолот-
ля (Ambystoma mexicanum). Гомозиготы 1/1 развиваются нор-
мально на ранних стадиях эмбриогенеза, но примерно на стадии
вылупления у них появляются аномалии многих органов, и они
погибают через несколько недель после вылупления. Исследова-
ли действие гена в опытах с парабиозом мутантных и нормаль-
ных зародышей и при трансплантации зачатков органов между
ними. Оказалось, что все формирующиеся органы мутантного
эмбриона в конечном итоге отмирают при парабиозе его с нор-
мальным зародышем. Трансплантаты мутантных органов (глаз,
конечностей, жабер, пронефроса и гонад) также не выживали
у нормальных реципиентов. В данном случае можно думать, что
ген 1 действует, если не во всех, то по крайней мере во многих
клеточных системах в течение позднего периода эмбриогенеза и
ранних стадий личиночного развития.
Плейотропия может быть результатом нарушения структуры
плазматических мембран вследствие изменения молекулярного
строения того или иного мембранного белка. Биосинтез белков
плазматических мембран находится под генетическим контролем
[Boyse, Old, 1969]. Изучение плазматических мембран мутантов
показало, что активный транспорт веществ, в частности амино-
53
кислот, через биологические мембраны связан с наличием в них
особых «транспортных» белков (пермеаз). Мембранные транс-
портные белки, контролирующие качественную и количествен-
ную специфику миграции веществ через плазматические мембра-
ны, имеют молекулярный вес примерно 30 000 [Pardee, 1968].
Известно много мутантных генов разных локусов, нарушающих
механизмы транспорта аминокислот, пуринов, витаминов, саха-
ров и других веществ через плазматическую мембрану. Одни
мутантные гены нарушают транспорт какой-либо одной специ-
фической аминокислоты, другие гены — определенной группы
аминокислот, а некоторые гены нарушают транспорт не только
всех аминокислот, но также и других веществ. Плазматические
мембраны представляют собой как бы мозаику специфических
транспортных белков. В ходе онтогенеза транспортные системы
клеток определенным образом меняются.
Некоторые наследственные заболевания человека обусловле-
ны нарушением транспорта аминокислот в клетку. Скрайве
[Scriver, 1969] считает, что гены многих локусов контролируют
синтез широкого спектра специфических мембранных белков и
мутации таких генов приводят к наследственным нарушениям
транспорта аминокислот. Болезнь Хартнепа возникает в резуль-
тате мутантного изменения белка, осуществляющего транспорт
триптофана, причем поражаются одновременно транспортные
системы кишечника и почечных канальцев [см. Краснопольская,
1970].
У мыши аутосомный рецессивный ген microcytic anaemia (mk)
обусловливает в гомозиготном состоянии тяжелую форму микро-
цитарной анемии, поражение кожи и сильное подавление роста.
У мышей mk/mk наблюдается дефицит железа в различных тка-
нях, причиной которого является недостаточное поступление его
в клетки. Было установлено, что у животных этого генотипа име-
ет место уменьшение абсорбции железа клетками слизистой
оболочки кишечника и гемопоэтической ткани [Bannerman, 1976].
Следовательно, возникновение плейотропных эффектов гена mk
у мыши обусловлено нарушением транспорта (поступления) же-
леза в разных клеточных системах.
Глюксон-Уелш и Кори [Gluecksohn-Waelsch, Cori, 1970] пола-
гают, что с изменением строения мембранного белка связаны
плейотропные эффекты 4 индуцированных радиацией мутаций
(делеций) локуса albino у мыши. Каждая из этих делеций вызы-
вает в гомозиготном состоянии отсутствие образования пигмен-
та, неактивность глюкозо-6-фосфатазы, нарушения размеров и
формы амеланотических пигментных гранул, аномалии вилочко-
вой железы и почек. По мнению этих авторов, ненормальное
строение мембран у гомозигот не позволяет связывать им тиро-
зиназу и глюкозо-6-фосфатазу, что может быть причиной струк-
турных дефектов амеланотических пигментных гранул и нару-
шения морфогенеза вилочковой железы и почек.
54
Экспериментальными исследованиями установлено, что ре-
цессивный ген taplid3 действует в клетках кожи куриных эмбрио-
нов и нарушает нормальную конденсацию мезенхимных клеток,
образующих зачаток пера. Наряду с этим данный ген нарушает
конденсацию предхрящевых мезенхимных клеток [Ede е. а., 1971].
Такое ненормальное поведение мезенхимных клеток у мутантов,
по-видимому, обусловлено дефектным строением их плазматиче-
ских мембран, что и является основой возникновения плейотроп-
ных эффектов.
Плейотропии может быть обусловлена изменением одним ге-
ном пролиферативной активности разных клеточных систем.
Возможно, этим определяются плейотропные эффекты генов ло-
куса dominant spotting (W) у мыши. Гомозиготы по мутантным
аллелям этого локуса характеризуются отсутствием пигментации
волос, тяжелой макроцитарной анемией и бесплодием. У живот-
ных, гомозиготных по генам локуса W, отсутствуют меланоциты
в луковицах волос [Silvers, 1956] вследствие первичного пораже-
ния нервного гребня [Mayer, Green, 1968; Мауег, 1970], уменьше-
на скорость размножения стволовых клеток гемопоэтической
ткани [Russell е. а., 1959; McCulloch е. а., 1964; Lewis е. а., 1967;
Bennett М. е. а., 1968] и первичных половых клеток [Mintz, Rus-
sell, 1957; Mintz, 1960]. Возникновение плейотропных эффектов
гена short-ear (se) у мыши, очевидно, обусловлено подавлением
этим геном скорости пролиферации предхрящевых клеток, в ре-
зультате чего у гомозигот наблюдаются уменьшение размеров и
дефекты многих костей скелета [Green, 1968].
У эмбрионов мышей генотипа Sp/Sp в результате первичного
поражения нервного гребня не образуются спинальные ганглии
и отсутствует пигментация кожи [Auerbach, 1954]. У мышей, го-
мозиготных по мутантным генам mi или Miwh, поражены многие
органы, развитие которых прямым или косвенным образом свя-
зано с эктомезенхимой, образующейся в результате распада
нервного гребня (ганглиозной пластинки) на клетки [Конюхов,
Осипов, Вахрушева, 1965; Конюхов, Осипов, 1968]. Плейотроп-
ные эффекты, в частности, нарушения пигментации и дефекты
слухового ганглия, генов локусов dominant spotting (W) и pie-
bald (s) у мыши также обусловлены поражением нервного греб-
ня [Mayer, Green, 1968; Deol, 1970b]. Следовательно, возникнове-
ние плейотропных эффектов генов может быть обусловлено
первичным дефектом одной общей закладки, дающей возникно-
вение нескольким дериватам. Плейотропию с таким механизмом
возникновения нельзя отнести ни к первичной, ни к вторичной,
-согласно классификации Хэдорна [Hadorn, 1961], так как ген дей-
ствует в одной клеточной системе, дериваты которой участвуют
в формировании многих органов. По нашему мнению, такого ро-
да плейотропию можно назвать первичной.
Плейотропию может имитировать действие двух тесно сцеп-
ленных мутантных генов, эффекты которых проявляются в раз-
55
личных клеточных системах. Однако такие ситуации встречают-
ся, по-видимому, крайне редко. Более часто имеет место выпаде-
ние небольших сегментов хромосом (делеций), включающих
несколько локусов, что должно отразиться на развитии разных
тканей. Гомозиготы с подобными хромосомными микроаберра-
циями обычно не жизнеспособны. Бриттен и Дэвидсон [Britten,
Davidson, 1969] полагают, что плейотропия может быть обуслов-
лена мутациями генов-регуляторов. Однако в пользу этой гипо-
тезы пока не получено каких-либо достоверных фактов.
Механизмы возникновения вторичной плейотропии. Подав-
ляющее большинство данных свидетельствует о широком рас-
пространении вторичной (относительной) плейотропии, которая
обусловлена межклеточными взаимодействиями развивающихся
тканей. В тех случаях, где первоначально предполагалась пер-
вичная плейотропия, более тщательные исследования показали
вторичную плейотропию. Грюнеберг [Griineberg, 1963] считает,
что первичной плейотропии вообще не существует, а во всех слу-
чаях имеется вторичная плейотропия. Другие авторы, рассмат-
ривая различные эффекты одного и того же гена в разных тка-
нях, имеют в виду также лишь относительную плейотропию
[Warkany, 1947; Gluecksohn-Waelsch, 1954; Green, 1966b]. Такой
взгляд на плейотропию побуждает искать общее происхождение
или невыясненные пути взаимодействия различных тканей, что
может пролить свет на некоторые механизмы развития.
Плейотропия может возникнуть в результате нарушения био-
химических, морфогенетических или эргонтических корреляций.
Действие мутантного гена нередко приводит к изменению биохи-
мически или физиологически сопряженных процессов. Неактив-
ность фермента, приводящая к блоку определенного звена про-
межуточного метаболизма, часто является причиной нарушения
многих метаболических путей в организме. У человека известно
более 30 различных наследственных болезней обмена веществ,
сопровождающихся слабоумием, вследствие поражения разви-
вающейся центральной нервной системы большими количества-
ми неиспользованных метаболитов. Примером возникновения
такой плейотропии может служить галактоземия. В результате
неактивности галактозо-1-фосфатуридилтрансферазы галактозо-
1-фосфат не превращается в глюкозо-1-фосфат. В организме
больного накапливается избыток неиспользованного галактозо-
1-фосфата, который подавляет активность фосфоглюкомутазы,
вследствие чего уменьшается гликолиз в тканях и возникает
комплекс патологических признаков (синдром): слабоумие, ге-
патоспленомегалия, цирроз печени, катаракта, задержка роста,
аминоауцидурия и альбуминурия. Другим примером такого
плейотропного действия гена, приводящего первично к инактива-
ции одного фермента, может служить гомоцистинурия, при кото-
рой наблюдаются вывих хрусталика, эмболии и тромбоз сосудов
с параличами, гангреной конечностей или некрозом миокарда.
56
высокий рост с худощавостью, остеопороз, кифосколиоз, чрез-
мерная гибкость суставов и гепатомегалия. У человека известно
около 150 ферментных дефектов, многие из которых вызывают
подобные множественные нарушения развития разных тканей и
органов [см. McKusick, 1978].
Все анатомические и физиологические изменения у карлико-
вых мышей генотипа dw/dw (замедленный рост, недоразвитие
щитовидной железы, надпочечников и гонад, стерильность, пони-
женный основной обмен) обусловлены первичным дефектом пе-
редней доли гипофиза [Bartkc, 1964]. Мутантный аутосомный
рецессивный ген hypogonodal (hpg) обусловливает у гомозигот-
ных мышей недоразвитие половых органов. У самцов hpg/hpg
очень маленькие семенники остаются в брюшной полости, а у са-
мок матка нитевидна и яичники настолько малы, что обнаружи-
ваются с большим трудом. Причиной недоразвития половых ор-
ганов у этих мутантных мышей является недостаточность гипо-
таламического гонадотропин-релизинг гормона, что приводит к
снижению содержания гипофизарных и циркулирующих лютеи-
низирующего и фолликулостимулирующего гормонов [Cattanach
е. а., 1977]. Гипергликемия, глюкозурия, ожирение, стерильность,
повышенная резистентность к действию инсулина у мышей, го-
мозиготных по гену obese, обусловлены недостаточностью опре-
деленного фактора, который продуцируется клетками поджелу-
дочной железы и повышает чувствительность периферических
тканей к действию инсулина [Strautz, 1970].
В случае других эндокринных заболеваний, связанных с на-
следственной недостаточностью или, наоборот, с избыточной сек-
рецией того или иного гормона, также возникает комплекс раз-
личных отклонений от нормы. Аутосомный рецессивный ген eye-
less (е) у аксолотля (Ambystoma mexicanum) первично действует
в клетках определенной области нервной пластинки, включаю-
щей зачатки глаз и гипоталамуса. У гомозигот в результате по-
ражения гипоталамуса вторично нарушается функция клеток
передней доли гипофиза и возникает стерильность (бесплодие).
Пересадка проспективной области переднего мозга, включающей
зачаток гипоталамуса (без зачатков глаз и передней доли гипо-
физа), от нормальных эмбрионов, находящихся на стадии ней-
рулы, к эмбрионам е/е приводила к восстановлению плодовито-
сти. В яичниках гомозигот, пересаженных к нормальным живот-
ным, наблюдали нормальное созревание яйцеклеток вплоть до
прохождения мейоза [VanDeusen, 1973].
У мышей, гомозиготных по мутантным аллелям локуса steel
(S1), макроцитарная анемия [McCulloch е. а., 1965] и отсутствие
пигментации волос [Мауег, Green, 1968; Мауег, 1970] возникают
не в результате первичного поражения стволовых гемопоэтиче-
ских клеток и меланобластов, а вследствие нарушения локаль-
ных специфических условий, необходимых для нормальной про-
лиферации, миграции или дифференцировки данных клеток. Эти
57
мутанты характеризуются также бесплодием вследствие того,
что первичные половые клетки у них не мигрируют из желточно-
го мешка в закладку половой железы [Bennett, 1956; Mintz, 1960].
Принимая во внимание эффекты мутантных аллелей этого локу-
са в отношении кроветворения и пигментации волос, можно ду-
мать, что нарушение миграции первичных половых клеток также
обусловлено не их первичным поражением, а ненормальным
влиянием окружающих тканей.
Для выяснения механизмов действия летального рецессивно-
го гена ulcere (и) у эмбрионов хвостатых амфибий Pleurodeles
waltlii были проведены следующие опыты: ассоциация мутант-
ных эмбрионов с нормальными в парабиозе или телобиозе, полу-
чение химерных зародышей, трансплантация зачатков органов и
гетеротипическая трансплантация задней и передней частей эм-
бриона. Показано, что действие гена и начинает проявляться с
момента выхода эмбрионов из яйцевых оболочек. Ни одна из
проведенных операций не предотвращала проявление эффектов
данного гена, приводящих к летальному исходу. Напротив, у
нормальных пара- и телобионтов развивалась анемия, которую
можно было предотвратить лишь разъединением эмбрионов
[Gounon, Collenot, 1975]. У личинок амфибий Pleurodeles waltlii,
гомозиготных по гену ас, число эритроцитов также сильно умень-
шено. При парабиозе мутантной личинки с нормальной у обеих
наблюдали резко выраженную анемию [Jaylet е. а., 1970]. Оче-
видно, гены и и ас контролируют образование определенного ве-
щества, подавляющего эритропоэз.
Из генетически пораженных тканей или органов в кровяное
русло могут выходить продукты мутантного гена и нарушать
развитие других органов. Так, например, продукт гена Ьрн у мы-
ши выходит из первично генетически пораженных зачатков ко-
стей и подавляет рост формирующейся большеберцовой кости, в
клетках которой не наблюдается экспрессии этого мутантного
гена [Гинтер, Конюхов, 1966а]. При совместном культивировании
in vitro на одном бумажном плоту генетически пораженных и
нормальных зачатков костей наблюдается подавление роста по-
следних. Прирост зачатков нормальных костей за двое суток
культивирования в присутствии генетически пораженных зачат-
ков был значительно меньше, чем в контроле, когда культивиро-
вали на одном плоту такое же число зачатков нормальных костей
[Konyukhov, Bugrilova, 1968]. Продукт мутантного типа Ср выхо-
дит из генетически пораженных зачатков длинных костей конеч-
ностей куриных эмбрионов Ср/+ и подавляет рост зачатков нор-
мальных костей, которые культивировали совместно с поражен-
ными (Elmer, 1968а]. В тканях куриного эмбриона Ср/+ продукт
этого мутантного гена накапливается в значительной концентра-
ции, и экстракты из таких тканей подавляют рост культивируе-
мых in vitro зачатков длинных костей конечностей нормальных
эмбрионов [Wolff, Kieny, 1963; Elmer, 1968b].
58
Явление эмбриональной индукции связано с переходом ве-
ществ из одной клеточной системы в другую при их контакте
[Saxen, Toivonen, 1962]. В этом случае продукты нормальных ал-
лелей одной тканевой закладки активируют гены другой. Про-
дукты мутантных генов отличаются от нормальных и не облада-
ют такими свойствами, вследствие чего существующие между
тканями формообразовательные связи распадаются. И. И. Шмаль-
гаузен [1942] отмечал, что мутантные гены нарушают взаимо-
зависимости во внутренних факторах индивидуального разви-
тия — морфогенетические корреляции. Многие факты, получен-
ные в основном в течение последних трех десятилетий, свидетель-
ствуют о том, что такой механизм возникновения множественных
генных эффектов встречается довольно часто у позвоночных.
У мексиканского аксолотля (Ambystoma mexicanum) мутант-
ные аутосомные рецессивные гены cardiac lethal (с) и premature
death (р) обусловливают в гомозиготном состоянии отсутствие
функционирующей кровеносной системы: у эмбрионов генотипа
с/с сердце вообще не образуется [Lemanski е. а., 1977], а у заро-г
дышей р/р отмечены его серьезные нарушения развития [Trotticr,
Armstrong, 1977]. Экспериментальное изучение места действия
этих мутантных генов, в частности использование методов пара-
биоза и трансплантации тканевых зачатков, показало, что гены
сир действуют в энтодермальных клетках. Поражение энтодер-
мы приводит уже вторично к нарушению развития сердца и дру-
гих структур зародыша, формирование которых зависит от ин-
дукционных влияний со стороны энтодермальных клеток.
Феногенетические исследования показывают, что всякое на-
рушение морфогенетических связей между частями одного орга-
на или разными органами неизбежно приводит к их недоразви-
тию. Наследственное поражение одного из компонентов сложно-
го органа, нарушая эволюционно возникшее тесное индуктивное
взаимодействие и корреляцию всех частей органа в процессе
развития, может вызвать аномалию всего органа. Например,
сильно замедленный рост глазного пузыря у эмбрионов мышей,
гомозиготных по гену fi, является причиной недостаточной ин-
дукции хрусталика, вследствие чего последний часто не отшну-
ровывается от эктодермы, а иногда даже совсем не образуется.
Нарушение развития хрусталика приводит к ненормальному фор-
мированию роговицы [Konyukhov, Vakhrusheva, 1969]. Подавле-
ние роста зачатка сетчатки у эмбрионов мышей, гомозиготных
по гену ог, обусловливает возникновение микрофтальмии без ко-
лобомы [Конюхов, Строева и др., 1963], а усиленный рост пиг-
ментного эпителия глаза у эмбрионов мышей, гомозиготных по
гену mi — микрофтальмии с колобомой [Muller, 1951—1952; Ко-
нюхов, Сажина, 1963]. На рис. 16 представлена возможная по-
следовательность событий, приводящих в итоге к развитию мик-
рофтальмии у мышей ог/ог.
59
Рис. 16. Схема последовательности событий, приводящих к
микрофтальмии у мышей генотипа ог/ог [Конюхов, Сажина,
ниями]
возникновению
19G2, с измене-
Развитие и функция фоторецепторов сетчатки в большей сте-
пени зависят от пигментного эпителия. Как было установлено на
химерных животных, первичное поражение пигментного эпителия
глаза у крыс генотипа rdy/rdy приводит к дегенерации фоторе-
цепторов [Mullen, LaVail, 1976]. Следовательно, дегенерация
фоторецепторов у крыс данного генотипа возникает в результате
вторичной плейотропии вследствие нарушения функциональной
активности пигментного эпителия глаза.
Экспериментальными исследованиями показано, что у позво-
ночных для индукции слуховой плакоды и для ее дифференци-
ровки большое значение имеют формативные влияния, исходящие
от продолговатого мозга. Мутантные гены Kreisler, dreher и
splotch нарушают развитие нервной трубки у ранних эмбрионов
мыши. Пораженная нервная трубка не оказывает нормального
индукционного влияния на слуховой пузырек, в результате чего
возникают аномалии внутреннего уха [Deol, 1968]. Ген fidget так-
же нарушает развитие продолговатого мозга, вследствие чего у
мышей, гомозиготных по этому гену> возникают вторично ано-
малии внутреннего уха [Konyukhov, Vakhrusheva, 1969; Конюхов,
Сажина, 1972]. Недостаточный рост мочеточника является при-
чиной недоразвития почек у эмбрионов мышей, гомозиготных по
гену Sd [Gluecksohn-Waelsch, Rota, 1963].
Поражение мутантным геном первичного организатора вы-
зывает цепь ненормальных процессов на последующих стадиях
эмбрионального развития, и как результат этого возникает боль-
шое разнообразие отдаленных генных эффектов. Мутантный ген
Т у мыши в гомозиготном состоянии поражает первичный орга-
низатор— хорду, что приводит к аномалиям нервной трубки и
сомитов [Bennett, 1964, 1975]. Как уже отмечалось, ген Sd подав-
ляет рост мочеточника у мыши. Однако это является лишь одним
из его отдаленных эффектов. Первично данный ген нарушает раз-
витие хорды, вследствие чего последовательно возникают ано-
малии разных органов [Griineberg, 1958].
В результате действия мутантных генов довольно часто воз-
никают гетерохронии в развитии тканей, которые могут ослаб-
лять формообразовательные связи и вызывать как усиление на-
рушения развития первично генетически пораженной ткани, так
и возникновение вторичных генных эффектов. У мышей, гомози-
готных по гену extra-toes (Xt), развивается микрофтальмия.
Причина этого заключается в удлинении переднего мозга ранне-
го эмбриона, в результате чего проксимальная часть глазного
стебелька выносится вперед, глазной пузырь деформируется и
нарушается его связь с хрусталиковой эктодермой [Johnson,
1967]. Следовательно, аномалии глаз у мышей Xt/Xt обусловле-
ны ненормальным смещением глазных зачатков относительно
хрусталиковой эктодермы. У куриных эмбрионов, гомозиготных
по гену talpid3 (ta3), поражена прехордальная мезодерма, что
проявляется в недоразвитии верхнечелюстных отростков, вслед-
61
ствие чего происходит сближение зачатков глаз друг с другом и
смещение их в вентральном направлении. Глазные зачатки уда-
ляются от хрусталиковой эктодермы, ослабляется формативное
влияние глазного пузыря на эктодерму, в результате чего у му-
тантов отшнуровывание хрусталикового пузырька от головной
эктодермы запаздывает [Ede, Kelly, 1964]. Следовательно, ано-
малии глаз у эмбрионов мышей Xt/Xt и кур ta3/ta3 являются вто-
ричными генными эффектами, обусловленными нарушением фор-
мообразовательных связей.
Ген dominant hemimelia (Dh) первично поражает сплапхни-
ческую мезодерму. Эмбрионы мышей, гетерозиготные или гомо-
зиготные по этому гену, имеют дефектный целомический эпите-
лий, который не оказывает необходимого индукционного влия-
ния на зачаток селезенки и эктодерму первичной кишки. В ре-
зультате: этого селезенка не образуется, а желудок и кишечный
тракт не достигают нормальных размеров. У мутантных эмбрио-
нов протяженность целома в каудальном направлении меньше,
чем в норме. Это обусловливает возникновение аномалий моче-
половой системы и скелета [Green, 1967]. У мышей, гомозиготных
по гену oligodactyly (ol), имеются аномалии скелета конечно-
стей, редуцирована или может даже полностью отсутствовать се-
лезенка [Freye, 1954]. Грин [Green, 1967] высказала предположе-
ние, что этот мутантный ген также первично поражает спланхно-
мезодерму.
И. И. Шмальгаузен [1942] писал, что в результате отсутствия
функции наследственно пораженных органов могут возникать
нарушения строения других органов, которые имеют с первыми
функциональные связи. Такие корреляции он назвал эргонтиче-
скими. У животных с наследственной анофтальмией или микро-
фтальмией имеет место поражение зрительных центров вследст-
вие отсутствия функции глаза [Chase, 1945; Сажина, 1965].
Вторичная плейотропия может возникнуть в результате ин-
токсикаций развития. При наследственных дегенерациях лизи-
рованные клеточные компоненты вызывают вторичные генные
эффекты. Пигментная дегенерация сетчатки у человека [Franco-
is, 1961; Кулеш, 1966] и собаки [Lucas, 1954; Barnett, 1962] часто
сопровождается катарактой, причем помутнение хрусталика по-
является сначала на заднем полюсе и позднее, чем дегенерация
сетчатки.
Возникновение плейотропии может быть обусловлено нару-
шением обмена металлов. Так, причиной наследственного гемо-
хроматоза является повышенная абсорбция железа из кишечно-
го тракта. У больных людей желесодержащий белок (гемосиде-
рин) откладывается в больших количествах в печени, сердце и
различных эндокринных железах, вследствие чего часто возни-
кают цирроз печени, сахарный диабет и усиление пигментации
кожи [Pollycove, 1966]. Поражение разных органов у людей на-
блюдается также при гепатолентикулярной дегенерации (болез-
62
ни Вильсона) — аутосомно-рецессивном заболевании, когда про-
исходит повышенное всасывание меди из кишечного тракта,
пролонгированное удержание ее во всех тканях тела и отложение
значительных количеств меди в различных органах [O’Reilly е. а.,
1976]. Синдром Менкеса, который контролируется локализован-
ным в Х-хромосоме рецессивным геном, также обусловлен нару-
шением метаболизма меди. Однако в отличие от болезни Виль-
сона, имеет место не избыточное отложение меди в тканях, а,
напротив, ее недостаточность, вследствие чего возникает пере”
рождение волокнисто-эластической ткани кровеносных сосудов
и, как результат этого, их хрупкость. У особей мужского пола,
имеющих данный мутантный ген, появляются многочисленные
кровоизлияния во многих органах, нарушающие их строение и
функцию. Индивиды с этим заболеванием обычно умирают в мо-
лодом возрасте. У больных с синдромом Менкеса наблюдаются
также изменение структуры волос (курчавость) и уменьшение
активности фермента тирозиназы, вследствие чего наступает
ослабление пигментации. Причиной недостаточности меди в ор-
ганизме является уменьшение скорости транспорта ее из клеток
тонкого кишечника в кровяное русло, что связано, очевидно, с
наследственным дефектом транспортной системы для меди в этих
клетках [Holtzman, 1976].
У мыши известно несколько наследственных дефектов мета-
болизма металлов. В частности, локализованный в Х-хромосоме
ген sex-linked anemia (sla) обусловливает возникновение гипо-
хромной анемии у молодых гемизиготных самцов (sla/Y) или
гомозиготных самок (sla/sla), причем симптомы анемии ослабе-
вают с возрастом животных. У мутантных мышей наблюдается
также увеличение размеров селезенки и торможение роста тела.
Ген sla действует в клетках плаценты и слизистой оболочки ки-
шечника, снижая скорость транспорта железа из этих клеток в
кровяное русло соответственно мутантных эмбрионов или мышей
в подсосный период развития [Bannerman, 1976]. Другой мутант-
ный ген brindlel (Mobr) локуса mottled, который также локали-
зован в Х-хромосоме, уменьшает транспорт меди из клеток тон-
кого кишечника, в результате чего пораженные самцы погибают
через 2 недели после рождения [Hunt, 1974]. Ген pallid (ра) в
гомозиготном состоянии обусловливает светло-бежевую окраску
шерсти и отсутствие отолитов во внутреннем ухе, вследствие че-
го в постэмбриональный период развития возникает атаксия.
Эти разные фенотипические эффекты гена ра связаны с наруше-
нием метаболизма марганца, в частности, пониженной скоростью
его транспорта. Добавление в пищу беременных мышей ра/ра
высоких концентраций марганца приводит к нормализации раз-
вития их потомства, т. е. эффекты гена ра не проявляются у го-
мозигот [см. Hurley, 1976].
Бонневи [Bonnevie, 1934] показала, что причиной аномалий
глаз и конечностей у мышей, гомозиготных по гену blebs (my),
63
является появление пузырьков жидкости под эктодермальным
эпителием эмбрионов. Первые признаки ненормального развития
глаз наблюдаются у эмбрионов my/my примерно на 12-е сутки
беременности. В результате скопления жидкости под головным
эпителием формирование роговицы и век сильно нарушается.
Однако хрусталик и сетчатка развиваются нормально. Автор
полагала, что скапливающаяся под эктодермальным эпителием
жидкость является по своему происхождению цереброспиналь-
ной. Однако Картер [Carter, 1959] привел данные в пользу того,
что наличие субэпидермальных пузырьков связано с поступле-
нием избыточного количества жидкости из мезенхимных клеток.
Аутосомный рецессивный ген fetal hematoma (fh) вызывает
у гомозиготных эмбрионов мыши сходные нарушения развития,
как и ген ту; причем образование субэпидермальных пузырьков
также, очевидно, связано с поступлением жидкости из мезенхим-
ных клеток [Center, 1977].
Мутантный ген eye-blebs (eb) обусловливает у 12—13-днев-
ных зародышей мышей eb/eb появление в области глаз и форми-
рующихся конечностей пузырьков жидкости, которые позднее
становятся геморрагичными. В результате этого у мышей eb/eb
сильно нарушается развитие глаз и конечностей. Последние в
некоторых случаях даже полностью отсутствуют. Возникновение
субэпидермальных пузырьков у эмбрионов eb/eb связано, по-ви-
димому, с поступлением жидкости из кровяного русла, так как у
мутантов были обнаружены мелкие кровеносные сосуды, откры-
вающиеся в субэпидермальные пузырьки [Beasley, Crutchfield,
1969].
У эмбрионов мышей, гомозиготных по гену patch (Ph), также
имеет место образование субэпидермальных пузырьков, что яв-
ляется причиной отека [Gnineberg, Truslove, I960]. Можно ду-
мать, что появление субэпидермальных пузырьков жидкости
может обусловливать развитие некоторых синдромов у человека.
Штерн [Stern, 1960] полагает, что таким образом возникает .син-
дром Бонневи—Ульриха.
В одной семье у 8 новорожденных мальчиков была отмечена
гидроцефалия. За исключением одного ребенка, который про-
жил несколько недель, все они умерли в течение 10 дней после
рождения. На вскрытии обнаружен стеноз сильвиева водопро-
вода, причем признаки опухолевых и воспалительных процессов
отсутствовали. Стеноз сильвиева водопровода в этой семье, оче-
видно, обусловлен мутантным рецессивным геном, локализован-
ным в Х-хромосоме [Sovik е. а., 1977]. Такие наследственные ано-
малии хорошо известны у человека и животных.
Таким образом, пути возникновения множественных эффек-
тов гена могут быть весьма разнообразными, но, как правило,
тщательное исследование позволяет обнаружить первичный эф-
фект данного гена в какой-либо одной клеточной системе.
Глава 2
РЕГУЛЯЦИЯ АКТИВНОСТИ ГЕНОВ
В ОНТОГЕНЕЗЕ
*
Если рассматривать на молекулярном уровне реализацию
признака начиная с прямого проявления активности гена —
транскрипции, то можно выделить несколько этапов в декоди-
ровании генетической информации транскрипция —^процессинг
и транспорт иРНК-^трансляция->посттрансляционный уровень.
На ранних стадиях эмбриогенеза регуляция экспрессии генов в
основном осуществляется на уровне двух первых этапов (транс-
крипции, процессинга и транспорта иРНК), а на более поздних
стадиях онтогенеза основное значение в регуляции экспрессии
генов приобретают трансляционный и посттрансляционный уров-
ни. Основным содержанием начальных этапов эмбриогенеза яв-
ляется взаимодействие непрерывно перестраивающихся главных
клеточных компонентов — ядра и цитоплазмы, в период клеточ-
ной дифференцировки и органогенеза приобретают большую
роль межклеточные взаимодействия, а позднее и гормональные
влияния. Следовательно, соотносительное значение регулирую-
щих экспрессию генов факторов не одинаково на разных этапах
онтогенеза.
Ядерно-цитоплазматические взаимодействия
Б. Л. Астауров [1968] в экспериментах по межвидовому андро-
генезу у тутового шелкопряда убедительно доказал ведущую
роль ядра в процессах индивидуального развития. Межвидовые
андрогенетические особи были получены путем осеменения яиц
дикого шелкопряда Bombyx mandarina спермой домашнего шел-
копряда Bombyx mori или, наоборот, осеменением яиц домаш-
него шелкопряда спермой дикого и в результате использования
метода инактивации женских ядер термическим воздействием.
После прогревания яиц при 40° С в течение 15 мин ядро яйце-
клетки шелкопряда часто остается на поверхности и не принима-
ет участия в процессах развития. В лишенных собственного ядра
яйцах происходит слияние ядер двух спермиев и образуется ди-
плоидное ядро дробления. У таких уникальных ядерно-цитоплаз-
3 Б. В. Конюхов 65
матических гибридов цитоплазма принадлежала одному из ро-
дительских видов, а ядро — другому. Андрогенетические особи
были всегда мужского пола и по всем изученным морфофизио-
логическим признакам походили на вид, от которого передава-
лись ядра.
Галльен [1971] получал ядерно-цитоплазматические гибриды
амфибий путем межвидовых пересадок диплоидных ядер, причем
для этой цели были использованы два четко различающихся
между собой вида рода Pleurodeles: Р. waltlii и Р poireti. Ядро
Р. waltlii трансплантировали в цитоплазму яйца Р. poireti и, на-
оборот, ядро Р poireti — в цитоплазму яйца Р. waltlii. У боль-
шинства таких ядерно-цитоплазматических гибридов начиная со
стадии гаструлы возникали серьезные нарушения развития, и
они погибали. Однако отдельные особи (примерно 2 %) достигали
взрослого состояния. По своим морфологическим, серологиче-
ским и кариологическим показателям они были подобны живот-
ным того вида, от которого брали ядро для пересадки. Следова-
тельно, генетическая информация развития закодирована исклю-
чительно в ДНК хромосом.
Цитоплазма зиготы, основную часть которой составляет ци-
топлазма яйцеклетки и совсем ничтожная часть приносится со
спермием, играет важнейшую роль в прохождении ранних эта-
пов эмбриогенеза и активации первой группы генов на этих ста-
диях развития. Цитоплазма яйцеклетки содержит значительно
больше различных белков, РНК и других видов молекул, чем
любая соматическая клетка. Эти молекулы яйцеклетки синтези-
руются в оогенезе и, следовательно, имеют материнское проис-
хождение.
Результаты исследований Бовери, Конклина, Дриша [Boveri,
Conklin, Driesch] и других авторов [см. Wilson Е. В., 1925] еще в
конце прошлого столетия указывали, на то, что определенные
участки цитоплазмы яйцеклетки могут содержать факторы, опре-
деляющие судьбу тех или иных дифференцирующихся клеток.
В результате неодинакового пространственного распределения
веществ в цитоплазме яйцеклетки, обозначаемого как ооплаз-
матическая сегрегация, при дроблении зиготы в бластомеры по-
падают разные вещества, т. е. цитоплазма их оказывается раз-
личной. Поэтому уже давно было постулировано, что активность
генов зависит от цитоплазмы. Это нашло подтверждение иссле-
дованиями на молекулярном уровне. Работы последних десяти-
летий, проведенные, в частности на амфибиях, показали, что
специализация бластомеров является результатом избиратель-
ной активации генов под влиянием разных факторов, присутст-
вующих в цитоплазме яйца [см. Davidson, 1968].
Работы Гердона [Gurdon, 1974] с введением ядер дифферен-
цированных клеток в энуклеированные яйцеклетки амфибий
убедительно показали ведущую роль цитоплазмы в регуляции
активности генов. Функциональное состояние ядра в этих иссле-
66
Ядра
из клеток мозга
Взрослой лягушка
ДНК РНК и ДНК РНК
не синтезируется не синтезируются не синтезируется
Рис. 17. Цитоплазматическая регуляция ядерной активности [Gurdon, 1974]
Ядра клеток мозга взрослых лягушек, которые не делятся и не синтезируют ДНК, по-
разному изменяют характер своей активности под влиянием цитоплазмы ооцита или
яйца. Активность ядер изменяется через 1 ч в яйцах, через 4 ч — в созревающих ооцитах
через 24 ч — в зрелых ооцитах
дованиях оценивали по синтезу ДНК и РНК, определяемому с
помощью меченых предшественников. Было установлено, что,
если ядро нейрона взрослой лягушки пересадить в активирован-
ную неоплодотворенную яйцеклетку, то в ядре начинается син-
тез ДНК, но синтез РНК прекращается. Следовательно, в цито-
плазме яйца содержатся активатор синтеза ДНК и репрессор
синтеза РНК, действующие независимо друг от друга на разные
группы генов. Ядра из клеток мозга взрослой лягушки, переса-
женные в зрелый ооцит, синтезируют РНК, но не ДНК, если эти
67
з*
ядра трансплантировать в ооцит, находящийся на стадии делений
созревания, то они не синтезируют ни ДНК ни РНК (рис. 17).
Ядра клеток нейрулы, синтезирующие все типы РНК, через
час после пересадки в яйцеклетку прекращали их синтез. По
мере развития ядерных трансплантатов, как и в ходе нормально-
го эмбриогенеза, последовательно возобновлялся синтез трех ти-
пов РНК: в середине периода дробления начинался синтез иРНК,
в конце дробления — тРНК и на стадии гаструлы — рРНК. Эти
данные указывают на то, что синтез каждого типа РНК зависит
от различных компонентов цитоплазмы. Таким образом, синте-
тическая активность пересаженного ядра изменяется и соответ-
ствует свойствам клетки-реципиента. Об этом свидетельствуют
также данные, полученные в опытах на гибридных соматических
клетках, которые образуются в результате слияния клеток друг
с другом в культуре.
В опытах по гибридизации соматических клеток часто ис-
пользуют инактивированный ультрафиолетовыми лучами вирус
Сендая, который определенным образом изменяет плазматиче-
скую мембрану и значительно увеличивает число гибридных
клеток. Сливаться могут соматические клетки очень отдаленных
видов животных организмов, в частности курицы и мыши. Из
двухъядерных клеток возникают одноядерные, ядро которых со-
держит хромосомы обоих родительских клеток.
Харрис (Harris, 1970а] в книге «Слияние клеток» рассмотрел
полученные на гибридных клетках факты, указывающие на пря-
мую зависимость активности генов от цитоплазмы. Так, с по-
мощью методов авторадиографии было показано, что ядро эрит-
роцита курицы, введенное в клетку тканевой культуры человека
или мыши, реагирует на сигналы чужеродной ему цитоплазмы
и начинает синтезировать ДНК и РНК. Реактивация ядра эрит-
роцита в гетерокарионе сопровождается сильным увеличением
его размеров и деконденсацией хроматина. Объем ядра эритро-
цита увеличивается в 20—30, а количество сухого вещества воз-
растает в 4—6 раз, причем последнее связано в основном с уве-
личением содержания белка. В эритроцитах курицы синтеза
нуклеиновых кислот не происходит и ядра имеют небольшие
размеры, характерные для ядер покоящихся высокодифференци-
рованных клеток. Следовательно, в гетерокарионе наблюдается
реактивация ядра эритроцита в результате влияния на него чу-
жеродной цитоплазмы интенсивно делящейся клетки, хотя для
активации генов эритроцита требуется довольно продолжитель-
ное время — несколько дней. В таких гетерокарионах обнаружен
синтез видоспецифических куриных антигенов плазматической
мембраны. Синтез специфических белков курицы не начинается
до тех пор, пока в эритроцитарном ядре не появляется ядрышко.
Последнее оказывает влияние на переход синтезированной иРНК
из ядра в цитоплазму.
68
Данные, полученные на гибридных клетках, показывают, что
цитоплазматические сигналы не являются строго видоспецифи-
ческими и влияют как на транскрипцию, так и на трансляцию
генетической информации. Чужеродная цитоплазма активно де-
лящейся клетки дерепрессирует в гибридной клетке гены, конт-
ролирующие синтез видоспецифических и общих клеточных бел-
ков, но экспрессия тканеспецифических генов в гибридных клет-
ках часто не проявляется [Harris, 1970а; Ephrussi, 1972].
Бернстейн и Макержи [Bernstein, Mukherjee, 1972] получали
гетерокарионы методом слияния бластомеров 2- и 4-клеточных
эмбрионов мыши с клетками линии А9. Ядра мышиных клеток
линии А9 синтезировали значительно больше РНК в цитоплазме
бластомеров 4-клеточных зародышей, чем в цитоплазме 2-кле-
точных эмбрионов. На основании этих фактов авторы пришли к
заключению, что цитоплазма бластомеров 2-клеточных зароды-
шей содержит вещества, подавляющие синтез РНК, а на стадии
4 бластомеров большинство таких подавляющих синтез РНК
факторов уже отсутствует. Полученные этими авторами данные
в другой работе [Bernstein, Mukherjee, 1973] свидетельствуют.,о
том, что цитоплазма бластомеров 2-клеточных эмбрионов мыши
содержит факторы, активирующие синтез РНК в ядрах куриных
эритроцитов, но ингибирующие синтез РНК в ядрах других ком-
петентных соматических клеток. Такие ингибирующие синтез
РНК факторы отсутствовали в цитоплазме бластомеров 4-кле-
точного зародыша. Деробертис и соавторы [DeRobertis е. а., 1977]
пересаживали ядра клеток HeLa в энуклеированные ооциты Xe-
nopus laevis. Было показано, что из 25 белков, которые проду-
цируются в клетках HeLa, только 3 синтезируются в ядерных
трансплантатах (ооцитах с ядрами клеток HeLa). Авторы счита-
ют, что цитоплазматические факторы ооцита действуют на транс-
крипционном уровне, выключая (репрессируя) большинство ге-
нов, работающих в клетках HeLa.
Межвидовые трансплантации ядер соматических клеток в
энуклеированные яйцеклетки амфибий также показали, что в
чужеродной цитоплазме не происходит нормальной активации
генома. Хенен [Неппеп, 1972] пересаживала ядра клеток бласту-
лы одного вида лягушек (Rana palustris) в энуклеированные
яйцеклетки другого вида (R. pipiens) и, наоборот, ядра бласто-
меров R. pipiens — в энуклеированные яйцеклетки R. palustris.
Развитие таких ядерно-цитоплазматических гибридов сильно на-
рушалось или останавливалось на стадиях гаструлы или нейрулы.
Изучение кариотипов ненормальных зародышей не показало ка-
ких-либо хромосомных аберраций. Если ядра бластомеров гиб-
рида (ядро R. palustris, цитоплазма яйцеклетки R. pipiens) пе-
ресаживали опять в свою цитоплазму (энуклеированную яйце-
клетку R. palustris), то развивались нормальные головастики.
Кусочки эктодермы ранней гаструлы таких ядерно-цитоплазма-
тических гибридов пересаживали па место удаленных сегментов
69
эктодермы ранней гаструлы R. palustris. В большинстве случаев
гибридные трансплантаты не дифференцировались дальше той
стадии, на которой развитие их останавливалось у интактного
ядерно-цитоплазматического гибрида, хотя трансплантаты со-
хранялись в течение нескольких дней [Неппеп, 1973]. Следова-
тельно, нарушение развития этих гибридов было обусловлено
ненормальной активностью генома в чужеродной цитоплазме, и
даже контакт с нормальными тканями не исправлял дефект
тканей гибридов.
Таким образом, регуляция активности генов в развитии поз-
воночных— результат сложных взаимодействий ядра и цито-
плазмы. Если цитоплазматические различия бластомеров вызы-
вают дерепрессию в них разных генов, то, со своей стороны, ак-
тивность неодинаковых генов приводит к еще большим цито-
плазматическим различиям, которые включают в действие дру-
гие наборы генов.
Межклеточные влияния
В ходе эмбриогенеза ядерно-цитоплазматические взаимо-
влияния дополняются гомо- и гетеротипическими клеточными
взаимодействиями, причем в этих случаях наблюдается переход
веществ из одних клеток в другие. Следует отметить, что уже
сравнительно давно была выдвинута гипотеза, согласие? которой
развитие осуществляется в результате действия диффундирую-
щих химических веществ. В разработку этой гипотезы большой
вклад внесли Шпеман [Spemann, 1938] и Чайлд [Child, 1941],
сформулировавшие представления об эмбриональных индукто-
рах и градиентах. Теория о градиентах концентрации определен-
ных химических веществ (дистантных агентов), запускающих те
или иные морфогенетические процессы, и сейчас используется для
объяснения механизмов развития высших организмов [Wolpert е.
а. 1975].
Если гормоны, относящиеся к категории диффундирующих ве-
ществ дальнего действия, оказывают влияние в течение длитель-
ного периода онтогенеза, то диффундирующие вещества ближ-
него действия, которые называют индуцирующими, действуют
только на определенном этапе дифференцировки клеток в эмб-
риогенезе. Явления эмбриональной индукции проявляются, в
частности, при развитии нервной трубки, хрусталика и почки
конечности, причем индукторами в этих случаях служат соответ-
ственно хордомезодерма, глазной пузырь и боковая мезодерма.
В результате индукции происходит дерепрессия тканеспецифиче-
ских генов. Первичная индукция, обусловливающая формирова-
ние нервной пластинки, вероятно, связана с белком, который
мигрирует из хордомезодермы в эктодермальные клетки [Faulha-
ber, 1972; Tiedemann, 1973, 1975]. Развитие хрящевых закладок
позвонков зависит от индуцирующих влияний со стороны хорды
70
и спинного мозга. Если добавить экстракты из хорды и спинного
мозга в культуральную среду, то мезенхимные клетки сомитов
2—3-дневных куриных эмбрионов образуют хрящ [Strudel, 1967].
Следует отметить, что формирование большинства органов у
позвоночных — результат вторичных индукций. При этом в ка-
честве индуктора обычно выступает ткань мезодермального
происхождения.
Экспериментальными исследованиями показано, что индуктор
поджелудочной железы представляет собой белок, синтезиру-
емый мезенхимными клетками. Индуцирующий белок сначала
стимулирует клетки компетентной ткани — энтодермального
эпителия — к делению, число клеток увеличивается, и затем они
дифференцируются в эндокринные и экзокринные клетки подже-
лудочной железы. Дифференцировка характеризуется последо-
вательным синтезом ферментов поджелудочной железы и гормо-
нов, причем различные гидролазы синтезируются последова-
тельно друг за другом в строго запрограммированном порядке.
Это показывает, что структурные гены, ответственные за синтез
каждого фермента, последовательно активируются. Не полученЪ
доказательств для существования гена-оператора, который ак-
тивирует «батарею» структурных генов, контролирующих одно-
временный синтез всех ферментов поджелудочной железы [Rut-
ter е. а., 1968; Clark, Rutter, 1972].
Для межклеточной передачи индуцирующих веществ, как
правило, необходимы клеточные контакты, что, возможно, обус-
ловлено быстрой деградацией веществ-индукторов во внекле-
точной среде. Финскими исследователями получены факты, сви-
детельствующие о том, что процесс индукции осуществляется
только при наличии тесных клеточных контактов, в результате
чего, очевидно, происходит переход молекул из одних клеток в
другие или обмен поверхностным материалом [Wartiovaara е. а.,
1974]. Эти авторы использовали в своих экспериментах нуклео-
поровые фильтры, имеющие поры одинакового размера с прямы-
ми каналами. Они считают, что ранее выполненные исследова-
ния с разделением индуцирующей и компетентной тканей мил-
липоровыми фильтрами не могли дать правильного ответа вслед-
ствие технического несовершенства этих фильтров: большой ва-
риабильности размеров и распределения пор.
Было показано, что индукция почечных канальцев спинным
мозгом происходит регулярно через нуклеопоровые фильтры с
диаметром пор 0,22—0,8 мкм. Во многих порах этих фильтров
были обнаружены цитоплазматические отростки. Индукция на-
блюдалась редко, если использовали фильтры с размерами пор
0,1 мкм, в которых только изредка были обнаружены глубоко
вдающиеся цитоплазматические отростки [Lehtonen е. а., 1975].
Аналогичные данные были получены при разделении нуклеопо-
ровым фильтром эпителиальной и мезенхимной частей зубного
зачатка мыши. Если использовали фильтры с диаметром пор
71
0,1 мкм, то не происходило дифференцировки одонтобластов и
адамантобластов [Thesleff е. а., 1977]. Следовательно, клеточные
контакты необходимы для процесса индукции. По мнению Воль-
фа [1971], ткани-индукторы не только активируют гены компе-
тентных клеток, но также и передают определенную информа-
цию. Если допустить такую возможность, то можно думать, что
передача генетической информации осуществляется посредством
перехода иРНК из клеток индуктора в компетентные клетки.
Однако не получено убедительных фактов в пользу этой гипо-
тезы.
Исследованиями лаборатории Тидемана [см. Tiedemann, 1973,
1975] было установлено, что индукторы являются белками с мо-
лекулярным весом около 30 000. Из большой массы туловищ
11-дневных куриных зародышей удалось выделить два индуци-
рующих фактора белковой природы, один из которых обладал
нейрализующим, а другой — вегетализующим действием,
так как он индуцировал ткани, нормально расположенные
в вегетативной части зародыша. Введение в бластоцель заро-
дыша амфибий нейрализующего фактора индуцировало образо-
вание таких структур, как мозг, глаза, хрусталики и слуховые
пузырьки, и инъекция вегетализующего фактора — мезо- и экто-
дермальных тканей (хорда, мышцы, мезотелий, клетки крови,
кишечник, печень и поджелудочная железа). Использование
флуоресциирующих антител показало, что индуцирующий фак-
тор проникает, по-видимому, в ядро клетки, вызывая изменения
его активности. Из 1 кг тканей И-дневных куриных эмбрионов
было получено 20 мкг высоко очищенного вегетализующего фак-
тора, введение 1-Ю-4 мкг такого высокоочищенного белка-ин-
дуктора в бластоцель зародышей амфибий на стадии ранней
гаструлы в 50% случаев приводило к образованию мезо- и экто-
дермальных тканей.
Используя меченый вегетализующий фактор, с помощью ав-
торадиографии удалось показать, что он проникает в клетки.
Через 18 ч после начала опыта радиоактивность была обнару-
жена над ядром. Выделен ингибитор этого индуцирующего фак-
тора, который также имеет белковую природу [Грунтц, 1978].
Тидеман [Tidemann, 1967] полагает, что белки-индукторы
могут связываться с репрессором, блокирующим транскрипцию,
и тем самым приводить к дерепрессии соответствующие гены в
компетентной ткани или могут взаимодействовать с факторами,
тормозящими процессы трансляции, в результате чего устраня-
ется блок на этом уровне проявления генных эффектов. Гроб-
стейн [Grobstein, 1966] считает, что индукторы могут влиять на
геном не прямо, а опосредованно через так называемые контро-
леры— локализованные в клетке вещества, которые распознают
и передают индукционные влияния на гены. Такой механизм
действия индукторов, конечно, нельзя исключить, однако мы не
располагаем какими-либо убедительными фактами для подкреп-
72
ления этой точки зрения. Механизм дерепрессии генов индукто-
рами остается неясным, и исследования в этом направлении мо-
гут пролить свет на общие механизмы регуляции генной актив-
ности в эмбриогенезе.
Мак-Махон [McMahon, 1974] выдвинул гипотезу, что в каче-
стве индукторов могут выступать низкомолекулярные физиоло-
гически активные вещества, такие, например, как циклические
нуклеотиды, серотонин, ацетилхолин и адреналин. По мнению
автора, эти вещества могут определять направление клеточной
дифференцировки. Возможно, такие простые соединения, так же
как ранее было показано для ионов, могут вызывать иеспеци-
фическую стимуляцию дифференцировки клеток. В частности,
они могут разрушать комплекс индуктор-ингибитор, освобождая
белки-индукторы, которые специфически влияют на процессы
развития. В настоящее время большинство данных свидетельст-
вует о том, что именно белки выполняют роль регуляторов ак-
тивности генов (см. также раздел «Детерминация, индукция и
компетенция» в гл. 5).
Межклеточные взаимодействия изменяют экспрессию генов^
на посттрансляционном уровне. В опытах совместного культиви-
рования мутантных и нормальных клеток было установлено, что
дефект обмена мукополисахаридов в фибробластах исправляет-
ся, если клетки от больного синдромом Хурлера (мукополисаха-
ридоз I типа) и индивида с синдромом Хантера (мукополисаха-
ридоз II) культивируются совместно. Такой же нормализующий
эффект наблюдается в случае совместного культивирования
фибробластов от больного (одним из этих заболеваний) и здо-
рового человека. Кроме того, среда, полученная от нормальных
культур, исправляет метаболический дефект фибробластов ин-
дивидов с синдромами Хурлера и Хантера, а среда, взятая после
культивирования фибробластов от больных синдромом Хантера,
исправляет метаболический дефект культивируемых клеток ог
индивидов с синдромом Хурлера, и наоборот.
Фибробласты больных синдромом Санфилипо (мукополиса-
харидоз III), который сходен клинически с синдромами Хурлера
и Хантера, коррегируются фибробластами других генотипов.
Факторы, высвобождающиеся в культуральную среду и исправ-
ляющие биохимический дефект мутантных клеток, являются
ферментами, которые катализируют различные стадии деграда-
ции мукополисахаридов. Синдромы Хурлера, Хантера и Санфи-
липо обусловлены недостаточностью разных ферментов, гидро-
лизующих мукополисахариды. Поэтому совместное культивиро-
вание этих типов мутантных клеток исправляет дефекты друг
друга.
Коррегирующими факторами являются лизосомные фермен-
ты, недостаточность которых имеет место при соответствующих
болезнях: синдром Хурлера обусловлен недостаточностью a-L-
идуронидазы, синдром Хантера — илуропатсульфатазы, а синд-
73
ром Санфилипо А — гепаран N-сульфатазы. Исправление дефек-
та мутантных клеток in vitro обусловлено включением фермента
из культуральной среды. Фибробласты больного синдромом Хур-
лера становятся нормальными после добавления в среду корре-
гирующего фактора Хурлера, который является не чем иным, как
специфической формой a-L-идуронидазы. Этот фермент избира-
тельно включается фибробластами. Кинетика утилизации кор-
регирующих факторов указывает на наличие особых рецепто-
ров на поверхности фибробластов и маркеров опознания на мо-
лекулах коррегирующих факторов {см. Neufeld, 1974; McKu-
sick, 1978].
Берк и соавторы [Burk е. а., 1968] культивировали совместно
клетки хомячка, генетически неспособные метаболизировать
гипоксантин или аденин, и нормальные клетки. При наличии
тесного контакта между мутантными и нормальными клетками
неспособные метаболизировать гипоксантин или аденин мутант-
ные клетки включали их в свой метаболизм. Если совместно
культивировали мутантные клетки хомячка, одни из которых
были неспособны метаболизировать гепоксантин (недостаточ-
ность гипоксантин-фосфорибозилтрансферазы), а другие аденин
(недостаточность аденин-фосфорибозилтрансферазы), то обе
мутантные линии клеток включали меченные по тритию гипок-
сантин и аденин. Такой феномен, когда фенотип мутантных кле-
ток при их тесном контакте с нормальными клетками исправ-
ляется в культуре, был назван метаболической кооперацией
[Subak-Sharpe е. а., 1969].
При совместном культивировании фибробластов больных лю-
дей с врожденной гиперурикозурией (синдром Леша — Найяна)
и нормальных индивидов также наблюдается исправление фе-
нотипа мутантных клеток. Культивируемые фибробласты от та-
ких больных по сравнению с фибробластами нормальных людей
включают очень мало гипоксантина и гуанина вследствие недо-
статочной активности гипоксантин-фосфорибозилтрансферазы.
Однако, если мутантные клетки смешать в равной пропорции с
нормальными, то мутантные клетки, растущие в тесном контак-
те с нормальными, практически нормально метаболизируют эти
вещества [Сох е. а., 1970]. Авторы считают, что такая метаболи-
ческая кооперация обусловлена переходом из нормальных фиб-
робластов в мутантные клетки продукта нормального фермента—
нуклеотида или его деривата, но не информационной макромо-
лекулы, контролирующей синтез данного фермента.
Если клетки мутантного и нормального фенотипов различ-
ного происхождения не образуют тесных контактов плазматиче-
скими мембранами, то метаболической кооперации не наблюда-
ется [Сох е. а., 1974]. Изучение метаболических взаимоотноше-
ний между мутантными, дефектными по гипоксантин-фосфори-
бозилтрансферазе (ГФРТ-) и нормальными (ГФРТ+) фибро-
бластами человека показало, что клеточные контакты образуют-
74
ся в отсутствие ядра и даже белкового синтеза, очевидно, в ре-
зультате сборки или подбора уже имеющихся мембранных струк-
тур.
Через образующиеся клеточные контакты происходит обмен
метаболитами, в частности, проходят нуклеотиды или дериваты
нуклеотидов, а также другие небольшие молекулы, необходимые
для исправления мутантного фенотипа [Сох е. а., 1976]. Некото-
рые данные указывают на возможность межклеточного переноса
молекул PHK[Kolodny, 1974].
Кокс и соавторы [Сох е. а., 1974; Сох, King, 1975] подчерки-
вают, что метаболическая кооперация, возникающая в резуль-
тате межклеточных взаимодействий, является важным механиз-
мом для гомеостаза и контроля метаболической активности у
многоклеточных организмов. В частности, такого рода межкле-
точные взаимодействия могут играть значительную роль в регу-
ляции процессов роста и дифференцировки.
Фентимен с сотрудниками [Fentiman е. а., 1976] изучали обра-
зование «метаболических» контактов между клетками различных
типов в смешанных культурах. При этом одну из культур метила
3Н-уридином и смешивали с немеченой культурой (реципиен-
том). После 3-часового совместного культивирования клетки
фиксировали и готовили радиоавтографы. Показано, что эпите-
лиальные и фибробластоподобные клетки молочной железы че-
ловека устанавливают метаболические контакты строго избира-
тельно только с клетками своего типа. В то же время злокаче-
ственные клетки линии MCF-7 опухоли молочной железы не об-
разовывали метаболических контактов как между собой, так и с
клетками других типов. Поскольку межклеточные взаимодейст-
вия участвуют в регуляции размножения и функционирования
клеток в организме, авторы полагают, что утрата клетками спо-
собности к метаболической кооперации может быть одной из
причин развития рака.
Действие гормонов на экспрессию генов
Наряду с веществами-индукторами, характеризующимися
контактным характером действия, большая роль в процессах
развития принадлежит гормонам, осуществляющим свое дейст-
вие дистантно, часто даже на значительном расстоянии от места
их секреции. М. С. Мицкевич [1978] в недавно опубликованной
монографии подробно рассмотрел формирование и роль эндо-
кринных механизмов, участвующих в регуляции процессов инди-
видуального развития животных.
Гормоны стероидной или полипептидной природы являются
мощными регуляторами активности генов в клетках-мишенях.
Стероидные гормоны (андроген, эстроген, альдостерон, прогесте-
рон, кортикостероиды и др.) проходят через плазматическую
мембрану и соединяются с цитоплазматическим рецепторным
75
белком; затем происходит активация стероид-рецепторного ком-
плекса и перенос его в ядро, где такой комплекс связывается со
строго определенным участком хроматина, приводя тем самым
к специфической транскрипции гена.
У мыши известен локализованный в Х-хромосоме мутантный
ген Tfm, который обусловливает нечувствительность клеток к те-
стостерону, что вызывает развитие симптомов тестикулярной
феминизации, когда мутанты, несмотря на наличие семенников,
напоминают по фенотипу самок [Ohno, 1971; Attardi, 1976]. Оно
[Ohno, 1971] полагает, что контролируемый мутантным геном
Tfm продукт теряет сродство к тестостерону, вследствие чего
мыши Tfm/Y характеризуются неиндуцибельным состоянием.
Добавление в культуральную среду стероидных гормонов
коры надпочечников индуцирует 5—15-кратное увеличение син-
теза фермента тирозинаминотрансферазы в культивируемых
клетках гепатомы крысы [Granncr е. а., 1968], причем гормон ока-
зывает такое действие только в определенные периоды клеточ-
ного цикла; индукция синтеза тирозинаминотрансферазы в куль-
тивируемых клетках гепатомы крысы наблюдается в поздний
Gi-период или в S-период [Martin е. а., 1969]. Описаны линии
клеток гепатомы, которые, несмотря на нормальный уровень ти-
розинаминотрансферазы, утратили способность реагировать по-
вышением синтеза этого фермента в ответ на введение стероидов
[Levisohn, Thompson, 1972]. У мышей обнаружены межлинейные
различия в тканевых реакциях на действие гидрокортизона. Вве-
дение 4 мг этого гормона на 11 — 14-е дни беременности вызывает
у мышей линии A/Sn расщепление нёба, но не нарушает развитие
эмбрионов мышей линии СВА [Lahti е. а., 1972].
Различные стероидные гормоны, включая эстроген и прогесте-
рон, контролируют развитие и функцию железистых клеток яйце-
вода курицы. Введение эстрогена молодым цыплятам приводит
к дифференцировке железистые клетки, которые синтезируют
основные белки белковой оболочки яйца, включая овальбумин,
кональбумин и лизоцим. Если введение эстрогена прекратить,
то железистые клетки сохраняются, но синтеза овальбумина не
происходит. Повторное введение эстрогена приводит к возобнов-
лению синтеза этого белка (рис. 18).
В клетках стимулированного прогестероном яйцевода кури-
цы комплекс прогестерон — рецепторный белок связывается с
негистоновыми хромосомными белками, что, очевидно, и является
причиной специфической транскрипции [Spelsberg е. а., 1971].
Юмалей и соавторы [O’Malley е. а., 1975] исследовали влияние сте-
роидных гормонов эстрогена и прогестерона на синтез специфи-
ческих белков овальбумина и овидина в железистых клетках
яйцевода молодых цыплят. Количество иРНК для овальбумина
определяли методом их гибридизации с комплементарными ДНК
(кДНК), т. е. с копиями, синтезированными на иРНК с помощью
^обратной транскриптазы. У молодых цыплят иРНК для овальбу-
76
Рис. 18. Действие эстрогена (Э) и прогестерона (П) на развитие и функцию клеток яйцевода курицы [Schimke е. а., 1973]
а — незрелый яйцевод; б, в — влияние на его клетки гормона (гормонов) в течение 1—4 дней: б — дифференцировка эпителиальных клеток,
в — образование железистых клеток; г — действие гормона в течение 5—8 дней: в железистых клетках синтезируются овальбумин и лизо-
цим; д — действие гормона в течение 10 дней: в результате дифференцировки эпителиальных клеток образуются реснитчатые и бокаловид-
ные клетки; е — яйцевод без гормонального воздействия с 10-го по 21-й день; ж — рестнмуляция яйцевода гормоном в течение 12—24 ч: возоб-
новление синтеза овальбумина и лизоцима в железистых клетках
трансхралцая
Ядерная
otfocmwta
аЯЯЯ тР///< Рррр
‘ I I I
транспорт
транс ояцая
фермент
Япеточнаяг
AfCMppOHO )
• ЦАМФ
♦ *
млекопитающих
Гармоны
Рис. 19. Гормональный контроль ак-
тивности генов у
[Wobus, 1971]
мина отсутствовали, но вскоре
после введения им эстрогена
эти иРНК появлялись и при-
мерно через 3 недели количе-
ство их достигало постоянного
уровня: 140 тыс. молекул на
клетку, что характерно для
взрослой курицы. После пре-
кращения введения эстрогена
цыплятам количество иРНК
для овальбумина снова снижа-
лось до нуля, но повторная
инъекция эстрогена приводи-
ла к появлению этих иРНК
уже через 30 мин. По данным
Пальмитера [Palmiter, 1975],
количество иРНК для оваль-
бумина достигает 70 тыс. мо-
лекул на клетку через 4 суток
после вторичного введения
эстрогена цыплятам.
В опытах по влиянию бел-
ков хроматина на экспрессию гена овальбумина в реконструи-
рованной системе показано, что экспрессия данного гена после
стимулирования эстрогеном зависит от происхождения экстра-
гируемых негистоновых белков. Это указывает на исключитель-
ную важность негистоновых белков в регуляции экспрессии ге-
нов [Tsai, O’Malley, 1977].
Полипептидные гормоны (соматотропный гормон, инсулин,
паратироидный гормон и др.) действуют первично на плазмати-
ческую мембрану и прежде всего влияют на систему цикличе-
ского АМФ (цАМФ), которая, будучи неспецифическим звеном
в индуцируемых гормонами реакциях, является универсальным
механизмом реализации их действия на клеточный метаболизм.
Специфическим в этой системе является сродство к соответст-
вующему гормону рецептора плазматической мембраны. Соеди-
няясь с мембранным рецептором, гормон действует на аденил-
атциклазу, которая в свою очередь катализирует образование
цАМФ из АТФ, в результате чего происходит накопление цАМФ,
который оказывает влияние на многие процессы клеточного ме-
таболизма, в частности, превращая неактивную форму фермента
в активную [Сох, King, 1975]. На рис. 19 дана схема возможных
влияний гормонов на экспрессию генов у млекопитающих.
Как указывалось выше, мутантные гены могут изменять чув-
ствительность периферических тканей к влиянию того или иного
гормона. Известны и другие случаи такого действия мутантных
генов. Так, мыши, гомозиготные по аутосомному рецессивному
гену obese (ob) или diabetes (db), а также мыши инбредных
78
линий NZO, кк и KL характеризуются повышенной резистент-
ностью к инсулину. В то же время крысы линии Brattleboro с на-
следственным несахарным диабетом почти в 2 раза более чувст-
вительны к внутривенному введению вазопрессина по сравнению
с нормальными животными, причем это различие более выраже-
но при введении низких доз гормона. С другой стороны, известны
наследственные заболевания человека и мутантные линии лабо-
раторных животных, характеризующиеся недостаточной секре-
цией определенного гормона, хотя периферические ткани в этих
случаях имеют нормальную чувствительность к действию гормо-
на. Гипофизы мышей с наследственной гипофизарной карлико-
востью генотипов dw/dw или df/df не секретируют или секрети-
руют очень мало соматотропного гормона, введение которого
этим мышам значительно усиливало их рост [см. Конюхов, 1969].
В ходе эволюции некоторые виды позвоночных утратили спо-
собность к секреции определенного гормона или их ткани приоб-
рели резистентность или нечувствительность к гормональному
влиянию. Введение тироксина головастикам бесхвостых амфибии,
ускоряет наступление метаморфоза. У аксолотля (Ambystoma
mexicanum) в обычных условиях содержания метаморфоз не
происходит и развитие заканчивается на стадии личинки. Послед-
ние становятся половозрелыми и успешно размножаются (неоте-
ния). Однако у аксолотлей метаморфоз можно индуцировать
введением тироксина. Следовательно, у аксолотля ткани сохра-
нили способность к экспрессии генов дефинитивной или взрослой
стадии онтогенеза. Однако эти гены не включаются в действие,
так как отсутствует соответствующий стимул. У других неотени-
чески размножающихся видов амфибий, наоборот, имеется сти-
мул, но ткани утратили способность реагировать на него [Weber,
1967]. Введением гормонов можно изменить экспрессию мутантных
генов, ослабить их эффекты и тем самым в определенной степени
нормализовать развитие пораженных тканей или органов. Обра-
ботка инсулином эмбрионов кур с наследственной полидактилией
подавляет у них развитие этого дефекта конечностей [Landauer,
1948]. Мыши, гомозиготные по мутантному гену elo, рождаются
с открытыми глазами, в то время как нормальные новорожден-
ные животные имеют сросшиеся веки. Пенетрантность гена elo
у гомозигот составляет 65%. Если вводить кортизон беременным
самкам в течение нескольких дней до закрытия век in utero, ко-
торое происходит в течение 17-го дня эмбрионального развития,
то у потомства от таких обработанных гормоном самок наблю-
дается значительное уменьшение частоты этой аномалии — до
4% [Watney, Miller, 1963].
Тиреоидные гормоны (тироксин, трийодтиронин) влияют на
многие процессы клеточного метаболизма, в частности на транс-
ляцию и активность ферментов, что приводит к ускорению роста
и дифференцировки тканей. Нами было показано, что определен-
ные дозы трийодтиронина (Т3) и тироксина (Т4) стимулируют
79
in vitro и in vivo рост пораженных костей у эмбрионов мышей
с наследственной ахондроплазией (генотип bpH/bpH), причем это
обусловлено усилением процесса гипертрофии хондроцитов. До-
бавление Т3 в культуральную среду приводит к стимулированию
роста зачатков малоберцовых костей 13-дневных эмбрионов
Ьрн/Ьр11. При концентрациях Т3 0,02; 0,2; 0,4 и 0,8 мкг на 1 мл
среды прирост в длину зачатков малоберцовых костей за 4 дня
культивирования равнялся соответственно 5, 18, 21 и 20%. На
среде с концентрацией Т3 2 мкг/мл рост зачатков малоберцовых
костей был несколько меньше, а при концентрации Т3 7 мкг/мл
зачатки этих костей, как и на среде без Т3, совершенно не росли
[Гинтер, Конюхов, 19666].
Введение 1-тироксина (ТА) в течение 11 —14 или 11 —16 суток
беременности вызывало специфическое стимулирование роста
костей конечностей у эмбрионов Ьрп/Ьрн, причем наиболее замет-
ное нормализующее действие гормона на рост наследственно
пораженных костей наблюдалось при введении его в дозе 4 мкг
на 1 г веса тела в течение 11 —14 суток беременности [Конюхов,
Малинина, 1967]. Введение гормона роста (соматотропного гор-
мона) в дозах 1, 2, 4 и 16 мкг на 1 г веса тела мышей в течение
И —14 суток беременности также стимулировало рост поражен-
ных костей задних конечностей у эмбрионов Ьрн/Ьрп Доза гор-
мона 1 мкг/г вызывала наибольшую специфическую стимуляцию
роста костей [Конюхов, Малинина, 1969].
Наиболее сильное изменение экспрессии мутантного гена в ре-
зультате гормональной терапии мы наблюдали в опытах на мы-
шах, гомозиготных по гену ocular retardation (ог). Этот аутосом-
ный рецессивный ген в гомозиготном состоянии подавляет раз-
множение клеток зачатка сетчатки [Конюхов, Строева и др.,
1963; Konyukhov, Sazhina, 1971]. Введение в течение 9—14 суток
эмбриогенеза соматотропного гормона значительно стимулиро-
вало рост пораженной сетчатки у мышей ог/ог, в результате чего
развитие глаза заметно улучшалось [Алексеев, Конюхов, 1972].
Следует отметить, что гормоны в зависимости от дозы, хими-
ческой природы и стадии эмбриогенеза оказывают разное влия-
ние на экспрессию мутантных генов, усиливая или ослабляя их
эффекты. На рис. 20 показано, что введение больших доз гормо-
на роста в течение 9—10 суток эмбриогенеза подавляло, а инъ-
екция малых доз этого гормона в период И —14 суток, наоборот,
усиливала размножение клеток сетчатки эмбрионов мышей
ог/ог. Введение кортизона на 11 — 14-е сутки эмбрионального раз-
вития оказывало сильное стимулирующее влияние на клеточную
пролиферацию в сетчатке эмбрионов ог/ог. Однако длительное
введение этого гормона в течение 9—14 суток эмбриогенеза по-
давляло рост сетчатки. Инъекция Т, на всех изученных сроках
развития подавляла размножение клеток в развивающейся сет-
чатке эмбрионов мышей ог/ог. При использовании гормонов и
других терапевтических воздействий нам не удалось ослабить
80
74^4
Рис. 20. Гистограммы, показывающие изменение числа клеток в сетчатке 15-
дневных эмбрионов мышей ог/ог в зависимости от гормонального воздействия,
по данным Алексеева, Конюхова [1972] и Алексеева [1973]
Введение гормонов: а — большие дозы ежедневно в течение 9—10 суток эмбриогенеза, б-w
малые дозы на протяжении 11 — 14 суток, в — большие и малые дозы на протяжении 9—
10 и 11 — 14 суток соответственно; / —гормон не вводили (контроль), 2 — трийодтиронин,
3 — соматотропный гормон, 4 — кортизон. По оси ординат — среднее число клеток на
один центральный срез сетчатки, в процентах по отношению к контролю. Число клеток
на один центральный срез сетчатки контрольных эмбрионов ог/ог (без воздействия гор-
монов) принято за 100%
экспрессию гена rd, нарушающего дифференцировку фоторецеп-
торов у мыши. Аналогичного рода данные были получены и дру-
гими исследователями.
Таким образом, опыты с введением гормонов мутантным жи-
вотным на различных стадиях эмбриогенеза показали, что силь-
нее изменяется экспрессия генов, контролирующих скорость раз-
множения клеток, а эффекты генов, влияющих на клеточную
дифференцировку, довольно стабильны. Все это указывает на
возможность успешной гормональной терапии наследственных
аномалий человека, обусловленных нарушением скорости раз-
множения определенных клеточных систем, а также на возмож-
ность усиления действия такого рода генов у сельскохозяйствен-
ных животных с целью повышения продуктивности последних.
Взаимодействие регулирующих белков с ДНК хромосом
и контроль транскрипции
Основными компонентами хроматина являются ДНК, гистоны
и негистоновые, или кислые, ядерные белки. Гистоны всех эука-
риотов могут быть разделены на 5 классов небольших мономеров
с молекулярным весом 10 000—20 000. Гистоны содержатся в
клетках примерно в равных количествах. Приняты следующие
обозначения гистонов (в скобках старые символы): богатые ли-
зином—Н1 (fl), Н2А (f2a2), Н2В (f2b) и богатые аргинином
81
НЗ (f3), Н4 (f2a 1). Кроме этих пяти гистонов в ядрах эритроци-
тов птиц содержится богатая лизином фракция Н5 (f2c), почти
полностью замещающая гистон Н1.
При электрофорезе в полиакриламидном геле обработанные
додецилсульфатом натрия негистоновые белки хроматина разде-
ляются на 10—30 компонентов. Среди них идентифицированы
ДНК- и РНК-полимеразы, ДНКазы, метилазы и деацетилазы
гистонов, специфические белки-рецепторы, связывающие гормо-
ны, и многие другие. Удаление гистонов из нуклеогистонов в бес-
клеточных системах in vitro повышает синтез РНК, а добавление
гистонов к препаратам ДНК, наоборот, приводит к реконструк-
ции нуклеогистона и угнетению синтеза РНК (см. Maclean, 1976].
Дерепрессирование генов, возможно, связано с обратимым
процессом ацетилирования гистонов, вследствие чего уменьша-
ется степень их взаимодействия с ДНК. Химическая модифика-
ция гистонов может быть обусловлена также их фосфорилиро-
ванием, в результате чего гистоны могут приобретать большую
специфичность взаимодействия с негистоновыми белками и ДНК.
Последовательность в фосфорилировании и дефосфорилирова-
нии, а также ацетилировании и деацетилировании тех или иных
гистонов может регулировать специфичность связывания гисто-
нов с участками ДНК и упаковку ДНК в хромосоме [Louie е. а.,
1974].
Многие данные указывают, что, по-видимому, не гистоны, а
кислые ядерные белки обеспечивают в основном механизмы спе-
цифической репрессии и дерепрессии генов. Негистоновые, или
кислые, ядерные белки составляют примерно 30% от количества
всех ядерных белков и характеризуются крайне высокой гетеро-
генностью. Молекулярный вес негистоновых хромосомных бел-
ков— 40 000—400 000. В отличие от гистонов кислые белки хро-
матина имеют отрицательный заряд, богаты остатками аспарто-
вой и глутаминовой кислот, содержат триптофан, характеризу-
ются большой скоростью обмена. В разных тканях они сильно
различаются как электрофоретически, так и по составу амино-
кислот. Поэтому многие авторы считают, что негистоновые хро-
мосомные белки могут быть регуляторами активности генов,
причем гистонам отводится роль неспецифических репрессоров,
а кислым ядерным белкам — специфических дерепрессоров
ДНК [Георгиев, 1970; Збарский, 1970; Allfrey, 1970; MacGillivray
е. а., 1972; Stein е. а., 1974].
Г. П. Георгиев [Georgiev, 1972] отмечает, что негистоновые
белки являются более подходящими кандидатами для специфи-
ческого распознавания последовательности оснований, чем ги-
стоны. Было установлено, что негистоновые хромосомные белки
обладают видовой и тканевой специфичностью, восстанавливают
in vitro ингибированный гистонами ДНК-зависимый синтез РНК
и определяют органную специфичность транскрипции хроматина
[см. Baserga, 1976}.
82
По мнению одних исследователей, кислые ядерные белки мо-
гут специфически связываться с гистонами и снимать репресси-
рующее действие тех или иных генов; другие исследователи пола-
гают, что негистоновые белки могут выступать как прямые анта-
гонисты гистонов; присоединяясь к определенным участкам ДНК,
кислые ядерные белки могут препятствовать здесь репрессирую-
щему действию гистонов, вследствие чего происходит избиратель-
ное репрессирование гистонами отдельных локусов. Следует от-
метить, что взаимодействие негистоновых хромосомных белков
и гистонов с теми или иными участками генома (ДНК) может
осуществляться только в течение репликации хромосом [Вогип,
1975].
Иммунологическими методами ядерные белки человека были
обнаружены в ядрах куриных эритроцитов, реактивированных в
гетерокарионе — эритроцит курицы X клетка HeLa. Следователь-
но, ядерные белки клеток HeLa мигрируют через цитоплазму
гетерокариона в ядро куриного эритроцита и индуцируют транс-
крипцию [Ringertz е. а., 1971]. Причем такая миграция ядерных
белков происходит очень быстро: через несколько минут послё
слияния клеток в ядре куриного эритроцита уже были обнару-
жены ранее синтезированные ядерные белки HeLa, а несколько
позднее в ядро эритроцита начинали мигрировать синтезирован-
ные de novo в гетерокарионе белки HeLa [Appels е. а., 1974].
Р. Б. Хесин и Б. А. Лейбович [1976] показали, что негистоно-
вые белки хроматина могут снимать гистонную блокировку, а
Уманский и соавторы [Umansky е. а., 1975] обнаружили специ-
фичность связывания этих белков с ДНК. На модельной системе
асцитной опухоли Эрлиха было установлено, что определенные
негистоновые хромосомные белки активируют транскрипцию с
уникальных последовательностей нуклеотидов ДНК, причем ме-
ханизм их действия заключается в инициации (запуске) синтеза
РНК. Из хроматина опухолевых клеток Эрлиха был выделен
также негистоновый белок типа фосфопротеида, который взаи
модействовал предпочтительно с повторяющимися последова-
тельностями нуклеотидов и в присутствии гомологичной РНК-по-
лимеразы ингибировал в этих участках ДНК транскрипцию
[Wang, 1976].
Негистоновые хромосомные белки, полученные из гомологич-
ных тканей, стимулируют in vitro транскрипцию ДНК значитель-
но сильнее, чем негистоновые белки из гетерологичных тканей.
В результате такой стимуляции появляются новые виды РНК,
что свидетельствует о дерепрессии генов [Wang, Kostraba, 1973].
Авторы подчеркивают, что именно негистоновые хромосомные
белки являются молекулами, регулирующими дерепрессию генов.
В опытах с реконструированным хроматином негистоновые
хромосомные белки ретикулоцитов активировали транскрипцию
глобиновых генов, а негистоновые белки из хроматина клеток
печени не обладали таким действием [Barrett е. а., 1974]. При
83
реконструкции хроматина куриных ретикулоцитов in vitro неги-
стоновая белковая фракция, регулирующая транскрипцию гло-
биновых генов, реассоциируется с ДНК раньше, чем происходит
реассоциация гистонов с ДНК. Следовательно, для того, чтобы
глобиновый ген мог транскрибироваться, специфический неги-
стоновый белок должен реассоциироваться с ДНК раньше, чем
произойдет реассоциация гистонов с ДНК. Этот процесс, очевид-
но, происходит in vivo в течение репликации ДНК [Gadski, Chae,
1978]. Гетероспецифические негистоновые белки хроматина про-
никают в клетки так же интенсивно, как и гомоспецифические.
Однако на дифференцировку клеток оказывают влияние лишь по-
следние [Mathieu е. а., 1976].
Фосфорилирование негистоновых хромосомных белков может
приводить к их модификациям и изменению сродства с теми или
иными участками ДНК [Stein с. а., 1974]. Скорость фосфорили-
рования кислых ядерных белков и гистонов не одинакова на про-
тяжении клеточного цикла. Так, в культурах клеток HeLa пока-
зано, что наибольшая скорость фосфорилирования гистонов на-
блюдается в середине S-периода, а кислых ядерных белков —
в фазах Gt и S [Allfrey е. а., 1974].
В некоторых дифференцирующихся клеточных системах были
отмечены изменения в наборе негистоновых хромосомных белков
[Spelsberg е. а., 1973]. Однако в развивающемся головном мозге
не удалось выявить каких-либо изменений этих белков [Olpe е. а.,
1973]. Бэнкс-Шлегель и соавторы [Banks-Schlegel е. а., 1976] про-
вели тщательное изучение негистоновых хромосомных белков в
процессе гистогенеза сетчатки и не смогли обнаружить различий
в составе, синтезе и фосфорилировании этих белков у 7-, 10- и
18-дневных куриных эмбрионов. Индуцирование in vitro гидро-
кортизоном глутаматсинтетазы — ферментного маркера диффе-
ренцировки сетчатки — также не сопровождалось какими-либо
изменениями негистоновых белков. Авторы полагают, что исполь-
зуемые ими методы, возможно, не позволяют выявить незначи-
тельных изменений этих белков в развивающейся сетчатке или
специфическая регуляция активности генов в данной ткани не
связана с изменением негистоновых хромосомных белков, а осу-
ществляется другими механизмами, в частности, на посттранс-
крипционном уровне.
Паул [Paul, 1972] считает, что в основе строения хромосом
эукариотов, так же как и прокариотов, лежит одна двунитчатая
молекула ДНК, с которой связаны гистоны, обусловливающие
сильную спирализацию ДНК. Автор допускает наличие особого
опознавательного участка, тесно сцепленного с промотором.
Определенная дестабилизирующая полианионовая молекула,
представляющая, очевидно, кислый ядерный белок, может со-
единяться с таким опознавательным участком, вследствие чего
происходит локальное уменьшение спирализации ДНК, позво-
ляющее РНК-полимеразе прикрепиться к промотору.
84
Болгарские исследователи Цанев и Сеидов [Tsanev, Sendov,
1971а] полагают, что кислые ядерные белки соединяются специ-
фически и необратимо с несколькими молекулами гистонов в на-
чальной зоне транскрипции локуса и тем самым дерепрессируют
его. Цитодифференцировка, по их мнению, обусловлена действи-
ем механизма блокирования — деблокирования транскрипции, а
функциональное состояние клетки регулируется менее жестким
механизмом репрессии — дерепрессии генов, который эволюцион-
но возник раньше, чем процесс блокирования — деблокирования.
Последний должен возникнуть по времени одновременно с появ-
лением у эукариотов стойкой цитодифференцировки.
Однако сейчас нет фактов для выделения таких двух различ-
ных механизмов регулирования активности генов на уровне
транскрипции. Многие данные указывают на то, что цитодиффе-
ренцировка контролируется на уровне транскрипции механизмом
репрессии — дерепрессии генов, а функциональное состояние
дефинитивных клеток регулируется, как правило, на посттранс-
крипционном уровне.
В клетках позвоночных обнаружены факторы белковой при-
роды, регулирующие синтез или активность ДНК-зависимой
РНК-полимеразы [Stein, Hausen, 1971]. Р. Б. Хесин [1971] пола-
гает, что регуляция активности генов на транскрипционном уров-
не наряду с действием регуляторных белков может быть также
обусловлена влиянием определенных факторов на РНК-полиме-
разу. В результате изменения структуры последней возможно
переключение синтеза РНК с одних локусов на другие. Возмож-
ная роль разных форм РНК-полимеразы в регуляции активности
генов в ходе развития мыши показана Уорнером и Верштигом
[Warner, Versteegh, 1974]. Однако необходимо получение допол-
нительных фактов для подтверждения этой гипотезы [Maclean,
1976].
В хромосомах высших организмов кроме ДНК и белков име-
ются также РНК. Считается, что РНК как продукт транскрипции
связаны с хромосомой непрочно и не являются ее структурным
компонентом. Боннер и Дамус [Bonner, 1969; Dahmus, Bonner,
1970], опираясь на свои данные, предложили гипотезу, согласно
которой специфичность гистонам как репрессорам отдельных
генов придают особые низкомолекулярные хромосомные РНК,
каждая из которых состоит примерно из 40 нуклеотидов. Такие
РНК могут сначала соединяться с негистоновыми белками, кото-
рые вместе с низкомолекулярными РНК обнаруживаются в на-
тивных нуклеогистонах, а затем связываются с гистонами. Хро-
мосомные РНК, по мнению этих авторов, могут обеспечивать
опознание локусов на ДНК, т. е. определять специфичность реп-
рессирования ДНК гистонами. Однако данные, полученные Ко-
лодни и Розенталем [Kolodny, Rosenthal, 1972], свидетельствуют
о том, что ядерные РНК не могут играть какой-либо роли в иден-
тификации последовательностей азотистых оснований ДНК.
85
Интересные факты о регуляции активности генов получены в
опытах с гибридизацией соматических клеток. Так, при гибриди-
зации клеток гепатомы крысы с фибробластами или лимфобла-
стами мыши были выделены клоны клеток, синтезировавшие сы-
вороточный альбумин мыши. Эти клоны клеток содержали, как
правило, два набора крысиных хромосом (2 генома) и один набор
хромосом мыши [Peterson, Weiss, 1972; Malawista, Weiss, 1974].
Синтез сывороточного альбумина не свойствен в норме фибро-
бластам, и поэтому полученные авторами данные позволяют
предполагать дерепрессию в гибридных клетках тканеспецифиче-
ского гена, контролирующего синтез этого белка. Некоторые кло-
ны гибридных клеток мышиной гепатомы с лейкоцитами челове-
ка синтезировали человеческий сывороточный альбумин, хотя
количество синтезированного сывороточного альбумина человека
в таких гибридах было в 100 раз меньше по сравнению с про-
дукцией ими мышиного альбумина [Darlington, 1974]. Броун и
Вейсс [Brown, Weiss, 1975] в гибридах — клетки крысиной гепа-
томы X лимфоидные клетки мыши — наблюдали синтез четырех
специфических ферментов печени мыши (тирозинаминотрансфе-
разы, аланинаминотрансферазы, альдолазы В и алкогольдегид-
рогеназы). Авторы считают, что продукция этих мышиных бел-
ков в гибридных клетках обусловлена, по-видимому, дерепрес-
сией в хромосомах лимфоидной клетки «молчащих», т. е. нерабо-
тающих генов.
Вейсс [Weiss, 1976] отмечает, что процесс дерепрессии генов
в гибридных клетках связан с определенными взаимодействиями
между родительскими геномами. Изучение синтеза специфиче-
ских белков печени в гибридах между клетками крысиной гепа-
томы и клетками других типов (эпителиальными, фибробласто-
подобными, лимфоидными) того же или других видов показало,
что в тех случаях, когда гибриды содержали диплоидные или
околодиплоидные родительские наборы хромосом, синтез специ-
фических белков печени частично или даже полностью подавлял-
ся. Утрата гибридом хромосом непеченочных клеток может при-
вести к проявлению ранее несинтезированных специфичных бел-
ков печени, причем различные специфичные белки печени могут
синтезироваться независимо друг от друга.
Слияние тетраплоидных клеток крысиной гепатомы с мыши-
ными фибробластами или лимфоидными клетками приводило
иногда к синтезу мышиных специфических белков печени, что,
возможно, определяется дерепрессией соответствующих генов.
В некоторых гибридах, у которых был частично подавлен синтез
крысиных специфических белков, также наблюдали активацию
новых генов в хромосомах другого родителя. Эти данные, свиде-
тельствующие о возможной дерепрессии у гибридов нефункцио-
нирующих в родительских клетках генов, показывают, что в про-
цессе дифференцировки не происходит утраты или необратимых
изменений молчащих (неактивных) генов.
86
У гибридов, полученных в результате слияния миобластов с
фибробластами мыши, не было обнаружено синтеза иРНК для
миозина. Такие гибридные клетки не синтезировали миозина, не
сливались друг с другом и не образовывали мышечные трубочки,
как это характерно для культивируемых in vitro миобластов
[Buckingham е. а., 1974]. В этой работе подробно исследован
только один клон гибридных клеток, и не исключено, что в дан-
ном клоне был потерян структурный геп для миозина. Если бы
удалось при дальнейшем субклонировании восстановить синтез
иРНК для миозина, то это было бы первым убедительным дока-
зательством репрессии структурного гена в гибридных клетках.
Бернхард [Bernhard, 1976], заканчивая обзор данных об экспрес-
сии генов в гибридных соматических клетках, отмечает, что в та-
кого рода исследованиях почти всегда остается открытым во-
прос, не были ли исследуемые авторами гены потеряны в ходе
клонирования клеток.
Основные компоненты хроматина — гистоны и кислые ядер-
ные белки — синтезируются в цитоплазме. Опыты с пересадкой
ядер соматических клеток в энуклеированные яйцеклетки амфи-
бий и многочисленные данные, полученные в исследованиях по
гибридизации клеток, указывают на важную роль цитоплазмати-
ческих факторов в регуляции активности генов на транскрипци-
онном уровне. Однако механизмы специфической репрессии и де-
репрессии генов у эукариотов остаются еще не выясненными.
Даже для таких довольно хорошо изученных генов, какими явля-
ются гены гемоглобинов, для которых выделены иРНК и опре-
делена последовательность аминокислот в их прямых белковых
продуктах — глобиновых цепях, контроль транскрипции неясен
[Maclean, 1976].
Контроль экспрессии генов
на посттранскрипционном уровне
Если регуляция активности генов на транскрипционном
уровне ограничена довольно очерченным кругом процессов —
репрессией или дерепрессией соответствующих участков ДНК и
синтезом РНК, то контроль экспрессии генов на посттранскрип-
ционном уровне является более многоэтапным, включающим, в
частности, процессинг и транспорт иРНК из ядра в цитоплазму,
инициацию и синтез белка на рибосомах, посттрансляционные
модификации белковых молекул.
Как указывалось выше, далеко не все гормоны взаимодейст-
вуют с дезоксирибонуклеопротеиновым комплексом, влияя непо-
средственно на процесс транскрипции. Гормоны часто оказывают
действие на посттранскрипционные события, в частности, на про-
цесс трансляции. Даже в тех случаях, когда гормон оказывает
влияние на транскрипцию, активность фермента может зависеть
от многих посттранскрипционных событий. Например, стероид-
87
ные гормоны индуцируют продукцию тирозинаминотрансферазы
в клетках печени млекопитающих на транскрипционном уровне,
обусловливая синтез специфической иРНК. Однако регуляция
количества данного фермента в клетке осуществляется на пост-
транскрипционном уровне [Tomkins е. а., 1972]. Стероидные гор-
моны вызывают увеличение активности щелочной фосфатазы в
культивируемых клетках HeLa, очевидно, в результате химиче-
ской модификации молекулы фермента [Сох, King, 1975].
Дифференциальная скорость трансляции разных иРНК в од*
ной и той же клетке является важным механизмом регуляции
синтеза белков у млекопитающих. Так, иРНК для a-цепей гемо-
глобина транслируется быстрее, чем иРНК для 0-цепей. Пост-
транскрипционная регуляция селективной трансляции иРНК, по-
видимому, играет важную роль в клеточной дифференцировке.
В частности, может быть конкуренция различных иРНК за рибо-
сомы или неодинаковая скорость деградации разных иРНК [см.
Maclean, 1976].
Многие структурные и ферментные белки являются димерами
или тетрамерами и не могут функционировать в мономерной
форме. Взаимодействие полипептидных цепей может регулиро-
вать белковый синтез на уровне трансляции. Снятие 0-цепсй ге-
моглобина с полирибосом, очевидно, регулируется наличием не-
большого пула свободных a-цепей, а присутствие свободных
легких цепей иммуноглобулина G влияет на снятие с полирибо-
сом тяжелых цепей [см. Lewin, 1970]. Инкубирование кроличьих
ретикулоцитов с добавлением в инкубационную среду различных
концентраций гемина показало, что гемин стимулирует синтез
глобина и подавляет синтез гема. В ретикулоцитах не происходит
синтеза иРНК и, следовательно, этот контроль осуществляется
на уровне трансляции. Добавление гемина, очевидно, ускоряет
процесс трансляции. Гем координирует сборку глобиновых цепей
молекулы гемоглобина. С другой стороны, синтез гема зависит
определенным образом от синтеза глобина [London е. а., 1967].
Внутриклеточная концентрация тетрамерных изоферментов
лактатдегидрогеназы зависит в большой степени от событий, про-
исходящих на посттрансляционном уровне. Сначала образуются
гомополимерные (А4 и В4), а затем уже гетерополимерные формы.
Причем на количество каждого из этих изоферментов влияют
многие внутриклеточные факторы [Fritz е. а., 1971].
У межродовых песцово шсьих гибридов была обнаружена
дополнительная фракция трансферрина, характеризующаяся
медленной электрофоретической подвижностью и отсутствующая
у обоих родительских видов. Поскольку трансферрины не имеют
четвертичной структуры, то эта фракция трансферрина не может
быть результатом молекулярной гибридизации двух разных ро-
дительских трансферринов. Возможно, дополнительная фракция
трансферрина у гибридов является химически модифицирован-
ной формой одного из родительских трансферринов. При этом
88
химическая модификация должна происходить внутриклеточно
в местах синтеза трансферрина, так как в образцах, полученных
при смешивании плазмы крови лисицы и песца, данная фракция
не найдена [Серов и др., 1976].
Такие посттрансляционные события, как скорость деградации
белковых молекул, связывание их с ингибиторами или мембрана-
ми являются важными механизмами регуляции экспрессии генов.
Например, тканеспецифический спектр изоферментов лактатде-
гидрогеназы определяется в основном скоростью деградации А-
и В-полипептидных цепей. В тканях сердца крысы гомополимер
А4 имеет более высокую скорость деградации по сравнению со
скоростью деградации любого тетрамера, содержащего полипеп-
тид В [Fritz е. а., 1973]. Исследование синтеза и деградации изо-
ферментов лактатдегидрогеназы в печени, почках, сердце и ске-
летных мышцах мышей (самцы линии C57BL/6J) показало, что
экспрессия структурных генов лактатдегидрогеназы отражает
разную скорость деградации этих изоферментов в различных
тканях, тогда как скорость синтеза А- и В-полипептидных цепей
в исследованных тканях была примерно одинакова [Nadal-Gi-
nard, 1978].
Скорость деградации каталазы в печени мышей линии
C57BL/Ha вдвое меньше, чем у мышей линии DBA/2, вследствие
чего у мышей первой линии в клетках печени содержится втрое
больше молекул этого фермента [Ganschow, Schimke, 1970].
В ходе развития мыши координированно изменяются активности
Р-глюкуронидазы, и р-галактозидазы. При этом соотношение
Р-глюкуронидаза/р-галактозидаза в различных органах колеб-
лется от 0,65 (в мозге) до 6,1 (в печени), что определяется нали-
чием органоспецифических систем, регулирующих скорость син-
теза и деградации данных ферментов [Meisler, Paigen, 1972)
В исследованиях на гибридных соматических клетках получе-
ны факты, свидетельствующие скорее о посттранскрипционном
блоке реализации эффектов тканеспецифических генов, чем об
их репрессии на уровне ДНК. Так, гибриды, полученные в ре-
зультате слияния синтезирующих меланин клеток меланомы си-
рийского хомячка или мыши с мышиными фибробластами, ока-
зались непигментированными, и у них не обнаружена активность
тирозиназы [Davidson е. а., 1966]. Однако примерно половина
клонов гибридных клеток, которые были получены в результате
слияния тетраплоидных пигментированных клеток меланомы с
фибробластами и, следовательно, содержали два генома клеток
меланомы и один геном фибробластов, были пигментированы и
имели высокую тирозиназную активность [Davidson R., 1972].
Уитакер [Whittaker, 1970] убедительно показал наличие пост-
транскрипционного блока в реализации эффектов пигментных
генов в культивируемых клетках.
У гибридов, полученных в результате слияния малигнизиро-
ванных клеток гипофиза крысы, синтезирующих in vitro гормон
89
роста, с фибробластами мыши, не обнаружено этого гормона
[Sonnenschein е. а., 1968]. В глиальных клетках гидрокортизон
индуцирует повышение активности глицерол-3-фосфатдегидроге-
назы. Однако у гибридов, полученных в результате слияния гли-
альных клеток крысы с мышиными фибробластами, гидрокорти-
зон не вызывал увеличения активности глицерол-3-фосфатдегид-
рогеназы [Davidson R., Benda, 1970]. Если эритробласт куриного
зародыша, синтезирующий гемоглобин, сливается с клеткой
тканевой культуры человека или мыши, то в гетерокарионе в
течение нескольких часов после слияния скорость синтеза гемо-
глобина увеличивается примерно в 10 раз по сравнению со ско-
ростью синтеза гемоглобина в самом эритробласте. Однако уже
в течение первого дня после слияния клеток скорость синтеза
гемоглобина начинает падать, и к 4—5-му дню продукция гемо-
глобина полностью прекращается. Регуляция синтеза гемогло-
бина в таком гетерокарионе, по мнению Харриса [Harris, 1970а],
осуществляется на уровне трансляции.
При слиянии клеток мышиной эритролейкемии с эритроид-
ными клетками костного мозга китайского хомячка или человека
у гибридов наблюдали совместное проявление глобиновых генов
обоих видов. Клетки эритролейкемии сходны по своим свойствам
с проэритробластами. При слиянии клеток эритролейкемии с
фибробластами человека не обнаружено экспрессии мышиных
глобиновых генов [Deisseroth, Nienhunsi, 1976]. У гибридов гли-
альная клетка крысы X фибробласт мыши содержание характер-
ного для глиальных клеток белка S 100 было примерно в 10 раз
меньше, чем в глиальной клетке [Benda, Davidson, 1971]. Актив-
ность тирозинаминотрансферазы у гибридов, полученных в ре-
зультате слияния клеток гепатомы крысы с фибробластами
мыши, была также в десять раз меньше, чем в клетках гепатомы
[Schneider, Weiss, 1971]. Томпсон и Гелертер [Thompson, Ge-
lehrter, 1971] отмечают, что нельзя исключить посттранскрипци-
онного блока синтеза или инактивации этого фермента в гибрид-
ных клетках.
Дэвидсон [Davidson R., 1974], рассмотрев многочисленные
данные, полученные на гибридных соматических клетках, указы-
вает, что для гибридов характерна утрата признаков дифферен-
цировки одной из родительских клеток. Некоторые гены специа-
лизированных клеток продолжают функционировать в гибридах.
Так, гибриды, полученные в результате слияния клеток нейро-
бластомы и фибробластов мыши, несмотря на высокую скорость
деления, имели признаки, характерные для нервных клеток:
активность ацетилхолинэстеразы, чувствительность к ацетилхо-
лину, специфический для нервных клеток белок и невриты [Minna
е. а., 1971, 1972].
Почему не проявляются эффекты многих тканеспецифических
генов дифференцированных клеток при слиянии их с фибробла-
стами, какими конкретными механизмами это обусловлено, пока
90
еще не ясно. В некоторых случаях нельзя полностью исключить
потери соответствующих хромосом или генов в процессе культи-
вирования [Sonnenschein е. а., 1968].
Дэвидсон [Davidson R., 1971] предложил гипотезу негативного
контроля, согласно которой в недифференцированных клетках
имеются вещества-регуляторы, репрессирующие все тканеспеци-
фические гены. Фибробласты, правда, нельзя отнести к катего-
рии недифференцированных клеток, так как они характеризуют-
ся определенной, хотя и неглубокой дифференцировкой.
Беквитц и Россоу [Beckwith, Rossow, 1974] подчеркивают, что
постулат о негативном генном контроле, основанный на отсутст-
вии проявления эффектов тех или иных тканеспецифических ге-
нов у гибридных клеток, указывает лишь на неполноту диффе-
ренцировки гибридов и ничего не говорит о механизмах этого
процесса. Неспособность к выражению определенной функции
дифференцированной клетки у гибрида, трактуемая часто как
доказательство в пользу негативного контроля активности гена
регуляторным продуктом, может быть обусловлена посттранс-
крипционными процессами. Об этом свидетельствуют также
данные, полученные на прокариотах. В частности, можно пред-
положить, что недифференцированная клетка содержит веще-
ство, взаимодействующее с позитивной контрольной системой
регуляции активности генов, например, разрушающее соответ-
ствующий индуктор или эффектор обратной связи. Возможны и
другие объяснения. По мнению этих авторов, слияние высокоспе-
циализированных клеток приводит к таким серьезным и быстро
возникающим изменениям фенотипа, что вряд ли они могут быть
результатом генных взаимодействий.
Эфрусси [Ephrussi, 1972] пишет, что в опытах с гибридиза-
цией соматических клеток ни в одном случае не получено доста-
точно убедительных данных, свидетельствующих о том, что по-
теря того или иного признака дифференцировки вызвана блоком
(репрессией) на уровне транскрипции, а не трансляции. Все при-
водимые до сих пор факты, как отмечает Эфрусси [1972], могут
быть следствием изменения экспрессии генов на посттранскрип-
ционном уровне.
Таким образом, рассмотренные выше данные свидетельствуют
о том, что отсутствие эффектов активного тканеспецифического
гена одной из родительских клеток в гибридной клетке не обяза-
тельно должно рассматриваться как репрессия данного гена ка-
ким-то гипотетическим веществом-регулятором, присутствующим
в цитоплазме другой родительской клетки: во многих случаях этс
обусловлено посттранскрипционным блоком реализации генети-
ческой информации. Влияние внутриклеточной среды на измене-
ние экспрессии того или иного гена на посттранскрипционном
уровне, очевидно, играет важную роль в клеточной дифферен-
цировке [Clever, 1968].
91
Взаимодействие структурных и регуляторных генов
Фенотип организма возникает в результате сложного взаи-
модействия многих тысяч генов, причем продукт одного гена мо-
жет выступать в качестве индуктора или репрессора другого
гена, а взаимодействие генных эффектов на посттранскрипцион-
ном уровне приводит к усилению или ослаблению экспрессии ге-
нов (Корочкин, 1977]. Как уже указывалось выше, в ходе раз-
вития широко наблюдаются взаимодействия структурных генов
(см. гл. 1). Наряду с такого рода генными взаимодействиями в
последние годы получено много данных о наличии у высших орга-
низмов взаимодействий регуляторных и структурных генов в
различных клеточных системах.
У прокариотов ген-регулятор управляет активностью гена-
оператора, который расположен рядом с группой структурных
генов и включает их в действие. Ген-регулятор контролирует син-
тез белкового репрессора, который связывается с оператором и
подавляет его активность. Присутствующее в цитоплазме клет-
ки вещество-индуктор соединяется с репрессором, оператор дере-
прессируется, и структурные гены начинают работать [Jacob, Mo-
nod, 1961]. В настоящее время отсутствуют факты, свидетель-
ствующие в пользу наличия такой оперонной системы у эукарио-
тов. Полученные на прокариотах данные указывают лишь на
возможную зависимость активности структурных генов у эука-
риотов от определенных регуляторных элементов (промоторов,
операторов, участков позитивного контроля и т. д.). Однако ме-
ханизмы, обеспечивающие активность определенных генов у
эукариотов, практически неизвестны. Многие авторы считают не-
приемлемым механическое перенесение на хромосомы высших
организмов оперонной модели регуляции генной активности про-
кариотов. Томас [Thomas, 1971] правильно утверждает, что рас-
крытие регуляции активности генов у Escherichia coli должно
рассматриваться как детская задача в сравнении с теми регу-
ляторными механизмами, которые имеют место в эмбриогенезе
высших организмов.
Дэвидсон [Davidson Е., 1968] полагает, что большая часть
генома эукариотов выполняет регуляторные функции, хотя, по
его мнению, структурные гены также могут выступать в качестве
регуляторных. Были предложены гипотезы об организации опе-
рона и регуляции активности генов на уровне транскрипции в
клетках высших организмов [Gcorgiev, 1969; Георгиев, 1973; Brit-
ten, Davidson, 1969; Davidson, Britten, 1973].
Модель оперона Г. П. Георгиева [1969, 1973] предполагает на-
личие двух основных частей: неинформативной и информатив-
ной. Неинформативная зона включает акцепторные участки
ДНК, которые не несут какой-либо информации, но могут специ-
фически взаимодействовать с определенными белками, преиму-
щественно с регуляторными. Информативная зона состоит из
92
структурных и регуляторных генов, несущих информацию о син-
тезе ферментов, структурных и регуляторных белков. Акцептор-
ная зона оперона может функционировать как по позитивному,
так и по негативному принципу. В первом случае регуляторные
белки, соединяющиеся с таким участком хроматина, являются
дерепрессорами, а во втором — репрессорами.
Бриттен и Дэвидсон {Britten, Davidson, 1969; Davidson, Brit-
ten, 1973] высказали гипотезу о механизмах регуляции актив-
ности генов у высших организмов, предполагая взаимодействие
так называемых активаторных РНК или синтезируемых на них
белков с рецепторным участком ДНК, который расположен ря-
дом с работающим (структурным) геном. Согласно их модели,
активаторные РНК синтезируются на интеграторных генах.
Оно [Ohno, 1971] полагает, что регуляция активности генов в
онтогенезе млекопитающих осуществляется менее сложными
механизмами, чем это принято считать в настоящее время. Его
мнение основано на том факте, что один локус может контроли-
ровать инактивацию у женских особей целой Х-хромосомы,
включающей сотни структурных генов. Механизм инактивации
Х-хромосомы является высокоспециализированным только для
данной хромосомы, и его нельзя распространять на все хромосо-
мы млекопитающих и тем более на все гены эукариотов.
У позвоночных, в частности у человека, известно много от-
клонений от нормы различных ферментов и других белков. Вы-
сказывались предположения, что некоторые из этих дефектов
могут быть связаны с мутациями генов-регуляторов или генов-
операторов, согласно известной модели регуляции активности
структурных генов для прокариотов. Однако более детальные
исследования всякий раз вскрывали структурные изменения де-
фектного белка, что должно указывать на мутацию структурного
гена [см. Harris, 1970Ь].
Для высших организмов еще не доказано наличие генов ре-
гуляторов и операторов в тОхМ смысле, как это принято для про-
кариотов, хотя у них несомненно должен существовать меха-
низм взаимодействия между генами разных локусов, определяю-
щий, в частности, начало и скорость синтеза ферментов и других
белков. В. А. Гвоздев [1968] и Р. Б. Хесин [1972] полаыют, что
данные о различных регуляторных факторах в соматических
клетках высших организмов свидетельствуют лишь о процессах
регуляции, а не о наличии оперонов в хромосомах. Отождествле-
ние описанных систем регуляций генов у эукариотов с опероном
бактерий хотя и заманчиво, но убедительно не доказано [Мгли-
нец, 1973].
Многие исследователи считают, что большая часть ДНК
позвоночных не несет прямых генетических функций. В основе
сложности генома высших организмов по сравнению с прокарио-
тами лежит не столько увеличение числа структурных генов,
контролирующих синтез белков, сколько более сложная система
93
контроля над сравнительно мало увеличенным числом фермен-
тов и структурных белков.
У человека синтез глобиновых цепей а, 0, б, Gy и Ау, входящих
ь состав двух взрослых типов гемоглобина НЬА (а202),
НЬА2 (а2б2) и фетального гемоглобина .HbF (а2у2), контролиру-
ется аллелями тесно сцепленных локусов Gy—Ау—6—0 и несцеп-
ленным с ними локусом а. Кендел и соавторы [Kendall е. а.,
1973] предполагают существование регуляторного гена Y, кото-
рый контролирует активность генов у- и 0-полипептидных цепей
в эритроидных клетках человека. По мнению этих авторов, гипо-
тетический регуляторный ген Y локализован между структурны-
ми глобиновыми генами Gy—Ау—Y—б—0 и на определенной ста-
дии онтогенеза репрессирует у-локус и дерепрессируег соответ-
ственно 0-локус. Случаи сохранения в течение всего онтогенеза
синтеза HbF, т. е. когда гемоглобин взрослых людей не содер-
жит 0- или б-полипептидных цепей, обусловлены, возможно, де-
лецией этого регуляторного гена. Однако не имеется убедитель-
ных доказательств в пользу существования такого регуляторно-
го гена.
Кабат [Kabat, 1972] высказал гипотезу, что в основе клеточ-
ной дифференцировки может лежать исключение из генома того
или иного гена в результате вырезания хромосомных петель при
внутрихромосомном кроссинговере. Таким механизмом регуля-
ции генной активности автор объясняет, в частности, смену син-
теза полипептидных цепей гемоглобина в онтогенезе человека.
Он полагает, что в эритропоэтинчувствительных клетках может
иметь место случайный внутрихромосомный кроссинговер, кото-
рый происходит между двумя гомологичными генами-операто-
рами, локализованными вблизи промотора. В результате такого
кроссинговера из хромосомы могут вырезаться Gy- и ^-глобино-
вые гены и под влиянием эритропоэтина отбираются клетки,
синтезирующие 0- и б-цепи. Эта гипотеза не находит подтверж-
дения в последних работах, в которых установлено сохранение
глобиновых генов в эритроидных клетках в ходе онтогенеза че-
ловека [Benz е. а., 1977; Papayannopoulou е. а., 1977].
У домашних овец имеются два аллеля, контролирующие син-
тез 0-полипептидных цепей гемоглобина. Нормальные взрослые
гетерозиготы синтезируют примерно в равных количествах гемо-
глобин А (а202А) и В (а202в). Если овца, имеющая аллель для
0А-полипептидных цепей, становится анемичной, у нее наблюда-
ется прекращение синтеза гемоглобина А и вместо него начина-
ется продукция гемоглобина С (а202с), вследствие чего взрос-
лые животные с анемией имеют примерно равные количества С-
и В-гемоглобинов. Изменение синтеза от НЬА к НЬС обратимо:
после окончания эритропоэтического стресса продукция 0с-гло-
бина прекращается и начинается опять образование 0А-глобина.
Ген для 0с-полипептидных цепей сцеплен с геном для 0А-поли-
пептидных цепей, и в нормальных условиях у животных, имею-
94
ших аллель для рА-цепей, экспрессия гена для рс-цепей наблю-
дается только в течение неонатального периода [Huisman е. а.,
1969]. У овец, гомозиготных по гену для рв-глобина, даже в слу-
чае тяжелой анемии гемоглобин С не образуется. Использование
комплементарной ДНК, синтезированной с помощью обратной
транскриптазы на иРНК для рв- и рс-глобинов, показало, что
ген для рс-глобина отсутствует в хромосоме, несущей рв-аллель.
Ген рс был, очевидно, потерян в этой хромосоме в результате
делеции в ходе эволюции [Benz е. а., 1977].
Регуляция экспрессии глобиновых генов рА и рс у овец (как
в онтогенезе, так и в случае анемии) осуществляется, очевидно,
способными к диффузии факторами. В опытах с культивирова-
нием костного мозга in vitro установлено, что гемоглобины А и
С синтезируются разными популяциями эритроидных клеток.
Костный мозг взрослых овец и коз культивировали на сгустках
плазмы. После добавления эритропоэтина исследовали образо-
вание колоний, продукцию взрослого гемоглобина А и синтез
гемоглобина С (a2₽2G)- При концентрации эритропоэтина мень-
ше 0,01 ед/мл в культурах костного мозга коз наблюдади обра-
зование колоний и продукцию взрослого гемоглобина. Макси-
мальный синтез гемоглобина С отмечен через 72—96 ч культиви-
рования, причем он был в 100 раз больше при добавлении эрит-
ропоэтина в культуральную среду. Колонии клеток костного
мозга овец на этом сроке культивирования продуцировали взрос-
лый гемоглобин, а через 96—120 ч наблюдали продукцию гемо-
глобина С. Осаждением в градиенте плотности были выделены
клетки, которые синтезировали разные количества гемоглобина
С. Кратковременное действие высоких концентраций эритропоэ-
тина на костный мозг овец (in vivo) и коз (in vitro) стимулиро-
вало образование клеток-предшественников колоний, которые
синтезировали гемоглобин С даже при низких дозах эритропоэ-
тина [Barker е. а., 1976]. Авторы полагают, что детерминирова-
ние эритроидных клеток для синтеза определенного типа гемо-
глобина происходит на ранних этапах их дифференцировки и
представляет, по-видимому, необратимый этап развития этих
клеток.
Многие факты свидетельствуют о том, что гены эмбриональ-
ных и взрослых глобинов работают в разных популяциях эритро-
идных клеток, причем это характерно как для млекопитающих,
так и для птиц и амфибий [Ingram, 1972; Shimizu 1976]. Поэтому
в основе регуляции активности разных глобиновых генов лежат
прежде всего механизмы их специфической дерепрессии и заме-
щения одной популяции эритроидных клеток другой.
Пейджан и соавторы [Paigen е. а., 1975, 1976] постулируют
наличие у млекопитающих регуляторных генов, детерминирую-
щих время и скорость синтеза того или иного фермента в ответ
на физиологические сигналы. Это предположение основывается
на различиях активности p-глюкуронидазы и р-галактозидазы у
95
мышей разных инбредных линий. Экспрессия структурного гена
для а-галактозидазы (символ гена Ags), локализованного в
Х-хромосоме мыши, варьирует в печени мышей разных инбред-
пых линий, что проявляется в различных уровнях ферментной
активности. Эти данные, по мнению Лусиса и Уеста [Lusis, West,
1978], могут свидетельствовать о том, что экспрессия гена Ags
в клетках печени мыши контролируется отдельным аутосомным
локусом.
У мыши известно два аутосомных локуса, Bgs и Bgt, влияю-
щие на активность 0-галактозидазы в различных органах. Сна-
чала полагали, что аллели локуса Bgs контролируют активность
р-галактозидазы в головном мозге, а аллели локуса Bgt — в пе-
чени [Felton е. а., 1974; Paigen е. а., 1976]. Однако более подроб-
ный анализ активности этого фермента в различных тканях по-
казал, что у мышей с высоким уровнем активности р-галакто-
зидазы в головном мозге активность этого фермента в других
тканях была относительно низкой и, наоборот, у мышей4с низким
уровнем активности данного фермента в головном мозге в дру-
гих тканях его активность была относительно высокой. Кроме
того, в пределах даже одного органа различные клеточные си-
стемы (например, экзокринная и эндокринная части поджелу-
дочной железы) имели разные уровни активности р-галактози-
дазы [Dewey, Mintz, 1978а]. Эти данные указывают на сложный
характер генетического контроля активности ферментов в раз-
ных клеточных системах.
На активность ферментов оказывают большое влияние фи-
зико-химические условия внутриклеточной среды (pH. ионная
сила, температура), и в некоторых случаях изменение pH может
даже изменить направленность действия фермента. Сложность
изучения регуляции метаболических процессов у высших орга-
низмов состоит в том, что различные биохимические и физиоло-
гические процессы объединяются в функциональные ансамбли
разного порядка, работающие в колебательных режимах [Поле-
вой, 1975]. Поэтому изменение активности какого-либо фермен-
та или эффектов того или иного гена может зависеть от многих
причин, и менее всего следует ожидать в таких случаях, что
существуют особые регуляторные гены.
Активность фермента может зависеть от наличия разных ал-
челей одного и того же локуса. Так, Хекансон [Hakansson, 1976]
исследовала активность 0-глюкуронидазы в тканях почки самцов
мышей линий DBA/2K1, C57BL/K1 и C57BL/6J-bf/bf после введе-
ния им 5а-дигидротестостерона. Оказалось, что активность это-
го фермента у мышей линии DBA в 10 раз выше по сравнению с
мышами линий C57BL. Применение возвратного скрещивания с
использованием маркерного локуса bf показало, что варианты
активности 0-глюкуронидазы у самцов мышей этих линий опре-
деляются в основном разными аллелями локуса Gur, контроли-
рующего синтез данного фермента.
96
У мышей некоторых линий в эритроидных клетках наблюда-
ется экспрессия генов локуса ЛДГ-А, но не аллелей локуса
лдг-в, вследствие чего в эритроцитах обнаруживается только
гомополимер А4. На основании этих фактов было постулировано
наличие локуса-регулятора ЛДГЬс1г-1. Гласс и Дойл [Glass,
Doyle, 1972] получили данные, указывающие на посттранскрип-
ционный контроль экспрессии локуса ЛДГ-В в эритроидных
клетках мышей. В эритроцитах мышей, гомозиготных по гену
Ldr-la (линия C57BL/6), был обнаружен низкомолекулярный
фактор, который препятствует молекулярной гибридизации субъ-
единиц А и В, в результате чего не образуется изофермент ЛДГ-4.
У гомозигот по гену Ldr-lb (линия SWR/J) этот изофермент об-
разуется. О. Л. Серов и Т. М. Хлебодарова [1973] сообщили о
сходной регуляции экспрессии генов ЛДГ у лисиц. Авторы на-
блюдали генетически контролируемое преобладание ЛДГ-2 в
эритроцитах некоторых животных. Следует отметить, что ген-
регулятор ЛДГ проявляет свое действие только в эритроидных
клетках и его влияние не обнаружено в других клеточных систе-
мах, в частности мозге, печени, почках, сердце и мышцах [Glass,"
Doyle, 1972]. Такое избирательное проявление гена-регулятора
Ldr-1 только в эритроидных клетках требует проведения допол-
нительных исследований.
На примере синтеза лактатдегидрогеназы в клетках эритро-
идного ряда мыши, крысы и других млекопитающих было пока-
зано, что органоспецифический спектр белков и изоферментов
может определяться не только дифференциальной активностью
структурных генов, но также и специфичностью функционирова-
ния генов-модификаторов в тканях, специализирующихся в раз-
ных направлениях [Корочкин и др., 1977].
Томкине с сотрудниками [Tomkins е. а., 1969, 1972; Ivarie е. а.,
1975] исследовали синтез тирозинаминотрансферазы в линии
клеток крысиной гепатомы. Для измерения количества тирози-
наминотрансферазы применяли меченые антитела. Если клетки
крысиной гепатомы сначала культивировать в присутствии сте-
роидного гормона, а затем в культуральную среду добавить сы-
воротку крови, то скорость синтеза тирозинаминотрансферазы
увеличивается примерно вдвое. Причем актиномицин Г) почти не
влияет, а циклогексимид ингибирует скорость этого синтеза.
В период стимуляции синтеза тирозинаминотрансферазы добав-
ление сыворотки увеличивало продукцию данного фермента бо-
лее чем па 90%, а синтез других белков только на 23%. Синтез
тирозинаминотрансферазы можно индуцировать стероидными
гормонами коры надпочечников только в конце Gr и в течение
S-периода клеточного цикла. В первые несколько часов Grne-
риода и в Go-период индуцировать синтез этого фермента не
удается. Для объяснения данного факта и других наблюдений
авторы предложили гипотетическую модель генетической регу-
ляции синтеза тпрозинаминотрансферазы в течение клеточного
4 В. В. Конюхов 97
цикла. Они считают, что наряду с наличием структурного гена
(S), определяющего структуру тирозинаминотрансферазы, дол-
жен быть ген (R), контролирующий синтез лабильного пост-
транскрипционного репрессора синтеза тирозинаминотранс-
феразы. Согласно предложенной модели, оба гена — S и R—
активны в течение индуцибельного периода (начиная с позд-
ней Gi-фазы и до начала О2-фазы), но при отсутствии индукто-
ра— стероидного гормона — продукт гена R связывается с иРНК
для тирозинаминотрансферазы, что блокирует трансляцию этой
РНК и в конечном итоге приводит к ее деградации. Если доба-
вить в культуру индуктор, то он ингибирует действие репрессора
и происходит трансляция иРНК для тирозинаминотрансферазы.
Тот факт, что стероидные гормоны коры надпочечников не могут
индуцировать синтез тирозинаминотрансферазы в G2- и раннем
Gi-периодах, обусловлен, по мнению авторов, репрессией обоих
генов, S и R.
В процессе дифференцировки пигментных клеток у млекопи-
тающих тирозиназа (тирозин-ДОФА-оксидаза) в свободном со-
стоянии обычно соединяется с цитоплазматическими ингибито-
рами, но, включившись в состав меланосомы, она становится
недоступной их действию. В некоторых случаях, когда актив-
ность тирозиназы отсутствовала или была сильно снижена, от-
мечены ультраструктурные дефекты матрикса меланосом [Queve-
do, 1973; Ikejima, Takeuchi, 1974]. Следовательно, отсутствие тиро-
зиназной активности может быть обусловлено первичными гене-
тическими дефектами матрикса меланосом.
В хрусталике амфибий был обнаружен ингибитор тирозина-
зы, а активность тирозиназы в непигментированных клетках ре-
генерирующего хрусталика тритона оказалась даже выше, чем
в пигментированных эпителиальных клетках радужины, из кото-
рых образуется хрусталик. Низкая активность тирозиназы в
клетках радужины, по-видимому, обусловлена наличием ее ин-
гибитора [Achazi, Yamada, 1972]. Эти данные указывают на то,
что активность тирозиназы в тканях глаза регулируется на пост-
трансляционном уровне, а не путем дерепрессии и репрессии со-
ответствующего гена. В клетках меланомы Клоудмана S 91 так-
же содержится ингибитор тирозиназы. Если к очищенным пре-
паратам тирозиназы добавляли надосадочную жидкость из кле-
ток меланомы, то активность тирозиназы падала примерно в
15 раз [Gianni, Weinberg, 1975].
Биохимический анализ гомогенатов тканей мышей-альбино-
сов (генотип с/с), приготовленных с использованием детергента
тритона Х-100, показал наличие в них тирозиназы. Добавление
гомогенатов тканей альбиносов к гомогенатам тканей пигменти-
рованных мышей приводило к подавлению тирозиназной актив-
ности в последних. Эти данные указывают на то, что локус albi-
no (с) у мыши не является структурным для тирозиназы. Му-
тантные аллели локуса с, очевидно, контролируют синтез какого-
98
то вещества, связывающего тирозиназу и ингибирующего ее ак-
тивность [Hearing, 1973].
Аксолотли, гомозиготные по гену а, являются альбиносами.
У них тирозиназа представлена в неактивной форме и может
быть активирована in vitro химотрипсином. В результате фрак-
ционирования экстрактов из тканей кожи мутантных и нормаль*
ных особей на сефадексе G-200 установлено, что молекулярный
вес неактивной тирозиназы у мутантов на 30 000 больше, чем в
норме. Мутантная тирозиназа, так же как и нормальная, состо-
ит из 4 субъединиц, каждая из которых на 8000 крупнее субъ-
единиц дикого типа. Активация тирозиназы может заключаться
в отщеплении ковалентно связанных фрагментов от протирози-
назной молекулы. Экстракты из тканей кожи аксолотлей геноти-
па а/а содержат фактор, ингибирующий активность тирозиназы
у аксолотлей и лягушек дикого типа. Этот ингибитор, очевидно,
взаимодействует обратимо с неактивной формой тирозиназы и
необратимо — с активной формой данного фермента [Harsa-
King, 1978]. Автор полагает, что нормальный аллель локуса «а
контролирует синтез активатора тирозиназы. У аксолотлей ге-
нотипа а/а функция этого активатора нарушена, что приводит к
постоянному присутствию ингибитора и латентной неактивной
формы тирозиназы.
Мутантный ген brachypodism-H (Ьрн) в гомозиготном состоя-
нии обусловливает развитие ахондроплазии, или диспропорцио-
нальной карликовости, у мыши. Этот ген действует в хрящевых
клетках зачатков костей, возникающих из мезенхимы постак-
сиальной части почки конечности, которая расположена каудаль-
нее ее продольной оси. Противоположную часть почки конечно-
сти называют преаксиальной. Выход продукта гена Ьри из гене-
тически пораженных зачатков костей приводит к нарушению
развития костей, возникновение которых связано с мезенхимой
преаксиальной части почки конечности, в частности большебер-
цовой кости. При культивировании in vitro зачаток большебер-
цовой кости эмбрионов Ьрн/Ьрп развивается нормально [Гинтер,
Конюхов, 1966а; Konyukhov, Ginter, 1966; Konyukhov, Bugrilova,
1968]. Ген bpH в одинарной дозе, т. е. у гетерозигот (Ьрп/+), по-
давляет рост зачатков костей как in situ, так in vitro примерно в
2 раза слабее, чем у гомозигот (Ьри/Ьрн). Определение размеров
хрящевых клеток диафизов малоберцовых костей 13-суточных
эмбрионов показало, что степень гипертрофии хрящевых клеток
у эмбрионов Ьрн/+ занимает промежуточное положение по отно-
шению к эмбрионам bpH/bpH и +/+• Следовательно, торможе-
ние роста зачатков костей конечностей геном Ьрп обусловлено
подавлением гипертрофии хрящевых клеток, которое пропорцио-
нально дозе гена. Экстракты из тканей 13-суточных эмбрионов
Ьрн/+ подавляют рост in vitro зачатков костей эмбрионов +/+
примерно вдвое слабее, чем экстракты из тканей эмбрионов
Ьрп/Ьрп Наличие дозового эффекта указывает, что ген Ьрн у
99
4*
мыши является структурным, а выделяющийся из пораженных
зачатков костей мутантных эмбрионов ростингибирующий фак-
тор представляет собой продукт данного мутантного гена [Буг-
рилова, Конюхов, 1971].
Данные ряда авторов свидетельствуют о различии морфоге-
нетических свойств мезенхимы постаксиальной и преаксиальной
частей почек конечностей позвоночных [MacCabc е. а., 1973; Fal-
lon, Crosby, 1975]. В каждой из этих частей почки конечности
создаются, очевидно, специфические условия для активации
определенных генов. Поэтому выяснение механизмов, обусловли-
вающих экспрессию гена Ьрн в хондробластах, возникающих
из мезенхимы постаксиальной части почки конечности, пред-
ставляло интерес. Полученные нами данные показывают, что
проявление эффектов гена Ьрн в хондробластах постаксиальной
части почки конечности обусловлено наличием в ней белкового
фактора, регулирующего экспрессию этого мутантного гена.
В преаксиальной части почки конечности данный фактор отсут-
ствует [Бугрилова, Конюхов, 1978]. Результаты этой работы из-
ложены ниже.
Использовали эмбрионов мышей с нормальными (генотип
+/+) и наследственно пораженными (bpH/bpH) конечностями,
имеющих сходную генетическую среду. За нулевой день бере-
менности считали день обнаружения вагинальной пробки. По-
лучали экстракты из целых почек конечностей И-суточных, а
также из пре- и постаксиальных частей почек конечностей 12-
суточных эмбрионов +/+• Ткани почки конечности гомогенизи-
ровали в растворе Хенкса при 4° С, после чего смесь центрифу-
гировали 10 мин при 10 000 g. Надосадочную жидкость исполь-
зовали в качестве экстракта. Зачатки большеберцовых костей
13-суточных эмбрионов мышей bpH/bpH или +/+ культивирова-
ли в течение двух суток в среде, содержащей экстракты из пре-
аксиальных частей (ЭПрЧ) или постаксиальных частей (ЭПЧ)
почек конечностей 12-суточных эмбрионов +/+• Конечная кон-
центрация белка экстракта в культуральной среде составляла
50 мкг/мл.
Скорость роста зачатков большеберцовых костей мутантных
эмбрионов при культивировании с ЭПЧ была достоверно ниже
скорости роста тех же зачатков, культивируемых в присутствии
ЭПрЧ или без этих экстрактов. ЭПЧ не оказывал влияния на
скорость роста зачатков большеберцовых костей 13-суточных
нормальных эмбрионов (+/+). Прирост этих зачатков за двое
суток культивирования в присутствии ЭПЧ был такой же, как
в контроле, когда данный экстракт не добавляли в питательную
среду (рис. 21).
Торможение роста культивируемых зачатков большеберцо-
вых костей 13-суточных эмбрионов Ьрн/Ьрп в присутствии ЭПЧ
является специфическим и указывает на содержание в клетках
постаксиальной части почки конечности 12-суточных эмбрионов
100
Таблица 5. Влияние экстракта из почек конечное!ей 11-суточных эмбрионов-
+/+ на прирост (в %) культивируемых в течение двух суток зачатков боль
шеберцовых костей 13-суточных эмбрионов
[Бугрилова, Конюхов, 1978]
Условия культивирован! я bpH/bpH +/+
X ± S- X р X S- X р
С экстрактом Без экстракта 31,0 + 1,64(16) 41,1±1,42(16) <0,001 41,5+ 0,99(16) 41,44 0,69(16) >0,1
Примечание. В скобках числ » культивируемых зачатк в к< стой.
фактора, регулирующего экспрессию гена Ьрн. Добавление дан-
ного фактора в культуральную среду обусловливает проявление
эффектов гена Ьр11 в зачатках большеберцовых костей генотип#
bpH/bpH. Этот регулирующий фактор не оказывал влияния на
экспрессию гена Ьрн в зачатках большеберцовых костей 14-су-
точных эмбрионов Ьрн/Ьрп. Прирост за двое суток культивиро-
вания зачатков этих костей в присутствии ЭПЧ (22,14= 1,68%)
достоверно не отличался от их прироста в среде без экстракта
(23,3+2,0%).
Были проведены опыты с целью обнаружения регулирующего
экспрессию гена Ьрп фактора в почке конечности И-суточных
эмбрионов +/+• Экстракт получали из целых почек конечностей,
так как на этой стадии развития трудно разделить почку конеч-
ности на пре- и постаксиальную части. Экстракт из целых почек
конечностей 11-суточных эмбрионов добавляли в культуральную
среду в дозе 100 мкг белка/мл, т. е. конечная концентрация бел-
ка этого экстракта в среде была вдвое большей, чем в вышеопи-
санных опытах с ЭПЧ и ЭПрЧ. Скорость роста зачатков боль-
шеберцовых костей 13-суточных эмбрионов bpH/bpH в присутствии
этого экстракта была достоверно ниже скорости роста зачатков
костей такого же генотипа, культивируемых без экстракта. Экс-
тракт из почек конечностей 11-суточных эмбрионов не оказывал
влияния на рост in vitro зачатков большеберцовых костей эмб-
рионов +/+ 13 суток развития (табл. 5). Полученные данные
показывают, что регулирующий экспрессию гена Ьри фактор
присутствует в почке конечности 11-суточных эмбрионов, но,
очевидно, в меньшем количестве, чем в почке конечности эмбрио-
нов 12 суток развития. В пользу этого свидетельствует более
высокая степень торможения роста зачатков костей в присутст-
вии ЭПЧ 12-суточных эмбрионов (24,9+1,74%), чем при добав-
лении в культуральную среду экстракта из целых почек конеч-
ностей 11-суточных эмбрионов (31,0+1,64%).
Скорость роста зачатков большеберцовых костей эмбрионов
bpH/bpH при культивировании их с прогретым или обработанным
101
Рис. 21. Экспрессия гена Ьрп в культивируемых in vitro зачатках большебер-
цовых костей 13-суточных эмбрионов мышей Ьрп/Ьрн под влиянием экстрак-
та из постаксиальных частей почек конечностей [Бугрилова, Конюхов, 1978]
ПК, — почка конечности; ЭПрЧ — экстракт из преаксиальных частей; ЭПЧ — экстракт из
постаксиальных частей почек конечностей 12-суточных эмбрионов 4-/4-; зачатки больше-
берцовых костей bpH/bpH—черные; зачатки большеберцовых костей 4-/4 белые; в
двойном кольце — культивирование зачатков большеберцовых костей без добавления
ЭПрЧ или ЭПЧ; /—5 — прирост (в %) зачатков костей за 2 суток культивирования (в скоб-
ках — число культивируемых зачатков): / — 43,4±1,60 (14), 2 —45,1±1,29 ( 24), 3 — 24,9±
1,74 (15), 4 — 39,0±1,82 (17), 5 — 37,7±0,75 (18). Заштрихованный столбик — проявление
гена Ьрн
Рис. 22. Влияние нагревания (60° С в течение 10 мин) и трипсина (500 мкг/мл)
на активность фактора, регулирующего экспрессию гена Ьрн [Бугрилова, Ко-
нюхов, 1978]
1— 41,3±0.83 (21), 2 — 23,6±0,92 (26), 3 — 40,1±1,14 (27), 4 — 41,1=4=1,33 (16). Обозначен
см. на рис. 21
трипсином ЭПЧ не отличалась от контроля — культивирование
без ЭПЧ. Добавление в культуральную среду нативного ЭПЧ
приводило к значительному торможению роста этих зачатков
(рис. 22). Следовательно, экспрессии гена Ьрп не наблюдается
в зачатках большеберцовых костей в присутствии ЭПЧ, прогре-
того при 60° С или обработанного трипсином. Эти факты свиде-
тельствуют о белковой природе фактора, регулирующего экс-
прессию гена Ьрп.
Для определения молекулярного веса данного фактора экст-
ракт из постаксиальных частей почек конечностей 12-суточных
эмбрионов + / + (ЭПЧ) фракционировали с помощью фильтра-
конуса Amicon и камер Minicon с различной величиной пор. В ре-
зультате фильтрации белковых растворов в камерах Minicon-25
102
остаются белки, молекулярный вес которых выше 25 000, а в ка-
мерах Minicon-15 — белки с молекулярным весом больше 15 000.
ЭПЧ (400 мкг белка/мл) центрифугировали при 3000 g в те-
чение 15 мин в конусе с мембранным фильтром, через поры ко-
торого проходят белки с молекулярным весом ниже 50 000.
Фильтрат в том же объеме в качестве исходного ЭПЧ (0,2 мл)
добавляли к 1,3 мл питательной среды, в которой культивирова-
ли зачатки большеберцовых костей 13-суточных эмбрионов
Ьрн/Ьр11 Прирост зачатков костей в присутствии фильтрата был
равен приросту зачатков, которые росли с исходным нефильтро-
ванным ЭПЧ, и был достоверно ниже, чем в контроле — культи-
вирование без ЭПЧ (рис. 23). Затем этот фильтрат, содержащий
фактор, который регулирует экспрессию гена Ьрн, переносили в
камеры Minicon-25 или Minicon-15. После фильтрации объем
оставшегося в камере белкового раствора доводили до исходно-
го раствором Хенкса и затем 0,2 мл такого раствора добавляли
к 1,3 мл среды, в которой культивировали зачатки большебер-
цовых костей 13-суточных эмбрионов bpH/bpH.
Эффекты гена Ьрн были обнаружены только в присутствии
белкового раствора из камеры Minicon-15. В данном случае при-
рост зачатков костей не отличался от их прироста в присутст-
вии исходного ЭПЧ и был достоверно ниже прироста зачатков
костей, культивируемых с белковым раствором из камер Mini-
con-25 (рис. 23). Прирост зачатков костей в присутствии белко-
вого раствора из камер Minicon-25 достоверно не отличался от
прироста зачатков костей, культивируемых без ЭПЧ. Следова-
тельно, фактор, регулирующий экспрессию гена Ьрн, проходит
через фильтры Minicon-25 и задерживается фильтрами Mini-
con-15, поэтому его молекулярный вес находится в пределах от
15 000 до 25 000.
Для изучения вопроса, на каком уровне — транскрипционном
или посттранскрипционном — фактор, присутствующий в ЭПЧ,
регулирует экспрессию гена Ьрп, зачатки большеберцовых ко-
стей 13-суточных эмбрионов ЬрИ/Ьр11 инкубировали в течение
5 ч с актиномицином D (1 мкг/мл), а затем после смены пита-
тельной среды культивировали двое суток с ЭПЧ или без него.
Актиномицин D в дозе 1 мкг/мл практически полностью подав-
лял синтез РНК (>95%) в культивируемых зачатках костей.
Концентрация актиномицина D 0,1 мкг/мл была недостаточна
для подавления синтеза РНК, а более высокие его концентрации
(2,5 и 5,0 мкг/мл) приводили к сильному ингибированию роста
культивируемых зачатков костей и дегенерации их клеток. При-
рост за двое суток культивирования зачатков костей, обработан-
ных актиномицином D (1 мкг/мл) и затем культивируемых с
ЭПЧ, был достоверно меньше, чем в контроле, где зачатки того
же генотипа, обработанные актиномицином D, культивировали
без ЭПЧ (рис. 24). Эти данные указывают на то, что экспрессия
гена Ьрн в культивируемых зачатках большеберцовых костей эм-
103
1 2 J 4 S
Рис. 23. Тестирование разных фракций экстракта из постаксиальных частей
почек конечностей 12-суточных эмбрионов +/+ [Бугрилова, Конюхов, 1978]
Z — 40,9±1,22 (22), 2- 21,3± 1,30 (21), 3 — 21,7±1,44 (25), 4 — 39,3± 1,39 (20), 5 — 21,4±0,93
(31). Обозначения см. на рис. 21
Рис. 24. Влияние экстракта из постаксиальных частей почек конечностей 12-
суточных эмбрионов мышей +/+ на экспрессию гена Ьрн в культивируемых
зачатках большеберцовых костей 13-суточных эмбрионов bpH/bpH после по-
давления синтеза РНК актиномицином D (1 мкг/мл в течение 5 ч) [Бугрило-
ва, Конюхов, 1978]
1 — 10,6±0,68 (30), 2 — 23,0±0,93 (24). Обозначения см. на рис. 21
брионов Ьри/Ьрп «индуцируется» ЭПЧ практически при полном
подавлении синтеза РНК. Следовательно, фактор, регулирую-
щий экспрессию гена Ьрн, действует на посттранскрипционном
уровне.
Результаты этой работы подтверждают данные других иссле-
дователей о существовании различий в морфогенетических свой-
ствах пре- и постаксиальных частей почки конечности. Получен-
ные нами факты объясняют причину отсутствия экспрессии му-
тантного гена Ьр11 в зачатках костей, возникающих из мезенхи-
мы преаксиальной части почки конечности, в частности больше-
берцовой. Как было показано ранее, скорость роста in vitro за-
чатков большеберцовых костей 13-суточных эмбрионов мышей
генотипа Ьрп/Ьрн не отличается от нормы [Konyukhov, Ginter,
1966]. Добавление в культуральную среду экстракта из постакси-
альных частей почки конечности 12-суточных эмбрионов +/+
приводит к экспрессии гена Ьри, а экстракт из преаксиальных
частей почки конечности не обладает таким свойством. Это по-
называет, что в постаксиальной части почки конечности в отли-
чие от ее преаксиальной части имеется фактор, регулирующий
экспрессию гена Ьрн. Этот фактор присутствует в почках конеч-
ностей 11- и 12-суточных эмбрионов, что совпадает по времени с
проявлением первых морфологических эффектов гена Ьрн у го-
мозигот [Малинина, 1969].
Локус Ьр11, очевидно, дерепрессируется в хондробластах за-
чатков костей как пре-, так и постаксиального происхождения.
Однако экспрессия генов этого локуса осуществляется только в
зачатках костей, возникающих из мезенхимы постаксиальной
части почки конечности благодаря присутствию в этих клетках
фактора, регулирующего экспрессию гена Ьрн на посттранскрип-
ционном уровне. Добавление экстракта из постаксиальных час-
тей почек конечностей 12-суточных эмбрионов +/+ в культу-
ральную среду не приводило к проявлению эффектов гена Ьрн
в культивируемых зачатках большеберцовых костей 14-сутоя-
ных эмбрионов bpH/bpH. В этот период эмбриогенеза локус Ьри,
по-видимому, уже не активен в хрящевых клетках формирую-
щейся большеберцовой кости.
Фактор, регулирующий экспрессию гена Ьрн, представляет
собой термочувствительный белок с молекулярным весом 15 000—
25 000, что позволяет рассматривать контролирующий его ген как
ген — регулятор экспрессии локуса Ьрн, причем регуляция осу-
ществляется на посттранскрипционном уровне. Следует отметить,
что белки, влияющие на различные процессы эмбрионального
развития (индукция тканевых закладок, цитодифференцировка
и клеточная пролиферация), имеют сходные молекулярные веса
и многие из них действуют на посттранскрипционном уровне
[Tiedemann, 1973, 1975].
Стрелер и соавторы [Strehler е. а., 1971] предложили гипотезу
генетического контроля развития высших организмов при помо-
щи специфического регулирования трансляционных механизмов.
Принимая во внимание неодинаковую активность амииоацил-
тРНК-синтетаз в разных клеточных системах, они считают, что
регулирование процессов роста, размножения и дифференцировки
клеток может осуществляться через контроль синтеза или степе-
ни активности этих ферментов. В частности, явление эмбриональ-
ной индукции авторы объясняют отсоединением в индуцируемых
клетках определенной синтетазы от репрессора, что приводит к
трансляции соответствующей кодовой группы нуклеотидов иРНК.
В результате этого может синтезироваться белок, который необ-
ходим для размножения или дифференцировки клеток той или
иной тканевой закладки. Такой механизм контроля над реализа-
цией генетической информации, возможно, имеет место в онто-
генезе. Однако необходимо получение дополнительных фактов
для обоснования этой гипотезы.
Механизмы взаимодействия регуляторных и структурных ге-
вов у позвоночных в большинстве случаев еще не ясны, хотя из-
105
вестно, что такого рода взаимодействия осуществляются на
транскрипционном, посттранскрипционном и посттрансляцион-
ном уровнях. Дальнейшие исследования, возможно, покажут, что
многие из рассматриваемых сейчас генов-регуляторов являются
структурными, а их функция регуляции других генов представ-
ляет собой результат взаимодействия эффектов двух структур-
ных локусов. Как было показано выше, взаимодействие продук-
тов разных структурных генов определяет время вступления в
действие гена или проявление его эффектов, а также приводит
к усилению или ослаблению экспрессии взаимодействующих ге-
нов (см. гл. 1).
*
Изучение механизмов регуляции активности генов в индиви-
дуальном развитии является одной из важнейших проблем со-
временной биологии. В зиготе гены не активны, дерепрессия или
активация генов происходит в ходе развития, причем в разных
клетках дерепрессируются различные гены. На любой стадии
дифференцировки клетки работает не более 5—10% генов, а
остальные гены находятся в неактивном, репрессированном со-
стоянии. В качестве репрессоров генов выступают особые бел-
ки— гистоны, синтез которых контролируется генами. Взаимо-
действие генов, проявляющееся через взаимовлияния молекул
репрессоров и дерепрессоров генов, ядра и цитоплазмы и различ-
ных клеточных систем друг с другом, определяет характер инди-
видуального развития высших организмов. Пока еще получено
мало данных, чтобы понять весь сложный процесс действия и
взаимодействия многих тысяч генов, контролирующих в конечном
итоге развитие организма. От накопления сведений в этой об-
ласти зависит понимание механизмов онтогенеза и возможные
пути его управления. На рис. 25 представлены основные этапы
реализации генетической информации в онтогенезе.
Главной задачей молекулярной биологии и генетики в тече-
ние трех предыдущих десятилетий было изучение структуры и
свойств нуклеиновых кислот, а сейчас пристальное внимание
исследователей привлечено к выяснению тонкого строения и
функции хромосом высших организмов, в частности человека и
позвоночных животных. Это объясняется тем, что ДНК сущест-
вует и функционирует в клетке в тесном сочетании с белком, а
именно в форме нуклеопротеида. Для понимания специфики ре-
прессии генов необходимо прежде всего выяснить принципы бел-
ково-нуклеинового узнавания.
Какой принцип лежит в его основе, пока еще не ясно, хотя
известны примеры, свидетельствующие в пользу существования
такого рода узнаваний. Так, фермент РНК-полимераза узнает
определенные последовательности нуклеотидов ДНК, прикреп-
ляется к промотору, откуда и начинается процесс транскрипции,
106
Рис. 25. Реализация наследственной информации в ходе развития позвоночных
Прерывистые стрелки указывают на основные этапы регуляции экспрессии генов на пост-
транскрипционном уровне
т. е. синтез РНК- Как уже рассматривалось выше, явление эмб-
риональной индукции обусловлено переходом веществ белковой
природы из одной клеточной системы в другую, вследствие чего
происходит дерепрессия определенных тканеспецифических ге-
нов. Следовательно дерепрессия генов в онтогенезе связана с
белково-белковым узнаванием. Решение вопросов специфическо-
го узнавания молекул друг другом позволит понять механизм ре-
гуляции генов и управлять этим процессом.
Глава 3
ЭКСПРЕССИЯ ГЕНОВ
В РАННЕМ РАЗВИТИИ
❖
Вряд ли необходимо доказывать важность ранних стадий
развития для становления сложной организации высших орга-
низмов. Этот вопрос уже давно решен многочисленными иссле-
дованиями эмбриологов, которыми установлена высокая чувст-
вительность ранних зародышей к действию тератогенных аген-
тов. Нарушения раннего эмбриогенеза приводят, как правило, к
летальному исходу или серьезным аномалиям многих клеточных
систем. Яйцеклетки представителей разных классов позвоноч-
ных сильно различаются между собой по размеру и строению.
У рыб, амфибий и птиц яйцеклетки содержат много желтка и
поэтому значительно крупнее, чем яйцеклетки млекопитающих.
Количество желтка влияет на характер дробления зиготы и про-
хождение ранних этапов эмбриогенеза. Еще сравнительно недав-
но мы имели в своем распоряжении лишь отрывочные данные о
генетическом контроле раннего развития позвоночных. Исполь-
зование методов молекулярной биологии и анализ эффектов му-
тантных генов позволили получить важные факты, 'проливаю-
щие свет на особенности действия генов в раннем развитии у
представителей разных классов позвоночных. Оказалось, что в
яйцеклетке и зиготе гены неактивны, активация первой группы
генов у представителей различных классов позвоночных проис-
ходит на разных стадиях раннего эмбриогенеза.
Экспрессия и активация генов
на ранних этапах развития рыб, амфибий и птиц
У костистых рыб синтез иРНК на хромосомных генах начи-
нается на стадии средней бластулы и не одновременно во всех
клетках. Так, в базальном слое клеток бластодермы вьюна син-
тез РНК начинается раньше и затем распространяется в на-
правлении от желтка к анимальному полюсу бластодермы. В от-
личие от хромосомных генов митохондриальные гены у вьюна
дерепрессируются на самых ранних этапах развития [Костома-
рова, Ротт, 1970; Kafiani, 1970]. Синтез белка у рыб до начала
108
гаструляции происходит на долгоживущих иРНК, синтезирован-
ных в оогенезе. Со стадии гаструлы белковый синтез идет на
новых иРНК, которые образуются в результате активации генов
на стадии средней бластулы [Krigsgaber, Neyfakh, 1972].
Количество ДНК в яйцеклетке амфибий в 1000, а в яйцеклет-
ке птиц в миллион раз больше, чем в гаплоидном наборе хромо-
сом за счет митохондриальных ДНК. В ходе дробления зиготы
не происходит репликации ДНК митохондрий, число митохонд-
рий и, следовательно, митохондриальной ДНК значительно
уменьшается, и уже к стадии гаструлы количество митохонд-
риальной ДНК в клетке соответствует ее количеству в клетке
взрослого организма [см. Neyfakh, 1971].
Холмес и Уитт [Holmes, Whitt, 1970] установили, что по ряду
свойств (электрофоретическая подвижность, специфичность в
отношении субстрата и ингибитора, изменение активности в он-
тогенезе) у костистой рыбы Fundulus heteroclitus 15 изофермен-
тов эстеразы можно разбить на 6—8 групп, синтез каждой из
которых, вероятно, контролируется одним или несколькими ло-
кусами. Некоторые из этих эстераз чувствительны к органиче-
ским соединениям фосфора, а другие резистентны к ним. На
ранних стадиях развития до стадии гаструлы чувствительные к
органическим соединениям фосфора изоферменты отсутствуют
и удается обнаружить лишь резистентную к органическим соеди-
нениям фосфора эстеразу (Ег-1). Начиная с гаструлы появля-
ется и постепенно усиливает свою активность чувствительная к
органическим соединениям фосфора эстераза (Es-1), а в период
интенсивного органогенеза обнаруживаются Es-2 и Ег-2, перед
стадией выклева из яйца появляются Es-З и Es-4.
У тропической аквариумной рыбы из семейства вьюновых
акантофтальмуса (Acantophthalmus kuhlii) экспрессия гена од-
ной из эстераз проявляется в конце эмбриогенеза и продолжа-
ется после выклева. У вьюна аналогичного фермента нет, тем
не менее у гибридных зародышей вьюнХакантофтальмус ген
этого фермента включается на той же стадии развития, как и у
акантофтальмуса [Ботвинник, Нейфах, 1977]. Путем инактива-
ции ядер актиномицином D или ионизирующей радиацией в вы-
соких дозах на последовательных этапах эмбрионального разви-
тия вьюна было установлено время активации генов, контроли-
рующих синтез альдолазы. Дерепрессия этого локуса происхо-
дит на стадии 21 ч, до стадии 36 ч (начало движений зароды-
ша) наблюдается увеличение активности альдолазы [Нейфах
и др., 1976].
У амфибий синтез белка на ранних стадиях развития, как и
у рыб, осуществляется на долгоживущих иРНК, запасенных в
оогенезе. В цитоплазме зрелых неоплодотворенных яйцеклеток
амфибий имеется большинство, если не все иРНК, которые не-
обходимы для белкового синтеза в течение ранних стадий раз-
вития. Однако эти иРНК находятся в неактивной (маскирован-
109
б 7 8 9 10 13 19 26 32 W 4У
бремя роста ооцита
N к.
Змее
100 ч
Н'Ч §!|ч£
Созревание в течениеЮч
Рис. 26. Относительные скорости синтеза нуклеиновых кислот в оогенезе
и раннем развитии амфибий [Gurdon, 1974]
ной) форме и становятся активными после оплодотворения [Ty-
ler, 1969]. Синтез иРНК и тРНК у амфибий начинается в конце
дробления и значительно увеличивается на стадии бластулы.
В начале гаструляции начинается синтез рРНК и образуются
новые рибосомы. На рис. 26 показано время и относительная
скорость синтеза нуклеиновых кислот как в оогенезе, так и в
течение ранних стадий развития амфибий.
Методом РНК—ДНК-гибридизации установлено, что число
дерепрессированных генов в ходе развития амфибий прогрессив-
но увеличивается, иными словами, по мере развития включают-
ся в действие все новые и новые гены. На ранних стадиях эм-
бриогенеза — бластуле, гаструле и нейруле — синтезируются
только короткоживующие иРНК. Со стадии хвостовой почки тка-
ни эмбриона содержат иРНК, как короткоживущие так и дол-
гоживущие (стабильные). Последние, очевидно, начинают син-
тезироваться на предыдущей стадии развития — нейруле [Denis,
1968]. Методом конкурентной гибридизации ДНК с РНК было
показано, что в ходе развития Xenopus laevis [Denis, 1968] и
Rana pipiens [Greene, Flickinger, 1970] происходит активация
все новых и новых генов, причем многие гены, включившись на
определенной стадии, продолжают транскрибироваться и на по-
следующих. В частности, было показано, что с меченой РНК ран-
них стадий хорошо конкурирует РНК, выделенная из зароды-
шей более старшего возраста и личинок. Некоторые авторы по-
лагают, что на иРНК, синтезированных на ранних стадиях эм-
бриогенеза^ образуются белки, которые регулируют активность
ПО
генов на стадии гаструлы. Изучение биологической роли этих
белков, принимающих участие в регуляции активности генов,
представляет важную задачу будущих исследований [Bracket,
Malpoix, 1971].
Кэрол и Синклер [Carroll, Sinclair, 1972] обнаружили, что
различия в размерах ядрышек у двух мутантов аксолотля появ-
ляются на стадии гаструлы. У Xenopus laevis известна делеция,
которая в гетерозиготном состоянии уменьшает число ядрышек в
диплоидных клетках вдвое, а у гомозигот ядрышки вообще от-
сутствуют (в норме в большинстве клеток содержится по 2 яд-
рышка). Гомозиготы по этой делеции (генотип о/о) погибают па
стадии свободно плавающей личинки (головастика). У них не
синтезируются рРНК, но синтез иРНК происходит нормально
[Brown, Gurdon, 1964]. Опыты с РНК—ДНК-гибридизацией по-
казали, что у данного мутанта утрачены локусы для 28S- и
18S-pPHK. У нормальных особей эти гены составляют ядрыш-
ковый организатор «ядрышкообразующей» хромосомы {Miller,
Knowland, 1970]. На основании исследований с этим мутантом
шпорцевой лягушки предложена схема биосинтеза рибосом, со-
гласно которой на ядрышковом организаторе синтезируются
рРНК, а формирование рибосом происходит в ядрышке, распо-
ложенном вблизи ядрышкового организатора и состоящем в ос-
новном из недостроенных рибосомных частиц [Birnstiel, Chip-
chase, 1970]. Зародыши Xenopus laevis генотипа о/о, в клетках
которых отсутствуют ядрышки и не происходит синтез рРНК,
развиваются до стадии плавающего головастика, имеющего мно-
гие функционирующие ткани, в частности мышцы, кровь и клет-
ки хрусталика. Это означает, что запас рибосом, созданный в
оогенезе, достаточен для прохождения ранних стадий развития
амфибий. Синтез иРНК начинается на стадии средней бласту-
лы, и процесс трансляции на новых иРНК происходит с по-
мощью рибосом, образованных в оогенезе.
У аксолотля известны два аутосомных рецессивных гена clea-
vage arrest (cl) и ova deficient (о), которые активны в оогенезе
и нарушают первые этапы эмбриогенеза. Мутантный ген о обус-
ловливает у гомозиготных самок блокирование развития их по-
томства на стадии гаструлы. Продукт нормального аллеля этого
локуса накапливается в оогенезе и определяет прохождение га-
струляции. Эмбрионы от самок о/о прекращают развитие на
стадии гаструлы, несмотря на то что яйцеклетки были оплодо-
творены спермой самцов дикого типа (рис. 27). Инъекция ядер-
ного сока из ооцитов или яиц дикого типа в яйца самок генотипа
о/о обеспечивает нормальное прохождение гаструляции. Если
судить по чувствительности к трипсину, то этот нормализующий
развитие фактор представляет собой белковую молекулу [Briggs,
Justus, 1968]. Однако, достигая поздних стадий эмбриогенеза
или плавающей личинки, «нормализованные» зародыши все-та-
ки прекращают развитие и погибают [Briggs, 1972].
Ill
Дласту/а
Яс/па/ю&Мжмср
tfpajtfa/naa гас-
/пруага
o/d
0сл7аяо#а#а/аяся
fl развитии гас-
агруага
Рис 27. Нормализация наследуемого по материнской линии дефекта разви-
тия ранних зародышей аксолотля путем инъекции цитоплазмы из яиц дикого
типа [Briggs, Justus, 1968]
Объяснения см. в тексте
Бразерс [Brothers, 1976] установила, что пересадка ядер из
нормальной бластулы (стадия 9) в энуклеированные яйцеклет-
ки самки аксолотля генотипа о/о обеспечивает нормальное раз-
витие. Однако если в мутантную яйцеклетку трансплантировать
ядро от нормальных зародышей более ранней стадии (стадия 8,
ранняя бластула), то развитие останавливается, как и у мутант-
ных зародышей, на стадии гаструлы. Эти данные указывают на
то, что при нормальном развитии вещество о4', которое синтези-
руется в оогенезе и является белком, влияет на ядра раннего
зародыша, после стадии 9 ядра приобретают способность к
дальнейшему развитию и в веществе о+ уже не нуждаются. Се-
112
рийные ядерные пересадки показали, что однажды приобретен-
ная способность к развитию у ядра сохранялась в мутантной ци-
топлазме в течение трех пассажей от яйцеклетки до стадии бла-
стулы. Автор считает, что синтезированный в оогенезе белок
(вещество о+) активирует на стадии бластулы определенные ло-
кусы, которые имеют важное значение для прохождения стадий
гаструлы и нейрулы.
Развитие эмбрионов cl/cl останавливается на прегаструля-
ционных стадиях. Введение цитоплазмы нормальных ооцитов в
оплодотворенные яйцеклетки, полученные от самок генотипа cl/cl,
не приводило к нормализации развития мутантных зародышей.
У ранних зародышей генотипа cl/cl, очевидно, изменен какой-то
компонент плазматической мембраны, в результате чего не про-
исходит нормального прикрепления бластомеров друг к другу
[Carroll, Van Deusen, 1973].
На разных стадиях развития в зародыши аксолотля инъеци-
ровали 3Н-лейцин и через 2—10 ч меченые белки разделяли
электрофоретически. Разделение меченых белков позволило об-
наружить синтез нового белка на стадии 64 бластомеров [Mala-
cinski, 1971]. Следовательно, образование этого белка происхо-
дит задолго до начала активации синтеза РНК, т. е. продукция
данного белка идет на иРНК, синтезированных в оогенезе.
Эти примеры показывают, что в оогенезе позвоночных функ-
ционируют гены, белковые продукты которых обеспечивают про-
хождение ранних стадий эмбриогенеза. Функция других генов,
работающих в оогенезе, выражается в синтезе долгоживущих
иРНК, на которых происходит синтез различных ферментов в
течение ранних этапов эмбрионального развития.
У бесхвостых амфибий синтез коллагена начинается на ста-
дии гаструлы и заметно возрастает в ходе эмбриогенеза [Green
Н. е. а., 1968; Klose, Flickinger, 1971]. Следует отметить, что
образование коллагена контролируется генами нескольких локу-
сов, определяющими синтез субъединиц (al, a2 и др.) и моди-
фицирующих их ферментов. В результате комбинаций разных
субъединиц возникают 5 различных типов коллагена. У заро-
дышей лягушки (Rana pipiens) активность тирозиназы наблю-
дается незадолго перед выклевом. Методом радиоиммунопреци-
питации неактивная форма этого фермента была обнаружена на
стадии ранней нейрулы. После предварительной слабой обработ-
ки трипсином гомогената тканей в нем проявляется тирозиназ-
ная активность (Benson, Triplett, 1974а]. Следовательно, неак-
тивная форма тирозиназы синтезируется и накапливается
задолго до начала ее функции. Эксперименты с введением ак-
тиномицина D в эмбрионы показали, что синтез иРНК для тиро-
зиназы начинается на стадии средней гаструлы. Это, очевидно,
связано с дерепрессией соответствующего локуса в эктодермаль-
ных клетках в результате индукционного влияния со стороны;
хордомезодермы [Benson, Triplett, 1974b].
113
На ранних стадиях эмбрионального развития лягушки в тка-
нях присутствуют 4 электрофоретически разделяемых изофер-
мента лактатдегидрогеназы, в период дифференцировки мышц
появляется пятый, а затем шестой изофермент. С началом бие-
ния сердца обнаруживаются еще 2 новых изофермента, а при
переходе головастика к свободному питанию появляется 9-й изо-
фермент лактатдегидрогеназы [Claycomb, Villee, 1971; Faulha-
ber, Lyra, 1975]. На жизнеспособных гибридах бесхвостых ам-
фибий (Rana pipiensXR. palustris) установлено, что гены, конт-
ролирующие синтез лактатдегидрогеназы, 6-фосфоглюконатде-
гидрогспазы, глутаматоксалоацетат-трансаминазы, глюкозофос-
фатизомеразы и малатдегидрогеназы, вступают в действие толь-
ко на 4—5-й день эмбриогенеза, т. е. после прохождения стадии
хвостовой почки. Активность этих ферментов в неоплодотворсн-
пых яйцеклетках и клетках эмбрионов первых дней развития
объясняется высокой стабильностью их молекул, синтезирован-
ных в оогенезе [Johnson К. Е., Chapman, 1971а; Wright, Subtel-
ny, 1971]. У эмбрионов Xenopus laevis аллели локуса, контроли-
рующего синтез глутаматоксалоацетат-трансаминазы, активиру-
ются примерно в этот же период эмбрионального развития —
между стадией хвостовой почки и началом циркуляции крови в
жабрах [Johnson К., Chapman, 1971Ь].
В эмбриогенезе птиц гены начинают дерепрессироваться
раньше, чем у амфибий и рыб. Так, синтез рРНК начинается у
курицы на средних стадиях дробления, т. е. когда развитие за-
родыша происходит еще в яйцеводе и матке [Wylie, 1972].
Действие генов
в раннем эмбриогенезе млекопитающих
В неоплодотворенной яйцеклетке млекопитающих примерно
Vs ДНК является митохондриальной. Пико и Чейз [Piko, Chase,
1973] показали, что митохондриальный геном не играет важной
роли на преимплантационных стадиях развития мыши. Яйце-
клетка млекопитающих содержит примерно в 100 раз больше
рРНК, чем любая клетка взрослого организма. В течение пе-
риода дробления (до стадии 16 клеток) количество рРНК на
клетку постоянно уменьшается, в результате чего один бласто-
мер на стадии морулы (21-клеточный зародыш) содержит такое
же количество рРНК, как и любая диплоидная клетка взросло-
го организма [Ellem, Gwatkin, 1968].
Синтез белка имеет место в неоплодотворенных яйцеклетках,
но сразу же после оплодотворения или партеногенетической ак-
тивации яйцеклетки мыши происходит резкое увеличение скоро-
сти белкового синтеза. Причем синтез белка частично идет на
долгоживущих иРНК, запасенных в оогенезе, так как новые
белки образуются даже после действия ингибиторов синтеза
РНК. Яйцеклетка содержит много ферментов, участвующих в
114
Рис. 28. Соотношение числа видов РНК, синтезированных на уникальных (У)
и повторяющихся (П) последовательностях нуклеотидов ДНК в ходе эмбрио*
налыюго развития [Church, Schultz, 1974]
/ — кролик, 2 — мышь. РНК, полученные из тканей эмбрионов разных стадий развития,
гибридизировали с высокомечсной ДНК из клеточных культур. По оси абсцисс — стадии
развития и возраст эмбрионов (7 и 14 дней); по оси ординат — гибридизация, %
синтезе белка, ДНК и РНК на ранних стадиях эмбриогенеза.
В течение преимплантационного периода развития происходят
заметные изменения активности ферментов: на стадии бластоци-.
сты по сравнению с зиготой активность одних ферментов значи-
тельно возрастает, а других уменьшается [см. Graham, 1973;
McLaren, 1976b].
В отличие от амфибий, рыб и птиц у млекопитающих актив-
ность генов начинается уже на первых стадиях дробления зиго-
ты. Обработка актиномицином D эмбрионов мыши на стадиях
дробления приводила к подавлению синтеза РНК и относитель-
но ранней остановке развития [Mintz, 1964а]. Английские иссле-
дователи Ноуленд и Грехэм {Knowland, Graham, 1972] показа-
ли, что синтез иРНК, а также других типов РНК (т, р) у мыши
начинается на стадии двух бластомеров. У кролика хромосом-
ные гены дерепрессируются также на стадии 2-клеточного заро-
дыша [Manes, 1971 ]. Доминантные летали, действие которых
проявляется на стадии 2 бластомеров, были обнаружены в опы-
тах с обработкой самок мышей химическими мутагенами [Gene-
roso, 1969].
С помощью метода РНК—ДНК-гибридизации установлено,
что в среднем 65% генома мыши и кролика представлено уни-
кальными последовательностями нуклеотидов ДНК. Уровень
гибридизации, т. е. доля активных генов для повторяющихся по-
следовательностей, изменяется незначительно в течение эмбрио-
нального развития мыши. Однако доля активных генов, транс-
крибируемых с уникальных последовательностей нуклеотидов
ДНК, изменяется весьма значительно (рис. 28). Если на ранних
115
стадиях эмбриогенеза дерепрессируется незначительное число
уникальных последовательностей нуклеотидов, то-после прохож-
дения стадии бластоцисты дерепрессия их резко возрастает и по
мере дальнейшего развития все больше и больше увеличивается
количество иРНК, синтезируемых на открывающихся уникаль-
ных последовательностях нуклеотидов ДНК [Church, Schultz,
1974].
Цитохимическим методом было показано, что активность ще-
лочной фосфатазы впервые обнаруживается в некоторых клет-
ках раннего эмбриона мыши на стадии морулы (8—16-клеточ-
ный зародыш) [Johnson L. V. е. а., 1977], а, но данным Ишиямы
и Ицкунрдо [Ishiyama, Izquierdo, 1977], в ходе эмбриогенеза
мыши, крысы и хомячка активность щелочной фосфатазы по-
является на 4-клеточной стадии. Активность кислой фосфатазы
отмечена в ооцитах, зиготе и на всех изученных стадиях дроб-
ления. Экспрессия локуса, контролирующего синтез «-галакто-
зидазы, обнаружена у 4-клеточного зародыша мыши [Adler е. а.,
1977]. Этот локус локализован в Х-хромосоме и активен во
всех исследованных тканях взрослого животного [Lusis, West,
1978].
Изучение ферментной активности лактатдегидрогеназы
(ЛДГ) позволило с достаточной определенностью оценить фено-
типическое выражение активности структурных генов ЛДГ-А и
ЛДГ-В в эмбриогенезе мыши. Дерепрессия локуса ЛДГ-А, ко-
дирующего полипептидные цепи А (М), происходит, по-видпмо-
му, у 5—6-суточных эмбрионов, а дерепрессия локуса ЛДГ-В,
кодирующего полипептидные цепи В (Н),— у 8-суточных эмб-
рионов. Показана тканевая и стадийная специфичность спект-
ров лактатдегидрогеназ в онтогенезе мыши, что указывает на
неодинаковую дифференциальную экспрессию генов локусов
ЛДГ-А и ЛДГ-В в различных органах на разных этапах разви-
тия [Brinster, 1971; Monk, Ansell, 1976; Коломбет, 1977; Колом-
бет, Гапиенко, 1977]. Ранний генетический контроль над синте-
зом ферментов глюкозофосфатизомеразы-1 [Brinster, 1973] и
гипоксантингуанинфосфорибозплтрансферазы [Epstein, 1972],
который оценивали по проявлению эффектов отцовского гена,
был обнаружен соответственно на 3-й (8-клеточный зародыш)
и 4-й дни эмбриогенеза мыши.
Высокоразрешающими методами электрофореза и контакт-
ной авторадиографии гелей было выявлено около 100 фракций
синтезируемых белков на ранних стадиях эмбриогенеза кроли-
ка. Причем новые фракции были обнаружены на стадии 8 бла-
стомеров и поздней морулы [Manes, 1975]. В ходе развития мы-
ши в период от 2-клеточного эмбриона до стадии ранней бла-
стоцисты появляется 20—25 новых белков с молекулярными ве-
сами в пределах 25 000—115 000 ^Epstein, Smith, 1974]. При по-
мощи высокоразрешающего метода двумерного электрофореза
удало-сь обнаружить различия в синтезе белков между внутрен-
116
ней клеточной массой и трофэктодермой, разделенными друг от
друга микрохирургически на стадии бластоцисты мыши [Van
Blerkom е. а., 1976].
Интересные данные о действии генов на ранних стадиях эм-
бриогенеза получены в результате интенсивных исследований
сложного локуса Т у мыши. Этот сложный локус, состоящий из
нескольких локусов, расположен в 17-й хромосоме недалеко от
сложного локуса гистосовместимости Н-2. Гены этих сложных
локусов, по-видимому, контролируют синтез белков, выполняю-
щих сходную функцию молекулярного распознавания [Vitetta
е. а., 1975]. На плазматических мембранах клеток морулы вы-
явлен антиген (антигены), известный как F9, который контроли-
руется одним из нормальных аллелей локуса Т. Количество ан-
тигена F9 на плазматических мембранах возрастает со стадии
двух клеток и достигает максимума у 8-клеточного зародыша
мыши. Этот локализованный на поверхности клеток антиген,
по-видимому, играет важную роль на ранних стадиях развития
[Artz с. а., 1973, 1974]. Продукты генов сложных локусов Т и
Н-2 имеют большое сходство по молекулярному весу, структуре
и локализации. Они связаны с p-2-микроглобулином плазмати-
ческой мембраны. Сложные локусы Т и Н-2 возникли, очевидно,
в результате дупликации первичного (анцестрального) гена, оп-
ределяющего механизм клеточного распознавания [Vitetta е. а.,
1975]. Антигены, синтез которых контролируется генами локусов
Н-3 и Н-6, обнаружены при помощи метода иммунофлуоресцен-
ции на плазматических мембранах бластомеров 6—8-клеточного
зародыша мыши. Причем наблюдается одновременная экспрес-
сия материнского и отцовского аллелей [Muggleton-Harris, John-
son, 1976].
Аллель Т обусловливает сильное укорочение хвоста у гете-
розигот (Т/ + ), а гомозиготы Т/Т погибают на 11-й день эмбрио-
нального развития в результате серьезного дефекта аллантоиса,
нарушающего формирование пупочного кровообращения. Ген Т,
очевидно, действует в клетках хордомезодермы. У эмбрионов
мышей Т/Т нарушается развитие сомитов и хорды, вследствие
чего не образуется задняя половина тела. Известно свыше
100 рецессивных t-генов сложного Т-локуса, примерно 73 из них
обусловливает гибель гомозигот (tx/tx) на различных стадиях
эмбриогенеза [Bennett, 1975; McLaren, 1976b]. Эриксон и соав-
торы [Erickson е. а., 1978] считают, что t-комплекс у мыши, оче-
видно, представляет собой пример «супергена» — большого сег-
мента хромосомы 17, включающего много генов, которые конт-
ролируют сходные или тесно связанные функции.
Мутантный ген t12 в гомозиготном состоянии вызывает деге-
нерацию клеток на стадии морулы, в результате чего эмбрионы
t12/t12 погибают, как правило, на стадии поздней морулы, т. е. на
-4-й день после оплодотворения [Mintz, 1964а, b; Calarco, Brown,
1968].
117
Электронно-микроскопическое исследование показало, что
эмбрионы мышей t12/t12 и tw32/tw32 отличаются от нормы уже на
2-клеточной стадии наличием в ядрах и цитоплазме липидных
включений. Некоторые эмбрионы t12/t12 погибают уже на 8-кле-
точной стадии [Hillman е. а., 1970]. Эмбрионы tw32/tw32 также
начинают погибать на 8-клеточной стадии. Однако развитие
большинства зародышей этого генотипа останавливается на ста-
дии ранней морулы, т. е. несколько раньше по сравнению с эм-
брионами t12/t12 [Hillman, Hillman, 1975]. В митохондриях эм-
брионов tw32/tw32 обнаружены кристаллоидные включения. Эм-
брионы t6/t6 погибают на стадии яйцевого цилиндра, но первые
ультраструктурные отличия от нормы наблюдаются на стадии
поздней бластоцисты, когда у мутантов в цитоплазме клеток
появляются крупные липидные включения. Позднее, на стадии
яйцевого цилиндра, еще не погибшие мутантные зародыши ха-
рактеризуются нормальным строением энтодермальных клеток,
в цитоплазме которых присутствуют липидные, а в митохондри-
ях — кристаллоидные включения [Nadijcka, Hillman, 1975].
Другие рецессивные аллели локуса Т у мыши также имеют
довольно ранние эффекты, хотя вступают в действие несколько
позднее. У эмбрионов t°/t° подавлено образование хордомезодер-
мы и смерть наступает на стадии гаструлы (6 дней после опло-
дотворения). Зародыши мышей генотипов tw5/tw\ tw9/tw9 и
twl/twl погибают соответственно на 7, 8 и 9-й дни развития. Куль-
тивирование мутантных и нормальных эмбрионов мышей in vitro
показало, что зародыши t12/t12 и tw5/twft лстальны на сходных ста-
диях развития как in vitro, так и in vivo [Wudl, Sherman, 1976].
Эти данные указывают на то, что гены t12 и tw5 являются ранни-
ми клеточными леталями. На рис. 29 схематически показано на-
рушение стадий раннего развития мыши в результате действия
мутантных генов сложного Т-локуса в гомозиготном состоянии.
Ген yellow (Ау) в гомозиготном состоянии обусловливает де-
генерацию клеток ранней бластоцисты, эмбрионы мышей поги-
бают до имплантации [Robertson, 1942; Pedersen, 1974]. Элект-
ронно-микроскопическое изучение показало, что эмбрионы Ау/Ау
отличаются от нормы на 4-клеточной стадии [Calarco, Pedersen,
1976]. Отцовский и материнский аллели Ау начинают действо-
вать, очевидно, на стадии 2-клеточного зародыша, что обуслов-
ливает запаздывание вступления во 2-е деление дробления не-
которых мутантных бластомеров {Pedersen, Spindle, 1976].
У зародышей мышей, гомозиготных по гену oligosyndactylism
(Os), наблюдаются дегенеративные изменения клеток на 64-кле-
точной стадии (4 дня после оплодотворения), что приводит к ги-
бели эмбрионов этого генотипа начиная с 5-го дня развития
[Van Valen, 1966]. Ген Os, очевидно, нарушает митотический ап-
парат, в результате чего клеточные деления блокируются на ста-
дии метафазы. В культуре происходит быстрый процесс дегене-
рации внутренней клеточной массы и уменьшение числа клеток
118
Морула
бластоциста
Имплантации,,
Развитие рост в нут- ///
трофобласта/^В^&ренней кле- '//у
лнтодермы точной массылк
Ранний яйцевой Лицевой
цилиндр цилиндр
Образование
вне j apo dtm O°o^
; шевой эн- nn~‘
> то дермы &
Лр
И 0\>
1 tfZ
суру
! to
^щипток^6 “образование CcP°P6fupodaннб/й
Образована
первичной
полоски
5
Поздний
лицевой
лицевого
цилиндра.
хорды, нервнойзародбми
трубки, со-
матов
Рис. 29. Нарушение ранних стадий эмбриогенеза мыши в результате дей-
ствия мутантных генов сложного Т-локуса [Bennett, 1975]
Пунктирные стрелки показывают эффекты мутантных генов
трофобласта. Ген Os вступает в действие не позднее 3,5 дней
после оплодотворения [McLaren, 1976b].
Гомозиготы по гену shadow (SH) у норки погибают перед
имплантацией [Nes, 1964].
Ген fused (Fu), который локализован на той же хромосоме
мыши, что и локус Т, первично поражает, очевидно, хордомезо-
дерму. У эмбрионов Fu/Fu наблюдаются дупликации структур
центральной нервной системы [Theiler, Gluecksohn-Waelsch,
1956]. Другой мутантный аллель этого локуса kinky (Fuki) вы-
зывает у гомозигот более серьезные аномалии развития по срав-
нению с геном Fu. У эмбрионов Fuki/Fuki отмечена гиперплазия
нейральной эктодермы, дупликации нервной трубки, хорды, пер-
вичной кишки и других структур, в результате чего гомозиготы
погибают на 8—10-й день эмбрионального развития [Gluecksohn-
Schoenheimer, 1949].
Мутантный ген blind (Bld) также нарушает развитие энто*
мезодермы. У эмбрионов мышей Bld/Bld первичная полоска не
образуется, размеры эктодермальных клеток сильно увеличены
и на стадии яйцевого цилиндра мутантные зародыши примерно
в 5 раз меньше по сравнению с нормой [Vankin, 1956]. Другой
119
мутантный аллель этого локуса dysoptic имеет сходные эффек-
ты: рост и дифференцировка тканей у зародышей, гомозиготных
по этому гену, прекращаются через 6—7 дней после оплодотво-
рения, причем не происходит формирования мезодермальных
структур. Гомозиготы погибают примерно на 9-й день эмбриоге-
неза [Watson W L., 1966].
Полудоминантный ген Dickie’s small eye (Dey) в отличие or
выше указанных генов вызывает нарушения развития зароды-
шевой эктодермы, вследствие чего гомозиготы погибают на 7-й
день эмбриогенеза. У гетерозигот также отмечены дефекты про-
изводных эктодермы, некоторые из них погибают на различных:
стадиях эмбрионального развития, а другие достигают взросло-
го состояния, имея серьезные аномалии глаз [Theiler е. а., 1978].
У человека некоторые мутантные гены также проявляют
свои эффекты на ранних стадиях развития. Так, Хертиг и со-
авторы [Hertig е. а., 1954] сообщили, что из 8 исследованных
ими ранних эмбрионов человека (до стадии имплантации) 4 име-
ли значительные дефекты и, несомненно, вскоре погибли бы,
если бы продолжали свое развитие в матке. В первые 3 мес бе-
ременности спонтанно абортируется 15—20% зародышей, одна-
ко большое число беременностей прерывается на столь ранних
стадиях, что это остается незамеченными или рассматривается
как незначительная задержка менструации. Рождением ребен-
ка завершается лишь 73 всех зачатий. Примерно 50% спонтан-
ных абортов обусловлено хромосомными аномалиями, приводя-
щими к гибели зародыши человека на ранних стадиях эмбрио-
генеза [Battin, 1977; Ford, 1977]. Это подчеркивает большое
значение наследственных факторов для прохождения ранних
этапов развития.
Таким образом, некоторые гены включаются в действие на
ранних стадиях эмбриогенеза и по мере развития зародыша все
больше и больше локусов начинает функционировать. На самых
ранних стадиях развития дерепрессируются гены, характеризую-
щиеся многократными повторами, в частности гены для тРНК,.
рРНК и гистонов, а также гены, контролирующие процессы об-
щего метаболизма и размножения клеток. На последующих эта-
пах развития активируются локусы, характеризующиеся уни-
кальными последовательностями нуклеотидов и детерминирую-
щие специализацию клеток формирующегося зародыша и морфо-
генез.
Глава 4
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ
КЛЕТОЧНОЙ ПРОЛИФЕРАЦИИ
*
Размножение, или пролиферация, клеток, так же как и дру-
гие основные процессы развития высших организмов — диффе-
ренцировка, гибель клеток и морфогенез,— находится под стро-г
гим генетическим контролем. Это обусловливает накопление не-
обходимого числа клеток на конкретной стадии формирования
того или иного органа. Хейнигер с соавторами [Heiniger е. а.,
1972] исследовали скорость включения радиоактивной метки в
ДНК и выведение ее из организма на мышах 19 инбредных ли-
ний. Была выявлена связь по крайней мере с 10 известными ло-
кусами, что указывает на полигенный контроль клеточной про-
лиферации. Принимая во внимание число разных иРНК в раз-
множающихся и неразмножающихся мышиных фибробластах,
Уильямс и Пенман [Williams, Penman, 1975] полагают, что ге-
ны, контролирующие клеточную пролиферацию, составляют
около 3% генома. Нарушение скорости пролиферации отдельных
клеточных систем является причиной врожденных уродств, гипо-
п гиперплазий, а также раковых заболеваний. Поэтому выясне-
ние механизмов регуляции клеточного деления представляет
интерес не только для понимания нормального развития, но так-
же и патогенеза многих аномалий человека, и прежде всего зло-
качественных новообразований.
Влияние генов
на скорость размножения клеток
В течение онтогенеза число делящихся клеток в формирую-
щихся тканях и органах неуклонно уменьшается. Исходя из об-
щего количества ДНК в эмбрионе и содержания ДНК на одну
клетку было подсчитано, что 12-дневный зародыш крысы состо-
ит примерно из 50 млн. клеток. Для этого требуется с момента
дробления зиготы 25 последовательных делений всех клеток, т. е.
число клеток развивающегося зародыша должно удваиваться
дважды за сутки. Ткани новорожденного крысенка содержат
примерно 3 млрд, клеток, для чего необходимо только 6 клеточ-
121
ыых делений за оставшийся 10-диевный период эмбрионального
развития. Число клеток у 3-месячного половозрелого животного
равняется приблизительно 67 млрд, и существенно не изменя-
ется до конца жизни [Enesco, Leblond, 1962].
Скорость размножения клеток на ранних стадиях эмбриоге-
неза может определять породные или линейные особенности жи-
вотных. Так, было показано, что различия в размерах кроликов
двух пород зависели от неодинаковой скорости деления или, как
еще говорят, дробления зигот: у кроликов крупной породы зиго-
ты дробились более быстро по сравнению с мелкой породой, а
зиготы гибридов имели промежуточную скорость дробления
[Gastie, Gregory, 1929; Gregory, Castle, 1931]. Уиттен и Дэгг
[Whitten, Dagg, 1962] обнаружили различия в скорости дробле-
ния зигот у мышей инбредных линий BALB и 129. У мышей ли-
нии BALB продолжительность первых двух делений дробления
была несколько больше по сравнению с мышами линии 129, в
результате чего эмбрионы мышей линии BALB были слабее раз-
виты к 10-му дню эмбриогенеза по сравнению с эмбрионами
мышей линии 129. Мак-Ларен и Боуман [McLaren, Bowman,
1973] установили, что различия в числе клеток у ранних эмбрио-
нов мышей линии C57BL и СЗН не обусловлены разной скоро-
стью дробления зигот. У самок мышей линии C57BL происходит
более ранняя активация яйцеклетки к дроблению и образованию
пронуклеусов, вследствие чего ранние зародыши мышей этой ли-
нии имеют больше клеток по сравнению с эмбрионами линии
СЗН. При этом ранняя активация зиготы к дроблению у «мышей
линии C57BL не зависит от генотипа самца, а определяется ис-
ключительно яйцеклеткой.
Анализ эффектов мутантных генов свидетельствует о генети-
ческом контроле скорости клеточной пролиферации. Действие
мутантных генов проявляется не во всех, а лишь в одной или
нескольких клеточных системах, и каждый из генов становится
активным на определенной стадии онтогенеза. Так, например,
ген splotch (Sp) увеличивает скорость размножения клеток
нервной трубки [Auerbach, 1954; Конюхов, Миронова, 1974], ген
syndactylism (sm) — клеток апикального эктодермального греб-
ня почки конечности зародыша [Griineberg, 1960], а ген ectopic
(ес) — клеток хрусталикового эпителия на ранних этапах пост-
натальной жизни мыши [Beasley, 1963]. Данн [Dunn, 1972] ис-
следовал эффекты делеции, захватывающей, очевидно, локус se
и какой-то другой прилегающий к нему ген у мыши. Эффекты
этой делеции, обозначенной символом se1, наблюдаются у гомо-
зиготных эмбрионов в возрасте 7 дней 16 ч, а примерно через
8 ч зародыши погибают. Эффекты делеции se1 проявлялись
прежде всего в чрезмерном росте внезародышевой эктодермы,
а мезодерма почти полностью отсутствовала. Автор считает, что
отсутствующий генетический материал, по-видимому, контроли-
рует пролиферацию клеток внезародышевой эктодермы, а по-
122
Таблица 6. Мутантные гены, обусловливающие уменьшение пролиферативной активности различных клеточных систем у мыши
Мутантный ген Псраженная кле- точная система или ткань Время действия гена Конечные эффекты гена Автор, год
fidget (fi) Центральная нервная система и сетчатка С 9-х суток эмбриогенеза Микрофтальмия и ненор- мальное поведение Konyukhov, Vakhrusheva, 1969; Konyukhov, Sazhina, 1971; Конюхов, Сажина, 1972
ocular retardation (or) Сетчатка С 10-х суток эмбриогенеза Микрофтальмия Конюхов и др., 1963; Konyukhov, Sazhina, 1971
leaner tgla £2 short-ear (se) Центральная нервная система Хондробласты и скелето- генная мезенхима С 5-6-го дня после рожде- ния С 13-х суток эмбриогенеза Отставание роста и ат- рофия некоторых органов Замедленное восстанов- ление костей после пере- лома и дефекты скелета Yoon, 1969 Green E. L., Green M. C., 1942; Green M., 1958, 1968
flexed-tail (f) Гемопоэтические клетки С 13-х суток эмбриогенеза до 7 дней после рожде- ния Транзиторная анемия Griineberg, 1942; Thompson L. M., e. a. 1966; Fowler e. a., 1967; Bateman A. L., Cole, 1972
dominant spotting (W) Первичные половые и стволовые гемопоэтичес- кие клетки С 12-х суток эмбриогенеза Бесплодие и макроцитар- ная анемия Russell, Fondal, 1951; Mintz, Russell, 1957; McCulloch e. a., 1964, 1965; Mayer, Green, 1968
diabetes (db р-Клетки поджелудочной железы После рожде- ния Сахарный диабет Like, Chick, 1969; Chick, Like, 1970
давление образования мезодермы возникает вторично в резуль-
тате гиперплазии внезародышевой эктодермы. Многие мутант-
ные гены подавляют скорость клеточной пролиферации в онто-
генезе мыши (табл. 6).
Аутосомный рецессивный ген white (d) подавляет скорость
пролиферации клеток нервного гребня (ганглиозной пластинки;
у эмбрионов аксолотля. Митотический индекс подсчитывали для
клеток нервного гребня на серийных срезах эмбрионов белой
(d/d) и черной (d/+ или + / + ) линий животных. Митотический,
индекс в нервном гребне зародышей черных аксолотлей был
выше, чем у белых. Эти различия обусловливают, в частности,,
меньшее число клеток в спинальных ганглиях у белых аксолот-
лей [Borack, 1972]. Ген d, очевидно, уменьшает также скорость
размножения пигментных клеток, в результате чего аксолотли
генотипа d/d имеют значительно меньше меланофор, чем нор-
мальные особи. Другой несцепленный с этим локусом аутосом-
ный рецессивный ген melanoid (m), наоборот, увеличивает ско-
рость пролиферации пигментных клеток у гомозигот [Hoerter,
1977}. Гены microphthalmia (mi) и white (Miwh) у мыши, по-ви-
димому, подавляют митотическую активность клеток нервного1
гребня, вследствие чего происходит уменьшение числа клеток в
его дериватах [Конюхов, Осипов, Вахрушева, 1965].
Если изменения пролиферативной активности, обусловленные
мутантным геном, сохраняются при культивировании поражен-
ной клеточной системы или ткани, то это указывает на авто-
номное проявление данного признака и его прямой генетический
контроль. Так, культивирование зачатков глаз мышей in vitro и
в передней камере глаза мышей показало, что ген ог действует
в клетках зачатка сетчатки, подавляя ее рост. Митотический ин-
декс (МИ) культивируемой in vitro сетчатки эмбрионов мышей
ог/ог был примерно втрое ниже, чем в норме [Конюхов, Строева
и др., 1963; Конюхов, Уголькова, 1978]. Митотический индекс
зачатка сетчатки 10-суточных эмбрионов мышей fi/fi через 48 ч
культивирования был достоверно меньше, чем МИ зачатка сет-
чатки + /+. После 72 и 96 ч культивирования эти отличия ста-
новились еще более выраженными. Митотические индексы за-
чатков сетчатки + / + ог/ог и fi/fi ог/ог были достоверно меньше
по сравнению с МИ зачатков сетчатки +/+ +/+ через 24 ч, а
после 48, 72 и 96 ч культивирования наблюдалось дальнейшее
уменьшение МИ сетчатки этих мутантных эмбрионов. После 72
и 96 ч культивирования МИ сетчатки fi/fi ог/ог был примерно
вдвое меньше, чем МИ сетчатки fi/fi +/+ и +/+ ог/ог и ниже
в 4 раза по сравнению с МИ сетчатки +/+ + /+. МИ сетчатки
11-суточных эмбрионов fi/fi +/+ через 48 ч культивирования
был достоверно меньше, чем МИ сетчатки +/+ + / + . МИ сет-
чатки + /+ ог/ог был втрое меньше по сравнению с МИ сетчат-
ки + /+ +/ + , а МИ сетчатки fi/fi ог/ог — примерно вдвое ниже,
чем МИ сетчатки + / + ог/ог. По скорости клеточной пролифера-
124
ции в сетчатке культивируемых зачатков глаз 11-суточных эм-
брионов генотипы мышей можно распределить следующим обра-
зом: + / + +/4-=fi/+ ог/+ >fi/fi + /-{->+/ + or/or>fi/fi ог/ог
[Конюхов, Уголькова, 1978].
Стоун и соавторы [Stone е. а., 1964] сообщили, что у не-
идентичных близнецов крупного рогатого скота, характеризую-
щихся эритроцитарным мозаицизмом, через определенное время
одна из популяций эритроидных клеток начинала преобладать
над другой, причем это не зависело от генотипа хозяина (реци-
пиента).
У мышей, гомозиготных по гену W, развивается макроцитар-
ная гипопластическая анемия. Химерные животные, полученные
в результате агрегации бластомеров мутантных (W/W) и нор-
мальных ( + /+) мышей, имели нормальную популяцию эрит-
роидных клеток. У мышей, гомозиготных по гену mk, возникает
микроцитарная анемия. Химерные мыши mk/mk*-> + /+ имели
практически все эритроциты нормального (+/ + ) генотипа
[Mintz, 1974]. У химерных мышей, полученных в результате аг-
регации бластомеров от мышей двух линий AKR и СВА, лимфо-
циты линии AKR всегда преобладали в количественном отноше-
нии над такими же клетками линии СВА [Tuffrey е. а., 1973].
У химер клетки мышей линии AKR присутствовали всегда в
большем числе почти во всех тканях за исключением мелано-
цитов и половых клеток [Barnes е. а., 1974; Ford е. а., 1974].
В этих случаях преобладание у химер одной клеточной популя-
ции над другой определяется генетически неодинаковой скоро-
стью размножения стволовых клеток.
Контролирование одним геном скорости пролиферации не-
скольких клеточных систем может быть обусловлено его актив-
ностью в разных типах клеток или чаще межклеточными взаи-
модействиями. Так, ген steel (S1) неактивен в гемопоэтических
клетках эмбрионов мыши, но уменьшение пролиферации этих
клеток происходит в результате их взаимодействия с генетиче-
ски пораженными клеточными системами [McCulloch е. а., 1965;
Mayer, Green, 1968]. У эмбрионов мышей, гомозиготных по ге-
нам microphthalmia (mi) или white (Miwh), наблюдается увели-
чение скорости размножения клеток наружного листка глазной'
чаши [МйПег, 1951 —1952; Конюхов, Сажина, 1963; Конюхов,
Осипов, 1968]. Как указывалось выше, эти мутантные гены на-
рушают развитие нервного гребня, вследствие чего пораженная
эктомезенхима не ингибирует, как в норме, пролиферацию кле-
ток наружного листка глазной чаши [Конюхов и др., 1965; Ко-
нюхов, Осипов, 1968]. Подавляющее клеточную пролиферацию
действие генов ог и fi у эмбрионов мыши ослабляется, если клет-
ки пораженного зачатка сетчатки оказываются в контакте с не-
нормально утолщенным наружным листком глазной чаши, ги-
перплазия которого обусловлена геном mi [Konyukhov, Sazhina.,
1966; Конюхов, Вахрушева, Осипов, 1971].
125
Некоторые мутантные гены нарушают функционирование эн-
докринных органов, вследствие чего происходит изменение ско-
рости пролиферации тех или иных клеточных систем. Так, ген
'iwarf у мыши первично поражает клетки, секретирующие гор-
мон роста. В результате отсутствия последнего сначала умень-
шается, а в дальнейшем полностью прекращается размножение
клеток внутренних органов [Winick, Grant, 1968]. Боуман и Мак-
Ларен [Bowman, McLaren, 1970] не нашли различий в числе
клеток у 3,5-дневных эмбрионов двух линий мышей, сильно от-
личающихся друг от друга по размерам тела. Взрослые особи
одной из этих линий были в 4 раза больше мышей другой ли-
нии. Различия в размерах тела этих линий животных, очевидно,
обусловлены неодинаковой активностью гормонов, которые конт-
ролируют скорость размножения клеток на более поздних эта-
пах онтогенеза.
Клеточный цикл
Клеточный, или митотический, цикл включает интерфазу и
митоз. Продолжительность клеточного цикла составляет гене-
рационное время (Т). В интерфазе происходят процессы макро-
молекулярного синтеза, обеспечивающие прохождение митоза
(М-периода).
Интерфаза состоит из пресинтетического (GJ, синтетическо-
го (S) и постсинтетического (G2) периодов, или фаз, клеточного
цикла. При обозначении фаз клеточного цикла функции перио-
дов митоза и синтеза ДНК были более или менее понятны, но
значение пре- и постсинтетических периодов не было ясно. Они
составляли как бы бреши или прорывы (по-английски gaps) в
понимании процессов клеточного цикла. Поэтому эти периоды
и назвали gap 1 (GJ и gap 2 (G2). Считают, что в Gj-периоде
имеют место процессы, приводящие к инициации синтеза ДНК,
но какие молекулярные события происходят в этот период кле-
точного цикла, во многом остается и сейчас неясным. В G2-ne-
риоде должны иметь место процессы, приводящие к делению яд-
ра и цитокинезу. По мере развития зародыша все большее чис-
ло клеток прекращает деление и начинает выполнять ту или
иную специализированную функцию. Клетки приступают к диф-
ференцировке после митоза, т. е. как бы остаются в Grne-
риоде. Выделяют стадию неделящихся, или покоящихся, клеток
(Go) когда клетки как бы «решают», вступить им опять в ми-
тотический цикл или встать на путь дифференцировки [Lajtha,
1963; Епифанова, Терских, 1968].
Многие факторы подавляют скорость размножения клеток,
временно блокируя прохождение митотического цикла на ран-
ней стадии Gi-периода или в О2-период. К таким факторам, в
частности, относятся способные к диффузии ткансспецифичсские
ингибиторы клеточной пролиферации — так называемые кейло-
126
ны (chalones). В этих случаях периоды «отдыха» клеток обозна-
чают Ri ( = G0) или R2 [cm. Prescott, 1976]. Блок митотического
цикла в О2-периоде приводит к возникновению тетраплоидных
клеток (количество ДНК 4с), увеличению их размеров и, сле-
довательно, гипертрофии (рис. 30).
Рис. 30. Схема клеточного цик-
ла
Пунктирные стрелки показывают
на альтернативный путь развития
клетки. Объяснения см. в тексте
Синтез ДНК начинается почти сразу после оплодотворения.
У амфибий в ходе дробления зиготы размножение клеток идет
очень быстро, на этих стадиях Gi-период у них отсутствует, а
G2 очень короткий. Обработка актиномицином D дробящихся
яиц амфибий не останавливает развития, и зародыш достигает
стадии бластулы, после чего развитие прекращается. Остановка
развития на этой стадии обусловлена подавлением активации
ядерных генов, которая у амфибий происходит на стадии бла-
стулы.
Дробление зиготы у мыши, как и у других млекопитающих,
проходит значительно медленнее по сравнению с низшими поз-
воночными. В период дробления генерационное время составля-
ет 11 ч, причем S-период длится 6 ч [Luthardt, Donahue, 1975].
До стадии ранней бластоцисты у эмбрионов мыши Gi-период
отсутствует. Появление на стадии бластоцисты в клеточном цик-
ле Gi-периода совпадает с проявлением признаков поздней реп-
ликации ДНК у одной из Х-хромосом. Возможно, в это время
синтезируются белки, необходимые для дальнейшей клеточной
дифференцировки, а также репрессор, инактивирующий одну из
Х-хромосом [Mukherjee, 1976].
После имплантации зародыша в матку скорость клеточного
деления резко возрастает, причем больше в эктодерме, чем в
энтодерме. Генерационное время в эктодермальных тканях 7,5-
дневного зародыша мыши равняется 5—6 ч [Snow, 1976].
На ранних стадиях эмбриогенеза все клетки зародыша де-
лятся, затем происходит уменьшение числа пролиферирующих
клеток и увеличение клеточного цикла в основном за счет Gi-
периода. Прсскот [Prescott, 1970] отмечает, что поскольку умень-
шение скорости клеточного размножения происходит главным
127
образом за счет удлинения Огпериода, то и механизмы, регу-
лирующие клеточное размножение, следует искать именно в
этом периоде клеточного цикла. Регуляция клеточного размно-
жения, по его мнению, эквивалентна регуляции перехода клеток
из Gt- в S-период. Чем же обусловлено удлинение Gj-периода
многих клеточных систем в ходе развития? На данный вопрос
сейчас нет однозначного ответа. Несомненно, здесь имеется пря-
мая связь с дифференцировкой клеток, в основе которой лежат
определенные процессы макромолекулярного синтеза. Различия
в генерационном времени разных клеточных систем обусловлены
также в основном неодинаковой продолжительностью Gi-перио-
да [см. Заварзин, 1967; Mitchison, 1971].
Данные о молекулярных процессах, характерных для раз-
личных периодов клеточного цикла, рассмотрены в ряде обзоров
[Mitchison, 1971; Thrasher, 1971; Епифанова, 1973; Ломакина,
1973; Baserga, 1976; Prescott, 1976]. Большой вклад в изучение
процессов макромолекулярного синтеза в ходе клеточного цикла
внесли работы, выполненные на синхронно делящихся клеточ-
ных культурах млекопитающих.
Было показано, что в пресинтетический период наблюдается
наибольший синтез РНК и белков, причем белковый синтез про-
грессивно нарастает и в конце данного периода увеличивается
в 2—3 раза по сравнению с начальным уровнем. В конце Grne-
риода начинается синтез иРНК для гистонов и продуцируется
фактор, индуцирующий синтез ДНК. В S-периоде синтезируют-
ся ДНК и гистоны, в О2-периоде — белки, необходимые для кон-
денсации хромосом и образования митотического аппарата, а в
М-периоде — негистоновые белки хроматина. Многие ферменты
синтезируются на определенной стадии клеточного цикла, пик
активности того или иного фермента приходится на Gr, S- или
О2-период. Ферменты, участвующие в синтезе ДНК, обнаружи-
ваются в конце Gi-периода, их высокая активность сохраняется
в течение S-периода. Негистоновые хромосомные белки синте-
зируются в течение всего клеточного цикла. В Gr и S-периоды
активны многие гены, а в G2- и М-периодах продолжается в ос-
новном процесс трансляции, а транскрипция имеет ограничен-
ный характер, т. е. действует меньше генов.
Методом авторадиографии на синхронизированных культу-
рах клеток млекопитающих было установлено, что синтез РНК
прекращается в поздней профазе митоза и возобновляется в
ранней телофазе. С помощью электронно-микроскопического
метода, позволяющего проводить прямой анализ матричной ак-
тивности ДНК в клетке, также было показано, что гены не ак-
тивны в метафазе, анафазе и ранней телофазе, хотя в профазе
и поздней телофазе некоторые гены активны [Nakatsu е. а., 1974].
Следовательно, полная неактивность генома имеет место только
в середине митоза.
128
В Gi-период синтезируются продукты, характерные для той
или иной клеточной системы. Так, в Gr период и ранний S-пе-
риод происходит синтез гемоглобина в эритроидных клетках
костного мозга [Yataganas е. а., 19701 и иммуноглобулинов в
лимфоидных клетках [Buell е. а., 1971]. Синтез тирозинамино-
трансферазы можно индуцировать кортикостероидами в куль-
тивируемых in vitro клетках гепатомы крысы только в последние
2/з Gi-периода и в S-период. В другие периоды клеточного цикла
не удается индуцировать синтез данного фермента [Martin е. а.,
1969]. Прескот [Prescott, 1976] считает, что в начале Gi-периода
имеется «точка» контроля (checkpoint) клеточного цикла. Если
имеются какие-либо нарушения, то происходит блокирование
митотического цикла на этой стадии цикла. Стадия покоя (Go)
отличается по характеру метаболических процессов от Gt-ne-
риода. Переход клеток из Go-периода в Gi-период сопровожда-
ется увеличением синтеза рРНК, а количество рибосом увели-
чивается более чем на 73 [Becker е. а., 1971]. При переходе лим-
фоцитов из Go-периода в Gi-период отмечено 5-кратное увели-
чение скорости синтеза иммуноглобулинов, затем в S- и G2-ne-
риоды происходит уменьшение синтеза этих белков [Lerner,
Hodge, 1971].
В ходе онтогенеза позвоночных, в частности млекопитающих,
наблюдается увеличение длительности клеточного цикла за счет
Gr и S-периодов. Продолжительность G2- и М-периодов для
большинства клеточных систем почти не меняется [см. Завар-
зин, 1967].
Генетический контроль клеточного цикла
У дрожжей известно 32 неаллельных ядерных гена, которые
контролируют синтез определенных белков, необходимых для
прохождения различных этапов клеточного цикла; 14 из этих
генов локализовано на генетической карте [Hartwell е. а., 1973].
Авторы считают, что число локусов, контролирующих прохож-
дение клеточного цикла, должно быть значительно больше.
У высших эукариотов генетический контроль клеточного цик-
ла изучен значительно хуже. Описаны мутантные гены, нару-
шающие прохождение клеточного цикла, причем гены влияют
прежде всего на длительность Gt- и S-периодов. Хоук и Ченг
[Houck, Cheng, 1974] сообщили, что генерационное время куль-
тивируемых in vitro кожных фибробластов больных с наслед-
ственным кистозным фиброзом значительно больше по сравне-
нию с фибробластами здоровых людей или пациентов, страдаю-
щих от других заболеваний. Причем продолжительность S- и
О2-периодов такая же, как в норме, а Gi-период увеличен вдвое:
45 ч при кистозном фиброзе против 22 ч — в норме. Однако в
другом исследовании не отмечено какого-либо изменения про-
должительности клеточного цикла культивируемых in vitro фиб-
5 Б. В. Конюхов
129
Таблица 7. Продолжительность клеточного цикла и его периодов (в часах)
в зачатке сетчатки 10-суточных эмбрионов мышей разных генотипов
[Konyukhov, Sazhina, 1971]
Ге.ютнп G2 S Gr!-M т
fi/fi 1 6,5 4,5 12
ог/ог 1,3 5,7 8 15
+/+ 1 6,5 2,5 10
робластов от больных кистозным фиброзом по сравнению с нор-
мой [Danes, 1976].
Продолжительность клеточного цикла культивируемых in
vitro лимфоцитов больных анемией Фанкони, обусловленной
аутосомным рецессивным геном, увеличена почти вдвое по
сравнению с нормой [Dutrillaux, Fosse, 1976].
Методом авторадиографии нами было установлено, что му-
тантные гены ог и fi удлиняют Gj-период клеточного цикла в
зачатке сетчатки эмбрионов мыши, в результате чего происхо-
дит уменьшение митотической активности и в конечном итоге
возникает микрофтальмия. У 10-суточных эмбрионов ог/ог ге-
нерационное время клеток зачатка сетчатки увеличено в 1,5 ра-
за, а у эмбрионов fi/fi — в 1,2 раза по сравнению с нормой
( + /+). Продолжительность Огпериода у эмбрионов ог/ог ока-
залась втрое, а у эмбрионов fi/fi — вдвое больше, чем у нор-
мальных зародышей. Другие периоды клеточного цикла в зачат-
ке сетчатки у эмбрионов ог/ог и fi/fi не отличаются от нормы
(табл. 7, рис. 31).
Опыты с многократным введением 3Н-тимидина показали, что
все клетки зачатка сетчатки 10-дневных эмбрионов ог/ог и fi/fi
так же, как и эмбрионов нормального генотипа (+/+) этого
возраста, участвуют в делении. Ген ог не действует в клетках
головного мозга. Определение митотических индексов в дорсаль-
ной области конечного мозга и вентральной части промежуточ-
ного мозга не показало достоверных различий между 10-днев-
ными эмбрионами генотипов ог/ог и +/+ [Konyukhov, Sazhina,
1971]. Мутантный ген fi наряду с увеличением Gf-периода в
зачатке сетчатки удлиняет этот период клеточного цикла также
в развивающемся головном мозге, что является причиной его
аномалий [Конюхов, Сажина, 1972]. Генерационное время кле-
ток исследованных отделов головного мозга (вентральной части
промежуточного, вентральной и дорсальной частей продолго-
ватого) у 10-суточных эмбрионов мышей fi/fi равняется И ч, а
у эмбрионов нормального генотипа — 9 ч. У мутантных зароды-
шей Gf-период увеличен вдвое по сравнению с нормой. Продол-
жительность других фаз клеточного цикла у мутантов не отли-
чается от нормы (табл. 8, рис. 32).
130
Рис. 31. Соотношение периодов клеточного цикла в зачатке сетчатки 10-су-
точных эмбрионов мышей генотипов fi/fi, ог/ог и +/+ [Konyukhov, Sazhina,
1971]
Рис. 32. Соотношение периодов клеточного цикла в головном мозге 10-суточ-
ных эмбрионов мышей генотипов fi/fi, Sp/Sp и +/+ [Конюхов, Сажина, 1972;
Конюхов, Миронова, 1974]
У мышей fi/fi возникают аномалии органов эктодермального
и мезодермального происхождения [Truslove, 1956]. Скорость
клеточной пролиферации в слуховых пузырьках эмбрионов fi/fi
и +/+ одинакова: все клетки принимают участие в делении,
генерационное время и отдельные фазы клеточного цикла у му-
тантов такие же, как в норме. Это свидетельствует о том, что
ген fi не активен в клетках слухового пузырька, а дефекты его
развития обусловлены недостаточностью индукционных влияний
со стороны пораженного продолговатого мозга [Конюхов, Са-
жина, 1972].
Следует отметить, что у эмбрионов fi/fi пораженный глазной
пузырь оказывает недостаточное индукционное влияние на хру-
сталиковую эктодерму, в результате чего возникают нарушения
развития хрусталика [Konyukhov, Vakhrusheva, 1969]. Дефекты
Таблица 8. Продолжительность клеточного цикла и его периодов (в часах)
в головном и спинном мозге 10-суточных эмбрионов мышей разных генотипов
[Конюхов, Сажина, 1972; Конюхов, Миронова, 1974]
Генотип G2 s Gi+M T
fi/fi 1 6 4 11
Sp/Sp 1 4,5 2,5 8
+/-!- 1 6 2 9
131
5*
хрусталика у мутантов не связаны с какими-либо изменениями
параметров его клеточного цикла [Сажина, Мастернак, 1972].
Анализ митотической активности хрусталикового эпителия куль-
тивируемых зачатков глаз 10-суточных эмбрионов мышей fi/fi
и +/+ не показал достоверных различий митотических индек-
сов хрусталикового эпителия между мутантным и нормальным
генотипами [Конюхов, Уголькова, 1978]. Эти данные указывают
на то, что ген fi не действует в клетках формирующегося хруста-
лика, а его аномалии у гомозигот возникают вторично в резуль-
тате поражения сетчатки. Следовательно, аномалии развития
хрусталика и внутреннего уха у мышей fi/fi первично не обу-
словлены нарушением их клеточной пролиферации, а являются
результатом ненормального морфогенеза этих органов вследст-
вие поражения тканей-индукторов.
Из клеточных культур выделены температурочувствительные
(ts) клоны клеток, у которых при непермиссивной (запрещаю-
щей) температуре 38—40° С наблюдается Gj—S-блок. В таких
темпсратурочувствительных .клонах клеток мутантные гены,
очевидно, действуют в Gf-периоде, нарушая определенные про-
цессы макромолекулярного синтеза, в результате чего не проис-
ходит инициации синтеза ДНК при непермиссивной темпера-
туре.
Температурочувствительный клон tsAF8, полученный из ли-
нии клеток сирийского хомячка ВНК 21/13, не синтезировал
ДНК при непермиссивной температуре (39,5°С). У этих мутант-
ных клеток, очевидно, изменен один из белков, синтезируемых
примерно в середине Gt-периода, вследствие чего клетки tsAF8
блокируются на границе периодов Gi и S [Burstin е,. а., 1974].
Температурочувствительные клоны, выделенные из линий кле-
ток К12 и СС439 китайского хомячка, по-видимому, имеют не-
нормальные белки, которые синтезируются в конце Огпериода.
При непермиссивной температуре наступает блок на границе
Gi—S [Smith В. J., Wigglesworth, 1973; Scheffler, Buttin, 1973].
Наха и соавторы [Naha е. а., 1975] исследовали 8 темпера-
турочувствительных мутантных клонов клеток, выделенных из
анэуплоидного клона А31 линии клеток BALB/3T3 мыши. У этих
температурочувствительных клонов при 38° С наблюдался
Gi—S-блок. У нормального клона клеток А31 время прохожде-
ния митотического цикла существенно не менялось при колеба-
нии температуры в пределах 33—38° С. Полученные авторами
данные показывают, что прохождение митотического цикла бло-
кируется у клеток мутантного клона tsA83 в ранний Gi-период,
а у tsA123 — примерно в середине, у tsA69, tsA90 и tsA92 — в
последней трети и, наконец, у tsA8, tsA122 и tsB23 — в конце
Gi-периода. Анализ с помощью электрофореза в полиакрила-
мидном геле ядерных белков у двух температурочувствительных
клопов клеток (tsA8, tsA83) показал, что развитие блока при
температуре 38° С сопровождалось появлением одного высоко-
132
молекулярного и исчезновением нескольких низкомолекулярных
нсгистоновых хромосомных белков.
Хроматографический анализ температурочувствительного
мутантного клона клеток китайского хомячка, характеризующе-
гося Gj—S-блоком при непермиссивной температуре (40° С),
показал нарушение синтеза всех классов гликопротеидов. Од-
нако общий белковый синтез и количество прикрепленных к
мембранам рибосом сохранялись на нормальном уровне при
40° С. Блок митотического цикла в Gi-периоде у данного клона
мутантных клеток, очевидно, обусловлен дефектом регуляции
синтеза гликопротеидов. В гибридных клетках этот мутантный
ген проявляет себя как рецессивный [Tenner е. а., 1977].
Минг и соавторы [Ming е. а., 1976] гибридизировали темпе-
ратурочувствительные мутантные клетки сирийского хомячка
tsAF8 с фибробластами от индивида, страдающего болезнью
Леша — Наяна. Клетки tsAF8 не могут расти при 39° С, блок
наступает в середине Gi-периода. В 9 гибридных клонах, отоб-
ранных при 39° С, имелось большинство хомячковых хромосом
и только одна (хромосома № 3) — человека. Эти данные ука-
зывают, что у человека ген, контролирующий одну из функций
клеточного цикла в середине Gi-периода, локализован в 3-й хро-
мосоме.
Изучение мутантных клонов клеток, дефектных по опреде-
ленному молекулярному процессу в G-фазе, представляет не-
сомненный интерес для выяснения механизмов генетического
контроля клеточного цикла.
Гены влияют на продолжительность S-периода. Проведенное
нами исследование показало, что ген splotch (Sp) в гомозигот-
ном состоянии сильно сокращает S-период, вследствие чего уве-
личивается митотическая активность в формирующейся цент-
ральной нервной системе мыши. В головном и спинном мозге
10-суточных эмбрионов Sp/Sp митотические индексы значитель-
но выше по сравнению с нормой. Эти различия связаны не с
увеличением продолжительности митоза у мутантов, а обуслов-
лены значительным уменьшением у них S-периода клеточного
цикла, который на 1,5 ч (25%) меньше, чем в норме (см. табл. 8,
рис. 32). Следовательно, уменьшение генерационного времени
приводит к повышению митотической активности в развиваю-
щейся центральной нервной системе у мутантов [Конюхов, Ми-
ронова, 1974].
Уилсон [Wilson, 1974] исследовала клеточную пролифера-
цию в пораженной части среднего мозга у 10- и 11-суточных эм-
брионов Sp/Sp, имеющих кранносхизис. Она также обнаружила
увеличение митотических индексов в головном мозге мутантных
эмбрионов. Однако, по ее данным, генерационное время проли-
ферирующих клеток пораженного отдела мозга у эмбрионов
Sp/Sp на 3,5 ч больше, чем у нормальных зародышей. Такое не-
соответствие — повышение митотического индекса и увеличение
133
генерационного времени у мутантов — автор объясняет увели-
чением продолжительности М-периода клеточного цикла, хотя
прямого определения продолжительности митоза в этой работе
не проводилось.
Для определения времени митоза мы использовали метод
облучения, основанный на блокировании перехода клеток из
G,-периода в митоз. Продолжительность М-периода вычисляли
по времени исчезновения всех фаз митоза после облучения. Для
клеток продолговатого и спинного мозга 10-суточных эмбрионов
Sp/Sp период М оказался таким же, как и в норме (см. табл. 8).
Расхождение результатов наших исследований с данными Уил-
сон, возможно, связано с тем, что она изучала клеточную про-
лиферацию у эмбрионов с сильным поражением головного мозга.
Мы использовали мутантных зародышей только с поражением
спинного мозга. Уилсон [Wilson, 1974] отмечает, что изменение
генерационного времени у изученных ею эмбрионов может быть
результатом нарушения развития головного мозга.
Уилсон и Цептер [Wilson, Center, 1974] сообщили, что у 10-
и 11-суточных эмбрионов мышей, гомозиготных по гену loop-tail
(Lp), в ненормально развивающемся головном мозге увеличе-
ны митотический индекс и генерационное время клеток по срав-
нению с нормой. Однако мы не смогли подтвердить эти данные.
Проведенное нами исследование показало, что митотические
индексы и продолжительность периодов клеточного цикла в го-
ловном и спинном мозге у 10-суточных эмбрионов мышей гено-
типа Lp/Lp не отличаются от нормы. Наряду с этим нами были
получены данные, указывающие, что ген Lp не активен в клет-
ках формирующейся центральной нервной системы, так как этот
ген не взаимодействует с геном Sp у двойных гетерозигот [Ко-
нюхов, Миронова, 1975],
Ген Lp взаимодействует с генами Fu и Т. Двойные гетеро-
зиготы Lp/+ Т/+ и Lp/+ Fu/+ в отличие от одинарных гете-
розигот Lp/+ +/+, Т/+ +/+ и Fu/+ +/+ нередко имеют
серьезные аномалии центральной нервной системы, обусловлен-
ные незакрытием нервной трубки [Strong, Hollander, 1949]. Ге-
ны Т и Fu в гетерозиготном, а особенно в гомозиготном состоя-
нии первично порожают развитие хорды; эти гены взаимодейст-
вуют и усиливают эффекты друг друга у двойных гетерозигот
[см. Gluecksohn-Waelsch, Erickson, 1970]. Взаимодействие гена
Lp с генами Т и Fu, первично поражающими хорду, свидетель-
ствует о том, что ген Lp активен в клетках формирующейся хор-
ды. Смит и Стейн [Smith, Stein, 1962] считают, что у эмбрионов
Lp/Lp имеет место замедленное превращение клеток первичной
полоски в клетки хорды. Незакрытие нервной трубки у эмбрио-
нов Lp/Lp возникает, очевидно, в результате поражения хорды,
т. е. является одним из вторичных эффектов этого гена. Воз-
можно, параметры клеточного цикла в формирующейся хорде
у зародышей Lp/Lp отличаются от нормы. Однако ответить на
134
этот вопрос можно только после проведения специального ис-
следования.
У позвоночных известны мутантные гены, нарушающие про-
хождение митоза. Так, мутантный ген lethal mitotique (1m) в
гомозиготном состоянии останавливает деление клеток на стадии
метафазы во всех тканях личинок тритона Pleurodeles wait 1 ii. По-
лученные экспериментальные данные указывают, что этот ген
проявляется автономно и нарушает, очевидно, синтез белков
митотического аппарата [Gounon, 1976]. У индеек мутантный
ген bn обусловливает блокирование митоза в эритроидных клет-
ках гомозигот, в результате чего в периферической крови по-
являются двухъядерные эритроциты. Ген bn вступает в действие
в дефинитивной популяции эритроидных клеток вскоре после
вылупления из яйца, и к 6-недельному возрасту число циркули-
рующих двухъядерных эритроцитов достигает максимума — 7%.
Этот мутантный ген, очевидно, нарушает формирование мито-
тического аппарата [Bloom е. а., 1970]. У человека также опи-
саны наследственные случаи блокирования митоза в клетках
эритроидного ряда [Wolff, Hofe, 1951].
Выделено несколько температурочувствительных линий кле-
ток хомячка, характеризующихся блокадой митоза в метафазе
при 39°С. В одной из этих линий ts-546 происходит почти не-
медленная блокада митоза в метафазе при повышении темпера-
туры до 39° С. Блокированные таким способом клетки морфоло-
гически похожи на К-метафазы. Дальнейшая инкубация при
39° С приводит к гибели клеток [Wang, 1974]. Клетки линии
ts-687 при 39° С вступают в митоз, однако на стадии анафазы
хромосомы не расходятся, в результате чего образуются круп-
ные моно-, би- и многоядерные клетки. Гибриды клеток ts-687
и клеток другого температурочувствительного мутантного клона
ts-546, полученные в результате спонтанного слияния, размно-
жались при 39° С нормально [Wissinger, Wang, 1978]. Блокада
митоза, очевидно, обусловлена изменением свойств одного из
белков веретена деления. Томпсон и Линдл [Thompson, Lindl,
1976] получили температурочувствительный мутантный клон
клеток MS 1-1 китайского хомячка с дефектом цитокинеза. Куль-
туры этого мутантного клона имели высокий процент полипло-
идных клеток, причем число полиплоидных, а также многоядер-
ных клеток увеличивалось при непермиссивной температуре
(38,5 и 39,5°С).
Гены, контролирующие синтез белков митотического аппа-
рата, действуют в Ог-периоде, но их эффекты проявляются позд-
нее в М-фазе, и как результат действия мутантных генов про-
исходит блокирование митоза.
Следует отметить, что ts-мутации могут нарушать разные
периоды клеточного цикла. Анализ таких мутантов представляет
большой интерес для изучения механизмов его генетического
контроля [Levine, 1978; Siminovitch, Thompson, 1978].
135
Регуляция синтеза ДНК
Деление клеток прежде всего связано с биосинтезом ДНК-
Хромосомы высших организмов состоят из многих единиц ре-
пликации, т. е. они являются мультирепликонными. В первой
половине S-периода происходит репликация эухроматиновой
ДНК, а во второй половине S-периода — гетерохроматиновой.
По некоторым данным, в хромосомах млекопитающих длина
одного репликона составляет в среднем 30 мкм, причем в каж-
дом репликоне синтез ДНК начинается в определенной точке
и идет в двух противоположных направлениях со скоростью 1 —
2 мкм в минуту [Amaldi е. а., 1972; Huberman, Tsai, 1973]. В по-
следнее время получены факты, указывающие на значительно
большие размеры репликонов у млекопитающих. В различных
клетках человека протяженность каждого репликона оказалась
одинаковой — в среднем 200 мкм, синтез ДНК в репликонах
разных клеток идет с одинаковой скоростью [Yurov, 1977]. Со-
гласно этим данным, на одну хромосому человека приходится
в среднем по 100 репликонов. Это число примерно в 10 раз мень-
ше ранее проведенных расчетов.
Основным условием для репликации ДНК является переход
ДНК из спирализованного в диффузное (деспирализованное)
состояние. Синтез ДНК в ядре носит полуконсервативный ха-
рактер и осуществляется многими ферментами. Непосредственно
в репликации ДНК У эукариотов принимают участие две ДНК-
полимеразы. Молекулярный вес ДНК-полимеразы I равен 30 000,
а ДНК-полимеразы II — 250 000. В пролиферирующих тканях
активность ДНК-полимеразы II значительно увеличивается, в
то время как активность ДНК-полимеразы I сохраняется при-
мерно на одном уровне. Ряд этапов в биосинтезе ДНК у эука-
риотов остается еще неизвестным [Baril е. а., 1974; Гаузе, 1975].
Макромолекулярные события, предшествующие синтезу
ДНК, должны иметь место в раннем Сгпериоде, но с какими
конкретными механизмами это связано, пока еще не ясно [см.
Thrasher, 1971]. Ровера и Базерга [Rovera, Baserga, 1971] ус-
тановили, что переход фибробластов человека из Go в Gj харак-
теризуется синтезом кислых ядерных белков, которые, по-види-
мому, дерепрессируют гены, контролирующие синтез белков,
необходимых для репликации ДНК.
Из культур соматических клеток млекопитающих были вы-
делены мутантные клоны с недостаточностью тимидинкиназы и
тимидилатсинтетазы [Sonnenschein е. а., 1969; Slack е. а., 1976].
Фосфорилирование молекул гистонов группы F1, очевидно,
играет важную роль в регуляции клеточной пролиферации. Не-
фосфорилированные молекулы гистонов F1 стабилизируют кон-
денсированное состояние ДНК, и требуется определенная сте-
пень их фосфорилирования для «обнажения» плотно упакован-
ных колец ДНК [Вогип, 1975]. У прокариотов обнаружен белок,
136
инициирующий репликацию ДНК, который запускает синтез
ДНК [см. Mitchison, 1971; Гаузе, 1975]. У эукариотов синтезу
ДНК предшествует синтез РНК и белка. Пересадка в энуклеи-
рованные яйцеклетки Xenopus laevis ядер неделящихся нервных
клеток взрослого животного показала, что в цитоплазме яйце-
клеток имеются факторы, индуцирующие синтез ДНК. Эти фак-
торы отсутствуют в ооците и появляются только в процессе его
созревания, когда наблюдается интенсивный синтез РНК и бел-
ка [Gurdon, 1970].
Опытами с гибридизацией соматических клеток установлено,
что если сливаются две клетки, одна из которых синтезирует
РНК и ДНК, а другая их не синтезирует, то активная клетка
индуцирует синтез нуклеиновых кислот в ядре неактивного парт-
нера. Цитоплазма клеток, находящихся в S-периоде, стимули-
рует синтез ДНК в ядре, которое было взято из клетки в Grne-
риоде. Индуктор синтеза ДНК продуцируется в начале S-перио-
да и поддерживается в течение этой фазы, отсутствуя в остальные
периоды клеточного цикла. Причем ДНК в О2-периоде не чув-
ствительна, по-видимому, к действию этого индуктора [см. Har-
ris, 1970а; Ephrussi, 1972; Ringertz, 1974]. Гордон и Кон [Gordon,
Cohn, 1971] получали гетерокарионы методом слияния недсля-
щихся макрофагов с клетками линий быстро делящихся in vitro
мышиных меланоцитов. Синтез ДНК в ядре макрофага такого
гетерокариона был тесно связан с синтезом РНК в ядре мела-
ноцита. Индуцирование делений клеток печени и почки мыши
сначала проявляется в увеличении скорости синтеза РНК, а за-
тем уже возрастает синтез ДНК. Причем синтезируются новые
специфические молекулы РНК, которые могут быть иРНК для
белков, ответственных за репликацию [Paul е. а., 1970]. Приро-
да индуцирующих синтез ДНК веществ остается неясной.
Как указывалось выше, подавление пролиферативной актив-
ности клеток сетчатки эмбрионов мыши генами fi и ог обуслов-
лено удлинением пресинтетического периода клеточного цикла.
У двойных гомозигот fi/fi ог/ог эти мутантные гены действуют
синергично, вследствие чего деление клеток в зачатке сетчатки
прекращается и развитие глаза останавливается на стадии чаши
[Конюхов, Вахрушева, Осипов, 1970].
Методом радиоавтографии с использованием 3Н-тимидина
показано, что у 11-дневных эмбрионов мышей генотипа fi/fi ог/ог
в зачатке сетчатки меньше ядер синтезируют ДНК по сравнению
с нормой ( + /+ +/+) и одинарными гомозиготами (fi/fi +/+
или +/+ ог/ог). В зачатке сетчатки 12-суточных зародышей
fi/fi ог/ог практически отсутствуют ядра, синтезирующие ДНК
[Konyukhov, Sazhina, 1975]. Гены fi и ог взаимодействуют так-
же синергично в культивируемой in vitro сетчатке эмбрионов
мышей fi/fi ог/ог, приводя к сильному ингибированию ее мито-
тической активности. Причем при культивировании зачатков
глаз И-суточных эмбрионов такое синергичное действие наблю-
137
дается уже через 24 ч, а при культивировании зачатков глаз
10-суточных эмбрионов — только после 72 ч культивирования.
В клетках сетчатки 11-суточных эмбрионов fi/fi ог/ог, очевидно,
накапливаются продукты мутантных генов, и поэтому при куль-
тивировании этих зачатков глаз сильное подавление митотиче-
ской активности в сетчатке наступает значительно быстрее, чем
при культивировании зачатков глаз 10-суточных эмбрионов дан-
ного генотипа [Конюхов, Уголькова, 1978]. Мутантные гены fi
и ог нарушают, по-видимому, различные процессы макромоле-
кулярного синтеза, происходящие в Gi-периоде и подготавли-
вающие репликацию ДНК. Синергичное взаимодействие продук-
тов этих неаллельных генов приводит к блокированию синтеза
ДНК в клетках формирующейся сетчатки.
Эфрусси и Вейс [Ephrussi, Weiss, 1967] наблюдали на меж-
видовых гибридах соматических клеток млекопитающих, что для
установления нового клеточного цикла гибридной клетки необ-
ходимо образование одного ядра. Слияние ядер в гибридной
клетке происходит во время митоза: два ядра гомокариона или
гетерокариона вступают в митоз одновременно, образуется одно
веретено и все хромосомы располагаются в одной метафазной
пластинке. В результате такого деления образуются две дочер-
ние одноядерные клетки (синкарионы), каждая из которых име-
ет хромосомы от обеих родительских клеток. Генерационное
время (Т) гибридных клеток крысаХмышь составляло проме-
жуточную величину между Т родительских видов, а у гибридов
сирийский хомячокХмышь оно было значительно длиннее, чем
Т у любого из родительских видов.
По мнению Эфрусси и Вейс [1967], эти факты указывают на
то, что начало синтеза ДНК связано с ядерной оболочкой, к ко-
торой, очевидно, прикрепляются интерфазные хромосомы. Дан-
ные других авторов также свидетельствуют о том, что реплика-
ция ДНК начинается на ядерной оболочке [Мосолов, 1968; Co-
mings, Kakefuda, 1968; Мосолов, Монахова, 1970]. Комингс и
Какефуда [Comings, Kakefuda, 1968] методом электронно-мик-
роскопической радиоавтографии показали на синхронизированно
делящихся в культуре клетках человека, что ДНК, меченная
3Н-тимидином в течение первых 10 мин S-периода, локализуется,
как правило, на ядерной оболочке или периферической области
ядра. Авторы высказали предположение, что точки инициации
синтеза ДНК репликонов связаны с ядерной оболочкой. Позд-
нее были получены факты, противоречащие зависимости репли-
кации ДНК от ядерной оболочки. Однако Хуберман [Huberman,
1974] привел дополнительные сведения в пользу того, что репли-
кация ДНК начинается на ядерной оболочке. Можно думать,
что индуцирующие синтез ДНК факторы первично влияют на
ядерную оболочку, где начинается репликация ДНК.
Процессы макромолекулярного синтеза, имеющие место в
клеточном цикле, несомненно, связаны друг с другом в опреде-
138
ленной последовательности, но каким образом, не известно.
Митчисон [Mitchison, 1971] выделяет два цикла: цикл репли-
кации ДНК и цикл роста. Основное доказательство существо-
вания этих двух циклов базируется на том факте, что в случае
блокирования синтеза ДНК культивируемых клеток избытком
тимидина рост клеток продолжается с нормальной скоростью.
Цикл репликации ДНК включает синтез ДНК и необходимых
для этого ферментов, а также синтез гистонов и белков митоти-
ческого аппарата. Наличие цикла роста, по мнению автора, яв-
ляется более гипотетичным, чем цикла репликации ДНК. К цик-
лу роста он относит все процессы макромолекулярного синтеза,,
обусловливающие увеличение клеточного объема.
В соматических клетках позвоночных содержатся вещества,
подавляющие или, наоборот, ускоряющие клеточные деления
[см. Baserga, 1976]. Из асцитной жидкости мышей, пораженных
асцитной опухолью Эрлиха, был выделен низкомолекулярный
фактор, который стимулировал синтез ДНК в изолированных
ядрах. Добавление его в культуральную среду приводило к
уменьшению Gi-периода клеток [Erhan е. а., 1970].
Тканеспецифические белки часто подавляют активность ге-
нов, контролирующих деление клеток, что сначала проявляется
в удлинении пресинтетической фазы, а в дальнейшем приводит
к полному прекращению клеточной пролиферации. Так, синтез
а-кристаллинов происходит в пролиферирующих клетках фор-
мирующегося хрусталика мыши, а начало синтеза у-кристалли-
нов совпадает по времени с прекращением деления клеток [Пла-
тонов и др., 1976]. Первичные эритробласты куриного эмбриона
после начала синтеза в них гемоглобина проходят 6 последо-
вательных делений. Причем продолжительность их клеточного
цикла возрастает с каждым делением в основном за счет увели-
чения длины Gr и S-периодов [Weintraub е. а., 1971]. Количе-
ство гемоглобина увеличивается с каждым клеточным циклом.
При этом скорость синтеза гемоглобина в течение первых кле-
точных циклов значительно больше, чем на последующих [Camp-
bell е. а., 1971]. В других клеточных системах также по мере
увеличения специфического продукта наблюдается удлинение
генерационного времени и, наконец, может происходить прекра-
щение деления.
На рис. 33 показана связь некоторых основных процессов
макромолекулярного синтеза с временем активности известных
локусов, контролирующих прохождение клеточного цикла.
Регуляция клеточной пролиферации может осуществляться
как на транскрипционном, так и посттранскрипционном уровнях.
Следует отметить, что у эукариотов в отличие от прокариотов
контроль над экспрессией генов широко представлен на пост-
транскрипционном уровне [Thomkins е. а., 1969]. Контрольные
механизмы клеточного деления работают на посттранскрипцион-
ном уровне тотчас же после завершения митоза [Thrasher, 1971].
139
Рис. 33. Схема основных про-
цессов макромолекулярного
синтеза и времени проявления
некоторых мутантных генов в
ходе клеточного цикла у позво-
ночных
ГК~, ТДС-— мутантные клоны кле-
ток с недостаточностью соответ-
ственно тимидинкиназы и тимиди-
латсинтетазы; is — температурочув-
ствительные мутантные клоны кле-
ток. Объяснения эффектов генов
см. в тексте
В частности, было показано, что сразу же после стимуляции
клеточного деления происходит увеличение синтеза белка на
стабильных иРНК.
Анализ эффектов мутантных генов у мыши свидетельствует
о том, что гены контролируют скорость клеточной пролиферации
через изменение синтеза тканеспецифических белков, так как
генные эффекты проявляются не во всех, а лишь в одной или
нескольких клеточных системах и каждый из генов становится
активным только на определенной стадии онтогенеза. В этой
связи большой интерес представляет изучение кейлонов — тка-
неспсцифических веществ, имеющих относительно небольшой
молекулярный вес и тормозящих размножение клеток в той тка-
ни, которая их вырабатывает. Действие кейлонов, являющихся
очевидно, гликопротеидами, обратимо, и они не цитотоксичны
[Laurence, 1973].
Плазматические (поверхностные) мембраны играют важную
роль в регуляции клеточного деления. Толщина плазматической
мембраны примерно 7,5 нм, она состоит из слоя фосфолипидных
молекул, заключенного между двумя слоями белковых молекул.
Сложность функций плазматической мембраны (активный транс-
порт метаболитов, контактное торможение, клеточное распозна-
вание и др.) является результатом наличия в ней специальных
структурных белков и соответствующих ферментов. Поверхность
клетки первой воспринимает сигналы к пролиферации и раньше
других клеточных структур на них реагирует, в частности, из-
менением своей проницаемости. В связи с этим было высказано
предположение, что проницаемость плазматической мембраны
может играть важную роль в регуляции клеточной пролифера-
ции [Васильев, Маленков, 1968].
Парди [Pardee, 1971] полагает, что в течение митотического
цикла плазматическая мембрана периодически изменяется, а
установление контакта между клетками вызывает фиксацию ее
140
свойств и ведет к остановке продвижения клетки по циклу. Внеш-
ние воздействия могут приводить к выходу клетки из состояния
покоя, причем сначала наблюдаются изменения свойств плаз-
матической мембраны. По мнению автора, плазматические мем-
браны злокачественных клеток в отличие от нормальных не об-
ладают свойством задерживать продвижение клетки на опреде-
ленной стадии клеточного цикла. Фокс и соавторы [Fox е. а.,
1971] на синхронизированной культуре клеток млекопитающих
обнаружили специфические локальные изменения плазматиче-
ской мембраны в период митоза, которые, по мнению авторов,
могут запускать процессы нового клеточного цикла, приводящие
в конечном итоге к следующему митозу.
Сивак [Sivak, 1972] на культурах фибробластов показал ве-
дущее значение плазматической мембраны в регуляции проли-
ферации клеток. Автор считает правильным предположение дру-
гих исследователей, что изменение активности ферментов плаз-
матических мембран может привести к каскаду реакций, которые
в конечном итоге препятствуют или способствуют прохождению
клеткой митотического цикла. В опытах на стационарной куль-
туре клеток китайского хомячка В. В. Терских и А. Г Маленков
[1973] наблюдали быстрое изменение проницаемости плазма-
тической мембраны и сдвиги в ионном составе клеток после воз-
действия стимулятора пролиферации. По мнению авторов, эти
изменения являются одним из ранних событий, предшествующих
вступлению клетки в митотический цикл.
Клейтон с соавторами [Clayton е. а., 1976] показали, что
гиперплазия хрусталикового эпителия у двух линий кур (Ну-1;
Ну-2), селектированных длительное время на высокую скорость
роста, связана с определенными изменениями плазматической
мембраны. Клетки гиперплазированного хрусталикового эпите-
лия обладают, очевидно, менее выраженным контактным инги-
бированием, быстрее агрегируются и образуют более крупные
агрегаты in vitro по сравнению с эпителиальными клетками нор-
мального хрусталика. Исследования на мутантных клетках с
измененной скоростью пролиферации могут пролить свет на
роль тех или иных компонентов плазматической мембраны в
регуляции клеточного деления. В этой проблеме важно уста-
новить, какие первичные изменения в плазматической мембране
влияют на регуляцию экспрессии генов.
Стимулирование клеточной пролиферации различными фак-
торами приводит прежде всего к повышению синтеза РНК
(транскрипционной активности) и увеличению синтеза негисто-
новых хромосомных белков [Baserga, 1976]. Чои и Роуз [Choe,
Rose, 1974] и Альфрей и соавторы [Allfrey, е. а., 1974] наблю-
дали миграцию негистоновых белков хроматина, способных свя-
зываться с ДНК, в ядра клеток, стимулированных к пролифе-
рации. Многие данные свидетельствуют о существенных разли-
чиях в негистоновых хромосомных белках между нормальными
141
и раковыми клетками. Такие различия обнаружены между клет-
ками линий WI-38 и 2RA, лимфоцитами и лейкемическими клет-
ками, клетками головного мозга и нейроэктодермальной опухо-
ли, печени крысы и гепатомы, нормальной и злокачественно пе-
рерожденной тканями грудной железы [см. Baserga, 1976].
Базерга [Baserga, 1976], рассмотрев свойства кислых ядер-
ных (негистоновых хромосомных) белков и данные, указываю-
щие на их роль в регуляции активности генов, полагает, что
стимулирующий пролиферацию клеток фактор обусловливает
выход из клетки (или фиксацию на клеточных мембранах) оп-
ределенных цитоплазматических макромолекул, блокирующих
трансляцию иРНК для негистоновых хромосомных белков. Пос-
ле снятия такого блока трансляции на этих иРНК синтезируют-
ся кислые белки, которые мигрируют в ядро и дерепрессируют
гены, контролирующие синтез белков, ответственных за репли-
кацию ДНК.
В исследованиях по выяснению механизмов такого сложного
многоступенчатого процесса, каким является клеточное деление,
необходимо усилить генетический подход. Широкое использова-
ние мутантных клонов клеток, дефектных как по различным
этапам биосинтеза ДНК, так и другим регуляторным механиз-
мам клеточного деления, позволит выяснить последовательность
молекулярных процессов, обеспечивающих прохождение мито-
тического цикла. Изучение этих вопросов имеет важное значение
для биологии и медицины, в частности, для управления такими
процессами, как регенерация и опухолевый рост.
Таким образом, деление клеток контролируется многими ге-
нами. Наибольшая активность генов наблюдается в Gr и S-пе-
риодах клеточного цикла, в О2-периоде действует меньше генов,
а в середине митоза геном не активен. Гены контролируют ско-
рость клеточной пролиферации путем изменения продолжитель-
ности периодов клеточного цикла, в основном Gr и S-фаз. В од-
них случаях это приводит к удлинению клеточного цикла и по-
давлению митотической активности, в других — к уменьшению
продолжительности генерационного времени и повышению ско-
рости клеточной пролиферации. Анализ эффектов мутантных ге-
нов, нарушающих различные молекулярные процессы клеточ-
ного цикла, имеет важное значение для понимания механизмов
регуляции деления клеток. В частности, представляют интерес
исследования мутантных клеток с измененной плазматической
мембраной.
Глава 5
ГЕНЫ
И ДИФФЕРЕНЦИРОВКА КЛЕТОК
*
Термин «дифференцировка» клеток не поддается строгому
определению. Дифференцировка клеток у высших организмов —
проявление разнообразия клеточного состава, что обеспечивает
более высокую эффективность в «разделении труда» клетками
при функционировании тканей и органов. Если исследовать под
микроскопом разные органы человека или одного и того же жи-
вотного, то можно легко убедиться, что клетки существенно
отличаются друг от друга по форме, размерам и тонкому строе-
нию. С другой стороны, клетки одинаковых тканей, например
мышечной или нервной, даже у животных, находящихся на раз-
личных этапах эволюционного развития, в частности у лягушки
и слона, имеют много сходных черт. Это связано с тем, что
клетки многоклеточных организмов специализированы (диффе-
ренцированы) для выполнения различных функций.
Такая специализация клеток появилась в ходе эволюционно-
го развития многоклеточных организмов и возникает регулярно
в онтогенезе каждого индивида или особи. Если простейшие мно-
гоклеточные, например губки, состоят лишь из трех отчетливо
выраженных типов клеток, то позвоночные животные — из не-
скольких сот типов клеток, возникающих из трех зародышевых
листков — эктодермы, мезодермы и энтодермы. Формирование
зародышевых листков связано с различной специализацией бла-
стомеров вследствие активности в них разных генов.
Выяснение механизмов дифференцировки клеток, т. е. ста-
новление их структурной и функциональной специализации из
тотипотентных клеток раннего зародыша, является одной из
центральных проблем современной биологии. По образному
выражению Уотсона [Watson, 1970], клеточная дифференциров-
ка — «сердце» эмбриологии. В широком смысле слова под диф-
ференцировкой понимают достижение клетками развивающегося
организма специализированного конечного состояния. Этот про-
цесс начинается с выделения на ранних стадиях эмбриогенеза
родоначальных (стволовых) клеток и включает ряд последова-
тельных митотических циклов, в течение которых синтезируются
143
специфические белки и другие продукты и происходит струк-
турная и функциональная специализация тех или иных клеточ-
ных типов.
Как было показано выше, гены контролируют индивидуаль-
ное развитие высших организмов начиная с самых ранних его
этапов (см. гл. 3). Общий принцип такого контроля сейчас по-
нятен: различные стадии онтогенеза контролируются разными
генами и в результате взаимодействия их первичных и вторич-
ных продуктов происходит дифференцировка клеток. В настоя-
щей главе рассматриваются механизмы генетического контроля
клеточной дифференцировки у позвоночных, хотя основные за-
кономерности этого процесса, очевидно, в определенной степени
сходны у всех эукариотов.
Тотипотентность клеток ранних зародышей
Вейсман [Weissmann, 1904] в своей известной «теории за-
родышевой плазмы» полагал, что каждый признак организма
представлен в половой клетке отдельной частицей—детерми-
натом. Общая сумма детерминантов представляет все части
взрослого организма с их особенностями. Детерминанты, со-
гласно этой гипотезе, локализованы в хромосомах и полный
набор детерминантов передается от одного поколения к друго-
му. Вейсман считал, что в течение дробления яйца детерминанты
распределяются по разным бластомерам, последующая сегрега-
ция детерминантов приводит к тому, что в конце концов в клетки
эмбриона попадают детерминанты только одного какого-либо
рода. В результате этого клетке не остается другого выхода,
как дифференцироваться определенным образом в соответствии
с имеющимися в се ядре детерминантами. Только для половых
клеток и предшествующих им клеток-родоначальниц Вейсман
допускал сохранение всего набора детерминантов.
Однако экспериментальные исследования эмбриологов ука-
зывали на то, что дифференцировка клеток связана не с утерей
тех или иных генов, а с различной активацией генов одного и
того же генома в разных клеточных системах. В частности, было
показано, что у низших позвоночных при регенерации тканей и
органов одни клетки могут иногда трансформироваться в другие
клеточные элементы. Такое явление получило название мета-
плазии. Если у тритона удалить хрусталик, то из клеток дорсаль-
ной части радужной оболочки глаза образуется новый хруста-
лик, который по строению и белковому составу идентичен хру-
сталику, возникающему в ходе нормального развития из голов-
ной эктодермы.
Эти факты противоречили гипотезе Вейсмана. Было также
установлено, что на ранних этапах развития, в период дробле-
ния зиготы, для бластомеров характерна тотипотентность, под
которой понимают способность клетки дифференцироваться в
144
любом из множества направлений (клеточных типов). Тотипо-
тентность клеток на первых стадиях эмбриогенеза была установ-
лена путем разделения ранних зародышей амфибий на отдель-
ные клетки (бластомеры). На 2-клеточной стадии развития от-
деляли друг от друга бластомеры, и из каждого из них возника-
ла нормальная особь. Если при помощи тонкой иглы убить один
из бластомеров 2-клеточного зародыша, то из оставшегося
бластомера образуется нормальное животное [см. Spemann,
1938].
Такие же факты были получены позднее и в опытах на мле-
копитающих. Из яйцевода черной крольчихи извлекали зародыш,
находящийся на 2-клеточной стадии, т. е. сразу после разделения
оплодотворенного яйца на два бластомера. Один бластомер уби-
вали, а другой нормальный бластомер пересаживали в матку се-
рой крольчихи, которая через определенное время родила черного
крольчонка. Даже разрушение трех из четырех бластомеров на
4-клсточной стадии приводило к возникновению нормальных жи-
вотных [Seidel, 1960]. Было показано, что любой бластомер
8-клсточпого кроличьего зародыша способен сформировать нор-
мальный взрослый организм [Moore с. а., 1968]. Рождение одно-
яйцевых близнецов у человека и различных видов животных так-
же указывает на тотипотентность клеток в течение первых ста-
дий развития.
Образование экспериментальных химер у млекопитающих в
результате агрегации бластомеров свидетельствует о тотипо-
тентности клеток раннего зародыша. Методика получения химер-
ных мышей с помощью агрегации бластомеров разных геноти-
пов была разработана независимо друг от друга польским эм-
бриологом Тарковским [Tarkowski, 1961, 1963] и американской
исследовательницей Минц [Mintz, 1962, 1971а]. С этой целью
обычно используют зародышей, находящихся на 8—12-клеточ-
ной стадии развития (2,5—3 суток после оплодотворения), кото-
рых вымывают из яйцеводов и обрабатывают in vitro проназой
для растворения яйцевой оболочки (zona pellucida). Затем осво-
бодившиеся от яйцевой оболочки бластомеры двух эмбрионов
агрегируют друг с другом при 37° С и такой смешанный агрегат
бластомеров культивируют in vitro в течение 24—48 ч. В куль-
туре химерные зародыши достигают стадии бластоцисты, и их
имплантируют в матку мыши-реципиента, которая за 3 дня до
этого была скрещена со стерильным (вазэктомированным) сам-
цом (рис. 34, а).
Гарднер [Gardner, 1968] предложил другой метод получе-
ния химерных животных, заключающийся во введении клеток
внутренней клеточной массы бластоцисты донора в бластоцель
реципиентного зародыша (рис. 34, б). Для инъекционного мето-
да используют микроманипулятор: специальной присоской удер-
живают бластоцисту-реципиент и при помощи иглы в стенке тро-
фобласта проделывают отверстие, через которое тонкой микро-
145
Рис. 34. Схема получения химерных мышей
д _ агрегация бластомеров мышей разных генотипов; б — введение клеток в бластоцель
пипеткой (внутренний диаметр примерно 20 мкм) вводят клет-
ку или несколько клеток эмбриона-донора в бластоцель вблизи
внутренней клеточной массы или непосредственно в нее (рис. 35).
Затем бластоцисту, как и при агрегационном методе получения
химер, пересаживают в матку мыши, находящейся на соответст-
вующей стадии ложной беременности. Можно вводить клетки
эмбрионов-доноров в бластоцель при помощи заостренной микро-
пипетки без предварительного прокола стенки трофобласта мик-
роиглой [Moustafa, Brinster, 1972а].
У химер не обнаружено каких-либо признаков иммунологи-
ческой несовместимости клеточных популяций разного генотипа.
У них толерантность скорее врожденная, чем приобретенная
[Mintz, Palm, 1969]. Химерные животные возникают в резуль-
тате агрегации двух зародышей, имеющих по два родителя. По-
этому химер называют иногда еще «четырехродительскими» жи-
вотными (tetraparental animals).
146
Рис. 35. Этапы введения клетки в бластоцисту [Gardner, 1978]
а — присасывающей пипеткой удерживают бластоцисту за полюс внутренней клеточной'
массы и затем поднимают ее в центр висячей капли (остальные микроинструменты под-
готовлены для операции); б — сомкнутые концы изогнутых назад игл введены в бласто-
цель немного в стороне от внезародышевого полюса. Бластоциста несколько сдвигается в
сторону, когда одну иглу отводят от другой; в —в оболочке и трофэктодерме сделана
довольно широкая щель, в которую вводится 3-я игла. После ее введения и перемещения
вверх щель превращают в трехгранное отверстие, нижняя пара игл изогнута назад; г —
пипетку вводят в бластоцель вдоль 3-й иглы, после этого инъецируют клетку
Тарковский [Tarkowski, 1961] впервые ввел термин «химе-
ры» для обозначения таких животных, а Минц [Mintz, 1967] ис-
пользовала другой синоним — аллофенные мыши, что указывает
на их происхождение в результате агрегации эмбрионов. Однако
термин аллофенные не совсем удачен и лучше его не использо-
вать. По-видимому, также лучше не использовать термин «мо-
заичные» для обозначения животных, возникших в результате
агрегации клеток двух зародышей, так как мозаичные особи об-
разуются из одной оплодотворенной яйцеклетки. Различные кле-
точные популяции у мозаиков возникают в ходе развития, как
результат мутаций, рекомбинаций или нерасхождения хромосом в
соматических клетках [см. McLaren, 1976а]. Для обозначения
экспериментальных химер используют знак *->. Так, А*-*В озна-
чает, что химеры образовались в результате агрегации клеток
зародышей линии мышей А и В.
147
С помощью агрегационного метода получения химер и раз-
личных маркерных генов, контролирующих пигментацию, струк-
туру волос, дегенерацию различных типов клеток и изофермен-
ты, установлено, что клетки зародыша млекопитающих на ста-
дии морулы обладают тотипотентностью: каждый бластомер спо-
собен дать развитие любому клеточному типу. Кроме того,
оказалось, что из одного бластомера может возникнуть несколько
различно дифференцированных типов клеток [см. McLaren,
1976а]. Это свидетельствует о том, что тотипотентность сохра-
няется по крайней мере до следующей стадии развития — бла-
стулы.
Инъекционный метод получения химерных животных, кото-
рый предложил Гарднер [1968], позволяет выяснить, когда про-
исходит потеря тотипотентных свойств клетками развивающего-
ся зародыша .млекопитающих. Мустафа и Бринстер [Moustafa,
Brmster, 1972b] вводили в бластоцель зародышей мыши клетки
эмбрионов-доноров, которые были на стадии бластоцисты или
на 2, 4 и 8 дней старше по сравнению с реципиентами. Исполь-
зуя пигментацию как маркер, исследовали химеризм у 15—17-
суточных эмбрионов. При введении в бластоцель клеток от до-
норских эмбрионов, которые были на той же стадии развития
(бластоцисты) или на 2 и 4 дня старше реципиента, химеризм
был обнаружен соответственно в 19, 15 и 3% случаев. Химер-
ных зародышей не удалось обнаружить в опытах, когда эмбрио-
ны-доноры были на 8 дней старше реципиентов. Изучение химер
в постэмбриональный период развития показало, что химеры
возникали только в тех случаях, когда клетки были взяты от за-
родышей-доноров, которые были старше не более чем на двое
суток по сравнению с реципиентными бластоцистами.
Данные этой работы не проливают свет на продолжительность
сохранения в эмбриогенезе клетками тотипотентных свойств, так
как авторы использовали для инъекций в бластоцель клетки не
какой-либо определенной дифференцирующейся клеточной си-
стемы, а смесь дезагрегированных клеток целого эмбриона.
Гарднер (1975) вводил в бластоцель реципиентных зароды-
шей по одной клетке внутренней клеточной массы зародышей-
доноров, находящихся также на стадии бластоцисты (стадия
64 клеток). Было показано, что клетки внутренней клеточной
массы, из которой возникает эмбрион, на этой стадии сохраняют
еще тотипотентность. Каждая клетка внутренней клеточной мас-
сы, состоящей примерно из 15 клеток, может дать возникнове-
ние всем 3 зародышевым листкам: эктодерме, мезодерме и энто-
дерме, причем любая клетка внутренней клеточной массы мо-
жет участвовать в формировании как тканей самого зародыша,
так и его внезародышевых оболочек.
148
Генетическая идентичность
ядер дифференцирующихся клеток
Несмотря на заметное структурное и функциональное несход-
ство различных клеточных типов, например клеток эпителия
кожи и нейронов головного мозга, число хромосом и количество
ДНК на ядро, как правило, одинаково. Константность, или по-
стоянство, хромосом и ДНК обусловлена особенностями мито-
тического деления клеток: при каждом клеточном делении про-
исходит удвоение количества ДНК и хромосом, в результате чего
образующиеся две дочерние клетки получают такое же количе-
ство хромосом и ДНК, как и в исходной материнской клетке.
Известно небольшое число видов низших многоклеточных
организмов (беспозвоночных), которые являются исключением
из правила постоянства хромосом. К таким видам, в частности
относится аскарида. У этого паразитического червя в ходе раз-
вития соматических клеток происходит потеря, или элиминация,
части хромосомного материала, но при образовании половых
клеток (гамет) не наблюдается такой элиминации вещества
хромосом. Однако такие случаи можно рассматривать лишь как
исключение из общего правила — сохранения количества ДНК
и хромосомного материала в ходе дифференцировки соматиче-
ских клеток.
Генетическая идентичность клеточных ядер раннего зароды-
ша была показана в опытах на амфибиях еще в 30-х годах на-
шего столетия. Осторожно перетягивая при помощи тонкой
волосяной петли оплодотворенное яйцо тритона, достигали раз-
деления зиготы на две половинки, одна из которых содержала
ядро, а другая была безъядерной. Ядерная половинка начинала
делиться, и из нее образовывался 16-клеточный зародыш. В те-
чение 4 клеточных делений объем каждого ядра уменьшался, и
стал возможен переход одного из них через образованное воло-
сяной петлей сужение в безъядерную половинку зиготы. Как
только одно из ядер 16-клеточного эмбриона попадало в цито-
плазму безъядерной половинки зиготы, она начинала делиться
и, затягивая сильнее волосяную петлю, ее полностью отделяли
от другой, уже развивающейся половинки зиготы. В результате
таких опытов было получено из одного оплодотворенного яйца
Два нормальных зародыша. Следовательно, даже после четырех
митотических делений клеточные ядра амфибии сохраняют то-
типотентность, т. е. каждое из них способно дать нормальный
зародыш со всеми характерными для него тканями и органами
[Fankhauser, 1930].
Американские исследователи Бриггс и Кинг [Briggs, King,
1952] разработали метод пересадки ядер соматических клеток
в безъядерные (энуклеированные) яйцеклетки лягушки. Этот
метод заключается в следующем. Тонкой иглой удаляют ядро из
яйцеклетки и при помощи очень тонкой стеклянной пипетки пе-
149
ресаживают в яйцеклетку ядро одной из клеток раннего заро-
дыша. В опытах на Rana pipiens было установлено, что если
использовать для пересадки ядра клеток зародыша, находяще-
гося на стадии бластулы, то примерно в 80% случаев наблюда-
ется образование нормальных зародышей. Однако менее 20%
яйцеклеток были способны к нормальному развитию после пере-
садки в них клеточных ядер зародыша, продвинувшегося на сле-
дующую стадию развития — гаструлу. Если использовали ядра
клеток зародыша, находящегося на еще более продвинутой ста-
дии развития — нейруле, когда происходит формирование за-
чатка центральной нервной системы, то ни в одном случае не
наблюдали образования нормальных зародышей. Если в безъ-
ядерные яйцеклетки трансплантировали ядра клеток первичной
кишки, которые возникают из зародышевого листка энтодермы,
то у эмбрионов отмечена ранняя гибель тканей эктодермального
и мезодермального происхождения (кожи, нервной и мышечной
системы). Ткани, образующиеся из энтодермы, в частности ткани
кишечника, были развиты значительно лучше [Briggs, King,
1957].
При использовании для пересадок ядер эктодермальных кле-
ток зародыша, например нервной пластинки, наоборот, наблюда-
ли недостаточное развитие эктодермальных и мезодермальных
производных [DiBcrardino, King, 1967]. Л. А. Никитина [1970],
пересаживая ядра эктодермальных клеток ранних зародышей в
безъядерные яйцеклетки четырех видов бесхвостых амфибий, так-
же сделала заключение, что со стадии поздней гаструлы все
больший процент ядер становится неспособным обеспечить нор-
мальное развитие.
Гердон [Gurdon, 1962] в опытах на другом виде бесхвостых
амфибий — южноафриканской жабе (Xenopus laevis) получил
несколько иные данные, чем исследователи, работавшие на ля-
гушке. Он не удалял ядра яйцеклеток хирургическим путем, а
разрушал их ультрафиолетовыми лучами. Несмотря на то что
Гёрдон использовал для пересадки в энуклеированные яйцеклет-
ки ядра уже дифференцированных клеток кишечного эпителия
плавающего головастика, небольшой процент таких ядер все же
обеспечивал развитие. В большинстве случаев яйцеклетки не раз-
вивались, но примерно 10% из них образовывали эмбрионы, боль-
шая часть которых достигала стадии бластулы (6,5%), некото-
рые— стадии головастика (2,5%) и только небольшая часть
яйцеклеток с пересаженными ядрами (1%) развивалась в поло-
возрелых особей.
В других опытах в энуклеированные яйцеклетки пересажива-
ли ядра культивируемых in vitro клеток (монослойные клеточ-
ные культуры) почки, легкого и эпидермиса кожи взрослых жи-
вотных. Было установлено, что некоторые из этих клеточных
ядер могут обеспечить -нормальное развитие вплоть до полово-
зрелого состояния. При этом существенных различий между яд-
150
рами клеток разных органов в способности поддерживать раз-
витие не обнаружено. Использование в качестве доноров и ре-
ципиентов животных с разным числом ядрышек в ядре показало,
что функционирование собственного ядра яйцеклетки было ис-
ключено [Laskey, Gurdon, 1970].
Маршалл и Диксон [Marshall, Dixon, 1977] показали,что ядра
клеток кишечника головастиков разного возраста при пересад-
ке их в энуклеированные яйцеклетки Xenopus laevis примерно в
равной степени обеспечивают развитие. Однако ядра клеток бла-
стулы значительно лучше обеспечивали развитие «ядерных
трансплантатов». Следовательно, ядра клеток бластулы имеют
больше потенций развития по сравнению с ядрами клеток кишеч-
ника головастиков. Трансплантированные в энуклеированные
яйцеклетки ядра лимфоцитов взрослых X. laevis обеспечивали
прохождение нормального эмбриогенеза. Происходящие из ядер
лимфоцитов головастики выглядели нормально, но затем вскоре
погибали [DuPasquier, Wabl, 1977].
Кобил и соавторы [Kobel е. а., 1973], работая с такой же ме-
тодикой энуклеации яйцеклеток, которую использовал Гердон,
в своих работах показали, что ядра дифференцированных кле-
ток головастиков X. laevis не обеспечивают прохождение разви-
тия ядерных трансплантатов через гаструляцию. Эти авторы
утверждают, что сейчас еще нельзя ответить однозначно на во-
прос, происходят ли в ходе дифференцировки необратимые изме-
нения ядра. Они отмечают, что как в их опытах, так и в работах
других авторов только ядра клеток тканей, характеризующиеся
высокой скоростью пролиферации, или ядра клеточных культур
обеспечивали прохождение развития ядерных трансплантатов
через гаструляцию вплоть до половозрелого состояния. Однако
остается открытым вопрос, можно ли рассматривать такие клет-
ки как дифференцированные. Возможно, в таких клеточных по-
пуляциях сохраняются малодифференцированные клетки. Так,
трансплантация в энуклеированные яйцеклетки ядер клеток
хрусталикового эпителия взрослой лягушки Rana pipiens обес-
печивала нормальное эмбриональное и постэмбриональное раз-
витие. В этих опытах ядра для пересадки брали из клеток хрус-
талика, предварительно культивированного in vitro [Muggleton-
Harris, Pczzella, 1972].
Как указывалось выше, после первичной пересадки ядер кле-
ток эпителия кишечника головастика в энуклеированные яйце-
клетки X. laevis большинство зародышей погибает до заверше-
ния гаструляции. Однако если от таких ядерных трансплантатов
использовать для пересадок клеточные ядра, то число зароды-
шей с нормальным развитием увеличивается и они развиваются
До более поздних стадий по сравнению с зародышами, получен-
ными в результате первичной пересадки ядер.
Для получения «ядерного» материала в опытах с серийной
пересадкой ядер яйцо, в которое ввели ядро клетки-донора, на-
151
пример кишечного эпителия, выращивают до стадии бластулы,
насчитывающей до 10 тыс. клеток; затем клетки бластулы де-
загрегируют и используют их в качестве доноров ядер для се-
рийной пересадки ядер в энуклеированные яйцеклетки (рис. 36).
Следовательно, серийные пересадки ядер соматических клеток
лучше обеспечивают развитие ядерных трансплантатов по срав-
нению с первичными пересадками ядер.
Диберардино и Хоффнер [DiBerardino, Hoffner, 1970] пола-
гают, что данные о нестабильной инактивации генов, полученные
в опытах с пересадкой ядер клеток эпителия кишечника питаю-
щегося головастика X. laevis, могут быть связаны с использова-
нием ядер первичных половых клеток, которые возникают в энто-
дерме и присутствуют в течение значительного времени среди
клеток кишки. Эти авторы, опираясь на результаты своих работ
по исследованию хромосомных аномалий в ядерных трансплан-
татах, считают, что в процессе дифференцировки клеток опре-
деленные участки хромосом сильно спирализуются (конденса-
ция хроматина). После пересадки ядер в цитоплазму энуклеиро-
ванной яйцеклетки хроматин таких участков не декондснсируется
и затем «выпадает» из генома в ходе развития ядерных транс-
плантатов. В результате такого рода делеций генетического ма-
териала возникают вышеописанные недостаточности в формиро-
вании определенных тканей, а также блокирование развития
эмбрионов. Однако большинство фактов свидетельствует скорее
о появлении в ходе дифференцировки необратимых изменений не-
которых участков хромосом или глубокой инактивации генов, свя-
занных с наличием эпигеномных изменений, чем об утрате тех или
иных генов.
Метод ядерных пересадок показал генетическую идентич-
ность ядер различных типов клеток одного и того же организма.
По мере дифференцировки клеток их ядра постепенно теряют
способность обеспечивать нормальное развитие яиц-реципнентов
[Gurdon, 1974].
Данные, полученные с помощью метода гибридизации
ДНК—РНК, также указывают на то, что в ходе клеточной диф-
ференцировки не наблюдается утраты каких-либо блоков генов,
а имеет место лишь более глубокая (стабильная) инактивация
неработающих генов. Так, было установлено, что способность
глобиновых иРНК гибридизоваться -с ДНК не зависит от ста-
дии созревания куриных эритроцитов. Кроме того, глобиновые
иРНК имели одинаковую степень гибридизации с ДНК других
клеточных систем, несмотря на их функциональные и биохими-
ческие различия, а также разное эмбриональное происхождение
[DeJimenez е. а., 1971].
Как будет показано ниже, на конечных этапах дифференци-
ровки некоторых клеток наблюдается деградация ядерной ДНК.
Не исключено, что деградация ДНК в той или иной степени ха-
рактерна для конечных этапов дифференцировки многих типов
152
Нсиплодолпворенное лицо
(двухъядрышкобал линия)
Ультра (риолетовое
облучение
у Яйцо-реципиенш
Аномальнь/й
зародыш
второй клон серийных зародышей (все одно ядрышковые)
Рис. 36. Схема пересадок ядер клеток кишечного эпителия головастика
в безъядерные яйцеклетки Xenopus laevis [Gurdon, 1968]
Яйцеклетки энуклеировали с помощью ультрафиолетового облучения. Ядра бластулы,
развившейся в результате первичной пересадки (/), используют для дальнейших серий-
ных пересадок. Две нормально дробящиеся бластулы (2), полученные в результате се-
рийных пересадок, развиваются в нормальных головастиков, а ядра 3-й (3), частично,
или атипично, дробящейся бластулы используют для получения 2-го серийного клона,
в котором развиваются как нормальные, так и уродливые зародыши
клеток. Поэтому правильнее рассматривать вопрос о количестве
ДНК в клетках до вступления их на конечные этапы дифферен-
цировки.
В отличие от животных организмов клетки растений не те-
ряют тотипотентных свойств в ходе клеточной дифференциров-
ки. Экспериментальными исследованиями показано, что любая
растительная клетка, не потерявшая в ходе своей дифференци-
ровки ядра или цитоплазмы, может в культуре превратиться в
каллусную или зиготоподобную клетку и дать начало новому
организму. Из одной соматической клетки in vitro были получены
целые растения моркови, табака и пастернака. В культуре пыль-
ников из микроспор могут возникнуть сначала эмбриоиды, а за-
тем уже и целые гаплоидные растения, которые представляют
большой интерес для решения важных проблем генетики и се-
лекции [Steward, 1970; Бутенко, 1975]. Сохранение клетками
растений тотипотентных свойств в ходе дифференцировки явля-
ется одним из существенных их отличий от клеток животных.
Цитодифференцировка — результат
специфической дерепрессии генов
В любой клетке животного организма и на любой стадии раз-
вития большая часть генов неактивна, а в дифференцирован-
ных клетках транскрибируется менее 10% генома. Дэвидсон
[Davidson Е., 1968] считает, что легче допустить наличие в клет-
ке регуляторных механизмов для специфической активации 10%
генов, чем для специфической репрессии 90% клеточного генома.
Фоулдс [Foulds, 1969] ввел понятие общего и факультативного
геномов. Он пишет: «В настоящее время считается общепринятым,
что избирательная работа определенных участков генома явля-
ется генетической основой дифференцировки клеток высших жи-
вотных. В этой связи я считаю полезным ввести понятия суммар-
ного и эффективного геномов. Под суммарным геномом я пони-
маю совокупность всех имеющихся в организме генов, которые в
принципе рано или поздно могут в нем проявиться. Под эффек-
тивным геномом я понимаю набор генов, эффективно использую-
щихся в соответствующем месте организма и в соответствующее
время. В принципе под эффективным использованием гена пони-
мается его транскрипция.»
Результаты опытов с ДНК—РНК-гибридизацией показали,
что примерно 70% активного генома соматических клеток мыши
представлены уникальными (неповторяющимимя) генами, а
остальные 30% —повторяющимися генами (Ю1—105 копий каж-
дого локуса) [Britten, Kohne, 1968]. В клетках печени и почки
мышей транскрибируется около 3%, а в клетках головного моз-
га — примерно 10% генома в расчете на число уникальных после-
довательностей нуклеотидов ДНК [Hahn, Laird, 1971]. Эти
авторы рассчитали, что в головном мозге взрослой мыши актив-
154
ны более 300 000 уникальных (неповторяющихся) участков, каж-
дый из которых имеет протяженность в среднем 1000 нуклеоти-
дов. Такое большое число активных уникальных локусов, по мне-
нию авторов, можно объяснить большой сложностью головного
мозга, состоящего из многих клеточных популяций. В этой-работе
нуклеиновые кислоты получали из целых органов, включающих
разные клеточные популяции. Поэтому число активных генов
на одну дифференцированную клетку должно быть по крайней
мере в несколько десятков раз меньше.
В течение 6 недель постнатального развития мыши и кроли-
ка число уникальных последовательностей нуклеотидов ДНК, с
которых транскрибируется РНК, увеличивается в головном моз-
ге и уменьшается в печени, почках, селезенке [Brown, Church,
1972]. Если увеличение числа активных генов в ходе постна-
тального развития головного мозга можно объяснить продол-
жающейся дифференцировкой его клеточных типов, то уменьше-
ние числа активных уникальных генов в других органах пока
не поддается какому-либо удовлетворительному объяснению.
Дифференцировку клеток можно рассматривать как резуль-
тат ядерно-цитоплазматических взаимодействий — генотипа
(ядра) и внутренней среды самой клетки, которая создается в
результате действия генов, а также межклеточных взаимодей-
ствий и других внешних по отношению к этой клетке факторов,
в частности гормонов. Бовери [Boveri, 1904] еще в начале на-
шего столетия высказал мысль, что цитоплазма определяет дея-
тельность клеточных ядер, т. е. цитодифференцировка зависит
от активности ядра, обусловленной, в свою очередь, цитоплаз-
мой.
Эмбриологами было установлено неодинаковое пространст-
венное распределение различных веществ в цитоплазме яйце-
клетки, вследствие чего при дроблении зиготы в бластомеры по-
падает разное количество тех или иных веществ, т. е. цитоплаз-
ма бластомеров оказывается различной. В результате этих
наблюдений было сделано заключение, что неодинаковая актив-
ность генов в разных клетках зависит от цитоплазмы. Морган
[Morgan, 1934] сформулировал следующую гипотезу: диффе-
ренцировка клеток обусловлена активностью разных генов од-
ного и того же генома. После того как было показано, что мате-
риальным носителем генетической информации является ДНК,
содержание которой оказалось одинаковым независимо от диф-
ференцировки соматических клеток одного и того же организма
[Mirsky, Ris, 1949], эта гипотеза получила дальнейшее развитие
[Stedman, Stedman, 1950; Mirsky, 1951].
Тот факт, что все дифференцирующиеся соматические клет-
ки одного организма имеют идентичный генотип, свидетельствует
о дерепрессии -разных генов в ходе дифференцировки различных
клеточных типов, возникающих из тотипотентных клеток ранне-
го зародыша. В начале эмбриогенеза важную роль в актива-
155
Рис. 37. GST-гипотеза клеточной диф-
ференцировки [Manner, 1971]
Объяснения см. в тексте
ции генов играют цитоплазма-
тические различия бластоме-
ров, затем — межклеточные
взаимодействия и на более
поздних стадиях онтогенеза —
гормональные влияния (см.
гл. 2). Ю. М. Оленов [1970] и
Ю. Б. Вахтин [1974] предложи-
ли понятие эпигеномной на-
следственности для объясне-
ния тех изменений функцио-
нальной активности генома, ко-
торые возникают в ходе цито-
дифференцировки и передают-
ся в ряду клеточных поколе-
ний.
Многие факты свидетель-
ствуют о том, что регулятора-
ми активности генов являются вещества, синтезированные на
предыдущей или более ранних стадиях развития. Продукты
вступивших в действие генов активируют гены, которые контро-
лируют более поздние этапы клеточной дифференцировки. Рат-
тер и соавторы [Rutter е. а., 1968] считают, что в ходе цитодиф-
ференцировки может быть много уровней регуляции активности
генов, один уровень следует за другим, образуя как бы каскад.
Маннер [Manner, 1971] предложил GST-гипотезу клеточной
дифференцировки, согласно которой все соматические клетки раз-
вивающегося эмбриона содержат гены, Gb G2, G3, ..., Gn, причем
ген Gi вступает в действие раньше гена G2, а ген G2 раньше
гена G3 и так далее (рис. 37). Каждый ген активируется опреде-
ленным веществом (стимулом). Следовательно, для вышеука-
занных генов должны быть стимулы Sb S2, S3, ..., Sn. Каждый
стимул действует в конкретный период развития Т (Тн Т2,
Т3, .. , Тп). Если во время 1 (TJ присутствует вещество 1 (SJ, то
ген 1 (GJ вступает в действие и клетка дифференцируется в кле-
точный тип 1 (CJ. В случае отсутствия в это время (TJSt ген
1 остается репрессированным и клетка смещается в новую вре-
менную фазу Т2. Если в течение Т2 действует S2, то ген 2 акти-
вируется и клетка дифференцируется в тип 2. Наконец, в случае
отсутствия вещества 2 (S2) ген 2 также остается репрессирован-
ным, а если присутствует S3 во время 3 (Т3), то ген 3 активиру-
ется и клетка дифференцируется в тип 3.
Автор этой гипотезы не предусматривает того факта, что на-
чало действия гена зависит от стадии развития клетки, от эф-
фектов других генов, дерепрессированных ранее. Время активи-
рования гена определяется прохождением клеткой предыдущих
этапов дифференцировки, контролируемых другими генами.
Если по какой-то причине ген 2 остался репрессированным, то
156
клетка не перейдет на следующий уровень дифференцировки и
ген 3 не будет дерепрессирован. Поэтому маловероятно утвержде-
ние Маннера [Manner, 1971] о том, что если ген 1 не будет дереп-
рессирован, то на следующей временной фазе активируется ген 2
или если и этот ген не будет дерепрессирован, то позднее
активируется ген 3. Если такая точка зрения правомочна, то
только для самых ранних стадий развития, когда клетки в той
или иной степени сохраняют тотипотентность.
После того как клетки эмбриона становятся на определенный
путь дифференцировки, время вступления в действие каждого
гена подготавливается всем предыдущим ходом развития дан-
ной клетки. Так, например, у эмбрионов мышей генотипа fi/fi
ог/ог мутантный ген fi, вступая в действие раньше гена ог, за-
медляет скорость пролиферации клеток зачатка сетчатки и тем
самым сдвигает время активации гена ог с 10-х на 11-е сутки
эмбрионального развития. У 10-суточных эмбрионов fi/fi ог/ог
ген ог не действует в клетках зачатка сетчатки, так как послед-
ний в результате активности гена fi еще не достигает соответ-
ствующей стадии развития. Размеры зачатка сетчатки у эмбрио-
нов fi/fi ог/ог этого возраста меньше, чем в норме [Конюхов,
Вахрушева, Осипов, 1970; Konyukhov, Sazhina, 1975].
Как уже рассматривалось в гл. 2, для регуляции генной ак-
тивности большое значение имеют межклеточные взаимодей-
ствия, которые, в частности, определяют время дерепрессии тка-
неспецифических генов или проявления их эффектов. У 'мышей
ог/ог mi/mi экспрессия гена ог проявляется на более поздних
стадиях развития сетчатки, чем у эмбрионов ог/ог +/+. Эффек-
ты гена ог наблюдаются у 10-дневных эмбрионов ог/ог +/ + , а
у эмбрионов ог/ог mi/mi их удается обнаружить только с 12 су-
ток эмбриогенеза [Konyukhov, Sazhina, 1966]. У эмбрионов мы-
шей, гомозиготных по генам fi и mi, ген mi полностью подавляет
эффекты гена fi начиная с 10 суток эмбрионального развития [Ко-
нюхов, Вахрушева, Осипов, 1971]. Можно предполагать, что из
пигментного эпителия, гиперплазированного в результате влия-
ния па него пораженной геном mi эктомезенхимы, переходит в
сетчатку определенное вещество, которое стимулирует рост сет-
чатки и тем самым подавляет экспрессию гена ог или fi.
Уиссон [Whisson, 1970а] полагает, что активность хромосом-
ных генов может зависеть от нехромосомных реплицирующихся
систем, в частности митохондрий. Нехромосомные наследствен-
ные факторы, по мнению автора, взаимно ингибируют друг дру-
га в оплодотворенном яйце. В ходе дробления зиготы и дальней-
шего деления клеток некоторые нехромосомные наследственные
факторы теряются, что приводит к дерепрессии или, наоборот, ре-
прессии определенные хромосомные гены, в результате чего и
происходит клеточная дифференцировка. Появление злокачест-
венных изменений автор рассматривает как процесс, аналогичный
Цитодифференцировке, но обусловленный большей потерей
157
нехромосомных наследственных факторов. Хотя автор и получил
некоторые факты, подкрепляющие его гипотезу [Whisson,
1970b], она остается в большой степени умозрительной. Если
допустить правомерность этой гипотезы, то следует признать
существование механизма, обеспечивающего закономерную по-
терю определенных нехромосомных наследственных факторов в
ряду клеточных делений. Однако в настоящее время мы не рас-
полагаем данными в пользу наличия такого механизма.
В исследованиях по гибридизации разных видов Xenopus
было установлено, что митохондриальная ДНК наследуется ци-
топлазматически и матерклинно. Большая часть митохондрий
дробящейся зиготы идет в соматические клетки, а из небольшой
фракции митохондрий яйца, которая попадает в цитоплазму жен-
ских первичных половых клеток, образуются все митохондрии
ооцитов следующей генерации [Dawid, Blacklcr, 1972]. У амфи-
бий митохондриальный геном не активен до стадии гаструлы
[Chase, Dawid, 1972]. Митохондриальные гепы у мыши активи-
руются в ходе дробления. Однако проведенные эксперименталь-
ные исследования показали, что развитие эмбриона мыши до
стадии бластоцисты не зависит от активности митохондриальных
генов [Piko, Chase, 1973].
В последнее время Каплан и Ордахл [Caplan, Ordahl, 1978]
предложили модель необратимой репрессии генов, согласно ко-
торой уменьшение потенций развития дифференцирующихся кле-
ток может быть результатом прогрессивно увеличивающейся
репрессии ранее активных генов. По мнению этих авторов, появ-
ление дифференциальной генной экспрессии в ходе развития раз-
ных клеточных систем обусловлено не избирательной (селектив-
ной) активацией, или дерепрессией, тканеспецифических генов, а
наоборот, ограничением или сужением транскрипционных потен-
ций клеток. Авторы полагают, что в оплодотворенном яйце все
гены транскрибируются, но скорость транскрипции разных генов
не одинакова, вследствие чего экспрессии многих генов не на-
блюдаются.
Следует отметить, что в настоящее время подавляющее боль-
шинство фактов свидетельствует в пользу другой модели — се-
лективной активации генов в разных дифференцирующихся кле-
точных системах. Браше [Brachct, 1975] отмечает, что за послед-
ние два десятилетия сделан громадный прогресс в изучении про-
цессов клеточной дифференцировки. Он подчеркивает, что диффе-
ренцировка клеток — результат специфической активации генов,
но молекулярные механизмы активации остаются неясными.
Детерминация, индукция и компетенция
В эмбриологии есть понятие «проспективные потенции тка-
ни», т. е. чем может стать та или иная ткань в соответствующих
условиях развития. Так, например, зародышевые листки при
158
культивировании их в изолированном состоянии обладают раз-
личными потенциями к развитию. Энтодерма в любых условиях
дифференцируется только в кишечник и его производные; экто-
дерма образует обычно эпителий; мезодерма, как правило, диф-
ференцируется в хорду и мышцы. В ходе развития происходит
постепенно сужение проспективных потенций и зародыш разде-
ляется на все большее число зачатков, имеющих все более узкие
возможности для дальнейшей специализации. Так, мезодерма
расчленяется на хорду, зачатки мышц, почек и сердца, а также
мезенхиму и кровяные клетки.
Под детерминацией эмбриологи понимают сужение проспек-
тивных потенций клеточных систем, т. е. фиксирование их раз-
вития в определенном направлении. Если процесс детерминации
имел место, то соответствующие части эмбриона становятся де-
терминированными. Другими словами, детерминация — пред-
шествующий дифференцировке «выбор» клеткой определенного
пути развития из ряда возможных, к которым она компетентна,
Шпеман [Spemann, 1938] писал, что детерминация есть при-
чинная обусловленность будущей судьбы частей зародыша,
д. п. Филатов [1934] определял детерминацию как процесс воз-
действия одних частей эмбриона на другие его части, благодаря
чему последние при наличии определенных условий приобретают
способность к дальнейшему развитию.
Экспериментально-эмбриологическими работами, выполнен-
ными на позвоночных животных, показано, что детерминация осу-
ществляется в результате эмбриональной индукции [см. Spe-
mann, 1938; Saxen, Toivonen, 1962; Игнатьева, 1971]. Так, при
помощи реципрокных трансплантаций презумптивных эпидер-
миса и нервной пластинки между эмбрионами тритона (Triturus
taeniatus) на стадии ранней гаструлы было установлено, что
нервная система в целом детерминируется в конце гаструляции,
хотя развитие ее отдельных частей детерминируется позднее.
Явление детерминации заключается в том, что та или иная
ткань зародыша после воздействия соответствующего индуктора
способна к самодифференцировке. При этом последняя может
наступить не сразу, а через некоторое время. Способность де-
терминированных тканей к дифференцировке зависит от нали-
чия минимальной массы клеток. Если не имеется необходимого
Для дальнейшего морфогенеза числа клеток, то дифференциров-
ка не наступает [Saxen, Toivonen, 1962].
Детерминация и дифференцировка выступают как два этапа
развития: во время детерминации происходит программирова-
ние клеток на определенный путь развития, а в ходе дифференци-
ровки осуществляется реализация этой программы — возникают
биохимические и морфологические различия между разными ти-
пами клеток. Эмбриологи уже давно объясняли тканевую детер-
минацию химической дифференцировкой, которая предшеств
морфологически видимым признакам дифференцировки. Гроб-
159
стейн [Grobstein, 1959] считает излишним понятие детермина-
ции, рассматривая этот процесс как один из этапов клеточной
дифференцировки.
Мы не знаем, какие изменения происходят в клетках во вре-
мя их детерминации и какие процессы необходимы, чтобы детер-
минированная клетка встала на путь дифференцировки. Чрезвы-
чайно важен вопрос о том, какие изменения претерпевает геном
клеток в связи с их детерминацией. Н. Г Хлопин [1949], по-ви-
димому, впервые сблизил понятие детерминации с наследствен-
ностью, определив детерминацию как «тканевую наследствен-
ность».
Клетки имагинальных дисков, из которых образуются различ-
ные дефинитивные органы дрозофилы, детерминируются на очень
ранних этапах эмбриогенеза. Каждый диск образуется из 10—
30 родоначальных клеток, которые во время личиночного перио-
да многократно делятся, в результате чего число клеток в от-
дельном диске увеличивается до 20 000—50 000. Несмотря на
многократные митотические деления, каждая клетка диска со-
храняет способность к образованию того или иного дефинитив-
ного органа, хотя клетки морфологически остаются в недиффе-
ренцированном эмбриональном состоянии. Экспериментально
было установлено, что все клетки диска являются детерминиро-
ванными и диск не содержит каких-либо интерстициальных или
недетерминированных клеток [см. Hadorn, 1972].
Возникновение детерминации обусловлено межтканевыми
взаимодействиями (см. раздел «Межклеточные влияния» в гл. 2).
Индукторами клеточной дифференцировки являются специфиче-
ские вещества, обладающие строго направленным действием
[Saxen, Toivoncn, 1962; Вольф, 1971].
Темин [Temin, 1971], основываясь на открытии у РНК-содер-
жащих онкогенных вирусов обратной транскриптазы (РНК-за-
висимой ДНК-полимеразы), высказал «протовирусную» гипотезу
механизма эмбриональной индукции. Он полагал, что в основе
эмбриональной индукции может лежать перенос цитоплазмати-
ческой РНК из индуцирующих клеток в индуцируемые. В по-
следних на тлипй «ппптовицусной» РНК, благодаря обратной
транскриптазе, синтезируются соответствующие молекулы ДНК,
что приводит в конечном итоге к продукции специальных типов
иРНК. Для подтверждения этой гипотезы необходимо твердо
установить, во-первых, переход РНК из одних клеток эмбриона
в другие, а во-вторых, присутствие обратной транскриптазы в
клетках эмбрионов.
Возможность перехода РНК из одной клетки в другую пока-
зана при культивировании in vitro фибробластов мыши [Kolod-
пу, 1972]. В исследованиях с эксплантированными ранними кури-
ными зародышами на стадии бластодермы было обнаружено, что
добавление в культуру препаратов РНК, полученных из опреде-
ленных органов, «индуцирует» формирование соответствующих
160
органов [Hillman, Niu, 1963]. Диспанде и соавторы [Deshpande
с. а., 1973] показали, что препараты РНК из сердца кур, обла-
дающие такого рода «индуцирующим» действием, представляют
собой иРНК. Интересно отметить, что добавление иРНК, полу-
ченных из тканей сердца теленка, приводило к образованию
пульсирующей сердечной ткани в куриных бластодермах при-
мерно в таком же проценте случаев, как и иРНК из сердца кур.
Авторы этих исследований интерпретируют полученные ими дан-
ные как результат индукций иРНК, которые активируют соот-
ветствующие тканеспецифические гены в клетках зародыша. Од-
нако таким наблюдениям можно найти и другое объяснение:
иРНК, проникая в клетки раннего эмбриона, вызывают синтез
определенных тканеспецифических белков, в результате чего и
происходит образование соответствующих структур. Такие мо-
дельные опыты, очевидно, не отображают истинных механизмов
индукционных процессов, которые имеют место в процессе нор-
мального эмбриогенеза.
Тайлер [Tyler, 1969] полагал, что в основе детерминации ле-
жит синтез клетками долгоживущих «маскированных» иРНК.
Тканеспецифические гены вступают в действие к моменту детер-
минации, но процесс трансляции на иРНК наступает позднее,
когда появляются признаки дифференцировки. По мнению авто-
ра, у ранних эмбрионов иРНК, как правило, переходят из ядра
в цитоплазму в неактивной (маскированной) форме и становятся
активными с наступлением процесса дифференцировки клеток.
Однако сам же автор отмечал, что его гипотеза встречает ряд
возражений. В частности, с ее позиций трудно объяснить необхо-
димость последовательного действия нескольких индукторов,
что имеет место в эмбриональном развитии, а также нередко на-
блюдающиеся реципрокные взаимодействия тканей.
Уоддингтон и Робертсон [Waddington, Robertson, 1969] уста-
новили, что детерминация развития имагинального глазного дис-
ка у куколки дрозофилы не обусловлена синтезом маскирован-
ных или неактивных иРНК. У позвоночных также не показано за-
висимости детерминации от маскированных иРНК.
В последние годы некоторые авторы предпочитают называть
детерминированные клетки коммитированными (committed cells),
а процесс детерминации — коммитированием (commitment).
Термин коммитирование имеет такую же смысловую нагрузку,
как уже давно используемый в биологической науке термин де-
терминация. Поэтому вряд ли целесообразно вводить в обиход
этот новый научный термин. Нигоп и Годет [Nigon, Godet, 1976]
считают, что стволовые гемопоэтические клетки позвоночных в
своем развитии проходят предетерминированное (прекоммити-
рованное) и детерминированное (коммитированное) состояния
и стадию дифференцировки (рис. 38). Стимул для предетерми-
нпрованного состояния обеспечивает переход стволовых кле-
ток одного типа — колониеобразующих единиц в селезенке
6 Г>. В Конюхов
161
для
пре де терминации
Стимул для * Стимул для
детерминации дифференцировки Д ифференцировка
Плюрипотентные клетки
с неограниченной прола -
-----срерацисй------?
------ КОЕ-С ......... ? ?
2
Клетки с ограничен-
“нрй пролиферацией
---------КОЕ-Кд--------1
-------- КОЕ - КГ------1
Эритропоэтин - чуДствитсЛб нь/С
-----------— клетки— 2
Возможный период детерминации
синтеза гемоглобина-1
Рис. 38. Схема детерминации гемопоэтических клеток [Nigon, Godet, 1976]
Объяснения см. в тексте
(КОЕ-С) — в стволовые клетки другого типа — колониеобразу-
ющие единицы в культуре (КОЕ-К) эритроидного (КОЕ-КЭ) и
гранулоцитарного (КОЕ-КГ) рядов. На предетерминированной
стадии возможен переход между этими стволовыми клетками.
Однако после стимула для детерминации стволовые клетки эри-
троидного и гранулоцитарного рядоп становятся жестко детер-
минированными и переход между ними уже невозможен. Пере-
ход из детерминированного состояния к стадии дифференциров-
ки обеспечивается, по терминологии авторов, сигналом действия,
или, другими словами, стимулом для дифференцировки. В ре-
зультате этого образуются эритробласты и гранулобласты, диф-
ференцирующиеся в дальнейшем соответственно в эритроциты и
гранулоциты. Природа двух первых стимулов не ясна, а стиму-
лом для дифференцировки, очевидно, является эритропоэтин.
Для развития позвоночных характерна многоступенчатая сме-
на индукторов. Известно 3 этапа индукционных воздействий в
развитии хрусталика: сначала на стадиях поздней гаструлы и
нейрулы переднеголовная (прехордальная) энтомезодерма ока-
зывает индуцирующее влияние на эктодерму, затем глазной
пузырь индуцирует образование хрусталиковой плакоды и пузырь-
ка и на стадии поздней глазной чаши, когда хрусталик отходит
от сетчатки, последняя оказывает индукционное воздействие на
клетки хрусталикового пузырька, а позднее и хрусталикового
эпителия, благодаря чему они начинают превращаться в волок-
на (рис. 39).
X ордомсзадерма
Индукция
Эктодерма
Энгт
Нервная пластинка
Глазной пузырь
Индукция Индукция
Хрустали-
ковая
эктодерма
Зачаток сетчатка
X р усталиковые
волокна
Индукция
Хрустали- Xрустали^
ковал >г ковыи
плакода пузырек
Индукция
Проспек/пивный
роговичный
зпигпелий
Передний
эпителий
роговицы
Рис. 39. Индукционные влияния в ходе развития глаза [Couloinbrc, 1965;
Упрощено)
1G3
6*
У некоторых видов низших позвоночных (амфибий) индукци-
онного влияния энтомезодермы достаточно для инициации диф-
ференцировки хрусталиковых клеток из эктодермы. Однако у
птиц и млекопитающих для формирования хрусталиковой пла-
коды из клеток хрусталиковой эктодермы необходима вторая
индукция со стороны глазного пузыря. Молекулярно-химический
механизм индуцирующего действия энтомезодермы в процессе
нейруляции не известен. Предетерминация хрусталиковой экто-
дермы со стороны энтомезодермы в ходе нейруляции, по-видимо-
му, не является обязательным условием для индукции хрустали-
ка, так как глазной пузырь способен индуцировать этот орган
даже в недетерминированной головной эктодерме [Woerdeman,
1962; Hoperskaya, 1972}.
Индуцирующее влияние презумптивной сетчатки (стенки глаз-
ного пузыря) на хрусталиковую эктодерму осуществляется даже
через миллипоровый фильтр, которым отделяли хрусталиковую
эктодерму от глазного пузыря [Muthukkaruppan, 1965; Jaaske-
lainen, Saxen, 1972]. Однако целлофан, вставленный между глаз-
ным пузырем и хрусталиковой эктодермой, блокирует образова-
ние хрусталика [McKeehan, 1958; Muthukkaruppan, 1965]. Это
свидетельствует о переходе из клеток глазного пузыря в хруста-
ликовую эктодерму молекул какого-то высокомолекулярного ве-
щества. В последние годы в глазном пузыре куриных зародышей
идентифицированы специфические белковые фракции, которые
могут секретироваться во внеклеточную среду и индуцировать
образование лентоидов в культивируемой головной эктодерме
(см. Михайлов, 1978]. Дальнейшие исследования должны пролить
свет на природу этих молекул и механизмы их специфической ак-
тивации генов.
Вскоре после контакта с глазным пузырем клетки хрусталико-
вой эктодермы из кубоидальных превращаются в цилиндриче-
ские, в результате чего образуется характерное утолщение —
хрусталиковая плакода. Методом молекулярной гибридизации
3Н-ДНК, комплементарной к очищенным препаратам 6-кристал-
линовой иРНК, показано, что синтез иРНК для 6-кристаллина
начинается у куриного зародыша на ранних стадиях формиро-
вания хрусталиковой плакоды: через 8—9 ч после индукции хру-
сталика глазным пузырем. Примерно через 4—5 ч после актива-
ции соответствующего гена в клетках формирующейся хрустали-
ковой плакоды удается обнаружить 6-кристаллин [Shinohara,
Piatigorsky, 1976].
Мы исследовали изменение транскрипционной активности ин-
терфазных ядер формирующегося хрусталикового пузырька
мыши при помощи электронно-микроскопического метода, кото-
рый заключается в окрашивании исследуемого материала акри-
диновым оранжевым и последующей его обработке ДНКзой
[Frenster, 1971; Lehmann, Slavkin, 1976]. Акридиновый оранжевый
связывается с транскрипционно активными участками эухрома-
164
тина и проявляется па электронограммах в виде электроноплот-
ных гранул. Такие гранулы не обнаруживаются в конденсиро-
ванном гетерохроматине, в ядрышке и цитоплазме. Этот метод
позволяет исследовать дерепрессию генов в процессе клеточной
дифференцировки. Было установлено, что в интерфазных ядрах
клеток центральной части инвагпнирующей хрусталиковой пла-
коды 9,5-суточных эмбрионов мышей гранул акридинового оран-
жевого содержится вдвое больше, чем в ядрах клеток головной
эктодермы, прилежащей к хрусталиковой плакоде. В ядрах кле-
ток отшнурованного от головной эктодермы хрусталикового пу-
зырька 10-суточных эмбрионов гранул акридинового оранжевого
значительно больше по сравнению с числом таких гранул в ядрах
клеток инвагинирующей хрусталиковой плакоды. Причем в ядрах
клеток проксимальной стенки хрусталикового пузырька, приле-
жащей к зачатку сетчатки, гранул акридинового оранжевого до-
стоверно больше, чем в ядрах клеток дистальной стенки [Коню-
хов, Колесова, 1977]. Следовательно, в ходе формирования хру-
сталиковой плакоды и пузырька происходит дерепрессия новых
генов и повышение транскрипционной активности. На этих ста-
диях развития хрусталика активируются тканеспецифические
гены, контролирующие синтез кристаллинов.
Активация генов для а-крнсталлинов у эмбрионов мыши про-
исходит на ранних стадиях образования хрусталиковой плакоды
в результате индуцирующего влияния глазного пузыря на хру-
сталиковую эктодерму. Причем если индукция произошла даже
в единичных клетках хрусталиковой плакоды, из которых в даль-
нейшем хрусталиковый пузырек не образуется, синтез а-кри-
сталлинов в этих клетках все же устанавливается, хотя и с боль*
шим запаздыванием по сравнению с нормой. Следовательно, ин-
дуцирующее влияние глазного пузыря приводит к дерепрессии
генов для а-кристаллинов, а прохождение нормального морфоге-
неза хрусталика способствует трансляции этих иРНК, в резуль-
тате чего в норме синтез а-кристаллинов начинается вскоре по-
сле индукции хрусталика глазным пузырем. Однако при отсут-
ствии морфогенеза хрусталика для этого требуется примерно
втрое больше времени. Для активации генов у- и р-кристаллинов
необходимо индуцирующее влияние зачатка сетчатки [Конюхов,
Малинина и др., 1978].
Реагирующая ткань после индукции и соответствующей диф-
ференцировки может стать индуктором для другой компетент-
ной ткани. Так, сформировавшийся после индукции глазным пу-
зырем хрусталиковый пузырек оказывает индукционное влияние
на головную эктодерму, в результате чего образуется передний
эпителий роговицы (см. рис. 39). Нервная трубка индуцирует
дифференцировку сомитов. Сомиты, в свою очередь, влияют на
развитие соматоплевральной мезодермы, из которой формиру-
ются грудинные части ребер и мезодермальная часть почек ко-
нечностей. Из вентральных частей сомитов (склеротомов) обра-
165
зуются позвоночник и позвонковые части ребер [Kieny е. а., 1972]..
Мезодермальная часть почки конечности, возникающая в ре-
зультате локального утолщения соматоплевры, индуцирует обра-
зование апикального эктодермального гребня. Последний возни-
кает из эпителия, покрывающего почку конечности эмбриона.
Киени [Kieny, 1960] рассматривает соматическую мезодерму про-
спективных областей почек конечностей как первичный индуктор
формирования конечности. Образовавшись, апикальный эктодер-
мальный гребень оказывает по принципу обратной связи индук-
ционное влияние на дифференцировку мезенхимных клеток
почки конечности.
Взаимодействие клеточных систем в онтогенезе требует стро-
гой временной зависимости в их развитии относительно друг
друга. Индуцирующая ткань всегда более дифференцирована по
отношению к индуцируемой, а последняя должна обладать спо-
собностью (компетенцией) отвечать на индукционные стимулы
в течение строго определенного времени. Если одно из этих ус-
ловий отсутствует, то происходит нарушение нормального раз-
вития. Следовательно, осуществление индукции зависит от прост-
ранственно-временного согласования процессов в обеих взаимо-
действующих системах — индуцирующей и компетентной. Такое
согласование возникло в течение эволюции как результат стаби-
лизирующего отбора [Шмальгаузен, 1942}. Мутации генов могут
нарушать это согласование, вследствие чего происходит распад
(дезинтеграция) корреляционной системы и возникновение мно-
гих отдаленных эффектов того или иного мутантного гена (см.
раздел «Плейотропня» в гл. 1).
Мутантные клетки могут утрачивать индуцирующую способ-
ность, вследствие чего не происходит индукции и дифференциров-
ки компетентных клеток. Хамфри [Humphrey, 1972] в опытах с ре-
ципрокной трансплантацией зачатков различных органов между
нормальными и мутантными эмбрионами аксолотля установил,
что аутосомный рецессивный ген cardiac lethal (с) действует в
клетках энтодермы. Последняя не оказывает соответствующего
индукционного влияния на формирующую сердце мезодерму,
вследствие чего у мутантов не образуется нормального функцио-
нирующего сердца и они погибают на поздних стадиях эмбриоге-
неза. Пересадка формирующей сердце мезодермы от мутантов к
нормальным эмбрионам приводила к развитию нормально функ-
ционирующих сердец, а при трансплантации такой мезодермы от
нормальных эмбрионов к мутантным наблюдался мутантный фе-
нотип: образовывались нефункционирующие (непульсирующие)
сердца. У мутантов в результате отсутствия кровообращения воз-
никают аномалии других органов. При парабиозе эмбриона гено-
типа с/с с нормальным (+/+) у мутанта все органы развива-
лись нормально за исключением сердца, формирование которого
останавливалось на такой же ранней стадии, как и у одиночно
развивающихся мутантных зародышей.
166
Следовательно, ген cardiac lethal у эмбрионов аксолотля пер-
вично нарушает развитие энтодермальных клеток, индуцирующих
образование сердца, а отсутствие функционирующего сердца вто-
рично приводит к появлению дефектов других органов, что в ко-
нечном итоге обусловливает гибель этих мутантных эмбрионов.
Электронно-микроскопическое изучение дифференцировки клеток
передней энтодермы — индуктора сердца — показало, что у му-
тантных зародышей развитие передней энтодермы происходит
значительно скорее, чем в норме. Это приводит к тому, что к ста-
дии формирования сердца мутантная энтодерма уже утрачивает
способность индуцировать мезодермальные клетки к образова-
нию функционирующего миокарда [Lemanski е. а., 1977].
Методом культуры органа была выявлена зависимость диф-
ференцировки метаиефрогенной мезенхимы, идущей на образо-
вание почек, от индукционных влияний со стороны зачатка моче-
точника [Grobstein, 1954]. Глюксон-Уелш и Рота [Gluecksohn-Wa-
elsch, Rota, 1963] с помощью реципрокных комбинаций метане-
фрогеиной мезенхимы и зачатка мочеточника от нормальных и
мутантных зародышей в культуре органа установили, что недо-
развитие почек у мышей генотипа Sd/ + и особенно Sd/Sd обу-
словлено замедленным ростом мочеточника.
С другой стороны, известны случаи, когда та или иная ткань
мутантного эмбриона не обладает соответствующей компетен-
цией. Так, у эмбрионов аксолотлей, гомозиготных по аутосом-
ному рецессивному гену eyeless (е), глазные пузыри не образу-
ются, что обусловлено первичным поражением небольшого участ-
ка нервной пластинки, включающего клетки зачатка глаза. Ре-
ципрокные пересадки презумптивной передней части нервной
пластинки (крыши бластоцеля) между нормальным и гомозигот-
ным по данному мутантному гену зародышами, находящимися
на стадии поздней бластулы, показали, что глазные пузыри не
возникают из мутантной эктодермы. Если трасплантировали пре-
зумптивную прехордальную мезодерму (дорсальную губу бла-
стопора) от нормальных (+/+) к мутантным (е/е) зародышам
на стадии ранней гаструлы, то глаза также не развивались. Од-
нако в опытах с пересадкой прехордальной мезодермы от му-
тантов нормальным зародышам происходило Формирование глаз.
Эти данные показывают, что мутантная прехордальная мезодер-
ма обладает нормальной индукционной способностью, а отсутст-
вие образования глаз обусловлено первичным действием му-
тантного гена eyeless в эктодермальных клетках ранних эмбрио-
нов аксолотля, вследствие чего мутантные клетки не обладают
соответствующей компетенцией к индукционным влияниям [Van
Deusen, 1973]. Мутантный геи ей у курицы, наоборот, удлиняет
период компетенции эктодермальных клеток почки конечности
по сравнению с нормой, вследствие чего возникает второй (экто-
пический) эктодермальный гребень и развиваются добавочные
структуры конечностей (Fraser R. A., Abbott, 1971а, Ь].
167
Клетки имеют специфические особенности в отношении к оп-
ределенным индукционным влияниям, т. е. они уже детермини-
рованы в своем развитии до того или иного индукционного воз-
действия. Так, из клеток нервного гребня возникает хрящевой
череп зародыша (хондрокраииум), причем основание черепа об-
разуют клетки одной части нервного гребня, а висцеральные
дуги — другой. Клетки нервного гребня, из которых возникают
висцеральные дуги, не способны образовывать кости основания
черепа. Если головную часть нервного гребня пересадить в тело
эмбриона, то из нее не образуется хрящевых структур. Сомиты
дают развитие хрящевой основе позвонков, а соматоплевральная
мезодерма — грудине, ребрам и мезодермальной части почки
конечности. При этом, как и в случае с нервным гребнем, клет-
ки «настроены» на определенные индуцирующие стимулы: соми-
ты образуют хрящ в результате индукционного влияния
со стороны спинного мозга, а мезодермальные клетки почки ко-
нечности — вследствие индуцирующих влияний со стороны апи-
кального эктодермального гребня [см. Zwilling, 1972]. Г В. Лопа-
шов и О. А. Хопёрская [1977] пишут, что не существует «недетер-
минированных» тканей — все они имеют свой путь развития, пре-
допределенный внутриклеточными факторами, и это характери-
зует состояние их компетенции.
По мнению А. А. Нейфаха [1970], компетенцию (способность
клеток отвечать на действие индуктора) следует рассматривать
как набор нескольких регуляторных белков в клетке и действие
фактора, вызывающего дифференцировку клеток, возможно,
обусловлено активацией одного из таких регуляторных белков.
Дэвидсон и Бриттен [Davidson Е. Н., Britten, 1971] полагают, что
компетенция может быть обусловлена синтезом особого «чув-
ствительного» белка, который синтезируется в клетке в резуль-
тате действия на нее ткани-индуктора. Чувствительный белок
влияет на чувствительный локус, инициирующий транкрипцию
главного набора генов-интеграторов. Между главным набором
генов-интеграторов и другими генами-интеграторами может об-
разоваться замкнутая связь, как бы внутриклеточный замок кор-
реляции. В результате этого в течение ряда клеточных циклов
сохраняется активность главных генов-интеграторов при отсут-
ствии активности соответствующих структурных генов, что, по
мнению авторов, и лежит в основе феномена компетенции. В этой
гипотезе много допущений: в частности, остается недоказанным
главное — наличие генов-интеграторов. Сами же авторы от-
мечают отсутствие каких-либо фактов, подкрепляющих их ги-
потезу.
Эфрусси [Ephrussi, 1972], отмечая неполноту наших знаний
о процессах развития высших организмов, подчеркивает, что в
настоящее время мы не имеем ответа на относительно простые
вопросы, касающиеся заключительной и наиболее доступной для
исследования стадии развития, т. е. дифференцировки в узком
168
смысле этого слова, не говоря уже о детерминации. Саксен и
соавторы [Saxen е. а., 1976], заключая свой обзор данных об ин-
дукционных тканевых взаимодействиях, подчеркивают, что, не-
смотря на многочисленные исследования, молекулярная природа
этих процессов остается неясной.
Пролиферативные и критические клеточные циклы
В стационарных условиях культивирования in vitro клетки мо-
гут длительное время размножаться, сохраняя свой фенотип.
Широко известно сохранение фибробластами присущих им
свойств в течение длительного культивирования. Като и Такая-
ма [Katoh, Takayama, 1977] получили стабильные линии хондро-
генных клеток китайского хомячка, которые в течение 1 года
культивирования in vitro сохраняли признаки хондроцитов. Сле-
довательно, при постоянных условиях культивирования клетки
могут многократно делиться без изменения их фенотипа. Это от-
носится в равной степени к дифференцированным и недифферен-
цированным клеткам. Такие митотические циклы, приводящие к
увеличению числа клеток без изменения их фенотипа, правомоч-
но называть пролиферативными.
Гробстейн [Grobstein, 1966] на симпозиуме по клеточной диф-
ференцировке обратил внимание на существование положитель-
ной корреляции между цитодифференцировкой и процессом ре-
пликации ДНК- Он отметил, что транскрипция может самым не-
посредственным образом зависеть от предшествующей реплика-
ции ДНК. Данные, полученные позднее, подтвердили эту точку
зрения. Было показано наличие тесной корреляции между син-
тезом специфического продукта, дифференцировкой и числом
клеточных делений. При блокировании митотических делений или
репликации ДНК клетки не достигают окончательной дифферен-
цировки [см. Tsancv, Sendov, 1971а].
Эпителиальные клетки молочной железы, продуцирующие
казеин, дифференцируются in vitro в результате последователь-
ного действия трех гормонов: инсулина, гидрокортизона и про-
лактина. Инсулин стимулирует митотическое деление клеток, в
течение которого гидрокортизон индуцирует увеличение комп-
лекса Гольджи и гранулярной эндоплазматической сети. Затем
совместное действие инсулина и пролактина стимулирует продук-
цию казеина. Если стимулированное инсулином деление клеток
блокировать, то дифференцировки клеток не происходит [Mills,
Topper, 1970]. При ингибировании синтеза ДНК в эритробластах
раннего куриного эмбриона синтез гемоглобина не начинается.
Однако если синтез гемоглобина в клетках начался, то инги-
биторы синтеза ДНК уже не оказывают существенного влияния
на данный процесс [Weintraub, 1975]. Это свидетельствует о том,
что хромосома в интерфазном ядре представляет собой очень
стабильную структуру и дерепрессия генов, контролирующих, в
169
Морула
бластула
Га струл а
'Гидрогенная
к л ст на
Хондрогенная
нлетна
двухдневный
змдр ион
Первичная меэен-
аимная нлетна
Миогенная ос- нлетна.
Миогеннаяfl - нлетна
Презумптивный. миодласгг? t
Миовласт (миозин, ан/r?UN
и др.]
'дестидневный
з^дрион
Рис. 40. Гипотетическая схема зависимости дифференцировки некоторых линий
клеток у куриного эмбриона от критических клеточных циклов [Holtzer,
1970b]
Вертикальные стрелки — пролиферативные клеточные циклы, не изменяющие фенотип;
наклонные стрелки — критические (квантальные) митотические циклы, приводящие к из-
менению фенотипа клетки
частности, синтез гемоглобина, происходит при «разрыхлении»,
или деконденсации ДНК, в процессе ее репликации.
Хольцер [Holtzer, 1970а, Ь] предложил выделить два типа
митозов: пролиферативный и критический, или квантальный
(critical, quantal). Увеличение числа клеток без изменения их
фенотипа обусловлено пролиферативными митозами, а прохож-
дение клеткой этапов дифференцировки — определенным числом
критических митозов. Так, например, автор полагает, что пер-
вичная мезенхимная клетка должна пройти 4 последовательных
критических клеточных цикла, каждый из которых продвигает ее
дифференцировку в направлении миобласта, когда начинается
синтез специфических мышечных белков (рис. 40).
Хольцер '[Holtzer, 1970b] допускает, что в клетках, предше-
ствующих миобласту (миогенных а- и (3-клетках и презумптив-
ном миобласте), синтезируются какие-то специфические белки,
которые должны быть отличны от миозина, актина и тропомиози-
на. Миобласты выходят из митотического цикла в Gf-периоде и
сливаются друг с другом, образуя многоядерные мышечные
трубочки. Синтез миозина начинается в одноядерных миоблас-
тах перед их слиянием [Bayne, Simpson, 1977]. Сразу после
слияния миобластов скорость синтеза миозина возрастает в 50—
100 раз. Такое же увеличение синтеза миозина наблюдается и в
неслившихся миобластах при уменьшении концентрации в куль-
туральной среде сыворотки и эмбрионального экстракта — сти-
муляторов клеточных делений [Emerson, Beckner, 1975]. После
170
слияния миобластов наблюдается резкое повышение активности
креатинфосфокиназы. При этом изозим креатинфосфокиназа I
(ВВ) замещается на форму III (ММ), что указывает на подавле-
ние экспрессии гена креатинфоскпназы В и включение в действие
гена креатинфосфокиназы М [Morris е. а., 1972].
У эмбрионов мышей генотипа mdg/mdg наблюдается наруше-
ние развития скелетных мышц: одноядерные миобласты не сли-
ваются друг с другом, вследствие чего не образуются многоядер-
ные мышечные трубочки. В дальнейшем все скелетные мышеч-
ные клетки дегенерируют. Напротив, сердечная и гладкая му-
скулатура у мутантов развивается нормально. Электронно-ми-
кроскопическое изучение показало, что наиболее ранним морфо-
логическим отклонением от нормы у пораженных миобластов
эмбрионов mdg/mdg являются ультраструктурные нарушения сар-
коплазматической сети [Platzer, Gluecksohn-Waelsch, 1972]. Эти
данные свидетельствуют о независимом генетическом контроле
дифференцировки скелетных мышц, с одной стороны, и сердеч-
ной и гладкой мускулатуры — с другой.
Опытами с маркировкой клеток у зародышей амфибий было
установлено, что родоначальные, или стволовые, клетки, из ко-
торых образуется зачаток сетчатки, локализованы компактной
группой в нервной пластинке [Jacobson, 1959]. У Xenopus laevis
ганглиозные клетки, промежуточные нейроны (биполяры, ама-
криновые п горизонтальные клетки) и фоторецепторы в цен-
тральной зоне зачатка сетчатки возникают между 28-й и 32-й
стадиями развития с интервалами примерно в один клеточный
цикл [Jacobson, 1968]. 5-бромдезоксиуридин блокирует вступле-
ние клеток в критические клеточные циклы, но позволяет им про-
ходить пролиферативные клеточные циклы. Обработка глаза
X. laevis 5-бромдезоксиуридином на 26-й стадии блокирует воз-
никновение палочек, колбочек и промежуточных нейронов, но не
препятствует нормальной дифференцировке ганглиозных клеток
[Bergey е. а., 1973]. Эти данные свидетельствуют о том, что в за-
чатке сетчатки должны быть по крайней мере два различных ти-
па родоначальных клеток, один из которых дает возникновение
ганглиозным клеткам центральной зоны.
Хант [Hunt, 1975] подчеркивает, что многие факты указывают
на большую стабильность направления развития нервных кле-
ток. Однако если увеличить продолжительность клеточных цик-
лов, то родоначальные клетки не дифференцируются в нейроны.
С помощью радиоавтографии нами было показано, что мутант-
ный ген fi в гомозиготном состоянии удлиняет пресинтетический
период клеточного цикла в зачатке сетчатки мыши [Konyukhov,
Sazhina, 1971]. Мы считали интересным исследовать выход кле-
ток из митотического цикла в дифференцировку входе гистогене-
за сетчатки у нормальных особей (генотип +/+) и мышей, гомо-
зиготных по гену fi. С этой целью самкам мышей fi/fi, скрещен-
ным с самцами fi/fi, вводили однократно 3Н-тимидин в дозе
171
Рис. 41. Гистограммы, показы-
вающие изменения числа силь-
но меченых ядер в ганглиоз-
ном слое сетчатки эмбрионов
мышей 4-/4- (а) и fi/fi (б) че-
рез 72 ч после введения 3Н-ти-
мидина на различных сроках
развития [Konyukhov, Sazhi*
па, 1976]
По оси абсцисс — возраст эмбрио-
нов. дин; по оси ординат — индекс
лыю меченых ядер, %
Рис. 42. Гистограммы, показы-
вающие изменения числа силь-
но меченых ядер в общем
ядерном слое сетчатки эмбрио-
нов мышей 4-/4- (и) и fi/fi (б)
через 72 ч после введения 3Н-
тимидпна на различных сроках
развития [Konvukhov, Sazhina,
1976]
Обозначения осей на рис. 41
5 мкКи/г веса тела на 11 — 17-е сутки беременности. Самок за-
бивали через 72 ч после инъекции изотопа или на 15-й день после
рождения. Сильно меченные ядра, содержащие не менее 20 зерен
серебра, рассматривались как ядра вышедших из митотического
цикла в дифференцировку клеток сетчатки.
Результаты проведенной нами работы показали, что у эмбри-
онов мышей генотипа fi/fi наблюдается запаздывание выхода
клеток развивающейся сетчатки в дифференцировку. У нормаль-
ных зародышей ( + /+) некоторые ганглиозные клетки централь-
ной зоны сетчатки выходят в дифференцировку на 11-й день
эмбриогенеза, тогда как у эмбрионов fi/fi этот процесс начина-
ется только на 12-й день, т. е. на сутки позже (рис. 41). Выход
в дифференцировку других типов клеток сетчатки у мутантных
эмбрионов также запаздывает по сравнению с нормой (рис. 42).
В периферической зоне сетчатки выход клеток из митотического
цикла в дифференцировку у эмбрионов fi/fi начинается на 2 дня
позже по сравнению с этим процессом у нормальных зародышей.
Число дифференцирующихся клеток в сетчатке эмбрионов fi/fi
на всех исследованных стадиях развития было меньше, чем в
норме. Изучение продолжительности и параметров клеточного
цикла у 15-суточных эмбрионов показало, что у мутантов сетчат-
ка менее зрелая по сравнению с сетчаткой эмбрионов +/ + . По-
следовательность выхода из митотического цикла в дифференци-
ровку разных типов клеток в сетчатке эмбрионов fi/fi такая же,
172
как в норме [Konyukhov, Sazhina, 1976]. Следовательно, ген fi,
увеличивая продолжительность клеточных циклов, сдвигает у
мутантов прохождение дифференцирующимися клетками сетчат-
ки критических митозов на более поздние стадии развития.
В сетчатке 10-дневных эмбрионов + / + продолжительность
клеточного цикла равняется 10 ч и все клетки делятся [Konyuk-
hov, Sazhina, 1971]. Если принять во внимание, что зачаток сет-
чатки у мыши возникает на 8-й день эмбриогенеза и на более
ранних стадиях развития сетчатки генерационное время пример-
но такое же (10 ч) или несколько меньше, то до выхода клеток
из митотического цикла в дифференцировку они должны разде-
литься примерно 10 раз. В этот период развития сетчатки, оче-
видно, имеют место в основном пролиферативные митозы, а кри-
тические клеточные циклы, обусловливающие репрограммиро-
вание функционирующего генома клеток, начинаются в сетчатке
после 10 дней эмбриогенеза.
На ранних стадиях органогенеза вступление клеток в крити-
ческие митотические циклы происходит, вероятно, после дости-
жения зачатком органа определенного размера. Необходимое
число клеток в зачатке органа, или его минимальная масса, до-
стигается в результате пролиферативных митозов. У 10-дневных
эмбрионов fi/fi генерационное время клеток зачатка сетчатки на
2 ч больше, чем в норме [Konyukhov, Sazhina, 1971]. Поэтому
клетки развивающейся сетчатки у мутантов завершают первые
10 клеточных циклов позднее по сравнению с нормой.
Как указывалось выше, в сетчатке 11-дневных эмбрионов fi/fi
в отличие от нормальных зародышей не наблюдается выхода
ганглиозных клеток из митотического цикла в дифференцировку.
Этот процесс у мутантов начинается только с 12 дней эмбриоге-
неза. Более существенные нарушения у мутантов отмечены в вы-
ходе в дифференцировку других типов клеток, что, возможно,
обусловлено запаздыванием дифференцировки ганглиозных кле-
ток, которые, по мнению Ханта [Hunt, 1975], влияют на диффе-
ренцировку позднее развивающихся клеток сетчатки.
Синтез тканеспецифических белков, в частности миозина и
хондромукопротеида, отсутствует при подавлении синтеза ДНК
на определенных стадиях дифференцировки соответствующих ли-
ний клеток. Эти факты, как полагают Хольцер и соавторы [Holt-
zer е. а., 1972], указывают на то, что на хромосомном уровне в
критические клеточные циклы скорее происходит дерепрессия,
чем репрессия генов. Если клетки тех или иных линий не прохо-
дят критических клеточных циклов, то тканеспецифические гены
не активируются и, следовательно, не происходит синтеза соот-
ветствующих тканеспецифических белков.
Результаты опытов Шииохары и Пятигорского [Shinohara,
Piatigorsky, 1976] свидетельствуют о том, что у куриных заро-
дышей инициация синтеза б-кристаллиновой иРНК происходит
на Gr и S-фазах первого после индукции хрусталика клеточного
173
цикла. В эмбриогенезе млекопитающих критический митоз для
дерепрессии генов, контролирующих продукцию а-кристаллинов,
также имеет место на ранних стадиях формирования хрустали-
ковой плакоды. В ходе нормального развития хрусталика мыши
клетки, содержащие а-кристаллины, удается впервые обнару-
жить на стадии хрусталикового пузырька, т. е. у 10-дневных за-
родышей (рис. 43; см. вклейку).
У эмбрионов мышей с наследственной анофтальмией (генотип
ey-1/ey-l еу-2/еу-2) устанавливается кратковременный и несовер-
шенный контакт глазного пузыря с хрусталиковой эктодермой.
В отличие от нормы у мутантов глазной пузырь и хрусталиковая
эктодерма отделены друг от друга слоем мезенхимных клеток и
только между центральной областью проспективной хрусталико-
вой плакоды и небольшой группой клеток стенки глазного пузы-
ря мезенхима отсутствует. Развитие хрусталика у мутантов обыч-
но прекращается на стадиях глубоко пнвагинирующей плакоды
или неотшнурованного от головной эктодермы пузырька, что ука-
зывает на недостаточное индукционное влияние со стороны глаз-
ного пузыря на хрусталиковую эктодерму [Chase, Chase, 1941;
Silver, Hughes, 1974]. Как указывалось выше, образование хру-
сталиковой плакоды происходит в результате второй индукции —
действия глазного пузыря на хрусталиковую эктодерму. У 10- и
11-дневных эмбрионов ey-1/ey-l еу-2/еу-2 в клетках аномальной
хрусталиковой плакоды а-кристаллины отсутствуют. Однако у
некоторых 12-дневных и почти у всех 13-дневных мутантных за-
родышей среди эктодермальных клеток, расположенных над об-
ластью деструктированного зачатка глаза, удается обнаружить
содержащие а-кристаллины клетки (рис. 44; см. вклейку).
Эти данные показывают, что активация генов, контролиру-
ющих синтез а-кристаллинов, происходит в результате индукци-
онного влияния глазного пузыря на клетки хрусталиковой экто*
дермы. Критический митотический цикл, в течение которого де-
репрессируются эти гены, должен пройти на ранних стадиях фор-
мирования хрусталиковой плакоды. Для осуществления процесса
дерепрессии генов в компетентных клетках достаточен кратковре-
менный контакт взаимодействующих тканей, в частности глаз-
ного пузыря и хрусталиковой эктодермы, а трансляция иРНК для
тканеспецифических белков может происходить даже при нару-
шении морфогенеза, хотя в этих случаях скорость белкового син-
теза значительно ниже, чем в норме.
Синтез у- и p-кристаллинов начинается соответственно у 11-
и 12-суточных эмбрионов мыши в формирующихся первичных
хрусталиковых волокнах после завершения ими последнего ми-
тотического цикла [Платонов и др., 1976; Конюхов, Малинина
и др., 1978]. В этом случае последний клеточный цикл в прокси-
мальной стенке хрусталикового пузырька должен быть кванталь-
ным для дерепрессии генов у- и p-кристаллинов. При аномаль-
ном морфогенезе хрусталика клетки проксимальной стенки хру-
174
Таблица 9. Последовательность процессов при трансформации клеток радужной
оболочки в хрусталиковые волокна в ходе регенерации хрусталика у тритона
[Yamada, 1972J
Дни после Клеточный
удаления хрусталика цикл Клеточные ссбыти
1—4 ‘Go-G, Активация ядрышка
3-5 S Первая индуцированная репликация ДНК
4—7 м Первый индуцированный митоз
6—11 — Выход из цитоплазмы меланосом. Депигментация
11—13 S, м Последняя репликация ДНК и митоз
12—15 ** Положительная реакция на общий набор кристаллинов
14—17 т Начало дифференцировки хрусталиковых волокон. Положительная реакция на общий набор кристал-
23-35 линов, в частности на у-кристаллины
т Дегенерация клеточных ядер
• —стационарная фаза. — конечная фаза.
сталикового пузырька продолжают интенсивно размножаться и
не происходит их преобразования в первичные хрусталиковые
волокна [Яковлев и др., 1977; Конюхов, Малинина и др., 1978].
При таком нарушении морфогенеза хрусталика, по-видимому,
имеют место лишь пролиферативные митозы. Критический кле-
точный цикл, в течение которого происходит дерепрессия генов
для у- и p-кристаллинов, является последним, после чего клетка
перестает делиться и продвигается к окончательной стадии диф-
ференцировки.
При регенерации хрусталика у тритона клетки краевой зоны
радужной оболочки должны пройти два клеточных цикла преж-
де, чем они начинают синтез специфических хрусталиковых бел-
ков (табл. 9). Причем после двух клеточных циклов необходимо
влияние специального фактора сетчатки [Yamada, 1972].
Некоторые авторы называют критический митоз дифференци-
рующим, подчеркивая тем самым его значение для процессов кле-
точной дифференцировки. Однако вряд ли целесообразно введе-
ние этого дополнительного термина, так как термины «критиче-
ский митоз» или «квантальный митоз» довольно прочно вошли в
научную литературу.
Синтез специфических белков
В основе дифференцировки клеток лежит синтез специфиче-
ских белков, которые определяют характерное строение и спе-
циализированные функции тех или иных клеточных систем.
175
В хрусталике синтезируются кристаллины, в печени — альбумин,
в клетках эпидермисакожи — кератины, в мышце — актин, мио-
зин и миоглобин, в щитовидной железе — тироглобулин, в мо-
лочной железе — казеин и лактоглобулин, в слизистой оболочке
желудка — пепсин, в поджелудочной железе — трипсин, химо-
трипсин, амилаза, инсулин и т. д. Синтез специфических белков
начинается на ранних стадиях формирования органа, а в процес-
се его развития увеличивается число специализированных клеток
и возрастает количество тканеспецифических белков. У человека
синтезируется примерно 100 тыс. разных белков, составляющих
70% сухого веса.
Жакоб и Моно [Jacob, Monod, 1963] подчеркивают, что клетки,
имеющие один и тот же геном и синтезирующие разные^белки,
следует рассматривать как различно дифференцированные. По-
явление специфических белков в процессе клеточной дифференци-
ровки обусловлено дерепрессией генов и синтезом соответству-
ющих иРНК.
Многие факты указывают на то, что один и тот же трансля-
ционный аппарат может использоваться разными иРНК. Так, вве-
дение кроличьих глобиновых иРНК и гемина в цитоплазму ооци-
та лягушки приводит к эффективному синтезу кроличьего гемо-
глобина, т. е. в цитоплазме ооцита лягушки идет не только
трансляция глобиновых иРНК, но также и сборка глобиновых
цепей в тетрамеры [Lane е. а., 1971]. Ноулэнд с соавторами [Know-
land е. а., 1973] вводили иРНК для коллагена мыши в ооциты
Xenopus laevis и наблюдали синтез этого тканеспецифического
белка. Трансляция иРНК для кристаллинов хрусталика быка
происходит в бесклеточной системе асцитных клеток Кребса II
[Mathews е. а., 1972] и лизате кроличьих ретикулоцитов [Berns
е. а., 1972].
В клеточных системах имеет место контроль над реализаци-
ей генетической информации на уровне трансляции. Так, Леви
и соавторы [Levy е. а., 1970] показали, что присутствующие в ци-
топлазме дифференцированных клеток белки могут блокировать
процесс трансляции некоторых иРНК. Они выделили из клеток
печени кислый белок, который подавлял синтез гемоглобина на
уровне трансляции, но не ингибировал синтеза сывороточного
альбумина в такой же бесклеточной системе. Скорость синтеза и
количество белка в клетке в большей степени зависят как от
трансляционных, так и посттрансляционных процессов.
Кристаллины. Наиболее хорошо изученные структурные бел-
ки — кристаллины — синтезируются в ходе дифференцировки
хрусталиковых волокон. Формирование хрусталика начинается
с утолщения головной или, точнее, хрусталиковой эктодермы над
глазным пузырем, в результате чего образуется хрусталиковая
плакода, которая впячивается в полость глаза и замыкается в
пузырек. После отделения хрусталикового пузырька от эктодер-
мального эпителия клетки его задней стенки, прилежащей
176
к зачатку сетчатки, удлиняются и заполняют всю полость пу-
зырька, образуя первичные хрусталиковые волокна. Передняя
стенка хрусталикового пузырька дает возникновение хрусталико-
вому эпителию, за счет размножения и дифференцировки клеток
которого происходит образование вторичных хрусталиковых во-
локон и рост хрусталика в течение эмбриональной и значитель-
ной части постэмбриональной жизни. В экваториальной области
формирующегося хрусталика можно видеть постепенный переход
клеток эпителия в высокоспециализированные хрусталиковые во-
локна.
По молекулярному весу, подвижности в электрическом поле и
антигенным свойствам различают а-, 0- и у-кристаллины, а у
птиц и рептилий еще также б-кристаллины. Молекулярный вес
а-кристаллинов около 1 000 000, у-кристаллинов — 20 000, а
Р-кристаллины представляют собой гетерогенную группу белков
с молекулярным весом 50 000—500 000. Молекула а-кристаллина
бычьего хрусталика является тетрамером и состоит из четырех
полипептидных цепей [Bloemendal е. а., 1972], а у-кристаллин
представлен только одной полипептидной цепью [Croft, 1971].
Блюмендал и соавторы [Bloemendal е. а., 1972} показали, что
а-кристаллипы хрусталика теленка представляют собой различ-
ные агрегаты, построенные из кислых (aAt, aA2) и основных
(aBb aB2) полипептидных цепей. Диаметр агрегатов колеблется
от 5 до 18 нм, что примерно совпадает с отмеченной другими
исследователями амплитудой колебания молекулярных весов
a-кристаллинов. Авторы высказывают предположение, что на-
личие разных по величине агрегатов a-кристаллинов может быть
связано с различными стадиями дифференцировки хрусталико-
вых волокон и по мере дифференцировки волокон размеры агре-
гатов увеличиваются.
Зваан [Zwaan, 1974], используя меченные флуоресцеином ан-
титела, показал, что синтез б-кристаллинов начинается в немно-
гих клетках инвагинирующей хрусталиковой плакоды куриного
эмбриона и по мере развития хрусталика все большее и большее
число клеток принимает участие в продукции этих кристаллинов.
Синтез а-кристаллинов начинается несколько позднее, чем б-кри-
сталлинов, и они впервые обнаруживаются в формирующихся
первичных волокнах.
Пятигорский с сотрудниками [Piatigosky е. а., 1972] метили
in vitro хрусталики 6-дневных куриных зародышей 3Н- или 14С-
валином, затем разделяли хрусталик на эпителий и волокна и
подвергали меченые белки электрофорезу. Было установлено,
что в хрусталиках куриных эмбрионов этого возраста преоблада-
ет белок с молекулярным весом 45 000 (б-кристалли.н). В эпи-
телии его синтез составляет только 35%, а в волокнистой части
хрусталика—80% общего синтеза. В эпителии синтезируются
еще другие белки, в том числе имеющие молекулярный вес
30 000 и 65 000, синтез которых почти отсутствует в волокнистой
177
части хрусталика. Эти исследователи культивировали хрустали-
ковый эпителий in vitro. Клетки его удлинялись, что напомина-
ло процесс образования волокон, и спектр синтезируемых бел-
ков изменялся от характерного для хрусталикового эпителия до
характерного для хрусталиковых волокон.
Таката и соавторы [Takata е. а., 1966], используя меченные
флуоресцеином антитела, установили, что в хрусталиковых во-
локнах тритона присутствует антиген, который отсутствует в
клетках хрусталикового эпителия. Этот факт указывает на дере-
прессию специфических генов в ходе дифференцировки хрустали-
ковых волокон.
По данным Папаконстантину [Papaconstantinou, 1967], в клет-
ках хрусталикового эпителия быка происходит интенсивный син-
тез а- и p-кристаллинов, а заметный синтез у-кристаллинов на-
чинается только в формирующихся хрусталиковых волокнах. По-
этому автор назвал у-кристаллины специфическими белками хру-
сталиковых волокон. Нётигер и соавторы [Nothiger е. а., 1971] со-
общили, что у-кристаллины присутствуют только в хрустали-
ковых волокнах и отсутствуют в эпителиальных клетках реге-
нерирующего хрусталика двух видов амфибий. При помощи мето-
да непрямой иммунофлуоресценции было также установлено, что
у изученных представителей двух видов хвостатых и одного вида
бесхвостых амфибий у-кристаллины синтезируются на стадии
хрусталикового пузырька в удлиняющихся клетках внутренней
его стенки. По мере дифференцировки хрусталиковых волокон
количество у-кристаллинов в них возрастает, о чем свидетельст-
вует постепенное увеличение иммунофлуоресценции [Brahma,
McDevitt, 1972].
Эти результаты подтверждают наблюдение Папаконстантину
[1967], что у-кристаллины являются специфическими белками
хрусталиковых волокон.
Синтез а-кристаллинов происходит в делящихся клетках хру-
сталика, т. е. продукция этих специфических белков не исклю-
чает клеточной пролиферации. Однако как только клетки разви-
вающегося хрусталика (проксимальной стенки хрусталикового
пузырька или эпителия) начинают преобразовываться в хруста-
ликовые волокна, митотические деления прекращаются и в хру-
сталиках млекопитающих появляются у-кристаллины [Papacon-
stantinou, 1967; Shubert е. а., 1970; Платонов и др., 1976]. У птиц
у-кристаллины не обнаружены, а б-кристаллины, которые рано
начинают синтезироваться в развивающемся хрусталике так же,
как а-кристаллины, не исключают клеточной пролиферации
[Zwaan, 1974].
Культивирование in vitro клеток хрусталикового эпителия
6- или 19-дневных куриных эмбрионов показало, что стимуля-
ция экспрессии б-кристаллинового гена не зависит от удлине-
ния культивируемых клеток. Ингибирование удлинения клеток
при добавлении в питательную среду колхицина не препятство-
178
вало синтезу как иРНК для 6-кристаллина, так и этого хруста-
ликового белка [Beebe, Piatigorsky, 1977].
Мы считали интересным выяснить последовательность син-
теза различных классов кристаллинов в ходе дифференцировки
хрусталиковых волокон у млекопитающих. С этой целью были
приготовлены высокоспецифические антисыворотки к препара-
там а-, 0- и у-кристаллинов хрусталика взрослой мыши. Мето-
дом непрямой иммунофлуоресценции установлено, что в про-
цессе развития хрусталика у мыши первыми синтезируются
а-кристаллины, затем у- и еще позднее 0-кристаллины [Плато-
нов и др., 1976; Конюхов, Малинина и др., 1978]. «-Кристал-
лины сначала появляются в отдельных клетках формирую-
щегося хрусталикового пузырька примерно на стадии его
отшнуровывания от головной эктодермы. Продукция этих
кристаллинов быстро возрастает. В результате этого удлиняю-
щиеся клетки проксимальной стенки хрусталикового
пузырька — формирующиеся первичные хрусталиковые волок-
на— содержат значительные количества а-кристаллинов; у- и
0-кристаллины начинают синтезироваться только на определен-
ных этапах дифференцировки хрусталиковых волокон. Эти
белки удается обнаружить впервые в хрусталиковых волокнах,
когда последние занимают 72 или 2/3 полости хрусталикового
пузырька. Одновременная обработка серийных срезов через
глаз 11-суточных эмбрионов мышей антителами к у- и 0-
кристаллинам показала, что синтез у-кристаллинов начинается
несколько раньше, чем 0-кристаллинов. Сходные данные о
последовательности синтеза разных классов кристаллинов были
получены при исследовании этих белков в морфогенезе
хрусталика крысы [McAvoy, 1978].
Мы исследовали синтез и локализацию а- и у-кристаллинов
в ненормально развивающихся хрусталиках мутантных мышей
[Яковлев и др., 1977]. В частности, были изучены 10—13- и
15-суточные эмбрионы мышей генотипов fi/fi +/+, +/+ ог/ог
и fi/fi ог/ог. У мутантных эмбрионов, за исключением +/+
ог/ог, синтез а-кристаллинов начинался несколько позднее, чем
в норме (+/+ +/+), но наблюдался во всех пораженных
хрусталиках, независимо от степени нарушения их развития.
Даже клетки сильно редуцированных хрусталиков (лентоидов)
13--15-суточных эмбрионов fi/fi + /+ и fi/fi ог/ог содержали
большие количества а-кристаллинов (рис. 45; см вклейку).
У нормальных эмбрионов мышей у-кристаллины были обнару-
жены в цитоплазме дифференцирующихся первичных хрустали-
ковых волокон начиная с 11 суток, а у эмбрионов +/+ ог/ог —
только с 13 суток развития (рис. 45, е). У эмбрионов мышей
fi/fi +/+ начало синтеза у-кристаллипов запаздывает примерно
на сутки по сравнению с нормой. Как только первичные
хрусталиковые волокна у мутантов достигают стадии диф-
ференцировки, соответствующей таковой у 11-суточных
179
эмбрионов нормального генотипа, в их цитоплазме появляются
у-кристаллнны. Следовательно, запаздывание синтеза этих
белков у мутантов обусловлено замедленным формированием
у них первичных хрусталиковых волокон. В случаях сильного
нарушения развития хрусталика у эмбрионов fi/fi +/+ и осо-
бенно fi/fi ог/ог, когда первичные хрусталиковые волокна не
образуются, в клетках таких пораженных хрусталиков не
удается обнаружить даже следов у-кристаллинов.
У эмбрионов мышей, гомозиготных по гену aphakia (ak),
нарушение развития хрусталика сходно с таковым у эмбрионов
fi/fi ог/ог. Хрусталиковый пузырек эмбрионов ak/ak, как пра-
вило, не отшнуровывается от головной эктодермы, и в полость
хрусталикового пузырька выселяются клетки из его стенок,
хрусталиковые волокна не образуются, в дальнейшем хрусталик
регрессирует [Varnum, Stevens, 1968; Zwaan, 1975]. Зваан
[Zwaan, 1975] при помощи метода иммунофлуоресценции не
смог обнаружить кристаллинов в клетках ненормально раз-
вивающегося хрусталика у эмбрионов мышей ak/ak, но более
поздние исследования этого автора указывают не на отсутствие,
а на запаздывание синтеза кристаллинов у эмбрионов мышей
данного генотипа по сравнению с нормой [цит. по Beebe, Piati-
gorsky, 1977].
Синтез p-кристаллинов начинается несколько позднее или,
другими словами, на более продвинутых стадиях дифференци-
ровки хрусталиковых волокон по сравнению с у-кристаллинами
(рис. 43, б, в). У мутантных эмбрионов p-кристаллины удалось
обнаружить только в тех случаях, когда хрусталик содержал
более или менее сформированные хрусталиковые волокна. Если
развитие хрусталика было сильно нарушено, как это наблю-
далось у некоторых эмбрионов fi/fi и особенно ey-1/ey-l
еу-2/еу-2, то клетки пораженного хрусталика не содержали ни
Р-, ни у-кристаллинов. Однако а-кристаллины присутствовали
даже в тех случаях, когда хрусталик был представлен группой
эктодермальных клеток. У 13-суточных эмбрионов ey-1/ey-l
еу-2/еу-2 на серийных срезах через область резорбированного
глаза удалось обнаружить в головном эпителии отдельные
клетки, содержащие большое количество а-кристаллинов
(см. рис. 44). Следовательно, у эмбрионов этого генотипа син-
тез а-кристаллинов имеет место даже в клетках резорбирую-
щейся хрусталиковой плакоды после кратковременного
индукционного влияния глазного пузыря.
Эти данные свидетельствуют о том, что у млекопитающих
активация генов, контролирующих синтез а-кристаллинов, про-
исходит на начальных этапах формирования хрусталиковой
плакоды и синтез а-кристаллинов имеет место даже при совер-
шенно ненормальном развитии хрусталика, в отсутствие его
морфогенеза.
180
Интересно отметить, что у птиц экспрессия гена для
fi-кристаллина, синтезирующегося первым в ходе развития
хрусталика, также не зависит от морфогенеза хрусталика и
происходит даже при подавлении in vitro процесса удлинения
клеток хрусталикового эпителия [Beebe, Piatigorsky, 1977].
Синтез у- и p-кристаллинов у млекопитающих начинается
па относительно поздних этапах дифференцировки хрусталико-
вых волокон. Для активации генов, контролирующих синтез у-
и 0-кристаллинов, необходимо индуцирующее влияние зачатка
сетчатки — третий этап индукционного влияния в развитии
хрусталика (см. рис. 39).
Модак и Пирсоне [Modak, Persons, 1971] показали, что у
куриного эмбриона в ходе дифференцировки клеток хрустали-
кового эпителия в волокна скорость синтеза РНК в ядрах
сначала увеличивается, достигая максимального уровня в
начавших удлиняться клетках и молодых волокнах, а затем
уменьшается в кортикальных волокнах. В ядрах глубоко рас-
положенных кортикальных волокон и центральной части
хрусталика синтез РНК отсутствует.
Милстон и соавторы [Milstone е. а., 1976] использовали
метод определения индивидуальных иРНК путем гибридизации
их с комплементарными ДНК, т. е. с копиями, синтезирован-
ными с помощью обратной транскриптазы на иРНК.
На очищенных иРНК для б-кристаллина курицы была синтези-
рована комплементарная 3Н-ДНК, с помощью которой было
показано, что в ходе дифференцировки клеток хрусталикового
эпителия в волокна число молекул иРНК для б-кристаллина
в ядрах увеличивается в несколько раз. Такое увеличение числа
матриц должно быть результатом усиления их транскрипции.
Ридер и Белл [Reeder, Bell, 1965] методом радиоавтографии
установили, что в клетках хрусталикового эпителия куриного
эмбриона белковый синтез идет на короткоживущих иРНК, а в
формирующихся хрусталиковых волокнах кортикальной части
хрусталика — на долгоживущих, или стабильных, иРНК.
По данным Йошида и Като [Yoshida, Katoh, 1972], на ранних
стадиях формирования хрусталика у куриного зародыша долго-
живущие иРНК отсутствуют, они появляются только после
12 дней инкубации (стабилизация иРНК). Синтез белка на
короткоживущих иРНК, вероятно, характерен для начальных
этапов дифференцировки всех типов клеток. Как только диф-
ференцировка становится более или менее морфологически
выраженной, синтез белка происходит на долгоживущих иРНК.
Присутствие стабильных иРНК в дифференцированной клетке
дает ей возможность осуществлять регуляцию на уровне транс-
ляции [Denis, 1968]. По мнению этого автора, разные стабиль-
ные иРНК могут транслироваться с различной скоростью на
рибосомах в зависимости от тех или иных потребностей клетки.
Стюарт и Папаконстантину [Stewart, Papaconstantinou,
181
1967) считают, что причиной стабилизации иРНК может быть
уменьшение или полная потеря пролиферативной активности.
Данные этих авторов свидетельствуют о том, что у эмбрионов
крупного рогатого скота белковый синтез в клетках хрустали-
кового эпителия идет на короткоживущих иРНК, а у взрослых
особей — на долгоживущих иРНК. Клетки хрусталикового
эпителия активно пролиферируют у эмбрионов, а в дефинитив-
ном хрусталике их деление прекращается.
Модак [Modak, 1972] полагает, что в ходе дифференцировки
хрусталиковых волокон, а также и других типов клеток про-
исходит прогрессивное уменьшение способности клетки репари-
ровать повреждения ДНК. Синтез ДНК прекращается в клетках
хрусталикового эпителия, которые проходят последний клеточ-
ный цикл, вступают в стационарную Сгфазу и начинают диф-
ференцироваться в волокна. В этот период, т. е. на самых ранних
стадиях дифференцировки хрусталиковых волокон, наблюдается
наивысший синтез РНК. По мере дифференцировки волокон
синтез РНК уменьшается и затем полностью прекращается, что
совпадает по времени с началом деградации ДНК. Потеря
клеткой репарирующих функций приводит к накоплению
повреждений в ДНК, а в конечном итоге — к пикнозу ядер и
полной деградации ДНК в дифференцированных хрусталико-
вых волокнах. Синтез кристаллинов продолжается несколько
дольше синтеза РНК. Как указывалось выше, это объясняется
тем, что на последних этапах дифференцировки волокон синтез
белков идет на долгоживущих иРНК (рис. 46).
Гемоглобины. Эритроидные клетки позвоночных в ходе
своей дифференцировки проходят следующие стадии: про-
эритробласт->базофильный эритробласт—^полихроматофильный
эритробласт-^ортохромный эритробласт (нормобласт)—^-рети-
кулоцит—^эритроцит. Синтез глобиновых иРНК и выход их в
цитоплазму прекращается на стадии полихроматофильного
эритробласта. Синтез гемоглобина начинается на стадии про-
эритробласта и происходит с наибольшей интенсивностью в
базофильных эритробластах, а затем на стадиях полихромато-
фильного эритробласта и ретикулоцита он снижается соответ-
ственно в 4 и 20 раз по сравнению со скоростью синтеза этого
белка в базофильном эритробласте. Следовательно, со стадии
полихроматофильного эритробласта не происходит транскрип-
ции глобиновых иРНК. Однако синтез гемоглобина про-
должается еще значительное время за счет долгоживущих
иРНК (рис. 47).
В эритроцитах рыб, амфибий и птиц ядро присутствует, но
не функционирует. Эритроциты млекопитающих лишены ядра.
Эмбриональное кроветворение происходит в иных органах, чем
у взрослого организма. В онтогенезе млекопитающих наблю-
дается такая последовательность смены органов кроветворения:
до рождения эритропоэз имеет место в желточном мешке,
182
Рис. 46. Процессы макромоле-
кулярного синтеза и деграда-
ция ДНК в ходе дифференци-
ровки хрусталиковых волокон
[Modak, 1972, с изменениями]
Стволовая
клетка
Репликация
^с//ликация
Период
синтеза
иРНК
Полихро
( мато/риль
Потеря пь/й зрит
ядра 1 родл а ст
? Ретику-
лоцит J
Период
синтеза
гемоглобина
Рис. 47. Периоды синтеза гло-
биновых иРНК и гемоглобина
в ходе дифференцировки эри-
троцита у млекопитающих
(^) эритроцит
печени и селезенке, а в постэмбриональный период — в красном
костном мозге. Механизмы регуляции эмбрионального гемо-
поэза отличаются от регуляции костномозгового дефинитивного
кроветворения [Feldman, Bleiberg, 1967].
На конечных этапах дифференцировки первичных ядерных
эритроидных клеток, образующихся в желточном мешке заро-
дыша мыши, синтез гемоглобинов эмбрионального типа также
продолжается определенное время на долгоживущих иРНК-
183
Таблица 10. Активность генов, контролирующих синтез глобиновых цепей
в онтогенезе человека
Примечание. «4—f-» — высокая степень экспрессии гена; <-|—Н» — средняя степень;
«+»— слабая степень; <—» — ген не активен.
Причем в этих клетках сначала выключаются глобиновые гены
(Fantoni е. а., 1969), а несколько позднее — гены, контроли-
рующие синтез неглобиновых белков [Selander, DeLaChapelle,
1971].
В онтогенеза человека в клетках эритробластического ряда
синтезируются а*, 8-, £-, 7-, 0- и 6-полипептидные цепи гемо-
глобина, причем цепи е и характерны для ранних эмбрионов
и синтез их прекращается в конце 2-го мес внутриутробной
жизни. Эмбриональные гемоглобины — Portland 1, Gower 1 и
Gower 2—обнаружены только на ранних стадиях эмбрио-
генеза. Синтез у-цепей характерен для плодного периода и
прекращается примерно через 5 мес после рождения. Синтез
a-цепей начинается у 3-недельных, а р-цепей — у 6-недельных
зародышей. Если синтез a-цепей происходит с одинаковой
скоростью начиная примерно с 6 недель внутриутробной
жизни, то синтез 0-цепей идет слабо в эмбриональный период,
и только к рождению он заметно усиливается и достигает своего
максимального уровня примерно к 6 мес постнаталыюго раз-
вития. Синтез 6-цепей наблюдается лишь у плодов позднего
возраста и сохраняется примерно на таком же низком уровне
после рождения [Huehns, Shooter, 1965; Nigon, Godet, 1976].
На рис. 48 показано изменение содержания полипептидных
цепей гемоглобина в эритроцитах, а в табл. 10 представлены
данные об активности генов, контролирующих синтез соответ-
ствующих типов гемоглобина в онтогенезе человека (см. также
гл. 1, раздел «Взаимодействие генов»).
184
В ходе развития мыши прекращение синтеза эмбриональных
гемоглобинов Еь Еы и Еш, состоящих из а-, х-, у- и z-глоби-
новых цепей, совпадает по времени с исчезновением из кровя-
ного русла зародыша примитивной (первичной) популяции
эритроидных клеток, которые образуются в желточном мешке.
На 10-й день эмбриогенеза мыши печень начинает функциони-
ровать как орган гемопоэза и появляется дефинитивная попу-
ляция эритроидных клеток, синтезирующих взрослый тип гемо-
глобина, который состоит из глобиновых цепей а и (3. Во время
Рис. 48. Синтез глобиновых по-
липептидных цепей в онтогене-
зе человека [Huehns, Shooter,
1965; е изменениями]
По оси ординат — количество поли-
пептидной цепи, %
печеночного эритропоэза наблюдается стабилизация иРНК для
глобиновых цепей, в результате чего в дефинитивной популяции
эритроидных клеток глобиновые цепи начинают синтезироваться
на долгоживущих иРНК [Marks, Rifkind, 1972].
У куриного зародыша синтез гемоглобина начинается на
стадии 7 сомитов. В эритроцитах 5-дневного зародыша содер-
жатся в основном 2 эмбриональных типа гемоглобина, синтез
которых уменьшается с 6-го дня инкубации, после этого начи-
нается продукция дефинитивного (взрослого) гемоглобина
[Grinnel, Lee, 1972]. Шалекамп с сотрудниками [Schalekamp
е. а., 1972] установили 3 периода синтеза гемоглобинов в онто-
генезе курицы. Первый период характеризуется наличием двух
основных эмбриональных гемоглобинов (Е3 и Е4) и двух
неосновных (минорных) эмбриональных гемоглобинов (Е2 и
Е5). В течение следующего периода, который начинается иа
6-й день и заканчивается к 12-му дню инкубации, гемоглобины
Е3 и Е4 замещаются основным дефинитивным гемоглобином
А2 и эмбриональным гемоглобином Е,. Последний период,
начинающийся на 12-й день инкубации, характеризуется появле-
нием еще одного дефинитивного гемоглобина А| и неосновного
эмбрионального гемоглобина Е6. В этот период развития умень-
шается количество эмбриональных гемоглобинов Е2 и Ё5, но
гемоглобины Е( и Е6 сохраняются до вылупления. Наряду с
Дефинитивными типами гемоглобинов (At, А2) у взрослой
курицы иногда обнаруживаются различные минорные гемо-
185
глобиновые фракции. Гемоглобины Аь А2 и Е,—Е6 имеют раз-
личный состав полипептидных цепей, начало синтеза которых
совпадает с вышеупомянутыми периодами продукции гемо-
глобинов.
Мутации структурных генов, контролирующих синтез поли-
пептидных цепей гемоглобина, характеризуются изменением
последовательности аминокислот в разных цепях гемоглобина»
обусловленным заменой нуклеотида в одном из кодонов ДНК.
В различных популяциях людей обнаружено более 200 струк-
турных вариантов гемоглобина, причем в большинстве случаев
имеет место замещение только одной аминокислоты в а- или
P-цепях [Weatherall, Clegg, 1976]. Механизмы возможной
регуляции активности глобиновых генов рассмотрены в гл. 2 в
разделе «Взаимодействие структурных и регуляторных генов».
Инсулин и экзокринные ферменты поджелудочной железы.
Раттер с сотрудниками [Rutter е. а., 1968, 1973; Clark, Rutter»
1972) на основании изучения синтеза специфических белков
(инсулина и экзокринных ферментов) в процессе дифференци-
ровки эндокринных и экзокринных клеток поджелудочной
железы крысы выделили 3 стадии (фазы) цитодифференци-
ровки: пре- или недифференцированное состояние (стадия I),
протодифференцированное состояние (стадия II) и дифференци-
рованное состояние (стадия III).
В клетках презумптивного зачатка поджелудочной железы
15—17-сомитпых эмбрионов (10,5 дней эмбриогенеза), который
представлен группой клеток дорсальной стенки первичной
кишки, этим авторам не удалось обнаружить инсулина,
т. е. клетки находились в предифференцированном состоянии
(стадия I). В клетках только что возникшего зачатка под-
желудочной железы 11-дневного эмбриона имеется очень
небольшое количество инсулина. Затем на 12-й день развития
(35—40-сомитные эмбрионы) количество инсулина возрастает
(104 молекул на клетку) и остается на таком уровне до
14-го дня беременности. Этот период соответствует по термино-
логии авторов стадии II, на стадии III (14—19 сутки эмбрио-
генеза) количество инсулина в каждой клетке возрастает в 200
и более раз (в среднем 107 молекул на клетку).
Специфические экзокринные ферменты также удалось
обнаружить у 12-дневных крысиных зародышей на ранних
стадиях развития поджелудочной железы. В этот период форми-
рования поджелудочной железы число молекул липазы состав-
ляло 103 на клетку, а амилазы—105 В течение следующих
3—4-дней развития число молекул ферментов увеличивается
примерно в 1000 раз и достигает максимального уровня,
в частности, 106 молекул липазы на клетку.
В соответствии с вышеназванными стадиями дифференци-
ровки авторы выделяют 3 возможных регуляторных уровня:
первичный, вторичный и третичный (рис. 49). Переход клеток
186
из продифференцированной в протодифференцированную ста-
дию обусловлен первичным уровнем регуляции, который
осуществляется в результате межклеточных взаимодействий
эпителия кишки и окружающей его мезенхимы. Из последней в
эпителиальные клетки первичной кишки переходит фактор
белковой природы, который активирует определенную группу
генов, контролирующих синтез специфических белков. Переход
клеток из протодифференцированного в дифференцированное
состояние требует вторичного уровня регуляции. Этот период
Рис. 49. Дифференцировка эндо-
кринных клеток поджелудочной
железы крысы и синтез специфи-
ческого белка — инсулина [Rut-
ter е. а., 1968; упрощено]
Состояние: / — продифференциро-
ванное, // — протодифференцироваи-
ное и /// — дифференцированное.
Уровни регуляции активноегн генов
указаны стрелками. По оси орди-
нат — относительное колнчеепк) ни
супина в одной клетке
сопровождается интенсивным размножением клеток и образо-
ванием ацинусов поджелудочной железы. Стадия III цитодиф-
ференцировки — дифференцированное состояние — характери-
зуется уменьшением скорости клеточной пролиферации и значи-
тельным внутриклеточным накоплением специфических белков.
Третичный уровень регуляции модулирует активность фермен-
тов или концентрацию каких-либо других белков в дефинитив-
ных клетках, например, в ответ на изменение диеты или уровня
гормона в крови. По мнению авторов, первичный и вторичный
уровни регуляции цитодифференцировки обусловлены измене-
нием активности генов на транскрипционном уровне, а третич-
ный уровень регуляции осуществляется в основном на уровне
трансляции.
В развивающейся поджелудочной железе крысы 0-клегки
островков Лангерганса, продуцирующие инсулин, удается
обнаружить при помощи электронного микроскопа только у
15—16-дневных эмбрионов (Pictet е. а., 1972]. Следовательно, син-
тез инсулина в поджелудочной железе начинается задолго до по-
явления признаков морфологической дифференцировки 0-клеток.
Интересно отметить, что в экзокринных органах дифферен-
цировка клеток не сопровождается прекращением их деления.
Так, довольно высокую митотическую активность имеют диф-
ференцированные клетки слюнных желез [Redman, Screebny,
1970] и ацинусов поджелудочной железы эмбрионов крысы
[Pictet е. а., 1972]. Следовательно, в тех случаях, когда про-
исходит выделение специфических клеточных белковых про-
дуктов в межклеточные пространства, цитодифференцировка
совместима с клеточным размножением.
187
Белки хрящевой ткани. В сомитах ранних эмбрионов наблю-
дается очень слабый синтез хондромукопротеида, который в
процессе дифференцировки хондроцитов стабилизируется и
сильно возрастает [Lash, 1968]. Клетки сомитов находятся в
протодифференцированном состоянии хондрогенеза, согласно
классификации стадий цитодиффереицировки, предложенной
Раттером и соавторами [Rutter е. а., 1968].
Определение активности специфических для хондроцитов
ферментов уридиндифосфат-глюкозо(УДФГ) -4-эпимеразы и
УДФГ-дегидрогеназы в формирующейся грудине куриных
зародышей показало, что в недифференцированных клетках
зачатка грудины их активность очень низкая и соответствует
уровню активности этих ферментов в других тканях. Затем в
период образования хондробластов, сопровождающийся
довольно высокой скоростью размножения последних, про-
исходит повышение активности данных ферментов, а после
прекращения деления хондробластов на стадии так называемого
созревания хондроцитов отмечен максимальный уровень фер-
ментной активности [Marzullo, Desiderio, 1972]. В опытах с
культивированием in vitro хондроцитов грудины 15-дневных
куриных зародышей Марцулло [Marzullo, 1972] подтвердил,
что значительное повышение активности специфических для
хрящевой ткани ферментов наблюдается после прекращения
деления дифференцирующихся хрящевых клеток. При этом
изменение активности специфических для хондроцитов фер-
ментов в процессе хондрогенеза происходит в соответствии с
моделью цитодифференцировки, предложенной Раттером и
соавторами [1968]. Мюллер и соавторы [МйПег е. а., 1977] при
помощи метода иммунофлуоресценции, используя специфиче-
ские антисыворотки к коллагену I и II типов, исследовали
синтез коллагена in vitro хондроцитами эмбрионов кур и круп-
ного рогатого скота. Суспензионные культуры и клетки, куль-
тивируемые в монослое с высокой плотностью, синтезировали
коллаген II типа, который характерен для нормальной хряще-
вой ткани. Хондроциты, пересеянные в монослойную культуру
низкой плотности, переключаются на синтез коллагена I типа,
причем это переключение происходит в каждой отдельной
клетке. Используя 14С-пролин, авторы показали, что митотиче-
ские деления и клеточные контакты необходимы для пере-
ключения синтеза коллагена с одного типа на другой.
Следует отметить, что на ранних этапах цитодифференци-
ровки синтез тканеспецифических белков идет даже с большей
скоростью, чем в дифференцированной клетке. Небольшое
количество тканеспецифических белков в закладке того или
иного органа обусловлено малым числом клеток, вставших на
путь специфического биосинтеза, и кратковременностью этого
синтеза. Было показано, что синтез гемоглобина в первичных
эритробластах куриного зародыша уменьшается с каждым
188
последующим клеточным делением, а после прекращения деле-
ния скорость синтеза гемоглобина в этой популяции эритроид-
ных клеток примерно в 4 раза меньше по сравнению с про-
лиферативной фазой их развития [Campbell е. а., 1971].
Клональная теория цитодифференцировки
Организм человека и позвоночных животных состоит из
нескольких сот типов клеток, возникающих из трех зародышевых
листков — эктодермы, мезодермы и энтодермы, которые пред-
ставляют собой набор родоначальных (стволовых, инициатор-
ных) клеток. Последние, многократно размножаясь, дают
образование клеточным клонам.
А. А. Нейфах [1959, 1961] методом радиационной инакти-
вации ядер обнаружил 2 периода морфогенетической активности
клеточных ядер в ходе развития рыб и амфибий: один из этих
периодов обеспечивает прохождение гаструляции, а другой -
постгаструляциоиного органогенеза. Первый период активности
ядер совпадает по времени с дерепрессией группы хромосомных
тенов, контролирующих процессы пролиферации и общего мета-
болизма клеток (так называемые гены домашнего хозяйства).
Второй период морфогенетической активности ядер совпадает
по времени с дерепрессией генов, детерминирующих стволовые
клетки.
А. С. Спириным с сотрудниками [1965] было показано, что
переД гаструляцией синтезированные ядрами зародыша вьюна
информосомы репрограммируют рибосомы. При этом может
иметь место частичный или полный распад старой материнской
иРНК.
Много важных сведений в пользу клональной теории цито-
дифференцировки получено в исследованиях на химерных
мышах. Минц [Mintz, 1970, 1971b], используя агрегационный
метод получения химер, показала, что клеточные системы,
а также ткани и органы состоят из клонов клеток, которые
образуются в результате многократных последовательных
делений одной родоначальной или, по ее терминологии, инициа-
торной клетки.
Инициаторные клетки возникают из тотипотентных клеток
на стадии ранней гаструлы. Так, миогенные, хондрогенные и
фиброгенные стволовые клетки генетически детерминируются
на этой стадии эмбриогенеза [Holtzer, 1970b]. Гены, ответствен-
ные за дифференцировку меланобластов, дерепрессируются
также на стадии ранней гаструлы [Mintz, 1970]. Хольцер и
соавторы [Holtzer е. а., 1972] полагают, что детерминация
стволовых клеток, которые в дальнейшем могут дать опре-
деленные клеточные линии, происходит даже в период дробле-
ния. Однако возможность такой ранней детерминации пока еще
является гипотетической.
189
Как указывалось выше, химерных мышей можно получить с
помощью введения одной или нескольких клеток зародыша в
бластоцель эмбриона другого генотипа. Используя такую мето-
дику, Гарднер и Лайон [Gardner, Lyon, 1971] показали, что
клоны пигментных клеток образуются после стадии бласто-
цисты. Полученные на химерных мышах данные свидетель-
ствуют о том, что у инициаторной клетки специфические локусы
дерепресснруются и затем сохраняются в активном состоянии
в течение ряда клеточных поколений, т. е. для всего клона
клеток характерна активность определенных генов. Поэтому
нельзя согласиться с Хольцером [Holtzer, 1970b], который
считает, что из линии хондрогенных или фиброгенных клеток
могут возникнуть миогенные клетки.
Первичные половые клетки (гоноциты) обособляются очень
рано в эмбриогенезе — еще до гаструляции, они не вовлекаются
в дифференциацию клеточного материала зародышевых листков
и сохраняют проспективные потенции будущих половых клеток
[см. Кнорре, 1971]. Сохранение тотипотентных свойств ядрами
гоноцитов связано с особенностями химического состава заро-
дышевой плазмы, которая защищает ядро от влияния остальной
цитоплазмы.
Следовательно, генетический контроль дифференцировки
клеток начинается уже на стадии ранней гаструлы, когда про-
исходит детерминация стволовых или инициаторных клеток.
Со стадии гаструлы все клетки зародыша генетически детерми-
нированы, т. е. их будущее развитие запрограммировано.
Стволовая клетка должна пройти несколько так называемых
критических клеточных циклов, каждый из них дерепрессирует
часть генома и продвигает клетку на определенную ступень
дифференцировки [Holtzer, 1970а, Ь].
Дайнстмен и Хольцер [Dienstman, Holtzer, 1975] считают,
что все клетки зародыша являются членами какой-либо одной
ИЗ МНОГИХ фуНКЦИОНаЛЬНЫХ ЛИНИЙ ИЛИ КЛОНОВ. При ЭТОМ НИ
одна клетка в результате деления не может сразу дать более
двух новых клеточных типов. Требуется 2 деления или
несколько последовательных делений для того, чтобы «бипотент-
иая» клетка смогла проявить свойства «мультипотентной»
системы. Так, например, для образования 32 типов клеток из
«тотипотентной» зиготы требуется как минимум 5 последова-
тельных клеточных делений. Сейчас не известны какие-либо
биохимические или цитологические маркеры, позволяющие раз-
личать клетки одной линии, относящиеся к разным клеточным
генерациям. В частности, не удается отличить первичные
мезенхимные клетки от их ближайших потомков — презумптив-
ных миобластов, презумптивных хондробластов или прс-
зумптивных фибробластов. Одной из важных проблем мио-
генеза, по мнению этих авторов, является выявление специфи-
ческих молекул, синтезируемых в презумптивном миобласте, и
190
выяснение вопроса, продолжается ли синтез таких молекул в
дочерних клетках-миобластах.
Зачатки органов возникают из группы родоначальных, или
стволовых, клеток, каждая из которых дает линию или клон,
дифференцирующийся в определенном направлении. Опытами
с маркировкой клеток у амфибии было установлено, что родо-
начальные клетки мезодермальных и энтодермальных тканей
(в частности, сомитов) локализованы в вегетативной части ран-
ней гаструлы, а родоначальные клетки эктодермальный тканей
(эпидермиса и нервной системы) — в ее анимальной части. При
этом родоначальные клетки для формирования мезодермы и
эктодермы амфибий детерминированы на стадии бластулы или
даже морулы, а детерминация родоначальных эктодермальных
клеток наступает несколько позднее. На стадии ранней гаструлы
имеются клетки, детерминированные к формированию эпидер-
мальной ткани, но их программа развития может быть еще
изменена в результате влияния различных индукционных
стимулов [см. Tiedemann, 1973].
Мезодермальные клетки почки конечности детерминированы
в своем развитии: одни из них становятся миогеннымн, другие
хондрогенными, а третьи — фиброгенными, причем стволовые
клетки этих линий генетически детерминируются, очевидно, уже
на стадии гаструлы [Holtzer, 1970а, Ь].
В клетках мезодермальной части почки конечности куриного
эмбриона еще до появления признаков морфологической диф-
ференцировки хондробластов синтезируются хондроитинсульфа г
и некоторые ферменты, характерные для хрящевой ткани
[Searls, 1967; Medoff, 196,7]. По мнению этих авторов, все
мезенхимные клетки ранней почки конечности сначала про-
являют хондрогенные свойства, а позднее некоторые из них
прекращают синтез мукополисахаридов и трансформируются в
миогенные клетки, которые начинают синтезировать миозин.
Медофф и Цвиллинг [Medoff, Zwilling, 1972] обнаружили
мышечный белок миозин в мезенхимных клетках почки конеч-
ности еще до каких-либо морфологических признаков диф-
ференцировки, характерных для миобластов.
Медофф и Цвиллинг [1972] и Каплан [Caplan, 1972]
высказали предположение, что на самых ранних стадиях раз-
вития зачатка конечности во всех мезенхимных клетках могут
быть активны специфические гены для миогенных, хондроген-
ных и фиброгенных линий клеток. Если мезенхимная клетка
встает на один из трех вышеуказанных путей дифференцировки,
то активность данного набора тканеспецифических генов
усиливается, а двух других репрессируется. Флауер [Flower,
1972] методом градиентного разделения клеток в бычьем
альбумине установил, что мезенхимные клетки почки крыла
куриного эмбриона начиная с самых ранних стадий формирова-
ния этого органа представлены хондрогенными, миогеннымн и
191
фиброгенными клеточными клонами, которые в культуре давали
возникновение хрящевым и мышечным клеткам, а также фибро-
бластам. По мнению автора, этот метод дает возможность
обнаружить гетерогенность клеток до появления в них харак-
терных генных продуктов.
Боннер и Хаушка [Bonner, Hauschka, 1974], культивируя
in vitro мезенхимные клетки почки нижних конечностей куриных
эмбрионов, установили, что клетки, детерминированные к диф-
ференциации в миобласты, присутствуют на самых ранних
этапах формирования зачатка конечности. Клетки, диф-
ференцирующиеся в миобласты in vitro, были также обнаружены
в мезодермальной части почки ноги человека, но на несколько
более поздних стадиях по сравнению с куриными эмбрионами
[Hauschka, 1974]. Дайнстмен с соавторами [Dienstman е. а.,
1974] убедительно показали, что мезодермальная часть почки
конечности куриных эмбрионов представлена хондрогенными и
миогенными линиями клеток. Авторы считают, что мезодерма с
самого начала своего развития является гетерогенным набором
разных клеточных типов. Следовательно, мезенхимные клетки
ранней почки конечности представлены по крайней мере тремя
клеточными популяциями. Индукционные влияния со стороны
апикального эктодермального гребня и определенная микро-
среда дерепрессируют в каждой из этих клеточных популяций
конкретные тканеспецифические гены, и, как результат этого,
начинается синтез специфических белков: миозина, актина,
хондромукопротеида или коллагена.
На химерных мышах установлено, что из определенного
числа клонов клеток возникают те или иные зачатки органов
[Mintz, 1970, 1971b].
У мышей, гомозиготных по гену retinal degeneration (rd),
с 7-го дня после рождения начинается дегенерация фото-
рецепторов сетчатки. У 25-дневных животных данного генотипа
палочки отсутствуют, а наружный ядерный слой представлен
лишь одним рядом ядер. Уегмен и соавторы [Wegmann е. а.,
1971] наблюдали у 26—30-дневных химерных мышей, получен-
ных в результате агрегации бластомеров мышей генотипов rd/rd
и +/+, участки нормальной сетчатки (8—10 рядов ядер в
составе наружного ядерного слоя и палочки такой же длгГны,
как и в норме) и участки с совершенно идентичной дегенера-
цией фоторецепторов, как у мышей rd/rd (0—2 ряда ядер
наружного ядерного слоя, отсутствие палочек). Причем граница
между нормальными и патологически измененными участками
сетчатки проходит довольно резко, что позволяет подсчитать их
число. Минц и Сеньял [Mintz, Sanyal, 1970] изучили серийные
срезы сетчаток у мышей rd/rd-<->+/+. В сетчатке таких химер,
имеющих примерно равное число клеток генотипов +/-г и
rd/rd, было обнаружено 5 участков с дегенерацией фото-
рецепторов и 5 участков нормальной сетчатки (рис. 50). Каж-
192
Рис. 43 (подпись на обороте)
1М* Заказ 4731
Рис.. 43. Появление и локализация различных классов кристаллинов в ходе нор-
мального развития хрусталика мыши [Конюхов, Малинина и др., 1978]
а — срез через глаз 10-дневного эмбриона обработан флуоресцирующими антителами к
а-кристаллинам; б — срез через глаз 11-дневпого эмбриона обработан флуоресцирующими
антителами к у-кристаллинам; в — срез через глаз 12-дневного эмбриона обработан флуо-
ресцирующими антителами к 0-кристаллинам. Наблюдение под флуоресцентным микро-
скопом. Увел. Х260
Рис. 44. Присутствие а-кристаллинов в клетках деструктированной хрустали-
ковой плакоды 13-дневного эмбриона мыши генотипа ey-1/ey-l су-2/еу-2 [Ко-
нюхов, Малинина и др., 1978]
а, б — серийные срезы через область деструктированного зачатка глаза обработаны
флуоресцирующими антителами к а-кристаллинам, наблюдение под флуоресцентным
микроскопом; в — срез б окрашен гематоксилином, наблюдение в проходящем свете.
Увел. Х600 |
6**
Рис. 45 д, е.
Рис. 45 ж, з.
I
Рис. 51. Плоскостной препарат, показывающий клональное происхождение
пигментного эпителия глаза мыши [Mintz, 1971с]
У химерной мыши +/+<-♦ с/с участки пигментированных
с непигментированными (светлые)
(черные) чередуются
Рис. 50. Клональное происхождение
фоторецепторного слоя сетчатки мы-
ши [Mintz, 1971с]
Рисунок сделан на основе двумерной ре-
конструкции серийных срезов сетчатки
химерной мыши, имеющей примерно равное
число клеток +/+ и rd/rd (дегенерация
сетчатки). В ходе развития сетчатки фото-
рецепторы rd/rd гибнут, в результате обра-
зуются «нулевые» поля (показаны черным).
На этом основано клональное картирова-
ние. Незакрашенные участки схемы соот-
ветствуют зонам нормальных фоторецепто-
ров, их звездчатое расположение показано
стрелками
дый из этих участков представлял, очевидно, клон одной родо-
начальной клетки. Авторы полагают, что зачаток сетчатки мыши
первоначально состоит из 10 клеток, каждая из которых дает
свой клон, причем клетки клона, размножаясь, располагаются
радиально и образуют компактную группу.
У химерных мышей, полученных в результате агрегации
бластомеров пигментированных и непигментированных мышей
(+/+ч<->с/с), наблюдается чередование пигментированных и
непигментированных участков пигментного эпителия глаза
(рис. 51; см. вклейку). Инициаторные клетки, радиально про-
лиферируя, формируют у химерных зародышей пигментирован-
ные и непигментированные зоны пигментного эпителия глаза
[Tarkowski, 1963; Mintz, Sanyal, 1970; Wegmann e. a., 1971;
Deol, Whitten, 1972]. Если получали химер методом агрегации
бластомеров мышей генотипов +/+ rd/rd (мыши пигментиро-
ванные с дегенерацией фоторецепторов) и с/с +/+ (альбиносы
с нормальной сетчаткой), то химеризм в сетчатке всегда сопро-
вождался химеризмом в пигментном эпителии, причем оба
глаза одного и того же животного были сходны по химеризму
сетчатки и пигментного эпителия. Тесная корреляция химеризма
в пигментном эпителии и сетчатке отмечена также в глазах
химерных мышей rd/rd с/с^->+/+ +/+ [Sanyal, Zeilmaker,
1974, 1976].
Эти данные указывают на то, что сетчатка и пигментный
эпителий возникают из общих родоначальных клеток, а затем в
клеточных ядрах развивающейся сетчатки и пигментного эпите-
лия активируются разные гены. Опытами с маркировкой клеток
в нервной пластинке зародышей амфибий были обнаружены
7 Б. В. Конюхов
193
группы родоначальных клеток, из которых возникают сетчатка,
гипоталамус, крыша или стволовая часть головного мозга
[Jacobson, 1959]. Сандерсон и соавторы [Sanderson е. а., 1974],
изучив различные мутантные фенотипы норок, характеризую-
щиеся ослаблением как общей пигментации тела, так и глаз,
показали, что у всех мутантов с ослабленной пигментацией
глаз наблюдаются нарушения распределения нервных волокон
в зрительном тракте. Авторы пришли к заключению, что рас-
пределение волокон зрительного нерва, направляющихся ог
сетчатки к коленчатым телам, контролируется генами, которые
первоначально влияют на дифференцировку клеток пигментного
эпителия. Последний, очевидно, оказывает влияние на рас-
пределение нервных волокон в зрительном тракте.
У химер, полученных в результате агрегации бластомеров
пигментированных и непигментированных мышей, химеризм был
обнаружен при микроскопическом изучении отдельных волос.
Одни волосы были пигментированы, другие не пигментированы,
а некоторые из них были как бы пятнистыми: ствол волоса
состоял из чередующихся пигментированных и непигментиро-
ванных клеток [McLaren, Bowman, 1969]. У мышей fz/fz^-> + /4-
в одном волосе были обнаружены 2 разные клеточные популя-
ции (клетки fz/fz и +/+), количественное соотношение этих
двух клонов клеток значительно влияло на форму волоса.
Следовательно, каждый волос возникает из нескольких клеточ-
ных клонов, а в формировании всего волосяного покрова мыши,
как полагает Минц [Mintz, 1970], участвует 150—200 клеточных
клонов, по 75—100 на каждую сторону тела.
Изучение химер, полученных в результате агрегации бласто-
меров мышей, которые различались между собой по аллелям
нескольких локусов, контролирующих окраску волосяного
покрова, показало, что характер пигментации волос возникает
благодаря взаимодействию по крайней мере двух клеточных
популяций. Если синтез пигмента целиком определяется гено-
типом меланоцита, то на характер распределения пигмента в
волосе большое влияние оказывают другие клетки волосяного
фолликула [Мак-Ларен, 1973].
На химерах, полученных методом агрегации бластомеров
мышей, различающихся по электрофоретическим вариантам
изоцитратдегидрогеназы, было показано, что скелетные мышцы
химер имеют гибридную форму данного димерного фермента
[Mintz, Baker, 1967]. Следовательно, мышечные трубочки воз-
никают в результате слияния нескольких миобластов.
Герхарт и Минц [Gearhart, Mintz, 1972] методом агрегации
бластомеров получали химерных эмбрионов мышей, гомозигот-
ных по разным аллелям, контролирующим элсктрофоретически
неодинаковые варианты димерного фермента глюкозофосфатизо-
меразы. В экстрактах из одного сомита 8—9-суточных эмбрио-
нов или наружного мускула глаза 15—65-дневных химер, как
194
правило, были обнаружены оба варианта этого фермента.
Принимая во внимание, что каждый наружный мускул воз-
никает из одного миотома, авторы сделали заключение: в обра-
зовании миотома участвуют как минимум 2 родоначальные
клетки. Эти факты также указывают на то, что процесс мио-
генеза обусловлен слиянием одноклеточных миобластов друг с
другом. Для образования одного сомита, очевидно, необходимо
8 клеточных клонов, каждый из которых возникает в результате
размножения одной инициаторной клетки. У эмбрионов мыши
образуется 65 пар сомитов [Rugh, 1968]. Следовательно, для
формирования всех сомитов требуется не менее 1040 родо-
начальных клеток.
Мур и Минц [Moore, Mintz, 1972] показали, что по крайней
мере 4 клона клеток участвуют в образовании одного позвон-
ка. По данным Уегмена [Wegmann, 1970], печень мыши возни-
кает в результате согласованного роста примерно 340 клеточ-
ных клонов. По оценке других авторов, число клеточных кло-
нов в печени может быть значительно больше [McLaren, 1976а].
Минц [1970] полагает, что вся популяция меланоцитов у мыши
образуется из 34 инициаторных клеток (примордиальных ме-
ланобластов), по 17 клеток на каждую сторону тела. Уолперт
и Гингелл-[Wolpert, Gingell, 1970] считают, что должно быть не
17, а 32 родоначальные клетки на каждую сторону тела, а, по
мнению Лайон [Lyon, 1970], таких примордиальных меланобла-
стов, приходящихся на каждую сторону тела, может быть даже
более ста. Льюис и соавторы [Lewis е. а., 1972] указывают на
то, что опыты с химерными мышами не позволяют точно уста-
новить число родоначальных клеток в период их детерминации.
Несбитт и Гартлер [Nesbitt, Gartler, 1971] полагают, что
стволовые клетки у млекопитающих детерминируются на ста-
дии бластоцисты, внутренняя клеточная масса которой пред-
ставляет собой набор этих клеток. Однако другие авторы счи-
тают, что детерминация родоначальных клеток происходит не-
сколько позднее, примерно на стадии гаструлы, т. е. после им-
плантации эмбрионов [Mintz, 1970, 1971b; Gearhart, Mintz,
1972].
При пересадке меченных 3Н-тимидином трансплантатов родо-
начальные (стволовые) клетки печени были обнаружены сна-
чала в энтодерме куриного зародыша на стадии первичной по-
лоски (стадия гаструлы). Затем они мигрировали в энтодерму
желточного мешка, и на стадии ранних почек нижних конечно-
стей из них образовывались передний и задний печеночные ди-
вертикулы [Rosenquist, 1971].
Мак-Ларен [McLaren, 1972], анализируя полученные на хи-
мерных мышах данные, подчеркивает важное значение той ста-
дии эмбриогенеза, когда возникают различия в пролиферации
инициаторных клеток разных клонов. Этот период, очевидно,
является критической стадией развития. От скорости размно-
7*
195
жения стволовых клеток зависит, будет ли определенный кле-
точный клон преобладать в составе данного органа, или он бу-
дет представлен минимальным числом клеток. Минц [1970] счи-
тает, что в течение развития и старения организма может на-
блюдаться селекция тех или иных клеточных популяций — про-
цесс, аналогичный естественному отбору в популяциях особей.
Взаимодействие клеточных популяций может приводить к ко-
личественному преобладанию одной из них в пределах той или
иной структурной единицы.
Минц [1970, 1971b] утверждает, что каждый клеточный тип
имеет мультиклональное происхождение, т. е. его клеточные
элементы возникают из нескольких инициаторных клеток, у ко-
торых дерепрессированы одни и те же специфические гены.
Клоны клеток могут различаться между собой фенотипически
вследствие неодинаковой экспрессивности функционирующих
генов, что может быть результатом различных межклеточных
взаимодействий. Как следствие таких фенотипических разли-
чий клонов, могут возникать субпопуляции клеток в пределах
одного и того же клеточного типа, благодаря чему достигается
более тонкая дифференцировка клеточной системы. Следова-
тельно, та или иная популяция соматических клеток представ-
ляет собой совокупность потомств отдельных стволовых клеток
или, другими словами, состоит из различных клеточных клонов.
Порядок расположения и число перьев и чешуек у птиц —
строго постоянные признаки породы и вида. Хотя перья и че-
шуйки имеют эктодермальное происхождение, определяющую
роль в их развитии играют мезодермальные клетки формирую-
щейся кожи, которые оказывают индукционное влияние на эк-
тодермальные клетки [см. Sengel, 1971]. Кемп и Роджерс
[Kemp, Rogers, 1972] показали, что кератины перьев и роговых
чешуек отличаются друг от друга, причем различия были так-
же обнаружены между кератинами одних и тех же тканей за-
родыша и взрослых птиц. Эти данные свидетельствуют о том,
что в каждой клеточной популяции, возникающей из клеток
эпидермиса зародыша, активируются разные гены из общего
набора структурных генов, контролирующих синтез кератинов.
Обособление разных популяций клеток, характеризующихся
своим набором активных генов и синтезирующих только одну
определенную группу кератинов, приводит к дифференцировке
морфологически различных дериватов эпидермиса зародыша,
таких, как перья и роговые чешуйки.
Хромаффинная ткань мозгового вещества надпочечника
млекопитающих состоит из двух видов клеток: вырабатываю-
щие адреналин и продуцирующие норадреналин. У некоторых
видов позвоночных все клетки хромаффинной ткани мозгового
вещества надпочечника вырабатывают только адреналин. Ад-
реналин представляет собой продукт метилирования норадре-
налина. Следовательно, в клетках обоих типов должны быть
196
активны разные тканеспецифические гены и эти клеточные по-
пуляции должны возникать из различных стволовых клеток.
Как указывалось выше, в онтогенезе человека наблюдается
замещение одних типов гемоглобинов другими. Методом имму-
нофлуоресценции было показано, что почти все эритроциты
(96%) крови новорожденного содержат фетальный гемоглобин
(HbF), а в крови взрослого человека лишь отдельные эритро-
циты имеют этот тип гемоглобина [Hosoi, 1965].
Рис. 52. Замещение первичных
клонов эритроцитов (/) дефи-
нитивной популяцией эритро-
идных клеток (2) и смена ор-
ганов гемопоэза в эмбриогенезе
курицы [Schalekamp е. а., 1972]
По оси абсцисс — возраст эмбрио-
нов, дни; по оси ординат — число
эритроцитов, %
Дж
Получены факты, свидетельствующие о том, что разные ти-
пы гемоглобинов синтезируются различными популяциями эри-
троидных клеток. В частности, было установлено, что у инди-
видов с наследственным сохранением фетального гемоглобина
в крови присутствуют 2 популяции эритроцитов, одна из кото-
рых содержит дефинитивный тип гемоглобина, а другая — фе-
тальный гемоглобин [Pawlak, Kozlowska, 1971]. Смена различ-
ных типов гемоглобинов в онтогенезе характерна также для
других видов млекопитающих, птиц и амфибий [Ingram, 1972;
Maclean, 1976; Nigon, Godet, 1976]. При этом замещение эмбрио-
нального гемоглобина дефинитивным обусловлено дерепресси-
ей разных локусов в различных популяциях эритроидных кле-
ток. Так, исчезновение эмбриональных (Ei—Е6) и появление
дефинитивных гемоглобинов (Аь А2) в онтогенезе курицы яв-
ляется результатом замещения первичных клонов эритроцитов
эритроидными клетками дефинитивных линий [Schalekamp е. а.,
1972]. Одновременно с этим наблюдается изменение органов
гемопоэза (рис. 52).
В последнее время при помощи метода прямой иммунофлуо-
ресценции было установлено, что в ходе развития курицы пере-
ключение синтеза гемоглобинов обусловлено сменой популяций
эритроидных клеток, т. е. синтез дефинитивных типов гемогло-
бина происходит в другой популяции эритроидных клеток, чем
синтез эмбриональных типов. В одной и той же эритроидной
клетке не удалось обнаружить вместе эмбриональный и дефи-
нитивный типы гемоглобинов: во всех случаях в клетке при-
197
сутствовали эмбриональные или дефинитивные гемоглобины
[Shimizu, 1976). Было также показано, что эмбриональный и
взрослый типы гемоглобинов не могут присутствовать одновре-
менно в одной и той же клетке развивающейся лягушки [Ма-
niatis, Ingram, 1971]. Следовательно, смена эмбрионального
гемоглобина на взрослый, очевидно, обусловлена не переклю-
чением активности соответствующих генов в пределах одной
клетки, а заменой одной клеточной популяции эритроидных кле-
ток, специализированной на синтез эмбрионального гемогло-
бина, на другую, которая синтезирует взрослый тип гемогло-
бина.
Эритроидные клетки головастиков бесхвостых амфибий син-
тезируют глобиновые цепи Тр-1 и Тр-2, а эритроидные клетки
взрослой лягушки — соответственно Fr-1 и Fr-2 [Ingram, 1972].
Эритроциты обработанных тироксином головастиков Rana са-
tesbiana синтезируют взрослый тип гемоглобина. Причем син-
тез этого гемоглобина совпадает по времени с появлением у
обработанных тироксином головастиков дефинитивной попу-
ляции красных кровяных клеток, которая возникла из опреде-
ленных стволовых клеток [Moss, Ingram, 1965, 1968]. Авторы
полагают, что тироксин подавляет пролиферацию гемопоэтиче-
ских клеток головастика и одновременно стимулирует размно-
жение новой линии (клона) клеток, в которой активны другие
гены, контролирующие синтез гемоглобина взрослой лягушки.
Таким образом, изменение синтеза типов гемоглобинов в ре-
зультате действия тироксина обусловлено заменой одной кле-
точной популяции гемопоэтических клеток другой.
Ингрем [Ingram, 1972] и Маркс и Рифкинд [Marks, Rifkind,
1972] считают, что в основе регулирования синтеза разных гло-
биновых цепей в онтогенезе человека и позвоночных животных
лежит замещение одних клонов эритроидных клеток на другие,
в частности, первичных (примитивных) клонов на дефинитив-
ные. Разные клеточные популяции, функционируя в различных
гемопоэтических органах, синтезируют специфичные для них
белки.
Происхождение стволовых клеток дефинитивной популяции
эритроцитов остается неясным: возникают ли они из плюрипо-
тентных стволовых клеток первичной популяции эритроидных
клеток, или имеют другие источники происхождения [Ingram,
1972; Marks, Rifkind, 1972]. Введение 3Н-тимидина в куриные
яйца показало, что стволовые клетки дефинитивной популяции
эритроидных клеток присутствуют на ранних стадиях развития
эмбриона (после 2—4 дней инкубации). Эти данные свидетель-
ствуют о том, что имеются, по-видимому, различные стволовые
клетки для первичной и дефинитивной популяций эритроидных
клеток [Bruns, Ingram, 1973]. Меткаф с сотрудниками [Metcalf
е. а., 1971] пропускали клетки костного мозга мыши через ко-
лонку со стеклянными бусами и фракционировали их центри-
198
фугированием в изотоническом градиенте в альбумине. Полу-
ченные фракции клеток тестировали на способность образовы-
вать колонии в селезенке и агаре. Результаты этой работы ука-
зывают на высокую степень гетерогенности стволовых клеток
костного мозга.
Исследованиями, проведенными на мышах мутантных ли-
ний, установлено, что формирование популяций эритроцитов,
гранулоцитов, тромбоцитов или иммунокомпетентных клеток
зависит от двух основных причин, а именно от функциональной
интактности стволовой клетки и наличия соответствующей мик-
росреды, необходимой для индукции дифференцировки исход-
ной стволовой клетки [см. Warner, Moore, 1971].
Концепция о значении стволовых клеток в процессах диффе-
ренцировки клеточных систем с каждым годом находит все
большее подтверждение. Так, изучение становления иммунной
системы у мыши показало, что клетки, обладающие потенция-
ми дифференцироваться в клетки — продуценты антител, появ-
ляются в желточном мешке эмбриона мыши к 9-му дню бере-
менности, а затем они мигрируют в печень. Через 6 недель после
рождения основным, если не единственным, источником стволо-
вых клеток является костный мозг. Для количественно нор-
мального антителогенеза требуется взаимодействие потомков
этих стволовых клеток с клетками, происходящими также из
костного мозга, но прошедшими через тимус [Тайен, 1972]. Кло-
нальный принцип дифференцировки антителопродуцирующих
клеток сейчас общепризнан [Barnet, 1969].
У млекопитающих широко известен функционально-генети-
ческий мозаицизм или феномен лайонизации, когда формиру-
ются клеточные клоны, различающиеся по активности родитель-
ских Х-хромосом. Исследование ранних стадий эмбриогенеза
показало, что запаздывание редупликации и гетерохрома-
тизация одной из Х-хромосом предшествуют образованию те-
лец полового хроматина, причем время их появления варьирует
у разных видов. Инактивирована может быть как отцовская,
так и материнская Х-хромосома; исключение составляют сум-
чатые, у которых, по-видимому, всегда инактивирована отцов-
ская Х-хромосома. Функционально-генетический мозаицизм
проявляется как на цитологическом, так и на биохимическом
уровнях. Особенно это четко наблюдается при анализе экспрес-
сии локализованных в Х-хромосоме генов, контролирующих
синтез изоферментов. Последние представляют собой различ-
ные молекулярные формы белка, обладающие одинаковой фер-
ментной специфичностью, но имеющие разную активность.
У одного и того же индивида больше сотни ферментов может
существовать в двух или более изозимных формах [Markert,
1968].
Аллели локализованного в Х-хромосоме человека локуса,
контролирующего синтез глюкозо-6-фосфатдегидрогеназы, у
199
гетерозигот действуют в разных популяциях клеток. При элек-
трофоретическом разделении в крахмальном геле обнаружи-
ваются 2 формы этого фермента — быстрая (А) и медленная
(В). Если выращивали клоны из отдельных фибробластов, по-
лученных от гетерозиготной женщины (АВ), то в каждом из
этих клеточных клонов присутствовал только изофермент А
или В. В смешанных культурах были обнаружены две формы
фермента — А и В [Davidson е. а., 1963].
У гибридных самок лошади и осла экспрессия материнского
(от лошади) аллеля глюкозо-6-фосфатдегидрогеназы наблюда-
ется в клетках крови, поджелудочной железы, мозга, почек,
слюнных желез, селезенки и лимфатических желез, а экспрес-
сия отцовского аллеля (от осла) отмечена только в клетках
печени. Эффекты обоих аллелей обнаружены в клетках щито-
видной железы и легких [Hook, Brustman, 1971]. Сходная карти-
на экспрессии аллелей этого локуса описана у песцово-лисьих
гибридов [Серов, Закиян, 1974].
Л. И. Корочкин [1977] полагает, что различная экспрессия
аллелей глюкозо-6-фосфатдегидрогеназы в разных органах обу-
словлена преимущественной пролиферацией клона клеток с
неинактивированной отцовской или материнской Х-хромосомой
:ла ранних стадиях формирования того или иного органа. Раз-
множающийся клон клеток, по-видимому, имеет определенные
преимущества перед другим клеточным клоном, который не
принимает участия в развитии органа. Однако механизмы та-
кой селекции клеточных клонов остаются неясными. Цитологи-
ческие исследования показали, что в энтодермальных клетках
желточного мешка мышиного эмбриона чаще инактивирована
отцовская Х-хромосома [Takagi, Sasaki, 1975]. Поэтому вероят-
но и другое предположение: инициаторные клетки, из которых
возникают клеточные клоны, имеют уже инактивированную X-
хромосому, так как инактивация одной из Х-хромосом у млеко-
питающих происходит на очень ранних стадиях эмбриогенеза,
возможно, даже до детерминации инициаторных клеток.
Стабильность дифференцированного состояния
Для позвоночных характерна устойчивость цитодифферен-
цировки в ряду клеточных поколений, что отчетливо проявля-
ется в опытах на клональных культурах. При нормальных ус-
ловиях наблюдается, как правило, необратимость процесса ци-
тодифференцировки, а возможность метаплазии ограничена
лишь трансформациями между относительно неспециализиро-
ванными клеточными типами [Grobstein, 1959].
Стабильность дифференцированного состояния клетки явля-
ется прежде всего особенностью клетки в целом, а не только ее
ядра. Рассмотренные выше опыты с пересадкой ядер соматиче-
ских клеток в энуклеированные яйцеклетки амфибий, а также
200
результаты исследований по гибридизации соматических кле-
ток свидетельствуют о зависимости функции ядра от цитоплаз-
мы, причем тотипотентность ядер сохраняется значительно
дольше в эмбриогенезе, чем тотипотентность клеток. Ядра всех
стволовых клеток, очевидно, обладают тотипотентными свойст-
вами в течение всего онтогенеза.
А. Г. Кнорре [1971, с. 107] пишет: «Мы не знаем, на какой
стадии (стадиях) те или иные изменения генетического аппара-
та клетки становятся если не принципиально необратимыми, то
в достаточной степени стойкими и ведут к закреплению опреде-
ленных путей дальнейшей дифференцировки клеток и тканей.
Весьма вероятно, что один из важных этапов этпх изменений
ядерного аппарата совпадает с дифференциацией клеточного
материала зародышевых листков». Некоторые авторы называ-
ют эпигеномной, или клеточной, наследственностью способность
поддерживать стабильность дифференцированного состояния в
ряду клеточных поколений [Оленов, 1970; Вахтин, 1974; Лопа-
шов, 1974]. Однако эти термины следует признать неудачными,
так как они подразумевают наличие какой-то особой наследст-
венности, которой не существует.
Фужита [Fujita, 1965] высказал предположение, что необра-
тимость цитодифференцировки у животных организмов обус-
ловлена инактивацией ДНК хромосом, которая затрагивает все
большее и большее число локусов по мере продвижения клетки
к специализированному конечному состоянию. Харрисон [Наг-
risson, 1971] на основании полученных им данных рассматривает
ядерную оболочку эукариотов как «репрессорную органеллу».
Он считает, что в ходе дифференцировки определенные сегмен-
ты ДНК становятся необратимо репрессированными и включа-
ются в структуру ядерной оболочки. В то же время работающие
блоки генов могут быть представлены рыхлыми петлями хрома-
тина, выступающими из ядерной оболочки.
Опыты с гибридизацией соматических клеток показали, что
свойства пересаженного в чужеродную цитоплазму ядра, в ча-
стности набор активных генов, как правило, сохраняются в те-
чение многих митотических циклов. Это указывает на то, что
наряду с цитоплазмой структурные изменения ядра могут быть
ответственны за стабильность клеточной дифференцировки.
На конечных стадиях цитодифференцировки ядро часто от-
ключается от контроля над биосинтезом белка, а у некоторых
высокоспециализированных типов дифференцированных клеток
оно даже дегенерирует. Так, в ходе дифференцировки клеток
хрусталикового эпителия в волокна сначала прекращается син-
тез ДНК, а затем РНК. Однако белковый синтез продолжается
еще значительное время на рапсе образованных долгоживущих
иРНК [Reeder, Bell, 1965]. Прекращение синтеза РНК в хруста-
ликовых волокнах совпадает по времени с началом процесса
Денуклеации [Modak, 1972]. По мере миграции клеток из рост-
201
кового слоя эпидермиса к роговому сначала прекращается син-
тез ДНК и митотические деления, затем — синтез РНК, и при
переходе клеток из зернистого слоя в роговой дегенерируют и
исчезают клеточные ядра [Bernstein I. A., Sibrack, 1972]. Как
указывалось выше, у млекопитающих прекращение синтеза
иРНК на стадии полихроматофильного эритробласта предше-
ствует превращению дифференцирующихся эритроидных кле-
ток в безъядерные эритроциты. Хотя в нормобластах и ретику-
лоцитах глобиновые иРНК не синтезируются, продукция гемо-
глобина происходит еще довольно интенсивно за счет долгожи-
вущих иРНК.
Известно несколько исключений из правила необратимости
процесса цитодифференцировки. Так, после удаления хруста-
лика из глаза хвостатых амфибий и некоторых других предста-
вителей позвоночных клетки дорсального сегмента радужной
оболочки начинают делиться и превращаются в хрусталиковые
волокна, содержащие специфичные для хрусталика белки —
кристаллины [Reyer, 1962; Yamada, 1967].
По данным японских исследователей Эгучи и Окада [Egu-
chi, Okada, 1973], клетки пигментного эпителия глаза куриных
зародышей при культивировании in vitro могут дать образова-
ние хрусталикоподобным структурам. Клетки пигментного эпи-
телия глаза 8,5-дневных куриных эмбрионов после нескольких
пассажей в культуре теряли пигментные гранулы и образовы-
вали «лентоиды», в которых при помощи иммуногистохимиче-
ского метода были обнаружены кристаллины. Некоторые «лен-
тоиды» были пигментированы. Авторы считают, что получен-
ные ими данные указывают на активацию нефункционирующих
генов, контролирующих синтез кристаллинов в культивируемых
клетках пигментного эпителия. Культивирование in vitro клеток
сетчатки куриных эмбрионов также приводило к возникнове-
нию лентоидов, в которых были обнаружены кристаллины [Ага-
ki, Okada, 1977]. Однако другие исследователи, используя метод
непрямой иммунофлуоресценции, не смогли обнаружить кри-
сталлины в лентоидах, образующихся in vitro из диссоцииро-
ванных, затем реагрегируемых и культивируемых в течение трех
и более суток клеток сетчатки 7-дневных куриных зародышей
[Katoh е. а., 1971].
Не исключена возможность того, что в экспериментах япон-
ских авторов имела место неспецифическая адсорбция мечен-
ных флуоресцеином антител на плазматических мембранах
культивируемых клеток. Эгучи и Окада [1973] сообщили, что
иммунные сыворотки против белков хрусталика были адсорби-
рованы экстрактами из гетерологических тканей и хрусталико-
вого эпителия. Однако клетки хрусталикового эпителия во мно-
гих отношениях должны быть иммунологически сходны с лен-
тоидами, которые состоят из клеток и не содержат хрусталико-
вых волокон. Следовательно, лентоиды должны содержать та-
202
кие же кристаллины, которые присутствуют в хрусталиковом
эпителии. Поэтому возникает недоумение, каким образом анти-
сыворотки, адсорбированные экстрактами из хрусталикового
эпителия, реагировали с кристаллинами образующихся в куль-
туре лентоидов.
Г. В. Лопашов [1974] сообщил, что если удалить с пигмент-
ного эпителия глаза мембрану Бруха, то под действием сетчат-
ки пигментный эпителий глаза головастиков и взрослых лягу-
шек Rana temporaria, R. esculenta и Xenopus laevis, личинок и
мальков карповой рыбы Leuciscus bergi превращается в сет-
чатку с ее основными клеточными типами. Для такого рода ме-
таплазии необходима минимальная масса клеток пигментного
эпителия и вхождение их в митотический цикл. Исходя из этих
данных, Г В. Лопашов [1974] считает, что ткани в начале их
терминальной дифференцировки могут служить источником
агентов, вызывающих образование себе подобных тканей, при-
чем клетки, способные к превращениям, должны находиться в
определенной фазе митотического цикла. В этих исследованиях
остается неясным, любая ли дифференцированная клетка пиг-
ментного эпителия способна к метаплазии, или среди клеток
пигментного эпителия имеются малодифференцированные
(стволовые или камбиальные) клетки, которые под влиянием
индуцирующих агентов могут изменять направление своего раз-
вития и дифференцироваться в сетчатку. В результате действия
мутантных генов у мышей зачаток сетчатки может развиваться
в пигментный эпителий, а наружный листок глазной чаши —
в сетчаткоподобную ткань. Однако изменение пути развития
этими зачатками происходит на ранних стадиях формирования
глаза, когда клетки еще не дифференцированы (см. гл. 1, раз-
дел «Взаимодействие генов».)
Согласно взглядам А. А. Заварзина [1945, 1947], которые в
последнее время нашли многочисленное экспериментальное
подтверждение, в тканях взрослых организмов всегда сохраня-
ется определенное количество исходных камбиальных (резерв-
ных) или, по новой терминологии, стволовых клеток, за счет ко-
торых и происходит обновление клеточного состава органов.
Регенерация тканей также осуществляется, как правило, в ре-
зультате размножения и дифференцировки стволовых клеток,
но не путем дедифференцировки уже дифференцированных
(зрелых) клеток данной ткани. В частности, установлено, что
мышечная ткань млекопитающих регенерирует за счет актива-
ции клеток-саттелитов, которые дифференцируются в миобла-
сты. Хольцер [Holtzer, 1970b] отмечает, что в свете этих фактов
следует пересмотреть всю литературу по мышечной регене-
рации.
Детерминированное состояние стволовых клеток может со-
храняться в течение многих митотических делений и после по-
явления благоприятных условий проявляется в соответствую-
203
щей цитодифференцировке. Это было показано, в частности,
при культивировании in vitro клеток регенерационной бластемы
хвоста ящерицы [Simpson, Сох, 1967] и зачатков зубов мыши
[Main, 1966]. Несмотря на то что в органной культуре клетки
зачатка зуба утрачивали морфологические признаки диффе-
ренцировки, они давали хорошо сформированные зубы через
56 дней после их имплантации новорожденным мышам.
Нарушения цитодифференцировки —
причина канцерогенеза
Основным отличием раковых клеток от нормальных являет-
ся их безудержный и не контролируемый организмом рост. Опу-
холевые клетки имеют многие признаки недифференцирован-
ных клеток и сходны с перевиваемыми in vitro клеточными ли-
ниями. В некотором смысле раковые клетки можно рассматри-
вать как клеточные линии, которые стали перевиваемыми in vi-
vo: они легко эксплантируются и обладают выраженной спо-
собностью давать колонии.
Молекулярные механизмы нормальной цитодифференциров-
ки и развития многих опухолей сходны, различие заключается
только в том, что в первом случае активность определенных ге-
нов строго фиксирована во времени, а во втором этот процесс
является случайным. Поэтому некоторые авторы справедливо
считают, что рак — «болезнь» клеточной дифференцировки, т. е.
результат ее нарушения [Markert, 1968; Pitot, 1968; Вахтин,
1974; Tsanev, 1975].
Возникновение эмбриональных опухолей — тератом или те-
ратокарцином обусловлено ненормальным развитием половых
клеток. Обычные места локализации спонтанных и индуциро-
ванных тератом у млекопитающих и птиц — яичники и семенни-
ки, где тератомы возникают в результате партеногенетической
активации яйца или развития первичных мужских половых кле-
ток. Тератомы состоят из хаотически расположенных многих
клеточных типов (иногда больше десяти), которые часто орга-
низованы как функционирующие ткани. Рост тератом происхо-
дит за счет пролиферации недифференцированных клеток, при-
чем некоторые из них обладают плюрипотентными свойствами
[Evans, 1972].
Тератокарциномы — сильно злокачественные опухоли, в ко-
торых наряду с различными типами дифференцированных кле-
ток постоянно возникают относительно недифференцированные
«эмбриональные» стволовые клетки. В результате размножения
и миграции таких стволовых клеток происходит рост и распро-
странение опухоли в организме. У мышей инбредной линии 129
довольно часто спонтанно возникает тератокарцинома семен-
ников. Проведенные скрещивания животных этой линии с мы-
204
щами других линий показали большое значение генотипа в воз-
никновении тератокарциномы [Stevens, 1967].
Если стволовые клетки тератокарциномы ввести мыши внут-
рибрюшинно, то в асцитной жидкости развиваются так назы-
ваемые эмбриоидные тела, которые сходны с нормальными эм-
брионами мыши на стадии морулы. При культивировании кле-
ток таких эмбриоидных тел образуются опухоли, состоящие из
нескольких клеточных типов. Следовательно, клетки тератом
пли тератокарцином могут дифференцироваться в различные
клеточные типы, но последние не способны правильно распола-
гаться в тканевые и органные системы. Первичным дефектом
таких клеток является, очевидно, изменение плазматической
мембраны. Ауэрбах [Auerbach, 1972] указывает, что содержа-
щие плюрипотентные клетки тератомы перекидывают мост
между нормальным и патологически измененным ростом, а
также между контролируемой и неконтролируемой дифферен-
цировкой. Изучение тератом может дать ценные сведения о
процессах развития.
Данные по пересадке ядер опухолевых клеток в энуклеиро-
ванные яйцеклетки амфибий, а также получение нормальных
химерных мышей в результате введения стволовых клеток те-
ратокарциномы (эмбриональной карциномы) в бластоцисты
показывают, что раковые клетки могут дать возникновение кло-
нам различных нормально дифференцирующихся клеток. Транс-
плантация в энуклеированные яйцеклетки ядер карциномы
сетчатки взрослой лягушки обеспечивала развитие ядерных
трансплантатов до стадии головастика [McKinnell, 1972]. Папа-
иоану и соавторы [Papaioannou е. а., 1975] пересаживали куль-
тивируемые in vitro клетки тератокарциномы в бластоцисты
мышей и получили несколько нормальных химер, а также хи-
мерных животных, имеющих опухоли различной локализации.
Из 185 бластоцист с клетками тератокарциномы, пересаженных
в яйцевод или матку самок-реципиентов, была получена
121 мышь, из которых было 11 химер, причем 7 из них имели
опухоли. Такой большой процент химер с опухолями, возмож-
но, был обусловлен недостаточно хорошо отработанной техни-
кой пересадки клеток в бластоцель.
Минц и Айлменси [Mintz, Illmensee, 1975] трансплантирова-
ли в бластоцель стволовые клетки тератокарциномы, которые
сохраняли раковые свойства в течение 8-летнего периода пас-
сирования в сингенных реципиентах. В 1967 г. была получена
тератома ОТТ 6050 с помощью пересадки 6-дневного эмбриона
(XY) мышей линии 129-SE/+ (черный окрас шерсти) под кап-
сулу семенника самца линии C57-b/b (C57BL/6-b/b; коричневый
окрас шерсти), где после дезорганизации данного эмбриона об-
разовалась тератома. Ее измельчили и ввели внутрибрюшинно
мышам C57-b/b, где она стала расти как асцитная опухоль,
представляющая собой «эмбриоидные тела». Центральная
205
Рис. 53. Схема, иллюстрирующая 8-летнюю историю исследований по пересад-
ке клеток тератокарциномы в бластоцель зародышей мышей линии С57-Ь/Ь
с целью получения химерных животных [Mintz, Illmensee, 1975]
часть этих эмбриодных тел состояла из стволовых клеток тера-
токарциномы (эмбриональной карциномы). В 1975 г. почти по-
сле 200 пассажей через сингенных реципиентов клетки терато-
карциномы вводили в бластоцель эмбрионов мышей линии
C57-b/b (коричневый окрас шерсти), и затем эти бластоцисты
трансплантировали в матку ложнобеременных самок. Из 280
пересаженных бластоцист с трансплантированными в них ство-
ловыми клетками тератокарциномы получено 45 эмбрионов и
48 мышей. Изучение 3 химерных мышей показало участие
стволовых клеток тератокарциномы в возникновении мелано-
цитов, эритроцитов и лейкоцитов, а также клонов клеток воло-
сяных фолликулов, печени, почек и вилочковой железы. Кроме
того, стволовые клетки тератокарциномы дали возникновение
гаметам, в частности спермиям, что было доказано скрещива-
нием химерного самца с самкой мыши линии C57-b/b. Рожде-
ние мышей от такого скрещивания (некоторые из них имели
генотип S17+, а другие----h/+) показало, что самец имел
нормальные спермин, возникшие из опухолевых клеток
(рис. 53).
В другой работе Айлменси и Минц [Illmensee, Mintz, 19761
установили, что введение даже одной стволовой клетки эмбрио-
нальной карциномы в бластоцель приводит к развитию химер-
206
ных животных, имеющих различные нормально дифференци-
рованные клоны клеток «опухолевого» происхождения.
Эти данные убедительно доказывают, что многие ранее
«молчащие» в раковых клетках гены полностью проявляют свое
действие как в ходе развития химерной мыши, так и у ее по-
томства. Следовательно, возникновение злокачественных ново-
образований может быть обусловлено изменением активности
нормального клеточного генома и мутации нельзя рассматри-
вать как единственную причину малигнизации.
В опытах с введением в бластоцель стволовых клеток тера-
токарциномы показано, что, если опухолевые клетки интегри-
руются в развивающийся эмбрион и находятся в тесном кон-
такте с нормальными клетками, они теряют раковые свойства,
нормально дифференцируются, в результате чего из них возни-
кают нормальные клеточные системы. Химерные органы (го-
ловной мозг, почки, печень, поджелудочная и слюнная железы)
по своей гистологической структуре и дифференцировке клеток
не отличаются от соответствующих нехимерных органов нор-
мальных (контрольных) животных. У химер не отмечено воз-
никновение опухолей даже в очень старом возрасте [Dewey,
Mintz, 1978b].
Если введенные в бластоцель стволовые клетки тератокар-
циномы не интегрируются в эмбрион, то они, как в культураль-
ной камере, продолжают оставаться опухолевыми и из них воз-
никает тератокарцинома. Причем других опухолей, кроме
тератокарцином, не образуется. Механизм нормализации стволо-
вых клеток тератокарциномы при их тесном контакте с нор-
мальными клетками остается неясным; большое значение,
очевидно, имеет взаимодействие плазматических мембран нор-
мальных и опухолевых клеток [Mintz, 1978]. Такого рода рабо-
ты представляют несомненный интерес для выяснения патоге-
неза и терапии раковых заболеваний.
Эфрусси [Ephrussi, 1972], отмечая сходство явлений подав-
ления злокачественности и выключения (при определенных ус-
ловиях) функции дифференцированных клеток (синтеза ткане-
специфических белков) пришел к выводу, что в основе злока-
чественности лежит изменение активности нормального генома
клетки. Таким образом, онкогенность — это не какое-то особое
свойство клетки, а нарушение ее дифференцировки. Однако, не
зная механизмов цитодифференцировки, нельзя сказать, какие
молекулярные изменения приводят к злокачественности. У опу-
холевых клеток прежде всего должны быть изменены плазма-
тические мембраны, вследствие чего утрачивается способность
к узнаванию клетками друг друга.
Ю. М. Оленов [1977] считает, что в нормальных тканях есть
механизм, обеспечивающий редифференцировку дедифференци-
рованных клеток. По его мнению, в клетках, вступающих на
путь малигнизации, такой механизм испорчен и, как следствие,
207
редифференцировка блокирована, что может лежать в основе
канцерогенеза.
Однако подавляющее большинство данных свидетельствует
о том, что возникновение опухолей обусловлено не дедифферен-
цировкой уже дифференцированных клеток, а превращением
нормальных дифференцирующихся клеток в малигнизирован-
ные в результате действия канцерогенных агентов. Нарушения
развития клеток чаще всего наблюдаются на ранних этапах
дифференцировки, хотя превращение нормальных клеток в ма-
лигнизированные может иметь место практически в течение
всего периода цитодифференцировки [Markert, 1968]. Раковые
клетки имеют многие признаки недифференцированных клеток,
и клетки некоторых опухолей синтезируют эмбриоспецифиче-
ские белки [Pierce, 1970].
По мнению Л. И. Корочкина [1977], в формирующейся пече-
ни крысы, очевидно, происходит смена клеточных популяций,
качественно отличающихся одна от другой по наличию альдо-
лазы С, причем сохранившиеся островки клеток с альдолазой
С (микроклоны) могут быть источниками гепатом в результате
влияния на них канцерогенных агентов. С помощью иммуноги-
стохимического метода Кунса было установлено, что подавля-
ющее большинство клеток печени 12-дневного зародыша крысы
содержит высокие концентрации альдолазы С. У 18-дневных
эмбрионов лишь отдельные группы клеток (по 10—25 клеток)
имеют этот фермент, а в печени взрослого животного эти груп-
пы клеток встречаются очень редко и число клеток в них умень-
шается до 2—5. Л. И. Корочкин [1977] считает, что число таких
микроклонов, вероятно, генетически детерминировано и разли-
чия между высоко- и низкораковыми линиями животных могут
быть обусловлены неодинаковым числом микроклонов «эмбрио-
нального» типа, способных дать начало опухолевой ткани.
Уелдон и Кирк [Wheldon, Kirk, 1973] допускают существова-
ние плюрипотентных и унипотентных стволовых клеток; для ци-
тодифференцировки необходимо 2 индукционных процесса,
причем только после 2-го наступает необратимость дифферен-
цировки. В результате первой индукции из плюрипотентных
стволовых клеток образуются унипотентные, которые хотя име-
ют определенную направленность своего развития, но могут
переходить обратно в плюрипотентные клетки. Согласно этой
гипотезе, возникновение ракового заболевания может быть обу-
словлено повышенной скоростью перехода унипотентных кле-
ток в плюрипотентные.
Однако, как уже указывалось выше, стволовые клетки де-
терминируются на ранних этапах эмбриогенеза и вряд ли мо-
гут быть плюрипотентными, хотя развитие их, конечно, может
изменяться в зависимости от микросреды и влияния экзоген-
ных факторов. Так, ген t9 сложного локуса Т у мыши нарушает
гаструляцию, приводя к чрезмерному росту и дезорганизации
208
материала первичной полоски. Эмбрионы, гомозиготные по это-
му гену, не образуют мезодермы и погибают с сильно разрос-
шейся первичной полоской, напоминающей эмбриональную опу-
холь. Артц и Беннет [Artzt, Bennett, 1972] трансплантировали
8-дневные эмбрионы t9/t9 в семенник взрослой мыши и через
месяц исследовали трансплантаты гистологически. Оказалось,
что из трансплантатов возникали эмбриональные опухоли экто-
дермальной природы. Мезодермальные дериваты почти отсут-
ствовали. Авторы полагают, что ген t9 блокирует дифференци-
ровку мезодермальных дериватов, вследствие чего стволовые
клетки нейроэпителия приобретают свойства раковых клеток.
По данным некоторых исследователей, в процессе малигни-
зации дерепрессируется больше генов, чем в дифференцирую*
щихся нормальных клетках [см. Turkington, 1972], а результаты
опытов других авторов свидетельствуют об ограничении синте-
за РНК в ядрах раковых клеток, причем ограничение тран-
скрипции, по-видимому, не затрагивает структурных генов.
В частности, было показано, что цитоплазма опухолевых кле-
ток печени содержит высокомолекулярный фактор, ограничи-
вающий транскрипцию на повторяющихся последовательностях
нуклеотидов ДНК [Дворкин и др., 1972].
Независимо от того, большее или меньшее число генов ра-
ботает в раковых клетках, возникновение последних более пра-
вильно рассматривать не как дедифференцировку уже диффе-
ренцированных клеток, а как результат ненормальной диффе-
ренцировки стволовых клеток. Большинство опухолей пред-
ставляет собой клеточные клоны-популяции, возникшие из од-
ной стволовой клетки [Nesbitt, Gartler, 1971]. Поэтому биологи-
ческим подходом к терапии раковых опухолей должно быть, по
мнению Пирса [Pierce, 1972], исправление дифференцировки
малигнизированных стволовых клеток.
Болгарские исследователи Цанев и Сендов [Tsanev, Sendov,
1971а, b] подчеркивают, что механизмы канцерогенеза и кле-
точной дифференцировки являются сходными, если в основном
не идентичными. В обоих случаях процесс развития многофаз-
ный, необратимый (исключая специальные условия) и связан-
ный с митотическим размножением клеток. Основное различие
они видят в том, что при малигнизации «деблокирование» ге-
нов является стохастическим процессом, а дифференцировка
клеток обусловлена строго запрограммированным прогресси-
рующим деблокированием ядерных генов. Дастин [Dustin.
1972], отмечая большое сходство механизмов канцерогенеза и
клеточной дифференцировки (в обоих случаях генотип клеток
не изменяется, а различия обусловлены лишь активностью раз-
ных генов), указывает, что исследование механизмов клеточ-
ной дифференцировки может способствовать пониманию кан-
церогенеза, н наоборот.
209
Зигота
аластдла
^репрессированы
общие гены
Гастру л а.
Дер епрессированы
гень/ стволовых
клеток
Гист о-и органогенез
^репрессированы
некоторые ткане-
специфические гены
Дерепрессированы
все тканеспецифи-
ческие гены
Дифференцированное
состояние
Рис. 54. Схема изменений ген-
ной активности и состояния
клеточного генома в ходе цито-
дифференцировки [Конюхов,
1973]
А — первичная половая клетка;
В и С — типы дифференцирующихся
клеток;
/—/V —стадии дифференцировки.
Репрессирование генома:
/ — нестойкое,
2 — более или менее стабильное,
3 глубокое,
4 — необратимое;
5 — дерепрессированные части
нома.
Пунктирные стрелки — индукцион-
ные влияния
ЕЗ/ I к
Рассмотренные в этой главе данные свидетельствуют о том,
что цитодифференцировка обусловлена последовательной мно-
гоступенчатой дерепрессией тканеспецифических генов тоти-
потентных клеток раннего зародыша. На рис. 54 представлена
схема, показывающая, что сначала дерепрессируются гены,
контролирующие размножение и процессы общего метаболиз-
ма клеток, затем активируются первые тканеспецифические ге-
ны, детерминирующие специализацию бластомеров в стволо-
вые клетки, а в период гисто- и органогенеза дерепрессируются
гены, которые контролируют синтез белков, специфичных для
тех или иных клеточных систем. В период образования ткане-
специфических белков обычно прекращается синтез ДНК, что
должно быть обусловлено репрессией генов, контролирующих
размножение клеток (рис. 54, В, III; С, III).
Цитодифференцировка сопровождается глубокой инактива-
цией неработающих генов, что и лежит в основе необратимо-
сти этого процесса. На терминальных стадиях дифференциров-
ки у многих клеток происходит полное репрессирование гено-
ма (рис. 54, С, IV), а у некоторых типов клеток (эритроциты
млекопитающих, хрусталиковые волокна, клетки рогового слоя
эпидермиса) разрушается также ядро. В других случаях не
наблюдается полной репрессии генома и дифференцированные
клетки синтезируют РНК и белки (рис. 54, В, IV). К таким
клеткам относятся, в частности, нейроны и гепатоциты.
210
На стадии гаструлы, когда происходит детерминация ство-
ловых клеток, дерепрессия разных гепов в тех или иных клет-
ках зависит в основном от влияния неодинаковой цитоплазмы,
в период органогенеза ведущее значение приобретают межкле-
точные влияния, а на более поздних этапах эмбриогенеза наря-
ду с межклеточными взаимодействиями большую роль начина-
ют играть гормоны.
Регуляция генной активности на ранних этапах эмбриональ-
ного развития, а также в период гисто- и органогенеза осуще-
ствляется как на уровне транскрипции, так и на посттранскрип-
ционном уровне, который может включать инактивацию иРНК>
изменение скорости ее транспорта и деградации, скорости ини-
циации трансляции и снятия полипептидных цепей с рибосом,
а также ряд других посттрансляционных процессов. После за-
вершения органогенеза регуляция экспрессии генов сводится к
типу усиления — ослабления функционирующих тканеспецифи-
ческих генов на уровне транскрипции путем изменения актив-
ности РНК-полимераз, а также на посттранскрипционном уров-
не, который, очевидно, имеет главенствующее значение в этот
период развития. Идентифицирование веществ, специфически
дерепрессирующих те или иные гены, представляет большой
интерес для понимания генетического контроля цитодифферен-
цировки. К сожалению, имеется мало сведений о механизмах,
регулирующих генную активность. Анализ мутантных феноти-
пов, характеризующихся изменением конкретных биохимиче-
ских и морфологических признаков, может способствовать по-
ниманию этих вопросов.
Глава 6
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ
МЕХАНИЗМЫ МОРФОГЕНЕЗА
*
Самосборка белковых структур, открытая молекулярными
биологами, может рассматриваться как один из первичных эле-
ментов морфогенеза. В основе самосборки лежат аллостеричес-
кие изменения комплекса белков. Два белка могут объединять-
ся в комплекс в соответствии с их строением и специфическим
сродством. Этот белковый комплекс приобретает свойства, отли-
чающиеся от свойств составляющих его белков, что позволяет
присоединиться к нему третьему белку. В свою очередь, новый
комплекс белков приобретает сродство к четвертому белку и т. д.
На некоторых стадиях для присоединения белка к комплексу
требуется ферментативный процесс. С помощью самосборки мо-
гут образовываться сложные структуры [Поглазов, 1970], к чис-
лу которых относится плазматическая мембрана [Whaley е. а.,
1971]. Новые мембраны часто образуются в непосредственной
близости от уже существующих мембранных структур, которые
выполняют как бы роль матриц. Такого рода биологические си-
стемы были названы Уоддингтоном [Waddington, 1962] «матрич-
ными», а возникновение мембран рассматривалось им как один
из механизмов формирования субклеточных структур.
Самосборка белковых структур играет основную роль в мор-
фогенезе бактериофага. К 1973 г. было известно 7 генов, ответ-
ственных за синтез белков головной части бактериофага X, и
11—хвостовой его части. Число генов, которые осуществляют
контроль всех морфогенетических процессов бактериофага Т4,
по-видимому, равняется 50—100. Геном бактериофага Т4 вклю-
чает 150—200 генов. Следовательно, число генов, контролирую-
щих морфогенез, составляет примерно 50% от всего генома. Ре-
гуляция морфогенеза бактериофага осуществляется на уровне
как транскрипции, так и трансляции [см. Нестерова, 1973; Wood,
1973].
Иберт [Ebert, 1972] в связи с открытием нового журнала
«Cell differentiation» отмечал, что, пока мы только разобрались
в самых простых системах — сборке клеточных частиц и морфо-
212
генезе бактериофага, возникновение формы остается огромной
и неисследованной областью биологии.
В онтогенезе высших организмов имеют место 3 тесно свя-
занных процесса — увеличение числа клеток, их специализация,
или дифференцировка, и морфогенез отдельных частей зароды-
ша, т. е. образование сложной надклеточной организации. В двух
предыдущих главах, которые были посвящены рассмотрению
имеющихся в настоящее время данных о роли генов в процессах
клеточной пролиферации и дифференцировки, достаточно ясно
прослеживается большая трудность в изучении этих биологичес-
ких явлений. Однако механизмы морфогенеза, под которым по-
нимают возникновение определенной макроструктуры с характер*
ной для нее формой, несомненно, еще сложнее.
Все свойства клеток, участвующих в морфогенетических про-
цессах, особенности плазматических мембран, способность выра-
батывать дистантные агенты и поддерживать компетенцию к их
действию, регуляция скорости размножения и синтез тканеспе-
цифических белков представляют собой результат их дифферен-
цировки на предшествующих этапах развития. Следовательно, в
основе морфогенеза позвоночных лежат прежде всего 2 тесно
сцепленных процесса — пролиферация и дифференцировка кле-
ток.
Изучением морфогенеза длительное время занимались экспе-
риментальные эмбриологи, которые и сейчас продолжают успеш-
но работать в этом направлении. Однако сейчас стало ясно, что,
поскольку морфогенез является генетически детерминированным
сложным и многоэтапным процессом, без привлечения генетики
решить эту проблему нельзя. Изучение мутантных фенотипов
может способствовать выяснению вопроса, каким образом из
полипептидных цепей, синтез которых детерминирован генами,
возникают клетки и органы определенной формы.
Эфрусси [Ephrussi, 1972], заканчивая свою книгу «Гибриди-
зация соматических клеток», подчеркивает, что по своему значе-
нию такие проблемы, как генетические основы морфогенеза мно-
гоклеточных организмов, роль взаимоотношений между различ-
ными типами клеток в морфогенезе, генетическая природа раз-
личных тканеспецифических компонентов плазматической мем-
браны и их роль в распознавании клетками друг друга при меж-
клеточных взаимоотношениях, занимают первое место в списке
фундаментальных и пока еще не решенных проблем молекуляр-
ной биологии.
Роль генов в морфогенезе клеток
Экспериментами на одноклеточной водоросли ацетабулярии убе-
дительно показана важная роль ядра в морфогенезе клетки, т. е.
в становлении ее определенной формы [см. Hammerling, 1953].
Ацетабулярии произрастают на небольших глубинах субтропи-
213
ческих и тропических морей и характеризуются заметными видо-
выми различиями. На вегетативной стадии развития ядро ацета-
булярии расположено в ее основании, в так называемом ризоиде,
рост стебля в длину и формирование шляпки всегда происходит
на апикальном конце, т. е. на верхушке. В исследованиях с раз-
личными ядерно-цитоплазматическими комбинациями было уста-
новлено, что не цитоплазма, а именно ядро контролирует форму
возникающей шляпки данной водоросли. Геммерлинг [Hammer-
ling, 1953] предположил, что образующиеся в ядре морфогене-
тические вещества, которые представляют собой «продукты дей-
ствия гена, связующее звено между геном и признаком», перено-
сятся в цитоплазму и определяют построение видоспецифичес-
кой шляпки. Проведенные в последние годы исследования с при-
влечением биохимических методик указывают, что такими мор-
фогенетическими веществами являются синтезируемые в ядре
иРНК.
Молекулярно-генетические механизмы морфогенеза однокле-
точных должны быть сходны с таковыми для отдельных клеток
высших организмов. Соннеборн [1974] пишет, что проблема мор-
фогенеза в основе своей одинакова для всех клеток и организмов
и заключается в том, чтобы объяснить специфические простран-
ственно-временные закономерности образования, превращения и
исчезновения частей, а также форму этих частей и целого. Далее
он указывает, что использование многоклеточными организмами
новых возможностей морфогенеза, которые дает многоклеточ-
ность, в частности, таких, как клеточные взаимодействия и диф-
ференциальная активность генов в разных клетках, не исключает
полностью морфогенетических механизмов, характерных для од-
ноклеточных.
У человека и различных представителей млекопитающих, в
особенности у мыши, известны мутантные гены, которые обус-
ловливают возникновение анемий, характеризующихся изменени-
ем размеров, формы и строения эритроцитов. Так, при сфероци-
тозе эритроциты имеют сферическую, а не двояковогнутую фор-
му, как в норме. Одним из наиболее важных белков плазматичес-
кой мембраны эритроцитов, которому приписывается централь-
ная роль в их деформируемости, является спектрин, составляю-
щий примерно 25% от количества всех белков плазматической
мембраны. У мышей с наследственным сфероцитозом обнаруже-
но резкое снижение спектрина в плазматической мембране эри-
троцитов [Valentine, 1978].
Морфогенез сперматозоидов также находится под генетичес-
ким контролем, на что указывает действие некоторых мутантных
генов у мыши. Ген Tfm поражает сперматоциты I порядка, а 3
гена (hop, hpy, р9) нарушают разные этапы дифференцировки
сперматиды у мыши [Bruce, Meistrich, 1972]. Флагеллярные
структуры и хвосты спермиев самцов р9/р8 нормальны, но разви-
тие головки нарушается. Во время формирования акросомы воз-
214
«икают различные ее аномалии, в частности, появляются мно-
жественные участки «имплантаций» акросом на ядрах сперма-
тид. На поздних стадиях формирования сперматиды происходит
конденсация хроматина, которая у мутантов часто полностью не
завершается. Все эти нарушения дают широкий спектр аномаль-
ных спермиев: от сперматозоидов с головками почти нормаль-
ной морфологии до спермиев, головки которых не содержат хро-
матина [Вгуап, 1977а].
У спермиев самцов hpy/hpy в большей степени нарушена их
хвостовая часть, чем головка. У мутантных спермиев вместо нор-
мальных флагеллярных структур обнаружены лишь частично
организованные компоненты хвоста (митохондрии и наружные
фибриллы). Дисгенез флагеллярных структур у мутантов, оче-
видно, является результатом нарушений их сборки [Вгуап,
1977b]. У самцов мышей tw2/tw2 сперматогенез также нарушается
на стадии сперматиды: наблюдаются разрывы ядерной оболоч-
ки, изменения перинуклеарного пространства и микротрубочки
подвергаются преждевременной деполимеризации [Dooher, Ben-
nett, 1974]. Эти данные свидетельствуют о том, что развитие го-
ловок и хвостов спермиев находится под контролем группы генов.
Последовательность дерепрессии генов
в ходе органогенеза
Как отмечалось выше, в оплодотворенной яйцеклетке — зиго-
те— гены не активны, на ранних стадиях (моруле, бластуле) де-
репрессируются гены, контролирующие процессы размножения
клеток и общего метаболизма, а начиная со стадии гаструлы ак-
тивируются тканеспецифические гены, определяющие синтез
тканеспецифических белков и дифференцировку тех или иных
типов клеток. По мере развития зародыша все больше и больше
генов начинает функционировать, а период органогенеза харак-
теризуется наибольшей генной активностью. Подавляющее боль-
шинство известных в настоящее время мутантных генов прояв-
ляет свою активность именно в этот период развития.
Известно много мутантных генов, нарушающих различные
этапы формирования тех или иных органов. У человека описано
более 120 различных форм наследственной глухоты [McKusick,
1978]. Примерно 20—30% из них обусловлено аутосомными до-
минантными генами, 60—70% — аутосомными рецессивными ге-
нами и 2%—генами, локализованными в Х-хромосоме. В сред-
нем 16% людей являются гетерозиготами по одному из рецес-
сивных генов. Некоторые из этих генов проявляют заметные
субклинические эффекты, а другие могут вызывать предраспо-
ложение к возникновению аномалий органа слуха у гетерозигот
в результате действия различных внешних факторов [Nance,
McConnell, 1973]. По мнению этих авторов, для развития уха
требуется взаимодействие нескольких сот генов.
215
Известно более 50 мутантных генов, которые вызывают ано-
малии внутреннего уха у мыши, причем гены вступают в дейст-
вие не сразу, а последовательно на разных стадиях развития,
начиная с образования слухового пузырька [Deol, 1970а].
Нарушение морфогенеза часто происходит не в результате
действия гена в клетках данного органа, а вследствие разруше-
ния соответствующих индукционных взаимодействий между
развивающимися структурами. Так, у эмбрионов мышей, гомо-
зиготных по генам Sp или Lp, возникновение аномалий внутрен-
него уха обусловлено ненормальными индукционными влияния*
ми со стороны пораженной нервной трубки на слуховую эктодер-
му [Deol, 1966]. Нарушение развития внутреннего уха у эмбрио-
нов мышей, гомозиготных по гену fi, возникает также вторично,
вследствие недостаточной индукции на слуховой пузырек со
стороны ненормально формирующегося продолговатого мозга
[Konyukhov, Vakhrusheva, 1969; Конюхов, Сажина, 1972]. Име-
ются наследственные аномалии внутреннего уха, обусловленные
действием мутантных генов в эктомезенхимных клетках, которые
образуются из нервного гребня и принимают участие, в частнос-
ти, в формировании слухового ганглия. В таких случаях возника-
ют синдромы, характеризующиеся глухотой и нарушением пиг-
ментации [Deol, 1970b].
Для формирования таких сложных органов, как, например,
глаз и конечность, необходимо взаимодействие многих сотен ге-
нов. Тот факт, что у человека известно около 250 наследствен-
ных болезней глаза [Francois, 1962], обусловленных действием
мутантных генов на разных стадиях онтогенеза, указывает на
сложный характер генетического контроля морфогенеза органа
зрения.
У мыши известно более 20 мутантных генов, нарушающих
различные этапы формирования глаза начиная с самой ранней
стадии развития этого органа — глазного пузыря. Причем каж-
дый ген включается в действие на конкретной стадии развития и
в определенной клеточной системе (рис. 55).
Гены еу-1 и еу-2 активируются на стадии образования глаз-
ного пузыря и сильно подавляют рост последнего, в результате
чего не происходит нормальной индукции хрусталика [Chase,
Chase, 1941; Silver J., Hughes, 1974; Конюхов, Малинина и др.,
1978]. Ген fi включается в действие несколько позже, подавляя
рост глазного пузыря и зачатка сетчатки [Konyukhov, Vakhru-
sheva, 1969]. Ген ог дерепрессируется еще позднее, уже после
формирования глазной чаши, и ингибирует рост зачатка сетчат-
ки [Конюхов, Сажина 1962; Конюхов, Строева и др., 1963]. Ге-
ны fi и ог действуют сходным образом, подавляя пролиферацию
клеток в развивающейся сетчатке, что связано со значительным
удлинением пресинтетического периода клеточного цикла [Ko-
nyukhov, Sazhina, 1971]. Эффекты гена rd, проявляющиеся в
деструкции фоторецепторов, впервые удается обнаружить при
216
Рис. 55. Место и время проявления мутантных генов, нарушающих морфоге-
нез глаза у мыши
помощи светового и электронного микроскопа на 8-й день после
рождения, т. е. практически на конечных этапах формирования
сетчатки [Noell, 1958; Caley е. а., 1972; Blanks е. а., 1974]. Фото-
рецепторы 7-дневных мышей rd/rd имеют пониженную актив-
ность фосфодиэстеразы циклического гуанозин-3',5'-монофосфа-
та (цГМФ) по сравнению с нормой, что приводит к сильному
увеличению концентрации цГМФ в формирующихся фоторецеп-
торах и в итоге — к их дегенерации [Lolley, Farber, 1976].
Другие гены действуют в развивающемся хрусталике. Ген ак
активируется в клетках хрусталиковой плакоды зародыша мы-
ши, нарушая формирование хрусталикового пузырька, что в
итоге приводит к отсутствию хрусталика — афакии [Varnum,
Stevens, 1968; Zwaan, 1975]. Как показало электронно-микро-
скопическое исследование, ген CatFr вступает в действие на опре-
деленных этапах дифференцировки первичных и вторичных хру-
сталиковых волокон, наиболее ранние видимые эффекты этого
гена — нарушение структуры ядерной оболочки [Конюхов, Ко-
лесова, 1976]. Имеются гены (1g, gp и 1г), нарушающие, по-ви-
Димому, только формирование вторичных хрусталиковых воло-
кон [Fraser F. С., Негег, 1950; Stein е. а., 1967; Harris, Fraser,
1968; Stein, Kettyle, 1973]. Эффекты этих генов изучены не под-
робно, и поэтому нельзя еще твердо говорить о времени их акти-
вации и месте действия. Ранние морфологически видимые эф-
217
фекты гена ес проявляются в клетках хрусталикового эпителия
примерно через 3 недели после рождения [Beasley, 1963]. Неко-
торые мутантные гены, например mi и его аллель Miwh, действу-
ют, очевидно, в клетках нервного гребня, и морфогенез глаза
нарушается вторично в результате ненормальных влияний со
стороны пораженной мутантным геном эктомезенхимы на на-
ружный листок глазной чашки [Конюхов, Сажина, 1963; Коню-
хов, Осипов, 1968].
Место действия многих вышеуказанных генов, контролирую-
щих развитие глаза у мыши, было установлено в результате
экспериментальных исследований. Траслов [Truslove, 1962] на
основании гистологического анализа высказала предположение,
что нарушение развития глаза у мышей генотипа ог/ог обуслов-
лено ненормальным кровоснабжением на ранних стадиях его
формирования. Однако культивирование зачатков глаз эмбрио-
нов ог/ог in vitro или трансплантация их в переднюю камеру
глаза взрослых нормальных мышей показали, что ген ог действу-
ет в клетках зачатка сетчатки, подавляя его рост и приводя в
конечном итоге к развитию микрофтальмии. Аномалия хруста-
лика у мышей ог/ог возникает вторично в результате поражения
сетчатки [Конюхов, Строева и др., 1963; Конюхов, Уголькова,
1978].
Тейлер с соавторами [Theiler е. а., 1976] исследовали эффек-
ты другого мутантного аллеля (ог3) этого локуса. Зачатки глаз
11 — 13-суточных эмбрионов мышей ог3/ог3, трансплантированные
в семенники гистосовместимых животных, оказались неспособ-
ными формировать сетчатку. Зачатки глаз ог3/+ при таких же
пересадках образовывали сетчатку.
Траслов [Truslove, 1956] показала, что у мышей, гомозигот-
ных по гену fi, нарушено развитие вестибулярного аппарата,
глаз и некоторых других органов. Она полагала, что уменьшение
размеров глаза у мышей fi/fi обусловлено первичным пораже-
нием развития хрусталика, который часто не отшнуровывается
полностью от головной эктодермы. Нами было установлено, что
ген fi вступает в действие на 9-е сутки эмбриогенеза, ингибируя
митотическую активность клеток глазного пузыря и головного
мозга [Konyukhov, Vakhrusheva, 1969]. Эти факты свидетельст-
вовали о первичном поражении сетчатки у мышей fi/fi. Однако
без экспериментального анализа нельзя было решить вопрос о
месте действия этого гена.
Для определения места действия гена fi зачатки глаз 10- и
11-суточных эмбрионов мышей генотипов +/+ +/+ (норма),
fi/fi +/+, +/+ ог/ог и fi/fi ог/ог культивировали in vitro в тече-
ние 24, 48, 72 и 96 ч. В результате этих исследований была пока-
зана экспрессия гена fi в клетках культивируемой сетчатки 10- и
11-суточных эмбрионов генотипа fi/fi +/+, что проявлялось в по-
давлении пролиферативной активности сетчатки. Ген fi не акти-
вен в клетках формирующегося хрусталика. Митотический ин-
218
деке хрусталикового эпителия культивируемых зачатков глаз
10-суточных эмбрионов fi/fi +/+ статистически достоверно не
отличался от митотического индекса хрусталикового эпителия
эмбрионов +/+ +/+ на всех изученных сроках культивирова-
ния. Следовательно, аномалии хрусталика у мышей, гомозигот-
ных по гену fi, возникают вторично вследствие подавления рос-
та зачатка сетчатки. Гены fi и ог взаимодействуют синергично в
культивируемой сетчатке эмбрионов fi/fi ог/ог, приводя к силь-
ному ингибированию ее митотической активности. После 72 ч
культивирования зачатков глаз 10-суточных эмбрионов сетчатка
зародышей fi/fi +/+ была значительно тоньше, чем в норме, а
сетчатка эмбрионов fi/fi ог/ог, как правило, состояла только
из одного ряда клеток. Сетчатка 11-суточных эмбрионов fi/fi
ог/ог уже через 48 ч культивирования была представлена одним
слоем клеток, содержащих гранулы меланина. Эти данные ука-
зывают на то, что оба мутантных гена, fi и ог, действуют в клет-
ках формирующейся сетчатки [Конюхов, Уголькова, 1978]. Деге-
нерация фоторецепторов сетчатки у мыши обусловлена действи-
ем гена rd в этих клетках, так как этот дефект не исправляется
при эксплантации глаза или сетчатки [Lucas, 1958; Sidman,
1963].
У человека известно более 150 наследственных аномалий ске-
лета как осевого, так и конечностей [McKusick, 1978]. Изучение
эффектов мутантных генов, нарушающих развитие конечностей
у мыши и курицы, показало, что гены контролируют их образо-
вание начиная с самой ранней стадии — почки конечности. У мы-
ши известно около 30 мутантных генов, нарушающих развитие
конечностей, а у курицы — более 20.
На рис. 56 показаны место и время обнаружения морфологи-
чески видимых эффектов некоторых из этих генов. Ряд генов
действует в клетках апикального эктодермального гребня: у мы-
ши— sm [Gruneberg, 1960] и Os [Milaire, 1962]; у курицы — ей
[Goetinck, 1964] и sc [Sengel, Abbott, 1963; Goetinck, 1966]. Дру-
гие гены активны в мезенхимных клетках почки конечности: у
мыши —ру [Chang, 1939]; у курицы —dp1, dp2, dp3 и dp4 (см.
MacCabe е. а., 1975], Ро, Pod, ta2 и ta3 [Goetinck, Abbott, 1964;
Goetinck, 1966] и wg [Zwilling, 1949, 1961]. У мыши 3 мутант-
ных гена — рс [Sisken, Gluecksohn-Waelsch, 1959], sy [Griineberg,
1962], Ps [Johnson D. R., 1969] —включаются в действие на бо-
лее поздних стадиях формирования почки конечности, нарушая
размеры и число мезенхимных конденсаций зачатков костей, что
в итоге приводит к сильному уменьшению размеров конечностей
У мышей рс/рс или отклонениям от нормы числа пальцев у жи-
вотных генотипов sy/sy, Ps/+ и Ps/Ps. Тот факт, что эти мутант-
ные гены обусловливают ненормальную агрегацию предхряще-
вых клеток, указывает на генетический контроль синтеза опре-
деленных веществ плазматической мембраны мезенхимных кле-
ток, образующих зачатки костей.
219
Рис. 56. Место и время проявления мутантных генов, нарушающих морфогенез
конечностей у мыши и курицы
Символы генов мыши — справа, курицы — слева
Аутосомный полудоминантный ген Ср в гетерозиготном со-
стоянии подавляет рост зачатков длинных костей у куриных
эмбрионов, в результате чего возникает сильное укорочение ко-
нечностей— ахондроплазия. Ген Ср, очевидно, действует в хон-
дроцитах всех длинных костей конечностей, в частности бедрен-
ной, большеберцовой и малоберцовой кости [Landauer, 1931,
1934; Wolff, Kieny, 1957; Kieny, Abbott, 1962а]. Ген dp4, локали-
зованный в Х-хромосоме курицы, действует в течение длитель-
ного периода развития и наряду с нарушением формирования
почки конечности подавляет рост зачатков длинных костей, воз-
никающих из мезенхимы преаксиальной части почки конечности,
в частности большеберцовой кости [Kieny, Abbott, 1962b].
220
Ген Id приводит к слиянию друг с другом мезенхимных закла-
док костей, вследствие чего сильно нарушается морфогенез пе-
редних и задних конечностей у мыши. В частности, локтевая
кость сливается с лучевой, а малоберцовая — с большеберцовой
[см. Green, 1966а]. Аутосомные рецессивные гены Ьрн и сп по-
давляют рост (гипертрофию) хрящевых клеток длинных костей
конечностей мыши. Ген Ьрн активен в клетках длинных костей,
возникающих из мезенхимы постаксиальной части почки конеч-
ности, в частности малоберцовой кости [Konyukhov, Ginter, 1966;
Малинина, 1969], а ген сп действует в хрящевых клетках эпифи-
зарных пластинок всех длинных костей конечностей на более
поздних этапах онтогенеза '[Konyukhov, Paschin, 1967].
Скорость белкового синтеза в хондроцитах малоберцовой
кости новорожденных мышей Ьрн/Ьрн значительно меньше, чем
в норме. Хотя мутантные хондроциты синтезируют нормальный
тип коллагена, скорость его синтеза примерно вдвое меньше по
сравнению с нормой [Rhodes, Elmer, 1975]. Плазматическая мем-
брана хондроцитов пораженных зачатков костей эмбрионов
bpH/bpH отличается от таковой нормальных хрящевых клеток
[Elmer, 1976].
Мутантный ген chondrodysplasia (cho) активируется в хонд-
роцитах, очевидно, несколько позже, чем ген bpH [Seegmiller
е. а., 1971], а ген cartilage anomaly (сап) начинает работать
раньше гена сп в хрящевых клетках эпифизарных пластинок
[Johnson D. R. Wise, 1971]. Подавление роста костей конечнос-
тей у эмбрионов мышей cho/cho, очевидно, обусловлено дефект-
ным синтезом коллагена в хондроцитах [Stephens, Seegmiller,
1976]. Хрящ грудины и необезызвествленных частей ребер 17-
дневных эмбрионов мышей сап/сап отличается от нормы пони-
женной скоростью белкового синтеза. В результате этого у
3-дневных мышей сап/сап содержится меньше коллагена в хря-
ще по сравнению с нормальными мышами того же возраста
[Johnson D. R., Hunt, 1974]. У мышей, гомозиготных по гену
brachymorphic (bm), длинные кости конечностей растут медлен-
нее, чем в норме. Это обусловлено в основном уменьшением раз-
меров зоны гипертрофии хондроцитов эпифизарных пластинок,
в которых отмечена пониженная скорость сульфатации кислых
мукополисахаридов [Orkin е. а., 1976]. Ультраструктурный анализ
показал наличие нормальных коллагеновых волокон в матриксе
хрящевых эпифизарных пластинок у новорожденных мышей
bm/bm. Однако количество протеогликана у мутантов оказалось
меньше по сравнению с нормой. Ген bm, очевидно, нарушает
синтез протеогликана хрящевыми клетками эпифизарных пла-
стинок [Orkin е. а., 1977].
Место действия многих указанных выше мутантных генов
было установлено в результате экспериментальных исследований
с помощью реципрокных пересадок тканей и зачатков органов
Между нормальным и мутантным организмами, а также культи-
221
вированием тканей in vitro. С помощью реципрокных пересадок
апикального эктодермального гребня (АЭГ) и мезодермальной
части почки конечности куриных эмбрионов установлено, что ге-
ны Ро, Pod, ta2 и ta3, обусловливающие полидактилию, действуют
в мезенхимных (мезодермальных) клетках [Zwilling, Hansboro-
ugh, 1956; Goetinck, Abbott, 1964; Fraser R. A., Abbott, 1968; Ede,
Flint, 1975], а ген eudiplopodia (eu), наоборот, активен в клетках
АЭГ почки нижней конечности [Goetinck, 1964; Fraser R. A., Ab-
bott, 1968]. Методом рекомбинаций нормальной мезодермальной
и мутантной эктодермальной частей и, наоборот,— мутантной ме-
зодермальной и нормальной эктодермальной частей почки конеч-
ности раннего зародыша показано, что локализованный в Х-хро-
мосоме рецессивный ген diplopodia4 (dp4), обусловливающий
полидактилию у курицы, действует в мезенхимных клетках за-
чатка конечности. Первичное поражение мезодермальной части
почки конечности приводит к вторичному нарушению развития
эктодермальной части, в результате чего образуется аномальный
АЭГ Три неаллельных аутосомных рецессивных гена diplopo-
dia1"3 (dp1, dp2, dp3) действуют, очевидно, также в мезенхимных
клетках зачатка конечности, а АЭГ поражается вторично [Мас-
Cabe е. а., 1975].
Опыты с эксплантацией зачатков костей показали, что гены
Ср и dp4 у курицы функционируют в хондроцитах зачатков длин-
ных костей конечностей [Wolff, Keiny, 1957; Abbott, Keiny, 1961;
Kieny, Abbott, 1962a, Ь]. Отсутствие роговых пластинок и шпор
на ногах у цыплят, гомозиготных по гену scaleless (sc), обуслов-
лено первичным поражением клеток эпидермиса, а развитие дер-
мы нарушается вторично [Sengel, Abbott, 1963]. При помощи
культивирования зачатков костей in vitro установлено, что ген
Ьрн у мыши действует в хрящевых клетках, возникающих из ме-
зенхимы постаксиальной части почки конечности, обусловливая
торможение их роста и дифференцировки [Konyukhov, Ginter,
1966]. Реципрокные трансплантации длинных костей конечностей
между 7- или 14-дневными мышами сп/сп и их нормальными сиб-
сами показали, что действие гена сп проявляется в хондроцитах
эпифизарных пластинок длинных костей конечностей [Konyuk-
hov, Paschin, 1967].
Мутантный аутосомный рецессивный ген ей в гомозиготном
состоянии обусловливает появление добавочных структур на дор-
сальной поверхности дистальных частей лог и крыльев у курицы.
Эффекты данного гена часто выражаются в удвоении пальцев,
возникающих из постаксиальной части почки конечности.
У куриных эмбрионов eu/eu образуется эктопическое эктодер-
мальное утолщение, или гребень, который появляется через день
или позже после формирования АЭГ У мутантов АЭГ регенери-
рует после его удаления с почки конечности на 20-й стадии, в то
время как в норме он не регенерирует даже после 18-й стадии.
Эктопический эктодермальный гребень образуется на дорсаль-
222
ной поверхности почки конечности мутантов даже на 22—23-й
стадиях, если удалить эктодерму на этих участках почки конеч-
ности у куриных эмбрионов более ранних стадий развития. Сле-
довательно, образование эктопического эктодермального гребня
не зависит от формирования АЭГ и эктодермальные клетки поч-
ки конечности мутанта могут формировать эктопический экто-
дермальный гребень в течение нескольких стадий. Такая спо-
собность мутантных эктодермальных клеток к образованию экто-
пического эктодермального гребня частично подавляется, если
эмбрионы инкубировать при пониженной температуре в период
формирования почки конечности [Fraser R. A., Abbott, 1971а].
Трансплантирование мезодермальной части почки конечности
нормальных зародышей на бок 2-дневным зародышам eu/eu при-
водило к развитию конечностей мутантного фенотипа, а пересад-
ка этой же части почки конечности от эмбрионов eu/eu к нор-
мальным реципиентам давала нормальные конечности. Транс-
плантирование мезодермальных частей нормальных почек конеч-
ностей на бок 3,5-дневным зародышам eu/eu обеспечивало фор-
мирование конечности, однако пересадки их к нормальным ре-
ципиентам такого же возраста в большинстве случаев не приво-
дили к развитию конечности [Fraser R. A., Abbott, 1971b]. Эти
данные свидетельствуют о том, что мутантный ген ей действует
в эктодермальных клетках и удлиняет время их компетенции,
вследствие чего наряду с АЭГ, образуется эктопический экто-
дермальный гребень.
Экспериментальными исследованиями на куриных эмбрио-
нах, гомозиготных по гену wingless (wg), было показано, что
мезодермальная часть почки крыла мутантов не обладает спо-
собностью поддерживать нормальное состояние АЭГ. В резуль-
тате этого последний не может индуцировать рост почки конеч-
ности, что и приводит к ее регрессии и отсутствию образования
крыльев. Следовательно, в данном случае имеет место наруше-
ние тесного реципрокного взаимодействия двух тканей [Zwilling,
1961].
Анализ наследственных аномалий скелета конечностей у поз-
воночных показал, что одни мутантные гены нарушают развитие
костей, возникающих из постаксиальной части почки конечнос-
ти, а другие гены, наоборот, обусловливают поражение костей,
происходящих из ее преаксиальной части. Эти данные указыва-
ют на неодинаковую активность генов в разных частях развиваю-
щейся почки конечности.
Трансплантация кусочков тканей из одних частей почки ко-
нечности в другие показала наличие в почке конечности несколь-
ких зон с разной морфогенетической активностью. Четкие раз-
личия в морфогенетических свойствах обнаружены между
преаксиальной и постаксиальной частями почки конечности, по-
следняя считается более активной в морфогенетическом отноше-
нии. В клетках постаксиальной части продуцируются 2 фактора:
223
так называемый поляризующий фактор, обусловливающий по-
лярность передне-задней оси конечности, и мезодермальный
фактор, ответственный за формирование дистальных структур
конечности [Fallon, Crosby, 1975; Cameron, Fallon, 1977]. Специ-
фичным действием может обладать даже гетерологичный мор-
фогенетический фактор. Так, например, поляризующая зона поч-
ки ноги мышиного эмбриона вызывает при трансплантации обра-
зование пальцев в формирующемся крыле куриного зародыша
[Tickle е. а., 1976].
В течение б поколений мышей производили отбор на опреде-
ленную относительную длину малоберцовой и лучевой костей.
Отбор на относительно длинные и короткие кости не затрагивал
размеров черепа, тазовых костей и первого шейного позвонка.
Характер изменения длины малоберцовой и лучевой костей
указывает на генетический контроль их развития [Hooper,
1977].
Эмбрионам млекопитающих присуща тенденция развиваться
по женскому типу, а изменение развития по мужскому типу яв-
ляется результатом действия генов по крайней мере двух локу-
сов, которые рассматриваются как первичные детерминирующие
мужской пол локусы. Один из них локализован в Y-хромосоме и
контролирует синтез мембранного белка, известного как H-Y-ан-
тиген. Этот локус определяет развитие эмбриональных индиффе-
рентных гонад в семенники. Последние, в свою очередь, продуци-
руют андрогены, под влиянием которых идет все экстрагональ-
ное развитие по мужскому типу. Реакция всех типов клеток-ми-
шеней на андрогены, за возможным исключением мужских поло-
вых клеток, зависит от сцепленного с Х-хромосомой Tfm-локуса,
контролирующего синтез специфического андрогенрецепторного
клеточного белка [Ohno, 1977].
У человека известно 18 мутантных генов, каждый из которых
нарушает определенную стадию половой дифференцировки. Ана-
лиз мутантных фенотипов показывает, что гены контролируют
морфогенез гонад, синтез половых гормонов и у особей мужско-
го пола — чувствительность клеток к действию трех гормонов, а
именно фактора, обусловливающего регрессию мюллеровых про-
токов, тестостерона и дигидротестостерона. Изучение эффектов
мутантных генов показало, что 2 андрогенных гормона, тестосте-
рон и дигидротестостерон, выполняют различную роль в вирили-
зации мочеполового тракта: тестостерон стимулирует рост воль-
фовых протоков, а дигидротестостерон изменяет направление
развития по мужскому типу мочеполового синуса и наружных
гениталий [Goldstein, Wilson, 1975].
У мыши известен фактор реверсии пола Sxr, локализованный
на 7-й аутосоме и обусловливающий переопределение женского
пола в мужской. У мышей XX 5хг/+ФактоР Sxr осуществляет
основные функции Y-хромосомы, хотя сперматогенез и не идет.
Гордон [Gordon, 1976] получал химерных мышей путем агрега-
224
ции нормальных бластомеров с бластомерами, несущими фактор
Sxr, для сравнения эффективности фактора Sxr и Y-хромосомы
в определении мужской половой дифференцировки. Химеры XX
Sxr/+«->XX +/+ имели нормальные мужские гениталии, но бы-
ли бесплодны. В некоторых случаях одна гонада представляла
собой небольшое яичко, содержащее островки овариальных тка-
ней, а другая — овотестис с разрушенными фолликулами. Гер-
мафродитизм у таких химер, очевидно, обусловлен тем, что фак-
тор Sxr не способен полностью заменить Y-хромосому. Химеры
XX^->XY обычно являются нормальными самцами, так как XY-
клетки индуцируют ХХ-клетки к развитию мужских половых ор-
ганов.
Фактор Sxr сцеплен с геном С окраски шерсти. Химерных
мышей, полученных путем агрегации бластомеров С/С Sxr/+ с
бластомерам с/с +/ + , скрещивали с мышами-альбиносами ге-
нотипа с/с +/+ и о судьбе половых клеток, несущих Sxr, суди-
ли по появлению животных с пигментированной шерстью. В ре-
зультате такого скрещивания было получено более 1200 потом-
ков, ни один из которых не мог быть образован из примордиаль-
ных половых клеток XX Sxr/+. Следовательно, такие клетки не
принимают участия в сперматогенезе и из них не возникают пол-
ноценные сперматозоиды даже при наличии фактора Sxr, детер-
минирующего развитие по мужскому типу. Эти данные показы-
вают, что фактор Sxr не так эффективен, как Y-хромосома, в
определении морфогенеза гонад по мужскому типу.
Наличие у самцов мышей XX Sxr/+ антигена H-Y, характер-
ного для особей XY-кариотипа [Bennett е. а., 1977], и поведение
половых хромосом у мышей XY Sxr/+ и Х0 Sxr/+ на стадии
диакинеза в мейозе [Winsor е. а., 1978] указывают, что измене-
ние пола у самок, несущих фактор Sxr, обусловлено, очевидно,
транслокацией части Y-хромосомы на аутосому.
У человека, мыши и других позвоночных известно много му-
тантных генов, вступающих в действие на разных стадиях онто-
генеза и нарушающих определенные этапы формирования цен-
тральной нервной системы, кожи волос и других органов [см.
Конюхов, 1969; Holmes L. В., 1974; McKusick, 1978].
Миграция и интеграция клеток
Если в основе клеточной дифференцировки лежит синтез тка-
неспецифических белков, то для образования тканей и органов
большое значение имеет поведение клеток, которое определяется
особенностями плазматических мембран. Роль плазматической
мембраны, образующей поверхность клетки, в межклеточных
взаимодействиях трудно переоценить: при ее помощи устанавли-
вается тесная связь клетки с непосредственно прилежащей вне-
клеточной средой или, как ее еще называют, микросредой. Плаз-
8 Б. В. Кон 225
матическая мембрана играет важную роль в осуществлении в
частности таких явлений, как межклеточные контакты, адгезия
и агрегация.
Если подвижные клетки приходят в соприкосновение друг с
другом и расходятся, то говорят о контакте между клетками.
Пришедшие в контакт клетки могут длительное время оставать-
ся тесно прижатыми друг к другу. Такие межклеточные взаимо-
действия рассматриваются как агрегация. Межклеточная агрега-
ция обусловлена прежде всего состоянием клеточной поверхнос-
ти, характеризующейся определенной степенью «клейкости» —
адгезией, что способствует прилипанию клеток друг к другу. Ес-
ли между агрегировавшими клетками возникают соединительно-
тканные или сосудистые структуры, то это указывает на образо-
вание из простых клеточных агрегатов тканей или органов.
Для формирования того или иного органа необходимо присут-
ствие в определенном месте всех клеток, обладающих общим
органным сродством. Если отделить друг от друга клетки како-
го-либо органа, то в культуре сначала происходит объединение
клеток разных типов, а уже позже из таких общих скоплений
клеток выделяются агрегаты одинаковых клеточных элементов,
представляющие собой как бы те или иные ткани. Высокая спе-
цифичность агрегации клеток, приводящая к образованию in vit-
ro ткани, показывает важную роль плазматических мембран в
морфогенезе [Moscona, Moscona, 1952].
Таунес и Хольтфретер [Townes, Holtfreter, 1955] дезагрегиро-
вали клетки ранних эмбрионов амфибий и исследовали их взаи-
модействие in vitro. Клетки сначала соединялись друг с другом
хаотично, однако позднее происходила рассортировка клеток в
соответствии с их свойствами. Если комбинировали эпидермаль-
ные клетки с мезодермальными или клетками нервной пластин-
ки, то эпидермальные клетки оказывались на поверхности, а
клетки мезодермы и нервной пластинки всегда располагались
внутри клеточного агрегата. При этом клетки нервной пластинки
образовывали структуры, сходные с пузырями головного мозга.
Если в клеточном агрегате присутствовали эпи-, мезо- и энтодер-
мальные клетки, то эпидермальные клетки оказывались на по-
верхности, а мезодермальные — между эпидермальными и экто-
дермальными клетками.
Де Лонг [DeLong, 1970] показал, что клетки гиппокампа
18,5-дневных эмбрионов мыши агрегируются в культуре и через
определенное время культивирования расположение клеток в
агрегатах становится примерно таким же, как в гиппокампе.
Клетки коры головного мозга 17,5—18,5-дневных эмбрионов мы-
ши также располагались in vitro в определенном порядке. Клет-
ки гиппокампа или коры головного мозга эмбрионов других
сроков развития не обладали такой способностью к упорядочен-
ному расположению в агрегатах. Следовательно, в определенный
период органогенеза клетки имеют способность к правильному
226
расположению относительно друг друга, они как бы узнают сво-
их партнеров.
Механизм ориентации или упорядоченной организации клеток
связан с синтезом специфических клеточных белков. Высокая
специфичность миграции клеток, возможно, обусловлена секре-
цией клетками определенных веществ. Клетки реагируют на
секретируемые ими специфические вещества и направленно дви-
жутся друг к другу [Edelstein, 1971].
Из теорий, объясняющих адгезию клеток, заслуживает вни-
мания гипотеза комплементарности макромолекул клеточных
поверхностей. К таким веществам в первую очередь относятся
гликопротеиды, а среди ферментных систем — гликопротеидгли-
козилтрансферазы [Bosmann, 1977]. По оценке Уоссермана
[Wassermann, 1972], в каждой соматической клетке млекопитаю-
щих может образовываться до 40 000 уникальных типов белко-
вых молекул, многие из которых входят в состав плазматичес-
ких мембран. Все соматические клетки, за исключением клеток
одного клона, имеют, очевидно, уникальные наборы полипептид-
ных цепей на плазматических мембранах. Уоссерман [1972] на-
звал такие выступающие на поверхности плазматических мем-
бран структуры молекулярными картами. Если структура моле-
кулярных карт плазматических мембран двух контактирующих
клеток взаимно комплементарна, то клетки избирательно при-
крепляются друг к другу, образуя клеточные комплексы.
У мыши известно около 50 локусов, которые контролируют
образование аллоантигенов, локализованных на плазматической
мембране. Число таких локусов, определяющих гистосовмести-
мость тканей, в действительности, очевидно, значительно больше
и составляет несколько сот [Klein, 1975]. Изучение мутантных
фенотипов показало, что особенности плазматических мембран
разных типов клеток генетически детерминированы [Boyse, Old,
1969; Scriver, 1969]. Мутантные гены могут изменять свойства
плазматических мембран, что приводит к ненормальному распо-
ложению клеток относительно друг друга и нарушению морфоге-
неза.
Большой набор мутантных генов сложного Т-локуса у мыши
делает возможным идентификацию генов, контролирующих ран-
ние стадии развития млекопитающих. Были исследованы эффек-
ты рецессивных t-аллелей, которые в гомозиготном состоянии
нарушают определенные этапы эмбриогенеза от стадии дробле-
ния до стадии нервной трубки [Bennett, 1975]. Причем каждый
t-аллель нарушает развитие мыши уникальным способом, что
может быть интерпретировано как неспособность мутантных
клеток к правильному распознаванию друг друга.
У эмбрионов мышей, гомозиготных по гену t9, большинство
мезодермальных клеток первичной полоски во время гаструля-
Ции не мигрирует в соответствующие области эмбриона. В ре-
зультате такой иммобилизации клеток первичная поДоска сильно
227
I
утолщается, нарушается развитие нервной пластинки и мутанты
погибают на 10-й день эмбриогенеза. Мезодермальные клетки
8-дневных эмбрионов t9/t9 имеют аномальную форму и ультра-
структуру, в частности, не образуют нормальных филоподий с
микрофиламентами [Spiegelman, Bennett, 1974]. Электронно-
микроскопическое изучение показало, что у эмбрионов Т/Т име-
ются дефекты клеточных контактов [Spiegelman, 1976].
Артц и соавторы [Artzt е. а., 1974] считают, что нормальный
аллель Т-локуса у мыши контролирует синтез специфического
поверхностного антигена плазматической мембраны. Этот анти-
ген имеет важное значение в раннем развитии зародыша, так
как мутантные аллели данного локуса обусловливают серьез-
ные нарушения эмбриогенеза. В частности, аллель t12 приводит
к изменению одного из поверхностных клеточных антигенов, что
может быть причиной гибели гомозигот на стадии морулы. Про-
дукт нормального аллеля Т-локуса может функционально заме-
щать антигены, контролируемые генами основного локуса ги-
стосовместимости. Биохимический анализ показал, что эти обе
группы антигенов имеют сходный молекулярный вес и строение
и связаны с p-2-микроглобулином плазматической мембраны
[Artzt, 1975]. Следовательно, гены Т-локуса контролируют син-
тез специфических веществ плазматической мембраны, уча-
ствующих в распознавании одних типов клеток другими, что не-
обходимо для осуществления процессов раннего морфогенеза
зародыша [Bennett е. а., 1972; Bennett, 1975].
Де Лонг и Сидмен [DeLong, Sidman, 1970] установили, что
клетки коры головного мозга 17,5—18,5-дневных эмбрионов мы-
шей, гомозиготных по гену reeler (rl), не обладают способно-
стью к правильному расположению в агрегатах. То же самое
характерно и для клеток мозжечка мышей rl/rl 3—4-дневного
возраста. Следовательно, нарушение строения мозжечка и коры
головного мозга у мышей генотипа rl/rl обусловлено поражени-
ем нервных клеток, которые теряют способность к правильному
расположению в стенках формирующегося головного мозга. Ре-
зультаты этих опытов указывают на то, что специфическое рас-
положение клеток в развивающейся нервной системе находится
под генетическим контролем.
В течение 3—15-дней постнатального развития мыши наблю-
дается миграция гранулярных нейронов из наружного грануляр-
ного слоя коры мозжечка по направлению к их дефинитивной
локализации вдоль прямых глиальных волокон Бергманна, ко-
торые образуют молекулярный слой. У мышей, гомозиготных по
мутантному гену weaver (wv), не происходит нормальной ми-
грации гранулярных нейронов через молекулярный слой коры
мозжечка. Большинство нейронов погибает вблизи места их про-
исхождения — в наружном гранулярном слое. У гетерозиготных
мышей wv/+ гранулярные нейроны мигрируют медленнее, чем
в норме, и меньшее число нейронов достигает дефинитивного
228
местоположения. Нарушение миграции гранулярных нейронов
у мутантов обусловлено ненормальным строением глиальных
клеток Бергманна [Rakic, Sidman, 1973]. На плазматических
мембранах клеток головного мозга и сетчатки куриных зароды-
шей были обнаружены тканеспецифические рецепторы, опреде-
ляющие специфичность адгезии и агрегации клеток [Balsamo,
Lilien, 1974].
Мезенхимные клетки почки конечности куриных эмбрионов,
гомозиготных по гену talpid 3 (ta3), обладают большей способ-
ностью к агрегации друг с другом in vitro по сравнению с таки-
ми же клетками нормальных зародышей [Ede, Agerbak, 1968].
Этот мутантный ген, обусловливающий гибель гомозигот на
6—8-й день инкубации, нарушает также нормальную конденса-
цию клеток, образующих зачаток пера. Такое ненормальное по-
ведение мезенхимных клеток у мутантов, по-видимому, обуслов-
лено дефектным строением их плазматических мембран [Ede
е. а., 1971]. Иде и Флинт [Ede, Flint, 1975] изучали движение
мезенхимных клеток зачатка крыла нормального ( + /+) и му-
тантного (ta3/ta3) куриных зародышей в культуре. Кусочки тка-
ней помещали в пластиковые чашки Петри и с помощью замед-
ленной киносъемки регистрировали миграцию клеток от кле-
точного фронта. Определяли время нахождения клеток в покое
и пройденный клетками путь за 100 с. Средняя скорость мигра-
ции нормальных клеток оказалась выше, чем мутантных, за счет
меньшего времени покоя. Форма мутантных клеток заметно от-
личалась от формы нормальных клеток: они имели короткие
заостренные микроворсинки и более выраженные ундулирую-
щие мембраны.
На ранних стадиях эмбриогенеза плазматические мембраны
имеют большую специфичность по сравнению с мембранами
клеток продвинутых стадий дифференцировки. Если смешивали
мезодермальные клетки почки конечности с клетками, имеющи-
ми такие же гистогенетические потенции, например сомитов или
соматоплевры, то происходило быстрое перераспределение кле-
ток по исходным «сортам», причем клетки вели себя примерно
так же, как если бы в смеси были клетки почки и печени. С дру-
гой стороны, если брали хондроциты из хряща конечности и
смешивали их с хондроцитами, полученными из хряща позвон-
ков, то такого перераспределения клеток не наблюдалось и хон-
дроциты различного происхождения оставались равномерно рас-
пределенными в общем основном веществе хряща [см. Zwilling,
1972]. Высокая специфичность плазматических мембран мало-
дифференцированных клеток играет важную роль в миграции
стволовых клеток и клеточных пластов к местам дефинитивной
локализации.
В норме позвоночным присуще определенное асимметричное
расположение внутренних органов — situs solitus (SS) viscerum.
Зеркальное по отношению к SS расположение внутренних орга-
229
нов — situs inversus (SI) встречается крайне редко. У мыши
мутантный аутосомный рецессивный ген iv, обусловливающий
у гомозигот SI, имеет 50% пенетрантность. Принимая во внима-
ние этот факт, Лейтон [Layton, 1976] высказал гипотезу, соглас-
но которой нормальный аллель локуса iv обладает полной до-
минантностью и контролирует развитие SS. Отсутствие контроля
со стороны нормального аллеля данного локуса приводит к воз-
никновению SS или SI у особей iv/iv случайным образом, т. е.
с 50%-ной вероятностью. Эта гипотеза применима для объясне-
ния генетического контроля нормального расположения вну-
тренних органов у всех позвоночных и у человека, в частности.
В формировании ткани и органа принимают участие различ-
ные клеточные клоны, в результате их взаимодействия происхо-
дит упорядоченное расположение и дальнейшая специализация
клеток. Аутосомный рецессивный ген downless (dl) обусловли-
вает ненормальное строение волос у мыши, причем гены этого
локуса действуют в клетках эпидермиса, а не дермы. У химер-
ных мышей dl/dl-<-> + /+ нормальные и мутантные волосы рас-
полагались в виде узких поперечных полос. Подобное располо-
жение волос отмечено также у экспериментальных химер по ал-
лелям локуса agouti, проявляющего свою активность в клетках
дермы. Эти данные указывают на то, что обе ткани растут сов-
местно, распространяясь в латеральном направлении, за счет
пролиферации клеток, расположенных в продольный ряд
[Green е. а., 1977].
Зачаток органа можно представить как определенным обра-
зом ориентированный набор стволовых клеток. Так, формирова-
ние конечности жестко детерминировано на стадии ранней поч-
ки, где имеется необходимый набор клеток, из которых возни-
кают все компоненты этого сложного органа. В ходе развития
почки конечности в дефинитивный орган не отмечено миграции
каких-либо клеточных элементов из других частей эмбриона.
Если пересаживали раннюю почку крыла куриного эмбриона на
место удаленной дистальной части почки крыла эмбриона более
поздней стадии развития, то развивалась дуплицированная ко-
нечность. Размеры костей, образовавшихся из пересаженной
почки крыла, не отличались от таких же костей другого кон-
трольного интактного крыла эмбриона-донора. После удаления
верхушки из оставшейся части почки крыла реципиента возни-
кали кости плеча и предплечья такого же размера, как кости
контрольного (другого) крыла этого же эмбриона [Summer-
bell е. а., 1973].
Для изучения генетического контроля морфогенеза крайне
важно выяснить механизмы регуляции активности генов, кон-
тролирующих синтез специфических белков плазматических мем-
бран стволовых клеток. Дерепрессия этих первых тканеспецифи-
ческих генов детерминирует чувствительность клетки к конкрет-
ным индукционным стимулам, особенности ее миграции и окон-
230
чатсльной локализации. Анализ мутантных фенотипов, харак-
теризующихся определенными изменениями плазматической
мембраны, представляет большой интерес для выяснения меха-
низмов генетической регуляции морфогенеза. Б. Л. Астауров
[1972, с. 557] писал: «Благодаря каким регуляторным механиз-
мам миллиарды клеток развивающегося существа образуют не
просто сумму, но коллектив, более слаженный и содружный, чем,
скажем, население земного шара, уступающее по численности
клеткам человеческого тела? На каких принципах и механизмах
зиждется сочетание таких как будто несовместимых свойств,
как жесткость и точность выполнения наследственной програм-
мы развития, с одной стороны, и пластичная способность к ра-
дикальной перестройке организации, к авторегуляции и реге-
нерации при нанесении тяжелых дефектов — с другой?» Степень
понимания этих вопросов будет зависеть от успехов в изучении
молекулярно-генетических механизмов морфогенеза.
Генетически программированная смерть клеток
и старение
Одной из основных особенностей морфогенеза многоклеточ-
ных организмов является гибель клеток, которая широко наблю-
дается при миграции клеточных пластов, образования диверти-
кулов и полостей, закрытии трубок и разделении различных за-
кладок органов. В ходе нормального развития погибают целые
клеточные популяции или даже органы, в частности некоторые
отделы мочеполового тракта и зародышевые кровеносные сосу-
ды. Процессы метаморфоза амфибий сопровождаются массовой
генетически обусловленной гибелью клеток, в результате чего
исчезают жабры и хвост личинок лягушек. Дегенерация и не-
кроз клеток происходят на одной и той же стадии и в строго
определенных местах зародыша [Gliicksmann, 1965; Орлова,
1972].
Саундерс и Фоллен [Saunders, Fallon, 1966] рассматривают
гибель клеток в эмбриогенезе как осуществление особой генети-
ческой «программы смерти». На стадии бластоцисты погибают
уже 6—8 клеток, что составляет примерно 10% всех клеток за-
родыша мыши. Гибнущие клетки фагоцитируются клетками
трофобласта или внутренней клеточной массы, из которой обра-
зуется в дальнейшем тело зародыша [El-Shershaby, Hinchliffe,
1974]. Гибель клеток имеет большое значение в морфогенезе
Центральной нервной системы, причем число дегенерирующих
нейронов довольно значительно [Hughes, 1961; Alley, 1974].
Мутантные гены обусловливают гибель многих клеточных
систем в ходе развития. Так, мутантные гены у мыши t12 и Ау
являются клеточными деталями, обусловливая гибель гомозигот
на ранних стадиях развития: ген t12 приводит к дегенерации кле-
ток зародыша на стадии морулы [Mintz, 1964а, Ь], а ген Ау —
231
на стадии ранней бластоцисты [Robertson, 1942; Pedersen, 1974].
В сетчатке мышей, гомозиготных по гену rd, наблюдается деге-
нерация всех фоторецепторов. Наследственная дегенерация фо-
торецепторов описана также у других видов млекопитающих и
человека [см. Конюхов, 1969]. Ряд мутантных генов у мыши при-
водит к дегенерации дифференцирующиеся чувствительные клет-
ки внутреннего уха [см. Deol, 1970а]. В мозжечке мышей, гомо-
зиготных по аутосомному рецессивному гену nervous (пг), гиб-
нет большинство клеток Пуркинье через несколько недель после
рождения [Sidman, Green, 1970].
Эмбрионы мышей, гомозиготные по гену t4, характеризуются
недостаточным развитием мезодермальных структур, клетки ко-
торых имеют дегенеративные изменения. Смерть эмбрионов
этого генотипа наступает между 8-м и 9-м днями внутриутроб-
ного развития [Moser, Gluecksohn-Waelsch, 1967]. Пять относи-
тельно рано действующих ^-аллелей (выявленных в диких по-
пуляциях мышей) обусловливают в гомозиготном состоянии де-
генерацию клеток базальной пластинки нервной трубки пример-
но на 7-й день эмбрионального развития, а у гомозигот по че-
тырем относительно поздно действующим ^-аллелям наблюда-
ется гибель клеток вентральной части заднего мозга на 9—10-й
день эмбриогенеза [Bennett D. е. а., 1959; Bennett D., 1964].
В опытах на химерных мышах установлено, что отсутствие
пигментации определенных участков кожи и волосяного покрова
(белая пятнистость) обусловлено генетически запрограммиро-
ванным отмиранием определенных клонов меланобластов. На-
личие больших белых пятен может быть обусловлено гибелью
двух соседних клонов клеток. Химерных мышей получали путем
агрегации бластомеров нормального ( + / + ) и мутантных гено-
типов: Miwh/Miwh, mibw/mibw или Wv/Wv [Mintz, 1970]. У мышей,
гомозиготных по одному из мутантных генов Miwh, mibw или Wv,
происходит, по-видимому, гибель всех клонов меланобластов на
довольно ранней стадии эмбриогенеза, в результате чего эти жи-
вотные не имеют пигментации шерстного покрова. Однако глаза
у них пигментированы. Это объясняется тем, что меланоциты
сосудистой и радужной оболочек глаза имеют другое происхож-
дение, чем пигментные клетки кожи. Первые образуются в ре-
зультате выселения клеток из глазного зачатка (наружного
листка глазной чаши), а последние являются дериватами нерв-
ного гребня (ганглиозной пластинки).
Большое сходство химерных мышей с мутантными живот-
ными свидетельствует, по мнению Минц [1970], о неодинаковой
выживаемости различных клонов меланобластов, что и является
причиной появления белой пятнистости. Так, у химерных мы-
шей, полученных в результате агрегации бластомеров Miwh/Miwh
и + / + , имеется непигментированный участок на вентральной
(брюшной) стороне тела, как и у мышей Miwh/ + . Минц [1970,
1971с] указывает, что различные клоны меланобластов просле-
232
живаются у мышей генотипов Miwh/ + , Wv/+ или То/ + , а кло-
ны клеток волосяных фолликулов — у мышей генотипов Та/+,
Avy/a, am/ara и AsAw/AsAw. Если у особей, гетерозиготных по ло-
кализованным в Х-хромосоме генам (То/+ или Та/+), присут-
ствие разных клеточных клонов легко объясняется с позиции ги-
потезы активности только одного мутантного аллеля в каждой
клетке, то у животных, гомо- или гетерозиготных по аутосомным
мутантным генам, пока еще нет удовлетворительного объясне-
ния механизмам, обеспечивающим наличие фенотипически раз-
ных клонов одних и тех же клеток.
Нам кажется, что наличие непигментированных участков на
вентральной стороне тела у мышей, гетерозиготных по генам Miw’J
или WT(Miwh/+, Wv/ + ), может быть связано с одной популяцией!
меланобластов, имеющих пониженную выживаемость или мень-
шую скорость миграции. Следует отметить, что меланобласты,
мигрируя из области нервного гребня, в самую последнюю оче-
редь достигают вентральной стороны тела. Дериваты нервного
гребня (спинальные ганглии, мозговое вещество надпочечников,
дерма и др.) у мышей, гомозиготных по мутантному гену Miwh,
уменьшены по сравнению с нормой. Сходным образом, только
в большей степени, поражены дериваты нервного гребня у мы-
шей, гомозиготных по гену mi, который является аллелем гена
Miwh [Конюхов, Осипов, 1968]. В. В. Осипов и М. П. Вахруше-
ва [1974] сообщили, что у эмбрионов мышей Miwh/Miwh митоти-
ческий индекс клеток нервного гребня меньше, чем в норме, а
миграция эктомезенхимных клеток в вентральном направлении
замедлена. Ген mi, очевидно, также подавляет скорость про-
лиферации и миграции эктомезенхимных клеток.
Экспериментальное изучение эффектов мутантных генов, об-
условливающих появление непигментированных участков шерст-
ного покрова у мышей, показало, что мутантные гены могут вы-
зывать определенные локальные изменения тканей, в результате
чего в этих местах имеет место гибель меланобластов, подавле-
ние их пролиферации и дифференцировки, а также нарушение
проникновения меланобластов в формирующиеся волосяные
фолликулы [Мауег, Maltby, 1964; Mayer, Green, 1968; Мауег,
1970, 1973].
У кур породы белый леггорн наблюдается генетически запро-
граммированная преждевременная гибель меланоцитов еще до
отложения меланина в кератиноцитах формирующегося пера,
вследствие чего в перьях накапливается лишь очень небольшое
количество меланина (гипомеланизм). Срок жизни меланоцитов
У кур породы белый леггорн как in vivo, так in vitro значительно
меньше, чем у кур пигментированных пород [Rawles, 1960].
Джимбоу и соавторы [Jimbow е. а., 1974] у эмбрионов кур по-
роды белый леггорн наблюдали агрегацию, деградацию и ауто-
фагоцитоз меланосом задолго до гибели меланоцитов. Авторы
полагают, что аутофагоцитоз меланосом обусловлен каким-то
233
генетическим дефектом в их созревании, образование и слияние
больших аутофагосом приводит, очевидно, мсланоииты к преж-
девременной гибели.
В результате введения содержащих ДНК препаратов от эм-
брионов кур пигментированных пород куриным эмбрионам с ги-
помеланизмом удается увеличить у последних продолжитель-
ность жизни меланоцитов. Так, Ланца [Lanza, 1974] вводил
нуклеопротеид из тканей 10-дневных зародышей кур пигменти-
рованной породы, меланоциты которой имеют нормальную про-
должительность жизни, эмбрионам кур белый плимутрок начи-
ная с 14 суток инкубации. У 6 из 12 опытных особей образова-
лись пигментированные перья. После обработки препарата дез-
оксирибонуклеазой он не обладал способностью приводить к
развитию пигментированных перьев. Эти факты указывают на
возможность изменения экспрессивности генов, контролирующих
продолжительность жизни клетки.
Формирование конечностей сопровождается гибелью и рез-
орбцией многих клеток, что способствует клеточным перемеще-
ниям и моделирует не только форму пальцев, но и контуры ко-
нечности в целом. Интересно отметить, что у насекомых, так же
как и у позвоночных, гибель клеток — непременное условие
морфогенеза конечностей [Whitten, 1969]. На генетическую
детерминированность отмирания клеток указывает тот факт, что
мутантные гены могут увеличивать или уменьшать зону некроза
клеток. Так, локализованный в Х-хромосоме рецессивный ген ws
повышает гибель мезенхимных клеток в передней зоне некроза
(преаксиальной части) почки конечности куриных эмбрионов по
сравнению с нормой. Зона некроза клеток значительно сильнее
выражена в почке крыла, чем ноги (рис. 57). У эмбрионов ws/ws
и Y/ws крылья не развиваются, а на ногах уменьшено число паль-
цев, отсутствует или сильно уменьшена большеберцовая кость.
У мутантных эмбрионов не образуется АЭГ почки крыла. Ген
ws, возможно, действует в мезенхимных клетках почки конечно-
сти, обусловливая их повышенную гибель, или, может быть,
этот ген активен в клетках эктодермальной части почки конеч-
ности, а повышенная гибель мезенхимных клеток возникает вто-
рично (Hinchliffe, Ede, 1973). Для выяснения места действия
гена ws необходимо провести экспериментальное исследование.
У куриных эмбрионов, гомозиготных по гену talpid3 (ta3), в
передней и задней зонах некроза почки конечности имеется
меньше дегенерирующих мезенхимных клеток, чем у нормаль-
ных зародышей. В результате этого у мутантов образуются
более крупные зачатки ног и развиваются добавочные пальцы—
полидактилия [Hinchliffe, Ede, 1967]. Мезенхимные клетки поч-
ки конечности куриных эмбрионов ta3/ta3 более резистентны к
повреждению, чем такие же клетки нормальных зародышей:
в культивируемых in vitro агрегатах клеток почки конечности
мутантов наблюдалось меньше дегенерирующих клеток по
234
Рис. 57. Зоны дегенерации и некроза мезенхимных клеток в почке крыла нор-
мальных (верхний ряд) и мутантных ws/ws или Y/ws (нижний ряд) куриных
эмбрионов [Hinchliffe, Ede, 1973]
Точками указаны зоны некроза; 19—26 — стадии развития. У нормальных эмбрионов пе-
редняя некротическая зона появляется па 21-й стадии и постепенно распространяется до
26-й стадии на дистальные участки почки конечности. У мутантов эта зона некроза четко
выражена на 19-й стадии, в течение 20—23-й стадий дегенерация клеток охватывает
остальную часть почки конечности, а к 25-й стадии у большинства мутантных эмбрионов
почка крыла исчезает
сравнению с агрегатами клеток нормальных эмбрионов [Ede,
Flint, 1972].
Хинчлиффи и Торогуд [Hinchliffe, Thorogood, 1974] исполь-
зовали витальные красители для локализации зон гибели мезен-
химных клеток на ранних этапах формирования конечностей у
нормальных и мутантных (ta3/ta3) куриных эмбрионов. В поч-
ках верхних и нижних конечностей 4,5-дневных нормальных
эмбрионов имеются центральная, передняя и задняя зоны не-
кроза мезенхимных клеток, которых нет у мутантов (рис. 58).
Отсутствие у эмбрионов ta3/ta3 гибели мезенхимных клеток в
центральной зоне, расположенной между мезенхимными конден-
сациями закладок большеберцовой и малоберцовой костей, не
приводит к разделению закладок этих костей друг от друга.
В развивающихся крыльях также не происходит разделения
закладок лучевой и локтевой костей. Формирующиеся пальцы
не отделяются друг от друга вследствие уменьшения числа де-
генерирующих мезенхимных клеток в межпальцевых зонах, и у
мутантных зародышей возникает синдактилия. Таким образом,
гибель клеток в определенных зонах играет морфогенетическую
роль в отделении одних тканевых закладок от других.
Мутантный полудоминантный ген dominant hemimelia (Dh)
обусловливает у гетерозиготных мышей (Dh/+) преаксиальную
235
Рис. 58. Схема хондрогенеза и зон гибели мезенхимных клеток в формирую-
щейся нижней конечности нормальных (Л) и мутантных (Б) куриных эмбрио-
нов в течение 3,5—9 дней инкубации [Hinchliffe, Thorogood, 1974]
2/—<35 — стадии развития. Зоны некроза клеток окрашены в черный цвет, точками обозна-
чены предхрящевые конденсации мезенхимных клеток (области интенсивного включения
35SOJ; хрящевые элементы очерчены линией. Кости: f — малоберцовая, t — большеберцо-
вая, т — плюсна. У мутантов (генотип ta3/ta3) отсутствует центральная зона некроза кле-
ток в почке конечности и уменьшены зоны гибели клеток в межпальцевых областях
полидактилию на задних конечностях. Цитологический анализ
развития почки конечности у эмбрионов мышей Dh/-b показал,
что у них в отличие от зародышей +/+ имеет место замедление
гибели клеток АЭГ, вследствие чего последний сохраняется у
мутантов значительно дольше по сравнению с нормой. Замед-
ление регрессии АЭГ у эмбрионов Dh/+ должно проявляться в
более длительном его индукционном воздействии на подлежа-
щие мезенхимные клетки почки конечности, в результате чего,
очевидно, и образуются у мутантов дополнительные структуры
задней конечности [Rooze, 1977]. Введение нормальным крысам
на 11 — 12-й день беременности цитозинарабинозида или фтор-
дезоксиуридина приводило к некоторому запаздыванию инициа-
ции гибели клеток в преаксиальной части АЭГ формирующихся
почек задних конечностей, вследствие чего у эмбрионов возника-
ла преаксиальная полидактилия [Scott е. а., 1977]. Эти данные
также свидетельствуют о важном морфогенетическом значении
своевременной и генетически запрограммированной гибели кле-
ток.
В контролировании процесса отмирания клеток на относи-
тельно поздних этапах онтогенеза большое значение имеют гор-
моны [см. Бердышев, 1968]. Однако на ранних стадиях эмбрио-
нального развития осуществление генетической «программы
смерти» клеток связано с цитоплазматическими различиями
бластомеров и межклеточными взаимодействиями. Изучение
резорбции хвоста головастика in vitro с применением ингибито-
ров синтеза РНК (актиномицин D) и белка (пуромицин и цикло-
гексимид) показало, что для осуществления генетически запро-
граммированной гибели клеток в течение метаморфоза амфибий
необходимо образование новых белков, в частности некоторых
протеолитических ферментов [Tata, 1971]. Следовательно, гене-
тически запрограммированная смерть клеток в онтогенезе так-
же обусловлена дерепрессией новых генов, как это характерно
для других клеточных систем, которые имеют программу на
дальнейшее развитие.
Многие данные свидетельствуют о том, что первичная про-
грамма продолжительности жизни и долголетия записана в ге-
номе. При этом долголетие следует рассматривать как резуль-
тат действия многих генов. В пользу наличия генетически кон-
тролируемого механизма старения и смерти организмов говорит
существование обширной группы видов, у которых смерть осо-
бей возникает в результате быстрого процесса, следующего за
половым размножением. Б. Ф. Ванюшин и Г Д. Бердышев
[1977] подчеркивают, что старение у многоклеточных организ-
мов— это предусмотренный программой индивидуального раз-
вития постепенный процесс повреждения и гибели клеток, при-
водящий к нарушению функций и в итоге к смерти индивида.
Авторы отмечают, что процессы старения переплетаются с про-
цессами развития, роста, функционирования организма, старе-
237
ние наступает сразу же после рождения человека и признаки
старения становятся заметными уже в 30—35 лет.
Хейфлик [Hayflick, 1975] показал, что эмбриональные фи-
бробласты человека и различных видов позвоночных животных
имеют строго определенный срок жизни. Число делений эмбрио-
нальных фибробластов пропорционально средней продолжи-
тельности жизни организма. Так, прежде чем погибнуть, эмбрио-
нальные фибробласты человека делятся примерно 50, мыши —
14—28, курицы—15—35, черепахи — 90—125 раз. Если фибро-
бласты хранить при температуре жидкого азота (—196° С), то
потенциал их деления сохраняется и после оттаивания. Тот факт,
что число делений эмбриональных фибробластов человека до и
после замораживания всегда одинаково (50± 10), указывает, по>
мнению автора, на генетическую основу старения.
Продолжительность жизни мыши примерно 2 года, но жи-
вотные одних инбредных линий живут значительно дольше, а
мыши других линий — меньше этого срока.
Обнаружена корреляция между скоростью репарации ДНК
в эмбриональных фибробластах и различной продолжитель-
ностью жизни мышей трех инбредных линий. Фибробласты от эм-
брионов мышей инбредной линии СВА/Н, характеризующейся
наибольшей продолжительностью жизни, «старели» in vitro че-
рез 45 делений и имели наиболее высокую скорость репаратив-
ного синтеза ДНК. Фибробласты от эмбрионов мышей линии
NZB с наименьшей продолжительностью жизни «старели» in
vitro через 22 деления и характеризовались наименьшей скоро-
стью репаративного синтеза ДНК [Paffenholz, 1978]. У больных
людей с синдромом Вернера и прогерией наблюдаются признаки
преждевременного старения, для их фибробластов характерна
ускоренная гибель в культуре и снижение скорости репарации
ДНК [Fulder, 1977].
Таким образом, многие факты свидетельствуют о том, что
старение происходит именно на клеточном уровне. В. В. Фроль-
кис [1975] подчеркивает, что механизмы, определяющие про-
должительность жизни, закреплены в ходе эволюции и пред-
определены в индивидуальном развитии организма; старение
является неотъемлемой частью индивидуального развития и
обусловлено активацией генов, контролирующих гибель клеток.
Подавление дерепрессии этих генов отодвигает гибель клеток.
Опираясь на такого рода факты, Фролькис [1975] пишет, что
признание возможности существования активного механизма
гибели клеток при старении делает реальностью воздействия,
замедляющие фатальное развитие этого процесса, увеличиваю-
щие продолжительность жизни.
Хотя старение генетически запрограммировано, экологиче-
ские факторы оказывают значительное влияние на продолжи-
тельность жизни организма. Человек живет в среднем 70 лег,
причем сыновья и дочери долгожителей имеют большую про-
238
Зигота
Стадия
двух
клеток
л/орула
бласто-
циста
Го струл а
Начало синтеза
дел на и ДНК
Начало синтеза
u,mtpPHK
Клетки
Потеря тотипотент-
ности. клетни дет ер'
Минированы к о бра зо-
ба нит трофобласта
U тела зап бри о на
Детерминация
стболобь/а
клеток
тот и по - Дерелрессия
тентнь/ общих генов
Дерелресси я ткане-
Образование спеца фи ческах
зачатков генов
органов из
клеточных клонов,
Г(/беле некоторб/х
клонов клеток
Рис. 59. Генетический контроль основных стадий развития млекопитающих
должительность жизни. Комфорт [1967] считает, что потенци-
альная продолжительность жизни человека в эпоху палеолита,
вероятно, не сильно отличалась от нашей, но ее реализация ста-
ла возможной благодаря развитию сложного общественного и
рационального поведения. Совершенствование здравоохранения
и улучшение социальных условий жизни могут не только ото-
двинуть начало старения, но и продлить деятельный работоспо-
собный период жизни человека.
Для объяснения механизмов клеточной дифференцировки и
морфогенеза Уоссерман [Wassermann, 1972] рассмотрел много
гипотетических представлений, из которых только 36 он называл
Фундаментальными. Это показывает неполноту наших знаний
239
в понимании процессов развития высших организмов. Даже в*
таких излюбленных для экспериментальных эмбриологов мо-
дельных системах, как конечность и глаз, на которых получены
важные факты о клеточных взаимодействиях в ходе онтогенеза,
молекулярные механизмы морфогенеза не ясны. Старк и Сирлс
[Stark, Searls, 1973], основываясь на проведенных опытах с ма-
териалом почки крыла куриных эмбрионов, указывают на то, что
конкретные механизмы четырех главных процессов морфогенеза
конечности (ориентированного в проксимо-дистальном направ-
лении роста, скорости клеточной пролиферации, гибели и диф-
ференцировки клеток) остаются неизвестными.
Проведенные опыты с агрегацией меченых бластомеров мы-
ши показали, что даже на стадии поздней морулы (32-клеточ-
ный зародыш) бластомеры млекопитающих сохраняют тотипо-
тентность [Stern, Wilson, 1972]. На стадии 64-клеточного заро-
дыша наружные клетки бластоцисты теряют тотипотентность и
становятся детерминированными в своем развитии — из них
формируется трофобласт [Gardner е. а., 1973]. Большинство ис-
следователей считают, что главными факторами, определяющи-
ми путь развития бластомеров млекопитающих являются микро-
среда и локализация бластомера в составе эмбриона, но моле-
кулярная основа такой детерминации остается неясной [Her-
bert, Graham, 1974].
Данные о генетическом контроле основных стадий развития
млекопитающих получены главным образом на мыши (рис. 59).
Установленные закономерности также характерны в определен-
ной степени для всех позвоночных. Сначала в ходе эмбриогенеза
дерепрессируются гены, контролирующие размножение и про-
цессы общего метаболизма клеток (так называемые гены до-
машнего хозяйства), затем на стадии гаструлы активируются
тканеспецифические гены, детерминирующие образование ство-
ловых клеток, а в период гисто- и органогенеза дерепрессиру-
ются гены, которые контролируют синтез белков, специфичных
для тех или иных клеточных систем.
Как было показано в гл. 5, цитодифференцировка обусловле-
на многоступенчатым дерепрессированием генома тотипотент-
ных клеток раннего зародыша, причем стадия гаструлы явля-
ется решающей или критической в этом отношении, так как на
этой стадии детерминируются стволовые (родоначальные, ини-
циаторные) клетки, из которых возникают определенные кле-
точные клоны. Детерминация стволовых клеток, очевидно, об-
условлена синтезом специфических белков плазматических мем
бран, которые определяют характер сродства клеток и обеспе-
чивают направленную миграцию клеточных клонов к местам
окончательной локализации.
240
ЗАКЛЮЧЕНИЕ
*
Проблема реализации генетической информации в индивиду-
альном развитии является одной из важнейших в современной
биологии. Если изучение нуклеиновых кислот вскрыло способы
хранения и передачи по наследству генетической информации и
синтеза белка, то исследование хромосомных белков и их связи
с ДНК должно пролить свет на регуляцию активности генов, ко-
торая определяется прежде всего основными белковыми компо-
нентами хромосом — гистонами и кислыми ядерными белками.
Репрессия генов гистонами — это лишь одна сторона регуляции
их действия. Вторую (и, пожалуй, наиболее важную) сторону
должны составлять определенные индуцирующие факторы, дей-
ствующие на систему репрессоров и выступающие как дерепрес-
соры генов.
Взаимодействия белков, основанные на узнавании одних бел-
ковых молекул другими, играют важную роль на всех уровнях
реализации наследственной информации: от специфической ак-
тивации тех или иных генов индуцирующими веществами и обра-
зования сложных белковых молекул из субъединиц до взаимо-
действия клеток и различных тканевых закладок. Регуляция экс-
прессии, или проявление генных эффектов на посттранскрипци-
онном уровне, составляет огромную и еще малоисследованную
область генетического контроля процессов онтогенеза.
Фенотип взрослого человека и позвоночных животных опре-
деляется взаимодействием многих тысяч генов. При этом посте-
пенная реализация наследственной информации приводит к то-
му, что зародыш приобретает все большее и большее сходство с
родительскими организмами. Вопрос о механизме реализации
заключенной в ДНК хромосом наследственной информации в
нужном объеме, в соответствующем месте и в необходимый мо-
мент развития составляет главную проблему морфогенеза, пред-
ставляющего собой наиболее интересное и сложное явление он-
тогенеза. И. И. Шмальгаузен [1964] отмечал, что в ходе нормаль-
ного морфогенеза, который складывался исторически по принципу
отбора наиболее целесообразных форм, взаимодействия внут-
ри системы носят характер взаимной стимуляции процессов, ве-
дущих к прогрессивному ее развитию; причем это в равной сте^
241
пени относится как к гомотопическим клеточным влияниям, т. е.
взаимодействиям между гомологичными клетками зачатка, так
и гетеротипической индукции, происходящей по типу влияния од-
ной закладки на другую.
Морфогенез у многоклеточных организмов тесно связан с кле-
точной дифференцировкой, эти два сложных биологических яв-
ления осуществляются в онтогенезе параллельно, и их невозмож-
но оторвать друг от друга. Первым решающим этапом клеточ-
ной дифференцировки и морфогенеза является детерминация на
стадии ранней гаструлы стволовых (инициаторных) клеток, из
которых возникают соответствующие клеточные клоны. При
этом важное значение имеет начальная скорость размножения
клонов, которая определяет число клеток данного клона в соста-
ве клеточных популяций того или иного органа.
У зародышей Xenopus laevis останавливали деление клеток
митомицином С или колцемидом на стадии ранней гаструлы. Не-
смотря на полную блокаду деления клеток, эмбрионы достигали
поздней нейрулы и число клеток у них было примерно таким же,
как на стадии ранней гаструлы, т. е. до обработки митомицином
С или колцемидом. У контрольных эмбрионов число клеток уве-
личилось за этот период развития в 7—8 раз, что должно быть
результатом прохождения всеми клетками трех клеточных цик-
лов [Cooke, 1973]. Если принять во внимание, что активация ге-
нов происходит только во время клеточных делений, то такие за-
родыши должны состоять в основном из стволовых клеток. Сле-
довательно, в течение поздней гаструлы и, возможно, даже ней-
рулы не происходит существенной дерепрессии генов, а увеличи-
вается только число стволовых клеток. Поэтому есть основание
полагать, что на стадии гаструлы зародыш позвоночных пред-
ставляет как бы мозаику стволовых клеток. Эти факты свиде-
тельствуют о важной роли ранних этапов развития в осуществле-
нии процессов морфогенеза. К сожалению, имеется очень мало
данных о генетическом контроле ранних стадий эмбриогенеза и
механизмах детерминации клеток.
Наиболее рано в развитии позвоночных наблюдается заклад-
ка и морфогенез центральной нервной системы, окончательная
дифференцировка и становление функций которой продолжается
еще длительное время в постэмбриональный период онтогенеза.
Вся клеточная популяция нервной пластинки разбита как бы на
закладки отдельных органов. Например, в нервной пластинке
имеется область глаза, которая представлена небольшой груп-
пой клеток, из которых в дальнейшем образуется сетчатка, при-
чем эти клетки детерминированы в своем развитии на стадии га-
струлы [Jacobson С. О., 1959]. Некоторые стволовые клетки не
дифференцируются, и за счет их размножения происходит уве-
личение размеров органа. Генетически запрограммированная ги-
бель определенных клеточных клонов на конкретной стадии раз-
вития является непременным условием морфогенеза.
242
В основе развития лежит каскадный принцип: вещества, син-
тезированные на предыдущих стадиях, дерепрессируют гены по-
следующей стадии. В период органогенеза главное значение в ре-
гуляции генной активности приобретают межклеточные взаимо-
действия. Вещества, синтезированные в одних клетках, могут ак-
тивировать соответствующие гены в других клеточных системах.
Межклеточные взаимодействия играют ведущую роль при раз-
витии глаза, центральной нервной системы, осевого скелета, ко-
нечностей, кожи, молочных желез, зубов, почки и других орга-.
нов. Поддержание гистологической структуры дефинитивного,
органа (морфостаз) также зависит от взаимодействия составля-
ющих его тканей [см. Лопашов, Строева, 1963; Saxen е. а., 1968;
Tarin, 1972].
Многие данные свидетельствуют о том, что старение организ-.
мов происходит на клеточном уровне и этот процесс генетиче-
ски запрограммирован (см. гл. 6). Теория, объясняющая долго-
летие запрограммированным временем жизни клеток, перекиды-
вает мост между геронтологией и биологией развития, одной из.
основных составляющих частей которой является генетика разви-
тия. С другой стороны, возникновение раковых заболеваний —
этого страшного недуга человечества, как результата нарушения
регуляции активности генов в ходе цитодифференцировки, сбли-
жает проблемы онкологии и генетики развития (см. гл. 5). До
тех пор, пока не будут исследованы молекулярно-генетические
механизмы дифференцировки клеток, останется много нерешен-
ных вопросов в патогенезе злокачественных новообразований.
В настоящее время известно более 2500 нозологических форм
наследственных болезней, от которых страдают многие миллио-
ны людей [McKusick, 1978]. Анализ уродств по материалам 24
крупнейших клинических тератологических центров 16 стран ми-
ра показал, что в среднем у 6% новорожденных имеются врож-
денные дефекты развития [Persaud, 1977]. В детских больницах
примерно 30% составляют пациенты с различными наследствен-
ными аномалиями [Childs, 1975]. Знание механизмов действия
мутантных генов и условий, влияющих на их эффекты, позволя-
ет исправлять некоторые нарушения обмена веществ. Однако
практически не имеется эффективных методов терапии наследст-
венных аномалий развития (врожденных уродств).
Следовательно, задачи, решаемые генетикой развития, име-
ют не только огромное теоретическое значение для понимания
сложных явлений онтогенеза, но представляют также большой
интерес для смежных медицинских дисциплин, исследующих
механизмы нарушения процессов нормального развития чело-
века.
Проблемы генетической инженерии, в частности получение
животных определенных генотипов и использование генной тера-
пии (введение в дефектные клетки нормальных генов) для ис-
правления наследственной патологии, также зависят от успехов.
243
генетики развития. Когда американские исследователи Бригс и
Кинг [Briggs, King, 1952] предложили изящный метод пересадки
ядер соматических клеток в энуклеированные яйцеклетки амфи-
бий, трудно было даже представить возможность проведения та-
ких микрохирургических операций на яйцеклетке млекопитаю-
щих, объем которой примерно в 1000 раз меньше по сравнению
с объемом яйца лягушки. Методы научного анализа разрабаты-
ваются сейчас стремительными темпами, опережая порой наше
воображение.
В 1977 г. Маркерт и Питерс [Markert, Petters, 1977] для полу-
чения инбредных линий животных предложили быстрый и эко-
номически выгодный метод, основанный на микрохирургической
технике: из оплодотворенного яйца млекопитающих удаляют
один пронуклеус (женский или мужской), другой пронуклеус
дпплоидизируют путем обработки яйца цитохалазином В, кото-
рый ингибирует цитокинез, но не останавливает деление ядра.
Затем зародыш выращивают in vitro до стадии бластоцисты и
пересаживают в матку самки-реципиента для дальнейшего раз-
вития. При помощи такого метода было получено 7 взрослых са-
мок мышей, причем 5 из них имели материнский, а 2 — отцовский
геном. Это зависело от того, какой пронуклеус был оставлен в
яйце — женский или мужской, что определяло развитие особи
по типу гиногенеза или андрогенеза. Хромосомный анализ по-
казал, что все 7 мышей имели нормальный диплоидный карио-
тип, включая две Х-хромосомы. Эти животные оказались гомози-
готными по всем изученным генам, хотя они возникли из зигот,
полученных в результате скрещивания мышей разных инбредных
линий. От 6 самок было получено потомство (Hoppe, Illmensee,
1977].
Следовательно, при помощи метода микрохирургии на зиго-
тах сразу можно получить особей женского пола, имеющих
100%-ную гомозиготность по всем локусам. Для получения ин-
бредных животных крупного рогатого скота обычными приемами
инбридинга требуются десятки лет работы.
Методы микрохирургии позволяют сейчас реально планиро-
вать клонирование млекопитающих путем пересадки ядер ство-
ловых соматических клеток в безъядерные яйцеклетки. Все осо-
би, полученные таким способом, будут генотипически совершен-
но идентичны исходному организму. Это позволит не только
сохранить генотип выдающихся в производственном отношении
животных, но и безгранично их размножать, что может иметь
революционизирующее значение в племенном животноводстве.
Методы получения экспериментальных химер млекопитаю-
щих могут быть использованы для фенотипической или даже,
возможно, генетической инженерии на уровне целого организма,
что представляет большой интерес, в частности, для создания
определенных биологических моделей наследственных болезней
человека. Так, используя инъекционный метод получения химер
244
и стволовые клетки тератокарциномы, сохраняющие тотипо-
тентные свойства в течение длительного периода культивирова-
ния in vivo или in vitro, можно вводить определенные мутантные
гены в организм мыши. Культивируемые in vitro стволовые клет-
ки тератокарциномы обрабатывают мутагеном, а затем на се-
лективных средах отбирают клон клеток, несущий интересую-
щий мутантный признак, и вводят эти клетки в бластоцисту мы-
ши известного генотипа.
При помощи такого экспериментального приема недавно бы-
ла получена модель наследственного заболевания человека, из-
вестного под названием синдрома Леша — Наяна и обусловлен-
ного недостаточностью фермента гипоксантин фосфорибозил-
трансферазы. Синтез этого фермента контролируется локусом,
локализованным в Х-хромосоме. Мутагенизированные стволо-
вые клетки тератокарциномы отбирали на резистентность к
6-тиогуанину. Клетки резистентного клона, введенные в бласто-
цель, после их нормального интегрирования в зародыш принима-
ли участие в формировании различных клеточных систем. У по-
лученных таким путем химер была обнаружена недостаточ-
ность изучаемого фермента почти во всех соматических тканях
(Dewey е. а., 1977]. Однако у таких химер половые клетки не об-
разовывались из пересаженных стволовых клеток тератокарци-
номы. Очевидно, это обусловлено тем, что данный мутагенизи-
рованный клон стволовых клеток тератокарциномы имел ненор-
мальный кариотип. Введение в бластоцель стволовых клеток те-
ратокарциномы с нормальным кариотипом приводит к образова-
нию у химер нормальных гамет, имеющих геном этих опухоле-
вых клеток [Mintz, Illmensee, 1975]. Поэтому можно думать, что
если использовать для пересадки в бластоцель мутагенизирован-
ные стволовые клетки тератокарциномы с нормальным карио-
типом, то можно ожидать передачи по наследству следующим
поколениям животных конкретных мутантных генов, возникших
в результате обработки мутагеном культивируемых in vitro кле-
ток. Такого рода исследования могут проводиться также и с
сельскохозяйственными животными при выведении новых пород.
Следует отметить, что генетика развития высших организмов,
в частности человека и позвоночных животных, является сравни-
тельно молодой наукой. Она сейчас находится скорее в стадии
роста, чем метаморфоза. Потребуется еще большая работа по
выяснению многих аспектов действия и взаимодействия генов в
ходе индивидуального развития, прежде чем станут понятны
механизмы генетического контроля таких сложных биологиче-
ских явлений, как деление клеток, их дифференцировка и осо-
бенно морфогенез.
ЛИТЕРАТУРА
Алексеев Е. И. Влияние кортизона на
эффекты гена ocular retardation в
эмбриогенезе мыши.— Бюл. экспе-
рим. биол. и мед., 1973, 75, № 2,
с. 91—94.
Алексеев Е. И., Конюхов Б. В. Влия-
ние соматотропного гормона и три-
йодтиронина на экспрессивность ге-
на ocular retardation у мыши.— Ге-
нетика, 1972, 8, № 7, с. 71—77.
Астауров Б. Л. Цитогенетика разви-
тия тутового шелкопряда и ее экс-
периментальный контроль. М.: Нау-
ка, 1968.
Астауров Б. Л. Генетика и пробле-
мы индивидуального развития.—
Онтогенез, 1972, 3, № 6, с. 547—
564.
Бердышев Г Д. Генетически обус-
ловленная гибель клеток. Ее меха-
низмы и значение в многоклеточном
организме.— Успехи соврем, биол.,
1968, 66, № 2, с. 226—246.
Ботвинник Н. М., Нейфах А. А. Экс-
прессия генов, контролирующих
эстеразы в эмбриональном разви-
тии гибридов рыб.— Онтогенез,
1977, 8, № 2, с. 176—180.
Бугрилова Р. С., Конюхов Б. В. Эф-
фект дозы гена brachypodism-H у
мыши.—Генетика, 1971, 7, № 9,
с. 76—83.
Бугрилова Р. С., Конюхов Б. В. Ре-
гулятор экспрессии гена brachypo-
dism-H у мыши.— Генетика, 1978,
14, № 10, с. 1809—1817.
Бутенко Р. Г Дифференцировка и
морфогенез в культуре тканей, кле-
ток и протопластов.—В кн.: Биоло-
гия развития растений. М.: Наука,
1975, с. 48—65.
Ванюшин Б. Ф., Бердышев Г Д. Мо-
лекулярно-генетические механизмы
старения. М.: Медицина, 1977.
Васильев Ю. М., Маленков А. Г Кле-
точная поверхность и реакции кле-
ток. Л.: Медицина, 1968.
Вахтин Ю. Б. Генетика соматических
клеток. Л.: Наука, 1974.
Вольф Э. Специфические межткане-
вые взаимодействия в органогене-
зе.— Арх. анат., 1971, 60, № 1,
с. 16—27.
Галльен К. Гибридизация путем меж-
видовых пересадок ядер и скрещи-
вания представителей рода Pleuro-
deles (Amphibia, Urodela).— Онто-
генез, 1971, 2, № 1, с. 55—63.
Гаузе Ю. Г Репликация ДНК.—
Журн. Всесоюз. хим. о-ва им. Д. И.
Менделеева, 1975, 20, № 3, с. 246—
252.
Г воздев В. А. Регуляция действия
генов у Drosophila melanogaster
(перспективы биохимических иссле-
дований).— Успехи соврем, биол.,
1968, 65, № 3, с. 398—423.
Гвоздев В. А. Связь между дозой
гена и синтезом макромолекул у
животных.— Изв. АН СССР. Сер.
биол., 1970, № 4, с. 499—507.
Георгиев Г. 77. О синтезе и транспор-
те мРНК в клеточном ядре.— В кн.:
Функциональная биохимия клеточ-
ных структур. М.: Наука, 1970,
с. 293—299.
Георгиев Г 77. О структуре единиц
транскрипции в клетках эукарио-
тов.— Успехи биол. химии, 1973,14,
№ 1, с. 3—46.
Гинтер Е. К., Конюхов Б. В. Плейо-
тропные эффекты гена brachypo-
dism-H у мыши.— Генетика, 1966а,
2, № 3, с 83—92.
Гинтер Е. К., Конюхов Б. В. Действие
трийодтиронина на рост in vitro
зачатков костей конечностей мы-
шей мутантной линии brachypo-
dism-H и C57BL/6J.— Бюл. экспе-
рим. биол. и мед., 19666, 61, № 6.
Грунц X. Изоляция и способы дей-
ствия морфогенетических факторов
в раннем эмбриогенезе.— Онтогенез^
1978, 9, №4, с. 323—332.
246
Дворкин Г. А., Ефимова В. Ф., Кога-
ницкая Л. И. Исследование ядер-
но-цитоплазматических отношений
в бесклеточной системе с изолиро-
ванными ядрами печени.— В кн.:
Молекулярные механизмы генети-
ческих процессов. М.: Наука, 1972,
с. 182-189.
Дубинин Н. П. Кд мл — мозаичная
организация генов эукариот.— ДАН
СССР, 1978, 243, № 4, с. 1059—
1061.
Епифанова О. И. Изучение регуля-
торных механизмов митотического
цикла с помощью ингибиторов
транскрипции и трансляции.— В кн.:
Клеточный цикл. Проблемы регуля-
ции. М.: Наука, 1973, с. 72—103.
Епифанова О. И., Терских, В. В. Пе-
риоды покоя и активной пролифе-
рации в жизненном цикле клеток.—
Журн. общ. биол., 1968, 29, № 4,
с. 392-402.
Заварзин А. А. Очерки эволюцион-
ной гистологии крови и соедини-
тельной ткани. М.; Л.; Изд-во АН
СССР, 1945. Ч. 1.
Заварзин А. А. Очерки эволюционной
гистологии крови и соединительной
ткани. М.; Л Изд-во АН СССР,
1947. Ч. 2.
Заварзин А. А. Синтез ДНК и кине-
тика клеточных популяций в онто-
генезе млекопитающих. Л.: Наука,
1967.
Збарский И. Б. Химическая органи-
зация клеточного ядра.— В кн.:
Функциональная биохимия клеточ-
ных структур. М.: Наука, 1970,
с. 266—285.
Збарский И. Б. Об организации ин-
теркинетического ядра.— Успехи со-
врем. генет., 1971, 3, с. 127—128.
Зверева Л. П., Беляев Д. К., Прива-
лова Г Н. Феногенетический ана-
лиз пигментации у мутантов аме-
риканской норки (Mustela vison
Schr.). II. Эффект мутации алеут-
ская и взаимодействие генов алеут-
ской и серебристо-голубой окраски
в генотипе сапфировых норок.
Влияние фактора «Стюарт» на пиг-
ментацию волоса.— Генетика, 1976,
12, № 2, с. 104—109.
Игнатьева Г М. Современное состоя-
ние проблемы первичной эмбрио-
нальной индукции.— В кн.: Итоги
науки (Морфология человека и жи-
вотных. Эмбриология). М.:
ВИНИТИ 1971, с. 5-81
Кнорре А. Г. Эмбриональный гпето*
генез. Л.: Медицина, 1971
Коломбет Л. В. Последовательность
включения локусов лактатдегидро-
геназы в раннем эмбриональном
развитии мыши.— Онтогенез, 1977,
8, № 3, с. 269—274.
Коломбет Л. В., Гапиенко Е. Ф. Ре-
прессия и дсрепрсссия локусов лак-
татдегидрогеназы в процессе раз-
вития мыши.— Бюл. эксперим. би-
ол. и мед., 1977, 83, № 5, с. 595—
597
Кольцов Н. К. Роль гена в физиоло-
гии развития.— Биол. журн., 1935,
4, № 5, с. 753-774.
Комфорт А. Биология старения. М.:
Мир, 1967.
Конюхов Б. В. Биологическое модели*
рование наследственных болезней
человека. М.: Медицина, 1969.
Конюхов Б. В. Генетический контроль
клеточной дифференцировки.— Ус-
пехи соврем, биол., 1973, 76, № 3,
с. 171 — 188.
Конюхов Б. В., Вахрушева М. П.,
Осипов В. В. Взаимодействие генов
fidget и ocular retardation у мы-
ши.— Генетика, 1970, 6, № 6,
с. 117—125.
Конюхов Б. В., Вахрушева М. П.,
Осипов В. В. Эпистаз гена micro-
phthalmia над геном fidget у мы-
ши.— Генетика, 1971, 7, № 1,с. 76—
83.
Конюхов Б. В., Колесова Н. А. Уль-
траструктурный анализ эффектов
гена dominant cataract-Fr у эмбри-
онов мыши.—Онтогенез, 1976, 7,
№ 3, с. 271—277.
Конюхов Б. В., Колесова Н. А. Уль-
траструктурное изучение транскрип-
ционной активности на ранних ста-
диях формирования хрусталика
мыши.— В кн.: Структура и функ-
ции клеточного ядра. Алма-Ата,
1977, с. 16—17.
Конюхов Б. В., Малинина Н. А. Дей-
ствие тироксина на развитие костей
задней конечности у эмбрионов
мышей мутантной линии brachypo-
dism-H.— Бюл. эксперим. биол. и
мед., 1967, 64, № 11, с. 125—129.
Конюхов Б. В., Малинина Н. А. Сти-
муляция роста костей конечностей
эмбрионов мышей мутантной линии
brachypodism-H соматотропным гор-
моном.— Бюл. эксперим. биол. и
мед., 1969, 67, № 1, с. 70—71.
Конюхов Б. В., Мединина Н, А., Буг-
247
рилова Р. С. и др. Изучение имму-
нологической специфичности рост-
ингибирующего фактора — продук-
та мутантного гена brachypodism-H
у мыши.— Изв. АН СССР. Сер. би-
ол., 1976, № 4, с. 509—516.
Конюхов Б. В., Малинина Н. А., Пла-
тонов Е. С., Яковлев М. И. Имму-
ногистохимическое изучение синте-
за кристаллинов в морфогенезе хру-
сталика мыши.— Изв. АН СССР.
Сер. биол., 1978, № 4, с. 507—517.
Конюхов Б. В., Миронова О. В. Дей-
ствие гена splotch на параметры
клеточного цикла в головном и
спинном мозге эмбрионов мыши.—
Онтогенез, 1974, 5, с. 407—411.
Конюхов Б. В., Миронова О. В. Ана-
лиз действия гена loop-tail у эмб-
рионов мыши.— Онтогенез, 1975,
6, № 6, с. 614—618.
Конюхов Б. В., Миронова О. В. Взаи-
модействие мутантных генов splotch
и fidget у мыши.— Генетика, 1979,
15, № 4, с. 641—645.
Конюхов Б. В., Осипов В. В. Меж-
аллельная комплементация генов
microphthalmia и white у мыши.—
Генетика, 1968, 4, № 11, с. 65—75.
Конюхов Б. В., Осипов В. В., Вахру-
шева М. П. Поражение дериватов
ганглиозной пластинки у мышей му-
тантных линий microphthalmia и
white.—Арх. анат., 1965, 49, № 8,
с. 100—107.
Конюхов Б. В., Пашин Ю. В., Гинтер
Е. К. Изучение первичного дей-
ствия гена у человека и позвоноч-
ных животных.— Успехи соврем,
биол., 1968, 65, № 2, с. 221—237.
Конюхов Б. В., Сажина М. В. Нару-
шение развития глаза у линии мы-
шей с микрофтальмией.— Журн.
общ. биол., 1962, 23, № 4, с. 256—
264.
Конюхов Б. В., Сажина М. В. Разви-
тие глаза у мышей мутантной ли-
нии microphthalmia.—Журн. общ.
биол., 1963, 24, № 4, с. 285—295.
Конюхов Б. В., Сажина М. В. Дей-
ствие гена fidget на пролиферацию
клеток головного мозга эмбрионов
мыши.— Генетика, 1972, 8, № 8,
с. 79—83.
Конюхов Б. В., Сажина М. В., Коле-
сова Н. А. Ультраструктурный ана-
лиз взаимодействия мутантных ге-
нов, нарушающих развитие сетчат-
ки у мышей.— Изв. АН СССР. Сер.
биол., 1976, № 6, с. 795—803.
Конюхов Б. В., Строева О. Г., Сажи-
на М. В., Липгарт Т. А. Поражение
сетчатки — причина микрофтальмии
у мышей мутантной линии ocular
retardation.—Арх. анат., 1963, 44,
№ 4, с. 36—43.
Конюхов Б. В., Уголькова Т. С. Изу-
чение места действия гена fidget и
его взаимодействия с геном ocular
retardation в культивируемой сет-
чатке эмбрионов мыши.— Онтоге-
нез, 1978, 9, № 5, с. 475—480.
Корочкин Л. И. Взаимодействие ге-
нов в развитии. М.: Наука, 1977.
Корочкин Л. И., Беляева Е. С. Диф-
ференциальная активность гомоло-
гичных локусов хромосом в онто-
генезе.— Онтогенез, 1972, 3, № 1,
с. 11—26.
Корочкин Л. И., Серов О. Л., Арон-
штам А. А. Генетика изофермен-
тов. М.: Наука, 1977.
Костомарова А. А., Ротт Н. Н. Авто-
радиографическое исследование
синтеза ядерных РНК у диплоид-
ных и гаплоидных зародышей вью-
на.— В кн.: Клеточное ядро и его
ультраструктуры. М.: Наука, 1970„
с. 258—262.
Краснопольская К. Д. Биохимическая
генетика болезней обмена.— Журн.
Всесоюз. хим. о-ва им. Д. И. Мен-
делеева, 1970, 15, № 6, с. 634—644.
Кулеш А. П. К вопросу о клинике и
лечении пигментной дегенерации
сетчатки.—Офтальмол. журн., 1966_
№ 5, с. 346—349.
Ломакина Л. Я. Регуляция биосинте-
за ДНК в митотическом цикле.—
В кн.: Клеточный цикл. Проблемы
регуляции. М. Наука, 1973, с. 9—
37.
Лопашов Г В. Клеточная наслед-
ственность, ее преодоление и вос-
становление органов.— Онтогенез,
1974, 5, № 6, с. 582—593.
Лопашов Г В., Строева О. Г Раз-
витие глаза в свете эксперимен-
тальных исследований. М.: Изд-во
АН СССР, 1963.
Лопашов Г В., Хопёрская О. А. Ме-
ханизмы индукции и программиро-
вание дифференцировки.— Онтоге-
нез, 1977, 8, № 6, с. 563—581.
Майр Э. Популяции, виды и эволю-
ция. М.: Мир, 1974.
Мак-Ларен А. Наследственность и
среда на клеточном уровне: изуче-
ние экспериментальных мышиных
химер.— Онтогенез, 1973, 4, с. 227.
248
Малинина Н. А. Изучение ранних
стадий развития конечностей у мы-
шей мутантной линии brachypo-
dism-H.— Генетика, 1969, 5, № 6,
с. 104—108.
Мглинец В. А. Структура генетиче-
ского локуса у многоклеточных ор-
ганизмов.— Успехи соврем, биол.,
1973, 76, № 2, с. 189—198.
Митрофанов В. Г Физиологические
основы и эволюция доминантно-
сти.— В кн.: Проблемы эксперимен-
тальной биологии. М.: Наука, 1977,
с. 21—31.
Михайлов А. Т. Экспериментальные
и биохимические аспекты индукции
хрусталика в эмбриогенезе.— Он-
тогенез, 1978, 9, № 3, с. 211—227.
Мицкевич М. С. Гормональные регу-
ляции в онтогенезе животных. М.:
Наука, 1978.
Мосолов А. Н. Модель функциониро-
вания и укладки ДНК в хромосо-
ме, учитывающая связь генома с
мембраной ядра.— Генетика, 1968,
4, № 12, с. 135—145.
Мосолов А. Н., Монахова М. А. Мо-
дель структурных превращений
хромосомы в клеточном цикле и ее
электронно-микроскопические дока-
зательства.— В кн.: Клеточное яд-
ро и его ультраструктуры. М.: Нау-
ка, 1970, с. 170—176.
Нейфах А. А. Использование метода
радиационной инактивации ядер
для исследования их функции в
раннем развитии рыб.— Журн. общ.
биол., 1959, 20, № 3, с. 202—213.
Нейфах А. А. Сравнительное радиа-
ционное исследование морфогене-
тической функции ядер в развитии
животных.— Журн. общ. биол.,
1961, 22, № 1, с. 42—57.
Нейфах А. А. Функция генов в раз-
витии и механизмы их активации.—
Журн. Всесоюз. хим. о-ва им. Д. И.
Менделеева, 1970, 15, № 6, с. 612—
624.
Нейфах А. А., Глушенкова М. А., Ку-
сакича А. А. Время действия генов,
контролирующих активность аль-
долазы в эмбриональном развитии
вьюна.— Онтогенез, 1976, 7, № 3,
с. 219—228.
Сейфах А. А., Тимофеева М. Я. Мо-
лекулярная биология процессов
развития. М.: Наука, 1977
Нестерова Г Ф. Генетический кон-
троль морфогенеза бактериофа-
гов.— Успехи соврем, биол., 1973,
76, № 1, с. 96—109.
Никитина Л. А. Исследование воз-
растных изменений ядер эктодермы
и ее производных методом ядер-
ных пересадок у бесхвостых амфи-
бий.— В кн.: Клеточное ядро и его
ультраструктуры. М.: Наука, 1970,
с. 250—253.
Оленов Ю. М. О генетических меха-
низмах дифференцировки клеток.—
Цитология, 1970, 12, № 1, с. 3—21.
Оленов Ю. М. Проблемы молекуляр*
ной генетики. Л.: Наука, 1977.
Орлова И. И. Физиологические де«
структивные процессы в эмбриоге-
незе.— Успехи соврем, биол., 1972,
73, № 1, с. 96—112.
Осипов В. В., Вахрушева М. П. Тор-
можение миграции эктомезенхимы
геном white у мышей.— Онтогенез,
1973, 4, № 3, с. 315—318.
Осипов В. В., Вахрушева М. П. Взаи-
модействие эктомезенхимы и глаз-
ного пузыря у мыши.— Онтогенез,
1974, 5, № 4, с. 401—403.
Платонов Е. С., Яковлев М. И., Ко-
нюхов Б. В. Изучение действия му-
тантных генов на синтез кристал-
линов в формирующемся хруста-
лике мыши. I. Ген dominant cata-
ract-Fr.— Онтогенез, 1976, 7, № 5,
с. 484—489.
Поглазов Б. Ф. Сборка биологиче-
ских структур. М.: Наука, 1970.
Полевой В. В. Регуляторные систе-
мы организмов.— Вести. Ленингр.
ун-та, 1975, № 15, с. 104—108.
Прокофьева-Бельговская А. А. Гете-
роцикличность родительских хромо-
сом.—ДАН СССР, 1946, 54, № 2,
с. 169-172.
Рокицкий П. Ф. Поле действия гена.
Изучение редуцирующих и прибав-
ляющих щетинки генов у Drosophi-
la melanogaster.— Журн. эксперим.
биол., 1929, 5, № 2, с. 182—214.
Сажина М. В. Изучение зрительного
анализатора у мышей с наслед-
ственной микрофтальмией.— В кн.:
Материалы конф, молодых ученых
Ин-та эксперим. биол. АМН СССР,
1965, с. 42—45.
Сажина М. В., Мастернак Т. Б. Ана-
лиз клеточной пролиферации хру-
сталиков эмбрионов мыши в норме
и при наследственной микрофталь-
мии.— Бюл. эксперим. биол. и мед.,
1972, 74, № 7, с. 107—109.
249
Серов О. Л., Закиян С. М. Изучение
экспрессии гомологичных генов у
межродовых песцово-лисьих гибри-
дов в постнатальном онтогенезе.—
В кн.: 5-е Всесоюз. совещ. эмбрио-
логов. М.: Наука, 1974, с. 160—161.
Серов О. Л., Закиян С. М., Корочкин
Л. И. и др. Экспрессия гомологич-
ных генов у межродовых песцово-
лисьих гибридов (Alopex lagopusX
XVulpes vulpcs). II. Электрофоре-
тический анализ преальбумина, аль-
бумина и трансферринов у песцо-
во-лисьих гибридов.— Генетика,
1976, 12, № 2, с. 110—115.
Серов О. Л., Закиян С. М., Куличков
В. А. Изучение механизмов экспрес-
сии родительских аллелей локуса
Gpd в эритроцитах мулов.— Гене-
тика, 1977, 13, № 10, с. 1761 — 1765.
Серов О. Л., Познахиркина Н. А., Ко-
рочкин Л. И. Экспрессия отцовско-
го изофермента 6-фосфоглюконат-
дегидрогеназы в раннем развитии
крысы,—ДАН СССР, 1975, 224,
№ 6, с. 1428—1430.
Серов О. Л., Хлебодарова Т. М. На-
следование изменений уровня ак-
тивности второго изозима лактат-
дегидрогеназы в эритроцитах у се-
ребристо-черных лисиц.— Генетика,
1973, 9, № 12, с. 45—48.
Соннеборн Т. М. Морфогенез у рес-
ничных инфузорий и его отношение
к клеточному морфогенезу в це-
лом.— Цитология, 1974, 16, № 9,
с. 1063—1088.
Спирин А. С., Белицина Н. В., Айтхо-
жин М. А. Информационные РНК
в раннем эмбриогенезе.— В кн.:
Клеточная дифференцировка и ин-
дукционные механизмы. М.: Наука,
1965, с. 18—37.
Тайен М. Л. Онтогенез иммунной си-
стемы у мышей. Исследования in
vivo и in vitro.— Онтогенез, 1972,
3, № 1, с. 27—38.
Тамаркина А. Д., Анненков Г А., Фи-
липпов И. К., Ламчингийн Т. Эф-
фект дозы гена цитоплазматиче-
ской супероксидисмутазы (СОД-1)
в эритроцитах больных с синдро-
мом Дауна.— Генетика, 1977, 13,
№ 5, с. 929—932.
Терских В. В., Маленков А. Г Дина-
мика ионного состава, синтеза РНК
и белка при индукции пролифера-
ции в стационарной культуре кле-
ток китайского хомячка.— Цитоло-
гия, 1973, 15, № 7, с. 868—874.
Тимофеев-Ресовский Н. В. О фено-
типическом проявлении генотипа. I.
Геновариация radius incompletus у
Drosophila funcbris.— Журн. экспе-
рим. бнол. Сер. А, 1925, 1, № 3/4,
с. 93—142.
Филатов Д. П. Детерминационные
процессы в онтогенезе.— Успехи со-
врем. биол., 1934, 3, № 4, с. 440—
456.
Фролькис В. В. Старение и биологи-
ческие возможности организма. М.:
Наука, 1975.
Хесин Р. Б. РНК-полимераза и регу-
ляция синтеза РНК в клетке.—
Вестн. АН СССР, 1971, № 11,
с. 42—49.
Хесин Р. Б. Состояние вопроса о ме-
ханизмах регуляции синтеза РНК
у низших и высших организмов.—
Успехи соврем, биол., 1972, 74, № 2,
с. 171 — 197.
Хесин Р. Б., Лейбович Б. А. Струк-
тура хромосом, гистоны и актив*
ность генов у дрозофилы.— Мол.
биол., 1976, 10, № 1.
Хлебодарова Т. М., Серов О. Л., Ко-
рочкин Л. И. Экспрессия аллелей
локуса Pgd в раннем развитии кры-
сы.—ДАН СССР, 1975, 224, № 6,
с. 1428—1430.
Хлопин Н. Г Советская эволюцион-
ная гистология.— Успехи соврем,
биол., 1949, 2, № 5, с. 246—265.
Хопёрская О. А. Нормализация син-
теза меланина в пигментном эпи-
телии глаз зародышей-альбиносов
ар шпорцевой лягушки.— ДАН
СССР, 1977, 236, № 4, с. 998—1000.
Хопёрская О. А., Голубева О. Н. Экс-
периментальное изучение мутант-
ного гена а1’, предотвращающего
нормальную дифференцировку ме-
ланинсинтезирующих клеток.— Ге-
нетика, 1977, 13, № 12, с. 2129—
2139.
Шмальгаузен И. И. Организм как це-
лое в индивидуальном и историче-
ском развитии. М.; Л.: Изд-во АН
СССР, 1942.
Шмальгаузен И. И. Регуляция фор-
мообразования в индивидуальном
развитии. М.: Наука, 1964.
Яковлев М. И., Платонов Е. С., Ко-
нюхов Б. В. Изучение действия му-
тантных генов на синтез кристал-
линов в формирующемся хрустали-
ке мыши. II. Гены fidget и ocular
retardation.— Онтогенез, 1977, 8,
№ 2, с. 115—120.
250
Abbott U., Kieny M. Sur la croissance
in vitro du tibio-tarsc et du perone
•de 1’embryon de poulet «diplopo-
<de».— C. r. Acad, sci., 1961, 252,
p. 1863—1865.
Achazi R., Yamada T Tyrosinase acti-
vity in the Wolffian lens regenera-
ting system.—Develop. Biol., 1972,
27, p. 295—306.
Adler D. A., West J. D.f Chapman V. M.
Expression of a-galactosidase in
preimplantation mouse embryos.—
Nature, 1977, 267, p. 838—839.
Albers L., Dray S., Knight K. Alloty-
pes and isozymes of rabbit a-aryl
esterase. Allelic products with dif-
ferent enzymatic activities for the
same substrates.— Biochemistry,
1969, 8, p. 4416—4424.
Alley К. E. Morphogenesis of the tri-
geminal mesencephalic nucleus in
the hamster: cytogcnesis and neuro-
ne death.— J. Embryol. and Exp.
Morphol., 1974, 31, N 1, p. 99—121.
Allfrey V. G. Changes in chromosomal
proteins at times of gene activati-
on.— Federat. Proc., 1970, 29,
p. 1447—1460.
Allfrey V. G., Inoue A.f Karn J. e. a.
Phosphorylation of DNA-binding
nuclear acidic proteins and gene
activation in the HeLa cell cycle.—
Cold Spring Harbor Sympos. Quant.
Biol., 1974, 38, p. 785—801.
Amaldi F., Carnevali F., Leoni L., Ma-
riotti D. Replicon origins in Chinese
hamster cell DNA. I. Labelling pro-
cedure and preliminary observa-
tions.—Exp. Cell Res., 1972, 74, N 4,
p. 367—374.
Appels R., Bolund L.f Ringertz N. P.
Biochemical analysis of reactivated
chick erythrocyte nuclei isolated
from chick/HeLa heterokaryons.—
J. Mol. BioL, 1974, 87, p. 339—355.
Araki M., Okada T S. Differentiation
of lens and pigment cells in cultu-
res of neural retinal cells of early
chick embrvos.— Develop. BioL,
1977, 60, N L p. 278—286.
Artzt K. Serological detection of anti-
gens specified by genes at the T/t
locus on sperm and embryonic
cells.—Genetics, 1975, 80, N 3,
Suppl., pt 1, p. 1 (Abstr.).
Artzt K., Bennett D. A genetically
caused embryonal ectodermal tumor
in the mouse.— J. Nat. Cancer Inst.,
1972, 48, p. 141 — 158.
Artzt K-, Bennett D., Jacob F. Primi-
tive teratocarcinoma cells express a
differentiation antigen specified by
a gene at the T-locus in the mou-
se.— Proc. Nat. Acad. Sci. U. S. A.,
1974, 71, p. 811—814.
Artzt K., Dubois P., Bennett D. e. a.
Surface antigens common to mouse
cleavage embryos and primitive te-
ratocarcinoma cells in culture.—
Proc. Nat. Acad. Sci. U. S. A., 1973,
70, N 10, p. 2988—2992.
Attardi B. Genetic analysis of steroid
hormone action.— Trends Biochem.
Sci., 1976, 1, p. 241—244.
Attfield M. Inherited macrocytic anae-
mias in the house mouse. III. Red
blood cell diameters.— J. Genet.,
1951, 50, p. 250—263.
Auerbach R. Analysis of the develop-
mental effects of a lethal mutation
in the house mouse.— J. Exp. Zool.,
1954, 127, p. 305—329.
Auerbach R. Controlled differentiation
of teratoma cells.— In: Cell Diffe-
rentiation. Proc. 1st Intern. Conf, on
Cell Differentiation/Ed. R. Harris,
P. Allin, D. Viza. Copenhagen:
Munksgaard, 1972, p. 119—123.
Balsamo J., Lilien J. Embryonic cell
aggregation: Kinetics and specifici-
ty of binding of enhancing factors.—
Proc. Nat. Acad. Sci. U. S. A., 1974,
71, p. 727—731.
Banks-Schlegel S. P., Martin T. E.t
Moscona A. A. Synthesis and phos-
phorylation of chromosomal non-
histone proteins during embryonic
development of neural retina.— De-
velop. Biol., 1976, 50, 1, p. 1—15.
Bannerman R. M. Genetic defects of
iron transport.— Federat. Proc.,
1976, 35, p. 2281—2285.
Barber N. The effects of maternal hy-
poxia on inheritance of recessive
blindness in mice.— Amer. J. Oph-
thalmol., 1957, 44, N 4, pt 2, p. 94—
101.
Baril E., Baril B., Elford H., Luftig
R. B. DNA polymerases and possib-
le multi-enzyme complex for DNA
biosynthesis in eukaryotes.— In: Me-
chanism and Regulation of DNA
Replication/Ed. A. R. Kolber, M. Ko-
hiyama. New York: Plenum Press,
1974, p. 275—291.
Barker J. E., Pierce J. E., Nienhuis
A. W Hemoglobin switching in
sheep and goats. VI. Commitment
of erythroid colony-forming cells to
251
the synthesis of beta globin.— J.
Cell Biol., 1976, 71, p. 715—726.
Barnes R. D., Tuffrey M., Drury L.,
Catty D. Unequal rates of cell pro-
liferation in tetraparental mouse
chimaeras derived by fusion of early
embryos.— Differentiation, 1974, 2,
p. 257—260.
Barnet F. M. Cellular immunology.
Cambridge: Univ. Press, 1969 (Пер.
с англ.: Бернет Ф. Клеточная им-
мунология. М.: Мир, 1971).
Barnett К. С. Hereditary retinal at-
rophy in the poodle.— Vet. Rec.,
1962, 74, p. 672—675.
Barrett T., Maryanka D.f Hamlyn
P. H. Gould H. J. Nonhistone pro-
teins control gene expression in re-
constituted chromatin.— Proc. Nat.
Acad. Sci. U. S. A., 1974, 71,
p. 5057—5061.
Bartke A. Histology of the anterior
hypophysis, thyroid and gonads of
two types of dwarf mice.— Anat.
Rec., 1964, 149, p. 225—236.
Baserga R. Multiplication and divisi-
on in mammalian cells. New York;
Basel: Marcel Dekker, 1976.
Bate С. M., Humphries G. Alpha-beta
thalassaemia.— Lancet, 1977, N 8020,
p. 1031—1033.
Bateman A. E., Cole R. J. Colony for-
ming cells in the livers of prenatal
flexed (f/f) anaemic mice.—Cell
and Tiss. Kinet, 1972, 5, p. 165—
173.
Battin M. J. Les avortements geneti-
ques.—Bordeau med., 1977, 10,
p. 595—606.
Bayne E. R, Simpson S. B., Jr. Detec-
tion of myosin in prefusion Go li-
zard myoblasts in vitro.— Develop.
Biol., 1977, 55, p. 306—319.
Beasley A. B. Inheritance and develop-
ment of a lens abnormality in the
mouse.—J. Morphol., 1963, 112,
p. 1 — 11.
Beasley A. B., Crutchfield F. L. Deve-
lopment of a mutant with abnorma-
lities of the eye and extremities.—
Anat. Rec., 1969, 163, p. 293 (Abstr).
Beck S. L. Frequencies of teratologies
among homozygous normal mice
compared with those heterozygous
for anophthalmia.—Nature, 1963,
200, p. 810—811.
Becker H.f Stunners С. P., Rudlow J. E.
Control of macromolecular synthe-
sis in proliferating and resting Sy-
rian hamster cells in monolayer cul-
ture. II. Ribosome complement in
resting and early Gi cells.—J. Cell.
Physiol., 1971, 77, p. 43—50.
Beckwith J., Rossow P. Analysis of
genetic regulatory mechanisms.—
Annu. Rev. Genet., 1974, 8, p. 1 —13.
Beebe D. C., Piatigorsky J. The con-
trol of o-crystallin gene expression,
during lens cell development: Dis-
sociation of cell elongation, cell di-
vision, o-crystal lin synthesis, and
cr-crystallin mRNA accumulation.—
Develop. Biol., 1977, 59, p. 174—
182.
Benda P., Davidson R. L. Regulation
of specific functions of glial cells
in somatic hybrids. I. Control of
SI00 protein.- J. Cell. Physiol.,
1971, 78, p. 209—216.
Bennett D. Developmental analysis of
a mutation with pleiotropic effect in
the mouse.— J. Morphol., 1956, 98,
p. 199—234.
Bennett D. Abnormalities associated
with a chromosome region in the
mouse. II. Embryological effects of
lethal alleles in t-region.— Science,
1964, 144, p. 263—267.
Bennett D. The T-locus of the mouse:
A review.—Cell, 1975, 6, p. 441 —
454.
Bennett D., Badenhausen S., Dunn
L. C. The embryological effects of
four late-lethal t-alleles in the mou-
se, which affect the neural tube and
skeleton.— J. Morphol., 1959, 105,
p. 105—137.
Bennett D., Dunn L. C. Repeated oc-
curences in the mouse of lethal al-
leles of the same complementation
group.— Genetics, 1964, 49, p. 949—
958.
Bennett D., Goldberg E., Dunn L. C.>
Boyse A. Serological detection of a
cell-surface antigen specified by the
T (brachyury) mutant gene in the
house mouse.— Proc. Nat. Acad. Sci.
U. S. A., 1972, 69, p. 2076—2080.
Bennett D., Mathieson B. J., Scheid M.
e. a. Serological evidence for H-Y
antigen in Sxr, XX sex reversed
phenotypic males.—Nature, 1977,
265, p. 255—257.
Bennett M., Cudkowicz G., Foster
R. S, Metcalf D. Hemopoietic pro-
genitor cells of W anemic mice stu-
died in vivo and in vitro.— J. Cell.
Physiol, 1968, 71. p. 211—226.
252
Benson S. C., Triplett E. L. The syn-
thesis and activity of tyrosinase
during development of the frog Ra-
na pipiens.— Develop. Biol., 1974a,
40, p. 270—282.
Benson S. C., Triplett E. L. Transcrip-
tionally dependent accumulation of
tyrosinase polyribosomes during
frog embryonic development and its
relationship to neural plate induc-
tion.—Develop. Biol., 1974b, 40,
p. 283—291.
Benz E., Turner P Barker J., Nien-
huis A. Stability of the individual
globin genes during erythroid dif-
ferentiation.— Science, 1977, 196,
p. 1213—1214.
Bergey G. K.t Hunt R. K., Holtzer H.
Selective effects of bromodeoxyuri-
dine on the development of embryo-
nic Xenopus laevis retina.— Anat.
Rec., 1973, 175, p. 271 (Abstr.).
Bernhard H. P. The control of gene
expression in somatic cell hybrids.—
Intern. Rev. Cytol., 1976, 47, p. 289—
325.
Berns A. J. M., Strous G. J. A. M.,
Bloemendal H. Heterologous in vit-
ro synthesis of lens a-crystallin po-
lypeptide.— Nature New BioL, 1972,
236, p. 7—9.
Bernstein I. A., Sibrack L. A. Chemi-
cal dynamics in epidermal differen-
tiation.— J. Invest. Dermatol., 1972,
59, p. 77—80.
Bernstein R. M., Mukherjee В. B. Con-
trol of nuclear RNA synthesis in
2-cell and 4-cell mouse embryos.—
Nature, 1972, 238, p. 457—459.
Bernstein R. M., Mukherjee В. B. Cy-
toplasmic control of nuclear activi-
ty in preimplantation mouse embry-
os.— Develop. BioL, 1973, 34, p. 47—
65.
Birnstiel M., Chipchase M. The nuc-
leolus: Pacemaker of the cell.— Sci.
J., 1970, 6, p. 41—47.
Blanks J. C., Adinolfi A. M., Lolley
R. N. Photoreceptor degeneration
and synaptogenesis in retinal-dege-
nerative (rd) mice.— J. Comp. Neu-
rol., 1974, 156, p. 95—106.
Bloemendal H., Berns T., Zweers A.
e. a. The state of aggregation of
a-crystallin detected after largesca-
le preparation by zonal centrifuga-
tion.—Eur. J. Biochem., 1972, 24,
p. 401—406.
Bloom A. D., Choi R. W., Lamb B. J.
Immunoglobulin production by hu-
man lymphocytoid lines and clones.
Absence of genic exclusion.— Sci-
ence, 1971, 172, p. 382-383.
Bloom S. E.t Buss E. G.f Strother G. K.
Cytological and cytophotometric
analysis of binucleated red blood
cell mutants (bn) in turkeys (Me-
leagris gallopavo).— Genetics, 1970’,
65, p. 51—63.
Boivin A., Vendrely R., Vendrely CL
Biochimic de I’hcredi te.— L’acide
desoxyribonucleiquc du noyau cellu-
lairc, depositaire des caracteres he-
reditaires; arguments d’ordre analy-
tique.— C. r. Soc. biol., 1948, 226r
p. 1061.
Bok D., Hall M. O. The role of the
pigment epithelium in the etiology
of inherited retinal dystrophy in the
rat.—J. Cell Biol., 1971, 49, p. 664-
682.
Bonner J. The control of genetic ac-
tivity.— In: Genetics and Develop-
mental Biology/Ed. H. J. Teas. Le-
xington: Univ. Kentucky Press, 1969,.
p. 128—148.
Bonner P. H., Hauschka S. D. ClonaP
analysis of vertebrate myogenesis.
I. Early developmental events in the.
chick limb.—Develop. Biol., 1974,.
37, p. 317—328.
Bonnevie K. Embryological analysis
of gene manifestation in Little and'
Bagg’s abnormal mouse tribe.— J.
Exp. ZooL, 1934, 67, p. 443—520.
Borack L. J. Gene action on prolifera-
tion and migration in the developing-
neural crest of black and white axo-
lotls, Ambystoma mexicanum,.
Shaw.—J. Exp. ZooL, 1972, 179,
p. 289—298.
Borun T W. Histones, differentiation^
and the cell cycle.— In: Cell Cycle*
and Cell Differentiation/Ed. J. Rei-
nert, H. Holtzer. Berlin: Springer-
VerL, 1975, p. 249—290.
Bosmann H. B. Cell surface enzymes:
Effects on mitotic activity and cell
adhesion.—Intern. Rev. CytoL, 1977,
50, p. 1—23.
Boubellk M., Lengerova A., Bailey
D. W., Matousek V A model for ge-
netic analysis of programmed gene
expression as reflected in the deve-
lopment of membrane antigens.—
Develop. Biol., 1975, 47, p. 206-
214.
Boveri T An organism produced se-
xually without characteristics of the
253
mother.—Amer. Natur., 1893, 27,
p. 222—232.
Boveri T. Ergebnisse fiber die chroma-
tische Substanz des Zcllkerns. Jena,
1904.
Bowden-Essien F. An in vitro study
of normal and mutant myogenesis
in the mouse.—Develop. Biol., 1972,
27, p. 351—364.
Bowman P., McLaren A. Cell number
in early embryos from strains of
mice selected for large and small
body size.— Genet. Res., 1970, 15,
p. 261—263.
Boyer S. H., Siggers D. C., Krueger
L. J. Caveat to protein replacement
therapy for genetic disease immuno-
logical implications of accurate mo-
lecular diagnosis.— Lancet, 1973,
p. 654—659.
Boyse E. A.f Old L. J. Some aspects
of normal and abnormal cell surfa-
ce genetics.— Annu. Rev. Genet.,
1969, 3, p. 269—290.
Bracket J. Nucleocytoplsmic interac-
tions in cell differentiation.— In: Mo-
lecular Biology of Nucleocytoplas-
mic Relationships/Ed. S. Puiseux-
Dao. Amsterdam: Elsevier, 1975,
p. 187—200.
Bracket J., Malpoix P. Macromolecu-
lar synthesis and nucleocytoplasmic
interactions in early development.—
Adv. Morphogen., 1971, 9, p. 263—
316.
Braconi L. Gene interaction in the
phenotypic expression of mental di-
seases.— Acta genet, med et gemel-
lol., 1976, 25, p. 240—243.
Brakma S. K., McDevitt D. S. Onto-
geny and localization of y-crystal-
lins in Ambystoma mcxicanum, Pleu-
rodeles waltlii and Rana tempora-
ria normal lens development.— J. Cell
Biol., 1972, 55, N 2, pt 2, p. 26.
Briggs R. Further studies on the ma-
ternal effect of the О gene in the
Mexican axolotl.— J. Exp. Zool.,
1972, 181, p. 271—280.
Briggs R., Justus J. T. Partial charac-
terization of the component from
normal eggs which corrects the ma-
ternal effect of gene О in the Mexi-
can axolotl.—J. Exp. Zool., 1968,
167, p. 105—116.
Briggs R., King T Transplantation of
living nuclei from blastula cells in-
to enucleated frogs eggs.— Proc.
Nat. Acad. Sci. U. S. A., 1952, 38,
p. 455—463.
Briggs R., King T. J. Changes in the
nuclei of differentiating endoderm
cells as revealed by nuclear trans-
plantation.— J. Morphol., 1957, 100,
p. 269—312.
Brinster R. L. The lactate dehydroge-
nase in preimplantation mouse em-
bryos of Quackenbuch and Swiss
mice.—FEBS Lett., 1971, 17, p. 41 —
44.
Brinster R. L. Paternal glucose phos<
phate isomerase activity in three-
day mouse embryos.— Biochem. Ge-
net., 1973, 9, p. 187—191.
Britten R. J., Davidson E. H. Gene re-
gulation for higher cells: A theory.—
Science, 1969, 165, p. 349—357.
Britten R. J. Kohne D. E. Repeated
sequences in DNA.— Science, 1968,
161, p. 529—540.
Bross K., Krone W. On the number of
ribosomal RNA genes in man.—
Humangenetik, 1972, 14, p. 137—
141.
Brothers A. J. Stable nuclear activati-
on dependent on a protein synthesi-
sed during oogenesis.— Nature,
1976, 260, p. 112—115.
Brown D. D., Gurdon J. B. Absence
of ribosomal RNA synthesis in the
anucleolate mutant of Xenopus lae-
vis.— Proc. Nat. Acad. Sci. U.S.A.,
1964, 51, p. 139—146.
Brown J. R., Church R. B. Transcrip-
tion of nonrepeated DNA during
mouse and rabbit development.—
Develop. BioL, 1972, 29, p. 73—84.
Brown J. E., Weiss M. C, Activation
of production of mouse liver enzy-
mes in rat hepatoma-mouse lymp-
hoid cell hybrids.— Cell, 1975, 6,
p. 481—494.
Bruce W. R., Meistrich M. L. Sperma-
togenesis in the mouse.— In: Cell
Differentiation/Ed. R. Harris. P. Al-
lin, D. Viza. Copenhagen: Munks-
gaard, 1972, p. 295—299.
Bruns G. A. P., Ingram V. M. Proge-
nitor cells of the definitive erythroid
series in the chick embryo.— Deve-
lop. Biol., 1973. 31, p. 192—194.
Bryan J. H. D. Spermatogenesis revi-
sited. III. The course of spermato-
genesis in a male-sterile pink-eyed
mutant type in the mouse.— Cell
and Tiss. Res., 1977a, 180, p. 173—
186.
Bryan J. H. D. Spermatogenesis revi-
sited. IV. Abnormal spermiogenesis
in mice homozygous for another ma-
254
lesterility-inducing mutation, hpy
(hydrocephalic-poTydactyl).— Cell
and Tiss. Res., 1977b, 180, p. 187—
201.
Buckingham M. E., Cohen A., Gros F.
e. a. Expression of the myosin gene
in a hybrid cell derived from a rat
myoblast and a mouse fibroblast.—
Biochimie, 1974, 56, p. 1571—1573.
Buell D. N.f Sox H. C.t Fahey J. L.
Immunoglobulin production in pro-
liferating lymphoid cells.— In: De-
velopmental Aspects of the Cell Cyc-
le/Ed. I. L. Cameron, G. M. Padilla,
A. M. Zimmerman, New York; Lon-
don: Acad. Press, 1971, p. 279—296.
Buettner-Janusch J. Evolution of se-
rum protein polymorphisms.— Annu.
Rev. Genet., 1970, 4, p. 47—68.
Bdrk R. R., Pitts J. D., Subak-Sharpe
J. H. Exchange between hamster
cells in culture.— Exp. Cell Res.,
1968, 53, p. 297—301.
Burstin S. J., Meiss H. K., Basilico
C. J. A temperature-sensitive cell
cycle mutant of the BHK cell line.—
J. Cell Physiol., 1974, 84, p. 397—
407.
Calarco P. G., Brown E. H. Cytologi-
cal and ultrastructural comparisons
of t12/t12 and normal mouse moru-
lae.—J. Exp. Zool., 1968, 168,
p. 169—185.
Calarco P. G., Pedersen R. A. Ultra-
structural observations of lethal yel-
low (Ay/Ay) mouse embryos.— J.
Embryol. and Exp. Morphol., 1976,
35, p. 73—80.
Caley D. W., Johnson C., Liebelt R. A.
The postnatal development of the
retina in the normal and rodless
CBA mouse: A light and electron
microscopic study.— Amer. J. Anat.,
1972, 133, p. 179—212.
Cameron J. A., Fallon J. Evidence for
polarizing zone in the limb buds of
Xenopus laevis.— Develop. Biol.,
1977, 55, p. 320—330.
Campbell G., Le M., Weintraub H.,
Mayall В. H., Holtzer H. Primitive
erythropoeisis in early chick embryo-
genesis. II. Correlation between he-
moglobin synthesis and the mitotic
history.—J. Cell Biol., 1971, 50,
p. 669—681.
Caplan A. I. The site and sequence of
action of 6-aminonicotinamide in
causing bone malformations of em-
bryonic chick limb and its relation-
ship to normal development.— De-
velop. Biol., 1972, 28, p. 71—83.
Caplan A. I., Ordahl С. P. Irreversib-
le gene repression model for control
of development.— Science, 1978, 201,
p. 120-130.
Carroll C., Sinclair J. Nucleolar orga-
nizer length variation associated
with rDNA redundancy level and
embryonic development.— J. Cell
Biol., 1972, 55, p. 34 (Abstr.).
Carroll C. R., Van Deusen E. B. Expe-
rimental studies on a mutant gene
(cl) in the Mexican axolotl which
affects cell membrane formation in
embryos from cl/cl females.— Deve-
lop. Biol., 1973, 32, p. 155—166.
Carter T. C. Embryology of the little
and bagg X-rayed mouse stock.— J.
Genet., 1959, 56, p. 401—435.
Castle W. E.f Gregory P. W. The em-
bryological basis of size inheritance
in the rabbit.—J. Morphol. and Phy-
siol., 1929, 48, p. 81 — 104.
Cattanach В. M., Iddon C. A., Charl-
ton H. M. c. a. Gonadotrophin-relea-
sing hormone deficiency in a mu-
tant mouse with hypogonadism.—
Nature, 1977, 269, p. 338—340.
Center E. M. Genetical and embryolo-
gical comparison of two mutations
which cause foetal blebs in mice.—
Genet. Res., 1977, 29, p. 147—157.
Champion M. J., Whitt G. S. Synchro-
nous allelic expression at the gluco-
sephosphate isomerase A and В loci
in interspecific sunfish hybrids.—
Biochem. Genet., 1976, 14, p. 723—
737.
Chang T. K. The development of po-
lydactylism in a special strain of
Mus musculus.— Peking Nat. Hist.
Bull., 1939, 14, p. 119—132.
Chase H. B. Studies on an anophthal-
mic strain of mice. V. Associated
cranial nerves and brain centres.—
J. Comp. Neurol., 1945, 83, p. 121 —
183.
Chase H. B., Chase E. B. Studies on
an anophthalmic strain of mice. I.
Embryology of the eye region.—J.
Morphol., 1941, 68, p. 279—301.
Chase J. W., Dawid I. B. Biogenesis
of mitochonodria during Xenopus
laevis development.— Develop. Biol.,
1972, 27, p. 504—518.
Chick W. L., Like A. A. Studies in
the diabetic mutant mouse. III. Phy-
siological factors associated with
alterations in beta cell proliferati-
255
on.— Diabetologia, 1970, 6, p. 243—
251.
Child С. M. Pattern and problems of
development. Chicago: Univ. Press,
1941.
Childs B. Genetic screening.— Anna.
Rev. Genet., 1975, 9, p. 67—89.
Choe B. K.> Rose N. R. Synthesis of
DNA-binding proteins during the
cell cycle of WI-38 cells.— Exp.
Cell Res., 1974, 83, p. 271—280.
Choke H. C. Genetical studies on ac-
tive transport —Sci. Progr., 1971,
59, p. 75—89.
Chung H.-М., Briggs R. Experimen-
tal studies on a lethal gene 1 in
the Mexican axolotl, Ambystoma
mexicanum.— J. Exp. Zool. 1975,
191, p. 33—47.
Church R. B., Schultz G. A. Differen-
tial gene activity in the pre- and
postimplantation mammalian em-
bryo.— Curr. Top. Develop., Biol.,
1974, 8, p. 179—202.
Clark W. R., Rutter W. J. Synthesis
and accumulation of insulin in the
fetal rat pancreas —Develop. Biol.,
1972, 29, p. 468—481.
Claycomb C., Villee C. A. Lactate de-
hydrogenase isozymes of Xenopus
laevis: Factors affecting their ap-
pearance during early develop-
ment.—Develop. Biol., 1971, 24,
p. 413—427.
Clayton R. M., Eguchi G., Truman
D. E. S. e. a. Abnormalities in the
differentiation and cellular proper-
ties of hyperplastic lens epithelium
from strains of chickens selected for
high growth rate.—J. Embryol. and
Exp. MorphoL, 1976, 35, p. 1—23.
Clever U. Regulation of chromosome
function.— Annu. Rev. Genet., 1968,
2, p. 11—30.
Comings D. E., Kakefuda T. Initiation
of deoxyribonucleic acid replication
at the nuclear membrane in human
cells.— J. Mol. Biol., 1968, 33,
p. 225—229.
Conconi F., Senno L. del. The mole-
cular defect of Ferrara 0-thalasse-
mia.— Ann. N. Y. Acad. Sci., 1974,
232, p. 54—64.
Cooke J. Morphogenesis and regula-
tion in spite of continued mitotic
inhibition in Xenopus embryos.—
Nature, 1973, 242, p. 55—57.
Cortner J. A., Coates P. M., Swobo-
da E., Schnatz J. D. Genetic varia-
tion of lysosomal acid lipase.— Pe-
diat. Res., 1976, 10, p. 927—932.
Coulombre A. J. The eye.— In: Orga-
nogenesis/Ed. R. L. De Haan, H. Ur-
sprung. New York: Holt, 1965,
p. 219—251.
Cox R. P. Early events in hormonal
induction of alkaline phosphatase in
human cell culture: Hormone-cell
interaction and its dependence on
DNA replication.— Ann. N. Y. Acad.
Sci., 1971, 179, p. 596—610.
Cox R. P., King J. C. Gene expressi-
on in cultured mammalian cells.—
Intern. Rev. Cytol., 1975, 43,
p. 281—351.
Cox R. P., Krauss M. R., Balis M. E.,
Dancis J. Evidence for transfer ol
enzyme product as the basis of me-
tabolic cooperation between tissue
culture fibroblast of Lesch-Nyhan
disease and normal cells.— Proc.
Nat. Acad. Sci. U. S. A., 1970, 67,
p. 1573—1579.
Cox R. P., Krauss M. R., Balis M. E.,
Dancis J. Metabolic cooperation in
cell culture: A model for cell-to-cell
communication.— In: Cell communi-
cation/Ed. R. P. Cox. New York:
Wiley, 1974, p. 67—95.
Cox R. P., Krauss M. R., Balis M. E.,
Dancis J. Studies on cell communi-
cation with enucleated human fibro-
blasts.—J. Cell Biol., 1976, 71,
p. 639—703.
Croft L. R. C-terminal amino acid se-
quence of bovine y-crystallin.— Bio-
chem. J., 1971, 121, p. 557—559.
Dagg С. P. Effects of fluorouracil in
the penetrance of two skeletal mu-
tants in mice.— Anat. Rec., 1965,
151, p. 341 (Abstr.).
Dahmus M. E., Bonner J. Nucleopro-
teins in regulation of gene functi-
on.—Federal. Proc., 1970, 29,
p. 1255—1260.
Danes B. Expression of the cystic fib-
rosis genotype in cultured somatic
cells.— Tex. Rcpts Biol, and Med.,
1976, 34, p. 135—150.
Darlington G. Production of human
albumin in mouse hepatoma-human
leukocyte hybrids.— In: Somatic cell
hybridization/Ed. R. L. Davidson,
F. de la Cruz. New York: Raven
Press, 1974, p. 159—161.
Davidson E. H. Gene activity in ear-
ly development.—New York; London:
Acad. Press, 1968 (Пер. с англ.:
Дэвидсон Э. Действие генов в ран-
нем развитии. М.: Мир, 1972)
256
Davidson E. H., Britten R. J. Note on
the control of gene expression du-
ring development.— J. Theor. BioL,
1971, 32, p. 123—130.
Davidson E., Britten R. Organization,
transcription, and regulaton in the
animal genome.— Quart. Rev. Biol.,
1973, 48, p. 565—613.
Davidson R. L. Regulation of diffe-
rentiation in cell hybrids.— Federat.
Proc., 1971, 30, N 3, Part 1, p. 926—
929.
Davidson R. L. Regulation of melanin
synthesis in mammalian cells: Ef-
fect of gene dosage on the expres-
sion of differentiation — Proc. Nat.
Acad. Sci. U. S. A., 1972, 69,
p. 951—955.
Davidson R. L. Gene expression in so-
matic cell hybrids.— Annu. Rev. Ge-
net., 1974, 8, p. 195—218.
Davidson R., Benda P. Regulation of
specific functions of glial cells in
somatic hybrids. II. Control of in-
ducibility of glycerol-3-phosphate
dehydrogenase.— Proc. Nat. Acad.
Sci. U. S. A., 1970, 67, p. 1870—
1877.
Davidson R., Ephrussi B.t Yamamo-
to K. Regulation of pigment syn-
thesis in mammalian cells, as studi-
ed by somatic hybridization.— Proc.
Nat. Acad. Sci. U. S. A., 1966, 56,
p. 1437—1440.
Davidson R., Nitowsky H., Childs B.
Demonstration of two population of
cells in the human female heterozy-
gous for glucose-6-phosphate dehy-
drogenase variants.— Proc. Nat.
Acad. Sci. U. S. A., 1963, 50, p. 481—
485.
Dawid J. B., Blackler A. W. Maternal
and cytoplasmic inheritance of mi-
tochondrial DNA in Xenopus.—De-
velop. BioL, 1972, 29, p. 152—161.
Deisseroth A., Nienhunsi A. Study of
markers of human erythroid diffe-
rentiation in hybrid cells.— In Vi-
tro, 1976, 12, p. 734—742.
DeJimenez E. S., Dominguez J. L.,
Webb F. H., Bock R. M. Comparati-
ve DNA-RNA hybridization in dif-
ferentiated cells.— J. MoL BioL,
1971, 61, p. 59—71.
De Long R. G. Histogenesis of fetal
mouse isocortex and hippocampus
in reaggregating cell cultures.—De-
velop. BioL, 1970, 22, p. 563—583.
De Long R. G.t Sidman R. L. Align-
ment defect of reaggregating cells
V29 Б. В. Конюхов
in cultures of developing brains of
reeler mutant mice.— Develop. Bi-
oL, 1970, 22, p. 584—600.
Denis H. Role of messenger ribonu-
cleic acid in embryonic develop-
ment.— Adv. Morphogen., 1968, 7,
p. 115—150.
Deol M. S. Influence of the neural tu-
be on the differentiation of the in-
ner ear in the mammalian embryo.—
Nature, 1966, 209, p. 219—220.
Deol M. S. Inherited diseases of the
inner car in man in the light of
studies on the mouse.— J. Med. Ge-
net., 1968, 5, p. 137—158.
Deol M. S. Mouse mutants with in-
ner car defects and their value in
biomedical research.— Coll. Intern.
C. N. R. S., 1970a, N 924, p. 279—
291.
Deol M. S. The relationship between
abnormalities of pigmentation and
of the inner car.— Proc. Roy. Soc.
London, B, 1970b, 175, p. 201—217.
Deol M. S„ Whitten W. K. Time of X
chromosome inactivation in retinal
melanocytes of the mouse.— Nature
New BioL, 1972, 238, p. 159—160.
DeRobertis E. M., Partington G. A.,
Longthorne R. F., Gurdon J. B. So-
matic nuclei in amphibian oocytes.
Evidence for selective gene expres-
sion.— J. Embryol. and Exp. Mor-
phoL, 1977, 40, p. 199—214.
Desphande A. R., Niu L. C., Niu M. C.
Requirement of informational mole-
cules in heart formation.— In: The
role of RNA in reproduction and
development/Ed. M. C. Niu, S. J.
Segal. Amsterdam: North-Golland,
1973, p. 229—246.
Dewey M. J., Martin D. W., Jr. Mar-
tin G. R., Mintz B. Mosaic mice
with teratocarcinoma-derived mutant
cells deficient in hypoxanthine pho-
sphoribosiltransferase.— Proc. Nat.
Acad. Sci. U. S. A., 1977, 74,
p. 5564—5568.
Dewey M. J., Mintz B. Genetic control
of cell-type-specific levels of mouse
P-galactosidase.— Develop. BioL,
1968a, 66, p. 560—563.
Dewey M. J., Mintz B. Direct visuali-
zation, by p-galactosidase histoche-
mistry, of differentiated normal cells
derived from malignant teratocarci-
noma in allophenic mice.— Develop.
BioL, 1978b, 66, p. 550—559.
DeBerardino M. A., Hoffner N. Origin
of chromosomal abnormalities in nu-
257
clear transplants — a reevaluation
of nuclear differentiation and nu-
clear equivalence in amphibians.—
Develop. Biol., 1970, 23, p. 185—
209.
DiBerardino M. A., King T. J. Deve-
lopment and cellular differentiation
of neural nuclear-transplants of
known karyotype.— Develop. Biol.,
1967, 15, p. 102—128.
Dienstman S. R., Biehl J., Holtzer S.,
Holtzer H. Myogenic and chondro-
gcnic lineages in developing limb
buds grown in vitro.— Develop. Bi-
ol., 1974, 39, p. 83—95.
Dienstman S. R.t Holtzer H. Myoge-
ncsis: A cell lineage interpretation.—
In: Cell Cycle and Cell Differentia-
tion/Ed. J. Reinert, H. Holtzer. Ber-
lin: Springer-Verl., 1975, p. 1—25.
Dooher G. B., Bennett D. Abnormal
microtubular systems in mouse sper-
matids associated with a mutant
gene at the T-locus.— J. Embryol.
and Exp. Morphol., 1974, 32, p. 749—
761.
Drews U., Blecher S. R., Owen D. A.,
Ohno S. Genetically directed prefe-
rential X-activation seen in mice.—
Cell, 1974, 1, p. 3—8.
Drain A., Beauchemin M. L. «Immo-
bile» (im), a recessive lethal muta-
tion of Xenopus laevis tadpoles.—
J. Embryol. and Exp. Morphol., 1975,
34, p. 435—449.
Ducos J., Marty Y., Sanger R., Race
R. R. Xg and X chromosome inacti-
vation.— Lancet, 1971, N 7717,
p. 219—220.
Dunn G. R. Embryological effects of
a minute deficiency in linkage gro-
up II of the mouse.—J. Embryol.
and Exp. Morphol., 1972, 27, p. 147—
154.
Dunn L. C., Bennett D. A comparison
of the effects, in compounds of se-
ven genetically similar lethal t alle-
les from populations of wild house
mouse.—Genetics, 1960, 45, p. 1531 —
1538.
Dunn L. C., Bennett D., Beasley A. B.
Mutation and recombination in the
vicinity of a complex gene.— Gene-
tics, 1962, 47, p. 285—303.
DuPasquier L., Wabl M. R. Transplan-
tation of nuclei from lymphocytes
of adult frogs into enucleated
eggs.— Differentiation, 1977, 8,
p. 9—19.
Dustin P. Jr. Cell differentiation and
carcinogenesis: A critical review.—
Cell and Tiss. Kinet., 1972, 5,
p. 519—533.
Dutrillaux B., Fosse A. M. Utilisation
du BrdU dans 1’etude du cycle cellu-
laire de sujets normaux et anorma-
ux.— Ann. genet., 1976, 19, p. 95—
102.
Ebert J. D. Cell differentiation today
and tomorrow.— Cell. Different.,
1972, 1, p. 1—4.
Ede D. A., Agerbak G. S. Cell adhe-
sion and movement in relation to
the developing limb pattern in nor-
mal and talpid mutant chick embry-
os.— J. Embryol. and Exp. Morphol.,
1968, 20, p. 81 — 100.
Ede D. A., Flint О. P. Patterns of cell
division, cell death and chondroge-
nesis in cultured aggregates of nor-
mal and talpid 3 mutant chick limb
mesenchyme cells.— J. Embryol. and
Exp. Morphol., 1972, 27, p. 245—
260
Ede D. A., Flint О. P. Cell movement
and adhesion in the developing
chick wing bud: Studies on cultu-
red mesenchyme cells from normal
and talpid3 mutant embryos.— J.
Cell. Sci., 1975, 18, p. 301—313.
Ede D. A., Hinchliffe J. R., Mees H. C.
Feather morphogenesis and fearther
pattern in normal and talpid3 mu-
tant chick embryos.— J. Embryol.
and Exp. Morphol., 1971, 25, p. 65—
83.
Ede D. A., Kelly W A. Developmen-
tal abnormalities in the head region
of the talpid 3 mutant of the fowl.—
J. Embryol. and Exp. Morphol.,
1964, 12, p. 161 — 182.
Edelstein В. B. Cell specific diffusion
model of morphogenesis.— J. Theor.
Biol., 1971, 30, p. 515—532.
Edwards J. A., Bannerman R. M., Krei-
mer-Birnbaum M. Sex-linked ane-
mia of the mouse: An effect of the
gene in the heterozygous state.—
Proc. XIV Intern. Congr. Hematol.
Brazil, 1972 (Abstr.), p. 12.
Edwards J. A., Hoke J. E. Defect of
intestinal mucosal iron uptake in
mice with hereditary microcyctic ane-
mia.— Proc. Soc. Exp. Biol, and
Med., 1972, 141, p. 81—84.
Eguchi G., Okada T. S. Differentiation
of lens tissue from the progeny of
chick retinal pigment cells cultured
in vitro: A demonstration of a switch
258
of cell-types in clonal cell culture.—
Proc. Nat. Acad. Sci. U. S. A., 1973,
70, p. 1495—1499.
Ellem K. A. D., Gwatkin R. B. L. Pat-
terns of nucleic acid synthesis in the
early mouse embryo.— Develop.
Biol., 1968, 18, p. 311—330.
Elmer W. A. In vitro and in situ ana-
lyses of the inhibitory effect of Cree-
per tissues.— J. Exp. Zool., 1968a,
169, p. 381—390.
Elmer W A. Experimental analysis of
the Creeper condition in chickens.—
Develop. BioL, 1968b, 18, p. 76—92.
Elmer W. A. Morphological and bio-
chemical modifications of cartilage
differentiation in the brachypod and
other micromelic mouse embryos.—
Colloq. Intern. C. N. R. S., 1976,
N 266, p. 235—241.
El-Shershaby A. M., Hinchliffe J. R.
Cell redundancy in the zona-intact
preimplantation mouse blastocyst:
A light and electron microscope
study of dead cells and their fate.—
J. Embryol. and Exp. Morphol., 1974,
31, p. 643—654.
Emerson Ch. P., Beckner S. K. Acti-
vation of myosin synthesis in fusing
and mononucleated myoblasts.— J.
Mol. Biol., 1975, 93, p. 431—447.
Enesco M., Leblond С. P. Increase in
cell number as a factor in the
growth of the organs and tissues
of the young male rat.— J. Embry-
ol. and Exp. Morphol., 1962, 10,
p. 530—562.
Engel W.f Wolf U. Synchronous acti-
vation of the alleles coding for the
S-form of the NADP-dependent ma-
late dehydrogenase during mouse
embryogenesis. — Humangenetik,
1971, 12, p. 162—166.
Ephrussi B. Hybridization of somatic
cells. Princeton: Univ. Press, 1972
(Пер. с англ.: Эфрусси Б. Гибриди-
зация соматических клеток. М.:
Мир, 1976).
Ephrussi В., Weiss М. С. Regulation
of the cell cycle in mammalian cells:
Inferences and speculations based
on observations of interspecific so-
matic hybrids.— In: Control Mecha-
nisms in Developmental Processes/
/Ed. M. Locke. New York; London:
Acad. Press, 1967, p. 136—169.
Epifanova О. L, Terskikh V. V. [Епи-
фанова О. И., Терских В. B.J On
the resting periods in the cell life
cycle.— Cell Tiss. Kinet., 1969, 2,
p. 75—93.
Epstein C. J. Expression of the mam-
malian X chromosome before and
after fertilization.— Science, 1972,
175, p. 1467—1468.
Epstein C. J., Smith S. A. Electropho-
retic analysis of proteins synthesi-
zed by preimplantation mouse em-
byos.— Develop. Biol., 1974, 40,
p. 233—244.
Erhan S., Reisher S., Franko E. A.
e. a. Evidence for «the Wedge», ini-
tiator of DNA replication.— Nature,
1970, 225, p. 340—342.
Erickson R. P., Lewis S. E., Slusser
K. S. Deletion mapping of the t com-
plex of chromosome 17 of the mo-
use.— Nature, 1978, 274, p. 163—
164.
Evans H. J. Molecular architecture of
human chromosomes.— Brit. Med.
Bull., 1973, 29, p. 196—202.
Evans H. J. Some facts and fancies
relating to chromosome structure in
man.— Adv. Hum. Genet., 1977, 8,
p. 347—438.
Evans M. J. The isolation and pro-
perties of a clonal tissue culture
strain of pluripotent mouse terato-
ma cells.— J. Embryol. and Exp.
Morphol., 11972, 28, p. 163—176.
Fallon J. F., Crosby G. M. The rela-
tionship of the zone of polarizing
activity to supernumerary limb for-
mation in the chick wing bud.—
Develop. Biol., 1975, 43, p. 24—34.
Fankhauser G. Zytologische Untersu-
chungen an geschniirten Triton-
Eiern. I. Die verzogerte Kernversor-
gung ciner Halfte nach hantelformi-
ger Einschniirung des Eies.— Roux’
Arch., 1930, 122, S. 117-139.
Fantoni A., DeLaChapelle A., Marks
P. A. Synthesis of embryonic hemo-
globins during erythroid cell deve-
lopment in fetal mice.— J. Biol.
Chem., 1969, 244, p. 675—681.
Farber R. A. Gene dosage and the
expression of electrophoretic patterns
in heteroploid mouse cell lines.— Ge-
netics, 1973, 74, p. 521—531.
Faulhauber L W Die Induktionsleis-
tung subzellularer Fraktione aus der
Gastrula von Xenopus laevis.— Ro-
ux’ Arch., 1972, 171, S. 87—108.
Faulhaber L W., Lyra L. Veranderun-
gen der Aktivitat und des Isoenzym-
musters der LDH (laktatdehydroge-
nase) wahrend der Entwicklung bei
259
9*
Urodelcn und Anuren (Tritunis al-
pestris und vulgaris, Ambystoma
mexicanum, Xenopus laevis).— Ro-
ux’ Arch., 1975, 176, S. 191—205.
Feinstein R. N. Acatalasemia in the
mouse and other species.— Biochem.
Genet., 1970, 4, p. 135—155.
Feldman M.f Bleiberg I. Studies on
the feedback regulation of haemo-
poiesis.— In: Cell Differentiation/
/Ed. A. V. S. De Reuck, J. Knight.
London: Churchill, 1967, p. 79—89.
Felton J., Meisler M., Paigen K. A lo-
cus determining p-galactosidase ac-
tivity in the mouse.— J. Biol. Chem.,
1974, 249, p. 3267—3272.
Fentiman L, Taylor-Papadimitriou J.,
Stoker M. Selective contact-depen-
dent cell communication.— Nature,
1976, 264, p. 760—762.
Fincham J. R. S. Genetic complemen-
tation. New York; Amsterdam: Ben-
jamin, 1966 (Пер. с англ.: Финчем
Дж. Генетическая комплементация.
М.: Мир, 1968).
Flower М. J. Cellular heterogenity in
the chick wing mesoblast. I. Ana-
lysis by equilibrium density gradient
centrifugation.— Develop. Biol.,
1972, 28, p. 583—602.
Foley К. M., Danes B. S., Bearn A. G.
White blood cell cultures in genetic
studies on the human mucopolysac-
charidoses.— Science, 1969, 164,
p. 424—426.
Ford С. E. Twenty years of human
cytogenetics.— Hereditas, 1977, 86,
p. 5—7.
Ford С. E., Evans E. P., Burten-Shaw
M. D. e. a. Marker chromosome ana-
lysis of tetraparental AKR^-*CBA-T6
mouse chimaeras.— Differentiation,
1974, 2, p. 321—333.
Forsthoefel P. F. Genetics and mani-
fold effects of Strongs’ luxoid gene
in the mouse, including its interac-
tions with Green’s luxoid and Car-
ter’s luxate genes.— J. Morphol.,
1962, 110, p. 391—420.
Forsthoefel P. F. The effects on mouse
development of interactions of 5-
fluorouracil with Strong’s luxoid
gene and its plus and minus modi-
fiers.— Teratology, 1972, 6, p. 5—
18.
Foulds L. Neoplastic development.
New York; London: Acad. Press,
1969, vol. 1.
Fowler J. H., Till J. E., McCulloch
E. A., Siminovitch L. The cellular ba-
sis for the defect in haemopoiesis
in flexcd-tailed mice. II. The speci-
ficity of the defect for erythropoie-
sis.— Brit. J. Haematol., 1967, 13,
p. 250—264.
Fox T. O., Sheppard J. R.t Burger
M. M. Cyclic membrane changes in
animal cells: Transformed cells per-
manently display a surface architec-
ture detected in normal cells only
during mitosis.— Proc. Nat. Acad.
Sci. U. S. A., 1971, 68, p. 244—247.
Francois J. Heredity in ophthalmolo-
gy. St. Louis: С. V. Mosby Co., 1961.
Francois J. Progress in ophthalmic ge-
netics.— Progr. Med. Genet., 1962,
2, p. 231—365.
Fraser F. C. The multifactorial/thre-
shold concept-uses and misuses.—
Teratology, 1976, 14, p. 267—280.
Fraser F. C., Herer M. L. The inheri-
tance and expression of the «lens
rupture» gene in the house mouse.—
J. Hered., 1950, 41, p. 3—7.
Fraser R. A., Abbott U. K. Tissue spe-
cificity of gene effects in two poly-
dactylous mutants of the chicken.—
Genetics, 1968, 60, p. 179 (Abstr.).
Fraser R. A., Abbott U. K. Studies on
limb morphogenesis. V. The expres-
sion of eudiplopodia and its experi-
mental modification.— J. Exp. Zool.,
1971a, 176, p. 219—236.
Fraser R. A., Abbott U. K. Studies on
limb morphogenesis. VI. Experiments
with early stages of the polydacty-
lous mutant eudiplopodia.—J. Exp.
Zool., 1971b, 176, p. 237—248.
Frenster J. H. Electron microscopic lo-
calization of acridine orange bind-
ing to DNA within human leukemic
bone marrow cells.— Cancer Res.,
1971, 31, p. 1128—1133.
Freye H. Anatomische und entwick-
lungsgeschichtliche Untersuchungen
am Skelett normaler und oligodac-
tyler Mause.— Wiss. Z. Univ. Halle,
Math.-naturwiss. KL, 1954, 3,
S. 801—824.
Fritz P., White E., Pruitt К., Vesell E.
Lactate dehydrogenase isozymes.
Turnover in rat heart, skeletal mus-
cle and liver.— Biochemistry, 1973,
12, p. 4034—4039.
Fritz P. J., White E. L., Vesell E. S.,
Pruit К. M. New theory of the con-
trol of protein concentrations in
animal cells.— Nature New BioL,
1971, 230, p. 119—122.
260
Fudenberg H. H., Warner N. L. Gene-
tics of immunoglobulins.— Adv. in
Human Genetics, 1970, 1, p. 131 —
209.
Fujii K., Kajiwara T., Kurosu H. Os-
teogenesis imperfecta: Altered con-
tent of type III collagen and pro-
portion of the crosslinks in skin.—
FEBS Lett., 1977, 82, p. 251—254.
Fujita S. Chromosomal organization
as a genetic basis of cytodifferen-
tiation in multicellular organisms.—
Nature, 1965, 206, p. 742—744.
Fulder S. A pathological race trough
life.— New Sci., 1977, 74, p. 122—
124.
Gadski R. A., Chae C.-B. Mode of
chromatin reconstitution. Elements
controlling globin gene.— Biochemi-
stry, 1978, 17, p. 869—874.
Galbraith D. B. Cell mass, hair type
and expression of the agute gene.—
Nature, 1969, 222, p. 288—290.
Ganschow R., Schimke R. Murine ca-
talase phenotypes.— Biochem. Genet.,
1970, 4, p. 157—167.
Gardner R. L. Mouse chimaeras ob-
tained by the injection of cells into
the blastocyst.— Nature, 1968, 220,
p. 596—597.
Gardner R. L. Analysis of determina-
tion and differentiation in the early
mammalian embryo using intra- and
interspecific chimeras.— In: Deve-
lopment Biology of Reproduction/
Ed. C. L. Markert, J. Papaconstan-
tinou. New York; London: Acad.
Press, 1975, p. 207—236.
Gardner R. L. Production of chime-
ras by injecting cells or tissue into
the blastocyst.— In: Methods in
Mammalian Reproduction/Ed. J. C.
Daniel. New York: Acad. Press, 1978,
p. 137—165.
Gardner R. L., Lyon M. F. X chromo-
some inactivation studied by injec-
tion of a single cell into the mouse
blastocyst —Nature, 1971, 231,
p. 385—386.
Gardner R. L., Papaioannou V. E.,
Barton S. C. Origin of the ectopia-
cental cone and secondary giant
cells in mouse blastocysts reconsti-
tuted from isolated trophoblast and
inner cell mass.— J. Embryol. and
Exp. Morphol., 1973, 30, N 3,
p. 561—572.
Gar//er S., Liskay R„ Campbell B. e. a.
Evidence for two functional X chro-
mosomes in human oocytes.— Cell
Different., 1972, 1, p. 215—218.
Gearhart J. D., Mintz B. Clonal ori-
gins of somites and their muscle de-
rivatives: Evidence from allophenic
mice.— Develop. Biol., 1972, 29,
p. 27—37.
Generoso W M. Chemical induction
of dominant lethals in female mi-
ce.— Genetics, 1969, 61, p. 461—470.
Georgiev G. P. [Георгиев Г 77.] On
the structural organization of ope-
ron and the regulation of RNA syn-
thesis in animal cells.— J. Theoret.
Biol., 1969, 25, N 3, p. 473—490.
Georgiev G. P. [Георгиев Г. 77.] The
structure of transcriptional units in
eukaryotic cells.— Curr. Top. Dev.
Biol., 1972, 7, p. 1—60.
Gianni A. M., Weinberg R. A. Mela-
nocyte-stimulating hormone promo-
tes activation of pre-existing tyro-
sinase molecules in Cloudman S91
melanoma cells.— Nature, 1975, 255,
p. 644—646.
Glass R. D., Doyle D. Genetic control
of lactate dehydrogenase expression
in mammalian tissues.— Science,
1972, 176, p. 180—181.
Clucksmann A. Cell death in normal
development.—Arch. Biol., 1965, 76,
p. 419—437.
Gluecksohn-Schoenheimer S. The ef-
fects of a lethal mutation respon-
sible for duplication and twinning in
mouse embryos.—J. Exptl Zool.,
1949, 110, p. 47—76.
Gluecksohn-Waelsch S. Some genetic
aspects of development.— Cold
spring Harbor Sympos. Quant. Bi-
ol., 1954, 19, p. 41—49.
Gluecksohn-Waelsch S., Cori C. F
Glucose 6-phosphatase deficiency:
Mechanisms of' genetic control and
biochemistry.— Biochem. Genet.,
1970, 4, N 1, p. 195—201.
Gluecksohn-Waelsch S.f Erickson R. P.
The T-locus of the mouse: Implica-
tions for mechanisms of develop-
ment.— Curr. Top. Develop. BioL,
1970, 5, p. 281—316.
Gluecksohn-Waelsch S., Rota T. R. De-
velopment in organ tissue culture
of kidney rudiments from mutant
mouse embryos.— Develop. Biol.,
1963, 7, p. 432—444.
Gluecksohn-Waelsch S., Schiff man
M. B., Thorndike J., Cori C. F. Com-
plementation studies of lethal alle-
les in the mouse causing deficiencies
261
of glucose-6-phosphatase, tyrosine
aminotransferase and serine dehy-
dratase.— Proc. Nat. Acad. Sci.
U. S. A., 1974. 71, p. 825—829.
Godlewski E. Jr. Das Vererbungsprob-
lem in Lichte der Entwicklungsmc-
chanik betrachtet.— In: Votrage und
Aufsatze fiber Entwicklungsmccha-
nik der Organizmen/Ed. W. Roux.
Leipzig, 1909, Bd. 9.
Goetinck P. F. Studies of limb mor-
phogenesis. II. Experiments with the
polydactylus mutant Eudiplopodia.—
Develop. BioL, 1964, 10, p. 71—91.
Goetinck P. F. Genetic aspects of skin
and limb development.— Curr. Top.
Develop. Biol., 1966, 1, p. 253—283.
Goetinck P. F., Abbott U. K. Studies
of limb morphogenesis. I. Experi-
ments with the polydactylus mutant
talpid2.— J. Exp. Zool., 1964, 155,
p. 161 — 170.
Goldschmidt R. Physiological Genetics.
New York: McGrow-Hill, 1938.
Goldstein J. L., Wilson J. D. Genetic
and hormonal control of male sexu-
al differentiation.—J. Cell. Physiol.,
1975, 85, Suppl., p. 365—378.
Gordon J. Failure of XX cells con-
taining the sex reversed gene to pro-
duce gametes in allophenic mice.—
J. Exp. Zool., 1976, 198, p. 367—373.
Gordon J. Modification of pigmenta-
tion patterns in allophenic mice by
the W gene —Differentiation, 1977,
9, p. 19—27.
Gordon S., Cohn Z. Macrophage-me-
lanocyte heterokaryons. II. The ac-
tivation of macrophage DNA synthe-
sis. Studies with inhibitors of RNA
synthesis —Exp. Med., 1971, 133,
p. 321—338.
Gottlieb F. J. Developmental genetics.
London: Chapman and Hall, 1966.
Gounon P. Etude experimentale d’une
mutation lethale du triton Pleurode-
les waltlii (Amphibien urodele).—
Bull. Soc. zool. France, 1976, 101,
p. 117—121.
Gounon P., Collenot A. Analyse ex-
perimentale de 1’expression de la
mutation lethale recessive («ulcere»)
chez 1’embryon de Pleurodeles walt-
lii (Amphibien urodele).— Experien-
tia, 1975, 31, p. 1461—1464.
Graham C. F. The necessary conditi-
ons for gene expression during early
mammalian development.— In: Ge-
netic mechanisms of development/
/Ed. F. H. Rudle. New York: Acad.
Press, 1973, p. 201—224.
Granner D. K., Hayashi Thompson
E. B., Tomkins G. M. Stimulation of
tyrosine aminotransferase synthesis
by dexamethasone phosphate in cell
culture.—J. Mol. Biol., 1968, 35,
p. 291—301.
Green E. L., Green M. C. The develop-
ment of three manifestations of the
short-ear gene in the mouse.— J.
Morphol., 1942, 70, p. 1 — 19.
Green H., Goldberg B., Schwartz M.,
Brown D. D. The synthesis of colla-
gen during the development of Xe-
nopus laevis.— Develop. Biol., 1968,
18, p. 391—400.
Green M. C. Effects of the short-ear
gene in the mouse on cartilage for-
mation in healing bone fractures.—
J. Exp. Zool. 1958, 137, p. 75—88.
Green M. C. Mutant genes and linka-
ges— In: Biology of the Laboratory
Mouse/Ed. E. L. Green. New York;
Toronto; Sydney; London: McGraw-
Hill Book Co, 1966a, p. 87—150.
Green M. C. Genes and development.—
In: Biology of the Laboratory Mo-
use/Ed. E. L. Green. New York; To-
ronto, Sydney; London: McGraw-
Hill Book, Co, 1966b, p. 329—336.
Green M. C. A defect of the splanch-
nic mesoderm caused by the mutant
gene dominant hemimelia in the mo-
use.—Develop. Biol., 1967, 15,
p. 62—89.
Green M. C. Mechanism of the pleio-
tropic effects of the short-ear mu-
tant gene in the mouse.— J. Exp.
Zool., 1968, 167, p. 129—150.
Green M. C. The laboratory mouse,
Mus musculus.— In: Handbook of
Genetics/Ed. R. C. King. New York;
London: Plenum Press, 1975, vol. 4,
p. 203—241.
Green M. C., Alpert B. N., Mayer
T. C. The site of action of the ich-
thyosis locus (ic) in the mouse, as
determined by dermal-epidermal re-
combinations.— J. Embryol. and
Exp. Morphol., 1974, 32, p. 715—721.
Green M. C., Durham D., Mayer T. C.,
Hoppe P. C. Evidence from chimae-
ras for the pattern of proliferation
of epidermis in the mouse.— Genet
Res., 1977, 29, N 3, p. 279—285.
Greene R. F., Flickinger R. A. Quali-
tative changes in DNA-like RNA
during development in Rana pipi-
262
ens.— Biochim. et biophys. acta,
1970, 217, p. 447—460.
Gregory P. W., Castle W. E. Further
studies on the cmbryological basis
of size inheritance in the rabbit.—
J. Exp. Zool., 1931, 59, p. 199—211.
Grinnell F., Lee J. C. Alterations in
the rate of hemoglobin synthesis
during chick embryogenesis.— J.
Coll. Physiol., 1972, 79, p. 111 — 116.
Grobstein C. Tissue interaction in the
morphogenesis of mouse embryonic
rudiments in vitro.— In: Aspects of
synthesis and Order in Growth/Ed.
D. Rudnick. Princeton: Univ. Press,
1954, p. 233—256.
Grobstein C. Differentiation of verte-
brate cells.— In: The Cell. J. Bra-
chet/Ed. A. E. Mirsky. New York:
Acad. Press, 1959, vol. 1, p. 437—
496.
Grobstein C. What we do not know
about differentiation.—Amer. Zool.,
1966, 6, p. 89—95.
Gruneberg H. The anaemia of flexed-
tailed mice (Mus musculus L.) I.
Static and dynamic haematology.—
J. Genet., 1942, 43, p. 45—68.
Gruneberg H. Genetical studies on
the skeleton of the mouse. XXII.
The development of Danforth’s short-
tail.— J. Embryol. and Exp. Mor-
phol., 1958, 6, p. 124—148.
Gruneberg H. Genetic studies on the
skeleton of the mouse. XXV. The
development of syndactylism.— Ge-
net. Res., 1960, 1, p. 196—213.
Gruneberg H. Genetical studies on the
skeleton of the mouse. XXXII. The
development of shaker with syndac-
tylism—Genet. Res., 1962, 3,
p. 157—166.
Gruneberg H. The pathology of deve-
lopment. A study of inherited ske-
letal disorders in animals. Oxford:
Blackwell, 1963.
Griineberg H. Threshold phenomena
versus cell heredity in the manife-
station of sex-linked genes in mam-
mals.— J. Embryol. and Exp. Mor-
phol., 1969, 22, p. 145—179.
Gruneberg H., McLaren A. The ske-
letal phenotype of some mouse chi-
maeras.— Proc. Roy. Soc. London
B, 1972, 182, p. 9—23.
Griineberg H., Truslove G. M. Two
closely linked genes in the mouse.—
Genet. Res., 1960, 1, p. 69—90.
Gurdon J. B. The developmental ca-
pacity of nuclei taken from intesti-
nal epithelium cells of feeding tad-
poles.— J. Embryol. and Exp. Mor-
phol., 1962, 10, p. 622—640.
Gurdon J. B. Transplanted nuclei and
cell differentiation.— Sci. Amer.,
1968, 219, p. 24—35.
Gurdon J. B. Nuclear transplantation
and the control of gene activity
in animal development.— Proc. Roy.
Soc. London B, 1970, 176, p. 303—
314.
Gurdon J. B. The control of gene ex-
pression in animal development.
Cambridge: Harvard Univ. Press,
1974 (Пер. с англ.: Гердон Дж. Ре-
гуляция функции генов в развитии
животных. М.: Мир, 1977).
Hadorn Е. Developmental genetics and
lethal factors. London: Methuen and
Co., 1961.
Hadorn E. Genetics on its way.— In:
Genetics Today/Ed. S. J. Geerts. Ox-
ford: Pergamon Press, 1965, vol. 2,
p. L.XIII—LXXII.
Hadorn E. Reversible and irreversible
changes in blastema cultures of Dro-
sophila.— In: Cell differentiation.
(First Intern. Conf. Cell Differentia-
tion)/Ed. R. Harris, P. Allin, D. Vi-
za. Copenhagen: Munksgaard, 1*9*72,
1972, p. 65—68.
Haecker К Entwicklungsgeschichtliche
Eigenschaftsanalyse (Phanogene-
tik). Jena, 1918.
Hahn W E., Laird C. D. Transcripti-
on of nonrepeated DNA in mouse
brain.— Science, 1971, 173, p. 158—
161.
Hakansson E. M. Genetic effects on
male mouse kidney glucuronidase
activity.— Biochem. Genet., 1976, 14,
p. 869—875.
Haldane J. B. S. The time of action
of genes, and its bearing on some
evolutionary problems.— Amer. Na-
tur., 1932, 66, p. 5—24.
Haldane J. B. S. On the biochemistry
of heterosis, and the stabilization
of polymorphism.— Proc. Roy. Soc.
London B, 1955, 144, p. 217—221.
Hamburgh M., Bornstein M. K. Mye-
lin synthesis in two demyelinating
mutations in mice.— Exp. Neurol.,
1970, 28, p. 471—476.
Hamburgh M., Herz R., Landa G, The
effect of trypan blue on expressi-
vity of the brachyury gene, «Т», in
mice.— Teratology, 1970, 3, p. Ill—
118.
263
Hamers M. N., Westerveld A., KhanM.,
Tager J. M. Characterization of a-
galactosidase isoenzymes in normal
and Fabry human-Chinese hamster
somatic cell hybrids.— Hum. Genet.,
1977, 36, p. 289—297.
Hdmmerling J. Nucleo-cytoplasmic re-
lationships in the development of
Acetabularia.— Intern. Rev. Cytol.,
1953, 2, p. 475—498.
Harris H. Behaviour of differentiated
nuclei in heterokaryons of animal
cells from different species.— Natu-
re, 1965, 206, p. 583—588.
Harris H. Cell fusion. Harvard: Univ.
Press, 1970a.
Harris H. The principles of human
biochemical genetics. Amsterdam;
London: North-Holland Publ. Co.,
1970b (Пер. с англ.: Харрис Г Ос-
новы биохимической генетики чело-
века. М.: Мир, 1973).
Harris М. W., Fraser F. С. Lid gap
in newborn mice: A study of its
cause and prevention.— Teratology,
1968, 1, p. 417—423.
Harrisson С. M. H. The arrangement
of chromatin in the interphase nu-
cleus with reference to cell differen-
tiation and repression in higher or-
ganisms.— Tiss. and Cell, 1971, 3,
p. 523—550.
Harsa-King M. L. Experimental stu-
dies on a mutant gene, a, causing
albinism in the axolotl, Ambystoma
mexicanum.— Develop. Biol., 1978,
62, p. 370—388.
Hartwell L. H., Mortimer R. K., Cu-
lotti J., Culotti M. Genetic control
of the cell division cycle in yeast.
V. Genetic analysis of cdc mu-
tants.—Genetics, 1973, 74, p. 267—
286.
Hauschka S. D. Clonal analysis of
vertebrate myogenesis. III. Develop-
mental changes in the muscle-colo-
ny-forming cells of the human fe-
tal limb.— Develop. Biol., 1974, 37,
p. 345—368.
Hayflick L. Current theories of biolo-
gical ageing.— Federat. Proc., 1975,
34, p. 9—13.
Hearing V. Tyrosinase activity in sub-
cellular fractions of black and al-
bino mice.—Nature New Biol., 1973,
245, p. 81—82.
Heiniger H. J., Chen H. W., Meier H.
e. a. Studies on the genetic control
of cell proliferation. I. Clearance of
DNA-bound radioactivity in 19 in-
bred strains and hybrid mice.— Li-
fe Sci., 1972, Part 2, 11, p. 87—96.
Hennen S. Morphological and cytolo-
gical features of gene activity in an
amphibian hybrid system.— Develop.
Biol., 1972, 29, p. 241—249.
Hennen S. Competence tests of early
amphibian gastrula tissue containing
nuclei of one species (Rana palu-
stris) and cytoplasm of another (Ra-
na pipiens).—J. Embryol. and Exp.
Morphol., 1973, 29, p. 529—538.
Herbert M. C., Graham C. F. Cell de-
termination and biochemical diffe-
rentiation of the early mammalian
embryo.— Curr. Top. Develop. Biol.,
1974, 8, p. 151 — 178.
Her tig A. T., Rock J., Adams С. E.,
Mulligan W. J. On the preimplan-
tation stages of the human ovum.—
Carnegie Inst. Washington Contrib.
Embryol., 1954, 35, p. 199—220.
Hillman N., Hillman R. Ultrastructural
studies of tw32/tw32 mouse embry-
os.—J. Embryol. and Exp. Mor-
phol., 1975, 33, p. 685—695.
Hillman N., Hillman R., Wileman G.
Ultrastructural studies of cleavage
stage t12/t12 mouse embryos —Amer.
J. Anat., 1970, 128, p. 311—340.
Hillman N. W., Niu M. C. Chick ce-
phalogenesis. I. The effect of RNA
on early cephalic development.—
Proc. Nat. Acad. Sci. U. S. A., 1963,
50, p. 486—493.
Hinchliffe J. R.t Ede D. A. Limb de-
velopment of polydactylous talpid3
mutant of the fowl.—J. Embryol.
and Exp. Morphol., 1967, 17, p. 385—
404.
Hinchliffe J. R., Ede D. A. Cell death
and the development of limb form
and skeletal pattern in normal and
wingless (ws) chick embryos.— J.
Embryol. and Exp. Morphol., 1973,
30, p. 753—772.
Hinchliffe J. R., Thorogood P. V. Ge-
netic inhibition of mesenchymal cell
death and the development of form
and skeletal pattern in the limbs of
talpid3 (ta3) mutant chick embry-
os.—J. Embryol. and Exp. Morphol.,
1974, 31, p. 747—760.
Hoerter J. D. Dosage effects of the
white (a) and melanoid (m) genes
on pigment pattern in Mexican axo-
lotl, Ambystoma mexicanum,
Shaw.— Develop. Biol., 1977, 59,
p. 249—254.
Hollander W. F. Complementary alle-
264
les at the mi-locus in the mouse.—
Genetics, 1968, 60, N 1, pt 2, p. 189
(Abstr.).
Holmes L. B. Inborn errors of mor-
phogenesis.— New Engl.: J. Med.
1974, 291, p. 763—773.
Holmes R. S., Whitt G. S. Develop-
mental genetics of the esterase iso-
zymes of Fundulus heteroclitus.—z
Biochem. Genet., 1970, 4, p. 471—
480.
Holtzer H. Proliferative and quantal
cell cycles in the differentiation of
musle, cartilage and red blood
cells.— In: Control Mechanisms in
the Expression of Cellular Pheno-
types/Ed. H. A. Padykula. New York;
London: Acad. Press, 1970a, p. 69—
88.
Holtzer H. Myogenesis.— In: Cell Dif-
ferentiation/Ed. O. A. Schjeide, J.
de Vellis. New York: Van Nostrand,
1970b, p. 476—503.
Holtzer H., Weintraub H., Mayne R.,
Mochan B. The cell cycle, cell line-
ages, and cell differentiation —Curr.
Top. Develop. Biol., 1972, 7, p. 229—
256.
Holtzman N. A. Menkes’kinky hair
syndrom: A genetic disease invol-
ving copper.— Federal. Proc., 1976,
35, p. 2276—2280.
Ho Mae W., O'Brien J. S. Hurler’s syn-
drome: Deficiency of a specific be-
ta galactosidase isoenzyme.— Scien-
ce, 1969, 165, p. 611—613.
Hook E„ Brustman L. Evidence for
selective differences between cells
with an active horse X chromosome
and cells with an active donkey X
chromosome in the female mule.—
Nature, 1971, 232, p. 349—350.
Hooper A. С. B. A further study of
the effects of selection for relative
bone length.—J. Anat., 1977, 124,
p. 495—496.
Hoornbeek F. R., Adams M.-J. Modi-
fication toward dominance of a re-
cessive lethal in the mouse.—J. He-
red., 1975, 66, p. 124—126.
Hoperskaya О. А. [Хопёрская О. A.]
Differentiation of lens- and iris-like
tissue in explants of the anterior
part of the frog neural plate.—
Arch. Entw. Meeh., 1972, 171, p. 1—
16.
Hopkinson D. A. Molecular aspects of
genetic polymorphism.— Biochimie,
1972, 54, p. 575—582.
Hoppe P. C., Illmensee R. Microsur-
gically produced homozygous dip-
loid uniparental mice.— Proc. Nat.
Acad. Sci. U. S. A., 1977, 74, p.
5657—5661.
Hoshino R., Nakane R., Rameyama У.
Effects of maternal administration
of trypan blue during pregnancy on
the manifestation of genetic microph-
thalmia (me) in mouse fetuses.—
Teratology, 1972, 6, p. 108 (Abstr.).
Hosoi T Studies on hemoglobin F
within single erythrocyte by fluore-
scent antibody technique.— Exp.
Cell Res., 1965, 37, p. 680—683.
Houck J. C., Cheng F. L. Defects in
the cell cycle of fibroblasts obtained
from patients with cystic fibrosis.—
Proc. Soc. Exp. Biol, and Med., 1974,
147, p. 167—170.
Hsia D. Yi-Y. Human developmental
genetics. Chicago: Year Book Med.
Publishers Inc., 1968.
Haberman J. A. DNA replication, the
nuclear membrane, and Okazaki
fragments in eukaryotic orga-
nisms.— In: Mechanism and Regu-
lation of DNA Replication/Ed. A. R.
Kolber, M. Kohiyama. New York:
Plenum Press, 1974, p. 299—319.
Haberman J. A., Tsai A. Direction of
DNA replication in mammalian
cells.—J. Mol. Biol., 1973, 75,
p. 5-12.
Huehns E. R.t Shooter E. M. Human
hemoglobins.— J. Med. Genet., 1965,
2, p. 48—90.
Hughes A. F. Cell degeneration in the
larval ventral horn of Xenopus lae-
vis.— J. Embryol. and Exp. Morp-
hol., 1961, 9, p. 269—284.
Huisman T. H. Lewis J. P., Blunt
M. H. e. a. Hemoglobin C in new-
born sheep and goats: A possible
explanation for its function and bio-
synthesis.— Pediat. Res., 1969, 3,
p. 189—198.
Humphrey R. R. Genetic and experi-
mental studies on a mutant gene (c)
determining absence of heart action
in embryos of the Mexican axolotl
(Ambystoma mexicanum).— Deve-
lop. Biol., 1972, 27, p. 365—375.
Humphrey R. R., Chung H.-M. Ex-
perimental studies on two mutant
genes, r and x, in the Mexican axo-
lotl (Ambystoma mexicanum).—
Develop. Biol., 1978, 62, p. 34—43.
Hunt D. M. Primary defect in cooper
transport underlies mottled mutants
Ю Ь. В. Конюхов
265
in the mouse.— Nature, 1974, 249,
p. 852.
Hunt R. K. The cell cycle, cell linea-
ge, and neuronal specificity.— In:
Cell Cycle and Cell Differentiation/
Ed. J. Reinert, H. Holtzer. Berlin:
Springer-VerL, 1975, p. 43—62.
Hurley L. S. Interaction of genes and
metals in development.— Federat.
Proc., 1976, 35, p. 2271—2275.
Hunt T., Hunter T., Munro A. Control
of hemoglobin synthesis: rate of
translation of the messenger RNA
for the a and 0 chains.— J. Mol.
Biol., 1969, 43, p. 123—133.
Ikejima T., Takeuchi T. Genetic modi-
fication of the molecular forms of
tyrosinase in the house mouse.—
Jap. J. Genet. 1974, 49, p. 37—43.
Illmensee K., Mintz F. Totipotency
and normal differentiation of sing-
le teratocarcinoma cells cloned by
injection into blastocysts.— Proc.
Nat. Acad. Sci. U. S. A, 1976, 73,
p. 549—553.
Ingram V. M. Embryonic red cell for-
mation.— Nature, 1972, 235, p. 338—
339.
Ishiyama V., Izquierdo L. The onset
of phosphatase activity in early
mammalian embryos.— J. Embryol.
and Exp. Morphol., 1977, 42, p. 305—
308.
Ivarie R. D., Fan W. J.-W., Tomkins
G. M. Analysis of the induction and
deinduction of tyrosine aminotran-
sferase in enucleated HTC cells.—
J. Cell Physiol, 1975, 85, Suppl,
p. 357—364.
Jaaskelainen M., Saxen L. Transfilter
lens induction in chick.— Ophthal-
mol. Res, 1972, 3, p. 19—20.
Jacob F., Monod J. Genetic regulatory
mechanisms in the synthesis of pro-
teins.—J. Mol. Biol, 1961, 3, p.
318—356.
Jacob F., Monod J. Genetic repression,
allosteric inhibition, and cellular
differentiation.— In: Cytodifferen-
tiation and Macromolecular Synthe-
sis/Ed. M. Locke. New York: Acad.
Press, 1963, p. 30—64.
Jacobson C. 0. The localization of
the presumptive cerebral regions in
the neural plate of the axolotl lar-
va.—J. Embryol. and Exp. Morphol,
1959, 7, p. 1—21.
Jacobson M. Cessation of DNA syn-
thesis in retinal ganglion cells cor-
related with the time of specifica-
tion of their central connections.—
Develop. Biol, 1968, 17, p. 219—232.
Jaylet A, Beetschen J.-C., Departs P.
Sur 1’existence d’une substance dif-
fusible cxer^ant un effect antiery-
throcytaire, chez les embryons de
1’Amphibien Pleurodeles waltii ho-
mozygotes pour le facteur ac. Re-
sultats d’experiences de parabiose et
de telobiose.— C. r. Acad. sci. Pa-
ris, 1970, D271, p. 233—236.
Jimbow K., Szabo G.t Fitzpatrick T. B.
Ultrastructural investigation of
autophagocytosis of melanosomes
and programmed death of melanocy-
tes in White Leghorn feathers: a stu-
dy of morphogenetic events leading
to hypomclanosis.— Develop. Biol,
1974, 36, p. 8—23.
Johnson D. R. Extra-toes: a new mu-
tant gene causing multiple abnor-
malities in the mouse.— J. Embryol.
and Exp. Morphol, 1967, 17, p. 543—
581.
Johnson D. R. Polysyndactyly, a new
mutant gene in the mouse.— J. Em-
bryol. and Exp. Morphol, 1969, 21,
p. 285—294.
Johnson D. R., Hunt D. M. Biochemi-
cal observations on the cartilage of
achondroplastic (can) mice.— J. Em-
bryol. and Exp. Morphol, 1974, 31,
p. 319—328.
Johnson D. R., Wise J. M. Cartilage
anomaly (can); a new mutant gene
in the mouse.— J. Embryol. and Exp.
Morphol, 1971, 25, p. 21—31.
Johnson К. E., Chapman V. M. Exp-
ression of paternal genes during
embryogenesis in the viable inter-
specific hybrid amphibian embryo
Rana pipiens 2 X Rana palustris сЛ
Electrophoretic analysis of five en-
zyme systems.— J. Exp. Zool, 1971a,
178, p. 313—318.
Johnson К. E., Chapman V. M. Exp-
ression of the paternal genes for
glutamate-oxaloacetate transamina-
se (GOT) during embryogenesis in
Xenopus laevis.— J. Exp. Zool,
1971b, 178, p. 319—324.
Johnson L. V., Calarco P. G., Siebert
M. L. Alkaline phosphatase activity
in the preimplantation mouse emb-
ryo.— J. Embryol. and Exp. Morp-
hol, 1977, 40, p. 83—89.
Kabat D. Gene selection in hemo-
globin and in antibody-synthesizing
cells.— Science, 1972, 175, p. 134—
140.
266
Kabat D., Koler R. D. The thalasse-
mias: Models for analysis of quan-
titative gene control —Adv. Hum.
Genet., 1975, 5, p. 157—222.
Kafiani С. [Кафиани KJ Genome
transcription in fish development.—
Adv. Morphogenesis, 1970, 8, p.
209—284.
Katoh A., Braver man AL, Yeh C. Neu-
ro-retinal «lentoids» contain no lens
antigens.—Exp. Cell Res., 1971, 66,
p. 65—68.
Katoh Y., Takayama S. Establishment
of clonal cell lines of hamster chon-
drocytes maintaining their phenoty-
pic traits.— Exp. Cell Res., 1977, 106,
p. 285—291.
Keeler С. E. Gene therapy.— J. Hered.,
1947, 38, p. 294—298.
Kemp D. J., Rogers G. E. Differentia-
tion of avian keratinocytes. Chara-
cterization and relationships of the
keratin proteins of adult and em-
bryonic feathers and scales.— Bio-
chemistry, 1972, 11, p. 969—975.
Kendall A. G., Ojwang P. J., Schroe-
der W. A., Huisman T. H. J. Hemo-
globin Kenya, the product of a y = p
fusion gene: Studies of the family.—
Amer. J. Hum. Genet., 1973, 25, p.
548—563.
Kieny M. Role inducteur du mesoder-
me dans la differenciation precoce
du bourgeon de membre chez 1’emb-
ryon de Poulet.— J. Embryol. and
Exp. Morphol., 1960, 8, p. 457—467.
Kieny M.t Abbott U. K. Contribution
a 1’etude de la diplopodie liee an se-
xe et de 1’achondroplasie Creeper
chez I’embryon de poulet: culture in
vitro des ebauches cartilagineuses
du tibiotarse et du perone.— Deve-
lop. Biol., 1962a, 4, p. 473—488.
Kieny M., Abbott U. K. L’extrait
d’embryon dyplopode-4-inhibe la
croissance des ebauches cartilagi-
neuses normalcs cultivees in vitro.—
C. r. Acad, sci., 1962b, 254, p. 1520—
1522.
Kieny M., Mauger A., Sengel P. Ear-
ly regionalization of the somitic me-
soderm as studied by the develop-
ment of the axial skeleton of the
chick embryo.— Develop. Biol.,
1972, 28, p. 142—161.
Klein J. Biology of the mouse histo-
compatibility-2 complex.—New York:
Springer-Verl., 1975.
Klose J., Flickinger R. A. Collagen
synthesis in frog embryo endoderm
cells.— Biochim. et biophys. acta,
1971, 232, p. 207—211.
Knowland J., Graham C. RNA synthe-
sis at two-cell stage of mouse deve-
lopment.—J. Embryol. and Exp.
Morphol., 1972, 27, p. 167—176.
Knowland J. S., Gurdon J. B., Laskey
R. A. Injection of messenger RNA
into living cells and its application
to the study of gene action in Xe-
nopus laevis.— In: The Role of RNA
in Reproduction and Development/
Ed. M. C. Niu, S. J. Segal. Amster-
dam, London: North — Holland
Publ. Co, 1973, p. 110—120.
Kobel H. R., Brun R. B., Fischberg M.
Nuclear transplantation with mela-
nophores, ciliated epidermal cells,
and the established cell-line A-8 in
Xenopus laevis.— J. Embryol. and
Exp. Morphol., 1973, 29, p. 539—
547.
Kolodny G. M. Cell to cell transfer of
RNA into transformed cells.— J. Cell.
Physiol., 1972, 79, p. 147—150.
Kolodny G. M. Transfer of macromo-
lecules between cells in contact.—
In: Cell Communication/ Ed. R. P.
Cox. New York: Wiley, 1974, p. 97—
111.
Kolodny G. M., Rosenthal L. J. Evi-
dence against RNA sequences par-
ticipating in gene repression.— J.
Cell Biol., 1972, 55, p. 140 (Abstr.).
Konyukhov В. V., Bugrilova R. S.
[Конюхов Б. В., Бугрилова P. С.]
Growth-inhibiting factor in embryos
of the mutant stock mouse brachy-
podism-H.— Folia biol. Ceskosl.,
1968, 14, p. 65—69.
Konyukhov В. V., Ginter E. К. [Ко-
нюхов Б. В., Гинтер E. К.] A stu-
dy of the action of the brachypo-
dism-H gene on development of the
long bones of the hind limbs in the
mouse.— Folia biol. (Ceskosl.), 1966,
12, p. 199—206.
Konyukhov В. V., Paschin Yu. V. [Ко-
нюхов Б. В., Пашин Ю. В.] Experi-
mental study of the achondroplasia
gene effects in the mouse.— Acta
biol. (Hung.), 1967, 18, p. 285—294.
Konyukhov В. V., Sazhina M. V. [Ко-
нюхов Б. В., Сажина M. В.] Intera-
ction of the genes of ocular retarda-
tion and microphthalmia in mice.—
Folia biol. (Ceskols.), 1966, 12, p.
116—123.
Konyukhov В. V., Sazhina M. V. [Ко-
нюхов Б. В., Сажина M. В.] Ge-
267
10*
netic control over the duration of
Gi phase.— Experientia, 1971, 27,
p. 970—971.
Konyukhov В. V„ Sazhina M. V. [№-
нюхов Б. В., Сажина M. В.] Inhi-
bition of DNA synthesis in the retina
of mouse embryos as a result of in-
teraction between the mutant genes
fidget and ocular retardation.—De-
velop. BioL, 1975, 45, p. 1—6.
Konyukhov В. V., Sazhina M. V. [Ko-
нюхов Б. В., Сажина M. В.] The
cell cycle and retinal histogenesis
in fidget mutant mice.— Develop.
BioL, 1976, 54, p. 13—22.
Konyukhov В. V.» Vakhrusheva M. P.
[Конюхов Б. В., Вахрушева М.П.]
Abnormal development of eyes in
mice homozygous for the fidget ge-
ne.— Teratology, 1969, 2, p. 147—
157.
Kraemer К- H., Weerd-Kastelein E. A.
de, Robbins J. H. e. a. Five comple-
mentation groups in xeroderma pig-
metosum.— Mutat. Res., 1975, 33,
p. 327—339.
Krigsgaber M. P., Neyfakh A. A.
[Кригсгабер M. П., Нейфах A. A.]
Investigation of the mode of nuclear
control over protein synthesis in
early development of loach and sea
urchin.— J. Embryol. and Exp. Mor-
phol., 1972, 28, p. 491—509.
Krooth R. S., Sell E. K. The action of
mendelian genes in human diploid
cell strains.— J. Cell. PhysioL, 1970,
76, p. 311—330.
Lahti A., Antila E.t Saxen L. The ef-
fect of hydrocortisone on the closu-
re of palatal shelves in two inbred
strains of mice in vivo and in vit-
ro.— Teratology, 1972, 6, p. 37—41.
Lajtha L. G. On the concept of the
cell cycle.— J. Cell, and Comp. Phy-
sioL, 1963, 60, Suppl. 1, p. 143—145.
Lamoreux M. L., Mayer T. C. Site of
gene action in the development of
hair pigment in recessive yellow
(e/e) mice.— Develop. BioL, 1975,
46, p. 160—166.
Landauer W. Untersuchungen fiber
das Kriiperhuhn. II. Morphologic
und Histologie des Skelets, insbe-
sondcre des Skelets der langen Ex-
tremitatenknochen.— Z. mikr.-anat.
Forsch., 1931, 25, S. 115—180.
Landauer W. Studies on the Creeper
fowl. VI. Skeletal growth of Creeper
chickens.— Storrs Agr. Exp. St.
Bull., 1934, N 193, p. 1—79.
Landauer W. The phenotypic modifi-
cation of hereditary polydactylism
of fowl by selection and by insu-
lin.—Genetics, 1948, 33, p. 133—
167.
Landis S. C., Mullen R. J. The deve-
lopment and degeneration of Purki-
nje cells in pod mutant mice.— J.
Comp. Neurol., 1978, 177, p. 125—
143.
Lane C. D., Marbaix G., Gurdon J. B.
Rabbit haemoglobin synthesis in
frog cells: The translation of reticu-
locyte gs RNA in frog oocytes.— J.
Mol. BioL, 1971, 61, p. 73—91.
Lanza R. P. Alteration of melanocy-
tes by DNA in White Plymouth Rock
chickens.— Nature, 1974, 252, p.
597—598.
Lash J. W. Chondrogenesis: Genoty-
pic and phenotypic expression.— J.
Cell. PhysioL, 1968, 72, Suppl. 1, p.
35—46.
Laskey R. A., Gurdon J. B. Genetic
content of adult somatic cells tes-
ted by nuclear transplantation from
cultured cells.—Nature, 1970, 228,
p. 1332—1334.
Laurence E. B. Experimental appro-
ach to the epidermal chalone.— Nat.
Cancer Inst. Monogr., 1973, N 38,
p. 37—45.
LaVail M. M., Sidman R. L., O’Neil D.
Photoreceptor-pigment epithelial
cell relationships in rats with inhe-
rited retinal degeneration. Radio-
autographic and electron microsco-
pe evidence for a dual source of
extra lamellar material.— J. Cell.
BioL, 1972, 53, p. 185—209.
Layton W. M., Jr. Random determina-
tion of a development process. Re-
versal of normal visceral asymmet-
ry in the mouse.— J. Hered., 1976,
67, p. 336—338.
Lehmann R., Slavkin H. C. Localiza-
tion of «transcriptively active* cells
during odontogenesis using acridi-
ne orange ultrastructural cytoche-
mistry—Develop. BioL, 1976, 49,
p. 438—456.
Lehtonen E., Wartiovaara J., Nord-
Ung S., Saxen L. Demonstration of
cytoplasmic processes in Millipore
filters permitting kidney tubule in-
duction.— J. Embryol. and Exp.
Morphol., 1975, 33, p. 187—203.
Lemanski L. F., Marx B. S., Hill C. S.
Evidence for abnormal heart induc-
tion in cardiac-mutant salamanders
268
(Ambystoma mexicanum).—Scien-
ce, 1977, 196, p. 894—896.
Lerner R. A., Hodge L. D. Gene exp-
ression in synchronized lymphocy-
tes: Studies on the control of syn-
thesis of immunoglobulin polypep-
tides.— J. Cell. Physiol., 1971, 77,
p. 265—275.
Levine A. J. Approaches to mapping
the temporal events in the cell cyc-
le using conditional lethal mu-
tants.— J. Cell. Physiol., 1978, 95,
p. 387—392.
Levisohn S., Thompson E. Tyrosine
aminotransferase induction regula-
tion variant in tissue culture.— Na-
ture New Biol., 1972, 235, p. 102—
104.
Levy F., Tichonicky L., Kruh J. Etude
de proteines cytoplasmiques acides
de cellules de foie inhibant la syn-
these acellulaire de 1’hemoglobi-
ne.— Biochim. et biophys. acta, 1970,
209, p. 521—531.
Lewin В. M. The molecular basis of
gene expression. London: Wiley,
1970.
Lewis J. H., Summerbell D.t Wol-
pert L. Chimaeras and cell lineage
in development.—Nature, 1972, 239,
p. 276—278.
Lewis J. P.t O'Grady L. F., Bernstein
S. E., Russell E. S., Trobaugh F. E.
Growth and differentiation of trans-
planted W/Wv marrow.—Blood,
1967, 30, p. 601—616.
Like A. A., Chick W L. Mitotic divi-
sion in pancreatic beta cells.— Sci-
ence, 1969, 163, p. 941—943.
Lolley R. N., Farber D. B. Abnormal
guanosine 3',5'-monophosphate du-
ring photoreceptor degeneration in
the inherited retinal disorder of
C3H/HeJ mice.— Ann. Ophthalmol.,
1976, 8, p. 469—473.
London I. M., Favill A. S.f Vanderhoff
G. A., Hunt T.t Grayzel A. I. Eryth-
roid cell differentiation and the syn-
thesis and assembly of hemoglo-
bin.— In: Control Mechanisms in
Developmental Processes/ Ed.
M. Locke. New York; London: Acad.
Press, 1967, p. 227—253.
Louie A. J., Candido E. P. M., Dixon
G. H. Enzymatic modifications and
their possible roles in regulating the
binding of basic proteins to DNA
and in controlling chromosomal
structure.— Cold Spring Harbor
Symp. Quant. Biol., 1974, 38, p.
803—819.
Lucas D. R. Retinal dystrophy in the
Irish setter. I. Histology.— J. Exp.
Zool., 1954, 126, p. 537—551.
Lucas D. R. Inherited retinal dyst-
rophy in the mouse: Its appearance
in eyes and retinae cultured in vit-
ro.— J. Embryol. and Exp. Morphol.,
1958, 6, p. 589—592.
Lusis A. J., West J. D. X-linked and
autosomal genes controlling mouse
a-galactosidase expression.— Gene-
tics, 1978, 88, p. 327—342.
Luthardt F. W., Donahue R. P. DNA
synthesis In developing two-cell
mouse embryos.— Develop. Biol.,
1975, 44, p. 210—216.
Lyon M. F. Gene action in the X-chro-
mosome of the mouse (Mus muscu-
lus L.).— Nature, 1961, 190, p, 372—
373.
Lyon M. F. Chromosomal and subchro-
mosomal inactivation.— Annu. Rev.
Genet., 1968, 2, p. 31—53.
Lyon M. F. Genetic activity of sex
chromosome in somatic cells of
mammals.— Phil. Trans. Roy. Soc.
London B, 1970, 259, p. 41—52.
Lyon M. F. X-chromosome inactivati-
on and developmental patterns in
mammals.— Biol. Revs Cambridge
Phil. Soc., 1972, 47, p. 1—35.
Lyon AL F. Gene and chromosome ina-
ctivation— Genetics, 1974, 78, p.
305—309.
Lyon AL F., Bechtol К. B. Derivation
of mutant t-haplotypes of the mou-
se by presumed duplication or dele-
tion.— Genet. Res., 1977, 30, p. 63—
76.
Lyon M. F., Meredith R. Investigations
of the nature of t-alleles in the mou-
se. II. Genetic analysis of unusual
mutant allele and its derivates.—
Heredity, 1964, 19, p. 313—325.
MacCabe J. A., MacCabe A. B., Ab-
bott U. K., McCarrey J. R. Limb de-
velopment in diplopodia4: a polyda-
ctylous mutation in the chicken.— J,
Exp. Zool., 1975, 191, p. 383—394.
MacCabe J. A., Saunders J. W,, Pic-
kett M. The control of the anteropo-
sterior and dorsoventral axes in em-
bryonic chick limbs constructed of
dissociated and reaggregated limb-
bud-mesoderm.— Develop. BioU
1973, 31, p. 323—335.
MacGillivray A. L, Paul J., Threl-
fall G. Transcriptional regulation in
269
eukaryotic cells.— Adv. Cancer Res.,
1972, 15, p. 93—162.
Maclean N. Control gene expression.
London: Acad. Press, 1976.
Main B. Retention of potential to dif-
ferentiate in long-term culture of
tooth germs.— Science, 1966, 152,
p. 778—779.
Malacinski G. M. Genetic control of
qualitative changes in protein syn-
thesis during early amphibian (Me-
xican axolotl) embryogenesis.— De-
velop. Biol., 1971, 26, p. 442—451.
Malawista S. E.t Weiss M. C. Expres-
sion of differentiated functions in
hepatoma cell hybrids: High fre-
quency of induction of mouse albu-
min production in rat hepatoma-
mouse lymphoblast hybrids.— Proc.
Nat. Acad. Sci. U. S. A, 1974, 71,
p. 927—931.
Manes C. Nucleic acid synthesis in
preimplantation rabbit embryos.— J.
Exp. Zool., 1971, 176, p. 87—96.
Manes C. Genetic and biochemical ac-
tivities in preimplantation emb-
ryos.— In: The Developmental Bio-
logy of Reproduction/ Ed. C. Mar-
kert, J. Papaconstantinou. New
York; London: Acad. Press, 1975,
p. 133—163.
Maniatis G.t Ingram V. Erythropoesis
during amphibian metamorphosis.—
J. Cell Biol., 1971, 49, p. 372—404.
Manner H. W. The G-S-T theory of
cellular differentiation.— Cur. Mod.
Biol., 1971, 3, p. 332—334.
Markert C. L. Neoplasia: A disease of
cell differentiation.— Cancer Res.,
1968, 28, p. 1908—1914.
Markert C. L., Petters R. M. Homozy-
gous mouse embryos produced by
microsurgery.— J. Exp. Zool., 1977,
201, p. 295—302.
Markert C. L., Whitt G. S. Molecular
varieties of isozymes.— Experientia,
1968, 24, p. 977—991.
Marks P. A., Rifkind R. A. Protein
synthesis: Its control in erythropoi-
esis.— Science, 1972, 175, p. 955—
961.
Marshall J. A., Dixon К. E. Nuclear
transplantation from intestinal epi-
thelial cells of early and late Xeno-
pus laevis tadpoles.— J. Ernbryol.
and Exp. Morphol., 1977, 40, p.
167—174.
Martin D. W.t Tomkins G. M., Gran-
ner D. Synthesis and induction of
tyrasine animotransferase in syn-
chronized hepatoma cells in cultu-
re.— Proc. Nat. Acad. Sci. U. S. A.,
1969, 62, p. 248—255.
Martin G. R., Epstein G. J.t Travis B.
e. a. X-chromosome inactivation du-
ring differentiation of female te-
ratocarcinoma stem cells in vitro.—
Nature, 1978, 271, p. 329—333.
Marzullo G. Regulation of cartilage
enzymes in cultured chondrocytes
and the effect of 5-bromodeoxyurL
dine.— Develop. Biol., 1972, 27, p.
20—26.
Marzullo G., Desiderio E. Tissue dis-
tribution and development of some
cartilage enzymes.— Develop. Biol.,
1972, 27, p. 13—19.
Masters C. J., Holmes R. S. Isoenzy-
mes and ontogeny.— Biol. Rev.,
1972, 47, p. 309—361.
Matalon R., Dorfman A. Acid mucopo-
lysaccharides in cultured human
fibroblasts.— Lancet, 1969, p. 838—
841.
Mathews M. B., Osborn M., Berns
A. J. M., Bloemendal H. Translation
of two messenger RNAs from lens
in a cell free system from Krebs II
ascites cells.— Nature New Biol.,
1972, 236, p. 5—7.
Mathieu C., Ferrer P., Dupuy M. H.,
Zalta J. P. Autoradiographic study
of the penetration of non-histone
chromatin proteins into differentia-
ting cells.— Experientia, 1976, 32,
p. 47—48.
Mayer T. C. A comparison of pigment
cell development in albino, steel and
dominant-spotting mutant mouse
embryos.— Develop. Biol., 1970, 23,
p. 297—309.
Mayer T. C. Site of gene action in
steel mice: Analysis of the pigment
defect by mesoderm-ectoderm re-
combinations.— J. Exp. Zool., 1973,
184, p. 345—352.
Mayer T. C. Cell interactions and the
development of pigment patterns.—
Genetics, 1975, 80, SuppL, p. 5—6
(Abstr.).
Mayer T. C., Green M. C. An experi-
mental analysis of the pigment de-
fect caused by mutations at the W
and SI loci in mice.— Develop. Biol.,
1968, 18, p. 62—75.
Mayer T. C., Green M. C. Epidermis
is the site of action of tably (Ta) in
the mouse.— Genetics, 1978, 90, p.
125—131.
270
Mayer T. C., Kleiman N. J., Green
M. C. Depilated (dep), a mutant ge-
ne that affects the coat of the mouse
and acts in the epidermis.— Gene-
tics, 1976, 84, p. 59—65.
Mayer T. C.t Maltby E. L. An experi-
mental investigation of pattern de-
velopment in lethal spotting and bel-
ted mouse embryos.— Develop. Biol.,
1964, 9, p. 269—286.
Mayer T. C., Miller С. K., Green M. C.
Site of action of the crinkled (cr)
locus in the mouse.— Develop. Biol.,
1977, 55, p. 397—401.
Mayer T. C., Mittelberger J. A.,
Green M. C. The site of action of the
fuzzy locus (fz) in the mouse, as
determined by dermal-epidermal re-
combinations.— J. Embryol. and
Exp. Morphol., 1974, 32, p. 707—713.
McAvoy J. W. Cell division, cell elon-
gation and the co-ordination of cry-
stallin gene expression during lens
morphogenesis in the rat.— J. Em-
bryol. and Exp. Morphol., 1978, 45,
p. 271—281.
McCulloch E. A., Siminovitch L., Till
J. E. Spleen-colony formation in
anemic mice of genotype WWV.—
Science, 1964, 144, p. 844—846.
McCulloch E. A., Siminovitch L., Till
J. E. e. a. The cellular basis of the
genetically determined hemopoietic
defect in anemic mice of genotype
Sl/Sld.—Blood, 1965, 26, p. 399—
410.
McDevitt D. S., Meza I., Yamada T.
Immunofluorescence localization of
the crystallins in amphibian lens de-
velopment, with special reference to
the gamma-crystallins.— Develop.
Biol., 1969, 19, p. 581—607.
McKeehan M. S. Induction of portions
of the chick lens without contact
with the optic cup.—Anat. Rec.,
1958, 132, p. 297—306.
McKinnell R. G. Nuclear transfer in
Xenopus and Rana compared.— In:
Cell Differentiation/ Ed. R. Harris,
P. Allin, D. Viza, Copenhagen: Mun-
ksgaard, 1972, p. 61—64.
McKusick V. A. Mendelian inheritance
in man. Catalogs of autosomal do-
minant, sutosomal recessive, and
X-linked phenotypes. Baltimore:
Yohns Hopkins Univ. Press, 1978.
McLaren A. Numerology of develop-
ment.—Nature, 1972, 239, p. 274—
276.
McLaren A. Mammalian chimaeras.
Cambridge: Univ. Press, 1976a.
McLaren A. Genetics of the early mou-
se embryo.— Ann. Rev. Genet..,
1976b, 10, p. 361—388.
McLaren A., Bowman P. Mouse chi-
maeras derived from fusion of em-
bryos differing by nine genetic fac-
tors.— Nature, 1969, 224, p. 238—
240.
McLaren A., Bowman P. Genetic ef-
fects on the timing of early deve-
lopment in the mouse.— J. Embryol.
and Exp. Morphol., 1973, 30, p. 491 —
498.
McMahon D. Chemical messengers in
development: A hypothesis.— Scien-
ce, 1974, 185, p. 1012—1021.
Medoff J. Enzymatic events during
cartilage differentiation in the
chick embryonic limb bud.— Deve-
lop. Biol., 1967, 16, p. 118—143.
Medoff L, Zwilling E. Appearance of
myosin in the chick limb bud.— De-
velop. Biol., 1972, 28, p. 138—141.
Meister M.t Paigen K. Coordinated
development of 0-glucuronidase and
P-galactosidase in mouse organs.—
Science, 1972, 177, p. 894—896.
Metcalf D., Moore M. A. S.t Short-
man K. Adherence column and buo-
yant density separation of bone mar-
row stem cells and more differentia-
ted cells.— J. Cell Physiol., 1971, 78,
p. 441—449.
Migeon B. Stability of X chromosomal
inactivation in human somatic
cells.—Nature, 1972, 239, p. 87—89.
Milaire J. Detection histochimique de
modifications des ebauches dans les
membres en formation chez la sou-
ris oligosyndactyl.— Bull. Acad. roy.
bclg., Cl. sci., 5е Ser, 1962, 48, p.
505—528.
Miller L., Knowland J. Reduction of
ribosomal RNA synthesis and ribo-
somal RNA genes in a mutant of
Xenopus laevis which organizes on-
ly a partial nucleolus. II. The num-
ber of ribosomal RNA genes in ani-
mals of different nucleolar types.—
J. Mol. Biol., 1970, 53, p. 329—338.
Mills E. S., Topper Y. J. Some ultra-
structural effects of insulin, hydro-
cortisone and prolactin on mammary
gland explants.—J. Cell BioL, 1970,
44, p. 310—328.
Milstone L. M„ Zelenka P., Piatigor-
sky J. 6-Crystallin mRNA in chick
lens cells: mRNA accumulates du-
271
ring differential stimulation of
6-crystallin synthesis in cultured
cells.— Develop. Biol., 1976, 48, p.
197—204.
Ming P.-M. L., Chang H. L„ Baser-
ga R. Release by human chromoso-
me 3 of the block at Gi of the cell
cycle, in hybrids between tsAF8
hamster and human cells.— Proc.
Nat. Acad. Sci. U. S. A., 1976, 73,
p. 2052—2055.
Minna J., Glazer D., Nirenberg M. Ge-
netic dissection of neural properties
using somatic cell hybrids.— Nature
New Biol., 1972, 235, p. 225—231.
Minna J., Nelson P., Peacock J. e. a.
Genes for neuronal properties ex-
pressed in ncuroblastomaXL cell
hybrids.— Proc. Nat. Acad. Sci.
U. S. A., 197-1, 68, p. 234—239.
Mintz B. Embryological phases of
mammalian gametogenesis.— J. Cell,
and Comp. Physiol., 1960, 56, Suppl.
1, p. 31—47.
Mintz B. Formation of genotypically
mosaic mouse embryos.— Amer.
Zool., 1962, 2, p. 432 (Abstr.).
Mintz B. Gene expression in the moru-
la stage of mouse embryos, as ob-
served during development of t12/t12
lethal mutant in vitro.—J. Exp.
Zool., 1964a, 157, p. 267—272.
Mintz B. Formation of genetically mo-
saic mouse embryos, and early deve-
lopment of lethal (t12/t12) — normal
mosaics.— J. Exp. Zool., 1964b, 157,
p. 273—299.
Mintz B. Gene control of mammalian
pigmentary differentiation. I. Clo-
nal origin of melanocytes.— Proc.
Nat. Acad. Sci. U. S. A., 1967, 58,
p. 344—351.
Mintz B. Gene expression in allophe-
nic mice.— In: Control Mechanisms
in the Expression of Cellular Pheno-
types/ Ed. H. A. Padykula. New
York; London: Acad. Press, 1970, p.
15—42.
Mintz B. Allophenic mice of multi-em-
bryo origin.— In: Methods in Mam-
malian Embryology/Ed. J. C. Da-
niel. San Francisco: Freeman, 1971a,
p. 186—214.
Mintz B. Clonal basis of mammalian
differentiation.— In: Control mecha-
nisms of Growth and Differentia-
tion/Ed. D. D. Davies, M. Balls.
Cambridge: Univ. Press, 1971b, p.
345—370.
Mintz B. Genetic mosaicism in vivo:
Development and disease in allophe-
nic mice.— Federat. Proc., 1971c, 30,
p. 935—943.
Mintz B. Gene control of mammalian
differentiation.— Ann. Rev. Genet.,
1974, 8, p. 411—470.
Mintz B. Gene expression in neopla-
sia and differentiation.— In: Harvey
Society Lectures, Ser. 71. New York:
Acad. Press, 1978, p. 193—245.
Mintz B., Baker W. W. Normal mam-
malian muscle differentiation and
gene control of isocitrate dehydro-
genase synthesis.— Proc. Nat. Acad.
Sci. U. S. A., 1967, 58, p. 592—598.
Mintz B., Illmensee K. Normal gene-
tically mosaic mice produced from
malignant teratocarcinoma cells.—
Proc. Nat. Acad. Sci. U. S. A., 1975,
72, p. 3585—3589.
Mintz B., Palm J. Gene control of he-
matopoiesis. I. Erythrocyte mosai-
cism and permanent immunological
tolerance in allophenic mice.— J.
Exp. Med., 1969, 129, p. 1013—
1027.
Mintz B., Russell E. S. Gene-induced
embryological modifications of pri-
mordial germ cells in the mouse.—
J. Exp. Zool., 1957, 134, p. 207—
237.
Mintz B., Sanyal S. Clonal origin of
the mouse visual retina mapped from
genetically mosaic eyes.— Gene-
tics, 1970, 64, Suppl., p. 43—44
(Abstr.).
Mirsky A. E. Some chemical aspects of
the cell nucleus.— In: Genetics in
the Twentieth Century/Ed. L. C.
Dunn. New. York: Macmillan Co.,
1951, p. 127—153.
Mirsky A. E.t Ris H. Variable and
constant components of chromoso-
mes.—Nature, 1949, 163, p. 666—
667.
Mitchison J. M. The biology of the cell
cycle.— Cambridge: Univ. Press.,
1971.
Modak S. P. A model for transcrip-
tional control in terminally differen-
tiating lens fiber cells.— In: Cell
differentiation/ Ed. R. Harris, P. Al-
lin, D. Viza. Copenhagen: Munks-
gaard, 1972, p. 339—342.
Modak S. P., Persons B. J. RNA
synthesis during lens cell differen-
tiation.— Exp. Cell Res., 1971, 64,
p. 473—476.
272
Monk M., Ansell J. Patterns of lactic
dehydrogenase isozymes in mouse
embryos over the implantation pe-
riod in vivo and in vitro.— J. Emb-
ryo!. Exp. Morphol., 1976, 36, p.
653—662.
Moore N. IF., Adams C. E.t Rowson
L. E. A. Developmental potential of
single blastomers of the rabbit
egg —J- Reprod. FertiL, 1968, 17, p.
527—531.
Moore W. J., Mintz B. Clonal model
of vertebral column and skull de-
velopment derived from genetically
mosaic skeletons in allophenic mi-
ce.— Develop. Biol., 1972, 27, p. 55—
70.
Morgan T. H. Embryology and gene-
tics. New York: Columbia Univ.
Press, 1934 (Пер. с англ.: Мор-
ган T. Развитие и наследствен-
ность. М.; Л.: Биомедгиз, 1937).
Morris J. E.t Cooke A., Cole R. J. Iso-
enzymes of creatine phosphokinase
during myogenesis in vitro.— Exp.
Cell Res., 1972, 74, p. 582—585.
Moser G. C., Gluecksohn-Waelsch S.
Developmental genetics of a recessi-
ve allele at the complex T-locus in
the mouse.— Develop. Biol., 1967, 16,
p. 564—576.
Moscona A., Moscona H. The dissocia-
tion and aggregation of cells from
organ rudiments of the early chick
embryo.— J. Anat., 1952, 86, p. 287—
301.
Moss B., Ingram V. M. The repression
and induction by thyroxin of hemo-
globin synthesis during amphibian
metamorphosis.— Proc. Nat. Acad.
Sci. U. S. A., 1965, 54, p. 967—974.
Moss B., Ingram V. M. Hemoglobin
synthesis during amphibian meta-
morphosis. II. Synthesis of adult he-
moglobin following thyroxine admi-
nistration.— J. Mol. Biol., 1968, 32,
p. 493—504.
Moustafa L. A., Brinster R. L. The fa-
te of transplanted cells in mouse
blastocysts in vitro.— J. Exp. Zool.,
1972a, 181, p. 181—192.
Moustafa L. A., Brinster R. L. Indu-
ced chimerism by transplanting emb-
ryonic cells into mouse blasto-
cysts.—J. Exp. Zool., 1972b, 181,
p. 193—202.
Muggleton-Harris A. L.t lohnson M. H.
The nature and distribution of sero-
logically detectable alloantigens on
the preimplantation mouse emb-
ryos.— J. Embryol. and Exp. Mor-
phol., 1976, 35, p. 59 -72.
Muggleton-Harris A. L., Pezzella K.
The ability of the lens cell nucleus
to promote complete embryonic de-
velopment through to metamorpho-
sis and its applications to ophthalmic
gerontology.— Exp. Gerontol., 1972,
7, p. 427—431.
Mukherjee A. B. Cell cycle analysis
and X-chromosome inactivation in
the developing mouse.— Proc. Nat.
Acad. Sci. U. S. A, 1976, 73, p.
1608—1611.
Mullen R. J. Neurological mutants:
Use of chimeras to determine site of
gene action.— Genetics, 1975, 80T
Suppl., p. 6 (Abstr.).
Mullen R. J. Site of ped gene action
and Purkinje cell mosaicism in cere-
bella of chimaeric mice.— Nature,
1977, 270, p. 245—247.
Mullen R. J., LaVail M. M. Inherited
retinal dystrophy: Primary defect in
pigment epithelium determined with
experimental rat chimeras.— Science,
1976, 192, p. 799—801.
Muller G. Die embryonale Entwick-
lung eines sich rezessiv vererbenden
Merkmals (Kolobom bei der Haus-
mans).— Wiss. Z. Martin Luther-
Univ. Halle-Wittenberg, 1951—1952,
1, S. 27—43.
Muller P. K, Lemmen C.t Gay
Gauss V., Kuhn K. Immunochemical
and biochemical study of collagen
synthesis by chondrocytes in cultu-
re.— Exp. Cell Res., 1977, 108, p.
47—55.
Muthukkaruppan V. Inductive tissue
interaction in the development of the
mouse lens in vitro.— J. Exp. Zool.,
1965, 159, p. 269—288.
Nadal-Ginard B. Regulation of lactate
dehydrogenase levels in the mou-
se.—J. Biol. Chem., 1978, 253, p.
170—177.
Nadijcka M., Hillman N. Studies of
t6/t6 mouse embryos.—J. Embryol.
and Exp. Morphol., 1975, 33, p. 697—
713.
Nadler H. L., Chacko C. M.f Rachme-
ler M. Interallelic complementation
in hibrid cells derived from human
diploid strains deficient in galactose-
1-phosphate uridyl transferase acti-
vity.— Proc. Nat. Acad. Sci. U.S.A.,
1970, 67, p. 976—982.
Naha P. M., Meyer A. L., Hewitt K.
Mapping of Gt phase of a mamma-
273
lian cell cycle.— Nature, 1975, 258,
p. 49—53.
Nakatsu S. L., Masek M. A., Land-
rum S.t Frenster J. H. Activity of
DNA templates during cell division
and cell differentiation.— Nature,
1974, 248, p. 334—335.
Nance №. E.t McConnell F. E. Status
and prospects of research in heredi-
tary deafness.— Adv. Hum Genet.,
1973, 4, p. 173—250.
Nes N. The homozygous lethal effect
of the Heggedal factor (shadow fac-
tor).— Acta agr. scand., 1964, 14,
p. 208—228.
Nesbitt M. N.t Gartler S. M. The ap-
plications of genetic mosaicism to
developmental problems.—Annu.
Rev. Genet., 1971, 5, p. 143—162.
Neufeld E. Uptake of lysosomal en-
zymes by cultured fibroblasts.—
In: Cell communication/ Ed. R. P.
Cox. New York, Wiley, 1974, p. 217—
231.
Neyfakh А. А. [Нейфах A. A.] Steps
of realization of genetic information
in early development.— Curr. Top.
Develop. Biol., 1971, 6, p. 45—77.
Nigon V., Godet Y. Genetic and morp-
hogenetic factors in hemoglobin syn-
thesis during higher vertebrate de-
velopment: An approach to cell dif-
ferentiation mechanisms.— Intern.
Rev. Cytol., 1976, 46, p. 79—175.
NoeU №. K. Studies on visual cell via-
bility and differentiation.— Ann.
N. Y. Acad. Sci., 1958, 74, p. 337—
361.
Nora J. J., Nora A. H. The evolution
of specific genetic and environmental
counseling in congenital heart disea-
ses.— Circulation, 1978, 57, p. 205—
213
Nothiger R., McDevitt D. S.t Yama-
da T. Detection of ^-crystallins in
the developing amphibian lens by
peroxidaselabelled antibodies.— Ex-
perientia, 1971, 27, p. 423—424.
Ockerman P. A., Hultberg B., Eriks-
son 0. Enzyme patterns in tissues
and body fluids in mucopolysaccha-
ridoses.— Clin. chim. acta, 1969, 25,
N l,o. 97—102.
Ohno S. Simplicity of mammalian re-
gulatory systems inferred by single
gene determination of sex phenoty-
pes.—Nature, 1971, 234, p. 134—137.
Ohno S. The Y-linked H-Y antigen lo-
cus and the X-linked Tfm locus as
major regulatory genes of the mam-
malian sex determining mecha-
nism.— J. Steroid Biochem., 1977, 8,
p. 585—590.
Olpe H. R., von Hahn H. P., Honeg-
ger C. G. The non-histone protein
pattern of rat brain during ontoge-
nesis.— Experientia, 1973, 29,
p. 665—666.
O’Malley B. №., Woo S. L. C., Harris
S. E. e. a. Steroid hormone regula-
tion of specific messenger RNA and
protein synthesis in eucaryotic
cells.—J. Cell. Physiol., 1975, 85,
Suppl., p. 343—356.
O’Reilly S., Dekaban A. S., Aamodt R.
c. a. Wilson’s disease and Menkes’
disease- a contrast in chronogene-
tics.—Acta med. auxol., 1976, 8, p.
147—154.
Orkin R. W., Pratt R. M„ Gill M.
Undersulfated chondroitin sulfate in
the cartilage matrix of brachymorp-
hic mice.— Develop. Biol., 1976, 50,
p. 82—94.
Orkin R. №., Williams B. R., Cranley
R. E. e. a. Defects in the cartilagi-
nous growth plates of brachymorp-
hic mice.— J. Cell Biol., 1977, 73, p.
287—299.
Paffenholz V. Correlation between
DNA reprair of embryonic fibrob-
lasts and different life span of 3 in-
bred mouse strains.— Meeh. Aging
and Develop., 1978, 7, p. 131—150.
Paigen 'K. Closing remarks tSympo-
sium genetic control of mammalian
metabolism).— Biochem. Genet.,
1970, 4, p. 237—242.
Paigen K., Meister M.t Felton J., Chap-
man V. Genetic determination of the
0-galactosidase developmental pro-
gram in mouse liver.— Cell, 1976, 9,
p. 533—539.
Paigen K., Swank R. T.. Tomino S.,
Ganschow R. E. The molecular gene-
tics of mammalian glucoronidase.—
J. Cell. Physiol., 1975, 85, Suppl., p.
379—392.
Palmiter R. Quantitation of parame-
ters that determine the rate of oval-
bumin synthesis.— Cell, 1975, 4,
p. 189—197.
Papaconstantinou J. Molecular aspects
of lens cell differentiation.— Scien-
ce, 1967, 156, p. 338—346.
Papaioannou V. E., McBurney M. №.,
Gardner R. L., Evans M. J. Fate of
teratocarcinoma cells injected in-
to early mouse embryos.— Nature,
1975, 258, p. 70—73.
274
Papayannopoulou Th., Mute P. E., Sta-
matoyannopoulos G., McGuire T. C.
Hemoglobin ontogenesis: Test of the
gene excision hypothesis.— Science,
1977, 196, p. 1215—1216.
Pardee A. B. Membrane transport pro-
teins.— Science, 1968, 162, p. 632—
637.
Pardee A. B. The surface membrane as
a regulator of animal cell division.—
In vitro, 1971, 7, p. 95—104.
Paul J. General theory of chromosome
structure and gene activation in
eukaryotes.—Nature, 1972, 238,
p. 444—446.
Paul J., Gilmour R. S., Thomou H.
e. a. Organspecific gene masking in
mammalian chromosomes.— Proc.
Roy. Soc. London B, 1970, 176,
p. 277—285.
Pawlak A. L., Kozlowska F. Expression
of hereditary persistence of fetal
hemoglobin under conditions of ac-
celerated hemolysis.— Genet. poL,
1971, 12, p. 593—595.
Pedersen R. A. Development of lethal
yellow (AY/AY mouse embryos in
vitro.— J. Exp. Zool., 1974, 188,
p. 307—319.
Pedersen R. A., Spindle A. J. Genetic
effects on mammalian development
during and after implantation.— Ci-
ba Found Symp., 1976, N 40,
p. 133—140.
Persaud T. Problems of birth defects.
Lancaster, 1977.
Peterson J., Weiss M. C. Expression
of differentiated function in hepato-
ma cell hybrids: Induction of mouse
albumin production in rat hepatoma-
mouse fibroblast hybrids.— Proc.
Nat. Acad. Sci. U. S. A., 1972, 69,
p. 571—575.
Piatigorsky J., Webster H. F., Craig
S. P. Protein synthesis and ultra-
structure during the formation of
embryonic chick lens fibers in vivo
and in vitro.— Develop. BioL, 1972,
27, p. 176-189.
Pictet R. L., Clark W. R., Wil-
liams R. H., Rutter W. J. An ultra-
structural analysis of the developing
embryonic pancreas.— Develop. BioL,
1972, 29, p. 436—467.
Pierce G. B. Differentiation of normal
and malignant cells.— Federat. Proc.,
1970, 29, p. 1248—1254.
Pierce G. B. Differentiation and can-
cer.— In: Cell Differentiation/Ed.
R. Harris, P. Allin, D. Viza. Copen-
hagen: Munksgaard, 1972, p. 100—
114.
Piko L., Chase D. G. Role of the mito-
chondrial genome during early de-
velopment in mice. Effects of ethi-
dium bromide and chlorampheni-
col.—J. Cell BioL, 1973, 58, p. 357—
378.
Pitot H. C. Some aspects of develop-
mental biology of neoplasia.— Can-
cer Res., 1968, 28, p. 1880—1887.
Platzer A. C., Gluecksohn-Waelsch S.
Fine structure of mutant (muscular
dysgenesis) embryonic mouse mus-
cle.— Develop. BioL, 1972, 28,
p. 242— 252.
Pollycove M. Hemochromatosis.— In:
The Metabolic Basis of Inherited
Discasc/Ed. J. B. Stanburgy, J. B.
Wyngaarden, D. S. Fredrickson. New
York: McGraw-Hill, 1966, p. 780—
810.
Poole T. W. Dermal-epidermal intera-
ctions and the site of action of the
yellow (AY) and nonagouti (a) coat
color genes in the mouse.— Develop.
BioL, 1974, 36, p. 208—211.
Poole T. W., Silvers W. K. An experi-
mental analysis of the recessive yel-
low coat color mutant in the mou-
se.— Develop. BioL, 1976, 48, p.
377—381.
Prescott D. M. The structure and re-
plication of eucaryotic chromoso-
mes.— Adv. Cell BioL, 1970, 1,
p. 57—117.
Prescott D. M. The cell cycle and the
control of cellular reproduction.—
Adv. Genet., 1976, 18, p. 99—
177.
Preto A., Lenzini E., Baccichetti C.,
Tenconi R. Trisomia 12p: UN nuovo
caso.—Acta med. auxoL, 1977, 9,
p. 171 — 172.
Quevedo W C. Genetic control of me-
lanin metabolism within the melanin
unit of mammalian epidermis.— J.
Invest. Dermatol., 1973, 60, p. 407—
417.
Rakic P., Sidman R. L. Weaver mutant
mouse cerebellum: Defective neuro-
nal migration secondary to abnor-
mality of Bergmann glia.— Proc.
Nat. Acad. Sci. U. S. A., 1973, 70,
p. 240—244.
Rasmusen B. A. The significance of
transferrin and R-O-i polimorphisms
in sheep.—Anim. Blood Groups and
Biochem.-Genet., 1976, 7, p. 147
155.
275
lian cell cycle.— Nature, 1975, 258,
p. 49—53.
Nakatsu S. L., Masek M. A., Land-
rum S„ Frenster J. H. Activity of
DNA templates during cell division
and cell differentiation.— Nature,
1974, 248, p. 334—335.
Nance W. E., McConnell F. E. Status
and prospects of research in heredi-
tary deafness.— Adv. Hum Genet.,
1973, 4, p. 173—250.
Nes N. The homozygous lethal effect
of the Heggedal factor (shadow fac-
tor).— Acta agr. scand., 1964, 14,
p. 208—228.
Nesbitt M. N.t Gartler S. M. The ap-
plications of genetic mosaicism to
developmental problems.— Annu.
Rev. Genet., 1971, 5, p. 143—162.
Neufeld E. Uptake of lysosomal en-
zymes by cultured fibroblasts.—
In: Cell communication/ Ed. R. P.
Cox. New York, Wiley, 1974, p. 217—
231.
Neyfakh А. А. [Нейфах A. A.] Steps
of realization of genetic information
in early development.— Curr. Top.
Develop. Biol., 1971, 6, p. 45—77.
Nigon V.t Godet У. Genetic and morp-
hogenetic factors in hemoglobin syn-
thesis during higher vertebrate de-
velopment: An approach to cell dif-
ferentiation mechanisms.— Intern.
Rev. Cytol., 1976, 46, p. 79—175.
Noell W. R. Studies on visual cell via-
bility and differentiation.— Ann.
N. Y. Acad. Sci., 1958, 74, p. 337—
361.
Nora J. J., Nora A. H. The evolution
of specific genetic and environmental
counseling in congenital heart disea-
ses.— Circulation, 1978, 57, p. 205—
213.
Nothiger R., McDevitt D. S.t Yama-
da T. Detection of y-crystallins in
the developing amphibian lens by
peroxidaselabelled antibodies.— Ex-
perientia, 1971, 27, p. 423—424.
Ockerman P. A., Hultberg B., Eriks-
son 0. Enzyme patterns in tissues
and body fluids in mucopolysaccha-
ridoses.— Clin. chim. acta, 1969, 25,
N 1, p. 97—102.
Ohno S. Simplicity of mammalian re-
gulatory systems inferred by single
gene determination of sex phenoty-
pes.—Nature, 1971, 234, p. 134—137.
Ohno S. The Y-linked H-Y antigen lo-
cus and the X-linked Tfm locus as
major regulatory genes of the mam-
malian sex determining mecha-
nism.— J. Steroid Biochem., 1977, 8,
p. 585—590.
Olpe H. R., von Hahn H. P., Honeg-
ger C. G. The non-histone protein
pattern of rat brain during ontoge-
nesis.— Experientia, 1973, 29,
p. 665—666.
O’Malley B. W., Woo S. L. C., Harris
S. E. e. a. Steroid hormone regula-
tion of specific messenger RNA and
protein synthesis in eucaryotic
cells.—J. Cell. Physiol., 1975, 85,
SuppL, p. 343—356.
O’Reilly S., Dekaban A. S., Aamodt R.
e. a. Wilson’s disease and Menkes’
disease- a contrast in chronogene-
tics.—Acta med. auxol., 1976, 8, p.
147—154.
Orkin R. W„ Pratt R. M.t Gill M.
Undersulfated chondroitin sulfate in
the cartilage matrix of brachymorp-
hic mice.— Develop. Biol., 1976, 50,
p. 82—94.
Orkin R. W.t Williams B. R.t Cranley
R. E. e. a. Defects in the cartilagi-
nous growth plates of brachymorp-
hic mice.— J. Cell Biol., 1977, 73, p.
287—299.
Paffenholz V. Correlation between
DNA reprair of embryonic fibrob-
lasts and different life span of 3 in-
bred mouse strains.— Meeh. Aging
and Develop., 1978, 7, p. 131—150.
Paigen R. Closing remarks ^Sympo-
sium genetic control of mammalian
metabolism).— Biochem. Genet.,
1970, 4, p. 237—242.
Paigen R., Meisler M., Felton J., Chap-
man V. Genetic determination of the
P-galactosidase developmental pro-
gram in mouse liver.— Cell, 1976, 9,
p. 533—539.
Paigen R., Swank R. T.. Tomino S.,
Ganschow R. E. The molecular gene-
tics of mammalian glucoronidase.—
J. Cell. Physiol., 1975, 85, Suppl., p.
379—392.
Palmiter R. Quantitation of parame-
ters that determine the rate of oval-
bumin synthesis.— Cell, 1975, 4,
p. 189—197.
Papaconstantinou J. Molecular aspects
of lens cell differentiation.— Scien-
ce, 1967, 156, p. 338—346.
Papaioannou V. E., McBurney M. W.y
Gardner R. L., Evans M. J. Fate of
teratocarcinoma cells injected in-
to early mouse embryos.— Nature,
1975, 258, p. 70—73.
274
Papayannopoulou Th., Nuie P. E., Sta-
matoyannopoulos G., McGuire T. C.
Hemoglobin ontogenesis: Test of the
gene excision hypothesis.— Science,
1977, 196, p. 1215—1216.
Pardee A. B. Membrane transport pro-
teins.— Science, 1968, 162, p. 632—
637.
Pardee A. B. The surface membrane as
a regulator of animal cell division.—
In vitro, 1971, 7, p. 95—104.
Paul J. General theory of chromosome
structure and gene activation in
eukaryotes.—Nature, 1972, 238,
p. 444—446.
Paul J., Gilmour R. S., Thomou H.
e. a. Organspecific gene masking in
mammalian chromosomes.— Proc.
Roy. Soc. London B, 1970, 176,
p. 277—285.
Pawlak A. L., Kozlowska F. Expression
of hereditary persistence of fetal
hemoglobin under conditions of ac-
celerated hemolysis.— Genet, pol.,
1971, 12, p. 593—595.
Pedersen R. A. Development of lethal
yellow (AY/AY mouse embryos in
vitro.— J. Exp. Zool., 1974, 188,
p. 307—319.
Pedersen R. A., Spindle A. J. Genetic
effects on mammalian development
during and after implantation.—Ci-
ba Found Symp., 1976, N 40,
p. 133—140.
Persaud T. Problems of birth defects.
Lancaster, 1977.
Peterson J., Weiss M. C. Expression
of differentiated function in hepato-
ma cell hybrids: Induction of mouse
albumin production in rat hepatoma-
mouse fibroblast hybrids.— Proc.
Nat. Acad. Sci. U. S. A., 1972, 69,
p. 571—575.
Piatigorsky J., Webster H. F., Craig
S. P. Protein synthesis and ultra-
structure during the formation of
embryonic chick lens fibers in vivo
and in vitro.—Develop. BioL, 1972,
27, p. 176—189.
Pictet R. L„ Clark W. R., Wil-
liams R. H., Rutter W. J. An ultra-
structural analysis of the developing
embryonic pancreas.— Develop. Biol.,
1972, 29, p. 436—467.
Pierce G. B. Differentiation of normal
and malignant cells.— Federat. Proc.,
1970, 29, p. 1248—1254.
Pierce G. B. Differentiation and can-
cer.— In: Cell Differentiation/Ed.
R. Harris, P. Allin, D. Viza. Copen-
hagen: Munksgaard, 1972, p. 109—
114.
Piko L., Chase D. G. Role of the mito-
chondrial genome during early de-
velopment in mice. Effects of ethi-
dium bromide and chlorampheni-
col.—J. Cell Biol., 1973, 58, p. 357—
378.
Pitot H. C. Some aspects of develop-
mental biology of neoplasia.— Can-
cer Res., 1968, 28, p. 1880—1887.
Platzer A. C., Gluecksohn-Waelsch S.
Fine structure of mutant (muscular
dysgenesis) embryonic mouse mus-
cle.— Develop. Biol., 1972, 28,
p. 242— 252.
Pollycove M. Hemochromatosis.— In:
The Metabolic Basis of Inherited
Diseasc/Ed. J. B. Stanburgy, J. B.
Wyngaarden, D. S. Fredrickson. New
York: McGraw-Hill, 1966, p. 780—
810.
Poole T. W. Dermal-epidermal intera-
ctions and the site of action of the
yellow (AY) and nonagouti (a) coat
color genes in the mouse.— Develop.
Biol., 1974, 36, p. 208—211.
Poole T. W., Silvers W. K. An experi-
mental analysis of the recessive yel-
low coat color mutant in the mou-
se.— Develop. Biol., 1976, 48, p.
377—381.
Prescott D. M. The structure and re-
plication of eucaryotic chromoso-
mes.— Adv. Cell Biol., 1970, 1,
p. 57—117.
Prescott D. M. The cell cycle and the
control of cellular reproduction.—
Adv. Genet., 1976, 18, p. 99—
177.
Preto A., Lenzini E., Baccichetti C.f
Tenconi R. Trisomia 12p: UN nuovo
caso.—Acta med. auxol., 1977, 9,
p. 171 — 172.
Quevedo W C. Genetic control of me-
lanin metabolism within the melanin
unit of mammalian epidermis.— J.
Invest. Dermatol., 1973, 60, p. 407—
417.
Rakic P., Sidman R. L. Weaver mutant
mouse cerebellum: Defective neuro-
nal migration secondary to abnor-
mality of Bergmann glia.—Proc.
Nat. Acad. Sci. U. S. A., 1973, 70,
p. 240—244.
Rasmusen B. A. The significance of
transferrin and R-O-i polimorphisms
in sheep.— Anim. Blood Groups and
Biochem.-Genet., 1976, 7, p. 147
155.
275
Ratnoff О. D., Jones P. K. The labora-
tory diagnosis of the carrier state
for classic hemophilia.— Ann. Intern.
Med., 1977, 86, p. 521—528.
Rawles M. E. The integumentary sy-
stem.— In: Biology and Compara-
tive Physiology of Birds/Ed. A. J.
Marshall. New York: Acad. Press,
1960, v. 1, p. 189—240.
Redman R. S., Screebny L. M. Prolife-
rative behavior of differentiating cells
in the developing rat parotid
gland.—J. Cell Biol., 1970, 46,
p. 81—87.
Reeder R., Bell E. Short- and long-li-
ved messenger RNA in embryonic
chick lens.— Science, 1965, 150,
p. 71—72.
Reyer R. W. Regeneration in amphi-
bian eye.— In: Regeneration/Ed. D.
Rudnick. New York: Ronald Press,
1962, p. 211—265.
Rhine S. A. Prenatal genetic diagnosis
and metabolic disorders.— Clin. Ob-
stet. and Gynecol., 1976, 19, p. 855—
870.
Rhodes K. R.t Elmer W. A. Aberrant
metabolism of matrix components
in neonatal fibular cartilage of bra-
chypod (bpH) mice.— Develop. Biol.,
1975, 46, p. 14—27.
Ringertz N. R. Regulation and gene ex-
pression in heterokaryons.— In: So-
matic Cell Hybridization/Ed. R. L.
Davidson, F. DeLaCruz. New York:
Raven Press, 1974, p. 239—260.
Ringertz N. R., Carlsson S., Ege T.,
Boland L. Detection of human and
chick nuclear antigens in nuclei of
chick erythrocytes during reactivation
in heterokaryons with HeLa cells.—
Proc. Nat. Acad. Sci. U. S. A., 1971,
68, p. 3228—3232.
Robertson G. G. An analysis of the
development of homozygous yellow
mouse embryos.—J. Exp. Zool., 1942,
89, p. 197—231.
Roman H. Studies of gene mutation in
Saccharomyces.— Cold Spring Har-
bor Symp. Quant. Biol., 195-6, 21,
p. 175—185.
Rooze M. A. The effect of the Dh gene
on limb morphogenesis in the mou-
se.— In: Morphogenesis and Malfor-
mation of the Limb/Ed. D. Bergsma,
W. Lenz. New York: Alan R. Liss,
Г977, p. 69—95.
Rosenquist G. C. The origin and mo-
vements of the hepatogenic cells in
the chick embryo as determined by
radioautographic mapping.— J. Em-
bryol. and Exp. Morphol., 1971, 25,
p. 97—113.
Rovera G., Baserga R. Early changes
in the synthesis of acidic nuclear
proteins in human diploid fibroblasts
stimulated to synthesize DNA by
changing the medium.— J. Cell. Phy-
siol., 1971, 77, p. 201—210.
Rugh R. The mouse, its reproduction
and development. Minneapolis: Bur-
gess Publ., 1968.
Russell E. S., Bernstein S. E., Law-
son F. A., Smith L. J. Long-conti-
nued function of normal blood-for-
ming tissue transplanted into gene-
tically anemic hosts.— J. Nat. Cancer
Inst., 1959, 23, p. 557—566.
Russell E. S.t Fondal E. L. Quantitati-
ve analysis of the normal and four
alternative degrees of an inherited
macrocytic anemia in the house mou-
se. I. Number and size of erythro-
cytes.— Blood, 1951, 6, p. 892—905.
Russell E. S., Thompson M. W., McFar-
land E. C. Analysis of effects of W
and f genic substitutions on fetal
mouse hematology.—Genetics, 1968,
58, p. 259—270.
Rutter W7. J., Kemp J. D., Bradshaw
W. S. e. a. Regulation of specific
protein synthesis in cytodifferentia-
tion.—J. Cell. Physiol., 1968, 72,
Suppl., p. 1—18.
Sanderson К J., Guillery R. W., Sha-
ckelford R. M. Congenitally abnor-
mal visual pathways in mink (Muste-
la vison) with reduced retinal pig-
ment.—J., Comp. Neurol., 1974, 154,
p. 225—248.
Sanyal S., Zeilmaker G. H. Gene action
and cell lineage in retinal develop-
ment in experimental chimeric mi-
ce.— Teratology, 1974, 10, p. 322
(Abstr.).
Sanyal S., Zeilmaker G. H. Compara-
tive analysis of cell distribution in
the pigment and the visual cell layer
of chimaeric mice.— J. Embryol. and
Exp. Morphol., 1976, 36, p. 425—
430.
Sassa S., Kappas A. Prenatal diagnosis
of a trait with the gene defect of
acute intermittent porphyria (AIP).—
Hum. Hered., 1977, 27, p. 209.
Saunders J. W. Jr., Fallon J. F. Cell
death in morphogenesis.— In: Major
Problems in Developmental Biolo-
gy/Ed. M. Locke. New York; Lon-
don: Acad. Press, 1966, p. 289—314.
276
Saxen L., Karkinen-Jaaskelainen M.,
Lehtonen E. e. a. Inductive tissue
interactions.— In: The Cell surface
in Animal Embryogenesis and Dcve-
lopment/Ed. G. Poste, G. L. Nicol-
son. Amsterdam: North — Holland,
1976, p. 331—407.
Saxen L., Koskimies 0., Lahti A. c. a.
Differentiation of kidney mesenchy-
me in an experimental model sy-
stem—Adv. Morphogen., 1968, 7,
p. 251—293.
Saxen L., Toivonen S. Primary embryo-
nic induction. London; New York:
Acad. Press, 1962 (Пер. с англ.:
Саксен Л., Тойвонен С. Первичная
эмбриональная индукция. М.: ИЛ,
1963).
Schalekamp М. Schalekamp М.,
Goor D. van, Slingerland R. Re-
evaluation of the presence of multiple
haemoglobins during the ontogenesis
of the chicken.— J. Embryol. and
Exp. Morphol., 1972, 28, p. 681 —
713.
Scheffler J. E., Buttin G. Conditional-
ly lethal mutations in Chinese ham-
ster cells. I. Isolation of a tempera-
ture-sensitive line and its investiga-
tion by cell cycle studies.— J. Cell.
Physiol., 1973, 81, p. 199—216.
Schimke R. T., Rhoads R. E., Pala-
cios R., Sullivan D. Ovalbumin
mRNA, complementary DNA and
hormone regulation in chick ovi-
duct.— In: The Role of RNA in Re-
production and Development/Ed.
M. C. Niu, S. J. Segal. Amsterdam:
North-Holland, 1973, p. 26—42.
Schneider J. A., Weiss M. C. Expres-
sion of differentiated functions in
hepatoma cell hybrids. I. Tyrosine
aminotransferase in hepatoma-fibro-
blast hybrids.— Proc. Nat. Acad. Sci.
U. S. A., 1971, 68, p. 127—131.
Scott W. J., Ritter E. J., Wolson J. G.
Delayed appearance of ectodermal
cell death as a mechanism of poly-
dactyly induction.—J. Embryol.
Exp. Morphol., 1977, 42, p. 93—104.
Scriver C. R. The human biochemical
genetics of amino acid transport.—
Pediatrics, 1969, 44, p. 348—357.
Searls R. L. The role of cell migration
in the development of the embryonic
chick limb bud.—J. Exp. Zool., 1967,
166, p. 39—50.
Seegmiller R., Fraser F. C., Sheldon H.
A new chondrodystrophic mutant in
mice. Electron microscopy of normal
and abnormal chondrogenesis.— J.
Cell BioL, 1971, 48, p. 580—593.
Seidel F. Die Entwicklungsfahigkeiten
isolierter Furchungszellen aus dem
Ei des Kaninchens Oryctolagus cuni-
culus.—Roux’Arch., 1960, 152,
S. 43—130.
Selander R. R., DeLa Chapelle A. The
control of differentiation in erythroid
cells.— Biochim. et biophys. acta,
1971, 247, p. 141-152.
Sengel P. The organogenesis and ar-
rangement of cutaneous appendages
in birds.— Adv. Morphogen., 1971, 9,
p. 181—230.
Sengel P., Abbott U. R. In vitro studies
with the scaleless mutant: Inte-
ractions during feather and scale dif-
ferentiation.—J. Hered., 1963, 54,
p. 255—262.
Shimizu R. Identification of hemoglo-
bin types contained in single chi-
cken erythrocytes by fluorescent anti-
body technique.— Develop. Biol.,
1976, 48, p. 317—326.
Shinohara T., Piatigorsky J. Quantita-
tion of o-crystallin messenger RNA
during lens induction in chick
embryos.— Proc. Nat. Acad. Sci.
U. S. A., 1976, 73, p. 2808—2812.
Shubert E. E., Trevithick /. R., Hollen-
berg M. J. Localization of gamma
crystallins in the developing lens of
the rat.— Canad. J. Ophthalmol.,
1970, 5, p. 353—365.
Sidman R. L. Organ-culture analysis of
inherited retinal degeneration in ro-
dents.— Nat. Cancer Inst. Monogr.,
1963, 11, p. 227—243.
Sidman R. L., Green M. C. «Nervous»,
a new mutant mouse with cerebellar
disease.—Coll. Intern. C. N. R. S.
Paris, 1970, N 924, p. 69—79.
Silver L, Hughes A. F. W. The rela-
tionship between morphogenetic cell
death and the development of conge-
nital anophthalmia.—J. Compar.
Neurol., 1974, 157, p. 281—301.
Silvers W. R. Pigment cells: Occurren-
ce in hair follicles.— J. Morphol.,
1956, 99, p. 41—55.
Silvers W. R. Tactics in pigment-cell
research.— In: Methodology in Mam-
malian Genetics/Ed. W. J. Burdette.
San Francisco: Holden-Day, 1963,
p. 323—336.
Siminovitch L., Thompson L. H. The
nature of conditionally lethal tem-
perature-sensitive mutations in soma-
277
tic cells.—J. Cell. Physiol., 1978, 95,
p. 361—364.
Simpson S. В., Cox P. G. Vertebrate
regeneration system: Culture in vit-
ro.— Science, 1967, 157, p. 1331 —
1332.
Sisken B. F., Gluecksohn-Waelsch S.
A developmental study of the muta-
tion «phocomclia» in the mouse.— J.
Exp. Zool., 1959, 142, p. 623—642.
Sivak A. Induction of cell division: Ro-
le of cell membrane sites.— J. Cell
Physiol., 1972, 80, p. 167—174.
Slack C., Morgan R. H. M., Carritt B.
e. a. Isolation and characterisation
of Chinese hamster cells resistant to
5-fluorodcoxyuridine.— Exp. Cell
Res., 1976, 98, p. 1 — 14.
Sloan H. R„ Uhlendorf B. W., Kan-
fer J. N. e. a. Deficiency of sphin-
gomyelin-clcaving enzyme activity in
tissue cultures derived from patients
with Niemann-Pick disease.— Bio-
chem. and Biophys. Res. Communs,
1969, 34, p. 582—588.
Smith B. J., Wigglesworth N. M. A tem-
perature-sensitive function in a Chi-
nese hamster line affecting DNA syn-
thesis.— J. Cell Physiol., 1973, 82,
p. 339—348.
Smith L. J., Stein R. F. Axial elongation
in the mouse and its retardation in
homozygous loop-tail mice.— J. Em-
bryo!. and Exp. Morphol., 1962, 10,
p. 73—87.
Smith-Reary P. F. Genetic structure
and function. New York; Toronto:
Halsted Press, 1975.
Snow M. H. Z. Embryo growth during
the immediate postimplantation pe-
riod.— Ciba Found. Symp., 1976,
N 40, p. 53—66.
Sofaer J. A. Hair follicle initiation in
reciprocal recombinations of down-
less homozygote and heterozygote
mouse tail epidermis and dermis.—
Develop. Biol., 1973, 34, p. 289—
296.
Sofaer J. A. Differences between tabby
and downless mouse epidermis and
dermis in culture.— Genet. Res.,
1974, 23, p. 219—225.
Sonnenschein C., DeWayne R., Yerga-
nian G. Karyotypic and enzymatic
characteristics of a somatic hybrid
cell line originating from dwarf ham-
sters.— Genetics, 1969, 62, p. 379—
392.
Sonnenschein C., Tashjian A. H. Jr.,
Richardson U.. J. Somatic cell hybri-
dization: Mouse-rat hybrid cell line
involving a growth hormonc-produ-
cing parent.— Genetics, 1968, 60,
p. 227—228.
Sovik 0., Birger C., Hagen van der,
Loken A. C. X-linked aqueductal
stenosis.—Clin. Genet., 1977, 11,
p. 416—420.
Spelsberg T. C., Mitchell W. M., Chy-
til F. e. a. Chromatin of the develo-
ping chick oviduct: Changes in the
acidic proteins.—Biochim. et biophys.
acta, 1973, 312, p. 765—778.
Spelsberg T. C., Steggles A. W., O'Mal-
ley B. W. Progesterone-binding com-
ponents of chick oviduct.— J. Biol.
Chem., 1971, 246, p. 4188—4197.
Spemann H. Embryonic development
and induction. New Haven: Yale
Univ. Press, 1938.
Spiegelman M. Electron microscopy of
cell interactions in T-locus mu-
tants.— In: Embryogenesis in ?4am-
mals/Ed. M. O’Connor. Ciba Found.
Symp., 1976, N 40, p. 199—220.
Spiegelman M., Bennett D. Fine stru-
ctural study of cell migration in the
early mesoderm of normal and mu-
tant mouse embryos (T-locus:
t9/t9).— J. Embryol. and Exp. Mor-
phol., 1974, 32, p. 723—738.
Stark R. J., Searls R. L. A description
of chick wing bud development and
a model of limb morphogenesis.—
Develop. Biol., 1973, 33, p. 138—153.
Stedman E., Stedman E. Cell specifi-
city of histones.— Nature, 1950, 116,
p. 780—781.
Stein G. S., Spelsberg T. C., Rlein-
smith L. J. Nonhistone chromosomal
proteins and gene regulation.—
Science, 1974, 183, p. 817—824.
Stein H., Hausen P. Factors influen-
cing the activity of mammalia RNA
polymerase.— Cold Spring Harbor
Symp. Quant. Biol., 1971, 35,
p. 709—717.
Stein R. F., Rettyle C. N. Further data
on the slit-lid mutant in mice and
the effect of cortisone and DOCA on
its development.— Teratology, 1973,
8, p. 51—54.
Stein R. F., Norris В. E.f Mason J.
Development of an open eye-lid mu-
tant in Mus musculus.— Develop.
BioL, 1967, 16, p. 315—330.
Stephens T. D., Seegmiller R. E. Nor-
mal production of cartilage glycosa-
minoglycan in mice homozygous for
278
the chondrodysplasia gene.— Terato-
logy, 1976, 13, p. 317—325.
Stern C. Principles of human genetics.
San Francisco; London: Freeman and
Co., 1960.
Stern M. S., Wilson I. B. Experimental
studies on the organization of the
preimplantation mouse embryo. I. Fu-
sion of asynchronously cleaving
eggs.— J. Embryol. and Exp. Mor-
phol., 1972, 28, p. 247—254.
Stevens L. C. The biology of terato-
mas.— Adv. Morphogen., 1967, 6,
p. 1—31.
Steward F. C. From cultured cells to
whole plants: The induction and
control of their growth and differen-
tiation.— Proc. Roy. Soc. London B,
1970, 175, p. 1—30.
Stewart J. A., Papaconstantinou J.
Stabilization of mRNA templates in
bovine lens epithelial cells.— J. MoL
Biol., 1967, 29, p. 357—370.
Stone W. F., Freedman J., Fregin A.
Possible somatic cell mating in twin
cattle with erythrocyte mosaicism.—
Proc. Nat. Acad. Sci. U. S. A., 1964,
51, p. 1036—1044.
Strautz R. L. Studies of hereditaryobe-
se mice (ob, ob) after implantation
of pancreatic islets in millipore fil-
ter capsules.— Diabetologia, 1970, 6,
p. 306—312.
Strehler B., Hirsch G., Gusseck D. e. a.
Codonrestriction theory of aging and
development.— J. Thcor. Biol., 1971,
33, p. 429—474.
Strong L. C., Hollander W. F. Heredi-
tary loop-tail in the house mouse ac-
companied by imperforate vagina and
with lethal craniorachischisis.—J.
Hered., 1949, 44, p. 59—69.
Strudel G. Some aspects of organoge-
nesis of the chick spinal column.—
In: Experimental biology and medi-
cine/Ed. E. Hagen, W. Wechsler,
P. Zilliken. Basel; New York: S. Kar-
ger. 1967, vol. 11, p. 183—198.
Subak-Sharpe J. H., Burk R. R., Pitts
J. D. Metabolic co-operation between
biochemically marked mammalian
cells in tissue culture.— J. Cell. Sci.,
1969, 4, p. 353—367.
Summerbell D., Lewis J. H., Wolpert L.
Positional information in chick limb
morphogenesis. — Nature, 1973, 244,
p. 492—496.
Takagi N. Differentiation of X chromo-
somes in early female mouse emb-
ryos.—Exp. Cell Res., 1974, 78,
p. 127—135.
Takagi N., Sasaki M. Preferential ina-
ctivation of the paternally derived
X chromosome in the extraembryonic
membranes of the mouse.— Nature,
1975, 256, p. 640—642.
Takagi N., Wake N., Sasaki M. Cyto-
logic evidence for preferential ina-
ctivation of the paternally derived
X chromosome in XX mouse blasto-
cysts.—Cytogenet. and Cell Genet.,
1978, 20, p. 240—248.
Takata C., Albright J. F.t Yamada T.
Gamma- crystallins in Wollfian lens
regeneration demonstration by im-
munofluorescence.— Develop. BioL,
1966, 14, p. 382—400.
Tarin D. Tissue interactions in morpho-
genesis, morphostasis and carcino-
genesis.—J. Theor. BioL, 1972, 34,
p. 61—72.
Tarkowski A. R. Mouse chimaeras de-
veloped from fused eggs.— Nature,
1961, 190, p. 857—860.
Tarkowski A. R. Studies on mouse chi-
maeras developed from eggs fused
in vitro.— Nat. Cancer Inst. Monogr.,
1963, 11, p. 51—71.
Tata J. R. Protein synthesis during
amphibian metamorphosis.— Curr.
Top. Develop. BioL, 1971, 6,
p. 79—110.
Tedesco T. A., Mellman W. J. Galacto-
semia: Evidence for a structural ge-
ne mutations.—Science, 1971, 172,
p. 727—728.
Temin H. The protovirus hypothesis:
speculations on the significance of
RNA-directed DNA synthesis for
normal development and for carcino-
genesis.— J. Nat. Cancer Inst., 1971,
46, p. Ill—VII.
Tenner A., Zieg J., Scheffler I. E. Gly-
coprotein synthesis in a temperature-
sensitive Chinese hamster cell cycle
mutant.—J. Cell. Physiol., 1977, 90,
p. 145—160.
Theiler R., Gluecksohn-Waelsch S. The
morphological effects and the deve-
lopment of the fused mutation in the
mouse.— Anat. Rec., 1956, 125,
p. 83—104.
Theiler R., Varnum D. S., Nadeau J. H.
c. a. A new allele of ocular retarda-
tion: Early development and morpho-
genetic cell death.—Anat. and Emb-
ryol., 1976, 150, p. 85—97.
Theiler R., Varnum D. S., Stevens L. C.
Development of Dickie’s small eye,
279
a mutation in the house mouse.—
Anat. and Embryol., 1978, 155,
p. 81—86.
Thesleff J., Lehtonen E., Wartiovaa-
ra J., Saxen L. Interference of tooth
differentiation with interposed fil-
ters.— Develop. Biol., 1977, 58,
p. 197—203.
Thomas C. A. The genetic organiza-
tion of chromosomes.— Annu' Rev.
Genet., 1971, 5, p. 237—256.
Thompson E. B., Gelehrter T. D.
Expression of tyrosine aminotran-
sferase activity in somatic-cell he-
terokaryons: Evidence for negative
control of enzyme expression.— Proc.
Nat. Acad. Sci. U. S. A., 1971, 68,
p. 2589—2593.
Thompson L. H., Lindl P. A. A CHO
cell mutant with a defect in cytoki-
nesis.—Somat. Cell Genet., 1976, 2,
p. 387—400.
Thompson M. McCulloch E. A., Si-
minovitch L., Till J. E. The cellular
basis for the defect in haemopoiesis
in flexed-tailed mice. I. The nature
and persistence of the defect.— Brit.
J. Haematol., 1966, 12, p. 152—160.
Thrasher J. D. Turnover of intracellu-
lar proteins.— In: Cellular and mo-
lecular renewal in the mammalian
body/Ed. I. L. Cameron, J. D. Thra-
sher. New York; London: Acad. Press,
1971, p. 153—219.
Tickle C., Shellswell G., Crawley A.,
Wolpert L. Positional signalling by
mouse limb polarisend region in the
chick wing bud.— Nature, 1976, 259,
p. 396—397.
Tiedemann H. Biochemical aspects of
primary induction and determina-
tion.— In: Biochemistry of Animal
Development. Ed. R. Weber. New
York; London: Acad. Press, 1967,
vol. 2, p. 3—55.
Tiedemann H. Pretranslational control
in embryonic differentiation.— In:
Regulation of Transcription and
Translation in Eukaryotes/Ed.
E. K. F. Bautz, P. Karlson, H. Ker-
sten. Berlin: Springer, 1973, p. 59—
79.
Tiedemann H. Substances with morpho-
genetic activity in differentiation of
vertebrates.— In: The biochemistry
of animal development/Ed. R. We-
ber. New York: Acad. Press, 1975,
vol. 3, p. 257—292.
Timofeef-Ressovsky N. W. [Тимофеев-
Рессовский H. В.] Studies on the
phenotypic manifestation of heredita-
ry factors. I. On the phenotypic ma-
nifestation of the genovariation ra-
dius incompletus in Drosophila fu-
nebris.—Genetics, 1927, 12, p. 128—
198.
Tomkins G. M., Gelehrter T D., Gran-
ner D. c. a. Control of specific gene
expression in higher organisms.—
Science, 1969, 166, p. 1474—1480.
Tomkins G. M., Levinson В. B., Bax-
ter J. D., Dethlefsen L. Further evi-
dence for posttranscriptional control
of inducible tyrosine aminotransfe-
rase synthesis in cultured hepatoma
cells.— Nature New Biol., 1972, 239,
p. 9—14.
Townes P. L., Holtfreter J. Directed
movements and selective adhesion
of embryonic amphibian cells.— J.
Exp. Zool., 1955, 128, p. 53—120.
Trottier T. M., Armstrong J. B. Experi-
mental studies on a mutant gene (p)
causing premature death of Amby-
stoma mexicanum embryos.— J.
Embryol. and Exp. Morphol., 1977,
39, p. 139—149.
Truslove G. M. The anatomy and deve-
lopment of the fidget mouse.— J. Ge-
net., 1956, 54, p. 64—86.
Truslove G. M. A gene causing ocular
retardation in the mouse.— J. Em-
bryol. and Exp. Morphol., 1962, 10,
p. 652—660.
Tsai M. J., O'Malley B. U7. Effects of
estrogen on gene expression in chick
oviduct.— In: Cell Differentiation Mi-
croorganisms, Plants and Animals/
/Ed. L. Nover, K. Mothes, Amster-
dam: North — Holland Publ. Co.,
1977, p. 109—125.
Tsanev R. Cell cycle and liver fun-
ction.— In: Cell cycle and cell dif-
ferentiation/Ed. J. Reinert, H. Holt-
zer, Berlin: Springer — Verl., 1975,
p. 197—248.
Tsanev R., Sendov Bl. Possible mole-
cular mechanism for cell differentia-
tion in multicellular organisms.— J.
Theor. Biol., 1971a, 30, p. 337—393.
Tsanev R., Sendov B. An epigenetic
mechanism for carcinogenesis.— Z.
Krebsforsch, 1971b, 76, S. 299-319.
Tuffrey M., Barnes R. D., Evans E. P.t
Ford С. E. Dominance of AKR lym-
phocytes in tetraparental AKR*->CBA-
T6T6 chimaeras.— Nature New BioL,
1973, 243, p. 207—208.
Turkington R. W. Regulation of gene
expression in normal and neopla-
280
stic mammary cells: a review.— J.
Nat. Cancer Inst., 1972, 48, p. 1231 —
1234.
Tyler A. «Masked» messenger RNA
and the determination process in
embryonic development.— In: Gene-
tics and Developmental Biology/Ed.
H. J. Teas. Lexington: Univ. Ken-
tucky Press, 1969, p. 107—127.
Umansky S. R., Kovalev Yu. 1., To-
karskaya V. I. [Уманский С. P., Ко-
валев Ю. И., Токарская В. И.] Spe-
cific interaction of chromatin non-
histone proteins with DNA.— Bio-
chim. et biophys. acta, 1975, 383,
p. 242—254.
Valentine W. N. Hereditary spherocy-
tosis revisited.— West. J. Med., 1978,
128, p. 35—45.
Van Blerkom J.t Barton S. C., John-
son M. H. Molecular differentiation
in the preimplantation mouse em-
bryos.— Nature, 1976, 259, p. 319—
321
Vande B. J. L., Cooper D. W., Shar-
man G. B., Poole W. E. Studies on
metatherian sex chromosomes. IV. X
linkage of PGK-A with paternal X
inactivation confirmed in erythrocy-
tes of grey kangaroos by pedigree
analysis.— Austral. J. Biol. Sci., 1977,
30, p. 115—125.
Van Deusen E. Experimental studies
on a mutant gene (e) preventing the
differentiation of eye and normal hy-
pothalamus primordia in the Axo-
lotl.— Develop. Biol., 1973, 34,
p. 135—158.
Vankin L. The embryonic effects of
«Blind», a new early lethal mutation
in mice.—Anat. Rec., 1956, 125,
p. 648 (Abstr.).
Van Valen P. Oligosyndactylism, an
early embryonic lethal in the mou-
se.— J. Embryol. and Exp. Morphol.,
1966, 15, p. 119—124.
Varnum D. S., Stevens L. C. Aphakia,
a new mutation in the mouse.—J.
Hered., 1968, 59, p. 147—150.
Vavilov N. J. [Вавилов H. И.\ The
law of homologous series in varia-
tion.—J. Genet., 1922, 12, p. 47—89.
Vitetta E. S., Artzt K., Bennett D. e. a.
Structural similarities between a
product of the T/t-locus isolated from
sperm and teratoma cells, and H-2
antigens isolated from splenocytes.—
Proc. Nat. Acad. Sci. U. S. A., 1975,
72, p. 3215—3219.
Waddington С. H. The strategy of the
genes. London: Allen and Unwin.
1957.
W addington С. H. New patterns in ge-
netics and development New York;
London: Columbia Univ. Press, 1962
(Пер. с англ.: Уоддингтон К. Морфо-
генез и генетика. М.: Мир, 1964).
Waddington С. Н., Robertson Е. Deter-
mination, activation and actinomy-
cin D insensitivity in the optic ima-
ginal disk of Drosophila.— Nature,
1969, 221, p. 933—935.
Wang R. J. Temperature-sensitive mam-
malian cell line blocked in mitosis.—
Nature, 1974, 248, p. 76—78.
Wang T. Y. Non-histone chromosomal
proteins in the control of gene acti-
vity.— Canad. J. Genet, and Cytol.,
1976, 18, p. 575 (Abstr.).
Wang T. Y., Kostraba N. C. Nonhistone
proteins as gene derepressor mole-
cules.— In: The Role of RNA in Rep-
roduction and Development/Ed. M. C.
Niu, S. J. Segal. Amsterdam: North-
Holland, 1973, p. 324—329.
Warkany J. Etiology of congenital
malformations.— Adv. Pediatr., 1947,
2, p. 1—63.
Warner C., Versteegh L. In vivo and
in vitro effect of a-amanitin on
preimplantation mouse embryo RNA
polymerase.— Nature, 1974, 248,
p. 678—680.
Warner N. L., Moore M. A. S. Defects
in hematopoietic differentiation in
NZB and NZC mice.—J. Exp. Med.,
1971, 134, p. 313—334.
Wartiovaara J., Nordling S., Lehto-
nen E., Saxen L, Transfilter indu-
ction of kidney tubules: Correlation
with cytoplasmic penetration into nu-
cleopore filters.—J. Embryol. and
Exp. Morphol., 1974, 31, p. 667—
682.
Wasser mann G. D. Molecular control of
cell differentiation and morphogene-
sis. New York: Dekker, 1972.
Watney M. J., Miller J. R. The effect of
cortisone on the penetrance of an
eye mutant in the house mouse.—
Proc. XI Intern. Congr. Genet, the
Hague, 1963, vol. 1, p. 183.
Watson J. D. Molecular biology of
the gene. New York: W. A. Benja-
min, 1970.
Watson M. L. Further test for the iden-
tity of «dysoptic» with «blind» in
mice.— Proc. Iowa Acad. Sci., 1966,
73, p. 384—387.
Weatherall D. L, Clegg J. B. Molecular
281
genetics of human hemoglobin.—
Annu. Rev. Genet., 1976, 10, p. 157—
178.
Weber R. Biochemistry of amphibian
metamorphosis.— In: Biochemistry of
animal development/Ed. R. Weber.
New York; London: Acad. Press,
1967, vol. 2, p. 227—301.
Wegmann T. G. Enzyme patterns in
tctraparental mouse liver.— Nature,
1970, 225, p. 462—463.
Wegmann T. G., LaVail M. M., Sid-
man R. Patchy retinal degeneration
in tetraparental mice.—Nature, 1971,
230, p. 333—334.
Weiner W., Lewis H. В. M., Moores P.,
Sanger R., Race R. R. A gene, y,
modifying the blood group anti-
gen A.—Vox sang., 1957, 2, p. 25—
37.
Weintraub H. The organization of red
cell differentiation.— In: Cell cycle
and cell differentiation/Ed. J. Rei-
nert, H. Holtzer. Berlin-: Springer-
Ver I., 1975, p. 27—42.
Weintraub H., Campbell G. LeM., Holi-
zer H. Primitive erythropoiesis in
early chick embryogenesis. I. Cell
cycle kinetics and the control of
cell division.— J. Cell Biol., 1971, 50,
p. 652—668.
Weiss M. The use of somatic cell hybri-
dization to prode the mechanism
which maintains cell differentia-
tion.— Excerpta med. Intern. Congr.
Ser., 1976, N 397, p. 19—20.
Weissmann A. Vortrage fiber Descen-
denztheorie. Jena, 1904.
Whaley G., Dauwalder M., Kephart J. E.
Assembly, continuity, and exchanges
in certain cytoplasmic membrane sy-
stems.— In: Origin and Continuity
of Cell Organelles. Berlin: Springer,
1971, p. 1—45.
Wheldon T. E., Kirk J. Induction, dif-
ferentiation and oncogenesis.— J.
Theor. Biol., 1973, 41, p. 261—268.
Whisson M. E. Cytoplasmic inheritan-
ce in metazoa and its relationship to
cell phenotype. I. Hypothesis.— Neo-
plasma, 1970a, 17, p. 451—462.
Whisson M. E. Cytoplasmic inheritance
in metazoa and its relationship to
cell phenotype. II. Preliminary expe-
riments on the effect of cytoplasmic
particles on ascites tumour cells.—
Neoplasma, 1970b, 17, p. 463—474.
White J. M. The synthesis of abnormal
haemoglobins — Biochimie, 1972, 54,
p. 657—663.
Whittaker J. R. The melanotic expres-
sion of embryonic pigment cells: re-
gulation in vitro and in situ.— In:
Control Mechanisms in the Expres-
sion of Cellular Phenotypes/Ed.
H. A. Padykula. New York: London:
Acad. Press, 1970, p. 89—108.
Whitten J. M. Cell death during early
morphogenesis: parallels between in-
sect limb and vertebrate limb deve-
lopment.— Science, 1969, 163,
p. 1456—1457.
Whitten W. K., Dagg С. P. Influence
of spermatozoa on the cleavage rate
of mouse eggs.—J. Exp. Zool., 1962,
148, p. 173—183.
Williams J. G., Penman S. The messen-
ger RNA sequences in growing and
resting mouse fibroblasts.— Cell,
1975, 6, p. 197—206.
Williamson B. DNA insertions and
gene structure.—Nature, 1977, 270,
p. 295—297.
Wilson D. B. Proliferation in the neural
tube of the splotch (Sp) mutant
mouse.—J. Comp. Neurol., 1974, 154,
p. 249—256.
Wilson D. B., Center E. M. The neural
cell cycle in the loop-tail (Lp) mu-
tant mouse.— J. Embryol. and Exp.
Morphol., 1974, 32, p. 697—705.
Wilson E. B. The cell in development
and heredity. New York: Macmillan,
1925 (Пер. с англ.: Вильсон Э.
Клетка и ее роль в развитии и на-
следственности. М.; Л.: Биомедгиз,
1936, т. 1—2, 1940).
Winfield J. В., Bennett D. Gene-terato-
gen interaction: potention of actino-
mycin D teratogenesis in house mou-
se by the lethal gene brachyury.—
Teratology, 1971, 4, p. 157—169.
Winick M., Grant P. Cellular growth
in the organs of the hypopituitary
dwarf mouse.— Endocrinology, 1968,
83, p. 544—547.
Winson E. J. T., Ferguson-Smith M. A.,
Shire J. G. M. Meiotic studies in mi-
ce carrying the sex reversal (Sxr)
factor.— Cytogenet. and Cell Genet.,
1978, 21, p. 11 — 18.
Wissinger 'W., Wang R. J. Studies on
cell division in mammalian cells. IV
A temperature-sensitive cell line de-
fective in postmetaphasc chromosome
movement.— Exp. Cell. Res., 1978,
112. p. 89—94.
282
Wobus U. Die Wirkung von Hormonen
auf dor Transkriptionsebene.— Biol.
Rdsch., 1971, 9, S. 155—163.
Woerdeman M. W. Eye-lens develop-
ment and some of its problems.—
Proc. Koninkl. nederl. acad. wet. C,
1962, 65, p. 145—159.
Wolfe H. G. Allelic interactions in
mouse pink-eyed dilution mutants.—
Genetics, 1975, 80, SuppL, pt 1, p. 85
(Abstr.).
Wolff E., Kieny M. Mise en evidence d’u-
ne action inhibitrice de 1’cxtrait d’emb-
ryons de la race de poules «Courtes-
pattes» Creaper sur la croissance
des tibias cultives in vitro.— C. r.
Acad, sci., 1957, 244, p. 1089—1091.
Wolff E., Kieny M. Recherches sur la
nature d’un facteur inhibitcur de la
croissance des os longs dans la race
du poule Creeper.— Develop. BioL,
1963, 7, p. 324—342.
Wolff J. A., Hofe F. H. von. Familial
erythroid multinuclearity.— Blood,
1951, 6, p. 1274—1283.
Wolpert L., Gingell D. Striping and the
pattern of melanocyte cells in chi-
macric mice.— J. Theor. BioL, 1970,
29, p. 147—150.
Wolpert L., Lewis J., Summerbell D.
Morphogenesis of the vertebrate
limb.—Ciba Found. Symp., 1975, 29,
p. 95—119.
Wood W B. Genetic control of bacte-
riophage T4 morphogenesis.— In:
Genetic Mechanisms of Development/
/Ed. F. H. Ruddle. New York: Acad.
Press, 1973, p. 29—46.
Wright D., Shaw Ch. Time of expres-
sion of genes controlling specific
enzymes in Drosophila embryos.—
Biochem. Genet., 1970, 4, p. 385—
394.
Wright D. A., Subtelny S. Nuclear and
cytoplasmic contributions to dehydro-
genase phenotypes in hybrid frog
embryos.— Develop. BioL, 1971, 24,
p. 119—140.
Wright S. Genic interaction.— In:
Methodology in mammalian genetics/
/Ed. W. J. Burdette. San Francisco:
Holden-Day, 1963, p. 159—188.
Wudl L., Chapman V. M. The expres-
sion of f-glucuronidasc during
preimplantation development of mou-
se embryos.—Develop. BioL, 1976,
48, p. 104—109.
Wudl L. R., Sherman M. I. In vitro
studies of mouse embryos bearing
mutations at the T locus: tw5 and
t12.—Cell, 1976, 9, p. 523—531.
Wylie С. C. The appearance and quan-
titation of cytoplasmic ribonucleic
acid in the early chick embryo.— J.
Embryol. and Exp. Morphol., 1972,
28, p. 367—384.
Yamada T. Cellular and subcellular
events in Wolffian lens regenera-
tion.— Curr. Top. Develop. BioL,
1967, 2, p. 249—283.
Yamada T. Control mechanisms in cel-
lular metaplasia.— In: Cell Differen-
tiation/Ed. R. Harris, P. Allin, D.
Viza. Copenhagen: Munksgaard,
1972, p. 56—60.
Yataganas X. Gahrton G., Thorell B.
DNA, RNA and hemoglobin during
erythroblast maturation. A cytopho-
tometric study.— Exp. Cell Res.,
1970, 62, p. 254—261.
Yoon С. H. Disturbances in develop-
mental pathways leading to a neuro-
logical disorder of genetic origin,
«leaner», in mice.— Develop. BioL,
1969, 20, p. 158—181.
Yoon С. H. Fine structure of the ce-
rebellum of «staggerer-reeler», a doub-
le mutant of mice affected by stag-
gerer and reeler conditions. I. The
premature disappearance of the exter-
nal granular layer and ensuing cere-
bellar disorganization.— J. Neuro-
pathol. Exp. Neurol., 1977a, 36,
p. 413—426.
Yoon С. H. Fine structure of the cere-
bellum of «staggerer-reeler», a doub-
le mutant of mice affected by stag-
gerer and reeler conditions. II. Pur-
kinje cell anomalies.— J. Neuro-
pathoL Exp. Neurol., 1977b, 36,
p. 427—439.
Yoon С. H. Fine structure of the cere-
bellum of «staggerer-reeler», a doub-
le mutant of mice affected by stag-
gerer and reeler conditions. III. Ber-
gmann fiber anomalies.— J. Neuro-
pathol. Exp. Neurol., 1977c, 36,
p. 440—452.
Yoon С. H., Coffey A. K. Interaction of
cerebellar mutant genes. IL Mice
doubly affected by «reeler» and
«weaver» conditions.— Brain Res.,
1975, 96, p. 219—232.
Yoshida K, Katoh A. Crystallin syn-
thesis by chicken lens. III. mRNA
stabilization under in vitro culture
conditions.— Exp. Cell Res., 1972, 71,
p. 361—371.
Yurov Yu. В. [Юров Ю. Б.] DNA re-
283
plication in human diploid cells of
different origin.— Cell Different.,
1977, 6, p. 95—104.
Zimmermann F. K. Allelic interactions
at the genetic and protein level.—
Biol. ZbL, 1972, 91, S. 17—29.
Zwaan J. Mitotic activity in the lens
rudiment of the chicken embryo be-
fore and after the onset of crystal-
lin synthesis. II. Immunofluorescence
studies.—Roux’Arch., 1974, 175,
S. 13—25.
Zwaan J. Immunofluorescent studies
on aphakia, a mutation of a gene
involved in the control of lens dif-
ferentiation in the mouse embryo.—
Develop. Biol., 1975, 44, p. 306—312.
Zwilling E. The role of epithelial com-
ponents in the developmental origin
of the «wingless» syndrome of chick
embryos.— J. Exp. Zool., 1949, 111,
p. 175—187.
Zwilling E Inductive mechanisms.—
In: 1st Intern. Conf. Malformations.
Philadelphia; Montreal: Lippincott,
1961, p. 133—139.
Zwilling E. Limb morphogenesis.— De-
velop. Biol., 1972, 28, p. 12—17.
Zwilling E., Hansborough L. A. In-
teraction between limb bud ectoderm
and mesoderm in the chick embryo.
III. Experiments with polydactylous
limbs.— J. Exp. Zool., 1956, 132,
p. 219-239.
указатели
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Автономность клеток 46
Агрегация бластомеров 41, 50, 125, 194 , 239
--метод 145—146
— клеток 226, 229
— меланосом 233
Адгезия 226, 229
Аддитивное взаимодействие генов 34, 35
Адреналин 196
Акаталаземия 11, 53
Акридиновый оранжевый 164—165
Акросома 214—215
Аксолотль 99, 124. См. также Ambystoma
— метаморфоз 79
— мутантные гены 47, 53 , 57, 111—113, 124,
166, 167
Активация генов 108—114
Актин 176
Актиномицин D 22
Аланинаминотрансфераза 86
Алкогольдегидрогеназа 86
Аллельное исключение 16—18
Аллельные гены 14—16, 20
Аллоантигены 227
Аллофенные мыши 147
Аллофены 46
Альбумин ,176
Альдолаза 86, 208
Амилаза 176
Аминоацил-тРНК-синтетаэы 205
Амплификация генов 9
Амфибии см. также Аксолотль; Лягушка;
Тритон
.— влияние гормонов на развитие 79
-— гемоглобины 197, 198
— генетика 6
— метаморфоз 231
— пересадка ядер 66—69
— сетчатка 171
— хрусталик 164
— цитодифференцировка 191
— экспрессия генов 109—114
Андрогенез 65—66, 244
Андрогены 224
Анемии у мышей 21—22, 63
— у овец 95
— у человека 39
Анофтальмия 21, 174
Антигены плазматической мембраны 117,
224, 225, 228
— эритроцитарные 39, 40
Апикальный эктодермальный гребень
см. АЭГ
а-Арилэстераза 16
Асимметрия расположения органов 229—
230
Аскарида, элиминация хромосомного ма*
териала 149
Атаксия 63
Аутофены 45—46
Ахондроплазия 12, 99
Ацетилхолинэстераза 90
Ацетобулярия 213—214
АЭГ 219
— гибель клеток 237
— размножение клеток 122
— роль в морфогенезе 222—223
--в эмбриональной индукции 166, 192
Бактериофаги 211—212
Белково-белковое узнавание 107, 241
Белок (белки) 26, 32, 33. См. также По-
вторяющиеся белки; Специфические
белки; Ферменты
— влияние на развитие 1'12, 113
— гетерополимерные 26, 27, 31—33
— дрожжей 129
— и компетенция клеток 169
— и морфогенез 212—213, 230
— мутантные 11 — 14
— полиморфизм 26
— синтез 9—10, 87, 88, 108—120, 173, 175—
189, 227
--в гетерокарионах 68, 69, 83
--в клеточном цикле 128—129, 137
— транспортные 54
— хромосом см. Гистоны; Негистоновые
белки
Бесплодие 55, 57, 58
Бластомеры см. также Агрегация
— и «программа смерти» 237
— тотипотентность 145, 155
Близнецы 125
Болезнь Вильсона 62—63
— Вольмана 12
— Менкеса 63
— Фабри 30
— Хартнепа 54
Большеберцовая кость, нарушение разви-
тия 22—25, 34
5-бромдезоксиуридин 171
Вегетализирующий фактор 72
Взаимодействие генных продуктов 19—20
- генов 5, 19-64, 92—106, 241
— клеточных систем 166
— межклеточные 70—75, 155, 160, 207, 225—
226, 237, 242
— наследственных и экзогенных факто-
ров 5
— регулирующих белков и ДНК 81—87
- РНК и ДНК 93
— ядра и цитоплазмы см. Ядерно-цито-
плазматические взаимодействия
285
Вирусы 160
Волосы морской свинки 34, 38
— мышей, нарушения развития 48, 51
---пигментация 51, 57, 191
---строение 230
— человека при болезни 63
Вторичные индукции 56—64, 71
Галактоземия 11, 30, 56
Галактозидазы 30, 89, 95, 96, 116
Галактозо-1-фосфат 56
Галактозо-1-фосфатуридилтрансфераза 11,
56
Ганглиозная пластинка см. Нервный гре-
бень
t-гаплотипы 27, 28
Гаптоглобины 12
Гемин 88
Гемоглобины 9, 13, 182—186
— синтез 88, 94 , 95, 129, 169, 176, 188-189,
197—198
— тины 32—33
Гемопоэз 161—163, 196—198
Гемохроматоз 62
Генетика, исторический обзор 3—4
Генетическая инженерия 243—244
Генетический контроль гемоглобинов 33
---клеточного цикла 129—135
--- развития 4, 5
---синтеза иммуноглобулинов 16
---старения и смерти 237, 238
Генная терапия 243—244
Геном митохондриальный 114
— суммарный 154
— эффективный 154
Гены см. также Локус; Митохондриаль-
ные гены; по названиям животных
— анцестральные 117
— в раннем эмбриогенезе 108—120
— гибели клеток 238
— главные 32
— глобиновые 90, 95, 184
— гомологичные 6
— действие 8—64
— и дифференцировка клеток 143—211
— и морфогенез 212—240
— «локальные», «нелокальные» 41
— «молчащие» 86, 207
— регуляция активности 5, 65—107
— строение 9, 10
Гены-интеграторы 93, 198
Гены-модификаторы 31, 32
Гены-операторы 92
Гены-регуляторы 92—106
---мутации в них 56
Гепаран N-сульфатазы 74
Гетероаллелн 30, 31
Гетерозиготность 31
Гетерозис 31
Гетерокарионы 90, 138
— гены 17, 30
— синтез ДНК 137
— эритроцит курицы — клетка мыши 68—
69
------клетка HeLa 83
Гетеротипические взаимодействия 70
Гетерохроматизация 17
Гетерохронии развития 61
Гибель клеток 3, 21, 231—240
---мозжечка 50
— меланобластов 49
— эмбрионов 47, 111, 112, 117—120
Гибридизация см. также Гибриды
— морских ежей 3
-РНК и ДНК 76, 78, ПО, 111, 115, 152,
154, 181
— соматических клеток 5, 68, 86
Гибриды 3
— взаимодействие геномов 86—91
— лошади и осла 200
— межвидовые 14—15, 109, 114, 158
— мерогониальные 3
— соматических клеток 86, 133, 135, 137—
138. См. также Гетерокарионы
Гидрокортизон 76, 90, 169
Гидроцефалия 64
Гиногенез 244
Гипоксантин 74
Гипоксантингуанинфосфорибозилтранс-
фераза 116
Гипоксантин-фосфорибозилтрансфераза 74'
Гипомеланизм 233, 234
GST-гипотеза 156—157
Гипофиз 51, 57
Гипофизарная карликовость 79
Гипохромная анемия 21—22, 63
Гистоны 81-82, 106, 136—137, 241
Гистосовместимость 39
— локусы 39, 117, 227, 228
Глаз см. также Пигментный эпителий;
Сетчатка; Хрусталик
— место проявления мутантных генов 217
— развитие 163, 164
----нарушение у мышей 28, 35—37, 42—
45, 59—63, 123-125, 167
Гликолиз 56
Гликопротеиды 133
Глицеральдегидфосфатдегидрогеназа
Глицерол-З-фосфатдегидрогеназа 90
Глобины 10, 88, 94, 95
— в гетерокарионе 90
Глутаматоксалацетат-трансаминаза 114
Глутаматсинтетаза 84
Глухота 215
Глюкозо-1-фосфат 56
Глюкозо-6-фосфатаза 54
Глюкозо-6-фосфатдегидрогеназа 17, 199—
200
— мулов 18
Глюкозофосфатизомераза 13, 15, 114, 116г
194
Р-Глюкуронидаза 15, 50, 89, 95, 96
Головной мозг, клеточный цикл 130, 131
----нарушение развития 51, 228
----происхождение 194
— уникальные последовательности 154—155
Гомеостаз 19, 21—23, 75
Гомоаллели 30—31
Гомозиготы тройные 43
Гомокарион 138
Гомотипические влияния 70, 242
Гомоцистинурия 56—57
Гонады 224
Гоноциты 190
Гормон роста 80, 89—90
Гормоны см. также по названиям
— влияние мутаций 57
---- на гибель клеток 237
----на развитие 70, 76—79
----на экспрессию генов 75—81, 87
Градиенты концентраций 70
Движение клеток 3. См. также Миграция
клеток
Дезоксирибонуклеиновая кислота (ДНК)-
8—10, 93, 106, 121, 241. См. также Комп-
лементарная ДНК; Репарация ДНК;
Репликация ДНК
----взаимодействие с белками 81—87
----в раннем эмбриогенезе 109, ПО,
114—116
----в хрусталике 149, 182, 183
---- постоянство 149
----синтез 127, 128, 132, 136-142
----в пересаженном ядре 67
----— у мутантов 35
286
Декодирование генетической информации
10, 65
Деление клеток 3. См. также Митотиче-
ские циклы
— блок 242, 244
— стимуляция 169
Делеции 9, 56
Дерепрессия (генов) в гетерокарионе 68—
69
— влияние гистонов 82
---- на гибель клеток 237
— в раннем эмбриогенезе 108—120
— и состояние хромосом 169—170
— последовательность 215—225
— при малигнизации 209
—^при цитодифференцировке 154—158, 173,
Дерепрессоры 211
Детерминация (развития клеток) 158—169,
189, 191, 211, 213
— определение 159
— плазматических мембран 227
— стволовых клеток 203—204
Дигидротестостерон. 96, 224
Диета 22
Дифференцировка 3, 65, 208, 209. См. так-
же Цитодифференцировка
— гипотеза 156—157
— и детерминация 159—160
— клеток и гены 143—211
— обратимость ее 202, 203
— роль в морфогенезе 213
---- инактивации хромосом 12—18
----межклеточных взаимодействий 75
ДНК см. Дезоксирибонуклеиновая кисло-
та
ДНК-полимераза 136
Доза гена 13, 22
Дозовая компенсация 17
Долголетие 237
Доминантно-рецессивные отношения 20,
26
Доминантные гены 20, 32
Дрожжи 129
Дрозофила 160, 161
Железо, обмен 51, 54, 63
Закон гомологических рядов 6
Заместительная терапия 11—12
Зигота 3, 8, 108
Злокачественность 156—157
Зубы 204
Идуронатсульфатаза 73
a-L-идуронидаза 73, 74
Изоцитратдегидрогеназа 194
Имагинальные диски 160, 161
Иммунная система 199
Иммуноглобулины 19, 88, 129
Инбредные линии 244
Индукция см. Эмбриональная индукция
Индукцирующая ткань 71, 132, 166
Индуцирующие вещества 71—75, 159, 160
— факторы 241
Индуцирующий белок 71
Инициаторные клетки 189, 190, 193
Инсулин 78-79, 169, 176, 186—187
Интеграция клеток 3, 225—231, 245
Интроны 9
Информационные РНК (иРНК) 5, 9, 10,
13-16, 20, 68, 88, 121, 176
----в гибридных клетках 87
----в раннем эмбриогенезе 108—111, 113—
116, 189
----в хрусталике 181, 182
----глобиновые 182, 183
----определение 76, 78
--------роль в детерминации 161
---в эмбриональной индукции 72, 161
Ииформосомы 189
иРНК см. Информационные РНК
Казеин 169, 176
Камбиальные клетки 203
«Канализация» развития 19
Канцерогенез 204—211
Канцерогены 208
Карликовость у мышей 57, 79, 99
Каскадный принцип развития 243
Каталаза 89
Кейлоны 126—127
Кенгуру 8
Кератины 196
Кислая фосфатаза 116
Кислые ядерные белки 241
Клеточная пролиферация см. Пролифера-
ция
Клеточные клоны, гибель 232, 233
---взаимодействие генов 44
---Дифференцировка 189—200, 242
— контакты 71
— линии 191, 192
— циклы 97, 98, 126—142, 169—175
Кодоминантность генов 11—14, 16, 20
Количественные признаки 32
Коллаген 53, 113, 176, 188
Колцемид 242
Коммитирование 161
Компетентная ткань 71, 166
Компетентные клетки 166
Компетенция 166, 168, 223
Комплементарная ДНК (кДНК) 76, 95
Комплементарность 30—32
— молекул 227
Конечности, детерминация развития 167
— кур, проявление мутантных генов 58,
61—62, 219, 220, 222—223, 229, 230
---гибель клеток 234—236
— мышей, нарушение развития 22—25, 34,
58, 62, 64, 219, 221, 224
---в культуре 99—104
Корреляционная система 166
Кости см. также Скелет
— конечности, отбор на длину 224
Краниосхизис 133
Креатинфосфокиназа 171
Креатины 176
Кристаллины 10, 164, 165, 173—182, 202—
203
Критические клеточные циклы 170—173
Кролики 9, 115, 122
Кроссинговер 94
Крысы, гепатома 86
— мутантные гены 50, 61
— нарушение развития глаз 50, 52, 61
— наследственные болезни 79
— поджелудочная железа 186, 187
Культура (in vitro) 46, 52
— выявление автономности признака 124
— детерминация клеток 160—161
— клеточный цикл 132—133, 137—139, 141
— определение межклеточных влияний
73—75
---места действия гена 48—51
--- плейотропии 58
— органа 167
— пролиферация 169
— синтез специфических белков 178—179,
188
— цитодифференцировка 192, 204
— эмбрионов 100—103
Куриные эмбрионы 6, 76—79
— аномалии скелета 219
— гемоглобины 169, 185, 188—189, 197
— линии 141
— мутантные гены 9, 58, 61, 62, 167, 219,
220, 222, 223, 229, 234—236
— развитие хрусталика 181
цитодифференцировка 191, 192, 198
287
Лайонизация 199
Лактатдегидрогеназа 13, 88, 89, 97, 114, 116
Лактоглобулин 176
Лентоиды 202—203
Лизоцим 77
Локус ЛДГ 97
— Н 39, 117
— mottled 63
— Rec 39—40
- se 122
— Т 26, 27, 31, 117—119, 227, 228
— Tem 39, 40
Лягушки см. также Rana
— гибриды 15
— пересадка ядер 205
— эмбриогенез 114
Макроцитарная анемия 55, 57
Малатдегидрогеназа 16, 114
Медь, обмен 62—63
Межаллельная комплементация 20, 26—31
Межклеточные взаимодействия см. Вза-
имодействия
— контакты 72, 226
Мезенхима, морфогенез 100, 222
— гибель клеток 234—236
Мезодерма, индукционные влияния 71
Меланин 48, 89
Меланобласты 49, 195
— гибель 232, 233
Меланогенез 36—37, 48—50, 55
Меланосомы 34, 37, 47, 233
Меланоциты 40—41, 195, 233—234
Метаболизм 96
— нарушения 51, 54, 62—63
Метаболическая кооперация 74, 75,
Металлы, нарушение обмена 51, 54, 62—
63
Метаморфоз 79, 231, 237
Метаплазия 200, 203
Методы см. также Культура; Парабиоз;
Радиоавтография; Трансплантация
— андрогенеза 65
— гибридизации соматических клеток 5, 67
—^Дермально-эпидериальиой комбинации
— микрохирургии 244
— определения места действия гена 46—52
— пересадки ядер 5, 149—153
— получения химер 145—148
Механика развития 4, 5
Миграция клеток 225—231
Миелинизация, нарушение 51
Р-2-микроглобулин 117, 228
Микроклоны 208
Микрофтальмия 21, 62
— у мышей 41, 55, 59—60
Микроцитарная анемия 54, 125
Миобласты 170—171, 190—192
Миоглобин 176
Миозин 170—171, 173, 176
Митоз, длительность 133—135
— пролиферативный и критический 170—
173
Митомицин С 242
Митотический аппарат, нарушение 118
— индекс 124
— цикл 126—142, см. также Клеточные
циклы
--влияние мутаций 36, 37
Митохондриальная ДНК 109, 158
Митохондриальные гены 6, 108, 158
Митохондриальный геном 1.14, 158
Митохондрии 118, 157, 158
Млекопитающие, активность генов 114—
120, 240
— развитие хрусталика 164
Мозаики 147
Мозаицизм окраски шерсти 17
— функционально-генетический 199
Мозаичная организация гена 10
Мозжечок, аномалии развития 34, 35,
228-229
Молекулярные карты 227
«Молчащая» ДНК 9, 10
Морские свинки 34, 38
Морфогенез 241—243
— механизмы 212—240
Морфогенетические корреляции 59
Мочеполовая система, нарушения разви-
тия 34, 61, 62, 224—225
Мукополисахаридоз 53, 73
Мукополисахариды 53
Мультифакториальное наследование 32
Мутации 11, 33
— и малигнизация 207
— как причина плейотропии 53, 55—56
Мыши см. также Химерные мыши
— аномалии скелета 219
— дробление 122
— продолжительность жизни 238
— символика и эффекты мутантных генов
см. Указатель латинских названий ви-
дов и генов
Мышцы 171, 194—195, 203
НАДФ-изоцитратдегндрогеназа 13
Наследственные болезни 3, 243. См. также-
Болезнь; Синдром; Человек
Неаллельные гены 31—44
Невроз 39
Негативный контроль экспрессии генов 91
Негистоновые хромосомные белки 82—85,
141-142, 241
Нейрализующий фактор 72
Неостения 79
Нервная система, индукционные влияния
61, 165
---место действия генов 50, 51
---митотическая активность 133—134
---развитие 171, 242
------гибель клеток 231—233
------детерминация 159
—.----нарушения 37—38, 44, 56, 119, 122—
124
Нервно-мышечные заболевания 51
Нервный гребень, гибель клеток 233
---детерминация 168
---нарушение развития 49, 55, 124
Нехромосомные наследственные факторы
114, 157, 158
Норки 34, 119, 194
Овальальбумин 9, 77, 78
Овцы, антигены 40
— гемоглобины 94, 95
Онтогенез 3—5, 213
— активность генов 14, 65, 225
Оогенез, активность генов 93, 114—113
- синтез ДНК 137
Оперон, модель 92—93
Органное сродство клеток 226
Органогенез 215,—225, 243
Остеогенез 53
Парабиоз 46, 47
— аксалотлей 53, 59, 166
— тритонов 58
Пенетрантность генов 5
Пепсин 176
Первичная индукция 70—71
Пересадка (трансплантация) ядер (в яй-
цеклетки) 5, 66—70, 112, 137, 149—154, 244
---серийная 151—153
Пермеазы 54
Перья (птичьи), проявление мутантных
генов 55, 229, 233—234
— развитие 196
288
Песцово-лисьи гибридЪ! 88—89
Печень 195, 208
Пигментная ксеродерма 30
Пигментный эпителий, обратимость диф-
ференцировки 202—203
----развитие 193—194
Плазматическая мембрана, антигены 117,
224, 225, 228
----нарушение структуры 53—55, 113
----роль в малигнизации 205, 207
------в морфогенезе 219, 225—231
------в регуляции деления клеток 140—
141
----самосборка 212
Плейотропия 44—64
Плюрипотентные клетки 204, 205, 208
Повторяющиеся гены 154
Поджелудочная железа, белки 176, 186—
187
----Р-галактозидаза 96
----индуцирующие влияния 71
---- развитие 186
Позвонки, развитие 195
Позитивная контрольная система 91
Полигенное наследование 32, 44
Полидактилия 235
Полимерия 31, 32
Половая реверсия 224—225
Половой хроматин 199
Поляризующий фактор 224
Порфирия 53
Постранскрипционная регуляция 11, 15
----и аллельное исключение 16, 18
----и клеточная пролиферация 139, 140
Посттранскрипционный блок 91
— контроль 87—92
Посттрансляционная регуляция 5, 65
Преимплатационный период развития 115.
См. также Эмбриогенез
Пренатальная диагностика 52
Прогестерон 76, 77
Пролиферативные клеточные циклы 169—
175
Пролиферация клеток в культуре 169
----генетический контроль 37, 41, 55, 57,
121-142, 137, 139
----гемопоэтических 198
----и синтез специфических белков 178,
187, 189
----роль в морфогенезе 213
----,— гистонов 136
Промотор 106
Проспективные потенции тканей 158—159
Протеогликан 221
«Протовирусная» гипотеза 160
Процессинг 5, 9, 65, 87
Птицы см. также Куриные эмбрионы
— гемоглобины 197
— перья 55, 196, 229, 233—234
— эмбриогенез 108, 114
Радиоавтография, определение индуктора
72, 75
----клеточного цикла 171—172
---- места действия генов 52
----синтеза белков 113
---- ядерной активности 68
Радужная оболочка 202
Размножение клеток 3. См. также Проли-
ферация
Распознавание клеток 228
— молекул 107, 241
Растения 154
Расщепление нёба 32
Регенерация 103, 203, 204
Редифференцировка 207—208
Репарация ДНК при пигментной ксеродер-
ме 30
---- роль в гибели клеток 238
Репликация ДНК 136, 138, 139, 142
— гена 10, 169
Репликоиы 136
Репрессия генома 154
Репрессия — дерепрессия генов 82, 85
Рецессивные гены 20
Рибонуклеиновая кислота (РНК) см. так-
же Рибосомные РНК; РНК-полимераза;
Транспортные РНК
--- активаторная 93
---в клеточном цикле 128, 137, 141
---в раннем эмбриогенезе 106, 108—111,
113—116
--- в хромосомах 85
--- переход из клетки в клетку 160
---при пересадке ядер 67—69
Рибосомные РНК (рРНК) 10, 68
---в раннем эмбриогенезе 111, 114, 115
---синтез в клеточном цикле 129
Рибосомы 111, 129, 133, 189
РНК см. Рибонуклеиновая кислота
РНК-полимераза 83, 106
рРНК см. Рибосомная РНК
Рыбы, гены 108—109
— гибриды 15
Самодифференцировка 159
Самосборка белковых структур 212
Свиньи 40
Селективная активация генов 158
Сердце, врожденные заболевания 32
— нарушения развития 59, 166
Серповидно-клеточная анемия 20
Сетчатка, дегенерация 41, 50, 81, 192, 193
— индукционные влияния 164
— клеточный цикл 130
— обратимость дифференцировки 203
— пролиферативная активность 137—138
— развитие 171—173, 192—194 , 242
---нарушение у крыс 50, 61, 171—173
------у мышей 35-37, 39, 43, 45, 59-61,
217—219
------ у человека 62
Синдактилия 235
Синдром Бонневи — Ульриха 64
— Дауна 13
— Леша — Наяна 245
— Ниемана — Пика 53
— при нарушениях метаболизма 56
— Санфилипо 73
— Хантера 73
— Хурлера 73
Синергизм взаимодействия генов 33—37
Синкарион 30, 138
Синхронность активации генов 14—16
Скелет, нарушение развития 22—25, 34, 55,
62, 223-224
— наследственные аномалии 219
Смерть клеток см. Гибель
Сомиты 71, 168, 195
Сперматогенез 214—215
— нарушения 50
Специфические белки 175—189
Старение 231—240, 243
Стволовые клетки 125, 161—163, 189—200,
203, 230, 242, 245
---миграция 229
«Суперген» 28, 117
Супероксидднсмутаза-1 13
Сфингомиелин 53
Талассемии 13—14, 39
Температурочувствительные клеточные
клоны 132—133, 135
Теория зародышевой плазмы 144
Тератогены 21—22
Тератокарциномы 17, 204—207, 245
Тератомы 204
Тимидинкиназа 136
289
Тиреоидные гормоны 79-81, 198
Тироглобулин 176
Тирозиназа в гибридных клетках 89
— влияние мутаций 33, 36, 37, 63
— в пигментных клетках 98, 99
— в раннем эмбриогенезе 113
Тирозинаминотрансфераза 76, 88, 129
— в гепатоме 97, 98
— в гибридных клетках 86, 90
Тироксин 198
Тканеспецифические продукты 51—52
Тотипотентность клеток зародышей 144—
148, 154, 189, 239
-- растений 154
-- тератокарцином 245
— ядер гоноцитов 190
Транскрипция (транскрибирование) б, 10,
11, 65, 106, 158, 164—165
— блокирование — деблокирование 85
— влияние цитоплазмы 69
— и аллельное исключение 16
— контроль 81—88
— при малигнизации 209
— регуляция клеточной пролиферации 139,
141
— уникальных последовательностей 154—
155
Трансляция 5, 9, 14, 65, 88, 161, 176
— блокирование 142
— влияние цитоплазмы 69
Трансплантация 46, 48—50, 57, 59. См. так-
же. Пересадка ядер
— почек конечностей мутантов 166, 223
— эмбрионов в семенник 209
Транспорт веществ, нарушение 53—54, 63
— иРНК 5, 65, 87
Транспортные РНК (тРНК) 10, 68, 108, 115
Трансферрины 12, 88—89
Трипановый синий 21, 22
Трипсин 176
Тритоны см. также Pleurodeles
— регенерация хрусталика 175
— клеточное ядро 149
тРНК см. Транспортная РНК
Уникальные последовательности 10, 115,
116, 154-155
Уридинфосфат-глюкозо(УДФГ)-4-эпиме-
раза 186
Уропорфириноген-1-синтетаза 53
Ухо 41, 55
— развитие 215
--нарушение 61, 63, 130, 216
Фагоцитоз 231
Фактор реверсии пола 224—225
Феногенетика 4, 5, 7
Фенокриз 14
Феомеланин 49
Ферменты 10, 46, 53, 88, 115. См. также
по названиям
— гетерополимерные 30, 31
— и плейотропия 56
— мутантные 11—14, 33
— при наследственных болезнях 73—75
— роль в морфогенезе 212
Фетальный гемоглобин 94
Фибробласты в культуре 169, 192
— мутации 52
— при наследственных болезнях 73—75
— срок жизни 238
Физиологическая генетика 4
Физиология развития 4, 5
Фосфоглицераткиназа-А 18
Фосфоглюкомутаза 56
6-фосфоглюконатдегидрогеназа 15, 16, 114
Фоторецепторы, влияние пигментного эпи-
телия 61
— дегенерация 50, 52
— дифференцировка 171, 192—493
5-фторурацил 21
Химерные мыши 41—42, 44, 145—148, 224—
225, 243
----волосы 194 , 230, 232—233
----и клональная теория 189—190, 192—
195
---- и тотипотентность клеток 148
---- определение места действия
46—48, 50, 51
----получение 145—148
---- инъекцией опухолевых клеток
205-207, 244—245
----пролиферация клеток 125
— органы 193, 207
Химическая дифференцировка 159
Химические мутагены 115
Химотрипсин 176
Хондрогенез 169, 186, 190, 191, 236
Хондроитинсульфат 191
Хондромукопротеид 173, 188
Хондроциты 169
Хорда, индукционные влияния 61, 70—71
— нарушение развития 117—119
Хордомезодерма, индукционные влияния
ИЗ
— нарушение развития 117—419
Хромаффинная ткань 196—197
Х-хромосома 17—18, 199, 200
Хромосомы 8, 81—87, 111, 136, 149, 169
— в пересаженных ядрах 152
Хрусталик, белки 175—183
— развитие 122, 163—165, 217
----нарушение 21, 28—29, 43, 59, 60, 132,
174, 217—218
Хрящевая ткань 188—189
Целомический эпителий, индукционные
влияния 62
Центральная нервная система см. Нерв-
ная система
Циклический аденозинмонофосфат (цАМФ>
78
Цитодифференцировка 242, 243
— и дерепрессия генов 154—158
— и канцерогенез 204—211
— клональная теория 189—200
— необратимость 200—204
Цитоплазма бластомеров 155
— индукция синтеза ДНК 68, 137
— регуляция активности генов 66—69, 11—
113, 148
Человек, белки 83, 93
— гемоглобины 32—33, 94, 184—186, 197
-гены 6, 38-39, 52, 214-216, 219, 224, 225
— дефектные ферменты 56—57
— митотические циклы 133, 135, 136
—мозг, нарушение развития 64
— наследственные болезни 11, 20, 30, 31,
39, 56, 62—63, 73—75, 214—216. См. также
Болезнь; Синдромы
— ранний эмбриогенез 120
— Х-хромосома 199
Череп, детерминация развития 16&
Шелкопряд 65
Шерсть см. также Волосы
— окраска 17, 34, 63, 205, 232—233;
Шизофрения 39
Щелочная фосфатаза 116
Эволюция 32
Экзокринные ферменты 186—187
Эксоны 9
290
Экспериментальные химеры см. Химерные
мыши
Экспрессия генов 5. См. также Гены
•---в гибридных клетках 87
----регуляция 89
эктодермальный гребень
Эмбриогенез 65
— ранний, клеточный цикл 127, 130—132,
134
----тотипотентность клеток 144—148
----экспрессия генов 149—153, 157
Эмбриология, исторический обзор 3—4
Эмбриональная индукция 59, 61, 62, 70—
75, 105, 107, 159, 163—169, 192, 196
Эмбриональное кроветворение 182—183, 185
Эндокринные заболевания 57, 75, 126
Эпигеномная наследственность 156, 201
Эпигенотип 19
Эпилепсия 39
Эпистаз 31—33
Эргонические корреляции 62
Эритроидные клетки 182, 183, 198
Эритропоэтин 94, 95
Эритроциты 197,—198
Эстеразы 109
Эстроген 76—78
Ядерная оболочка 138, 201
Ядерно-цитоплазматические взаимодей-
ствия 4, 5, 65—70, 155
Ядерно-цитоплазматические гибриды 66—
69. См. также Пересадка ядер
Ядерные белки см. Гистоны; Негистоновые
белки
Ядра, генетическая изменчивость 149—154
— дифференцировка 201—202. См. также
Пересадка ядер
— морфогенетическая активность 189
— реактивация 68
Ядрышковый организатор 111
Яйцевод курицы 76—78
Яйцеклетки 108, 109, 114. См. также Пе-
ресадка ядер
Ящерица 204
УКАЗАТЕЛЬ МУТАНТНЫХ ГЕНОВ
Кролик, Ess 16
Крысы, rdy 50, 61
Курица, Ср. 58, 220
— diplopodia (dp1—dp2) 219, 220, 222
— eu 167, 219, 220, 222, 223
— Po 219, 220, 222
— talpid (ta2, ta3) 61, 62, 219, 220, 222, 229,
234-236
— sc 219
— wingless (wg) 219, 220, 223
Мыши, a 34
— agouti (A) 40, 50, 230
— albino (c) 29, 33, 41, 42, 54, 98, 225
— aphakia (ak) 180, 217
— blebs (my) 63—64
— blind (Bld) 119
— brachymorphic (bm) 221
— brachypodism-Н (bp^) 12, 22—25, 80,
99-105, 221
— brindler (Mobr) 63
— cartilage anomaly (can) 221
— Cat 217
— chondrodysplasia (cho) 221
— cn 221
— crinkled (cr) 48—49
— Danforth’s short tail (Sd) 34
— depilated (dep) 48
- df 79
— diabetes (db) 78-79, 123
— Dickie’s small eye (Dey) 120
— dilute 51
— dominant cataract-Fr 21
---hemimelia (Dh) 62, 235, 237
---spotting (W) 41, 42, 49, 51, 55, 123, 125
— downless (dl) 48
— dreher 61
— dw 57, 79
— dwarf 51
— dystrophia muscularis 51
— eb 64
— ectopic (ec) 122, 217
— extension (e) 49
— extra-toes (Xt) 61
- ey-1. ey-2 174, 180, 216, 217
- fidget (fi) 35-37, 43, 45, 49, 123-125, 130—
132, 137, 157, 171—173, 179, 180, 216—218
— flexed tail (f) 123
— fetal hematoma (fh) 64
— fused (Fu) 44, 119, 134
— fuzzy (fz) 48, 194
--- 11 03, J 1 i
hop 214
— hpy 214, 215
— hypogonoda) (hpg) 57
— ichthyosis (ic) 48
— iv 230
— Kreisler 61
- Ldr 97
- Id 221
— leaner (tg^a) 123
- 1g 217
- lethal 51
— loop-tail (Lp) 44, 134, 216
— Ir 217
— luxate 21
— luxoid 21
— mibw233
— Miwbcjw. white
- miws29
— microcytic anaemia (mk) 51, 54, 125
— microphthalmia (mi) 41, 45, 55, 59, 124.
125, 157, 217, 233
— mottled 63
— muscular dysgenesis (mdg) 51, 171
— obese (ob) 78—79
— ocular retardation (or) 35, 41, 42, 45, 59,
60, 80, 81, 123—125, 130, 137, 157, 179, 180,
217
— oligosyndactylism (Os) 118—119,219
- p 29, 34
- ps 214
— pa 63
— patch (Ph) 64
— pc 219
— ped 50, 51
— piebald (s) 49, 55
291
I I I I I I I I I I I 1 I I I I I I I
Po 219
Ps 219
py 219
radius incompletus 19
Rec 39—40
reeler (rl) 34, 35, 51, 228
retinal degeneration (rd) 41, 50, 81, 192,
193, 217
Sd 34, 61, 167
se 122
sex-linked anaemia (sla) 21—22, 63
short-ear (se) 41, 55, 123
siren (srn) 34
splotch (Sp; 37, 38, 44, 55, 61, 122, 131,
133, 216
staggerer (sg) 34, 35
steel (SI) 49, 57
syndactylism (sm) 122, 219
Sxr 224—225
sy 219
T 22, 26, 27, 31, 44, 61, 117-119, 134, 208,
227 228
— t 26—28, 31, 117—И9, 208, 209, 227, 228, 231,
232
-tw2 215
— Tern 39-40
- Tfm 76, 214
— tufted (tf) 27
— vestigial tail (vt) 41
“ Wv 232, 233
— waddler 51
— weaver (wv) 34
— white (Miwh) 28—29, 45, 55, 124, 125, 232,
233
— yellow (ДУ) 118, 231—232
Acantophthalmus kuhlii 109
Ambystoma mexicanum 79
----cardiac lethal (c) 59
----cleavage arrest (cl) 111, 113
----eyeless (e) 57, 167
----1 53
----melanoid (m) 124
----ova deficient (o) 111—113
----premature death (p) 59
----r 47
— — melanoid (m) 124
----X 47
Bombyx mandarina 65
— mori 65
Fundulus heteroclitus 109
Leuciscus bergi 203
Pleurodeles poireti 66
- waltlii 66
----ac 58
----16thal mitotique (Im) 135
---- ulcere (u) 59
Rana esculenta 203
— palustris 69, 70, 114
— pipiens 69, 110, 113, 114, 150
— temporaria 203
Triturus taeniatus 159
Xenopus laevis 69, 110, 114, 137, 150, 15L
153, 158, 171, 176, 203, 242
- a₽47-48
— immobile (Im) 47
— о 111
ОГЛАВЛЕНИЕ
Введение 3
Глава 1. Действие гена 8
Кодоминантный характер проявления генных эффектов на
биохимическом уровне ... И
Синхронность активации аутосомных аллельных генов 14
Случаи аллельного исключения 16
Взаимодействие генов 19
Плейотропия 44
Глава 2. Регуляция активности генов в онтогенезе 65
Ядерно-цитоплазматические взаимодействия 65
Межклеточные влияния 70
Действие гормонов на экспрессию генов ... 75
Взаимодействие регулирующих белков с ДНК хромосом и
контроль транскрипции . . 81
Контроль экспрессии генов на посттранскрипционном уровне 87
Взаимодействие структурных и регуляторных генов 92
Глава 3. Экспрессия генов в раннем развитии 108
Экспрессия и активация генов на ранних этапах развития
рыб, амфибий и птиц . . . . 108
Действие генов в раннем эмбриогенезе млекопитающих 114
Глава 4. Генетический контроль клеточной пролиферации 121
Влияние генов на скорость размножения клеток 121
Клеточный цикл . . . 126
Генетический контроль клеточного цикла 129
Регуляция синтеза ДНК 136
Глава 5. Гены и дифференцировка клеток 143
Тотипотентность клеток ранних зародышей . . 144
Генетическая идентичность ядер дифференцирующихся кле-
ток . ... 149
Цитодифференцировка — результат специфической дере-
прессии генов 154
Детерминация, индукция и компетенция . . 158
Пролиферативные и критические клеточные циклы 169
Синтез специфических белков . . 175
Клональная теория цитодифференцировки . 189
Стабильность дифференцированного состояния .... 200
Нарушения цитодифференцировки — причина канцерогенеза 204
Глава 6. Молекулярно-генетические механизмы морфогенеза 212
Роль генов в морфогенезе клеток . . 213
Последовательность дерепрессии генов в ходе органогенеза 215
Миграция и интеграция клеток . . 225
Генетически программированная смерть клеток и старение 231
Заключение 241
Литература 246-
Предметный указатель 285
Указатель мутантных генов 291
CONTENS
Introduction 3
Chapter 1. Gene action 8
Codominant expression of gene effects at the biochemical
level 11
Synchronous activation of autosomal allelic genes 14
Cases of allele inactivation 16
Gene interaction 19
Pleiotropy 44
Chapter 2. Regulation of gene action in ontogenesis 65
Nuclear — cytoplasmic interactions 65
Intercellular relationships 70
Hormonal regulation of gene expression . 75
Interaction of regulatory proteins with chromosomal DNA,
and control of genetic transcription . . . . 81
Control of gene expression at the post-transcriptional level 87
Interaction between structural and regulatory genes 92
Chapter 3. Gene expression in early development 108
Gene expression and activation at early stages of fish,
amphibian and avian development 108
Gene action in early mammalian embryogenesis 114
Chapter 4. Genetic control of cell proliferation 121
Effect of genes on cell proliferation rate 121
Cell cycle . . . . 126
Genetic control of cell cycle 129
DNA synthesis regulation 136
Chapter 5. Genes and cell differentiation 143
Totipotency of early embryo cells 144
Genetic identity of nuclei in differentiating cells . 149
Cytodifferentiation — a result of specific gene derepression 154
Determination, induction and competence 158
Proliferative and quantal cell cycles 169
Synthesis of specific proteins . 175
Clonal theory of cytodifferentiation 189
Stability of differentiated state 200
Cytodifferentiation disturbances — a cause of cancerogenesis 204
Chapter 6. Molecular genetic mechanisms in morphogenesis 212
The role of genes in cell morphogenesis 213
The sequence of gene derepression during organogenesis . 215
Cell migration and integration 225
Genetic programmed cell death and aging 231
Conclusion 241
References 246
Indexes 285