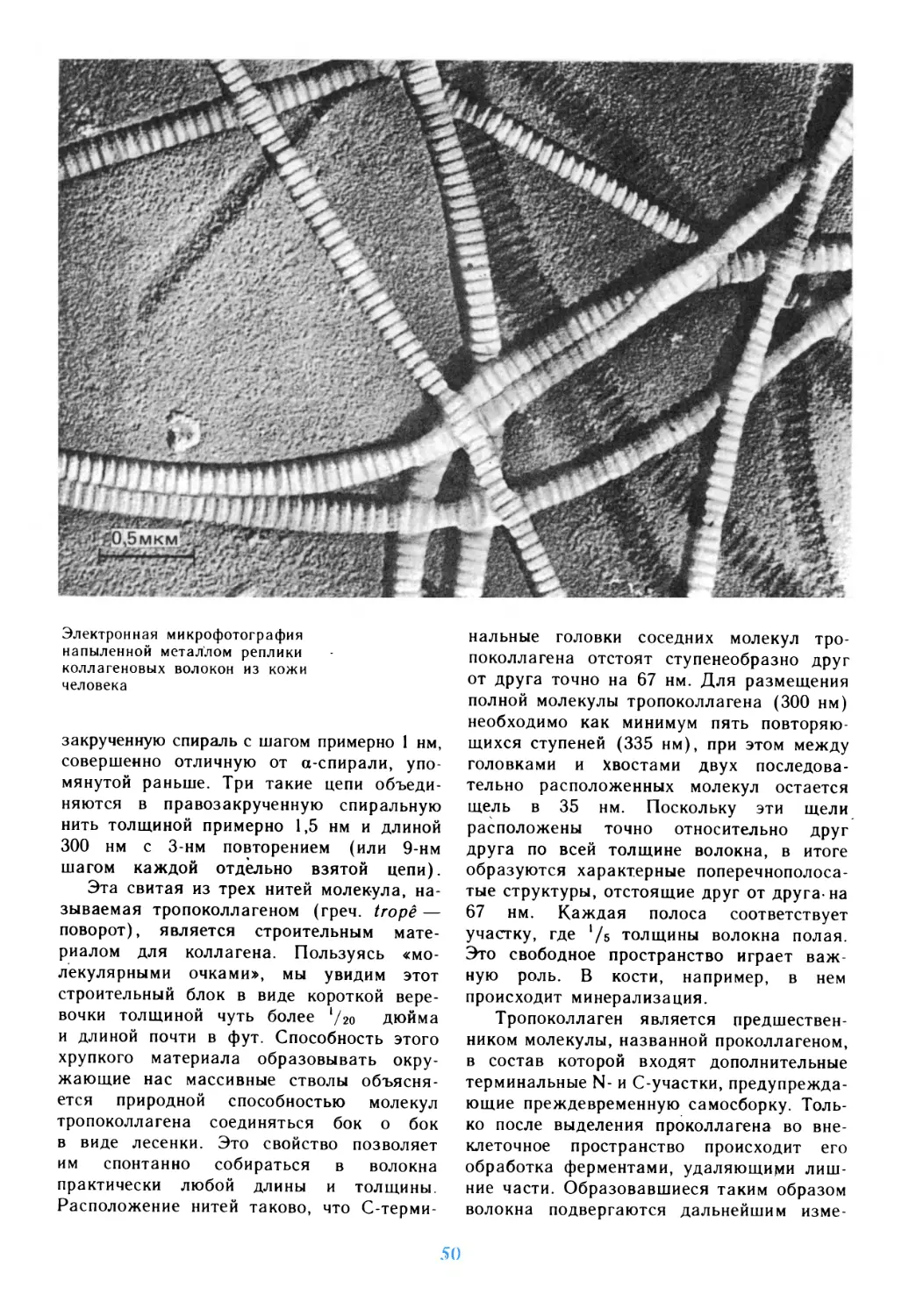
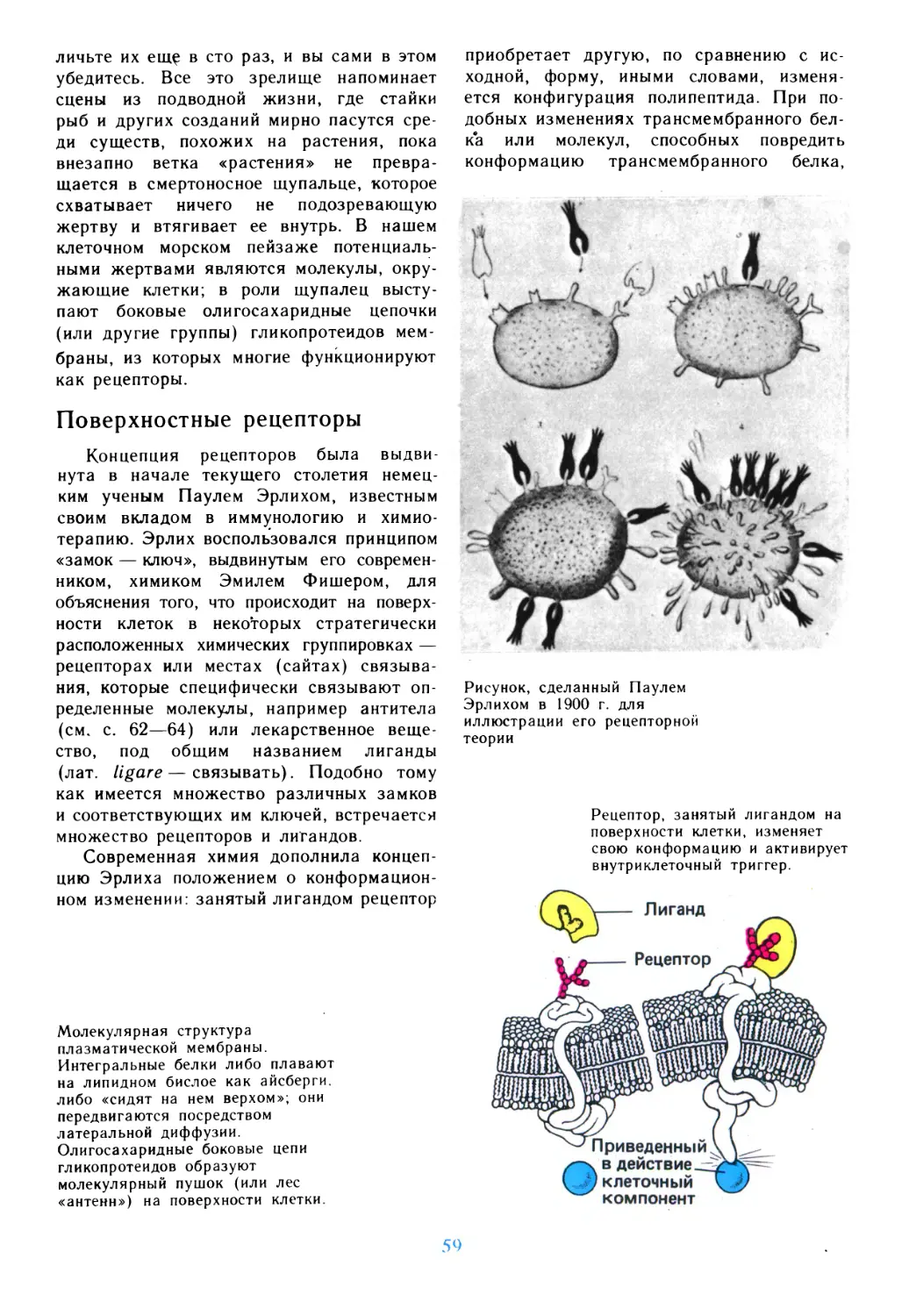
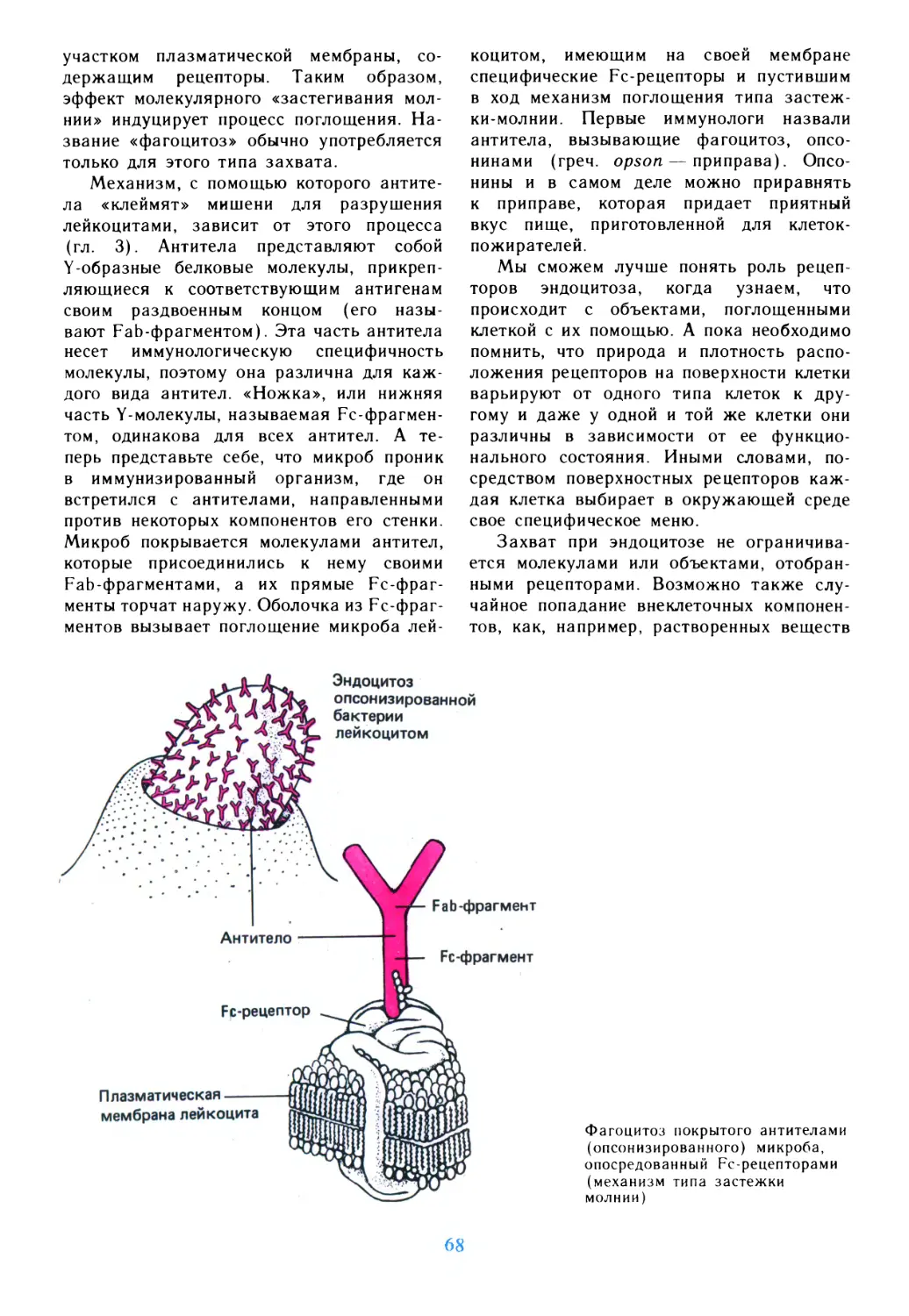
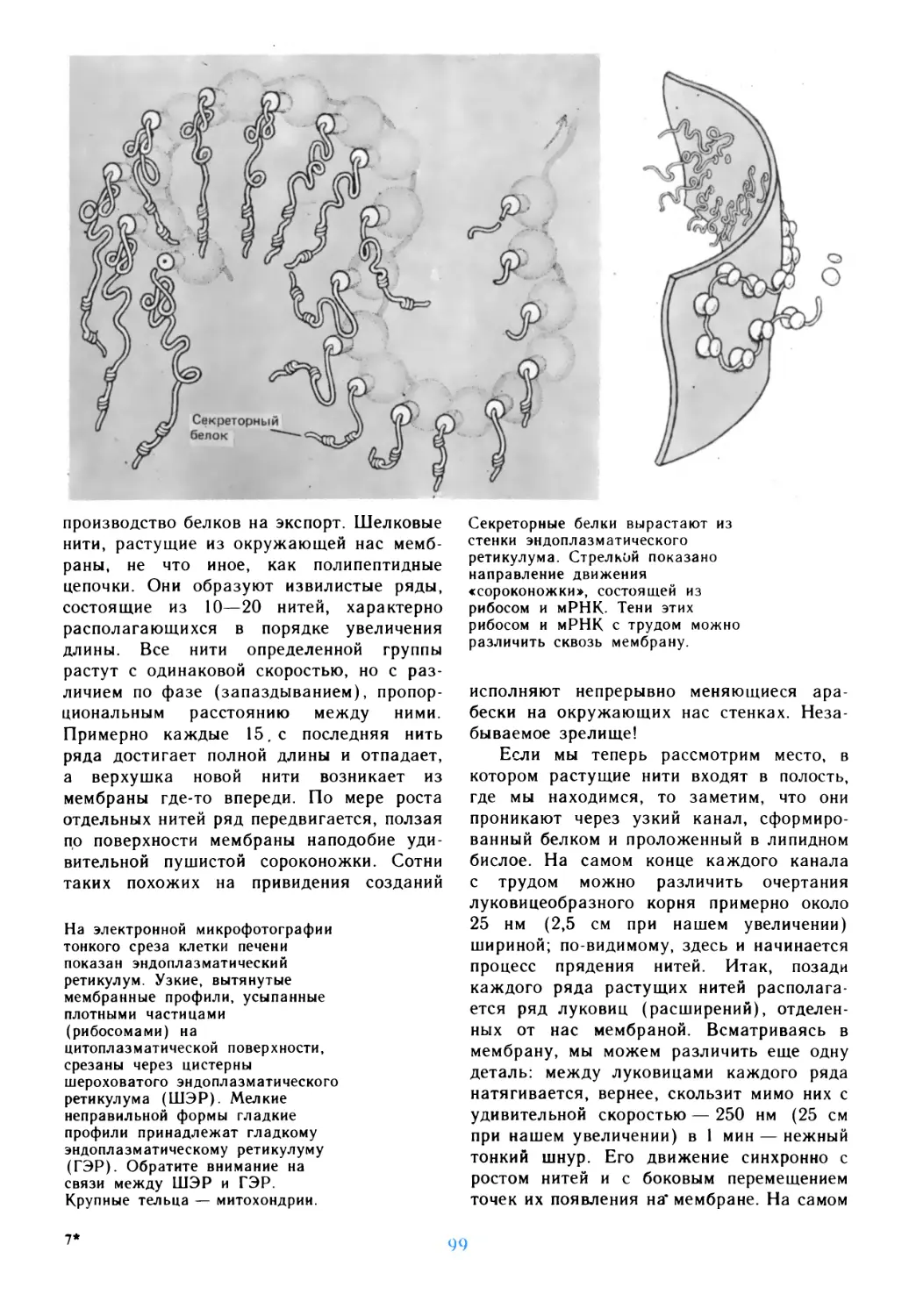
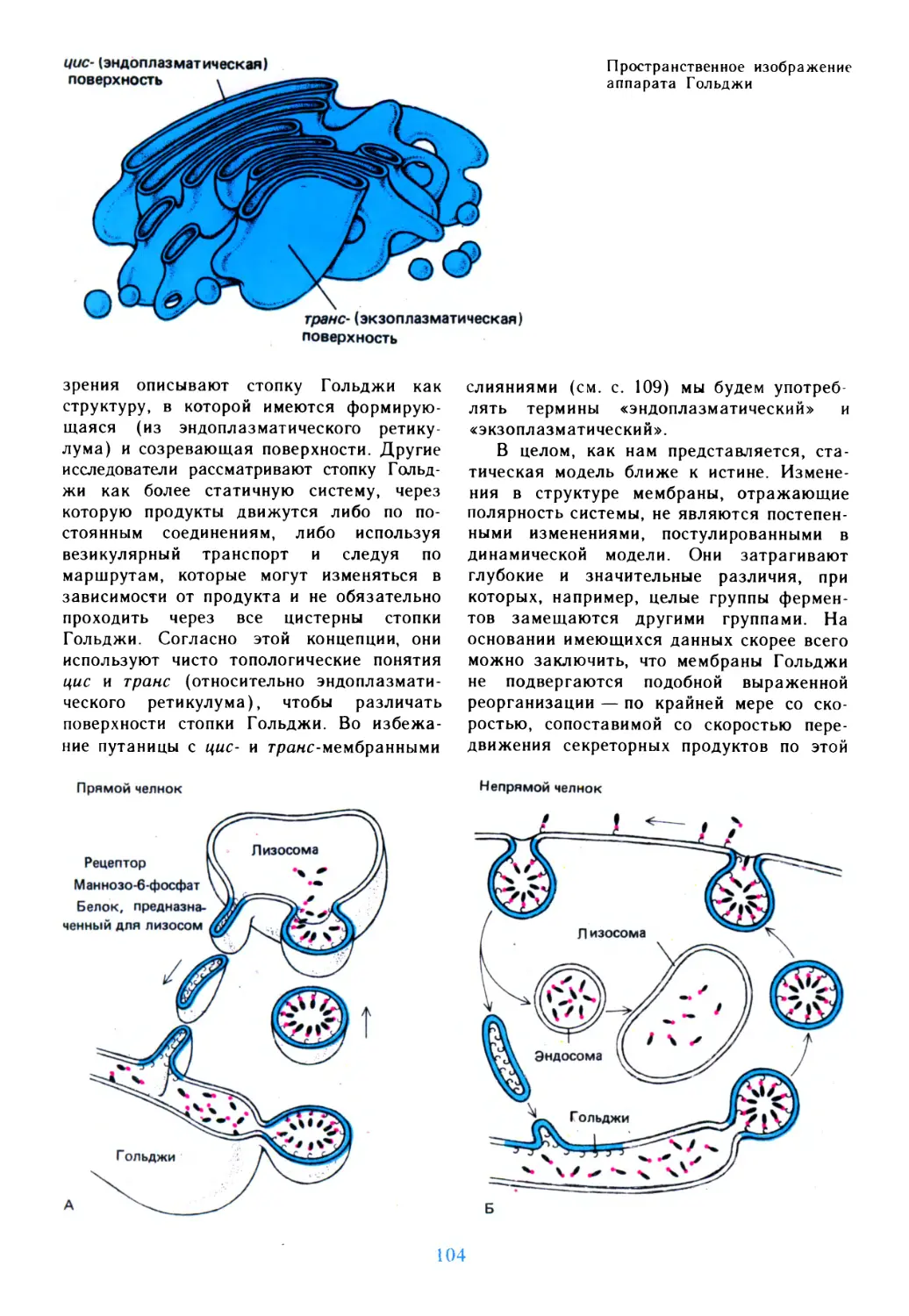
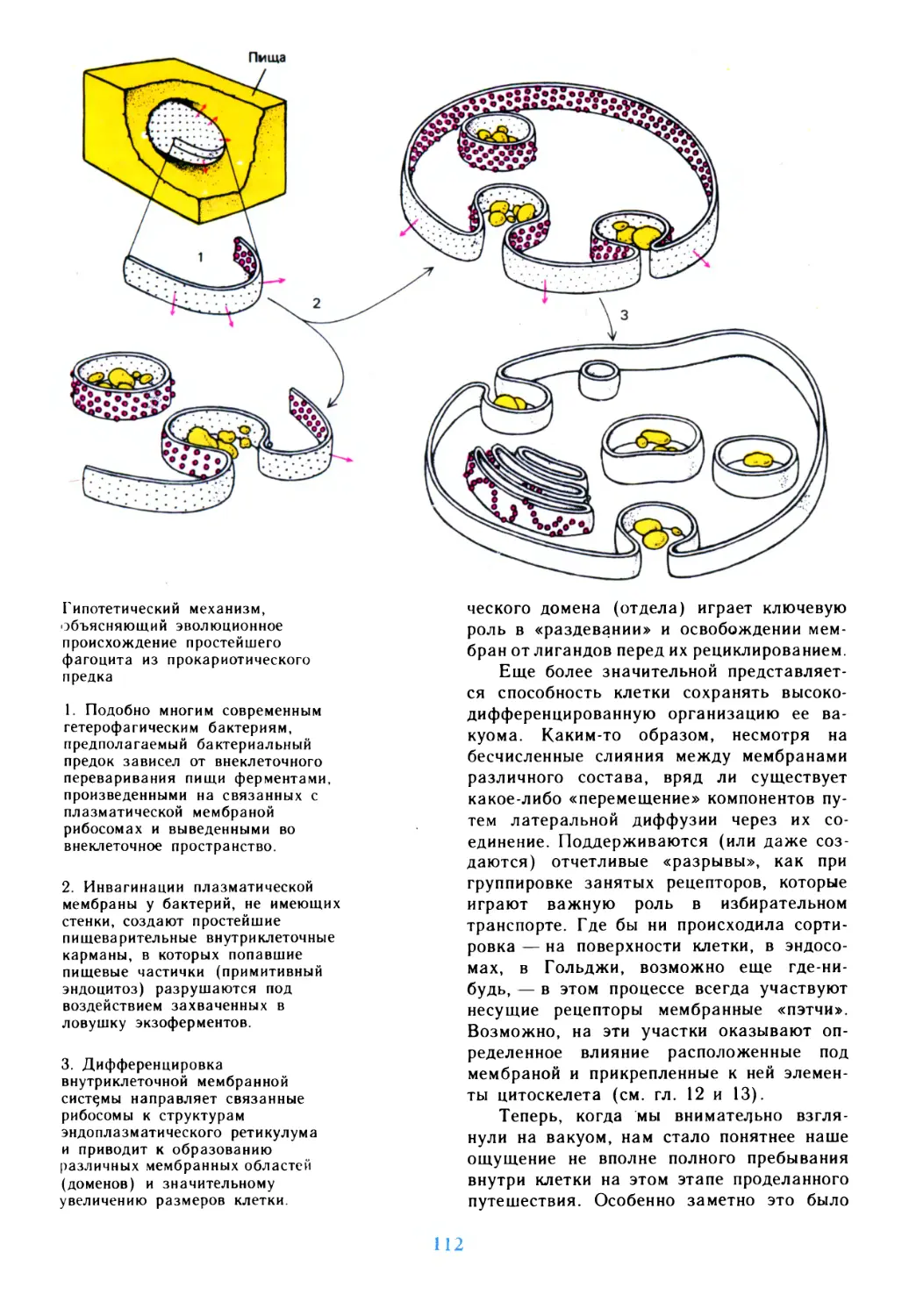
Author: Дедюлов К.
Tags: материальные основы жизни биохимия молекулярная биология биофизика общая биология биология биология клетки
Year: 1987
Text
Путешествие в мир живой клетки
Christian de Duve
A GUIDED TOUR OF THE LIVING CELL
VOLUME ONE
Illustrated by Neil O. Hardy
This book is published in collaboration with
The Rockfeller University Press
SCIENTIFIC
AMERICAN
LIBRARY
An imprint of Scientific American Books, Inc.
New York
КРИСТИАН
ДЕДЮВ
Путешествие
вмир
живой клетки
Иллюстрации Нила О. Харди
Перевод с английского
канд. мед. наук Н. И. Ковальской и
канд. биол. наук И. В. Саниной
Москва «Мир»
1987
ББК 28.05
Д26
УДК 577.2
де Дюв К.
Д26 Путешествие в мир живой клетки: Пер. с англ./Предисл.
Ю. А. Овчинникова. — М.: Мир, 1987. — 256 с, ил.
Известный американский биолог, лауреат Нобелевской премии Кристиан де Дюв
предлагает читателю заглянуть в удивительный мир живой клетки — основы
животного и растительного мира, Вместе с автором книги, выступающим в роли гида,
увлеченный старшеклассник, студент-бяолог или медик, или же просто читатель,
проявляющий интерес к достижениям современной науки, совершат нелегкое, но
захватывающее путешествие и откроют для себя немало нового в области биологии
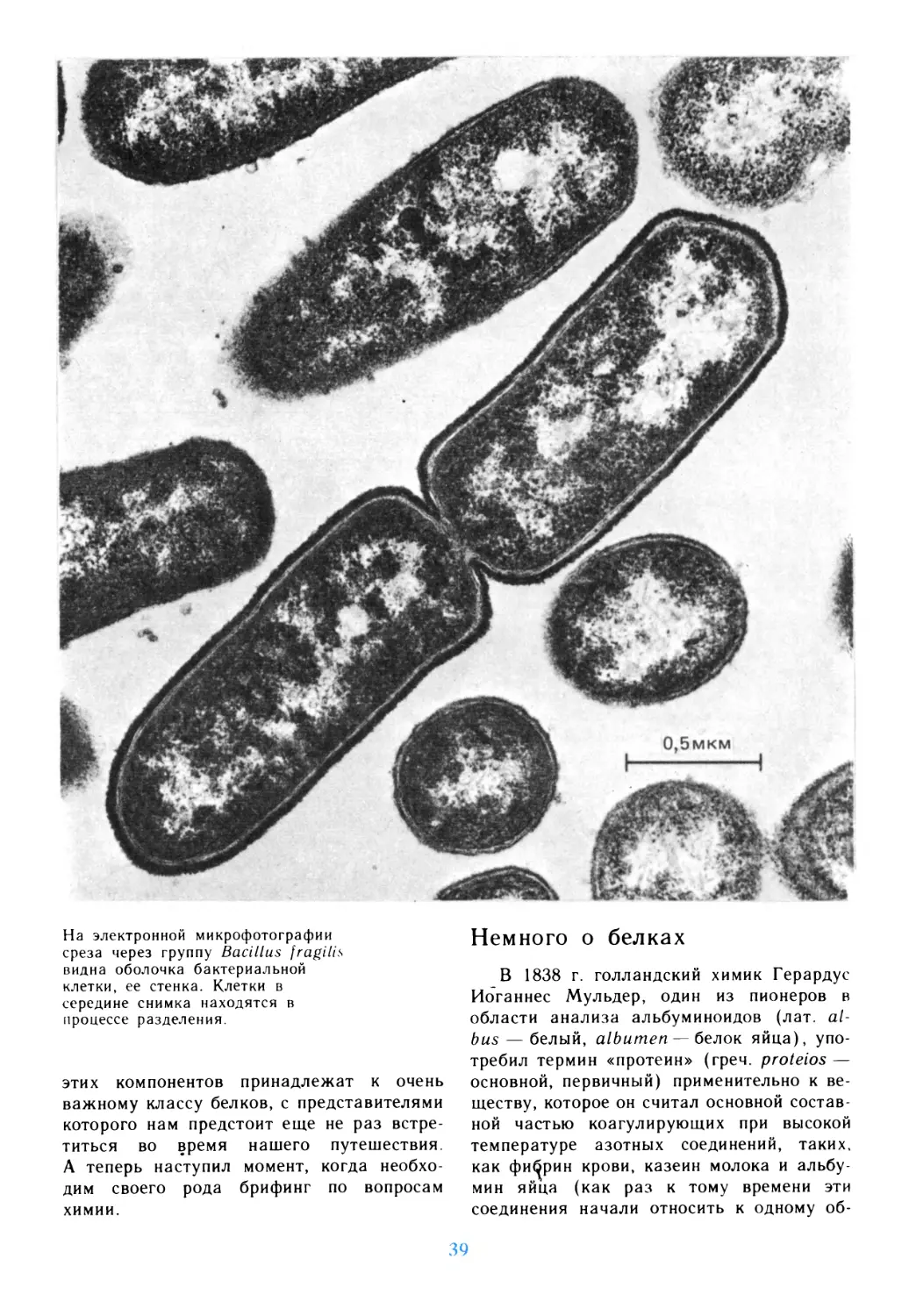
клетки. В значительной мере этому способствуют многочисленные
микрофотографии, цветные иллюстрации и схемы.
2001020000—239
Д 133—87, ч. 1 ББК 28.05
041 (01)— 87
Редакция научно-популярной
и научно-фантастической литературы
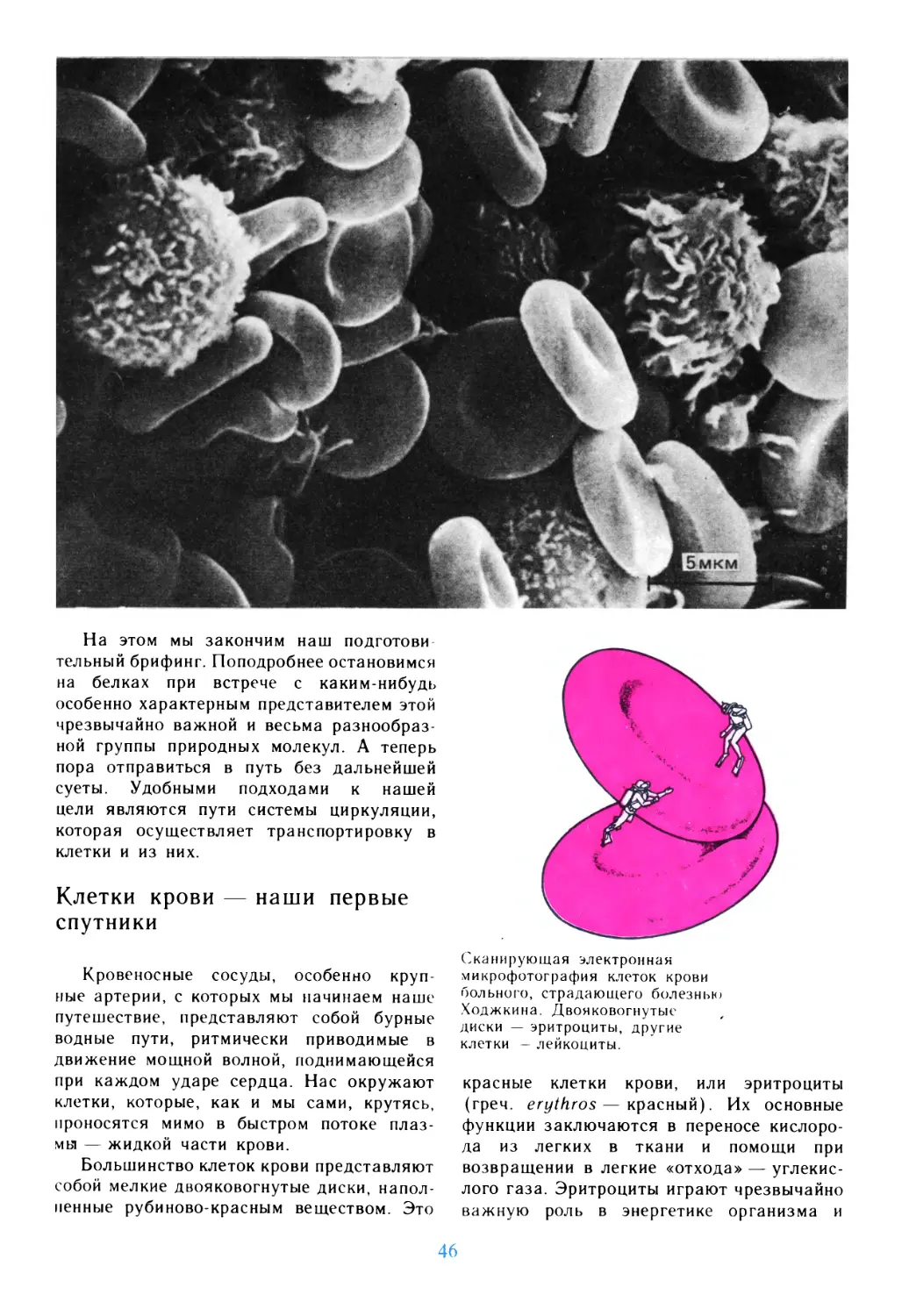
© 1984 by the de Duve Trust
© перевод на русский язык, «Мир», 1987
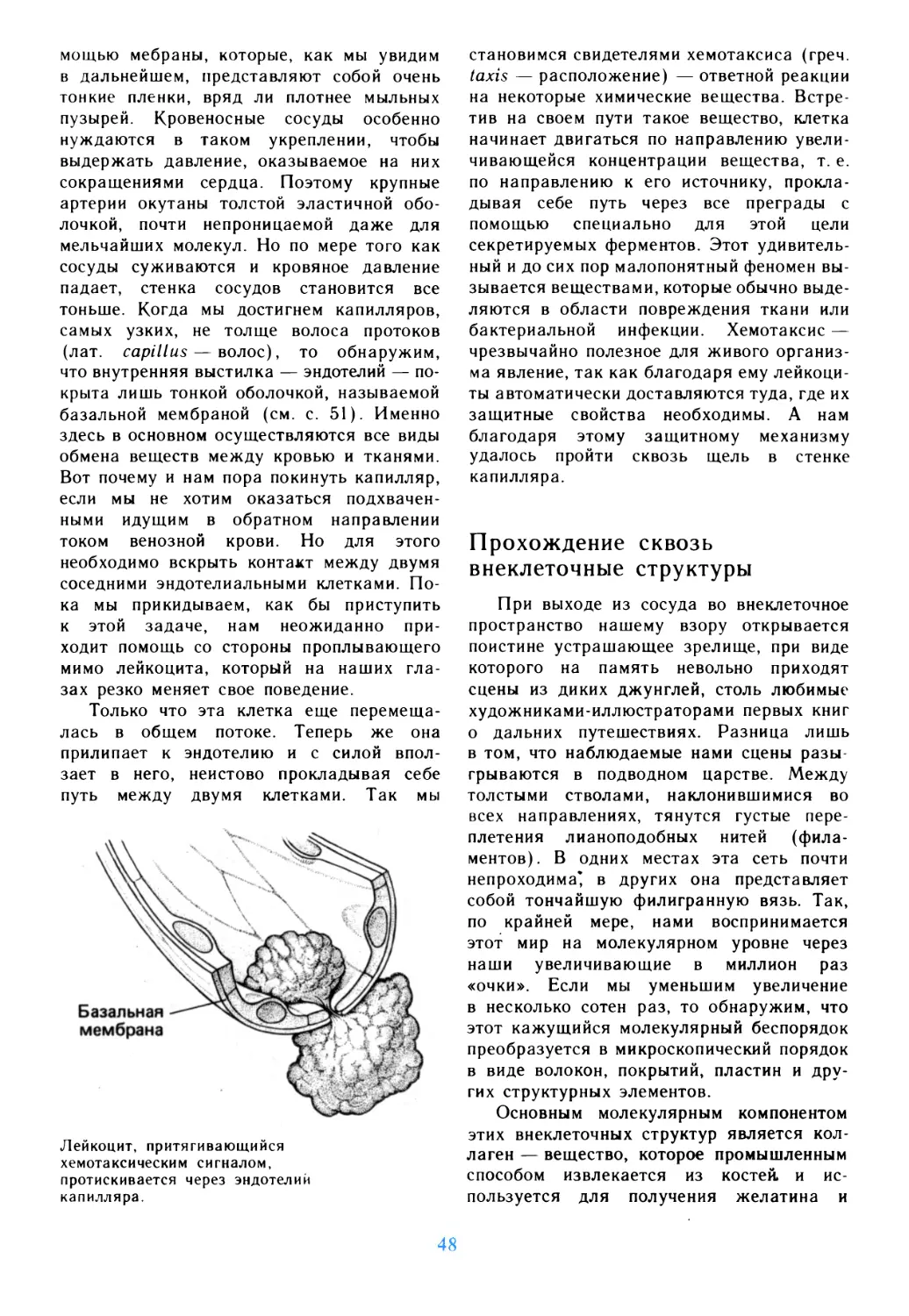
Предисловие
к русскому изданию
Наше время отмечено возросшим
интересом людей к познанию живой природы.
Решение проблем продовольствия, борьбы
с болезнями вновь и вновь возвращает нас
к необходимости постижения законов
'жизнедеятельности, к поиску путей
максимального использования потенциала живых
организмов в интересах человека. Неуклонно
растут ряды тех, кто решительно выступает
за сохранение окружающей среды,
бережное отношение к биосфере, за то, чтобы
целительная сила и чарующая красота
лесов, лугов, рек, озер и морей, парков и
садов служили не только нынешнему, но и
грядущим поколениям. Пытливый ум
человека все глубже проникает в тайны живой
материи, пытаясь дать объяснение самому
сложному и самому удивительному
явлению природы, которое называется жизнью...
Универсальной ячейкой жизни является
клетка. Клеточные структуры вездесущи,
они охватывают мир бактерий, растений,
животных, человека, подчеркивая их
общность, их органическое единство в
огромном царстве живой природы. В клетке
сконцентрированы все важнейшие
атрибуты живого и прежде всего способность к
росту и размножению. Если клетку
дробить, как это делают исследователи, то
отдельные клеточные системы еще
сохраняют свои функции, порой сложные и
многообразные, но то, что присуще жизни как
явлению, безвозвратно теряется. Конечно,
мы используем термины «живые молекулы»,
говорим о «волшебных» свойствах ДНК и
ферментов, но это не более чем
преувеличение, рожденное вдохновением и любовью
ко всему, что дает начало
жизнедеятельности. Трезвая оценка неизбежно приводит
к выводу, что элементарная основа
жизни — живая клетка.
Каковы главные особенности клетки?
Любая клетка окружена оболочкой,
мембраной, отделяющей ее от внешнего мира.
Мембрана проницаема лишь
избирательно — вход в клетку и выход из нее
различных метаболитов и ионов находится под
постоянным контролем мембранных систем.
Все это обеспечивает создание в клетке
своего, особого «микромира», который
сохраняется почти неизменным при любых
изменениях окружающей среды.
Клетка — совершенная биоэнергетическая
машина. За счет создания разности
потенциалов на мембране, превращений
энергоемких соединений типа аденозинтрифос-
форной кислоты клетка вырабатывает
энергию, необходимую для ее
функционирования. Коэффициент полезного действия
ее энергетических установок достаточно
высок, и при благоприятных условиях, на
хорошей питательной среде, клетка может
не только обеспечивать свои внутренние
потребности, но и быть активным
агентом, используемым для переработки
подходящего субстрата. Примером могут
служить клетки микроорганизмов,
перерабатывающие парафины в кормовой белок
или проводящие деградацию
разнообразных отходов в нетоксичные продукты.
Клетка — мощная информационная
система, с которой вряд ли могут состязаться
самые современные
электронно-вычислительные комплексы. Она работает по
единой, согласованной программе, где все
процессы взаимозависимы, взаимосвязаны,
строго фиксированы в пространстве и
времени. Главные банки данных сосредоточены
в клеточном ядре, они заключены в
структуре гигантской молекулы ДНК.
Расшифровка, считывание этой информации идет
на специальных устройствах, с участием
сложных белков, но осуществляется
быстро и надежно. Емкость информационных
клеточных систем, использующих химический
принцип записи информации, колоссальна
и не имеет аналогий в тех средствах
информационной техники, которые сегодня
используются человеком. Роль
информационных лент и дисков выполняют
нуклеиновые кислоты и белки.
В клетке ежесекундно осуществляются
тысячи превращений, и есть все основания
сравнивать ее с миниатюрным химическим
заводом, где осуществляется производство
сотен продуктов, в том числе весьма
сложных; все процессы не только полностью
скоординированы и «автоматизированы»,
но и базируются на истинно «безотходной
технологии». Здесь есть чему учиться
химической промышленности, которая пока
доставляет нам немало хлопот.
Наконец, клетка — это запутанный
лабиринт структур, связанных сетью
переходов, каналов, по которым непрерывно
движутся продукты разнообразных
превращений и синтезов. Основой коммуника
ций являются мембранные системы, в том
числе специальные мембранные «пузырьки»,
осуществляющие челночные операции
между различными компонентами клетки.
Непрерывное движение, бесконечные
потоки веществ — причем без аварий и
дорожных происшествий — это и есть основа
тех процессов жизнедеятельности, которые
не перестают поражать наше воображение.
Ценность книги Кристиана де Дюва
«Путешествие в мир живой клетки»
заключается прежде всего в том, что в ней
живая клетка описывается во всем
многообразии ее структур, весьма полно, я бы
даже сказал, энциклопедично. Автор
приглашает . читателя быть вместе с ним
счастливым путешественником, которому
предоставилась возможность посетить
самые таинственные районы загадочного
мира клеточных структур, понять их
особенности, назначение, природу
происходящих в них процессов. На все автор имеет
свой, порой своеобразный взгляд, и это
хорошо отражается в прекрасных
иллюстрациях, нередко выполненных с
подлинным мастерством и талантом. Вряд ли
найдешь сегодня другую йнигу, где клетка
была бы представлена столь
монументально, а ее системы были бы развернуты как
на подробной карте, с четким описанием
топографии важнейших центров и
комплексов.
Совершая «кругоклеточное»
путешествие, автор пользуется средствами
наблюдения, которые позволяют ему видеть
главные морфологические особенности в клетке,
ее надмолекулярные структуры, которые
относятся, так сказать, к уровню
электронной микроскопии высокого разрешения.
Это мембраны, митохондрии, лизосомы,
рибосомы,, ядра и т. п. Молекулы, даже
гигантские, мы видим реже, и это не
удивительно. Ведь только в клетке
кишечной палочки свыше 1000 белков, а число
белков в клетках животного
происхождения исчисляется сотнями тысяч.
Другими словами, путешествуя по
лабиринтам клетки, автор остается в мире
клеточной биологии, и это представляется
вполне оправданным и логичным.
Единственное, о чем можно пожалеть, так это о
некоторой статичности общей картины,
когда характеристики клеточных структур
оттесняют на второй план динамизм их
превращений и взаимодействий. Но это
недостаток почти всех книг и пособий по
современной биологии, ибо динамику
живых систем, особенно внутриклеточных,
трудно адекватно описать и иллюстрировать.
Сегодня изучение живой клетки имеет
определяющее значение для
научно-технического прогресса в тех областях, которые
связаны с современной биологией. Клетка
стала центральным объектом не только
фундаментальных биологических
дисциплин, но вышла на передовые позиции и в
биотехнологии. Именно на клеточном
уровне мы пытаемся понять природу процессов
регуляции, взаимодействия различных
биохимических систем, постепенно
подбираемся к тайнам процессов развития и
дифференцировки. Хотелось бы верить, что
в скором времени удастся достигнуть
относительной ясности пусть на таком
простейшем объекте, как клетка Е. coil.
В прикладных же разработках мы
научились успешно манипулировать с клетками
не только бактерий, но также растений и
животных, и не случайно сегодня говорят
о наступлении эры клеточной инженерии.
Первые результаты уже показывают, что
влияние клеточной инженерии на прогресс
медицины и сельского хозяйства будет,
пожалуй, большим, чем в случае инженерии
генетической. Сегодня в мире созданы и
успешно работают десятки и сотни центров
клеточной биотехнологии, их
результативность растет, и эта результативность
непосредственным образом связана с уровнем
наших знаний о клетке, ее компонентах,
о функции ее важнейших систем. И вклад
таких книг, как книга К. де Дюва, в общий
прогресс наших знаний о живой клетке
несомненен. Тем более, если книга,
написанная популярно и занимательно,
предложена широкому читателю, не только
работающему в сфере биологии, но и просто
интересующемуся ее проблемами и
перспективами.
Академик Ю. Овчинников
Эта книга для Тьерри, Анн,
Франсуазы и Алена
Посвящается их матери
Какие чудеса открылись бы человеку, будь
его глаза способны разглядеть очертания и
движения мельчайших частиц в крови и других
жидкостях живых организмов столь же
отчетливо, как очертания и движения самих
живых существ!
ДЖОН ЛОКК.
ОПЫТ О ЧЕЛОВЕЧЕСКОМ РАЗУМЕ
Предисловие
Ежегодно во время рождественских
каникул один из профессоров
Рокфеллеровского университета в Нью-Йорке читает
цикл лекций перед 550 тщательно
отобранными учениками старших классов. Цикл
состоит из четырех лекций. В 1976 г. мне
было предложено провести этот лекторий,
получивший название «Рождественского
лектория по вопросам наук имени Альфреда
Мирского» — в честь выдающегося уче
ного, специалиста по изучению ядра клетки,
основавшего лекторий в 1959 г.
Чтение подобных лекций — задача не
простая, хотя и весьма многообещающая.
Сложность ее заключается в том, что в
подобной аудитории неповторимым
образом сочетается живой интерес ко всему
новому, свойственный молодости, с
поистине устрашающим объемом новейшей
информации в отдельных, частных вопросах.
Так, мои молодые слушатели, по всей
вероятности, знали все про ДНК, но вряд
ли имели представление о всех
подробностях структуры других составных частей
клетки. Обдумывая, каким образом
построить лекции так, чтобы они получили
правильную картину об организации клетки, я
пришел к выводу, что лучше всего
отправиться вместе с ними в путешествие по
клетке. Это дало бы нам возможность
самим уменьшиться до размеров бактерий
или соответственно увеличить размеры
клетки в миллионы раз, что в конечном
итоге свелось бы к одному и тому же. В
результате мы могли бы свободно гулять,
вернее, плавать по клетке, рассматривая
структуру ее составных частей, наблюдать
их в действии и разобраться в принципах
их функционирования. Чем дольше я про
никался этой мыслью, тем больше она мне
нравилась. И, что еще важнее, она при
шлась по вкусу и моей аудитории.
С тех пор прошло семь лет, и моя четы
рехчасовая фантастическая повесть раз
рослась до объемистого опуса из де
вятнадцати глав. Мне самому работа над
ней, равно как и чтение самих
рождественских лекций, доставляла огромное
удовольствие. Боюсь даже, что иногда я просто
забывал о том, что книга предназначается
для читателя. Мое «Путешествие» — не
учебник, цель которого предложить
студенту в рамках определенной учебной
программы достаточно полный обзор
информации, имеющейся по этому вопросу. В еще
меньшей степени оно представляет собой
тщательно документированное
исследование или обзор, предназначенный для
специалистов. Вместе с тем это и не
популяризация такого типа, когда трудности скрыты
под вуалью кажущейся простоты и
ясности. Как явствует из названия, это описание
путешествия, где всего предусмотреть
нельзя. Случается, что гид — руководитель
группы — в одних местах останавливается
дольше положенного, излагая какие-то
подробности или же делясь своими
личными соображениями. В других же случаях
он торопится, наверстывая упущенное
время, и в результате рассказ его получается
коротким и поверхностным. Что касается
моего повествования, то я хочу поделиться
с читателем сугубо личными взглядами,
выработанными за несколько десятилетий,
посвященных исследованию «дома, где мы
все родились», — как назвал клетку Альбер
Клод, — и размышлениями о скрытых в
нем чудесах. Не удивительно поэтому, что
мой рассказ испытал на себе влияние моих
симпатий и антипатий и что он отражает
степень моей осведомленности (или
недостаток таковой) в тех или иных вопросах.
Книга эта не предназначена специально
для студента, ученого или
неподготовленного читателя. Но я надеюсь, что и студент,
и ученый, и неспециалист найдут в ней
главы или разделы, представляющие для
них интерес, и простят автору имеющиеся
в работе недостатки.
Я сохранил изначальную идею
путешествия, во время которого туристы
уменьшаются в своих размерах или клетка
увеличивается в миллионы раз. Такой прием
позволяет увидеть составные части клетки
невооруженным глазом, и только в редких
случаях приходится пользоваться так
называемыми «молекулярными очками».
Сочувствую тем читателям, которым не
понравится, что автор серьезного научного
труда прибегает к подобным вольностям,
и которые не желают, чтобы их
превращали в микроскопических «цитонавтов»,
однако не считаю нужным приносить им мои
извинения. Ничто в самой природе науки
не говорит о том, что она непременно
должна быть серьезной. Единственная
реальная опасность в моем подходе к
описанию научных фактов заключается в том,
что использование метафор при передаче
трудных для понимания явлений, в
частности в антропоморфическом описании
процессов, наблюдаемых в живой клетке,
может невольно привести к искажению их
сущности, ибо весьма соблазнительно
вообразить, что указанным процессам
присущи планомерность и преднамеренная
целенаправленность, характеризующие
действия человека. От души надеюсь, что
образы, к которым я прибегал в ходе
нашего путешествия, никого не введут в
заблуждение.
Клетки содержат множество
сложнейших структур. Естественно, что нам
хотелось бы увеличить их до размеров,
доступных зрению человека. Это обычно
достигается с помощью оптических
инструментов и электронных микроскопов. Даже
у молекул наблюдается своя анатомия, и
значительная часть современной биохимии
занята исследованиями правильного ее
пространственного изображения. Во время
путешествия мы с Нилом Харди, моим
неутомимым и преданным помощником, в
пределах имеющейся в нашем
распоряжении информации очень старались изобра
зить эти структуры с наибольшей
точностью, не поступаясь вместе с тем
доступностью изложения. Тем не менее в ряде
случаев приходилось прибегать к помощи
воображения и отказываться от
полемизирования. Невзирая на так называемую
«революцию в биологии» наши знания о
клетке до сих пор фрагментарны. Биология
же как наука развивается очень быстро, и
в лучшем случае мне удавалось
воспользоваться последними данными, которые,
увы, отнюдь не всегда являются
окончательными. Что касается иллюстраций, то
мне показалось интересным представить
работы, имеющие некоторый исторический
интерес. В итоге порой я отдавал
предпочтение работе старого мастера, хотя по
технике исполнения*она и уступала более
современной. Наряду с этим в создании
этой книги со мной сотрудничали и
некоторые современные художники.
Анатомическое описание, даже если оно
включает описание движущихся частей
организма, редко раскрывает их
функционирование и почти никогда не объясняет
механизма. О том, как функционирует
живая клетка, можно узнать только с
помощью биохимии. Не желая утомлять
читателя длинными рядами формул сложных
молекул и описанием запутанных реакций,
но вместе с тем отвергая часто
встречающееся поверхностное и уклончивое
описание сложнейших биохимических процессов,
я старался сосредоточить внимание на тех
формах жизнедеятельности, которые
кажутся мне наиглавнейшими, и проходил
мимо многочисленных индивидуальных
особенностей, которые подчас затеняют и в
какой-то степени скрывают сущность
явления. Я опирался на энергетику больше, чем
на органическую химию. Возможно,
подобный подход окажется не по вкусу тем
читателям, которых реально действующие
механизмы интересуют больше, нежели
абстрактные концепции, особенно если иметь
в виду, что я даже осмелился придумать
несколько довольно необычных терминов,
таких, как «окфос-блок» и «двуликий, или
промежуточный, Янус», дабы не вдаваться
во все подробности. Единственное, о чем я
прошу тех, кого, быть может, не
удовлетворяет такое мое отношение к материалу,
это чтобы они не поддавались первому
впечатлению, чтобы они хотя бы повременили
с выражением своего недовольства и
ненадолго вооружились терпением. Хочу
надеяться, что вскоре они и сами обнаружат,
что выбранный мною способ изложения
помогает читателю видеть метаболический
лес в целом, как бы глобально, даже не
располагая сведениями об отдельных
деревьях. Правда, я допускаю, что здесь не
обошлось без влияния моего галльского
темперамента, который плохо приживается
на чужих берегах.
Работы, подобные моей, не рождаются
без поддержки и помощи множества
людей. В первую очередь я хочу
поблагодарить тех 550 старшеклассников, вместе с
которыми я отправился в путешествие в
мир живой клетки 27—28 декабря 1976 г.
Их живой интерес и заданные ими
вопросы зародили во мне мысль о создании
этой книги. И все-таки вряд ли я взялся бы
за эту оказавшуюся впоследствии
труднейшую работу, если бы на этом не настояли
Билл Бейлисс и его коллеги, сотрудники
«Рокфеллер Юниверсити Пресс», и если бы
записи лекций не вызвали интереса и
поддержки Хаймэ Эчеверри (Буэнос-Айрес).
Два человека оказали мне бесценную
помощь — и не только из-за отличного
качества и значительности их вклада в
работу, но и потому, что благодаря им
даже те виды работ, которые часто
кажутся нудными, мучительными, порой
превращались в истинное наслаждение. Один
из них — уже упомянутый мной Нил Хар-
ди. Будучи талантливым художником, он
по собственной инициативе углубился в
биохимию и в итоге узнал о ней больше,
чем если бы обучался под моим
руководством. Я же, пользуясь его добротой,
нещадно его эксплуатировал в моих
неуклюжих поисках ясности и точности
иллюстраций. Вторым ближайшим моим
помощником была Элен Джордан Уоддел.
В прошлом директор издательства
«Рокфеллер Юниверсити Пресс», она
прочитывала бесчисленные варианты рукописи,
твердой рукой, не признавая половинчатых
решений, изымала неправильные
конструкции, стилистические погрешности и
неудачные формулировки, но при этом всегда
помнила о личностных особенностях
автора, быть может, даже в тех случаях,
когда в этом и не было особой
необходимости. И Нил, и Элен впоследствии стали
моими добрыми друзьями.
Позже мне во многом помогали
редакторы издательства «Сайнтифик Америкэн
Букс»: Нил Паттерсен, Линда Чепут и
Пэгги Миттелстадт. Последней я обязан
очень многим за искреннюю преданность
своему делу, бесконечное терпение и
глубокий профессионализм, проявленные при
наведении последнего лоска на книгу и
подготовке ее к выходу в свет в условиях,
подчас приближающихся к стрессовым.
Многие из моих друзей и коллег охотно
откликнулись на мои иногда
обременительные просьбы предоставить иллюстративный
материал для книги. Среди них назову
Пьера Бодуэна, Вольфганга Беермана,
Марселя Бесси, Роберта Бладгуда, Дэниела
Брэнтона, Ральфа Бринстера, Джона Кэрн
са, Пьера Шамбона, Дэвида Чейза,
Изабеллу Коппенс, Ричарда Диккерсона, Дэви
да Дресслера, Мэрилин Фаркхар, Уолтера
Фирса, Брайана Форда, Вернера Франке,
Юкио Фудзики, Джозефа Голла, Айана
Гиббонса, Джерома Гросса, Пьера Гийо,
Франсуазу Агено, Этьенна де Арвэна,
Джона Хейзера, Джеймса Хирша, Ганса-
Петера Гофмана, Дэвида Хогнесса, Хью
Хаксли, Джеймса Джемисона, Мориса
Карновски, Джона Кэндрю, Ричарда Кес-
села, Ульриха Лемли, Эммануэла Марголи-
аша, Арвида Маунсбаха, Оскара Миллера,
Элдона Ньюкома, Алекса и Филлис Но-
викофф, Джорджа Пэлейда, Доналда Пар-
сонса, Кита Портера, Ивэнса Рота, Элен
Шио, Сэмюела Силверстайна, Сиднея Там-
ма, Германа ван ден Берге, Мартена
Венгуйса, Лео Вернона, Юджина Виджила,
Люка Уотеркейна, Джеймса Уотсона,
Мориса Уилкинса и Хайнца Гюнтера Витмана.
Приношу им всем глубокую благодарность.
Благодарю также Фонд Арпа в Париже,
покойного Бэкминстера Фуллера, Дэна
Диксона, Карла Коопмана, Генри Мура,
Энрико ди Ровасенда, Нью-Йоркский музей
искусств (Метрополитен), Нью-Йоркский
музей современного искусства и
Ватиканский музей за оказанную мне помощь в
художественном оформлении книги.
В заключение хочу выразить свою
благодарность многочисленным секретарям,
которые несчетное число раз
перерабатывали все новые и новые варианты рукописи.
Я не в состоянии назвать всех по имени, но
хотел бы отметить Норму Мюзиек и
Патрицию Лахи (Брюссель). Моя особая
признательность Кэрри Половецки, которая
участвовала в самый трудный нью-йоркский
период работы и вынесла все только
благодаря своей несокрушимой выдержке,
полному спокойствию в самых стрессовых
ситуациях и исключительной преданности
делу.
Искренне благодарю также Миклоша
Мюллера, прочитавшего всю рукопись и
сделавшего множество полезных замечаний,
Жака Бертэ, просмотревшего приложение
по биоэнергетике, и многих рецензентов,
имена которых мне незнакомы,
отметивших (зачастую в достаточно резкой
форме) ошибки и неточности и высказавших
свои возражения по поводу ряда терминов
и стиля изложения. Ошибки в изложении
фактического материала я по мере
возможности исправил всюду. Что же
касается стиля и терминологии, то я не всегда
следовал советам моих рецензентов. Хочу
подчеркнуть, что я один несу полную
ответственность за множество оставшихся в
работе крупных и мелких погрешностей.
К длинному списку людей, коим я
обязан за помощь в работе, хочу присоединить
жену, детей, друзей и коллег по обе
стороны Атлантического океана. Они терпеливо
смирялись с тем, что книга отнимала у
меня много времени, требовала все
большего внимания и делала меня все более и
более раздражительным. Не знаю, смогу ли
я когда-либо воздать им должное за все
муки и долготерпение. Однако если мне
удалось передать читателю хотя бы
частицу того чувства восторженного удивления
и благоговения, радости и волнения,
которое испытывает исследователь живой
клетки в процессе ее изучения, то буду считать,
что мое время и мои усилия потрачены не
совсем зря.
Кристиан де Дюв
Нью-Йорк — Нетен,
апрель 1984
1
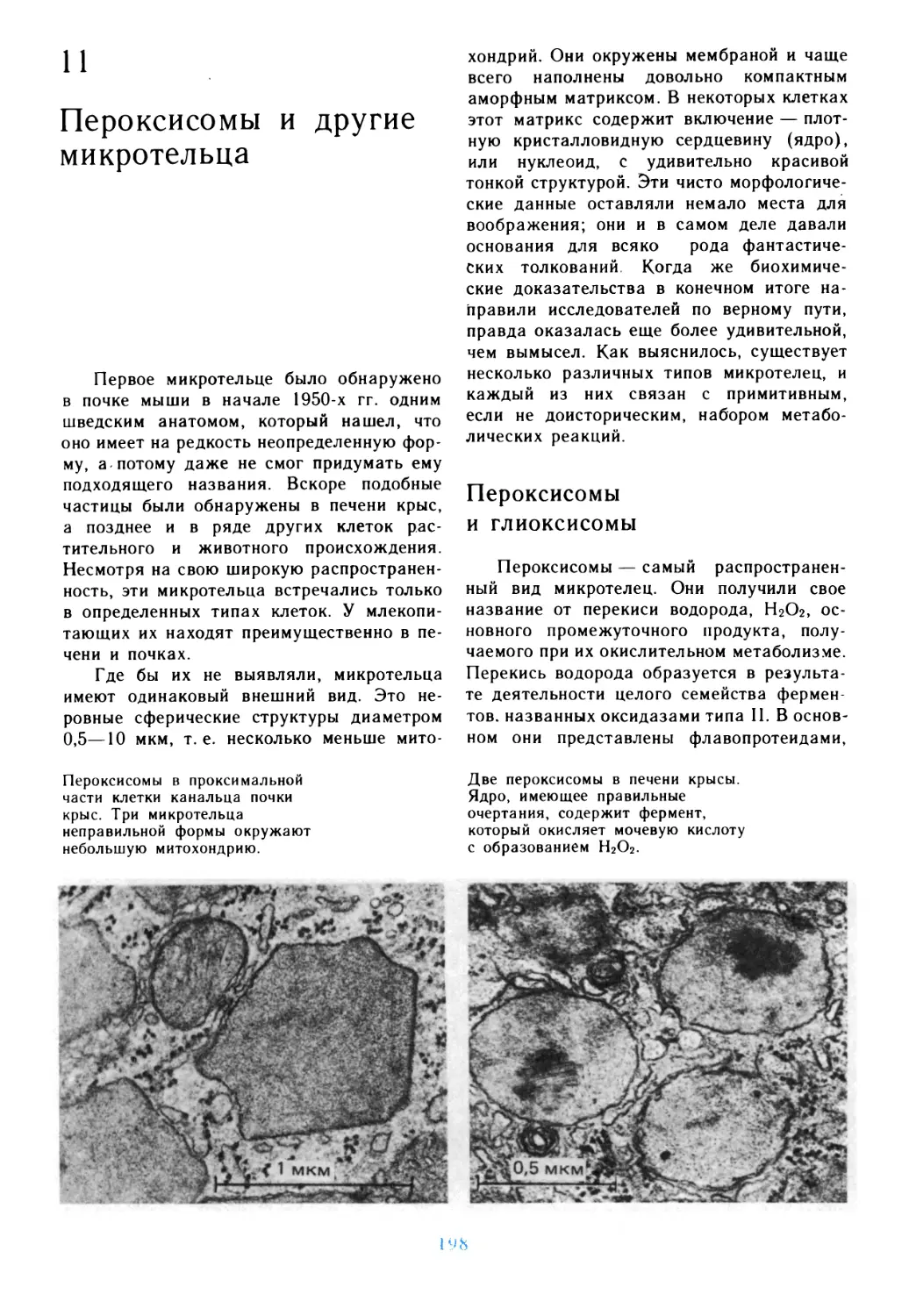
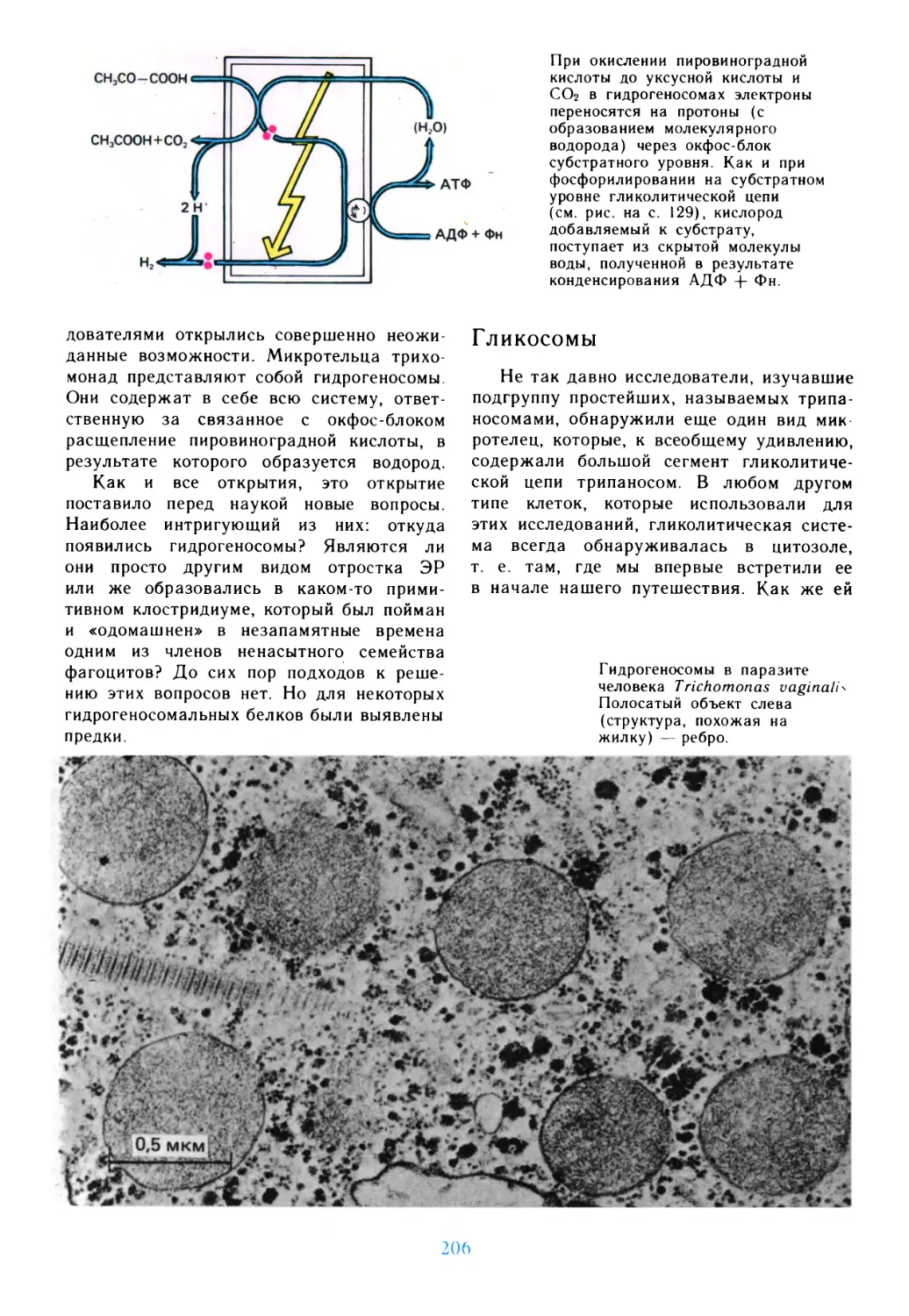
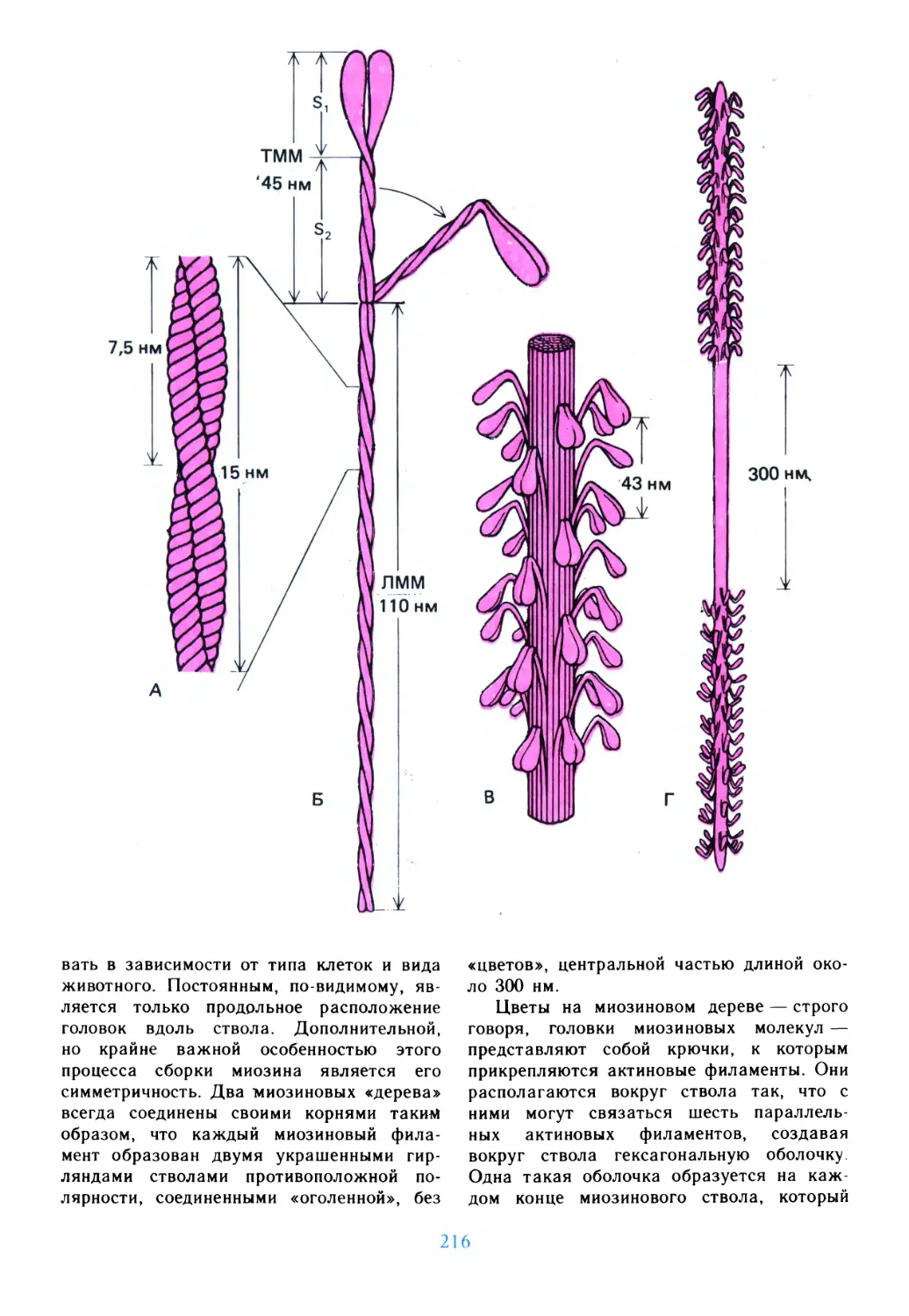
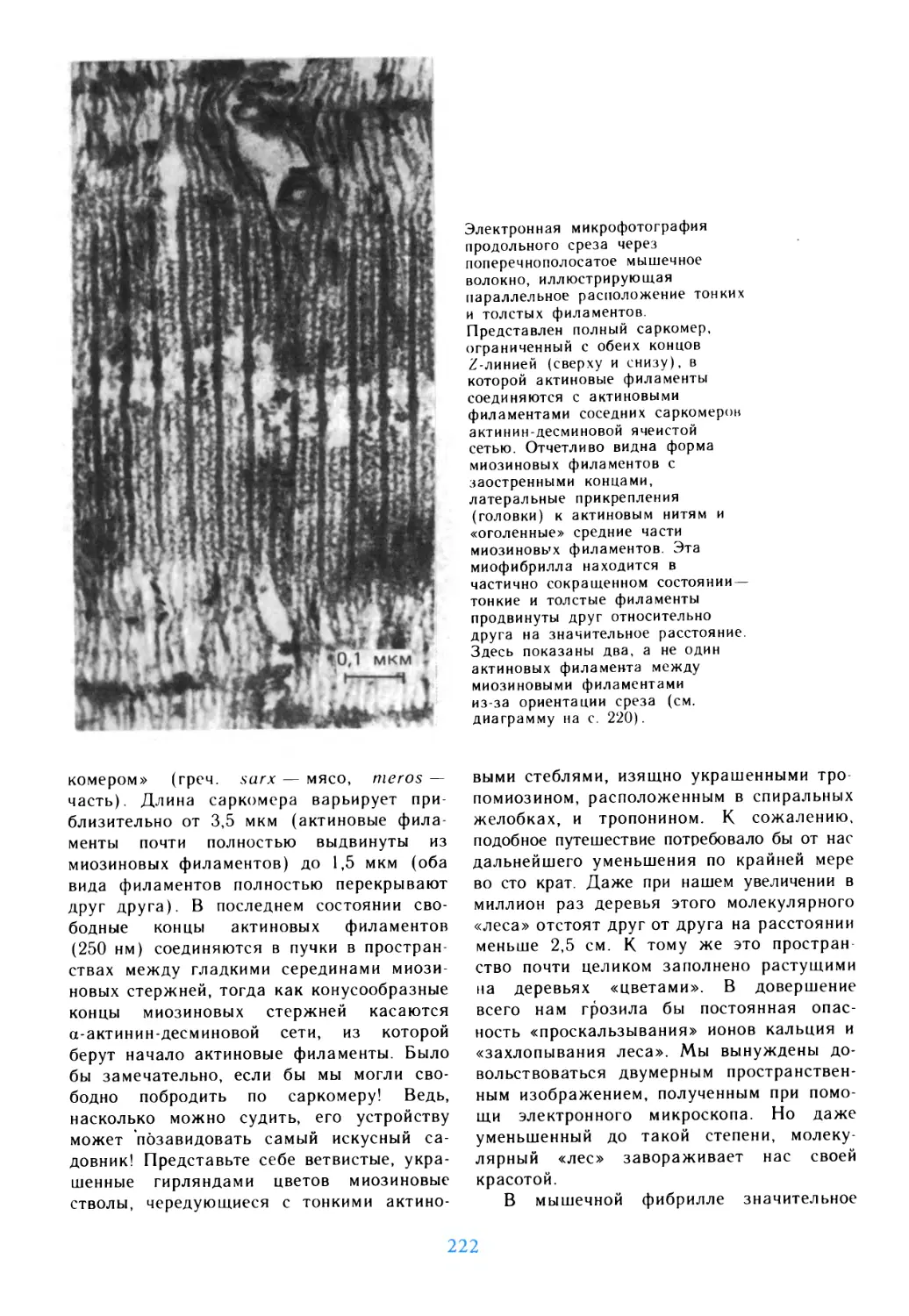
Подготовка
к путешествию
живые клетки, обобщающие основные,
наиболее характерные проявления жизни.
Большая часть нашего путешествия
пройдет среди этого разнообразия клеток,
но все же иногда мы будем
останавливаться и на отдельных определенных клетках.
Поэтому перед началом путешествия
следует познакомиться с различными типами
клеток, которые могут встретиться на
нашем пути.
Организм человека состоит из несколь
ких сотен типов клеток, каждый из которых
представлен триллионами индивидуумов.
Нам предстоит посетить незнакомый
мир, удивительный, таинственный и в хо же
время очень далекий от наших
повседневных представлений. Это мир, который
существует в каждом из нас и в любом
живом организме, увеличенный более чем
в 10 миллиардов раз. Все организмы
состоят из одной или более единиц
микроскопических размеров, называемых клетками,
которые, находясь в определенных условиях,
способны вести независимую жизнь.
Путешествуя по клетке, мы с вами будем
рассматривать жизнь в ее наиболее
элементарной и основной форме. Но вначале сделаем
краткое вступление.
Мир клетки
Прежде всего договоримся о том, что
такого понятия, как какая-то отдельная
живая клетка, нет. Есть только живые
клетки, бесчисленное множество их
разновидностей. Если мы будем рассматривать
даже наиболее очевидные характеристики
клеток — размеры, форму, характер
движения и другие внешние проявления, — мы
обнаружим их колоссальное разнообразие.
При этом основные черты сходства всех
клеток могут ускользнуть от нашего
взгляда, как это произошло с первыми учеными,
работавшими с микроскопом более 150 лет
назад. Но если мы с вами, путешествуя,
проникнем в глубь клеток, то их сходство
выявится. Когда мы достигнем мира
субмикроскопических структур и будем
знакомиться с их молекулярными
функциями, различия между клетками в значи
тельной степени сотрутся. Говоря о живой
клетке как об объекте путешествия, мы
подразумеваем нечто, объединяющее все
Это нервные, мышечные клетки, клетки
желез, крови и другие; каждый тип имеет
ряд различных подтипов. Как указывают
названия, клетки определенных типов
группируются в органы или системы
органов, выполняющие специфические функции.
Способ их группировки часто играет
решающую роль в проявлении функций
клеток. Например, поперечнополосатые
мышечные клетки похожи друг на друга и
обладают способностью к сокращению. Порядок
их объединения определяет различия
между сотнями различных мышц в теле
человека. Типы связи клеток достигают
вершины сложности в центральной нервной
системе, состоящей из десятков миллиардов
клеток, каждая из которых связана с
десятками тысяч таких же клеток. Подоб
ные связи устанавливаются между
клетками, которые каким-то образом выявляют и
распознают друг друга, а затем
объединяются вместе. Их ассоциации стабилизи
руются и поддерживаются рядом
внеклеточных структурных элементов,
ответственных главным образом за формирование
определенной характерной структуры каждого
типа ткани.
Наши ближайшие сородичи, другие
млекопитающие, по строению и
организации похожие на нас, имеют такие же типы
клеток. Сходные клеточные типы имеются
и у более далеких видов животных.
Типичные мышечные или нервные клетки
обнаруживаются у рыб, насекомых, моллюсков,
червей, но их организация по мере
понижения уровня упрощается. Еще ниже, на
уровне низших беспозвоночных, характер клеток
сам по себе начинает меняться — от
многоклеточных организмов к колониям
полуавтономных клеток. На самой нижней ступени
этой лестницы находятся полностью
независимые простейшие, например амебы,
состоящие из одной клетки.
Растения также состоят из различных
типов клеток, объединенных структурными
элементами. Но организация растений
отличается от животных. Их структура в
основном зависит от запасания солнечной
энергии, которая утилизируется в
специальных фабриках световой энергии,
зеленых хлоропластах. Если их удалить, то
останется нечто, напоминающее животную
клетку. Как и у животных, у растений
имеются различные уровни организации —
от наиболее сложных цветковых растений
и деревьев до наиболее просто
устроенных одноклеточных водорослей. У их не-
фотосинтезирующих сородичей, грибов,
также имекл^я ранги сложности,
нисходящие от высших грибов до плесени и
дрожжей.
Все эти клетки, составляющие
животное и растительное царства, построены по
одному общему плану. В частности, их
тела имеют в своем составе объемную
центральную структуру определенной
формы, называемую ядром, и разделены на
многочисленные четко выраженные
отделения мембранными перегородками. Такие
клетки называются эукариотическими (греч.
ей — хорошо, полностью и karyon — ядро).
Именно эти клетки мы посетим.
Путешествие в основном будет проходить в нашем
родном царстве животных, и лишь
изредка мы будем заглядывать в мир растений.
Наряду с эукариотами существует
более простая форма живых клеток,
называемых прокариотами из-за того, что их
ядро имеет примитивную структуру. К
прокариотам относятся бактерии. Их размеры
намного меньше, чем у эукариотов, они
живут отдельными особями или
объединены в примитивные колонии и имеют очень
простую внутриклеточную организацию.
Тем не менее бактерии обитают в
колоссальном числе видов животных, они
умудрились заселить наиболее негостеприимные
участки окружающей среды, в том числе
насыщенные парами водоемы, в которых
бьют горячие источники, и насыщенную
солью воду высыхающих морей. Бактерии
имеются повсюду, они выполняют немало
весьма важных функций, благодаря
которым остатки мертвых организмов
превращаются в вещества, которые вновь
включаются в круговорот жизни. Без бактерий
жизнь эукариотов вскоре бы замерла.
Однако некоторые бактерии
болезнетворны — они способны внедряться в высшие
организмы и вызывать заболевания.
Если мы сделаем увеличение
микроскопа на порядок больше, то обнаружим
вирусы. Они уже не считаются клетками, так
как не могут самостоятельно существовать.
Несмотря на это, вирусы обладают одним
ключевым атрибутом жизни —
способностью подавать сигналы для начала своей
репродукции, при условии, что имеется
необходимое «оборудование». Его они
находят обычно при проникновении в клетку
эукариотов или прокариотов. Оказавшись
внутри клетки, вирусы перенимают
клеточные механизмы передачи генетической
информации и таким образом
размножаются, что, как правило, приводит к
разрушению и гибели клетки, в которую они
внедрились.
История живых организмов
(четвертое измерение)
Мир молекул
Чтобы узнать, каким образом построена
клетка и как она работает, необходимо
прибегнуть к языку химии. А так как
процессы химического превращения,
происходящие в живых клетках, исключительно
важны, следует пользоваться наиболее
усложненной формой этого языка. Именно
отражением этой сложности и прогресса в
понимании химических процессов
объясняется бурное развитие биохимии в последние
годы.
Однако не все туристы могут оказаться
учеными. И будет очень обидно, если вся
прелесть и очарование жизни клетки
откроются только небольшой группе
знатоков, знакомых с миром биомолекул.
Разумеется, мы заинтересованы взять с собой
как можно больше людей и приложим
усилия к тому, чтобы предоставить такую
возможность всем желающим. Но все же
нам понадобятся некоторые знания
химии — без них большая часть путешествия
окажется бессмысленной.
Итак, допустим, что все мы в некоторой
степени знакомы с концепциями и
законами химии. По возможности я буду
использовать образы и модели для объяснения
основных химических понятий. Полагаю, что
научная строгость и точность не
пострадают от такого вынужденного упрощения.
При этих условиях, надеюсь, наше
путешествие станет возможным для
многих. Более того, думаю, что у всех
путешественников возникнет желание глубже
проникнуть в мир молекул, так как
наслаждение от изучения жизни живой клетки
станет еще больше. Ведь для того, чтобы
любоваться пирамидами и сокровищами
фараона Тутанхамона, вовсе не
обязательно быть египтологом. Однако, чем больше
вы узнаете историю этих знаменитых
объектов, тем больше удовольствия и пользы
получите от их созерцания.
Проблема размеров
Клетки измеряются в микронах (1 мкм —
одна миллионная часть метра),
молекулы— в нанометрах (1 нм — одна
миллиардная часть метра). Столь малые частицы
очень трудно увидеть глазом. Возьмем, к
примеру, среднюю клетку эукариотов.
Неравномерно сферическая по форме, она
имеет диаметр около 25 мкм, или 2,5
тысячных сантиметра, так что один миллиард
клеток поместится плотно в 2,5 кубических
сантиметра. Диаметр бактерий составляет
около 1 мкм; в одну клетку эукариотов
может поместиться свыше 10 000 бактерий.
Многие вирусы настолько малы, что тысячи
их могут занять одну бактериальную
клетку, или же десятки миллионов миллиардов
поместятся в одном кубическом
сантиметре. Это невозможно даже представить!
В нашем путешествии мы преодолеем
это препятствие, уменьшившись до
размеров бактерии, то есть примерно в миллион
раз во всех трех измерениях. Другими
словами, мы останемся такими, как есть, но
все наше окружение увеличится в миллион
раз. Увеличенная во столько раз Земля
окажется гораздо дальше положения
Солнца, лучу света понадобится более 18 часов
для прохождения от одного полюса до
другого, а клетка вырастет до размеров
большой аудитории. Теперь мы с вами
можем остановиться на любой части
клетки, привлекшей наше внимание, и
различить отдельную ее деталь, вплоть до
молекулы.
Четвертое измерение
Биология, как геология и космология,
тесно связана с историческими событиями.
Объекты ее исследования насчитывают
возраст около нескольких миллиардов лет.
Это четвертое измерение стало очевидным
только около 200 лет назад, когда были
обнаружены окаменелости, которые, как
доказали ученые, не являются жертвами
Великого потопа или шалостями некоего
божества, посадившего несколько мертвых
видов среди живых особей (так полагали
некоторые). Это были кости и оболочки
давно вымерших животных, окаменевшие
отпечатки растений, которые пышно цвели
много тысячелетий назад. По мере
разработки методов определения возраста в
геологии исторические события начали
проясняться: чем древнее были остатки
ископаемых, тем примитивнее оказывался
уровень их организации. Так, выяснилось,
что моллюски появились раньше рыб,
развитие которых в свою очередь
предшествовало возникновению пресмыкающихся.
Птицы и млекопитающие появились позже,
за ними последовало появление первых гу-
маноидов. На основании полученных
учеными данных в первой половине XIX в. была
создана концепция эволюции живых
организмов, вершиной которой явилось
опубликование в 1859 г. Ч. Дарвином основопола»
гающей работы «Происхождение видов
путем естественного отбора».
Хотя окаменелые остатки содержат
ключи к разгадке эволюции клеток,
недавние достижения в области биохимии и
молекулярной биологии снабдили нас
новыми мощными средствами, позволившими
воспроизвести прошлое путем исследования
настоящего. Открытия в этой области
вызвали большой интерес, и четвертое
измерение вошло в биологию клетки и проникло в
концепции о живой клетке и ее составе.
В таком путешествии, как наше, мы не
можем пройти мимо этих фактов. Поэтому
иногда, делая остановку, мы с вами будем
возвращаться к происхождению и
эволюции наблюдаемых явлений.
Инструменты и их развитие
Чуть более 300 лет отделяют нас от того
времени, когда впервые была замечена
живая клетка; ныне мы являемся
свидетелями массового внедрения туризма и средств
популяризации в этой области. Каждая
веха, возникшая на пути, который вел
исследователей в глубь клетки, связана с
появлением нового инструмента или
прибора. Вот почему нам следует
остановиться на основных этапах этого пути.
Морфологический подход
Мир клеток невидим невооруженным
глазом. Он оставался полностью
неизведанным до середины XVII столетия, пока
люди с пытливым умом и искусными
руками не научились шлифовать линзы и
использовать их для расширения
возможностей зрения. Одним из первых создателей
микроскопа был англичанин Роберт Гук —
физик, метеоролог, биолог, инженер,
архитектор, один из самых замечательных
представителей своего времени. В 1665 г. он
опубликовал прекрасный альбом рисунков
под названием «Микрография»,
изображающих его наблюдения под микроскопом.
Среди них был и тонкий срез пробковой
ткани дерева, структура которого
напоминала соты, четкое и правильное расположе
ние «микроскопических пор», или «клеток».
Гук использовал слово «клетки» в его
подлинном смысле, имея в виду маленькие
камеры наподобие помещений, в которых
сидят заключенные, или монашеских келий.
Это слово закрепилось в науке, но теперь
оно означает не мелкие дырочки, которые
видел Гук в мертвой коре дерева, а
«зернышки» вещества, заполняющего поры
живого дерева.
Одним из одареннейших современников
Гука был голландец Антони ван Левенгук,
создавший более двухсот микроскопов
особой конструкции. Они состояли из
небольшого стеклянного шарика, вставленного в
медную пластинку. Держа такое
приспособление близко к глазу и рассматривая
через стеклянный шарик различные
предметы, укрепленные на кончике иглы, при
этом работая винтом, Левенгук смог
добиться увеличения в 270 раз и сделал
замечательные открытия. Он сумел впервые
увидеть то, что было им названо «аниман-
кулюсы», в крови, сперме и воде, взятой
из болот и прудов. Достойно удивления,
что Левенгуку удалось увидеть даже
бактерии, которые он зарисовал с такой
точностью, что специалисты и сейчас могут их
распознать.
Однако не все исследователи, в
прошлом пользовавшиеся микроскопом,
оказались столь наблюдательными. Когда дело
доходило до объектов, таких малых, как
живые клетки, которые ученые наблюдали с
помощью примитивных инструментов, очер
тания их были настолько расплывчатыми,
что большинство деталей приходилось
дополнять за счет воображения. Одни
исследователи — и таких было немало —
проявили похвальную сдержанность и не
давали воли своей фантазии. Другие же
пользовались ее преимуществами вовсю и
достигали при этом большой известности,
как, например, француз Готье д'Агости,
восторженный приверженец теории
преформизма, суть которой заключается в том,
что, по предположению, в головке спер-
мальной клетки находится полностью
сформированный ребенок.
В течение долгого времени
исследования с помощью микроскопа проводились
в основном вокруг мира клетки, пока в
1827 г. итальянскому физику Джованни
Батисте Амичи не удалось исправить
основные оптические аберрации линз. Увели-
2—1452
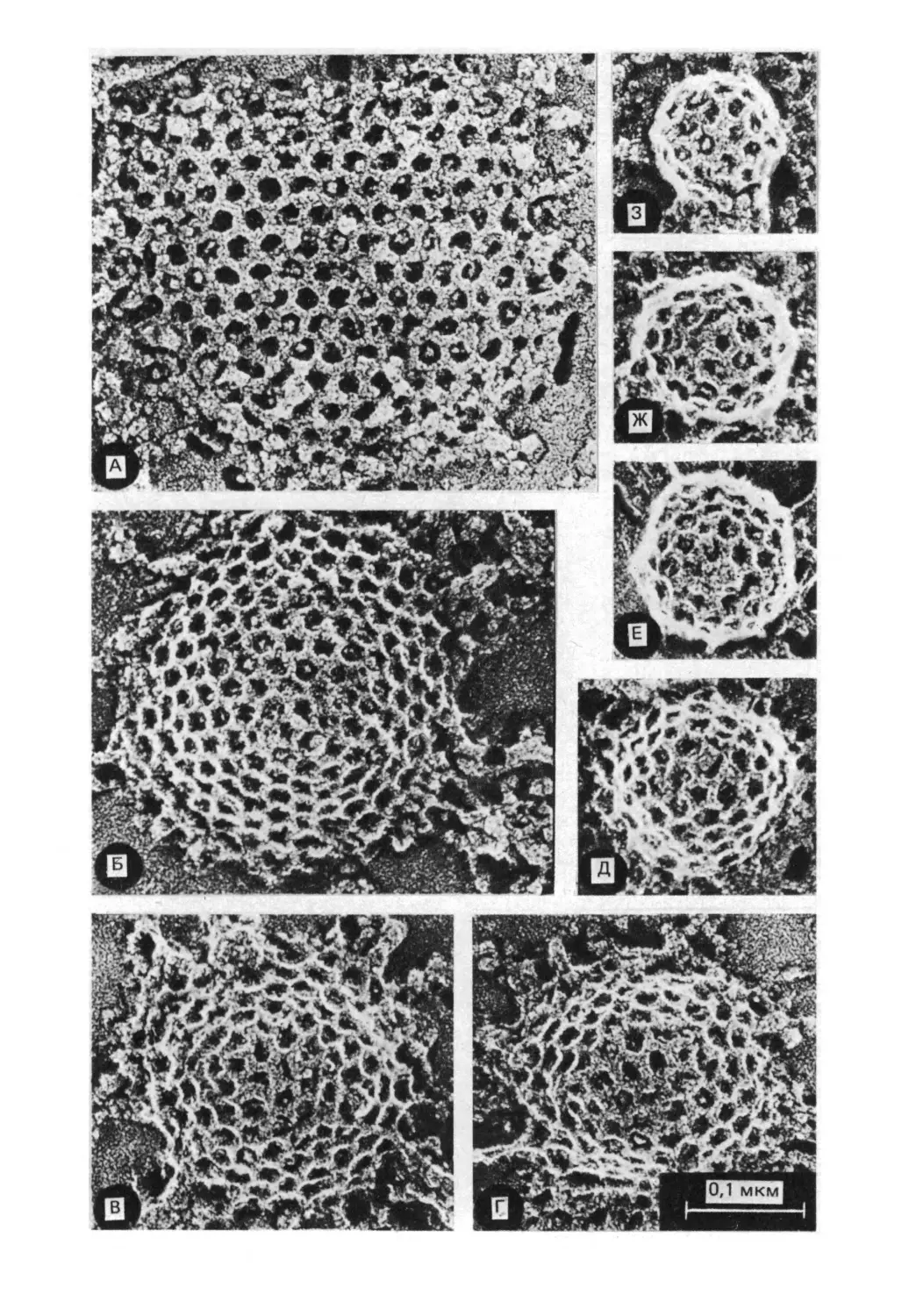
Микроскоп Роберта Гука
и масляная лампа, которую он
использовал для освещения
(рисунок самого изобретателя
в его книге «Микрография»)
чение четкости изображения имело такие
важные последствия, что уже через
несколько лет можно было сформулировать
общую теорию, согласно которой все
растения и животные состоят из одного или
более элементов — клеток. Эта теория
была предложена для растений в 1837 г.
На историческом рисунке Роберта
Гука микроскопической структуры
тонкого среза пробковой ткани
изображены небольшие полости,
которые Гук назвал клетками.
Эта фотография сделана
английским биологом Брайаном
Дж. Фордом в Кардиффском
университете с помощью
сканирующего электронного
микроскопа, который усиливает
рельеф объекта. Изображен
срез пробковой ткани, сходный
с рисунком Роберта Гука. Срез
был сделан Антони ван Левенгуком
в 1674 г. и обнаружен Фордом
в 1981 г. среди писем Левенгука,
адресованных Королевскому
обществу в Лондоне (секретарем
общества был Гук).
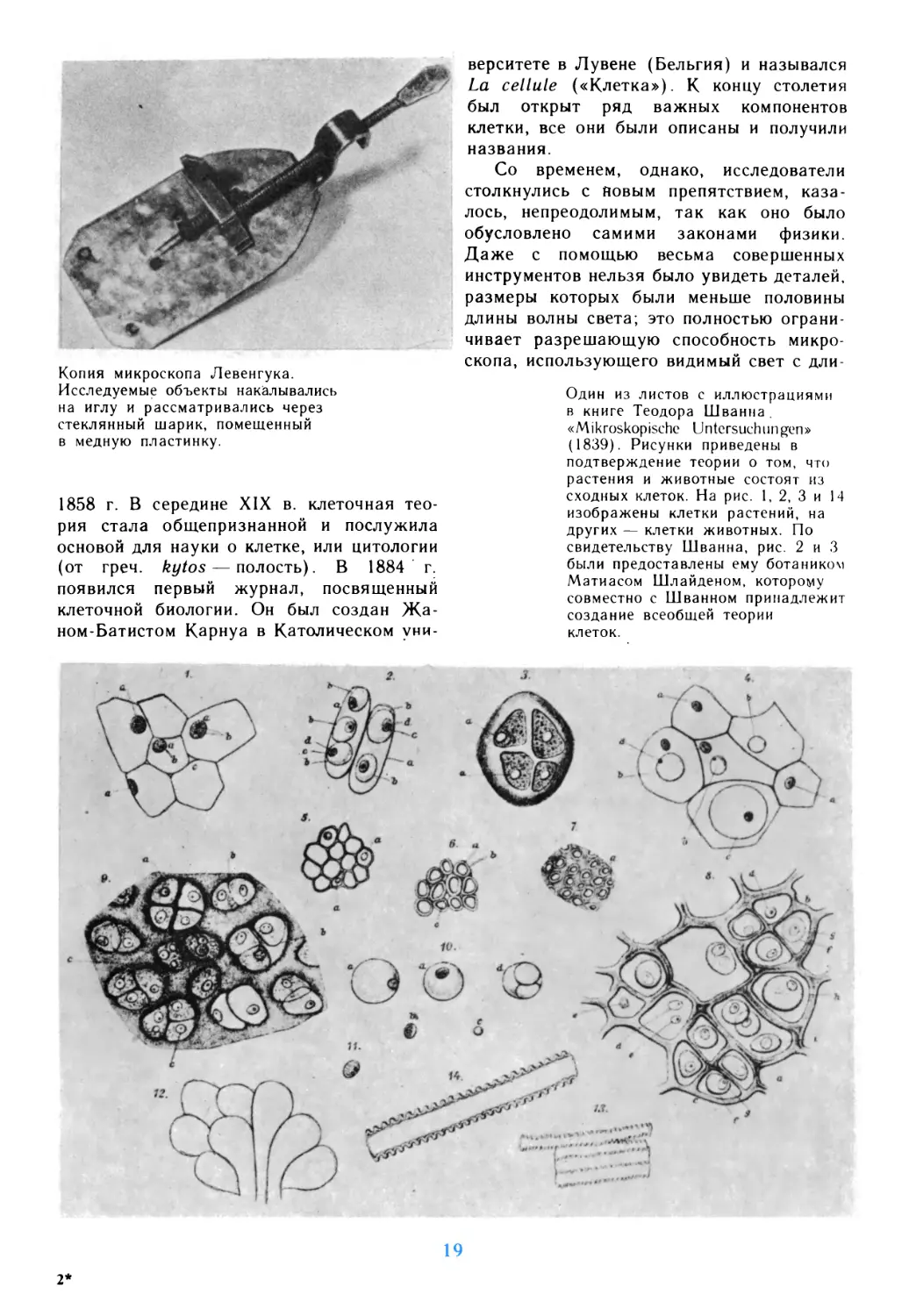
немецким ботаником Маттиасом Шлейде-
ном и распространена на животный мир его
другом, физиологом Теодором Шванном
Немного позже ее дополнил патолог
Рудольф Вирхов, который в 1885 г.
провозгласил: Omnis cellula e cellula — «каждая
клетка происходит из клетки», что является
перефразированным выражением: Отпе
vivum ex ovo — «любой живой организм
происходит из яйца», принадлежащим
Уильяму Гарвею, английскому врачу,
который впервые обнаружил циркуляцию крови
(Гарвей умер за несколько лет до
открытия Роберта Гука). Вирхов также первым
развил клеточную теорию в патологии, о
чем свидетельствует название его книги
«Клеточная патология», опубликованной в
Копия микроскопа Левенгука.
Исследуемые объекты накалывались
на иглу и рассматривались через
стеклянный шарик, помещенный
в медную пластинку.
1858 г. В середине XIX в. клеточная
теория стала общепризнанной и послужила
основой для науки о клетке, или цитологии
(от греч. kytos — полость). В 1884 г.
появился первый журнал, посвященный
клеточной биологии. Он был создан
Жаном-Батистом Карнуа в Католическом
университете в Лувене (Бельгия) и назывался
La cellule («Клетка»). К концу столетия
был открыт ряд важных компонентов
клетки, все они были описаны и получили
названия.
Со временем, однако, исследователи
столкнулись с новым препятствием,
казалось, непреодолимым, так как оно было
обусловлено самими законами физики.
Даже с помощью весьма совершенных
инструментов нельзя было увидеть деталей,
размеры которых были меньше половины
длины волны света; это полностью
ограничивает разрешающую способность
микроскопа, использующего видимый свет с дли-
Один из листов с иллюстрациями
в книге Теодора Шванна.
«Mikroskopische Untersuchungen»
(1839). Рисунки приведены в
подтверждение теории о том, что
растения и животные состоят из
сходных клеток. На рис. 1, 2, 3 и 14
изображены клетки растений, на
других — клетки животных. По
свидетельству Шванна, рис. 2 и 3
были предоставлены ему ботаником
Матиасом Шлайденом, которому
совместно с Шванном принадлежит
создание всеобщей теории
клеток.
Одна из 144 гравюр,
иллюстрирующих книгу Рудольфа
Вирхова „Cellularpathologie"
(1858). Вирхов впервые
обнаружил, что клетки происходят
из клеток, а не путем
кристаллизации из аморфной
плазмы, как предполагал Шванн.
ной волны около 0,25 мкм. В мире клеток
такие размеры достаточно велики —
разумеется, относительно. Только представьте,
что в окружающем нас мире нельзя
различить ни одну деталь, которая была бы
меньше 25 см! Это все, что смогли бы
увидеть исследователи с помощью
классического микроскопа, если бы они пустились
в путешествие по живой клетке,
увеличенной в миллионы раз, что мы с вами и
собираемся предпринять.
Химический подход
К тому времени, когда микроскописты
трудились над усовершенствованием своих
приборов, относится второй этап изучения
клетки — начало ему положили открытия
Титульный лист первого издания
первого журнала по цитологии,
опубликованного в 1884 г.
Портрет Лавуазье с женой,
написанный Луи Давидом в
1788 "г., за шесть лет до того,
как французский физик был
приговорен к смертной казни
гильотинированием судьей,
сказавшим: «Республика не
нуждается в ученых».
Исторический портрет долгое
время висел в библиотеке
Рокфеллеровского института
медицинских исследований
(теперь Рокфеллеровского
университета), где были сделаны
многие открытия в области
современной клеточной биологии.
Ныне находятся в
Метрополитен-музее в
Нью-Йорке.
таких ученых, как француз Антуан де
Лавуазье, англичанин Джозеф Пристли и
другие; в конце XVIII в. они создали
новую науку — химию. В отличие от морфо
логии, которая развивается от сложного к
простому, химия продвигается от простого
к сложному. Начиналась химия с
идентификации элементов, атомов и затем
продвигалась по пути изучения некоторых их
более простых комбинаций молекул.
Исторической вехой проникновения химии в
живой мир является впервые проведенный
немецким ученым Фридрихом Вёлером в
1828 г. синтез биологической молекулы —
мочевины. Это позволило пересечь границу
между неорганической и органической
химией, которая, по мнению многих, могла
быть преодолена только с помощью «жиз-
ненной силы».
Следующие сто лет отмечены
значительными успехами в наших
представлениях о химическом составе живых клеток.
Были открыты, очищены, структурно
изучены и получены синтетическим путем
аминокислоты, сахара, жиры, пурины,
пиримидины и другие небольшие
существующие в природе молекулы. Ученым
удалось в известной мере составить
представление о метаболизме этих веществ в
организме и путях образования из них
основных биологических молекул: белков,
полисахаридов и нуклеиновых кислот.
Но тут опять возникли труднопреодолимые
препятствия на пути к прогрессу. Перед
сложностями структурной комплексности,
обнаруженными в этих крупных молекулах,
классическая химия оказалась почти
бессильной.
Экспериментальный подход
В течение длительного времени клетки
изучали в основном путем наблюдения за
ними. Но по мере развития
экспериментального метода в естественных науках
к нему начали прибегать и при
исследовании живых организмов. Это в
значительной степени облегчалось мощным взрывом
биомедицинских изысканий, проводимых во
второй половине прошлого столетия.
Физиология, фармакология, генетика,
бактериология, иммунология, экспериментальная
эмбриология, сравнительная и
эволюционная биология — все эти науки во многом
помогли проникнуть в мир живой клетки и
лучше узнать его. Наиболее важное
событие, относящееся к началу нашего века,
связано с именами американца Росса Гар
рисона и француза Алексиса Карреля,
которые установили, что клетки животных
можно культивировать в пробирке
наподобие одноклеточных организмов. Тем самым
они продемонстрировали способность
клеток к независимой жизни и создали метод
культивирования, который и по сей день
оказывает значительную помощь
исследователям.
Вместе с тем эти достижения, по сути
революционные, по-прежнему были
основаны на методах, которые волей-неволей
оставались непрямыми, а клетки
продолжали существовать сами по себе, будучи
практически закрытыми «черными
ящиками». Вот почему, несмотря на
значительный прогресс во всех областях науки,
все еще существовала неисследованная
область между наименьшей различимой
в световом микроскопе частицей и наиболее
крупной молекулой, доступной химическому
исследованию. На карте знаний о живой
клетке эта область охватывала широкое
пространство, превышающее два порядка
увеличения, оставаясь terra incognita.
Ученые сознавали, что в этой таинственной,
казалось бы, недоступной территории
скрыты принципиально важные понятия и
концепции, без знания которых жизнь
клеток навсегда останется нераскрытой, но
могли только с огорчением взирать на нее.
Однако кое-кто из них не сдавался. Идя
по стопам своих предшественников, они
призвали изобретательность на помощь
пытливости в надежде осуществить
единственно возможное: улучшить методы
исследования.
1945 год: прорыв
Длительные непрерывные усилия
внезапно принесли желанные результаты в
конце второй мировой войны; именно тогда
благодаря удивительному стечению
обстоятельств почти в одно и то же время ученые
обогатились целым рядом новых мощных
инструментов и методов исследования.
В морфологии таким инструментом стал
электронный микроскоп. Созданный еще в
30-е гг., он обладал достаточной
разрешающей способностью, позволяющей про
никнуть в дотоле неизвестное пространство
Первое изображение клетки,
полученное под электронным
микроскопом Кейтом Р. Портером
Альбером Клодом и Эрнестом
Ф. Фулламом и опубликованное
в Journal of Experimental
Medicine за 1945 г.
клетки вплоть до структур размером в
нанометр. Вместе с тем слабая
проникающая способность электронного пучка
требовала приготовления очень тонких образцов
материала — не более нескольких
миллионных долей дюйма — и высокого вакуума.
Столь жесткие требования создавали
значительные технические трудности, которые
многих обескуражили. Но некоторые
исследователи упорствовали,
воодушевленные перспективами прогресса,
открывающимися при применении новой техники.
В удивительно короткий срок им удалось
разработать методы для подготовки
образцов тканей и сконструировать приборы для
получения из них ультратонких срезов.
Качество изображения объектов неуклонно
повышалось, что позволило к началу
60-х гг. морфологически описать многие
из ранее неизвестных структур.
В свою очередь биохимия также
обогатилась целым рядом принципиально новых
приборов и методов. Наиболее важными
из них оказались хроматография и мечение
изотопами. Особый интерес представляла
хроматография, основанная на очень
простом феномене — образовании каемки или
ореола вокруг пятна. Этот феномен знаком
каждому, кто когда-либо видел, как на
промокательной бумаге растекается капля
чернил, или пытался удалить пятно
специальным раствором. В основе этого явления
лежат различия в скорости движения
разных красок в потоке растекающейся
жидкости. Некоторые краски могут двигаться
вместе с растворителем, но многие
запаздывают в той или иной степени, что
объясняется их связыванием с волокнами бумаги
или ткани. Именно так образуются
концентрические круги. В начале текущего
столетия русский физиолог и биохимик
растений Михаил Семенович Цвет первым
использовал этот феномен. Пропуская
экстракт из листьев через вертикальную
трубку, заполненную адсорбирующим
порошком, он сумел разделить основные
пигменты листьев — зеленый и
оранжевый — и получить их в виде отдельных
окрашенных полос или колец вдоль трубки.
Свой метод он назвал «хроматографией»
(греч. khroma — цвет, graphein —
записывать).
Цвет умер относительно молодым, и
потенциальные возможности его
замечательного метода долгое время, вплоть до
начала 40-х гг., оставались неиспользованными.
Сейчас существует множество вариантов
хроматографии — не ограниченной,
разумеется, пигментированными молекулами, а
Хроматография. Простое
устройство, аналогичное
изображенному на этом
рисунке, было использовано
М. С. Цветом для разделения
основных пигментов в экстракте
из листьев. Прибор состоит из
колонки с порошком адсорбента,
через который просачивается
жидкость.
А. Экстракт из листьев
пропускают через колонку. Все
пигменты остаются связанными
в верхней части адсорбционной
колонки.
Б. После нанесения вещества
на колонку через нее пропускают
соответствующую жидкость
(элюант), которая перемещает
различные пигменты с разными
скоростями в зависимости от силы
их связывания с адсорбентом.
применимой ко всем веществам, которые
могут быть идентифицированы аналитиче
ским методом. Близким к хроматографии
методом является электрофорез в геле, при
котором не поток растворителя, а
электродвижущая сила способствует
передвижению и разделению электрически
заряженных компонентов. Описанные методы
произвели подлинный переворот в области
химического разделения и анализа. Теперь
на следовых количествах смеси
практически любого состава можно без особых
усилий провести анализ, который раньше
был полностью недоступен ученым или
требовал от них трудоемких повторных
экстракций, преципитаций или кристалли
заций и больших количеств исходного
материала.
Вторым методом, радикально изменив
шим химическое исследование живых
клеток, явился метод изотопного мечения.
Изотопы — это разновидности одного и
того же химического элемента,
отличающиеся по атомной массе. Некоторые
изотопы существуют в природе, а многие
могут быть получены искусственным путем
в процессе ядерных реакций. Так, помимо
атома водорода 'Н с атомной массой 1,
наиболее распространенного в природе,
существуют тяжелый природный изотоп
2Н (дейтерий) и еще более тяжелый искус
ственный изотоп 3Н (тритий). Все три раз-
Начало
68 000
45 000
24 000
21 500
18 400
14 300
6 500
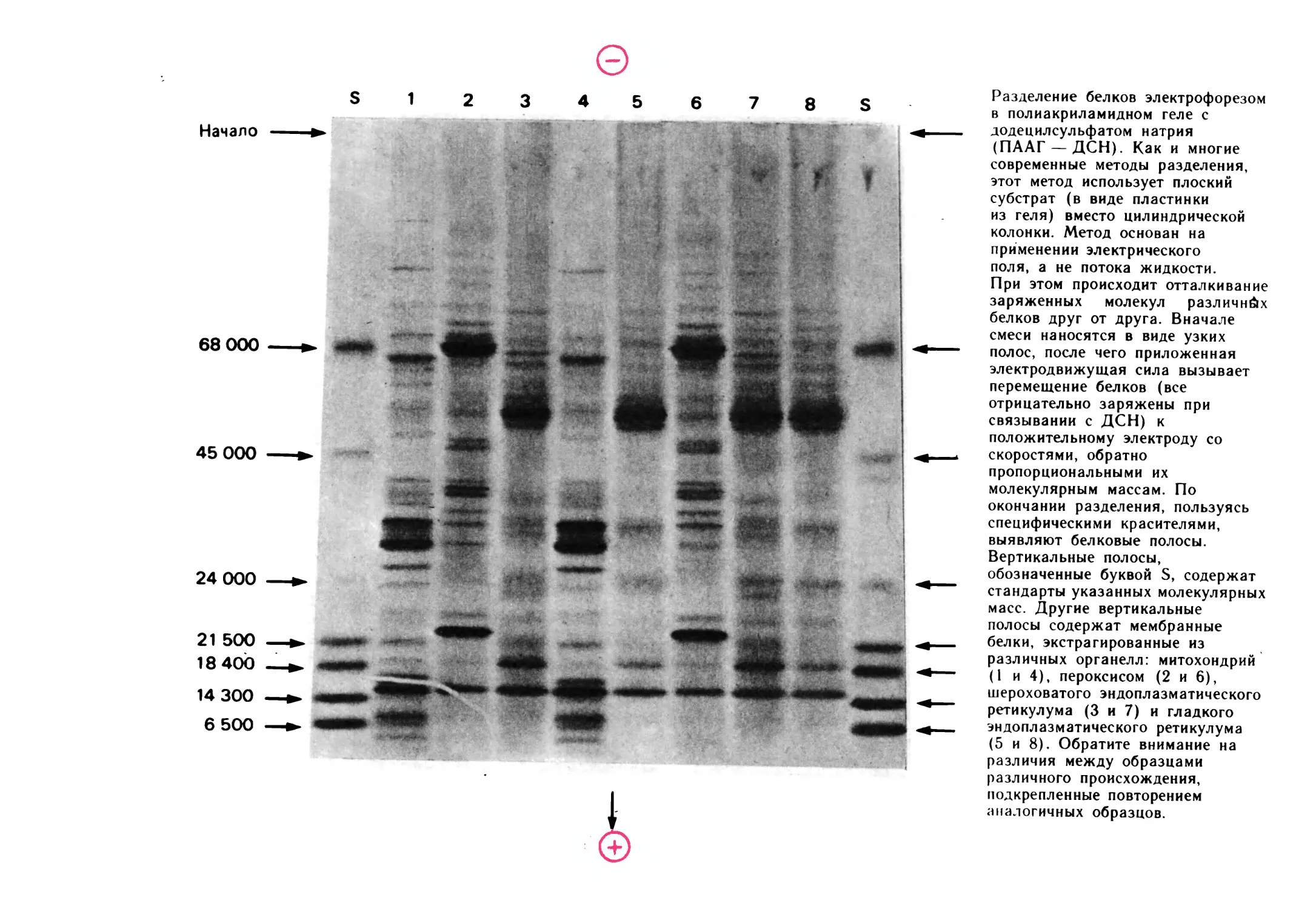
Разделение белков электрофорезом
в полиакриламидном геле с
додецилсульфатом натрия
(ПААГ —ДСН). Как и многие
современные методы разделения,
этот метод использует плоский
субстрат (в виде пластинки
из геля) вместо цилиндрической
колонки. Метод основан на
применении электрического
поля, а не потока жидкости.
При этом происходит отталкивание
заряженных молекул различных
белков друг от друга. Вначале
смеси наносятся в виде узких
полос, после чего приложенная
электродвижущая сила вызывает
перемещение белков (все
отрицательно заряжены при
связывании с ДСН) к
положительному электроду со
скоростями, обратно
пропорциональными их
молекулярным массам. По
окончании разделения, пользуясь
специфическими красителями,
выявляют белковые полосы.
Вертикальные полосы,
обозначенные буквой S, содержат
стандарты указанных молекулярных
масс. Другие вертикальные
полосы содержат мембранные
белки, экстрагированные из
различных органелл: митохондрий
(1 и 4), пероксисом (2 и 6),
шероховатого эндоплазматического
ретикулума (3 и 7) и гладкого
эндоплазматического ретикулума
(5 и 8). Обратите внимание на
различия между образцами
различного происхождения,
подкрепленные повторением
аналогичных образцов.
новидности водорода имеют весьма схожие
химические свойства: они соединяются с
кислородом с образованием воды, с
углеродом — с образованием углеводородов
и т. д. Но они отличаются друг от друга
по масс-спектрографий, которая, как
явствует из самого названия, разделяет
атомы в соответствии с их массой. Особенно
легко выявляется тритий, так как в
дополнение ко всему он радиоактивен, как и
большинство изотопов, используемых для
мечения.
Преимущество исследований с помощью
изотопов заключается в том, что они ис
пользуются для специфического мечения
определенных молекул или частей молекул;
таким образом, эти молекулы можно
узнать и отличить от родственных им
молекул почти без нарушения общей структуры
Наиболее плодотворно этот метод
используется при анализе биосинтетических про
цессов, большая часть которых не могла
бы быть раскрыта иным путем. Например,
с получением меченых аминокислот
появилась возможность изучать их соединение
в белки в живом организме или в
экспериментальных условиях, даже несмотря на
бесконечно малое количество вновь
образованного белка по сравнению с предсуще-
ствующим содержанием белка. Вновь
образованные белки, не выявляемые
химическим путем, могли быть определены и даже
измерены благодаря их радиоактивности.
Использование изотопов для подобных
исследований началось накануне второй
мировой войны; в то время были доступны
несколько природных ( Н, I5N) или
искусственных (32Р) изотопов. Однако широкое
распространение этот метод получил лишь
с созданием атомных реакторов и
производством широкого спектра радиоизотопов
по доступной цене. Без метода меченых
атомов поистине феноменальные
достижения последних десятилетий в клеточной
и молекулярной биологии были бы
Невозможны. Метод служит одним из важных
примеров использования атома в мирных
целях.
Хотя и морфология, и биохимия,
обогащенные новыми методиками, постоянно
совершенствовались, все же для ликвидации
существующего между ними разрыва по-
прежнему испытывалась необходимость в
создании мостика. Этот разрыв становился
все меньше по мере развития методов
разделения клетки на части таким образом,
что каждую из них можно было полностью
изучить. Для этого* биохимики должны
были прежде всего научиться «раскрывать»
клетку настолько осторожно, чтобы
выделить ее хрупкие составные части, но при
этом не повредить их. Как только это было
достигнуто, появилась возможность
использовать различия в физических свойствах, в
частности величине и плотности, тех или
иных составных частей клетки для
отделения их друг от друга. Методы,
применяемые для подобного фракционирования,
основывались главным образом на центри
фугировании. В этом отношении развитие
центрифугирования как аналитического
метода и создание высокоскоростных
ультрацентрифуг в 20-е — 30-е гг. сыграли весьма
важную роль.
Благодаря удивительному
историческому совпадению все новые методы стали
доступными почти одновременно в середине
40-х гг. Среди многих имен, связанных
с этими событиями, имя Альбера Клода,
умершего в мае 1983 г., заслуживает
особого упоминания. Клод родился в Бельгии
на пороге нового века, а в 1929—1949 гг.
работал в Рокфеллеровском
научно-исследовательском медицинском институте в
Нью-Йорке, где впервые самостоятельно,
практически без посторонней помощи
использовал электронный микроскоп для
изучения клеток,'а также разработал
основные методы фракционирования клеток при
помощи центрифугирования. Тем самым,
образно говоря, он ввел армии морфологов
и химиков на девственные территории
клетки, объединил их и показал, сколь
плодотворно такое объединение. Сегодня
область, открытая Клодом, настолько
хорошо изучена, что позволяет даже совершать
путешествие по ней, что мы и собираемся
сделать. Однако одна часть клетки — ее
важнейшая центральная часть, ядро — ос
талась бы в значительной степени недо
ступной, если бы не произошло еще одно
событие.
Бум в молекулярной биологии
Это событие происходило параллельно
с массированным вторжением в эукариоти
ческую клетку, но на самой границе живого
мира. А началось оно с попытки проанали
зировать с помощью генетики особенности
Вводятся
радиоактивные
аминокислоты
Через три минуты
животное забивают и
экстрагируют белки
Белки,
образованные
в течение трех
последних минут,
радиоактивны
некоторых простых вирусов,
инфицирующих бактерии и названных
бактериофагами — пожирателями бактерий. Это скром
ное исследование оказалось верным
подходом к проблеме генетической организации,
которая даже у этих простейших
организмов была необыкновенно сложной.
Длительное время новая дисциплина,
известная сегодня как молекулярная
биология, ограничивалась изучением вирусов и
бактерий. Но затем она буквально
ворвалась во владения эукариотов и обогатила
исследователей новыми тонкими методами,
с помощью которых теперь изучаются
самые укромные уголки клетки.
Молекулярная биология также породила новый
мощный метод рекомбинации ДНК,
который может оказать глубокое влияние на
будущее человечества.
Из нашего краткого исторического
обзора следует важный вывод: решающая
роль в развитии и прогрессе науки
принадлежит новым приборам и методам. Это,
разумеется, не означает отрицания
решающей роли творческих возможностей интел
лекта, интуиции, воображения, порой даже
гениальности ученых на каких-то этапах.
Но они пропадут втуне без средств
технического прогресса, обеспечивающих
контакт с реальным миром. В свое время Клод
сказал: «В истории цитологии зачастую
обнаруживалось, что прогресс невозможен
до случайного появления новых
технических средств». Много таких «случайностей»
накопилось с той поры, как Роберт Гук
впервые направил зеркальце микроскопа
на срез пробки. Далеко идущие
последствия этих «случайностей» вылились в
основные открытия последних десятилетий.
И хотя всегда трудно оценить в
историческом аспекте эпоху, в которой ты живешь,
мне кажется, что вторая половина
текущего столетия запомнится людям
благодаря величайшим открытиям в области
человеческого знания — возможно,
наиважнейшим сегодня, так как они касаются
основных механизмов жизни.
Три примера, иллюстрирующих
использование радиоактивных
изотопов.
A. Использование меченых
аминокислот в качестве субстратов
для точного измерения количества
синтезированного из них белка,
даже если это количество
чрезвычайно мало по сравнению
с общим количеством
присутствующего белка.
Б. Радиографическое изображение
белков, синтезированных из
радиоактивных аминокислот (как
в части А), после разделения
в ПААГ — ДСН (см. предыдущий
рисунок).
B. Высокоразрешающая
авторадиография в сочетании
с электронной микроскопией
используется для локализации вновь
синтезированных белков в части
клетки, занятой шероховатым
эндоплазматическим ретикулумом.
На этом срезе через клетку из
поджелудочной железы морской
свинки, получившей инъекцию
меченной тритием аминокислоты
(*Н-лейцин) за три минуты до
забоя, каждый плотный
причудливый завиток представляет
собой след, оставленный на
фотоэмульсии одним электроном,
излученным в данном месте
радиоактивным белком.
Фактор личности
Как говорят, ученые не читают книгу о
Природе. Они ее пишут. Это, разумеется,
не означает, что занятия наукой сродни
занятию литературой. Напротив,
исследователи делают все возможное, чтобы
остаться верными фактам, а коллективный
процесс, при помощи которого факты
получают и обобщают, способствует
объективности.
Однако, как ни старайся, достичь
идеальной объективности невозможно. Нет
такого понятия, как факт сам по себе.
Существуют только регистрации и
интерпретации фактов отдельными личностями. Даже
простейшие наблюдения мы получаем через
наши органы чувств, которые действуют
как высоко избирательные, но весьма
субъективные фильтры, пропускающие
только некоторые ограниченные сигналы из
окружающего нас мира. Мы значительно
расширили возможности наших органов
чувств благодаря аппаратуре, однако
только за счет введения дополнительных
фильтров. Линза позволяет выявить более
мелкие детали, чем глаз, но не без искажения.
Мы можем проникнуть еще глубже при
помощи электронного микроскопа, достичь
атомов методом рентгеновской дифракции,
Фракционирование клеток
методом дифференциального
центрифугирования впервые
было разработано Альбером
Клодом и его учениками
В. Шнайдером,
Дж. Хогебумом и Дж. Пелейдом.
Вначале клетки помещают
в раствор сахарозы
(измельчитель состоит из
толстостенной стеклянной
трубки и плотно пригнанного
пестика, который одновременно
с вращением передвигается
вверх-вниз). Полученный
гомогенат (не вполне
соответствующий термин,
поскольку основная черта
полученного раствора — его
гетерогенность)
центрифугируют при низкой
скорости, чтобы осадить
самые тяжелые компоненты
(в основном ядра). Затем
на более высоких скоростях
центрифугируют супернатант,
чтобы получить
митохондриальную фракцию.
После этого, уже при очень
высоких скоростях (40 000 об/
/мин и более), производят
центрифугирование, чтобы
осадить мелкие клеточные
частицы, составляющие
микросомальную фракцию.
Растворимые компоненты
и очень мелкие частицы
остаются в последнем
супернатанте. В целом при
дифференциальном
центрифугировании гомогенат
разделяется на четыре фракции.
Каждая фракция сильно
загрязнена и гетерогенна,
поэтому требуется дальнейшее
фракционирование более
совершенными методами. Один
из них, известный как
центрифугирование в градиенте
плотности, показан на рисунке
справа внизу. Неочищенная
митохондриальная фракция
наслаивается на градиент
плотности, после чего под
влиянием значительной
центробежной силы происходит
перемещение частиц вниз по
градиенту, пока они не
достигнут позиции, в которой
их плотность сравняется с
плотностью среды (позиция
равновесия). Так удается
разделить клеточные
компоненты в соответствии с их
плотностями. В приведенном
эксперименте частицы,
имеющиеся в неочищенной
митохондриальной фракции,
были разделены на три группы:
митохондрии, лизосомы и
пероксисомы.
выявить субатомарные частицы, пользуясь
ускорителем высокой энергии. Но получае
мая при этом картина все в большей сте
пени будет зависеть от тщательно разра
ботанных теорий, сложных приборов и
тонких манипуляций.
Сам процесс отбора полученных фактов
привносит дополнительный субъективный
элемент. Это присуще даже
«созерцательным» наукам. Астроном не имеет власти
над звездами, за которыми он наблюдает,
тем не менее он сам решает, куда
направить телескоп, и таким образом влияет на
развитие астрономии. Еще более важную
роль индивидуальное решение играет в
экспериментальных науках. Каждый экспе
римент — это вопрос, заданный Природе.
Как и во всех вопросах, ответ в известной
степени зависит от того, как задан вопрос.
Исследователи хорошо осведомлены об
этой опасности, но, сколько бы они ни
старались, полностью избежать ее не в
состоянии.
Наконец — и это самое важное, —
следует помнить, что накопление данных —
только малая часть научного процесса.
Главное — каким образом
интерпретировать собранные сведения, чтобы создать
теории, способствующие прогрессу наших
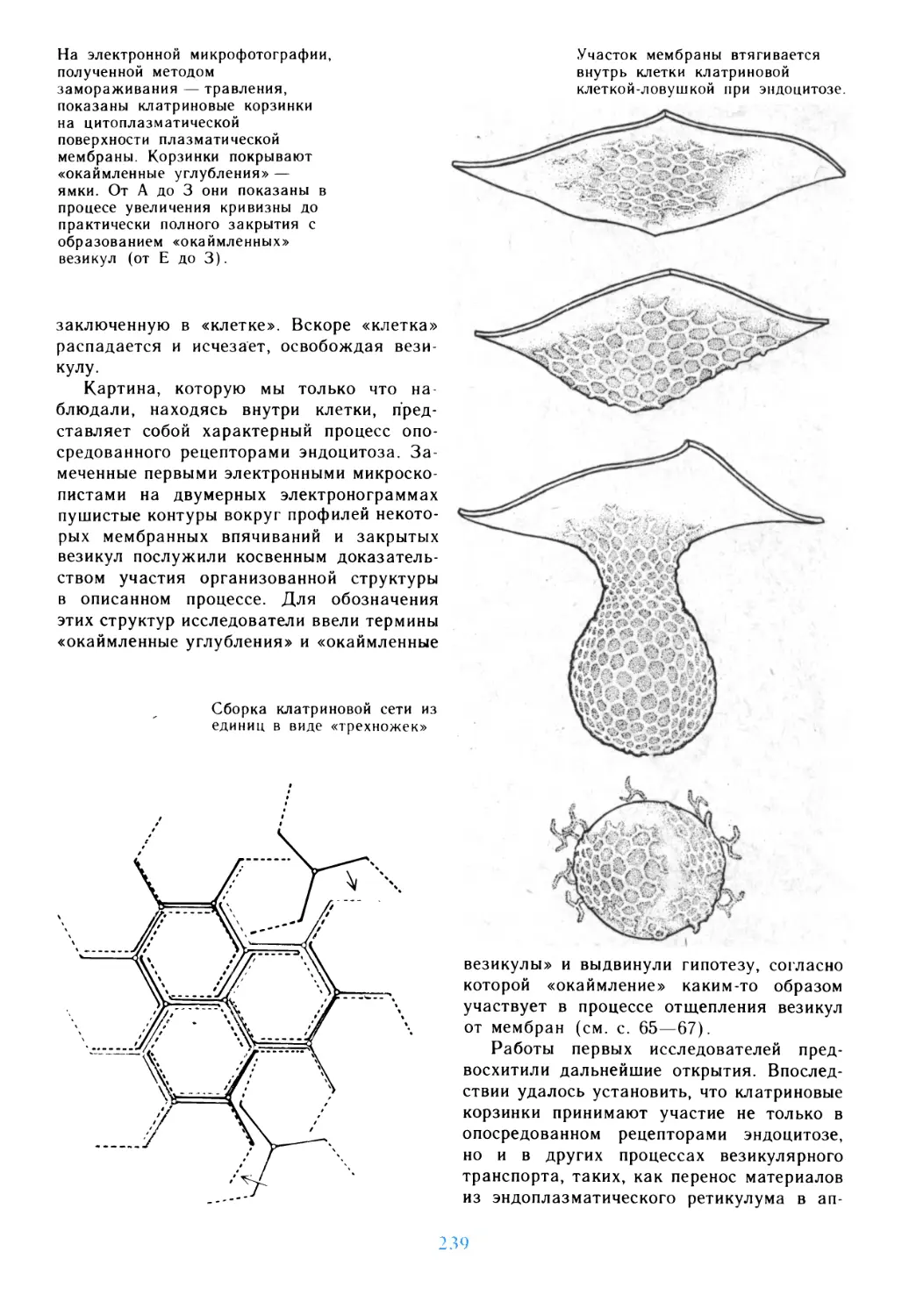
Вехи, характеризующие
вторжение человека в мир живой
клетки. На диаграмме, в виде
функции от времени, показаны
достижения морфологии при
анализе объектов уменьшающихся
размеров и достижения химии
при изучении молекул
возрастающей величины.
«Ничейная земля» между
микроскопическими и
макромолекулярными
«территориями» была
«оккупирована» одновременно
с обеих сторон сразу после
окончания второй мировой войны.
знаний. Создание теории — это
напряженный творческий процесс, несущий на себе
отпечаток личности автора. Вот почему мы
говорим о теории относительности
Эйнштейна так же, как о «Джоконде»
Леонардо да Винчи. И делается это не только
для того, чтобы воздать дань уважения
Эйнштейну, но и по той причине, что
теория относительности при всей ее
универсальности сохраняет сугубо
индивидуальные, личностные черты, свойственные
только ее создателю. Целью науки является
достижение полной объективности, однако
путь к этому лежит через многократные
приближения. На любой стадии
исследования может создаться впечатление, что цель
достигнута, однако в процессе дальнейшей
работы зачастую обнаруживается, что
такое впечатление — всего лишь иллюзия.
Обо всем сказанном следует помнить
во время нашего путешествия. Каждый
факт, каждая область знаний, каждое со
бытие, каждый процесс и каждый меха
низм, которые будут вам представлены
как нечто осязаемое, на самом деле
являются результатом кропотливой работы
многих человеческих умов. Исследователи
многократно перерабатывали, взвешивали и
обдумывали множество схем и цифр,
полученных в ходе тонких и сложных
экспериментов с биологическими объектами при
помощи совершенной техники. Иных путей
проникновения в микромир клетки не
существует, и ученые имеют все основания
гордиться достигнутым. Однако всегда
существует опасность искажения материала при
трактовке полученных данных. Нередки
также случаи, когда, наталкиваясь при
изложении материала на пробелы в наших
знаниях, исследователь вынужден
прибегать к догадке. В результате одни и те же
факты разными учеными могут
интерпретироваться по-разному в зависимости от их
узкой специальности и субъективных
взглядов.
В идеале мне следовало бы ознакомить
читателя со всеми имеющимися фактами
с тем, чтобы он сам сделал
соответствующие выводы. Но это означало бы, что вы,
уважаемые читатели, получите такой объем
информации, с которым вряд ли могли бы
справиться тысячи ученых, работающих
во всех уголках земного шара. Возможно,
надо было хотя бы назвать имена многих
ученых, как я сделал это в отношении
Эйнштейна, отчасти для того, чтобы
воздать им должное, а главным образом с
той целью, чтобы познакомить читателя с
учеными, внесшими свой вклад в ту или
иную область биологии. И тем не менее
имена исследователей можно назвать лишь
в исключительных случаях, так как в
современной науке вклады отдельных ученых
тесно переплетены. Вот почему по ходу
нашего путешествия я лишь изредка буду
называть имена ученых. Незримо же они
будут постоянно сопровождать нас в
путешествии по живой клетке, стоять за
каждым явлением, которое будет
рассматриваться, за каждым процессом, в котором
мы попытаемся разобраться.
Справедливости ради следует, однако, добавить, что
истинное положение вещей может
оказаться несколько искаженным ввиду
субъективных пристрастий или недостатков
вашего гида. Об этом нужно помнить.
Маршруты
Взглянем на карту
Прежде чем отправиться в путешествие
по клетке, взглянем на ее карту, чтобы
разобраться, куда следует держать путь,
что нас ожидает и как лучше организовать
само путешествие. Сейчас мы только
назовем основные части клетки и их функции.
Со временем, в ходе путешествия мы
познакомимся с ними поближе.
Наиболее типичным свойством любой
эукариотической клетки, известным уже
ранним цитологам, было различие между
находящимся в центральной части клетки
ядром и окружающей его цитоплазмой.
Эти две части соотносятся друг с другом
примерно так же, как косточка вишни с ее
мякотью (слово «ядро» произошло от
латинского nucleus — орех). Подобно вишне,
клетка покрыта кожицей, или мембраной —
плазмалеммой или плазматической
мембраной.
Ядро — это хранилище генетической
информации клетки, размещенной в
химически закодированном виде в
определенных единицах (структурах), хромосомах.
Как правило, они настолько тесно
переплетены, что кажется, будто они образуют
единую массу — хроматин, неравномерно
разделенный на более плотные (гетерохро-
матин) и менее плотные (эухроматин)
участки. В хроматине имеются одна или
несколько структур специального
назначения — ядрышки. Вся эта масса полностью
заключена в мембрану и пропитана
жидкостью — нуклеоплазмой.
Основные функции ядра имеют прямое
отношение к переработке информации.
Сюда входит хранение или, в случае
необходимости, восстановление генетической
информации и особенно ее транскрипция.
Этим термином обозначается крайне
сложный, высокоизбирательный процесс, с
помощью которого специфические инструкции
считываются с хранящейся информации и
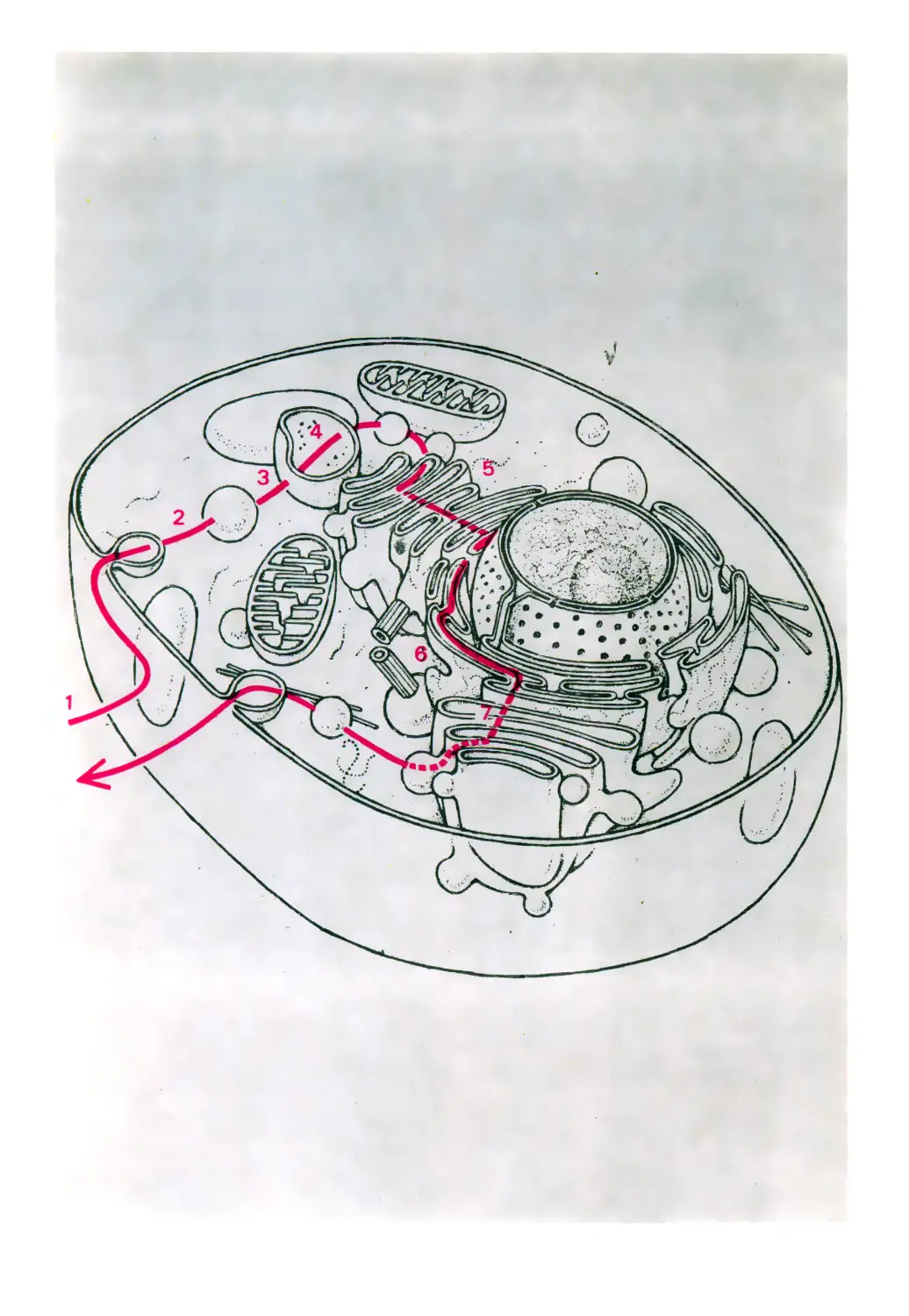
Карта клетки
Плазматическая мембрана
Цитозоль
Лизосома
Эндосома
Эндоцитоз
Центриоль
Экзоцитоз
Секреторная гранула
Рибосомы
Митохондрия
Пероксисомэ
Аппарат Гольджи
Ядро
Ядрышко
Цитоскелет
Шероховатый
эндоплазматический
ретикулум
Гладкий
эндоолазматическии
ретикулум
Аппарат Гольджи
передаются в цитоплазму для экспрессии.
Посредством этих механизмов гены
передают свои команды клетке. При подготовке
клетки к делению ядро должно выполнить
еще одну работу: подготовить полный и
точный дубликат генетической
информации. Затем ядро подвергается сложному
процессу реорганизации, называемому
митозом, в ходе которого хромосомы
становятся временно различимыми в виде
отдельных палочек. В*результате этих изменений
образуются два ядра.
Цитоплазма состоит из бесформенного
геля — цитозоля, поддерживаемого цито-
скелетом и содержащего ряд погруженных
в него органелл. Последние осуществляют
разнообразные функции, связанные с
работой клетки «на экспорт» («внешние дела»)
и «для себя» («внутренние дела»).
«Внутренние дела» живой клетки в
основном связаны с биосинтезом и
производством энергии. Биосинтез — процесс,
продолжающийся непрерывно, даже в
клетке, которая не растет, ибо клетки
химически не статичны. Они постоянно и с
высокой скоростью разрушают и
восстанавливают большую часть своих компонентов.
При этом расходуется много энергии.
Энергия нужна также для других видов
деятельности клеток, связанных с
передвижением, молекулярным транспортом,
производством электричества, передачей
информации и в некоторых случаях с излучением
света. Клетки покрывают эти расходы
энергии, разрушая богатые энергией
питательные вещества, получаемые из
окружающей среды или из собственных запасов.
Клетки зеленых растений и фотосинтези
рующие бактерии получают необходимую
энергию за счет поглощения и утилизации
солнечного света. Совокупность всех этих
реакций составляет процесс, который
ученые называют метаболизмом и который в
свою очередь подразделяется на анаболизм
(процессы биосинтеза) и катаболизм
(реакции распада).
Системы, выполняющие столь
разнообразную деятельность, размещены в цито-
золе и в ряде тесно связанных с ним
органелл. Среди последних следует выделить
митохондрии (называемые часто силовыми
станциями клетки), где протекают
основные окислительные реакции —
осуществляются механизмы, благодаря которым
энергия, высвобождаемая в ходе
окислительных реакций, вновь улавливается и
приобретает форму, необходимую для
утилизации клеткой; хлоропласты, в которых
происходит фотосинтез в клетках зеленых
растений; микротельца, гетерогенное
семейство метаболических органелл, из
которых важнейшими являются пероксисомы.
Необходимо также упомянуть о различных
структурах, связанных с клеточным
движением; о рибосомах, являющихся центрами
синтеза белка и, следовательно, основными
исполнителями указаний генетических
команд, исходящих из ядра. И наконец,
назовем разнообразные цитомембраны, ко
торые не только участвуют во «внешних
делах» клетки (см. ниже), но и содержат
целый ряд важных метаболических систем.
Под словами «внешние дела» мы под
разумеваем различные способы
взаимодействия клетки с внешним миром и обменные
процессы между ними. Помимо
плазматической мембраны, которая по сути дела
является границей клетки, эта активность
присуща также сложнейшей сети
внутриклеточных мембран, связанных с
плазматической мембраной и образующих
множество замкнутых мешковидных структур. Эти
структуры способны устанавливать —
прямо или косвенно — временные связи друг
с другом или с плазматической мембраной.
Они предназначены для хранения,
переработки и внутриклеточной транспортировки
веществ, получаемых извне и расщепляемых
на составные части внутри клетки, или
веществ, образуемых внутри клетки для экс
порта. Чрезвычайно важно, что в ходе всех
этих обменов никогда не происходит ни
малейшего повреждения или разрыва мембран.
Таким образом содержимое «мешочков»
всегда отграничено мембранами от цито-
золя. Подобно плазматической мембране
при обмене веществ между клеткой и
окружающей средой, эти мембраны выступают
в качестве посредников, пропуская вещества
в сегрегированные участки (мешочки)
клетки к из них.
Система цитомембран (ранние
цитологи называли се ныне почти забытым, но
достойным восстановления термином «ва-
куом») состоит из двух раздельных, однако
тесно связанных между собой отделов,
служащих соответственно для импорта и
экспорта. Они в свою очередь
подразделяются на функционально различные
подотделы, компартменты. В отдел импорта
входят: специализированные участки
плазматической мембраны, служащие для захвата
внеклеточного материала посредством эн-
доцитоза, компартмент хранения,
образованный эндосомами, занятыми в основном
сортировкой и перемещением захваченных
в клетку веществ, и комплекс
пищеварительных вакуолей, или лизосом, в которых
захваченные вещества расщепляются на
составные части. Экспортная система
начинается с шероховатого (гранулярного) эн-
доплазматического ретикулума (сети),
который собирает и дорабатывает вновь
синтезированные и предназначенные для экс
порта белки. Белки синтезируются в
рибосомах, прикрепленных к пограничным
мембранам ретикулума. Посредством эндо
плазматического ретикулума с гладкой
поверхностью (к нему рибосомы не при
крепляются) эта структура связана со
сложной системой аппарата Гольджи.
В этих двух компартментах протекает
дальнейший процесс переработки и
сортировки экспортируемого материала. Из
аппарата Гольджи после накопления и
концентрации в секреторных гранулах
продукты направляются к периферии клетки,
откуда они выводятся посредством экзоци-
тоза. Специальный набор везикул
переносит вещества из аппарата Гольджи к лизо-
сомам. Другие везикулы вовлечены в ре-
циркулирование мембран, принимающих
участие в описанных процессах.
Исходя из сказанного, разобьем наше
путешествие на три четко разграниченных
маршрута.1
Маршрут 1: окрестности
и клеточная поверхность, вакуом
Начнем с кровеносного сосуда и
приблизимся к клетке настолько, чтобы можно
было увидеть некоторые внеклеточные
структуры. Постепенно приближаясь к
клетке, внимательно изучим ее поверхность
и перейдем к изучению вакуома, проникнув
в него при помощи эндоцитоза и выйдя из
него при помощи экзоцитоза. Во время
пребывания в вакуоме воспользуемся
местной системой массовых перевозок, чтобы
побывать во всех частях этого комплекса.
Мы сможем не только непосредственно
наблюдать за ходом внутриклеточных
перевозок, но и участвовать в процессах
внутриклеточных перемещений и изменений
веществ, которые либо импортируются в
клетку, либо синтезируются в ней для
экспорта. В этой части нашего путешествия
мы сможем также познакомиться с
основными составными компонентами клетки:
белками, полисахаридами и липидами, а
также с некоторыми создаваемыми из них
структурами.
1 Здесь рассматриваются только два марш
рута. Анализу третьего, конечного маршрута к
ядру клетки посвящена отдельная книга
К. де Дюва, которая является продолжением
«Путешествия в мир живой клетки» — Прим. ред.
Маршрут 2: цитозоль
и цитоплазматические органеллы
Второй маршрут позволит нам
направиться прямо в цитозоль, из которого мы
последовательно посетим все основные
органеллы, связанные с ним. Это даст нам
возможность поближе познакомиться с
метаболизмом и основными принципами,
управляющими преобразованием энергии и
биосинтезом. К тому времени, когда мы
достигнем рибосом, мы сможем
познакомиться с передачей биологической
информации и переносящими ее молекулами, т. е. с
нуклеиновыми кислотами.
Необходимое снаряжение
для подводного плавания
Разрешите сделать последнее замечание,
пока мы еще не отправились в путь. Клетки
живут в воде, даже если организмы, частью
которых они являются, живут на суше.
Возьмем, например, наши собственные
клетки. За исключением внешних слоев
кожи, состоящих из мумифицированных,
мертвых клеток, все клетки нашего тела
погружены в какую-нибудь жидкость, будь
то кровь или производное от нее. Точно так
же клетки растений омываются
растительным соком. Даже наиболее устойчивые
бактерии нуждаются во влаге. Они могут
выжить и в отсутствие влаги, но только
переходя в состояние спячки; все процессы
приостанавливаются, и это состояние
длится до тех пор, пока вода не вернет их к
жизни. Состояние спячки может наступать и в
жизни более.сложных клеток, например
плесени или семян.
Таким образом, путешественники в мир
живой клетки напоминают исследователей
подводного царства из фильмов Жака
Кусто. Они путешествуют вплавь, ибо без
воды многое из того, чем они любуются,
сморщилось бы наподобие тех хрупких
существ, которые покрывают поверхность
подводных камней.
Итак, наденьте акваланг и прыгайте в
воду.
Мы отправляемся в путь!
3—1452
Маршрут 1
Окрестности
и клеточная
поверхность; вакуом
Подход к клетке через внеклеточные
структуры и обзор ее поверхности.
Проникновение в клетку путем эндо-
цитоза и наблюдение за процессом
сортировки в эндосомах.
Подход к лизосоме при помощи
слияния эндосом с лизосомами.
Посещение лизосомального
пространства.
Проникновение в челнок лизосома —
аппарат Гольджи и немедленное
отправление вверх по течению в эндоплазмати-
ческий ретикулум для достижения
мешочков с шероховатой поверхностью.
Наблюдение за синтезом секреторных
белков и прослеживание их пути в ходе
процессинга вдоль эндоплазматического
ретикулума и обратно в аппарат Гольджи.
Посещение аппарата Гольджи.
Проникновение в секреторную
гранулу и выход при помощи экзоцитоза.
Внеклеточные
структуры.
Знакомство
с полисахаридами
и протеинами
(белками)
Перед тем как войти в живую клетку,
взглянем на ее поверхность, имеющую
заслуживающие интереса особенности.
Однако найти одиночную клетку нелегко, так
как по большей части клетки окружены
довольно развитой сетью внешней защиты
и «лесами», которые часто полностью
прячут клетку от глаза и значительно
затрудняют подход к ней. Эти структуры не
являются составными частями клетки, но они
создаются ими из
веществ-предшественников, которые секретируются самими
клетками и впоследствии соединяются в
различные комбинации практически любой
возможной формы и последовательности, от
мягкого геля до плотного дерева и
скорлупы. Иногда они пропитаны минералами,
которые могут придавать их органическому
матриксу прочность камня или твердость
эмали. Эти внеклеточные конструкции
служат своеобразными опорами клетки;
именно им клетка обязана той формой, которую
жизнь создает на нашей планете. Без них
не было бы ни деревьев, ни цветов, ни
животных — ничего, кроме аморфной массы
илистой слизи, представляющей собой
мириады беспорядочно двигающихся
друг по другу клеток.
Мечта архитектора
Внеклеточные структуры особенно
выражены у растений, где они формируют
непрерывный жесткий каркас, в котором
каждая отдельная клетка имеет
собственную камеру — начальные «клетки»,
впервые обнаруженные Робертом Гуком в виде
микроскопических ячеек в куске пробки.
Основной компонент этой твердой сети
получил название целлюлозы. Наиболее
распространенная среди всех органических
веществ на земле, целлюлоза, по
определению химиков, есть не что иное, как полимер
простого сахара — глюкозы. Полимеры —
это гигантские молекулы, образованные
многими (греч. polys) частями (греч.
meros), так называемыми мономерами
(греч. monos — единичный). Все
пластмассы и искусственные волокна представляют
собой полимеры. Полимерами являются
также основные составные элементы
живых организмов, включая полисахариды
(греч. sakkharon — сахар), к которым
принадлежит целлюлоза, и белки
(протеины), к которым мы вскоре перейдем.
В отличие от искусственных полимеров,
которые обычно имеют неопределенную
величину, ограниченную по существу
матрицей в момент полимеризации, естественные
полимеры имеют определенную
молекулярную величину. Они состоят из макромолекул
(греч. makros — большой), в которых
строительные блоки собраны определенным
образом. Их молекулярные массы варьируют
в основном от нескольких тысяч до
нескольких сотен тысяч дальтон (дальтон —
масса атома водорода). В исключительных
случаях макромолекулы достигают одного
миллиона дальтонов или более. Соответственно
объем молекул, если они имеют глобулярную
структуру, измеряется несколькими
нанометрами. Фибриллярные молекулы могут
вырастать до нескольких сотен нанометров
в длину. Большая часть макромолекул по
своему характеру фибриллярна и от
природы наделена свойством образовывать
характерные мульти макромолекул я рные
соединения. Часто эти соединения закреп
ляются химическими поперечными мое
тиками.
Целлюлоза представляет собой очень
простой полимер, состоящий
исключительно из одного типа мономера — глюкозы.
Таким образом, по своему составу он
идентичен крахмалу, основному углеводному
На электронной микрофотографии
поперечного среза через верхушку
корешка фасоли Phaseolus vulgaris
видно, что каждая клетка
занимает отдельную ячейку.
Роберт Гук обнаружил только
стенки этих камер (см.
иллюстрации на с. 18)
резервному веществу растительных клеток,
и гликогену, аналогу крахмала в клетках
животных. И тот, и другой являются
простыми полимерами глюкозы. Однако
благодаря особенностям химической
структуры целлюлоза чрезвычайно устойчива
к разрушению, как химическому, так и
биологическому. В очищенном виде она
служит в качестве почти нерасщепляюще-
гося фиброзного компонента хлопка, льна
и бумаги и таких химических производных
веществ, как ацетат целлюлозы или
целлофан. Целлюлозу могут разрушать только
некоторые микроорганизмы. Основной
экологической нишей этих микроорганизмов
является пищеварительный тракт
травоядных животных, что вне всяких сомнений
только идет на пользу последним, ибо
благодаря своим «милым гостям», они в
состоянии переваривать целлюлозу. У
большинства же других млекопитающих —
в том числе и у нас с вами — целлюлоза
выделяется в почти неизменном виде. Она
О
°© о @ ©
Мономеры ©
Разветвленный
полимер
По дим ер
с поперечными
связями
Линейный полимер
Биологические полимеры состоят
из мономеров, представляющих
собой молекулы различной формы
величиной 0,3—1,0 нм. Даже при
увеличении в миллион раз они
кажутся только крошечными
крапинками.
составляет волокнистую часть нашей пищи
и в значительной степени формирует
плотную часть кала. Растения наряду с
целлюлозой используют и ряд других
структурных молекул. В частности, исключительная
упругость деревьев обеспечивается
содержанием в них фенольного полимера,
называемого лигнином (лат. lignus — дерево).
Бактерии также полностью окружены
плотной стенкой. Она состоит из ряда
веществ, характерных исключительно для
мира бактерий. Эта стенка действует как
защитная оболочка, помогающая
бактериальной клетке выдержать тяжелые условия
окружающей среды. Благодаря ей
бактерии — возбудители инфекционных
заболеваний — способны уклоняться от наших
средств защиты или сопротивляться им.
Оболочка некоторых бактерий даже после их
гибели сохраняет способность
совершать токсическую атаку. В свою
очередь наши собственные клетки, особенно
лейкоциты — основные защитники
человека — способны «узнавать» только оболочку
врага. Они бросаются в бой и в конечном
итоге убивают бактерии при помощи
сложных движений, обусловленных химическим
распознаванием (некоторые из этих
механизмов рассматриваются в гл. 4 и 5).
Любопытно, что пенициллин и родственные ему
антибиотики убивают микробы, нарушая
структуру их клеточной стенки, и таким
образом блокируют рост бактерий. Лизоцим —
естественный антибактериальный агент,
встречающийся в лейкоцитах и в слезной
жидкости, убивает бактерии, разрушая их стенку.
В животном мире отдельные клетки
редко окружены оболочкой. Чаще всего
они, тесно прижавшись друг к другу,
образуют характерной формы кластеры,
которые в свою очередь скрепляются и
поддерживаются внеклеточными структурами
различного вида. Эти свойства клетки в
значительной степени объясняют богатство
организации и эволюционную способность
животного мира. В качестве примера
можно привести развитие нервной системы.
К сожалению, у нас нет времени для того,
чтобы исследовать архитектурные
особенности каждой ткани или органа, которые
удивительным образом приспособлены для
выполнения своей функции. Посмотрим
лишь на основные компоненты, которые
используются для этой удивительной
конструкторской деятельности. Некоторые из
На электронной микрофотографии
среза через группу Bacillus fragilis
видна оболочка бактериальной
клетки, ее стенка. Клетки в
середине снимка находятся в
процессе разделения.
этих компонентов принадлежат к очень
важному классу белков, с представителями
которого нам предстоит еще не раз
встретиться во время нашего путешествия.
А теперь наступил момент, когда
необходим своего рода брифинг по вопросам
химии.
Немного о белках
В 1838 г. голландский химик Герардус
Иоганнес Мульдер, один из пионеров в
области анализа альбуминоидов (лат.
albas— белый, albumen — белок яйца),
употребил термин «протеин» (греч. proteios —
основной, первичный) применительно к
веществу, которое он считал основной
составной частью коагулирующих при высокой
температуре азотных соединений, таких,
как фибрин крови, казеин молока и
альбумин яйца (как раз к тому времени эти
соединения начали относить к одному об-
щему классу). Сам термин «протеин» был
предложен Мульдеру шведским ученым
Йёнсом Якобом Берцелиусом, одним из
основоположников химии и «отцом» теории
катализа.
Если вспомнить, когда все это
происходило, то не приходится удивляться тому,
что и Мульдер, и Берцелиус многое
понимали чрезмерно упрощенно, тем не менее
предложенная ими терминология оказалась
пророческой. Как выяснилось позднее,
протеины не только первичные агенты
всех процессов жизнедеятельности, — они,
подобно своему тезке Протею,
древнегреческому морскому божеству, обладают
способностью принимать бесчисленные,
самые разнообразные формы1.
Мы в этом легко убедимся, настроив
наши «молекулярные очки» до высокой
разрешающей способности, позволяющей
детально рассмотреть предметы величиной
всего в несколько нанометров. Даже при
увеличении в миллион раз такие объекты
все еще будут выглядеть не больше
комара. Однако если рассмотреть под
соответствующим увеличительным стеклом
структуру комаров и других существ, равных
им по размеру, то нашему взору
откроется множество разнообразнейших форм и
структур. Ту же картину можно наблюдать,
изучая белки при дальнейшем увеличении.
Разница лишь в том, что их формы более
абстрактны и своими изящными изгибами
скорее напоминают биоморфные
скульптуры Ганса Арпа, нежели суставные
угловатости (изгибы) насекомых. Одни белки
имеют глобулярную, почти сферическую
форму, другие, менее правильной формы,
изогнуты, извиты или покрыты бугорками,
третьи вытягиваются в тонкие нити,
нередко спирально закрученные. Форма белков
изменчива: они набухают, пульсируют,
удлиняются, сокращаются или
раскручиваются, иногда с ошеломляющей
внезапностью.
1 В отечественной научной литературе
общепринят термин «белки», которым мы и будем
пользоваться. — Прим. ред.
2 В отечественной научной литературе
общепринят термин «ферменты». Им мы и будем
пользоваться. -■ Прим. ред.
Большая часть белков находится
внутри клетки, где основная их функция
связана с катализом. Если бы шведский
химик Берцелиус мог узнать об этом, он,
несомненно, пришел бы в -восторг, ибо
именно он ввел этот термин (греч. kata —
вниз, lysis — ослабление) для обозначения
свойства некоторых веществ (получивших
название катализаторов) облегчить
протекание реакций, непосредственно не
принимая в них участия. Известно, что
существуют неорганические катализаторы, они
применяются в химической
промышленности, но в живой клетке обнаружены
настоящие фокусники-катализаторы. Жизнь,
даже если это жизнь ничтожного микроба,
возможна только при наличии многих
тысяч химических реакций; большинство
из них в искусственных условиях
воспроизвести невозможно, а если это и удается,
то только при определенных условиях —
высоком давлении и температуре или
кислой среде, — которые несовместимы с
жизнью. В живых клетках, однако, эти реакции
осуществляются необычайно просто и
быстро благодаря участию специфических
катализаторов, называемых энзимами. Это
слово, которое образовано от греческого
гуте (дрожжи, закваска), напоминает нам
о той исторической роли, которую сыграли
исследования процесса алкогольной
ферментации в описании первых
внутриклеточных катализаторов (см. гл. 7). Был также
принят термин «фермент», который сейчас
оставлен2.
Практически каждая химическая
реакция, происходящая в живом организме,
протекает при участии специфического
фермента, действие которого, как мы
увидим во второй части нашего путешествия,
часто дополняется одним или несколькими
кофакторами, или коферментами. Все
известные нам ферменты являются белками,
следовательно, число различных вариантов
белков значительно — по меньшей мере,
несколько тысяч в каждой клетке; они
обычно составляют около 20 % от ее
веса, т.е. половину сухого веса (клетки).
Помимо выполнения своей функции
катализаторов белки принимают участие в
таких процессах, как регуляция,
транспортировка, передвижение и многие другие, а
также играют важную роль, будучи
компонентами внутриклеточных и
внеклеточных структур. Иными словами, белки
Змея. Скульптура Ганса Аргш
действительно являются основной состав
ной частью живой клетки.
Под воздействием высокой температуры
или других физических или химических
агентов белки легко теряют не только свою
уникальную форму, но и свою каталити
ческую силу. Этот процесс называется
денатурацией. Долгое время процесс
денатурации считался необратимым, и это
положение выдвигалось в качестве
аргумента, доказывающего, что процесс сборки
живых структур должен управляться
особой силой или особым принципом. Сейчас
эта точка зрения устарела; доказано, что
в ряде случаев денатурация обратима.
Пластмассовая модель молекулы
миоглобина, переносчика
кислорода в клетках красной
мышцы. Белая, похожая на
червя структура представляет
собой свернувшуюся
полипептидную цепь (см. рисунок
на с. 45); темный диск —
железосодержащая геминовая
группа, связывающая кислород
(см. гл. 9). Гемоглобин,
переносчик кислорода в
эритроцитах, состоит из четырех
субъединиц, напоминающих по
форме молекулу миоглобина.
В форме, присущей молекуле белка, нет
ничего исключительного, она представляет
собой не что иное, как наиболее
вероятную конфигурацию, которую молекула
примет в соответствующих условиях.
Весьма поучительно через наши
«молекулярные очки» взглянуть на смесь
денатурированных белковых молекул — все они
выглядят одинаково и различаются только
размерами. Вместо множества
замысловатых, интересных и своеобразных форм
и структур перед нами окажется клубок
спутанных, длинных, чрезвычайно тонких
нитей. Теперь, полагаю, нам легче понять,
почему денатурация часто выступает как
необратимое явление: отдельная нить не в
состоянии выпутаться из общего клубка
и принять характерную для нее форму,
если для этого не будут созданы особые
условия. Что еще важнее, благодаря
денатурации мы получаем возможность
увидеть в структуре молекулы белка нечто
такое, что в противном случае могло бы
ускользнуть от нашего внимания. Все
белки являются нитевидными молекулами.
Бесчисленное множество форм, которое мы
наблюдаем, обусловлено спиралями и
изгибами нитевидно расположенных атомов.
Как мы знаем из химии, общей
структурой, объединяющей все эти различные
формы, является остов (цепь), который
образован из простой шестиатомной пов
торяющейся единицы, встречающейся до
нескольких сотен раз:
варение):
ОН О Н
II I II I
—С—N — + Н2О ► -С—ОН + Н—N— .
В результате расщепления всех этих
связей в данной цепи образуются вещества
следующей структуры:
Н Н О
Н—N—С—С—ОН.
I
R
Эти вещества называются
аминокислотами, так как содержат аминогруппу
(—NH2) и карбоксильную группу (—СООН).
Более точное их название а-аминокислоты,
поскольку обе группы присоединяются к
а-углероду. Еще более точным обозначением
является термин L-a-аминокислоты, ибо
все они (за исключением оптически
неактивного глицина) имеют конфигурацию
типа L вокруг асимметричного а-углерода.
Их стереоизомеры, D-аминокислоты,
встречаются в некоторых компонентах бактерий,
включая антибиотики, но не в белках.
В образовании белков участвуют 20
различных аминокислот. Их структуры
соответствуют (за исключением одного
варианта, пролина) приведенной выше
формуле и различаются только составом
боковой группы, R. Названия аминокислот,
Центральный атом углерода каждой
единицы в структурной цепи имеет одну
свободную валентность. Она может соединиться
с одной из двадцати различных химических
групп, ответственных за специфические
свойства, которые отличают одни молекулы
белка от других. Связь между единицами
называется пептидной. Этот термин
напоминает нам о том, что эта связь гидро-
лизуется пищеварительным ферментом —
пепсином, компонентом желудочного сока
(греческое слово pepsis означает пище-
их сокращения и условные обозначения
приведены в табл. 1. Позже мы узнаем,
что некоторые из этих условных
обозначений используются также для
обозначения нуклеозидов — другой важной
группы веществ. В соответствующем контексте
смешать их трудно. Там, где такая
опасность все-таки существует, принято
использовать сокращения из трех букв.
Аминокислоты, связанные между собой
пептидной связью, называются остатками,
а возникающие цепи — пептидами. Зачас-
Таблица I
Аминокислота
Алании
Аргинин
Аспарагин
Аспарагиновая
кислота
Цистеин
Глутаминовая
кислота
Глутамин
Глицин
Гистидин
Изолейцин
Лейцин
Лизин
Метионин
Фенилаланин
Пролин
Серии
Треонин
Триптофан
Тирозин
В алии
Сокращение
Ala
Arg
Asn
Asp
Cys
Glu
Gin
Gly
His
He
Leu
Lys
Met
Phe
Pro
Scr
Thr
Tnp
Туг
Val
Условное
обозначение
A
R
N
D
С
E
Q
G
H
I
L
К
M
F
P
S
T
W
Y
V
тую термину «пептид» предшествует
греческий префикс, обозначающий число
остатков аминокислот в цепи: например,
ди; три; тетра; пента; олиго (мало); поли
(много).
В целом пептидные цепи соответствуют
общей структуре:
H2N—СН—СО—NH—СН—СО—
I I
Ri R2
— NH-CH-CO -NH—CH-COOH
I I
Rn-\ R,
Они имеют свободную концевую
аминогруппу (N-терминальную слева),
свободную концевую карбоксильную группу
(С-терминальнуюсправа) ил—1 пептидных
связей.
Пептиды различаются числом (дг),
природой, порядком или последовательностью
своих аминокислотных остатков. Их можно
сравнить со словами разной длины, в
написании которых использован алфавит, сое-
тоящий из двадцати букв. Это особенно
наглядно видно, если в записи
использованы однобуквенные символы. Так, напри
мер, тетрапептид Cys-Glu-Leu-Leu
становится CELL, а нонапептид Ala-Arg-Cys-
His-Glu-Thr-Tyr-Pro-Glu превращается в
ARCHETYPE. По существу, вся эта книга
могла бы быть написана языком пептидов,
если бы в нем не отсутствовали
буквенные знаки В, J, О, U, X и Z.
Пептиды представляют собой
подвижные структуры благодаря присущей им
способности вращаться вокруг N—С- и
С—С- осей. Вращения вокруг самой
пептидной связи не происходит. В результате
пептиды приобретают более или менее
извитую' форму в зависимости от того,
притягиваются или отталкиваются
отдельные их части, а также от способности
этих частей связывать или выделять
молекулы воды. Кроме того, извилистость
(складчатость) пептидной цепи часто
зависит от наличия веществ, с которыми
она способна соединяться. Многие
подобные взаимодействия имеют физическую
природу и не вызывают образования
истинных химических (ковалентных)
связей. Характер этих взаимодействий зависит
от двух сил, которые часто называют
именами открывших их исследователей:
французского физика Кулона и
голландского физика Ван-дер-Ваальса.
Силы Кулона — это электростатические
силы. Под их воздействием происходит
притяжение электрических зарядов с
противоположными знаками и отталкивание
электрических зарядов с одинаковыми
знаками. В состав некоторых аминокислот
входят R-группы, которые заряжены либо
положительно, либо отрицательно при
физиологических условиях. Другие
аминокислоты, не будучи заряженными,
поляризованы, иными словами, в них наблюдается
локальное перемещение зарядов, созда
ющее положительный и отрицательный
полюсы. Все эти группы могут
взаимодействовать электростатически.
Полярные, содержащие атом водорода,
группы могут электростатически
соединяться с отрицательными или отрицательно
поляризованными группами посредством
особой водородной связи, при которой
атом водорода принадлежит обеим
группам. Ниже представлен один из таких
видов связи, играющий очень важную роль
в биологии:
Эта связь (пунктирная линия) может
соединять два пептида. Поэтому она играет
важную роль в конформации белков и
соответственно во всех структурных,
каталитических и других функциональных
свойствах, зависящих от этой
конформации. Несколько позже, в ходе нашего
путешествия мы увидим, что феномен
попарного соединения оснований в
нуклеиновых кислотах, определяющий передачу
всей генетической информации в живом
мире, зависит от такой же связи и от
другой, сходной водородной связи: -
Ван-дер-ваальсовы силы ответственны
за притяжение, существующее между
неполярными группами, состоящими только
из углерода и водорода, такими, как- в
углеводородах, входящих в состав
бензина и других нефтепродуктов. В ряде
аминокислот встречаются R-группы,
способные устанавливать связи посредством
ван-дер-ваальсовых сил.
Ключевым моментом при всех этих
взаимодействиях является
асимметричность молекулы воды, благодаря которой
она становится полязированной:
Таким образом, молекула воды способна
соединиться электростатически со всеми
электрически заряженными или поляри^
зованными группами, которые по этой
причине получили название гидрофильных.
В отличие от этих групп неполярные
группы не имеют сродства к воде; они
гидрофобны, т. е. отталкивают воду. Это
явление всем нам хорошо знакомо: так,
масло с водой не смешивается, поверхности
некоторых пластиков не промокают — они
гидрофобные. Правда, термин
«гидрофобный» в какой-то мере может ввести в
заблуждение. Строго говоря, гидрофобные
группы воду не отталкивают; они
отталкиваются водой в результате сильной
гидрофильности самих молекул воды, тесно
соединенных друг с другом водородными
связями.
Поскольку клеточная среда в
значительной степени содержит воду,
взаимодействия с водой оказывают большое
влияние на конформационные изменения
полипептидной цепи. Упрощенно картина
выглядит так: полипептидная цепь
принимает форму, при которой наибольшее число
гидрофильных групп оказывается на ее
поверхности или в щелях, доступных
воздействию воды, тогда как гидрофобные группы
размещаются во внутренних, недоступных
для воды участках, где они имеют
возможность взаимодействовать между собой.
Белки, в которых возможна сегрегация групп
на основе аффинитета к воде, обычно
растворимы в ней, в то время как белки, не
способные окружить себя гидрофильной
оболочкой, размещаются в гидрофобных
областях, где их гидрофобные участки попадают
под влияние сил, действующих по типу
ван-дер-ваальсовых. Как мы вскоре
увидим, такими структурами в основном
являются мембраны.
Важным фактором, определяющим кон-
формацию белков, является тенденция
полипептидных цепей скручиваться в
спиралевидную структуру, стабилизированную
водородными связями между
расположенными по соседству пептидными цепями.
Наиболее часто встречается структура
типа а-спирали с шагом (между витками)
0,54 нм, содержащая 3,6 остатков в одном
витке. а-Спираль образует относительно
неподвижный стержень толщиной
примерно 1 нм с узловатой поверхностью,
образованной R-группами остатков.
Некоторые аминокислоты не могут
приспособиться к этой структуре и разрывают ее.
Поэтому а-спиральные участки обычно
относительно коротки. Целые молекулы
белка обычно содержат несколько таких
стержней, соединенных (обычно под углом)
группами менее упорядоченной конфигурации.
В исключительных случаях
последовательность полипептида такова, что позволяет
поддерживать расположение а-спирали на
значительном протяжении. Подобные
молекулы по своей природе нитевидные. Кроме
а-спирали возможны и другие
расположения пептидов; иногда две или три
полипептидные цепи закручиваются вместе
Структура молекулы миоглобина.
Белок состоит из восьми
а-спиральных сегментов,
уложенных вокруг погруженного
в них гема (гем изображен
в цвете). Буквы А — Н относятся
к а-спиральным сегментам,
а числа — к аминокислотным
остаткам.
(это так называемые суперскрученные
спирали) и придают структуре нитевидную
форму. Функция таких волокнистых белков
в основном связана со структурной
функцией и передвижением.
Помимо указанных внутренних факторов
форма, принимаемая полипептидной цепью,
зависит также от взаимодействия между
самой цепью и другими молекулами
белковой или небелковой природы. Многие
наиболее важные функции белков зависят
именно от таких взаимодействий, подчас
оказывающих решающее влияние на кон-
формацию соответствующих молекул.
Иногда данная структура скрепляется
истинной ковалентной связью между двумя
участками одной и той же полипептидной
цепи или между двумя цепями. Наиболее
типичной связью этого типа является
дисульфидная связь —S—S—, которая
возникает при окислении тиоловых (—SH)
групп из двух цистеиновых остатков:
2Cys—SH *Cys—S—S—Cys + 2H
Многие белки состоят из одной
полипептидной цепи; другие содержат две
или более отдельные цепи или субъединицы,
связанные между собой нековалентными
силами притяжения, а иногда ковалент-
ными связями, такими, как дисульфидные
мостики.
На этом мы закончим наш подготови
тельный брифинг. Поподробнее остановимся
на белках при встрече с каким-нибудь
особенно характерным представителем этой
чрезвычайно важной и весьма
разнообразной группы природных молекул. А теперь
пора отправиться в путь без дальнейшей
суеты. Удобными подходами к нашей
цели являются пути системы циркуляции,
которая осуществляет транспортировку в
клетки и из них.
Клетки крови — наши первые
спутники
Кровеносные сосуды, особенно
крупные артерии, с которых мы начинаем наше
путешествие, представляют собой бурные
водные пути, ритмически приводимые в
движение мощной волной, поднимающейся
при каждом ударе сердца. Нас окружают
клетки, которые, как и мы сами, крутясь,
проносятся мимо в быстром потоке
плазмы — жидкой части крови.
Большинство клеток крови представляют
собой мелкие двояковогнутые диски,
наполненные рубиново-красным веществом. Это
Сканирующая электронная
микрофотография клеток крови
больного, страдающего болезнью
Ходжкина. Двояковогнутые
диски ■— эритроциты, другие
клетки — лейкоциты.
красные клетки крови, или эритроциты
(греч. erythros — красный). Их основные
функции заключаются в переносе
кислорода из легких в ткани и помощи при
возвращении в легкие «отхода» —
углекислого газа. Эритроциты играют чрезвычайно
важную роль в энергетике организма и
содержат необходимый для организма
белок — красный переносчик кислорода —
гемоглобин. Однако сами по себе клетки
вряд ли заслуживают особого внимания,
ибо они полностью дегенерируют и по
существу обречены на смерть. Эритроциты
не содержат ни митохондрий, ни рибосом,
ни системы внутриклеточных мембран, а у
млекопитающих они не имеют даже ядра.
Изредка мы можем столкнуться с
белыми клетками крови, или лейкоцитами
(греч. leukos — белый). Лейкоциты
различаются формой и размерами, но сейчас, во
время мимолетных столкновений с ними, мы
не успеваем их хорошенько рассмотреть.
Позже, в более спокойной обстановке мы по
знакомимся с ними поближе.
По мере того как сужаются артерии и
скорость течения замедляется, нам удается
бросить взгляд на клетки, выстилающие
стенки кровеносных сосудов. Это эндоте-
лиальные клетки (от греч. endon — внутри,
thele — сосок), образующие сплошной слой,
чем-то напоминающий неравномерно
выложенную черепичную крышу или мостовую.
Они настолько плоские, что их ядра
выдаются в просвет сосуда; от этого стенка сосуда
приобретает холмистый вид. Клетки
эндотелия плотно соединены между собой
контактами разного типа и образуют
тонкую, непрерывную трубчатую оболочку,
служащую важнейшим фильтром и
регулятором обменных процессов между
кровью и тканями. Такого типа контакты
характерны не только для эндотелия.
Большинство клеток соединены между
собой подобным же образом и организованы
в оболочки, столбики, кластеры, мешочки
или другие различные многоклеточные
структуры, из которых построены ткани и
органы. Наиболее прочными межклеточны
ми контактами являются десмосомы (греч.
desmos — соединение, soma — тело), в
которых две клетки соединены плотной связью
и скреплены пучками поперечно идущих
волокон, проникающих глубоко в их
цитоплазму. Эти волокна носят название
тонофиламентов (греч. tonos — натяжение).
Имеются несколько других типов
контактов клеток, включая контакт, названный
щелевым, в котором соседние клетки
соединены плотно упакованными рядами
полых цилиндрических «кольев» длиной
примерно 15 нм и диаметром 8 нм;
диаметр внутреннего отверстия составляет
1,5 — 2 нм. Проникая своими концами в
мембраны соседних клеток, эти структуры
связывают клетки, разделенные узкой
щелью, но позволяют по своим внутренним
каналам осуществлять межклеточный
перенос электрических токов и небольших
ионов и молекул.
Без дополнительных поддерживающих
структур образующиеся посредством этих
контактов многоклеточные содружества
не смогли бы выдержать даже ничтожное
напряжение. Сами контакты устояли бы,
но не устояли бы соединяемые с их no-
Различные типы коптакто
мощью мебраны, которые, как мы увидим
в дальнейшем, представляют собой очень
тонкие пленки, вряд ли плотнее мыльных
пузырей. Кровеносные сосуды особенно
нуждаются в таком укреплении, чтобы
выдержать давление, оказываемое на них
сокращениями сердца. Поэтому крупные
артерии окутаны толстой эластичной
оболочкой, почти непроницаемой даже для
мельчайших молекул. Но по мере того как
сосуды суживаются и кровяное давление
падает, стенка сосудов становится все
тоньше. Когда мы достигнем капилляров,
самых узких, не толще волоса протоков
(лат. caplllus — волос), то обнаружим,
что внутренняя выстилка — эндотелий —
покрыта лишь тонкой оболочкой, называемой
базальной мембраной (см. с. 51). Именно
здесь в основном осуществляются все виды
обмена веществ между кровью и тканями.
Вот почему и нам пора покинуть капилляр,
если мы не хотим оказаться
подхваченными идущим в обратном направлении
током венозной крови. Но для этого
необходимо вскрыть контакт между двумя
соседними эндотелиальными клетками.
Пока мы прикидываем, как бы приступить
к этой задаче, нам неожиданно
приходит помощь со стороны проплывающего
мимо лейкоцита, который на наших
глазах резко меняет свое поведение.
Только что эта клетка еще
перемещалась в общем потоке. Теперь же она
прилипает к эндотелию и с силой
вползает в него, неистово прокладывая себе
путь между двумя клетками. Так мы
Лейкоцит, притягивающийся
хемотаксическим сигналом,
протискивается через эндотелий
капилляра.
становимся свидетелями хемотаксиса (греч.
taxis — расположение) — ответной реакции
на некоторые химические вещества.
Встретив на своем пути такое вещество, клетка
начинает двигаться по направлению
увеличивающейся концентрации вещества, т. е.
по направлению к его источнику,
прокладывая себе путь через все преграды с
помощью специально для этой цели
секретируемых ферментов. Этот
удивительный и до сих пор малопонятный феномен
вызывается веществами, которые обычно
выделяются в области повреждения ткани или
бактериальной инфекции. Хемотаксис —
чрезвычайно полезное для живого
организма явление, так как благодаря ему
лейкоциты автоматически доставляются туда, где их
защитные свойства необходимы. А нам
благодаря этому защитному механизму
удалось пройти сквозь щель в стенке
капилляра.
Прохождение сквозь
внеклеточные структуры
При выходе из сосуда во внеклеточное
пространство нашему взору открывается
поистине устрашающее зрелище, при виде
которого на память невольно приходят
сцены из диких джунглей, столь любимые
художниками-иллюстраторами первых книг
о дальних путешествиях. Разница лишь
в том, что наблюдаемые нами сцены разы
грываются в подводном царстве. Между
толстыми стволами, наклонившимися во
всех направлениях, тянутся густые
переплетения лианоподобных нитей (фила-
ментов). В одних местах эта сеть почти
непроходима* в других она представляет
собой тончайшую филигранную вязь. Так,
по крайней мере, нами воспринимается
этот мир на молекулярном уровне через
наши увеличивающие в миллион раз
«очки». Если мы уменьшим увеличение
в несколько сотен раз, то обнаружим, что
этот кажущийся молекулярный беспорядок
преобразуется в микроскопический порядок
в виде волокон, покрытий, пластин и
других структурных элементов.
Основным молекулярным компонентом
этих внеклеточных структур является
коллаген — вещество, которое промышленным
способом извлекается из костей, и
используется для получения желатина и
Вид первобытного леса на богат он такими аминокислотами, как
Амазонке глицин, пролин и гидроксипролин. Обратите
внимание на то, что гидроксипролин не
значится в списке 20 аминокислот, приве-
клея. Отсюда и произошло его назва- денном в табл. 1. Он образуется из
ние (греч. kolla — клей). Коллаген пред- остатков пролина уже после синтеза
ставляет собой белок. Основной его еди- полипептида и характерен для коллагена,
ницей является длинная полипептидная Специфичной чертой этого полипептида
цепь из 1055 аминокислот. Особенно является также его скручивание в лево-
Путешественник по клетке
пробирается сквозь
соединительнотканные джунгли.
Обратите внимание на толстые
коллагеновые стволы и
переплетения протеогликановых
лиан.
4—1452
Электронная микрофотография
напыленной металлом реплики
коллагеновых волокон из кожи
человека
закрученную спираль с шагом примерно 1 нм,
совершенно отличную от а-спирали,
упомянутой раньше. Три такие цепи
объединяются в правозакрученную спиральную
нить толщиной примерно 1,5 нм и длиной
300 нм с 3-нм повторением (или 9-нм
шагом каждой отдельно взятой цепи).
Эта свитая из трех нитей молекула,
называемая тропоколлагеном (греч. trope —
поворот), является строительным
материалом для коллагена. Пользуясь
«молекулярными очками», мы увидим этот
строительный блок в виде короткой
веревочки толщиной чуть более '/го дюйма
и длиной почти в фут. Способность этого
хрупкого материала образовывать
окружающие нас массивные стволы
объясняется природной способностью молекул
тропоколлагена соединяться бок о бок
в виде лесенки. Это свойство позволяет
им спонтанно собираться в волокна
практически любой длины и толщины.
Расположение нитей таково, что С-терми-
нальные головки соседних молекул
тропоколлагена отстоят ступенеобразно друг
от друга точно на 67 нм. Для размещения
полной молекулы тропоколлагена (300 нм)
необходимо как минимум пять
повторяющихся ступеней (335 нм), при этом между
головками и Хвостами двух
последовательно расположенных молекул остается
щель в 35 нм. Поскольку эти щели
расположены точно относительно друг
друга по всей толщине волокна, в итоге
образуются характерные
поперечнополосатые структуры, отстоящие друг от друга- на
67 нм. Каждая полоса соответствует
участку, где 'Д толщины волокна полая.
Это свободное пространство играет
важную роль. В кости, например, в нем
происходит минерализация.
Тропоколлаген является
предшественником молекулы, названной проколлагеном,
в состав которой входят дополнительные
терминальные N- и С-участки,
предупреждающие преждевременную самосборку.
Только после выделения проколлагена во
внеклеточное пространство происходит его
обработка ферментами, удаляющими
лишние части. Образовавшиеся таким образом
волокна подвергаются дальнейшим изме-
Структура коллагенового волокна
обнаруживает ступенчатое
расположение трехнитчатых
молекул тропоколлагена.
нениям, включая укрепление за счет
поперечных связей. Принято считать, что
эти процессы продолжаются в течение
всей жизни организма и причастны к
наблюдаемому по мере старения
организма снижению эластичности
соединительнотканных структур.
Коллагеновые волокна — основные
компоненты жесткого каркаса, посредством
которого укрепляются поддерживающие
структуры. Эти волокна можно уподобить
стальным прутьям в железобетоне или
волокнам стекловолокна. Расположенные
параллельными пучками, они участвуют
в создании самых разных продольных
частей организма, вплоть до связок и
сухожилий. Их пространственные
переплетения формируют каркас тканей и органов,
включая части собственно скелета, такие,
как хрящ и кость.
Эти разнообразные структуры строятся
из нескольких различных типов коллагена.
Один из них, тип IV, обычно встречается
в плоских образованиях. В сочетании с
другими белками, такими, как ламинин
(лат. lamina — тонкая пластина) и фибро-
нектин (лат. nectere — связывать), и про-
теогликанами (см. ниже) он образует
эластичное пластинообразное вещество
толщиной 50—100 нм, из которого состоят
так называемые базальные мембраны.
Термин «базальные мембраны», возникший
на заре гистологии, нельзя считать
удачным. Строение базальных мембран в
корне отличается от строения клеточных
мембран, с которыми нам предстоит
встретиться. По существу они представляют
собой стенки. Иногда они окружают
отдельные клетки, уподобляясь стенкам
бактериальных или растительных клеток,
однако чаще окружают или поддерживают
многоклеточные образования различных
форм и размеров. Одной из функций
базальной мембраны является снабжение
клетки покрытием, благодаря которому
последняя в состоянии ползать или
прикрепляться. Другая функция — служить
молекулярным фильтром. Базальные
мембраны капилляров играют особенно
важную роль при отборе веществ, которые
проникают из крови в ткани. Наиболее
совершенный по структуре и функции
такой фильтр находится в капиллярах
мозга (так называемый гематоэнцефали-
ческий барьер).
В некоторых участках, например в
артериальной стенке, используется другой
филаментозный белок — эластин. Подобно
коллагену, эластин собирается в нити,
которые в свою очередь формируют более
сложные стуктуры, главным образом
волокна и плоские пластины, или ламеллы.
Однако в отличие от аналогичных структур,
построенных из коллагена, эластиновые
волокна стремятся принять волнистую или
ребристую форму, что позволяет им
растянуться до полутора раз и вновь спонтанно
сократиться, как только закончится
растяжение. Как свидетельствует само
название, эластин придает эластичность
(упругость) соответствующим образованиям.
Подобно железобетону или
стекловолокну, фиброзная сеть поддерживающих
структур погружена в аморфный мат-
рикс, или наполнитель, носящий название
основного вещества, которое на
молекулярном уровне представляет собой
ячеистое образование из тонких макромолекул.
Эти молекулы включают ряд важных
полисахаридов, многие из которых одним
концом прикреплены к протеиновому
стержню (протеогликаны). В зависимости от
природы макромолекул и их жесткости
образующийся матрикс может быть либо
вязкой жидкостью, либо вести себя как
гель, либо достигать твердости и
упругости хряща или панциря морского рака.
Иногда, как, например, в костной ткани,
зубах, кораллах, в раковинах моллюсков
и в других биоминеральных структурах,
матрикс в значительной степени заполнен
кристаллическими отложениями
минеральных солей.
Как правило, на пути в клетку встает
еще одно препятствие: богатое углеводами
покрытие, так называемая поверхностная
оболочка, или гликокаликс (греч. kalyx —
оболочка). Ее толщина и внешний вид
варьируют в зависимости от типа клетки
от едва различимого нежнейшего пушка
до настоящей базальной мембраны.
Связанная с клеточной мембраной
относительно слабыми силами, поверхностная
оболочка служит для поддержания определенного
микроокружения вокруг клеток, защищая
их от некоторых физических или
химических воздействий, а также помогая им
распознавать родственные структуры и
устанавливать связи с ними и с
соединительнотканными структурами.
Поверхность клетки
Знакомство
с мембранами
и липидами
На путешественника, впервые
увидевшего поверхность клетки, наибольшее,
впечатление производит ее неровность и
изменчивость. За редкими исключениями,
клетки характеризуются чрезвычайно
сложно устроенной поверхностью,
специфичной для каждого типа клеток.
Поверхность одних испещрена глубокими щелями
или покрыта кратероподобными
углублениями. Поверхность других деформирована
выростами (выбуханиями), называемыми
псевдоподиями (греч. pous, podos — нога),
или усеяна пальцевидными выростами —
микроворсинками (лат. villas — ворс) или
ресничками (лат. сШит — ресница).
Имеются и клетки со складчатой
поверхностью — кажется, будто она покрыта
тонкими вуалями. Короче, разнообразие их
бесконечно.
Крайне подвижная кожа
Сканирующий электронный микроскоп
раскрыл перед нами редкую красоту
поверхности клетки, однако он не в
состоянии показать постоянное движение этих
узоров и их калейдоскопические изменения.
Колеблются реснички; волнуются мембра-
нозные вуали; склоняются и извиваются
микроворсинки; выдвигаются наружу
псевдоподии; там, где только что была
спокойная поверхность, внезапно взрываются
кратеры, извергающие продукты секреции,
или, наоборот, зияют инвагинации (впя
чивания), втянутые в глубь клетки. Иног
да, как мы недавно наблюдали, вся клетка
содрогается или начинает уползать под
влиянием какого-то неуловимого химиче
ского сигнала.
Несмотря на все эти непрерывные,
порой беспорядочные изменения, клетка всег
да остается охваченной плотно прилегаю
щей мембраной, которая приспосабли
вается к любому изменению ее формы с
кажущейся легкой пластичностью. Эта
мембрана называется плазматической
мембраной, или плазмалеммой (греч.
plasma — форма; lemma — оболочка). Она
представляет собой тонкую пленку
толщиной около 10 нм. Даже при увеличении
в миллион раз мы получим не более 1 см.
На первый взгляд, это слишком тонкая
оболочка для структуры величиной с боль
шую аудиторию (а именно таков объем
клетки при увеличении в миллион раз)
В действительности же, когда мы поближе
рассмотрим внутреннюю поверхность мем
браны, окажется, что она не единственная
структура, несущая на себе всю тяжесть
содержимого: с внутренней стороны ей
помогает целый ряд поддерживающих
структур.
Заключение внутри себя содержимого
клетки — лишь одна из многочисленных
функций плазматической мембраны,
которая по сути представляет собой
важнейший орган клетки. Плазмалемма — очень
сложная и динамичная структура,
регулирующая практически каждое взаимодей
ствие между клеткой и ее окружением,
включая взаимодействие с другими клет
ками. А осуществляется это благодаря ее
уникальной структуре, включающей два
основных типа составляющих молекул:
фосфолипиды и белки.
На сканирующей электронной
микрофотографии клетки
слизистой оболочки
желудочно-кишечного тракта
видны микроворсинки.
Уроки с мыльным пузырем
Секрет устройства мембран — не только
плазматической, но и всех биомембран —
заключается в липидном двойном слое —
бислое (греч. lipos — жир). Простейшим
примерам липидного бислоя служит
мыльный пузырь. Мыла (соли жирных кислот)
представляют собой линейные молекулы, в
состав которых входят только углерод и
водород, если не считать концевую
отрицательно заряженную карбоксильную груп
пу СОСТ. Пользуясь терминологией, к
которой мы прибегали в гл. 2, когда
говорили об аминокислотах, мы можем
сказать, что эти молекулы имеют длинный
гидрофобный хвост и гидрофильную
головку. Такие молекулы называются амфипа-
тическими (или амфифилическими), что
по-гречески означает «любящий двоцх».
Липиды, входящие в состав мембран,
сложнее, чем простые виды мыла, но они
тоже амфипатические. Их разветвленная
гидрофобная хвостовая часть состоит из
двух цепей жирных кислот, а большая
гидрофильная головка содержит
отрицательно заряженную группу фосфорной
кислоты, которая в свою очередь связана с
другой, часто положительно заряженной
группой; такие образования носят название
фосфолипидов.
Когда амфипатические вещества
смешиваются с водой, их молекулы спонтанно
принимают конфигурацию,
удовлетворяющую одновременно двум противоположным
требованиям. Они связываются таким
образом, что их гидрофильные головки
погружаются в воду, в то время как
гидрофобные хвосты в контакт с водой не
вступают, а контактируют только между собой
Модели молекул фосфолипида
и мыла
Различные структуры,
образованные амфипатическими
веществами и воздухом, водой
и воздухом или водой и маслом
и с другими гидрофобными веществами —
маслом, пластмассой или воздухом,
которые могут быть вокруг. По существу,
таким путем могут образоваться три
структуры: однослойные (монослойные),
мицеллы и двуслойные (бислойные).
Молекулярные монослои образуются на границе
между водой и воздухом или какой-либо
гидрофобной жидкостью. Мицеллы
возникают в воде в виде сферических
кластеров с обращенными вовнутрь хвостами
и смотрящими наружу головками.
Смешайте раствор мицелл с воздухом, и
мицеллы соединятся и окружат пузырьки
воздуха однослойной пленкой (эффект
пены, поверхностный эффект). Если же
смешать мицеллы с маслом или потереть, ими
загрязненную, засаленную поверхность,
мицеллы изменятся с образованием
монослоев, покрывающих диспергированные
капли масла или жира (эмульсифицирую-
щий или очищающий эффект). Двуслойные
структуры образуются при определенных
условиях как граница между двумя
фазами аналогичной природы. Возможны два
варианта образования границ. Если две
используемые фазы гидрофобны — как,
например, воздух, — то головки молекул
будут направлены внутрь, соединенные
тонким слоем воды, а хвосты молекул будут
торчать по обе стороны от бислоя. Такова
структура мыльных пузырей. Если же обе
фазы представляют собой жидкости, то
хвосты молекул окажутся внутри бислоя,
а головки — снаружи.
Фосфолипиды обладают выраженной
способностью формировать двуслойные
структуры — бислои — при смешивании с
водой. Их раздвоенные гидрофобные
хвосты слишком громоздки и с трудом
размещаются внутри мицелл, в то же время
они хорошо приспособлены для двуслойной
структуры. Они спонтанно смыкаются в
везикулы, которые могут состоять из
одного бислоя или нескольких
концентрически расположенных бислоев в
зависимости от способа их получения. Эти
искусственно созданные фосфолипидные
везикулы, названные липосомами, оказались
важным инструментом при исследовании
клетки. Природная склонность фосфолипи-
дов собираться в водной среде в бислои
лежит в основе структуры обычных мембран,
которые в качестве основной единицы
содержат фосфолипидный бислои толщиной
5—6 нм. Кроме того, в состав мембран
входят различные белковые молекулы, о
которых речь пойдет ниже.
Некоторые важные свойства биологи
ческих мембран, как и мыльных пузырей,
объясняются структурой липидного бислоя.
Одним из них является подвижность
мембран. Липидный бислои — по существу
жидкое образование, в пределах которого
молекулы могут свободно передвигаться в
плоскости бислоя и перестраиваться
практически в любую форму, причем без потери
контактов, что соответствует их взаимному
притяжению.
Такая пластичность характерна и для
мыльных пузырей, отличающихся от
клеточных мембран только большим
поверхностным натяжением и соответственно
большей жесткостью. Форма мыльного
пузыря может меняться, например, при
дуновении ветра, однако он всегда стре
мится принять сферическую форму,
которая уменьшает до минимума
поверхностное натяжение. У клеточной мембраны,
поддерживаемой, с одной стороны, цито-
плазматическими структурами, а с другой,
находящейся в контакте с водной средой,
более низкое поверхностное натяжение, и
поэтому она подвижнее, чем мыльный
пузырь.
Текучесть бислоев зависит от
способности гидрофобных хвостов свободно
скользить друг относительно друга. В свою
очередь, эта способность зависит от
температуры. При температуре ниже некой
критической температуры, называемой
переходной, которая зависит от природы
липидов, гидрофобные цепочки застывают,
образуя упорядоченную жесткую
структуру, которая несовместима с функциями,
выполняемыми мембранами. Клетки,
адаптированные к различным температурам,
содержат в составе своих мембран липиды
с соответственно различными переходными
температурами. Текучесть бислоев зависит
также от погруженных в мембрану
веществ, которые влияют как на скольжение
гидрофобных цепей, так и на их
застывание — свертывание. Холестерин, один из
основных компонентов плазматической
мембраны всех эукариотических клеток,
своей важной ролью обязан именно этим
взаимодействиям.
Вторым важным свойством бислоев
является их способность самозамыкаться.
Мыльные пузыри отделяются
и самозамыкаются (1), делятся
(2) и сливаются (3).
Посмотрим еще раз на мыльный пузырь.
Если его разрезать пополам, то получим
не две половинки мыльного пузыря, а два
мыльных пузыря; они меньше, но целые.
При столкновении два мыльных пузыря
сливаются, и вся структура изменяется с
образованием одного, более крупного
пузыря. Точно так же на основе
самозамыкания, присущего этому типу структур,
возможно слияние и расщепление липид-
ных бислоев.
В отношении клетки это свойство
проявляется следующим образом: если
мембрану клетки проколоть иглой и вытащить
ее обратно, то место прокола
автоматически закроется. Даже если разрезать
клетку микроножом на две части, то и
тогда каждая ее часть будет окружена
замкнутой плазматической мембраной.
И напротив, можно заставить клетки
слиться, наподобие мыльного пузыря,
путем слияния их плазматических мембран.
Это явление происходит в физиологиче
ских условиях, например при развитии
мышечной > ткани, но оно может быть
воспроизведено и искусственным путем.
Электронная микрофотография
многослойной липосомы,
полученная методом напыления
реплики после замораживания
скалывания
Ученые используют его при получении
моноклональных антител. Ниже мы увидим,
что слияние мембран также играет,«ажную
роль во многих внутриклеточных
процессах.
К третьей особенности липидных
бислоев (мембранного типа) относится их
непроницаемость для молекул, растворимых
в воде. Такие молекулы не в состоянии
пройти через бислой, ибо для этого им
необходимо пересечь маслянистую пленку,
образованную гидрофобными хвостами
фосфолипидных молекул. Чтобы физически
проникнуть сквозь такую пленку, вещество
само должно быть гидрофобным или
воспользоваться изменением температуры и
протиснуться через случайные щели,
открывшиеся в бислое в результате
молекулярных перемещений. Именно так
происходит обмен водой и другими очень
мелкими молекулами между клеткой и
окружающей ее средой. Однако, как правило,
бислой представляют собой чрезвычайно
эффективный барьер, который позволяет
клеткам сохранять свои составные части и
преграждает путь внеклеточным
веществам. Этот способ весьма экономичен и в
какой-то мере напоминает методы обороны
средневековых городов, окружавших себя
рвами и стенами. Однако города
нуждались также в мостах и воротах, которые
обеспечивали и контролировали движение
в город и из него, ибо в противном случае
жизнь горожан не могла бы протекать
нормально. Липидный бислой, который
немногим отличается от средневекового
рва, самостоятельно не может
осуществлять эту функцию; требуется участие
мембранных белков — молекул,
обладающих более высокой специфичностью.
От бислоев к мембранам:
роль белков
Как уже говорилось в предыдущей
главе, белки, не способные прятать свои
гидрофобные группы внутрь гидрофильной
оболочки, обычно находят удобное для
себя место в мембранах. Внутри мембраны
проблема разрешается таким образом, что
они погружают свои гидрофобные части в
липидные бислои, в то время как
гидрофильные части выходят в окружающую
воду. В зависимости от структуры
гидрофильных и гидрофобных групп молекулы
могут либо плавать на липидном бислое
наподобие айсберга, либо сидеть на нем
«верхом». В первом случае все
гидрофильные группы будут направлены в одну
сторону, во втором гидрофильные группы
будут выступать по обе стороны мембраны
(трансмембранные белки). Некоторые из
этих расположений чрезвычайно сложны.
Бактериородопсин, основной компонент
фотохимического аппарата микроба Halobium
(см. гл. 10), опоясывает бислой семь раз.
Ацетилхолиновый рецептор (см. гл. 13)
состоит из двух единиц, каждая из
которых в свою очередь состоит из пяти
трансмембранных полипептидов,
сгруппированных вокруг центрального канала. В этих
и других известных примерах такого рода
белковые части, пересекающие бислой,
состоят из а-спиральных стержней, содер
жащих 21—27 аминокислотных остатков,
по большей части гидрофобных.
Белки, у которых одна или более
гидрофобных групп погружены в липидный
бислой мембраны, носят название
интегральных, или внутренних мембранных,
белков (независимо от того, пересекают
они бислой или нет). Те белки, которые
с какой-либо стороны прикреплены к
мембране, но внутрь липидного бислоя не
проникают, называются периферическими,
или наружными.
Благодаря текучести, являющейся, как
мы уже отмечали, одним из основных
свойств липидных бислоев, мембранные
белки свободно перемещаются в плоскости
мембраны за счет латеральной диффузии.
Эта свобода — неотъемлемая часть
выполнения ряда функций, и мы ею вскоре
воспользуемся в наших собственных целях,
однако она имеет ограничения, вызванные
взаимодействием мембранных белков с
другими находящимися внутри и вне
мембраны компонентами. Некоторые из
этих взаимодействий модифицируются
специфическими молекулами, связанными с
мембранными белками. Последствия этих
реакций могут иметь большое
функциональное значение.
Характерной чертой плазматической
мембраны является то, что многие из ее
наружных белковых компонентов представ
ляют собой гликопротеиды, т. е. они
содержат олигосахаридные боковые цепочки,
образованные молекулами Сахаров.
Плазматическая мембрана содержит также
некоторые гликолипиды. В образовании этих
углеводных компонентов, имеющих
зачастую ветвистое строение, участвует деся
ток и более молекул различных Сахаров
Они покрывают поверхность клетки неж
ным молекулярным «пушком». На самом
же деле это не пушок, а щупальца. Уве-
личьте их еще в сто раз, и вы сами в этом
убедитесь. Все это зрелище напоминает
сцены из подводной жизни, где стайки
рыб и других созданий мирно пасутся
среди существ, похожих на растения, пока
внезапно ветка «растения» не
превращается в смертоносное щупальце, которое
схватывает ничего не подозревающую
жертву и втягивает ее внутрь. В нашем
клеточном морском пейзаже
потенциальными жертвами являются молекулы,
окружающие клетки; в роли щупалец
выступают боковые олигосахаридные цепочки
(или другие группы) гликопротеидов
мембраны, из которых многие функционируют
как рецепторы.
Поверхностные рецепторы
Концепция рецепторов была
выдвинута в начале текущего столетия
немецким ученым Паулем Эрлихом, известным
своим вкладом в иммунологию и
химиотерапию. Эрлих воспользовался принципом
«замок — ключ», выдвинутым его
современником, химиком Эмилем Фишером, для
объяснения того, что происходит на
поверхности клеток в некоторых стратегически
расположенных химических группировках —
рецепторах или местах (сайтах)
связывания, которые специфически связывают
определенные молекулы, например антитела
(см. с. 62—64) или лекарственное
вещество, под общим названием лиганды
(лат. ligare — связывать). Подобно тому
как имеется множество различных замков
и соответствующих им ключей, встречается
множество рецепторов и лигандов.
Современная химия дополнила
концепцию Эрлиха положением о конформацион-
ном изменении: занятый лигандом рецептор
приобретает другую, по сравнению с
исходной, форму, иными словами,
изменяется конфигурация полипептида. При
подобных изменениях трансмембранного
белка или молекул, способных повредить
конформацию трансмембранного белка,
Рисунок, сделанный Паулем
Эрлихом в 1900 г. для
иллюстрации его рецепторной
теории
Рецептор, занятый лигандом на
поверхности клетки, изменяет
свою конформацию и активирует
внутриклеточный триггер.
Молекулярная структура
плазматической мембраны.
Интегральные белки либо плавают
на липидном бислое как айсберги,
либо «сидят на нем верхом»; они
передвигаются посредством
латеральной диффузии.
Олигосахаридные боковые цепи
гликопротеидов образуют
молекулярный пушок (или лес
«антенн») на поверхности клетки.
между внутриклеточной и внеклеточной
средой устанавливается сообщение. Многие
важнейшие виды взаимодействия клетки с
окружающей средой или с другими
клетками протекают именно благодаря
рецепторам.
На поверхности любой клетки
встречается множество различных рецепторов,
каждый из которых представлен сотнями
тысяч молекул. Многие из них — хотя не
обязательно все — гликопротеиды. Они
покрывают клетку целым лесом
молекулярных антенн, предлагая наблюдателю
весьма забавное зрелище. Поскольку мимо
клетки проплывают подхваченные
водоворотами и течениями, окружающими ее,
самые разнообразные молекулы,
ежеминутно в какой-нибудь точке происходит
какой-либо эффектный захват. Иногда в
процессе связывания участвует не один
рецептор, а несколько. Случается даже, что
сотни рецепторов принимают участие в
иммобилизации крупного объекта, например
бактерии.
Событие, которое часто следует за
захватом — и это хорошо видно с нашего
пункта наблюдения, — поглощение, ничем
не отличающееся от аналогичного случая
в подводном мире. Это наиболее
драматический момент во всем представлении,
разыгрываемом рецепторами. Сперва
образуется ямковидное углубление, в него
невидимой силой втягивается рецептор
вместе с добычей и вскоре исчезает из
виду. Кстати, и мы позднее воспользуемся
этим механизмом, чтобы впервые попасть
в клетку. Но подробнее об этом поговорим
в следующей главе.
Среди веществ, которые захватываются
рецепторами, многие — специфические
переносчики или мессенжеры, называемые
гормонами; гормоны производятся в других
органах и попадают в клетку с потоком
крови. Гормоны, связавшиеся с клеточными
рецепторами, обычно в конечном итоге
попадают внутрь клетки. Однако перед этим
их связывание запускает определенный
клеточный ответ. С того места, где мы
находимся, видны только трепетания
рецептора в момент его захвата лигандом.
Когда мы окажемся в цитозоле, нашему
взору откроются структуры на внутренней
поверхности мембраны, с которыми свя
заны рецепторы, и механизмы, посредством
которых эти структуры осуществляют спе
цифическую ответную реакцию клетки
(см. гл. 13).
Тонким, но очень важным изменением,
опосредованным некоторыми рецепторами,
когда они оккупированы, является так
называемое «раскрытие ворот». Это
временное раскрытие канала, по которому
определенные ионы или вещества
поступают в клетку или выводятся из нее.
Чтобы оценить важность этого процесса,
нам необходимо ближе познакомиться с
механизмом проникновения молекул через
плазматическую мембрану.
Молекулярный транспорт
через плазматическую
мембрану
Жизнедеятельность клетки зависит от
непрерывного проникновения внутрь
клетки и от выхода из нее многочисленных
разнообразных веществ. Все они проходят
через плазматическую мембрану, и
большинство из них высоко гидрофильны.
Поступают в клетку для удовлетворения
потребностей, связанных с ростом и
энергией, сахара, аминокислоты и другие
питательные вещества, а удаляются
продукты обмена и отходы, которые в
противном случае загромождали бы клетку.
Кроме того, ионы должны переходить из
окружающей среды в клетку и обратно,
с тем чтобы поддерживался ионный
состав внутриклеточной среды, который очень
отличен от ионного состава во
внеклеточной среде. Так, внутриклеточная среда
значительно богаче ионами калия и
гораздо беднее ионами натрия, чем
внеклеточная. Эти различия вызывают
просачивание, которое должно компенсироваться
ионным транспортом в обратном
направлении. В результате осуществляется
значительный двусторонний транспорт через
границу, которая, как мы помним, состоит
в основном из непрерывного фосфолипид-
ного бислоя, почти непроницаемого для
большинства гидрофильных молекул.
Для поддержания такого транспорта
прежде всего необходима достаточно
большая площадь поверхности клетки. В самом
деле, основной функцией микроворсинок,
этих пальцевидных выступов, плотно
покрывающих поверхность некоторых
клеток (см. с. 53), как раз и является увели-
Типы молекулярного транспорта
/. Диффузия. Источник энергии:
отрицательное концентрационное
различие по ходу движения.
Скорость медленная.
2. Проникновение. Источник
энергии: тот же, что и при
диффузии. Скорость очень
медленная.
3. Облегченный транспорт.
Источник энергии: тот же, что
и мри диффузии. Скорость
быстрая.
4. Активный транспорт. Источник
энергии: внешний (обычно АТФ).
Скорость быстрая.
чение размеров площади, доступной для
обменов между клеткой и окружающей ее
средой. Вот почему их чаще находят на
поверхности клеток, особенно активно
участвующих в обмене, таких, например, как
клетки, выстилающие слизистую
желудочно-кишечного тракта или канальца почек.
Вторым необходимым условием
является наличие соответствующих каналов в ли-
пидном бислое. В этих каналах имеются
трансмембранные белки, действующие в
качестве специфических переносчиков для
перемещающихся веществ, а в отдельных
особых случаях в качестве контролируемых
каналов, или ворот, работа которых
обусловлена процессом связывания
специфического лиганда или электрического
возмущения.
И наконец,, еще одно условие:
доступность энергии. В данном случае решающее
значение имеет то, направляется ли
транспорт по градиенту концентрации (от
большей концентрации к меньшей) или против
него. Перенос веществ в сторону меньшей
концентрации (т. е. по градиенту
концентрации) может происходить спонтанно,
но это сопровождается выравниванием
градиента концентрации; в результате
источник энергии может истощаться. Для
непрерывного транспорта веществ
необходимо поддерживать градиент концентрации
веществ по обе стороны мембраны путем
образования соответствующего вещества
или его поступления по одну сторону
мембраны, в то время как по другую
сторону осуществляется потребление или
удаление этого вещества. Транспорт вещества
в сторону меньшей концентрации носит
название диффузии (если на его пути нет
преград) и переноса или проникновения
(если его путь преграждает барьер).
Транспорт считается облегченным, если
ему способствует какой-нибудь переносчик
или трансполицирующая система (система
переносчиков), действующая в качестве
катализатора. Транслокаторы,
катализирующие облегченный транспорт,
называются пермеазами. Термином «ионофор»
(греч. phereln — носить) принято
обозначать особую группу переносчиков,
осуществляющих транспорт некоторых ионов
через мембраны.
Для транспорта против градиента
концентрации необходима энергия; связанный
с этим механизм сложнее. Системы,
осуществляющие активный транспорт, обычно
называют насосами. Наиболее важными
являются насосы, перекачивающие поло
жительно заряженные ионы, в частности
ионы водорода (Н+), натрия (Na + ),
калия (К"1") или кальция (Са+). В
результате их активности часто создается
электрический дисбаланс по обе стороны
мембраны (мембранный потенциал).
Преобразование энергии в митохондриях (гл. 9) и
хлоропластах (гл. 10), как и все
проявления биоэлектричества, неразрывно связано
с этим видом перераспределения заряда.
Именно взаимодействием насосов и
контролируемых каналов для ионов, позволяющих
получить очень быстрые изменения
генерированных мембранных потенциалов,
определяются электропроводность нервов,
деятельность мозга, мышечное возбуждение,
сердечный ритм, стимуляция желез и
многие другие феномены, относящиеся к
жизнедеятельности нашего организма.
Насосы питают те латентные токи, которыми
современная медицина научилась
пользоваться для диагностических целей. Они же
поддерживают разряды в несколько сотен
вольт, с помощью которых электрический
скат и электрический угорь оглушают свою
жертву.
В настоящее время все множество
транспортных механизмов, которыми
усыпана поверхность клетки, обнаруживается
только по потокам молекул и ионов,
входящих и выходящих из клетки. Но у нас
будет возможность ближе ознакомиться с
их работой внутри клетки, когда чуть
позже мы окажемся по другую сторону
плазматической мембраны (см. гл. 13).
Идентичность и иммунное
распознавание
У плазматической мембраны есть еще
одна важная функция: снабжать клетки
«удостоверением личности». В качестве
такового клетке служит ряд
специфических химических групп, известных под
названием трансплантационных антигенов,
или антигенов гистосовместимости.
Первыми были открыты антигены,
определяющие группы крови А и В. Известно, что
некоторые из нас имеют группу крови А,
а другие — В, АВ или О. Иными словами.
по составу крови людей можно разделить
на четыре группы, представляющие собой
четыре возможных комбинации (22),
которые получаются в зависимости от
присутствия или отсутствия одного из двух
признаков.
Сейчас в человеческом организме
открыты многие трансплантационные антигены.
Их число и полиморфизм столь велики,
что вряд ли возможно отыскать двух
индивидов с полностью идентичными их
комбинациями. Такие случаи наблюдаются
лишь у однояйцовых близнецов.
Трансплантационные антигены представлены
(более или менее полно) на поверхности
каждой клетки данного индивида; они
специфичны для каждого человека. Вот
почему их с полным правом считают
таким же надежным средством
идентификации человека, как отпечатки пальцев.
В организме эти химические
опознавательные знаки постоянно подвергаются
проверке со стороны специальных
защитных клеточных сил — лимфоцитов, агентов
иммунной системы, которые обладают
способностью по поверхностным маркерам
распознавать любой вторгшийся в пределы
организма агент и разрушить его или
участвовать в его уничтожении.
Лимфоциты из ряда основных органов, таких,
как селезенка, тимус, лимфатические узлы,
миндалины и различные так называемые
лимфоидные бляшки, циркулируют в крови
и лимфе.
Существует два типа лимфоцитов, Т- и
В-лимфоциты, названные так по основным
местам их образования: тимусу и костному
мозгу (первоначально бурса (сумка)
Фабрициуса— лимфоидный орган у птиц).
В пределах каждого типа имеется
несколько подклассов. Т-лимфоциты, по крайней
мере их основной подкласс под названием
цитотоксические лимфоциты, представляют
собой «пехоту» иммунной системы; у них
имеются особые приспособления, с
помощью которых они при непосредственном
контакте убивают другие клетки,
используя механизм «поцелуй смерти».
В-лимфоциты можно уподобить артиллерии или,
скорее, ракетным установкам в виде
плазматических клеток, которые выпускают
ракеты, известные под названием антител
и обладающие способностью
специфически соединяться со своей мишенью.
Антитела, или иммуноглобулины, по своей
природе — белки и сами они не убивают,
а служат средствами распознавания для
целого ряда механизмов истребления. Так,
в частности, соединившись со своей
мишенью, они заставляют ее прикрепляться
к рецептору, находящемуся на поверхности
лейкоцитов, которые зате'м ее поглощают
и разрушают. Этот механизм, являющийся
основной защитой организма против
микробов к вирусов, подробнее будет
рассмотрен в гл. 4. Антитела также приводят в
действие растворимую систему
уничтожения, которая находится в крови и известна
как комплемент.
Совершенно очевидно, что такая
система защиты крайне нужна нашему
организму. По сути, без нее мы не смогли* бы
выжить. Вместе с тем это преимущество
сопряжено с опасностью ложного
опознавания и, как следствие, истребления
«друзей». Тут-то и вступают в игру
трансплантационные антигены. В период
эмбрионального развития человека лимфоциты
овладевают искусством узнавать специфичные
антигены, имеющиеся на поверхности наших
клеток, и относиться к таким клеткам
«по-дружески». Лимфоциты — крайне
строгие контролеры; они обнаруживают
малейшие отклонения от индивидуального
набора, обозначаемого как «свое». Считается
даже, что лимфоциты в состоянии найти
и уничтожить некоторые раковые клетки,
имеющие почти такое же «удостоверение
личности», как и нормальные. Естественно,
что они без труда узнают клетки,
принадлежащие другому организму, и поэтому
препятствуют успешной хирургической
трансплантации тканей или органов.
Трансплантации обычно предшествует
тщательное типирование трансплантационных
антигенов реципиента и потенциальных
доноров с тем, чтобы выбрать оптимальное
их сочетание. После операции пациент
получает иммунодепрессивные препараты,
которые, ослабляя отторжение, к
сожалению, одновременно снижают устойчивость •
больного к инфекциям, а возможно, и
способность организма отторгать раковые
клетки. Природа снабдила человека
другим, лучшим, способом, позволяющим
избежать иммунное отторжение. Но, увы,
мы не знаем, каков его механизм. Речь
идет о способе, который используется
эмбрионами: они добиваются того, что
матери не замечают чужеродных маркеров
(антигенов), доставшихся эмбрионам от
отцов. Правда, у некоторых женщин
иммунная система не способна
функционировать подобным образом, поэтому у них
наблюдаются повторные спонтанные
выкидыши (аборты), вызванные реакцией
иммунного отторжения.
В отличие от других защитных сил,
существующих в природе, организация
лимфоцитов такова, что каждый
отдельный лимфоцит способен узнавать только
один определенный тип чужеродных
молекул — это равносильно тому, как если бы
каждый отдельный солдат мог сражаться
только с одним агрессором определенного
типа. А так как таких молекул миллионы,
если не миллиарды, то основная часть
наших лимфоцитов никогда не вступает в
бой; если же бой и происходит, то число
защищающих человеческий организм
лимфоцитов по необходимости невелико.
Зачастую их гораздо меньше, чем
нападающих врагов.
Такой путь защиты может показаться
в высшей степени неэффективным, однако,
пожалуй, только он позволяет соединить
огромную многосторонность системы с
полной надежностью распознавания, а это
самое главное. Только представьте себе,
каковы были бы последствия, работай
система по принципу «главное — нажать
на курок, а вопросы потом». По-видимому,
лишь принцип «один лимфоцит — одна
мишень» гарантирует необходимое
сочетание безопасности и эффективности.
Природа нашла прекрасный выход из
проблемы немногочисленности лимфоцитов: когда
лимфоцит встречает и распознает свою
специфическую мишень, он начинает
размножаться. Вот еще один, чрезвычайно
важный, пример опосредованного
рецепторами клеточного ответа. Распознавание
осуществляется посредством связывания
специфических поверхностных рецепторов
лимфоцита с мишенью, которое приводит к
митогенному ответу (стимуляция
митозов). Благодаря этому механизму
образуется целая армия, или клон (греч.
klon — ветка), идентичных лимфоцитов,
направленных против мишени. Так орга
низм иммунизируется.
У этого мощного механизма имеется
только один недостаток: чтобы запустить
его*в действие, требуется время, и, если
враг очень силен, армия защитников может
Функционирование иммунной
системы посредством селекции
к.понов
Антиген
Рецептор
опоздать. Поэтому мы прибегаем к
прививкам, т. е. вводим в организм «чучело»
врага, например ослабленный вирус или
убитые бактерии, которые сами по себе уже
не в состоянии вызвать серьезное
заболевание, но все еще несут чужеродные
опознавательные знаки, вызывающие
распознавание, размножение лимфоцитов и
образование антител. В последнее время
для вакцинации используются
специфические поверхностные белки или
экстрагированные из патогенных микроорганизмов
пептиды, или полученные искусственным
путем методами генной инженерии или
органического синтеза пептиды
(синтетические вакцины).
В дальнейшем мы еще вернемся к
удивительным механизмам, благодаря
которым лимфоциты в ходе дифференцировки
приобретают свои специфические
поверхностные маркеры и затем, встречаясь с
соответствующим антигеном, подвергаются
стимуляции и размножаются. К
сожалению, как и все чудеса живого мира,
иммунная за-щита иногда дает осечку. Дефекты
системы могут быть врожденными и столь
выраженными, что ребенок должен
постоянно содержаться в стерильных
условиях. Иммунная система может отказать
и в более поздний период жизни человека,
как, например, при недавно обнаруженном
синдроме приобретенного
иммунологического дефицита (СПИД). И наоборот,
иммунная система может вдруг обрушиться
не только на врагов,, но и на друзей,
поражая предательскими аутоиммунными
атаками печень, почки, суставы или другие
органы больного.
Проникновение
в клетку: эндоцитоз
и везикулярный
транспорт
Описанные вкратце в предыдущей главе
пути проникновения в клетку посредством
переноса, облегченного транспорта или
активного транспорта ограничены только
небольшими молекулами. За редкими
исключениями, даже единичные
макромолекулы не в состоянии преодолеть
плазматическую мембрану; ясно, что для нас
этот путь нереален. К счастью, существует
другой, более пригодный путь
проникновения в клетку, который открыт не только
для макромолекул, но и для более
крупных объектов, включая вирусы, бактерии и
фрагменты различных клеток. И связан
этот путь с эндоцитозом —
опосредованным мембранами процессом захвата
объектов.
Эндоцитоз
Для того чтобы лучше понять, что такое
эндоцитоз, нам придется вернуться в
прошлый век. Место действия — сицилийский
город Мессина, где русский зоолог Илья
Мечников, живший там в добровольной
ссылке, наблюдал в микроскоп за
прозрачной личинкой морской звезды. Как
вспоминал ученый в своих мемуарах, «семья ушла
в цирк полюбоваться выступлениями
необыкновенных обезьян». В тот момент,
когда Мечников следил за странствующей
клеткой, передвигающейся наподобие
амебы по тканям личинки, ему вдруг пришла
в голову неожиданная мысль: что, если
в каждом организме имеется группа
подвижных клеток, назначение которых
обнаруживать, преследовать, поглощать и
уничтожать непрошеных пришельцев, например
вирусы или микробы? Этот интуитивный
вывод сделал Мечникова одним из
основоположников иммунологии. С помощью
друга-эллиниста он придумал термин для
«пожирающей клетки», назвав ее фагоци
том (греч. phageln — питаться). Сам же
процесс поглощения твердой частицы,
например бактерии, стал называться
фагоцитозом, что буквально означает «клеточный
процесс поедания».
В начале 30-х гг. нашего столетия
американский биолог Уоррен Льюис
обнаружил, что клетки в состоянии поглощать
также капельки жидкости; он назвал это
явление пиноцитозом (греч. pinein — пить).
Со временем оказалось, что фагоцитоз
и пиноцитоз — проявления более общего
механизма захвата, которому дали назва
ние эндоцитоз.
Эндоцитоз может осуществляться по
разному, но неизменно зависит от плазма
тической мембраны, служащей
«перевозочным средством» для проникновения внутрь
клетки. Каким бы ни был захваченный
клеткой объект, он всегда входит в нее,
окутанный мембранозным мешком,
образованным из инвагинации (впячивания)
плазматической мембраны. Как мы уже
знаем, биомембраны характеризуются
текучестью и свойством самозамыкания. Это
поможет нам лучше понять физические
аспекты рассматриваемого явления.
Представим себе такую картину: небольшой
участок оболочки мыльного пузыря
втягивается внутрь, после чего, отделившись
от этого мыльного пузыря, образует
маленький пузырь, заключенный внутри
большого. Вопрос о том, каким образом
происходит втягивание участка оболочки и
каков его механизм, весьма сложен. Мы
ответим на него, когда окажемся внутри
клетки и увидим процесс изнутри.
Сейчас же, находясь вне клетки, мы
можем увидеть немало интересных
явлений, связанных с эндоцитозом. Наиболее
удивительной представляется роль,
которую при эндоцитозе играют поверхностные
рецепторы. Как мы отмечали в
предыдущей главе, часто за соединением
рецептора с лигандом следует их втягивание
в клетку. По сути дела основная функция
многих рецепторов в том и состоит, что
они отбирают из внеклеточной среды
материал для последующего
внутриклеточного поглощения. Этот процесс носит назва
ние эндоцитоза, опосредованного
рецепторами. Он лучше всего виден, когда в
5—1452
околоклеточную среду вводятся молекулы ляются и их края сужаются. В конце
лиганда, который специфически связывает- концов остается только отверстие не боль-
ся с определенным типом рецептора. При ше булавочной головки, но и оно вскоре
захвате молекул-лигандов соответствую- полностью исчезает, тогда как мембрана
щие занятые рецепторы быстро сходятся снова становится гладкой. По существу в
со своей «добычей» к образовавшимся в ходе этого процесса мембрана лишилась
мембране углублениям, а затем постепенно целого участка — «пэтча», который, пре-
исчезают по мере того, как ямки углуб- вратившись в закрытую везикулу, содер-
Фагоцитоз эритроцита макрофагом
мыши. Обратите внимание на
тонкий ободок цитоплазмы,
который полностью обволакивает
захваченный эритроцит.
жащую поглощенные вещества, свободно
передвигается внутри клетки. Для
обозначения везикул приняты следующие
термины: „фагосома", „пиносома", „эндосома",
,,фагоцитарная", „пиноцитарная" или ,,эн-
доцитарная вакуоль". Термин ,,эндосома"
приобрел специальное значение; им стали
обозначать «кислотную сортировочную
станцию», в которой захваченные
материалы подвергаются первичной
внутриклеточной переработке (см. с. 70).
Тенденция связанных лигандами
рецепторов группироваться в эндоцитарных
углублениях служит прекрасной
иллюстрацией способности мембранных белков
свободно передвигаться в плоскости липидного
бислоя благодаря латеральной диффузии.
Что заставляет их собираться вместе, пока
не ясно. Возможно, в некоторых случаях
это вызвано поперечным связыванием
двухвалентными или мультивалентными
лигандами. В других случаях создается
впечатление, что рецепторы вообще находятся в
постоянном движении. Независимо от того,
загружены они лигандами или нет,
рецепторы то исчезают в эндоцитарных ямках,
то непрерывным потоком появляются на
поверхности клетки, напоминая в какой-то
степени работу эскалатора или
транспортера. Как в транспортере и эскалаторе, здесь
механизм скрыт от глаз. Мы увидим его,
когда посетим цитозоль. Снаружи нам
только видна неясная структура,
напоминающая «клетку», которая находится на
дне эндоцитарной ямки; она словно
втягивает участок («пэтч») мембраны внутрь и
превращает его в вакуоль. Сделанная из
Два изображения пиноцитоза,
осуществляемого моноцитом
человека. Инвагинации
плазматической мембраны вот-вот
сомкнутся и оторвутся в виде
везикул. Обратите внимание на
пушистое «окаймление» вокруг
отпочковывающейся везикулы
на правом снимке. Окаймление
быстро исчезает после закрытия
везикул и не выявляется вокруг
пиноцитозных везикул в
цитоплазме.
Опосредованный рецепторами
зндоцитоз
A. Лиганды связываются с
рецепторами.
Б. Загруженные лигандами
рецепторы собираются в области
«окаймленных» углублений.
B. «Окаймленное» углубление
превращается в глубокую
инвагинацию.
Г. Инвагинация отделилась,
превратившись в «окаймленную»
везикулу, которая находится в
процессе сбрасывания своего
окаймления.
клатрина (см. гл. 12), эта структура на
поперечном срезе выглядит как щетинистая
оболочка. Поэтому о ямках и везикулах,
ограниченных ею, говорят, что они
«окаймлены» или покрыты щетинистой
оболочкой.
Другой тип эндоцитоза, который в
значительной степени зависит от межрецеп-
торных связей, наблюдается, когда
молекулы лиганда прикреплены к поверхности
крупного объекта, например бактерии^
Как только установлен контакт между
объектом и мембраной (путем соединения
нескольких рецепторов и лиганда), с
соседних участков поверхности клетки
подключаются дополнительные рецепторы. Их
связывание вызывает прогрессивное
обволакивание покрытого лигандами объекта
участком плазматической мембраны,
содержащим рецепторы. Таким образом,
эффект молекулярного «застегивания
молнии» индуцирует процесс поглощения.
Название «фагоцитоз» обычно употребляется
только для этого типа захвата.
Механизм, с помощью которого
антитела «клеймят» мишени для разрушения
лейкоцитами, зависит от этого процесса
(гл. 3). Антитела представляют собой
Y-образные белковые молекулы,
прикрепляющиеся к соответствующим антигенам
своим раздвоенным концом (его
называют Fab-фрагментом). Эта часть антитела
несет иммунологическую специфичность
молекулы, поэтому она различна для
каждого вида антител. «Ножка», или нижняя
часть Y-молекулы, называемая Fc-фрагмен-
том, одинакова для всех антител. А
теперь представьте себе, что микроб проник
в иммунизированный организм, где он
встретился с антителами, направленными
против некоторых компонентов его стенки.
Микроб покрывается молекулами антител,
которые присоединились к нему своими
Fab-фрагментами, а их прямые Fc-фраг-
менты торчат наружу. Оболочка из Fc-фраг-
ментов вызывает поглощение микроба
лейкоцитом, имеющим на своей мембране
специфические Fc-рецепторы и пустившим
в ход механизм поглощения типа
застежки-молнии. Первые иммунологи назвали
антитела, вызывающие фагоцитоз, опсо-
нинами (греч. opson — приправа). Опсо-
нины и в самом деле можно приравнять
к приправе, которая придает приятный
вкус пище, приготовленной для клеток-
пожирателей.
Мы сможем лучше понять роль
рецепторов эндоцитоза, когда узнаем, что
происходит с объектами, поглощенными
клеткой с их помощью. А пока необходимо
помнить, что природа и плотность
расположения рецепторов на поверхности клетки
варьируют от одного типа клеток к
другому и даже у одной и той же клетки они
различны в зависимости от ее
функционального состояния. Иными словами,
посредством поверхностных рецепторов
каждая клетка выбирает в окружающей среде
свое специфическое меню.
Захват при эндоцитозе не
ограничивается молекулами или объектами,
отобранными рецепторами. Возможно также
случайное попадание внеклеточных
компонентов, как, например, растворенных веществ
Фагоцитоз покрытого антителами
(опсонизированного) микроба,
опосредованный Fc-рецепторами
(механизм типа застежки
молнии)
в поглощенных каплях жидкости. Такой
процесс представляет собой пиноцитоз в
первичном значении этого термина.
Названный жидкофазным эндоцитозом, он
способствует захвату больших количеств
различных продуктов, поскольку клетка еже
дневно легко «выпивает» количество
жидкости, равное ее объему. Только
представьте себе человека, выпивающего в день
по 68—90 литров жидкости!
Еще больше поражает количество
мембран, перемещающихся в процессе эндоци-
тоза. В течение часа клетка в состоянии
поглощать при эндоцитозе мембрану,
площадью вдвое превышающей площадь
поверхности плазматической мембраны
клетки, включая складки и пальцевидные
выступы. Вряд ли клетки способны создать
новую мембрану с такой скоростью.
Поэтому они постоянно возвращают (ре-
циклируют) в поверхностную мембрану те
ее участки, которые они использовали при
эндоцитозе.
Рискованный старт
Теперь мы готовы отправиться внутрь
клетки. Но прежде надо соответствующим
образом одеться. По причинам, которые
нам вскоре станут понятными, мы должны
надеть на себя кислотоустойчивую и
недоступную для лизосом одежду, если хотим
избежать внезапного — и фатального —
окончания нашего путешествия.
Материалом для нашего костюма послужит
восковое вещество, экстрагированное из
клеточной стенки бацилл проказы, которое
придаёт этой бацилле удивительную ре-
зистентность к внутриклеточному
перевариванию. Поверх костюма следует надеть
плащ, имеющий на поверхности
подходящий лиганд, чтобы клетка, которую мы
планируем посетить, могла нас узнать и
впустить. Если это будет лейкоцит, то
на плаще должны находиться антитела для
Fc-рецепторов. Для других клеток может
понадобиться другая одежда — помните, что
поверхностные рецепторы варьируют от
клетки к клетке. Это значит, что мы можем
до известной степени выбрать цель нашего
путешествия, не забывая покрыть себя
соответствующим лигандом.
С учетом наших размеров (даже после
уменьшения в миллион раз мы
сопоставимы с крупной бактерией) мы должны
внедриться в клетку путем фагоцитоза
Однако мы узнаем больше, если попросим
клетку сделать исключение и поместить нас
в окаймленное углубление. Это даст нам
возможность участвовать в эндоцитозе
совместно с различными связанными с
рецепторами молекулами и испытать его
с точки зрения его жертв или объектов. Мы
знали, на что идем, тем не менее очень
неприятно, когда тебя постепенно обволакивают
складки наползающей мембраны. Но еще
тяжелее становится на душе, когда,
разорвав последнюю связь с внешним миром,
наше непрочное суденышко погружается в
глубокий мрак цитоплазмы, проплывая
мимо огромных теней, едва различимых
сквозь полупрозрачную мембрану.
Первым признаком того, что наше
поглощение клеткой завершено, является
нарастающее закисление среды внутри
нашего мембранного корабля. Ионы
водорода Н+, или протоны, ответственные за
это, проникают к нам из окружающего
цитозоля посредством энергозависимого
протонного насоса (гл. 3). Предполагается,
что насос уже размещен в углублениях
клеточной поверхности, но выбрасываемые
им протоны растворяются и уносятся
внеклеточной жидкостью. Когда же
углубления закрываются, образуя везикулы,
протоны остаются в ловушке, где они быстро
накапливаются, пока не достигают
концентрации 20 микроэквивалентов на 1 л
(рН 4,7) в отличие от концентрации
протонов в цитозоле около нейтральных
значений (0,1 микроэквивалента на 1 л, или
рН 7,0). В результате закисления
значительно снижается аффинитет многих лиган-
дов к их рецепторам, вследствие чего ли-
ганды полностью отделяются от мембраны.
По счастью, наш плащ сделан из лигандов
такого типа, и теперь мы свободно
плаваем в едкой жидкости, наполняющей
эндоцитарную вакуоль, благодаря судьбу
за кислотоустойчивое одеяние, которое
мы позаимствовали у бацилл проказы.
Немало других лигандов присоединились к
нам, но некоторые остаются
прикрепленными к своим рецепторам.
Тем временем окружающая нас
мембрана позволяет нам увидеть спектакль,
удивительно похожий на тот, что мы
наблюдали на поверхности клетки. Вновь
мы видим рецепторы — отдельные из них
заняты, но многие свободны. Они скапли-
Процесс сортировки в эндосоме
после эндоцитоза. Два типа
лигандов (желтые и голубые
точки) захватываются вместе в
ходе опосредованного рецепторами
эндоцитоза. В результате
закисления содержимого эндосомы
(показано красным) при помощи
протонного насоса желтые
лиганды отделяются от своих
рецепторов и переходят в
лизосому при слиянии эндосомы с
лизосомой. До этого участки
мембраны («пэтчи») отшепляются
от эндосомы и возвращаются к
поверхности клетки. Один «пэтч»
возвращается к месту
проникновения лигандов в клетку,
захватив некоторое количество
содержимого эндосомы
(регургитация); другой
передвигается к противоположной
стороне клетки с группой голубых
лигандов, сохранивших связь с
рецепторами, и выпускает лиганды
за пределы клетки (диацитоз, /
см. с. 73).
ваются в углубляющихся щелях и
постепенно исчезают в цитоплазме в виде
мелких уплощенных везикул; последние либо
возвращаются к клеточной поверхности,
либо направляются к структурам, которые
мы пока не в состоянии разглядеть. Вся
эта деятельность направлена на
возвращение мембраны, без чего, как мы видели,
эндоцитоз не мог бы длительно
продолжаться. Но описываемый процесс
протекает не стихийно: он предусматривает
множество высокоспециализированных
процессов сортировки и реорганизации.
Определенные рецепторы и другие
компоненты мембраны избирательно концент
рируются на удаляемых из мембраны
участках — «пэтчах» и вместе с ними
перемещаются, сопровождаемые теми
заглоченными материалами, которые
остались прикрепленными к рецепторам или
прикрепились к ним в кислой среде,
созданной протонным насосом. В это же
время к окружающей нас мембране
присоединяются участки — «пэтчи» мембран,
поступивших в составе вновь прибывших
эндоцитарных вакуолей, которые
сливаются с нашей. По существу мы находимся
в настоящей органелле, являющейся
первой станцией на пути импортируемого
клеткой материала. На этой станции
рецепторы выгружают свою добычу и
возвращаются к постам на поверхности клетки
для выполнения работы; исключение
составляет небольшое число рецепторов,
которые отправляются вместе с грузом в
глубь клетки. Эта органелла получила
название промежуточного компартмента,
или рецептосомы, или эндосомы. Последний
термин имеет обобщенное значение; он
используется для обозначения эндоцитар-
ной вакуоли (см. с. 67), название которой
в настоящее время сохранено для эндоци-
тарной сортировочной станции.
Все эти мембранные перестановки не
обходятся без некоторого «слюнотечения»,
или регургитации (заброса) жидкого
содержимого. Но в конечном итоге
разложенные на составные части вещества и
отделившиеся лиганды остаются внутри
эндосом (или возвращаются в этот ком-
партмент при новом эндоцитарном
заглатывании). Вместе с ними и мы
продолжаем наше рискованное путешествие по
цитозолю, подтягиваемые и направляемые
невидимыми нитями, частями цитоскелета,
как это станет ясно в гл. 12.
Неожиданно прямо перед нами
вырастают очертания темного неуклюжего
«дирижабля» грязно-коричневого цвета.
Столкновение неизбежно.
Сам по себе удар почти не ощущается,
но его последствия ужасающи, так как
базальная мембрана нашего суденышка
в момент столкновения соединилась с
мембраной встретившегося нам объекта и
мы оказались в чрезвычайно неприятном
Наша эндосома столкнулась и
слилась с лизосомой, выбросив
свое содержимое в сильно
коррозийную переваривающую*
жидкость. Всюду видны признаки
разрушения.
окружении. Куда бы мы ни взглянули,
всюду видны следы разрушения: разного
вида изуродованные молекулы,
бесформенные осколки, едва узнаваемые обломки
бактерий и вирусов, фрагменты
митохондрий, завитки мембран, поврежденные
рибосомы — все это находится в процессе
растворения и исчезает у нас на глазах.
Судя по всему, мы попали в какую-то
страшно едкую жидкость. Это конец пути
для всех, если не считать нескольких
особенно стойких 'существ. Это было бы и
концом нашего пути, не будь мы одеты в
защитные костюмы. На языке химии этот
выраженный и чрезвычайно неразборчивый
процесс разрушения на составные части,
свидетелями которого мы стали,
называется перевариванием, а «дирижабль»,
с которым мы столкнулись, — это
переваривающий «карман», или лизосома (ли-
тическое тело). Вся следующая глава
будет посвящена этой негостеприимной,
однако в высшей степени нужной части
клетки. Но прежде реконструируем
события, приведшие нас в лизосому.
Трюк с комнатой без дверей
За каких-нибудь несколько минут,
подобно призракам, мы просочились сквозь
несколько герметически закрытых стен —
«барьеров»: сначала из внеклеточной
среды во внутриклеточную эндосому, а затем
из эндосомы в лизосому. Одновременно мы
видели, как целые участки мембран —
«пэтчи» присоединялись к окружающей
нас тонкой структуре или отделялись от
нее, ни разу не повредив или разорвав
эту структуру. Вне всяких сомнений, это
обстоятельство озадачило бы самого
Шерлока Холмса, хотя он, по всей
вероятности, оглушил бы доктора Уотсона целой
лекцией об основных свойствах липидных
бислоев, ибо ключ к нашим перемещениям
лежит в способности мембран соединяться.
Этот феномен является физической основой
везикулярного транспорта, основного
средства массовых транспортировок через
множественные, окруженные мембранами
компартменты клетки, к изучению которых
мы приступили на этом первом маршруте
нашего путешествия.
Везикулярный транспорт зависит от
двух четко разграниченных событий,
которые на языке перевозок могут быть
описаны как слияние и разделение, в плане
содержимого — как смешивание и
отделение (разделение), а в плане механизма —
как цис- и транс-мембранные соединения
(слияния). Чтобы яснее представить себе
эти определения, присмотримся сначала
внимательнее ко второму этапу нашего
путешествия, когда эндосома соединилась
с лизосомой. Это, несомненно, было
образцом слияния, приведшего к
перемешиванию содержимого. Слияние произошло
при соединении и реорганизации мембран
двух телец, которые приблизились одно
к другому своими цитоплазматическими
поверхностями (поверхностями мембран,
находящимися в прямом контакте с
цитоплазмой). Такой тип соединения мы
будем называть ^ыс-мембранным
соединением. Этот термин удобен не только потому,
что он напоминает cyt, но и потому, что
префикс цис означает «по эту сторону»,
Различные формы везикулярного
транспорта, осуществляемые с
помощью цис- и
гранс-мембранных слияний
а транс — «по ту сторону». В
справедливости такого обозначения мы убедимся,
посмотрев на мембраны изнутри клетки.
Легко заметить, что этот тип цис-со-
единения является универсальным
механизмом: содержимое любых двух везикул,
взаимодействующих таким путем,
перемешивается. Особый вид цыс-соединения
наблюдается при слиянии цитоплазматиче-
ской везикулы с плазматической
мембраной. В этом случае содержимое везикулы
по выходе из клетки смешивается с
внешней средой. Это явление, названное экзо-
цитозом, играет важную роль при
секреции. На нем мы подробнее остановимся
в гл. 6.
А теперь рассмотрим событие,
благодаря которому мы в свое время впервые
попали в клетку, а именно закрытие эндо-
цитарной инвагинации. Это явление
представляет собой разделение — в том смысле,
что небольшой объем отделяется от
внешнего мира и изолируется от него,
превращаясь в содержимое эндосомы. Если
внимательно присмотреться к механизму
разделения, то обнаружится также
зависимость этого феномена от слияния мембран
в виде суживающихся краев, что ведет к
сближению их наружных, или транс-по-
верхностей; вновь этот механизм является
универсальным. Любая везикула,
подвергающаяся этому процессу, разделяется на
две. Так, в частности, окончательное
отделение везикул от нашей эндосомы,
которое мы наблюдали, также протекало по
принципу гранс-соединения мембран.
Вот так и раскрылся секрет комнаты
«без дверей». Все, что необходимо, чтобы
переправить груз через ряд «закрытых
стен», будь то при импорте, как только
что наблюдалось, или при экспорте (см.
гл. 6), — это чередование процессов
слияния и разделения, обеспечивающихся
соответственно цис- и граис-соединениями
мембран. «Элементарно, дорогой Уотсон».
Но так ли это? Только в чисто
описательном смысле. Мы до сих пор очень мало
знаем о том, какие силы приводят
мембраны в такое положение, при котором
становятся возможными слияние и
реорганизация липидных бислоев, и от каких
факторов зависит удивительная
специфичность этих состояний. Следует подчеркнуть,
что все процессы слияний подчиняются
строгим правилам. Цитоплазматическая
везикула не просто сливается с первым
попавшимся на ее пути объектом,
окруженным мембраной.
Везикулярньш транспорт также
представляет собой основной механизм для
передвижения мембранного материала по
клетке и через нее. Насколько известно,
фрагменты мембран—«пэтчи»—всегда
передвигаются в виде закрытых везикул, хотя
они могут быть очень плоскими и
практически лишенными содержимого. Именно
таким путем вернулся на поверхность клетки
и тот участок мембраны, что принес нас в
клетку, или возвращаются другие
аналогичные ему участки. Как мы уже видели,
подобное рециклирование является
настоятельной потребностью, обусловленной
огромным расходованием мембранного
материала при эндоцитозе. Рециклирование
мембран происходит в основном за счет
эндосом, но может продолжаться еще
некоторое время после слияния эндосом с
лизосомами. Это позволяет хрупким
рецепторам спасаться от гибели в лизосомах.
В исключительных случаях таким же
образом могут быть спасены вещества, прочно
связанные с отделяющимися фрагментами
мембраны — «пэтчами». Везикулы,
образованные таким путем, могут направляться
либо прямо к плазматической мембране и
вновь встраиваться в нее путем экзоцитоза,
либо следовать окольным путем (см. гл. 6).
Роль эндоцитоза
Вряд ли можно охарактеризовать
клетку как радушного хозяина, если иметь в
виду, что первой ее приемной для гостей
является лизосома. Но клетки и в самом
деле гостей не жалуют. Им нужно, чтобы
их кормили. Эндоцитоз—прежде всего и
больше всего механизм питания клетки
Для многих одноклеточных организмов,
таких, например, как простейшие, и низших
беспозвоночных, эндоцитоз — единственный
механизм питания. Пища, как все мы
знаем, должна поступать в желудок для
переваривания. Это и есть задача, выполняемая
при слиянии эндосом и лизосом.
Правда, чем выше по эволюционной
лестнице живых организмов мы
поднимаемся, тем меньше они нуждаются в таком
механизме питания. Клетки человека,
например, находят в крови и во внеклеточных
жидкостях достаточное количество пита
тельных мелких молекул, которые все вмес
те формируют то, что французский физиолог
Клод Бернар назвал «внутренней средой».
Таким образом, наши клетки могут скорее
позволить себе питаться при помощи
молекулярного транспорта (гл. 3), чем при
помощи поглощения (захвата) веществ.
Однако путь эндоцитоза не был отвергнут
эволюцией—просто эндоцитоз стал более
тонким, избирательным и приспособленным
к широкому кругу функций. Большинство
из них связано с процессом переваривания
в лизосомах и будет рассмотрено в
следующей главе. Вместе с тем имеются и
исключения из этого правила. Так,
большинство эндосом, формирующихся на
обращенной в просвет сосудов поверхности
выстилающих их плоских эндотелиальных
клеток, не перехватываются лизосомами. Они
мигрируют к той стороне клетки, которая
обращена к тканям, и там, сливаясь с
плазматической мембраной, выгружают свое
содержимое. В данном случае за эндоцитозом
непосредственно следует экзоцитоз, что
служит средством транспортировки
некоторых компонентов крови через клеточный
слой (пласт). Этот процесс называется диа-
цитозом (греч. dia — через) или иногда
гра«с-цитозом.
В некоторых клетках поступление
питательных веществ посредством эндоцитоза и
диацитоз происходят одновременно.
Например, клетки печени направляют часть
поглощенных ими веществ к лизосомам, а
часть—в желчные протоки. И те, и другие
вещества проникают в клетку одинаковым
путем как единое, смешанное содержимое
одной и той же вакуоли. Только после
захвата они разделяются и направляются к
соответствующим пунктам назначения при
помощи уже известного нам процесса
сортировки.
Иногда эндосомы изменяются таким
образом, что процесс их слияния с
лизосомами задерживается. В таких случаях
эндосомы служат вакуолями временного
хранения. По имеющимся данным, такие
процессы протекают в яйцеклетках некоторых
насекомых, использующих захваченные
эндоцитозом экзогенные белки для
формирования желтка. После оплодотворения
активируется слияние гранул желтка с
лизосомами и начинается процесс переработки
желтка, что необходимо для питания эм-
бриона. Мы не знаем точно, каким
способом в подобных случаях достигается
задержка слияния эндосом с лизосомами, но
известно, что этот процесс может
контролироваться изнутри эндоцитарной вакуоли.
Такой способностью обладают захваченные
в ходе эндоцитоза вещества, которые
связываются с клеточной мембраной,
например конканавалин А, — гликопротеин,
экстрагированный из плодов джекфрута.
Этим же свойством обладают некоторые
микроорганизмы, в частности
туберкулезная бацилла. Благодаря этой своей
особенности последняя способна предпринять
внутриклеточное внедрение, оставаясь и
размножаясь внутри эндосомы.
Родственная ей бацилла проказы использует иной
способ: она покрывается устойчивой к
процессу переваривания оболочкой—мы тоже
воспользовались ею—и фактически живет
и размножается в лизосомах.
Питание клетки:
лизосомы
и внутриклеточное
пищеварение
(переваривание)
Основным следствием описанных выше
процессов слияния и разделения является
возможность временного соединения и
разделения содержимого клетки между всеми
ограниченными мембранами отсеками,
которые могут вовлекаться в указанные
процессы. Термином «пространство», или
«компартмент», принято обозначать группу
отсеков, связанных подобным образом.
Лизосомальное пространство
Лизосомы, число которых в одной
клетке достигает нескольких сотен, образуют
типичное пространство. Случайному
наблюдателю это родство лизосом далеко не
всегда очевидно. Дело в том, что
разнообразие и полиморфизм — наиболее
характерные черты лизосомального компарт-
мента. Встречаются лизосомы
всевозможных форм и размеров; особым
разнообразием отличается их внутренняя структура.
Это разнообразие отражено в
морфологической терминологии. Имеется множество
терминов для обозначения частиц, которые
нам сейчас известны как лизосомы. Среди
них: плотные тельца, остаточные тельца,
миелиновые тельца, мультивезикулярные
тельца, цитосомы и цитосегресомы и
многие, многие другие. Терминология
патологических образований еще более
многочисленна, так как многие из
видоизмененных внутриклеточных включений,
наблюдаемые в пораженных тканях, также
являются лизосомами.
Однако, как только мы обратимся к
их биологической функции, выяснится, что
все они — места, где перевариваются
поступающие в клетку вещества. И тогда нам
станет понятной их структурная
гетерогенность: содержимое лизосом составляют
в основном вещества в процессе
переваривания и непереваренные остатки. Если
исследовать несколько сотен взятых наугад
желудков, то обнаружится, что их
содержимое тоже значительно варьирует в
зависимости от того, когда и что ел хозяин
того или иного желудка. Но, поняв, что
разнообразное содержимое желудка и
является его характерной чертой, можно
без особого труда определить, что
рассматриваемый орган во всех случаях идентичен.
Разнообразие его содержимого может
даже оказаться диагностическим фактором.
Аналогичное явление наблюдается и в
Концепция пространства или
компартмента. На диаграмме
видно, как три везикулы,
содержащие различные
компоненты (А, В и С), могут быть
превращены в три идентичные
везикулы, в которых компоненты
теперь перемешаны благодаря
способности структур сливаться
друг с другом за счет цис-
мембранного слияния или делиться
за счет гранс-мембранного
слияния.
Морфологическая гетерогенность
лизосом. На электронной
микрофотографии альвеолярного
макрофага кролика большая часть
цитоплазматических структур
представляет собой лизосомы.
Обратите внимание на
разнообразие размеров, формы и
внутренней структуры. Ядро в
левом верхнем углу в виде
полумесяца как бы окружает
богатый лизосомами участок
клетки, который немецкие
исследователи иногда обозначают
словом Hof (двор).
биологии клетки. Сейчас, рассматривая в
электронный микроскоп частичку,
окруженную однослойной мембраной, с
беспорядочной внутренней структурой,
исследователь знает, по предшествующему опыту,
что, по-видимому, перед ним лизосома.
С точки зрения химии переваривать
пищу означает подвергнуть ее гидролизу,
т. е. при помощи воды расщепить
различные связи, посредством которых соединены
строительные блоки естественных
природных макромолекул. В качестве примера
можно привести пептидные связи,
соединяющие аминокислоты в белках, глико-
зидные связи, соединяющие сахара в
полисахаридах, и эфирные связи между
кислотами и спиртами. По большей части эти
связи весьма устойчивы и разрываются
только при жестких условиях температуры
и значениях рН (кислая или щелочная
среда). Живые организмы не в состоянии ни
создать, ни выдержать подобные условия,
а между тем пищу они переваривают без
труда. И делают это с помощью особых
катализаторов — гидролитических
ферментов, или гидролаз, которые секретируются
в пищеварительные полости.
Гидролазы — специфические
катализаторы. Каждая из них расщепляет только
строго определенный тип химической связи.
Поскольку пища обычно состоит из многих
компонентов с разнообразными
химическими связями, для пищеварения необходимо
одновременное согласованное или
последовательное участие различных ферментов.
И действительно, пищеварительные соки,
секретируемые в желудочно-кишечный
тракт, содержат большое число различных
гидролаз, что позволяет человеческому
организму усваивать множество сложных
пищевых продуктов растительного и
животного происхождения. Однако эта
способность ограничена. Например, как уже
упоминалось в гл. 2, человеческий организм
не в состоянии переваривать целлюлозу.
Эти основные положения относятся, по
существу, и к лизосомам. В каждой лизосо-
ме мы находим целую коллекцию
различных гидролаз — идентифицировано более
50 видов, — которые в совокупности
способны полностью или почти полностью
переваривать многие из основных
природных веществ, включая белки,
полисахариды, липиды, нуклеиновые кислоты и их
комбинации и производные. Однако, как и
желудочно-кишечный тракт человека, ли
зосомы характеризуются некоторыми огра
ничениями в своей переваривающей
способности.
Хотя лизосомальные переваривающие
ферменты и влияют на многочисленные
химические связи и вещества, все они
имеют одно общее свойство: лучше всего они
работают в слегка кислой среде, имея
оптимум при кислых значениях рН между 3,5
и 5,0. Именно в силу этого в лизосомах,
как и в эндосомах, из которых они
произошли, с помощью протонного насоса
поддерживается кислая среда (см. гл. 4).
Лизосомальное пространство занимает
центральное место в структуре
(организации) клетки. По путям, приносящим в ли-
зосому вещества для переваривания, идут
материалы не только из внеклеточного
пространства, но и из самой клетки.
Продукты переваривания составляют основную
часть выносящего потока. Кроме того,
лизосомальное пространство особыми
путями связано также с подразделом клеточной
экспортной индустрии, который снабжает
его необходимыми ферментами (см. гл. 6).
Как и следовало ожидать для
ограниченного мембраной пространства, для его
связей с другими отделами используются два
транспортных средства: «проникновение»
всех веществ, способных пересечь
мембрану (при необходимости с помощью
специальных насосов или пермеаз), и
везикулярный транспорт для всех остальных
веществ.
До сих пор не ясно, каким образом
лизосомальному пространству клеток
удается избежать саморазрушения. Подобно
другим биомембранам, лизосомальная мем
брана состоит из белков и фосфолипидов,
которые в принципе могут быть переварены
ферментами лизосом. В самом деле, когда
участки мембраны отделяются в ходе ауто-
фагической сегрегации (см. с. 83), они
полностью разрушаются. В то же время,
находясь в составе лизосомальной
оболочки, они резистентны к перевариванию.
Более того, они создают на редкость прочную
броню, которая эффективно защищает
окружающую цитоплазму от разрушающе
го действия содержимого лизосомального
компартмента. Ключ к этой загадке пока
не найден. Можно только предположить,
что поверхностные компоненты, возможно
гликопротеиды, выстилающие внутреннюю
поверхность лизосомальной мембраны,
уложены таким образом, что их химические
связи становятся недосягаемыми для
гидролаз, к которым они чувствительны.
Можно также предположить, что эта особая
конформация поддерживается
метаболическими системами, расположенными в
прилегающей к лизосоме цитоплазме; она
нарушается, когда связь с цитоплазмой
прерывается.
Разумеется, такое объяснение—отнюдь
не объяснение. Оно скорее напоминает
ответ одного персонажа комедии Мольера
«Мнимый больной». Когда во время
шуточного экзамена его спросили, почему опий
действует как снотворное, будущий врач
торжественно (и по-латыни, чтобы это
звучало более научно) ответил: «Потому
что опий обладает свойством вызывать
сон, природа которого состоит в том, чтобы
вызывать отупление чувств». Право же,
мы мало чем от него отличаемся, когда
утверждаем (с такой же глубиной), что
лизосомальная мембрана резистентна к
перевариванию потому, что «выстилающая
ее поверхность имеет резистентную по
отношению к ферментам конформацию».
К сожалению, это действительно все,
что нам пока известно.
Гетерофагия
Захват и переваривание внеклеточных
материалов называется гетерофагиеи (греч.
heieros — другой). Эту способность мы
унаследовали от наших далеких однокле-
точных предков, которые первыми
научились преследовать живую добычу, убивать
ее и переваривать внутри клетки. Гетеро-
фагия представляет собой основной
механизм пищеварения у простейших
одноклеточных организмов и низших
беспозвоночных и сохраняется почти в неизменном
виде у лейкоцитов, в функцию которых
входит преследование и уничтожение
непрошеных гостей.
Однако между свободно живущими
простейшими и лейкоцитами имеется
принципиальная разница. Для простейших
одноклеточных организмов эндоцитоз — вопрос
жизни и смерти. Само их существование
зависит от ежедневного захвата бактерий.
Что же касается лейкоцитов, то они живут
в богатой жирами жидкости, полной саха-
ров, аминокислот и других мелких молекул,
которые можно использовать
непосредственно, без предварительного
переваривания. Лейкоциты в гетерофагии не
нуждаются. Наоборот, гетерофагия их убивает.
Лейкоциты созданы таким образом, что
только раз в жизни они могут наесться
вволю. Они образуются в костном мозгу,
загружаются лизосомальными гидролазами
и другим смертоносным оружием и затем
Общая схема функции лизосом.
Большое круглое тельце
представляет собой все
лизосомальное пространство.
1. Основной процесс,
происходящий в лизосомальном
пространстве, переваривание
(гидролиз) биологических
полимеров до мономеров
катализируется гидролитическими
ферментами (гидролазами), для
оптимальной активности которых
необходима кислая среда
(протоны, или ионы Hf).
2. Субстраты для переваривания
поступают в лизосомальное
пространство из внеклеточной
среды путем эндоцитоза
{трансслияние) с последующим слиянием
(^wc-слияние) эндосомы с
лизосомой, часто после
предварительной сортировки
содержимого и мембран в
эндосоме.
3. Другие субстраты поступают из
самой клетки путем
интрализосомального
почкования с последующим
отделением (^ыг-слияние)
почки.
4. Вновь образованные ферменты
передаются в лизосомы
везикулами Гольджи (цис-
слияние). Протонный насос
активно транспортирует протоны
в лизосомы благодаря энергии
АТФ (см. гл. 7).
5. Продукты переваривания
диффундируют или
транспортируются через
лизосомальную мембрану в
цитозоль. Непереваренные
вещества, не способные пройти
через мембрану подобным
образом, остаются в лизосомах
в виде остаточных продуктов.
6. Большая часть мембранного
материала, присоединенного к
лизосомальным мембранам,
удаляется путем гранс-слияния и
возвращается к поверхности
клетки либо непосредственно,
либо через аппарат Гольджи.
Небольшая часть мембран
попадает внутрь лизосом при
аутофагической сегрегации и
там переваривается. Обратите
внимание, что гра«с-поверхность
лизосомальной мембраны
резистентна к перевариванию,
пока ее цис-поверхность находится
в контакте с цитоплазмой, но
только до начала сегрегации.
отправляются на поиски врага. При
встрече с ним они пожирают столько врагов,
сколько в силах съесть, после чего
умирают, превращенные естественным отбором
в самоубийственных обжор во благо
человеческого организма. До роковой встречи
лейкоциты питаются в основном мелкими
молекулами, которые они захватывают из
окружающей среды посредством различных
транспортных систем, расположенных в их
плазматической мембране. Лейкоциты в
основном осмотрофические (греч. osmos —
толкать; trophe — пища), тогда как
свободно живущие простейшие
одноклеточные — фаготрофические.
Клетки человека и вообще клетки
большинства многоклеточных организмов в
основном осмотрофические. Для них эндоци-
тоз и лизосомальное переваривание не
имеют такого жизненного значения, как
для низших организмов — для последних
эти процессы представляют собой
единственно возможный способ получения
питательных веществ. Однако даже у высших
организмов гетерофагия выполняет
определенные пищеварительные функции, по
скольку некоторые пищевые продукты, в
частности железо или холестерин,
доставляющиеся белками, используются только
после поглощения и переработки последних.
Следует добавить, что в многоклеточных
организмах гетерофагия приспособлена к
широкому кругу функций, служащих
скорее организму в целом, а не отдельным
клеткам. С примером подобной
адаптации — иммунной защитой — мы уже
встречались у лейкоцитов. Сходная деятельность
наблюдается у макрофагов,
представляющих собой группу клеток, разбросанных
по всем тканям и характеризующихся
чрезвычайно выраженной и неразборчивой
фагоцитарной активностью. Макрофаги
также участвуют в защите организма, но
помимо этого выполняют роль основных
«чистильщиков» и «мусорщиков». Мы
находим их в легких, где они беспрестанно
чистят поверхность альвеол, подбирают
частицы пыли, сажи, смолы, поглощают
бактерии, вирусы и любые другие
вещества, принесенные вдыхаемым воздухом.
Все, что они не могут переварить,
откладывается в их лизосомах, и, когда лизосомы
наполняются, макрофаги, завершив свою
миссию, сморщиваются и умирают, а затем
с мокротой удаляются из организма.
Физиологическая адаптация
гетерофагии
A. Защита: лейкоцит захватывает
и уничтожает патогенную
бактерию.
Б. Очистка легочной альвеолы:
макрофаг поглощает частицы
пыли, микробы, вирусы и другие
инородные объекты.
B. Реконструкция кости:
остеокласт разрушает костный
матрикс на фрагменты
посредством секретируемых
кислых и лизосомальных
гидролаз, завершая разрушение
эндоцитозом и лизосомальным
перевариванием фрагментов.
Г. Образование тироксина
в щитовидной железе:
I) тироглобулин секретируется в
просвет фолликула; 2)
тироглобулин подвергается
эндоцитозу фолликулярными
клетками и переваривается в
лизосомах; 3) одним из продуктов
переработки является тироксин,
который диффундирует в
околоклеточные пространства,
откуда он поступает в кровь
и лимфу.
Д. Почечная реабсорбция: белки
и другие макромолекулы,
профильтрованные через почечный
клубочек, подвергаются эндоцитозу
в клетках проксимальных
канальцев и перевариваются
в лизосомах.
Другие клетки действуют более
избирательно и при помощи своих эндоцитар-
ных рецепторов удаляют из окружающей
среды специфические молекулы. Как
правило, функция, обеспеченная такой
активностью, есть регуляция посредством
разрушения. Например, многие гормоны
поступают в клетки путем эндоцитоза и
разрушаются в лизосомах только после
связывания с поверхностными рецепторами и
«извлечения» (запуска) внутриклеточных
эффектов. Таким образом, будучи
одновременно чувствительным прибором и «эндо-
цитарной ловушкой», рецептор как
запускает, так и лимитирует гормональную
активность.
Гетерофагия участвует также в
обновлении (см. с. 83) и перестройке
нерастворимых внеклеточных структур. Так, кости
содержат клетки, названные остеокластами
(греч. klastos — разрушенный), которые,
подобно кротам, заняты тем, что
прорывают туннели и галереи через костный
матрикс. С этой целью они секретируют
кислые и лизосомальные ферменты в
слепой конец туннеля; таким образом они
растворяют кристаллы гидроксиапатита
(комплекс фосфата кальция и гидроксида),
составляющего основную часть минералов
кости, и демонтируют каркас из коллаге-
новых волокон, формирующий
органический матрикс ткани. Весь этот процесс
завершается фагоцитозом и
внутриклеточным перевариванием обломков.
Восстановление разрушенной ткани происходит при
помощи клеток-строителей, названных
остеобластами (греч. blastos — зародыш),
которые создают новые костные элементы,
или трабекулы (уменьшительное от
латинского trabs — балка).
Иногда эндоцитоз используется для
возвращения веществ. Именно так
происходит с белками, которые просочились
через почки. Проходя через почечные
канальца, они реабсорбируются,
перерабатываются и превращаются в аминокислоты.
Удивительный пример возвращения
обнаруживается в некоторых клетках, в
частности в фибробластах, производящих
большую часть коллагена и других
компонентов соединительной ткани; На
поверхности этих клеток имеется специальный
рецептор для лизосомальных ферментов,
которые таким образом удаляются из
внеклеточной среды, где они могут причинить
вред организму, и возвращаются в лизосо-
мы, где они приносят пользу. Такие же
рецепторы встречаются и внутри клетки,
где они выполняют ключевую роль в
механизме, посредством которого вновь
синтезированные лизосомальные ферменты
переносятся к месту их назначения (см. гл. 6).
Случается даже, что гетерофагия
служит толчком к синтетической активности.
Это происходит, например, в щитовидной
железе, когда в результате переработки
тироглобулина в лизосомах образуется
гормон тироксин. Тироглобулин представляет
собой йодированный белок, образованный
клетками щитовидной железы и
выделенный ими в общий внеклеточный резервуар;
при соответствующей стимуляции он вновь
захватывается и перерабатывается этими
же клетками.
Приведенные примеры иллюстрируют
Схематическое изображение
четырех стадий аутофагии
(самопожирания)
1. Обособление путем
внутрилизосомального почкования
(впячивания) участка цитоплазмы.
2. Сегрегация путем цис-слияния.
3. Переваривание.
4. Очищение.
Размеры сегрегированного
материала позволяют отличить
макроаутофагию от
микроаутофагии. В результате
множественных
микроаутофагических изменений
образуются мультивезикулярные
тельца.
ft—1452
удивительное функциональное
разнообразие гетерофагии. Возникнув изначально в
качестве мощных помощников в процессе
питания, лизосомы в ходе эволюции
приобрели чрезвычайно ценное свойство, на
основании которого были созданы
бесчисленные функциональные варианты. Но это
только одна сторона медали.
Аутофагия
Помимо гетерофагии клетки
занимаются и аутофагией, иными словами,
«поедают» и переваривают небольшие кусочки
своего собственного вещества (греч.
autos — сам). Это происходит не только
тогда, когда они лишены пищи и
вынуждены обходиться собственными ресурсами,
но и тогда, когда в изобилии снабжаются
питательными веществами. Удивительна
скорость этого саморазрушения. Обычной
клетке печени, например, требуется меньше
недели для разрушения большей части
своего содержимого.
О том, что такой процесс происходит,
трудно предположить, даже изучая клетку
с помощью тончайших морфологических
и химических методов. Клетка печени
может жить в течение многих лет, и все это
время ее структура и химический состав
мало изменяются. Интенсивный
молекулярный обмен, происходящий за этим внешне
неизменным фасадом, обнаружился только
тогда, когда в распоряжении
исследователей появились изотопы и с их помощью
удалось отличить химически идентичные
молекулы друг от друга. Тогда и
обнаружилось, что клетки постоянно разрушают
и восстанавливают свои составные части
с удивительной быстротой. Клетки
напоминают те старые дома, которые на первый
взгляд кажутся такими же, какими они были
в момент их строительства, хотя на самом
деле их столько раз ремонтировали, что
от первоначальных оконных рам, черепицы
или даже кирпичей и досок почти ничего
не сохранилось. Но процесс, который для
дома может длиться столетиями,
укладывается в дни для живой клетки.
Кругооборот (turnover), как назван
этот процесс молекулярного обновления,
представляет собой тонко
отрегулированный процесс. Каждая составная часть
клетки имеет свою собственную
характерную среднюю продолжительность жизни.
Молекулы белка, например, в зависимости
от их структуры живут от нескольких часов
до*нескольких дней. Из этого следует, что
для каждого вида белка существуют
'специфичные скорости синтеза и распада и,
чтобы клетка оставалась неповрежденной,
они должны быть идеально
сбалансированы. То же характерно и для
большинства других клеточных компонентов, за
исключением ДНК, которая полностью не
заменяется, хотя и подвергается местным
повреждениям и восстановлениям.
Для разрушения своих собственных
составных частей клетки нуждаются в
процессах переваривания в такой же степени,
как и при разрушении экзогенных веществ
аналогичной сложной природы. В
обеспечении переваривающей активности клетки
принимают участие несколько различных
систем. Среди них лизосомы, которые
служат своеобразной «свалкой» и местом
для удаления множества внутриклеточных
материалов, главным образом крупных
объектов, таких, как целые участки цито-
Аутофагическая вакуоль.
Электронная микрофотография
тонкого среза ткани печени крысы
после инъекции гормона
глюкагона, стимулирующего
аутофагию. Аутофагическая
вакуоль, расположенная в
верхней части», содержит две
митохондрии (М) и
эндоплазматический ретикулум
(ЭР). Вблизи наружной мембраны
аутофагической вакуоли видны
остатки другой мембраны. Сразу
под этой вакуолью находится
вторая аутофагическая вакуоль,
содержащая митохондрию. Эта
вакуоль,по-видимому, слилась с
лизосомой (Л), определяемой по
ее плотному полиморфному
содержимому.
плазмы, митохондрии, кластеры рибосом
и фрагменты мембран, отделившиеся от
эндоплазматического ретикулума. Эти
объекты проникают в лизосомальный ком-
партмент, пользуясь одним из трюков
«с закрытой комнатой» (гл. 4), что по
существу аналогично механизму отделения
цитоплазматических почек от клеток. При
почковании участок цитоплазмы,
выступающий из клетки, отделяется от нее в
результате прогрессирующего сужения и
окончательного отделения соединяющего
их мостика посредством ^wc-мембранного
слияния. Возможно, похожий механизм
воздействует на каплю цитоплазмы,
которая вдается в просвет лизосомы; в итоге
почка отделяется в просвет лизосомаль-
ного компартмента, становясь Жертвой
клеточной аутофагии. Множественные
аналогичные события приводят к
образованию характерных структур, описанных
морфологами как мультивезикулярные
тельца.
На ранних стадиях после
аутофагической сегрегации пойманные в ловушку
цитоплазматические объекты, находясь
внутри мембранного заточения, еще могут
быть идентифицированы. Вначале они
окружены двумя мембранами, что
соответствует только что описанному
механизму почкования. Затем мембрана,
окружающая изолированную почку,
разрушается. По мере переваривания
содержимое почки становится неузнаваемым.
Термином «аутофагическая вакуоль» принято
обозначать все структуры, которые можно
идентифицировать по наличию
вышеописанных характерных черт, возникающих
при аутофагии. Показано, что помимо
лизосом в начальном механизме
сегрегации могут участвовать другие меморан-
ные структуры. Возникающие таким
образом аутофагические вакуоли вначале могут
не содержать пищеварительных ферментов;
они приобретают их при последующем
слиянии с лизосомами.
Сталкиваясь с объемом
саморазрушения, происходящего в живой клетке,
интересно бы понять, каковы выгоды столь
дорогостоящей активности. Вероятно, в
своей примитивной форме аутофагия, как
и гетерофагия, служила для обеспечения
пищеварительной функции: она
обеспечивала выживание организма при
голодании и эволюционировала в высокоэффек-
тивный процесс, в ходе которого
клеточные компоненты разрушались по мере
уменьшения потребности в них. Благодаря
аутофагии клетка длительное время может
существовать без пищи. Она прогрессивно
использует собственные вещества, но так
разумно, что остается организованной и
способной функционировать в течение
длительного времени. Это также .справедливо
и для организмов. Узники гитлеровских
лагерей смерти, превратившиеся в
ходячие скелеты, выжили за счет
расходования белков из второстепенных для орга-
Два вида кринофагии. Две
электронные микрофотографии
иллюстрируют кринофагию в
гормонсекретирующих клетках
гипофиза. Слева показана плотная
секреторная гранула, только что
слившаяся с мультивезикулярным
тельцем, по-видимому лизосомой.
Справа внутри
мультивезикулярного тельца и
плотного тельца обнаруживается
секреторный продукт. Обратите
внимание, что мембрана
секреторной гранулы не проникла
внутрь, а встроена в
лизосомальную мембрану
(цис-слитше). Эта черта отличает
кринофагию от аутофагии.
низма мышц, чтобы снабжать
питательными веществами жизненно важные
органы — сердце, мозг и кровь. Многие из них
поправились на удивление быстро, как
только вновь получили питательные
вещества, нужные для восстановления
тканей.
Аутофагия остается первичным
клеточным ответом при недостатке пищи у
большинства современных живых организмов,
включая высших животных, у которых
она может быть также стимулирована
гормонами, в частности глюкагоном,
активирующим мобилизацию резервов
организма. Но, очевидно, самоподдержание
едва ли объясняет непрерывный и
интенсивный обмен составных частей клетки,
которые отменно питаются большую часть
времени. Основные преимущества,
получаемые клетками от аутофагии,
заключаются в их омоложении и адаптивности.
Благодаря кругообороту клетки
постоянно замещают свои составные части на
аналогичные новые и таким образом
достигают своеобразной «вечной молодости».
Возьмем к примеру клетки мозга
пожилого человека. Эти клетки работали в течение
десятилетий, однако ббльшая часть их
митохондрий, рибосом, мембран и других
Поврежденные внеклеточные структуры
Эволюционная дилемма: что
делать с остатками лизосом в
многоклеточных организмах?
Если остатки удаляются тем же
путем, как это происходит в
одноклеточных организмах, то
вышедшие ферменты могут
повредить внеклеточные структуры.
Если же остатки хранятся в
лизосомах, то это может повлечь
за собой перегрузку лизосом.
Между этими двумя бедствиями
эволюция выбрала второе как
менее пагубное, о чем
свидетельствует состояние
«хронического запора» у
большинства клеток.
органелл не старше одномесячного
возраста. За все годы своего существования
клетки разрушали и обновляли
составляющие их молекулы сотни, тысячи, а
некоторые даже свыше 100 000 раз. Однако
происходившие события оставляют
некоторый след в виде нарастающего
накопления в лизосомах бурых непереваренных
остатков. Этот так называемый пигмент
старения, или липофусцин, выдает возраст
клетки. Возможно, это один из недостатков
работы клетки (результат не совсем
идеальной работы лизосом), что в
конечном итоге лишает ее способности
оставаться вечно юной, — если, как
предполагают, перегрузка лизосом связана с
процессом старения клетки (см. ниже).
Вторым важным преимуществом ауто-
фагии следует считать адаптивность.
Разрушенная часть клетки может быть
замещена не только идентичной, но в случае
необходимости другой, более подходящей
для данного момента. Одни изменения
возникают на какое-то время в ответ на
те или иные изменения окружающей среды;
другие являются частью фундаментального
процесса дифференцировки и развития
клетки.
В клетках желез наблюдается особый
вид аутофагии, так называемая крино-
фагия (греч. krinein — просеивать или
отделять, в переносном смысле — секрети-
ровать). Кринофагия осуществляется
путем прямого слияния секреторных гранул
с лизосомами (^мс-слияние) и приводит
к разрушению секреторного материала.
Она представляет собой важный регуля-
торный механизм (см. следующую главу).
Очищение лизосом
В кишечнике конечные продукты
пищеварения (переваривания) «очищаются» в
результате кишечной абсорбции: они
удаляются клетками слизистой, обычно при
помощи активных насосов, и попадают в
кровеносное русло. Нечто подобное
происходит и в лизосомах. Различные мелкие
молекулы, образовавшиеся в процессе
переваривания, диффундируют или переносятся
через лизосомальную мембрану в
цитоплазму, где их используют метаболические
системы клетки. Вполне вероятно, что
очищение лизосом происходит не без участия
специальных систем переносчиков,
расположенных в мембране, но они пока не
охарактеризованы.
Но что случается, если переваривания
не происходит или оно неполное и не
достигает той стадии, на которой его продукты
могут быть очищены? Что, к примеру,
происходит, если клетки захватывают
устойчивый к перевариванию материал или
если они страдают какой-либо
недостаточностью пищеварения?
У большинства простейших организмов
и низших беспозвоночных подобные
ситуации не вызывают особых последствий, так
как их клетки обладают способностью
избавляться от содержимого своих старых лизо-
сом, попросту выбрасывая его в
окружающую среду. Этот процесс, образно
названный клеточной «дефекацией» (очищением),
зависит от экзоцитоза. У высших животных
многие клетки, вернее большая их часть,
по-видимому, неспособны опорожнять свои
лизосомы таким образом. Они, так сказать,
находятся в состоянии хронического
«запора». Как мы увидим дальше, именно этот
серьезный недостаток лежит в основе
многочисленных патологических состояний,
связанных с перегрузкой лизосом.
Альтернатива, к сожалению, столь же плоха, а
возможно даже хуже, что следует из
патологии: выброс содержимого лизосомы в
окружающие ткани вызывает значительное
повреждение внеклеточных структур
ферментами лизосом, которые выходят вместе
с непереваренными остатками. Можно
предположить, что описанное клеточное
опорожнение подавлялось в ходе
естественного отбора, в результате чего
эволюция развивалась в направлении все
большей многоклеточной организации.
Снабжение лизосом
ферментами
Лизосомальные гидролазы, как и все
ферменты, представляют собой белки.
Следовательно, они сами повторяют путь всех
других белков, проникающих в лизосомы,
и должны быть переварены
соответствующими протеолитическими ферментами. Тот
факт, что они выполняют свою работу
должным образом, свидетельствует о
медленном процессе протеолитического
переваривания. Это не должно нас удивлять, ибо
без устойчивых к перевариванию
ферментов не могли бы существовать и сами
лизосомы. Что же касается природы этой
устойчивости, то, судя по всему, в ее
основе лежит способность ферментов
сохраняться в плотно упакованной форме- в
кислой среде, преобладающей в их
естественной среде обитания. Как правило,
белковая нить должна быть хотя бы
частично расплетена, или денатурирована
(гл. 2), чтобы стать доступной для протео-
литических ферментов. Многие белки
денатурируются в кислой среде. Очевидно,
лизосомальные ферменты представляют
собой исключение, чем и объясняется их
жизнеспособность в лизосомальной среде.
Они, разумеется, не вечны и должны
замещаться по мере разрушения. Чтобы
выяснить, как именно происходит такое
замещение, мы должны проникнуть в
другой отдел клетки, ее экспортный компарт-
мент, одной из функций которого является
производство лизосомальных ферментов.
Это мы сделаем в следующей главе, а
сейчас нам остается только наблюдать
конечную стадию доставки ферментов в лизо-
сому. Как и следовало ожидать, вновь
образованные ферменты прибывают в
мембранной упаковке и проникают в лизо-
сомальное пространство посредством
слияния мембран (^ыс-слияние). Такие свежие
упаковки ферментов называют первичными,
или девственными, лизосомами в отличие
от активно переваривающих вторичных
лизосом.
Пищеварительные
расстройства клетки
Диспепсия, повышенная кислотность,
запор и другие расстройства
пищеварения — удел всего человечества, источник
малоприятного состояния дискомфорта
страдающих этим людей, а также весьма
прибыльной индустрии по производству
обезболивающих препаратов. И все же эти
неприятности — ничто по сравнению с
болезнями пищеварения, поражающими
клетки. Сейчас, когда исследователи-медики
Пример генетической болезни
накопления в лизосомах: болезнь
накопления гликогена типа II,
или болезнь Помпа. Из-за
генетической недостаточности
лизосомальной гидролазы, в норме
ответственной за переваривание
крахмалоподобного
полисахаридного гликогена,
проникающего в лизосомы путем
аутофагии, этот материал
накапливается в лизосомах. На
приводимых электронных
микрофотографиях фрагмента
печени ребенка, умершего от
этого заболевания, видны частицы
гликогена, характеризующиеся
высокой плотностью и звездчатой
структурой. Вверху показана
ранняя стадия включения
гликогена в плотные лизосомы,
внизу — полностью заполненная
гликогеном разбухшая лизосома.
перешли на субклеточный и молекулярный расстройства, поражающего определенные
уровни изучения, обнаружилось, что очень клетки.
многие болезни — не что иное, как прояв- Как мы уже имели возможность убе-
ления того или иного пищеварительного диться, большинство наших клеток страда-
ет от «запора», который нельзя
рассматривать как болезнь, ибо это естественное
состояние клетки. Вместе с тем это и
серьезный недостаток, делающий наши лизо-
сомы весьма уязвимыми из-за риска
оказаться перегруженными непереваренными
веществами. Наиболее драматические
примеры перегрузки лизосом можно увидеть
у детей, страдающих генетическим
дефицитом какого-то лизосомального фермента.
В настоящее время известно более 25
таких дефицитов. Они составляют группу
генетических болезней накопления (хранения),
примером которых может быть хорошо
изученная болезнь Тея — Сакса1. При
каждой из них наблюдается выраженный
дефицит лизосомального фермента. В
результате лизосомы переполняются
веществами, которые не могут быть переварены
из-за отсутствия соответствующего
фермента; они постепенно разбухают и
достигают огромных размеров, в итоге приводя
к смерти клетки. К счастью, такие болезни
накопления в лизосомах встречаются
редко, но они причиняют большие страдания:
больные дети часто страдают выраженной
задержкой умственного развития и
умирают в раннем возрасте.
Помимо генетических дефектов
перегрузку лизосом могут вызывать и многие
другие причины. Она наблюдается при
артериосклерозе, встречается как серьезное
осложнение при некоторых болезнях почек
и может быть вызвана лекарственными
препаратами. Чем больше мы узнаем об
этом, тем очевиднее становится, что
перегрузка лизосом является наиболее частой
клеточной патологией, лежащей в основе
многочисленных болезней. В какой-то
степени этот процесс универсален и
неизбежно сопровождает старение, ибо не
существует иного пути, по которому могла бы
пойти клетка, чтобы полностью избежать
попадания в лизосомальный компартмент
неперевариваемой молекулы. Попав в лизо-
сому, молекула не может выйти из нее
снова. Следовательно, со временем
лизосомы наполняются остатками молекул.
При некоторых патологических
состояниях силы, которые предотвращают
внеклеточный выход содержимого лизосом, разру-
Амавротическая идиотия, вызванная пол
ным отсутствием в клетках фермента гексозо
аминидазм А. Прим. ред.
шаются. Такое может случиться, например,
при попытке клетки поглотить очень
крупные объекты (например, агрегаты
антиген — антитело) или плоскую поверхность,
как, например, безальную мембрану,
случайно покрытую (гл. 4) аутоантителами
(антитела против эндогенных составных
компонентов). Открытые эндоцитарные
инвагинации (впячивания) сливаются с лизо-
сомами, что позволяет содержимому
лизосом вытекать во внеклеточное
пространство. В результате описываемого
патологического процесса развивается тяжелейшая
эрозия внеклеточных структур, которая
наблюдается при ревматоидном артрите и
некоторых других аутоиммунных болезнях.
Этот факт свидетельствует о том, что
клеточный «запор», несмотря на многие его
недостатки, необходим.
Другой часто наблюдаемый лизосо
мальный синдром развивается при
некоторых повреждениях лизосомальной
мембраны. Все еще не понятно, какое волшебство
делает мембрану лизосом устойчивой к
перевариванию. Если же лизосомальная
мембрана все-таки «сдается», то
расположенная рядом с лизосомой цитоплазма
подвергается ферментативной атаке. В
результате могут развиться выраженные
повреждения клетки вплоть до ее смерти.
Подагра, асбестоз и силикоз (болезнь
«черных» легких у шахтеров) — примеры
состояний, при которых, по-видимому,
происходят подобные повреждения.
И наконец, несколько слов о роли
лизосом в развитии некоторых инфекций. В
какой-то степени большинство интенсивно
протекающих инфекций можно
рассматривать как результат нарушения
лизосомальной защиты. Иначе говоря, микроорганизм
становится патогенным, если он способен
избежать разрушения в лизосомах. В этом
отношении наши бактериальные враги
обладают удивительной
изобретательностью. Достаточно незначительного
промаха нашей иммунной системы, не дающей
сигнала тревоги, и микроорганизм, не
будучи покрытым антителами, ускользает от
фагоцитоза. Другие микроорганизмы
подавляют слияние эндосом с лизосомами
(вспомните туберкулезную бациллу) или,
подобно возбудителю лепры, устойчивы к
лизосомальному разрушению. Третьи
ускользают от разрушения, разрывая
мембрану эндосом или лизосом при помощи
Внутриклеточный
выброс
Патология пищеварения клеток,
три основных лизосомальных
синдрома.
Перегрузка
Внеклеточный выброс
экзотоксина (секретируемого токсического
вещества). Наиболее вероломные
микроорганизмы «позволяют» себя убить и затем
осуществляют «посмертное мщение»,
отравляя организм эндотоксином
(токсическим веществом эндогенного
происхождения), который образуется в результате
переваривания в лизосомах их клеточной
стенки.
Направление
лекарственных веществ
в лизосомы
Существует много причин для
целенаправленного введения лекарственных
веществ в лизосомы. Наиболее очевидная —
исправление некоторых местных
расстройств, многие из которых, как мы только
что видели, имеют разное происхождение.
Но в других случаях лизосомы
используются не столько как мишени, сколько как
средство терапевтического вмешательства.
Большая группа веществ — среди них
многие лекарственные препараты, а также ряд
красителей, в частности нейтральный
красный — спонтанно направляется в
лизосомы, где происходит очень быстрое их
накопление до концентрации, в несколько
сотен раз превышающей их концентрацию
в других частях клетки. Все эти вещества,
называемые лизосомотропными,
представляют собой слабые основания; они легко
проходят сквозь мембраны, включая лизо-
сомальную, в непротонированной,
незаряженной и соответственно липофильной
форме. Под влиянием кислой среды лизосом
эти вещества получают протоны и
приобретают один-два положительных заряда,
которые не позволяют им пересечь
мембрану в обратном направлении.
Этот феномен протонной ловушки не
ограничивается лизосомами. Он встречается
в эндосомах и в других структурах
(некоторые отделы комплекса Гольджи?),
сохраняя кислую среду за счет работы
протонного насоса, и лежит в основе ряда
интересных явлений. Наиболее эффектным
является прижизненное (витальное)
окрашивание, при котором все эндосомо-лизосо-
мальное пространство светится подобно
Лизосомы и инфекция. Диаграмма
иллюстрирует некоторые
механизмы, посредством которых
патогенные микроорганизмы
ускользают, ингибируют или
сопротивляются деструктивному
воздействию лизосом либо,
напротив, превращают эти
механизмы защиты в средство,
вызывающее локальное или
системное повреждения.
созвездию ярких звезд. Известный более
сотни лет, этот феномен лишь недавно
получил объяснение. Другим примером
лизосомотропизма может служить
вакуолизация клеток, возникающая в результате
осмотического набухания захваченных
структур. Кроме того, многие лизосомо-
тропные вещества препятствуют
перевариванию в лизосомах, нейтрализуя местную
кислотность, а иногда также подавляя
одну или более гидролаз. Такие механизмы
лежат в основе ряда токсических эффектов
и терапевтических воздействий. Интересным
примером может служить антималярийный
препарат хлороквин, являющийся
выраженным ли*зосомотропным веществом и
накапливающийся, как полагают, в
лизосомах малярийного плазмодия; в них-то
он и блокирует переваривание
гемоглобина — единственного источника питания
плазмодия, живущего в эритроцитах.
Другой путь проникновения в
лизосомы — эндоцитоз. Этот способ сулит
особенно обнадеживающие перспективы
благодаря своей избирательности.
Проникновение в клетку путем эндоцитоза
регулируется поверхностными рецепторами,
которые варьируют от одного клеточного типа
к другому. Теперь, когда нам кое-что
Лизосотиотропизм слабых
оснований по механизму
протонной ловушки. Проникающая
непротонированная форма В
превращается в лизосоме в
непроникающую протонированную
форму ВН+. Вода поступает по
осмотическому градиенту.
Источником энергии для этого
процесса служит АТФ, который
расходуется на работу протонного
насоса, переносящего протоны в
лизосому.
Лизосомотропизм путем эндоцитоза
и его использование для доставки
лекарственных веществ к
специфическим мишеням. Комплекс
лекарственное вещество —
переносчик избирательно
захватывается клетками,
имеющими рецепторы для
переносчика на поверхности
клетки-мишени. В лизосомах
лекарственное вещество отделяется
от переносчика под влиянием
фермента и переносится к его
мишени, например к ядру.
Последствие лизосомотропизма
иллюстрируется вакуолизацией.
Изображенный на
микрофотографии фибробласт
вакуолизирован при обработке
хлороквином.
известно о происходящих в лизосомах
процессах, мы можем добавить новую
страницу к нашему рассказу.
Предположим, мы хотим направить лекарство
избирательно к определенному типу клеток —
например раковой клетке или патогенному
паразиту. Если выбранная нами мишень
имеет рецепторы, которых нет или они
менее выражены на клетках, которые мы
намерены защитить, то осложнений но
предвидится. Все, что надо сделать, это
прикрепить лекарство к переносчику,
который распознается этими рецепторами,
причем использовать такую химическую связь,
которая расщепляется внутри лизосом.
И хотя для этого требуются некоторые
дополнительные условия, по существу
перед нами концепция, вселяющая надежду,
что в будущем в руках ученых могут
появиться «волшебные пули».
Значение биодеградации
Большинство исследователей живого
преисполнены глубокого восхищения
биосинтезом, этой удивительной способностью
живых организмов, включая даже
простейших бактерий, производить сотни
специфических веществ, многие из которых
настолько сложны, что даже современная
наиболее сложная химическая технология
не в состоянии их воспроизвести. В
противовес биосинтезу биодеградация видится
как естественный и неминуемый «путь
всего живого>, рок, постоянно угрожающий
«чудотворно хрупкой» фабрике
цитоплазмы; она представляется скорее как угроза
жизни, нежели жизненная функция.
В самом деле, биосинтез представляет
собой поистине замечательное явление, и
значительную часть нашего путешествия
мы посвятим рассмотрению его ключевых
энергетических и информационных
аспектов. Однако биодеградация, будучи
значительно проще биосинтеза, как теперь
начинает выясняться, не менее важна. Не
появись соответствующие гидролазы
приблизительно в тот же период, что и первые
белки, нуклеиновые кислоты, полисахариды
и другие биополимеры, не было бы
биосферы, а существовала бы только «пласто-
сфера». Не было бы ни адаптации, ни
дифференцйровки, ни эволюции, ни самой
жизни. «Фабрика жизни» на самом деле
отнюдь не хрупкая. Она в значительной
степени образована очень прочными
молекулами, которые при нормальных условиях
не менее прочны, чем полистирол или поли-
винилхлорид. Переваривание, как мы уже
видели, происходит только в присутствии
соответствующих катализаторов.
Следовательно, биодеградация —
незаменимый, жизненно необходимый процесс.
Между тем по самой своей природе она
одновременно и угрожает жизни. Столь
узкую тропинку между жизнью и смертью
нельзя вверять случайному процессу.
И действительно, биодеградация
представляет собой четко контролируемую
активность, охраняемую искусной сетью
защитной обороны. Таков урок, который мы
выносим после посещения этого
пленительного лизосомального компартмента,
позволяющего каким-то образом снабдить
грубый и неразборчивый распад веществ
необходимым разделением и провести его в
удивительно безопасных условиях. А
теперь мы должны найти выход из лизосом.
Бегство из лизосом
Еще каких-нибудь несколько лет назад
никто в здравом уме не отважился бы
войти в клетку путем эндоцитоза, не
заручившись твердой гарантией, что лизосо-
мальный компартмент можно обойти. Ибо,
перефразируя знаменитое дантевское
изречение, нужно было «оставить надежду
всякому, туда входящему» — во всяком
случае в это верили. Даже если бы вам
удалось вырваться обожженным кислотой
или разрезанным на куски гидролазами, вы
навсегда остались бы узниками «мембра-
нозной тюрьмы», бесконечно
перегоняемыми из одного отсека в другой капризной
игрой цис- и rpawc-слияний. Об этом
свидетельствует бесчисленное множество
достоверных примеров, включая целый ряд
патологических состояний, связанных с
перегрузкой лизосом.
Однако, как мы теперь знаем, такая
точка зрения не вполне справедлива.
Из лизосом существует выход, причем не
один, а несколько, связанных с различными
внутриклеточными путями, ведущими либо
к плазматической мембране, либо к
аппарату Гольджи. Все, что необходимо
сделать, — это схватиться за подходящий
участок мембраны («пэтч»), который
вскоре отделится и вытащит нас из
лизосомального пространства. Трудность,
вероятно, состоит в том, чтобы крепко держаться
за мембрану в лизосомальной среде.
Многие вещества, которые связываются с
рецепторами плазматической мембраны,
отщепляются под влиянием кислой среды в
лизосомах или ферментативной обработки.
Содержимое лизосом губительно
сказывается даже на некоторых рецепторах,
которые в результате разрушаются. Таким
образом, к тому моменту, когда участок
мембраны отделяется от лизосомальной
мембраны для возвращения на периферию
клетки, он передвигается «голым», с
гладкой поверхностью. По крайней мере так мы
интерпретируем тот факт, что столь мало
удаляется из лизосом, несмотря на
непрерывное рециклирование окружающих их
мембран. Мы должны допустить далее, что
мембранные участки («пэтчи»)
передвигаются в такой форме — возможно, в виде
очень мелких везикул, — что для
транспортировки жидкости остается лишь
небольшое пространство. Это обстоятельство
может осложнить наше бегство из
лизосом. Но мы все-таки рискнем.
Проследовав за мембраной весь путь
до поверхности клетки, мы снова вернемся
туда, откуда начали свой маршрут. Однако
некоторые рециклирующие мембраны
перемещаются окольным путем и
останавливаются в аппарате Гольджи, возможно,
чтобы, воспользовавшись случаем,
восстановить повреждение мембраны, полученное
при прохождении через лизосомальный
компартмент. Кроме того, существует
прямой челнок лизосома — аппарат Гольджи,
доставляющий свежие ферменты из
аппарата Гольджи в лизосомы. Воспользуемся
этим средством, которое «рекламируется»
специфическими рецепторами для лизосо-
мальных ферментов на перемещающихся
участках («пэтчах») мембран. Это
позволит нам добраться вполне удобно, если не
комфортабельно, к нашему следующему
объекту: экспортному департменту
(отсеку) клетки.
Экспортная
индустрия клетки:
эндо плазматический
ретикулум,
аппарат Гольджи
и секреция
Живые клетки производят все виды
экспортных материалов; они их собирают,
дорабатывают, упаковывают и
транспортируют в виде цепочки взаимосвязанных
ограниченных мембраной образований,
которые в конце концов выгружают путем
экзоцитоза. Эти вещества в основном
состоят из белков или углеводов, часто
соединенных в виде гликопротеинов или
протеогликанов. Они составляют весьма
обширный каталог.
Каталог веществ
Сначала мы обнаруживаем множество
веществ, образованных для экспорта на
небольшие расстояния и используемых
клетками для организации или очистки
непосредственного окружения.
Перегородки, волокна, матриксы и все остальные
компоненты каркаса, удерживающего
клетки вместе и придающего тканям и органам
их характерную архитектуру, собираются
из растворимых предшественников, таких,
как проколлаген (гл. 2), которые
образуются и разгружаются на месте. Ферменты,
разрезающие и соединяющие эти
строительные блоки, также образуются и секре-
тируются на месте благодаря экспортному
аппарату клеток. «Специалистами» такой
конструкторской работы по праву следует
назвать остеобласты, создающие каркас
кости, хондробласты, формирующие мат-
рикс хряща, и фибробласты, образующие
волокна соединительной ткани.
Как правило, в живом мире созидание
предусматривает и разрушение. Этот
процесс происходит внеклеточно при помощи
литических ферментов, которые также
являются продуктами клеточного экспорта.
Рисунок, показывающий, как
различные продукты,
произведенные экспортным
аппаратом клетки, выгружаются
путем экзоцитоза: в
околоклеточные пространства
(строительные блоки и ферменты
доработки внеклеточных
структур) (А); в лизосомы
(кислые гидролазы) (Б); в
кровяное русло (белки плазмы,
иммуноглобулины, секреты
эндокринных желез) (В); в
секреторный проток (экзокринная
секреция) (Г). Не все клетки
производят все виды продуктов,
но большинство производят более
одного продукта и поэтому
нуждаются в диспетчерской или
сортировочной системе.
С точки зрения отдельных клеток литиче-
ские ферменты выступают в качестве
средства инвазии (вторжения); они разрезают
внеклеточные структуры и расчищают пути
для продвижения клеток. Без такой
секреции лейкоцит, выведший нас из кровяного
русла, не смог бы прорваться через ба-
зальную мембрану капилляра. Раковые
клетки, вероятно, осуществляют
характерную для них инвазивность благодаря особо
агрессивной активности подобного рода.
Но такие же средства разрушения весьма
полезны также оседлым клеточным
сообществам, поскольку они наделяют их спо-
собностью очищать, восстанавливать и
переделывать свою среду обитания.
Все клетки стремятся, образно говоря,
очистить свои «пороги», но
специализированные клетки делают разрушение
внеклеточных структур основным занятием всей
своей жизни. Мы уже встречали
остеокласты, которые прорывают себе путь через
костный матрикс с помощью смеси лизо-
сомальных гидролаз (гл. 5). Фибробласты,
как ни удивительно, также выступают в
виде «фиброкластов». При
соответствующей стимуляции они выделяют мощную
коллагеназу, специфически разрезающую
коллагеновые волокна, и специфическую
протеазу, воздействующую на структурные
протеогликаны (гл. 2). Такая секреция
физиологически очень важна, но
одновременно в ней таятся серьезные
патологические опасности, как мы наблюдали в
случае перегрузки лизосом (гл. 5).
Другой крупный отсек клеточной экс^
портной индустрии связан с производством
материалов, предназначенных для
перевозки на значительные расстояния. Клетки,
осуществляющие этот вид работы, обычно
объединяются в специальные органы,
именуемые железами, которые разделяются на
две группы. В экзокринных железах
секреторные продукты собираются в протоках
и по ним переправляются к специфическим
пунктам назначения. В отличие от них
в эндокринных, или беспротоковых,
железах продукты секреции выделяются в
околоклеточные пространства, из которых они
по кровеносным сосудам распространяются
по всему организму.
Наиболее изученные секреты экзокрин
ных желея, такие, как слюна или
панкреатический сок (секрет поджелудочной
железы), снабжают ферментами органы
желудочно-кишечного тракта. Но существует
и множество других желез. Железы
располагаются в коже, в веках, в слуховых
проходах, в половых путях и во многих
других областях человеческого организма.
Вырабатываемые в них продукты служат
для смазки, защиты, водонепроницаемости,
обеззараживания, создания «запаха» и
химической связи, а также для
переваривания.
Наиболее важными секретами
эндокринных желез являются гормоны. Но
среди них необходимо различать
полипептидные гормоны (такие, как инсулин или гор
моны гипофиза; они производятся и транс
мортируются в структурах, которые мы
собираемся вскоре посетить) и ряд других
химических переносчиков-посредников —
небольших молекул, включая тироксин,
эпинефрин, ацетилхолин и половые
гормоны (стероиды), которые либо
диффундируют из клетки через плазматическую
мембрану, либо высвобождаются,
пользуясь особыми приспособлениями, которые
мы не сможем рассмотреть в нашем
путешествии.
Отдельная группа продуктов клеточного
экспорта представлена белками плазмы
крови; многие из них синтезируются в
печени, за исключением антител,
синтезируемых в плазматических клетках,
образованных из В-лимфоцитов (гл. 3).
И наконец, существуют лизосомальные
ферменты. Терминологически они не
заслуживают названия «экспортные продукты»,
так как в основном используются внутри
клетки. На практике же пространство, в
которое они изливаются, находится в
непосредственной близости от внеклеточного
пространства, из которого оно образуется
посредством эндоцитоза; лизосомальные
ферменты могут работать даже вне клетки
(об этом мы упоминали в гл. 5). С этих
позиций лизосомальные ферменты
характеризуются как секреторные продукты. Судя
по всему, сама клетка рассматривает их
в качестве таковых, ибо использует свой
экспортный аппарат для снабжения ими
лизосом.
Секреция представляет собой
специализированный процесс, в ходе которого
каждый продукт обычно вырабатывается одним
или несколькими типами клеток. Но клетки
часто производят несколько продуктов,
иногда для различных целей. Это означает,
что экспортный механизм клетки должен
включать целый ряд систем отправления,
которые, например, посылают кислые
гидролазы в лизосомы, белки крови и
гормоны — в кровяное русло, экзокринные
продукты — в соответствующие выводные
протоки, а структурные элементы и ремодели-
рующие их агенты — в прилегающее
околоклеточное пространство.
Некоторые процессы клеточного
экспорта регулируются только продукцией; клетки
распоряжаются своими «товарами» по мере
их производства и не держат про запас
Именно таким образом ведут себя плазма
тические клетки, секретирующие
иммуноглобулины, а также фибробласты —
основные производители структурного
коллагена. Однако другие клетки, в частности
секретирующие гормоны или компоненты
пищеварительных соков, хранят свои
продукты в специальных гранулах и выделяют
их только по команде. Мы рассмотрим
непрерывную и прерывистую секрецию,
чтобы выяснить различия между ними.
Во многих случаях клетки экспортируют
не полностью доработанные продукты,
оставляя конечную доработку, которая
обычно не что иное как протеолитическое
расщепление, до прибытия в пункт
назначения. Они это делают особенно
тщательно, если конечный продукт потенциально
опасен и может вызвать локальное
повреждение. В таких случаях клетки производят
«безвредный» предшественник, который
превращается в конечный продукт только
там и тогда, когда в нем возникает
необходимость. Именно таким путем
производятся многие пищеварительные ферменты,
включая некоторые лизосомальные
гидролазы, — я виде неактивных проферментов,
или зимигенов. Существуют разрушающие
ткани ферменты (коллагеназа) и ряд
систем крови, участвующих в образовании
и диссоциации тромбов, в клеточном
убийстве и других «опасных» процессах.
Структурные компоненты, предназначенные
для объединения в нерастворимые
агрегаты, также вырабатываются в виде
крупных предшественников, неспособных
соединяться спонтанно. Примером может
служить тропоколлаген, секретируемый в^ виде
растворимого проколлагена (гл. 2).
Доработка различных предшественников
происходит вне клеток при помощи ферментов,
которые сами являются продуктами
экспорта. Таким образом, участвующие в этом
процессе клетки связаны сложными
взаимодействиями.
Иногда, когда в целях безопасности
необходимы особенно строгие гарантии,
включается целый каскад реакций
активации предшественников между начальным
запуском и конечной стадией доработки.
Типичным примером может служить
процесс свертывания крови, в ходе которого
происходит протеолитическое превращение
растворимого белка крови, известного под
названием фибриноген, в фибрин,
формирующий нерастворимую сеть. Осуществля
ющий это превращение фермент тромбин
присутствует в виде своего неактивного
предшественника — протромбина. При
повреждении ткани из клеток
высвобождаются некоторые вещества, инициирующие
активацию протромбина посредством
сложной цепи последовательных протеолитиче-
ских реакций. Замечательным примером
такого механизма может служить
активация комплемента — мощной «убивающей»
системы крови, связанной с антителообра-
зующими клетками (гл. 3). Эта система
включает не менее девяти различных
циркулирующих белковых молекул; некоторые
из них состоят из нескольких субъединиц.
В результате связывания одного из этих
компонентов с Fc-хвостами связанных им-
муноглобулиновых молекул происходит
запуск ряда последовательных
взаимодействий, заканчивающихся созданием
сложной структуры, похожей на подъемный
кран; при ее помощи в плазматической
мембране покрытой антителами клетки
пробуравливается отверстие,
«выпускающее жизнь». На основании этих и других
подобных примеров можно предположить,
что число ступеней между запускающим
событием и финалом находится в прямой
Непрерывная секреция
Прерывистая секреция
При постоянной секреции продукт
выгружается по мере его
производства. При прерывистой
секреции продукт хранится и
выгружается только при
соответствующем сигнале.
зависимости от опасности, связанной со
случайным запуском процесса. Протеолити-
ческие каскады — это путь Природы по
созданию множественных контрольных
устройств «неудача — сохранение».
Волшебная пряха
«Фабрики», где клетки производят
продукты на экспорт, обычно не доступны
для посетителей извне. Аппарат Гольджи,
в который мы прибыли из лизосом, лежит
на полпути к конвейеру. Если мы хотим
проследить производственный процесс с
самого начала, нам следует прежде всего
форсировать путь вверх по течению. Наше
незаконное путешествие сопряжено с
многими трудностями, приходится
преодолевать немало узких полостей и извилистых
туннелей. Но этот небольшой участок
вскоре заканчивается по мере
проникновения в глубокое ущелье впечатляющих
размеров — часть эндоплазматического ре-
тикулума (сети), или ЭР.
Термин «ретикулум» по-латыни
означает сеть. Выбор этого термина отражает
двумерное представление морфологов об
ЭР, которые наблюдали эту систему в
поперечном сечении в виде тонких нитей
филиграни. Эти линии представляют собой
края мембран, срезанных перпендикулярно
их плоскости. Трехмерная
(пространственная) реконструкция показала, что
мембраны образуют большие уплощенные
мешочки, или цистерны, полностью
изолированные, за исключением соединений —
постоянных или временных, — которые
связывают их друг с другом и с аппаратом
Гольджи.
Рассматриваемые изнутри плоские
мембранозные стенки цистерн ЭР кажутся
построенными по такому же бислойно-
белковому плану, что и плазматическая
мембрана и стенки эндосом и лизосом.
Однако мембраны ЭР тоньше, глаже и
подвижнее; фосфолипиды в их бислое имеют
иное строение, а связанный с ними
холестерин практически отсутствует.* Белки также
отличаются и в значительной степени
лишены боковых углеводных цепочек. Эн-
доплазматические мембраны лишены
характерного «щетинистого» вида
плазматической мембраны. В отличие от последней
они покрыты пучками очень тонких шелко-
После того как путешественники
по клетке проложили путь
против секреторного потока
вверх по течению, они попадают в
глубокое узкое ущелье
внушительных размеров. Это
цистерна эндоплазматического
ретикулума, стены которой покрыты
пучками растущих полипептидных
цепей.
вистых нитей, которые придают им вид
мерцающей паутины. Мерцание — это не
просто оптический эффект, оно отражает
движение: шелковистые нити растут, и с
довольно ощутимой скоростью,
приблизительно 1 нм/с, что при нашем увеличении
в миллион раз составляет свыше 5 см/мин.
Они растут стабильно до тех пор, пока не
достигают длины 50—200 нм, после чего
отпадают и уносятся с потоком. Мы
погружаемся в море движущегося шелка.
На наших глазах здесь происходит
7—1452
производство белков на экспорт. Шелковые
нити, растущие из окружающей нас
мембраны, не что иное, как полипептидные
цепочки. Они образуют извилистые ряды,
состоящие из 10—20 нитей, характерно
располагающихся в порядке увеличения
длины. Все нити определенной группы
растут с одинаковой скоростью, но с
различием по фазе (запаздыванием),
пропорциональным расстоянию между ними.
Примерно каждые 15. с последняя нить
ряда достигает полной длины и отпадает,
а верхушка новой нити возникает из
мембраны где-то впереди. По мере роста
отдельных нитей ряд передвигается, ползая
по поверхности мембраны наподобие
удивительной пушистой сороконожки. Сотни
таких похожих на привидения созданий
На электронной микрофотографии
тонкого среза клетки печени
показан эндоплазматический
ретикулум. Узкие, вытянутые
мембранные профили, усыпанные
плотными частицами
(рибосомами) на
цитоплазматической поверхности,
срезаны через цистерны
шероховатого эндоплазматического
ретикулума (ШЭР). Мелкие
неправильной формы гладкие
профили принадлежат гладкому
эндоплазматическому ретикулуму
(ГЭР). Обратите внимание на
связи между ШЭР и ГЭР.
Крупные тельца — митохондрии.
Секреторные белки вырастают из
стенки эндоплазматического
ретикулума. Стрелкой показано
направление движения
«сороконожки», состоящей из
рибосом и мРНК. Тени этих
рибосом и мРНК с трудом можно
различить сквозь мембрану.
исполняют непрерывно меняющиеся
арабески на окружающих нас стенках.
Незабываемое зрелище!
Если мы теперь рассмотрим место, в
котором растущие нити входят в полость,
где мы находимся, то заметим, что они
проникают через узкий канал,
сформированный белком и проложенный в липидном
бислое. На самом конце каждого канала
с трудом можно различить очертания
луковицеобразного корня примерно около
25 нм (2,5 см при нашем увеличении)
шириной; по-видимому, здесь и начинается
процесс прядения нитей. Итак, позади
каждого ряда растущих нитей
располагается ряд луковиц (расширений),
отделенных от нас мембраной. Всматриваясь в
мембрану, мы можем различить еще одну
деталь: между луковицами каждого ряда
натягивается, вернее, скользит мимо них с
удивительной скоростью — 250 нм (25 см
при нашем увеличении) в 1 мин — нежный
тонкий шнур. Его движение синхронно с
ростом нитей и с боковым перемещением
точек их появления на* мембране. На самом
деле, шнур с вереницей луковиц и
представляет собой настоящую сороконожку —
похожее на призрак создание, чьи
растущие волосы мы только и видим. Имя этого
скрытого демона — полисома, сокращенное
от полирибосомы.
Рибосомы представляют собой мелкие
частицы, в которых происходит синтез
белка во всем живом мире. Их работа
заключается в соединении аминокислот в
полипептидные цепочки. Соответствующие
инструкции об этом рибосомы получают от
переносчиков РНК, или мРНК, которые
являются сегментами рибонуклеиновой
кислоты (отсюда сокращение РНК) и несут
фрагменты генетической информации,
транскрибированной (списанной) с дезокси-
рибонуклеиновой кислоты (ДНК). мРНК—
это тонкие нитевидные молекулы,
бегущие через рибосомы наподобие ленты
в магнитофонной кассете. Однако вместо
передачи информации одной рибосоме в
единицу времени они пробегают через
10 или более рибосом одновременно и
таким образом связывают их в единую нить,
полисому. Представьте себе ленту,
бегущую через ряд кассет, каждая из которых
закреплена за отдельным исполнителем.
Каждый из них исполнит одну и ту же
музыку, но в форме канона или фуги с
интервалом, пропорциональным
расстоянию между кассетами: в то время как
последний в ряду только начинает
увертюру, первый уже в коде. Именно так
происходит в полисомах, за исключением того,
что они воспроизводят записанное на ленте
послание в виде специфической
последовательности аминокислот, а не звуков. Все
рибосомы одной полисомы читают один и
тот же текст, иными словами,
воспроизводят один и тот же полипептид. Причем
делают это с одинаковой скоростью, но
не синхронно друг с другом: чем больше
протяженность транслированной
(прочитанной) ленты, тем длиннее
синтезированная часть полипептида. Следует отметить,
что полипептиды растут в области своих
корней (т. е. на рибосомах), а не в области
верхушек. Если сравнить две растущие
цепи, исходящие из одной полисомы, то
легко обнаружить, что более короткая цепь
идентична терминальному участку более
длинной цепи.
Детальнее эту картину можно
рассмотреть при посещении цитозоля. Сейчас же
мы воспользуемся преимуществом нашего
местопребывания, чтобы ответить на
вопрос, вызвавший бурные обсуждения среди
ученых: действительно ли все отдельные
пучки, растущие на стенках одной
цистерны ЭР, состоят из одинаковых поли
пептидов? Или они различны, но предназначены
для одной и той же цели? Или же это
совершенно случайная смесь
полипептидов? Сталкиваясь с проблемой отправки
различных продуктов в разные пункты
назначения, клетки, казалось бы, смогли
найти простое решение этой проблемы,
разделяя производство по образцу
химических предприятий. Но, судя по всему,
экспортная индустрия клеток так не
работает. Она направляет все продукты в один
котел, а позже их сортирует.
Процессинг
и транспортировка
В большинстве случаев полипептидные
цепи представляют собой лишь
полуфабрикаты секреторных продуктов; они
требуют значительной дальнейшей доработки
и «отделки» перед тем, как будут готовы
к отправке. Одни из них снабжаются
боковыми углеводными цепочками,
содержащими 10 и более молекул сахара (глико-
зилирование), другие связываются с ли-
пидами, иногда во много раз
превышающими их массу, как, например, липопро-
теины плазмы, вырабатываемые в печени.
Все цепи должны принять
соответствующую конфигурацию, причем для некоторых
молекул необходимо участие специальных
химических мостиков-связей, обычно ди-
сульфидных связей: S — S. И наконец,
в результате дополнительной протеолитиче-
ской обработки многие молекулы
уменьшаются.
Некоторые изменения, в частности гли-
козилирование, начинаются еще до
полной сборки полипептидных цепей. Другие
происходят по мере продвижения молекул с
током секреторных продуктов во время
скольжения их вдоль мембран, на которых
расположены ферменты, участвующие в
доработке. В этот процесс вовлечен целый
комплекс биохимических реакций, но даже
с нашей выгодной позиции внутри цистерн
ЭР мы часто в состоянии видеть лишь
немногим более, чем финальные стадии. В ос-
новном события развертываются на цито-
плазматической поверхности мембран, где
в изобилии имеются строительные блоки и
энергетические запасы; само внутреннее
пространство ЭР служит главным образом
собирательным каналом и местом сборки.
Такая организация напоминает
происходящее на автомобильном заводе, где
двигатель, кузов, шасси, колеса и другие части
машины производятся в отдельных цехах
и затем просто собираются на конвейере с
минимальной затратой рабочей силы.
То, что мы обнаружили, характерно
для полипептидных цепей, которые
синтезируются рибосомами на цитозольной
стороне мембраны ЭР и в готовом виде
переправляются в цистерны ЭР.
Липидные.компоненты и углеводные боковые цепочки
также собираются на цитозольной
поверхности и транспортируются через мембрану.
Каков способ переправки углеводов через
мембраны? Этот вопрос ставит нас в тупик,
ибо сахара гидрофильны и не могут
беспрепятственно пройти через липидный бислой.
Известно, что в этом процессе участвует
гидрофобный переносчик молекул, долихол,
но как он работает, не ясно. Подробнее мы
остановимся на этом, когда будем
рассматривать механизмы биосинтеза (гл. 8 и 13).
Реакции внутри полостей ЭР, будучи
весьма ограниченными в количественном
отношении, высокоспецифичны и
избирательны. Каждый полипептид
дорабатывается характерным и воспроизводимым
образом. То, что на первый взгляд
кажется само собой разумеющимся (а именно
беспорядочная, случайная доработка
может привести только к хаосу), в
действительности исполнено глубокого смысла.
Если полипептид А, но не полипептид В,
претерпевает определенное изменение, то
только потому, что участвующий в этой
реакции фермент «узнает» — иными
словами, связывается в каталитически
эффективной форме — нечто, что имеется в А и
отсутствует в В. И это нечто может быть
только аминокислотной последовательностью,
по крайней мере в начале. Последующий
этап определяется предыдущим, как,
например, прикрепление данной молекулы
сахара. Но прежде всего инструкции
должны быть заложены в самом
полипептиде, чья структура уже есть выражение
генетического сигнала. Следовательно, этот
сигнал определяет не только структурные
и функциональные свойства полипептида
при рождении, но и всю цепь событий,
участвующих в доработке и модификации
его молекулы, ее перемещении внутри и вне
клеток, соединении с другими молекулами
и включении в различные части клетки, а
также в иных превращениях. Другими
словами, гены определяют всю
«пространственную (четырехмерную) историю»
белковых молекул.
А теперь вернемся к секреторным
полипептидам, которые будем сопровождать в
их дальнейшем путешествии. По мере
нашего продвижения вперед мы замечаем,
как постепенно истончаются шелковистые
выросты на поверхности мембраны.
Полипептидные пучки встречаются все реже и
реже и в конце концов исчезают, что
означает исчезновение полисом,
передвигающихся по цитоилазматической поверхнос
ти мембран. Это изменение отчетливо про
слеживается на поперечных срезах. В тех
участках, где имеются полисомы,
обнаруживаются выступы в виде плотных точек,
выстроенных вдоль мембран и придающих
им шероховатый вид; мембраны, не
несущие полисом, гладкие. Отсюда термины
«шероховатый (гранулярный) эндоплазма-
тический ретикулум» (ШЭР) и «гладкий
эндоплазматический ретикулум» (ГЭР),
присвоенные этим двум частям ЭР. Как
уже отмечалось, переход от одной части к
Связь между эндоплазматическим
ретикулумом и аппаратом
Гольджи может осуществляться
динамически за счет челночных
передвижений везикул или быть
постоянной за счет извитых
канальцев. Оба варианта на
тонком срезе выглядят одинаково.
Рисунок «внутреннего сетчатого
аппарата», выполненный
Камилло Гольджи в начале
текущего века
другой происходит постепенно. Однако к
моменту нашего вступления в гладкую
часть ЭР картина существенно меняется.
Мы достигаем конца просторной эндоплаз-
матической полости и приближаемся к
извилистым проходам, которые пересекли
во время нашего путешествия вверх по
течению. Теперь мы находимся на
подступах к аппарату Гольджи, но уже на
законных основаниях, вместе с
секреторным потоком.
Форму переходных элементов,
соединяющих эндоплазматический ретикулум и
аппарат Гольджи, различить нелегко. На
некоторых этапах нашего путешествия мы
как бы протискивались сквозь извитые
протоки, на других же перемещались в
маленьких изолированных капсулах.
Другими словами, непонятно: средства связи,
к которым мы прибегаем, постоянны и
имеют трубчатую форму или непостоянны и
представляют собой везикулы, которые
используют трюк мыльных пузырей
«слияние — разделение» для транспортировки
секреторных продуктов из одного компарт-
мента в другой? Этот вопрос до сих пор
обсуждается и ответ может быть
различным для разных клеток. Здесь мы вновь
сталкиваемся со сложностью
воспроизведения пространственной картины на основе
имеющихся двумерных поперечных срезов.
Разрежьте поперек свернутую трубку или
расположенные в ряд везикулы, и вы
увидите одну и ту же картину: ряд
округлых профилей.
Упаковка и доставка
Место, где мы сейчас находимся,
получило свое название по имени итальянского
гистолога Камилло Гольджи, который на
пороге текущего столетия открыл эту
систему в нервных клетках, пропитанных
солями металла, и описал ее в виде тонкой
сети, названной внутренним сетчатым
аппаратом.
Истинная пространственная форма
аппарата Гольджи (часто называемого
просто Гольджи) все еще выясняется. Он имеет
несколько характерных компонентов, но
структурные детали варьируют от клетки к
клетке, и точные границы этой системы
не установлены. Гольджи представляет
собой комплекс крупных и мелких
окруженных мембраной полостей «беспорядочного»
вида (за которым на самом деле
скрывается высокая степень упорядоченности),
часто располагающийся в «товарном скла
де» и «упаковочных центрах».
Самым крупным и наиболее типичным
компонентом Гольджи является диктиосома
(греч. dlktyon — сеть), названная так
благодаря представлениям Гольджи об этой
системе. Конечно, аппарат Гольджи такая
же сеть, как и эндоплазматический
ретикулум; он просто кажется сетью на
поперечном срезе. Диктиосома представляет собой
скопление нескольких крупных
уплощенных, мембранозных цистерн, тесно
спрессованных друг с другом наподобие стопки
крупных двустенных чаш. Эта структура
напоминает стопку и потому, что имеет
изогнутые поверхности: одну вогнутую,
другую выпуклую. Сейчас мы находимся
в первой цистерне на выпуклой
поверхности вблизи эндоплазматического ретику-
лума. Стенки этой структуры незначительно
отличаются от стенок гладкого ЭР. Однако
по мере продвижения от одной полости к
другой в направлении от выпуклой к
вогнутой поверхности стопки мембраны
становятся толще и грубее, увеличивается
количество холестерина в липидном бислое
и углеводных боковых цепей в мембранных
белках. Окружающие нас мембраны явно
становятся все более похожими на
плазматическую мембрану. Эта полярность
отражает присущую аппарату Гольджи функ-
На электронной микрофотографии
показано расположение аппарата
Гольджи в клетке экзокринного
отдела поджелудочной железы.
Типичная «стопка» занимает
центральную часть
электронограммы. Позади ее
цис-, или эндоплазматической,
поверхности (слева) расположены
профили (ШЭР), заканчивающиеся
в переходных элементах ГЭР и
соединяющих везикулах. Со
стороны транс-, или
экзоплазматической, поверхности
«стопки» цитоплазма заполнена
везикулами различной величины,
включая три крупные вакуоли,
демонстрирующие
последовательные стадии
созревания зимогсновых гранул
(ЗГ) из конденсирующей вакуоли
(KB). Мелкая везикула,
содержащая мембранозные кольца,
представляет собой лизосому (Л).
цию упаковки. Секреторные продукты,
проходя через аппарат Гольджи,
передвигаются от «контейнеров», похожих по
структуре на эндоплазматическии ретику-
лум, к «контейнерам», построенным
подобно плазматической мембране. Такое
изменение, вероятно, необходимо перед выходом
продукта из клетки путем слияния с плаз
матической мембраной и экзоцитоза.
Как именно секреторные продукты
движутся через аппарат Гольджи -- вопрос,
страстно обсуждаемый учеными. По
мнению некоторых, цистерны вместе с
содержимым передвигаются от одной позиции к
другой в пределах «стопки»; при этом их
мембраны непрерывно изменяются и в
конце концов распадаются на везикулы,
которые и доставляют продукты к пункту
назначения. Приверженцы этой точки
Пространственное изображение
аппарата Гольджи
зрения описывают стопку Гольджи как
структуру, в которой имеются
формирующаяся (из эндоплазматического ретику-
лума) и созревающая поверхности. Другие
исследователи рассматривают стопку
Гольджи как более статичную систему, через
которую продукты движутся либо по
постоянным соединениям, либо используя
везикулярный транспорт и следуя по
маршрутам, которые могут изменяться в
зависимости от продукта и не обязательно
проходить через все цистерны стопки
Гольджи. Согласно этой концепции, они
используют чисто топологические понятия
цис и транс (относительно
эндоплазматического ретикулума), чтобы различать
поверхности стопки Гольджи. Во
избежание путаницы с цис- и граяс-мембранными
слияниями (см. с. 109) мы будем употреб
лять термины «эндоплазматический» и
«экзоплазматический».
В целом, как нам представляется,
статическая модель ближе к истине.
Изменения в структуре мембраны, отражающие
полярность системы, не являются
постепенными изменениями, постулированными в
динамической модели. Они затрагивают
глубокие и значительные различия, при
которых, например, целые группы
ферментов замещаются другими группами. На
основании имеющихся данных скорее всего
можно заключить, что мембраны Гольджи
не подвергаются подобной выраженной
реорганизации — по крайней мере со
скоростью, сопоставимой со скоростью
передвижения секреторных продуктов по этой
системе. Отсюда следует, что содержимое
и вместилище не могут двигаться
одновременно; такой вывод противоречит мнению,
постулированному динамической моделью.
По мере продвижения по аппарату
Гольджи секреторные белки подвергаются
значительной доработке, включая
частичное укорочение некоторых боковых цепей
олигосахаридов, которые были собраны в
ЭР, добавление фосфатных групп (так
называемое фосфорилирование) или
жирных кислот (ацилирование) и дальнейшее
протеолитическое расщепление.
Второй важной функцией Гольджи
является сортировка. Как это происходит,
известно до некоторой степени только для
кислых гидролаз, предназначенных , для
пищеварительной системы лизосом. Но
попытаемся воспроизвести, отчасти
гипотетически, ход событий. В Гольджи лизосо-
мальные ферменты получают характерную
адресную метку в виде концевых маннозо-
6-фосфатных групп, прикрепленных к
некоторым олигосахаридным боковым цепям.
Фермент, ответственный за их
прикрепление, не метит аналогичным образом другие
гликопротеины: он «узнает» специфическую
структуру (предположительно аминокислот
Избирательный транспорт
лизосомальных ферментов из
Гольджи в лизосомы
А. Структура лизосомальных
ферментов такова, что они
могут быть субстратами для
ферментных систем,
катализирующих прикрепление
маннозо-6-фосфатных
группировок. Мембраны Гольджи
имеют рецепторы для
маннозо-6-фосфатных групп,
сгруппированные в инвагинациях
(возможно, «окаймленных»),
которые превращаются в везикулы,
направленные к лизосомам.
В кислой лизосомальной среде
ферменты отделяются от
рецепторов, которые
возвращаются обратно в Гольджи.
Б. Существует и другой путь, по
которому нагруженные гидролазой
рецепторы доставляются к
поверхности клетки и оттуда
путем эндоцитоза возвращаются в
клетку. В кислой среде эндосом
ферменты отделяются, а
освобожденные рецепторы
возвращаются в Гольджи.
Ферменты вместе с содержимым
эндосом попадают в лизосомы.
ную последовательность или тип
последовательности), типичную для всех
лизосомальных гидролаз. Последующее опознава
ние маннозо-6-фосфатной метки произво
дится специфическими сайтами (местами)
связывания, сгруппированными на
внутренней поверхности некоторых участков
мембраны Гольджи. Посредством этих сайтов
из смеси секреторных белков «выуживают
ся» лизосомальные ферменты.
Нагруженные ими участки мембран отрываются в
виде везикул, которые избирательно
движутся к лизосомам (или к эндосомам) и,
сливаясь с ними, разгружают содержимое
при контакте с кислой средой лизосом.
По-видимому, затем опорожненные
везикулы возвращаются к аппарату Гольджи.
Однако этот удивительный механизм
сортировки несовершенен; некоторые
молекулы лизосомальных ферментов
сопровождают основной секреторный поток и
выходят во внеклеточное пространство. Если
они были тщательно помечены, их можно
еще спасти, поскольку, как мы уже вкратце
упоминали в гл. 5, рецепторы для маннозо-
6-фосфата также обнаруживаются на
плазматической мембране многих клеток. Среди
исследователей все еще дискутируется
возможность перехода большей части
загруженных рецепторов из Гольджи к
лизосомам через поверхность клетки, хотя
существование прямого
внутриклеточного пути кажется весьма вероятным.
Во всяком случае, благодаря
существованию внеклеточного пути истинная секреция
лизосомальных ферментов отчасти
происходит даже при нормальных условиях.
При патологических состояниях, когда
нарушается транспорт ферментов к
лизосомам, она может значительно усиливаться.
Последствия такого истечения, однако,
менее драматичны, чем при разгрузке
лизосом (дефекации), так как некоторые
лизосомальные гидролазы, включая особенно
опасные катепсины (протеазы),
синтезируются в форме неактивных проферментов,
которые активируются только после
попадания в лизосомы.
Помимо доставки к месту назначения
упаковка должна соответствовать способу
доставки секреторных продуктов,
непрерывному или прерывистому. При
непрерывной секреции продукты постоянно выходят
из аппарата Гольджи, упакованные в
мелкие мембранозные везикулы, которые
Экзоцитарное выделение
секреторных гранул в экзокринной
части поджелудочной железы.
Зимогеновая гранула (ЗГ)
приближается к плазматической
мембране (ПМ). Соединение двух
мембран в результате цис-
слияния приводит к образованию
экзоцитарной инвагинации (ЭК).
Электронная микрофотография
нейтрофильного полиморфно-
ядерного лейкоцита кролика.
Крупные плотные гранулы
представляют собой азурофильные
гранулы, соответствующие
лизосомам в других клетках.
Более мелкие и не столь плотные
гранулы, известные как
специфические, не являются
лизосомами. Оба типа гранул в
больших количествах выделяются
в фагоцитарные вакуоли.
отпочковываются от Гольджи, и разгру- больших конденсирующих вакуолях, кото-
жают содержимое во внеклеточное прост- рые превращаются в зрелые секреторные
ранство путем экзоцитоза. При прерывистой гранулы — крупные, плотноупакованные,
секреции продукты концентрируются в окруженные мембраной структуры, име
ющие характерные для железистых клеток
черты. Гранулы высвобождают свое
содержимое путем экзоцитоза, но только при
соответствующей стимуляции — часто
сложной цепи нервных и гормональных
переключений, которые завершаются
локальным выходом ацетилхолина. Этот
переносчик соединяется с рецептором„на клеточной
поверхности (см. гл. 3), и наступившее
в результате конформационное изменение
запускает механизм выхода секреторных
гранул путем экзоцитоза, возможно впуская
ионы кальция в клетку. Если же стимул не
поступает и клетка продолжает
вырабатывать секреторные гранулы, они начинают
сливаться с лизосомами, а не с
плазматической мембраной, и излишки секреторных
продуктов разрушаются кринофагиеи (гл. 5).
Лизосомальные гидролазы обычно
транспортируются в лизосомы постоянно. Но
существует одно поразительное
исключение: полиморфноядерный лейкоцит. Эта
клетка крови производит и хранит
лизосомальные гидролазы в течение нескольких
поколений в ходе своего развития и диф-
ференцировки от стволовой клетки,
находящейся в костном мозгу; то же касается
лизоцима и ряда других бактерицидных
агентов. Лейкоцит накапливает эти
вещества в двух типах крупных цитоплазмати-
ческих гранул, известных как азурофиль-
ные и специфические гранулы. Гранулы
остаются по существу инертными в
цитоплазме до тех пор, пока клетка, соблазнен
ная соответствующими антителами-припра-
вой (опсонизация), не начнет пожирать
себя и бактерии или другие инородные
частицы (гл. 4). В результате происходит
массированный выход содержимого гранул
в фагоцитарные вакуоли и, как следствие,
убийство и переваривание добычи (гл. 5).
Как мы уже знаем, после участия в такой
борьбе лейкоцит в отличие от других
фагоцитирующих клеток не восстанавливается.
Высокая степень специализации,
превратившая его в контролируемый секреторный
объект, одновременно сделала его и
объектом, секретирующим всего лишь раз. В конце
своей фагоцитарной схватки лейкоцит
погибает.
Образование мембраны
Как известно, мембраны никогда не
образуются de novo. Они всегда возникают
из предсуществующих мембран путем до-,
бавления дополнительных составных
частей. Этот процесс, возможно, столь же
стар, как и эволюция. Каждое поколение
передает последующему, в основном через
яйцеклетку, запас ранее сформированных
(предсуществующих) мембран, из которых
Схематическое изображение
секреторного пути. На правой
стороне диаграммы можно видеть
путь и сопутствующий процессинг
секреторных белков, начиная с их
сборки на связанных с
мембранами рибосомах до выхода
путем экзоцитоза. На левой
стороне диаграммы показано, как
интегральные белки плазматической
мембраны, синтезированные в
эндоплазматическом ретикулуме,
используют тот же путь, чтобы
достичь места своего назначения.
путем прироста, прямо или опосредованно,
образуются все мембраны организма.
Как мы выясним при осмотре эндоплаз-
матического ретикулума со стороны цито-
золя, именно он является основным местом
биосинтеза мембран. Здесь образуется
большая часть фосфолипидов и
холестерина, а также многие интегральные
мембранные белки, которые, как и секреторные
белки, синтезируются на связанных
рибосомах, но в отличие от них не попадают в
полость ЭР, а после окончания синтеза
остаются погруженными в липидный би-
слой. Не все белки ЭР производятся таким
путем. Некоторые из них синтезируются в
цитозоле на свободных рибосомах и
встраиваются в мембраны позднее. С другой
стороны, многие белки других мембран
(не ЭР) образуются в ЭР и затем
перемещаются к месту своего назначения. Такие
белки перемещаются параллельно с
секреторными продуктами, но скорее с участием
самих мембран, а не через полости ЭР.
Белки перемещаются путем латеральной
диффузии вдоль физически непрерывных
доменов мембран, группируются на
участках, которые предназначены для
везикулярного транспорта продуктов и таким
образом перескакивают от одного домена
к другому, пока не достигнут своего места
назначения — будь то Гольджи,
плазматическая мембрана, лизосомы или еще какое-
либо другое место. Подобно секреторным
белкам, такие вновь образованные
интегральные мембранные белки в ходе своего
перемещения могут подвергаться
экстенсивному процессингу. Таковы, например,
многие гликопротеины, характерно
свешивающие свои олигосахаридные боковые
цепочки с поверхности клетки; они
приходят сюда из эндоплазматического
ретикулума через Гольджи и по дороге получают
углеводные компоненты.
Замыкание цикла
Существует несколько способов выхода
из аппарата Гольджи в зависимости от
того, какими опознавательными знаками
мы воспользуемся, собираясь покинуть
Гольджи. Если мы не хотим вернуться
в лизосомы, нам следует избегать маннозо-
6-фосфата. За этим исключением, все
остальные выходы приводят к некой точке
вне клетки, и мы можем воспользоваться
прерывистой секрецией, представляющей
нам наибольшие возможности для
приспособления. Но даже в этом случае наше
путешествие далеко не из приятных.
Прежде всего мы должны попасть в
конденсирующую вакуоль и выдержать почти
непереносимое давление, по мере того как
из вакуоли будет выкачиваться вода, а
продукты секреции вокруг нас уплотнятся
до почти твердого состояния. Затем
наступает ожидание в состоянии острого
физического дискомфорта и нарастающего
страха перед кринофагией, которая может
помешать нашему бегству и отбросить
нас в лизосомальное пространство. Когда
же наконец открывается выход из клетки,
то это происходит с необыкновенной силой
и стремительностью. Экзоцитарная
разгрузка секреторных гранул представляет
собой взрывной процесс. Гранулы
скапливаются и толкают друг друга, стремясь
возможно скорее попасть на периферию
клетки. Часто они сливаются с другими
гранулами, лежащими на их пути, вызывая
глубокие дефекты на поверхности клетки и
выгружая массы секреторных продуктов.
Внешнему наблюдателю это явление
напоминает внезапное извержение гряды
вулканов, истинное «клеточное
землетрясение». Беспомощным спутникам
секреторных продуктов сам экзоцитоз приносит
последнее напряжение, к счастью,
кратковременное и легко забываемое в сладости
вновь обретенной свободы. И вот уже
обратно в целительное, успокаивающее
внеклеточное море, где мы вновь созерцаем
покрытую углублениями движущуюся
поверхность клеточной мембраны с ее
извивающимися отростками и колышащейся
вуалью. Мы завершили цикл: вошли в
клетку путем эндоцитоза, бродили, плутая,
по нескончаемой веренице ее комнат и
коридоров и вышли путем экзоцитоза.
Это было увлекательное, но в известном
смысле нереальное путешествие, подобное
странствию по сюрреалистическому
лабиринту. Всюду пустые стены,
нескончаемые вереницы мембран, всегда плотно
упакованных, таинственно мерцающих,
скрывающих от нашего взора
многочисленные механизмы, которые, судя по их
продукции, должны обладать удивительной
сложностью. Ясно одно: пока мы с трудом
вошли в клетку, и нам следует отыскать
путь, позволяющий преодолеть эту вечную
«Тревожное путешествие»
(рисунок Джорджо де Чирико)
преграду. Но перед тем, как сделать это,
окинем последним оценивающим взглядом
всю цитомембранную систему.
Вакуом
В начале XX столетия французские
цитологи предложили название «вакуом» для
обозначения сложной системы вакуолей и
гранул, обнаруженной в растительных и
животных клетках. По их мнению, вакуом
состоял из множества цитоплазматических
структур, в том числе аппарата Гольджи,
за исключением митохондрий, которые они
рассматривали как отдельную систему,
хондриом. Такое разделение оказалось
настоящим предвидением, и слово «ваку
ом», которое ранее не находило всеобщего
признания, заслуживает быть
воскрешенным. Термин «вакуолярная система»,
который иногда используется в таком же
значении сегодня, более расплывчатый, посколь
ку им длительное время обозначали только
импортную часть всей системы.
Импорт и экспорт, каждый с
соответствующими реакциями процессинга в них, —
основные функции вакуома. Если, однако,
рассматривать анатомическую и
функциональную организацию системы, то
наиболее доразительной чертой окажется ее
разделение на два домена аппаратом
Гольджи.
Эндоплазматический ретикулум (ЭР),
или эндоплазматический домен,
располагается по одну сторону от Гольджи — цис-
сторону, которую мы называем эндоплаз-
матической. Связанный с производством
белков, ЭР имеет отчетливо выраженную
полярность от участков, связывающих
рибосомы, в шероховатом ЭР к переходным
элементам между гладким ЭР и Гольджи.
За исключением этой асимметрии,
мембраны ЭР, которые также являются местом
«обитания» некоторых метаболических
систем, не связанных с секрецией (см. гл. 13),
во многом однородны по составу.
Продвижение по этой части вакуома
осуществляется весьма просто и в одном направлении.
ЭР направляет свое содержимое в Гольджи
Передвижение содержимого
клетки в контейнерах. Аппарат
Гольджи служит центральным
сортировочным помещением и
каналом между эндоплазматической
и экзоплазматической областями.
1 — челнок Гольджи —
эндоплазматический ретикулум;
2 — секреторный челнок
Гольджи — плазматическая
мембрана; 2' — кринофагическое
отклонение; 3 — челнок Гольджи—
лизосома; 3' — альтернативный
путь из Гольджи к лизосомам
через плазматическую мембрану и
эндосому; 4 — эндоцитарный
челнок плазматическая мембрана —
эндосома; 4' — альтернативный
эндоцитарный путь в обход
эндосомы; 5 — возвращение
плазматической мембраны (а)
регургитацией, (б) диацитозом,
(в) через Гольджи, (г) через
лизосому; 6 — путь эндосома —
лизосома; 7 — аутофагическая
сегрегация.
со слегка заметным обратным током.
Согласно имеющимся данным, секреторные
продукты перемещаются через
эффективную одностороннюю «замок — ловушку»,
даже если их транспорт может зависеть от
двустороннего направленного мембранного
челнока. Это означает также, что
импортный поток останавливается у барьера
Гольджи. Действительно, материалы,
захваченные эндоцитозом, не попадают в
эндоплазматический домен. Нам удалось сделать
это, но только прокладывая путь через
«ловушку».
Совсем иная картина наблюдается по
другую сторону от аппарата Гольджи, где
располагается то, что можно назвать экзо-
плазматическим доменом вакуома (не
общепринятое, но весьма полезное название,
которое мы распространяем на транс-по-
верхность аппарата Гольджи). Этот домен
включает множество везикул, вакуолей и
гранул всевозможной формы и величины,
связанных с аппаратом Гольджи, друг с
другом и с околоклеточным пространством
сложной сетью транспортных путей.
Мембраны, окружающие эти структуры, имеют
некоторые общие свойства с
плазматическими мембранами. Они толще мембран ЭР
(около 10 нм против 7 нм) в значительной
степени из-за большей плотности олигоса-
харидных боковых цепочек, расположенных
на внутренней поверхности. Они также
содержат преобладающее количество
некоторых фосфолипидов, таких, как сфинго-
миелин, и высокие концентрации
холестерина. Однако их белковый состав далеко не
однороден, даже плазматическая мембрана
разделена на отдельные области.
Передвижение в этой части вакуома
чрезвычайно затруднено и осуществляется
в разных направлениях. Из Гольджи
основной поток секреторных продуктов
направляется к сайтам (местам) их выгрузки,
расположенным на клеточной поверхности,
либо непрерывно посредством цепочки
мелких везикул, либо прерывисто, с
промежуточной остановкой в секреторных
гранулах после концентрации в конденсирующих
вакуолях. По одному из важных путей
кислые гидролазы доставляются из
Гольджи в лизосомы. Кроме того, перегрузка
секреторного пути ведет к открытию кри-
нофагического обходного пути, который
направляет избыточные продукты из
секреторных гранул в лизосомы.
Фагоцитоз, опосредованный
рецепторами эндоцитоз и, возможно, другие формы эн-
доцитоза составляют импортные пути. Они
сходятся в основном в лизосомах, но по
пути могут, особенно проходя через эндо-
сомы, образовывать ответвления — пути,
которые обходят лизосомы и по которым
поглощенные материалы доставляются к
тому месту, где они проникли в клетку
(так называемая регургитация), или
переносятся через клетку к определенному
внеклеточному району (диацитоз), или
доставляются в гранулы хранения.
Эта сеть транспортных путей,
по-видимому, значительно усложнится, если
одновременно рассматривать движение как
содержимого, так и контейнеров, в которых
оно перемещается. Еще до недавнего
времени величину перемещения контейнеров
недооценивали. Обычно считалось, что
мембранный материал, включенный в
плазматическую мембрану при экзоцитозе,
возвращается при эндоцитозе, присоединяется
к лизосомальным мембранам при слиянии
эндосом с лизосомами, поглощается при
аутофагической сегрегации и в конце
концов разрушается при переваривании в
лизосомах. Как полагали, в целях
компенсации новая мембрана создается в эндоплаз-
матическом ретикулуме и передается в
Гольджи для замещения материала,
израсходованного плазматической
мембраной, при экзоцитозе. Согласно этой
концепции, известной как теория «мембранного
потока» и включающей динамическую
модель функционирования Гольджи (см.
с. 104), вновь синтезированные мембраны
проходят через один экспортно-импортный
цикл и затем разрушаются. Иными
словами, клетка использует имеющиеся в ее
распоряжении свободные контейнеры.
Однако концепция оказалась
несостоятельной, когда удалось оценить степень
выраженности передвижения контейнеров.
Железистая клетка способна удваивать
поверхность своей плазматической
мембраны при каждой секреторной разгрузке.
Макрофаг заглатывает каждый час в два
раза большую поверхность, чем
поверхность его плазматической мембраны.
Подобные скорости по меньшей мере на
порядок больше, чем скорости обмена
составных частей мембран. Вот почему клеточные
контейнеры не могут быть свободными;
они должны находиться в состоянии
оборота.
Пути рециклирования (перемещения)
мембран все еще выясняются. Возможно,
наряду с прямыми челноками они
включают окольные пути. Центр этого
рециклирования мембран лежит в области клетки,
иногда называемой ГЭРЛ (сокращение от
слов: Гольджи — эндоплазматический ре-
тикулум — лизомосы), основным
компонентом которой теперь принято считать эндо-
сомы. Удивительно, что это быстрое и
сложное рециклирование контейнеров лишь
незначительно нарушает идущий в одном
направлении транспорт содержимого, хотя,
как мы уже видели (гл. 4), и
наблюдается некоторое «слюнотечение». Судя по
всему, клетка располагает эффективными
механизмами для передвижения пустых
контейнеров, возможно в виде уплощенных
везикул. По-видимому, кислая среда в эндо-
сомо-лизосомальной части экзоплазмати-
Гипотетический механизм,
объясняющий эволюционное
происхождение простейшего
фагоцита из прокариотического
предка
1. Подобно многим современным
гетерофагическим бактериям,
предполагаемый бактериальный
предок зависел от внеклеточного
переваривания пищи ферментами,
произведенными на связанных с
плазматической мембраной
рибосомах и выведенными во
внеклеточное пространство.
2. Инвагинации плазматической
мембраны у бактерий, не имеющих
стенки, создают простейшие
пищеварительные внутриклеточные
карманы, в которых попавшие
пищевые частички (примитивный
эндоцитоз) разрушаются под
воздействием захваченных в
ловушку экзоферментов.
3. Дифференцировка
внутриклеточной мембранной
системы направляет связанные
рибосомы к структурам
эндоплазматического ретикулума
и приводит к образованию
различных мембранных областей
(доменов) и значительному
увеличению размеров клетки.
ческого домена (отдела) играет ключевую
роль в «раздевании» и освобождении
мембран от лигандов перед их рециклированием.
Еще более значительной
представляется способность клетки сохранять высоко-
дифференцированную организацию ее ва-
куома. Каким-то образом, несмотря на
бесчисленные слияния между мембранами
различного состава, вряд ли существует
какое-либо «перемещение» компонентов
путем латеральной диффузии через их
соединение. Поддерживаются (или даже
создаются) отчетливые «разрывы», как при
группировке занятых рецепторов, которые
играют важную роль в избирательном
транспорте. Где бы ни происходила
сортировка — на поверхности клетки, в эндосо-
мах, в Гольджи, возможно еще
где-нибудь, — в этом процессе всегда участвуют
несущие рецепторы мембранные «пэтчи».
Возможно, на эти участки оказывают
определенное влияние расположенные под
мембраной и прикрепленные к ней
элементы цитоскелета (см. гл. 12 и 13).
Теперь, когда мы внимательно
взглянули на вакуом, нам стало понятнее наше
ощущение не вполне полного пребывания
внутри клетки на этом этапе проделанного
путешествия. Особенно заметно это было
в экзоплазматическом домене, где мы
наблюдали поистине удивительную картину
перемещения, когда кусочек мембраны,
которому в данный момент случилось
оказаться в составе клеточной
мембраны, в следующий момент мог стать
частью эндосомо-лизосомальной системы,
чуть позже появиться в Гольджи и в конце
концов вернуться обратно на поверхность
клетки, и все это за несколько минут! Пер-
меазы, насосы и другие транспортные
системы, присутствующие на плазматической
мембране, по-видимому, продолжают свою
работу при попадании внутрь,
катализируя те же обменные реакции между цитозо-
лем и содержимым везикул, как они это
делают, находясь на клеточной
поверхности, между цитозолем и внеклеточной
средой. (Однако эффекты могут быть не
одинаковы; вспомним протонный насос.) На
самом деле, «с точки зрения
функционирования», мы только наполовину находимся в
клетке — или наполовину вне клетки, —
пребывая внутри экзоплазматического
домена вакуома. То же характерно и для его
содержимого, которое либо Только что
попало в клетку путем эндоцитоза, либо
вскоре будет удалено из клетки путем экзоцито-
за. Мы оказываемся чуть глубже в клетке,
попадая в эндоплазматический домен, за
счет того, что «замок», или «ловушка»
Гольджи защищает нас от захвата
внеклеточными объектами. С другой стороны,
безвозвратная передача содержимого эндо-
плазматического ретикулума в экзоплазма-
тический домен, чаще всего с последующим
выбросом во внеклеточное пространство,
отчетливо придает полостям эндоплазмати-
ческого ретикулума характер пре-внекле
точного пространства.
Экспорт у прокариотов
и происхождение
эукариотических клеток
Наличие вакуома является
характерной чертой эукариотических клеток.
Большинство бактерий совсем не имеют
внутриклеточных мембран. Эукариоты произо
шли от прокариотов около миллиарда
лет назад. Рассматривая экспортный
механизм у прокариотов, мы получим некоторое
представление о том, как произошла эта
важная трансформация, ключевая для
появления всех растительных и животных
клеток на земном шаре.
Большинство бактерий секретируют
белки в окружающую их среду. Среди этих
белков преобладают гидролитические экзо-
ферменты, выполняющие пищеварительную
функцию. Интересно и, возможно, весьма
показательно, что эти экзоферменты
производятся и выталкиваются полисомами,
прикрепленными к внутренней поверхности
плазматической мембраны бактерий, во
многих отношениях так же, как начальные
экспортные белки переносятся через
мембрану эндоплазматического ретикулума.
Сходство даже распространяется на
молекулярные механизмы этого процесса, что
наводит на мысль о происхождении
шероховатого (гранулярного)
эндоплазматического ретикулума эукариотов из
плазматической мембраны их прокариотических
предков, возможно в результате некоего
прогрессивного процесса впячивания мембраны
в клетку. Для такого процесса
необходима подвижность клеточной оболочки, что
дает возможность предположить
отсутствие ригидной оболочки у наших пред
полагаемых отдаленных предков. Такие
«голые» бактериальные клетки могут
образоваться под влиянием лизоцима
(протопласты), а также возникать
случайно в природе (L-формы). Они очень
хрупкие, но при определенных обстоятельствах
их ранимость может быть компенсирована
необыкновенным эволюционно
приобретенным преимуществом — подвижностью
поверхностного слоя. Возможно, именно этим
объясняется образование углублений в
плазматической мембране и особенно
внутриклеточной везикулизации таких углуб-
лений-впячиваний, характерных для
эндоцитоза; при этом экзоферменты,
вырабатываемые в связанных с мембранами
полисомах, остаются внутри везикул, где они
воздействуют на любой внеклеточный
материал, захваченный в процессе поглощения.
Последний можно рассматривать как
простейшую возможную форму
внутриклеточного пищеварения внутри вакуолей,
имеющих свойства эндосом, лизосом и цистерн
шероховатого эндоплазматического
ретикулума.
Даже в столь примитивной и случайной
форме такое приобретение дает явное
эволюционное преимущество,
благоприятствующее любой возможности мутации, кото-
X—
рая приводит к дальнейшему развитию.
До сих пор клетка, чтобы извлекать пользу
из переваривающей способности своих
экзоферментов, должна была полагаться
на внеклеточное переваривание. Если
клетки не имели других средств для
существования, они практически были обречены на
пребывание внутри снабжающей их пищи,
как личинки мух в головке сыра. Начиная
же с этого времени они получали свободу,
могли бродить «по свету» и активно
преследовать свою добычу, живя на
фагоцитированных бактериях или других
поглощенных материалах. Образно говоря, такое
развитие предвещало начало клеточной
«эмансипации».
Другим важным последствием
постулированного изменения может быть
возможность роста. Клетки зависят от обмена с
окружающей их средой и ограничены в
своей способности к росту площадью
поверхности, доступной для таких обменов.
Мы уже могли убедиться в гл. 3 в важной
роли микроворсинок и других
поверхностных выростов для обменных процессов.
Развитие внутриклеточной вакуолярной
системы, находящейся в непосредственной
связи с внешней средой через эндоцитар-
ные образования и ограниченной
мембраной плазматического типа, которая
снабжена всеми необходимыми транспортными
системами, может многократно усилить
обменную способность клеток и таким
образом позволит ей достичь значительных
размеров. Одновременно происходит и
прогрессивная дифференцировка цитомем-
бранной системы: рибосомы постепенно
направляются к более глубоким участкам
системы, а периферические части системы
развиваются в плазматическую мембрану
и участки с гладкой поверхностью вакуома
современных эукариотов.
Согласно этой гипотезе, важнейший
эволюционный шаг от прокариотов к
эукариотам был сделан с участием
«крупного примитивного» фагоцита. Возможно,
мы никогда не узнаем, что же произошло
на самом деле. Но интересно, что самая
популярная теория эволюционного
приобретения таких важных органелл
эукариотов, как митохондрии и хлоропласты,
зависит от появления именно такого типа
клетки (см. гл. 9 и 10). Более того, если
рассматриваемая гипотеза окажется
верной, наше представление о вакуоме как о
тем или иным образом простирающейся
основной границе между клеткой и
окружающей средой, насчитывающей тысячи
внутриклеточных мешочков, укоренится в
истории эволюции.
Маршрут 2
Цитозоль и
цитоплазматические
органеллы
Использование способности вирусов
к обертыванию для проникновения в
цитозоль путем эндосом.
Обследование цитозоля и его
разнообразного содержимого.
Наблюдение анаэробного гликолиза
и знакомство с переносом электронов и
восстановлением энергии путем фосфори-
лирования.
Путешествие по биосинтезирующим
фабрикам и знакомство с групповым
переносом.
Посещение митохондрий и изучение
их генераторов энергии движения
протонов.
Попутная экскурсия в мир растений
и наблюдение за тем, как хлоропласты
используют солнечную энергию.
Наблюдение за пероксисомами и
другими микрочастицами.
Остановка на разнообразных
скелетных и подвижных элементах.
Повторное путешествие по цитозо-
лю, заострение внимания на цитоплазма-
тических поверхностях мембран.
Последний всеобъемлющий взгляд
на цитозоль как на звено регуляции
метаболизма.
Наблюдение за сборкой белка на
рибосомах.
В ожидании у ядерной оболочки
перед вступлением в митоз.
Цитозоль: гликолиз,
перенос электронов
и восстановление
анаэробной энергии
искусному способу: к моменту, когда
эти частицы готовы покинуть клетку
хозяина, они приобретают способность
распространять инфекцию на соседние
клетки. Как только вирусы покидают
клетку-хозяина, они заворачивают свои
На первый взгляд может показаться,
что даже уменьшенные в миллион раз
громоздкие частицы, имеющие наши
.размеры, не способны проникать через
плазматическую мембрану без каких-либо
непоправимых повреждений клетки. Однако
имеется достаточно доказательств тому,
что это 4иожет происходить. При ряде
инфекционных заболеваний возбудитель,
будь то вирус, бактерия или даже
простейший паразит, спокойно существует
и развивается в цитозоле живой клетки
больного. Он попал в клетку из
окружающей среды и таким образом успешно
преодолел плазматическую мембрану, не
уничтожив при этом клетку-хозяина.
Проникновение
сквозь завесу
Методы, с помощью которых эти
вторгшиеся агенты проникают через мембрану в
клетку, разнообразны, но всегда в их основе
лежит обман клетки, который мы можем
уподобить знаменитому троянскому коню.
Сначала атакующий микроорганизм
прикидывается беззащитной жертвой и без
сопротивления позволяет клетке поглотить себя.
Затем, когда излишне доверчивый хозяин
уже готов сбросить свою добычу в кислую
лизосомальную ванну, коварный захватчик
обнажает свое тайное оружие, которое
обычно представлено растворяющим мембрану
ферментом или токсином, вскрывающим
эндоцитарные вакуоли и освобождающим
микроорганизм до его разрушения.
Некоторые вирусы, например
возбудители гриппа, прибегают к еще более
Путь, по которому некоторые
инкапсулированные в мембрану
вирусы путешествуют от одной
клетки к другой
А1. Часть мембраны вируса
связана с плазматической
мембраной инфицированной
клетки. Вновь образованный
вирусный нуклеокапсид
приближается к этой области.
А2. Нуклеокапсид вдавливается в
вирусную мембрану и образует
выпячивание (типа почки).
A3. «Почка» отделяется от
клетки, высвобождая при этом
инкапсулированный в мембрану
вирус.
Б1. Вирусные частицы пойманы
клеткой Б путем эндоцитоза.
Б2. Эндоцитарная инвагинация
закрывается и образуется
эндосома, содержащая вирус.
БЗ. Под воздействием протонных
насосов внутренняя среда
эндосомы окисляется. Контакт с
кислотами способствует слиянию
вирусной мембраны с
эндосомальной мембраной, что
приводит к выходу свободных
нуклеокапсидов в цитоплазму.
тельца, состоящие из нуклеиновых кислот
и белков (нуклеокапсиды), в особые
кусочки плазматических мембран,
построенных по их указаниям. После встречи с
другой клеткой они подвергаются влиянию
различных процессов внутри беззащитной
жертвы, что в данном случае включает
и погружение в кислую ванну. Затем
происходит удивительная вещь: оболочка,
содержащая вирус, каким-то образом
возбуждается после местного контакта
с кислой средой, сливается с мембраной
вакуольной ловушки и выпускает своего
инфекционного обитателя в цитоплазму.
Такой механизм, вероятно, имеет место
в эндосомах перед их слиянием с лизо-
сомами.
Вот почему для безопасного
проникновения в клетку нам потребуется всего
лишь некий волшебный инструмент,
который можно занять (на время) у
микроорганизмов. У нас есть выбор между
химической «отмычкой» мембран и
автоматическим приспособлением, которое
запускается под воздействием кислоты и
открывает мембрану. Предлагаю
воспользоваться последним способом. Он не
потребует от нас никаких действий и на
нем не скажется неправильно
рассчитанное время. При этом мы вспомним то
волнующее состояние, которое пережили
раньше, когда впервые надели другой вид
лизосомно-защитного одеяния и
погрузились в глубины клеточной системы
вакуолей, изобилующей пещерами.
За кулисами
Наш «вирусный проводник» поступил
так, как и следовало ожидать, и теперь
мы находимся в центре цитоплазмы.
Вокруг нас много странных объектов,
и потребуется некоторое время для их
подробного изучения. Но сначала
необходимо хорошенько оглядеться.
Возможно, нашим первым впечатлением
будет ощущение, что мы находимся за
сценой какого-то театра и видим обратную
сторону декораций с веревками и блоками,
благодаря которым они двигаются. Эндосомы,
лизосомы, эндоплазматические цистерны,
мешочки и пузырьки аппарата Гольджи,
секреторные гранулы — все те структуры
в виде пузырьков, которые мы видели
только изнутри, теперь мы созерцаем
снаружи. Все вместе они составляют
тысячи шариков различных размеров и
форм, начиная от сферических структур и
кончая бесформенными мешочками.
Молочно-белые или блекло-коралловые, а иногда
охряно-коричневые лизосомы опалесцируют
в полутени цитоплазмы. Их поверхности
в основном атласно-гладкие, за
исключением тех шершавых участков, по
которым ползают полисомы, и небольших
конических или сферических
возвышенностей, образованных решетками клатри-
новых нитей. Позднее мы вернемся к
этим загадочным выростам.
Некоторые более крупные мембранные
мешочки, части эндоплазматического ре-
тикулума и аппарата Гольджи,
объединяются друг с другом витками трубчатых
соединений. Одни представляют собой
крупную систему, вялую и неподвижную,
поверхность которой изменяется только
при выдавливании внутреннего пенистого
содержимого. Другие медленно дрейфуют,
подхваченные каким-то внутренним цито-
плазматическим потоком, или неожиданно
делают сальто, словно подброшенные
невидимой пружиной. Между ними легко
и бесшумно двигаются стайки мелких
везикул, многие из которых имеют
наружную оболочку. В этом густом потоке
транспорта часто происходят столкновения.
Как правило, они не имеют последствий,
и оба партнера выпутываются из этой
ситуации, не пострадав. Но время от
времени в результате столкновения
происходит слияние или расщепление, что
вызывает небольшой местный взрыв, от
которого ударные волны распространяются
по всей цитоплазме.
Между этими, теперь уже знакомыми
нам частями импортно-экспортного
механизма разбросан ряд толстых
продолговатых телец ярко-розового цвета, резко
контрастирующих с окружением.
Размерами и формой они напоминают бактерии
и находятся в состоянии нескончаемого
движения — изгибаются, дергаются,
расталкивают соседние структуры с неустанным
автоматизмом, сходным с поведением
подростков в дискотеке. Время от времени
они взрываются и распадаются на
несколько частей или объединяются, образуя
фантастически похожие на гидру
структуры. Это митохондрии, главные центры по
Эндоплазматический
ретикулум
о
производству энергии в клетке (см. гл. 9).
В некоторых клетках, например в
печени или почках, можно встретить еще
один тип тускло-зеленых гранул,
окруженных мембраной. Это пероксисомы. Они
несколько меньше митохондрий и
встречаются в скоплениях, вероятно, из-за того,
что связаны друг с другом (гл. 11).
Если вместо животной клетки мы
посетим растительную, то зрелище,
открывшееся нашему взору, во многом будет
похожим, только еще более разноцветным
и ярким, ибо помимо уже перечисленных
компонентов мы встретимся с
ярко-зелеными центрами фотосинтеза — хлороплас-
тами (см. гл. 10). Нам также может
встретиться одна или несколько связанных
с мембраной вакуолей и гранул, в которых
растения откладывают свои запасы
крахмала и масла, а также те восхитительные
пигменты, которые украшают их цветы.
Но не следует думать, что это великолепие
является прерогативой только
растительного мира. Если человек представляет
собой тусклое, неяркое создание, цветовая
гамма которого зависит в основном от
цветового эффекта только одной черной
краски, меланина, упакованного в тельца,
называемые меланосомами, то окраска
многих других видов животных — птиц,
бабочек, рыб — по яркости не уступает
самым красивым цветам.
Вместе эти частицы занимают более
половины всего объема клетки.
Пространство между ними заполнено вязким,
желатинообразным матриксом,
образующим цитозоль или клеточный сок,
который является основным веществом клетки.
Этот отдел ограничен только
плазматической мембраной снаружи и мембранной
оболочкой, окружающей ядро внутри клетки.
Таким образом, мы можем свободно
двигаться в нем, огибая цитоплазматиче-
ские тельца, а иногда протискиваясь
сквозь них, если они плотно прижаты
друг к другу. Примерно так же нам
приходится поступать в каком-нибудь музее
авиации, загроможденном красочными
экспонатами.
И все-таки мы не настолько свободны,
как это кажется. Нашему движению
мешает целый ряд других препятствий.
С одним из них мы уже встречались
(детальнее рассмотрим в следующей главе).
Это рибосомы, которые обычно
представляют собой прядки из 10—20 частиц,
объединенных нитью информационной РНК.
До сих пор такие полисомы мы видели
только на поверхности мембран ЭР,
однако многие из них также свободно
плавают в цитозоле, где и выполняют
свои функции. Рибосомы с тонкими нитями
растущих полипептидных цепей
представляют собой вероломные ловушки, подобно
невидимым морским водорослям на пути
пловца.
В некоторых областях, например возле
гладких соединений, связывающих ЭР
с аппаратом Гольджи, мы можем
натолкнуться на почти непреодолимые
препятствия: плотные скопления белоснежных
частиц размерами с рибосому. Однако
если мы рассмотрим их в наше
молекулярное увеличительное стекло, то увидим,
что они очень отличаются от рибосом.
Каждая частица выглядит как отдельная
древовидная структура, разветвляющаяся
на тысячи отростков; в свою очередь,
каждый из них является цепью молекул
глюкозы, связанных друг с другом своими
концами. Это частицы гигантских
макромолекул крахмалистого полисахарида,
называемого гликогеном или иногда
«животным крахмалом». Гликогеновые «деревья»
обладают способностью объединяться в
небольшие «рощицы», которые образуют
«леса» поистине огромных размеров. Они
хорошо различимы под электронным
микроскопом и выглядят как агрегаты,
состоящие из небольших плотных частиц,
называемых «гликогеновыми озерами».
Другим препятствием на нашем пути
является железосодержащий белок ферри-
тин, темно-коричневая компактная частица
гораздо меньше молекулы гликогена. Хотя
под электронным микроскопом она едва
заметна, столкновение с ней довольно опасно:
почти на четверть ферритин состоит из
твердой гидроокиси железа. Добавим, что
по пути нам будут встречаться также
разбросанные крупные капли запасенного жира
с водоотталкивающими поверхностями.
И наконец, цитозоль во многих
участках перекрещивается довольно плотной
сетью перекладин и канатов, состоящих
из микронитчатых и микротрубчатых
элементов. Эти структуры объединяют
различные части клетки друг с другом;
они определяют форму клетки и отвечают
за ее прикрепление к соседним клеткам
и другим внеклеточным якорным точкам.
Сама по себе сеть не статична, отдельные
ее части постоянно разъединяются и вновь
объединяются, а то скользят друг мимо
друга благодаря маленьким молекулярным
двигательным элементам. От подобных
изменений зависит движение как внутри
клетки, так и ее самой. В гл. 12 мы
рассмотрим эти разнообразные структуры,
составляющие «кости и мышцы» наших
клеток.
Если отбросить гранулярные и
нитчатые элементы, населяющие цитозоль,
то все равно останется значительное
количество вещества — примерно одна треть
Электронная микрофотография
среза клетки печени
новорожденной крысы. В верхней
правой части можно видеть часть
ядра (Я), окруженного оболочкой.
Обратите внимание на поры в
ядерной оболочке и рибосомы,
прикрепленные к ней со стороны
цитоплазмы. Большая часть
цитоплазмы около ядра занята
параллельными рядами цистерн
шероховатого эндоплазматического
ретикулума (ШЭР). Расширенные
концы цистерн — промежуточные
элементы, заполненные продуктами
секреции, скорее всего в процессе
отрыва. Обратите также внимание
на срезы через одинаковые
элементы. Между цистернами
ШЭР находятся две митохондрии
(М), а также пероксисома (П).
Плотная область слева состоит
из частичек гликогена,
образующих гликогеновое «озеро»
(Гл).
от общей массы клетки. Оно состоит в
основном из водорастворимых компонентов
и образует непосредственно сам цитозоль.
Об архитектуре этой части живой клетки
много спорят. Одни исследователи считают,
что цитозоль функционирует как обычный
концентрированный раствор беспорядочно
разбросанного вещества. По мнению
других, это высокоорганизованная система,
составные части которой связаны между
собой специфическими взаимодействиями
или неподвижны благодаря сети «микро-
трабекул». Некоторые ученые придержи
ваются того мнения, что в цитозоле
происходят постоянные обратимые
переходы между этими двумя состояниями.
Такая концепция, получившая название
«трансформация зольгеля»,
сформировалась на заре коллоидной химии. Скорее
всего в каждой гипотезе имеется
рациональное зерно, а реальность представляет
собой компромисс между ними. В целом же
беспорядочность, вероятно, преобладает
над организацией. Судя по всему, цитозоль
каким-то образом проникает в любые
закоулки и щели клетки, не занятые чем-либо
другим. Он является основным ее наполни
телем, настоящим почвенным веществом
клетки, но наполнителем не инертным;
в нем разыгрываются некоторые наиболее
жизненно важные события, в частности те,
что связаны с энергией. И хотя цитозоль —
не единственный энергетически важный
участок, а для многих клеток и не самый
главный, однако это, по всей видимости,
самая древняя с точки зрения
геологического времени часть клетки и поэтому
он может много рассказать о зарождении
жизни.
Энергия — извечная проблема
Жизнь — это активный процесс,
зависящий от постоянно совершающихся
различных видов работы. Возьмем, к
примеру, наиболее типичные ее
характеристики: рост и размножение. В создании
новой клетки принимают участие тысячи
молекул белков, нуклеиновых кислот,
углеводов, жиров и других сложных веществ
из крахмала или из сравнительно простых
строительных блоков. Для этого клеткам
необходима энергия. Иными словами, они
должны уметь получать энергию из окру-
жающего пространства и использовать ее
для совершения химической работы. Кроме
того, живые организмы двигаются,
вырабатывают электричество, преобразуют свое
окружение, иногда даже излучают свет.
Все это требует энергии. Как мы увидим
при посещении митохондрий и хлоро-
пластов, эволюция подошла к проблеме
клеточной энергии весьма продуманно. Но
нужные решения потребовали около
одного миллиарда лет для своего
осуществления. Между тем на протяжении всего этого
времени жизнь бурно развивалась. Как же
она справлялась с проблемой энергии?
Мы предполагаем, что энергетическая
проблема решалась с помощью различных
систем, которые в настоящее время
имеются в цитозоле. Разумеется, доказательств
этому у нас нет, так как невозможно
повернуть время вспять, чтобы выяснить, как
все происходило на самом деле. Нет также
никаких следов и доказательств того, как
совершалась каждодневная работа
ранними формами жизни в остатках и
отпечатках древних организмов. Единственное, о
чем они свидетельствуют, это о том, что
около 3,2 миллиарда лет назад
существовал микроб Eobacterium isolatum, который,
судя по отпечаткам, обитал кое-где в горах
Южной Африки и был очень похож на
некоторые современные бактерии. Следы
еще более раннего микроорганизма, Jsua-
sphaera, существовавшего 3,8 миллиарда
лет назад, обнаружены в Гренландии.
Почти с уверенностью можно сказать, что в
те древние времена в атмосфере Земли
содержалось очень мало кислорода,
который, как принято считать, является в
основном продуктом фотосинтеза. Таким
образом, Isuasphaera, Eobacterium и
многие потомки этих бактерий могли
получать энергию с помощью анаэробных
механизмов — механизмов, способных
поддерживать жизнь (греч. bios) без
(отрицание по-гречески — а-) воздуха (греч. аег).
То, что мы обнаруживаем в цитозоле
высших клеток и в клеточном соке многих
современных бактерий, является
анаэробным механизмом выработки энергии, который
известен как гликолиз. Сказанное дает
основание предположить, что эта система
почти не претерпела изменений и мало
отличается от той, которая имелась в
первых живых организмах, начавших населять
Землю около 4 миллиардов лет назад.
В самом деле, в гликолизе сохранилось
много примитивных черт, в том числе
относительная простота. В этом отношении
цитозоль можно рассматривать как
хорошую основу процесса снабжения
биологической энергией. Но, чтобы наше посещение
оказалось плодотворным, нам необходимо
более острое зрение, чем то, которым мы
пользовались до сих пор. Это требуется
не столько для того, чтобы различать
сложные молекулярные структуры — их
количество будет строго ограничено и
минимально, — сколько для того, чтобы
понять ключевые концепции, без которых мы
скорее всего не сможем разобраться в
решениях энергетической проблемы,
стоявшей перед жизнью.
Имеется и другой исторический аспект,
касающийся этой части нашего
путешествия. В некотором роде мы пойдем по
стопам ранних исследователей,
которые впервые выдвинули принципы
биоэнергетики, поскольку анаэробный
гликолиз смело можно назвать колыбелью
динамической биохимии. Можно даже
сказать, что он явился ключевым
элементом в развитии человеческой цивилизации.
О его существовании люди узнали
тысячелетия назад, столкнувшись с процессом
брожения, и наши далекие предки
прибегали к нему для изготовления закваски,
сыров, алкогольных напитков. Однако эти
старинные отрасли промышленности
оставались почти полностью эмпирическими до
1856 г., когда некий Биго, винодел из
французского города Лилля, неожиданно
оказался перед угрозой разорения. По
какой-то непонятной причине содержимое в
чанах, где происходило брожение сахарной
свеклы, прокисло и вместо спирта
образовалась молочная кислота. Биго обратился
за помощью к молодому химику из Парижа,
незадолго до того поступившему на работу
в местный университет и, по слухам,
превосходно себя зарекомендовавшему.
Молодой ученый согласился помочь и в конце
концов решил проблему и спас предприятие
Биго. Одновременно он сделал открытие,
которое перевернуло многие научные
представления: оказывается, анаэробное
брожение вызывается живыми
микроорганизмами. Имя этого молодого ученого — Луи
Пастер. Позднее, в 1897 г. немецкий химик
Эдуард Бухнер обнаружил, что чистый
«сок», выделяемый дрожжами, — не что
иное, как цитозоль дрожжевых клеток, и
он способствует превращению сахара в
спирт. Таким образом, Бухнер показал,
что функции микроорганизмов в процессе
спиртового брожения — чисто химический
процесс, не зависящий от особой
жизненной силы, свойственной живым
организмам, как полагал Пастер. Бухнер также
положил начало химическому изучению
системы гликолиза, существующей в цито
золе клеток, и тем самым проложил путь
обширным исследованиям, благодаря
которым мы в настоящее время имеем полное
представление о метаболизме.
Термин «метоболизм» происходит от
греческого слова, обозначающего
изменения (буквально «акт разбрасывания», от
ballein — бросать). Этим словом
обозначается совокупность химических процессов,
протекающих в живых организмах.
Метаболизм подразделяется на анаболизм (греч.
ana — вверх) и катаболизм (греч. kata —
вниз). Анаболизм включает все процессы,
требующие затрат энергии и
термодинамически являющиеся эндергоническими
(греч. endon — внутри; ergon — работа).
Главная его функция — биосинтез.
Катаболизм составляют реакции, производящие
энергию, в связи с чем они называются
экзергоническими (греч. ех'—из). При
необходимости катаболизм поддерживает
анаболизм, так же как и все другие
работы, выполняемые живыми организмами
(кроме тех реакций, которые снабжаются
энергией непосредственно от внешних
источников, в основном света).
К тому времени, когда Бухнер сделал
свое открытие, были известны только
некоторые общие черты отдельных
метаболических процессов, их механизмы
оставались невыясненными. Гликолиз — первый
из изученных метаболических процессов.
Потребовалась 40-летняя упорная работа
многих ученых с мировым именем, прежде
чем был завершен этот поистине
титанический труд, который до сих пор остается
одним из самых замечательных и
многообещающих примеров научного детектива
всех времен. Однако удалось выяснить
всего какой-нибудь десяток химических
реакций, менее одной сотой от того
количества метаболических реакций, которые
были изучены за последующие 40 лет.
Важность открытия гликолиза заключается
в том, что оно было первым. Зная
только исходную точку — простую
молекулу сахара глюкозы и конечный
продукт — молочную кислоту в одном
случае и этиловый спирт и углекислый
газ — в другом, даже самые
проницательные химики-органики не могли бы
предугадать удивительно сложный окольный
путь, по которому движется природный
процесс. Каждый шаг сулил
неожиданность, а выяснение всех этапов
потребовало от исследователей огромного терпения
и упорства, особенно если учесть крайне
примитивный уровень приборов того
времени: несколько пробирок для проб,
горелку Бунзена, весы, световой микроскоп.
Но как только путь прояснился, он стал
маяком, освещающим весь ход
последующих событий. Для нас гликолиз также
будет служить маяком в нашем путеше
ствии.
Гликолиз: производящая
энергию «змея»
Дрожжевые клетки перерабатывают
сахар в этиловый спирт (этанол) в процессе
двенадцати последовательных химических
реакций, которые образуют реакционную
цепь (метаболическую «змею»):
Глюкоза -—► А -—► В ► J —*
>- К ► Этанол + СО2.
Такой же путь проходят до десятой
ступени молочнокислые бактерии (те са
мые, что загрязняли чаны винодела Биго^;
те же процессы происходят и в наших
мышцах, когда им приходится делать
внезапное усилие. Только на одиннадцатой
ступени их путь разветвляется и
становится иным, чем у дрожжей; при этом
происходит превращение промежуточного
продукта J (пировиноградной кислоты) в
молочную кислоту вместо образования
СОг и этилового спирта.
Таким образом, спиртовое и
молочнокислое брожение отличаются только в
самом конце реакционной цепи. До этого
они проходят один и тот же маршрут,
известный как гликолитическая цепочка.
Этот маршрут не оставляет заметного
следа в цитозоле, ибо у «змеи» нет ощутимой
плоти. Если мы оденем наши химические
«очки», обладающие большим увеличением,
то увидим хаотическое, беспорядочное
движение молекул А, В, ..., J, К, смешанных
с множеством других промежуточных про-
Реакции анаэробного брожения
вызываются живыми
микроорганизмами. Рисунок,
принадлежащий Луи Пастеру,
изображает увиденное им под
микроскопом в капле свекольного
сока при брожении.
дуктов других реакций. Объединяют все
эти реакции и составляют плоть «змеи»
стрелки; каждая из них указывает на
наличие специфических ферментов (гл. 2),
которые катализирурт указанные
химические превращения. Последовательность
участия двенадцати ферментов,
вовлеченных в гликолитическую цепь,
автоматически вытекает из природы их
субстратов и продуктов реакций. Реакция, дающая
начало образованию D из С, должна
непременно последовать сразу же после
превращения В в С и предшествовать
образованию Е из D. Для направления
молекул к месту их назначения никаких
физических каналов не требуется.
Кажущийся хаос, который мы видим,
заключает в себе высокую степень
упорядоченности, динамическую организацию,
обусловленную свойствами участвующих
ферментов.
Этот урок гликолиза можно обобщить.
За каждой из тысяч химических реакций,
протекающих в живых клетках,
скрывается фермент. Сейчас это общеизвестный
факт, но его установили только после того,
как была разгадана гликолитическая цепь,
ответственная за спиртовое брожение
в дрожжевых клетках. Энзимология, наука
о ферментах, значительно обогатила наше
понимание как самой жизни, так и химии
и теперь начинает приносить большую
практическую пользу. Ферменты, выделенные из
природных источников, широко
используются в промышленности. Условия нашего
путешествия не позволят нам детально
останавливаться на этой важной отрасли
биохимии. Но мы должны постоянно помнить
о том, что любая наблюдаемая нами
деятельность независимо от ее природы
обусловлена каталитическим участием ферментов.
Ферментам, как правило, помогают
дополнительные вещества, называемые
кофакторами или коферментами. В гликолизе
необходимо обратить внимание на два
кофактора. Один из них называется НАД,
что означает ликотинамидадениндинуклео-
тид. Как вы еще заметите, биохимики
очень любят сокращения. Но у них есть
оправдание: большинство веществ, с
которыми им приходится иметь дело, слишком
сложные, чтобы их можно было называть
полностью при каждом упоминании.
НАД.— одно из них, и мы даже не будем
пытаться рассматривать его химическую
структуру. Однако хотелось бы отметить,
что никотинамидная часть молекулы — это
витамин РР, что означает pellagra preven-
tiva. Его нехватка в пище вызывает
пеллагру — тяжелое заболевание системы
пищеварения, ранее широко
распространенное на Американском континенте. И это
не единственный пример. Большинство
витаминов действуют как коферменты или
являются их частью, именно поэтому
организм не может обходиться без витами-
нов. С функцией НАД мы познакомимся
несколько позднее.
Другой кофактор, который следует
рассмотреть, обозначается как АТФ, или
аденозинтрифосфат. В конечном итоге нам
придется изучать его структуру, но в
данный момент необходимо знать лишь, что
молекула АТФ может быть гидролизована
(разрушена с помощью воды) на адено-
зиндифосфат (АДФ) и неорганический
фосфат (Фн) и, наоборот, может быть
образована (с потреблением энергии) при
конденсации АДФ и Фн с выделением
воды:
АТФ + Н2О ^"термическая дДД) + ф
эндотермическая
Важность функции АТФ в процессе
гликолиза выяснилась после того, как
было показано, что разрушение глюкозы
связано с образованием АТФ: при
превращении каждой молекулы глюкозы в
молочную кислоту или этиловый спирт
происходило фосфорилирование двух молекул
АДФ и превращение их в АТФ. Эта
взаимосвязь непоколебима. Если синтез
АТФ не происходит, например в случае
нехватки АДФ, гликолиз прекращается.
Истинный смысл этого удивительного
явления выяснился только после
установления энергетики самого процесса.
Брожение глюкозы приводит к высвобождению
свободной энергии: на каждую
грамм-молекулу (г-моль) распавшейся глюкозы
образуется около 47 килокалорий (ккал).
С другой стороны, образование АТФ из
АДФ + Фн требует затрат энергии: около
14 ккал на 1 г-моль образующегося АТФ.
Следовательно, из 47 ккал,
высвобожденных при разрушении глюкозы, 2x14=28 ккал,
или 60% идет на образование АТФ,
вместо того чтобы рассеиваться в виде тепла.
Гликолиз снабжает энергией синтез АТФ;
в объединении этих двух процессов и
заключается механизм восстановления
энергии.
Изучение этого вопроса, как и прежде,
началось с гликолиза. Когда позднее
последовательно были открыты другие ката
болические процессы, оказалось, что и они
связаны с образованием АТФ. Не только
гликолиз, но катаболизм в целом снабжает
энергией процесс образования АТФ:
взаимосвязь лежит в основе универсального
механизма восстановления энергии.
Что же можно сказать относительно
самой молекулы АТФ? Зачем нужен ее
синтез? Ответ на этот вопрос, вернее намек
на ответ, впервые был получен в начале
1930-х годов, после того как выяснилось,
что мышца, теряющая способность к
гликолизу после отравления (моноиодуксусной
кислотой), все же может осуществлять
небольшую часть работы за счет запасен
ной, «связанной с фосфатом энергии».
Со временем было показано, что
химическая реакция, прямо связанная с
сократительным механизмом, есть не что иное,
как гидролиз АТФ до АДФ и Фн.
Следовательно, АТФ является недостающим
связующим между гликолизом и мышечной
работой. Гликолиз способствует
образованию АТФ; расщепление АТФ снабжает
энергией работу мышц:
V2 Глюкозач /АДФ + Фн
Y у Работа
Молочная кислота ^^ АТФ + Hi О
Это было открытие необычайной
важности, распахнувшее одну из главных
дверей на пути к пониманию сущности
живого. Ибо не только мышечная работа,
В хаотическом беспорядочном
движении молекул А, В J, К
каждый фермент выбирает свой
собственный субстрат и переводит
его в следующий промежуточный
продукт в метаболической цепи.
Порядок создается из хаоса
благодаря специфичности
ферментов.
В результате обязательного
связывания клетка вынуждена
использовать 60% энергии,
высвобожденной в процессе
гликолиза, для получения АТФ из
АДФ -}- Фн. В свою очередь
расщепление АТФ снабжает
энергией различные виды
биологической работы.
но и практически любой другой вид
работы, выполняемой живыми организмами,
снабжается энергией от АТФ. Рассмотрим,
хотя бы поверхностно, любой биодвигатель,
будь то ионный насос в мембране,
сократительные волокна в жгутике, генератор
света в личинке светляка или любые
другие сложные синтетические реакции,
посредством которых живые организмы
вырабатывают свои собственные
компоненты: практически всюду мы обнаружим
АТФ, выступающий в виде источника
энергии. Это главное топливо жизни, и функция
катаболизма заключается в способности
поддерживать восстановление АТФ:
Пищевые продукты ч /АДФ + Фн.
Y ^Работа
Продукты распада ^^АТФ + Н2О
Иллюстрацией такого взаимодействия
служит классический (исторический)
пример анаэробных дрожжей. Этот организм
растет и размножается, достигая
удивительного совершенства химической
инженерии и передачи информации, с тем
только, чтобы могла образоваться одна-
единственная новая крошечная клетка ;
дрожжей, полностью похожая на свою
предшественницу. Все это дрожжевая
клетка делает за счет превращения сахара в
спирт, используя этот процесс как
единственный источник энергии. И эта энергия
через АТФ питает тысячи различных
процессов, подобно тому, как энергия
сжигаемых угля или нефти, преобразованная
в электричество, обеспечивает
удивительные достижения современной технологии.
Во время нашего путешествия мы
постоянно будем обращаться к АТФ.
Последний урок, который мы получаем,
изучая гликолиз, касается механизма
сопряжения. Для этого необходимо
внимательнее рассмотреть анатомию нашей
гликолитической «змеи». Возможно, эта
часть путешествия кое-кому из туристов
покажется чересчур сложной. К сожалению,
более простого пути нет. Клетка — это
биохимическая машина. Ее работу
невозможно понять без хотя бы поверхностного
знакомства с определенными
физико-химическими представлениями.
Горение без доступа воздуха
С химической точки зрения, гликолиз
заключается в простом делении пополам
молекулы глюкозы и перестройке ее
атомов, которые не приводят ни к
приобретению, ни к потере материи:
или
б|гб
(глюкоза)
о,н12о6 —
(глюкоза)
2СН3-СНОН—СООН
(молочная кислота)
- 2СН3—СН2ОН
(этанол)
2СО2
Подсчитайте количество атомов с двух
сторон стрелок, и вы обнаружите
одинаковое количество атомов углерода,
водорода и кислорода. С головы до хвоста
«змея» не приобретает и не теряет массы.
Однако между этими частями в теле
«змеи» возникают довольно сложные и тон
кие изменения; все они направлены на
осуществление одной-единственной
функции — получение АТФ. Это происходит на
шестой и седьмой стадиях гликолиза в
результате сложного процесса
окислительно-восстановительного фосфорилиро-
вания.
Роль пяти стадий, предшествующих
этой основной реакции, заключается в
подготовке молекул глюкозы к участию в ней.
Это весьма сложная и дорогостоящая
работа, так как она связана с
превращением 6-углеродной молекулы глюкозы в
две молекулы фосфорилироваиного 3-угле-
родного соединения, называемого фосфо-
глицериновым альдегидом. Две фосфатные
группы, необходимые для этой цели,
поступают от АТФ, так что мы
сталкиваемся с поистине парадоксальной
ситуацией: реакция, предназначенная для
образования АТФ, начинается с ее
потребления! И это не исключение. Многие
питательные вещества прежде, чем стать
пригодными для расщепления, требуют
активизации, которая происходит с
потреблением энергии. Это еще один из видов
поденной работы, которая взвалена на
молекулу АТФ, ответственную за все
хозяйство клетки. Разумеется, начальный
вклад энергии в последующем с лихвой
оправдывается, иначе он был бы
бессмысленным.
С образованием фосфоглицеринового
альдегида мы подходим к главнейшей
реакции гликолиза, которая заключается в
окислении этого компонента в фосфогли-
цериновую кислоту и сопряженном с
ним конденсировании АДФ и Фн в АТФ.
Не станем останавливаться на всех
деталях этой реакции, ибо это увлечет нас
в дебри химии. Но один из аспектов
заслуживает внимания: речь идет об
истинном значении слова «окисление». Всем нам
знакомо выражение, что мы получаем
энергию, «сжигая» пищу. Но аналогия с
каким-то типом двигателя внутреннего
сгорания, которая при этом возникает в
нашем сознании, является искажением
реальности, а потому нуждается в исправлении.
Строго говоря, превращение
фосфоглицеринового альдегида в фосфоглицериновую
кислоту происходит при добавлении одного
атома кислорода к альдегидной группе
(СНО) с образованием карбоксильной
группы кислоты (СООН). В этом смысле
процесс напоминает тип окисления,
сопровождающий сгорание. Однако при
сгорании на воздухе из атмосферы поступает
дополнительный атом кислорода, чего нет в
нашем случае. Гликолиз — это анаэробный
процесс, который происходит при полном
отсутствии кислорода. Здесь мы имеем
дело со «сгоранием без доступа воздуха».
Но если не атмосферный кислород, то
что же является источником
дополнительного атома кислорода, приобретаемого
фосфоглицериновым альдегидом? Ответ на
наш вопрос — вода, хотя это не обычная
вода из окружающей среды. Это молекула
воды, которая получается из совместного
конденсирования АДФ и Фн и поступает
непосредственно в реакции окисления в
химически связанной форме. Мы
указываем на этот факт, заключив Н2О в скобки;
теперь, если обозначить оставшийся фос-
фоглицериновый радикал буквой R,
уравнение реакции будет выглядеть следующим
образом:
АДФ + Фн-
R—СНО + (Н2О) -
АТФ +(Н2О),
R-COOH—2Н.
Из уравнения видно, что смысл
окислительной стадии заключается в удалении
водорода. Это так называемая
дегидрогенизация. Но здесь мы вновь должны
проявить осторожность. Водород,
образующийся в этой реакции, не является
газообразным водородом Н2, стабильной
двухатомной молекулой. Это реактивный атом
водорода, Н, который никогда не
встречается в свободной форме, но переносится
или обменивается при посредничестве
носителей в такой форме или в виде
отдельного электрона (е~), с которым он
свободно уравновешивается согласно
взаимодействию
Протоны, или ионы водорода, Н+,
участвующие в этом равновесии, всегда
имеются в водной среде благодаря
диссоциации воды:
H2O^Hf +OH".
Таким образом, окислительную реакцию
гликолиза можно записать и как
удаление электронов:
R —CHO+
2H + .
То, что справедливо для гликолиза,
справедливо и для большинства других
окислительных реакций в живых
организмах. Как правило, реакции биологического
окисления происходят без
непосредственного участия кислорода, путем удаления
атомов водорода или электронов. Такой тип
реакций, по-видимому, унаследован с тех
давних времен, когда впервые зародилась
жизнь, и подвергался эволюции на
протяжении сотен миллионов лет в отсутствие
атмосферного кислорода. Когда
окисляемая молекула приобретает кислород, как,
например, в рассматриваемом случае,
источником дополнительного кислорода
служит вода или какие-либо реакции, при
которых образуется вода.
Что касается атмосферного кислорода,
который необходим для всех аэробных
организмов, в том числе и для нас с вами,
его роль заключается в том, чтобы
собирать электроны, высвобождающиеся при
окислительных реакциях:
72О2+ 2е~ + 2Н+^Н2О.
Конечный результат тот же, что и при
обычном процессе сгорания, однако
механизм иной. В этом легко убедиться с
помощью тяжелого изотопа 18О, который
можно отличить от широко
распространенного изотопа |6О в масс-спектрографе.
Если глюкоза сжигается в печи в
присутствии 18Ог, изотоп будет выявляться в
составе образующегося СО2, что
свидетельствует о соединении углерода глюкозы с
атмосферным кислородом. Если же
глюкоза сжигается в живом организме,
дышащим 18О2, то образующийся изотоп мы
найдем не в составе выдыхаемого СО2, а
в НгО. Это, на первый взгляд, тривиальное
различие составляет суть разницы,
существующей между жизнью и смертью. Ни у
одного организма не развился способ
восстанавливать энергию в биологически
пригодной форме из реакции окисления при
сгорании. Напротив, имеются бесчисленные
способы извлечения энергии посредством
электронного переноса. Время от времени
мы будем возвращаться к этому важному
вопросу. Необходимо отметить, что в
некоторых биологических реакциях
действительно происходит добавление кислорода.
Такие реакции, называемые реакциями
оксигенации (в отличие от реакций
окисления), не принимают . непосредственного
участия в окислительном процессе
восстановления энергии.
Реакция, обратная окислению, —
приобретение атомов водорода или
электронов — называется восстановлением. Так
как электроны и атомы водорода не
способны циркулировать в свободном виде в
водной среде, оба вида реакций тесно
связаны между собой. Электроны не могут
высвобождаться, не будучи «пойманными»;
если одно вещество окислилось, другое
непременно должно восстановиться. Вот
почему реакции всегда бывают
окислительно-восстановительными (с переносом
электронов). Ферменты, катализирующие
такие переносы электронов, называются
электронтрансферазами или оксидоредук-
тазами.
На основной окислительной стадии
гликолиза акцептором электронов является
НАД"1", окисленная форма кофактора НАД,
роль которого в этом и бесчисленном
множестве других метаболических
процессов определяется способностью выступать
в качестве переносчика электронов:
НАД+ + 2е~ + Н+ — НАДН.
Тогда полная реакция электронного
переноса схематически запишется в
следующем виде:
R-CHO -|- (Н2О) + НАД+ —
-~ R—СООН + НАДН + Н+
Это и есть реакция, связанная с
образованием АТФ (из которой, как вы,
вероятно, помните, она получает свою скрытую
молекулу воды). Каков бы ни был
механизм этого сопряжения, он означает, что
перенос одной пары электронов от фосфо-
глицеринового альдегида к НАД"1",
во-первых, высвобождает свободную энергию,
достаточную для образования одной
молекулы АТФ, и, во-вторых, подвергается
ограничению, ибо этот процесс может
происходить только при одновременном
образовании АТФ.
Формально эту систему можно
рассматривать как электрохимический
преобразователь, который превращает поток
электронов в химическую работу. Поэтому
мы можем применить общую теорию
электричества, которая гласит следующее:
максимальное количество работы (реальная
работа всегда меньше из-за неизбежных
потерь тепла), которое может быть
выполнено электрическим двигателем,
определяется (в джоулях) количеством электричест-
ва (в кулонах), проходящего через
двигатель, умноженным на разность потенциалов
(в вольтах) электрического генератора.
В данном случае мы знаем количество
работы. Она требует затраты 14 ккал
(586 кДж) для образования 1 г-моль АТФ.
Нам также известно количество
электричества, проходящего через систему:
2 электрона на молекулу образующегося
АТФ, или 2 электрон-эквивалента, или
фарадея (2x96 500=193 кКл) на
1 г-моль АТФ. Если разделить джоули
Гликолитическая «змея»,
рассеченная таким образом, чтобы
можно было увидеть
электрохимический синтезатор
АТФ, связанный с основным телом
электронным циклом. В петле 2
(реакции 6 и 7) электронная пара
падает вниз на 300 мВ от
фосфоглицеринового альдегида к
НАД+. При этом происходит
сопряженное конденсирование
АДФ и Фн в АТФ. В петле 4
(реакции 11 — молочнокислое
брожение и 12—спиртовое
брожение) электронная пара
возвращается в основное тело
«змеи» от НАДН.
на кулоны, получится минимальное
напряжение нашего электрического источника:
0,3 В или 300 мВ. Другими словами,
перенос электронов между фосфоглицери-
новым альдегидом и НАД+ должен
происходить при разности потенциалов как
минимум 300 мВ, иначе он не сможет
снабдить энергией синтез АТФ.
Конечно, гликолитическая «змея»
построена далеко не так, как обычный
электрический генератор. Она не имеет
штепсельных розеток, в которые можно было бы
вставить вольтметр и проверить наше
заключение. Но в ней содержится донор
электронов (фосфоглицериновый альдегид)
и акцептор электронов (НАД+). Чтобы
перенос электронов произошел, сродство
к электронам у акцептора должно быть
сильнее, чем у донора. . Это сродство
можно измерить. Оно называется
окислительно-восстановительным, или редокс-
потенциалом, и выражается в вольтах.
Каждая редокс-пара
(восстановитель/окислитель, например, фосфоглицериновый
альдегид/фосфоглицериновая кислота,
НАДН/НАД+) обладает своим
характерным редокс-потенциалом. Как мы уже
9—1452
установили в ходе предыдущих расчетов,
при переносе пары электронов,
необходимом для образования одной молекулы АТФ
из АДФ и Фн, разность между
окислительно-восстановительными потенциалами в
парах донора и акцептора должна быть
не меньше 300 мВ, что в действительности
соответствует двум парам при гликолизе.
После того как главная задача, а
именно образование АТФ, успешно решена,
гликолитическая цепочка должна
завершить свои дела и подвести итог
проделанной работе. Это составляет основную
функцию оставшейся части цепочки.
Необходимо решить судьбу трех участников
гликолиза: 1) фосфата, который
первоначально был пожертвован цепи молекулой
АТФ; 2) воды, которая поступила в цепь
на окислительной стадии с тем, чтобы
снабдить дополнительным кислородом фос-
фоглицериновую кислоту, и 3) электронов,
которые покинули цепь на той же стадии.
Эти дисбалансы теперь компенсируются.
Во-первых, молекула воды отщепляется.
Во-вторых, фосфатная группа
возвращается к АДФ для восстановления АТФ,
который был затрачен в самом начале
процесса. И, в-третьих, НАДН возвращает
свои электроны.
При молочно-кислом брожении
акцептором является пировиноградная кислота,
которая восстанавливается до молочной
кислоты:
СНз—СО—СООН + НАДН + Н+ -^
— СНз-СНОН-СООН + НАД+
При спиртовом брожении акцептором
является ацетальдегид — продукт декар-
боксилирования пировиноградной кислоты,
который восстанавливается до этилового
спирта:
СНз—СО—СООН -* СНз—СООН + СО2,
СНз—СОН -f НАДН -f H+ -*
— СНз—СН2ОН 4- НАД+
Последние электронные переносы
происходят при очень малой разности
потенциалов, без какой-либо энергетической
выгоды. Они необходимы лишь для того,
чтобы сделать систему автономной. Если
отрезать хвост «змеи» и заменить его
другим акцептором для сбора электронов,
поступающих от НАДН, система будет
по-прежнему превосходно справляться со
своей работой по производству АТФ,
только теперь уже в качестве
окислительной системы, и ее конечным продуктом
будет пировиноградная кислота:
С6Н,2Об — 2СН3—СО-СООН 4- 4е+ + 4Н+
(глюкоза) (пировиноградная
кислота)
Окфос1:
золотой энергетический
механизм жизни
Некоторые детали гликолигической
«змеи», будучи всеобъемлющими,
применимы ко всему энергетическому обмену.
Наиболее универсальное из этих
обобщений касается производства АТФ. Всюду
в природе эта главная часть
энергетической «валюты» образуется, как и при
гликолизе, в результате сопряженных
электрохимических реакций, которые
связывают фосфорилирование АДФ с
переносом электронов посредством разности
электрических потенциалов. Исключений
из этого правила нет. Животные, растения,
грибы, бактерии, все живые существа,
включая человека, получают АТФ в
результате процессов, состоящих из таких
сопряженных реакций. Как и следовало
предположить, в природе происходит
множество разнообразных реакций этого типа
и их химия зачастую сложна. Не станем
вникать в детали этих реакций, но все же
попытаемся отчасти понять работу
основных энергетических центров клетки при
их посещении.
Назовем системы, которые
катализируют окислительно-восстановительное
фосфорилирование окфос-блоками, и
представим их схематически в виде закрытой
в ящике молнии, как это изображено
на рисунке. Обратите внимание на то, что
употребляемая нами терминология и
символы не относятся к общепринятому языку
биохимии. Они введены здесь
исключительно для облегчения восприятия
материала в процессе нашего путешествия.
1 Слово «окфос» образовано из первых двух
букв слова «окислительное» и первых трех букв
слова «фосфорилирование». — Прим. перев.
ТФ+ Н20
АДФ +фн
Окфос-блок — универсальный
генератор энергии. Он получает
пару электронов от
восстановленного донора (Д) и
возвращает ее к окисленному
акцептбру (А) на уровне
потенциала, который как минимум
ниже на 300 мВ. Путь электронов
через окфос-блок проходит таким
образом, чтобы АДФ и Фн
объединились в АТФ с
высвобождением воды. Этот
механизм часто бывает
обратимым, что позволяет
электронной паре подниматься на
уровень потенциала почти на
300 мВ выше за счет гидролиза
АТФ.
В основе окфос-блока лежит принцип
электрохимического преобразователя,
который объединяет процесс сборки одной
молекулы АТФ из АДФ и Фн с падением
двух электронов посредством разности
потенциалов, равной 300 мВ. Электроны
поступают в окфос-блок от донора (Д),
который переходит из восстановленного
состояния в окисленное, и собираются на
другом конце акцептором (А), который
превращается из окисленного состояния
в восстановленное. В зависимости от
природы участвующих в процессе молекул
протоны могут сопровождать или не
сопровождать электроны.
При гликолизе донорная пара
представлена фосфоглицериновым альдегидом/фос-
фоглицериновой кислотой, а акцепторная
пара -- НАД+/НАДН. Но это лишь
частный случай. В других системах
используются другие доноры или акцепторы или
совокупность тех и других; в результате
создается огромное количество окфос-бло-
ков с самыми разнообразными
механизмами работы. На нашем пути встретятся
многие из них. Одни, как, например, при
гликолизе, получают электроны от
метаболических субстратов и поэтому о них говорят,
что они катализируют реакции фосфорили-
рования субстратного уровня. Ряд других,
включая наиболее значимые, например,
те, что протекают в митохондриях и хлоро-
пластах, питаются электронами от НАДН
и других носителей. Они катализируют
реакции фосфорилирования на уровне
носителей; механизм их действия полностью
отличается от механизма, наблюдаемого
при фосфорилированиях субстратного
уровня. Подробнее на этих механизмах мы
остановимся в гл. 9.
Окфос-блоки получают энергию от
потока электронов. Для работы им
необходимо соединиться с источником, а также
коллектором электронов. Гликолиз и другие
виды анаэробного брожения обладают
характерной особенностью, заключающейся
в следующем: их поток электронов питается
от одного-единственного потока вещества
благодаря тому, что метаболическая цепь
вырабатывает свой собственный конечный
акцептор электронов. Главное
преимущество этого вида метаболизма в том, что от
окружающей среды требуется только
соответствующее питание, например глюкоза. Но
в то же время он необычайно
расточительный, ибо конечные продукты брожения,
такие, как молочная кислота или этанол —
энергетически богатые молекулы. Как мы увидим
в дальнейшем, когда они покидают клетку,
то свыше 90% потенциальной энергии
глюкозы остается неиспользованными. Такого
не должно быть, и, действительно, это
исключительный случай. Чаще электроны,
высвобожденные в окислительных
реакциях, собираются непосредственно или
косвенными путями экзогенным электронным
акцептором; в этом случае клетке не
нужно отказываться от ценных веществ, и ка-
таболическая деградация субстрата может
продолжаться дальше. Но тогда для
поддержания потока электронов требуется
двойной поток вещества.
Вещества, способные выполнять роль
электронного акцептора, в изобилии
встречаются в природе: это сульфатный ион
Пищевые
продукты
• (НгО)
Продукты
брожения
Пищевые
продукты
АТФ (+Н2О)
АДФ + Фм
С02, S 05~ и т. д.
Н2О
АТФ + Н2О
Н2О
2НГ
■>
J
АДФ + Фн
При анаэробном брожении
одного потока вещества
достаточно для поддержания
электронного потока и сборки
АТФ через окфос-блок благодаря
тому, что акцептор электронов
образуется метаболически из
донора электронов. При гликолизе,
например (см. рис. на с. 129),
мировиноградная кислота (или
ацетальдегид) образуется из
фосфоглицеринового альдегида.
SO4" (который может быть восстановлен
до S или сероводорода H2S); ион железа
Fe)+ (который быстро восстанавливается
до Fe2+); нитратный ион NO5" (который
быстро превращается в нитритный N0^
и далее в аммиак 1МНз); ССЬ (который
может быть восстановлен до метана,
СН4) и даже простой протон, Н+ (который
может превратиться в газообразный
водород, Н2). Самым распространенным и
эффективным электронным акцептором
является молекула кислорода, Ог, которая
восстанавливается до воды, НгО (а иногда
до перекиси водорода, Н2О2).
Каждое из перечисленных веществ
наряду со многими другими используется не
которыми организмами в качестве
электронных акцепторов благодаря
соответствующим ферментам. Их восстановление
лежит в основе многих природных явлений;
в частности, им объясняются сернистые
испарения, преобразования
железосодержащих пород, рециркуляция атмосферного
азота, а также таинственные излучения
в виде призрачных блуждающих огоньков,
которые вспыхивают на поверхности болот..
Между бактериями, вызывающими эти
У аэробных гетеротрофов для
поддержания потока электронов и
сборки АТФ через окфос-блок
необходим двойной поток
вещества. Один из них вводит
электроны, получаемые из
продуктов питания, в окфос-блок.
При участии воды они окисляются
до конечных продуктов распада.
Другой поток, поддерживаемый
кислородом, служит для сбора
электронов из конечных окфос-
блоков.
явления, и бесчисленным множеством
живых организмов, в том числе человеком,
который дышит атмосферным кислородом,
имеется скрытая общая связь: все они
поддерживают вырабатывающие энергию
метаболические процессы окисления с
помощью экзогенного акцептора электронов.
Здесь мы сталкиваемся с новым
важным обобщением. Не только глюкоза, но
любое другое питательное вещество,
используемое живым организмом для
поддержания своих энергетических
потребностей, снабжает электронами АТФ-генери-
рующий окфос-блок. Просто нет другого
источника метаболической энергии для
гетеротрофных организмов — тех, что пи
таются продуктами биосинтетической
деятельности других организмов (греч. hete-
ros — другие; trophe — пища). Аутотрофы
(греч. autos — сам) также поставляют
электроны в окфос-блоки, но из других
источников.
«Сгорание» пищи для получения
энергии на деле означает расщепление
пищевых продуктов и обогащение их
кислородом за счет воды таким образом, чтобы
можно было получить электроны, которые
поступают в АТФ-генерирующий окфос-
блок, из которого они затем собираются
кислородом (или каким-либо другим
акцептором).
Как мы увидим при посещении
митохондрий, жизнь проявила удивительную
изобретательность в использовании этого
потока электронов, поставив на пути
метаболических электронов до четырех
последовательных окфос-блоков. Многие
электроны, спускаясь вниз, преодолевают разность
потенциалов примерно в 1 В и более.
Таким путем может быть восстановлено и
использовано для образования АТФ почти
80% свободной энергии, высвобождаемой
при окислении продуктов питания. Мы еще
вернемся к этому вопросу в гл. 9.
Поток электронов:
обобщенное представление
Не все виды обмена электронов
происходят через АТФ-генерирующие окфос-
блоки. Довольно часто электроны
переносятся через небольшую разность
потенциалов с незначительными изменениями в
свободной энергии. Иногда они
наталкиваются на более существенную разность
потенциалов, но без какого-либо
принуждения, которое позволило бы клетке
использовать высвобождаемую энергию.
В этом отношении биологические
электроны можно уподобить рекам. Как и
водопады, крутые падения электронов
встречаются не часто, и не всегда каждое из
них используется в качестве источника
энергии на электростанции.
Подобный «гидродинамический» образ
полезен: он заставляет нас помнить о том,
что электроны не всегда текут внутри
живых клеток, как они это делают в
электрическом проводнике; их обмен происходит
на разных стадиях между
восстановленным донором и окисленным акцептором.
В результате донор окисляется и
становится способным выступать в роли
акцептора для другого донора, занявшего более
высокий энергетический уровень. Акцептор
же после восстановления может служить
донором для акцептора более низкого
энергетического уровня. Итак, электроны
падают от одного носителя к другому до
тех пор, пока не достигнут конечного
акцептора. Им обычно является кислород.
Вот почему электроны не плывут вниз,
Воображаемый «каскад
электронов». Каждый бассейн
содержит редокс-пару. Соединения
между бассейнами образуются
за счет электрон переносящих
ферментов. Высота бассейна над
уровнем моря определяет
направление потока и высоту
его падения. Многие электроны,
падающие вниз с 300 мВ
или больше (для пары
электронов), участвуют в работе
механизмов, восстанавливающих
энергию (окфос-блоков).
преодолевая пороги разного уровня, как
это свойственно рекам, а низвергаются
через ряд последовательных крутых
ступеней различной высоты. «Карты» электрон
ных потоков живых клеток напоминают не
столько естественную сеть водных путей,
сколько системы взаимосвязанных
бассейнов, которые столь искусно возводились
в XVII в. в садах очень богатых людей.
Но в отличие от садовых архитекторов,
которые старались использовать красоты
ландшафта для эстетического
наслаждения, естественный отбор отдавал
предпочтение такому виду энергии, который
использовал очертания «местности» так,
чтобы вырабатывалось как можно больше
уступов для падения электронов. При этом
высота уступов была достаточной, чтобы
окфос-блоки снабжались энергией.
Аналогия с гидродинамикой помогает
нам оценить важный аспект переноса
электронов, о котором мы упоминали лишь
вскользь, а именно абсолютный уровень
потенциала, при котором электроны либо
отдаются, либо принимаются. В нашем
представлении это соответствует высоте
бассейнов, их положению над уровнем
моря. Располагая такими данными, мы
можем точно предсказать по разнице высот
между двумя бассейнами направление
потока воды между ними, а также
максимальную энергию, которую можно
получить от падения определенного количества
воды из более высокого бассейна в
бассейн, расположенный ниже (или, наоборот,
минимальную работу, которую необходимо
проделать, чтобы накачать определенное
количество воды вверх из нижнего
бассейна в верхний).
Эквивалентом высоты над уровнем моря
для электронных резервуаров является
окислительно-восстановительный потенциал
(в вольтах) соответствующих редокс-пар.
Зная его, можно легко установить
происходящие энергетические изменения. Но
для оценки потенциальной энергии
электронов удобнее рассчитать свободную энергию
реакции для каждого отдельного случая,
при котором одна пара
электрон-эквивалентов переносится на кислород с
образованием воды. Мы выбрали кислород
в качестве акцептора из-за его
универсальной функции конечного электронного
акцептора у всех аэробных организмов.
Взять, к примеру, пару НАДН/НАД4 .
Мы установили реакцию
НАДН + Н+ + 7гО2 ► НАД+ + Н2О.
Свободная энергия этой реакции
ДСокисл.(надн/над*) выражается в
килокалориях на пару электрон-эквивалентов и
служит прямым выражением максимального
объема работы, которая может быть
совершена при падении электронов из
бассейна с НАД и на всем протяжении их
пути вниз в направлении к пункту,
который для большинства организмов
является нулевым уровнем энергии: к воде.
Это соответствует электронному
потенциалу (не путать с
окислительно-восстановительным потенциалом) пары НАДН/НАД+
Как и все изменения свободной энергии,
электронные потенциалы меняются вместе
с изменением состояния системы. В приве-
Графическое изображение
электронного потока через
гл и политическую цепь. При
«физиологических» условиях
(пунктирные линии) система
находится в равновесии. На правой
(голубой) стороне изображена
ситуация, при которой нисходящий
электронный поток, сопряженный
с образованием АТФ,
устанавливается в результате
увеличения электронного
потенциала пары
фосфоглицериновый
альдегид/фосфоглицериновая
кислота и снижения потенциала
молочная кислота/паровиноградная
кислота. Подобные изменения
связаны с соответствующими
изменениями в соотношении
концентрации восстановленной
и окисленной формы в каждой
паре. В левой (красной) стороне
изображена ситуация, при
которой восходящему потоку
электронов, поддерживаемому за
счет гидролиза АТФ, оказано
предпочтение.
денном примере концентрация НАДН и
НАД"1", а также иона водорода (рН),
парциальное давление кислорода и
температура— все вместе определяют точное
значение Дбокисл. (НАдн/нАд+Ь Ясно, что мы не
в состоянии осуществить столь тонкие
измерения, и в большинстве случае мы не
располагаем необходимыми для этого
данными. Все, что можно сделать, это
попытаться как можно точнее представить
условия, характерные для живой клетки.
Установленные при этом показатели
АСокисл будут называться
«физиологическими» электронными потенциалами;
кавычки служат напоминанием о том, что
мы имеем дело с приблизительными
значениями, подверженными определенным
отклонениям даже в идеальных условиях.
При гликолизе «физиологические»
электронные потенциалы приблизительно равны
—63 ккал на пару электрон-эквивалентов,
перенесенных на кислород для каждой
пары фосфоглицериновый альдегид/фос-
фоглицериновая кислота, и около — 49 ккал
на пару электрон-эквивалентов,
перенесенных на кислород для каждой пары
НАДН/НАД+, так же как и для пар
этанол/ацетальдегид и молочная кислота/
пировиноградная кислота. Эти величины,
^ Глицериновый альдегид/(ф) Глицериновая кислота
Молочная кислота/Пировиноградная кислота
приведенные здесь со знаком минус, чтобы
указать на экзергоническую природу
происходящих реакций, показывают, что
гликолиз происходит почти при
термодинамическом равновесии. Между фосфоглицери-
новым альдегидом и НАД+ разность
потенциалов составляет 14 ккал на пару
электрон-эквивалентов; этого вполне
достаточно, чтобы снабдить энергией сборку
1 г-моль АТФ. Между НАДН и ацеталь-
дегидом или пировиноградной кислотой
разность потенциалов незначительная. Это
означает, что система легко обратима и
направление потока электронов зависит от
незначительных изменений. Когда гликолиз
выполняет катаболические функции, как
мы установили в этой главе, уровень в
верхнем бассейне несколько выше или
ниже, чем в нижнем бассейне, по
сравнению с указанным, поэтому поток
электронов может свободно направляться вниз и
поддерживать энергетически сборку АТФ.
Но если уровень электронов изменяется
в обратном направлении и АТФ поступает
из другого источника, поток электронов
тоже изменяет свое направление, и
гликолиз начинает выполнять анаболическую
роль. Так происходит, например, в печени,
когда углеводы образуются из
неуглеводных источников (глюконеогенез), и у расте
ний (у которых вместо НАД имеется
НАДФ), когда требуемый АТФ
производится в процессе вырабатывания световой
энергий (см. гл. 10).
Обратите внимание на следующее:
«цена» образования АТФ не более постоянная
величина, чем «стоимость» любого другого
вида «физиологической» свободной
энергии. Она сама по себе подвержена
колебаниям, будучи зависимой от
внутриклеточных концентраций АТФ, АДФ и
неорганического фосфата. Если, например,
концентрация АТФ снижается, а АДФ —
повышается, что случается в процессе
тяжелой работы, то для образования АТФ
потребуется менее 14 ккал /г-моль, и
равновесие гликолитического окфос-блока
соответственно изменится. Как мы увидим в
гл. 9 и 14, основной регуляторный
механизм данного явления зависит именно от
такого рода взаимодействия.
8
Цитозоль: перенос
и биосинтез групп
Куда отправляется АТФ после того,
как покидает окфос-блоки? На этот
вопрос ответить не просто, так как АТФ
устремляется в сотни невидимых
направлений, иными словами, проникает через сотни
градиентов концентраций, — туда, где
совершается работа и потребляется АТФ.
Некоторые из этих путей ведут к
мембранам, доставляя к ним топливо,
необходимое для работы транспортных механизмов,
например натрий-калиевого насоса. По
другим АТФ поступает к сократительным
волокнам для поддержания механической
работы. Однако большинство путей
останавливается здесь, в цитозоле, где АТФ увле
кается какой-нибудь молекулой. После
некоторой борьбы часть АТФ присваивается
столкнувшейся с ним молекулой. Эта связь
обычно кратковременная и вскоре
прерывается в результате нового столкновения
и образования новой связи. Так может
продолжаться еще раза два, но в
конечном счете обмены молекулярными группами
заканчиваются образованием устойчивой
связи между двумя строительными
блоками, используемыми клеткой для построения
своих составных частей.
Движущийся АТФ
Какой бы ни была отправная точка
АТФ, каким бы извилистым ни был
маршрут этой молекулы, большинство путей
АТФ в цитозоле направлено на
выполнение главной функции — биосинтеза.
Установив схемы движений молекул АТФ, мы
находим ответы на ключевой вопрос,
которого мимоходом касались в предыдущей
главе: каким образом клетке удается
построить тысячи различных соединений,
пользуясь одним-единственным источником
энергии, а именно расщеплением АТФ на
АДФ и Фн — важнейшим процессом,
который восстанавливается благодаря окфос-
блокам? Попробуем рассмотреть эту
проблему в более точных выражениях.
Большинство биосинтетических реакций
представляют собой дегидратационное кон
денсирование между двумя молекулярными
строительными блоками:
Х-ОН + Y-H ► X-Y -f Н2О.
Имеется много различных «иксов» и
«игреков». В их число входят
аминокислоты, комбинация которых друг с другом
дает белки; простые сахара, которые
объединяются в полисахариды и другие
углеводные компоненты; мононуклеотиды,
которые полимеризуются в нуклеиновые
кислоты; жирные кислоты, которые,
объединяясь с глицерином и другими спиртами,
образуют липиды, а также множество
других, более специализированных
молекул. Для правильного их объединения
необходимы два условия: информация и
энергия.
Биосинтетические группировки не
образуются беспорядочным образом. Они
основываются на определенном типе X,
который связывается с определенным типом Y.
Как правило, указания, согласно которым
происходит правильный выбор
биосинтетического партнера, закодированы в
специфичности вовлеченных в процесс
ферментов. При образовании самих
ферментов инструкции поступают от генов,
которые замыкают круг, снабжая самих себя
информацией для собственного удвоения.
Мы не станем сейчас подробно
останавливаться на этом аспекте проблемы.
Энергетическая потребность биосинтеза
обусловлена тем, что дегидратационное
конденсирование не может происходить
спонтанно в водной среде.
Подавляющий избыток воды сдвигает равновесие
такой реакции далеко в
противоположную сторону, а именно в сторону
гидролиза. Чтобы процесс стал обратимым,
необходимо проделать работу, а для
этого свободная энергия должна
поступать в систему из какого-то внешнего
источника. В живой клетке таким
источником служит гидролиз АТФ, благодаря
которому, как уже указывалось, на
1 г-моль производится 14 ккал энергии:
АТФ + Н2О -* АДФ + Фн.
В зависимости от типа реакции на
образование каждой молекулы X—Y
потребляется одна или более молекул АТФ.
Общий баланс свободной энергии всегда
отрицательный, что не только соответствует
законам энергетики, но и чаще всего
делает биосинтетические процессы по
существу необратимыми при любых условиях.
Возникает вопрос: каким образом энергия
передается из одной реакции в другую?
Происходящим вначале расщеплением
АТФ и последующим использованием
высвобожденной в итоге энергии для
связывания X и Y этого не объяснить. Все», что
мы можем получить в результате
гидролиза АТФ, — это тепло, т. е. беспорядочное
движение молекул, которое в условиях,
преобладающих в живой клетке, не может
направляться и использоваться для снаб
жения энергией специфического процесса.
Расщепление АТФ и образование X—Y
должны быть сопряжены, только тогда
один процесс будет снабжать энергией
другой. Секрет такого сопряжения прост:
никогда не рвать настоящую связь, всегда
производить взаимный обмен с помощью
механизма группового переноса.
Групповой перенос:
второй золотой
энергетический механизм
жизни
Групповой перенос — основа
биосинтеза. Его проявления бесконечно
разнообразны и часто крайне запутаны, но главный
принцип удивительно прост. По существу
он заключается в переносе химического
радикала или группы от донора к акцептору.
Схематически этот процесс выглядит так:
А—В -f С ** [А В С] ^ А + В—С,
где буквами А, В и С обозначен вид
молекулярных группировок, в частности В —
переносимая группа. Как видно из схемы,
в групповой перенос вовлечены некоторые
виды неустойчивых триад промежуточных
продуктов (они показаны внутри скобок),
в которых одна группа временно
принадлежит бывшему и настоящему партнерам.
Это типичный пример извечного
треугольника на молекулярном уровне: А—В
представляют собой достаточно счастливую
пару до появления С, который после
некоторого непонятного обмена партнерами
уводит с собой В. В соответствии с той
злодейской ролью, которую в данном
случае играет С, подобную реакцию можно
представить как нападение С на В или Как
лизис (расщепление) группы А—В под
влиянием группы С. (Пример: гидролиз,
при котором вода выступает в качестве
атакующего агента.) Жертва атаки, А,
называется остаточной группой. Если
реакция протекает справа налево, то группы
меняются ролями: А является атакующей
группой или литическим агентом, а С —
остаточной группой. И в том, и в другом
случае происходит перенос В, что
позволяет считать термин «перенос» наиболее
удачным для обозначения этого процесса.
Чтобы подобного рода драма могла
произойти среди людей, необходимы два
условия. Во-первых, ее участников должны
связывать интимные отношения.
Во-вторых, В должен иметь большую склонность
или сродство к С, чем к А, что делает связь
В—С более прочной, чем А—В. Если
помнить о дистанции, отделяющей мир
человека от мира молекул, то окажется, что
реакции переноса групп подчиняются тем
же двум условиям.
Первое из них — кинетическое условие
реакции. Обычно требуется участие
специфического фермента или трансферазы,
способствующих достаточно тесному контакту
А—В с С (или В—С с А), с тем чтобы
появилась возможность дестабилизации
существующей связи и образования
промежуточного продукта, состоящего из трех
составных частей. В клетках содержатся сотни
таких групповых трансфераз. Вместе с
электронными трансферазами они составляют
более 90% общего количества ферментов
в живом организме.
Вторым условием является
термодинамика. Если связь В—С сильнее, чем А—В,
для разрыва связи В—С необходимо
приложить больше усилий, чем для А—В.
Это означает, что при связывании В с С
теряется больше свободной энергии, чем при
связывании В с А. Поэтому на
энергетической шкале группа В в связи В—С располога-
ется ниже, чем в А—В, и при первой возмож-
Групповой перенос требует двух
условий: 1) наличия фермента
(трансферазы), способного
сближать молекулы А—В и
атакующее вещество С таким
образом, чтобы был возможен
перенос В, и 2) В должен иметь
большее сродство к С, чем к А
(например, групповой потенциал
связи В—С должен быть ниже,
чем у связи А—В).
ности упадет на еще более низкий уровень.
То же можно сказать и о человеческих
отношениях: проникнувшись чувством к одному
человеку, мы не гарантированы от того, что
не влюбимся в большей степени в другого.
Но в мире молекул важна не только сила
двух связей. Относительное содержание
четырех участников (А—В, С, А и В—С)
также очень важно. Молекулярные
«супружеские неверности» — массовые события,
вовлекающие множество участников. Связь,
способная устоять перед десятком
атакующих групп, не выдержит штурма 10 000
групп из-за влияния концентрации на силу
химических реакций.
Большинство переносчиков
биологических групп действуют согласно механизму
так называемой нуклеофильной атаки; это
означает, что атакующий агент обладает
сродством к положительно заряженным
радикалам (ядро атома заряжено
положительно) . Электрофильные атаки
встречаются реже, если не считать наиболее
ярко выраженной формы — электронного
транспорта.
Нуклеофильные атаки обычно
осуществляются отрицательно заряженными
ионами или их протонированными двойниками
В первом случае реакция особенно простая
Если имеются протонированные агенты
то происходит обмен протонов со средой,
как при электронном переносе:
В обеих формулах нестабильный
тройственный промежуточный продукт имеет
одинаковую структуру. Он состоит из двух
отрицательно заряженных групп,
соперничающих между собой за право обмена
электронной парой с таким же
положительно заряженным радикалом В+:
Победителем, как мы уже видели,
окажется тот, кто свяжется с группой на более
низком энергетическом уровне. Очень
важно звать энергетический уровень,
занимаемый данной группой в ее различных
положениях; не менее важно знать и
энергетический уровень, занимаемый электронами,
поскольку в данном случае можно
предсказать спонтанные направления
группового переноса между любыми двумя
партнерами и одновременно рассчитать
максимальное количество работы, которое может
быть совершено при этом переносе (что
является в то же время и минимумом,
который необходим для того, чтобы
реакция переноса пошла в обратном
направлении).
Наиболее удобным способом оценки
энергетического уровня переносимых групп
в данной комбинации представляется
определение ее свободной энергии гидролиза
ЛОридр, т. е. свободной энергии, высво
бождаемой при атаке группы со стороны
воды или гидроксильного иона ОН~
Например,
А—В + Н2О^ АН + В-ОН
или
В—С
f В—
Свободная энергия этих реакций
гидролиза называется групповым потенциалом.
Установленные для «физиологических»
условий, которые приближаются к
условиям, преобладающим в живой клетке,
групповые потенциалы позволяют правильно
оценить энергетические уровни
переносимых групп, так же как электронные
потенциалы характеризуют переносимые
электронные пары. В обоих случаях мы
измеряем уровни относительно наиболее
распространенных природных веществ, служащих
для нас точками отсчета: НгО или ОН~, вые
тупающих в роли акцептора групповых по
тенциалов, О2 (до Н2О), выступающего
в роли акцептора электронных потенциалов
(Обратите внимание на важную роль воды.)
Согласно сказанному выше,
«физиологические» показатели ДОгидр (а-в) и
AGrHap (ВС) представляют собой группою
вые потенциалы группы В в ее
комбинациях А—В и В—С соответственно. «Физиоло
гическую» свободную энергию при переносе
группы В от А—В к С несложно вычислить
из разности двух групповых потенциалов:
AGnepenoc = А^гидр. (A-B) — А^гидр. (В- С) •
Если (отрицательный) потенциал А—В
больше по абсолютной величине В—С, то
AG переноса отрицательный: В падает с
более высокого энергетического уровня в
А—В на более низкий в В—С; его перенос
из А—В в С может происходить
спонтанно. В обратном случае перенос будет эндер-
гоническим, и В должен быть снабжен
свободной энергией, чтобы подняться с
более низкого уровня в А—В на более
высокий в В—С.
Групиовы-е потенциалы также
оказываются удобными средствами для оценки
свободных энергий сопряженных
биосинтетических реакций. Если, например, де-
гидратационная сборка одной молекулы
X—Y (см. с. 137) поддерживается
гидролизом п молекул АТФ и расщеплением их
на АДФ и Фн, то независимо от
механизма сопряжения справедливо следующее
взаимоотношение:
AG6
(АТФ-АДФ) —
Как было впервые показано Фрицем
Липманном, одним из основателей
современной биоэнергетики, связи,
обнаруживаемые в природных веществах, бывают
двух видов: высокоэнергетические,
обозначаемые волнистой линией (~), и
низкоэнергетические, обозначаемые прямой
линией (—). Концевая связь АТФ с
фосфатом — прототип высокоэнергетических
связей. Многие связи, имеющиеся в
природных соединениях (эфиры, амиды, пептиды,
гликозиды), являются
низкоэнергетическими; их «физиологические» групповые
потенциалы составляют от —6 до —8 ккал на
1 г-моль. Именно благодаря различию
между двумя типами связей протекает
гидролиз АТФ, снабжающий энергией
биосинтетические процессы. На вопрос, каким
образом это происходит, ответ гласит:
с помощью двуликого Януса.
Знакомство с Янусом,
двуликим посредником
У древних римлян было божество по
имени Янус — в честь него назван месяц
январь. Янус был двуликим — одно его
лицо обращено в прошлое, другое — в
будущее. Биохимия открыла своего Януса в
качестве связующего демона биосинтеза. Он
образуется в результате нуклеофильной
атаки кислородсодержащего строительного
блока (X—ОН или X—О ) на АТФ или
какую-либо родственную богатую энергией
молекулу, которую мы обозначим условно
А—В, чтобы не вдаваться в дебри химии.
Атака начинается атомом кислорода:
В этой реакции осуществляется перенос
радикала В+ (группы В) от А—В к X—О .
Двойственный характер структуры В—О—X
объясняется тем, что она может также
участвовать в переносе радикала Х+
(группы X), например при атаке со стороны строи
тельного блока Y—Н или Y~:
Теперь посмотрим, что происходит,
когда две реакции протекают одна за другой.
Активация
Половина реакции, записанная слева на
приведенной выше схеме, означает
следующее (принимая во внимание обе левые
стрелки):
справа
Мы наблюдаем гидролиз А—В и дегид-
ратационное конденсирование X—Y. Но
воды в этой реакции нигде нет. Она
переносится в скрытой форме от X—ОН к В—ОН
центральным атомом кислорода Януса,
когда происходит (в большей или меньшей
степени) возврат группового потенциала от
А—В в связь X—Y. Таким образом, Янус
выполняет роль передатчика связанной с
группой энергии и носителя скрытой воды;
образно говоря, это Меркурий и Аквариус
в одном лице, если позволительна такая
вольность в отношении мифологии.
Этот механизм можно подтвердить
экспериментально, добавив к клеткам
молекулы X—ОН, меченные тяжелым
изотопом — кислородом |8О, и
проанализировав продукты реакции на
масс-спектрографе. 18О обнаруживается в В—ОН, а
не в воде, как можно было бы ожидать,
если бы реакция представляла собой
обычное дигидратационное конденсирование.
Таков многоликий механизм биосинтеза
Но суть его всегда заключается в после
довательном транспорте групп, связанных
двуликим промежуточным звеном
(посредником). Характерные анатомические черты
посредника — две способные к переносу
группы, связанные центральным атомом
кислорода. При приближении к ним слева
можно увидеть богатую энергией группу В,
связанную с носителем X—О~. При
приближении справа вполне убедительно
покажется, что группа X предлагается
носителем В—О~.
Согласно этой общей схеме, биосинтез
всегда происходит как минимум в два
этапа, объединенных Янусом. Первый этап,
зависящий от какого-либо типа переноса
групп от энергетического донора (АТФ или
другой родственной молекулы), необходим
для того, чтобы поднять группу X с
нулевого энергетического уровня (X—ОН) на
высокоэнергетический уровень, который она
занимает в Янусе. Этот этап называется
активацией. Второй, заключительный этап
или сборка, во время которого группа X
переносится к ее естественному
акцептору Y, сопровождается понижением уровня
активации с высокоэнергетического до
уровня X—Y.
В одном из вариантов этого основного
двухэтапного механизма, имеющем важное
значение, Янус жертвует свою
активированную группу носителю, который сам
переносит ее к конечному биосинтетическому
акцептору, как показано ниже в
последовательности реакций.
В таком трехэтапном механизме
группа X, в комбинации с носителем, остается
на сравнительно высоком энергетическом
уровне, оставляя основную часть энергии
для последнего этапа сборки (см. выше),
что вполне соответствует процессу,
который приводит к образованию стабильного
продукта. Таким образом, работа клетки во
многом напоминает работу носителя,
который сначала поднимает строительные
материалы вверх с помощью подъемного
крана, затем передвигает их вокруг в
горизонтальном направлении и только после
этого опускает на место.
В ряде случаев активация и сборка
осуществляются ферментом, затем катали-
зирующим какой-то согласованный
процесс, в котором Янус остается связанным
с ферментом. Такие бифункциональные
ферменты называются синтетазами или лигазами
(лат. ligare — связывать). Без них многие
биосинтетические процессы были бы
неэффективными или вовсе бы не происходили.
Промежуточные продукты часто
представляют собой крайне нестабильные молекулы,
которые не в состоянии долго
существовать в одиночку. Нередко они являются
соединениями с таким высоким групповым
потенциалом, что не могут с помощью
сопряженного расщепления донорской груп-
Последовательный групповой
перенос. В первой реакции В
отделяется от А с помощью
атакующего агента X,
предлагающего кислород. Но в
игру вступает новый атакующий
агент Y, он отделяет X от В,
который остается, удерживая
кислород, ранее привлекший его
к себе. Промежуточный продукт
В—О—X, так называемый
двуликий Янус, состоит из двух
способных к переносу групп,
участвующих в реакциях I и II,
объединенных кислородом, который
переходит от одного «владельца»
к другому.
Активация
Н
А—
Промежуточная
сборка
Н
Янус
Н
—Y
Конечная сборка
Активация
'--* С - >
Транспорт
(нулевой энергетический уровень).
Сборка
—Y
пы А—В, единственного источника энергии,
образовываться в концентрациях,
достаточно высоких для их эффективного
распространения между двумя физически
разобщенными ферментами. Посредники
связаны с ферментами и стратегически
располагаются таким образом, чтобы их можно
было немедленно захватить в процессе
экзергонической сборки. Такое
расположение помогает преодолеть трудности
описанного процесса.
С другой стороны, зачастую для клетки
важно, а иногда даже необходимо, чтобы
два этапа синтеза происходили на разных
участках. Активация требует затрат
энергии и участия АТФ; обычно она
происходит в цитозоле или каком-нибудь участке,
тесно связанном с цитозолем и
снабженном молекулами АТФ, например на цито-
зольной стороне мембраны. Что же
касается сборки, то она во многом зависит от
получения информации, которая легко
обеспечивается структурным субстратом,
например рибосомами при синтезе белка
или нуклеиновыми кислотами в
хромосомах. Другое преимущество поэтапного
физического разделения заключается в том,
что при этом обеспечивается
централизация. Одной-единственной реакции
активации достаточно для каждой группы X,
чтобы затем ее можно было перенести в
готовой к утилизации форме к любому коли-
Двуликий Янус состоит из двух
способных к переносу групп,
связанных центральным атомом
кислорода. Атакуемый слева, он в
результате отдает группу В + ,
справа — группу Х+. В каждом
случае оставшаяся группа
остается с кислородом.
честву участков сборки. На самом же деле
экономия энергии еще больше: клетка
часто использует этап транспортировки для
модификации или какого-либо изменения
группы X, так что энергия от одной реакции
может питать несколько биосинтетических
блоков для химической модификации
каждого из них.
Когда сборка отделена от
активации, требуется стабильная транспортная
форма активированного строительного
блока; вот почему этап активации должен быть
достаточно экзергоническим сам по себе,
чтобы производить достаточные
концентрации вещества. Этим требованиям отвечают
некоторые посредники Януса; их часть
В—О выступает в качестве носителя
группы X. В других случаях требования
удовлетворяются благодаря специфическим
носителям. Почти неизменно в таких случаях
активация строительных блоков и их
прикрепление к носителю совершаются одним
ферментом типа лигазы, а несколько
важных коферментов являются носителями
групп.
Роль активации как предпосылки
метаболического процесса не. ограничивается
биосинтезом. На самом деле значительная
часть метаболизма требует прежде всего
активации субстрата. Это характерно так-
При биосинтезе стадия активации
служит для поднятия
строительного блока X на
высокоэнергетический уровень
(групповой потенциал) при
помощи АТФ. На стадии сборки
группа переносится к конечному
акцептору Y со значительным
снижением потенциала. В ряде
случаев активированная группа
переносится с небольшим
снижением потенциала на
носитель С, от которого она
затем переходит к конечному
акцептору Y.
Активация
Транспорт
Сборка
же для многих катаболических реакций,
как мы могли убедиться на примере
гликолиза. Таким образом, носители групп
служат своего рода «рукоятками»,
посредством которых присоединенные молекулы
представляются модифицирующим фер
ментом.
Но вот наконец настало время облечь
схематические абстракции в химическую
плоть. Готовясь к нашему путешествию, мы
всячески старались избегать химических
тонкостей. Но есть предел тому, что можно
понять в основополагающем механизме
химии без знания химического языка. Те, для
кого следующая часть нашего путешествия
покажется слишком сложной, не должны
терять самообладания. Даже если они во
многом пропустят ее, то позже смогут
присоединиться к нам без особого труда. Те
же из вас, кто имеет лучшую подготовку по
биохимии, надеюсь, получат удовольствие
от путешествия и, возможно, с высоты
птичьего полета смогут по-новому
взглянуть на биосинтез. Итак, приглашаем
последовать за нами.
Источник энергии
группового переноса
В сокращенном названии АТФ буквой А
обозначен аденозин. Это нуклеозид,
который определяется как комбинация
основания, в данном случае аденина с атомом
1 углерода рибозы — пятиуглеродного
сахара, или пентозы. В подобных нуклеозид-
ных комбинациях с рибозой участвуют три
других важных основания: гуанин,
который, как и аденин, относится к группе
пуринов, цитозин и урацил — представители
пиримидинов. Соответствующие нуклеозиды
называются гуанозином (Г), цитидином
(Ц) и уридином (У).
Не останавливаясь подробно на
структуре оснований, сконцентрируем наше
внимание на другом конце молекулы нуклеози-
да, который занят атомом углерода в
положении 5 рибозы (его принято обозначать
5' в отличие от атома 5 основания). Этот
углерод несет гидроксильную группу ОН,
которая в наиболее естественных
сочетаниях с нуклеозидом несет форфорильную
группу. Такие нуклеозидмонофосфаты
называются нуклеотидами; они обозначаются
как адениловая, гуаниловая, цитидиловая
или уридиловая кислоты или сокращенно
АМФ, ГМФ, ЦМФ, УМФ, где буквы МФ
обозначает монофосфат.
С этой концевой фосфорильной группой
нуклеотидов могут связываться
дополнительно одна-две фосфорильные группы по
типу связи, которая имеется в пирофосфор-
ной кислоте (пирофосфатная связь).
В этих случаях образуются нуклеозиддифос-
фаты АДФ, ГДФ, ЦДФ и УДФ, а также
нуклеозидтрифосфаты АТФ, ГТФ, ЦТФ и
УТФ (табл. 2).
Таким образом, обозначив нуклеозид
символом N (который означает А, Г, Ц или
У) и связав его с 5'-гидроксильной груп-
Таблица 2
Основание
Аденин
Гуанин
Цитозин
Урацил
Нуклеозид
Аденозин (А)
Гуанозин (Г)
Цитидин (Ц)
Уридин (У)
Нуклеозид-
монофосфат
Адениловая
кислота
(АМФ)
Гуаниловая
кислота
(ГМФ)
Цитидиловая
кислота
(ЦМФ)
Уридиловая
кислота
(УМФ)
Нуклеозид-
дифосфат
АДФ
ГДФ
ЦДФ
УДФ
Нуклеозид-
трифосфат
АТФ
ГТФ
ЦТФ
УТФ
пои, получим
N—ОН
О
и
N—О— Р—0"
1
о-
0
II
II
N—О—Р—0—
1
О'
0
0
II
II
р—о-
1
0"
0 0
Нуклеозид (Н)
Нуклеозид-
монофосфат
(НМФ)
Нуклеозид-
дифосфат
(НДФ)
N—О— Р—О— Р—О— Р—0~ Нуклеозид-
а I p I y I трифосфат
О- О" О- (НТФ)
Все НТФ являются настоящими супер-
янусоподобными типами молекул, трижды
двуликими. Три атома кислорода,
связанные с фосфорильными группами (а, р, y)>
по отдельности представляют собой
определенные пары групп, способных к переносу.
Это свойство делает НТФ чувствительными,
по крайней мере теоретически, к
воздействию шести видов нуклеофильных атак,
которые можно обозначить следующим
образом: ар, <Xd, PP, Pd, Yp» Yd, где а, р, y —
связи, подвергающиеся атаке, а индексы р и
d — проксимальный и дистальный концы
(по отношению к N):
а у
0]
Y ' Г»
J ?
О
L
р-
О"
(А-
о
f
О"
Уб
На самом деле все эти реакции
происходят крайне неравномерно. За
исключением редких атак ар и pd, все
биосинтетические атаки на НТФ происходят в
положениях рр и Yd- До сих пор неизвестны
случаи атак ad или Yp-
Большинство биосинтетических
процессов можно классифицировать как
регулярно действующие двух- и трехступенчатые
механизмы, зависящие от одного из
указанных выше типов атак. Как и следует
ожидать в этой весьма сложной области,
основная тема иногда сопровождается
вариациями. Но для знатоков, которыми
мы можем считать всех туристов, которые
до сих пор не покинули нас, решение этой
проблемы не составляет труда. Один нети
пичный, на первый взгляд, случай проис
ходит, когда НТФ действует по типу
Януса, в качестве донора группы в про
цессе конечной сборки. Однако нам только
кажется, что этот одноступенчатый
механизм не подчиняется правилу двух этапов.
Группа, которая жертвуется НТФ,
подвергается предварительной активации — со
стороны ли группы, которая переносится
от какой-либо другой молекулы НТФ, или
благодаря работе окфос-блока, или в
результате и того и другого — перед тем,
как осуществляется ее экзергонический
перенос. В таких случаях этап активации
совпадает с фазой восстановления
обычного двух- или трехступенчатого механизма
(см. с. 146—149).
Групповые потенциалы, участвующие в
различных видах атаки на НТФ,
различаются между собой. Как уже
упоминалось, «физиологическая» свободная
энергия гидролиза связи y в АТФ равна
примерно — 14 ккал/г-моль. Все концевые
фосфорильные группы в НТФ и в НДФ
имеют одинаковый групповой потенциал.
В отличие от них «физиологическая»
свободная энергия гидролиза связи р в НТФ
значительно выше, частично из-за
различия стандартной свободной энергии
гидролиза (около 3 ккал/г-моль) и, что важнее,
из-за того, что большинство клеток
содержат высокоактивные пирофосфатазы, гид-
ролизующие неорганический фосфат по
мере его образования. Поэтому гидролиз
р-связи сопровождается гидролизом
образующегося пирофосфата:
НТФ + Н20^ НМФ + ФФн ДСгидр
ФФн -|- Н2О
НТФ + 2Н2а~* НМФ + 2Фн
(общий)
Такой же конечный результат может
быть достигнут при гидролизе сначала у-,
а затем р-связей; в каждом из этих
случаев «физиологические» свободные энергии
реакций известны:
НТФ + Н2О -* НДФ + Фн — 14 ккал/г-моль
НДФ + Н20 -* НМФ + Фн — 14 ккал/г-моль
НТФ + 2Н2О -* НМФ +2Фн — 28 ккал/г-моль
Независимо от того, начнется процесс
с р- или с Y-CBfl3H» изменение общей
свободной энергии при гидролизе обеих
10—1452
связей должно быть одинаковым. Поэтому,
согласно элементарным правилам подсчета,
бГИдр. (Р-СВЯЗЬ) = 28 ЛОГИдр (ффН).
«Физиологическая» свободная энергия
гидролиза р-связи НТФ зависит от
величины Д(/ГИдр. (ффн), т. е. от того, насколько
близко к состоянию равновесия действие
пирофосфата изменяет концентрацию ФФн
и Фн. Определить это точно невозможно.
Но вполне допустимо, с точки зрения
высокой активности ферментов, что
достигается состояние, очень близкое
равновесию, иными словами, что ДСгидр. (ффН) = 0.
В соответствии со сказанным мы примем
для «физиологической» свободной энергии
гидролиза р-связи максимальную величину,
равную —28 ккал/г-моль. Любопытно
отметить, что у некоторых микроорганизмов
не образуются очень низкие концентрации
пирофосфата; они функционируют за счет
экономии пирофосфата. По-видимому,
расход лишней энегии, получаемой в
результате реакций, протекающих по (5-механиз-
му благодаря действию пирофосфатаз,
не является жизненной необходимостью.
Что касается а-связи, то ее
«физиологическая» свободная энергия гидролиза
имеет величину около —7 ккал/г-моль
НМФ. В силу указанной выше причины
(гидролиз ФФн) она приближается к
величине — 21 ккал/г-моль НДФ и — 35 ккал/г-моль
НТФ (распространяя рассуждения до
ФФФн).
В табл. 3 суммированы величины
групповых потенциалов, которыми мы будем
пользоваться в наших дальнейших
рассуждениях. Необходимо помнить, что эти
величины подвержены довольно значительным
изменениям, зависящим от условий, кото-
Таблица /У
Реакция гидролиза
НТФ — НДФ + Фн
НДФ^НМФ+ Фн
НМФ -► Н -f Фн
НТФ -► НМФ -f ФФн (2 Фн)
НТФ -► Н + ФФФн (3 Фн)
НДФ—- Н + ФФ (2Фн)
ФФн -► 2 Фн
ФФФн ->► ФФн 4 Фн (3 Фн)
«Физиологическая»
Лбгидр. (ккал/г-моли
— 14
— 14
—7
— 28
— 35
— 21
-О
-О
рые преобладают в клетке. Но они все же
могут помочь нам лучше понять основные
энергетические характеристики биосинтети
ческих механизмов.
Когда связь НТФ разрывается для
совершения биосинтеза, ее необходимо
восстановить. В случае у-связи в АТФ
восстановлением занимается окфос-блок. В
любом другом случае связь НТФ
восстанавливается за счет одной или нескольких
Y-связей АТФ благодаря действию транс-
фосфорилирующих ферментов, которые
катализируют следующие реакции:
АТФ + Н — АДФ + НМФ.
АТФ + НМФ *=* АДФ -f НДФ.
АТФ 4- НДФ «=* АДФ 4- НТФ.
Первая реакция необратима из-за
существенных различий в «физиологической»
Н2О
свободной энергии гидролиза между
у-связью АТФ и а-связью НМФ. В двух
других реакциях происходит обмен связей
с одинаковым энергетическим уровнем и
они легко обратимы. Вот почему стоимость
такого рода переносов определяется
действием окфос-блоков, которые оплачивают
счета по затрате энергии. Следует, однако,
заметить, что этот счет покрывает только
часть биосинтетических процессов —
зачастую существенную, а иногда даже
единственную, — которая зависит от переносов
групп. Могут также происходить и другие
процессы, особенно электронный перенос от
высокоэнергетических доноров.
Биосинтетические восстановительные процессы играют
особо важную роль среди аутотрофных
организмов (см. гл. 10).
Объединяя различные
восстановительные реакции, мы закончим этот раздел
сводной диаграммой, на которую в
дальнейшем будем ссылаться как на
центральный восстановительный механизм. Этот
механизм способствует также активации
таких строительных блоков, как, например,
Фн или НМФ, которыми жертвуют в
одноступенчатых биосинтетических
процессах. Заметим, что ФФн не может быть
включен в НТФ сам по себе, а должен
быть сначала гидролизован (то же
происходит и с ФФФн, не указанным в
диаграмме из-за того, что его появление
в свободной форме, если вообще он ветре
чается, крайне редкое и мимолетное яв
ление).
ФФн
НДФ (АДФ)
НМФ(АМФ)
Н (А)
Центральная система восстановления
10*
Дополнительная экскурсия
Мы подошли к тому моменту нашего
путешествия, когда многие его участники,
судя по всему, мечтают об отдыхе. Однако
кое-кто, возможно, не прочь проверить
только что приобретенные знания. Для
самых любознательных путешественников мы
предлагаем дополнительную экскурсию,
необязательную для остальных. В ходе
экскурсии мы бегло ознакомимся с основами
биохимии и научимся распознавать
некоторые простые модели среди множества
сложных и бесконечно разнообразных
химических механизмов, с помощью
которых живая клетка умудряется производить
тысячи веществ, — большинство из них до
сих пор не способна синтезировать наша
самая современная техника. Строительные
блоки будут представлены, как правило,
в ионизированной форме (X—О~ и Y~),
если они не будут протонированы. При
необходимости будет указано движение
протонов. В детали химических структур мы
вдаваться не станем.
Одноступенчатый процесс
В этих реакциях некоторая часть НТФ
переносится к конечному
биосинтетическому акцептору. Переносимая группа берется
от предшественника, обычно от Фн или
НМФ; на нашей сводной двухступенчатой
диаграмме он обозначен как строительный
блок X—О~, предварительно
активированный или включенный в НТФ с помощью
центрального восстановительного
механизма. Жертвуемая молекула НТФ обладает
свойствами посредника — двуликого Януса.
Реакции, зависящие от переноса у<\.
НТФ, вовлеченный в эти реакции, почти
всегда представлен молекулой АТФ и
действует как НДФ-носитель, переносящий
фосфорильную группу.
Большая часть фосфора, содержащегося в
природных веществах (это разнообраз
ные группы, которые включают нуклео-
зидфосфаты, несколько коферментов,
нуклеиновые кислоты, фосфолипиды и
многочисленные метаболиты), первым вступает
в комбинации по такому типу реакции.
Исключение составляют концевая фосфо-
рильная группа самой молекулы АТФ,
которая включается благодаря действию
окфос-блока, и те случаи, когда
неорганический фосфат атакует предсуществую-
щую связь (фосфоролиз).
«Стоимость» биосинтетического
преобразования уже установлена:
'Аббиосинт. = — 14 — ДСгидр (y _. ф, .
Обычные фосфатные эфиры, в том числе
и НМФ, имеют «физиологические»
групповые потенциалы от —6 до —8 ккал/г-моль.
Таким образом, потеря свободной энергии,
связанная с их образованием, колеблется
между 8 и 6 ккал/г-моль, что делает
реакцию практически необратимой. Однако
ряд других фосфатных компонентов имеют
«физиологические» групповые потенциалы
около —14 ккал/г-моль, что делает транс-
фосфорилирование с участием АТФ легко
обратимым (AG ~ 0). Среди них — все
НТФ и НДФ, которые, как мы уже видели,
могут свободно подвергаться трансфосфори-
лированию с участием АТФ. Благодаря
этим реакциям любые НМФ или НДФ,
которые образуются, немедленно реактиви
руются в НТФ и готовы к участию в
новом биосинтетическом процессе (см.
выше). И напротив, в случае острой потреб
ности АТФ, например в начале работы
мышц, клетки могут обратиться за
помощью к собственным молекулам НТФ
и НДФ (в том числе, и к АТФ) для
восстановления затраченных молекул АТФ
путем обратимых реакций трансфосфорили
рования. Но главная ответственность пада
ет на другую группу высокоэнергетических
соединений, называемых фосфогенами, для
которых характерно наличие амидофосфат-
ной связи. Фосфогеном позвоночных
служит креатинфосфат, образующийся из
креатина по Yd-типу реакций переноса
фосфорильной группы от АТФ:
АТФ + Креатин ^ АДФ + Креатин ~ Ф.
Равновесие этой реакции
благоприятствует образованию АТФ. Только при
достаточно высоком соотношении
концентраций АТФ и АДФ, что, например,
наблюдается в клетках, не подверженных
энергетическому стрессу, происходит сдвиг
реакции слева направо: запас креатин-
фосфата восстанавливается. Как только
начинается потребление АТФ и уровень
АДФ поднимается, направление реакции
изменяется справа налево и креатинфосфат
служит для восстановления АТФ из АДФ.
Это позволяет клетке продержаться до того
времени, пока окфос-блок не заработает
в полную силу.
Ферменты, катализирующие Yd-реакции
трансфосфорилирования из АТФ,
называются фосфокиназами или просто киназами
(греч. kineln — двигаться). Помимо участия
во многих биосинтетических процессах.и в
кругообороте энергии фосфокиназы также
выполняют важную роль в качестве
инициаторов катаболических реакций. Именно
в этих реакциях установили их
существование, после чего было обнаружено,
что перед поступлением в гликолизную
цепь глюкоза должна быть активирована
«гексокиназой» (см. гл. 7).
Имеется также особая группа фосфо-
киназ, действующих на белки. Они
управляют рядом регуляторных процессов,
включая ответственные за деление клеток,
и поэтому могут быть вовлечены в процесс
беспорядочного размножения раковых
клеток.
Реакции, зависящие от ^-переноса.
НТФ, принимающий участие в этом редком
типе реакций, выступает как НМФ-носи
тель, несущий пирофосфорильную группу
(предварительно отделенную от Фн и
активированную с помощью центрального
восстановительного механизма):
К числу важнейших акцепторов фос-
форильной группы относится тиамин, или
витамин Bi — первый среди всех
обнаруженных витаминов. Тиаминпирофосфат
(ТПФ) является очень важным кофермен-
том в реакциях декарбоксилирования.
Чтобы отделить от Фн пирофосфорильную
группу, требуется 28 ккал. Часть этой энергии
запасается в ТПФ и высвобождается толь-
Схематическое изображение
одноступенчатых биосинтетических
реакций. Строительными блоками
являются неорганический фосфат
или мононуклеотиды. Они
активируются в центральной
системе восстановления до НТФ,
откуда переносятся к своему
конечному акцептору в виде
фосфорильной (Yd),
пирофосфорильной (0d) или
нуклеотидильной (рр) групп.
ко после гидролиза группы ФФ. Однако
между свободной энергией гидролиза пи-
рофосфатной связи, связывающей ФФ с
АМФ в АТФ, и энергией присоединения
эфира к тиамину в ТПФ имеется
существенная разница. Она составляет от
—8 до —10 ккал/г-моль. Этого вполне
достаточно, чтобы сделать транспирофос-
форилирование полностью необратимым.
Реакции, зависящие от ^-переноса.
НТФ здесь представлен активированной
группой НМФ, связанной с пирофосфат-
ным носителем, как показано в верхней
части приводимой ниже схемы.
Энергетический вклад пирофосфатазы делается на
начальной стадии реакции переноса,
поэтому для формирования связи НМФ—У
имеется около 28 ккал/г-моль.
Большинство процессов, при которых
происходит включение нуклеотидильных
групп в стабильные продукты биосинтеза,
протекают по типу рр транснуклеотидили-
рования. К ним относятся
фундаментальные процессы образования РНК и ДНК,
а также реакции, протекающие в процессе
синтеза НАД и других коферментов, таких,
как НАДФ, ФАД, и кофермента А
(см. с. 158—159); все они также содержат
АМФ. Аденилирование играет важную роль
в регуляции некоторых ферментных белков.
В отдельных самоатакующих вариациях
реакций (Зр-переноса атакующим веществом
является внутренняя З'-гидроксильная
группа самой переносимой нуклеотидильной
группы. Важнейшая реакция такого рода,
катализируемая аденилатциклазой,
приводит к образованию 3' 5'-циклического
НДФ
НДФ—О
Многие связи, образующиеся в
результате Рр-переноса, высокоэнергетические.
Несмотря на это, данный тип реакций
полностью необратим in vivo благодаря
действию пирофосфатазы.
Двухступенчатые процессы
Реакции этого класса подчиняются
основным правилам последовательного
переноса групп. Они либо катализируются
одним ферментом лигазного типа и затем
проходят путь посредника Януса,
связанного с ферментом, либо переносятся с
помощью двух различных ферментов, нередко
физически отделенных друг от друга.
Янус переносит группу X с места
активации к месту сборки вместе с группой от
активированного НТФ, выступающей в
качестве носителя в комбинации с атомом
кислорода, отобранным от строительного
блока X—Y".
Реакции, зависящие от у^-переноса.
Они протекают с участием НТФ в каче
стве носителя группы X в составе
посредника Януса:
—Y
Суммарная реакция: НТФ + X —О" + V
— V + НДФ -f Фн.
АМФ (цАМФ), важного внутриклеточного
медиатора действия гормонов:
(-V) oTi ^
о
У
А—О—Р—<.
О
О
I
О
о
о
АТФ
В ряде таких реакций строительный
блок X—О~ представлен карбоновой
кислотой и в роли двуликого посредника
выступает соответствующий ацил фосфат:
О
О
R—С—О—Р—О
I
О
Такие соединения обычно нестабильны.
Кроме того, подобно многим ангидридам —
веществам, образующимся при дегидрата-
ционном конденсировании двух кислот, — они
являются высокоэнергетическими, с
групповыми потенциалами, имеющими величину,
сравнимую с величиной потенциала у-связи
пирофосфата (ангидрид фосфорной
кислоты) в молекулах НТФ. Это препятствие
можно устранить с помощью ферментов
типа лигаз. В таких случаях АТФ
выступает в роли стандартного поставщика
энергии, а лигазы являются АДФ-обра-
зующими (не путать с АМФ-образующими
лигазами, которые нам встретятся при
рассмотрении реакций, снабжаемых
энергией р-связи).
Конечными акцепторами
активированной ацильной группы часто выступают
аммиак (NH3) или первичные
аминогруппы (R—NH2). Образующаяся при этом
амидная связь (—СО—NH—) имеет
сравнительно низкую «физиологическую»
свободную энергию гидролиза, от —6 до
—8 ккал/г-моль. Таким образом, процесс
в целом является достаточно экзергони-
ческим, а потому и необратимым. Синтез
аспарагина из аспарагиновой кислоты,
а глутамина — из глутаминовой кислоты
(см. гл. 2) и трипептида глутатиона из
глутаминовой кислоты, цистеина и
глицина — все это примеры двухступенчатого
согласованного механизма, использующего
энергию Vd-связи. То же можно сказать
и о синтезе производных карбамоила
(R—СО—NH2), к которым относятся
промежуточные продукты, образующиеся при
синтезе аминокислоты аргинина, а также
мочевины и пиримидиновых оснований.
Но эта реакция представляет для нас
интерес своей особенностью: активация и
сборка катализируются двумя различными
ферментами, связанными со свободно
циркулирующим посредником Янусом, карба-
моилфосфатом. Термодинамическая
сложность, возникающая на пути такого
механизма, преодолевается в ходе
согласованного процесса, посредством которого кар-
бамат — субстрат на стадии активации —
образуется в виде связанного с ферментом
АДФ—О—
АДФ-О"
NH3
АДФ-О—
АДФ-О
(Карбамоил фосфат)
Y-
Суммарная реакция: 2 АТФ -+- Бикарбонат + Аммиак + Y"
Карбамоил — Y + 2АДФ + 2Фн + 2Н+.
продукта конденсации бикарбоната с
аммиаком. Этот процесс также катализируется
посредством двухступенчатого Yd-механиз-
ма. Таким образом, перед нами цепь двух
последовательных Yd-двухступенчатых
механизмов. Первые три реакции
катализируются одним трифункциональным
ферментом — карбамоилфосфатсинтетазой,
при участии двух нестабильных связанных
•ферментом посредников (они указаны
внутри скобок в последовательности реакций
в верхней части схемы): карбоксилфосфа-
та, продукта Януса, получаемого в
результате первой активации, и карбамата,
продукта первой стадии сборки, который
затем становится субстратом при вторичной
активации. Вторая стадия сборки
(пунктирные стрелки) катализируется отдельным
ферментом.
На образование низкоэнергетической
амидной связи карбамата и
высокоэнергетической связи его ангидрида с фосфорной
кислотой затрачиваются две усвязи> или
28 ккал/г-моль, что в сумме составляет
20—22 ккал/г-моль. Весь процесс в
сильной степени экзергонический благодаря
запасам энергии в связанном с
ферментами карбамате. То же относится и к
последующему переносу карбамоильной
группы, к ее биосинтетическому акцептору,
в результате которого она переводится
с высокого уровня группового потенциала
на низкий.
Иногда конечный продукт двухступенча
той Yd-реакции, х—Y, сам по себе явля
ется высокоэнергетическим соединением,
например тиоэфир (характеризующийся
связью —СО—S). В этом случае процесс
легко обратим и может также
способствовать образованию НТФ из
соответствующего НДФ и Фн за счет расщепления
связи X—Y:
О
II
R— С—S—R' + НДФ + Фн ^
О
II
*=* R —С—О" + R'—SH + НТФ.
Реакции такого типа играют важную
роль в действии некоторых окфос-блоков
на субстратном уровне, в которых тиоэфир-
ная связь образуется за счет
окислительного конденсирования R1—SH-тиола с
альдегидом (R — СН= 0):
О
II
R—С—Н + R'—SH^
О
II
^ R—С—S—R' + 2е~ + 2Н +
Добавив эти две реакции, получим
полную картину окисления альдегида до
соответствующей кислоты с сопряженным
образованием НТФ. Этот процесс
протекает в окфос-блоке гликолитической
цепи (гл. 7):
О
II
R—С—Н
О
II
*=* R—С—О" + НТФ + 2е~ + 2Н '.
В другом окфос-блоке на субстратном
уровне окисляемым субстратом является
а-кетокислота, которая в подобной
окислительной комбинации с тиолом образует
тиоэфир и побочный продукт декарбокси-
лирования:
О
II
R—С— СОСГ + R'—SH ^
О
II
R —С—S—R' + СО2 + 2е~ + Н+
В этих реакциях R1—SH-тиол играет
каталитическую роль в процессе
сопряжения. Тиоэфир является промежуточным
продуктом очень редкого типа. Он способен
выполнять функции преобразователя
электронсвязанной энергии и энергии,
связанной с группами, и может
образовываться за счет той или другой энергии
Реакции, зависящие от
псевдо-у^-переноса. При синтезе гликогена,
разветвленного древовидного полимера, состоящего
из тысяч молекул глюкозы (см. гл. 2 и 7),
активированные гликозильные единицы пе
реносятся на концы растущих ветвей
(«рост с хвоста», см. с. 155) с УДФ в
качестве носителя:
Гликоген
Гликоген-
(Моносахарид)
(2Фн< ) "О—
V (H2O);
АДФ—О—
АДФ-О
Y—
Суммарная реакция: АТФ -(- НТФ + Моносахарид + Y
Гликозил — Y + АДФ -|- НДФ -f ФФн (2Фн).
Этот пример может служить образцом
синтеза углеводов, независимо от того,
являются ли они дисахаридами, олигоса-
харидными боковыми цепочками глико-
протеинов и гликолипидов или
полисахаридами. Всякий раз активированные
молекулы Сахаров передаются акцептору с
помощью НДФ, который, в зависимости от
природы сахара, может быть представлен
УДФ, АДФ, ГДФ или ЦДФ. Перенос
осуществляется непосредственно до
конечного биосинтетического акцептора, как при
синтезе гликогена, или с помощью
жирорастворимого носителя долихилмоно- или
дифосфата, как при некоторых реакциях
гликозилирования, которые происходят в
эндоплазматическом ретикулуме (гл. 6).
НДФ-носители действуют как «рукоятки».
Например, молекула глюкозы претерпевает
ряд метаболических трансформаций в
процессе прикрепления к УДФ.
Любопытно, что структура НДФ-саха-
ров полностью соответствует структуре,
которую можно ожидать для посредников,
образующихся при ур-переносе (перенос
НДФ) на свободную молекулу сахара:
НТФ + Сахар >■ НДФ—Сахар 4- Ф"
Однако природа пошла не по этому
пути. На самом деле НДФ-сахара
образуются за счет 0р-переноса с участием
гликозилфосфата в качестве акцептора.
Сам гликозилфосфат образуется
непосредственно или косвенно в результате уд-
трансфосфорилирования из АТФ, как
показано в приводимой выше схеме.
Обратите внимание на двойственный
характер двуликого посредника Януса.
В начальной стадии своего образования
он имеет два лица — НМФ-ное и гликозил-
фосфорильное. При реакциях сборки с ним
происходит метаморфоза и он
превращается в молекулу с НДФ-иловым и гли-
козиловым ликами. Из-за гидролиза ФФн
каждая гликозильная часть (6—8 ккал/г-моль)
«стоит» двух у-связей или 28 ккал/г-моль,
что вдвое дороже по сравнению со
стоимостью простого двухступенчатого Yp'Me~
ханизма. Почему природа не
воспользовалась последним путем, остается только
гадать. Быть может, не представлялось
такой возможности, а быть может, такой
путь имеет недостатки, которые мы не
замечаем.
Реакции, зависящие от fa-переноса.
В этих очень редких реакциях пирофосфат
является носителем групп X в посреднике
Янусе, как показано на схеме.
НМФ'— О—
НМФ— О~
2Фн<
(Н2О)
Суммарная реакция: НТФ -|- X — О + Y" >■
> X — Y + НМФ + ФФн (2 Фн).
Общее количество энергии, расходуемой
на синтез X—Y, 28 ккал/г-моль. Однако
большая ее часть может оставаться в
двуликом промежуточном продукте,
поскольку это стадия сборки, которая
выигрывает от низких концентраций ФФн,
образующихся в результате действия пиро-
фосфатазы. Эти процессы отличаются от
Рр-механизма (см. ниже).
Важнейший X—О~ строительный блок
Pd двухступенчатых реакций — 5-фосфори-
боза, молекула, остающаяся при гидролизе
пуринового или пиримидинового оснований
и мононуклеотида. Перестройка некоторых
мононуклеотидов может происходить
согласно типичному Pd-двухступенчатому
механизму с участием фосфорибозилпиро-
фосфата (ФРПФ) в качестве посредника
Януса. Например, гуанин может
объединиться с 5-фосфорибозой и образовать
ГМФ, как показано выше.
Такое «спасение» оснований — только
одна из функций ФРПФ. Кроме того,
он является промежуточным продуктом при
синтезе аминокислот гистидина и
триптофана, а также тех, которые имеют пури-
новое кольцо.
Другим ключевым промежуточным
продуктом, имеющим структуру X—О—ФФ,
является изопентенилпирофосфат —
предшественник важных жирорастворимых
молекул, в том числе хиноновых электронных
переносчиков (см. гл. 9 и 10), а также
витаминов A, D, Е и К, стеролов и
стероидов, каротиноидов, терпеноидов, латек
са (резины), эфирных масел и многих
других веществ из группы изопреновых:
СН2 О О
II II II
СНз—С—СН2—СН2—О—Р—О—Р—0~
о- о
Изопентилпирофосфат
Это важное вещество образуется не в
результате Pd-пирофосфатного переноса, а
путем сложного механизма, включающего
два уафосфорильных переноса. Иными
словами, здесь мы сталкиваемся с псевдо-
Р-механизмом. В совокупности с подлинным
механизмом он оказывает дополнительную
энергетическую поддержку на стадии
сборки благодаря действию пирофосфатазы и
заслуживает того, чтобы мы его здесь
рассмотрели.
Как правило, -две или больше 5-угле-
родных единиц объединяются вместе с
высбождением неорганического пирофос-
фата; этот процесс происходит при помощи
повторяющегося механизма переноса, при
котором конечный атом углерода изопен-
тилпирофосфата является акцептором, а
растущая цепь — переносимой группой
(см. приводимую ниже схему реакций).
Перед нами типичный пример «роста с
головы» удлиняющейся цепочки. Синтез
жирных кислот (см. с. 161) и белка
происходит по-другому. Характерная черта
данных механизмов заключается в том,
что «двуглавый» продукт реакции
активации сначала выступает в роли акцептора
части цепочки, которая уже почти
закончила свой рост, а затем выполняет функции
группового донора. Если же рост проис-
АМФ
АМФ—О
(Фосфорибоза)
(2Фн<
(Н2О)'
Гуанин
—Гуанин (ГМФ)
Суммарная реакция: АТФ -\- ФР -f- Гуанин ►■ ГМФ -+- АМФ + ФФн (2 Фн).
(2Фн<
(Н2О)
Изо-О— (Ф4
ходит с хвоста, «двуглавый»
промежуточный продукт сразу же отдает группу
растущей цепочке. Этот процесс наблюдали
при синтезе полисахаридов.
Реакции, зависящие от ^-переноса.
-Изо-О—
о—
Здесь мы рассматриваем, вероятно,
наиболее широко распространенный
биосинтетический механизм. Он происходит
согласно следующей схеме с участием НМФ—О—X
в качестве промежуточного продукта:
-О—
/2Фн
V (н2о)
—Y
Суммарная реакция: НТФ + X — О -f- Y
► X — Y + НМФ + ФФн (2 Фн).
Y—
Суммарная реакция: ЦТФ + Фосфорилхолин + Y
- Y — Фосфорилхолин + ЦМФ + ФФн (2 Фн).
Преимущество этого механизма
заключается в том, что он полностью обладает
силой р-связи (до 28 ккал/г-моль), т. е.
энергией, необходимой для активации.
Получающиеся в результате
промежуточные вещества часто представляют собой
нестабильные молекулярные соединения,
которые остаются связанными с
ферментами. Активация и сборка
катализируются в отработанной последовательности
с помощью единственного фермента. Эти
лигазы используют АТФ в качестве
энергетического донора, как это делают АДФ-
образующие лигазы, которые
катализируют подобные согласованные реакции,
снабжаемые энергией от 7"связи (см. с. 150).
К важным ферментам этой группы
принадлежит ДНК-лигаза — один из основных
агентов, участвующих в синтезе ДНК.
Ряд других биосинтетических процессов
осуществляется с помощью АМФ-образую-
щих лигаз.
Для некоторых двухступенчатых
процессов, зависящих от (5р-переноса,
требуется участие двух отдельных ферментов,
связанных стабильным промежуточным
продуктом, в котором активированная
группа X переносится НМФ-ностелем.
Напомним, что таким образом образуются
НДФ-сахара, хотя при сборке они ведут
себя несколько иначе. Более
ортодоксальные промежуточные, продукты этого же
класса образуются при (5р-переносе между
ЦТФ и различными фосфорилированными
строительными блоками, используемыми
при синтезе фосфолипидов, в том числе
фосфатидных кислот, фосфорилхолина,
фосфорилэтаноламина. Эти соединения имеют
Схематическое изображение
двухступенчатых биосинтетических
реакций. Кислородсодержащий
строительный блок (X—О~)
активируется с помощью НТФ и
превращается в посредника Януса,
в котором он связан с
фосфорильной (Yd).
пирофосфорильной (pd),
нуклеотидильной ((5р) или
нуклеозиддифосфорильной
(псевдо-^р) группами. После
переноса активированного
строительного блока к конечному
акцептору продукты распада
использованной НТФ вновь
воссоединяются благодаря
центральной системе
восстановления.
структуру ЦДФ—R и таким образом
обозначаются (например, ЦДФ-холин).
Однако в отличие от НДФ-сахаров они не
выступают в роли R-доноров при
последующей сборке, а продолжают вести себя
как промежуточные продукты, внешне
выглядящие как ЦМФ и R-фосфорил, как
показано на схеме.
Трехступенчатые процессы
Эти процессы систематически
начинаются с двухступенчатого согласованного
механизма, катализируемого лигазой. Они
отличаются от других уже рассмотренных
нами процессов того же типа тем, что
активированная группа прикреплена к
носителю, а не к биосинтетическому
строительному блоку. Конечная сборка
осуществляется на третьей стадии переносом
группы от носителя к биосинтетическому
акцептору.
Реакции, зависящие от у<\-переноса.
Два важных комплекса группы с носителем
собираются с помощью АТФ-образующих
лигаз по общей схеме Yd-двухступенчатого
последовательного переноса групп. Один
из них — карбоксибиотин, имеющий
сходную с карбаматом структуру, и связанный
с ферментом карбоксилфосфат; он
выступает в роли посредника и является
донором активированных карбоксильных групп
в ряде реакций карбоксилирования, как
показано на схеме.
Биотин, или витамин Н, который играет
каталитиче'скую роль во всем трехступенча
том процессе, принадлежит к молекулам,
представляющим исторический интерес
В названии этого вещества нашло свое
отражение раннее открытие в области
пищеварения, касающееся фактора роста
дрожжей, которое принадлежит
бельгийскому биохимику Эжену Вильдьерсу.
Исследователь был так поражен жизненной
силой найденного им фактора, что назвал
его «биос». Позднее производное от этого
названия нашло отражение в названии
одного из витаминов в память
выдающегося открытия. При выполнении функций
переносчика биотин ковалентно
связывается с гибкой полипептидной
«рукояткой», входящей в мультиферментный
комплекс, который содержит лигазу и карбокси-
лазу. Его транспортная функция
ограничена челночным движением карбоксильных
групп между активными центрами двух
ферментов.
Похожий трехступенчатый механизм, но
с участием формилфосфата, связанного с
ферментом, выступающим в роли
посредника, служит для прикрепления форматов
(солей муравьиной кислоты) (Н—СО—О)
к носителю, тетрагидрофолату (ТГФ)
производному витамина фолиевая кислота
АДФ—О—
АДФ—О~
Биотин
Биотин
Биотин
Y—
О
Суммарная реакция: АТФ + Бикарбонат + Y ► Y— С — О + АДФ + Фн.
(лат. folium—лист), который является
одним из скрытых ингредиентов шпината,
известного своими противоанемическими
свойствами. ТГФ не только несет
активированную формильную группу к различным
формилтрансферазам, но нередко
«предлагает» ее некоторым модифицирующим
ферментам, способным переводить ее в мете-
ниловую (—СН=), метиленовую (—СН2—),
гидроксиметиленовую (—СНгОН), метиль-
ную (—СНз) или формиминовую
(—CH=NH) группы. Каждая группа
принимает участие в ряде реакций переноса.
Таким образом, мы имеем дело с весьма
«многосторонним» коферментом, который
действует одновременно и как носитель,
и как «рукоятка» для активированных
групп. Среди многих веществ, образование
которых зависит от ТГФ, назовем
аминокислоту метионин (см. с, 162—163), пури-
новые основания и пиримидиновое
основание тимин, один из компонентов ДНК.
Реакции, зависящие от ^-переноса.
С помощью этого механизма происходят
два главных биологических процесса.
В обоих карбоновая кислота (R—СО—О~)
является строительным блоком, а АТФ
используется в качестве энергетического
донора; оба зависят от АМФ-образующей
лигазы для создания стабильного,
растворимого ацилнесущего комплекса при
помощи связанного с ферментами ацил-АМФ-
посредника:
Одним из таких процессов является
синтез белка, в котором аминокислоты
являются X—О~ строительными блоками, а
соответствующие транспортные РНК
(тРНК) — носителями. Отметим, что
полипептидные цепи растут с «головы»
(см. с. 154—155). Это означает, что между
промежуточной и конечной стадиями
сборки в приведенной схеме имеется допол
нительная стадия, на которой комплекс
носитель —СО—R (аминоацил-тРНК)
выполняет роль акцептора растущей цепи.
В другом процессе, также
происходящем с помощью трехступенчатого рр-ме-
ханизма, используется набор органических
кислот, среди которых имеются жирные
кислоты, обнаруживаемые в липидах в
качестве строительных блоков X—О~, и
кофермент А, выступающий в роли
носителя. Своим названием последний обязан
тому, что впервые его обнаружили как
кофактор в реакциях ацетилирования. Он
является производным витамина F, или
пантотеновой кислоты, — повсеместно
распространенного вещества (греч. pantothen —
всюду); в свое время оно получило весьма
сомнительную известность как
восстановитель волосяного покрова: нехватка
витамина вызывает преждевременное поседение
у крыс.
Кофермент А — сложная молекула,
содержащая, помимо пантотеновой кислоты,
несколько других составляющих, в том
-о—
Носитель"
Носитель
Носитель "
Y—
О
О
Суммарная реакция: АТФ + R — С — О + Y
у С — R + АМФ + ФФн (2 Фн).
Схематическое изображение
трехступенчатых биосинтетических
реакций. Двухступенчатые
механизмы (см. предыдущий
рисунок) служат для
присоединения активированного
строительного блока к носителю
С, от которого он доставляется
к конечному акцептору.
числе молекулу АМФ. Это вещество имеет
в своем составе тиольную группу (—SH)
в качестве реактивного конца и
сокращенно обозначается КоА—SH. Производными
ацил-КоА являются тиоэфиры, которые,
как мы уже отмечали, представляют собой
высокоэнергетические соединения с
«физиологическими» групповыми
потенциалами порядка —14 ккал/г-моль. Тем не
менее их образование высокоэкзергонично,
так как требует 28 ккал/г-моль.
Основными акцепторами Y—Н-ациль-
ных групп, представляемых кофермен-
том А, являются спирты:
О
КоА—S—С—R + R'—ОН-
О
*R'—О—С—R + КоА—SH.
Получаемые в результате реакции эфи-
ры — низкоэнергетические соединения,
которые осуществляют заключительный
перенос и делают его практически необратимым
процессом. Среди молекул, образующихся
таким образом, имеются ненромедиатор
ацетилхолин (уксусная кислота плюс
холин), различные эфиры жирных кислот
и глицерин, обнаруживаемые в
нейтральных липидах и фосфолипидах, а также
ряд других веществ. Кофермент А
участвует в ряде других важнейших реакций
как медиатор активированных ацильных
групп, метаболическая «рукоятка» и
участник некоторых окфос-блоков субстратного
уровня. (Вспомните роль тиоэфирных
связей в работе таких блоков, о которых шла
речь на с. 151 —153.) Это ключевой участок
клеточного механизма.
Несколько исключений,
подтверждающих правило
Белки, нуклеиновые кислоты,
нейтральные липиды, фосфолипиды, полисахариды,
стероиды, терпеноиды, нуклеотиды, кофер-
менты, аминокислоты, пурины, пиримиди-
ны — этот далеко не полный список
веществ, которые встретились нам за время
короткой экскурсии, выглядит как
справочник по современной биохимии «Кто есть
кто». Уже сейчас ясно, что наша простая
схема позволила ответить на многие
вопросы. Но ничего удивительного, что на все
вопросы ответить не удалось. Об
отдельных исключениях из правил следует
упомянуть.
Во-первых, некоторые реакции переноса
не зависят от прямой нуклеофильной
атаки. Среди них назовем трансаминирование
и транстиолирование, в ходе которых в
действительности происходит обмен групп.
Кроме того, встречаются случаи, и таких
немало, когда образующаяся связь имеет
более высокую свободную энергию
гидролиза, чем связь НТФ, используемая в
процессе биосинтеза. Интересно, откуда же
идет снабжение энергией, вернее, как она
высвобождается? Как и следовало
ожидать, почти всегда ее источником служит
гидролиз АТФ. Что же касается средств,
то их можно классифицировать как
«повышение энергии донора» или «понижение
энергии акцептора».
Примером первого случая служит
процесс сульфурилирования — реакций, в ходе
которых эфирные сульфогруппы суль-
фомукополисахаридов и сульфолипидов
образуются из неорганического сульфата.
Реакция начинается типичной рр-атакой
сульфата на АТФ; в результате
образуется двуглавый аденилилсульфат,
который высвобождается в легко растворимой
форме. Однако «физиологическая»
свободная энергия гидролиза этого ангидрида
настолько высока (особенно при очень
низких концентрациях неорганического
сульфата, преобладающих в большинстве
живых клеток), что даже полный комплект
из 28 ккал/г-моль, образующийся в
результате разрыва р-связи АТФ, недостаточен,
чтобы повысить концентрацию этого
ангидрида до уровня, необходимого для его
распространения и достижения отдаленных
участков сборки. Поэтому он не может
служить донором сульфогрупп (реакция
указана пунктирными стрелками на схеме).
Природа эту проблему решила путем
фосфорилирования З'-гидроксильной
группы аденилилсульфата — высокоэкзергони-
ческой реакции, способной повысить
концентрацию ее фосфорилированного
продукта как минимум на четыре порядка
по сравнению с субстратом. Образующийся
З'-фосфоаденилилсульфат способен
выполнять роль транспортной модели и в ряде
реакций сборки действует как донор
АДФ-О
АМФ—О~
Н2О
Нет (AG > 0)
О
II
v- Y—S—О"
О
Да (АО < 0)
О—
сульфогрупп. После того как он выполнит
свои обязанности, 3-фосфатная группа
АМФ расщепляется. Полностью процесс
выглядит следующим образом:
2АТФ + SO4^ + Y" ►
_^ у—SOiT + АМФ + АДФ + ФФн (2Фн) -f Фн.
Расход энергии составляет 42 ккал/г-
моль.
Примеры акцепторного активирования
можно наблюдать при синтезе жирных
кислот, например в порфириновом кольце,
а также в ряде реакций аминирования.
В каждом случае акцептор в конечной
сборочной реакции соединяется с
карбоксильной (—СО—О) или ацильной
(—СО—R—) группой, которая отделяется
после сборки. Тем самым свободная
энергия декарбоксилирования или дезацилиро-
вания добавляется к потенциалу
отдаваемой группы для поддержания
стоимости образования новой связи, как
показано на приводимой ниже схеме.
Носитель
Носитель"
или
Носитель
Носитель'
Y—
Y—
ЬЬО
"О-
2Н*
При синтезе жирных кислот донором
является растущая ацильная цепь, а в
роли носителя выступает белок-носитель
(ацилпереносящий белок, АПБ), активная
группа которого состоит из части молекулы
кофермента А. Акцептор — малонил-АПБ,
производное малонил-КоА, который
активирован ацетил-КоА в реакции карбокси-
лирования (с помощью биотин-зависимого
Vd-механизма, наподобие описанного на
с. 157), как показано на схеме внизу.
Заметим, что конечным продуктом
реакции сборки ((3-кетоацил-АПБ на два
углеродных атома длиннее, чем донор ацил-
АПБ) выступает вещество, которое было
бы получено при прямом переносе
ацильной группы на ацетил-АПБ. Однако
обычно такой реакции не происходит, так как
потенциал переносимой ацильной группы
в р-кетоацильном продукте намного выше,
чем у тиоэфирного донора. Эта реакция
происходит в живых клетках (с кофер-
ментом А в качестве носителя), но в
обратном направлении (тиолиз (5-кетоацил-
КоА производного при посредничестве
кофермента А), как часть процесса
деградации жирных кислот. Путем карбоксили-
рования акцептора ацетил-АПБ за счет
дополнительных 14 ккал/моль клетка
снабжается дополнительной энергией, равной
6—8 ккал/г-моль. Этого достаточно для
сдвига реакции в направлении сборки.
Реакция заключается в наращивании
цепочки к двууглеродному строительному
блоку. После сокращения цепочки на две
0-кетогруппы процесс повторяется,
чередуясь со стадиями редукции до тех пор,
пока не будет построена вся цепочка
Перед нами еще один пример роста
цепочки с «головы» (с. 154—155).
Аналогичная стадия имеется и при
построении порфиринового кольца, идуще
го на формирование таких важных
молекул, как гемоглобин, цитохромы (гл. 9) и
хлорофиллы (гл. 10). В этом случае
донором является сукцинил-КоА, акцепто
ром — аминокислота глицин, которая в
данной реакции ведет себя как
метиламин (СНз—NHJ"), активированный в
результате карбоксилирования (см. верхнюю
схему на с. 163). В результате
вырабатывается 6-аминолевулиновая кислота —
предшественник порфиринового кольца.
В реакциях аминирования, которые,
за редким исключением, представляют
собой невыгодные в термодинамическом
плане реакции из-за низкой концентрации
аммиака в клетках, последний заменяется
в качестве акцептора глутамином
(амидом глутаминовой кислоты), который
образуется в результате типичного у^-двухсту-
пенчатого процесса, как мы видели раньше.
В этих реакциях аминирования глутамин
обладает свойствами молекулы аммиака,
11 — 1452
о
(Ацетил-КоА) KoA-S—С—СН3 + НО-
АПБ-S-
О
(Малонил- КоА) KoA-S—С—СН2-
АПБ-SH -^
КоА—SH ^
О
АПБ-S—С—СН2-
О
АПЬ-SH
АПБ-S—С—СН2-
активированной в результате ацилирова-
ния с глутаминовой кислотой (см. схему
на с. 163).
В некоторых реакциях аминирования
активированной формой аммиака является
аспарагиновая кислота. Механизм реакций
отличается от рассмотренного нами.
В заключение нашего короткого
путешествия по биосинтетическим причудам
клетки познакомимся с важнейшим
представителем крайне редких процессов,
зависящих от ар-атаки на АТФ (трансаденози-
лирование). Атакующим агентом здесь
выступает метионин — аминокислота,
характеризующаяся наличием тиометильной
группы (—S—СНз). В данном случае
атака осуществляется атомом серы, а не
атомом кислорода. Кроме того, последующие
реакции сборки включают в себя перенос
не целой активированной молекулы, а
только ее концевой метильной группы, которая
оказывается легко переносимой из-за
положительного заряда, приобретенного атомом
серы при аденозилировании.
Неорганический трифосфат — другой продукт
ар-атаки — образуется не сам по себе, а в
результате гидролиза до неорганического
фосфата и пирофосфата; последний затем
расщепляется под влиянием пирофосфата-
зы (см. схему на с. 163, внизу).
Этот процесс ответствен за многие
важные реакции метилирования, в том
числе и за относящиеся к нуклеиновым
кислотам, что, как вы заметите, весьма дорого
обходится клетке: почти 35 ккал/г-моль.
Процесс начинается не с крахмала и
метанола (СНзОН) в качестве строительного
блока; источником метильной группы
служит метионин. Последний
восстанавливается из гомоцистеина; при этом донором
метила является метилтетрагидрофолат
(см. с. 157—158):
Гомоцистеин + ТГФ—СНз
>-Метионин -f- ТГФ.
KoA— S—
(Сукцинил—KoA)
KoA—SH
+H3N—CH2-
(Глицин)
(5—Аминолевулиновая кислота)
NH3 ^+^ "О—
АТФ
АДФ + Фн
(Глутаминовая кислота)
Носитель-
Н2О
NH2—
(Глутамин)
Носитель *" ф ^ NH2— + "О—
2 Н+
(Глутаминовая кислота)
I(H2O)
12Фн ' /и глч )ФФН" ^H
Н2О
-ОН
s—сн2—сн2—сн—coo -
' (Метионин)
-S^CH2—СН2—СН
:н—соо~
—S—СН2—СН2—СН—COO"
NH3+
2—С
HS—СН2—СН2—СН—COO
(Гомоцистеин)
Y—
9
Митохондрии: дыхание
и аэробное
восстановление энергии
Для нас, как и для большинства живых
организмов, возДух настолько жизненно
необходим, что мы не можем себе
представить жизни без него. И тем не менее,
как уже отмечалось в гл. 7, жизнь
зародилась и длительное время существовала в
мире, лишенном кислорода. Только после
возникновения механизма фотосинтеза,
известного специалистам как
фотосистема II (а произошло это, вероятно, около
3 миллиардов лет назад, см. гл. 10),
кислород начал поступать в атмосферу
в значительных количествах, и его
концентрация медленно поднималась до
современного уровня, составляющего 20%.
Этот феномен представлял собой угрозу
для жизни и послужил причиной
исчезновения многих видов организмов, сходных
с современными облигатными анаэробными
организмами. Дело в том, что
молекулярный кислород способен взаимодействовать
различными способами с
восстанавливающимися биологическими молекулами; в
результате образуются такие
высокотоксичные продукты, как супероксидный ион Ог~
и перекись водорода Н2О2. У выживших
в этих условиях организмов, кроме тех,
что нашли убежище в свободной от
кислорода нише, развились защитные
ферменты, в частности супероксиддисмутаза
и каталаза (гл. 11). А некоторые со
временем преуспели настолько, что
«приручили» кислород и превратили era в самого
верного союзника жизни — этого им
удалось достигнуть благодаря приспособлению
АТФ-генерирующих окфос-блоков к
использованию кислорода в качестве конечного
акцептора электронов. И теперь их
многочисленные потомки заполняют большую
часть живого мира.
«Приручение» кислорода
Судя по известным анаэробным
бактериям, адаптация к кислороду, по-видимому,
происходила постепенно. В конечном счете
этот процесс увенчался одним из
величайших достижений Природы — созданием
фосфорилирующей дыхательной цепочки:
рядом, который состоит из 15 с лишним
электронных носителей. Разность
потенциалов между НАДФ и кислородом
составляет в целом 1, 070 мВ. Цепочка построена
таким образом, что включает до трех
последовательных окфос-блоков в ряду.
Такого рода систему можно обнаружить
в плазматической мембране некоторых
современных бактерий, которые, как
предполагают, унаследовали ее от древнейших
предков, впервые приобретших
плазматическую мембрану около миллиарда лет
назад. По существу такая же система
имеется и на внутренней стороне двух
мембран, окружающих митохондрии, —
это отдельные, покрытые оболочкой тельца
размерами с бактерии, во множестве
разбросанные по всей цитоплазме
подавляющего большинства эукариотов
растительного и животного происхождения; в этих
клетках митохондрии выполняют роль
главных центров дыхания и восстановления
окислительной энергии. Связь между
бактериальными и митохондриальными
системами (если допустить, что таковая
существует, а это вполне вероятно)
представляет собой захватывающую гипотезу.
В наиболее популярной версии этой
истории «героем» выступает примитивный
фагоцит — гипотетическая гигантская
прожорливая, как бактерия, клетка, которая
считается промежуточной формой между
прокариотами и эукариотами (см. гл. 6).
Среди ее ежедневной добычи, во всяком
случае так гласит упоминаемая версия,
имелись некоторые аэробные бактерии,
которые не были захвачены и
уничтожены с целью получения пищи. Но эти
бактерии в свою очередь пощадили своего
захватчика в отличие от многих
уцелевших патогенных бактерий. Более того,
они установили с ним постоянное, выгодное
для обеих сторон симбиотическое
сотрудничество. Их потомки дожили до наших
дней в виде митохондрий эукариотов.
Полностью слившись с клеткой-хозяином, что
вполне естественно и должно было про-
Гипотеза эндосимбионтного
происхождения митохондрий.
Примитивный фагоцит (см. гл. 6)
поглощает аэробные бактерии,
которые имеют высокоразвитую
систему окислительного
фосфорилирования в
плазматической мембране, и
вступают с ним в симбиоз. Эти
бакерии произошли от
фотосинтетических бактерий (см.
гл. 10) с появлением в
атмосфере кислорода. После
эндосимбиотической адаптации
они развились в митохондрии
в организме примитивного
эукариотического предка всех
животных и растительных клеток.
изойти более чем за миллиард лет
совместной жизни, эти органеллы тем не менее
сохранили остатки генетической системы
типичного бактериального вида наряду с
некоторыми другими рудиментарными
свойствами, присущими их предкам. Как мы
увидим в следующей главе, хлоропласты
растительной клетки скорее всего также
произошли из симбиотически
приспособленных фотосинтетических бактерий.
Эта теория, известная под названием
эндосимбионтной гипотезы, имеет немало
доказательств в свою пользу, в том числе
некоторые филогенетические древа,
созданные на основе молекулярных
последовательностей. Однако ученые ничего не берут
на веру, особенно когда дело касается
восстановления событий далекого
прошлого. По мнению некоторых исследователей,
митохондрии с таким же успехом могли
произойти из внутренних складок
плазматической мембраны увеличивающейся
аэробной бактерии, подобно тому как
образовался вакуом (гл. 6), но с другим типом
дифференцировки, который привел к
разделению фосфорилирующей дыхательной
цепи на отдельные везикулы. Можно
предположить и ряд других вариантов, в том
числе независимое происхождение
бактериальных и митохондриальных систем
путем конвергентной эволюции.
Скромному гиду не следует брать на
себя смелость предлагать аргументы,
которые до сих пор вызывают спор среди
знатоков. Однако для тех, кто питает
романтическую склонность к
эндосимбионтной гипотезе, не могу не упомянуть о
некоторых чертах митохондрий (и хлоро-
пластов), которые свидетельствуют в
пользу их происхождения из бактериальных
эндосимбионтов.
Некоторые анатомические
детали
Термин «митохондрия» восходит к
греческому слову mitos, что означает «нить»,
и chondros — зерно. В нем нашел
отражение внешний нитчатый облик
митохондрий в некоторых типах клеток. Однако в
других клетках митохондрии могут иметь
форму прутка, яйца или шара. Иногда
несколько митохондрий образуют
причудливые сцепления, которые, как
утверждают, могут включать целую митохондриаль-
ную популяцию клетки, превращаясь в
необычную свернутую спиралью открытую
структуру, напоминающую скульптуры
Генри Мура. Размеры митохондрий
колеблются, но имеют тенденцию к увеличению по
мере увеличения размеров клетки и
На электронной микрофотографии
представлены бактериальные
эндосимбионты, живущие в
цитоплазме простейшего
организма Pyrsonytnpha, который
в свою очередь паразитирует в
задней кишке термита
Reiicuiiterm.es.
Полулежащая фигура.
Скульптура Генри Мура
Модель, восстановленная из
серийных срезов и изображающая
одну гигантскую митохондрию
дрожжевой клетки
составляют 1 мкм и выше. Увеличьте эту
«фигуру» в миллион раз, и вы приблизите
ее размеры к нашим собственным. В случае
удачи, особенно если мы правильно
выберем объект исследования (например, в
мышечной ткани крыльев синей мясной
мухи имеются особенно крупные
митохондрии), можно даже втиснуться в них.
Однако не следует и думать, что мы
сможем проникнуть внутрь целыми и
невредимыми. Нам будет необходимо прибегнуть
к вивисекции.
Снаружи митохондрия кажется
заключенной в тонкую гладкую полупрозрачную
оболочку. Через эту внешнюю мембрану
просматривается внутренняя —
ярко-розовая, испещренная многочисленными
глубокими бороздками. Если смотреть изнутри,
то структуры, соответствующие этим
бороздкам, оказываются гребнями, или крис-
тами (лат. crista — гребень), которые
образуют ряд непрерывных перегородок с
внутренней стороны митохондриального
тела. В действительности кристы
представляют собой не что иное, как выросты
На срезе митохондрии островковой
клетки поджелудочной железы
морской свинки видны
непрерывная внешняя мембрана и
внутренняя мембрана; последняя
образует многочисленные
неполные хребтовидные
перегородки — митохондриальные
кристы.
На пространственной модели,
воссоздаю идей анатомию
митохондрии, показано
расположение крйст. Как видно на
увеличенной части, внутренняя
сторона внутренней мембраны
имеет небольшие выпуклости (см.
электронную микрофотографию
на с. 173).
непрерывной, полностью замкнутой
внутренней мембраны. Мы можем в этом
удостовериться, если прорвем внешнюю
мембрану и дадим митохондрии
возможность впитать воду, нарушив в некоторой
степени осмотический баланс. Она
довольно сильно набухнет, но при этом ее
внутренняя мембрана останется целой и не
развернется. Образование крист (а в
некоторых типах клеток они заменены
трубчатыми выростами) — это приспособление,
позволяющее увеличивать поверхность
мембраны без увеличения объема тела.
В важности подобного увеличения мы
убедимся, когда узнаем, что внутренняя
мембрана — истинное сердце силовой
установки клетки, ее подлинный генератор
энергии; она содержит дыхательную цепь
и связанные с ней системы фосфорили-
рования.
С точки зрения эволюции принято
считать, что внутренняя мембрана произошла
из плазматической мембраны какого-то
предполагаемого древнего бактериального
эндосимбионта. Внешняя же мембрана,
вероятно, произошла из системы вакуолей
древнего предка хозяина-фагоцита. И в
самом деле, она обладет некоторым сходст-
вом с эндоплазматическим ретикулумом, с
которым ее объединяет, например, наличие
особого пигмента, цитохрома Ьъ.
Энергетика
окисления
митохондриального
Полость, ограниченная плотной,
внутренней митохондриальной мембраной,
заполнена жидкостью, митохондриальным
матриксом. Это богатый белками раствор,
в основном состоящий из катаболических
ферментов, вовлеченных в окислительное
расщепление всех основных пищевых
продуктов, в том числе аминокислот, которые
составляют белки, жирных кислот, которые
являются основными компонентами липи-
дов, и пировиноградной кислоты, которая,
как мы уже знаем, образуется в цитозоле
в виде продукта аэробного гликолиза. Все
эти пути объединяются в центральном
метаболическом водовороте, известном как
цикл Кребса. Свое название он получил в
честь Ганса Кребса, англо-немецкого
биохимика, обнаружившего это явление в
конце 1930-х гг.
В этих превращениях участвует пестрая
коллекция экзотических молекул; мы не
будем пытаться их выявить, отметим
только конечные продукты, которые являются
очень простыми веществами: это вода,
углекислый газ, аммиак или мочевина,
неорганический сульфат, т. е. те или почти те
вещества, которые образуются при
сгорании в печи. Но здесь мы имеем дело с
удивительно холодной печью, в которой
вещество сгорает, а тепла образуется
мало.
Этот парадокс, как вы, возможно,
помните из гл. 7, объясняется просто: пищевые
продукты не смешиваются с кислородом,
они взаимодействуют с водой и в
результате отдают атомы водорода или электроны
соответствующим акцепторам. Такого рода
превращения протекают при температуре
клетки; при этом высвобождается
небольшое количество энергии. В редких случаях,
когда пищевые продукты производят
довольно большое количество энергии, они
направляются для участия в работе окфос-
блоков на субстратном уровне, как, в
частности, происходит при гликолизе.
Возьмем, к примеру, глюкозу. На
каждую молекулу этого сахара/ окисляемого в
живой клетке, высвобождается в общей
сложности 12 пар электронов:
С6Н,2О6 + 6Н2О
-f
24H + .
Две из этих пар образуются за счет
окислительного гликолиза
(«ампутированная змея», см. гл. 7):
С6Н,2О6
2СН3—СО-СООН + 4е - + 4Н +.
Другие десять получены при дальней
шем окислении в цикле Кребса из молекул
пировиноградной кислоты, образующейся в
результате гликолиза:
2СН3—СО—СООН + 6Н2О
6СО2 + 20*
20H +
При гликолизе, как мы уже убедились,
электроны переносятся на НАД1 через
окфос-блок субстратного уровня:
4е~ + 2Н+ + 2НАД + + 2АДФ + 2Фн ►
► 2НАДН + 2АТФ + 2Н2О
В цикле Кребса четыре из пяти пар
электронов, высвобожденных в результате
окисления одной молекулы
пировиноградной кислоты, переносятся на НАД"1", в
одном случае через окфос-блок субстрат
ного уровня. Пятая пара поступает к фла
виновому коферменту, ФАД (см. ниже)
Таким образом, для двух молекул
пировиноградной кислоты имеем:
-► 8НАДН + 2ФАДН2 + 2АТФ + 2Н2О
Сложив оба процесса, получим:
24е~ + 14Н+ + 10НАД+ + 2ФАД +
-f 4АДФ -f 4Фн ► 10НАДН +
4- 2ФАДН2 4- 4АТФ 4 4Н2О
что для анаэробного окисления глюкозы,
которое обычно происходит в живой клетке
с участием быстро вступающих в реакцию
электронных акцепторов, дает:
СбН,2О6 4- 2Н2О 4- 10НАД+ 4- 2ФАД 4
+ 4АДФ 4- 4Фн ► 6СО2 4- ЮНАДН 4
4- ЮН+ 4- 2ФАДН2 4 4АТФ.
Аэробная часть этого процесса связана
с переносом электронов от восстановлен-
Таблица 4
Пищевые продукты
Глюкоза
Пальмитиновая кислота
Глутаминовая кислота
Свободная энергия окисления (ккал/г-моль),
извлеченная из
НАДН
490
1519
343
ФАДН2
74
555
74
АТФ*
56
84
28
Тепло
66
180
33
Всего
686
2338
478
* АТФ, образованный при фосфорилировании на субстратном уровне, минус АТФ, использованный на
активацию субстрата.
ных коферментов к кислороду:
10НАДН + 10Н+ + 2ФАДН2 + 6О2 ►
> 10НАД+ + 2ФАД + 12Н2О.
Энергетические балансы анаэробных и
аэробных частей легко вычислить. Как мы
уже видели (гл. 7), «физиологическая»
свободная энергия окисления (электронный
потенциал) НАДН составляет —49 ккал
на пару электрон-эквивалентов,
переносимых на кислород. С учетом того, что
«физиологический» электронный потенциал
ФАДНг составляет около —37 ккал на
пару электрон-эквивалентов, переносимых
на кислород, для аэробной части сумма
составит —564 (10X49 + 2X37) ккал/г-моль
окисленной глюкозы.
С другой стороны, согласно
калориметрическим измерениям, «физиологическая»
свободная энергия окисления глюкозы с
кислородом в качестве электронного
акцептора равна — 686 ккал/г-моль. В таком
случае анаэробный баланс составляет
примерно — 122 (686—564) ккал/г-моль, из
которых 56 (4Х 14) ккал/г-моль получены
в результате работы окфос-блока на
субстратном уровне, а 66 расходуются на
теплоту.
Другими словами (см. табл. 4), когда
живая клетка «сжигает» глюкозу с
использованием собственных электронов вместо
кислорода, то сохраняется более 90%
свободной энергии, которая будет потеряна,
если в процессе в роли акцептора
участвует кислород. Большая часть этой энергии
запасается в виде восстановленных кофер
ментов и меньшая часть — в виде АТФ. По ана
логии с гидродинамикой, которую мы про
вели в конце гл. 7, это означает, что элект
роны, высвобождаемые при биологическом
окислении глюкозы, в первую очередь
переносятся в энергетически богатые резервуары,
расположенные намного выше уровня
вода/кислород. В восьми из двенадцати
случаев эти переносы осуществляются
через небольшие различия в высоте, с
малой потерей энергии. В остальных случаях
различия в высоте значительные, но
падение электронов используется в работе
«Холодное сгорание» с водой в
качестве источника кислорода
способствует полному окислению
пищевых продуктов. Менее 10%
высвобождаемой энергии
рассеивается в виде тепла.
Большая часть запасается в виде
высокоэнергетических электронов в
НАДН и в меньшей степени в
виде восстановленных
флавопротеидов. Небольшая
часть энергии поддерживает
работу окфос-блоков субстратного
уровня, производящих АТФ.
\с электронами
ФАДН2 20%)
Связанная
АТФ 5% с группами
Тепло 8% Потеря
СО2, S 0 5~, другие продукты отхода
1 2 3
Пищевые продукты Пищевые продукты Пищевые продукты
Распределение электронов
Раствор 1. Электроны
возвращаются в метаболический
поток и выделяются вместе с
продуктами анаэробного брожения.
К недостаткам относятся слабое
использование пищевых продуктов
и строгое стехиометрическое
ограничение.
Раствор 2. Электроны свободно
переносятся к кислороду (или к
другому экзогенному акцептору).
Преимуществом является большая
подвижность и полное окисление
пищевых продуктов, но выход
готовой к использованию энергии
(АТФ) очень низкий.
Раствор 3. Электроны переносятся
на кислород через
фосфорилирующую дыхательную
цепочку. Пищевые продукты
используются полностью, с
высоким энергетическим выходом.
окфос-блоков субстратного уровня, произ понять положение наших древних анаэроб
водящих АТФ. ных предков. Поскольку НАД, ФАД и дру
Жирные кислоты и аминокислоты в гие электроннесущие коферменты находятся
основном претерпевают такой же вид хо- в клетке в каталитических количествах, пре-
лодного сгорания, как пальмитиновая и имущества холодного сгорания проявляют
глутаминовая кислоты (см. табл. 4). Их ся только в том случае, если для
электрополное окисление сопровождается запаса- нов, запасаемых в этих коферментах,
имением свыше 90% свободной энергии, полу- ется возможность оттока. При брожении
чаемой при сгорании, в, энергетически проблема решается путем возврата элект-
богатых кофакторах. ронов в субстратный поток. При этом про-
Зная эти показатели, мы можем лучше цесс протекает, но с очень низким энерге-
тическим выходом. Так, анаэробный
гликолиз, как мы убедились, дает только
47 ккал/г-моль использованной глюкозы,
или менее 7% энергии, которая может
быть получена при полном окислении. Он
снабжает клетку только двумя молекулами
АТФ, или 28 ккал готовой к использованию
энергии.
Другой недостаток брожения
заключается в том, что он налагает жесткие
стехиометрические ограничения на
метаболические пути. Субстрат отдает ровно
столько электронов, сколько поступит
обратно в субстратный поток. Однако если
электроны, запасаемые в коферментах,
выгружаются на экзогенный акцептор, эти
ограничения перестают существовать.
В таких случаях любой вид окисляемого
пищевого продукта можно полностью
использовать. Это обеспечивает большую
степень гибкости и зачастую лучший
энергетический выход, по крайней мере с
точки зрения клетки. Однако, с точки
зрения мировых запасов энергии, крайне
расточительно, если электроны будут
выгружаться без возврата энергии.
Еще раз обратимся к примеру с
глюкозой. Как мы имели возможность убедиться,
фосфорилирование на субстратном уровне
обеспечивает анаэробное брожение двумя
молекулами АТФ или 28 ккал/г-моль
использованной глюкозы. Из табл. 4 видно,
что при полном окислении этот выход
удваивается. Но какой дорогой ценой!
В то время как при брожении
высвобождается только 47 ккал из полученных 686, а
оставшиеся возвращаются в окружающую
среду в виде энергетически богатых
молекул молочной кислоты или этанола, при
свободном окислении все 686 ккал
растрачиваются для ничтожно малого
дополнительного выигрыша, составляющего
28 ккал/г-моль использованной глюкозы.
И если при изобилии с таким
расточительством еще можно мириться, то при
нехватке пищи оно становится преступным.
И все же, возможно, некоторые
примитивные аэробные организмы действовали
именно таким путем, и у самых развитых
эукариотов до сих пор происходят такие
расточительные реакции (гл. 11).
Очевидно, единственный путь свести к
минимуму непроизводительную затрату
энергии окисления — использовать
энергию, которая высвобождается при переносе
электронов от восстановленных кофермен-
тов к конечному акцептору. Но это
сопряжено с удачным расположением окфос-
блоков на пути движения электронов.
В ходе эволюции сформировалось немало
приспособлений такого рода, которые
«впряглись в одну упряжку» с
определенными акцепторами электронов. Наилучшие
результаты были достигнуты с кислородом,
выступающим в роли конечного акцептора,
особенно после того как фосфорилирующая
дыхательная цепочка приобрела свою
окончательную структуру — такую,
которую мы сегодня обнаруживаем в
митохондриях и некоторых аэробных бактериях.
Клетки, оснащенные такими современными
«спасателями» энергии, в состоянии
производить до 38 молекул АТФ из одной-
единственной молекулы глюкозы,
восстанавливая около 80% всей свободной
энергии, высвобождаемой в результате
окислительного процесса в готовой к усвоению
и использованию форме.
Фосфорилирующая
дыхательная цепь
Митохондриальные энергетические
преобразователи располагаются
исключительно внутри розового, складчатого «футляра»,
который образует внутреннюю мембрану
телец. Это очень тонкая оболочка
толщиной 7 нм, при нашем увеличении в
миллион раз она составит чуть больше 60 мм.
Снаружи она гладкая, а изнутри покрыта
мелкими узелками. Узелки имеют в
диаметре около 9 нм (что составляет примерно
80 мм при увеличении в миллион раз) и
прикрепляются к мембране короткими,
узкими стволиками, отчего внутренняя
сторона мембраны похожа на поверхность,
покрытую крошечными грибами.
Электронная микрофотография
митохондриальных крист при
сильном увеличении. Препарат был
негативно окрашен
электронноплотным
фосфотунгстатом калия, который
четко выявляет выпуклости на
ножках, выступающие в
митохондриальный матрикс.
Выпуклости содержат АТФ-
управляемые протонные насосы.
Для дальнейшего исследования нам ной инженерии. Вся поверхность мембраны
потребуется наше молекулярное увеличи- покрыта микросферами; каждая из них
тельное стекло. Вид, который открывается состоит из 15—20 различных видов элек-
с его помощью, поистине удивителен; это тррнных носителей, объединенных для
один из величайших шедевров молекуляр- обеспечения необходимого электронного
переноса. Вч одном-единственном теле
митохондрий может существовать почти 100 000
таких микросфер.
Эти микросферы, обычно называемые
дыхательными цепочками, включают набор
различных молекул. Наиболее известные
среди них — флавины и гемы. Флавины
(лат. flavus — желтый) — удивительный
класс зеленовато-желтых пигментов,
образованных из рибофлавина, или
витамина В2. Наиболее важными флавиновыми
производными являются флавинмононуклео-
тид (ФМН) и флавинадениндинуклеотид
(ФАД). Их основное свойство заключается
в способности выступать в роли носителей
водорода. Таким образом, они служат
коферментами для многочисленных фла-
виновых дегидрогеназ.
Гемы (греч. halma — кровь) — близкие
родственники хлорофиллов, зеленых
фотосинтетических пигментов, с которыми их
роднит одно характерное свойство: наличие
порфиринового ядра — плоской,
дискообразной молекулы, состоящей из четырех
пиррольных колец, связанных метеновыми
(—СН=) мостиками. В центре диска
имеется отверстие, окруженное электронами
четырех резонирующих атомов азота. Если
мы поместим в отверстие ион магния, то
получим молекулу хлорофилла. При замене
иона магния на ион железа получится гем
Благодаря свойству железа принимать
форму двухвалентного (Fe2+) или
трехвалентного (Fe3"1") иона гем представляет собой
электронный носитель:
Гем—Fe2+ ^ Гем—Fe3+ + е~.
В комбинации с белками гемы образуют
целый набор «доспехов», состоящий из
разноцветных молекул с оттенками от
кроваво-красного до горохово-зеленого. Все
они в той или иной степени участвуют в
утилизации кислорода. Наиболее известная
функция заключается в доставке
кислорода, который переносится красным
кровяным пигментом — гемоглобином. В
дыхательной цепочке гемопротеиды
представлены рядом цитохромов, названных так из-за
того, что они были обнаружены среди самых
первых пигментов, постоянно
присутствующих в клетках.
Помимо двух упомянутых главных
классов переносчиков электронов
дыхательная цепь содержит дифенолы, которые
окисляются до соответствующих хинонов,
железосерные белки, в которых ионы,
несущие электроны, заключены в оболочке
сульфгидрильных групп, связанные с
белками ионы меди и, возможно, другие
компоненты. Отметим (как тему для
дальнейшего обсуждения), что одни из этих
молекул выступают непосредственно как
электронные носители (гемопротеиды и металло-
протеиды), тогда как другие переносят
атомы водорода (т. е. электроны в
комбинации с протонами).
Внутри каждой дыхательной
микросферы эти различные молекулы организованы
таким образом, что могут работать как
высокоэффективные «сборочные бригады»
электронов. Это означает прежде всего, что
они построены в виде нисходящих
электронных потенциалов, поэтому электроны могут
Молекулярная «сборочная
бригада» для электронов.
Компоненты дыхательной цепи
организованы таким образом, что
колебания температуры и круговые
движения способствуют контакту
электроннесущих центров одного
компонента с двумя соседними.
легко падать от одного компонента к
другому. Кроме того, они ориентированы друг
к другу так, чтобы их активные центры
могли легко обмениваться электронами
с партнерами по обеим сторонам; для
достижения необходимых контактов достаточно
только малейших изменений положения,
вызванных тепловыми колебаниями и
вращениями. И наконец, они должны подходить
к соответствующим входным и выходным
отверстиям. Как мы увидим, главный вход
обеспечивается флавопротеидным ферментом,
который переносит электроны от матричной
НАДН к верхней части дыхательной цепи.
На более низких энергетических уровнях
существуют несколько вторичных вводов.
Главное выводное отверстие ведет к
кислороду через сложный комплекс цитохромов и
меди, известный в настоящее время как
цитохромоксидазы, но первоначально
названный его первооткрывателем, немецким био:
химиком Огто Варбургом, Atmungs ferment,
т. е. дыхательный фермент. Нам это назва
ние представляется наиболее подходящим,
поскольку большая часть кислорода,
потребляемого для дыхания, в биосфере
используется благодаря данному ферменту.
Для сборки такой электронно-транс
портной цепи требуется большое
искусство. И все же эти архитектурные ухищрения
кажутся почти тривиальными по сравнению
с некоторыми другими свойствами
дыхательной цепи, так как микросферы
являются не только электронными проводниками.
Они также проводники энергии,
организованные таким образом, чтобы улавливать
энергию, излучаемую электронами по мере
их падения к кислороду, и тем самым
подготовить их к использованию в
биологической работе с АТФ. Другими словами, в
микросферах содержатся окфос-блоки.
Это вносит два дополнительных
условия в их устройство. Во-первых, потенциал
носителей должен быть сбалансирован
таким образом, чтобы обеспечить
необходимое падение электронов. Вспомним: для
производства парой электронов энергии,
достаточной для поддержания синтеза
молекул АТФ, электроны должны упасть вниз
с разностью потенциалов как минимум
300 мВ. Во-вторых, электроны,
претерпевающие такие падения, должны
подчиняться условиям, так или иначе связывающим
их поток с синтезом АТФ. Такая же
картина наблюдается при прохождении потока
воды через гидротурбину, в результате
чего вырабатывается электричество.
Первое условие обеспечивается весьма
умело и эффективно. На пути движения
электронов имеется по крайней мере три
окфос-блока или фосфорилирующих
участка, объединенных вместе. Это так
называемые участки I, II и III, разделенные
платформами, которые мы обозначим как
уровни НАДН, Ь — Q и с. Каждый из них
получил свое название от характеристик
носителя электронов. Каждая платформа
доступна для электронов, поставляемых
извне соответствующими донорами.
Электроны могут быть вновь собраны от них с
помощью таких искусственных акцепторов,
как, например, феррицианид или метилено-
вый синий. Однако, как правило,
единственным выходом электронов является
кислород при нулевом уровне энергии.
Начнем с рассмотрения уровня с. Он
получил название от цитохрома с, своего
основного компонента. Среди веществ;
способных отдавать электроны в цепь на
этом уровне, имеется аскорбиновая
кислота, или витамин С — вещество,
содержащееся в свежих фруктах и овощах и
предотвращающее развитие цинги — обычной
болезни мореплавателей в прошлом.
(Слово «аскорбиновая» произошло от
сочетания греческой приставки «а», означающей
«нет», и английского слова scorbut —
цинга.) Не ясно, связано ли
противоцинготное свойство витамина С непосредствен
но с его способностью отдавать электроны,
хотя и не исключено, что это
осуществляется каким-то особым путем. Однако в
лабораторных экспериментах аскорбиновая
кослота взаимодействует с митохондриями
на с-уровне, и это позволило выявить
окфос-блок на участке III, когда
обнаружилось, что одна молекула АТФ
синтезируется для каждой пары электронов,
перенесенной с аскорбиновой кислоты на кислород
Подход к участку II осуществляется
через Ь — Q-уровень, названный так
потому, что в нем находятся одновременно
цитохром Ь и кофермент Q, или убихи-
нон — электронный носитель хинонового
типа. С уровнем Ь — Q связано несколько
ФАД-зависимых флавопротеидов: они
служат входными отверстиями для
электронов, поступающих от определенных
метаболических субстратов, таких, как
янтарная кислота — промежуточный продукт
мВ
1000
800
600
400
200
0 L
НАДН
Участок I
Янтарная
кислота—
ацилКоА
Участок 11
Аскорбиновая с=п J
кислота '
Участок
Килокалории на пару
электрон-эквивалентов,
переносимых на кислород
50
Уровень b — Q
АТФ
Уровень с
АТФ
Н20
Уровень
вода/кислород
40
30
20
10
Фосфорилирование дыхательной
цени. Пары электронов, падающие
к кислороду, проходят через один
или три окфос-блока, в
зависимости от уровня, на который
они поступают.
цикла Кребса и жирные производные
ацил-кофермента А — активированные
формы жирных кислот. Когда пара
электронов поступает на этот уровень, она
падает вниз через два последовательных
окфос-блока. При этом образуются две
молекулы АТФ.
Уровень НАДН занят специфическим
флавопротеидом, который переносит
электроны от НАДН на участок I фосфорилиро-
вания. Для каждой электронной пары,
поступающей на этот уровень и
собираемой кислородом на дне, синтезируется
всего три молекулы АТФ. НАД+ сам по
себе служит электронным акцептором в
бесчисленном ряде реакций. Таким
образом, в этот поток направляется
большинство катаболических электронов у
аэробных организмов.
Эффективность этих митохондриальных
трансформаторов поистине удивительна.
При. участии НАДН, выступающего в роли
донора электронов, свыше 85% свободной
энергии окисления восстанавливается в
виде АТФ: ЗХ 14=42 ккал на пару электрон-
эквивалентов из общей суммы 49. При
участии ФАДНг эффективность несколько
меньше, но все же значительна и
составляет 2Х 14=28 ккал на пару
электрон-эквивалентов из 37, или 76%.
В сочетании с высокой эффективностью
реакций холодного сгорания общая
эффективность процесса достигает 80%. Эту
величину легко рассчитать по данным,
приведенным в табл. 4. А данные эти
просто ошеломляют! С ними не идут в
сравнение никакие источники энергии,
созданные руками человека. Они отражают
удивительное свойство энергетических
преобразователей, заключенных в
микросферах внутренней мембраны митохондрий.
Механизм работы этих
преобразователей занимал умы лучших исследователей
более трех десятков лет. По мнению
английского ученого Питера Митчелла,
родоначальника широко распространенной
хемиосмотической теории, все дело в
движущей протоны силе. Эта проблема для
туристов представляет исключительную
трудность, но все же попытаемся к ней
приблизиться. Ибо, как нам станет ясно
из гл. 10, это один из центральных
механизмов жизни, а потому его рассмотрение
стоит затраты дополнительных усилий.
Сила, движущая протоны,—
секрет окфоса
Внутренняя мембрана митохондрий
непроницаема для протонов: сквозь нее не
могут проникнуть ионы водорода. А значит,
она непроницаема и для гидроксильных
ионов, ОН", которые в противном случае
могли бы выступать в качестве носителей
ионов Н+, забирая их с собой в виде Н2О
и возвращая в виде ОН~ На самом же
деле мембрана полностью непроницаема
для ионов: ни один ион, будь он
отрицательно или положительно заряжен, не
может проникнуть сквозь нее в ощутимых
количествах путем пассивной диффузии.
Все распределение ионов между
митохондриями и окружающим цитозолем четко
регулируется с помощью специальных
ворот или насосов.
Имеется такой насос, вернее, два типа
насосов, и для протонов. Оба
предназначены для того, чтобы насильственно
перекачивать протоны из митохондрий при
условии снабжения энергией. Оба они
обратимы, иными словами, могут
вырабатывать энергию за счет внутреннего потока
протонов. Но их энергетическое снабжение
различно: один насос работает за счет
электронов, другой — за счет АТФ. Короче
говоря, секЪет окфоса заключается в том,
что поток электронов и синтез АТФ
связаны между сЬбой протондвижущей силой.
Рассмотрим сначала насос,
работающий за счет АТФ. При расщеплении одной
молекулы АТФ на АДФ и неорганический
фосфат насос выводит п протонов из тела
митохондрии. Он может продолжать
работать таким образом до тех пор, пока
способен превосходить потенциал протонов,
образующийся снаружи. Когда же этот
потенциал становится равным мощности
насоса, последний перестает работать,
точно так же, как это происходит с
электрическим насосом, который способен
накачивать воду только на определенный
уровень в зависимости от мощности
электродвигателя. Мощность насоса, работающего
под действием АТФ, нам известна: она
составляет примерно 14 ккал/г-моль
расщепляющейся молекулы АТФ. Поэтому
максимальный уровень, на который он
может поднять протоны, равен
приблизительно 14/п ккал/протон-эквивалент.
По такому же принципу работает и
электрон-управляемый насос, если не
считать того, что он снабжается энергией,
высвобождаемой парой электронов,
падающих вниз через разность потенциалов.
Если эта разность составляет 300 мВ, то
получаемая энергия будет равняться
14 ккал/пара электрон-эквивалент. Такой
насос, как и АТФ-управляемый насос,
перестанет работать, когда потенциал
протонов достигнет 14/л
ккал/протон-эквивалент, где п — количество протонов, которое
насос перемещает на каждую пару
падающих электронов. Оказывается, что
значение п для двух типов насосов одинаково;
в противном случае сопряженная система,
описанная здесь, не смогла бы работать.
Если теперь нам известно, что два
насоса работают совместно против одного и
того же потенциала протонов и один из
них оказывается чуть сильнее другого,
то более мощный насос поднимет
потенциал протонов выше предельного уровня
более слабого насоса, который, если он
обратим, начнет работать в обратном
направлении. То же происходит с двумя
электрическими насосами,
перекачивающими воду вверх в один и тот же
резервуар: если один из них сильнее, он
поднимет воду на уровень, достаточный для
того, чтобы направить поток обратно через
более слабый насос и заставить его
работать в качестве генератора. В обратимой
системе такого типа количество электриче-
12—1452
Максимум электронов
Максимум АТФ -
Протонный потенциал
АТФ Электроны
АТФ
Модель, подтверждающая
хемиосмотическую теорию. Два
насоса — один управляемый
электронами, другой — АТФ —
направляют протоны на верх
одного и того же резервуара,
создавая электронный потенциал.
Если один насос сильнее другого,
то он поднимает протонный
потенциал выше максимальной
возможности другого насоса,
который в этом случае будет
работать в обратном направлении.
Обычно электрон-управляемый
насос мощнее и для получения
АТФ вызывает обратный ход
АТФ-управляемого насоса.
ства, вырабатываемого вторым насосом,
будет равно количеству электричества,
потребляемого первым насосом, за
исключением ничтожно малых потерь из-за
несовершенства системы. Таким образом
электрическая энергия передается с помощью
гидравлического преобразователя.
Аналогичная ситуация наблюдается в
митохондриальной мембране, только уже
с другими видами насосов и энергии. Чаще
всего более мощным из двух митохонд-
риальных насосов оказывается тот,
который приводится в действие электронами,
ибо он все время снабжается топливом
в процессе метаболизма, тогда как АТФ
постоянно потребляется для выполнения
различных видов работы в клетке. Вот
почему АТФ-управляемые насосы работают
в обратном направлении, создавая АТФ
с помощью протондвижущей силы, которая
снабжается потоком электронов.
Обычно эта система не работает в
обратном направлении, так как для этого не
существует отдельного источника АТФ
Но может случиться, что один из электрон
управляемых насосов окажется более мощ
ным, чем другие. Как мы помним, в дыха
тельной цепи имеются три окфос-блока,
каждый из которых связан с разными
Примеры обратного переноса
электронов. Падение одной
электронной пары от янтарной
кислоты к кислороду приводит к
двум «всплескам» протондвижущей
силы на сайтах II и III. При
снабжении НАД"1", играющего
роль акцептора, от янтарной
кислоты доставляются две
дополнительные электронные пары,
которые затем переносятся через
сайт I, действуя в обратном
направлении за счет
протондвижущей силы,
образующейся на сайтах II и III.
Аналогично две электронные пары
переносятся от аскорбиновой
кислоты на кислород через
сайт III, приводя к двум
«всплескам», которые помогают
третьей электронной паре
забраться наверх от аскорбиновой
кислоты к НАД"1" через Аайты II
и I, действующие в обратном
направлении.
носителями электронов, а следовательно,
с разными насосами гшотонов. Самый
мощный из них тот, что находится на
участке III. Его разность потенциалов
близка к 500 мВ, поэтому он в основном
необратим, тогда как насосы на участках
I и II легко обратимы; их разность потен
циалов около 300 мВ. Благодаря дополни
тельному падению до участка III
электроны, поступающие в систему на уровнях с
или Ь — Q, способны вырабатывать потен
циал протонов, достаточный для того что
бы направить поток электронов в обратную
сторону через участок или участки, рас по
ложенные выше их места вхождения. Что
бы такой обратимый электронный перенос
стал возможным, необходим подходящий
акцептор, например НАД4"; с его помощью
будет происходить сбор электронов, подия
тых на более высокий энергетический
уровень. Такой феномен был воспроизведем
в митохондриях в экспериментах. Как мь>
увидим ниже, обратный перенос электронов
происходит в физиологических условия>
во многих аутотрофных организмах, где
он играет чрезвычайно важную
биологическую роль.
Пытаясь представить себе эту систему,
вы должны понять, что митохондриальн'он1
12*
протонные насосы не секретиоуют просто
кислоту, как это делает, например,
протонный насос слизистой, выстилающей
желудок. Дело в том, что вытесняемые
протоны не сопровождаются отрицательно
заряженными ионами и не обмениваются
на другие положительно заряженные ионы.
Как только протоны выталкиваются
наружу, нарушается электрический баланс за
счет потери положительных зарядов внутри
митохондрий, а по всей митохондриальной
мембране образуется электрический
потенциал, положительный снаружи. По мере
увеличения потенциала становится все
труднее выталкивать протоны наружу
против этого потенциала — вспомним, что,
согласно закону Кулона, одноименные
заряды отталкиваются друг от друга.
В конце концов насос не выдержит пере
грузки и остановится, когда работа, необ
ходимая для проталкивания дополнитель
ного положительного заряда против элект
рического потенциала, сравняется с мощ,
ностью насоса. Другими словами, протон
ный потенциал в этой системе выражается
в основном в виде разности
электрического потенциала через мембрану.
Существует небольшое различие в кислотности
между внутренней и внешней частями
митохондрий, мо оно несущественно.
Мы можем рассчитать мембранный
потенциал митохондрии, зная, что мощ
ность насоса составляет 14/п ккал/протон
эквивалент (58 600/лг Дж/протон-эквива
лент) или
По Митчеллу, п = 2; в таком случае
потенциал мембраны равен 300 мВ. Но не
все ученые разделяют точку зрения
Митчелла. Некоторые утверждают, что ai = 3
или 4; в этих случаях потенциал будет
составлять 200 или 150-мВ соответственно.
Другие считают, что величина
мембранного потенциала еще ниже, и не потому,
что они не согласны со стехиометрией
Митчелла, а потому, что, по их мнению,
протонный потенциал частично
проявляется в конформационных изменениях
мембраны. К сожалению, у нас нет необходимого
вольтметра, позволяющего решить этот
вопрос. Да и зрение наше не настолько
острое, чтобы можно было обнаружить,
изменяются ли очертания и формы молекул
при энергизации микросфер.
Что же мы знаем о самих насосах?
Увы, очень мало. Известно несколько
АТФ-управляемых протонных насосов.
Помните, один из них находится в
мембране эндосом и лизосом? Что же касается
молекулярного механизма, связывающего
перенос протонов с гидролизом АТФ, то
ни для одного из насосов он еще не открыт.
Известно только, что митохондриальный
АТФ-управляемый протонный насос
находится в маленьких узелках, выступающих
с внутренней стороны мембраны; их можно
выборочно разрушить веществом,
называемым олигомицином. Как указывает само
название, олигомицин получают из
плесени (греч. mykes — плесень). В нашем
путешествии мы встретимся и с другими
«Петлевая» гипотеза, предложенная
Митчеллом для объяснения
сопряжения между электронным
переносом и выталкиванием
протонов. В каждом участке
фосфорилирования .электроны
принимают на себя функцию
переноса протонов наружу, после
чего возвращаются
«обнаженными»
«мицинами». Они являются поистине бес
ценными помощниками биохимиков и
молекулярных биологов, помогая им
расшифровать некоторые наиболее сложные
биологические механизмы. Интересно, что все
эти вещества в некотором роде
представляют собой ответвления от пенициллина
До открытия последнего немногие ученые
проявляли интерес к плесени. Но после
того, как стало известно, что плесневый
грибок (Penicillium notatum) производит
вещество (вполне понятно названное
пенициллином), способное остановить развитие
некоторых патогенных микробов, начался
широкий поиск других плесневых
продуктов, обладающих свойствами антибиотиков.
С этой целью по всему миру отбирали
сотни тысяч линий плесени и получали
большой «урожай» активных веществ.
Некоторые из них, например
стрептомицин, были использованы в клинике. Но от
большинства других пришлось отказаться,
так как они оказались крайне токсичными
для организма человека. Эти вещества
подавляют ряд важных биологических
процессов, в частности транскрипцию
ДНК, синтез белка или окислительное фос-
форилирование. В биохимии нередко
о работе какого-либо механизма можно
судить по тому, как он блокируется
ингибиторами. Вот почему эти вещества,
будучи непригодными для лечения людей,
оказались бесценными для науки. Этот факт,
как, впрочем, многие другие в истории
науки, лишний раз свидетельствует о том,
сколь непредсказуемы открытия и сколь
недальновидны те бюрократы, к
сожалению, все чаще встречающиеся в
последнее время, которые ограничивают деятель
ность ученых строго определенными про
граммами.
Возвращаясь к электрон-управляе-
мым протонным насосам, мы должны
уяснить для себя их место в молекулярной
архитектуре самих микросфер, поскольку
их работа зависит от обязательного
сопряжения между переносом электронов и
выведением протонов. Митчелл высказал
простую, но любопытную гипотезу
относительно такого сопряжения: он
предположил, что электроны поступают в окфос-
блоки в виде атомов водорода,
поставляемых из митохондрий, а покидают окфос-
блоки «обнаженными», сбросив протоны
снаружи. Согласно модели Митчелла, мик
росферы образованы из перемежающихся
Некоторые виды работы, которые
могут быть совершены с помощью
митохондриальной
протондвижущей силы. Протоны
могут возвращаться внутрь
благодаря сопряженному синтезу
АТФ. Они могут также
возвращаться вместе с
низкоэнергетическими электронами
и переводить их на более высокий
уровень или обмениваться на
ионы кальция благодаря носителю
кальция, как правило,
имеющемуся в мембране, или
быть обменены на калий при
добавлении валиномицина
(ионофора калия, полученного
из плесени), или возвращаться с
помощью добавленного протонного
ионофора (разъединяющий агент)
с разрушением потенциала и
рассеиванием энергии в виде
тепла. Обратите внимание, что
все эти виды работы могут
также происходить з„а счеТ~
АТФ-синтезирующего аппарата,
действуя в обратном направлении
как выталкивающая протоны
АТФ-гидролаза.
водород- и электроннесущих сегментов,
которые образуют петли в толще
мембраны. Если это действительно так, вопрос
ясен. Но, спрашивается, какого рода
ограничения должна налагать молекулярная
анатомия микросфер на поток электронов?
Ограничение заключается в том, что
электроны проталкиваются по синусоидальному
пути, который ведет их попеременно от
одной стороны мембраны к другой, причем
в одном направлении вместе с протонами,
а в другом — без них. На самом деле,
механизм гораздо сложнее, чем следует из
нашего упрощенного описания; он
включает в себя тонкие физико-химические и
конформационные изменения, связанные с
прохождением носителей от окисленного
состояния к восстановленному. Добавьте
все эти требования к перечисленным выше,
и перед вами будет весьма сложный,
четко работающий механизм. Не
забывайте, что весь он умещается в крошечной
«биочастице» толщиной в 0,3-миллионную
и шириной в одну миллионную часть
дюйма!
Из-за внутренних структурных
ограничений митохондриальные окфос-блоки не
расходуют энергию зря. Поток электронов
и синтез АТФ по необходимости
сопряжены; это означает, что скорость потока
электронов (а также субстрата и
потребления кислорода) автоматически доводится
до скорости потребления АТФ. В состоянии
покоя используется мало АТФ и,
следовательно, потребление пищи и дыхание
находятся на низком уровне. Но как только
появляется внезапная потребность в АТФ,
например у спортсмена, начинающего
забег, электронный поток тут же
многократно увеличивается, вызывая
одновременно пропорциональное увеличение ката-
болического окисления и потребления
кислорода. Этот регуляторный механизм
называется дыхательным контролем.
Дыхательный контроль зависит от силы
связывания, которая в свою очередь
определяется непроницаемостью мембраны для
протонов. Любое вещество, способное
транспортировать протоны через липидный
бислой мембраны (протонный ионофор),
тут же вызовет разрушение протонного
потенциала и, таким образом, приведет к
раскрытию системы. Известны многие
такие разъединяющие вещества. Их
прототипом служит 2,4-динитрофенол.
Другим способом снятия заряда с
мембранного потенциала является внесение
в систему положительно заряженного иона,
способного проникать через мембрану в
митохондрии. Но, для того чтобы это
произошло, в мембране должен быть
подходящий носитель. В природе существует
носитель для ионов кальция, поэтому
митохондрии стремятся предохранить свое
окружение от ионов кальция. Это важный
регуляторный механизм (см. гл. 12). Путь для
поступления ионов калия можно создать
искусственно, внося валиномицин,
плесневый токсин, обладающий свойствами ионо-
фора калия. Заметим, что при этом работа
все же производится. Электронный поток
поддерживает активный транспорт
добавленного катиона внутрь митохондрий в
обмен на транспорт протонов наружу.
В заключение необходимо указать, что
окфос-блоки субстратного уровня,
например такие, какие имеются при гликолизе
или в цикле Кребса, работают не за счет
протондвижущей силы. Они относятся к
чисто химическим преобразователям.
Длительное время ученые представляли
механизм фосфорилирования на субстратном
уровне как связанное с мембраной фосфо-
рилирование на уровне медиаторов,
которое имеется в митохондриях, ибо
большинство из них искали несуществующие
химические посредники.
Рост и размножение
митохондрий
Митохондрии растут и делятся так, как
этого следует ожидать от симбиотических
микроорганизмов. Однако в отличие от их
предполагаемых бактериальных
предшественников они вряд ли производят хотя бы
один из своих компонентов. Большинство
митохондриальных белков синтезируется в
экстрамитохондриальной цитоплазме
согласно приказам, посылаемым из ядра.
Но, каким образом белки направляются
в митохондрии и проходят через два слоя
мембраны митохондрий, еще далеко не
ясно.
С определенностью можно сказать, что
это происходит не так, как у бактерий.
Бактерии сами производят белки с
помощью своих рибосом, считывая информацию
с генов. Казалось бы, симбиотические
потомки должны были последовать приме-
ру своих далеких предков. Поскольку это
не так, значит, мы должны отвергнуть
симбиотическую теорию происхождения
митохондрий. Но не обязательно, так как
митохондрии не полностью контролируются
генами ядра. У них имеется собственная
генетическая система, очень примитивная и
рудиментарная, кодирующая только
небольшое количество белков. Но все же она
цельная, законченная, содержит ДНК, а
также все другие структуры, необходимые
для репликации, транскрипции и
трансляции генетической информации. Эта система
функционирует, что проявляется в синтезе
некоторых специфических митохондриаль-
ных белков, например части комплекса
цитохромоксидазы. Она даже может
подвергаться мутациям, которые поэтому
передаются цитоплазмой, а не ядром, согласно
обычному менделевскому хромосомному
механизму. Типичный пример
наследственных изменений, затрагивающих митохонд-
риальную ДНК, — так называемая «petite»
мутация дрожжей.
Удивительно другое: система митохонд-
риального генетического аппарата имеет
типичные черты бактерий. ДНК кольцевая,
напоминающая бактериальную ДНК.
Рибосомы меньше цитоплазматических и почти
таких же размеров, как бактериальные.
Их способность синтезировать белки
блокируется антибиотиком хлорамфениколом,
ингибитором синтеза белка бактерий, но не
синтеза белка эукариотов; на синтез белка
не влияет циклогексимид — ингибитор
белкового синтеза эукариотов, который также
неактивен у бактерий. И, что самое
поразительное, митохондрии даже не
«разговаривают» на языке, свойственном всей
остальной клетке; у них несколько иной
генетический код.
Таковы несколько причин, в силу
которых многие ученые верят в происхождение
митохондрий от каких-то далеких прока-
риотических предков, которые были
«усыновлены» эндосимбиотическим путем.
В процессе длительной интеграции они
постепенно утеряли контроль над
собственной судьбой, но все же умудрились
сохранить определенные признаки своей ранее
существовавшей автономии, которые
пронесли без изменения в ходе длительного,
изнуряющего процесса эволюции. Они в
какой-то степени проливают свет на
исторические события необычайной важности,
которые происходили более миллиарда лет
назад. События эти могли бы навсегда
остаться погребенными во мраке прошлого,
если бы не митохондрии-«сплетники».
Однако взгляды на раскрытие тайн
расходятся, и эти явления интерпретируются
разными учеными по-разному.
10
Хлоропласты:
аутотрофия
и фотосинтез
Хотя наше путешествие в основном
касается животных клеток, оно будет не
полным, если мы, пусть не надолго, не
заглянем в мир растений. Растения
относятся к общей группе аутотрофов —
буквально это значит «самопитающиеся
организмы». Правильнее называть их лито-
трофами (греч. lithos — камень), но это
менее распространенное название. Вместе с
тем «пищевые продукты» аутотрофов и в
самом деле полностью поступают из мира
минералов в виде двуокиси углерода
(ССЬ), воды (НгО), нитрата (NO;T),
сульфата (SO42 ) и подобных неорганических
компонентов. В них содержатся
необходимые элементы, но в совершенно
«некалорийном» виде, не представляющем
ценности с энергетической точки зрения. Ауто-
трофы нуждаются в дополнительном
источнике энергии, так как не могут подобно
гетеротрофам (органотрофам) черпать
энергию из пищи.
Как выжить
в безжизненном мире
В каком виде находится эта энергия?
Есть несколько ответов на этот вопрос, но
они все сводятся к одному слову:
электроны. То, что электроны необходимы для
аутотрофного образа жизни, вытекает из
природы их строительных блоков. Чтобы
перевести СОг, ЬЬО, NOr, SC>4~ и другие
вещества в углеводы, белки, липиды и
другие биологические компоненты,
необходим большой приток электронов —
практически столько, сколько высвобождается при
окислении этих составных частей у гетеро-
трофов. Что электроны должны иметься
в достаточных количествах, можно пред
положить, исходя из наших знаний о гете-
ротрофах. Если какой-либо организм имеет
как минимум один функциональный
свободный окфос-блок, он может использовать
электроны для выработки АТФ и
полностью удовлетворить свою потребность в
энергии.
Электроны должны поставляться на
достаточно высоком энергетическом уровне.
Что касается синтеза АТФ, эти требования
варьируют и зависят от уровня, с которого
электроны покидают окфос-блок. При этом
необходимо только, чтобы они поступали
на уровне, превышающем уровень их
выхода по крайней мере на 300 мВ (если,
как это обычно бывает, они поступают
парами). Однако для восстановительного
синтеза, при котором электроны чаще всего
поступают на уровне, как минимум
эквивалентном, уровню НАДН, требование
более строгое. Причина очевидна: это
уровень, с которого большая часть
запасаемых электронов падает вниз при
катаболизме.
В примитивных системах аутотрофное
восстановление происходит при участии
НАДН, т. е. с тем же коферментом, что и
катаболическое окисление. Гликолиз у
животных также протекает по этому пути.
Как мы видели в конце гл. 7, окфос-блоки
гликолитической цепи работают на уровне,
близком к термодинамическому
равновесию, поэтому даже сравнительно
небольших изменений концентраций участвующих
веществ достаточно, чтобы повлиять на
направление потока электронов через блок
и вызвать в клетке переключение
гликолиза на глюконеогенез.
Предусмотрев все, Природа создала
особый кофермент для биосинтетического
восстановления и тем самым отделила
анаболизм от катаболизма. Этот
кофермент, являющийся фосфорилированным
производным НАД, называется НАДФ, что
означает: никотинамидадениндинуклеотид-
фосфат. Несмотря на близкое родство с
НАД, НАДФ функционирует по-иному.
За крайне редким исключением, дегидро-
геназы используют один кофермент, а не
оба сразу. Благодаря такому особому
способу управления, который при
необходимости поддерживается затратой энергии,
резервуар НАДФН образуется при
значительно более высоком энергетическом уров-
Разделение работы между НАД
и НАДФ. Чтобы выполнить
анаэробную функцию, резервуар
НАДФН формируется на более
высоком энергетическом уровне,
чем НАДН, который играет
основную роль при катаболизме.
не, чем НАДН: это составляет около
1200 мВ выше уровня вода/кислород, или
55 ккал/пара электрон-эквивалент,
перенесенных на кислород. Это согласуется с
выводом о том, что единственным
направлением электронов при их движении под
действием собственной энергии является
направление вниз. Таким образом, при
синтетическом восстановлении электроны
падают вниз с уровня НАДФН до
субстратного. При катаболизме они падают еще
ниже, от субстрата к НАД+, от НАДН —
к следующему акцептору и так далее на
протяжении всего пути к кислороду.
Помимо необходимого снабжения
высокоэнергетическими электронами для ауто-
трофного пути' жизни требуется
соответствующий каталитический механизм. В
основном он напоминает механизм гетеро-
трофов в силу легкой обратимости многих
реакций, протекающих в этих организмах.
Но некоторые процессы уникальны и
характерны только для аутотрофов.
Чтобы попытаться понять аутотрофные
по
ы\п
механизмы, мы должны ^представить в
своем воображении далeKoeVдалекое прошлое,
пребиотические временад около 4,5
миллиардов лет назад, когда, по мнению
большинства ученых, наша молодая
остывающая и все еще безжизненная планета
постепенно превратилась в очаг
органического синтеза. Что происходило в те
незапамятные времена, никогда не узнать в
деталях. Но можно предположить, что
благодаря сочетанию благоприятных
химических и физических факторов начали
спонтанно образовываться органические
молекулы разных типов (среди них было
немало веществ, ставших строительными
блоками современных живых организмов).
Этому скорее всего способствовали
богатая влагой, углекислым и азотным газами
атмосфера, энергия в виде тепла,
ультрафиолетовое излучение, разряды молний,
наличие каталитических глин и других
минералов и, наконец, мелкие лужицы воды,
в которых инкубировался сгущающийся
«первичный бульон». Все это могло бы
показаться плодом разыгравшейся фантазии,
но ученые уже воспроизвели в
лабораторных условиях некоторые события и
факторы, которые, по мнению геофизиков,
господствовали в пребиотические времена.
Что произошло далее, представить
еще труднее. Каким-то образом
происходило образование различных полимеров,
они беспрерывно объединялись
беспорядочным, случайным образом. Из этих
полимеров лишь немногие дали начало
соединениям, которые содержали зародыши
самовоспроизведения и саморегуляции. С этого
времени вступил в свою силу естественный
отбор. Потребовался союз двух факторов,
случайности и необходимости, чтобы про-
Зарождение жизни
изошло дальнейшее объединение все
возрастающей сложности и организационной
стабильности. В конечном счете появились
структуры, которые мы сегодня назвали бы
живыми клетками. Как это ни невероятно,
процесс в целом занял не более миллиарда
лет. К тому времени организмы,
напоминающие бактерии, уже существовали в
таких отдаленных друг от друга регионах,
как Гренландия и Северная Африка.
Итак, зародилась жизнь.
Если вам трудно поверить в то, что
такие сложные клетки, как бактериальные,
могли появиться в рассматриваемый
период, вы можете последовать за
Фрэнсисом Криком, который прославился
открытием двойной спирали, и предпочесть
другое толкование. А суть его сводится к тому,
что первые бактериальные клетки были
привнесены на нашу планету космическим
кораблем, посланным далекой
цивилизацией (теория направленной панспермии).
Но даже если вы разделяете такую
натянутую теорию происхождения жизни, вам,
конечно же, не удастся решить саму проблему
происхождения жизни. Вы только перене
сете ее в более отдаленную точку
пространства и времени, допустив, что для
спонтанного появления жизни в другом месте
существовали более благоприятные
условия, чем на нашей планете. Учитывая, что
нам неведомы условия, существовавшие
на Земле миллиарды лет назад, аргументы
в пользу создания жизни как космического
импортного продукта кажутся вполне
возможными. Заметим также, что современная
теория, рассматривающая происхождение
самой Вселенной как результат Большого
взрыва, который произошел около 15 мил
лиардов лет назад, оставляет нашим пред
полагаемым предкам едва ли больше
времени для достижения их необыкновенно
высокого уровня развития от стартовой
черты, чем нам для достижения нашего
уровня развития. Теория также не
допускает возможности, что жизнь является
вечным свойством Вселенной,
присутствующим в зародышевом состоянии в
космическом пространстве, как предполагал около
100 лет назад шведский ученый Сванте
Аррениус, родоначальник оригинальной
теории панспермии. Впрочем, Аррениус
больше известен как автор уравнения,
определяющего влияние температуры на
скорость химических реакций.
Но вернемся к нашему рассказу. Ран
ние бактерии, которые появились на Земле
или в каком-нибудь другом месте в те
далекие времена, могли начать вести
гетеротрофный образ жизни, т. е. существовать
за счет питания из почвы и потребления
органических веществ, производимых в
ходе абиотических (неживых) процессов.
Но рано или поздно абиотический источник
снабжения питательными веществами
истощился, и по крайней мере одной группе
организмов пришлось приспособиться к
аутотрофии. В противном случае жизнь бы
угасла.
По всей видимости, организмы,
достигшие аутотрофного образа жизни,
приобрели высокоэнергетические электроны из
своего ближайшего окружения. В
минеральном мире существуют, хоть и не очень
многочисленные, источники «хороших»
электронов. Некоторые мы можем
обнаружить и сейчас, а в те времена, когда
преобладала в высокой степени
восстанавливающая атмосфера, их должно было
быть гораздо больше. В качестве примера
приведем газообразный водород, окись
углерода и особенно некоторые сернистые
пары, испускаемые при извержении
вулканов. Вероятно, не случайно многие
современные аутотрофные бактерии принадле-
жат к группе тиобактерий (греч. theion —
сера). Они свидетельствуют о тех
временах, когда зародилась жизнь в мире,
наполненном сильным запахом тухлых яиц,
хоть это и звучит не очень романтично.
Электроны, поступавшие извне на
довольно высоком энергетическом уровне,
примерно около 50 ккал/пара электрон-
эквивалент выше уровня вода/кислород,
могли с помощью определенного катализа
поддерживать необходимые аутотрофные
восстановительные процессы. Но для этих
примитивных гетеротрофов снабжение АТФ
все еще представляло основную проблему,
если у них происходило анаэробное
брожение, зависящее от фосфорилирования на
субстратном уровне (см. гл. 7). Для
преобразования электронного «топлива» они
нуждались в новом двигателе, окфос-блоке,
который получал бы электроны от
внешнего донора и возвращал бы их к внешнему
акцептору, как это происходит в
дыхательной цепи митохондрий. Когда именно
впервые появилось такое приспособление
в истории жизни, мы сказать не в
состоянии. Но вполне вероятно (если только
ранние биоэнергетические механизмы
полностью не отличались от современных),
что такая обязательная предпосылка для
аутотрофной жизни возникла до или в
крайнем случае одновременно с самой
аутотрофией. Хотя нам до сих пор не
известно, как работал этот примитивный
механизм, логично допустить, что он
зависел от протондвижущей силы и
представлял собой прототип универсального
энергетического преобразователя у аутотро-
фов и гетеротрофов — будь они
прокариотами или эукариотами.
Возможно, ранние аутотрофы, от
которых произошли все современные формы
жизни, приобрели это важнейшее свойство
изначально как адаптацию к
экстремально кислой окружающей среде. С такого
рода адаптацией мы сейчас сталкиваемся
у термоацидофильных бактерий,
относящихся к группе археобактерий (греч.
arkhaios — древний). Принято считать, что
они имеют особо древнее происхождение.
Как указывает их название, /гермоацидо-
филы, которые обнаруживаются в горячих
серных источниках, приспособлены и к
высокой температуре, и к высокой
кислотности. Они выживают в таких
экстремальных условиях благодаря активному
накачиванию протонов извне и использованию
образующегося градиента для совершения
разнообразной работы.
Какова бы ни была доля истины в
наших предположениях (если современные
организмы вообще сравнимы с самыми
ранними формами жизни),
примитивнейшие аутотрофы использовали
высокоэнергетические электроны для биосинтети
ческого восстановления и для снабжения
топливом окфос-блока, прикрепленного к
внешнему электронному акцептору более
низкого энергетического уровня (только не
к кислороду, которого в те времена скорее
всего не было). Если сделать эти окфос-
блоки обратимыми и связать их в ряды,
состоящие из двух-трех подобных блоков,
работающих на более низких
энергетических уровнях, чем в дыхательной цепи,
получится гораздо более подвижный
механизм, способный использовать новый класс
электронных доноров среднего
энергетического уровня. В таком случае окфос-блоки
(блок) более низкого энергетического
уровня будут (будет) служить для
покрытия энергетических нужд, в том числе
стоимости перевода на более высокий
энергетический уровень электронов,
необходимых для биосинтетических реакций
восстановления. Окфос-блоки более высокого
уровня осуществляют подъем за счет
протекания реакций в обратном направлении,
используя с этой целью энергию,
поступающую снизу, как это происходит в
митохондриях (гл. 9). Такие структуры в той
или иной форме характерны для
современных хемолитотрофов. Многие из них
являются аэробами и появились позднее в
процессе эволюции. Но некоторые
анаэробные хемолитотрофы известны и сейчас,
например Desulfovibrio desulfuricans (H2
восстанавливает SO4) и Thiobacillus
denintificans (БгОз" восстанавливает
NOr).
Если бы развитие эволюции
остановилось на том этапе, жизнь, продолжай она
существовать, осталась бы на крайне
примитивном уровне и занимала бы
ненадежные, специализированные и по существу
со временем вырождающиеся
экологические ниши, в которых была бы возможна
хемолитотрофия. Для продвижения
эволюции требовалось еще одно важнейшее
изобретение: использование солнечного
света. Трудно сказать, произошло это разви-
Хемолитотрофия требует:
1) экзогенного электронного
донора для поддержания как
анаболических реакций
восстановления, так и
катаболического снабжения
энергией; 2) экзогенного
электронного акцептора,
расположенного по крайней мере
на 300 мВ ниже донора, чтобы
могло произойти образование АТФ,
и 3) наличия не менее одного
окфос-блока, находящегося между
донором и акцептором. Если
электронный донор обладает
достаточно высоким потенциалом,
чтобы непосредственно
восстановить НАД+ (А), система
удовлетворяет необходимым
требованиям. В противном случае
для подъема электронов на
уровень НАДН требуется один или
больше обратимых окфос-блоков
(Б).
тие до или после появления хемолитотро-
фии. Обе формы аутотрофии
предъявляют в основном одинаковые требования
к потокам электронов в окфос-блоках.
У фотосинтезирующих организмов
появилось другое характерное свойство — они
получили возможность использовать
световую энергию для подъема на более
высокий уровень электронов с помощью
фотоэлектрической единицы.
Покорение Солнца
Волшебным компонентом этой единицы
является хлорофилл (греч. khloros —
зеленый, phyllon — лист) — магнийсодержащее
производное тетрапиррольного (греч. tet-
rara — четыре) порфиринового кольца.
Если магний заменить железом, то
получится образование, которое является
активным составляющим гемоглобина, цито-
хромов (в том числе дыхательных
ферментов) и других гемопротеидов (см. гл. 9).
Важность этой молекулы для успеха
жизни на Земле трудно переоценить. Но вот
что любопытно: по крайней мере у одного
организма в наши дни тоже есть
фотоэлектрическая единица, но содержит она
каротин (химическое производное
витамина А) — вещество, не имеющее никакого
родства с хлорофиллом. Речь идет о
пурпурной бактерии Halobacterium haloblum ~~
любящего морскую воду микроба из
группы археобактерий, которые живут на
поверхности испаряющихся солеварен. Хотя
каротинсодержащие вещества не очень
успешно улавливают солнечную энергию,
им принадлежит ключевая роль в развитии
фотокоммуникации. Родопсин (греч. rho-
don — розовый, opsls — зрение), один из
главных светочувствительных пигментов
глаза — близкий родственник бактериоро-
допсина, основного составляющего
фотоэлектрического генератора в мембране
Halobacterium.
Основная функция биологических
фотоэлектрических единиц заключается в
приеме электронов от низкоэнергетического
донора, в подъеме их на более высокий
энергетический уровень с помощью света и
в отдаче соответствующему акцептору. Эта
система может иметь несколько выходов
энергии, но при любых условиях должна
быть связана с окфос-блоком, через
который активизированные светом электроны
могут падать на более низкий
энергетический уровень; это связано с выработкой
потенциала протонов, который снабжает
энергией процесс сборки АТФ или
выполнение любой другой работы. Такого рода
комбинация фотоединиц с окфос-блоком
способствует процессу фотофосфорилирова-
ния, который может быть цикличным или
нецикличным в зависимости от того,
возвращаются сошедшие на низкий
уровень электроны в фотоединицу или пере
носятся к внешнему акцептору.
При бактериальной фототрофии
донором является органическая
(фотоорганотрофия) или
неорганическая (фотолитотрофия)
молекула с довольно высоким
электронным потенциалом. Пример
А относится к зеленым
фотосинтетическим бактериям,
электроны которых поступают
через окфос-блоки и затем
поднимаются с помощью
фотоединицы, которая доставляет
их к НАД+ или возвращает к
окфос-блоку (циклическое
фотофосфорилирование), возможно,
с помощью второго окфос-блока.
Пример Б относится к
пурпурной фотосинтетической
бактерии. Процесс протекает
так же, но фотоединица не
способна к подъему электронов
непосредственно до уровня НАДН.
Дополнительный приток энергии
достигается за счет обратимого
окфос-блока. Некоторые доноры
взаимодействуют напрямую с
фотоединицей. При фототрофии
у растения (пример В)
фотосистема II поднимает
электроны от воды к эндогенному
акцептору, который отдает их
фотосистеме I. Последняя
работает так же, как система в
зеленой фотосинтетической
бактерии (пример А), но
пользуясь НАДФ+ в качестве
конечного акцептора вместо НАД"1"
Количество окфос-блоков,
включенных в электрон-
транспортную цепь, разделяющую
две фотоединицы, не известно.
Обратите внимание на то, что
электроны «путешествуют» через
фотоединицы по отдельности.
Путем такой комбинации снабжение
электронами восстановительных процессов
биосинтеза может происходить либо
непосредственно из фотоединицы, если ее
активированный уровень достаточно высок,
либо косвенно, после дополнительного
повышения напряжения за счет окфос-бло-
ка, функционирующего в обратном
направлении, как во второй форме хемолитотро-
фии. Что касается электронных доноров,
то они относятся в основном к
минеральному миру (фотолитотрофия). Но известны
также случаи фотоорганотрофии. Они,
возможно, представляют собой
промежуточные формы между гетеро- и аутотрофией.
Сегодня наиболее примитивные
комплексы, зависящие от хлорофилла,
обнаруживаются в фотосинтетических пурпурных
и зеленых серных бактериях. Эти
организмы используют набор серных
компонентов в качестве доноров электронов и
зависят от фотохимического аппарата,
известного как фотосистема I. Большинство из
них строго анаэробные. Гораздо более
прогрессивная система, которую по праву
можно считать верхом совершенства ауто-
трофного образа жизни, — это
фотосистема II. Для нее характерно использование
воды в качестве донора электронов; эту
воду она окисляет до молекулярного
кислорода. Организмы, обладающие
фотосистемой II, достигли наивысшего уровня
энергетической автономии и для работы своих
«двигателей» нуждаются только в воде и
солнечном свете. Сама по себе фотосистема
II не может поднимать электроны на
протяжении всего пути от воды до НАДН. Она
доставляет их к фотосистеме I, которая
в свою очередь поднимает электроны до
уровня НАДФН. Обе фотосистемы связаны
фосфорилирующей
электронно-транспортной цепью, благодаря которой происходит
циклическое и нециклическое фотофосфо-
рилирование. Вершиной этого эпохального
в эволюции события явились
микроорганизмы, известные как синезеленые водоросли.
Хоть эти организмы и не родственники
морских водорослей, которые принадлежат
к эукариотам, водорослями их называют
из-за тенденции к объединению и
образованию различных видов нитчатых структур.
Научное название синезеленых — циано
бактерии (греч. kyanos — голубой); они
принадлежат к прокариотам.
Когда все это произошло? По крайней
мере 2,5 миллиарда лет назад, если судить
по четким отпечаткам и окаменелостям
водорослей в горных породах того времени
(Ганфлинтские сланцы), обнаруженным в
Канаде, или около 3,2 миллиарда лет
назад и даже еще раньше, если
основываться на некоторых отпечатках,
найденных в прекембрийских горных породах
Южной Африки. С момента своего
возникновения цианобактерии были «обречены»
на успех. Они распространились по всей
планете, покрыли ее колоссальной сетью
химических «фабрик», работающих на
солнечной энергии, и в течение почти 2
миллиардов лет полноправно господствовали над
эволюцией жизни на Земле. Благодаря
обильной пище они способствовали новому
бурному расцвету гетеротрофного образа
жизни и в конце концов положили начало
ответвлению высокоспециализированных
прожорливых фагоцитирующих клеток,
предположительно явившихся предками
всех эукариотов (гл. 6). Наряду с этим
цианобактерии радикально преобразовали
экологические условия на Земле, постоянно
выделяя в атмосферу кислород. В
результате адаптации к новым условиям возникла
аэробная жизнь (см. гл. 9) в основном
благодаря преобразованию исходного фо-
тофосфорилирующего аппарата в фосфори-
лирующую дыхательную цепь. Потребление
кислорода прогрессивно поднималось до
тех пор, пока не достигло равновесия
с его производством, приведя в движение
большое, управляемое Солнцем электрон-
Большое электронное «чертово
колесо» жизни
ное «чертово колесо» биосферы: от воды к
жизни через фотосинтез и обратно к воде
через дыхание. В итоге знаменательное
приобретение аэробных свойств
фагоцитами, от которых произошли митохондрии
и примитивные эукариоты, было
завершено. Во всяком случае так утверждают
сторонники эндосимбионтной гипотезы.
Затем, примерно 1,5—1 миллиард лет
назад, был разыгран последний,
завершающий акт в этой длительной эволюционной
драме, а быть может, его следовало
назвать прологом в свете тех событий,
которые за ним последовали. Вновь некоторые
бактерии, пойманные фагоцитами, сумели
выжить и установить симбиотические связи
со своими захватчиками. «Гостями» в этом
случае явились цианобактерии, а
«хозяевами» — примитивные эукариоты, уже
имеющие митохондрии. В результате
новые клетки приобрели второй тип эндо-
симбионтов, которые со временем
развились в хлоропласты — фотосинтезирующие
органеллы одноклеточных зеленых
водорослей и их многоклеточных потомков —
зеленых растений. Разумеется, описываемые
события чисто гипотетические. Однако
механизм, который, как предполагают,
способствовал появлению хлоропластов,
основывается на большем количестве
косвенных улик, нежели теория эндосимбиотиче-
На электронной микрофотографии
можно видеть два
фотосинтезирующих эндосимбионта,
родственных цианобактериям
(цианеллам), внутри клетки
одноклеточного двужгутикового
простейшего Cyanophora paradoxa.
Возможно, это и есть
отсутствующая связь между
цианобактериями и хлоропластами.
ского происхождения митохондрии, и
получил широкое признание.
Итак, через 3 миллиарда лет после
того, как на поверхности нашей планеты
впервые забурлила жизнь, через каких-
нибудь 50 триллионов поколений бактерий
на сцену наконец вступили фантастически
Бактериальный фотосинтез
развивался в два этапа: через
приобретение фосфорилирования
на уровне носителя и
фотосистемы I и через
приобретение фотосистемы II.
Согласно эндосимбионтной
гипотезе, цианобактерии были
поглощены древними эукариотами
(гл. 9), затем поселились в
клетке-хозяине и превратились
в хлоропласты одноклеточных
зеленых водорослей, от которых,
как полагают, произошли все
растения.
бурно развивающиеся растения и живот
ные, строение которых постоянно
усложнялось.
Зеленые особняки жизни
Хлоропласты напоминают митохондрии
по наличию двух окружающих мембран:
наружной, которая, как предполагают,
произошла из системы вакуолей предковых
фагоцитов, и внутренней, которая,
по-видимому, унаследована от плазматической
мембраны древних эндосимбионтов — сине-
зеленых водорослей. Они отличаются от
митохондрий размером и цветом. Как
правило, они намного крупнее митохондрий.
Их размеры достигают нескольких микрон,
и нам в ходе нашего путешествия не
составило бы особого труда проникнуть внутрь
На электронной микрофотографии
листа тимофеевки луговой
Phleum pratense видно, что
хлоропласт заполняет почти всю
цитоплазму. Обратите внимание
на то, как пачки тилакоидов
образуют граны. Клетка
прикрепляется к стенке (см.
электронную микрофотографию
на с. 37). Структура, вклиненная
между хлоропластом (он виден
полностью) и частью хлоропласта,
расположенного справа, —
митохондрия.
хлоропластов, не будь они переполнены
множеством мембран.
Эти мембраны, как и митохондрии,
произошли из складок внутренней
мембраны, но с тем важным отличием, что
выпячивания отделились от мембраны и
образовали мешочки в форме дисков. Мешочки
получили название тилакоидов (греч. thy-
lakos — мешочек). Несколько тилакоидов
образуют цилиндрическую структуру,
названную граной. Каждый хлоропаст
состоит из нескольких гран, часто связанных
трубчатыми соединениями. Система
внутренних мембран поддерживает
фотосинтетический аппарат.
Этот механизм включает фосфорили-
рующую электронно-транспортную цепочку,
граничащую сбоку с двумя
фотоэлектрическими единицами. Цепочка напоминает
митохондриальные микросферы. Она также
состоит из ряда структурно связанных
электронных носителей, включающих ме-
таллопротеиды ' (железо, медь), флавопро-
теиды, хиноны и цитохромы. Электроны,
циркулирующие через микросферы,
подчиняются тем же ограничениям, что и в
митохондриях; они выкачивают протоны
наружу, создавая протонный потенциал. Но
«наружу» в тилакоидах на самом деле
означает «внутрь», так как тилакоид
представляет собой запечатанный мешочек в
отличие от митохондриальной кристы,
которая является открытой внутренней
складкой. В результате создается впечатление,
Ультраструктура хлоропласта
будто митохондрии и хлоропласты
накачивают протоны в противоположных
направлениях. Однако это не совсем так. В
каждой из этих структур отрицательно
заряженная сторона мембраны ориентирована к
матриксу.
Как и митохондриальная внутренняя
мембрана, тилакоидная мембрана содержит
АТФ-управляемый протонный насос,
который находится в узелках, выступающих в
пространство матрикса. Не совсем ясно,
сколько последовательных окфос-блоков
связано с электронно-транспортными
цепочками. Установлено, что один, а
возможно, два блока находятся на основном,
нециклическом пути. По-видимому, на
циклическом пути имеется дополнительный
окфос-блок.
Сами фотосистемы состоят в основном
из связанного с белком хлорофилла, с
которым в свою очередь связаны
различные количества второстепенных пигментов,
таких, как красные или голубые фикобили-
ны (тетрапирролы с открытыми концевыми
группами, напоминающие пигменты желчи)
и желтые, оранжевые или красные
каротины и связанные с ними ксантофиллы (греч.
xanthos — желтый). Когда листья
начинают менять свой цвет, первым исчезает
хлорофилл и ярким пламенем загораются
второстепенные пигменты, радуя наш глаз
осенним буйством.
По определению вещество
окрашивается в силу того, что поглощает какую-то
часть падающего на него видимого света.
Его цвет соответствует свету, который не
поглощается, иными словами, дополняет
поглощенный свет. Так, хлорофиллы
зеленого цвета, так как они поглощают
красный цвет (с длиной волны, 680—700 нм);
оранжевые каротиноиды поглощают
голубой цвет (длина иолны около 4^0 нм) и т. д.
В тилакоидных мембранах имеется
несколько сотен таких молекул, которые
организованы в тесно связанные единицы,
сгруппированные вокруг одной молекулы
особого белково-хлорофиллового
комплекса, обозначенного как Р 700 или Р 680 в
фотосистемах I и II соответственно (в
зависимости от длины волны максимального
поглощения света). Чтобы лучше понять
работу такой единицы, оставим ее на время
в темноте, а затем внезапно осветим
вспышкой света. Пигменты поглощают
свет определенной длины волны (в
зависимости от их спектра поглощения) и
возбуждаются. Этот процесс включает
дестабилизацию электрона внутри молекулярной
структуры, что достигается количеством
энергии, равным тому, которое
соответствует поглощаемому кванту света.
У большинства пигментов энергия,
полученная таким образом, быстро
рассеивается в виде колебаний молекул
(тепла) или иногда повторно излучается в виде
света при более высокой длине волны
(флуоресценция). При этом
дестабилизированный электрон падает вниз до уровня,
на котором он находится в состоянии покоя.
Этого не происходит в Р-комплексах, что и
определяет их биологическую
эффективность. Благодаря своему стратегическому
положению в тилакоидной мембране они
переносят дестабилизированный электрон
к акцептору более высокого электронного
потенциала, расположенному поблизости, и
заполняют образовавшуюся электронную
пустоту (положительную ячейку)
электроном, взятым от низкоэнергетического
донора. Таким образом они способствуют подъему
электрона с уровня донора на уровень
акцептора с помощью световой энергии. В Р 680
донором является вода, а акцептором —
носитель, расположенный где-то в верхней
13—1452
Наружная
мембрана
Внутренняя
х мембрана
Ти л а ко ид
Развитие граны. Тилакоиды
выдавливаются из складок
внутренней мембраны; таким
образом, внутренняя поверхность
тилакоидной мембраны
соответствует внешней поверхности
внутренней мембраны хлоропласта.
части электронно-транспортной цепи.
В Р 700 донором является цитохром,
расположенный на выводной части элект
ронно-транспортной цепи, а акцептором —
ферредоксин — железосерный белок с
высоким электронным потенциалом, который
переносит электроны на НАДФ+ или в
конечном счете вновь в
электронно-транспортную цепь.
Вот почему пигменты Р представляют
собой истинные фотоэлектрические
преобразователи. Все дополнительные молекулы
хлорофилла и других окрашенных веществ,
с которыми они связаны в каждой фото
Фотосинтетический аппарат
зеленых растений (ФД —
ферредоксин). Обратите внимание
на то, что электроны
«путешествуют» через фотоединицу
по отдельности.
синтетической ячейке, выступают только в
роли коллекторов света или солнечных
антенн. Их структура такова, что они
способны обмениваться энергией друг с
другом с исключительно высокой скоростью
(возбужденный перенос), тем самым
значительно повышая эффективность системы.
Любой квант световой энергии, пойманный
одним из компонентов ячейки, может быть
доставлен к центральному пигменту Р и
использован для фотоэлектрического
преобразования. Это возможно при условии,
что связанная с акцептором молекула
свободна и в состоянии принять электрон, а
кроме того, имеется донор, готовый
заполнить освободившееся пространство.
Количество энергии, образующейся в
результате улавливания кванта света,
легко вычислить, пользуясь формулой Планка.
Для красного цвета длина волны равна
700 нм, энергия — 6,77X Ю~20 кал/квант
света, или 41 ккал/Э. Если один квант
сдвигает один электрон через каждую
фотосистему, что очень похоже на истину,
потребуется 2X2X41 или 164 ккал
световой энергии для того, чтобы перенести
одну пару электрон-эквивалентов от воды
к НАДФ+. Как мы уже видели, энергетиче-
ский уровень в резервуаре НАДФН
достигает примерно 55 ккал над уровнем
вода/кислород. Таким образом,
эффективность фотовосстановительного процесса
порядка 34%. Но это справедливо лишь в
том случае, если не принимать во внимание
прироста АТФ. Перенос электронов от
фотосистемы II к фотосистеме I происходит
по меньшей мере через один окфос-блок,
добавляя не меньше 8% к энергии,
получаемой в виде АТФ. Что касается
циклического фосфорилирования, осуществляемого
через фотосистему I и
электронно-транспортную цепь, ее минимальная
эффективность составляет примерно 17%. Но эта
минимальная величина может быть
увеличена вдвое и даже втрое, если циркули
рующие электроны проходят не через один,
а через большее число окфос-блоков.
Вопрос до конца не выяснен, как, впрочем, и
многие тонкости на пути фотоэлектронов.
Некоторые исследователи даже
утверждают, что фотосистема II в состоянии сама
поднимать электроны на всем пути от воды
до НАДФ+; в данном случае
эффективность процесса будет намного выше
установленной нами ранее.
Даже самые низкие показатели работы
этой системы при использовании одного
кванта света намного выше, чем в
фотохимических системах. Это необходимо
иметь в виду тем, кто пытается приручить
солнечную энергию. Превзойти
многоклеточное покрывало, состоящее из
бесчисленного множества микропреобразователей,
которые цианобактерии и их потомки
сплели вокруг Земли, — задача не из легких.
Быть может, стоит попытаться найти более
эффективные пути, чтобы заставить эти
организмы работать на нас, а не
соперничать с ними.
Темновые реакции
Единственной световоп реакцией при
фотосинтезе является двухступенчатое
фотоэлектрическое преобразование, в
процессе которого из воды экстрагируются
электроны, а их потенциал поднимается
почти до 1200 мВ. В результате такой
реакции образуются НАДФН и АТФ. Их
количества достаточно, чтобы
поддерживать все аутотрофные биосинтетические
механизмы, причем справляются они со
своей задачей в отсутствие\вета.
Именно так это происходит, например, у нефото-
синтетических хемолитотрофных организ
мов.
Прежде, чем покинуть хлоропласты,
нам следует хотя бы мельком взглянуть
на наиболее известную из темновых
реакций, а именно на фиксацию СО2.
Проследить ее удалось исключительно с помощью
радиоизотопной техники, использованной в
сочетании с хроматографическим
разделением (гл. 1). Осветив листья в присутствии
радиоактивного 14СО2 в течение с
каждым разом укорачивающихся промежутков
времени (всего каких-нибудь несколько
секунд), а затем выделив из них и разделив
меченые компоненты, ученые смогли
установить, что самым ранним продуктом
фиксации СО2 является фосфоглицериновая
кислота. Благодаря этой разгадке начался
поиск соответствующих реакций, и вскоре
они были найдены. Это удивительный
процесс, в котором дифосфорилированный
пятиуглеродный сахар, рибулозо-1,5-дифос
фат, вступает в реакцию с СО2 и водой и
дает в результате реакции две молекулы
фосфоглицериновой кислоты. Фермент,
катализирующий эту реакцию, связан с тила-
коидной мембраной.
С фосфоглицериновой кислотой мы уже
встречались при рассмотрении центральной
стадии окислительного фосфорилирования
при гликолизе. Фотосинтез воспользовался
этим «доисторическим» окфос-блоком для
выполнения ключевой восстановительной
стадии — вначале в том виде, в каком он
имелся, а затем произошла замена кофер-
мента НАД на НАДФ. Воспользовавшись
преимуществами высокоэнергетического
потенциала, который развивается в
резервуарах НАДН и НАДФН, этот процесс
заставляет электроны двигаться в
обратном направлении через окфос-блок,
потребляя при этом АТФ. Таким образом, из
фосфоглицериновой кислоты образуется
фосфоглицериновый альдегид с помощью
одной пары электронов, полученных от
НАДН или НАДФН и за счет свободной
энергии гидролиза АТФ.
В фотосинтезе эти реакции являются
ключевыми. Они включены в сложный
циклический процесс, известный как цикл
Келвина (назван так в честь его
первооткрывателя, американского химика). Мы
не станем углубляться в подробности,
рассмотрим только конечный результат.
13*
Темновая реакция
1. Фиксация углекислого газа,
катализируемая ключевым
ферментом рибулозо-1,5-
дифосфаткарбоксилазой, присущей
аутотрофам.
2. Восстановительное выделение
кислорода, катализируемое
окфос-блоком на субстратном
уровне в гликолитической цепи
(см. гл. 7), работающим в
обратном направлении, но с НАД
вместо НАДФ (в растительных
клетках, не у бактерий).
Кислород выделяется
высокоэнергетическими
электронами от НАДФН после
гидролиза АТФ. Получающаяся в
результате вода содержится в
продуктах распада АТФ (она
появляется всегда сразу после
регенерации АТФ как следствие
фотофосфорилирования).
3. Перестройка, приводящая к
образованию глюкозы, главного
продукта фотосинтеза (который
хранится в виде ее полимера,
крахмала). Комплексная система
ферментов (так называемая
система пентозофосфатного пути)
катализирующая перестройку,
приводит к тому, что 12 молекул
трехуглеродного соединения
фосфоглицеринового альдегида
(36 С) затем превращаются в
шесть молекул пятиуглеродного
рибулозо-5-фосфата (30 С)
и одну молекулу глюкозы (6 С).
Эта система также имеется
(с небольшими модификациями) у
большинства гетеротрофных
организмов, у которых она
поддерживает важные
метаболические функции.
4. Фосфорилиро%вание рибулозо-5-
фосфата, подготавливающее его
к участию на стадии 1.
Обратите внимание на то, что в
каждом круге цикла шесть
молекул СОг в результате
восстановления конденсируются
в одну молекулу глюкозы с
помощью 12 электронных пар,
снабженных НАДФН, и
дополнительной энергии,
получаемой после гидролиза 18
молекул АТФ.
Молекула глюкозы образуется из шести
молекул СОг и шести молекул воды. 12 пар
электронов, которые должны выделить
12 лишних атомов кислорода, снабжаются
от НАДФН. Дополнительные
энергетические затраты покрываются за счет
гидролиза в общей сложности 18 молекул АТФ.
Что это означает в терминах
энергетического выхода? Дебит: окисление 12
молекул НАДФН (660 ккал) плюс расщепление
18 молекул АТФ (252 ккал), что в целом
составляет 912 ккал/г-моль образующейся
глюкозы. Кредит: 686 ккал/г-моль,
свободная энергия окисления глюкозы; эффектив-
ность в целом составляет 75%. Чтобы этого
добиться, необходимо по меньшей мере
12 X 164 ккал световой энергии.
Следовательно, максимальная эффективность
фотосинтеза составляет 35%. Она может быть
несколько ниже в зависимости от
количества и локализации окфос-болка в
электронно-транспортной цепи.
У животных ключевой кофермент цикла
Келвина отсутствует. Но они, как и расте
ния, используют НАДФН в качестве
основного электронного донора в восстано
вительном синтезе, например при преоб
разовании углеводов в жиры. Как и у рас
тений, у животных развивается
значительный энергетический уровень в резервуаре
НАДФН, составляющий около 55 ккал/пара
электрон-эквивалент, или 1200 мВ. Это
достигается с помощью определенных
веществ, действующих как
высокоэнергетические электронные доноры; главное из них
глюкозо-6-фосфат. При необходимости
электроны могут направляться от НАДН к
НАДФ+ посредством зависимого от
энергии процесса, который протекает в
митохондриях. И наоборот, существует
механизм строгого контроля и регуляции
избытка электронов, при котором лишние
электроны из резервуара НАДФН падают
до НАД+.
Рост и размножение
хлоропластов
Все сказанное о биогенезе митохондрий
относится и к хлоропластам. Эти частицы
также обладают полным генетическим
аппаратом. И хотя он богаче, чем аппарат
митохондрий, но контролирует синтез
только небольшой части всех белков
хлоропластов. Как и в митохондриях, аппарат
обладает свойствами, присущими
бактериям, и, вероятно, также является рудиментом
древнего эндосимбионта, в данном случае
цианобактерии. Хлоропласты, подобно
митохондриям, характеризуются генетической
непрерывностью и могут подвергаться
мутациям, которые передаются через
цитоплазму.
Вместе с тем автономность
хлоропластов ограничена так же, как и у
митохондрий. Большая часть их компонентов
производится цитоплазматическими
рибосомами под контролем ядерных генов. Как и в
случае с митохондриями, способ, которым
эти компоненты проникают сквозь мембра
ны хлоропластов и занимают в них надле
жащее место, не вполне ясен.
11
Пероксисомы и другие
микротельца
Первое микротельце было обнаружено
в почке мыши в начале 1950-х гг. одним
шведским анатомом, который нашел, что
оно имеет на редкость неопределенную
форму, а потому даже не смог придумать ему
подходящего названия. Вскоре подобные
частицы были обнаружены в печени крыс,
а позднее и в ряде других клеток
растительного и животного происхождения.
Несмотря на свою широкую
распространенность, эти микротельца встречались только
в определенных типах клеток. У
млекопитающих их находят преимущественно в
печени и почках.
Где бы их не выявляли, микротельца
имеют одинаковый внешний вид. Это
неровные сферические структуры диаметром
0,5—10 мкм, т.е. несколько меньше мито-
Пероксисомы в проксимальной
части клетки канальца почки
крыс. Три микротельца
неправильной формы окружают
небольшую митохондрию.
хондрий. Они окружены мембраной и чаще
всего наполнены довольно компактным
аморфным матриксом. В некоторых клетках
этот матрикс содержит включение —
плотную кристалловидную сердцевину (ядро),
или нуклеоид, с удивительно красивой
тонкой структурой. Эти чисто
морфологические данные оставляли немало места для
воображения; они и в самом деле давали
основания для всяко рода
фантастических толкований. Когда же
биохимические доказательства в конечном итоге
направили исследователей по верному пути,
правда оказалась еще более удивительной,
чем вымысел. Как выяснилось, существует
несколько различных типов микротелец, и
каждый из них связан с примитивным,
если не доисторическим, набором
метаболических реакций.
Пероксисомы
и глиоксисомы
Пероксисомы — самый
распространенный вид микротелец. Они получили свое
название от перекиси водорода, Н2О2,
основного промежуточного продукта,
получаемого при их окислительном метаболизме.
Перекись водорода образуется в
результате деятельности целого семейства
ферментов, названных оксидазами типа II. В
основном они представлены флавопротеидами,
Две пероксисомы в печени крысы.
Ядро, имеющее правильные
очертания, содержит фермент,
который окисляет мочевую кислоту
с образованием Н2О2.
Пероксисома в печени морской
свинки. Кристалловидное ядро,
которое как и в пероксисомах
печени крыс, содержит оксидазу
мочевины, имеет правильную
гексагональную решетку.
иногда — белками в комплексе с медью,
которые используют молекулярный
кислород как электронный акцептор и
восстанавливают его до Н2О2:
RH2
О2
H2O2
Электронные доноры в этих реакциях
представлены аминокислотами, жирными
производными ацил-кофермента А,
пуринами и некоторыми продуктами метаболизма
углеводов, такими, как молочная кислота.
Другими словами, к ним относятся
представители всех основных классов
питательных веществ.
Перекись водорода, образующаяся в
пероксисомах, далее метаболизируется
благодаря действию каталазы — зеленого гемо-
протеида, который восстанавливает Н2О2 до
воды с использованием в качестве
электронного донора некоторых небольших по
размерам органических молекул (этанол,
метанол или муравьиная кислота) и в от
сутствие подходящего донора самой
перекиси водорода:
или
R Г12 "Т~ Н2О2
Н2О2 + Н2О2
R' + 2Н2О
О2 + 2Н2О.
Последняя реакция называется
реакцией дисмутации. В ней одна молекула
перекиси водорода восстанавливается, а другая
окисляется. Окончательным результатом
процесса является распад Н2О2 с
выделением кислорода. Катализу можно увидеть
в действии, если слегка смочить ранку
перекисью водорода: кислород начнет
пениться. Каталазк — один из наиболее
быстро действующих ферментов. Она была
обнаружена в 1018 г. французским химиком
Жаком ТенароД!, открывшим Н2О2.
Действуя Совместно, пероксисомальные
оксидазы и /каталазы приводят к тому,
что окисление происходит согласно следую
щему механизму:
о2
• о2
г л
RH2 R
R'H2
R'
2 Н2О
Сравните эту дыхательную цепь с той,
которая имеется в митохондриях, и вам
сразу бросится в глаза различие между
безрассудным расточительством и
разумной бережливостью. В обоих случаях
результат одинаков: происходит окисление
всех видов питательных продуктов,
сопровождающееся восстановлением кислорода
до воды. Но если в митохондриях большая
часть свободной энергии сгорания
возвращается в виде готовой к использованию
АТФ, то в пероксисомах она рассеивается
в виде тепла. Этот недостаток
компенсируется удивительной простотой конструкции.
Такое впечатление, будто пероксисомальный
тип дыхания возник задолго до того, как
объединились вместе нежные митохондри-
альные микросферы. Возможно, он
представляет собой одну из самых ранних
адаптации живых организмов к кислороду,
как мы об этом говорили в гл. 9.
Помимо окислительных ферментов
пероксисомы могут, в зависимости от типа
клеток, содержать разнообразные системы.
Наибольшую ценность среди них
представляет глиоксилатный цикл — вариант цикла
Кребса, который играет существенную роль
в преобразовании жиров в углеводы. Это
очень важный биохимический процесс.
Среди прочих функций он позволяет
богатым жирами проросткам растений, в ча
стности бобам клещевины, использовать
собственные жировые запасы при
прорастании. Пероксисомы, содержащие такую си-
'стему, получили название глиоксисом.
У животных глиоксилатный цикл оказался
ранней жертвой эволюции. Он по-прежнему
имеется у наиболее низших форм, но
отсутствует у многих высших позвоночных, в
том числе млекопитающих. Мы можем
получить жир из углеводов — привилегия, от
которой многие из нас были бы счастливы
отказаться, — но бессильны повернуть этот
процесс вспять из-за того, что наши
пероксисомы не являются глиоксисомами.
Хотя микротельца,
идентифицированные как пероксисомы, и не присутствуют во
всех типах клеток, в природе они
распространены повсеместно. Их обнаруживают у
разных видов растений и животных, в
плесени, грибах и простейших. Это
обстоятельство, а также примитивный характер их
дыхательного аппарата позволили
предположить, что все пероксисомы —
эволюционные потомки одной прачастицы, имевшейся
в первой эукариотической клетке, от
которой, как полагают, произошли все
растения и животные. Возможно, древняя перок-
сисома уже была частью примитивного
фагоцита в премитохондриальные времена
и выполняла, пусть несовершенно, но
эффективно, весьма важные функции защиты
от кислорода.
Эта гипотеза ставит перед историками
науки два весьма непростых вопроса.
Первое: почему пероксисомы не исчезли в
результате естественного отбора после того,
как к ним присоединились лучше
оснащенные митохондрии? Такое вполне могло
произойти во многих клетках, хотя даже такая
возможность вызывает споры. Во многих
клетках млекопитающих, в которых обычно
отсутствуют микротельца, находят
крошечные, связанные с мембраной частицы; в
силу того, что они содержат каталазу и
иногда другие типичные пероксисомальные
ферменты, частицы были названы микро-
пероксисомами.
Несмотря на значительное истощение
их метаболического потенциала (один из
примеров тому — потеря глиоксилатного
цикла), пероксисомы у млекопитающих ни
в коем случае нельзя считать
«ископаемыми органеллами», представляющими
интерес только как рудименты. Они, бесспорно,
выполняют важные функции: пероксисомы
вовлечены в некоторые пути метаболизма
липидов, а также, по-видимому,
холестерина, принимают участие в расщеплении
аминокислот, в том числе D-аминокислот,
которые встречаются только у бактерий, а
также в катаболизме пуринов. Насколько
известно, они не снабжают клетку
энергией, но производимое ими тепло иногда
имеет физиологическое значение. Утверждают,
что специфическая коричневая жировая
ткань, которая помогает норвежским
крысам пережить суровые холода зимы, своей
термогенной способностью частично
обязана пероксисомам. Имеются также указания
на то, что пероксисомы играют
существенную роль в синтезе определенных фосфоли-
пидов, называемых плазмалогенами. Воз-
На электронной микрофотографии
эндосперма боба клещевины
видны многочисленные капли
жира (выглядящие как
отверстия), митохондрии (тельца
средней плотности с
внутренними мембранами) и
глиоксисомы (темные микротельца
с грубым гранулярным
матриксом). На вставке в верхней
части фотографии изображено
характерное объединение в
грозди глиоксисом вокруг жира,
который они переводят в углевод.
можно, лучшее доказательство важности
этих органелл у млекопитающих дает
патология. Имеется очень редкое генетическое
нарушение у людей, известное как болезнь
Цельвегера, при которой в печени и почках
морфологически не выявляются
микротельца, тогда как в норме они присутствуют
там в больших количествах.
Новорожденные, страдающие таким тяжким недугом,
живут всего несколько месяцев.
У низших животных и простейших и
особенно в мире растений функции перок-
сисом еще более важные и разнообразные.
Мы уже убедились в ключевой роли перок-
сисом в метаболизме, в частности
глиоксисом, которые превращают жиры в
углеводы. Бесчисленное множество растений,
которые «упаковывают» свои семена в ли-
пидные оболочки, не смогли бы без этого
размножаться. Зеленые листья, содержащие
пероксисомы необыкновенной красоты,
зависят от очень сложного трехстороннего
сотрудничества между этими микрочастичками,
хлоропластами и митохондриями в
сохранении продуктов фотосинтеза. В противном
случае они были бы потеряны при
фотодыхании (фотодыхание — это вид индуциров/н-
ного светом дыхания, которое обусловлено
особым ниспровержением центрального
фермента цикла Келвина под действием
кислорода). Подобное взаимодействие
имеет большое экономическое значение, так как
влияет на чистый «фотосинтетический
урожай» многих сельскохозяйственных культур.
Особо поразительное приспособление перок-
сисом наблюдается у отдельных линий
дрожжевых клеток. Если они, растут на
метаноле или на алканах (которые
представляют собой насыщенные углеводороды,
какие, например, имеются в нефти), или
на каких-либо других необычных
питательных средах, являющихся единственным
источником углерода, эти клетки отвечают
необычайно большим повышением уровня
некоторых пероксисомальных ферментов,
необходимых для расщепления этих
субстратов. Чтобы разместить ферменты, перок-
сисомы сильно увеличиваются в размерах
и количестве. Иногда клетки настолько
переполнены пероксисомами, что эти
частицы принимают форму квадратных
коробочек.
Если задуматься над этим, то можно
прийти к следующему выводу: в том, что
клетки должны были сохранить пероксисо-
мы даже после того, как приобрели
митохондрии, нет ничего удивительного. С само
го начала пероксисомы обладали
полезными свойствами, которых не было у
митохондрий, и поэтому клетки их оставили.
Не исключено также, что какие-то их
свойства стали очень важными на последней
стадии, например после исчезновения
какого-либо свойства митохондрий в результате
мутации. И все-таки пероксисомы, имею-
Микропероксисомы подвздошной
кости морских свинок были
окрашены с помощью
цитохимической реакции, в основе
которой лежит окисление
диаминобензидина каталазой в
присутствии Н2О2. Обратите
внимание на многочисленные
митохондрии в цитоплазме и на
срезах микроворсинок в верхнем
правом углу.
щиеся в современных организмах, отли
чаются от ранних — так по крайней мере
кажется. Если собрать воедино все
индивидуальные функции, которые в наши дни
можно проследить в различных типах
пероксисом, и допустить, что все они
произошли от общего предка, перед нами
предстанет образ предшественника
пероксисом, обладающего мощным обменом
веществ и характеризующегося значительной
гибкостью; по сравнению с ним его
современные потомки выглядят жалким
подобием.
А теперь зададимся вторым вопросом,
который волнует историков науки: каким
образом примитивным эукариотам или их
прокариотическим фагоцитарным предкам
удалось обзавестись такими мощными ор-
ганеллами? Еще несколько лет назад этот
вопрос не мог даже возникнуть, так как
ученые твердо полагали, что пероксисомы
вырастают из эндоплазматического ре.тику-
лума (ЭР) в виде выпуклых почек и в
некоторых клетках они остаются
прикрепленными к нему посредством мембранных
стебельков. Но такая точка зрения
подверглась сомнению. Исследователи,
ведущие поиск пероксисомальных белков в
цистернах ЭР, были разочарованы. Они
обнаружили, что белки образуются в
свободных полисомах и секретируются в
цитозоле, откуда они затем проникают в
пероксисомы посредством какого-то
неизвестного механизма. Что же касается
вопроса о существовании связи между перокси-
сомами и ЭР, то его явно следует
пересмотреть и изучить заново. Как вы, верно,
помните, все мембраны под электронным
микроскопом выглядят относительно похо-
На микрофотографии клетки
табачного листа пероксисома с
очень красивой кристаллической
структурой, которая, как
предполагают, содержит каталазу,
вклинивается между двумя
хлоропластами и прилегает к
митохондрии. Локализация
пероксисомы отражает близкую
метаболическую взаимосвязь,
существующую между тремя
органеллами.
На фотографиях видны
удивительные структура и
упаковка пероксисом в клетке
дрожжей Hansenula polymorpha,
приспособленных к среде,
содержащей метанол в качестве
единственного источника углерода.
A. На тонком срезе можно
видеть цитоплазму, почти
полностью занятую пероксисомами
в форме коробочек.
Б. Тот же вид, но рельефно
выраженный. Модель выполнена
углеродным методом из
препарата, который был
раздроблен в замороженном
состоянии и затем оттенен
платиной.
B. При большом увеличении
видно, что почти вся
пероксисома заполнена
кристаллической структурой.
Структура состоит из молекул
фермента, который окисляет
метанол с образованием Н2О2.
жими, а потому исследователи, изучавшие
с его помощью тонкие срезы тканей, не
имели нашей возможности трехмерного
рассмотрения клеточных структур. К
сожалению, даже картина, которая предстает
перед нами, не настолько ясна, как нам бы
хотелось. И все-таки создается
впечатление, будто пероксисомы образуют кисти
взаимосвязанных частичек, но они
отделены от ЭР.
Если пероксисомы не являются
ответвлением ЭР — что, между прочим, вполне
возможно как в филогенетическом, так и в
онтогенетическом плане, — происхождение
этих таинственных микротелец следует
искать в каком-нибудь другом месте.
Некоторые исследователи клеток, чье
воображение подогрето гипотезами, которые
вертятся вокруг митохондрий и хлороплас-
тов, выдвинули следующее предположение:
пероксисомы могут быть эволюционными
потомками других бактериальных эндосим-
бионтов, появившихся в более древние
времена. С этим предположением
согласуется примитивный характер
дыхательного механизма. Несмотря на это,
необходимо подчеркнуть, что в отличие от
митохондрий и хлоропластов сами пероксисомы
не дают доказательств в пользу такого
высказывания. Насколько известно, они
полностью лишены ДНК, рибосом или
других частей генетического аппарата.
Но отсутствие доказательств не исключает
саму гипотезу. В конце концов, если эндо-
симбионты смогли превратиться в
составную часть клетки на 90%, как, например,
митохондрии и хлоропласты, почему нельзя
это сделать на все 100%? Когда-нибудь
мы получим ответ на интересующие нас
вопросы, допросив белки этих микротелец
и выделив из их молекулярной структуры
элементы рудиментарных напоминаний об
истории эволюции пероксисом.
Гидрогеносомы
Мы уже неоднократно подчеркивали
необходимость в подходящем акцепторе
для сбора электронов на их выходе из
окфос-блока. Но лишь вскользь упоминали
о том, каким может быть простейшее'
решение этой проблемы, а оно заключается
в использовании в качестве акцепторов
протонов:
2е~ + 2Н+
Н2.
Протоны в изобилии имеются всюду.
Почему же тогда мы все не вдыхаем
водород, вместо того чтобы вдыхать
кислород? Некоторые организмы так и делают.
Но их очень мало, возможно, из-за того,
что протоны — самые невыгодные
акцепторы из всех акцепторов, которые только
может использовать клетка. Образование
водорода происходит на очень высоком
энергетическом уровне, примерно на 50
или более ккал выше уровня
вода/кислород. Это означает, что, если
используемую энергию получать из окфос-блоков,
находящихя между донором и акцептором,
субстрат должен доставлять свои
электроны на уровень по крайней мере 64 ккал/
/пара электрон-эквивалент. Только
несколько веществ (в их числе пировиноградная
кислота) способны выдержать такую
энергию.
В мире бактерий существует небольшая
группа облигатных анаэробных
организмов, клостридий, которые производят
водород. Среди них имеются патогенные
организмы, вызывающие газовую
гангрену — инфекцию, которая развивается в
«плохо проветриваемых» ранах. Эти
бактерии, по всей видимости, имеют очень древ
нюю эволюционную историю; они
развились в отдельную ветвь в те
далекие-далекие дни, когда жизнь была
исключительно анаэробной. Они так и не
научились приспосабливаться к наличию
кислорода, а быть может, утратили эту
способность после того, как овладели ею.
Но все сказанное — не более как
предположение.
Как ни удивительно, способность
производить водород присуща в мире животных
небольшой подгруппе простейших, трихо-
монадам, большинство которых
паразитирует в половых путях животных и людей.
Они являются одними из основных
возбудителей болезней, передаваемых половым
путем. Эти паразиты способны
существовать как в присутствии, так и в
отсутствие воздуха. При анаэробном образе
жизни они поддерживают свои
энергетические потребности специфическими
реакциями, в которых пировиноградная
кислота окисляется до уксусной кислоты и СО2
и высвобожденные электроны поступают к
водороду через окфос-блок субстратного
уровня:
СНз—СО—СООН + (Н2О) >
► СНз—СООН + СО2 + 2е- + 2Н + ,
АДФ + Фн ► АТФ + (Н2О),
2е~ + 2Н1 ^Н2.
При аэробном образе жизни трихомо-
нады прекращают производство водорода
и переключаются на
кислородно-зависимый метаболизм, хотя и крайне простого
типа, так как сами организмы лишены
митохондрий.
Однако у них имеются выпуклые микро
тельца. Несколько лет назад это
обстоятельство взбудоражило ученых, которые
решили, что обнаружен прямой потомок
примитивных фагоцитов, отпрыск клетки,
которая никогда не захватывала мито-
хондриального эндосимбионта. Вплоть до
наших дней этот организм в процессах
окислительного метаболизма зависит от
работы древних подлинных пероксисом.
Но, как часто случается в науке, когда
выдвинутая гипотеза была подвергнута
тщательному экспериментальному
испытанию, ответ оказался разочаровывающим и
отрицательным. Вместе с тем перед иссле-
При окислении пировинограднои
кислоты до уксусной кислоты и
СО2 в гидрогеносомах электроны
переносятся на протоны (с
образованием молекулярного
водорода) через окфос-блок
субстратного уровня. Как и при
фосфорилировании на субстратном
уровне гликолитической цепи
(см. рис. на с. 129), кислород
добавляемый к субстрату,
поступает из скрытой молекулы
воды, полученной в результате
конденсирования АДФ -\- Фн.
дователями открылись совершенно
неожиданные возможности. Микротельца трихо-
монад представляют собой гидрогеносомы.
Они содержат в себе всю систему,
ответственную за связанное с окфос-блоком
расщепление пировинограднои кислоты, в
результате которого образуется водород.
Как и все открытия, это открытие
поставило перед наукой новые вопросы.
Наиболее интригующий из них: откуда
появились гидрогеносомы? Являются ли
они просто другим видом отростка ЭР
или же образовались в каком-то
примитивном клостридиуме, который был пойман
и «одомашнен» в незапамятные времена
одним из членов ненасытного семейства
фагоцитов? До сих пор подходов к
решению этих вопросов нет. Но для некоторых
гидрогеносомальных белков были выявлены
предки.
Гликосомы
Не так давно исследователи, изучавшие
подгруппу простейших, называемых трипа-
носомами, обнаружили еще один вид мик
ротелец, которые, к всеобщему удивлению,
содержали большой сегмент
гликолитической цепи трипаносом. В любом другом
типе клеток, которые использовали для
этих исследований, гликолитическая
система всегда обнаруживалась в цитозоле,
т. е. там, где мы впервые встретили ее
в начале нашего путешествия. Как же ей
Гидрогеносомы в паразите
человека Trichomonas vaginali
Полосатый объект слева
(структура, похожая на
жилку) — ребро.
На электронной микрофотографии
видны две гликосомы в
цитоплазме Trypanosoma brucei -
возбудителя сонной болезни у
скота. Одна гликосома содержит
кристалловидное ядро
неизвестного химического состава.
удалось отделиться внутри ограниченных
мембраной микротелец в цитоплазме
трипаносом?
Здесь вновь возникает соблазн запол
нить незнание воображением. Могло ли так
произойти, не перестаем мы удивляться,
что гликосомы — как их назвали по вполне
понятным причинам — тоже произошли от
эндосимбионта, на сей раз от
примитивного организма, в котором происходил
процесс брожения? Возможно ли, что его
захватчик был спасен своей жертвой от
последствий, которые в противном случае
привели бы к пагубной мутации его гли-
колитического аппарата? Если это так, то
предполагаемое событие до сих пор имеет
резонанс, и весьма неприятный, хотя с тех
пор прошло более миллиарда лет. Ибо
среди трипаносом имеются
отвратительнейшие паразиты животных и человека,
вызывающие такие тяжкие заболевания, как
сонная болезнь в Африке и ужасная
болезнь Чага в Южной Америке.
12
Цитокости и
цито мышцы
(кости и мышцы клетки)
Формы живых клеток, включая
бесконечно изменяющиеся поверхностные
складки, выступы и инвагинации, так наглядно
показанные сканирующей электронной
микроскопией, обусловлены в основном
сложной внутренней поддерживающей
системой перекрещивающихся плотных
волокон и полых трубок, которые создают то,
что известно как цитоскелет клетки. Эти
элементы цитоскелета как раз и
представляют собой те балки и канаты,
которые мы заметили при первом
проникновении в цитозоль. Но они были заслонены
от нас множеством шарообразных
объектов, заполняющих цитоплазму. Если бы
нам удалось удалить эти объекты, то мы
могли бы заметить, что компоненты
цитоскелета могут достигать внушительной
длины, иногда проходя через всю клетку;
все они соединены множеством способов
удивительной красоты и часто
поразительной упорядоченности. Освободите
загроможденный музей от его содержимого,
и только тогда вы по достоинству оцените
изящную и талантливую архитектуру
выставочных залов.
Цитоскелет
У нас нет возможности освободить
загроможденную клетку таким образом, но
мы можем использовать антитела,
направленные против белков цитоскелета, чтобы
покрыть определенным образом и выявить
структурные элементы, в состав которых
входят эти белки. Если эти антитела несут
в себе молекулы флуоресцентного
красителя, то структуры, к которым они
прикрепляются, будут казаться покрытыми
слоем флуоресцентного красителя.
Посмотрите на такие клетки в
ультрафиолетовом свете, и весь цитоскелет, покрытый
антителами, ярко засветится на темном
фоне, словно освещенный неоновыми
трубками.
Этот изящный метод, получивший
название иммунофлуоресценции, нуждается в
большом количестве предварительных
биохимических исследований, поскольку перед
тем, как белки будут использованы для
получения антител, они должны быть
очищены. Дополнительную трудность
представляет то обстоятельство, что некоторые
цитоскелетные белки — слабые иммуноге-
ны, т. е. они не так быстро вызывают
образование антител при введении
животным разных видов. Это объясняется тем,
что гомологичные цитоскелетные белки,
даже принадлежащие совершенно разным
видам, имеют весьма сходную химическую
структуру и поэтому не распознаются
иммунной системой как чужеродные. Такое
эволюционное сохранение структуры
убедительно свидетельствует о том, что
функциональные свойства белков зависят от
специфических аминокислотных
последовательностей, которые, претерпевая
незначительные изменения, не теряют своих
свойств. Не удивительно, что большинство
мутаций, повреждающих такие белки, не
совместимы с сохранением их функции и
удаляются в ходе естественного отбора.
Прекрасные картины, выявленные им-
мунофлуоресценцией, способны передать
только застывшие «кадры» мира, который
постоянно меняется. Клетки неустанно
изменяют форму, перемещают свое
содержимое, создают цитоплазматические
потоки, проталкивают некоторые гранулы в
резко меняющихся направлениях, изгибают
и деформируют мембраны. Они движутся
во все стороны, вращаются, ползают,
плавают, сокращаются, вытягиваются,
уплощаются вдоль поверхности или
протискиваются сквозь узкие отверстия, хватают,
окружают и заглатывают крупные частицы,
выпускают и втягивают обратно
псевдоподии, выдавливают содержимое из
гранул накопления, размахивают волнистыми
вуалями и спиралевидными жгутиками и
ресничками, создавая вокруг себя потоки.
Какова же роль цитоскелета в столь
неистовом движении?
Ответ на этот вопрос, как и следовало
ожидать, заключается в следующем:
цитоскелет — это не неподвижный каркас, или
Кератиновая сеть в клетках
кенгуровой крысы (РЖ
выявленная методом
иммунофлуоресценции
скелет, и даже не сочлененная система,
как можно было бы предположить исходя
из названия. Он представляет собой
гораздо более гибкую и сложную систему,
состоящую из структурных элементов;
только некоторые из них являются истин
ными фиксаторами. Остальные обладают
удивительной способностью быстро
распадаться на крошечные строительные блоки
и вновь собираться в структуры различной
формы, что и объясняет разнообразие тех
изменений и превращений, на которые
способны клетки. Что касается более
упорядоченных форм движения, совершаемых
клетками или их частями, то они,
по-видимому, зависят преимущественно от
скольжения одного структурного элемента
по другому; этот процесс вызывается
снабженными АТФ поперечными мостиками
между двумя элементами.
Различные части этого механизма
состоят исключительно из разного рода
белковых молекул, наделенных способностью
взаимодействовать с родственными им
веществами или другими цитоскелетными
белками; в результате они автоматически
превращаются в те удивительные
поддерживающие структуры и кружевные сети,
которые становятся видимыми в
ультрафиолетовом свете благодаря
флуоресцирующим антителам. Только изредка
удается выявить эти структуры во всей их
красоте и сложности с помощью
электронного микроскопа. В большинстве случаев
он позволяет лишь мельком увидеть
отдельные элементы скелета в виде полых
микротрубочек или плотных филаментов.
Последние в зависимости от их диаметра
разделяют на тонкие (6—7 нм),
промежуточные (8—10 нм) и толстые (15—20 нм)
филаменты. Крайне редко, например в
фибриллах мышечных клеток, в ресничках
или других симметрично расположенных
поверхностных выростах, молекулярная
архитектура цитоскелета достигает такой
удивительной степени упорядоченности, что
отчетливо выявляется на одном
соответствующим образом ориентированном ультра-
14—1452
тонком срезе. Такого рода картины не
только существенно облегчают интерпретацию
наиболее часто получаемых изображений
структур в разных плоскостях, но и
доставляют морфологам огромное
эстетическое наслаждение.
В функциональном отношении
определенные цитоскелетные элементы служат
только для создания внутреннего, по
существу статичного, остова клетки и для
связывания клеток посредством различных
соединений. Большинство промежуточных
филаментов (нитчатых структур)
принадлежит к элементам такого типа. В
соответствии с их ролью в структурной диффе-
ренцировке они характеризуются
различными свойствами в разных типах клеток.
В качестве примера назовем кератин в
эпителиальных клетках, виментин в мезен-
химальных клетках, десмин в мышечных
клетках и нейрофиламенты в нервных
клетках. Другие цитоскелетные элементы
присутствуют во всех клетках, хотя их
устройство может значительно варьировать
в зависимости от типа клеток; они вы
полняют как двигательную, так и струк
турную функции. Примерами этих
элементов являются актин-миозиновая система,
система микротрубочка — динеин и клат-
рин. В силу ограниченности времени
и пространства, неизбежно сужающей
масштаб и глубину нашего путешествия,
бросим на них лишь беглый взгляд.
Кератин,
материал прочности
Термином «кератин» (греч. keras —
рог) обозначают семейство богатых серой
фиброзных белков, основных составных
частей кожи, шкур животных, волос,
рогов, копыт, ногтей, чешуи, перьев,
клювов — одним словом, наружных покровов
и производных кожи, которыми
позвоночные вооружаются против нападения врагов
из внешнего мира. В отличие от
защитных покрытий у растений и низших
животных, которые создаются внеклеточно из
секреторных продуктов, у позвоночных
аналогичные структуры образуются внут-
риклеточно в результате замечательного
процесса дифференцировки.
Этот процесс совершается в эпителиаль
ных клетках. Последние образуются из
стволовых клеток, формирующих глубокий
Кератинизация. Рисунок .
иллюстрирует прогрессивную
дифференцировку эпидермальной
клетки по мере подталкивания ее
по направлению к поверхности
кожи вновь образующимися
клетками из герминативного
слоя.
слой под кожей. Стволовые клетки делятся
неравномерно на недифференцированные
стволовые клетки, остающиеся в
герминативном слое, и дифференцирующиеся
дочерние клетки/ По мере шелушения
поверхностных слоев кожи дочерние клетки,
в свою очередь подталкиваемые к
поверхности более молодым поколением дочерних
клеток, медленно перемещаются, чтобы
заменить их.
Если бы мы посетили такую молодую
эпителиальную клетку в начале ее
путешествия по направлению к периферии,
то увидели бы, что ее цитоплазма тут и
там пересечена плотными волокнами
толщиной около 8 нм (треть дюйма при нашем
увеличении). При более близком
знакомстве волокна оказываются пучками
филаментов, образованных из более тонких
нитей, которые на первый взгляд
напоминают структуру тропоколлагена. Как и
основная единица волокон соединительной
ткани, элементарная субъединица кератина
представляет собой трехнитчатую
суперспираль, составленную из белковых, также
спирально скрученных цепей. Шаг
скрученной спирали аналогичен таковому для
тропоколлагена и равен приблизительно
6,5 нм. Однако при более близком
знакомстве обнаруживаются существенные
различия между двумя структурами. В
кератине трехнитчатая спираль закручена
Структура кератинового
филамента. Основная единица
представляет собой трехнитчатую
левозакрученную спираль с шагом
6,5 нм и длиной 60—90 нм,
построенную из трех различных
полипептидных цепей; каждая из
них на большем своем протяжении
скручена в правильную
правозакрученную а-спираль.
Такие нити соединяются конец в
конец и собираются латерально с
образованием характерных
промежуточных филаментов
диаметром 8 нм.
влево, а не вправо, как в тропоколлагене.
Три составляющие его полипептидные цепи
обычно различны и каждая закручена
в типичную правовращающую а-спираль
наподобие спирали во многих белках
(гл. 2). Мы встретимся с удивительными
примерами этой структуры несколько
позже, в миозине и тропомиозине. С другой
стороны, спиральная структура коллагена
с ее поворотом влево и высотой шага
1 нм уникальна и объясняется
необычным аминокислотным составом и
последовательностью. Субъединицы кератина
также короче тропоколлагена: 60—90 нм
против 300 нм. Они собираются продольно
и поперечно с образованием характерных
промежуточных филаментов диаметром 8 нм.
Кератиновые пучки образуют рыхлую
трехмерную сеть, окружающую ядро
структурой в виде корзинки и натянутую между
пластинками прикрепления,
расположенными вдоль плазматической мембраны.
Как правило, эти пластинки скрепляются
при помощи определенного плотного
клейкого материала с аналогичными
пластинками на поверхности соседних клеток,
образуя тем самым плотные адгезивные
контакты, или десмосомы, которые
привлекли наше внимание при первом визите
в кровеносный сосуд (гл. 2). Тонофиламен
ты, прикрепляющие кератиновые волокна.
направляются от десмосом латерально в
глубь клетки и располагаются в десмосо-
мах таким образом, чтобы установить
прямые связи между кератиновыми сетями
двух соседних клеток.
По мере своего медленного продвижения
от слоя герминативных стволовых клеток к
поверхности кожи эпителиальные клетки
производят кератин во все
увеличивающихся количествах за счет массивной
аутофагии (самопожирания) своего
содержимого. Одновременно кератиновые
волокна начинают интенсивно связываться
посредством поперечных дисульфидных связей
между собой и с компонентами аморфного
матрикса. К тому моменту, когда клетки
достигают поверхности кожи, они
сморщиваются и высыхают, становятся
безжизненными, инертными, но в то же время
чрезвычайно плотными. Прочно скрепленные друг
с другом десмосомами, они образуют
единый защитный пласт, роговой слой, который
постоянно удаляется за счет
поверхностного шелушения (десквамации) и
замещается новыми дифференцированными
эпителиальными клетками.
Если шелушению препятствует
объединение наползающих клеточных слоев, то
роговой слой утолщается до образования
14*
мозоли. Если немного изменить характер
роста клеток, модифицировать природу или
соотношение различных полипептидов,
строящих кератин, и степень их
поперечного связывания, то в результате
образуются чешуя, ноготь, коготь, рог или
клюв. Если дифференцирующиеся клетки
растут в виде трубки, а не пласта, то
образуются все виды волос и игл (шипов),
а путем более сложных взаимодействий —
птичьи перья, колючки и пушок пернатых.
В* самом деле, число архитектурных
вариантов, которые эволюция создавала путем
кератинизации, беспредельно.
Тысячелетиями некоторые из них обеспечивали человека
одеждой и орудиями труда. Даже в наш
век господства пластмасс ни одно
искусственное волокно все еще не может
конкурировать с кератином, который образуется
у ангорской козы.
Как упоминалось выше, кератин —
типичный продукт эпителиальных клеток.
В клетках других типов поддерживающие
промежуточные волокна — филаменты
построены из других белков, которые
объединяются по-иному. Но время не позволяет
детально остановиться на их строении, а
потому вернемся к «обобщенной» клетке,
представляющей основной объект нашего
путешествия.
Актин-миозиновая система
Актин и миозин — два белка, ответствен
ные за замечательную двигательную
систему, впервые выявленную в мышечных
клетках, но, как теперь известно,
существующую во всех клетках: тонкие актино-
вые филаменты (нити) обпазуют так
называемые «цитокости», а толстые миозиновые
филаменты — «цитомышцы».
Актиновые филаменты обычно
группируются в тонкие пучки, которые тянутся
через всю цитоплазму подобно телефонным
проводам (так называемые волокна
напряжения) либо переплетаются в виде
различных кабелей, ремней, покрытий или
паутины, которые чаще всего служат для
укрепления плазматической мембраны. Они
также составляют осевые стержни,
поддерживающие такие поверхностные выросты,
как микроворсинки. Каждый актиновый
филамент толщиной 6—7 нм (около 60 мм
при нашем увеличении в миллион раз)
состоит из двух переплетенных нитей.
Структура актинового филамента.
Глобулярный, или G-актин,
представляет собой яйцевидную
белковую молекулу, имеющую
две пары комплементарных
(«замок — ключ») сайтов
прикрепления, одну полярную,
другую — латеральную. Сайты
дают возможность молекулам
полимеризоваться с образованием
скрученных двухнитчатых волокон
(фиброзный, или F-актин),
содержащих 14 пар
мономерных молекул в одном
полном витке (77 нм).
Полимеризация, будучи
направленным процессом,
начинается от точки прикрепления
филаментов и является обратимой.
Она нуждается в АТФ и
блокируется цитохалазином В
(ядом, получаемым из грибов).
Структура тропомиозина. Эта
двухнитчатая суперспираль
длиной 41 нм состоит из двух
идентичных полипептидных цепей
а-спиральной структуры на
большем своем протяжении,
закрученных друг вокруг друга с
шагом 7 нм.
Расположение тропомиозина
вокруг актинового филамента
В отличие от другиих нитевидных
структур, с которыми мы сталкивались
до сих пор, такими, как коллаген и
кератин, актиновые нити образуются не из
фибриллярных белков, а скорее из маленьких
белковых шариков (глобул) обычного
скрученного типа, соединенных
комплементарными сайтами связывания, расположенными
на двух полюсах. Тем самым актиновая
нить напоминает одну из тех бесконечно
растущих цепей или рядов, которые можно
построить из одинаковых взаимосоединяе-
мых частей, которые часто даются детям
для проверки их комбинаторных навыков.
Как и эта цепь, актиновая нить
характеризуется полярностью, определяемой
направлением оси «замок—ключ» в
составляющих ее частях. В случае актина цепь
не одинарная, а двойная, поскольку
составляющие ее части (единицы) имеют второй
сайт «замок—ключ», находящийся сбоку.
Связывание двух параллельных нитей этими
сайтами происходит с направленным слегка
вправо поворотом, создающим вытянутую,
состоящую из двух нитей спираль с шагом
77 нм (около 7,5 см при нашем увеличении),
которая содержит 14 пар субъединиц в
одном витке.
Субъединицы активных филаментов
называют глобулярным, или G-актином.
Продукт их полимеризации представляет
собой фиброзный, или F-актин.
Взаимопревращаемость этих двух форм — вот
фактор, позволяющий живым клеткам
демонтировать некоторые части своего акти-
нового скелета и собирать их снова, но уже
по-другому. Эти взаимопревращения
контролируются сложной регуляторной системой,
до сих пор во многом нерасшифрованной,
при активном участии АТФ. На молекуле
G-актина существует специфический сайт
связывания для АТФ. При полимеризации
актина молекула АТФ гидролизуется и
образующийся АДФ остается связанным
с F-актином. Перед тем, как структура
распадается, АДФ замещается на АТФ.
Как правило, спиральные желобки,
разделяющие две нити актинового фила-
мента, заняты тонкой нитью, образованной
молекулой другого белка, так называемого
тропомиозина (греч. trope — поворачивать,
mys— мышца). Эта молекула
представляет собой закрученную влево спираль
длиной около 41 нм, образованную двумя
идентичными полипептидными а-спираль-
ными на большем своем протяжении
цепями с шагом 7 нм. Перед нами второй
пример а-спирали, которую мы недавно
видели, рассматривая волокна кератина.
Отметим, однако, что тропомиозин состоит
из двух спирально скрученных нитей, а
кератин — из трех. В актиновом филаменте
каждая молекула тропомиозина
простирается на расстояние, соответствующее
расположению семи G-актиновых субъединиц,
или половине витка спирали.
Следовательно, на каждый 77-нм виток F-актина
приходится две пары димерных молекул
тропомиозина, закручивающихся вместе с
14 парами G-актиновых субъединиц.
Только в поперечнополосатых мышечных
клетках эта повторяющаяся структура
содержит четыре дополнительные молекулы
другого белка, тропонина, который
прикрепляется к актиновой нити вблизи
соединения между последовательными
молекулами тропомиозина. Тропонин, как мы
увидим дальше, играет ключевую роль в
регуляции мышечного сокращения.
Актиновые филаменты одним своим
концом — всегда одним и тем же
относительно полярности филамента — прочно
прикреплены к плоской дископодобной
структуре. Помимо идентифицированного
белка u-актинина в состав этой структуры
входят и другие белки. Эти точки при
крепления остаются даже после демонтажа
филаментов и служат сайтами «ядрообра-
зования» для роста новых филаментов.
Цитохалазин В (яд, получаемый из
грибов) обладает способностью связываться
с растущими концами активновых
филаментов и ингибировать их дальнейшее
удлинение. Эта способность позволяет
цитохалазину противостоять другой
клеточной активности, вызывающей ремодели-
рование актинового цитоскелета, что
чрезвычайно важно для анализа самой этой
активности.
Диски прикрепления актиновых
филаментов в свою очередь прикреплены к
специальным участкам — «пэтчам» на
внутренней поверхности плазматической
мембраны либо друг к другу, либо к
другим внутриклеточным органеллам. Именно
таким образом они формируют самые
разнообразные положения, которые можно
обнаружить в различных типах клеток
или в одной и той же клетке в разных
функциональных состояниях. Прикрепление
этих дисков обеспечивается рядом
структурных белков (название которых
намекает на их свойства), таких, как, винкулин
(лат. vincula — связь), анкирин (греч.
ankyra — крючок, ловушка) или спектрин
(название объясняется тем, что белок
впервые был выделен из «теней»
эритроцитов). В мышечных клетках
многочисленные диски прикрепления соединены белком
десмином (греч. desmos—связь) с
образованием структуры, напоминающей две
склеенные спинками щетки с направленной
в разные стороны щетиной.
Мы увидим, как эти «щетины»
функционируют при мышечном сокращении.
Но прежде представляется полезным
изучить один пучок из нескольких актиновых
филаментов, начиная с точки их
прикрепления. Сначала филаменты образуют
довольно рыхлый запутанный клубок; такое
впечатление, будто они держатся вместе
только за счет их общего прикрепления. Но
постепенно они собираются в цилиндр из
шести филаментов вокруг длинного
центрального стержня толщиной около 15 нм.
Сам стержень простирается за концы
филаментов, достигая в длину нескольких
сотен нанометров (иногда до 1 мкм), и
заканчивается, как сердцевина, во втором,
симметрично ориентированном пучке фила-
Простейшая цитомышца. Толстый
миозиновый филамент соединяет
два противоположно направленных
пучка из шести тонких актиновых
филаментов. Благодаря
приложенному усилию происходит
передвижение актиновых
филаментов к центру миозинового
стержня; тем самым точки
прикрепления А и Б приближаются
друг к другу.
ментов. Наше увеличение в миллион раз
позволяет увидеть неподвижный прут
длиной около метра и толщиной примерно
1,5 см, соединяющий два противоположно
направленных пучка из шести идентичных
двойных извитых проволок толщиной
около 60 мм.
Этот соединяющий прут, или стержень,
образован миозином, уникальным белком,
название которого, как и тропомиозина,
происходит от греческого слова mys
(мышца). Миозин — двойная молекула
длиной 155 нм (немногим более 15 см при
нашем увеличении). По форме молекула
миозина напоминает клюшку для игры
в гольф (с расщепленной головкой) или,
пользуясь более романтичным сравнени
ем, двойной цветок на длинной ножке
По своему строению стержень молекулы
(около 135 нм длиной и 2 нм толщиной)
очень похож на тропомиозин. Он
представляет собой левозакрученную двухнитчатую
суперспираль с шагом около 7,5 нм,
образованную двумя идентичными почти
идеальными а-спиральными
полипептидными цепями. Миозиновый стержень
представляет собой самую длинную из
аналогичных структур, известных в природе.
На его верхнем конце две нити
разделяются на две подвижные
ножки-стебельки, которые постепенно закручиваются в
двойные глобулярные «цветы» или «голов
ки»; каждая «головка» состоит из
терминальной части одной из нитей
стержня, или тяжелой цепи, сплетающейся с
двумя дополнительными легкими цепями.
В структуре миозинового стержня имеется
одна неправильность, обеспечивающая
существование шарнира между гидрофобной
дистальной частью длиной около 110 нм
и более гидрофильной проксимальной
частью несущей головки. В результате
протеолитический фермент трипсин может
разрезать молекулу миозина на две части:
легкий меромиозин (ЛММ) и тяжелый
меромиозин (ТММ). Второй шарнир
существует между головками и стержнем в
тяжелом меромиозине; он чувствителен
к расщепляющему действию другого про
теолитического фермента, папаина, кото
рый разрезает тяжелый меромиозин на два
субфрагмента Si и S2-
Миозиновые молекулы обладают
удивительным свойством спонтанно собираться
в пучки, которые напоминают
миниатюрные экзотические деревья, украшенные
изящными гирляндами цветов. «Ствол»
этого дерева образован из стержней
миозиновых молекул, соединенных вдоль
своими гидрофобными частями из ЛММ;
стержни располагаются ступенчато и
спирально таким образом, что возможно
неограниченное удлинение ствола при
постоянной толщине (за исключением
заостренной верхушки). Головки, или
«цветы», выступают из ствола на более
гидрофильных участках ЛММ, образуя
гирлянду, которая спирально
закручивается вокруг ствола. Истинная
конфигурация этой структуры все еще не ясна и,
как полагают, может значительно варьиро-
вать в зависимости от типа клеток и вида
животного. Постоянным, по-видимому,
является только продольное расположение
головок вдоль ствола. Дополнительной,
но крайне важной особенностью этого
процесса сборки миозина является его
симметричность. Два "миозиновых «дерева»
всегда соединены своими корнями таким
образом, что каждый миозиновый фила-
мент образован двумя украшенными
гирляндами стволами противоположной
полярности, соединенными «оголенной», без
«цветов», центральной частью длиной
около 300 нм.
Цветы на миозиновом дереве — строго
говоря, головки миозиновых молекул —
представляют собой крючки, к которым
прикрепляются актиновые филаменты. Они
располагаются вокруг ствола так, что с
ними могут связаться шесть
параллельных актиновых филаментов, создавая
вокруг ствола гексагональную оболочку
Одна такая оболочка образуется на
каждом конце миозинового ствола, который
Структура толстого филамента.
Элементарная единица
представляет собой молекулу
миозина (Б), длинную
сдвоенную белковую молекулу,
которая состоит из длинного
(135 нм) хвоста, раздвоенного на
луковицеобразные концы, или
головки. Хвост представляет
собой скрученную спираль из
двух идентичых, почти
идеальных а-спиральных нитей
(А). Одна неправильность в этой
структуре образует шарнир
между гидрофобным стеблем-
стволом длиной 110 нм и более
гидрофильной «шейкой», на
которой сидят «головки». Этот
шарнир легко разрезается
протеолитическими ферментами с
образованием тяжелых (ТММ) и
легких (ЛММ) меромиозинов.
Шарнир между «головкой» и
«шейкой» в ТММ также легко
разрезается с образованием
субфрагментов Si и S2.
Молекулы миозина обладают
замечательной способностью
собираться в толстые пучки-
стержни толщиной 15—20 нм
и длиной 1,5—15 мкм и более.
Молекулы соединяются своими
гидрофобными хвостовыми
частями, образованными ЛММ,
а их «ножки» и «головки»,
образованные ТММ, выступают
на поверхности стержня, образуя
правильные спиральные ряды.
Эти ряды расположены
симметрично (Г). В середине
стержня располагается
«оголенный» сегмент длиной
300 нм, без головок; он образован
переплетенными стволами,
которые несут головки первого
ряда на каждой стороне.
тем самым соединяет два
противоположных актиновых пучка.
Такое расположение требует, чтобы
актиновые филаменты имели определенным
образом ориентированные сайты
связывания для миозиновых головок. Это свойство
может быть -использовано для
идентификации актиновых филаментов на
тканевых срезах и определения их полярности.
Миозиновые головки, ферментативно
отрезанные от стержня и очищенные,
используются как реагенты. Они специфически
связываются с актиновыми филаментами и
«украшают» их типичными наконечниками,
острие которых направлено в сторону
свободного конца актинового филамента.
Полярность актинового филамента
обусловлена «декорацией»
с изолированными миозиновыми
головками (Si-фрагменты).
Слева — электронная
микрофотография, справа —
модель.
До сих пор мы видели, что миозиновый
ствол служит просто связующим стержнем
между двумя пучками актиновых фила
ментов — картина красивая, но статичная.
Однако стоит нескольким ионам кальция
достичь этой системы, как взору туриста,
путешествующего по живой клетке,
предстанет одно из самых поразительных
проявлений молекулярной пиротехники:
внезапно миозиновые головки оживают и
начинают неистово сгибаться на своих
ножках, где бы они ни прикреплялись
к сайтам связывания на актиновом фила-
менте, подтягивая его на 10 нм внутрь
в направлении середины ствола. После
этого они ослабляют «хватку». Однако к
тому моменту другие миозиновые головки
приходят в соприкосновение с актиновыми
сайтами связывания и осуществляют
дальнейшее их подтягивание и перемещение
на 10 нм. Это продолжается до тех пор,
пока присутствуют ионы кальция (а также
АТФ, см. ниже). Все актиновые филаменты
Механизм скользящих нитей
актин-миозиновой сократительной
системы. В присутствии ионов
кальция АТФ-несущие головки
миозина связываются с актином и,
становясь активными,
осуществляют гидролиз АТФ.
Гидролиз АТФ обязательно
сопряжен со связыванием
миозиновых головок и продольным
перемещением актиновых
филаментов относительно
центрального миозинового
филамента.
на каждом конце миозинового стержня
«подтягиваются» одинаково, тем самым
давая возможность двум противоположно
направленным пучкам актиновых
филаментов, связанных миозиновым стержнем,
скользить друг к другу и притягивать
соответствующие точки прикрепления
ближе к середине, т. е. сближать их. При этом
расстояние между соседними точками
прикрепления сокращается, хотя ни один
из филаментов, соединяющих эти точки,
не укорачивается. Филаменты скользят
относительно друг друга, используя
своеобразный молекулярный «храповик».
В ходе этого процесса совершается
механическая работа и поэтому требуется
энергия, которая, что вряд ли вас удивит,
поставляется за счет гидролиза АТФ в
АДФ и Фн. Миозиновые головки в действи
тельности представляют собой высокоспе
цифичные гидролизующие АТФ ферменты
(АТФазы). Они могут проявлять свою
каталитическую активность при трех
условиях: 1) будучи связаны с актином;
2) будучи активированы ионами кальция
(механизм активации мы рассмотрим
позднее) и 3) имея возможность при этом
сгибаться. Непременное сопряжение между
химическими реакциями гидролиза АТФ
и конформационным изменением, которое
заставляет головку связанного с актином
миозина сгибаться на ножке и продви
гаться вдоль актинового филамента, —
важнейшее, основополагающее свойство,
позволяющее актин-миозиновой системе
превращать свободную энергию гидролиза
АТФ в механическую работу.
Вид выполняемой работы зависит от
расположения в клетке двух точек
прикрепления, которые притягиваются друг
к другу, и их топологических
взаимоотношений. Нередко одна точка
прикрепления остается фиксированной, а
перемещается только другая точка. Рассмотрим,
например, ползание клетки. Участок
плазматической мембраны, к которому
прикреплен пучок актиновых филаментов, плотно
прикрепляется к субстрату (адгезивная
пластинка); после прикрепления к
субстрату актин-миозиновый комплекс
укорачивается и тащит все, что к нему
прикреплено, вплоть до целой клетки через ее
цитоскелет по направлению к пластинке
адгезии. Как только движение
прекращается, адгезивная пластинка
«отклеивается» и впереди появляются новые
пластинки адгезии, образованные
складчатыми выростами, ламеллоподиями (лат.
lamella — маленькая тонкая пластинка;
греч. pous, podos — нога), которые
выпускают клейкие пальцевидные выросты —
филоподии (лат. filum — нить). По мнению
некоторых исследователей, описанное
явление может лежать в основе механизма
амебоидного движения, посредством
которого клетки передвигаются по направлению
(положительный хемотаксис) или от
(отрицательный хемотаксис) определенных
объектов, посылающих химические сигналы.
Как мы уже видели, актиновые волокна
нередко располагаются непосредственно
под плазматической мембраной в виде
поясов или сплетений различной формы,
иногда связанных с осевыми волокнами
Особый метод быстрого
замораживания и глубокого
травления позволяет выявить
пучки актиновых филаментов,
расположенные вдоль
цитоплазматической поверхности
плазматической мембраны
фибробласта. Актиновые волокна
«украшены» отдельными
миозиновыми головками
(Si-фрагменты). Структуры,
похожие на проволочную сетку,
представляют собой клатриновые
корзинки над «окаймленными»
ямками.
в сердцевине микроворсинок и других
клеточных выростов. Уплотнение пояска
вызывает сокращение клетки; сокращение
сплетения приводит к сжатию клетки,
сморщиванию или округлению ее
поверхности, образованию складок, выступов или
впячиваний или других деформаций
поверхности клетки; натяжение или
подтягивание осевых волокон вызывает наклон
микроворсинки. И, если точки
прикрепления фиксированы на внутриклеточных
органеллах, можно видеть, как последние
перемещаются друг относительно друга и
относительно клеточной поверхности.
В самом деле, нетрудно представить,
по крайней мере теоретически, как
неисчислимое многообразие движений,
производимых живыми клетками, может
осуществляться координированной работой сотен
крошечных миозиновых цитомышц, активно
перемещающих актиновые цитокости в
различных направлениях. Здесь можно
провести аналогию со сложным
человеческим организмом: ведь и сложные
движения нашего собственного тела можно
объяснить работой мышц по перемещению
костей или образованию складок кожи.
Но потребуется множество ультрамикроско-
На диаграмме показано, как
латеральное соединение актиновых
и миозиновых филаментов
приводит к сборке миофибриллы с
правильным гексагональным
расположением.
пических исследований и анализов, пока
недоступных нашим современным
техническим средствам, прежде чем ученые
сумеют детально описать и объяснить в
терминах перемещения детальную
анатомию внутриклеточных костей и мышц. Эти
трудности усугубляются и тем
обстоятельством, что форма и взаимосвязи многих
цитокостей изменяются, равно как и
расположение сайтов для прикрепления
многих цитомышц. Кроме того, как мы
убедимся ниже, в клетках имеется вторая
цитоскелетная система, образованная
микротрубочками, и второй тип цитомышц,
динеин, связанный с этой системой.
Сила, развиваемая актин-миозиновой
системой, зависит от числа миозиновых
головок, дружно работающих " в данный
конкретный момент, т. е. в тот отрезок
времени, в течение которого филаменты
По мере приближения точек
прикрепления актиновых
филаментов к актинин-десминовой
ячеистой сети (Z-линия) их
расположение изменяется от
гексагонального к прямоугольному.
взаимодействуют, и от числа
параллельных филаментов, которые объединяются в
этом усилии. Если мы рассмотрим
единичную актин-миозиновую связь, то заме'-
тим, что каждый из шести актиновых
филаментов, окружающих миозиновый
стержень, имеет на своей свободной
поверхности не занятые сайты для
связывания с миозином. Исходя из этой
особенности, можно предположить, что шесть
филаментов первого пучка связывают
дополнительные миозиновые стержни, кото-
На этой электронной
микрофотографии поперечного
среза через поперечнополосатое
мышечное волокно отчетливо
выявляется гексагональное
расположение тонких (актин) и
толстых (миозин) филаментов.
Микрофотография, как и
приводимая на с. 222,получена
более 30 лет назад; будучи
историческими документами, обе
они сыграли заметную роль в
развитии теории скользящих
нитей мышечного сокращения.
рые в свою очередь могут окружить себя
дополнительными филаментами и т. д.
Повторяя такое расположение филаментов,
мы придем к структуре с гексагональной
симметрией, в которой каждый миозиновый
филамент окружен шестью актиновыми
филаментами, а каждый актиновый
филамент — тремя миозиновыми стержнями,
чередующимися с тремя актиновыми
филаментами. Если в такой структуре
обездвижить актиновые филаменты, склеив их
а-актининовые корешки, и затем
проскользнуть мимо вставленных миозиновых прутков,
то в конце можно натолкнуться на
«щетину» тонких актиновых филаментов,
расположенных на расстоянии 15—25 нм друг
от друга на каждом углу правильной
гексагональной решетки, в которой каждый
шестиугольник окружает отверстие,
соответствующее толстому миозиновому фила-
менту. Это достигается с помощью
соединительного белка, десмина, о котором мы
упоминали выше. В мышечных клетках
десмин образует также прямоугольную
сеть, которая принимает гексагональную
форму при погружении миозиновых
стержней в актиновую щетину.
В поперечнополосатой мышце
позвоночных все актиновые филаменты имеют
одинаковую длину 1 мкм, а все миозиновые
стержни — 1,5 мкм. Целая единица из
двух противоположно направленных
актиновых «щетин», соединенных центральными
миозиновыми стержнями, называется «cap-
Электронная микрофотография
продольного среза через
поперечнополосатое мышечное
волокно, иллюстрирующая
параллельное расположение тонких
и толстых филаментов.
Представлен полный саркомер,
ограниченный с обеих концов
Z-линией (сверху и снизу), в
которой актиновые филаменты
соединяются с актиновыми
филаментами соседних саркомеров
актинин-десминовой ячеистой
сетью. Отчетливо видна форма
миозиновых филаментов с
заостренными концами,
латеральные прикрепления
(головки) к актиновым нитям и
«оголенные» средние части
миозиновых филаментов. Эта
миофибрилла находится в
частично сокращенном состоянии—
тонкие и толстые филаменты
продвинуты друг относительно
друга на значительное расстояние.
Здесь показаны два, а не один
актиновых филамента между
миозиновыми филаментами
из-за ориентации среза (см.
диаграмму на с. 220).
комером» (греч. sarx — мясо, meros —
часть). Длина саркомера варьирует
приблизительно от 3,5 мкм (актиновые
филаменты почти полностью выдвинуты из
миозиновых филаментов) до 1,5 мкм (оба
вида филаментов полностью перекрывают
друг друга). В последнем состоянии
свободные концы актиновых филаментов
(250 нм) соединяются в пучки в
пространствах между гладкими серединами
миозиновых стержней, тогда как конусообразные
концы миозиновых стержней касаются
а-актинин-десминовой сети, из которой
берут начало актиновые филаменты. Было
бы замечательно, если бы мы могли
свободно побродить по саркомеру! Ведь,
насколько можно судить, его устройству
может позавидовать самый искусный
садовник! Представьте себе ветвистые,
украшенные гирляндами цветов миозиновые
стволы, чередующиеся с тонкими
актиновыми стеблями, изящно украшенными тро
помиозином, расположенным в спиральных
желобках, и тропонином. К сожалению,
подобное путешествие потребовало бы от нас
дальнейшего уменьшения по крайней мере
во сто крат. Даже при нашем увеличении в
миллион раз деревья этого молекулярного
«леса» отстоят друг от друга на расстоянии
меньше 2,5 см. К тому же это простран
ство почти целиком заполнено растущими
на деревьях «цветами». В довершение
всего нам грозила бы постоянная
опасность «проскальзывания» ионов кальция и
«захлопывания леса». Мы вынуждены
довольствоваться двумерным
пространственным изображением, полученным при
помощи электронного микроскопа. Но даже
уменьшенный до такой степени,
молекулярный «лес» завораживает нас своей
красотой.
В мышечной фибрилле значительное
На диаграмме представлены
основные черты поперечной
исчерченности. Анизотропный
диск (А) постоянной длины
образован миозиновыми
филаментами, проникающими
обоими концами между
актиновыми филаментами на
различное расстояние в
зависимости от степени сокращения
волокна. Изотропный диск /
содержит только актин; его
длина зависит от степени
сокращения, /-диск разделен
пополам Z-линией, в которой
актинин-десминовая ячеистая сеть
скрепляет концы двух групп
актиновых филаментов вместе.
Средние участки миозиновых
филаментов образуют //-зону в
середине Л-диска.
число саркомеров связано в группы дес-
мином, который не только соединяет места
прикрепления актина с образованием
соответствующим образом расположенной
«щетины», но также, как упоминалось ранее,
склеивает две такие щетины «спина к
спине». Именно регулярное чередование
различных зон придает фибрилле ее
характерную поперечную полосатость (исчерчен-
ность). Такие фибриллы могут достигать
огромных размеров по масштабам
клеточной шкалы. Они образуются из сотен
клеток, которые, сливаясь, образуют
синцитии (греч. syn — „с"). Фибриллы
окружены сложной системой мембран,
служащих главным образом для быстрого
высвобождения и возвращения ионов
кальция, посредством чего регулируется
мышечное сокращение, и рядами
митохондрий, обеспечивающих их энергией в
виде АТФ.
Фибрилла может находиться в трех
состояниях. В отсутствие АТФ и кальция
актин и миозин жестко сцеплены. Это
состояние наблюдается при трупном
окоченении, наступающем после смерти
организма, когда прекращается производство
АТФ. Стоит добавить АТФ, и структура
становится податливой, пластичной. На
головке миозина имеется связывающий АТФ
сайт; когда он занят, головка не может
Структура поперечнополосатой
мышцы. Каждое волокно
представляет собой гигантский
многоядерный синцитий,
содержащий пучок миофйбрилл,
окруженных сарколеммой.
Три состояния актин-миозиновой
системы
А. Расслабление. В присутствии
ЛТФ и в отсутствие ионов кальция
система пластична. Филаменты
свободно скользят друг
относительно друга.
Б. Сокращение. Добавление
ионов кальция вызывает
взаимодействие миоз-иновых
головок с актиновыми филаментами
(см. две следующие иллюстрации).
В то время как происходит
гидролиз АТФ, актин перемещается
вниз.
В. Окоченение. Удаление кальция
в отсутствие АТФ «запирает»
систему в состоянии окоченения.
Добавление АТФ восстанавливает
состояние расслабления (А).
Структура молекулы тропонина.
Как показано слева, он образован
из тропомиозинсвязывающеи
субъединицы (Т) и
актинсвязывающей субъединицы
(И) (так как она ингибирует
связывание миозина с актином),
соединенных кальциисвязывающеи
субъединицей (С). Форма и
положение С-субъединицы
меняются в зависимости от
присутствия ионов кальция. Это
конформационное изменение
нарушает положение Т- и И-
субъединиц друг относительно
друга. Рисунок воображаемый, так
как истинная форма молекулы
не известна.
Сдвоенный филамент (справа),
укомплектованный тропомиозином
и тропонином: в отсутствие
ионов кальция (off-позиция) (А),
в присутствии ионов кальция
(оппозиция) (Б). Перемещение
тропомиозина многократно
увеличено для большей ясности.
взаимодействовать с актином (в
отсутствие кальция, см. ниже), и филаменты
беспрепятственно скользят друг
относительно друга. Такие волокна почти не
сопротивляются пассивному растяжению
до тех пор, пока другие структурные
элементы не вмешаются, чтобы
предотвратить полное расхождение составляющих
их филаментов. Это состояние свойственно
разгибательной мышце при сокращении
соответствующей сгибательной мышцы.
Третье состояние фибрилла испытывает
благодаря ионам -кальция, которые
действуют через молекулы тропонина,
прикрепленные к актиновым филаментам
Тропонин состоит из трех субъединиц
Одна субъединица связывается с актином
и называется И, так как ингибирует
прикрепление миозина. Вторая субъединица,
названная Т, связывается с
тропомиозином. Эти две субъединицы соединены
третьей, С, связывающей ионы кальция.
С-субъединица служит пусковым
механизмом (триггером) мышечного сокращения.
В отсутствие кальция ее положение
таково, что нити тропомиозина находятся
вне желобков в актиновых филаментах и
покрывают миозинсвязывающие сайты
(off-позиция). Под влиянием ионов
кальция С-субъединицы тропонина изменяются
таким образом, что тропомиозин
перемещается по направлению к желобкам акти-
нового филамента (on-позиция). Это по
зволяет миозину взаимодействовать с
актином, который одновременно активирует
гидролиз АТФ и связанное конформацион-
ное изменение, которое мы наблюдали
в одном актин-миозиновом пучке. Отметим,
что в фибрилле каждый актиновый
филамент тянут три миозиновых, согласованно
действующих филамента. Однако не все
миозиновые головки действуют
одновременно; они активно помогают
передвижению только тогда, когда «стратегически»
располагаются относительно сайтов
связывания на актине. Так обеспечивается очень
плавное скольжение и укорочение. Если
укорочение встречает сопротивление,
развивается напряжение. Это состояние
сохраняется до тех пор, пока С-субъединица
тропонина занята кальцием и имеется
достаточное количество АТФ для покрытия
энергетических затрат.
Тропонин обнаружен только в
поперечнополосатой мышце. В других мышечных
и немышечных клетках сокращение
обеспечивается иными средствами. Но основные
принципы, по-видимому, универсальны.
Насколько известно, актиновые филаменты
противоположной полярности всегда
устроены так, что обладают способностью
скользить по направлению друг к другу,
используя для этого своеобразный
механизм типа «храповика», обеспечиваемый
энергией за счет расщепляющих АТФ
головок миозинподобных молекул.
Прежде чем продолжить наше
путешествие, остановимся, чтобы в последний
раз взглянуть на актиновую молекулу,
15—1452
эту, бесспорно, одну из удивительнейших
конструкций из атомов, которую мы имели
возможность подробно рассмотреть. Это не
гигантская молекула. Она имеет
молекулярную массу 42 000 дальтон и
образована 374 аминокислотами. Вместе с тем
пространственное расположение этой
-цепочки таково, что образуется не менее
восьми специфических идеально
расположенных сайтов связывания: четыре сайта
для взаимодействия актиновых молекул
между собой с образованием двухспираль-
ного F-актина; один сайт для АТФ/АДФ,
вовлеченных в процесс полимеризации;
один-два сайта для тропомиозина; один
сайт для И-субъединицы тропонина и один,
особенно важный сайт для прикрепления и
одновременной активации расщепляющей
АТФ головки миозина. Кроме того, более
слабые сайты связывания позволяют акти-
новым волокнам соединяться поперечно,
образуя правильно структурированные
пучки, или стержни. Как появилась такая
необычная конструкция, пока неизвестно.
Но, возникнув, она практически не
изменилась в ходе эволюции: в структуре
актина, от амебы до кролика, практически
не произошло никаких изменений..
Система тубулин — динеин
Свыше миллиарда лет назад живой
организм «открыл» для себя преимущество
строительства опорных элементов из
трубчатых элементов; открытие это нашими
инженерами сделано лишь недавно. Как
полагают, это эволюционное приобретение
было получено благодаря обычному
механизму «случайная мутация — естественный
отбор». Возможно, какой-то актиноподоб-
ный глобулярный белок, обладающий
способностью к продольной самосборке,
претерпел генетическое изменение и в
результате утратил способность к латеральному
объединению, после чего отдельные фила-
менты начали образовывать
цилиндрические структуры — пласты вместо двои
ных спиралей.
И действительно, тубулин, составная
часть микротрубочек, представляет собой,
как и актин, небольшой глобулярный
белок диаметром около 4 нм, имеющий
комплементарную ось «замок—ключ», что
позволяет осуществлять безграничное ли
нейное объединение молекул. Однако
имеются два тубулина, обозначенные как а и
р, которые, несомненно, являются
эволюционными близнецами, о чем
свидетельствует ярко выраженное сходство их
аминокислотной последовательности.
Существует предпочтительное а—^-соединение,
которое остается стабильным при распаде
микротрубочек, поэтому истинным
эквивалентом G-актина следует считать а—р-ге-
теродимер;а не мономер. Эти субъединицы
линейно объединяются посредством
обратимых р—а-связей с образованием прото-
филаментов (греч. protos — первый).
Последние в свою очередь объединяются лате-
рально посредством второй системы
«замок—ключ», ступенчато, таким образом,
что каждая а—р-субъединица граничит
с соседней р—а-парой, сдвинутой примерно
на четверть ее длины. Образующийся
пласт имеет не плоскую, а изогнутую
поверхность и превращается в
цилиндрическую структуру, когда ровно 13 прото-
филаментов выстраиваются в ряд бок
о бок.
Как и в случае превращения G-актина
в F-актин, сборка микротрубочек связана
с гидролизом нуклеозидтрифосфата, но в
этом случае ГТФ (вместо АТФ для
актина). Существует связывающий ГТФ сайт
на а—р-гетеродимере. При сборке ГТФ
расщепляется на ГДФ, который остается
связанным, и Фн, который
высвобождается. Если принять во внимание упомянутое
выше сходство, можно допустить, что
между актином и тубулином имеется
эволюционное родство; произошли генетические
изменения, вполне возможно явившиеся
ключевым событием дивергенции. В
результате один ген принял две формы
(предшественники генов а- и р-тубулина). Однако
все, что нам известно об аминокислотной
последовательности актина и тубулина, не
подтверждает эту гипотезу. «•
Независимо от их эволюционного
происхождения, развитие микротрубочек,
бесспорно, сыграло важную роль в появлении
эукариотов, в растительных и животных
аналогах которых они повсеместно
присутствуют. Согласно одной теории,
микротрубочки впервые появились у некоторых
жгутиковых микроорганизмов (которые
постепенно становились симбиотически
адаптированными общими предшественниками
эукариотов), чтобы обеспечить эти клетки
|^ 28 нм
Рисунки наверху слева показывают,
(в высшей степени схематично),
как очень похожие а- и р-молекулы
тубулина соединяются
преимущественно с образованием
стабильных гетеродимеров,
которые в свою очередь
собираются продольно в
протофиламенты при помощи
полярно расположенных
устройств «замок — ключ».
Другое аналогичное устройство,
расположенное сбоку, позволяет
протофиЛа ментам соединяться в
цилиндрическую структуру,
насчитывающую 13
протофиламейтов, с наружным
диаметром 28 нм и внутренним
диаметром 14 нм. При
латеральном ступенчатом
соединении создается
левозакрученная спиральная
периодичность чередующихся
а- и р-единиц с шагом витка
12 нм и правозакрученная
спиральная периодичность
идентичных единиц с шагом витка
40 нм. Ассоциированные с
микротрубочками белки
располагаются в желобках.
15*
наряду с другими преимуществами и
элементами митотического веретена. Но в
отличие от митохондрий и хлоропластов
центриоли — организующие центры
митотического веретена, удваивающиеся при
каждом делении клетки, — судя по всему,
не содержат ДНК.
Для туриста, вознамерившегося
проникнуть в клетку и экипированного
увеличивающими в миллион раз приборами
(очками, микроскопом, биноклем и т. д.),
микротрубочки предстают в виде неких
толстостенных садовых шлангов с
наружным диаметром немногим более 2,5 см
(28 нм — их истинная величина) и
внутренним диаметром 1,25 см (14 нм—
истинная величина). Микротрубочки имеют
бугристую поверхность; выступы
диаметром около 4 нм расположены 13
продольными рядами, в которых незначительные
различия в форме отражают регулярное
чередование а- и (3-субъединиц. В
результате зигзагообразного расположения рядов
выступы образуют многообразие спираль-
На электронной микрофотографии
тонкого среза через
культивируемую клетку человека
видны многочисленные
микротрубочки, бегущие по
цитоплазме, по обе стороны от
вытянутой митохондрии.
ных структур вокруг трубки. Среди них
имеются правозакрученная спираль из
одинаковых субъединиц (все а или р) с шагом
витка 40 нм и левозакрученная спираль
из чередующихся субъединиц а и р с
шагом 12 нм. Как правило, основной скелет
затем обрастает дополнительными белками
(ассоциированные с микротрубочками
белки, или МАБ), частично погруженными в
продольные желобки, а частично свободно
выступающими в виде волосков или
пушистых выростов, также спирально
обвитыми вокруг стержня микротрубочки. В
целом микротрубочки представляют собой
весьма привлекательное зрелище. Но еще
привлекательнее структуры, для
строительства которых они используются.
Многие такие структуры образуются
из подвижных микротрубочек. Они
непостоянны и изменчивы, так как являются
продуктами динамического равновесия
между двумя противоположными
процессами, которые продолжаются более или
менее постоянно. Это равновесие легко
нарушается. Так, распаду микротрубочек
благоприятствуют охлаждение, высокое
давление, ионы кальция и такие
лекарственные вещества, как колхицин или
некоторые алкалоиды (винбластин, винкрис-
тин), экстрагированные из барвинка
малого Vinca rosea. Названные лекарственные
вещества связываются со свободными
гетеродимерами и тем самым препятствуют
их соединению друг с другом. С другой
стороны, нагревание и обработка тяжелой
водой благоприятствуют сборке
микротрубочек.
Мир клеток изобилует поразительными
примерами упомянутых феноменов. Среди
путешественников по живой клетке особой
популярностью пользуется группа простей-
Микрофотография Echinosphaerium
nucleofilutn. Обратите внимание
на радиально отходящие от
тела клетки аксоподы.
шихНеПогоа (греч. hellos — солнце; zoon —
животное). Эти одноклеточные организмы
получили свое название благодаря тому,
что они выпускают длинные тонкие жесткие
отростки—лучи (аксоподы), радиально
расходящиеся во все стороны от тела
клетки и достигающие в длину 0,5 мм. Только
представьте себе картину, открывающуюся
вашему взору через увеличительные
стекла: огромный шар диаметром свыше 10 м
утыкан гигантскими отростками,
достигающими 1,5 м в ширину и более 500 м в
длину! Если вы решитесь прогуляться по
Электронная микрофотография
среза через аксопод Echinosphaerium
nucleofilum. Обратите внимание на
двухспиральное расположение
микротрубочек с 12-кратной
симметрией.
одному такому отростку, то обнаружите,
что он поддерживается центральным
стержнем (осью), образованным сотнями
параллельных микротрубочек, поперечно
связанных в удивительную двойную
спираль с 12-кратной симметрией. Вы заме-
Микрофотография красной
хроматофорной клетки (эритрофор)
рыбы Holocentrus rufus с
рассеянными пигментными
гранулами
тите также двустороннее движение частиц
и молекул; они деловито перемещаются
вдоль оси, связывающей тело клетки с
верхушками аксопод, где наряду с другими
событиями происходит и эндоцитоз.
Если же Heliozoa попадетv. в поток
холодного воздуха, то мы станем
свидетелями поистине драматической картины:
не только «затормозится» движение в
аксоподах вплоть до полной его остановки,
но и вся опорная система из
микротрубочек распадется на части. Через каких-
нибудь два часа не останется ни одной
микротрубочки, и аксоподы полностью
сократятся, превратив «солнце» в голый
шар, утерявший свои лучи. Однако не все
потеряно, что смогут понять те, кому
удастся среди массы новых молекул,
заполняющих теперь клетку, распознать
гетеродимерные строительные блоки, из
которых были построены распавшиеся
микротрубочки. Достаточно небольшого притока
тепла, и все будет восстановлено.
Разбуженные слабым нагреванием,
микротрубочки начнут вырастать из корешков, так
называемых центров организации
микротрубочек, что прячутся в глубине
клеточного тела. Вскоре поверхность клетки
покроется сотнями новых аксопод и в
считанные часы «солнце» опять засияет
своими лучами.
В коже многих ракообразных, рыб,
земноводных и пресмыкающихся
содержатся звездчатые пигментированные
клетки, хроматофоры, которые образуют
радиальные отростки, поддерживаемые
каркасом из микротрубочек; вдоль
микротрубочек с удивительной скоростью внутрь
или наружу движутся пигментные гранулы.
Под влиянием определенных гормонов, на
секрецию которых воздействует свет,
гранулы могут быстрее чем за секунду
скапливаться в центре клетки, отчего она ста-
На сканирующей электронной
микрофотографии поверхности
простейшего Parameclum tetraurella
видны ряды ресничек,
остановленных в середине их
синхронного колебания.
Электронные микрофотографии
эритрофора Holocentrus rufus
(см. микрофотографию на
с. 230). Слева — с рассеянными
пигментными гранулами, справа —
с агрегированными пигментными
гранулами.
новится почти прозрачной, или проникать
в отростки, вызывая потемнение клетки
У некоторых животных в этих
перемещениях участвуют независимо два или более
типа пигментных гранул разного цвета.
В этом-то и заключен секрет хамелеона:
заденьте его микротрубочки, и тут же
убедитесь в искусстве его маскировки.
Возможно, самыми необыкновенными
клеточными отростками, укрепленными
микротрубочками, следует считать
аксоны — нитевидные отростки, по которым
нервные клетки (нейроны)
посылают свои сигналы. Длина аксонов в нер
вах более крупных млекопитающих
достигает нескольких метров. Жизненно важные
связи и обмены между телом клетки и
ветвящимися окончаниями аксона на всем
этом огромном расстоянии
поддерживаются и осуществляются так называемыми
аксональными токами; их самый быстрый
компонент распространяется со скоростью
до 8 мкм/с. Увеличенный в миллион раз,
такой аксон мог бы «перекрыть»
Атлантический океан. По нему за считанные дни
можно было бы переправить вещества
произведенные в теле нейрона — скажем,
в Нью-Йорке,— к месту назначения в нерв
ные окончания, — в некую точку на
побережье Ирландии.
Одно из назначений микротрубочек —
вызывать или поддерживать некоторые
структурные асимметрии в клетках
(например, удлинение растущих мышечных
клеток); они также предназначены для
строительства внутриклеточных каркасов,
обычно для поддержания направленного
транспорта или передвижения.
Во всех упомянутых примерах
микротрубочкам, как элементам цйтоскелета,
отведена явная структурная роль. Но
благодаря изменчивости формы они способны
выполнять и морфогенетическую функцию
при сборке и демонтировании. И наконец,
они часто создают направленные пути и
поддерживающие структуры для некоторых
форм направленного перемещения
внутриклеточных объектов или веществ. В качест
ве движущей силы этих транспортных
феноменов могут выступать актин-миозино-
вые цитомышцы. Но существует и другая
возможность, как показали исследования
более стабильных систем микротрубочек,
участвующих в создании двух основных
двигательных органелл клеток — ресничек
и жгутиков.
Реснички представляют собой
пульсирующие, колеблющиеся выросты. Они
сгибаются и разгибаются, оставаясь
преимущественно в одной плоскости, с частотой от
10 до 40 колебаний в секунду. Ресничек
обычно много и располагаются они
параллельными рядами, а их движения можно
уподобить волнам от сигналов
возбуждения. Чтобы как следует насладиться этим
зрелищем, следует уменьшить увеличение
до нескольких десятков тысяч раз вместо
обычного увеличения в миллион раз и
воспользоваться ускоренной киносъемкой и
замедленной системой воспроизведения.
Тогда поверхность клетки покажется вам
полем зрелой пшеницы, клонящейся под
порывом ветра. Колебания ресничек
вызывают соответствующее перемещение
клетки в окружающей жидкости. Если клетка
свободна, она двигается (вспомним
реснитчатые простейшие одноклеточные
организмы); если же клетка фиксирована, то
колебания ресничек формируют поток
жидкости. Направление этих движений можно
изменить. Например, если туфелька (Рага-
mecium) наталкивается на препятствие,
она тут же отплывает обратно. Изменение
движения происходит под влиянием ионов
кальция, высвобождающихся при ударе.
Жгутики длиннее ресничек и обычно
располагаются по одиночке или в
небольшом количестве — на хвостовом конце
свободно плавающих клеток, таких, как
жгутиковые простейшие, гаметы (половые
клетки) морских водорослей или
сперматозоиды животных. Как и реснички,
жгутики движутся в одной плоскости, но их
движение волнообразное, а не колебательное.
Они выполняют функцию пропеллера.
(Некоторые бактерии также имеют жгутики, но
они устроены по-иному; тубулин обнаружен
только у эукариотов).
За небольшими отклонениями, все
реснички и жгутики имеют одинаковую
молекулярную структуру, основанную на так
называемой модели 9 + 2. В центре
находится пара микротрубочек, латерально
соединенных поперечными мостиками. Эта
центральная пара, заключенная в
оболочку, окружена цилиндром из 9
параллельных дублетов микротрубочек,
присоединенных к ней радиальными «спицами». Каждый
дублет состоит из одной полной
микротрубочки (А), образованной 13 протофила-
ментами, к которой посредством трех
общих протофиламентов присоединяется
неполная микротрубочка (*В), образованная
только 10 протофиламентами. А-субъеди-
ница из каждого дублета посылает пары
Эти электронные микрофотографии,
полученные в начале 60-х гг.,
выявили характерную структуру
жгутиков у простейших
Pseudotrichonympha. На продольном
срезе слева виден корень жгутика
продолжающийся в базальное
тельце (TF — переход от жгутика
к базальному тельцу, ТВ —
переход между проксимальным и
дистальным участками
базального тельца, су —
центральный цилиндр, fm —
мембрана жгутика). Поперечные
срезы в центре иллюстрируют
структуру жгутика и
базального тельца на разных
уровнях (см. диаграмму на
с. 234). Продольные срезы
справа отражают структуру
дистальных участков базального
тельца.
тангенциально ориентированных боковых которые по описанию похожи на гантели
«ручек» к В-субъединице прилежащего или леденцы, повторяются продольно с
дублета в направлении по часовой стрелке, интервалом в 20 нм. Всего в создании этой
если смотреть сверху. Эти боковые «ручки», удивительной структуры участвует более
Структура реснички. Слева
показано продольное сечение через
нижнюю часть аксонемы и
верхнюю часть базального тельца.
Справа изображена тонкая
структура реснички на трех
разных уровнях. Часть 1
отображает типичную структуру
аксонемы 9 -+- 2 с центральным
дублетом микротрубочек и кольцом
из 9 дублетов, соединенных
парами динеиновых боковых ручек.
Часть 3 отображает типичную
структуру «колеса телеги»
базального тельца с триплетами
микротрубочек, соединенными с
центральным цилиндром
посредством «спиц».
Промежуточная область,
соединяющая аксонему с
базальным тельцем, показана в
части 2 (см. электронные
микрофотографии на с. 233 и 235).
сотни различных белков. Благодаря своей
способности к связыванию они
объединяются в искусно вылепленный стержень,
известный под названием аксонема (греч.
пета — нить). Толщина аксонемы
достигает 0,3 мкм (или 30 см при нашем
увеличении в миллион раз), и ее красота, как и
красота саркомера, доставляет наибольшее
удовольствие на поперечном срезе.
В том месте, где аксонема погружается
в цитоплазму, ее структура изменяется.
На продольном срезе через
ресничку простейшего Tetrahymena
thermophilia, полученном методом
замораживания — травления,
видны четыре дублета
микротрубочек, соединенных
рядами динеиновых ручек.
Центральная пара микротрубочек обры
вается и далее замещается одной полой
осью. Что же касается периферических
дублетов микротрубочек, то, проникая в
цитоплазму, они более не соединяются
боковыми ручками, а приобретают третью
неполную микротрубочку (С),
сливающуюся с В-компонентом дублета таким же
образом, как В-компонент сливается с А-
компонентом. Радиальные пластинки
соединяют полученные триплеты с
центральной осью, замещая спицы аксонемы.
Этот корешок называется кинетосомой
(греч. kinein — двигаться), или базальным
тельцем. Базальное тельце обладает
удивительной способностью к организации:
например, после отсечения реснички или
жгутика оно дает начало новым отросткам.
В аксонемах ресничек и жгутиков
микротрубочки и их радиальные
соединения образуют искусно сплетенную цито-
скелетную сеть, обладающую такой
степенью упругости, подвижности и
эластичности, которая необходима как для
осуществления, так и для ограничения
напряжения при сгибании. Боковые «ручки»
представляют собой генерирующие
энергию цитомышцы, заставляющие структуру
сгибаться. Они образованы белком динеи
ном (греч. dynamls — сила), который, как
и миозиновые головки, обладает
способностью катализировать гидролиз АТФ
через обязательное конформационное
изменение. В результате этого механохимичес-
кого события происходит относительное
перемещение двух дублетов микротрубочек,
соединенных активированным динеином
боковых «ручек», которое напоминает
скольжение актиновых нитей вдоль миозиновых
филаментов, вызываемое АТФ.
Таков принцип работы молекулярного
механизма. Разумеется, детали его
значительно сложнее. В частности, бесспорно,
что девять рядов динеиновых боковых
ручек не могут активироваться
одновременно. Ручки, расположенные в (или около)
плоскости сгибания (которая
перпендикулярна плоскости центральной пары
микротрубочек), должны работать по принципу
возвратно-поступательного движения.
Тогда те, что расположены с одной стороны,
расслабляются, а противоположные им
сокращаются, и наоборот. В то же время
боковые ручки, лежащие в (или около)
плоскости, перпендикулярной плоскости
сгибания, остаются в значительной степени
пассивными. Сложнейший механизм этого
явления все еще ускользает от
проницательного взгляда исследователей клетки.
До сих пор не ясно, участвуют ли
динеиновые цитомышцы в других формах
внутриклеточного движения, для которых
микротрубочки служат цитоскелетом, или
эта функция осуществляется миозиновыми
филаментами, передвигающими
соответственным образом прикрепленные актиновые
нити. В любом случае обнаруживается
отчетливый параллелизм при сравнении
двух основных клеточных двигательных
систем: обе функционируют за счет
скользящего перемещения цитокостей под
влиянием натяжения специальных цитомышц,
расщепляющих АТФ.
Клатрин
В мире клеток чудесам нет конца. Когда
американский архитектор Бакминстер Фул
лер построил свой знаменитый
геодезический купол, вряд ли он подозревал, что
сотни миллионов лет тому назад Природа
создала молекулу белка, которая сама
могла полностью создать такую же струк
туру. Этот белок назван клатрином (греч.
klethra, лат. clathrum — решетчатый
барьер). При первой же возможности
клатрин даже в пробирке спонтанно собирается
в структуры, напоминающие корзиночки;
эти структуры, как и геодезический купол,
образованы сетью шестиугольников с
небольшим количеством пяти- и
семиугольников.
Мы можем наблюдать за этим
процессом и одновременно получить
представление о его сущности, изучая внутреннюю
поверхность плазматической мембраны в
том участке («пэтче»), на
противоположной стороне которого рецепторы, занятые
соответствующими лигандами,
сгруппированы и готовы к поглощению эндоцитозом
О начале этого феномена возвещают тор
чащие сквозь мембрану на нашей стороне
пучки хвостов рецепторных молекул. По-
видимому, приведенные в состояние
готовности таким же путем субъединицы
клатрина, собранные из какого-то цито-
плазматического запаса, начинают поли-
меризоваться в том «пэтче» мембраны,
где виднеются пучки рецепторов, покрывая
его структурой, которая на первый взгляд
Геодезический купол Бакминстера
Фуллера '
напоминает оборванный кусочек мелкой
проволочной сетки.
Присмотревшись, можно заметить, что
каждая субъединица представляет собой
структуру, состоящую из трех «ног», или
«трискелион» (греч. skelos — нога), с
«бедрами» и «голенями» длиной около
20 нм (немногим меньше 2,5 см при нашем
увеличении). Эти субъединицы
соединяются латерально вдоль своих «конечностей»
с образованием гексагональной ячейки, в
которой каждая вершина занята центром
«трискелиона», а каждая сторона
образована четырьмя конечностями — двумя
«бедрами» и двумя «голенями», —
расположенными бок о бок. Но эти «трехножки» не
плоские, а изогнутые. Перемещаясь по
часовой стрелке, они соединяются
выпуклыми поверхностями. Таким образом, по
мере расширения образованная ими
структура постепенно «раздувается», и
приобретает форму типичного геодезического
купола. В процессе приспособления к
увеличивающейся кривизне некоторые
трехножки отваливаются, и тогда правильная
гексагональная решетка сети в некоторых
участках нарушается за счет появления
небольшого количества пяти- и
семиугольников. Эти структуры быстро собираются,
пользуясь тем же механизмом, что и
шестиугольники, лишь с незначительными
конформационными изменениями
участвующих «трехножек». В ходе процесса
кривизна купола продолжает
увеличиваться, а наружный обод натягивается, в
результате купол постепенно принимает
форму грушевидной корзинки. Но вот «края»
корзинки смыкаются, корзинка
превращается в клетку-ловушку, а участок
плазматической мембраны («пэтч») — в везикулу,
На электронной микрофотографии,
полученной методом
замораживания — травления,
показаны клатриновые корзинки
на цитоплазматической
поверхности плазматической
мембраны. Корзинки покрывают
«окаймленные углубления» —
ямки. От А до 3 они показаны в
процесе увеличения кривизны до
практически полного закрытия с
образованием «окаймленных»
везикул (от Е до 3).
Участок мембраны втягивается
внутрь клетки клатриновой
клеткой-ловушкой при эндоцитозе.
заключенную в «клетке». Вскоре «клетка»
распадается и исчезает, освобождая
везикулу.
Картина, которую мы только что
наблюдали, находясь внутри клетки,
представляет собой характерный процесс
опосредованного рецепторами эндоцитоза.
Замеченные первыми электронными микроско-
пистами на двумерных электронограммах
пушистые контуры вокруг профилей
некоторых мембранных впячиваний и закрытых
везикул послужили косвенным
доказательством участия организованной структуры
в описанном процессе. Для обозначения
этих структур исследователи ввели термины
«окаймленные углубления» и «окаймленные
Сборка клатриновой сети из
единиц в виде «трехножек»
везикулы» и выдвинули гипотезу, согласно
которой «окаймление» каким-то образом
участвует в процессе отщепления везикул
от мембран (см. с. 65—67).
Работы первых исследователей
предвосхитили дальнейшие открытия.
Впоследствии удалось установить, что клатриновые
корзинки принимают участие не только в
опосредованном рецепторами эндоцитозе,
но и в других процессах везикулярного
транспорта, таких, как перенос материалов
из эндоплазматического ретикулума в ап-
На электронной микрофотографии,
полученной методом
замораживания — травления,
показаны «окаймленные
углубления» — ямки (вид сбоку),
покрытые клатриновыми корзинками
на разных стадиях «удушения»
(впячивания) плазматической
мембраны и превращения ее в
закрытую везикулу.
парат Гольджи. Однако, как работает
клатрин, до сих пор далеко не ясно.
Наблюдая за поведением этой
удивительной молекулы, мы задаемся рядом
мучительных вопросов. Что на этих маленьких
участках мембраны («пэтчах»), столь
различных по происхождению и функции,
где образуются клатриновые корзинки,
является ядрообразующим сигналом,
инициирующим полимеризацию? Откуда
берется свободная энергия для этого процесса
и действительно ли она, как мы
предполагаем, обеспечивает работу по отделению
везикул от плоской мембраны? Если это
так, то каким образом осуществляется
эндоцитоз без помощи клатрина? Что
заставляет клатриновую корзинку
отваливаться после завершения ее функции?
Сейчас мы не знаем ответов на эти
вопросы, как, впрочем, и на бесчисленное
множество других. Но, если доверять
примерам истории, можно с уверенностью
предсказать, что когда-нибудь турист,
совершающий путешествие по живой клетке,
посчитает эти вопросы столь
увлекательными, что займется исследованиями клетки
и не остановится до тех пор, пока не
получит ответы на все эти вопросы. Уже в
наши дни существуют косвенные
доказательства, что ионы кальция могут
способствовать полимеризации, а АТФ —
реверсии этого процесса.
Микротрабекулы
Исследователи, изучающие клетки при
помощи самых точных из ныне доступных
инструментов и методов, таких, как
электронный микроскоп в 1 MB или метод
быстрого замораживания или глубокого
травления при приготовлении образцов
тканей для сканирующей электронной
микроскопии, обнаружили тончайшую
волокнистую сеть филаментов,
пронизывающую весь цитозоль и прикрепленную
многочисленными точками прикрепления ко
всем имеющимся цитоплазматическим
структурным компонентам. Элементы этой
сети получили название
«микротрабекул» — буквально сверхминиатюрные лучи
(или перекладинки). На самом деле
микротрабекулы не столь миниатюрны: их
толщина примерно 10—15 нм; таким образом,
они, бесспорно, толще актиновых филамен
тов и, возможно, сравнимы по толщине с
миозиновыми филаментами. Причина, по
которой они не были обнаружены ранее,
заключается в их малой длине и случайной
ориентации в ячеистой сети. Для
распознавания микротрабекул как составных частей
сети потребовалось их
пространственное выявление.
Из картин микротрабекулярной сети,
которые вспоминаются до сих пор,
становится ясно, что микротрабекулы придают
цитозолю значительно большую
структурную жесткость и организованность, чем
нам показалось при первом знакомстве с
этой частью клетки. Признаться, наше
продвижение на том этапе было достаточно
трудным и неуклюжим, и мы могли не
заметить эту нежную паутину. Но вместе с
тем существуют и некоторые сомнения
относительно реальности
микротрабекулярной сети: ведь она делает клетку почти
«сверхорганизованной», а химически до сих
пор не идентифицирована, что весьма
удивительно с учетом ее
распространенности. Проблема усугубляется тем
обстоятельством, что исследователи, выявившие
микротрабекулярную сеть при помощи
современного сложнейшего
инструментария, изучали мертвые, а не живые клетки.
Обусловлена ли трабекулярная ячеистая
сеть артефактом фиксации или каким-либо
другим посмертным изменением — вопрос
спорный. Но тот факт, что различные части
клетки часто передвигаются согласованно,
подтверждает точку зрения о
существовании между ними соединяющей сети.
Кальций и подвижность клеток
В ходе краткой экскурсии по
поперечнополосатой мышце мы обнаружили
электрифицирующий эффект ионов кальция,
которые, соединяясь с тропонином С, вызывают
такое конформационное изменение этой
белковой субъединицы, что прикрепленный
тропомиозин перемещается и более не
16—1452
препятствует взаимодействию актина с
миозином и гидролизу АТФ.
Это лишь один из многочисленных
примеров важных пусковых функций,
осуществляемых кальцием. Ионы кальция
также стимулируют гладкомышечные
волокна, а возможно, все типы актин-миози-
новых систем, ингибируют сборку
микротрубочек, останавливают или изменяют
колебания ресничек, влияют на
полимеризацию клатрина и могут участвовать в
мембранных слияниях, которые определяют
эндоцитоз, экзоцитоз, а также слияние
и разделение внутриклеточных везикул.
И наконец, ионы кальция активируют ряд
ферментов, в частности некоторые киназы
белков (гл. 8). Эти ферменты выполняют
важные регуляторные функции, поскольку
биологическая активность белков, на
которые они воздействуют, в высшей мере
зависит от их фосфорилирования. Тем самым
белки, активность которых обусловливается
фосфорилированием, зависят от кальция.
К их числу, относится, по-видимому, миозин
гладких мышц. И напротив, белки, которые
активны только в дефосфорилированной
форме, «закрываются» ионами кальция.
При осуществлении всех этих функций
ионы кальция действуют опосредованно через
кальцийсвязывающий белок, кальмодулин.
Подобно тропонину С, кальмодулин также
претерпевает конформационное изменение
при связывании с кальцием. Именно этот
измененный белок обусловливает эффекты,
присущие кальцию. Его функциональное
сходство с тропонином далеко не случайно.
Оба белка состоят в тесном родстве, о чем
свидетельствует выраженное сходство их
аминокислотных последовательностей, и, по
видимому, они являются эволюционными
потомками общего предка.
Такие важные функции предполагают
существование внутриклеточных
резервуаров кальция, снабженных чрезвычайно
эффективными насосами и разгружающими
клапанами. Самые высокоорганизованные
системы обнаружены в
поперечнополосатых мышцах, особенно в летательных
мышцах насекомых, которые переходят из
состояния покоя в активное состояние до
нескольких сотен раз в секунду. В
поперечнополосатой мышце кальций хранится в
специализированной форме эндоплазмати
ческого ретикулума, так называемом сарко
плазматическом ретикулуме, который тесно
оплетает саркомеры; при этом расстояние,
которое должны пройти ионы кальция,
очень короткое. Высвобождение кальция из
этого резервуара может происходить почти
мгновенно благодаря существованию
глубоких впячиваний в плазматической
мембране (Т-система), тесно связанных с
саркоплазматическим ретикулумом в так
называемой триаде. При возбуждении
мышечного волокна волна деполяризации
распространяется вдоль плазматической
мембраны и, проходя через систему триад,
временно вызывает просачивание ионов
кальция из саркоплазматических
резервуаров. Мощный насос, находящийся в
саркоплазматической мембране, с помощью
АТФ всасывает ионы кальция обратно с
такой же скоростью, с какой они
высвобождались.
Специализированные домены эндоплаз-
матического ретикулума, аналогичные сар-
коплазматическому ретикулуму, могут
существовать и в некоторых других клетках.
Однако наиболее распространенными
резервуарами кальция являются, с одной
стороны, внеклеточная жидкость и, с
другой, митохондрии. Каждый из них
снабжен кальциевым насосом. Насос в
плазматической мембране выкачивает
кальций из клетки. Насос, находящийся
во внутренней митохондриальной мембране,
который, как мы уже видели, запускается
протондвижущей силой с помощью
природного кальциевого ионофора,
концентрирует кальций в митохондриальном матриксе.
Благодаря этим двум насосам в цитозоле
поддерживается очень низкая
концентрация кальция. Любое локальное изменение
в плазматической или внутренней
митохондриальной мембранах, замедляющее
работу кальциевого насоса или, наоборот,
увеличивающее выход кальция, вызывает
локальное же повышение концентрации
кальция в цитозоле. Это, в свою очередь,
приведет к усиленному связыванию кальций-
связывающих сайтов кальмодулина и разт
витию отдельных упомянутых выше
эффектов. Некоторые нервные импульсы,
ряд гормонов и поверхностных лигандов
вызывают подобные изменения в
плазматической мембране. Внутриклеточные
посредники, возникающие под влиянием
метаболических изменений или, возможно,
как в случае циклического АМФ, в ответ
на поверхностное воздействие, влияют
подобным же образом на внутреннюю мито-
хондриальную мембрану.
Источники иллюстраций
с. 18 (слева)
Courtesy of Dr. Brian J. Ford, Cardiff
Universty.
с 18 (справа)
Courtesy of Carl Zeiss Inc., Thornwood,
New York.
с 20
© The Metropolitan Museum Art.
с 22
From The Journal of Experimental Medicine,
1945, 81, p. 233, fig. 2, ©permission of the
Rockeller University Press.
с 24
Courtesy of Dr. Yukio Fujiki.
с 26 (вверху)
Courtesy of Dr. Yukio Fujiki.
с 26 (внизу)
Courtesy of Dr. James D, Jamieson and Dr.
George E. Palade.
с 37
Courtesy of Dr. Eldon H. Newcomb.
с 39
Courtesy of Dr. David Chase.
C. 41 (вверху)
Photography by Etienne Bertrand Weill.
Arp Hans. Serpent. © by ADAGP, Paris, 1984.
c. 41 (внизу)
Photography by Edward Liegh/Courtesy of Sir
John Kendrew.
с 45
Adapted from a diagram in the chapter
on ,,X-ray Analysis and Protein Structure" by
R. E. Dickerson, in vol. II of The Proteins
(H. Neurath ed.). Academic Press Inc., © 1964.
с 46
Courtesy of Dr. Etienne de Harven and Niva
Lampen. Sloan Kettering Institute, New York.
с 49 (вверху)
Illustration from "The Naturalist on the River
Amazons" by H. W. Bates.
с 50
Courtesy of Dr. Jerome Cross.
с 53
From Tissues and Organs: A Text-Atlas of
Scanning Electron Microscopy by Richard
G. Kessel and Randy H. Kardon.
W. H. Freeman and Co. © 1979.
с 56
Courtesy of Dr. Pierre Bacdhuin and Dr.
Pierre Guiot
16*
c. 59 (вверху)
Courtesy of Proceedings of the Royal
Society of London, 66, plate 6.
с 66 '
Courtesy of Dr. Samuel C. Silverstein.
с 76
Courtesy of Helen Shio.
с 82
Courtesy of Dr. Pierre Baudhuin.
с 84
Courtesy of Dr. Marilyn Gist Farquhar.
с 87
Courtesy of Dr. Pierre Baudhuin.
с 91
Courtesy of Helen Shio.
с 98
Courtesy of Dr. George E. Palade.
с 103
Courtesy of Dr. George E. Palade.
с 106 (вверху)
Courtesy of Dr. George E. Palade.
с 106 (внизу)
Courtesy of Dr. Marilyn Gist Farquhar.
с 109
De Chirico Giorgio. The Anxious Journey.
The Museum of Modern Art, New York.
с 120
Courtesy of Dr. George E. Palade.
с 124
Drawing by Lois Pasteur reproduced dy Rene
Dubos in his chapter ,,Pasteur and Modern
Science", pp. 17—32, in The Pasteur
Fermentation Centennial 1857—1957. © 1958
by Chas. Pfizer & Co., Inc.
с 166
Courtesy of Dr. Robert A. Bloodgood,
University of Virginia.
c. 167 (вверху)
Courtesy of Dr. Hans-Peter Hoffman and Dr.
Charlotte Avers.
с 167 (внизу)
Reclinig Figure (I), Courtesy of Henry Moore.
с 168 (вверху)
Courtesy of Dr. George E. Palade.
с 173
Courtesy of Dr. Donald F. Parsons.
c. 191 (вверху)
Courtesy of Dr. Leo P. Vernon.
с 192
Courtesy of Dr. Eldon H. Newcomb.
с 198 (слева)
Courtesy of Dr. Arvid B: Maunsbach.
с 198 (справа)
Courtesy of Dr. Pierre Baudhuin.
c: 199
Courtesy of Dr. George E. Palade.
с 201
Courtesy of Dr. Eugene Vigil.
Agricultural Research Center, Beltsville,
Maryland.
с 202
Courtesy of Dr. Phyllis Novikoff arid Dr.
Alex Novikoff.
с 203
Courtesy of Dr. Eldon H. Newcomb.
Published in E. H. Newcomb ,,Ultrastructure
and Cytochemistry of Plant Peroxisomes and
Glyoxysomes", Annals of the New York Academy
of Science, 386, p. 230 (1982).
с. 204 (вверху)
Courtesy of Dr. Marten Veenhuis. Published
in J. P. Van Dijken, M. Veenhuis and W. Harder.
,,Peroxisomes of Methanol-Grown Yeast", Annals
of the New York Academy of Science, 386,
p. 201 (1982).
с 204 (внизу)
Courtesy of Dr. Marten Veenhuis.
с 206
Courtesy of Dr. Helen Shio.
с 207
Courtesy of Dr. Pierre Baudhuin.
с 209
Courtesy of Dr. Werner W. Franke.
с 217
Courtesy of Dr. Hugh Huxley.
с 219
Courtesy of Dr. John Heuser.
с 221
Courtesy of Dr. Hugh Huxley.
с 222
Courtesy of Dr. Hugh Huxley.
с 228 (вверху)
Courtesy of Dr. Keith R. Porter.
с 228 (внизу)
Courtesy of Dr. L. E. Roth.
с 229
Courtesy of Dr. L. E. Roth and Dr.
Y. Shigenaki, University of Tennessee,
Knoxville and Hiroshima University
respectively.
с 230
Courtesy of Dr. Keith R. Porter.
с 231 (вверху)
Courtesy of Dr. Keith R. Porter.
с 231 (внизу)
Courtesy of D. Sidney L. Tamm.
с 233
Courtesy of Dr. Ian R. Gibbons.
с 235
Courtesy of Dr. John Heuser.
с 237
Courtesy of Buckminster Fuller Archives.
с 238
Courtesy of Dr. John Heuser.
с 240
Courtesy of Dr. John Heuser.
Предметный указатель
Авторадиография 26
Адаптация, клеточная 85, 92, 164
Аденилатциклаза 150
Аденилирование 150
Аденилилсульфат 159—161
Аденин 144
Аденозин 144
АДФ (аденозиндифосфат) 144, 147, 156, 157, 160,
177, 205, 213, 218
Азурофилы 107
Аксонемы 234, 235
Аксоны 230, 231
Аксоподы 228, 229
Активация
при гликолизе 127, 149
при групповом переносе 140—142, 145, 146,
148—151, 156, 159—161 •
Актин.210, 212, 226, 231, 235, 241
Актинин 214, 220, 222, 223
Алкалоиды 228
Алканы 201
Алкоголи 64, 136, 159. См. также Этанол
Альбумин 39
Альдегиды 127, 152—153
Альфа-спираль 44, 45, 58, 211, 213, 221
Амеба 14
Амидная связь 139, 151
Амидофосфатная связь 148
Аминоацил-тРНК 158
Аминокислоты 20, 42—45, 77, 136. См. также
Специфические аминокислоты
доноры электронов 199
меченые 25, 26
перечень 43
последовательность 99, 100, 104, 209, 227, 242
распад 169, 200
а-Аминолевулиновая кислота
Аммиак 151, 162, 169
АМФ (аденозинмонофоофат) 144, 149, 151, 156,
158—161
См. также Циклический АМФ
Амфипатические (амфифилические) молекулы 54 — 58
Анаболизм 123, 135
Анаэробные механизмы 121 — 135, 205—206
Ангидриды 151
Анкирин 213
Антибиотики 42, 181, 183
механизмы действия 38
Антигены 60
агрегаты антиген — антитело 88
трансплантация 62, 63
Антимикробные агенты 39, 107
Антитела 59
биосинтез 95
механизм действия 62, 63, 68, 97, 107
моноклональные 58
флуоресцентные 208—210
АПБ (ацил-переносящий белок) 161 — 162
Аппарат Гольджи (комплекс Гольджи) 32, 78, 89
92, 97, 100—113
транспортный механизм, теории 104, 109—111
тубулярные (канальцевые) связи 118—119
Аргинин 151
Артериосклероз 86
Археобактерии 187
Асбестоз 89
Аскорбиновая кислота 175, 176, 179
Аспарагин 151
Аспарагиновая кислота 151, 162
Ассоциированные с микротрубочками белки (АМБ)
227, 228
Атом водорода
при гликолизе 127
транспорт 174, 182—184
АТФ (аденозинтрифосфат) 128—133
в биосинтезе 136—163
— микротрубочках 236
— протонном насосе 78, 192 193
поперечные связи 210
при гликолизе 125—128
— дыхании 169—182
— мышечном сокращении 212, 213, 217, 222 — 226,
241, 242^243
— образовании водорода 205
— фотосинтезе 188—197
у аутотрофов 184—187
АТФазы 217
Аутоантитела 88
Аутоиммунные болезни 64, 84
Аутотрофы 132, 147, 179, 184—197
анаэробные 185^-187
эволюция 185—187
Аутофагические вакуоли 79—80
Аутофагия 77, 78, 80 — 85, 110, 211
Ацетальдегид 130, 134
Ацетил-АПБ 161
Ацетил -КоА 161
Ацетилхолин 95, 159
рецептор для 58, 106
Ацилирование 104
Ацил-АМФ 158
Ацил-АПБ 161
Ацил-КоА 161, 176, 199
Ацил-переносящий комплекс 158 161 — 162
Ацилфосфат 150
Ацильная группа 161
Базальная мембрана 48, 51, 88, 95
Базальное тельце (кинетосома) 233 — 235
Бактерии 14, 15, 19, 32
аэробные 164—165, 168
захват 60, 67, 68, 80, 107
клеточные стенки 38—39
метаболизм 111, 182—183, 189-191, 200
патогенные 62, 90, 204 — 205
размеры 16
серные 190
структура 231 — 232
эволюция 185—187
Бактериородопсин 58, 188
Бактериофаги 27
Бациллы
В. fragilis 39
лепрозойные (лепры) 69, 74, 89
молочнокислые 123
структура 232
туберкулеза 74, 89
Белки 20, 38, 40—46. См. также Флавопротеины,
Гематопротеины, Металлопротеины,
Плазматические белки
бактериальные 182
биосинтез 25, 26, 32, 97—100, 104, 106—108, 136.
142—143, 154, 158, 195
глобулярные 212—236
денатурация 41—42, 86
конформационные изменения 58 — 61, 218, 235.
241-243
мембранные 24—25, 58 — 61, 63, 67, 97 104
106-108, ПО
митохондриальные 24 — 25, 182—183
молекулярное время жизни 81
обновление 80
пероксисомальные 205
секреторные 106—107, 109, 112
структура 42—45
структурные 208—243
трансмембранные 58—61
фибриллярные 44 — 43, 50—52, 210—226
Беспозвоночные 13, 73, 77, 85
Бикарбонат 151 —152
Биодеградация 92 — 93
Биосинтез 31—32, 136—162. См. также
Специфические вещества
двухступенчатые процессы 150—157
одноступенчатые— 145—150
трехступенчатые— 157—159
Биотин 157, 161
Биохимия, развитие 16, 20, 22 — 29
Биоэлектричество 62
Биоэнергетика 32, 60—62. См. Энергетика
Бислои см. Липидные бислои
Болезни. См также Иммунная система: Инфекции
генетические нарушения 86, 183, 201
лизосомно-индуцированные 88—92
паразитические 207
передающиеся половым путем 205
Болезнь Помпа 87
— Тэй-Сакса 72
— Ходжкииа 46
— Цельвегера 201
Чага 207
Болезнь накопления гликогена 87
Брожение 122-123, 128-130, 186—187
энергетика 169—172
Вакуоли 103. См. также Конденсирующие вакуоли;
Вакуоли хранения 73
Вакуолизация 90 — 91
Вакуом 32, 109 - 114
Вакцинация 63
Валиномицин 181
Ван-дер-Ваальса силы 44
Везикулы 32, 103, 114, 118. См. также Эндосомы
искусственные 54—57
окантованные (окаймленные) 66 — 68, 238, 239,
241
эндоцитарные 67 — 74
Везикулярный транспорт 71—74, 77, 104, 106—107,
109-111, 241, 243
Винбластин 228
Винкулин 215
Вирусы. См. также Бактериофаги
защита от 63
механизм инвазии 117—118
размеры 15—16
размножение 16
Витальная окраска 90
Витамины
А 188
В, (тиамин) 149
В2 (рибофлавин) 174
С (аскорбиновая кислота) 175, 176, 179
F (пантотеновая кислота) 158
жирорастворимые 154
фолиевая кислота 157—158
Н (биотин) 157, 161
РР (pellagra preventiva) 124
Внеклеточная жидкость 242
Внеклеточные структуры 36—52
Внутриклеточная среда 61
Вода
как питательное вещество 185
полярная природа 44
при реакциях группового переноса 139, 140
— фотосинтезе 190, 191, 193, 194
скрытая 127—128, 129, 139, 169, 205
Водород газообразный 186
энергия образования 205, 206
Водородная связь 44
Водородные ионы См. Протоны
Водоросли 16 См. также Цианобактерии
гаметы 232
зеленые 191
окаменелость 190
сине-зеленые 190
Волокна См. Белки фибриллярные
Газовая гангрена 205
ГДФ (гуанозиндифосфат) 144, 227
Гексокиназа 149
Гемоглобин 41, 47, 161, 174
переваривание 91
Гемопротеины 174—175, 199
Гемы 41, 45, 174—175 '
Генетика 25
Генетическая система 31, 32, 44, 100
бактериальная 164—165, 182—183
митохондриальная 182—183
хлоропластов 197
Генная инженерия 25, 63
Геодезический купол 237
Гетеротрофы 132
Гетерофагия 77—81
Гидрогеносомы 205—206
Гидроксиапатит 80
Гидроксильный ион 139, 144, 177
Гидроксиметильная группа 158
Гидроксипролин 50
Гидролазы, лозосомальные 77—79, 86—90, 92—95,
104—107, 111
ингибирование 92
Гидролиз 75—77, 136, 137, 139
АТФ 125, 126, 213, 218, 225, 235, 241—242
ГТФ 227
свободная энергия гидролиза 139, 145—147, 148,
151, 158—161
Гидрофильные группы 44, 53—58, 60
Гидрофобные 44, 53-58, 100, 106
Гипофиз 84
Гипофизарные гормоны 94
Гистидин 154
Гликоген 38, 152
Гликогеновые озера 120, 121
Гликозидные связи 77, 139
Гликозилирование 100, 152
Г ликозилфосфат 152
Гликокаликс 52
Гликолиз 123—135, 148
в гликосомах 206—207
гликолитическая змея 126, 128—130
окфос-единица 152, 182, 184—185, 195—197
энергетика 123—135, 169, 170
Гликолипиды 58, 153
Гликопротеины 58, 59, 74, 104, 107
скручивание (свертывание) 77
Гликосомы 206—207
Глиоксилатный цикл 199—201
Глиоксисомы 199, 200, 201
Глицерин 136, 159
Глицин 42, 50, 151, 161
Глутамин 151
Глутаминовая кислота 151, 161, 162
Глутатион 151
Глюкагон 82
Глюкоза 38. См. также Гликолиз
биосинтез 195—197
окисление 169—170
Глюкоза-6-фосфат 197
Глюкозильные единицы 152
Глюконеогенез 135, 184
ГМФ (гуанозинмонофосфат) 144, 155
Голодание 84
Гомоцистеин 162
Гормоны 59, 60, 96, 243
индуцированные светом 230
регуляция 77 — 79, 81, 150
типы 209
Грана 192—194
Гранулы зимогены 103, 105—106
Гранулы — 96, ПО, 119
Грипп 117
Групповые потенциалы 139, 140, 143, 145, 148—149,
150—151, 159—161
перечень 147
Группы крови 62
ГТФ (гуанозинтрифосфат) 155, 227
Гуанин 144, 155
Гуанозин 144. См. также ГДФ, ГМФ, ГТФ
Дальтон (единица массы) 38
Деацилирование 161
Дегидрогеназы 172—175
Дегидрогенизация 127, 128
Дейтерий 23
Декарбоксилирование 149, 152, 161
Десмин 210, 215, 220, 222 — 223
Десмосомы 47, 21 1
Дефекация, клеточная 85—86
Диаминобензидин 202 — 203
Диацитоз 70, 73, 1 10—11 1
Диктиосомы 102—104
Динеин 210, 220, 234, 235
Дисмутация 199
Дифенолы 174
Диффузия 62. См. также Латеральная диффузия
Дисульфидные связи 45, 100, 211
ДНК 81 — 83, 99-100, 158, 228
биосинтез 150, 156
митохондриальная 183
транскрипция 31
Долихилфосфат 153
Долихол 102
Дрожжи
метаболизм 122-123, 126, 201—202
митохондрии 167
мутации 183
ростовой фактор 157
Дыхание
митохондриальное 169- 182
пероксисомальное 198—199
регуляторные механизмы 180—184
эволюция 164—165, 172, 190-191, 198—199
Жгутиковые 231 —236
Железо
ион 132
в белках 77, 120—121, 174, 175, 194
Железы
кринофагия 84
механизм секреции 106, 110
типы 94
Жизнь, происхождение 185—186. См. также Ацили-
рование
Жирные кислоты 54, 136, 158, 159, 169
метаболизм 161, 170—171, 176
синтез 154, 161
Жиры 20
метаболизм '77
превращение в углеводы 199, 201
Заболевания с генетическими дефектами 86
Закисление
лизосом 78
эндосом 69, 70
Застегивание, молекулярное (типа молнии) 68
Зимогены (проферменты) 96, 105
Изопентенилпирофосфат 154
Изопреновая группа 154
Изотопы 23, 25
методы мечения 24, 25, 81, 128, 140, 195
Иммунная система 62-64, 68, 78
дефекты 64
ускользание 63, 90
Иммуноглобулины 63, 96, 97. См. также Антитела
Иммунофлуоресценция 208 — 209
Ингибирование, метаболическое 91—92, 181
Инсулин 95
Инфекция, механизмы 38—39, 90
Ионофоры 62
Калориметрия 170
Кальмодулин 240
Кальций
ионы, транспорт 62, 107, 181, 242
как активатор молекул 218, 223 — 225, 227, 232,
242—243
Капилляры 48, 51, 95
Карбамат 152
Карбамоилфосфатсинтетаза 152
Карбоксибиотин 157
Карбоксилаза 157
Карбоксильная группа 54, 161
Карбоксилфосфат 152, 157
Карбоновые кислоты 127, 158
Каротин 188, 193
Каротиноиды 154
Каскадные реакции 96 — 97, 133, 242-243
Катаболизм 123, 124, 134, 135, 144, 185
Каталаза 164, 199, 200, 201
Каталитический процесс 40
Катепсины 105
Кератин 209, 210, 212, 213—217
а-кетокислоты 152
р-кетоацил-АПБ 161
Киназы (фосфокиназы) 179, 242
Кинетосома 233, 234, 235. См. также Базальнос
тельце
Кислород
атмосферный 121-123, 128, 164, 190
реакции группового переноса 139 144
транспорт, в крови 47, 173—174
фотосинтез 190, 195
электронный акцептор 128, 132 135, 164, 169
172, 173—175, 199-200
Кислотность
адаптация к 187
эффекты 69, 86, 92, 105, 1 10- 1 13, 168
Кислоты 77, 80. См. также Специфические кислоты
Клатрин 71, 210, 219, 237—242
Клетки
адаптация 86
взаимодействие с окружающей средой 59 — 62
движение 32, 209-210, 218-219
картирование 31, 34, 110, 115
киллинг 96
кластеризация (группировка) 13, 39—40, 47 — 48
культивирование in vitro 21
механизмы импорта 74, 109—110
— питания 74
— репродукции 149
— экспорта 93—113
названия 19
нарушение пищеварения 86 — 89
поверхность 53-64
размеры 14—15
рост 114
секреторные продукты 94—97, 105
типы 13
фракционирование 28, 27
Клетки печени 98, 120—121
аутофагия 81, 82
биосинтез 94, 100, 135
механизмы питания 73—74
микротельца в 119, 198—201
пораженные 87
Клеточная теория 20, 21
Клешевина, боб 73
Клоны 63, 64
Клостридия 203-204
Ковалентные связи 45
Кожа 50, 210—212
Коллаген 49, 50—52, 95
переваривание 87
структура 50, 51
тип IV 51, 52
Коллагеназа 94, 95
Колхицин 228
Комплемент 63, 96
Конденсирующие вакуоли 103, 106, 108, 110
Конканавалин А 81
Концентрация
и химический потенциал 137—139
градиент концентраций 60—62
Корни 37
Костный мозг 62, 79, 106
Кость
минерализация 51
разрушение 80, 95
строение 80, 95
Кофакторы см. Коферменты
Коферменты 124, 125, 149, 158, 159, 169, 172 — 174,
183
Кофермент А (КоА) 150, 158—159, 161, 162
KoQ (убихинон) 175
синтез 149—150
Краски: лизосомотропизм 89
Крахмал 38
запасание (хранение) 119
Креатинфосфат 148
Кринофагия 84, 85, 106, 109, ПО
Кристы 167—168, 172—173, 192
Кровеносные сосуды 46 — 50, 52, 73, 95
Кровь. См. также Белки плазмы, Лейкоциты,
Эритроциты
свертывание 96,97
транспортная функция 51, 59, 62, 85, 95
Кругооборот
клеточный 80—85
молекулярный 109—111
Ксантофиллы 193
Кулоновские силы 43 44
Ламинин 52
Латекс 154
Латеральная диффузия 62
Легкие
очищение 77 — 79
Лейкоциты 13, 46, 47, 95
полиморфноядерные 105—107
фагоцитоз 39, 63, 68, 78
хемотаксис 48
Лейцин 26
Лекарства
лизосомотропные 89—91
нацеленность 91
Лигазы 142, 150, 156, 157
Лиганды 58—61, 67 — 70, 112, 242
Лигнин 38
Лизис 136—137. См. также Гидролиз, Гликолиз,
Переваривание
Лизосомы 32, 70 — 71, 73—95, 103, 109—111, 180.
См. также Гидролазы
лизосомальное пространство, концепция 75 — 78
перегрузка 85—90, 92, 93
функции 78, 90, 112
Лизосомотропизм 89—91
Лизоцим 41, 106, 112
Лимфатические узлы 62
Лимфоидные бляшки 62
Лимфоциты
механизм действия 63—64
Липидные бислои 53—58
подвижность, текучесть 57—58, 67
слияние и разделение 58, 71
состав 97, 99, 104, 106
Липиды 136, 159
метаболизм 77,200, 201
хранение 121, 200 — 201
Липосомы 54 — 57
Липофильные вещества 91
Липофусцин 85
Литотрофы 184
ЛММ (легкий меромиозин) см. Меромиозин
Магний, в хлорофилле 174, 188
Макромолекулы 20, 38, 77, 120
Макрофаги 66, 75—76, 78, 109—111
Малонил-АПБ 161
—КоА 161
Малярия 91—92
Манноза-6-фосфат 105—106
Масла 154
хранение 119
Масс-спектрограф 25, 128, 140, 193
Медь в металлопротеинах 174, 199
Мезенхимальные клетки 210
Меланосомы 119
Мембранный потенциал 62
Мембранные пэтчи (участки) 67—74, 92—93,
104—105, 112
Мембранного тока теория 109—111
Мембраны. См. также Белки, Плазмалемма
биосинтез 107—108
внутриклеточные 32
гидрофобные участки 44
лизосомальные 77, 84, 85, 88—91, 180
митохондриальные 164—165, 168, 172, 174, 175,
180, 182, 193
мышечные 223
рециклирование 32, 69—74, 78, 92—93, 109—113
структура 53—58
хлоропластов 192—195, 197
цис- и rpawc-слияния 71—72, 75—78, 82, 86
цитозольная поверхность 142
эволюция 114
экзоплазматические 109—113
эндоплазматические 97, 99
эндосомальные 180
ядерные 31
Меромиозин 216—217
Мессенджер РНК (информационная) 99, 120
Мессенджеры (переносчики)
ацетилхолин 94, 105—106
гормоны 59—60, 94—95
цАМФ 242
Метаболизм 32, 121 —123. ,Сж. также Специфические
вещества, Процессы
эволюция 121 — 122, 126—127, 199—201
Металлопротеины 77—79, 120—121, 174, 175,
192—193, 198—199
Метанол
донор электронов 199
метаболизм 162, 201—204
Метениловая группа 158
Метеновые мостики 174
Метиламин 161
Метиленовая группа 158
Метиленовый синий 175
Метилирование 162
Метилтетрагидрофолат 162
Метильная группа 158
Метионин 162
Метод замораживания — травления 219, 235, 238, 240
Микробы. См. также Бактерии; Вирусы
анаэробные 122
защита против 63
инфекционные 38—39, 181
окаменелости 122
Микроворсинки 53, 54, 60, 114, 202, 203, 212, 219
Микропероксиеомы 200—203
Микроскоп, развитие 18—20
Микротельца 32, 198-207
Микротрабекулы 241
Микротрубочки 210, 220, 225—236, 242-243
Миоглобин 41, 45
Миндалины 62
Минеральные соли 36, 51—52
Миозин 215, 216—226, 235, 242
как реагент 217 — 218
Миофибриллы 52, 210, 220, 222—226
Митогенный ответ 63
Митоз 31
Митотическое веретено 228
Митохондрии 32, 82, 98, 109, 118, 119, 167, 168, 192,
193, 198, 223, 228
белки 24 — 25
окфос-единицы 131, 132
происхождение 114, 164—165, 168-169, 183
рост и размножение 182—183
структура 165—169, 172-174
энергетика 62, 169—182, 197, 242
Мицеллы 54—55
Мозг
гематоэнцефалический барьер 52
клетки, кругооборот 85
Мокрота 77
Молекулярная биология 25
последовательность 164
Молекулярный транспорт 60 — 62
Молочная кислота
продукция 122, 123, 125, 126, 129, 130, 172
электронный донор 199
Монойодуксусная кислота 125
Мономеры 38
Мононуклеотиды 136, 154
Монослои 54—55
Моноциты 66
Морфология, микроскопическая: развитие 18—22, 29
Мочевина 151
Мукополисахариды 160
Мультивезикулярные тельца 81—82, 84
Муравьиная кислота 199
производные 157
Мутации 183, 197, 209
Мыльный пузырь 53—58
Мышцы
гладкие 225
метаболизм 125, 148
поперечнополосатые 13, 213-214, 221—226, 241
регуляция сокращения 213—214, 223—226
рост 58
структура 212 — 226
Z-линия 220, 222
НАД (никотинамидадениндинуклеотид) 124, 150, 171
НАД+ 128—135, 169, 176, 179, 188, 189
НАДН 128 135, 170, 175, 176, 185, 188, 189, 197
НАДФ (никотинамидадениндинуклеотидфосфат) 135,
150, 185, 196, 197
НАДФ+ 189, 194, 195
НАДФН 185, 189, 190, 194—197
Насекомые
летательные мышцы 242
яйцеклетки 73
Насосы, транспорт 62, 113
в слизистых клетках 85
натрий-калиевый 62, 136
протонный 69, 70, 77, 78, 91, 112, 117, 172,
177-181, 187, 193
Натриевый ион, транспорт 60, 62, 181
Нейрофиламенты 210
Нервная система 13, 40
Нервные импульсы 242
клетки 13, 102, 230—231
Нитратный ион 132, 184
Носители
ионов кальция 181
при групповом переносе 140-143, 148 150 I ")'>
153, 156-159
электронов 172-177, 193 195
Нуклеиновые кислоты 20, 136
биосинтез 142
метилирование 162
переваривание 77
спаривание оснований 44
Нуклеозиды 42, 144 163
перечень 144
Нуклеоиды 198
Нуклеокапсиды 117- 118
Нуклеоплазма 31
Нуклеотиды 144
Нуклеофильная атака 138, 139, 145, 159, 160
Область ГКРЛ 111
Окаймленные углубления 67, 68, 219, 238, 240, 241
Окисление 152
анаэробное 127
свободная энергия 170, 175, 176, 196, 197
энергетика 169—182
Окислительно-восстановительные реакции 127—130
Окислительно-восстановительный потенциал 129, 134
Окись углерода 186
Оксидаза мочевой кислоты 199
Оксидазы, тип II 198
Окфос-единицы 130 135, 136, 145, 147, 148 152
164, 165, 172, 175 -176
субстратный уровень 152, 153, 159, 169, 170, 171.
182, 200, 205
у аутотрофов 177 182, 184 197
Олигомицин 180
Олигосахариды 58, 100, 104, 108, 116 -
Опсонин 68, 88, 107
Органеллы 31, 32, 70, 165, 191, 219, 231 235
Осмотрофы 79
Основное вещество 52
Остеобласты 80, 94
Остеокласты 80, 95
Отравление
актиновых нитей 212, 215
мышц 125
Пальмитиновая кислота 170
Панкреатические клетки (клетки поджелудочной
железы) 13, 26, 103, 168
Панкреатический сок 95
Пантотеновая кислота 158
Папаин 215
Пеллагра 124
Пенициллин 39, 181
Пентозофосфатные пути 196
Пентозы 144
Пепсин 42
Пептидные связи 42, 44, 77, 139
— цепочки 43, 63, 211, 214, 217, 225
биосинтез 97—100, 120, 158
в мембранах 58
скручивание (сворачивание) 41, 43, 44, 58, 100
структура 43—45, 50 — 52
Перекись водорода 166, 198—200
Перекрестные связи, химические 38, 51, 67, 68
Перенос возбуждения 192
Пермеазы 61, 78, 112
Пероксисомы 24, 32, 119-120, 180—187
Пигмент старения (липофусцин) 85
Пигменты 85, 1 19
гранулы 230, 231
дыхательные 174-175
зрительные 188
фотосинтетические 193, 194
Пиносомы 67
Пиноцитоз 65, 67, 69
Пиримидины 144
синтез 152, 153
Пировиноградная кислота 123
окисление 169, 170, 205, 206
Пирофосфат 146, 147, 149, 153
Пирофосфатазы 145, 146, 149, 150, 154, 162
Пирофосфатная связь 144
Пиррольные кольца 174, 188, 193
Пищеварение (переваривание) 76—77
внеклеточное 114
внутриклеточное 71, 75—93, 114
желудочно-кишечное 77, 85, 94
эволюция 114
Плазмалемма 30, 32, 53—54, 104, 106, 192
бактериальная 113, 164, 166
белки 58—59, 111
вирусы, действие 117, 118
деполяризация 242
инвагинация 66, 67, 72, 89, 112—114
молекулярный транспорт через 60—62
Т-система 242
участки прикрепления 211, 215, 218-219, 223
Плазмалогены 200
Плазматическая мембрана, см. Плязмалемма
Плазматические белки 94, 95, 100
— клетки 62, 96
Пластинки 51, 235
Пластинчатые выросты, ламеллоподии 218
Плесень 33, 181, 200
Поверхностный слой см. Гликокаликс
Подагра 88
Полимеризация
структурных белков 212, 213, 225, 237, 242
Полимеры 38, 78, 185
Полипептиды см. Пептидные цепочки
Полисахариды 20, 35, 52, 120. См. также Олиго-
сахариды
биосинтез 136, 153, 155
переваривание 77
Полисомы (полирибосомы) 97—100, 118. См. также
Рибосомы
бактериальные 112, 114
цитоплазматнческие 120, 203
Полярные группы 43-44
Порфириновое кольцо 174, 188
синтез 161, 162
Почки
болезни 86
канальцевые клетки 13, 61
микротельца в ПО, 198, 199, 201
реабсорбция 80
Предшественники, биосинтетические 36, 51, 94,
96—97, 105, 154
Пробка 18, 19, 36
Пролин 42, 50
Прокариоты 16, 112. См. также Бактерии
Проколлаген 51, 94, 96
Простейшие 166, 228, 231, 233, 238
механизм питания 73, 79
микротельца 200, 201, 205 — 207
разгрузка лизосом 85
Протеаза 94, 105
Протеогликаны 49, 52, 94 — 95
Протеолиз 77, 96, 97, 100, 217
Протондвижущая сила 177—182, 187
Протонные ловушки 89—91, 179—180
Протонный потенциал 177-180, 192-193
Протоны
как электронные акцепторы 133, 205
перенос 138
транспорт 62, 69, 177
Протопласты 113
Протофиламенты 227 — 231
Протромбин 97
Проферменты см. Зимогены
Псевдоподии 53
Пурины 20, 144
катаболизм 200
синтез 155, 158
электронный донор 199
Разность потенциалов (электрическая) 128—130, 133,
175, 177—180, 184. См. также Мембранный
потенциал. Окислительно-восстановительный (ре-
докс-) потенциал. Электронный потенциал.
Протонный потенциал
Раковые клетки 63
выявление лимфоцитами 63
инвазия 95
нацеливание лекарств 91
размножение 149
Растения
внеклеточные структуры в 36—38
• клетки 119, 200—203
метаболизм 135, 184—197
организация 13—16
Реакции ацетилирования 158
— восстановления 128—130, 147, 184, 190, 195—197.
См. также
электронный перенос
— группового переноса 137—163
— последовательные 139—143
— карбоксилирования 157, 161, 162
— конденсации
дегидратация 125, 127, 136—137, 139—140,
150—151
окисление 152
— окисления 128
Реакция аминирования 160—162
Ревматоидный артрит 88
Регуляторные механизмы
— для гормонов 79, 85, 150
— ферментов 150
при дыхании 181—182
— клеточном делении 149
— мышечном сокращении 213, 223—226
— секреции 96
— транспорте кальция 181
фосфокиназы 149, 242
электронный поток 195—197
Реснички 43, 210, 232—236, 242
Рецепторы 58—61, 91—93. См. также Эндоцитоз,
опосредованный
рецепторами
для ацетилхолина 58, 105
■— лизосомальных ферментов 80, 104—105
кластеризация 67—68, 112
кругооборот (рециклирование) 70, 73, 104—106
на лейкоцитах 63, 68
— лимфоцитах 63
регуляторная роль 78
Рецептосомы 70
Рибоза 144
Рибосомы 32, 82, 97— 99, 106, 112, 114, 120—121, 142.
См. также Полисомы
бактериальные 182
митохондриальные 197—198
связанные 112
цитоплазматические 106, 107, 120—124, 197—198
Рибофлавин 174
Рибулозо-1,5-дифосфат 195, 196
Рибулозо-1,5-дифосфаткарбоксила:*а 195, 196
Рибулозо-5-фосфат 196
РНК
биосинтез 150
переносчик 99
Роговой слой 211
Родопсин 188
«Рост с головы» 154—155, 158, 161
— с хвоста» 152, 155
Саркомер 222—223, 242
Саркоплазматический ретикулум 242
Сахара 20, 58, 60. См. также Гликолиз, Олигосаха-
риды, Специфические сахара, Полисахариды
Сахариды см. Олигосахариды, Полисахариды
Свет, энергия 192. См. также Фотосинтез и секреция
гормонов
Связи химические: высоко- и низкоэнергетическис
137. См. также Типы специфических связей
Связки 51
Секреторные гранулы 84, 85, 103, 105, ПО
Секреция 94—114
нарушения 105
типы 96, 105
Селезенка 62
Сера
в белках 174, 194
как питательное вещество 184, 187
при биосинтезе 162
Серные бактерии 190
Силикоз 90
Синтетаза см. Лигазы
Синцитиум 223
Системы сопряженных реакций 125, 130—131
в митохондриях 175—182
при биосинтезе 137—143, 144—163
— гликолизе 123—135
Сканирующий электронный микроскоп 53
Слизистые клетки 53, 60, 85
Слияние и разделение ограниченных мембраной
структур 71—74, 75—78, 82, 86, 95
Слюна 95
Соединительная ткань 80, 94
Сонная болезнь 207
Спектрин 215
Сперматозоид 18, 232
СПИД (синдром приобретенного иммунологического
дефицита) 64
Спиральные структуры 44, 45, 50, 58, 211, 212, 213,
227 — 229
Старение клеточное 85
Стволовые клетки 105—107, 210
Стероиды 95, 154
Стрептомицин 163
Сукцинил-КоА 161, 163
Сульфатный ион как электронный акцептор 131 —132
Сульфолипиды 158—159
Сульфурилирование 158—159
Супероксиддисмутаза 164
Суиерскрученные спирали 44, 211, 214, 217
Сухожилия 51
Сфингомиелин 111
Табак 203
Темновые реакции фотосинтеза 195—197
Температура
и организация микротрубочек 228
— текучесть липидных бислоев 57
— электронный потенциал 134
Теория панспермии 186
— преформации 18
Термиты 166
Термоацидофилы 187
Терпеноиды 154
Тетрагидрофолат (ТГФ) 157—158
Тетрапирролы 174, 188, 193
Тиаминпирофосфат (ТПФ) 151
Тилакоиды 192—196
Тимин 158
Тимус 62
Тиобактерии 187
Тиолиз 161
Тиоловая группа 159
Тиометильная группа 162
Тиоэфиры (серные эфиры) 152, 159, 161
Тиреоглобулин 80
Тироксин 95
биосинтез 80
Ткани 13, 47—48, 51—52, 94
ТММ см. Меромиозин 216-217
Токсины мембранорастворимые 117
Тонофиламенты 47
Трабекулы 80
Трансаденозилирование 162, 163
Трансаминирование 162
Транснуклеотидилирование 150
Транспирофосфорилирование 148, 149
Транспортная РНК (тРНК) 150, 158
Транспортные механизмы 32, 136—137, 231. См.
также Везикулярный перенос, Молекулярный
транспорт, Насосы, Пермеазы, Фагоцитоз,
Секреция, Экзоцитоз, Эндоцитоз
Транстиолирование 159
Трансферазы
групповые 136—137
электронные 128, 136—137
Трансформация зольгеля 121
Трансфосфорилирование 144—163
Трансцитоз см. Диацитоз
Трипсин 217
Триптофан 154
Трискелион 239
Тритий 24—25
Трифосфат неорганический 160
Трихомонады 205
Тромбин 97
Тропоколлаген 50—51, 96, 211
Тропомиозин 213—217, 223—225, 241
Тропонин 213, 223—225, 241, 242
Трупное окоченение 225
Туберкулезная палочка 75, 90
Тубулин 225—235
Убихинон (KoQ) 175
Углеводы 136. См. также Специфические углеводы,
превращение в жиры 197
Углекислый газ (двуокись углерода) 47
как питательное вещество 184
— электронный акцептор 131 — 132
продукция 205
фиксация 195
УДФ (уридинфосфат) 127, 152—153
Уксусная кислота 205
УМФ (уридинмонофосфат) 127
Урацил 127
Уридин 127. См. также УДФ, УМФ, УТФ
УТФ (уридинтрифосфат) 127
Фагосомы 67
Фаготрофы 77—79
Фагоцитоз 65—68, 69, 109—111
Фагоциты 65, 106—107, 190, 191
и эволюция 112, 114, 164—165, 168, 200. 205-206
ФАД (флавинадениндинуклеотид) 150, 169—170, 171,'
175
ФАДН2 169—170, 176
Ферменты 40, 48. См. также Специфические
ферменты и типы ферментов
активация 242
биосинтез 94, 96
лизосомальные 78, 80, 96, 104—107
литические 94—95, 96
мембранорастворимые 117
митохондриальные 169, 170
мультиферментный комплекс 158
пероксимальные 199—200, 202 — 203
специфичность 124, 125, 137
устойчивые к пищеварению 86
Ферредоксин 194
Ферритин 119—121
Феррицианид 175
Фибриллы см. Миофибриллы
Фибрин, биосинтез 97
Фибринолизин 97
Фибробласты 80, 94—96, 219
Фибронектин 52
Фикобилины 193
Филаменты 210—211, 212—226
Филоподии 219
Фильтры молекулярные 52
Флавины 174. См. также ФАД
Флавопротеины 175, 192, 198
Флуоресценция 193
ФМН (флавинмононуклеотид) 174
Фолиевая кислота 158
Формилтрансфераза 158
Формилфосфат 157 •
Формиминовые группы 158
Фосфагены 148
Фосфат неорганический 125—137, 177, 218, 228
Фосфатидные кислоты 156
Фосфоаденилилсульфат 160
Фосфоглицериновая кислота 127, 195, 196
Фосфоглицериновый альдегид 127 129, 134, 195
196
Фосфолипиды 53—58, 60, 77, 97 — 99, 106—107,
109-111, 158, 159
биосинтез 156, 200
5-фосфорибоза 154
Фосфорибозилпирофосфат (ФРПФ) 154
Фосфорилирование 104, 144 — 145, 160, 242. См.
также Окфос-единица, Трансфосфорилирование
окислительно-восстановительное 125—135
циклическое 188—191, 195
Фосфорилхолин 156
Фосфорилэтаноламин 156
Фосфоролиз 148
Фосфотунгстат калия 172
Фотодыхание (световое дыхание) 185
Фотосинтез 164, 188—197, 201
реакции 193—197
Фотосистема I 189—191, 195
- II 164, 189—191, 195—196
Фототрофия 189—191
Фотофосфорилирование 188—190, 195
Фотоэлектрические единицы 188—190, 193—197
Хамелеон 231
Хемиосмотическая теория 177—182
Хемолитотрофия 187—189
Хемотаксис 218—219
Хиноны 154, 175, 192
Хлорамфеникол 183
Хлороквин 90, 91
Хлоропласты 14, 32, 119, 203
метаболизм 62, 130—131, 193-197
происхождение 119, 165, 191
рост и размножение 197
структура 192—193
Хлорофилл 161, 174, 188, 193
комплексы белково-хлорофилловые 193
Холестерин 57, 79, 99, 104-107, ПО, 200
Хондриом 109
Хондробласты 93
Хроматин 31
Хроматография 23 — 25, 195
Хроматофоры 230, 231
Хромосомы 31, 142
Хрящ 52, 94
ЦДФ (циклический дифосфат) 11, 153
Целлюлоза 36—38, 79
Центральный восстановительный механизм 136,
145—149
Центриоли 228, 235
Центрифугирование 27, 28
Цианобактерия 190, 191, 195, 196
Цикл Кельвина 195—196, 201
— Кребса 169, 175-176, 182, 199
Циклический АМФ 150, 242
Циклогексимид 183
ЦМФ (цитидинмонофосфат) 144, 156
Цистеин 45, 151
Цистерны 97—99
Цитидин 127. См. также ЦДФ, ЦМФ, ЦТФ
Цитозин 144
Цитозоль 21—32, 69, 70, 112, 119. См. также
Цитоплазма
архитектура 121
метаболизм 106, 136—163
уровень кальция 242
Цитология, развите 18—28
Цитоплазма 30, 31—32, 82, 100. См. также Цитозоль
метаболизм 77, 85, 181 — 183
описание 117—121
Цитоплазматические гранулы 107
Цитоскелет 31, 70, 112, 121, 208—243
Цитохалазин В 214
Цитохромоксидаза 175, 183
Цитохромы 161, 174, 194
и 175
Ьъ 169
с 175
ЦТФ (цитидинтрифосфат) 144, 156
Щелевые контакты 47—48
Щитовидная железа 80
Эволюция 15—18, 40, 73, 86, 242
аэробы 164—165, 172, 190, 200
аутотрофия 187—188
аутофагия 84
бактерия 186—188, 205
конвергентная 165
лизосомы 80, 92
метаболизм 121 — 122, 127—128, 200
микротельца 201—202, 203, 205—207
микротрубочки 225—227
митохондрии 165- 169, 183
фототрофия 190—191
эукариоты 112—114, 228
Экзергонические реакции . 125, 135, 142—143, 150—
152, 159, 161
Экзотоксины 90
Экзоферменты 112—114
Экзоцитоз 32, 72, 73, 85—86, 94, 95, 104—106, 108.
242
Эластин 52
Электричество: производимая работа 128—129
Электронная микроскопия 97, 210, 241
развитие 22 >
Электронный перенос 126—135, 145—146
акцепторы 128, 130, 131 133, 193—194, 199
в митохондрии 169 182
водопадный механизм 197
обратимый 135, 179—180, 195
при гликолизе 127—131
у аутотрофов 184—196
— потенциал 133—135, 138—139, 170, 176, 194—195
Электроны
дестабилизация 193
фотоактивация 188—190, 193—194
Электрофильная атака 138—139
Электрофорез 24, 26
Эндергонические реакции 125, 138—139
Эндоплазматический ретикулум 82, 97—102, 107 —
114, 169, 203, 242
гладкий 24, 32, 98, 103
трубчатые соединения 120, 121
шероховатый 24—26, 32, 98, 100, 103, 112,
120—121
Эндосимбионтная гипотеза 164—165, 169, 183.
190—191, 192, 197, 203—205, 207
Эндосомы 32, 67, 70, 73, 104, 110—111, 112
вирусы 118
протонная ловушка 91, 180
Эндотелиальные клетки 47, 73
Эндотоксин 90
Эндоцитоз 32, 65—71, 78, 91, 96, 228. См. также
Пиноцитоз, Фагоцитоз
опосредованный рецепторами 63—70, 110, 236—
241
роль 73
Энергетика 32, 60 — 62, 121 — 123
биосинтез (групповой** перенос), 137—163
гликолиз 123—163, 169, 171 — 172
митохондриальное окисление 169—182
молекулярный транспорт 60—62
образование водорода 205
фотосинтез 193—197
Эпинефрин 95
Эпителиальные клетки: дифференцировка 210—212
Эритроциты 13, 46, 47
фагоцитоз 66
Этанол
как электронный донор 199
продукция 122, 123, 125, 130, 131, 172
Эукариоты 15
происхождение 112—114
размеры 16
Эфирная связь 77
Эфиры 139, 159
Ядро 30, 31, 76, 119—121, 211
Ядрышки 198
Яйцеклетки 73
Янтарная кислота 176, 179
Янус двуликий (промежуточный) 123—159
Указатель латинских
названий
Cyanophora paradoxa 191
Desuljovibrio desulfuricans 187
Echinosphaerium nucleofilum 228—229
Eobacterium isolatum 122
Halobaclerium halobium 188
Hansenula polymorpha 204
Holocentrus rub us 230, 231
Isuasphaera 122
Paramecium 231
Penicillium notatum 181
Phaseolus vulgaris 37
Phleum pratense 192
Pseudolrichonympha 233
Pyrsonympha 166
Tetrahymena thermophilia 235
Tiobacillus denitrificans 187
Trichomonas vaginalis 206
Trypanosoma brucei 207
Содержание
Предисловие к русскому изданию 5
Предисловие 9
1
Подготовка к путешествию 13
Мир клетки 13
Мир молекул 16
Проблема размеров 16
Четвертое измерение 16
Инструменты и их развитие 17
Фактор личности 27
Маршруты 30
Необходимое снаряжение для подводного
плавания 33
Маршрут 1
Окрестности и клеточная
поверхность; вакуом 35
Внеклеточные структуры.
Знакомство с полисахаридами
и протеинами (белками) 36
Мечта архитектора 36
Немного о белках 39
Клетки крови — наши первые спутники 46
Прохождение сквозь внеклеточные
структуры 48
Поверхность клетки. Знакомство
с мембранами и липидами 53
Крайне подвижная кожа 53
Уроки с мыльным пузырем 54
От бислоев к мембранам: роль белков 58
Поверхностные рецепторы 59
Молекулярный транспорт через
плазматическую мембрану 60
Идентичность и иммунное распознавание 62
Проникновение в клетку: эндоцитоз
и везикулярный транспорт 65
Эндоцитоз 65
Рискованный старт 69
Трюк с комнатой без дверей 71
Роль эндоцитоза 73
Питание клетки: лизосомы и
внутриклеточное пищеварение
(переваривание) 75
Лизосомальное пространство 75
Гетерофагия 77
Аутофагия 82
Очищение лизосом 85
Снабжение лизосом ферментами 86
Пищеварительные расстройства клетки 86
Направление лекарственных веществ
в лизосомы 89
Значение биодеградации 92
Бегство из лизосом 92
Экспортная индустрия клетки:
эндоплазматический ретикулум,
аппарат Гольджи и секреция 94
Каталог веществ 94
Волшебная пряха 97
Процессинг и транспортировка 100
Упаковка и доставка 102
Образование мембраны 107
Замыкание цикла 108
Вакуом 109
Экспорт у прокариотов и происхождение
эукариотических клеток 113
Маршрут £
Цитозоль и цитоплазматические
органеллы 116
Цитозоль: гликолиз, перенос
электронов и восстановление
анаэробной энергии 117
Проникновение сквозь завесу 117
За кулисами 118
Энергия — извечная проблема 121
Гликолиз: производящая энергию
«змея» 123
Горение без доступа воздуха 126
Окфос: золотой энергетический
механизм жизни 130
Поток электронов: обобщенное
представление 133
8
Цитозоль: перенос и биосинтез
групп 136
Движущийся АТФ 136
Групповой перенос: второй золотой
энергетический механизм жизни 137
Знакомство с Янусом, двуликим
посредником 139
Источник энергии группового переноса 144
Дополнительная экскурсия 148
и
Митохондрии: дыхание и аэробное
восстановление энергии 164
«Приручение» кислорода 164
Некоторые анатомические детали 165
Энергетика митохондриального
окисления 169
Фосфорилирующая дыхательная цепь 172
Сила, движущая протоны, — секрет
окфоса 177
Рост и размножение митохондрий 182
10
Хлоропласты: аутотрофия
и фотосинтез 184
Как выжить в безжизненном мире 184
Покорение Солнца 188
Зеленые особняки жизни 192
Темновые реакции 195
Рост и размножение хлоропластов 197
Пероксисомы и другие микротельца 198
Пероксисомы и глиоксисомы 198
Гидрогеносомы 205
Гликосомы 206
12
Цитокости и цитомышцы (кости
и мышцы клетки) 208
Цитоскелет 208
Кератин, материал прочности 210
Актин-миозиновая система 212
Система тубулин — динеин 226
Клатрин 236
Микротрабекулы 241
Кальций и подвижность клеток .241
Источники иллюстраций 243
Предметный указатель 245
Указатель латинских названий 255
Научно-популярное издание
Кристиан де Дюв
ПУТЕШЕСТВИЕ В МИР ЖИВОЙ КЛЕТКИ
Заведующий редакцией В. С. Власенков
Ст. научный редактор И. Я. Хидекель
Мл. научный редактор М. А. Харузина
Художник Ю. С. Урманчиев
Художественный редактор Н. М. Иванов
Технический редактор Т. А. Максимова
Корректор Т. П. Пашковская
ПБ № 6197
Сдано в набор 24.07.86. Подписано к печати 19.03.87.
Формат 70 X 100'/i6. Бумага офсетная № 1
Печать офсетная. Гарнитура литературная.
Объем 8 бум. л. Усл. печ. л. 20,80. Усл. кр.-отт. 79,24.
Уч.-изд. л. 23,61. Изд. № 9/4962. Тираж 50 000 экз.
Зак. 1452. Цена 2 руб. 20 коп.
Издательство «Мир» 129820, ГСП, Москва, И-110,
1-й Рижский пер., 2
Ярославский полиграфкомбинат Союзполиграфпрома
при Государственном комитете СССР по делам
издательств, полиграфии и книжной торговли.
150014, Ярославль, ул. Свободы, 97