Text
И.Н.Семенов
ХИМИЯ: ПОСОБИЕ ДЛЯ ПОСТУПАЮЩИХ В ВУЗ
Л.: Изд-во Ленингр. ун-та, 1989. 224 с.
В отличие от существующих в данном пособии сделан упор на углубленное
повторение основных понятий и законов химии, «узловых» вопросов, от
понимания которых зависит осмысление изучаемого в школе фактического
материала. На небольшом числе примеров показаны главные закономерности
поведения химических систем, общие приемы подхода к их рассмотрению, то, как
свойства вещества определяют его применение. Приводимые вопросы и
упражнения выбраны из тех, которые предлагались на вступительных экзаменах в
химические вузы или использовались автором на Подготовительном отделении
ЛГУ. Как правило, для ответа не нужны громоздкие расчет и — надо лишь
хорошо усвоить основные законы химии.
Предназначено прежде всего для абитуриентов, самостоятельно готовящихся к
экзамену в вуз, но будет полезно также слушателям подготовительных отделений
и курсов.
Оглавление
Предисловие (3). — Роль химии в развитии народного хозяйства
страны (5).
Раздел I. ОБЩАЯ ХИМИЯ
Глава 1. Основные понятия и законы химии 15
§ 1. Предмет химии (15). — § 2. Атомно-молекулярная теория (15).—
§ 3. Химический элемент (19). — § 4. Простое вещество. Аллотропия
(22). — § 5. Сложное вещество. Моль. (23). — § 6. Закон Авогадро
(24) — § 7. Валентность. Степень окисления. Химические формулы
(26) — Упражнения к главе 1 (28).
Глава 2. Химические реакции 31
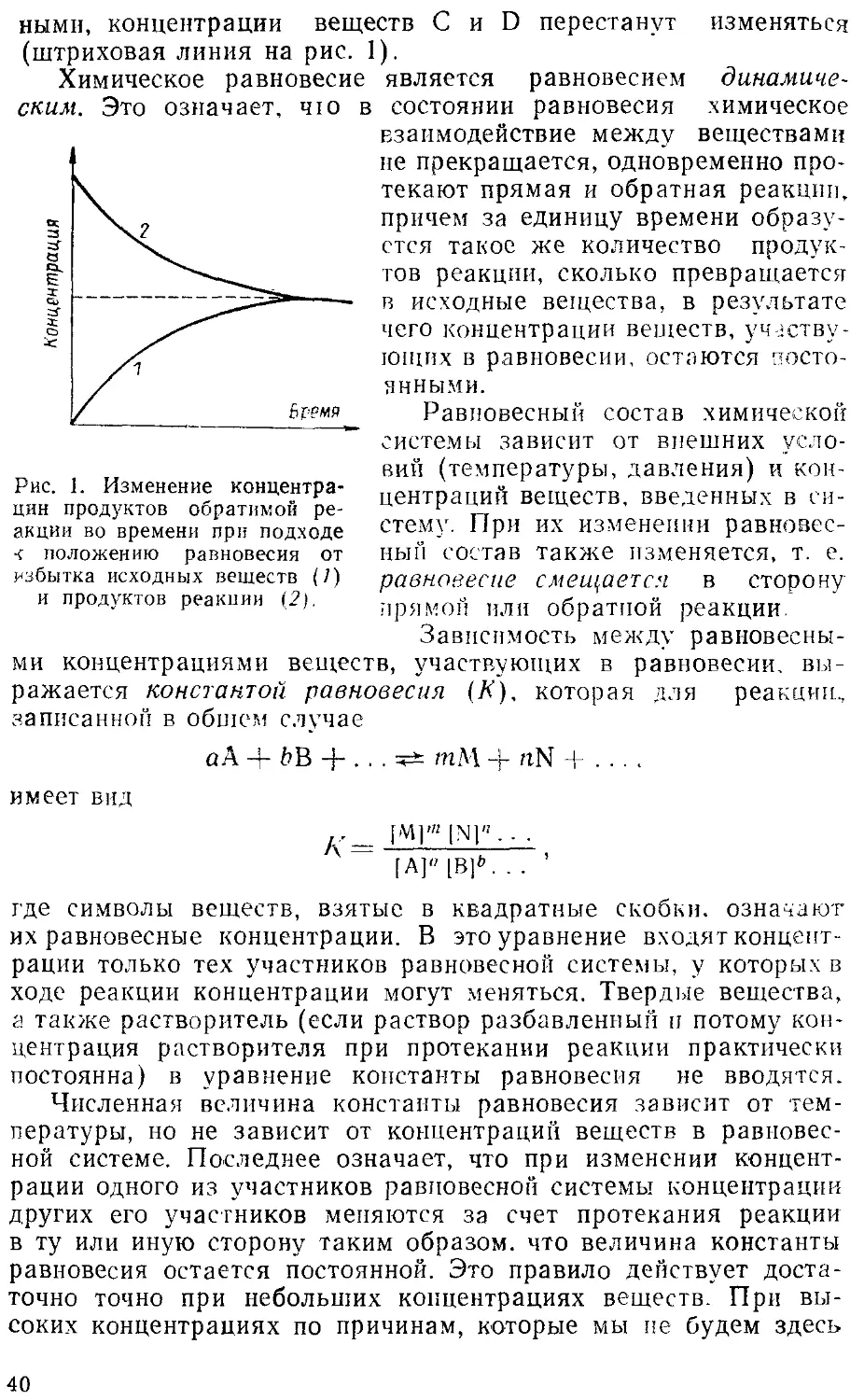
§ 1. Уравнения химических реакций (31). — § 2. Типы химических
реакций (32). — § 3. Химическое равновесие (37). — § 4. Скорость
химических реакций (43). — § 5. Катализ (50). — Упражнения к
главе 2 (55).
Глава 3. Классы неорганических соединений 58
§ 1. Оксиды (58). — § 2. Основания (61). — § 3. Кислоты (62). — § 4.
Амфотерные оксиды и гидроксиды (64). — § 5. Соли (60).— § 6.
Двойные и смешанные соли. Краткие сведения о комплексных
соединениях (70). — § 7. Написание графических формул оксидов,
оснований, кислот и солей (72). — Упражнения к главе 3 (74).
Глава 4. Химия растворов 76
§ 1. Дисперсные системы (76). — § 2. Общая характеристика
растворов (78). — § 3, Сольваты и гидраты (80). — § 4. Тепловые
явления при растворении (82). — §5. Способы выражения
концентрации растворов (82). — § 6. Растворимость и ее зависимость
от внешних условий (84). — § 7. Равновесия в водных растворах
электролитов (87). — § 8. Ионное произведение воды. Водородный
показатель (95). — § 9. Гидролиз солей (97). — § 10. Произведение
растворимости. Условия образования и растворения осадков (100).
— Упражнения к главе 4 (104).
Глава 5. Периодический закон и строение вещества 110
§ 1. Последовательность заполнения электронами энергетических
уровней. Явление периодичности (110). — § 2. Структура
периодической системы (114). — § 3. Элементарные представления о
химической связи (121). — §4. Строение кристаллов (130). —
Упражнения к главе 5 (134).
Глава 6. Окислительно-восстановительные реакции 136
§ 1. Основные понятия (136). — §2. Типы окислительно-
восстановительных реакций (137). — § 3. Типичные окислители и
восстановители (138). — § 4. Составление уравнений окислительно-
восстановительных реакций (139). — § 5. Электролиз (144). —
Упражнения к главе 6 (148).
Раздел II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
Глава 7. Простые вещества 150
§ 1. Металлы и неметаллы (150). — § 2. Окислительно-
восстановительные свойства простых веществ. Ряд напряжений
металлов (158). — § 3. Общие свойства металлов. Сплавы (161). — §
4. Получение металлов из природных соединений (169). — § 5.
Получение неметаллов в виде простых веществ (175).
Глава 8. Соединения элементов главных подгрупп 178
§ 1. Соединения с водородом (178). — §2. Кислородные соединения
(184).
Глава 9. Особенности химии элементов побочных подгрупп 200
§ 1. Общая характеристика элементов (200). — §2. Специфика простых
веществ и соединений, образуемых переходными элементами (205).
Приложение. Задачи и упражнения 211
§ 1. Разбор некоторых задач (211). — § 2. Задачи типа предлагаемых
на конкурсных экзаменах (218). — Ответы к задачам (223).
ПРЕДИСЛОВИЕ
Предлагаемое пособие рассчитано прежде всего на абиту-
риентов, самостоятельно готовящихся к вступительным экза-
менам в вуз, но, безусловно, будет полезным также слушате-
лям подготовительных отделений и курсов.
Главное внимание в пособии уделено общей химии, т. е. ос-
новным понятиям и законам химии. Хорошо усвоив этот раз-
дел, абитуриент сможет более сознательно повторять описа-
тельный материал неорганической и органической химии.
Для объяснения направления химических процессов в посо-
бии используются элементарные представления о химическом
равновесии, на которые, по мнению автора, в недостаточной
степени опираются в школе как на методическое средство при
подаче фактического материала. Так, при повторении химии
растворов с помощью константы равновесия легко объяснить
влияние разбавления иа степень диссоциации электролитов, вы-
падение и растворение осадков и т. д. Автор убежден, что при
изучении химического равновесия можно на первых порах
обойтись без сложного математического аппарата и в то же
время научиться грамотно применять эти представления к хи-
мическим системам, изучаемым в школе, в частности к таким
производственным процессам, как получение моноксида угле-
рода, аммиака и серного ангидрида. Это позволит абитуриенту
избежать механического заучивания фактов из учебника и са-
мостоятельно делать выводы о том, какие условия должны спо-
собствовать сдвигу равновесия в данной системе в нужном на-
правлении.
Пособие ни в коей мере не подменяет повторение химии по
учебникам для средней школы. В нем лишь акцентируются те
моменты, на которые следует обратить особое внимание при
подготовке к экзамену, и более подробно излагаются некоторые
положения общей химии. Это делается для того, чтобы абиту-
риент лучше понял причины тех или иных химических явлений
и в какой-то мере научился их предсказывать.
В соответствии с новой школьной программой по химии в
пособии более подробно рассмотрены такие темы, как элементы
побочных подгрупп, соединения переменного состава, комплек-
сные соединения, металлы и металлургические процессы.
Ограниченный объем книги не позволил подробно изложить
химию отдельных элементов, поэтому неорганическая химия
подается в обобщенном виде, причем основой для обобщения
служит периодическая система: примеры конкретных химиче-
ских систем являются иллюстрацией общих закономерностей и
моделью для самостоятельного рассмотрения аналогичных си-
стем. Вовсе не обязательно запоминать все числа и формулы
веществ, приводимые во втором разделе (если они не входят
3
в материал школьного курса), но надо хорошо усвоить выводы
из этих примеров.
Для закрепления навыков пользования химической номенк-
латурой при чтении уравнений реакций и вообще при устном
ответе следует произносить названия веществ по международ-
ной номенклатуре, а не читать символы элементов и индексы
в формуле (например, «купрум-эс-о-четыре»). Для выработки
этого навыка в пособии широко используются названия ве-
ществ по международной номенклатуре вместо их формул, ес-
ли последние очевидны.
В новой программе по химии для средней школы отдельная
тема (10 учебных часов) посвящена роли химии в развитии на-
родного хозяйства страны. Этот материал кратко рассматрива-
ется в начале книги.
Для лучшего усвоения материала в конце глав 1—-6 при-
водятся упражнения. Их рекомендуется выполнять в том по-
рядке, в каком они даются в книге, так как упражнения рас-
считаны па последовательное закрепление положений каждой
главы и расположены в порядке возрастания их сложности. В
конце пособия приведены задачи, большинство из которых
предлагалось на вступительных экзаменах в вузах Москвы и
Ленинграда. Расчетные задачи по органической химии принци-
пиально не отличаются от расчетных задач по неорганической
химии, есть лишь отличия, связанные со спецификой состава,
строения и свойств органических веществ.
Хочется еще раз обратить внимание на то, что успешно ре-
шать химические задачи возможно лишь при условии твердого
усвоения основных понятий и законов химии. Тот факт, что
эти понятия образуют единую стройную систему, находит от-
ражение в размерности величин, количественно характеризую-
щих эти понятия. Неправильная размерность величин в расче-
тах может привести к цепочке ошибок в решении задачи, и, на-
оборот, проверяя размерность величин, получаемых при расче-
тах, легче найти ошибку в решении задачи. Численные величины
в условиях по возможности подобраны таким образом, чтобы
при решении избегать громоздких вычислений, лишь отвлекаю-
щих от химической сути задачи и логики ее решения.
Если у абитуриента возникнет интерес к химическим зада-
чам, ему можно порекомендовать следующие сборники:
Середа И. П. Конкурсные задачи по химии. Изд. 3-е.
Киев, 1978. 192 с.
Сборник конкурсных задач по химии с решениями /Под
ред. М. А. Володиной. М., 1983. 248 с.
Ефимов А. И., Кар цо в а Л. А., Луцкая И. М. Задачи
по химии. Л., 1986. 120 с.
Автор с благодарностью примет все критические замечания в
адрес книги.
4
РОЛЬ химии
В РАЗВИТИИ НАРОДНОГО ХОЗЯЙСТВА СТРАНЫ
В своей повседневной жизни мы потребляем продукты и
используем материалы, произведенные химической промышлен-
ностью на основании достижений химической науки. Химия да-
ет нам одежду, материалы для постройки жилья, а через ис-
пользование ее в сельском хозяйстве — и пищу. Химия лечит
человека, когда он болеет, улучшает комфорт его быта. Таким
образом, химия активно участвует в обеспечении материальной
базы для удовлетворения самых главных потребностей чело-
века.
С достижениями химии мы иногда соприкасаемся непосред-
ственно— в виде продукции химической промышленности,
иногда косвенно — через производимое другими отраслями про-
мышленности и сельским хозяйством, в которых широко приме-
няется химизация. Химизация производства — это использова-
ние химических свойств вещества в процессе материального про-
изводства, т. е. включение элементов химической технологии в
самые разнообразные производства. Поэтому сфера действия
химизации гораздо шире, нежели только собственно химические
производства (такие, как производство кислот и щелочей, удоб-
рений, синтетических материалов, моющих средств, химических
средств защиты растений и т. д.). В современной технологии хи-
мические методы обработки вещества широко применяются в
металлургии, энергетике, нефтегазовой промышленности, строи-
тельстве, пищевой и других отраслях промышленности.
Химическая технология — это гораздо более мощный спо-
соб приспособления взятого из природы вещества к потребно-
5
стам людей. Она позволяет использовать не одно, а многие
свойства вещества за счет его превращения в продукты с раз-
ными свойствами. Так, в коксохимическом производстве из ка-
менного угля получают кокс, горючие газы и прочие продукты
сухой перегонки, у которых, в свою очередь, эксплуатируются
разные физические и химические свойства. Например, бензол и
его гомологи участвуют в синтезе множества новых веществ
(химические свойства) и используются как растворители (фи-
зические свойства). Даже свойства шлаков (каменноугольного
к металлургического) оказались настолько ценными, что по-
следние находят применение в производстве стройматериалов
и в дорожном строительстве.
Обычно каким-то нужным нам свойством обладает не одно,
а несколько веществ. Например, многие металлы обладают
значительной электропроводностью. Однако на практике мы
выбираем одно или ряд веществ, обладающих данным свойст-
вом. руководствуясь при этом следующими главными требова-
ниями:
1. Выбранное вещество имеет самый оптимальный количе-
ственный показатель, характеризующий нужное нам свойство.
Скажем, из металлов высокую электропроводность имеют се-
ребро. медь, алюминий.
2. Выбранное вещество легко либо добывать в природе, ли-
бо получать искусственно из природного сырья. Давно, напри-
мер. отработана технология производства чистой электротех-
нической меди; в больших количествах производят и алюми-
ний. которого в природе больше, чем меди.
3. Производство выбранного вещества не требует большого
расхода энергии и мало загрязняет отходами окружающую сре-
ду. Изделия из него после использования можно снова превра-
тить в полезную продукцию. Так, из отработанных электротех-
нических изделий вновь извлекают медь, которую используют
как вторичное сырье. Экономия сырья, энергии, труда, а также
охрана окружающей среды — с этим постоянно следует счи-
таться при превращении изъятых из природы веществ в полез-
ную продукцию.
В ходе научно-технической революции в хозяйственный
круговорот включается все большее число веществ, препаратов,
материалов, а также типов воздействия на вещество, его обра-
ботки (высокие давления, сверхнизкие температуры, радиа-
ционное воздействие, а в последнее время — плавка в невесо-
мости и т. д.). Все углубляющаяся химизация производства,
внедрение достижений химии в быт порождают и свои пробле-
мы. Так, на Земле появилось .много химических соединений,
созданных людьми и не характерных для природы. Такие ве-
щества не всегда легко встраиваются в природный круговорот
веществ, поэтому зачастую способность природных экосистем
6
к самоочищению оказывается недостаточной для их перера-
ботки.
Процесс загрязнения окружающей среды нехарактерными
для нее веществами, ранее имевший локальный характер, в
современную эпоху принял глобальные размеры. К примеру,
глобальные масштабы приняло попадание в биосферу значи-
тельных количеств таких несвойственных ей элементов, как
ртуть п свинец. Задача химиков и других специалистов заклю-
чается в том, чтобы создать такие технологии производства, ко-
торые исключали бы попадание вредных веществ в окружаю-
щую среду.
В отношении продукции химической промышленности спе-
циалисты выдвигают требование: ни одно вещество не допу-
скать к использованию в промышленных .масштабах до тех
пор, пока не будет разработана методика его разложения до
продуктов, безвредных для окружающей среды. «Встраивание»
\ц ' ских соединений, являющихся отходами технологиче-
ской деятельности, в тот или иной искусственный круговорот
веществ, с тем чтобы продукты их распада возвращались в ок-
ружающую среду в форме, не мешающей нормальному функ-
ционированию биосферы, — одна из задач, стоящих перед но-
вой областью химии — экохимией.
Когда речь заходит о проблемах, возникающих при химиза-
ции производства, забывают иногда о том, что сама химическая
технология содержит в себе огромные потенциальные возмож-
ность: для охраны среды и ресурсов. Ведь, используя достиже-
ния химии, можно превращать в полезную продукцию не толь-
ко с пециально добытое природное сырье, но и отходыпроизвод-
стза — как химического, так и других. На это обращал внима-
ние еще Д. И. Менделеев, провозвестник широкой химизации
производства, когда писал, что «техника старается снять слив-
ки со всякого рода отбросов и их пустить в оборот, т. е. восполь-
зоваться ими для увеличения количества товаров, выпускаемых
фабриками и заводагми».*
До недавнего времени рост промышленного производства
обеспечивался в основном за счет все возрастающего количест-
ва добываемого природного сырья. При этом лишь малая часть
извлекаемого из недр Земли вещества (1 — 3%) превращалась
в полезную продукцию — остальное составляло разного рода
отходы. В настоящее время перед промышленностью поставлена
задача резко увеличить выход полезной продукции при том же
количестве добытого сырья. В решении этой задачи важная
роль отводится химии. Чем глубже химическая наука познает
свойства вещества, чем больше будет совершенствоваться хи-
мическая технология, тем больше откроется возможностей для
* Менделеев Д. И. Сочинения. В 25 томах. Л.; М., 1937—1954. Т. 21.
С. 441.
применения элементов и их соединений, а тем самым — и для
безотходных и малоотходных производств. Достижения химиче-
ской технологии позволяют исключить отравление воздуха и
воды, создавать экономически приемлемые методы обезврежи-
вания опасных для окружающей среды веществ и возврата от-
ходов в технологический круговорот веществ.
Проблема охраны окружающей среды и проблема природ-
ных ресурсов тесно связаны между собой. Чем полнее перера-
батывается сырье, чем полнее извлекаются из пего нужные нам
вещества, тем меньше остается отходов. В современной техно-
логии находят применение почти все химические элементы, а
список соединений, используемых в народном хозяйстве, бы-
стро растет. Все химические элементы содержатся в природе в
достаточных количествах, чтобы обеспечить развитие цивилиза-
ции на неопределенно долгий срок. Однако степень доступно-
сти минеральных ресурсов разная. По мере совершенствования
химической технологии становится рентабельным извлечение
нужных элементов из все более бедных источников сырья, в
том числе и из отходов и отвалов, из которых извлечение этих
элементов раньше считалось нерентабельным.
Путь к решению проблемы обеспечения сырьем на будущее
лежит через разработку методов более рационального исполь-
зования минеральных ресурсов планеты, замену дефицитных
видов сырья на менее дефицитные, нахождение и освоение но-
вых источников сырья, его комплексное использование, нахож-
дение менее энергоемких способов переработки сырья, утили-
зацию отходов и экологизацию производства.
Одним из источников сырья станет Мировой океан. Океан-
ская вода содержит в сумме 5-1016 т растворенных солей. В
настоящее время из морской воды в значительных количествах
добывается магний. Создание рентабельных способов добычи
из нее других металлов — тоже важная задача для химиков.
Запасы в океане некоторых элементов, используемых в народ-
ном хозяйстве, следующие (в тоннах): магний — 2.1-10’5,
бром — 106-10’2, фтор — 2-Ю12, под — 93-109, цинк—16-10%
олово, медь, уран — 5-109, ванадий, марганец—3-109, сереб-
ро— 0,5-109, свинец, ртуть — 50- 10е, золото — 6-Ю6.
Ценные элементы содержатся также в конкрециях — обра-
зованиях, устилающих в некоторых местах дно океана. Конкре-
ции содержат главным образом марганец и железо, а также
никель, кобальт, медь и др. Общие запасы конкреций оцени-
ваются в 1500 млрд т, причем, по подсчетам ученых, каждый
год образуется 10 млн т новых отложений. Добыча и перера-
ботка конкреций станет в будущем важным источником мар-
ганца, железа и других элементов.
Химии отводится важная роль в осуществлении Энергетиче-
ской программы СССР и вообще в решении проблемы обеспе-
чения человечества энергией в предвидимом будущем. В послед-
8
ние десятилетия интенсивное потребление нефти привело к то-
му, что стало ощущаться истощение наиболее доступных и лег-
ко разрабатываемых ее месторождений, вследствие чего себе-
стоимость добычи нефти неуклонно возрастала, а с нею — и
цены на нефтепродукты. Для дальнейшего развития энергетики
требуется постепенное вытеснение нефти из некоторых сфер ее
применения, замена ее на иные источники энергии. Это камен-
ный уголь, низкокалорийные виды топлива, все большее ис-
пользование ядерных реакторов для производства электроэнер-
гии, а в будущем — для металлургии и теплоснабжения. В пер-
спективе в определенных масштабах будет использоваться так-
же солнечная энергия.
В связи с этим химики вместе со специалистами других об-
ластей знаний разрабатывают процессы подготовки низкока-
лорийных топлив к сжиганию, а также решают проблемы, свя-
занные с охраной окружающей среды при сжигании твердых
топлив. Так, ископаемые угли содержат значительные количе-
ства серы, которая при сгорании топлива может попадать в ат-
мосферу в виде сернистого газа. Работы по созданию экологи-
чески безвредных способов использования твердых видов топ-
лива ведутся совместно учеными ряда стран, входящих в СЭВ.
Разрабатываются экономически рентабельные технологии пере-
работки бурых углей в жидкое и газообразное топливо.
Весьма многообразны задачи, стоящие перед химиками в
области дальнейшего развития ядерпой энергетики. Без сов-
ременной химии, и. в частности, без ее специфической обла-
сти— радиохимии, ядерная энергетика вообще была бы невоз-
можна. Вклад химиков в совершенствование и развитие ядер-
ной энергетики выражается в создании технологии переработки
уранового сырья, а также отработавших тепловыделяющих
элементов, в создании материалов для реакторов, разработке
средств защиты людей и окружающей среды на случай аварий-
ных ситуаций.
Энергия Солнца является важнейшим воспроизводимым ис-
точником энергии на нашей планете. К тому же это самый «чи-
стый» источник энергии, поскольку использование солнечной
энергии не связано с загрязнением окружающей среды СО2 или
продуктами неполного сгорания, золой, радиоактивными изо-
топами и т. д. Небезынтересен тот факт, что одна сотая часть
поверхности Сахары получает примерно столько же энергии
за единицу времени, сколько ее потребляется во всем мире за
то же время. Однако у солнечной энергии есть существенный
недостаток: она рассеяна на большой площади, и ее мощность,
приходящаяся на единицу земной поверхности, невелика. По-
этому пока нет рентабельных способов ее прямого использова-
ния в таких же масштабах, в каких используется ископаемое
топливо или ядерная энергия.
Химики во всем мире разрабатывают материалы и химиче-
9<
ские системы для разного рода преобразователей и накопите-
лей солнечной энергии. Например, широко ведутся работы по
созданию термохимических циклов разложения воды с исполь-
зованием солнечной энергии, по созданию химических накопи-
телен энергии.
Ядерная и солнечная энергетика тесно смыкается с тем пер-
спективным направлением в технике, которое получило назва-
ние водородной энергетики. Водород как горючее имеет то
главное преимущество перед углеводородами, применяемыми в
настоящее время в качестве моторного горючего, что при его
сгорании образуется вода. Тем самым исключается выброс в
атмосферу таких продуктов неполного сгорания углеводородов,
как СО, сажа и др. Получение водорода требует энергетических
затрат. Эту энергию и могли бы давать преобразователи сол-
нечной энергии, а также ядерные электростанции в часы низ-
кой нагрузки. Часть полученного водорода можно было бы ис-
пользовать в химической промышленности, в металлургии, а
также в генераторах тепловых электростанций — уже в часы
пиковых нагрузок.
С помощью водородной энергетики ученые надеются преодо-
леть главную трудность на пути широкого использования энер-
гии Солнца — ее низкую концентрацию на поверхности Земли.
Используя те или иные системы для получения с помощью сол-
нечной энергии водорода, можно было бы таким образом кон-
центрировать и запасать энергию Солнца. Возможно, для этой
цели в будущем станут создавать «водородные плантации», на
которых специально выведенные водоросли будут производить
водород как продукт фотосинтеза. Через водородную энергети-
ку ядерная и солнечная энергетика стали бы косвенно исполь-
зоваться на неэлектрифицированно|М транспорте.
Химическая промышленность и сама является одним из
крупнейших потребителей энергии, поэтому одна из актуаль-
нейших задач сегодняшнего дня — снижение затрат энергии в
химико-технологических процессах. Это достигается путем
уменьшения энергетических потерь, с одной стороны, и исполь-
зозания энергии, выделяющейся при протекании производствен-
ных экзотермических реакций, с другой. Технологические схе-
мы. в которых используется энергия производственных реакций,
получили название химических энерготехнологий.
В энерготехнологических схемах энергетические установки
(котлы-утилизаторы, газовые и паровые турбины) взаимосвяза-
ны с химико-технологическими установками в единую систему,
в которой химические реакторы одновременно, например, вы-
дают пар заданных параметров. Энерготехнологические систе-
мы реализуются прежде всего на базе агрегатов большой мощ-
ности— крупнотоннажных установок для синтеза аммиака,
производства серной кислоты, аммиачной селитры. Уже созда-
ны химические производства, работающие без подвода энер-
го
гии извне. В настоящее время аммиак и азотную кислоту полу-
чают в таких схемах, покрывая затраты энергии за счет энер-
гетического эффекта соответствующих реакций.
Рост населения земного шара делает все более острой проб-
лему производства питания. В решении этой проблемы химия
также призвана сыграть исключительно важную роль.
Наша страна обеспечивает себя необходимым продовольст-
вием. одновременно оказывая помощь другим странам. Задача
состоит в том, чтобы улучшить структуру питания и повысить
в нем долю высококачественных продуктов. Этой цели служит
одобренная майским (1982 г.) Пленумом ЦК КПСС Продо-
вольственная программа СССР на период до 1990 г. Вклад
химии в выполнение Продовольственной программы, повышение
продуктивности сельского хозяйства и пищевой промышленно-
сти осуществляются через совершенствование производства
удобрений, современных средств защиты растений, искусствен-
ных кормов для сельскохозяйственных животных, регуляторов
роста растений и животных, витаминов, медикаментов, средств
для сохранения урожая и консервации пищевых продуктов с
сохранением их питательной ценности.
Пэ общему объему производства минеральных удобрений
СССР вышел на первое место в мире. В настоящее время глав-
но’ задачей в этой области является не только увеличение
количества, ио п повышение качества и эффективности произво-
ди’.олх удобрений, а также создание .менее энергоемких, безот-
ходных способов их производства. Ученые работают над созда-
ние;,.' новых форм удобрений, обеспечивающих растения всеми
нужными им элементами, в том числе микроэлементами, с за-
программированным действием этих удобрений в зависимости
от фаз роста растений, когда потребность в разных элементах
разная. Разрабатываются пути получения бесхлорных удобре-
ний (ион хлора в избытке вреден большинству сельскохозяйст-
венных культур) и фосфорных удобрений бескислотными спо-
соба мп. Внедряется технология производства фосфорных удоб-
рений из шлаков черной металлургии. Этим достигаются сразу
две цели: отходы одного производства становятся сырьем для
другого, а полученные удобрения помимо фосфора содержат
еще известь и микроэлементы, которые тоже нужно вносить в
почву для повышения урожайности.
Мощной отраслью химической промышленности является
производство азотных удобрений. У нас в стране в год произво-
дится около 7 млн т азотных удобрений, на что тратится около
трети всех энергозатрат промышленности, работающей на сель-
ское хозяйство. В то же время клубеньковые бактерии, живу-
щие на корнях бобовых растений, фиксируют атмосферный
азот, переводя его в усвояемую растениями форму за счет
солнечной энергии. При этом соединения азота используются
растением полностью. Они не вымываются из почвы и не при-
11
водят к бурному развитию в водоемах водорослей, как это бы-
вает при использовании обычных минеральных удобрений.
Сейчас ученые, привлекая методы генной инженерии, пытают-
ся вывести азотфиксирующие микроорганизмы, которые могли
бы жить в симбиозе не только с бобовыми растениями. В более
дальней перспективе есть надежда даже ввести гены азотфик-
сации непосредственно в сельскохозяйственные культуры. Это
дало бы огромную экономию сырья и энергии.
В союзе с биологами, используя методы биотехнологии, хи-
мики работают над созданием и внедрением в практику живот-
новодства белковых искусственных кормов для сельскохозяй-
ственных животных. Одна из главных пелен этих исследова-
ний— производить кормовой белок не из углеводородов нефти,
а из менее дефицитного сырья: природного газа, метанола, от-
ходов сельского хозяйства, лесной и пищевой промышленности.
Например, из опилок можно получать биомассу с содержанием
белка до 20%. Важно, что микробиологический синтез позволя-
ет получать белок с высоким содержанием самых ценных (не-
заменимых) аминокислот. Еще одна важная задача, стоящая
перед химиками, — разработка прямых методов синтеза особо
ценных в составе кормов веществ, в частности некоторых ами-
нокислот и витаминов.
Современные химические средства защиты растений — пе-
стициды — включают инсектициды, убивающие вредных насе-
комых, фунгициды — вещества, применяемые для борьбы с
грибковыми заболеваниями растений, гербициды, подавляющие
сорную растительность, и другие препараты. По объему произ-
водства пестицидов Советский Союз стоит на втором месте в
мире. Сейчас усилия исследователей направлены на создание
пестицидов нового поколения, более эффективных и потому по-
требляемых в меньших дозах (десятки граммов на гектар вме-
сто килограммов — как пестициды старшего поколения). Они
обладают более направленным действием и потому менее опас-
ны для людей и сельскохозяйственных животных. Созданы пе-
стициды, разлагающиеся в почве через несколько дней и даже
часов после применения и потому наносящие гораздо меньший
ущерб окружающей среде, нежели применяемые до сих пор.
Для защиты растений от вредителей начинают применяться
феромоны — вещества, ничтожные дозы которых привлекают
насекомых, например самцов определенного вида; их можно
таким образом заманить в ловушки и уничтожить. Другие пре-
параты вносят аномалии в поведение животных, препятствуя их
размножению. Ценность такого рода препаратов заключается
в том, что они действуют избирательно на данный вид вредите-
лей, не трогая полезных насекомых.
Создание и внедрение в практику новых химических средств
защиты растений — задача непростая. Это, как правило, веще-
ства, по сложности структуры сходные с современными фарма-
12
цевТическими препаратами. Их синтез многостадиен. Из огром-
ного количества веществ, предлагаемых в качестве новых пе-
стицидов, к практическому использованию после тщательных
испытаний допускаются лишь единицы. Задачи, стоящие перед
химиками, работающими в этой области, включают разработ-
ку наиболее экономичных методов синтеза как самих пестици-
дов, так и веществ, служащих исходными для их производства,
повышение селективности действия препаратов, уменьшение не-
желательных побочных эффектов от их применения, организа-
цию контроля над их применением.
Химики создают и впредь будут создавать все новые и но-
вые материалы со специфическими свойствами, требующиеся
для самых различных областей науки, техники, быта. В настоя-
щее время большая часть органического синтеза использует в
качестве исходного сырья нефть. В будущем нефть в значи-
тельной степени будет заменена на уголь, в связи с чем наряду
с нефтехимией важное значение приобретает углехимия. Хими-
ки интенсивно трудятся и над созданием новых неорганических
материалов. Уже сейчас изготовлены образцы изделий, в кото-
рых цемент успешно заменяет такой материал, как фарфор. По-
лучен даже цемент, изделия из которого обладают значитель-
ной гибкостью. В большом масштабе в технике применяются
так называемые композиционные материалы (композиты), пред-
ставляющие собой такое сочетание веществ с разными свойст-
вами, при котором образуется новый материал с исключитель-
но ценными техническими качествами. Так, материал, получен-
ный направленной кристаллизацией бора в алюминии( волокна
бора встраиваются в «матрицу» из алюминия), находит приме-
нение там, где требуется высокая прочность в сочетании с лег-
костью, например в авиации.
Роль химической науки, химизации производства и быта,
неуклонно возраставшая в ходе НТР, будет повышаться и в бу-
дущем. Но на данном этапе развития цивилизации появились
и новые задачи, связанные с масштабами химического обмена
веществ между обществом и природой. Еще академик
А. Е. Ферсман писал, что человек геохимически переделывает
мир. В настоящее время производственная деятельность людей
охватывает почти все вещество биосферы, она сильно влияет на
общепланетарный обмен веществ, выходя даже за пределы
земной атмосферы в космос. Этот искусственный обмен веществ
стал по своему объему и геологическим последствиям сравним
с естественными процессами в масштабах планеты.
В связи со столь большими масштабами использования ве-
щества и энергии возникает необходимость перехода химизации
производства на качественно новый уровень, отвечающий за-
кладываемым сейчас основам цивилизации XXI века. В ближай-
шем будущем должен стать объектом сознательного управле-
ния, на научной основе, химизм систем, включающих громад-
13
ные массы вещества: большие водные системы, такие как бас-
сейны больших рек, водохранилищ, даже отдельных морей,
воздушные бассейны целых районов, почвенные системы н т. д.
Столь сложная и многогранная проблема требует для своего
решения усилий самых разных специалистов, занятых в естест-
венных, технических, общественных науках. И, конечно, огром-
ная роль в изучении, контроле и управлении столь большими
массами вещества принадлежит химической науке и химиче-
ской технологии.
Раздел I
ОБЩАЯ ХИМИЯ
Г .1 а в а 1
ОСНОВНЫЕ понятия и законы ХИМИИ
§ 1. предмет химии
Химия изучает вещества и их превращения, явления, сопро-
вождающие эти превращения, и законы, управляющие ими.
Среди веществ, которые нас окружают, следует различать ин-
дивидуальные вещества и смеси. Последние содержат более
одного индивидуального вещества. Каждое индивидуальное ве-
щество характеризуется составом (из каких элементов оно со-
стоит и в каких соотношениях находятся эти элементы), строе-
нием (как атомы этих элементов расположены в пространстве л
связаны между собой) и свойствами, причем свойства вещества
определяются его составом и строением. Различают качест-
венный (из каких элементов) и количественный (в каких соот-
ношениях) состав вещества. Изучение состава, строения и
свойств веществ, как природных, так и созданных человеком,
позволяет объяснить, как именно состав и строение влияют на
свойства вещества, а значит, предсказывать свойства вещества
на основании его состава и строения, а также создавать новые
вещества, новые материалы с заранее заданными свойствам».
Явления, при которых из одних веществ получаются другие,
отличающиеся от исходных своим составом, называются хими-
ческими явлениями, или химическими реакциями. Химические
явления следует отличать от физических, при которых не про-
исходит преврашения одних веществ в другие, а меняется лишь
форма или физическое состояние вещества. Если образование
одних индивидуальных веществ нз других — химическое прев-
ращение, то образование смеси из двух или более индивидуаль-
ных веществ — физическое превращение.
§ 2. АТОМНО-МОЛЕКУЛЯРНАЯ ТЕОРИЯ
Представим себе, что мы уменьшаем количество некоторого
вещества, подвергая его образец делению. До каких пор можно
осуществлять такое деление? Этот вопрос ставился людьми с
1S
древнейших времен. Ответ на него был получен в конце
XVIII —начале XIX века, в эпоху становления химии на науч-
ную основу, и составил суть атомно-молекулярной теории, или
атомно-молекулярного учения. В настоящее время эта теория
является основой всего естествознания. Последующее развитие
науки, расширившее наши представления о строении вещества,
в целом подтвердило правильность атомно-молекулярного уче-
ния.
Основные положения атомно-молекулярной теории состоят
в следующем. Все вещества состоят из химически неделимых
частиц — атомов. В свою очередь, атомы могут соединяться
между собой, образуя молекулы — частицы, состоящие из раз-
ного числа атомов. В противоположность атомам молекулы хи-
мически делимы. Химические реакции представляют собой раз-
рушение одних молекул и образование других. Таким образом,
молекулы являются наименьшими частицами индивидуального
вещества, сохраняющими его химические свойства, его хими-
ческую индивидуальность.
Например, молекула воды содержит дза атома водорода и
один атом кислорода и обладает характерными химическими
.свойствами индивидуального вещества воды. Даже отдельные
молекулы воды, содержащиеся в ее парах, будут реагировать
с оксидом натрия. Химическим путем можно разложить воду
па водород и кислород, при этом образуются двухатомные мо-
лекулы водорода и кислорода. Химические свойства последних
будут иными, нежели химические свойства молекулы воды.
Атомы же кислорода и водорода при разложении воды, как и
при всяком химическом превращении, сохранятся — они лишь
войдут в состав других молекул.
Все молекулы одного вещества одинаковы, по отличаются
от молекул любого другого вещества своим составом и строени-
ем. Состав и строение, как мы уже упоминали, определяют
свойства молекулы и вещества в целом. Напротив, свойства
веществ, состоящих из разных молекул, будут разными. При
физических превращениях, таких как плавление, испарение ве-
ществ, молекулы не разрушаются, как в случае химических ре-
акций.
В жидком и твердом состояниях (их объединяют под общим
названием «конденсированные состояния») не все вещества со-
стоят из молекул. Например, нет отдельных молекул в кристал-
лах алмаза или оксида кремния — эти кристаллы составлены
атомами, связанными между собой столь же прочными химиче-
скими связями, как атомы в молекуле. А кристаллы или рас-
плав хлорида натрия состоят нз заряженных частиц — ионов.
Следовательно, определение молекулы как наименьшей ча-
стицы вещества, сохраняющей его химические свойства, спра-
ведливо лишь для тех веществ, которые состоят из молекул.
Тем не менее иногда мы прибегаем к условности, употребляя
16
термин «молекула» по отношению к веществам, в структуре
которых отдельных молекул нет. Атомы же можно определить
как химически неделимые частицы, из которых состоят молеку-
лы или кристаллы веществ.
Атомно-молекулярная теория объяснила существование
различных агрегатных состояний вещества, соотношение объе-
мов реагирующих газообразных веществ, позволила сформули-
ровать законы, описывающие поведение газов.
Рассмотрим с точки зрения атомно-молекулярной теории три
состояния вещества: газ, жидкость и твердое тело. В состоянии
газа или пара вещество состоит из отдельных молекул — одно-
атомных или многоатомных, в зависимости от природы веще-
ства и внешних условий. Эти молекулы находятся в хаотиче-
ское: движении, соударяясь друг с другом, и при отсутствии
внешних сил свободно распространяются в пространстве, запол-
нят. например, весь объем сосуда, в который введен газ.
В жидкостях молекулы или ионы также находятся в состоянии
хаотического движения, но перемещаются лишь в пределах не-
которого объема, ограниченного поверхностью раздела между
жидкостью и окружающей средой. Если ввести небольшое ко-
личество жидкости в пустой сосуд, то она соберется на дне со-
суда. а в остальном его объеме распространятся пары этой
жидкости. Длина свободного пробега частиц между соударе-
ния •’п в жидкости значительно меньше, чем в газе.
В твердом теле образующие его частицы (атомы, ионы, мо-
лекулы) колеблются около некоторых точек (узлов кристалли-
ческой решетки), лишь изредка меняя свое положение. Как и
жидкость, твердое тело занимает определенный, соответствую-
щий данным условиям (давление и температура) объем, не за-
висящий от объема сосуда, в который поместили твердое тело.
Атомы имеют определенную массу. А так как в ходе хими-
ческой реакции атомы сохраняются, то отсюда вытекает, что
масса веществ, вступивших в реакцию, равна массе веществ,
образовавшихся в результате реакции. Так формулируется
, закон сохранения массы веществ при химической реакции (за-
кон Ломоносова — Лавуазье). Этот закон имел огромное зна-
чение для становления атомно-молекулярного учения. Он явля-
' ется частным случаем закона сохранения массы — энергии в
применении к химическим реакциям. В принципе, с выделени-
ем или поглощением энергии в ходе химической реакции долж-
5 но быть связано и некоторое изменение массы веществ, однако
это изменение столь мало, что в химических расчетах им пре-
небрегают.
Утверждение в науке закона сохранения массы и представ-
ления об атомах позволили поставить следующий вопрос: соеди-
няются ли химические элементы между собой в каких-то оп-
ределенных соотношениях или количественные соотношения
между элементами в их соединениях неопределенны и зависят
2 с н. у-------- —— , 17
от того, сколько каждого элемента было взято для реакции. В
первом случае для какой-то пары элементов следовало ожидать
образования лишь небольшого числа соединений с четко опре-
деленным составом, причем состав каждого из них должен был
резко отличаться от состава других соединений. Во втором слу-
чае можно было бы ожидать, что получится непрерывный ряд
соединений, состав которых изменялся бы постепенно. Иными
словами, в первом случае состав химических соединений был
бы определенным и нс зависел от условий реакции, в том числе
от избытка одного из компонентов, а во втором случае — не-
определенным. Этот вопрос в начале XIX века составил суще-
ство полемики между двумя выдающимися химиками —
К-Л.Бертолле и Ж-Л. Прустом. Пруст отстаивал первую точку
зрения, Бертолле—вторую, приводя в качестве аргумента свой-
ства растворов, которые остаются однородными, даже если их
состав изменяется в широких пределах.
В конечном итоге химики в большинстве своем согласились
с точкой зрения Пруста, и в химии утвердился еще один важ-
ный закон — закон постоянства состава: каждое химическое
соединение имеет определенный, и постоянный качественный и
количественный состав, не зависящий от способа его получения.
Закон постоянства состава сыграл большую роль в развитии
химии. Он способствовал окончательному утверждению атоми-
стики, поскольку через соотношения между массами элементов,
входящих в состав тех или иных соединений, позволял найти
важнейшую характеристику элемента — относительную массу
его атомов.
Впоследствии были обнаружены соединения, состав которых
колеблется в известных пределах. К ним относятся, например,
некоторые оксиды переходных элементов — железа, титана и
др. Соединения, имеющие переменный состав, называются не-
стехиометрическими. Иначе их называют бертоллидами, или
недальтопидными соединениями ( в противоположность стехио-
метрическим или дальтонидам, имеющим постоянный состав).
Нестехиометрических соединений, в том числе важных для
практики, сейчас известно очень много.
Как же определить границы применимости закона постоян-
ства состава? Этот закон строго справедлив только для тех ве-
ществ, которые состоят из отдельных молекул. Действительно,
если в образце вещества наряду с молекулами одного состава
(например, Н2О) присутствуют молекулы другого состава (на-
пример, Н2О2), то мы вправе сделать вывод, что вещество не
является чистым — в данном случае вода загрязнена перокси-
дом водорода. Очистив воду от пероксида водорода, скажем,
перегонкой, мы можем получить чистое вещество, которое бу-
дет подчиняться закону постоянства состава. Все молекулы это-
го вещества будут иметь одинаковый качественный и количест-
18
венный состав НаО, т. е. будут содержать 11,1% водорода и
88,9% кислорода (по массе).
Среди веществ, которые в конденсированном состоянии не
содержат отдельных молекул, встречаются соединения как
практически постоянного состава (например, хлорид натрия),,
так и явно переменного (оксид железа (II), оксиды титана и
др.). Примеры нестехиометрических соединений будут даны в
главе 9.
§ 3. ХИМИЧЕСКИЙ ЭЛЕМЕНТ
Атом состоит из положительно заряженного ядра и одного
или нескольких отрицательно заряженных электронов, окружа-
ющих ядро. Суммарный заряд электронов по абсолютной вели-
чине равен заряду ядра, поэтому атом в целом электронейтра-
лен. Электронную структуру атомов мы рассмотрим в главе 5.
Ядро атома состоит из протонов (р) и нейтронов (я) и ха-
рактеризуется зарядом (Z) и массой. Протон имеет положи-
тельный заряд, равный по абсолютной величине заряду элект-
рона (этот заряд принят за единицу), нейтрон не имеет заряда,
а его масса близка к массе протона. Таким образом, масса яд-
ра зависит от числа протонов и нейтронов в ядре, а его за-
ряд— только от числа протонов. Масса электрона много мень-
ше массы протона и нейтрона, поэтому масса атома в целом
определяется массой протонов и нейтронов в ядре. Сумму чис-
ла протонов и нейтронов в ядре называют массовым числом
(А). Это всегда целое число.
Выше мы уже использовали термин «элемент» — теперь
уточним это понятие. Химическим элементом называют сово-
купность атомов с одинаковым зарядом ядра или, что то же
самое, с одинаковым числом протонов в ядре. Так, все атомы с
зарядом ядра +8 (имеющие в ядрах по восемь протонов), яв-
ляются атомами одного элемента — кислорода. Таким образом,
заряд ядра является главной характеристикой химического
элемента.
Атомы одного элемента могут различаться по числу нейт-
ронов. Разновидности атомов, в ядрах которых содержится оди-
паковое число протонов, но разное число нейтронов, называются
изотопами. Следовательно, один элемент может состоять из не-
скольких изотопов, имеющих разные массовые числа. Вследст-
вие этого главными характеристиками того или иного изотопа
являются заряд ядра и массовое число. Эти характеристики за-
писывают в виде числовых индексов около символа элемента:
слева вверху — массовое число, слева внизу — заряд ядра. На-
пример, запись 928U означает: изотоп элемента урана (Z=92)
с массовым числом 238. Иногда заряд ядра опускают (пишут
23SU, или уран-238), так как сам по себе символ элемента
2*
19
позволяет легко найти в периодической таблице или в любом
справочнике по химии заряд ядра этого элемента.
Большинство элементов встречается в природе в виде двух
или более изотопов. Так, водород на Земле состоит из двух
изотопов с массовыми числами 1 и 2 в соотношении примерно
1 : 7000. Еще один изотоп водорода с (массовым числом 3 об-
разуется в значительных количествах при работе ядерных ре-
акторов. Кроме того, искусственным путем получены очень не-
устойчивые изотопы водорода с массовыми числами 4 и 5.
Атом каждого изотопа характеризуется определенной мас-
сой. За единицу массы атомов принята атомная единица массы
(а. е. м.) (ее называют также углеродной единицей, у. е.), рав-
ная 1/12 массы атома 12С. Масса атома, выраженная в а.е. м.,
называется относительной атомной массой, или просто атомной
массой (А,-, иногда — просто А). В силу целого ряда причин
(изучаемых в курсе физики) атомная масса даже одного изо-
топа любого элемента — величина не целочисленная. Угле-
род-12 составляет исключение, потому что он, по определению,
взят за основу для единицы атомных масс.
Атомная масса элемента — средневзвешенная (средняя с
учетом относительного содержания) величина для всех природ-
ных изотопов этого элемента. Так, атомная масса хлора, равная
35,453, является средневзвешенной величиной для смеси, состо-
ящей из 75,77% атомов хлора с А,.==34,969 и 24,23% атомов
хлора с А,.=36,966, и вычисляется по формуле
. '34,969-7-5,77 66,966-24.33 1Г„ _
Ar (Cl) =-----------------------= do,4o3 — Зо,о.
Соотношение между содержанием разных изотопов одного
элемента сохраняется в природе более или менее постоянным
независимо от происхождения вещества. Кислород, например,
состоит из 99,76% 16О, 0,20 % 18О и 0,04 % 17О. Однако небольшие
отклонения все же наблюдаются. По сравнению с кислородом
речной и океанской воды в кислороде земной атмосферы содер-
жание тяжелых изотопов чуть выше; кислород, входящий в со-
став вод, идущих с больших глубин горячих источников, со-
держит несколько меньше тяжелых изотопов. Но эти отклоне-
ния незначительны и для практических целей в большинстве
случаев не играют роли.
Поведение атомов в химических реакциях определяется
прежде всего зарядом ядра и в гораздо меньшей степени — их
массой (при одинаковом заряде). Поэтому часто принимают,
что химические свойства веществ не меняются при замене в них
одного изотопа на другой изотоп того же элемента. Строго го-
воря, это не совсем так. Чем больше относительная разница в
массах изотопов, тем сильнее различаются физические и хими-
ческие свойства соответствующих веществ. Особенно явно это
различие проявляется в случае изотопов водорода с массовыми
20
числами 1, 2 и 3. Для них употребляются даже свои названия
и символы: {Н — протий, или обычный водород; ?D — дейтерий,
или тяжелый водород; ?Т — тритий, или сверхтяжелый водород.
Как влияет изотопный состав вещества на его физические
свойства, видно из следующего сравнения: Н2, D2 и Т2 имеют
температуру кипения (при атмосферном давлении) соответст-
венно— 252,8, — 249,6 и — 248,3°С. Температура плавления
«обычной» (Н2О), «тяжелой» (D2O) и «сверхтяжелой» (Т>0)
воды равна 0, 3,81 и 4,49°С. Как следует из приведенных дан-
ных, разница в физических свойствах оказывается значитель-
ной.
Что касается химических свойств веществ, содержащих рез-
ные изотопы одного элемента, то они также не идентичны. Не-
сколько различаются энергетические эффекты реакций с уча-
стием разных изотопов, что ведет к различию в величинах кон-
стант равновесия для реакций одного вида. Поэтому, если в ка-
кой-то реакции реагируют вещества одинакового элементарного
состава, но содержащие разные изотопы одного элемента, то
продукты реакции могут обогащаться одними изотопами и
обедняться другими. Многократно повторяя реакцию, можно
получить высокую степень обогащения одним изотопом или
даже практически чистый изотоп. Так, при электролизе вод-
ного раствора щелочи на катоде восстанавливается преимуще-
ственно протий, а остаток слегка обогащается дейтерием. В
этом состоит промышленный способ получения тяжелой волы.
Биохимические свойства тяжелой воды несколько отличаются от биохи-
мических свойств обычной воды. Тяжелая вода не поддерживает жзрвь
растений и животных, но, по-видимому, небольшое увеличение содержания
дейтерия в воде оказывает стимулирующее действие на жизненные процессы.
Существуют также методы разделения изотопов, основан-
ные на различии физических свойств веществ, содержащих раз-
ные изотопы одного элемента, например метод газовой диффу-
зии, когда в процессе диффузии через пористую перегородку
летучего соединения оно обогащается более легким изотопом
входящего в его состав элемента. В настоящее время многие
элементы получают в виде чистых изотопов в значительных ко-
личествах. Например, годовое производство тяжелой воды со-
ставляет несколько сот тонн. Тяжелая вода используется в
ядерных реакторах и научных исследованиях. В больших ко-
личествах осуществляется разделение изотопов урана, нужных
для ядерной энергетики.
Все элементы кроме стабильных изотопов имеют также не-
стабильные, радиоактивные изотопы, большинство из которых
было получено искусственно, поскольку на Земле их либо во-
обще нет, либо количества настолько малы, что не удается их
обнаружить. Лишь некоторые радиоактивные изотопы имеют
такой большой период полураспада (время, за которое распа-
21
дается половина от первоначально имевшегося числа ядер), что
присутствуют на нашей планете в сравнительно больших коли-
чествах. Это, например, 235U, 238U и 40К.
Поскольку все-таки химические свойства разных изотопов
одного элемента близки, а при малой разнице атомных масс —
практически идентичны, радиоактивные изотопы используют в
так называемом методе меченых атомов, когда с помощью до-
бавки в препарат радиоактивного изотопа какого-то элемента
удается проследить судьбу этого элемента в исследуемом про-
цессе, например, миграцию его в тканях растения, исследовать
механизм химической реакции и т. д.
§ 4. ПРОСТОЕ ВЕЩЕСТВО. АЛЛОТРОПИЯ
В результате сочетания одинаковых атомов образуется про-
стое вещество, которое, следовательно, есть форма существова-
ния элемента в свободном состоянии. Часто дают и такое оп-
ределение: простыми веществами называют вещества, образо-
ванные из атомов только одного элемента. Иногда простые
вещества называют еще «элементарными», или «свободными»
(например, «элементарный кремний», «свободный хлор»).
При сочетании разных атомов образуется сложное вещест-
во, или химическое соединение. Путем соответствующих хими-
ческих операций всякое сложное вещество может быть разло-
жено на отдельные составляющие его элементы, которые при
этом получаются в виде простых веществ.
Не следует путать понятия «элемент» и «простое вещество».
Если атомы кислорода соединяются по двое в молекулы, то это
будет простое вещество — молекулярный кислород, или если
атомы меди соединяются друг с другом, образуя кристалличе-
скую решетку (металлического типа, то получается простое ве-
щество— металлическая медь. В обоих случаях мы можем ска-
зать: это простое вещество состоит из атомов такого-то элемен-
та. Но вот, например, в оксиде меди, в котором атомы меди
соединены с атомами кислорода, есть элемент кислород и эле-
мент медь, но уже нет простых веществ — металлической меди
и молекулярного кислорода.
Таким образом, «элемент» — понятие абстрактное, характе-
ризующее составную часть простых и сложных веществ. Поня-
тие же «простое вещество» — конкретное, характеризующее
конкретное вещество, образуемое данным видом атомов в сво-
бодном состоянии.
Один и тот же химический элемент может образовывать не-
сколько простых веществ. Явление, при котором один элемент
образует разные простые вещества, отличающиеся по своему
строению и свойствам, называется аллотропией. Простые веще-
ства, образованные одним элементом, называются аллотропны-
ми видоизменениями этого элемента. Например, аллотропными
22
видоизменениями элемента кислорода являются газы озон и
кислород, аллотропными видоизменениями углерода — алмаз,
графит и карбин, фосфора — белый, красный, фиолетовый и
черный фосфор. Аллотропия — широко распространенное явле-
ние. Она наблюдается также у железа, серы, олова и др.
Аллотропные видоизменения одного элемента отличаются
друг от друга либо по числу атомов в молекуле (кислород и
озон), либо по строению кристаллической решетки (аллотро-
пия углерода, фосфора). Примеры аллотропии мы рассмотрим
более подробно в главе 7.
§ 5. СЛОЖНОЕ ВЕЩЕСТВО. МОЛЬ
Сложными веществами, или химическими соединениями, на-
зываются вещества, образованные атомами более чем одного
элемента. Например, вода представляет собой химическое сое-
динение, поскольку состоит из двух элементов — водорода и
кислорода. Состав химического соединения устанавливают на
основании анализа и синтеза. Анализ означает разложение
соединения на вещества с более простым и известным составом,
синтез — получение соединения из веществ с более простым и
известным составом.
Относительной молекулярной массой (AI,.), или просто мо-
лекулярной массой, вещества называется масса его молекулы,
выраженная в а. е. м. Молекулярная масса равна сумме атом-
ных масс всех атомов, входящих в молекулу, умноженных на
число этих атомов в молекуле. Так, молекулярная масса
Н2ЗОл равна сумме 1-24-32+16-4 = 98, поскольку в состав
молекулы серной кислоты входят два атома водорода, один
атом серы и четыре атома кислорода, а округленные значения
атомных .масс этих элементов равны 1, 32 и 16.
При химических расчетах широко используется понятие
«моль». Моль — это единица количества вещества, которая со-
держит столько структурных единиц (реальных или условных
частиц), сколько содержится атомов в 0,012 кг изотопа12С, т. е
6,024 9-1023 (или приблизительно 6,02-1023). Это число называ-
ют числом Лвогадро (Na). Под структурными единицами под-
разумеваются атомы, ионы, молекулы, определенные группы
частиц (совокупность входящих в формулу атомов, даже если
в составе вещества нет отдельных молекул), а также электроны
и другие частицы. При использовании термина «.моль» эти
структурные единицы должны быть специфицированы, т. е.
должно быть указано, о каких частицах идет речь. Слово
«моль» после числа не склоняется.
Например, 1 моль газообразного кислорода (О2) содержит
6,02-1023 молекул О2 или 12,05-1023 атомов О, т. е. 2 моль О.
1 моль хлорида натрия содержит 6,02-1023 ионов Na+ и столь-
ко же ионов С!-, т. е. 6,02-1023 структурных единиц NaCL
23
Чтобы наглядно представить себе, сколь велико число Аво-
гадро, воспользуемся следующими сравнениями. Если 1 моль
каких-то атомов равномерно распределить по всей поверхности
нашей планеты, то на 1 кв. см будет приходиться 30 000 ато-
мов. Если бы все население Земли начало считать все частицы
в моле этих частиц, то, произнося по одному числу в секунду и
работая по 8 часов в сутки, всем людям пришлось бы делать
подсчет более 10 млн лет.
Молярное количество вещества (/г, употребляется тднже
обозначение у)—это величина, характеризующая количество
вещества и равная частному от деления числа частью .V
(структурных единиц) на число Авогардо N д. Единица ты пре-
ния— моль. Например, если имеется 6,02-102! молекул Су, то
V 6О'-Н)1
//(Os)= — = ^1-- .0,01 моль 0Л).
В скобках следует указывать, о каких именно структурных
единицах идет речь, например /г (СаС12-6Н2О) =0,5 моль,
п(Са2+)=3 моль, /г(Н+) = 1 моль. В химии употребляются
также кратные величины: киломоль (кмоль), равный 1000 моль,
и миллимоль (.ммоль), равный 0,001 моль.
Молярная масса (М) вещества представляет собой массу
одного моля этого вещества и равна частному от деления ?сас-
сы вещества в килограммах на его количество в молях: М =
— т/п (кг/моль). На практике часто пользуются кратной еди-
ницей: г/моль. В этом случае молярная .масса численно равна
относительной .молекулярной .массе данного вещества (или от-
носительной атомной массе, если речь идет об атомах какого-
то элемента). Например: /И(С12)=70,9 г/моль; М (С 5) ==
= 35,45 г/моль; М(CuSO4 • 5Н2О) =250 г/моль.
§ 6. ЗАКОН АВОГАДРО
Формулировка закона Авогадро следующая: в равных объ-
емах разных газов при одинаковых условиях (температура и
давление) содержится одинаковое число молекул.
Из закона Авогадро вытекают два важных следствия:
1) моль любого газа при одинаковых условиях занимает один
и тот же объем; 2) при нормальных условиях (н. у.), т. е. при
температуре 0°С и давлении 1,013-105 Па (1 атм), моль любого
газа занимает объем около 22,4 л. Этот объем называют мо-
лярным объемом газа (Ем), единица измерения его — л/моль.
Таким образом, молярный объем представляет собой частное
от деления объема газа в литрах на его количество в молях:
VM=V/n. Молярная масса и молярный объем данного газа свя-
заны соотношением М=Умр, где р — плотность газа, г/л.
Следует твердо помнить, что закон Авогадро и следствия из
него применимы только к газам при невысоких давлениях. В
24
этих условиях расстояния между молекулами газа гораздо
больше, чем размеры самих молекул, и объем, занимаемый
молекулами, составляет лишь очень небольшую долю от обще-
го объема газа. Поэтому объем газа определяется практически
только расстояниями между молекулами, а эти расстояния при-
мерно одинаковы для всех газов при одинаковых условиях. При
более высоких давлениях, чем атмосферное, наблюдаются от-
клонения от закона Авогадро, тем большие, чем выше давле-
ние. Отклонения при высоких давлениях связаны с тем, что
расстояния между молекулами делаются сравнимыми с разме-
рами самих молекул.
Из закона Авогадро следует также, что плотности газов в
одинаковых условиях находятся в таком же отношении, как их
молекулярные массы. Следовательно, зная молекулярные массы
двух газов, мы можем вычислить плотность одного газа по от-
ношению к другому. Отношение массы определенного объема
одного газа к массе такого же объема другого газа в тех же
условиях называется плотностью первого газа по второму, или
относительной плотностью. Так, плотность любого газа по во-
дороду Пнг равна Л4г/2, где Мг — молекулярная масса данного
газа.
На практике часто требуется знать, во сколько раз данный
газ тяжелее воздуха, т. е. найти плотность данного газа по
воздуху. Воздух — смесь газов, поэтому нельзя говорить о мас-
се молекулы воздуха, однако можно вычислить среднюю моле-
кулярную массу воздуха. Так как воздух содержит по объему
примерно 4/5 азота (Мг = 28) и 1/5 кислорода (Мг = 32),
средняя молекулярная масса воздуха составит 28-4/5+32-1/5=
= 29 а. е. м. Следовательно, плотность любого газа по воздуху
равна Л4,-/29.
Если некоторый газ находится не при нормальных услови-
ях, и требуется, например, найти объем, который он занимал
бы при и. у., то пользуются уравнением объединенного газового
закона
РУ _Р.Уп
Т ~ 273 ’
где Р и Т — соответственно давление и температура (К), при
которых находится газ; V — его объем при тех же условиях;
Ра, Vo — давление и объем газа при н. у. (объем и давление
могут измеряться в любых единицах, но обязательно одинако-
вых для правой и левой части равенства).
Объем, занимаемый данной массой газа при любых усло-
виях, можно найти из уравнения Клапейрона — Менделеева
PV = тРТ/М,
здесь Р — давление газа, Па; V — его объем, м3; пг— масса га-
за, кг; R — газовая постоянная, равная 8,3141 Дж/(моль-К);
Т — температура, К; М— молярная масса, кг/моль.
25
§ 7. ВАЛЕНТНОСТЬ. СТЕПЕНЬ ОКИСЛЕНИЯ.
ХИМИЧЕСКИЕ ФОРМУЛЫ
Качественный и количественный состав вещества изобража-
ют с помощью химической формулы, составляемой на основа-
нии валентностей (степеней окисления) элементов, образующих
данное вещество. Валентностью называют число, показываю-
щее, со сколькими одновалентными атомами соединен (или за-
мещает их) атом данного элемента. За единицу валентности
принята валентность атома водорода, который считается одно-
валентным, Таким образом, валентность элемента в соединении
с водородом определяется числом атомов водорода, присоеди-
няемых одним атомом данного элемента.
Некоторые химические элементы практически во всех соеди-
нениях имеют постоянную валентность, другие обнаруживают
переменную валентность. Так, кислород всегда двухвалентен,
углерод в органических соединениях четырехвалентеи, железо
может быть двух- и трехвалентным.
Когда неизвестно строение вещества и нет возможности ус-
тановить, сколько других атомов соединено с данным атомом,
истинная валентность этого атома неизвестна. В таких случаях
используют более удобное понятие степени окисления, или
окислительного числа. Степень окисления можно определить как
формальное число, которое вычисляется на основании состава
соединения исходя из предположения, что оно состоит из за-
ряженных частиц — ионов (что далеко не всегда справедливо!).
Таким образом, степень окисления соответствует формальному
заряду атома в соединении. Поэтому по знаку и величине сте-
пень окисления может быть положительной, отрицательной и
дробной. В простых веществах, где атомы одинаковы, степень
окисления атомов принимают равной нулю.
Степень окисления атома в соединении «можно вычислить, ес-
ли известны степени окисления всех других атомов в этом сое-
динении. При вычислении степени окисления придерживаются
следующих правил: 1) алгебраическая сумма степеней окисле-
ния всех атомов в формуле соединения равна нулю (что соот-
ветствует электропейтральному веществу); 2) степень окисле-
ния кислорода равна — 2, за исключением перекисных соедине-
ний и соединения со фтором; 3) степень окисления водорода
(за исключением гидридов металлов) равна -|-1; 4) степень
окисления металлов в соединениях всегда положительна.
Степень окисления иногда не совпадает с валентностью эле-
мента в данном веществе. Так, в молекуле О2 (простое веще-
ство) степень окисления кислорода принимается равной нулю,
в то время как валентность атомов кислорода в этой молекуле
равна двум. Другой пример: в пероксиде водорода Н2О2 сте-
пень окисления кислорода равна —1, в то время как валент-
26
ность равна двум — каждый атом кислорода связан как с ато-
мом водорода, так и с другим атомом кислорода
,(Н-О—О-Н).
В химии используются разные виды формул, причем каж-
дый вид формул несет в себе определенную информацию о ве-
ществе.
Суммарная формула (эмпирическая, брутто-формула)—это
простейший вид формулы. Она правильно отражает состав ве-
щества и степени окисления входящих в него элементов, но
ничего не говорит о его строении, т. е. о последовательности и
кратности связей между атомами. Например, формула диокси-
да кремния SiO2 показывает лишь, что в этом соединении на
один атом кремния приходятся два атома кислорода, но ничего
не говорит о структуре оксида кремния; она очень похожа на
эмпирическую формулу углекислого газа СО2, однако строение
этих двух веществ разное. Другой пример: в молекуле серной
кислоты атом водорода соединен с атомом кислорода, однако
из формулы H2SO4 это не следует.
Молекулярная формула точно передает число атомов, вхо-
дящих в (Молекулу. Иногда она совпадает с эмпирической фор-
мулой (например, Н2О, СО2, С6Н6), в других случаях является
кратной от эмпирической формулы. Эмпирическая формула
высшего оксида фосфора Р2О5 правильно передает состав и
степень окисления фосфора, молекулярная же формула этого
соединения — удвоенная, Р4Ою, так как именно из таких моле-
кул состоит это вещество.
Структурная формула отражает не только состав, по и
строение вещества. Однако следует всегда помнить, что она не
дает точной информации о пространственном расположении
атомов. Так, структурная формула пропана
Н И 1(
I I I
н-с-с-с- н
I 1 I
н н н
показывает, в какой последовательности связаны между собой
атомы, по не отражает длину этих связей и углы между ними.
Действительно, здесь все связи изображены в виде черточек
одинаковой длины, и располагаются они одна относительно
другой под прямым углам; на самом же деле соответствующие
связи расположены под иными углами, причем связи С—Н и
С—С имеют разную длину.
Структурные формулы широко применяются в органической
химии. При изображении молекул сравнительно сложных орга-
нических веществ часто используют упрощенные структурные
формулы, в которых отдельные группировки атомов записыва-
ют целиком, без детализации их строения. Например:
27
н н и
II -С-С-С - о - н.
н н н
i । i'.'i 11 si'I структурная i’pop\i\ла
СН3-СН;-СН2-ОН
упрощенная структурная формула
Графическая формула — это условная структурная формула,
которая может не совпадать с истинной структурной формулой.
Графическая формула правильно передает степень окисления
атомов, но не всегда соответствует истинному строению вещест-
ва. Графические формулы пишут для неорганических веществ,
условно принимая, что эти вещества состоят из отдельных мо-
лекул, что далеко не всегда соответствует действительно:?!!.
Так, графическая формула диоксида кремния O = Si = O. Кис-
лород, по определению, имеет степень окисления —2, кремний,
как нетрудно подсчитать, +4, именно это и передает гра-
фическая формула. Однако в действительности атом крем-
ния связан не с двумя, а с четырьмя атомами кислорода, и
структурная формула для диоксида кремния имеет следующий
вид:
О О О
-О—Si—О—Si—О—
О О О
(пунктиром обозначено продолжение структуры во все стероны
за счет повторения изображенных здесь структурных элемен-
тов), но и эта формула не вполне точно передает строение
диоксида кремния, поскольку на самом деле структура его
трехмерна, а структурная формула пишется на плоскости.
Упражнения к главе 1
1. Какие из перечисленных веществ представляют собой смеси, а ка-
кие— индивидуальные вещества: углекислый газ, вода океана, почва, сода,
гранит, железо, лед, кислород, поваренная соль?
2. Как доказать, что воздух — смесь индивидуальных веществ?
3. Как доказать, что вода: а) индивидуальное вещество, а не смесь;
б) соединение, а не простое вещество?
4. Каково различие между понятиями «масса атома», «атомная пасса»
и «массовое число»?
5. Сколько различных двухатомных молекул может быть образовано,
если исходить из трех изотопов водорода: Н, Г< и Т?
6. Какие заряд ядра, массовое число и порядковый номер имеет атом,
содержащий 17 протонов, 18 нейтронов н 17 электронов? Как записать сим-
вол атома, отличающегося от предыдущего только тем, что он содержит
18 электронов?
7. В каком случае в приведенных ниже выражениях слово «ртуть»
употребляется по отношению к простому веществу: 1) ртуть можно полу-
чить восстановлением солей ртути; 2) в разрядной трубке находятся пары
28
ртутя; 3) ртуть используется в медицинских термометрах; 4) промышленные
отходы содержали сульфид ртути?
8. Можно ли сказать, что водород и кислород входят в состав воды
как простые вещества?
9, Чем дышат животные и человек: элементом кислородом? кислоро-
дом — простым веществом?
10, Одинаковые ли соединения получатся, если сжигать: а) белый или
красный фосфор; б) алмаз или графит?
И. Сохранится ли различие между алмазом и графитом при их испа-
рении?
1-’ . Сохранится ли различие между обычным кислородом и озоном при
пере .оде в твердое состояние?
13. Вычислите массовое соотношение между углеродом и кислородом в
о'д| де углерода (IV).
14. Вычислите процентное содержание азота в следующих веществах,
пр: меняемых как минеральные удобрения: нитрат калия, нитрат аммония,
мочеолна CO(NH2)2. Какое из них богаче всего азотом?
15. Вычислите массу железа, содержащегося в 150 г пирита FeS2.
16. Сколько меди содержится в 1 т породы, на 80% состоящей из
(СиОНЬСОз?
17, Какая из руд богаче всего железом: Fe2O3 (красный железняк),
FejC, (магнитный железняк), 2Fe2O3-3H2O (бурый железняк), FeCO3 (сиде-
рите- Дайте отвес, не прибегая к вычислению процентного содержания.
18. Какую массу медного купороса CuSO.( • 5Н2О надо взять, чтобы
в нел содержалось 3,2 г меди?
1У. Руда содержит 90% Fe3O4. Вычислите массу руды, которая потре-
буется для получения 1 т железа.
20. Вычислите процентное содержание каждого элемента в медном ку-
поросе CuSO4-5H2O.
21. Прокаливанием какого количества карбоната кальция, содержащего
20% не разлагающихся при нагревании примесей, можно получить такое же
кол честно СО2, какое образуется при сжигании 52 кг ацетилена?
22. В каких случаях точно соблюдается закон постоянства состава, а в
каких — пет?
23, Какую информацию об индивидуальном веществе содержит форму-
ла S'.O>?
24, Вычислите степени окисления: а) брома в КВг, Вг2, КВгО3; железа
в Fe.O3, Fe3O.(, BaFeO4; в) серы в K2S, I\2SO4. Na2S2O7; г) углерода в
Са(НСО3)2, (CuOH)2CO3, НСООН; д) кислорода в Н2О, Fe3O4, Na2O2,
К:О. КО2.
25, 53,4% массы одного из оксидов азота приходится на кислород. Уста-
новите формулу оксида.
26. Напишите формулу соединения, содержащего (по массе) 3,2 части
теллтра, 1,6 частей кислорода и 0,05 частей водорода. Вычислите степень
окис гения теллура в этом соединении.
27. Соединение некоторого элемента Э имеет формулу Э3О4 и содержит
по --.ассе 72,4% Э. Какой это элемент?
28. 15,81 г соединения содержит 5,00 г фосфора, 0,49 г водорода, осталь-
ное кислород. Установите простейшую формулу соединения.
29. При восстановлении 1,194 г оксида двухвалентного металла было
получено 0,954 г этого металла. Оксид какого металла был взят?
30. Установите простейшую формулу минерала берилла, содержащего
(по массе) 13,95% ВеО, 18,97% А12О3 и 67,08% SiO2.
31. Аспирин имеет следующий элементарный состав: 4,45% водорода,
35,55% кислорода и 60,00% углерода. Afr = 180. Установите молекулярную
формулу аспирина.
32. При сгорании вещества, состоящего из углерода, водорода и серы,
получено 2,64 г углекислого газа, 1,62 г воды и 1,92 г сернистого газа. Како-
ва простейшая формула этого вещества?
33. При сгорании 0,7935 г органического соединения образовалось
29
1,5180 г СО2 и 0,9315 г воды. Установите формулу соединения, если его-
молекулярная масса 46.
34. Для каких из перечисленных веществ в одинаковых объемах при
одинаковых условиях содержится одинаковое число атомов: Н2О, Н2, Не,
О2, Оз, СаО?
35. В каких объемах азота и воды при н. у. содержится 310м молекул?
36. Вычислите массу при нормальных условиях 1 л озона, 3 л метана,,
10 л воздуха.
37. Какой объем займет при н. у. 1 г углекислого газа, бутана, водо-
рода?
38. Масса одного литра газа, находящегося при и. у., равна 1,25 г. Вы-
числите: а) его молекулярную массу; б) массу одной молекулы; в) плот-
ность по водороду.
39. Какой объем займут при и. у. 11 г газа, если его плотность по
воздуху 1,52?
40. Некоторый газ находится при н. у. При какой температуре (считая
давление постоянным) его концентрация уменьшится вдвое?
41. При некоторых условиях плотность паров серы по воздуху рав-
на 2,22. Сколько атомов (в среднем) содержится в молекулах газообразной
серы в этих условиях?
42. Будет ли подниматься в воздухе шар-зонд, наполненный: а) мета-
ном, б) этаном? Весом оболочки пренебречь.
43. Во сколько раз плотность газа по водороду отличается от его плот-
ности по воздуху?
44. Вычислите плотность по водороду газовой смеси, которая образуется
при разложении серного ангидрида па сернистый ангидрид и кислород, если
разложилось 20% серного ангидрида, а температура такова, ч'о исе вещест-
ва находятся в газообразном состоянии.
45. При некоторой температуре плотность по водороду меси NO2 и
N2O4 равна 25. Сколько процентов NO2 (по объему) содержится в смеси?
46. Сколько литров СО и СО2 находится в 25 л (и. у.) смеси этих га-
зов, если известно, что ее масса 37,18 г?
47. Сколько литров водорода (и. у.) получится при действии избытка
разбавленной серной кислоты па 6,5 г цинка?
48. Какие объемы (н. у.) диоксида азота, кислорода г. роды должны
прореагировать, чтобы получился 1 моль азотной кислоты?
49. Какой объем хлороводорода (н. у.) Надо растворить ь иоде, чтобы
образовавшийся раствор смог полностью прореагировать с 0.2 моль магния?
50. Какой объем кислорода нужен для сжигания А литров смеси мета-
на и моноксида углерода, взятых в объемном соотношении 1 : 4? Все объемы
измеряются при одинаковых условиях.
51. 11 г пропана сожгли в 33,6 л кислорода. Вычислите молярные коли-
чества всех веществ после реакции.
52. 20 мл смеси СО и СО2 добавили к 20 мл кислорода. После того как
смесь сожгли, ее общий объем, приведенный к начальным условиям, соста-
вил 36 мл. Вычислите объем каждого газа в исходной смеси,
53. В закрытом сосуде емкостью 11,2 л, наполненном хлором при н. у.,
сгорело 4,6 г натрия. Как изменилось давление газа после реакции? Объемом
твердых веществ можно пренебречь.
54. При сжигании 29 г газа образуется 88 г СО2 и 45 г воды. 1 л этого
газа имеет массу 2,59 г. Установите молекулярную формулу газа.
55. При сжигании смеси, содержащей 1 моль неизвестного газа и
2 моль кислорода, образовалось 2 моль углекислого газа и 1 моль азота.
Установите формулу газа.
56. При сгорании 32 г некоторого вещества образовалось 44 г СО2 и
36 г Н2О. Плотность паров этого вещества по водороду 16. Какова форму-
ла вещества?
57. Установите формулу вещества, при сжигании 0,18 г которого было
30
получено 0,132 г СО2 и 0,108 г воды, а также выделилось в свободном со-
стоянии 67,2 мл азота (н. у.).
58. На восстановление 5,4 г вещества, состоящего из железа и кисло-
рода, было израсходовано 1,68 л СО (н. у.). Установите формулу вещества.
Глава 2
ХИМИЧЕСКИЕ РЕАКЦИИ
§ 1. УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Запись химической реакции посредством химических формул
называют химическим уравнением. Составление химических
уравнений основано на использовании основных законов химии,
в том числе закона сохранения массы веществ при химической
реакции и закона постоянства состава.
Как и алгебраические уравнения, химические уравнения
можно складывать и вычитать. Сумма двух химических урав-
нений изображает суммарный химический процесс. Однако сле-
дует помнить, что химическое уравнение отражает процесс,
идущий в определенном направлении, поэтому в отличие от ал-
гебраических уравнений в химических уравнениях при переста-
новке правой и левой частей меняется их смысл — направление
процесса.
Числа, стоящие перед формулами веществ в химических
уравнениях, называют стехиометрическими числами (стехио-
метрическими коэффициентами, или просто коэффициентами).
Они отражают соотношение молярных количеств веществ, уча-
ствующих в реакции. Таким образом, в химических уравнениях
под формулой вещества подразумевают не только одну моле-
кулу, но и моль этого вещества.
Именно здесь проявляется продуктивность понятия «моль»
для химии. Ведь моль любого вещества содержит одинаковое
число молекул (или рассматриваемых в данном процессе дру-
гих структурных единиц). Отсюда следует, что если мы пра-
вильно указываем в уравнении реакции число участвующих в
ней структурных единиц вещества (молекул, атомов, ионов и
т. д.), то уравнение правильно покажет и соотношение числа
молей участников реакции. Если молекула одного из участни-
ков реакции имеет, например, в два раза большую массу, чем
молекула другого участника реакции, то и молярные массы
этих веществ будут находиться в таком же соотношении. Зна-
чит, с помощью уравнения легко вычислить отношения между
массами участвующих в реакции веществ, что и используется
при решении химических задач, в количественном анализе,
при расчете баланса веществ в химических производст-
вах и т. д.
31
Так как число молей одного вещества, реагирующих с од-
ним молем другого вещества, может быть дробным, при состав-
лении химических уравнений допускается написание дробных
коэффициентов. Однако более удобными обычно оказываются
целочисленные коэффициенты, поэтому дробные величины при-
водят к целочисленным, умножив все коэффициенты в уравне-
нии на знаменатель дробного коэффициента. Аналогичным об-
разом, если все коэффициенты в уравнении окажутся кратными
какому-то числу, их сокращают на это число.
Для несложных уравнений, например в случае многих реак-
ций, в ходе которых не меняется степень окисления элементов,
коэффициенты находят подбором. При этом удобнее сначала
уравнивать атомы металла, затем — элементы, характерные для
кислотных остатков (например, азот, серу, фосфор и т. д.),
после этого — водород (если он присутствует в уравнении) и
лишь последним — кислород. Для уравнений окислительно-вос-
становительных реакций коэффициенты находят с помощью
особых приемов, которые будут рассмотрены в главе 6.
Следует отдавать себе отчет в том, какую информацию несет
уравнение реакции. Оно точно передает количественные соот-
ношения между веществами, участвующими в реакции, что ис-
пользуется в химических расчетах. Но уравнение реакции ни-
чего не говорит о промежуточных стадиях, через которые про-
текает реакция, о промежуточных веществах и состояниях этих
веществ, а также о роли катализаторов, влияющих на скорость
протекания реакции. Уравнение реакции указывает лишь ис-
ходные и конечные вещества, исходное и конечное состояние
химической системы.
§ 2. ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
Химические реакции можно классифицировать по разным
признакам. Можно их различать по числу и составу исходных
веществ и продуктов реакции.
Если при реакции из двух или более веществ образуется
одно вещество, такая реакция называется реакцией соединения.
Например:
с + 02=С02,
СаО У- СО2 = СаСО3.
Среди реакций соединения можно выделить частный случай —
реакции полимеризации, когда одинаковые молекулы соединя-
ются, образуя более крупную молекулу. Самый простой случай
полимеризации — димеризация, т. е. образование одной моле-
кулы из двух более простых:
2NO, = N2O4.
Если из одного вещества получается два (или более), реак-
ция является реакцией разложения. Например:
СаСОз — CaO 4-СОг,
2Н2О2 = 2Н2О + О2.
Нетрудно заметить, что реакции разложения обратны реакци-
ям соединения. Реакции разложения часто протекают при на-
гревании, в этом случае говорят: реакция термического разло-
жения.
Если в реакции число продуктов такое же, как число ис-
ходных веществ, то это либо реакция обмена, либо реакция
замещения. Так, при реакции
К2СО3 + СаСЬ = СаСОз - 2КС1
число исходных веществ и продуктов реакции одинаково. Лег-
ко заметить, что в этой реакции ее участники как бы обмени-
ваются своими составными частями: происходит обмен кислот-
ных остатков, соединенных с данным атомом металла, без из-
менения степеней окисления элементов, входящих в состав
реагирующих веществ. Такие реакции называются реакциями
обмена. Частным случаем реакций обмена являются реакции
между кислотами и основаниями (реакции нейтрализации).
Реакции обмена в водных растворах доходят практически
до конца в том случае, если хотя бы один из продуктов реакции
малорастворим, выделяется в виде газа или разлагается в мо-
мент выделения (правило Бертолле). При рассмотрении раст-
воров электролитов (глава 4) мы добавим к этому правилу еще
один пункт, а также рассмотрим более подробно направление
реакций в водных растворах электролитов.
В реакциях
Mg+2HCI = MgCl2 + H.f,
Cl2 + 2KBr = 2КС1 + Br2,
В которых число исходных веществ и продуктов реакции также
одинаково, простое вещество реагирует с соединением, в ре-
зультате чего в соединении замещается один элемент. Отсюда
и название реакций такого типа — реакции замещения. Про-
дуктами реакции замещения являются новое соединение и но-
вое простое вещество.
Можно различать химические реакции также по тому, ме-
няется ли в результате реакции степень окисления элементов.
Реакции, в результате которых степени окисления элементов
меняются, называются окислительно-восстановительными.
Так, реакции замещения являются окислительно-восстанови-
тельными, поскольку степень окисления элемента в простом ве-
ществе принимается равной нулю, а степень окисления элемен-
Та в соединении отличается, за редкими исключениями, от ну-
Ля- Реакции обмена не являются окислительно-восстановитель-
ными. Это нетрудно проверить, подсчитав степени окисления
элементов в реакциях обмена и замещения, приведенных выше.
3 СеМсКОВ р; pj
Что же касается реакций соединения и разложения, то они
могут быть окислительно-восстановительными, но могут и не
быть. Например, реакции образования солей (СаСО3) из ос-
новного и кислотного оксидов (соответственно СаО и СО2) не
являются окислительно-восстановительными. То же относится и
к реакциям разложения солей на основной и кислотный окси-
ды, кислот — на ангидрид и воду и оснований — на основной
оксид и воду. Однако можно привести примеры реакций соеди-
нения и разложения, в ходе которых степени окисления элемен-
тов меняются:
С О2 = СО2,
2КСЮ3 = 2КС1 + ЗО2.
Химические реакции классифицируют и по знаку энергети-
ческого эффекта. Все реакции сопровождаются выделением или
поглощением энергии, т. е. обменом энергией с окружающей
средой. Этот обмен энергией может осуществляться в форме
тепловой, световой, механической, электрической энергии и т. д.
Но так как существует эквивалентность между разными вида-
ми энергии, то количество энергии, которое выделяется или
поглощается при химической реакции, называют энергетиче-
ским, или тепловым, эффектом реакции. Если при реакции энер-
гия выделяется во внешнюю среду, реакция называется экзо-
термической. Если, наоборот, энергия поглощается химической
системой из окружающей среды, реакция называется эндотер-
мической.
Энергетические эффекты химических процессов имеют ог-
ромное практическое значение, так как многие химические
реакции (например, горение углеводородов нефти или составных
частей каменного угля) люди сознательно используют в каче-
стве источника энергии для промышленности и в быту. Экзо-
термические процессы окисления жиров и углеводов служат
источником энергии, необходимой для жизнедеятельности жи-
вотных и растений.
Знание энергетических эффектов химических реакций важно
еще и потому, что знак и величина энергетического эффекта
(наряду с другими факторами) позволяют предсказать, будет
ли осуществляться реакция в тех или иных условиях. Так, ок-
сид кальция при комнатной температуре и атмосферном давле-
нии поглощает углекислый газ именно потому, что эта реак-
ция— экзотермическая. Напротив, одной из причин неустойчи-
вости некоторых соединений азота является экзотермичность
реакций их разложения. Поэтому7 термохимию, изучающую
энергетику химических реакций, необходимо знать, для того
чтобы успешно управлять химическими и многими другими
процессами.
Химические уравнения, в которых указан энергетический
эффект реакции, называются термохимическими. В совремеи-
34
ной химической литературе принято записывать энергетический
эффект реакции в левой части термохимического уравнения.
При такой форме записи перед числом, показывающим абсо-
лютную величину энергетического эффекта, стоит знак «плюс»
при эндотермической реакции, и знак «минус» — при экзотер-
мической. Абитуриенту рекомендуется пользоваться именно та-
кой формой записи термохимических уравнений, поскольку она
используется на последующих этапах обучения. Примеры тер-
мохимических уравнений:
Нз + С12 — 185 кДж = 2НС1 (экзотермическая реакция),
N2 + О2 + 180 кДж = 2NO (эндотермическая реакция),
ЗН2 4- N2 — 92,4 кДж = 2NH3 (экзотермическая реакция).
Как и алгебраические уравнения, термохимические уравне-
ния можно складывать и вычитать. Если правую и левую ча-
сти термохимического уравнения поменять местами, оно будет
отражать обратную реакцию, поэтому и знак энергетического
эффекта изменится на противоположный. Путем сложения и
вычитания термохимических уравнений с известными значения-
ми энергетических эффектов можно вычислить энергетический
эффект реакции, для которой в силу каких-то причин экспери-
ментальное его определение затруднено.
Поясним это иа примере. Пусть требуется найти энергети-
ческий эффект реакции получения СО из простых веществ
(графита и кислорода), если известны энергетические эффек-
ты реакций горения графита н СО:
С О2 — о93,э кДж = СО2,
СО + 1/2О2 — 283 кДж = СО2
(дробный коэффициент при кислороде во втором уравнении
взят для того, чтобы количество молей атомов углерода было
одинаковым в обоих уравнениях). Вычтя второе уравнение из
первого (или, что то же самое, поменяв местами правую и ле-
вую части второго уравнения, а затем сложив полученное урав-
нение с первым), будем иметь
С + О2 + СО2 + (283—393,5) кДж = СО2 + СО - 1 /20,.
Сократив 1 моль С02 и 1/2 моль 02 в правой и левой частях
Уравнения, получаем термохимическое уравнение интересую-
щей нас реакции:
С + 1/2 02 — 110,5 кДж = СО.
Термохимические расчеты основаны на двух законах тер-
мохимии, вытекающих из закона сохранения энергии. Первый
За«он термохимии (закон Лавуазье — Лапласа, 1780 г.): энер-
гетический эффект прямой реакции равен энергетическому эф-
фекту обратной реакции с обратным знаком. Второй закон тер-
мохимии (закон постоянства сумм тепла, или закон Гесса,
1840 г.): энергетический эффект химического процесса зависит
только от начального и конечного состояний химической систе-
мы и не зависит от промежуточных стадий.
Из формулировки закона Гесса можно понять, почему при
записи термохимических уравнений всегда должно быть ясно,
о каких именно начальных п конечных состояниях веществ, уча-
ствующих в реакции, идет речь. Поэтому в приведенных выше
расчетах было специально оговорено состояние углерода — гра-
фит. Когда в реакции участвует, например, кислород или водо-
род, обычно из условий протекания реакции ясно, что речь идет
<> газах, состоящих из двухатомных молекул. Если же, напри-
мер, в реакции горения образуется вода, то надо обязательно
указывать, к какому состоянию воды — жидкому или газооб-
разному— относится величина энергетического эффекта реак-
ции. Действительно:
Н2 (газ) ф- 1/2 О2 (газ) — 241,8 кДж — Н2О (газ),
Н2 (газ) -f- 1/2 О2 (газ) —285,8 кДж = Н2О (жидк.).
Причина большего энергетического эффекта во второй реак-
ции — выделение дополнительного количества энергии при кон-
денсации водяного пара.
Химические реакции делят также по признаку обратимости.
Некоторые реакции идут практически только в одном направ-
лении, другие сравнительно легко меняют направление при из-
менении условий. В первом случае мы говорим, что реакция
необратимая, во втором — что она обратимая. Чтобы подчерк-
нуть, что данная реакция обратима (в том интервале условий,
в котором она рассматривается), в уравнении реакции вместо
знака равенства пишут знак обратимости (^).
Например, реакция СаСОз СаО + СО, в интервале темпе-
ратур от комнатной до 1000°С обратима. При низких темпе-
ратурах она идет преимущественно в сторону образования
СаСОз, при высоких — наоборот, в сторону разложения СаСОз.
причем в тем большей степени, чем выше температура. Реак-
ция 2 КСЮз = 2 КС1 + 3 О2 практически необратима, т. е. про-
текает в одном направлении практически до конца. Следует
иметь в виду, что многие реакции мы считаем необратимыми
лишь в первом приближении — сильно изменив условия, мож-
но иногда добиться протекания реакции в обратном направ-
лении.
Обратимая реакция доходит до некоторого состояния рав-
новесия, зависящего от внешних условий, в частности от тем-
пературы. Понятие о химическом равновесии — одно из важ-
нейших понятий в химии. Рассмотрим его подробнее.
36
§ 3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Чтобы лучше понять сущность химического равновесия и
причины, по которым химическая система стремится к состоя-
нию равновесия, рассмотрим некоторые физические процессы
и законы, управляющие этими процессами. Представление о на-
правленности процессов в природе формируется у человека
даже без специального обучения, оно возникает как интуи-
тивное, на основании повседневного опыта. Человек с детства
знает, что тяжелые предметы падают вниз. Позже он узнаёт,
что макроскопические тела падают вниз потому, что притя-
гиваются к Земле.
Наблюдение простых механических процессов приводит к
выводу, что, как правило, самопроизвольно совершаются та-
кие процессы, которые сопровождаются уменьшением потен-
циальной энергии. Так, при падении тела на Землю умень-
шается потенциальная энергия системы данное тело — Земля.
Если же механический процесс сопровождается возрастанием
потенциальной энергии, то он не будет совершаться самопро-
извольно. Действительно, камень сам собой не оторвется от
поверхности Земли и не устремится вверх. Поднять его мож-
но, только затратив (подведя извне) определенное количест-
во энергии.
Химическим аналогом механического процесса (падение
камня) является экзотермическая реакция: оба процесса ха-
рактеризуются уменьшением запаса энергии системы. Напра-
шивается вывод, что самопроизвольно будут протекать лишь
экзотермические реакции. В свое время так и полагали, и
положение это получило название принципа Бертло —Том-
сена.
Однако накопление знаний о химических реакциях пока-
зало, что достаточно распространены и эндотермические реак-
ции, особенно при высоких температурах. Вообще, во всех
явлениях, в которых участвуют не макроскопические тела как
единое целое, а большие количества малых частиц (молеку-
лы, атомы, ионы), направление самопроизвольно протекающе-
го процесса нельзя однозначно предсказать только по знаку
энергетического эффекта, т. е. по изменению запаса энер-
гии в системе.
Это подтверждают простые примеры. Молекулы газов,
составляющих атмосферу Земли, притягиваются к ней и, ка-
залось бы, должны упасть на поверхность Земли, образовав
плотный и не очень толстый слой. Но этого не происходит —
атмосфера распространяется далеко от поверхности планеты,
хотя плотность атмосферы с удалением от поверхности посте-
пенно уменьшается. Другой пример. Как хорошо известно, при
испарении жидкости, например воды, затрачивается энергия
в количестве, равном скрытой теплоте испарения, и в этом
37
смысле испарение жидкости подобно самопроизвольному
взлету камня вверх. Однако испарение все же происходит.
Значит, наряду с тенденцией к уменьшению запаса энергии
есть какая-то другая тенденция, действующая в противополож-
ном направлении.
Мы знаем, что при любой температуре, отличной от абсо-
лютного нуля, частицы (молекулы, атомы, ионы) находятся в
состоянии теплового движения. В случае газа, когда движе-
ние молекул не ограничивается поверхностью раздела, т. е.
границами тела, хаотическое движение молекул приводит к то-
му, что они распределяются в возможно большем пространст-
ве. Тенденция к хаотическому движению имеет место и в жид-
ком и твердом теле, но в этом случае ее проявление более
ограничено.
Эта вторая тенденция и конкурирует с первой — к миниму-
му энергии системы. Результатом конкуренции их является
установление в системе некоторого состояния равновесия. Так,
молекулы воздуха распределяются в атмосфере Земли таким
образом, что их концентрация закономерно убывает с высотой.
Если легко испаряющемуся жидкому или твердому веществу
предоставить некоторый замкнутый объем, то через какое-то
время концентрация паров этого вещества достигнет опреде-
ленной величины, соответствующей давлению насыщенного
пала при данной температуре, и дальнейшее испарение прекра-
тится, т. е. установится равновесие между паром и жидко-
стью или твердым веществом.
Поскольку тенденция к распределению частиц в возможно
большем объеме связана с тепловым движением, она прояв-
ляется в тем большей степени, чем выше температура. Следо-
вательно, каждой температуре будет соответствовать опреде-
ленное соотношение в степени проявления обеих тенденций и
свое состояние равновесия для данной системы. Температура
кипения жидкости или возгонки твердого тела — это та тем-
пература, при которой обе тенденции уравновешивают друг
друга при атмосферном давлении.
Все сказанное выше применимо и к химическим системам:
каждой температуре, как и вообще каждому набору внешних
условий, в которых может находиться химическая система, со-
ответствует некоторое состояние равновесия для этой системы.
Раз установившись, такое состояние при неизменных условиях
уже не будет меняться. Химическая система, находящаяся в со-
стоянии равновесия, называется равновесной. Состав реакци-
онной смеси, соответствующий равновесию, называется равно-
весным составом, а концентрации веществ, находящихся в рав-
новесии, — равновесными концентрациями.
Однако неизменность системы во времени еще не означает,
что в системе установилось химическое равновесие. Иногда ско-
рость перехода системы от какого-то ее неравновесного состоя-
.38
ния к равновесному,!, е. скорость возможного в этой системе
химического процесса, практически равна нулю. В таких слу-
чаях говорят, что система находится в «замороженном», или
метастабильном, состоянии. Например, гремучий газ — смесь
водорода с кислородом — может сохраняться при комнатной
температуре неопределенно долгое время в неравновесном, ме-
тастабильном состоянии, так как реакция водорода с кислоро-
дом при этой температуре «заморожена».
В любом случае химическая система сможет самопроиз-
вольно (в отсутствие внешних воздействий) изменяться лишь в
направлении к состоянию равновесия, даже если скорость это-
го изменения ничтожна. Например, вода при комнатной тем-
пературе и атмосферном давлении не сможет в измеримой сте-
пени самопроизвольно разлагаться на водород и кислород, в
то время как смесь двух объемов водорода с одним объемом
кислорода должна будет, хотя и с ничтожной скоростью, стре-
миться рано или поздно практически полностью превратиться
в воду. Поэтому критерием истинного химического равновесия
является возможность достижения его с двух сторон — в дан-
ном случае со стороны гремучего газа и со стороны чистой
воды. Что же касается метастабильного состояния химической
системы, которое реализуется за счет замороженпости того или
иного химического процесса, то это состояние хотя практически
и не изменяется во времени, однако не может быть достигнуто
с обеих сторон — от избытка исходных веществ и от избытка
продуктов реакции.
Достижение равновесия с двух сторон можно проиллюстри-
ровать графически (рис. 1). Пусть в некоторой химической
системе проводится обратимая реакция
А (газ) + В (газ) С (газ) + D (газ).
Каждой температуре будет отвечать определенное соотноше-
ние концентраций исходных веществ и продуктов реакции. Если
при некоторой температуре, при которой реакция идет с доста-
точной скоростью, смешать вещества А и В, то начнется пре-
вращение их в вещества С и D. Концентрации последних бу-
дут увеличиваться во времени (кривая 1 на рис. 1). В общем
случае реакция пойдет не до конца, т. е. не до полного превра-
щения веществ А и В, а лишь до некоторого предела, отвечаю-
щего положению равновесия при данной температуре.
Если в начальный момент времени при той же температу-
ре взять вещества С и D, то между ними также начнется реак-
ция. В результате концентрации веществ С и D будут убывать
(кривая 2). Этот процесс также не дойдет до конца, а лишь
до предела, отвечающего состоянию равновесия при данной
температуре. Таким образом, по истечении некоторого времени
кривые 1 и 2 должны практически слиться. После этого при
условии, что температура и другие условия остаются постоян-
39
нымп, концентрации веществ С и D перестанут изменяться
(штриховая линия на рис. 1).
Химическое равновесие является равновесием динамиче-
ским. Это означает, чю в
Рис. 1. Изменение концентра-
ции продуктов обратимой ре-
акции во времени при подходе
к положению равновесия от
избытка исходных веществ (1)
и продуктов реакции (2).
состоянии равновесия химическое
взаимодействие между веществами
не прекращается, одновременно про-
текают прямая и обратная реакции,
причем за единицу времени образу-
ется такое же количество продук-
тов реакции, сколько превращается
в исходные вещества, в результате
чего концентрации веществ, участву-
ющих в равновесии, остаются посто-
янными.
Равновесный состав химической!
системы зависит от внешних усло-
вий (температуры, давления) и кон-
центраций веществ, введенных в си-
стему. При их изменении равновес-
ный состав также изменяется, т. е.
равновесие смещается в сторону
прямой или обратной реакции.
Зависимость между равновесны-
ми концентрациями веществ, участвующих в равновесии, вы-
ражается константой равновесия (Л), которая для реакции,
записанной в общем случае
йА 4- ЬВ + . . . тМ nN + ... .
имеет вид
[М]'" |N1” . .
[А]” [В]". . . ’
где символы веществ, взятые в квадратные скобки, означают
их равновесные концентрации. В это уравнение входят концент-
рации только тех участников равновесной системы, у которых в
ходе реакции концентрации могут меняться. Твердые вещества,
а также растворитель (если раствор разбавленный п потому кон-
центрация растворителя при протекании реакции практически
постоянна) в уравнение константы равновесия не вводятся.
Численная величина константы равновесия зависит от тем-
пературы, но не зависит от концентраций веществ в равновес-
ной системе. Последнее означает, что при изменении концент-
рации одного из участников равновесной системы концентрации
других его участников меняются за счет протекания реакции
в ту или иную сторону таким образом, что величина константы
равновесия остается постоянной. Это правило действует доста-
точно точно при небольших концентрациях веществ. При вы-
соких концентрациях по причинам, которые мы не будем здесь
40
рассматривать, величина константы равновесия может не-
сколько меняться в зависимости от концентрации веществ.
Характер смещения равновесия при изменении условий опи-
сывается принципом Ле Шателье (1884 г.). Суть его заключа-
ется в следующем: если на систему, находившуюся в состоя-
нии равновесия, оказано внешнее воздействие (изменены тем-
пература, давление, добавлены или выведены из системы неко-
торые количества веществ), то в системе происходит сдвиг
равновесия (п соответственно изменение равновесного соста-
ва) в направлении, ослабляющем это воздействие.
Рассмотрим действие этого принципа подробнее. При по-
вышении температуры (при получении системой дополнитель-
ной энергии) равновесие экзотермической реакции смещается
в сторону увеличения концентрации исходных веществ, а рав-
новесие эндотермической реакции — в сторону увеличения кон-
центрации продуктов реакции, т. е. в обоих случаях — в на-
правлении эндотермического процесса, при котором частично,
поглощается дополнительная энергия. Напротив, при пониже-
нии температуры равновесие смещается в сторону экзотерми-
ческой реакции.
В реакциях с участием газообразных веществ при повыше-
нии давления (и, следовательно, увеличении числа молекул в
единице объема) равновесие смещается в сторону уменьшения
числа молей газа (уменьшается число молекул в единице объе-
ма. что при постоянном объеме соответствует понижению дав-
ления). И наоборот, при понижении давления равновесие сме-
щается в сторону увеличения числа молей газа (увеличивается
объем, занимаемый газом при постоянном давлении).
Если в реакции участвуют только конденсированные фазы
(твердые вещества и жидкости), то влияние давления на рав-
новесие подчиняется тем же закономерностям: при повышении
давления равновесие смещается в сторону преимущественного-
протекания того процесса, который сопровождается уменьше-
нием объема. Однако, так как при изменении давления объем
твердых и жидких веществ меняется несравненно меньше, не-
жели объем газов, то и заметного смещения равновесия в слу-
чае жидких и твердых веществ можно достичь лишь при очень
высоких давлениях.
Увеличение концентрации одного из исходных веществ пу-
тем ввода в систему дополнительного количества этого веще-
ства смещает равновесие в сторону образования продуктов-
реакций (расходуется часть дополнительно введенного вещест-
ва), а повышение концентрации одного из продуктов — в сто-
рону образования исходных веществ. Напротив, уменьшение
концентрации одного из реагирующих веществ ведет к смеще-
нию равновесия в сторону обратной реакции, а уменьшение
концентрации одного из продуктов — к смещению равновесия в
сторону прямой реакции.
4Г
Отсюда следует, что, вводя избыток тою или иного участ-
ника равновесной системы или отбирая какое-то вещество из
системы, можно управлять выходом продуктов реакции. Этим
широко пользуются на практике.
Вернемся к схематической реакции, приведенной на с. 39.
Пусть, например, вещество А является более ценным, чем ве-
щество В, и потому желательно возможно полнее превратить
А з продукт реакции. Очевидно, в таком случае надо взять
избыток вещества В — тогда равновесие сместится в сторону
более полного превращения А в продукт. Если, наоборот, по
каким-то причинам мы хотим, чтобы вещество А по возможно-
сти меньше вступало в реакцию с В, надо ввести в систему
побольше вещества С или D. Таким же образом поступают,
если надо подавить образование продуктов реакции (С и D):
в систему вводят избыток вещества С (если хотят получить
меньше продукта D) или вещества D (если нужно уменьшить
образование С). Подобным приемом часто пользуются в ана-
литической химии, когда хотят, чтобы какой-то ион возможно
полнее перешел в осадок — прибавляют избыток реактива,
осаждающего этот иоп из раствора.
Конкретные примеры, в которых находит применение прин-
цип Ле Шателье, рассмотрены в разделе II, а в главе 4 более
подробно излагаются вопросы, касающиеся равновесий в вод-
ных растворах электролитов.
В заключение этого параграфа отметим, что изучение зако-
номерностей, управляющих химическим равновесием, очень
важно для понимания химии вообще. Константа равновесия —
это та характеристика химической системы, которая позволяет
судить о том, будет ли протекать та или иная химическая ре-
акция. Хотя по равновесию судят о некотором состоя-
нии химической системы, косвенно в этой информации со-
держатся сведения и о процессе, о направлении самопроизволь-
ного процесса. Дело в том, что каждый химический процесс
может идти лишь в направлении достижения состояния равно-
весия, соответствующего данным условиям. Это означает, что,
зная, каким должно быть состояние равновесия в данных усло-
виях, мы можем предсказать, в каком направлении будут про-
текать химические превращения в топ пли иной системе.
Например, для системы, состоящей из 2 моль атомов Н и
1 моль атомов О при температуре 1000°С и атмосферном дав-
лении, равновесному состоянию соответствует наличие практи-
чески только молекул Н2О, и лишь с исчезающе малой веро-
ятностью в такой системе могут появляться молекулы На, О2
или свободные атомы этих элементов. Следовательно, можно
утверждать, что при смешении 1 моль Н2 с 1/2 моль О2 в этих
условиях должна протекать реакция
н2 + 1/2 02 = Н2О,
42
которая закончится практически полным превращением исход-
ных веществ в молекулы воды.
То же самое произойдет, если привести к таким же усло-
виям, скажем, смесь 1 моль Н2, 1/2 моль О2 и 1 моль Н2О:
пойдет реакция между молекулами Н2 и О2, которая закончит-
ся практически полным их превращением в Н2О. Если при-
вести к тем же условиям 1 моль Н2О, то разложение молекул
воды, хотя и может, в принципе, происходить, но с очень ма-
лой вероятностью, поскольку равновесная концентрация Н2 и
О2 в этих условиях ничтожно мала, и потому реакция прак-
тически не пойдет.
На основании учения о химическом равновесии впервые уда-
лось объяснить и предсказать направление химических процес-
сов, научно обосновать условия для максимального выхода про-
дуктов реакций и разработать технологию таких крупнотон-
нажных производств, как синтез аммиака.
§ 4. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Скорости химических реакций, законы их протекания во
врсг'оаи изучает раздел химии, называемый химической кине-
тикой. Скорость химической реакции (у) представляет собой
изменение концентрации (С) вещества, участвующего в реак-
ции. за единицу времени (/), т. е. v-kC/M. Изменения кон-
цент ?ацнй разных веществ связаны между собой стехиометри-
л уравнением реакции, поэтому скорость реакции можно
еы, а^ать через изменение во времени концентрации любого
из веществ, входящих в уравнение реакции, как исходных, так
и конечных. При этом, независимо от того, увеличивается или
уменьшается в ходе реакции концентрация данного вещества,
скорость реакции всегда считается положительной.
Скорость реакции зависит от природы реагирующих ве-
ществ, их концентраций и внешних условий (прежде всего
от температуры). Если в реакции участвуют вещества в кон-
денсированной фазе (например, твердые), то скорость реакции
зависит также от степени их измельчения, т. е. от величины
поверхности контакта между реагирующими веществами. В ре-
акциях с участием газов на их скорость сильно влияет давле-
ние, поскольку при повышении давления увеличивается кон-
центрация газообразных веществ.
В зависимости от природы реагирующих веществ в одних
и тех же условиях, например при комнатной температуре и
атмосферном давлении, реакции могут протекать очень мед-
ленно (некоторые реакции между органическими веществами,
коррозия металлов, многие реакции между твердыми вещества-
ми) или, наоборот, очень быстро (реакции между растворами
электролитов, реакция C12-f-2HI = I2 + 2HCl). В промежуточ-
ном случае скорость реакции может быть такой, что ее легко
43
измерить в ходе короткого опыта, как, например, для реак-
ции
Н2О2 + 2 HI = 2 Н2О + 12.
Иногда скорость возможной (приводящей к состоянию равно-
весия) реакции настолько мала, что ее можно считать практи-
чески равной нулю. В таких случаях говорят, что реакция «за-
морожена» (мы уже встречались с этим термином примени-
тельно к химическому равновесию).
Для предсказания скорости реакции в тех или иных усло-
виях, а также для управления химическими процессами необ-
ходимо знать, как скорость химической реакции зависит от
условий, в которых она протекает. Изучение влияния различ-
ных факторов на скорость реакции позволяет делать выводы
и об ее механизме, т. е, о последовательности стадий, через ко-
торые протекает реакция.
Зависимость скорости реакции от концентрации
реагирующих веществ
Рассмотрение главных факторов, влияющих на скорость хи-
мических процессов, мы начнем с влияния концентрации реа-
гентов, причем вначале будем говорить о гомогенных реакци-
ях, т. е. о реакциях, протекающих в одной фазе (однородной
среде), например в газе или растворе.
Химическая реакция всегда представляет собой некоторую
перегруппировку атомов — их обмен местами, разъединение
или, наоборот, объединение отдельных атомов или групп ато-
мов в более сложные группы. Естественно, что подоб-
ные процессы могут происходить лишь при столкнове-
нии реагирующих частиц, точнее—при их сближении на ко-
роткое время на достаточное расстояние. Например, процесс
образования нодоводорода из молекулярных водорода и иода
Н2 + 12 = 2Н1
может произойти лишь при сближении молекул реагентов до
таких расстояний, на которых атомы водорода из молекулы Н2
уже смогут взаимодействовать с атомами иода из молеку-
лы 12.
Рассмотрим реакцию, протекающую за счет соударения од-
ной молекулы А с одной молекулой В. Для осуществления та-
кой реакции необходимо, чтобы молекулы А и В в некоторый
момент времени оказались одновременно в каком-то элементе
объема, имеющем молекулярные размеры. Вероятность того,
что в этом элементе объема окажется молекула А (№а), оче-
видно, пропорциональна количеству молекул в единице объе-
ма, т. е. их концентрации: WA^C,e, вероятность того, что в
44
этом же объеме окажется молекула В, пропорциональна кон-
центрации молекул В: 1Гв<^Св.
Из теории вероятности известно, что вероятность одновре-
менного осуществления двух независимых событий равна про-
изведению вероятностей каждого из этих событий. Следова-
тельно, вероятность того, что и молекула А, и молекула В ока-
жутся одновременно в одном и том же элементе объема (1^дв),
т. е. столкнутся, пропорциональна произведению -концентраций
веществ А и В:
Й >СдСв.
Соответственно и скорость реакции будет пропорциональна
произведению концентраций веществ А и В
л = /гСЛСв.
Если химическая реакция осуществляется в ходе одновре-
менного столкновения двух частиц А и одной частицы В, то,
как легко показать с помощью рассуждений, аналогичных при-
веденным выше,
с = kC~\Ca •
В общем случае зависимость скорости реакции от концен-
трации реагирующих веществ выражается так называемым ки-
нетическим уравнением, которое для реакции с участием а мо-
лекул вещества А и b молекул вещества В имеет вид
v = fe[Ap[Bp.
Здесь квадратные скобки означают молярные концентрации
веществ А и В; k — величина, называемая константой скоро-
сти реакции, зависящая от природы реагирующих веществ и от
температуры, но независящая от концентрации. Численно кон-
станта скорости равна скорости реакции в данных условиях
при концентрации реагирующих веществ 1 моль/л. Смысл ки-
нетического уравнения состоит в том, что вероятность столкно-
вения реагирующих молекул тем выше, чем больше их концен-
трации.
Следует иметь в виду, что показатели степени в кинетиче-
ском уравнении относятся не к стехиометрическому уравнению
реакции (которое, как мы знаем, показывает лишь начальное
и конечное состояния химической системы), а к реально про-
исходящим актам химического взаимодействия, осуществляю-
щимся через столкновение частиц. Поскольку чаще всего реак-
ции идут через несколько стадий, которые не отражаются сум-
марным уравнением реакции, то лишь в редких случаях пока-
затели степени в кинетическом уравнении совпадают со стехио-
метрическими коэффициентами. Например, окисление аммиака
45
кислородом описывается следующим стехиометрическим урав-
нением:
4 NH3 + 3 О2 = 2 N2 + 6 Н2О.
Но можно заранее сказать, что эта реакция не совершается
путем одновременного столкновения семи молекул — вероят-
ность такого события исчезающе мала. Поэтому, если бы урав-
нение реакции реально отражало ее механизм (т. е. последо-
вательность протекания стадий реакции), скорость реакции
была бы практически равна нулю.
Вообще в отношении реакций, у которых сумма стехиомет-
рических коэффициентов для исходных веществ больше двух
или трех, молено утверждать, что они совершаются как цепь
отдельных стадий, в каждой из которых участвуют две, мак-
симум три молекулы. Кинетическое уравнение, определяемое
из опыта, будет в этом случае относиться не к суммарному
уравнению реакции, а к гой (самой медленной) ее стадии, ко-
торая определяет скорость реакции в целом.
Даже в случае реакций, стехиометрическое уравнение кото-
рых имеет малое значение суммы коэффициентов при реагиру-
ющих веществах, такое уравнение лишь в редких случаях от-
ражает механизм процесса и показывает число реагируют,их
частиц. Редкими исключениями, когда показатели степени б ки-
нетическом уравнении соответствуют стехиометрическим ?[оэф-
фициентам, являются, например, реакции
Н2 + 12 = 2 HI,
2 NO2 = N2O4.
Они-то обычно и используются в учебном процессе для иллю-
страции зависимости скорости реакции от концентрации реаги-
рующих веществ.
В некоторых учебных пособиях приводится вывод формулы для констан-
ты равновесия через равенство скоростей прямой и обратной реакций. Дей-
ствительно, по мере протекания прямой реакции концентрации исходных ве-
ществ уменьшаются, что приводит к уменьшению скорости прямой реакции;
концентрации продуктов реакции при этом растут, поэтому скорость обрат-
ной реакции увеличивается. Когда скорости прямой н обратной реакций
сравняются, наступит состояние равновесия.
В этом рассуждении само по себе представление о том, что в состоянии
равновесия скорости прямой и обратной реакций равны, верно. Однако вы-
вод формулы для константы равновесия через равенство математических
выражений для этих скоростей, в принципе, неверен, так как показатели
степени в выражениях для скорости реакции и для константы равновесия
не обязательно одни и те же. Напротив, как мы убедились выше, чаще
всего они разные. Поэтому такой вывод формулы для константы равновесия
следует рассматривать лишь как весьма условный учебный прием, облегчаю-
щий формирование общих представлений о константе равновесия как об
общем пределе прямой и обратной реакций, нэ корректно применимый лечь
в некоторых частных случаях, о которых говорилось выше.
46
Приведенное выше кинетическое уравнение относится к го-
могенным реакциям. В гетерогенных реакциях (протекающих
на поверхности раздела двух фаз) концентрация, например,
твердого вещества, реагирующего с газом или раствором, оста-
ется постоянной, поэтому в кинетическое уравнение не входит.
В этом случае в реакцию вступают частицы твердого веще-
ства, находящиеся у поверхности, поэтому скорость реакции
зависит от величины этой поверхности и от скорости подвода
к ней реагентов, находящихся в жидкой или газовой фазе. В
результате на скорость реакции оказывают влияние степень
дисперсности твердого вещества, а также скорость дифф; л
и перемешивания.
Можно привести множество примеров влияния величины поверхнс; >i
на скорость химического процесса. Наиболее интересными в этом отношении
являются так называемые пирофорные металлы. Это тонкодисперсиые го-
рошки металлов, которые получают восстановлением или термическим раз-
ложением соединений, содержащих эти металлы, при невысоких температу-
рах, чтобы образующиеся частицы металла не спекались в более крупные
Так, разложением оксалата железа (II) при невысоких температурах полу-
чают порошок металлического железа с очень большим отношением величи-
ны поверхности частиц порошка к их массе. Если такой порошок сыпать на
воздухе с некоторой высоты, то его частицы, падая, успевают загореться
Такая способность вещества загораться на воздухе п называется пирофср-
ностью. Как известно, реакция между компактным железом и кислородом
воздуха при комнатной температуре протекает очень медленно. Однако ?а
счет большой поверхности соприкосновения металла с воздухом скоро,
реакции в начальный момент оказывается достаточно большой, чтобы значь-
тельно повысить температуру порошка. Это еще больше ускоряет реакцию,
что, в свою очередь, приводит к еще большему повышению температуры го-
рошка и т. д. В результате скорость реакции повышается настолько, что
протекает как горение.
Зависимость скорости реакции от температуры
С повышением температуры скорость реакций, как прави-
ло, возрастает. Так, при комнатной температуре в гремучем
газе практически отсутствует взаимодействие между кислоро-
дом и водородом. При 400 °C реакция идет с небольшой, но
заметной скоростью и завершается примерно через 80 дней.
При 500 °C она заканчивается за 1—2 часа, а при температу-
рах выше 600 °C происходит взрыв гремучего газа, т. е. реак-
ция протекает мгновенно.
Число, показывающее, во сколько раз возрастает скорость
реакции при повышении температуры на 10 °C, называется тем-
пературным коэффициентом скорости (у) этой реакции. Чаще
всего повышение температуры на 10 °C ускоряет реакцию в
2—3, реже в 4 раза (правило Вант-Гоффа).
Как мы видим, повышение температуры обычно приводит
к значительному увеличению скорости реакции, в то время как
число столкновений между молекулами при этом возрастает
47
лишь незначительно. Уже одно это показывает, что увеличение
скорости реакции с температурой нельзя объяснить только че-
рез увеличение числа соударении молекул. Более того, исполь-
зуя уравнения кинетической теории газов, можно подсчитать
число соударений за единицу времени для какой-то пары реаги-
рующих веществ, например для газообразных иода и водорода,
и на основании этого вычислить ожидаемую скорость реакции
.исходя из предположения, что все соударения между молеку-
лами приводят к реакции. Но в действительности скорость
реакции оказывается гораздо меньше рассчитанной величины.
Отсюда следует вывод, что для акта химического взаимо-
действия недостаточно простого столкновения молекул. При
столкновении взаимодействуют, очевидно, не все молекулы —
часть из них претерпевает упругое соударение, т. е., отталки-
ваясь друг от друга, хими-
чески не изменяется. Мы
/ знаем, что каждая молеку-
S, / г \ \ ‘,а представляет собой об-
§ / /I \ \ лако отрицательного заря-
’ // \\ да, окружающее положи-
§ // i тельно заряженные ядра.
При столкновении молекул
Пкт Е эти облака должны оттал-
киваться друг от друга. Для
Рис. 2. Распределение молекул по преодоления отталкивания
энергии. г „
требуется определенная
энергия. Поэтому, столкнув-
шись, молекулы могут прореагировать лишь в том случае, если
их энергия превышает некоторое значение, называемое энерги-
ей активации (Езкт).
Если большое количество молекул заключено в каком-то
объеме и находится при постоянной температуре, то за счет
хаотических соударений при тепловом движении запас энергии
у разных молекул будет разным. Часть молекул будет обла-
дать некоторым наиболее вероятным запасом энергии (Ew)
Количество молекул, обладающих иным запасом энергии, бу-
дет тем меньше, чем больше отклоняется их энергия от зна-
чения Ew. На рис. 2 (кривая 1) показано типичное распреде-
ление молекул по энергии при постоянной температуре.
При повышении температуры увеличивается i'w, и кривая
распределения энергии сдвигается в сторону больших энергий,
т. е. возрастает число молекул, обладающих запасом энергии, пре-
вышающим некоторое заданное значение, в том числе равным
или большим величины /Дкт (кривая 2). При этом даже не
очень большое повышение температуры и, следовательно, Ew
приводит к возрастанию во много раз доли молекул, обладаю-
щих энергией, равной или большей Езкт. Это и является при-
48
чиной быстрого увеличения скорости химических реакции при
повышении температуры.
Зависимость скорости химической реакции от температу-
ры выражается уравнением Аррениуса
k = Ae~E акт lRT,
где А — некоторый коэффициент пропорциональности, завися-
щий от природы реагирующих ве-
ществ; е — основание натуральных
логарифмов; R — газовая постоянная и
Т — абсолютная температура. Мно-
житель е“£акт RT в этом уравнении по-
казывает долю молекул, обладающих
энергией, большей или равной £акт,
от общего числа молекул (согласно
кинетической теории газов). Посколь-
ку Еакт входит в уравнение скорости
£ Г
i
исходные j
SeutecmSa
продукта
реакций
реакции в показателе степени, даже
сравнительно небольшое изменение
энергии активации приведет к резко-
му возрастанию скорости реакции.
Так. если £аКт<40 кДж/моль, то при
комнатной температуре реакция пой-
Рис. 3. Активационный барь-
ер реакции.
I — энергия активации; II —
энергетический эффект реак-
ции.
дет очень быстро; если же £акт> 150 кДж/моль, то при комнат-
ной температуре реакция будет протекать крайне медленно. На-
пример, для реакций между ионами, имеющими противополож-
ные заряды, когда не надо преодолевать сил отталкивания,
£,•< - очень мало, и такие реакции протекают практически мгно-
венно после смешения реагирующих веществ.
Температурный коэффициент скорости реакции также зави-
сит от величины энергии активации. При комнатной темпера-
туре значениям £акт 60, 90 и 120 кДж/моль соответствуют зна-
чения у 2, 3 и 4.
Энергию активации иногда сравнивают с неким энергетиче-
ским барьером («активационный барьер»), который требуется
преодолеть, чтобы стало возможным химическое взаимодейст-
вие сталкивающихся частиц. Графическое изображение его по-
казано на рис. 3. Образно говоря, энергия активации как бы
берется реагирующей системой «взаймы», а затем возвраща-
ется, суммируясь с энергетическим эффектом реакции. Если
соударяющиеся частицы обладают энергией, достаточной для
того, чтобы «взойти» на этот барьер, то они образуют неустой-
чивую группировку атомов, которую называют активированным
комплексом. Иными словами, энергия активации — это энергия,
необходимая для того, чтобы реагирующие частицы образова-
ли активированный комплекс.
Поскольку активированный комплекс обладает значитель-
ным запасом энергии (равным £акт), он неустойчив и может
4 Сс-.те.чов И. И.
49
распадаться как на исходные вещества, так и на продукты
реакции. Образуются ли продукты или исходные вещества, бу-
дет зависеть от величины константы равновесия для этой реак-
ции. В состоянии активированного комплекса химические свя-
зи в исходных частицах уже ослаблены, как бы надорваны, и
одновременно начали образовываться новые связи, хотя они не
стали еще столь прочными, как в конечных продуктах. Энер-
гия, выделяющаяся при начавшемся образовании новых свя-
зей, частично компенсирует энергию, необходимую для разрыва
старых связей, а это снижает активационный барьер. Без об-
разования активированного комплекса энергия активации бы-
ла бы большей, а скорость реакции много меньшей.
§ 5. КАТАЛИЗ
Катализом называется изменение скорости химической реак-
ции в присутствии некоторых веществ, называемых катализато-
рами. Как правило, количество катализатора очень невелико
по сравнению с содержанием реагирующих веществ. Если ре-
акция протекает под действием катализатора, то она называ-
ется каталитической. Катализ очень широко используется в
современной химической технологии.
Что же такое катализатор? Катализ — очень сложное явле-
ние, природа которого изучена не до конца, поэтому и строгое
определение катализатора дать трудно. Формально считается,
что после завершения реакции состав катализатора остается
неизменным, хотя может измениться его физическое состояние,
например, он может из компактного вещества превратиться в
порошок. По крайней мере катализатор пе входит в суммар-
ное уравнение реакции, и его количество не связано с количе-
ствами реагирующих веществ стехиометрическими соотношени-
ями. Если не считать случайных потерь (уноса порошка ката-
лизатора током реакционной смеси и т. и.), его количество по-
сле завершения реакции остается таким же, каким оно было
до ее начала, т. е., в противоположность реагирующим вещест-
вам, он не расходуется в ходе реакции. Поэтому можно дать
такое определение: катализатор — это вещество, которое влия-
ет на скорость протекания реакции и после ее окончания воз-
вращается в исходное состояние. Ускорение химических реак-
ций в присутствии катализатора происходит потому, что ката-
лизатор изменяет механизм реакции и она протекает через
стадии, каждая из которых характеризуется более низкой энер-
гией активации, чем без катализатора.
В зависимости от того, однородна или неоднородна среда,
в которой протекает каталитическая реакция, различают два
вида катализа: гомогенный и гетерогенный. При гомогенном
катализе и катализатор, и реагенты находятся в одной фазе
(однородной среде), например в газе или в растворе. При ге-
50
терогенном катализе катализатор и реагенты находятся в раз-
ных фазах, допустим, газообразная реакционная смесь про-
пускается над твердым катализатором.
Гомогенный катализ, как правило, связан с образованием
реакционноспособных промежуточных соединений. Примером
гомогенного катализа может служить окисление SO2 до SOa
(или соответственно сернистой кислоты до серной) кислородом
в присутствии оксидов азота. Механизм реакции следующий:
молекула NO легко присоединяет кислород:
NO + 1/2 О2 = NO2.
Образовавшаяся молекула NO2 может отдавать кислород на
окисление сернистого ангидрида:
SO2 + NO2 = SO3 -Г NO.
Регенерированная таким образом молекула NO присоединяет
кислород и снова участвует в окислении сернистого ангидрида
и т. д.
К гомогенному катализу можно отнести и влияние раствори-
теля на ход реакций в растворах. Обычно каталитическое дей-
ствие растворителя тем сильнее, чем более полярны его моле-
кулы. Это можно объяснить деформацией реагирующих моле-
кул под влиянием молекул растворителя, что повышает реак-
ционную способность реагирующих веществ.
При гетерогенном катализе реакция происходит на поверх-
ности катализатора, поэтому особую роль играет величина по-
верхности, а также химический состав и структура поверхност-
ного слоя катализатора. В свою очередь, структура катализа-
тора зависит от способа его приготовления, в частности от тер-
мической обработки. Наилучшими каталитическими свойства-
ми обладают катализаторы, приготовленные при возможно бо-
лее низкой температуре и имеющие несовершенную кристал-
лическую структуру. Поэтому катализаторы на базе оксидов
чаще всего получают разложением соответствующих гидрокси-
дов или малоустойчивых солей — оксалатов, нитратов и т. д.
Катализаторы на базе металлов обычно изготовляют путем
восстановления их соединений водородом. Например, часто
применяемый в качестве катализатора оксид алюминия полу-
чают обезвоживанием гидроксида при температуре не выше
400 °C. Никелевые катализаторы, используемые для реакций
гидрирования, получают восстановлением оксида никеля водо-
родом при 300 °C (если катализатор получать при более высо-
кой температуре, его активность снижается).
В механизме гетерогенного катализа большую роль играют
химическое поглощение реагирующих веществ на поверхности
катализатора (хемосорбция) и перевод их в более активное
состояние за счет деформации их молекул (так называемая
«активированная адсорбция»). Поскольку молекулы делаются
4*
51
более активными, снижается энергия активации для данного
процесса. Так, для реакции синтеза иодоводорода из простых
веществ в присутствии платины энергия активации понижает-
ся примерно в три раза по сравнению с энергией активации
тон же реакции, но без катализатора.
При гетерогенном катализе обычно каталитическим дейст-
вием обладает не вся поверхность катализатора, а лишь ее не-
значительная часть, так называемые активные центры. В поль-
зу этого говорят следующие факты. Есть вещества, известные
под названием каталитических ядов, которые, попадая на по-
верхность катализатора, «отравляют» его, т. е. выводят из
строя. Например, платиновые катализаторы отравляются соеди-
нениями мышьяка, селена, теллура. Соединения серы отравля-
ют катализатор для синтеза аммиака. Отравление катализато-
ра вызывается очень небольшим количеством каталитического
яда. достаточным для адсорбции или химического взаимодейст-
вия лишь на небольшой части его поверхности. Следовательно,
активной в отношении катализа является лишь часть поверх-
ности катализатора.
Активными центрами па поверхности катализатора являют-
ся, по-видимому, места, где нарушается однородность кристал-
лической структуры, углы, трещины на поверхности, искаже-
ния структуры, точки контакта двух фаз. Вероятно, именно
последнее обстоятельство является причиной резкого усиления
каталитической активности в результате добавления промото-
ров — веществ, которые сами по себе не ускоряют реакцию, но
активируют катализатор. Например, добавление оксида алю-
миния усиливает каталитическую активность железного ката-
лизатора для синтеза аммиака.
Гетерогенным катализом объясняется влияние на скорость
реакции материала сосуда, в котором проводится реакция. Так.
например, в платиновом сосуде реакция соединения водорода и
кислорода начинается уже при комнатной температуре.
Следует отметить, что теория гетерогенного катализа еще
недостаточно разработана, поэтому подбор катализаторов про-
изводится в значительной степени эмпирическим путем. Важ-
ную роль при этом играет электронная структура веществ на
поверхности катализатора. Каталитическим действием часто
обладают металлы, не слишком легко теряющие электроны, а
также вещества с полупроводниковыми свойствами.
Действие катализаторов (как гомогенных, так и гетероген-
ных), как правило, специфично: одно и то же вещество может
быть хорошим катализатором для одной реакции или группы
реакций, но практически не влиять на скорость других реак-
ций. Специфичностью действия катализаторов часто пользу-
ются в органической химии, когда путем правильного выбора
катализатора удается осуществить одну из нескольких воз-
можных параллельных реакций.
52
Очень высокой специфичностью действия характеризуются
ферменты.— белковые вещества, являющиеся катализаторами
биохимических процессов. Ферменты занимают промежуточное
положение между гомогенными и гетерогенными катализатора-
ми, поскольку представляют собой макромолекулы. Так, фер-
мент нитрогеназа, ответственный за фиксацию атмосферного
азота клубеньковыми бактериями, имеет молекулярную .массу
около 350 000 а.е.м. (примерно в пять раз большую, чем гемо-
глобин). В организме человека действует несколько десятков
тысяч ферментов, катализирующих специфические реакции. 3
современной биотехнологии внедряется широкое использование
иммобилизованных, закрепленных на полимерном носителе,
ферментов. Это позволяет проводить реакции по хорошо отра-
ботанной в промышленности технологин1 гетерогенного ката-
лиза.
Влияние катализатора на скорость реакции может прот.з-
ляться и в неявной форме, так как катализатором может быть
вещество, являющееся обычной примесью к реактивам. На-
пример, многие реакции, изучаемые в школе, протекают в при-
сутствии следов воды, но не идут, если пытаться проводить их
в тех же условиях, но с тщательно обезвоженными реагента-
ми. Возможно, именно с этим связано каталитическое дейст-
вие стеклянных сосудов на некоторые реакции — стекло со-
держит небольшие количества воды в разных формах. Напри-
мер, реакция между водородом и фтором в стеклянном сосуде
начинается при гораздо более низкой температуре, чем в сосу-
де из серебра. По-видимому, каждая реакция, в которой уча-
ствует реактив не очень высокой степени чистоты, в той или
иной мере каталитическая.
Иногда катализатором реакции могут быть ее же продукты.
Такое явление называется автокатализом. Например, при окис-
лении щавелевой кислоты перманганатом калия КМпО4 реак-
ция ускоряется по мере того, как в системе накапливаются
продукты реакции — ионы Мп2+, катализирующие эту реакцию.
При окислении различных веществ азотной кислотой в роли
катализатора выступает оксид азота (IV), образующийся при
восстановлении азотной кислоты. Реакция идет по следующему
механизму:
NO2 + (потерянный восстановителем) = NOT,
NOF+H+=HNO2,
HNO2 + HNO3=H2O+2NO2,
NO2 + = . .. и т. д.
Таким образом, NO2 здесь выполняет роль промежуточного
активного окислителя. Именно с присутствием в ней NO2 свя-
53
зана более сильная окислительная способность дымящей азот-
ной кислоты.
Посторонние вещества могут не только ускорять, но и за-
медлять реакции. Такое явление иногда называют отрицатель-
ным катализом, а соответствующее вещество — ингибитором
(от английского inhibit — препятствовать, сдерживать). Дей-
ствие ингибитора сводится к дезактивации либо «положитель-
ных» катализаторов, либо активных частиц реагентов и про-
межуточных продуктов, например свободных радикалов в цеп-
ных реакциях. Поскольку при этом ингибитор претерпевает
химические превращения, термин «отрицательный катализ» в
данном случае не вполне точен. Ингибиторы применяются на
практике для защиты металлов от коррозии (ингибиторы кор-
розии), для стабилизации малоустойчивых веществ (например,
пероксид водорода не разлагается гораздо дольше, если до-
бавить в него немного ортофосфата натрия) и для других це-
лен.
Какое же действие оказывает катализатор на химическую
реакцию и химическое равновесие?
Увеличить скорость реакции можно, вообще говоря, двумя
способами: повышением температуры и введением катализато-
ра. Однако влияние этих двух факторов на протекание реак-
ции и ее результат принципиально различно. Температура из-
меняет не только скорость реакции, но и состояние равновесия.
При повышении температуры будет увеличиваться скорость
реакции, но одновременно и сместится равновесие, т. е. изме-
нится равновесный состав химической системы. Поэтому, по-
вышая температуру, чтобы ускорить реакцию, мы получим по-
сле ее завершения, в принципе, иное равновесие, нежели при
более низкой температуре. И это смещение равновесия не всегда
происходит в нужную нам сторону (например, если мы повы-
шаем температуру, чтобы ускорить реакцию образования нодо-
водорода из простых веществ).
Катализатор же не изменяет величины константы равнове-
сия реакции при данной температуре. Поэтому он может уско-
рить лишь такую реакцию, которая в данных условиях прин-
ципиально возможна и без катализатора, т. е. протекает в на-
правлении от неравновесного состояния химической системы к
равновесному, но без катализатора идет слишком медленно.
Таким образом, катализатор не смещает равновесия, а влияет
лишь на скорость его установления, понижая активационный
барьер и ускоряя тем самым как прямую, так и обратную
реакцию.
Если при некоторых условиях система уже достигла состоя-
ния равновесия, то введение самого активного катализатора
(при сохранении условий неизменными) не окажет на равно-
весие никакого воздействия. Например, при комнатной темпе-
ратуре реакция водорода с кислородом принципиально воз-
54
ложна, хотя н «заморожена». Поэтому гремучий газ может в
отсутствие катализатора сохраняться при комнатной темпера-
туре неопределенно долгое время без появления сколько-ни-
будь ощутимых количеств продукта реакции — воды. С введе-
нием катализатора, например тонкодисперсной платины, реак-
ция идет со значительной скоростью и доходит до состояния
равновесия, которое при комнатной температуре и атмосфер-
ном давлении практически полностью смещено в сторону обра-
зования воды. Протекание при этих же условиях в сколько-
нибудь ощутимой степени обратной реакции невозможно: она
шла бы тогда от состояния равновесия. Значит, бессмысленно
искать катализатор, который позволил бы разлагать воду на
водород и кислород при комнатной температуре без подвода
энергии извне.
Другой пример. Использование катализатора при синтезе
аммиака позволяет проводить процесс при более низкой тем-
пературе, чем без него, при этом равновесие смешено в сторо-
ну образования продукта — равновесный состав отвечает зна-
чительной концентрации аммиака (при повышенном давле-
нии). Без катализатора скорость реакции в тех же условиях
была бы практически ничтожной.
В курсе органической химии встречаются реакции, в которых из одних
и тех же исходных веществ, используя разные катализаторы, получают раз-
ные продукты. На первый взгляд, может создаться впечатление, что катали-
затор позволяет как-то «обойти» стремление системы к равновесному состоя-
нию. Это противоречие кажущееся. В подобных случаях просто осуществля-
ется одна из нескольких, как говорят, термодинамически возможных (веду-
щих к состоянию равновесия) реакций, причел концентрация каждого про-
дукта реакции приближается к равновесной для данных условий величине.
В органической химии за счет сравнительно небольших энергетических эф-
фектов реакций в состоянии равновесия зачастую могут сосуществовать в
заметных концентрациях сразу несколько продуктов, соответствующих не-
скольким параллельно протекающим реакциям.
Не следует также забывать, что для получения различных продуктов,
во-первых, в той или иной мере изменяют условия проведения реакции, что
вызывает смещение равновесия. Во-вторых, саму технику проведения реак-
ции строят таким образом, чтобы обеспечить в ходе процесса выделение
нужного продукта из реакционной смеси (например, путем отгонки), что по-
зволяет увеличить его выход. Действительно, отбирая из реакционной смеси
один из продуктов реакции, мы тем самым нарушаем равновесие и застав-
ляем систему в ее стремлении к достижению равновесия «воспроизводить»
(в соответствии с принципом Ле Шателье) отбираемое вещество. Таким об-
разом, использование катализаторов ни в коей мере не противоречит учению
о химическом равновесии.
Упражнения к главе 2
1. Укажите, к какому типу (соединения, разложения, замещения или
обмена) относятся приведенные ниже реакции, какие из них являются окис-
лительно-восстановительными, подберите стехиометрические коэффициенты:
СаО-ЬН2О-»Са(ОН)2,
Н2+О2—► Н2О,
СаСОз СаО + СОг,
55
CuCl2+Fe-> FeCl2+Cu,
H2S+O2 —H2O+S,
Mg+HCl->H2+MgCl2,
KOH + H3PO4 K3PO4 + H2O,
K.I+Br2-»KBr+I2,
HgO —> Hg+O2,
K2SO4 + Ba (N O3) 2_ BaSO4+KNO3,
FeS2 + O2 -> SO2+Fe2O3,
Ks[Fe(CX) 6] + FeSO4 Fe3(Fe (CN)6]2 + KsSC%
2, После того как порошок магния некоторое время нагревали на Еозду-
хе, его масса увеличилась на 10% от первоначальной. Вычислите соотноше-
ние молярных количеств металла и оксида в порошке после нагрева
3. При протекании реакции образования аммиака из простых не . в
замкнутом объеме через некоторое время концентрации азота, водорода а 1-
миака оказались равными соответственно 0,02, 0,05 и 0,03 моль/л. Вг ли-
те исходные концентрации азота и водорода.
4. 2 г технического препарата едкого натра, содержавшего приметь хло-
рида натрия, растворили в воде и к полученному раствору добавили раствор
нитрата серебра до прекращения выпадения осадка. Масса осадка после про-
мывки и высушивания составила 0,287 г. Вычислите процентное содержание
хлорида натрия в препарате.
5. К раствору, содержащему 17 г нитрата серебра, прибавили 7,8 г хло-
рида бария. Какое вещество и в каком количестве останется в растворе
после образования осадка?
6. К, раствору, содержащему 41,5 г дихлорида меди, прибавили 14 г же-
лезных стружек. Как изменится масса металлических стружек после реак-
ции?
7. Какой объем (н. у.) воздуха, в состав которого входит 20% кислорода
по объему, потребуется для сжигания 1 т угля, содержащего 25% негорю-
чих примесей?
8. Вычислите процентное содержание сульфида цинка в руде, если из
110 кг этой руды можно получить 32,5 кг цинка, имеющего 5% примесей.
9. Вычислите массу препарата, содержащего 80% карбоната магния, ко-
торая потребуется для приготовления 36 г сульфата магния.
10. Хватит ли 25 л воздуха (н.у.) для полного сгорания 4 г метана?
11. Вычислите объем сернистого газа (н.у.), который можно получить
обжигом ?0 т пирита FeS2, если выход реакции составляет 80%.
12. Вычислите объем водорода (н.у.), который получится при гзанмо-
действии 6,88 г технического циика с избытком соляной кислоты, если по-
тери водорода по разным причинам составляют 10%, а цинк содержит 5%
примесей, не вытесняющих из кислоты водород.
13. Из 200 г оксида алюминия было получено 1,6 кг алюмокалиевых .-вас-
цов. Вычислите выход реакции в процентах от теоретического.
14. Электролизом 10т оксида алюминия получили 4,5 т металла. Вы-
числите выход реакции в процентах от теоретического.
15. Сколько литров газа (н.у.), на 80% состоящего из СО2, надо взять
для реакции с гидроксидом кальция, чтобы получить 30 г СаСО3?
16. Руда содержит 72% сульфида ртути (II). Сколько нужно взять руды,
чтобы получилось 150 г ртути, если выход реакции составляет 65% от тео-
ретического?
17. Сколько надо взять технического иода, содержащего 2% примесей,
чтобы получить 200г чистого иода путем сублимации (возгонки), если по-
тери при сублимации составляют 3%?
18. Можно ли получать энергию, осуществляя такой цикл: разложить
воду иа водород и кислород, затем соединить их с образованием воды,
снова разложить воду на водород и кислород, снова соединить их с обра-
зованием госы н т. д.?
19. При сжигании 72 г очень чистого графита выделилось 2360 кДж
тепла. Составьте термохимическое уравнение для реакции образования СО2
из графита и молекулярного кислорода.
20. При сжигании 1 л ацетилена (и. у.) с образованием СО2 (газ) и
Н2о (жидк.) выделяется 58,0 кДж тепла. Составьте термохимическое урав-
нение реакции горения ацетилена.
21. На основании термохимического уравнения
2Mg+O2—1223 кДж=2 MgO
вычислите, какое количество энергии выделится при сжигании 1 кг магния.
22. При соединении алюминия с кислородом выделяется 1673 кДж энер-
гии на 1 моль оксида алюминия. Сколько энергии выделится при сжига-
нии в кислороде 18 г алюминия?
23. При образовании 1 моль Н2О (жидк.) из простых веществ выде-
ляется 286 кДж энергии. Сколько энергии выделится при сжигании 1 м- во-
дорода (н.у.); при образовании 1 кг жидкой воды из простых веществ?
24. При сжигании 1 л этана, этилена или ацетилена (н. у.) с образова-
нием газообразных продуктов сгорания выделяется соответственно 64. 51 и
56 кДж тепла. Почему из этих трех газов для сварки используют нмен:-.-э
ацетилен?
25. При восстановлении 80г оксида железа (III) алюминием выделяется
426,3 кДж тепла. При сгорании 5,4 г металлического алюминия выделяется
167,3 кДж тепла. На основании этих данных, используя закон Гесса, вы-
числите энергетический эффект при образовании 1 моль оксида железа ПП).
26. Две одинаковые стеклянные ампулы заполнили оксидом азота (IV)
и запаяли. Затем одну из них поместили в кипящую воду, а другую поло-
жили на лед. Будет лн отличаться окраска вещества в двух ампулах?
27. При сливании растворов хлорида железа (III) и роданида аммония
NH4SCN появляется темно-красная окраска за счет образования соедине-
ния Fe(SCN)3. Почему окраска ослабевает при добавлении к раствору кри-
сталлов хлорида аммония?
28. Для реакции димеризации оксида азота(IV) при некоторых усло-
виях равновесные концентрации мономера и димера равны соответствен., о
0,02 и 0,05 моль/л. Вычислите константу равновесия и исходную концентра-
цию мономера, если процесс протекает при постоянном объеме.
29. При нагревании смеси азота с водородом в присутствии катализа-
тора в замкнутой системе при некоторой температуре равновесные концен-
трации участников реакции составили: [N2] = 3 моль/л, [Н2] = 9 мо.тг л,
[NH3] = 2 моль/л. Вычислите константу равновесия и исходные конпентващщ
азота и водорода.
30. Для реакции
FeO(TB.) +Н2(газ)=г*Ре(тв.) +Н2О (газ)
при некоторой температуре константа равновесия К=4. Исходная концен-
трация водорода 0,5 моль/л. Вычислите равновесные концентрации газо-
образных участников реакции, если она протекает при постоянном объеме.
31. Почему при пропускании СО2 через взвесь карбоната кальция в веде
идет реакция
СаСО3+СО2 + Н2О = Са (НСО3) 2,
а при кипячении водного раствора Са(НСО3)2 — обратная реакция?
32. Почему при восстановлении углем оксида меди образуется в осн ов-
ном СО2, а при восстановлении углем Са3(РО4)2 (в присутствии оксида
кремния) — СО?
33. Руководствуясь принципом Ле Шателье, для реакции
С(тв.) 4-2Н2(газ)—75 кДж^СН4(газ)
определите направление смещения равновесия: а) при повышении темпера-
туры; б) при понижении давления; в) при удалении водорода из реакцион-
ного пространства.
34. С повышением температуры равновесие реакции
57
2Н2(газ) +S2(ra3) = 2H2S (газ)
смещается влево Экзо- или эндотермической является эта реакция?
35. Как можно сместить вправо равновесие приведенных ниже реакций:
повышая или понижая температуру, увеличивая или уменьшая давление или
концентрацию одного из исходных веществ или продуктов реакции:
2С (тв.) +О2(газ) —221 кДж = 2С0 (газ),
25О2(газ) +О2(газ)—197 кДж=8О3(газ).
2\!О2(газ) + 113 кДж=21\Ю(газ) +О2(газ),
4НС1(газ)+О2(газ) — 114 кДж=2Н2О(газ) +2СЬ (газ)?
36. Как изменится скорость реакции между газообразными иодом и
водородом, если увеличить давление в 3 раза?
37. Во сколько раз возрастет скорость суммарной реакции
2N20s(ra3) =2N2O4(ra3) +О2(газ)
при увеличении концентрации N2O5 в 2 раза, если реакция идет через сле-
дующие стадии.
1) N2O5= N2O34-O2 (медленная),
2) N2O3 = \O2 + NO (быстрая),
3) NO+N2O5=3NO2 (быстрая),
4) 2NO2 = N2O4 (быстрая)?
38. Как изменится скорость реакции при повышении температуры от 20
до 100 °C, если температурный коэффициент скорости в данном интервале
температур равен 2?
39. Реагируют газообразные вещества А, В и С. При постоянной кон-
центрации веществ А и В удвоение концентрации вещества С приводит
к увеличению скорости реакции в 4 раза. При постоянной концентрации ве-
ществ А и С удвоение концентрации вещества В приводит к увеличению ско-
рости реакции в 2 раза. При постоянной концентрации веществ В и С удвое-
ние концентрации вещества А не сказывается иа скорости реакции. Составьте
на основании этих данных кинетическое уравнение реакции. Как изменится
скорость реакции при увеличении давления в 5 раз?
Глава 3
КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
§ 1. оксиды
Различают четыре главных класса неорганических соеди-
нений: оксиды, основания, кислоты н соли.
Оксидами называют бинарные (состоящие из двух элемен-
тов) соединении, образуемые каким-то элементом с кислородом,
причем атомы кислорода в таком соединении не связаны между
собой. Этим оксиды отличаются от пероксидов (перекисей),
супероксидов (надперекисей) и озонидов, содержащих группи-
ровки из связанных между собой атомов кислорода. В оксидах
кислород имеет степень окисления — 2.
Названия оксидов составляют из слова «оксид» и названия
элемента в родительном падеже. Если элемент проявляет в сво-
их оксидах разные степени окисления, то последняя указыва-
ется римской цифрой в скобках после символа элемента. Иног-
58
да вместо указания степени окисления элемента к слову «ок-
сид» добавляют приставку, соответствующую греческому чис-
лительному, обозначающему число атомов кислорода в форму-
ле (моно-, ди-, три-, тетра-). Употребительны также историче-
ски сложившиеся эмпирические названия оксидов. В случае
кислотных оксидов название можно производить от названия
соответствующей кислоты с добавлением слова «ангидрид».
Так, для оксида СО2 употребляют следующие названия (в пере-
численном выше порядке): оксид углерода (IV), диоксид угле-
рода, углекислый газ, угольный ангидрид.
Оксиды делят на солеобразующие и несолеобразующие. По-
следние называют также индифферентными (безразличными).
Примерами несолеобразующих оксидов являются СО, SiO,
N2O, NO. Солеобразующим оксидам, как видно из их назва-
ния, соответствуют соли. По отношению их к кислотам и осно-
ваниям солеобразующие оксиды делятся на основные, кислот-
ные и амфотерные.
Основными называют оксиды, которые взаимодействуют с
кислотами, образуя соль и воду, например:
СаО + 2 НС1 — СаС12 + Н2О.
Основным оксидам соответствуют основания, например оксиду
кальция соответствует основание Са(ОН)2-
Кислотными называют оксиды, которые взаимодействуют
с основаниями, образуя соль и воду, например:
Са(ОН)2 + СО2 = СаСО3|-гН2О.
Кислотным оксидам соответствуют кислоты, например оксиду
СО2 соответствует кислота Н2СО3.
Амфотерные оксиды обладают свойствами как основных,
так и кислотных оксидов, взаимодействуя и с кислотами, и с
основаниями. Амфотерным оксидам соответствуют амфотерные
основания. Например:
А120з + 3 H2SO4 == Al2 (SO4) з + 3 Н2О,
А120з + 2NaOH + 3 Н2О = 2 Na[AI (ОН)4].
Основные оксиды — твердые при комнатной температуре,
как правило, тугоплавкие вещества. Они образуются металла-
ми в невысоких степенях окисления (I—II). Химическая связь
в таких оксидах преимущественно ионная, в их структуре нет
отдельных молекул. Примеры основных оксидов: К2О, СаО,
FeO.
Кислотные оксиды в отличие от основных, как правило, пла-
вятся и кипят при сравнительно низких температурах, некото-
рые из них газообразны при комнатной температуре и атмос-
ферном давлении. Они образуются неметаллами (например,
СО2, Р2О5, SO3), а также металлами в высоких степенях окис-
ления (например, V2Os, СгО3, МпоО?). Химическая связь в та-
59
ких оксидах ковалентная; наиболее типичные кислотные окси-
ды состоят в конденсированном состоянии из отдельных мо-
лекул.
Если металл проявляет переменную степень окисления, то
при ее возрастании свойства его оксидов меняются от основных
к кислотным: МпО — основной оксид, МпО2—амфотерный,
Мп2От — кислотный.
Химические свойства оксидов.
1. Взаимодействие основных оксидов с водой с образова-
нием основания (если оно растворимо):
СаО + Н2О = Са(ОН)2.
Многие основные оксиды, например оксид меди, с водой непо-
средственно не взаимодействуют, однако им также соответст-
вуют основания (нерастворимые).
2. Взаимодействие основных оксидов с кислотами:
СиО + 2 НС1 = СиС12 + Н2О.
Все основные оксиды взаимодействуют с кислотами, образуя
соль и воду.
3. Взаимодействие кислотных оксидов с водой, при этом
образуются кислоты:
so3 + Н2О = H2SO4.
Некоторые кислотные оксиды, например оксид кремния, с во-
дой не взаимодействуют, однако им также соответствуют кис-
лоты.
4. Взаимодействие кислотных оксидов с основаниями:
2 КОН + СО2 = К2СО3 + Н2О.
Все кислотные оксиды реагируют со щелочами (см. ниже), об-
разуя соль и воду, но иногда такая реакция при комнатной
температуре идет очень медленно, например в случае отсяда
кремния. Очень медленно протекают реакции между кислот-
ными оксидами и малорастворпмыми основаниями.
Способы получения оксидов. 1. Во многих случаях оксиды
можно получать реакцией соединения простых веществ с кис-
лородом, чаще всего при нагревании:
С О2 — СО2 (кислотный оксид),
2 Mg + О2 = 2 MgO (основной оксид).
Оксиды некоторых элементов, например золота, нельзя полу-
чить соединением с кислородом; их получают косвенным путем
исходя из других соединений этого элемента.
2. Ряд оксидов получают термическим разложением соот-
ветствующих оснований, кислот, а также некоторых солей, на-
пример карбонатов, нитратов, оксалатов:
Си (ОН), = СиО + Н2О,
60
H2SiO3 = SiO, + Ii.>O,
CaCO3 = CaO-|-CO,.
3. Если ангидриду соответствует разлагающаяся при обыч-
ных условиях кислота или основному оксиду — разлагающееся
основание, то оксид можно получить действием кислоты или
щелочи на соответствующую соль, при этом оксид образуется
за счет разложения кислоты или основания:
К2СОз + 2 НС1 = 2 КС1 + Н2О + СО2 (кислотный оксид),
2 Ag\O3 + 2 КОН — 2 KNO3 + Н2О + Ag2O (основной оксид).
Рассмотренные выше типичные способы получения оксидов
являются универсальными. Для получения каких-то конкрет-
ных оксидов используют также более частные способы, при-
менимые к отдельным оксидам или к отдельным группам окси-
дов. Например, оксид углерода (II) получают действием угле-
кислого газа на раскаленный уголь, а серный ангидрид—окисле-
нием сернистого ангидрида кислородом в присутствии катали-
затора. Сказанное относится и к приводимым ниже типичным
способам получения оснований, кислот и средних солей.
§ 2. ОСНОВАНИЯ
Основания—соединения, состоящие из атома металла и од-
ной или нескольких гидроксогрупп (ОН). Число гидроксогрупп
основания, способных замещаться на кислотный остаток, назы-
вают кислотностью основания. Основания делят на две труп-
ПЫ. с II льные и слабые. Сильные основания хорошо раствори-
мы з воде, растворы их мылки на ощупь, разъедают кожу и
ткани, поэтому их называют еще едкими щелочами. Слабые
основания малорастворимы в воде, иногда их условно называют
нерастворимыми. Особое положение занимает раствор амми-
ака з воде, содержащий молекулы гидроксида аммония, NH4OH.
Аммиак хорошо растворим в воде, но такой раствор ведет се-
бя как сравнительно слабое основание.
Названия оснований образуются из слова «гидроксид» и на-
звания металла в родительном падеже. Если для металла ха-
рактерно более одной степени окисления, указывается и сте-
пень окисления, например: Fe(OH)3 — гидроксид железа (III).
Для некоторых оснований до сих пор употребляют устоявшиеся
названия: NaOH— едкий натр, КОН — едкое кали, Са(ОН)2—
гашеная известь.
Химические свойства оснований. 1. Действие растворимых
оснований на индикаторы (см. главу 4, § 8).
2. Все основания взаимодействуют с кислотами, образуя
соль и воду. Эти реакции называются реакциями нейтрали-
зации:
Си (ОН) 2 + H2SO4 = CuSOi + 2 Н2О.
61
3. Взаимодействие оснований с кислотными оксидами. Рас-
творимые основания взаимодействуют с кислотными оксидами,
образуя соль и воду:
2 КОН + СО2 = К2СО3 + Н2О.
4. Реакции обмена между растворимыми основаниями ц
солями, когда образуются новое основание и новая соль:
2 КОН + FeSO4 = Fe(OH)2| + K2SO4.
5. Разложение оснований при нагревании. Нерастворимые
основания при нагревании разлагаются на оксид и воду:
Си (ОН) 2 = СиОД Н2О.
Такие реакции протекают уже при небольшом нагревании, на-
пример для гидроксида меди — ниже температуры кипения
воды. Напротив, гидроксиды щелочных металлов разлагаются
лишь при очень высоких температурах.
Способы получения оснований. 1. Действие щелочных и ще-
лочноземельных металлов на воду. При этом выделяется во-
дород:
2 Na + 2 Н2О = 2 NaOH + Н2|.
2. Получение щелочей электролизом водных растворов их
солей, обычно — хлоридов (см. глава 6, §5).
3. Взаимодействие с водой основных оксидов, которым со-
ответствуют растворимые основания:
СаО + Н2О = Са(ОН)2.
4. Действие растворимых оснований на соли:
CuSO4 + 2 КОН = Cu(OH)2| + K2SO,
§ 3. кислоты
Кислотами называют сложные вещества, состоящие из ато-
мов водорода, способных замещаться атомами металла, и ато-
мов или групп атомов, называемых кислотными остатками. По
составу кислоты делят на кислородные, или кислородсодержа-
щие (например, НзРОД, и бескислородные (например, НС1).
Число атомов водорода, содержащихся в формуле кислоты
и способных замещаться на металл, называется основностью
кислоты. В зависимости от величины основности кислоты де-
лят на одноосновные (НС1), двухосновные (H2SO4) и трехос-
новные (Н3РО4). Основность кислоты может не совпадать с чи-
слом атомов водорода в ее формуле, так как не все атомы во-
дорода могут замещаться на металл. Например, фосфористая
кислота Н3РО3 двухосновна. Структурная формула этой кисло-
ты имеет вид
62
H-O\ Z/O
Н О'7 \н.
Атом водорода, присоединенный непосредственно к фосфору,,
на металл не замещается. В молекуле уксусной кислоты
СНзСООН только один из четырех атомов водорода замеща-
ется на металл, поэтому уксусная кислота одноосновная.
Таблица 1. Названия кислот и соответствующих их средним солям
кислотных остатков
Формула На 'ванне
кислоты Назвihhc кислоты «ислотного остатка
HF Фтороводородная (плавиковая) Фторид
НС1 Хлороводородная (соляная) Хлорид
нею Хлорноватистая Гипохлорит
нсю2 Хлористая Хлорит
НСЮз Хлорноватая Хлорат
НС1О4 Хлорная Перхлорат
НВг Бромоводородная Бромид
HI Иодоводородная Иодид
H2S Сероводородная Сульфид ;
HfcSOs Сернистая Сульфит
H2SO4 Серная Сульфат
HNO3 Азотная Нитрат
HNO2 Азотистая Нитрит
H3PO3 Фосфористая Фосфит
НР.Оэ Метафосфорная Метафосфат
HSPO4 Ортофосфорная (фосфорная) Ортофосфат (фос-
фат)
H4P2O7 Пирофосфорная Пирофосфат
Н2СОз \гольная Карбонат
H2SiO3 Кремниевая Силикат
НМпО4 Марганцовая Перманганат
H2CrO4 Хромовая Хромат
Н2СГ2О7 Дихромовая Дихромат
Названия бескислородных кислот составляют из названия
элемента с добавлением «-водородная», например HI — иодо-
водородная кислота. Названия кислородньщ кислот произво-
дят от названия элемента, причем, если он образует больше
одной кислородной кислоты, проявляя при этом разные степени
окисления, то в названиях этих кислот используют разные суф-
фиксы, а также приставки. Так, суффикс «-ист» употребляют
в названиях кислот, соответствующих более низкой степени
окисления элемента, образующего кислоту. Например, H2SO4—
серная кислота, H2SO3 — сернистая кислота. Названия кислот,
с которыми наиболее часто приходится иметь дело на практи-
ке, приведены в табл. 1. Для некоторых кислот употребляют
также исторически сложившиеся названия, не связанные с ка-
кой-либо строгой системой (HCN — синильная кислота, НС1 •—
соляная кислота).
63
При обычных условиях кислоты могут быть твердыми (фос-
форная), жидкими (серная) или растворами газов в воде (со-
ляная) .
Химические свойства кислот. 1. Действие растворов кислот
на индикаторы (см. главу 4, §8).
2. Взаимодействие кислот с основаниями:
НС1 + КОН = КС1 + Н2О.
3. Взаимодействие кислот с основными оксидами:
H2SO4 + MgO = MgSO4 + н2о.
4. Действие кислот на металлы. С металлами, стоящими в
ряду напряжений до водорода, растворы некоторых кислот
(например, серной и соляной) вступают в реакцию с образо-
ванием соли и водорода:
2НС1 + Fe = FeCk + H2f.
При действии азотной кислоты на металлы (в тех случаях, ког-
да не наблюдается пассивирующее действие концентрированной
НХОз на металл) также образуются соли, но (и это следует
твердо запомнить) водород не выделяется.
5. Взаимодействие кислот с солями. Растворимые в воде
кислоты вступают в реакции с солями, образуя другую кислоту
и другую соль:
2 HCI + K2SiO3 = H2SiO3| + 2 КС1.
Такие реакции протекают в соответствии с правилами, сформу-
лированными для реакций обмена (глава 2, § 2).
Способы получения кислот. 1. Взаимодействие ангидрида с
водой:
SO3 + Н2О = H2SO4.
2. Взаимодействие простого вещества с водородом (обыч-
но при повышенных температурах) с последующим растворени-
ем продукта реакции в воде — это один из способов получе-
ния бескислородных кислот:
Н2 + С12 = 2HCL
3. Реакция обмена между солью и сильной кислотой:
2 КзРО4 + 3 H2SO4 = 3 K2SO4 +2 Н3РО4,
Na2SiO3 + 2 НС1 = 2 NaCl +H2SiO3|.
Это обычный способ получения летучих, малорастворимых и
слабых кислот.
§ 4. АМФОТЕРНЫЕ ОКСИДЫ И ГИДРОКСИДЫ
Амфотерными называются оксиды и гидроксиды, проявляю-
щие как основные, так и кислотные свойства, т. е. реагирую-
•64
щие соответственно и с кислотами, и со щелочами. Амфотер-
ными свойствами обладают многие оксиды и гидроксиды. Ок-
сиды и гидроксиды алюминия, цинка и хрома (III), рассматри-
ваемые в школе как амфотерные, — это лишь наиболее типич-
ные примеры, когда и кислотные, и основные свойства прояв-
ляются в соизмеримой степени. Некоторые оксиды и гидрокси-
ды, обычно относимые к основным оксидам и основаниям, мо-
гут обнаруживать слабые кислотные свойства, что проявляется
в их реакции с концентрированным раствором щелочи или при
сплавлении с основным оксидом. Так, например, свежеосаж-
денные гидроксид меди (II) и гидроксид железа (III) раство-
ряются в концентрированных растворах щелочей. Соли, соот-
ветствующие гидроксиду железа (III) как кислоте (она назы-
вается железистой кислотой), которые в электротехнике из-
вестны под названием «ферриты», получают сплавлением
РегО3 со щелочами.
Нельзя употреблять термин «амфотерность» по отношению к металлам,
в частности к алюминию, как иногда делают абитуриенты. Металлы не про-
являют кислотно-основных свойств в том смысле, в каком мы употребляем
эти понятия в школе, и потому не могут быть амфотерными-—ими могут
быть только оксиды и гидроксиды. Кроме того, амфотерность, так же как
основной или кислотный характер, — свойство конкретного оксида (и соответ-
ствующего ему гидроксида) данного элемента: каждый оксид этого эле-
мента (а их у элемента часто бывает несколько) обладает своим набором
свойств. Так, у многих металлов оксиды проявляют амфотерные и даже
кислотные свойства, если степень окисления металла в оксиде достаточно
велика. Примером могут служить оксиды марганца, хрома. Поэтому, не го-
воря уже о неправильности применения термита «амфотерность» к элементу,
а не к его кислородному соединению, нельзя судить о кислотно-основном ха-
рактере соединений какого-то элемента лишь на основании одного из его
оксидов.
Так как амфотерные гидроксиды растворимы в растворах
щелочей, то для получения их обменной реакцией между
солью и щелочью, например
А1С1з4-ЗКОН = А1(ОН)3| +ЗКС1,
нельзя брать избыток щелочи — это приведет к растворению
амфотерного гидроксида. <
В пособиях по химии приводятся разные формулы соедине-
ний, образующихся при взаимодействии гидроксидов цинка,
алюминия и хрома (III) с растворами щелочей. Так, в случае
алюминия встречаются формулы NaAlCh, Na[Al(OH)4] и
Na3[Al(OH)6],
Здесь нет никакого противоречия — вце связано с разной
степенью гидратации этих соединений (см. главу 4) и с раз-
ным количеством щелочи, участвующей в их образовании. В
растворе в равновесии находятся разные гидратные формы
соединений, причем по мере концентрирования раствора, и тем
более его выпаривания, равновесие смещается в сторону менёе
5 Семенов И. Н.
6S
гидратированных форм. Так, если в растворах алюминатов
щелочных металлов присутствует иои [А1(ОН)4]- (при этом
еще гидратированный), то в безводном состоянии алюминаты
содержат ион А1ОГ (метаалюмийат-иои), соответствующий ме-
таалюминиевой кислоте НА1О2, т. е.
Al(OH)3 + NaOH = Na[Al(OH) J,
Na [Al (OH)4] = NaA102 -f- 2 H2O.
В присутствии избытка щелочи образуется ион [А1(ОН)6]3~,
так как гидроксид алюминия взаимодействует с едким натром
по уравнению
Al(OH)34-3NaOH = Na3[Al(OH)6].
В водных растворах солей алюминия ион А13+ гидратиро-
ван, например, до [А1 (Н2О)б]3+. Под действием щелочи эти
шесть молекул воды могут частично или полностью замещать-
ся ионами ОН-, в результате чего образуются такие ионы, как
[А1(Н2О)2(ОН)4]- или [А1(ОН)6]3~ • Если от первого из этих
ионов отнять две молекулы воды, то получится ион [А1(ОН)4]-,
а если отнять четыре молекулы воды, то получится метаалю-
минат-ион АЮ~. Таким образом, когда в случае водных раство-
ров мы пишем ион АГ1- или А1ОГ—это упрощение.
Аналогичным образом обстоит дело с продуктами взаимо-
действия оксидов и гидрооксидов хрома (III) и цинка со ще-
лочью. Например, реакцию гидроксида цинка со щелочью мож-
но записать двумя способами:
Zn (ОН) 2 + 2 КОН = K2ZnO2 + 2 Н2О,
Zn(OH)2 + 2KOH = K2[Zn(OH)4].
§ 5. СОЛ И
Солями называются соединения, состоящие из атомов ме-
талла и кислотных остатков. Соли можно рассматривать как
продукты реакции нейтрализации, когда атомы водорода кис-
лоты замещаются на атомы металла, а гидроксогруппы осно-
вания — на кислотный остаток. Если в реакции нейтрализации
участвуют многоосновная кислота и многокислотное основание,
то в зависимости от соотношения количеств кислоты и основа-
ния могут образовываться три типа солей.
Если не все атомы водорода в молекуле кислоты замеща-
ются на металл (избыток кислоты), образуется кислая соль, на-
пример:
2 H2SO4 + Cu(OH)2 = Cu(HSO4)2 + 2 Н2О.
Если не все гидроксогруппы основания замещаются на кислот-
ный остаток (избыток основания), образуется основная соль-.
66
2 Cu(OH)2 + H2SO4 = (CuOH)2SO4-f-2 H20.
Если и атомы водорода кислоты, и гидроксогруппы основания
полностью расходуются при реакции нейтрализации (образуя
воду), то получится средняя соль:
Cu(OH)2 + H2SO4 = CuSO4 + 2 Н2О.
Таким образом, кислые соли содержат атомы водорода,
способные замещаться на металл и участвовать в реакции
нейтрализации. Поэтому кислые соли могут реагировать с ос-
нованиями, превращаясь в средние соли или в другие соли с
меньшим числом атомов водорода в формуле. Например:
КН2РО4 + 2 кон = КзРО4 + 2 Н2О,
кн2ро4 + кон = к2нро4 + Н2О.
Основные соли содержат гидроксогруппы, которые могут
обмениваться на кислотный остаток и участвовать в реакции
нейтрализации. Поэтому основные соли могут реагировать с
кислотами, превращаясь в средние соли или в другие основ-
ные соли с меньшим числом гидроксогрупп в формуле:
Fe (ОН)2С1 + 2 НС1 = FeCl3 + 2 Н2О,
Fe (ОН)2С1 + НС1 = Fe(OH)Cl2 + Н2О.
Растворимость кислых солеи является промежуточной меж-
ду растворимостью соответствующей кислоты и средней соли,
а растворимость основных солей — промежуточной между
растворимостью соответствующего основания и средней соли.
При этом чем больше атомов водорода в формуле кислой со-
ли, тем ближе ее растворимость к растворимости кислоты, и
чем больше гидроксогрупп в формуле основной соли, тем бли-
же ее растворимость к растворимости основания. Примером
могут служить соли гидроксида кальция и фосфорной кислоты,
применяемые в качестве фосфорных удобрений: раствори-
мость их убывает в ряду НзРО4>Са(Н2РО4)2>СаНРО4>
>Саз (РО4) 2.
При обычных условиях соли представляют собой твердые
вещества с ионной кристаллической решеткой.
Название средней соли по международной номенклатуре
составляется из латинского названия кислотного остатка (см.
табл. 1) и названия металла в родительном падеже. Если ме-
талл проявляет переменную степень окисления, то после на-
звания металла в скобках указывают его степень окисления
(обычно римской цифрой). Например: FeCl3 — хлорид железа
(III), FeSO4 — сульфат железа (II). Для солей бескислород-
ных кислот часто употребляют названия, строящиеся по тому
же принципу, что для оксидов и вообще для бинарных (состо-
ящих из двух элементов) соединений, указывая с помощью
5»
67
греческого числительного число атомов неметалла: FeCl2—
дихлорид железа, FeCls — трихлорид железа.
Для кислых солей перед названием кислотного остатка ста-
вится приставка «гидро-», если в кислотном остатке содержит-
ся один атом водорода, и «дигидро-», — если два атома
водорода. Например: СаНРО4 — гидрофосфат кальция,
Са(Н2РО4)2— дигидрофосфат кальция.
В названия основных солей вводится приставка «гидроксо-»,
если атом металла связан с одной гидроксогруппой, и «дигид-
роксо-» — если с двумя гидроксогруппами: A1OHSO4 — суль-
фат гидроксоалюминия, [Al (OH)2]2SO4— сульфат дигидроксо-
алюминия (иначе «гидроксосульфат алюминия» и «дигидроксо-
сульфат алюминия», но это менее точные названия).
В химической литературе встречаются старые русские иазваиия солей.
Для солей кислородных кислот они состоят из прилагательного, составлен-
ного из названия кислоты (без окончания) и слова «кислый», и названия ме-
талла в именительном падеже. Например, CaSO4 — сернокислый кальций,
K2SO3 — сернистокислый калий. Старые русские названия солей бескисло-
родных кислот состоят из прилагательного, образованного от названия не-
металла, и названия металла в именительном падеже. При этом если ме-
талл, проявляющий разные степени окисления, находится в высшей степени
окисления, то прилагательное содержит суффикс «н», а если металл имеет
только одну степень окисления или находится в низшей степени окисления,
то прилагательное содержит суффикс «ист.». Например: FeCl3 —хлорное же-
лезо, FeCls — хлористое железо, К.С1—хлористый калий. От абитуриента на
вступительном экзамене по химии требуется знание международной номен-
клатуры, поэтому старую русскую номенклатуру специально выучивать ие
следует, ио полезно иметь о ией представление, чтобы не быть поставлен-
- ным в тупик, встретив ее, например, в названиях удобрений илн химических
реактивов.
Химические свойства солей. 1. Взаимодействие солей с ме-
таллами. Металлы, расположенные левее в ряду напряжений
(условно называемые более активными), могут вытеснять ме-
таллы, стоящие правее, из их солей:
Си + 2 AgNO3 = 2 Ag + Cu(NO3)2.
2. Действие кислот на соли:
ВаС12 + H2SO4 = BaSO4| + 2 НС1.
3. Действие щелочей на соли:
MgSO4 + 2 КОН = Mg (ОН) 2| + K2.SO4.
4. Взаимодействие двух солей (реакция обмена):
AgNO3 + КС1 = AgCl| +KNO3.
Способы получения средних солей. 1. Синтез из простых
веществ (так можно получить соли бескислородных кислот):
2Fe + 3Cl2 == 2FeCl3.
2. Взаимодействие основного и кислотного оксидов:
68
CaO -J- CO2 == СаСОз.
3. Действие кислоты на основной оксид:
CuO + H2SO4 = CuSO4 + Н2О.
4. Реакция нейтрализации между кислотой и основанием:
Mg (ОН) 2 + 2 НС1 = MgCl2 + Н2О.
5. Действие кислотного оксида на основание:
Са(ОН)2 + СО2 == СаСО3| + Н2О.
6. Взаимодействие соли и растворимого основания:
FeSO4 + 2 NH4OH = Fe (ОН) 2| + (NH<) 2SO4.
7. Действие кислоты на соль:
K2SiO3 + 2 НС1 = 2 КС1 + H2SiO3!.
8. Реакция обмена между двумя солями:
СаС12 + К2СО3 = СаСО3! +2 КС1.
9. Действие кислот на металлы, стоящие в ряду напряже-
ний до водорода:
Fe + 2 НС1 = FeCl2 + H2f.
10. Действие металла, стоящего левее в ряду напряжений,
на соль металла, стоящего правее в ряду напряжений:
C11SO4 + Fe — FeSO4 + Си.
Перечисленные способы получения солей являются универ-
сальными. Отдельные соли можно получать более частными
способами, например цинкаты и алюминаты — действием соот-
ветствующих металлов на щелочь, силикат кальция — дейст-
вием оксида кремния на карбонат кальция при нагревании,
соли кислородных кислот хлора — взаимодействием хлора со
щелочами, нитриты щелочных металлов — термическим разло-
жением нитратов и т. д.
Учащихся иногда пугает большое число типов реакций при
рассмотрении химических свойств и способов получения окси-
дов, оснований, кислот и солей. Однако, как нетрудно убедить-
ся, один и тот же тип реакций фигурирует в этой теме обычно
не один раз. Так, реакция между основным оксидом и кисло-
той является иллюстрацией и одного из способов получения
солей, и химических свойств как оксидов, так и кислот. Это
значительно облегчает изучение данной темы.
Генетическая связь между классами неорганических ве-
ществ. Как мы могли убедиться на приведенных выше приме-
рах, из веществ, принадлежащих к одному классу, можно, сле-
дуя некоторым правилам и типовым приемам, получить веще-
ства, принадлежащие к другим классам. Это можно изобра-
зить следующей схемой:
69
Металл Неметалл
-Г I
Основном оксид Кислотный оксид
Основание Кислота
I---------> Соль ч---------1
Таким образом, в генетической связи между классами неорга-
нических веществ можно выделить две главные линии связи,
идущие от металлов и от неметаллов, например:
Са -+ СаО ->Са (ОН)2-^Са3(РО4)2,
Р Р2О5 Н3РО4 Са3 (РО4) 2.
Помимо главных линий можно привести и другие линии. Так, мы
знаем, что соли можно получить реакцией между кислотными и основными
оксидами, реакцией кислотных оксидов с основаниями или основных окси-
дов с кислотами, а также действием кислот на металлы, расположенные в
левой части ряда напряжений. Учащиеся могут попробовать в качестве
упражнения самостоятельно выявить другие линии генетической связи между
классами неорганических соединений, используя в качестве теоретической
основы материал данной главы.
§ 6. ДВОЙНЫЕ И СМЕШАННЫЕ СОЛИ.
КРАТКИЕ СВЕДЕНИЯ О КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
Если смешать растворы, содержащие одинаковое молярное
количество сульфата алюминия и сульфата калия, а затем
упарить такой раствор, то получатся кристаллы не двух исход-
ных солей, а новой соли состава KAI (SO4) 2• 12Н2О (алюмока-
лиевые квасцы). Соли, содержащие два разных металла и один
кислотный остаток, называются двойными солями. Квасцы,
представляющие собой двойные сульфаты одновалентного ме-
талла (или аммония) и трехвалентного (железа, хрома, алюми-
ния), являются одним из наиболее характерных примеров
двойных солей, широко применяемых на практике.
Если соль содержит атомы одного металла, но разные кис-
лотные остатки, такую соль называют смешанной. Примером
может служить белильная известь Са(С1О)С1, в состав которой
входят два кислотных остатка — хлорид и гипохлорит. В вод-
ных растворах двойные и смешанные соли ведут себя как
смесь соответствующих- простых солей, например алюмокалие-
вые квасцы — как омесь сульфатов калия и алюминия.
В некоторых случаях смешение двух солей, содержащих
один кислотный остаток, приводит к образованию раствора,
проявляющего иные свойства, нежели растворы каждой из ис-
ходных солей в отдельности. Например, смесь цианида железа
(III) Fe(CN)3 и> цианида калия KCN в молярном соотношении
1:3 не дает характерных реакций на трехвалентное железо,
так как образуется новое соединение K3[Fe(CN)6], в котором
группа атомов, помещенная в квадратные скобки, связана до-
70
вольно прочно и в обменных реакциях ведет себя как единое
целое. Такне соединения называются комплексными соедине-
ниями.
В структуре комплексного соединения имеется центральный
атом, илн комплексообразователъ, в роли которого чаще всего
выступает положительный нон металла, в нашем примере
Fe3+. Центральный атом окружен некоторым количеством дру-
гих частиц (ионов, нейтральных молекул), называемых лиган-
дами. Число лигандов, окружающих центральный атом, назы-
вается координационным числом данного центрального атома
(в нашем случае центральный атом Fe окружают шесть лиган-
дов CN~, следовательно, координационное число атома Fe рав-
но 6). Лиганды составляют внутреннюю координационную сфе-
ру, или просто координационную сферу. При записи формул
комплексных соединений центральный атом и координационную
сферу часто помещают в квадратные скобки, например
[Fe(CN)6]3~. Внутренняя координационная сфера может быть
окружена еще некоторым количеством частиц, составляющих
так называемую внешнюю координационную сферу. Обычно это
ионы, компенсирующие суммарный заряд центрального атома
и лигандов (в нашем примере это ионы К+). Таким образом,
соединение в целом является электронейтральным. Именно в
виде таких ионов (в случае Ks[Fe(GN)6] в виде ионов К+ и
[Fe(CN)6]3-) комплексное соединение находится в водных ра-
створах.
Частным случаем комплексных соединений являются кристаллогидраты и
гидратированные иоиы. Гидратация иона — зто, в сущности, образование
комплексного нона, в котором лигандами служат молекулы воды. Так, фор-
мулу кристаллогидрата трихлорида хрома более точно следовало бы запи-
сывать как формулу комплексного соединения [Сг(Н2О)б]С1з. В кристалло-
гидратах вода может находиться не только во внутренней координационной
сфере, но и во внешней. Например, строение кристаллов медного купороса
можно передать следующей формулой: [Cu(H2O)4]SO4 • Н2О. Однако для про-
стоты при записи уравнений реакций в водных растворах мы изображаем
ионы металла как простые.
Практическое значение комплексных соединений исключи-
тельно велико. Комплексные соединения широко применяются
в технологических процессах. Так, например, в гидрометаллур-
гии они используются для извлечения нужных элементов из
руд. В аналитической химии их используют для переведения в
раствор, отделения и открытия тех или иных элементов. Широ-
ко применяются они и в препаративной неорганической химии.
Комплексные соединения входят в состав электролитов, из ко-
торых гальваническим путем наносятся металлические покры-
тия. Образование на поверхности металла прочной, нераство-
римой и химически стойкой пленки, состоящей из комплексных
соединений с некоторыми веществами (ингибиторы коррозии),
защищает металл от коррозионных воздействий. Комплексные
соединения служат промежуточными веществами в некоторых
71
каталитических процессах, особенно соединения переходных
металлов с органическими лигандами. Многие биохимически
активные вещества, например гемоглобин, хлорофилл, витамин
В12, гемоцианин, являются комплексными соединениями. Такие
соединения изучает бионеорганическая химия — новая область
химии.
В настоящее время химия комплексных соединений быстро
развивается.
§ 7. НАПИСАНИЕ ГРАФИЧЕСКИХ ФОРМУЛ ОКСИДОВ,
ОСНОВАНИЙ, КИСЛОТ И СОЛЕЙ
Учащиеся часто испытывают затруднения при написании
графических формул неорганических соединений, в особенности
солей. Между тем записывать графические формулы совсем не-
трудно, если хорошо усвоить несколько простых приемов их
написания. Начнем с самого простого случая.
Оксиды. Следует написать символы атомов данного элемен-
та, соединив их с символами атомов кислорода, помня, что кис-
лород двухвалентен. Если в формуле оксида имеется два ато-
ма элемента, образующего этот оксид, то один атом кислорода
соединяем сразу с двумя атомами данного элемента. Для ок-
сидов состава ЭгО, ЭО, Э2О3, ЭО2, Э2О5, ЭО3, Э2О7 и ЭО4 гра-
фические формулы соответственно будут иметь вид
Э-О-Э, Э = 0. Сн Э-О—э=о, о=э = о,
о о о
II II II
О = Э—О— Э=О, О-- Э О, О -Э-О-Э-о о=^э=о
II II И II II ’ И
О О О 0 0 о
Разумеется располагать на бумаге символы элементов не обя-
зательно точно так, как сделано выше — ведь графическая фор-
мула не передает расположения атомов в пространстве; важно
лишь сохранять последовательность соединения атомов с уче-
том их валентностей (степеней окисления). Например, форму-
лу оксида типа Э2О3 можно написать и так:
Э Э
// \
ООО.
Основания. Соединяем атомы металла с нужным числом
гидроксогрупп—О—Н. При этом следует помнить, что водород
не соединяется непосредственно с атомом металла, а связан с
ним через атом кислорода. Например:
О—Н
К—О—Н, Н—О —Са —О —Н, или Са/
о-н.
-72
Кислоты. Так как бескислородные кислоты — бинарные сое-
динения, написание их графических формул мало отличается
от написания графических формул оксидов. Надо лишь соеди-
нить символ элемента с атомами водорода, например:
н
H-Cl, \<-
н
В случае кислородных кислот атомы водорода, замещающи-
еся на металл, соединяются с атомами центрального (т. е. ха-
рактерного для данной кислоты) элемента только через атомы
кислорода. Поэтому, найдя степень окисления центрального
атома, присоединяем к нему столько гидроксогрупп, сколько
атомов водорода в молекуле, а оставшиеся атомы кислорода
присоединяем к центральному атому через двойную связь. Ес-
ли в формуле кислоты два атома центрального элемента, то их
соединяем через атом кислорода. Приведем графические фор-
мулы ортофосфорной Н3РО4 и пирофосфорной Н4Р2О7 кислот:.
/О-Н Н-Оч ZO-H
Q_p Q j-j уР О Р.
и Н' H-OZ ||ХО- Н.
хо-н о о
Соли. Поскольку соли можно рассматривать, с одной сторо-
ны, как продукты замещения атомов водорода кислоты на
атомы металла, а с другой — как продукты замещения гндрок-
согрупп основания на кислотные остатки, то для составления
графической формулы соли надо сначала написать графиче-
скую формулу кислотного остатка, которая, в свою очередь,
легко выводится из графической формулы кислоты. (Убрав из
графической формулы кислоты те атомы водорода, которые в
данной соли замещены на металл, получают графическую фор-
мулу кислотного остатка, причем его валентность равна числу
атомов водорода, замещенных на металл). Затем, "комбинируя
нужное число атомов металла и кислотных остатков, с учетом
их валентностей получают графическую формулу соли. В слу-
чае основных солей пишут атом металла с соответствующим
числом гидроксогрупп; валентность такого остатка от основа-
ния равна числу гидроксогрупп, замещенных на кислотный ос-
таток.
В качестве примера составим графические формулы сред-
ней, кислой и основной солей, образованных исходя из гидрок-
сида меди (II) и угольной кислоты. Эти соли будут иметь сле-
дующие формулы: СиСО3, Си(НСОз)з и (СиОН)гСОз. Снача-
ла, руководствуясь сказанным выше, пишем графические фор-
мулы гидроксида меди и угольной кислоты:
,О-Н Н—Оч
Си< , )С=О.
О-Н н-о/
7»
В случае средней соли остаток от основания и кислотный оста-
ток будут иметь вид
С< , \с=о.
4 —oz
Из них легко составить графическую формулу карбоната ме-
ди (II):
/О\
Си/ )С=О.
В случае кислой соли кислотный остаток
Н-Оч
,СО.
-О7
Теперь легко написать графическую формулу кислой соли: '<
Н-О,
;С=О
/0/
Си,
О,
>с=о.
Н-О'
Остаток от основания, входящий в состав основной соли,
ZO-H
Си/
Соответственно графическая формула основной соли записыва-
ется следующим образом:
/О—Н
Си/
ХОХ
О '
Си/
О—и .
Упражнения к главе 3
1. Какие оксиды можно получить термическим разложением следующих
веществ: Fe(OH)3, Mg(OH)2, H2SiO3, СаСО3, Cu(NO3)2?
2. Дайте все возможные названия следующим оксидам: Мп2О7, СгО3, NO,
N3O3, СО, СО2, SO3.
3. Дайте названия кислотам, формулы которых приведены ниже, н вы-
ведите формулы их ангидридов: Н3ВО3, H2WO4, HVO3, H2SeO3, H3AsO4,
H2SeO4.
4. При действии соляной кислоты на смесь цинка и оксида цинка мас-
сой 20 г выделилось 0,2 моль газа. Вычислите процентный состав смеси.
5. Каким количеством едкого кали можно заменить в реакции нейтрали-
зации 20 г едкого натра?
74
6. Для полной нейтрализации некоторого количества КОН потребова-
лось А граммов серной кислоты. Какое количество хлороводорода потребо-
валось бы для той же цели?
7. Как изменяются кислотно-основные свойства в следующем ряду:
Сг(ОН)2—Сг(ОН)з—Н2СгО4? Ответ проиллюстрируйте уравнениями реакций.
8. Какие из перечисленных оснований взаимодействуют с кислотами, но
не взаимодействуют со щелочами: Са(ОН)2, Mg(OH)2, Zn(OH)2, КОН,
А1(ОН)3, Ва(ОН)'2?
9. Какие из перечисленных оксидов взаимодействуют с кислотами, ио ие
взаимодействуют со щелочами: CaO, ZnO, Li2O, Р2О5, СО2, А12О3, MgO,
Сг2О3?
ГЭ. С какими из веществ, формулы которых приведены ниже, может
вступать в реакцию углекислый газ? Напишите уравнения реакций и назо-
вите продукты: HCl, О2, NO2, КОН, Н2О.
И. С какими из веществ, формулы которых приведены ниже, может
вступать в реакцию оксид магния? Напишите уравнения реакций и назовите
продукты: Ва(ОН)2. HCl, СО2, О2, HNO3.
12. С какими из веществ, формулы которых приведены ниже, может
вступать в реакцию гидроксид железа(Ш)? Напишите уравнения реакций и
назовите продукты: КС1, HCl, КОН, О2, Н2О, HNO3.
Г1 С какими из веществ, формулы которых приведены ниже, может
вступать в реакцию соляная кислота? Напишите уравнения реакций и назо-
вите продукты: Zn, ZnO, ZnCl2, HNO3, Ca(OH)2, H2SiOs, Cu, Zn(OH)Cl.
14. Почему при прибавлении к раствору КОН небольшого количества
раствора соли алюминия не образуется осадок, а при прибавлении неболь-
шого количества КОН к раствору соли алюминия — образуется?
15. В колбу с водой ввели равные масс,ы серной кислоты и едкого натра.
Какой должна быть реакция получившегося раствора: кислой, нейтральной
или щелочной?
16 Какие из перечисленных ниже веществ могут быть использованы для
поглощения водяных паров: CuO, CuSO4, CaO, Р2О5, NaCl, Fe2Os, H2SO4?
17. В раствор, содержавший 2 моль серной кислоты, добавили 2 моль
едкого натра, а затем раствор осторожно выпарили. Какая соль и в каком
колпзезтве останется?
18. Какие из перечисленных кислот могут образовывать кислые соли: со-
ляная, уксусная, сероводородная, фосфорная, иодоводородная?
19. Какие из гидроксидов перечисленных металлов могут образовывать
основные соли: железо(Ш), магний, натрий, кальций, литий, цезий?
29. Напишите уравнения реакций между соляной кислотой и карбонатом
кальция: а) при избытке соляной кислоты; б) при избытке(карбоната кальция.
21. Как превратить среднюю соль в кислую; кислую — в среднюю; сред-
нюю — в основную и основную — в кислую? Приведите примеры реакций.
22. Сколько граммов едкого кали должно прореагировать с 24,5 г фос-
форной кислоты, чтобы образовался только дигидрофосфат калия?
23. Сколько гидрофосфата калия надо прибавить к раствору, содержа-
щему 12.25 г фосфорной кислоты, чтобы после этого в растворе был только
дигидрофосфат калия?
24. Какой максимальный объем СО2 (и. у.) может поглотиться при про-
пускании его через раствор, содержащий 20 г гидроксида натрия? Количество
СО2, растворенного в воде, не учитывать.
25. Напишите графические формулы всех кислых солей, образуемых каль-
цием и фосфорной кислотой; всех основных солей, образуемых железом (III)
и серной кислотой.
26. Какой объем углекислого Газа (и. у.) можно получить из 21 г гндро-
карбоиата натрия: а) при нагревании; б) при действии сильной кислоты?
27. Напишите уравнения реакций получения солей, названия которых
приведены ниже (укажите все возможные способы): сульфат меди, карбо-
нат кальция, нитрат алюминия.
28. Раствор, содержавший 60 г едкого натра, насыщен углекислым газом,
75
полученным при действии избытка соляной кислоты на 200 г карбоната каль-
ция. Какая соль и в каком количестве образовалась?
29. Напишите уравнения реакций, соответствующих превращениям:
сульфат алюминия-> хлорид алюминия-* нитрат алюминия-* оксид-
алюминия -* алюминат калия -* гидроксид алюминия -> хлорид
гидроксоалюминия -> хлорид алюминия.
30. Могут ли одновременно находиться в растворе (или в контакте
с ним) следующие пары веществ: ортофосфат кальция и нитрат калия; гид-
роксид магния и едкий натр; оксид алюминия и соляная кислота; хлорид
бария и сульфат калия; нитрат меди и азотиач кислота; карбонат кальция и
углекислый газ; медь и соляная кислота; гидрокарбонат натрия и едкий
натр? Напишите уравнения реакций.
31. Установите формулу двойной соли, если при прокаливании 0,6120 г
ее выделилось 0,2647 г кристаллизационной воды, а остаток, состоявший из
сульфатов калия и хрома, содержал 0,1071 г сульфата калия.
32. Почему при добавлении к раствору сульфата меди водного раствора
аммиака сначала выпадает голубой осадок, а при дальнейшем прибавлении
аммиака он растворяется с образованием темно-синего раствора? Ответ под-
твердите уравнениями реакций.
33. В приведенных ниже комплексных солях назовите центральный атом,
вычислите его степень окисления и координационное число, укажите ли-
ганды и внутреннюю сферу комплекса: K[Pt (NH3) Cls], [Сг (Н2О) SCI]CI2,
Ca2[Fe(CN)e], [Cr(H2O)6]Cl3.
34. Напишите уравнения обменных реакций между K4Fe(CN)6] и CuSO<;
Na3[Co(CN)6] и FeSO4; Кз[Ре(СМ)6] н AgNO3, имея в виду, что образующие-
ся в результате реакции комплексные солн малорастворпмы в воде.
35. Используя магний, серу, воду и воздух, составьте уравнения реакций
получения возможно большего числа соединений, указав условия проведения
реакций.
Глава 4
ХИМИЯ РАСТВОРОВ
§ 1. ДИСПЕРСНЫЕ СИСТЕМЫ
Перед тем как начать рассмотрение химии растворов, вве-
дем понятие «дисперсные системы». Под последними подразу-
мевают такие физико-химические системы, в которых в какое-
то вещество, называемое дисперсионной средой, включены ча-
стицы другого вещества, называемого распределенным, или дис-
пергированным, веществом. Так как и среда, и распределенное
в ней вещество могут находиться в одном нз трех агрегатных
состояний, возможны девять типов дисперсных систем, приме-
ры которых приведены в табл. 2.
На практике наиболее часто приходится встречаться с дис-
персными системами, в которых среда — жидкость. К ним отно-
сятся такие важные природные системы, как кровь, молоко,
морская и речная вода, а также разнообразные жидкие систе-
мы, используемые в технике. Жидкие дисперсные системы ве-
дут себя по-разному в зависимости от размера частиц распре-
деленного вещества. В соответствии с этим различают взвеси,
коллоидные растворы и истинные растворы.
76
Таблица 2. Примеры девяти типов дисперсных систем
Распределен- ное вещество Дисперсионная среда
газ ЖИДКОСТЬ твердое
Газ Жидкость Твердое Воздух Туман Пыльный воздух Раствор СО2 в воде Молоко 4 Глина в воде Пеиоалюминий Мокрая древесина Многие горные породы
Если размеры распределенных частиц сравнительно велики
{больше ~ 100 нм), такие дисперсные системы называют взве-
сями. В свою очередь, взвеси делятся на суспензии и эмульсии;
в первых распределенное вещество твердое, во вторых — жид-
кое. Частицы взвесей видны невооруженным глазом или в
обычный оптический микроскоп.
Взвеси — непрочные системы. В зависимости от того, тяже-
лее или легче среды распределенное в ней вещество, частицы
последнего оседают нли, наоборот, всплывают, и дисперсная
система разрушается. Так, из взвеси глины в воде постепенно
оседают на дно сосуда частицы глнны, а на поверхности моло-
ка постепенно собираются частички жира. При прочих равных
условиях чем крупнее взвешенные частицы н чем больше раз-
ница в плотности распределенного вещества и среды, тем бы-
стрее разделяются взвеси.
Если частицы распределенного вещества имеют размеры
порядка 1 — 100 нм, такие дисперсные системы называются
коллоидными растворами, или золями. Частицы, образующие
коллоидный раствор, нельзя увидеть в обычный микроскоп, но
их можно различить в ультрамикроскопе, где свет падает сбо-
ку или сзади, в результате чего в поле зрения видны светлые
точки, соответствующие рассеянию света диспергированными
частицами. В определенных условиях коллоидные растворы мо-
гут распадаться с образованием взвесей и затем расслаиваться.
К коллоидным растворам относятся некоторые системы, играю-
щие большую роль в живой природе и в технике, например ра-
створы белков в воде, некоторые клеи и т. д.
В случае, когда диспергированное вещество распределено в
среде в виде молекул или ионов, дисперсную систему называ-
ют истинным 'раствором, или просто раствором. Истинные раст-
воры не отстаиваются и устойчивы к физическим воздействиям
(если в них прн этом не происходит химических превращений
растворенного вещества, например его взаимодействия с раст-
ворителем) и могут претерпевать лишь химическое разложе-
ние.
Вообще говоря, не существует резких границ как между ис-
тинными и коллоидными растворами, так и между коллоидны-
ми растворами и взвесями. Например, прн последовательной
77
полимеризации органических веществ можно наблюдать посте-
пенный переход от истинных к коллоидным растворам.
§ 2. ОБЩАЯ ХАРАКТЕРИСТИКА РАСТВОРОВ
Итак, под растворами в узком смысле обычно подразумева-
ют истинные растворы, чаще всего — жидкие. Хотя на практике
мы постоянно имеем дело с растворами, дать строгое опреде-
ление раствора отнюдь не просто, поскольку часто к растворам
относят системы, значительно различающиеся по своей приро-
де и свойствам. Условимся называть раствором гомогенную
систему, состоящую из двух и более компонентов (исходных
индивидуальных веществ).
В случае двухкомпонентных растворов одни из компонентов
является растворителем, а другой — растворенным веществом.
Обычно считают растворителем тот компонент, который при
данных условиях в чистом виде находится в том же агрегат-
ном состоянии, что и раствор. Например, если к воде добавлен
хлорид натрия, то его мы считаем растворенным веществом, а
воду—растворителем. Если же оба компонента в чистом виде
находятся в одинаковом агрегатном состоянии, то растворите-
лем называют вещество, присутствующее в большем количест-
ве. В случае систем, состоящих из трех и более компонентов,
говорят о наличии одного растворителя и нескольких раство-
ренных веществ (раствор нескольких солей в воде) или сме-
шанного растворителя (например, в химии иногда применяют-
ся водно-спиртовые или водно-ацетоновые растворы).
В школе изучаются главным образом водные растворы, ко-
торые можно определить как гомогенные системы, в которых
молекулы или ноны растворенного вещества распределены меж-
ду молекулами воды. При этом следует помнить, что раствор
даже одного вещества в воде — сложная система, имеющая оп-
ределенную структуру.
Некоторые закономерности поведения растворов, например
изменение температуры кипения и замерзания растворов с
концентрацией, можно объяснить, считая растворы простой ме-
ханической смесью частиц разных сортов. Однако далеко не
все в поведении растворов объясняется таким образом. Многие
свойства растворов возможно понять лишь исходя из представ-
ления о них, как о химических системах. Таким образом, пра-
вильнее считать растворы системами, промежуточными между
механическими смесями и химическими соединениями.
Действительно, с одной стороны, растворы сближает с ме-
ханическими смесями то, что для их образования не требуется
определенного стехиометрического соотношения между количе-
ствами растворенного вещества и растворителя. Кроме того,
растворы сравнительно легко могут быть разделены на кампо-
78
ренты с помощью простых физических операций (перегонка,
кристаллизация).
С другой стороны, как и в случае химических соединений,
образование растворов сопровождается энергетическими эффек-
тами. Это, а также другие легко наблюдаемые явления указы-
вают на то, что при образовании растворов имеет место взаи-
модействие растворенного вещества с растворителем. Во мно-
гих случаях, растворив какую-то соль в воде, а затем выпарив
раствор, мы получаем кристаллы не исходной соли, а ее соеди-
нение с водой — кристаллогидрат (см. ниже). Трудно предпо-
ложить, что такое соединение с растворителем образовалось
только при выпаривании раствора (прн уменьшении концентра-
ции растворителя), а не существовало в растворе (при большей
концентрации растворителя).
Растворение часто сопровождается изменением цвета веще-
ства. Так, безводный сульфат медн бесцветен, а его водные ра-
створы и образующийся при их выпаривании кристаллогидрат —
синие. Другой пример. Пары иода (иод в виде газа, состоящего
из отдельных молекул) имеют фиолетовый цвет. Очевидно, та-
кой же цвет должны были бы иметь его растворы, если бы в
них иод находился в виде свободных молекул. Однако цвет
растворов иода в разных растворителях разный: в тетрахлори-
де углерода — фиолетовый, как у паров иода, в бензоле — тем-
но-красный, в этиловом спирте — коричневый. Окраска веще-
ства зависит от того, какие кванты видимого света оно погло-
щает, а это, в свою очередь, определяется состоянием элект-
ронной оболочки атомов. Если окраска растворов нода в общем
случае отлична от той, какая присуща самим молекулам иода,
значит, при растворении иода меняется состояние электронов
в его молекулах, т. е. имеет место химическое взаимодействие.
Наконец, как и соединения, растворы гомогенны по составу
и свойствам.
Следовательно, растворы — это не просто смеси веществ, а
сложные физико-химические системы, в которых имеет место
взаимодействие между частицами растворенного вещества и
растворителя. Соответственно растворение—не простое меха-
ническое смешивание веществ, а сложный физико-химический
процесс. Такая точка зрения на растворы, как на результат
химического взаимодействия между растворителем и раство-
ренным веществом, была сформулирована Д. И. Менделеевым
и его учениками и получила название химической, или гидрат-
ной, теории растворов. Растворам Д. И. Менделеев дал следу-
ющее определение: «Растворы представляют жидкие диссоциа-
ционные системы, образованные частицами растворителя, ра-
створенного тела и тех определенных нестойких, но экзотерми-
ческих соединений, которые между ними происходят, одного
или нескольких, смотря по природе составляющих начал»
(3887). ч
79
§ 3. СОЛЬВАТЫ И ГИДРАТЫ
По современным представлениям в растворах имеются более
или менее прочные соединения между частицами (молекулами
или ионами) растворенного вещества и растворителя. В общем
случае они называются сольватами, а в частном случае водных
растворов — гидратами. Соответственно процесс образования
соединений между частицами растворенного вещества и раство-
рителя называется сольватацией (для любых растворов) или
-гидратацией (для водных растворов). Одновременно в растворе
могут сосуществовать разные формы сольватов, так же как и
разные агрегаты из частиц растворителя, находящиеся между
собой в равновесии. Это равновесие определяется концентраци-
ей растворенного вещества и температурой.
Устойчивость сольватов и гидратов может быть различной.
В одних случаях при выделении растворенного вещества из ра-
створа (путем упаривания или охлаждения последнего) соль-
ваты разлагаются, в других они настолько устойчивы, что мо-
гут выделяться из раствора в кристаллическом состоянии. Кри-
сталлы, в состав которых входят молекулы растворителя, назы-
ваются кристаллосольватами, а если растворителем является
вода — кристаллогидратами. Вода, входящая в состав кристал-
логидратов, называется кристаллизационной.
Вот несколько кристаллогидратов, с которыми, часто прихо-
дится иметь дело на практике: FeSO4-7H2O (железный купо-
рос), CaSO4-2H2O (гипс), CuSO4-5H2O (медный купорос),
MgSO4-7H2O (горькая соль), Na2CO3-10H2O (кристаллическая
сода), Na2SO4-10H2O (глауберова соль), Na2B4O7-ЮН2О (бу-
ра). Следует иметь в виду, что названия, шжещенные в скоб-
ках, относятся именно к кристаллогидратам; соответствующие
безводные (не содержащие кристаллизационной воды) соли име-
ют другие названия. Например, CuSO4 называют сульфатом
меди, безводный карбонат натрия — «кальцинированной содой»
(«кальцинация» означает «прокаливание»; при прокаливании
кристаллическая сода теряет кристаллизационную воду). Ино-
гда к названию безводной соли просто прибавляют слово «без-
водный», а в названии кристаллогидрата с помощью греческого
числительного указывают число молей воды, приходящихся на
моль данного вещества. Например, СаС12 — безводный хлорид
кальция, СаС12-6Н2О — гексагидрат хлорида кальция.
Кристаллогидраты в большинстве случаев представляют со-
бой соединения, в которых молекулы воды связаны донорно-
акцепторной связью с катионом, а образовавшаяся частица
(катионный аквакомплекс) электростатически притягивается к
аниону. Нетрудно видеть, что по своей химической природе
кристаллогидраты близки к комплексным соединениям. Сила
взаимодействия между ионом и полярной молекулой воды за-
висит от заряда и размера иона: чем меньше радиус иона и чем
80
выше его заряд, тем сильнее это притяжение и тем более ста-
бильным оказывается гидратированный ион (аквакомплекс).
Таким образом, состав кристаллогидратов и их устойчивость за-
висят от характера катиона и аниона.
Часто одной и той же безводной соли соответствует несколь-
ко кристаллогидратов с разным содержанием воды. Устойчи-
вость каждого кристаллогидрата зависит от температуры и
давления паров воды в окружающей атмосфере. В общем слу-
чае при повышении температуры и понижении давления паров
воды устойчивыми оказываются кристаллогидраты, все более
бедные водой. Соли многозарядных катионов, как правило, об-
разуют кристаллогидраты, устойчивые даже при температуре
кипения воды, в то время как соли с однозарядными катионами
даже при комнатной температуре кристаллизуются из раство-
ров в виде безводных солей.
Как и для любой физико-химической системы, взаимные переходы между
безводной солью и ее кристаллогидратами определяются законами, управ-
ляющими химическим равновесием. Если при какой-то температуре давление
паров воды окажется ниже, чем равновесное давление паров воды над
кристаллогидратом, этот кристаллогидрат будет неустойчив в данных усло-
виях и начнет более или менее быстро терять воду, превращаясь в кристал-
логидрат с меньшим содержанием воды (при условии, что последний устой-
чив при данной температуре и данном давлении паров воды) или в без-
водную соль. Такой процесс называют «выветриванием» кристаллогидратов.
Например, кристаллы Na2SO4-10H2O при 25 °C постепенно выветриваются на
воздухе, так как они устойчивы только при давлении паров воды выше
2,5-103 Па.
Напротив, если давление паров воды выше, чем равновесное давление
паров воды над кристаллогидратом при этой температуре, кристаллогидрат
может образовываться из безводной соли или более бедного водой кристал-
логидрата путем поглощения паров воды из окружающей атмосферы. Так,
безводный сульфат меди, представляющий собой бесцветный порошок, на
влажном воздухе делается голубым за счет образования кристаллогидрата
CuSO4-5H2O. На этом явлении основано, например, использование безводного
хлорида кальция для поглощения паров воды и осушки газов в лабора-
торной практике.
Так как потеря воды кристаллогидратом — эндотермический процесс, то,
в соответствии с принципом Ле Шателье, равновесное давление паров воды
над кристаллогидратом повышается с ростом температуры. Поэтому обычный
способ обезвоживания кристаллогидратов состоит в их нагревании, жела-
тельно при пониженном давлении. Именно так обезвоживают хлорид каль-
ция и другие вещества, чтобы использовать их затем для осушки газов.
Надо, однако, иметь в виду, что в случае кристаллогидратов некоторых
солей, особенно образованных многозарядными катионами, обезвоживание
сопровождается более или менее заметным гидролизом (см. §9 этой главы).
Так, гексагидрат хлорида алюминия при нагревании подвергается следующим
превращениям:
А1С13-6Н2О -> А1ОС1 х Н2О -* А12О3-у Н2О.
Об этом следует помнить при иаписаиии уравнений реакций получения со-
лей. Многие из реакций, которые мы пишем в учебных целях, пригодны для
получения не безводных солей, а их водных растворов. Например, нельзя
получить безводный хлорид железа(III) простым выпариванием раствора ок-
сида или гидроксида железа(Ш) в соляной кислоте.
6 Семенов И. Н. 81
§ 4. ТЕПЛОВЫЕ ЯВЛЕНИЯ ПРИ РАСТВОРЕНИИ
Образование раствора какого-то вещества, находившегося
до этого в конденсированном состоянии, можно представить се-
бе состоящим из двух этапов. На первом этапе разрушается
структура исходного вещества, т. е. разрушаются связи между
составляющими его ионами, молекулами, или полярные моле-
кулы подвергаются ионизации (см. § 7). Этот процесс требует
затраты энергии. На втором этапе образуются соединения меж-
ду частицами растворенного вещества и растворителя. Этот
процесс сопровождается выделением энергии. Суммарный энер-
гетический эффект растворения представляет собой алгебраи-
ческую сумму этих двух эффектов.
В тех случаях, когда затраты энергии на разрушение струк-
туры растворяемого вещества превышают выигрыш в энергии
за счет образования сольватов, процесс растворения оказыва-
ется эндотермическим. Так, при растворении нитрата аммония
в воде происходит сильное охлаждение образующегося раствора,
при этом на моль NH4NO3 поглощается 27 кДж тепла. Напро-
тив, если при сольватации выделяется больше энергии, чем за-
трачивается на разрушение структуры исходного вещества, про-
цесс растворения в целом оказывается экзотермическим. При
растворении в воде гидроксида калия раствор разогревается:
на моль КОН выделяется около 55 кДж тепла. Сильным разо-
греванием сопровождается и растворение серной кислоты в
воде.
§ 5. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Концентрация растворов, под которой понимают количество
растворенного вещества, содержащееся в определенной массе
или в определенном объеме раствора, является одной из глав-
ных характеристик любого раствора. В химии применяются
разные способы выражения концентрации растворов.
Процентная концентрация (или массовая доля, выраженная
в процентах) показывает количество граммов растворенного
вещества в 100 г раствора (обозначается Смасс%, или просто
С %). Таким образом,
С% = ^-100,
где — масса растворенного вещества, г; m — масса раство-
ра, г. Единица измерения—проценты, т. е. относительная вели-
чина, следовательно, процентная концентрация — величина без-
размерная. Пользоваться процентной концентрацией удобно
тогда, когда требуется знать массу растворенного вещества,
содержащуюся в данной массе раствора или в данном объеме
раствора известной плотности.
82
Молярная концентрация (См, или просто С, но с указанием
в скобках, о концентрации каких именно частиц идет речь) по-
казывает количество молей вещества в одном литре раствора.
Таким образом, молярная концентрация представляет собой
отношение молярного количества растворенного вещества к
объему раствора:
См = п/К
где п — молярное количество вещества, моль; V — объем раст-
вора, м3. Как следует из сказанного, единица измерения —
моль/м3. Но в практических целях используют обычно кратную
величину: моль/дм3, или моль/л; последнюю иногда сокращен-
но обозначают буквой М. Раствор, содержащий 1 моль раство-
ренного вещества в 1 л, называется молярным. Если раствор со-
держит иное число молей в 1 л, то это число прибавляется к
названию. Например, раствор, содержащий 0,2 моль едкого
кали в 1 л, является 0,2-молярным, и его концентрация обозна-
чается следующим образом: См = 0,2М, или С(КОН) =
=0,2 моль/л. В последнем случае в скобках указаны частицы,
количество которых измеряется в молях.
Молярной концентрацией очень удобно пользоваться тогда,
когда растворы разных веществ известной молярной концентра-
ции используются для проведения химических реакций: зная
концентрацию и объем одного раствора, легко найти объем
другого раствора известной концентрации, нужный для реакции
с первым раствором. Например, если взято 50'мл 1 М раствора
КОН, то для его нейтрализации потребуется 100 мл 0,5 М ра-
створа соляной кислоты или 50 мл 0,5 М раствора серной кис-
лоты — в этом нетрудно убедиться, подсчитав молярное коли-
чество вещества в каждом из взятых растворов и написав две
реакции нейтрализации.
Так как процентная концентрация показывает массу веще-
ства в определенной массе раствора, а молярная концентра-
ция — его количество в определенном объеме раствора, для пе-
ресчета молярной концентрации в процентную и наоборот необ-
ходимо знать плотность раствора.
В химии широко используют, особенно для газовых систем, еще два спо-
соба выражении концентрации: в молярных и объемных процентах. Поскольку
объем газа при постоянных условиях пропорционален числу молей, то при
невысоких давлениях, когда поведение газов мало отклоняется от описы-
ваемого законами для идеальных газов, эти две величины совпадают.
Молярный процент показывает долю (в процентах) молярного- количе-
ства данного вещества (п) от молярного количества всей смеси (псм), т. е.
число молей данного вещества в 100 моль смеси:
п
Смол. % 100 %-
Объемный процент показывает процентную долю объема данного веще-
ства (V), содержащуюся в общем объеме смеси (VCM), т. е. количество мл
6* 83
вещества в 100 мл смеси (или количество литров вещества в 100 л смеси):
V
^об. % — усм ’ %-
§ К. РАСТВОРИМОСТЬ И ЕЕ ЗАВИСИМОСТЬ
ОТ ВНЕШНИХ УСЛОВИЙ
Способность вещества растворяться в данном растворителе
называется растворимостью данного вещества в этом раство-
рителе. Абсолютно нерастворимых веществ не существует.
Каждой паре растворитель — растворенное вещество соответст-
вует определенное равновесное состояние, зависящее как от
природы растворителя и растворенного вещества, так и от
внешних условий. Равновесие может быть в очень сильной сте-
пени (но не абсолютно!) смещено в сторону чистых компонен-
тов, т. е. одно вещество в другом будет растворяться лишь в
ничтожно малой степени, — в этом случае мы говорим, что
данное вещество в данном растворителе практически нераство-
римо (для краткости слово «практически» обычно опускают).
Равновесие может быть сильно смещено в сторону образования
раствора, тогда компоненты раствора могут даже смешиваться
между собой в любых соотношениях. Примерами .могут слу-
жить в первом случае система золото —вода или парафин —
вода, во втором — система вода — серная кислота. Наконец,
часто встречается промежуточный случай — данное вещество в
данном растворителе растворяется в значительном, но ограни-
ченном количестве.
Мерой растворимости служит количество растворенного ве-
щества в его насыщенном растворе в данном растворителе при
определенных условиях, выражаемое либо в процентах, либо в
массовых или объемных единицах, отнесенных к 100 г или к
100 мл растворителя (соответственно г/100 г или мл/100 мл).
Наиболее часто растворимость выражают количеством граммов
растворенного вещества, образующим насыщенный раствор в
100 г растворителя при данных условиях. Эту величину назы-
вают коэффициентом растворимости, или растворимостью.
Таким образом, в учебной литературе под словом «растворимость» под-
разумевают два разных понятия. С одной с~ороны, растворимостью назы-
вают способность вещества растворяться в данном растворителе( хорошо
растворимо, мало растворимо, практически нерастворимо), т. е. свойство.
С другой стороны, растворимостью называют один из конкретных способов
количественного выражения этой способности.
По величине растворимости в данном растворителе (напри-
мер, в воде) вещества делят на хорошо растворимые (раство-
ряется более 1 гв 100 г растворителя), малорастворимые (при-
мерно от 0,01 до 1 г в 100 г растворителя) и практически не-
растворимые (растворимость менее 0,01 г на 100 г растворите-
ля). Конечно, такое деление очень условно, однако оно
«4
оказывается удобным для многих практических целей, напри-
мер при составлении учебных таблиц растворимости солей,
кислот и оснований в воде.
Растворимость зависит от природы растворяемого вещества
и растворителя, а также от внешних условий — температуры и
давления. Что касается зависимости от природы растворяемого
вещества и растворителя, то существует правило: подобное ра-
створяется в подобном. Если оперировать характеристиками мо-
лекул, то можно сказать, что вещества с малополярными или
неполярными молекулами лучше растворяются в малополярных
или неполярных растворителях. Так, газообразные при обычных
условиях вещества растворяются в органических растворите-
лях лучше, чем в воде. Вполне понятными исключениями явля-
ются аммиак и галогеноводороды, т. е. вещества с полярными
молекулами, которые лучше растворяются в воде.
В газообразных веществах взаимодействие между частица-
ми минимально. Поэтому образование смеси газов (газообраз-
ного раствора) осуществляется лишь за счет тенденции частиц
к рассеиванию в пространстве; преодоления же взаимодействия
между частицами исходных компонентов в этом случае практи-
чески не требуется. Как следствие, газы обычно смешиваются
в любых соотношениях, т. е. взаимная растворимость их неог-
раниченна. Но при очень высоких давлениях, когда плотности и
расстояния между молекулами у газов близки к соответствую-
щим величинам для жидкостей, иногда происходит расслоение
газов. Такое явление наблюдается, например, в смесях азота
с аммиаком при давлении 5-Ю8 Па и температуре 140°С.
При оценке взаимной растворимости жидкостей возможны
три случая: 1) неограниченная взаимная растворимость (на-
пример, системы серная кислота — вода, этанол — вода);
2) практическое отсутствие взаимной растворимости (бензол —
вода); 3) ограниченная взаимная растворимость (диэтиловый
эфир — вода, фенол — вода, никотин — вода).
Как и всякое физико-химическое равновесие, равновесие
между раствором и осадком, определяющее растворимость, за-
висит от температуры: если процесс растворения эндотермиче-
ский, то растворимость возрастает с повышением температуры,
если он экзотермический, то растворимость уменьшается с тем-
пературой. Так, растворение большинства солей в воде — эндо-
термический процесс, соответственно их растворимость растет
с повышением температуры. Напротив, газы обычно растворя-
ются в воде с выделением тепла (хлороводород, аммиак, водо-
род, азот, кислород), поэтому их растворимость уменьшается с
увеличением температуры.
Зависимость растворимости от давления подчиняется тем же
закономерностям, которые были сформулированы выше для
смещения физико-химического равновесия. Когда процесс раст-
ворения сопровождается уменьшением объема, повышение дав-
85
ления способствует увеличению растворимости. Больше всего
объем уменьшается при растворении газов, поэтому зависи-
мость от давления наиболее сильно выражена для газов.
Зависимость растворимости газов в жидкостях от давления
выражается' законом Генри: при постоянной температуре раст-
воримость газа пропорциональна его парциальному давлению.
Иногда закон Генри формулируют иначе: объем газа, раство-
римого в данном количестве жидкости, не зависит от давления.
Действительно, из закона Бойля — Мариотта следует, что объ-
ем, занимаемый данным количеством газа, обратно пропорцио-
нален давлению. С одной стороны, при повышении давления в п
раз во столько же раз увеличивается количество газа, раство-
римого в данном количестве жидкости, но с другой — газ сжи-
мается такжё в п раз. В результате объем (но не масса и не
молярное количество!) газа, растворимого в данном количест-
ве жидкости, остается постоянным. Если в жидкости растворя-
ется смесь газов (например, воздух), растворимость каждого
из них пропорциональна его парциальному давлению.
Как следует из сказанного выше, растворимость твердых и
жидких веществ в жидкостях мало зависит от давления, поэ-
тому на практике приходится учитывать лишь температурную
зависимость растворимости. Изображают эти зависимости в
Рис. 4. Кривые растворимости неко-
торых солей в воде.
виде так называемых кривых
растворимости. Обычно (хотя и
не всегда) растворимость твер-
дых веществ в воде увеличива-
ется с повышением температу-
ры (рис. 4). Если растворяемое
вещество образует устойчивые
в твердом состоянии гидраты,
то и безводное вещество, и
каждый из кристаллогидратов
характеризуются своей зависи-
мостью растворимости от тем-
пературы, поэтому кривая рас-
творимости имеет изломы, со-
ответствующие переходу от од-
ного равновесия твердое — раствор к другому. Примером может
служить приведенная на рис. 5 кривая растворимости сульфата
натрия в воде. Перелом на кривой при 32 °C соответствует раз-
ложению кристаллогидрата Na2SO4-10 Н2О. При более низких
температурах раствор находится в равновесии с кристаллогид-
ратом, при более высоких — с безводной солью.
Раствор, содержащий максимально возможную в данных
условиях концентрацию растворенного вещества, называется
насыщенным. В насыщенном растворе данное вещество в тех
же условиях не может больше растворяться, и раствор находит-
ся в равновесии с'избытком растворяемого вещества. Раствор,
J86
в котором концентрация растворенного вещества меньше, чем
в насыщенном (в тех же условиях), называется ненасыщенным.
При тех же условиях в нем может раствориться еще некоторое
количество вещества, следова-
тельно, ненасыщенный раствор
не находится в равновесии с
избытком растворяемого веще-
ства.
Раствор, содержащий боль-
ше растворенного вещества,
чем должно быть в насыщен-
ном растворе при тех же усло-
виях, называется пересыщен-
ным. Избыток растворенного
вещества может выделяться из
о го ад so so 1М
Рис. 5. Кривая растворимости суль-
фата натрия в воде.
пересыщенного раствора, при этом раствор становится насыщен-
ным. Таким образом, пересыщенный раствор — неустойчивая,
неравновесная система, стремящаяся перейти в равновесное со-
стояние, т. е. в состояние насыщенного, раствора. Пересыщенные
растворы иногда образуются при охлаждении растворов, насы-
щенных при более высокой температуре, если выделение избыт-
ка растворенного вещества из раствора почему-либо затруднено,
например из-за вязкости раствора или из-за сложной формы
частиц, которые должны образовывать кристаллы растворен-
ного вещества.
Так как пересыщенные растворы — метастабильные (не со-
ответствующие истинному равновесию) состояния, они имеют
тенденцию к самопроизвольному распаду, т. е. кристаллизации
избытка растворенного вещества. Кристаллизацию пересыщен-
ного раствора можно вызвать, внеся <в него кристаллик того же
вещества, которое в нем растворено. Иногда кристаллизация
начинается и при попадании в раствор пылинок, при трении
стенок сосуда под слоем раствора стеклянной палочкой, а так-
же на царапинах на стенках сосуда. Во всех этих случаях
центрами кристаллизации, от которых начинается выпадение
кристаллов, оказываются твердые поверхности, около которых
частицы растворенного вещества расположены примерно так
же, как в кристаллах, которые должны выпадать из раствора.
Образование пересыщенных растворов и их кристаллизацию
при внесении затравки легко наблюдать, например, на раство-
рах ацетата натрия или тиосульфата натрия (применяемого в
фотографии под названием «гипосульфит»).
§ 7. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Теория электролитической диссоциации
Известно, что водные растворы некоторых веществ, напри-
мер глюкозы, ацетона, почти не проводят электрический ток, в
то время как водные растворы других веществ, например пова-
ренной соли, соляной кислоты, едкого натра, напротив, хорошо
проводят электрический ток. Вещества, которые в расплаве или
в растворе проводят электрический ток, называются электро-
литами. Давно было замечено, что для растворов электролитов
наблюдаются отклонения (как позже убедились — кажущиеся)
от некоторых законов, характеризующих растворы. Так, вычис-
ленные на основании этих законов температуры замерзания и
кипения растворов электролитов соответствовали как бы завы-
шенным концентрациям растворенных веществ.
Особенности таких растворов объяснила теория электроли-
тической диссоциации С. Аррениуса. Согласно этой теории
электролиты в расплаве или в растворе подвергаются иониза-
ции (электролитической диссоциации), т. е. распадаются на
положительно и отрицательно заряженные частицы, называе-
мые ионами. Последние могут состоять как из отдельных ато-
мов (например, Са2+), так и из групп атомов с зарядом, рав-
ным или кратным заряду электрона (например, СОз-, РО1“).
Положительно заряженные ионы называются катионами, так
как под действием электрического поля они движутся к катоду,
а отрицательные — анионами, так как под воздействием элект-
рического поля они движутся к аноду.
Таким образом, вследствие электролитической диссоциации
водные растворы электролитов, во-первых, проводят электри-
ческий ток (так как в них присутствуют носители электриче-
ского заряда — ионы), и, во-вторых, в растворе увеличивается
количество частиц растворенного вещества и, следовательно, их
концентрация. Последним и объясняется отклонение свойств
раствора от свойств чистого растворителя. Например, при дис-
социации 1 моль хлорида натрия, если принять, что она проте-
кает полностью, в растворе окажется 1 моль ионов Na+ и
1 моль ионов С1. т. е. общее количество частиц растворенного
вещества окажется вдвое большим, нежели в отсутствие дис-
социации на ионы.
Электролиты можно разделить на две группы: истинные и потенциаль-
ные. Истинные электролиты — это вещества, имеющие ионную кристалличе-
скую решетку. Их расплавы содержат высокие концентрации иоиов, поэтому
и водные растворы истинных электролитов з большой степени состоят из
иоиов. К истинным электролитам относятся, например, почти все соли, а так-
же гидроксиды щелочных металлов.
Потенциальные электролиты — это вещества, образующие ионы лишь под
действием полярных молекул растворителя, например воды. К иим относятся
многие кислоты, а также органические основания. Например, электропровод-
ность серной кислоты в жидком состоянии (по сути дела, в расплаве)
очень мала, что свидетельствует об очень малой степени диссоциации ее иа
ионы. Напротив, водные растворы серной кислоты средней концентрации
хорошо проводят электрический ток, значит, разбавлеииая водой сериая кис-
лота в сильной степени диссоциирует на ионы.
С. Аррениус был сторонником так называемой «физической»
теории растворов, которая объясняла явление диссоциации на
88
ионы чисто физическими причинами (высокая диэлектрическая
проницаемость воды), не принимая во внимание специфическое
химическое взаимодействие между частицами растворенного ве-
щества и растворителя. (Полярность молекул и диэлектриче-
ская проницаемость образованного этими молекулами вещества
связаны между собой, поэтому диссоциацию электролитов в
полярном растворителе можно одинаково удачно объяснять и
через высокую диэлектрическую проницаемость растворителя,
и через полярность его молекул.)
Дальнейшее развитие представлений о растворах электро-
литов, с учетом химического взаимодействия между растворен-
ным веществом и растворителем, связано с работами Д. И. Мен-
делеева и И. А. Каблукова. По современным представлениям
диссоциация электролита в растворе сопровождается сольвата-
цией. Энергия, выделяющаяся при сольватации, частично или
даже с избытком компенсирует затраты энергии для разрыва
вещества на ионы. Таким образом, ионизация в растворе дела-
ется энергетически возможной именно благодаря сольватации.
Далее мы будем рассматривать исключительно водные ра-
створы электролитов, с которыми чаще всего приходится иметь
дело на практике. Каковы причины электролитической диссо-
циации в водных растворах? Для ответа на этот вопрос надо-
обратиться к строению молекулы воды и к особенностям жид-
кой воды как растворителя. Строение молекулы воды можно>
изобразить следующей схемой:
,бх
Нх II
-Д_
Знаки « + » и «—» около атомов водорода и кислорода означа-
ют, что на этих атомах имеется некоторый, как говорят, эффек-
тивный заряд, возникающий вследствие того, что электронные-
облака, соответствующие связи атомов водорода с атомами
кислорода, несколько сдвинуты в сторону атомов кислорода.
Таким образом, связь между атомами водорода и кислорода
полярная, а так как молекула имеет форму треугольника, то
полярность связей Н—О делает полярной и молекулу Н2О в
целом. В свою очередь, полярность молекул воды приводит к
тому, что жидкая вода имеет высокую диэлектрическую прони-
цаемость (при комнатной температуре около 80).
Роль воды при растворении истинного электролита, например-
хлорида натрия, заключается в следующем. Поскольку в кри-
сталлической решетке этого вещества уже имеются заряжен-
ные частицы, можно предположить, что на поверхности кри-
сталла будет происходить взаимодействие между этими заря-
женными частицами и полярными молекулами воды. Это взаи-
модействие может ослабить связь между ионами в решетке и
тем самым способствовать их переходу в раствор в виде гидра-
тированных ионов. При растворении хлорида натрия в раствор
8!>
будут переходить катионы Na+ и анионы С1_, причем молеку-
лы воды будут притягиваться к ионам Na+ отрицательными
концами, а к ионам С1~ — положительными. Таким образом,
вокруг каждого из ионов образуется гидратная оболочка из оп-
ределенным образом ориентированных молекул воды.
С энергетической точки зрения процесс растворения кри-
сталла хлорида натрия с образованием гидратированных ионов
Na+ и С1_ можно представить себе состоящим из двух процес-
сов: 1) превращение кристалла в свободные ионы Na+ и С1~;
2) гидратация этих ионов. Первый процесс требует затраты
энергии на разрушение кристаллической решетки, второй со-
провождается выделением энергии. Очевидно, суммарный энер-
гетический эффект представляет собой алгебраическую сумму
энергетических эффектов этих двух процессов. Большинство
солей имеют прочные кристаллические решетки, поэтому за-
трата энергии на ее разрыв оказывается большей, нежели вы-
игрыш в энергии за счет гидратации ионов, в результате боль-
шинство солей растворяется в воде эндотермически.
Если растворяющееся вещество — потенциальный электро-
лит, состоящий из более или менее полярных молекул (напри-
мер, хлороводород), взаимодействие этих молекул с полярными
же молекулами воды приведет к разрыву молекул растворяе-
мого вещества на ионы, причем этот процесс будет протекать
тем легче, чем более полярна связь в молекулах растворяемого
вещества и чем более полярны молекулы растворителя (это
естественно, так как сильнее притяжение между частицами пе-
реходящего в раствор вещества и молекулами растворителя).
Например, этиловый спирт — менее полярный растворитель,
чем вода, поэтому в спиртовых растворах ионизация раство-
ренных веществ происходит слабее, чем в водных растворах.
А в неполярных растворителях, таких, как бензол, тетрахлорид
углерода и др., ионизация растворенных веществ обычно и во-
все’не наблюдается.
Следует еще раз подчеркнуть, что ионы существуют в растворах элек-
тролитов и в отсутствие электрического тока, двигаясь в растворе хаотически,
без какого бы то ни было преимущественного направления. Под действием
же внешнего постоянного электрического поля, приложенного к раствору
электролита, в движении ионов, в целом хаотическом, появляется тем не
менее некоторое преобладающее направление, некоторая постоянная состав-
ляющая. За счет этого происходит направленный перенос зарядов через
раствор — это и есть протекание через раствор электрического тока.
Характер ионов, которые образуются при диссоциации не-
органических соединений в водных растворах, дал основание
для деления этих веществ на важнейшие классы: соли, основа-
ния, кислоты. При диссоциации соли в растворе образуются
ионы .металла и ионы кислотного остатка, при диссоциации ос-
нования — ионы металла и ионы гидроксила и при диссоциа-
ции кислоты—ионы водорода и ионы кислотного остатка.
00
Ион водорода, представляющий собой, в сущности, ядро
;атома водорода, т. е. протон, гидратируется особенно легко,
поэтому в водных растворах он существует в виде соединения
с молекулой воды, НзО+, в свою очередь гидратированного.
Такой ион называют ионом оксония, или гидроксония. Учиты-
вая сказанное, взаимодействие потенциального электролита,
например хлороводорода, с водой можно представить следую-
щим образом (см. § 3 главы 5) :
Н:д:+Н:С1:^[н:б:н] + [:9.1:] •
В большинстве случаев в уравнениях реакций с участием кис-
лот в водных растворах пишут просто Н+, чтобы не вводить
в уравнение лишнюю молекулу воды.
Итак, с позиций теории электролитической диссоциации
можно определить кислоты как соединения, дающие в водном
фастворе ионы Н+ (или Н3О+), а основания — как соединения,
дающие в водном растворе ионы ОН-.
Степень диссоциации. Константа диссоциации
Электролитическая диссоциация — равновесный процесс. Од-
новременно с ионизацией в растворе или в расплаве электроли-
та идет и обратный процесс—моляризация (соединение ионов
в молекулы). В результате в расплаве или в растворе всякого
электролита, в принципе, сосуществуют и находятся в равнове-
сии диссоциированная (ионы) и недиссоциированная (молеку-
лы) формы. Как и всякое физико-химическое равновесие, рав-
новесие между диссоциированной и недиссоциированной фор-
мами зависит от температуры, природы растворителя и раство-
ренного вещества и его концентрации. Известно, что сила
притяжения между электрическими зарядами обратно пропор-
циональна диэлектрической проницаемости среды. Так как вода
имеет диэлектрическую проницаемость, примерно в 80 раз
большую, чем вакуум, электростатическое притяжение между
ионами в водном растворе значительно слабее, чем в вакууме.
Это помогает сдвигу равновесия в сторону ионизации.
Рассмотрим теперь некоторые характеристики равновесного
состояния в условиях электролитической диссоциации, причем
для разбавленных растворов электролитов, не полностью диссо-
циирующих на ионы в таких растворах.
Для количественной' характеристики ионизации служат две
величины: степень диссоциации, т. е. отношение количества
ионизированных молекул к общему количеству молекул в раст-
воре (выражается в долях от единицы или в процентах), и
константа диссоциации, или константа равновесия процесса
диссоциации. Например, для диссоциации уксусной кислоты
как равновесного процесса
91
СНзСООН Ч* СНзСОО- + н+
константа диссоциации записывается следующим образом:
[СН,СОО-] [Н+]
Л — [CH-jCOOHJ
(в квадратных скобках — молярные концентрации соответству-
ющих веществ).
Строго говоря, в уравнение следует подставлять не концентрации, а так
называемые «активности» веществ, или эффективные концентрации, пред-
ставляющие собой произведение концентрации на «коэффициент активности»,,
который отражает различные взаимодействия между молекулами и ионами в
растворе. Но для разбавленных растворов можно с достаточной точностью
пользоваться просто величинами концентраций.
Будучи константой равновесия, константа диссоциации
электролита в растворе зависит от природы электролита и ра-
створителя, а также от температуры, но не зависит от концент-
рации раствора (для достаточно разбавленных растворов).
При разбавлении раствора числитель и знаменатель дроби
в выражении константы диссоциации должны измениться в
равное число раз — только в этом случае сохранится постоян-
ство величины константы. Но так как прн диссоциации увели-
чивается число частиц, то число сомножителей в числителе
больше, чем в знаменателе. Поэтому если в приведенном выше
примере [СНзСООН], например, уменьшится в 10 раз, то каж-
дый из сомножителей числителя, т. е. [Н+] и [СН3СОО~]Г
должен уменьшиться лишь в у 10~3 раза. Следовательно, при
разбавлении раствора концентрация недиссоциированной фор-
мы уменьшается быстрее, чем концентрация диссоциированной'
формы, иными словами, при разбавлении растворов электроли-
тов степень диссоциации последних увеличивается.
В общем случае, если электролит диссоциирует с образова-
нием только двух ионов на одну диссоциирующую частицу
(например, AB=f±A++B_), то, как следует из определения сте-
пени диссоциации, концентрация каждого из этих ионов равна
аС (где а — степень диссоциации, С—молярная концентрация
электролита в растворе), концентрация недиссоциированных
молекул равна, очевидно, (1—а) С. Подставив эти величины в
выражение для константы диссоциации, получим
К=^-
— закон разбавления Оствальда. Для не очень разбавленных
растворов, когда а мало, это уравнение превращается в следу-
ющее: К=а2С или а,=УК[С (приближенная формула закона
разбавления).
Степень диссоциации электролита можно вычислить на ос-
новании экспериментального определения отклонений свойств
раствора от свойств чистого растворителя, так как эти откло-
92
«ения пропорциональны концентрации частиц растворенного
вещества. Поскольку степень диссоциации зависит от концент-
рации раствора, а константа диссоциации — нет, последняя яв-
ляется более универсальной характеристикой электролита в
данном растворителе, чем степень диссоциации.
Электролиты делят на сильные, средней силы и слабые. Де-
ление это весьма условно. Обычно считают сильными электро-
литы, которые в 0,1 М растворе диссоциированы не менее чем
на 30%, слабыми — те, которые в этих условиях диссоциирова-
ны менее чем на 3%, промежуточное положение занимают
электролиты средней силы. В водных растворах сильными
электролитами являются почти все соли, а также сильные ки-
слоты (например, соляная, серная, азотная, хлорная) и силь-
ные основания (гидроксиды щелочных и щелочноземельных
металлов). Слабые кислоты и основания относятся к слабым
электролитам (они потому и ведут себя как слабые кислоты
.или основания, что в водном растворе образуют малые концен-
трации ионов Н+ и ОН-, определяющих соответственно кислые
или основные свойства).
Многоосновные кислоты и многокислотные основания дис-
социируют в растворе ступенчато, и каждой ступени диссоциа-
ции соответствует своя константа диссоциации. Например, для
диссоциации фосфорной кислоты
[Н*] Гн2РОг1
Н3РО4 Н+ + Н2РОГ, = 7,5-ЮЛ
1пзг'“'41
9 [Н+] [НРО1~1
П2РОГ^ Н+ +НРС) -, АГ2 = -—Д----------1-L = 6,3-К)-4;
[H2PO4-j
НРОД^ Н+ + РОД, К3 = j — 1,3-10~12.
Уменьшение величины константы от первой ступени к третьей
связано с тем, что оторвать протон становится все труднее по
мере того, как растет отрицательный заряд у образующейся
частицы.
Что произойдет, если к раствору слабого электролита при-
бавить другой, сильный электролит, содержащий один из
ионов, образующихся при диссоциации первого электролита,
например к раствору уксусной кислоты прибавить ацетат ка-
лия? Как соль СН3СООК диссоциирует в водном растворе
почти полностью. Поэтому при добавлении этой соли в раство-
ре резко возрастет концентрация ионов СН3СОО-. Чтобы при
этом величина
[СН,СОО"] [Н+]
Л-- [СН3СООН1
осталась постоянной, должна увеличиться концентрация недис-
93
социированной уксусной кислоты или должны уменьшиться
концентрации ионов Н+ и СН3СОО~. И то, и другое произой-
дет, если часть ионов Н+ и СН3СОО~ образует молекулы,
СН3СООН. Соответственно степень диссоциации СН3СООН
уменьшится. Этот пример показывает, что степень диссоциации
слабого электролита уменьшается при введении в его раствор-
ионов, одинаковых с образуемыми им самим.
Ионные уравнения реакций
Реакции между электролитами в растворах сводятся к взаи-
модействию ионов. Чтобы подчеркнуть это, при рассмотрении
реакций между электролитами в растворах пишут не молеку-
лярные, а ионные уравнения реакций — полные и сокращенные.
При написании ионных уравнений следует помнить, что не-
электролиты (например, СОо), слабые электролиты (например,
Н2О, СН3СООН), а также малорастворимые (по сравнению с
другими участниками реакции) вещества (например, AgCl)
записываются в ионных уравнениях в молекулярной форме.
Например, реакцию между водными растворами нитрата се-
ребра и хлорида калия можно записать следующим образом:
Ag+ + NO;f + К+ + Cl- = AgClj + K+ + NOT
{полное ионное уравнение реакции). Поскольку состояние
ионов К+ и NOF до и после реакции мало изменяется, можно
считать, что эти ионы не принимают участия в реакции. Тогда
их можно сократить и рассматриваемую реакцию записать в
виде сокращенного ионного уравнения-.
Ag+ + Cl- = AgCl|.
Последнее уравнение хорошо передает тот факт, что реакция
сводится к взаимодействию ионов серебра и хлора, образую-
щих осадок, независимо от того, какие именно растворимые со-
ли, содержащие эти ионы, были взяты для проведения реакции.
Рассмотрим еще два примера написания ионных уравнений:
действие серной кислоты на ортофосфат калия и действие со-
ляной кислоты на карбонат кальция. В реакции
2 К3РО4 + 3 H2SO4 = 3 K2SO4 + 2 Н3РО4
фосфорная кислота — слабый электролит, поэтому ее правиль-
нее записывать в молекулярной форме. Напротив, серная ки-
слота, а также обе соли — сильные электролиты, поэтому их
следует записывать в ионной форме. Тогда полное ионное урав-
нение реакции имеет вид
6 К+ + 2 РО4“ + 6 Н+ + 3 SO4~ = 6 К+ + 3 SO4“ 4- 2 Н3РО4,
а сокращенное ионное уравнение —
94
2 РО3Г ~г 6 Н+~ 2 Н3РО4, или РОГ + ЗН+== Н3РО4.
В реакции
СаСОз + 2 НС1 = СаС12 + Н2О + СО2|
СаСОз — малорастворимое вещество, Н2О — слабый электро-
лит, СО2 не является электролитом. Полное ионное уравнение
СаСОз + 2 Н+ + 2 С1- = Са2+ + 2 С1~ + Н2О + СО2|.
Сокращенное ионное уравнение
СаСОз + 2 Н+ = Са2+ + Н2О + CO2f
хорошо передает суть реакции: под действием кислот (т. е.
ионов Н+) карбонат кальция растворяется с образованием со-
ли кальция и выделением углекислого газа.
При написании реакций между растворами электролитов
всякий раз надо представить себе, нет ли какой-нибудь причи-
ны, мешающей реальному протеканию той или иной реакции.
Например, если раствор электролита взаимодействует с твер-
дым веществом и при этом один из продуктов малорастворим,
то реакция 'может быстро прекратиться за счет того, что на
поверхности твердого исходного вещества образуется слой тоже
твердого продукта реакции, препятствующего дальнейшему ее
протеканию. Именно поэтому для получения углекислого газа
действием кислоты на мрамор берут соляную, а не серную ки-
слоту, так как в случае серной кислоты мрамор быстро покры-
вается слоем гипса (CaSO4-2H2O) и реакция практически не
идет.
По той же причине, если требуется привести пример реак-
ции между основным оксидом и кислотой, не следует брать
оксид кальция и серную кислоту. Гораздо более удачными бу-
дут, скажем, оксид кальция и соляная кислота или оксид маг-
ния и серная кислота. Приводя пример реакции замещения
между металлом и солью менее активного металла, не следует
брать активный металл, взаимодействующий с водой, — в этом
случае помимо интересующей нас реакции пойдут и другие, в
результате чего состав продуктов усложнится.
§ 8. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
Вода — очень слабый электролит, диссоциирующий по схеме:
Н2О^Н++ОН_ (или 2Н2Оч=ьН3О++ОН_). Выражение для
константы диссоциации воды
[Н+] [ОН-]
л - [Н2О]
можно переписать и в другой форме:
Я[Н2О] = [Н+] [ОН-].
95
Так как диссоциирована лишь ничтожно малая доля от общего
числа молекул воды, концентрацию недиссоциированных моле-
кул можно считать постоянной. Поэтому произведение К [НгО]
можно представить в виде
Kw=K[H2O] = [H+][OH-].
Величина Kw называется ионным произведением воды. Как
и константа диссоциации, ионное произведение воды зависит от
температуры. При температуре около 25°C /\w=10~14.
Постоянство величины /\w требует, чтобы изменение кон-
центрации одного из ионов, на которые диссоциирует вода,
компенсировалось изменением концентрации другого иона в
противоположную сторону. На основании этого, зная концентра-
цию ионов Н+ в каком-то растворе, легко вычислить концент-
рацию ионов ОН- и, наоборот, зная концентрацию ионов ОН-,
.легко вычислить концентрацию ионов Н+:
[ОН-] = Kw/[H+]; [Н+] = Kw/[OH-].
На практике это означает, что для характеристики каккислых,
так и щелочных растворов достаточно указать концентрацию
лишь ионов водорода. Так как последняя обычно выражается чи-
слом 10 в отрицательной степени, значительно удобнее пользо-
ваться десятичным логарифмом концентрации ионов водорода,
взятым с обратным знаком;эта величина называется водород-
ным показателем (pH): рН=—lg[H+].
В чистой воде содержатся одинаковые концентрации ионов
водорода и гидроксила; при комнатной температуре [Н+] =
= [ОН-] — 10-7 моль/л. Поэтому pH чистой воды при комнат-
ной температуре равен 7. В кислой среде, где концентрация
ионов Н+ больше (а ионов ОН- меньше), чем в чистой воде,
рН<7; в щелочной среде, где концентрация ионов ОН- больше
(а ионов Н+ меньше), чем в чистой воде, рН>7. Зная pH раст-
вора, нетрудно найти концентрацию в нем ионов водорода и
гидроксила:
[Н+] = 10-рн; [ОН-] = 10-(‘4-рн).
Для приблизительного определения величины pH служат
кислотно-основные индикаторы.
Иногда ошибочно полагают, что индикатор указывает на кислую или
щелочную среду. Это не совсем так: каждый индикатор меняет окраску в
определенной области pH, разной для разных индикаторов. Поэтому неверно,
например, утверждение, что метилоранж в кислой среде красный. У этого
индикатора изменение окраски происходит в интервале pH около 3—5. При
pH 5, т. е. еще в кислой среде, метилоранж будет уже желтым, как в ще-
лочной среде. Из наиболее употребительных индикаторов лишь лакмус из-
меняет окраску как раз вблизи pH 7.
Часто употребляют универсальные индикаторы, представля-
ющие собой смеси из нескольких индикаторов, каждый из ко-
торых изменяет окраску в своей области pH. В результате сум-
96
марная окраска индикатора (Меняется в довольно широкой об-
ласти pH, т. е. универсальный индикатор имеет более широкий
диапазон применения. Индикаторы позволяют определять pH
с точностью до десятых долей от единицы. Существуют более
точные способы определения pH, основанные на использовании
специальных приборов, называемых рН-метрами.
§ 9. ГИДРОЛИЗ СОЛЕЙ
В общем случае гидролизом веществ называется их разло-
жение под действием воды, например:
СОС12+2 Н2О = Н2СО3 + 2 НС1,
C2H5ONa + Н2О = С2Н5ОН + NaOH.
Еще более общее явление — взаимодействие веществ с раство-
рителями— называют сольволизом. Здесь мы будем рассмат-
ривать только частный случай сольволиза — гидролиз солей,
понимая под этим взаимодействие соли с водой (процесс, об-
ратный нейтрализации кислоты основанием). Чтобы понять яв-
ления, которыми сопровождается гидролиз солей, используем
здесь представления о химическом равновесии.
В некоторых случаях, например при взаимодействии соля-
ной кислоты и гидроксида натрия, равновесие гидролиз — нейт-
рализация практически полностью смещено в сторону реакции
нейтрализации:
NaOH + HCl -> NaCl + Н2О.
Это происходит потому, что и соляная кислота, и гидроксид
натрия — сильные электролиты, а вода — очень слабый элект-
ролит. Ионы Н+ и ОН-, образующиеся при диссоциации HCI и
NaOH, прочно связываются в молекулы воды, в результате че-
го равновесие смещается в сторону нейтрализации этих ионов.
Поэтому при растворении хлорида натрия в воде обратная ре-
акция, т. е. гидролиз, практически не идет.
Иное дело, если соответствующее данной соли основание
или кислота (или оба вместе) является слабым или малораст-
воримым электролитом. Тогда в состоянии равновесия в раст-
воре соли будут присутствовать заметные концентрации про-
дуктов гидролиза, а в некоторых случаях произойдет даже пол-
ный гидролиз соли.
Рассмотрим типичные случаи гидролиза солей.
1. Гидролиз соли, соответствующей сильному основанию и
слабой кислоте, например СН3СООК:
СНзСООК + НОН СНзСООН + кон.
Запишем это уравнение в ионной форме, учитывая, что
СНзСООК и КОН в водном растворе как сильные электролиты
7 Семенов И. Н. §7
практически полностью диссоциированы, а СНзСООН и Н2О •—
слабые электролиты:
СНзСОО- + К+ 4-НОН =₽* СНзСООН + он- + к+.
В первом приближении можно считать, что состояние ионов К+
не изменяется в ходе реакции, т. е. гидролиз сводится к следу-
ющему:
СНзСОО- 4- НОН СНзСООН 4- он-.
Уксусная кислота — слабый электролит, но все же более силь-
ный, чем вода, поэтому между участниками реакции установит-
ся состояние равновесия, в котором концентрации молекул
СНзСООН и ионов ОН- сравнительно невелики. Тем не менее
гидролиз ацетата калия приведет к увеличению концентрации
ионов ОН- в растворе по сравнению с чистой водой; в этом
легко убедиться, измерив pH такого раствора.
Из сокращенного ионного уравнения гидролиза можно ви-
деть, что, в принципе, безразличнб, гидролизуется ли
СН3СООК или какая-то другая соль уксусной кислоты с силь-
ным основанием: фактически происходит гидролиз иона
СНзСОО-, т. е. иона, соответствующего слабой кислоте. Иными
словами, анион слабой кислоты, отняв от молекулы воды ион
водорода, присоединяет его к себе, превращаясь в молекулу
слабой кислоты, а в растворе остается ион ОН-. (Кстати, имен-
но для того, чтобы нагляднее изобразить такой процесс, в
уравнениях гидролиза удобнее записывать воду в.виде НОН.)
Итак, в результате гидролиза соли, отвечающей слабой ки-
слоте и сильному основанию, раствор приобретает щелочную
реакцию. Насколько среда будет щелочной, зависит от силы
кислоты. Так, при гидролизе цианида калия
KCN 4- НОН ч=ь КОН 4- HCN
или сокращенно:
CN- 4- НОН ОН- 4- HCN
раствор приобретает более щелочную реакцию, чем при гидро-
лизе ацетата калия, поскольку HCN — более слабая кислота,
чем уксусная. Из опыта известно, что в 0,1 М растворе KCN
гидролизован примерно на 1%, а ацетат калия — лишь на
0,01%.
2. Гидролиз соли, соответствующей слабому основанию и
сильной кислоте, например NH4C1: ч
NH4C1 4- НОН NH^OH 4- НС1
или сокращенно:
NHt 4- НОН NH4OH 4- Н+.
Из этого уравнения видно, что катион, соответствующий слабо-
му основанию, отнимает от молекулы воды ион ОН-, в резуль-
98
штате чего в растворе возрастает концентрация ионов Н+. Итак,
Ив результате гидролиза соли, соответствующей слабому осно-
£ванию и сильной кислоте, раствор приобретает кислую реак-
< цию.
Так как гидроксид аммония диссоциирован сильнее, чем во-
“да, равновесие гидролиза значительно смещено влево, и коли-
чество ионов Н+ в растворе сравнительно невелико (в 0,1 М
растворе хлорид аммония гидролизован примерно на 0,01%).
Чем слабее соответствующее основание, тем в большей степени
идет гидролиз соли и тем более кислую реакцию имеет ее ра-
створ. Например, довольно кислую реакцию обнаруживают
растворы сульфата и хлорида алюминия вследствие того, что
гидроксид алюминия — очень слабое основание.
3. Гидролиз соли, соответствующей слабому основанию и
слабой кислоте. Естественно, что когда и основание, и кислота,
образующие данную соль, являются слабыми электролитами,
это в еще большей степени благоприятствует протеканию гид-
ролиза. Так, в 0,1 М растворе ацетат аммония гидролизован на
0,5%, т. е. примерно в 50 раз сильнее, чем хлорид аммония или
ацетат калия в растворах той же концентрации. При этом, если
степень диссоциации кислотны больше, чем степень диссоциа-
ции основания, раствор имеет слабокислую реакцию (например,
раствор ацетата алюминия), а если степень диссоциации ки-
слоты меньше, чем степень диссоциации основания, — щелоч-
ную реакцию (например, раствор сульфида аммония). Если же
степени диссоциации и кислоты, и основания примерно одина-
ковы, раствор имеет реакцию, близкую к нейтральной. Приме-
ром может служить гидролиз ацетата аммония:
NH4+ + сн3соо- 4- НОН NH4OH 4- СН3СООН.
Действительно, водный раствор ацетата аммония имеет запах
как аммиака, так и уксусной кислоты. Так как константы дис-
социации NH4OH и СН3СООН примерно одинаковы (около
1,8-10~5), а следовательно, одинаковы и степени диссоциации
их в растворе одной и той же концентрации, такой раствор
имеет почти нейтральную реакцию.
Если соответствующие данной соли основание и кислота —
очень слабые электролиты, то гидролиз может привести к пол-
ному разложению соли при ее растворении в воде. Например:
А125з + 6НОН-^2А1(ОН)з!+3H2S|.
Гидролиз солей, которым в растворе соответствуют много-
зарядные ионы, проходит ступенчато, с образованием основных
или кислых солей. Например, гидролиз хлорида железа (III)
протекает в три ступени:
1) FeCl3-(- НОН Fe (ОН) С12 + НС1,
Fe3++ НОН Fe (ОН) 2++ Н+;
. 99
2) Fe(OH)Cl2 + HOH^Fe(OH)2Cl + HCl,
Fe(OH)2+ + HOH=₽tFe(OH)2++ H+;
3) Fe(OH)2Cl + HOH^Fe(OH)3 + HCl,
Fe(OH)2+ + HOH Fe(OH)3 + H+.
Гидролиз карбоната калия также проходит через две стадии:
1) К2СО3 + НОН КНСОз + КОН,
СО1~ + НОН НСОГ+ ОН-;
2) КНСОз + НОН Н2СО3 + КОН,
НСОз~+ НОН Н2СОз(Н2О + СО2) + ОН-,
т. е. НСО3“^СО2 + ОН-.
Во многих случаях практически реализуется в заметной сте-
пени только первая стадия гидролиза солей с многозарядными
ионами, так как в растворе создается определенная концентра-
ция ионов Н+ или ОН-, препятствующая дальнейшему гидро-
лизу за счет смещения равновесия следующих стадий влево в
соответствии с принципом Ле Шателье.
Гидролиз усиливается при разбавлении раствора и при 'по-
вышении температуры. Следовательно, для подавления гидро-
лиза необходимо работать с холодными концентрированными
растворами, а также желательно вводить в них избыток одного
из продуктов гидролиза (опять-таки в соответствии с принци-
пом Ле Шателье), например, при гидролизе солей слабых ки-
слот — щелочь, а при гидролизе солей слабых оснований — ки-
слоту. Так, можно уменьшить гидролиз хлорида железа (III)
в водном растворе, если добавить к раствору немного соляной
-кислоты, и, наоборот, повысить гидролиз этой соли, если раст-
вор нагреть.
Действие, которое оказывает в данном случае добавление кислоты (из-
быток ионов Н+), легко увидеть, написав для равновесия
Fe3+ + HOH^FeOFF " + Н+
выражение константы равновесия с учетом того, что концентрация воды
остается практически постоянной:
[FeOFI-+] [Н+1
А — [Fes+j
При увеличении сомножителя [II] постоянство К требует уменьшения
[FeOH2+] и увеличения [Fe3+], т. е. гидролиз иона Fe3+ уменьшается.
§ 10. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ.
УСЛОВИЯ ОБРАЗОВАНИЯ И РАСТВОРЕНИЯ ОСАДКОВ
Произведение растворимости не изучается в школьном курсе
химии. Однако для того чтобы лучше понять причины, по ко-
торым реакции между растворами электролитов, сопровождаю-
щиеся выпадением или растворением осадков, идут в том или
100
1цном направлении, полезно хотя бы вкратце познакомиться с
’этим понятием.
Допустим, что имеется насыщенный водный раствор мало-
растворимой соли АХВЙ. Так как концентрация раствора неве-
лика, будем считать, что находящаяся в растворе соль полно-
“стью диссоциирована. Равновесие между раствором и нераство-
рившейся солью можно выразить уравнением
A.v'Bl/ ХА //В,
где А и В — катион и анион с соответствующими зарядами. По-
скольку Ад-Ву — твердое вещество, константа равновесия для
процесса растворения соли может быть записана в виде про-
изведения концентраций катиона и аниона в степенях, равных
стехиометрическим коэффициентам хну. Такое произведение
концентраций ионов малорастворимого электролита в его на-
сыщенном растворе называется его произведением растворимо-
сти (ПР):
ПР = [A] V[B]^ = const.
Как и всякая константа равновесия, ПР не зависит от кон-
центраций входящих в него ионов, но зависит от температуры,
причем довольно сильно. Например, для хлорида серебра ПР
в интервале температур 5—100°С меняется примерно в 100
раз. Значения ПР, приводимые в справочниках, относятся
обычно к комнатной температуре.
Очевидно, если в каком-то растворе произведение концент-
раций ионов в соответствующих степенях меньше ПР для соот-
ветствующей соли, раствор этой соли будет ненасыщенным.
Если же это произведение окажется больше ПР для соответст-
вующей соли при данной температуре, раствор будет пересы-
щенным '(неустойчивым), и из такого раствора должен выпасть
осадок.
Произведение растворимости полнее характеризует раство-
римость вещества, чем, например, количество этого вещества,
которое может раствориться в определенном количестве раст-
вора или растворителя. Коэффициент растворимости относится
только к раствору вещества в чистой воде, в то время как ПР
позволяет учесть и влияние на растворимость общего иона,
присутствующего в растворе.
Поясним это на примере. Для сульфата кальция ПР=
= 6-10~5. Пусть концентрация ионов Са2+ в растворе состав-
ляет 0,1 моль/л. Используя величину ПР, нетрудно найти мак-
симальную концентрацию ионов SO1- в таком растворе:
[Са2+] [SOl ] = 6-10'г’,
[SOl-] =6-10-5/[Са2+] =6-10-5/0,1 =6-10-4 моль/л.
Возьмем другую концентрацию ионов Са2+, например 10~3
101
моль/л. Максимальная концентрация ионов SO4~ (с учетом но-
вой концентрации ионов Са2+) составит 6 -10~5/10—3 = 6-10-2
моль/л, т. е. в 100 раз больше, чем в предыдущем случае. Сле-
довательно, чем выше концентрация ионов Са2+, тем ниже кон-
центрация ионов SOi~ в насыщенном растворе, и, наоборот,
чем выше концентрация SO4^ , тем ниже концентрация Са2+.
Таким образом, в насыщенном растворе малорастворимого
электролита концентрация одного из образуемых им ионов за-
висит от концентрации другого. Этим пользуются на практике,
когда требуется возможно полнее перевести какой-то ион в
осадок (например, при анализе), так как даже сравнительно
небольшой избыток иона-осадителя резко увеличивает полноту
осаждения данного иона.
Рассмотрим реакцию обмена, когда и среди исходных ве-
ществ, и среди продуктов имеются малорастворимые вещества.
Например:
CaSO4 -|- МазСОз = СаСОз 4“ NajSO4.
И сульфат, и карбонат кальция — малорастворимые вещества.
Для СаСО3 ПР = 5-10-9, для CaSO4 ПР = 6-10~5. В насыщен-
ном растворе CaSO4 в чистой воде концентрации ионов Са2+ и
SO4~ равны. Следовательно, [Са2+] — [SO4“] = УПР~8-10“3.
Аналогично можно вычислить концентрацию ионов Са2+ в на-
сыщенном растворе СаСО3 в чистой воде: [Са2+] —УПР~7Х
Х10-5. Прибавление небольшого избытка карбоната натрия
еще понизит концентрацию ионов Са2+ в насыщенном растворе
СаСО3.
Так как в насыщенном растворе СаСО3 концентрация ионов
Са2+ меньше, чем в насыщенном растворе CaSO4, то ионы Са2+,
появляющиеся за счет растворения CaSO4, будут образовывать
с ионами СО3~ осадок СаСО3. В результате концентрация
ионов Са2+ станет меньше величины, соответствующей насы-
щенному раствору сульфата кальция. Поэтому растворится но-
вая порция CaSO4, а СаСО3 опять выпадет в осадок. Это будет
происходить до тех пор, пока весь сульфат кальция не превра-
тится в карбонат кальция. Таки,м образом, приведенная выше
реакция осуществима за счет того, что карбонат кальция менее
растворим, чем сульфат, т. е. карбонат более полно выводит
ионы Са2+ из раствора, чем сульфат.
При образовании малодиссоциированных соединений, как и
в случае малорастворимых соединений, происходит связывание
ионов, а значит, и смещение равновесия в растворах. Равнове-
сия реакций между сильными кислотами и сильными основани-
ями практически полностью смещены в сторону нейтрализации
ионов Н+ и ОН- именно потому, что при этом образуется та-
кой слабый электролит, как вода. Образование малодиссоции-
рованных соединений может приводить и к растворению осад-
:з2
ков. Это возможно тогда, когда в малодиссоциированном сое-
динении ионы связаны прочнее, чем в осадке. В результате то
небольшое количество ионов, которое находится в растворе в
равновесии с осадком, связывается с образованием малодиссо-
циированного соединения. Из осадка в раствор переходят но-
вые порции ионов, которые, в свою очередь, тоже образуют ма-
лодиссоциированное соединение. В конечном итоге осадок ра-
створяется. Следовательно, при растворении малорастворимого
соединения и образовании малодиссоциированного соединения
играет роль как ПР первого, так и константа диссоциации вто-
рого.
Например, сульфиды ряда (металлов (железа (II), цинка,
марганца (II) и др.) растворяются в кислотах потому, что об-
разуется сероводород, в водном растворе представляющий со-
бой очень слабую кислоту, да к тому же еще способный выде-
ляться из раствора в виде газа:
MeS 4- 2 Н+ — H2S f + Ме2+
(Me — двухвалентный металл). В этом случае H2S полнее свя-
зывает ионы серы, чем соответствующий сульфид.
Однако сульфиды других металлов, например меди (II), се-
ребра, свинца, ртути, нерастворимы в разбавленных кислотах.
Их ПР настолько малы, что ионы серы сильнее связаны в суль-
фиде металла, чем в H2S. Поэтому, например, сульфид меди
можно получить, осаждая ион меди сульфид-ионом в кислой
среде:
Сн2+ + H2S -> CuSj + 2 н+.
Напротив, FeS растворим в кислотах с образование?.: сероводо-
рода (лабораторный способ получения H2S):
FeS + 2Н+= Fe2+ + H2Sf.
Угольная кислота — очень слабый электролит и к тому же
легко разлагается на углекислый газ и воду. Поэтому карбона-
ты, малорастворимые в воде, например карбонат кальция, ра-
створяются в кислотах:
СаСОз +2 Н+ = Са2+ + Н2СО3 (Н2О + СО/).
Осадки могут растворяться также за счет образования хо-
рошо растворимых и прочных комплексных соединений, в кото-
рых один из составляющих осадок ионов связан прочнее, чем
в осадке. Малорастворимый в воде хлорид серебра растворя-
ется в избытке водного раствора аммиака, так как ионы сереб-
ра образуют с молекулами аммиака прочный комплексный ион
fAg(NHs)2]+. Фотографический фиксаж также растворяет га-
логениды серебра за счет связывания ионов Ag+- в прочные
комплексные ионы. Связывание ионов Са2+ в прочные комплек-
сные соединения — один ид способов устранения жесткости во-
103
ды, ибо связанные в комплекс ионы Са2+ уже не образуют
осадков, например, с мылами.
Приведенные выше примеры обменных реакций в растворах
электролитов позволяют сформулировать в дополнение к ска-
занному в главе 2 еще одно правило, касающееся протекания
реакций обмена: реакции обмена идут в прямом направлении,
если образуются слабые электролиты, или происходит связыва-
ние ионов, на которые диссоциируют исходные вещества, в
прочные комплексные соединения.
Упражнения к главе 4
1. Почему хлороводород растворяется в воде с выделением тепла, а хло-
рид натрия — с поглощением тепла?
2. Почему растворение в воде безводного СаС12 сопровождается повыше-
нием температуры, а растворение кристаллогидрата СаС12-6Н2О— ее пони-
жением?
3. Почему безводный сульфат меди бесцветный, а медный купорос го-
лубой?
4. Какие явления, сопровождающие процесс растворения, указывают на
наличие химического взаимодействия между растворенным веществом и рас-
творителем?
5. Почему уксусная кислота хорошо растворима н в полярных раство-
рителях (например, в воде), и в неполярных (например, в тетрахлорметане
СС14)?
6. При обезвоживании 2,82 г кристаллогидрата нитрата марганца было
получено 1,76 г безводной соли. Сколько молей кристаллизационной воды при-
ходится на 1 моль соли в кристаллогидрате?
7. Установите формулу одного из кристаллогидратов сульфата натрия,
если при обезвоживании его масса уменьшилась на 47% от первоначальной.
8. В каком соотношении находятся массы безводного сульфата меди и
медного купороса, требующиеся для приготовления одного и того же коли-
чества раствора одной и той же концентрации?
9. Растворение 5 г безводного сульфата меди в большом количестве
воды сопровождается выделением 1,55 кДж энергии, а растворение такой же
массы медного купороса — поглощением 0,23 кДж энергии. Вычислите энер-
гетический эффект и напишите термохимическое уравнение процесса образо-
вания CuSO4 • 5Н2О нз безводной соли и воды.
10. Вычислите массу серной кислоты, содержащейся в 400 мл 60%-ного
раствора (плотность 1,5 г/см3).
11. Вычислите процентную концентрацию серной кислоты в растворе, по-
лученном смешиванием 0,5 моль H2SO4 н 451 г воды.
12. Сколько молей серной кислоты содержится в 49 г 5%-ного раствора?
13. В каком количестве воды надо растворить 20 г вещества, чтобы по-
лучить 10%-ный раствор?
14. Сколько граммов бромида натрия надо растворить в 200 г воды, что-
бы получить 10%-ный раствор?
15. К 200 г 15%-ного раствора хлорида натрия прибавили 300 мл воды.
Вычислите процентную концентрацию полученного раствора.
16. Сколько граммов воды надо прибавить к 200 г 5%-ного раствора,
чтобы получить 2%-ный раствор?
17. К какому количеству воды нужно добавить 100 г 80%-ного раствора,
чтобы приготовить 20%-ный раствор?
18. Сколько граммов 20%-ного раствора потребуется для приготоЬлейня
200 г 4 %-кого раствора?
19. Смешали 200 мл 50%-ного раствора некоторого вещества (плот-
ность 1,5 г/см3) и 500 мл 20%-ного раствора (плотность 1,2 г/см3) того же
вещества. Какова процентная концентрация полученного раствора?
104
20. Имеется 30г 10%-ного раствора и 100 г 50%-ного раствора одного и
того же вещества. Из них требуется приготовить максимально возможное
количество 40%-ного раствора. Какую массу каждого из растворов следует
для этого взять?
21. При упаривании 20кг 3%-ного раствора соли масса раствора умень-
шилась на 4 кг. Какой стала процентная концентрация раствора после
упаривания?
22. При упаривании 15%-ного раствора соли из каждого килограмма рас-
твора было удалено 400 г воды. Вычислите процентную концентрацию рас-
твора после упаривания.
23. Для получения поваренной соли использовали рассол, который имел
нлогность 1,10 г/см3 и общую концентрацию солей 23%, из которых 80%
приходилось на хлорид натрия. Вычислите массу соли, которую можно полу-
чить нз 1 м3 рассола, если потерн при производстве составляют 35%.
24. Какой объем хлороводорода (н.у.) надо растворить в 320г воды для
получения 20%-ного раствора.
25. Сколько литров аммиака (н. у.) потребуется для приготовления 2СС мл
10%-ного раствора аммиака, имеющего плотность 0,95 г/см3.
26. Какие объемы воды и 80%-ного раствора серной кислоты (плот-
ность 1,74 г/см3) необходимо взять для приготовления 500мл 10%-ного
раствора (плотность 1,07 г/см3)?
27. Какие объемы 20%-ного (плотность 1,14 г/см3) и 6%-ного (плотность
1,04 г/см3) растворов серной кислоты необходимо взять, чтобы приготовить
5 л 10%-ного раствора (плотность 1,07 г/см3)?
28. Какие массы железного купороса FeSO4-7H2O и воды потребуются
для приготовления 700г 10%-ного раствора сульфата железа(П)?
29. В каком количестве воды надо растворить 32,2 г глауберовой соли
Na2SO4-ЮНгО, чтобы получить 5%-ный раствор Na2SO4?
30. Сколько глауберовой соли требуется растворить в 500 г воды, чтобы
получить 27%-ный раствор Na2SO4?
31. Какие массы 5%-ного раствора сульфата натрия и глауберовой
соли следует взять для приготовления 50 г 40%-ного раствора Na2SO4?
32. Сколько граммов едкого натра надо взять для приготовления 3 л 0,5 М
раствора?
33. Вычислите массу кристаллической соды Na2CO3-ЮН2О, которая по-
требуется для приготовления 2,5 л 0,4 М раствора Na2CO3.
34. В воде растворили 0,179л хлороводорода (н.у.) и объем довели до
250 мл. Вычислите молярную концентрацию полученного раствора.
35. Вычислите молярную концентрацию раствора, полученного разбавле-
нием 25 мл 0,2 М раствора до объема 200 мл.
36. Смешали 800 мл 0,5 М раствора вещества А и 1200 мл 0,2 М рас-
твора вещества В. Вычислите молярную концентрацию веществ А и В в по-
лученном растворе, считая, что они не реагируют между собой и что объем
смеси равен сумме объемов исходных растворов.
37. В каком объемном соотношении необходимо смешать 1М и 0,01 М
растворы одного и того же вещества, чтобы получить 0,1 М раствор?
38. В 100 мл раствора (плотность 1,15 г/см3) содержится 24,5 г серной
кислоты. Вычислите процентную и молярную концентрации раствора.
39. Чему равна молярная концентрация 60%-ного раствора серной кисло-
ты? Плотность раствора 1,50 г/см3.
40. Какой объем 15%-ного раствора серной кислоты (плотность 1,10 г/см3)
нужно взять для приготовления 0,2 л 0,25 М раствора?
41. До какого объема нужно разбавить 30 мл 20%-ного раствора хло-
рида меди(П) (плотность 1,29 г/см3), чтобы получить 0,5 М раствор (плот-
ность последнего принимаем равной плотности воды)?
42. Вычислите процентную и молярную концентрации раствора азотной
кислоты, полученного смешением 100 мл 90%-ного раствора (плотность
1,5 г/см3) и 80мл 40%-ного раствора (плотность 1,25 г/см3). Плотность по-
лученного раствора 1,4 г/см3.
105
43. Сколько молей НС1 нужно для нейтрализации 112 мл 25%-ного рас-
твора КОН (плотность 1,24 г/см3)?
44. Сколько миллилитров 10%-ного раствора серной кислоты (плотность
1,08 г/см3) потребуется для реакции с 28 г железа? Сколько литров газа
(н. у.) выделится при этом?
45. Сколько граммов Na2COsl0H2O потребуется для реакции со 100 мл
20%-ного раствора НС1 (плотность 1,10 г/см3)?
46. Для полной нейтрализации раствора, содержащего 0,8 г гидроксида
натрия, потребовалось 32 мл раствора соляной кислоты. Вычислите моляр-
ную концентрацию раствора кислоты.
47. Вычислите массу сульфата магния, которая получится при взаимо-
действии Юг металлического магния с 50мл 10%-ного раствора серной кис-
лоты (плотность 1,07 г/см3).
48. К 252,1 мл 36,5%-ного раствора соляной кислоты (плотность
1,19 г/см3) прибавлено 800 мл 28%-ного раствора КОН (плотность 1,25 г/см3).
Какой объем 2М раствора серной кислоты потребуется добавить к полу-
ченному раствору до полной нейтрализации?
49. 150 г 36%-ной соляной кислоты реагирует с 16 г цинка. Вычислите
массу образовавшегося хлорида цинка и его процентную концентрацию в по-
лученном растворе.
50. Вычислите объем 4М раствора КОН, который потребуется для по-
глощения 23г оксида азота(1У), если при этом образуются нитрат и нитрит.
51. Вычислите молярную концентрацию раствора Ре(МОз)з, если из
300 мл такого раствора все содержавшееся в нем железо было выделено в
виде Fe2O3 и масса последнего составила 0,48 г.
52. На чашках весов уравновешены два стакана, в каждом из которых
находится по 50г 20%-ного раствора азотной кислоты. В один из стаканов
насыпали 25 г СаСОз, в другой — 25 г MgCO3. На какую чашку весов и ка-
кую массу гирек надо добавить после окончания реакции, чтобы восстанови-
лось равновесие? Испарением жидкости пренебрегаем.
53. Сколько граммов металлического калия и воды надо взять, чтобы
получить 50г 25%-ного раствора КОН?
54. Для анализа порошка магния, содержащего прнмесь оксида, 1,6 г об-
разца растворили в 400 мл 0,5 М раствора соляной кислоты. На нейтрализа-
цию избытка соляной кислоты пошло 200 мл 0,4 М раствора едкого иатра.
Каково процентное содержание оксида магния в смеси?
55. В каком количестве воды нужно растворить 6,02-1024 молекул серного
ангидрида, чтобы получить 10%-ный раствор серной кислоты?
56. Вычислите массу 20%-ного олеума, которую надо добавить к 150 г
воды, чтобы получить 20%-ную серную кислоту.
57. При 30 °C концентрация насыщенного раствора хромата калия рав-
на 40%. Сколько воды потребуется для растворения 20 г хромата калия?
58. Коэффициент растворимости соли равен 25 н 60 г на 100 г воды
соответственно при 20 и 80 °C. Сколько соли выделится, если 320 г рас-
твора этой соли, насыщенного прн 80 °C, охладить до 20 °C?
59. Сколько потребуется взять воды и нитрата калия, чтобы приготовить
раствор, из которого при охлаждении от 80 до 18 °C выпадет в осадок 35 г
этой соли? Растворимость нитрата калия прн 18 и 80 °C равна соответст-
венно 30 и 170 г на 100 г воды.
60. Насыщенный при 30 °C раствор сульфата меди имеет концентрацию
20,0% (в расчете на безводную соль). Сколько воды потребуется для рас-
творения 50 г медного купороса CuSO4-5H2O?
61. Растворимость СаС12 при 10 и 50 °C соответственно равна 65 и 132 г
безводной соли на 100 г воды. Сколько гексагидрата хлорида кальция вы-
делится при охлаждении 116 г насыщенного раствора от 50 до 10 °C?
62. Сколько потребуется воды и безводного сульфата меди, чтобы при-
готовить насыщенный прн 100 °C раствор, из которого при охлаждении до
20°С выпадет в осадок 400 г медного купороса CuSO4-5H2O, если раствори-
мость безводной соли при 20 и 100 °C равна соответственно 21 и 75 г на 100 г
воды?
1-96
63. Какие из перечисленных веществ являются электролитами: С2Нз,
:КС1, НзРО,, СНзСООК, СН3СООН, CdSO4, СС14, HI, C6Ht2O6, НС1О4?
64. Одинакова лн молярная концентрация ионов водорода в растворах
НС1 и СН3СООН одной и той же молярной концентрации?
65. Почему электропроводность водного раствора НС1 гораздо выше
электропроводности жидкого хлороводорода?
66. Почему при нейтрализации 1 моль КОН азотной и уксусной кисло-
тами выделяется разное количество энергии?
67. Назовите ионы, концентрация которых близка к 0,01, 0,02 илн
0,03 моль/л в 0,01 М растворах следующих веществ: КС1, CuSO4, Ca(NO3)2,
Ва(ОН)2, К3РО4, КН2РО4, СНзСООН, FeOHCh, Mg(HCO3)2, NaHSO4,
KA1(SO4)2.
68. Нужно приготовить 5 л раствора со следующей концентрацией раство-
ренных веществ: C(KNO3)=0,3 моль/л, C(Na3PO4) =0,1 моль/л, C(NaNO3) =
= 0,1 моль/л. В лаборатории оказались лишь Кз₽О4 и NaNO3. Можно лн из
них приготовить раствор нужного состава? Если да, то сколько молей каж-
дого из этих веществ потребуется?
69. Напишите полные и сокращенные ионные уравнения следующих реак-
,ций, если они осуществимы в водном растворе:
CuO + H2SOt -» Ba (NO3)2 + AMSO4)3
MgCO, + HNOj- СаСОз + K2SO4-
Pb (NO:..)3 + ZnFe (OH + HCi -
NaHaPOj -f- NaOi l (два варианта) -> MgOHNO.} •+- HNO,; ->
70. Могут лн одновременно находиться в растворе перечисленные ниже
.пары веществ? Ответ подтвердите ионными уравнениями:
KCl + Na2SO4, СаСЬ + КгСОз,
КОН-р FeCl3, NaOH + K2SO4,
NH4OH+H2SO4, NaHCO3+NaOH
71. Составьте молекулярные уравнения, соответствующие следующим
схемам:
А1(ОН)3+ОН^[А1(ОН)6р-
СаСО3+Н+,
Fe-j-H"-->....
72. Какие реакции возможны при сливании попарно (в разных комбина-
циях) растворов перечисленных веществ: нитрата серебра, гидроксида бария,
хлорида магния, сульфата калия, нитрата меди? Уравнения возможных реак-
ций запишите в ионной форме.
73. В некотором объеме раствора слабой одноосновной кислоты нахо-
дится 5,96-1020 недиссоциированных молекул этой кислоты и 6,02-Ю18 ионов
водорода. Вычислите степень диссоциации кислоты в таком растворе.
74. Как изменится степень диссоциации уксусной кислоты в водном рас-
творе, если в пего ввести некоторое количество хлороводорода?
. 75. Почему при ступенчатой диссоциации электролитов величина кон-
станты диссоциации для каждой следующей ступени меньше, чем для преды-
дущей?
76. Вычислите молярное количество и число ионов водорода, содержа-
.щихся в 1 мл 0,1 М раствора азотистой кислоты, если степень диссоциации
в таком растворе составляет 6%.
77. -, Концентрация ионов водорода в 0,01 М растворе одноосновной кис-
лоты равна 2- 10 s моль/л. Вычислите константу диссоциации этой кислоты.
78. В 0,5 л раствора слабой одноосновной кислоты содержится 3 1021 мо-
лекул этой кислоты и 6-Ю'9 ионов Н+. Каковы константа диссоциации и сте-
пень диссоциации кислоты в данном растворе?
79. Вычислите степень диссоциации синильной кислоты HCN в 0,2 М
растворе, если для этой кислоты К=7,2-10_10.
80. Степень диссоциации хлорноватистой кислоты НС1О в 0,2 М раство-
107
ре равна 0,04%. Вычислите концентрацию ионов водорода в таком растворе
и константу диссоциации кислоты.
81. Константа диссоциации бензойной кислоты прн комнатной темпе-
ратуре равна 6,4-10-5. Вычислите молярную концентрацию раствора бензой-
ной кислоты, в котором она диссоциирована на 4%.
82. Металлический цинк и соляная кислота реагировали с выделением
водорода. Затем в реакционную систему был добавлен ацетат натрия, после
чего выделение водорода резко замедлилось. Почему это произошло?
83. Можно ли на основании окраски индикатора однозначно и точно
назвать величину pH раствора?
84. В какую сторону изменится pH при добавлении: а) хлорида аммо-
ния к водному раствору КОН; б) хлорида аммония к раствору аммиака;
в) ацетата натрия к раствору соляной кислоты; г) ацетата натрия к раствору
уксусной кислоты?
85. Как надо изменить концентрацию ионов водорода в растворе, чтобы
его pH увеличился на 1?
86. Вычислите pH 0,01 М растворов HCI, H2SO4, КОН, Са(ОН)2 и HNO2
(в последнем случае степень диссоциации считать равной 20%), а также
0,05 М раствора NaOH.
87. Вычислите pH раствора, полученного смешением 54,3 мл 98%-ной
серной кислоты (плотность 1,84 г/см3) с водой до объема 5 л.
88. Вычислите отношение концентраций ионов Н и ОН~ в водном
растворе, pH которого (при 25 °C) 11.
89. Исходя из величины ионного произведения воды (10-и прн 26°C),
вычислите константу диссоциации воды при той же температуре.
90. Вычислите pH 0,171%-иого раствора Ва(ОН)2, считая дисссигацию
полной, а плотность раствора равной плотности воды.
91. Вычислите молярные концентрации следующих вешеств в водных
растворах на основании pH этих растворов: НС1, pH 2; H2SO4, рНЗ; КОН,
pH 11; Ва(ОН)2, pH 10.
92. Вычислите pH 0,04 М раствора НС1О, если константа диссоциации
этой кислоты равна 4-Ю-8.
93. 0,5 М раствор слабой кислоты имеет pH 4. Вычислите константу дис-
социации этой кислоты, принимая, что она одноосновная.
94. Константа диссоциации азотистой кислоты равна 4 • 10-4. Вычислите
концентрацию раствора азотистой кислоты, при которой она диссоциирована
на 2%, и pH такого раствора.
95. Раствор слабой одноосновной кислоты (К=4-10-5) имеет pH 2,7.
Какова молярная концентрация раствора?
. 96. Как изменится pH 0,01 М раствора серной кислоты, если добавить
к нему равный объем воды?
97. Как изменится pH 0,1 М раствора уксусной кислоты, если ею раз-
бавить водой в 4 раза?
98. Какое количество воды надо добавить к 150 мл раствора HCI, pH ко-
торого 1,4, чтобы он стал 2,4?
99. 0,1 М растворы двух кислот разбавили в 10 раз. При этом pH рас-
твора первой кислоты повысился примерно на 1, а раствора второй кисло-
ты -— примерно на 0,3. Что можно сказать о силе этих кислот?
100. Вычислите pH растворов, полученных смешением равных объемов:
а) растворов щелочи, имеющих pH 12 и 13, б) растворов сильной кислоты,
pH которых 2 и 3.
101. Как'должна измениться концентрация ионов водорода, чтобы pH
раствора изменился от 12 до 10; от 6 до 5; от 10 до 6?
102. Какой объем 0,2 М раствора КОН надо прибавить к 10 мл 0,5 М
раствора соляной кислоты, чтобы довести pH до 7?
103. К 12,6 мл 7,37%-ного раствора серной кислоты, имеющего плотность
1,05 г/см3, прибавили 487,4 мл 0,0205 М раствора КОН. Определите pH- раст-
вору после нейтрализации.
КМ. Смешали 50 мл раствора щелочи, имеющего pH 12, и 150 мл рас-
108
трора сильной кислоты, pH которого 3. Определите pH раствора после сме-
шения,
105. В каком объемном соотношении необходимо смешать раствор силь-
ной кислоты, имеющий pH 3, и раствор щелочи, имеющий pH 12, чтобы по-
лучить раствор, pH которого 10?
106. Получится ли нейтральный раствор, если смешать растворы, содер-
жащие 1 моль уксусной кислоты и 1 моль едкого натра?
107. Какие из перечисленных ниже солей в водной среде подвергаются
гидролизу? Напишите уравнения гидролиза и укажите реакцию их водных
растворов (кислая, нейтральная, щелочная): К2СО3, Cr2(SO4)3, KNO3, Na2SO3,
Си(СН3СОО)2.
108. Имеются растворы хлорида натрия, едкого натра, гидрокарбоната
натрия, карбоната натрия, хлорида железа(П) и хлорида железа(Ш) оди-
наковой молярной концентрации. Расставьте формулы веществ в порядке воз-
растания pH их водных растворов.
109. Почему при нагревании раствора гидрокарбоиата натрия pH воз-
растает-1
ПО. Почему возрастает pH при добавлении гидроксида кальция в рас-
твор карбоната натрия?
111. Почему металлический цинк может реагировать с горячим раство-
ром хлорида цинка? Ответ подтвердите уравнениями реакций,
112. Какая соль в большей степени подвергается гидролизу: К2СО3 или
АЬ(СОз)з? Когда гидролиз соли идет практически до конца? Приведите при-
меры солей, гидролизующихся практически необратимо.
113. Почему при сливании растворов сульфата алюминия и сульфида
натрия образуется ^осадок гидроксида алюминия, а при действии хлорида
аммония на раствор силиката натрия выпадает осадок кремниевой кислоты?
Ответ подтвердите уравнениями реакций.
114. Можно ли осадить сульфид железа (II), пропуская сероводород
через раствор FeCl2? Можно лн осадить сульфид меди, пропуская сероводо-
род через раствор СиС12?
115. Растворимость BaSO4 составляет 1,05-10-5 моль/л. Вычислите про-
изведение растворимости BaSO4.
116. В «Основах химии» Д. И. Менделеева говорится: «Вода растворяет
1/25 000 своего веса плавикового шпата». Вычислите на основании этого
величину произведения растворимости плавикового шпата CaF2.
117. При 25 °C в воде растворяется 0,145 г Са(ОН)2 на 100 г воды.
Вычислите ПР Са(ОН)2, pH насыщенного водного раствора Са(ОН)2 и pH,
выше которого Са(ОН)2 начнет осаждаться из раствора, концентрация ионов
кальция в котором 1 моль/л. Плотность раствора считаем равной плотности
воды
118. ПР Ag2CO3 — 6,15-10-12. Вычислите молярную концентрацию соли и
каждого из ионов в насыщенном растворе, а также растворимость соли в
граммах на 100 г раствора, считая его плотность равной плотности воды.
119. Минеральная вода из некоторого источника представляет собой на-
сыщенный раствор сульфата кальция, для которого ПР = 6-10~5. Вычислите
массу кальция, содержащегося в стакане (200 мл) такой воды.
120. Сколько воды потребуется для растворения 1 г фторида кальция,
если его произведение растворимости равно 4-Ю-11?
121. Зная, что для хлорида серебра ПР= 1,6-10~10, определите, во сколько
раз отличается растворимость хлорида серебра в чистой воде от его раство-
римости в 0,1 М растворе хлорида калия.
122. Выпадет ли осадок при смешивании равных объемов 0,02 М раство-
ра нитрата серебра и 0,1 М раствора хлорида магния? ПР для AgCl равно
1,610-10.
123. Объем мирового океана составляет примерно 1,4 1018м3. Концентра-
ция сульфат-иона в океанической воде около 0,03 моль/л. Чему равна пре-
дельная масса ионов кальция, которые могут быть растворены во всем объеме
мирового океана, если для CaSO4 ПР=6-10~5?
109
Г л а в a 5
ПЕРИОДИЧЕСКИЙ ЗАКОН И СТРОЕНИЕ ВЕЩЕСТВА
§ 1. ПОСЛЕДОВАТЕЛЬНОСТЬ ЗАПОЛНЕНИЯ ЭЛЕКТРОНАМИ
ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ. ЯВЛЕНИЕ ПЕРИОДИЧНОСТИ
Помимо знания главных фактов, касающихся истории от-
крытия Д. И. Менделеевым периодического закона, абитуриент
должен хорошо понимать связь периодического закона со стро-
ением атома, а также характер изменения свойств элементов,
простых веществ и соединений в периодах и подгруппах пери-
одической системы. Зная основные закономерности в периоди-
ческой системе, надо уметь предсказывать вероятные свойства
того или иного элемента и его соединений по известным из
школьного курса химии свойствам соседних с ним элементов.
Вспомним основные сведения о поведении электронов в ато-
мах. Свойства электронов и других микрообъектов таковы, что
для их описания оказываются недостаточными законы Ньюто-
на, на которых основывается классическая механика и которые
применимы лишь к макроскопическим телам. В частности, вме-
сто точных координат можно говорить лишь о вероятности на-
хождения электрона в какой-либо точке около ядра атома.
В связи с этим электрон в атоме удобно описывать как некое
облако отрицательного заряда («электронное облако»), причем
плотность этого облака в какой-то точке пропорциональна веро-
ятности нахождения в ней электрона. Изображая электронное
облако на рисунке, имеют в виду, что изображается условная
поверхность, ограничивающая область, в которой сосредоточе-
на большая часть (скажем, 95%) электронного облака, плот-
ность которого хотя и очень быстро, но все же постепенно убы-
вает по мере удаления от ядра.
Электроны в атоме располагаются по энергетическим уров-
ням (первый, второй, третий и т. д.), которые, в свою очередь,
состоят из подуровней, обозначаемых латинскими буквами
(s-, р-, d- и /-подуровни). Максимальное число электронов на
каждом уровне равно 2/г2, где п — порядковый номер уровня.
Таким образом, на первом уровне не может быть больше двух
электронов, на втором — не больше 8, на третьем—18 и на
четвертом — 32. По ряду причин, рассмотрение которых выхо-
дит за рамки школьного курса, максимальное число электронов
на данном уровне достигается не всегда, поэтому эксперимен-
тально наблюдается не более 32 электронов на всех уровнях,,
начиная с четвертого.
На первом уровне могут находиться только s-электроны.
Так как электронное облако s-электрона имеет сферическую
симметрию, оно может быть ориентировано относительно трех
ПО
координатных осей одним единственным способом; в таком слу-
чае говорят, что имеется одна s-орбиталь, на которой могут
поместиться два электрона, отличающиеся знаком собственного
магнитного момента («спин»).
На втором и последующих уровнях, помимо «-подуровня, есть
еще р-подуровень. Электронное облако р-электрона имеет осевую
симметрию, поэтому возможны три ориентации р-облаков
вдоль трех координатных осей, что соответствует трем р-орби-
галям. Поскольку одна орбиталь может вмещать два электро-
на, на каждом р-подуровне может находиться не больше 6
электронов. На третьем и последующих уровнях помимо «- и
р-подуровней имеется еще d-подуровень, вмещающий 10 элект-
ронов, располагающихся на пяти d-орбиталях. На четвертом
и последующих уровнях есть помимо перечисленных выше еще
/-подуровень, вмещающий 14 электронов, располагающихся на
семи f-орбиталях.
В многоэлектронном атоме энергия электронов на «-, р-,
d- и /-подуровнях разная (строго говоря, речь идет об энергии
всего атома, соответствующей нахождению электрона на том
или ином уровне, но для простоты мы часто говорим просто об
энергии данного электрона). Минимальная энергия соответ-
ствует «-подуровню, затем в порядке возрастания энергии сле-
дуют р-, d- и /-подуровни.
Переход от атома водорода к атомам с последующими атом-
ными номерами можно представить себе как происходящий
путем последовательного введения протонов в ядро, сопровож-
дающегося увеличением его заряда, а также соответствующе-
го количества электронов в электронную оболочку атома. В
свободном, невозбужденном, атоме (содержащем электроны в
состоянии, отвечающем минимуму энергии) новый электрон по-
падает на тот свободный подуровень, который характеризуется
минимальной энергией, т. е. соответствует минимуму энергии
всей системы, состоящей из ядра и окружающих его электро-
нов. Поэтому при увеличении заряда ядра атомов от водорода
до аргона включительно последовательно заполняются первый,
второй и третий уровни, причем сначала s-, затем р-подуровни.
Электронные конфигурации первых восемнадцати элементов
приведены в табл. 3. (Числа перед латинскими буквами в таб-
лице означают порядковый номер уровня, а числа, записан-
ные наподобие показателя степени, — число электронов на со-
ответствующем подуровне; каждая стрелка символизирует
электрон, а ее направление — знак его магнитного момента.)
На третьем уровне максимальное число электронов равно
18 (два электрона на «-подуровне, 6 электронов — на р-под-
уровне и 10 — на d-подуровне). Однако после заполнения 3s- и
Зр-подуровней следующие два электрона попадают не на 3d-,
а на 4«-подуровень, начиная застройку четвертого уровня—в
этом случае энергия системы оказывается более низкой, чем
111
Таблица 3. Электронные конфигурации элементов I—IV периодов
« распределение электронов по орбиталям для элементов I и II периодов
периодической системы
Н 1st
Не 1s*
Li
Be ls‘2s2
B ls’2sW
c Is32s-22p2
П
I \ I
И П
0 06
И И И
П II I I I
О lss'2s-2p‘
П] И ЕЛПП
F Is 2s’2p->
Ne ls22s-2p3
Na ls'-2s22p33s1
Mg ls22ss2p°3s2
Al ls-2s22p->3s23pi
Si 1 ss2s22p33s23p’
P ls22s32p33s23p3
S ls-2s-2p33s23p‘
ЕЗ ЕЗ ЕПЕЕПЕ
ЕЗ ЕЗ ЕШЖ
Cl ls22s22p63s23p6
Аг ls22s22p33s23p6
К ls22s22p33s23p64s'
Са ls22s22pe3s23p64s2
Sc ls22s22p63s23p634'4s2
Т1 ls22s22p63s23p«3d24s2
112
Продолжение табл. 3
V ls-2ss2p63s23pe3d34sI Zn 1 s22s22p°3s23/>63dI04s-'
Сг ls22s22p63s23pe3ds4s1 Ga I s32s32/>e3s23p63rfI04s44/>1
Мп 1 s22s22p63s23pe3dI04s24pe Ge 1 s!2s22pe3s23pe3dI04s24p2
Fe ls22s22p63s23p63d64s2 As 1 s22s22pe3s*3pe3d«>4s34/P
Со ls22s22p63s23p63d74s2 Se 1 s -2s22p63s33p63dio4S24p4
№ ls22s22p63s23p63ds4s2 Br 1 s-2s 22рв3523рв3 rfi«4s24/>5
Си 1 s22s22p63s23p63d54s2 Kr 1 s32s22p63s23p63dio4s24pe
при попадании электронов на Зс?-лодуровень. И лишь после
кальция (Z = 20) начинается заполнение Зй-подуровня, что со-
ответствует элементам с порядковыми номерами от 21 (скан-
дий) до 30 (цинк) включительно. У цинка третий уровень ока-
зывается целиком заполненным, поэтому у следующих за ним
шести элементов заполняется 4р-подуровеиь.
При сравнении приведенных в табл. 3 электронных конфи-
гураций элементов обращает на себя внимание тот факт, что
при последовательном увеличении заряда ядра периодически
повторяется как количество электронов, находящихся на внеш-
нем уровне, так и симметрия их облаков. Свойства химических
элементов определяются строением электронных оболочек их
атомов и прежде всего электронами, находящимися на внешнем
уровне, которые выступают в роли валентных электронов, т. е.
электронов, ответственных за химические связи, образуемые
данным атомом как с такими же, так и с другими атомами.
Валентные электроны определяют все химическое поведение
элемента. Поэтому с возрастанием атомного номера (заряда
ядра) свойства химических элементов также изменяются пери-
одически. Таким образом, именно периодическое появление
аналогичных электронных конфигураций является физической
причиной периодичности, составляющей сущность периодиче-
ского закона, открытого Д. И. Менделеевым в 1869 г.
Важно отметить, что периодический закон был открыт Мен-
делеевым еще задолго до того, как было установлено, что ато-
мы состоят из ядер и электронов. Менделеев положил в основу
формулировки периодического закона атомную массу (по тер-
минологии того времени — «атомный вес»), но тем не менее в
некоторых случаях расположил элементы не в порядке возра-
стания атомных масс, а в том порядке, который диктовался
всей совокупностью их свойств. В настоящее время периодиче-
ский закон формулируется так: свойства элементов, а также
образуемых ими простых и сложных веществ являются перио-
дической функцией от зарядов их ядер.
Открытие периодического закона позволило Менделееву объ-
3 Семенов И. Н.
113
единить все химические элементы, часто весьма непохожие один
на другой, в единую естественную (т. е. основанную на объек-
тивном признаке) систему — периодическую систему — и пока-
зать, что свойства элементов и образуемых ими конкретных
веществ закономерным образом зависят от их положения в
этой системе. Таким образом, периодический закон и периоди-
ческая система элементов составили основу химической систе-
матики.
Одновременно с открытием периодического закона и на
основании его Менделеев предсказал свойства нескольких неиз-
вестных тогда элементов, а также исправил атомные массы
ряда элементов. Наиболее детально и точно были предсказаны
им свойства элементов с вероятными атомными массами 44, 68
и 72. Вскоре были открыты эти элементы, получившие названия
«галлий» (Лг = 69,7), «скандий» (45,0) и «германий» (72,6).
Предсказания Менделеева были блестяще подтверждены экспе-
риментальными данными о свойствах простых веществ п соеди-
нений этих элементов.
Открытие периодического закона и утверждение в науке
учения о периодичности стимулировало развитие теории строе-
ния атома и тем самым оказало огромное влияние на развитие
не только химии, но также физики и других связанных с физи-
кой и химией наук. В дальнейшем к известным элементам при-
бавилась группа открытых после 1893 г. инертных газов.
В 1912 г. Мозли показал, что основой периодичности являются
не атомные массы, а заряды ядер. Исследования Мозли под-
твердили правильность расположения в периодической системе
тех элементов, которые, если использовать атомные массы как
основу для системы, стояли не на своем месте: это кобальт
(Лг = 58,9) перед никелем (58,7), теллур (127,6) перед иодом
(126,9) и аргон (39,9) перед калием (39,1). С точки зре?1ия
заряда ядра эти элементы были размещены в системе пра-
вильно. Одновременно был уточнен и вопрос о числе еще не
открытых элементов до урана (Z=92). В частности, было дока-
зано, что в первом периоде нет элементов между водородом и
гелием и что общее число элементов между барием и танталом,
где предполагалось существование еще не открытых элемен-
тов, равно 16.
§ 2. СТРУКТУРА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Периодический закон — особый закон природы по широте
охвата явлений, так как он объединяет целую совокупность
частных закономерностей, составляющих как бы тонкую струк-
туру периодичности. РТногда эти закономерности проявляются
в сравнительно простом и явном виде, в других случаях —
менее явно, а иногда их еще предстоит выявить, над чем и
работают исследователи.
114
Абитуриент должен четко различать понятия «периодиче-
ский закон», «периодическая система» и «периодическая таб-
лица». Периодический закон — это объективно существующий
закон природы, который можно открыть, как и всякий закон
природы, но нельзя быть его «творцом» (как иногда неправиль-
но говорят о Д. И. Менделееве). Нельзя его и «развить» — раз-
вить можно учение о периодичности, т. е. систему наших зна-
ний о сущности и проявлениях периодического закона.
На основании периодического закона Д. И. Менделеев смог
построить систему классификации химических элементов — пе-
риодическую систему, т. е. выявить связи между элементами,
отражающие их сходство и различие. Эту систему Менделеев
называл «естественной», так как она основана на существую-
щем в природе законе — периодическом законе. Фундаменталь-
ной характеристикой химического элемента является его поряд-
ковый номер в системе, отражающий объективную характери-
стику— заряд ядра. Столь же объективной характеристикой
элемента является его принадлежность к тому или иному пе-
риоду.
Законы природы можно выражать в виде математических
формул, графиков, таблиц. Чем сложнее закон, тем труднее вы-
разить его в виде формулы или графика. Сущность периодиче-
ского закона и основанной на нем системы элементов лучше
всего передается в табличной форме. Периодическая таблица —
это графическое изображение периодической системы.
За сто с лишним лет после открытия периодического закона было пред-
ложено множество вариантов периодических таблиц, в том числе и весьма
экзотических (объемные, спиральные и т. д.). Хотя одни варианты являются
более удачными, другие — менее удачными, невозможно найти какую-то
единственно правильную форму периодической таблицы. Конкретные проявле-
ния периодического закона очень сложны, поэтому сложна и структура
периодической системы, что не допускает однозначного графического изобра-
жения ее. В разных конкретных случаях оказываются наиболее удобными
разные формы периодической таблицы, лучше всего подчеркивающие инте-
ресующие пас формы проявления периодического закона н связи между
элементами, т. е. акцентирующие внимание на разных характеристиках перио-
дической системы.
Связи между элементами, их сходство или, наоборот, различие, т. е.
именно то, что позволяет объединить все элементы в единую систему, оста-
ются, конечно, неизменными при переходе от одной формы таблицы к другой.
Так, неизменными остаются порядковый помер элемента и принадлежность
его к тому или иному периоду. Следовательно, система элементов остается
единой при многообразии форм ее табличного изображения.
Из всего многообразия форм периодических таблиц наибо-
лее удачными для учебных целей оказались немногие, причем
весьма близкие к тем, которыми пользовался сам Д. И. Мен-
делеев. Эти варианты таблиц можно разделить на две основ-
ные группы: 1) короткая, или короткопериодная, форма и
2) длинная, или длиннопериодная, форма. Обе формы были
предложены самим Д. И. Менделеевым в первые годы после
8!
115
открытия периодического закона: длинная форма — в 1869 г.,
короткая (причем в виде, очень близком к принятому в настоя-
щее время) —в 1871 г. Перед тем как сравнивать эти две фор-
мы периодических таблиц, рассмотрим несколько главных по-
нятий, относящихся к структуре периодической системы.
Периодом в периодической системе называется последова-
тельность элементов, расположенных в порядке возрастания за-
ряда ядра, начинающаяся водородом или щелочным металлом
и заканчивающаяся инертным газом. Началу периода соответ-
ствует начало заполнения электронами нового энергетического
уровня. В периодической системе к настоящему времени име-
ется 7 периодов, что соответствует заполнению электронами
семи энергетических уровней.
Так как первый энергетический уровень вмещает лишь два
электрона, то в первом периоде всего два элемента. Второй
уровень вмещает 8 электронов, что соответствует восьми эле-
ментам во втором периоде. Хотя на третьем уровне максималь-
но может находиться 18 электронов, из-за того, что после за-
полнения 3s- и Зр-подуровней начинается заполнение 4я-под-
уровня, в третьем периоде, как и во втором, только восемь эле-
ментов. Первые три периода называются короткими. Следую-
щие за ними периоды содержат по 18 элементов (четвертый и
пятый) или по 32 элемента (шестой и седьмой) и потому назы-
ваются длинными. Первый элемент каждого периода имеет на
внешнем уровне один электрон, последний элемент периода —
восемь электронов (за исключением гелия, у которого два элек-
трона).
Размещение в периодической таблице восемнадцати элемен-
тов длинных периодов в один ряд приводит к длинному вари-
анту таблицы. В другом случае длинные периоды делят на два
ряда — тогда получается короткий вариант таблицы. При этом
в первый ряд длинного периода попадают элементы, у которых
заполняются s-подуровни (s-элементы), а также 8 элементов,
у которых заполняются d-подуровни (d-элементы) — всего
10 первых элементов каждого длинного периода. Остальные
элементы периода — еще два d-элемента, а также 6 элементов,
у которых происходит заполнение р-подуровней (р-элемен-
ты),— попадают в другой ряд. Таким образом, в коротком ва-
рианте таблицы число рядов больше, чем число периодов.
И в коротком, и в длинном варианте таблицы элементы,
у которых происходит заполнение f-подуровней (эти два семей-
ства по 14 f-элементов, следующих за лантаном и актинием и
потому называемых лантанидами, или лантаноидами, и актини-
дами, или актиноидами), помещают условно в одну клетку
с лантаном или с актинием, кроме того, выделяя эти элементы
отдельно от основной таблицы. Лишь иногда, например в фор-
ме периодической таблицы по Н. Бору, когда периоды распола-
гаются в виде пирамиды, каждый из них, в том числе содер-
116
жащий 32 элемента, записывается в один ряд. Такая форма
таблицы удобна для физиков. Химики же предпочитают поль-
зоваться либо обычным «менделеевским» длинным вариантом,
либо (чаще) — коротким вариантом, удобным своей компакт-
ностью и хорошо отражающим химические аналогии между
элементами.
Элементы, расположенные в одном вертикальном столбце
короткой формы периодической таблицы, образуют одну груп-
пу. Каждая группа состоит из двух подгрупп. Подгруппы, в ко-
торые входят элементы как больших, так и малых периодов,
называются побочными, или дополнительными. В короткой
форме таблицы символы элементов, относящихся к главной и
побочной подгруппам одной группы, записывают со смещением
к противоположным краям клетки, так что они образуют как
бы две вертикальные после'довательности в пределах одного
столбца. В длинной форме таблицы их помещают в разных
столбцах, обозначая как подгруппы А и Б.
Какие имеются основания для того, чтобы помещать эле-
менты главной и дополнительной подгрупп в одну группу?
Для ответа на этот вопрос надо разобраться в том, какие элек-
троны у этих элементов являются валентными (могут быть
использованы для образования химической связи) и потому
определяют химическое поведение элемента.
В главные подгруппы попадают $- и p-элементы, у которых
валентными являются s- и р-электроны. Сумма s- и р-электро-
нов на внешнем уровне равна номеру группы. В побочных под-
группах расположены элементы, в атомах которых происходит
заполнение d-подуровней предпоследнего уровня. У этих эле-
ментов помимо s-электронов внешнего уровня валентными мо-
гут быть также d-электроны с предпоследнего уровня. Взглянув
на периодическую таблицу и подсчитав у какого-нибудь эле-
мента побочной подгруппы III—VII групп сумму этих s- и
d-электронов, нетрудно убедиться, что она равна количеству
валентных электронов элементов главной подгруппы той же
группы. Таким образом, можно сказать, что в основе построе-
ния короткой формы периодической таблицы (напомним еще
раз, что она была предложена Д. И. Менделеевым еще в
1871г.!) лежит заполнение электронами внешнего уровня с уче-
том d-электронов на предпоследнем уровне.
В любой из главных подгрупп электронные конфигурации
элементов аналогичны, т. е. на внешнем уровне имеется одина-
ковое количество электронов с одинаковой симметрией элек-
тронных облаков. Вследствие этого такие элементы обнару-
живают большое сходство между собой, что конкретно прояв-
ляется в сходстве образуемых ими простых и сложных веществ.
Иными словами, элементы одной главной подгруппы — полные
аналоги.
Хотя в пределах одной побочной подгруппы электронные
117
конфигурации атомов могут несколько различаться вследствие
перехода электронов между d- и s-подуровнями, это не ведет
к существенным различиям в свойствах элементов. Поэтому
элементы одной побочной подгруппы также являются между
собой полными аналогами.
Однако, как мы убедились выше, конфигурации валентных
электронов у элементов главной и дополнительной подгрупп
одной и той же группы существенно различны. В результате
такие элементы обнаруживают большое сходство по одним
свойствам (например, имеют одинаковую максимальную сте-
пень окисления) и в то же время оказываются весьма непохо-
жими по другим свойствам (например, в виде простых ве-
ществ). Следовательно, элементы главной и побочной подгрупп
одной группы являются неполными аналогами (подробнее см.
главу 9). (Далее в этой главе, говоря об изменении свойств в
периодах п группах, мы будем иметь в виду только элементы
главных подгрупп. Особенности же элементов побочных под-
групп будут изложены в главе 9.)
Рассмотрим теперь основные закономерности изменения
свойств в периодах.
1. Возрастает электроотрицательность элемента, т. е. умень-
шается способность атомов терять электроны и увеличивается
способность присоединять их. Это связано с увеличением заряда
ядра, вследствие чего внешние электроны, находящиеся на од-
ном уровне, все сильнее притягиваются ядром. В результате в
начале периода находятся типичные электроположительные эле-
менты (металлы), а в конце периода, перед инертными га-
зами— типичные электроотрицательные элементы (неметаллы).
2. Увеличивается максимальная положительная степень
окисления, равная числу электронов на внешнем уровне, т. е.
номеру группы, за исключением кислорода и фтора. Не для
всех элементов соединения, соответствующие максимальной
степени окисления, равной номеру группы, оказываются устой-
чивыми. Так, только недавно получены соединения брома (VII);
для инертных газов производные, в которых степень окисления
их равна VIII, пока получены только для ксенона и криптона,
причем у последнего они очень непрочные.
3. Для электроотрицательных элементов убывает по абсо-
лютной величине отрицательная степень окисления, равная вось-
ми минус номер группы.
4. Ослабевают основные свойства оксидов и гидроксидов
элементов и одновременно усиливаются их кислотные свойства.
В главных подгруппах с увеличением заряда ядра свойства
элементов, а также соответствующих им простых веществ и
соединений изменяются следующим образом.
1. Уменьшается электроотрицательность элемента, соответ-
ственно усиливаются металлические свойства и ослабевают не-
металлические. Например, в V группе азот — типичный неме-
118
талл, фосфор — неметалл, у которого одно из аллотропных ви-
доизменений обладает значительной электропроводностью (чер-
ный фосфор), мышьяк и сурьма — элементы, занимающие про-
межуточное положение между типичными металлами и типич-
ными неметаллами, и, наконец, висмут — металл.
2. Уменьшается прочность соединений, в которых элементы
данной подгруппы имеют высшую степень окисления. Так, для
борз и алюминия характерны исключительно производные, в ко-
торых эти элементы имеют степень окисления +3; в случае же
таллия даже растворение металла в азотной кислоте приводит
к образованию соединений таллия (I). SiO2 — единственный
устойчивый при обычных условиях оксид кремния, и окисли-
тельные свойства для него не характерны (не отмечается тен-
денции к отдаче части кислорода с понижением степени окис-
ления); напротив, РЬО2 термически неустойчив и является силь-
ным окислителем. Фосфаты — вполне устойчивые соединения,
для которых не характерны окислительные свойства, в то вре-
мя как висмутаты (производные висмута в степени окисления
+ 5) малоустойчивы и являются сильными окислителями.
3. Уменьшается устойчивость соединений, в которых элемент
проявляет отрицательную степень окисления. Так, фосфин
РН3 — значительно менее устойчивое соединение, нежели ам-
миак. Аналоги фосфина — арсин AsHs, стибин SbH3 и висму-
тин В1Н3 — еще менее устойчивы.
4. Усиливаются основные свойства оксидов и гидроксидов.
(Следует помнить, что кислотно-основные свойства оксида или
гидроксида зависят еще и от степени окисления элемента. По-
этому сравнивать следует соединения с одинаковыми степенями
окисления элементов-а на логов.)
Рассматривая изменение свойств элементов в подгруппах,
нетрудно заметить, что всегда особыми оказываются элементы
второго периода — как в виде простых. веществ, так и в виде
соединений. Например, в ряду галогенов соединения фтора до-
вольно сильно отличаются от соединений его аналогов: фторид
серебра довольно хорошо растворим в воде, в то время как
хлорид, бромид и иодид серебра практически нерастворимы;
напротив, фторид кальция практически нерастворим в воде,
а хлорид, бромид и иодид кальция хорошо растворимы; в вод-
ном растворе фтороводород образует значительно более сла-
бую кислоту, чем остальные галогеноводороды. Металлические
бериллий и литий обнаруживают меньшую химическую актив-
ность по отношению к воде и кислороду, чем их аналоги.
Отличие элементов второго периода от их аналогов связано
со строением электронных оболочек атомов. У атомов элемен-
тов второго периода мало внутренних электронов. Когда, на-
пример, у лития один единственный 2я-электрон на внешнем
уровне будет использован для образования связи, на атоме ли-
тия останется только два ls-электрона. В случае же натрия в
119
образовании связи участвует Ss-электрон, и на атоме Na оста-
ется на восемь внутренних электронов больше, чем на атоме Li.
Отсюда различие в размерах соответствующих ионов, в энерге-
тике кристаллических решеток и растворов с их участием.
Резкое различие между элементами второго и последующих
периодов наблюдается и в проявляемых ими степенях окисле-
ния. Если кислород исключительно двухвалентен, то для серы
в кислородных соединениях обычны степени окисления +4 и +6.
Хотя в основном (невозбужденном) состоянии атома электрон-
ные конфигурации этих элементов аналогичны и соответствуют
лишь двум неспаренным электронам, в случае серы один или
два электрона, получив небольшое количество энергии,
могут перейти на подуровень 3d (возбужденное состояние ато-
ма). За счет этого число неспаренных электронов станет боль-
шим и в пределе равно шести. Возбудить же атом кислорода,
чтобы увеличилось число неспаренных электронов, практически
невозможно. Для этого электроны со второго уровня должны
были бы перейти на третий, так как на втором уровне нет ва-
кантных с?-орбиталей, переход на которые увеличил бы число
неспаренных электронов. Переход же электронов на следующий
уровень требует слишком большой затраты энергии, которая
не скомпенсируется энергией образования химической связи,
и потому такой переход в химической реакции не осуществим.
При сравнении элементов второго и третьего периодов интересно отме-
тить также диагональную аналогию, которая заключается в том, что по не-
которым свойствам свободных атомов, простых веществ и соединений эле-
менты второго периода оказываются похожими на элементы, расположенные
в третьем периоде в соседней группе справа: литий — на магний, бериллий —
на алюминий, бор — на кремний, углерод — на фосфор, кислород—-на хлор.
Действительно, по многим свойствам литий больше похож на магний,
чем на остальные щелочные металлы; например, литий, как и магний,
легко реагирует с азотом и углеродом с образованием нитрида и карбида.
Бериллий больше похож на алюминий, чем на магний и щелочноземельные
металлы: оксид и гидроксид бериллия амфотерны, как оксид и гидрооксид
алюминия, в то время как оксид и гидроксид магния проявляют исключи-
тельно основные свойства. В виде простого вещества бор больше похож
иа кремний, чем на типичный металл алюминий. Одна из аллотропных мо-
дификаций фосфора — черный фосфор — по электрическим свойствам схожа
с графитом, в то время как твердый или жидкий азот — типичный изолятор.
По окислительным свойствам хлор гораздо ближе к кислороду, чем к фтору.
Действительно, реакция
2С1,+2Н2О^4НС1+О2,
в которой хлор и кислород выступают в роли конкурирующих окислителей
по отношению к водороду, обратима. Как мы видим, иногда диагональная
аналогия оказывается даже более явной, чем вертикальная в подгруппе.
Причина диагональной аналогии—резкое изменение свойств при пере-
ходе от элементов второго периода к элементам третьего периода, о кото-
ром говорилось выше. В этом случае степень изменения свойств по верти-
кали делается соизмеримой с их изменением при переходе от одной группы
к соседней. Поэтому, иапример, при переходе от натрия к литию свойства
изменяются примерно так же, как прн переходе от натрия к магнию.
120
На основании^сходства в химическом поведении некоторые
элементы объединяют в «семейства» элементов, такие как ще-
лочные металлы (литий и его аналоги), щелочноземельные ме-
таллы (кальций и его аналоги), галогены (фтор и его ана-
логи), семейство железа (железо, кобальт, никель), семейство
платины, или платиновые металлы (рутений, родий, палладий,
осмий, иридий, платина), а также редкоземельные элементы
(скандий, иттрий, лантан и 14 лантаноидов). Искусственно по-
лученные элементы, следующие за ураном, называют трансура-
новыми.
Понятия «редкоземельные элементы» и «лантаноиды» часто путают.
Между тем это не одно и то же. Лантаноиды — это элементы, заряды ядер
которых имеют промежуточные значения между зарядами ядер лантана и
гафния. К ним относятся 14 элементов: церий, празеодим, неодим, прометий,
самарий, европий, гадолиний, тербнй, диспрозий, гольмий, эрбий, тулий, ит-
тербий, лютеций. В число редкоземельных элементов входят помимо пере-
численных еще три элемента: скандий, иттрий и лантан. Это объединение
17 элементов под общим названием удобно потому, что скандий, иттрий и
лантан очень похожи по своим химическим свойствам на лантаноиды. По-
этому н в природе все 17 элементов обычно встречаются в одних и тех же
рудах.
Когда химики сравнивают какие-нибудь однотипные соединения редко-
земельных элементов, эти соединения обычно располагают в ряд в порядке
уменьшения радиуса трехзарядных ионов этих элементов. При этом лантан
оказывается перед церием, т. е. перед первым элементом ряда лантаноидов,
иттрий — среди лантаноидов между Dy н Но, a Sc — после лантаноидов, за
лютецием. В таком ряду все свойства соединений редкоземельных элементов
изменяются плавно.
§ 3. ЭЛЕМЕНТАРНЫЕ ПРЕДСТАВЛЕНИЯ
О ХИМИЧЕСКОЙ СВЯЗИ
Химической связью называют силы, удерживающие атомы
в молекулах или кристаллах. Для того чтобы между двумя
атомами образовалась химическая связь, необходимо, чтобы
энергия системы из двух атомов была ниже, чем энергия отдель-
ных атомов. Следовательно, объяснить причину образования
химической связи — значит, объяснить, почему при ее образо-
вании энергия системы понижается.
Сближающиеся ядра атомов должны, в принципе, отталки-
ваться друг от друга, в результате чего энергия системы будет
повышаться. Значит, понижения энергии системы можно до-
стигнуть двумя путями: либо за счет более сильного притяже-
ния электронов к ядрам (как к «своему», так и к «чужому»),
нежели в свободных атомах, либо за счет их перераспределе-
ния между взаимодействующими атомами таким образом, что
атомы приобретут заряд и станут притягиваться один к дру-
гому. В любом случае понижение энергии системы связано
с изменением состояния электронов при образовании связи
между атомами. Следовательно, для выяснения причин обра-
зования химической связи надо посмотреть, как изменяется со-
121
стояние электронов при соединении атомов в более сложную
систему.
Чтобы количественно охарактеризовать взаимодействие
между атомами в молекуле или кристалле, необходимо учесть
взаимодействие между всеми частицами, из которых состоят
атомы в молекуле или кристалле: между электронами, между
электронами и ядрами, а также между ядрами. Математически
это чрезвычайно сложная задача и для самых простых моле-
кул, даже если решать ее только на базе законов классической
механики. Она еще больше осложняется тем, что поведение
электронов в атомах, молекулах и кристаллах подчиняется за-
конам квантовой механики. Поэтому даже в квантовой хи-
мии— области химии, изучающей химическую связь, для коли-
чественного описания молекул (в конечном итоге для расчета
энергии химической связи и, следовательно, прочности соеди-
нений) вводят целый ряд упрощений и используют самую со-
временную вычислительную технику.
Еще больше упрощений приходится вводить, чтобы рассмат-
ривать химическую связь и строение веществ на уровне школь-
ной программы по химии. Поэтому обращаем внимание абиту-
риента на то, что представления о химической связи, изложен-
ные в этой книге, как и в любом учебном пособии, являются
элементарными, это крайнее упрощение в действительности
очень сложного явления.
Рассматривая взаимодействие двух атомов, можно выделить
два крайних случая: а) соединяются одинаковые атомы или
атомы, мало отличающиеся по электроотрицательности; б) со-
единяются атомы, резко отличающиеся по электроотрицатель-
ности. Этим двум случаям отвечают два типа химической
связи: ковалентная и ионная. И хотя в школьном курсе
химии мы считаем, что эти два типа химической связи — нечто
прямо противоположное, на самом деле в реальных химических
системах можно наблюдать постепенный переход от одного
типа связи к другому.
Ковалентная связь
Ковалентную (или, как ее еще называют, гомеополярную)
связь можно рассматривать как результат того, что электрон-
ная пара принадлежит сразу двум взаимодействующим ато-
мам. Наглядно это можно представить себе так: в результате
перекрывания электронных облаков между ядрами атомов про-
исходит концентрирование отрицательного заряда (почему
именно оно происходит, можно объяснить только с помощью
квантовой механики), что приводит к стягиванию этих ядер и
к понижению энергии системы. ’
Чтобы образовалась электронная пара, принадлежащая
двум атомам, эти атомы должны (при обычном механизме
122
образования связи) иметь неспаренные электроны на внешнем
(валентном) уровне, т. е. на внешних орбиталях должно нахо-
диться по одному электрону. Например, свободные атомы водо-
рода и хлора имеют следующие электронные конфигурации:
Н Is1 Cl ls22s22p63s23p5.
При этом валентные электроны распределяются по орбиталям
следующим образом:
н Q
TS
С1[П
3s
Зп
Таким образом, и у водорода, и у хлора имеется по одному
неспаренному электрону. Наличие на внешних орбиталях как
неспаренных, так и спаренных электронов (двух электронов
с противоположным знаком магнитного момента на одной орби-
тали) можно изобразить и таким образом:
Н- ,С1:
Образование из атомов водорода и хлора молекул Н2, С12 и
НС! передается следующими схемами:
Н- + - Н -* Н: Н,
:С1- + -С1: - :С1:С1:,
Н- 4- -С1:->Н :С1:
На этой схеме общие для двух соединяющихся атомов элек-
тронные пары обозначены двумя точками между символами
атомов. Электронные пары, не используемые атомами для
образования связи, обозначены парами точек около символа
соответствующего атома; такие электронные пары называются
непод елейными, а способ изображения электронного строения
молекул — электронными формулами.
Приведенные выше электронные формулы показывают, что
при образовании ковалентной связи атомы как бы дополняют
своп электронные оболочки (с учетом электронов, принадлежа-
щих сразу двум атомам) до конфигурации инертного газа,
т. е. до восьми (в случае водорода — до двух, как у гелия)
электронов на внешнем уровне (правило октета). Такая элек-
тронная конфигурация отличается особой устойчивостью.
Следует отметить, что когда увеличение количества неспаренных электро-
нов и, следовательно, валентности элемента достигается за счет использова-
ния d-орбиталей, нарушается правило октета, требующее наличия в соеди-
нении вокруг данного атома восьми внешних электронов, либо принадлежа-
щих только этому атому (ионная связь), либо общих с другими атомами (ко-
123
валентная связь). Это нужно учитывать при составлении электронных формул
таких соединений, как, например, пентахлорид фосфора, трнокснд серы.
С учетом сказанного можно дать теперь определение ва-
лентности. Это число электронных пар, соединяющих данный
атом с другими в соединении. При обычном механизме обра-
зования ковалентной связи (может быть еще донорно-акцеп-
торный механизм, который будет рассмотрен ниже) максималь-
ная валентность элемента равна числу неспаренных электро-
нов в атоме. Отсюда следует важное свойство ковалентной
связи, а именно ее насыщаемость: данный атом может быть
связан ковалентной связью лишь с определенным числом дру-
гих атомов, но не образует прочных связей со всеми близко
к нему расположенными атомами. Например, в жидком кисло-
роде атомы кислорода связаны попарно в молекулы О2, но не
образуют прочных связей вне этих молекул, т. е. с атомами
кислорода соседних молекул.
Другое важное свойство ковалентной связи — ее направлен-
ность. Чтобы образовалась прочная ковалентная связь, атомы
должны быть определенным образом расположены друг, отно-
сительно друга. Это вытекает из симметрии электронных обла-
ков, участвующих в образовании ковалентной связи: связь бу-
дет тем прочнее, чем сильнее перекрываются электронные
облака.
Два атома могут быть связаны между собой более чем од-
ной электронной парой. Число электронных пар, связывающих
два атома, называется кратностью связи. В случае двойных
и тропных связей поделены соответственно две и три электрон-
ные пары, например:
О::О, :N:.;N:
Как мы видим, оба атома окружены восемью электронами, т. е.
действует правило октета.
Для изображения строения веществ с ковалентной связью
пользуются структурными формулами, в которых каждая об-
щая электронная пара изображается чертой, соединяющей два
атома; кратность связи при этом обозначается числом черто-
чек между символами соответствующих атомов:
Н—О—Н, о = О, О = С = О, N = N.
Структурные формулы удобны своей наглядностью. В част-
ности, по ним легко подсчитывать валентность элемента в дан-
ном соединении, помня, что она равна сумме кратностей свя-
зей, образуемых атомами этого элемента с другими атомами.
Ковалентная связь может быть полярной или неполярной в
зависимости от того, какие атомы образуют связь. Если, на-
пример, двухатомная молекула образована двумя одинако-
выми атомами, то отрицательный заряд общей электронной
124
пары распределится между ними поровну. В таком случае го-
ворят, что связь неполярная. Если же соединяются два атома
с существенно разной электроотрицательностью, то облако
отрицательного заряда общей электронной пары сместится в
сторону более электроотрицательного атома и связь будет
полярной. В порядке возрастания электроотрицательности не-
металлы располагаются в следующий ряд: Si, В, Sb, As, Н, Р,
Те, Se, С, I, S, Br, Cl, N, О, F, которым пользуются для каче-
ственной оценки полярности связей между неметаллами.
Следует различать полярность связей и полярность молекулы в целом.
Полярность молекулы представляет собой векторную сумму полярностей
отдельных связей. Симметричные молекулы могут быть неполярными, несмот-
ря на полярность имеющихся в них связей. Так, линейная молекула СО2
(О = С=О) неполярна, хотя связь С=О поляриа. В молекуле тетрахлорнда
углерода СС14 связи С—С1 полярны, однако молекула в целом неполярна,
так как имеет симметричную форму правильного тетраэдра, в результате чего
полярности всех четырех связей взаимно компенсируют друг друга.
Когда молекула полярна, говорят, что в ней имеется диполь, т. е. си-
стема из пространственно разделенных положительного и отрицательного
зарядов. Например, диполь имеется в молекуле воды, имеющей форму тре-
угольника с углом 104,5° между связями О—Н; на атоме кислорода имеется
некоторый отрицательный заряд, а на атомах водорода — небольшой поло-
жительный. Для простоты этот диполь часто изображают на рисунках в виде
вытянутого овала со знаками «+» и «—» на концах.
Донорно-акцепторное взаимодействие
Эта разновидность химической связи по характеру сил, дей-
ствующих между атомами, принципиально не отличается от
обычной ковалентной связи. Различие состоит лишь в том, что
оба электрона, необходимых для образования связи, в данном
случае предоставляются одним атомом. Таким образом, пра-
вильнее говорить не о донорно-акцепторной связи (хотя это
выражение часто встречается в литературе), а о донорно-
акцепторном механизме образования ковалентной связи.
Для образования связи по донорно-акцепторному меха-
низму необходимо, чтобы один из соединяющихся атомов (до-
нор) имел на рнешнем уровне неподеленную электронную пару,
а другой атом (акцептор) — свободную внешнюю орбиталь, на
которой формально могла бы разместиться эта электронная
пара.
Атомы, участвующие в донорно-акцепторном взаимодей-
ствии, не обязательно должны быть свободными, они могут
входить в состав каких-то молекул. Следовательно, в этом вза-
имодействии могут участвовать как атомы, так и молекулы и
ионы. Например, по донорно-акцепторному механизму может
возникнуть связь между ионом водорода (акцептор) и молеку-
лой аммиака (донор), поскольку ион водорода имеет вакант-
ную ls-орбиталь, а молекула аммиака — неподеленную элек-
тронную пару.
125
И Н 1+
И- -I- :N: н . Н :N: Н ,
Н Н
в результате чего образуется ион аммония NH^.
Донорно-акцепторное взаимодействие имеет большое зна-
чение в хнмни растворов: именно по такому механизму осу-
ществляется взаимодействие между частицами растворенного
вещества и нейтральными молекулами растворителя, приводя-
щее к образованию сольватов. Один из примеров — гидратация
иона водорода:
Н Г И 1+
Н+ + :б: Н -> |Н:б: Н]
акцептор донор
Другой пример: ион [А1(ОН)4]_, существующий в растворах
алюминатов, образуется за счет донорно-акцепторного взаимо-
действия иона ОН' с гидроксидом алюминия:
ОН
[Н :O:J~ + cl: ОН -
ОН
донор акцептор
он
НО :А1: ОН
ОН
Соединения, образующиеся в результате доиорио-акцепториого взаимо-
действия, служат хорошей иллюстрацией того, что понятия «валентность» и
«степень окисления» неидентпчны. Азот в молекуле аммиака и в ионе аммо-
ния имеет одну и ту же степень окисления — 3. Действительно, условно мы
считаем, что азот принимает электроны от водорода. Но, во-первых, он не
может принять больше трех электронов (у пего всего три вакансии на внеш-
них орбиталях). Во-вторых, превращение молекулы аммиака в ион аммо-
ния сопровождается присоединением не атома, а иона водорода, у которого
вообще нет ин одного электрона. И, в-третьих, соединения, содержащие ион
аммония, можно получить присоединением нейтральной молекулы аммиака
к другим нейтральным молекулам — кислотам или воде — без изменения сте-
пеней окисления атомов в них, например:
NHs+HCI = NH4C1,
nh3+h2o=nh4oh.
Следовательно, при образовании иона NH4' из молекулы аммиака степень
окисления азота не меняется, оставаясь равной —3. Однако число электрон-
ных пар, связывающих атом азота с другими атомами, иначе говоря, валент-
ность азота в ионе аммония равна четырем.
Ионная связь
Можно представить себе крайний случай, когда электрон-
ные облака, ответственные за связь между двумя атомами,
полностью переходят с одного атома на другой, в результате
чего атомы превращаются в заряженные частицы — ионы. Связь
при этом будет осуществляться за счет взаимного притяжения
противоположно заряженных ионов. Такая связь называется
ионной, а соединения, состоящие из ионов, — ионными соедине-
I26
ниями. Очевидно, ионная связь может возникнуть в том слу-
чае, если электроотрицательность двух элементов различается
наиболее сильно, т. е. один из атомов относится к числу наи-
более электроположительных элементов (типичный металл),
а другой — к числу наиболее электроотрицательных (типичный
неметалл).
Как показывают экспериментальные данные, такой предель-
ный случай не реализуется на 100% даже для атомов, столь
разных по электроотрицательности, как щелочные металлы и
галогены. Однако в качестве очень удобного приближения счи-
тают типично ионными соединения между самыми электропо-
ложительными и самыми электроотрицательными элементами.
Примером типично ионного соединения является хлорид нат-
рия, хотя заряды атомов натрия и хлора в этом соединении по
абсолютной величине заметно ?иеныпе единицы.
Силы межмолекулярного взаимодействия
Силы, которые удерживают молекулы в молекулярной решетке (см. ни-
же) или в жидкой фазе, объединяются под общим названием сил межмоле-
кулярного взаимодействия, или межмолекулярных сил. Их называют еще
«силами Ваи-дер-Ваальса», или вандерваальсовыми силами, по имени ученого,
который вывел уравнение газового состояния, учитывающее взаимное притя-
жение молекул. Как и вообще химическая связь, эти силы имеют в конеч-
ном итоге электрическую природу.
Чтобы понять природу межмолекулярных сил, рассмотрим поведение ней-
тральных молекул в электрическом поле. Под действием электрического поля
полярные молекулы вещества в той или иной степени ориентируются по на-
правлению поля. Это явление называется ориентационной поляризацией.
Тепловое движение стремится нарушить ориентацию молекул. В результате
устанавливается некое равновесное состояние, зависящее от температуры и
приложенного поля.
Ориентация будет тем сильнее, чем больший диполь имеет молекула.
Кроме того, под действием электрического поля в молекулах происходит
некоторое смещение электронных облаков относительно ядер. Результатом яв-
ляется так называемый индуцированный диполь, увеличивающий обший ди-
польный момент молекулы. Очевидно, индуцированный диполь существует до
тех пор, пока на молекулу влияет внешнее поле. Он может возникнуть даже
в таких симметричных молекулах, как Н2 или СС14.
Теперь посмотрим, какое значение имеет поведение молекул в электри-
ческом поле для возникновения межмолекулярных сил. Если две полярные мо-
лекулы окажутся рядом, то они притянутся друг к другу разноименно заря-
женными концами. Возникающие в результате этого ориентационные силы бу-
дут стремиться удерживать молекулы вместе.
Помимо этого, на каждую молекулу будет влиять поле соседней моле-
кулы, что приведет к деформации электронных облаков молекулы и
появлению у нее индуцированного диполя, причем под влиянием поля
полярной молекулы диполь индуцируется даже в неполярной молекуле.
В результате дополнительно возникают индукционные силы межмолекуляр-
ного взаимодействия.
Особый случай — взаимодействие между неполярными молекулами, вза-
имное притяжение которых объясняют наличием так называемого диспер-
сионного взаимодействия. Дисперсионные силы возникают за счет колебатель-
ных движений ядра и электронов друг относительно друга, в результате чего
в атоме возникают как бы флуктуирующие диполи. Образование этих дипо-
лей можно представить наглядно, воспользовавшись представлением об элек-
127
тронах как о частицах, вращающихся вокруг ядра: с той стороны атома, на
которой в данный момент находится электрон, имеется избыток отрицатель-
ного заряда и, следовательно, с другой* стороны атома — избыток положи-
тельного заряда. При сближении частиц флуктуации диполей делаются со-
гласованными по фазе, т. е. такими, что отрицательный конец одного диполя
примыкает к положительному концу другого диполя, несмотря на быструю
перемену знака заряда. В результате между частицами возникает притя-
жение.
Дисперсионные силы очень быстро убывают с расстоянием, поэтому дис-
персионное взаимодействие проявляется только при тесном сближении частиц.
Этот вид межмолекуляриого взаимодействия универсален, ибо он возникает
между любыми частицами, независимо от наличия у них заряда или дипо-
лей. Например, только дисперсионным взаимодействием можно объяснить
притяжение между атомами инертных газов (по характеру поведения одно-
атомными молекулами) в жидкой и твердой фазах.
Водородная связь
Если сравнивать температуры кипения соединений элемен-
тов главных подгрупп седьмой, шестой и пятой групп с водо-
родом, то в случае фтороводорода, воды а аммиака темпера-
туры кипения оказываются аномально высокими, хотя обычно
в ряду аналогичных веществ одной подгруппы температура ки-
пения растет с увеличением молекулярной массы и у HF, Н2О
и NH3 должна была бы быть минимальной. Это означает, что
в этих веществах велика энергия межмолекулярного взаимо-
действия, а последнее связано с наличием в них так называе-
мых водородных связей между молекулами.
Возникновение водородной связи можно объяснить следую-
щим образом: атом водорода, связанный в молекуле с наибо-
лее электроотрицательным и небольшим по размеру атомом,
взаимодействует не только с ним, ио и с таким же атомом, вхо-
дящим в состав другой молекулы. Например, в случае фторо-
водорода атом водорода связан ковалентной связью с атомом
фтора «своей» молекулы, по еще и водородной связью (изобра-
жается пунктиром)—с атомом фтора соседней молекулы:
F—H...F—H...F—Н.
Возможность образования водородной связи является ре-
зультатом особых свойств атома водорода, а именно — нали-
чия у него одного единственного электрона. Если облако отри-
цательного заряда электрона сильно смещается к другому ато-
му (что происходит, когда водород соединен ковалентной
связью с сильно электроотрицательным элементом), то оста-
ется мало закрытый электронным облаком протон — частица
с единичным зарядом и очень малым радиусом. Это создает
возможность для донорно-акцепторного взаимодействия между
протоном и неподеленной электронной парой сильно электро-
отрицательных элементов, таких как фтор, кислород, азот, вхо-
дящих в состав другой молекулы.
Таким образом, водородная связь — это специфический вид
взаимодействия между молекулами, который не сводится просто
128
к электростатическому притяжению между диполями, как в
случае обычного межмолекулярного взаимодействия, а имеет
донорно-акцепторный характер. Поэтому энергия (и, следова-
тельно, прочность) водородной связи выше энергии вандер-
ваальсового межмолекулярного взаимодействия (последняя
порядка нескольких кДж/моль), хотя и ниже энергии кова-
лентных связен (порядка сотен кДж/моль). Так, энергия водо-
родной связи между молекулами фтороводорода составляет
около 40 кДж/моль, между молекулами воды — около
25 кДж/моль. От обычного межмолекулярного взаимодействия
водородная связь отличается также своей специфичностью
(образуется лишь с определенными атомами), направлен-
ностью и насыщаемостью — свойствами, характерными для ко-
валентной связи.
Некоторые аномальные физические свойства воды обуслов-
лен:.,: способностью ее молекул образовывать водородные свя-
зи: именно благодаря им вода находится при комнатной тем-
пературе в жидком, а не газообразном состоянии, как, напри-
мер, сероводород — вещество с большей, чем у воды, молеку-
лярной массой. Водородные связи играют большую роль в
структуре льда, водных растворов (в том числе биологических
систем), кристаллогидратов. Так, в кристаллах медного купо-
роса CuSO4-5H2O одна молекула воды присоединена к гидра-
тирозанному иону меди через водородные связи, что иллюстри-
рует следующая схема:
Если водородная связь между молекулами достаточно проч-
на, она может сохраняться и в газообразном состоянии. Так,
при испарении фтороводорода в пар переходят полимерные мо-
лекулы (HF),, в парах воды также сохраняется некоторое ко-
личество молекул (Н2О)2.
На примере фтороводорода, между молекулами которого образуется особо
прочная водородная связь, можно наблюдать, как сказывается водородная
связь па химических свойствах вещества. Хотя в молекуле HF только один
атом водорода, фтороводородная кислота может образовывать кислые соли
типа KHF2, NH4HF2 и т. п., являющиеся производными димера H2F2. Изме-
рения электропроводности водных растворов фтороводородной кислоты по-
казывают, что в растворе образуются преимущественно анионы HF7 . В этом
ионе оба атома фтора связаны с атомом водорода одинаково прочно, т. е.
происходит перераспределение электронных плотностей, в результате чего
обе связи между водородом и фтором становятся равноценными.
9 Сеченов II. Н. 129
Водородная связь возникает между молекулами органиче-
ских соединений, содержащих группы —ОН и —NH2. Приме-
рами могут служить спирты и карбоновые кислоты. Ассоциа-
ция молекул за счет водородных связей приводит к тому, что
спирты н карбоновые кислоты имеют более высокие темпера-
туры кипения, чем соответствующие им альдегиды, между мо-
лекулами которых водородные связи не образуются. Наличием
водородных связей объясняется образование димеров муравьи-
ной и уксусной кислот в парах
До сих пор речь шла о межмолекулярных водородных свя-
зях, но встречаются и внутримолекулярные водородные связи.
Примером может служить орто-салициловая кислота
Он
в которой водородная связь осуществляется между водородом
гидроксильной группы и кислородом карбоксильной группы.
В этом соединении наличие водородной связи способствует
отщеплению иона водорода в карбоксильной группе, вследствие
чего орто-салициловая кислота оказывается значительно более
сильной, чем мета- и лара-изомеры, в которых гидроксильная
и карбоксильная группы находятся на большем расстоянии, что
препятствует образованию внутримолекулярной водородной
связи.
Внутримолекулярные водородные связи играют очень важ-
ную роль в структуре белков.
§ 4. СТРОЕНИЕ КРИСТАЛЛОВ
Твердые тела могут быть аморфными и кристаллическими.
В противоположность аморфному состоянию кристаллическое
состояние характеризуется упорядоченным расположением ча-
стиц в пространстве. С энергетической точки зрения кристалли-
ческое состояние по сравнению с аморфным характеризуется
более низкой внутренней энергией, поэтому аморфные тела
способны самопроизвольно превращаться в кристаллические —
кристаллизоваться.
В строении твердых тел различают ближний и дальний по-
рядок расположения составляющих их частиц. Под ближним
130
Рис. 0. Кристаллическая структура
каменной соли (NaCl).
порядком подразумевают способ взаимного расположения со-
седних частиц относительно данной. Ближний порядок, хотя и.
в несколько искаженном виде, сохраняется и в аморфном со-
стоянии, однако в аморфном состоянии отсутствует дальний
порядок расположения частиц, характерный лишь для кристал-
лического состояния. Под дальним порядком подразумевают,
что определенный закон размещения частиц в пространстве вы-
полняется на любом рас-
стоянии от данного атома.
Зная координаты несколь-
ких частиц и закон их раз-
мещения в пространстве,
можно предсказать, как
разместятся частицы в кри-
сталле на большом рас-
стоянии от исходных частиц.
Например, в кристалле
каменной соли ближний по-
рядок характеризуется тем,
что каждый ион натрия
окружен шестью ионами
хлора, образующими вокруг
иона натрия правильный ок-
таэдр (рис. 6). Наличие же
в этом кристалле дальнего
порядка означает, что если
в какой-то точке есть, например, ион натрия, то, зная закон, по
которому строится структура кристалла, можно предсказать
положение ионов натрия и хлора на сколь угодно большом рас-
стоянии от данного иона.
Именно наличие дальнего порядка придает правильность,
регулярность структуре кристалла. За счет же своей правиль-
ной структуры кристаллы обычно анизотропны (их свойства
различаются в зависимости от направления в кристалле).
Пространственное расположение частиц в кристалле назы-
вается кристаллической решеткой. Она изображается в виде
пересекающихся прямых, соединяющих узлы кристаллической
решетки — центры частиц, образующих решетку. В зависимости
от характера связей между частицами в кристаллической ре-
шетке различают молекулярные, атомные, ионные и металли-
ческие кристаллические решетки.
Молекулярные решетки
Кристаллы с молекулярными решетками, или молекуляр-
ные кристаллы, — это такие кристаллы, в узлах решеток кото-
рых находятся отдельные молекулы. Вещества, состоящие из
молекул с ковалентной связью, образуют молекулярные кри-
сталлы. В таких кристаллах действуют два типа сил: сильные
9*
I3J
силы ковалентной связи внутри молекулы и гораздо более сла-
бые силы межмолекулярного взаимодействия. Так как для раз-
рыва последних требуется небольшая энергия, молекулярные
кристаллы легко разрушаются (например, при небольшом по-
вышении температуры) с образованием отдельных молекул.
Поэтому вещества с молекулярными решетками характери-
зуются низкими температурами плавления и кипения (и, сле-
довательно, высокой летучестью), а также невысокой механи-
ческой прочностью. Таковы, например, кристаллические ре-
шетки воды, твердых кислорода и азота, галогенов, «сухого
льда.е, многих органических веществ.
Входящие в состав таких решеток молекулы могут быть и
одноатомными, как в типично молекулярных решетках инерт-
ных газов в твердом состоянии. Следовательно, главное здесь
не тип частиц, находящихся в узлах решетки, а характер вза-
имодействия между ними.
Атомные решетки
Существуют кристаллические решетки, в которых атомы
связаны прочными ковалентными связями таким образом, что
в решетке нельзя выделить отдельные молекулы. Такие ре-
шетки называются атомными решетками. Примерами атомных
решеток могут служить, например, кристаллы алмаза и карбо-
рунда SiC. В решетке алмаза каждый атом углерода связан
прочными ковалентными связями с четырьмя другими атомами
углерода, расположенными по отношению к нему по верши-
нам тетраэдра, в центре которого находится данный атом
углерода.
Свойства таких кристаллов определяются прочными свя-
зями между атомами, поэтому в противоположность веществам
с молекулярными решетками вещества с атомными решетками
имеют высокие температуры плавления и кипения, а также
высокую твердость.
Ионные решетки
Соединения с ионной связью образуют кристаллические ре-
шетки, в узлах которых находятся ионы. Причиной связи
между ионами с противоположными зарядами является элек-
тростатическое притяжение, поэтому ионная связь в противопо-
ложность ковалентной не обладает направленностью и насы-
щаемостью: любой ион притягивается к любому числу нахо-
дящихся поблизости от него и расположенных любым образом
относительно него ионов с противоположным зарядом, а также
отталкивается от всех находящихся рядом ионов одинакового
с ним заряда. Например, в кристаллической решетке хлорида
натрия каждый ион натрия сильнее всего притягивается к шести
расположенным вокруг него ионам хлора. То же самое можно
132
сказать С> любом ионе хлора: он сильнее всего притягивается
к шести расположенным вокруг него ионам натрия^
В состав ионных решеток могут входить не только элемен-
тарные ионы (состоящие из одного элемента), но и сложные,
например анионы кислородных кислот (оксоанионы).
Как и в атомных кристаллах, в ионных решетках нельзя
выделить какую-то группу атомов и назвать ее молекулой, сле-
довательно, в ионных решетках также отсутствует «слабое зве-
но» в виде более слабых межмолекулярных взаимодействий. По-
этому, как и для веществ с атомными решетками, для ионных
соединений характерны высокие температуры плавления п ки-
пения и соответственно низкая летучесть и высокая механиче-
ская твердость. Так, хлорид натрия имеет температуру плавле-
ния около 800°C и температуру кипения выше 1400°C.
В .отличие от веществ с атомными решетками типично ион-
ные соединения в расплаве и водном растворе ведут себя как
электролиты, т. е. диссоциируют на ионы.
Кристаллические решетки, в которых отсутствуют отдель-
ные молекулы, иногда объединяют под общим названием «ко-
ординационные решетки». Такие решетки образует в твердом
состоянии большинство неорганических веществ. Лишь лпи
высоких температурах в парообразном состоянии можно обна-
ружить отдельные молекулы этих веществ, например молекулы
хлорида натрия.
Реальные вещества часто образуют кристаллические ре-
шетки, характер которых является промежуточным между рас-
смотренными выше типами. Даже в таких веществах, которые
мы привыкли считать ионными, например в оксиде кальция или
оксиде магния, на самом деле не происходит полного перехода
электронных облаков, соответствующих валентным электронах!,
от атомов кальция или магния к атомам кислорода, т. е. связь
в них далеко не идеально ионная. Еще в меньшей степени про-
исходит потеря электронов атомами металла и присоединение
их атомами кислорода в кристаллической решетке оксида алю-
миния. Последняя является примером промежуточной между
ионной и атомной решетками. В отношении таких решеток
часто говорят о «степени ионности», которую, однако, трудно
оценить количественно. Рассуждая же чисто качественно, мож-
но сказать, что в случае оксида алюминия степень ионности
достаточна для того, чтобы раствор этого вещества в расплав-
ленном криолите вел себя как электролит (см. главу 7).
Металлические решетки
Характерные свойства металлов (подробнее они будут рас-
смотрены в § 3 главы 7) объясняются строением их кристалли-
ческих решеток и характером связей в них. Поэтому иногда го-
ворят о «металлической связи» как об особом случае химиче-
ской связи. Если ковалентная связь между двумя атомами осу-
133
ацествляется за счет обобществлении валентных электронов, при-
надлежащих этим днум атомам, то металлическая связь осу-
ществляется за счет обобществления электронов в масштабе
-всего кристалла.
Достаточно точно объяснить природу химической связи в
решетках металлов в рамках тех знаний, которые дает школь-
ная программа по химии, невозможно, поэтому на данном эта-
пе обучения приходится ограничиваться упрощенными пред-
ставлениями, суть которых сводится к следующему. Когда
атомы типичных электроположительных элементов образуют
металлическую решетку, электронные облака валентных элек-
тронов этих атомов взаимодействуют между собой, создавая
единую систему, единое облако отрицательного заряда, обте-
кающее со всех сторон остающиеся положительные ионы. Сле-
довательно, связь в типичной металлической решетке является
ненаправленной. В свою очередь, пенаправленность связей при-
водит к тому, что атомы располагаются в металлической ре-
шетке наиболее простым способом, образуя так называемые
«плотные упаковки», т. е. максимально плотно занимая про-
странство.
Резкой границы между металлами и неметаллами не существует. При
переходе от типичных металлов к элементам, у которых металлические
спойстга несколько ослаблены, появляются ковалентные связи в кристалли-
ческой решетке, вообще характерные для неметаллов. На образование этих
связей расходуется то или иное количество валентных электронов, которые
в типично металлической решетке определяли бы типично металлические
свойства. В результате металлические свойства ослабевают. Направленный
характер ковалентных связей приводит к потере металлами пластичности—
юнп делаются более хрупкими.
Графит представляет собой промежуточный случай между металличе-
ской и атомной решетками. Внутри каждого слоя углеродные атомы свя-
заны ковалентной неполярной связью, в то время как электроны, обеспечи-
вающие связь между слоями, находятся в состоянии, близком к состоянию
электронов в металле.
Таким образом, можно наблюдать постепенный переход от металлических
решеток к атомным. Элементы, для которых характерны такие решетки, ино-
гда называют полуметаллами. В периодической таблице они располагаются
на границе между типичными металлами и типичными неметаллами. Ослаб-
ление металлических свойств за счет использования «металлических» элек-
тронов для образования ковалентных связей происходит и тогда, когда в
сплавах образуются соединения между металлами (см. главу 7) пли когда
металлы принимают в свою решетку атомы других элементов (см. главу 9).
Упражнения к главе 3
1. На основании положения элемента в периодической системе пред-
скажите максимальную (по абсолютной величине) положительную и отри-
цательную степени окисления мышьяка, селена, астата.
2. Напишите формулы высших оксидов циркония, ванадия, вольфрама.
3. На основании известных Вам свойств алюминия предскажите свой-
ства простого вещества н типичных соединений галлия. Постарайтесь найти
в литературе характеристики этих веществ, известные из опыта и пред-
сказанные Д. И. Менделеевым. Сравните их.
4. Проделайте то же для германия и мышьяка на основании известных
"Вам свойств соответственно кремния и фосфора. В чем состоят вероятные
Л 34
отличия германия от кремния и мышьяка от фосфора, если основываться на
знании характера изменения свойств элементов в главных подгруппах перио-
дической системы?
5. Зная характер изменения свойств в периодах периодической систе-
мы, попробуйте предсказать свойства теллура на основании известных Вам
свойств иода.
6. Сравните хром и серу в виде простых веществ и в виде соединений,
соответствующих высшей степени окисления этих элементов. Какие выводы
можно сделать из такого сравнения?
7. Попробуйте разными способами оценить физические характеристики
(температуры плавления и кипения, плотность и т, д.) следующих простых
веществ: франция, астата и технеция. Полугенные Вамп величины сравни-
те с приводимыми в учебниках и справочниках.
8. В какой части периодической системы расположены элементы, кото-
рые могут образовывать газообразные при обычных условиях оксиды?
9. Как изменяются кислотные свойства оксидов в следующем ряду
N 2О3— Р-2О3— AsjO-j— S Ь2О3— Bi2O3?
10. Как изменяется устойчивость соединений в следующих рядах
SO3-SeO3—ТеО3: CrO3—МоО3—WO3?
11. Сходство между какими элементами больше: между фосфором и
азотом или между фосфором и мышьяком? Объясните причины.
12. Приведите примеры существенных различий между элементами вто-
рого и третьего периодов.
13. Объясните, почему в природе свинец встречается в основном в виде
PbS, а олово — в виде SnO2.
14. Д. И. Менделеев в первом варианте короткой формы периодической
таблицы поместил медь в VIII группу сразу после железа, кобальта и ни-
келя, в побочную же подгруппу I группы — лишь в скобках. Какие для
этого имелись основания?
1-5 . Исходя из свойств водорода в виде простого вещества и .характера
образуемых им соединении, объясните, почему этот элемент помещен как в
I, так и в VII группе периодической системы. Сравните Ваш ответ с тем,
какой дается в Приложении.
16. Почему практически легче разделять соединения актиноидов, чем
лантаноидов?
17. Насколько точно утверждение: «Все вещества состоят пз молекул,
а все молекулы состоят из атомов»?
18. В каких пз перечисленных ниже веществ связь ионная, а в каких —
ковалентная (укажите, полярная или неполярная): HBr, NaBr, CS2. H2S,
Mgl2, PH3, SF,;, F2, S3, CaCI2, SO2, SiH4, CC14, AgCl. Для веществ с кова-
лентной связью изобразите схему электронного строения молекулы.
19. Почему молекула воды полярпа, а молекула СО2 — нет?
20. Почему теплопроводность графита выше, чем теплопроводность ал-
маза?
21. Почему аммиак хорошо растворим в воде и его раствор имеет ще-
лочную реакцию, в то время как метан плохо растворим и воде и его рас-
твор имеет нейтральную реакцию?
22. Почему молекула BF3 плоская, а молекула NH3 пирамидальная?
Какими примерно должны быть углы между связями в молекуле BF3-NH3,
образующейся по донорно-акцепторному механизму? На какую знакомую
Вам молекулу она должна быть похожа?
23. Какие из перечисленных ниже веществ в твердом состоянии построе-
ны из отдельных молекул: хлорид калия, метан, мочевина, иод, гидроксид
натрия, кислород, карбоиат кальция?
24. Почему от воды к сероводороду температура кипения понижается,
а от сероводорода к селеноводороду и теллуроводороду—повышается?
25, Этиловый спирт С2Н5ОН имеет температуру кипения 78 °C. Почему
у меркаптана C2H3SH температура кипения ниже (37°C), хотя молекулярная
масса больше?
135
26. Молекулярная масса хлорида четырсхвалеитного элемента относится
к молекулярной массе его оксида, как 7 :2, Какой это элемент?
27. При растворении в кислоте 2.22 г металла, расположенного во II
группе периодической системы, выделилось 0,762л водорода (н.у.). Какой это
металл?
28. При взаимодействии с хлором 47,9 г металла, стоящего в IV гр. нпе
периодической системы, было получено 189,9 г хлорида. Назовите этот ме-
талл.
29. К 15 мл 0,2 М раствора сульфата некоторого металла, расположен-
ного в третьем периоде, прибавили 45 мл 0,2 М раствора хлорида бария.
При этом образовалось 2,097 г осадка. Сульфат какого металла был т-зят?
Глава 6
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
§ 1. ОСНОВНЫЕ ПОНЯТИЯ
Окислительно-восстановительные реакции сопровождаются
переходом электронов от одних участвующих в реакции ,.;иц
(атомов, ионов, молекул) к другим. Процесс потери электронов
частицей называется ее окислением, а сама частица, теряющая
электроны, — восстановителем. Процесс присоединения элек-
тронов частицей называется ее восстановлением, а сама части-
ца, принимающая электроны, — окислителем. Таким образом,
в ходе окислительно-восстановительной реакции окислитель
восстанавливается, а восстановитель окисляется.
В химических реакциях окисление одного вещества всегда
сопровождается восстановлением другого, и наоборот. Коли-
чество электронов, принимаемых окислителем, равно количе-
ству электронов, теряемых восстановителем, поэтому химиче-
ская система в целом остается электронейтральной. Это озна-
чает, что если мы нашли в уравнении реакции вещество, кото-
рое в ходе реакции, например, восстанавливается, то следует
искать в том же уравнении вещество, которое в ходе реакции
окисляется, и наоборот.
Мы уже неоднократно встречались с таким понятием, как
«степень окисления» (окислительное число). Напомним, что это
формальная величина, которую вычисляют на основе формулы
соединения исходя из условного допущения, что связь между
атомами в данном соединении ионная. Несмотря на формаль-
ный характер понятия «степень окисления», использование его
оказывается весьма продуктивным при рассмотрении окисли-
тельно-восстановительных реакций, в частности при нахожде-
нии коэффициентов уравнений окислительно-восстановительных
реакций методом окислительных чисел.
Так как электрон заряжен отрицательно, при окислении
степень окисления атома изменяется в положительную сторону,
а при восстановлении — в отрицательную. Из предыдущей гла-
136
вы мы знаем, что при образовании химической связи между
двумя разными атомами во многих случаях происходит не пе-
реход электронов, а лишь некоторое смещение электронного
облака валентных электронов от одного атома к другому.
В высших степенях окисления все атомы вообще склонны
образовывать соединения с ковалентной связью, а не ионной.
Так, в ионе МпОГ связь между атомами кислорода и марганца
ковалентная полярная, и заряд на атоме марганца отнюдь ле
7 (как формальная степень окисления), а во много раз
меньше.
Говоря, что степень окисления марганца в таком ионе <::с-
ленно равна +7 и что при восстановлении этого иона до мар-
ганца в степени окисления +2 атом марганца принимает лпь
электронов, мы допускаем очень большую условность. Правиль-
нее говорить, что ион МпОГ превращается в ион Мп2+, совер-
шенно не касаясь при этом вопроса о том, какие заряды име-
ются на атомах марганца и кислорода в ионе МпОГ- Коли-е-
ство электронов, которое переходит от восстановителя к окис-
лителю при таком превращении, также равно пяти — в этом
мы сможем убедиться чуть позже. Таким образом, применяя
заведомо условный формальный подход (степень окисления),
мы получаем верный количественный результат (количество
электронов, получаемых окислителем от восстановителя).
§ 2. ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ
РЕАКЦИЙ
Окислительно-восстановительные реакции можно разделить
на три типа: межмолекулярные, внутримолекулярные и реак-
ции диспропорционирования.
Межмолекулярными называются окислительно-восстанови-
тельные реакции, в результате которых изменяется степень
окисления атомов в разных веществах. Таким образом, в роли
окислителя и восстановителя в этом случае выступают разные
вещества. Например:
2 Са + О2 = 2 СаО.
С такого рода окислительно-восстановительными реакциями мы
встречаемся чаще всего.
Окислительно-восстановительные реакции, в результате ко-
торых меняется степень окисления разных атомов в одном и
том же веществе, называются внутримолекулярными. В этом
случае в роли окислителя и восстановителя выступают разные
атомы в одном и том же соединении. Например:
2 КСЮз = 2 КС1 + ЗО2.
Здесь хлор восстанавливается, а кислород окисляется.
Окислительно-восстановительные реакции, в ходе которых
одновременно понижается и повышается степень окисления од-
ного и того же элемента, называются реакциями диспропорцио-
нирования (дисмутации). В таких реакциях в роли окислителя
и восстановителя выступают атомы одного и того же элемента.
Например:
4 КСЮз = КС1 + 3 ксю4.
Реакции диспропорционирования возможны, когда з исходном веществе
элемент имеет промежуточную степень окисления. Обратные реакции, в ре-
зультате которых из двух степеней окисления одного элемента образуется
новая степень окисления, промежуточная между исходными, называются ре-
акциями конпропорционирования (конмутации). Вместо терминов «диспро-
порционирование» п «коппропорционирование» употребляют также термин
«самоокисление-самовосстановление».
§ 3. ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ
Типичными окислителями могут быть:
1) простые вещества, образуемые атомами с большой элек-
троотрицательностью, т. е. типичные неметаллы, расположен-
ные прежде всего в главных подгруппах шестой и седьмой
групп периодической системы;
2) вещества, содержащие элементы в высших и промежу-
точных положительных степенях окисления, в том числе в виде
ионов, как простых, элементарных (Fe3+), так и кислородсо-
держащих, или оксоанионов (перманганат-ион);
3) перекисные соединения (пероксиды, супероксиды);
4) анод электролизной ячейки.
Наиболее часто на практике в качестве окислителей при-
меняются кислород и озон, хлор, бром, пероксид водорода и
пероксид натрия, хроматы, дихроматы, перманганаты, кисло-
родные кислоты хлора и их соли, азотная кислота, концентри-
рованная серная кислота, диоксид марганца.
Типичными восстановителями могут быть:
1) простые вещества, атомы которых имеют низкую элек-
троотрицательность (металлы, расположенные в левой части
ряда напряжений);
2) катионы металлов в низших степенях окисления (Fe2H.
Сг3+);
3) отрицательные элементарные ионы (например, сульфид-
ион);
4) кислородсодержащие анионы (оксоанионы), соответст-
вующие низшим положительным степеням окисления элемента
(нитрит, сульфит);
5) катод электролизной ячейки.
На практике в качестве восстановителей наиболее часто
используются щелочные и щелочноземельные металлы, сульфи-
ды, сульфиты, галогеноводороды (кроме фтороводорода), соли
двухвалентного железа, органические вещества — формальде-
гид, глюкоза, щавелевая кислота, а также углерод, водород, мо-
ноксид углерода и алюминий при высоких температурах.
Если какое-то вещество содержит элемент в промежуточ-
ной для него степени окисления, то будет ли это вещество в
конкретной реакции вести себя как окислитель или как восста-
новитель, зависит от его партнера по реакции. Например, ни-
трит-ион МОГ в кислой среде выступает в роли окислителя по
отношению к иону I- и в роли восстановителя по отношению
к иону МпОГ.
§ 4. СОСТАВЛЕНИЕ УРАВНЕНИЙ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
У абитуриентов часто вызывает затруднение составление
уравнений окислительно-восстановительных реакции. Трудности
обычно связаны с нахождением вероятных продуктов реакции
и с установлением стехиометрических коэффициентов, которые
в уравнениях окислительно-восстановительных реакций могут
быть довольно большими.
Если в задании не даны формулы всех продуктов реакции,
то их следует найти на основании химических свойств веществ,
участвующих в реакции, а также знания типичных реакций
между классами химических веществ. Во-первых, нужно найти
окислитель и восстановитель в дайной реакции. Для этого надо
знать, какие вещества при обычных условиях являются типич-
ными восстановителями и типичными окислителями и какие
степени окисления характерны для элементов, определяющих
окислительно-восстановительные свойства этих соединений.
Если для одного из них характерны окислительные свойства,
а для другого — восстановительные, то мы можем быть уве-
рены, что между этой парой веществ возможна окислительно-
восстановительная реакция.
Во-вторых, надо знать, до каких степеней окисления восста-
навливаются (окисляются) в данных условиях (в частности, при
данной кислотности среды) элементы, входящие в состав окис-
лителя (восстановителя). В-третьих, учитывая среду, в которой
протекает реакция, надо найти те конкретные соединения, ко-
торые могут быть продуктами реакции, т. е. смогут существо-
вать в данной химической системе в данных условиях. Напри-
мер, кислотный оксид не может, естественно, образоваться в
присутствии щелочи, а основной оксид — в присутствии кисло-
ты, поскольку кислотный оксид реагирует со щелочью, а основ-
ной оксид — с кислотой. Задача облегчается тем, что в водных
растворах обычно устойчиво лишь небольшое число степеней
окисления одного элемента и потому круг возможных продук-
тов реакции сужается.
Рассмотрим в качестве примера реакцию перманганата ка-
лия с соляной кислотой, применяемую для получения хлора в
13!)
лабораторных условиях. Перманганаты — сильные окислители.
В зависимости от среды они восстанавливаются до следующих
степеней окисления марганца: в кислой среде — до Мп (11), т. е.
до иона Мп2+, в нейтральной или слабощелочной среде — до
Мп (IV), обычно в виде МпО2, и в очень концентрированном
растворе щелочи — до Мп (VI), до манганат-иона МпОщ-
Хлороводород и его водный раствор — соляная кислота —
обладают восстановительными свойствами, окисляясь чаще
всего до свободного хлора. Восстановительные свойства хлоро-
водорода обусловлены тем, что он содержит атом хлора в пре-
дельной отрицательной степени окисления, т. е. в предельно
восстановленном состоянии. В присутствии такого сильного
окислителя, как перманганат калия, хлороводород, несомнен-
но, должен окисляться.
Итак, среди вероятных продуктов реакции будут свобод-
ный хлор и какое-то соединение двухвалентного марганца, по-
скольку реакция протекает в присутствии соляной кислоты,
т. е. в кислой среде. Можно написать неполную схему реакции:
НС1 + КМпО4-^С12 + Мп(2+)+ ....
Довольно часто учащиеся затрудняются найти продукты
восстановления солей, анион которых выступает в роли : ..це-
лителя. В данном случае мы должны ответить на вопросы: ка-
кое именно соединение марганца образуется? в виде каких со-
единений окажутся после окончания реакции два других эле-
мента, входящих в состав перманганата калия и не меняющих
в ходе реакции степень окисления, — калий и кислород?
Для поиска ответов на эти вопросы можно рекомендовать
следующий формальный прием. Будем рассматривать соль :ык
соединение двух оксидов — основного К2О и кислотного МщО7.
Это вполне законный прием: ведь мы знаем, что соль можно
получить соединением основного оксида с кислотным, а фор-
мулы некоторых солей сложного состава, например силикатов,
мы даже иногда записываем как соединения соответствующих
оксидов. Так как именно в Мп2О7 содержится тот элемент, ко-
торый в ходе реакции восстанавливается, — марганец, то м-эж-
но условно принять, что Мп2О7 превращается в МпО, отдавая
при этом часть кислорода на окисление НС1.
Следовательно, в результате восстановления перманганата
калия должны были бы получиться два оксида: К2О и МпО.
Но эти основные оксиды реагируют с находящейся в избытке
соляной кислотой, образуя соответствующие хлориды: ДС1
и МпС12. Что же касается кислорода, то, очевидно, с водо-
родом (из «разрушенной» молекулы НС1) он даст воду, при
этом степень окисления как водорода, так и кислорода ме-
няться не будет.
Значит, полную схему реакции (но еще не уравнение, по-
140
скольку не найдены стехиометрические коэффициенты) можно
записать следующим образом:
HCI + КМпО4-> С12 + МпС12 + KCI + Н2О.
Как мы видим, нахождение вероятных продуктов даже такой
сравнительно сложной окислительно-восстановительной реак-
ции подчиняется строгой химической логике.
Следующий этап — нахождение стехиометрических коэффи-
циентов. Ои основан на равенстве количества электронов, по-
терянных восстановителем и полученных окислителем, поэтому
нахождение коэффициентов начинают с составления так назы-
ваемых уравнений полуреакций окисления и восстановления.
Это делают двумя методами: 1) методом окислительных чисел
(его называют еще методом электронного баланса, но это на-
звание неточно, так как любой метод нахождения коэффи-
циентов основан на электронном балансе — на равенстве коли-
чества электронов, потерянных восстановителем п полученных
окислителем) и 2) ионно-молекулярным методом (последний
иногда называют методом полуреакций, но это название тоже
неточное, так как при любом методе мы делим процесс на две
полуреакции).
Используя метод окислительных чисел, мы условно считаем,
что атомы имеют заряд, равный их степени окисления, и по-
теху принимаем, что в ходе окислительно-восстановительной
реакции отдельные атомы принимают или отдают электроны
независимо от того, каков на самом деле заряд атомов. Урав-
нения полуреакций в этом случае называются электронными.
Например, для реакции между соляной кислотой и перманга-
натом калия электронные уравнения имеют следующий вид:
Mn(4-7)4-5e- = Мп(2+),
2 С1 (—1) — 2е- = С12.
Недостатком метода окислительных чисел является то, что
атог.'ам приписываются заряды, зачастую очень далекие от дей-
ствительности. Тем не менее этот метод помимо своей простоты
удобен применительно к реакциям в безводных условиях, когда
нет диссоциации на ионы, например для реакций термического
разложения, взаимодействия твердого вещества с газообразным,
гщи реакциях, сопровождающих горение, обжиг, сплавление
веществ и т. д. Метод окислительных чисел подробно разбира-
ется в школе, поэтому методику нахождения стехиометрических
коэффициентов этим методом мы рассматривать не будем.
В тех же случаях, когда речь идет о реакциях в водных
растворах, более методически удачным является ионно-молеку-
лярный метод. Он используется и при изучении химии в вузе,
поэтому абитуриенту рекомендуется освоить именно этот метод.
В ионно-молекулярном методе мы оперируем ионами и мо-
лекулами, реально существующими в реакционной системе.
141
При этом действуют общие правила записи ионных уравнений,
рассмотренные в главе 4, т. е. сильные электролиты записы-
ваются в виде ионов, а слабые электролиты, газы и малораст-
воримые вещества —в виде молекул. Окислительные числа (сте-
пени окисления) вообще не фигурируют в полуреакциях, мы
можем даже их не знать.
Если в полуреакциях участвуют кислородсодержащие ионы,
то для уравнивания числа атомов кислорода в уравнения полу-
реакций вводят необходимое число ионов Н+ (если реакция
протекает в кислой среде) или молекул Н2О и ионов ОН~ (если
реакция протекает в щелочной среде). Таким образом, в урав-
нениях полуреакций учитывается среда, в которой протекают
процессы окисления и восстановления. В окончательном урав-
нении полуреакции в правой и левой частях должны быть оди-
наковыми как число атомов каждого элемента, так и сумма
зарядов.
Используя ионно-молекулярный метод, для реакции между
КМпО4 и НС1 мы должны будем писать в уравнении полуреак-
ции восстановления ионы Мп2+ и МпОф, поскольку именно
такие ионы существуют (в гидратированном состоянии) в реак-
ционной системе. Восстановление сопровождается превраще-
нием иона МпОф в нон Мп2+, при этом четыре атома кисло-
рода, содержавшиеся в ионе МпОГ, войдут в состав четырех
молекул воды; степень окисления кислорода не изменится. Для
образования четырех молекул воды понадобится восемь ионов
Н+, которые надо добавить в левую часть уравнения полуреак-
ции; степень окисления водорода также не меняется. Учитывая
алгебраическую сумму зарядов всех ионов, участвующих в по-
луреакции восстановления, и добавив нужное число электро-
нов для равенства зарядов в правой и левой частях уравнения,
получаем
8Н+ + МпОГ + 5е- = Мп2- + 4 Н2О.
Для полуреакций, в которых участвуют простое вещество и
соответствующий ему элементарный ион, форма записи для
двух методов практически совпадает. Полуреакння окисления
иона хлора записывается так:
2 С1~ — 2е~ = С12.
Для электронейтральности системы в целом необходимо,
чтобы число электронов, присоединяемых за счет первой полу-
реакции, было равно числу электронов, теряемых за счет вто-
рой полуреакции. Для этого на две элементарные полуреакции
восстановления должны приходиться пять элементарных полу-
реакций окисления:
8 Н+ + МпОГ + 5е~ = Мп2+ + 4 Н2О X 2
2С1- — 2е-= Cl2 Х5
142
Умножим полуреакции на эти множители и сложим их:
2 МпО4~+ 16 Н+ + 10 Cl" = 2 Мп2+ 4- 8 Н2О + 5 С12.
Это сокращенное ионное уравнение окислительно-восстано-
вительного процесса. Мы уже встречались с сокращенными
ионными уравнениями при рассмотрении реакций обмена в рас-
творах электролитов. Вспомним, что в таких уравнениях запи-
саны лишь ионы и молекулы, которые в ходе реакции претер-
певают те или иные превращения. Что же касается ионов, ко-
торые по окончании реакции остаются неизменными, то они в
сокращенное ионное уравнение не входят. Значит, чтобы пре-
вратить сокращенное ионное уравнение в полное, надо доба-
вить в него эти ионы.
В нашем примере, поскольку ионы Н+ вводятся в реакцию
в виде соляной кислоты, следует добавить в уравнение столько
ионов С1~, чтобы их общий заряд стал равным по абсолютной
величине общему заряду ионов Н+, т. е. 6 ионов С1“. Аналогич-
ным образом в уравнение следует добавить два иона К+, кото-
рые вводятся в систему с ионами МпОГ. Прибавлять иоиы С1"
и К+ надо, естественно, и в правую, и в левую части уравне-
ния, чтобы равенство не нарушилось. В результате получаем
полное ионное уравнение данной реакции:
2 К+ + 2 МпОГ+ 16 Н+ + 16 С1- == 2 К+ + 2 Мп2- -4- 8 Н2О +
+ 5 С12 + 6 Cl-
Или в молекулярной форме:
2 КМпО4 + 16 НС1 = 2 КС1 + 2 МпС12 + 5 С12 + 8 Н2О.
Одно из преимуществ ионно-молекулярного метода состоит
в том, что некоторые из продуктов реакции (в данном случае
КС1 и Н2О) появляются в окончательном уравнении автомати-
чески, как результат составления полуреакций и дальнейших
операций с ними. Другое преимущество метода в том, что с его
помощью легко находить коэффициенты для реакций, в кото-
рых разные атомы одного вещества одновременно изменяют
свои степени окисления, так как в этом методе нахождение са-
мих по себе степеней окисления не требуется. Примером может
служить реакция, идущая по схеме
Cu2S + HNO3^Cu(NO3)2 + H2SO4 + NO.
где меняют степень окисления одновременно сера и медь, вхо-
дящие в состав Cu2S. Применяя ионно-молекулярный метод,
получим следующие уравнения полуреакций:
Cu2S + 4 Н2О — 10е~ = 2 Cu2+ + SO4~ + 8 Н+,
NOF+ 4 Н+ + Зе- = NO + 2 Н2О.
Дальнейшие операции по нахождению коэффициентов в этом
уравнении учащиеся могут проделать самостоятельно.
143
§ 5. ЭЛЕКТРОЛИЗ
Электролизом называется электрохимический окислительно-
восстановительный процесс, протекающий на электродах при
прохождении электрического тока через расплав или раствор
электролита. Процесс электролиза осуществляется в электроли-
зере (электролитической ячейке), представляющем собой сосуд
с раствором или расплавом электролита, в который погружены
два электрода; один из них соединен с положительным, а дру-
гой— с отрицательным полюсом внешнего источника э.д.с.
В растворе или расплаве электролита ионы находятся в хао-
тическом тепловом движении. Под действием электрического
поля от внешнего источника э.д.с. в их движении появляется
преимущественное направление: катионы движутся преимуще-
ственно к катоду, анионы — к аноду. Это преимущественное
поправление в движении ионов проявляется как электрический
ток, протекающий через раствор.
Катод соединен с отрицательным полюсом источника э.д.с.
н, следовательно, заряжен отрицательно, поэтому он служит
источником электронов. Анод соединен с положительным полю-
сом источника э.д.с. и имеет положительный заряд, поэтому он
принимает электроны. Таким образом, на катоде происходит
процесс восстановления, а на аноде — процесс окисления. В ре-
зультате каждого из этих процессов могут получаться как элек-
тронсйтральные вещества, так и ионы. Суммарным продуктом
этих двух процессов являются электронейтральные вещества.
Как и во всякой окислительно-восстановительной реакции, при
электролизе число электронов, приобретаемых при катодном
восстановлении, равно числу электронов, теряемых при анодном
окислении.
Таким образом, электролиз отличается от других окисли-
тельно-восстановительных реакций тем, что здесь процессы
окисления и восстановления пространственно разделены и пе-
реход электронов от восстановителя к окислителю происходит
через проводник электрического тока. При этом анод служит
как бы «абстрактным» окислителем, а катод — столь же «абст-
рактным» восстановителем. Более того, электрический ток яв-
ляется одновременно самым сильным окислителем и самым
сольным восстановителем, поэтому электрохимическим путем
можно получать вещества, являющиеся самыми сильными из
известных химических окислителей или восстановителей.
Для того чтобы правильно предсказывать продукты элек-
тролиза в случае, когда в системе одновременно находятся раз-
ные катионы или разные анионы, необходимо руководство-
ваться знаниями о сравнительной окислительно-восстановитель-
ной способности соответствующих ионов.
В случае металлов, чем правее находится металл в ряду
напряжений, тем легче восстановить его катион до свободного
(44
металла (см. главу 7, § 2). При электролизе раствора или рас-
плава, содержащего разные катионы металлов, в первую оче-
редь будут восстанавливаться те из них, которые расположены
правее в ряду напряжений. При электролизе водных растворов
ионы металлов, стоящих в ряду напряжений правее водорода,
восстанавливаются на катоде. Катионы металлов, стоящих в
ряду напряжений между алюминием и водородом, восстанав-
ливаются одновременно с молекулами воды (вода восстанавли-
вается до водорода). Катионы металлов, стоящих в ряду на-
пряжений слева до алюминия включительно, из водных раство-
ров не восстанавливаются — в этом случае восстанавливаются
только молекулы воды.
В отношении поведения анионов при электролизе водных
растворов следует руководствоваться следующим правилом:
в случае анионов галогеноводородных кислот (кроме фторидов)
на аноде окисляются галогенид-ионы, образуя свободный гало-
ген; если же раствор содержит только анионы кислородных
кислот, то на аноде будут окисляться молекулы воды с выде-
лением кислорода. Сказанное относится к случаю, когда анод
изготовлен из инертного материала, например из графита или
платины, не окисляющихся при проведении электролиза в вод-
ном растворе.
Если в системе имеются разные анионы, то в первую оче-
редь окислятся на аноде те из них, которые являются более
сильными восстановителями. Например, при одновременном
присутствии в системе хлорид-, бромид-, иодид- и фторид-ионов
первым окислится иодид (поскольку из галогенид-ионов он са-
мый сильный восстановитель), затем — бромид, а за ним —
хлорид. Если система представляет собой расплав, т. е. не со-
держит воды, то вслед за хлорид-ионом станет окисляться
фторид-ион. В водном же растворе фторид-ион вообще не бу-
дет окисляться, вместо него анодному окислению будет под-
вергаться вода, при этом будет выделяться свободный кис-
лород.
Рассмотрим несколько наиболее типичных примеров электро-
лиза расплавов и водных растворов электролитов.
Электролиз расплава хлорида натрия
Это самый простой пример. В такой системе имеются только
катионы натрия и анионы хлора. Поэтому на электродах мо-
гут протекать лишь процессы с их участием:
К(—) Na++e~ = Na,
А(+): 2С1- —2е- = С12.
Таким образом, продуктами электролиза будут металлический
натрий и свободный хлор.
Ю Семенов И. Н.
145
Электролиз водного раствора хлорида натри»
В этом случае в системе имеется вода, которая является
слабым электролитом и тоже может подвергаться электролизу.
Следовательно, в таком растворе есть два рода катионов —
Na+ и Н+ (точнее, Н3О+) и два рода анионов — ОН- и С1~.
В отношении катионов применим сформулированное выше
правило: так как натрий расположен в ряду напряжений левее
алюминия, то на катоде будет происходить восстановление мо-
лекул воды:
К(—): 2 Н2О + 2е-= Н2| + 2 ОН-
Такая форма записи наглядно показывает, почему при электро-
лизе водного раствора хлорида натрия щелочь накапливается
именно в катодном пространстве, если созданы препятствия для
перемешивания электролита.
Иногда процесс восстановления водорода пз воды на катоде записывают
таким образом:
К(-): 2 Н+ + 2 e~=H2f.
Какая форма записи правильна — первая или вторая? Такой вопрос ча-
сто задают абитуриенты. Ответ на него простой: верны обе формы записи,
но первый содержит больше информации. Действительно, вода — очень
слабый электролит, и потому концентрация ионов водорода в нейтральном,
растворе, как мы уже знаем, ничтожно мала. Мы уже условились записы-
вать в уравнениях окислительно-восстановительных и других реакций слабые
электролиты в молекулярной форме. Первую форму записи следует пони-
мать так: около катода постоянно расходуются ионы водорода, т. е. равно-
весие Н2О if* Н+ + ОН~ все время смещается вправо, поэтому стремление
системы к равновесию выражается в том, что диссоциируют все новые и но-
вые порции воды; образующиеся при этом ионы водорода восстанавливают-
ся, а ионы гидроксила остаются в растворе. Следовательно, первая форма
записи показывает сумму двух процессов: диссоциации воды и восстанов-
ления попов Н+, а вторая — лишь восстановление ионов водорода, но про-
тиворечия между этими двумя формами записи нет.
На аноде в соответствии с приведенным выше правилом для
анионов будет окисляться хлорид-ион (как при электролизе
расплава хлорида натрия).
Итак, при электролизе водного раствора хлорида натрия на
катоде будет выделяться водород, на аноде — хлор, а в катод-
ном пространстве будут накапливаться ионы Na+ и ОН , т. е.
едкий натр.
Электролиз водного раствора сульфата натрия
Как и в предыдущем случае, на катоде будет восстанавли-
ваться водород воды.
Что касается процесса на аноде, то на основании сформу-
лированного выше правила на нем будут окисляться молекулы
воды, а не анионы кислородных кислот. Уравнение для про-
цесса окисления воды тоже можно записать двумя спосо-
146
бами — как окисление молекул воды и как окисление гидро-
ксильных ионов:
А(+): 2Н2О — 4е_<= 4 Н++ О2|,
А(+): 4ОН- —4е- = 2H2O4-O2f.
Как и для катодного процесса, первая форма записи более
точная: она хорошо передает тот факт, что в анодном простран-
стве накапливаются катионы Н+ и идущие к аноду анионы SO«~.
Суммарный процесс в расчете на участие четырех электро-
нов в катодном и анодном процессах сводится к следующему:
6 Н2О .= 2 Н2| + 4 ОН- + О2+ 4- 4 Н+.
Если катодное и анодное пространства разделены таким обра-
зом, что образующиеся в них растворы не перемешиваются, то
в катодном пространстве будет накапливаться раствор едкого
натра, а в анодном — серной кислоты. Если же растворы из
катодного и анодного пространств перемешиваются, то ионы Н+
и ОН~ взаимно нейтрализуются, образуя воду, и в растворе
остается лишь сульфат натрия, т. е. не расходующееся при
электролизе исходное вещество. Следовательно, в этом случае
электролиз сводится к электролизу воды. Аналогичным обра-
зом, как электролиз воды, будет протекать и электролиз вод-
ных растворов серной кислоты или едкого натра. Во всех трех
случаях роль растворенного вещества сводится к увеличению
электропроводности раствора, благодаря чему электролиз воды
идет быстрее.
В случае электролиза раствора серной кислоты процесс на
катоде правильнее записать как восстановление ионов Н+,
присутствующих в большой концентрации:
К(-): 2 Н+ + 2е- = Н2|,
а процесс на аноде при электролизе раствора щелочи — как
окисление присутствующих в большой концентрации ионов
ОН-:
А(+): 4 ОН“ — 4е_ = 2 Н2О + O2f.
Электролиз водного раствора сульфата меди
Медь стоит в ряду напряжений правее водорода, поэтому
на катоде будут восстанавливаться до металла ионы меди:
К(—): Си2+ + 2е~ = Си.
На аноде, как и в предыдущем случае, будут окисляться мо-
лекулы воды и выделяться кислород. Таким образом, в раство-
ре будет накапливаться серная кислота.
Электролиз водного раствора сульфата меди с медным анодом
До сих пор мы рассматривали случаи, когда материал ано-
да не влияет на характер продуктов электролиза, т. е. электро-
Ю* 147
лиз с инертным анодом. Но материал анода может быть и та-
ким, что в процессе электролиза окисляться станут не анионы
электролита, а сам анод. Такой анод называется растворимым.
В простейшем случае материал растворимого анода — тот же
металл, ионы которого содержатся в электролите. Рассмотрим,
как будет проходить электролиз водного раствора сульфата
меди, если анод изготовлен из меди.
Как и в предыдущем случае, на катоде будет происходить
восстановление ионов меди до металла. На аноде вместо мо-
лекул воды будет окисляться металлическая медь, переходя в
раствор в виде катионов:
А(+): Си —2е~ = Си2+.
Следовательно, при электролизе водного раствора сульфата
меди с медным анодом процессы на катоде и на аноде прямо
противоположны, и электролиз сводится к переносу меди с ано-
да на катод.
Такого рода процессы используются для нанесения защит-
ных и декоративных металлических покрытий на различные
изделия (покрытие медных сплавов серебром или золотом, же-
лезных сплавов никелем, хромом, кадмием), а также для рафи-
нирования (очистки) металлов. Например, так получают рафи-
нированную медь для нужд электротехники.
Электролиз в большом масштабе используется в химиче-
ской промышленности для получения едкого натра, хлора и
водорода, а также некоторых металлов — натрия, кальция,
магния.
Упражнения к главе 6
1. Может ли анион галогеноводородных кислот выступать в реакциях
в роли окислителя?
2. В лаборатории часто получают сероводород действием соляной кис-
лоты на сульфид железа (II). Можно ли для этих целей вместо соляной
кислоты использовать азотную?
3. Какие из перечисленных оксидов могут проявлять только окислитель-
ные свойства в реакциях с простыми веществами (кроме фтора): ОзО,
СгО3. SO2, CaO, CI2O7, SiO2, FeO, Р2О3, NO?
4. В каком из перечисленных веществ фосфор в реакциях с их участием
может быть: а) только восстановителем, б) только окислителем: Р, РН3,
Р2О5, Н3РО3, Са3Р2, Са3(РО4)2?
5. В каком из перечисленных веществ при их вступлении в реакции мар-
ганец может выступать в роли: а) только восстановителя, б) только окисли-
теля, в) и окислителя, и восстановителя: МпО2, Мп3О4, Мп, МпО, К2МПО4,
КМпО4?
6. Напишите полные уравнения реакций, идущих согласно приведенным
ниже схемам. Для нахождения коэффициентов используйте ионио-молекуляр-
ный метод:
p+hno3-^h3po4+no+ ... ,
MnO2+KClO3+KOH->K2MnO4+KCl+...,
КСгОг+Вгг+КОН->К2СгО4ч-КВг 4- ... ,
FeS+HNO3->-Fe(NO3)3+Fe2(SO4)3+NO+ ... ,
148
КгМпО^ 4- Н2О-^КМпО^+МпО2 4- КОН,
KI + KNO2+H2SO^I2+NO4-K2SO44- ...,
HC1O34-H2S->HC14-H2SO4.
7. Какой объем концентрированной (39%-ной) соляной кислоты (плот-
ность 1,2 г/см3) потребуется для реакции с 15,8г перманганата калия?
Вычислите объем (н. у.) выделяющегося при этом газа. Считаем, что реак-
ция протекает до конца и газ полностью выделяется из раствора.
8. 208,5 мг кристаллогидрата сульфата железа(Н) обесцвечивают в сер-
нокислом растворе 7,5 мл 0,02 М раствора перманганата калия. Сколько мо-
лей воды содержит 1 моль кристаллогидрата?
9. Почему при электролизе водных растворов нитрата кальция и гидро-
ксида калия на электродах выделяются одни и те же вещества? Напишите
схемы протекающих при этом процессов.
10. Водный раствор содержит смесь нитратов серебра, меди, железа(П)
н свинца одинаковой концентрации. В какой последовательности будут выде-
ляться металлы при электролизе этого раствора?
11. Напишите схемы процессов, протекающих на катоде и аноде, а также
продукты, выделяющиеся на электродах и остающиеся в растворе или рас-
плаве электролита, если электролизу подвергаются расплав едкого натра,
расплав смеси хлорида и бромида калия, водный раствор хлорида меди
(в последнем случае с инертным анодом и с анодом из меди).
12. При электролизе 1 л раствора хлорида меди (плотность раствора
принимаем равной плотности воды) на катоде выделилось 12,7 г меди.
Вычислите объем газа (и. у.), выделившегося на аноде, и процентную кон-
центрацию исходного раствора, считая, что соль подверглась электролизу
полностью.
13. Каково процентное содержание нитрата серебра в техническом пре-
парате, если при полном электролизе 1,8005 г этого препарата получено
1,1033 г серебра?
14. При электролизе расплава хлорида одновалентного металла на элек-
тродах выделилось 3,12г металла и 0,896л хлора (н.у.). Хлорид какого ме-
талла подвергался электролизу?
15. Вычислите процентную концентрацию раствора, образовавшегося в
результате электролиза 400мл 10%-ного раствора гидроксида натрия (плот-
ность 1,1 г/см3), если известно, что при электролизе выделилось 56л кисло-
рода (и. у.).
Раздел II
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Глава 7
ПРОСТЫЕ ВЕЩЕСТВА
§ .1. МЕТАЛЛЫ И НЕМЕТАЛЛЫ
Деление элементов на металлы и неметаллы
Свойства атомов химических элементов конкретно проявля-
ются в свойствах простых веществ и соединений, образуемых
этими атомами. Однако физические и химические свойства ин-
дивидуальных веществ сложным образом зависят от строения
электронной оболочки атома, поэтому не всегда на основании
положения элемента в периодической системе можно совер-
шенно точно предсказать свойства каждого его соединения.
Тем не менее в пределах одного класса веществ можно делать
определенные обобщения.
Все химические элементы мы делим на металлы и неметал-
лы. Сам по себе термин «металл», так же как и обратный ему
термин «неметалл», употребляется в учебной литературе по
химии в двух смыслах: 1) по отношению к элементу, как об-
щая характеристика его химического поведения; 2) по отноше-
нию к простому веществу и его конкретным физическим свой-
ствам.
В первом смысле под термином «металл» подразумевают
электроположительный элемент, обратным же термином — «не-
металл»— обозначают электроотрицательный элемент. Когда
же употребляют термин «металл» во втором смысле, имеют в
виду, что простое вещество обладает определенным комплексом
физических свойств, в том числе значительной электропровод-
ностью, причем с определенным характером проводимости
(«металлическая проводимость»), отличающейся, скажем, от
характера проводимости полупроводников. Вещество, не про-
водящее электрический ток, называют изолятором.
В первой главе мы познакомились с явлением аллотропии
и теперь знаем, что простые вещества, соответствующие одному
и тому же элементу, могут обладать весьма различающимися
физическими свойствами, в том числе как разной электропро-
водностью, так и различным характером и механизмом прово-
!,50
димости электрического тока. Например, графит хорошо про-
водит электрический ток и потому используется в электротех-
нической промышленности для изготовления электродов, щеток
электродвигателей и т. д., в то время как другое аллотропное
видоизменение углерода — алмаз — в чистом виде является ти-
пичным изолятором.
Химики под металлами подразумевают элементы, которые в
обычных условиях (при комнатной температуре и атмосферном
давлении) образуют вещества с типичными металлическими
свойствами. Однако в условиях, сильно отличающихся от
обычных, многие элементы, которые мы привыкли относить к
неметаллам, могут образовывать вещества с явно металличе-
скими свойствами. Например, если фосфор подвергнуть дав-
лению, в 3-104 раз превышающему атмосферное, то он перей-
дет в форму с металлическими свойствами: металлической
проводимостью, металлическим блеском. Увеличив давление
еще на порядок, можно наблюдать переход в металлическое
состояние у иода.
Водород, который мы привыкли рассматривать как типич-
ный неметалл, под давлением, в миллионы раз превышающим
атмосферное, переходит в металлическое состояние, т. е. ста-
новится металлом в физическом смысле. Напротив, если нат-
рий испарить, то в парообразном состоянии он не будет обла-
дать такими свойствами, как металлической проводимостью
или металлическим блеском.
В связи с двояким (химическим и физическим) смыслом
термина «металл» лучше делить элементы на электроположи-
тельные и электроотрицательные, тем более что электроотри-
цательность элемента можно, хотя бы приближенно, оценить
количественно. Электроположительные элементы склонны обра-
зовывать простые вещества с металлическими свойствами (в
физическом смысле), а электроотрицательные элементы—с не-
металлическими. Чем более электроположительным является
элемент, тем, как правило, сильнее выражены металлические
свойства у образуемых им простых веществ. И наоборот,
чем более электроотрицательным является элемент, тем силь-
нее неметаллические свойства (в частности, низкая электропро-
водность) у соответствующего простого вещества.
Для простоты же и краткости мы обычно употребляем тер-
мин «металл» (в химическом смысле) вместо «электроположи-
тельный элемент» и термин «неметалл» вместо «электроотрица-
тельный элемент». Например, когда химики говорят, что метал-
лические свойства элементов ослабевают в третьем периоде от
натрия к хлору или в главной подгруппе четвертой группы от
свинца к углероду, имеется в виду постепенное изменение все-
го характера поведения элемента. Сюда относится не только
постепенное исчезновение у простого вещества в конденсиро-
ванном состоянии характерных для металлов физических
151
свойств, но и такое изменение химических характеристик эле-
мента, как усиление тенденции к проявлению отрицательной
степени окисления, ослабевание основного и усиление кислот-
ного характера высших оксидов.
Большинство элементов периодической системы — металлы.
Поскольку в периодах и группах тенденция к потере и присое-
динению атомами электронов изменяется плавно, нельзя про-
вести резкую границу между металлами и неметаллами. При-
близительная же граница в главных подгруппах проходит по
диагонали периодической таблицы (в ее короткой форме) при-
мерно между бериллием и бором, алюминием и кремнием, гер-
манием и мышьяком. Элементы, расположенные вблизи этой
границы (например, германий), имеют свойства как металлов,
так и неметаллов; соответствующие им простые вещества ча-
сто обладают электропроводностью полупроводникового или
металлического типа, но в последнем случае значения электро-
проводности более низкие, чем у типичных металлов.
В периодической таблице справа налево и сверху вниз ха-
рактер и строение простых веществ, образуемых элементами
главных подгрупп, изменяются в сторону увеличения числа
атомов в молекуле, а характер структуры — от молекулярной
к атомной и, наконец, к металлической. Так, инертные газы
образуют одноатомные молекулы, галогены и кислород — двух-
атомные, сера и фосфор -- молекулы с большим числом ато-
мов (Р4, Ss), углерод, кремний и бор имеют атомные решетки,
где уже нет отдельных молекул, а алюминий и элементы, рас-
положенные влево и вниз от него в периодической таблице, —
типичные металлические решетки.
Если кристаллические решетки металлов отличаются друг
от друга сравнительно мало, то структура неметаллов, напро-
тив, характеризуется очень большим разнообразием. Поэтому
более разнообразны и физические свойства их, в противопо-
ложность довольно однотипным физическим свойствам метал-
лов. Неметаллы при комнатной температуре находятся и в
твердом (углерод), и в жидком (бром), и в газообразном
(азот) состояниях, очень разнообразна их окраска, механиче-
ские свойства.
Электроположительные элементы характеризуются способ-
ностью образовывать в химических системах (кристаллы,
растворы) элементарные (состоящие из одного элемента) по-
ложительные ионы, например К+, Са2+, А13+, и неспособно-
стью образовывать элементарные отрицательные ионы. Самые
электроотрицательные элементы легко образуют отрицатель-
ные ионы: F~, С1~, О2-, S2-. Поэтому иногда типичные электро-
положительные элементы (металлы) называют катпоногенами,
а типичные электроотрицательные элементы (неметаллы) —
анионогенами. Нужно только помнить при этом, что имеется?
в виду способность к образованию элементарных ионов, а не-
152
сложных, состоящих из двух и более элементов, как, например,,
анионы кислородных кислот Сг2О7~, МпОГ и т. п.
Типичные примеры аллотропии неметаллов
Разнообразие структур, характерных для неметаллов, при-
водит к тому, что их аллотропные видоизменения могут резко
различаться по свойствам. Наглядным примером тому служит
аллотропия углерода.
Структура алмаза построена таким образом, что по отно-
шению к каждому атому углерода другие атомы расположены
по вершинам описанного вокруг него тетраэдра, в центре кото-
рого находится первый атом (рис. 7). Все четыре связи между
центральным атомом и соседними имеют одинаковую длину
0,154 нм и одинаковую прочность. Симметричность и проч-
ность этих связей приводит к тому, что алмаз — самое твердое-
из встречающихся в природе веществ.
Алмаз
гpatpum
Рис. 7. Структуры алмаза и графита.
Светлый кружок—атом, расположенный в вершине куба; кружок с точкой — атом в-
пентре )рани; темный — атом внутр» куба.
В структуре графита атомы расположены слоями, причем
в каждом слое они образуют сетку из правильных шестиуголь-
ников. Слои расположены один относительно другого таким-
образом, что атом углерода одного слоя находится над цент-
ром шестиугольника другого слоя (рис. 7). Расстояние меж-
ду ближайшими атомами углерода внутри слоя равно 0,142 нм,
расстояние же между слоями значительно больше, 0,335 нм (в
идеально правильной решетке, в реальной — несколько боль-
ше). В результате связи между слоями гораздо менее прочны,,
чем связи между атомами внутри каждого слоя, поэтому гра-
фит легко обрабатывается и измельчается, образуя плоские-
чешуйки.
Алмаз и графит различаются не только твердостью, но и
внешним видом: алмаз прозрачен, а графит — нет. Чистый ал-
1.53;
маз является хорошим изолятором, в то время как электро-
проводность графита близка к электропроводности металлов.
Так называемый аморфный углерод, получаемый при не-
полном сгорании органических веществ в виде древесного угля,
сажи и т. д., состоит из очень мелких, плохо сформировавших-
ся кристаллов графита с частично искаженной структурой.
Алмаз и графит сильно различаются по своему химическому
поведению, причем это касается не только реакционной спо-
собности, что обычно для аллотропных видоизменений одного
элемента. Графит не только более реакционноспособен, чем
алмаз, но и, реагируя с некоторыми веществами, может обра-
зовывать такие продукты, каких не образует алмаз. Эти про-
дукты представляют собой результат внедрения атомов и це-
лых молекул между слоями углеродных атомов в решетке
графита. «Соединения графита», как их называют, имеют пере-
менный состав и не соответствуют обычным представлениям
о валентности элементов. Так, в решетку графита могут вне-
дряться атомы фтора, кислорода, щелочных металлов, молеку-
лы трихлорида железа, органические молекулы.
Из этих двух давно известных аллотропных видоизменений углерода
наибольшую ценность представляет более редкий в природе алмаз. Лишь
крупные алмазы, которым можно придать правильную огранку, используются
в ювелирном деле. Главное применение алмаза — в промышленности: для
бурения скважин, для резки стекла, как абразив для шлифовки различных
твердых материалов, в том числе ювелирных алмазов. Для этого не обяза-
тельно требуются крупные алмазы — иногда достаточно алмазной «пыли».
Как это ни кажется на первый взгляд странным, алмаз при атмосфер-
ном давлении находится в метастабильном, «замороженном» состоянии. Тер-
модинамически устойчив он лишь при очень высоких давлениях. Если при
атмосферном давлении нагреть алмаз выше 1000 °C, то он начнет самопроиз-
вольно превращаться в графит. При температурах порядка 1700—1800 °C и
атмосферном давлении этот процесс протекает очень быстро.
Превращение алмаза в графит сопровождается выделением небольшого
количества энергии, следовательно, обратный процесс — эндотермический.
Кроме того, плотность алмаза (3,51 г/см3) значительно выше, чем плотность
графита (2,2 г/см3 у реального графита, 2,6 г/см3 — теоретическая), т. е.
переход графит — алмаз сопровождается уменьшением объема. Отсюда мож-
но сделать вывод, что, согласно принципу Ле Шателье, осуществлению пе-
рехода графит—алмаз должны способствовать высокое давление и высокая
температура. Повышение температуры должно также увеличивать скорость
перехода. Основная технологическая трудность на пути осуществления син-
теза алмаза из графита состояла в том, что требовалось создать в реак-
ционном пространстве одновременно высокую температуру и очень высо-
кое давление, а при высоких температурах большинство материалов теряют
прочность и не смогут удержать высокое давление.
Все же эта проблема была успешно решена, и в 1955 г. при давлении
выше 5-103МПа и температуре выше 2000 °C были впервые синтезированы
кристаллы алмаза величиной до 1 мм. С тех пор было налажено производство
искусственных технических алмазов в значительных количествах. В настоящее
время мировое производство искусственных алмазов измеряется тоннами
в год.
При промышленном синтезе алмазов используются давления в тысячи
МПа и температуры от 1500 до 3000 °C, причем такие условия поддержи-
ваются несколько часов. Процесс ведут в присутствии катализаторов, кото-
154
,рыми служат некоторые металлы, например никель. Основную массу про-
дукции составляют небольшие кристаллы и алмазная пыль.
Одновременно изучаются иные способы синтеза алмаза, в том числе при
низких давлениях, например наращиванием мелких кристаллов алмаза.
В этом случае речь идет не о достижении равновесного в данных условиях
-состояния, а, напротив, создании таких условий, когда равновесие устано-
виться не успевает. Например, разлагая углеводороды около поверхности
алмаза, стремятся провести процесс так, чтобы при конденсации образовав-
шихся паров углерода он как бы задержался на промежуточной ступеньке —-
в виде решетки алмаза, не успев превратиться в равновесное в этих условиях
состояние — графит. В особых условиях удается вырастить даже довольно
крупные кристаллы алмаза, пригодные для ювелирной обработки.
Поскольку в структуре алмаза все связи между атомами
углерода одинаковы, их образование можно рассматривать ис-
ходя из представления об хр3-гибридизации, характеризующей-
ся тетраэдрической симметрией (объемная структура). (Типы
гибридизации подробно изучаются в курсе органической хи-
мии.) Структуру же графита с углами между связями в од-
ном слое 120° (плоская структура) можно рассматривать как
следствие хр2-гибридизации. Естественно поэтому предполо-
жить, что должна существовать третья форма углерода, отве-
'чающая sp-гибридизации (линейная структура), состоящая из
длинных полимерных молекул, например (—С=С—)^.
Действительно, в начале 60-х годов группе советских уче-
ных удалось получить такое вещество путем реакции окисли-
тельной поликонденсации, т. е. путем связывания в полимер-
ную цепочку остатков ацетилена, образовывавшихся при окис-
лении ацетиленида меди. Это вещество было названо карби-
ном (окончание «-ин» указывает на наличие тройной связи).
Впоследствии было показано, что карбин может быть получен
в разных формах и содержит как полиацетиленовые
. . .—С = С—С=еС—С = С—. . ., так и поликумуленовые цепочки
. . . = С = С = С = С = С = С = . . .. Позднее карбин был найден
и в природе — в метеоритном веществе.
Карбин, получаемый в лаборатории, представляет собой по-
рошок темного цвета, при комнатной температуре химически
весьма инертный. Он обнаруживает полупроводниковые свой-
ства, причем его электропроводность резко возрастает при об-
лучении видимым светом. За счет сосуществования разных ти-
пов связи и разных способов укладки цепей из углеродных ато-
мов в кристаллической решетке физические свойства карбина,
в том числе твердость, могут меняться в широких пределах.
Так как молекула ацетилена устойчива при очень высоких
температурах (вспомним, что даже метан — одно из самых
устойчивых органических веществ — разлагается при высоких
температурах с образованием ацетилена), естественно ожидать
такой же устойчивости и от карбина. Действительно, карбин
устойчив при нагревании без доступа воздуха до температур
155
выше 2000 °C, лишь при температурах около 2300 °C наблю-
дается его переход в графит.
Карбин привлекает внимание ученых как перспективный
материал для изготовления полупроводников, могущих рабо-
тать при высоких температурах, а также сверхпрочных воло-
кон. Теория предсказывает, что карбин, близко подходящий к
рассматриваемой в физике модели одномерного кристалла, хо-
рошо соответствует требованиям, выдвигаемым при постановке
проблемы создания материалов с наибольшими значениями
как теоретической, так и реально достижимой прочности, по-
тому, в частности, что в нем прочные химические связи, а в це-
пи нет «слабых звеньев».
Двухатомный кислород и озон — пример аллотропии, свя-
занной с разным числом атомов в молекуле. Озон сильно отли-
чается от обычного кислорода по физическим свойствам. Так,,
температуры плавления и кипения у кислорода равны соответ-
ственно —219 и —183 °C, у озона соответственно —250 и
—112 °C. В газообразном состоянии озон имеет синеватый цвет,,
в жидком — темно-синий, а в твердом состоянии—фиолетово-
черный.
Разница же в химических свойствах озона и двухатомного
кислорода особенно велика. Это связано как с тем, что озон,,
образующийся из двухатомного кислорода эндотермически,,
имеет по сравнению с ним избыток энергии, так и с небольшой
величиной энергии активации реакций с участием озона. Озон
легко отдает один атом кислорода, проявляя сильные окисли-
тельные свойства. Так, он окисляет почти все металлы, в том
числе серебро:
2 Ag Оз = Ag2O -р О2.
Двухатомный кислород серебро не окисляет. Озон разрушает
органические материалы, например резину, некоторые органи-
ческие вещества под действием озона воспламеняются.
Озон может образовываться при действии солнечного света
на продукты неполного сгорания моторных топлив, содержащие
слабо связанный кислород (например, органические перекиси —
производные пероксида водорода). В задымленном воздухе
озон реагирует с углеводородами, образуя альдегиды типа
акролеина, обладающие слезоточивыми свойствами. Так обра-
зуется так называемый «фотохимический смог». Содержащий-
ся в воздухе озон раздражает легкие, увеличивает износ авто-
мобильных шин.
Озон во всех агрегатных состояниях,, но особенно — в кон-
денсированном состоянии, легко взрывается от целого ряда
причин, например от удара. В твердом состоянии при —250 °C
он взрывается при прикосновении. Катализаторами его раз-
ложения в смеси с обычным кислородом могут являться орга-
нические вещества и поверхность твердых веществ. Распад
156
•озона происходит также под действием видимого света с дли-
ной волны 580—650 нм. Наоборот, под действием ультрафио-
летового излучения с длиной волны около 185 нм происходит
синтез озона; именно такой процесс имеет место в верхних
слоях атмосферы, за счет чего в ней существует озонный слой,
задерживающий губительную для всего живого коротковолно-
вую ультрафиолетовую радиацию Солнца.
Озон легко обнаруживается по окислительному действию на
раствор иодида калия:
О3 + 2 KI + Н2О = О2 + 12 + 2 КОН.
Выделяющийся иод может быть обнаружен с помощью крах-
мала. В технике и в лабораторных условиях озон получают
действием тихого электрического разряда на кислород или
воздух.
Из двух аллотропных видоизменений одного элемента наи-
менее устойчивое обычно более реакционноспособно, более
растворимо и имеет большее давление пара. Например, белый
фосфор в противоположность красному имеет запах, несколько
растворим в воде и значительно более реакционноспособен.
Те неметаллические элементы, которые в обычных условиях
существуют в виде газообразных двухатомных молекул, прояв-
ляют много большую химическую активность, будучи получены
в одноатомном состоянии (действием электрического разряда,
ультрафиолетового излучения и т. п.). Это относится не только
к кислороду и водороду. Даже азот, полученный в атомарном
состоянии при действии на молекулярный азот высокочастот-
ного электрического разряда, при обычных условиях соединя-
ется с серой, фосфором и многими металлами.
Мы рассмотрели два примера аллотропии, иллюстрирую-
щих два типичных случая — разное строение кристаллической
решетки и разное строение молекул. Могут наблюдаться и сме-
шанные случаи, когда разные аллотропные видоизменения од-
ного элемента образуются как за счет разного строения кри-
сталлической решетки, так и за счет разного числа атомов в
молекуле. Например, две кристаллические модификации эле-
ментарной серы (моноклинная и ромбическая) состоят из од-
них и тех же циклических молекул S8 и отличаются лишь рас-
положением этих молекул в кристаллической молекулярной
решетке. Поэтому они мало различаются по своим физиче-
ским свойствам и практически идентичны по химическим. Пла-
стическая сера, содержащая разные молекулы, в том числе и
линейные, отличается от моноклинной и ромбической гораздо
сильнее.
157
§ 2. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ.
РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ
Одной из наиболее важных характеристик простых веществ,
являются их окислительно-восстановительные свойства, отра-
жающие способность простых веществ переходить в соедине-
ния, т. е. от нулевой степени окисления к другим степеням
окисления. Следует хорошо уяснить различия в окислительно-
восстановительных свойствах металлов и неметаллов в виде'
простых веществ.
Поскольку металлы проявляют исключительно положитель-
ные степени окисления, то в виде простых веществ они могут
только окисляться, т. е. выступать только в роли восстановите-
лей. Но при этом металлы способны образовывать как поло-
жительно заряженные элементарные ионы (например, Мп2+),
так и отрицательно заряженные кислородсодержащие анионы
(например, МпОГ)- В последнем случае, несмотря на отрица-
тельный заряд иона в целом, степень окисления марганца рав-
на + 7, так как каждый атом кислорода имеет степень окис-
ления —2. Еще раз напомним, что формальная степень окис-
ления далеко не совпадает с реальным зарядом марганца и
кислорода; связь между марганцем и кислородом в этом слу-
чае ковалентная полярная.
Неметаллы могут проявлять как положительные, так и от-
рицательные степени окисления. Поэтому неметаллы в виде
простых веществ могут и окисляться, и восстанавливаться.
Так, свободный хлор может восстанавливаться до иона СП
или окисляться, например, до иона CIO*-. Однако если в отри-
цательных степенях окисления наиболее электроотрицательные
элементы могут образовывать соединения с ионной связью, то
в положительных степенях окисления они всегда образуют
ковалентную (хотя и полярную) связь с другими элементами.
При движении в периодах слева направо и в главных под-
группах снизу вверх соответственно изменению свойств элемен-
тов от металлических к неметаллическим восстановительные
свойства простых веществ ослабевают, а окислительные — уси-
ливаются. Чем более сильным (слабым) окислителем является
свободный неметалл, тем слабее (сильнее) восстановительные
свойства соответствующего ему элементарного отрицательного
иона. Например, в случае галогенов окислительные свойства
свободного галогена усиливаются в ряду I2<Br2<C12<F2, а
восстановительные свойства изменяются в обратной последова-
тельности: F“<Cl-<Br-<I~.
Из неметаллов, образующих двухатомные молекулы, наибо-
лее сильными окислителями являются кислород и галогены.
Последние даже по отношению к воде выступают в роли окис-
лителей, окисляя входящий в ее состав кислород:
158
Cl2 + н2о = нею + НС1 = 2 НС1 + о.
Наиболее энергично такая реакция идет с фтором. На первой
стадии фтор вытесняет из воды кислород:
F2 + H2O = 2 HF + О,
образовавшийся атомарный кислород реагирует с остальными
участниками реакции, образуя Н2О2, Оз и F2O.
Окислительные свойства кислорода и хлора близки (хотя
хлор легче переходит в активное состояние за счет меньшей
прочности его молекулы). Поэтому хлор и кислород могут кон-
курировать как окислители в некоторых реакциях. Так, в про-
шлом веке техническим способом получения хлора служила
реакция
4 HCI (газ) + О2 (газ)— 117 кДж 2 С12 (газ) + 2 Н2О (газ).
Эта реакция экзотермическая и сопровождается некоторым
уменьшением объема. Значит, следует ожидать, что ниже
какого-то температурного предела равновесие реакции будет
смещено вправо. Действительно, при температуре ниже
~600°С равновесие смещено вправо, а выше этой температу-
ры — влево.
По мере продвижения в периодах влево восстановительные
свойства элементов усиливаются довольно быстро. Сера хоро-
шо горит в кислороде. В еще большей степени это относится
к фосфору. Углерод в виде древесного угля, кокса и т. п. име-
ет широкое промышленное применение в качестве восстанови-
теля.
Перейдем теперь к металлам. Выше мы отмечали, что чем
сильнее восстановительные свойства отрицательного иона гало-
гена, тем слабее окислительные свойства свободного галогена.
Аналогичным образом, чем сильнее восстановительные свойст-
ва металла, тем слабее окислительные свойства образуемого
им положительного иона (тем труднее такой ион восстановить
до металла). Так, металлический натрий является очень силь-
ным восстановителем, в то время как окислительные свойства
иона Na+ выражены очень слабо. И наоборот, металлическое
серебро является очень слабым восстановителем, зато окисли-
тельные свойства иона Ag+ выражены довольно сильно.
Относительная восстановительная способность разных ме-
таллов позволяет расположить их в так называемый ряд напря-
жений, или электрохимический ряд металлов. В этом ряду ме-
таллы располагаются в порядке ослабления восстановитель-
ных свойств простых веществ и усиления окислительных
свойств соответствующих этим металлам положительных ионов.
Металлы, чаще всего упоминаемые в школьном курсе химии,
располагаются в ряду напряжений в следующем порядке:
Li К Са Na Mg Al Zn Fe Pb H2 Cu Hg Ag Au.
159
Таким образом, в ряду напряжений слева находятся метал-
лы, которые в контакте с водными растворами будут проявлять
сильные восстановительные свойства. Напротив, образующиеся
при их окислении ионы будут проявлять слабые окислительные
свойства. Поэтому такие металлы легко окислить, но соответ-
ствующие ионы трудно восстановить. В правой части ряда на-
пряжений находятся металлы, являющиеся слабыми восстано-
вителями. Их ионы проявляют довольно сильные окислитель-
ные свойства. Поэтому такие металлы трудно окислить, но со-
ответствующие ионы легко восстановить.
Положение металла в ряду напряжений устанавливается на основании
измерения э.д.с. определенным образом составленного гальванического эле-
мента, в котором данный металл служит одним из электродов. Отсюда и на-
звания «ряд напряжений» или «электрохимический ряд». Таким образом, по-
ложение металла в ряду напряжений основано на точно определяемой экс-
периментальным путем характеристике. Поэтому иногда употребляемое вы-
ражение «ряд активности» — весьма неточное. Химическая активность веще-
ства зависит от многих факторов, в частности от степени измельчения ве-
щества, от его партнера по реакции. Например, тонкодисперсное «пирофорное»
железо гораздо активнее взаимодействует с кислородом воздуха, чем каль-
ций, а такие «малоактивные» (как иногда их называют, основываясь иа по-
ложении в ряду напряжений) металлы, как серебро и ртуть, в тонкодисперс-
ном состоянии довольно быстро реагируют с серой уже при комнатной темпе-
ратуре, в то время как для реакции между железом и серой в виде крупно-
зернистых порошков требуется сильное нагревание.
Если говорить о неметаллических элементах, то можно сравнить хими-
ческую активность белого фосфора и молекулярного азота по отношению
к кислороду: белый фосфор при незначительном подогреве загорается на
воздухе, азот достаточно активным по отношению к кислороду становится
только при высоких температурах. А ведь если руководствоваться тем, что
«активность» (на самом деле речь идет об электроотрицательности) неметал-
лов растет в главных подгруппах снизу вверх, то азот надо считать более
«активным» неметаллом, чем фосфор. Из щелочных металлов литий (наиме-
нее электроположительный из них) выступает в роли партнера, по отноше-
нию к которому азот оказывается наиболее химически активным, реагируя
с ним даже при комнатной температуре, в то же время не реагируя, напри-
мер, с цезием.
Положение металла в ряду напряжений характеризуется
процессом его окисления с образованием гидратированного
иона, соответствующего низшей устойчивой в водном раство-
ре степени окисления металла. Поэтому ряд напряжений от-
носится к водным растворам. Данный металл может вытеснять
(т. е. восстанавливать) из растворов их солей все металлы,
находящиеся справа от него в ряду напряжений.
В ряд напряжений включен также водород. Металлы, нахо-
дящиеся слева от водорода, могут восстанавливать водород из
растворов кислот, содержащих 1 моль ионов Н+ в литре.
Что касается вытеснения водорода из воды, то, во-первых,
процесс восстановления водорода осложняется действием ря-
да побочных факторов. Во-вторых, концентрация ионов водо-
рода в воде в 10 7 раз меньше, и, следовательно, равновесие
160
реакции металла с водой сильно смещается в сторону обратно-
го процесса, т. е. выделение водорода из воды затруднено, и
вытеснять его способны при комнатной температуре лишь ме-
таллы, стоящие в ряду напряжений слева от магния, т. е. ще-
лочные и щелочноземельные металлы. Порошкообразный маг-
нии реагирует с водой при нагревании; с кипящей водой реа-
гирует тонкий порошок алюминия. При еще более высоких тем-
пературах восстанавливает водород из паров воды железо:
3 Fe + 4 Н2О == Fe3O4 + 4 Н2|.
Подбирая примеры реакций вытеснения металлов из раство-
ров их солей, не следует брать очень активные металлы, на-
пример щелочные или щелочноземельные. Ведь эти металлы
реагируют с ведой, давая водород и раствор щелочи, которая
будет вызывать побочные реакции.
Нужно также иметь в виду, что иногда реакция вытеснения,
которая согласно ряду напряжений должна иметь место, в дей-
ствительности не происходит. Например, алюминий не вытес-
няет медь из раствора медного купороса, хотя вытесняет ее из
раствора хлорида меди (II). Причина заключается в том, что
хлорид-ион способен разрушать поверхностную пленку на алю-
минии (за слет образования комплексных соединений), а суль-
фат-ион ее разрушить не может.
Положение металла в ряду напряжений зависит от ряда факторов и
в первую очередь от положения металла в периодической системе, хотя за-
висимость эта и не простая. Внимательно изучая ряд напряжений, мы можем
заметить, что последовательность расположения некоторых элементов в нем
соответствует последовательности их расположения в периодической системе.
Например, натрий, магний и алюминий рассоложены в ряду напряжений в
той же последовательности, в какой они следуют один за другим в третьем
периоде. Однако такая простая зависимость между положением металлов в
периодической системе и в ряду напряжений наблюдается не всегда. На про-
стую проекцию периодической системы в ряд напряжений накладывается
действие осложняющих факторов.
Так, в случае щелочных металлов первым в ряду напряжений стоит не
цезий, как, казалось бы, можно было ожидать, а литий, хотя атом лития
намного труднее теряет электрон, чем атом цезия. В чем же причина осо-
бого положения лития в ряду напряжений? Выше говорилось, что ряд на-
пряжений характеризует процесс окисления металла с образованием гидра-
тированного иона. Чем легче протекает этот процесс, тем левее распола-
гается металл в ряду напряжений. В случае лития важную роль играет лег-
кость гидратации иона лития: из-за своих малых размеров он притягивает
к себе отрицательные концы полярных молекул воды сильнее, чем ион цезия
(гораздо более крупный), так как расстояние между центрами отрицатель-
ного и положительного зарядов в случае лития оказывается меньшим. В ре-
зультате суммарный процесс (потеря электронов, а затем гидратация обра-
зующегося иона) оказывается в случае лития энергетически более выгодным,
чем в случае цезия.
§ 3. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
Электроположительные и электроотрицательные элементы
Ранее говорилось, что электроположительные элементы от-
личает легкость потери их атомами валентных электронов.
Ц Семенов И. Н. 151
Иными словами, для отрыва этих электронов требуется срав-
нительно небольшая энергия.
Попытаемся ответить на вопрос, почему атомы этих элемен-
тов легко теряют электроны? Для этого сравним три элемента:
фтор, натрий и хлор. Фтор и хлор — типичные электроотрица-
тельные элементы. Для отрыва электронов от атомов этих эле-
ментов требуется большая затрата энергии, зато они легко при-
соединяют дополнительные электроны до восьми (правило ок-
тета). Натрий же, расположенный в периодической системе
между фтором и хлором, напротив, легко теряет электрон. По-
чему столь сильно различается поведение атома натрия, с од-
ной стороны, и атомов фтора и хлора, с другой? Часто можно
слышать примерно такой ответ: «У натрия только один элек-
трон, поэтому он его легко теряет, а у фтора и хлора — по
семь электронов, т. е. не хватает одного электрона до завер-
шенной электронной конфигурации, поэтому они легко прини-
мают электрон». Это не объяснение, а лишь констатация фак-
та, поскольку остается необъясненным главное: почему же нат-
рий «стремится» отдать электрон, а хлор и фтор — присоеди-
нить его, образовав завершенную конфигурацию.
Объяснение же состоит в следующем. При переходе от фто-
ра к натрию заряд ядра увеличивается на две единицы, число
электронов тоже увеличивается на два. Но одновременно на-
чинается заполнение нового, третьего электронного уровня, а
второй уровень, заполненный восемью электронами, оказывает-
ся внутренним по отношению к третьему. Внутренние, т. е.
первый и второй уровни, содержащие в сумме десять электро-
нов, хорошо закрывают (как говорят, «экранируют») заряд
ядра, поэтому электрон, находящийся на третьем уровне в ато-
ме натрия (заряд ядра 4-11), притягивается к ядру намного
слабее, чем электроны, находящиеся на втором уровне в ато-
ме фтора, заряд ядра которого 4-9. Электроны, находящиеся
на втором уровне у фтора, экранируются от ядра лишь элек-
тронами первого уровня, по этой причине дополнительный элек-
трон легко притягивается к ядру и образуется отрицательный
ион фтора.
При переходе от натрия к хлору заряд ядра растет от 4-11
до 4-17. Соответственно увеличивается и общее число электро-
нов в атоме, однако число внутренних электронов, экранирую-
щих заряд ядра, остается прежним. Вот почему внешние элек-
троны притягиваются к ядру в атоме хлора гораздо сильнее,
чем в атоме натрия. Отсюда — легкость потери электронов
атомом натрия и других щелочных и щелочноземельных метал-
лов, а в несколько меньшей степени — и всех остальных эле-
ментов металлического характера.
Таким образом, металлы — это элементы с хорошей экра-
нировкой ядра внутренними электронами. Этим определяются
физические и химические свойства металлов.
162
Кристаллическое и электронное строение металлов
В свободном состоянии электроположительные элементы
образуют простые вещества с типичными металлическими свой-
ствами. К таким свойствам относятся, во-первых, характер-
ный «металлический» блеск, т. е. высокая способность отра-
жать видимый свет, и, во-вторых, более высокая по сравнению
со многими неметаллами пластичность, вызванная возможно-
стью скольжения друг относительно друга плоскостей, образо-
ванных атомами в кристаллической решетке металла. Благода-
ря этому для металлов, хотя и в разной степени, характерны
ковкость, тягучесть и другие важные для практики свойства.
В-третьнх, металлы отличаются высокой тепло- и электропро-
водностью. Для последней характерно то, что она уменьшается
при повышении температуры и при переходе металла в жидкое
состояние.
Типичные свойства металлов обусловлены нх кристаллическим и элек-
тронным строением. Структура большинства металлов при невысоких темпе-
ратурах представляет собой так называемую плотную упаковку атомов, гео-
метрически соответствующую максимально плотному заполнению объема ша-
рами одинакового размера. Один слой плотной упаковки легко наблюдать.
Рис. 8. Расположение шаров в плотной упаковке.
если насыпать в какую-нибудь коробку несколько десятков одинаковых ша-
риков, а затем наклонить коробку и постучать по ней. При этом если ие
все, то хотя бы часть шариков расположится таким образом, что образует
параллельные ряды, причем каждый следующий ряд будет сдвинут по отно-
шению к предыдущему ровно на половину диаметра шарика (рис. 8,а).
Для максимального использования пространства второй слой шаров дол-
жен, во-первых, иметь такое же расположение внутри слоя, как первый, и,
во-вторых, располагаться поверх первого слоя так, чтобы шары второго слоя
П* 163
иопадали । в. лупки, образованные тремя шарами первого слоя. Таким обра-
зом, если смотреть на кладку из шаров в направлении, перпендикулярном
плоскости слова, । второй, слой оказывается смещенным по отношению к пер-
Юму.
Гексагональная структура
Кубическая гранецентприройанная
структура
Рис. 9. Плотноупакованные
пространственные структуры.
Рассматривая рис. 8, а, легко заметить, что число лунок между шарами
первого слоя вдвое превышает число шаров в слое. Действительно, каждый
шар окружен шестью лунками, каждая из которых принадлежит трем ша-
рам, т. е. 1/3 каждой лунки на шар; следовательно, каждому шару принад-
лежат (1/3) -6=2 лунки. Поэто-
му, в принципе, второй слой
можно разместить над первым
двумя способами (рис. 8,6 и в).
Однако эти два способа размеще-
ния шаров одинаковы с точки
зрения симметрии расположения
шаров — один из них можно по-
лучить из другого простым пово-
ротом.
В случае же, когда поверх
второго слоя шаров располагается
третий, два способа размещения
шаров третьего слоя приводят
к двум принципиально разным
способам их пространственного
расположения. В одном слу-
чае (рис. 8, г) шары третьего
слоя оказываются точно над ша-
рами первого слоя (если смот-
Рис. 10. Кубическая объемно-цен- реть в направлении, перпендику-
трализоваиная структура. лярном плоскости слоя). Такой
. . . _ способ укладки шаров называется
гексагональной плотной упаковкой, или гексагональной структурой. В другом
случае (рис. 8,д) шары третьего слоя оказываются смещенными (если смо-
треть в том же направлении) по отношению к шарам второго и третьего
164
слоев (шары третьего слоя расположены над пустотами .рторого и третьего
слоя). Такой способ укладки называется кубической плотной .упаковкой, или
кубической гранецентрированной структурой. На рис.' '9 показаны простран-
ственные структуры, соответствующие этим двум видам ’плотной упаковки
шаров.
Как в гексагональной, так и в кубической .плотной упаковке имеются
два вида пустот—тетраэдрические и октаэдрические. Тетраэдрическая пу-
стота образуется, когда лунку между шарами одного слоя закрывает шар
другого слоя. Пустота называется тетраэдрической потому, что ограничи-
вающие ее шары расположены по вершинам тетраэдра. Октаэдрическая пу-
стота образуется, когда поверх лунки между тремя шарами одного слоя
располагаются три шара другого слоя. Название связано с Тем, что огра-
ничивающие пустоту шары располагаются по вершинам октаэдра. На один
шар приходятся две тетраэдрические пустоты и одна октаэдрическая. Послед-
няя несколько крупнее первых.
В обеих плотиоупакованных структурах координационное число (число
атомов, окружающих данный) равно 12, а пространство'заполнено шарами
на 74%. У металлов часто встречается также кубическая объемно-центриро-
ванная структура (рис. 10) с координационным числом 8. Эта структура не
является плотной упаковкой, она более рыхлая.
Металлы с кубической гранецентрированнбй структурой
(например, медь, серебро, золото) более ковки и пластичны,
чем металлы с гексагональной (титан, цирконий, гафний) или
кубической объемно-центрированной структурой (ванадий, нио-
бий, молибден, тантал, хром, вольфрам). Большая, пластич-
ность металлов с кубической гранецентрированной структурой
объясняется тем, что слои с плотной упаковкой располагаются
по четырем направлениям, перпендикулярным объемным диа-
гоналям куба. Пластичность же металлов связана .с возможно^
стью скольжения слоев атомов вдоль таких плоскостей.
Что касается электронного строения металлов, то наиболее
простая модель исходит из наличия в кристаллической решет-
ке металлов положительных ионов, окруженных свободными
электронами, которые передвигаются хаотически, наподобие
молекул газа (так называемый «электронный газ»), В этом
случае для количественного описания поведения электронов в
металле удается применить уравнения, описывающие поведе-
ние молекул в газе.
Такая модель хорошо объясняет оптические свойства ме-
таллов, их высокую тепло- и электропроводность, деформируе-
мость. Действительно, если исходить из наличия в решетках
металлов свободных электронов, то легко себе представить,
что при наложении на такую решетку внешнего электрическо-
го поля в хаотическом движении электронов появится некото-
рое преимущественное направление, т. е. составляющая скоро-
сти в направлении от отрицательного полюса внешнего источ-
ника тока к положительному будет несколько большей, чем со-
ставляющие скорости в других направлениях. Это означает,
что в решетке металла будет происходить перенос электриче-
ских зарядов, иными словами, через металл будет протекать
электрический ток.
165
Высокую теплопроводность металлов тоже легко объяснить
наличием свободных электронов: хаотически движущиеся ча-
стицы способны переносить тепло. Хорошо объясняется и пла-
стичность металлов: как бы ни сдвигались одна относительно
другой плоскости, образованные положительными ионами в
кристаллической решетке металлов, между ними всегда будут
находиться электроны, как бы склеивающие такие плоскости
за счет электростатического притяжения к обеим плоскостям.
Такая простая модель все же оказывается недостаточной для полного
объяснения физических свойств металлов. Однако более совершенная коли-
чественная модель, так называемая зонная теория твердого тела, включает
кваитовомеханический аппарат и потому не может быть рассмотрена в рам-
ках курса химии средней школы. Суть ее сводится к тому, что валентные
электроны металлов рассматриваются как принадлежащие всей кристалличе-
ской решетке, а не отдельным атомам. Эти электроны могут легко прини-
мать порции энергии, что эквивалентно увеличению их скорости в электри-
ческом поле, т. е. проводимости, вследствие чего такие электроны называют
электронами проводимости. Зонная теория твердого тела хорошо объясняет
электрические свойства не только металлов, но н полупроводников и изоля-
торов.
Физические свойства металлов
За исключением ртути все металлы при нормальных усло-
виях — твердые вещества. Среди металлов, твердых при ком-
натной температуре, самым легкоплавким является цезий, тем-
пература плавления которого 28 °C. Вообще же температуры
плавления металлов лежат в интервале от —39 °C (ртуть) до
+ 3410 °C (вольфрам).
Большинство металлов имеет серебристо-белый цвет, исклю-
чение составляют медь (красный) и золото (желтый). Но если
изготовить очень тонкую пленку металла, то наблюдаемый на
просвет цвет будет иным, чем цвет компактного металла, на-
пример зеленым для золота и голубым для серебра.
Плотность металлов изменяется в широких пределах. Са-
мый легкий из них (литий) имеет плотность 0,53 г/см3, самый
тяжелый (осмий) — 22,5 г/см3. Почти все металлы тяжелее во-
ды. Металлы, имеющие плотность менее 3 г/см3, называют лег-
кими, а имеющие плотность 8—10 г/см3 и более — тяжелыми.
К первым относятся, например, магний и алюминий, ко вто-
рым — серебро, свинец, ртуть.
Некоторые металлы очень мягкие: щелочные металлы легко
режутся ножом. Другие, напротив, очень твердые. Например,
хром (самый твердый из металлов) царапает стекло. Самый
пластичный и ковкий металл — золото.
Электропроводность металлов, имеющих наибольшее прак-
тическое применение, убывает в следующем ряду: серебро
>медь>алюминий>цинк>железо>свииец. Теплопроводность
изменяется примерно в той же последовательности. При по-
вышении температуры усиливаются колебания в кристалличе-
166
ской решетке металла, что создает помехи энергетическим пе-
реходам электронов. Поэтому с повышением температуры элек-
тропроводность металлов понижается.
Как показывают исследования с помощью рентгеновских
лучей, используемые на практике образцы металлов состоят
из микрокристаллов. Механические свойства металла в боль-
шой степени зависят от размеров, формы и расположения кри-
сталлов в них, на что, в свою очередь, влияет скорость охлаж-
дения металла при его кристаллизации из расплава, а в слу-
чае сплава двух или более металлов — также состав сплава.
Размеры кристаллов зависят также от чистоты металла. Для
очень чистых металлов в определенных условиях можно полу-
чить отдельные довольно крупные кристаллы («монокри-
сталлы») .
Благодаря своим механическим свойствам, позволяющим
применять к ним самые разнообразные методы обработки, ме-
таллы имеют огромное значение для. технологии. Многие свой-
ства металлов могут существенно изменяться от их термиче-
ской обработки, что чаще всего связано с наличием разных
кристаллических модификаций металла. На этом основана, в
частности, закалка стали. Кроме того, изменяя скорость
охлаждения металла и тем самым скорость кристаллизации,
а также подвергая металл деформациям, можно менять в ши-
роких пределах природу, размеры, форму и взаимное располо-
жение микрокристаллов металла или сплава, придавая ему
желаемые свойства.
Сильно влияет па свойства металлов и присутствие приме-
сей, иногда даже в малых концентрациях. Так, широкое при-
менение титана началось только после того, как научились
получать его достаточно чистым — до этого он считался непри-
годным для большинства видов механической обработки из-за
своей хрупкости, связанной, как оказалось, с наличием при-
месей.
Сплавы
В расплавленном состоянии металлы обычно смешиваются
друг с другом с образованием однородной жидкой фазы. При
затвердевании расплава образуются сплавы, фазовый состав
которых может быть разным в зависимости от характера ис-
ходных компонентов.
В принципе, могут наблюдаться три типа поведения компо-
нентов по отношению один к другому. Во-первых, сплав может
представлять собой однородный твердый раствор (например,
сплав серебра с золотом). Во-вторых, может образоваться ме-
ханическая смесь кристаллов исходных компонентов (сплав
сурьмы со свинцом). В-третьих, в сплаве могут присутствовать
кристаллы химических соединений между металлами — так на-
167
зываемых интерметаллических соединений (например, в спла-
вах магния с оловом, меди с цинком). Могут быть и смешан-
ные случаи, например, когда исходные компоненты обнаружи-
вают ограниченную взаимную растворимость в твердом состоя-
нии, т. е. каждый из них может принять в свою кристалличе-
скую решетку некоторое количество другого компонента до
определенной концентрации, зависящей от температуры. В этом
случае сплав двух металлов будет представлять собой смесь
двух твердых растворов.
Таким образом, при приготовлении сплавов имеется воз-
можность осуществить различные комбинации кристаллов
твердых растворов, чистых компонентов и интерметаллических
соединений. К всему сказанному остается еще добавить, что
сплавы в процессе их приготовления, как правило, подверга-
ются быстрому охлаждению, поэтому в них часто присутству-
ют фазы, метастабильные при низких температурах. Благодаря
разнообразию фазового состава, размеров кристаллов различ-
ных фаз, способов их сцепления между собой, а также благо-
даря разнообразию физико-химических свойств отдельных кри-
сталлов, присутствующих в сплавах, свойства последних несрав-
ненно более разнообразны, чем свойства чистых металлов. По-
этому сплавы и используются столь широко в современной
технике.
За счет образования интерметаллических соединений у спла-
ва могут появиться такие свойства, каких не было у соответ-
ствующих чистых металлов. Например, некоторые сплавы об-
ладают ферромагнитными свойствами (т. е. таким же типом
магнитных свойств, как у железа), хотя исходные металлы в
тех же условиях не ферромагнитны. Дюралюминий приобре-
тает совсем новые свойства по сравнению с главным компо-
нентом этого сплава — алюминием — и вторым по концентра-
ции компонентом — медью. Сплав, содержащий около 2/3 ме-
ди и 1/3 олова («зеркальная бронза»), совершенно не похож
по внешнему виду на медь: например, цвет его ближе к цвету
серебра. Свойства латуни также связаны с образованием не-
скольких интерметаллических соединений.
Приведем примеры некоторых сплавов цветных металлов,
наиболее часто используемых в технике.
1. Оловянные бронзы — сплавы меди с оловом, содержа-
щие также добавки цинка, свинца, фосфора.
2. Специальные (безоловянные) бронзы—двойные или бо-
лее сложные сплавы меди с алюминием (алюминиевые брон-
зы), бериллием (бериллиевые бронзы), никелем и другими ме-
таллами.
3. Латунь — сплав меди с цинком, иногда с добавками алю-
миния, железа, марганца и других металлов.
4. Баббиты — мягкие антифрикционные (обеспечиваюьдие
малый коэффициент трения) сплавы на основе олова, свинца
168
и кальция. Эти сплавы используются для изготовления вкла-
дышей подшипников.
Интересный пример сплавов — амальгамы (сплавы ртути с другими ме-
таллами). В зависимости от состава амальгамы могут быть при комнатной
температуре твердыми или жидкими. Амальгамы щелочных металлов ведут
себя во многих отношениях подобно свободным щелочным металлам, напри-
мер реагируют с водой, образуя водород и раствор щелочи, но реакция идет
менее бурно. Поэтому амальгамы щелочных металлов удобно применять
в качестве восстановителей. Золото и серебро легко и быстро растворяются
в ртути, это используется в так называемом амальгамном способе извле-
чения этих металлов из горных пород.
Набор свойств, которые можно получить у сплава, значительно расши-
рится, если вводить в сплав неметаллическую фазу, например тугоплавкие
оксиды алюминия, магния, циркония, гафния, карбиды или нитриды пере-
ходных элементов. Поскольку такие материалы содержат в себе как метал-
лическую, так и керамическую (оксид, карбид, нитрид) составляющую, их
называют керметами.
Используя те или иные сочетания металла и керамики, можно в широ-
ких пределах варьировать свойства керметов, придавая им твердость или,
наоборот, пластичность, нужную электропроводность, огнеупорность. Кер-
меты часто применяют для изготовления конструкций, работающих в особо
тяжелых условиях (детали реактивных двигателей, ядерных реакторов, тор-
мозных колодок). Металлокерамические твердые сплавы используются для
изготовления металлорежущего инструмента. Такие сплавы получают мето-
дом порошковой металлургии из наиболее твердых карбидов переходных
металлов, зерна которых сцементированы более мягким металлом-связкой.
В качестве карбида чаще всего выбирают карбид вольфрама, а также твер-
дые растворы карбидов титана, вольфрама и тантала, а в качестве связки —
кобальт или никель.
§ 4. ПОЛУЧЕНИЕ МЕТАЛЛОВ
ИЗ ПРИРОДНЫХ СОЕДИНЕНИЙ
Металлы в природе
Некоторые металлы, расположенные в правой части ряда
напряжений п имеющие сравнительно непрочные соединения
(главным образом переходные металлы VIII и I групп), встре-
чаются в природе в металлическом «самородном» состоянии.
Прежде всего это относится к золоту и металлам семейства
платины. Последние обычно находятся в виде смеси, в которой
преобладает платина (чаше всего около 80%). Реже встреча-
ется самородное серебро — обычно в виде сплава с золотом.
Медь и ртуть, соединения которых более прочны, хотя и могут
встретиться в самородном виде, но очень редко.
Металлы, стоящие в ряду напряжений перед водородом, на-
ходятся в природе только в виде соединений (исключение со-
ставляет лишь железо с примесью кобальта и никеля, имеющее
метеоритное происхождение). Это оксиды, сульфиды, карбона-
ты, силикаты и другие соединения.
Многие руды металлов представляют собой оксиды или
гидроксилы с тем или иным содержанием связанной воды:
Fe2O3 (красный железняк, или гематит), Fe3O4 (магнитный же-
163-
лезняк), TiO2 (рутил), МпО2 (пиролюзит), SnO2 (оловянный
камень), А12Оз-хН2О (боксит), Fe2O3-xH2O (бурый железняк).
Тяжелые металлы часто находятся в природе в виде сульфи-
дов: ZnS (цинковая обманка), PbS (свинцовый блеск), FeS2
(железный колчедан), FeCuS2 (медный колчедан, или халько-
пирит), Cu2S (медный блеск), Ag2S (аргентит), HgS (кино-
варь), MoS2 (молибденит). Некоторые металлы встречаются
в виде карбонатов: FeCO3 (сидерит), СаСО3 (известняки),
MgCO3 (магнезит), MgCO3-CaCO3 (доломит). Для щелочных
и щелочноземельных металлов характерны также залежи хло-
ридов и сульфатов: CaSO4-2H2O (гипс), NaCl (каменная
соль), КС1 (сильвинит), KCl-MgCl2-6H2O (карналлит). Встре-
чаются и соединения металлов иного типа: Na3AlF6 (криолит),
ТеО-Сг2Оз (хромистый железняк), (Na, K)2O-Al2O3-2SiO2
(нефелин), МеРО4 (монацитовый песок, где Me—редкоземельные
элементы).
Некоторые металлы принадлежат к рассеянным элементам,
т. е. редко встречаются в концентрированном виде, а обычно
содержатся в небольших концентрациях в различных горных
породах. Так, ванадий в заметных количествах присутствует в
различных природных силикатах (например, в граните) и суль-
фидах. Германий в небольших концентрациях содержится в
свинцово-цинковых рудах, а также в каменном угле, из золы
которого его извлекают в виде оксида германия. Кадмий явля-
ется примесью к цинку в цинковых рудах. Соединения некото-
рых металлов в небольших концентрациях содержатся в океан-
ской воде и в воде некоторых горячих источников.
В природе соединения металлов, применяемых в технике,
всегда смешаны с тем или иным количеством других соеди-
нений, которые являются ненужным балластом («пустой поро-
дой»). Иногда руда может быть отделена от этого балласта
физическими методами (флотацией, магнитной сепарацией и
т. д.). Такие процессы называются обогащением руды.
Получение металлов из их соединений
В тех случаях, когда металл содержится в руде в виде
сульфида, карбоната или гидроксида, его сначала переводят
в оксид, прокаливая руду иа воздухе. Так, из цинковой обман-
ки прокаливанием на воздухе получают оксид цинка:
2 ZnS + 3 О2 = 2 ZnO + 2 SO2.
В последние годы все больше используются как источник
сырья многокомпонентные руды, а также руды, содержащие
сравнительно невысокий процент ценных элементов. Для пере-
работки таких руд широко используется метод хлорной метал-
лургии, который состоит в том, что руду обрабатывают хлором
при высокой температуре (так называемый хлорирующий об-
жиг). Иногда вместо хлора применяют другие хлорирующие
и 70
агенты, например тетрахлорид углерода, фосген СОС12. Эти
вещества при высоких температурах разлагаются с образова-
нием активного хлора, поэтому могут быть более энергичными
хлорирующими агентами, чем сам хлор. Например, тетрахло-
рид углерода хлорирует оксиды при более низкой температу-
ре, чем свободный хлор.
Хлорирующий обжиг часто ведется в присутствии угля.
Роль угля заключается в том, что за счет связывания кисло-
рода в оксиды углерода нли СОС12 равновесие реакции вытес-
нения кислорода хлором смещается вправо. Так, при хлориро-
вании титанового концентрата в присутствии угля идет реак-
ция
TiO2 -f- С -f- 2 CI2 = TiC 14 -{- СО2.
В результате хлорирующего обжига многие из содержащихся
в руде металлов переходят из оксидов в хлориды или оксохло-
риды (соединения металла с кислородом и хлором одновремен-
но), которые для большинства металлов более летучи, чем ок-
сиды, поэтому при хлорирующем обжиге обычно происходит
возгонка хлоридов и оксохлоридов. За счет разной летучести
этих соединений возможно разделение даже близких по свой-
ствам элементов.
В настоящее время хлорная металлургия применяется для
производства титана, ниобия, тантала, циркония, гафния, ред-
коземельных элементов, германия, кремния, олова и даже алю-
миния. Она является эффективной при переработке не только
многокомпонентных руд, но и промышленных отходов, содер-
жащих ценные элементы, металлолома, отработанных тепло-
выделяющих элементов ядерных реакторов и т. п. Она нашла
широкое применение в металлургии редких металлов. Преиму-
ществами хлорной металлургии по сравнению с традиционны-
ми способами извлечения металлов из руд являются полнота
вскрытия сырья (полнота извлечения из него ценных элемен-
тов), а также высокая избирательность. Метод требует совер-
шенной технологии и высокой культуры производства, посколь-
ку хлор и его летучие соединения очень токсичны и химически
агрессивны.
Полученные хлориды и оксохлориды — достаточно реакци-
онноспособные соединения, которые легко подвергаются даль-
нейшей переработке как для получения металлов, так и для
переведения их в другие соединения. Например, при перера-
ботке руд, содержащих титан, получают тетрахлорид титана,
который затем сжигают, получая тонкодисперсный диоксид ти-
тана — минеральную составляющую широко применяемых ти-
тановых белил.
Таким образом, во многих случаях металлургические про-
цессы сводятся к восстановлению оксидов или хлоридов (ре-
же — других галогенидов). В тех случаях, когда процесс вос-
171
становления ведется в безводных условиях при высокой темпе-
ратуре, его называют пирометаллургическим процессом, или
пирометаллургией.
При выборе восстановителя для восстановления металла
из его оксида руководствуются прежде всего соображениями
экономичности. Наиболее дешевым восстановителем является
кокс — богатый углеродом твердый остаток, образующийся при
сухой перегонке хороших («коксующихся») сортов каменного
угля, а также оксид углерода (II). Поэтому везде, где это воз-
можно, в качестве восстановителя используют эти два веще-
ства, причем СО обычно получают в самой системе, в которой
восстанавливают металл, например в доменной печи, продувая
воздух через слой раскаленного угля.
Восстановление оксида железа (III) идет ступенчато — сна-
чала до Fe3O4, затем до FeO и, наконец, до металла. При тем-
пературе, при которой в доменной печи протекает реакция
FeO+СО = Fe + CO2,
равновесная концентрация СО2 ниже равновесной концентра-
ции СО, т. е. равновесие значительно сдвинуто в сторону об-
ратной реакции. Однако за счет поддержания высокой кон-
центрации СО и непрерывного удаления СО2 равновесие уда-
ется сместить в нужную сторону, и восстановление имеет ме-
сто. При высоких температурах параллельно идет процесс вос-
становления FeO углеродом:
FeOH-C = Fe + CO.
Прохождению этой реакции помогает то, что один из продук-
тов реакции — газ. Это один из примеров проявления той са-
мой тенденции к распределению частиц вещества в возмож-
но большем объеме, о которой говорилось при рассмотрении
химического равновесия.
Эта тенденция проявляется тем сильнее, чем выше темпера-
тура, поэтому чем прочнее оксид, тем более высокие темпера-
туры потребуются для того, чтобы добиться восстановления
оксида углем. Например, хром восстанавливается из оксида
хрома (III) при температурах выше 1500 °C. Углеродом уда-
ется восстановить и еще более прочный оксид ванадия (III),
но для этого требуются очень высокие температуры. В про-
мышленности восстановление этого оксида проводят в ваку-
уме (при непрерывном откачивании образующегося СО), что
способствует смещению равновесия вправо. При очень высо-
ких температурах в электропечах углеродом восстанавливает-
ся кремний из его оксида — на этом основан промышленный
способ получения кремния.
Когда образующийся металл имеет невысокую температу-
ру кипения, он может при восстановлении выделяться в газооб-
разном состоянии. В этом случае увеличение числа молей газо-
172
образных веществ при реакции позволяет восстановить оксиды
даже таких металлов, которые стоят довольно далеко влево
в ряду напряжений, например цинка:
ZnO (тв.)4- С (тв.) = СО (газ)Zn (газ).
Можно даже и магний восстановить углем из оксида магния,
но для этого потребуются температуры порядка 2000 °C.
Некоторые элементы, например переходные металлы,при вос-
становлении их из оксидов углем образуют термически устойчи-
вые карбиды или смесь карбида с металлом. Примесь карбида
может ухудшить технологически важные характеристики метал-
ла, например сделать его хрупким. В таких случаях в каче-
стве восстановителя применяют более дорогой водород, как,
например, для восстановления вольфрама из его оксида:
WO3 + 3H2= W-)-3H2O (газ).
Водород часто используют для восстановления редких метал-
лов из их соединений, например платины.
Так как водород можно получить достаточно чистым, в то
время как кокс по самому способу его получения из каменного
угля содержит много примесей, при восстановлении оксидов
водородом получают гораздо более чистые металлы, чем при
восстановлении коксом и даже СО. Поэтому водород часто
применяют для восстановления металлов из их соединений в
лабораторных условиях. Например, когда требуется получить
очень чистое железо, то, проводя реакции перехода от одного
класса веществ к другому, добиваются выделения чистой со-
ли железа; последняя при нагревании разлагается до оксида,
который затем восстанавливается водородом.
Для восстановления металлов из очень прочных оксидов при-
меняют металлотермию — процесс восстановления при высокой
температуре, в котором восстановителем служит другой металл —
чаще всего кальций, магний или алюминий. В частном случае,
когда восстановителем является алюминий, этот способ восста-
новления называется алюминотермией, или алюмотермией. Так
из оксидов получают ванадий, хром, марганец. Например:
Сг2О3 2 А1 == 2 Сг -ф А12О3.
Метод основан на том, что образование оксида алюминия со-
провождается очень большим выделением энергии, поэтому,
несмотря на затрату энергии для разрушения исходного окси-
да металла, процесс восстановления металла алюминием ока-
зывается экзотермическим.
В тех случаях, когда исходным сырьем для восстановления
•является галогенид (например, хлорид, полученный в результа-
те хлорирующего обжига руды), также можно использовать
173
металлотермический способ восстановления. Так, титан (в виде
титановой губки) получают магииетермическим восстановле-
нием хлорида:
TiC 14 + 2 Mg = 2 MgCl2 + Ti.
Затем губчатый титан переплавляют в вакууме или в атмос-
фере инертного газа для получения компактного металла.
Распространенным методом получения металлов, образую-
щих прочные оксиды, является электролиз расплавов их гало-
генидов. Таким путем в промышленности получают металлы
главных подгрупп первой и второй групп (в наибольшем мас-
штабе— натрий и магний), а также редкоземельные металлы..
При этом побочным продуктом является выделяющийся на ано-
де свободный галоген (чаще всего — хлор).
Электролиз тугоплавких оксидов часто проводят, раство-
ряя их в более легкоплавких галогенидах. Для получения алю-
миния подвергают электролизу раствор оксида алюминия в рас-
плавленном криолите NaaAlFe. Это делается для понижения-
температуры расплава, подвергаемого электролизу: чистый ок-
сид алюминия (корунд) плавится при 2050 °C, чистый крио-
лит— при 1009 °C, а смесь криолита с 10,5% оксида алюми-
ния— при 961 °C. Анод изготовляется из угля, поэтому выде-
ляющийся при электролизе кислород реагирует с материалом
анода, образуя смесь СО и СО2. Катодом же служит собираю-
щийся на дне электролизной ванны расплавленный алюминий.
Некоторые металлы используются в больших количествах
для производства сплавов. В таких случаях не требуется вы-
плавлять из руд более или менее чистый металл, а можно по-
лучать его в виде концентрированного сплава с тем металлом,
добавкой к которому он будет в дальнейшем служить. Так,,
восстанавливая углеродом при высокой температуре в электро-
печах смеси оксидов железа с оксидами хрома, марганца или
молибдена, получают соответственно феррохром, ферромар-
ганец или ферромолибден — сплавы соответствующих металлов
с железом, содержащие также углерод. Иногда для получения
подобных сплавов используют металлотермию (так, например,
получают феррованадий). Эти сплавы идут затем на произ-
водство легированных сталей.
Металлы, имеющие очень высокие температуры плавления,
получаются при восстановлении из соединений обычно в виде
порошка, а не слитка. Например, вольфрам восстанавливается
из его триоксида водородом при температуре около 1000 °C, в
то время как температура плавления вольфрама — около
3400 °C. Для превращения порошка в компактный металл его
прессуют и подвергают спеканию, т. е. нагреванию при темпе-
ратуре несколько ниже температуры плавления. При этом
можно сразу придать металлу форму готового изделия. Такой
способ обработки металла называется порошковой металлур-
174
гией. Методом порошковой металлургии получают, например,
различные сверхтвердые сплавы на основе вольфрама, воль-
фрамовую проволоку, многочисленные композиционные мате-
риалы.
В современной металлургии все шире применяются гидроме-
таллургические методы, суть которых заключается в том, что
руду обрабатывают раствором реагента — чаще всего кисло-
ты или щелочи, а также веществ, образующих с нужным ком-
понентом руды комплексное соединение, в результате чего»
нужные элементы переходят в раствор. Из этого раствора их
можно выделить электрохимическим восстановлением пли чи-
сто химическими методами, например осаждением при дейст-
вии на этот раствор сероводорода или углекислого газа.
Так, например медную руду обрабатывают серной кисло-
той, а полученный раствор медного купороса для извлечения
меди либо подвергают электролизу, либо осаждают из него
медь на железных стружках. Вытеснение одного металла из
раствора его соли другим металлом называется в технике
цементацией; этот метод удобен тем, что позволяет выделять
из раствора даже весьма малые количества металла. Он часто
применяется для извлечения ценных металлов из растворов их
соединений, например серебра из содержащих его жидких про-
мышленных отходов.
Гидрометаллургические методы находят все более широкое
применение для подземного выщелачивания руд, когда реагент
(например, серная кислота) закачивается в толщу руды, а
полученный раствор выкачивается на поверхность и перера-
батывается.
§ 5. ПОЛУЧЕНИЕ НЕМЕТАЛЛОВ
В ВИДЕ ПРОСТЫХ ВЕЩЕСТВ
Помимо инертных газов, которые содержатся в атмосфере
и в виде включений в некоторых горных породах (прежде все-
го гелий), всего четыре неметалла встречаются в природе в
свободном состоянии в значительных количествах или в кон-
центрированном виде. Это углерод (графит и алмаз), «самород-
ная» сера, а также азот и кислород атмосферы.
Из наиболее электроотрицательных элементов хлор и фтор
получают в виде простых веществ электролизом: фтор — элек-
тролизом расплавов фторидов (получая одновременно соот-
ветствующий металл), хлор — электролизом растворов хлори-
дов натрия или калия, а также как побочный продукт при по-
лучении наиболее электроположительных металлов электро-
лизом расплавов их хлоридов. Бром и иод обычно получают,
действуя на содержащее их сырье хлором, например, обраба-
тывая им золу морских водорослей для извлечения из нее
иода.
175
Кислород в лабораторных условиях можно получать элек-
тролизом раствора щелочи. Однако в промышленности этот
способ используется редко, так как гораздо дешевле получать
кислород фракционированным испарением жидкого воздуха.
Правда, кислород, полученный электролитическим путем, отли-
чается высокой чистотой.
Существует много способов получения водорода. Некоторые
из них применяются только в лаборатории или имеют чисто
познавательный интерес. Все они включают либо электролиз
(например, водного раствора щелочи), либо действие йосста-
иовителей на воду и другие водородсодержащие соединения.
Например:
1) действие наиболее электроположительных металлов на
разбавленные растворы кислот:
2 НС1 4- Zn = ZnCI2 + H2f;
2) действие металлического цинка или алюминия на ще-
лочь:
Zn + 2 КОН = K2ZnO2 + H2f;
3) взаимодействие гидридов щелочных и щелочноземель-
ных металлов с водой:
СаН2 4~ 2 Н2О = Са(ОН)2 4-2 H2f;
4) железопаровой способ, когда-то имевший широкое при-
менение:
4 Н2О + 3 Fe = Fe3O4 + 4 H2f.
Большие количества водорода, требующиеся современной
промышленности для производства аммиака, органического
синтеза и т. д., получают главным образом исходя из водяного
газа или метана — главной составной части природного газа.
В случае метана при высоких температурах в присутствии ка-
тализаторов идут следующие реакции:
СН4 + Н2О = СО + 3 Н2,
СН4 4- СО2 = 2 СО + 2 Н2,
СН4 4- 1/2 О2 = СО 4- 2 Н2.
Водяной газ получается при прохождении водяного пара
через раскаленный уголь:
Н2О 4- С = СО 4- Н2,
следующая реакция
Н2О 4- СО = СО2 4- Н2
— конверсия монооксида углерода в присутствии катализато-
ра. Углекислый газ отделяют, растворяя его в воде под дав-
лением.
176
Кремний в промышленном масштабе получают восстанов-
лением его оксида углем в электропечах при высокой темпе-
ратуре:
SiO2 + 2 С = 2 СО + Si.
Он используется в черной металлургии как «раскислитель»
(т. е. восстановитель), а также добавляется в сталь для улуч-
шения ее свойств. Для этих целей не обязателен чистый крем-
ний, можно взять его сплав с железом (ферросилиций). Этот
сплав получают, восстанавливая при высокой температуре
углем смесь железной руды и оксида кремния.
Чистый кремний образуется при высокотемпературной ре-
акции между газообразным тетрахлоридом кремния и цинком:
SiCl4 + 2 Zn .= 2 ZnCl2 + Si.
В лабораторных условиях кремний получают, восстанавливая
диоксид кремния магнием; для начала реакции требуется силь-
ный локальный нагрев, после чего реакция идет за счет выде-
ляющегося тепла:
SiO2 + 2 Mg — 293 кДж = 2 MgO 4- Si.
С помощью магния как восстановителя можно получить так-
же бор:
B2O3 + 3Mg — 530 кДж = 3 MgO 4-2 В.
В тех случаях, когда при получении элемента в свободном
состоянии приходится исходить из очень прочных его соедине-
ний, стараются провести процесс так, чтобы, во-первых, часть
продуктов восстановления также связывалась в прочные соеди-
нения и, во-вторых, чтобы при реакции увеличивалось число
молей газа. Это позволило бы добиться осуществления реак-
ции при достаточно высокой температуре. Например, фосфор
получают нагреванием в электрической печи смеси фосфорита
с углем и оксидом кремния:
Са3(РО4)2 4- 3 SiO2 4- 5 С = 3 CaSiO3 4- 5 СО 4- 2 Р.
Здесь оксид кремния служит для связывания оксида кальция,
образующегося при восстановлении фосфорита. Выделение пя-
ти молей СО на моль фосфорита дает возможность провести
эту эндотермическую реакцию при высоких температурах.
Полученные пары фосфора конденсируются с образованием
белого фосфора, состоящего из молекул Р4. При длительном
нагревании его без доступа воздуха при температуре около
300 °C получают красный фосфор. t
12 Семенов И. Н.
177
Глава 8
СОЕДИНЕНИЯ ЭЛЕМЕНТОВ ГЛАВНЫХ ПОДГРУПП
§ 1. СОЕДИНЕНИЯ С ВОДОРОДОМ
Все соединения элементов главных подгрупп с водородом
можно разделить на три типа: ионные, летучие и полимерные.
Щелочные и щелочноземельные металлы образуют с водоро-
дом ионные соединения, или ионные гидриды. Элементы глав-
ных подгрупп IV—VII групп образуют летучие соединения с во-
дородом. И, наконец, бериллий и магний (не относящиеся к ще-
лочноземельным металлам, хотя и стоят с ними в одной под-
группе), а также алюминий дают с водородом полимерные гид-
риды.
Следует отметить, что термин «гидрид» употребляют как
в широком смысле слова — по отношению к соединению любого-
элемента с водородом, так и в более узком, называя так толь-
ко соединения металлов с водородом. Наибольшее применение
находят ионные и летучие гидриды. Их мы и рассмотрим
ниже.
Ионные гидриды
В ионных гидридах связь между атомом металла и водо-
родом ионная, причем водород образует здесь отрицательный
ион Н_, принимая на ls-орбиталь дополнительный электрон,
в результате чего он приобретает конфигурацию электронов
инертного газа гелия. В этом отношении поведение атома во-
дорода в гидридах щелочных и щелочноземельных металлов
похоже на поведение атомов галогенов в галогенида.х с теми,
же металлами. По физическим свойствам и по строению кри-
сталлических решеток ионные гидриды также схожи с соот-
ветствующими галогенидами. Например, гидриды щелочных
металлов кристаллизуются по типу каменной соли (NaCI),.
образуя типично ионную решетку, в которой каждый ион ще-
лочного металла окружен шестью ионами водорода, а каждый
ион водорода — шестью ионами щелочного металла. Как и во-
обще вещества с ионными решетками, ионные гидриды имеют
сравнительно высокие температуры плавления.
Ионные гидриды получают непосредственным взаимодействи-
ем простых веществ при нагревании. Самый устойчивый из;
гидридов щелочных металлов — гидрид лития — плавится без
разложения при 680 °C. Расплав гидрида лития проводит элек-
трический ток, переносчиками тока являются ионы Li+ и Н~;
при его электролизе на катоде выделяется металлический ли-
тий, а на аноде — водород.
Ионные гидриды — очень сильные восстановители. Они
энергично взаимодействуют с водой, причем атом водородам
178
гидрида (в степени окисления —1) восстанавливает атом водо-
рода воды (в степени окисления +1), в результате чего выде-
ляется водород, а в растворе остается щелочь: .
KH + H2O = H2f+ кон,
СаН2 + 2 Н2О == 2 H2f + Са(ОН)2.
Химическая активность ионных гидридов растет в том же
направлении, что и активность соответствующих металлов — от
легких элементов к тяжелым. Гидриды рубидия и цезия даже
воспламеняются во влажном воздухе; гидриды щелочноземель-
ных металлов несколько менее активны, чем гидриды щелоч-
ных металлов.
Наибольшее практическое значение имеют гидриды лития и
кальция. Гидролиз этих соединений является удобным, хотя
и дорогим способом получения водорода в полевых условиях.
Он применяется для наполнения шаров-зондов и надувных спа-
сательных средств на воде. Количество водорода, образующего-
ся на единицу массы гидрида лития, довольно велико: исходя
из 1 моль этого гидрида, т. е. 8 г, можно получить 2 г водоро-
да, т. е. 22,4 л при и. у.
Гидриды лития, кальция и натрия используются также как
восстановители в различных неорганических и органических
синтезах.
Летучие водородные соединения
К этому типу гидридов относятся водородные соединения,
температуры кипения которых невысоки, вследствие чего при
обычных условиях они либо представляют собой газы, либо,
находясь в конденсированном состоянии, имеют заметное дав-
ление пара. В твердом состоянии они образуют типичные мо-
лекулярные решетки.
Летучие водородные соединения — наиболее практически
важная группа соединений с водородом. К ним относятся та-
кие часто встречающиеся в природе или используемые в про-
мышленности вещества, как вода, метан и другие углеводоро-
ды, аммиак, сероводород, галогеноводороды. Многие из лету-
чих водородных соединений находятся в виде растворов в поч-
венных водах, в составе живых организмов, а также в газах,
образующихся при биохимических и геохимических процессах,
поэтому весьма велика их биохимическая и геохимическая
роль. Если не считать воды, все летучие водородные соедине-
ния при большой концентрации более или менее токсичны, а
также обладают резким, характерным для каждого из них за-
пахом (аммиак, хлороводород, сероводород).
Рассмотрим способы получения некоторых летучих водород-
ных соединений. Начнем с синтеза аммиака, используя пред-
ставления, сформулированные ранее о химическом равновесии.
179
12*
Синтез аммиака исключительно важен для практики, посколь-
ку аммиак является исходным веществом для получения мно-
гих соединений азота, в том числе азотных удобрений.
Так как реакция 1\[2+ЗН2 = 2МНз экзотермическая и сопро-
вождается уменьшением числа молей газа, то увеличению вы-
хода аммиака должны способствовать повышение давления и
понижение температуры. Однако молекулы азота и водорода
достаточно прочны, особенно молекула азота — для разрыва ее
на атомы требуется энергия почти в 1000 кДж. Как правило,
энергия активации процесса тем выше, чем прочнее связи в
молекулах исходных веществ. Поэтому для данной реакции
энергия активации велика, и, чтобы проводить ее при достаточ-
но низких температурах, когда выход аммиака высок, надо ис-
пользовать катализатор.
Обычно в качестве катализатора для синтеза аммиака ис-
пользуют железо с добавками соединений алюминия и щелоч-
ных металлов, служащих промоторами. Активность твердого
катализатора зависит от способа его получения. В данном
случае катализатор приготовляют, вводя в реактор для синте-
за аммиака FeaCh (каталитическая активность получается наи-
высшей, если получать катализатор из этого оксида) с нуж-
ными добавками. Поскольку при работе реактора через него
пропускают смесь азота и водорода под высоким давлением и
при температуре порядка 500 °C, оксид железа в этих усло-
виях восстанавливается до металла.
Даже наилучшие катализаторы, которыми располагает сов-
ременная химическая технология, позволяют провести реакцию
синтеза аммиака с приемлемой скоростью лишь при темпера-
турах порядка 500 °C, когда при атмосферном давлении равно-
весие значительно смещено влево и выход аммиака очень мал.
Чтобы сместить равновесие вправо и добиться достаточного
выхода аммиака, приходится повышать давление до несколь-
ких десятков МПа. Но и в этом случае выход его еще далеко
не 100%-ный, поэтому после отделения полученного аммиака
непрореагировавшую азотоводородную смесь снова вводят в
реактор.
Азотфиксирующие бактерии с помощью ферментных систем
осуществляют фиксацию атмосферного азота, т. е. превращение
его в производные аммиака, при комнатной температуре, когда
равновесие в достаточной степени смещено в сторону синтеза
аммиака даже при атмосферном давлении. Хотя исследование
Такого рода ферментных систем и разработка их аналогов для
химической промышленности ведутся уже многие годы, про-
блема синтеза аммиака в «мягких» условиях (при комнатной
температуре и атмосферном давлении) в промышленном мас-
штабе еще не решена.
”. Реакция синтеза из простых веществ другого технически
важного соединения — хлороводорода — при комнатной темпе-
180
ратуре в отсутствие катализатора и некоторых других воздей-
ствий заморожена, поскольку исходные молекулы достаточно
прочны. Чтобы заставить их взаимодействовать, надо или суще-
ственно поднять температуру, или ввести катализатор, или
инициировать реакцию облучением реакционной смеси кванта-
ми ультрафиолетовой части спектра.
При промышленном способе получения НС1 достаточно под-
жечь смешивающиеся реагенты, и затем реакция будет проте-
кать как горение в зоне смешивания, т. е. необходимая темпе-
ратура будет поддерживаться за счет энергетического эффекта
реакции.
Под действием же ультрафиолетового излучения процесс идет
как фотохимическая реакция и заключается в следующем. По-
глотив квант лучистой энергии, молекула хлора (которая ме-
нее прочна, чем молекула водорода) распадается на свободные
атомы, которые, конечно, гораздо более активны химически,
чем молекулярный хлор. Столкнувшись с молекулой водоро-
да, атом хлора образует молекулу хлороводорода и свободный
атом водорода, т. е. новую активную частицу. В свою очередь,
атом водорода, сталкиваясь с молекулой хлора, дает новую
молекулу НС1 и снова свободный атом хлора и т. д.:
Cl24-/iv—С1,
С1 + н2-> на + н,
Н + С12->НС1 + С1... .
Таким образом, по ходу процесса одна активная частица,
вступая в реакцию, порождает другую активную частицу. Та-
кие реакции называются цепными. Цепной механизм реакции
приводит к тому, что за счет одного кванта энергии может осу-
ществиться превращение очень большого количества молекул
водорода и хлора в молекулы НС1.
Одним из методов получения летучих водородных соедине-
ний является гидролиз различных соединений. Например, если
подействовать водой на фосфид кальция Са3Р2, то образуется
фосфин РНз:
Са3Р2 + 6Н2О = 3 Са (ОН)2 + 2 PH3f.
Помимо фосфина при этой реакции получается некоторое количество дифос-
фина Р2Н4— жидкого при обычных условиях соединения фосфора с водоро-
дом. Если фосфин является аналогом аммиака, то Р2Н4 является аналогом
другого соединения азота с водородом — гидразина N2H4 (H2N— NH2). Так
как Р2Н4— чрезвычайно активное вещество, сильный восстановитель, воспла-
меняющийся на воздухе, то образующийся при реакции газ вспыхивает, хо-
тя сам фосфин при комнатной температуре с молекулярным кислородом не
взаимодействует.
Фосфин — гораздо менее прочное соединение, чем аммиак.
Его горение сопровождается выделением большого количества
тепла:
181
2 РНз + 4 02 = Р2О5 +3 Н20.
При гидролизе карбидов электроположительных элементов
образуются углеводороды. Например, при гидролизе СаС2 и
А14Сз получаются соответственно С2Н2 и СН4:
СаС2 + 2 Н2О = Са (ОН)2 + С2Н2|,
. А14Сз+ 12Н2О = 4А1 (ОН)3 + 3CH4f.
Силицид магния Mg2Si взаимодействует с кислотой с обра-
зованием силана SiH4 (аналога метана):
Mg2Si + 4 HCl = SiH4f + 2 MgCl2,
а также других кремневодородов, аналогичных гомологам ме-
тана.
Галогеноводороды и сероводород в водных растворах яв-
ляются кислотами и образуют соответствующие соли. Эти во-
дородные соединения могут быть получены действием кислот
на их соли. Наиболее часто для этих целей используют сер-
ную кислоту, так как она при комнатной температуре нелету-
ча, является сильной кислотой, а в промышленных условиях
играет роль и то, что это самая дешевая кислота.
При проведении таких реакций следует, однако, учитывать
восстановительные свойства водородных соединений. Покажем
это на примере галогеноводородов. В § 2 главы 7 мы отмеча-
ли, что чем сильнее окислительные свойства свободного гало-
гена, тем слабее восстановительные свойства образуемого им
элементарного иона. Сказанное относится и к галогеноводоро-
дам. Так, если свободный фтор является самым сильным окис-
лителем из галогенов, то фтороводород — самый слабый вос-
становитель из галогеноводородов.
При переходе от HF к НС1 мы наблюдаем появление за-
метных, хотя пока еще слабо выраженных восстановительных
свойств. Действительно, хлороводород можно окислить до сво-
бодного хлора действием очень сильных окислителей, таких как
МпО2, псрманганат-ион или дихромат-ион в кислой среде.
Именно так и получают хлор в лаборатории. Однако даже та-
кой сравнительно сильный окислитель, как концентрированная
серная кислота, не окисляет хлороводород. Поэтому и можно
получать НС1, действуя концентрированной серной кислотой
на хлорид, натрия даже при нагревании — эта реакция лежит
в основе одного из промышленных способов получения соляной
кислоты.
Если мы. попробуем получать бромоводород таким же спо-
собом— действуя концентрированной серной кислотой на бро-
мид натрия, то помимо реакции обмена будет протекать по-
бочная реакция окисления бромоводорода серной кислотой
2 НВг + H2SO4 = Br2 + SO2 + 2 Н2О,
,182
и, таким образом, часть бромоводорода окислится серной кис-
лотой до свободного брома. В результате полученный бромо-
водород будет сильно загрязнен свободным бромом. Следова-
тельно, восстановительные свойства НВг значительно сильнее
восстановительных свойств НС1.
При реакции иодида натрия с серной кислотой вытесняемый
HI тут же почти полностью окисляется до свободного иода,
а серная кислота при этом может восстанавливаться даже до
сероводорода. Значит, иодоводород проявляет свойства еще бо-
лее сильного восстановителя, чем остальные галогеноводо-
роды.
Усиление восстановительных свойств летучих водородных
соединений в подгруппах по мере увеличения порядкового но-
мера элемента является общей закономерностью для всех глав-
ных подгрупп. Так, сероводород — намного более сильный вос-
становитель, чем вода. Именно вследствие его восстановитель-
ных свойств нельзя получать сероводород действием концент-
рированной серной кислоты на сульфиды. Например, при дей-
ствии этой кислоты на сульфид железа (II) образуются сер-
нистый газ и свободная сера. Поэтому для получения серово-
дорода исходя из сульфида железа (II) используют соляную
кислоту:
FeS + 2 НС1 = H2Sf + FeCl2.
Вряд ли требует объяснения, что нельзя получить HI, НВг
или HsS вытеснением их из солей столь сильным окислителем,
как азотная кислота.
Химическая природа водных растворов летучих водородных
соединений различна. Галогеноводороды в водных растворах
диссоциируют как кислоты, хотя сами по себе (например, жид-
кие НС1 и НВг) практически не проводят ток (являются по-
тенциальными электролитами). Следует, однако, помнить, что
хлороводородная, бромоводородная и иодоводородная кисло-
ты— сильные, а фтороводородная — значительно более слабая.
Сероводород и его аналоги ведут себя в водном растворе как
слабые кислоты.
Аммиак в водном растворе проявляет свойства основания.
При его растворении в воде устанавливается сложное равно-
весие: наибольшая часть молекул аммиака находится в раство-
ре просто в виде гидратированных молекул NH3-aq (символ
«aq» означает, что число молекул воды, образующих гидраты
с молекулой аммиака, неопределенно); одновременно в равно-
весии участвуют гидроксид аммония и ионы, на которые он
диссоциирует:
NH3 (газ) + хН2О NH3 • aq NH4OH NH4+ + ОН-.
Если прибавить твердую щелочь к концентрированному водно-
му раствору аммиака, то из него будет выделяться газообраз-
183
ный аммиак — в этом состоит один из часто применяемых в ла-
боратории способов получения газообразного аммиака. При-
чину выделения аммиака легко понять, вспомнив, как влияют
на химическое равновесие различные факторы. В данном случае
введение щелочи резко повышает концентрацию ионов ОН~
(ведь сам аммиак создает в водном растворе невысокую кон-
центрацию этих ионов). Увеличение концентрации ионов ОН~
смещает равновесие влево, увеличивая концентрацию недиссо-
циированных молекул NH4OH, а следовательно, и концентрацию
молекул аммиака, в результате чего из раствора выделяется
газообразный аммиак.
При рассмотрении донорно-акцепторной связи мы уже го-
ворили о том, что ион аммония образуется за счет присоеди-
нения иона Н+ к молекуле NH3. В водном растворе равнове-
сие диссоциации воды Н2О^Н++ОН- смещается вправо за
счет того, что какое-то количество ионов водорода участвует
в образовании иона NH^, вследствие чего в растворе аммиака
увеличивается концентрация ионов ОН-, т. е. он делается ще-
лочным. л'
Молекула фосфина РНз также способна присоединить ион
водорода, при этом образуется ион фосфония PHt- Известен
ряд солей фосфония с сильными кислотами, хотя они гораздо
менее прочны, чем соответствующие соли аммония.
§ 2. КИСЛОРОДНЫЕ СОЕДИНЕНИЯ
Общая характеристика
При последовательном переходе от элементов главной под-
группы I группы к элементам главной подгруппы VII группы
химическая связь в оксидах изменяется от ионной (в оксидах
щелочных и щелочноземельных металлов) до типично кова-
лентной (в оксидах галогенов, серы, азота, углерода), а кри-
сталлические решетки — от типично координационных до мо-
лекулярных. Поэтому оксиды элементов главных подгрупп,
расположенных в правой части периодической таблицы, особен-
но вверху, являются при обычных условиях либо газами, либо
довольно летучими твердыми и жидкими веществами, в то
время как оксиды элементов главных подгрупп I, II, III и, если
не считать углерод, IV групп — нелетучие при обычных усло-
виях твердые вещества, часто весьма тугоплавкие (например,
оксид алюминия).
Что касается кислотно-основных свойств оксидов и их гид-
ратов, то при движении в периодах вправо ослабевают основ-
ные свойства оксидов и гидроксидов и усиливаются кислотные.
Иллюстрацией могут служить высшие оксиды и соответствую-
щие им гидроксиды элементов третьего периода:
184
Na2O — основной оксид
MgO — » >
А12О3 — амфотерный оксид
SiO2 — кислотный оксид
Р2О6 — « «
SO3 — « <
С12О7 — « «
NaOH — сильное основание
Mg(OH)2— слабое основание
А1 (ОН),, — амфотерный гидроксид'
H«SiO3 — слабая кислота
Н3РО4‘ - »
HoSOt — сильная кислота
НС1О4 -
Таким образом мы имеем наглядный переход от щелочи
(NaOH) к одной из самых сильных кислот (НСЮ4).
При движении вниз в главных подгруппах усиливаются ос-
новные свойства оксидов и гидроксидов и ослабевают кислот-
ные. Например, азот в степени окисления +5 дает сильную
кислоту — азотную, фосфор — более слабую фосфорную кис-
лоту; оксид бора — кислотный оксид, в то время как оксид
алюминия— амфотерный.
Если один элемент образует несколько оксидов, то основ-
ные свойства сильнее у низших оксидов и их гидратов, а кис-
лотные — у высших.
Прочность оксидов (количественно характеризуемая энер-
гетическим эффектом реакции их образования) в конце каж-
дого периода уменьшается, и в итоге почти все оксиды гало-
генов экзотермически разлагаются до простых веществ, т. е.
это непрочные соединения, легко отдающие кислород.
Равно как уменьшается устойчивость производных с выс-
шими степенями окисления в главных подгруппах от легких
элементов к тяжелым, точно так же высшие оксиды тяжелых’
элементов тоже оказываются сравнительно непрочными и лег-
ко отдают избыток (по сравнению с низшими оксидами) кис-
лорода. Поэтому как все кислородные соединения галогенов,,
так и высшие оксиды самых тяжелых элементов главных под-
групп оказываются сильными окислителями.
Изменение прочности высших оксидов и их окислительных
свойств в главных подгруппах хорошо прослеживается на при-
мере IV группы. В присутствии избытка кислорода даже при
довольно высоких температурах единственными устойчивыми
оксидами углерода и кремния являются соответственно СОг и
SiO2. Чтобы восстановить эти два соединения, требуются силь-
ные восстановители (например, магний) при высокой темпера-
туре. Что же касается РЬО2, то это настолько сильный окисли-
тель, что в азотнокислом растворе он окисляет Мп2+ до МпОГ.
Именно сильные окислительные свойства высшего оксида свин-
ца используются в свинцовом аккумуляторе.
Далее мы рассмотрим некоторые частные аспекты химии,
кислородных соединений элементов главных подгрупп, требую-
щие, на наш взгляд, более подробного объяснения. Начнем с
водорода.
1853
Пероксид водорода
Помимо воды водород образует еще одно кислородное сое-
динение, которое имеет широкое практическое применение; Это
пероксид, или перекись, водорода. Строение молекулы Н!2О2
изображено на рис. 11, для сравнения рядом изображено строе-
ние молекулы воды.
Рис. 11. Строение молекул Н2О и Н2О2.
Пероксид водорода — малоустойчивое вещество. При ком-
натной температуре реакция его разложения почти замороже-
на и протекает с очень малой скоростью. Поэтому пероксид
водорода можно транспортировать и хранить длительное вре-
мя. Однако если к нему добавить катализатор, например ди-
оксид марганца, то процесс размораживается и пойдет с боль-
шой скоростью. Катализаторами, способствующими разложе-
нию пероксида водорода, могут оказаться случайно попавшие
в него вещества. Особенно опасен в этом отношении концент-
рированный пероксид водорода, который может разлагаться
со взрывом.
Почему неустойчив пероксид водорода? Для ответа на этот
вопрос обратимся к энергетике кислородных соединений водо-
рода. Об устойчивости или неустойчивости какого-то соедине-
ния можно говорить лишь при условии, если уточнить при
этом, относительно какого другого состояния, какого другого
сочетания тех же химических элементов оно устойчиво или не-
устойчиво.
Сравним реакции разложения воды и пероксида водорода
до простых веществ:
Н2О (жидк.)Д- 286 кДж — Н2 (газ)+ 1/2 О2 (газ),
Н2О2 (жидк.)Д- 188кДж= Н2 (газ)Д- О2 (газ).
Как мы видим, разложение пероксида водорода до газообраз-
186
ных водорода и кислорода требует очень большой затраты
энергии, хотя и несколько меньшей, чем разложение воды до
тех же конечных продуктов. На основании этого при комнат-
ной температуре разложение его до Н2 и О2 следует считать
маловероятным, т. е. относительно превращения в смесь Н2 и
О2 пероксид водорода при комнатной температуре должен быть
вполне устойчив-
Но возможна и другая реакция, энергетический эффект ко-
торой читатель сможет рассчитать самостоятельно (образец
такого расчета приведен в § 2 главы 2):
Н2О2 (жидк.) — 98 кДж = Н2О (жидк.)ф- 1/2 О2 (газ).
Как мы видим, эта реакция экзотермическая и вдобавок сопро-
вождается выделением 1/2 моль газа, т. е. два фактора делают
ее осуществимой.
Таким образом, пероксид водорода неустойчив при комнат-
ной температуре только потому, что атомы водорода и кисло-
рода могут образовать энергетически гораздо более выгодное
сочетание—-смесь воды и кислорода. Разобранный пример с
пероксидом водорода имеет общее значение. Химические свой-
ства некоторого соединения можно понять, лишь рассматривая
одновременно с ним другие вещества, в которые данное соеди-
нение может превратиться. Химическая реакция—это всегда
результат конкуренции между различными веществами.
Пероксид водорода проявляет как окислительные, так и
восстановительные свойства. В реакции с KJ
Н2О2 + H2SO4+2 KI = I2 + K2SO4 + 2 H2O
пероксид водорода — окислитель, а в реакции с КМпО4
5Н2О2 + 3 H2SO4 + 2 KMnO4=K2SO4 + 2 MnSO4 + 8 Н2О + 5 O2f
— восстановитель. Но чаще всего Н2О2 выступает в роли окис-
лителя, восстановительные же свойства проявляются в реак-
циях с наиболее сильными окислителями, такими как перман-
ганат- или дихромат-ион в кислой среде.
Процессы, в которых пероксид водорода обнаруживает окис-
лительные свойства, можно представить следующей схемой:
Н-0 Н\
| —> O-J-O (на окисление)
Н О н/
Это хорошо видно на примере реакции
PbS + 4 Н2О2 = PbSO4 + 4 Н2О.
Процессы, в которых пероксид водорода проявляет восстано-
вительные свойства, выражает схема:
Н-0 О
' —> I! -|- 2Н (на восстановление),
Н-О О
187
лежащая в основе, например, взаимодействия пероксида водо-
рода с таким сильным окислителем, как озон:
Оз -f- Н2О2 = Н2О -|- 2
Для нахождении ионно-молекулярным методом коэффициентов в реак-
циях с участием пероксида водорода записывают следующие полуреакции
его окисления и восстановления:
Н2О2 — восстановитель:
щелочная среда: Н2О2 + 2 ОН- — 2е~ = О2 | -г 2Н2О,
кислая среда: Н3О2—2е-=О»| + 2 Н+;
Н2О2 — окислитель:
щелочная среда: Н2О2 + 2е~ = 2 ОН-,
кислая среда: Н2О2 + 2 И4 + 2е~ = 2 Н2О.
Кислородные соединения щелочных
и щелочноземельных металлов
Абитуриенты часто совершают ошибку, когда говорят, что
при горении щелочных металлов на воздухе образуются окси-
ды типа Ме2О (где Me — щелочной металл). Это верно лишь
для лития. Что же касается остальных щелочных металлов, то,
хотя оксиды типа Ме2О для них и существуют, при горении
щелочные металлы присоединяют большее количество кисло-
рода. Для получения же оксидов типа Ме2О приходится ис-
пользовать косвенные методы.
Натрий сгорает в кислороде с образованием главным об-
разом пероксида натрия (по русской номенклатуре — перекись
натрия) Na2O2, а калий — с образованием супероксида калия
(по русской номенклатуре — надперекись калия) КО2. Иссле-
дование структуры Na2O2 и КО2 показало, что в кристалличе-
ских решетках этих соединений имеются ионы щелочного, ме-
талла и соответственно ионы О2~ и ОГ.
Щелочноземельные металлы также образуют пероксиды,,
прочность которых повышается от кальция к барию. Если пер-
оксид стронция и тем более кальция удается получить лишь при
повышенном давлении кислорода, то пероксид бария ВаО2
получают путем нагревания ВаО в токе воздуха до 500 °C. При
более высоких температурах равновесное давление кислорода
для реакции 2 ВаО + О2=2 ВаО2 превышает атмосферное, по-
этому при горении металлического бария на воздухе, когда тем-
пература реакционной системы очень высока, присоединение
кислорода к барию доходит лишь до ВаО.
Наибольшее практическое значение имеют пероксиды натрия
и бария. Пероксид натрия является сильным окислителем. На-
пример, его взаимодействие с безводной («ледяной») уксусной
кислотой сопровождается вспышкой. При взаимодействии пе-
1ЗД
роксида натрия с водой образуется щелочь и выделяется кис-
лород:
2 Na2O2 + 2 Н2О = 4 NaOH + О2|.
Пероксид натрия часто используется как окислитель в неорга-
ническом и органическом синтезе.
При взаимодействии с кислотами пероксиды металлов дают
пероксид водорода, на основании чего их следует рассматривать
как производные Н2О2. Действие пероксида бария на серную
кислоту используют для получения Н2О2.
Оксид углерода (II)
Рассмотрим весьма важную для топливной энергетики и
потому хорошо изученную реакцию получения оксида углеро-
да (II), или окиси углерода:
С (тв.)+ СО2 (газ)+ 172 кДж =₽* 2 СО (газ).
Так как эта реакция эндотермическая, ее протеканию должно
способствовать повышение температуры; напротив, при низких
температурах равновесие должно быть смещено в сторону раз-
ложения СО на углерод и углекислый газ (реакция диспропор-
ционирования) .
При общем давлении, равном атмосферному, и при темпера-
турах ниже ~400 °C равновесие практически нацело сдвинуто
в сторону диспропорционирования СО, а выше ~1000 °C— в
сторону образования СО. В интервале 400—1000 °C прямая и
обратная реакции в заметной мере конкурируют. Если взять
либо чистый СО, либо СО2 в контакте с таким же молярным
количеством угля и выдержать их при какой-либо температу-
ре в этом интервале, то образуется некая равновесная смесь
СО, СО2 и угля. Около 700 °C концентрации СО и СО2 в газо-
вой смеси, находящейся в равновесии с твердым углеродом,
будут примерно одинаковыми. '
Когда СО, полученный при высокой температуре, охлажда-
ется достаточно медленно, равновесие в системе успевает уста-
новиться, давление СО по мере понижения температуры пони-
жается, и около 400 °C оксид углерода (II) диспропорционирует
практически нацело. Однако ниже ~300 °C реакция диспро-
порционирования СО идет очень медленно, а при комнатной
температуре ее скорость и совсем ничтожна. Поэтому, если СО,
полученный при высокой температуре, резко охладить, удается
сохранить его при комнатной температуре в метастабильном,
замороженном, состоянии. Так поступают при промышленном
получении СО. По этой же причине СО («угарный газ») попа-
дает в помещения, если перекрыть дымоход в печи, в которой
находятся еще очень горячие угли.
Когда же «замороженный» СО медленно нагревается, то,
189
начиная с температуры около 300 °C, реакция диспропорциони-
рования размораживается, и он постепенно разлагается.
За счет большого энергетического эффекта реакции окисле-
ния СО последний является хорошим восстановителем, что ши-
роко используется, например, в металлургии. Восстановитель-
ная способность СО в высокотемпературных реакциях сравни-
ма с восстановительной способностью водорода, что хорошо
видно из приведенных реакций:
СО (газ) -|- 1/2 О2 (газ) — 283 кДж — СО2 (газ),
Н2 (газ)+ 1/2 О2 (газ) — 242 кДж — Н2О (газ).
Действительно, энергетические эффекты этих реакций близки,
и обе они сопровождаются одинаковым изменением объема
(при одинаковых условиях).
Сравнивать восстановительные свойства СО и Н2 удобно и
на примере уже встречавшейся нам реакции
СО (газ) + Н2О (газ) — 41 кДж Н2 (газ) + СО2 (газ).
Эту реакцию можно рассматривать как конкуренцию водоро-
да и СО за кислород: слева направо СО отнимает кислород от
воды, справа налево водород отнимает кислород от углекисло-
го газа. При температуре около 800 °C константа равновесия
для этой реакции равна единице, т. е. восстановительные свой-
ства СО и Н2 можно считать одинаковыми. При температуре
ниже 800 °C более сильным восстановителем оказывается СО
(равновесие смещается в сторону экзотермической реакции),
выше этой температуры — водород (равновесие смещается в
сторону эндотермической реакции).
Большой экзотермической эффект реакции окисления СО
до СО2 позволяет также использовать его как удобное газо-
образное топливо. На практике чаще всего применяют не чи-
стый СО, а различные газовые смеси, содержащие СО, напри-
мер генераторный газ, получаемый пропусканием воздуха через
слой раскаленного угля в шахтной печи. В нижней части печи
идет реакция
С(тв.) + О2 (газ) — 394 кДж = СО2 (газ).
Образовавшийся углекислый газ проходит через слой угля,
окисляя его до моноксида углерода:
С (тв.) СО2 (газ) + 172 кДж = 2 СО (газ).
Первая реакция экзотермическая, вторая — эндотермическая.
В целом процесс экзотермический, поэтому в печи поддержи-
вается необходимая температура. Если в печь продувается воз-
дух, полученный газ содержит, естественно, азот. При продува-
нии кислорода основную часть полученного газа составляет
СО, остальную — примеси за счет веществ, содержащихся в
коксе, и СО2.
190
При действии на раскаленный уголь водяного пара
С (тв.)+ Н2О (газ)+ 131 кДж = СО (газ) 4- Н2 (газ)
получают так называемый водяной газ, имеющий большую
калорийность. Поскольку эта реакция эндотермическая, через
печь поочередно пропускают водяной пар (температура угля
понижается) и воздух (температура снова повышается). Обра-
зующиеся газы можно собирать отдельно (генераторный и во-
дяной газы) или вместе (так называемый смешанный газ). Ге-
нераторный, водяной и смешанный газы используются не толь-
ко как топливо, но и для различных синтезов, а также для по-
лучения водорода (водяной и смешанный газ).
Характерной чертой химии оксида углерода (II) является
склонность к реакциям присоединения. Так, при пропускании
смеси СО с хлором над активированным углем при небольшом
нагревании образуется фосген СОС12:
СО “f- С12 = СОС12.
Взаимодействие СО с водородом при температуре 250—
350 °C в присутствии катализатора (оксид цинка со следами
марганца в качестве промотора) приводит к образованию ме-
танола:
СО+ 2 Н2 = СН3ОН.
В других условиях получаются метан и другие предельные угле-
водороды, что делает СО потенциальным сырьем для произ-
водства синтетических моторных топлив.
Оксид углерода (II) может выступать в роли лиганда в комплексных
соединениях. Присоединяясь к гемоглобину крови, моноксид углерода тем
самым лишает его способности переносить кислород — с этим связано ток-
сическое действие СО на человека и тех животных, в крови которых содер-
жится гемоглобин.
При небольшом нагревании СО реагирует с некоторыми переходными
металлами, образуя так называемые карбонилы — соединения с невысокой
температурой плавления, в которых несколько молекул СО присоединены
к атому металла через углерод. Самый прочный нз них — тетракарбонил ни-
келя Ni(CO)4, используемый в промышленном масштабе для очистки никеля
от примесей.
Кислородные соединения кремния
Переходя от углерода к его аналогу — кремнию, мы обна-
руживаем резкое отличие в свойствах оксидов. Если высший
оксид углерода при атмосферном давлении находится в газо-
образном состоянии при температурах выше —78 °C, то оксид
кремния, напротив, представляет собой твердое при комнатной
температуре вещество с температурой плавления выше 1700 °C.
Столь резкое различие в поведении этих оксидов связано с об-
щей тенденцией в изменении характера структур оксидов по
периодической системе: по мере уменьшения электроотрица-
191
тельности элементов структура их оксидов в твердом состоянии
изменяется от молекулярной к атомной и затем к ионной.
Оксид кремния может существовать в разных кристалличе-
ских модификациях, из которых наиболее известен кварц, ча-
сто встречающийся в природе; если при этом он образует круп-
ные кристаллы, его называют горным хрусталем. В основе
структуры всех кристаллических модификаций SiO2 лежат
• кремний , О кислород
Рис. 12. Кремнекислородные тет-
раэдры.
кремнекислородные тетраэдры,
т. е. группировки атомов SiO«,
в которых атом кремния рас-
положен в центре, а четыре
атома кислорода — в верши-
нах тетраэдра (рис. 12). Кварц
является примером оптически
активных кристаллов, которые
вращают плоскость поляриза-
ции проходящего через них
света.
В случае СО2 мы имеем де-
ло практически с солями толь-
ко одной кислоты — угольной.
Кремниевому ангидриду соот-
ветствует большое число кис-
лот общей формулы хН2ОХ
XpSiOo. Известны производ-
ные кислот состава H2O-SiO2,
или H2SiOs (кремниевая),
H2O-2SiO2, или H2Si2O5 (дикремниевая), 2H2O-SiO2, или
H«SiO4 (ортокремниевая), а также 3H2O-2SiO2, 4H2O-SiO2.
Кислоты, отвечающие у>1, называются поликремниевыми.
При замещении водорода кремниевых кислот полностью или
частично на металл получаются простые силикаты. Как и в
структуре оксида кремния, в основе структуры силикатов ле-
жат кремнекислородные тетраэдры, которые могут разным спо-
собом соединяться через кислород. Структуры нескольких сили-
катных анионов показаны на рис. 13.
Разнообразие и сложность состава и строения природных
и искусственных силикатов связаны также с легкостью замеще-
ния в них одних катионов другими, в результате чего обра-
зуются различные сложные силикаты. Например, образцы рас-
пространенного минерала оливина, взятые из разных пород,
имеют различный состав за счет замещения некоторого коли-
чества магния в исходной формуле Mg2SiO4 на двухвалентное
железо.
Важным для строения силикатов является то, что атомы
кремния могут замещаться на близкие по размеру атомы алю-
миния. Поскольку алюминий трехвалентен, а кремний четы-
рехвалентен, то при замене каждого атома кремния на атом
192
алюминия в структуру должен быть введен одновалентный ка-
тион, например калия или натрия, или чтобы какие-то катионы
замещались на другие катионы с большей валентностью. Так
• кремний , о кислород
Рис. 13. Структуры некоторых силикатных
анионов.
образуются разнообразные алюмосиликаты. Названия и фор-
мулы некоторых из них приведены ниже:
(ортоклаз
Полевые шпаты •!альбит
(анортит
Слюды
К,О А1„О3 -6S1O.
Na2O А'1.,6., • GSiOo
СаО-АПб., 2SiO2
мусковит К3О ЗА12О3 • 6SiO2 2Н2О
биотит К2О • 6 ре) О-Al2O3-6SiO2-2H2O
Цеолиты
Тальк
Нефелин
{анальцит
натролит
томсонит
Na2O • А12Оз • 4SiO2 • 2Н.О
ха2О • А12О3 • 3SiO2 2Н»О
Na2O • 4СаО • 5А12О3- I0SiO2 • I2H..O
3MgO • 4SiO2 • Н2О
Na2O • А12О3 2SiO3
Цеолиты — одна из разновидностей алюмосиликатов — име-
ют рыхлую кристаллическую структуру, представляющую со-
бой сетку из соединенных через атомы кислорода кремнекисло-
родных тетраэдров. В пустотах этой сетки расположены моле-
кулы воды и катионы металлов. Благодаря такой структуре в
цеолитах особенно легко происходит замена ионов, что позво-
ляет использовать их (как природные, так и искусственные —
пермутиты) в качестве ионообменных веществ. Последние ши-
роко применяются в современной технологии, например для
удаления из воды ионов металлов.
При обезвоживании некоторых цеолитов в их структуре образуются
узкие сквозные каналы, в которые могут внедряться молекулы некоторых
веществ, например СО2, Н2О, NH3, а также органические молекулы. В ва-
13 Семенов И. Н.
193
кууме или при нагревания цеолиты легко выделяют поглощенные вещества,
сохраняя при этом свою структуру практически неизменной. Так как каналы
имеют в узкой части определенные размеры — обычно от 0,3 до 1,2 нм в.
диаметре, в структуру цеолита могут войти не всякие молекулы, а только
те, размер которых не больше этой величины. Это позволяет использовать
цеолиты в качестве молекулярных сит, которые производят как бы сорти-
ровку молекул по их размерам. Так, с помощью молекулярных сит удается-
разделить изомеры углеводорода одного и того же состава, но с нормаль-
ной и разветвленной цепью. Молекулярное сито с диаметром канала 0,35 нм
поглощает азот, но не задерживает аргон.
Цеолиты для технических целей чаще всего получают искусственным пу-
тем. Их широко применяют для очистки и осушки газов и жидкостей, для
избирательного выделения некоторых компонентов из смесей, как носители
для катализаторов.
Некоторые другие алюмосиликаты, например бентонит (глина со слои-
стой структурой) Н2О • АЬОз • (3—4)SiOj, также способны поглощать
значительные количества воды и других веществ. Это позволяет использо-
вать бентонит, например, в технологических процессах очистки нефтепро-
дуктов.
В природе под действием воды и углекислого газа в соче-
тании с другими воздействиями происходит сложный процесс
физического и химического разрушения силикатов, в резуль-
тате которого образуются такие продукты, как кварцевый пе-
сок и каолин. Химический процесс выветривания на примере
алюмосиликата ортоклаза может быть выражен уравнением
2 KAlSi3O8 + 2 Н2О + СО2 = К2СО3 + H4Al2Si2O9 + 4 SiO2.
ортоклаз каолин кварц
Как сам оксид кремния, так и многие природные и искус-
ственные силикаты могут быть получены в стеклообразном со-
стоянии. При рассмотрении кристаллических решеток отмеча-
лось, что для кристаллического состояния характерно наличие
как ближнего, так и дальнего порядка размещения частиц в.
пространстве. В веществе, находящемся в стеклообразном со-
стоянии, отсутствует дальний порядок размещения частиц, од-
нако в какой-то степени сохраняется ближний порядок. Так, в
стеклообразном оксиде кремния наличие ближнего порядка
выражается в том, что в нем, как и в кристалле, имеются крем-
некислородные тетраэдры, правда, иногда искаженные, одна-
ко взаимная ориентация этих кремнекислородных тетраэдров
может быть разной.
Различия между кристаллической и стеклообразной струк-
турами оксида кремния видны на рис. 14 (изображена только-
часть структуры, образующая сетку из атомов, находящихся
примерно на одной поверхности; атомы кислорода, связанные
с атомами кремния и выступающие за пределы этой сетки, на
рисунке не показаны).
Отсутствие дальнего порядка приводит к тому, что в про-
тивоположность кристаллическому веществу стекло изотропно,
т. е. его свойства, измеренные в разных направлениях, одина-
ковы. Свойства кристаллического твердого тела скачкообразно-
194
изменяются при температуре плавления, поскольку при этой
температуре происходит разрушение дальнего порядка. В стек-
лообразном теле нет дальнего порядка, и переход к свойствам
жидкости происходит в широком интервале температур. Имен-
но поэтому у стекла отсутствует температура плавления, и
вместо нее используют другую характеристику — температу-
ру размягчения. Это температура, при которой стекло начинает
в заметной степени подвергаться пластической деформации.
Естественно, что температуру размягчения можно назвать лишь
приблизительно.
• кремний ? О кислород
Рис. 14. Структура кристаллического и стеклообразного оксида кремния.
Стеклообразное состояние возникает тогда, когда при бы-
стром охлаждении вязкого расплава упорядочение структу-
ры — образование дальнего порядка, требующее значительной
перегруппировки атомов, не успевает совершиться. Так как при
дальнейшем понижении температуры вязкость еще более воз-
растает, неупорядоченное стеклообразное состояние сохраня-
ется неопределенно долгое время. Прозрачность стекла, благо-
даря которой оно находит столь широкое применение, связана
именно с тем, что при затвердевании его не происходит кри-
сталлизации. Если бы стекло состояло из отдельных достаточ-
но крупных кристаллов, на поверхности раздела между ними
происходило бы отражение света, и стекло потеряло бы про-
зрачность.
Стекло — это вещество, находящееся в неравновесном со-
стоянии. Поэтому, если длительное время нагревать его при
такой температуре, при которой составляющие его структурные
элементы приобретают некоторую подвижность, но которая ле-
жит ниже температуры плавления соответствующего кристал-
лического вещества, может произойти самопроизвольная кри-
13* 195
сталлизациястекла— расстекловывание. Как показывает изу-
чение древних стеклянных изделий, расстекловывание медлен-
но протекает и при обычной температуре; по-видимому, этому
способствует присутствие воды.
Производя кристаллизацию стекла в контролируемых условиях таким
образом, чтобы образовались кристаллы, спаянные стеклом, получают мате-
риалы, сочетающие полезные свойства как стеклообразного, так и кристал-
лического состояния. Такие материалы называются ситаллами. Последнее
время в технике к ним проявляется большой интерес. Ситаллы прочны и хи-
мически стойки, что позволяет использовать их для трубопроводов и других
деталей аппаратуры химической промышленности. Некоторые из них обла-
дают высокими диэлектрическими свойствами и используются для изготов-
ления изоляторов. Применение ряда ситаллов связано с другим ценным свой-
ством— жаростойкостью. Шлакоситаллы, получаемые на основе шлаков
металлургических производств, являются хорошим строительным материа-
лом. Фотоситаллы, содержащие соединения меди, серебра и золота, обла-
дают светочувствительностью, причем изображение в них может быть полу-
чено не только на поверхности, но и в объеме.
Обычное (так называемое «оконное») стекло представляет
собой смесь силикатов примерного состава Na2O-CaO-6SiO2.
Его получают сплавлением кварцевого песка, известняка и
<соды:
Na2CO3-j-CaCO34-6 SiO2=Na2SiO34-CaSiO3-|-4 SiO2+2 СО2.
В высокотемпературных процессах взаимное вытеснение кислот
или ангидридов подчинено следующему правилу: менее лету-
чая кислота или ангидрид вытесняет более летучую кислоту
или ангидрид, поскольку при этом возрастает число молей га-
за. Поэтому в противоположность водным растворам, где вза-
имное вытеснение кислот определяется их силой как электро-
литов и где, действуя углекислым газом на раствор соли крем-
ниевой кислоты, можно вытеснить ее как более слабую, чем
угольная
Na2SiO3 ~f- СО2 Н2О = Na2CO3 H2SiO3^-,
при сплавлении карбонатов кальция и натрия с оксидом крем-
ния последний вытесняет СО2 из карбонатов. Подобного рода
процессы взаимного вытеснения кислот и ангидридов при вы-
соких температурах имеют большое значение как в промыш-
ленности, так и в природе — в геохимических процессах.
При .достаточно высоких температурах оксид кремния мо-
жет вытеснять и серный ангидрид из сульфатов (SO3 при этом
•частично диссоциирует на SO2 и О2), например:
Na2SO4 SiO2 = Na2SiO3 -|-SO3 (SO2 1/2 O2).
Этот процесс позволяет при производстве стекла заменить со-
ду на более дешевый сульфат натрия. Если при этом добав-
лять уголь, одновременно происходит восстановление S (VI)
до S (IV), .что способствует основной реакции, так как суль-
196
фиты менее прочны, чем сульфаты, и вытеснить из них ангид-
рид легче. ;•
Поскольку обычное стекло — силикатная система, а крем-
ниевая кислота — слабая кислота, то при соприкосновении
стекла с водой, по крайней мере на его поверхности, должен
иметь место гидролиз. Действительно, если к растертому в по-
рошок стеклу прилить воду и добавить фенолфталеин, то
раствор окрашивается в малиновый цвет за счет того, что
вследствие гидролиза поверхностного слоя стекла, в раствор
переходят гидроксиды натрия и кальция.
В обычных условиях гидролиз стекла идет главным образом
при первом контакте с водой, а потом , кремниевые кислоты,
образующиеся при гидролизе, покрывают поверхность стекла
пленкой, защищающей его от дальнейшего действия воды. Од-
нако в тех случаях, когда по характеру работы в растворе не
должны присутствовать даже следы щелочи, пользоваться по-
судой из обычного стекла нельзя. Тогда используют более до-
рогое кварцевое стекло или плавленый кварц (стеклообразный
оксид кремния).
Кварцевое стекло имеет и другие преимущества- Перед обычным стеклом.
Так, одним из недостатков обычного стекла является то, что оно плохо-
переносит термические удары, т. е. резкие перепады температур. При рез-
ком охлаждении обычного стекла внешний слой его сжимается, в толще
стекла возникают большие механические напряжения, превышающие предел
прочности стекла, и оно разрушается. У кварцевого стекла коэффициент
термического расширения в несколько раз меньше, чем у обычного стекла,
поэтому оно выдерживает гораздо большие Перепады температур. Кроме
того, у кварцевого стекла значительно выше температура размягчения, по-
этому его используют для работы при высоких температурах. Другим цен-
ным свойством кварцевого стекла является прозрачность для ультрафиоле-
товых лучей.
Путем частичной замены оксида натрия, кальция или кремния Па оксиды
других элементов получают многочисленные специальные сорта стекол: лабо-
раторные тугоплавкие стекла содержат значительное количество В2О3; раз-
личные цветные стекла получают введением в стекло оксида хрома (III) (зе-
леное), соединений марганца (фиолетовое), коллоидного золота (рубиновое)
и т. д.; оптическое стекло с большим показателем преломления. содержит
оксид свинца. Некоторые сорта стекол разработаны с расчетом- на то, чтобы
в него можно было впаивать металл, что важно для изготовления электро-
вакуумных приборов. Для этого коэффициенты термического расширения
стекла и металла (чаще всего — молибден) должны быть близки, чтобы спай
не нарушался при нагревании.
Существуют стекла, содержащие вместо оксида кремния оксид бора или
другие оксиды. Можно приготовить также бескислородные стекла, содержа-
щие вместо кислорода серу или селен. Наконец, в стеклообразном состоя-
нии Можно получить многие вещества. Так, при быстром охлаждении водя-
ного пара до температур ниже —160 °C получают в стеклообразном со-
стоянии воду.
Оксиды азота
Переходя к азоту, мы наблюдаем резкое уменьшение устой-
чивости кислородных соединений. Для всех газообразных при
обычных условиях оксидов азота процесс образования оксида
197
из простых веществ эндотермический, причем наиболее эндо-
термический для NO. Тем не менее, когда воздух продувается
через электрическую дугу, образуется именно оксид азота (II).
Причина состоит в том, что реакция
N2 (газ) + О2 (газ) +181 кДж = 2 NO (газ)
не сопровождается изменением числа молей газа, в то время
как реакция образования из простых веществ любого другого
оксида азота связана с уменьшением числа молей газа, по-
скольку при этом из двухатомных молекул образовывались бы
молекулы с большим числом атомов (N2O, NOa и др.).
Эта реакция использовалась в одном из способов получе-
ния азотной кислоты, однако такой процесс требует большой
затраты энергии, а выход NO невелик (всего несколько процен-
тов), поэтому сейчас главную массу NO для производства
азотной кислоты получают другим путем — каталитическим
окислением аммиака.
В отсутствие катализатора аммиак горит в кислороде с об-
разованием азота и воды:
4 NH3 + 3 О2 = 2 N2 + 6 Н2О.
На поверхности катализатора из платины или ее сплава с пал-
ладием идет другая реакция:
4 NH3 4- 5 О2 = 4 NO 4- 6 Н2О.
Поскольку платина и ее сплавы катализируют также процесс
разложения NO на азот и кислород, стараются смесь аммиака
с воздухом пропустить через катализатор как можно быстрее.
Если контакт смеси с поверхностью катализатора длится не
более 10-4 секунды, то распад NO не успевает произойти.
Малая прочность оксидов азота есть следствие исключи-
тельной прочности молекулы N2: образование моля N2 из сво-
бодных атомов азота сопровождается выделением 945 кДж.
Поэтому, например, смесь 1 моль азота и 1 моль кислорода
при обычных условиях оказывается энергетически более вы-
годным состоянием, чем 2 моль NO.
Оксид серы (VI)
Получение серного ангидрида для производства серной кис-
лоты — еще один важный технологический процесс. Какие усло-
вия способствуют максимальному выходу SO3, легко показать,
используя принцип Ле Шателье. Реакция
2 SO2 (газ) 4- О2 (газ) — 197 кДж ++ 2 SO3 (газ)
экзотермическая, поэтому для смещения равновесия в сторону
максимального выхода серного ангидрида требуется возможно
более яизкая температура. Именно по этой причине при сжи-
138
гании серы, пирита FeS2 и других содержащих серу веществ
образуется SO2 лишь с небольшой примесью SO3: высокая
температура, при которой происходит горение этих веществ,
способствует смещению равновесия приведенной выше реакции
влево.
Однако при низких температурах эта реакция заморожена.
Чтобы разморозить ее, применяют катализатор, чаще всего
оксид ванадия V2O5 или некоторые другие соединения вана-
дия.
Поскольку реакция
Н2О 4- SO3 — 63 кДж = H2SO4
экзотермическая, казалось бы, серный ангидрид должен легко
поглощаться водой. Однако при пропускании через толщу во-
ды пузырьков газа, содержащего SO3, значительная доля сер-
ного ангидрида не поглощается водой. Дело в том, что при
комнатной и более высокой температуре вода имеет довольно
большое давление пара. Поэтому пузырек газа, проходя через
воду, быстро насыщается водяными парами, и в результате
значительная часть SO3 реагирует с водяными парами в объе-
ме пузырька раньше, чем достигнет его поверхности. Обра-
зуется туман из капелек серной кислоты, который очень плохо
поглощается водой.
Чтобы образование такого тумана не происходило, газ, со-
держащий серный ангидрид, пропускают не через воду, а через
достаточно концентрированную серную кислоту, давление водя-
ных паров над которой очень мало. При поглощении ангидри-
да кислотой образуются более сложные кислоты состава
H2O-xSO3, где Л‘>1. При х—2 образуется пиросерная кисло-
та H2S2O-. Серная кислота, содержащая избыток серного ан-
гидрида, носит техническое название «олеум». Его можно
разбавить водой до серной кислоты любой нужной концент-
рации.
Кислородные соединения хлора
Значение оксидов хлора невелико, зато кислородные кисло-
ты хлора и их соли имеют большое практическое применение.
Рассмотрим изменение окислительных свойств в ряду
НСЮ—НСЮг—НСЮз—НСЮ4. Казалось бы, при переходе от
НСЮ к НСЮ4 окислительные свойства должны усиливаться,
так как при этом повышается степень окисления хлора. В дей-
ствительности же самым сильным окислителем является хлорно-
ватистая кислота НСЮ, а наименее сильным — хлорная НСЮ4.
Вообще окислительные свойства кислородных кислот тем силь-
нее, чем легче они отдают кислород, т. е. чем менее они устой-
чивы. Хлорноватистая кислота менее устойчива, чем хлорная,
и легко распадается с промежуточным образованием атомар-
ного кислорода:
199
нею = HCI 4- о,
поэтому и является более сильным окислителем.
Окислительные свойства, устойчивость и сила кислородных
кислот хлора в зависимости от его степени окисления изменя-
ются следующим образом:
сила кислот, устойчивость
----------------------—>.
нею НС1О2 НС1О3 НС1О4
окислительные свойства
У солей этих кислот окислительные свойства изменяются в
том же направлении, т. е. при обычных условиях гипохлориты
являются очень сильными окислителями. Гипохлорит натрия
NaClO применяется как окислитель при отбеливании бумаги и
тканей, а также для дезинфекции наряду с хлорной известью.
Для водных растворов хлоратов (соли НСЮз) и перхлоратов
(соли НСЮ4) при обычных условиях окислительные свойства
не характерны, но при повышенных температурах они легко
отдают кислород и проявляют сильные окислительные свойст-
ва. Поэтому перхлораты являются важной составной частью
твердых ракетных топлив, а хлорат калия (бертолетова соль)
входит в состав некоторых пиротехнических смесей. Смесь
КСЮ3 с красным фосфором взрывается от удара. Взрывоопас-
ны также смеси хлоратов и перхлоратов с органическими ве-
ществами.
Глава 9
ОСОБЕННОСТИ ХИМИИ
ЭЛЕМЕНТОВ ПОБОЧНЫХ ПОДГРУПП
§ 1. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ
Особенности элементов побочных подгрупп, проявляющиеся
в характерных для них степенях окисления, в физических и
химических свойствах простых веществ и соединений, образо-
ванных этими элементами, обусловлены особенностями элект-
ронного строения их атомов.
В атомах элементов побочных подгрупп наряду с ns-электро-
нами, где п — порядковый номер уровня, имеются незавер-
шенные (за исключением элементов подгруппы цинка) конфи-
гурации (п—1) d-электронов. В случае элементов подгруппы ме-
ди хотя и может достигаться заполнение целиком d-подуровня,
но только за счет перехода на него электронов с s-подуровня
следующего уровня. Поэтому элементы дополнительных (по-
бочных) подгрупп называют еще d-элементами. Так как в ко-
200
роткой форме периодической таблицы d-элементы как бы за-
полняют переход от главной подгруппы II группы (s-элемен-
ты) к главной подгруппе III группы (p-элементы), то ряды из
десяти d-элементов называют также переходными элементами,
переходными металлами, элементами вставных декад, или
d-сериями (3d-cepHH, 4d-cepHH и Sd-серия).
Поскольку скандий и его аналоги во многих своих соедине-
ниях находятся в виде трехзарядных положительных ионов
(потеряв два s-электрона и единственный d-электрон предпос-
леднего уровня), а цинк и его аналоги имеют завершенный
d-подуровень, то наиболее характерными для переходных эле-
ментов особенностями обладают элементы от титана до меди
включительно, а также их аналоги — от циркония до серебра
и от гафния до золота. Эти элементы являются, таким обра-
зом, типичными переходными элементами. Ниже речь пойдет
прежде всего о них.
Следует обратить внимание на некоторое отличие в элек-
тронных конфигурациях атомов при переходе от одного эле-
мента к другому по подгруппе в главных и дополнительных
подгруппах. В главной подгруппе одной группы у всех элемен-
тов электронные конфигурации в невозбужденном состоянии
(в состоянии с минимальной энергией) подобны. Например,
С—ls22s22p2, Si—ls22s22p63s23p2, аналогично у германия, оло-
ва и свинца. У элементов же, стоящих в дополнительной под-
группе одной группы, электронные конфигурации атомов могут
несколько различаться. Например:
хром —... 4s> никель —... 4s2
молибден — ... 4<Д 5s1 палладий — ... 4rf10 —
вольфрам—... 5d4 6s2 платина —... 5rf9 6s1
Как мы видим, у хрома, молибдена и платины на внешнем
s-подуровне на один электрон меньше, чем у большинства
переходных элементов, а у палладия вообще отсутствуют внеш-
ние s-электроны. Такие переходы электронов связаны с близо-
стью энергий ns- и (п—1)d-подуровней (строго говоря, речь
идет не об энергии одного электрона на том или ином подуров-
не, а об энергии всей системы, всех электронов в поле ядра).
Благодаря этому d-электроны наряду с s-электронами могут
участвовать в образовании химической связи разных типов.
Поэтому свойства как простых веществ, так и соединений, об-
разуемых переходными элементами, определяются и s-, и
d-электронами. Кроме того, благодаря близости энергий этих
электронов формальное различие в конфигурациях внешних
электронов у некоторых переходных элементов, стоящих в од-
ной группе, не приводит к большой разнице в химическом по-
ведении этих элементов, и они являются полными аналогами.
Насколько схожи между собой элементы главной и побоч-
ной подгрупп одной группы? В качестве примера сравним про-
201
изводные марганца и хлора (два элемента, проявляющие ши-
рокий набор степеней окисления) в низших и высших степенях
•окисления.
Низший оксид хлора СЬО при комнатной температуре на-
.ходится в газообразном состоянии, с водой образует хлорнова-
тистую кислоту НСЮ. Как сам оксид, так и кислота являются
сильными окислителями: при соприкосновении СЬО с восста-
новителями может произойти взрыв. Жидкий СЬО (т. кип.
+ 3°С) может взорваться просто при переливании из одного
сосуда в другой, что свидетельствует об очень низкой устой-
чивости этого вещества.
Напротив, низший оксид марганца МпО— при обычных
условиях кристаллическое нелетучее вещество, термически
устойчивое, чаще всего выступающее в роли восстановителя, с
преимущественно основными свойствами. Этому оксиду соот-
ветствует основание, восстановительные свойства которого про-
являются в том, что оно окисляется на воздухе. Зная, как за-
висят свойства оксидов одного элемента от степени окисления,
можно предсказать свойства гипотетического оксида МпгО:
это должен быть основной оксид и еще более сильный восста-
новитель, чем МпО. Таким образом, свойства низших оксидов
марганца и хлора резко различаются.
Что же касается высших оксидов марганца и хлора —
Мп2О7 и С12О7, то оба они при комнатной температуре жидко-
сти, очень неустойчивы — легко взрываются при нагревании,
являются ангидридами сильных кислот — НМпСЬ и НСЮ«.
Оба оксида и соответствующие им кислоты проявляют свойст-
ва сильных окислителей. Как мы видим, в случае высших окси-
дов аналогия между хлором и марганцем проявляется весьма
явно.
Если добавить к тому же, что в виде простых веществ газо-
образный при обычных условиях хлор и металлический марга-
нец совершенно непохожи один на другой, то можно утверж-
дать: аналогия между хлором и марганцем проявляется тем
-сильнее, чем выше степень окисления этих элементов. Это об-
щая закономерность, наблюдаемая при сравнении элементов
главной и побочной подгрупп одной группы.
Строгое объяснение этой закономерности выходит за
рамки школьного курса химии. Не очень строгое объяснение,
ставящее целью лишь подчеркнуть сходство и различие элек-
тронной структуры атомов хлора и марганца в разных валент-
ных состояниях, состоит в следующем. Электронная конфигура-
ция свободного атома марганца—ls22s22p63s23p63d54s2, свобод-
ного атома хлора — /s22s22p63s23p5. Если хлор и марганец про-
являют невысокие степени окисления, то они используют для
•образования химических связей только часть валентных элек-
тронов. В случае марганца используются в первую очередь два
внешних s-электрона, а на атоме остается какое-то число d-элек-
:202
тронов; в случае же хлора на внешнем энергетическом уровне
атома остаются $- и р-электроны. Следовательно, электронные
конфигурации оказываются разными.
Если же и атом марганца, и атом хлора используют для
образования связей по семь электронов, то оставшиеся на ато-
мах электроны образуют аналогичные конфигурации, соответ-
ствующие электронным конфигурациям инертных газов
ls22s22p63s23ps и \s22s22ps для Мп и CI. Отсюда аналогия в
«свойствах производных высших степеней окисления марганца
и хлора.
За .исключением переходных элементов VIII и I групп, мак-
симальная реально проявляемая в виде достаточно устойчивых
соединений степень окисления их численно равна номеру груп-
пы. В побочной подгруппе VIII группы степень окисления +8
наблюдается только у рутения и осмия. Что касается элемен-
тов побочной подгруппы I группы, то у них степень окисления
может быть и больше единицы. Так, медь чаще проявляет сте-
пень окисления +2, чем +1; для золота характерны степени
окисления +1 и +3, а серебро, хотя чаще всего имеет степень
«окисления +1, может образовывать соединения, в которых сте-
пень окисления его +3.
В З^-серии, начиная с марганца, делается характерным на-
ряду с другими двухвалентное состояние элемента. Но если
для получения оксида двухвалентного марганца требуется
действие восстановителей на производные более высоких сте-
пеней окисления, то оксиды никеля (II), меди (II) и цинка (II)
легко образуются при окислении металлов или при разложении
термически непрочных солей.
Наличие сравнительно большого числа валентных электро-
нов с близкой энергией приводит к тому, что для переходных
элементов отмечается сравнительная легкость перехода от од-
ной степени окисления к другой (железо из +2 в +3, марга-
нец в разных степенях окисления и т. д.).
По причинам, объяснение которых выходит за рамки элементарных
представлений о поведении электрона в атоме, в атомах отличаются повы-
шенной устойчивостью конфигурации электронов, соответствующие не только
«целиком заполненному электронами подуровню, но и заполненному наполо-
вину. Именно поэтому для атома хрома оказывается устойчивой электрон-
ная конфигурация не .. .3d44s2, а .. .3<Z54s' — последняя соответствует напо-
ловину заполненному ЗД-подуровню. Конфигурацию d5 приобретает, напри-
мер, атом марганца (электронная конфигурация которого... 3d54s2), когда он
теряет два электрона, илн атом железа (.. ,3d64s2), теряя три электрона.
Именно этим можно объяснить устойчивость производных Мп(П) и Fe(III).
В побочных подгруппах в отличие от главных устойчивость
соединений, соответствующих высшим степеням окисления, не
уменьшается, а возрастает с увеличением порядкового номера
элемента. Так, если нагревать на воздухе или в кислороде по-
рошок металлического хрома, то он окислится лишь до СгзО3.
203
Высший же оксид хрома, СгОз — непрочное вещество'
(очень сильный окислитель), легко теряющее часть кислорода и
потому неустойчивое при высоких температурах. Напротив,
МоОз и WO3 — прочные соединения, образующиеся, в частно-
сти, при прокаливании соответствующих металлов на воздухе.
Другой пример — переходные элементы VIII группы. Желе-
зо при нагревании на воздухе окисляется до степени окисления
+ 3, причем, если температура достаточно высока, образуется
смешанный оксид, Fe3O4, содержащий железо в степенях окис-
ления +2 и +3. Лишь в присутствии сильных окислителей
удается получить довольно непрочные производные железной
кислоты H2FeO4 со степенью окисления железа +6, однако со-
ответствующий оксид выделить не удалось. В то же время ана-
логи железа — рутений и осмий — образуют оксиды, соответст-
вующие степени окисления +8. Если RuO4— малоустойчивое
вещество, которое получают косвенным путем, то OsO4 — сое-
динение вполне устойчивое, образующееся при окислении ме-
талла на воздухе. Кстати, это единственный пример вполне
устойчивого оксида, в котором элемент имеет степень окисле-
ния + 8.
Если сравнить энергию отрыва электрона от атома элемен-
та в периоде, то при росте заряда ядра на единицу для пере-
ходных элементов она изменяется гораздо меньше, чем для
остальных. Энергия отрыва электрона — очень важное свойст-
во атома, которое определяет, в сущности, всю химию элемен-
та. В результате свойства соседних по периоду переходных
элементов оказываются гораздо более близкими, чем свойства
соседних непереходных элементов одного периода. Так, если
бром является аналогом хлора, но резко отличается, скажем,
от селена или криптона, то железо, кобальт и никель обнару-
живают значительное химическое сходство между собой. Бо-
лее того, у никеля много общего в химическом поведении
с медью.
Таким образом, помимо общего для всех элементов перио-
дической системы вертикального сходства (аналогия свойств
в подгруппах) определенное значение приобретает горизонталь-
ное сходство (горизонтальная аналогия) между переходными
элементами, соседствующими в периоде. Горизонтальная ана-
логия проявляется, например, в свойствах двухзарядных ионов
переходных элементов Sd-серии, а почти все элементы этой
вставной декады образуют в водных растворах двухзарядные
ионы. Свойства солей, в состав которых входят эти ионы, ока-
зываются во многом похожими (например, железный, никеле-
вый и медный купоросы). Разумеется, мы не увидим подобной
аналогии в свойствах, скажем, производных элементов от маг-
ния до серы в степени окисления +2.
Горизонтальная аналогия особенно сильно выражена в
«триадах» переходных элементов VIII группы: сходство между
204
железом, кобальтом и никелем оказывается даже более силь-
ным, чем сходство по вертикали — между железом и рутением,
кобальтом и родием, никелем и палладием. Действительно, тем-
пературы плавления железа, кобальта и никеля равны соответ-
ственно 1539, 1492 и 1453 °C, т. е. отличаются не более чем на
100°C, в то время как температура плавления ближайшего ана-
лога железа по вертикали — рутения — около 2500 °C.
Наличие горизонтальной аналогии между переходными эле-
ментами не следует рассматривать, как нечто противоречащее
вертикальной аналогии в периодической системе. Вертикальная
аналогия наблюдается для всех элементов периодической систе-
мы. Что же касается горизонтальной аналогии, то она в слу-
чае переходных элементов как бы накладывается на верти-
кальную аналогию, в некоторых случаях оказываясь даже
более явной.
Если сравнивать элементы главной и побочной подгрупп
каждой группы в периодической системе, то в I группе сход-
ство между неполными аналогами очень мало (сравните, на-
пример, отношение к воде золота и цезия), затем постепенно
растет к IV группе (отмечается большое сходство между мно-
гими соединениями кремния и титана), а затем снова умень-
шается от V к VIII группе.
§ 2. СПЕЦИФИКА ПРОСТЫХ ВЕЩЕСТВ И СОЕДИНЕНИЙ,
ОБРАЗУЕМЫХ ПЕРЕХОДНЫМИ ЭЛЕМЕНТАМИ
Простые вещества, образуемые элементами побочных и
главных подгрупп, сильно различаются по своим свойствам.
Если элементы главных подгрупп в свободном состоянии суще-
ствуют как в виде типичных металлов, характеризующихся
металлическими свойствами, в том числе металлической прово-
димостью, так и столь же типичных изоляторов и полупровод-
ников, то все элементы побочных подгрупп в виде простых ве-
ществ являются типичными металлами.
Вообще физические свойства переходных металлов изменя-
ются в более узком диапазоне, чем простых веществ, образуе-
мых элементами главных подгрупп. Последние, как мы убеди-
лись выше, при комнатной температуре могут быть твердыми,
жидкими или газообразными, в то время как переходные ме-
таллы, за исключением ртути, при комнатной температуре
твердые. Большинство переходных металлов имеют довольно
высокие температуры плавления, что связано с возможностью
использования ими для образования химических связей в кри-
сталлической решетке металла большого числа валентных
электронов (в том числе на d-орбиталях). Исключениями яв-
ляются цинк, кадмий и ртуть — именно потому, что у них
d-подуровень целиком заполнен.
205
Как и для всех металлов, для переходных металлов харак-
терны восстановительные свойства, однако в пределах d-сери»
восстановительные свойства простых веществ изменяются в до-
вольно широких пределах. Если скандий и его аналоги в ка-
кой-то мере похожи по своим восстановительным свойствам на
щелочноземельные металлы, то для окисления тяжелых метал-
лов I и VIII побочных подгрупп, например золота и платины-,,
требуются очень сильные окислители. Слабые восстановитель-
ные свойства и, как следствие, малая реакционная способность-
в окислительной атмосфере тяжелых металлов побочных под-
групп I и VIII групп дали повод назвать их благородными ме-
таллами. Используются они там, где требуется особая стой-
кость к окислению, в частности для изготовления химически
инертной посуды, защитных покрытий, инертных электродов,
неокисляющихся контактов, а также ювелирных изделий.
При переходе от меди и ее аналогов к цинку и его аналогам
восстановительные свойства простых веществ снова возраста-
ют. Цинк является одним из наиболее часто применяемых в ла-
бораторных условиях восстановителей.
В отличие от соединений элементов главных подгрупп сое-
динения переходных элементов, как правило, более ярко окра-
шены. В этом легко убедиться на примере наиболее типичных
солей элементов Sd-серии. Ярко окрашены, например, многие
соли хрома (III), железа, кобальта, никеля, меди, а также
хромат- и дихромат-ионы, соединения марганца в разных сте-
пенях окисления. Не случайно среди наиболее употребительных
минеральных пигментов много соединений железа, кобальта,
меди, хрома. Одной из причин окраски, т. е. поглощения кван-
тов света в видимой области спектра, является наличие вакант-
ных мест на d-орбиталях, энергия которых может быть раз-
личной в зависимости от окружения данного атома. Переход
электронов с одной орбитали на другую сопровождается погло-
щением порций энергии, как раз соответствующих квантам
видимого света.
Характерная черта химии переходных элементов, в частно-
сти их оксидов, сульфидов, гидридов и других бинарных сое-
динений, — обилие нестехиометрических соединений (соединений
переменного состава). Это связано как с возможностью сосу-
ществования разных степеней окисления переходного элемента,
так и со структурными особенностями таких соединений. (По
отношению к нестехиометрическим соединениям вместо терми-
на «соединение» часто употребляют термин «фаза», так как в
данном случае он лучше характеризует индивидуальное веще-
ство.)
Так, гидриды многих переходных элементов по своему строе-
нию являются типичными соединениями внедрения, или фаза-
ми внедрения, т. е. представляют собой результат внедрения
атомов водорода в кристаллическую решетку металла. В главе
206
7 говорилось о том, что в плотных упаковках, каковыми и яв-
ляются кристаллические структуры многих металлов, имеются,
два вида пустот: тетра- и октаэдрические. Фазы внедрения
образуются тогда, когда в эти пустоты попадают небольшие
по размеру атомы, например атомы водорода. Так как число-
октаэдрических пустот равно числу атомов, образующих плот-
ную упаковку, а число тетраэдрических пустот в два раза
больше, то именно количеством пустот, а не валентностями эле-
ментов определяются формулы гидридов переходных элемен-
тов. При этом обычно заполняются не все имеющиеся пустоты,
в результате чего коэффициенты в формулах оказываются не-
целочисленными и состав гидридов — переменным.
Вследствие своих структурных особенностей гидриды пере-
ходных элементов резко отличаются по физическим и хими-
ческим свойствам от гидридов щелочных и щелочноземельных
металлов и тем более от летучих гидридов неметаллов. При по-
глощении типичным переходным металлом даже сравнительно-
больших количеств водорода сохраняются такие физические
свойства исходного металла, как высокая электропроводность
и металлический блеск, однако резко возрастает хрупкость.
Остается неизменной, хотя и в несколько искаженном виде,
структура исходного металла. Все это дает основания назы-
вать гидриды такого типа металлообразными, или металличе-
скими, а также твердыми растворами водорода в переходном
металле.
Соединениями внедрения являются многие нитриды и кар-
биды типичных переходных элементов. Именно поэтому форму-
лы карбидов часто оказываются совсем не похожими на те, ко-
торые следовало бы ожидать исходя из обычных валентностей
этих элементов. Кстати, карбиды переходных элементов IV и
V групп принадлежат к самым тугоплавким веществам: тем-
пературы плавления некоторых из них приближаются к 4000 °C,
а для карбидов более сложного состава (включающих более
одного переходного элемента)—даже превышают это значе-
ние.
Примерами нестехиометрических оксидов могут служить ок-
сиды титана и железа — металлов, широко применяемых в тех-
нике.
Представим себе, что каким-то образом осуществляется присоединение
кислорода к титану небольшими порциями, причем после присоединения каж-
дой порции кислорода система успевает достичь равновесного состояния.
До определенного предела, соответствующего примерно формуле TiOo.s, или
TijO, будет сохраняться кристаллическая решетка металлического титана и
происходить внедрение атомов кислорода в октаэдрические пустоты в этой
решетке. Таким образом, все промежуточные составы между чистым тита-
ном и TijO можно считать твердым раствором кислорода в титане, или фа-
зой внедрения.
При дальнейшем присоединении кислорода к титану образуется новая
фаза с иным строением кристаллической решетки. Количество этой фазы-
207
будет расти по мере увеличения количества кислорода, присоединившегося
к титану, за счет уменьшения количества первой фазы, а когда первая фаза
исчезнет, вторая фаза будет до некоторого предела поглощать кислород.
Таким образом, состав второй фазы при сохранении ее однородности может
колебаться в довольно широких пределах. Эти пределы зависят от темпе-
ратуры: при 1200 °C они соответствуют составам примерно ТЮо.з и TiOi.s,
т. е. состав фазы отклоняется в обе стороны от стехиометрической фор-
мулы TiO. Интервал, в котором может изменяться состав нестехиометриче-
ского соединения с сохранением однородной фазы, имеющей характерное
для нее кристаллическое строение, называется областью гомогенности фазы.
Как связана широкая область гомогенности оксида титана (II) со струк-
турой этого вещества? Кристаллическая решетка этой фазы построена по
знакомому нам типу решетки каменной соли NaCl. Но в отличие от послед-
ней в решетке оксида титана(II) имеется большое число незанятых узлов,
предназначенных как для атомов металла, так и для атомов кислорода.
Более того, даже если какой-то образец этой фазы имеет строго стехиомет-
рический состав 'ПО, в решетке все равно будет незанятым некоторое коли-
чество тех и других узлов. Если фаза содержит избыток титана, то соот-
ветственно увеличивается степень заполнения узлов решетки, предназначен-
ных для атомов титана; если же фаза содержит избыток кислорода, уве-
личивается степень заполнения узлов, в которых должны быть атомы кис-
лорода.
Нестехиометрическим соединением является и низший оксид железа.
При 1000 °C его состав находится в пределах от FeOi,02 до FeOi.n. Харак-
терно, что состав FeO вообще не попадает в пределы области гомогенности
при обычных условиях — лишь при высоком давлении кислорода можно по-
лучить вещество стехиометрического состава FeO. Эта фаза тоже имеет кри-
сталлическую структуру типа каменной соли. Избыток кислорода по сравне-
нию с железом связан с тем, что многие узлы в решетке, предназначенные
для атомов железа, остаются незанятыми. Равенство нулю алгебраической
суммы степеней окисления всех атомов, образующих фазу, достигается за
счет того, что большинство атомов железа находится в степени окисления
+2, а часть —в степени окисления +3.
Похожую природу имеет и сульфид железа (II). В erq структуре запол-
нены не все узлы кристаллической решетки, предназначенные для атомов
железа, и потому состав его отклоняется от стехиометрического в сторону
избытка серы.
В принципе, любое твердое соединение, не состоящее из
отдельных молекул, т. е. имеющее координационную решетку,
может обнаруживать переменный состав. Отклонение от стехио-
метрии связано, во-первых, с удалением части атомов из кри-
сталлической решетки и, во-вторых, с изменением валентности
оставшихся атомов. Этот процесс предполагает затрату неко-
торого количества энергии, поэтому вероятность его осущест-
вления должна увеличиваться с повышением температуры.
Отнесение того или иного вещества с координационной ре-
шеткой к соединениям переменного или постоянного состава
условно, оно связано с чувствительностью метода исследова-
ния. Обычно мы считаем стехиометрическими соединениями
такие, у которых количественный химический анализ не обна-
руживает отклонений от стехиометрии. Однако более тонкие
структурно-чувствительные методы позволяют выявить откло-
нения от стехиометрии даже у некоторых из тех соединений,
208
которые мы привыкли считать соединениями постоянного со-
става.
Например, количественный химический анализ не обнару-
живает отклонений от стехиометрии у оксида цинка. Однако
электропроводность оксида цинка при повышенных темпера-
турах зависит от парциального давления кислорода в окру-
жающей атмосфере. Объяснение состоит в том, что при малом
парциальном давлении кисдорода и повышенных температурах
оксид цинка содержит меньше кислорода, чем соответствует
формуле ZnO. Наличие избыточных (по сравнению с кислоро-
дом) атомов металла в решетке оксида цинка и приводит к из-
менению его электропроводности, а также цвета — с белого на
желтый.
Свойства реальных кристаллов всегда отклоняются от тех,
какие следуют из идеальной модели кристаллической решетки.
Доказательством может служить диффузия вещества в твер-
дом теле. Действительно, в идеальной кристаллической решет-
ке, в которой атомы (ионы) занимают все предназначенные
им позиции (узлы решетки) и вне этих позиций находиться
не могут, перемещение атомов было бы крайне затруднено.
Ведь положение атома в узле решетки отвечает . минимуму
энергии, и, чтобы удалить атом из такой позиции, требуется
затратить какое-то количество энергии. При не очень высоких
температурах лишь небольшое количество атомов располагает
достаточным запасом энергии, чтобы покинуть узел кристал-
лической решетки. Для осуществления же диффузии надо, что-
бы атом не только покинул один узел, но и занял другой узел
в решетке. В случае идеальной решетки мы считаем, что со-
седние позиции заняты другими атомами, которые, в свою оче-
редь, тоже не могут освободить их, переместившись в другие
позиции, так как все позиции в решетке заняты. Таким образом,
чтобы осуществилась диффузия в идеальном кристалле, долж-
но одновременно переместиться большое число атомов, что
крайне мало вероятно.
Тот факт, что в действительности диффузия в твердом теле
имеет место, объясняется как раз наличием дефектов в кри-
сталлической структуре. Эти дефекты могут быть двух типов:
а) атом занимает положение, не соответствующее закону дан-
ной структуры, например между узлами решетки; б) атом от-
сутствует в предназначенном ему узле решетки, т. е. в решетке-
имеется вакансия. Образование дефектов обоих типов должно
в какой-то мере происходить при любой температуре, отличной
от абсолютного нуля. Если в кристаллической решетке имеют-
ся вакансии, то соседние с ними атомы, приобретя достаточную
энергию, смогут покинуть свои позиции и занять вакансии,
освободив тем самым новые узлы (создавая новые вакансии).
При этом не требуется одновременного накопления большим
числом атомов энергии, необходимой для перехода на другие
14 Семенов И. Н.
209
позиции. Поэтому для кристалла, в структуре которого есть
дефекты, вероятность осуществления диффузии резко возра-
стает.
Роль диффузии в твердом теле особенно велика при раз-
личных высокотемпературных процессах. Например, газовая
коррозия сплавов железа (т. е. окисление их при высокой
температуре под действием различных газов) связана с диффу-
зией вещества через слой оксида железа (II). Действительно,
после того как в начальный момент коррозии на поверхности
металла образуется тонкий слой оксида, дальнейшее окисле-
ние может происходить только за счет диффузии. Оказалось,
что через слой оксида переносится не кислород (что было бы
естественно ожидать), а атомы железа, которые на поверхно-
сти оксида реагируют с кислородом, достраивая кристалличе-
скую решетку оксида. Диффузия же атомов железа возможна
потому, что в кристаллической решетке оксида железа (II)
имеются вакансии в узлах, предназначенных для атомов же-
леза.
Образование нестехиометрических соединений вообще ока-
зывает большое влияние на технологически важные характери-
стики переходных металлов. Например, растворение кислоро-
да в кристаллической решетке титана резко понижает его пла-
стичность. Это было одной из причин, почему титан, выделен-
ный в металлическом состоянии уже давно, долгое время не
удавалось получить достаточно пластичным, чтобы освоить из-
готовление изделий из него и тем самым открыть дорогу ши-
рокому использованию титана в промышленности.
Переходные элементы образуют большое число прочных
комплексных соединений, многие из которых выступают в роли
катализаторов в различных реакциях.
Следует отметить особую биохимическую роль переходных
элементов. Обычно они содержатся в живых организмах в
очень малых количествах (за исключением железа в организ-
ме животных). Поэтому они называются микроэлементами.
Интересно, что элементы З^-серии имеют большее значение
для живых организмов, чем элементы 4d- и 5й-серий. Типичные
микроэлементы — это марганец, кобальт, медь, цинк, ванадий,
молибден. Более тяжелые переходные элементы часто явля-
ются ядами практически при любых концентрациях. Таковы,
например, ртуть и свинец. Но даже те элементы, которые не-
обходимы организму в малых дозах, в больших концентраци-
ях становятся ядами, как, например, медь или цинк.
ПРИЛОЖЕНИЕ
Задачи и упражнения
§ 1. Разбор некоторых задач
Большинство задач в объеме школьной программы основано на рас-
четах по химическим уравнениям. Обычно для решения таких задач состав-
ляют уравнение реакции, подсчитывают величины молярных масс веществ,
а затем делают расчет методом пропорций, в которые подставляют массы,
•объемы (для газов) или молярные количества веществ.
Пропорциональность между количествами участников реакции сохраня-
ется независимо от того, выражены лн эти количества в единицах массы,
объема (для газов) или числом молей. Поэтому можно в одной строке (или
в одном столбце) пропорции записать, например, количества газов в литрах,
а в другой строке (столбце) — в граммах или килограммах, при этом лишь
следует внимательно следить за размерностью величин, получаемых как на
промежуточных этапах расчетов, так и в конечном результате. Сказанное
относится и к задачам, основанным на термохимических уравнениях, при
решении которых в одном столбце (или строке) пропорции могут стоять
количества веществ (масса, число молей нли объем газов), а в другом
столбце (строке) — количество энергии.
Расчеты, в которых используются молярные количества веществ, зача-
стую оказываются более продуктивными, чем расчеты через массы веществ,
особенно в тех случаях, когда имеет место цепочка химических превраще-
ний или когда в зависимости от соотношения количеств реагирующих ве-
ществ могут получаться разные продукты. Рассмотрим несколько примеров.
Задача. Найти массу карбоната кальция, образовавшегося при действии
на гашеную известь углекислого газа, полученного при сжигании ацетилена,
если последний получен действием воды на 16 г карбида кальция. На всех
стадиях выход реакций считать 100%-ным.
Решая эту задачу, ие обязательно писать уравнения промежуточных
реакций, достаточно составить схему, показывающую соотношения .между
молярными количествами участвующих в реакции веществ. Действительно,
из 1 моль СаС2 получится 1 моль C^Hj, затем 2 моль СО2 и, наконец,
2 моль СаСОз. А4 (СаСОз) и Af(CaC2) равны соответственно 100 и 64г/моль.
16 г СаС2 — это 16 г: 64 г/моль=0,25 моль. Составим следующую пропорцию:
1 моль СаС2.....................2 моль СаСО3
0,25 моль СаС2................х моль,
откуда х=0,5 моль или 50 г СаСОз.
Задача. Какая соль и в каком количестве образуется при пропускании
1,12 л СО2 (и. у.) через раствор, содержащий 16,8 г КОН?
При нейтрализации раствора КОН углекислым газом может образо-
ваться либо средняя, либо кислая соль:
14* 211
2К0Н+С02= К2СО3+Н20,
кон+со2=кнсо3.
Как следует из этих уравнений, молярные количества КОН, реагирующие
с 1 моль СО2, в двух реакциях разные. Значит, для решения задачи сле-
дует прежде всего найти молярные количества каждого нз реагирующих ве-
ществ. Вычислив величину молярной массы КОН (56 г/моль) и используя
следствие из закона Авогадро, находим
«(КОН) = 16,8 : 56 г/моль=0,3 моль,
«(СО2) = 1,12л :22,4л/моль = 0,05 моль.
Соотношение молярных количеств реагирующих веществ показывает, что
имеет место первая из приведенных выше реакций — для нее требуется,
чтобы молярное количество КОН было вдвое больше молярного количества
СО2 (по условию задачи в 6 раз больше). Количество продукта реакции
определяется по тому реагенту, который присутствует в недостатке. В дан-
ном случае молярное количество К2СО3 равно молярному количеству СО2,
т. е. 0,05 моль. Умножив эту величину на молярную массу КгСО3, получим
массу продукта в граммах: 0,05 моль • 138 г/моль=6,9 г.
Распространенным типом расчетных задач по химии являются такие,
в которых смесь двух веществ реагирует с каким-то веществом, причем в
обоих случаях образуется один и тот же продукт. Например, смесь двух
.металлов реагирует с кислотой с выделением водорода.
Зачастую абитуриенты пытаются решать задачи такого типа, составляя
одно уравнение реакции, в которое вписывают оба компонента смеси, напри-
.мер два металла. Это — грубая ошибка. Ведь смеси в противоположность
'Химическим соединениям не подчиняются закону постоянства состава: в раз-
, ных случаях состав смеси может быть разным, в то время как коэффи-
циенты в уравнении реакции указывают на определенные соотношения
•между ее участниками. Поэтому, если в задаче требуется, например, найти
•состав смесн двух металлов, вытесняющих из кислоты водород, для каж-
дого металла надо написать отдельное уравнение реакции. Приведем при-
мер задачи такого типа.
Задача. При взаимодействии 10,4 г смеси железа и магния с соляной
•кислотой выделилось 6,72 л водорода (н. у.). Определите массу каждого
металла в смеси.
Удобнее всего решать эту задачу, используя в промежуточных расче-
тах молярные качества участников реакции. Начнем с того, что обозначим
молярные количества железа и магния соответственно через х и у. Соста-
вим уравнения реакций:
Fe+2HCl=FeCl2+H2t,
Mg-f-2HCl=MgCl2+H2f.
Из уравнений реакций следует, что молярное количество водорода, выде-
ляющегося за счет растворения железа, равно молярному количеству же-
леза, а молярное количество водорода, выделяющегося за счет растворения
магния, — числу молей магния. Следовательно, в сумме молярное количе-
ство водорода равно х+у. Пересчитав приведенный в условиях задачи
объем водорода на его молярное количество (п=6,72 л: 22,4 моль/л =
0,3 моль), можем составить уравнение х+г/=0,3. Так как это уравнение со-
держит два неизвестных, очевидно, для решения задачи надо составить еще
какое-то уравнение' и решить систему двух уравнений с двумя неизвестными.
Если для составления первого уравнения мы использовали одну из чис-
ленных величии, приведенных в условиях задачи, — объем водорода, то для
составления второго уравнения надо использовать вторую величину — мас-
су смеси, равную сумме'масс железа и магния. Масса каждого металла
равна проязведению ег’о' молярного количества на молярную массу, т. е.
56х+24у= 10,4.
,212
Остается решить систему уравнений. Из первого уравнения
у=0,3—х.
Подставив эту величину во второе уравнение, получаем
56х+24 • 0,3—24х= 10,4,
32х= 10,4—7,2=3,2,
откуда х— 0,1 моль, у=0,2 моль. Следовательно, масса железа равна
56-0,1 = 5,6 г, а масса магния 24-0,2=4,8 г.
Разобранный пример не надо путать со случаем, когда компоненты
смеси реагируют с образованием разных продуктов. Тогда задача сводится
к обычным расчетам по уравнениям реакций для каждого компонента смеси
в отдельности.
Еще один распространенный тип задач — нахождение молекулярной фор-
мулы вещества на основании результатов его анализа. Установить молеку-
лярную формулу вещества — значит найти, сколько атомов каждого из эле-
ментов входит в состав молекулы этого вещества. Для этого надо опреде-
лить молекулярную массу вещества, например, на основании плотности
паров вещества по водороду или другому газу.
Задача. Установите молекулярную формулу вещества, при сжигании
3,68г которого получено 2,88г воды и 2,688 л углекислого газа (н. у.). Плот-
ность паров исследуемого вещества по водороду 46.
Зная объем СО2, образовавшегося при сжигании образца, нетрудно вы-
числить молярное количество СО2 и, следовательно, молярное количество1
атомов С, так как 1 моль СО2 содержит 1 моль С: 2,688 л : 22,4 л/моль=
= 0,12 моль СО2, т. е. 0,12 моль С в образце. Аналогичным образом найдем
молярное количество воды: 2,88 г: 18 г/моль = 0,16 моль Н2О. Так как одна
молекула воды содержит два атома водорода, молярное количество атомов
Н в образце равно 0,16 • 2=0,32 моль Н.
Итак, мы нашли молярные количества углерода и водорода в образце.
Мог ли он содержать еще какой-то элемент? Да, мог, но только один — кис-
лород, который вошел бы в состав продуктов сгорания, «замаскировавшись»
кислородом, использованным при горении. Чтобы узнать, содержался ли кис-
лород в исходном образце, надо сравнить массу образца с суммарной мас-
сой углерода и водорода. Масса 0,12 моль С равна 0,12 моль • 12 г/моль=
= 1,44 г С, масса 0,32 моль Н равна 0,32 моль-1 г/моль = 0,32 г Н. В сумме
это составляет 1,76 г. Значит, образец содержал еше кислород, молярное
количество которого нетрудно найти: 3,68—1,76=1,92г О, т. е. 1,96г:
: 16 г/моль = 0,12 моль О.
Следовательно, соотношение молярных количеств углерода, водорода и
кислорода равно 0,12:0,32:0,12, т. е. 3:8:3. Простейшая формула веще-
ства С3Н8О3. Так как плотность по водороду 46, молекулярная масса равна
46 • 2=92 а.е.м. Эта же величина получается и из простейшей формулы.
Таким образом, простейшая формула совпадает с молекулярной.
Распространенной ошибкой абитуриентов является использование моляр-
ного объема газов при нормальных условиях (22,4л/моль) для решения за-
дач, в условиях которых не говорится, что объемы газов измерены при н.у.
Задача. Определите состав (в объемных процентах) смеси сероводорода
и кислорода, если при сжигании ее было получено 200 мл сернистого газа и
40 мл кислорода не вступило в реакцию.
ДЛя нахождения объемов сероводорода и кислорода абитуриенты часто
составляют пропорцию, в которой фигурируют стехиометрические коэффи-
циенты уравнения реакции и величина 22,4 л/моль. Это, во-первых, неверно,
так как в условиях задачи не сказано, что объемы измерены при н.у., и,
во-вторых, в этом иет необходимости. Ведь стехиометрические коэффициенты
пропорциональны молярным количествам веществ и, следовательно, объемам
газов, участвующих в реакции. Соотношения между объемами газов оста-
213
<нутся теми же, если условия отличаются от нормальных (при изменении
температуры или давления объемы изменяются одинаково для всех газов).
Значит, согласно уравнению реакции
2H2S + ЗО2 == 2SO2+2Н2О
на образование 200 мл сернистого газа потребуется 200 мл H2S и 300 мл О2.
Суммарный объем кислорода равен 340 мл, весь объем исходного газа
540 мл. Отсюда легко найти состав исходной газовой смеси в объемных
процентах.
Задача. Сколько граммов металлического натрия должно прореагиро-
вать с 89 мл воды, чтобы получился 20%-иый раствор гидроксида натрия?
В этой задаче вода играет двоякую роль. Во-первых, она расходуется
в реакции Na + H2O = NaOH +1/2 Н2 (кстати, это один нз случаев, когда
дробный стехиометрический коэффициент оказывается удобным). Во-вторых,
вода служит растворителем для продукта реакции — NaOH. Это типичный
пример задачи* решать которую удобнее всего, обозначив неизвестную
массу реагирующего вещества через х: m(Na)=x. Тогда масса растворен-
ного вещества m(NaOH) =40х : 23, где 40 и 23 — соответственно Af(NaOH)
и 44(Na). Масса раствора равна сумме масс реагирующих веществ (х г нат-
рия+89 г воды) за вычетом массы выделившегося водорода (ш(Н2) : 23,
так как на 1 моль натрия выделяется 0,5 моль Н2). Итак, можем записать:
40 х : 23 20
89 + х - х : 23 = 100 '
Решив это уравнение, найдем, что х=11,5г.
Задача. При сгорании 13,44 л смеси СО, СН4 и С2Н2 образовалось
17,92 л СОг и 9 г воды. Объемы газов измерены при нормальных усло-
виях. Сколько литров каждого газа содержалось в смеси?
Напишем уравнения реакций горения СО, СН4 и С2Н2 в расчете на
1 моль каждого газа:
СО+1/2 О2 = СО2,
СН4+2 О2 — СОа + 2 Н2О,
С2Н2+5/2 О2=2 СО2+Н2О.
Нетрудно убедиться, что в случае СО и СН4 объемы образовавшегося СО2
равны объему сгоревшего газа, а в случае С2Н2 объем СО2 вдвое больше
объема СгН2. Иными словами, объем полученного СО2 больше объема исход-
ных газов на величину, равную объему СгН2, т. е. И(СгН2) = 17,92—13,44 =
= 4,48 л.
Остальной объем (13,44—4,48=8,96 л) приходится на СО и СИ,.
Из этих двух газов лишь СН4 при сгорании образует воду. Количество
образовавшейся воды 9 г, т. е. 0,5 моль. При сгорании 4,48 л (0,2 моль)
С2Н2 дадут согласно уравнению реакции 0,2 моль воды. Остальные 0,3 моль
Н2О образуются за счет сгорания СН4; из уравнения реакции находим, что
для этого требуется 0,15 моль СН4, т. е. 3,36 л СН4. Остальной объем смеси
(5,60 л) приходится на СО.
Задача. Сосуд неизвестной вместимости наполнен неизвестным газом,
находящимся при и.у. В сосуд ввели какую-то жидкость, в которой газ пол-
ностью растворился, при этом жидкость заполнила весь объем сосуда, и по-
лученный раствор был тщательно перемешан. Определите концентрацию по-
лученного раствора.
На первый взгляд кажется, что в задаче слишком много неизвестных:
объем сосуда, характер газа и растворителя. Однако все упрощается, если
вспомнить закон Авогадро и следствия из него. Действительно, если 1 моль
газа при и.у. занимает объем 22,4 л, то в 1 л содержится 1/22,4 моль газа.
Иными словами, молярная концентрация газа при и. у. равна 1/22,4 моль/л.
После растворения газа в жидкости как его молярное количество, так и
объем, который ои займет, распределившись в жидкости, останутся преж-
?14
ними. Следовательно, прежней останется и его концентрация, равная 1/22,4,
или примерно 0,045 моль/л.
Задача. Концентрация насыщенного раствора К2СГ2О7 при 18 и 78 °C
соответственно равна 10 и 40%. Сколько граммов дихромата калия выде-
лится из раствора, если 300 г насыщенного при' 78 °C раствора этой соли
охладить до 18 °C?
При 78 °C 100 г насыщенного раствора содержит 40 г соли и 60 г воды,
а 300 г насыщенного раствора, как нетрудно вычислить с помощью пропор-
ции, содержит 120 г соли и 180 г воды. При охлаждении из раствора будет
выпадать только соль, а вся вода останется в растворе. При 18 °C в 100 г
раствора будет содержаться Юг соли и 90 г воды, значит, в 180 г воды рас-
творится 20 г соли. Разность между количеством соли, растворяющимся в
180 г воды при 78 и 18 °C, составит 120—20 = 100 г. Следовательно, при
охлаждении раствора от 78 до 18 °C из него выпадет 100 г К2СГ2О7.
Задача. Концентрация насыщенного раствора карбоната натрия в расчете
на безводную соль при 8 и 70 °C равна соответственно 10 и 30%. Сколько
граммов кристаллогидрата Na2CO3-10H2O выпадет из 200 г насыщенного
при 70 °C раствора при его охлаждении до 8 °C?
Молярные массы безводной соли и кристаллогидрата равны 106 и
286 г/моль. При 8 °C в 100г раствора находится Юг Na2CO3 или
10 • 286/106 = 27 г кристаллогидрата и 73 г воды, не входящей в состав кри-
сталлогидрата. В 200 г раствора, насыщенного при 70 °C, содержится 60 г
Na2CO3 или 60 • 286/106= 171 г кристаллогидрата и 29 г воды, не входящей
в состав кристаллогидрата.
Следовательно, при 8 °C в 73 г воды может раствориться 27 г кристал-
логидрата. В охлажденном до этой температуры растворе имеется 29 г
«лишней» по сравнению с кристаллогидратом воды, в которой может раство-
риться хг кристаллогидрата. Составим пропорцию:
73г Н2О...................27г Na2CO3. ЮН2О
29 г...................х, х= 11 г.
Разность между массой кристаллогидрата, которая может раствориться в
данном количестве воды при 70 и 8 °C (171—11 = 160 г), соответствует массе
кристаллогидрата, выделяющегося из раствора.
При решении задач подобного рода на результат не влияет то обстоя-
тельство, что при более высокой температуре насыщенный раствор может
находиться в равновесии с безводной солью или иным кристаллогидратом,
нежели тот, который выпадает при более низкой температуре. Ведь суть рас-
четов состоит в нахождении избыточного количества кристаллогидрата, су-
ществующего при низкой температуре.
Задача. Выдерживание образца серного ангидрида при некоторой срав-
нительно высокой температуре привело к тому, что половина его разложи-
лась на сернистый ангидрид и кислород. Вычислите среднюю молекулярную
массу образовавшейся смеси газов.
Сериый ангидрид разлагается по реакции
SO3=SO2-1-1 /2 О2.
Приняв объем исходного SO3 за 100%, найдем, что в образовавшейся смеси
газов объемы SO3, SO2 н О2 составляют соответственно 50, 50 п 25% от
исходного; сумма 125%.
Средняя молекулярная масса смеси равна сумме произведений молеку-
лярной массы каждого компонента на его долю в смеси. Учитывая, что Мг
SO3, SO2 и О2 равны соответственно 80, 64 и 32 а.е.м., можем записать:
50 -80 50 64 25 • 32
Мг (ср.) = —+ -|25~ + 125" = 32 + 25,6 + 6,4 = 64 а- е- м-
Можно решить эту задачу и другим способом. Будем считать, что раз-
ложение SO3 происходит при постоянном давлении. Так как объем образо-
215
вавшегося газа составляет 125% от исходного, суммарное молярное количе-
ство его относится к молярному количеству исходного газа, как 125 : 100.
Масса же газа осталась постоянной. Следовательно, молярная масса, пред-
ставляющая собой отношение массы к молярному количеству вещества, для
образовавшейся смеси равна 80 • 100/125=64 г/моль.
Вопрос. Будет ли реагировать металлическое железо со следующими
веществами: с газообразным хлором при нагревании, соляной кислотой, рас-
твором сульфата меди, разбавленной азотиой кислотой, разбавленной сер-
ной кислотой, концентрированной азотной кислотой, концентрированной сер-
ной кислотой? Напишите уравнения реакций.
Главная трудность, которая возникает у абитуриентов при ответе на
этот вопрос, состоит в нахождении степени окисления железа в продукте
реакции. Здесь следует руководствоваться следующим правилом. Сильные
окислители, такие как концентрированная серная кислота (при нагревании)
или разбавленная азотная кислота, реагирующие с металлами без выделе-
ния-водорода, а также свободный хлор окисляют железо- до степени окис-
ления + 3 (при написании уравнений реакций металлического железа с та-
кими кислотами следует, конечно, помнить, что концентрированные серная
и азотная кислоты на холоду пассивируют железо).
Что же касается более слабых окислителей (ион Н+ соляной или раз-
бавленной серной кислоты, ион меди), то они окисляют железо лишь до сте-
пени окисления +2. Действительно, например, ион Н+, окисляя металл, сам
восстанавливается до свободного водорода — сильного восстановителя, осо-
бенно в момент выделения. Естественно поэтому предположить, что если
даже среди продуктов реакции и оказалось бы Fe(III), оно тут же восста-
новилось бы до Fe(II) выделяющимся водородом.
Данный пример показывает, что при составлении уравнений предполагае-
мых реакций всегда следует оценивать возможные продукты с точки зрения
их способности к сосуществованию — как между собой, так и с избытком
реагентов.
Вопрос. Какая кислота более сильная — фтороводородная или иодоводо-
родная?
Иодоводородная кислота является сильной кислотой. Что касается фто-
роводородной, то она относится к электролитам средней силы — в 0,1 М вод-
ном растворе диссоциирована примерно на 10%. Причины того, насколько
сильной кислотой будет галогеноводород в водном растворе, довольно
сложны и представляют собой сумму нескольких факторов, действующих под-
час в противоположных направлениях. Процесс диссоциации галогеиоводорода
при растворении состоит из следующих стадий (вспомним закон Гесса):
1) разрыв молекулы на свободные атомы; 2) превращение атомов в ионы,
т. е. потеря электрона атомом водорода и присоединение электрона атомом
галогена; 3) гидратация этих ионов.
По сравнению с другими галогенами фтор как более электроотрицатель-
ный элемент сильнее притягивает дополнительный электрон, а иои фтора в
силу меньших размеров и потому более сильного кулоновского взаимодей-
ствия с полярными молекулами воды сильнее гидратируется. Стало быть,
последние два фактора способствуют ионизации HF, увеличивая силу кис-
лоты. Напротив, большая прочность молекулы HF (для разрыва ее на атомы
требуется вдвое больше энергии, чем для разрыва молекулы НГ) препятст-
вует ионизации, уменьшая силу кислоты. Действие этого фактора оказы-
вается более сильным, чем двух других.
Таким образом, прочность связи Н—F — главная причина того, почему
Это вещество является в водном растворе значительно более слабой кис-
лотой, нежели другие галогеноводороды.
Часто фтороводородную кислоту считают сильной иа том основании, что
она обладает свойством разъедать органические материалы, например кожу,
а также растворять оксид кремния. Однако это — специфические свойства
(йторово.тородной кислоты, «е являющиеся поямым следствием концентрации
ионов водорода в ее растворах. Кстати, щелочные растворы, в которых кон-
центрация ионов водорода, естественно, очень мала, тоже разрушают кожу
216
и многие другие органические материалы и медленно растворяют оксид
кремния.
Иногда абитуриенты, обнаруживающие хорошие знания по истории от-
крытия периодического закона, по связи периодичности со строением атома,
затрудняются на основании своих теоретических знаний делать практические
выводы; например предсказывать свойства не изучаемого в школе химиче-
ского элемента по его положению в системе. То, что делать такие предска-
зания не так уже сложно, показывает следующий пример.
Вопрос. Какие формулы должны иметь оксиды селена и их гидраты?
Пользуясь периодической таблицей, опишите свойства этих соединений.
Селен расположен в главной подгруппе VI группы, т. е. является пол-
ным аналогом серы. Можно предположить, что селен, как и сера, способен
образовывать два устойчивых оксида: SeO2 и SeO3. Подобно оксидам серы
эти оксиды должны иметь кислотные свойства и являться ангидридами кис-
лот, формулы которых, вероятно, будут следующими: H2SeO3 и H2SeO4. Дей-
ствительно, селен образует такие оксиды и кислоты. По аналогии с кисло-
родными соединениями серы, изучаемыми в школе, эти кислоты можно на-
звать соответственно селенистой и селеновой, а оксиды — селенистым и селе-
новым ангидридами.
Зная, что устойчивость производных высших степеней окисления элемен-
тов уменьшается в главных подгруппах от более легких элементов к тя-
желым, мы можем предположить, что окислительные свойства селенового*
ангидрида и селеновой кислоты (т. е. их способность отдавать кислород на
окисление) выражены сильнее, чем окислительные свойства серного ангид-
рида и серной кислоты. Это и наблюдается в действительности. Как правило,
в рядах аналогичных соединений температуры плавления и кипения повы-
шаются при возрастании молекулярной массы. Значит, оба оксида селена
должны иметь более высокие температуры плавления и кипения, чем соот-
ветственно сернистый н серный ангидриды. Это тоже наблюдается в дейст-
вительности.
Таким же образом можно предсказывать неизвестные нам заранее свой-
ства соединений других элементов, используя знания об элементах, изучае-
мых в школе.
Вопрос. Почему в периодической таблице водород часто помещают не
только в первую, ио и в седьмую группу (причем в одной из них его сим-
вол обычно пишут в скобках) ?
Водород вообще является особенным элементом. Если рассматривать
свойства однотипных веществ, образуемых элементами одной из главных
подгрупп, то окажется, что чем меньше порядковый номер элемента, тем
больше он отличается от соседей по вертикали. Водород как самый легкий
элемент резко отличается от всех других химических элементов.
Теперь о месте водорода в периодической системе. В пользу того, чтобы
помещать водород в I группу, говорит прежде всего его способность обра-
зовывать положительно заряженный ион в водной среде. То, что этот ион
обладает особыми свойствами, в частности подвергается особо сильной гид-
ратации, в результате чего образуется ион Н3О^. не меняет сути дела — это
связано с малыми размерами иона Н+ (фактически протона). Если идти от
более тяжелых элементов I группы к легким, то уже у лития делаются за-
метными особые свойства, связанные с малыми размерами его иона. Гало-
гены в противоположность водороду в водных растворах не обнаруживают
Тенденции к образованию положительных ионов, т. е. в этом отношении они
совсем не похожи на водород.
Однако есть соединения, в которых водород существует в виде отрица-
тельного иона. Это гидриды щелочных и щелочноземельных металлов (а так-
же, возможно, и некоторых других). Способность водорода находиться в
кристаллической решетке в виде отрицательно заряженных иоиов резко от-
личает его от щелочных металлов и, наоборот, сближает с галогенами
217
Юднако в водных растворах в отличие от галогенов водород отрицательного
иона не образует.
В виде простого вещества водород, с одной стороны, при нормальных
условиях образует двухатомную молекулу, как и галогены, но с другой —
при очень высоком давлении переходит в металлическое состояние (опять
проявляется сходство со щелочными металлами).
Если рассматривать окислительно-восстановительные свойства простых
веществ, то водород более закономерно поместить в I группу, а не в VII.
Действительно, подобно щелочным металлам водород является довольно
сильным восстановителем. Восстановительные свойства щелочных металлов
ослабевают от тяжелых металлов к более легким. У водорода оии более
слабые, чем у остальных элементов этой подгруппы. Как видим, отмечен-
ная выше закономерность соблюдается. Свободные галогены — сильные окис-
лители, причем их окислительные свойства усиливаются от иода к фтору.
•Значит, с точки зрения окислительно-восстановительных свойств простых
веществ считать водород полноправным членом подгруппы галогенов можно
было бы только в том случае, если бы он проявлял еще более сильные
окислительные свойства, чем свободный фтор!
Как мы могли убедиться, можно привести достаточно весомые доводы
в пользу того, чтобы помещать водород и в I, и в VII группу. Однако мно-
гие химики (в том числе и автор) считают, что лучше всего помещать во-
дород в главную подгруппу I группы, но не забывать при этом его осо-
бых свойств как самого легкого элемента.
Вопрос. Какие элементы называются щелочноземельными?
Как это ии странно, часто на этот простой вопрос дают неправильный
ответ, относя к таким элементам магний и бериллий. А ведь уже само на-
звание «щелочноземельный» исторически возникло потому, что оксиды этих
элементов («земли») дают с водой щелочь. Но щелочи образуют только
оксиды Са, Sr, Ва и Ra. Что же касается магния, то его оксид с водой вза-
имодействует очень плохо, и щелочи при этом не образуется. В этом мог
убедиться каждый, кто при занятиях гимнастикой натирал руки магнезией
(это одно из названий оксида магния). Если бы MgO взаимодействовал
с водой с образованием щелочи, то имеющаяся иа руках влага, реагируя
с MgO, превратилась бы в сильиощелочной раствор, что привело бы к хи-
мическому ожогу кожи, одиако этого ие происходит. Оксид же бериллия
амфотерен, и ему соответствует амфотерный гидроксид с очень слабыми кис-
лотными и основными свойствами. Итак, щелочноземельные металлы — это
Са, Sr, Ва и Ra.
§ 2. Задачи типа предлагаемых
иа конкурсных экзаменах
1. При анализе сплава серебра путем растворения его в азотной кисло-
те с последующим осаждением хлорида серебра масса последнего оказа-
лась равной массе взятого для анализа образца сплава. Какова массовая
.доля (в процентах) серебра в сплаве?
2. Вычислите число молекул в 1 мл воздуха при и. у.
3. Какой объем кислорода необходим для сжигания 10 л смеси СО и
Н2, если ее плотность по водороду равна 6,2. Изменится ли объем кисло-
рода, если соотношение СО и Н2 в смеси будет иным?
4. В какой массе карбоната кальция содержится столько же углерода,
сколько в 32 г метана?
5. Установите формулу вещества, в состав которого входят водород,
углерод, кислород и азот в массовом соотношении 1 : 3 : 4 : 7.
6. При сжигании вещества, состоящего из водорода и азота, образо-
валось 0,27 г воды и 168 мл азота (и. у.). Исходное вещество в газообразном
состоянии имеет плотность по воздуху 1,1. Установите его молекулярную
-формулу.
7. В каком объемном соотношении следует смешать метан и водород,
218
•чтобы для полного сгорания любого объема этой смеси расходовался такой
же объем кислорода при тех же условиях? Изменится ли это соотношение,
если изменить условия, при которых измеряется объем газов?
8. При н. у. 4,48 л смеси азота и углекислого газа имеют массу 8 г.
^Вычислите массу каждого газа в смеси.
9. 2 л смеси азота с метаном после поджигания взаимодействуют без
-остатка с 2 л кислорода. Определите состав смеси по объему.
10. Один из оксидов хлора содержит 47,4% кислорода. Плотность по
водороду этого оксида в газообразном состоянии равна 33,75. Установите
формулу оксида.
11. Какое количество нитрата аммония и с помощью каких реакций
можно получить, имея в распоряжении 112л воздуха (н.у.) и неограниченное
.количество воды?
12. На основании термохимического уравнения
СН4+2 О2—804 кДж=СО2+2 Н2О
•вычислите, сколько тепла выделится при сжигании 1 м3 метана, взятого при
щ. у.
13. Через избыток известковой воды был пропущен 1 л смеси СО и
СО2. Выпавший при этом осадок был отфильтрован, высушен, взвешен. Его
масса оказалась равной 2,45 г. Вычислите состав газовой смеси в объем-
ных процентах.
14. Прн обработке навески, состоящей из смеси кремния, алюминия и
карбоната кальция, раствором щелочи выделилось 17,92 л газа (п. у.); при
•обработке такой же навески соляной кислотой выделилось тоже 17,92 л
газа (н. у.), при пропускании которого через раствор гидроксида кальция
образовалось 16,2 г кислой кальциевой соли. Установите состав смеси.
15. При прокаливании 50 г смеси карбоната аммония, фосфата магния
карбоната кальция ее масса уменьшилась до 21,6 г. При добавлении к этому
•остатку воды и пропускании в полученную взвесь избытка СО2 осталось 16 г
.нерастворимого остатка. Вычислите массу каждой соли в смесп.
16. Из 12 г оксида магния при действии на него избытка галогеново-
дородной кислоты получено 28,5 г соли. Какая кислота была взята?
17. При растворении в щелочи 4,5 г сплава алюминия с магнием выде-
лилось 3,36 л водорода (н. у.). Вычислите процентный состав сплава.
18. При нагревании 6,06 г нитрата щелочного металла образовалось
5,10 г нитрита. Нитрат какого металла был взят?
19. При действии соляной кислоты на смесь магния с карбонатом маг-
ния выделилось 11,2 л газа (и. у.). После сжигания газа и конденсации
водяных паров объем газа уменьшился до 4,48 л (и. у.). Определите про-
центное содержание металлического магния в смеси.
20. Смешали 200 мл 50%-кого (плотность 1,5 г/см3) и 500 мл 20%-иого
(плотность 1,2 г/см3) растворов соляной кислоты. Вычислите процентную
концентрацию полученного раствора.
21. Какой объем хлороводорода (и. у.) надо взять для получения 100 мл
35%-ного раствора соляной кислоты (плотность 1,175 г/см3)?
22. В закрытом сосуде взорвано 60 мл смеси водорода с избытком
кислорода, находившейся при 110 °C и атмосферном давлении. После взры-
ва и проведения продуктов реакции к тем же условиям объем газовой сме-
сп составил 48 мл. Вычислите состав (по объему) исходной смеси.
23. Вычислите процентную концентрацию раствора, полученного раство-
рением 11,2 л аммиака (н. у.) в 191,5 г воды.
24. При обработке 3,8 г смеси карбоната и гидрокарбопата натрия со-
ляной кислотой выделилось 896 мл газа (и. у.). Определите массу каждой
соли в смеси.
25. Какие молярные количества фосфата калия и нитрата натрия сле-
дует взять, чтобы раствор содержал те же ионы и в том же количестве, что
и раствор, содержащий 0,3 моль нитрата калия, 0,1 моль фосфата натрия и
0,1 моль нитрата натрия?
26. Для нейтрализации ортофосфориой кислоты, полученной сжиганием
219
некоторого количества фосфора, израсходовано 25 мл 25 %-иого раствора
гидроксида натрия (плотность 1,28 г/см3), причем при нейтрализации образо-
вался гидрофосфат натрия. Вычислите массу исходного фосфора.
27. Какую массу 7,45%-иого раствора хлорида калия, следует подверг-
нуть электролизу, чтобы выделившийся газ вытеснил из бромида калия 16 г
брома?
28. При обжиге 48,5 г сульфида неизвестного двухвалентного металла
выделился газ, который обесцветил раствор, содержавший 127 г иода. Ка-
кой это металл?
29. Сколько литров хлора и водорода (н. у.) потребуется для полу-
чения 200 г 18,25%-иого раствора соляной кислоты?
30. После гидрирования смеси метана с этиленом ее плотность по водо-
роду возросла на 0,25. Вычислите состав исходной смеси в объемных про-
центах.
31. Какие вещества и в каком количестве следует взять для получения
50 г 13,6%-кого раствора этилата натрия в этиловом спирте?
32. При полном электролизе 1 л водного раствора нитрата меди (плот-
ность раствора принимаем равной плотности воды) на аноде выделилось
3,36 л газа (н. у.). Вычислите массу вещества, выделившегося на катоде, и
процентную концентрацию исходного раствора.
33. В каком массовом соотношении следует взять две навески металли-
ческой меди, чтобы при внесении одной из них в концентрированную серную-
кислоту, а другой — в разбавленную азотиую выделились одинаковые объемы-
газов?
34. Установите молекулярную формулу органического вещества, при сжи-
гании 4,6 г которого было получено 8,8 г СО2 и 5,4 г воды. Плотность паров-
этого вещества по водороду равна 23.
35. При сжигании 1,44 г вещества образовалось 0,53 г карбоната натрия,.
1,456 л СО2 (н. у.) и 0,45 г воды. Установите формулу вещества.
36. Для сжигания 20 л смеси метана и пропана израсходовано 55 л
кислорода. Вычислите состав смеси метана и пропана в объемных процен-
тах.
37. Какие вещества и в каком количестве образуются при взаимодейст-
вии 10,8 г бутадиена с 48 г брома?
38. К 4 л смеси метана и этилена прибавили 4 л водорода и всю смесь
пропустили при нагревании над платиновым катализатором, после чего объем
смеси уменьшился до 7 л. Вычислите объемный состав исходной смеси.
39. Плотность по водороду смеси метана и этилена 12,5. Вычислите
состав смеси в объемных процентах.
40. Установите молекулярную формулу и напишите возможные струк-
турные формулы соединения, при сжигании 0,2 моль которого образуется
10,8 г воды и 17,92 л углекислого газа (н. у.).
41. Бромная вода, содержащая 6 г брома, полностью прореагировала с
23,5 г водного раствора фенола. Вычислите процентную концентрацию раство-
ра фенола.
42. При восстановлении 61,5 г нитробензола получено 44 г анилина.
Каков выход реакции в процентах от теоретического?
43. Какая масса глюкозы подверглась спиртовому брожению, если при-
этом выделилось столько же газа, сколько его образуется при полном сгора-
нии 20 мл метанола (плотность 0,8 г/см3) ?
44. Смесь метана и этилена подвергли гидрированию, после чего плот-
ность смеси газов по водороду составила 13,25. Определите соотношение-
объемов метана и этилена в исходной смеси.
45. При полном окислении 3,92 г смеси муравьиной, уксусной и щавеле-
вой кислот образовалось 2,24 л СО2 (н. у.). Для нейтрализации' того же-
количества смесн потребовалось 80 мл раствора едкого натра, содержащего-
40 г NaOH в 1 л. Вычислите молярное количество каждой кислоты в
смеси.
46. Установите молекулярную формулу этиленового углеводорода, зная,,
что после его взаимодействия с избытком бромоводорода относительная мо-
220
лекулярная масса продукта оказалась в 2,45 раз больше, чем у исходного
углеводорода.
47. К 560 мл смеси этилена и ацетилена добавили водород до объема
2 л. После пропускания полученной смеси газов над платиновым катализа-
тором ее объем уменьшился на 33,6%. Определите объемный состав исход-
ной смеси. Все объемы измеряются в одинаковых условиях.
48. При сжигании 6 г некоторого вещества в 3,36 л кислорода было по-
лучено 2,24 л СО2, 3,6 г воды и 2,24 л азота. Объемы газов измерены при
и. у. Установите формулу вещества.
49. После взрыва смеси одного объема газообразного углеводорода и
двух объемов кислорода образовалось два объема водяного пара и один
объем СО2. Все объемы газов измерены в одинаковых условиях. Установите
формулу углеводорода.
50. При реакции металлического калия с 1,48 г алифатического спирта
выделилось 224 мл водорода (н. у.). Установите молекулярную формулу
спирта.
51. При действии металлического натрия на 29 г смеси этилового и
пропилового спиртов выделилось 6,72 л водорода (н. у.). Вычислите массу
каждого спирта в смеси.
52. 200 мл паров органического вещества, состоящего из углерода, во-
дорода и кислорода, смешали с 900 мл кислорода и сожгли. Общий объем
газов после реакции составил 1,3 л, после конденсации паров воды .— 700 мл,
после пропускания через раствор щелочи — 100 мл. Объемы газов измерены
в одинаковых условиях. Установите формулу вещества.
53. Какой объем СО (н. у.) должен вступить в реакцию с NaOH, чтобы
образовалось 8,5 г формиата натрия?
54. Каротин имеет молекулярную формулу С4оН56. Сколько двойных
связей в молекуле каротина, если 1,072 г каротина прореагировали в при-
сутствии катализатора с 492,8 мл водорода (н. у.) ?
55. Какую массу перманганата калия и какой объем 40%-ной соляной
кислоты (плотность 1,2 г/см3) нужно взять для получения количества хлора,
достаточного для того, чтобы прохлорировать 11,2 л этилена (н. у.)?
56. При нагревании водного раствора пирофосфорной кислоты Н4Р2О7
образуется ортофосфорная кислота, Какой должна быть процентная кон-
центрация раствора пирофосфорной кислоты,, чтобы при нагревании его
получился 10%-иый раствор ортофосфорной кислоты?
57. Вычислите процентную концентрацию раствора хлорида натрия,
если при пропускании хлора, выделившегося в результате полного элек-
тролиза 250 г такого раствора, через раствор KI образовалось 6,35 г иода.
58. При растворении в соляной кислоте 10,4 г смеси железа и магния
выделилось 6,72 л водорода (н. у.). Определите массу каждого металла в
смеси.
59. При обработке избытком соляной кислоты 15,5 г смеси алюминия,
магния и меди выделилось 7,84 л газа (н. у.). Не растворившийся в соля-
ной кислоте остаток обработали концентрированной азотной кислотой, при
этом выделилось 5,6 л газа (н. у.). Вычислите массу каждого металла в
смеси.
60. При реакции одновалентного металла с водой образуется хорошо
растворимое в воде вещество и выделяется газ, причем масса растворенного
вещества в граммах относится к объему выделившегося газа (н. у.) в
литрах, как 5:1. Какой это металл?
61. Газ, выделившийся при нагревании 10,7 г хлорида аммония с из-
бытком щелочи, был поглощен раствором, содержавшим 19,6 г ортофос-
форной кислоты. Вычислите состав и массу получившейся соли.
62. Какой должна быть масса алюминия, чтобы при действии на него
кислоты получилось количество водорода, достаточное для восстановления
окспда меди, образовавшегося при термическом разложении 6,66 г малахита
(СиОН)2СО3?
63. Для анализа на содержание углекислого газа 1120 л (н. у.) воз_-
духа из промышленного помещения пропустили через раствор, содержащий
221
избыток Ва(ОН)2. При этом выпал осадок массой 3,94 г. Вычислите содер-
жание СО2 в воздухе в объемных процентах.
64. Остаток после прокаливания 53,6 г смеси карбонатов кальция и маг-
ния имел массу 27,2 г. Определите массу каждой соли в смеси.
65. Вычислите процентный состав смеси, состоящей из порошков алю-
миния, магния и песка, если известно, что при действии на 2,5 г этой смеси’
раствора едкого натра выделяется 1,12 л водорода, а при обработке такого-
же количества смеси соляной кислотой выделяется 2,24 л водорода. Объемы:
газов измерены при н. у.
66. 2 г смеси нодида и хлорида калия растворили в воде, через рас-
твор пропустили избыток хлора, затем раствор выпарили и остаток нагре-
вали до постоянной массы. Масса остатка составила 1,634 г. Определите-
процентное содержание иодида калия в смеси.
67. Навеску из смеси медных, железных и золотых опилок обработали
концентрированной азотиой кислотой. При этом выделилось 6,72 л газа
(н. у.) и осталось 10,4 г опилок. При растворении такой же навески в со-
ляной кислоте выделилось 3,36 л газа (и. у.). Определите массу каждого ме-
талла в смеси.
68. При действии нитрата серебра на раствор, содержавший 6 г сме-
си бромидов калия и натрия, было получено 10,46 г бромида серебра. Вы-
числите массу каждой соли в смеси.
69. При растворении в воде 15,4 г сплава калия с натрием выделилось.
6,72 л водорода (н. у.). Каково молярное соотношение металлов в сплаве?
70. В 20 мл 32%-ного раствора едкого натра (плотность 1,35 г/см3)
растворили СО2, полученный сжиганием 1,12 л этана (н. у.). Какая обра-
зуется соль и какова ее концентрация в растворе?
71. Какой объем 8%-ного раствора гидроксида натрия (плотность-
1,09 г/см3) нужно взять для нейтрализации 75 мл раствора серной кислоты,,
если известно, что из 10 мл того же раствора можно получить 0,233 г
сульфата бария.
72. Какое количество серного ангидрида и 49%-ной серной кислоты по-
требуется для приготовления 300 г 83,3%-ного раствора серпой кислоты?
73. При сжигании смеси 40 мл неизвестного газа с 30 мл кислорода-
образовалось 20 мл азота и такое количество воды, при действии на кото-
рую избытком металлического натрия выделяется 30 мл водорода. Установи-
те формулу газа.
74. К 3 л смеси оксидов азота (II) и азота(IV) с относительной плот-
ностью по водороду 18,2 прибавили 2 л кислорода. Как изменится после
этого объем смеси? Все объемы измерены при одинаковых условиях.
75. В результате полного окисления 7,83 г сплава двух металлов обра-
зовалось 14,23 г смеси их оксидов, причем степени окисления двух металлов-
равны соответственно +2 и +3, а молярные количества двух оксидов оди-
наковы. При обработке смеси этих оксидов щелочью пе растворилось 4,03 г
смеси. Какие металлы содержал сплав?
76. 24,8 г оксида одного из щелочных металлов растворили в 175,2 г
воды. Вычислите процентную концентрацию полученного раствора, если ок-
сид содержал 25,8% кислорода.
77. 58,8 г дихромата калия было восстановлено пропусканием через
его раствор некоторого количества сернистого газа. Определите массу и со-
став соли, которая образовалась бы при пропускании такого же количества
сернистого газа через 300 г 3,4%-ного раствора аммиака.
78. 0,74 г смеси уксусного и муравьиного альдегидов прореагировали
с избытком аммиачного раствора оксида серебра, в результате чего восста-
новилось 6,48 г серебра. Чему равна масса каждого альдегида?
79. На нейтрализацию 7,2 г какой одноосновной органической кислоты-
потребовалось 29,28 г, 5М раствора КОН (плотность 1,22 г/см3)?
80. Какое количество карбоната кальция теоретически потребуется для
получения такого количества карбида кальция (углерод имеется в избытке),
чтобы из последнего можно было получить через ацетилен 15 г уксусной-
кислоты?
222
ОТВЕТЫ К ЗАДАЧАМ
Глава 1
13. 3:8. 14. 14%, 35%, 47%. 15. 70 г. 16. 461 кг. 17. Магнитный желез-
няк. 18. 12,5 г. 19. 1,54 т. 20. 25,6% Си, 12,8% S, 4% Н н 57,6% О
21. 500 кг. 25. NO. 26. Н2ТеО4, +6. 27. Железо. 28. Н3РО4. 29. Меди.
30. ЗВеО • А12О3 • 6SiO2. 31. СЭН8О4. 32. C2H6S. 33. С2Н6О. 34. Н2 и О2._
35. 112 л азота, 90 мл воды. 36. 2,14 г, 2,14 г, 12,9 г. 37. 0,509 л, 0,386 л,
11,2 л. 38. 28; 4,67-10-23, 14. 39. 5,6 л. 40. 273 °C. 41. Два. 43. Плот-
ность по водороду в 14,5 раз больше. 44. 36,4. 45. 91,3%. 46. 16,7 л СО,
8,3 л СО2. 47. 2,24 л. 48. 22,4 л NO2, 5,6 л Ог, 9 мл Н2О. 49. 8,96 л.
50. 0,8 А. 51. 0,25 моль О2, 0,75 моль СО2, 1,00 моль Н2О. 52. 8 мл СО,.
12 мл СО2. 53. Уменьшилось в 1,25 раза. 54. С4Ню. 55. C2N2. 56. СН4О.
57. CO(NH2)2. 58. FeO.
Глава 2
2. 17:3. 3. 0,035 моль/л азота, 0,095 моль/л водорода. 4. 5,8%. 5. 4,3 г
AgNO3. 6. Увеличится иа 2 г. 7. 7000 м3. 8. 41,8%. 9. 31,5 г. 10. Не хватит.
11. 8960 м3. 12. 2,02 л. 13. 86%. 14. 85%. 15. 8,4 л. 16. 372 г. 17. 210,4 г.
19. Энергетический эффект реакции 393 кДж. 20. Энергетический эффект ре-
акции 2600 кДж. 21. 25,5 МДж. 22. 558 кДж. 23. 12,8 МДж, 15,9 МДж.
25. 820,4 кДж/моль. 28. /<=125, 0,12 моль/л. 29. [N2] = 4 моль/л, [Н2]=
= 12 моль/л, 1,83 • 10~3. 30. [Н2О] = 0,4 моль/л, [Н2] = 0,1 моль/л. 36. Увели-
чится в 9 раз. 37. В 2 раза. 38. Увеличится в 256 раз. 39. v=k [В] [С]2; уве-
личится в 125 раз.
Глава 3
4. 65,4% цника. 5. 28 г КОН. 6. 0,745 А. 15. Щелочная. 17. 2 моль
NaHSO4. 22. 14 г. 23. 21,75 г. 24. 11,2 л. 26. а) 2,8 л; б) 5.6 л. 28. 126 г
NaHCO3. 31. KCr(SO4)2 • 12Н2О.
Глава 4
6. 6 моль. 7. Na2SO4-7H2O. 8. 16:25. 9. 61,1 кДж. 10. 360 г. 11. 9,8%.
12. 0,025 моль. 13. 180 г. 14. 22,2 г. 15. 6%. 16. 300 г. 17. 300 г. 18. 40г.
19. 30%. 20. 30 г 10%-иого и 90 г 50%-иого. 21. 3,75%. 22. 25%. 23. 131,5 кг.
24. 49,1 л. 25. 25,03 л. 26. 468,1 и 38,4 мл. 27. 1341 и 3674 мл. 28. 128 и
572 г. 29. 251,8 г. 30. 789 г. 31. 5,2 г раствора и 44,8 г соли. 32. 60 г.
33.286 г. 34. 0,032 М. 35. 0,025 М. 36. 0,2 моль/л А н 0,12 моль/л В.
37. 1 : 10. 38. 21,3%, 2,5 М. 39. 9,2 М. 40. 29,7 мл. 41. До 115 мл. 42. 70%,
22S
15,6 М. 43. 0,62 моль. 44. 454 мл, 11,2 л. 45. 86 г. 46. 0,625 М. 47. 6,55 г.
48. 500 мл. 49. 33,4 г, 20,2%. 50. 125 мл. 51. 0,02 М. 52. Добавлять ие на-
до— карбонаты в избытке. 53. 8,7 г калия, 41,5 г воды. 54. 25%. 55. 9 кг.
56. 35,5 г. 57. 30 г. 58. 70 г. 59. 25 г воды, 42,5 г KNO3. 60. ПО г. 61. 66 г.
62. 104,6 г воды, 78,4 г CuSO4. 68. 0,5 моль КзРО4, 2 моль NaNO3. 73. 1%.
74. Уменьшится. 76. 6-Ю-6 моль, 3,61 • 1018 ионов. 77. 4-Ю-10. 78. К=
= 4-10~6, а=2%. 79. 6-10“5. 80. 8-Ю-5 моль/л, 3,2 - 10~8. 81. 4-10~2 М.
85. Уменьшить в 10 раз. 86. 2; 1,7; 12; 12,3; 2,7; 12,7. 87. 0,4. 88. 1 : 108.
89. 1,8- 10-1% да. 12,3. 91. 0,01; 5 10-“; 10—3; 5-Ю-5 моль/л. 92. 4,4.
93. 2-Ю-8. 94 1 М, 1,7. 95. 0,1 М. 96. Увеличится на 0,3. 97. Увеличится на
0,3. 98. 1350 мл. 99. Первая — сильная, вторая — слабая. 100. а) 12,74;
б) 2,26. 102. 25 мл. 103. 1,7. 104. 11,24. 105. 9:1. 108. FeCl3, FeCl2, NaCI,
NaHCO3. Na2CO3, NaOH. 115. 1,1 -10-10. 116. 5-10-10. 117. nP = 3-10~5;
12,6; 11,74. 118. 1,15-IO-4 моль/л соли и карбонат-иона, 2,3- 10~4 моль/л Ag%
растворимость ЗД • 10-3 г. 119. 0,06г. 120. 60 л. 121. В чистой воде в 8000
раз выше. 122. Да. 123. Порядка 1014 т.
Глава 5
26. Углерод. 27. Цинк. 28. Титан. 29. Алюминия.
Глава б
7. 62,4 мл, 5,6 л. 8. 7 моль. 12. 4,48 л хлора, 2,69% СиС12. 13. 96.5%.
14. Калия. 15. 12,57%.
Задачи типа предлагаемых на конкурсных экзаменах
1. 75,3%. 2. 2,69 • 1019 молекул. 3. 5 л. 4. 200 г. 5. N2H4CO, или
(NH2)2CO. 6. N2H4. 7. 1 : 2. 8. 1,4 г азота и 6,6 г углекислого газа. 9. 50%
каждого. 10. С1О2. 11. 4 моль. 12. 35,9 МДж. 13. 55% СО2. 14. 3,1 р крем-
ния, 10,8 г алюминия, 20 г СаСОз. 15. 24 г (NH4)2CO3, 16 г Mg3(PO4)2 и
10 г СаСО3. 16. Соляная кислота. 17. 60% алюминия. 18. Нитрат калия.
19. 30%. 20. 30%. 21. 25,2 л. 22. 24 мл Н2, 36 мл О2. 23. 4,25%. 24. 2,12 г
Na2CO3, 1,68 г NaHCO3. 25. 0,1 моль К3РО4, 0,4 моль NaNO3. 26. 3,1 г.
27. 200 г. 28. Цинк. 29. 11,2 л каждого. 30. 25% этилена. 31. 2,3 г Na, 47,8 г
С2Н5ОН. 32. 19,2 г, 5,6%. 33. 2:3. 34. С2Н5ОН. 35. NaC7H5O2, или
CeHsCOONa. 36. 15 л СН4, 5 л С3Н3. 37. 0,1 моль С4Н6Вг2, 0,1 моль С4Н6Вг4.
38. 3 л СН4, 1 л С2Н4. 39. 75% С2Н4. 40. С4Н6. 41. 5%. 42. 94,7%. 43. 45 г.
44. 25% СН4. 45. По 0,02 моль каждой. 46. С4Н8. 47. 448 мл. С2Н4, 112 мл
С2Н2. 48. N2H4CO. 49. СН4. 50. С4Н9ОН. 51. 23 г этилового и 6 г пропило-
вого. 52. С3Н6О. 53. 2,8 л. 54. 11. 55. 31,6 г, 122 мл. 56. 9%. 57. .1,17%.
58. 5,6 г железа, 4,8 г магния. 59. 2,7 г алюминия, 4,8 г магния, 8 г меди.
60. Калий. 61. 23,0 г NH4H2PO4. 62. 1,08 г. 63. 0,04%. 64. 33,6 г MgCO3,
20,0 г СаСОз. 65. 36% А1, 48% Mg, 16% SiO2. 66. 33,2%. 67. 9,6 г Си, 8,4 г
Fe, 2,0 г Аи. 68. 4 г NaBr, 2 г КВг. 69. 1 : 5. 70. 33,7% Na2CO3. 71. 6,88 мл.
72. 138 г SO3 и 162 г раствора. 73. NH3. 74. Уменьшится на 0,9 л. 75. Маг-
ний и алюминий. 76. 16%. 77. 59,4 г NH4HSO3. 78. 0,44 г ,СН3СНО и 0,3 г
СН2О. 79. СНзСООН. 80. 0,25 моль или 25 г.
ОГЛАВЛЕНИЕ
Предисловие (3). —Роль химии в развитии народного хозяйства страны (5).
Раздел 1. ОБЩАЯ ХИМИЯ
Глава 1. Основные понятия и законы химии .
§ 1. Предмет химии (15).— § 2. Атомно-молекулярная теория (15).—
§ 3. Химический элемент (19). — §4. Простое вещество. Аллотро-
пия (22).— § 5. Сложное вещество. Моль. (23).— § 6. Закон Азо-
гадро (24). —§7. Валентность. Степень окисления. Химические
формулы (2Q). —Упражнения к главе / (28).
Глава 2. Химические реакции..........................................
§ 1. Уравнения химических реакций (31).— § 2. Типы химических
реакций (32).— § 3. Химическое равновесие (37). — § 4. Скорость
химических реакций (43). —§ 5. Катализ (50), — Упражнения к гла-
ее 2 (55).
Глава 3. Классы неорганических соединений.............................
§ 1. Оксиды (58). — § 2. Основания (61). — § 3. Кислоты (62), —
§ 4. Амфотерные оксиды и гидроксиды (64). — § 5. Соли (&). —
§ 6. Двойные и смешанные соли. Краткие сведения о комплексных
соединениях (70). —§7. Написание графических формул оксидов,
оснований, кислот и солей (72). — Упражнения к главе 3 (74).
Глава 4. Химия растворов ............................................
§ 1. Дисперсные системы (76). — § 2. Общая характеристика рас-
творов (78). — § 3. Сольваты и гидраты (80). —§ 4. Тепловые явле-
ния при растворении (82). — §5. Способы выражения концентра-
ции растворов (82). — § 6. Растворимость и ее зависимость от
внешних условий (84).— §7. Равновесия в водных растворах элек-
тролитов (87). — § 8. Ионное произведение воды. Водородный по-
казатель (95). —§9. Гидролиз солей (97). — § 10. Произведение
растворимости. Условия образования и растворения осадков
(100). — Упражнения к главе 4 (104).
Глава 5. Периодический закон и строение вещества ....
§ 1. Последовательность заполнения электронами энергетических
уровней. Явление периодичности (110).— § 2. Структура периодиче-
ской системы (114). — § 3. Элементарные представления о хими-
ческой связи (121).— § 4. Строение кристаллов (130). — Упражнения
к главе 5 (134).
Глава 6. Окислительно-восстановительные реакции......................
§ 1. Основные понятия (136). — §2. Типы окислительно-восстанови-
тельных реакций (137). — § 3. Типичные окислители и восстано-
вители (138). — §4. Составление уравнений окислительно-восста-
новительных реакций (139). — § 5. Электролиз (144). — Упражнения
к главе 6 (148).
Раздел!!. НЕОРГАНИЧЕСКАЯ ХИМИЯ
Глава 7. Простые вещества............................................
§ 1. Металлы и неметаллы (150). —§2. Окислительно-восстанови-
тельные свойства простых веществ. Ряд напряжений металлов
(158). —§ 3. Общие свойства металлов. Сплавы (161). — § 4. Полу-
чение металлов из природных соединений (169). — §5. Получение
неметаллов в виде простых веществ (175).
Глава 8. Соединения элементов главных подгрупп.......................
§ I. Соединения с водородом (178). — §2. Кислородные соединения
(184).
Глава 9. Особенности химии элементов побочных подгрупп
§ 1. Общая характеристика элементов (200). — § 2. Специфика про-
стых веществ и соединений, образуемых переходными элементами
(205).
Приложение. Задачи и упражнения...............................
.-' 4 1. Разбор некоторых задач (211).— § 2. Задачи типа предлагае-
мых на конкурсных экзаменах (218). — Ответы к задачам (223). .
15
31
58
76
110
136
150
178
200
211
БЕСПЛАТНЫЕ
УЧЕБНИКИ!
ВРЕМЕН СССР
БОЛЬШАЯ БИБЛИОТЕКА
НА САЙТЕ
«СОВЕТСКОЕ ВРЕМЯ»
sovietime.ru
СКАЧАТЬ