Author: Реунов А.А.
Tags: общая и теоретическая биология зоология биология издательство наука размножение животных сперматогенез многоклеточные животные
ISBN: 5-02-033687-4
Year: 2005
Text
% t
1 , ' • t ■ , ;
I
i I i
\
I
I ч
I
I
J
*\
*. л
>
V
*
российская академия наук
дальневосточное отделение
институт биологии моря
А.А. Реунов
Сперматогенез
многоклеточных
ЖИВОТНЫХ
МОСКВА НАУКА 2005
УДК 573
ББК 28.67
Р44
Ответственный редактор
академик ВЛ. КАСЬЯНОВ
Рецензенты:
доктор биологических наук В.Н. ИВАНКОВ,
доктор биологических наук В.В. ЮШИН
Реунов А.А.
Сперматогенез многоклеточных животных / А.А. Реунов ; [отв. ред. В.Л.
Касьянов] ; Ин-т биологии моря. - М.: Наука, 2005. - 123 с. - ISBN 5-02-033687-4 (в пер.).
В монографии на основе литературных и оригинальных данных обсуждаются вопросы эволюции
сперматозоидов, полиморфизм мужских гамет, терминологические проблемы сравнительной спермато-
логии и представление о сперматогенезе Metazoa. На примере ряда видов беспозвоночных и позвоночных
проведен анализ ультраструктурных особенностей дифференциации примитивных, модифицированных
и аберрантных сперматозоидов. Предложена концепция эволюции спсрматогенных клеток, согласно
которой жгутиковость последних является плезиоморфным признаком. По мнению автора, в филогенезе
многих таксонов произошел переход от анцестральной категории, образно характеризуемой как
"жгутиковый" сперматогенез, к типу "специализированного" сперматогенеза, при котором сперматогенные
клетки свободны от структурного сходства с архаичной жгутикевой клеткой. Книга иллюстрирована
рисунками и электронограммами.
Для цитологов, зоологов, эмбриологов, интересующихся вопросами репродуктивной биологии, а
также студентов биологических факультетов.
ТП 2005-11-118
Reunov А.А.
Spermatogenesis of multicellular animals / А.А. Reunov ; [Ed. by V.L. Kas'yanov] ;
Institute of Marine Biology. - Moscow : Nauka, 2005. - 123 p. - ISBN 5-02-033687-4
(incloth).
The monograph presents literature and original data on sperm evolution, polymorphism of male gametes,
terminological problems and metazoan spermatogenesis. Using a wide range of invertebrate and vertebrate species, an
analysis of ultrastructural features of primitive, modified and aberrant spermatozoa differentiation was conducted.
The author offers the concept of evolution of spermatogenic cells suggesting that flagellation of latter is a plc-
siomorphic sign. Correspondingly phylogenesis of numerous taxa might display a transition from the ancestral
category, characterised as "flagellate" spermatogenesis, to the type of "specialized" spermatogenesis when
spermatogenic cells are free of similarity to the archaic flagellate cell. The book is abundantly illustrated with drawings and
micrographs.
For cytologists, zoologists and embryologists who are interested in reproductive biology questions, and for
students of biological faculties.
ISBN 5-02-033687-4 © Российская академия наук, 2005
© Реунов А.А., 2005
© Редакционно-издательское оформление.
Издательство "Наука", 2005
ОТ АВТОРА
Идея этой книги родилась из кажущегося ничтожным по своему значению
факта обнаружения жгутиков у сперматогенных клеток некоторых морских
беспозвоночных. Первой реакцией моих коллег в России и за рубежом при
обнародовании данной особенности был скепсис, который в процессе дискуссии
закономерно сменялся благосклонной солидарностью. Например, профессор
Родезского университета Южной Африки Элан Ходсон сначала отказался
считать демонстрируемые мною жгутиковые клетки брахиопод и двустворчатых
моллюсков сперматогониями на том основании, что согласно
общепризнанному мнению, изложенному в учебниках цитологии, формирование жгутиков
сперматозоидов всегда начинается на заключительном этапе сперматогенеза -
в сперматидах. Позднее Элан признал, что и более ранние сперматогенные
клетки могут быть жгутиковыми, но это произошло только после того, как я
показал ему его собственную статью, в которой на фото был очевиден
жгутиковый сперматогоний в гонаде хитона. С удивлением глядя на странный
жгутик, Элан Ходсон согласился с существованием феномена, который далее
образно характеризуется как "жгутиковый сперматогенез" и с того момента стал
первооткрывателем этого явления у хитонов.
Я благодарен случайно обнаруженным жгутикам за несомую ими
значимость, в конечном итоге позволившую сформулировать гипотезу эволюции га-
метогенных клеток. В некоторой степени их заслуга есть и в том, что работа на
великолепных берегах Дальнего Востока России, на знойных флоридских
пляжах Смитсониановской морской биологической станции, в бритвенно-скали-
стых прибойных зонах Южной Африки и у полного глубокого тепла
Южно-Китайского моря Гонконга сделала мою научную жизнь экзотично-интересной и
насыщенной знакомствами с прекрасными людьми разных национальностей.
С огромным удовольствием я выражаю признательность своему учителю в
области гаметогенеза профессору А.Л. Дроздову, директору Института биологии
моря ДВО РАН академику В.Л. Касьянову, члену-корреспонденту РАН В.В.
Малахову, члену-корреспонденту РАН А.В. Адрианову, профессору В.В. Исаевой,
профессору Э.Н. Ходсону, профессору М.Е. Райе, профессору В.Л. Клепал,
профессору Р.С.С. By, доктору философии Д.В.Т. Ау, к.б.н. А.В. Чернышеву, к.б.н.
С.Ш. Даутову, к.б.н. Е.Е. Костиной, аспирантам О.В. Юрченко, СЮ. Незнановой,
Я.Н. Александровой и А.В. Калачеву за совместные исследования
сперматогенеза у некоторых представителей многоклеточных животных. Я признателен
профессору А.В. Реунову, профессору Д.М. Кумминсу и профессору Б.А. Афцелиу-
су за ценные советы, данные мне в процессе написания этой монографии.
ВВЕДЕНИЕ
На биологических факультетах гаметогенез у многоклеточных
животных традиционно преподается как часть эмбриологии. Начало этой
традиции затеряно в том далеком времени, когда эмбриологи носили
парики и исследовали свои объекты в светооптическом приборе,
изобретенном гениальным А. ван Левенгуком. Судя по хронологии развития
цитологических исследований, формирование копошащихся живчиков
довольно долго представлялось второстепенным процессом, лишь
предвосхищавшим великолепную и загадочную цепь событий,
начинающуюся после проникновения живчика в яйцеклетку. Несмотря на бурное
развитие эмбриологии, даже на рубеже XIX и XX столетий только
некоторые ученые исследовали дифференциацию половых клеток,
делая это в очень ограниченном круге животных. Однако в XX в.
ультраструктурные, биохимические, молекулярно-биологические и
генетические аспекты гаметогенеза у различных представителей Metazoa стали
объектом широчайшего интереса, и сегодня область науки, которая
условно может быть охарактеризована как "гаметология", пожалуй,
обрела статус равнозначный эмбриологии.
Одним из направлений гаметологии является сравнительная спермато-
логия. Развитие электронной микроскопии выявило значительное
разнообразие ультраструктуры мужских гамет, исследованию которых было
посвящено большое количество публикаций. Совокупность накопленныхультра-
структурных данных позволила итальянскому "сперматологу" Б. Баччетти
[Baccetti, 1984] сформулировать концепцию эволюции сперматозоидов
многоклеточных животных, которая с некоторыми неизбежными
дополнениями пользуется признанием и сегодня.
Несмотря на успехи в области понимания эволюционных
преобразований морфотипов зрелых мужских гамет, в сравнительной сперматологии все
еще отсутствует концепция эволюции ранних сперматогенных клеток -
сперматогониев, сперматоцитов и сперматид, благодаря довольно
длительной дифференциации которых и происходит формирование
сперматозоидов. В данной книге внимание читателей привлечено к вопросу эволюции
именно этих клеток, которая, по мнению автора, происходила наряду с
эволюцией дифференцированных гамет.
Согласно современным представлениям, главным вектором
эволюции сперматозоидов является последовательная трансформация
примитивного морфотипа в модифицированный, а модифицированного -
4
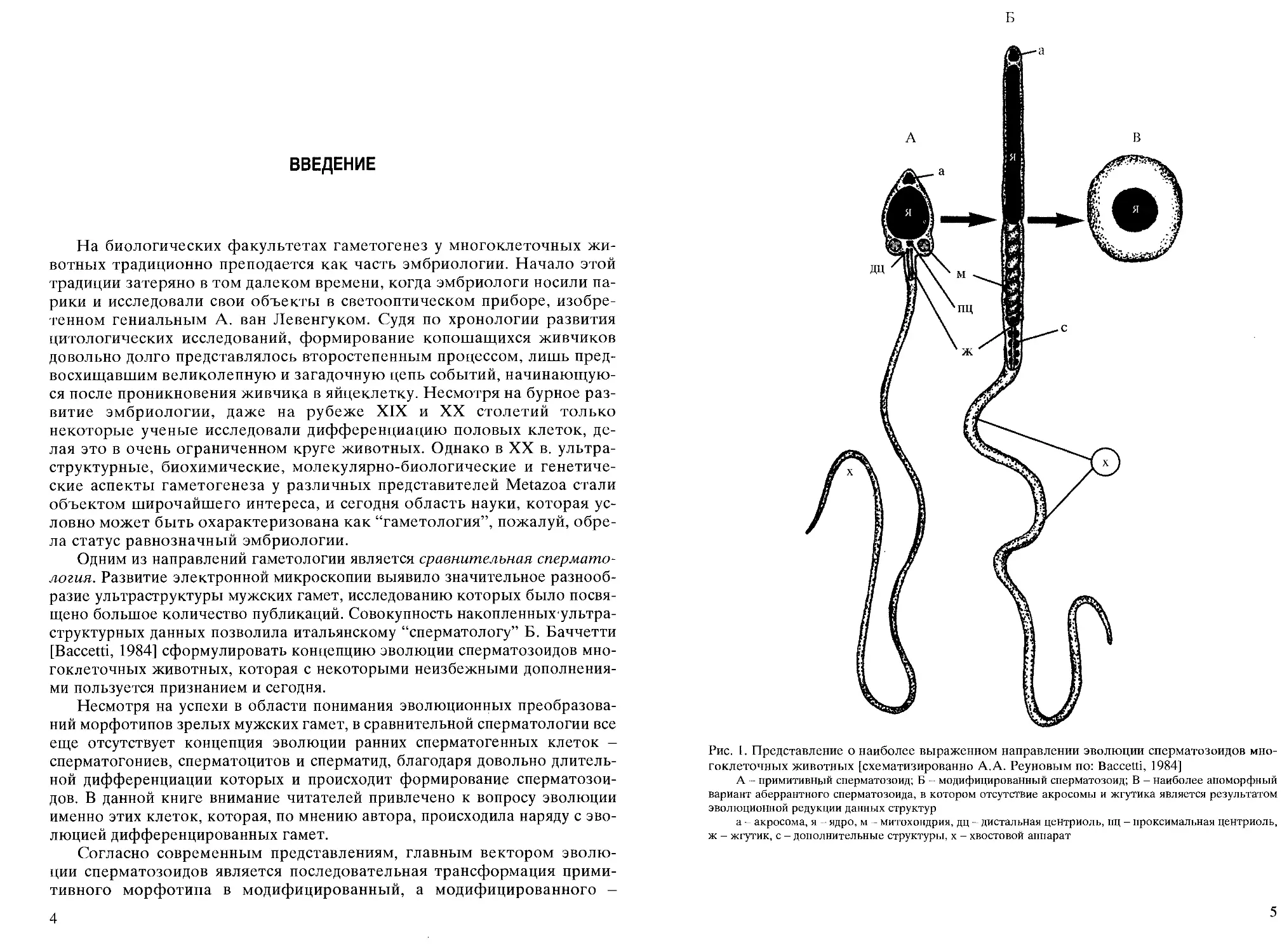
Рис. 1. Представление о наиболее выраженном направлении эволюции сперматозоидов
многоклеточных животных [схематизированно А.А. Реуновым по: Baccetti, 1984]
А - примитивный сперматозоид; Б - модифицированный сперматозоид; В - наиболее апоморфный
вариант аберрантного сперматозоида, в котором отсутствие акросомы и жгутика является результатом
эволюционной редукции данных структур
а - акросома, я - ядро, м - митохондрия, дц - дистальная центриоль, пц - проксимальная центриоль,
ж - жгутик, с - дополнительные структуры, х - хвостовой аппарат
5
в аберрантный (рис. 1 А-В). Примеры полной или частичной реализации
этой простой формулы прослеживаются во многих таксонах
многоклеточных животных. Для того, чтобы нагляднее продемонстрировать суть
преобразований, вероятно, произошедших в ультраструктуре ранних
сперматогенных клеток, сперматогенез в данной книге рассматривается
путем последовательного сопоставления примеров дифференциации
каждого из трех морфотипов мужских гамет, привлеченных из
филогенетически удаленных групп.
Глава 1
ПРЕДСТАВЛЕНИЯ ОБ ЭВОЛЮЦИИ СПЕРМАТОЗОИДОВ
МНОГОКЛЕТОЧНЫХ ЖИВОТНЫХ
Открытие сперматозоидов было сделано изобретателем светооптиче-
ской оптики нидерландцем А. ван Левенгуком в 1677 г. Этот исследователь,
обнаруживший царство Protozoa, принял движущиеся клетки за
разновидность простейших. Так как объектом исследования были пациенты,
больные сифилисом, то именно новым "анималькулям" А. ван Левенгук
приписал роль возбудителей страшного заболевания. Впоследствии он установил,
что данные "простейшие" являются нормальным компонентом семени
людей, собак, птиц и других животных [по: Baccetti, 1984].
Термин "сперматозоид" впервые был введен К. Бэром в 1827 г. [по:
Данилова, 1977]. Первый тезис сравнительной сперматологии принадлежит А.
фон Келликеру [Kolliker, 1841 - по: Afzelius, 1984], который заключил, что
семя различных животных содержит подвижные спермин, морфология
которых варьирует в очень узких пределах. Это положение было
опровергнуто Г. Ретциусом [Retzius, 1904 - по: Franzen, 1956], который провел
сравнительный анализ сперматозоидов представителей различных групп
животных и показал их бесконечные вариации. Этот исследователь пришел к
выводу, что в природе не существует даже двух видов беспозвоночных или
позвоночных с одинаковыми сперматозоидами, чем сформулировал
основополагающий принцип видовой специфичности морфологии мужских гамет.
Ему понадобилось увидеть сперматозоиды всего лишь нескольких десятков
видов животных, чтобы прийти к заключению, которое не опровергнуто
до сих пор. Действительно, пока не найден ни один пример структурного
совпадения сперматозоидов у разных, даже близких, видов. Г. Ретциус
[Retzius, 1904 - по: Franzen, 1956] обнаружил, что многие примитивные
морские организмы, использующие наружный способ осеменения, имеют
сперматозоиды довольно простого типа и назвал этот тип "примитивным".
Мужские гаметы, которые выглядели более сложными по сравнению с
примитивным морфотипом, он охарактеризовал как "модифицированные" и
"аберрантные" [Retzius, 1904; 1909 - по: Franzen, 1956]. Считается [Afzelius,
1984], что именно этот первый опыт выделения морфологических вариаций
сперматозоидов положил начало ликвидации хаоса в сперматологии.
С 50-х г. XX в. наиболее заметный вклад в развитие сравнительной
сперматологии был внесен последователем Г. Ретциуса зоологом А. Франзеном,
который стал автором концепции, предполагающей существование
корреляции между морфологией сперматозоидов и способом осеменения. При
исследовании мужских гамет в широком ряду морских обитателей, он подтвер-
7
дил предположение Ретциуса о том, что примитивными сперматозоидами
обладают беспозвоночные с наружным осеменением. Благодаря его
наблюдениям стало очевидно, что организмы с усложненными типами осеменения
(наружно-внутреннее или внутреннее) имеют преимущественно
модифицированные сперматозоиды с удлиненными головками или аберрантные
мужские гаметы, отличающиеся как от примитивных, так и от
модифицированных спермиев [Franzen, 1955; 1956; 1970]. Представление о трех основных
типах мужских гамет (примитивный, модифицированный, аберрантный),
постепенно формируемое работами Г. Ретциуса [Retzius, 1904 - по: Franzen,
1956], А. Франзена [Franzen, 1955; 1970], Б. Баччетти и Б. Афелиуса
[Baccetti, Afzelius, 1976], легло в основу теории эволюции сперматозоидов
многоклеточных животных, окончательно сформулированной Б. Баччетти
[Baccetti, 1984; 1985].
В соответствии с этой теорией наружное осеменение и примитивный
сперматозоид (рис. 1 А), который у различных Metazoa конвергентно
соответствует морфотипу, определяемому наличием пулевидной головки с
отходящим от нее жгутиком (9 + 2), являются исходными категориями
репродуктивной эволюции. У беспозвоночных, для которых наружное осеменение
не является возможным в силу специфических условий обитания (в толще
донного грунта, тесном пространстве трубки и др.) или небольших размеров
тела, сформировались различные способы наружно-внутреннего, а затем и
внутреннего способов осеменения, предвосхищающих становление
настоящей копуляции. Одним из переходных репродуктивных паттернов является
передача сперматофора. В примитивном варианте самец просто оставляет
сперматофор в месте, в котором его находит самка, при таком половом
акте партнеры даже не встречаются друг с другом [Lipovsky et al, 1957 - по:
Baccetti, Afzelius, 1976]. Более прогрессивные варианты передачи
сперматофора сопровождаются его фиксацией на теле самки или даже его введением
в женские половые пути, что повышает успех процесса осеменения. В
некоторых случаях возможен перенос сперматофора путем прокалывания
стенки тела, что называется дермальной или гиподермальной импрегнацией
[Whitman, 1889; Manton, 1938 - по: Baccetti, Afzelius, 1976]. Другой
переходной разновидностью внутреннего осеменения является псевдокопуляция,
при которой встреча гамет происходит в толще наружного слизистого
кокона. Собственно копуляцией считается процесс внутреннего осеменения, при
котором используются половые органы, а сперматозоиды переносятся в
толще жидкости, вырабатываемой специализированными железами [см.
Baccetti, Afzelius, 1976; Baccetti, 1984].
Как резюмировано в совместной монографии Б. Баччетти и Б. Афцели-
уса [Baccetti, Afzelius, 1976], становление способов осеменения, отличных от
наружного, сделало условия движения мужских гамет более сложными. Так,
покидая сперматофор, сперматозоиды выполняют перемещение, специфика
которого различна у разных представителей. У некоторых беспозвоночных
они движутся по телу самки в поисках полового отверстия, а у других -
продвигаются в толще паренхимы или в половых протоках. В условиях
псевдокопуляции и копуляции мужские гаметы находятся в вязкой среде. Во всех
подобных случаях им приходится преодолевать значительное механическое
сопротивление. Следствием появления осложненных условий явилась моди-
8
фикация примитивного морфотипа, на основе которого возникли
сперматозоиды, имеющие удлиненное ядро и хвостовой аппарат, усиленный
дополнительными структурами и муфтообразным расположением митохондрий.
Несмотря на филогенетически сопряженное разнообразие таких клеток, их
строение в различных таксонах в общих чертах подчинено единому
морфотипу, который принято характеризовать как "модифицированный
сперматозоид" (рис. 1 Б). Таким образом, на определенном этапе появилась более
мощная модель репродуктивной клетки [см. Baccetti, Afzelius, 1976; Baccetti,
1984; 1985].
Согласно концепции Б. Баччетти [Baccetti, 1984], дальнейший ход
эволюции определялся развитием форм внутреннего осеменения, в процессе
совершенствования которых прогрессировал комплекс благоприятных
условий взаимодействия гамет. Одним из следствий становления рациональных
репродуктивных способов явилось ослабление необходимости в активном
движении. Такие механические факторы как оснащение жгутика
дополнительным количеством микротрубочек или фибрилл, объединение
митохондрий в спиральные ленты или удлиненные конгломераты, только у
некоторых современных форм многоклеточных служат усилению двигательной
активности. В большинстве же случаев периаксонемальные структуры,
присутствующие в хвостовых аппаратах модифицированных сперматозоидов,
выполняют скелетную функцию, не направлены на усиление кинетических
свойств, а часто и ограничивают их [Fawcett, Ito, 1965; Baccetti et al., 1976;
Данилова, 1978; Baccetti, 1984; 1985]. В эволюции сперматозоидов многих
таксонов осуществилось не просто ограничение, а резкое ослабление
подвижности, "методом" которого явилось появление измененных аксонемальных
формул, таких, например, как 9 + 0, 9+1,9 + 3, 9 + 4, 9 +5, 9 +7, а также
таких как 12 + 0, 18 + 0 и многих других [см. Baccetti et al., 1969; Данилова, 1978;
Afzelius, 1982; Baccetti, 1984]. Еще более радикальным средством редукции
жгутиков стало их полное исчезновение в результате чего появились
безжгутиковые формы мужских гамет, неподвижных или передвигающихся
амебоидно [Baccetti, 1984; 1985].
Одним из постулатов, внедренных в сперматологию Б. Баччетти
[Baccetti, 1984], является представление о том, что в эволюции акросом
сперматозоидов многоклеточных животных также существует тенденция к
упрощению строения и полному исчезновению. Итальянский исследователь
предположил, что в результате становления рациональных форм
осеменения происходило упрощение яйцевых оболочек, в результате чего начала
ослабевать необходимость в их активном преодолении, что явилось
причиной редукции акросом в некоторых ветвях Metazoa. Этой гипотезе были
созвучны данные о том, что, например, у насекомых Diptera наблюдается
эволюция от акросом с перфораториумами к более простым акросомам без
перфораториумов [Dallai et al., 1984]. Позитивным аргументом явилось и то,
что у позвоночных прослеживается переход от акросомы,
функционирующей по классическому типу с образованием актинового филамента [Franklin,
1970; Cherr, Clark, 1984], к более упрощенному варианту акросомной
реакции в виде везикуляции мембраны шапочковидной акросомы с
последующим выходом акросомального материала [Bedford, 1970; Russel et al., 1979;
Meizel, 1984]. Очень вероятным, представляется то, что постепенная редукция
9
акросомы модифицированных сперматозоидов, связанная с упрощением
яйцевых оболочек или возникновением в них специализированных
отверстий - микропиле, привела к полному исчезновению акросом у спермиев
представителей многих групп [Baccetti, 1984; 1985].
Таким образом, в эволюции модифицированных спермиев, по-видимому,
существуют две тенденции, связанные с постепенным совершенствованием
внутреннего осеменения - тенденция к исчезновению жгутика и тенденция к
исчезновению акросомы. Частичное или полное совпадение результатов
этих тенденций, по мнению Б. Баччетти [Baccetti, 1984], привело к
возникновению разнообразных спермиев аберрантного типа, у которых наличие
акросомы может сочетаться с отсутствием жгутика, а жгутик может
присутствовать в спермиях, лишенных акросом. У некоторых беспозвоночных
произошла полная потеря акросом и жгутиков, например, у нематод [Ward et al.,
1981; Baccetti et al., 1983], ручейников [Fridlander, Morse, 1982], термитов
[Baccetti et al., 1981]. Схематично наиболее апоморфный паттерн
аберрантного спермия, не имеющего никаких признаков акросомы и жгутика,
представлен на рис. 1 В.
Итак, согласно теории Б. Баччетти [Baccetti, 1984; 1985], представление
об эволюции сперматозоидов многоклеточных животных сводится к
пониманию данного процесса как постепенного морфологического
преобразования примитивного морфотипа в модифицированный, а
модифицированного - в аберрантный (рис. 1 А-В).
Стройность теории Б. Баччетти в начале 1990-х гг. была нарушена
антагонистической версией, декларирующей эволюционную первичность
сперматозоидов модифицированного типа. Это предположение, выдвинутое
Б. Джемисоном [Jamieson, 1991a] и, поддержанное его последователями
[Rouse, Fitzhugh, 1994; Buckland-Nicks, Sheltema, 1995], основано на том
факте, что представители некоторых базовых таксонов беспозвоночных имеют
не примитивные, а модифицированные сперматозоиды. В результате
возникла гипотеза, предполагающая, что внутреннее осеменение и
модифицированные сперматозоиды являются анцестральными для ранних Bilateria
[Buckland-Nicks, Sheltema, 1995]. По мнению авторов новой версии,
примитивные сперматозоиды могли возникнуть неотенически из недодифферен-
цированных сперматид, потенциально направленных на формирование
модифицированных мужских гамет. Несмотря на то что эта гипотеза
выглядит интересной, ее суть легко ставится под сомнение предположением
о том, что модифицированные гаметы обсуждаемых видов являются
продуктом эволюции примитивных гамет вымерших предковых форм.
Позитивно конформистскими кажутся представления о более
разноплановом пути эволюции способов осеменения и сопряженной с ним эволюции
сперматозоидов, согласно которым как примитивные, так и
модифицированные и аберрантные сперматозоиды могли являться продуктом эволюции
анцестральных гамет и способов осеменения [см. Дроздов, 1984; Реунов,
Малахов, 1993; Дроздов, Иванков, 2000; Reunov, Klepal, 2004]. В то же время
кажется вполне вероятным, что версия, созданная Б. Баччетти [Baccetti, 1984],
действительно отражает направление генеральной линии эволюции
мужских гамет, происходившей в большинстве крупных таксонов
многоклеточных животных.
Глава 2
ПРОБЛЕМЫ ХАРАКТЕРИСТИКИ
МУЖСКИХ ГАМЕТ
При изучении публикаций, посвященных сперматогенезу и строению
сперматозоидов, для автора этой книги стал очевиден терминологический
кризис, существующий в сперматологической литературе. В данной главе
изложена суть этого кризиса и предлагается уже частично опубликованное
[Реунов, 1993; Реунов, 1998а] дополнение к классификации сперматозоидов
Metazoa.
Как уже говорилось выше (см. гл. 1), Г. Ретциус [Retzius, 1904 - по:
Franzen, 1956] обнаружил, что многие примитивные морские организмы,
использующие наружный способ осеменения, имеют сперматозоиды
довольно простого типа и назвал этот тип "примитивным". Мужские
гаметы, которые выглядели иначе, он характеризовал как
"модифицированные" и "аберрантные" [Retzius, 1904; 1909 - по: Franzen, 1956].
Впоследствии термины "примитивный сперматозоид", "модифицированный
сперматозоид" и "аберрантный сперматозоид" были использованы
А. Франзеном [Franzen, 1955; 1956], после чего они прочно вошли в
научную литературу и часто используются вплоть до настоящего времени.
Но, уже около 20 лет назад стало ясно, что постоянно расширяющееся
представление о разнообразии сперматозоидов уже не может быть
исчерпывающе охарактеризовано только этими традиционными
терминами. Так, например, среди беспозвоночных, обнаружены примеры
структурных отклонений от схемы примитивного сперматозоида,
сформулированной Г. Ретциусом и А. Франзеном. Согласно этой схеме,
примитивный сперматозоид (см. рис. 1 А) имеет сферическую или коническую
головку с отходящим от нее жгутиком. Головка состоит из акросомы,
ядра, а также средней части, в которой находятся митохондрии,
кольцеобразно сгруппированные вокруг центриолей (проксимальной и дисталь-
ной), одна из которых (дистальная) является базальным тельцем
жгутика. Однако среди примитивных сперматозоидов можно встретить такие
морфологические особенности как отсутствие акросомы, удлиненное
ядро, асимметричность, единые митохондриальные конгломераты,
объединенные центриоли и т.д. [Afzelius, 1978; Berruti et al., 1978; Cotelli et al.,
1980; Franzen, 1982; Реунов, 1993; Pashchenko, Drozdov, 1998; Rouse, Pitt,
2000]. Частая встречаемость в примитивных сперматозоидах
структурных вариаций, не соответствующих описаниям Г. Ретциуса и А. Франзе-
на, поставила под сомнение универсальность термина "примитивный
сперматозоид".
11
С употреблением терминов "модифицированный сперматозоид" и
"аберрантный сперматозоид" также имеются некоторые проблемы. Во-первых,
существуют промежуточные формы гамет, в строении которых
присутствуют элементы, как модифицированных, так и аберрантных сперматозоидов.
Во-вторых, авторы иногда, по-видимому, не видят большой разницы между
понятиями модифицированность и аберрантность. Так, например, спермин
нематод сначала могут быть названы аберрантными, а затем с тем же
подтекстом модифицированными [см. Coomans, 1981]. В ряде случаев
становится понятным, что авторы предпочитают использование термина
"аберрантный" вместо термина "модифицированный" и в этом случае речь идет
только о примитивных и аберрантных сперматозоидах [см. Sawada, 1984; Liicht,
Pfannenstiel, 1989]. Согласно некоторым литературным источникам, в
природе существуют только примитивные и модифицированные
сперматозоиды; при этом подразумевается, что термины "модифицированность" и
"аберрантность" являются синонимами [см. Rouse, Pitt, 2000]. Таким
образом, суть кризиса терминов Г. Ретциуса и А. Франзена заключается в том,
что понятия "примитивный сперматозоид", "модифицированный
сперматозоид" и "аберрантный сперматозоид" уже не достаточны для того, чтобы
охарактеризовать все разнообразие гамет промежуточных форм, а термины
"модифицированный" и "аберрантный", по мнению многих авторов,
являются взаимозаменяемыми.
Антагонистическим по отношению к традиционным терминам является
терминологический подход, введенный Д. Рузом и Б. Джемисоном [Rouse,
Jamieson,1987]. Предложенная ими реклассификация основана на выделении
промежуточного типа гамет. Для примитивных сперматозоидов (истинно
наружное осеменение), предложен термин "эктакваспермии".
Модифицированные сперматозоиды (внутреннее осеменение), охарактеризованы как
"интроспермии". Промежуточные формы, которые изначально
выбрасываются самцом в воду, а затем проникают в самку, названы "энтаквасперми-
ями". Эта классификация получила поддержку среди многих исследователей.
Совсем недавно Д. Руз и К. Питт [Rouse, Pitt, 2000] вынесли терминологии
Г. Ретциуса и А. Франзена суровый приговор и призвали исследователей к
полному переходу к терминам Д. Руза и Б. Джемисона. Тем не менее,
большинство авторов продолжает сохранять приверженность традиционной
терминологии, что приводит к существованию двух терминологических лагерей.
При рассмотрении этих конкурентных концепций, следует отметить,
что термины Г. Ретциуса и А. Франзена являются структурными, а
термины Д. Руза и Б. Джемисона - функциональными. Первые
характеризуют строение сперматозоидов, а вторые дают представление о способе
осеменения. Отдавая предпочтение системе Д. Руза и Б. Джемисона, мы
должны признать невозможность существования упорядоченных
структурных характеристик мужских гамет многоклеточных животных. Не
звучит ли это обескураживающе для цитологов и зоологов,
использующих морфологические параметры сперматозоидов в филогении? По
мнению автора книги, признание беспомощности традиционных терминов
Г. Ретциуса и А. Франзена является совершенно необоснованным. Их
сохранение представляется желательным, если признать желательным
сохранение сравнительно-морфологического подхода в характеристике
12
мужских гамет Metazoa. К тому же, успешное использование категорий
"примитивный сперматозоид", "модифицированный сперматозоид" и
"аберрантный сперматозоид" является легко осуществимым путем их
комбинированного использования [см. Реунов, 1993].
О МОДИФИЦИРОВАННОСТИ И АБЕРРАНТНОСТИ
СПЕРМАТОЗОИДОВ
Прежде чем предложить принцип комбинированного использования
традиционных терминов Г. Ретциуса и А. Франзена, следует
конкретизировать значение понятий модифицированность и аберрантность.
Характеризуя термины "модифицированный сперматозоид" и "аберрантный
сперматозоид", нужно вспомнить о том, что между ними существует
большая разница, в свое время подчеркиваемая классиками
сравнительной сперматологии [см. Afzelius 1982]. Термин "модифицированный
сперматозоид" имеет определенные морфологические критерии, описанные в
ряде работ [Franzen, 1956; Fawcett, 1970; Anderson, Persone, 1975; Afzelius,
Ferragutti, 1978 a, b; Afzelius, Dallai, 1988; Curtis et al., 1989; Jamieson et al.,
1996; Scheltinga et al., 2001]. Модифицированные сперматозоиды,
приспособленные к движению в плотных средах в условиях копуляции и
псевдокопуляции имеют довольно характерный устойчивый комплекс
признаков, конвергентно и независимо возникший в различных группах, что
делает такие репродуктивные клетки весьма похожими у различных
животных (см. гл. 1). Сперматозоиды этого типа имеют акросому, длинное
веретеновидное ядро, центриолярный аппарат из структурно единых цен-
триолей и хвостовую часть, в которой кроме жгутика могут
присутствовать дополнительные структуры. Митохондрии объединены в единый
удлиненный муфтообразный конгломерат, который в свое время
характеризовался как "Nebenkern" [Depdolla, 1928 - по: Franzen, 1956],
окружающий начальную часть жгутика. Данные структурные основы, иногда
дополненные варьирующими в разных группах специфическими
признаками, обуславливают обобщенную схему модифицированного
сперматозоида (см. рис. 1 Б).
Сперматозоиды аберрантного типа, встречающиеся у многих
беспозвоночных, не имеют единого плана строения. Разнообразие признаков
является, пожалуй, единственной общей чертой, характерной для аберрантных
мужских гамет. Само понятие тип сперматозоидов в данном случае условно
ибо под типом здесь может пониматься лишь условное объединение
структурно вариабельных репродуктивных клеток, приспособленных к
различным формам наружно-внутреннего и внутреннего осеменения.
Таким образом, очевидно значительное различие между понятиями
модифицированность и аберрантность. Модифицированность - это
соответствие конкретному типу сперматозоида. Аберрантность - это любое
отклонение от стереотипов примитивного и модифицированного сперматозоида.
Возвращение в научную литературу данного, изначально подразумеваемого
[см. Afzelius, 1982], но постепенно утраченного разграничения, необходимо
не только для восстановления утерянного смысла, но и для решения
терминологических недоразумений.
13
ХАРАКТЕРИСТИКА ПРИМИТИВНЫХ СПЕРМАТОЗОИДОВ
Каким образом в рамках схемы Ретциуса-Франзена могут быть
охарактеризованы разновидности примитивных сперматозоидов, имеющие
выраженные отличия от этой схемы? По мнению автора книги, данная задача
должна быть решена путем использования комбинированных терминов,
которые позволят выделить несколько категорий мужских гамет
примитивного типа.
Необходимо отметить, что примитивные сперматозоиды,
соответствующие описанию Г. Ретциуса и А. Франзена, скорее всего, не являются
самыми архаичными, а представляют собой продукт эволюции анцестральных
гамет [Реунов, Малахов, 1993; Дроздов, Иванков, 2000]. Взгляды многих
авторов о прототипе сперматозоида многоклеточных животных были
приведены в подробном обзоре А.Л. Дроздова [1984], по мнению которого,
прототипом следует считать мужские гаметы (флагеллоспоры) колониальных
жгутиконосцев, обычно имеющие два жгутика. Согласно гипотезе А.А. Ре-
унова и В.В. Малахова [1993], прототипом строения мужских гамет могли
являться клетки, сравнимые с жгутиковыми клетками бластулообразных
личинок. Это мнение основано на том факте, что в различных группах
простейших гаметами являются вегетативные клетки, испытавшие ту или иную
модификацию в связи с условиями осеменения. Преобразования, которые
испытывают гаметы простейших в сравнении с вегетативными клетками,
позволяют предположить, что и гаметы многоклеточных формировались на
основе плана строения эмбриональных недифференцированных
жгутиковых клеток. Как известно, наиболее примитивными среди Metazoa
считаются именно жгутиковые клетки [см. Малахов, 1990; Юшин и др., 1993; Frick,
Ruppert, 1997] имеющие ядро, большее или меньшее число митохондрий,
комплекс Гольджи, две центриоли, одна из которых является базальным
тельцем жгута. Им свойственно достаточно большое количество
цитоплазмы. Спермин, близкие по строению к такой жгутиковой клетке,
встречаются в наиболее примитивных группах многоклеточных. Так, у губок описаны
сперматозоиды с относительно большим объемом цитоплазмы, ядром,
содержащим неконденсированный хроматин, несколькими обычного размера
митохондриями, пузырьками, происходящими из аппарата Гольджи [Tuzet et
al., 1970; Ефремова, Папковская, 1980; Dias, Connes, 1980; Baccetti et al., 1986;
Paulus, 1989]. У ортонектид - примитивных многоклеточных из группы
Mesozoa сперматозоиды также имеют ядро с неконденсированным
хроматином, большой объем цитоплазмы, малоизмененные органеллы и тоже
могут обсуждаться, как сравнимые с прототипом [см. Малахов, 1990; Реунов,
Малахов, 1993]. Однако, вероятно и то, что данные примеры не являются
гарантированными носителями анцестральных признаков, а представляют
случаи специализации. Останки метазойных животных с безоговорочно ан-
цестральным паттерном мужских гамет сегодня покоятся в палеозойских
отложениях земной коры и недоступны для исследования. Применительно к
современной репродуктивной биологии, анцестральные гаметы могут
обсуждаться только гипотетически. Тем не менее, фундаментальная позиция в
категории "примитивный сперматозоид", по мнению автора, принадлежит
гипотетическому "анцестрально-примитивному сперматозоиду", по морфо-
14
типу близкому к недиференцированной жгутиковой клетке Metazoa.
Последующие ярусы этой категории должны быть заполнены примитивными
мужскими гаметами во всех разновидностях.
Одной из разновидностей являются примитивные сперматозоиды,
приспособленные к наружному осеменению, строение которых согласуется со
схемой (см. рис. 1 А), изначально сформулированой Г. Ретциусом [Retzius,
1904 - по: Franzen, 1956], пользовавшимся возможностями светового
микроскопа, а затем переутвержденной А. Франзеном [Franzen, 1955; 1956; 1970;
1983], в распоряжении которого была уже и электронная микроскопия.
Используя метод ультраструктурного анализа, А. Франзен подтвердил
значительную степень ультраструктурного сходства, конвергентно
сформировавшегося в процессе эволюции в примитивных сперматозоидах различных
беспозвоночных. На примере сперматозоида сипункулиды Phascolion cryptus
[по: Reunov, Rice, 1993] мы можем продемонстрировать, что характерными
особенностями примитивных мужских гамет являются компактная
обтекаемая головка и отходящий от нее жгутик, которые не содержат избыточной
цитоплазмы и так плотно "обтянуты" клеточной мембраной, что даже при
наружном рассмотрении в головке сперматозоида хорошо различимы
составляющие ее компоненты: акросома, ядро и средняя часть (см. вклейку,
табл. 1 А). Акросома состоит из электроноплотного акросомального ша-
почковидного конуса (акросомальной везикулы), под которым локализован
более светлый периакросомный материал (табл. 1 Б). Ядро содержит
конденсированный электроноплотныи хроматин (табл. 1 Б). Средняя часть
включает центриолярный аппарат, состоящий из двух центриолей, одна из
которых (дистальная) является базальным тельцем жгутика. Центриоли
окружены митохондриями (табл. 1 Б), организованными в кольцо, состоящее
из пяти органелл (табл. 1 Г). Неотъемлемым структурным признаком
примитивных сперматозоидов является перицентриолярный комплекс дисталь-
ной центриоли (базального тельца жгутика), состоящий из девяти
радиальных перицентриолярных элементов, которые можно увидеть на поперечных
срезах (табл. 1 Д). Проксимальная центриоль, прилегающая к базальному
тельцу, обычно оснащена одиночным перицентриолярным элементом,
имеющим вид фибриллярного отростка, локализованного в зоне ядерного
углубления - центриолярной ямке (табл. 1 Е). Абсолютным свойством
примитивных сперматозоидов является жгутик, строение которого соответствует
формуле 9 + 2 (табл. 1 Ж).
При относительно полном соответствии схеме Ретциуса-Франзена,
примитивные сперматозоиды разных видов многоклеточных животных имеют
индивидуальные особенности строения. Конкретизируя данную
вариабельность, А. Франзен и С. Райе [Franzen, Rice, 1988] подчеркивали, что митохон-
дриальное кольцо, у некоторых видов состоит не из пяти, а из четырех
митохондрий (см. вклейку, табл. 2 А), а среди ядер обычны округлая, овальная
и трапециевидная формы. Ультраструктурные исследования показали, что
даже перицентриолярные элементы могут быть устроены по-разному. Так,
например, перицентриолярный элемент проксимальной центриоли
сперматозоида альционарии Gersemia fruticosa имеет грибовидную форму
(табл. 2 Б), чем отличается от пальцевидного элемента сипункулиды P.
cryptus (табл. 1 Е). У гидромедузы Gonionemus vertens каждый из девяти радиаль-
15
ных выступов дистальной центриоли имеет три дополнительных
разветвления (табл. 2 В), а у актинии Anthopleura orientalis данные выступы
окаймлены сплошным кольцом (табл. 2 Г). Для примитивных сперматозоидов
характерна морфологическая вариабельность акросом, которую можно
оценить, рассмотрев, например, конусовидную акросому сипункулиды P. cryptus
(табл. 1 А) и шпилевидную акросому двустворчатого моллюска Perna viridis
(табл. 2 Д). Помимо различий в общей морфологии для акросом характерны
специфические ультраструктурные особенности. Например, акросомальная
везикула сперматозоида сипункулиды P. cryptus имеет темную
перфорированную кайму (табл. 1 В). Типичной особенностью периакросомного
материала сперматозоида P. viridis является наличие поперечно-исчерченного
осевого стержня (табл. 2 Е). Приведенные примеры демонстрируют лишь
два возможных варианта строения акросом, организация которых в
примитивных сперматозоидах может быть представлена самыми различными
"архитектурными" паттернами [см. Jamieson, Rouse, 1989].
Несмотря на некоторое структурное разнообразие примитивных
сперматозоидов, которые могут быть описаны в рамках схемы Г. Ретциуса и
А. Франзена, их принадлежность к одной категории является возможной в
силу ограниченности критериев, заданных этими исследователями. К числу
критериев можно отнести минимальное количество цитоплазмы,
незначительную вариабельность морфологии ядра в пределах округлой, овальной и
трапецивидной форм, характер расположения и количество митохондрий,
наличие двух центриолей, снабженных перицентриолярными элементами,
строение жгутика, а также симметричное расположение всех органоидов
относительно передне-задней оси клетки. Акросома любой формы, каким бы
своеобразным не был паттерн ее внутренней организации, легко
вписывается в схему Г. Ретциуса и А. Франзена, если является структурой,
симметрично расположенной в апикальной части сперматозоида.
Для того, чтобы отделить сперматозоиды, соответствующие схеме
Г. Ретциуса и А. Франзена, от мужских гамет других типов автор книги уже
предлагал [Реунов, 1993] обратиться к категории "классический
сперматозоид", введенной Б. Баччетти [Baccetti, 1984]. Данный термин был использован
итальянским исследователем как аналог термина примитивный
сперматозоид. Существуя раздельно друг от друга, эти определения, относящиеся к
одному понятию, лишь усугубляют терминологическую проблему. Но,
по-видимому, является вполне уместным применение термина "классический
сперматозоид" в комбинации с термином "примитивный сперматозоид".
В этом случае, разновидности мужских гамет, соответствующих схеме Рет-
циуса-Франзена, некоторые варианты строения которых представлены
здесь на электронограммах (табл. 1 А-Ж; табл. 2 А-Е) можно
охарактеризовать в рамках категории "примитивно-классический сперматозоид".
Распространенной категорией мужских гамет являются сперматозоиды,
используемые при наружном или наружно-внутреннем осеменении, но при
этом имеющие вытянутые ядра, что является причиной удлиненности
клеток. Удлиненность в этом случае может быть как незначительной (см.
вклейку, табл. 3 А), так и выраженной настолько, что гаметы уже трудно
считать примитивными и хочется назвать модифицированными (табл. 3 Б).
Тем не менее, в большинстве подобных случаев продолговатость ядра явля-
16
ется единственным признаком, отличающим сперматозоид от примитивно-
классического морфотипа. Так, например, сперматозоиды двустворчатого
моллюска Musculus laevigatus имеют значительно удлиненное ядро
(табл. 3 Д) и, если бы средняя часть этих гамет содержала удлиненный ми-
тохондриальный конгломерат, их безоговорочно можно было бы считать
модифицированными. Но, средняя часть сперматозоида М. laevigatus
устроена по типу примитивно-классических сперматозоидов, что делает
невозможным его отнесение к категории "модифицированный сперматозоид".
Сперматозоиды морских ежей обычно имеют слегка удлиненное ядро
(табл. 3 А, В) и единое митохондриальное кольцо (табл. 3 Г). Казалось бы
налицо два признака модифицированных сперматозоидов, но следует
отметить, что морфологически данные признаки выражены не очень явно. Мо-
дифицированность ядра и митохондриального воротничка имеет, как бы,
зачаточный вид, вследствие чего сперматозоид морского ежа все-таки трудно
назвать модифицированным. По мнению автора, в случаях, когда набор
признаков модифицированного сперматозоида выражен недостаточно полно
или недостаточно явно, данные признаки следует присоединять к
характеристике примитивного сперматозоида, считая их элементами
модифицированное™ [Реунов, 1993]. Так, сперматозоид морского ежа Anthocidaris cras-
sispina (табл. 3 А, В, Г) можно охарактеризовать как "примитивный с
элементами модифицированное™", такими как удлиненность ядра и кольцевое
строение митохондрии. Сперматозоид двустворчатого моллюска М.
laevigatus (табл. 3 Б, Д) является "примитивным с элементом модифицированно-
сти" в виде удлиненного ядра.
Когда в структуре примитивного сперматозоида содержатся
оригинальные (аберрантные) элементы, "искажающие" внешний и/или внутренний
морфотипы схемы Ретциуса-Франзена, сперматозоид можно
характеризовать с упоминанием этих элементов. Например, аберрантными элементами
сперматозоида актинии A. orientalis [по: Реунов, Костина, 1991] являются:
отсутствие акросомы, наличие проакросомальных везикул, асимметричное
расположение проакросомальных везикул не над апикальной поверхностью
ядра, а у его боковой поверхности, выраженная асимметричность кольцевой
митохондрии, большое количество цитоплазмы в средней части (см.
вклейку, табл. 4 А). Сперматозоид полихеты Neanthes japonica [no: Sato, Osanai,
1986] в целом является примитивным. Однако примитивный паттерн в
данном случае искажен наличием таких элементов аберрантности как: дисталь-
но направленная конусовидность ядра, большое количество цитоплазмы в
средней части, беспорядоченное расположение митохондрий (табл. 4 Б).
Достаточно даже внешнего взгляда на головки сперматозоидов полихеты
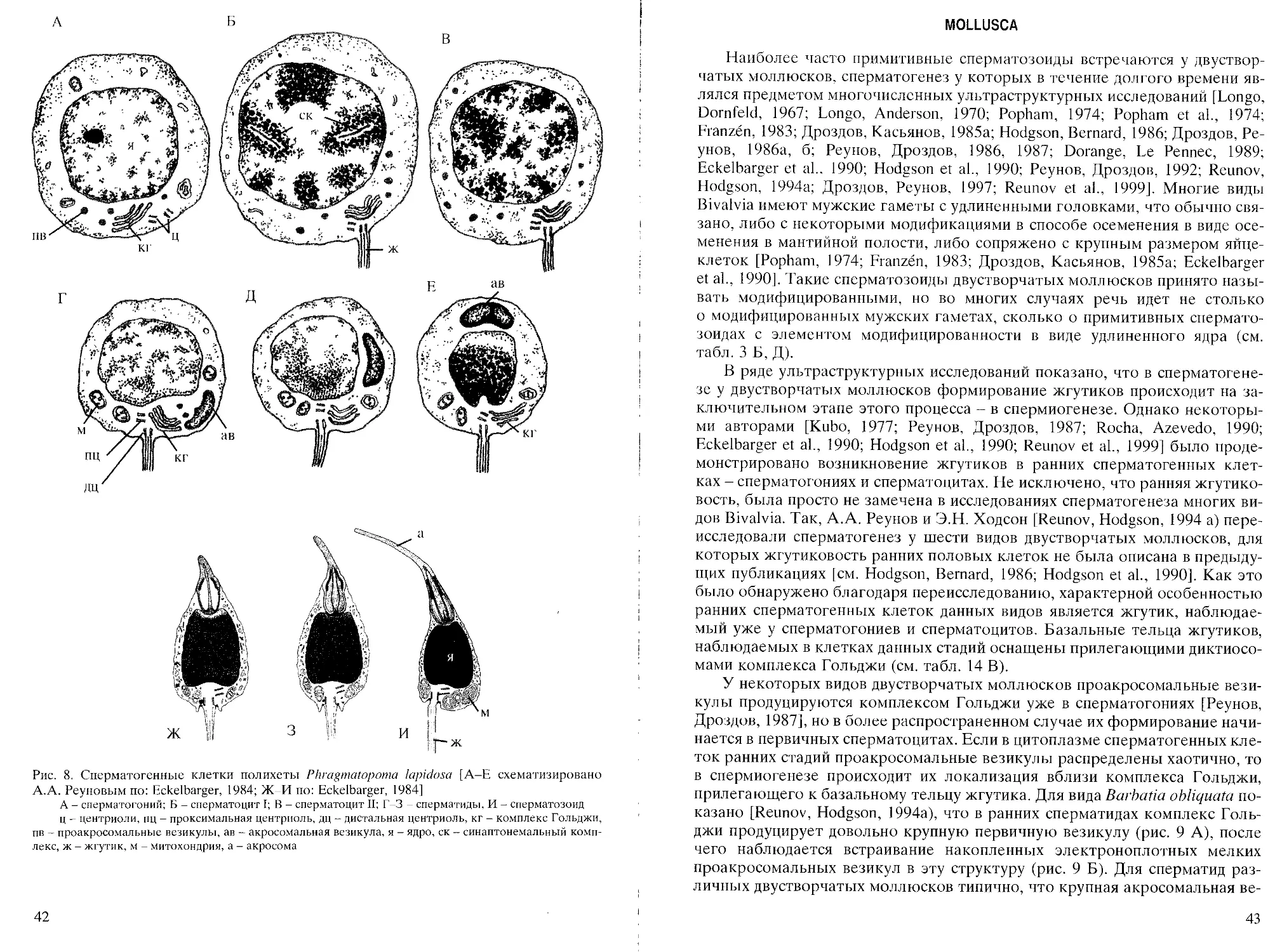
Phragmatopoma lapidosa [no: Eckelbarger, 1984], чтобы увидеть насколько
явно примитивный паттерн в данном случае изменен наличием такого
элемента аберрантности как боковая направленность акросомы (табл. 4 В). У
основания ядра сперматозоида двустворчатого моллюска Modiolus difficilis
[по: Дроздов, Реунов, 1986а; 1997] обнаружено не четыре или пять, как это
характерно для примитивно-классического морфотипа, а тринадцать
митохондрий, что является уникальной особенностью гамет модиолуса и может
считаться элементом аберрантности (табл. 4 Г). Сперматозоид
двустворчатого моллюска Septifer keenae [по: Реунов, Дроздов, 1986] был бы образцом
2 Реунов А. А. п
примитивно-классического типа, если бы его жгутик не был оснащен так
называемыми [см. Afzelius, 1982] "боковыми плавниками" (табл. 4 Д). Данное
структурное дополнение, обнаруженное у примитивных спермиев
некоторых двустворчатых моллюсков [Дроздов, Машанский, 1979], полихет
[Bertout, 1976], иглокожих [Hylander, Summers, 1975] и костистых рыб
[Afzelius, 1979], не учтено в схеме Ретциуса-Франзена, относится к разряду
оригинальных и, по-видимому, может трактоваться, как элемент
аберрантное™. В примитивных сперматозоидах костистых рыб элементом
аберрантное™ является отсутствие акросомы (табл. 4 Е).
Рассмотрение данных примеров позволяет увидеть насколько
разнообразными могут быть элементы аберрантности. Очевидно, что в
процессе дальнейших исследований будут описываться все новые и новые
варианты аберрантных особенностей, дополняющих структуру
примитивных сперматозоидов, характеристика которых может осуществляться в
рамках категории "примитивный сперматозоид с элементом
(элементами) аберрантности".
Довольно часто структура примитивных сперматозоидов может быть
дополнена как элементами модифицированности, так и элементами
аберрантности. Например, в сперматозоиде альционарии G.fruticosa [по: Реунов,
Даутов, 1991] кроме таких элементов аберрантности как утолщенность
средней части (см. вклейку, табл. 5 А) и отсутствия акросомы (табл. 5 Б),
имеется элемент модифицированности в виде слегка удлиненного ядра
(табл. 5 Б). В сперматозоиде немертины Procephalothris sp. [no: Reunov,
Klepal, 1997] модифицированность проявляется в удлиненности ядра
(табл. 5 В, Г) и кольцевой организации митохондрии (табл. 5 Д), а аберрант-
ность сопряжена с асимметричным расположением акросомы,
примыкающей к апикальной поверхности ядра боковой частью (табл. 5 Г). В
сперматозоиде двустворчатого моллюска Divariscintilla troglodytes [no: Eckelbarger
et al., 1990] присутствуют аналогичный элемент аберрантности в виде
асимметричного расположения акросомы и элемент модифицированности,
проявляющийся в удлиненности ядра (табл. 5 Е), но митохондриальное кольцо
состоит из пяти митохондрий (табл. 5 Ж), что является атрибутом
примитивно-классического паттерна мужских гамет. Таким образом, примитивные
сперматозоиды немертины и двустворчатого моллюска имеют по одному
элементу аберрантности (асимметричное расположение акросомы), но
различны по количеству элементов модифицированности; в первом случае их
два (удлиненность ядра, кольцевая митохондрия), а во втором - один
(удлиненность ядра). Дополняя структуру примитивного сперматозоида в разных
количественных вариациях, элементы модифицированности и
аберрантности обусловливают самостоятельную категорию мужских гамет, которая
может быть охарактеризована комбинированным термином "примитивный
сперматозоид с элементами модифицированности и аберрантности".
Таким образом, по мнению автора, можно выделить пять
разновидностей примитивных сперматозоидов, таких как "анцестрально-примитивный"
(гипотетический), "примитивно-классический", "примитивный с элементом
(элементами) модифицированности", "примитивный с элементом
(элементами) аберрантности", "примитивный с элементами модифицированности и
аберрантности". При общей характеристике мужских гамет, относящихся к
18
одному из перечисленных подразделении, представляется вполне уместным
употребление односложного термина "примитивный сперматозоид",
введенного еще Г. Ретциусом в 1904 г. [Retzius, 1904- по: Franzen, 1956].
ХАРАКТЕРИСТИКА МОДИФИЦИРОВАННЫХ СПЕРМАТОЗОИДОВ
Термин "модифицированный сперматозоид" должен употребляться при
относительно полном соответствии общей схеме, сформулированной еще на
светооптическом уровне Г. Ретциусом [Retzius, 1904 - по: Franzen, 1956] и
А. Франзеном [Franzen, 1956], а затем конкретизированной в электронно-
микроскопических исследованиях многих биологов [см. Данилова, 1978]. На
примере модифицированных сперматозоидов насекомых Megaselia scalaris
[по: Curtis et al., 1989] и Sialis lutaria [no: Afzelius, Dallai, 1988] можно
продемонстрировать, что с точки зрения общего морфотипа модифицированный
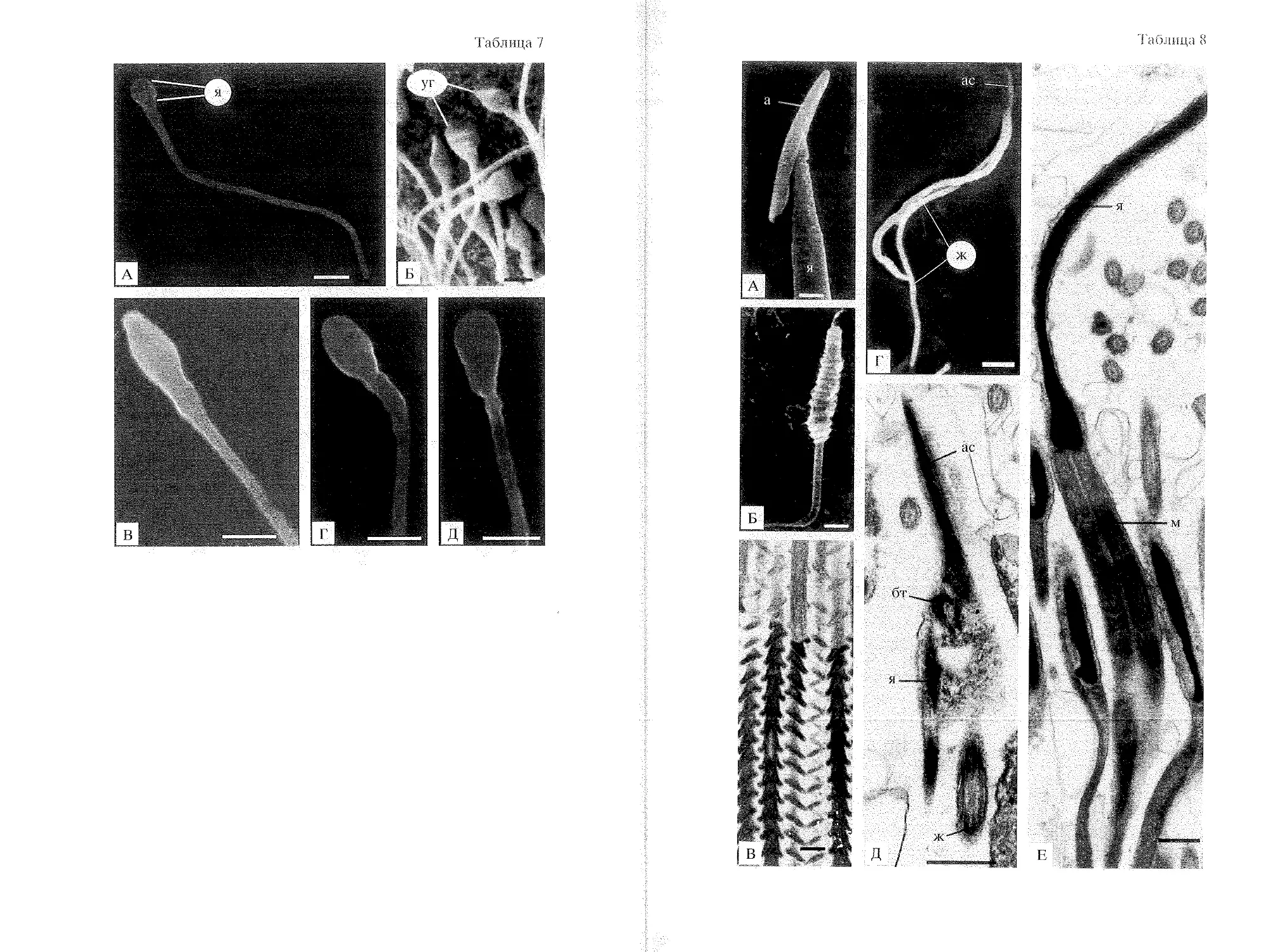
сперматозоид является удлиненной клеткой (см. вклейку, табл. 6 А), в
которой, как и в примитивном сперматозоиде имеются акросома, ядро, средняя
часть и хвостовой аппарат (табл. 6 А, Б). Разнообразные структурные
вариации акросом, встречающихся в модифицированных сперматозоидах
различных беспозвоночных и позвоночных, по-видимому, могут быть
рассмотрены как вписывающиеся в модифицированный паттерн, если они
являются симметричным продолжением ядра, а ультраструктурная организация их
вариаций по сути мало чем отличается от вариаций акросом примитивных
сперматозоидов. Длина ядра у модифицированных сперматозоидов может
быть различной; от длины ядра, сопоставимой с таковой у примитивных
сперматозоидов (см. вклейку, табл. 7 А) до длины, равной нескольким
десяткам микрометров. Митохондрии всегда организованы в удлиненную
"муфту", окружающую начальную часть жгутика. Муфта либо представляет
собой единую удлиненную митохондрию, либо состоит из двух или нескольких
удлиненных митохондрий. В некоторых случаях митохондрии закручены
вокруг жгутика (рис. 2 А). Кроме того, как это показано здесь на примере
модифицированного сперматозоида рептилии Pogona barbata [по: Oliver et al.,
1996], митохондриальный комплекс может состоять из группы небольших
митохондрий, соединенных друг с другом электроноплотной субстанцией
(табл. 6 В). В отличие от примитивных гамет, жгутик в модифицированных
сперматозоидах всегда оснащен скелетными структурами (табл. 6 В, Г).
Центриолярный аппарат в норме состоит из двух центриолей. Если
проксимальная центриоль может иметь перицентриолярный элемент, то, как это
постулировано М. Феррагути [Ferraguti, 1984], отсутствие каких-либо пери-
центриолярных элементов у базального тельца жгутика является типичным
свойством модифицированных сперматозоидов. Как и в примитивных
сперматозоидах, строение жгутика модифицированных мужских гамет во
многих случаях соответствует формуле 9 + 2.
Комбинированная характеристика модифицированных сперматозоидов
должна применяться при наличии в их структуре элементов, не входящих в
общую схему модифицированного сперматозоида. Например, характерной
особенностью сперматозоидов многих млекопитающих является ядро,
длина которого скорее соответствует таковой у примитивных сперматозоидов,
чем у модифицированных [см. Дроздов, Иванков, 2000]. В этом случае,
19
А Б
Рис. 2. Схема сперматозоида человека, представленная в двух проекциях [по: Fawcett, 1975]
а - акросома, я - ядро, м - митохондрия, ж - жгутик
внешнее сходство модифицированных сперматозоидов с примитивными
очень велико (табл. 7 А). Не исключено, что миниатюризация размеров
головок модифицированных сперматозоидов вторично произошла в эволюции
некоторых ветвей позвоночных животных, у которых вследствие большого
размера половых протоков самок условия осеменения приблизились к типу
наружного [Braden, Austin, 1954 - по: Baccetti, Afzelius, 1976]. Как бы там ни
было, но примитивно-подобная морфология головок модифицированных
сперматозоидов не позволяет считать такие гаметы полностью
соответствующими эталону модифицированного морфотипа. Их структурная
характеристика возможна при использовании комбинированного термина
"модифицированный сперматозоид с элементом примитивности", если считать таким
элементом укороченное ядро. Часто в строении модифицированных сперма-
20
тозоидов описывают оригинальные элементы, не сравнимые ни с
примитивным ни с модифицированным морфотипами. В сперматозоиде человека,
например, таким элементом является уплощенность головки (табл. 7 Б), из-за
чего схема человеческого сперматозоида обычно изображается в двух
проекциях (рис. 2 А, Б). Таким образом, наш сперматозоид, являясь
модифицированным, кроме элемента примитивности имеет еще и элемент
аберрантности. К аберрантным элементам можно отнести асимметрично
расположенную акросому (см. вклейку, табл. 8 А) в сперматозоиде сумчатого
млекопитающего Sminthopsis crassicaudata [no: Breed et al., 1989]. К ним
принадлежит закрученность головок, которая, может быть как частичной
(табл. 8 Б), например, у представителя гастротрих Mesodasys adenotubulatus
[по: Fregni et al., 1999], так и полной (табл. 8 В), что характерно для пиявок
[по: Garavaglia et al., 1974]. Примером аберрантного несоответствия канону
модифицированного сперматозоида являются замещенность акросомы ак-
росомо-подобной структурой и локализация базального тельца жгута у
основания данной структуры (табл. 8 Д), что типично для сперматозоида фо-
рониды Phovonopsis harmeri [no: Reunov, Klepal, 2004]. Одной из аберрантных
особенностей является измененность формулы жгутика 9 + 2 в сторону
самых различных комбинаций, что связано с регрессией двигательной
активности, произошедшей в эволюции модифицированных сперматозоидов
многих беспозвоночных [Baccetti, 1984; 1985]. Если мы захотим увидеть полный
перечень оригинальных структурных особенностей, дополняющих строение
модифицированных сперматозоидов различных животных, то перед нами
предстанет огромный список, который никогда не будет закончен в силу
неисчерпаемости возможных вариаций. Тем не менее, все вариации легко
вписываются в понятие "элементы аберрантности" и любой даже самый
усложненный модифицированный сперматозоид, может быть охарактеризован
комбинированным термином "модифицированный сперматозоид с
элементом (элементами) аберрантности" [Реунов, 1993]. В случае необходимости
описание сперматозоида может сопровождаться детальным описанием
таких элементов.
При общей характеристике модифицированных мужских гамет как не
имеющих элементов примитивности и/или аберрантности, так и имеющих
их, представляется вполне уместным употребление односложного
традиционного термина Г. Ретциуса [Retzius, 1904 - по: Franzen, 1956] и А. Франзена
[Franzen, 1955; 1956] - "модифицированный сперматозоид".
ХАРАКТЕРИСТИКА АБЕРРАНТНЫХ СПЕРМАТОЗОИДОВ
Употребление термина "аберрантный сперматозоид" оправдано при
глубоком своеобразии мужских гамет. В различных таксонах многоклеточных
животных такие гаметы очень разнообразны с точки зрения внешней
морфологии. Здесь приведены примеры форм аберрантных сперматозоидов -
"булавовидной" (см. вклейку, табл. 9 А) - у двукрылого насекомого
Oligotrophus juniperinus [no: Dallai, Mazzini, 1989], "конусовидной"
(табл. 9 Б) - у нематоды Enoplus anisospiculus [no: Yushin, Malakhov, 1994],
"двуветвистой" (табл. 9 В) - у ракообразного Armadillidium vulgare [no:
Cotelli et al., 1976], и "медузоидной" (табл. 9 Г) - у ракообразного
21
Phynchocinetes typus [no: Barros et al., 1986]. Данные формы представляют
лишь незначительную часть бесчисленных морфологических вариаций,
возможных в категории "аберрантный сперматозоид". Ультраструктурная
организация аберрантных мужских гамет, как правило, представлена набором
специфических органоидов. Например, цитоплазма сперматозоида
нематоды Halichoanolaimus possjetiensis [no: Yushin, 2003a], содержит "фиброзные
тела" (табл. 9 Д), характерные для нематод, но, не имеющие аналогов в
половых клетках других многоклеточных животных.
Существуют аберрантные сперматозоиды, в дифференциации и
строении которых рекапитулируют анцестральные морфотипы примитивного
и/или модифицированного сперматозоидов. Распространенным вариантом
является спермиогенез, при котором ранняя сперматида похожа на
примитивный сперматозоид, который вскоре превращается в модифицированный
сперматозоид, постепенно утрачивающий признаки модифицированного
спермия и приобретающий аберрантные особенности. Примером такой
дифференциации являются, например, сперматогенные клетки
псевдоскорпиона Mastigoproctus giganteus [Phillips, 1976]. В этом случае округлый
неподвижный сперматозоид, содержит в цитоплазме закрученные ядро и
жгутик (см. вклейку, табл. 10 А). Аберрантные сперматозоиды полихеты
Ophryotrocha puerilis [по: Berruti et al., 1978] не имеют жгутиков, но содержат
апикально расположенную акросому и митохондрии, сосредоточенные под
ядром, чем очень напоминают головки примитивных мужских гамет
(табл. 10 Б). Подобные примеры свидетельствуют о существовании
аберрантных паттернов мужских гамет, характеристика которых возможна
только при использовании комбинированных терминов. Так, сперматозоид
псевдоскорпиона М. giganteus может быть охарактеризован как
"аберрантный с элементами модифицированное™" в виде закрученных ядра и
жгутика. Соответственно, сперматозоид полихеты О. puerilis является
"аберрантным с элементом примитивности", заключающимся в отдаленном сходстве
организации головки спермия с примитивным морфотипом.
Можно резюмировать, что наряду с полной аберрантностью существуют
варианты неполной аберрантности, которые могут быть описаны
комбинированными терминами. В случаях, когда общая характеристика является
достаточной, различные "оттенки" аберрантных гамет могут
характеризоваться единым традиционным термином Г. Ретциуса [Retzius, 1904; 1909 -
по: Franzen, 1956] и А. Франзена [Franzen, 1955; 1956] - "аберрантный
сперматозоид".
УЛЬТРАСТРУКТУРНЫЙ АНАЛИЗ КАК МЕТОД
ОПРЕДЕЛЕНИЯ ТИПА СПЕРМАТОЗОИДА
Комбинированное использование традиционных терминов,
утвержденных Г. Ретциусом [1904; 1909 - по: Franzen, 1956] и А. Франзеном [Franzen,
1955; 1956], может являться средством структурной характеристики гамет, в
строении которых пересекаются признаки различных морфотипов.
Заключение о типе строения сперматозоида должно вырабатываться после
детального ультраструктурного анализа, так как в некоторых случаях только на
основе электронно-микроскопического исследования можно разобраться в
22
преобладании того или иного морфотипа. Так, например, головки мужских
гамет двустворчатого моллюска М. laevigatus на светооптическом уровне
выглядят удлиненными, как у модифицированных сперматозоидов
(см. табл. 3 Б). Но после рассмотрения под электронным микроскопом
становится понятным, что данные сперматозоиды соответствуют
примитивному типу, хотя и имеют элемент модифицированности в виде удлиненного
ядра (см. табл. 3 Д). Как у форониды P. harmeri [no: Reunov, Klepal, 2004], так
и у ракообразного A. vulgare [no: Cotelli et al., 1976] обнаружены близкие
морфологически сперматозоиды двуветвистой формы (см. табл. 8 Г; 9 В).
Однако внутреннее строение гамет этих видов различно. В сперматозоиде
A. vulgare жгутик отсутствует; одна из ветвей заполнена
поперечно-исчерченным материалом, а вторая включает акросомальный и ядерный отделы,
устроенные своеобразно и не имеющие сходства как с примитивным, так и
модифицированным морфотипами [Cotelli et al., 1976], что свидетельствует
о глубокой аберрантности спермия данного представителя ракообразных. У
форониды одна из ветвей сперматозоида является жгутиком, базальное
тельце которого аберрантно смещено к основанию акросомоподобной
структуры (см. табл. 8 Г, Д), а другая представляет собой "тело"
модифицированного сперматозоида, состоящее из удлиненного ядра, к базальной части
которого прилегают митохондрии (см. табл. 8 Е). В силу того, что
модифицированный морфотип в данном случае явно доминирует, сперматозоид
форониды следует характеризовать как "модифицированный с элементами
аберрантности", такими как замещенность акросомы акросомо-подобной
структурой и апикальная локализация жгутика. Таким образом, несмотря на
морфологическую близость, сперматозоид рака - аберрантный, а сперматозоид
форониды - модифицированный.
По мнению автора, при комбинированном использовании традиционных
категорий (примитивный сперматозоид, модифицированный сперматозоид
и аберрантный сперматозоид), степень преобладания которых в строении
сперматозоида должна устанавливаться на основе
электронно-микроскопического анализа, терминологическая система Г. Ретциуса и А. Франзена [по:
Franzen, 1955; 1956; Afzelius, 1982] готова к структурной характеристике
любых типов мужских гамет, каким бы широким не было их разнообразие.
ЧТО ТАКОЕ ПОПУЛЯЦИЯ СПЕРМАТОЗОИДОВ?
При ознакомлении с содержанием предыдущих глав, читатель узнал то,
что, в принципе, и ожидал узнать - самец каждого вида Metazoa имеет
сперматозоиды, строение которых соответствует определенному
ультраструктурному плану, характерному для данного вида. Однако все не так просто,
потому что у многих живых существ обнаружены дополнительные
структурно отличные сперматозоиды, присутствие которых сформировало
представление о популяциях сперматозоидов. Собственно, первая информация о
разнообразии сперматозоидов в семени человека и некоторых животных
содержалась уже в рисунках А. ван Левенгука (рис. 3). После появления
сведений о существовании сперматозоидов, сопряженных с мужским или женским
полом, возник миф об их различной морфологии и возможности регуляции
человеческого пола путем отбора спермиев, содержащих либо X, либо Y
23
Рис. 3. Разновидности мужских гамет, обнаруженные А. ван Левенгуком в популяции
сперматозоидов человека [по: Chemes, Rawe, 2003]
хромосому [см. Baccetti, Afzelius, 1976]. Несмотря на то что этот миф был
убедительно развенчан Ван Дюйном [van Duijn, 1958] в мире возникла сеть
шарлатанских клиник, эксплуатирующих идею использования гиносперма-
тозоидов и андросперматозоидов с целью торговли полом. В настоящее
время наиболее авторитетные сперматологи мира считают, что
"разнополые" сперматозоиды человека не имеют морфологических различий и
существуют в едином варианте (см. рис. 2А, Б), предложенном Д. Фаусеттом
[Fawcett, 1975]. Тем не менее, очевидно и то, что по сравнению с другими
млекопитающими Homo sapiens обладает наибольшим популяционным
разнообразием мужских гамет [Baccetti, Afzelius, 1976; Рузен-Ранге, 1980;
Chemes, Rawe, 2003].
Конечно же, в популяции мужских гамет как человека, так и других
Metazoa всегда присутствует некоторое количество аномальных клеток,
возникновение которых является следствием внешних воздействий и сбоев в
генетической программе, обеспечивающей дифференциацию [Escalier, 2002;
Chemes, Rawe, 2003]. Поэтому, например, в популяции сперматозоидов
морского ежа A. crassispina встречаются сперматозоиды-гиганты (см.
вклейку, табл. 11 А) и клетки, содержащие аномальный набор органоидов
(табл. 11 Б, В), а даже у здорового представителя Н. sapiens, кроме типичных
спермиев, встречаются самые различные морфологические варианты гамет
(см. табл. 7 В-Д), максимальное количество которых достигает
тринадцати [Perezsanchez et al., 1994]. Как правило, аномальные гаметы не имеют
24
стабильного плана строения и могут иметь различные формы.
По-видимому, аномальные сперматозоиды есть у каждого самца Metazoa и
соотношение фертильности и стерильности зависит не столько от факта их наличия,
сколько от их процентного содержания [Рузен-Ранге, 1980; Chemes, Rawe,
2003].
Кроме аномальных линий, в популяциях сперматозоидов многих Metazoa
обнаружены и дополнительные варианты детерминированных, но
морфологически отличных гамет. Это явление, называемое диморфизмом в случае
наличия единственного дополнительного морфотипа, было описано, в
сперматогенезе некоторых таксонов, например, у аннелид [Boi et al., 2001;
Ferraguti et al, 2002], ракообразных [Blades-Eckelbarger, Youngbluth, 1982],
моллюсков [Healy, 1982; Jespersen et al., 2002], иглокожих [Eckelbarger et al.,
1989; Au et al, 1998; Юрченко, Реунов, 2004], насекомых [Phillips, 1970; Dallai,
Afzelius, 1985; Friedlander, 1997]. В свое время С. Кушакевич [Kuschakewitch,
1913, 1921 - по: Hodgson, 1997] предложил для характеристики диморфич-
ных сперматозоидов термины "типичный" и "атипичный". Но, впоследствии
Д. Хили и Б. Джемисон [Healy, Jamieson, 1981] подвергли критике термин
"атипичный" в силу несомого им подтекста ненормальности, и предложили
термины "эусперматозоид" и "парасперматозоид" для осеменяющего и
дополнительного типов мужских гамет.
Помимо диморфизма известно явление триморфизма мужских гамет,
которое распространено, например, у брюхоногих моллюсков.
Классификация триморфных сперматозоидов Gastropoda, основанная на количестве
хроматина в ядре, была предложена Ф. Мевесом [Meves, 1903 - по: Hodgson,
1997]. Для сперматозоидов с обычным содержанием хроматина автор
предложил термин "эупиренный сперматозоид". Для гамет с количеством
хроматина, уменьшенным благодаря диминуции, он ввел термин "олигопиренный
сперматозоид", а для сперматозоидов, полностью лишенных хроматина,
был предложен термин "апиренный сперматозоид". В литературе нередко
употребляется термин "полиморфизм" [см. Hodgson, 1997], который может
наводить на мысль о возможности существования и большего количества
детерминированных мужских гамет. Однако такие варианты популяций
сперматозоидов пока не обнаружены.
Феномен существования дополнительных типов мужских гамет,
открываемый у все новых и новых представителей многоклеточных животных, в
некоторых случаях получил объяснение, подразумевающее выполнение
данными гаметами определенных функций, таких, например, как
транспортная и питающая [Рузен-Ранге, 1980; Hodgson, 1997; Buckland-Nicks, 1998].
Тем не менее, в некоторых публикациях присутствие парасперматозоидов
характеризуется авторами, как интригующее [Liitzen et al., 2001; Jespersen et
al., 2001]. Особенно загадочным является существование так называемых
[по: Рузен-Ранге, 1980; Chemes, Rawe, 2003] гетерогенных форм -
сперматозоидов, различающихся лишь в некоторых деталях и предположительно
имеющих равнозначные шансы к осеменению. Например, совершенно
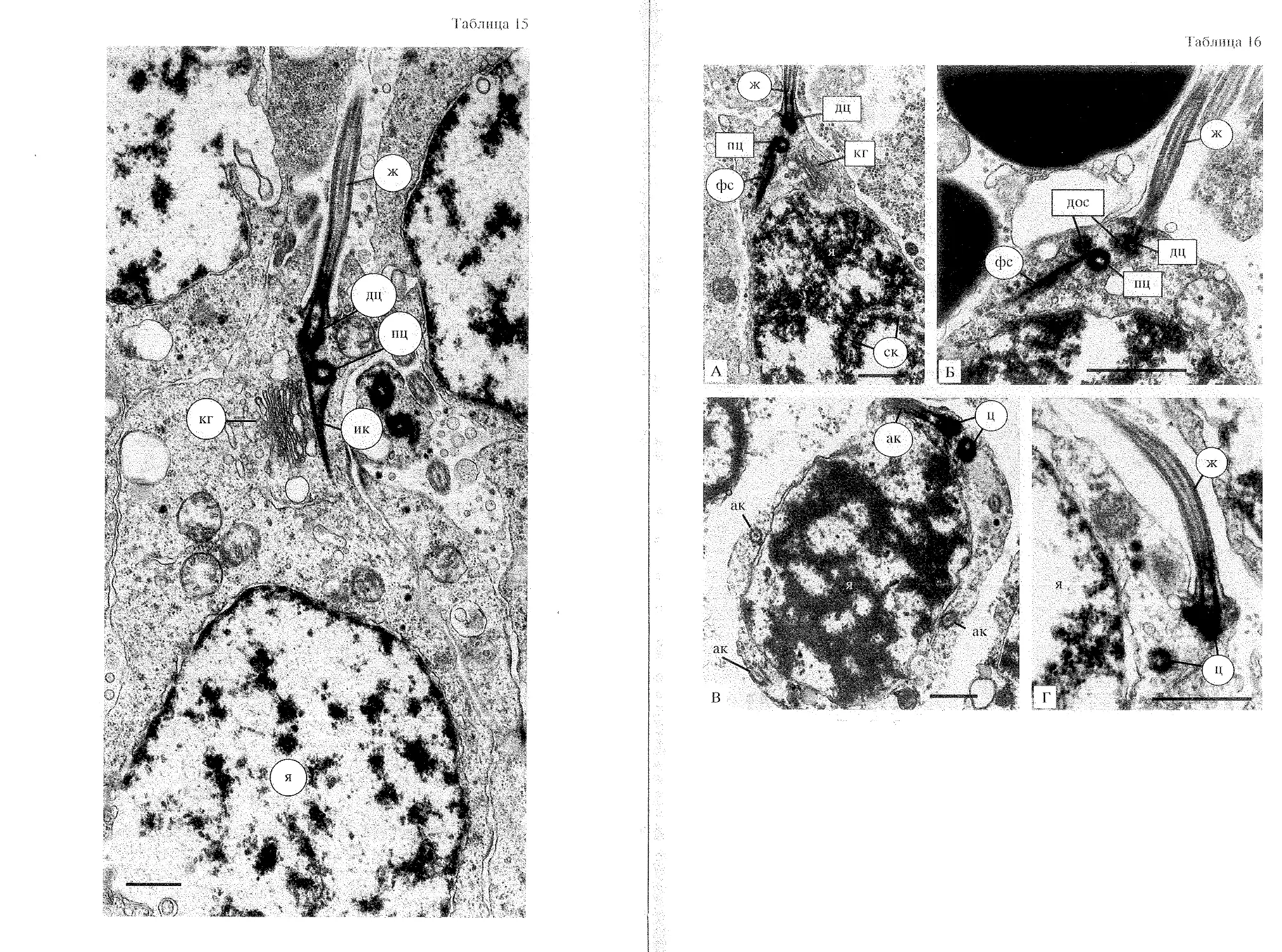
непонятно почему у морского ежа A. crassispina [по: Au et al., 1998], наряду с
наиболее распространенным типом сперматозоида, имеющим симметричную
кольцевую митохондрию (табл. 11 Г), есть и другой вариант мужской
гаметы с асимметричной митохондрией (табл. 11 Д), встречающийся реже, но
25
также составляющий значительную часть клеточной популяции Может
быть в условиях меняющихся токов морской воды для успешного
наружного осеменения нужны сперматозоиды с различными баллистическими
свойствами? А может быть возникновение данных гамет не является причинно
закрепленным, а сопряжено с эволюционным процессом, происходящим
в данной популяции мужских гамет? Пока объяснение полиморфизма и
гетерогенности не может выйти за рамки спекулятивных рассуждений
а выяснение истинных причин этих явлений является задачей будущих
исследований. ww
Таким образом, давая характеристику сперматозоиду какого-либо вида
Metazoa, мы должны отдавать себе отчет в том, что речь идет не о
единственном, а лишь о главном или даже об одном из главных типов мужских
гамет в данной популяции.
Глава 3
ТРАДИЦИОННЫЕ ПРЕДСТАВЛЕНИЯ О СПЕРМАТОГЕНЕЗЕ
У МНОГОКЛЕТОЧНЫХ ЖИВОТНЫХ
Исследования сперматогенеза были начаты в конце XIX в. Основные
термины, такие как "сперматоциста", "сперматогоний", "сперматоцит" и
"сперматида", предложил В. Сен-Жорж [Valette St. George, 1876 - по: Рузен-
Ранге, 1980] при исследовании мужских половых клеток амфибий. На
сегодняшний день все еще остается неизменным мнение о том, что
особенностью сперматогенеза у многоклеточных животных является постоянство
составляющих его процессов, достигнутое и закрепленное отбором уже на
ранних этапах филогенеза, а эволюция сперматогенеза осуществлялась
главным образом путем эволюции вспомогательных элементов [Габаева,
1982]. Различают "диффузный" сперматогенез, характерный для
беспозвоночных, не имеющих гонад, "локализованный солитарныи" (при котором
развитие спермиев протекает в гонадах, но без участия вспомогательных
элементов) и "локализованный алиментарный" (при котором сперматоген-
ные клетки развиваются в гонадах при участии вспомогательных
элементов) [Коршельт, Гайдер, 1902 - по: Габаева, 1985]. Под вспомогательными
элементами понимаются клетки фолликулярного эпителия или клетки,
которые у позвоночных называются клетками Сертоли, а у беспозвоночных
характеризуются самыми различными терминами такими как
"фолликулярные клетки", "вспомогательные клетки", "питающие клетки", "интерстици-
альные клетки", "питающие фагоциты" [Рузен-Ранге, 1980; Габаева, 1982;
Buckland-Nicks, Chia, 1986; Cavey, Markel, 1994; Reunov et al., 2001]. Исходным
свойством клеток, "берущих на себя" вспомогательную функцию,
по-видимому, была способность к формированию фолликул или сперматоцист при
диффузном сперматогенезе, так как это наблюдается, например, у губок и
некоторых кишечнополостных [Рузен-Ранге, 1980; Габаева, 1982; Дроздов,
Иванков, 2000]. В семенниках более высокоразвитых беспозвоночных и
позвоночных клетки фолликулярного эпителия выполняют питающую,
поддерживающую, защитную, выстилающую, фагоцитарную и гормонально-
регуляторную функции [Габаева, 1982; Айзенштадт, 1984; Райцина, 1985;
Stefanini et al., 1985; Sakai, Yamashina, 1989; Хотимченко и др., 1993; Cavey,
Markel, 1994; J0rgensen, Ltitzen, 1997; Reunov et al., 2004a, b; Реунов и др.,
2004 б).
Электронно-микроскопически дифференциация сперматозоидов
изучается с начала 1960-х гг. Результаты исследований обобщены в ряде
монографий и обзоров [см. Phillips, 1974; Welsch, Storch, 1976; Данилова, 1978, 1982;
Рузен-Ранге, 1980; Райцина, 1982, 1985; Stefanini et al., 1985; Pudney, 1995;
27
Johnson, 1995; Krioutchkova, Onishchenko, 1999]. Благодаря данным
публикациям создано представление о строении и последовательности развития
сперматогенных клеток, согласно которому схема сперматогенеза у
многоклеточных животных включает три этапа:
1. Сперматоцитогенез - стадия размножения сперматогониев.
Детальная классификация сперматогониев, основанная на морфологии
ядер, существует только для млекопитающих [Leblond, Clermont, 1952 -
по: Данилова, 1982]. Установлено, что сперматогонии - это клетки,
имеющие эндоплазматический ретикулум, аппарат Гольджи, митохондрии,
большое количество свободных рибосом и полисом. Неотъемлемой
частью сперматогониев являются половые детерминанты (или
зародышевая плазма), происхождению и локализации которых посвящено большое
количество ультраструктурных и молекулярно-биологических
исследований. Несмотря на усилия многих цитологов и молекулярных биологов,
роль зародышевой плазмы в процессе детерминирования клеток
полового пути еще не выяснена, но благодаря исследованиям последних лет
установлено, что значительное участие в формировании данной субстанции
принимает матрикс митохондрий [см. Reunov et al., 2000; Исаева, Реунов,
2001; Реунов и др., 2004а).
2. Мейоз (созревание) - процесс, включающий спаривание хромосом,
кроссинговер и два деления созревания сперматоцитов. Как правило, спер-
матоциты имеют тот же набор органоидов, что и сперматогонии. Визуально
материал половых детерминантов присутствует в цитоплазме
сперматоцитов в остаточных количествах. Основным признаком, по которому
происходит идентификация первичных сперматоцитов, являются синаптонемальные
комплексы, формирующиеся на стадии зигонемы - пахинемы [см.
Данилова, 1978; 1982]
3. Спермиогенез - стадия превращения сперматиды в сперматозоид.
В спермиогенезе происходит формирование жгутика. Акросомальная
везикула возникает из пузырьков, продуцируемых комплексом Гольджи,
который локализован над апикальной частью ядра. В конце спермиоге-
неза излишки цитоплазмы, комплекс Гольджи, рибосомы и
эндоплазматический ретикулум аккумулируются в резидуальном тельце, которое
выводится из клетки.
Неотъемлимой особенностью сперматогенеза у многоклеточных
животных является наличие между развивающимися сперматогенными
клетками межклеточных мостиков, существование которых впервые
было обнаружено в электронно-микроскопическом исследовании М. Бурго-
са и Д. Фоусетта [Burgos, Fawcett, 1955 - по: Данилова, 1978]. Считается,
что несинцитиальное, неклональное развитие мужских половых клеток
является редким исключением, встречающимся только среди низших
беспозвоночных.
Нужно отметить, что в работах, на основании которых сформировалась
схема сперматогенеза, как правило, использовались данные, полученные
для многоклеточных, имеющих модифицированные сперматозоиды.
Однако, как об этом уже говорилось в двух предыдущих главах, в природе
существуют три основных типа сперматозоидов (см. рис. 1 А-В), структура
которых, по-видимому, определена эволюцией способов осеменения. Спермато-
28
генез таксонов с примитивными и аберрантными сперматозоидами,
исторически не был в центре внимания и изучался фрагментарно. А между тем
исследования развития этих сперматозоидов в различных таксонах
беспозвоночных подчас демонстрируют весьма оригинальные особенности, не
попадающие под традиционное представление об ультраструктурной картине
сперматогенеза у многоклеточных животных. Примеры таких
несоответствий будут рассмотрены в последующих главах. По-видимому, традиционная
схема сперматогенеза отражает специфику этого процесса в узком круге
таксонов, обладающих модифицированными сперматозоидами, которые
по сути являются репродуктивными клетками "второго" яруса эволюции
(см. рис. 1 А-В). Необходимо сравнительное рассмотрение цитологической
картины формирования примитивных, модифицированных и аберрантных
сперматозоидов, соответственно относящихся к "первому", "второму" и
"третьему" эволюционным ярусам с целью создания более целостного
представления об ультраструктурных особенностях сперматогенеза у
многоклеточных животных.
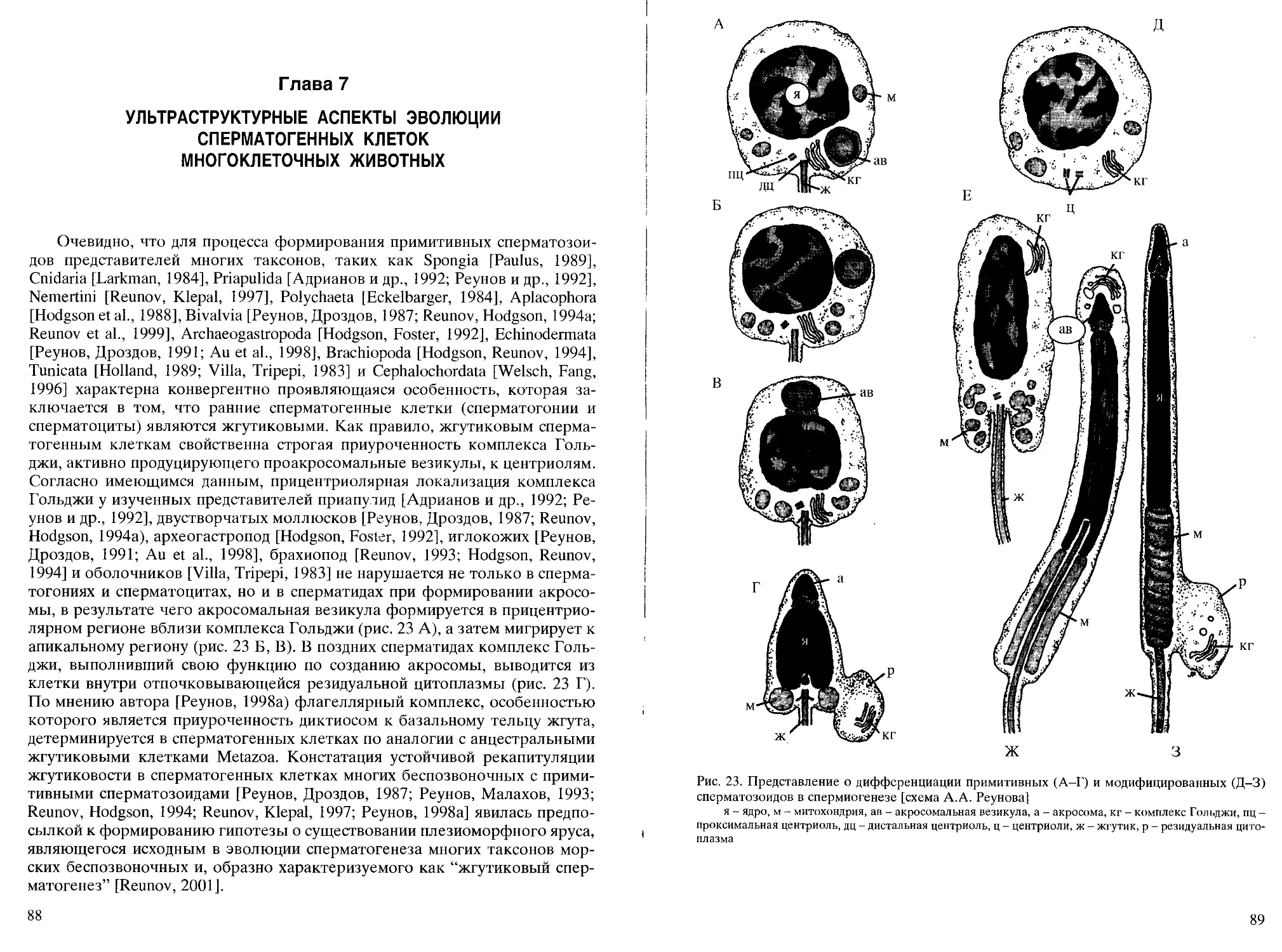
Глава 4
СПЕРМАТОГЕНЕЗ У МНОГОКЛЕТОЧНЫХ ЖИВОТНЫХ
С ПРИМИТИВНЫМИ СПЕРМАТОЗОИДАМИ
Примитивные мужские гаметы, а также наружный и
наружно-внутренний типы осеменения распространены в таких таксонах как губки [см.
Малахов, 1990; Boury-Esnault, Jamieson, 1999; Дроздов, Иванков, 2000], ор-
тонектиды [Kozloff, 1969 - по: Малахов, 1990; Slyusarev, Ferraguti, 2002],
кишечнополостные [Hinsch, Clark, 1973; Hinsch, 1974; Carre, 1984; Реунов,
Костина, 1991; Реунов, Даутов, 1991; Corbelli et al., 2003], гребневики
[Franc, 1973], немертины [Turbeville, Ruppert, 1985], приапулиды
[Адрианов и др., 1992; Реунов и др., 1992], эхиуриды [см. Дроздов, Иванков,
2000], сипункулиды [Rice, 1974; Sawada, 1980; Klepal, 1993; Reunov, Rice,
1993], аннелиды [Jamieson, Rouse, 1989], моллюски [Дроздов, Реунов,
1997; Reunov et al., 1999; Suwanjarat, 1999], членистоногие [Tilney, Inoue,
1985], иглокожие [Дроздов, Касьянов, 1985а; Реунов, Дроздов, 1991], бра-
хиоподы [Sawada, 1973; Afzelius, Ferraguti, 1978a; Reunov, 1993],
полухордовые [Colwin et al., 1957; Franzen, Sensenbaugh, 1985], оболочники [Flood,
Afzelius, 1978], головохордовые [Holland, Holland, 1989], костистые рыбы
[см. Jamieson, 1991b; Medina et al., 2003]. Судя по данным световой
микроскопии [Westblad, 1949 - no: Franzen, Afzelius, 1987], примитивными
сперматозоидами обладает и турбелляриообразный организм Xenoturbella
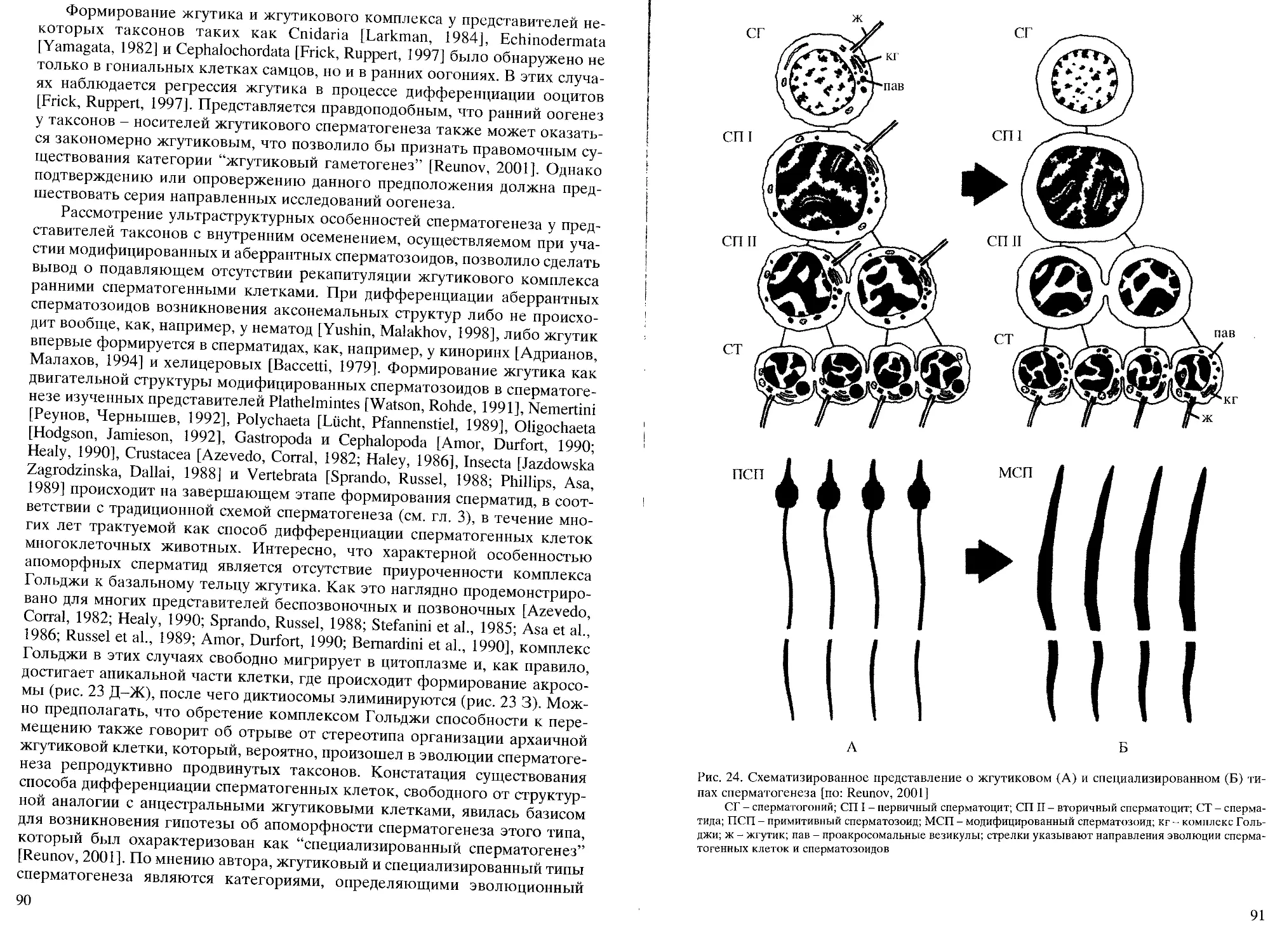
bocki, принадлежность которого к плоским червям является предметом
дискуссий [см. Franzen, 1956; Afzelius, 1982; Реунов, Малахов, 1993;
Дроздов, Иванков, 2000].
В данной главе будет проведен сравнительный анализ
ультраструктурных особенностей дифференциации примитивных сперматозоидов у
представителей губок, кишечнополостных, приапулид, немертин, полихет,
двустворчатых моллюсков, брахиопод, иглокожих, асцидий и костистых рыб,
сперматогенез у которых описан достаточно детально.
SP0NGIA
Сперматозоиды губок в целом можно считать примитивными, но,
безусловно, нуждающимися в комбинированной характеристике.
Особенностями данных гамет являются: большое количество цитоплазмы,
наличие вакуолей, разрозненное расположение митохондрий, недокон-
денсированный хроматин ядра. Как было сказано выше (см. гл. 2),
трактовка таких признаков спермиев Spongia может быть двоякой. Если счи-
30
V
<
% ))
ав кг
Рис. 4. Сперматозоид губки Oscarella lobularis (А) [по: Baccetti et al., 1986]. Схема спермиоге-
неза губки Spongilla lacustris [no: Paulus, 1989] (Б-Д)
а - акросома, ж - жгутик; ц - центриоли, я - ядро, м - митохондрия, ц - центриоли, ав - акросомо-
подобная везикула, кг - комплекс Гольджи, мм - межклеточный мостик, р - резидуальное тело
31
тать, что выше названные особенности унаследованы от анцестральных
жгутиковых клеток, то уместным мог бы быть комбинированный
термин "примитивный сперматозоид с элементами анцестральности". Если
принять версию об апоморфном происхождении этих признаков,
то сперматозоиды можно было бы характеризовать как "примитивные
с элементами аберрантности". По-видимому, однозначного ответа о
том, каковым является статус указанных элементов сперматозоидов
губок нет.
В свое время существовало мнение, что отсутствие акросомы является
абсолютным свойством сперматозоидов Spongia [см. Baccetti, Afzelius, 1976].
Считалось, что наряду со сперматозоидами кишечнополостных, спермин
губок в эволюционном смысле предшествуют акросомальным спермиям.
Однако Б. Баччетти с соавт. [Baccetti et al, 1986] удалось обнаружить вид
Oscarella lobularis, спермин которого (рис. 4 А) имеют типичную акросому,
подобную акросомам в сперматозоидах многих морских беспозвоночных.
Кроме того, формирование временной структуры, напоминающей акросо-
мальную везикулу (рис. 4 Б), постепенно элиминирующейся с резидуальным
телом (рис. 4 В-Д), было обнаружено в спермиогенезе губки Spongilla lacus-
tris [Paulus, 1989]. Эти открытия позволяют предполагать, что
сперматозоиды губок произошли от акросомальных мужских гамет, но для проверки
данной гипотезы нужны исследования спермиогенеза у гораздо большего
количества видов губок. Не исключено, что в этом типе беспозвоночных
мужские гаметы могут иметь как признаки анцестральности в виде
большого количества цитоплазмы и недоконденсированного хроматина, так и
элементы аберрантности в виде вторичного отсутствия акросомы и других
признаков.
Интересно, что жгутики сперматозоидов губок не являются
необходимыми на протяжении всего процесса сближения мужских и женских
гамет. Осеменение у губок не является абсолютно наружным.
Сперматозоиды Spongia способны перемещаться в морской воде, но перед
инкорпорацией в яйцеклетку они теряют жгутики и принимают амебоидную
форму, после этого они либо самостоятельно перемещаются между
соматическими клетками оплодотворяемой особи [Ефремова, Папковская,
1980], либо внедряются в хоаноциты - носители, которые доставляют их
к яйцеклетке [Gatenby, 1920; Tuzet, 1930 - по: Franzen, 1956; Hoshi, 1985;
Иванова, 1988; Малахов, 1990; Дроздов, Иванков, 2000]. Таким образом,
осеменение у губок может быть охарактеризовано как
наружно-внутреннее.
Губки, являясь представителями наиболее эволюционно примитивных
многоклеточных животных, обладают весьма упрощенными гаметоформи-
рующими тканями. По словам Э. Рузен-Ранге [1980], именно у губок
является возможным выявление того минимального комплекса условий, при
котором возможен гаметогенез. Губки не имеют эмбриологически
детерминированных герминативных клеток и репродуктивных органов; в формировании
половых клеток у них самое непосредственное участие принимают
соматические клетки. Если оогонии развиваются из археоцитов [Sailer,
Weissenfelds, 1985; Sailer, 1988], то мужские половые клетки формируются
из хоаноцитов жгутиковых камер [Tuzet et al., 1970; Diaz, Connes, 1980; Еф-
32
ремова, Папковская, 1980; Gaino et al., 1984, 1986; Суходольская,
Папковская, 1985; Paulus, Weissenfels, 1986].
На ультраструктурном уровне детальное исследование
сперматогенеза у Spongia выполнено В. Паулюсом [Paulus, 1989] у единственного
представителя. Этот исследователь показал, что у губки S. lacustris
формирование сперматогония начинается путем увеличения размера одного
из хоаноцитов, составляющих стенку жгутиковой камеры. Как и другие
хоаноциты, данная клетка имеет жгутик. Хоаноцит, претерпевающий
изменения, выделяется из состава стенки жгутиковой камеры и
некоторое время локализован на ее периферии в мезенхиме. На этом этапе в
цитоплазме хоаноцита возникает вакуоль, которая заключает жгутик
внутри клетки и, вероятно, резорбирует его, так как он исчезает.
Принято считать, что с этого момента клетка перестает быть хоаноцитом и
становится сперматогонием. Как правило, сперматогонии претерпевают
ряд митотических делений.
Дальнейшее развитие сперматогенных клеток происходит в сперма-
тоцистах. В формировании сперматоцист принимают участие археоциты,
которые также находятся в мезенхиме. Контактируя друг с другом,
археоциты формируют стенку сперматоцисты, внутри которой заключены
группы сперматогониев. Изначально сформированные сперматоцисты
имеют небольшой диаметр, однако постепенно происходит увеличение
их размеров путем слияния соседних цист. В процессе формирования цист
сперматогонии трансформируются в сперматоциты I без изменения
размеров. Для первичных сперматоцитов, которые идентифицируются по
наличию синаптонемальных комплексов в ядре, характерно присутствие
аксонем, процесс формирования которых детально рассмотрен в работе
В. Паулюса [Paulus, 1989]. В цитоплазме каждого первичного спермато-
цита, готовящегося к первому мейотическому делению, возникают две
аксонемы (рис. 5 А-Б; см. вклейку, табл. 12 А), генерируемые центриоля-
ми. Перед делением аксонемы становятся наружными жгутиками
(рис. 5 В-Е; табл. 12 Б). По данным В. Паулюса [Paulus, 1989] первичный
сперматоцит в анафазе имеет два жгутика, каждый из которых
становится жгутиком вторичного сперматоцита. Изначально сперматоцит II
имеет один жгутик, оставшийся от первичного сперматоцита. Однако перед
вторым делением созревания на его противоположном полюсе
возникает второй жгутик. Таким образом, сперматоцит II перед вторым
делением созревания также имеет два жгутика, расположенных на
противоположных концах клетки.
При делении вторичного сперматоцита возникают две сперматиды,
каждая из которых имеет жгутик. В публикации В. Паулюса [Paulus, 1989]
ничего не сказано о локализации комплекса Гольджи в сперматогониях и спер-
матоцитах. Тем не менее, в сперматидах очевидна прицентриолярная
локализация диктиосом (см. рис. 4 Б). Везикулы, которые, продуцируются
комплексом Гольджи со стадии первичных сперматоцитов по мнению автора
[Paulus, 1989] являются проакросомальными. В позднем спермиогенезе
происходит отторжение части цитоплазмы, содержащей как комплекс
Гольджи, так и его производные (см. рис. 4 Д).
3 Реунов А. А.
33
A
Б
Рис. 5. Схема формирования жгутиков в сперматоците первого порядка у губки Spongilla
lacustris [no: Paulus, 1989]
А - сперматоцит I с двумя аксонемами, возникшими в цитоплазме; Б - две аксонемы формируют
клеточный выступ; В - сперматоцит с двумя торчащими жгутиками; Г - сперматоцит с погруженными
жгутиками; Д - сперматоцит с расходящимися жгутиками; Е - сперматоцит с полярно расположенными
жгутиками, базальные тельца которых формируют веретено деления
ц - центриоли, ак - аксонема, я - ядро, м - митохондрия, ж - жгутик, стрелки указывают
направление движения флагеллярных комплексов
34
CNIDARIA
Половое размножение у книдарий происходит за счет наружного и
наружно-внутреннего осеменения. В каждой группе можно найти примеры
того и другого. Среди Hydrozoa наружно-внутреннее осеменение
свойственно гидридам, многим метагенетическим гидроидным, всем гипогене-
тическим гидроидным. Наружное осеменение широко распространено у
метагенетических гидроидных с выраженным медузоидным поколением.
У многих сцифоидных медуз осеменение наружное, однако Crysoara,
Cyanea, Aurelia и некоторым другим свойственно наружно-внутреннее
осеменение [Miller, 1985; Реунов, Малахов, 1993]. У некоторых
коралловых полипов (актинии Metridium, Actinia, Sagartia), которые либо
раздельнополы, либо гермафродитны, осеменение и последующее развитие яиц
протекают в гастральной полости [Chia, 1976; Реунов, Костина, 1991].
Среди альционарий известны формы с наружным осеменением [Yamazato
et al. 1981; Benayahu, Loya, 1986]. Для всех кишечнополостных
характерно отсутствие каких-либо половых протоков. У медуз спермин
выбрасываются в морскую воду через разрывы в стенке гонады. У кораллов
половые клетки через разрывы гонад попадают сначала в гастроваскуляр-
ную полость, а затем через ротовое отверстие выводятся наружу [Chia,
1976; Рузен-Ранге, 1980].
Электронно-микроскопические исследования показывают, что за
исключением сифонофоры вида Muggiaea kochii, сперматозоид которого
имеет акросому [Carre, 1984], для кишечнополостных, рассмотренных в
Hydrozoa, Scyphozoa и Anthozoa, характерны сперматозоиды, не
имеющие акросом, сравнимых с таковыми у примитивных сперматозоидов
[Hinsch, Clark, 1973; Hinsch, 1974; Реунов, Костина, 1991; Реунов, Даутов,
1991]. Акросомоподобный аппарат представлен в мужских гаметах
кишечнополостных набором разрозненных цельных или кольцеобразных
везикул, окруженных мембраной. В спермиях гидромедуз и сцифомедуз
проакросомальные везикулы локализованы у боковой поверхности
апикальной части ядра (см. вклейку, табл. 13 А), а в гаметах коралловых
полипов - в базальной части (см. табл. 4 А). Отсутствие настоящих
акросом является признаком, который, по мнению многих исследователей,
позволяет подчеркнуть эволюционную анцестральность спермиев
кишечнополостных. В соответствии с традиционным представлением
[Baccetti, Afzelius, 1976; Baccetti, 1984; 1985], проакросомальные
везикулы в сперматозоидах Cnidaria являются эволюционными
предшественниками акросом, характерных для примитивных сперматозоидов
большинства морских беспозвоночных. Однако, как это продемонстрировано для
одного из представителей Hydrozoa, проакросомальные везикулы не
принимают никакого участия в процессе проникновения спермиев в
яйцеклетку [Yamashita, 1988]. Инкорпорация спермиев у Cnidaria
происходит только на анимальном полюсе яйца, покрытом утонченной в этом
месте фибриллярной оболочкой. Тонкая (около 7-10 мкм) студенистая
оболочка, покрывающая яйцеклетки кишечнополостных, активно
преодолевается спермиями без какой-либо акросомной реакции [Miller,
1985; Yamashita, 1988]. Спермин, привлеченные к анимальному полюсу
35
яйцеклетки благодаря хемотаксису, имеющему большое значение у
Cnidaria [Miller, 1985], практически не имеют серьезных препятствий на
пути к слиянию клеточных мембран мужской и женской половых
клеток. Можно, по-видимому, считать, что отсутствие акросомы в таких
условиях биологически целесообразно. Остается только открытым вопрос
почему в спермиях кишечнополостных все же существует акросомаль-
ный материал в виде проакросомальных везикул? Японский
исследователь М. Ямашита [Yamashita, 1988], обсуждая эту проблему,
предположил, что проакросомальные везикулы являются скорее не
предшественниками, а рудиментами акросомы, вероятно существовавшей в анцест-
ральных спермиях кишечнополостных. А.А. Реунов [1998 б] показал,
что в сперматидах гидромедузы G. vertens помимо мелких
проакросомальных везикул происходит формирование структуры, напоминающей
акросомальную везикулу. В течение спермиогенеза данная структура,
возникающая из диктиосом аппарата Гольджи подобно акросоме
расположена над апикальной поверхностью ядра (табл. 13 Б), а затем
смещается в базальную часть клетки, где выводится наружу (табл. 13 В).
Данный феномен, напоминающий явление формирования временной
акросомы, известный у двустворчатого моллюска Laternula limicola [Kubo,
1977] и некоторых костистых рыб [Mattei, Mattei, 1978; Billard, 1983],
безусловно требует дальнейшего исследования среди других видов
кишечнополостных. Если механизм эвакуации акросомо-подобной структуры
окажется распространенным, то предположение об отсутствии
акросомы в сперматозоидах кишечнополостных, как вторично приобретенном
признаке, будет представляться вполне правомочным.
Как и у губок, у кишечнополостных наглядно прослеживается процесс
формирования гамет из клеток, которые по своим морфологическим
признакам практически не отличаются от соматических жгутиковых
эпителиальных клеток. У гидроидных источником возникновения половых клеток
являются жгутиковые интерстициальные клетки эктодермы [Burnet et al.,
1966; Schincariol et al., 1967; Davis, 1973; Tardent, 1974]. По мнению П. Брие-
на [Brien, 1966 - по: Рузен-Ранге, 1980], нет оснований полагать, что среди
интерстициальных клеток имеется определенная группа клеток, которые
можно было бы считать первичными половыми. Однако, в энтодермальной
гастродерме гидромедузы Phialidium gregarinum обнаружены
интерстициальные клетки, содержащие половые детерминанты ("nuage") в цитоплазме
[Рузен-Ранге, 1980]. Таким образом, представляется вероятным, что у
гидроидных наличие цитоплазматических половых детерминантов является
единственным фактором, отличающим первичные половые клетки от
соматических.
Ультраструктурные исследования показали, что характерной
особенностью сперматогенеза гидроидных является жгутиковость ранних спер-
матогенных клеток [Stagni, Lucchi, 1970; Zihler, 1972; Moore, Dixon, 1972].
Как это наиболее наглядно продемонстрировано у гидр [Moore, Dixon,
1972], при накоплении интерстициальных клеток в спермариях
происходят их митотические деления, в результате чего возникают клетки
меньших размеров, по-видимому, сперматогонии. В зрелых семенниках число
таких клеток увеличивается и в них происходят характерные изменения
36
хроматина. Клетки этого типа имеют небольшой жгутик и, по мнению
авторов, являются сперматоцитами I. Показано, что у вторичного спер-
матоцита имеются два жгутика. В результате второго деления
созревания каждая сперматида получает один жгутик. Формирование аксонем
было обнаружено и нами в ранних сперматогенных клетках гидромедузы
G. vertens (см. табл. 12 В).
У коралловых полипов [Dewel, Clark, 1972, Lyke, Robson, 1975; Schmidt,
Holtken, 1980; West, 1980; Larkman, Carter, 1980; Larkman, 1984; Van-Praet,
1990] общим признаком ранних сперматогенных клеток безусловно
является возникновение жгутиков, что подтверждают и наши данные (см.
табл. 12 Г, Д).
X. Шмидт и Б. Хольткен [Schmidt, Holtken, 1980] предположили, что
существование аксонем и жгутиков доказывает происхождение
сперматогенных клеток Cnidaria из жгутиковых энтодермальных
эпителиальных клеток. В мужских гаметоцитах кишечнополостных не существует
фиксированной локализации аппарата Гольджи около базальных телец
жгутиков. В сперматидах гидромедуз проакросомальные везикулы
формируются диктиосомами, расположенными над апикальной
поверхностью ядра [Yamashita, 1988]. Отстраненность комплекса Гольджи от
базального тельца жгутика характерна и для сперматогенных клеток
коралловых полипов (см. табл. 12 Д).
PRIAPULIDA
Сперматогенез и строение сперматозоидов приапулид на
ультраструктурном уровне были исследованы в ряде работ [Afzelius, Ferraguti, 1978b;
Storch et al., 1989; Alberti, Storch, 1988; Storch, Higgins, 1989; Адрианов и др.,
1992; Реунов и др., 1992; Адрианов, Реунов, 1992; Адрианов, Малахов, 1996].
Установлено, что для крупных приапулид, обладающих наружным
осеменением, таких как Priapulus caudatus и Halicryptus spinulosus, типичными
являются наружное осеменение и примитивно-классические сперматозоиды
(рис. 6 3, И). Для карликовых приапулид Tubiluchus corallicola и Т. philip-
pinensis характерны модифицированные сперматозоиды, приспособленные
к внутреннему способу осеменения, типичному для данных видов [см. Alberti,
Storch, 1988; Storch, Higgins, 1989; Адрианов, Малахов, 1996].
Ультраструктурные особенности дифференциации сперматогенных клеток всех стадий у
приапулид были рассмотрены только у двух макробентосных видов P.
caudatus и Я. spinulosus [Адрианов и др., 1992; Реунов и др., 1992; Адрианов,
Реунов, 1992].
Показано, что характерной особенностью сперматогенеза P. caudatus
(рис. 6 А-Д; 3) и Я. spinulosus (рис. 6 А-В; Е, Ж, И) является наличие
жгутика уже на стадиях первичного (рис. 6 Б; см. вклейку табл., 14 А) и
вторичного (рис. 6 В) сперматоцитов. Типично, что около базального тельца жгутика
всегда локализован комплекс Гольджи, который уже в сперматоцитах
продуцирует проакросомальные везикулы (табл. 14 А).
Формирование акросом в сперматидах приапулид P. caudatus и Я.
spinulosus своеобразно для каждого из данных видов [Адрианов и др., 1992;
Реунов и др., 1992; Адрианов, Реунов, 1992; Адрианов, Малахов, 1996]. У при-
37
Рис. 6. Сперматогенные клетки макробентосных приапулид [по: Адрианов, Реунов, ] 992]
А-В - ранние стадии, сходные для Priapulus caudatus и Halicryptus spinulosus: сперматогоний (А),
первичный сперматоцит (Б), вторичный сперматоцит (В); Г, Д - спермиогенез P. caudatus; Е, Ж - спермиоге-
нез Н. spinulosus; 3 - сперматозоид P. caudatus; И - сперматозоид Н. spinulosus; стрелки указывают на ак-
росомальные везикулы, формирующиеся в сперматоцитах и сперматидах
я - ядро, ск - синаптонемальный комплекс, кг - комплекс Гольджи. ж - жгутик, м - митохондрия
апулюса в результате объединения разрозненных проакросомальных
везикул в прицентриолярном регионе клетки формируется крупная акросомаль-
ная везикула (рис. 6 Г). В течение спермиогенеза происходит постепенная
миграция этой структуры на апикальный полюс клетки (рис. 6 Д). У халик-
риптуса, напротив, везикулы-предшественники не объединяются вблизи ба-
зального тельца жгутика, но мигрируют к месту их слияния над апикальной
поверхностью ядра (рис. 6 Е, Ж). В обоих случаях комплекс Гольджи
элиминируется в течение спермиогенеза.
38
NEMERTIN!
Для немертин типичны наружное осеменение и наружно-внутреннее
осеменение в слизи. У некоторых видов известно наружно-внутреннее
осеменение, при котором сперматозоиды проникают в оводукты женских
гонад. Сперматозоиды у немертин бывают, как примитивными, так
модифицированными и аберрантными [Franzen, 1956; Gerner, 1969; Afzelius, 1971;
Turbeville, Ruppert, 1985; Strieker, Cavey, 1986; Реунов, Чернышев, 1992;
Jespersen, 1994; Reunov, Klepal, 1997].
Среди немертин с наружным осеменением и примитивными
сперматозоидами ультраструктурные особенности дифференциации сперматогенных
клеток изучены только у Procephalothrix sp. Показано [Reunov, Klepal, 1997],
что сперматогоний и первичные сперматоциты этого вида немертин
являются жгутиковыми клетками. Как в сперматогониях, так и в сперматоцитах
около центриоли, являющейся базальным тельцем жгутика, локализован
комплекс Гольджи, который уже в сперматогониях и сперматоцитах
продуцирует электроношютные проакросомальные везикулы (рис. 7 А, Б).
Морфологически обособленная стадия вторичного сперматоцита у
Procephalothrix sp. отсутствует, так как оба мейотических деления ядра
происходят в пределах первичного сперматоцита (рис. 7 В, Г). В гонаде можно
наблюдать только первичные сперматоциты, сперматиды и мейотически
делящиеся клетки. Согласно нашим наблюдениям жгутик, обнаруживаемый
еще у сперматогония (рис. 7 А), сохраняется неизменным на протяжении
обоих делений мейоза и постепенно становится "собственностью" одной из
четырех ранних сперматид (рис. 7 Д). Характерно, что в течение
спермиогенеза жгутики возникают и у трех других сперматид (рис. 7 Е). Таким
образом, все четыре сперматиды являются жгутиковыми клетками, в которых
около базального тельца жгутика располагается комплекс Гольджи,
продуцирующий проакросомальные везикулы. В более поздних сперматидах
проакросомальные везикулы сливаются в единую акросомальную везикулу,
причем формирование этой структуры неизменно осуществляется в
прицентриолярном регионе (рис. 7 Ж). Впоследствии происходит миграция акросо-
мальной везикулы на апикальный полюс клетки (рис. 7 3, И), где она
превращается в акросому, расположенную асимметрично по отношению к
продольной оси клетки (рис. 7 К; см. табл. 5 Г). В течение спермиогенеза
митохондрии концентрируются вокруг основания ядра и в конечном итоге
формируют единую кольцевую митохондрию (см. табл. 5 Д). Ядро меняет
форму из округлого в удлиненное. Наблюдается постепенная конденсация
хроматина (рис. 7 Ж-К). Развивающиеся сперматиды соединены
межклеточными мостиками, которые утрачиваются в позднем спермиогенезе.
Таким образом, у представителя наиболее примитивных немертин
(Procephalothrix) сперматогенные клетки всех стадий обладают жгутиком,
около базального тельца которого локализован комплекс Гольджи, уже со
стадии сперматогониев продуцирующий проакросомальные везикулы.
Сопряженность базального тельца и комплекса Гольджи сохраняется в
сперматогенных клетках всех стадий, включая сперматиды в период формирования
акросомы (рис. 7 А-3). В позднем спермиогенезе диктиосомы
элиминируются из клетки.
39
Рис. 7. Сперматогенные клетки немертины Procephalothrix sp. [схематизировано А.А.
Реуновым по собственным данным]
А - сперматогоний; Б-Г - сперматоциты; Д-И - спермиогенез; К - сперматозоид
ж - жгутик, кг - комплекс Гольджи, ц - центриоли, пв - проакросомальные везикулы, я - ядро, м -
митохондрия, ав - акросомальная везикула, а - акросома
40
POLYCHAETA
Среди полихет широко распространено наружное осеменение [Schroeder,
Hermans, 1975]. Кроме того, встречаются разновидности
наружно-внутреннего и внутреннего осеменения, которые характеризуются такими терминами
как гиподермальная импрегнация, перенос сперматофоров и сперматоцейгм
[Hsieh, Simon, 1990], копуляция [Westheide, 1984] и псевдокопуляция [Daly,
1973]. Известно также наружно-внутреннее осеменение внутри трубки
[Eckelbarger, 1984]. Данное разнообразие способов осеменения определяет и
разнообразие спермиев полихет, описанное в ряде публикаций [Scharnofske,
1986; Rouse, Jamieson, 1987; Eckelbarger, Grassle, 1987; Rouse, 1988; Jamieson,
Rouse, 1989; von Nordheim, 1989; Franzen, Rice, 1988; Bentley, Serries, 1992;
Rouse, Gambi, 1998; Marotta et al., 2003]. Считается доказанным, что исходным
у полихет является наружное осеменение, а в качестве исходного типа
сперматозоида может рассматриваться примитивный сперматозоид,
приспособленный к наружному осеменению. Производными этого типа являются
широко встречающиеся у полихет примитивные сперматозоиды с элементами
модифицированное™ и аберрантности. Известны также модифицированные
сперматозоиды, модифицированные сперматозоиды с различными
проявлениями аберрантности, а также аберрантные сперматозоиды.
Сперматогенез Polychaeta довольно хорошо изучен на
ультраструктурном уровне с рассмотрением всех стадий сперматогенных клеток [Bertout,
1976; Sawada, 1984; Eckelbarger, 1984; Rice, Eckelbarger, 1989; Bentley, Pacey,
1989; Liicht, Pfannenstiel, 1989; Pacey, Bentley, 1992]. По общему мнению,
ранние сперматогенные клетки прикреплены к стенке целома. Кластеры более
поздних сперматогониев отделяются и их дальнейшее развитие происходит
в процессе "свободного плавания" в среде целомической жидкости.
Ни в одной из публикаций, посвященных сперматогенезу полихет не
говорится о формировании жгутиков в сперматогониях, но, вероятно, при
более детальном ультраструктурном исследовании в сперматогониях могут
быть обнаружены признаки аксонем, формирующихся в цитоплазме.
Характерной особенностью сперматогониев (рис. 8 А) некоторых полихет
является продуцирование проакросомальных везикул комплексом Гольджи
[Bertout, 1976; Kubo, Sawada, 1977]. Для сперматоцитов (рис. 8 Б; В; см.
табл. 14 Б) обычен жгутик, вблизи базального тельца которого
расположена проксимальная центриоль и комплекс Гольджи. По данным К. Экельбар-
гера [Eckelbarger, 1984], у полихеты Phragmatopoma lapidosa каждый
первичный сперматоцит имеет один короткий неподвижный жгутик. У каждого
вторичного сперматоцита присутствует один длинный жгутик, который
слегка движется из стороны в сторону. Жгутик ранней сперматиды хорошо
развит и активен. Так же как в сперматогенных клетках более ранних
стадий, комплекс Гольджи в сперматидах изначально локализован около цент-
риолей и продуцирует проакросомальные везикулы. Здесь же в прицентри-
олярном регионе благодаря объединению мелких проакросомальных
везикул происходит формирование крупной акросомальной везикулы (рис. 8 Г).
После того, как укрупняющаяся акросомальная везикула смещается
(рис. 8 Д) и локализуется над ядром (рис. 8 Е), происходит постепенное
формирование видоспецифичной акросомы (рис. 8 Ж-И).
41
Рис. 8. Сперматогенные клетки полихеты Phragmatopoma lapidosa [А-Е схематизировано
А.А. Реуновым по: Eckelbarger, 1984; Ж-И по: Eckelbarger, 1984]
А - сперматогоний; Б - сперматоцит I; В - сперматоцит II; Г-3 - сперматиды, И - сперматозоид
ц - центриоли, пц - проксимальная центриоль, дц - дистальная центриоль, кг - комплекс Гольджи,
пв - проакросомальные везикулы, ав - акросомальная везикула, я - ядро, ск - синаптонемальный
комплекс, ж - жгутик, м - митохондрия, а - акросома
42
MOLLUSCA
Наиболее часто примитивные сперматозоиды встречаются у
двустворчатых моллюсков, сперматогенез у которых в течение долгого времени
являлся предметом многочисленных ультраструктурных исследований [Longo,
Dornfeld, 1967; Longo, Anderson, 1970; Popham, 1974; Popham et al., 1974;
Franzen, 1983; Дроздов, Касьянов, 1985а; Hodgson, Bernard, 1986; Дроздов, Ре-
унов, 1986а, б; Реунов, Дроздов, 1986, 1987; Dorange, Le Pennec, 1989;
Eckelbarger et al. 1990; Hodgson et al., 1990; Реунов, Дроздов, 1992; Reunov,
Hodgson, 1994a; Дроздов, Реунов, 1997; Reunov et al., 1999]. Многие виды
Bivalvia имеют мужские гаметы с удлиненными головками, что обычно
связано, либо с некоторыми модификациями в способе осеменения в виде
осеменения в мантийной полости, либо сопряжено с крупным размером
яйцеклеток [Popham, 1974; Franzen, 1983; Дроздов, Касьянов, 1985а; Eckelbarger
et al., 1990]. Такие сперматозоиды двустворчатых моллюсков принято
называть модифицированными, но во многих случаях речь идет не столько
о модифицированных мужских гаметах, сколько о примитивных
сперматозоидах с элементом модифицированное™ в виде удлиненного ядра (см.
табл. 3 Б, Д).
В ряде ультраструктурных исследований показано, что в
сперматогенезе у двустворчатых моллюсков формирование жгутиков происходит на
заключительном этапе этого процесса - в спермиогенезе. Однако
некоторыми авторами [Kubo, 1977; Реунов, Дроздов, 1987; Rocha, Azevedo, 1990;
Eckelbarger et al., 1990; Hodgson et al., 1990; Reunov et al., 1999] было
продемонстрировано возникновение жгутиков в ранних сперматогенных
клетках - сперматогониях и сперматоцитах. Не исключено, что ранняя жгутико-
вость, была просто не замечена в исследованиях сперматогенеза многих
видов Bivalvia. Так, А.А. Реунов и Э.Н. Ходсон [Reunov, Hodgson, 1994 а)
переисследовали сперматогенез у шести видов двустворчатых моллюсков, для
которых жгутиковость ранних половых клеток не была описана в
предыдущих публикациях [см. Hodgson, Bernard, 1986; Hodgson et al., 1990]. Как это
было обнаружено благодаря переисследованию, характерной особенностью
ранних сперматогенных клеток данных видов является жгутик,
наблюдаемый уже у сперматогониев и сперматоцитов. Базальные тельца жгутиков,
наблюдаемых в клетках данных стадий оснащены прилегающими диктиосо-
мами комплекса Гольджи (см. табл. 14 В).
У некоторых видов двустворчатых моллюсков проакросомальные
везикулы продуцируются комплексом Гольджи уже в сперматогониях [Реунов,
Дроздов, 1987], но в более распространенном случае их формирование
начинается в первичных сперматоцитах. Если в цитоплазме сперматогенных
клеток ранних стадий проакросомальные везикулы распределены хаотично, то
в спермиогенезе происходит их локализация вблизи комплекса Гольджи,
прилегающего к базальному тельцу жгутика. Для вида Barbatia obliquata
показано [Reunov, Hodgson, 1994a), что в ранних сперматидах комплекс
Гольджи продуцирует довольно крупную первичную везикулу (рис. 9 А), после
чего наблюдается встраивание накопленных электроноплотных мелких
проакросомальных везикул в эту структуру (рис. 9 Б). Для сперматид
различных двустворчатых моллюсков типично, что крупная акросомальная ве-
43
А Б В
Рис. 9. Спермиогенез (А-Д) двустворчатого моллюска Barbatia obliquata [схематизировано
А.А. Реуновым по собственным данным]
я - ядро, м - митохондрия, кг - комплекс Гольджи, пав - первичная акросомальная везикула, пв -
проакросомальная везикула, ав - акросомальная везикула, пм - периакросомный материал, а - акросома,
пц - проксимальная центриоль, дц - дистальная центриоль, ж - жгутик
зикула, сформировавшаяся вблизи комплекса Гольджи, затем мигрирует к
апикальной поверхности ядра, где происходит дальнейшее формирование
акросомы (рис. 9 В-Д).
BRACHIOPODA
Среди брахиопод известно только наружное осеменение и описаны
только примитивные сперматозоиды (рис. 10 Д), которые могут быть отнесены
к двум разновидностям, типичным для классов Articulata и Inarticulata.
Сперматозоиды, характерные для представителей Articulata, имеющие элемент
44
Рис. 10. Сперматогенные клетки брахиопод [схематизировано А.А. Реуновым по
собственным данным]
А - сперматогоний; Б - первичный сперматоцит; В - вторичный сперматоцит;
Г - сперматида; Д - сперматозоид
я - ядро, м - митохондрия, пд - субстанция полового детерминанта, пв - проакросомальная
везикула, ц - центриоли, кг - комплекс Гольджи, ж - жгутик, ск.- синаптонемальный комплекс, а'в -
акросомальная везикула, а - акросома
модифицированности в виде кольцевой митохондрии [Afzelius, Ferraguti,
1978а; Reunov, 1993; Hodgson, Reunov, 1994], согласно предположению
Б.Афцелиуса и М. Феррагути [Afzelius, Ferraguti, 1978a] более близки по
строению к спермиям низших вторичноротых, тогда как спермин Inarticulata
[Sawada, 1973; Afzelius, Ferraguti, 1978a; Chuang, 1983] подобны таковым у
низших первичноротых. С.Х. Чуанг [Chuang, 1983] полагал, что более
усложненная организация спермиев Articulata отражает возможно существующую у них
разновидность внутреннего осеменения, хотя факт такового не был
установлен. Э.Н. Ходсон и А.А. Реунов [Hodgson, Reunov, 1994] предположили, что обе
версии не могут считаться абсолютно доказанными, так как исследования
проведены на незначительном количестве видов брахиопод. Скорее всего
различия в морфологии мужских гамет в данном случае свидетельствуют об
отсутствии близкого родства между классами Articulata и Inarticulata.
Сперматозоиды представителей Inarticulata могут быть отнесены к
примитивно-классическому типу, тогда как спермин Articulata являются примитивными с элементом
модифицированности в виде кольцевой митохондрии.
Сперматогенез с рассмотрением всех стадий был исследован только у
видов Discinisca tenius и Kraussina rubra, относящихся соответственно к
Articulata и Inarticulata [Hodgson, Reunov, 1994]. Несмотря на принадлежность
к различным классам, ультраструктурные особенности дифференциации
мужских гамет очень близки у обоих видов. Выраженной особенностью
формирующихся сперматогониев и сперматоцитов, является присутствие
крупных липидных включений, исчезающих в сперматидах.
Сперматогенные клетки имеют жгутики (рис. 10 А-Д). Как в сперматогониях (рис. 10 А),
так и в сперматоцитах (рис. 10 Б, В) и сперматидах (рис. 10 Г) около базаль-
ного тельца жгутика локализован комплекс Гольджи. В сперматидах акро-
45
сомальная везикула формируется в ирицентриолярном регионе (рис. 10 Г), а
затем смещается к апикальному полюсу клетки, где становится акросомой
сперматозоида (рис. 10 Д). Митохондрии концентрируются в зоне базально-
го тельца жгутика, окружая центриоли и комплекс Гольджи (рис. 10 Г),
который вскоре элиминируется и отсутствует в сперматозоиде (рис. 10 Д).
ECHINODERMATA
Среди иглокожих известны примеры наружно-внутреннего осеменения
[Buckland-Nicks et al., 1984], но для подавляющего большинства
Echinodermata характерно наружное осеменение, при котором
сперматозоиды преодолевают толстые студенистые оболочки яйцеклеток. По способу
преодоления студенистой оболочки сперматозоиды иглокожих могут быть
разделены на две разновидности. К одной из них принадлежат мужские
гаметы морских ежей, преодолевающие данную оболочку способом
активного проникновения и совершающие акросомную реакцию при
соприкосновении с желточной оболочкой яйцеклетки [Jessen et al., 1973; Marshall, Luykx,
1973]. У других иглокожих известны сперматозоиды, которые совершают
акросомную реакцию уже при соприкосновении со студенистой оболочкой,
после чего акросома формирует растущий актиновый выступ, за который
яйцеклетка как бы втягивает сперматозоид в свою цитоплазму [Colwin et al.,
1975; Hylander, Summers, 1975; Sousa, Azevedo, 1985; Tilney, Inoue, 1985;
Дроздов, Касьянов, 1985а; Дроздов, Иванков, 2000].
Сперматозоиды иглокожих относят к примитивному типу, хотя для
мужских гамет морских звезд, морских лилий, голотурий и офиур обычен такой
элемент модифицированности как кольцевая митохондрия. Для спермиев
морских ежей характерны два элемента модифицированности, одним из
которых является единый митохондриальный конгломерат, имеющий
кольцевую форму, а другим - удлиненность ядра (см. табл. 3 А, В, Г). Помимо
элементов модифицированности сперматозоиды иглокожих могут быть
дополнены элементами аберрантности, заключающимися в неравной толщине
кольцевой митохондрии и асимметричном положении акросомы.
На ультраструктурном уровне особенности сперматогенных клеток
иглокожих были изучены у представителей морских ежей [Longo, Anderson,
1969; Kato, Ishikawa, 1982; Eckelbarger et al., 1989; Reunov, Hodgson, 1994 b; Au
et al., 1998; 1999], голотурий [Atwood, 1974a, b; Реунов, Дроздов, 1991],
офиур [Yamashita, 1983; Yamashita, Iwata, 1983; Buckland-Nicks et al., 1984],
морских звезд [Sousa, Azevedo, 1988; Yamagata, 1988] и морских лилий [Bickell et
al., 1980].
Наиболее детально ультраструктурные механизмы сперматогенеза
исследованы у морских ежей. Дифференциация мужских половых клеток от
стадии сперматогониев до стадии зрелых сперматозоидов рассмотрена
несколькими исследователями [Longo, Anderson, 1969; Kato, Ishikawa, 1982;
Reunov, Hodgson, 1994b; Au et al., 1998; 1999], которые независимо друг от
друга констатировали факт формирования жгутиков ранними сперматоген-
ными клетками у различных видов Echinoidea. Так, например, в сперматого-
нии морского ежа Anthocidaris crassispina жгутиковый комплекс состоит
из двух центриолей, соединенных исчерченным корешком. Неотъемлемой
46
Рис. 11. Сперматогенные клетки морского ежа Anthocidaris crassispina [схематизировано
А.А. Реуновым по собственным данным]
А - сперматогоний; Б - первичный сиерматоцит; В - делящийся первичный сперматоцит; Г-Е -
вторичные сперматоциты
ж - жгутик, ц - центриоли, кг - комплекс Гольджи, ик - исчерченный корешок, я - ядро, фс -
фибриллярная структура, ск - синаптонемальиый комплекс, ак - аксонема
47
частью жгутикового аппарата являются диктиосомы комплекса Гольджи
(рис. 11 А; табл. 15). У первичных сперматоцитов исчерченный корешок
уже не наблюдается, но у проксимальной центриоли появляется
фибриллярная структура (см. вклейку, табл. 16 А). У более поздних первичных
сперматоцитов происходит возникновение дочерних центриолей (табл. 16 Б) после
чего пара центриолей, сопряженных с фибриллярной структурой,
мигрирует на противоположный полюс клетки, вероятно, благодаря активности
фибриллярной структуры (рис. 11 Б, В). Наблюдая вторичные сперматоциты,
отличающиеся от сперматоцитов первого порядка меньшим размером, мы
закономерно обнаруживали сперматоциты II как с торчащим жгутиком, так
и с внутренней аксонемой, сформированной одной из центриолей и
закрученной вокруг ядра (рис. 11 Г, Д; табл. 16 В). Это позволяет полагать, что
первое мейотическое деление происходит при наличии у клетки только
одного жгутика (рис. 11 В). Судя по всему, часть сперматоцитов II обретает
жгутик позже, когда аксонема выходит наружу (рис. 11 Д-Е) и становится
жгутиком, который некоторое время выглядит как бы прижатым к клетке
(табл. 16 Г). Подобная последовательность событий наблюдается и при
втором мейотическом делении. Поэтому у A. crassispina присутствуют как спер-
матиды с изначально наружным жгутиком, унаследованным от вторичного
сперматоцита (см. вклейку, табл. 17 А), так и сперматиды, в которых
аксонема развивается в цитоплазме (табл. 17 Б; В). В свете данных наблюдений
вполне естественным представляется тот факт, что только у половины
сперматозодов A. crassispina жгутик формируется дистальным способом
(табл. 17 А). Другая половина гамет претерпевает процесс выхода жгутика
наружу, после чего он сначала ориентирован апикально (табл. 17 Г), а затем,
постепенно открепляясь от головки сперматозоида (табл. 17 Д), обретает
дистальную направленность (табл. 17 Е).
Необходимо отметить, что наши представления о процессе
формирования жгутиков в мейозе A. crassispina противоречат данным К. Като и
М. Ишикава [Kato, Ishikawa, 1982], согласно которым у морского ежа
Hemicentrotus pulcherrimus перед каждым делением созревания жгутик
втягивается в цитоплазму и резорбируется. Так как собственно механизм
деструкции жгутиков не был описан японскими исследователями, можно
предполагать, что они считали резорбируемыми жгутиками аксонемы,
формирующиеся внутри сперматогенных клеток. Хотя не исключено и то, что у
морских ежей могут встречаться различные паттерны мейотического цилиоге-
неза.
Электронно-микроскопические исследования сперматогенеза у
голотурий Cucumaria lubrica, Leptosynapta clarki [Atwood, 1974a, b; Atwood, Chia,
1974], а также у дальневосточного трепанга Apostichopus japonicus [Дроздов
и др., 1986; Реунов, Дроздов, 1991] показали, что сперматогонии данных
видов имеют базальное тельце с проросшим из него жгутиком. Вблизи базаль-
ного тельца обычно расположен комплекс Гольджи. Для сперматоцитов
также характерно наличие жгутика. Комплекс Гольджи, который
по-прежнему локализован около центриолей, продуцирует в сперматоцитах проак-
росомальные везикулы.
У морских звезд [Sousa, Azevedo, 1988; Yamagata, 1988] первичные
половые клетки имеют жгутик, базальное тельце которого снабжено поперечно-
48
исчерченным корешком. Неподалеку от центриолей расположен комплекс
Гольджи. У гермафродитной морской звезды Asterina minor первичные
половые клетки такого типа дифференцируются как в сперматогонии, так и в
оогонии [Yamagata, 1982]. Таким образом, и сперматогонии и первичные
оогонии у данного вида морской звезды являются жгутиковыми клетками.
Исследования сперматогенеза офиур представлены рассмотрением
этого процесса у видов Amphipholis kochii и Ophiura sarsii [Yamashita, Iwata, 1983;
Yamashita, 1983]. В этих работах авторы уделили особое внимание
формированию акросом и жгутиков. Было показано, что формирование проакросо-
мальных везикул происходит в сперматогониях благодаря активности
комплекса Гольджи, расположенного около центриолей. Так же как у A. kochii,
так и у О. sarsii жгутики наблюдаются у ранних сперматогенных клеток со
стадии профазы первого мейотического деления.
Среди морских лилий наиболее детально на ультраструктурном уровне
был исследован сперматогенез у Florometra serratissima. Авторы [Bickell et
al., 1980] показали, что в цитоплазме сперматогониев содержатся две
центриоли (дистальная и проксимальная). От дистальной центриоли в
цитоплазму простирается поперечно-исчерченный корешок. В течение первой мейо-
тической профазы дистальная центриоль теряет поперечно-исчерченный
корешок и формирует аксонему. Комплекс Гольджи, расположенный около
центриолей, начинает продуцировать проакросомальные везикулы.
У иглокожих формирование сперматид протекает по единому
механизму. Акросомальная везикула возникает в базальной части сперматиды
благодаря слиянию мелких проакросомальных везикул, продуцируемых
комплексом Гольджи. В дальнейшем происходит миграция акросомальной
везикулы на апикальный полюс клетки и нужно отметить, что комплекс
Гольджи не следует за этой структурой, а сохраняет прицентриолярную
локализацию [Реунов, Дроздов, 1991]. Митохондрии, группирующиеся вокруг
центриолей, объединяются в единую кольцевую митохондрию. Аппарат
Гольджи, выполнивший функцию формирования акросомы, удаляется из клетки
с резидуальной цитоплазмой [Sousa, Azevedo, 1988; Yamagata, 1988; Au et al.,
1998].
Таким образом, несомненно общей особенностью дифференциации
сперматогенных клеток иглокожих является раннее формирование
жгутиков, наиболее детально описанное у морских ежей, но известное также у
голотурий, морских звезд, офиур и морских лилий. Для всех изученных
иглокожих характерна локализация комплекса Гольджи около базального
тельца жгутика на всех стадиях сперматогенных клеток.
Необходимо отметить, что при исследованиях герминативного эпителия
иглокожих некоторые исследователи [Longo, Anderson, 1969] подчеркивали
существование единого жгутикового паттерна, характерного для клеток це-
ломического эпителия, интерстициальных клеток и ранних сперматогенных
клеток. По мнению биологов, изучавших эмбриогенез иглокожих [Юшин и
др., 1993] моноцилиарность клеток, наблюдаемая в различных тканях
взрослых особей объясняется повторением данными клетками структуры
примитивной жгутиковой клетки. Таким образом, жгутиковость сперматогенных
клеток Echinodermata скорее всего сопряжена с рекапитуляцией архаичного
морфотипа, присущего эмбриональным клеткам.
4 Реунов А. А.
49
ASCIDIACEA
Среди оболочников процесс осеменения рассмотрен только для асцидий,
у которых он в большинстве случаев является наружным. При наступлении
нереста асцидий, являющиеся гермафродитами, одновременно
выбрасывают в морскую воду как сперматозоиды, так и яйцеклетки. Тем не менее,
самоосеменения в данном случае не происходит и к контакту способны
только гаметы разных особей [Berrill, 1975; Rosati, 1985]. Спермин асцидий
(рис. 12 Ж), как правило, имеют очень маленькие акросомы. По словам
Ф. Росати [Rosati, 1985], акросомы так малы, что у некоторых видов их
существование сомнительно. Тем не менее, в большинстве случаев акросома
существует и представлена уплощенной везикулой, расположенной в
апикальной части ядра и совершающей акросомную реакцию при контакте с
желточной оболочкой яйцеклетки. Характерной особенностью данных
гамет является единственная удлиненная митохондрия, расположенная лате-
рально по отношению к ядру [Cloney, Abbott, 1980; Cotelli et al., 1980; Villa,
Tripepi, 1983]. Примитивный сперматозоид в данном случае имеет элемент
модифицированности (удлиненное ядро) и три элемента аберрантности,
таких как отсутствие проксимальной центриоли, одна митохондрия и ее
асимметричное положение.
Яйцеклетки асцидий покрыты сложной системой оболочек, благодаря
которой они считаются одним из наиболее элегантных вариантов архитектуры
ооцитов, встречаемых у Metazoa [Woollacott, 1977]. Система покровов состоит
из слоя наружных фолликулярных клеток, желточной оболочки, за которой
следует перивителлиновое пространство, содержащее особые клетки,
формирующие палисад вокруг яйцеклетки. Показано, что на преодоление этих трех
слоев сперматозоид тратит около двух минут [Lambert, 1982]. Напомним, что
у большинства морских беспозвоночных для преодоления яйцевых оболочек
(студенистой и желточной) сперматозоидам необходимо всего несколько
секунд. У асцидий, в наиболее типичном случае, при контакте сперматозоида с
первой оболочкой яйцеклетки его митохондрия увеличивается в пять-семь
раз, а затем смещается вдоль жгутика, по мере того, как спермий проникает
через оболочки. Когда жгутик исчезает внутри яйцевых покровов,
митохондрия остается за его пределами. Интересной особенностью яйцеклеток
асцидий является отсутствие кортикальных гранул, которые при осеменении у
большинства многоклеточных животных формируют оболочку
оплодотворения, предотвращающую полиспермию. Блокировка проникновения лишних
сперматозоидов у асцидий происходит за счет молекулярной перестройки
собственно клеточной мембраны [Rosati et al., 1977].
Вопросы дифференциации сперматогенных клеток асцидий
рассмотрены в ряде работ [Kubo et al., 1978; Villa, Tripepi, 1982, 1983; Cotelli et al., 1980;
Cloney, Abbott, 1980]. Женский и мужской компартменты гермафродитных
асцидий часто соседствуют в гонаде. По данным авторов, наблюдавших
сперматогонии [Cotelli et al., 1980], хроматин в ядрах этих клеток мелкогра-
нулирован. Одно или два ядрышка локализованы около ядерной мембраны.
В цитоплазме присутствуют удлиненные митохондрии (рис. 12 А).
Для первичных сперматоцитов (рис. 12 Б) типично появление синаптоне-
мальных комплексов на стадии зиготены-пахитены. В сперматоцитах асци-
50
Рис. 12. Сперматогенные клетки асцидий [схематизировано А.А. Реуновым по: Kubo et al.,
1978; Villa, Tripepi, 1983]
A - сперматогонии; Б - первичный сперматоцит; В-Е - сперматиды; Ж - сперматозоид
м - митохондрия, мм - межклеточный мостик, ск - синаптонемальный комплекс, ц - центриоли, кг -
комплекс Гольджи, пв - проакросомальная везикула, ав - акросомальная везикула, а -акросома, я - ядро,
ж - жгутик
51
дии Halocynthia roretzi авторы [Kubo et al., 1978] обнаружили парные центри-
оли с локализованным около них аппаратом Гольджи. У асцидий Ascidia
malaca, Ascidiella aspersa и Phallusia mamillata также найдены центриоли с
прилежащим комплексом Гольджи [Villa, Tripepi, 1983]. Кроме того, для
этих видов было показано, что дистальная центриоль является базальным
тельцем жгутика, отрастающего от сперматоцита (рис. 12 Б). У асцидий А.
aspersa комплекс Гольджи продуцирует везикулы, которые вполне
сравнимы с проакросомальными везикулами других беспозвоночных [Villa, Tripepi,
1983]. Так же как в сперматогониях, в цитоплазме сперматоцитов асцидий
присутствуют удлиненные разрозненные митохондрии. Авторы, как
правило, не описывают вторичные сперматоциты, подразумевая, что их
ультраструктура аналогична структуре сперматоцитов I.
Ранние сперматиды (рис. 12 В) и средние сперматиды (рис. 12 Г, Д)
сохраняют центриолярный аппарат со жгутиком и прилегающим комплексом
Гольджи. В поздних сперматидах и спермиях комплекс Гольджи отсутствует
(рис. 12 Е, Ж). Так же как и в сперматоцитах, удлиненные митохондрии
ранних сперматид расположены в цитоплазме беспорядочно. На апикальной
поверхности ядра появляется электроноплотная структура, характеризуемая
как "темное плато" (рис. 12 В). По мнению ряда авторов, это скопление
электроноплотного материала в сперматидах асцидий является субстанцией,
организующей конденсацию хроматина и выступающей как субстрат для
локализации акросомальной везикулы. Конденсация хроматина начинается
от зоны темного плато и носит спиральный характер. В процессе спермио-
генеза происходит объединение митохондрий и формирование одной
крупной удлиненной митохондрии, которая в средних сперматидах (рис. 12 Г, Д),
поздних сперматидах (рис. 12 Е), а также в спермиях (рис. 12 Ж)
расположена латерально по отношению к ядру. Из имеющихся описаний не совсем
понятно где именно происходит объединение проакросомальных везикул, но,
судя по всему, акросомальная везикула формируется неподалеку от центри-
олей, либо у боковой поверхности ядра (рис. 12 Г, Д), после чего смещается
к темному плато (рис. 12 Е). Становясь акросомой, акросомальная везикула
сильно уплощается (рис. 12 Ж).
TELEOSTEI
Для всех позвоночных, за исключением рыб, характерны
исключительно модифицированные сперматозоиды или модифицированные
сперматозоиды с элементами примитивности и/или аберрантности. Рыбы являются
единственной группой Vertebrata, в которой обнаружены все три категории
сперматозоидов (рис. 1 А-В), характерных для многоклеточных животных
[Boisson et al., 1967; Billard, 1970; 1986; Jespersen, 1971; Гинзбург, 1977;
Afzelius, 1978; Grier, 1981; Jaana, Yamamoto, 1981; Stanley, 1983; Cherr, Clark,
1984; Thiaw et al., 1986; 1990; Mattei, 1970; 1988; Mattei et al., 1989; Кауфман,
1990; Jamieson, 1991a; Дроздов, Иванков, 2000]. Согласно предположениям
Б. Джемисона [Jamieson, 1991a], рыбы возникли от предка, имевшего
наружное осеменение и примитивные сперматозоиды, а впоследствии среди них
появились формы, использующие внутреннее осеменение и гаметы
модифицированного типа. Тот же исследователь считает, что во многих таксонах
52
Pisces был возможен вторичный возврат к наружному осеменению и спер-
миям примитивного типа. По теории Б. Баччетти и Б. Афцелиуса [Baccetti,
Afzelius, 1976] костистые рыбы могли возникнуть в пресноводных водоемах,
вследствие чего их примитивные сперматозоиды не имеют акросом, для
которых пресная вода является неблагоприятным осмотическим фактором.
Отсутствие акросом у морских костистых рыб эти исследователи связывали
с возможностью становления последних, как ветви пресноводных форм.
Обобщения К. Маттеи [Mattei, 1988], позволяют предполагать, что,
вторично возникнув, наружное осеменение и примитивные сперматозоиды в
некоторых таксонах вновь подвергались эволюционным преобразованиям, опять
приближаясь к внутреннему осеменению и становясь базисом для
модифицированных и аберрантных сперматозоидов. Трудно что-либо возразить
данным представлениям, соответствующим сложности и гипотетичности
филогенетических отношений, существующих между различными
таксонами суперкласса Pisces [см. Дроздов, Иванков, 2000; Иванков, 2001].
Ультраструктурные исследования дифференциации примитивных
сперматозоидов, на основании которых можно сделать вывод об особенностях
этого процесса у рыб, наиболее детально выполнены для некоторых видов
Teleostei [Grier, 1981; Дроздов и др., 1981; Billard, 1983; Lopes et al, 1987;
Thiaw, Mattei, 1989; Lou, Takahashi, 1989; Silveira et al., 1990; Yamashita et al.,
1990; Lahnsteiner, Patzner, 1990; Van Vuren, Fishelson, 1990; Fishelson et al.,
1990; Munoz et al., 2002]. На основании этих работ и результатов наших
собственных исследований можно заключить, что для формирования
примитивных сперматозоидов костистых рыб не характерны явления
рекапитуляции структуры жгутиковой клетки и раннего формирования
проакросомальных элементов. В ранних сперматогенных клетках костистых рыб (см.
вклейку, табл. 18 А) центриоли (табл. 18 Б) не формируют аксонем.
Формирование жгутиков впервые происходит в сперматидах (табл. 18 В, Г), как это
характерно для традиционной схемы сперматогенеза многоклеточных
животных (см. гл. 3). В спермиогенезе некоторых костистых рыб не найдено
никаких признаков формирования акросомы. Мы, например, не
обнаружили каких-либо структур, напоминающих акросомальные элементы, в
сперматидах представителя лососевых рыб Oncorhynchus kisutch (табл. 18 В).
Однако среди костистых рыб известны примеры рекапитуляции акросомы.
Так, в ранних сперматидах Salmo gairdneri наблюдаются начальные стадии
формирования акросомальной вакуоли, которая постепенно регрессирует
[Billard, 1983]. В спермиогенезе Lepadogaster lepadogaster авторы [Mattei,
Mattei, 1978] характеризуют подобную структуру, как "остаточная акросо-
ма". Нам удалось обнаружить формирование вакуоли, напоминающей акро-
сомальную везикулу, возникающую путем расширения одной из диктиосом
комплекса Гольджи, в сперматидах камбалы Cleisthenes herzensteini
(табл. 18 Д). Однако, даже в случае рекапитуляции начальных этапов
формирования акросомы в сперматидах, зрелые примитивные сперматозоиды
костистых рыб не имеют акросом (см. табл. 4 Е).
У рыб сперматозоиды проникают в яйцеклетку через специальные
отверстия яйцевых оболочек - микропиле. Наличие данных отверстий показано,
как у хрящевых рыб, имеющих модифицированные сперматозоиды с акросо-
мами, так и у костистых, примитивные спермин которых не имеют акросом.
53
Для яйцеклеток более примитивных рыб характерно наличие нескольких
микропиле, а у представителей более эволюционно продвинутых таксонов, как
правило, имеется только одно микропиле [Koch, Lambert, 1990].
УЛЬТРАСТРУКТУРНЫЕ ОСОБЕННОСТИ ДИФФЕРЕНЦИАЦИИ
ПРИМИТИВНЫХ СПЕРМАТОЗОИДОВ
Как уже обсуждалось в гл. 4, сперматозоиды губок и кишечнополостных
в эволюционном смысле принято считать наиболее примитивными, еще не
имеющими настоящих акросом [Baccetti, Afzelius, 1976; Baccetti, 1984].
Нужно отметить, что данное представление возникло на основе исследований
конечного продукта сперматогенеза - сперматозоидов. Тем не менее, как
это было показано выше, у губки Spongilla lacustris происходит
формирование проакросомальных везикул в сперматоцитах [Paulus, 1989]. В ранних
сперматидах S. lacustris формируется акросомоподобная структура, которая
вакуолизируется и устраняется из клетки в течение спермиогенеза. Поздние
сперматиды и спермин губок в большинстве случаев не имеют ни акросом,
ни акросомоподобных везикул. Исключение составляет губка О. lobularis, у
спермиев которой есть акросома, аналогичная акросомам примитивных
спермиев других морских беспозвоночных [Baccetti et al., 1986]. Пока это
единственный случай, описанный среди губок.
Крупная акросомоподобная везикула была обнаружена и в сперматидах
гидромедузы G. vertens. Показано [Реунов, 19986], что для "поведения" этой
структуры характерна тенденция к апикальной локализации, после чего
происходит ее миграция в базальную часть сперматиды, где она выводится
за пределы клетки.
Главное отличие, которое наблюдается в спермиогенезе
кишечнополостных по сравнению с формированием спермиев губок заключается в том,
что у Spongia из сперматид элиминируются все структуры,
предположительно являющиеся проакросомальными, а у Cnidaria происходит лишь их
частичная эвакуация. На примере гидромедузы G. vertens продемонстрировано
[Реунов, 19986], что, несмотря на устранение крупной акросомоподобной
везикулы, мелкие проакросомальные везикулы сохраняются в
сперматозоидах. Детальное исследование М. Ямашита позволяет считать, что эти
везикулы остаются интактными при проникновении сперматозоида в
яйцеклетку и, таким образом, не выполняют акросомальную функцию [Yamashita,
1988].
Анализ спермиогенеза G. vertens индуцирует весьма интересный вопрос
о взаимосвязи крупной акросомоподобной везикулы и мелких
проакросомальных везикул, для ответа на который целесообразно рассмотреть
процесс возникновения акросом у других беспозвоночных. Известно, что
механизм формирования акросомальной везикулы может быть различным у
разных видов [Адрианов, Реунов, 1992]. Как показало наше исследование
формирования акросомальной везикулы у некоторых видов двустворчатых
моллюсков [Reunov, Hodgson, 1994a] и брахиопод [Hodgson, Reunov, 1994], этот
процесс может начинаться с возникновения крупного пузырька, в который
встраиваются более мелкие проакросомальные везикулы. Появление
подобной структуры было показано также в спермиогенезе олигохет. Автор
54
[Jaana, 1983] назвал ее "первичной акросомальной везикулой". Вероятно, у
гидромедуз крупная акросомоподобная структура в прошлом могла
функционировать как первичная акросомальная везикула, служащая для
накопления в ней более мелких проакросомальных пузырьков. Процесс эвакуации
данной структуры, вероятно возникший в эволюции Cnidaria, по-видимому,
разрушил механизм формирования полноценной акросомы. Не исключено,
что проакросомальные везикулы, наблюдаемые сегодня в спермиях
кишечнополостных, не вступают в финальную фазу формирования акросомы
вследствие редукции первичной акросомальной везикулы. Нужно заметить,
что среди кишечнополостных возникновение временных
акросомоподобных везикул обнаружено только у представителя гидромедуз, тогда как у
сцифомедуз и коралловых полипов такие структуры пока не найдены.
Можно предположить, что механизм их рекапитуляции был утрачен спермато-
генными клетками более эволюционно продвинутых таксонов
кишечнополостных. Однако, для того, чтобы предположения об эволюционных
тенденциях дифференциации сперматогенных клеток Cnidaria превратились в
твердые убеждения необходимо наличие большего количества
ультраструктурных данных об особенностях формирования акросомальных структур у
представителей всех таксонов.
Таким образом, одной из главных особенностей, составляющих сходство
сперматогенеза губки S. lacustris и гидромедузы G. vertens, является
формирование временных акросомоподобных структур. Благодаря данному факту
можно предполагать, что мужские гаметы предковых форм Spongia и
Cnidaria обладали акросомами и, если редукция акросомальных элементов
будет обнаружена в сперматогенезе большего количества видов,
традиционное представление [см. Baccetti, Afzelius, 1976; Baccetti, 1984] о ходе
эволюции гамет в данном ярусе филогенетического древа может быть
существенно скорректировано.
Сравнительный анализ показывает, что в развитии примитивных
спермиев рассмотренных представителей морских беспозвоночных
присутствуют такие общие особенности, как раннее возникновение проакросомальных
везикул и жгутиков, что не характерно для традиционной схемы
сперматогенеза (см. гл. 3).
Причины столь нестандартного развития акросом дискутировались
рядом авторов. Так, например, М. Ямашита [Yamashita, 1983] предположил,
что раннее развитие проакросомальных везикул у офиур скоррелировано с
большим размером акросомы зрелого спермия и короткой
продолжительностью сперматогенного цикла. Но проакросомальные везикулы в ранних
сперматогенных клетках обнаружены и у многих морских беспозвоночных,
обладающих обычной скоростью протекания сперматогенеза [см. Reunov,
Klepal, 1997], что едва ли позволяет считать гипотезу японского
исследователя единственно возможной. У некоторых беспозвоночных таких,
например, как брахиоподы прослеживается закономерность, которая выражается
в зависимости времени начала продуцирования проакросомальных везикул
от размера акросомы. Так, у брахиоподы Descinisca tenuis сперматозоид
имеет большую акросому и проакросомальные везикулы начинают
формироваться в сперматогониях, в то время как у брахиоподы Kraussina rubra
спермин имеют маленькие акросомы и формирование везикул акросомальной
55
природы начинается в спермиогенезе [Hodgson, Reunov, 1994]. Пока не
совсем понятно является ли подобная зависимость распространенной среди
других представителей многоклеточных животных и прояснение этого вопроса
потребует направленного ультраструктурного исследования. Существует
также гипотеза, согласно которой раннее возникновение проакросомаль-
ных везикул является плезиоморфной особенностью, характерной для
формирования примитивных спермиев многоклеточных животных [Реунов,
1998а].
Жгутиковость - распространенная особенность сперматогониев и спер-
матоцитов, дифференцирующихся в примитивные сперматозоиды.
Выполняют ли жгутики в данном случае какую-либо функцию? Может быть у
беспозвоночных, у которых кластеры сперматогенных клеток плавают в цело-
мической жидкости, например, у полихет и сипункулид, наличие жгутиков
необходим, как средство локомоции? Едва ли, так как жгутики сперматоци-
тов полихет почти неподвижны [Eckelbarger, 1984], а у сипункулид спермато-
гонии и сперматоциты вообще не имеют жгутиков [Reunov, Rice, 1993].
Коллекционируя аргументы против функциональности'жгутиков, можно
спекулятивно принять к сведению и то, что явление их раннего формирования не
возникло в сперматогенезе костистых рыб, у некоторых из которых
примитивные сперматозоиды, вероятно, возникли вторично [Jamieson, 1991a]. В
рассуждениях о возможных причинах ранней жгутиковости является
возможным и предположение о рекапитулятивном характере формирования
аксонем и жгутиков, что, вероятно, может быть сопряжено с активным
состоянием генетически детерминированного анцестрального механизма,
делающего ранние гаметогенные клетки похожими на прототипичные
жгутиковые формы. Как это обсуждалось выше (см. гл. 2), с такими формами
могут сравниваться как жгутиковые одноклеточные [Дроздов, 1984; Дроздов,
Иванков, 2000], так и недифференцированные жгутиковые клетки
многоклеточных животных [Реунов, Малахов, 1993]. Аргументом,
подкрепляющим версию формирования рудиментарных жгутиков, по-видимому, может
являться то, что в течение эмбриогенеза их "сомнительное" формирование
происходит также в некоторых типах соматических клеток беспозвоночных
[Gardiner, Rieger, 1980; Юшин и др., 1993] и позвоночных [Sorokin, 1962;
Michelinee, George, 1974; Amemiya, 1975; Wilsman, Fletcher, 1978; Ohno, Park,
1983; Gonzalez et al., 1985; Park et al., 1988]. Впервые предположение о руди-
ментарности жгутиков у клеток некоторых типов было высказано С.
Сорокиным [Sorokin, 1962].
Раннее возникновение жгутиков и проакросомальных везикул в данной
книге рассматриваются параллельно, так как и та и другая особенность
одновременно проявляется при формировании примитивных сперматозоидов.
Будучи независимыми друг от друга, эти явления встречаются в
сперматогенных клетках беспозвоночных в различных комбинациях. Так, у губок,
кишечнополостных, приапулид, немертин, полихет, двустворчатых
моллюсков, иглокожих, брахиопод в сперматогониях и сперматоцитах обнаружены
как проакросомальные везикулы, так и жгутики. У турбеллярий,
сипункулид в ранних сперматогенных клетках (сперматоциты) присутствуют только
проакросомальные везикулы, а жгутики возникают традиционным путем в
сперматидах. В ряде случаев (моллюски, брахиоподы) в досперматидных
56
клетках были обнаружены жгутики, но формирование акросом начинается
в сперматидах. Таким образом, в сперматогенезе у многоклеточных
животных можно выделить три типа комбинированного проявления раннего
формирования проакросомальных везикул и жгутиков.
Общей особенностью дифференциации примитивных сперматозоидов
является прицентриолярный способ формирования акросомы в
сперматидах. У исследованных представителей приапулид [Адрианов и др., 1992;
Реунов и др., 1992], немертин [Reunov, Klepal, 1997], полихет [Eckelbarger, 1984],
двустворчатых моллюсков [Реунов, Дроздов, 1987; Reunov, Hodgson, 1994],
археогастропод [Hodgson et al., 1990], брахиопод [Hodgson, Reunov, 1994] и
иглокожих [Longo, Anderson, 1969; Atwood, 1974b; Реунов, Дроздов, 1991]
формирование акросомальной везикулы происходит в базальной части
сперматиды, после чего возникшая структура перемещается к апикальной
поверхности ядра. У беспозвоночных подобный механизм встречается и в
формировании модифицированных сперматозоидов, например, у олигохет
[Lanzavecchia, Donin, 1972] и бабочек [Lai-Fook, 1982]. Хотя, как это
обсуждается далее (см. гл. 7), для дифференциации модифицированных мужских
гамет прицентриолярный способ формирования акросомальной везикулы
не является типичным.
Возникновение и первичная локализация акросомальной везикулы в
прицентриолярном регионе "примитивных" сперматид обеспечивается еще
не совсем понятным механизмом. Как показывают наблюдения различных
исследователей, формирование акросомальной везикулы происходит
вблизи центриолей в том случае, когда комплекс Гольджи также расположен
неподалеку от этих структур. Таким образом, явление возникновения
акросомальной везикулы в базальной части сперматиды скорее всего связано с
локализацией комплекса Гольджи около базального тельца жгутика, которая
у многих видов не нарушается в течение всех стадий сперматогенеза.
Учитывая широкую встречаемость явления локализации комплекса Гольджи
около базального тельца жгутика среди жгутиковых одноклеточных
организмов [см. Кусакин, Дроздов, 1998] и недифференцированных жгутиковых
клеток, типичных для представителей многих групп низших
многоклеточных [см. Малахов, 1990; Юшин и др., 1993; Frick, Ruppert, 1997], вероятно,
можно рассматривать проявление той же особенности в сперматогенных
клетках, как признак, унаследованный от анцестральных клеточных форм.
В сперматогенезе у некоторых беспозвоночных с примитивными
сперматозоидами, приуроченность комплекса Гольджи к базальному тельцу
жгутика не является столь детерминированной. Например, у некоторых
кишечнополостных диктиосомы обнаружены в отдалении от основания
жгутика как в ранних сперматогенных клетках, так и в сперматидах [Yamashita,
1988]. О перемещении диктиосом к переднему полюсу сперматиды
говорилось еще в описании спермиогенеза турбелляриообразного организма
X. bocki, выполненном на светооптическом уровне [Franzen, 1956]. Вероятно,
свободное состояние комплекса Гольджи в сперматогенных клетках
является эволюционным приобретением, лишь иногда встречаемым в
сперматогенезе у представителей с примитивными сперматозоидами, но, как это
подчеркивается далее (см. гл. 5, 7), являющимся типичным свойством
дифференциации модифицированных мужских гамет.
Глава 5
СПЕРМАТОГЕНЕЗ У МНОГОКЛЕТОЧНЫХ ЖИВОТНЫХ
С МОДИФИЦИРОВАННЫМИ СПЕРМАТОЗОИДАМИ
Согласно классическим представлениям модифицированные
сперматозоиды (рис. 1 Б) представляют собой второй ярус эволюции мужских гамет,
возникший в процессе становления псевдокопуляторных и копуляторных
способов осеменения в море и на суше [Baccetti, Afzelius, 1976; Baccetti, 1984].
Гаметы такого типа описаны у турбеллярий [Cifrian et al., 1988], коловраток
[Ferraguti, Melone, 1999], тихоходок [Kristensen, 1979], гастротрих [Teuchert,
1976; Ferraguti, Balsamo, 1995; Guidi et al., 2003], погонофор [Franzen, 1973],
вестиментифер [Southword, Coates, 1989], немертин [Franzen, Sensenbaugh,
1988; Реунов, Чернышев, 1992], приапулид [Alberti, Storch, 1988; Storch,
Higgins, 1989], пентастомид [Wingstrand, 1972], аннелид [Ferraguti, 1984;
Jamieson, Rouse, 1989; Cardini et al., 2000; Marotta et al., 2003], онихофор
[Storch, Ruhberg, 1990], мшанок [Franzen, 1984], форонид [Franzen, Ahlfors,
1980; Reunov, Klepal, 2004], членистоногих [Baccetti, 1979], щетинкочелюст-
ных [Alvarino, 1983], моллюсков [Amor, Durfort, 1990], оболочников [Holland,
1989], некоторых рыб [Jamieson, 1991a; Meisner et al., 2000], круглоротых
[Morisawa, 1995] и других позвоночных [Scheltinga et al., 2000; 2001], включая
человека [Fawcett, 1975]. В спермиогенезе дифференциация
модифицированных сперматозоидов закономерно происходит путем морфологического
видоизменения сперматид, имеющих сходство с примитивными
сперматозоидами и это позволяет считать примитивные сперматозоиды эволюционным
базисом для возникновения модифицированных мужских гамет. Переход от
примитивности к модифицированности параллельно и независимо
происходил в мире мужских гамет различных таксонов. Благодаря этому во многих
современных группах, таких, например, как немертины, аннелиды,
членистоногие и моллюски, существуют архаичные представители с
примитивными спермиями и эволюционно продвинутые представители, для которых
характерны модифицированные мужские гаметы. Не исключено, что в
некоторых группах модифицированные сперматозоиды могли возникнуть, минуя
наружный способ осеменения и классический паттерн примитивных сперми-
ев, непосредственно от гамет анцестральных многоклеточных организмов
[Реунов, Малахов, 1993]. Для ряда таксонов предполагается исходность
модифицированного паттерна мужских гамет с последующим возникновением
примитивных сперматозоидов [Buckland-Nicks, Sheltema, 1995; Jamieson,
1991b]. Тем не менее, данные предположения, даже в случае реальности
обсуждаемых явлений, относятся к репродуктивной эволюции лишь
некоторых таксонов, не отрицая существования генерального характера преемст-
58
венности примитивного и модифицированного типов мужских гамет
(см. рис. 1 А, Б), свойственного многим группам многоклеточных животных.
Исторически общие представления о сперматогенезе сложились при
исследовании этого процесса у эволюционно продвинутых многоклеточных
животных с модифицированными сперматозоидами. Поэтому описание
дифференциации модифицированных мужских гамет земноводных [Mizuhira
et al, 1986; Rastogi et al., 1988; Sprando, Russel, 1988; Bernardini et al., 1990],
рептилий, птиц и млекопитающих [Рузен-Ранге, 1980; Бурнашева, 1982;
Stefanini et al, 1985; Asa et al., 1986; Segretain, Roussel, 1988; Sakai, Yamashina,
1989; Russel et al, 1989; Phillips, Asa, 1989; Jamieson et al., 1996; Scheltinga et al.,
2001], охарактеризованное выше как традиционная схема сперматогенеза
(см. гл. 3), считается чем-то вроде энциклопедии формирования
сперматозоидов у Metazoa. He возвращаясь к описанию традиционной схемы, мы
остановимся лишь на некоторых "необычных" вариантах ультраструктурного
морфогенеза модифицированных сперматозоидов.
PLATHELMINTHES
Все плоские черви размножаются копулятивным внутренним
осеменением, но самая примитивная разновидность копуляции при отсутствии
половых протоков (подкожная импрегнация) характерна для бескишечных
турбеллярий Acoela [см. Дроздов, Иванков, 2000]. Спермин турбеллярий
(рис. 13 Е) представляют собой вытянутые веретеновидные или нитевидные
клетки, имеющие, как правило, два жгутика, отходящих от переднего или
заднего конца гаметы, организация которых соответствует формуле 9+1
[Cifrian et al., 1988; Ishida, Teshirogi, 1988]. В базальной части спермиев
турбеллярий описаны электроноплотные везикулы, которые вполне сравнимы
с проакросомальными везикулами в сперматозоидах кишечнополостных
[см. Hendelberg, 1983]. Как и в случае с кишечнополостными, вполне
правомочно предположение о рудиментарности данных структур в мужских
гаметах плоских червей. Сперматозоиды турбеллярий способны двигаться не
только благодаря биению жгутиков, но и за счет сгибания длинного тела
клетки. Общий план строения данных гамет позволяет отнести их к
модифицированному типу, дополненному такими элементами аберрантности как
"наличие проакросомальных везикул вместо истинной акросомы", "базаль-
ная локализация проакросомальных везикул", "наличие двух жгутиков
вместо одного". У некоторых представителей Turbellaria известны
безжгутиковые аберрантные сперматозоиды [Дроздов, Иванков, 2000].
Ультраструктурные данные по сперматогенезу Turbellaria собраны в
ряде обзоров [Иванов, Мамкаев, 1973; Рузен-Ранге, 1980; Hendelberg, 1983;
Gremigni, 1983; Sopott-Ehlers, Ehlers, 1986; Cifrian et al., 1988; Дроздов,
Иванков, 2000]. Показано, что ультраструктура сперматогониев турбеллярий,
идентична таковой необластов - мультипотентных клеток паренхимы, из
которых, по-видимому, формируются половые клетки [Рузен-Ранге, 1980;
Teshirogi, 1986].
Рассмотрим особенности дифференциации сперматогенных клеток
турбеллярий на примере Bothromesostoma personatum - представителя отряда
Rhabdocoela, сперматогенез которого описан [Cifrian et al., 1988] достаточно
59
Рис. 13. Сперматогенные клетки турбеллярии Bothromesostoma personatum [схематизировано
А.А. Реуновым по: Cifrian et al., 1988]
А - сперматогоний; Б - сперматоцит; В-Д - сперматиды; Е - сперматозоид
я - ядро, мм - межклеточный мостик, кг - комплекс Гольджи, пв - проакросомальные везикулы, ск -
сииаптонемальный комплекс, м - митохондрия, мт - межцентриолярное тело, ж - жгутик
60
детально и является типичным для ресничных червей. Два дорсально
ориентированных семенника В. personatum содержат все стадии сперматогенных
клеток. Сперматогоний (рис. 13 А) имеют ядра с волнистым контуром и
выраженным ядрышком. Первичные сперматоциты (рис. 13 Б) являются
наиболее крупными клетками. На стадии зиготены-пахитены в их ядрах
присутствуют синаптонемальные комплексы. На стадии первичных и вторичных
сперматоцитов аппараты Гольджи, содержащиеся в цитоплазме, начинают
продуцировать электроноплотные проакросомальные везикулы (рис. 13 Б),
накапливающиеся в последующих клеточных стадиях. В цитоплазме
сперматоцитов имеются шероховатый ретикулум, митохондрии, рибосомы и
гранулы гликогена. В спермиогенезе ядро принимает продолговатую форму
(рис. 13 В), а затем возникают два жгутика (рис. 13 Г). Вытягивающееся
ядро формирует заостренную апикальную часть сперматозоида, удлиняется
базальная часть (рис. 13 Д). У турбеллярии базальная часть сперматиды,
называемая зоной дифференциации [Cifrian et al., 1988], выглядит также как и
у сперматид других плоских червей (выступ цитоплазмы и две аксонемы,
между которыми присутствует характерное для спермиогенеза многих
Plathelminthes межцентриолярное тело (рис. 13 Г, Д). Факт возникновения
двух жгутиков в спермиогенезе турбеллярии и других плоских червей
является одним из аргументов гипотезы, предполагающей, что двужгутиковые
флагеллоспоры (мужские гаметы жгутиконосцев) могут рассматриваться
как прототип гамет многоклеточных животных [Дроздов, 1984; Дроздов,
Иванков, 2000].
0LIG0CHAETA
При довольно сложном процессе псевдокопуляции у олигохет гермафро-
дитные партнеры обмениваются порциями сперматической жидкости,
которая до момента осеменения содержится в семяприемниках [см. Иванов и др.,
1958]. При наступлении времени откладки, в зоне пояска каждой особи
формируется кокон, который сбрасывается особью через передний конец тела.
При прохождении кокона мимо женских половых отверстий, в него
попадает несколько собственных яйцеклеток особи. Последующее движение
позволяет кокону достичь мужских половых отверстий, из которых в него
поступает сперма партнера, "запасенная" при копуляции. Осемененный кокон
откладывается в почву. Мужские гаметы олигохет, относятся к категории
модифицированных сперматозоидов [Ferraguti, Erseus, 1999].
Развитие мужских гамет происходит обычно в X-XI сегментах. Процесс
развития сперматозоидов у олигохет хорошо исследован во всех четырех
подклассах [Ferraguti, 1983; 1984 Ferraguti, Jamieson, 1984; Jamieson, 1988],
хотя эти исследования касаются главным образом спермиогенеза. Полный
процесс сперматогенеза, описанный у .видов Branchiura sowerbyi и
Microchaetus pentheri [Casellato et al., 1987; Hodgson, Jamieson, 1992],
обобщенно представлен на рис. 14 А-Е. Среди сперматогониев выделяют одиночные
протогонии [Casellato et al., 1987], которые, по-видимому, являются
первичными сперматогониями. Более поздние сперматогоний скомпанованы в мо-
рулы, состоящие из 2, 4, 8 клеток. Сперматогоний и последующие стадии
этих клеток присоединены цитоплазматическими мостиками к общей безъ-
61
Рис. 14. Сперматогенные клетки олигохет [схематизировано А.А. Реуновым по: Casellato
et al., 1987; Ferraguti, 1984]
A - сперматогоний, Б - сперматоцит, В-Д - сперматиды, Е - сперматозоид
я - ядро, ц - цитофор, ск - синаптонемальный комплекс, м - митохондрия, пц - проксимальная цен-
триоль, дц - дистальная центриоль, кг - комплекс Гольджи, ав - акросомальная везикула, ж - жгутик,
мт - микротрубоки, а - акросома
62
ядерной, окруженной мембраной цитоплазматической структуре - цитофо-
ру. Как правило, цитоплазма цитофора лишена рибосом и выглядит на элек-
тронограммах более светлой по сравнению со сперматогенными клетками.
В цитоплазме сперматогенных клеток ранних стадий (рис. 14 А, Б)
присутствуют удлиненные продолговатые митохондрии, эндоплазматический ре-
тикулум. В ядрах зиготенных сперматоцитов обычны синаптонемальные
комплексы. Формирование жгутиков и акросом происходит в сперматидах.
Различные описания свидетельствуют, что спермиогенез олигохет весьма
однотипен. Как правило, акросомальная везикула возникает неподалеку от
комплекса Гольджи, который локализован в прицентриолярном регионе
(рис. 14 В). Формирование и практически полная комплектация акросомы
осуществляются в средней части сперматиды в базальном цитоплазматиче-
ском выступе (рис. 14 Г, Д). При удлинении сперматиды, в процессе
которого в цитоплазме появляются микротрубочки (рис. 14 Г-Е), происходит
смещение сформированной акросомы на апикальный полюс клетки (рис. 14 Е).
^ ^ ^
Ультраструктурный паттерн сперматогенеза у олигохет имеет
некоторые особенности, являющиеся типичными и для дифференциации мужских
гамет полихет (см. гл. 4). У тех и других наблюдается пример цитофорного
типа соединения развивающихся сперматогенных клеток с тем лишь
отличием, что у полихет данный тип встречается только у некоторых
представителей [Sawada, 1984], а не является общим, как у олигохет. К общему
относится также то, что формирование акросомальной везикулы происходит
неподалеку от центриолярного аппарата жгутика. Выраженное отличие, на
которое можно обратить внимание при сравнении схем сперматогенеза
полихет (см. рис. 8 А-И) и олигохет (рис. 14 А-Е) касается процессов
формирования акросом и жгутиков. Если, для полихет обычно раннее развитие
жгутиков и элементов акросомы в сперматогониях и сперматоцитах, то для
олигохет характерен традиционный способ формирования данных структур в
спермиогенезе. Таким образом, сперматогенез аннелид является примером,
позволяющим предполагать, что раннее возникновение проакросомальных
везикул и жгутиков характерно для дифференциации примитивных
сперматозоидов и не свойственно развитию модифицированных мужских гамет.
ARTHROPODA
Членистоногие - богатейший по количеству видов тип, представители
которого (скорпионы) в силуре стали первыми сухопутными обитателями
земли [Хадорн, Венер, 1989]. Представитель хелицеровых - мечехвост
{Limulus), имеет наружное осеменение и сперматозоиды, строение которых
соответствует примитивному типу [Tilney, 1985]. Среди ракообразных был
открыт вид Speleonectes benjamini, выделенный в самостоятельный класс
Remipedia, имеющий сперматозоиды, близкие к примитивной модели [Yager,
1989]. Мужские гаметы в данном случае транспортируются в половые пути
самки путем переноса сперматофоров, состоящих всего из нескольких
сперматозоидов. Последние обладают акросомой с осевым стержнем, бочонко-
63
видным ядром с конденсированным хроматином и жгутиком (9 + 2),
отходящим от базальной части ядра. Соответствие спермия 5. benjamini
примитивной модели послужило подкрепляющим обстоятельством в пользу
помещения Remipidia в основание филогенетического древа Crustacea, хотя вопрос
остается спорным, так как по составу последовательности рибосомальных
РНК обсуждаемый таксон ближе к ветвям Copepoda и Cirripedia [Jamieson,
1991b]. Во всяком случае существование примитивного сперматозоида у
Remipedia является аргументом в пользу происхождения ракообразных от
предка, имевшего наружное осеменение и примитивные сперматозоиды. К
сожалению, процессы формирования примитивных спермиев Limulus и
Speleonectes пока не изучены и мы не можем сравнить их с особенностями
дифференциации примитивных сперматозоидов других представителей
многоклеточных животных.
Для членистоногих характерно копулятивное осеменение,
осуществляемое либо посредством пениса, либо с помощью передачи сперматофоров,
транспортируемых приспособленными для этого конечностями [Хадорн,
Венер, 1989]. У представителей Tardigrada, Onychophora, Pycnogonida,
Arachnida, Crustacea, Symphyla, Pauropoda, Chilopoda и Insecta обнаружены
модифицированные сперматозоиды, которые, по мнению Б. Баччетти
[Baccetti, 1979], эволюционировали от репродуктивных клеток
примитивного типа. Среди членистоногих формирование модифицированных
сперматозоидов электронно-микроскопически наиболее детально изучено у
ракообразных. Напомнив, что среди Crustacea модифицированные сперматозоиды
обнаружены в подклассе Maxillopoda (Ascothoracica, Cirripedia, Branchiura,
Mystacocarida) [Munn, Barnes, 1970; Barnes et al., 1971; Kubo et al., 1979;
Grygier, 1982; Jamieson, 1991b; Дроздов, Иванков, 2000], мы остановимся на
примере дифференциации мужских гамет у представителя усоногих раков
рода Balanus.
Сперматогенные клетки балянусов изображены на рисунке
(рис. 15 А-Е) в соответствии с микрофотографиями, приведенными в
наиболее исчерпывающих публикациях [см. Kubo et al., 1979; Azevedo, Corral,
1982]. Сперматогонии Pollicipes cornucopia (рис. 15 А) не демонстрируют
признаков формирования аксонем и проакросомальных везикул. В сперма-
тоцитах комплекс Гольджи локализован около центриолей и продуцирует
электроносветлые везикулы (рис. 15 Б). В ранних сперматидах (рис. 15 В)
комплекс Гольджи расположен около базального тельца жгутика. В
процессе спермиогенеза клетка становится вытянутой, прогрессирует конденсация
хроматина и начинается удлинение ядра. Происходит аберрантное смещение
формирующегося жгутика, который углубляется в цитоплазму так, что его
базальное тельце оказывается в апикальном регионе сперматиды (рис. 15 Г).
Нужно отметить, что даже при этом смещении комплекс Гольджи остается
локализованным около базального тельца (рис. 15 В, Г). На этом этапе к
светлым везикулам, продуцируемым со стадии сперматоцитов, добавляются
электроноплотные проакросомальные пузырьки, которые также
возникают из диктиосом комплекса Гольджи (рис. 15 Г). Светлые везикулы,
объединяясь, формируют аберрантную структуру (рис. 15 Г-Д), которую при
описании сперматозоида (рис. 15 Е) называют "вспомогательной капелькой"
("accessory droplet", [Munn, Barnes, 1970]). Электроноплотные проакросомаль-
64
Рис. 15. Сперматогенные клетки усоногого ракообразного Pollicipes cornucopia
[схематизировано А.А. Реуновым по: Azevedo, Corral, 1982]
А - сперматогонии; Б - первичный сперматоцит; В-Д - сперматиды; Е - сперматозоид
я - ядро, м - митохондрия, мм - межклеточный мостик, ск - синаптонемальный комплекс, ц - цент-
риоли, кг - комплекс Гольджи, ев - светлые везикулы, пв - проакросомальные везикулы, ав - акросо-
мальная везикула, вк - вспомогательная капелька, бт - базальное тельце, ж - жгутик
ные везикулы объединяются вблизи центриолей и аппарата Гольджи,
образовывая крупную акросомальную везикулу (рис. 15 Г), которая вскоре
видоизменяется (рис. 15 Д) и превращается в акросому (рис. 15 Е). Митохондрии
смещаются в базальную часть сперматиды (рис. 15 Г, Д), где формируют
единую митохондрию. В сперматозоиде (рис. 15 Е) единственная удлиненная
митохондрия располагается под ядром. Сперматозоид при его внешней мо-
дифицированности имеет выраженные элементы аберрантности во
внутреннем строении. К этим элементам относятся смещенность базального
тельца жгутика к акросоме и наличие вспомогательной капельки, окружаю-
5 Реунов А. А. /:с
щей ядро и жгутик. Физиологический смысл данных аберрантных
особенностей не совсем понятен, хотя известно, что благодаря вспомогательной
капельке подвижность сперматозоидов ограничена. В процессе копуляции,
когда сперматозоиды посредством длинного пениса гермафродитной особи,
функционирующей как самец, через оперкулярное отверстие вводятся в
мантийную полость особи, функционирующей как самка [см. Корн, 1988],
вспомогательная капелька утрачивается сперматозоидами, после чего они
становятся более подвижными и вступают в процесс осеменения, активно
преодолевая оболочку яйцеклетки. Судя по тому, что исчезновение
капельки происходит путем стремительного сжатия, можно предполагать что ее
содержимое является эндогенным источником энергии, активизирующим
движение сперматозоидов [Munn, Barnes, 1970; Barnes et al., 1971].
Приведенный пример демонстрирует несколько усложненный вариант
традиционной схемы сперматогенеза. Ее традиционность подтверждается
тем, что формирование акросомы и жгутика происходит в спермиогенезе.
Однако приуроченность комплекса Гольджи к базальному тельцу жгутика
свидетельствует о сохранении архаичного типа организации флагеллярного
комплекса, типичного для сперматогенных клеток, дифференциирующихся
в примитивные сперматозоиды (см. гл. 4). Между тем погруженность
жгутика в цитоплазму и возникновение вспомогательной капельки являются
аберрантными "нетрадиционными" процессами, известными только в
сперматогенезе усоногих раков. Можно предполагать, что ультраструктурные
исследования формирования модифицированных сперматозоидов в широком
ряду представителей членистоногих позволили бы расширить наше
представление о процессах, дополняющих традиционную схему сперматогенеза в
типе Arthropoda.
M0LLUSCA
Большая часть ультраструктурных данных, касающихся сперматогенеза
моллюсков с модифицированными сперматозоидами, получена для
переднежаберных брюхоногих моллюсков (Prosobranchia). В отличие от
представителей других отрядов Prosobranchia (Neritimorpha, Mesogastropoda, Neogastropoda)
в наиболее архаичном таксоне - Archaeogastropoda типичными являются
наружное осеменение и примитивные сперматозоиды, особенностям
формирования которых посвящено несколько публикаций [Buckland-Nicks, Shia, 1986;
Hodgson, Bernard, 1988; Healy, 1989; Hodgson et al., 1990; Hodgson, Foster, 1992].
Показано, что у всех исследованных видов археогастропод процесс развития
спермиев протекает однотипно и практически идентичен таковому у
двустворчатых моллюсков. Для сперматогенеза археогастропод, как и для
дифференциации мужских гамет Bivalvia, характерно возникновение проакросо-
мальных везикул и жгутиков на ранних стадиях сперматогенных клеток.
Формирование акросомальной везикулы в сперматидах происходит путем
объединения отдельных проакросомальных везикул, причем этот процесс
закономерно происходит в базальной части клетки неподалеку от центриолей.
Впоследствии наблюдается миграция акросомальной везикулы на апикальный
полюс клетки и ее локализация в ядерном впячивании, где осуществляется
дальнейшее видоспецифичное развитие акросомы.
66
Сперматогенез у Prosobranchia с копулятивным размножением и
модифицированными сперматозоидами также исследован в ряде работ [Рузен-
Ранге, 1980; Healy, 1983; Afzelius et al., 1989; Amor, Durfort, 1990]. Половой
эпителий обычно синцитиален. У многих видов хорошо прослеживаются
линии типичного сперматогенеза и парасперматогенеза [Melone et al., 1980;
Healy, 1986]. На примере Мигех brandaris показано [Amor, Durfort, 1990], что
сперматогонии, дающие начало клеточным клонам эупиренной (типичной)
линии, имеют ядра округлой, овальной или лобулярной формы. Хроматин
представлен в виде довольно крупных электроноплотных конгломератов,
присоединенных к ядерной мембране более тонкими перемычками. В спер-
матоцитах ядра увеличиваются в размерах. Пространство нуклеоплазмы
значительно сокращается за счет увеличения объема хроматина. В
хроматине первичных сперматоцитов присутствуют синаптонемальные комплексы.
В цитоплазме как сперматогониев, так и сперматоцитов можно наблюдать
центриоли, комплекс Гольджи и митохондрии (рис. 16 А). В ранних
сперматидах ядро имеет округлую форму, центриолярный аппарат расположен под
центриолярной ямкой, вокруг центриолей ориентированы митохондрии и
комплекс Гольджи (рис. 16 Б). В сперматидах более поздней стадии ядро
принимает форму чаши (рис. 16 Б-Д). В ядерное углубление, достигающее
акросомального участка, погружается базальное тельце жгута, который
формируется в спермиогенезе. В поздних сперматидах и сперматозоидах
базальное тельце жгутика отделено от апикальной цитоплазмы лишь тонкой
перемычкой ядерного материала (рис. 16 Д, Е), что не типично для
канонического модифицированного сперматозоида, базальное тельце жгутика
которого не погружено в ядро, а расположено под ним [Curtis et al., 1989;
Scheltinga et al., 2001]. Углубленное положение жгутика в сперматозоиде
М. brandaris несомненно может считаться элементом аберрантности.
Характерной особенностью спермиогенеза является то, что комплекс Гольджи
теряет прицентриолярную локализацию и смещается в апикальный регион
клетки (рис. 16 Б-Д). Акросомальная везикула формируется, когда
комплекс Гольджи локализован над апикальной поверхностью удлиняющегося
ядра. Это происходит благодаря расширению одной из цистерн, которая и
превращается в акросомальную везикулу (рис. 16 Е). После формирования
акросомы комплекс Гольджи смещается в среднюю часть клетки (рис. 16 Ж)
и выводится из цитоплазмы. В течение спермиогенеза митохондрии
объединяются (рис. 16 Г-Е) и формируют закрученный конгломерат вокруг аксо-
немы (рис. 16 Ж).
% % %
Характерной особенностью процесса дифференциации
модифицированных мужских гамет брюхоногих моллюсков, продемонстрированного
на примере М. brandaris, является его соответствие традиционной схеме
сперматогенеза (см. гл. 3). В этом случае возникновение элементов
акросомы и хвостового аппарата происходит на заключительном этапе - в
спермиогенезе. Нужно отметить, что подобный способ дифференциации
описан и у головоногих моллюсков, для которых типичны
модифицированные спермин. Даже у головоногих, мужские гаметы которых близки
67
Рис. 16. Сперматогенные клетки брюхоногого моллюска Murex brandaris [по: Amor, Durfort,
1990]
А - сперматоцит; Б-Е - сперматиды; Ж - сперматозоид
ц - центриоли, кг - комплекс Гольджи, я - ядро, м - митохондрия, ав - акросомальная везикула, а -
акросома, ж - жгутик
68
к примитивному типу, например, у кальмаров [Healy, 1990], жгутики и акросо-
мальные везикулы возникают в спермиогенезе, а цистерны комплекса
Гольджи способны перемещаться к апикальному полюсу сперматиды.
Таким образом, у кальмаров имеет место случай, когда примитивные
спермин формируются способом, типичным для модифицированных
сперматозоидов. Тем не менее, формирование примитивных
сперматозоидов архаичных моллюсков, таких как хитоны [Hodgson et al., 1988;
Пащенко, 1993], двустворчатые моллюски [Реунов, Дроздов, 1987; Reunov,
Hodgson, 1994a] и археогастроподы [Hodgson, Foster, 1992] закономерно
отличается от традиционной схемы сперматогенеза возникновением
жгутиков и проакросомальных везикул в ранних стадиях сперматогенных
клеток (сперматогонии, сперматоциты). Для сперматогенных клеток
двустворчатых моллюсков, археогастропод и хитонов, превращающихся в
примитивные спермин, характерна прицентриолярная локализация
комплекса Гольджи во всех клеточных стадиях. Даже в сперматидах аппарат
Гольджи расположен в прицентриолярном регионе, в результате чего
формирование акросомальной везикулы происходит в базальной части
клетки.
Пожалуй, можно считать, что в типе Mollusca существуют два типа
дифференциации сперматогенных клеток. Один из них, протекающий с ранним
возникновением жгутиков и проакросомальных везикул, характерен для
формирования примитивных сперматозоидов. Другой вариант,
сопряженный с возникновением жгутиков и проакросомальных везикул в
сперматидах и соответствующий описанию традиционной схемы сперматогенеза,
свойственен развитию модифицированных мужских гамет.
УЛЬТРАСТРУКТУРНЫЕ ОСОБЕННОСТИ ДИФФЕРЕНЦИАЦИИ
МОДИФИЦИРОВАННЫХ СПЕРМАТОЗОИДОВ
Как упоминалось выше (см. гл. 3), паттерн формирования мужских
гамет, часто трактуемый как универсальный для многоклеточных
животных, по сути является схемой формирования модифицированных
сперматозоидов. Существование так называемой традиционной схемы
сперматогенеза, отражающей способ формирования
модифицированных мужских гамет, не подлежит сомнению. Примеры, приведенные в
гл. 5, подчеркивают тот факт, что у некоторых беспозвоночных схема не
всегда полностью совпадает с эталоном. Дифференциация мужских
гамет у рассмотренных представителей турбеллярий, олигохет, усоногих
раков и гастропод соответствует данной схеме, но дополнена
примитивными и аберрантными механизмами. Так, например, в развитии
модифицированных спермиев турбеллярий В. personatum примитивным является
процесс возникновения проакросомальных везикул на ранней стадии
дифференциации - в сперматоцитах, а аберрантным может считаться
формирование двух жгутиков. У олигохет В. sowerbyi и М. pentheri
формирование акросомы происходит в прицентриолярном участке
цитоплазмы, что является плезиоморфным способом, типичным для
дифференциации примитивных мужских гамет. В спермиогенезе балянуса
69
P. cornucopia налицо плезиоморфная сопряженность комплекса Гольджи
и центриолей, но при этом формируется аберрантная структура
(вспомогательная капелька) и происходит аберрантное смещение базального
тельца жгутика к акросоме. Аберрантной особенностью является и
локализация апикальной части жгутика в глубоком ядерном впячивании,
что характерно для сперматозоида брюхоного моллюска М. brandaris.
Случаи рекапитуляции плезиоморфных черт в дифференциации
модифицированных сперматозоидов, по-видимому, указывают на
происхождение модифицированного паттерна формирования мужских гамет от
способа, характерного для развития примитивных мужских
репродуктивных клеток. Проявление аберрантных особенностей, по всей
видимости, определяет тенденцию к аберрантизации данного паттерна, которая
во многих таксонах привела к формированию аберрантных схем
дифференциации сперматозоидов.
Глава 6
СПЕРМАТОГЕНЕЗ У МНОГОКЛЕТОЧНЫХ ЖИВОТНЫХ
С АБЕРРАНТНЫМИ СПЕРМАТОЗОИДАМИ
Аберрантными считаются мужские репродуктивные клетки, структурно
отличающиеся от стереотипов примитивного и модифицированного
сперматозоида и частично или полностью отошедшие от двух основных принципов
этих клеток - движения с помощью жгутика и преодоления яйцевых
оболочек с помощью акросомы. К этой категории не относятся примитивные и
модифицированные сперматозоиды, имеющие элементы аберрантности
(см. гл. 2).
Аберрантные спермин описаны у губок [см. Малахов, 1990; Дроздов,
Иванков, 2000], трихоплакса [Grell, Benwitz, 1981], скребней [Marchand,
Mattei, 1976], коловраток [Melone, Ferraguti, 1999], плоских червей [Castilho,
Barandela, 1990; Watson, Rohde, 1991], немертин [Gerner, 1969], волосатиков
[Donin, Cotelli, 1977; Schmidt-Rhaesa, 1997], нематод [Baccetti et al, 1983], ки-
норинх [Адрианов, Малахов, 1994], дициемид [см. Дроздов, Иванков, 2000],
полихет [Westheide, 1984; Jamieson, Rouse, 1989], членистоногих [Baccetti,
1979], костистых рыб [Jamieson, 1991b]. Дифференциация аберрантных
мужских гамет наиболее детально изучена у некоторых плоских червей, кино-
ринх, нематод и членистоногих. Целью данного раздела является
рассмотрение примеров, формирующих представление о характере
ультраструктурных преобразований, происходящих в формировании аберрантных
сперматозоидов.
PLATHELMINTHES
В отличие от турбеллярий, для самых архаичных из которых (Acoela)
характерна копуляция посредством подкожной импрегнации, а сперматозоиды
являются модифицированными (см. гл. 5), у других Plathelminthes известны
спермин аберрантного типа и способ копуляции, задействующий половые
пути [Парамонов, 1962]. Строение спермиев плоских червей специфично в
каждом классе, но ультраструктурный анализ [см. Justine, Mattei, 1983;
Justine et al., 1985; Xylander, 1989; Mahendrasingam et al., 1989; Watson, Rohde,
1991; Justine, 1993] показал, что аберрантные мужские гаметы сосальщиков,
моногеней и ленточных червей являются апоморфными вариациями модели
модифицированного сперматозоида, характерного для турбеллярий (см.
гл. 5). Основным критерием, позволяющим говорить о данном сходстве,
является двужгутиковость. Жгутики, строение которых обычно соответствует
формуле 9 + 1 [Mahendrasingam et al., 1989], локализованы в цитоплазме
71
A
В
В
Рис. 17. Сперматозоиды трематоды Multicotyle purvisi (А), моногенеи Heterocotyle sp. (Б) и це-
стоды Trilocularia acanthiaevulgaris (В) [схематизировано А.А. Реуновым по: Watson, Rohde,
1991; Justine, Mattei, 1983; Mahendrasingam et al., 1989]
ж - жгутик, ц - центриоль, м -митохондрия, я - ядро
72
клетки (рис. 17 А-В). Сперматозоиды Trematoda, Monogenea и Cestoda
имеют элемент модифицированности в виде удлиненной формы, благодаря
которой внешне они напоминают модифицированные мужские гаметы. В них
никогда не обнаруживаются проакросомальные везикулы, характерные для
гамет турбеллярий, и отсутствуют какие-либо иные акросомальные
элементы. Локализация органоидов в спермиях различных представителей
Plathelminthes может быть различной. Так, в сперматозоиде трематоды
Multicotyle purvisi [no: Watson, Rohde, 1991] ядро занимает базальную часть
клетки, а два длинных жгутика являются единственными компонентами
цитоплазмы (рис. 17 А). У моногенеи Heterocotyle sp. [no: Justine, Mattei, 1983]
один из жгутиков редуцирован, но остаточное базальное тельце
расположено в апикальном регионе неподалеку от базального тельца жгутика,
простирающегося по всей длине клетки; вдоль жгутика тянется длинная
митохондрия, контактирующая с базально расположенным ядром (рис. 17 Б).
Единственным компонентом сперматозоида цестоды Trilocularia acanthiaevulgaris
[по: Mahendrasingam et al., 1989] являются два жгутика и ядро, закрученное в
апикальном регионе так пространно, что верхняя оконечность клетки
имеет булавовидное утолщение (рис. 17 В). Если внешняя морфология сперми-
ев трематод, моногенеи и цестод вполне сравнима с модифицированным
морфотипом, то рассмотрение внутреннего строения доказывает их абер-
рантность, заключающуюся в несовпадении с планом внутренней
организации модифицированных сперматозоидов. Так, в первом и во втором случаях
аберрантным является базальное расположение ядра (рис. 17 А, Б), а в
третьем (рис. 17 В) аберрантной можно считать его апикальную закрученность.
Проявлениями аберрантности являются отсутствие акросомы, наличие двух
жгутиков, редукция одного из жгутиков, единственная длинная
митохондрия. В дальнейших исследованиях спермиев плоских червей безусловно
будут обнаружены разнообразные и самые неожиданные варианты
аберрантности, которую, тем не менее, можно считать частичной вследствие
сохранения в составе гамет жгутиков, указывающих на происхождение спермиев
Plathelminthes от жгутиковых клеток.
Одной из общих особенностей сперматогенеза у плоских червей
является кластерное развитие, при котором гаметоциты соединены с общей
безъядерной, окруженной мембраной массой цитоплазмы - цитофором. Цито-
форы (рис. 18 А-В) описаны в каждом классе Plathelminthes. Причем, если у
трематод [Hendelberg, 1963; Daddow, Jamieson, 1983; Castilho, Barandela, 1990;
Watson, Rohde, 1991], моногенеи [Justine, Mattei, 1983; Justine et al., 1985;
Justine, 1993] и цестод [Justine, 1986; Mahendrasingam et al., 1989; Xylander,
1989] формирование цитофоров является абсолютной закономерностью, то
у турбеллярий встречается как цитофорный, так и хаотический тип
формирования половых клеток [Рузен-Ранге, 1980]. Учитывая, что из всех четырех
классов турбеллярий наиболее эволюционно примитивны, по-видимому,
можно предположить, что цитофорный тип формирования является апо-
морфным признаком, который у трематод, моногенеи и цестод приобрел
абсолютный характер.
Общей особенностью сперматогенеза представителей всех четырех
классов плоских червей является характер функционирования цитофоров на
завершающем этапе дифференциации сперматозоидов - в спермиогенезе
73
A
Б
Рис. 18. Сперматогенные клетки цестоды Trilocularia acanthiaevulgaris [схематизировано
А.А. Реуновым по: Mahendrasingam et al., 1989]
Сперматогонии (А) и сперматоциты (Б), объединенные цитофором; В - сперматиды, объединенные
цитофором (звездочка), в котором локализованы резорбируемые митохондрии; Г - сперматида; Д -
сперматозоид
я - ядро, ц - центриоли, ск - сипнаптонемальные комплексы, м - митохондрии, сп - сперматида, кг -
комплекс Гольджи, ж - жгутик
74
цитофор поглощает резидуальную цитоплазму, отторгаемую поздними
сперматидами. Вероятно, апоморфным признаком сперматогенеза
Plathelminthes, можно считать резорбцию митохондрий в цитофоре. Если в
сперматогенезе у турбеллярий митохондрии принимают активное участие в
формировании гамет и сохраняются в зрелых спермиях, то у некоторых
трематод, моногеней и цестод эти органеллы исчезают в конце спермиогенеза.
В сперматогенных клетках турбеллярий диктиосомы комплекса
Гольджи продуцируют электроноплотные пузырьки (см. рис. 13 Б-Е), которые
по аналогии с подобными структурами в гаметах кишечнополостных
принято считать проакросомальными везикулами [Hendelberg, 1983], хотя, как и у
кишечнополостных, участие таких везикул в осеменении Plathelminthes
является довольно спорным [Sopott-Ehlers, 1986]. В сперматогенных клетках
трематод, моногеней и цестод комплекс Гольджи либо формирует электроносвет-
лые везикулы (рис. 18 Г), не имеющие отношения к акросомальной
субстанции, либо его функция отчетливо не выражена [Mahendrasingam et al., 1989].
Можно предположить, что в сперматогенезе данных таксонов акросомо-
формирующая функция комплекса Гольджи утрачена.
Таким образом, анализ особенностей дифференциации сперматогенных
клеток плоских червей позволяет заметить отчетливое проявление
тенденций регрессии акросомальных элементов, еще наблюдаемых у турбеллярий,
но уже отсутствующих в других классах, и нейтрализации жгутиков,
которые у моногеней, трематод и цестод погружены в цитоплазму, а у
некоторых видов представлены неполным набором вследствие исчезновения
одного из жгутиков (рис. 17 Б). Выраженной является тенденция к уменьшению
значимости митохондрий, которые в мужских гаметах некоторых плоских
червей отсутствуют. По-видимому, находки глубоко аберрантных мужских
гамет, полностью утративших признаки акросом, жгутиков и, вероятно,
лишенных митохондрий, принципиально возможны среди представителей
Plathelminthes.
NEMATODA
Для всех нематод характерно внутреннее копулятивное осеменение.
Спермин всегда аберрантны, что проявляется в отсутствии у них акросом, жгутиков
и ядерных оболочек. Кроме того, их аберантность определяется наличием
специфических структур, таких как мембранные органеллы и фиброзные тела,
характерных только для нематод [Burghardt, Foor, 1975; Yushin, 2003a, b].
Среди нематод распространены поляризованные спермин, передняя часть
которых оснащена псевдоподиями, а задняя содержит главное тело клетки (см.
табл. 9 Б), но встречаются и гаметы без определенной полярности [Baccetti
et al., 1983]. При характеристике сперматозоидов нематод описывают их
незрелую стадию, имея ввиду спермин, находящиеся в гонаде самца, и их зрелое
состояние, наступающее при попадании спермия в половые пути самки, где
мужские гаметы обретают способность к движению с помощью псевдоподий [Foor,
1970; Burghardt, Foor, 1975; Yushin, 2003a, b]. Таким образом, если в задачу
входит исследование зрелых сперматозоидов, их нужно искать не в самцах, а в
осемененных самках, половая система которых содержит мужские гаметы,
полученные при копуляции [см. Юшин, Малахов, 1999].
75
Благодаря ряду исследований [Favard, 1961; Lee, 1971; Beams, Sekhon,
1972; Neill, Wright, 1973; Yushin, Coomans, 2000; Yushin, Spiridonov, 2001;
Юшин, Зограф, 2002; Yushin, Malakhov, 1994; 1998; 2003; Yushin, 2003a, b;
Yushin, Zograf, 2004] представление об ультраструктурных особенностях
сперматогенеза нематод является достаточно полным. Сперматогонии, как
правило, имеют сферическую форму, но в некоторых случаях могут быть
удлиненными. Характерной особенностью ядра является выраженное
ядрышко. В цитоплазме сперматогониев присутствуют митохондрии,
свободные рибосомы, гладкий эндоплазматический ретикулум, липидные гранулы,
комплексы Гольджи, микротрубочки. Клетки данной стадии претерпевают
регулярные митотические деления, после которых между ними
сохраняются временные межклеточные мостики. В некоторых случаях уже на этой
стадии сперматогонии соединены с рахисом (или цитофором) - структурой,
которая у некоторых видов выполняет роль резидуального тела [Lee, 1971;
McLaren, 1973; Wright et al., 1973].
По сравнению со сперматогониями ранние сперматоциты являются
клетками более крупного размера, имеют большее ядро и более плотное
ядрышко. У первичных сперматоцитов перинуклеарные цистерны расширены и
ядерная мембрана часто является одним целым с цистернами эндоплазмати-
ческого ретикулума [Neill, Wright, 1973]. На этом этапе исчезает ядрышко,
увеличивается количество полирибосом, митохондрии мигрируют к
периферии ядра [Lee, 1971; Beams, Sekhon, 1972; McLaren, 1973]. При передвижении
сперматоцитов по семеннику в телогонических семенниках и смещении этих
клеток к центральной полости гонады в хологонических семенниках в
цитоплазме первичных сперматоцитов у некоторых представителей нематод
происходит увеличение количества цистерн комплекса Гольджи, формирующих
так называемые "мембранные органеллы" (МО), являющиеся уникальными
структурами мужских гаметогенных клеток нематод [Foor, 1970; Yushin,
2003а]. Мембранные органеллы формируют комплексы с "фиброзными
телами" (ФТ), материал которых, продуцируется эндоплазматическим ретикулу-
мом [Lee, 1971; McLaren, 1973; Юшин, Зограф, 2002; Yushin, Malakhov, 2003].
В сперматидах МО-ФТ комплексы распадаются на отдельные МО и ФТ. Как
правило, МО из распавшихся комплексов располагаются по периферии спер-
матид, а в сперматозоидах, находящихся в половых путях самки, они
способны экскретировать свое содержимое. На определенном этапе данный
механизм даже рассматривался как акросомная реакция спермиев нематод [Clark
et al, 1967], но эта точка зрения не получила поддержки у большинства
авторов, так как выброс происходит слишком далеко от осеменяемых яйцеклеток
[см. Foor, 1983]. Фиброзные тела (см. табл. 9 Д), содержащиеся в
сперматозоидах после распада МО-ФТ комплексов, при окончательном созревании
сперматозоида в половых путях самки, трансформируются в цитоскелет его
псевдоподий [Yushin, Spiridonov, 2001; Юшин, Зограф, 2002; Yushin, 2003a]. У
некоторых нематод ФТ возникают без участия МО, которые отсутствуют
[Yushin, Coomans, 2000; Юшин, Зограф, 2002]. Известны случаи, когда
несмотря на наличие МО не формируются ФТ [Yushin, 2003b]. У некоторых видов
сперматогенез происходит без формирования как МО, так и ФТ [Yushin,
Zograf, 2004]. Тем не менее, даже без возникновения фиброзных тел, как
промежуточной инстанции формирования цитоскелета, в зрелых спермиях синте-
76
зируются цитоскелетные белки и происходит формирование псевдоподий.
Таким образом, у нематод известно два типа дифференциации сперматогенных
клеток, один из которых сопряжен с формированием мембранных органоидов
и фиброзных тел, а второй протекает без возникновения этих специфических
структур, отсутствие которых интерпретируется [Yushin, 2003a], как
вторичная редукция произошедшая в эволюции сперматогенеза Nematoda.
Уникальной особенностью дифференциации сперматогенных клеток
нематод является исчезновение в сперматогенезе ядерной мембраны,
которая не восстанавливается после второго деления созревания. Ядерная
мембрана сохраняется только в сперматозоидах свободноживущих морских
нематод из отряда Enoplida, что, по-видимому, свидетельствует о примитивном
положении данного таксона в системе класса Nematoda [Baccetti et al., 1983;
Yushin, Malakhov, 1994; Юшин, Малахов, 1999].
Среди нематод не известны представители, в сперматогенезе которых
рекапитулировали бы признаки формирования акросомы. Не найдены
виды, особенности дифференциации мужских гамет которых
свидетельствовали бы об эволюции безжгутиковых спермиев из жгутиковых прототипов.
Центриоли, обнаруженные в сперматозоидах некоторых нематод, имеют
редуцированную структуру и не проявляют признаков формирования аксо-
нем [Baccetti et al., 1983].
Резюмируя особенности сперматогенеза у нематод, нужно отметить, что у
них, как и у некоторых других беспозвоночных, например, плоских червей и
аннелид, развивающиеся сперматогенные клетки соединены с цитофором, а
также, как это характерно для Metazoa, связаны цитоплазматическими
мостиками и подчиняются универсальной последовательности мейотических
делений созревания. Между тем, преобразования, происходящие собственно в
сперматогенных клетках, носят уникальный характер. Цитологические
процессы направлены не на формирование акросомного и жгутикового
аппаратов, а на возникновение структур, таких как мембранные органеллы и
фиброзные тела, не имеющих аналогов в гаметоцитах представителей других
таксонов многоклеточных животных. Кроме наличия ядерной оболочки в
спермиях червей из отряда Enoplida, в сперматогенезе нематод отсутствуют
какие-либо признаки, указывающие на происхождение аберрантное™
спермиев Nematoda из примитивных или модифицированных гамет. Аберрантные
цитологические процессы, происходящие в сперматогенезе нематод,
характерны только для "нематологической" модели сперматогенеза.
KINORHYNCHA
Вопросы репродуктивной биологии киноринх рассмотрены в
нескольких публикациях [см. Higgins, 1974; Nyholm, 1976; 1977; Nyholm, Nyholm,
1982; Brown, 1983; Адрианов, Малахов, 1991; 1994; Adrianov, Malakhov, 1999].
Киноринхи раздельнополы. Самец прикрепляет сперматофор в районе го-
нопора самки, что, по мнению А.В. Адрианова и В.В. Малахова [1994],
следует считать не копуляцией, а разновидностью наружно-внутреннего
осеменения, являющегося переходным к настоящему внутреннему.
Благодаря вытянутой форме, а также наличию удлиненного ядра и
жгутика, сперматозоиды киноринх (рис. 19 А-В) на первый взгляд кажутся мо-
77
Рис. 19. Сперматогенные клетки кинрринх [по: Адрианов, Малахов, 1994]
А - сперматозоид Echinoderes dujardini; Б - сперматозоид Е. capitatus; В - сперматозоид Pycnophyes
communis; Г - движения сперматозоида P. communis; Д-И - схемы строения стадий сперматогенеза и
сперматозоида P. kielensis (Д- сперматогоний, Е - сперматоцит, Ж - поперечный срез сперматиды, 3 -
поперечный срез сперматозоида, И - участок продольного среза сперматозоида
ж - жгутик, ф - сократимые фибриллы, gl, g2, g3 - гранулы 1,2,3-го типов; м - митохондрии, я - ядро
78
дифицированными. Тем не менее, внутренняя структура этих клеток столь
своеобразна, что отнесение их к категории модифицированных
сперматозоидов не представляется возможным. Большое количество цитоплазмы, ее
наполненность гранулами различных типов, отсутствие митохондрий в
мужских гаметах некоторых видов, отсутствие акросомы, характер
расположения ядра, дополнительных фибрилл и жгутика параллельно друг другу
(рис. 19 И) являются оригинальными особенностями сперматозоидов кино-
ринх, определяющими их аберрантность. Лишь оконечность жгутика
является наружной (рис. 19 А-В), тогда как большая его часть аберрантно
прилегает к головке спермия [Nyholm, Nyholm, 1982; Адрианов, Малахов, 1994].
Удлиненность ядра в данном случае является элементом модифицированно-
сти, дополняющим структуру аберрантного спермия. Сперматозоиды кино-
ринх подвижны и способны к червеобразным изгибам (рис. 19 Г). Данный
тип движения обеспечивается пучком электроноплотных филаментов [см.
Адрианов, Малахов, 1994], тянущихся в цитоплазме параллельно жгутику и
ядру (рис. 19 3, И).
Особенности сперматогенных клеток киноринх на рисунке показаны
(рис. 19 Д-И) на примере вида Pycnophyes kielensis [по: Адрианов, Малахов,
1994]. Сперматогоний (рис. 19 Д) контактируют с центральной структурой -
рахисом (цитофором). Для сперматогониев характерно обилие
митохондрий, шероховатого эндоплазматического ретикулума и свободных рибосом.
В цитоплазме сперматоцитов (рис. 19 Е) начинается синтез включений,
последовательно возникающих в течение дифференциации сперматогенных
клеток. Выделяют три типа включений [см. Nyholm, Nyholm, 1982;
Адрианов, Малахов, 1994]. В сперматоцитах благодаря активизации
многочисленных диктиосом комлексов Гольджи происходит первый этап формирования
так называемых гранул 1-го типа (рис. 19 Е). В течение спермиогенеза
гранулы 1-го типа становятся осмиофильными глобулами. Кроме того, в спер-
матидах появляются гранулы 2-го и 3-го типов (рис. 19 Ж). Гранулы 2-го
типа тоже возникают из цистерн комплексов Гольджи, но заполнены рыхлой
субстанцией. Гранулы 3-го типа формируются из митохондрий, за счет чего
в мужских репродуктивных клетках киноринх происходит значительная
редукция количества этих органелл, которые, например, в зрелых спермиях
P. kielensis отсутствуют вообще [Адрианов, Малахов, 1994]. Кроме
формирования гранул, в сперматидах появляется жгутик, происходит вытягивание
конденсирующегося ядра, которое теряет ядерную оболочку,
закладывается пучек из двадцати электроноплотных фибрилл (рис. 19 3), которые
тянутся в цитоплазме параллельно жгутику и ядру (рис. 19 И). Акросома в
сперматогенных клетках не формируется и ее отсутствие является
характерной особенностью сперматозоидов всех исследованных видов киноринх.
Возникновение в сперматидах жгутика, организация которого
соответствует формуле 9 + 2, по-видимому, является следствием того, что предко-
вые формы спермиев киноринх были жгутиковыми клетками. Учитывая,
что киноринхи, вероятно, произошли от анцестральных головохоботных, по
организации сравнимых с современными приапулидами [Малахов,
Адрианов, 1995; Адрианов, Малахов, 1999] весьма логичным представляется
рассмотрение примитивного сперматозоида, типичного для макробентосных
приапулид [Afzelius, Ferraguti, 1978b; Адрианов и др., 1992; Реунов и др., 1992;
79
Адрианов, Малахов, 1996], как клеточной формы, исходной для мужских
гамет киноринх. В этом случае представляется вероятным, что в эволюции
репродуктивных клеток киноринх доминировала тенденция к исчезновению
акросомы, признаки формирования которой полностью отсутствуют в
сперматогенезе у современных Kinorhyncha.
ARTHROPODA
Как уже говорилось выше (см. гл. 5), среди членистоногих существуют
современные представители, имеющие как примитивные, так и
модифицированные сперматозоиды. Исследования сперматозоидов, проведенные
среди Pycnogonida, Arachnida, Crustacea и Insecta, позволили также выявить
существование многих видов, обладающих различными вариантами
аберрантных репродуктивных клеток [Baccetti, 1979]. В данном разделе будут
рассмотрены примеры формирования аберрантных мужских гамет у некоторых
представителей хелицеровых, ракообразных и трахейных.
Для хелицеровых типично внутреннее осеменение, осуществляемое
либо с помощью копуляции, в которой участвует пенис, либо путем переноса
спермиальных сгустков, спермиальных капсул или сперматофоров с
помощью педипальп [Lopez, 1977; Legendre, Lopez, 1978; Juberthie et al., 1981; Xa-
дорн, Венер, 1989]. В некоторых таксонах пауков спермиальные капсулы
содержат синцитиальные сперматозоиды, названные "synspermia" [Alberti,
1985], что является уникальным способом упаковки, не обнаруженным у
других арахнид и даже всех других представителей животного царства.
Во многих случаях аберрантные сперматозоиды хелицеровых
представляют собой продукт эволюции типичных модифицированных гамет,
которыми обладают некоторые представители скорпионов и псевдоскорпионов
[Baccetti, 1979]. Доказательством этому служит рекапитуляция структуры
модифицированных спермиев, происходящая в спермиогенезе
паукообразных. В таких случаях аберрантные спермин являются инцистированными
формами модифицированных сперматид, удлиненные ядра и жгутики
которых закручиваются в цитоплазме становящихся округлыми сперматозоидов
(см. табл. 10 А).
На примере детального исследования сперматогенеза псевдоскорпиона
Diplotemnus sp. [no: Bawa, Werner, 1988] можно продемонстрировать, что
изначально выраженные перестройки, происходящие в сперматогенезе
арахнид, сопряжены с митохондриями, которые в сперматогониях
рассредоточены в цитоплазме (рис. 20 А), а в сперматоцитах начинают объединяться и
сливаться (рис. 20 Б, В). Сперматоциты II содержат незначительное
количество укрупненных митохондрий (рис. 20 В). В ранних сперматидах
митохондрии приобретают удлиненную форму (рис. 20 Г) и к стадии средних
сперматид формируют митохондриальный конгломерат (рис. 20 Д). В поздних
сперматидах и спермиях эта митохондриальная структура занимает в клетке
центральное положение (рис. 20 Е). Хотя у Diplotemnus sp. поздние сперма-
тиды не трансформируются в клетки, напоминающие модифицированные
сперматозоиды, как это характерно для М. giganteus [no: Phillips, 1976], ядро
в спермиогенезе Diplotemnus sp., тем не менее, постепенно вытягивается
и закручивается в цитоплазме (рис. 20 Д, Е). Апикальная оконечность ядра
80
обтянута акросомои, возникающей в спермиогенезе (рис. 20 Д, Е). Аксонема,
впервые появляющаяся в сперматидах, также подвергается закручиванию
(рис. 20 Г-Е). Особенностью гамет псевдоскорпиона Diplotemnus sp., на
которую обращают внимание исследователи [Bawa, Werner, 1988], является
разобщенность митохондрий и аксонемы, что, по их мнению, сопряжено с
отсутствием у аксонемы двигательной роли, хотя строение аксонем спермиев
псевдоскорпионов соответствует оптимальной формуле 9 + 2.
Таким образом, характерной особенностью дифференциации
аберрантных спермиев псевдоскорпионов является совмещенность паттерна развития
модифицированного сперматозоида и аберрантных процессов, которые как
бы искажают финальный этап формирования половых клеток, нейтрализуя
жгутик и акросому путем локализации данных структур в цитоплазме. У
представителей некоторых арахнид таких, например, как Palpatoria и Acarina, абер-
рантизация развития мужских репродуктивных клеток зашла так далеко, что
вообще не сопровождается возникновением акросом и аксонем, а спермин, по
словам Б. Баччетти [Baccetti, 1979], напоминают спермин нематод.
Для ракообразных, кроме представителей подкласса Maxillopoda (см.
гл. 5), характерны аберрантные сперматозоиды с отсутствующей или
ограниченной подвижностью, демонстрирующие широчайший спектр
возможных проявлений аберрантности [Schon, Martens, 1998]. Примеры,
приведенные на фотографиях (см. табл. 9 В, Г), дают представление о том,
насколько различными могут быть аберрантные морфотипы мужских гамет
Crustacea. Перенос спермиев осуществляется либо путем прикрепления
сперматофора неподалеку от полового отверстия самки (Иванова-Казас,
1979], либо посредством копуляции с использованием пениса [McGregor,
Kesling, 1969].
Особенностью развития аберрантных сперматозоидов ракообразных
является оригинальность способов их формирования. В качестве одного из
примеров необычных внутриклеточных механизмов дифференциации
можно привести сперматогенез представителя десятиногих раков - омара
Enoplometopus occidentalis [Haley, 1986]. Считается, что акросома в
сперматозоидах многоклеточных животных формируется из везикул, продуцируемых
комплексом Гольджи (см. гл. 3). Однако у омара формирование акрос'омы
происходит при участии своеобразных вакуолярных элементов, которые
охарактеризованы автором [Haley, 1986], как "митохондриоподобные тела-1".
Эти структуры наблюдаются со стадии сперматогониев (рис. 21 А).
В сперматоцитах они сливаются в более крупные конгломераты, внутри
которых начинают формироваться специфические "ламеллярные структуры"
(рис. 21 Б). В сперматидах этот процесс завершается формированием так
называемого "ламеллярного региона" (рис. 21 В), который занимает
значительную часть цитоплазмы сперматид. В более поздних сперматидах в зоне
ламеллярного региона формируются везикулы, характеризуемые [по: Haley,
1986] как "митохондриоподобные тела-П" (рис. 21 Г). Благодаря слиянию
митохондриоподобных тел-И происходит формирование акросомы
(рис. 21 Г, Д). Зрелый спермий омара (рис. 21 Д), имеет акросому,
состоящую из акросомальной везикулы и периакросомного материала, под
которым сохраняется остаток ламеллярного региона. Две центриоли
расположены под акросомои и являются организаторами микротрубочек, служащих
82
Рис. 21. Сперматогенные клетки омара Enoplometous occidentalis [схематизировано А.А. Реуно-
вым по: Haley, 1986]
А - сперматогоний; Б - сперматоцит; В, Г - сперматиды; Д - сперматозоид
я - ядро, м1 - митохондриоподобные тела I, м 2 - митохондриоподобные тела II, лс - ламеллярные
структуры, лр - ламеллярный регион, ск - синаптонемальный комплекс, а - акросома, мт -
микротрубочки, ц - центриоли, х - хроматин; мм - межклеточный мостик
скелетом радиальных клеточных выступов. Базальная часть головки
заполнена неконденсированным хроматином. Неконденсированность ядерного
материала свойственна сперматозоидам десятиногих раков, в молекулярной
структуре хроматина которых отсутствуют гистоновые белки [см. Baccetti,
Afzelius, 1976].
Другим весьма интересным примером формирования мужских гамет,
встречающихся среди высших раков, является спермиогенезу креветки
83
Palaemonetes paludosus, описанный Л. Кехлером [Koehler, 1979].
Уникальность спермиогенеза данного вида ракообразного заключается в характере
формирования акросомальной субстанции, которая проникает в спермати-
ды в виде проакросомальных везикул, поступающих из вспомогательных
клеток. Выраженными особенностями спермиогенеза в данном случае
также являются элиминация центриолей, исчезновение ядерной оболочки и
отсутствие конденсации хроматина.
Среди представителей ракообразных обычны не только аберрантные
способы ультраструктурного формирования гамет, но и своеобразные
паттерны взаимодействия сперматогенных клеток с соматическими
вспомогательными клетками семенников. Например, у веслоногого рака Labidocera
aestiva [Blades-Eckelbarger, Youngbluth, 1982] развитие сперматид происходит
не в условиях контактирования с вспомогательными клетками, как это
считается обычным в сперматогенезе многоклеточных животных [Рузен-Ранге,
1980], а внутри этих клеток. Если для сперматогониев и сперматоцитов еще
характерно наличие межклеточных мостиков, то на стадии сперматид
данные структуры утрачиваются. Сперматиды проникают во вспомогательную
клетку в базальной области и внутри сформированной гетерофагосомы
мигрируют к ее апикальной части. Из вспомогательных клеток путем экзо-
цитоза сперматиды выходят в просвет семенника, где происходит их
упаковка в сперматофоры. Остаточное количество гамет вновь поглощается
вспомогательными клетками и резорбируется в их цитоплазме. Данный
механизм взаимодействия развивающихся мужских гамет и вспомогательных
клеток пока не имеет аналогов, известных в литературе.
Приведенные примеры не претендуют на освещение всего разнообразия
цитодифференцировок аберрантных мужских гамет ракообразных, но
показывают насколько неожиданными могут быть их варианты.
Различные паттерны копуляции и осеменения с помощью
разнообразных способов переноса сперматофора характерны для мириапод и
насекомых. Некоторые представители Myriapoda [Rosati et al., 1970] и Insecta
[Baccetti, Dallai, 1973] имеют модифицированные сперматозоиды,
соответствующие типичному образцу данной модели спермия (см. табл. 6 А, Б) или
слегка усложненные некоторыми аберрантными особенностями. Во многих
случаях модифицированные спермин насекомых имеют строение жгутика
9 + 2 и трактуются как предковые для данной группы членистоногих
[Baccetti, 1985]. Для ряда насекомых характерны модифицированные
сперматозоиды с измененными формулами жгутика, такими как 9 + 0, 9 + 9 + 2,
9 + 9 + 0 и т.д. Как это уже отмечалось в гл. 1, видоизменения формулы
жгутика, как правило, ослабляют его двигательную способность, что связано с
необходимостью снижения кинетического потенциала сперматозоида
[Baccetti, 1984].
Как и у хелицеровых, у трахейных широко распространены
аберрантные спермин, формирующиеся из сперматид, напоминающих
модифицированные сперматозоиды [Baccetti, 1979], а также аберрантные гаметы, не
имеющие признаков модифицированности в строении. Примером последних
может являться сперматозоид Oligotrophies juniperinus [no: Dallai, Mazzini,
1989], имеющий булавовидную форму, не содержащий ничего кроме двух-
дольчатого ядра и цитоплазмы (см. табл. 9 А). Считается, что тенденции
84
А Б В Г
Рис. 22. Сперматогенные клетки мухи Monarthropalpus buxi [no: Jazdowska Zagrodzinsca, Dallai,
1988]
A - вторичный сперматоцит (СП II) и резидуальная клетка (РК); Б-Г - морфологические стадии
спермиогенеза, Д-3 - ультраструктурные стадии спермиогенеза, И - сперматозоид
мм - межклеточный мостик, кг - комплексы Гольджи, м - митохондрии, мт - микротрубочки, ак -
аксонемы, я - ядро, ят - ядерные плотные тела
эволюции спермиев трахейных заключаются в аберрантизации гамет
модифицированного типа [Baccetti, 1984]. Данная эволюционная тенденция
заметна при рассмотрении трахейнодышащих в целом и, кроме того, она
проявляется в каждом отдельно взятом таксоне. Так, например, для термитов,
является вполне очевидным то, что более примитивные Isoptera имеют
аберрантные спермин, сохраняющие признаки модифицированных гамет.
Аберрантные спермин эволюционно продвинутых Isoptera, как правило, уже не
имеют признаков модифицированности [Baccetti et al., 1981].
В качестве примера аберрантного сперматогенеза у трахейных, можно
привести исследование этого процесса у представителя Diptera - мухи
85
Monarthropalpus buxi [no: Jazdowska Zagrodzinska, Dallai, 1988]. В
сперматогенезе у данного вида аберрантная направленность наблюдается с момента
первого деления созревания. При делении первичного сперматоцита получаются две
клетки, только одна из которых превращается во вторичный сперматоцит.
Вторая клетка становится резидуальной (рис. 22 А). При делении вторичного
сперматоцита формируются две сперматиды, которые в течение всего сперми-
огенеза сохраняют контакт с резидуальной клеткой (рис. 22 Б-Г), в конце
спермиогенеза резидуальная клетка дегенерирует. В процессе спермиогенеза
система комплексов Гольджи резорбируется, так и не приступив к
продуцированию проакросомальных везикул. Митохондрии перемещаются в переднюю
часть клетки. Хроматин ядра не достигает полной конденсации, формируется
околоядерная зона, включающая специфические электроноплотные ядерные
тела. Хвостовая часть спермия содержит большое количество аберрантных
аксонем, каждая из которых состоит из 150-180 дублетов (рис. 22 Д-И).
Данный пример показывает крайне аберрантный способ сперматогенеза, при
котором своеобразными являются как характер происходящих внутриклеточных
превращений, так и способ второго мейотического деления.
Анализ имеющихся данных позволяет считать, что среди членистоногих
эволюционные преобразования касались не только ультраструктуры
мужских гамет, но и цитологических механизмов их формирования. Результатом
этой эволюции явился переход от паттерна дифференциации сперматоген-
ных клеток, соответствующего традиционной схеме сперматогенеза (см.
гл. 3), к различным апоморфно-аберрантным вариантам этого процесса.
УЛЬТРАСТРУКТУРНЫЕ ОСОБЕННОСТИ ДИФФЕРЕНЦИАЦИИ
АБЕРРАНТНЫХ СПЕРМАТОЗОИДОВ
На основе вышерассмотренных примеров становится очевидным, что
аберрантность сперматогенных клеток и спермиев может быть как
частичной, так и полной. Критериями "глубины" аберрантности являются с одной
стороны - степень присутствия акросомы и/или жгутика, а с другой -
наличие специфичных структур и механизмов, не свойственных процессам
дифференциации примитивных и модифицированных сперматозоидов.
Так, описанные в гл. 6 варианты сперматогенеза плоских червей, киноринх
и хелицеровых, являются примерами частично аберрантной дифференциации,
при которой акросома и жгутик либо переводятся в нейтральное состояние
путем погруженности этих структур в цитоплазму, либо наблюдается полное
отсутствие одного из этих компонентов. Обычным способом ослабления или
полной нейтрализации двигательной активности жгутика является изменение
его оптимальной структуры (9 + 2) в сторону различных аберрантных
вариантов строения, что неоднократно было показано в мужских гаметах многих
беспозвоночных, таких, например, как плоские черви и трахейнодышащие.
Приспособлением, регрессирующим кинетические свойства жгутика, является
наличие скелетных структур, контролирующих жгутиковую активность (см.
гл. 1). У киноринх ограничителем биений жгутика может считаться сама
головка сперматозоида, к которой он примыкает по всей длине.
Среди примеров, рассмотренных в гл. 6, в качестве аберрантной мужской
гаметы, имеющей нейтрализованную акросому, был рассмотрен спермато-
86
зоид псевдоскорпиона Diplotemnus sp. Дополняя тему об акросомах
аберрантных спермиев, нужно вспомнить о том, что существуют и
безжгутиковые аберрантные сперматозоиды с полноценно функционирующими акро-
сомами, что, например, известно среди полихет и ракообразных [Berruti et
al., 1978; Cotelli, Donin, 1983; Dougherty, Dougherty, 1989]. Гаметы такого
типа являются разновидностью частично аберрантных сперматозоидов.
У некоторых видов Crustacea акросомы безжгутиковых аберрантных
спермиев формируются необычными способами. Так, у омара Е. occidentalis
механизм формирования акросомы связан не с диктиосомами комплекса
Гольджи, как это характерно для дифференциации акросом примитивных и
модифицированных сперматозоидов, а определяется активностью
оригинальных (аберрантных) органоидов, таких как митохондриоподобные тела
и ламеллярные структуры. У креветки P. paludosus акросомальные
компоненты поступают в сперматиды из вспомогательных клеток, что является
паттерном крайне специализированного процесса формирования акросомы,
не имеющего ничего общего с традиционным способом. Вероятно, данные
примеры могут трактоваться как варианты замаскированной аберрантности
акросом, которые лишь морфологически напоминают обычные акросомы,
но по источнику возникновения являются глубоко специфичными
структурами, которые Б. Баччетти и Б. Афцелиус [Baccetti, Afzelius, 1976]
характеризовали как "псевдоакросомы". Видимо, такие акросомы нужно считать
аберрантными, а аберрантность спермиев, не имеющих жгутика и
обладающих псевдоакросомами, может считаться полной.
Полная аберрантность подразумевает абсолютное отсутствие
традиционных признаков, таких как формирование акросомы и жгутика как в
строении зрелых сперматозоидов, так и в ранних сперматогенных клетках.
Аберрантность спермиев в этих случаях обеспечивается путем
функционирования оригинальных (аберрантных) процессов и возникновением
структур, характерных только для некоторых таксонов. Ярким примером такого
способа формирования мужских гамет является сперматогенез нематод.
Как это было показано в гл. 6, аберрантность может затрагивать и
достаточно общие категории формирования гамет. Так, у мухи М. buxi
объектом аберрантизации явился даже характер мейотических делений, а у
креветки P. paludosus аберрантен способ взаимодействия сперматогенных и
вспомогательных клеток.
В силу того, что аберрантный сперматогенез вряд ли когда-нибудь будет
изучен у всех его носителей, все разнообразие возможных форм аберрантных
дифференцировок скорее всего не будет познано никогда. Как это
установлено в многочисленных исследованиях Б. Баччетти [см. Baccetti, 1979; 1985],
аберрантные механизмы формирования сперматозоидов, как правило,
являются продолжением эволюции схем сперматогенеза, типичных для
многоклеточных животных с примитивными и модифицированными сперматозоидами.
Факт, что, являясь эволюционно продвинутыми по отношению к
примитивным и модифицированным мужским гаметам, аберрантные сперматозоиды в
большинстве случаев принадлежат представителям таксонов беспозвоночных,
дает человечеству возможность смиренно улыбнуться при мысли о непродви-
нутости собственных мужских гамет, относящихся к категории
"модифицированный сперматозоид", соответствующей лишь второму эволюционному ярусу.
Глава 7
УЛЬТРАСТРУКТУРНЫЕ АСПЕКТЫ ЭВОЛЮЦИИ
СПЕРМАТОГЕННЫХ КЛЕТОК
МНОГОКЛЕТОЧНЫХ ЖИВОТНЫХ
Очевидно, что для процесса формирования примитивных
сперматозоидов представителей многих таксонов, таких как Spongia [Paulus, 1989],
Cnidaria [Larkman, 1984], Priapulida [Адрианов и др., 1992; Реунов и др., 1992],
Nemertini [Reunov, Klepal, 1997], Polychaeta [Eckelbarger, 1984], Aplacophora
[Hodgson et al., 1988], Bivalvia [Реунов, Дроздов, 1987; Reunov, Hodgson, 1994a;
Reunov et al., 1999], Archaeogastropoda [Hodgson, Foster, 1992], Echinodermata
[Реунов, Дроздов, 1991; Au et al., 1998], Brachiopoda [Hodgson, Reunov, 1994],
Tunicata [Holland, 1989; Villa, Tripepi, 1983] и Cephalochordata [Welsch, Fang,
1996] характерна конвергентно проявляющаяся особенность, которая
заключается в том, что ранние сперматогенные клетки (сперматогонии и
сперматоциты) являются жгутиковыми. Как правило, жгутиковым сперма-
тогенным клеткам свойственна строгая приуроченность комплекса Голь-
джи, активно продуцирующего проакросомальные везикулы, к центриолям.
Согласно имеющимся данным, прицентриолярная локализация комплекса
Гольджи у изученных представителей приапулид [Адрианов и др., 1992;
Реунов и др., 1992], двустворчатых моллюсков [Реунов, Дроздов, 1987; Reunov,
Hodgson, 1994a), археогастропод [Hodgson, Foster, 1992], иглокожих [Реунов,
Дроздов, 1991; Au et al., 1998], брахиопод [Reunov, 1993; Hodgson, Reunov,
1994] и оболочников [Villa, Tripepi, 1983] не нарушается не только в сперма-
тогониях и сперматоцитах, но и в сперматидах при формировании акросо-
мы, в результате чего акросомальная везикула формируется в прицентрио-
лярном регионе вблизи комплекса Гольджи (рис. 23 А), а затем мигрирует к
апикальному региону (рис. 23 Б, В). В поздних сперматидах комплекс
Гольджи, выполнивший свою функцию по созданию акросомы, выводится из
клетки внутри отпочковывающейся резидуальной цитоплазмы (рис. 23 Г).
По мнению автора [Реунов, 1998а) флагеллярный комплекс, особенностью
которого является приуроченность диктиосом к базальному тельцу жгута,
детерминируется в сперматогенных клетках по аналогии с анцестральными
жгутиковыми клетками Metazoa. Констатация устойчивой рекапитуляции
жгутиковости в сперматогенных клетках многих беспозвоночных с
примитивными сперматозоидами [Реунов, Дроздов, 1987; Реунов, Малахов, 1993;
Reunov, Hodgson, 1994; Reunov, Klepal, 1997; Реунов, 1998а] явилась
предпосылкой к формированию гипотезы о существовании плезиоморфного яруса,
являющегося исходным в эволюции сперматогенеза многих таксонов
морских беспозвоночных и, образно характеризуемого как "жгутиковый
сперматогенез" [Reunov, 2001].
Рис. 23. Представление о дифференциации примитивных (А-Г) и модифицированных (Д-3)
сперматозоидов в спермиогенезе [схема А.А. Реунова]
я - ядро, м - митохондрия, ав - акросомальная везикула, а - акросома, кг - комплекс Гольджи, пц -
проксимальная центриоль, дц - дистальная центриоль, ц - центриоли, ж - жгутик, р - резидуальная
цитоплазма
Формирование жгутика и жгутикового комплекса у представителей
некоторых таксонов таких как Cnidaria [Larkman, 1984], Echinodermata
[Yamagata, 1982] и Cephalochordata [Frick, Ruppert, 1997] было обнаружено не
только в гениальных клетках самцов, но и в ранних оогониях. В этих
случаях наблюдается регрессия жгутика в процессе дифференциации ооцитов
[Frick, Ruppert, 1997]. Представляется правдоподобным, что ранний оогенез
у таксонов - носителей жгутикового сперматогенеза также может
оказаться закономерно жгутиковым, что позволило бы признать правомочным
существования категории "жгутиковый гаметогенез" [Reunov, 2001]. Однако
подтверждению или опровержению данного предположения должна
предшествовать серия направленных исследований оогенеза.
Рассмотрение ультраструктурных особенностей сперматогенеза у
представителей таксонов с внутренним осеменением, осуществляемом при
участии модифицированных и аберрантных сперматозоидов, позволило сделать
вывод о подавляющем отсутствии рекапитуляции жгутикового комплекса
ранними сперматогенными клетками. При дифференциации аберрантных
сперматозоидов возникновения аксонемальных структур либо не
происходит вообще, как, например, у нематод [Yushin, Malakhov, 1998], либо жгутик
впервые формируется в сперматидах, как, например, у киноринх [Адрианов,
Малахов, 1994] и хелицеровых [Baccetti, 1979]. Формирование жгутика как
двигательной структуры модифицированных сперматозоидов в
сперматогенезе изученных представителей Plathelmintes [Watson, Rohde, 1991], Nemertini
[Реунов, Чернышев, 1992], Polychaeta [Lucht, Pfannenstiel, 1989], Oligochaeta
[Hodgson, Jamieson, 1992], Gastropoda и Cephalopoda [Amor, Durfort, 1990;
Healy, 1990], Crustacea [Azevedo, Corral, 1982; Haley, 1986], Insecta [Jazdowska
Zagrodzinska, Dallai, 1988] и Vertebrata [Sprando, Russel, 1988; Phillips, Asa,
1989] происходит на завершающем этапе формирования сперматид, в
соответствии с традиционной схемой сперматогенеза (см. гл. 3), в течение
многих лет трактуемой как способ дифференциации сперматогенных клеток
многоклеточных животных. Интересно, что характерной особенностью
апоморфных сперматид является отсутствие приуроченности комплекса
Гольджи к базальному тельцу жгутика. Как это наглядно
продемонстрировано для многих представителей беспозвоночных и позвоночных [Azevedo,
Corral, 1982; Healy, 1990; Sprando, Russel, 1988; Stefanini et al., 1985; Asa et al.,
1986; Russel et al., 1989; Amor, Durfort, 1990; Bernardini et al., 1990], комплекс
Гольджи в этих случаях свободно мигрирует в цитоплазме и, как правило,
достигает апикальной части клетки, где происходит формирование акросо-
мы (рис. 23 Д-Ж), после чего диктиосомы элиминируются (рис. 23 3).
Можно предполагать, что обретение комплексом Гольджи способности к
перемещению также говорит об отрыве от стереотипа организации архаичной
жгутиковой клетки, который, вероятно, произошел в эволюции
сперматогенеза репродуктивно продвинутых таксонов. Констатация существования
способа дифференциации сперматогенных клеток, свободного от
структурной аналогии с анцестральными жгутиковыми клетками, явилась базисом
для возникновения гипотезы об апоморфности сперматогенеза этого типа,
который был охарактеризован как "специализированный сперматогенез"
[Reunov, 2001]. По мнению автора, жгутиковый и специализированный типы
сперматогенеза являются категориями, определяющими эволюционный
90
СП!
СПИ
Рис 24. Схематизированное представление о жгутиковом (А) и специализированном (Б) ти-
ПЭХ TIZZZZ^T^IZL спермаТоц„Т; СП И- вторичный сперматоцит; СТ - сперма-
тидаПСП? пРримиТивный сперматозоид; МСП - модифицированный сперматозоид; ^~^~^
^жи; ж-жгутик; пав - проакросомальные везикулы; стрелки указывают направления эволюции сперма-
тогенных клеток и сперматозоидов
91
переход, произошедший в филогенезе многих таксонов (рис. 24 А, Б).
Разнообразные аберрантные процессы, накладывающиеся на схему
формирования модифицированных сперматозоидов, являются апоморфными
преобразованиями, в совокупности представляющими третий ярус эволюции спер-
матогеннных клеток Metazoa.
В свете данной концепции мужские гаметы примитивного типа,
свойственные беспозвоночным с жгутиковым сперматогенезом, представляются
наиболее плезиоморфными по сравнению с модифицированным и
аберрантным морфотипами, дифференциация которых в большинстве случаев
происходит по типу специализированного сперматогенеза, утратившего анцест-
ральную жгутиковость. По-видимому, спор о приоритете примитивного и
модифицированного морфотипов мужских гамет (см. гл. 1) должен быть
разрешен в пользу традиционной теории [Franzen, 1955; 1956; Baccetti,
Afzelius, 1976; Baccetti, 1984; 1985], согласно которой ультраструктурный
паттерн примитивного сперматозоида, по предложению автора [Реунов,
1998а], включающий такие разновидности сперматозоидов как "анцестраль-
но-примитивный" (гипотетический), "примитивно-классический",
"примитивный с элементом (элементами) модифицированное™", "примитивный с
элементом (элементами) аберрантности", "примитивный с элементами мо-
дифицированности и аберрантности" (см. гл. 2), является исходным морфо-
типом, давшим начало модифицированным и аберрантным разновидностям
мужских гамет.
Глава 8
С ЧЕМ СОПРЯЖЕН ЖГУТИКОВЫЙ
ПАТТЕРН СПЕРМАТОГЕНЕЗА?
В силу изначальной привязанности к эволюционно преемственным
паттернам мужских гамет, концепция жгутикового и специализированного
сперматогенеза подразумевает приуроченность данных типов
дифференциации половых клеток к типам сперматозоидов, предполагая доминирующую
"прикрепленность" жгутикового сперматогенеза - к примитивному
сперматозоиду, а специализированного сперматогенеза к модифицированному и
аберрантному паттернам гамет. Тем не менее, благодаря некоторым
исследованиям существуют очевидные примеры несоответствия данной
закономерности. Так, например, формирование сперматозоидов у сипункулиды
вида Phascolion criptus, обладающего, как и другие сипункулиды [Rice, 1974;
Baccetti, 1977; Sawada, 1980; Rice, 1989; Klepal, 1993; Reunov, Rice, 1993]
примитивно-классическим паттерном сперматозоида (см. табл. 1 А, Б),
сперматогенез происходит без рекапитуляции структуры жгутиковой клетки спер-
матогониями и сперматоцитами [Reunov, Rice, 1993]. Светооптическое
исследование показывает, что кластеры сперматоцитов, которые при
отсутствии гонад, характерном для сипункулид, содержатся в их целомической
жидкости, не оснащены жгутиками (см. вклейку, табл. 19 А). Жгутики
появляются только на стадии сперматид (табл. 19 Б), кластеры которых также в
изобилии обнаруживаются в содержимом целома. В то же время, примеры
формирования жгутиков в ранних сперматогенных клетках достаточно
давно известны у некоторых представителей Insecta [Friedlander, Wahrman, 1971;
LaFountain, 1976; Данилова, 1982; Wolf, Kyburg, 1989], у которых базальные
тельца полярных жгутиков являются организаторами прикрепительной
субстанции микротрубочек веретена мейотического деления. Возникновение
жгутиков со стадии первичных сперматоцитов обнаружено у представителя
оболочников - пиросомы Pyrosoma atlanticum [Holland, 1989] - вида,
сперматозоиды которого относятся к категории модифицированных с элементами
аберрантности.
Вследствие того, что примеры несоответствий являются крайне
редкими, данные случаи изначально были расценены [Реунов, 1998а] как
исключения, недостаточные для опровержения общей тенденции, оговоренной
выше (см. гл. 7). Однако дальнейшие исследования показывают, что как
отсутствие рекапитуляции жгутиков в дифференциации примитивных
сперматозоидов, так и их возникновение у сперматогенных клеток,
превращающихся в модифицированные сперматозоиды, может встречаться более
часто, чем это казалось ранее. Так, например, жгутиковость абсолютно не
93
Рис. 25. Сперматогенные клетки брахиопод (А-Д) и форониды (Е-Н) [схематизировано
А. А. Реуновым по собственным данным]
Брахиоподы (Discinisca tenuis, Kraussina rubra): A - сперматогоний; Б — первичный сперматоцит;
В - вторичный сперматоцит; Г - сперматида; Д - сперматозоид. Форонида {Phoronopsis harmed): E -
сперматогоний; Ж - первичный сперматоцит; 3, вторичный сперматоцит; И-М - спермиогенез; Н -
сперматозоид; м - митохондрия, пд - субстанция полового детерминанта, ц - центриоли, бт - базальное тело,
кг - комплекс Гольджи, ж - жгутик, пав - проакросомальная везикула, ав - акросомальная везикула,
рц - резидуальная цитоплазма, а - акросома, я - ядро, ас - акросомоподобная структура
94
свойственна сперматогенным клеткам костистых рыб (см. табл. 18 А, Б),
для которых типичны примитивные сперматозоиды (см. табл. 4 Е).
Исследования, проведенные нами на лососевых и камбаловых рыбах, показали,
что центриоли сперматогониев и сперматоцитов этих представителей
позвоночных (табл. 18 Б), не проявляют способности к формированию аксо-
нем и возникновение жгутиков происходит в ранних сперматидах
(табл. 18 В, Г), как это характерно для традиционной схемы
сперматогенеза многоклеточных животных (см. гл. 3). Жгутиковый тип сперматогенеза
был недавно обнаружен у форониды вида Phoronopsis harmeri,
сперматозоид которого охарактеризован авторами [Reunov, Klepal, 2004] как
модифицированный с элементами аберрантности. Таким образом, у Lophophorata
жгутиковость сперматогенных клеток свойственна не только брахиопо-
дам (рис. 25 А-Д), для которых характерны примитивные
сперматозоиды [Franzen, 1956; Reunov, 1993; Hodgson, Reunov, 1994], но и форонидам
(рис. 25 Е-Н), для которых обычны модифицированные мужские
гаметы [Herrmann, 1997; Reunov, Klepal, 2004]. Складывается впечатление,
что модифицированный паттерн сперматозоида не является
препятствием для проявления феномена, характеризуемого как "жгутиковый
сперматогенез", хотя нужно отметить полное отсутствие данных о его
встречаемости в формировании аберрантных сперматозоидов. Но, уже то, что
примеры жгутикового сперматогенеза могут быть обнаружены у
представителей с модифицированными мужскими гаметами, является
достаточным, чтобы начать поиск дополнительных причин, объясняющих
явление формирования жгутиков у ранних сперматогенных клеток
Metazoa.
По мнению автора, основанному на дальнейшем анализе вышерас-
смотренных явлений, жгутиковость сперматогониев и сперматоцитов
зависит скорее не от типа сперматозоида, свойственного данному
животному, а от типа его первичных половых клеток (ППК). Так, например, у
сипункулид, у которых жгутиковый сперматогенез не обнаружен
[Reunov, Rice, 1993], гениальные клетки формируются из
безжгутиковых ППК, локализованных среди безжгутиковых клеток, составляющих
эпителий основания мускула-ретрактора [Rice, 1993]. У форонид,
которым жгутиковый сперматогенез свойственен [Reunov, Klepal, 2004], го-
нии формируются из жгутиковых ППК, расположенных среди
жгутиковых клеток вазоперитонеальной ткани [Темерева, 2001]. Возможно, что
безжгутиковость или жгутиковость сперматогенных, а также,
по-видимому, и оогенных клеток в данных случаях сопряжена с безжгутиково-
стью и жгутиковостью ППК, формирующих гонии. Учитывая, что
ППК, судя по некоторым данным [Yamagata, 1982], морфотипически
сходны с недифференцированными эмбриональными клетками,
причины их безжгутиковости и жгутиковости, вероятно, следует искать, в
прояснении факта безжгутиковости или жгутиковости
недифференцированных эмбриональных клеток. У некоторых беспозвоночных ранние
эмбриональные (стволовые) клетки при формировании бластулы, по
сути являющейся первым эпителием, рекапитулируют строение
эпителиальных жгутиковых клеток, в результате чего можно наблюдать
явление жгутиковых бластул [Yamashita, 1986; Малахов, 1990; Юшин и др.,
95
1993; Herrmann, 1997]. Весьма логичным кажется предположение, что,
если эмбриональные стволовые клетки являются носителями жгутико-
вости, то и весь набор клеток, участвующих в морфогенезе, представлен
жгутиковым морфотипом. Иллюстрацией к этой гипотезе может
служить, например, эмбриональное развитие и взрослое состояние
иглокожих, у которых строение моноцилиарной жгутиковой клетки
рекапитулирует большая часть эмбриональных и дифференцированных
соматических клеток в различных тканях [Norrevang, Wingstrand, 1970; Wood,
Cavey, 1981; Юшин и др., 1993], что находит естественное выражение в
жгутиковости клеток герминативного эпителия - оогониев [Yamagata,
1982], сперматогониев [Реунов, Дроздов, 1991] и соматических
вспомогательных клеток гонад [Cavey, Markel, 1994; Reunov et al., 2004b).
Созвучен данному предположению и ранний эмбриогенез форонид, у
которых жгутиковость бластул [Herrmann, 1997] сопряжена с
последующим проявлением жгутиковости клеток вазоперитонеальной ткани,
в которой дифференцируются жгутиковые репродуктивные клетки
[Темерева, 2001]. В то же время у сипункулид жгутиковые бластулы не
обнаружены, ППК не являются жгутиковыми и жгутики, возникающие
в течение эмбриогенеза, детерминированы как специализированные
структуры, постепенно появляющиеся в определенных участках тела
личинок [Rice, 1975; Lundin, Schander, 2003]. Как видно из примеров,
безжгутиковость и жгутиковость ППК и формирующихся из них спер-
матогенных клеток коррелируют с изначальной безжгутиковостью и
жгутиковостью стволовых клеток. Для выяснения того, насколько
закономерным является проявление данной корреляции необходимо
проведение широкого исследования раннего эмбриогенеза методами световой
и сканирующей электронной микроскопии у представителей различных
таксонов.
Таким образом, по мнению автора книги, феномен жгутикового
сперматогенеза, по-видимому, сопряжен с жгутиковостью ППК,
которая в некоторых таксонах "просматривается" как следствие
жгутиковости стволовых клеток. Вопрос о том, является ли жгутиковость
стволовых клеток рудиментарной или же она определена функциональной
необходимостью, вероятно, не может быть однозначно решенным для всех
животных. Скорее всего жгутиковость бластул у некоторых
представителей Metazoa необходима как локомоторный фактор расселения
личинок [см. Касьянов, 1989; Kasyanov et al., 1998], а у других является
функционально неподкрепленной и может быть расценена как плезиоморф-
ный признак, унаследованный от анцестральных жгутиковых клеток. Не
исключено, что в некоторых случаях отсутствие жгутиков в раннем
эмбриогенезе свидетельствует об утрате плезиоморфной жгутиковости
стволовыми клетками данных организмов.
Весьма интересным является вопрос о рудиментарности и
функциональности жгутиков клеток млекопитающих. Жгутики, обнаруженные у многих
типов эмбриональных и дифференцированных клеток Mammalia, в более
ранних публикациях обсуждались авторами как рудиментарные органеллы
[см. Michelinee, George, 1974; Amemiya, 1975; Ohno, Park, 1983; Gonzalez et al.,
1985; Park et al., 1988]. Описания примеров нефункциональности жгутиков и
96
ФОТОТАБЛИЦЫ
Таблица 1
им -
^V--<?B)
/
Таблица 2
ш
irffeW
■,t*
Таблица 3
«—-L J
:": -, Г" "
%#
«Sty.
Таблица 4
Л ' "'- > г-X- '-ft WJ^JJ
X \^?\Т&Г$
E
/ *-
Габлица 5
Таблица 6
сч
# %
ikb.
*
1:
г
i
Эр
■1 *
н
;■■? ■ v'
О ** fil||wW Ш1^
■3
*
Таблица 7
Таблица 8
Га блица 9
Таблица
Л Т-
■ "i «' ...
#■■■
It*' . n
йй?
A
• %
Таблица 1 I
Таблица 12
^jl i£^bw.,
t
4$
•fl
Ч с
У ■
##u
' fa» V
4.
Таблица 13
s»«e
%.
Таблица V-
Г™ U^Ut'
'*■
.&
''У*
■-'■*:-Я*$к. • •■-
ш
J*>
Таблица 15
tf
«
*tf
#
i^fcj»
V:
>TV,
Таблица 16
Таблица 17
Габлица 18
*
'---v 1.■ * •» JbI
Таблица 19
■ Y
- '• J *.«
N
ресничек клеток млекопитающих можно найти и в современной
периодике [см. Fuchs, Schwark, 2004; Bird, 2004]. Тем не менее, все большее
количество данных свидетельствует о наличии специфических функций,
выполняемых этими структурами. Например, в раннем эмбриогенезе
вращение жгутиков меняет положение эмбриона [Brueckner, 2001] и
создает ток жидкости, играющий роль в становлении асимметрии левой и
правой половин тела [Stern, 2002; Yokoyama, 2004]. У одонтобластов -
клеток, вырабатывающих дентин в течение жизни зуба, через жгутик
осуществляется связь между внешним раздражителем и синтетической
активностью одонтобласта [Magloire et al., 2004]. Жгутики в клетках
почек являются детекторами тока жидкости, при наличии дефектов
которых, нарушается функция почек [Yoder et al., 2002; Yokoyama, 2004]. A
жгутики хондроцитов служат механорецепторами, играющими важную
роль в процессе формирования скелета [Jensen et al., 2004]. Существуют
и другие варианты функций жгутиков. Нужно отметить, что в
большинстве публикаций речь идет о так называемых первичных жгутиках
различных клеток млекопитающих, имеющих организацию 9 + 0 [Magloire
et al., 2004; Eley et al., 2004]. Но встречаются и жгутики, строение
которых соответствует обычной формуле. Например, давно известно, что
жгутики остеоцитов черепа плода крысы, имеют организацию 9 + 2,
снабжены базальным тельцем и проксимальной центриолью, причем
около центриолей локализован комплекс Гольджи [Michelinee, George,
1974]. Вероятно, именно структурное сходство с архаичным типом
жгутиковой клетки Metazoa, отчетливо проявляющееся в подобных случаях,
не раз заставляло авторов балансировать между рудиментарностью и
функциональностью жгутиков клеток млекопитающих. Учитывая, что
стволовые клетки, составляющие морулы и бластоцисты Mammalia, по-
видимому, не имеют "склонности" к рекапитуляции структуры
жгутиковых клеток [см. Белоусов, 1980; Maro, Pickering, 1984], предположение об
утрате архаичной жгутиковости и приобретении клетками
млекопитающих функциональной жгутиковости кажется более предпочтительным,
хотя данный вопрос остается открытым для предположений и
дальнейших исследований.
Таким образом, не исключено, что, говоря об эволюционной
преемственности "жгутиковых" и "специализированных" гениальных клеток, мы
гипотетически можем подразумевать факт существования жгутикового
(архаичного) и безжгутикового (эволюционно продвинутого) типов
недифференцированных эмбриональных (стволовых) клеток (рис. 26). Вполне
возможно, что в зависимости от типа стволовых клеток, явление
жгутикового гаметогенеза может присутствовать или отсутствовать у
многоклеточных животных с любым типом мужских гамет. Вероятно, что анцестральная
жгутиковость стволовых клеток наиболее часто встречается у
беспозвоночных с примитивными мужскими гаметами. По-видимому, именно с этим
сопряжена выраженная приуроченность жгутикового сперматогенеза к
категории "примитивный сперматозоид".
7 Реунов А. А,
97
ОБЪЯСНЕНИЯ К ФОТОТАБЛИЦАМ
Таблица 1. Примитивно-классический сперматозоид сипункулиды Phascolion ayptus [no:
Reunov, Rice, 1993]
А - внешний вид сперматозоида (сканирующая электронная микроскопия - СЭМ); Б - продольный
срез головки сперматозоида (трансмиссионная электронная микроскопия - ТЭМ); В - продольный срез
акросомы сперматозоида (ТЭМ); Г - митохондриальное кольцо, состоящее из пяти митохондрий, на
поперечном срезе средней части головки (ТЭМ); Д - комплекс дистальнои центриоли, состоящий из
девяти радиальных перицентриолярных элементов на поперечном срезе средней части сперматозоида (ТЭМ);
Е - продольный срез через центриолярный аппарат сперматозоида (ТЭМ); Ж - поперечный срез
жгутика сперматозоида (ТЭМ)
ж - жгутик, а - акросома, я - ядро, сч - средняя часть, ав - акросомальная везикула, пм - периакро-
сомный материал, м - митохондрия, пц - проксимальная центриоль, дц - дистальная центриоль, ц - цен-
триоль, ця - центриолярная ямка, пэ - перицентриолярные элементы дистальнои центриоли, п - пери-
центриолярный элемент проксимальной центриоли
Шкала А - 1 мкм; Б - 1 мкм; В - 1 мкм; Г - 0,5 мкм; Д - 0,5 мкм; Е - 0,5 мкм; Ж - 0,1 мкм
Таблица 2. Особенности строения примитивно-классических сперматозоидов
А - поперечный срез митохондриального кольца в средней части сперматозоида гидромедузы
Gonionemus veneris (ТЕМ) (фото А.А. Реунова); Б - продольный срез центриолярного аппарата альционарии
Gersemia fruticosa (ТЕМ) [по: Реунов, Даутов, 1991]; В - продольный срез перицентриолярного комплекса
дистальнои центриоли гидромедузы G. veneris (ТЕМ) (фото А.А. Реунова); Г - продольный срез
перицентриолярного комплекса дистальнои центриоли актинии Anthopleura orientalis (ТЕМ) [по: Реунов, Костина,
1991]; Д - общий вид сперматозоида двустворчатого моллюска Perna viridis (СЭМ) [по: Reunov et al., 1999];
Е - продольный срез сперматозоида двустворчатого моллюска P. viridis (ТЭМ) [по: Reunov et al., 1999]
м - митохондрия, дц - дистальная центриоль, пц - проксимальная центриоль, п - одиночный пери-
центриолярный элемент проксимальной центриоли, р - разветвления перицентриолярного элемента
дистальнои центриоли, к - периферическое кольцо перицентриолярного комплекса дистальнои центриоли,
а - акросома, пм - периакросомный материал, ос - осевой стержень, ж - жгутик, я - ядро
Шкала: А - 0,5 мкм; Б - 0,5 мкм; В - 0,5 мкм, Г - 0,5 мкм, Д - 1 мкм, Е - 0,5 мкм
Таблица 3. Примитивные сперматозоиды с элементами модифицированности
А, В, Г - сперматозоиды морского ежа Anthocidaris crassispina (A - СЭМ; В, Г - ТЭМ) [по: Au et al.,
1998]; Б, Д - сперматозоиды двустворчатого моллюска Musculus laevigatus (Б - СМ; Д - ТЭМ) (фото
А.А. Реунова); СМ - световая микроскопия
а - акросома, я - ядро, м - митохондрия, ж - жгутик
Шкала: А - 1 мкм; Б - 10 мкм; В - 1 мкм , Г - 0,5 мкм; Д - 1 мкм
Таблица 4. Примитивные сперматозоиды с элементами аберрантности
А - сперматозоид актинии Anthopleura orientalis (ТЭМ) [по: Реунов, Костина, 1991]; Б -
сперматозоид полихеты Neanthes japonica (ТЭМ) [по: Sato, Osanai, 1986];
В - сперматозоид полихеты Phragmatopoma lapidosa (СЭМ) [по: Eckelbarger, 1984]; Г - поперечный срез
средней части сперматозоида двустворчатого моллюска Modiolus difficilis (ТЭМ) [по: Дроздов, Реунов,
19866]; Д - поперечный срез жгутиков сперматозоидов двустворчатого моллюска Septifer keenae (ТЭМ)
(фото А.А. Реунова); Е - продольный срез сперматозоида малоротой камбалы Glyptocephalus stelleri
(ТЭМ) (фото СЮ. Незнановой)
я - ядро, м - митохондрия, пав - проакросомальные везикулы, ц - цитоплазматический вырост, ж -
жгутик, а - акросома, п - плавники
Шкала: А - 1 мкм; Б - 1 мкм; В - 1 мкм, Г - 1 мкм, Д - 0,5 мкм, Е - 0,5 мкм
99
Таблица 5. Примитивные сперматозоиды с элементами модифицированности и
аберрантное™
А, Б - сперматозоиды альционарии Gersemia fruticosa (A - СМ; Б - ТЭМ) (фото А.А. Реунова);
В-Д - сперматозоиды немертины Procephalothrix sp. (В - СЭМ, Г, Д - ТЭМ) [по: Reunov, Klepal, 1997];
Е, Ж - сперматозоид двустворчатого моллюска Divariscintilla troglodytes (ТЭМ) [по: Eckelbarger et al.,
1990]
ж - жгутик, ц - цитоплазматический вырост, я - ядро, м - митохондрия, а - акросома, с - средняя
асть, ма - место, в котором в примитивных спермиях локализована акросома, которая в данном случае
отсутствует
Шкала: А - 1 мкм; Б - 1 мкм; В - 1 мкм , Г - 1 мкм, Д - 0,5 мкм, Е - 0,5 мкм, Ж - 0,5 мкм
Таблица 6. Модифицированные сперматозоиды
А - модифицированный сперматозоид насекомого Megaselia scalaris (СМ) [по: Curtis et al., 1989]; Б -
модифицированный сперматозоид насекомого Sialis lutaria (ТЭМ) [по: Afzelius, Dallai, 1988]; В, Г -
хвостовой аппарат модифированного сперматозоида рептилии Pogona barbata (ТЭМ) [по: Oliver et al., 1996]
а - акросома, я - ядро, сч - средняя часть, х - хвостовой аппарат, м - митохондрия, ж - жгутик,
эс - межмитохондриальная электронно-плотная субстанция, ее - скелетные структуры
Шкала: А - 5 мкм; Б - 1 мкм; В - 0,5 мкм, Г - 0,5 мкм
Таблица 7. Сперматозоиды человека
А - общий вид сперматозоида (СЭМ) (фото А.А. Реунова); Б - для человеческих сперматозоидов
характерна уплощенность головок [по: Bronson et al., 1989]; В-Д - морфологические разновидности
сперматозоидов человека (СЭМ) (фото А.А. Реунова)
я - ядро, уг - уплощенные головки
Шкала: А - 1 мкм; Б - 0,5 мкм; В - 1 мкм; Г - 1 мкм; Д - 1 мкм
Таблица 8. Модифицированные сперматозоиды с элементами аберрантности
А - сперматозоид сумчатого млекопитающего Sminthopsis crassicaudata (СЭМ) [по: Breed et al., 1989];
Б - сперматозоид представителя гастротрих Mesodasys adenotubulatus (СЭМ) [по: Fregni et al., 1999];
В - сперматозоид пиявки Erpobdella octoculata (ТЭМ) [Garavaglia et al., 1974]; Г-Е - сперматозоид форо-
ниды Phoronopsis harmeri (Г - СЭМ; Д, Е - ТЭМ) [по: Reunov, Klepal, 2004]
а - акросома, я - ядро, ас - акросомоподобная структура, ж - жгутик, бт - базальное тело, я - ядро,
м - митохондрия
Шкала: А - 0,5 мкм; Б - 1 мкм; В - 1 мкм, Г - 1 мкм; Д - 0,5 мкм, Е - 0,5 мкм
Таблица 9. Аберрантные сперматозоиды
А- сперматозоид насекомого Oligotrophus juniperinus (ТЭМ) [по: Dallai, Mazzini, 1989], Б -
сперматозоид нематоды Enoplus anisospiculus (СМ) [по: Yushin, Malakhov, 1994]; В - сперматозоид ракообразного
Armadillidium vulgare (CM) [no: Cotelli et al., 1976]; Г - сперматозоид ракообразного Rhynchocinetes typus (СЭМ)
[no: Barros et al., 1986]; Д - сперматозоид нематоды Halichoanolaimus possjetiensis (ТЭМ) [no: Yushin, 2003a]
я - ядро, п - псевдоподии, а - акросомальный регион, х - хвостовой аппарат, ф - фиброзные тела
Шкала: А - 1 мкм; Б - 10 мкм, В - 1 мкм, Г - 1 мкм, Д - 1 мкм
Таблица 10. Аберрантные сперматозоиды с элементами примитивности и модифицированности
А - сперматозоид псевдоскорпиона Mastigoproctus giganteus (ТЭМ) [по: Phillips, 1976]; Б -
сперматозоид полихеты Ophryotrocha puerilis (ТЭМ) [по: Berruti et al., 1978]
я - ядро, ж - жгутик, а - акросома, м - митохондрии
Шкала: А - 0,5 мкм; Б - 0,5 мкм
Таблица 11. Популяция сперматозоидов морского ежа Anthocidaris crassispina
А - гигантский сперматозоид (ТЕМ) (фото А.А. Реунова); Б - сперматозоид с двумя ядрами (ТЕМ)
[фото А.А. Реунова]; В - сперматозоид, содержащий аномальное количество центриолей (ТЕМ) (фото
А.А. Реунова); Г, Д - разновидности нормальных сперматозоидов (СЭМ) [по: Au et al., 1998]
я - ядро, ц - центриоли, м - митохондрия
Шкала: А - 1 мкм; Б - 0,5 мкм; В - 0,5 мкм, Г - 0,5 мкм; Д - 1 мкм
Таблица 12. Сперматогенные клетки Spongia и Cnidaria
А, Б - сперматоциты губки Spongilla lacustris (ТЭМ) [по: Paulus, 1989]; В - сперматогоний
гидромедузы Gonionemus vertens (ТЭМ) (фото А.А. Реунова); Г - сперматогоний актинии Anthopleura orientalis
(ТЭМ) (фото А.А. Реунова); Д - сперматоцит альционарии Gersemia fruticosa (ТЭМ) (фото А.А. Реунова)
я - ядро, а - аксонема, ц - центриоли, ж - жгутик, г - комплекс Гольджи
Шкала: А - 1 мкм; Б - 1 мкм; В - 1 мкм, Г - 0,5 мкм; Д - 0,5 мкм
100
Таблица 13. Сперматогенные клетки кишечнополостных
А - сперматозоид гидромедузы Cladonema uchidai (ТЭМ) [по: Yamashita, 1988]; Б-В - сперматиды
гидромедузы Gonionemus vertens (ТЭМ) (фото А.А. Реунова)
я - ядро; м - митохондрия; ж - жгутик; ав - акросомоподобная везикула; наконечники указывают
на проакросомальные везикулы.
Шкала: А - 0,2 мкм; Б - 0,5 мкм; В - 0,5 мкм
Таблица 14. Сперматогенные клетки морских беспозвоночных
А - сперматоцит приапулиды Halicryptus spinulosus (ТЭМ) [по: Адрианов и др. 1992]; Б -
сперматоцит полихеты Phragmatopoma lapidosa (ТЭМ) [по: Eckelbarger, 1984]; В - сперматогоний двустворчатого
моллюска Barbatiafoliata (ТЭМ) [по: Reunov, Hodgson, 1994a]
ж - жгутик, дц - дистальная центриоль, пц - проксимальная центриоль, ц - дочерние центриоли, кг -
комплекс Гольджи, пв - проакросомальные везикулы, я - ядро
Шкала: А - 0,5 мкм; Б - 0,5 мкм; В - 1 мкм.
Таблица 15. Сперматогоний морского ежа Anthocidaris crassispina (ТЭМ) [по: Au et al., 1998]
ж - жгутик, дц - дистальная центриоль, пц - проксимальная центриоль, ик - исчерченный корешок,
кг - комплекс Гольджи, я - ядро
Шкала: 0,5 мкм.
Таблица 16. Сперматоциты (А-Г) морского ежа Anthocidaris crassispina (ТЭМ) [по: Au et al.,
1998J
ж - жгутик, дц - дистальная центриоль, пц - проксимальная центриоль, кг - комплекс Гольджи, фс -
фибриллярная структура, ск - синаптонемальный комплекс, я - ядро, доц - дочерние центриоли, ц -
центриоли, ак - аксонема
Шкала: А - 0,5 мкм; Б - 0,5 мкм; В - 0,5 мкм, Г - 0,5 мкм
Таблица 17. Сперматиды (А-Е) морского ежа Anthocidaris crassispina (ТЭМ) [по: Au et al.,
1998]
я - ядро, ж - жгутик, дц - дистальная центриоль, пц - проксимальная центриоль, ц - центриоли, кг -
комплекс Гольджи, м - митохондрия, фс - фибриллярная структура, а - акросома
Шкала: А - 0,5 мкм; Б - 0,5 мкм; В - 0,5 мкм, Г - 0,5 мкм, Д - 0,5 мкм; Е -0,5 мкм
Таблица 18. Сперматогенные клетки костистых рыб
А - сперматогоний кижуча Oncorhynchus kisutch (ТЭМ) (фото А.А. Реунова); Б - сперматоцит
О. kisutch (ТЭМ) (фото А.А. Реунова); В - сперматида О. kisutch (ТЭМ) (фото А.А. Реунова); Г, Д -
сперматиды остроголовой камбалы Cleisthenes herzensteini (ТЭМ) (фото СЮ. Незнановой)
я - ядро, ц - центриоли, ж - жгутик, кг - комплекс Гольджи, ав - акросомоподобная везикула
Шкала: А - 10 мкм; Б - 0,5 мкм; В - 0,5 мкм; Г - 1 мкм; Д - 0,5 мкм
Таблица 19. Сперматоциты (А) и сперматиды (Б) сипункулиды Phascolion cryptus (CM) [no:
Reunov, Rice, 1993]
Шкала: А - 5 мкм; Б - 5 мкм
ЛИТЕРАТУРА
Адрианов А.В., Малахов В.В. Тонкое строение сперматозоидов и особенности
сперматогенеза беломорских киноринх Pycnophyes kielensis (Homalorhagida) Pycnophyidae // Зоол. журн.
1991. Т. 70, №4. С. 28-36.
Адрианов А.В., Малахов ВВ. Киноринхи: Строение, развитие, филогения и система. М.:
Наука, 1994. 262 с.
Адрианов А.В., Малахов ВВ. Приапулиды (Priapulida): Строение, развитие, филогения и
система. М.: КМК scientific press, 1996. 266 с.
Адрианов А.В., Малахов В.В. Головохоботные черви (Cephalorhyncha) Мирового океана:
(Определитель морской фауны). М.: КМК scientific press, 1999. 328 с.
Адрианов А.В., Реунов АА. Особенности сперматогенеза и сперматозоидов
беломорской приапулиды Halicryptus spinulosus II Докл. АН СССР. 1992. Т. 321, № 3. С. 506-508.
Адрианов А.В., Реунов А.А., Малахов В.В. Тонкое строение семенников и особенности
сперматогенеза у беломорской приапулиды Halicryptus spinulosus (Cephalorhyncha,
Priapulida) // Зоол. журн. 1992. Т. 71, № 1. С. 31-39.
Айзенштадт Т.Б. Цитология оогенеза. М.: Наука, 1984. 247 с.
Белоусов Л.В. Введение в общую эмбриологию. М.: Изд-во МГУ, 1980. 216 с.
Бурнашева С.А. Биохимия движения сперматозоидов // Современные проблемы
сперматогенеза. М.: Наука. 1982. С. 225-249.
Габаева Н.С. О строении и функциях фолликулярного эпителия семенников
позвоночных//Там же. 1982. С. 108-159.
Габаева Н.С. О тенденциях эволюционных изменений гаметогенеза и его
вспомогательных структур в филогенезе Metazoa // Вопросы эволюции онтогенеза. М.: Наука, 1985.
С. 90-100.
Гинзбург А.С. Ультраструктура сперматозоида и акросомная реакция Acipenser stellatus 11
Проблемы экспериментальной биологии. М.: Наука, 1977. С. 246-256.
Данилова Л.В. Успехи в изучении развития и ультраструктуры сперматозоидов
(К 300-летию открытия сперматозоида) // Онтогенез. 1977. Т. 8, N 6. С. 17-23.
Данилова Л.В. Ультраструктурное исследование сперматогенеза. М.: Наука, 1978. 206 с.
Данилова Л.В. Сперматогонии, сперматоциты, сперматиды // Современные проблемы
сперматогенеза. М.: Наука, 1982. С. 25-62.
Дроздов АЛ. О прототипе спермиев многоклеточных животных // Цитология. 1984.
Т. 26, № 7. С. 759-766.
Дроздов АЛ., Иванков В.Н. Морфология гамет животных: значение для систематики и
филогении. М.: Круглый год, 2000. 458 с.
Дроздов АЛ., Касьянов ВЛ. Размеры и форма гамет у иглокожих // Онтогенез. 1985а.
Т. 16, № 1.С. 49-59.
Дроздов АЛ., Касьянов ВЛ. Размеры и форма гамет у морских двустворчатых
моллюсков // Биология моря. 19856. № 4. С. 33-40.
Дроздов АЛ., Касьянов В Л., Реунов А. А. Ультраструктура гонад голотурии Stichopus
japonicus II Цитология. 1986. Т. 28, № П. С. 1256-1258.
Дроздов АЛ., Колотухина Н.К., Максимович А.А. Особенности гистологического
строения семенников и ультраструктура сперматозоидов горбуши // Биология моря. 1981. № 1.
С. 49-53.
102
Дроздов АЛ., Машанский В.Ф. Акросомная реакция сперматозоида мидии Crenomytilus
grayanus II Цитология. 1979. Т. 21. С. 657-661.
Дроздов АЛ., Реунов А.А. Сперматогенез и ультраструктура сперматозоидов у модиолу-
са // Там же. 1986а. Т. 28, № 10. С. 1069-1074.
Дроздов АЛ., Реунов А.А. Морфология гамет съедобной мидии из Белого, Японского
морей и Авачинской губы // Биология моря. 19866. № 4. С. 52-55.
Дроздов АЛ., Реунов А.А. Морфология спермиев двустворчатых моллюсков-митилид //
Там же. 1997. Т. 23, № 3. С. 156-163.
Ефремова СМ., Папковская М.В. Сперматогенез байкальской губки Lubomirskia
baicalensis (Pallas). Ультраструктурное исследование // Арх. анатомии и гистологии
эмбриологии. 1980. Т. 79. С. 88-95.
Иванков В.Н. Репродуктивная биология рыб. Владивосток: Изд-во ДВГУ, 2001. 223 с.
Иванов А.В., Мамкаев Ю.В. Ресничные черви (Turballaria): Их происхождение и
эволюция. Л.: Наука, 1973. 221 с.
Иванов А.В., Полянский Ю.И., Стрелков А.А. Большой практикум по зоологии
беспозвоночных. Ч. 1. М.: Сов. наука, 1958. 340 с.
Иванова Л.В. Особенности строения сперматозоидов и оплодотворения у известковых
губок // Симпозиум по онтогенезу морских беспозвоночных. Владивосток: ДВНЦ АН СССР,
1988. С. 37-38.
Иванова-Казас ОМ. Сравнительная эмбриология беспозвоночных животных.
Членистоногие. М.: Наука, 1979. 224 с.
Исаева В.В., Реунов А.А. Половая плазма и детерминация клеток половой линии: роль
митохондрий // Биология моря. 2001. Т. 27, № 4. С. 231-237.
Касьянов ВЛ. Репродуктивная стратегия морских двустворчатых моллюсков и
иглокожих. Л.: Наука, 1989. 183 с.
Кауфман З.С Эмбриология рыб. М.: Агропромиздат, 1990. 272 с.
Корн ОМ. Биология размножения усоногих раков отряда Thoracica // Биология моря.
1988. Т. 25, № 2. С. 3-15.
Кусакин ОТ., Дроздов АЛ. Филема органического мира. Ч. 2. Прокариоты и низшие эв-
кариоты. СПб.: Наука, 1998. 358 с.
Малахов В.В. Загадочные группы морских беспозвоночных. М.: Изд-во МГУ, 1990. 144 с.
Малахов В.В., Адрианов А.В. Головохоботные (Cephalorhyncha) - новый тип животного
царства. М.: КМК scientific press, 1995. 1999 с.
Парамонов А.А. Основы фитогельминтологии. М.: Изд-во АН СССР, 1962. 480 с.
Пащенко СВ. Сперматогенез и ультраструкутра спермиев у четырех видов хитонов
Японского моря // Цитология. 1993. Т. 35, № 6-7. С. 15-22.
Райцина С.С. Цикл сперматогенного эпителия и кинетика сперматогенеза у
млекопитающих // Современные проблемы сперматогенеза. М.: Наука, 1982. С. 73-82.
Райцина С.С. Сперматогенез и структурные основы его регуляции. М.: Наука, 1985.
206 с.
Реунов А.А. О классификации сперматозоидов Metazoa // Биология моря. 1993, № 2.
С. 45-54.
Реунов А.А. Ультраструктурные аспекты сперматогенеза многоклеточных животных.
Автореф. дис. ... докт. биол. наук. Владивосток, 1998а. 42 с.
Реунов А.А. Акросомоподобная везикула в спермиогенезе гидромедузы Gonionemus
vertens // Докл. РАН. 19986. Т. 359, № 1. С. 128-129.
Реунов А.А., Адрианов А.В., Малахов В.В. Ультраструктурное исследование
сперматогенеза приапулиды Priapulus caudatus L. // Цитология. 1992. Т. 34, № 5. С. 76-82.
Реунов А.А., Даутов С.Ш. Ультраструктура сперматозоида альционарии Gersemia fruti-
cosa II Докл. АН СССР. 1991. Т. 321, № 3. С. 604-605.
Реунов А.А., Дроздов АЛ. Ультраструктура сперматогониев, сперматоцитов и сперма-
тид дальневосточного трепанга // Цитология. 1991. Т. 33, № 6. С. 27-32.
Реунов А.А., Дроздов АЛ. Ультраструктура сперматозоидов у двустворчатых
моллюсков Adula falcatoides и Septifer keenae // Биология моря. 1986, № 5. С. 74—76.
Реунов А.А., Дроздов АЛ. Сперматогенез и ультраструктура сперматозоидов у мидии
Mytilus coruscus // Цитология. 1987. Т. 29, № 3. С. 260-266.
Реунов А.А., Дроздов АЛ. Акросомная реакция спермиев у четырех видов
двустворчатых моллюсков митилид // Там же. 1992. Т. 34, № 1. С. 89-93.
103
Реунов А.А., Костина Е.Е. Исследование ультраструктуры сперматозоида актинии
Anthopleura orientalis II Там же. 1991. Т. 33, № 10. С. 73-78.
Реунов А.А, Малахов ВВ. Эволюция строения сперматозоидов у беспозвоночных //
Успехи соврем, биологии. 1993. Т. 1. С. 3-16.
Реунов А.А., Незнанова С.Ю., Александрова Я.Н., Исаева ВВ. Ультраструктурное
исследование взаимодействия герминативных гранул и митохондрий у Apostichopus japonicus
(Echinodermata, Holothuroidea) и Pleuronectes asper (Teleostei, Pleuronectidae) // Биология моря.
2004a. Т. 30, N 3. С. 244-246.
Реунов А.А., Незнанова С.Ю., Иванков В.Н. Сравнительное исследование
постнерестовой деструкции сперматозоидов у камбаловых рыб Hippoglossoides {Cleisthenes) herzensteini и
Hippoglossoides duhius (Teleostei, Pleuronectidae) // Цитология. 20046. Т. 46, № 8. С. 704-709.
Реунов А.А., Чернышев А.В. Строение семенника и сперматогенез немертины
Tetrastemma nigrifrons II Там же. 1992. Т. 34, № 6. С. 13-20.
Рузен-Ранге Э. Сперматогенез у животных. М.: Мир, 1980. 255 с.
Суходольская А.Н., Панковская М.В. Электронно-микроскопическое исследование
сперматогенеза у пресноводных губок Ephydatia fluviatilis и Spongilla lacustris // Цитология.
1985. Т. 27. С. 297-302.
Темерева Е.Н. Микроскопическая анатомия и ультраструктура форониды Phoronopsis
harmeri Pixell (1912). Автореф. дис. ... канд. биол. наук. М., 2001. 24 с.
Хадорн Э., Венер Р. Общая зоология. М.: Мир, 1989. 523 с.
Хотимченко Ю.С.,Деридович И.И., Мотавкин П.А. Биология размножения и регуляция
гаметогенеза и нереста у иглокожих. М.: Наука, 1993. 168 с.
Юрченко О.В., Реунов А.А. Диморфизм сперматозоидов у морского ежа
Strongylocentrotus nudus // Биология моря. 2004. Т. 30, № 5. С. 403^105.
Юшин ВВ., Бухарцева Н.В., Малахов В.В. Электронно-микроскопическое исследование
развития дальневосточного трепанга Stichopus japonicus от бластулы до диплеврулы //
Цитология. 1993. Т. 35, № 1. С. 22-29.
Юшин В.В., Зограф Ю.К. Электронно-микроскопическое исследование сперматогенеза
у свободноживущей морской нематоды Neochromadora poecilosoma (Chromadorida,
Chromadoridae) // Биология моря. 2002. Т. 28, № 1. С. 47-52.
Юшин ВВ., Малахов В.В. Спермин нематод отряда Enoplida имеют ядерную оболочку //
Докл. РАН. 1999. Т. 367, № 5. С. 718-720.
Adrianov A.V., Malakhov V.V. Kinorhyncha // Reproductive biology of invertebrates. Oxford; New
Delhi: IBH Publ. 1999. Vol. 9, pt a/Ed. K.G. Adiyodi, R.G. Adiyodi. P. 193-211.
Afzelius B.A. The spermatozoon of the nemertine Malacobdella grossa I I J. Submicrosc. Cytol.
1971. Vol. 3. P. 181-192.
Afzelius B.A. Fine structure of the garfish spermatozoon // J. Ultrastruct. Res. 1978. Vol. 64.
P. 309-314.
Afzelius B.A. The flagellar apparatus of marine spermatozoa // Proc. of Symp. of the Soc. for Exp.
Biol. "Prokaryotic and eukaryotic flagella". Bath: Pitman press, 1982. P. 495-519.
Afzelius B.A. Spermiogenesis in Myzostomum cirriferum // Vid. medd. Dan. maturhist. foren.
Ser. V. 1984. Vol. 145, N 1. P. 11-21.
Afzelius B.A., Dallai R. Spermatozoa of Megaloptera and Raphidioptera (Insecta,
Neuropteroidea) //J. Ultrastruct. and Mol. Struct. Res. 1988. Vol. 101. P. 185-191.
Afzelius B.A., Ferraguti M. Fine structure of brachiopod spermatozoa // J. Ultrastruct. Res. 1978a.
Vol. 63. P. 308-315.
Afzelius B.A., Ferraguti M. The spermatozoon of Priapulus caudatus Lamark // J. Submicrosc.
Cytol. 1978b. Vol. 10. P. 71-79.
Alberti G. Spermientypen bei Webspinnen (Araneae, Arachnida) // Verh. Disch. Zool. Ges. Wien.
1985. Bd. 151. S. 252-257.
Alberti G., Storch V. Internal fertilization in a Meiobenthic priapulid worm: Tubiluchus philip-
pinensis (Tubiluchidae, Priapulidae)//Protoplasma. 1988. Vol. 143. P. 193-196.
Alvarino A. Chaetognatha // Reproductive biology of invertebrates. Chichester etc.: Wiley, 1983.
Vol. 2: Spermatogenesis and sperm function / Ed. K.G. Adiyodi, R.G. Adiyodi. P. 531-544.
Amemiya T. Cilia in the retinal pigment epithelium of the adult rat // J. Opthalmol. Res. 1975.
Vol. 7, N 4. P. 292-295.
Amor M.J., Durfort M. Changes in nuclear structure during eupyrene spermatogenesis in Murex
brandaris // Mol. Reprod. Develop. 1990. Vol. 25. P. 348-356.
104
Anderson W., Persone P. The form and function of spermatozoa: A comparative view // The
functional anatomy of the spermatozoon / Ed. B. Afzelius. Oxford: Pergamon press, 1975. P. 3-14.
Asa C, Phillips DM., Stover ./. Ultrastructure of spermatozoa of the crested tinamou //
J. Ultrastruct. and Mol. Struct. Res. 1986. Vol. 94, N 2. P. 170-175.
Atwood D.G. Fine structure of the spermatozoon of the sea cucumber Leptosynapta clarki
(Echinodermata: Holothuroidea) // Cell and Tissae. Res. 1974a. Vol. 149, N 2. P. 223-233.
Atwood D.G. Fine structure of spermatogonia, spermatocytes and spermatids of the sea cucumbers
Cucumaria lubrica and Leptocynapta clarki (Echinodermata: Holothuroidea) // Canad. J. Zool. 1974b.
Vol. 52, N 11. P. 1389-1396.
Atwood D.G., Chia F.S. Fine structure of an unusual spermatozoon of a brooding sea cucumber
Cucumaria lubrica // Ibid. 1974. Vol. 52, N 4. P. 519-523.
Au D.W.T., Reunov A.A., Wu R.S.S. Four lines of spermatid development and dimorphic
spermatozoa in the sea urchin Anthocidaris crassispina (Echinodermata, Echinoidea) // Zoomorphology. 1998.
Vol. 118. P. 159-168.
Au D.W.T., Reunov A.A., Wu R.S.S. Two patterns of flagellum development during
spermiogenesis of Diadema setosum and Salmacis bicolor (Echinodermata: Echinoidea) // Invertebr. Reprod.
Develop. 1999. Vol. 35, N 2. P. 147-150.
Azevedo C, Corral L. Ultrastructural study of spermatozoon and spermiogenesis of Pollicipes
cornucopia (Crustacea; Cirripedia) with special reference to nucleus maturation // J. Submicrosc. Cytol.
1982. Vol. 14, N 4. P. 641-654.
Baccetti B. Lo spermatozoo dei Sipunculidi // Rend. Sci. fis. mat. natur. 1977. Vol. 51. P. 25-33.
Baccetti B. Ultrastructure of sperm and its bearing on arthropod phylogeny // Arthropod phyloge-
ny / Ed. A.P. Gupta. Princeton (N.J.), 1979. P. 609-644.
Baccetti B. Evolution of the spermatozoon // Bol. zool. 1984. Vol. 51, N 1. P. 25-33.
Baccetti B. Evolution of the sperm cell // Biology of fertilization. N.Y.: Acad, press, 1985. Vol. 2.
Biology of the sperm / Ed. C.B. Metz and A. Monroy. P. 3-58.
Baccetti В., Afzelius B.A. The biology of the sperm cell. Basel; N.Y.: Karger, 1976. 181 p.
Baccetti В., Dallai R. The spermatozoon of Arthropoda. XXV. New accessory tubule patterns of
the sperm tail of Diplura // J. Microsc. 1973. Vol. 16. P. 341-344.
Baccetti В., Dallai R., Callaini G. The spermatozoon of Arthropoda: Zootermopsis nevadensis and
Isopteran sperm phylogeny // Intern. J. Invertebr. Reprod. 1981. Vol. 3, N 2. P. 87-99.
Baccetti В., Dallai R., Giusti F. The spermatozoon of Arthropoda. VI. Ephemeroptera //
J. Ultrastruct. Res. 1969. Vol. 29, N 3. P. 343-349.
Baccetti В., Dallai R., Grimaldi D.Z.S., Marinari A. The evolution of the nematode
spermatozoon // Gamete Res. 1983. Vol. 8. P. 309-323.
Baccetti В., Gaino E., Sara M. A sponge with acrosome: Oscarella lobularis // J. Ultrastruct. and
Mol. Struct. Res. 1986. Vol. 94. P. 195-198.
Baccetti В., Pallini V., BurriniA.G. The accessory fibres of the sperm tail. III. High-sulfur and low-
sulfur components in mammals and cephalopods //J. Ultrastruct. Res. 1976. Vol. 57, N 3. P. 289-308.
Barnes H., Klepal W., Munn E.A. Observations on the form and changes in the accessory droplet
and motility of the spermatozoa of some cirripedes // J. Exp. Mar. Biol. Ecol. 1971. Vol. 7. P. 173-196.
Barros C, Dupre E., Viveros L. Sperm-egg interactions in the shrimp Rhynchocinetes typus //
Gamete Res. 1986. Vol. 14. P. 171-180.
Bawa S.R., Werner G. Mitochondrial changes in spermatogenesis of the pseudoscorpion
Diplotemnus sp. // J. Ultrastruct. and Mol. Struct. Res. 1988. Vol. 98, N 3. P. 281-293.
Beams H.W., Sekhon S.S. Cytodifferentiation during spermiogenesis in Rhabditis pellio II
J. Ultrastruct. Res. 1972. Vol. 38. P. 511-527.
Bedford I.M. Sperm capacitation and fertilization in mammals // Biol. Reprod. 1970. Vol. 2, N 2.
P. 128-158.
Benayahu Y., Loya Y. Sexual reproduction of a soft coral: Synchronous and brief annual spawning
of Sarcophyton glaucum (Quoy a. Gaimard, 1833) //Biol. Bull. 1986. Vol. 170, N 1. P. 32^12.
Bentley M.G., Pacey A.A. A scanning electron microscopical study of sperm development and
activation in Arenicola marina L. (Annelida: Polychaeta) // Invertebr. Reprod. Develop. 1989. Vol. 15, N 3.
P. 211-219.
Bentley M.G., Serries K. Sperm ultrastructure in two species of the polychaete genus Harmothoe
(Polynoidae) // Helgoland... wiss. Meeresuntersuch. 1992. Bd. 46. S. 171-184.
Bernardini G., Podini P., Maci R., Camatini M. Spermiogenesis in Xenopus laevis: from late
spermatids to spermatozoa // Mol. Reprod. Develop. 1990. Vol. 26. P. 347-355.
105
Berrill N.J. Chordate: Tunicate // Reproduction of marine invertebrates / Ed. A.C. Giese and
J.S. Pearse. N.Y.: Acad, press, 1975. Vol. 2. P. 241-282.
Berruti G., Ferraguti M., Donin C.L.L. The aflagellate spermatozoon of Ophryotrocha: A line of
evolution of fertilization among polychaetes // Gamete Res. 1978. Vol. 1. P. 287-292.
Bertout M. Spermatogenese de Nereis diversicolor O.F. Muller (Annelide Polychete). 1.
Evolution du cytoplasme et elaboration de l'acrosome // J. Microsc. Biol. Cell. 1976. Vol. 25, N 1.
P. 87-94.
Bickell L.R., Chia F.S., Crawford B.J. A fine structural study of the testicular wall and
spermatogenesis in the crinoid Florometra serratissima (Echinodermata) // J. Morphol. 1980. Vol. 166.
P. 109-126.
Billard R. La spermatogenese de Poecilia reticulata. IV. La spermiogenese: etude ultrastruc-
turale // Ann. Biol. Anim. Biochim. Biophys. 1970. Vol. 10. P. 493-510.
Billard R. Spermiogenesis in the rainbow trout (Salmo gairdneri): An ultrastructural study // Cell
and Tissue Res. 1983. Vol. 233, N 2. P. 265-284.
Billard R. Spermatogenesis and spermatology of some teleost fish species // Reprod. Nutrit.
Develop. 1986. Vol. 26. P. 877-920.
Bird S.D. Mesothelial primary cilia of peritoneal and other serosal surfaces // Cell Biol. Intern.
2004. Vol. 28, N 2. P. 151-159.
Blades-Eckelbarger P.I., Youngbluth M.J. The ultrastructure of spermatogenesis in Labidocera
aestiva (Copepoda: Calanoida) //J. Morphol. 1982. Vol. 174, N 1. P. 1-15.
Boi S., Fascio U., Ferraguti M. Nuclear fragmentation characterises paraspermiogenesis in Tubifex
tubifex (Annelida, Oligochaeta) // Mol. Reprod. Develop. 2001. Vol. 59. P. 442^150.
Boisson C, Mattel C, Mattel X. Troisieme note sur la spermiogenese de Protopterus annectens
(dipneuste) du Senegal // Bull. Inst. Fondam. Afr. Noire Ser. A., Sci. Natur. 1967. Vol. 29.
P. 1097-1107.
Boury-Esnault N., Jamieson B.G.M. Porifera // Reproductive biology of invertebrates. N.Y.:
Wiley, 1999. P. 1-20. Vol. 9, pt A: Progress in male gamete ultrastructure and phylogeny / Ed.
Adiyodi R.G. Adiyodi.
Breed W.G., Leigh СМ., Bennett J.H. Sperm morphology and storage in the female reproductive
tract of the fat-tailed dunnart Sminthopsis crassicaudata (Marsupialia: Dasyuridae) // Gamete Res.
1989. Vol. 23. P. 61-75.
Bronson R.A., Cooper G.W., Phillips D.M. Effects of anti-sperm antibodies of human sperm ultra-
structure and function // Human Reprod. 1989. Vol. 4, N 6. P. 653-657.
Brown R. Spermatophore transfer and subsequent sperm development in a Homalorhagid
kinorhynch//Zool. scr. 1983. Vol. 12. P. 257-266.
Brueckner M. Cilia propel the embryo in the right direction // Amer. J. Med. Genet. 2001. Vol. 101.
P. 339-344.
Buckland-Nlcks J. Prosobranch parasperm: Sterile germ cells that promote paternity? // Micron.
1998. Vol. 29. P. 267-280.
Buckland-Nicks J., Chia F.S. Formation of the acrosome and basal body during spermiogenesis in
a marine snail Nerita picea (Mollusca: Archaeogastropoda) // Gamete Res. 1986. Vol. 15, N 1.
P. 13-23.
Buckland-Nicks J., Scheltema, A. Was internal fertilization an innovation of early Bilate-
ria? Evidence from sperm structure of a mollusc // Proc. Roy. Soc. London. B. 1995. Vol. 261.
P. 11-18.
Buckland-Nicks J., Walker C.W., Chia F.S. Ultrastructure of the male reproductive system and of
spermatogeneis in the viviparous brittle-star Amphipholis squamata II J. Morphol. 1984. Vol. 179.
P. 243-262.
Burghardt R.C., Foor W.E. Rapid morphological transformations of spermatozoa in the uterus of
Brugia pahangi (Nematoda: Filaroidea) //J. Parasitol. 1975. Vol. 61. P. 343-350.
Burnet A.L., Davis L.E., Ruffing F.E. A histological and ultrastructural study of germinal
differentiation of interstitial cells arising from gland cells in Hydra viridis II J. Morphol. 1966. Vol. 120. P. 1-8.
Cardini A., Ferraguti M., Gelder R.S. A phylogenetic assessment of the branchiobdellidan family
Branchiobdellidae (Annelida, Clitellata) using spermatological and somatic characters // Zool. scr.
2000. Vol. 29, N 4. P. 347-366.
Carre D. Existence d'un complexe acrosomal chez les spermatozoids du cnidaire Muggiacea
kochli (Siphonophore, Calycophore): Differenciation et reaction acrosomale // Invertebr. Reprod.
Develop. 1984. Vol. 7. P. 95-103.
106
Casellato S., Martinucci G., Zoja E. Ultrastructural features of gametogenesis during the life cycle
in Branchiura sowerbyi Beddard (Oligochaeta, Tubificidae) // Hydrobiologia. 1987. Vol. 155.
P. 145-154.
Castilho F., Barandela T. Ultrastructural study on the spermiogenesis and spermatozoon of the
Metacercariae of Microphallus primas (Digenea), a parasite of Carcinus maenas II Mol. Reprod.
Develop. 1990, Vol. 25. P. 140-146.
Cavey M.J., Markel K. Echinoidea // Microscopic anatomy of invertebrates. Wiley-Liss, N.Y.,
1994. Vol. 14. Echinodermata. P. 345^100.
Chemes H.E., Rawe V.Y. Sperm pathology: A step beyond descriptive morphology: Origin,
characterization and fertility potential of abnormal sperm phenotypes in infertile men // Human Reprod.
Update. 2003. Vol. 9, N 5. P. 405^128.
Cherr G.N., Clark W.H. An acrosome reaction in sperm from the white sturgeon Acipenser trans-
montanus //J. Exp. Zool. 1984. Vol. 232, N 1. P. 129-139.
Chia F.S. Sea anemone reproduction: Patterns and adaptive radiation // Coelenterata Ecol. and
Behav. 1976. Vol. 14. P. 261-270.
Chuang S.H. Brachiopoda // Reproductive biology of invertebrates. Chichester: Wiley, 1983.
Vol. 2: Spermatogenesis and sperm function /Ed. K.G. Adiyodi and R.G. Adiyodi. 1983. P. 517-530.
Cifrian В., Martinez-Alos S., Garcia-Corrales P. Ultrastructural study of spermatogenesis and
mature spermatozoon of Bothromesostoma personatum (Rhabdocoela, Typhloplanoida) // Progr. Zool.
Vol. 36. 1988. P. 310-314.
Clark W.H., Moretti R.L., Thompson W.W. Electron microscopic evidence for the presence of an
acrosomal reaction in Ascaris lumbricoides // Exp. Cell. Res. 1967. Vol. 47. P. 643-647.
Cloney R.A., Abbott L.C. The spermatozoa of ascidians: acrosome and nuclear envelope // Cell, and
Tissue Res. 1980. Vol. 206. P. 261-270.
Colwin A.L., Colwin L.H., Philpott D.E. Electron microscope studies of early stages of sperm
penetration in Hydroides hexagonus (Annelida) and Saccoglossus kowalevskii (Enteropneusta) //
J. Biophys. and Biochem. Cytol. 1957. Vol. 3, N 3. P. 489-502.
Colwin L.H., Colwin A.L., Summers R.G. The acrosomal region and the beginning of fertilization
in the holothurian Thyone briareus // The functional anatomy of the spermatozoon. Oxford: Pergamon
press, 1975. P. 27-38.
Coomans A. Aspects of the phylogeny of nematodes // Atti Accad. naz. Lincei. 1981. Vol. 49.
P. 161-174.
Corbelli A., Avian M., Marotta R., Ferraguti M. The spermatozoon of Carybdea marsupialis
(Cubozoa, Cnidaria) // Invertebr. Reprod. Develop. 2003. Vol. 43, N 2. P. 95-104.
Cotelli F., Donin C.L.L. Ultratructure of the spermatozoon of Squilla mantis // Acta zool. 1983.
Vol. 64, N 2/3. P. 131-137.
Cotelli F., Ferraguti M., Lanzavecchia G., Donin C.L.L. The spermatozoon of Peracarida. I. The
spermatozoon of terrestrial isopods // J. Ultrastruct. Res. 1976. Vol. 55. P. 378-390.
Cotelli F., Santis R., Rosati F., Monroy A. Acrosome differentiation in the spermatogenesis of
Ciona intestinalis // Develop. Growth and Differ. 1980. Vol. 22, N 3. P. 561-569.
Curtis S.K., Benner D.B., Musil G. Ultrastructure of the spermatozoon of Megaselia scalaris Loew
(Diptera: Brachycera: Cyclorrhapha: Phoridea; Phoridae) //J. Morphol. 1989. Vol. 200. P. 47-61.
Daddow L.Y.M., Jamieson B.G.M. An ultrastructural study of spermiogenesis in Neochasmus sp.
(Cryptogonimidae: Digenea: Trematoda) // Austral. J. Zool. 1983. Vol. 31, N 1. P. 1-14.
Dallai R., Afzelius B.A. Membrane specializations in the paired spermatozoa of dytiscid water
beetles // Tissue. Cell. 1985. Vol. 17, N 4. P. 561-572.
Dallai R., Baccetti В., Mazzini M., Sabatinelli G. The spermatozoon of three species of
Phlebotomus (Phlebotominae) and the acrosomal evolution in nematoceran dipterans // Intern. J. Insect
Morphol. Embriol. 1984. Vol. 13, N 1. P. 1-10.
Dallai R., Mazzini M. The spermatozoon of the gall-midge Oligotrophidi (Diptera, Cecidomyiidae)
// Boll. zool. 1989. Vol. 56. P. 13-27.
Daly J.M. Some relationships between the process of pair formation and gamete maturation in
Harmothoe imbricata (L.) (Annelida: Polychaeta) // Mar. Behav. Physiol. 1973. Vol. 1. P. 277-284.
Davis L.E. Ultrastructural changes during dedifferentiation and redifferentiation in the
regenerating isolated gastrodermis // Biology of hydra. N.Y.: Acad, press, 1973. P. 171-219.
Dewel W.C., Clark W.H. An ultrastructural investigation of spermatogenesis and the mature
sperm in the anthozoan Bunodosoma cavvernata (Cnidaria) // J. Ultrastruct. Res. 1972. Vol. 40.
P. 417^31.
107
Diaz J.P., Connes R. Etude ultrastructurale de la spermatogenese d'une demosponge // Biol. Cell.
1980. Vol. 38. P. 225-230.
Donin C.L.L., Cotelli F. The rod-shaped sperm of Gordioidea (Aschelminthes, Nematomorpha) //
J. Ultrastruct. Res. 1977. Vol. 61. P. 193-200.
Dorange G., he Pennec M. Ultrastructural characteristics of spermatogenesis in Pecten maximus
(Mollusca, Bivalvia) // Invertabr. Reprod. Develop. 1989. Vol. 15, N 2. P. 109-117.
Dougherty W.J., Dougherty M.M. Electron microscopical and histochemical observations on
melanized sperm and spermatophores of pond-cultured shrimp Penaeus vannamei // J. Invertebr. Pathol.
1989. Vol. 54. P. 331-343.
Eckelbarger K.J. Ultrastructure of spermatogenesis in the reef-building polychaete
Phragmatopoma lapidosa (Sabellariidae) with special reference to acrosome morphogenesis // J.
Ultrastruct. Res. 1984. Vol. 89, N 2. P. 146-164.
Eckelbarger KJ., Bieler R., Mikkelsen P.M. Ultrastructure of sperm development and mature
sperm morphology in three species of commensal bivalves (Mollusca: Galeommatoidea) // J. Morphol.
1990. Vol. 205. P. 63-75.
Eckelbarger K.J., Grassle J.P. Spermatogenesis, sperm storage and comparative sperm
morphology in nine species Capitalla, Capitomastus and Capitellides (Polychaeta, Capitellidae) // Mar. Biol.
1987. Vol. 95. P. 415^129.
Eckelbarger К J., Young СМ., Cameron J. L. Ultrastructure and development of dimorphic sperm
in the abyssal echinoid Phrissocystis multispina (Echinodermata: Echinoidea): Implications for deep sea
reproductive biology //Biol. Bull. 1989. Vol. 176. P. 257-271.
Eley L., Turnpenny L., Yates L.M. et al. A perspective on inversin // Cell Biol. Intern. 2004.
Vol. 28, N2. P. 119-124.
Escalier D. Genetic approach to male meiotic division deficiency: The human macronuclear
spermatozoa // Mol. Human Reprod. 2002. Vol. 8, N 1. P. 1-7.
Favard P. Evolution des ultrastructures cellulaires aucours de la spermatogenese de l'Ascaris //
Ann. Sci. natur. (zool.). 1961. Vol. 12. P. 53-152.
Fawcett D.W. A comparative view of sperm ultrastructure // Biol. Reprod. 1970. Vol. 2, N 1.
P. 90-127.
Fawcett D.W. The mammalian spermatozoa // Develop. Biol. 1975. Vol. 44. P. 394-436.
Fawcett D.W., Ito S. The fine structure of bat spermatozoa // Amer. J. Anat. 1965. Vol. 116, N 3.
P. 567-610.
Ferraguti M. Annelida-Clitellata // Reproductive biology of invertebrates. Chichester: Wiley, 1983.
Vol. 2: Spermatogenesis and sperm function. P. 343-376.
Ferraguti M. Slanted centriole and transient anchoring apparatus during spermiogenesis of an
oligochaete (Annelida) //Biol. Cell. 1984. Vol. 52, N 2. P. 175-180.
Ferraguti M., Balsamo M. Comparative spermatology of Gastrotricha: Advances in spermatozoal
phylogeny and taxonomy // Mem. Mus. Nat. Hist. Natur. 1995. Vol. 166. P. 105-117.
Ferraguti M., Erseus C. Sperm types and their use for a phylogenetic analysis of aquatic clitellates
// Hydrobiologia. 1999. Vol. 402. P. 225-237.
Ferraguti M., Fascio U., Boi S. Mass production of basal bodies in paraspermiogenesis of
Tubificinae (Annelida, Oligochaeta) //Biol. Cell. 2002. Vol. 94. P. 109-115.
Ferraguti M., Jamieson B.G.M. Spermiogenesis and spermatozoal ultrastructure in Hormogaster
(Hormogastridae, Oligochaeta, Annelida) // J. Submicrosc. Cytol. 1984. Vol. 16. P. 307-316.
Ferraguti M., Melone G. Spermiogenesis in Seison nebaliae (Rotifera, Seisonidea): Further
evidence of a rotifer-acanthocephalan relationship // Tissue and Cell. 1999. Vol. 31, N 4. P. 428^140.
Fishelson L., Gibson R.N., Delarea Y. Unusual cell organelles during spermiogenesis in two
species of gobies (Gobiidae, Teleostei) // Cell and Tissue Res. 1990. Vol. 262. P. 397^100.
Flood P.R., AfzeliusB.A. The spermatozoon of Oikopleura dioica Fol (Larvacea, Tunicata) // Ibid.
1978. Vol. 191. P. 27-37.
Foor W.E. Spermatozoon morphology and zygote formation in nematodes // Biol. Reprod. 1970.
Vol. 2. P. 177-202.
Foor W.E. Nematoda // Reproductive biology of invertebrates. Chichester: Wiley, 1983. Vol. 2:
Spermatogenesis and sperm function. P. 221-256.
Franc J.M. Etude ultrastructurale de la spermatogenese de Ctenaire Beroe ovata // J. Ultrastruct.
Res. 1973. Vol. 42. P. 255-267.
Franklin L.E. Fertilization and the role of the acrosomal region in non-mammals // Biol. Reprod.
1970. Vol. 2, N 2. P. 159-176.
108
Franzen A. Comparative morphological investigations into the spermatogenesis among Mollusca
//Zool. bidr. Uppsala. 1955. Vol. 30. P. 399-456.
Franzen A. On spermatogenesis, morphology of the spermatozoon and biology of fertilization
among invertebrates // Ibid. 1956. Vol. 31. P. 355^482.
Franzen A. Phylogenetic aspects of the morphology of spermatozoa and spermiogenesis //
Comparative spermatology. N.Y.: Acad press, 1970. P. 29-46.
Franzen A. The spermatozoon of Siboglinum (Pogonophora) // Acta Zool. 1973. Vol. 54.
P. 179-192.
Franzen A. Ultrastructure of the biflagellate spermatozoon of Tomopteris helgolandica Greef,
1879 (Annelida, Polychaeta) // Gamete Res. 1982. Vol. 6. P. 29-37.
Franzen A. Ultrastructural studies of spermatozoon in three bivalve species with notes on
evolution of elongated sperm nucleus in primitive spermatozoa // Ibid. 1983. Vol. 7, N 3. P. 199-214.
Franzen A. Ultrastructure of spermatids and spermatozoa in the cyclostomatous bryozoan
Tubulipora (Bryozoa, Cyclostomata) // Zoomorphology. 1984. Vol. 104. P. 140-146.
Franzen Д., Afzelius B.A. The ciliated epidermis of Xenotorbella bocki (Platyhelminthes,
Xenoturbellida) with some phylogenetic considerations // Zool. scr. 1987. Vol. 16, N 1. P. 9-17.
Franzen A., Ahlfors K. Ultrastructure of spermatids and spermatozoa in Phoronis, phylum
Phoronida // J.Submicrosc. Cytol. 1980. Vol. 12. P. 585-597.
Franzen A., Rice S.A. Spermatogenesis, male gametes and gamete interactions: The ultrastructure
of Polychaeta // Microfauna marina / Ed. W. Westheide, CO. Hermans. Stuttgart; N.Y.: Fischer, 1988.
Vol. 4. P. 309-333.
Franzen A., Sensenbaugh T. Spermiogenesis and ultrastructure of spermatozoa in Saxipendium
coronatum (Hemichordata, Enteropneusta) with consideration on their relation to reproduction and
dispersal // Zoomorphology. 1995. Vol. 105. P. 303-307.
Franzen A., Sensenbaugh T. The spermatozoon of Gononemertes parasita (Nemertea,
Hoplonemertea) with a note of sperm evolution in the nemerteans // Invertebr. Reprod. Develop. 1988.
Vol. 14. P. 25-36.
Fregni E., Balsamo M., Ferraguti M. Morphology of the reproductive system and spermatozoa of
Mesodasys adenotubulatus (Gastrotricha: Macrodasyida) // Mar. Biol. 1999. Vol. 135. P. 515-520.
Frick J.E., Ruppert E.E. Primordial germ cells and oocytes of Branchiostoma virginiae
(Cephalochordata, Acrania) are flagellated epithelial cells: Relationship between epithelial and primary
egg polarity //'Zygote. 1997. Vol. 5. P. 139-151.
Friedlander M. Control of the eupyrene-apyrene sperm dimorphism in Lepidoptera // J. Insect
Physiol. 1997. Vol. 43. P. 1085-1092.
Friedlander M., Morse J.C. The aberrant spermatozoa of Hydropsychidae Caddisflies
(Trichoptera): An electron microscope analysis on spermiogenesis // J. Ultrastruct. Res. 1982. Vol. 78,
N 1. P. 84-94.
Friedlander M., Wahrman J. The number of centrioles in insect sperm: A study in two kinds of
differentiating silkworm spermatids // J. Morphol. 1971. Vol. 134. P. 384-398.
Fuchs J.L., Schwark H.D. Neuronal primary cilia: A review // Cell Biol. Intern. 2004. Vol. 28, N 2.
P. 111-118.
Gaino E., Burlando В., Buffa P., Sara M. Ultrastructural study of spermatogenesis in Oscarella
lobularis (Porifera, Demospongiae)//Intern. J. Invertebr. Reprod. Develop. 1986. Vol. 10. P. 297-305.
Gaino E., Burlando В., Zunino L. et al. Origin of male gametes from choanocytes in Spongia
officinalis (Porifera, Demospongiae) // Ibid. 1984. Vol. 7, N 1. P. 83-93.
Garavaglia C, Donin L.L., Lanzavecchia G. Ultrastructural morphology of spermatozoa of
Hirudinea // J. Submicrosc. Cytol. 1974. Vol. 6. P. 229-244.
Gardiner S.L., Rieger R. Rudimentary cilia in muscle cells of annelids and echinoderms // Cell and
Tissue Res. 1980. Vol. 213. P. 247-252.
Gerner L. Nemertinen der Gattungen Cephalothrix und Ototyphlonemertes aus dem marinen
Mesopsammal // Helgoland, wiss. Meeresuntersuch. 1969. Bd. 19. S. 68-110.
Gonzalez S., Von Bassewitz D.B., Grundmann E. et al. Rudimentary cilia in hyperplastic,
metaplastic and neoplastic cells of the lung and pleura // Pathol. Res. Pract. 1985. Vol. 180.
P. 511-515.
Grell K.G., Benwitz G. Erganzende Untersuchungen zur Ultrastruktur von Trichoplax adhaerens
F.E. Schulze (Placozoa) // Zoomorphology. 1981. Vol. 98. P. 47-67.
Gremigni V. Platyhelminthes - Turbellaria // Reproductive biology of invertebrates. Chichester:
Wiley, 1983. Vol. 1: Ovogenesis, oviposition and oosorption. P. 67-102.
109
Grier H.J. Cellular organization of the testis and spermatogenesis in fishes // Amer. Zool. 1981.
Vol. 21. P. 345-357.
Grygier M.J. Sperm morphology in Ascothoracida (Crustacea: Maxillopoda): Confirmation of
generalized nature and phylogenetic importance // Intern. J. Invertabr. Reprod. 1982. Vol. 4.
P. 323-332.
Guidi L., Ferraguti M., Pierboni L., Balsamo M. Spermiogenesis and spermatozoa in
Acanthodasys aculeatus (Gastrotricha, Macrodasyida): An ultrastructural study // Acta zool. 2003.
Vol. 84. P. 77-85.
Haley S.R. Ultrastructure of spermatogenesis in the Hawaiian red lobster Enoplometopus occiden-
talis (Randall) //J. Morphol. 1986. Vol. 190, N 1. P. 81-92.
Healy J.M. Ultrastructure of paraspermatozoa, euspermatozoa and eusperm-like spermatozoa of
Obtortio ef fulva (Prosobranchia: Cerithiacea) // Helgoland, wiss. Meeresuntersuch. 1982. Bd. 35, N 4.
P. 489-500.
Healy J.M. Ultrastructure of euspermiogenesis in the mesogastropod Stenothyra sp.
(Prosobranchia, Rissoacea, Stenothyridae) //Zool. scr. 1983. Vol. 12, N 3. P. 203-214.
Healy J.M. Euspermatozoa and paraspermatozoa of the relict cerithiacean gastropod Campanile
symbollcum (Prosobranchia, Mesogastropoda) // Helgoland, wiss. Meeresuntersuch. 1986. Bd. 40,
N 1/2. P. 201-218.
Healy J.M. Ultrastructure of spermiogenesis in the Gastropod Calliotropis glyptus Watson
(Prosobranchia: Trochidae) with special reference to the embedded acrosome // Gamete Res. 1989.
Vol. 24. P. 9-19.
Healy J.M. Ultrastructure of spermatozoa and spermiogenesis in Spirula spirula (L.): systematic
importance and comparison with other cephalopods // Helgoland, wiss. Meeresuntersuch. 1990. Bd. 44.
S. 109-123.
Healy J.M., Jamieson B.J.M. An ultrastructural examination of development and mature
paraspermatozoa in Pyrazus ebenius (Mollusca, Gastropoda, Potamididae) // Zoomorphology. 1991. Vol. 98.
P. 101-109.
Hendelberg J. Paired flagella and nucleus migration in the spermiogenesis of Dicrocoelium and
Fasciola (Digenea, Trematoda) //Zool. bidr. Uppsala. 1963. Vol. 35. P. 569-589.
Hendelberg J. Platyhelminfhes-Turbellaria // Reproductive biology of invertebrates. Chichester:
Wiley, 1983. Vol. 2: Spermatogenesis and sperm function. P. 75-104.
Herrmann K. Lophophorates, Entoprocta and Cycliophora. Phoronida // Microscopic anatomy of
invertebrates. N.Y.: Wiley, 1997. Vol. 13. P. 207-235.
Higgins R.P. Kinorhyncha // Reproduction of Marine Invertebrates. N.Y.: Acad, press, 1974.
Vol. LP. 507-518.
Hinsch G.W. Comparative ultrastructure of cnidarian sperm // Amer. Zool. 1974. Vol. 14.
P. 457^165.
Hinsch G.W., Clark W.H. Comparative fine structure of Cnidaria spermatozoa // Biol. Reprod.
1973. Vol. 8. P. 62-73.
Hodgson A.N. Paraspermatogenesis in gastropod molluscs // Invertebr. Reprod. Develop. 1997.
Vol. 31. P. 31-38.
Hodgson A.N., Baxter J.M., Sturrock M.G., Bernard R.T.F. Comparative spermatology of 11
species of Polyplacophora (Mollusca) from the suborders Lepidopleurina, Chitonina and
Acanthochitonina // Proc. Roy. Soc. London B. 1988. Vol. 235. P. 161-177.
Hodgson A.N., Bernard R.T.F. Observation on the ultrastructure of the spermatozoon of two
mytilids from the south-west coast of England // J. Mar. Biol. Assoc. UK. 1986. Vol. 66. P. 385-
390.
Hodgson A.N., Bernard R.T.F. A comparison of the structure of the spermatozoa and
spermatogenesis of 16 species of patellid limpet (Mollusca: Gastropoda: Archaeogastropoda) //J. Morphol. 1988.
Vol. 195, N2. P. 205-223.
Hodgson A.N., Bernard R.T.F., Van der Horst G. Comparative spermatology of three species of
Donax (Bivalvia) from South Africa // J. Moll. Stud. 1990. Vol. 56. P. 257-265.
Hodgson A.N., Foster G.G. Structure of the sperm of some South African archaeogastropods
(Mollusca) from the superfamilies Haliotoidea, Fissurelloidea and Trochoidea // Mar. Biol. 1992.
Vol. 113. P. 89-97.
Hodgson A.N., Heller J., Bernard R.T.F. Ultrastructure of the sperm and spermatogenesis in five
south african species of the trochid genus Oxystele (Mollusca, Prosobranchia) // Mol. Reprod. Develop.
1990. Vol. 25. P. 263-271.
110
Hodgson A.N., Jamieson B.G.M. Spermatogenesis in the earthworm Microchaetus pentheri
(Oligochaeta, Microchaetidae) // Zoomorphology. 1992. Vol. 112. P. 57-66.
Hodgson A.N., Reunov A.A. Ultrastructure of the spermatozoon and spermatogenesis of the bra-
chiopods Discinisca tenuis (Inarticulata) and Kraussina rubra (Articulata) // Invertebr. Reprod.
Develop. 1994. Vol. 25, N 1. P. 23-31.
Holland L.Z. Fine structure of spermatids and sperm of Dollioletta gegenbauri and Doliolum
nationalis (Tunicata: Thaliacea): Implications for tunicate phylogeny // Mar. Biol. 1989. Vol. 101.
P. 83-95.
Holland N.D., Holland L.Z. The fine structure of the testis of a lancelet (=amphioxus),
Branchiostoma floridae (phylum Chordata: subphylum Cephalochordata = Acraniata) // Acta zool.
1989. Vol. 70. P. 211-219.
Hsieh H.L., Simon J.L. The sperm transfer system in Kinbergonuphis simoni (Polychaeta:
Onuphidae) // Biol. Bull. 1990. Vol. 178. P. 85-93.
Hylander B.L., Summers R.G. An ultrastructural investigation of the spermatozoa of two ophi-
uroids Ophiocoma echinata and Ophiocoma wendti: Acrosomal morphology and reaction // Cell and
Tissue. Res. 1975. Vol. 158. P. 151-168.
Ishida S., Teshirogi W. Comparison of spermatozoa among freshwatter planarian species // Progr.
in Zool. 1988. Vol. 36. P. 297-302.
Jaana H. The fine structural study of spermiogenesis in the freshwater oligochaete Tubifex hattai
with a note on the histone transition in the spermatid nucleus // J. Fac. Sci., Hokkaido Univ. Ser. VI.
1983. Vol. 23. P. 163-178.
Jaana H., Yamamoto T.S. The ultrastructure of spermatozoa with a note on the formation of the
acrosomal filament in the lamprey Lampetra japonica // Jap. J. Ichthyol. 1981. Vol. 28, N 2. P. 135-147.
Jamieson B.G.M. On the phylogeny and higher classification of the Oligochaeta // Cladistics. 1988.
Vol. 4. P. 367^110.
Jamieson B.G.M. Fish evolution and systematics: Evidence from spermatozoa. Cambridge:
Cambridge Univ. press, 1991a. 319 p.
Jamieson B.G.M. Ultrastructure and phylogeny of crustacean spermatozoa // Mem. Queensland
Mus. 1991b. Vol. 31. P. 109-142.
Jamieson B.G.M., Oliver S.C., Scheltinga D.M. The ultrastructure of the spermatozoa of Squamata.
I. Scincidae, Gekkonidae and Pygopodidae (Reptilia) // Acta zool. 1996. Vol. 1. P. 85-100.
Jamieson B.G.M., Rouse G.W. The spermatozoa of the polychaeta (Annelida): An ultrastructural
review // Biol. Rev. 1989. Vol. 64. P. 93-157.
Jazdowska-Zagrodzinska В., Dallai R. Spermiogenesis in the gall-midge Monarthropalpus buxi
(Cecidomyiidae, Diptera)// J. Ultrastruct. and Mol. Struct. Res. 1988. Vol. 100. P. 156-165.
Jensen C.G., Poole C.A., McGlashan S.R. et al. Ultrastructural, tomographic and confocal imaging
of the chondrocyte primary cilium in situ // Cell Biol. Intern. 2004. Vol. 28. P. 101-110.
Jespersen A. Fine structure of the spermatozoon of the australian lungfish Neoceratodus forsteri //
J. Ultrastruct. Res. 1971. Vol. 37. P. 178-185.
Jespersen A. Spermiogenesis, sperm structure and fertilization in the palaeonemertean
Cephalothrix rufifrons (Nemertini, Anopla) // Zoomorphology. 1994. Vol. 114. P. 119-124.
Jespersen A., Kosuge Т., Liitzen J. Sperm dimorphism and spermatozeugmata in the commensal
bivalve Pseudopythina macrophthalmensis (Galeommatoidea, Kelliidae) // Ibid. 2001. Vol. 120.
P. 177-189.
Jespersen A., Liitzen J., Morton B. Ultrastructure of dimorphic sperm and seminal receptacle in the
hermaphrodites Barrimysia siphonosomae and Pseudopythina ochetostomae (Bivalvia,
Galeommatoidea) // Ibid. 2002. Vol. 121. P. 159-172.
Jessen H., Behnke O., Wingstrand K.G., Rostgaard J. Actin-like filaments in the acrosomal
apparatus of spermatozoa of a sea urchin // Exp. Cell Res. 1973. Vol. 80, N 1. P. 47-54.
Johnson L. Efficiency of spermatogenesis // Microsc. Res. Technol. 1995. Vol. 32. P. 385-422.
J0rgensen C, Liitsen J. Ultrastructure of the nongerrninal cells in the testes of ascidians
(Urochordata) and their role in the phagocytosis of sperm // Zoomorphology. 1997. Vol. 117.
P. 103-113.
Juberthie C, Lopez A., Kovoor J. Spermiogenesis and spermatophore in Telema tenella
Simon (Araneae: Telemidae): An ultrastructural study // Intern. J. Invertabr. Reprod. 1981. Vol. 3.
P. 181-191.
Justine J.L. Ultrastructure of spermatozoon of the cestode Duthiersia fimbriata Diesing, 1854
(Pseudophyllidea, Diphyllobothriidae) // Canad. J. Zool. 1986. Vol. 64. P. 1545-1548.
Ill
Justine J.L. Ultrastructure des monogenes: Listes des especes et des organes etudies // Bull. Fr.
pechepiscic. 1993. Vol. 328. P. 156-188.
Justine J.L., Lambert A., Mattei X. Spermatozoon ultrastructure and phylogenetic relationships in
the monogeneans (Platyhelminthes) // Intern. J. Parasitol. 1985. Vol. 15, N 6. P. 601-608.
Justine J.L., Mattei X. Comparative ultrastructural study of spermiogenesis in Monogeneans
(Flatworms). 2. Heterocotyle (Monopisthocotylea, Monocotylidae) //J. Ultrastruct. Res. 1983. Vol. 84.
P. 213-223.
Kasyanov V.L., Kryuchkova G.A., Kulikova V.A., Medvedeva L.A. Larvae of marine bivalves and
echinoderms / Ed. by D.L. Pawson, New Delhi: Amerind, 1998. 288 p.
Kato K.H., Ishikawa M. Flagellum formation and centriolar behavior during spermatogenesis of
the sea urchin Hemicentrotus pulcherrimus 11 Acta embriol. morphol. exp. 1982. Vol. 3, N 1. P. 49-66.
Klepal W. Spermatogenesis and spermatozoa of Aspidosiphon muelleri (Sipuncula): An
ultrastructural study //J. Submicrosc. Cytol. Pathol. 1993. Vol. 25, N 2. P. 203-212.
Koch R.A., Lambert C.C. Ultrastructure of sperm, spermiogenesis and sperm-egg interactions in
selected invertebrates and lower vertebrates which use external fertilization // J. Electron. Microsc.
Technol. 1990. Vol. 16. P. 115-154.
Koehler L.D. A unique case of cytodifferentiation: Spermiogenesis of the prawn Palaemonetes
paludosus //J. Ultrastruct. Res. 1979. Vol. 69. P. 109-120.
Krioutchkova M.M., Onishchenko G.E. Structural and functional characteristics of the centrosome
in gametogenesis and early embryogenesis of animals // Intern. Rev. Cytol. 1999. Vol. 185. P. 107-156.
Kristensen R.M. On the fine structure of Batillipes noerrevangi Kristensen, 1978
(Heterotardigrada). 3. Spermatogenesis // Pr. zool. 1979. Vol. 25. P. 97-105.
Kubo M. The formation of a temporary acrosome in the spermatozoon of Laternula limicola
(Bivalvia, Mollusca) //J. Ultrastruct. Res. 1977. Vol. 61, N 1. P. 140-148.
Kubo M., Ishikawa M., Numakunai T. Differentiation of apical structures during spermiogenesis
and fine structures of the spermatozoon in the Ascidian Halocynthia roretzi II Acta embriol. exp. 1978.
Vol. 3. P. 283-295.
Kubo M., Nakashima S., Tsukahara J., Ishikawa M. Spermiogenesis in barnacles with special
reference to organization of the accessory body // Develop. Growth and Differ. 1979. Vol. 21, N 5.
p. 445^456.
Kubo M., Sawada N. Electron microscope study on sperm differentiation in Perinereis brevicirris
(Polychaeta) // Cell Struct, and Funct. 1977. Vol. 2. P. 135-144.
Lai-Fook I. Structural comparison between eupyrene and apyrene spermiogenesis in Calpodes
ethlius (Hesperiidae, Lepidoptera) // Canad. J. Zool. 1982. Vol. 60. P. 1216-1230.
La Fountain J.R. Analysis of bifefringence and ultrastructure of spindles in primary
spermatocytes of Nephrotoma suturalis during anaphase // J. Ultrastruct. Res. 1976. Vol. 54, N 3.
P. 333-346.
Lahnsteiner F., Patzner R.A. Spermiogenesis and structure of mature spermatozoa in blenniid
fishes (Pisces, Blenniidae) // J. Submicrosc. Cytol. Pathol. 1990. Vol. 22, N 4. P. 565-576.
Lambert C.C. The ascidian sperm reaction // Amer. Zool. 1982. Vol. 22, N 4. P. 841-849.
Lanzavecchia G., Donin L.L. Morphogenic effects of microtubules. II. Spermiogenesis in
Lumbricus terrestris // J. Submicrosc. Cytol. 1972. Vol. 4. P. 247-260.
Larkman A.U. An ultrastructural study of the establishment of the testicular cysts during
spermatogenesis in the sea anemone Actinia fragacea (Cnidaria: Anfhozoa) // Gamete Res. 1984. Vol. 9,
N 3. P. 303-327.
Larkman A.U., Carter M.A. The spermatozoon of Actinia equina L. var. mesembryanthemum // J.
Mar. Biol. Assoc. U. K. 1980. Vol. 60. P. 193-204.
Lee D.L. The structure and development of the spermatozoon of Heterakis gallinarum
(Nematoda)//J. Zool. 1971. Vol. 164. P. 181-187.
Legendre R., Lopez A. Presence de'un spermatophore dans le genre Apneumonella (Araneae,
Telemidae): Valeur systematique et problemes de biologie sexuelle // Bull. Soc. zool. France. 1978.
Vol. 103. P. 35^12.
Longo F.J., Anderson E. Sperm differentiation in the sea urchins Arbacia punctulata and
Strongylocentrotus purpuratus // J. Ultrastruct. Res. 1969. Vol. 27. P. 486-509.
Longo F.J., Anderson E. An ultrastructural analysis of fertilization in the surf clam Spisula solidis-
sima H Ibid. 1970. Vol. 33, N 5. P. 495-514.
Longo F.J., Dornfeld E.J. The fine structure of spermatid differentiation in the mussel Mytilus
edulis II Ibid. 1967. Vol. 20, N 5/6. P. 462^180.
112
Lopes R.A., Lopes O.V.P., Paula C.V. et al. On the reproduction of brazilian fishes. IX.
Spermatogenesis of the surubim Pseudoplaty stoma coiruscans Agassiz 1829 (Pisces, Pimelodidae) //
Ars vet. 1987. Vol. 3, N 1. P. 17-22.
Lopez A. Sur un nouveau mode de reproduction chez les araignees: Existence de spermatophores
chez Telema tenella Simon, 1882 (Telemidae) //Bull. Soc. zool. France. 1977. Vol. 102. P. 261-266.
Lou Y.H., Takahashi H. Spermiogenesis in the nile tilapia Oreochromis niloticus with notes on a
unique pattern of nuclear chromatin condensation // J. Morphol. 1989. Vol. 200. P. 321-330.
Lilcht J., Pfannenstiel Н.Э. Spermatogenesis in Platynereis massiliensis (Polychaeta: Nereidae) //
Helgoland, wiss. Meeresuntersuch. 1989. Bd. 43. P. 19-28.
Lundin K., Schander C. Epidermal ciliary ultrastructure of adult and larval sipunculids
(Sipunculida) // Acta zool. 2003. Vol. 84. P. 113-119.
Liitzen J., Sakamoto H., Taguchi A., Takahashi T. Reproduction, dwaft males, sperm dimorphism
and life cycle in the commensal bivalve Peregrinamor ohshimai Shoji (Heterodonta: Galeommatoidea:
Montacutidae) // Malacologia. 2001. Vol. 43. P. 313-325.
Lyke E.B., Robson E.A. Spermatogenesis in Anthozoa: differentiation of the spermatid // Cell and
Tissue Res. 1975. Vol. 157. P. 185-205.
Magloire H., Couble ML., Romeas A., Bleicher F. Odontoblast primary cilia: facts and
hypotheses // Cell Biol. Intern. 2004. Vol. 28, N 2. P. 93-99.
Mahendrasingam S., Fairweather I., Halton D.W. Spermatogenesis and the fine structure of the
mature spermatozoon in the free proglottis of Trilocularia acanthiaevulgaris (Cestoda, Tetraphyllidea)
// Parasitol. Res. 1989. Vol. 75. P. 287-298.
Marchand В., Mattei X. La spermiogenese des Acanthocephales. I. L'appareil centriolaire et fla-
gellaire au cours de la spermiogenese d'Illiosentis furcatus var. africana Golvan, 1956
(Paleacanthocephala, Phadinorhynchidae) // J. Ultrastruct. Res. 1976. Vol. 54. P. 347-358.
Maro В., Pickering SJ. Microtubules influence compaction in preimplantation mouse embryo //
Ibid. 1984. Vol. 84. P. 217-232.
Marotta R., Ferraguti M., Martin P. Spermiogenesis and seminal receptacles in Aeolosoma
singular (Annelida, Polychaeta, Aeolosomatidae) // Ital. J. Zool. 2003. Vol. 70. P. 123-132.
Marshall R.D., Luykx P. Observations on the centrioles of the sea urchin spermatozoon // Develop.
Growth and Differ. 1973. Vol. 14, N 4. P. 311-323.
Mattei C, Mattei X. La spermiogenese d'un poisson teleosteen (Lepadogaster lepadogaster). I. La
spermatide // Biol. Cell. 1978. Vol. 32. P. 257-266.
Mattei X. Spermiogenese comparee des poisson // Comparative spermatology / Ed. B. Baccetti.
N.Y.; L.: Acad, press, 1970. P. 57-69.
Mattei X. The flagellar apparatus of spermatozoa in fish: Ultrastructure and evolution // Biol. Cell.
1988. Vol. 63. P. 151-158.
Mattei X., Thiam D., Thiaw O.T. Le spermatozoide de Ophidion sp. (Poisson, Teleosteen):
Particularities ultrastructurales du flagelle//J. Ultrastruct. and Mol. Struct. Res. 1989. Vol. 102. P. 162-169.
McGregor D.L., Kesling R.V. Copulatory adaptations in ostracods. Pt I. Hemipenes of Candona //
Contrib. Mus. Paleontol. Univ. Mich. 1969, Vol. 22, N 13. P. 169-191.
McLaren D.J. The structure and development of the spermatozoon of Dipetalonema viteae
(Nematoda: Filarioidea)// Parasitology. 1973. Vol. 66. P. 447^163.
Medina A., Megina C, Abascal F.J., Calzada A. The sperm ultrastructure of Merluccius merluc-
cius (Teleostei, Gadiformes): Phylogenetic considerations // Acta zool. 2003. Vol. 84. P. 131-137.
Meisel S. The importance of hydrolytic enzymes to an exocytotic event the mammalian sperm
acrosome reaction // Biol. Rev. 1984. Vol. 59. P. 125-157.
Melone G., Donin C.L.L., Cotelli F. The paraspermatic cell (atypical spermatozoon) of
Prosobranchia: A comparative ultrastructural study // Acta zool. 1980. Vol. 61. P. 191-201.
Melone G., Ferraguti M. Rotifera // Reproductive biology of invertebrates. Vol. 9, pt A. New
Delhi: Oxford; IBH publ. со, 1999. P. 157-169.
Michelinee F., George N.J. Bone cell cilia: Vestigial or functional organelles? // Calcified Tissue
Res. 1974. Vol. 17, N 1. P. 81-87.
Miller R.L. Sperm chemo-orientation in animal sperm // Biology of fertilization. N.Y.; L.: Acad
press, 1985. Vol. 2: Biology of fertilization / Ed. C.B. Metz and A. Monroy. P. 276-337.
Mizuhira V., Futaesaku Y., Ono M. et al. The fine structure of the spermatozoa of two species of
Rhacophorus (arboreus, schlegelii). I. Phase-contrast microscope, scanning electron microscope and
cytochemical observations of the head piece// J. Ultrastruct. and Mol. Struct. Res. 1986. Vol. 96, N 1/3.
P. 41-53.
8 Реунов A. A.
113
Moore G.P.M., Dixon K.E. A light and electron microscopical study of spermatogenesis in Hydra
couliculata //J. Morphol. 1972. Vol. 137. P. 483-502.
Morisawa S. Fine structure of spermatozoa of the hagfish Eptatretus burgeri (Agnatha) // Biol.
Bull. 1995. Vol. 189. P. 6-12.
Munn E.A., Barnes H. The structure of the axial filament complex of the spermatozoa of Balanus
balanus // Exp. Cell Res. 1970. Vol. 60. P. 277-284.
Munoz M., Sabat M., Mallol S., Casadevall M. Gonadal structure and gametogenesis of Trigla lyra
(Piesces: Triglidae) // Zool. Stud. 2002. Vol. 41, N 4. P. 412^120.
Neill B.W., Wright K.A. Spermatogenesis in the hologonic testis of the trichuroid nematode
Cappilaria hepatica (Bancroft, 1893)// J. Utrastruct. Res. 1973. Vol. 44. P. 210-234.
Nordheim H.V. Vergleichende Ultrastruktur-Untersuchungen der Eu- und Paraspermien von 13
Protodrilus-Arten (Polychaeta, Annelida) und ihre taxonomische und phylogenetische Bedeutung //
Helgoland, wiss. Meeresuntersuch. 1989. Bd. 43. S. 113-156.
Norrevang A., Wingstrand K.G. On the occurrence and structure of choanocyte-like cells in some
echinoderms // Acta zool. 1970. Vol. 51. P. 249-270.
Nyholm K.G. Ultrastructure of the spermatozoa in Homalorhagida Kinorhyncha // Zoon. 1976.
Vol. 4. P. 11-18.
Nyholm K.G. Receptaculum seminis and morphological hermaphroditism in Homalorhaga
Kinorhyncha II Ibid. 1977. Vol. 5. P. 7-10.
Nyholm KG. , Nyholm P.G. Spermatozoa and spermatogenesis in Homalorhaga Kinorhyncha //
J. Ultrastruct. Res. 1982. Vol. 78. P. 1-12.
Ohno Т., Park P. An ultrastructural study of rudimentary cilia in the malignant and benign tumours
of peripheral nerves // J. Clin. Electron Microsc. 1983. Vol. 12. P. 81-92.
Oliver S.C., Jamieson G.M., Scheltinga DM. The ultrastructure of spermatozoa of Squamata. II.
Agamidae, Varanidae, Colubridae, Elapidae and Boidae (Reptilia) // Herpetologica. 1996. Vol. 52, N 2.
P. 216-241.
Pacey A.A., Bentley M.G. An ultrastructural study of spermatogenesis and sperm morula
breakdown in Arenicila marina (L.) (Annelida: Polychaeta) // Helgoland, wiss. Meeresuntersuch. 1992.
Bd. 46. S. 185-199.
Park P., Manabe S., Ohno T. Incidence and ultrastructure of rudimentary cilia in benign and
malignant peripheral nerve tumors // Ultrastruct. Pathol. 1988. Vol. 12. P. 407^118.
Pashchenko S.V., Drozdov A.L. Morphology of gametes in five species of Far-Eastern chitons //
Invertebr. Reprod. Develop. 1998. Vol. 33, N 1. P. 47-56.
Paulus W. Ultrastructural investigation of spermatogenesis in Spongilla lacustris and Ephydatia
fluviatilis (Porifera, Spongillidae) // Zoomorphology. 1989. Vol. 109. P. 123-130.
Paulus W., Weissenfels N. The spermatogenesis of Ephydatia fluviatilis (Porifera) // Ibid. 1986.
Vol. 106, N 3. P. 155-162.
Perezsanchez F., Demonserrat J.J., Soler C. Morphometric analysis of human sperm morphology
// Intern. J. Androl. 1994. Vol. 17, N 5. P. 248-255.
Phillips DM. Insect sperm: Their structure and morphogenesis // J. Cell Biol. 1970. Vol. 44, N 2.
P. 243-277.
Phillips DM. Nuclear shaping during spermiogenesis in the whip scorpion // J. Ultrastruct. Res.
1976. Vol. 54, N 3. P. 397-405.
Phillips DM., Asa C.S. Development of spermatozoa in the Rhea // Anat. Rec. 1989. Vol. 223.
P. 276-282.
Pop ham J.D. Comparative morphometric of the acrosomes of the sperms of "externally" and
"internally" fertilizing sperms of the shipworms (Teredinidae, Bivalve, Mollusca) // Cell and Tissue.
Res. 1974. Vol. 150. P. 291-297.
Popham J.D., Dickson M.R., Goddard C.K. Ultrastructural study of the mature gametes of two
species of Вankia (Mollusca: Teredinidae) // Austral. J. Zool. 1974. Vol. 22, N 1. P. 1-12.
Pudney J. Spermatogenesis in nonmammalian vertebrates // Microsc. Res. Technol. 1995. Vol. 32.
P. 459-497.
Rastogi K.R., Bagnara J.T., Iela L., Krasovich M.A. Reproduction in the mexican leaf frog
Pachymedusa dacnicolor. IV. Spermatogenesis: A light and ultrasonic study // J. Morphol. 1988.
Vol. 197. P. 277-302.
Reunov A.A. Ultrastructural investigation of spermiogenesis in Rhynchonella psitta-
cea (Tentaculata, Brachiopoda) // Invertebr. Reprod. Develop. 1993. Vol. 24. N 3.
P. 213-216.
114
Reunov A.A. Is the "flagellate" pattern of spermatogenesis plesiomorphic in Metazoa? //Ibid. 2001.
Vol. 40, N 2/3. P. 239-242.
Reunov A.A.,Au D.W.T., Wu R.S.S. Spermatogenesis of the green-lipped mussel Perna viridis with
dual patterns of acrosome and tail development in spermatids // Helgoland, wiss. Meeresuntersuch.
1999. Bd. 53. S. 62-69.
Reunov A.A., Hodgson A.N. Ultrastructure of the spermatozoa of five species of south african
bivalves (Mollusca), and an examination of early spermatogenesis // J. Morphol. 1994a. Vol. 219.
P. 275-283.
Reunov A.A., Hodgson A.N. An ultrastructural investigation of spermatogenesis and sperm
structure in six species of South African sea urchin // Echinoderms through time. D. Rotterdam: Balkema,
1994b. P. 849-855.
Reunov A.A., Isaeva V.V., Au D.W.T., Wu R.S.S. Nuage constituents arising from mitochondria: Is
It possible? // Develop. Growth and Differ. 2000. Vol. 42, N 2. P. 139-143.
Reunov A.A., Kalachev A.V., Yurchenko O.V., Au D.W.T. Selective resorption in nutritive
phagocytes of the sea urchin Anthocidaris crassispina II Zygote. 2004a. Vol. 12. P. 71-73.
Reunov A.A., Klepal W. Ultrastructural investigation of spermatogenesis in nemertine worm
Procephalothrix sp. (Palaeonemertini, Anopla) // Helgoland, wiss. Meeresuntersucn. 1997. Bd. 51, N 2.
S. 125-135.
Reunov A.A., Klepal W. Ultrastructural study of spermatogenesis in Phoronopsis harmeri
(Lophophorata, Phoronida) // Ibid. 2004. Vol. 58. P. 1-10.
Reunov A.A., Rice M. Ultrastructural observations on spermatogenesis in Phascolion cryptum
(Sipuncula) // Trans. Amer. Microsc. Soc. 1993. Vol. 112, N 3. P. 195-207.
Reunov A.A., Yurchenko O.V., Kalachev A.V. Presence, character and number of accessory cells in
holothurian male germinative epithelium: An ultrastructural study // Invertebr. Reprod. Develop. 2001.
Vol. 40, N1. P. 49-52.
Reunov A. A., Yurchenko O.V., Kalachev A.V.,Au D.W.T. An ultrastructural study of phagocytosis
and shrinkage in nutritive phagocytes of the sea urchin Anthocidaris crassispina II Cell and Tissue Res.
2004b. Vol. 318, N 2. P. 419-428.
Rice M.E. Gametogenesis in three species of Sipuncula: Phascolosoma agassizii, Golfingia puget-
tensis and Themiste pyroides // Cellule. 1974. Vol. 70. P. 295-313.
Rice M.E. Sipuncula. // Reproduction of marine invertebrates. N.Y.: Acad, press, 1975. P. 67-127.
Rice M.E. Comparative observations of gametes, fertilization and maturation in sipunculans //
Reproduction, genetics and distribution of marine organisms. Fredensborg: Olsen and Olsen, 1989.
P. 167-182.
Rice M.E. Sipuncula // Microscopic anatomy of invertebrates. N.Y.: Wiley, 1993. Vol. 12.
P. 237-325.
Rice S.A., Eckelbarger К J. An ultrastructural investigation of spermatogenesis in the holopelagic
polychaetes Vanadis formosa and Krohnia lepidota (Polychaeta: Alciopidae) // Biol. Bull. 1989.
Vol. 176. P. 123-134.
Rocha E., Azevedo C. Ultrastructural study of the spermatogenesis of Anodonta cygnea L.
(Bivalvia, Unionidae) // Invertebr. Reprod. Develop. 1990. Vol. 18, N 3. P. 169-176.
Rosati F. Sperm-egg interaction in Ascidians // Biology of fertilization. N.Y.: Acad, press, 1985.
Vol. 2. P. 361-388.
Rosati F., Baccetti В., Dallai R. The spermatozoa of Arthropoda. X. Araneids and the lowest myri-
opods // Comparative spermatology /Ed. B. Bacceti. N.Y.: Acad, press, 1970. P. 247-254.
Rosati F., Monroy A., Di Prisco P. Fine structural study of fertilization in the ascidian Ciona
intestinalis // J. Ultrastruct. Res. 1977. Vol. 58. P. 261-270.
Rouse G.W. An ultrastructural study of the spermatozoa of Eulalia sp. (Phyllodocidae),
Lepidonotus sp. (Polynoidea), Lumbrineris sp. (Lumbrineridae) and Owenia fusiformis (Oweniidae) //
Helgoland, wiss. Meeresuntersuch. 1988. Bd. 42, N 1. S. 67-78.
Rouse G.W., Fitzhugh K. Broadcasting fables: Is external fertilization really primitive? Sex, size,
and larvae in sabellid polychaetes // Zool. scr. 1994. Vol. 23. P. 271-312.
Rouse G.W., Gambi M.C. Sperm ultrastructure and spermathecal structure in Amphiglena sp.
(Polychaeta: Sabellidae) //Inverteb. Biol. 1998. Vol. 117, N 2. P. 114-122.
Rouse G.W., Jamieson B.GM. An ultrastructural study of the spermatozoa of the polychaetes
Eurythoe complanata (Amphinomidae), Clymenella sp. and Micromaldane sp. (Maldanidae), with
definition of sperm types in relation to reproductive biology // J. Submicrosc. Cytol. 1987. Vol. 19, N 4.
P. 573-584.
115
Rouse G.W., Pitt К. Ultrastructure of the sperm of Catostylus mosaicus and Phyllorhiza punctata
(Scyphozoa, Cnidaria): Implications for sperm terminology and the inference of reproductive
mechanisms // Invertebr. Reprod. Develop. 2000. Vol. 38. P. 23-34.
Russel L., Peterson R., Freund M. Direct evidence for formation of Rybrid vesicles by fusion of
plasma and outer acrosomal membranes during the acrosome reaction in boar spermatozoa // J. Exp.
Zool. 1979. Vol. 208, N 1. P. 41-56.
Russel L.D., Saxena N.K., Turner T.T. Cytoskeletal involvement in spermiation and sperm
transport//Tissue and Cell. 1989. Vol. 21, N 3. P. 361-379.
Sakai Y'., Yamashina S. Mechanism for the removal of residual cytoplasm from spermatids during
mouse spermiogenese // Anat. Rec. 1989. Vol. 223. P. 43^18.
Sailer U. Oogenesis and larval development of Ephydatia fluviatilis (Porifera, Spongillidae) //
Zoomorphology. 1988. Vol. 108. P. 23-28.
Sailer U., Weissenfels N. The development of Spongilla lacustris from the oocyte to free larva
(Porifera, Spongillidae) // Ibid. 1985. Vol. 105. P. 367-374.
Sato M., Osanai K. Morphological identification of sperm receptors above egg microvilli in the
polychaete Neanthes japonica // Develop. Biol. 1986. Vol. 113. P. 263-270.
Sawada N. Electron microscope studies on gametogenesis in Lingula unguis II Zoology. 1973.
Vol. 82. P. 178-188.
Sawada N. An electron microscopic study of spermatogenesis in Golphingia ikedai // Acta zool.
1980. Vol. 61. P. 127-132.
Sawada N. Electron microscopical studies of spermatogenesis in polychaetes // Stuttgart; N.Y.:
Fischer, 1984. P. 100-114 (Fortschr. Zool; Bd. 29).
Scheltinga DM., Jamieson B.G.M., Espinoza RE., Orrell K.S. Descriptions of the mature
spermatozoa of the lizards Crotaphytus bicinctores, Gambelia wislizenii (Crotaphytidae) and Anolis caroli-
nensis (Polychrotidae)(Reptilia, Squamata, Iguania) //J. Morphol. 2001. Vol. 247. P. 160-171.
Scheltinga DM., Jamieson B.G.M., Trauth S.E., Mcallister C.T. Morphology of the spermatozoa
of the iguanian lizards Uta stansburiana and Urosaurus ornatus (Squamata, Phrynosomatidae) //
J. Submicrosc. Cytol. Pathol. 2000. Vol. 32, N 2. P. 261-271.
Schincariol A. L., Haborsky J., Winner G. Cytology and ultrastructure of differentiating interstitial
cells in spermatogenesis in Hydra fusca // Canad. J. Zool. 1967. Vol. 45. P. 590-593.
Schmidt H., Holtken B. Peculiarities of spermatogenesis and sperm in Anthozoa // Developmental
and cellular biology of coelenterates. Amsterdam: Elsevier: North-Holland, 1980. P. 41^16.
Schmidt-Rhaesa A. Ultrastructural observation of the male reproductive system and spermatozoa
of Gordius aquaticus L., 1758 // Inverteb. Reprod. Develop. 1997. Vol. 32, N 1. P. 31^10.
Schon I., Martens K. Sex determination in non-marine ostracods // Sex and parthenogenesis:
Evolutionary ecology of reproductuve modes in non-marine ostracods. Leiden, 1998. Chap. 2: Sex
determination in non-marine ostracods. P. 25-36
Schroeder P. C, Hermans CO. // Reproduction of marine biology. N.Y.: Acad, press, 1975.
Vol. 3: Annelids and Echiurans; Annelida: Polychaeta. P. 1-213.
Segretain D., Roussel C. Endocytic origin for periaxonemal vesicles along the flagellum during
mouse spermiogenesis // Gamete Res. 1988. Vol. 21. P. 451^-63.
Silveira H., Rodrigues P., Azevedo C. Fine structure of the spermatogenesis of Blennius pholis
(Pisces, Blenniidae) //J. Submicrosc. Cytol. Pathol. 1990. Vol. 22, N 1. P. 103-108.
Slyusarev G.S., Ferraguii M. Sperm structure of Rhopalura littoralis (Orthonectida) // Invertebr.
Biol. 2002. Vol. 121, N 2. P. 91-94.
Sopott-Ehlers В., Ehlers U. Differentiation of male and female germ cells in neoophoran
Plathelminthes // Advances in invertebrate reproduction. N.Y.: Elsevier, 1986. Vol. 4. P. 187-194.
Sorokin S. Centrioles and the formation of rudimentary cilia by fibroblasts and smooth muscle cells
//J. Cell. Biol. 1962. Vol. 15. P. 363-377.
Sousa M., Azevedo C. Acrosomal reaction and early events at fertilization in Marthasterias
glacialis (Echinodermata: Asteroidea) // Gamete Res. 1985. Vol. 11. P. 157-167.
Sousa M., Azevedo C. Fine structural study of the acrosome formation in the starfish Marthasterias
glacialis (Echinodermata, Asteroidea) //Tissue and Cell. 1988. Vol. 20, N 4. P. 621-628.
Southword E.C., Coates K.A. Sperm masses and sperm transfer in a vestimentiferan Ridgeia pisce-
sae Jones, 1985 (Pogonophora, Obturata) // Canad. J. Zool. 1989. Vol. 67. P. 2776-2781.
Sprando R.L., Russel L.D. Spermiogenesis in the bullfrog (Rana catesbeiana): A study of
cytoplasmic events including cell volume changes and cytoplasmic elimination // J. Morphol. 1988.
Vol. 198. P. 303-319.
116
Stagni A., Lucchi ML. Ultrastructural observations on the spermatogenesis in Hydra attenuata //
Comparative spermatology / Ed. B. Baccetti. N.Y.: Acad, press, 1970. P. 357 - 362.
Stanley H.P. The fine structure of spermatozoa of Hydrolagus colliei (Chondrichthyes,
Holocephali) //J. Ultrastruct. Res. 1983. Vol. 83. P. 184-194.
Stefanini M., Conti M., Geremia R., Ziparo E. Regulatory mechanisms of mammalian
spermatogenesis //Biology of fertilization. N.Y.; L.: Acad, press, 1985. Vol. 2: Biology of the sperm. P. 59-92.
Stern С Embryology: fluid flow and broken symmetry // Nature. 2002. Vol. 418. P. 29-30.
Storch V., Higgins R.P. Ultrastructure of developing and mature spermatozoa of Tubiluchus coral-
licola (Priapulida) //Trans. Amer. Micros. Soc. 1989. Vol. 108, N 1. P. 45-50.
Storch V., Ruhberg H. Electron microscopic observations on the male genital tract and sperm
development in Peripatus sedgwicki (Peripatidae, Onychophora) // Invertebr. Reprod. Develop. 1990.
Vol. 17, N 1. P. 47-56.
Strieker S. A., Cavey M.J. An ultrastructural study of spermatogenesis and the morphology of the
testis in the nemertean worm Tetrastemma phillospadicola (Nemertea, Hoplonemertea) // Canad. J.
Zool. 1986. Vol. 64. P. 2187-2202.
Suwanjarat J. Ultrastructure of the spermatogenesis of the cockle Anadara granosa L. (Bivalvia:
Arcidae) // Helgoland wiss. Meeresuntersuch. 1999. Bd. 53. S. 85-91.
Tardent P. Gametogenesis in the genus Hydra // Amer. Zool. 1974. Vol. 14. P. 447^-56.
Teshirogi W. On the origin of neoblast in freshwater planarians (Turbellaria) // Hydrobiologia.
1986. Vol. 132. P. 207-216.
Teuchert G. Electronenmikroskopische Untersuchungen uber die Spermatogenese und
Spermatohistogenese von Turbanella cornuta Remane (Gastrotricha) // J. Ultrastruct. Res. 1976.
Vol. 56. P. 1-14.
Thiaw O.T., Mattel X. Different aspects of tubulin polymerization in spermatids of
Cyprinodontidae (Fish, Teleost) //J. Ultrastruct. and Mol. Struct. Res. 1989. Vol. 102. P. 122-131.
Thiaw O.T., Mattel X., Romand R., Marchand B. Reinvestigation of spermatic flagella structure:
The teleostean Cyprinodontidae // Ibid. 1986. Vol. 97, N 1/3. P. 109-118.
Thiaw O.T., Thiam D., Mattel X. Extension of proximal centriole in a teleost fish spermatozoon //
J. Submicrosc. Cytol. Pathol. 1990. Vol. 22, N 3. P. 357-360.
TllneyL.G. The acrosomal reaction//Biology of fertilization. N.Y.; L.: Acad, press. 1985. Vol. 2:
Biology of sperm. P. 157-209.
Tilney L.G., Inoue S. Acrosomal reaction of the Thyone sperm. III. The relationship between actin
assembly and water influx during the extension of the acrosomal process //J. Cell Biol. 1985. Vol. 100,
N 4. P. 1273-1283.
Turbevllle J. M., Ruppert E.E. Comparative ultrastructure and the evolution of nemertines // Amer.
Zool. 1985. Vol. 21. P. 53-71.
Tuzet O., Garrone R., Pavans de Ceccatty M. Observations ultrastracturales sur la spermatogenese
chez la demosponge Aplysilla rosea Schulze (Dendroceratidae): Une metaplasie exemplaire // Ann. sci.
natur. Zool. France. 1970. Vol. 12. P. 27-50.
Van Duljn С Biometry of human spermatozoa // J. Roy. Microsc. Soc. 1958. Vol. 77.
P. 12-18.
Van-Praet M. Gametogenesis and the reproductive cycle in the deep-sea anemone Paracalllactis
stephensoni (Cnidaria, Actiniaria) //J. Mar. Biol. Assoc U. K. 1990. Vol. 70. P. 163-172.
Van Vuren J.H.J., Fishelson L. Ultrastructural features of the gonad of the Capoeta damascinus I
Barbus canls hybrid Hi. Electr. Microsc. Soc. S. Afr. 1990. Vol. 5.
P. 171-172.
Villa L., Tripepi S. An electron microscope study of spermatogenesis and spermatozoa of
Microcosmus sabatieri (Ascidiacea; Tunicata) // Acta embriol. morphol. exp. N.S. 1982. Vol. 3, N 3
P. 201-215.
Villa L., Tripepi S. An electron miccroscope study of spermatogenesis and spermatozoa of Ascidia
malaca, Ascidiella aspersa and Phallusia mamillata (Ascidiacea, Tunicata) // Acta embriol. morphol.
Exp. 1983. Vol. 4. P. 157-168.
Ward S., Argon Y., Nelson A.G. Sperm morphogenesis in wild-type and fertilization-defective
mutants of Caenorhabdltis elegants II J. Cell Biol. 1981. Vol. 91, N 1. P. 26-44.
Watson N.A., Rohde K. Ultrastructure of spermatogenesis and sperm of Multlcotyle purvisi
(Plathelminthes, Aspidogastrea) //Zoomorphology. 1991. Vol. 110. P. 347-356.
Welsch U'., Fang Y.Q. The reproductive organs of Branchiostoma // Isr. J. Zool. 1996. Vol. 42.
P. 183-212.
117
Welsch U., Storch V. Comparative animal cytology and histology. L.: Sidwic and Jackson, 1976.
321 p.
West D.L. Spermiogenesis in the Anthozoan Aiptasiapallida //Tissue and Cell. 1980. Vol. 12, N 2.
P. 243-253.
Westheide W. The concept of reproduction in polychaetes with small body size: adaptations in
interstitial species // Polychaete reproduction. Stattgart; N.Y.: Fischer, 1984. P. 267-287.
Wilsman NJ., Fletcher T.F. Cilia of neonatal articular chondrocytes incidence and morphology //
Anat. Rec. 1978. Vol. 190, N 4. P. 871-889.
Wingstrand K.G. Comparative spermatology of a pentastomid Raillietiella hemidactyli and a
branchiuran crustacean Argulus foliaceus with a discussion of pentastomid relationship // Kgl. Dan.
vidensk. selsk. skr. 1972. Vol. 19. P. 5-72.
WolfK.W., Kyburg J. The restructuring of the flagellar base and the flagellar necklace during
spermatogenesis of Ephestia kuehniella Z. (Pyralidae, Lepidoptera)// Cell and Tissue Res. 1989. Vol. 256.
P. 77-86.
Wood R.L., Cavey M.J. infrastructure of the coelomic lining in the podium of the starfish
Stylasteriasforreri//Ibid. 1981. Vol. 218. P. 449^173.
Woollacott R.M. Spermatozoa of ciona intestinalis and analysis of ascidian fertilization //
J. Morphol. 1977. Vol. 152. P. 77-78.
Wright К A.,Hope W.D., Jones N.O. The ultrastracture of the sperm of Deontostoma californicum,
a free-living marine nematode // Proc. Helminthol. Soc. Wash. 1973. Vol. 40. P. 30-36.
Xylander W.E.R. Ultrastractural studies on the reproductive system of Gyrocotylidea and
Amphilinidea (Cestoda): Spermatogenesis, spermatozoa, testes and vas deferens of Gyrocotyle//Intern.
J. Parasitol.1989. Vol. 19, N 8. P. 897-905.
Yager J. Pleomothra apletocheles and Godzillignomus frondosus, two new genera and species of
remipede crustaceans (Godzilliidae) from anchialine caves of the Bahamas // Bull. Mar. Sci. 1989.
Vol.44, N3. P. 1195-1206.
Yamagata A. Studies on reproduction in the hermaphroditic sea star Asterina minor, the
functional male gonads, "ovotestes" // Biol. Bull. 1982. Vol. 162. P. 449^156.
Yamagata A. Ultrastracture of spermatogenesis in the sea star Asterina minor II Gamete Res. 1988.
Vol. 19, N2. P. 215-225.
Yamashita M. A fine structural study of spermatogenesis in the brittle-star Ophiura sarsii
(Echinodermata: Ophiuroidea) with a demonstration of the precocious formation of the acrosome // J.
Fac. Sci. Hokkaido Univ. Ser. VI. 1983. Vol. 23, N 3. P. 254-265.
Yamashita M. In vitro maturation of the brittle-star Amphipholis kochii oocytes induced by cyclic
AMP//Z00I. Sci. 1986. Vol. 3. P. 467^177.
Yamashita M. A fine structural study of the fertilization process of the jellyfish Cladonema uchidai //
Develop. Growth and Differ. 1988. Vol. 30, N 1. P. 81-89.
Yamashita M., Iwata F. Ultrastractural observations on the spermatogenesis of the brittle-star
Amphipholis kochii Lutken (Echinodermata: Ophiuroidea) //Publ. Seto Mar. Biol. Lab. 1983. Vol. 28,
N 5/6. P. 403-^15.
Yamashita M., Onozato H., Nakanishi Т., Nagahama Y. Breakdown of the sperm nuclear envelope
is a prerequisite for male pronucleus formation: Direct evidence from the gynogenetic crucian carp
Carassius auratus Langsdorfii // Develop. Biol. 1990. Vol. 137. P. 155-160.
Yamazato K., Sato M., Yamashiro H. Reproductive biology of an alcyonarian coral Lobophytum
crassum Marenzeller // Proc. 4th Intern, coral reef symp. Manila, 1981. Vol. 2. P. 671-678.
Yoder B.K., Hou X., Guay-Woodford L.M. The polycystic kidney desease proteins polycystin-1,
polycystin-2, polaris and cystin are co-localized in renal cilia // J. Amer. Soc. Nephrol. 2002. Vol. 13.
P. 2508-2516.
Yokoyama T. Motor or sensor: A new aspect of primary cilia function // Anat. Sci. Intern. 2004.
Vol. 79, N 2. P. 47-54.
Yushin V.V. Ultrastracture of spermatozoa in the free-living marine nematode of the
family Selachinematidae (Chromadorida: Cyatholaimina) // Russ. J. Nematol. 2003a. Vol. 11, N 2.
'P. 81-90.
Yushin V.V. Ultrastracture of spermatogenesis in the free-living marine nematode Anticoma poss-
jetica (Enoplida: Anticomidae // Nematology. 2003b. Vol. 5, N 5. P. 777-788.
Yushin V.V., CoomansA. Ultrastracture of sperm development in the free-living marine nematodes
of the family Chromadoridae (Chromadorida: Chromadorina) // Ibid. 2000. Vol. 2, N 3. P. 285-
296.
118
Yushin V.V., Malakhov V.V. Ultrastracture of sperm cells in the female gonoduct of free-living
marine nematodes from genus Enoplus (Nematoda: Enoplida) // Fundam. Appl. Nematol. 1994 Vol 17,
N6. P. 513-519.
Yushin V.V., Malakhov V.V. Ultrastracture of sperm development in the free-living marine
nematode Enoplus anisospiculus (Enoplida: Enoplidae) // Ibid. 1998. Vol. 21, N 3. P. 213-225.
Yushin V.V., Malakhov V.V. Spermatogenesis and nematode phylogeny // Nematol. Monogr. and
Perspectives. 2003. Vol. 2. P. 1-11.
Yushin V.V., Spiridonov S.E. Ultrastracture of sperm development in Heth mauriesi Adamson,
1982 (Rhigonematida: Hethidae) //Russ. J. Nematol. 2001. Vol. 9. N 2. P. 119-126.
Yushin V.V., Zograf Y.K. Ultrastracture of spermatozoa in the free-living marine nematode
Paracanthonchus macrodon (Nematoda, Chromadorida) // Invertebr. Reprod. Develop. 2004 Vol 45
N 1. P. 59-67.
Zihler J. Zur Spermatogeneze und Befrachtungsbiologie von Hydra // W. Roux, Arch.
Entwicklungsmech. Organism, 1972. Bd. 169. S. 239-267.
ОГЛАВЛЕНИЕ
От автора 3
Введение 4
Глава 1
Представления об эволюции сперматозоидов многоклеточных животных 7
Глава 2
Проблемы характеристики мужских гамет 11
О модифицированности и аберрантности сперматозоидов 13
Характеристика примитивных сперматозоидов 14
Характеристика модифицированных сперматозоидов 19
Характеристика аберрантных сперматозоидов 21
Ультраструктурный анализ, как метод определения типа сперматозоида 22
Что такое популяция сперматозоидов? 23
Глава 3
Традиционные представления о сперматогенезе у многоклеточных животных 27
Глава 4
Сперматогенез у многоклеточных животных с примитивными сперматозоидами 30
Spongia 30
Cnidaria 35
Priapulida 37
Nemertini 39
Polychaeta 41
Mollusca 43
Brachiopoda 44
Echinodermata 46
Ascidiacea 50
Teleostei 52
Ультраструктурные особенности дифференциации примитивных сперматозоидов 54
Глава 5
Сперматогенез у многоклеточных животных с модифицированными сперматозоидами 58
Plathelminthes 59
Oligochaeta 61
Arthropoda 63
120
Mollusca 66
Ультраструктурные особенности дифференциации модифицированных сперматозоидов 69
Глава 6
Сперматогенез у многоклеточных животных с аберрантными сперматозоидами 71
Plathelminthes 71
Nematoda 75
Kinorhyncha 77
Arthropoda 80
Ультраструктурные особенности дифференциации аберрантных сперматозоидов 86
Глава 7
Ультраструктурные аспекты эволюции сперматогенных клеток многоклеточных
животных 88
Глава 8
С чем сопряжен жгутиковый паттерн сперматогенеза? 93
Объяснения к фототаблицам 99
Литература 102
CONTENTS
Preface of the author 3
Introduction 4
Chapter 1
The concepts of evolution of spermatozoa of multicellular animals 7
Chapter 2
The problems of characteristics of male gametes 11
About modified and aberrant patterns of spermatozoa 13
Characteristics of primitive spermatozoa 14
Characteristics of modified spermatozoa 19
Characteristics of aberrant spermatozoa 21
The ultrastructural analysis as a method of identification of the sperm type 22
What is a sperm population? 23
Chapter 3
Traditional concept of spermatogenesis in multicellular animals 27
Chapter 4
Spermatogenesis in multicellular animals with primitive spermatozoa 30
Spongia 30
Cnidaria 35
Priapulida 37
Nemertini 39
Polychaeta 41
Mollusca 43
Brachiopoda 44
Echinodermata 46
Ascidiacea 50
Teleostei 52
The ultrastructural features of primitive spermatozoon differentiation 54
Chapter 5
Spermatogenesis in multicellular animals with modified spermatozoa 58
Plathelminthes 59
Oligochaeta 61
Arthropoda 63
122
Mollusca 66
The ultrastructural features of modified spermatozoon differentiation 69
Chapter 6
Spermatogenesis in multicellular animals with aberrant spermatozoa 71
Plathelminthes 71
Nematoda 73
Kinorhyncha 77
Arthropoda 80
The ultrastructural features of aberrant spermatozoon differentiation 86
Chapter 7
The ultrastructural aspects of metazoan spermatogenic cell evolution 88
Chapter 8
What is a reason of flagellate spermatogenesis? 93
The explanations to photoplates 99
Literature 102
Научное издание
Реунов Аркадий Анатольевич
СПЕРМАТОГЕНЕЗ
МНОГОКЛЕТОЧНЫХ
ЖИВОТНЫХ
Утверждено к печати
Ученым советом
Института биологии моря
Дальневосточного отделения
Российской академии наук
Зав. редакцией Н.А. Степанова
Редактор Н.М. Александрова
Художник Ю.И. Духовская
Художественный редактор В.Ю. Яковлев
Технический редактор В. В. Лебедева
Корректор ЗД. Алексеева
Подписано к печати 25.04.2005
Формат 70 х 100У16. Гарнитура Тайме
Печать офсетная
Усл.печ.л. 10,4 + 1,6 вкл. Усл.кр.-отт. 12,3
Уч.-изд.л. 13,5. Тип. зак. 4042
Издательство "Наука"
117997, Москва, Профсоюзная ул., 90
E-mail: secret@naukaran.ru
Internet: www.naukaran.ru
Отпечатано с готовых диапозитивов
в ГУП "Типография "Наука"
199034, Санкт-Петербург, 9-я линия, 12