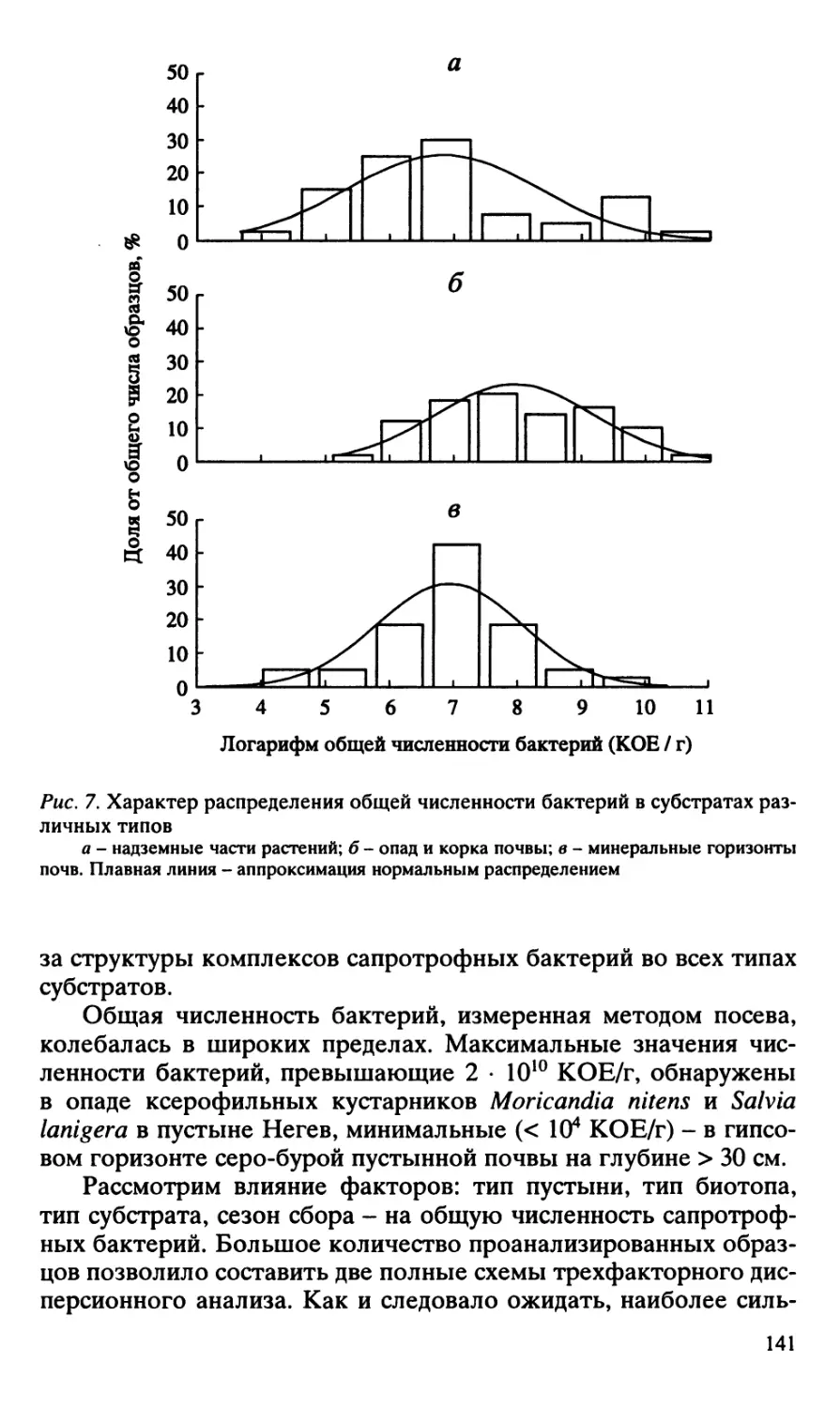
Author: Добровольская Т.Г.
Tags: почвоведение почвенные исследования биология микробиология почвы
ISBN: 5-94628-074-0
Year: 2002
Text
СТРУКТУРА
Московский государственный университет
им. М.В. Ломоносова
Факультет почвоведения
Т.Г.ДОБРОВОЛЬСКАЯ
СТРУКТУР/!
Б/1КТ6РМ/1ЛЬШ>1Х
СООБЩЕСТВ
ПОЧВ
Ответственный редактор
доктор биологических наук,
профессор Д.Г. Звягинцев
МОСКВА
ИКЦ «АКАДЕМКНИГА»
2002
УДК 631.4
ББК 40.3
Д56
Издание осуществлено при поддержке
Российского фонда фундаментальных исследований
по проекту № 02-04-62019
Добровольская Т.Г.
Структура бактериальных сообществ почв. - М.: ИКЦ
"Академкнига", 2002. - 282 с.
ISBN 5-94628-074-0
В книге на основе ретроспективного эволюционно-биосферного подхода
прослеживаются этапы формирования и структура бактериальных сообществ почв. Проведено
сравнение таксономического состава и принципов организации бактериальных
сообществ в водных и наземных экосистемах, показана роль растений и животных как
центров формирования бактериоценозов. Автором оцениваются и сравниваются результаты
определения бактериального разнообразия почв на основе современных молекулярно-
биологических и традиционных фенотипических методов, предлагаются новые подходы
и индексы для характеристики структуры почвенных бактериальных сообществ.
Описаны бактериальные комплексы разных типов почв, показаны особенности их пространст-
венно-временнбй организации. Проанализированы многочисленные экологические
функции бактерий как компонентов почвенных микробных сообществ.
Для специалистов-микробиологов, почвоведов, экологов, может служить в качестве
учебного пособия для студентов высших учебных заведений, обучающихся по этим
специальностям.
ISBN 5-94628-074-0 © Т.Г. Добровольская, 2002
© ИКЦ "Академкнига", 2002
К 250-летию
Московского государственного
университета им. М.В. Ломоносова
ВВЕДЕНИЕ
В последние десятилетия в науке о почвах было создано
новое направление - экологическое, основанное главным образом
на изучении функций почв в экосистемах и биосфере в целом.
Все многочисленные экологические функции почв
проанализированы в книгах Г.В. Добровольского и Е.Д. Никитина (1990,
2000). Особенно значима роль, которую выполняет почвенный
покров в качестве биогеохимической мембраны,
обеспечивающей устойчивый обмен веществом и энергией между
литосферой, атмосферой, гидросферой и всеми обитающими на Земле
организмами (Добровольский, 1999). Эта глобальная функция
почвы осуществляется благодаря почвенным организмам, среди
которых бактериям принадлежит особая роль, так как именно
прокариотные сообщества создали и поддерживали состав
атмосферы Земли. Недаром почвенная микробиология в течение
длительного времени развивалась как почвенная бактериология. И в
настоящее время, несмотря на возрастающий интерес ко всем
группам почвенных микроорганизмов (в том числе и эукариот-
ным) как жизненно необходимым для функционирования и
саморегулирования экосистем Земли и ее биосферы, одной из
центральных проблем микробиологии остается оценка
бактериального разнообразия почв.
Основная цель настоящей книги - показать, как
формировались и как организованы бактериальные сообщества почв,
применив для этого ретроспективный эволюционно-биосферный
подход, позволяющий рассмотреть расселение бактерий по
природным нишам от первых цианобактериальных сообществ
докембрия до современных сложных фитоценозов. Проведены
оценка и сравнение принципов организации бактериальных
сообществ в водных и наземных экосистемах, показана роль
растений и животных как центров формирования бактериоцено-
зов. Даны примеры как "переселения" бактерий разных
таксонов в почву из водных экосистем, так и сохранения многими ба-
3
ктериями исходных водных местообитаний, связанных с их эко-
лого-физиологическими особенностями. При сравнении
таксономического состава бактериальных сообществ,
ассоциированных как с водными, так и наземными водорослями и высшими
растениями, становится очевидным, что эти сообщества близки
друг другу и являются результатом длительной коэволюции
бактерий с водорослями, экскреты которых селективно
подавляли рост грамположительных бактерий, что привело к
доминированию протеобактерий в большинстве бактериальных
сообществ, ассоциированных как с низшими, так и высшими
растениями.
Почва характеризуется как трехфазная полидисперсная
система, способная создать условия для развития в ней как "водных"
форм бактерий благодаря наличию почвенного раствора,
множества капилляров и водных пленок, так и "наземных" бактерий,
которые прочно адсорбировались на почвенных частицах и
приспособились к жизни в твердофазном субстрате, осуществляя
активную деятельность в адсорбированном состоянии. Для
континентальной ветви бактерий почва служит не только средой
обитания, но и средой, в которой происходила, по-видимому, их
эволюция.
В книге содержатся материалы, раскрывающие как историю
развития представлений о разнообразии бактериального
населения почв, так и новые подходы к экологической оценке
микробных ресурсов почв. В основу изложения данных по составу
почвенных бактериальных сообществ положен принцип иерархии
местообитаний микроорганизмов, разработанный коллективом
сотрудников (при участии автора) кафедры биологии почв
факультета почвоведения МГУ, возглавляемым профессором
Д.Г. Звягинцевым. Согласно этому принципу, сообщества
рассматриваются путем последовательного перехода от меньшего
масштаба к большему: от микро- и мезопочвенных локусов к
почвенному профилю, биогеоценозу (с учетом его вертикальной
дифференциации на ярусы), биому.
Автор предлагает набор экологических индексов, которые
необходимы для характеристики структуры бактериальных
сообществ и бактериального разнообразия почв. В результате
оценки и выбора наиболее значимых из них дается описание
бактериальных комплексов разных типов почв в разных природно-
климатических зонах.
Для описания временных изменений в структуре
бактериальных сообществ предлагается метод сукцессионного анализа,
позволяющий в условиях почвенных микрокосмов моделировать
разные типы водно-воздушного режима. Показано, что такой
4
метод позволяет значительно повысить степень учета
бактериального разнообразия (расширить спектр диагностируемых
таксонов).
Специальная глава книги посвящена сравнению результатов
оценки бактериального разнообразия почв современными моле-
кулярно-биологическими методами и традиционным
методом посева. Обсуждаются причины расхождения в описании
бактериального разнообразия, полученного разными методами,
оцениваются возможности и перспективы интеграции разных
методов.
На основании всего изложенного в книге материала,
касающегося описания структуры почвенных бактериальных
сообществ, автор пытается с новых позиций взглянуть на одну из
вечных проблем в почвенной микробиологии - "почвенные" и
"непочвенные" бактерии. Суть этих позиций сводится не столько к
установлению четкого разграничения этих экологических
группировок, сколько к расширению понятия "почвенные"
бактерии, исходя из концепция почвы как "системы из множества ме-
зо- и микросред обитания с совершенно различными условиями"
(Звягинцев, 1987). Отсюда следует, что к "почвенным" следует
относить не только те бактерии, которые адсорбированы на
почвенных частицах, но и все множество бактерий,
ассоциированных с растениями, беспозвоночными животными,
простейшими, грибами, т.е. все бактерии, которым почва и
сопряженные с ней субстраты предоставляют условия для
жизнедеятельности.
Основным объектом исследования в настоящей работе
является блок гетеротрофных аэробных и
факультативно-анаэробных бактерий. Приведены списки таксонов таких форм
почвенных бактерий и указана их приуроченность к определенным
биотопам и локусам.
Из всех функций почвенных бактерий наболее подробно
анализируется их участие в круговороте азота и углерода.
Показано, что одни и те же бактерии способны выполнять разные,
часто противоположные функции, и, наоборот, некоторые
функции бактерий дублируются эукариотными
микроорганизмами, что согласуется с основными принципами строения и
функционирования комплекса почвенных микроорганизмов
(Звягинцев, 1987).
Я благодарна сотрудникам и аспирантам кафедры биологии
почв и других учреждений, в содружестве с которыми были
проведены многочисленные исследования, результаты которых
вошли в настоящую книгу. В течение многих лет моим постоянным
помощником и коллегой по работе в области изучения бактери-
5
альных сообществ почв была доцент кафедры Л.В. Лысак,
которой выражаю искреннюю признательность.
Особо хочется поблагодарить ответственного редактора,
профессора Д.Г. Звягинцева и доцента И.П. Бабьеву за ценные
советы и критические замечания, высказанные в процессе
подготовки настоящей книги, профессора М.М. Умарова за
консультации по разделам книги, посвященным анализу роли бактерий
в процессах превращения азота.
Автор весьма признательна доценту кафедры И.Ю. Чернову
за постоянную помощь в статистической обработке данных
и подготовке иллюстративного материала для настоящей книги
и доктору биологических наук B.C. Гузеву за любезно
предоставленные микрофотографии клеток бактерий, помещенные на
1-й и 4-й сторонах переплета.
Глава 1
АНАЛИЗ СОСТАВА БАКТЕРИАЛЬНЫХ
СООБЩЕСТВ ЗЕМЛИ, ФОРМИРОВАВШИХСЯ
В ПРОЦЕССЕ ЭВОЛЮЦИИ БИОСФЕРЫ
Наиболее простыми из всех организмов, существующих на
Земле, являются прокариотные (безъядерные) организмы.
Общее количество прокариотных микроорганизмов на нашей
планете к настоящему времени составляет 4-6 • 1030 клеток, в них
содержится 350-550 млрд т органического углерода, что
составляет весьма значительную долю от углерода, запасенного в
растениях. Количество азота, содержащегося в прокариотной
биомассе (85-130 млрд т), и фосфора (9-14 млрд т) превышает в 10 раз
содержание этих элементов в растениях (Whitman et al., 1998).
Таким образом, бактерии представляют собой живые резервуары
огромных запасов органического вещества и различных
питательных элементов на Земле. Они являются самыми древними
обитателями Земли. Предполагается, что условия для
возникновения жизни могли создаться на Земле 4,4 млрд лет назад
(Evolution..., 1998). Возраст следов ископаемых цианобактерий,
сохранившихся в виде литифицированных цианобактериальных
сообществ (строматолитов) составляет 3,5 млрд лет (Варравуна,
Австралия). Именно эти прокариотные сообщества,
процветавшие в докембрии во внутриконтинентальных водоемах,
сформировали первую биосферу с устойчивым круговоротом веществ
(Заварзин, 1984, 1997).
Можно предположить, что в это время начался гидроземный
процесс почвообразования как первый этап единого
почвообразовательного процесса на Земле. Согласно точке зрения
почвоведа В.К.Бахнова, каждому этапу развития биосферы
соответствовала определенная форма почвообразования: гидроземная
(подводная), атмоземная (болотная) и литоземная (на корах
выветривания). Гидроземное почвообразование было самым
древним и длительным, оно продолжалось более 2,5 млрд лет и
соответствовало периоду господства водорослей на Земле (Бахнов,
1986). Однако в последнее время был выдвинут ряд аргументов в
7
пользу наземного, а не подводного образования докембрийских
строматолитов, как это считалось ранее (Крылов, Заварзин
1988), но при этом сам вопрос о дифференциации суши и моря
применительно к глубокому докембрию считается спорным. По
всей видимости, в те времена на окраинах континентов
формировались обширные мелководные бассейны с постоянно
меняющимся уровнем воды и без настоящей береговой линии. Именно
в этом "вымершем" ландшафте (ни суша, ни море) и процветали
строматолитовые экосистемы (Еськов, 2000). Согласно этой
концепции и учитывая, что жизнь всегда концентрируется на
границе суши и воды, можно предположить, что происходило
одновременное освоение и водных, и наземных территорий бактериями.
Таким образом, если начало формирования
почвообразовательного процесса датировать докембрием, то возраст бактерий
и возраст первых примитивных почв сближаются во времени.
Эти факты являются основанием для применения
ретроспективного эволюционного подхода (возвращения к тем эпохам, когда
создавалась биосфера Земли) к анализу состава современного
бактериального населения почв. Иными словами, источники
формирования бактериальных комплексов почв следует искать в
далеком прошлом, когда еще не было настоящих почв с
дифференцированным профилем, появившихся в девоне под тропическими
лесами (Ковда, 1985).
Чтобы подойти к анализу вертикального распределения
бактерий в наземных экосистемах, необходимо знать, какие
факторы определяют стратификацию и таксономический состав
бактериальных сообществ в акваториях. Для этого мы рассмотрим
организацию микробных сообществ в пресноводных и морских
акваториях.
1.1. БАКТЕРИИ В ПРЕСНОВОДНЫХ
И МОРСКИХ ЭКОСИСТЕМАХ
Основными факторами, которые определяют
распространение бактерий в водной среде, являются освещенность,
температурный, кислородный и газовый режимы, солевой состав (Гор-
ленко и др., 1977; Дубинина, 1978). В зависимости от содержания
растворенного кислорода, всю водную массу подразделяют на
ряд экологических зон: аэробную, микроаэрофильную и
анаэробную. В каждой зоне обитают бактерии разных
таксономических групп, выполняющие разные экологические функции.
В аэробной зоне в поверхностной пленке воды преобладают
планктонные формы, имеющие приспособления для
поддержания их во взвешенном состоянии: жгутики, прикрепительные дис-
8
ки, простеки, газовые вакуоли, малые размеры клеток 'также
препятствуют их быстрому оседанию. Здесь доминируют олиго-
трофные почкующиеся и простекобактерии. Из почкующихся
обнаруживаются роды Hyphomicrobium, Pedomicrobium, Plancto-
myces, Pasteuria, Ancylomicrobium, Seliberia, Blastobacter; из
простекобактерии - Caulobacter, Asticaccaulis, Prosthecomicrobium,
Prostecochloris. Типично планктонными бактериями являются
также спириллы. Кроме своеобразных морфологических
приспособлений, позволяющих им обитать в этой зоне, существует
и специализация типов обмена бактерий: фототрофия, метило-
трофия, нитрификация.
Под поверхностной пленкой воды расположено множество
подзон, составляющих эконишу водной массы: подзоны
фотосинтеза, продукции биомассы гетеротрофных бактерий, продукции
органического вещества хемолитотрофами, деструкции
органического вещества, подзона термоклина в аэробной зоне. Авто-
трофную ассимиляцию С02 осуществляют фототрофные и
бесцветные серобактерии, тионовые, нитрифицирующие и
водородные. Однако заметные величины продукции органического
вещества за счет хемосинтеза наблюдаются только в соленых
водоемах с повышенным содержанием водорода.
В экологической нише деструкции органического вещества
идет разложение фитопланктона и высшей водной
растительности. До 80% взвешенного органического вещества разлагается в
водной массе в аэробных условиях, не достигая дна, - до глубины
10 м. Лизис живых клеток цианобактерий и зеленых водорослей
осуществляется миксобактериями, флексибактериями,
вибрионами (Celtvibrio). Миксобактерии и спороцитофаги разлагают
клетчатку, крахмал, альгиновую кислоту, глюкозиды. Хитин
разрушают представители родов Lysobacter и Вепескеа, агар - Algino-
monas, Vibrio, Agrobacterium, Cytophaga, Sporocytophaga.
В микроаэрофильной зоне (слой воды 2-3 м), где
присутствуют одновременно кислород, водород, метан, сероводород, закис-
ные формы железа и марганца, функционируют водородокисля-
ющие, метанокисляющие, тионовые, железобактерии,
некоторые формы фотосинтезирующих бактерий.
В анаэробной зоне, в поверхностном слое ила обитают
скользящие, либо прикрепленные к субстрату формы бактерий: флек-
сибактерии, нитчатые серные - Beggiatoa, Thiothrix, зеленые
скользящие фототрофные нитчатые бактерии, факультативно-
анаэробные цитофаги Cytophaga succinicans и Cyt. fermentas,
строго анаэробные виды рода Fusobacterium, нитчатые бактерии
родов Pelonema, Peloploca, Leucothrix, железобактерии - Metallo-
genium, Hyphomicrobium, Seliberia. Здесь же были обнаружены
9
факультативно-анаэробные виды бацилл - Bacillus polymyxa и
Вас. circulans, и сульфатредукторы. Анаэробный распад в
поверхностном слое ила осуществляют клостридии,
сульфатредукторы и энтеробактерии. В качестве конечных продуктов
образуются жирные кислоты, Н2, С02, спирты, ацетат, лактат.
Еще ниже расположена ниша сульфатредуцирующих и мета-
нобразующих бактерий. Здесь идет анаэробный распад
опустившегося на дно фитопланктона и остатков водной растительности
с образованием Н2, С02 и уксусной кислоты, которые служат
источником для образования метана бактериями вида Methanosar-
cina barkerii и других видов метаногенов. Сульфатвосстанавлива-
ющие бактерии - постоянные спутники метаносарцины, они
обусловливают как анаэробные условия, так и снабжение
восстановленными соединениями серы.
Таким образом, в акваториях существует четкая
стратификация микробных сообществ, определяемая освещенностью,
газовым режимом, солевым составом. Поэтому каждой зоне
соответствуют свои специфические эколого-трофические и
таксономические группы бактерий. Все вышеприведенные сведения
взяты из книги В.М. Горленко, Г.А. Дубининой и СИ. Кузнецова
"Экология водных микроорганизмов" (1977). Они необходимы
для последующего сравнения структуры и организации
бактериальных сообществ почв. Несколько забегая вперед, можно
сказать, что в почве бактерии не только не плавают в воде (за
исключением пойменных почв во время паводков или рисовников),
а, наоборот, прочно адсорбированы на почвенных частицах,
корнях растений, поверхности гиф грибов, создавая тем самым
огромное количество мезо- и микролокусов, которые определяют,
в конечном счете, разнообразие почвенных бактериальных
сообществ. Кроме того, совсем другие факторы определяют
вертикальное распределение бактерий, так как почва - сложная и
гетерогенная среда, в которой одновременно присутствуют
жидкая, твердая и газообразная фазы. Исходя из вышесказанного,
логически можно предсказать наличие совсем других адаптивных
особенностей почвенных бактерий в отличие от водных.
Хочется отметить, что большинство родов бактерий, приведенных
выше в качестве типичных водных форм, либо вообще не
обнаружены в почве, либо встречаются в качестве минорных
компонентов в гидроморфных почвах. В то же время, некоторые бактерии
"перекочевали" из воды в почву, при этом ключевую роль
сыграли наземные растения и почвенные животные - те экониши, в
которые переселились бактерии из водных растений и животных.
Особое место среди бактерий акваторий занимают фото-
трофные прокариоты. Их систематика и экология подробно рас-
10
смотрены в книге Е.Н. Кондратьевой "Автотрофные
прокариоты" (1996). Все они типично водные организмы, обитающие в
озерах, прудах, заболоченных участках рек, лиманах, серных
источниках, морских бухтах и заливах. Они могут расти как в
толще воды, так и на поверхности ила и подводных предметах. Эта
группа бактерий также практически не обнаруживается в почвах
за исключением некоторых родов пурпурных несерных
бактерий, которые выделяются исключительно из залитых водой почв
рисовников. Все новые роды аэробных аноксигенных фототроф-
ных бактерий, описанные в настоящее время и представляющие
особую ветвь эволюции, выделены также из водных сред. Два
рода - Erythrobacter и Roseobacter - морские, и шесть
пресноводные - Erythromicrobium, Roseococcus, Porphyrobacter, Acidiphilum,
Erythromonas и Sandaracinobacter (Yurkov, Beatty, 1998). И лишь
оксигенные фототрофные цианобактерии являются эвритопны-
ми. Цианобактерии настолько широко расселились по разным
биотопам, что невозможно перечислить все их местообитания: от
горячих источников до снега и почв, от поверхности водорослей
и высших водных растений до коры деревьев и вулканической
лавы (Кондратьева, 1996). Анализу роли цианобактериальных
сообществ в становлении всей прокариотной системы в настоящей
книге посвящена отдельная глава.
Недавно описанная группа специфических анаэробных фото-
трофных бактерий - гелиобактерии - позволяет предположить
эволюцию и переход к наземному образу жизни и среди других
фототрофных бактерий. Описанные в 80-е годы XX в. роды
Heliobacteriwn и Heliobacillus (Определитель..., 1997), по составу
пептидогликана оказались ближе к грамположительным
бактериям, чем грамотрицательным. На основании анализа 16S рРНК
подтвердилась их принадлежность к фирмакутам с низким
содержанием ГЦ. Наряду с бациллами и клостридиями к таким
грамположительным бактериям относятся роды Sporomusa, Seleno-
monas, Megasphaera и др., которые по строению клеточной
стенки похожи на грамотрицательные формы, а по ее составу -
на грамположительные, более того, у некоторых видов найдены
даже эндоспоры. В отличие от других фототрофных прокариот
гелиобактерии были обнаружены не только в почвах
рисовников, но и в аридных почвах (Кондратьева, 1996). Гелиобактерии -
пример приспособления анаэробных фототрофных бактерий
к существованию в наземной среде, благодаря формированию
у них грамположительной клеточной стенки, более устойчивой
к периодическому высушиванию, и появлению эндоспор. Новые
формы спорообразующих гелиобактерии, имеющие спиральную
форму и отнесенные к новому роду и виду Heliospira daurica, бы-
11
ли выделены из содовых озер (Gorlenko et al., 1997). Новый род
оказался филогенетически близок к спорообразующим сульфат-
редукторам Desulfobacterium dehalogens.
По данным большинства авторов, полученным как на
основании посева воды, водных растений и органов животных на
питательные среды, так и путем прямой электронной
микроскопии, в водных средах доминируют грамотрицательные
бактерии - представители класса Proteobacteria. Под электронным
микроскопом видны вибрионы, длинные нитевидные формы,
бактерии с простеками, фимбриями, выростами, почкующиеся
бактерии (Константинова, Лаптева, 1979). Следует сказать, что в
большинстве публикаций, посвященных анализу
таксономического состава бактериальных сообществ акваторий,
используется для анализа, как правило, лишь верхний слой воды, а в
качестве питательной среды - мясо-пептонный агар (МПА). Спектр
бактерий, определенный таким образом, состоит из следующих
родов: Pseudomonas, Alcaligenes, Acinetobacter, Vibrio, Aeromonas,
Flavobacterium, Caulobacter.
Пространственная и сезонная динамика олиготрофных
бактерий лучше всего изучена на бактериях рода Caulobacter.
Показано, что эти бактерии ассоциированы с фитопланктоном, в ме-
зотрофных озерах они составляют 1-10% от общего количества
бактерий. В озерах олиготрофного и дистрофного типов они
доминируют в зоне скопления детрита и отмершего планктона.
Анализ сезонной динамики каулобактеров в Рыбинском
водохранилище выявил их максимальное количество летом - в мае и
конце июля (Лаптева, 1977, 1987). Численность бактерий этого рода
в водохранилищах на 1-3 порядка выше по сравнению с другими
сапротрофными бактериями (Беляев, 1967).
Для оценки распределения по глубине двух типичных
популяций бактерий в евтрофном озере были использованы методы
эпифлюоресцентной микроскопии и моноклональных антител
(Weinbauer, Hofle, 1998). Было показано, что популяции вида
Comamonas acidovorans сосредоточены в оксиэпинемноне, в то
время как Aeromonas hydrophila - в аноксигенном термоклине
(металимнон), т.е. в слое воды с наивысшей микробной
активностью. Исследуемые бактерии авторы дифференцируют также по
типам стратегий. Представители рода Aeromonas -
быстрорастущие г-стратеги (оппортунисты), в то время как бактерии рода
Comamonas - устойчивые к воздействию протист К-стратеги
(равновесные популяции).
За последние годы были описаны новые роды и виды проте-
обактерий, выделенных из акваторий. Многочисленные
дискуссии возникли при установлении местообитаний бактерий вида
12
Rahnella aquatilis (семейство Enterobacteriaceae). Первоначально
выделенные из воды, а затем из клинического материала и
пищи, бактерии этого вида, как оказалось впоследствии, широко
распространены в природе. Они были обнаружены также в
содержимом кишечника дождевых червей, улиток, слизней (Brenner
et al., 1998). Бактерии этого же вида были выделены в качестве
"психротрофных колиформ" из высокогорных почв (Horie et al.,
1985).
Представители семейства Vibrionaceae - род Shewanella -
также выделялись из разных биотопов - пресной и морской воды,
портящейся рыбы, фекалий и клинического материала.
Несмотря на установленную гетерогенность вида Sh. putrefaciens,
состоящего из 4 геновидов, были описаны еще два новых вида: Sh. alga
(галотолерантный) и Sh. baltica (Ziemke et al., 1998). Бактерии
этого рода играют важную роль в превращениях органического
вещества в анаэробных условиях, сопровождающихся
восстановлением Fe+3, МП+4, NOJ. В результате проведения эколого-гео-
графических исследований неизбежно возникает вопрос:
является один и тот же вид эвритопным или существует множество
разных видов, приуроченных к разным местообитаниям, но не
различающихся по фенотипическим признакам?
Широко распространенными в пресных водах, но только в
1980-е гг. описанными, являются уникальные микроорганизмы,
составляющие отдельную ветвь в бактериальном царстве -
порядок Planctomycetales. Это почкующиеся бактерии, образующие
розетки, имеющие кратерообразные структуры на поверхности
клеточной стенки и не содержащие пептидогликан. Отсутствие
пептидогликана сближает эти бактерии с хламидиями и мико-
плазмами, а наличие у планктомицетов ядерных тел,
окруженных мембраной - с эукариотами. Планктомицеты представляют
особый интерес с точки зрения молекулярной эволюции и
клеточной биологии (Fuerest, 1995). Выделенные в чистую культуру
планктомицеты включают 4 рода и 7 видов. Они обнаружены не
только в пресной воде, но и в гиперсоленых лагунах и
термальных источниках. Планктомицеты обладают уникальным
скользящим движением, неизвестным среди почкующихся бактерий, и
фототаксисом, необычным для гетеротрофов. Возможно, что
это связано с их адаптацией к обитанию в цианобактериальных
матах, из которых они были выделены. Использование этими
бактериями N-ацетилглюкозамина предполагает их возможную
роль в деградации хитина в водных экосистемах (Fuerest, 1995).
Из грамположительных бактерий из водных сред
выделяются представители родов Corynebacterium, Mycobacterium, Micro-
13
coccus, Curtobacterium, Brevibacterium. Молочнокислые бактерии
обнаруживаются в иловых отложениях пресноводных водоемов и
в пищеварительном тракте рыб (Квасников и др., 1977). В
донных осадках озер велика также численность целлюлолитических
бактерий, как анаэробных, так и аэробных. В качестве
характерных бинарных культур целлюлолитиков называются пары
Clostridium cellobioparum и Bacillus polymyxa (Луста, Намсараев,
1988).
В последнее время в связи с появлением проблемы
глобального истощения биологического разнообразия начались
комплексные исследования по изучению биоты в разных регионах
России. Особый интерес представляет Байкальский регион.
Ложе Байкала и его водосборного бассейна, расположенного на
Центральноазиатском плато, относится к одному из самых
древних участков земной суши. Результаты изучения разнообразных
групп растений, животных и микроорганизмов в водных и
наземных экосистемах этого региона изложены в монографии
"Биоразнообразие Байкальской Сибири" (1999).
В воде и донных осадках оз. Байкал изучены различные
группы фототрофных, хемолитотрофных и гетеротрофных
бактерий. С помощью специфических иммунных сывороток
определены на видовом уровне метанобразующие, метанокисляющие и
сульфатредуцирующие бактерии. Что касается характеристики
сапротрофного комплекса бактерий в воде озера, то, несмотря на
длинный список видовых названий (более 150 видов), трудно
сделать какие-либо выводы о специфичности, либо доминировании
отдельных родов или видов в этом биотопе. Это связано с тем,
что, как отмечают и сами авторы (Козырева и др., 1999),
представленные данные являются обобщением литературных сведений
по таксономическому составу бактерий, определенных в разное
время, разными методами, по разным определителям. Можно,
однако, отметить, что наибольшее число перечисленных видов
принадлежит к родам Pseudomonas и Bacillus, т.е. наиболее
изученным и широко распространенным во многих биотопах.
Бактерии, определенные молекулярно-генетическими
методами в пробах воды оз. Байкал, были отнесены к видам: Caulo-
bacter crescentus, Caulobacter subvibrioides, Flavobacterium ferrug-
ineum, Escherichia colif Bacillus mycoides (Белькова и др., 1996).
Если каулобактеры являются характерными обитателями
акваторий, то Escherichia coli (индикатор загрязнения воды) и Вас.
mycoides (типичный педобионт), представляются случайно
занесенными из других биотопов. Большая часть бактерий не были
идентифицированы, так как отличия от наиболее близких
последовательностей из EMBL-банка составили 3-15%, что может свиде-
14
тельствовать о принадлежности водных бактерий к новым
таксонам, либо к видам с еще не определенной последовательностью
16S рРНК.
При установлении таксономической принадлежности
бактерий, выделенных из поверхностного слоя осадков озера на
основании анализа структуры фрагментов гена 16S рРНК, было
установлено наличие 15 видов бактерий, относящихся к родам
Gallionella, Xanthomonas, Pseudomonas, Vibrio, Caulobacter,
Escherichia, Propionibacterium, Actinomyces (Козырева и др., 1999). В
полученном списке родов бактерий необходимо также разобраться
с точки зрения выявления аборигенов и представителей аллох-
тонной микрофлоры, что практически невозможно без
определения структуры сообщества (количественного соотношения
таксонов). При определении биоразнообразия бактерий на
различных глубинах оз. Байкал на основании последовательности
16S рРНК (Денисова и др., 1999) было показано, что большая
часть выявленных бактериальных последовательностей имеет
очень низкое сходство с известными последовательностями. На
филогенетическом дереве такие последовательности образуют
отдельные кластеры, что предположительно указывает, по
мнению авторов, на эндемичную природу соответствующих
бактерий. Однако полученные результаты не дают пока никакой
новой информации, касающейся особенностей биологии и
экологических функций этих бактерий.
Уникальными водными экосистемами являются содовые
озера, для которых характерны высокая концентрация солей и
щелочные условия. В последнее время содовые озера вызывают
особый интерес исследователей в связи с проблемами
формирования и функционирования биотических сообществ в
экстремальных условиях, а также вопросами возникновения и
эволюции прокариотных сообществ на Земле. Результаты
микробиологических исследований в содовых озерах Забайкалья, а также
содовых озерах других регионов и континентов изложены в
обзорах (Бархутова и др., 1999; Заварзин, 1993; Заварзин и др., 1999;
Zavarzin, Zhilina, 2000). Авторам удалось показать, что алкало-
фильное сообщество включает представителей основных
филогенетических ветвей - цианобактерий, аэробных и анаэробных
архей, протеобактерий, спирохет, грамположительных бактерий
(Clostridiaceae, Bacillaceae) - и составляет полноценную
функциональную систему. Описаны новые таксоны среди сульфатредук-
торов, гомоацетогенов и метаногенов. Из высокощелочных
содовых озер, а также морских водоемов, были выделены новые
формы сероокисляющих гетеротрофных бактерий, которые
оказались способными окислять не только тиосульфат, но также
15
сульфид и элементную серу. Описано два новых рода -
уникальный сульфит-окисляющий нейтрофил Sulfitobacter и алкалофиль-
ная эритробактерия Roseinatronobacter. К классу протеобактерий
(подгруппе гамма) принадлежат и выделенные из содовых озер
Забайкалья, Кении и США новые облигатно автотрофные тио-
новые бактерии, представляющие неизвестную ранее алкало-
фильную ветвь (Сорокин, 2000).
Бактерии в речных экосистемах изучены в значительно
меньшей степени, чем в озерах, что связано, вероятно, с проточно-
стью и, следовательно, нестабильностью микробных сообществ,
а также постоянным привнесением в реку различных веществ и
микроорганизмов из других биотопов.
Анализ более 900 культур аэробных гетеротрофных
бактерий, выделенных из донных осадков и воды лесной реки,
протекающей в штате Теннесси (США), показал явное доминирование
в этих субстратах грамотрицательных бактерий - 66,7% (Halda-
Alija, Johnston, 1999). Определение культур до рода проводилось с
помощью трех классических микробиологических тестов -
системы API и ARDRA (рестрикционный анализ амплификатов ри-
босомальной ДНК) и анализ жирных кислот. Выделенные
культуры были отнесены к родам Pseudomonas, Flavobacterium, Chro-
mobacterium, Acinetobacter, Alcaligenes, Aeromonas, Methylobacte-
rium, Enterobacter и др. Из грамположительных бактерий были
обнаружены Micrococcus, Corynebacterium, Bacillus, Sporolacto-
bacillus. Проведенные авторами исследования показали, что на
таксономический состав и выживаемость бактерий в реках
влияют температура воды и хищничество, связанные с сезонностью.
Так, зимой, по сравнению с летним сезоном, уменьшалась
численность бактерий Enterobacter, Alcaligenes, Aeromonas и
грамположительных бактерий. Из 123 изолятов 35%
грамотрицательных бактерий и 72% грамположительных бактерий были не
способны к росту при температуре +4 °С. Зимой в воде
доминировали бактерии рода Pseudomonas, все они росли при температуре
+4°С.
В связи с изучением влияния загрязнения рек на состав
бактериальных сообществ были проведены исследования на р. Арге в
Испании (Goni-Uriza et al., 1999). Пробы отбирались в верхнем и
нижнем течении реки, на разных расстояниях от источника
антропогенного загрязнения. Было выделено 409 штаммов
бактерий и установлено, что наиболее часто встречающимися на всех
участках реки были бактерии рода Aeromonas, которые
считаются убиквистами пресных вод. Плотность бактерий родов
Aeromonas, Pseudomonas, Shewanella, Comamonas и Xanthomonas
также не зависела от места взятия образца. В качестве минорных
16
компонентов выделялись Vibrio и Chryseomonas. Доля бактерий
семейства Enterobacteriaceae значительно увеличивалась на тех
участках реки, которые находились близко от источника
загрязнений. Интересующий нас аспект этой работы, связанный с
анализом таксономического состава бактериальных сообществ рек,
заключается в выводе о доминировании и разнообразии в реках
бактерий, принадлежащих к группе грамотрицательных
бактерий (класс Proteobacteria).
Анализ сезонной динамики состава бактериальных
сообществ в воде р. Протвы (Головченко и др., 2000) показал, что ее
постоянными обитателями являются спириллы (род Aquaspiril-
lum). Они доминировали как в летний, так и в зимний сезоны.
Осенью в речной воде преобладали скользящие бактерии - цито-
фаги и миксобактерии, что связано с поступлением
растительного опада в реку в этот сезон. В целом разнообразие бактерий
в воде было гораздо ниже, чем в других субстратах водных
экосистем (растения, ил, пойменные почвы). Представители
семейства Vibrionaceae, которые считаются характерными
обитателями акваторий, доминировали не в воде, а в фитосфере водных
растений, они были обнаружены также в качестве минорных
компонентов в иле.
В морях проведено значительно больше
микробиологических исследований, чем в пресноводных водоемах. В обзоре
И.Е. Мишустиной (1978), посвященном анализу
таксономического состава гетеротрофных бактерий в морях, приводятся списки
родов бактерий, в состав которых кроме тех, которые постоянно
обнаруживаются и в озерах, входят специфические формы,
характерные только для моря. Это связано прежде всего с хлоридно-
сульфатным (NaCl и MgS04) составом океанской воды.
Большинство морских микроорганизмов требуют наличия 3% NaCl
в среде.
В перечне родов бактерий в качестве наиболее типичных для
морей называются: Alteromonas, Photobacterium, Beneckea, Deleya,
Spirochaeta, Thiobacillus, Nitrosospira, Nitrosococcus. В
пограничной полосе моря (литораль), где органическое вещество
представлено водорослями, доминируют скользящие бактерии семейства
Cytophagaceae. Они гидролизуют агар, альгиновую кислоту,
хитин, целлюлозу. Многие виды, разрушающие эти субстраты,
принадлежат к родам Saprospira, Herpetosiphon и Flexibacter и
требуют морской соли для роста (Мишустина, 1978). В донных
отложениях морей, пресных и соленых водоемов много кек метаногенов,
так и метанокисляющих бактерий. Доля метанотрофных
бактерий в донных осадках Черного моря 19-40%, в воде - 9-10%.
Процесс аэробного окисления метана в донных отложениях и
17
водной толще Черного моря ограничен верхними осадками шель-
фовой зоны и кислородсодержащими водами. Метилотрофные
бактерии представлены там следующими родами: Methylobacter
(30-45%), Methylomonas (19-25%), Methylocystis (2-8%), Methylo-
sinus (5-26%), Methylococcus (2-7%) (Гальченко и др., 1988).
Характерными для морей считаются светящиеся фотобактерии,
представленные родами Вепескеа, Lucibacterium, Photobacterium
(Воробьева, Медведева, 1981).
В прибрежных водах Индии было подсчитано соотношение
грамотрицательных и грамположительных форм бактерий
(Alavandi, 1989). Оно составило 88% в пользу первых, среди них
пигментных видов - 23%. Частота встречаемости родов протео-
бактерий была следующей (%): Pseudomonas - 13, Aeromons - 13,
Moraxella - 8, Flexibacter -10.
Гипотеза о том, что микроорганизмы моря не являются
пришельцами с суши, а присущи морской среде изначально, была
высказана в конце XIX в. (Fischer, 1894). Все последующие
исследования подтверждали эту гипотезу. Было описаны множество
бактерий, характерных исключительно для морских экосистем.
Самая последняя сводка данных по таксономическому составу
бактериальных сообществ морских экосистем приведена в книге
"Морские микроорганизмы и их вторичные биологически
активные метаболиты" (Михайлов и др., 1999). Роды Alteromonas, Pseu-
doalteromonas, Colwella, Idiomarina, являющиеся типично
"морскими", было предложено объединить в семейство Alteromonada-
сеае (Иванова, Михайлов, 2001). Типичными обитателями морей
являются также представители родов Oceanospirillum, Deleya,
Halomonas, Acinetobacter, Moraxella, Psychrobacter, Mesophylo-
bacter, Alysiella, Branhamella, Chromobacterium и Janhtinobacterium.
В то же время роды Aeromonas, Allomonas, Plesiomonas, хотя и
могут быть выделены из морских сред, более широко
распространены в пресных водоемах, многие из них вызывают болезни рыб
(Михайлов и др., 1999).
В связи с олиготрофностью морских вод многие виды
морских микроорганизмов приурочены к местам развития
водорослей и поселений морских животных. По приуроченности к
разным экологическим нишам бактерии могут быть разделены на
несколько групп: 1) приуроченные к ареалам расселения
животных, 2) ассоциированные с водорослями прибрежных и
открытых районов, 3) связанные с частицами детрита микробные
сообщества водной толщи, илов литорали, шельфа и батиали, 4)
связанные с деятельностью других микроорганизмов (Bdellovibrio) и
др. (Мишустина, 1978). В каждой из этих ниш складывается свой,
специфический состав бактериальных сообществ.
18
Известны множественные симбиозы между бактериями и
морскими животными. Так, например, симбиоз между серными
хемолитотрофными бактериями и погонофорами, а также
моллюсками, в которых эти бактерии поселяются на поверхности и
в тканях жабр. Черви и моллюски поглощают сероводород и
кислород жабрами. Их кровь может переносить и H2S и 02, в
результате происходит снабжение бактерий этими газами, в трофо-
сомах погонофор найдены также метанокисляющие бактерии
{Methylococcus и Methylomonas). Червь использует в качестве
питания органические вещества, образуемые бактериями при
окислении метана. Их питание зависит от поглощения метана
бактериями (Рейнхаймер, 1995). Для пищеварительного тракта мидий
наиболее характерными оказались факультативно-анаэробные
бактерии Vibrio и Aeromonas из протеобактерий, из грамположи-
тельных - Propionibacterium и Bacillus (Щеглова, Щеглов, 1995).
В отдельных видах губок (Verongia) бактерии заполняют до 38%
объема тканей животного. Эти бактерии представлены родами
Photobacterium (26%), Bacillus (23%), Pseudomonas (11%), Flavo-
bacterium (6%), Acinetobacter (4%), Micrococcus (5%), Moraxella
(0,5%). В воде и грунте также преобладали грамотрицательные
бактерии, доминировали Vibrio и Aeromonas, но соотношение
этих родов другое, чем у бактерий, ассоциированных с
животными (Иванова, Шевченко, 1995).
Исследования, проведенные в Марсельской лаборатории
морской микробиологии (Бианки, 1995), показали, что чаще
всего ассоциированы с животными вибрионы. Бактерии рода Vibrio
составляют больше половины от той суммы бактерий, которые
вступают в различные отношения с морскими позвоночными
и беспозвоночными животными. Вибрионы разлагают хитин
и ткани мертвого организма, выделяют факторы роста. У
моллюсков Японского моря они вызывали болезнь, называемую
"коричневое кольцо". В целомической жидкости мидий 67%
приходится на долю светящихся бактерий Photobacterium, 20% -
Aeromonas и 12% - Vibrio. Светящиеся бактерии находятся в
тесной ассоциации с бентосными животными - обитателями
коралловых рифов. Они регулярно встречаются на поверхности тела
и в кишечнике многих донных животных, но ни с одним не
связаны облигатно, доминирует среди них Vibrio harvey. В рыбах
преобладают светящиеся бактерии рода Photobacterium. Они
составляют от 0,1 до 10% от общей численности бактерий в водах
и до 60-70% в лагунах коралловых рифов. Более 50% рыб и
головоногих моллюсков содержат светящиеся бактерии в
кишечнике. Светящиеся бактерии способны разлагать хитин,
входящий в состав тел морских животных. Разные виды светящихся
19
бактерий приурочены к разным животным (Гительзон,
Воробьева, 1988).
В то же время в большинстве образцов воды превалировали
псевдомонады, которые исчезали в глубоких отложениях. Кори-
неподобные бактерии практически не обнаруживались в воде, их
больше было в осадках, но они составляли не более 10% от
общего числа бактерий. Эта группа, доминирующая в почве,
обнаруживается в морях в качестве минорных компонентов. Из 53
выделенных штаммов 20 были отнесены к роду Brevibacterium, 18 -
Cellulomonas, 8 - Corynebacterium, 7 - Arthrobacter (Бианки, 1995).
Из морской воды выделяются также нокардиоподобные
бактерии Nocardia и Rhodococcus, из морского грунта - виды Rhodo-
coccus maris, /?. marinonascens и R. rhodochrous. Однако все
Корине- и нокардиоподобные бактерии составляют минорную часть
морских бактериальных сообществ, их доля не превышает 10%
жизнеспособной микрофлоры. Среди бацилл в отложениях
доминировала группа видов Bacillus subtilis, В. licheniformis, В. pumilis,
B.firmus, В. lentus, В. badius. Однако лишь один вид бацилл
можно причислить к морским - В. marinus (Михайлов и др., 1999).
В морской воде обнаруживаются также микрококки, они
представлены видами Micrococcus roseus, M. agilist M. sedentarius.
Редко выделяются микрококки родов Planococcus и Aerococcus. В
целом, грамположительные бактерии составляют меньшую по
численности и разнообразию комплексов часть микроорганизмов
океанов Земли по сравнению с грамотрицательными, в отличие
от в почвы (Михайлов и др., 1999).
С морскими водорослями ассоциированы агаролитические
бактерии. Деструкторами штормовых выбросов макрофитов
являются бактерии родов Cytophaga, Flavobacterium, а также
представители коринеподобных бактерий (Nocardiat Arthrobacter,
Corynebacterium) и анаэробные спорообразующие бактерии рода
Clostridium (Кондратьева, Тен Хак Мун, 1995). Наиболее
активными гидролитиками являются цитофаги и нокардии. Они
расщепляют агар, каррагенан, ламинарии, целлюлозу, хитин.
Описаны новые роды, близкие к цитофагам - Lewinella и Polaribacter
(Sly et al., 1998; Gosink et al., 1998), а также новые виды агароли-
тических цитофаг и флавобактерий (Кондратьева, 1996).
Наиболее интересной в плане обобщения
бактериологических исследований по водным экосистемам является работа
(Allen et al., 1983), в которой приводится пространный перечень
доминирующих и минорных компонентов в бактериальных
сообществах воды, осадков, водорослей, рыб и зоопланктона. Была
собрана коллекция из 600 штаммов, выделенных из
вышеперечисленных биотопов. В результате определения по 124 призна-
20
кам вся коллекция была разделена на 14 кластеров.
Доминировали: Acinetobacter calcoaceticus, Aeromonas hydrophila, Aeromonas
salmonicida (на погибающей рыбе), Alcaligenes sp., Enterobacter
aerogenes, Escherichia coli, Hafnia alvei, Pseudomonas fluorescens,
Serratia sp., Vibrio feuvialis, Yersinia. Таким образом, в составе
бактериальных сообществ водных экосистем доминировали
исключительно протеобактерии, среди которых большую часть
составляли факультативно-анаэробные бактерии из семейств Entero-
bacteriaceae и Vibrionaceae. Новые виды бактерий из семейства
Enterobacteriaceae, принадлежащие к родам Ewingella (Е. america-
па) и Serratia (S. fonticola), были выделены из моллюсков (Muller
et al., 1995 а, б).
Анализ психрофильных и барофильных бактерий морских
глубин показал их принадлежность к одному из родов у-под-
класса протеобактерии: Shewanella, Photobacterium, Colwella,
Moritella. Предполагается, что генотип, связанный с барофилией,
возникал независимо среди представителей различных родов
этого класса (De Long et al., 1997). К у-подклассу протеобактерии
принадлежат и выделенные из морских осадков Средиземного
моря в качестве нового вида бактерии Ferrimonas balearica,
активно участвующие в восстановлении железа. Филогенетически
бактерии этого вида связаны с представителями таксонов
Shewanella, Vibrio marinus, Alteromonas haloplanktis (Rossello-Mora et al.,
1995).
Из воды и льда морей Арктики и Антарктики изолированы и
описаны в качестве новых родов и видов бактерии Octadecabacter
arcticus и О. antarcticus, также принадлежащие к классу
протеобактерии (Gosink et al., 1997). Бактерии Mesophilobacter marinus,
близкие к родам Moraxella, Acinetobacter и Psychrobacter, также
являются типичными для морей. Они способны расти в среде,
содержащей 20 г NaCl и 10 г MgCl2 (Nishimura et al., 1989).
Интересным объектом, с точки зрения дифференциации
бактерий на морские и наземные на видовом уровне, является род
Agrobacterium. Так, к морским видам, образующим
звездообразные агрегаты, относятся виды A. atlanticum, A. ferrugineum,
A. gelatinovorum, A. meteori и A. stellatum, к наземным - A. tumefa-
ciens, A. rhizogenes, A. rubi, A. vitis. На основании всех тестов, в том
числе и 16S рРНК, предлагается реклассифицировать морские
виды Agrobacterium и создать для них новые роды - Ruegeria,
Stappia и Ahrensia. Название Agrobacterium предполагается
оставить только для наземных видов (Joshihito, 1998). Возможно, что
интенсификация усилий в проведении подобных исследований
поможет более четко разграничить морские и наземные
бактерии, придав им разный таксономический статус.
21
Следует отметить, что в качестве минорных компонентов
в бактериальном сообществе водных экосистем называют (Allen
et al., 1983) следующие таксоны: из протеобактерий - Agrobacte-
rium, Erwinia, Cytophaga, Flavobacterium, Flexibacter, Klebsiella,
Moraxella, из грамположительных бактерий - Arthrobacter,
Micrococcus, Staphylococcus, Bacillus. Большинство бактерий, которые
перечислены как минорные компоненты бактериоценозов
водных экосистем, являются, как будет показано ниже,
характерными и часто доминирующими членами бактериальных сообществ
в разных субстратах и локусах наземных экосистем - ризосфере,
подстилке, кишечнике почвенных беспозвоночных, почве. Таким
образом, создается основа для последующего анализа расселения
"водных" бактерий по различным наземным местообитаниям.
1.2.ЦИАНО- И А Л ЬГО БАКТЕРИАЛЬНЫЕ
ВОДНЫЕ СООБЩЕСТВА
Самые древние прокариотные сообщества - цианобактери-
альные - относятся к докембрийскому периоду, что было
доказано путем анализа строматолитов - биогенных пород, главными
агентами формирования которых были цианобактерии.
Предполагается также, что все бактерии, представляющие собой
окружение центрального ядра, состоящего из фототрофных
цианобактерии - первых продуцентов органического вещества -
появились одновременно с цианобактериями (Заварзин, 1990а).
Поскольку цианобактерии, судя по ископаемым формам, мало
изменялись в течение истории Земли, можно рассматривать
современные биоценозы с доминированием цианобактерии, как
реликтовые. Анализу формирования цианобактериальных
сообществ, соотношения эколого-трофических групп бактерий в нем,
исследованию алкалофильных микробных сообществ как
центров происхождения наземной микрофлоры посвящены работы
Г.А. Заварзина с сотрудниками (Заварзин, 1990а, 1993; Заварзин
и др., 1999). В этих публикациях было показано, что грамотрица-
тельные бактерии, большинство которых объединены в класс
Proteobacteria, составляют окружение центрального ядра из
цианобактерии и разлагающих их некромассу организмов.
Каков же реальный спектр таксонов протеобактерий,
выявляемый при анализе современных цианобактериальных матов?
Сравнение послойного распределения микроорганизмов в гало-
фильных матах из различных местообитаний показало их
значительное сходство (Венецкая, Герасименко, 1988). Для матов
характерно наличие трех зон, имеющих специфический состав
бактерий: оксигенного фотосинтеза с цианобактериями, анокси-
22
генного фотосинтеза с пурпурными и зелеными бактериями и де-
струкционной зоны с сульфатредукторами и метанобразующи-
ми бактериями. Электронно-микроскопическое изучение
послойной структуры галофильных матов лагун Арабатской
стрелки позволило выявить большое разнообразие микроорганизмов:
1-й слой - Microcoleus chtonoplastes; 2-й слой - флексибактерии
Chloroflexus, простекобактерии; 3-й слой - Chromatium, Thiocystis,
Thiocapsa, Pelodicton, Beggiatoa, а также несерные пурпурные -
Rhodopseudomonas и спирохеты; 4-й слой - Desulfovibrio, Methano-
galobium.
Электронно-микроскопический анализ микроорганизмов в
альгобактериальном мате из термального сульфидного
источника около оз. Байкал позволил также выявить в 1-сантиметровой
толще мата чередование по вертикали четырех слоев с
постепенной заменой одних таксономических форм другими (Юрков,
Горленко, 1989). Указывается на постоянную ассоциацию
термофильных нитчатых зеленых бактерий с термофильными циа-
нобактериями. Альгобактериальные маты исследовались и в
пресноводных системах, где они формировались при умеренных
температурах в области выходов горячих грифонов (термальная
площадка р. Большая; Юрков, Горленко, 1990). В состав матов
входят цианобактерии, диатомеи, пурпурные бактерии Thiocapsa
roseopersicina и Rhodopseudomonas palustris. Из альгобактериаль-
ного мата был выделен новый вид пресноводных аэробных
бактерий Erythrobacter sibiricus. Род Erythrobacter является
родственником несерных пурпурных бактерий и представляет особый
интерес с точки зрения таксономии и эволюции. Свет -
дополнительный источник энергии для этих аэробных фототрофов, не
выделяющих кислород в процессе фотосинтеза. Впоследствии
были описаны еще 6 родов пресноводных и один род морской
аэробных фототрофных бактерий (Yurkov, Beatty, 1998).
Изучение алкалофильных сообществ содовых озер,
представляющих, по мнению Г.А. Заваризна с соавторами (Заварзин
и др., 1999), аналог прокариотных сообществ, развивавшихся
1 млрд лет тому назад, показало, что в цианобактериальных
матах, формирующихся в этих озерах, обитают 34 вида
цианобактерии, принадлежащих к пресноводным бентосным формам.
Мат имел толщину 10 мм, в нем различались 4 слоя, его
структура практически соответствовала матам - предшественникам
строматолитов. В одном из слоев также доминировали
пурпурные бактерии Chromatium и Rhodopseudomonas, Наличие
фототрофных пурпурных бактерий является одной из характерных
черт микробного сообщества этих водоемов. В центральноази-
атских содовых озерах В.М. Горленко обнаружил массовое раз-
23
витие уникальных анаэробных фототрофных гелиобактерий,
отнесенных к новому роду - Heliospira daurica. Культура имеет
ярко-зеленый цвет и содержит бактериохлорофилл g.
Это облигатный алкалофил с оптимумом рН 9. Гелиобактерий -
грамположительные фототрофы, филогенетически
относящиеся к кластеру клостридий с АТ-типом ГЦ. Основная функция
аноксигенных фототрофов, к которым относятся как
пурпурные, так и гелиобактерий, - анаэробное окисление сульфида,
образуемого сульфатвосстанавливающими бактериями,
сопряженное с вторичной продукцией органического вещества (Заварзин
и др., 1999). Мы не будем обсуждать ту схему трофических
отношений в алкалофильном сообществе содовых озер и
таксономический состав разных функциональных групп, которые
приводятся в цитируемой выше работе, так как нас интересуют
только те группы бактерий, которые тесно связаны с цианобактери-
ями или водорослями.
Итак, из опубликованных экспериментальных материалов,
посвященных анализу таксономического состава
бактериальных сообществ циано- и альгобактериальных матов, следует,
что основными компонентами этих сообществ являются проте-
обактерии, среди которых доминируют различные группы
фототрофных аноксигенных бактерий. Другие типы бактерий и
возможные схемы функционирования этих сообществ
приводятся скорее как гипотетические (Заварзин, 1989, 1990а, в,
1993), не подкрепленные экспериментальным всесторонним
исследованием таксономического состава с выделением и
идентификацией разнообразных таксонов бактерий, с учетом доли
таксонов в сообществе, сезонной динамики и прочих факторов,
необходимых для выявления таксономической структуры
сообщества. Практически осуществление такого исследования
почти невозможно, так как требует не только мониторинга за
сообществами в таких экзотических районах, как места
расположения гидротермальных источников или содовых озер, но и
привлечения специалистов разного профиля.
Следует учитывать, что цианобактериальные маты
сохраняются в настоящее время лишь в таких экзотических биотопах,
как гиперсоленые морские лагуны, выходы термальных
источников, дно содовых озер и др. В то же время, цианобактерии вме^
сте с эукариотными водорослями, появившимися в венде, на
протяжении геологической истории постепенно завоевали
множество различных, в том числе и наземных, местообитаний.
Внеклеточные метаболиты водорослей являются основой
трофических связей водорослей с другими организмами и
обусловливают формирование вокруг клеток автотрофов специфиче-
24
ской экониши, определяемой в гидробиологии термином "фико-
сфера". Предполагают, что экскреция водорослями
органических соединений возникла в ходе эволюции и была в
значительной мере направлена на установление симбиотических
отношений между водорослями и гетеротрофными микроорганизмами
(Вольберг, 1988; Глаголева, 1991; Hellebust, 1974). Среди экзоме-
таболитов водорослей идентифицировано более 300 веществ,
относящихся к различным классам химических соединений, среди
которых преобладают углеводы, органические кислоты,
азотсодержащие вещества и липиды. В морских и пресноводных
водоемах 10-40% общей первичной продукции фитопланктона
выделяется в среду и ассимилируется гетеротрофами. Одним из самых
распространенных экзометаболитов водорослей является глико-
левая кислота. На среде с гликолатом было выделено более
400 видов бактерий, причем бактерии-спутники Chlorella vulgaris
утилизировали только гликолат, являющийся регулятором роста
водорослей (Chrost, Siuda, 1978).
Взаимодействие водорослей и бактерий определяется не
только продуктами экскреции водорослей, возможен обмен
витаминами, стимуляция процесса азотфиксации у цианобактерий
бактериями-спутниками, что связано с выделением ими факторов
роста и понижении концентрации кислорода (Зенова и др., 1995).
Чтобы изучить взаимодействие организмов в симбиозах,
необходимо создание модельных систем, в которых подбираются и
изучаются различные пары организмов. Такие исследования были
проведены с многочисленными лабораторными культурами
водорослей и бактерий. Так, в водных культурах зеленой
водоросли доминировали эрвинии, использующие в качестве субстрата
малат и сукцинат. На безазотистой среде были получены
искусственные азотфиксирующие ассоциации - Chlamydomonas rein-
hardii и Klebsiella pneumoniae (Nicolov et al., 1983) и Chlamydomonas
и Rhizobium leguminosarum (Dryanovska, Zakova, 1985). Причем, в
присутствии ризобий водоросль полностью сохраняла
хлорофилл, тогда как аксеничная культура желтела и лизировалась
уже на 30-е сутки. Такой же эффект наблюдали в первой
ассоциации, которая приобретала, кроме того, более высокую, по
сравнению с аксеничной культурой бактерий, азотфиксирующую
активность. Симбиоз водорослей и бактерий приводит к задержке
процесса старения у водоросли, увеличивая продолжительность
ее стационарной фазы и сохраняя высокое содержание
пигментов и скорость фотосинтеза (Штина, Панкратова, 1974).
Возможно, что бактерии разлагают автоингибиторы роста водорослей,
накапливающиеся в стационарной фазе их роста (Вольберг,
1988).
25
Продукты экскреции водорослей могут служить сильными
аттрактантами для бактерий. Так хемотаксис азоспириллы
наблюдался по отношению к экзометаболитам водоросли Halo-
chlorella rubescens, среди которых преобладали фумарат, малат и
сукцинат (Reinold et al., 1985). Состав культуральной жидкости
водорослей Spirulina, Chlamydomonas и Chlorella определял
доминирование того или другого таксона бактерий-спутников
(Кондратьева, Пименова, 1976). При изучении видового состава
бактерий, сопутствующих микроводорослям в культуре (Борисова,
1996), было показано, что бактерии представлены в среднем
7-12-ю видами. В нестерильных условиях открытых установок
для выращивания хлореллы доминировали псевдомонады
(36-88%) и флавобактерии (8-66%), остальные таксоны были
представлены родами Agrobacterium, Achromobacter, Alcaligenes,
Hyphomicrobium, Caulobacter. Спорадически выделялись Xantho-
monas, Serratia, Micrococcus. При выращивании хлореллы в
лабораторных и полупромышленных установках было выявлено
доминирование псевдомонад (51%), представленных 13-ю видами
(Леонова, 1968). Как постоянные спутники разных видов
водорослей (Phormidium, Tribonema, Chlorococcum и др.)
зарегистрированы Caulobacter, Hyphomicrobium и Rhizobium (Громов, 1964,
1967). Seliberia обнаружена на трихомах Nodularia spumigena
(Smarda, 1985). Был описан новый род почкующихся бактерий
Chamaesiphonosira cymbellicola, ассоциированный с диатомовыми
водорослями (Geitler, 1975).
Видовой состав бактерий, развивающихся в культуре
Chlamydomonas reinhardtii, практически не отличался от такового в
культуре Chlorella (Кондратьева, Пименова, 1976). Он включал
8 видов грамотрицательных бактерий: Pseudomonas stutzeri,
Ps. caudata, Ps. putida, Ps. aeruginosa, Ps. ambiqua, Agrobacterium
radiobacter, Achromobacter pestifer\ У 10 видов галофильных
водорослей Dunaliella в альгологически чистых культурах,
выделенных из разных местообитаний (соль из Мертвого моря, вода
соленых озер, засоленные почвы), были обнаружены в качестве
постоянных спутников экстремальные галофильные краснопиг-
ментные архебактерии Halobacterium sp., умеренно галофильные
эубактерии Pseudomonas mendocina и Alteromonas vaga, слабо га-
лофильный Rhodococcus luteus.
В лабораторных культурах цианобактерий были
обнаружены бактериальные спутники, относящиеся к 7 родам и 38 видам
(Андреюк и др., 1990). Преобладающими в слизи цианобактерий
были бактерии рода Pseudomonas, встречались также
представители родов Chromobacterium, Flavobacteriumt Rhizobium, Caulo-
bacter, Streptomyces, Micrococcus, Mycobacterium. По мере старе-
26
ния цианобактерий происходит уменьшение таксономического
разнообразия бактерий за счет выделения ими бактерицидных
веществ, в результате чего остаются лишь облигатные спутники
цианобактерий.
Подведем итоги проведенного выше анализа
таксономического состава бактерий, ассоциированных с культурами
водорослей. Как следует из списков бактериальных таксонов и как
подчеркивают многие исследователи, в циано- и альгобактериаль-
ных сообществах доминируют грамотрицательные бактерии.
Такая структура бактериального компонента сообществ
неслучайна, она определяется образованием водорослями как
антибиотиков, так и других бактерицидных веществ, которые
избирательно ингибируют рост грамположительных бактерий. Так,
антибиотик мускорин, выделенный из цианобактерий Nostoc mucso-
rwn, подавлял рост некоторых дрожжей и грамположительных
бактерий (Jacob, 1961).
Бактерицидную активность водорослей связывают также с
выделением ими в среду свободных жирных кислот (СЖК).
Среди последних доминируют длинноцепочечные линолевая и лино-
леновая кислоты. Первые работы в этой области были начаты
еще в 1944 г. (Pratt, Fong, 1949) с одноклеточной зеленой
водорослью Chlorella. "Хлореллин" подавлял рост грамположительных
бактерий, особенно бацилл, но практически не действовал на
грамотрицательные. Предполагается, что СЖК действуют на ци-
топлазматическую мембрану, поэтому устойчивость грамотрица-
тельных бактерий к этим веществам объясняется защитной
ролью липидов, содержащихся в их клеточной стенке. Было
экспериментально продемонстрировано (Громов, Скрупская, 1965)
действие жирных кислот на бактериальный спектр. Ингибирова-
ние роста регистрировалось по наличию стерильных зон вокруг
бумажных дисков, пропитанных растворами СЖК. Зоны
радиусом 5-22 мм были обнаружены на газонах всех культур
грамположительных бактерий, включая роды Arthrobacter, Rhodococcus,
Bacillus (кроме актиномицетов), в то время как
грамотрицательные бактерии исследуемых родов Pseudomonas, Methylobacterium,
Azospirillum, Rhizobium оказались устойчивыми к воздействию
этих кислот. Опыты по выращиванию культур бактерий в
жидких средах с добавлением линоленовой кислоты показали, что
пороговая концентрация для грамположительных бактерий
составила 0,1, а для грамотрицательных 5 тМ. Бациллы ингибиро-
вались уже при концентрации 0,02 тМ. В результате
исследования липидной фракции растворенного органического вещества
природных вод было установлено, что максимальное количество
обнаруживаемых в них непредельных жирных кислот корреля-
27
тивно связано с периодами "цветения" водоемов, т.е. липиды в
водных экосистемах - продукты экскреции водорослей.
Другая группа веществ, обусловливающая
антибактериальную активность водорослей, - хлорофиллиды -
предшественники синтеза хлорофилла либо продукты его деградации
(Максимова, Сидорова, 1986). Эти вещества также ингибируют рост
грамположительных бактерий, но не действуют на грамотрица-
тельные бактерии и грибы. И хлорофиллиды, и СЖК - группа
светоиндуцированных антибиотиков, образуемых водорослями.
Известно также, что при массовом развитии цианобактерий и
зеленых водорослей накапливаются фенольные соединения,
продукты распада которых также могут действовать как ингибиторы
роста (Таутс, 1983). Недаром во время "цветения" водоемов
наблюдали при резком снижении общей численности
микроорганизмов полное элиминирование представителей
грамположительных бактерий (Chrost, 1975). Аналогичные данные были
получены в отношении морских одноклеточных водорослей (Там-
биев и др., 1981).
Можно считать, что в процессе геологической истории, на
протяжении которой формировались и функционировали циано-
и альгобактериальные сообщества, была выработана
целенаправленная экскреция водорослями тех веществ, которые с одной
стороны могли привлечь бактерии в качестве полезных для них
симбионтов, а с другой - избавиться от ненужных или опасных
для них организмов путем выделения разнообразных
бактерицидных веществ. Думается, что селективное ингибирующее
воздействие водорослей именно на грамположительные бактерии
связано с тем, что еще на самых ранних этапах формирования ци-
анобактериальных матов докембрия трофическое окружение ци-
анобактериального ядра состояло из представителей грамотри-
цательных бактерий (класс Proteobacteria), в то время как
грамположительные бактерии, попадающие, вероятно, из наземных
субстратов, были "опасными пришельцами", так как многие из
них обладали гидролитическими свойствами.
Схема возможного функционирования цианобактериального
сообщества, в которой показаны потоки характерных веществ,
объединяющих группы протеобактерий в трофическую систему,
была составлена Г.А. Заварзиным (Заварзин, 1990а). Среди
протеобактерий были обнаружены самые разнообразные
экологические группировки - олиготрофы и копиотрофы, сероокисляющие
и метанотрофы, сульфидогены и метаногены, из гидролитиков -
только миксобактерии. Было продемонстрировано, что такое
сообщество способно обеспечивать полный круговорот веществ и
потому устойчиво. Было также предположено, что в представлен-
28
ной схеме ядро из цианобактерий может быть заменено эукариот-
ными водорослями или высшими растениями. Однако в этой
схеме отсутствуют грамположительные бактерии, а сам факт их
отсутствия не обсуждается. Впоследствии Г.А. Заварзин (1990b),
анализируя филогенетическую классификацию прокариот,
указывал на возможную роль грамположительных бактерий в
разложении ими некромассы водорослей. Сходящиеся в одну область
ветвей Cyanobacteria, Firmicutes и Proteobacteria на
филогенетическом древе прокариот рассматриваются как залог формирования
устойчивого сообщества. Вопрос только в том, когда
образовалось такое сообщество. Все приведенные выше в тексте факты об
ингибировании цианобактериями и водорослями
грамположительных бактерий (фирмакут), косвенно свидетельствуют о более
позднем появлении последних в водных экосистемах.
Судя по многочисленным литературным данным, некромассу
водорослей в водоемах разлагают в основном грамотрицатель-
ные бактерии - цитофаги, спороцитофаги, флексибактерии, ми-
ксобактерии, флавобактерии. Лизис живых клеток
цианобактерий и зеленых водорослей может осуществляться флексибакте-
риями, миксобактериями, а также Cellvibrio fulvus (Gunnison,
Alexander, 1975). Особую роль в разрушении органического
вещества в водоемах, в том числе и водорослей, играет Sporocytophaga
cauliformis. В морях в роли деструкторов агара, альгиновой
кислоты, гликозидов и прочих веществ, входящих в состав
водорослей, выступают протеобактерии Alginomonas, Vibrio, Cytophaga,
Sporocytophaga, Agrobacterium (Горпенко и др., 1977; Мишустина,
1978; Михайлов и др., 1999). Большинство видов цианобактерий
и зеленых водорослей активно лизировались штаммом Cytophaga
sp., который рос как на живых, так и на автоклавированных
клетках этих организмов, уничтожая их за 1-10 суток. Природа
литического агента осталась невыясненной (Buell, Fahey, 1969).
Описана флексибактерия, лизирующая цианобактерий, а также
паразит бактерий на водорослях Bdellovibrio chlorellavorus.
Однако паразитизм бактерий на водорослях, в отличие от
паразитизма на грибах, - редкое явление (Громов и др., 1972, 1980).
Таким образом, у цианобактерий, а позднее у эвкариотных
водорослей, сложились разнообразные взаимоотношения с про-
теобактериями. Среди представителей этого класса существуют
разные экологические группировки - и те, которые питаются
прижизненными выделениями водорослей, и те, которые
разлагают некромассу водорослей, и те, которые используют
продукты деградации и лизиса водорослей. Формирование и эволюция
бактерий с грамотрицательным строением клеточной стенки,
большинство представителей которых ныне объединены в класс
29
Proteobacteria, увлекательно описаны в статье Г. Мюллера (Mul-
ler, 1977). Автор предполагает, что эволюция клеточной стенки
грамотрицательных бактерий (грациликут) происходила в
водной среде с постепенным усложнением состава, начавшись уже в
докембрии или кембрии. В качестве косвенных доказательств
этого положения он приводит следующие: доминирование
именно грамотрицательных бактерий в современных водных
экосистемах, а также наличие у них подвижности и других
адаптационных приспособлений к обитанию в водной среде.
Обзор таксономии и экологии водных форм бактерий,
приведенный нами выше, также свидетельствует в пользу этой
гипотезы. Более того, известно, что грамотрицательные бактерии
имеют, в отличие от грамположительных, наружную мембрану, в
состав которой входят липопротеиды, липополисахариды и другие
липиды, которые как-бы наклеены снаружи на муреиновый
каркас (Шлегель, 1987). По-видимому, дополнительная липидная
мембрана у грамотрицательных бактерий возникла в качестве
защитной реакции на высокую концентрацию натрия в морской
среде, так как синтез липидов включается при увеличении
концентрации этого элемента - сигнала о возможном повреждении
клеточной мембраны. Опыт показывает, что вытекающая из
поврежденной клетки протоплазма немедленно покрывается вновь
возникающей липопротеидной мембраной, т.е. имеется
аварийный запас фосфолипидов и белков для быстрой сборки
мембраны. У большинства наземных живых существ все живые клетки
содержат натрий в концентрациях, значительно меньших, чем в
морской среде, а концентрация калия в клетках во много раз
выше, чем во внешней среде. В наземных организмах происходят
процессы, в которых главенствующую роль начинают
приобретать ионы калия, а ионы натрия являются ингибиторами
внутриклеточных ферментативных процессов (Шноль, 1979).
Необходимость эволюции клеточной стенки прокариот при
переходе от водного к наземному образу жизни была связана с их
адаптацией к высушиванию и солнечной инсоляции. В итоге
образовалась толстая мукопептидная оболочка, характерная для
грамположительных бактерий. У этих бактерий доля муреино-
вой сетки, представляющей опорный каркас клетки, составляет
30-70% сухой массы клеточной стенки, в то время как у
грамотрицательных - менее 10%. Предполагается (Muller, 1977), что
грамположительные бактерии (они рассматриваются на примере
микрококков) расселялись по суше в палеозойской формации
вскоре после заселения суши растениями и животными в аридном
климате (силур-девон), а также в период увеличения
пространства суши и уменьшения морских территорий в перми и триасе.
30
В связи с трудностями интерпретации палеомикробиологических
данных ответить на вопрос о разнице во времени появления гра-
мотрицательных и грамположительных бактерий в настоящее
время пока невозможно. Молекулярно-биологические методы
секвенирования протеинов и нуклеиновых кислот обеспечили
новый подход к оценке эволюции бактерий в терминах
"эволюционных часов". При этом высказываются разные гипотезы, часто
противоположные.
Так, вопреки общепринятым в последнее время рисункам
филогенетических древ, в которых ветви бактерий, архей и эукари-
от отходят от одного корня, а порядок ветвления отражает
последовательность происхождения таксонов (Olsen et al., 1986;
Woese, 1987; Pace, 1999), появилась схема однолинейной
последовательной эволюции бактерий (Gupta, 1998, 2000). Согласно этой
схеме, эволюция шла от монодерм (бактерий, имеющих один
слой клеточной стенки, т.е. грамположительных) к дидермам
(грамотрицательным бактериям с двуслойной клеточной
мембраной). В основу построения такой линии был положен один
признак - данные секвенирования протеинов, кодирующие
последовательность олигонуклеотидов в 16S рРНК. При этом
эволюционная цепочка выглядит следующим образом: грамположитель-
ные бактерии с низким ГЦ —> грамположительные бактерии
с высоким ГЦ —> Deinococcus —> Thermus —> зеленые несерные
бактерии —> цианобактерии —> спирохеты —> Chlamydia —> Cytop-
haga —> Aquifex —> Flavobacteria —> зеленые серные бактерии —>
протеобактерии. Такая схема возвращает нас назад к
дарвинистскому монофилетическому подходу, взамен которого
впоследствии была предложена явно прогрессивная гипотеза В.И.
Вернадского, утверждавшего, что с самого начала должно было
существовать сообщество функционально различных организмов.
Эта гипотеза получила развитие в работах Г.А. Заварзина
(1990а, в, 1995), который построил на основании анализа
функционирования сохранившихся до настоящего времени цианобакте-
риальных матов, аналогичных таковым реликтовым,
гипотетическую схему функционирования древнего цианобактериального
сообщества. В этом сообществе окружение
цианобактериального ядра составляют разнообразные эколого-трофические группы
бактерий, обеспечивающие полный круговорот веществ и
устойчивость сообщества. На филогенетическом древе бактерий циа-
но- и протеобактерии представляют ветви, сходящиеся в одну
область; сюда же попадает и третья ветвь - грамположительные
бактерии. Это указывает на существование в прошлом прасооб-
щества из филогенетически и функционально различных
организмов. При таком подходе ни одну ветвь нельзя считать предко-
31
вой по отношению ко всей совокупности бактерий, а
представление об эволюции сообществ, а не отдельных организмов более
соответствует современному уровню знаний (Заварзин, 1990а, в)
К проблеме эволюции и расселения бактерий по разным эко-
нишам мы еще вернемся, сейчас же заметим, что, сравнивая
таксономический состав и биологические особенности бактерий в
водных и наземных экосистемах, мы не ставим задачу выяснить
какие формы бактерий - водные или наземные - появились
раньше, мы подбирали литературные и собственные
экспериментальные данные для подтверждения тезиса: эволюция грамотрица-
тельных бактерий происходила в водной среде в
противоположность грамположительным (особенно бактериям актиномицет-
ной линии), представляющих континентальную ветвь прокариот.
При этом следует учитывать, что одни представители протеоба-
ктерий "вышли" из воды на сушу, заняв множество различных
экониш, в то время как другие так и остались на "своих" местах в
водных экосистемах. Что касается палеонаходок грамположи-
тельных бактерий, то известно лишь, что в вендских отложениях
(670-570 млн лет назад, период становления и развития
многоклеточных эвкариотных организмов) на вендотениевых
водорослях были обнаружены первые мицелиальные водные актиноми-
цеты (Заварзин, 1984).
Переходя к анализу таксономической структуры альгобакте-
риальных сообществ, складывающихся в наземных экосистемах,
будет уместно привести данные о таксономическом составе
бактерий, участвующих в деструкции водорослей на границе
суша-море. Интересным представляется факт обнаружения
разнообразных представителей как грамположительных, так и грамо-
трицательных бактерий, которые участвуют в деструкции
штормовых выбросов водорослей и трав. Это представители родов
Nocardia, Arthrobacter, Corynebacterium, Cytophaga, Flavobacterium
(Кондратьева, Тен Хак Мун, 1995). На талломе бурых
водорослей обнаружены клостридии. Таким образом, континентальная
ветвь прокариот (актинобактерии) включается в процесс
гидролиза водорослей вместе с протеобактериями в таких
пограничных биотопах, как прибрежные зоны морей.
1.3. НАЗЕМНЫЕ АЛЬГОБАКТЕРИАЛЬНЫЕ СООБЩЕСТВА
После выхода высших растений на сушу водоросли перестали
играть ту главенствующую роль фототрофов-продуцентов
органического вещества, которую они выполняли ранее. Эта
функция перешла к высшим растениям, но остались участки суши, на
32
которых происходит массовое разрастание водорослей. Любая
нарушенная почва или субстрат, на котором начинается
почвообразовательный процесс - вулканические выбросы, техногенные
отвалы, почвы после пожарищ, выработанные торфяники,
выходы скальных пород, такыры и др., осваиваются, прежде всего,
почвенными водорослями, особенно одноклеточными зелеными
(Зенова и др., 1995). Массовое разрастание водорослей в верхнем
слое почвы (0-5 мм), известное как "цветение", приводит к
формированию специфической почвенной экониши, которая была
названа "альгосфера" (Громов, 1956). Анализу взаимоотношений
почвенных водорослей с различными компонентами биоценоза -
бактериями, актиномицетами, грибами, высшими растениями и
животными, посвящены обзоры (Зенова, 1984; Зенова,
Звягинцев, 1994; Звягинцев, Зенова, 2001). Выходу обзоров
предшествовали работы аспирантов и сотрудников кафедры биологии почв
ф-та почвоведения МГУ, в которых принимала участие и автор
настоящей книги, проводимые при консультациях известного
отечественного альголога Э.А. Штины. Остановимся на
результатах исследований, связанных с выявлением пространственной
организации и таксономической структуры бактериальных
сообществ, формирующихся в альгосфере, а также взаимоотношений
гетеротрофных бактерий с водорослями в альгобактериальном
сообществе.
Впервые была продемонстрирована наземная ярусная
структура альгобактериального сообщества, представляющего собой
корочку толщиной около 1 см, как и в альгобактериальных
матах (Дедыш, 1990; Дедыш и др., 1992). В первом ярусе (0-1 мм),
на растущих верхушках водорослей доминировали
разнообразные протеобактерии, среди которых значительную долю
(30-90%) составляли бактерии родов Pseudomonas и Flavobac-
terium. Там же обнаруживались стрептомицеты. Эти аэробные
бактерии снижали парциальное давление кислорода, позволяя
функционировать микроаэрофилам-азотфиксаторам,
обитающим во втором ярусе (1-3 мм) на отмирающих нижних частях
водорослей. И, наконец, в третьем ярусе (3-10 мм) - в почве под
водорослями - доминировали грамположительные бактерии: ко-
ринеподобные и спорообразующие. Такая ярусная организация
не случайна. В непосредственном окружении водорослей могут
быть, как уже указывалось ранее, лишь грамотрицательные
бактерии, так как выделяемые водорослями свободные жирные
кислоты, хлорофиллиды и фенольные соединения подавляют
рост грамположительных бактерий. Вследствие этого в
"цветущей" почве формируется специфический бактериальный
комплекс, резко отличающийся по составу от почвенного микробно-
33
Таблица 1
Таксономический состав бактериального комплекса "цветущих'* почв
Таксон
Относительное обилие, %
"Цветущая" почва
Контроль
Pseudomonas
Flavobacterium
Rhizobium
Methylobacterium
Vibrio
Azospirillum
Xanthomonas
Caulobacter
Agrobacterium
Alcaligenes
Gluconobacter
Arthrobacter
Rhodococcus
* Селективная среда с малатом кальция.
28
20
3
1.7
1,3
2(24)
2
1
0,3(6)*
0,13
0,11
9
0,6
12
0
0
0
0
0
0
0
0
0
0
53
4
го комплекса. В его состав входят представители разнообразных
таксонов протеобактерий. Родовой состав и относительное
обилие таксонов в бактериальных сообществах альгосферы и в
окружающей контрольной почве приведены в табл. 1 (Дедыш и
др., 1992).
Анализ таксономического состава бактерий в альгосфере
позволяет констатировать, что в окружении почвенных
водорослей, также как и в фикосфере и в цианобактериальных матах,
доминируют протеобактерий. Численность бактерий
вышеназванных таксонов достигала 107 КОЕ/г почвы с водорослевыми
разрастаниями. Наиболее интересным представляется
экологическая приуроченность к цветущим почвам бактерий родов
Azospirillum, Rhizobium, Methylobacterium, Caulobacter. С одной стороны,
все эти бактерии - и активные диазотрофы азоспириллы, и ризо-
бии, и метилобактерии, и типично водный олиготроф каулобак-
тер - были обнаружены и в водных альгобактериальных
сообществах. С другой стороны, азоспириллы, ризобии и
метилобактерии, как известно, ассоциированы либо образуют симбиозы с
высшими растениями. Эти факты позволяют представить себе
цепочку, по которой происходило расселение названных и других
протеобактерий из воды на сушу: водоросли в водных
экосистемах - водоросли в наземных экосистемах - ризосфера и филло-
сфера высших растений. Более детальный анализ бактериаль-
34
ных сообществ, ассоциированных с высшими растениями, будет
дан в последующих главах.
Спектр актиномицетов в альгосфере близок к таковому в
почве без водорослей и включает представителей родов:
Streptomyces, Streptoverticillium, Streptosporangium, Actinomadura,
Geodermatophilus, Micromonospora. В водорослевых разрастаниях
наблюдали более активное развитие мицелия актиномицетов,
связанное, вероятно, со стимулирующим действием экзометабо-
литов водорослей (Дедыш, 1990; Дедыш и др., 1992). Что
касается взаимодействия мицелиальных актиномицетов с водорослями,
то этому направлению посвящены специальные исследования
(Зенова и др., 1980, 1988,1995). Один из самых интересных и
экологически значимых выводов из этих работ - обнаруженная у
стрептомицетов способность вступать в симбиоз с зелеными
водорослями с образованием лишайникоподобного таллома,
который был назван авторами "актинолишайником". Такие симбиозы
складываются обычно в местах, где начинается первичный
почвообразовательный процесс - на поверхности пород (чаще
карбонатных), на выработанных торфяниках. Экспериментально
сформированный лишайникоподобный таллом обладает
стабильностью, в нем поддерживается определенное соотношение
компонентов с доминированием актиномицетного мицелия, он
имеет слоистую структуру и приобретает новые, эмерджентные
свойства по сравнению с составляющими его компонентами.
Клетки водорослей в этом талломе проходят нормальный цикл
деления, роста, отмирания; в то время как у актиномицетов
нарушается процесс спорообразования (Kalakoutskii et al., 1990). Цено-
зообразующая роль актиномицета в актинолишайнике
проявляется в регуляции численности водоросли, стимуляции
образования хлорофилла и стабилизации бактериального звена системы
(Калакуцкая и др., 1993).
Если вспомнить о нахождении первых актиномицетов на
водорослях в вендских отложениях, то можно себе представить
длительную коэволюцию водорослей и мицелиальных прокариот,
приведшую к формированию тесных симбиозов типа актиноли-
шайника. Возможно, что актиномицеты сыграли не меньшую
роль, чем грибы, образовавшие с водорослями симбиоз в виде
лишайника, в освоении наземных твердофазных субстратов и
образовании первичных примитивных почв.
Процессы, аналогичные первичному почвообразованию на
выходах горных пород, происходят и в городских экосистемах,
например, на поверхности каменных строений. Показано
(Сомова и др., 1998), что в локусах массового разрастания водорослей
и цианобактерий на поверхности зданий формируются сложные
35
альгобактериальные сообщества, в которых также была
обнаружена ассоциация типа актинолишайника. Во всех
исследованных образцах процент актиномицетного мицелия в прокариот-
ном комплексе колебался в пределах 30-60%, как и на
поверхности карбонатных пород (Зенова и др., 1988). В весенние и
осенние периоды, благоприятные для развития водорослей, в
бактериальном комплексе доминировали всегда ассоциированные с
водорослями протеобактерии, представленные цитофагами, ми-
ксобактериями и фототрофными бактериями. В качестве
минорных компонентов из очагов разрастания водорослей
выделялись азоспириллы, азотобактер, простекобактерии. В более
сухие (лето) или холодные (зима) сезоны, не способствующие
развитию водорослей, на поверхности зданий преобладали
устойчивые к неблагоприятным условиям актинобактерии. Последние
обнаруживались в большом количестве на поверхности
строений, незаселенных автотрофами, по аналогии с поверхностью
почвы или породы, лишенной водорослевых разрастаний
(Сомова и др., 1998).
Таким образом, в самых разных биотопах, где наблюдается
массовое развитие водорослей или цианобактерий, им
сопутствуют, с одной стороны, грамотрицательные протеобактерии, а с
другой - грамположительные мицелиальные прокариоты, с
которыми они образуют симбиозы, свидетельствующие о
длительной симбиогенной эволюции.
1.4. БАКТЕРИИ И ВЫСШИЕ РАСТЕНИЯ
Если в цианобактериальных матах и наземных водорослевых
корочках весь бактериальный комплекс сконцентрирован в
1-сантиметровом слое (хотя и разделенном на ярусы), то с
появлением высших растений произошло пространственное
разобщение бактерий в связи с их расселением по различным органам
растений, иногда значительно удаленным друг от друга.
Поскольку каждый из органов растений представляет особую экони-
шу по отношению к поселяющимся там микроорганизмам, были
предложены термины, определяющие эти ниши. Филлосфера -
надземные части растений, ризосфера - подземные, геммисфе-
ра - почки растений, спермосфера - семена. Впоследствии для
более четкого отделения поверхности листьев и корней от зон,
прилегающим к ним, появились термины "филлоплана" и "ризо-
плана". Бактерии обнаруживаются также на цветах, ягодах,
плодах и даже в сокотечении растений.
Освоение бактериями экониш, связанных с прижизненными
выделениями растения, происходило не только путем поселения
36
микроорганизмов на поверхности различных органов растений
(эпифитное сообщество), но и путем внедрения их в ткани
растений (эндофитное сообщество). В результате сформировались
как взаимополезные для растений и микроорганизмов симбио-
тические связи, так и неблагоприятные для растений
антагонистические связи, связанные с появлением фитопатогенов. Все
микробиологические исследования ризосферы и филлосферы,
начатые более полувека назад, связаны большей частью с
прикладными аспектами микробиологии. Это поиск
микроорганизмов - стимуляторов роста сельскохозяйственных растений,
разработка биологических основ борьбы с фитопатогенами,
изучение влияния почвенных условий на микробные сообщества и
рост растений. В результате в качестве объектов исследования
выбирались, главным образом, разнообразные культурные
растения.
Из всего обширного материала, посвященного проблеме
взаимоотношений микроорганизмов с высшими растениями,
предполагается выбрать лишь анализ таксономического состава
бактерий в филлосфере и ризосфере под углом зрения, связанным с
переходом бактерий от водорослей, как центров формирования
бактериальных сообществ, к высшим растениям как фототро-
фам-эдификаторам. Предполагается рассмотреть также разные
типы связей бактерий с растениями, складывающиеся в процессе
эволюции.
1.4.1. СИМБИОЗЫ АЗОТФИКСИРУЮЩИХ БАКТЕРИЙ
С РАСТЕНИЯМИ
Поскольку традиционно считается, что симбиозы азотфикси-
рующих бактерий с растениями формируются в специальных
клубеньках, образуемых на корнях растений, целесообразно
начать обзор литературы с анализа происхождения и функций
корневых и стеблевых клубеньков. Образование клубеньков на
надземных и подземных частях растений не обязательно связано с
нахождением там азотфиксирующих бактерий. Как уже
упоминалось ранее, предполагается, что еще до симбиоза бобовых
растений с ризобиями на их стеблях, листьях и корнях
образовывались клубеньки. Их можно рассматривать как ботанический
феномен, одно из атавистических приспособлений у растений к
запасанию крахмала (Парийская, Клевенская, 1979), которые лишь
в процессе эволюции стали заселяться бактериями.
Кстати, способность к образованию стерильных клубеньков
на растениях продемонстрирована экспериментально при воздей-
37
ствии на них химических нодулирующих агентов (Nie et al., 1992).
В литературе периодически появлялись сообщения о нахождении
клубеньков на листьях или корнях разных растений, при этом
предполагалось, что в этих клубеньках находятся азотфиксирую-
щие бактерии по аналогии с уже известными симбиозами. В
некоторых случаях там действительно обнаруживали азотфиксиру-
ющие бактерии - например, Klebsiella на листьях тропических
растений, в других случаях они отсутствовали - например, в
клубеньках на корнях злака лисохвоста, поэтому в них не было
зарегистрировано нитрогеназной активности (Умаров, 1986). Особый
интерес в плане эволюции взаимоотношений бактерий с
растениями представляет анализ местообитаний и биологии бактерий
рода Phyllobacterium (Lambert et al., 1990). Род Phyllobacterium б^т
описан в 1984 г. (Knosel, 1984), оба вида этого рода - P. myssi-
пасеагит и P. rubiacearum - обитатели клубеньков,
формирующихся на листьях тропических растений. Род Phyllobacterium был
включен в семейство Rhizobiaceae; другие роды этого семейства -
Rhizobium, Bradyrhizobium, Azorhizobium, Agrobacterium
(Новикова, 1995).
По результатам гибридизации ДНК-рРНК было
установлено, что бактерии рода Phyllobacterium, с одной стороны,
наиболее близки, к бактериям родов Agrobacterium и Rhizobium, а с
другой - к таким далеким по биологии и экологии родам, как
Brucella, Mycoplana и Ochrobacterium. Первоначально
обнаруженные в клубеньках на листьях тропических растений Ardisia и
Pavell, филлобактерии при попытке их повторного
инфицирования не вызвали нодуляцию. Поэтому вопрос о том, насколько
представители рода Phyllobacterium ассоциированы с
клубеньками, остается открытым. Невозможно ответить и на вопрос о
том, каково разнообразие бактерий, принимающих участие в но-
дуляции. Ранее бактерии, выделенные из клубеньков на листьях
этих растений, были отнесены к родам Chromobacterium,
Xanthomonas, Klebsiella, Phyllobacterium. Жизненный цикл
Phyllobacterium myssinacearum (бывшее название Bacterium follicola)
был описан еще в 1938 г. (De Jongh, 1938). Автор сообщил, что
эти бактерии выживают на семенах и колонизируют при
прорастании семян последовательно листовые, затем цветочные
почки, цветы и плоды.
В 1990 г. появилось сообщение о постоянном обнаружении
видов Phyllobacterium на поверхности корней (при отсутствии
клубеньков) молодых растений сахарной свеклы (Lambert et al.,
1990). Более 5 тыс. штаммов было изолировано из ризопланы
1 тыс. растений сахарной свеклы на триптиказо-соевом агаре
(TSB). В результате идентификации наиболее часто встречаю-
38
щихся типов колоний с помощью метода "fingerprint" было
установлено, что они принадлежат к родам Pseudomonas и Phyllo-
bacterium. Представители последнего рода были детально
изучены разными методами: электрофорезом белковых профилей,
молекулярно-генетическими методами, системой API. С их
помощью удалось дополнить и дать более точное описание рода
Phyllobacterium, составленное ранее только на основании
изучения трех штаммов. Молекулярно-генетические исследования
позволили установить, что первые этапы инфицирования растений
бактериями рода Phyllobacterium аналогичны таковым,
происходящим при инвазии корней как клубеньковыми бактериями
рода Rhizobium, так и фитопатогенными бактериями Agrobacterium
tumefaciens, и контролируются общими генами. Филлобактерии
не проявили фитопатогенных свойств. Предполагается (Lambert
et al., 1990), что филлобактерии представляют собой
изначальный (более примитивный) край континуума, ведущего к
специализированным симбиотическим бактериям, таким, как ризобии
или агробактерии. Однако у представителей рода
Phyllobacterium не было обнаружено ни генов, ответственных за азотфи-
ксацию, ни генов, которые включаются при установлении
тесных связей между бактериями и растениями. Виды
Phyllobacterium показали только 73% гомологии с кластером Rhizo-
biaceae.
Другим примером формирования клубеньков на стеблях
растений, не связанных с азотфиксирующими симбиозами, является
описанное в предыдущем разделе поселение коринеформных
бактерий в галлах, индуцируемых нематодами.
Таким образом, формирование клубеньков или галлов на
различных органах растений не всегда связано с
принадлежностью обитающих там бактерий к группе активных диазотрофов
или фитопатогенов. Все эксперименты, связанные с
искусственной паранодуляцией, свидетельствуют о том, что формирование
клубеньков на различных органах растений могло возникать
в естественных условиях на разных этапах эволюции много раз,
в разных группах как растений, так и бактерий. Сохранили
стабильность лишь самые стойкие симбиозы, в которых
установились наиболее тесные связи между партнерами на уровне
контроля генами.
Более того, данные по 16S рРНК свидетельствуют о полифи-
летическом происхождении клубеньковых бактерий. Так,
оказалось, что бактерии Bradyrhizobium, образующие клубеньки на
корнях Glycine (соевые), ближе к несимбиотическим бактериям
Rhodopseudomonas, Afipia и Nitrobacter; а представители Rhizobium
ближе не к клубеньковым бактериям, а к фитопатогенным Agro-
39
bacterium и патогенам Brucella и Bartonella (Новикова, 1995).
Интересным представляется факт установления родственных связей
между факультативно-метилотрофными бактериями,
образующими красный пигмент, и бактериями одного из 5 классов Rhizo-
biaceae, созданных на основании геномной структуры (Heuman et
al., 1984).
Бобово-ризобиальные симбиозы. Образование тесных
симбиозов ризобий с бобовыми растениями, в результате которых в
клубеньках, образующихся на корнях этих растений,
размножаются ризобий, способные к активной фиксации азота из
атмосферы и снабжении азотом растений-хозяев, произошло, как
предполагают (Norris, 1956. Цит. по: Парийская, Клевенская,
1979), в меловой период.
Меловой период - промежуток времени между 135 и 65 млн
лет тому назад - занимает особое место в истории Земли.
Обширные участки континентов были затоплены мелководными
морями. В конце мелового периода произошла морская
регрессия и похолодание. Биоценотический кризис начался с
растительного покрова суши - происходило замещение сообществ
голосеменных растений сообществами покрытосеменных. Это привело
к полной перестройке сухопутных экосистем и ускорению
темпов эволюции. Первоначально цветковые "победили" в
околоводных биогеоценозах, в середине мела - вдали от воды (Иванов,
2000).
Мы рассмотрим формирование симбиотических связей
бактерий с растениями в эволюционном аспекте как переход водных
фототрофных бактерий на другой путь метаболизма и заселение
ими наземных экониш на примере анализа местообитаний родов
Photorhizobium-Rhizobium. В обзоре, посвященном
фотосинтетическим ризобиям (Fleischman, Kramer, 1998), обсуждаются как
таксономия и филогения ризобий, содержащих бактериохлоро-
филл, так и высказываются гипотезы относительно их
эволюции. Фотосинтетические ризобий были обнаружены в
клубеньках, образующихся на стеблях водных бобовых растений,
произрастающих в основном в тропиках или субтропиках по берегам
рек. Высокая влажность и погруженность корней и стеблей этих
растений в воду способствовали процессу нодуляции.
Предполагается, что ризобий проникали в стебли в местах, где был
нарушен эпидермис. Было доказано, что эндофиты, изолированные
из этих клубеньков, содержат бактериохлорофилл а. Фотосинте-
зирующий аппарат ризобий наиболее близок к аэробным анокси-
генным фотогетеротрофам. Свет стимулировал образование
пигмента, оптимальным режимом для его накопления было 16 ч
света и 8 ч темноты.
40
Стимуляция синтеза бактериохлорофилла при освещении
характерна и для метилотрофных фотосинтетических бактерий
рода Methylobacterium, в то время как большинство водных анокси-
генных аэробных фототрофных бактерий образуют хлорофилл
даже при длительном выращивании в темноте. Стеблевые
клубеньки исследованных бобовых растений представляют собой
автономные структуры, которые могут функционировать вне
растения благодаря способности к фиксации азота из атмосферы и
углерода за счет фотосинтетической системы. Возможно, что
бактероиды используют углерод, полученный при фотосинтезе,
в качестве источника энергии и как редуктант для фиксации
азота в течение ночи.
Таким образом, наличие фотосинтезирующих систем
позволяет выживать ризобиям, когда запас углерода лимитирован.
Такая ситуация складывается на поверхности листьев.
Многочисленные популяции ризобий были обнаружены на поверхности
листьев Sesbania и Aeschynomene, они образовывали клубеньки на
стеблях надземных частей растений-хозяев, инокулируя их после
дождей (Adebayo et al, 1989). В таких аэробных условиях при
периодическом освещении и лимитации субстрата должна начать
функционировать фотосинтезирующая система бактерий, при
которой их рост стимулируется освещением. Под поверхностью
листьев создаются при этом особенно благоприятные условия.
На основании как молекулярно-биологических, так и физиоло-
го-биохимических методов исследования этих бактерий, было
показано, что они филогенетически принадлежат к кластеру
Bradyrhizobium, составляя отдельный таксон внутри этой группы,
возможно, на уровне вида.
По мере того как растения-хозяева колонизировали более
аридные биотопы (меловой период), нодуляция стеблей
становилась более затрудненной и переместилась в подземный ярус -
на корни. Фототрофная система, став более ненужной, была
потеряна. Однако гены фотосинтеза, даже при потере хлорофилл-
содержащего пигмента ризобиями, еще обнаруживались в
штаммах ризобий, образующих клубеньки на корнях Aeschynomene
indica, произрастающих на почвах умеренной зоны (Fleischman,
Kramer, 1998).
Эволюция клубеньковых бактерий дала несколько
удаленных друг от друга ветвей. Быстрорастущие штаммы образуют
три ветви: Rhizobium, Sinorhizobium и Agrobacterium. Одна из этих
ветвей включает только штаммы Sinorhizobium, в то время как
две другие представлены бактериями двух родов - Rhizobium и
Agrobacterium. Штаммы Mesorhizobium формируют четвертую
филогенетическую ветвь, эволюционно близкую штаммам Phyl-
41
lobacterium. Медленнорастущие штаммы рода Bradyrhizobium,
в том числе и фотосинтезирующие ризобии, составляют пятую,
наиболее удаленную ветвь (Новикова, 1995). Данные
филогенетического анализа свидетельствуют о том, что ветви быстро-
и медленнорастущих азотфиксирующих ризобий разошлись еще
до появления наземных растений, а дивергенция родов Bradyrhi-
zobium и Rhizobium произошла перед выходом растений на сушу
(Ochman, Wilson, 1987).
В наземных экосистемах фоторизобии постепенно были
заменены гетеротрофными ризобиями, внедрившимися в корни
различных травянистых растений из семейства бобовых. Как уже
упоминалось ранее, такой симбиоз возник между древними
бобовыми растениями и ризобиями в меловой период (Norris,1956.
Цит. по: Парийская, Клевенская, 1979). Поскольку симбиоз
зародился в тропиках, наиболее древними могут считаться те группы
ризобий, которые инокулируют тропические древесные бобовые
растения. Причину возникновения симбиоза именно с бобовыми
растениями Д. Норрис видит в историческом прошлом семейства
бобовых, т.е. в те времена, когда экологические условия
способствовали возникновению азотфиксации (тропический климат и
бедность почв азотом), наибольшее распространение имели
бобовые растения (Парийская, Клевенская, 1979). Однако у
наиболее древних бобовых - цезальпиниевых - способность к
симбиозу обнаружена лишь у 40% родов, в то время как у эволюционно
более продвинутых мотыльковых и мимозовых - у 84-95%
родов. Высказывается гипотеза, согласно которой предки бобовых
обладали лишь определенной "преадаптацией"
(предрасположенностью) к мутуалистическому взаимодействию с бактериями,
которая в ходе эволюции реализовалась в форме способности к
азотфиксирующему эндосимбиозу.
Анализ связи между таксономическим положением
партнеров и их симбиотическими признаками показал, что у бобовых
растений способность к образованию клубеньков имеет более
древнее происхождение, чем способность к формированию
эффективного симбиоза, тогда как у ризобий наиболее древним
симбиотическим признаком является способность к
азотфиксации. Это позволяет предположить, что "преадаптация" бобовых
растений состояла в формировании на корнях клубеньковопо-
добных структур, в которых могли поселяться диазотрофные
бактерии. Одной из функций, которую выполняли
псевдоклубеньки у предков бобовых, могло быть накопление и хранение
крахмала. Поэтому выдвинутая ранее гипотеза о происхождении бо-
бово-ризобиального симбиоза из нестойких ассоциаций между
свободноживущими азотфиксаторами и корнями растений, пер-
42
воначально неспособных к образованию клубеньков (Парийская,
Клевенская, 1979), считается в настоящее время мало
обоснованной (Проворов, 1996).
Д. Норрис (Norris, 1956. Цит. по: Парийская, Клевенская,
1979) делит все клубеньковые бактерии на два типа: 1) древний,
тропический с широкой вирулентностью и низкими
потребностями в питательных веществах - тип "коровьего гороха"; 2)
современный, имеющий ограниченное количество хозяев, зависящий
от высокого содержания кальция. К последнему относятся
клубеньковые бактерии клевера. Род Trifolium считается древним, он
произошел от тропических видов бобовых, обитавших в горных
районах, что и позволило клеверу широко распространиться при
похолодании климата. Зависимость современных клубеньковых
бактерий клевера от содержания кальция объясняется тем, что
их предки жили в почвах по берегам высыхающего мелового
моря. Эволюция симбиотических свойств шла от широкой
специфичности к узкой, от низкого уровня азотфиксации к высокому
(Парийская, Клевенская, 1979).
В условиях современных тропиков, где обитает около 90%
видов семейства бобовых, наиболее распространено
малоспецифичное взаимодействие партнеров, но низкая азотфиксирующая
активность. Для бобовых умеренных широт, где обитают более
специализированные и эволюционно молодые представители
подсемейства мотыльковых, типично высокоспецифическое
взаимодействие по типу "групп перекрестной инокуляции" с
высокой азотфиксирующей активностью (Проворов, 1996).
Если считать, что большинство родов, входящих в класс Рго-
teobacteria и являющихся типичными обитателями фитопланы
наземных растений, перед выходом растений на сушу уже
существовали в качестве компонентов циано- и альгобактериальных
сообществ (Заварзин, 1990а, в), то логично предположить, что и
ризобии первоначально находились в симбиозе с водорослями.
Существуют косвенные доказательства, подтверждающие
наличие тесных связей между водорослями и ризобиями. При
подборе пар для создания искусственных альгобактериальных систем
было показано, что водоросль Chlamydomonas reinhardi в
присутствии Rhizobium leguminosarum полностью сохраняла хлорофилл,
тогда как аксеничная культура желтела и лизировалась (Drya-
nowska, Zakova, 1985). Ризобии постоянно обнаруживались и в
наземных разрастаниях водорослей (Дедыш и др., 1992). Связь
Rhizobium с корнями водного бобового растения Neptunia natans
сохранилась и до настоящего времени. Тестирование 18 изоля-
тов ризобии, выделенных из этого растения, позволило
установить их специфичность по отношению к растению-хозяину. Эти
43
культуры оказались неспособными вызывать нодуляцию у
других видов бобовых растений (Subba-Rao et al., 1995). В настоящее
время они выделены в новый род Allorhizobium (Martinez-Romero
et al., 1999). Длительная коэволюция ризобий с растениями
привела к установлению сложных генетических взаимосвязей
между ними.
В настоящее время любой симбиоз следует рассматривать
как многоэтапный процесс, сопровождающийся почти
непрерывным обменом сигналами между партнерами (Калакуцкий,
Шарая, 1990). Анализу бобово-ризобиальных симбиозов
посвящено много обзоров, эта тема не раз обсуждалась на
симпозиумах и конференциях в связи с проблемой фиксации азота
прокариотами и урожаем сельскохозяйственных культур. Мы
рассмотрим лишь два аспекта: роль ассоциативных бактерий
и эндомикоризных грибов в формировании
бобово-ризобиальных симбиозов и взаимоотношения ризобий с небобовыми
растениями.
При интродукции ризобий в почву было обнаружено, что
иногда они не оказывали положительного действия на растения,
пока не вносили другие ризосферные бактерии. Внесение таких
пар культур, как Rhizobium-Azospirillum или Rhizobium-B. poly-
туха, в 2-3 раза увеличивало число клубеньков у растений
(Tchebotar et al., 1997). Азоспириллы локализовались на
клубеньках или около них. Авторы считают, что образование
дополнительных локусов инфицирования - возможный механизм
стимуляции образования клубеньков. Совместная интродукция
R. leguminosarum и стрептомицета почти на порядок
увеличивала уровень численности ризобий в ризосфере по сравнению с
чистой культурой ризобий (Polyanskaya, Zvyagintsev, 1995).
Предполагается, что стрептомицеты с их гидролазной
активностью способны снабжать ризобий субстратами, являющимися
продуктами гидролиза полимеров.
Поскольку большинство травянистых растений, в том числе и
бобовых, имеют на корнях везикулярно-арбускулярную
микоризу, то неизбежен контакт микоризных грибов с ризобиями, в
результате которого складывается двойной симбиоз у бобовых
растений (Крюгер, Селиванов, 1982). Было выявлено
взаимополезное влияние этих партнеров (Ganry et al., 1982; Кураков, 1985).
Грибы усиливали фиксацию азота из атмосферы,
осуществляемую клубеньковыми бактериями, но не внедрялись в сами
клубеньки. В свою очередь, ризобий благоприятно влияли на
формирование эндомикоризы и снабжение грибов азотом.
Значимость существования тройной симбиотической системы: бобовое
растение-эндомикоризный гриб-ризобии особенно четко прояв-
44
ляется на растениях с замедленной начальной фазой роста и на
почвах с низким содержанием подвижного фосфора (Якоби и др.,
1995). При инокуляции бобовых селекционными штаммами арбу-
скулярно-микоризных грибов (АМГ) увеличивается количество
и масса клубеньков, азотфиксирующая активность и
продуктивность растений. При выращивании люцерны в аридных условиях
рекомендуется использовать одновременно микоризацию и
инокуляцию семян люцерны бактериями Rhizobium meliloti. При этом
увеличивается нодуляция, симбиотическая азотфиксация и
поглощение фосфора, что положительно влияет на рост растений
и урожай (Salem et al., 1998).
Существует гипотеза об эволюционной связи микоризных
и ризобиальных симбиозов (La Rue, Weeden, 1994. Цит. по: Про-
воров, 1996). Она основана на том, что:
- некоторые мутации бобовых, лишающие их способности
формировать клубеньки, нарушают также и способность к мико-
ризации;
- синтезируемые ризобиями Nod-факторы, индуцирующие у
хозяина развитие клубеньков, представляют собой хитиноподоб-
ные молекулы, синтез которых характерен для грибов;
- при развитии как микоризы, так и клубеньков у бобовых не
наблюдается индукции защитных реакций.
Кроме тесных связей ризобий с бобовыми растениями и
микоризными грибами, открылся новый аспект во
взаимоотношениях ризобий с растениями, связанный с изучением колонизации
корней как бобовых, так и небобовых растений Rhizobium legumi-
nosarum bv. trifolii. Было показано, что представители Rhizobia-
сеае способны вступать в несимбиотические ассоциативные
взаимоотношения с корнями небобовых растений без образования
клубеньков. При этом через 14 недель после инокуляции
микроколонии ризобий были обнаружены не только в ризоплане, но и
во внутреннем пространстве ткани центрального корня
небобовых растений. Однако корни бобовых растений более
эффективно колонизировались как ризобиями, так и другими
ассоциативными бактериями, чем корни небобовых растений (Schloter et al.,
1997). Может быть, в этом явлении и содержится ответ на
вопрос - почему именно бобовые растения были выбраны
ризобиями в качестве хозяев.
В последние годы появилось новое направление в изучении
взаимоотношений растений с бактериями, основанием для
которого послужили сообщения о возможности образования
псевдоклубеньков (para-nodules) на корнях небобовых растений при
воздействии на них различных нодулирующих агентов и о
способности бактерий заселять эти новообразования. Это явление получи-
45
ло название "паранодуляция". Нодулирующие агенты могут
быть как абиотические, так и биотические. К первым относятся
2,4-дихлорфеноксиуксусная кислота (2,4-Д), индолилуксусная
кислота и другие различные ауксины. Все эти вещества в низких
концентрациях действуют как фитогормоны. Для успешного
образования псевдоклубеньков оказалось необходимым уменьшить
высокое парциальное давление кислорода и понизить
кислотность среды.
Под действием нодулирующих агентов клеточная стенка
приобретает свойства пластичности, губчатости, что способствует
проникновению бактерий. Для заселения новообразованных
клубеньков предложено использовать различные азотфиксирующие
бактерии. В качестве инокулянтов применяли бактерии,
относящиеся к активным азотфиксаторам: Rhizobium, Azorhizobium,
Azospirillum, Azotobacter, Derxia, Klebsiella и др. С помощью
световой и электронной микроскопии было установлено
проникновение этих бактерий внутрь растительных клеток корня и
существование их как стабильной популяции (Cocking, Davey, 1991; Nie
et al., 1992; Christiansen-Weniger, 1995).
Впоследствии оказалось возможным получение
псевдоклубеньков на корнях небобовых растений без введения
химического нодулирующего агента, с помощью чистых культур или
ассоциаций различных видов бактерий, вносимых на семена
или побеги растений. Так, был получен стабильный эндосимби-
оз между корнями рапса и естественной ассоциацией азотфик-
сирующих бактерий, состоящей из Arthrobacter sp., Bacillus fir-
mus и Klebsiella terrigena (Glagoleva et al., 1998). В зоне роста
корня под влиянием вносимых бактерий появлялись клубень-
ково-подобные структуры. Морфологические изменения как
самих корней, так и бактерий, которые прикреплялись к
поверхности этих структур, облегчало внедрение бактерий в
ткани корня. Наблюдали 5-кратное увеличение нитрогеназной
активности при колонизации диазотрофами внутренних тканей
корня.
Морфологическая организация псевдоклубеньков и
особенности локализации в них бактерий были изучены при обработке
простерилизованных семян рапса ассоциацией, состоящей из
бактерий Micrococcus sp. и Rhodococcus sp. (Ковальская, 1999;
Ковальская и др., 2001). Было показано, что р-клубеньки
представляют собой укороченные утолщенные боковые корни,
формирующиеся в зоне корневых волосков. Они образовывались на
7-10-е сутки после инокуляции, их среднее количество на корнях
месячного растения достигало 25 при диаметре р-клубеньков
около 1 мм. В основании псевдоклубеньков в зоне каллусного
46
разрастания наблюдали ориентированное прикрепление
бактерий к поверхности клеток растения и их иммобилизацию в слизи,
которая защищает клетки бактерий от физического воздействия
почвенных частиц и способствует возрастанию их азотфиксиру-
ющей активности. Полученные р-клубеньки являются
благоприятной экологической нишей для развития и активного
функционирования бактерий в этих условиях.
Наиболее высоким и стабильным уровнем азотфиксации
отличалась ассоциация Azotobacter nigricans + Bacillus sp. Азотфик-
сирующая активность внутри псевдоклубеньков в модельных
опытах в 5-6 раз, а в вегетационных в 2 раза была выше, чем при
простой ассоциации бактерий с корнями рапса. При этом
повышалась и продуктивность растений - на 39-41% по сравнению
с контролем (растения без псевдоклубеньков).
Таким образом, связь ассоциативных диазотрофных
бактерий с растениями оказалась более тесной, чем это
предполагали ранее, когда было принято четкое разделение на фитопато-
генные и симбиотические бактерии, способные внедряться в
ткани корня, с одной стороны, и эпифитные, обитающие на
поверхности корня и неспособные проникать в ткани корня, -
с другой. Многочисленные опыты по изучению колонизации
корней различных растений бактериями позволили установить
не только эндосимбионтное существование многих видов
бактерий, но и выделить эффективных колонизаторов корня в
особую группу "ризобактерий". Поскольку практически все ризо-
бактерии стимулируют рост растений благодаря фиксации
молекулярного азота, выделению разнообразных физиологически
активных веществ и антибиотиков против фитопатогенных
микроорганизмов, для них был предложен термин "plant growth
promoting rhizobacteria" или сокращенно "PGPR" (Nehl et al.,
1997).
Симбиоз актиномицетов рода Frankia с небобовыми
растениями (актинориза). Актиномицеты, которые традиционно
считаются типично почвенными микроорганизмами и
рассматриваются как континентальная ветвь прокариот, обладающих
приспособлениями для жизни в твердофазном субстрате (Калакуцкий,
Агре, 1977), оказались не менее тесно связанными с растениями,
чем одноклеточные бактерии. Возможно, эти мицелиальные
прокариоты прошли такую же коэволюцию с растениями, что и
эукариотные мицелиальные организмы (Каратыгин, 1993), и, так
же как и последние, способствовали выходу растений на сушу.
Анализу связей актиномицетов с растениями посвящен
специальный обзор (Калакуцкий, Шарая, 1990). Мы остановимся лишь на
некоторых аспектах.
47
Во-первых, актиномицеты, как и одноклеточные бактерии,
оказались способными не только развиваться на поверхности
корней, но и проникать в их ткани. Так, актиномицеты были
обнаружены в эндоризосфере внутри кортикальных клеток старых
корней пшеницы. Удельное содержание актиномицетов в маце-
рированной корневой ткани растений дюн оказалось в 2,5-10 раз
выше, чем в ризосфере, и достигало 8 млн КОЕ/г. Возможно, что
как и грибы актиномицеты способны снабжать растения
фосфором, используя труднодоступные для растений соединения; они
образуют также несколько групп соединений, активно
связывающих железо - сидерофоры (микобактины, нокобактины, гидро-
ксаматы). Последние также образуются грибами (Калакуцкий,
Шарая, 1990).
С другой стороны, многие виды актиномицетов являются фи-
топатогенами и вызывают различные заболевания растений
(парша картофеля, различные гнили). Аналогично бобово-ризо-
биальным комплексам, актиномицеты рода Frankia оказались
способными проникать в корневую систему многих небобовых
(в основном древесных и кустарничковых растений), вызывать
образование специализированных корневых клубеньков и
активно фиксировать атмосферный азот. Такой симбиоз получил
название "актинориза". Анализу этого симбиоза посвящены
обзоры (Калакуцкий, Парийская, 1982; Добрица, 1988; Калакуцкий,
Шарая, 1990; Benson, 1988 и др.) и сборники по итогам
специализированных международных симпозиумов.
Франкии - медленнорастущие спорангиоактиномицеты. Они
образуют три типа клеток: ветвящийся и редкосептированный
мицелий, спорангии с неподвижными спорами и особые
терминальные вздутия, именуемые "везикулами". Группа генетически
неоднородна, степень гомологии ДНК между штаммами
колеблется от 39 до 94%, они различаются также по способности к
усвоению углеводов и специфичности по отношению к растениям-
хозяевам. Установлена гомология между структурными генами
нитрогеназы (nif KDH) франкий и Klebsiella pneumoniae,
наблюдалась ДНК-ДНК гибридизация с генами гидрогеназы и глутамат-
синтетазы Bradyrhizobium (Benson, 1988).
Мы остановимся лишь на сравнительных аспектах бобово-
ризобиальных и актиноризных симбиозов, анализ которых
дается в обзорах (Калакуцкий, Шарая, 1990; Benson, 1988). Следует
сказать, что открытый значительно позднее, по сравнению с ри-
зобиями, эффект актиноризы оказался как по набору
инфицируемых растений, так и по масштабам азотфиксации значительно
более широко распространенным. Масштаб ежегодной
биологической азотфиксации в насаждениях актиноризных растений со-
48
поставим с таковым на полях люцерны и на порядок превосходит
итоги деятельности свободноживущих прокариот. Спектр
растений, инфицируемых франкиями, включает более 160 видов,
относящихся к 23 родам, 8 семействам и 7 порядкам. Среди других
аэробных диазотрофов франкии выделяются высокой степенью
устойчивости процесса азотфиксации к кислороду, приближаясь
по этому показателю к цианобактериям, образующим гетероци-
сты. Это связано с тактикой защиты этими микроорганизмами от
кислорода нитрогеназного комплекса.
Проникновению актиномицетов рода Frankia в растение и
установлению симбиоза могут способствовать, как и в случае с
микоризным симбиозом, бактерии-"хелперы". Ряд актиномицетов -
некоторые виды Streptomyces и Nocardia (N. autotrophica, N.
vaccina) - содействуют образованию азотфиксирующих клубеньков
на корнях ольхи. Высказывается предположение, что жизнь но-
кардий N. vaccinii связана с растениями (Малишкайте и др., 1987).
Планируется для выведения актиноризных растений в будущем
(в спектр таких растений предполагается включить как лесные,
так и сельскохозяйственные виды) создать гибриды франкий со
стрептомицетами.
Повышению активности азотфиксации в клубеньках
способствует также совместная инокуляция франкий с микоризными
грибами (Cleveland et al., 1983). Из клубеньков, образуемых
франкиями на корнях ольхи, было выделено значительное
количество сапротрофных микромицетов, относящихся к двум классам -
Hyphomycetes и Basidiomycetes (Кочкина и др., 1994). Было
показано, что грибы изначально отсутствуют в актиноризных
клубеньках, но появляются там с течением времени. Их видовое
разнообразие невелико, но состав весьма специфичен по сравнению
с почвой, а функции пока не ясны. Авторы предполагают, что
клубеньки являются элективными средами для тех
микромицетов, численность которых в почве мала. В качестве
селективного агента называется уникальный пигмент хиноидной природы,
образуемый франкиями в клубеньках. Этот пигмент обладает
широким спектром антибиотического действия. Было
установлено (Иванушкина и др., 1994), что пигмент стимулирует рост
микромицетов, которые являются характерными обитателями
клубеньков (Cylindrocarpon gracile), но угнетает рост грибов,
выделяющихся из почвы вокруг клубеньков, но никогда не
встречающихся в клубеньках. Авторы не исключают, что есть и другие
механизмы, создающие селективность актиноризных клубеньков
как среды обитания микромицетов. Предполагается также, что
последние могут играть роль деструкторов, способствующих
освобождению франкиальных пропагул с целью максимально эф-
49
фективного инфицирования молодых корневых волосков (Ива-
нушкина и др., 1994).
Таким образом, по мере накопления наших знаний о природе
различных симбиозов, меняются представления о количестве
партнеров в них, которых оказывается значительно больше и
которые необходимы для создания устойчивых взаимополезных
симбиозов. Тем самым подтверждается основной экологический
закон о значимости симбиозов для поддержания и сохранения
устойчивости экосистем (Каратыгин, 1993; Бигон и др., 1989).
Симбиозы растений с цианобактериями (синцианозы).
Несмотря на то, что большинство цианобактерий являются свобод-
ноживущими и широко распространенными фотосинтезирующи-
ми прокариотами в разных природных биотопах, в том числе и
экстремальных, существует небольшое число видов
цианобактерий, которые образуют специфические ассоциации с
некоторыми группами эукариотных организмов, такими, как водоросли,
грибы, печеночные мхи, папоротники и некоторые виды
голосеменных и покрытосеменных растений. Когда цианобактерий
развиваются в симбиозе, они претерпевают резкие изменения как в
морфологии, так и физиологии и биохимии. У эндофитных
цианобактерий происходит увеличение размеров вегетативных
клеток, изменение их ультраструктуры, редукция нитей, увеличение
частоты образования гетероцист, наблюдается редукция
фотосинтетической активности. Цианобактерий, которые могут быть
партнерами в симбиозах, относятся к родам Anabaena, Calothrix,
Fisherella, Nostoc и Seytonema (Stewart et al., 1983). Цианобионты
находятся в специфических локусах - в муцигеле у основания
листьев Gunnera, специализированных полостях листьев Azolla, в
дискретной зоне кортекса корневого клубенька у саговниковых.
Классическим примером симбиотической азотфиксирующей
ассоциации является симбиоз водного папоротника Azolla и
азотфиксирующей цианобактерий рода Anabaena. Все сведения об
организации и физиолого-биохимических особенностях этого
симбиоза даны в обзоре (Гоготов, Лауринавичене, 1989). Хотя азолла
распространена в основном в странах с тропическим климатом,
она предпочитает обитание в стоячих водах с прохладной водой.
Это небольшое (0,7-1,8 см) растение, плавающее на поверхности
воды. Цианобактерий находятся в специальных полостях на
нижней стороне верхней доли листьев азоллы. Их рост происходит
синхронно с развитием полости листа, затем скорость роста ана-
бены снижается и начинается формирование гетероцист. В
отличие от других симбиотических ассоциаций у Л. azollae отсутствует
стадия свободноживущего симбионта. Азоллу, не содержащую
цианобактерий, не удается повторно инфицировать. Оба партне-
50
pa являются фотосинтезирующими организмами, хотя вклад в
фотосинтетическую активность эндосимбионта составляет не
более 6-10%. Нитрогеназа, обеспечивающая ассимиляцию N2,
локализована в гетероцистах Д. anabaena.
Были сообщения о том, что в полостях азоллы, кроме циано-
бактерий, обнаружены сапротрофные бактерии Alcaligenes fae-
calis и Caulobacter fusiformis (Newton, Hermann, 1979). Однако
впоследствии, когда посев из азоллы был сделан с предварительной
поверхностной стерилизацией пакетов цианобактерий (Gates et
al., 1980), постоянно высевался лишь один тип бактерий. По
морфологическим особенностям, циклу развития и физиолого-био-
химическим признакам изоляты явно принадлежали к группе ко-
ринеформных бактерий, но поскольку не был сделан хемотаксо-
номический анализ и не установлен тип клеточной стенки,
авторы (Gates et al., 1980) сомневаются относительно родовой
принадлежности этих бактерий, предполагая в качестве возможных
кандидатов роды Arthrobacter или Corynebacterium. Судя по тому,
что исследуемые бактерии - аэробы, и гидролизуют крахмал,
вероятнее их принадлежность к роду Arthrobacter. Позднее (Forni et
al., 1990) артробактер был обнаружен в спорокарпах азоллы, что
свидетельствует о том, что он, как и цианобактерий, проходит
вместе с растением через все стадии его развития. Было
предложено рассматривать бактерии этого рода в качестве третьего
партнера в симбиозе азолла-анабена (Carrapico, 1991).
Электронно-микроскопические исследования подтвердили
нахождение клеток коринеподобных бактерий (КПБ) в полости
азоллы, ассоциированных с клетками цианобактерий. Их
численность достигает одной клетки на одну клетку водорослей (Peters
et al., 1978). Роль этих бактерий пока не ясна. Необходимы
дальнейшие исследования, чтобы установить: влияют ли метаболиты
этих бактерий на становление симбиоза между водорослями и
папоротником. Можно предположить, что они поддерживают
низкую концентрацию кислорода в полостях азоллы, необходимую
для азотфиксации цианобактерий, и выделяют слизь, которая
может иметь значение для инфекции папоротника цианобактери-
ями (Gates et al., 1980).
Одной из важнейших функций бактобионтов в симбиозе
азолла-анабена, установленной в последнее время, является
выделение ими лектинов, за счет которых происходит адгезия
бактобионтов к эпидермальным клеткам листьев азоллы и их
агглютинация. Экстракты протеинов 6 культур бактерий показали
положительную реакцию гемагглютинации (Serrano et al., 1999).
Именно эта реакция лежит в основе феномена биологического
распознавания при взаимодействии симбионтов с хозяином.
51
Ранее уже упоминалось, что цианобактерии образуют
симбиозы с несколькими видами водорослей, мхов, одним видом
покрытосеменных растений (Gunnera), но лишь в одном из
симбиозов - с саговниковыми растениями - цианобактерии находятся в
клубеньках на корнях этих растений. Саговниковые растения
относятся к голосеменным двудомным растениям, обитающим в
субтропических и тропических регионах на бедных известковых
почвах. Саговниковые растения появились на Земле в позднем
карбоне около 370-350 млн лет назад, но своего расцвета
достигли в мезозое. Класс саговниковых эволюционно связан с
семенными древовидными папоротниками. Современные
древовидные формы, похожие на пальму, могут достигать 20 м в
высоту, но существуют и микроформы, не превышающие 3 см (Груш-
вицкий, Чавчавадзе, 1978). Характерной особенностью корневой
системы саговниковых является наличие специализированных
"воздушных" корней, находящихся на поверхности почвы. На
таких корнях образуются коралловидные корневые клубеньки,
напоминающие по морфологии актиноризные клубеньки. Эти
клубеньки инфицируются цианобактериями родов Nostoc или
Anabaena. Каждый род саговниковых содержит специфический
эндофит, который локализуется в заполненном муцигелем
пространстве, во внешнем кортексе корневого клубенька.
Возможно, что у цианобактерии, как и у ризобий, гены, ответственные за
инфицирование, находятся в плазмидах и являются общими у
пары цианобактерии-саговниковые растения. Азот, фиксируемый
цианобактериями, поступает в основную часть корня растения
(Stewart et al., 1983). У цианобактерии, находящихся в симбиозе с
растениями, наблюдается изменение ряда биохимических
процессов: так, у них перестает работать фотосистема и они переходят
на гетеротрофный тип питания, у клеток теряется клеточная
стенка, они превращаются в протопласты амебоидной формы,
оставаясь метаболически активными (Baulina et al., 2000).
По одной из гипотез о механизме инфицирования корней
цианобактериями, последние проникают в корень через ходы в
поверхностной оболочке, проделанные бактериями-спутниками,
выделяющими целлюлолитические и пектинолитические
ферменты (Grilli et al., 1988; Grobellar et al., 1987). Предполагается,
что фенольные соединения, накапливающиеся в больших
количествах в этой зоне, могут ингибировать рост других бактерий в
этом биотопе (Obukowicz, et al, 1981; Lobakova et al., 2000).
Таксономический состав гетеротрофных бактерий, ассоциированных с
симбиотическими цианобактериями и обнаруженных в
апикальной части корневых клубеньков саговниковых растений, пока не
выяснен.
52
1.4.2. АССОЦИАТИВНЫЕ БАКТЕРИИ В ФИТОСФЕРЕ
ВЫСШИХ РАСТЕНИЙ
Термин "ассоциативные бактерии" или "ассоциативные
взаимоотношения" не имеет четкого определения. Удачное, на наш
взгляд, раскрытие этого понятия дано в обзоре, посвященном
анализу генетического контроля процессов взаимодействия
бактерий с растениями в ассоциациях (Каменев, Муромец, 1999,
С. 1482): «Обычно к ассоциативным бактериям относят штаммы,
взаимодействие которых с растениями не приводит к
образованию каких-либо специализированных структур типа клубеньков
на корнях растений, однако характеризуется образованием
специфических бактериальных соединений и структур,
способствующих прикреплению бактерий к корням растений и
проникновению их в межклеточные пространства и даже клетки кортекса
корней. Формирование ассоциации включает несколько стадий:
перемещение бактерий к корням за счет хемотаксиса;
прикрепление бактерий к корням и "заякоривание" на них, часто с
образованием фибриллярного материала вокруг бактерий;
проникновение бактерий внутрь корня и колонизация межклеточного
пространства между эпидермисом и кортексом (иногда
проникновение внутрь кортекса)». В связи со способностью бактерий
проникать в клетки корня был предложен и другой термин - "эндофит-
ные бактерии".
Однако в 50-70-е годы XX в., когда только начинали
проводиться исследования по изучению взаимодействия бактерий с
растениями и еще не были известны те сложные механизмы,
которые обусловливают взаимосвязь бактерий с растениями,
употреблялись и используются до настоящего времени термины:
"эпифитные бактерии", "эккрисотрофные бактерии", "бактерии
филлосферы, ризосферы, ризопланы". Анализировать
таксономический спектр бактерий в ризосфере и филлосфере,
приводимый в работах полувековой давности на родовом уровне,
представляется практически нереальным. Это связано с
невозможностью установить соответствие между многими старыми
названиями родов и видов и современными, упразднением некоторых
названий родов и видов, описанием многочисленных новых
таксонов бактерий. Однако на уровне крупных групп - грамположи-
тельные и грамотрицательные, споровые и неспоровые,
одноклеточные и мицелиальные прокариоты - выводы о структуре
бактериальных сообществ в фитосфере, сделанные в те годы,
совпадают с современными.
Изучая смену бактериальных компонентов в ризосфере в
процессе вегетации растения, некоторые исследователи (Кра-
53
сильников, 1958; Возняковская, 1969; Vagnerowa et al., 1960;
Leben, 1961) отмечали, что на начальных этапах роста растений
доминируют грамотрицательные бактерии - псевдомонады и
флавобактерии, азотобактер, которые по мере старения
растений заменяются грамположительными - бациллами, микобак-
териями, стрептомицетами. Такой характер сукцессии связан с
заменой бактерий, питающихся продуктами экзоосмоса
растений (эккрисотрофами), на гидролитиков, разлагающих
корневой отпад, старые корешки, микробную биомассу. Другой
причиной смены состава бактериальных сообществ в процессе
вегетации растений является изменение состава корневых
выделений у растений, служащих источником питания для бактерий.
Так, в ризосфере ячменя у молодого растения обнаруживалось
20% бактерий, требующих для роста аминокислот, а у старого -
только 1% (Wallace, King, 1954). Аналогичную смену эколого-
трофических группировок бактерий наблюдали по мере
удаления от поверхности корня и переходу в окружающую корни
почву.
В настоящее время большинство исследователей считают,
что основную часть ризосферного микробного сообщества
составляют грамотрицательные бактерии (Debette, Blondeau 1980;
Kleeberger et al., 1983; Scher et al., 1984; Lambert et al, 1987).
Однако, как справедливо замечают авторы, исследовавшие
распределение бактерий по разным участкам корня (Liljeroth et al., 1991),
интерпретация полученных результатов во многом зависит как
от методики отбора образца для анализа (взять всю корневую
систему, включающую как старые, так и молодые корни, или
разделить их), так и от питательной среды, используемой для
посева. По их мнению, наиболее рациональным для выявления
типично эккрисотрофных бактерий, является анализ бактериальных
сообществ, расположенных на самом кончике корня, где
концентрируются растворимые органические соединения, выделяемые
растением. При этом поселяющиеся там бактерии не только
предпочитают использовать именно те органические кислоты,
которые доминируют в экссудатах корня, но и обнаруживают
хемотаксис к этим соединениям. Известно, что для азоспирилл
наиболее сильными аттрактантами являются малат, фумарат, сукци-
нат - органические кислоты, выделяемые как водорослями, так и
корнями высших растений (Reinhold et al., 1985; Дедыш, 1990).
Был установлен также хемотаксис флюоресцирующих
псевдомонад к экссудатам семян соевых бобов (Scher et al., 1985).
Хемотаксис индуцировался некоторыми аминокислотами, но не сахара-
ми. В отсутствие семян или экссудатов движения бактерий в
почве не наблюдалось. Оптимальными условиями для подвижности
54
и хемотаксиса Erwinia herbicola были температура 29 °С, наличие
аспарагина, гистидина и серина, а из органических кислот - мала-
та и тартрата (Klopmeyer, Ries, 1987).
Другой показатель, который может быть использован для
подтверждения принадлежности бактерий к группе эккрисотро-
фов, - скорость роста. Так, было установлено, что для
псевдомонад, являющихся типичными представителями сообщества ризо-
планы, время генерации составляет 5 ч, в то время как для
бацилл, характерных почвенных обитателей, - 35 ч (Bowen, Rovira,
1973).
Вышеприведенные данные свидетельствуют о попытке
разными способами выделить то сообщество бактерий, которое
наиболее тесно связано с растением, питаясь его прижизненными
выделениями и обеспечивая, в свою очередь, растение как
усвояемыми формами азота, так и различными стимуляторами роста.
В этом плане выделение эндоризосферы как внутренней области
корня или листа, в которой обитают бактерии, внедрившиеся в
растительные ткани, позволило еще более уточнить набор
таксонов бактерий, ассоциированных с растениями. В последнее время
появляется все больше данных о внедрении бактерий, которые
считались настоящими эпифитами, в корни растений без особого
вреда для последних. Среди эндофитов найдены представители
протеобактерий всех подклассов. Чаще всего они относятся к
родам Azospirillum, Herbaspirillum, Acetobacter. Некоторые из этих
бактерий обнаруживаются только в фитосфере, в то время как
выделить их из почвы не удается. Это - Herbaspirillum seropedi-
сае, Acetobacter diazotrophicus, Azoarcus sp. Предполагается, что
эти бактерии существуют в почве в "некультивируемой форме".
В связи с этим предложено называть такие формы
ассоциативных бактерий облигатными эндофитами, прочие -
факультативными эндофитами (Каменева, Муромец, 1999).
Примером попытки дифференциации бактериальных
сообществ ризосферы, эндоризосферы и почвы на основании их
таксономического состава могут служить исследования
бактериального населения прикорневой зоны огурца (Mahaffee, Kloepper,
1997). В списках таксонов приводится более 50 названий родов
бактерий, представители которых были выделены из трех
сравниваемых биотопов (идентификация культур проводилась на
основании анализа метиловых эфиров жирных кислот). Некоторые
из них были представлены единичными штаммами, поэтому
наиболее значимыми показателями явились частота выделения тех
или иных таксонов из разных экониш (было выделено в общей
сложности более 6 тысяч штаммов). В почве доминирующими
оказались представители рода Bacillus (67% от общего числа учи-
55
тываемых родов), далее в порядке убывания следовали роды
Arthrobacter, Burkholderia, Micrococcus, Pseudomonas (их доля не
превышала 3-8%). В ризосфере примерно равные доли
составили Bacillus и Pseudomonas (по 16%), за ними следовали неиденти-
фицированные изоляты, далее роды Agrobacterium и Enterobacter
(8%), Burholderia (5%), Chryseobacterium (6,5%). В эндоризосфере
доминировали практически те же роды, что и в ризосфере.
Подобное вычисление доминирования тех или иных таксонов
на основании количества выделенных изолятов каждого таксона,
представляется, на наш взгляд, весьма субъективным и не
отражает структуру бактериального сообщества. По данным
большинства исследователей, в ризосфере, и тем более
эндоризосфере, доминируют разнообразные протеобактерии - как аэробные,
так и факультативно-анаэробные. В данном случае, хотя и
отмечается явное доминирование бацилл в почве, они же
оказываются преобладающими (хотя их процент намного ниже) везде, в то
время как такие типичные эндофиты, как агробактерии и энте-
робактерии, составили всего 8% от общего числа выделенных
родов бактерий. Возможно, это связано также с составом среды,
используемой авторами для учета бактерий (триптиказо-соевый
агар), на которой получают преимущество в росте такие быстро-
распространяющиеся бактерии, как спорообразующие.
Перечень родов бактерий-эндофитов, обнаруженных на
корнях клевера и картофеля (Sturz et al., 1998), включает более
30 родов, из которых 80% составляют протеобактерии. С
наибольшей частотой встречаемости выделялись роды:
Pseudomonas, Agrobacterium, Xanthomonas, Variovorax, Curtobacterium -
с корней клевера, Pseudomonas, Pantoea, Curtobacterium - с
клубней картофеля. В список таксонов входят также факультативно-
анаэробные бактерии - Enterobacter, Klebsiella, Erwinia, Serratia,
Shewanella, Vibrio, Comamonas. Большинство представителей
бактерий самых разных родов оказались нейтральными по
отношению к тем растениям, на корнях которых они обитают.
Некоторые из них проявили антагонистическую активность по
отношению к фитопатогенным грибам.
Развитию исследований в области изучения бактериальных
сообществ, ассоциированных с растениями, способствовал новый
этап, связанный с обнаружением повышенной азотфиксирующей
активности в ризосфере и филлосфере небобовых растений.
Многочисленные эксперименты, проведенные с использованием
новых методов определения азотфиксации, продемонстрировали
широкое распространение азотфиксации в фитоплане растений
различных семейств в разных типах экосистем. Такой тип
азотфиксации, в отличие от симбиотической, осуществляемой бакте-
56
риями в клубеньках бобовых растений, был назван
ассоциативной (Умаров, 1984, 1986).
Было показано, что суммарный уровень азотфиксации в
почве при наличии растений значительно выше, нежели в их
отсутствие. Это объясняется тем, что продукты экзоосмоса и
корневого опада растений являются энергетическим субстратом для бак-
терий-диазотрофов, кроме того, высокая поглотительная
способность корней растений способствует быстрому оттоку
азотсодержащих метаболитов азотфиксаторов и поддерживает тем
самым высокую активность нитрогеназы. Установленная
зависимость ассоциативной азотфиксации от активности
фотосинтетической деятельности растения свидетельствует о тесном
сопряжении двух уникальных биологических процессов -
азотфиксации и фотосинтеза. Масштабы ассоциативной азотфиксации в
биогеоценозах зоны умеренного климата могут достигать
размеров 50-150 кг/га за вегетационный период (Умаров, 1986). Ранее
функция азотфиксации приписывалась лишь ограниченному
кругу свободноживущих бактерий - Azotobacter, Clostridium, Azospi-
rillum, Beijerinckia, Derxia. Впоследствии выяснилось, что роль
азотобактера и клостридий в фиксации азота из атмосферы не
так велика по сравнению с факультативно-анаэробными
бактериями, такими, как энтеробактерии в целинных лесных почвах и
бактерии рода Xanthobacter в окультуренных почвах южной зоны
(Мишустин и др., 1986).
Спектр диазотрофных бактерий постоянно пополняется
новыми таксонами. В настоящее время считается, что к фиксации
азота из атмосферы способны 80-90% всех известных бактерий.
Исключение составляют представители типично
континентальной ветви прокариот - мицелиальные актиномицеты, у которых
(кроме франкий, образующих симбиоз с корнями многих
небобовых растений), не обнаружено нитрогеназы. Слабой азотфикси-
рующей активностью характеризуются и другие представители
бактерий актиномицетной линии (Умаров, 1986). Однако недавно
было установлено наличие уникальной нитрогеназы у
термофильного актиномицета Streptomyces thermoautotrophicus, для
которой характерны высокая эффективность использования
энергии и способность функционировать в аэробных условиях, т.е., в
отличие от ранее известных типов нитрогеназ, она не ингибиро-
валась молекулярным кислородом (Ribbe et al., 1997).
Вопрос о приуроченности разных видов азотфиксирующих
бактерий к ризосфере определенных типов травянистых
растений является дискуссионным. Так, например, сообщалось, что на
корнях тропических пастбищных злаков доминируют
бактерии Azotobacter paspalii, Beijerinckia indica, Azosprillum brasilense и
57
Az. lipoferum (Dobereiner, 1974). В ризосфере сахарного тростника
к вышеперечисленным прибавляются Derxia, Clostridium и Vibrio,
на корнях зерновых культур в качестве наиболее характерных
диазотрофов обнаружены Klebsiella pneumoniae, Enterobacter
cloaceae, Erwinia herbicola, Spirillum sp., Bacillus sp. (Larson, Neal,
1976). Ассоциации бактерий-диазотрофов в ризосфере растений
могут быть как экторизосферными, так и эндоризосферными.
Так, ассоциацию Beijerinckia indica с сахарным тростником
Дж. Доберейнер (1974) относит к типу экторизосферной, так как
бейеринкии обнаруживаются в ризосферной почве, а не на
корнях. Ассоциация Azospirillum с тропическими злаками или
Azotobacter paspalii с растением Paspalum notatum - эндоризосфер-
ная, так как бактерии локализованы в слое муцигеля.
В результате изучения большого количества диазотрофных
бактерий, выделенных из ризосферы растений разных семейств
(Умаров, 1984, 1986), не было выявлено какой-либо
приуроченности определенных видов бактерий к тем или иным видам
растений. Подтверждением этого могут служить и положительные
результаты экспериментов по инвазии корней риса и пшеницы
бактериями родов Acetobacter и Herbaspirillum, выделенными из
корней тростника (Kennedy et al., 1997). Другой пример -
инокуляция корней пшеницы бактериями Azorhizobium caulinodans,
выделенными из клубеньков на стеблях и корнях тропических
бобовых растений (Sabry et al., 1997). Было установлено
формирование эндофитной ассоциации азоризобий с корнями пшеницы:
клетки этих бактерий обнаруживали внутри ксилемы и
меристемы корня. При этом колонизация сопровождалась повышением
нитрогеназной активности.
Особое бактериальное сообщество складывается в
ризосфере риса в связи с его выращиванием в заливаемых водой почвах:
там доминируют различные анаэробные фототрофные бактерии
и цианобактерии, представленные родами Rhodospirillum, Rhodo-
microbium, Rhodopseudomonas, Rhodobacter (Нелидов, 1993; Редь-
кина, 1997). На корнях риса были обнаружены также и другие
представители фототрофных бактерий - рода Azoarcus, близкого
к Rhodocyclus purpureus. В гнотобиотической культуре эти
бактерии оказались способными колонизировать эндофитно корни
риса. Они проникали в кортекс, везикулярную систему, ксилему и
корневые волоски (Reinholdhurek, Hurek, 1997). Бактерии всех
вышеперечисленных таксонов относятся к активным азотфиксато-
рам, способствующим успешному культивированию риса.
На VI Международном симпозиуме по микробной экологии,
состоявшемся в Барселоне в 1992 г., а также XI Международном
конгрессе по азотфиксации в Париже в 1997 г. большинство док-
58
ладов были посвящены ассоциативным азотфиксирующим
бактериям - их таксономическому составу, анализу колонизации ими
корней растений, изучению их взаимоотношений с растениями, в
том числе и на молекулярно-генетическом уровне, поиску среди
них антагонистов к фитопатогенным организмам и др.
Поскольку нас интересует состав бактерий в ризосфере высших растений,
мы обращали внимание на те таксоны бактерий, которые были
упомянуты в качестве наиболее активных и часто
встречающихся диазотрофов, ассоциированных с корнями разных видов
растений. Вот далеко не полный перечень этих родов: Azospirillum,
Herbaspirillum, Acetobacter, Agrobacterium, Azotobacter, Pseudomo-
nas, Enterobacter; Klebsiella, Burkholderia, Flavobacterium,
Campylobacter. Как видим, все перечисленные бактерии принадлежат к
грамотрицательным бактериям класса Proteobacteriae, которые
прошли длительную коэволюцию с растениями, начиная от
водорослей. Практически все эти названия уже упоминались нами
ранее в качестве примеров бактерий, ассоциированных с
водорослями.
Однако в ризосфере большинства растений, как правило,
развивается сложная по составу, смешанная популяция
микроорганизмов, способная к активной азотфиксации (Умаров, 1986).
Наиболее часто в качестве партнеров в ассоциациях
обнаруживаются целлюлозоразрушающие и диазотрофные бактерии -
например, Cellulomonas gelida (или Bacillus macerans) и Azospirillum sp.y
либо Azotobacter и Myxococcus. Бинарный консорциум из
ризосферы злака (ежи сборной), состоящий из Klebsiella terrigena и
Bacillus firmus, обладал в 3 раза большей азотфиксирующей
активностью по сравнению с чистыми культурами (Zlotnikov et al.,
1997). Причем, свойства ассоциации зависели от соотношения
компонентов; максимум азотфиксации наблюдался при
содержании бацилл по биомассе 55%. Основой устойчивости данной
ассоциации было взаимодействие ее компонентов через
метаболиты - фенол и парааминобензойную кислоту. Следует отметить,
что неслучайно в качестве членов ассоциаций названы бациллы.
Среди последних наибольшей азотфиксирующей активностью
отличаются виды Вас. polymyxa и Вас. macerans. Эти виды были
перенесены на основании их генетических особенностей в новый,
недавно созданный род Paenibacillus (Lebuhn et al., 1997).
Подчеркивается, что характерной особенностью бактерий этого рода
является их высокая азотфиксирующая активность. В работе
(Shabaev et al., 1989) показана на практике возможность
успешной интродукции мутантов Bacillus polymyxa, обладающих
активной нитрогеназой, в ризосферу растений рапса, редиса и
тритикале. При этом максимум азотфиксации соответствовал фазе цве-
59
тения этих растений. Положительное влияние интродуцирован-
ных бактерий на урожай растений авторы объясняют не только
азотфиксацией, но и выделением бактериями гиббереллинов и
бактериостатических веществ.
Все исследователи, изучавшие влияние азотфиксирующих
бактерий на небобовые растения, отмечают, что в основе их
действия на растения (особенно, когда они находятся в ассоциациях)
лежит комплекс взаимосвязанных свойств: азотфиксация,
выделение физиологически активных веществ и антагонизм по
отношению к фитопатогенным грибам и бактериям. Эти свойства ри-
зосферных бактерий и являются ответом на вопрос: каковы
функции бактерий в ризосфере?
Бактериальное сообщество филлопланы рассматривается,
как правило, изолированно от ризосферного сообщества, хотя
оба они тесно связаны друг с другом и имеют много общих
представителей. В обзоре, посвященном анализу численности,
таксономического состава и методам исследования эпифитных
бактерий (Jacques, Morris, 1995), приводится перечень родов и видов
бактерий, изолированных разными исследователями и в разное
время из филлосферы наземных растений умеренной зоны. В
перечень родов аэробных грациликут входят следующие: Pseudo-
monas, Xanthomonas, Methylobacterium, Gluconobacter, Acetobacter,
Acinetobacter, Alcaligenes, Chryseomonas, Flavobacterium, Janthino-
bacterium. Из факультативно-анаэробных грамотрицательных
бактерий перечислены следующие роды: Enterobacter, Erwinia,
Klebsiella, Rahnella, Serratia, Chromobacteriwn, Zymomonas.
Наибольшее число видов бактерий принадлежат к родам Pseudo-
monas, Erwinia, Klebsiella. Фирмакуты представлены родами:
Micrococcus, Staphylococcus, Streptococcus, Leuconostoc, Bacillus,
Lactobacillus, Arthrobacter, Cellulomonas, Curtobacterium, Clavi-
bacter. Однако данные о выделении грамположительных
бактерий из филлопланы приводятся на основе только трех ссылок и
все перечисленные таксоны относятся к бактериям, выделенным
в основном из листьев оливы О lea europaea L. (Ercolani, 1991),
и лишь стафилококк и клавибактер выделены из растений Lolium
регеппе и Lactuca sativa.
Большое количество молочнокислых бактерий и
азотобактера было обнаружено в филлосфере сельскохозяйственных
культур (Prasad et al., 1984). Причем, доля бактерий рода
Lactobacillus последовательно уменьшалась в ряду: однодольные
растения - небобовые двудольные - бобовые растения. В фил-
лоплане однодольных растений была максимальной доля проте-
олитических бактерий и азотобактера. В ксилеме виноградной
лозы 78% от общего числа бактериальных изолятов были пред-
60
ставлены родами Pseudomonas и Enterobacter (Bell et al., 1995).
Из всех проверенных на патогенность штаммов только 6
оказались потенциально патогенными. В качестве эндофитных
бактерий П. Фишером с соавторами из стеблей маиса также были
выделены как аэробные, так и факультативно-анаэробные
бактерии (Fisher et al., 1992). Они представлены видами: Pseudomonas
fluorescens, P. corrugata, P. marginalis, Enterobacter agglomerans,
Klebsiella pneumonia, K. terrigena. Авторы отмечают
максимальную концентрацию этих бактерий на нижних (ближе к почве)
стеблях растений.
Постоянными обитателями филлосферы как дикорастущих,
так и культурных растений являются метилотрофные бактерии.
Связь розовоокрашенных факультативно-метилотрофных
бактерий (РОФМ) с растениями была установлена рядом авторов
(Corpe, Rheem, 1984; Малашенко и др., 1996; Holland, 1997). Эти
бактерии проявили необычную устойчивость к высоким дозам
радиации, вследствие чего было предложено использовать их в
качестве индикаторов радиационного загрязнения (Малашенко и
др., 1996). Для представителей этой группы прокариот,
относящихся к роду Methylobacterium, была показана их локализация на
листьях: клетки бактерий располагаются под слоем восковой
кутикулы и перехватывают метанол, выделяемый растением и
аккумулирующийся под кутикулой (Corpe, Rheem, 1984). В филло-
плане различных растений пустынных экосистем постоянно
обнаруживались бактерии рода Methylobacterium. Их встречаемость
на растениях пустыни Кызылкум составила 40% (Добровольская
и др., 1999). Если учесть, что специфической особенностью
пустынных растений является образование воскового налета на
листьях для защиты от чрезмерного нагревания и иссушения,
становится понятной локализация метилобактерий в этих локусах.
Предполагается, что филлоплана может служить
местообитанием и других, еще более устойчивых к радиации бактерий
рода Deinococcus (Murray, 1986). Поскольку у одного из штаммов
Methylobacterium обнаружен синтез цитокининов, можно
предположить, что розовые метилобактерий являются фитосимбион-
тами, связанными с растениями через фитогормоны и другие
ростовые факторы. Результаты проведенных недавно
исследований микробных сообществ филлосферы 11 различных видов
растений (Шепеляковская и др., 1999) определенно указывают
на связь с растениями не только бактерий рода Methylobacterium,
но и представителей других таксонов аэробных метилобактерий.
Так, из ризосферы кукурузы был выделен апигментный факуль-
тативно-метилотрофный представитель рода Paracoccus,
который был описан как новый вид Paracoccus kondratievae nov. sp.
61
(Доронина, Троценко, 2000). Этот уникальный алкалофильный,
хемолитотрофный и термотолерантный организм (рост при
20-50 °С и рН 7,5-10,5) оказался способным использовать в
качестве источников углерода не только метанол и метаноламин,
но и ацетон и тиосульфат, расти в атмосфере водорода,
кислорода и углекислого газа и усваивать сахара, спирты, органические
и аминокислоты.
Другой представитель метилобактерий, принадлежащий к
группе облигатных метилотрофов, был недавно выделен из фил-
лосферы кукурузы и описан как новый вид Methylovorus mays
(Доронина и др., 2000). У представителей этого вида, впрочем,
как и у вышеназванного вида Paracoccus, были обнаружены гены
синтеза и секреции цитокининов, что подтверждает
принадлежность этих бактерий, как и Methylobacterium> к настоящим фито-
симбионтам. Установление связи метилобактерий с растениями
представляется особенно значимой в плане подтверждения
гипотезы, согласно которой метанол является природным
соединением, циркулирующим между растениями и атмосферой, а
выделение метанола устьицами растений является неотъемлемой функ7
цией листьев (MacDonald, Fall, 1992).
Детальное обследование бактериальной микрофлоры листьев
цикория было выполнено с помощью метода "fingerprint" (Van
Outryve et al., 1989). Были изучены протеиновые профили 590
штаммов. Преобладающими были грамотрицательные бактерии
(105 штаммов, 101 тип "fingerprint"), среди них преобладали
флюоресцирующие и нефлюоресцирующие Pseudomonas, Erwinia her-
bicola, Erwinia sp. и Flavobacterium. Грамположительные бактерии
составили 17% штаммов, выделенных из сорта цикория Alba,
который был выращен на почве в отличие от сортов, выросших на
гидропонике. Авторы делают вывод о том, что значительная доля
грамположительных бактерий в филлоплане цикория Alba связана
с контактом растения с почвой, в которой до 60% могут составлять
такие фирмакуты, как бациллы и артробактер (Atlas et al., 1981).
В листьях цикория, отобранных с растений, выращенных на
гидропонике, грамположительные бактерии составляли не более 0-8%.
Сравнение состава бактериальных сообществ листьев,
корней и семян цикория, выполненных этими же авторами,
показало, что одни и те же виды псевдомонад и ксантомонад
обнаруживались как на листьях, так и на корнях всех типов изученных
растений. Однако представители родов Citrobacter sp., Alcaligenes
denitrificans и Serratia liquefaciens выделялись с листьев только
"почвенного" цикория, что подтверждает, по мнению авторов,
тезис о том, что почва является источником многих видов
бактерий, колонизирующих филлоплану. На корнях были обнаруже-
62
ны бактерии вида Alcaligenes paradoxus, в отличие от A. denitrifi-
cans, выделенного с листьев.
Принципиально соглашаясь с авторами во взгляде на почву
как на источник формирования сообществ филло- и ризопланы,
следует отметить, что приводимые ими примеры не очень
удачны. Так, выделение одного из видов Alcaligenes с листьев, а
другого с корней цикория, скорее всего случайно. Неубедительным
представляется и обнаружение бактерий родов Citrobacter и
Serratia на листьях только "почвенного" цикория, так как эти
бактерии ассоциированы, как правило, не с почвой, а с насекомыми
или почвенными беспозвоночными. На семенах доминировали
бактерии Erwinia herbicola - Enterobacter agglomerans и Arthro-
bacter. Внутри семян сорняков (Kremer, 1987) были обнаружены
кроме тех же, что и на цикории эрвиний, протеобактерии родов
Pseudomonas, Flavobacterium, Alcaligenes, Acinetobacter, а из грам-
положительных - Bacillus и Lactobacillus. Следует уточнить, что
такой спектр был выявлен через 10 дней после сбора семян и их
хранения при температуре + 100 °С. Более 80% выделенных из
семян бактерий этих родов проявили антимикробную активность
по отношению к фитопатогенным грибам.
Бактерии из семян расселяются при их прорастании как по
корням, так и по надземным частям растений. Вопрос о сходстве
и различии в составе прокариотных сообществ растений в его
надземной и подземной сферах до настоящего времени является
нерешенным. Это связано, на наш взгляд, прежде всего с тем, что
имеются лишь единичные работы, в которых один и тот же
исследователь одними и теми же методами анализирует и
сравнивает бактериальные комплексы растения с учетом всех его экониш
(семена, листья, цветы, плоды, корни).
Анализ приводимых разными исследователями списков
бактериальных таксонов, выделенных из филлосферы и ризосферы
разных видов растений за последние годы, позволяет все же
выделить в качестве общих и наиболее типичных для этих биотопов
следующие: Pseudomonas, Xanthomonas, Flavobacterium, Agrobac-
terium, Erwinia, Klebsiella. Согласно нашим данным, полученным
в результате изучения таксономического состава бактерий,
ассоциированных с разными видами растений в разных природно-
климатических зонах, в этот список необходимо также включить
бактерии родов Aquaspirillum, Cytophaga и порядка Myxobac-
terales. Все эти бактерии являются типичными обитателями как
филло-, так и ризосферы. Следует учитывать также
приуроченность бактерий некоторых родов преимущественно к
определенным частям растений. Так, известно, что основным природным
местообитанием бактерий рода Gluconobacter, требующих высо-
63
кой концентрации сахара, являются пыльца и сок цветов, пчелы,
мед (Павленко, Лойцянская, 1978). Предполагают, что глюконо-
вая кислота - единственная кислота, содержащаяся в меде,
является продуктом жизнедеятельности глюконобактера. Бактерии
Gluconobacter oxydans синтезируют полисахарид леван, слизистые
массы которого окружают клетки, находящиеся на поверхности
цветов и защищающие их от высушивания и ультрафиолетовой
радиации. Эти бактерии не способны усваивать сахара и
многоатомные спирты, основным источником питания для них
является этанол, уксусная и молочная кислоты.
Бактерии рода Acetobacter обнаруживают на поверхности
различных ягод и фруктов и в соках, где они могут вызывать
процесс уксуснокислого брожения при соответствующих условиях.
На семенах, как уже упоминалось выше, доминируют бактерии
рода Erwinia. Сохранение эрвиний на семенах в процессе их
хранения рассматривается в качестве индикатора благоприятного
режима хранения семян. При нарушении режимов хранения
(увеличении влажности воздуха) наблюдается вытеснение эрвиний
(аборигенов) микрококками, бациллами и грибами, в результате
чего происходит загнивание и гибель семенного материала (Ми-
шустин, Трисвятский, 1963; Кононков и др., 1980). Анализ инги-
бирующего воздействия прорастающих семян цикория на
различные виды бактерий показал, что их бактерицидные свойства
проявлялись по отношению к артробактеру, но не к аборигенам
семян - эрвиниям (Van Outryve et al., 1989).
Связь эрвиний с опыляющими цветы насекомыми была
установлена в исследованиях Н.С. Новиковой (Новикова, 1963).
Из тысячи проанализированных насекомых, принадлежащих к
различным семействам, 40% содержали в своем организме в
качестве доминирующего вида Pseudomonas herbicola.
Таксономическое положение этого вида в результате изучения и уточнения
его свойств претерпевало последовательные изменения по пути:
Pseudomonas herbicola - Erwinia herbicola - Enterobacter agglomer-
ans (Beji et al., 1988). Сравнительное изучение штаммов этого
вида, выделенных из насекомых, со штаммами, выделенными из
надземных органов растений, показало их полную идентичность.
Для подтверждения были использованы серологические методы
и реакции со специфическими бактериофагами. В модельных
опытах было доказано перенесение бактерий Pseudomonas
herbicola из насекомых на соцветия кок-сагыза (Новикова, 1963).
Автор отмечает, что кроме вышеуказанного вида из кишечного
тракта, поверхности тела насекомых и филлопланы
растений чаще других выделялись также флюоресцирующие
псевдомонады.
64
Таким образом, источником бактерий для формирования
бактериальных сообществ филлопланы являются семена,
насекомые и почва. В меньшей степени оказывают влияние такие
факторы, как перенос бактерий из других биотопов с ветром,
дождем, животными и т.д. Состав бактериальных сообществ ризо-
планы складывается как из почвенных, так и находящихся на
семенах бактерий, которые колонизируют корень по мере его
роста. Следует учитывать при этом, что одни виды бактерий в
равной степени характерны и постоянно выделяются из всех частей
растения, другие приурочены к определенным органам растения.
В списках бактерий, приводимых разными авторами в
качестве характерных обитателей филлосферы растений, обращает
на себя внимание отсутствие грамоположительных бактерий
(кроме бацилл). Это связано, по нашему мнению, как с составом
сред, используемых для выделения бактерий из фитосферы, так
и игнорированием исследователями сезонной динамики
бактериальных сообществ в процессе вегетации растений. Применение
безазотистых сред для изучения комплекса диазотрофных
бактерий в фитосфере позволило, как уже упоминалось выше,
значительно расширить список бактерий, ассоциированных с
растениями. Однако доля активных диазотрофов среди грамположи-
тельных бактерий (кроме бацилл и клостридий) очень низка.
Представители актиномицетной линии обладают слабой нитро-
геназной активностью, поэтому в перечне диазотрофных
прокариот доминируют протеобактерии. С другой стороны,
использование богатых сред (МПА, МПА + сусло, триптиказо-соевый
агар и др.) также не способствовало выявлению актинобакте-
рий, так как на этих средах доминировали псевдомонады и
бациллы, обладающие более высокими скоростями роста по
сравнению с актинобактериями и поэтому заполняющие все
пространство среды.
Недаром для выделения корине- и нокардиоформных
бактерий разрабатывались специальные селективные среды с
антибиотиками (Seiler, Kammerbauer, 1986) или красителями (Hage-
dorn, Holt, 1975), ингибирующими рост как грамотрицательных,
так и грамположительных (спорообразующих) бактерий. Были
предложены также методы предварительной обработки
посевного материала растворами щелочей (Третьякова и др., 1994)
или прогревания субстратов перед посевом (Добровольская,
Третьякова, 1991) для элиминирования грамотрицательных
бактерий и создания условий для роста и учета актинобактерий.
В результате стало возможным определение численности и
разнообразия актинобактерий на растениях, растительных
субстратах, в почве.
65
Было показано, что бактерии актиномицетной линии как
представители континентальной ветви прокариот заняли многие
экониши, ассоциированные с растениями. Так, бактерии рода
Curtobacterium, первоначально выделенные из зерен риса
(Jamada, Komagata, 1972), впоследствии были обнаружены на
луговых травах Подмосковья, где они составляли 15-43% от
общего числа выделенных бактерий (Головлев, 1983), а также на осо-
ках и злаках в лесных биогеоценозах (Добровольская и др.,
1985). Экологическая связь куртобактерий с растениями
подтверждается их способностью использовать ксилозу в качестве
предпочтительного субстрата и зависимостью от аминокислот и
витаминов, что характерно для эпифитов (Головлев, 1983).
Большинство видов куртобактерий являются, однако, не
эпифитами, а фитопатогенами, вызывающими различные заболевания
сельскохозяйственных культур. Они сохраняются внутри семян
и переносятся вместе с ними, инфицируя систематически
растения-хозяева.
Вид Curtobacterium plantarum оказался убиквистом - бактерии
этого вида были выделены с поверхности листьев 200 видов
растений, как древесных, так и травянистых, как дикорастущих, так
и культурных из 25 стран мира (Dunleavy, 1989). При
искусственном заражении листьев бобовых и зерновых культуральной
жидкостью С. plantarum не было получено никаких симптомов
заболеваний, в то время как другой вид C.flaccumfaciens вызывал
некроз листьев бобовых культур. Предполагается (Dunleavy, 1989),
что эпифитный вид С. plantarum является предком
куртобактерий, которые в процессе эволюции перешли от эпифитного к
паразитическому образу жизни. Образование бактериями вида
С. plantarum индолилуксусной кислоты, являющейся
стимулятором роста, позволяет отнести их к бактериям, способствующим
росту растений ("promoting growth bacteria").
С растениями оказались связанными и представители других
родов коринеформных бактерий. Из листьев, стеблей, корней,
семян и галлов, образуемых нематодами на поверхности
надземных частей растений, выделено более 100 штаммов
коринеформных бактерий (Dorofeeva et al., 1996). Они были отнесены к
следующим родам: Curtobacterium (40%), Rathaybacter (34%), Aureobac-
terium (13%), Clavibacter (4%) и Cellulomonas (1%). Часть
выделенных культур (30%) не подходила по своим свойствам ни к одному
из известных родов бактерий. Авторы предполагают, что
разнообразие коринеформных бактерий, характеризующихся пепти-
догликаном В2 (куда входят роды Aureobacterium, Curtobacterium,
Clavibacter, Rathaybacter), значительно больше и они более
широко распространены в природе, чем считалось ранее.
66
Одним из специфических природных локусов, где
концентрируются вышеназванные бактерии, являются галлы на стеблях и
листьях растений разных видов. Образование галлов
индуцируется различными патогенными для растений нематодами
подсемейства Anguina, они же переносят бактерии (служат вектором
переноса) на растение-хозяина (Bird, 1981; Evtushenko, Dorofeeva et al.,
1994). При электронной микроскопии во внутриклеточном
пространстве и разрушенных клетках галлов были
обнаружены в большом количестве клетки коринеформных бактерий.
Основной симптом заболевания растений - желтая бактериальная
слизь, образующаяся в результате размножения бактерий в
галлах, расположенных на листьях, стеблях и семенах растений.
Недавно описан новый род коринеподобных бактерий (КПБ) -
Agreia bicolorata gen. nov., sp. nov. (Evtushenko et al., 2001),
выделенный из листовых галлов на растении Calamagrosis neglecta (вей-
ник) и стеблевых галлов Elythrigia repens (пырей ползучий).
Галлы индуцировались нематодами родов Heteroanguina и Anguina
соответственно. Высказывается точка зрения (Bird, 1981),
согласно которой ассоциации растение-нематоды-бактерии можно
рассматривать более широко - как симбиозы, которые
находятся при определенных условиях в равновесии с природой. Когда
среда изменяется человеком, баланс нарушается и эта симбиоти-
ческая ассоциация может стать патогенной для растений.
Другим экзотическим природным локусом, из которого
были выделены разнообразные актинобактерии, является
ризосфера растений мангровых зарослей (Takeuchi, Hatano, 1999).
У 25 штаммов, выделенных из ризосферы растений мангровых
лесов в эстуариях рек (Япония), была определена
последовательность нуклеотидов в 16S рРНК, проведен хемотаксономический
анализ и ДНК-ДНК гибридизация. В результате установлена
родовая и видовая принадлежность этих культур, выявлены новые
виды. Актинобактерии были представлены родами Agromyces,
CellulomonaSy Gordonia, Micrococcus, Microbacterium,
Mycobacterium и Rhodococcus. Авторы обращают особое внимание на
обнаружение микобактерий (род Mycobacterium) в исследуемых
биотопах, так как большинство видов микобактерий являются
патогенами и их обычно выделяют не из природных источников, а из
клинического материала. Следует отметить, что бысторастущие
микобактерий (по классификации Раньона), к которым
принадлежат и выделенные из мангр микобактерий, неоднократно
обнаруживались и в других природных местообитаниях. Так, в
степных экосистемах микобактерий постоянно выделялись из филло-
сферы, травостоя, ветоши и почв (Нестеренко и др. 1985; Черня-
ковская и др., 1990). Они были представлены видами М. phlei,
67
M.fortuitum, M. parafortuitum, M. gordonae. Перечень разных видов
рода Mycobacterium, в том числе и М. leprae, обнаруженных
в основном на растениях болот и сфагновых мхах, дается в
обзоре (Калакуцкий, Шарая, 1990).
Еще более благоприятным типом экосистем для изучения
бактерий актиномицетной линии являются пустыни.
Доминирование актинобактерий во всех ярусах пустынных биогеоценозов, в
том числе и в фитосфере, можно рассматривать как результат
расселения бактерий континентальной ветви по наземным
биотопам, так как пустыни являются примером ландшафтов, где
адаптация организмов к условиям суши выражена наиболее
резко. Приуроченность протеобактерий к растениям,
произрастающим в нормальных, либо избыточных условиях увлажнения,
является лишь дополнительным подтверждением гипотезы о
длительной коэволюции протеобактерий и растений в водной среде.
В пустынных экосистемах, при дефиците влаги четко
прослеживается дифференциация бактериальных комплексов в
надземной и подземной частях растений (Добровольская и др., 1993,
1997, 1999). При общем доминировании актинобактерий в
бактериальных комплексах пустынь, они представлены разными
родами на листьях и корнях одного и того же растения. Так, в филло-
плане травянистых растений пустынь в составе бактериальных
сообществ доминировали актинобактерий родов Micrococcus,
Rhodococcus, Clavibacter, Geodermatophilus. На корнях
преобладали бактерии других родов - Cellulomonas, Promicromonospora,
Arthrobacter, Streptomyces. Особенно следует остановиться на
бактериях родов Clavibacter и Geodermatophilus, которые постоянно
выделялись нами из филлопланы деревьев (саксаул), цветущих
травянистых растений и злаков среднеазиатских пустынь. В
отличие от всех известных видов Clavibacter, являющихся фитопа-
тогенами и имеющих желтый цвет колоний, выделенные нами
культуры клавибактеров не были фитопатогенами, они имели
розовый цвет колоний, а иногда образовывали и черный
пигмент. На основании изучения морфологии, физиологических и
хемотаксономических особенностей этих культур и сравнения их
с известными видами они были описаны нами как новый вид
рода Clavibacter - Clavibacter desertorum (Evtushenko, Akimov et al.,
1994). Возможно, что этот эпифитный вид, по аналогии с Curto-
bacterium plantarum (Dunleavy, 1989) - единственный среди прочих
фитопатогенных видов является центром эволюции и
конвергенции видов в пределах рода Clavibacter.
Актинобактерий рода Geodermatophilus поражают своим
полиморфизмом: агрегаты кокков, объединенные общей
оболочкой; цепочки почкующихся клеток, напоминающие псевдомице-
68
лий, смена жизненных форм при переходе от растений как
местообитаний этих организмов к почве. Все это результат адаптации
к экстремальным условиям, в которых фенотипический
полиморфизм организмов бывает особенно резким. Наличие карати-
ноидных и меланоидных пигментов, защищающих клетки гео-
дерматофилов от УФ радиации, свидетельствует в пользу
адаптации этих организмов к повышенной инсоляции, характерной для
пустынь. Возможно, что именно в пустынях сохраняются многие,
сформировавшиеся в прошлом виды актинобактерий, от
которых впоследствии произошли и другие, расселившиеся по суше и
перешедшие на паразитический образ жизни на культурных
растениях. Напрашивается аналогия с центрами происхождения
культурных растений Н.И. Вавилова, в которых сохранились
дикорастущие предшественники.
Микрококки и родококки, колонии которых имеют
разнообразные оттенки (от розово-красных до желто-оранжевых),
также являются аборигенами в бактериальных сообществах фито-
сферы пустынных растений. Следует отметить, что для всей
группы актинобактерий характерно высокое содержание ГЦ-пар
оснований в ДНК, что рассматривается как приспособление
организмов (наряду с пигментацией) к перенесению повышенных
доз солнечного облучения (Калакуцкий, Агре, 1977). Что
касается мицелиальных спороактиномицетов, образующих
воздушный мицелий и споры, то они, как правило, не характерны для
филлопланы растений, это типичные педобионты, либо
обитатели подстилок и ризосферы. Хотя и существуют сведения о
нахождении на поверхности растений актиномицетов родов
Micromonospora и Streptomyces, неизвестно находятся ли они там
в активной форме или в виде спор, попадающих туда
различными путями из почвы (с ветром, дождем) и аккумулирующихся
в филлоплане. Предполагается, что находясь в воздухе, споры
актиномицетов приобретают электрический заряд, который
способствует процессу адсорбции клеток гидрофобной
поверхностью растений (Калакуцкий, Шарая, 1990). В филлосфере
пустынных растений актиномицеты рода Micromonospora
являются доминантами актиномицетного комплекса (Зенова и др.,
1994). Наиболее интересным представляется факт обнаружения
актиномицетов рода Actinoplanes на растениях, в том числе
на цветках. Для селективного выделения представителей этого
рода используют живую пыльцу растений. В отличие от филло-
сферы, в ризосфере как дикорастущих, так и культурных
растений постоянно обнаруживаются многие виды родов Streptomy-
ces и Micromonospora (Калакуцкий, Шарая, 1990; Зенова,
Звягинцев, 1997).
69
Таким образом, не всегда в фитосфере растений доминируют
протеобактерии. Следует отметить, что вопрос о соотношении
протео- и актинобактерий в природных бактериальных
сообществах, в том числе и в фитосфере, не может быть решен, если эти
группы бактерий учитывать на разных средах, как это и делается
в большинстве исследований. Необходим учет максимального
количества разнообразных сапротрофных бактерий на одной и той
же среде. Мы использовали для этой цели среду, предложенную
(Jamada, Komagata, 1972) в качестве "poor" (бедной) среды для
выделения коринеформных бактерий, несколько модифицировав ее
состав (Добровольская и др., 1989). Преимущество этой среды
состоит в низкой концентрации органических веществ (1 г/л), при
которой эксплерентные формы бактерий несколько
ограничиваются в росте, предоставляя тем самым возможность для роста и
учета более медленнорастущих актинобактерий. При этом
становится возможным определить относительное обилие основных
типов таксонов, т.е. таксономическую структуру сообщества.
Представляется, что состав бактериальных комплексов,
ассоциированных с растениями, и характер их пространственной
дифференциации в надземной и подземной частях растения во многом
определяются влажностью среды обитания растений. Так, в фил-
лоплане разных типов болотных растений всегда доминируют
протеобактерии. Они представлены родами Aquaspirillum и Klebsiella.
Большинство других родов бактерий, доля которых в сообществе
составляет менее 30%, также представлены в основном протеоба-
ктериями. В лесных биогеоценозах Окского государственного
заповедника, где периоды избыточного увлажнения почв
чередуются с периодами их быстрого высушивания (благодаря их легкому
механическому составу), в спектр потенциальных доминантов
бактериальных комплексов филлопланы входят как грамотрицатель-
ные бактерии (роды Aquaspirillum, Cytophaga, порядок Мухо-
bacterales), так и грамположительные (роды Cellulomonas, Rhodo-
coccus, Micrococcus). Следует отметить, что доля коринеподобных
бактерий в бактериальном комплексе филлосферы увеличивается
при переходе от лесных к луговым экосистемам. Так, в пойменных
ландшафтах она составляет наряду со скользящими бактериями
(миксобактерии и цитофаги) более 30%. Процентное содержание
актинобактерий продолжает нарастать по мере увеличения арид-
ности экосистем. Все это лишний раз подтверждает, что
актинобактерий - континентальная ветвь прокариот.
Таким образом, спектр бактериальных таксонов в
фитосфере зависит от очень многих факторов. На результаты анализа
будет влиять и в какой почвенно-климатической зоне, и в каком
типе биогеоценоза (лес, болото, луг, агроценоз) проводятся иссле-
70
дования, в какое время года и при какой погоде проводится отбор
образцов. Чаще всего в работах приводятся лишь списки родов
или видов бактерий, обнаруженных в исследуемом биотопе, в
лучшем случае указывается частота их встречаемости,
рассчитанная на основании процентного содержания штаммов данного
таксона от общего числа выделенных штаммов, что является
весьма субъективной характеристикой. Реже, как это было
показано выше, дается количественная характеристика
относительного обилия таксонов в бактериальных сообществах, из анализа
которой можно сделать выводы об экологической значимости
тех или иных бактерий. Однако и таким способом
представленные данные позволяют говорить лишь об условном
доминировании тех или иных бактерий в фитосфере, так как при этом всегда
подразумевается учет бактерий на среде определенного состава.
Вопрос о том, типичны ли бактерии данного таксона для
данного местообитания, может быть решен и другим путем - с
помощью выявления их кинетических характеристик: скорости роста,
времени генерации, характера динамики популяций при
инокуляции в данное местообитание, определения уровня его активности.
Этот набор показателей послужил основой для создания целого
направления в микробиологии - популяционной микробиологии,
связанного с изучением динамики численности конкретных
популяций непосредственно в природных местообитаниях.
Результаты такого анализа с количественным описанием процессов
размножения, гибели, миграции, определением относительной
экологической стратегии внесенных популяций обобщены в работах
П.А. Кожевина (1989, 2000).
В качестве доказательства того, что ризосфера является
наиболее благоприятным, по сравнению с почвой, природным
биотопом для азоспирилл, были использованы следующие
кинетические характеристики (Лукин, 1988): 1) популяция Azospirillum
brasilense размножалась и сохранялась на высоком уровне
численности в прикорневой зоне растений; 2) клетки в этом биотопе
имели более высокую по сравнению с почвой вероятность
размножения, а по скорости колонизации поверхности корня азоспи-
риллы опережали комплекс почвенных бактерий. Аналогичные
выводы были сделаны в результате подобных опытов с
бактериями рода Pseudomonas. Однако пока таких данных о бактериях
разных родов и видов мало, а определение скорости колонизации
бактериями разных биотопов довольно сложно в методическом
отношении.
Хотелось бы в заключение еще раз подчеркнуть, что при
обсуждении таксономического состава бактериальных комплексов
фитосферы следует учитывать следующее:
71
- структура бактериальных комплексов как в филлосфере,
так и ризосфере динамична, она меняется в процессе вегетации
растений и зависит от методики отбора и анализа образцов
(например, отделение ризосферы от ризопланы с помощью
специальных приемов), состава используемых для посева сред,
природно-климатической зоны, к которой приурочены растения;
- существуют бактерии, которые выделяются с равной
частотой из всех экониш, предоставляемых растением, и бактерии,
приуроченные к определенным органам растений - цветкам,
семенам, ягодам, корням, поэтому ставить в качестве
дискуссионного вопрос о том, одинаковы или различны по составу
бактериальные сообщества филло- и ризосферы, как это делают многие
исследователи, неправомочно, так как на него не может быть
однозначного ответа;
- чтобы судить о том, насколько типичны те или иные
бактерии для экониш, связанных с растением, необходимо выявить их
долю, кинетические характеристики и функции, связанные с их
основным местообитанием.
Если вернуться назад к анализу списков бактерий,
характерных для воды, водорослей и водных сосудистых растений, и
сравнить их с таковыми для наземных растений, то становится ясно,
что большинство видов протеобактерий перешло вместе с
растениями из водных в наземные экосистемы. Именно
протеобактерий наиболее тесно связаны с растениями: они не только эккри-
сотрофы, они внедрились в ткани корня и стали
факультативными или облигатными эндосимбионтами растений. Среди них
наибольшее число бактерий, являющихся активными диазотрофами.
Грамположительные бактерии также постепенно заполняли
экологические ниши, предоставляемые растениями. Часть этих
бактерий - типичные обитатели как ризосферы растений, так и
почвы (Arthrobacter, Bacillus, Rhodococcus, Promicromonospora,
Cellulomonas, разные роды спороактиномицетов и др.), другие -
населяют надземные органы растений (особенно в условиях
дефицита влаги) и, попадая с опадом на поверхность почвы,
участвуют в процессе разложения растительных остатков.
1.5. РОЛЬ ВОДНЫХ И НАЗЕМНЫХ РАСТЕНИЙ
В ФОРМИРОВАНИИ БАКТЕРИАЛЬНЫХ СООБЩЕСТВ
ПОЧВ
В предыдущих разделах мы рассмотрели организацию и
таксономический состав бактериальных сообществ в водных
экосистемах. На основании анализа литературных источников было
показано, что стратификация микробных сообществ в акватори-
72
ях определяется, прежде всего, освещенностью, газовым
режимом и солевым составом вод. Каждой зоне соответствуют
специфические эколого-трофические и таксономические группы
бактерий. Однако доминируют в водных экосистемах представители
грамотрицательных бактерий, большинство которых
объединено ныне в класс Proteobacteria, в пределах которого обнаружены
представители всех эколого-трофических группировок,
необходимых для поддержания гомеостаза экосистемы. Гидролиз
водорослей и других водных растений осуществляется скользящими
бактериями - миксобактериями, цитофагами, флексибактерия-
ми. Симбионтами водных животных и деструкторами их
остатков, содержащих хитин, являются представители разных родов
светящихся бактерий, среди которых доминируют вибрионы.
Планктонные формы бактерий имеют приспособления как для
передвижения в воде (жгутики, газовые вакуоли), так и для
прикрепления к различным субстратам - простеки,
прикрепительные диски и др. Они представлены множеством родов,
относящихся к копиотрофам и олиготрофам. Типично водными
формами бактерий являются также фототрофные прокариоты и
скользящие серные бактерии. Существует множество родов бактерий,
представители которых характерны только для моря, в то же
время обнаруживаются и общие для пресноводных и морских
экосистем роды и виды.
Нам представляется, что все приведенные выше факты
свидетельствуют в пользу гипотезы о длительной эволюции и
адаптации бактерий, имеющих состав клеточной стенки,
характерный для грамотрицательных бактерий, к водной среде.
Немаловажную роль в этом процессе сыграли водоросли. При сравнении
структуры бактериальных комплексов в альго- и фитосфере
водных и наземных растений выявляется селективное влияние
различных метаболитов водорослей на таксономический состав
бактериальных сообществ, приведшее к отбору в альго- и
фитосфере преимущественно грамотрицательных форм бактерий.
Поскольку формирование взаимоотношений растений с
бактериями рассмотрено в эволюционном аспекте от древнейших
цианобактериальных матов до современных фитоценозов,
можно представить себе путь, по которому происходило расселение
бактерий по наземным эконишам, и оценить роль растений в
этом процессе как центров формирования бактериальных
сообществ. Если в древнейших цианобактериальных матах и
наземных водорослевых корочках все бактериальное население было
сконцентрировано в 1-сантиметровом слое, то с появлением
высших растений произошло четкое пространственное разделение
бактериальных сообществ по различным органам растения, час-
73
то значительно удаленных друг от друга, что определило, в
конечном счете, пространственно-функциональную организацию
бактериальных сообществ в наземных экосистемах.
Микроочаговая локализация бактерий на листьях и корнях связана с
местами наиболее интенсивного выделения экссудатов растениями.
Среди разнообразных форм эккрисотрофных бактерий
обнаружены представители всех подклассов протеобактерий. С другой
стороны, в фитосфере растений, произрастающих в аридном
климате, в эпифитном сообществе бактерий доминируют акти-
нобактерии - представители континентальной ветви грамполо-
жительных прокариот, способные выживать в условиях
повышенной инсоляции и высушивания. Этот факт свидетельствует в
пользу постепенного заселения наземных растений и грамполо-
жительными бактериями.
Прокариотные организмы поселялись не только на
поверхности, но проникали и внутрь растения, вызывая разрастание
растительных тканей в виде клубеньков на корнях или стеблях
растений и образуя с ними различные симбиозы (бобово-ризоби-
альные, актинориза, синцианозы). На примере анализа эволюции
бобово-ризобиальных комплексов показан переход бактерий от
фототрофного образа жизни (в стеблевых клубеньках водных
растений) к гетеротрофному (в корневых клубеньках наземных
растений).
Не только симбиотические, но и ассоциативные бактерии,
колонизирующие поверхность небобовых растений, оказались
тесно связанными с растениями. Многие из них способны
проникать во внутриклеточное пространство и ксилему, не только не
принося при этом вред растению, но, наоборот, стимулируя их
рост путем обеспечения азотом и различными физиологически
активными веществами. В свою очередь, растения регулируют
суточную и сезонную динамику азотфиксации бактерий за счет
фотосинтатов, экскретируемых в среду, что свидетельствует о
сопряженности процессов азотфиксации и фотосинтеза.
Растения являются центром формирования бактериальных
сообществ не только при жизни, но и после отмирания. Процесс
деструкции растительных остатков микроорганизмами, в том
числе и бактериями, визуально запечатлен в виде
стратифицированных слоев подстилки и почвенных генетических горизонтов.
Анализ таксономического состава и роли бактерий в процессах
разложения растительных остатков будет дан в последующих
главах.
Глава 2
ОРГАНИЗАЦИЯ БАКТЕРИАЛЬНЫХ
СООБЩЕСТВ ПОЧВ
Если в главе 1 основное внимание было уделено роли
растений как центров формирования бактериальных сообществ,
а почва при этом упоминалась лишь при сравнении состава
бактериального населения филлосферы, ризосферы и почвы, то
настоящая глава будет посвящена почве и ее уникальным
свойствам, позволяющим разным группам организмов развиваться и
сохраняться в ней.
В течение длительного времени на почву смотрели только с
позиций агронома, рассматривая лишь одну из ее функций -
плодородие, благодаря которому обеспечивается урожай растений.
Лишь в последнее время в связи с осознанием биосферной роли
почвы в поддержании устойчивости экосистем и жизни на Земле,
почву стали оценивать как главную экологическую нишу
организмов суши, в свою очередь обеспечивающих глобальные
функции почв (Добровольский, Никитин, 1990, 2000).
По отношению к микроорганизмам почва, в связи с ее
гетерогенностью и малыми размерами микроорганизмов, не может
рассматриваться как едийая, однородная среда обитания.
Представление о почве как системе с множеством микро- и мезосред
обитания микроорганизмов с совершенно различными
условиями было разработано выдающимся почвенным микробиологом
нашего времени Д.Г. Звягинцевым. В его уникальной
монографии "Почва и микроорганизмы" (Звягинцев, 1987), в которой
предлагаются новые концепции строения и функционирования
комплекса почвенных микроорганизмов, можно найти ответы на
многие вопросы, которые сейчас задаются микробиологами в
связи с повышением интереса к изучению микробного
разнообразия почв.
Поскольку в последующих разделах настоящей книги будут
описываться бактериальные сообщества в почвенных мезо- и ми-
кролокусах, представляется необходимым дать краткую характе-
75
ристику почвы как структурированной, полидисперсной
системы, способной обеспечить существование микроорганизмов с
самыми разными потребностями.
Прежде всего, почва - это трехфазная система, включающая
газовую, жидкую и твердую фазы. Твердые частицы и агрегаты
делят почву на многочисленные микрозоны. Часть
микроорганизмов адсорбируется на поверхности почвенных частиц, а часть
занимает внутриагрегатное пространство. Микрозональность
почвы основывается на создании локусов с разными значениями
рН, окислительно-восстановительного потенциала,
минералогического состава, локальном поступлении органических остатков
и корневых выделений.
Микроорганизмы, благодаря своим мельчайшим размерам
и способности быстро размножаться и быстро переходить к
покою, за короткий срок осваивают микрозону, в которой они
способны выжить при исчерпании запасов питания. При
изучении монолитов разных типов почв с помощью
люминесцентного микроскопа было показано (Звягинцев, 1973), что клетки
микроорганизмов, как правило, собраны в микроколонии,
которые отделены друг от друга огромными пустыми
пространствами, что исключает возможность тесного взаимодействия между
ними. Отсюда автор делает вывод о большей, чем считалось
ранее, значимости метода изучения чистых культур в почвенной
микробиологии. С другой стороны, в таких зонах почвы, как
ризоплана, ризосфера, микосфера, куда поступают продукты
экскреции разных организмов, можно предположить большую
организованность микробного мира, проявляющуюся в
формировании сообществ, внутри которых складываются разные
типы взаимоотношений между членами этих сообществ. Далее
будет дана бактериологическая характеристика большинства
почвенных мезо- и микролокусов, сейчас же проанализируем,
как развивались и менялись представления о бактериальном
населении почв.
2.1. ИСТОРИЯ РАЗВИТИЯ ПРЕДСТАВЛЕНИЙ
О СТРУКТУРЕ И РАЗНООБРАЗИИ
БАКТЕРИАЛЬНЫХ СООБЩЕСТВ ПОЧВ
Прежде чем приступить к анализу эволюции представлений
о микробных сообществах почв и их структуре, следует обсудить
саму концепцию "сообщества" как определенного уровня
организации жизни. В самых общих чертах термин "сообщество"
означает совокупность всех сосуществующих в пространстве и вре-
76
мени популяций, взаимодействующих друг с другом. При этом
подразумевается, что между отдельными сообществами имеются
вполне естественные границы, и сообщество следует
рассматривать, прежде всего, как некое организованное целое. В этом
смысле употребление термина "микробное сообщество"
означает довольно искусственное выделение группы популяций только
по признаку размеров. Насколько естественны границы такой
группировки? Образуют ли почвенные микроорганизмы
действительно сообщество, или в этом случае следует применять
другие термины ("ассамблея", "гильдия", "таксоцен"),
предлагавшиеся в ходе многочисленных дискуссий на эту тему?
Микробиологи в качестве синонимов используют термины:
"микробоценоз", "ассоциация", "комплекс", "группировка" и др.
Мы не намерены вдаваться в терминологическую дискуссию и
будем использовать термин "микробное сообщество" в самом
широком смысле, понимая его как набор популяций
микроорганизмов (всех или относящихся к определенной группе) в некоем
рассматриваемом пространстве. Даже при таком формальном
подходе имеется предмет для изучения, лежащий вне дискуссии
о том, как определять сообщество, а именно - его структура,
т.е. набор отдельных элементов (например, таксонов), их
относительное обилие, пространственное и временное расположение,
а также взаимосвязи между ними. Структуру имеет любая
группировка, вне зависимости от ее функционального единства и
естественности границ. Основное возражение против строгой
трактовки сообщества как раз и состоит в том, что "естественное"
сообщество остается чисто умозрительным понятием.
Экспериментальный анализ структуры сообщества становится
возможным только после выделения в качестве объекта какой-либо
группы популяций, учитываемых конкретным методом.
В самом общем смысле структура - это внутреннее
устройство объекта. Представление о структуре возникает, когда мы
выделяем в исследуемом объекте различные элементы,
анализируем набор этих элементов, их количественное соотношение и
взаимосвязи между ними. При анализе таких сложных систем, как
микробные сообщества, мы вправе выделять элементы
различной природы, например, таксоны микроорганизмов, морфотипы,
физиологические группы. Следовательно, можно говорить о
различных аспектах изучения структуры микробного сообщества.
Нам представляется целесообразным выделить 4 таких основных
аспекта: функциональный, морфологический, таксономический
и экологический, которые наиболее часто фигурируют в работах
почвенных микробиологов, но, конечно, не исчерпывают всех
возможных подходов.
77
Функциональная структура - соотношение
разных "физиологических" (азотфиксаторы, аммонификаторы,
нитрификаторы, денитрификаторы, целлюлозоразрушающие)
или эколого-трофических (гидролитики, копиотрофы, олиготро-
фы) групп.
Морфологическая структура -
соотношение разных морфотипов: одноклеточных и мицелиальных,
клеток разной формы (палочки, кокки, нити, спирали) - для
бактериального сообщества, споры и мицелий - для сообщества мик-
ромицетов.
Таксономическая структура - соотношение
таксонов, выделяемых на разном иерархическом уровне: видов,
родов, семейств, классов.
Экологическая структура определяется
соотношением жизненных форм микроорганизмов, различным
отношением к экологическим факторам.
Почвенные микробиологи, описывая микробные сообщества
почв, невольно освещали тот или иной из этих аспектов, хотя и
не употребляли понятие "структура" (Звягинцев и др., 1999).
Изучение бактериального населения почв, начатое еще в
30-е годы XX в. в разных странах мира, развивалось в нескольких
направлениях: 1) определение численности разных
физиологических групп бактерий; 2) определение распространения и
соотношения в почвах неких групп бактерий, объединенных по морфо-
лого-таксономическому принципу (спорообразующие и
неспороносные бактерии, кокковидные и палочковидные, коринеподоб-
ные и др.); 3) изучение численности и функций бактерий
отдельных родов в разных типах почв; 4) попытка охарактеризовать
бактериальные сообщества разных типов почв на основе
объединения разных показателей.
Рассмотрим более подробно развитие каждого из этих
направлений. Начнем с самого распространенного и наиболее
критикуемого еще со времен С.Н. Виноградского и СП. Костычева, но
до настоящего времени используемого метода оценки структуры
микробных сообществ почв. Он основан на сравнении
численности микроорганизмов, входящих в состав разных
"физиологических групп", участвующих в почвенных процессах. При этом
делают посев из разведений почвенной суспензии на ряд
питательных сред, позволяющих учесть физиологические группы: аммо-
нификаторов, нитрификаторов, денитрификаторов, азотфикса-
торов, сульфатредукторов, аэробных и анаэробных
разрушителей клетчатки и др.
В качестве примеров использования такого подхода для
характеристики почв может быть приведен целый ряд статей, опуб-
78
ликованных в 1930-е гг. в журнале "Почвоведение". Например,
в статье А.И. Рокицкой (Рокицкая, 1931) были приведены очень
детальные, на 40 страницах, описания характера роста культур на
разных средах. Интенсивность роста определяли по
трехбалльной системе. В результате был дан перечень процессов,
расположенных в порядке убывания их интенсивности: от анаэробных
азотфиксаторов до сульфатредукторов. Авторам этой и многих
аналогичных работ не удалось выявить достоверную
корреляцию между соотношением физиологических групп и
определенными типами почв или генетическими горизонтами.
Физиологическая структура оказалась очень консервативной, мало
зависящей от характеристик почвы.
Несмотря на такие выводы, продолжали выходить серии
статей и сборники, содержащие характеристику микрофлоры
разных типов почв, составленную на основании вышеописанного
подхода. Одна из ведущих российских почвенных микробиологов
Т.В. Аристовская писала по этому поводу: "Некоторые
микробиологи всю почвенную микробиологию сводят по существу к
стандартному групповому анализу и превращают ее в
микробиологию без микробов" (Аристовская, 1962, с. 8). Однако
благодаря разработанным и имеющимся в разных микробиологических
лабораториях стандартам, позволяющим описывать и сравнивать
бактериальный состав разных типов почв по численности разных
физиологических групп, не требующим особой квалификации
микробиологов, этот рутинный метод продолжал использоваться
даже в 1970-1990-е гг. Он был усовершенствован введением
различных индексов (минерализации, олиготрофности, педотрофно-
сти), которые рассчитываются как отношение численности
микроорганизмов на разных средах.
Ценность этих подходов уже давно пора пересмотреть с
учетом новых данных, накопленных в области изучения физиологии,
таксономии и экологии микроорганизмов. В настоящее время
доказано, что одни и те же виды микроорганизмов могут в разных
условиях осуществлять противоположные физиологические
процессы, например аммонификацию, азотфиксацию и денитрифи-
кацию, окисление и восстановление элементов. С другой
стороны, каждый физиолого-биохимический процесс в почве строится
на функционировании нескольких дублирующих друг друга
микроорганизмов (принцип дублирования). В связи с
полифункциональностью видов следует говорить о физиологических
процессах, проводимых микроорганизмами, а не о физиологических
группах (Звягинцев, 1987).
Групповой анализ микробных сообществ почв, сложившийся
еще в 1930-е гг., в течение длительного времени не сопровождал-
79
ся определением таксонов на родовом или видовом уровнях.
Более дробное подразделение бактерий осуществлялось разбиением
на группы: спорообразующие - неспороносные, микобактерии -
псевдомонады. На основании вычисления соотношений этих
групп было охарактеризовано большинство типов зональных
почв (Микрофлора почв северной..., 1966; Микрофлора почв
южной..., 1966). Следует сказать, что такое описание мало
продвинуло проблему дифференциации микробных сообществ разных
типов почв. Однако даже на таком групповом уровне был выявлен
ряд интересных особенностей в структуре бактериальных
сообществ: увеличение доли бацилл и актиномицетов и
бактериального вклада в процесс деструкции целлюлозы в южных почвах по
сравнению с северными.
Особое внимание микробиологов привлекла группа корине-
подобных бактерий. Термин "коринеподобные" или "корине-
формные" бактерии был предложен Йенсеном (Jensen, 1952) для
широко распространенных в природе сапротрофных и фитопато-
генных бактерий, морфологически подобных патогенным кори-
небактериям (род Corynebacteriwn). В отечественной литературе
эта группа бактерий изучалась под названием "микобактерии" -
от названия рода Mycobacterium. Следует помнить и о других
терминах, используемых микробиологами при экологических
исследованиях бактерий, аналогичных или близких к корине- и мико-
бактериям: коринебактерии, нокардии, нокардиоподобные, но-
кардиоформные бактерии, проактиномицеты, актинобактерии.
Такое длинное предисловие необходимо в связи с огромным
количеством публикаций, посвященных изучению
распространения этой группы бактерий в почвах, которой разные авторы
дают разные названия. Первое упоминание о нахождении плео-
морфных грамположительных бактерий в почвах содержится в
работе Зенгена (Zongen) 1914 г., а с конца 1920-х гг. начинается
интенсивное изучение этих почвенных бактерий в разных
странах мира - Германии (Haag), США (Conn), Англии (Topping),
Австралии (Jensen), Дании (Oerskov), Канады (Lochhead, Burton),
Новой Зеландии (Robinson, Loutit), Советском Союзе (Красильни-
ков, Сушкина, Теппер и др.). Анализ и обсуждение этих и более
поздних работ дается в обзорах (Головлев, 1978; Нестеренко и
др., 1985; Паников и др., 1989; Veldkamp, 1970; Cacciari, Lippi,
1986).
Установлено, что коринеподобные бактерии встречаются
практически во всех типах почв, начиная от Арктики и кончая
жаркими пустынями, т.е. они являются космополитами. Однако
их численность и относительная доля от общего числа бактерий,
учитываемых методом посева, оказались различными в разных
80
типах почв. Так, в черноземах Европейской части б. СССР при
высокой численности (до 106 КОЕ/г почвы) процентное
содержание микобактерий составило всего лишь 17-20%, в то время
как в тундровых почвах при численности на порядок меньше, чем
в черноземе, их доля составила 50-90% (Умаров, 1972).
В работах других исследователей (Бабьева, 1971; Сушкина,
Цюрупа, 1973) обращается внимание на преобладание микобактерий
в примитивных каменистых почвах Памира и Тянь-Шаня и
почвах арктических пустынь и тундр, т.е. в олиготрофных биотопах.
О доминировании кокковых форм в почвах Гренландии и
Антарктики, которые, как можно предположить сейчас, относились
к коринеподобным бактериям, сообщалось в работах
зарубежных исследователей (Darling, 1940; Jensen, 1951; Flint, Stout, 1960).
Этот вывод получил подтверждение и объяснение в дальнейшем,
когда появилась возможность дифференциации на роды в
пределах группы коринеподобных бактерий и стало ясно, что в почвах
доминируют и "преуспевают" (Gray, 1976) бактерии рода Arthro-
bacter (Conn, Dimmick, 1949), и что большинство публикаций,
посвященных изучению распространения мико- и коринеподобных
бактерий в почвах, касаются именно этого рода. Артробактер,
подобно лягушке в физиологии, явился тем излюбленным
объектом, на котором были проведены всевозможные исследования
по изучению морфологии, цикла развития, метаболизма,
кинетики роста, популяционной динамики, устойчивости к разным
факторам среды - сухости, отсутствию пищи, высокой или низкой
кислотности среды. Цитирование этих работ заняло бы
несколько десятков страниц. Следует лишь отметить, что благодаря
таким всесторонним исследованиям удалось объяснить
"преуспевающее" положение артробактера в почвах с низким содержанием
органических веществ и в аридных. Устойчивость этого
организма к различным стрессам объясняется К-типом жизненной
стратегии, сближающей артробактер с другими олиготрофами.
Проявлениями К-отбора являются: способность усваивать
питательные вещества из крайне разбавленных растворов,
несбалансированный рост за счет феноменально быстрого потребления
лимитирующего субстрата без размножения клеток в момент снятия
субстратного лимитирования, инерционность роста, сложность
клеточного цикла (Паников и др., 1989).
Следует отметить, что многие из вышеназванных
характеристик можно отнести и к представителям другого рода
коринеподобных бактерий - Rhodococcus (Zopf, 1891; Goodfellow, Alderson,
1977), называемого в ранних публикациях пигментными (розово-
красно-оранжевые оттенки) микобактериями или нокардиями
комплекса "rhodochrous". Родококки обнаружены во всех типах
81
почв как широтной, так и вертикальной зональности (Головлев,
1983; Нестеренко и др., 1985; Добровольская и др., 1996), но
являются большей частью минорными компонентами бактериальных
комплексов. Специфическим местообитанием этих организмов
являются почвы с высоким содержанием солей (Красильников и
др., 1934; Нестеренко и др., 1985; Лысак и др., 1994). Некоторые
виды родококков способны к росту при концентрации NaCl в
среде, равной 10%. Родококки обнаруживаются также в качестве
характерных компонентов в почвах и других биотопах, связанных с
месторождениями нефти, газов, озокеритов, что коррелирует с
их способностью усваивать различные углеводороды. На основе
множественности оттенков пигментации культур родококков,
коррелирующих с их физиологическими особенностями, был
составлен ключ для их видовой идентификации (Нестеренко и др.,
1985). Использование этого ключа при проведении почвенно-ми-
кробиологических исследований позволило подсчитать
процентное содержание разных видов в почвах степных экосистем.
Первое место по частоте встречаемости занял вид Rhodococcus ery-
thropolis (56%), далее в порядке убывания следуют виды
R. rubropertinctus (11%), R. luteus (8%), R. opacus (6%). Остальные
виды в исследуемых почвах обнаружены не были (Нестеренко и
др., 1985). К этому списку можно добавить виды R. terrae и R. lon-
gus, выделенные нами (Добровольская и др., 1996) также из
черноземов, но в другом регионе. Таким образом, анализ группы ко-
ринеподобных бактерий в почвах стал постепенно переходить не
только на родовой, но частично и на видовой уровень.
Определение видов в пределах рода Arthrobacter оказалось
практически невозможным, так как большинство культур артро-
бактерий не имеют пигментации, а тот набор физиологических
признаков, который давался в таблицах в качестве
дифференцирующих, как оказалось впоследствии, отражал часто не видовые,
а штаммовые особенности. Однако обсуждение этого вопроса
требует особого рассмотрения и связано с изменением самого
понятия вида у бактерий. Анализ местообитаний бактерий,
принадлежащих к другим родам из группы коринеподобных бактерий,
будет дан в последующих главах книги.
Не менее изученным, чем артробактер, является другой род
бактерий - Azotobacter, с которого началось изучение процесса
азотфиксации у аэробных бактерий. Анализу распространения
азотобактера в почвах разных природно-климатических зон
посвящено огромное число статей и монографии Н.Н. Сушкиной
(1949) и Г.Н. Блинкова (1959). Было показано, что азотобактер
предпочитает гумусированные гидроморфные почвы под
травянистой растительностью с нейтральной реакцией среды, напри-
82
мер, пойменные. Бактерии этого рода практически не
обнаруживались в кислых лесных почвах. Однако впоследствии была
продемонстрирована способность разных штаммов азотобактера
расти при низких значениях рН (5,5) и также активно проводить
фиксацию азота, как и в нейтральной среде (Блинков, 1955).
Предполагалось (Сушкина, Сергунина, 1955), что для
азотобактера губителен процесс подзолообразования, протекающий под
хвойными лесами: при внесении в подзолистую почву под
ельником популяция азотобактера быстро элиминировалась. По
нашим данным (неопубликованным), таннины, содержащиеся в
хвое ели, оказывают ингибирующее воздействие на рост культур-
как азотобактера, так и артробактера, чем, вероятно, и
объясняется отсутствие этих бактерий в подстилках и почвах под
хвойными лесами.
Другим хорошо изученным родом из группы активных диазо-
трофов является Clostridium. В отличие от азотобактера, это
анаэробный организм. Выяснению закономерностей
распространения бактерий этого рода, а также сульфатредуцирующих
анаэробов в почвах разных природно-климатических зон,
посвящены многолетние исследования, проводившиеся на кафедре
микробиологии Московской сельскохозяйственной академии
им. К.А. Тимирязева. Итоги этих исследований подведены в
обзоре специалиста в области изучения этих бактерий В.Т. Емцева
(1984). Установлено, что ареалы оптимального размножения для
разных родов и видов анаэробов неодинаковы, и группировки
доминантных видов различны для почв разных климатических зон.
Сахаролитические анаэробы преобладают в северных, а протео-
литические, пуринолитические и сульфатредуцирующие
анаэробные бактерии - в южных почвах. Показано, что изученные
бактерии осуществляют в почве фиксацию молекулярного азота
атмосферы, трансформацию белков, пуриновых и пиримидино-
вых соединений, редукцию соединений серы. Выявлена диазо-
трофная активность у сульфатредуцирующих бактерий в
затопляемых почвах, показана роль этих бактерий в процессе содооб-
разования в почве.
По мере расширения спектра бактерий, являющихся
активными азотфиксаторами, были организованы исследования,
связанные с изучением распространения в почвах диазотрофных
бактерий на родовом, а иногда и видовом уровне. Так, было показано,
что в лесных дерново-подзолистых почвах доминирующей
группой азотфиксаторов являются энтеробактерии, принадлежащие к
видам Enterobacter aerogenes, Klebsiella pneumonia, Citrobacter inter-
medius (Калининская, Лаврова, 1988). Авторы объясняют
приуроченность этих бактерий к кислым лесным почвам их способно-
83
стью расти и фиксировать азот при низких значениях рН и низких
температурах. Активность азотфиксации возрастала в ряду:
почвы под ельником —> почвы под березняком и липняком —>
окультуренные почвы. Однако по сравнению с клостридиями,
доминирующими в пахотных почвах, продуктивность азотфиксации у эн-
теробактерий значительно ниже, поэтому в лесных почвах и азот-
фиксация значительно ниже, чем в окультуренных. В засоленных
такыровидных почвах в составе комплекса азотфиксирующих
бактерий доминировали представители совсем других родов, чем в
лесных почвах: Xanthobacter flavus и Alcaligenes paradoxus
(Кравченко, Калининская, 1988). Их доминирование объясняется их со-
леустойчивостью (рост при содержании 2-4% NaCl в среде) и
повышенными значениями температурного оптимума (20-35 °С).
Следует отметить, что новый этап в изучении
распространения азотфиксирующих бактерий разных таксонов в почвах
начался в связи с установлением факта тесной корреляции между
процессом азотфиксации бактерий и фотосинтезом растений.
Было показано, что растения являются ведущим экологическим
фактором, определяющим динамику и продуктивность
ассоциативной азотфиксации в почвах и биоценозах, и что способностью
к азотфиксации обладает большинство почвенных бактерий.
Поэтому анализ таксономического состава бактерий-диазотрофов
стали проводить в ризосфере разных типов растений, а не в
почве, что, впрочем, не умаляет роль почвы, обеспечивающей рост
растений. Установлено, что ассоциативная азотфиксация
наиболее активно протекает при давлении почвенной влаги около
0,25 МПа, в то время как температура не оказывает заметного
влияния на динамику азотфиксации (Умаров, 1984).
В связи с появлением принципиально новых результатов,
связанных с установлением приуроченности процесса азотфиксации
к фитосфере растений (ассоциативная азотфиксация) и
обнаружением способности к азотфиксации у широкого круга бактерий,
многие публикации, посвященные анализу распространения в
разных типах почв тех или иных родов активных азотфиксато-
ров, потеряли смысл.
Известно, что азотфиксирующие бактерии часто
развиваются в симбиозе с целлюлозоразрушающими микроорганизмами,
от которых они получают источники питания и энергии,
необходимые для осуществления такого энергоемкого процесс как
азотфиксация. Однако довольно долго бактерии, проводящие азот-
фиксацию и разложение целлюлозы, изучались изолированно.
Целлюлозоразрушающие бактерии начали изучать в почвах еще
в 1930-1950-е гг. (Мишустин, 1938; Имшенецкий, 1953). Тогда
было показано, что в окультуренных почвах в комплексе целлю-
84
лолитиков больше цитофаг и вибрионов, а в естественных
биоценозах - миксобактерий, среди которых преобладает род Polyan-
gium. Причем, в черноземах доминировал вид P. ferrugineum с
красной окраской, а в подзолистых почвах - P. cellulosae var. lu-
teum с желто-оранжевой окраской плодовых тел (Мишустин,
1938).
При изучении целлюлозных бактерий в почвах Кольского
п-ова (Жукова, 1962) было установлено, что из неосвоенных
почв наиболее часто выделяются представители родов Sporo-
cytophaga и Sorangium, а из окультуренных - Vibrio (более
позднее название Cellvibrio). Интересными представляются
наблюдения автора, касающиеся разных температурных границ роста
для целлюлозоразрушающих бактерий, выделенных из
северных и южных почв. Так, штаммы Sorangium cellulosum из почв
архипелага Северная Земля разрушали клетчатку при 4 °С, в то
время как тот же вид бактерий из почв Казахстана не был
способен к росту при той же температуре. Оптимальная
температура для роста популяций этого вида также отличалась и
составляла 24 °С и 28 °С соответственно. Границы рН для роста
исследуемых бактерий оказались очень широкими: 3,3-9,2 - Sorangium,
4,2-9,2 - Sporocytophaga, 5,4-9,2 - Vibrio.
Анализу распространения целлюлозных микроорганизмов в
почвах Сибири посвящена монография Н.Н. Наплековой (1974).
В ней приведены результаты многолетних исследований
сообществ целлюлозоразрушающих бактерий в разных типах почв,
из которых следует, что разнообразие бактерий этой группы
увеличивается от подзолистых почв к серым лесным и черноземам.
В выщелоченных и южных черноземах в качестве
бактериальных целлюлолитиков приводятся разные виды родов Cytophaga,
Sporocytophaga, Polyangium, Sorangium, Vibrio, в то время как в
подзолистых почвах обнаружены только бактерии Sporocytop-
haga myxococcoides.
Изучение миксобактерий, выделенных из почв Испании (Ruiz
et al., 1987), показало, что из 50 проб, отобранных из почв разных
регионов Гранады, были выделены в основном представители
семейства Мухососсасеае, а род Myxococcus был представлен
наибольшим числом видов. Поскольку в систематике всех групп
бактерий постоянно происходят изменения и переименования
таксонов, описываются новые, то сопоставление последних данных
с таковыми многолетней давности затруднительно.
Интересным открытием явилось обнаружение олиготроф-
ных простекобактерий в колониях целлюлозоразрушающих
бактерий, использующих продукты расщепления целлюлозы бак-
териями-гидролитиками. Благодаря удачно выбранной модели,
85
в которой процессы разложения органического вещества шли
достаточно интенсивно, а этапы этого разложения были четко
разделены во времени (внесение соломы в такыровидную
почву), удалось установить последовательность в развитии разных
родов простекобактерий в зависимости от этапов
минерализации. В начале разложения соломы в почве доминировали
бактерии родов Caulobacter и Prosthecomicrobium, к концу
минерализации увеличивалось разнообразие простекобактерий и к
вышеназванным родам добавились Ancalomicrobiumy Stella, Hyphomicro-
Ыит (Васильева, 1984).
Следует отметить, что описанные выше взаимодействия цел-
лозоразрушающих и диссипотрофных бактерий являются
примером синтрофных взаимоотношений, когда одна из групп
сосуществующих популяций микроорганизмов обеспечивает условия
деятельности другой. Диссипотрофные бактерии в природных
экосистемах вездесущи и более (в 100-1000 раз) многочисленны, чем
копиотрофные микроорганизмы. Их участие в
функционировании экосистем как концентраторов рассеянной энергии лишь
начинает осознаваться (Никитин, 1982, 2001).
В результате изучения динамики роста этих бактерий в
почвах было показано, что их выживаемость максимальна по
сравнению с другими эколого-трофическими группами бактерий -
титр олиготрофных прокариот в стерильной почве сохранялся в
течение длительного времени на более высоком уровне, чем ев-
трофных бактерий (Никитин и др., 1981). Представители многих
родов и видов диссипотрофных бактерий оказались способными
к использованию не только углеводов и аминокислот, но и
газов - водорода и этилена. Наиболее активными были бактерии
родов Renobacter и Blastobacter (Слабова, Никитин, 1986).
Большинство представителей олиготрофных бактерий были
выделены из акваторий, их обнаружению в почвах способствовало
использование электронной микроскопии для прямого микроско-
пирования почв и применение агаризованной почвы для
культивирования (Никитин и др., 1966; Никитин, 1971). В смывах с
почвенных сред под электронным микроскопом были обнаружены
разнообразные формы бактерий - стебельковые, спирально
изогнутые, нитчатые, клетки с необычными придатками,
звездообразные, ультрамикробы.
Было показано, что на почвенных и обычных средах
отбираются разные типы бактерий. На почвенных средах были
выделены новые формы олиготрофных бактерий - грамотрицательные
палочковидные бактерии со сферическими вздутиями на
поверхности, описанные как новый вид Agrobacterium polyspheroidum
(Никитин и др., 1966). Впоследствии этот вид был переописан как
86
Prosthecomicrobium polyspheroidum nov. comb, (Васильева и др.,
1976). Бактерии почковидной формы, содержащие большое
количество газовых вакуолей в клетках, были также обнаружены
на агаризованных почвенных экстрактах и описаны как новый
род и вид - Renobacter vacuolatum (Никитин, 1971). На средах,
содержащих фульваты, из почв были выделены необычные про-
стекобактерии с радиальной симметрией клетки, описанные в
качестве новых родов Angulomicrobium, Stella и Labrys (Васильева и
др., 1979; Васильева, Семенов, 1984; Vasilyeva, 1985). Диагнозы
этих родов узаконены и вошли в 9-е издание "Определителя
бактерий Берджи" (Bergey's manual..., 1994). При изучении
распространения простекобактерий в почвах была установлена
сезонность их обилия, приуроченная к концу вегетационного периода,
т.е. к заключительным этапам разложения органических
веществ (Васильева, 1990).
Издавна считавшиеся типично водными микроорганизмами
простекобактерий рода Caulobacter были обнаружены в почвах
всех природно-климатических зон (Беляев, 1968, 1970). Для их
выделения автору пришлось применить нетрадиционные
способы учета - педоскопы, посев на разведенные жидкие среды с
последующей фазово-контрастной микроскопией, рассев
накопительных культур на плотные почвенные среды. Было показано,
что максимальной численности бактерии рода Caulobacter
достигают в иллювиальных горизонтах торфяно-глеевых,
каштановых, солонцовых почв, предпочитая влажные субстраты с
невысокой концентрацией органических веществ.
В почвах были обнаружены и представители олиготрофных
бактерий, имеющие клетки S-образной, спиралевидной или
кольцевидной форм - это роды Microcyclus (ныне Ancylobacter), Spiro-
soma, Flectobacillus (Слабова, Никитин, 1986). Таким образом,
постепенно пополнялись сведения, касающиеся распространения
в почвах и особенностей физиологии олиготрофных протео-
бактерий.
Спорообразующие бактерии рода Bacillus оказались тем
удачным объектом для исследования, на котором стало
возможным не только осуществить видовую дифференциацию, но и
доказать применимость закона о географической зональности
В.В. Докучаева к микроорганизмам (Мишустин, 1947, 1954).
Поскольку бациллы, благодаря образованию специфичных и
легкораспознаваемых колоний на предложенной среде (мясо-пептон-
ный и сусло-агар в соотношении 1:1), довольно легко
диагностировать до вида, удалось установить четкие различия в
доминирующих видах в северных и южных почвах. Так, было показано
доминирование видов Вас. cereus, Вас. mycoides и Вас. virgulus в се-
87
верных подзолистых и дерново-подзолистых почвах, видов
Вас. megaterium и Вас. idosus - во всех типах южных почв и вида
Вас. subtilis - в каштановых почвах и сероземах (Мишустин, 1954,
1975).
Кроме изучения географии отдельных групп или родов
бактерий в почвах, издавна делались попытки охарактеризовать
бактериальные сообщества разных типов почв в целом. Как уже
упоминалось ранее, описание таких сообществ проводилось на
основе изучения либо соотношения разных физиологических
групп бактерий, либо таких крупных морфолого-таксономиче-
ских групп, как спорообразующие, псевдомонады (куда относили
все подвижные грамотрицательные бактерии), актиномицеты,
коринеподобные бактерии. При этом постепенно в публикациях
появлялись данные с перечислением уже определенных таксонов
внутри этих групп - семейств или родов. Так, при изучении
состава бактериальной флоры в почве соснового леса (Goodfellow,
1968) была выявлена высокая доля бацилл в гор. А - 58%,
которая снижалась в гор. С до 23%, при увеличении доли грамотрица-
тельных бактерий и стрептомицетов вниз по почвенному
профилю. Среди определенных до вида бацилл наиболее активными
гидролитиками оказались виды Bacillus cereus и Вас. subtilis, в то
время как комплекс Вас. circulans- Вас. laterosporus оказался
неактивным.
Характеризуя микрофлору торфянисто-подзолистых почв,
А. Холдинг с соавторами (Holding et al., 1965) отмечают высокую
долю бацилл в составе бактериального комплекса этих почв
(67% в гор. А), 15% составляли грамотрицательные бактерии,
8 - стрептомицеты и 5% - грамположительные кокки. Дается
перечень родов, входящих в группу грамотрицательных бактерий:
Pseudomonas, Xanthomonas, Achromobacter, Alcaligenes, Agrobacte-
rium. Отмечается, что 0-14% в пределах этой группы составляют
факультативно-анаэробные бактерии. Соотношение видов
бацилл следующее (%): Вас. circulans - 8-85, Вас. brevis - 8-58,
Вас. sphaericus - 8-50, Вас. cereus - 0-60, Вас. megaterium - 0-9,
Вас. pumilis - 0-10. Авторы отмечают также медленный рост и
плохую споруляцию некоторых видов бацилл, стимулируемую
внесением сернокислого марганца. Аналогичное явление было
обнаружено при изучении спорообразования у бактерий в почвах
островов Земли Франца-Иосифа (Сушкина, 1963).
Следует особо остановиться на проблеме соотношения
бацилл и коринеподобных бактерий в почвах северных широт, так
как в публикациях исследователей, изучавших бактериальную
флору почв тундр и арктических пустынь, содержатся весьма
противоречивые данные по встречаемости представителей этих
88
групп бактерий. Так, например, сообщалось, что артробактер не
встречается в большинстве почв тундр и если обнаруживается, то
только в верхних горизонтах почв под мохово-лишайниковой
растительностью (Сорокина и др., 1984), а доля бацилл в почвах
тундр не превышает 2% (Паринкина, 1989). Другие
исследователи (Сушкина, Цюрупа, 1973; Darling, 1940; Jensen, 1951; Flint,
Stout, 1960), наоборот, сообщали о доминировании артробактера
и отсутствии либо редкой встречаемости бацилл в арктических
почвах.
Чтобы разрешить эти противоречия, мы решили рассмотреть
распределение вышеуказанных групп бактерий в пределах одной
и той же местности (Западный Таймыр), но с учетом разных
элементов мезо- и микрорельефа, соответствующих разным типам
фитоценозов и почв. В исследуемом районе хорошо выявляются
природные экотопические и сукцессионные ряды, например:
пятно голое - пятно, заросшее лишайниково-водорослевой
корочкой - валик под травами - торфянистая почва трещин. Было
установлено, что коринеподобные бактерии, представленные в
тундре исключительно родом Arthrobacter, приурочены к олиго-
трофным субстратам: поверхности незаросших пятен, глеевым
горизонтам почв, породе. Относительное обилие бактерий этого
рода составляет при этом 60-99%. В распределении спорообразу-
ющих бактерий рода Bacillus наблюдается противоположная
тенденция - они доминируют в тех элементах нанорельефа или
горизонтах почв, где присутствуют разлагающиеся растительные
остатки: очес мха, торф, почва валика, густо пронизанная корнями
растений. В этих биотопах доля бацилл от общего числа
бактерий составляет 25-60%. Абсолютная численность как
артробактера, так и бацилл колеблется в исследуемых почвах от 0,3 до
4,5 млн/г. Однако в надмерзлотном горизонте на глубине 45 см
плотность бактериальных популяций возрастает на порядок при
соотношении родов Arthrobacter'.Bacillus 9:1 (Лысак,
Добровольская, 1982).
Приведенные нами данные, касающиеся экологии
артробактера, были впоследствии подтверждены О.М. Паринкиной и
дополнены сведениями о распространении грамотрицательных
бактерий в почвах того же региона (Паринкина, 1989). Автор
приводит данные по распространению в разных биотопах арктотун-
дровых почв бактерий родов Pseudomonas, Achromobacter и
Arthrobacter. Отмечается приуроченность грамотрицательных
бактерий вышеуказанных родов к влажным почвам со слабораз-
ложившимся опадом и кислой реакцией среды, а артробактера -
к почвам, лишенным моховой дернины (полигоны, пятна),
и к сухим щебнистым, лишайниковым и куртинным тундрам.
89
Анализируя таксономический состав бактерий,
ассоциированных с разлагающимися растительными остатками, нельзя не
остановиться на бактериальных сообществах лесных подстилок,
где процессы деструкции растительного опада идут более
активно по сравнению с почвенными горизонтами. В большинстве
работ по почвенной микробиологии этот биогеоценотический
горизонт как бы исключался из поля зрения почвенных
микробиологов. Это связано с тем, что до настоящего времени вопрос о
том, считать ли подстилку почвенным горизонтом или особым
биогеоценотическим слоем, требующим особой системы
описания, дискутируется в почвенной литературе (Зонн, 1983; Карпа-
чевский, 1983; Богатырев и др., 1993). Не вдаваясь в эту
дискуссию, следует заметить, что микробиологи, изучавшие роль
микроорганизмов разных групп в процессах деструкции
растительных остатков, невольно обращались к анализу состава и функций
бактерий в лесных и степных подстилках.
Судя по спектру таксонов, который приводится в этих
работах, бактериальное разнообразие значительно выше в
подстилках, чем в нижележащих под ней почвенных горизонтах (Heath
et al., 1966; Gyllenberg, Eklund, 1974; Goodfellow, Dawson, 1978).
Однако отсутствие комплексных исследований, которые
включали бы одновременный анализ состава микробных сообществ
во всем почвенном профиле, включая подстилку, а тем более и
субстраты наземного яруса, не позволяло сделать определенные
выводы о различиях в таксономической структуре микробных
комплексов в разных ярусах и горизонтах. Тем не менее, судя по
публикациям, намечалась тенденция к расширению субстратов,
включаемых в микробиологический анализ для оценки вклада
микроорганизмов разных групп в круговорот элементов. В
качестве примера можно привести работу (Caldwell et al., 1979), в
которой определялась численность микроорганизмов, обладающих
целлюлазной, арилсульфатазной, ксиланазной и азотфиксирую-
щей активностью, выделенных из разных субстратов.
Исследовали следующий спектр растительных субстратов, характерных
для хвойного леса: кора, листья, эпифитные мхи, цианофильные
и нецианофильные лишайники, верхний слой почвы.
Однако в приведенных авторами результатах исследований
содержатся, в основном, данные по численности бактерий,
учитываемых на средах с разными субстратами, без определения
таксономической принадлежности микроорганизмов. Было
показано, что численность бактерий (чашечный метод) на всех
используемых субстратах одного порядка, за исключением коры и
хвои, где она на 2 порядка ниже, и определяется, в основном,
влажностью. Процентное содержание бактерий было определе-
90
но лишь для флюоресцирующих псевдомонад и стрептомицетов.
Псевдомонады обнаруживались только в образцах мха и
верхнего слоя почвы (по-видимому, подстилки), они составляли всего
0,1-1,8% от общего числа учитываемых бактерий. Стрептомице-
ты выделялись из всех образцов мха и почвы, но их доля в
микробном комплексе была также мизерной (0,005-2,2%). Азотфик-
сирующая активность была максимальной в цианофильных
лишайниках.
Детальное изучение бактериальных сообществ,
участвующих в превращениях железа и марганца в почвах, на основе
использования гуматных и фульватных сред привело к открытию
и описанию новых таксонов почвенных бактерий (Аристовская,
1965). Были описаны роды Pedomicrobium Arist. (1961) и Seliberia
Arist. et Parink. (1965). Изучение микробных пейзажей разных
типов подзолистых почв позволило выявить смену
таксономического состава железо-марганцевых и других форм бактерий по
сезонам и их распределение по почвенному профилю. Показано,
что в сухие периоды железо-марганцевые бактерии
представлены, главным образом, видами родов Pedomicrobium и Metallo-
genium, с увеличением влажности возрастает роль Seliberia, при
избыточном увлажнении появляется Gallionella. Наиболее
разнообразное бактериальное население сосредоточено в
подстилках и аккумулятивных горизонтах, в то время как бактериальная
флора иллювиальных горизонтов состоит преимущественно из
бактерий родов Caulobacter, Hyphomicrobium и Bacillus
(Аристовская, 1965).
Изучение бактерий, участвующих в превращениях железа и
марганца, было продолжено Тен Хак Муном (1977),
исследовавшим микрофлору почв островов Притихоокеанской зоны. В этих
специфических типах почв, развивающихся на фоне активных
современных вулканических процессов и не имеющих аналогов на
континенте, обнаружено большое разнообразие
железо-марганцевых бактерий, представленных родами: Metallogenium,
Pedomicrobium, Siderocapsa, Gallionella, Lepthothrix. Описаны
новые виды марганецокисляющих бактерий: Naumaniella poly тог-
pha и Pedomicrobium capsulatum (Тен Хак Мун, 1977).
Из вышеприведенного материала видно, как происходило
накопление знаний о бактериальных сообществах почв разных
биомов. Однако следует отметить, что микробиологи часто
продолжают использовать уже устаревшие, не оправдавшие себя
методы оценки структуры микробных сообществ: определение
соотношения численности бактерий, выросших на минеральном
и органическом азоте; определение доли грибов и бактерий по
методу посева и др.
91
Основным недостатком при описании микробных сообществ
почв, которые приводятся в упоминавшихся выше публикациях,
является отсутствие количественных показателей, которые
должны способствовать раскрытию структуры бактериального
сообщества. Такие показатели, характеризующие
биоразнообразие, давно используются в других биологических науках -
фитоценологии, зоологии, биогеографии, микологии. Перечень
экологических индексов, применяемых в настоящее время в
биологии, дан в книге Э. Мэгарран (1992). В микробиологию и
особенно в бактериологию, развивавшуюся в течение длительного
времени в отрыве от общей экологии, методы современной синэко-
логии только начинают внедряться.
Другим недостатком, тормозящим раскрытие картины
бактериального разнообразия почв, является использование
большинством микробиологов при посевах так называемого "среднего
образца почв" - обычно это смешанный образец (из 3-5 точек) из
верхнего органо-аккумулятивного горизонта почв, на основании
анализа которого впоследствии характеризуется микробоценоз
всей почвы. Таким образом, разнообразные микробные
сообщества, формирующиеся в подстилках и разных генетических
горизонтах почв, остаются вне поля зрения микробиологов. Кроме
того, для характеристики микрофлоры разных типов почв часто
использовались окультуренные почвы, которые резко
отличаются от их аналогов под естественной растительностью, что
необходимо учитывать при сравнении микробоценозов разных
типов почв по данным разных авторов.
2.2. НОВЫЕ ПОДХОДЫ К ЭКОЛОГИЧЕСКОЙ ОЦЕНКЕ
МИКРОБНЫХ РЕСУРСОВ ПОЧВ
("НОВЫЕ ВОЗМОЖНОСТИ СТАРОГО МЕТОДА")
"Новые возможности старого метода" - определение,
заимствованное из статьи И.Ю. Чернова (1997), точно отражает суть
идеи, согласно которой традиционный метод посева и выделения
чистых культур не только следует сохранить, несмотря на
появление современных молекулярно-биологических методов, но и
расширить его возможности, используя для количественной
характеристики микробных сообществ с учетом разработанных в
общей экологии индексов разнообразия.
Рассмотрим новые подходы к анализу микробного
разнообразия почв, которые были разработаны сотрудниками кафедры
биологии почв факультета почвоведения МГУ (и автором
настоящей книги в их числе) под руководством проф. Д.Г. Звягинцева.
92
Предлагаемый системный подход (Звягинцев и др., 1994, 1997,
19996, в) основан, прежде всего, на концепции иерархии
местообитаний микроорганизмов. От традиционного масштаба
рассмотрения (средние образцы - генетические горизонты почв -
почвенный профиль) интересы почвенных микробиологов
сместились как в сторону детализации, т.е. изучения мезо- и
микрозональной архитектуры микробного сообщества почвы, так и в
сторону генерализации, т.е. попыток взглянуть на микробные
сообщества в биогеоценотическом и общегеографическом
масштабах. Чтобы располагать всей этой информацией, необходим
постепенный переход от меньшего масштаба к большему.
Особого внимания заслуживает при этом рассмотренное
нами ранее понятие о почве как множестве микросред,
предоставляющих возможности для развития самых разнообразных групп
микроорганизмов. Такие внутрипочвенные среды могут быть
разбиты на несколько основных типов: связанные с
неоднородностью минеральной составляющей (различные почвенные
новообразования типа ортштейнов, журавчиков и др.), подземные
части растений (ризосфера, ризоплана), зоны вокруг гиф грибов
(мико- и микоризосфера), ходы червей (дрилосфера), копролиты,
кишечный тракт и поверхностные покровы почвенных
беспозвоночных животных. В каждом из этих локусов складывается
особый тип микробных сообществ, поэтому для анализа
бактериального разнообразия почвы необходим отбор образцов с учетом
всех или хотя бы большинства микрозон. Условия микрозон
необходимо воспроизводить в макромасштабах на питательных
средах. Таких вариантов по составу сред и условий
культивирования могут быть сотни. Естественно, что на одной среде из одного
местообитания вырастает лишь 1% от тех форм бактерий,
которые, в принципе, возможно выделить из почвы. Увеличение
числа местообитаний, воспроизводимых на питательных средах,
может, следовательно, расширить спектр учитываемых таксонов
бактерий в десятки раз.
С другой стороны, появилось стремление взглянуть на
микробные сообщества почв в масштабе всего биогеоценоза, что
связано с новой трактовкой представления о почве как открытой
системе и признанием роли почвы в развитии и
функционировании отдельных экосистем и биосферы в целом (Добровольский,
Никитин, 1990, 2000). Чтобы оценить закономерности
пространственного распределения микроорганизмов в пределах
биогеоценоза нами был предложен вертикально-ярусный анализ
микробных сообществ, заключающийся в одновременном исследовании
микробных комплексов во всех ярусах экосистемы: надземном
(филлоплана древесных и травянистых растений); наземном
93
(подстилки, моховой и лишайниковый покров, напочвенные
разрастания водорослей); почвенном (включая все почвенные
генетические горизонты). Каждый из ярусов представляет по
отношению к микроорганизмам определенный набор субстратов как
сред обитания, а переход от одного яруса к другому - плавный
переход от живых частей растений к находящимся на разных
стадиях разложения растительным остаткам и минеральным
горизонтам, бедным легкодоступными органическими веществами.
Одним из предлагаемых нами подходов к экологической
оценке микробных ресурсов почв является географический,
представляющий собой дальнейшее развитие эколого-географи-
ческого направления в отечественной микробиологии. Оно
сформировалось в 1940-1950-х гг. и связано, прежде всего, с
именем академика Е.Н. Мишустина. Однако после периода
интенсивного накопления данных и дискуссий 1950- 1960-х гг. интерес
к микробной биогеографии как в нашей стране, так и за рубежом
стал снижаться. Одна из причин этого - интенсивное развитие ге-
носистематики и существенная реорганизация системы
классификации прокариот на основе предполагаемых
филогенетических связей организмов, вызвавшая сомнения многих
микробиологов-экологов в адекватности идентификации
микроорганизмов по классическим фенотипическим признакам.
Наблюдаемый в последние годы подъем в области изучения
состава микробных сообществ различных биогеоценозов в
значительной степени связан с необходимостью решения
практических задач, касающихся защиты и сохранения окружающей
среды. Несмотря на появление различных молекулярно-биологиче-
ских методов исследования сообществ микроорганизмов in situ,
мы считаем необходимым и далее развивать "классический"
подход, ограничиваясь фенотипической идентификацией
прокариот на уровне достаточно крупных таксономических групп,
легко распознаваемых визуально или с помощью простейших
тестов. При этом возможно проводить массовые анализы,
необходимые для выявления стохастических по своей природе
закономерностей географического распространения
культивируемых микроорганизмов. Развиваемое нами направление
включает сравнительно-географический анализ структуры микробных
сообществ, рассматриваемых в масштабе целых биогеоценозов
(Звягинцев и др., 1993; Чернов, 1993).
При оценке микробного разнообразия почв следует также
учитывать, что структура микробных комплексов изменяется во
времени, при этом наблюдаются как сезонная динамика
микроорганизмов (разная для разных групп), так и сукцессионные
изменения, направленность которых определяется разными факто-
94
рами, вскрываемыми, как правило, в модельных опытах.
Поэтому, сукцессионный подход в комплексе с вертикально-ярусным
и микролокусным позволили выявить основные закономерности
в организации микробных сообществ в пространстве и времени
на примере некоторых групп эукариотных и прокариотных
микроорганизмов (Звягинцев и др., 19996, в).
Нами было предложено в качестве таксономической
единицы биоразнообразия бактерий использовать не вид, а род, а в
некоторых случаях и таксоны более высокого порядка, когда
идентификация до рода по фенотипическим признакам затруднена,
например, в порядке Myxobacterales или группе Flavobacterium-
Cytophaga. Думается, что при эколого-географических
исследованиях, когда оцениваются и сравниваются сообщества бактерий
разных типов почв и разных природно-климатических зон, более
эффективным будет принять за операционную единицу именно
такие, т.е. более крупные, чем вид, таксоны. При этом
общепринятые в синэкологии индексы разнообразия, такие как индекс
Шеннона (сс-разнообразие) или индекс Уилсона-Шмиды (Р-разно-
образие), вполне оказываются применимыми для
количественной оценки бактериального разнообразия почв и сопряженных
субстратов. Однако более информативными следует считать
показатели, характеризующие иерархическую и синтипологиче-
скую структуру бактериальных сообществ: соотношение
бактерий различных родов в сообществе; частоту встречаемости и
доминирования бактерий определенных родов; спектры
потенциальных доминантов; таксономический состав бактерий в
пределах каждой из эколого-трофических групп; соотношение проте-
обактерий и актинобактерий (Добровольская и др., 1997, 1999;
Звягинцев и др., 19996, в). При обработке полученных данных
возможно использовать те же методы (например, метод главных
компонент), что и в работах, посвященных оценке
биоразнообразия почв на основе молекулярно-биологических методов.
Таким образом, нам представляется вполне реальным
выявление бактериального разнообразия почв на основании как
разработанных нами подходов, так и показателей, в основе которых
лежит идентификация бактерий преимущественно до рода по
простым фенотипическим признакам, прибегая в то же время,
когда это необходимо, к хемотаксономическим и молекулярно-
биологическим методам.
При оценке бактериального разнообразия почв на основе
метода посева следует придерживаться следующих принципов: не
стараться описать разнообразие всех групп и таксонов бактерий,
включая гетеротрофов, хемолитотрофов, фототрофов, строгих
анаэробов и облигатных метанотрофов, что практически невоз-
95
можно, а выбрать в качестве модельной одну из групп бактерий,
все представители которой способны расти на одной и той же
питательной среде. При этом появляется возможность определения
доли разных таксонов бактерий в сообществе, складывающемся
на используемой среде, выявления доминантов, субдоминантов и
минорных компонентов, т.е. анализ сообщества на основании
использования различных общепринятых синэкологических
показателей. Можно считать, что модельная группа была выбрана
удачно, если удалось установить закономерности распределения
и особенности таксономической и типологической структуры
исследуемого бактериального комплекса, отражающие адаптацию
бактерий к условиям, складывающимся в данном типе
экосистемы, почвы или природно-климатической зоны. Следует
отметить, что все общебиологические закономерности, связанные с
расселением и пространственно-временной организацией
биотических сообществ, были выявлены на определенных выборках,
например птицы, беспозвоночные животные, бабочки и т.д.
Мы избрали в качестве модельной группы комплекс
аэробных и факультативно-анаэробных бактерий, включающий более
50 родов, которые могут быть выделены из почвы и
сопряженных субстратов и способны к росту на модифицированной нами
пептонно-глюкозо-дрожжевой среде (Добровольская и др., 1989).
Рассмотрим результаты применения такого подхода для
характеристики структуры бактериальных сообществ в наземных
экосистемах с учетом иерархии местообитаний бактерий.
2.3. БАКТЕРИИ В ПОЧВЕННЫХ МЕЗО-
И МИКРОЛОКУСАХ
Бактерии как компонент микробного сообщества
лишайников. Первичный процесс почвообразования начинается на
выходах скальных пород под воздействием лишайников,
представляющих собой уникальный, в плане адаптации к наземным условиям,
симбиоз гриба и водоросли. Анализ микробных сообществ,
складывающихся в талломе лишайников, и роли лишайников в
процессе почвообразования был дан еще в 1949 г. известным
микробиологом Д.М. Новогрудским, внесшим большой вклад в
развитие почвенной микробиологии. Им было показано, что таллом
лишайника механически и химически раздробляет поверхность
породы, превращая ее в мелкодисперсную массу, которая
обогащается гумифицированными остатками лишайника. В
результате этих процессов возникает лишайниковый мелкозем, в
котором создаются условия для поселения более требовательных к
96
условиям среды организмов - мхов и высших растений.
"Образование гумусовых веществ из тел лишайников является важным
процессом в развитии жизни на Земле и процессов
почвообразования" (Новогрудский, 19496, с. 519).
Поскольку гумус образуется в результате деструкции
растительных остатков, встал вопрос - кто разлагает лишайниковый
таллом? Задав себе этот вопрос, ученый начал поиски целлюло-
зоразрушающих бактерий в лишайниках. Многочисленные
образцы лишайников были собраны в высокогорных областях на
выходах пород и в равнинной местности на поверхности почвы и
коры деревьев. В результате посева этих образцов на среды,
содержащие в качестве источника углерода фильтровальную
бумагу, было показано, что во всех видах лишайников содержатся
целлюлозоразрушающие микроорганизмы. Они были
представлены грибами разных родов, обитающих на поверхности
таллома, и аэробными целлюлозоразрушающими бактериями рода
Cellvibrio, населяющими внутреннюю поверхность таллома. Все
эти микроорганизмы разрушали отмирающие гонидии
водорослей, оболочки которых состоят из целлюлозы.
Полученные результаты послужили основанием для
постановки вопроса Д.М. Новогрудским о лишайнике как сложном
микробном ценозе, в котором одни компоненты связаны симбиоти-
ческими связями (гриб и водоросль), а другие - метабиотически-
ми (целлюлозоразрушающие грибы и бактерии - гонидии
водорослей). В лишайниках были обнаружены и азотфиксирующие
бактерии родов Azotobacter и Beijerinckia (Красильников, 1949;
Генкель, Плотникова, 1973). Согласно современным
представлениям, азотфиксирующие и целлюлозоразрушающие
микроорганизмы обычно находятся в ассоциациях, представляющих собой
пример синтрофных взаимоотношений, строящихся на обмене
факторами роста. Поэтому, обнаружение в лишайниках
представителей вышеназванных групп позволяет представить себе
наличие именно такой ассоциации внутри лишайникового ценоза, что
еще более расширяет число возможных партнеров, из которых
формируется лишайниковый микробоценоз.
При изучении микробных сообществ литофильных
лишайников Памира, проведенном в 1970-е гг. сотрудниками кафедры
биологии почв факультета почвоведения МГУ, было показано,
что доминирующими среди бактериальных комплексов
лишайников (при высеве на пептонные среды) были микрококки,
колонии которых окрашены в различные оттенки розово-красных и
желто-оранжевых тонов. Их численность колебалась от
нескольких десятков тысяч до 3 млн/г субстрата. Всестороннее
таксономическое изучение выделенных культур микрококков позволило
97
отнести их к роду Micrococcus - видам М. agilis, M. luteus и
М. aurantiacus (Добровольская, 1975, 1983). Отсутствие у этих
культур гидролазной активности, потребность в аминокислотах и
витаминах при наличии каротиноидных пигментов,
защищающих бактерии от повышенной дозы ультрафиолетового
облучения, характерного для Памира, позволили установить
принадлежность микрококков к группе эккрисотрофов, питающихся
прижизненными выделениями растений (в данном случае
лишайников). Таким образом, представление о лишайнике как
сложном, многокомпонентном микробоценозе продолжает
развиваться, и еще много аспектов этой проблемы остаются
нерешенными.
Бактерии как компоненты микосферы и микоризосферы.
Возможность непосредственно наблюдать взаимоотношения
между микроорганизмами, складывающимися в почве, появилась с
возникновением прямой микроскопии почв. Вначале это были
стекла обрастания Н.Г. Холодного (1935), затем было
предложено покрывать стекла агаризованной средой перед закладкой в
почву (Рыбалкина, Кононенко, 1953, 1957). Впоследствии стекла
обрастания были заменены стеклянными капиллярами с
плоскими стенками - педоскопами (Перфильев, Габе,1961). Внедрение
методов прямой микроскопии в почвенную микробиологию
позволило по-новому взглянуть на микробный мир почвы, оценить
его in situ.
Анализ микробных пейзажей почв разных типов,
полученный на основании просмотра капиллярных педоскопов,
заложенных в почву, показал, прежде всего, особую роль грибов как ор-
ганизмов-средообразователей, или эдификаторов (Аристовская,
1965). Микромицеты, обладающие мощным аппаратом экзофер-
ментов, создают вокруг себя среду, насыщенную продуктами их
обмена, что привлекает в эту сферу другие группы организмов,
среди которых особую роль играют бактерии. В микробных
пейзажах почв постоянно наблюдали обрастание мицелия грибов
бактериальными клетками. В одних случаях складывались симбио-
тические отношения между грибами и бактериями, в других -
происходил лизис грибных гиф в результате воздействия миколи-
тических бактерий и вместо нитей мицелия оставались лишь
бактериальные клетки, сохраняющие свое первоначальное
расположение вдоль исчезнувших гиф (Рыбалкина, Кононенко, 1957;
Аристовская, 1965). Аналогичные картины наблюдали еще
ранее на стеклах обрастания (Starkey, 1938; Новогрудский, 1956).
На грибном мицелии часто развиваются актиномицеты,
обладающие хитиназами, способными гидролизовать клеточную
стенку грибов. При изучении динамики популяций микромицетов
98
и актиномицетов в почве (Кожевин, 1989; Кожевин и др. 1979;
Полянская, Мирчинк, 1986) было показано, что пик
максимальной численности последних отстает во времени от грибного, т.е.
после вспышки грибной активности происходит рост
актиномицетов как на живых и отмирающих гифах, так и на продуктах их
автолиза. Роль актиномицетов в регулировании плотности
грибных популяций рассматривается в ряде книг и обзоров
(Калакуцкий, Агре, 1977; Зенова, 1984; Звягинцев, Зенова, 2001).
Сообщается, что в кислых подстилках и почвах, где продуктивность
грибов особенно велика, стрептомицеты играют главную роль в
разложении грибного мицелия. В процессе разложения хитина в
этих почвах повышается значение рН за счет выделения актино-
мицетами более нейтральных метаболитов, при этом отмечается
сукцессионная смена ацидофильных актиномицетов нейтрофила-
ми (Williams, Robinson, 1981; Зенова, 1984).
Среди организмов, способных лизировать клеточные стенки
грибов, называют, кроме актиномицетов, самые разнообразные
бактерии - Pseudomonas fluorescens, Achromobacter denitrificans,
Proteus vulgaris, Bacillus mesentericus, Bacillus cereus (Мирчинк,
1988). О миколитических бактериях из рода Pseudomonas
сообщалось еще в 1930-1940-е гг. (Худяков, 1935; Новогрудский, 1949а),
когда был подробно описан поэтапный процесс лизиса грибных
гиф миколитическими бактериями, однако природа литических
веществ не была установлена. Вызывает сомнение родовая
принадлежность исследованных этими, а затем и другими учеными
миколитических бактерий рода Pseudomonas. Известно, что
псевдомонады - типичные копиотрофы, и не способны разрушать
какие-либо полимеры в связи с отсутствием у них внеклеточных
гидролитических ферментов. Поскольку ранее под термином
"псевдомонады" подразумевалась обширная гетерогенная группа
грамотрицательных палочковидных, подвижных, часто
образующих флюоресцирующий пигмент бактерий, можно
предположить, что она включала множество различных родов. В описании
миколитических псевдомонад Д.М. Новогрудским указывается
на большую морфологическую и физиологическую
гетерогенность этой группы.
Судя по описанной автором вибриоидной форме многих
культур из этой группы, можно предположить, что он имел дело не с
псевдомонадами, а с целлюлозоразрушающими вибрионами
(Cellvibrio), а, возможно, и с цитофагами. В настоящее время во
всех руководствах по экологии и идентификации бактерий
перечисляются в качестве потенциальных микроболитических
агентов те бактерии, которые способны не только реутилизировать
микробную биомассу, но разрушать и растительные полимеры -
99
целлюлозу, крахмал, пектин, хитин, лигнин. Гидролитический
блок таких бактерий включает миксобактерии, цитофаги,
некоторые вибрионы, актиномицеты и отдельные представители
бактерий актиномицетной линии (целлюломонады, промикромо-
носпоры), а также бациллы и клостридии. Все они обладают
соответствующим набором ферментов, в том числе глюкозидаза-
ми, хитиназами, липазами и др.
Наиболее подробно изучены природные местообитания и
таксономический состав бактерий, обладающих дрожжелитиче-
ской активностью (Сорокин, Бабьева, 1982; Черняковская, 1995).
Показано, что в тех ярусах и локусах, где наблюдается
наивысшая концентрация как бактерий, так и дрожжевых грибов, -
лесные и степные подстилки, растительный опад, кишечник и
экскременты почвенных беспозвоночных - обнаруживается и
максимальное количество дрожжелитических бактерий, среди
которых доминируют представители актиномицетной линии: Strepto-
myces, Agromyces, Promicromonospora, Mycobacterium, Micrococcus.
Во многих случаях наблюдали лизис мертвых и живых клеток
дрожжей бактериями (Черняковская, 1995). Дрожжелитические
и миколитические бактерии используются в биотехнологии
для промышленного получения кормового и пищевого белка
из микроорганизмов (Коновалов, Воротило, 1977; Павлова,
1979), а также для борьбы с фитопатогенными грибами.
Другим примером антагонистических взаимоотношений
грибов и бактерий может служить образование бактериями
антибиотиков в качестве защитного механизма, выработанного в
процессе коэволюции грибов, бактерий и растений. Сложилось
целое направление в сельскохозяйственной микробиологии,
связанное с поиском и практическим применением в сельском
хозяйстве бактерий-антагонистов фитопатогенных грибов. Однако
это особая, самостоятельная область исследований, которую мы
не будем здесь рассматривать.
Антагонизм грибов и бактерий оказалось возможным
использовать и для мониторинга за присутствием экологически
опасных грибов при вермокомпостировании.
Экспериментальные исследования (Ищенко, 1995) показали, что на развитие
таких грибов могут оказывать ингибирующее влияние бактерии,
содержащиеся в пищеварительном тракте и экскрементах верми-
компостных червей. При этом наибольший ингибирующий
эффект на развитие фитопатогенных грибов оказывали бактерии
родов Bacillus и Promicromonospora. В то же время представители
родов Pseudomonas, Aquaspirillum и Vibrio стимулировали
прорастание спор и развитие мицелия накапливающихся в вермикомпо-
сте фито- и зоогенных грибов. Таким образом, между грибами и
100
бактериями могут складываться как антагонистические, так и
симбиотические взаимоотношения.
Поскольку нас интересует микосфера как благоприятный
биотоп в почве для развития многих групп бактерий, то, прежде
всего, следует рассмотреть бактерии, развивающиеся в качестве
эпифитов на гифах почвенных грибов. Образцом детального
изучения взаимоотношения грибов с такими бактериями является
вошедший во все книги и учебники в качестве примера симбиоз
грибов с марганецокисляющими бактериями рода Metallogenium.
Комплексы грибов с этими бактериями постоянно выделяются
из различных горизонтов почвенного профиля, подстилок,
растительного опада и даже филлопланы (Болотина, 1975;
Болотина, Мирчинк, 1975; Тен Хак Мун и др., 1977; Мирчинк, 1988; Мир-
чинк и др., 1970).
Сосуществование марганецокисляющих бактерий со
многими видами почвенных и эпифитных грибов сложилось в
результате их длительного симбиоза, благодаря которому бактерии
используют выделяемую грибами перекись водорода для
окисления марганца (Дубинина, 1977). Было установлено (Болотина,
1975) активное участие бактерий Metallogenium в окислении
марганца в почвах с образованием конкреций, в выветривании
минералов и почвообразующих пород. Не исключено, что и другие
формы бактерий, отнесенные как и Metallogenium к микоплазмам
(Балашова, 1974), окажутся при более детальных и комплексных
исследованиях спутниками грибов. Такое предположение
основано на потребностях микоплазм в факторах роста, витаминах, си-
дерофорах, которые могут поставляться грибом в процессе его
жизнедеятельности.
Многие грибы в природных условиях находятся в
ассоциациях с азотфиксирующими бактериями. Грибы не способны, как и
все эукариоты, фиксировать атмосферный азот, однако в
ассоциациях с грибами азотфиксирующая активность бактерий
значительно возрастает по сравнению с чистыми культурами диазо-
трофных бактерий (Кононков и др., 1979). Азотфиксирующие
ассоциации грибов с бактериями были выделены из почвы и
подстилки хвойного леса. Было отобрано 96 комплексов грибов с
бактериями. Грибы принадлежали к различным видам родов
Penicillium и Trichoderma, а бактерии были представлены
бациллами и артробактером (Bacillus megaterium, В. circulans, В. poly-
туха, Arthrobacter globiformis). Грибы выделяют в качестве
метаболитов такие вещества, как моносахариды, органические
кислоты, витамины, необходимые бактериям. Особенно часто
наблюдали симбиозы диазотрофных бактерий с целлюлозоразрушаю-
щими грибами. Предполагается, что это связано с высокой
101
целлюлолитической активностью грибов, снабжающих бактерии
доступным энергетическим материалом, необходимым для
осуществления процесса азотфиксации. В свою очередь, бактерии
снабжают грибы необходимым для них азотом.
Существуют примеры усиления азотфиксирующей
активности диазотрофных бактерий в ассоциациях с дрожжевыми
грибами. Синэргизм при азотфиксации выявлен в совместных
культурах дрожжей и бактерий в разных природных средах: в
почве - Lipomyces starkeyi и Beijerinckia (Dommerques, Mutaft-
chiev, 1965), Lipomyces lipofer и Pseudomonas sp. (Бабьева и др.,
1977); в филлосфере - Rhodotorula glutinis и Erwinia herbicola
(Бабьева, Садыков, 1980). При исследовании бактериально-
дрожжевых ассоциаций в сокотечении деревьев (Бабьева, Рос-
сихина, 1987) было показано, что свыше 70% активных
диазотрофных бактерий образовывали естественные комплексы с
дрожжами Trichosporon pullulans, Hansenula henricji, Zygosaccha-
romyces baillii и др.
Таким образом, взаимоотношения бактерий с грибами,
складывающиеся в природных биотопах, весьма разнообразны - от
взаимополезных (мутуалистических) до антагонистических.
Менее всего изучены состав и функции бактериальных сообществ,
формирующихся в микосфере почвенных грибов. Имеющиеся
сведения, как было показано выше, ограничиваются
констатацией факта скопления бактериальных клеток вокруг гиф грибов,
наблюдаемого на стеклах обрастания и в педоскопах,
установлением симбиотических взаимоотношений между марганецокисля-
ющими бактериями и грибами и описанными выше ассоциациями
диазотрофных бактерий с почвенными микромицетами и
дрожжами. Значительно лучше изучены взаимоотношения бактерий
с микоризообразующими грибами.
"Микоризу можно определить как эволюционно
сложившуюся между корнями высших растений и грибами, а также нередко
и прокариотами, трофоценотическую, структурно оформленную
ассоциацию, в которой перечисленные организмы
воспроизводятся и сосуществуют в физиологически и экологически
взаимозависимом состоянии и в отношениях, называемых мутуалисти-
ческим симбиозом" (Каратыгин, 1993, с. 137). В этом четком и
объемном определении, данном автором одной из
увлекательнейших книг в области биологии и эволюции "Коэволюция
грибов и растений", хотелось бы убрать лишь одно слово -
"нередко", касающееся прокариотного члена симбиоза. Тем более, что
далее автор пишет о формировании древних, сложных синтроф-
ных ассоциаций, состоящих из представителей трех царств
органического мира: растения, грибы и бактерии.
102
Бактерии - первые прокариотные организмы, возраст
которых, по последним данным, отодвигается все более назад к
моменту образования Земли. Связь бактерий с растениями,
прошедшими длительную коэволюцию от водорослей в водных
экосистемах до сложных наземных фитоценозов, в которых бактерии
являются обязательным компонентом каждого из ярусов
биогеоценозов, рассмотрена в обзоре "Растения как центры
формирования бактериальных сообществ" (Звягинцев и др., 1993).
Несмотря на то, что бактерии, как и грибы, способны вступать в симби-
отические взаимоотношения с растениями, в течение
длительного периода времени анализировались изолированно пары:
растения-грибы, растения-бактерии. Изучение всех трех членов муту-
алистического симбиоза, сложившегося для обеспечения
растений фосфором (грибы) и азотом (бактерии), началось лишь в
последние десятилетия и является одним из перспективных
направлений в области изучения формирования и эволюции наземных
фитоценозов и биосферы в целом.
Позитивное влияние микоризы на рост и развитие растений
многопланово и связано не только с улучшением минерального
питания растений, особенно фосфорного, но и с гормональным
регулированием, повышением устойчивости растений к
патогенам (Кураков, 1985; Вагеа et al., 2000; Broughton, 2000).
Микоризные грибы изменяют количество и качество корневых
экссудатов, что влияет, в свою очередь, на ризосферную микрофлору и
микрофауну (Linderman, 1988). Для определения той экониши,
которая формируется вокруг микоризованных корней и
оказывает влияние на всю окружающую биоту, был предложен термин
"микоризосфера" (Rambelli, 1973). Основное отличие между ри-
зосферным эффектом вокруг немикоризованных корней и
эффектом микоризосферы заключается в образовании экстрамат-
рикальных (extra-matrical) гиф микоризных грибов, которые
распространяются на значительные расстояния в почвенную толщу
(Graham et al., 1982). Эти гифы, проникая в почву, оказывают
такое же заметное влияние на почвенную микрофлору, как и
мицелий немикоризных почвенных грибов. Для обозначения той
сферы, которая создается вокруг гиф грибов в почве и которая
характеризуется увеличением плотности и особым составом
микробных сообществ, был предложен термин "микосфера" (Gilburt,
Linderman, 1971). Было показано, что внешние гифы везикуляр-
но-арбускулярных микоризных грибов выделяют вещества,
вызывающие агрегацию органогенных частиц почвы.
Грибы-микоризообразователи взаимодействуют с широким
спектром почвенных организмов как в микоризосфере, так и в
почве. Анализу этих связей посвящены обзоры (Linderman, 1988;
103
Fitter, Garbaye, 1994). Характер взаимоотношений микоризных
грибов с другими организмами может быть самый
разнообразный - от ингибирования до стимуляции, от конкуренции до
мутуализма. Если бактерии способствуют формированию микоризы,
то роль беспозвоночных животных сводится, наоборот, к
выеданию мицелия. Микоризные грибы оказывают влияние на
характер взаимоотношений растений-хозяев с другими организмами -
как патогенами (фитонематоды, фитопатогенные грибы и
бактерии), так и мутуалистами (азотфиксирующие бактерии).
Контакт микоризных грибов с азотфиксирующими
бактериями осуществляется в ризосфере и ризоплане растений постоянно,
потому что в ризосфере сосредоточено максимальное
количество разнообразных как симбиотических, так и ассоциативных ди-
азотрофных бактерий (Умаров, 1986). С другой стороны,
известно, что 100% голосеменных растений и около 80% цветковых
растений имеют микоризу; причем, объем, занимаемый
мицелием эктомикоризных грибов по отношению к объему ткани
корня, составляет 35-45%, у эндомикоризных грибов - 10-15%
(Каратыгин, 1993). Симбиоз грибов с прокариотами имеет особое
значение, так как грибы не способны к фиксации азота, в то
время как более 80-90% бактерий осуществляют процесс фиксации
азота из атмосферы (Умаров, 1986). Экспериментально было
доказано (Daft et al., 1985), что эндомикоризные грибы бобовых
растений, в свою очередь, стимулируют фиксацию азота,
осуществляемую бактериями рода Rhizobium в клубеньках,
образующихся на корнях этих растений. Бактерии рода Azospirillum,
являющиеся также активными азотфиксаторами среди
ассоциативных бактерий, были изолированы с поверхности спор
микоризных грибов рода Glomus (Tilak et al., 1989).
Анализ динамики бактерий Azospirillwn brasilense и Pseudomo-
nas fluorescens в ризосфере картофеля показал положительное
влияние этих бактерий на формирование везикулярно-арбуску-
лярной микоризы; при этом наиболее многочисленная и активная
популяция Pseudomonas fluorescens была обнаружена в экзоризо-
сфере, в то время как преимущественное развитие Azospirillwn
brasilense было зарегистрировано в ризоплане и эндоризосфере
растений. Микоризация позволила повысить численность азоспи-
рилл в ризоплане в 10-100 раз (Ключников, Кожевин, 1990).
У всех 6 видов эндомикоризных грибов рода Gigaspora,
отобранных в различных географических районах, были
обнаружены бактерии-симбионты, принадлежащие к роду Burkholderia
(Bonfante et al., 2000).
Интересным представляется анализ тройного симбиоза
между микоризным грибом Glomus fasciculatus, почвенным грибом
104
Aspergillus niger и активной диазотрофной бактерией Beijerinckia
mobilis. При инокуляции корней лука микоризным грибом и бей-
еринкией значительно увеличивался вес растений и содержание
азота в них. Инокуляция аспергиллом не оказывала влияния на
рост лука, в то время как бейеринкии стимулировали споруля-
цию микоризного гриба. При использовании всех трех
компонентов в качестве инокулята получали синэргический
положительный эффект (Manjunath et al., 1981).
При совместной инокуляции корней томата микоризным
грибом Glomus fasciculatus и диазотрофной бактерией Azotobacter
chroococcum также наблюдали синэргический эффект в
результате которого значительно улучшился рост и урожай томатов
(Bagyaraj, Menge, 1978). Такой эффект был связан с тем, что
микоризный гриб увеличивал численность популяции азотобактера
в ризосфере и поддерживал ее в течение длительного времени на
высоком уровне, в свою очередь азотобактер усиливал
инфицирование корней и образование спор у микоризного гриба. Кроме
того, внесение азотобактера приводило к уменьшению
популяции микромицетов в ризосфере томата, что связано с
антагонистическим действием этого вида бактерий по отношению к
некоторым грибам (Mishustin, 1966). При совместной инокуляции
Glomus-Azotobacter наблюдали увеличение численности и
естественных популяций ризосферных бактерий и актиномицетов.
Считается, что благоприятное воздействие азотобактера на рост
растений и микоризного гриба связано не только с его азотфик-
сирующей активностью, но и с образованием физиологически
активных веществ, стимулирующих рост этих организмов
(Brown, 1975).
При анализе ассоциации микоризного гриба с фосфатраство-
ряющими бактериями (Barea et al., 1975) было установлено, что в
основе положительного воздействия бактерий на микоризную
инфекцию лежит выделение бактериями физиологически
активных веществ, а не растворение ими фосфата. Показано влияние
гриба Glomus fasciculatus на соотношение физиологических и
эколого-трофических групп бактерий в ризосфере и ризоплане
маиса и клевера. В ризоплане микоризованных растений
наблюдали увеличение численности бактериальных, но не актиноми-
цетных, популяций. В ризосферной почве микоризованных
растений численность микроорганизмов не менялась, но
увеличивалась доля факультативно-анаэробных бактерий при снижении
содержания флюоресцирующих псевдомонад и
актиномицетов по сравнению с ризосферой немикоризованных растений.
Вытяжки из ризосферной почвы микоризованных растений
оказывали ингибирующее воздействие на споруляцию корневого
105
патогена Phytophtora (Meyer, Linderman, 1986). Некоторые
бактерии могут оказывать супрессивное влияние на формирование
микоризы - например, Streptomyces (Krishna et al., 1982), что связано
с их хитиназной активностью.
Для эффективного управления микробными популяциями
необходимо изучить и знать особенности развития и
взаимодействия микроорганизмов разных групп в пределах микоризосферы.
Практически все публикации, связанные с изучением эндомико-
ризы, лежат в области анализа взаимоотношений эндомикориз-
ные грибы-фитопатогенные грибы-бактерии-антагонисты
патогенов и связаны с поиском биологических методов борьбы и
контроля за фитопатогенами сельскохозяйственных растений (Кура-
ков, 1985; Gryndler et al., 1995; Vosatka et al., 1995; Inglis et al.,
1996).
Если эндомикориза - древний симбиоз, восходящий к
морским симбиотическим ассоциациям грибов с водорослями, играла
существенную роль в освоении суши сосудистыми растениями, то
эктомикориза - эволюционно более молодой симбиоз,
возникший в экосистеме триаса одновременно с появлением
голосеменных растений. Грибы-образователи эктомикориз
преимущественно относятся к высшим агарикальным грибам,
филогенетически более молодым, чем возбудители эндомикориз. Их огромное
видовое разнообразие при отсутствии заметного видового
разнообразия древесных пород растений обеспечивает успешное
функционирование лесных сообществ бореального пояса (Каратыгин,
1993). Такое введение необходимо для последующего анализа
структуры бактериальных сообществ, формирующихся в экто-
микоризосфере лесных биогеоценозов. При этом следует иметь в
виду, что корни растений оказываются связанными мицелием в
единый комплекс, а гифы грибов могут распространяться от
корней в глубину почвы на расстояние 1-8 см (Каратыгин, 1993).
Повышенная концентрация бактерий в микоризосфере
древесных пород растений была зарегистрирована еще в 1960-е гг.
(Katznelson et al., 1962; Егорова, Рауготис, 1968, 1976). При
определении численности микроорганизмов разных групп на микори-
зованных и немикоризованных корнях саженцев березы было
установлено, что количество бактерий на микоризованных корнях
выше в 2 раза, а актиномицетов в 10 раз. В то же время
численность почвенных микромицетов была, наоборот, ниже в
микоризосфере, чем на немикоризованных корнях. Для прокариот,
выделенных из микоризы, отмечалась большая метаболическая
активность и большая потребность в факторах роста по сравнению с
бактериями, не ассоцированными с грибами (Katznelson et al.,
1962).
106
На увеличение численности актиномицетов в ризосфере
деревьев (как хвойных, так и лиственных), по сравнению с
окружающей почвой, указывают и другие авторы (Егорова, Рауготис,
1968; Рунов, Мишустина, I960). Если в почве около 80%
составляли бактерии и 20% - актиномицеты, то в ризосфере деревьев
доля актиномицетов увеличивалась до 40-60%. Интересным
также представляется наблюдение авторов, касающееся
доминирования вегетативных клеток бацилл на корнях ели, а их спор -
в почве. Многие авторы отмечали обилие коринеформных
бактерий в ризосфере деревьев (Dahm, Strzelczyk, 1977; Kampert,
Strzelczyk, 1975).
Сравнение родового состава бактериальных сообществ в
ризосфере, микоризосфере сосны и окружающей почве (Dahm,
1984) показало, что в первых двух биотопах доминируют
бактерии, близкие к группе видов Arthrobacter globiformis, в то время
как в почве - спорообразующие бактерии группы Bacillus circu-
lans. Во всех исследуемых местообитаниях обнаруживались в
качестве минорных компонентов псевдомонады, нокардиоподоб-
ные и неидентифицированные грамотрицательные бактерии.
В локусах микосферы была выше доля аммонифицирующих и
денитрифицирующих бактерий, но ниже содержание бактерий-
гидролитиков. Оптимальной температурой роста для бактерий
из всех трех местообитаний была 20-26 °С, оптимальными
значениями рН - 7. Различия проявились лишь при значениях рН 8 -
изоляты из микоризосферы не росли в щелочной среде. При рН
5,5 не росли большинство бактерий из зоны ризосферы.
Мнения разных исследователей по поводу присутствия в
микоризосфере тех или иных физиологических групп бактерий
довольно противоречивы. Одни авторы считают, что там
создаются особенно благоприятные условия для развития
аммонифицирующих бактерий (Katznelson et al., 1962), другие (Rambelli, 1973)
констатируют заселение микоризосферы азотфиксирующими
бактериями при отсутствии таких групп гидролитических
бактерий, как протеолитические, амилолитические, целлюлолитиче-
ские и пектинолитические (De Leval, Remade, 1969). На низкую
долю бактерий как гидролитического, так и олиготрофного
комплекса бактерий в микоризосфере по сравнению с окружающей
почвой указывают и другие авторы (Dahm, 1984).
Думается, что по аналогии с ризосферой в микоризосфере
должны обитать представители разных эколого-трофических
групп бактерий, обладающие разными функциями и
стратегиями. Такое предположение основывается на том, что в этих
биотопах создаются условия для развития микроорганизмов,
обладающих самыми разнообразными потребностями в питании,
107
реализуемыми как за счет поступления экссудатов из гиф грибов
и корней растений, так и отмирающих частей мицелия и корней,
на которых развиваются гидролитики и сменяющие их со
временем копиотрофы и олиготрофы. На разных стадиях сукцессии
должны функционировать разные микроорганизмы,
участвующие как в деструкции растительных и микробных остатков, так и
в других процессах, связанных с круговоротом азота, углерода,
железа и других элементов в биогеоценозах. Кроме того,
согласно современным представлениям (Звягинцев, 2001), один и тот
же организм способен участвовать в самых разнообразных
физиологических процессах, часто взаимопротивоположных -
нитрификации и денитрификации, аммонификации и азотфиксации
и др., что лишает смысла разделение бактериальных сообществ
по принципу физиологических групп.
Некоторые базидиомицеты, образующие массивные колонии
и пронизывающие значительные объемы почвы, формируют ми-
целиальные маты. В результате создается огромное
пространство гифосферы, оказывающее воздействие на численность и
структуру других групп почвенных организмов. Анализу этого
явления посвящена докторская диссертация Л.Л. Великанова (1997).
Им показано стимулирующее воздействие макромицетов,
формирующих мицелиальные маты, на рост бактерий - степень
увеличения численности бактерий в колониях макромицетов
колебалась от двух- до 77-кратного, наиболее часто наблюдалось
3-15-кратное. Некоторые микоризные грибы, например Paxillus
involutus, Mycena рига, отдельные виды Amantia, оказывали,
наоборот, ингибирующее влияние на рост бактерий. В их гифосфе-
ре численность бактерий была в 2-6 раз ниже, чем в
окружающей почве. Большинство микоризных грибов оказывали
отрицательное воздействие на актиномицеты - 57% изученных видов
агарикоидных базидиомицетов снижали численность актиноми-
цетов в пределах гифосферы в 1,5-10 раз. У 9 видов
макромицетов проявилось нейтральное отношение к актиномицетам -
численность актиномицетов в пределах колоний базидиомицетов и
вне их практически не различалась. Гифосфера оказывала
воздействие и на почвенные микромицеты: в колониях
агарикоидных базидиомицетов наблюдали значительное снижение
численности микромицетов. Особенно подавлялась активность целлю-
лозоразрушающих микромицетов, что связано с конкуренцией
агарикоидных макромицетов за субстрат.
Во многих работах сообщается о связи диазотрофных
бактерий с различными микоризными грибами. Так, из эктомикоризы
пихты выделили представителей наиболее широко известных
родов активных азотфиксирующих бактерий - Clostridium и Azospi-
108
rillum (Li, Hung, 1987). Азоспириллы выделяли не только из ми-
коризосферы, но и из спорокарп грибов Laccaria laccata и Rhizo-
pogon vinicolor (Li, Castellano, 1987). Высказывается
предположение, что азот, фиксируемый азоспириллами, особенно необходим
грибам во время образования спор. Более того, в процессе
эволюции сложилось приспособление для привлечения грибами
нужных им бактерий для восполнения потребностей в азоте -
вещества, выделяемые спорами грибов, действуют на подвижные
бактерии как аттрактанты (Gupta, Arora, 1987). В состав
выделений, играющих роль аттрактантов, могут входить моносахариды,
спирты, аминосахара и аминокислоты. Поскольку конидии
имеют более тонкие стенки по сравнению с хламидоспорами и скле-
роциями, они наиболее сильно притягивают бактерий.
Была предпринята попытка и совместного культивирования
эктомикоризных грибов сосны с бактериями, выделенными из
той же микоризосферы (Strzelczyk et al., 1987). Культивирование
проводили с 5 бактериальными штаммами при 20 °С и рН 4,5 и 6.
Все штаммы принадлежали к роду Arthrobacter, и все они
оказывали стимулирующее воздействие на рост эктомикоризных
грибов, особенно при рН 6. Это не удивительно, если учесть, что
большинство артробактерий не способны к росту при рН ниже 5,
и даже при значениях рН 6 растут не все штаммы.
Исследовалось влияние бактерий и других таксонов на
формирование микоризы у сеянцев сосны Pinus sylvestris L. Спектр
бактерий включал Arthrobacter sp., Bacillus subtilis, Pseudomonas
fluorescens и Frankia sp. Было установлено, что действие
бактерий на процесс образования микоризы зависит как от вида
грибного симбионта, так и от вида бактерий. Бактерии рода
Arthrobacter стимулировали рост микоризных и сосущих корней.
Культуры Bacillus subtilis стимулировали длину латеральных корней,
но ингибировали удлинение стебля и главного корня у сеянцев
сосны (Rozycki et al., 1994). Другой вид спорообразующих
бактерий - Bacillus mycoides - постоянно выделялся в высокой
концентрации из спорокарпа подземного мицелия грибов (Armando et al.,
1993). Бактерии этого вида чаще выделялись из темноокрашен-
ных спорокарп.
Есть сведения о положительном влиянии
флюоресцирующих псевдомонад на процесс формирования симбиоза между эк-
томикоризным грибом Laccaria bicolor и пихтой (Freyklett et al.,
1997; Frey et al., 1997). Бактерии, которые способствуют
формированию микоризного симбиоза, получили название "МНВ" -
"Mycorrhization Helper Bacteria" (Garbaye, 1994; Dupponois, Gar-
baye, 1991). Одним из таких "хелперов" является вид
Pseudomonas fluorescens, изолированный из спорокарпа микоризного гри-
109
ба Laccaria bicolor. Бактерии этого вида способствовали
образованию микоризы даже при низких концентрациях
бактериального инокулюма. Выделенный штамм нельзя было отнести ни к
эндофитам, ни к ризобактериям, более того, он не был
ассоциирован и со спорокарпом микоризного гриба. При внесении
популяций этого штамма в почву и ризосферу его численность
уменьшалась со временем. Выяснилось, что эта культура
прикрепляется к стенке гиф L. bicolor, а в спорокарп попадает
редко, когда распространяется по гифам. Высказывается несколько
гипотез, касающихся механизма действия бактерий-"хелперов"
(Frey-Klett et al., 1997), из которых наиболее обоснованной
считается ранний эффект воздействия бактерий-"хелперов" на рост
грибов - на стадии, предшествующей симбиозу. Бактерии
стимулируют рост грибов, увеличивая тем самым вероятность
контакта грибов с корнями.
Для дальнейшего уточнения связей между
флюоресцирующими псевдомонадами и микоризным грибом L. bicolor было
выделено и идентифицировано 300 штаммов бактерий из микоризо-
сферы, микоризы и прилегающей почвы (Frey et al., 1997). Изоля-
ты определялись первоначально с помощью системы BIOLOG,
а затем "PCR-DNA fingerprint" методом, и отнесены к разным
биоварам P.fluorescens. Оказалось, что культуры этих бактерий,
выделенные из микоризосферы, использовали углеводы,
некоторые спирты и органические кислоты, например трегалозу,
сорбит, инозит, адонит, фукозу и др. Некоторые из этих углеводов
экскретируются корнями пихты. Сахар трегалоза образуется
многими грибами и некоторыми беспозвоночными животными,
он был обнаружен во всех видах эндо- и эктомикоризы.
Трегалоза накапливается даже в чистых культурах Laccaria bicolor.
Именно трегалоза использовалась всеми штаммами
флюоресцирующих псевдомонад, выделенными из микоризосферы, в то же
время, штаммы биоваров псевдомонад, выделенные из почвы,
использовали аминокислоты, некоторые органические кислоты,
а также N-ацетилглюкозамин - продукт гидролиза хитина,
поступающий из мертвых грибных гиф (Frey et al., 1997). Таким
образом, была установлена четкая взаимосвязь между микоризным
грибом и флюоресцирующими псевдомонадами - "хелперами".
О концентрации флюоресцирующих псевдомонад во всех ло-
кусах микоризосферы сосны сообщается и в другой публикации,
посвященной анализу структуры бактериального сообщества в
симбиозах: Pinus sylvestris-Suillus bovinus и Pinus silvestris - Paxil-
lus involutus (Timonen et al., 1998). Спорообразующие бактерии
были наиболее обильны вне микоризосферы и ризосферы - в
гумусовом горизонте почвы. Бактериальные сообщества микори-
110
зосферы и неколонизированной грибами почвы отличались по их
предпочтительному использованию углеводов, органических
кислот и аминокислот. Бактерии, ассоциированные с грибом Suillus
bovinis, предпочитали в качестве источника углерода маннит, в то
время как ассоциированные с грибом Paxillus involutus -
фруктозу. Были показаны также различия в таксономическом составе
бактериальных сообществ микоризосферы сухих сосновых
лесов и торфяных питомников, где выращивают саженцы сосны.
Авторы делают вывод о комбинированном влиянии типа почвы,
вида грибного симбионта и места локализации бактерий на
состав бактериальных сообществ, ассоциированных с эктомико-
ризой сосны.
Думается, что такой вывод позволит в какой-то мере
объяснить те противоречия, которые выявляются в результате
анализа публикаций по теме, касающейся численности и
таксономического состава бактерий в микоризосфере. Констатация то
повышенного, то пониженного количества бацилл, актиномицетов,
псевдомонад в микоризосфере разными авторами связана,
вероятно, с разной методикой отбора образцов (имеется в виду разное
расстояние от поверхности корня) и их последующей обработкой
(количеством отмывок, обработкой на ультразвуковом
дезинтеграторе). Представляется необходимым проводить отбор
образцов из микоризосферы и окружающей почвы с учетом
множественности локусов, образующихся по мере распространения
корней и гиф грибов-микоризообразователей в почву. Примером
такого рационального подхода к анализу микробных сообществ
микоризосферы является упоминавшаяся выше работа (Timonen
et al., 1998), в которой авторы сделали конкретные, хорошо
обоснованные выводы:
1. Понятие ризосферы как экониши, в которой создается и
поддерживается высокая концентрация бактерий (Lynch, 1994),
не может быть распространено на эктомикоризу, формируемую
в естественных лесных почвах, так как численность бактерий как
во внутреннем, так и внешнем слое микоризосферы примерно
одинакова. Так называемый ризосферный эффект был
обнаружен только в микоризе, образуемой на корнях саженцев сосны,
выращиваемой в торфяных питомниках.
2. Вид Pseudomonas fluorescens, типичный для ризосферы
травянистых растений, не был обнаружен ни в микоризосфере, ни
в гумусовом горизонте кислых лесных почв. Ограниченное
количество штаммов этого вида было выделено из микоризосферы
сосновых лесов Польши (Rozycki et al., 1986). Таким образом,
псевдомонады не являются характерным компонентом
бактериальных сообществ, ассоциированных с эктомикоризой, формиру-
111
ющейся в естественных лесных сообществах. Положительное
влияние Pseudomonas fluorescens на формирование микоризы,
описанное рядом авторов, было получено при исследованиях в
торфяных питомниках, а не в естественных лесах.
3. Лучшими кандидатами на роль бактерий, которые могут
быть рекомендованы для микоризации саженцев сосны,
являются представители рода Bacillus, Эти бактерии постоянно
выделяются из микоризосферы хвойных пород деревьев как
естественных лесов, так и питомников. Возможность их практического
применения уже была продемонстрирована (Garbaye, Duponnois,
1992). Среди бацилл обнаружены штаммы с высокой азотфикси-
рующей активностью (Li et al., 1992).
4. Использование системы BIOLOG для идентификации
бактерий, выделенных из микоризосферы, позволило определить
лишь 50% культур, что связано, как считают авторы, с
отсутствием информации о многих видах бактерий, обитающих в
природных биотопах.
5. На основе анализа спектра использования разных
источников углерода все культуры бактерий четко разделились на две
группы, коррелирующие с их местос^битанием, - штаммы из
лесных почв и штаммы из торфяных почв питомников. Причем, по
набору культур бактерии из искусственных почв питомника
были намного ближе к бактериальным сообществам почв агроцено-
зов, чем к сообществам лесных почв. Они включали
представителей Pseudomonas fluorescens, Enterobacter sp.f Agrobacterium
tumefaciens. Это связано с тем, что в течение года сеянцы сосны,
подобно сельскохозяйственным культурам в агроценозах,
поддерживались в условиях полноценного питания, что и привело к
селекции вышеуказанных форм бактерий.
6. Оптимальным источником углерода для бактерий из всех
местообитаний был метилпуриват. Из углеводов наиболее легко
усвояемым был маннит - один из основных экзометаболитов
многих микоризных грибов. Карбоксикислоты и аминокислоты
предпочтительно использовались бактериями из неколонизиро-
ванной грибами почвы, в то время как продукт деструкции
хитина, N-ацетилглюкозамин - бактериями, обитающими за
пределами внутреннего слоя микоризосферы. Предлагается изучить
состав источников углерода, соответствующих составу экссудатов
микоризы, - сложной смеси экзометаболитов корней растений-
хозяев, микоризных грибов и бактерий. Рекомендуется включить
в спектр углеводов для идентификации бактерий, выделяемых из
микоризосферы, маннит и трегалозу.
Таксономический состав батериальных сообществ
микоризосферы, установленный путем использования прибора BIOLOG,
112
определялся типом биоценоза, в котором формировалось мико-
ризосферное сообщество. Грамотрицательные бактерии из ми-
коризосферы лесных почв были представлены родами Сарпосу-
tophaga, Erwinia, Pausterella, Sphingobacterium, Vibrio, Xanthomo-
nas. Вторую группу составляли изоляты из почв питомников -
кластеры Pseudomonas-Burkholderia cepacia-Pseudomonas glathei.
Большинство грамположительных бактерий были определены
как виды Bacillus кроме нескольких штаммов, определенных как
Promicromonospora enterophila и Cellulomonas turbata. Из образцов
лесных почв выделялись в основном виды Bacillus: В. macquarien-
sisf В. polymyxa и В. sphaericus. Из торфяных почв питомника
чаще выделялись виды В. gordonae и В. ту со ides.
Из плодовых тел эктомикоризного гриба Tuber borchii Vitta
были выделены и определены с помощью молекулярно-биологи-
ческих методов как флюоресцирующие псевдомонады, так и
спорообразующие бактерии (Barbieri et al., 2000). Псевдомонады
оказались близкими к группе видов Pseudomonas fluorescens и
Pseudomonas syringae. Спорообразующие бактерии были
отнесены к филогенетической ветви, включающей виды В. subtilis и
В. cereus, а также роду Paenibacillus. Ранее у этих штаммов была
выявлена целлюлолитическая и хитинолитическая активность,
способствующая открытию споровых сумок и прорастанию ас-
коспор (Gazzanelli et al., 1999).
Необходимы дальнейшие исследования микоризосферы на
уровне всего биотического сообщества, включающего как
микоризные грибы, так и ассоциированные с ними бактерии, актино-
мицеты, микромицеты, представителей микрофауны.
Бактерии, ассоциированные с почвенными
беспозвоночными. Сапротрофные бактерии являются постоянными спутниками
либо симбионтами почвенной мезофауны. Они населяют
пищевой субстрат (почва, листья, травы, подстилка),
пищеварительный тракт и экскременты животных. Дождевые черви,
многоножки, мокрицы, жуки, личинки двукрылых насекомых и другие
беспозвоночные прямо или косвенно влияют на численность,
биомассу и таксономический состав почвенных бактериальных
сообществ. Трофическая деятельность беспозвоночных,
включающая процессы поглощения пищи, ее переваривания, экскреции
и транспорта продуктов экскреции по почвенному профилю,
является одним из ведущих факторов, определяющих
таксономическую структуру и функции почвенных бактериальных
сообществ.
В результате проведения многочисленных научных
исследований в области изучения зообактериальных комплексов как
отечественными, так и зарубежными микробиологами и зоолога-
113
ми, к настоящему времени считаются уже достоверно
установленными многие факты, подтверждающие тесную взаимосвязь
бактерий с почвенными беспозвоночными. Так, большинством
исследователей показано, что суммарная численность, биомасса
и активность бактерий увеличиваются в направлении пища —>
—> экскременты: потребляя различные органические субстраты,
служащие им пищей, почвенные беспозвоночные селективно
выедают одни бактерии, стимулируют рост других или
предоставляют местообитание (кишечник) третьим. Чтобы не цитировать
длинный перечень работ, подтверждающих эти выводы,
достаточно сослаться на некоторые обзоры (Козловская, 1976;
Андерсон, Инесон, 1988; Третьякова и др., 1996; Вызов, 2001; Anderson,
1987; Lee, Pankhurst, 1992; Byzov et al., 1996).
Выберем из всей имеющейся литературы и собственных
исследований только те данные, которые касаются
таксономического состава бактериальных сообществ, ассоциированных с
почвенными беспозвоночными и их функций. Это необходимо
в связи с постановкой и разрешением следующих вопросов:
показать, что локусы концентрации беспозвоночных животных в
почве являются специфическими местообитаниями бактерий, в
которых формируются особые по таксономическому составу и
функциям бактериальные сообщества, существенно
отличающиеся от бактериальных комплексов фоновой почвы.
Большинство исследователей, изучавших таксономический
состав бактериальных комплексов, ассоциированных с
почвенными беспозвоночными, отмечают, что бактерии в кишечнике
животных иные, чем в подстилке или почве, которыми они
питаются. Так, в подстилке широколиственных лесов (дуб и вяз)
доминировали грамотрицательные палочки родов Pseudomonas,
Erwinia, Achromobacter, в то время как в кишечнике диплопод и
фекалиях преобладали бактерии группы Echerichia coli и
Klebsiella pneumoniae (Ineson, Anderson, 1985). Авторы отмечают,
что способность расти анаэробно является важным свойством
при селекции бактерий из кишечника и экскрементов.
О наличии факультативно-анаэробных бактерий в
кишечнике диплопод, представленных родами Klebsiella и Enterobacter,
сообщают и другие авторы (Marialigeti et al., 1985). В заднем
отделе кишечника изопод Oniscus asellus доминировали
представители семейств Enterobacteriaceae - Enterobacter agglomerans и
Vibrionaceae - Plesiomonas (Griffits, Wood, 1985). О наличии
постоянной факультативно-анаэробной популяции бактерий в
кишечнике мокриц (не определялась их таксономическая
принадлежность) и отсутствии строго анаэробных бактерий
сообщалось в работе исследователей (Reyes, Tiedje, 1976), которые изу-
114
чали влияние лабораторного содержания и голодания на
бактериальную микрофлору кишечника изопод. Авторы считают, что
доминирование факультативно-анаэробных бактерий в
кишечнике объясняется довольно низкой концентрацией кислорода
благодаря ограниченному транспорту газов и активному
дыханию. Отсутствие облигатных анаэробов свидетельствует о том,
что кишечник диплопод и изопод не является местообитанием
с постоянно анаэробными условиями, что согласуется с простой
трубковидной формой кишечника этих животных в отличие от
термитов и типулид, имеющих плотнозаселенную анаэробами
заднюю часть кишечника.
Из кишечника червей Eisenia lucens было выделено 473
штамма бактерий, 73% из них оказались принадлежащими к роду Vibrio
(Marialigeti, 1979). На доминирование бактерий семейств Entero-
bacteriaceae и Vibrionaceae в кишечнике дождевых червей
указывают и другие авторы (Третьякова, 1993; Contreras, 1980).
С пищеварительным трактом почвенных беспозвоночных
ассоциированы не только факультативно-анаэробные протеобак-
терии. Большинство авторов, в том числе и упомянутых выше
работ, указывают на обнаружение в кишечнике и экскрементах
беспозвоночных животных многих представителей и грамполо-
жительных бактерий. Среди них перечисляются бактерии родов
Bacillus, Micrococcus, Nocardia, Cytophaga, часто обнаруживаются
разнообразные представители порядка Myxobacterales.
Особое направление в изучении зоомикробых комплексов
связано с анализом бактерий актиномицетной линии в
пищеварительном тракте и экскрементах почвенных беспозвоночных.
При этом особая роль отводится нокардиоподобным бактериям
рода Promicromonospora. Показано, что распространение этих
организмов ограничивается кишечником и экскрементами
диплопод и предполагается, что промикромоноспоры прошли
тесную коэволюцию с диплоподами-хозяевами (Szabo et al., 1983).
Они встречаются как характерные обитатели кишечника
многих видов диплопод. Анализ взаимоотношений промикромонос-
пор с другими бактериальными обитателями кишечника
показал, что они находятся в состоянии нейтрального мутуализма
(Marialigeti et al., 1985). Популяции промикромоноспор высокой
плотности, обнаруженные в заднем отделе кишечника диплопод
Chromatoiulus projectus, были описаны как новый вид
Promicromonospora enterophila (Jager et al., 1983). В кишечнике
других диплопод - Glomerix hexasticha - тоже были обнаружены
нокардиоформные бактерии, но они отличались от этого вида и
занимали промежуточное таксономическое положение между
представителями родов Oerskovia и Promicromonospora (Chu et al.,
115
1987). Анализ пищеварительного тракта и экскрементов
почвенных диплопод Pahyiulis flavipes показал, что среди актинобакте-
рий доминируют стрептомицеты и нокардиоподобные бактерии,
близкие к описанным выше представителям группы Promicro-
monospora - Oerskovia (Вызов и др., 1993). Кишечник почвенных
беспозвоночных оказался благоприятной средой для развития и
мицелиальных актиномицетов разных родов - Streptosporangium,
Actinomadura, Micromonospora, Streptoverticillium и др. (Бабкина,
1995).
Во всех работах, посвященных изучению зообактериальных
комплексов, приводятся многочисленные списки бактерий,
обнаруженных в пище, пищеварительном тракте и экскрементах
почвенных беспозвоночных. Несмотря на то, что кишечник
изолировали и исследовали отдельно от других субстратов, большей
частью оставалось непонятным - какие бактерии специфичны
именно для кишечника, а какие проходят вместе с пищей
транзитом и обнаруживаются в экскрементах. Для решения этого
вопроса необходимо было отделить стенки кишечника от его
содержимого и исследовать их отдельно. В результате применения
особых методических приемов, позволивших осуществить такое
разделение, удалось описать два типа кишечных бактериальных
сообщества для почвенных диплопод и червей (Byzov et al., 1996;
Третьякова и др., 1996). Аборигенное "пристеночное
сообщество" состоит в основном из представителей
факультативно-анаэробных бактерий семейств Enterobacteriaceae и Vibrionaceae,
населяющих внутреннюю поверхность эпителия и кутикулы всех
отделов кишечника (рис. 1, рис. 2, а). У кивсяков доминирующими
были бактерии Klebsiella pneumoniae и Enterobacter cloaceae, а как
минорные компоненты выделялись представители рода Plesio-
monas. Близкие по таксономическому составу бактерии были
обнаружены и в "пристеночном сообществе" кишечника дождевых
червей - Klebsiella pneumoniae, Aeromonas sp.9 Plesiomonas sp.
Численность этих бактерий была максимальна в заднем отделе, она
достигала 100 млн клеток на 1 г сухого вещества кишечных
тканей. Это сообщество было стабильно в условиях смены режимов
питания (в том числе и голодания животных) и имело сходный,
как показано выше, на уровне родов, состав у диплопод и червей.
Можно предположить, что аналогичное по составу
"пристеночное сообщество" бактерий имеется и у других представителей ме-
зофауны.
Экспериментально доказаны особые функции
"пристеночного микробного сообщества": поддержание гомеостаза эндоэкоси-
стемы, реутилизация внутренних экскрементов животного (пери-
трофическая мембрана), эндогенное питание макроорганизма.
116
Рис. 1. Структура бактериального сообщества в подстилке, кишечнике и
экскрементах диплопод
Группы бактерий: 1 - факультативно-анаэробные протеобактерии; 2 - аэробные
протеобактерии; 3 - стрептомицеты; 4 - коринеподобные (КПБ); 5 - бациллы
Мутуалистические отношения между микроорганизмами
"пристеночного сообщества" могут преобразовываться в
антагонистические, когда один из компонентов замещается другим.
Результатом этого может быть гибель животного (Третьякова и др.
1992; Звягинцев и др., 1996; Вызов, 2001).
"Полостное сообщество" или "сообщество содержимого
кишечника" представлено транзитными формами, часть которых
размножается, проходя через кишечник, другая часть лизирует-
ся. Состав этого сообщества во многом определяется составом
бактерий в пищевом субстрате, используемом в пищу мезофау-
ной. Так, анализ таксономической структуры бактериальных
комплексов в опаде широколиственных лесов, служащем пищей
для кивсяков, в содержимом их кишечника и свежих
экскрементах показал почти полную идентичность этих сообществ
(Третьякова и др., 1996), которые включали в качестве доминантов
бактерии рода Pseudomonas, группы среднего обилия были
представлены бактериями родов Flavobacterium, Bacillus, Streptomyces,
Rhodococcus (см. рис. 1). Отличительной особенностью состава
бактериальных комплексов экскрементов кивсяков было
наличие второго доминанта (кроме Pseudomonas) - Promicromonospora
sp., что косвенно свидетельствует о размножении этих бактерий
в кишечнике. Методом сканирующей электронной микроскопии
было подтверждено, что бактерии группы Promicromonospora-
Oerskovia колонизируют стенки кишечника, его содержимое и
остатки перитрофической мембраны (рис. 2, б).
117
iл
* ш
пг
Я&К
A..4J
1
2 мкм
Га
1^г
:-
HI 2 мкм
шШШШШ < '
Рис. 2. Бактерии в кишечнике диплопод:
а-г - на внутренней поверхности стенки кишечника; д-з - в содержимом кишечника
К важнейшим функциям бактерий, проходящих вместе с
пищей через кишечник, относятся разложение полимеров, в
результате которого образуются мономеры, используемые в пищу
бактериями "пристеночного сообщества", и участие в питании
макроорганизма. Предполагается также, что локализующиеся в
118
заднем отделе кишечника актиномицеты способны разрушать
перитрофическую мембрану диплопод, состоящую из хитина
(Бабкина, 1995).
Для решения вопроса о том, какие формы бактерий лизиру-
ются в кишечнике, а какие там размножаются, необходимо
проведение модельных опытов с чистыми бактериальными
культурами, мечеными либо с помощью изотопов, либо с генетической
маркировкой (например, использование антибиотикоустойчи-
вых штаммов). Внесение таких культур в субстрат, служащий
для беспозвоночных животных пищей, позволяет в этом случае
проследить за судьбой внесенных популяций. Так, для изучения
динамики популяций бактерий Pseudomonas sp. и Promicromono-
spora citrea в системе: пища-кишечный тракт - экскременты,
использовали прием скармливания животным стрептомицинустой-
чивых штаммов этих бактерий (Третьякова и др., 1996).
Объектами исследования служили почвенные многоножки (кивсяки)
Pachyiulus flavipes и дождевые черви Eisenia fetida. Наблюдали
общую тенденцию увеличения численности бактерий в
экскрементах кивсяков по сравнению с кормом: псевдомонад - в
3-18 раз, промикромоноспор - 2-30 раз. Близкие результаты
были получены при кормлении червей этими же культурами.
Полученные данные свидетельствуют о размножении
выбранных для опыта бактерий в процессе их прохождения через
кишечник. Для диплопод суммарное время генерации составляет
4,5-11 ч, для червей - 0,7-2,1 ч. Сходные цифры были
приведены ранее и другими авторами (Звягинцев и др., 1987; Anderson,
Bignel, 1980).
Известно также, что некоторые формы бактерий лизируются
в кишечнике беспозвоночных. В опытах с меченым изотопом
водорода было показано, что в процессе прохождения бактерий
через кишечник ассимилировалось по 53% Pseudomonas syringae и
Erwinia herbicola и 29% Esherichia coli (Андерсон, Инесон, 1987).
Аналогичные работы были выполнены с мечеными по углероду
культурами Pseudomonas и Flavobacterium на мокрицах (Reyes,
Tiedje, 1976). Эти авторы показали, что плотность этих бактерий
резко уменьшалась, особенно после голодания, в результате
лизиса бактерий и использования их в качестве пищи, а углерод
включался в ткань кишечника макроорганизма. Механизмы,
включающиеся при этом: увеличение количества пищеварительных
ферментов или автолиз (Reyes, Tiedje, 1976). Одним из механизмов
переваривания микроорганизмов может быть селективное ингиби-
рующее воздействие на бактерии кишечной жидкости. Так, было
показано, что кишечная жидкость кивсяков Pachyiulus flavipes ин-
гибировала рост бактерий Azospirillum brasilense и Pseudomonas
119
stutzeri, в то время как бактерии Pseudomonas putida не только
выживали, но и размножались в кишечной жидкости кивсяков (Zvya-
gintsev et al, 1994). Таким образом, почвенные животные
получают за счет микроорганизмов пищеварительного тракта
полноценную белковую пищу. Проводится интересная аналогия между
беспозвоночными животными и жвачными млекопитающими - обе
группы животных используют микроорганизмы кишечника для
переваривания корма и восполнения потребности в необходимых
аминокислотах (Покаржевский, 1985).
Описанный выше селективный лизис клеток может
стимулировать рост и деление выживших клеток бактерий (Anderson,
Bignel, 1980). Примеры размножения бактерий некоторых
таксонов в кишечнике беспозвоночных приведены выше. Вопрос
о росте и размножении бактерий неотделим от их функций.
Из всех многочисленных функций прокариот, осуществляемых
ими в кишечнике, наиболее значимыми и в то же время
дискуссионными являются: способность разрушать полимеры,
поступающие в пищу, и способность фиксировать азот
непосредственно в кишечнике.
Гидролитическая активность бактерий, особенно целлюло-
литическая, многократно обсуждалась в связи с постановкой
вопроса о том, имеются ли собственные целлюлазы у почвенных
беспозвоночных или они используют симбиотических бактерий
для гидролиза целлюлозы (Стриганова, 1970, 1980; Козловская,
1976). Наличие собственных целлюлаз у беспозвоночных
животных методически трудно доказуемо в связи с невозможностью
полностью освободить их от сопутствующих микроорганизмов.
Косвенным подтверждением наличия целлюлаз микробного
происхождения явились данные о значительно большем содержании
этих ферментов в содержимом кишечника кивсяков, чем в их
тканях (Стриганова, 1980). Несмотря на то, что еще в 1960-е гг.
была предложена гипотеза, согласно которой разложение
клетчатки в кишечнике почвенных сапрофагов осуществляется в
основном микроорганизмами (Nielson, 1962), вопрос о наличии
собственных целлюлаз у почвенных сапрофагов продолжает
периодически обсуждаться в печати. С другой стороны, достоверно
установлено, что доля и разнообразие целлюлозоразрушающих
бактерий в содержимом кишечника достаточно высоки. В
пищеварительном тракте разных представителей мезофауны были
обнаружены целлюлолитические бактерии самых разных
таксонов: Cytophaga, Cellvibrio, Clostridium, Myxobacterales, причем,
численность целлюлозоразрушающих бактерий в кишечнике как
диплопод, так и мокриц в десятки раз выше по сравнению с их
количеством в опаде.
120
Вспышка массового размножения целлюлолитических и пек-
тинолитических бактерий в процессе переваривания пищи
представляет, по мнению Л.С. Козловской (Козловская, 1976), пример
временно-симбиотических связей сапрофагов с почвенными
бактериями. Однако все приведенные выше факты лишь косвенно
указывают на вероятность деструкции целлюлозы в кишечнике
беспозвоночных животных. Для подтверждения необходимо
получить информацию, включающую данные о соотношении
углерода на входе-выходе (пища-экскременты), что возможно лишь
при использовании модельных опытов с меченым углеродом.
В результате проведения таких экспериментов и подсчета
баланса углерода (Звягинцев и др., 1987) идея о деструкции полимеров
в кишечнике сапрофагов была подвергнута сомнению и была
высказана точка зрения, согласно которой в пищеварительном
тракте почвенных беспозвоночных происходит лишь усвоение
мономеров, содержащихся в растительных остатках, кишечными мик-
робосимбионтами.
Потребность животных в белковом азоте реализуется путем
поступления микробного азота экзогенно вместе с пищей и
эндогенно за счет реутилизации бактерий-симбионтов кишечника.
Что касается второго пути, то он связан с вопросом об
осуществлении процесса азотфиксации непосредственно в кишечнике
животных за счет размножения там диазотрофных бактерий
и является дискуссионным. Одни исследователи (Kalpan, Harten-
stein, 1977) не обнаружили нитрогеназной активности в
кишечнике червей, другие (Citernesi, 1977) зарегистрировали ее
наличие.
Косвенным свидетельством активности диазотрофных
бактерий, ассоциированных с червями, является усиление
нитрогеназной активности в 5 раз в почве, в которой содержались дождевые
черви, по сравнению с контрольными образцами почвы без
червей, а также повышение азотфиксирующей активности в копро-
литах (Simek, Pizl, 1989). Специальное исследование,
посвященное анализу нитрогеназной активности в кишечнике червей
вышеназванного вида, обитающего в дерново-подзолистой почве
липового леса (Стриганова и др., 1988, 1993), позволило выявить
локализацию процесса азотфиксации в кишечном тракте червей.
Было подсчитано, что в период весеннего максимума активности
популяций червей в их кишечнике связывается до 1 кг азота/га
почвы, причем актуальная азотфиксация отмечена в
содержимом задней кишки исследуемых червей. Учитывая высокую
численность червей вида Aporrectodea caliginosa в липовом лесу,
содержащих в кишечнике активные диазотрофные бактерии, и
низкую нитрогеназную активность в почвенном горизонте, где
121
обитают черви, можно предположить, что активность червей
вносит определенный вклад в процессы связывания
атмосферного азота в почве (Стриганова и др., 1988,1993). Выявлена
способность кишечного бактериального сообщества осуществлять и
процесс денитрификации in vivo (Karsten, Drake, 1997).
Из кишечника дождевых червей были выделены и такие
редкие для бактериальных почвенных комплексов бактерии, как
фотосинтезирующие пурпурные, относящиеся к видам Rhodop-
seudomonas palustris и Rhodomicrobium vannielii (Gest, Favinger,
1992). Несмотря на то, что размножение бактерий этой группы в
кишечнике не подтверждено экспериментально, авторы
предполагают, что черви могут использоваться для селективного
выделения пурпурных бактерий из природных биотопов.
Дрилосфера - специфическая зона почвы толщиной в
несколько миллиметров, окружающая ходы дождевых червей
(Bouche, 1975). Она занимает лишь 1-2% от объема почвы,
однако в ней сконцентрирована значительная доля почвенных
микроорганизмов разных физиологических групп - более 40%
аэробных и 13% анаэробных азотфиксаторов, 16% денитрификаторов
от всего количества бактерий этих групп, обнаруженных в
фоновой почве (Тиунов, 1993в). Исследования показывают, что
уровень биологической активности в дрилосфере сравним с таковым
в копролитах червей (Loquet, 1978; Тиунов, 1993а). И это не
случайно, так как в дрилосфере создаются благоприятные условия
аэрации и влажности, а также имеются богатые азотом и
энергией прижизненные выделения червей (мускус и урина). Все это
способствует формированию активного комплекса
микроорганизмов, причем особенно резко увеличивается активность
бактерий цикла азота и ферментов того же цикла. Накопление нингид-
ринположительных веществ в дрилосфере было в 2,5-10 раз
интенсивнее, чем в интактной почве, а уреазная активность
увеличивалась на 30-40% по сравнению с почвой, которую
заглатывали черви (Тиунов, 1993б,в).
Высокая биологическая активность в стенках ходов червей
коррелирует с повышенной численностью и биомассой
микроорганизмов в этих специфических биотопах (Devliegher, Verstraete,
1997). Однако, как выяснилось при дифференцированном учете
численности и биомассы разных групп микроорганизмов
(Полянская, Тиунов, 1996), в дрилосфере наблюдается резкое изменение
соотношения бактерии-грибы в пользу значительного
увеличения бактерий по сравнению с окружающей почвой. Именно этим
объясняется повышенная активность процессов азотфиксации и
трансформации азота в галереях дождевых червей, отмеченная
выше.
122
Чрезвычайно мало известно о таксономическом составе ми-
кробоценозов дрилосферы. Нами были проведены исследования
по определению численности и таксономического состава
бактериальных комплексов в стенках нор дождевых червей
Lumbricus terrestris L. (Тиунов и др., 1997). Было показано, что
влияние норы распространяется только на 5-8 мм окружающей
почвы. Это касается как содержания общего азота и углерода,
так и численности и таксономической структуры
бактериального комплекса. В стенках жилых нор было обнаружено в
3,5-10 раз больше бактериальных клеток по прямому
люминесцентному методу и на порядок больше по методу посева, чем на
расстоянии 10 мм от нее. В стенках нежилых нор также
наблюдали превышение плотности бактериальных популяций по
сравнению с фоновой почвой, но несколько меньшее, чем в
варианте с жилыми норами.
Таксономическая структура бактериального сообщества в
стенках нор дождевых червей существенно отличалась от
таковой в контрольной почве. Во все 4 срока отбора образцов (с июня
по сентябрь) наблюдали монодоминантную стабильную
структуру бактериоценоза во внутреннем, примыкающем к просвету
хода слое дрилосферы (Тиунов и др., 1997). В качестве доминанта
фигурировали спириллы (род Aquaspirillum). Вторую, но
значительно меньшую по относительному обилию, группу составляли
цитофаги. По мере удаления от стенки хода червей (на
расстояние 5-10 мм) менялся и состав сообщества: уменьшалась доля
спирилл и цитофаг и увеличивалась доля бацилл, стрептомице-
тов, миксобактерий. Доминирование в дрилосфере спирилл -
типичных гидробионтов и характерных обитателей почв с
избыточным увлажнением, связано с высокой влагоемкостью
выстилающего слоя хода. Средняя гравиметрическая влажность
внутреннего слоя дрилосферы (2 мм) на глубине 5-10 см составляла
в июне более 25% по сравнению с 19% в окружающей почве.
Таким образом, повышенная влажность на стенках ходов червей
благоприятствует размножению влаголюбивых бактерий.
В другой серии экспериментов, целью которых было
выявление влияния обитаемости норы дождевых червей на численность
и состав микробных комплексов (Тиунов и др., 2001), было
показано, что в стенках жилых нор в осенний период доминировали
бактерии родов Cellulomonas и Promicromonospora. Они
составляли более 50% от общего числа таксонов, учитываемых на
используемой среде. В стенках как жилых, так и пустых нор было
зафиксировано также существенное увеличение относительного
обилия бактерий родов Aquaspirillum, Cytophaga и Arthrobacter. В
окружающей почве преобладали представители родов Bacillus
123
и Streptomyces - типичные педобионты, которые часто находятся
в почве в покоящемся состоянии в виде спор и конидий.
Таким образом, спектр доминирующих форм бактерий в дри-
лосфере всегда бывает иной по сравнению с почвой, причем
влияние дрилосферы уже не сказывается на расстоянии более 10 мм
от ходов червей. В стенках нор осенью, когда идет активное
разложение растительного опада, доминируют подстилочные
формы бактерий - целлюломонады, промикромоноспоры, цитофаги,
миксобактерии. Летом из дрилосферы постоянно выделяются
спириллы - индикаторы влажности почвы, которая, как правило,
выше в дрилосфере. Высокая численность целлюлозоразрушаю-
щих бактерий в ходах червей и их копролитах свидетельствует о
том, что активная деструкция растительных остатков происходит
не только в подстилке, но и в многочисленных почвенных локу-
сах, связанных с деятельностью дождевых червей.
Состав бактерий в необитаемых норах значительно
варьировал: посевы из стенок необитаемых нор показали большой
разброс в таксономическом составе бактериальных сообществ.
Возможно, что прекращение деятельности червя ведет к нарушению
обмена между разными участками стенок норы и появлению
локальных вариаций в составе бактериального комплекса. С
помощью методов ординации было продемонстрировано, что посевы
из стенок жилых нор формируют компактный кластер,, что
указывает на однородность бактериального сообщества. Посевы
проб контрольной почвы также близки по составу друг другу,
в то время как образцы из стенок необитаемых нор показали
большой разброс (рис. 3).
Влияние червей на формирование таксономического состава
бактериальных комплексов почв было подтверждено и в
условиях лабораторного эксперимента (Добровольская и др., 1996).
В опытах использовали дождевых червей, относящихся к двум
морфоэкологическим типам: почвенные черви Aporrectodea
caliginosa (Sav.) и почвенно-подстилочные черви Lumbricus rubel-
lus Hoffm. Для интерпретации полученных результатов
необходимо привести методику постановки опыта. В опытных сосудах
с образцами из гор. А1 аллювиально-дерновой пойменной
почвы культивировалось по 5 экземпляров червей одного вида,
контролем служила почва без червей. Опыт проводили в
двукратной повторности. Начало сукцессии было инициировано
увлажнением почвы до 65%. В сосудах поддерживали постоянную
температуру 15 °С. Пробы почвы для проведения
микробиологического анализа отбирали из сосудов на 3-, 5-, 7- и 30-й дни
сукцессии. Посев проводили общепринятым методом посева из
разведений на глюкозо-пептонно-дрожжевую среду.
124
г S*
/
/
/
/
/
L /
Г i
I о
/'""*?X
Контроль^ ^'
i i
Пустая нора ^
^чч
о
* о о D р)
а ,/
—Л '"'
/' Жилая нора
j i i i i i
-6 -4
-2
0 2 4
Функция 1
10
Рис. 3. Положение сапротрофных бактериальных комплексов стенок жилых и
пустых нор дождевого червя Lumbricus terretris и контрольной почвы в осях дис-
криминантного анализа
Каждая точка соответствует результатам одного посева. Эллипсы ограничивают
область 95%-ной вероятности. Пробы взяты на глубине 6-15 см
На протяжении первых двух недель опыта наблюдали как
многократное (в 5-10 раз) увеличение численности бактерий в
почве с червями по сравнению с контрольной почвой (рис. 4), так
и иную динамику таксономического состава бактериальных
сообществ (рис. 5). Если в контрольной почве доминировали грам-
положительные формы бактерий - бациллы и коринеподобные,
то в почве с червями развивались в основном грамотрицательные
бактерии. Чаще других в качестве ассоциированных с червями
прокариот выделялись спириллы, факультативно-анаэробные
бактерии семейств Enterobacteriaceae и Vibrionaceae и миксобакте-
рии. Поскольку известно о преимущественном развитии именно
этих групп бактерий в кишечнике и копролитах червей (Contre-
ras, 1980; Ineson, Anderson, 1985; Byzov et al., 1996),
неудивительно, что они аккумулировались в лабораторном микрокосме
(сосудах с почвой) и выделялись из всей массы почвы, в которой
обитали черви, а не только из дрилосферы, как это было в опытах с
посевами из природной почвы. Спириллы, энтеробактерии и
вибрионы относятся к r-стратегам, которые способны за короткий
период достигнуть высокой численности и осуществить быстрый
захват ресурсов. Они активно заселяют новые, неосвоенные
местообитания, где им не грозит конкуренция со стороны других
организмов (Звягинцев и др., 1993). Доминирование перечисленных
125
Lrubellus Lrubellus
Рис. 4. Численность сапротрофного бактериального комплекса в контрольной
почве и в почве, содержащей дождевых червей (среднее из двух повторностей)
на 3-й (я), 7-й (б), 15-й (в) и 30-й (г) день сукцессии
выше бактерий - r-стратегов в сосудах с червями на ранних
стадиях сукцессии определяется как поступлением в почву с копро-
литами и поверхностными экскретами червей значительного
количества легкодоступных и богатых азотом органических
соединений, так и преимущественным развитием бактерий этих
таксонов в кишечнике и свежих копролитах червей. На 30-й день
опыта различия в таксономическом составе бактериальных
комплексов почв с червями и без червей сглаживаются. Можно
предположить, что по мере развития сукцессии в обоих вариантах почв
происходит вытеснение r-стратегов, обладающих слабой
конкурентной способностью, К-стратегами. В результате
происходит увеличение бактериального разнообразия,
сопровождающееся исчезновением доминантов и выравниванием структуры
сообщества. В этот период из почв выделялись цитофаги, миксо-
бактерии, бациллы, коринеподобные бактерии, актиномицеты
(см. рис. 5).
126
60h
a
Щ
kwv
K.V4V
б
гчЧЧЧл
hwvj
E^2 UZA7
4 EH 9
5
И
г И
1
я ^
Ha.
ш
0
Кччч1
КучуГ
Контроль Axaliginosa Контроль A.caliginosa
Lrubellus Lrubellus
Рис. 5. Таксономический состав сапротрофного бактериального комплекса
в контрольной почве и в почве с дождевыми червями (среднее из двух повтор-
ностей на 3-й (а), 7-й (б), 15-й (в) и 30-й (г) день сукцессии
/ - коринеподобные; 2 - бациллы; 3 - актиномицеты; 4 - энтеробактерии; 5 -
азотобактер; 6 - спириллы, 7 - миксобактерии; 8 - цитофаги; 9 - прочие
Результаты проведенного опыта свидетельствуют о том,
что деятельность дождевых червей оказывает значительное
воздействие на динамику ранних стадий бактериальной
сукцессии в почве, стимулируя развитие протеобактерий с г-типом
стратегии. Этот вывод согласуется с высказыванием одного из
крупных отечественных зоологов И.В. Стебаева, согласно
которому беспозвоночные животные "омолаживают" сукцессию,
возвращая ее на более ранние стадии (Стебаев, 1984).
Как было показано в предыдущих разделах, беспозвоночные
животные, благодаря своим тесным трофическим взаимосвязям с
бактериями, способны оказывать значительное воздействие на
численность и состав бактериальных сообществ почв. Оно
может проявляться разными путями. Во-первых, кишечник почвен-
127
ных сапрофагов представляет своего рода ферментер для
развития многих групп бактерий, которые с экскрементами животных
попадают в почву, где продолжается их дальнейшее
размножение. Во-вторых, сама ткань кишечника представляет собой
специфическое местообитание для факультативно-анаэробных про-
теобактерий, позволяющее им существовать в почвенном ярусе.
В-третьих, почвенные беспозвоночные, особенно черви,
благодаря своей локомоторной деятельности являются векторами
переноса разных форм микроорганизмов по почвенному профилю.
И, наконец, формирование червями дрилосферы - той
специфической зоны, в которой создаются особенно благоприятные
условия для развития бактерий в почве, способствует развитию
в ней особого по составу бактериального сообщества.
Рассмотрим более подробно судьбу бактерий после их
поступления вместе с экскрементами в почву. Необходимо знать, как
долго сохраняются в естественных условиях те изменения в
структуре бактериального сообщества, которые произошли в
результате пассажа субстрата через кишечник сапрофагов. Для этого,
прежде всего, необходимо проследить за жизнедеятельностью
бактерий в экскрементах.
Все исследователи, изучавшие зоомикробные комплексы,
отмечают, что численность бактерий в экскрементах почвенных
беспозвоночных животных превышает таковую в опаде или
почве в 10-100 раз. По некоторым данным (Shaw, Pawluk, 1986)
общее число бактерий и актиномицетов в экскрементах червей
было на 1-3 порядка выше, чем в контрольной почве. При этом
процессы деструкции пищевого субстрата, начавшиеся еще в
кишечнике сапрофагов, продолжают еще более активно
осуществляться в экскрементах. Так, активность целлюлозоразрушающих
бактерий возрастает втрое по сравнению с их активностью в почве
(Козловская, 1976, 1984). Это коррелирует и с увеличением доли
целлюлозоразрушающих бактерий - миксобактерий и цитофаг -
в экскрементах. В копролитах дождевых червей численность
цитофаг составила 106 по сравнению с 102 в контрольной почве.
Эти бактерии были способны гидролизовать не только
целлюлозу (Shaw, Pawluk, 1986), 35% изолятов цитофаг использовали ман-
наны, 55% - гидролизовали грибной агар и хитин.
Следует сказать, что и другие группы бактерий, входящие
в гидролитический блок бактерий - бациллы и актиномицеты -
также постоянно выделялись из экскрементов разных почвенных
сапрофагов. Причем, спорообразующие бактерии, численность
которых в 5 раз превышала таковую в почвах, находились в
экскрементах в вегетативной форме, что свидетельствует об их
активной жизнедеятельности в этих локусах (Козловская, 1985).
128
Все это согласуется с предположениями о том, что в
экскрементах беспозвоночных размножаются многочисленные
"подстилочные" бактерии, а не специфические симбионты кишечника
(Anderson, Bignel, 1980; Chu et al., 1987). Однако соотношение
бактериальных группировок в экскрементах не постоянно и резко
изменяется в зависимости от типа субстрата, которым питаются
животные (состав подстилки или почвы), и их "возраста".
Сравнение таксономического состава бактериальных
комплексов в "свежих" и хранящихся при разных условиях
экскрементах диплопод позволило выявить резкие изменения в их
составе (Черняковская, 1995). В "свежих" экскрементах
присутствовали все группы бактерий, т.е. те, которые выделялись как из
подстилки, так и из стенок и содержимого кишечника. При этом
доминировали бактерии гидролитического комплекса: актино-
мицеты составляли 40%, коринеформные - 20, бациллы - 10,
аэробные и факультативно-анаэробные протеобактерии - 20%.
При выдерживании экскрементов диплопод в стерильных
условиях во влажной камере в течение 5 суток наблюдали активный
рост аэробных протеобактерии, составивших около 80% от
всего бактериального блока. При высушивании экскрементов
диплопод на воздухе получали иную картину: доминирование
устойчивых к высушиванию бацилл, миксобактерий, коринеформных
бактерий. Таким образом, формирование и динамика
бактериального сообщества экскрементов во многом зависят от тех
условий, которые складываются после поступления экскрементов
в почву.
Жизнедеятельность дождевых червей стимулирует и процесс
нитрификации: численность нитрифицирующих бактерий
увеличивается в их экскрементах в 10-100 раз, что связано с
накоплением аммиачного азота в этих микролокусах (Козловская, 1984).
Высоким оказалось и количество анаэробных бактерий: в копро-
литах червей Octolasion tyrtaeum и Aporrectodea turgida оно
составило 106 по сравнению с 102 в почве, причем уровень плотности
анаэробов был один и тот же независимо от типа почвы (Shaw,
Pawluk, 1986). Авторы делают выводы о влиянии
червей-геофагов на численность анаэробов в копролитах, а следовательно, и
в почве.
Существует много общего между деструкцией подстилки
жвачными животными и земляными червями. Те благоприятные
физико-химические условия, которые складываются для
развития микроорганизмов в экскрементах жвачных животных,
создаются и в копролитах червей (Parle, 1963). Общие черты
микробиологической картины экскрементов жвачных и дождевых
червей: обогащение экскрементов бактериями, актиномицетами,
129
увеличение доли цитофаг и анаэробных бактерий (Shaw and
Pawluk, 1986).
Обогащенные микроорганизмами экскременты, находясь в
почве, становятся центрами биохимических превращений, где
процессы разложения органического вещества сопровождаются
синтезом гуминовых веществ. Значительное увеличение
количества гумусовых кислот и особенно фракций, связанных с
кальцием, происходит при переработке экскрементов диплопод
дождевыми червями. В экскрементах 1-месячного срока количество
энзимов в несколько раз превосходило таковое в почве,
происходило и накопление витаминов группы В. Анализ 20-дневных
экскрементов диплопод, соприкасавшихся и не соприкасавшихся с
почвой, показал, что при контакте с почвой состав
бактериальных комплексов становится более разнообразным, при этом
особенно интенсифицируется процесс разложения клетчатки и
пектина (Козловская, 1976).
Несмотря на множество примеров, приводимых для
подтверждения значительного влияния почвенных беспозвоночных
животных на таксономический состав и функции бактериальных
комплексов почв, пока невозможно ответить на вопрос: в какой
степени проявляется влияние локально сформированных
сообществ на почвенное микробное сообщество в целом?
Существуют некоторые косвенные данные, свидетельствующие о таком
влиянии. Во-первых, в бактериальном сообществе
ферментативного слоя лесной подстилки, который в значительной степени
сформирован из экскрементов беспозвоночных, доминируют те
же бактерии, что и в свежих экскрементах (Третьякова и др.,
1996, Byzov et al., 1996). Во-вторых, учитывая, что за год в
поверхностных слоях гумусового горизонта пастбищ и
естественных травянистых фитоценозов образуется слой копролитов в
Ъ-4 мм (Lee, 1985), который, можно предположить, играет
особую роль в формировании почвенных бактериальных сообществ
и их жизнедеятельности.
Роль беспозвоночных животных в концентрации микробной
жизни возрастает в пессимальных условиях. Так, под моховой
дерниной тундровых почв в слое 0-6 см, где сконцентрированы
все экскременты животных, сосредоточено 90% всех почвенных
бактерий (Стебаев, 1958). По ходам червей в пределах
почвенного профиля происходит перемещение бактерий самых
разнообразных таксонов. Эта векторная роль червей начинает
использоваться в прикладных аспектах. Так, симбионтные азотфиксирую-
щие бактерии Rhizobium trifolii вносили в экскременты червей,
которые затем помещали в почву. Одновременно запускались и
черви. Оказалось, что число корневых клубеньков на корнях
130
клевера возрастало в 5 раз в присутствии дождевых червей, чем
без них. Присутствие дождевых червей повышало также массу
корней на 20-30%, вес надземных органов на 125%, содержание
азота в листьях на 5-25%. При размещении экскрементов червей
на поверхности почвы без внесения самих червей все
приведенные показатели были значительно меньше (Doube et al., 1994).
Способность беспозвоночных животных перемещать
значительную бактериальную биомассу в пространстве может быть
использована в будущем для обогащения почвы полезными
микроорганизмами - как стимуляторами роста растений, так и
антагонистами фитопатогенных бактерий. Уже появились публикации
(Bernard et al., 1994), в которых анализируются взаимоотношения
между земляными червями, полезными почвенными
микроорганизмами и корневыми патогенами.
2.4. СТРУКТУРА БАКТЕРИАЛЬНЫХ
КОМПЛЕКСОВ ПОЧВ
О показателях структуры бактериальных сообществ.
Прежде, чем переходить к характеристике бактериальных комплексов
почв в целом, следует рассмотреть вопрос об экологических
показателях, используемых для оценки структуры бактериальных
сообществ и бактериального разнообразия.
В современной экологии хорошо известен ряд общих
закономерностей формирования структуры сообществ. Для их изучения
используется ряд абстрактных понятий и математических
методов, из которых наиболее популярны концепция
информационного разнообразия, анализ параметрических распределений
относительного обилия видов, количественная оценка
структурного сходства сообществ. Исследования структуры микробных
сообществ значительно отстают по уровню теоретических
заключений и носят в основном описательный характер. В
микробиологии исследования синэкологического направления очень редки
(Чернов, 1985, 1997) и осложнены целым рядом методических
трудностей, связанных, прежде всего, с необходимостью
разработки сред и методов учета, выделения и идентификации
микроорганизмов, причем разных для каждой таксономической
группы. Особенно трудно изучать структуру прокариотных
комплексов. Современная идентификация бактерий основывается на
использовании трудоемких молекулярно-биологических и
биохимических методов, малопригодных для экологических
исследований, требующих массовых определений. Кроме того, сама
концепция вида у прокариот недостаточно разработана. Поэтому
131
разнообразие бактерий традиционно оценивали на уровне таксо-
номически гетерогенных физиологических групп, таких, как ам-
монификаторы, нитрификаторы, целлюлозоразрушающие и т.п.
Однако подобные группы представляют собой обязательные
функциональные блоки любой зрелой экосистемы и,
следовательно, мало пригодны для сравнительного анализа
разнообразия микробных сообществ.
В наших исследованиях в качестве модельной группы был
выбран комплекс эпифитно-сапротрофных аэробных и
факультативно-анаэробных бактерий, включающий представителей
примерно 50 родов, потенциально способных к росту на специально
разработанной среде (Добровольская и др., 1989). Объектами
исследований служили образцы различных субстратов, взятых с
учетом вертикальной структуры биогеоценоза и содержащие
различные части растений, подстилку и почвенные горизонты.
Представленные ниже данные - попытка сравнения в
терминах общей синэкологии различных показателей структуры
бактериальных комплексов, рассматриваемых в масштабе всего
биогеоценоза. Для сравнения мы выбрали два наиболее
контрастных типа экосистем: болота и пустыни, для которых следует
ожидать и максимально возможных различий в структуре их про-
кариотного населения. Сравнительный анализ полученных
данных может дать представление о том, какие показатели
структуры бактериальных комплексов являются наиболее
консервативными, а какие следует в первую очередь использовать в
диагностических и типологических целях.
Исследования проводили в течение 1988-1994 гг. в азиатских
субтропических пустынях (Пустынная станция Ботанического
института Узбекской АН, Бухарская обл., Узбекистан;
заповедник "Репетек", Чарджоуская обл., Туркмения; Кибуц Седе-Бо-
кер, Израиль) и болотах хвойно-широколиственных лесов
Русской равнины (Западно-Двинский стационар, Тверская обл.,
Россия). В наиболее типичных для каждого района биотопах
отбирали образцы субстратов, которые могут быть расположены в
виде следующего пространственно-сукцессионного ряда: живые
части растений - сухие части растений - опад или подстилка -
почвенные горизонты. Образцы отбирали в различные сезоны года
в течение нескольких лет.
Для выделения бактерий эпифитно-сапротрофного
комплекса использовали стандартную среду, содержащую глюкозу,
пептон, гидролизат казеина и дрожжевой экстракт (Добровольская
и др., 1989). Характеристика биотопов, субстратов, методов
учета и идентификации бактерий приведены нами ранее (Методы ...,
1991; Головченко и др., 1993; Добровольская и др., 1994).
132
Общая численность бактерий на глюкозо-пептонно-дрожже-
вой среде, выраженная в КОЕ/г субстрата, представляет один из
наиболее консервативных показателей. Широкие колебания
общей численности между отдельными образцами в пределах
ЮМО10 КОЕ/г носили случайный характер и практически не
зависели от географического района, типа биотопа и времени
взятия образцов. Единственным фактором, оказывающим
достоверное, хотя и слабое (не более 20%) влияние на численность
бактерий, является тип субстрата (части растения, опад, корни или
минеральные горизонты почв), т.е. его физико-химические
особенности и положение в ярусной структуре биогеоценоза. Средние
значения общей численности бактерий в обоих типах экосистем
были несколько выше в разлагающихся растительных остатках
(опад, подстилка, мертвые части мхов), чем на живых частях
растений и в почве.
Далее будут последовательно проанализированы все
используемые нами экологические показатели, позволяющие
охарактеризовать структуру бактериальных сообществ.
Из-за исключительной вагильности микроорганизмов
различиям в таксономическом составе бактериальных комплексов
вряд ли можно придавать такое же значение, какое придается
сравнительным анализам таксономических списков, например в
геоботанике. Если практически полные таксономические
списки растительности или животного населения отдаленных
географических районов могут почти не иметь общих видов, то,
исходя из классического постулата Бейеринка "все есть всюду, но
среда отбирает", можно ожидать, что полные таксономические
списки группы определяемых одним методом бактерий в
различных географических точках должны быть сходными, а все
различия обусловлены просто недоучетом малочисленных
таксонов. Из-за методических особенностей учета и невозможности
визуального контроля при таксономическом анализе
микробных сообществ всегда будут оставаться сомнения в полноте
таксономических списков. С этих позиций более корректно было
бы сравнивать не полученные "полные" таксономические
списки бактерий, а списки только тех таксонов, обилие которых
превышает некоторый условно установленный уровень.
Проанализировав достаточно большое количество образцов
различных субстратов, мы выявили в каждом образце доминирующие
роды, относительное обилие которых превышало 30% от общей
численности всех бактерий в образце, и составили списки таких
потенциальных доминантов для бактериальных комплексов
болот и пустынь (табл. 2). Количество потенциальных доминантов
в болотах и пустынях примерно одинаково, но их состав принци-
133
Таблица 2
Спектры потенциальных доминантов в сообществах бактерий
Группы бактерий
Болота
Пустыни
Протеобактерии
Enterobacteriaceae
Vibrionaceae
Spirillaceae
Скользящие бактерии
Актинобактерии
Enterobacter
Klebsiella
Proteus
Aeromonas
Plesiomonas
Vibrio
Aquaspirillum
Flavobacterium-
Cytophaga
Streptomyces
Flavobacterium-
Cytophaga
Myxobacterales
Arthrobacter
Cellulomonas
Clavibacter
Geodermatophilus
Micrococcus
Rhodococcus
Streptomyces
пиально отличается. Мы считаем спектр потенциальных
доминантов одним из наиболее репрезентативных показателей
таксономической структуры микробных комплексов, отражающим
климатические и географические особенности исследуемой
экосистемы (Чернов, 1993). Важно, что его определение не очень
трудоемко, так как включает идентификацию только
доминирующих форм.
Общее количество выделенных таксонов приблизительно
одинаково в обоих типах экосистем и составляет около 20 родов
бактерий. Примерно одинакова и видовая насыщенность
отдельных группировок: в среднем в посевах из одного образца и в
пустынях и в болотах обнаруживалось от 4 до 5 бактериальных
таксонов. Средняя величина инвентаризационного разнообразия
бактериальных группировок в отдельных образцах различных
субстратов, рассчитанного на основании оценок относительного
обилия таксонов, несколько выше в пустынных сообществах,
однако это различие недостоверно. В обоих типах экосистем
значения индекса Шеннона при очень широких случайных колебаниях
были несколько выше в подстилке и других разлагающихся
остатках, чем в почве и на растениях. Другими словами, сравнивае-
134
Рис. 6. Главные компоненты
варьирования таксономической
структуры группировок бактерий на
различных субстратах в болотных
(а) и пустынных (б) экосистемах
мые типы экосистем очень
слабо различаются по
уровню инвентаризационного
разнообразия бактерий, т.е.
разнообразия,
определяемого количеством
обнаруживаемых данным методом
таксонов и их относительным
обилием.
Совершенно иная
картина возникает при анализе
дифференцирующего
разнообразия, отражающего
разнородность отдельных
группировок бактерий по их
таксономической структуре.
Ординация всех
проанализированных образцов по
таксономической структуре
бактериальных группировок,
например методом анализа
главных компонент (рис. 6), показывает, что в болотных
экосистемах подавляющее число группировок очень близки друг другу
и образуют один довольно компактный кластер, из которого
значительно выделяются лишь единичные образцы. В пустынях,
напротив, бактериальные группировки значительно более
"индивидуальны" по таксономической структуре, т.е. среди них можно
выделять значительно большее количество типов. Эта же
ситуация может быть отражена с помощью используемых в синэколо-
гии индексов ^-разнообразия.
Дифференцирующее Р-разнообразие оказывается более
мобильным показателем, чем инвентаризационное, даже при
статистической оценке последнего. Эту особенность следует
учитывать в прикладных исследованиях, например, при оценке влияния
стрессовых факторов на структуру микробных сообществ.
Существенные различия в структуре бактериальных
комплексов пустынных и болотных экосистем обнаруживаются при
анализе их ярусной дифференциации, которую можно рассмат-
1,2
0,8
0,4
0
-0,4
-0,8
-1,2
1,2-0,8-0,4 0
б
0,4 0,8 1,2
1,2
0,8
0,4
0
-0,4 |-
-0,8
-1,2
о
-1,2-0,8-0,4 0 0,4 0,8 1,2
Фактор 1
135
ривать как частное проявление дифференцирующего
разнообразия. Наиболее наглядно ярусная структура бактериальных
сообществ видна при сравнении вероятностей относительного
доминирования различных таксономических групп бактерий в
ряду: надземные части растений-опад-нижние горизонты почв.
Вероятности доминирования определяли как долю образцов,
в которых относительное обилие данной таксономической
группы превышало 30% от общего числа проанализированных
образцов.
Бактериальные сообщества пустынных экосистем имеют
хорошо выраженную ярусную структуру, которая проявляется в
смене таксономического состава бактерий в вертикальном про-
странственно-сукцессионном ряду: на надземных частях
пустынных растений наиболее обильны скользящие бактерии,
микрококки, в пустыне Негев еще и флавобактерии. В наземном ярусе
(в опаде, мхах, растительных остатках) спектр доминирующих
групп шире и включает, кроме вышеперечисленных,
представителей рода Clavibacter и различных грамотрицательных
бактерий. В минеральных почвенных горизонтах серо-бурых
пустынных почв доминируют в основном спороактиномицеты и корине-
подобные бактерии из рода Arthrobacter, значительно реже -
бациллы. В болотах во всех ярусах резко преобладают
представители одних и тех же групп, в основном спирилл и
факультативно-анаэробных протеобактерий, таким образом, ярусная
дифференциация бактериальных сообществ здесь практически
отсутствует. Эти различия можно также интерпретировать как
проявление различных типов пространственной организации
бактериальных сообществ: дискретного - в пустынях и
континуального - в болотных экосистемах.
Экологическая структура бактериальных комплексов болот
и пустынь особенно показательна и требует более детального
обсуждения. В общем, состав жизненных форм и эколого-трофиче-
ских групп бактерий связан с их таксономическим составом. Все
представители преобладающих в болотных экосистемах
протеобактерий (кроме скользящих бактерий) относятся к группам
копиотрофов и олиготрофов. Среди характерных для пустынь
актинобактерий преобладают гидролитики. Известно, что в
пустынях происходит быстрая минерализация растительного опада,
чему благоприятствует и высокая численность бактерий-гидро-
литиков. В болотных экосистемах замедленные процессы
деструкции коррелируют с низкой долей гидролитиков, особенно в
верховых болотах.
Различия в таксономическом составе бактериальных
комплексов наглядно отражает такой показатель, как отношение числа
136
грамположительных и грамотрицательных бактерий, или, иначе,
актино- и протеобактерий. Этот индекс диаметрально
противоположный в пустынных и болотных экосистемах (табл. 3). Среди
идентифицированных штаммов, выделенных из различных
субстратов в болотных сообществах, наиболее широко
представлены различные протеобактерий: спириллы, вибрионы, энтеробак-
терии. В пустынях преобладали актинобактерии: микрококки,
коринеподобные бактерии, спороактиномицеты.
Анализ морфологических и культурально-физиологических
особенностей доминирующих бактерий позволил выявить целый
ряд признаков, которые можно рассматривать в качестве
адаптивных. Так, доминирующие в болотных экосистемах бактерии
характеризуются простым жизненным циклом, подвижностью,
многие из них приспособлены к пониженному содержанию
кислорода, апигментные, неустойчивые к высушиванию, с низким
содержанием ГЦ в ДНК (40-50%). У бактерий, преобладающих
в пустынях, в условиях дефицита влаги, обнаруживаются
противоположные свойства. Для них характерны тенденция к мицели-
альной организации, типичной для твердофазного субстрата,
наличие сложного цикла развития с образованием агрегатов,
покрытых слизистой капсулой, или плодовых тел, синтез кароти-
ноидных и меланоидных пигментов. Все актинобактерии
представляют собой довольно монолитную группу с высоким
содержанием ГЦ в ДНК (60-75%).
Напрашивается вывод о том, что болотные и пустынные
экосистемы можно рассматривать как системы, отражающие
ступени эволюции микробного мира при переходе от водного к
наземному образу жизни. Согласно гипотезе Г. А. Заварзина (1989),
самые древние из амфибиальных ландшафтов - это прибрежные
цианобактериальные маты докембрия, в которых были
обнаружены в качестве постоянных симбионтов протеобактерий, т.е.
группа, которая и сейчас доминирует в современных
амфибиальных экосистемах. Актиномицеты, так же как и грибы, с их мице-
лиальной организацией, являются континентальной ветвью
микроорганизмов, сыгравшей особую роль при выходе жизни на
сушу (Калакуцкий, Агре, 1977). Вступая в мутуалистические
взаимоотношения в виде лишайников, актинолишайников,
различных микориз, они облегчили условия для развития наземной
растительности. Пустыни являются примером ландшафтов, где
адаптация организмов к условиям суши выражена наиболее
резко. Бактерии актиномицетной линии служат примером
приспособления к наземному существованию на прокариотном уровне.
Микробиологи еще очень далеки от теоретических
обобщений, касающихся классификации микробных сообществ. Для
137
Таблица 3
Показатели структуры бактериальных сообществ болот и пустынь
Показатель
Численность бактерий
(КОЕ/г)
среднее
пределы колебаний
Тип пространственной
организации
Болота
Общее обилие
1,9 • 108
4,0 102-2,6 109
Континуальный
Пустыни
2,6 • 108
1,9- lO4-^- 1010
Дискретный
Таксономическая структура
Число обнаруженных
таксонов
Среднее количество таксонов
в образце
а-разнообразие (индекс
Шеннона)
среднее
пределы колебаний
Р-разнообразие (индекс Уил-
сона и Шмиды)
Число потенциальных доми-
нантов
Грамположительные бакте-
рии/Грамотрицательные
бактерии
22
4,6
1,13
0-2,67
0,2
10
2,5/1
Экологическая структура
Доминирующие трофические
группы
Доля гидролитиков
Копиотрофы
5-20%
18
4,4
1,69
0,14-2,81
0,8
11
1/2
Гидролитики
70%
Типичные адаптивные признаки популяций
Жизненный цикл
Морфологическая
дифференциация (мицелий, плодовые
тела)
Подвижность
Пигментация
Устойчивость к высушиванию
Нуклеотидный состав ДНК
Тип стратегии
Простой
Редко
Подвижные
(жгутики)
Апигментные
Нет
АТ-тип
г
Сложный
Часто
Неподвижные
Ярко
пигментированные
Устойчивы
ГЦ-тип
К
138
прогресса в этой области необходимы не только новые методы
учета и идентификации микроорганизмов, но и новые подходы,
сближающие микробную экологию с современной синэкологией
растений и животных. Необходимо развитие методов
сравнительного анализа структуры микробных сообществ на разных
иерархических уровнях: почвенные микро- и мезолокусы,
горизонты, ярус, биогеоценоз, природно-климатическая зона. В ряде
предыдущих работ мы продемонстрировали возможность син-
экологического анализа бактериальных комплексов на уровне
всего биогеоценоза (Головченко и др., 1993; Добровольская и др.,
1994; Черняковская и др., 1990). Неизбежен также переход от
чисто описательных сравнений к изучению абстрагируемых
количественных показателей структуры микробных сообществ:
оценкам уровня разнообразия, степени пространственной
дифференциации. Мы попытались сделать первые шаги в этом
направлении, выбрав для исследования достаточно однородную
модельную группу микроорганизмов и наиболее контрастные типы
сравниваемых экосистем.
Данные, суммированные в табл. 3, показывают, что
различные показатели структуры бактериальных комплексов,
рассматриваемых в масштабе всего биогеоценоза, имеют неодинаковое
значение. Наименее изменчивы валовые и усредненные
показатели: уровень общей численности, видовая насыщенность и
общее обилие таксонов, инвентаризационное разнообразие.
Наиболее изменчивыми и информативными являются показатели,
характеризующие иерархическую и синтипологическую структуру
бактериальных сообществ: спектры потенциальных доминантов,
уровень дифференцирующего разнообразия, характер ярусной
структуры, соотношения экологических групп. Именно эти
параметры и определяют те особенности микробных сообществ,
которые отражают и характеризуют тип экосистемы.
2.4.1. СТРУКТУРА БАКТЕРИАЛЬНЫХ КОМПЛЕКСОВ
ПОЧВ АРИДНЫХ ЛАНДШАФТОВ
В предыдущих разделах мы сравнивали бактериальные
сообщества двух контрастных типов экосистем - болотных и
пустынных, охарактеризовав их на основании различных синэко-
логических показателей и отобрав наиболее значимые из них.
В настоящем и последующих разделах предполагается более
детально описать структуру бактериальных комплексов в
различных типах биогеоценозов (БГЦ) в пределах каждой из
рассматриваемых контрастных типов биомов - пустыни и
таежные леса.
139
В каждом районе для исследования выбирали наиболее
распространенные типы биотопов. Их подробное описание дано в
публикациях (Добровольская и др., 1994, 1999). Ниже приводится
краткая характеристика биотопов.
Пустыня Кызылкум:
- солянково-полынная глинистая пустыня с доминированием
кустарников Artemisia turanica и Salsola arbuscula. Почвы
серо-бурые пустынные легкосуглинистые, с глубины 30-40 см
подстилаемые гипсом;
- солянковая глинистая пустыня с преобладанием S. arbuscula
и S. gemmascens на супесчаных серо-бурых пустынных почвах;
- закрепленные мелкобугристые пески с кандымово-осоко-
вой растительностью с преобладанием Calligonum microcarpum.
Пустыня Каракумы:
- песчаная пустыня на закрепленных барханных песках под
смешанным саксаульником.
Пустыня Негев:
- глинисто-каменистая пустыня с парнолистниковой
растительностью {Zygophillum dumosum) на примитивных
сильнокаменистых почвах;
- вади - специфические биотопы с богатой кустарниковой
растительностью, формирующиеся вдоль русел временных
водотоков на периодически увлажняемых слоистых аллювиальных
песчаных почвах.
И в среднеазиатских пустынях, и в пустыне Негев были
исследованы варианты как глинистых, так и песчаных пустынь.
В дальнейшем принадлежность биотопа к одному из этих типов
рассматривается в качестве градаций фактора "тип биотопа".
В каждом биотопе на участке примерно 10 х Юм отбирали
средние образцы следующих субстратов (в дальнейшем
рассматриваются как градации фактора "тип субстрата"): 1) зеленые ве-
гетирующие части растений; 2) сухие надземные части растений;
3) опавшие части растений, обычно образующие фрагментарную
подстилку у оснований кустов; 4) корни; 5) почва из различных
минеральных горизонтов до глубины 30-40 см. Эти субстраты
можно также рассматривать как пространственно-сукцессион-
ный ряд, соответствующий стадиям разложения растительных
остатков, а также интерпретировать как элементы ярусного
сложения биогеоценоза.
Распределение общей численности бактерий во всех типах
субстратов (как на растениях, так и в опаде и в минеральных
почвенных горизонтах) вполне удовлетворительно описывается
нормальным законом (рис. 7), что делает корректным применение
методов параметрической статистики для сравнительного анали-
140
#
I
О
ев
2
I
О
а
3456789 10 И
Логарифм общей численности бактерий (КОЕ / г)
Рис. 7. Характер распределения общей численности бактерий в субстратах
различных типов
а - надземные части растений; б - опад и корка почвы; в - минеральные горизонты
почв. Плавная линия - аппроксимация нормальным распределением
за структуры комплексов сапротрофных бактерий во всех типах
субстратов.
Общая численность бактерий, измеренная методом посева,
колебалась в широких пределах. Максимальные значения
численности бактерий, превышающие 2 • 10ю КОЕ/г, обнаружены
в опаде ксерофильных кустарников Moricandia nitens и Salvia
lanigera в пустыне Негев, минимальные (< 104 КОЕ/г) - в
гипсовом горизонте серо-бурой пустынной почвы на глубине > 30 см.
Рассмотрим влияние факторов: тип пустыни, тип биотопа,
тип субстрата, сезон сбора - на общую численность
сапротрофных бактерий. Большое количество проанализированных
образцов позволило составить две полные схемы трехфакторного
дисперсионного анализа. Как и следовало ожидать, наиболее силь-
141
ная зависимость обнаружена между уровнем общей плотности
бактерий, с одной стороны, и характером субстрата и
положением его в пространственно-сукцессионном ряду от живых частей
растений до минеральных горизонтов почв, с другой. Однако
более интересна достоверная связь средней численности бактерий
во всех субстратах и типа пустыни: в пустыне Негев средняя
численность бактерий была достоверно выше, чем в пустынях
Средней Азии. Это же было обнаружено ранее для дрожжевых
грибов - их численность на растительных субстратах в осенний
период также была достоверно выше в пустыне Негев по
сравнению с пустынями Каракумы, Кызылкум и предгорьями Копет-
Дага (Babjeva, Chernov, 1995). Наряду с другими факторами,
выявленные различия могут быть связаны с климатическими
особенностями пустыни Негев. В любом случае полученные
результаты показывают, что даже такой параметр, как уровень средней
плотности бактерий, достаточно приближенно измеренный
методом посева, может служить критерием географических
различий.
Довольно неожиданной оказалась очень слабая и
малодостоверная связь численности бактерий и сезона сбора образцов,
которую удалось количественно оценить для пустыни Кызылкум.
Ожидаемого заметного увеличения численности бактерий в
весенний период, наиболее влажный и активный период в пустыне,
не обнаружено. По-видимому, общий пул бактерий остается в
целом достаточно постоянным, а меняется лишь его активная
часть. Не обнаружена также какая-либо связь между средним
уровнем численности бактерий и характером биотопа.
Среди субстратов пространственно-сукцессионного ряда
максимальная численность бактерий (в среднем 109 КОЕ/г в
среднеазиатских пустынях и 1010 КОЕ/г в пустыне Негев) была
характерна для опада пустынных растений, включающего в основном
остатки листьев и ветвей кустарников, а также остатки
эфемеров. Концентрация бактерий на надземных мертвых частях
растений была в среднем на 1-2 порядка ниже, и еще ниже на живых
частях растений. Численность бактерий также закономерно
снижалась по профилю почв (в песчаных пустынных более резко,
чем в суглинистых серо-бурых пустынных) и на глубине 30-40 см
составляла не более 104 КОЕ/г (см. рис. 7).
Горизонтальная неоднородность в распределении бактерий в
основном определялась фито- и зоогенным влиянием. Наиболее
четко это влияние прослеживалось для верхних слоев почв,
особенно коркового горизонта серо-бурых пустынных почв.
Концентрация бактерий в верхнем 5-сантиметровом слое почвы
была существенно выше вблизи кустарников (3,6 • 107-5 • 106) и под
142
Таблица 4
Таксономические группы бактерий, выделенных из субстратов
субтропических пустынь, и показатели их относительного обилия
Группа
Cellulomanas,
Curtobacterium
Micrococcus, Kocuria,
Rhodococcus
Myxobacterales
Streptomyces
Arthrobacter
Clavibacter
Methylobacterium
Geodermatophilus-
Blastococcus
Bacillus
Flavobacterium
Актинобактерии
Протеобактерии
Встречаемость, %
71,8
69,4
64,5
50,0
45,2
23,4
21,8
17,7
16,1
12,9
97,6
83,0
Средняя доля от
общей
численности, %
9,2
11,7
14,7
13,5
10,6
2,7
1,4
1,0
1,2
3,5
50,5
24,8
* Отношение числа образцов, в которых группа составляла
Веро
ятность до-
минирования , %
7,3
10,5
17,7
16,9
15,3
2,4
0,8
0,0
0,8
4,8
68,5
37,0
более 30% общей
численности бактерий, к общему числу проанализированных образцов.
разрастаниями эфемеров (9,8 • 106-3,0 • 106), чем на голых
участках (2,8 ¦ 106-1,3- 106).
Численность бактерий в верхних горизонтах почв
существенно повышалась также в специфических зоогенных локусах,
связанных с деятельностью беспозвоночных. Например, в колониях
муравьев-жнецов, в ходах термитов, в инкрустированных в почве
остатках помета животных концентрация бактерий, как правило,
на два порядка превышала значения "фоновой" почвы, взятой на
некотором расстоянии от этих локусов.
Всего в ходе работы идентифицировано 20 фенотипических
(таксономических) групп, состоящих, в основном, из бактерий
одного рода. Для бактерий тех групп родов, которые можно
вычленить из общего массива по фенотипическим характеристикам,
были определены основные синэкологические показатели
(табл. 4). На основании этих показателей выделенные группы
бактерий можно разбить на две категории:
1) бактерии с высокой встречаемостью (45-70%) и высоким
средним обилием (10-15%): группы желтопигментированных
коринеформных бактерий (преимущественно представители ро-
143
дов Cellulomonas и Curtobacterium), мицелиальных актиномице-
тов {Streptomyces sp.) и кокковидных организмов
(преимущественно Micrococcus и Kocuria), относящихся к порядку Actinomy-
cetales, а также представители порядка Myxobacterales (протео-
бактерии);
2) бактерии, встречаемость которых в разных субстратах
составляет в среднем 15-23%, а средняя доля от общей
численности - не более 3%. Это розовоокрашенные организмы родов
Clavibacter, комплекса Geodermatophilus-Blastococcus (актиноба-
ктерии), а также Flavobacterium и Methylobacterium (протеобак-
терии).
Отметим, что бактерии первой категории довольно широко
распространены и в других типах биомов, в то время как
известные представители родов Clavibacter и комплекса
Geodermatophilus-Blastococcus были изолированы ранее преимущественно
из пустынных биотопов.
Бактериальные сообщества пустынь характеризуются в
целом высоким относительным обилием бактерий актиномицетной
линии. Хотя встречаемость, рассчитанная по всем
проанализированным образцам, достаточно высока как для актино-, так и для
протеобактерий, взятых в сумме, средняя доля от общей
численности и вероятность доминирования вдвое выше для актинобак-
терий, чем для протеобактерий.
Среднее информационное разнообразие в группировках
бактерий, оцененное с помощью индекса Шеннона, постепенно
снижалось в пространственно-сукцессионном ряду от 2,5 на свежих
растительных субстратах до 1 в почве. Неслучайность
относительных обилий рассматриваемых групп бактерий,
определенных по соотношению колоний в посевах, подтверждается
достаточно закономерным уменьшением показателя их выравненно-
сти (индекса Пиелу) по профилю почвы (рис. 8), другими
словами, в нижней части профиля более выражено доминирование
представителей 1-3-й рассматриваемых групп. В подавляющем
числе почвенных образцов - это апигментные представители
родов Arthrobacter, Rhodococcus и близких организмов (Gordonaf
Dietzia), а также рода Streptomyces. В надземной части простран-
ственно-сукцессионного ряда - от живых частей растений до
подстилки - выравненность более высокая и доминирование
отдельных групп менее выражено.
Сравнение таксономической структуры бактериальных
сообществ на надземных (живые и сухие части растений,
растительный опад) и подземных (корни и минеральные горизонты почв)
субстратах обнаружило их существенное различие (рис. 9). В
надземном ярусе преобладали актинобактерии родов Micrococcus,
144
Индекс Пиелу
О 0,2 0,4 0,6 0,8
ений
ed
Си
I
V
S
ed"
S
vo
Ё?
cd"
9
О
Живые
Сухие
Опад
0-1
1-5
5-10
10-20
20-30
>30
Рис. 8. Распределение средней выравненное™ относительного обилия (индекс
Пиелу) по ярусам пустынных биогеоценозов:
/ - Кызылкум, 2 - Негев
Clavibacter, Cellulomonas, Geodermatophilus, Promicromonospora,
большинство которых пигментированные, а также протеобакте-
рии из группы миксобактерий. В надземном ярусе
среднеазиатских пустынь среди протеобактерий были также обильны мети-
лобактерии, а в пустыни Негев - флавобактерии. В подземном
же ярусе среди актинобактерий в большинстве случаев
обнаруживались апигментные бактерии рода Arthrobacter, бациллы и
стрептомицеты, а среди протеобактерий - миксобактерий, цито-
фаги и различные апигментные формы, не поддающиеся фено-
типической идентификации.
Характерно высокое обилие на корнях пустынных растений
целлюлозоразрушающих бактерий, осуществляющих
разложение отмирающих корешков (целлюломонад, скользящих
бактерий, актинобактерий рода Promicromonospora). На корнях были
обильны также грамотрицательные подвижные протеобактерий,
характерные для прикорневой зоны растений и почв гумидного
климата (роды Aquaspirillwn, Pseudomonas, Enterohacter), которые
не встречались в других субстратах пустынь. Таким образом, над-
145
PQ
100
80
60
40
20
0
20
40
60
80
100
100 г
80
60Н
40 Н
20 Н
О
20
40
60
80
100
1
1 1 1 1 1
2
1 1 1 1 J
У
1
!
ы
I
п
N
1
1
б
1
n
Era
ЯТ5Ш
1 2 3
ч
4 5 б 7 8 9 10 11 12
Рис. 9. Сравнение родов бактерий по встречаемости на растительных остатках
и в минеральных горизонтах почв (а), на надземных частях и корнях
растений (б):
Субстраты: I - надземные; // - подземные. Бактерии: 1 - Methylobacterium;
2 - Myxobacterales; 3 - апигментные протеобактерии, 4 - Micrococcus; 5 - Clavibacter;
6 - Cellulomonas; 7 - Geodermatophilus; 8 - Promicromonospora; 9 - Rhodococcus; 10 -
Bacillus; 11 - Arthrobacter и Nocardioides; 12 - Streptomyces
земный и подземный ярусы пустынь четко различаются по
набору и встречаемости бактериальных таксонов.
На основании данных об относительном обилии, пигментации
и приуроченности к определенным субстратам все выделенные
бактерии были разбиты на 5 групп (табл. 5). Две пигментные
группы актинобактерий и одна группа протеобактерии -
характерны для надземных частей растений и опада, где их доля может
составлять 60%. В почвенном ярусе, включая корни пустынных
растений, корку почвы и более глубокие почвенные горизонты,
146
Таблица 5
Эколого-таксономические группы бактерий в субтропических пустынях
Номер
группы
Состав группы
Основные местообитания
1 Розово-красно-оранжевые актино-
бактерии: Rhodococcus,
Geodermatophilus, Clavibacter
2 Желтопигментные актинобактерии:
Cellulomonas, Promicromonospora
3 Апигментные актинобактерии:
Arthrobacter, Nocardioides, Streptomyses
4 Розово-оранжевые протеобактерии:
Methylobacterium, Azospirillum,
Flavobacterium, Cytophaga,
Myxobacterales
5 Апигментные протеобактерии:
Alcaligenes, Enterobacter, Pseudomonas
Надземные части растений
Опад, верхние горизонты
почв
Минеральные горизонты
почв
Надземные части растений
Корни растений
максимально содержание апигментных актинобактерии и
протеобактерии. Такое распределение бактерий по ярусам
прослеживается во всех типах пустынных биогеоценозов и наиболее четко
выявляется при анализе смены ярусных потенциальных доминан-
тов. На зеленых вегетирующих частях растений доминировали
розово-красные колонии клавибактеров, метилобактерий и кок-
ковидных бактерий актиномицетной линии эволюции. На сухих
листьях и ветвях кустарников преобладали миксобактерии и
скользящие бактерии, колонии которых окрашены в красно-
оранжевые тона. В опаде пустынных растений, где происходит
активная переработка растительных остатков, доминантной
группой являются целлюлозоразрушающие бактерии,
представленные как скользящими бактериями, так и целлюломонадами. На
корнях доминировали апигментные подвижные протеобактерии,
в почве - представители родов Arthrobacter и стрептомицеты.
Таким образом, таксономическая структура бактериальных
группировок в индивидуальном образце определяется, прежде
всего, положением субстрата в пространственно-сукцессионном
ряду. Дисперсионный анализ показал, что сила влияния типа
субстрата составляет 26%, в то время как влияние типа пустыни не
превышает 2%.
Ординация исследованных образцов по характеру
таксономической структуры бактериальных группировок методами много-
147
0,4 г
0,2 \-
0 Р
<n -0,2 Г
&
О -0,4
-0,6
-0,8
-1.0
О
о
А А
А
¦ о«° х
OQBO
О ШР
О
X
О 1
Ш 2
А 5
О 4
X 5
X
А АХ
^ О
О
о
-±L
¦1,0
-0,5
0,5
Фактор 1
Рис. 10. Ординация индивидуальных образцов различных субстратов
субтропических пустынь по таксономической структуре их бактериальных группировок
методом главных компонент
1 - надземные части растений; 2 - опад; 3 - корка почвы (0-1 см); 4 - минеральные
горизонты почв; 5 - корни растений
мерной статистики (рис. 10) подтвердила определяющее
значение положения субстрата в пространственно-сукцессионном ряду
в формировании таксономической структуры группировки.
В пространстве первых двух факторов все индивидуальные
образцы образуют достаточно непрерывную структуру, в которой,
тем не менее, можно выделить два основных "сгущения".
Первый, наиболее компактный кластер образуют группировки в
минеральных горизонтах почв. Как правило, они характеризуются
высоким (в сумме до 80-90%) относительным обилием двух
типично педобионтных родов актинобактерий: Streptomyces и
Arthrobacter. Второй, более "размытый" кластер образуют
группировки на живых и мертвых надземных частях растений и в опа-
де. Их объединяет преобладание родов Micrococcus, Kocuria и
Rhodococcus, миксобактерий, а также более высокое
информационное разнообразие, в основном за счет большей выравненное™
относительных обилий родов. Между этими двумя "сгущениями"
148
имеется множество переходных вариантов, где могут быть
одинаково обильны типичные роды как из первого кластера, так и
из второго. Такие "переходные" группировки встречаются
преимущественно в самых верхних горизонтах почв (в корковом
горизонте серо-бурых почв глинистых пустынь), а также на корнях
растений.
Наличие подобных кластеров, выявляемых при анализе
сходства таксономической структуры индивидуальных группировок
бактерий, само по себе очень интересно. Оно свидетельствует об
определенной дискретности структуры микробных сообществ, о
возможности создания их неформальной классификации и
подтверждает так называемый "блочный принцип" формирования
сообществ. Ранее мы неоднократно показывали, что выраженная
дискретность характерна для рассматриваемых в масштабе
целого биогеоценоза сообществ бактерий и дрожжевых грибов в
различных географических зонах
Пустыни Средней Азии и пустыня Негев существенно
различаются по климатическим характеристикам. Одним из наиболее
важных отличий пустыни Негев являются постоянные утренние
туманы, которые могут служить дополнительным источником
влаги для организмов, обитающих в надземном ярусе. Ранее
было показано (Чернов и др., 1997), что эта особенность вызывает
существенную перестройку в таксономической структуре эпи-
фитных дрожжевых грибов в пустыне Негев. Однако в случае
бактериальных комплексов значительных отличий между типами
пустынь не выявлено. Это можно объяснять тем, что в данном
случае сравнивается соотношение достаточно крупных
таксономических групп бактерий, которые могут включать более стено-
топные виды, для идентификации которых недостаточно только
фенотипических признаков.
Тем не менее, некоторые достоверные различия в частоте
встречаемости бактериальных таксонов в разных пустынях все
же обнаруживаются (табл. 6). В пустыне Негев по сравнению со
среднеазиатскими пустынями частота встречаемости бактерий
родов Clavibacter и Bacillus была заметно меньше, не
обнаружены представители семейства Geodermatophilaceae и рода Methylo-
bacterium, встречаемость которых в пустынях Средней Азии
составляла 10-43%. При этом организмы рода Flavobacterium были
выделены из 38% проанализированных субстратов пустыни
Негев и ни разу не встречены в Средней Азии. В качестве
особенности бактериальных сообществ пустыни Каракумы следует
отметить высокую долю розовопигментных клавибактеров.
Результаты дисперсионного факторного анализа показали
высокую достоверность различий по встречаемости флавобакте-
149
Таблица 6
Встречаемость таксономических групп бактерий в различных пустынях во
всех субстратах, %
Группы бактерий
Протеобактерии
Myxobacterales
Methylobacterium
Flavobacterium
Актинобактерии
Cellulomonas
Micrococcus, Kocuria, Rhodococcus
Streptomyces
Arthrobacter
Clavibacter
Geodermatophilus
Bacillus
Кызыл кум
84
57
41
0
100
67
64
49
48
25
21
21
Каракумы
81
67
10
0
95
57
67
14
29
57
43
19
Негев
88
74
0
38
98
86
79
69
50
5
0
7
рий и метилобактерий (при уровне значимости < 0,05). Другие
отличия в таксономической структуре бактериальных сообществ
разных типов пустынь могут быть обусловлены и случайными
колебаниями.
С рядом местообитаний, проанализированных нами в
пустынях Кызылкум и Негев, связано выделение специфических родов
бактерий, не встречавшихся на растениях и в почве. Речь идет о
субстратах, формирующихся в результате жизнедеятельности
животных: муравейниках, термитниках, выбросах мокриц, а
также экскрементах теплокровных животных. Из таких субстратов
были выделены бактерии родов Microbacterium (Aureobacterium),
Curtobacterium, Oerskovia. Представители двух первых родов
обнаружены также на корнях Calligonum macrocarpum.
Относительное обилие этих бактерий в указанных субстратах было
невысоким, однако, в сочетании с другими доминирующими родами
актинобактерии они составляли основное ядро бактериального
сообщества. Например, в выбросах мокриц доля бактерий актино-
мицетной линии равнялась 77%, в том числе Arthrobacter и Nocar-
dioides ~ 51%, Oerskovia - 8%, Clavibacter и Curtobacterium - 8%,
Streptomyces - 10%. В экскрементах кулана доля бактерий родов
Clavibacter и Curtobacterium превышала 30% от общей
численности бактерий. Розовопигментные виды рода Clavibacter\
выделенные из этого субстрата, образовывали внеклеточный меланоид-
ный пигмент. В растительной трухе на поверхности муравейника
актинобактерии, принадлежащие к родам Promicromonospora,
150
Clavibacter, Curtobacterium и нескольким родам кокковидных
организмов, составляли около 90%.
Анализ таксономического состава бактериальных сообществ
в зоогенных субстратах позволяет предположить, что
обнаруженные в них бактерии прошли через кишечник травоядных
животных и насекомых с растительной пищей. Так, известно, что
бактерии рода Curtobacterium широко распространены в
растительных субстратах. Они были обнаружены более чем на 200
видах растений из 62 семейств (Dunleavy, 1989). Организмы родов
Rathayibacter, Clavibacter, а также некоторых видов
Curtobacterium и Microbacterium (Aureobacterium), относятся к фитопатоге-
нам и часто обнаруживаются в галлах, образуемых на растениях
нематодами рода Anguina (Evtushenko, Dorofeeva et al., 1994).
Бактерии группы Promicromonospora-Oerskovia являются типичными
компонентами кишечной микрофлоры беспозвоночных
животных (диплопод, мокриц), перерабатывающих растительный опад
(Byzov et al., 1996). В модельных опытах по скармливанию
бактерий рода Promicromonospora диплоподам и червям было
показано, что их численность резко возрастает после прохождения
через кишечник животного (Третьякова и др., 1996).
Результаты синэкологического анализа бактериальных
комплексов пустынных биогеоценозов свидетельствуют в пользу
особой значимости бактерий актиномицетной линии в этом типе
биомов. Спектр потенциальных доминантов в бактериальных
сообществах пустынь включает разнообразные роды актинобакте-
рий. Рассмотрим более конкретно, с учетом спектра выделенных
родов бактерий, адаптационные особенности бактериальных
комплексов филлоплана и опада пустынных растений, наиболее
подверженных инсоляции и иссушению. Все типичные для этих
субстратов бактерии имеют разные жизненные формы в цикле
развития: палочка-кокк или мицелий-палочка-кокк. Кокковид-
ная стадия может рассматриваться как жизненная форма актино-
бактерий, более приспособленная для перенесения
неблагоприятных условий. Показано (Boylen, 1973), что при низких
скоростях роста, связанных с недостатком источников питания, артро-
бактер развивается исключительно в виде кокков. Именно в этой
жизненной форме он находится и в почве, где способен
переносить длительные периоды высушивания. При благоприятных
условиях кокки прорастают, образуя палочковидные или мицели-
альные структуры.
Большинство исследованных актинобактерий эпифитно-под-
стилочного комплекса, подверженные воздействию прямого
солнечного света, образуют пигменты желтых, оранжевых и
красных оттенков преимущественно каротиноидной природы, а неко-
151
торые из них - и меланоидные пигменты. Среди спороактиноми-
цетов, выделенных из растительных субстратов исследуемых
типов биогеоценозов, преобладали черноокрашенные виды рода
Micromonospora (Зенова, Чернов и др., 1996).
В почвах пустынь, также как и в почвах других биомов,
актинобактерии представлены в основном апигментными
формами. Бактерии рода Arthrobacter, причем исключительно апиг-
ментные виды, доминирующие в почвах всех типов пустынь,
являются типичными педобионтами, устойчивыми к
высушиванию и голоданию.
Укажем также на тот факт, что актиномицеты
доминировали среди изученных нами субстратов в основном в почвенном
ярусе. Это отмечалось неоднократно и ранее. Считается, что ми-
целиальный образ жизни этих организмов - следствие их
адаптации к твердофазному субстрату. Для почв исследуемых
пустынных биогеоценозов характерны высокое видовое разнообразие
стрептомицетов и значительная доля моноспоровых актиномице-
тов (Зенова, Чернов и др., 1996).
Следует более подробно остановиться на бактериях, которые
были объединены в одну группу на основании их довольно
низких (средних, без учета ярусности) показателей встречаемости и
обилия, и которые, по нашему мнению, могут рассматриваться
как индикаторные для пустынных экосистем. Это бактерии
комплекса Geodermatophilus-Blastococcus, Clavibacter и Methylobac-
terium.
Geodermatophilus. Детальное описание культур этого рода,
выделенных нами в среднеазиатских пустынях, дано ранее
(Добровольская и др., 1993). Здесь хотелось бы лишь обратить
внимание на уникальный жизненный цикл этих прокариот,
позволяющий им, по-видимому, существовать на растениях и в почве в
разных жизненных формах. В розово-оранжевых культурах этих
бактерий, изолированных с поверхности листьев растений,
доминируют агрегаты кокков, объединенных общей полисахаридной
оболочкой, предохраняющей клетки от высушивания (S-форма).
Из почв, особенно из поверхностной солевой корочки,
выделяются окрашенные большей частью в черный цвет культуры,
представляющие собой почкующиеся зооспоры и
напоминающие псевдомицелий дрожжей (R-форма). Многие почвенные изо-
ляты в процессе культивирования изменяют свою окраску от
розовой до черной, при этом наблюдается и последовательная
смена жизненных форм. Данное обстоятельство может быть
результатом адаптации организмов к экстремальным условиям, в
которых фенотипический полиморфизм организмов бывает особенно
резким. Недавно из почвы холодной пустыни Антарктики были
152
выделены бактерии, которые по морфологическим, хемотаксо-
номическим и геномным характеристикам оказались близки к
филогенетической ветви Geodermatophilus-Blastococcus. Для этих
микроорганизмов было предложено создать новый род Modesto-
bacter gen. nov. и вид М. multiseptatus sp. nov. (Mevs et al., 2000). Это
свидетельствует о том, что представители Geodermatophilaceae
способны адаптироваться к диаметрально противоположным
экстремальным условиям (антарктические геодерматофилы
росли при 0 °С).
Образование плотного таллома клеток, заключенных в
общую оболочку, выполняющую роль капсулы, характерно не
только для геодерматофилов, но и для некоторых видов красных
и оранжевых микрококков. Цикл развития таких микрококков
из литофильных лишайников Памира и Тянь-Шаня описан нами
ранее (Добровольская, 1983). Многоклеточный таллом
микрококков дробится в разных направлениях по множественным
перегородкам, как и у геодерматофилов, на более мелкие агрегаты
и отдельные клетки неправильной формы - коккоиды.
Аналогичные формы микрококков выделялись в исследуемых
пустынных биогеоценозах. Не исключено, что микрококки являются
одной из стадий развития геодерматофилов, получивших в
результате расхождения экологических ниш возможность
самостоятельного существования. Аналогичное явление наблюдается у
некоторых гетеробазидиальных грибов, мицелиальные и
дрожжевые стадии которых существуют в различных экологических
нишах.
Clavibacter. Род Clavibacter был создан в 1984 г. (Davis et al.,
1984) для фитопатогенных бактерий, вызывающих остановку
роста корневых волосков у сахарного тростника. Он включил в
себя как вновь описанные виды, так и переведенные туда из рода
Corynebacterium виды, имеющие другой тип клеточной стенки,
чем коринебактерии. Представители трех видов этого рода были
обнаружены в галлах, образуемых нематодами на многих
травянистых растениях (Collins et al., 1986). Колонии всех известных
видов клавибактерий либо апигментные, либо окрашены в
желтые и оранжевые тона.
Постоянно выделяемые нами с листьев и из опада пустынных
растений клавибактеры были представлены исключительно ро-
зовоокрашенными культурами. Некоторые из них образовывали
еще и меланоидный пигмент. Следует отметить, что эти
бактерии не были приурочены к какому-либо типу растений, они
выделялись из деревьев (саксаулы), кустарников, травянистых
растений (эфемеров и злаков). На основании тщательного изучения
морфологических, физиологических и хемотаксономических
153
особенностей этих бактериальных культур и сравнения их с
известными видами они были описаны нами как новый вид рода
Clavibacter - С. desertorum (Evtushenko et al., 1994в). Возможно,
что именно в пустынях сохраняются многие сформировавшиеся
в прошлом бактериальные виды, от которых произошли
впоследствии и другие, в том числе и фитопатогенные формы.
Methylobacterium. Бактерии этого рода - факультативно-ме-
тилотрофные бактерии, способные использовать кроме
метанола довольно широкий круг источников углерода (Bergey's
manual..., 1994). По литературным данным, метилобактерии
выделяются из воды, почвы, воздуха, растений. В многочисленных эко-
лого-географических исследованиях бактериальных комплексов
в разных типах экосистем мы очень редко обнаруживали
метилобактерии - в основном на растениях в виде минорных
компонентов. В то же время во всех типах фитоценозов
среднеазиатских пустынь из филлопланы и опада пустынных растений
постоянно выделялись и часто входили в спектр потенциальных
доминантов розовоокрашенные протеобактерии рода
Methylobacterium,
Установлены локусы местообитания метилотрофных
бактерий на растениях - это листовая поверхность растений под
восковой кутикулой (Corpe, Rheem, 1989). Выделяемый растениями
метанол задерживается под кутикулой и используется метилотроф-
ными бактериями. Если учесть, что специфической особенностью
пустынных растений является образование воскового налета на
листьях для защиты от чрезмерного нагревания и иссушения,
становится понятным частое обнаружение этих бактерий в филло-
плане различных растений пустынных экосистем.
Таким образом, эколого-биологическая структура
бактериальных сообществ пустынь характеризуется особым спектром
жизненных форм бактерий, чередующихся в процессе цикла их
развития, доминированием пигментных актинобактерий,
устойчивых к инсоляции и высушиванию, аэробным типом обмена,
высоким содержанием ГЦ в ДНК. Все эти признаки отражают
эволюционно сложившиеся адаптации прокариотных
микроорганизмов к экстремальным условиям жизни в пустыне.
Проведенный анализ прокариотных комплексов пустынь,
расположенных в разных, географически удаленных друг от
друга районах, позволил выявить общие закономерности в
организации их пространственной и таксономической структуры. К ним
относятся:
- концентрация численности и разнообразия бактерий в
наземном ярусе, в основном на мертвых частях растений и в
периодически образующейся фрагментарной подстилке;
154
- доминирование в бактериальном комплексе бактерий акти-
номицетной линии и миксобактерий;
- четкая дифференциация таксономической структуры в про-
странственно-сукцессионном ряду (надземные части растений-
опад-почва);
- присутствие специфических индикаторных групп разного
таксономического ранга, таких, как Geodermatophilus, Clavibacter
desertorum.
Прослеживается ряд морфолого-физиологических адаптации
преобладающих в пустынях прокариот к условиям
экстремальной сухости: синтез каротиноидных и меланоидных пигментов,
тенденция к мицелиальной организации, наличие сложного
цикла развития.
2.4.2. СТРУКТУРА БАКТЕРИАЛЬНЫХ КОМПЛЕКСОВ
ПОЧВ ГУМИДНЫХ ЛАНДШАФТОВ
В настоящем разделе будут рассмотрены особенности
организации и таксономической структуры бактериальных
комплексов в почвах восточно-европейской подзоны южной тайги.
Набор исследуемых почв включает сопряженные ряды почв гидро-
морфного ряда, отражающие эволюцию почвенного покрова при
заболачивании, и почвы мезоморфного ряда. Все почвы
сформировались под лесными фитоценозами, большей частью под
ельниками, на разных элементах рельефа и подстилаются разными
породами, что отражается в гидрофизических и биохимических
особенностях этих почв. Исследования проводились на
территориях Центрально-Лесного государственного биосферного
заповедника (ЦЛГБЗ) и Западно-Двинского стационара,
представляющих собой вторично-моренную равнину (Тверская обл.). В этих
лесных и болотно-лесных биогеоценозах проводились и
проводятся многолетние стационарные комплексные исследования
почвенного покрова и почвенной биоты.
Нами исследовались также почвы Окского государственного
заповедника, расположенного в подзоне южной тайги, но
значительно южнее - в Рязанской обл. Особенностью этой территории
являются эоловые (дюнные) формы рельефа междуречий и
песчаные почвы, сформировавшиеся на древнеаллювиальных
и приледниковых песчаных отложениях (Заповедники ..., 1979).
Центрально-Лесной государственный биосферный
заповедник. Одним из важнейших направлений природоохранной
деятельности, в том числе охраны почвенного покрова и сохранения
биоразнообразия, является изучение экосистем заповедных тер-
155
риторий в качестве эталонов ненарушенных ландшафтов.
ЦЛГБЗ может служить эталоном лесных экосистем центральной
части Европейской России.
Работы по изучению почвенной биоты были начаты в
заповеднике в 1990-е гг. в рамках научных программ кафедр
географии и биологии почв факультета почвоведения МГУ и
Лаборатории экологических функций почв Института проблем экологии и
эволюции им. А.Н. Северцова РАН и Института почвоведения
МГУ РАН под руководством академика РАН Г.В.
Добровольского. Основные цели исследований: выявление закономерности
функционирования почв ненарушенных южнотаежных
ландшафтов и определение роли фауны и микроорганизмов в
экологических функциях почв.
Анализ данных, полученных в результате изучения
структуры и динамики почвенной микро- и нанофауны в почвах ЦЛГБЗ,
был дан ранее (Добровольский и др., 1997; Трофимов, 1998).
В настоящем разделе обобщены данные шестилетней работы
микробиологов по изучению пространственно-функциональной
организации микробных сообществ в разных типах
биогеоценозов заповедника (Головченко и др., 2000). В качестве объектов
исследования были выбраны 6 типов модальных почв,
репрезентативно отражающих сложность и комплексность почвенного
покрова ЦЛГБЗ. Почвенные разности приурочены к
определенным элементам рельефа, почвообразующим породам и типам
леса и различаются степенью дифференциации профиля на
генетические горизонты, наличием и характером преобразования
элювиальной по илу толщи, морфологией диагностических
горизонтов и рядом химических показателей. Методы и объекты
исследования подробно описаны в работах (Головченко и др., 1995;
Алехина и др., 1997; Трофимов, 1998.)
Почвы мезоморфного ряда изучались под двумя типами леса:
ельник-черничник на торфянисто-подзолистой поверхностно-ог-
леенной (так называемой белоподзолистой) почве, занимающей
плоский водораздел, и ельник сложный на буроземе,
расположенный на выпуклом элементе склона, оконтуривающего
долину лесного ручья.
Анализ вертикально-ярусной организации бактериальных
сообществ в этих биогеоценозах показал, что различные биогеоце-
нотические горизонты заселены бактериями неодинаково.
Содержание прокариотных микроорганизмов в обоих типах лесных
экосистем увеличивалось в ряду: зеленые части растений —>
—> опад —» подстилка. Цифры, характеризующие численность
бактерий в большинстве субстратов, были несколько выше для
ельника неморального, чем для ельника черничного. Число бак-
156
териальных клеток на растениях колебалось от 107 до 1010 КОЕ/г
растительного материала, причем численность бактерий на
листьях травянистых растений и мхах была выше, чем на хвое.
Максимальная концентрация бактерий была зарегистрирована в
опаде и верхних слоях (L) подстилок в обоих типах ельников и
составляла 109-1010 КОЕ/г. В ферментационном слое (F) плотность
бактерий уменьшалась на порядок, а в слое Н подстилки ельника
черничного падала до 107 КОЕ/г. В исследуемых ельниках
наблюдалось снижение (на порядок и более) плотности
бактериальных популяций при переходе от подстилки к почвенным
горизонтам, причем оно носило более резкий характер в белоподзо-
листой почве, подстилку которой сменяет обедненный
подзолистый горизонт.
Из различных субстратов были выделены бактерии,
отнесенные к 7 таксономическим группам: спириллы, миксобактерии,
цитофаги, группа грамотрицательных бактерий, включающая
роды Flavobacterium, Pseudomonas и Xanthomonas, коринеподоб-
ные бактерии (роды Cellulomonas, Rhodococcus), бациллы и стреп-
томицеты. Анализ распределения бактерий по элементам
вертикальной структуры ельника черничного и ельника неморального
подтвердил установленные ранее для других типов леса
закономерности в пространственном размещении микробных
сообществ с убыванием численности в пространственно-сукцессион-
ном ряду от подстилки к почвенным горизонтам и концентрацией
максимального бактериального разнообразия в лесных
подстилках (Звягинцев и др., 1991, 1993).
Различия между бактериальными комплексами вертикально-
ярусных элементов экосистемы проявились при анализе
вероятности доминирования различных таксономических групп. Этот
показатель определяли как отношение образцов, в которых
данная таксономическая группа составляет более 30 % от общей
численности бактерий, к общему количеству
проанализированных образцов. Прежде всего, обращает на себя внимание частое
доминирование бактерий-гидробионтов, представленных
спириллами, во всех элементах вертикально-ярусной структуры
ельников. Частота доминирования других групп бактерий зависела от
характера субстрата. На растениях в круг потенциальных доми-
нантов входили коринеподобные бактерии и грамотрицательные
бактерии родов Flavobacterium, Pseudomonas и Xanthomonas.
В подстилках более значимой группировкой наряду со
спириллами становились скользящие бактерии, представленные миксоба-
ктериями и цитофагами. В почвенном ярусе содоминантами
спирилл были бациллы и стрептомицеты, т.е. те прокариоты,
которые образуют покоящиеся формы.
157
Индекс Шеннона, бит
Ahf
А2
охр
б
1 2
L
F
Н
'бел
i i \ \
/' \
у /
л
/
/
/
*
/
/
/
/
/
i
. 1 \
Рис. Л. Изменение разнообразия бактерий (индекс Шеннона) по профилю
бурозема (а) и белоподзолистой почвы (б) весной (7), летом (2) и осенью (3)
В результате идентификации основных бактериальных доми-
нантов было установлено, что среди спорообразующих бактерий,
представленных 5-ю видами, доминируют
факультативно-анаэробные виды Bacillus circulans и В. cereus. Видовой спектр
бактерий рода Cytophaga (6 видов) также включал редкий для
представителей этого рода факультативно-анаэробный вид Cytophaga
succinicans.
Анализ общего информационного разнообразия бактерий в
исследуемых почвах позволил зарегистрировать максимальные
показатели бактериального разнообразия (индекс Шеннона) для
подстилок обоих типов, особенно для их ферментационного слоя
(рис. 11). Однако спектр потенциальных доминантов был шире в
подстилке бурозема.
Различия между анализируемыми почвами были выявлены и
при сравнении бактериальных комплексов почвенных
горизонтов, что связано с особенностями строения их органопрофиля.
Так, бактериальное информационное разнообразие в почвенном
ярусе бурозема было выше, чем в белоподзолистой почве,
благодаря наличию следующего за подстилкой гумусово-аккумулятив-
ного горизонта, который содержит большой спектр
бактериальных таксонов, тогда как в белоподзолистой почве подстилку
сменяет обедненный подзолистый горизонт (см. рис. 11).
Иллювиальные горизонты исследуемых почв отличались по
родовому составу коринеподобных бактерий, являющихся харак-
158
терными обитателями этих глубин. В буроземе коринеподобные
бактерии более разнообразны. Они представлены артробакте-
ром, родококками и микрококками, причем доля артробактера
составляла 87%. В белоподзолистой почве артробактер
отсутствовал, его заменяли желтопигментированные, неидентифициро-
ванные нами до рода коринеподобные бактерии, которые
составляли примерно равные доли с другими представителями актино-
бактерий.
Мониторинг за сезонной и годовой динамикой структуры
бактериальных комплексов в исследуемых почвах позволил
оценить (с помощью факторного дисперсионного анализа) влияние
различных факторов на показатели численности и разнообразия
выявляемых бактериальных группировок. Оценивали влияние
следующих факторов: тип почвы, тип субстрата (тип горизонта)
и год исследования. Результаты дисперсионного анализа выявили
достоверное (при уровне значимости 0,9) максимальное влияние
типа субстрата на численность бактерий сапротрофного
комплекса. Плотность бактериальных популяций постепенно убывает
от подстилок к иллювиальным горизонтам, на этом фоне как
сезонные, так и годовые колебания численности весьма
незначительны.
На таксономический состав бактериальных комплексов
достоверное влияние оказывал год исследований (характеризуемый
количеством выпавших осадков), далее в порядке убывания
степени влияния следовали тип субстрата и тип почвы. Индекс
Шеннона был самым низким во всех биогеоценотических горизонтах
бурозема и белоподзолистой почвы в год с минимальным
количеством выпавших осадков. В этот же период проявились и
наиболее четкие различия по индексу Шеннона как между типами
почв, так и между горизонтами. В более влажные годы при более
высоких общих показателях разнообразия эти различия были
сглажены.
Влажность определяла и характер распределения бактерий
по ярусам. В те сроки анализа, когда почвы были насыщены
водой почти до ее водовместимости, наблюдалось континуальное
распределение бактерий в пределах всей полуметровой толщи,
включая подстилки. В более засушливые периоды, когда
влажность почвы была меньше, чем общая (наименьшая) влагоем-
кость, наблюдали дискретный тип распределения бактериальных
таксонов, т.е. регистрировали четкие различия между составом и
соотношением родов в бактериальных сообществах
подстилочного и почвенного ярусов. При этом в подстилке доминировали
скользящие бактерии (цитофаги и миксобактерии), а в
почвенных горизонтах - бациллы и коринеподобные бактерии.
159
80
60
I
б
i
i
ш
тт 2
П22 3
ига 4
ПП 5
6
Рис. 12. Влияние годовой влажности на таксономический состав бактериальных
комплексов белоподзолистой почвы
Образцы: а - свежеотобранные во "влажные" периоды; б - свежеотобранные в
"сухие" периоды; в - воздушно-сухие. Бактерии: 1 - спириллы; 2 - миксобактерии; 3 - цито-
фаги-флавобактерии; 4 - стрептомицеты; 5 - бациллы; 6 - коринеподобные бактерии
Изменение структуры бактериального комплекса в
белоподзолистой почве в зависимости от "влажного" или "сухого" года
показано на рис. 12. При высокой влажности доминируют
спириллы - типичные гидробионты, при более низкой влажности -
преобладают миксобактерии, при этом в 10 раз увеличивается
доля бацилл. При дальнейшем высушивании почвы в
лабораторных условиях (на воздухе) продолжает увеличиваться доля
бацилл (до 40%), т.е. эта группа становится доминирующей,
одновременно возрастает содержание коринеподобных бактерий и
стрептомицетов. Однако такая структура бактериального
комплекса не свойственна исследуемым почвам при анализе их в
естественном состоянии без предварительного высушивания
образцов. Все это свидетельствует о том, что исследуемые почвы
постоянно, независимо от сезона и года находятся в условиях
сильного переувлажнения, поэтому таксономическая структура
бактериального комплекса, определяемая, прежде всего,
влажностью, незначительно меняется в зависимости от сезона и типа
почвы.
Поскольку в большинстве случаев уже известны функции
микроорганизмов, принадлежащих к определенным таксонам,
установление таксономической принадлежности микроорганизмов,
характерных для данных почв, позволяет высказать
предположение о роли этих микроорганизмов в данных типах БГЦ. Итак, в
160
исследуемых почвах сапротрофный комплекс бактерий
представлен разнообразными таксонами. В него входят представители
всех эколого-трофических группировок: гидролитики, копиотро-
фы, олиготрофы. Гидролитический бактериальный блок
представлен бациллами, скользящими бактериями (миксобактерии и
цитофаги) и бактериями актиномицетной линии (роды Cellulo-
monas, Nocardioides, Micromonospora, Streptomyces).
И в буроземе, и в белоподзолистой почве бактерии,
способные к деструкции полимеров и особенно целлюлозы,
обнаруживались по всему профилю. Их численность и доля выше там, где
происходит наиболее активная деструкция растительных
остатков, т.е. в подстилках и верхних гумусированных горизонтах.
Различия в таксономическом составе гидролитических
комплексов бактерий двух исследуемых типов почв проявлялись при
анализе как подстилок, так и почвенных горизонтов. Подстилка
бурозема на протяжении всего анализируемого срока
характеризовалась не только более широким спектром бактерий-гидроли-
тиков, но и высокой частотой их доминирования в подстилочном
бактериальном сообществе. В почвенных горизонтах бурозема
частота встречаемости всех таксонов, входящих в состав
гидролитического комплекса, также была максимальной, а
доминирующими группами были миксобактерии и цитофаги. В морфонах
элювиального горизонта белоподзолистой почвы из комплекса
бактерий-гидролитиков "выпадали" коринеформные бактерии и
цитофаги, а доминантами выступали бациллы и стрептомицеты.
Следует также отметить, что численность этой функциональной
группы менее резко убывала с глубиной в буроземе по
сравнению с белоподзолистой почвой, что, очевидно, связано с более
высоким содержанием и плавным убыванием гумуса по профилю
этой почвы. Численность бактерий-гидролитиков коррелирует с
ферментационной активностью почв. Определение целлюлоли-
тической активности в исследуемых почвах выявило довольно
высокие ее значения в горизонтах Ahf и Bf бурозема, в то время
как в белоподзолистой почве активность разложения целлюлозы
была низкой.
Мониторинг за динамикой структуры бактериальных
комплексов двух типов почв: бурозема и белоподзолистой почвы,
расположенных на разных элементах рельефа и
характеризующихся разным водно-воздушным режимом, позволил установить их
контрастность и на бактериологическом уровне. Она
заключается в следующем:
1) в буроземе (как в подстилке, так и в почвенном ярусе)
выше бактериальное разнообразие и больше доля и спектр
бактерий-гидролитиков, чем в белоподзолистой почве, что объясняет-
11-4549
161
ся более благоприятными условиями для осуществления
процесса деструкции растительных остатков;
2) иллювиальные горизонты исследуемых типов почв
различаются по спектру и соотношению таксонов в группе коринепо-
добных бактерий, являющихся характерными обитателями этих
горизонтов;
3) в белоподзолистой почве за все время мониторинга в
составе бактериального комплекса ни разу не обнаружен артробак-
тер - организм, чувствительный к повышенной кислотности
среды, в то время как в буроземе он встречается во всех почвенных
горизонтах.
В структуре почвенного покрова заповедника более одной
трети занимают почвы гидроморфного ряда: болотно-подзоли-
стые и болотные, тяготеющие к плоским водоразделам.
Характерными компонентами ландшафта являются также дерново-
глеевые почвы, приуроченные к поймам местных ручьев,
дренирующих склоны (Генезис..., 1979; Гончарук, 1995).
Сравнение бактериальных комплексов почв разной степени
гидроморфизма проводили на основании изучения численности и
таксономического состава (в динамике) бактерий
гидролитического блока, способных разлагать различные полимеры,
используя для этого метод репликаторов (Добровольская и др., 2000).
Бактерии гидролитического комплекса в дерново-глеевой
почве и буроземе составляли максимальную, по сравнению с
подзолистой и верховой торфяно-глеевой почвами, долю, а их
численность достигала в подстилке 109 КОЕ/г субстрата (рис. 13). На
средах с карбоксиметилцеллюлозой, крахмалом и пектином
доминировали цитофаги, а в случае ингибирования грамотрица-
тельных бактерий их место занимали стрептомицеты, целлюло-
монады и бациллы. Бактерии этих же таксонов оказались
преобладающими при учете прокариот, способных лизировать
микробную биомассу, в качестве которой использовались клетки
дрожжей. Выделенные из дерново-глеевой почвы спириллы,
являющиеся характерными компонентами переувлажненных почв,
оказались способными к расщеплению лецитина и твина, что
указывает на их возможную роль в качестве липолитических
агентов в этой почве.
В белоподзолистой и верховой торфяно-глеевой почвах ами-
лолитическое сообщество на начальных стадиях сукцессии было
представлено цитофагами и миксобактериями, а на более
поздних - актиномицетами, миксобактериями и бациллами. Среди
спорообразующих бактерий на крахмальной среде преобладали
бациллы видов В. cereus и В. megateriwn, на среде с целлюлозой -
В. circulans, B. brevis, B. globisporus. В реутилизации дрожжевой
162
Логарифм численности бактерий (КОЕ / г)
4 6 8 10
&
<)?
оз
А1
i
11 11 11 11 11 . i . t . i .. . i 11 t.
1
i . i . 1 1 1 i
ШЖЖЖМ"
ШШШШШ
ШШШ
i
i . i 1 ii '
•••••'
СИ 1
ШЗ 2
У77Л 3
Рис. 13. Распределение бактерий гидролитического комплекса (на разных
субстратах) по профилю дерново-глеевой почвы
Субстраты: J - карбоксиметилцеллюлоза; 2 - крахмал; 3 - пектин
биомассы в изучаемых почвах принимали участие два вида цито-
фаг: С. johnsonae и С. succinicans, а также бациллы вида В. circu-
lans. Как в белоподзолистой, так и верховой торфяно-глеевой
почве спорообразующие бактерии, представленные в основном
факультативно-анаэробными видами, оказались основными
агентами, способными разлагать карбоксиметилцеллюлозу
(КМЦ), крахмал, пектин, микробную биомассу, лецитин, твин и
белки. Их численность в органогенных горизонтах колебалась от
103 до 105 КОЕ/г, и была максимальной на среде с КМЦ.
Копиотрофы, способные использовать только
водорастворимые мономеры (углеводы, органические кислоты, спирты) были
представлены в исследуемых почвах спириллами, микрококками,
факультативно-анаэробными бактериями (семейства Enterobacte-
riaceae и Vibrionaceae). Спириллы - организмы, характерные для
водных сред, поэтому их наличие, а тем более доминирование в
некоторых горизонтах, свидетельствует, как указывалось ранее,
об избытке влаги в исследуемых почвах.
Таким образом, как численность, так и таксономический
состав сапротрофного блока бактерий зависят, прежде всего, от
специфики самого почвенного объекта, определяемого
множеством факторов: составом опада, рН почвы, типом
водно-воздушного режима и др. Однако одним из главных факторов,
определяющих таксономическую структуру бактериальных сообществ
163
почв таежной зоны, является влажность - производная от
погодных условий и гидротермического режима почв. Влажность
определяет:
1) характер распределения бактерий по ярусам
(континуальный при повышенной влажности и дискретный в более "сухие"
периоды);
2) уровень информационного разнообразия (более высокий
во влажные периоды);
3) соотношение таксонов в прокариотном комплексе
микроорганизмов (доминирование спирилл при избыточном
увлажнении и увеличение доли бацилл и бактерий актиномицетной линии
в более "сухие" годы).
К специфическим особенностям таксономического состава
бактериальных комплексов исследуемых почв можно отнести
доминирование бактерий-гидробионтов, а также наличие многих
форм факультативно-анаэробных бактерий - представителей
семейств Enterobacteriaceae и Vibrionaceae, родов Bacillus и Cytop-
haga. Все это также свидетельствует в пользу адаптации
бактерий к условиям переувлажнения почв. В почвах болотных
экосистем процентное содержание "водных" форм прокариот
достигает максимальных величин (Головченко и др., 1993).
Для почв гумидной зоны наиболее характерными
элементами, мигрирующими по почвенному профилю, являются железо и
марганец. Железо-марганецокисляющие бактерии были
обнаружены во всех горизонтах белоподзолистой почвы и бурозема, их
доля в обоих типах почв нарастала со временем (сукцессионный
анализ) и с глубиной (Алехина и др., 1997).
Среди железо- и марганецокисляющих бактерий основную-
долю составляли бациллы, спириллы и миксобактерии, т.е.
доминирующие в исследуемых почвах бактерии. Их доля
составляла в почвенных горизонтах около 40%. Среди других
бактериальных таксонов способность к окислению соединений железа
и марганца обнаруживалась лишь у единичных штаммов.
Следовательно, способностью к окислению соединений железа и
марганца обладают широко распространенные в почвах
"банальные формы" бактерий, а не только те таксоны,
представители которых участвуют в формировании
железо-марганцевых почвенных новообразований (Pedomicrobium, Galionella,
Seliberia и др.).
Различия в разнообразии и составе микробных комплексов
разных типов почв ЦЛГБЗ связаны большей частью с разными
гидротермическими режимами этих почв, что, в свою очередь,
определяется местоположением этих почв в рельефе. Так, при
сравнении контрастных представителей почв мезоморфного ря-
164
да - бурозема и белоподзолистой почвы - все показатели,
характеризующие разнообразие микроорганизмов разных групп,
значительно выше для микробных комплексов бурозема, в котором
складываются лучшие для биоты условия водно-воздушного
режима по сравнению с белоподзолистой почвой. Тип фитоценоза
и, следовательно, качество опада, равно как и кислотность почв,
также оказывают влияние на таксономическую структуру
микробных комплексов. Так, в дерново-глеевой почве,
формирующейся под мощной травянистой растительностью и лиственными
породами деревьев, с нейтральной реакцией среды, складывается
широкий таксономический спектр бактерий-гидролитиков, в то
время как в подзолистых и торфяных почвах бактерии этой эко-
лого-трофической группы представлены одним родом, а
основную роль в деструкции полимеров в этих почвах играют грибы.
Представителей некоторых родов бактерий - Arthrobacter и
Azotobacter - можно рассматривать в качестве индикаторов на
повышенную кислотность почв: они не обнаруживаются в кислых
подзолистых и торфяных почвах, но постоянно выделяются из
дерново-глеевой почвы и бурозема.
Бактерии, наряду с грибами, также принимают участие в
деструкции растительных остатков. На разных этапах в этом
процессе участвуют представители разных эколого-трофических
групп бактерий, таксономический состав которых приводится в
настоящем обзоре. Но не менее значимым представляется
участие бактерий в процессах превращения железа, марганца,
алюминия и прочих соединений в почве. Как было показано выше,
функцию окисления Fe и Мп могут осуществлять разнообразные
формы бактерий. По-видимому, существенна также роль
доминирующих во влажных почвах бактерий, образующих слизь (ми-
ксобактерии, спириллы и др.), и почвенных дрожжей (липомице-
тов) в процессах оструктуривания почв.
Благодаря большому запасу и высокому разнообразию
микроорганизмов, находящихся на разных уровнях организации,
поддерживается пул микроорганизмов-дублеров, способных
выполнять ту или иную экологическую функцию при изменяющихся
условиях среды. Тот спектр таксонов разных групп
микроорганизмов, который выявлен нами в результате многолетних
исследований таксономического состава микробных комплексов
заповедных почв, может быть использован для составления списка
таких дублеров.
Западно-Двинский стационар. Анализ иерархической
структуры бактериальных комплексов в сопряженном ряду гидро-
морфных и полугидроморфных почв Западно-Двинского
стационара показал четкое доминирование во всех ярусах апигментных
165
протеобактерий, представленных спириллами и факультативно-
анаэробными бактериями из семейств Enterobacteriaceae и Vibrio-
naceae. Доминирование этой группы протеобактерий в
бактериальном комплексе верхового торфяника было подтверждено
сравнительным анализом структуры этих комплексов в 16
различных образцах из поверхностных горизонтов одной и той же
почвы и в 25 - на выборочных глубинах почвенного профиля. Во
всех вариантах процентное содержание этой группы гидробион-
тов колебалось от 44 до 90% по горизонтальной структуре и от
64 до 96% по вертикальной (рис. 14). Благодаря способности этих
бактерий, обладающих жгутиками, к передвижению в водной
среде, они обнаруживаются во всех ярусах болотно-лесных
экосистем, образуя как горизонтальный, так и вертикальный
континуум. Все они являются типичными копиотрофами,
усваивающими различные водорастворимые мономеры - сахара,
органические кислоты, спирты.
Континуум создается и другими бактериальными формами -
олиготрофами, многие из которых были выделены и описаны
как типичные гидробионты. Это роды Caulobacter, Hyphomicro-
bium, Prosthecomicrobium. Их численность колебалась от 1,5 ¦ 105
до 4,8 ¦ 1011 клеток/г почвы. Простекобактерии всех трех родов
достигали максимальной концентрации в самой богатой почве -
низинном торфянике. Клетки каулобактера и гифомикробиума
были обнаружены практически на всех глубинах торфяника
(5-6 м) вплоть до подстилающей породы. Их численность была
довольно стабильна за исключением бактерий рода
Prosthecomicrobium, клетки которых встречались лишь до глубины 1 м (Го-
ловченко и др., 1993).
Вторая группа бактерий, занимающая значительную долю в
бактериальном комплексе исследуемых почв, также
представлена грамотрицательными бактериями, образующими, в отличие
от бактерий-доминантов, пигментные (желтые и оранжевые)
колонии. Это скользящие бактерии родов Flavobacterium и Cytop-
haga и миксобактерии - представители порядка Myxobacterales.
Процентное содержание этой группы бактерий увеличивается от
4% в торфянисто-подзолистой почве до 16% в высокозольном
низинном торфянике. Аналогичным образом возрастает
относительное обилие бактерий рода Beijerinckia - бактерий, которые
часто образуют тесные ассоциации с целлюлозоразрушающими
скользящими бактериями (рис. 15)
Относительное содержание и разнообразие грамположитель-
ных бактерий в исследуемом ряду почв очень низки. Их спектр
определяется, в основном, бациллами и стрептомицетами. Доля
бацилл максимальна (хотя и не превышает 8% в среднем) в ни-
166
20
Доля протеобактерий, %
40 60 80
100
120
0
1
2
3
4
5
6
7
8
—i
о
8
о
о
о
-
-
-
-i , -тт-| , , ,
<Ъ° °о о° т° ^ б^Р^^ЗЙЯ^^Эо00 °
°° CD 0 ° <*ю°? ^ О Ф° °0
$ ° °о о
ОО О 1 ^P°/vO°0
\ \
О О О О | Л J О
о ,о
1 ,
1
о о о о о Jo
i i
ОООО COCO |
! \
1 ¦
(DCDCdO Ю
! 1
<DO <DJO »
! '.
О О CKDp 00|0
1 1
о о со» о q
1 1
1 1
О О О ICD |
1
1
1
о оо oj
1
1
о J оо
1
о J о
1
1
о о d
1
1
1
1
г
1
1
оо
о о со со
о о о оо
оо оо
о
о о о
о о о
ОС? О0 CDOCD
1 °
о\°
°\ °
\
1
1
Рис. 14. Относительное обилие протеобактерий в верховом торфянике
Западно-Двинского стационара
Пунктирные линии - доверительные интервалы при р = 0,95
зинном высокозольном торфянике, в то время как наибольшим
содержанием стрептомицетов (14% в среднем) отличается
дерновая почва. Коринеподобные бактерии (КПБ) являются
минорными компонентами во всех исследуемых почвах. Их доля
составляет менее 1% в почвах окраин болот и увеличивается до 4% в
высокозольном низинном торфянике. Последний тип почв
характеризуется максимальным процентным содержанием всех вышена-
167
10 I
XL
1П П п
10
6
2
г
- .ПпП
12 3 4 5
П
П
12 3 4 5
! e
in 1 1 1 1
12 3 4 5
Рис. 15. Относительное обилие разных групп бактерий в почвах
Западно-Двинского стационара
Группы бактерий: а - бейеринкии; б - миксобактерии; в - бациллы; г - коринепо-
добные; д - стрептомицеты; е - цитофаги. Типы почв: J - торфянисто-подзолистая;
2 - дерново-подзолистая; 3 - верховой торфяник; 4 - низинный нормальнозольный
торфяник; 5 - низинный высокозольный торфяник
званных бактериальных таксонов кроме стрептомицетов
(см. рис. 15). Разные типы почв отличаются друг от друга не
только по относительному обилию бактериальных таксонов, но и по
их пространственно-временной динамике. Для торфяной
низинной почвы максимальное содержание цитофаг и бейеринкии
наблюдалось на глубине 3-6 м, где они составляли иногда 35-20%
соответственно. В исследуемых полугидроморфных почвах
наблюдали диаметрально противоположную картину, характерную
для большинства зональных почв - концентрацию всех
бактериальных группировок в верхних горизонтах. Для этих почв более
четко выражена и сезонная динамика структуры бактериальных
комплексов. Так, в торфянисто-подзолистой почве цитофаги,
обнаруживаемые весной лишь в верхних горизонтах (2-8%), за
летне-осенний период распространялись по всему профилю, и их
доля увеличивалась до 10-30% в органогенных горизонтах, в
минеральных - не превышала 5%. В дерновой перегнойной почве
максимум стрептомицетов приходится на глубину 30-60 см, а их
доля увеличивалась в осенний период, когда они составляли
53-86%.
Для большинства типов почв наблюдали также тенденцию
увеличения численности и доли скользящих бактерий, бацилл и
168
коринеподобных бактерий от весны к осени. Наличие сезонной
динамики в численности и соотношении таксонов в сторону
увеличения доли гидролитиков в осенний период (актиномицеты,
бациллы, скользящие бактерии) косвенно свидетельствует об
участии этих групп бактерий в процессе деструкции растительных
остатков, хотя в целом доля бактерий гидролитического
комплекса очень мала. Особого внимания заслуживает анализ
таксономического состава цитофаг, среди которых доминируют целлю-
лозоразрушающие виды. Следует заметить, что виды рода
Cytophaga довольно четко можно определить по пигментации
колоний, реакции на пигмент флексирубин, наличии или
отсутствии уреазы, каталазы, оксидазы и некоторым физиолого-биохи-
мическим особенностям (Bergey's manual..., 1994). В результате
идентификации 30 штаммов культур цитофаг, выделенных из
исследуемых почв, они были отнесены к следующим видам:
Cytophaga aurantiaca, С. flevescens, С. psychrophila и С. succinicans. Все
эти виды, согласно их первоначальному описанию, были
выделены из воды, а вид С. succinicans является, кроме того, и
факультативно-анаэробным. Бактерии рода Sporocytophaga были
определены нами как виды Sp. flava и Sp. cauliformis. Последний вид
также является факультативно-анаэробным. Таким образом,
выделение цитофаг-гидробионтов, в том числе и редких среди
цитофаг факультативно-анаэробных видов, из гидроморфных почв
с пониженным содержанием кислорода представляется
неслучайным.
Все выделенные штаммы рода Beijerinckia, образующие
характерные колонии в виде возвышающихся из плотной слизи
"башен", принадлежат к одному виду - Beijerinckia mobilis (Bergey's
manual ..., 1994). Следует отметить способность бактерий этого
рода и вида, в том числе, расти при низких значениях рН в среде,
отсюда понятна приуроченность именно этих бактерий к
исследуемым кислым почвам, в то время как близкий "родственник" -
Azotobacter - обнаруживается лишь в нейтральных почвах.
Поскольку бациллы являются характерными компонентами
лесных почв, а их видовой состав меняется при переходе от
северных почв к южным (Мишустин, 1954), представлялось
целесообразным определить их видовой состав в болотных почвах. Кроме
типичного для почв северных лесов вида В. cereus нами были
обнаружены виды В, lentus и B.firmus, образующие колонии с
розовой и оранжевой пигментацией и, по-видимому, характерные для
мхов и торфов. Детальное описание этих культур и их видовые
диагнозы даны нами ранее (Надирова и др., 1992). Из низинных
торфяников были также выделены бациллы как с круглыми, так
и овальными спорами, формирующимися в спорангиях плектри-
169
диального типа. Они были определены нами как виды В. sphaeri-
cus и В. circulans. Последний вид также является факультативно-
анаэробным. Обращает на себя внимание очень небольшая доля
и разнообразие коринеподобных бактерий, обнаруженных лишь
в высокозольном низинном торфянике. Только в этом типе гид-
роморфных почв встречается артробактер, отсутствующий во
всех других типах исследованных нами почв. Родококки
представлены банальным эвритопным видом R. erytropolis, выделяемым
в качестве минорного компонента из различных субстратов и
почв. Целлюломонады обнаружены лишь в подстилке и верхних
горизонтах низинного высокозольного торфяника, а
микрококки, представленные видами A/, roseus и М. agilis, приурочены, в
основном, к живым растениям.
Таким образом, уточнение таксономического состава
бактериальных блоков гидроморфных и сопряженных с ними полугид-
роморфных почв на родовом и видовом уровне позволило
выявить особенности эколого-таксономической структуры прока-
риотных комплексов в этих биотопах. Она заключается, кроме
явного доминирования протеобактерий, в особом видовом
составе цитофаг, спороцитофаг и бацилл, среди которых
значительную долю составляют факультативно-анаэробные виды.
Установленная нами высокая концентрация простекобактерий
коррелирует с континуальным профильным распределением целлюлозо-
разрушающих бактерий в торфяниках. Это не случайно, так как
известно, что простекобактерий являются постоянными
спутниками целлюлозоразрушающих бактерий и образуют с ними
прочные ассоциативные связи (Васильева, 1984). Спектр родов и
видов в бактериальных сообществах исследуемых
биогеоценозов отражает адаптацию бактерий к обитанию в земноводных
ландшафтах с пониженным содержанием кислорода и кислой
реакцией среды.
В результате сравнения 5-ти типов сопряженных почв по
частоте встречаемости и относительному обилию в них
бактериальных таксонов, были установлены разные типы
бактериальных сообществ болот и почв окраин болот, характеризующиеся
увеличением доли бактерий гидролитического комплекса
(скользящие бактерии, бациллы, целлюломонады, стрептомицеты) в
ряду: торфянисто-подзолистая почва-дерновая-верховой
торфяник-низинные торфяники. Это связано с одновременным
увеличением содержания органического вещества в почвах
торфяников, состоящих преимущественно из растительных остатков
разной степени разложения, в деградации которых принимают
участие и бактерии гидролитического комплекса (Добровольская,
Головченко, 1999).
170
Окский государственный заповедник. Особенностью
территории этого заповедника являются эоловые формы рельефа
междуречий и песчаные почвы, сформировавшиеся на древнеаллю-
виальных и приледниковых песчаных отложениях. Исследовали
5 типов биогеоценозов и почв, расположенных на разных
элементах рельефа: ельник-кисличник на
мелко-торфянисто-подзолистой почве водораздела; сосняк-беломошник на поверхностно-
подзолистой почве 2-й надпойменной террасы; сосняк-зелено-
мошник на дерново-слабоподзолистой почве 1-й надпойменной
террасы, пойменная дубрава на аллювиально-дерновой почве в
пойме р. Пра; пойменный злаково-разнотравный луг на аллюви-
ально-дерново-луговой почве. Образцы отбирались (как и в
других заповедниках) с учетом вертикально-ярусной структуры
биогеоценозов, т.е. анализировались все субстраты в пространствен-
но-сукцессионном ряду от живых частей растений до
минеральных горизонтов почв. Определяли численность и
таксономический состав блока аэробных и факультативно-анаэробных
бактерий в динамике с учетом как пространственных, так и временных
(сезонных) факторов (Добровольская и др., 1995).
Анализ профильного распределения бактерий отражает
характерную для лесных биогеоценозов картину постепенного
убывания плотности бактериальных популяций от подстилок
(107-109 КОЕ/г) к минеральным нижним почвенным горизонтам
(КИ-Ю6 КОЕ/г). Сезонные колебания численности бактерий
характерны в основном для подстилок, т.е. для самых динамичных
фитоценотических горизонтов, и определяются, главным
образом, влажностью. Установлено, что биотопами с максимальной
концентрацией микроорганизмов являются лесные подстилки и
дернина (пойменный луг). В почвенном ярусе всех исследуемых
типов почв численность бактерий на порядок меньше. Такой
характер вертикального распределения микроорганизмов является
типичным для большинства почв разных климатических зон
(Полянская, 1996).
Анализ частоты встречаемости бактерий различных родов в
вертикально-ярусной структуре разных типов БГЦ показал
резкие изменения этого показателя во времени. Так, при анализе
субстратов сухой осенью 1992 г. (40 мм осадков), каждый из
8 учитываемых бактериальных таксонов имел свои,
различающиеся показатели частоты встречаемости в напочвенном и
почвенном ярусах (рис. 16). В почвенном ярусе частота
встречаемости бактерий различных родов убывала от стрептомицетов до
цитофаг. В напочвенном ярусе наблюдали противоположную
картину. Осенью 1993 г., характеризующейся затяжными
дождями (120 мм осадков), наблюдали совершенно иную картину в со-
171
I
1
100
80
60
40
20
0
20
40
60
80
100
б
Ws
%&
ШЬ
12 3 4 5 6 7 8
Рис. 16. Встречаемость бактериальных доминантов в надземном (/) и подземном
(//) ярусах лесных биогеоценозов Окского заповедника в сухую (а) и влажную
(б) осень
Бактерии: 1 - стрептомицеты; 2 - миксобактерии; 3 - спириллы; 4 - родококки и
микрококки; 5 - бациллы; 6 - цитофаги; 7 - коринеподобные; 8 - целлюломонады
отношении бактериальных таксонов в вертикально-ярусной
структуре БГЦ: каждый из исследуемых таксонов имел равную
частоту встречаемости как в напочвенном, так и в почвенном
ярусах.
Таким образом, повышенная влажность способствует
проникновению бактерий, характерных для растений, либо
подстилок, в почвенные горизонты и, наоборот, нетипичные для филло-
сферы бактерии - бациллы и стрептомицеты, обнаруживаются
на растениях. В результате различия, существовавшие в
структуре бактериальных комплексов между ярусами, сглаживаются
(Павлова, 1998).
Перестройка таксономического состава бактериальных
комплексов в зависимости от влажности прослеживается наиболее
четко при использовании такого показателя экологического
разнообразия как частота доминирования. Во влажные сезоны (ле-
172
а
* 80
I 4°
в °
g
Й 80
| 40
i 2 5 4 .
ifa
б
iHnn in
.11. II .11. 1 \VA YAVA
5 6 7 8 12 3 4 5 6 7 8
Рис. 17. Спектр потенциальных бактериальных доминантов в двух типах
ландшафтов Окского заповедника в сухую (/) и влажную (//) осень {а - хвойные
леса террас; б - пойменные ландшафты)
Бактерии: 1 - спириллы; 2 - бациллы; 3 - миксобактерии; 4 - кори не подобные;
5 - цитофаги; б - стрептомицеты; 7 - родококки и микрококки; 8 - целлюломонады
то и осень 1993 г.) с максимальной частотой доминирования на
всех типах растений: мхах, хвое, листьях деревьев и кустарников,
травах - во всех типах исследуемых фитоценозов обнаруживали
спириллы (рис. 17). Сухой осенью 1992 г. в бактериальном
комплексе филлопланы доминировали другие группы бактерий -
скользящие и коринеподобные. Аналогичную картину замены
доминантов в бактериальном комплексе при переходе от сухого
к влажному периоду наблюдали при анализе нижних слоев
подстилки и почвенных горизонтов. При низкой влажности в этих
биотопах доминировали стрептомицеты, при высокой -
спириллы и бациллы. Таким образом, в результате обводнения
субстратов всех ярусов, наступающего после затяжных дождей,
микроорганизмы оказываются в условиях, близких к таковым в
земноводных биотопах, и, так же как в болотах, доминирующими
становятся типично водные формы бактерий - спириллы. В болотах
к спириллам присоединяются факультативно-анаэробные
бактерии, принадлежащие к различным родам (Головченко и др.,
1993). В исследуемых биотопах такие формы прокариот не
обнаружены. Кроме спирилл в переувлажненных почвах
обнаруживаются все группы бактерий, характерные для напочвенного яруса,
т.е. эпифитный комплекс, включающий различных
представителей грамотрицательных бактерий. Следует отметить, что набор
потенциальных доминантов эпифитного комплекса значительно
173
шире, чем почвенного. Это цитофаги, миксобактерии, спириллы,
разные группы коринеподобных бактерий. Часто встречаются
два бактериальных доминанта (содоминанты) в разных
соотношениях. Наиболее типичны следующие пары: спириллы-цито-
фаги и спириллы-миксобактерии.
Разные типы БГЦ, расположенные на разных элементах
рельефа (хвойные леса на террасах, дубрава и луг на поймах),
отличались по таксономическому составу доминирующих групп
бактерий лишь в засушливые периоды, когда влажность почвы
была меньше, чем общая (наименьшая) влагоемкость. В те сроки
анализа, когда почва была насыщена влагой почти до ее водо-
вместимости, бактериальные комплексы разных типов БГЦ не
отличались друг от друга по набору потенциальных доминантов
(см. рис. 17). Следует иметь в виду, что все исследуемые типы фи-
тоценозов находятся в одной климатической зоне на одной
территории, сформировавшейся в послеледниковый период, и
представляют собой ряд сопряженных БГЦ. Аналогичные
результаты были получены при сопоставлении разных типов БГЦ и
соответствующих им типов почв на территории Западно-Двинского
стационара (см. предыдущий раздел).
Сопряженность биогеоценозов и почв обусловливает
однотипность бактериального населения этих биотопов. На прокари-
отном уровне четкие различия в спектре бактериальных
доминантов обнаруживаются лишь при сравнении таких контрастных
географических зон, как, например, пустыни и болота. В
пределах одной климатической зоны, а тем более микрорайона, поиск
различий в таксономическом блоке бактерий требует перехода
на другой уровень исследований - видовой, что невозможно при
крупномасштабных экологических исследованиях. На уровне
родов и групп бактерий эпифитно-сапротрофного комплекса его
таксономический состав определяется влажностью и типом
субстрата, что и было продемонстрировано в представленных нами
данных.
Пойменные ландшафты малых рек. В предыдущих разделах
мы рассмотрели почвы, расположенные в зоне таежных лесов,
которые характеризуются разной степенью гидроморфизма, как
правило, связанной с климатическими условиями этой зоны.
Результаты анализа факторов, обусловливающих
таксономическую структуру бактериальных комплексов в этих почвах,
свидетельствуют о том, что первое место по значимости занимает
фактор влажности. Логическим продолжением таких работ явились
исследования структуры бактериальных комплексов в условиях
временного затопления почв водой, т.е. такого режима, который
характерен для пойменных почв.
174
"Поймы рек являются ландшафтами высокой плотности
жизни, высокой геохимической энергии живого вещества. В этой
связи вполне понятной становится и высокая интенсивность
почвообразовательного процесса в поймах рек. Она проявляется в
большом размере биологического круговорота элементов,
интенсивной жизнедеятельности почвообитающих животных и
микроорганизмов, в динамичности химических и биохимических
процессов, обусловливающих высокий уровень эффективного и
потенциального плодородия пойменных почв" (Добровольский,
1968, с. 4). Для разработки региональных критериев
рационального использования пойменных почв и сохранения их
биоразнообразия необходимо синтезировать знания специалистов
различных областей, в том числе и микробиологов. Однако
большинство публикаций по микробиологии пойменных почв датировано
1960-1980-ми годами. Анализ бактериальных сообществ в них
сводится к определению численности и состава на уровне
физиологических групп или отдельных родов бактерий (Бабьева, 1961,
1962; Сергунина, 1963; Laudelout et al., 1978; Kilbetrus et al., 1979;
Carballas et al., 1983).
Мы проводили исследования на полигоне Боровской учебно-
научной станции МГУ (Боровский р-н, Калужская обл.) и
Одинцовского р-на (Московская обл.). Районы относятся к умеренно-
континентальным в климатическом отношении с годовым
количеством осадков 600 мм, среднемноголетней температурой
января -10,3°, июля + 17,5°.
В качестве объектов исследования были выбраны поймы
р. Протвы (затопляемый во время половодий и паводков участок
низкой поймы и участок высокой поймы, занимающий
прирусловую часть берегового склона) и р. Медвенки. Выбранные
участки представляют собой естественные луга под злаково-разно-
травно-бобовыми ассоциациями на аллювиально-луговых
типичных тяжелосуглинистой (пойма р. Протвы) и среднесуглинистой
(пойма р. Медвенки) почвах.
Образцы отбирались в летний, осенний и зимний периоды в
пойме р. Протвы и в осенний период в пойме р. Медвенки.
Анализировались субстраты в пространственно-сукцессионном ряду:
живые части растений (стебли, листья, цветы и корни), их
отмирающие части - ветошь, почвенные горизонты, ил и речная вода.
Численность бактерий в пойменных биогеоценозах
варьировала от 105 до 109 КОЕ/г в зависимости от местоположения
образца в "вертикальном" ряду: от зеленых частей растений до
минеральных почвенных слоев (рис. 18). Максимальная
концентрация бактерий была выявлена в дернине и ветоши, минимальная -
в переходном к материнской породе горизонте ВС. Разница меж-
175
if
ев
ас
Листья
Цветки
Опад
Корни
Ad
А1
В1
ВС
к*
*<и
h-OH
5 6 7 8 9 10
Логарифм численности бактерий (КОЕ / г)
Рис. 18. Средние значения логарифма численности бактерий в субстратах
пойменных биогеоценозов
ду плотностью бактериальных группировок в верхних и нижних
слоях аллювиально-луговых почв составила 3-4 порядка.
Тип распределения численности сапротрофных бактерий по
профилю пойменных почв не отличается от большинства типов
почвенных разностей, проанализированных методом посева.
Заселенность бактериями филлосферы исследуемых пойменных
БГЦ такая же, как и в болотных БГЦ (Головченко и др., 1993)
и на порядок ниже по сравнению с лесными БГЦ (Головченко
и др., 1995). Дерновый горизонт аллювиальных почв отличается
меньшей насыщенностью бактериальной составляющей, чем
подстилки почв мезоморфного и гидроморфного рядов
почвообразования (Головченко и др., 1993, 1995; Добровольская и др.,
1995).
Мониторинг численности бактерий в различных
компонентах вертикальной структуры пойменных БГЦ (листья, стебли,
цветы, корни растений, все почвенные горизонты) в течение
двух сезонов (лето и осень) позволил составить схему двухфак-
торного дисперсионного анализа, в результате проведения
которого было показано, что численность бактерий в пойменных
БГЦ достоверно зависит от положения исследуемого образца в
пространственно-сукцессионном ряду (типа субстрата) и сезона
сбора образцов.
Так, осенью плотность бактериальных группировок на всех
частях растений была на 1-2 порядка выше, чем летом
(максимум приходился на метелки злаков). В почвенных горизонтах
сезонные колебания численности бактерий имели место только в
176
органо-аккумулятивном горизонте (А1), где отмечено
десятикратное превышение бактериального титра в летний период по
сравнению с осенним. Отсутствие заметной разницы между
численностью бактерий в различных почвенных горизонтах в
аналогичные сроки наблюдения было отмечено и в почвах пойменных
лугов Окского заповедника (Добровольская и др., 1995).
Анализ пойменных почв в зимний период выявил увеличение
численности бактерий (на порядок) в верхних гумусированных
горизонтах и отсутствие ее флуктуации в минеральных слоях.
Из гипотез, объясняющих увеличение содержания микробного
титра в промерзших почвах, можно назвать более высокую
степень десорбции клеток (Звягинцев, 1987), дробление клеток и
замедление их вымирания в этот период (Рахно и др., 1971).
Среднее информационное разнообразие в группировках
бактерий, оцененное с помощью индекса Шеннона, достоверно
определялось типом субстрата и не зависело от сезона сбора образцов
(результаты двухфакторного дисперсионного анализа, где
факторами выступали "тип субстрата" и "сезон"). Индекс Шеннона
постепенно нарастал от филлосферы к ризосфере, достигая
своего максимального значения (2,9) в дерновом горизонте (Ad);
затем постепенно снижался к иллювиальным горизонтам.
При сравнении почв высокой и низкой пойм было показано,
что разнообразие выше в горизонтах заливаемой почвы.
Исключением является дернина, в которой индекс Шеннона одинаков и
имеет максимальное значение для обоих типов пойм.
Анализ таксономического состава бактериальных
комплексов в ряду, связанном с растительными субстратами (филлосфе-
ра, ризосфера и ветошь), показал, что в поймах обеих рек в фил-
лосфере и ризосфере общими доминантами являются
пигментные коринеформные бактерии и миксобактерии, а
субдоминантами - скользящие целлюлозоразлагающие цитофаги и
миксобактерии. Значительную долю в бактериальном комплексе
ризосферы составляют бактерии рода Arthrobacter (типичные педоби-
онты). Бактериальный комплекс ветоши можно
охарактеризовать как гидролитический, так как он представлен (за
исключением спирилл) бактериями, являющимися деструкторами таких
полимеров, как целлюлоза, крахмал, хитин и др. - миксобакте-
риями, цитофагами, стрептомицетами, бациллами и целлюломо-
надами.
Для бактериального сообщества почвы заливаемой поймы
р. Протвы характерна высокая по всему профилю доля спирилл -
типичных планктонных форм, а для незаливаемой поймы этой же
реки - высокая по всему профилю доля пигментных корине-
подобных бактерий и их доминирование в дерновом горизонте
177
р. Протва,
низкая пойма
р. Протва,
высокая пойма
р. Медвенка,
высокая пойма
s
хо
о
о
о
Ю
О
§
I
ЕШД
П^П
JZL
П
12 3 4 5 6 12 3 4 5 6
12 3 4 5 6
Рис. 19. Относительное обилие таксономических групп бактерий в
генетических горизонтах аллювиально-луговых почв: Ad (я), А1 (б), В1 (в), ВС (г)
Бактерии: 1 - пигментные коринеподобные; 2 - бациллы; 3 - стрептомицеты;
4 - артробактер; 5 - спириллы; 6 - скользящие бактерии
(рис. 19). Они представлены родами Arthrobacter, Micrococcus,
Rhodococcus и Cellulomonas. Еще большая доля этих бактерий
обнаружена в профиле пойменной почвы р. Медвенки. Несмотря на
то, что пойма р. Медвенки заливается паводковыми водами, по
составу бактериального комплекса пойменная почва здесь сходна с
незаливаемым участком поймы р. Протвы. Это связано с тем, что
размер поймы р. Медвенки в 10 раз меньше, чем у р. Протвы и па-
178
водковые воды здесь быстро сходят, не оказывая существенного
влияния на состав почвенного бактериального комплекса.
Соотношение других групп бактерий - типичных педобион-
тов, таких, как Bacillus, Streptomyces и Arthrobacter, примерно
одинаково в профиле почв обеих пойм. Общей особенностью
структуры их бактериального сообщества является доминирование в
органо-аккумулятивных горизонтах почв скользящих бактерий.
Различия между исследуемыми пойменными почвами
проявляются также на уровне минорных и средних по обилию групп.
Так, почвы заливаемой поймы характеризуются большим
разнообразием компонентов этих групп в органо-аккумулятивных и в
иллювиальных горизонтах (наряду с миксобактериями эту
группу здесь составили азоспириллы, азотобактер и каулобактер).
В почвах высокой поймы спириллы всегда входят в блок
минорных компонентов бактериальных сообществ, в отличие от
низкой поймы, где доля бактерий-гидробионтов в отдельные сроки
может повышаться до 20% от общего числа бактерий.
Распределение таксономических групп бактерий по
профилям почв заливаемой и незаливаемой пойм резко различается
(рис. 20). Так, в почвах высокой поймы характер профильного
распределения - дискретный. Доля одних бактерий (типичных
педобионтов) с глубиной нарастает - роды Arthrobacter, Bacillus,
Streptomyces; других ("подстилочные формы" - скользящие и
пигментные коринеформные бактерии) - уменьшается с глубиной.
Относительное обилие бактерий-гидробионтов - спирилл - в
этих почвах невысокое и мало меняется по профилю.
Аналогичное распределение таксономических групп бактерий можно
наблюдать в различных почвах водораздельных территорий, не
испытывающих длительного переувлажнения.
Иной характер распределения - континуальный, отмечен
для почв низкой поймы. Периодическое затопление
паводковыми водами способствует проникновению в нижележащие
горизонты бактерий, характерных для растений и верхних
органо-аккумулятивных горизонтов, что, в свою очередь, способствует
более равномерному распределению по профилю большинства
учитываемых групп бактерий. Следует также отметить
высокую, по сравнению с незатопляемыми пойменными почвами,
долю спирилл, чутко реагирующих на избыток влаги в любой
почве. Высокий процент спирилл и равномерное распределение
бактерий различных таксонов по профилю сближают
периодически затапливаемые аллювиальные почвы с торфяниками (Го-
ловченко и др., 1993).
Почвы заливаемой поймы различаются не только
пространственной выравненностью бактериальных сообществ, но и вре-
179
Относительное обилие, %
а б
О 20 40 60 80 100 0 20 40 60 80 100
ШШ1 НН2 ЕЭ5 Е=Н Ш5 I \б
Рис. 20. Распределение бактерий различных таксонов по профилю пойменных
почв высокой (а) и низкой (б) пойм
Бактерии: J - Aquaspirillum; 2 - скользящие; 3 - Bacillus; 4 - Streptomyces\ 5 - Arthro-
bacten б- коринеформные
менной, так как по сезонам доли и соотношение бактериальных
таксонов практически не меняются. В отличие от почв низкой
поймы, в почвах высокой поймы имеет место сезонная динамика
некоторых таксономических групп:
- доминирование артробактера (38% от общего числа
бактерий) отмечено в летний период;
- к осени возрастает доля бактерий-деструкторов (бацилл,
миксобактерий и цитофаг);
- спириллы выявляются только в зимний период, когда
почвы высокой поймы переувлажнены обильными осенними
осадками и покрыты снежным покровом; к зиме увеличивается и доля
стрептомицетов (с 22% до 38%), возможно за счет накопления в
почвах покоящихся форм.
Поскольку поймы испытывают периодическое затопление
паводковыми водами, был проанализирован также
таксономический состав бактерий в речной воде. Разнообразие
бактериального сообщества воды гораздо ниже, чем почвенных горизонтов.
Чтобы выяснить, насколько стабилен состав бактериального
сообщества на различных участках русла, определялся состав до-
180
Филлосфера
наземных растений
Ризосфера
наземных растений
Дернина
32 г
24|-
16
8h
Л_Л-
LnlL
liiii i
1дП_
Jl
mm
о
о
5
I
32
24
16
8
О
Филлосфера
водных растений
б
Ризосфера
водных растений
Ил
ШНШПп- пШНПпп II 1пПпП111 и
123456789 1011 123456789 1011 123456789 1011
Рис. 21. Относительное обилие таксономических групп бактерий в наземных (а)
и водных (б) субстратах пойменных биогеоценозов
Бактерии: 1 - факультативно-анаэробные; 2 - родококки; 3 - коринеподобные;
4 - спириллы; 5 - миксобактерии; 6 - цитофаги; 7 - азоспириллы; 8 - артробактер; 9 -
бациллы; 10 - стрептомицеты; // - олиготрофные бактерии
минантов в воде р. Медвенки. Установлено, что спектр
потенциальных доминантов в речной воде довольно стабилен и
представлен спириллами, цитофагами и миксобактериями. Наблюдается
лишь смена доминантов: во все сезоны, кроме осени,
доминируют спириллы, а осенью - скользящие бактерии. Спириллы
выделяются во все сезоны и в почве заливаемой поймы р. Протвы,
а скользящие бактерии являются доминантами в дерновом
горизонте. Таким образом, на таксономическую структуру
бактериальных комплексов пойменных почв оказывают влияние
паводковые воды, с которыми приносятся бактерии, характерные для
речной воды.
Помимо определения бактериального сообщества речной
воды был проанализирован таксономический состав бактерий
в филлосфере и ризосфере водных растений, а также в иле
(рис. 21). Отличительной чертой бактериальных сообществ
водных растений и донных отложений является присутствие в их со-
181
mil щи ш* ? <
Рис. 22. Частота встречаемости таксономических групп бактерий в различных
типах субстратов пойменных биогеоценозов %:
У - 75-100; 2 - 33-67; 3 - 8-17; 4 - 0
ставе факультативно-анаэробных бактерий семейства Vibriona-
сеае. Эти бактерии являются доминантами на листьях и стеблях
водных растений, субдоминантами - на корнях, а в иле входят в
группу минорных компонентов. Кроме обнаружения
факультативно-анаэробных бактерий, следует отметить более высокий
процент спирилл и родококков на водных растениях по
сравнению с травянистыми растениями пойменных БГЦ, а также
высокое относительное обилие (50% от общей численности
бактерий) бентосных форм бактерий (миксобактерии и цитофаги)
в иле.
Охарактеризовать структуру бактериальных комплексов в
объеме всего биогеоценоза (всех ярусов) можно с помощью
таких синэкологических показателей, как частота встречаемости
(ЧВ) и частота доминирования (ЧД) таксономических групп.
Анализ субстратов с учетом выделенных по частоте
встречаемости родов бактерий (рис. 22) позволил выявить как общие,
так и дифференцирующие черты в таксономической структуре
бактериальных сообществ различных ярусов.
Общим является то, что практически из всех анализируемых
субстратов пойменных БГЦ с высокой долей вероятности
выделяются пигментированные коринеформные бактерии и
миксобактерии.
Дифференцирующие черты: в филлоярусе наиболее часто
встречались яркоокрашенные формы скользящих и корине-
182
формных бактерий; особенностью этого яруса можно считать
обнаружение спирилл и азоспирилл в 50% проанализированных
образцов. Ветошь и корни занимают промежуточное положение
между филлосферой и почвенным ярусом по структуре
бактериальных сообществ, причем ветошь по частоте встречаемости
таксономических групп ближе к растительным субстратам, а
корни - к почвенным. Органо-аккумулятивные горизонты -
субстраты, где частота встречаемости большинства учитываемых групп
относится к первой категории, т.е. максимальна. Здесь с высокой
долей вероятности можно встретить и представителей филло-
сферы, и типичных педобионтов (стрептомицеты, бациллы, арт-
робактер). Специфика минеральных горизонтов исследуемых
почв проявляется в обнаружении в этих субстратах азотобактера
и невысокой частоте встречаемости скользящих и пигментных
коринеформных бактерий.
Более информативным показателем для сравнения
типологии бактериальных сообществ различных ярусов оказался спектр
потенциальных доминантов. В филлосфере он представлен
максимальным (7) количеством таксономических групп, из которых
наиболее значимыми являются пигментные коринеформные
бактерии (роды - Arthrobacter, Cellulomonas, Promicromonospora,
Rhodococcus) и миксобактерии. В ризосфере потенциальными
доминантами были представители трех бактериальных
группировок, две из которых являются общими с филлосферой ("желтые"
КПБ и миксобактерии) и одна (артробактер) - с почвенными
горизонтами. Следует отметить, что набор потенциальных
доминантов почвенного яруса уже эпифитного и включает 5 таксонов.
Отличие типа бактериальных сообществ этого яруса от
остальных проявляется в доминировании здесь характерных
педобионтов - бацилл и стрептомицетов.
С целью выявления спектра бактерий, способных проводить
процессы деструкции растительных полимеров, изучен
гидролитический комплекс бактерий ветоши, корней и гумусовых
горизонтов пойменных почв. С помощью метода репликаторов
(Kauri, 1980) определялись численность и таксономическая
принадлежность бактерий, участвующих в разложении лецитина,
твина, белков, крахмала, микробной биомассы (дрожжей и
бактерий), карбоксиметилцеллюлозы (рис. 23).
Осенью в исследуемых субстратах максимальной по
содержанию (от 106 КОЕ/г в Ad до 104 КОЕ/г в А1) была группа
бактерий, обладающих протеазной, липазной и лецитиназной
активностью. В результате идентификации этих бактерий они
были отнесены к родам Bacillus (виды В. cereus и В. cereus var. my-
coides), Aquaspirillum и порядку Myxobacterales. Далее, в порядке
183
si
h
Ветошь
:/
Корни И
I!
a
й"
Ad
Al
^2
¦¦ 3
^^^g^^g
^\\\\\\\\\N
^^"
3 4 5 6 7
Логарифм численности бактерий (КОЕ/г)
Рис. 25. Численность бактерий гидролитического комплекса в различных
субстратах пойменных биогеоценозов:
/ - протеолитические; 2 - амилолитические; 3 - целлюлолитические
убывания численности, следовала группа амилолитических
бактерий, представленная скользящими бактериями (миксобакте-
риями и цитофагами) и стрептомицетами. Титр бактерий (мик-
собактерий, бацилл и стрептомицетов), утилизирующих карбок-
симетилцеллюлозу (КМЦ), оказался минимальным в органо-ак-
кумулятивном горизонте А1 (103 КОЕ/г). Основная масса этих
бактерий сосредоточена в ветоши и дерновом горизонте, где
наиболее напряженно идут процессы разложения растительного
опада.
Известно, что в почве всегда имеется пул микроорганизмов,
экологическая функция которых сводится к поддержанию го-
меостатического состояния в почве. Эти функции могут быть
обеспечены за счет поочередного преимущественного развития
той или иной функциональной группы микроорганизмов. В
разрушении целлюлозы, хитина и реутилизации микробной
биомассы могут участвовать миксобактерии, цитофаги, бациллы,
стрептомицеты; целлюломонады и промикромоноспоры. Роль
стрептомицетов и бацилл, безусловно, выше в почвенных
горизонтах, представителей остальных групп - в ярусах, связанных
с растениями (филлосфера, ризосфера, ветошь, дернина). Родо-
кокки, артробактер, спириллы способны усваивать
алифатические и ароматические соединения. Следует также отметить, что
спириллы - типичные компоненты переувлажненных почв,
оказались способными к расщеплению лецитина и твина, что указы-
184
вает на их возможную функциональную роль в качестве липоли-
тических агентов в пойменных почвах. Ранее было показано,
что эту функцию спириллы выполняют в дерново-глеевой
почве, также испытывающей переувлажнение (Добровольская,
Меньших, 2000).
Анализ различных синэкологических показателей (общая
численность бактерий, среднее информационное разнообразие,
относительное обилие, частота встречаемости, частота
доминирования таксономических групп бактерий, пространственная и
временная вариабельность и т.д.), позволил выявить как общие
(сближающие пойменные луга с другими типами экосистем), так
и специфические черты бактериальных сообществ пойменных
БГЦ.
Численность и таксономический состав бактериальных
комплексов пойменных биогеоценозов, как и других типов БГЦ,
изменяется по ярусам (субстратам) и по сезонам. Тип
распределения численности бактерий по компонентам ярусной структуры
пойменных лугов не отличается от такового в лесах:
бактериальный титр нарастает от филлосферы к ярусам, связанным с
переработкой опада (ветошь, дернина, подстилка) и
уменьшается вниз по профилю в соответствии с убыванием корневой
массы и органических веществ. В пойменных почвах разница между
плотностью бактериальных группировок в верхних и нижних
почвенных слоях составила 3-4 порядка, что связано с резким
убыванием гумуса вниз по профилю и неглубоким
проникновением в почвенную толщу корней трав и злаков, имеющих
мочковатую корневую систему.
Что касается сезонной динамики численности бактерий в
различных ярусах пойменных биотопов, то в них, также как в
лесных и болотных (Головченко и др., 1995, 2000), был отмечен
осенний пик численности, связанный с опадом, слущиванием
и разложением отмирающих частей растений. В
таксономической структуре бактериального комплекса в этот период
происходит сдвиг в сторону увеличения бактерий-гидролитиков (для
пойменных почв - миксобактерий, цитофаг, стрептомицетов,
целлюломонад). Наиболее отчетливо эта особенность
проявилась в почвенных горизонтах высокой поймы, тогда как в почве
низкой поймы, из-за периодической промываемости профиля,
соотношение и доли таксономических групп практически не
менялись по сезонам.
В смене таксономических групп бактерий по вертикальной
структуре различных БГЦ наблюдается природный континуум
бактериальных сообществ, создаваемый бактериальными
таксонами, ассоциированными с живыми растениями, которые в
185
большем или в меньшем количестве обнаруживаются во всех
ярусах (Звягинцев и др., 1991, 1993). Для лесных
биогеоценозов - это спириллы, псевдомонады, флавобактерии, энтеробак-
терии и коринеподобные бактерии (как минорный компонент).
Особенность пойменных биотопов состоит в том, что
континуум здесь создается миксобактериями и пигментированными ко-
ринеподобными бактериями (роды Arthrobacter\ Promicromo-
nospora, Cellulomonas, Rhodococcus). Эта группировка составляет
в филлосфере > 60% от общей численности бактерий, в
дернине и ветоши - > 40%, в почвенных горизонтах - > 20%. Следует
также отметить высокую частоту встречаемости (75-100%)
этих бактерий во всех ярусах, кроме иллювиальных горизонтов
почвенного яруса, где процент их встречаемости варьировал от
30 до 67.
На фоне бактерий, создающих континуум бактериальных
сообществ в пойменных БГЦ, происходит смена (в почвенном
ярусе) или перегруппировка (в дернине) ярусных доминантов, что
позволяет говорить о дискретности бактериальных сообществ в
вертикальной структуре - еще одной закономерности в
распределении бактерий по ярусам в наземных экосистемах (Звягинцев и
др., 1991, 1993).
Общие доминанты почвенного яруса пойменных и лесных
биотопов - спириллы, бациллы и стрептомицеты. В спектр
потенциальных доминантов пойменных почв, кроме
вышеназванных бактерий, вошли миксобактерии и артробактер.
Доминирование спирилл и миксобактерии в пойменных почвах
(находящихся периодически в аквальных условиях), как и в почвах гид-
роморфного ряда почвообразования, связано с длительным
переувлажнением. Следует также отметить, что и в пойменных
почвах заливаемой поймы, и в торфяниках наблюдается
равномерное распределение по профилю различных таксономических
групп. Но если в торфяниках такой характер распределения
связан, в большей мере, с органогенной природой торфов (Голов-
ченко и др., 1993), то в аллювиально-луговых почвах - с
промывным режимом, возникающим благодаря легкому механическому
составу иллювиальных горизонтов (супесь и песок) и
длительному нахождению этих почв под водой.
Доминирование артробактера характерно не только для
исследуемых (с нейтральной реакцией среды), но и для
большинства типов почв (Звягинцев др., 1991; Добровольская и др.,
1996). Считается, что артробактер "чувствителен" к низким
значениям рН среды и поэтому не обнаруживается в кислых
подзолистых почвах и торфяниках. Мы предполагаем, что
отсутствие бактерий этого рода в вышеназванных биотопах связа-
186
но с другими факторами - ингибирующим влиянием фенольных
соединений, содержащихся как в хвойном опаде, так и
сфагновом мхе.
В любом типе БГЦ можно выделить ярус, где общая
численность и разнообразие бактерий характеризуются
максимальными значениями (Звягинцев и др., 1991,1993). Для лесных и
болотных экосистем - это подстилки (Головченко и др., 1993, 2000),
для пойменных биотопов - ветошь (максимальная численность)
и дернина (максимальное разнообразие). Дернина пойменных
почв - субстрат, в котором относительное обилие, частота
встречаемости большинства таксономических групп бактерий, а
также индекс Шеннона, характеризующий среднее информационное
разнообразие, достигают наибольших величин. Ветошь
пойменных лугов характеризуется не только максимальной
численностью, но и высокой долей (80%) в бактериальном сообществе
группы бактерий-гидролитиков (миксобактерий, цитофаг,
бацилл, стрептомицетов и целлюломонад).
Таким образом, особенностями пойменных БГЦ следует
считать: максимальную численность бактерий в ветоши;
обнаружение во всех ярусах миксобактерий и пигментных коринеподоб-
ных бактерий; максимальное разнообразие бактериального
сообщества в дернине.
Бактериальные сообщества почвы низкой поймы
отличаются от таковых почв высокой поймы величиной индекса Шеннона
(выше в целом для низкой поймы, за счет минорных и средних по
обилию групп); долей бактерий гидробионтов (выше для низкой
поймы), характером распределения по профилю
таксономических групп бактерий (в низкой почве - континуальный, в
высокой - дискретный); сезонной динамикой таксономических групп
бактерий (в низкой пойме - отсутствует, в высокой - имеет
место только для некоторых групп бактерий).
Фитосфера водных растений, речная вода и ил отличаются
от фитосферы наземных растений и почв меньшим
бактериальным разнообразием и высокой долей
факультативно-анаэробных протеобактерий и спирилл в исследуемом
бактериальном блоке. В воде обеих исследованных рек на их различных
участках и во все наблюдаемые сезоны доминируют спириллы,
а осенью - скользящие бактерии. Аналогичная сезонная
динамика в смене доминантов наблюдается и в бактериальном
сообществе заливаемой поймы, что свидетельствует о влиянии
поемного режима на состав бактериального комплекса
пойменных почв.
187
2.5. АНАЛИЗ ДИНАМИКИ СТРУКТУРЫ
БАКТЕРИАЛЬНЫХ СООБЩЕСТВ
И БАКТЕРИАЛЬНОГО РАЗНООБРАЗИЯ ПОЧВ
МЕТОДОМ СУКЦЕССИОННОГО АНАЛИЗА
Одним из методов оценки микробного разнообразия почв
является сукцессионный анализ микробных сообществ. Для
осуществления такого анализа в лаборатории проводят моделирование
различных режимов с целью повышения полноты учета
бактериального разнообразия, и выявления того специфического типа
сообщества, который отражает его адаптацию к условиям,
складывающимся в данном типе почв.
Ранее нами применялись варианты сукцессионного анализа с
выдерживанием свежеотобранных образцов в лаборатории при
постоянной влажности (60% от полевой влагоемкости) для
изучения бактериального разнообразия почв Центрально-Лесного
государственного биосферного заповедника (Алехина и др., 1997,
2001; Алехина, Добровольская, 1999). Показано, что при
выбранных условиях не происходит значительного изменения в
таксономической структуре бактериальных комплексов исследуемых
почв во времени. Анализ результатов, полученных в этих
опытах, послужил основанием для внесения изменений в постановку
опыта: образцы почвы предварительно высушивались, а затем
регидратировались. Однако предстояло еще решить вопрос о
том, как влияют процесс высушивания и сроки хранения
почвенных образцов в высушенном состоянии на сохранение исходного
бактериального разнообразия в них.
Динамика структуры бактериальных комплексов в процессе
высушивания почвенных образцов. От того каким образом
высушиваются и в течение какого срока хранятся почвенные образцы
в воздушно-сухом состоянии, будут зависеть результаты
оценки бактериального разнообразия при регидратации этих
образцов. С этой целью высушивали образцы гор. А1 дерново-глеевой
почвы при двух разных режимах: на воздухе в чашках Петри с
закрытой крышкой до воздушно-сухого состояния (2-3%) и в
эксикаторе над насыщенным раствором K2S04 до максимальной
гигроскопической влажности (5-6% - абсолютная влажность).
Абсолютная влажность исходных образцов - 65%. Периодически
отбирались для посева навески (1г) почвы на разных этапах ее
высушивания (0, 3, 8, 20, 80, 120, 180, 240-е и 360-е сут. от начала
высушивания). Численность и таксономический состав
бактериального комплекса определяли методом посева.
Независимо от режимов высушивания наблюдали сначала
(в течение 40 суток от начала опыта) плавное падение влажности
188
50 100 150 200 250
Сутки
100 200 300 400
Сутки
Рис. 24. Динамика влажности в образцах дерново-глеевой почвы при разных
способах высушивания
1 - быстрое высушивание; 2 - медленное высушивание
Рис. 25. Динамика бактериального разнообразия при разных способах
высушивания образцов дерново-глеевой почвы
У - быстрое высушивание; 2 - медленное высушивание
Рис. 26. Динамика относительного
обилия грамположительных (2) и
грамотрицательных (7) бактерий при
высушивании образцов
дерново-глеевой почвы
200 300
Сутки
400
исследуемой почвы, а затем - ее резкое уменьшение (рис. 24).
Почва достигала 2-3% влажности на 80-е сутки при высушивании
на воздухе (в чашках Петри с закрытыми крышками) и 5-6% на
160-е сутки при высушивании в эксикаторе. В течение
последующих 200 суток хранения влажность почвы сохранялась на этих
уровнях. Изменение численности бактерий сапротрофного
комплекса коррелировало с падением влажности почвы: наблюдали
уменьшение плотности популяций в 2-3 раза со стабилизацией на
уровне 3-4 млн/г при высушивании на воздухе и 5-6 млн/г при
высушивании почвы в эксикаторе, в последнем случае наблюдали
синусоидные колебания численности в течение всего года.
В процессе высушивания почвы происходит снижение
бактериального разнообразия: индекс Шеннона постепенно снижался
от 2 до 1 (рис. 25). Как и численность бактерий, разнообразие
снижается более плавно при медленном высушивании почвы,
т.е. в эксикаторе. Однако общее информационное разнообразие
189
никак не отражает те изменения, которые происходят в
сообществе в связи со сменой условий его существования. Для этого
необходимы наблюдения за перестройкой иерархической
структуры сообщества. На уровне таксонов высокого ранга изменения
заключаются в постепенном снижении доли грамотрицательных
протеобактерий с одновременным увеличением обилия грампо-
ложительных бактерий (рис. 26). Аналогичные изменения в
бактериальном комплексе почв при их высушивании были
неоднократно описаны в работах Н.А. Красильникова, Е.Н. Мишусти-
на и других авторов. В настоящем исследовании предпринята
попытка анализа динамики структуры почвенных бактериальных
комплексов на родовом уровне.
В течение первых 20 сут. высушивания спектр
грамотрицательных бактерий включал представителей следующих родов:
Azotobacter, Cytophaga, Alcaligenes, Chromobacterium, ассоциацию
Myxobacterales с Aquaspirillum, группу диссипотрофов (Caulo-
bacter и почкующиеся бактерии). Среди протеобактерий
доминировали либо миксобактерии в ассоциации со спириллами (8-е и
20-е сут.), либо Azotobacter (0-е сут.). Среди актинобактерий
были обнаружены представители родов Rhodococcus, Arthrobacter,
Streptomyces, но их доля в бактериальном сообществе почв не
превышала 10-12%. На 80-120-е сут. (в зависимости от типа
высушивания) структура бактериального сообщества исследуемой
почвы существенно изменялась: доминантов нет,
протеобактерий и актинобактерий представлены примерно равными долями,
но почва еще оставалась пригодной для выделения из нее
большинства форм бактерий, которые присутствовали во влажной
почве. При последующем высушивании почвы (160-е сут. и
далее) в почве остаются лишь актинобактерий и бациллы. При
этом 40-55% составляют стрептомицеты, далее в порядке
убывания следуют артробактер - 20-32% и бациллы - 10-20%. В
качестве минорных компонентов из сухой почвы выделяют также ро-
дококки и представители рода Nocardioides (120-е и 360-е сут.
опыта соответственно).
Интересным представляется факт выживания спирилл в
сухой почве - они сохраняются в слизи миксобактерии,
устойчивых к высушиванию благодаря образованию цист. Ассоциация
миксобактерии со спириллами выделялась на всех стадиях
высушивания почвы вплоть до 1 года опыта, хотя их доля в
сообществе неизменно уменьшалась. Для объяснения поведения споро-
образующих бактерий рода Bacillus в процессе высушивания
почвы нужны дополнительные исследования, так как
необходимо знать, в каком состоянии они находятся в почве - активном
(вегетативные клетки) или покоящемся (в виде спор).
Возможно
но, что доминирование бацилл во влажной почве (на 3-е сут.)
связано с их активным размножением, а на 120-е сут. - с
накоплением спор в почве.
Можно предположить, что в связи с прогнозируемым
всеобщим потеплением климата (Добровольский, Куст, 1995) в
структуре бактериального комплекса гидроморфных почв будет
происходить значительная перестройка в сторону увеличения доли
устойчивых к высушиванию бактерий (бацилл и актинобакте-
рий) и уменьшения содержания протеобактерий. Такой прогноз
основывается не только на рассмотренных выше результатах
модельного опыта, но и на наблюдениях за сезонной динамикой
бактериальных комплексов почв Окского заповедника,
расположенного, как и ЦЛГБЗ, в подзоне южной тайги (Добровольская
и др., 1995). Так как почвы Окского заповедника имеют легкий
механический состав, оказалось возможным наблюдать за
изменениями в бактериальных комплексах, которые происходят в
почвах после летних дождей в процессе естественного быстрого
высушивания. В зависимости от влажности почв, определяемой
количеством выпавших за сезон осадков, в бактериальном
комплексе доминируют либо спириллы с миксобактериями (во
влажные периоды), либо стрептомицеты и коринеформные бактерии
(в засушливые периоды).
Таким образом, как при естественном, так и искусственном
высушивании почв наблюдается одна и та же картина:
перестройка таксономической структуры бактериального
сообщества почв с увеличением доли грамположительных бактерий -
актинобактерий и бацилл, устойчивых к высушиванию. Эти
формы бактерий принадлежат к эколого-трофической
группировке гидролитиков, способных осуществлять разложение
различных полимеров. Поэтому вероятно, что в процессе
глобального потепления климата, сопровождаемого уменьшением
осадков в подзоне южной тайги, процесс бактериального
разложения опада будет интенсифицироваться. Данные,
полученные нами относительно сроков сохранения исходного
биоразнообразия при высушивании почвы (2-3 мес. в зависимости от
типа высушивания), могут быть использованы для решения
вопросов пригодности для микробиологического анализа
почвенных образцов, хранящихся в высушенном состоянии. Однако
для разных типов почв такие показатели будут, по-видимому,
разными.
Динамика структуры бактериальных комплексов при
инициации сукцессии увлажнением почвы. В качестве объектов
исследования использовали органо-аккумулятивные горизонты трех
типов почв, контрастных по характеру водного режима и фито-
191
ценозу: бурозем (гор. Ahf) и дерново-глеевая (гор. А1) почвы из
ЦЛГБЗ Тверской обл. и чернозем (гор. А) из Ростовской обл.
Бурозем сформирован под ельником сложным на выпуклых
элементах склонов на моренном суглинке, имеет кислую
реакцию среды и супесчаный гранулометрический состав,
содержание гумуса 4,5%. В этой почве не происходит длительного застоя
влаги из-за интенсивного внутрипочвенного стока.
Дерново-глеевая легкосуглинистая почва формируется в
долине ручья под ольшаником страусниково-таволговым; почвооб-
разующей породой служит пылеватый легкий суглинок,
подстилаемый карбонатной мореной. Почва имеет нейтральную
реакцию среды и характеризуется высоким содержанием гумуса -
6,8%.
Чернозем южный находится на водоразделе под злаково-раз-
нотравной растительностью, имеет суглинистый состав и
слабощелочную реакцию среды, содержание гумуса 7,7%.
Почвы высушивали до воздушно-сухого состояния, а потом
инициировали сукцессию увлажнением до двух уровней
влажности: максимальной капиллярно-сорбционной влагоемкости
(МКСВ) и капиллярной влагоемкости (KB). Образцы почв
помещали в чашках Петри в эксикатор и поддерживали влажность на
постоянном уровне. Периодически отбирали и анализировали
навески почвы (1 г) в разные сроки сукцессии (0-е, 10-е, 20-е, 40-е,
70-е, 100-е, 170-е сут.). Начало опыта (нулевые сутки)
соответствует воздушно-сухому состоянию.
Численность и таксономический состав бактериального
комплекса выявляли методом посева, описанным выше. Основная
гидрофизическая характеристика (ОГХ) определялась в
интервалах низких давлений адсорбционно-статическим методом над
насыщенными растворами солей и в интервалах высоких давлений
с помощью зондового капилляриметра (Воронин, 1986). На
основании ОГХ были рассчитаны некоторые водно-физические
свойства почв (табл. 7). Зависимость капиллярно-сорбционного
давления почвенной влаги от влажности показывает различия
исследуемых почв во всем диапазоне влажностей и позволяет
определить некоторые почвенно-гидрологические "константы". В этой
работе мы использовали две "константы" - максимальную ка-
пиллярно-сорбционную влагоемкость (МКСВ) и капиллярную
влагоемкость (KB).
По абсолютным значениям влажности в интервале низких
значений давления почвенной влаги почвы располагаются в
следующем порядке: дерново-глеевая > чернозем > бурозем.
Соответственно изменяются и значения общей эффективной
удельной поверхности: в дерново-глеевой почве она в 2 раза
192
Таблица 7
Некоторые водно-физические свойства почв Центрально-Лесного
государственного биосферного заповедника
Тип почвы
Удельная
поверхность
почв,
м2/г
Водо-
вмести-
мость
почв, %
Почвенно-
гидрологи-
ческие
константы
Абсолютная
влажность
почвы, %
Давление
почвенной
влаги, Мпа
Толщина
водной
пленки,
мкм
Чернозем
Бурозем
Дерново-
глеевая
54
40
110
37,5
46
65,5
мксв
KB
мксв
KB
мксв
KB
21,5
24,5
30
38
45
57
-0,0223
-0,0147
-0,0316
-0,0147
-0,0447
0,0147
6,72
10,21
4,74
10,21
3,36
10,21
больше, чем в черноземе и в 2,5 раза больше, чем в буроземе
(см. табл. 7). Известно, что чем больше удельная поверхность
почвы, тем больше влаги, питательных веществ и
микроорганизмов она может удержать. В интервале высоких значений
давления почвенной влаги, где в удержании воды преобладает
роль капиллярных сил, последовательность почв иная: дерново-
глеевая > бурозем > чернозем. Из вышеизложенного видно, что
дерново-глеевая почва по физическим свойствам резко
отличается от других почв.
Проследим за изменением численности и структуры
бактериальных комплексов исследуемых почв. При инициации сукцессии
увлажнением предварительно высушенной почвы наблюдается
подъем численности бактерий в течение первых 10 сут. во всех
типах исследуемых почв независимо от уровня поддерживаемой
влажности. В дерново-глеевой почве прослеживается резкий
скачок численности - от 5 до 250 млн. КОЕ/г почвы (в 50 раз), в то
время как в буроземе и черноземе - от 10 до 100 млн КОЕ/г
почвы (в 10 раз). Вероятно, это связано с большой удельной
поверхностью дерново-глеевой почвы.
Наряду с увеличением численности бактерий наблюдаются
изменения и в бактериальном разнообразии почв. В образцах
почв гумидных ландшафтов (бурозем и дерново-глеевая почва)
происходит постепенное увеличение бактериального
разнообразия во времени. Максимальные значения индекса Шеннона
зарегистрированы в исследуемых почвах на 40-е сут. опыта при
влажности почвенных образцов, соответствующих капиллярной
влагоемкости этих почв. При этом общее бактериальное разно-
13-4549
193
образие в дерново-глеевой почве выше, чем в буроземе, а в
черноземе, который относится к почвам семиаридного ландшафта,
в бактериальном разнообразии происходят диаметрально
противоположные изменения по сравнению с вышеописанными.
После увлажнения образцов чернозема наблюдается снижение
бактериального разнообразия, причем резкое уменьшение индекса
Шеннона происходит при выдерживании образцов при
влажности, соответствующей капиллярной влагоемкости.
Обнаруженные закономерности в изменении бактериального разнообразия
во времени в почвенных образцах, поддерживаемых при разных
режимах влажности, подтвердились в результате проведения
трехфакторного дисперсионного анализа. Было показано, что
индекс Шеннона достоверно зависит от стадии сукцессии, что
повышает значимость сукцессионного анализа как метода,
позволяющего повысить полноту учета бактериального
разнообразия почв.
Каждый из исследуемых типов почв характеризуется
определенной таксономической структурой бактериального
сообщества, которая также изменяется во времени. Так, в буроземе
(рис. 27) в воздушно-сухом образце доминировали бациллы, в
качестве минорных компонентов выделялись актинобактерии и ми-
ксобактерии. При увлажнении сухой почвы уже на 10-е сут.
опыта снижается доля бацилл, увеличивается доля бывших ранее
минорными компонентов - представителей протеобактерий: Azoto-
bacter, Aquaspirilium, Alcaligenes. Происходит перестройка
структуры сообщества: исходное монодоминирование сменяется более
выровненным сообществом, в котором таксоны представлены
примерно равными долями.
Разнообразие становится максимальным на 40-е сут. опыта.
При этом при меньшем значении влажности почвы (МКСВ),
когда образуются тонкие водные пленки, выше доля и
разнообразие грамположительных бактерий: Bacillus, Arthrobacter, Rhodo-
coccus, Cellulomonas, Micrococcus, Streptomyces. При большей
влажности (KB), для которой характерна максимально
возможная толщина водной пленки на плоской поверхности, выше доля
и разнообразие грамотрицательных бактерий: Azotobacter, Aquas-
pirillum, Myxobacterales, Alcaligenes, Cytophaga, Flavobacterium и
различных представителей диссипотрофных протеобактерий.
Таким образом, с помощью режима высушивание-увлажнение
до двух параметров влажности удалось повысить полноту учета
бактериального разнообразия в буроземе в 3 раза.
На рис. 28 представлена динамика структуры бактериальных
комплексов в дерново-глеевой почве при двух уровнях
влажности. В исходном воздушно-сухом образце, как и в буроземе, доми-
194
Максимальная капиллярно-
сорбционная влагоемкость
Капиллярная влагоемкость
80 гп
60
40
20
0
I
60
50
40
30
20
10
0
JL
п -
П
60
50
40
30h
20
10
0
П,ппПП
-JL
п ,пПП
п П П п
1 2 3 4 5 б 7 8 9 1011 121314 1 2 3 4 5 б 7 8 9 10111213 14
Рис. 27. Динамика структуры бактериальных комплексов органо-аккумулятив-
ного горизонта (Ahf) бурозема при его регидратации до двух уровней влажности
на начало (а), 10-е (б) и 40-е (в) сутки опыта
Бактерии: 1 - Bacillus; 2 - Rhodococcus; 3 - Arthrobacter, 4 - Cellulomonas; 5 -
Micrococcus; 6 - Streptomyces\ 7 - Azotobacten 8 - Aquaspirillum\ 9 - Myxobacterales; 10 - Cytophaga;
11 - Flavobacterium; 12 - Alcaligenes; 13 - диссипотрофные бактерии; 14 - Azospirillum
нировали бациллы - 50%, 5-20% составляли актинобактерии и
миксобактерии. При увлажнении происходит изменение
структуры сообщества: к 10-м сут. опыта разнообразие бактерий
возрастает и уже значительную долю начинают составлять грамотри-
цательные бактерии, а к 40-м сут., как и в буроземе,
бактериальное разнообразие максимально, оно увеличилось примерно в 3
раза. При поддержании влажности на уровне МКСВ, в этой
почве происходит увеличение разнообразия и доли актинобактерии,
выделяются представители родов Cellulomonas, Nocardioides,
Promicromonospora, Micrococcus. При. создании капиллярной вла-
195
Максимальная капиллярно-
сорбционная влагоемкость
Капиллярная влагоемкость
#
50
40
ЗОН
20 Н
10
0
i
JL
а
JL
«
50 г
4о[
30 [
20 L
10
0
J3 П_
1п_п . и
ПП
50
40
30
20
10
0
пПпПтППп
1пП
п
пПпп
-D »
0J
1 2 3 4 5 6 7 8 910111213141516 1 2 3 4 5 6 7 8 910111213141516
Рис. 28. Динамика структуры бактериальных комплексов органо-аккумулятив-
ного горизонта (А1) дерново-глеевой почвы при ее регидратации на начало (а),
10-е (б) и 40-е (в) сутки опыта
Бактерии: 1 - Bacillus', 2 - Rhodococcus; 3 - Arthrobacter; 4 - Cellulomonas\ 5 - Nocar-
diodes; 6 - Micrococcus', 7 - Streptomyces; 8 - Promicromonospora; 9 - Azotobacter,
10 - Aquaspirillum; 11 - Myxobacterales; 12 - Cytophaga; 13 - Alcaligenes; 14 - Flavobacterium;
15 - Pseudomonas\ 16- диссипотрофы
гоемкости (в толстых водных пленках) в бактериальном
сообществе исследуемой почвы возрастает доля и разнообразие протео-
бактерий. На 40-е сут. опыта они представлены родами
Aquaspirillum, Pseudomonas, Cytophaga, Azotobacter, Alcaligenes,
Flavobacterium, порядком Myxobacterales, а также диссипотрофными
протеобактериями. Такой состав сообщества сохраняется до 70-х
сут., а затем разнообразие постепенно снижается. Именно в этот
период - 40-70-е сут., нам удалось выделить наибольшее
разнообразие и долю диссипотрофных протеобактерий, которые
обычно не выделяются чашечными методами. Была создана кол-
196
лекция этих бактерий, среди которых обнаружены
представители редко выделяемых и возможно новых родов. Таким образом,
при использовании двух режимов увлажнения дерново-глеевой
почвы к исходному бактериальному разнообразию (5 таксонов)
добавились еще 11 таксонов.
Приуроченность максимального бактериального
разнообразия к 40-м сут. после увлажнения предварительно высушенного
образца, по-видимому, не случайна. Именно на 30-40-е сут. после
регидратации почвенных образцов отмечали максимальную
численность разных физиологических групп бактерий и другие
исследователи (Кочкина, 1981; Кожевин, 1989). Возможно, что
увеличение численности и разнообразия бактерий в этот период
связано с их ростом на продуктах автолиза грибов, так как известно,
что пик численности бактерий наблюдается вслед за отмиранием
грибов (Polyanskaya, Zvyagintsev, 1995), а также с выходом части
бактерий из анабиотического состояния. Известно (Звягинцев,
1987), что в тонких капиллярах микроорганизмы могут
находиться в латентном состоянии, при создании благоприятных условий
они могут выходить из анабиоза. На 40-е сут. после увлажнения
высушенной почвы, по-видимому, создаются наилучшие условия
для развития бактерий.
В отличие от дерново-глеевой почвы и бурозема в черноземе
(рис. 29) при увлажнении высушенного образца состав
сообщества практически не менялся во времени. Характерной
особенностью исходной бактериальной структуры этой почвы является
отсутствие доминантов. Из сухой почвы был выделен довольно
широкий спектр бактериальных таксонов, в основном это
представители актинобактерий: роды Arthrobacter, Rhodococcus,
Cellulomonas, Nocardioides, Promicromonospora, Streptomyces, a
также бациллы и миксобактерии; незначительную долю
составляли бактерии родов Cytophaga, Flavobacterium и Beijerinckia. При
увлажнении чернозема бактериальное разнообразие
исследуемого комплекса бактерий не только не увеличивалось, но даже
несколько уменьшалось. По-видимому, таксономический состав
бактериального комплекса чернозема, в котором доминируют
устойчивые к высушиванию актинобактерий, отображает то
состояние недостатка влаги, которое характерно для данного типа
почв в естественных условиях. Подтверждением этому являются
значительно большие величины индексов бактериального
разнообразия в образцах чернозема, поддерживаемых при меньшей
влажности почв, т.е. при максимальной капиллярно-сорбционной
влагоемкости, по сравнению с капиллярной влагоемкостью.
Таким образом, уровень влажности разных типов почв,
характерный для естественных условий и определяющий водовмести-
197
Максимальная капиллярно- Капиллярная влагоемкость
сорбционная влагоемкость
о
i
4>
О
30
25
20
15
10
5
0
ПП 11п П11П п
пИП
30
25
20
15
10
5
0
П „
-EL-
_лй
п П П п
1 2 3 4 5 6 7 8 9 1011121314 1 2 3 4 5 6 7 8 9 10 11 121314
Рис. 29. Динамика структуры бактериальных комплексов органо-аккумулятив-
ного горизонта (А) чернозема при его регидратации:
Бактерии: 1 - Bacillus; 2 - Rhodococcus; 3 - Arthrobacter; 4 - Cellulomonas\ 5 - Noca-
rdioides; 6 - Micrococcus; 7 - Streptomyces; 8 - Promicromonospora; 9 - Curtobacterium\
10 - Aquaspirillum\ 27- Myxobacterales; 12 - Cytophaga; 13 - Flavobacterium\ 14 - Beijerinckia
мость и поглотительную способность агрегатов, коррелирует
с численностью и таксономическим составом бактериального
комплекса этих почв.
Какие же показатели, характеризующие структуру
бактериальных почвенных комплексов, наиболее полно могут отразить
адаптивность бактерий к водно-воздушному режиму каждого из
рассматриваемых типов почв?
Ранее (Добровольская и др., 1997) нами было установлено,
что тип бактериального сообщества почв, связанный с адаптацией
к данному типу экосистемы, наиболее четко можно
охарактеризовать на основе соотношения таких крупных классов, как акти-
198
нобактерии и протеобактерии. Именно этот индекс позволил
раскрыть типологическую структуру бактериального
сообщества исследуемых почв.
Соотношение протеобактерии и актинобактерий оказалось
диаметрально противоположным в почвах, резко
различающихся по водному режиму. Этот показатель составил (2—4)/1 в
буроземе и 1/2 в черноземе. Это означает, что в бактериальном
комплексе бурозема независимо от типа используемого в опыте
увлажнения всегда доминировали грамотрицательные бактерии, в
черноземе - грамположительные. Особое место занимает дерно-
во-глеевая почва. При капиллярной влагоемкости в ней
преобладают грамотрицательные бактерии, а при максимальной капил-
лярно-сорбционной - грамположительные (см. рис. 28). Обилие
протеобактерии связано с периодическим затоплением глеевого
горизонта этих почв. Развитию актинобактерий
благоприятствуют нейтральная реакция среды и наличие в подстилке листьев и
трав, с которыми, как правило, ассоциированы коринеподобные
бактерии. Какие же факторы влияют на соотношение
протеобактерии и актинобактерий? Трехфакторный дисперсионный
анализ показал, что наиболее значимым является тип почвы.
Дерново-глеевая почва характеризуется наибольшим
разнообразием бактерий. Наши исследования по изучению общего
микробного разнообразия в этой почве показали, что в ней очень
низкая численность грибов и актиномицетов (Алехина и др.,
2001). Поэтому можно предположить, что бактерии выступают в
роли дублеров, т. е. выполняют функции этих мицелиальных
организмов.
Проанализировав данные, которые мы представили в этой
работе и те результаты, которые были получены нами ранее
(Алехина и др., 1997; Алехина, Добровольская, 1999), мы сочли
возможным предложить методические рекомендации по
проведению сукцессионного анализа:
1) для оценки бактериального разнообразия в почвах гумид-
ных ландшафтов лучше использовать увлажнение
предварительно высушенных образцов почвы, а не свежеотобранного образца;
2) для более полного учета актинобактерий следует
выдерживать почву при низких параметрах влажности, например
максимальной капиллярно-сорбционной влагоемкости, а
протеобактерии - при капиллярной влагоемкости.
Почему же именно увлажнение предварительно высушенной
почвы, а не свежеотобранного образца позволяет наиболее
полно охарактеризовать таксономический состав бактериальных
комплексов исследуемых почв? В тот момент, когда мы
отбираем образцы для последующей постановки опыта, почва уже нахо-
199
дится на каком-то неизвестном нам этапе сукцессии. Поэтому для
более полной характеристики сукцессионных изменений,
протекающих в почвах, образцы следует привести к начальному этапу
сукцессии, т.е. необходимо высушить почву, а затем уже
инициировать сукцессию ее увлажнением.
Итак, использование почвенных микрокосмов с
моделированием разных вариантов водно-воздушного режима почв,
обеспечивающих мониторинг состава и структуры почвенных
бактериальных сообществ во времени, позволяет не только расширить
спектр таксонов бактерий, т.е. повысить степень учета
бактериального разнообразия, но и выявить характерный для каждой
почвы тип сообщества, который отражает его адаптацию к тем
условиям, которые складываются в этой почве.
Глава 3
ПРОБЛЕМА ОЦЕНКИ БАКТЕРИАЛЬНОГО
РАЗНООБРАЗИЯ ПОЧВ
На XV Международном конгрессе почвоведов, состоявшемся
в Мексике в 1994 г., был проведен специальный симпозиум
"Почвы и биоразнообразие". Этой проблеме были посвящены
доклады Д.Г. Звягинцева по микробному разнообразию почв (Zvyagin-
tsev, 1994) и Г.В. Добровольского о значимости почвы в
сохранении биоразнообразия (Dobrovolsky, 1994). Руководитель
симпозиума д-р В. Сомбрек (Нидерланды) выразил надежду, что в
ближайшее время будет выработана программа исследований
почв как генератора и хранителя биологического разнообразия
Земли.
О возрастающем интересе к микробному разнообразию почв
свидетельствуют и появившиеся в последние годы обзоры на эту
тему в отечественном журнале "Почвоведение" (Добровольская
и др., 1996; Звягинцев и др., 1996) и в зарубежном "Soil Science"
(Kennedy, Gevin, 1997). Обзорам предшествуют вступительные
статьи главных редакторов (Добровольский, 1996; Tate, 1997),
в которых обращается внимание на недооценку роли почвы как
среды обитания и сохранения всего разнообразия жизни на
планете и почвенных микроорганизмов, как жизненно необходимых
для функционирования и саморегулирования экосистемы Земли
и ее биосферы. Р. Тейт перечисляет главные вопросы, на
которые следует ответить в будущем почвенным микробиологам:
1. Как могут существовать в 1 г почвы так много видов (до
4 тыс.) и популяций микроорганизмов?
2. Как связана структура почвенного бактериального
сообщества со структурой микробного сообщества в целом?
3. Какие свойства почвы определяют активность или
пассивность представителей микробного сообщества в проведении
определенных биохимических процессов?
4. Можем ли мы контролировать микробное разнообразие
почв и структуру сообщества таким образом, чтобы поддержи-
201
вать стабильность функционирования микробных сообществ и
гомеостаз почвенной экосистемы в целом?
Думается, что ответ на предпоследний вопрос уже имеется в
виде стройной концепции строения и функционирования
комплекса почвенных микроорганизмов, разработанной Д.Г.
Звягинцевым (Звягинцев, 1987), в которой учитывается роль избыточного
пула микроорганизмов и ферментов в почве, большого спектра
микроорганизмов-дублеров, осуществляющих одни и те же био-
геоценотические функции при разных почвенных условиях.
Что касается последнего вопроса, то он представляет собой
одну из главных целей почвенной микробиологии будущего -
научиться управлять микробными популяциями.
Отсутствие ответов на большинство вопросов, которые были
поставлены очень давно, связано, прежде всего, с ограничением
методов почвенной микробиологии. Вступление в новую эру
молекулярно-биологических исследований и использование
соответствующих методов для анализа почвенных микробных
сообществ позволит, по мнению Тейта, интенсифицировать усилия в
области изучения микробного разнообразия.
Анализу методов и подходов к оценке микробного
разнообразия почв посвящена вышедшая в 1999 г. статья (Rondon et al., 1999),
в которой также подчеркивается роль почвы как источника
микробного разнообразия. Авторы вышеназванных и других
публикаций по этой теме акцентируют внимание на очень слабой
изученности почвенного микромира и приводят при этом цифры,
подтверждающие это - известно лишь 1-5 % почвенных бактерий.
Неизбежный вывод, который следует из анализа таких цифр,
сводится к признанию неэффективности существующих методов,
используемых для оценки микробного разнообразия почв.
Преимущества и недостатки каждого из известных в настоящее время
методов представлены в обзорах (Kennedy, Gewin; 1997; Rondon et al.,
1999). Поэтому мы лишь перечислим основные: традиционный
чашечный метод посева почвенных суспензий на питательные
среды, метод мультисубстратного тестирования (метаболический
потенциал сообщества), анализ профилей метиловых жирных
кислот, разные модификации молекулярно-биологических методов.
3.1. АНАЛИЗ РЕЗУЛЬТАТОВ ОПРЕДЕЛЕНИЯ
БАКТЕРИАЛЬНОГО РАЗНООБРАЗИЯ ПОЧВ
МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИМИ МЕТОДАМИ
Внедрение молекулярно-биологических методов в
почвенную микробиологию вселило надежду на разрешение проблем,
связанных с оценкой микробного разнообразия почв. В качестве
202
явных преимуществ этих методов перечисляются следующие:
отпадает необходимость использования трудоемких процедур
посева, культивирования и выделения чистых культур
микроорганизмов, при этом определяемое разнообразие бактериальных
сообществ в сотни и более раз выше по сравнению с разнообразием
коллекций бактерий, выделенных из этих же мест (Torsvik et al,
1990, 1996; McVeigh et al., 1996; Chandler et al., 1997). Возможным
становится учет и тех групп бактерий, которые не способны
расти в лабораторных условиях - так называемые "некультивируе-
мые формы". Была также продемонстрирована вероятность
обнаружения с помощью молекулярно-биологических методов
анализа новых эволюционных линий на филогенетическом древе
прокариот (McVeigh et al., 1996).
Вышеизложенные преимущества генетических методов
позволяют сделать следующий вывод: те группы и таксоны
бактерий, которые определяются по методу посева, представляют
собой очень небольшую часть бактериального сообщества почв,
более того, предполагается, что разнообразие определяется
часто совсем не теми таксонами, которые выявляются в качестве
доминирующих на тех или иных питательных средах. Таким
образом, ставятся под сомнение все традиционные, применяемые в
течение почти столетия методы оценки разнообразия микробных
сообществ почв.
Прежде чем перейти к анализу бактериального разнообразия
почв, перечислим основные методологические приемы,
используемые в области молекулярной биологии применительно к
анализу бактериального разнообразия почв и продемонстрируем
новые возможности использования традиционного чашечного
метода для количественной оценки бактериального разнообразия
почв. Целесообразно также оценить и сравнить картины
бактериального разнообразия почв, полученные молекулярно-генети-
ческими и культуральными методами, и очертить перспективы
развития исследований в области микробного разнообразия почв.
Наиболее часто в микробной экологии применяются
следующие молекулярно-биологические методы исследования
бактериальных сообществ почвы:
1) изучение экстрактов ДНК из почвы при помощи метода
реассоциации (Torsvik et al., 1990, 1996) и дифференциального
центрифугирования в градиенте CsCl (Harris, 1994);
2) экстракция из почвы нуклеиновых кислот (ДНК и РНК)
с последующей амплификацией фрагментов гена 16S рРНК при
помощи полимеразной цепной реакции (ПЦР) и детальное
изучение амплифицированных фрагментов разнообразными молеку-
лярно-генетическими методами (Amann et al., 1995);
203
3) изучение бактериальных популяций почвы "in situ"
методом гибридизации с олигонуклеотидными маркерами (ДНК- и
РНК-зондами), мечеными флуоресцентными красителями
(Amann et al., 1995).
Чтобы оценить результаты определения бактериального
разнообразия почв на основании молекулярно-биологических
методов, необходимо проанализировать с экологической точки
зрения те списки групп и таксонов бактерий либо филогенетические
древа, которые были получены с помощью этих методов в США,
Японии, Австралии и Англии.
США, сельскохозяйственная опытная станция в
Арлингтоне при Университете в Висконсине. Почва под клеверно-
травяной смесью, используемая под пастбище (Borneman et al.,
1996).
Почва хорошо дренирована, грунтовые воды находятся на
глубине 25 м. По механическому составу почва илисто-глинистая,
содержит 4,4% органического вещества в гор. А1, рН 6,5. Были
отобраны 4 пробы с глубины 0-10 см.
На основании сравнения последовательностей гена 16S рРНК
почвенных клонов с имеющейся в базах данных информацией об
известных организмах бактериальное разнообразие исследуемой
почвы было описано следующим образом: Proteobacteria - 16%;
Cytophaga-Flexibacter-Bacteroides - 21,8%; грамположительные
бактерии с низким процентом ГЦ - 21,8%.
Среди изученных клонов 3% принадлежат
предположительно к группе Planctomyces-Chlamydia, a 39% - оказались вне
основных линий известных таксонов, изображенных в
филогенетическом древе Олсена (Olsen et al., 1994). Два клона были отнесены
к химерам.
Обсудим полученные результаты. Образцы почв отбирались
на клеверном поле, где на корнях клевера должны обитать
клубеньковые бактерии Rhizobiwn trifolii - представители ос-подклас-
са протеобактерий. Однако только 1,6% клонов были близки к
этой филогенетической ветви. Сами авторы высказывают
некоторое недоумение по поводу полученных данных. Практически
не были обнаружены в исследуемой почве (только 0,8%)
представители актиномицетной линии, т.е. грамположительные
бактерии с высоким содержанием ГЦ. Учитывая, что почва под
клеверным полем хорошо дренирована и имеет нейтральную
реакцию среды, в ней теоретически должны преобладать бактерии
актиномицетной линии. Низкая гомология практически всех
почвенных клонов с известными таксонами (71-85% и ниже) не
позволила отнести их к каким-либо конкретным таксонам даже на
уровне рода.
204
Таким образом, бактериальное разнообразие исследуемой
почвы охарактеризовано на уровне таких крупных групп, как
протеобактерии, цитофаги-флексибактерии и грамположитель-
ные бактерии с низким содержанием ГЦ. Представители всех
этих таксонов присутствуют в любом типе почв и никак не
характеризуют особенности данной почвы. В то же время другие
типично почвенные обитатели - бактерии актиномицетной линии -
не обнаружены, равно как и ризобии - симбиотические азотфик-
сирующие бактерии, образующие клубеньки на корнях клевера.
Известно, что ризобии могут размножаться и тем более
сохраняться в почве и должны были попасть в почвенные пробы,
которые отбирали с глубины 0-10 см.
Авторы статьи в заключение констатируют, что для
дифференциации полученных ими крупных филотипов на более мелкие
таксономические единицы, т.е. роды или виды, необходимо
выделить из почвы микроорганизмы и определить их
морфологические и физиологические особенности, что представляется
авторам методически трудно осуществимым.
Япония, ферма от Университета Кюшу, почва под
посевами сои {Veda et aL, 1995).
Образцы почвы отбирали с глубины 1-5 см. Характеристика
почвы не приводится. Было проанализировано 17 почвенных
клонов, 3 клона отнесены к химерам, т.е. артефактам ПЦР.
Констатируется наличие следующих крупных групп: грамположи-
тельные бактерии с высоким содержанием ГЦ, зеленые серные
бактерии, протеобактерии, креноархеи и клоны, которые не
попадают ни в один из 11 известных основных филотипов домена
Bacteria, представленных в виде филогенетического древа (Olsen
et al., 1994).
Авторы обращают особое внимание на обнаружение в
исследуемой почве последовательностей, характерных для архебакте-
рий, принадлежащих к Crenarchaeota. Это облигатные
термофилы, растущие в диапазоне температур 74-103 °С, выделяющиеся,
как правило, из кипящих сольфатарных вод. Однако авторы
ссылаются на работы других исследователей, также обнаруживших
эту группу архебактерий в необычных биотопах, где
складываются условия крайне неблагоприятные для их
жизнедеятельности - холодные воды Антарктики и Аляски, а также морские
холодные местообитания (Fuhrman et al., 1994; De Long et al., 1998).
Нахождение креноархеи в океане и почве заставляет, по мнению
авторов, пересмотреть их экологические ниши и значимость в
глобальной экологии. Однако нам представляется это
преждевременным, так как без выделения этих организмов в чистую
культуру и определения диапазона температур, в пределах кото-
205
рых они способны развиваться, все рассуждения относительно
возможностей развития и функционирования в почвах
представителей Crenarchaeota остаются на уровне спекуляций.
Большинство других последовательностей имеют очень
отдаленное родство с известными представителями бактерий. Лишь
2 почвенных клона имели высокую степень сходства (95 и 97%) с
представителями Rhodocyclus gelantinosus и Pseudomonas flaves-
cens, один - 89,9% сходства с Agrobacterium tumefaciens. Как и в
предыдущем случае, когда в почве под клеверным полем не
были обнаружены ризобии, в данном исследовании они также не
найдены. Зато делается предположение о нахождении
последовательностей, имеющих хотя и отдаленное, но родство с франкия-
ми, что представляется очень странным, учитывая, что
представители рода Frankia образуют азотфиксирующие клубеньки на
корнях кустарников, а не бобовых травянистых растений,
являющихся основным компонентом изучаемого фитоценоза.
Основные выводы, которые делают авторы, следующие:
1) бактериальный комплекс почвы поля, засеянного соей,
содержит как истинные бактерии, так и археи;
2) за исключением последовательностей, относящихся к про-
теобактериям, большинство проанализированных почвенных
клонов были далеки (менее 90% идентичности) от каких-либо
известных, имеющихся в базах данных. Авторы сетуют на то, что
неизвестно, какие из них типичны для почвы, а какие нет;
3) среди последовательностей бактерий обнаружены
совершенно новые, не проявившие какой-либо филогенетической
близости к известным клонам.
Чтобы решить вопрос о том, какие организмы преобладают
в почвенном образце, исследователи полагают, что необходимо
использование дополнительных методов, таких, например, как
гибридизация проб с олигонуклеотидными маркерами. Авторы
сожалеют, что используемый ими молекулярно-биологический
метод полностью игнорирует физиологию и экологию
большинства почвенных организмов и считают, что в дальнейших
исследованиях необходимым окажется метод выделения и
культивирования почвенных бактерий, обнаруженных предварительно на
ДНК уровне. Заканчивается статья признанием факта
рудиментарное™ наших знаний в области пространственного
распределения и таксономического состава основных типов бактерий в
почвенной толще.
Австралия, Квинсленду морской порт Брисбейн, почва не
описана (Liesack, Stackebrandt, 1992).
Почвенные образцы отобраны у подножия горы из слоя
5-10 см. В результате проведения анализа экстрактов ДНК обна-
206
ружено присутствие двух больших групп последовательностей,
близких к протеобактериям, - подгруппы а и 8.
Последовательности 3-й группы не могут быть отнесены ни к одному из
известных таксонов и представляют, по мнению авторов, новую
филогенетическую линию бактерий.
Большинство клонов 1-го кластера (14
последовательностей) проявили существенную степень родства с азотфиксирую-
щими симбиотическими бактериями сс-подкласса протеобакте-
рий: роды Bradyrhizobium, Azorhizobium и Photorhizobium. Семь
клонов проявили отдаленное сходство с членами семейства
Planctomycetaceae, представляющего уникальную
эволюционную линию в царстве бактерий. Филогенетический анализ
показал, что один из клонов был близок к Planctomyces limnophilus,
а другой - к Isosphaera pallida. Однако степень родства между
почвенными клонами и последовательностями генов 16S рРНК
родов Isosphaera и Gemmata так низка (63-73%), что
принадлежность клонов именно к этим родам весьма сомнительна.
Остальные почвенные клоны (их 22) являются, по-видимому, членами
новой эволюционной ветви, имеющими общих предков среди
планктомицетов и хламидий.
Обсуждается феномен обнаружения в почве
последовательностей, близких к планктомицетам, так как до настоящего
времени планктомицеты встречались только в водных средах. Авторы
заключают, что нахождение этих последовательностей в почве
ставит под сомнение водную среду как единственное
местообитание этих организмов.
Итак, каково же бактериальное разнообразие исследуемой
почвы Австралии? Есть бактерии, относящиеся к а-подклассу
протеобактерий - ризобии, хотя о наличии бобовых растений в
исследуемой почве, к сожалению, не сообщается. Обнаружены
также таксоны, близкие к планктомицетам, и почвенные клоны,
имеющие общих предков как среди планктомицетов, так и среди
хламидий. Нахождение планктомицетов в почве, расположенной
рядом с океаном, не представляется нам странным (приливы
океана, перенос с ветром водяных брызг и, следовательно,
возможное перемещение планктомицетов из воды в почву). Открытым
остается вопрос о возможности размножения планктомицетов
в почве.
Англия. Почва под буковым лесом (McVeigh et al.> 1996).
Образцы почвы отобраны на глубине 5-20 см. Цель
исследования - поиск новых актиномицетных форм в почвах под
широколиственными лесами Европы.
В процессе исследования выделено 53 почвенных клона,
которые были размещены по 7 группам, 6 из которых образовали
207
кластеры внутри филлума актиномицетов. Небольшая группа
почвенных клонов проявила невысокое сходство с актиномице-
тами родов Sporichthya polymorpha и Frankia. Две
последовательности образовали единую монофилетическую группу, положение
которой в пределах актиномицетной линии неопределенно. Один
из почвенных клонов близок к Propionibacterium acnes, другой -
к Corynebacteriwn renale. Следует заметить, что последний вид
является патогенным для человека и животных, первый - условно
патогенным, вызывающим гемолиз эритроцитов.
Четыре клона образовали новые линии, связанные с хорошо
известными видами Mycobacterium (опубликованы сиквенсы
100 штаммов и видов микобактерий). Практически все
обнаруженные в исследуемой почве микобактерий относятся к группе
медленнорастущих видов Mycobacterium: M. celatum, M. cooki,
М. simiae, M. avium, M. scrofulaceu и др. Большинство этих видов
патогенны и вызывают легочные инфекции и лимфадениты у
человека и животных.
Известно, что выделение и культивирование в лаборатории
медленнорастущих видов бактерий требует создания сложных
сред и условий, которые не может предоставить почва. В то же
время многие быстрорастущие виды микобактерий являются са-
протрофными и широко распространены в разных типах почв
(Нестеренко и др., 1978, 1985). Представляется странным, что
они не обнаружены в анализируемой почве, равно как и другие
бактерии актиномицетной линии (типичные педобионты): Strep-
tomyces, Arthrobacter, Rhodococcus, Promicromonospora (Зенова и
др., 1996). Авторами выявлена также группа
последовательностей, показывающих связь с Actinomadura madurae.
Необходимо отметить по этому поводу, что в лесу средообра-
зующими факторами являются низкие значения рН среды,
небольшое (1-3%) содержание гумуса. Эти условия способствуют
распространению в лесных почвах актиномицетов рода
Streptosporangium, среди которых присутствуют ацидотолерант-
ные формы. Актиномицеты рода Actinomadura характерны для
почв более южных зон (черноземы, каштановые почвы) и редко
обнаруживаются в почвах под лесом (Галатенко и др., 1990;
Зенова, Звягинцев, 1994). В лесных подстилках доминирующими
формами актиномицетов являются, наряду со стрептомицетами,
микромоноспоры (Зенова, Звягинцев, 1997). Таким образом,
опять наблюдается явное несоответствие между оценкой
микробного разнообразия, полученного молекулярно-генетически-
ми методами и традиционным методом посева. Полученные
результаты заставляют задуматься и о причинах накопления в
исследуемой почве патогенных бактерий.
208
При анализе бактериального разнообразия горных озер
Америки (Hiorns et al., 1997), выполненного с помощью молекулярно-
биологических методов, был обнаружен лишь один род и один
вид актиномицетов - Streptomyces ambofaciens. Известно (Proka-
ryotes..., 1981), что для озер наиболее характерны представители
родов Micromonospora, Streptosporangium, Actinoplanes, но
представители этих родов не были обнаружены в этом эксперименте.
Актиномицеты рода Streptomyces - типичные почвенные
обитатели, хотя могут быть обнаружены в качестве минорных
компонентов и в любых других биотопах. Возможно, что наличие
многих таксонов актиномицетов не регистрируется в связи с их
малой численностью, так как применение универсальных
бактериальных праймеров позволяет обнаруживать таксоны, доля
которых в образце превышает 1%. Повысить точность метода
возможно при использовании для ПЦР в качестве прямого прайме-
ра бактериального, а в качестве обратного - родоспецифическо-
го актиномицетного. Применение этого метода позволило
выявить более высокое разнообразие актиномицетов в почвенных
образцах.
При сравнении состава актиномицетов в двух типах почв
(названия почв не даются) было показано (Heuer et al., 1997), что
разнообразие актиномицетных сообществ выше в одной почве, чем
в другой. Такое заключение было сделано на основании анализа
расположения полос на электрофореграммах, представляющих
фрагменты гена 16S рРНК. Однако никакого вывода о
разнообразии актиномицетов на таксономическом уровне не было
сделано.
Американскими и российскими учеными был проведен
филогенетический анализ бактериальных сообществ тундровых
почв в районе р. Колымы (Zhou et al., 1997). Показано, что
большинство выделенных клонов принадлежат разным
подгруппам класса Proteobacteria и менее 12% - грамположитель-
ным бактериям; 16% клонов близки к филогенетической ветви,
включающей Fibrobacter, Planctomyces, Bacteroides, спирохеты
и зеленые серные бактерии. Интересными представляются
данные о значительной доле среди протеобактерий таких
анаэробных форм, как сульфатредукторы, что авторы связывают с
перенасыщением почв тундры влагой в течение длительных
периодов времени. Однако 70% клонов имели
последовательности, которые отличались (на 5-15%) от всех известных
последовательностей, имеющихся в базах данных. Авторы
проводят сравнение своих результатов с данными других
исследователей (Borneman et al., 1996; Liesack, Stackebrandt, 1992; Ueda et
al., 1995), полученными путем использования тех же методов.
209
Констатируется, что бактериальные сообщества тундровых
почв резко отличаются от всех других, с которыми было
проведено сравнение. На основании этого авторы делают выводы,
что бактерии в тундровых почвах представлены, по всей
вероятности, новыми таксонами (на уровне родов или семейств),
представители которых еще никогда не были изолированы
в чистую культуру и, следовательно, пока ничего не известно
об их физиологии и функциях.
Кроме рассмотренных выше работ, существует еще
несколько десятков публикаций, посвященных оценке микробного
разнообразия почв разных стран (Канада, Финляндия, Нидерланды,
США и др.), проведенной с помощью молекулярно-биологиче-
ских методов. Ссылки на эти работы даны в обзоре (Rondon et al.,
1999). Принципиально новых результатов по сравнению с теми,
что были обсуждены ранее, не получено. Можно лишь
дополнить перечень бактерий, обнаруженных в почвах с помощью
этих методов, группами Holophaga-Acidobacterium (Kuske et al.,
1997) и Verrucomicrobia (Hugenholtz et al., 1998). Эти группы,
именуемые пока "division", включают в большинстве случаев не-
культивируемые формы.
О картине бактериального разнообразия почв, выявленной
с помощью молекулярно-биологических методов, можно сказать
следующее:
1. Констатируется наличие в почвах крупных таксонов на
уровне классов или групп ("division"), например, грамположи-
тельные бактерии с высоким или низким процентом ГЦ, протео-
бактерии разных подклассов, зеленые серные бактерии, планк-
томицеты, спирохеты, креноархеи.
2. Большинство почвенных клонов имеют очень низкую
степень гомологии с имеющимися в базах данных сведениями о
фрагментах последовательностей известных родов или видов
бактерий, поэтому высказываются предположения только об их
примерном положении на филогенетическом древе и возможном
родстве с теми или иными таксонами. Следует сказать и о
сомнениях относительно принципиальной возможности использования
гомологии 16S рРНК в качестве маркера ("метронома
эволюции") положения организма на филогенетическом дереве и в
таксономической системе. Обоснование такого заключения дано
в обзоре Е.Л. Головлева (1998а).
3. Большая доля почвенных клонов описывается в качестве
возможных претендентов на роль совершенно новых филумов
царства бактерий, но при этом не обнаруживаются, например,
постоянно выделяемые из большинства типов почв бактерии ак-
тиномицетной линии - континентальная ветвь прокариот.
210
4. Некоторые критические комментарии по поводу картины
бактериального разнообразия, полученного с помощью молеку-
лярно-биологических методов, иногда высказывают сами
авторы публикаций (Stackebrandt et al., 1993; Ueda et al., 1995; Borne-
man et al., 1996). Представляется парадоксальным отсутствие ри-
зобий в почве под бобовыми культурами при нахождении там
бактерий, типичных для пресноводных или морских
местообитаний (термофильные креноархеи или зеленые серные бактерии)
и, наоборот, доминирование ризобий в почве на берегу океана
в Австралии (хотя на присутствие бобовых растений не
указывается).
5. При обсуждении полученных данных не учитываются
экологические основы биоразнообразия: не ставится вопрос о том,
могут ли те или иные формы бактерий, обнаруженные в данной
почве, размножаться и функционировать в ней или они просто
привнесены из других биотопов и сохраняются в почвенном
банке микроорганизмов.
Таким образом, то бактериальное разнообразие почв,
которое представляется в виде филогенетического древа,
составленного на основании данных молекулярно-генетических анализов,
значительно более неопределенно и неконкретно, чем то,
которое определяется обычными методами посева. Такие крупные
группы, как грамположительные бактерии с высоким или
низким процентом ГЦ, протеобактерии и др. присутствуют
практически в каждой почве, поэтому сравнение разных типов почв по
наличию или отсутствию таксонов на уровне таких классов или
групп не представляет особого интереса.
Факты совпадения последовательностей клонов из почв с
таковыми, полученных из базы данных, так малочисленны, что
перечень обнаруженных таксонов родового и тем более видового
уровня ограничивается двумя-тремя названиями; причем,
обнаруженные в образцах почвы таким методом бактерии, с
экологической точки зрения, часто оказываются весьма случайными для
анализируемой почвы. Кроме того, как признают и сами авторы
публикаций, при генетическом методе оценки бактериального
разнообразия почв пока невозможно сказать что-либо о
физиологических особенностях и экологических функциях тех
бактерий, которые обнаруживаются в данной почве. Для этого
требуется выделение чистых культур и изучение их физиолого-биохи-
мических особенностей.
Итоги использования молекулярно-биологических методов
в почвенной микробиологии для оценки разнообразия
микробных сообществ почв за последние 20 лет подведены в
фундаментальной обзорной статье микробиолога из Университета Флори-
211
ды (США) А. Ограма (Ogram, 2000). Автор отмечает, что за эти
годы разработаны новые молекулярно-генетические методы,
которые вошли в качестве рутинных тестов в микробиологические
лаборатории многих стран. Однако, несмотря на то, что
возрастает число почвенных микробиологов, использующих эти
методы, имеются существенные трудности и недостатки, которые
должны быть преодолены прежде, чем эти методы найдут
широкое применение.
В числе основных трудностей, которые предстоит
преодолеть в будущем, называются: очистка нуклеиновых кислот,
экстрагируемых из почв, от гумусовых веществ (с учетом специфики
физико-химических свойств разных типов почв); повышение
эффективности лизиса бактериальных клеток с учетом разной
степени устойчивости к лизису разных групп бактерий; необходимое
увеличение фрагментов ДНК, так как использование небольших
фрагментов повышает вероятность появления артефактов ПЦР;
переход на количественные показатели, позволяющие оценить
относительное обилие индивидуальных филогенетических групп
в почвенном образце или относительную активность этих групп
(в этом плане перспективен "метод микрочипов");
необходимость разработки методов, которые позволили бы оценить
физиологическое разнообразие и экологическую роль так
называемых "некультивируемых" форм бактерий. В конце статьи автор
заключает, что молекулярно-генетические методы не являются
панацеей от всех трудностей, возникающих при анализе
почвенных сообществ. Наиболее рациональным представляется
полифазный подход, при котором необходимо использование самых
разных методов, в том числе и традиционного метода
изолирования культур на питательные среды.
В результате изучения микробного разнообразия почв моле-
кулярно-биологическими методами возникло множество новых
вопросов. Они сформулированы авторами обзора (Rondon et al.,
1999):
1. Насколько полны сведения о последовательностях 16S
рРНК культивируемых форм бактерий в имеющихся базах
данных?
2. Много ли новых, неизвестных таксонов содержится в той
части бактериального сообщества, которое относят на
основании результатов молекулярно-биологического анализа к "не-
культивируемым" формам? Каковы их функции в почве и как
это определить?
3. Насколько филогенетическое разнообразие
некультивируемых форм бактерий отражает их физиологическое
разнообразие?
212
3.2. ПОЧЕМУ ОЦЕНКИ БАКТЕРИАЛЬНОГО
РАЗНООБРАЗИЯ ПОЧВ,
ОПРЕДЕЛЕННОГО МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИМИ
И ТРАДИЦИОННЫМИ МЕТОДАМИ ПОСЕВА,
НЕ СОВПАДАЮТ?
Следует начать со сравнения числа видов бактерий,
рассчитанных на основании определения скорости реассоциации ДНК,
экстрагированной непосредственно из почвы, с числом видов
бактерий, определенных по скорости реассоциации суммарной
ДНК биомассы бактерий, собранной с поверхности питательной
среды, на которую был произведен посев из этой же почвы
(Torsvik et al., 1996). Нам представляется, что то количество
типов бактерий, которое подсчитывается методом посева,
значительно занижено вследствие использования заведомо
некорректного метода сравнения. Проанализируем, как оценивалось
бактериальное разнообразие почвы методом посева.
Почвенные образцы высевали на одну агаризованную среду
(ее состав не приводится). Авторы решили, что 90 изолятов
достаточно для характеристики всего разнообразия бактерий,
выявляемых на данной среде. И это разнообразие оказалось в 170 раз
ниже такового, полученного при анализе тотальной ДНК,
выделенной прямо из почвы. Авторы вполне убедительно оценивают
причины такого разрыва: не учитываются при посеве на одну
среду то разнообразие субстратов, их концентрация и условия
культивирования, которые требуются для выделения самых
разных эколого-трофических групп бактерий, а также
неспособность некоторых бактерий расти на твердой среде и др. Но тогда
приводимые цифры, оценивающие различие в бактериальном
разнообразии в 170 раз, лишены всякого смысла, так как на
одной среде учитывается только малая доля имеющегося в почве
бактериального разнообразия.
Чтобы выявить методом посева наиболее полный спектр
бактерий, обитающих в данной почве, необходим посев на целый
ряд сред, предполагающих возможность выделения бактерий из
разных эколого-трофических и таксономических групп. Нужны
специальные среды и особые условия культивирования для
выделения целлюлозоразрушающих бактерий (аэробных и
анаэробных), сульфатредукторов, метилотрофов и метаногенов, хемоли-
тотрофов и фототрофов, олиготрофных бактерий, актиномице-
тов и бактерий актиномицетной линии и т.д. Даже устаревший
ныне метод посева из почв на ряд сред для выявления так
называемых "физиологических групп" - нитрификаторов, денитри-
фикаторов, азотфиксаторов, целлюлозоразрушающих и т.д. -
213
дал бы значительно большие величины бактериального
разнообразия, чем посев на одну среду. Если бы такой эксперимент был
проведен, то разрыв между бактериальным разнообразием
почвы, оцениваемой разными вышеприведенными методами,
сократился бы в 50-100 раз. И только тогда можно было бы
рассуждать о проценте тех известных таксонов, которые мы учитываем
в почвах, по сравнению с неизвестными до сих пор формами. Те
цифры (0,1-10%), которые, по мнению многих авторов,
характеризуют долю известных нам форм бактерий, представляются
весьма заниженными. Некоторые исследователи, исходя из этих
цифр, делают еще более безапелляционные выводы: только 1%
почвенных бактерий относятся к культивируемым формам, все
остальные - к некультивируемым. На такую неправомерную
трактовку соотношения культивируемых и некультивируемых
форм микроорганизмов указывают и другие авторы (Rondon et
al., 1999).
Многие бактерии находятся в почве в особом состоянии,
которое определяется некоторыми авторами как "некультивируе-
мое жизнеспособное состояние" ("нжс"). Предложена
физиологическая модель перехода бактериальных клеток в некультиви-
руемое состояние. Для перехода в культивируемое состояние
также необходимо создание особых условий, например,
выдерживание клеток бактерий в течение некоторого времени в среде,
содержащей ключевые соединения цикла Кребса, - пируват,
ацетат и др. (Головлев, 19986). Если не учитывать этого, то при
выделении из почвы происходит недоучет известных форм
бактерий, не способных в момент их выделения дать рост на
используемой среде в силу их особого состояния в почве. Известно,
например, что при выделении из сухой почвы способность бактерий к
образованию колоний значительно ниже по сравнению с таковой
для бактерий, изолируемых из увлажненных почв с внесенным в
них субстратом (Кожевин, 1989).
Аналогичные примеры напрашиваются при определении
соотношения численности бактерий по прямому методу (подсчет
под люминесцентным микроскопом) и методу посева
(коэффициент К). Так, в почве этот показатель может составлять от 100 до
1000, в то время как в ризосфере этот разрыв уменьшается до 10
(Кожевин, 1989). Все эти примеры подтверждают разное
состояние клеток бактерий в почве и, следовательно, их большую (как
в ризосфере или увлажненной почве с внесением субстрата) или
меньшую (как в сухой почве) готовность к прорастанию,
определяемую методом посева.
С другой стороны, разнообразие последовательностей генов
16S рРНК, выделяемых из микробной биомассы почв, будет все-
214
гда выше разнообразия соответствующих последовательностей
культур, выделенных из той же почвы. Причины такого
расхождения следующие: более высокая генетическая неоднородность
природных популяций по сравнению с популяциями
коллекционных культур (Torsvik et al., 1990, 1996); задержка времени реассо-
циации в связи с недостаточной очисткой препарата ДНК из
почвы от гумусовых веществ (Torsvik, 1990); наличие в почве
значительного пула внеклеточных, частично трансформированных
нуклеиновых кислот (Асеева и др., 1977); присутствие в почве
значительной доли некультивируемых форм, неспособных к росту
на лабораторных средах, но вносящих свой вклад в разнообразие
ДНК сообщества (Ward et al., 1995; Головлев, 19986);
образование "химерных" последовательностей в ходе ПЦР (Amann et al.,
1995); горизонтальный перенос генов между бактериями и
рекомбинации между хромосомными генами близкородственных
видов (Torsvik et al., 1996; Головлев, 1998а).
Почва является банком, где сохраняются самые
разнообразные формы микроорганизмов, многие из которых вообще не
способны развиваться ни в почве, ни на искусственных средах, их
местообитанием может быть организм человека или животных,
водные и морские экосистемы, термальные источники, пищевые
продукты и другие субстраты. Таким образом, пытаясь
учитывать множество присутствующих в почве типов бактериальной
ДНК путем анализа амплифицированных последовательностей
гена 16S рРНК, мы определяем генофонд всего микробного
мира, сосредоточенный в почве.
3.3. О ПЕРСПЕКТИВАХ ОЦЕНКИ БАКТЕРИАЛЬНОГО
РАЗНООБРАЗИЯ ПОЧВ И ВОЗМОЖНОСТЯХ
ИНТЕГРАЦИИ РАЗНЫХ МЕТОДОВ
Нам представляется, что, несмотря на имеющиеся на
сегодняшний день глубокие противоречия в результатах оценки
бактериального разнообразия почв молекулярно-биологическими и
традиционными методами посева, в будущем возможно идти по
пути одновременного использования этих методов, основываясь
на принципах полифазной таксономии, с успехом применяемой
в настоящее время при идентификации микроорганизмов (Van-
damme et al., 1996). Полифазная таксономия предполагает путь
последовательного получения различного рода данных и
информации об организмах, включающей как фенотипические
признаки, так и генотипические. Следует отметить, что в настоящее
время в рибосомальной базе данных (RDP) содержатся сведения
215
о почти 10 000 тыс. полных и частичных последовательностях
фрагментов генов 16S рРНК коллекционных культур и
"почвенных клонов" (Maidak et al., 1999), база эта все время
пополняется, что позволит со временем более точно трактовать сведения,
получаемые на основании изучения амплификации фрагментов
гена 16S рРНК экстрактов ДНК из почвы.
Примером интеграции разных методов для анализа
микробного разнообразия почв может служить работа (Watts et al., 1999),
в которой использовались традиционные методы
культивирования, генетический анализ и потенциальная метаболическая
активность почв, определяемая с помощью "BIOLOG".
Установлена корреляция между скоростью деградации загрязнителей
почвы, метаболической активностью, генетическим разнообразием
и численностью бактерий.
Думается, что совместная работа молекулярных биологов,
микробиологов и почвоведов должна начинаться с самых первых
шагов исследования - с методических подходов к отбору
почвенных проб для анализа образцов, что представляется весьма
значимым в плане интерпретации полученных результатов. На этом
этапе необходимо привлечение почвоведов, которые должны
грамотно описать и определить тип почвы, разделив ее на
генетические горизонты, определив их механический состав, водно-
физические и химические свойства. В большинстве публикаций,
посвященных оценке бактериального разнообразия почв
с помощью молекулярно-генетических методов, не указывается
ни тип почвы, ни ее положение в рельефе, ни название
горизонта, из которого отбирается образец, не всегда приводится и
описание растительности, нет описания климата и диапазона
температур, которые определяют водно-воздушный режим почв.
Только при таком описании можно будет дискутировать о
возможности функционирования в той или иной почве термофильных кре-
ноархей или анаэробных фототрофных бактерий.
Далее, необходим отбор почвенных образцов с учетом как
вертикально-ярусной структуры, так и почвенных мезо- и микро-
локусов. Поскольку таксономический состав микробных
сообществ подвержен сезонным изменениям, следует проводить
отбор проб несколько раз в году, учитывая влажность и
температуру почв.
Следует отметить, что появились уже положительные
примеры отхода от средней пробы при отборе почвенных образцов для
определения бактериального разнообразия. В работе Г. Лидема-
на с соавторами (Luedemann et al., 1999) образцы отбирались
послойно из почвенного монолита, залитого водой с учетом
градиента кислорода. Из каждого слоя толщиной 0,2 мм экстрагирова-
216
лась ДНК, дальнейший анализ проводился методом "fingerprint".
Установлена корреляция между типом сообщества и
концентрацией кислорода, определяемой глубиной почвы. Сравнительный
анализ последовательностей фрагментов гена 16S рРНК
показал, что в оксигенных почвенных слоях доминируют популяции
протеобактерий, а в лишенных кислорода слоях - грамположи-
тельные бактерии Bacillus и Clostridium.
Наметился дальнейший прогресс в плане
усовершенствования методов в целях определения метаболизма и функций
бактерий, в том числе и присутствующих в почве в некультивируемом,
но жизнеспособном состоянии. Для этого предлагаются
следующие новые подходы (Rondon et al., 1999) - метагеномный
(metagenome), связанный с клонированием и анализом больших
фрагментов почвенной бактериальной ДНК, и экспрессионного
клонирования (expression-cloning). При этом становится
возможным охарактеризовать не только гены 16S рРНК, но и
структурные гены, ответственные за работу отдельных ферментов, таких,
например, как нитратредуктаза, рибулозофосфаткарбоксилаза,
метанолгидрогеназа и др. Это первые шаги к поиску связи между
таксономической структурой и функционированием почвенных
микробных сообществ.
Разработан также метод, который позволяет распознавать
редкие или новые филогенетические группы при помощи
предварительного исключения из ПЦР наиболее многочисленных
последовательностей путем их связывания со специфическими
пептидами (Wintringerode et al., 1999).
Для количественной оценки структуры микробных
сообществ предложено использовать набор экологических индексов,
рассчитанных на основании данных молекулярно-биологическо-
го метода и анализа профилей метиловых эфиров жирных
кислот и фосфолипидов (Peacocki et al., 1999). Этот набор включал
такие индексы, как обилие, выравненность, коэффициент
сходства между сообществами и др. Результаты показали
значительную корреляцию между индексами, вычисленными по данным
разных методов. Аналогичные индексы было предложено
использовать ранее и нами (Добровольская и др., 1997,1999) для
характеристики структуры бактериальных сообществ,
определяемой по методу посева.
Не менее значимым, чем усовершенствование и интеграция
методов, является развитие направления в области изучения
микробного разнообразия почв, связанного с описанием тех мест и
экосистем, где обитают и размножаются разнообразные, в том
числе и уникальные, формы микроорганизмов. Разработанный
нами вертикально-ярусный и географический подходы к анализу
217
микробных сообществ имеют своей целью дать такое описание.
Аналогичные взгляды, касающиеся необходимости точного
описания нахождения и относительного обилия разных видов
микроорганизмов в природных экосистемах, высказывают и другие
авторы (Kennedy, Gewin,1997; Rondon et al., 1999). Они
предлагают охранять и сами природные ресурсы, содержащие высокое
микробное разнообразие. Ранее подобная точка зрения была
высказана Г.А. Заварзиным, утверждавшим, что защите должны
подлежать не отдельные микроорганизмы в пробирках, а
природные биоценозы (Заварзин, 1990).
Подготавливаемая в настоящее время российскими
почвоведами Красная книга почв по аналогии с таковыми для растений и
животных, также имеет своей целью описать и рекомендовать к
сохранению не только редкие типы почв, но и их "содержимое" -
генетический фонд биоразнообразия жизни на Земле. Имеет
смысл и длительная криоконсервация почвенных образцов,
представляющих особый интерес в плане сохранения в них
разнообразных, в том числе и древних, форм почвенных
микроорганизмов. Известно о сохранении жизнеспособности бактерий в
породах возрастом в несколько млн лет. Причем вывод
микроорганизмов из анабиоза не требует каких-либо специальных приемов,
он происходит довольно быстро на обычных питательных средах
и при обычных условиях (Zvyagintsev, 1995).
Таким образом, сочетание природоохранных мероприятий
с одновременным усовершенствованием и интеграцией методов
оценки почвенного микробного разнообразия позволит
объединить в будущем усилия ученых, направленные на сохранение
стабильности экосистем и биосферы в целом.
3.4. ИТОГИ АНАЛИЗА СОСТАВА БАКТЕРИАЛЬНОГО
НАСЕЛЕНИЯ ПОЧВ: НОВЫЙ ВЗГЛЯД
НА СТАРУЮ ПРОБЛЕМУ - "ПОЧВЕННЫЕ"
И "НЕПОЧВЕННЫЕ" БАКТЕРИИ
Особого внимания заслуживает вопрос, который
дискутируется в почвенной микробиологии уже на протяжении полувека:
какие бактерии считать "почвенными", а какие
"непочвенными"? Такой вопрос задается и в настоящее время, в том числе в
работах по молекулярной биологии.
С.Н. Виноградский еще в 40-е годы XX в. предложил
разделить почвенную микрофлору на две эколого-трофические
группы: зимогенную и автохтонную. Первая использует
растительные остатки, поступающие в почву, вторая - гумусовые
соединения. Он считал, что только автохтонная микрофлора является
218
постоянно действующей и истинно почвенной, и ее надо изучать
в длительно парующей почве без растений. Впоследствии было
показано, что многие представители зимогенной микрофлоры
способны использовать и гумусовые соединения, и, наоборот,
"автохтонные" бактерии - простые водорастворимые вещества,
и, следовательно, нет смысла разделять почвенные
микроорганизмы по этому принципу.
Развивая представление о функционировании микробных
сообществ почв, Г.А. Заварзин выделил уже не два, а 10 типов
"микрофлор", взаимодействующих друг с другом в соответствии с их
трофическими возможностями и разным отношением к
экологическим факторам (Заварзин, 1970). Представители каждой из
этих групп обнаруживаются в почве. Думается, что
подразделение микроорганизмов на "почвенные" и "непочвенные" весьма
условно, и разные исследователи будут использовать разные
критерии для такой дифференциации. С точки зрения почвенного
микробиолога, изучающего микробное разнообразие с позиций
оценки функциональной роли микроорганизмов в различных
почвенных и биосферных процессах, представляется целесообразным
избрать следующие принципы: считать "почвенными" все
бактерии, которые способны размножаться и функционировать (а не
только сохраняться!) в почве с учетом всех множественных эко-
ниш, которые предоставляет им почва или сопряженные с ней
субстраты в наземном и надземном ярусах. Это филлосфера и
ризосфера, напочвенные разрастания водорослей, микосфера и дри-
лосфера (стенки ходов дождевых червей), почвенные
новообразования, тела беспозвоночных животных и их экскременты и т.д.
Все "почвенные" бактерии являются компонентами
различных биотических сообществ, складывающихся в почве в процессе
их взаимоотношений с растениями, почвенными
беспозвоночными животными, простейшими, грибами. Они способны
осуществлять уникальные функции связывания атмосферного азота (азот-
фиксации), нитрификации, денитрификации, сульфатредукции
и участвовать в деструкции растительных остатков в ассоциациях
с другими представителями почвенной биоты. Спектр таксонов,
входящих в эту группу бактерий, можно определить, используя
принцип последовательного исключения. С этой целью нами был
проведен экологический анализ всех родов бактерий,
включенных в последнее краткое издание "Определителя бактерий Берд-
жи" (1997). Были выписаны основные природные местообитания
этих родов и соответствующие их эконишам биологические
особенности. На этой основе исключались в качестве "непочвенных"
те группы и роды бактерий, которые теоретически не способны
существовать в предоставляемых им почвой условиях.
219
В Определитель включено около 530 родов бактерий,
размещенных по 35 группам. Группы - сборные, в них объединены
бактерии по разным признакам: окраске по Граму, морфологии,
характеру обмена, отношению к экстремальным факторам,
участию в процессах метаногенеза, сульфатредукции, окисления
серы и др. Из 35 групп практически целиком можно исключить
15 групп как "непочвенные", так как в их состав входят
представители таксонов бактерий, требующих для своего существования
таких специфических условий, которые не могут быть
реализованы в почве или сопряженных субстратах.
Прежде всего, это патогенные бактерии, эконишей которых
является организм человека или животных, хотя они могут, как и
все бактерии, сохраняться в почве как в банке. Патогенные
бактерии выделяются, как правило, из различного клинического
материала (кровь, мокрота, экскременты и др.) и требуют сложных
богатых сред. Они представлены в Определителе либо
отдельными группами [спирохеты (группа 1), риккетсии и хламидии
(группа 9), микоплазмы (группа 30)], либо входят в состав
гетерогенных по местообитаниям и биологическим особенностям
групп. В сумме патогенные бактерии составляют около 100
родов, т.е. 20% от общего числа известных родов бактерий.
Другой ряд "непочвенных" форм составляют многие
обитатели пресноводных и морских экосистем. Сюда относятся
большинство хемо- и фотолитотрофных бактерий, участвующих в
основном в превращениях серы и ее соединений. Среди них много
экстремофилов - термофилов, галофилов и ацидофилов. Вся
группа аноксигенных фототрофных бактерий (28 родов) -
типично водные формы, образующие маты в лагунах и выходах
термальных источников или окрашенные стратифицированные
зоны в озерах и морях. И только единичные представители этих
бактерий обнаруживаются в почвах, залитых водой, например в
рисовых чеках. В последнее время, однако, именно из почв
выделены уникальные фототрофные строго анаэробные бактерии,
являющиеся единственными представителями грамположительных
бактерий среди фототрофов, образующие эндоспоры и
содержащие особый бактериохлорофилл g. Это роды Heliobacter и Helio-
bacillus (Определитель..., 1997).
Большинство строго анаэробных бактерий, образующих
метан (метаногены), также являются "непочвенными". Это
обитатели бескислородных морских осадков и иловых отложений,
соленых маршей; 60% метаногенов являются галофилами. В
почвах обнаруживаются лишь представители одного-двух родов.
Различные представители экстремофилов, входящие в состав
самых разных групп бактерий, также можно отнести к "непочвен-
220
ным". Это либо обитатели кипящих сольфатарных вод, для
которых температурный диапазон составляет 70-100°, либо кислых
вод подземных шахт с рН 1-3, либо галофильные архебактерии.
Особую группу типично водных форм составляют сероокис-
ляющие и плоские нитчатые скользящие бактерии, пелонемы,
а также бактерии, образующие чехлы. Это обитатели озер,
ручьев, источников. С другой стороны, существуют облигатно
морские формы бактерий, требующие для роста определенной
концентрации ионов натрия в среде. Так, например, практически все
представители семейства Alteromonadaceae не выделяются из
наземных биотопов. Эти протеобактерии являются типичными
обитателями прибрежных и открытых вод морей и океанов,
донных осадков, кишечного тракта морских животных (Иванова и
ДР., 2001).
Нитрифицирующие бактерии представлены в природе в
основном галофильными видами, и лишь некоторые виды
обнаружены в почве. Генетическое разнообразие хемоавтотрофных ам-
монийокисляющих бактерий в почве оказалось очень низким,
они были представлены лишь Nitrosospira-like бактериями (Aakra
et al., 1999).
При исключении вышеназванных представителей бактерий,
основной эконишей которых являются либо организм человека и
животных, либо пресноводные и морские экосистемы, в числе
"почвенных" остается около 190 родов. Из них 35 составляют ци-
анобактерии - специфические оксигенные фототрофные
бактерии, имеющие широкое распространение в природе: от соленых
водоемов и горячих источников, где они образуют многослойные
маты, до коры деревьев, поверхности скал и почв. Эта группа
рассматриваться здесь не будет, ей посвящены многочисленные
книги и обзоры. Остальные роды представлены в основном гете-
ротрофами, среди которых преобладают аэробные и
факультативно-анаэробные формы. Из числа так называемых
"почвенных" бактерий мы не исключаем тех представителей "водных"
форм бактерий, которые способны существовать в водной фазе
почв. Многие из них являются типичными обитателями
переувлажненных почв. Это диссипотрофные почкующиеся, либо про-
стекобактерии, например, роды Caulobacter, Hyphomicrobium,
Pedomicrobium, Gallionella и др. Хотелось бы еще раз
подчеркнуть условность разделения прокариот на "водные" и
"почвенные". Однако все же прослеживается явная тенденция в
преобладании протеобактерии в водных экосистемах со всем их
огромным морфотипическим и таксономическим разнообразием и
адаптивными признаками, выработанными в процессе эволюции
для обитания в водной среде: жгутики, простеки, прикрепитель-
221
ные диски, чехлы, газовые вакуоли и пр. В почвах, особенно в ее
твердой фазе, доминируют грамположительные бактерии. Это,
прежде всего, актиномицеты, представляющие наземную,
континентальную ветвь прокариот и приспособившиеся к жизни в
твердофазном субстрате благодаря своей мицелиальной
организации (Калакуцкий, Агре, 1977). В качестве основного
местообитания практически всех 55 родов мицелиальных актиномицетов в
Определителе указана почва.
Обширную группу других типично почвенных обитателей
представляют бактерии, тоже принадлежащие к актиномицетной
линии, но отличающиеся от актиномицетов либо отсутствием
настоящего мицелия, либо его наличием на ранних стадиях
развития, с последующей его фрагментацией на палочковидные и кок-
ковидные элементы. Это нокардио- и коринеподобные бактерии.
Самые широко распространенные среди них в почвах - это
бактерии родов Arthrobacter, Rhodococcus и Cellulomonas. С
растениями и животными наиболее тесно связаны протеобактерии,
представленные различными подгруппами этого класса (хотя и среди
актинобактерий обнаруживаются как различные симбионты
растений и животных, так и фитопатогены). Приуроченность
определенных родов бактерий к определенным почвенным мезо-
и микролокусам и типам почв и экосистем была рассмотрена
нами на некоторых примерах выше.
За вычетом мицелиальных актиномицетов, которые нами не
рассматриваются [так как существует отдельная монография,
посвященная их экологии (Звягинцев, Зенова, 2001)], в числе
"почвенных" бактерий остаются примерно 100 родов. Из них
представители 80 родов способны расти на используемой нами для
посева и учета бактерий среде, что свидетельствует о высокой доле
родов "почвенных" бактерий, которые могут быть определены,
используя традиционный метод посева. Применив далее
различные синэкологические индексы для характеристики структуры
бактериального сообщества, можно охарактеризовать
бактериальное разнообразие почв гораздо полнее, глубже и
экологически правдоподобнее по сравнению с таковым, полученным на
основании молекулярно-биологических методов.
Ниже приведен перечень родов бактерий, местообитанием
которых является почва или сопряженные с ней субстраты.
Список составлен по данным "Определителя бактерий Берджи"
(1997), а также по другим литературным источникам и
собственным данным автора. Нами предпринята попытка разделения
этого большого спектра бактерий на группы по их приуроченности
к определенным ярусам, или локусам, связанным с почвой и
сопряженными с ней субстратами:
222
ПРИРОДНЫЕ МЕСТООБИТАНИЯ АЭРОБНЫХ
И ФАКУЛЬТАТИВНО-АНАЭРОБНЫХ
ГЕТЕРОТРОФНЫХ БАКТЕРИЙ
Клубеньки на корнях или листьях растений
Бактерии-симбионты1
Allorhizobium
Azorhizobium
Bradyrhizobium
Rhisobium
Sinorhizobium
Phyllobacterium
Rhizomonas
Frankia
Филлосфера и ризосфера, опад, лесные и луговые подстилки
Грамотрицательные бактерии
Agromonas
Alcaligenes
Aminobacter
(Pseudomonas aminovorans)
Aquaspirillum
Azospirillum
Cellvibrio
Comamonas
(P. acidovorans, P. testosteronii)
Cytophaga
Enterobacter
Erwinia
Flavobacterium
Hydrogenophaga
(P.flava, P. palleronii и др.)
Грамположительные бактерии
Agromyces
Arthrobacter
Aureobacterium
Cellulomonas
Clavibacter
Curtobacterium
Geodermatophilus
223
Herbaspirillim
Klebsiella
Lactobacillus
Methylobacterium
Methylovorus
Myxococcus
Polyangium
Pseudomonas
Sorangium
Sphingobacterium
Sporocytophaga
(Fravobacterium spiritovorum,
F. multivorum)
Xanthomonas
Micrococcus
Mycobacterium
Nocardia
Nocardioides
Oerskovia
Promicromonospora
Rhodococcus
Цветы, ягоды, фрукты
Acetobacter
Gluconobacter
Frateuria
Zymomonas
Почвенный ярус
Alcaligenes
Agromonas
Agromyces
Aquaspirillum
Azotobacter
Arthrobacter
Bacillus1
Beijerinckia
Deinococcus
Derxia
Exiguobacterium
Jantinobacterium
Nitrobacter
Paracoccus
Phenylobacterium
"Spirillum pleomorphum"
Streptomyces
Terrabacter
Clostridium
Xanthobacter
Chromobacterium
Группа диссипотрофных бактерий
(выделяющихся методом предельных разведений в жидких
средах)
Caulobacter
Blastobacter
Hyphomicrobium
Prostecobacter
Stella
Verrucomicrobium
Различные "водные" формы бактерий, которые могут
обитать в переувлажненных почвах
Acidovorax
Acinetobacter
Ancylobacter
(Microcyclus aquaticus)
Azomonas
Buttiauxella
Flectobacillus
Облигатные метанотрофы
Methylobacillus
Methylococcus
Methylomonas
Methylophilus
Methylovorus
Rahnella
Rugamonas
Serpens
Spirillum
Spirosoma
Variovorax
(Alcaligenes paradoxus)
224
Почвы болотных экосистем, кишечник
почвенных беспозвоночных
Факультативно-анаэробные бактерии
Aeromonas Plesiomonas
Bacteroides Proteus
Chromobacterium Serratia
Corynebacterium Staphylococcus
Enterobacter Vibrio
Klebsiella Xanthobacter
Oerskovia Xenorhabdus
Pantoea
Затопляемые почвы (почвы рисовых чеков)
Clostridium Methanobacterium
Desulfotomaculum Rhodomicrobium
Desulfovibrio Rhodospirillum
Heliobacillus Rhodopseudomonas
Heliobacter
Засоленные почвы (солончаки)
Bacillus
Haloarcula
Halococcus
Micrococcus
Natronobacterium
Volcaniella
Почвенные железисто-марганцевые
новообразования
Pedomicrobium
Metallogenium
Gallionella
Seliberia
1 Эти бактерии при их выделении из почвы практически невозможно
идентифицировать по обычным фенотипическим признакам - они определяются по растению-хозяину
с использованием методов иммунной флюоресценции и молекулярно-биологических
методов.
2 В настоящее время различные виды рода Bacillus выделены в самостоятельные
роды - Virgibacillus, Paenibacillus, Aneurinibacillus, Brevibacillus, Halobacillus, Alicyclobacillus,
Amphibacillus, Sporosarcina, Marinococcus. Их дифференциация по фенотипическим и мо-
лекулярно-биологическим признакам и филогенетическое древо даны в обзоре
(Heyndrickx et al.,-1998).
225
Большинство бактерий, ассоциированных с растениями,
выделяются из почв в качестве минорных компонентов; однако при
высокой влажности почв многие из них перемещаются вместе
с водой в почвенную толщу и размножаются там, о чем
свидетельствует их высокое относительное обилие - они входят в
классы среднего обилия или в доминанты. Типично ризосфер-
ные бактерии, ассоциированные с растениями, также
составляют значительную долю общего числа почвенных бактерий,
поэтому разграничение бактерий по их местообитаниям по линии
надземного, наземного и почвенного ярусов весьма условно.
Нами перечислены бактерии тех родов, для которых в качестве
местообитания указана почва или которые наиболее часто
выделяются из неризосферной (т.е. фоновой) почвы и локусов,
связанных с жизнедеятельностью почвенных беспозвоночных
животных.
Таким образом получается, что из почв и сопряженных с
ними субстратов обычным методом посева на различные
питательные среды можно выделить до 100 родов бактерий. Однако,
учитывая, что бактерии распределены по разным мезо- и микроло-
кусам и в разных природно-климатических зонах создаются
разные условия для жизнедеятельности тех или иных бактерий, из
одного местообитания на одной среде (нами использовалась глю-
козо-пептонно-дрожжевая среда) выделяется, как правило, не
более 20 родов, представители которых входят в комплекс
аэробных и факультативно-анаэробных бактерий.
При оценке бактериального разнообразия почв в целом
следует всегда учитывать особенности и специфику исследуемых
типов почв. Так, например, совершенно особые условия для
развития бактерий складываются в таких засоленных почвах, как
солончаки, или в затопляемых почвах рисовых чеков.
Экстремальные галофильные архебактерии, которые выделялись ранее
лишь из морей, соленых озер, лагун, оказались типичными
обитателями и засоленных почв (Звягинцева, 1989). Из содовых
солончаков Армении были выделены галоалкалофильные
архебактерии Natronobacterium pharaonis и /V. occultus, из сульфатных
солончаков Туркмении - углеводородиспользующие галофилы
рода Haloarcula, описанные как новый вид Н. distributus, из солевой
корки серозема - галофильные кокки рода Halococcus, тоже
отнесенные к новому виду - Н. turkmenicus (Звягинцева, Тарасов,
1987).
Однако экстремальные галофилы не входят в число доми-
нантов бактериального комплекса солончаков. Изучение
таксономической структуры бактериальных комплексов в различных
ярусах солончаковых биогеоценозов на побережьях Аральского
226
и Мертвого морей, пустыни Кызылкум, Ростовской обл.
показало, что основными ее компонентами являются галотолерантные
бактерии, представленные небольшим количеством родов
(Лысак и др., 1994). Галофильные архебактерии,
представленные в исследуемых почвах родами Halobacterium и Halococcus,
часто выделялись и лучше росли в смешанных культурах с
бациллами. Авторы делают выводы, согласно которым
экстремальные условия засоленных почв способствуют отбору
специфических форм галотолерантных и галофильных бактерий,
последние не являются преобладающими в солончаках.
Наибольшей галотолерантностью обладали бактерии родов Bacillus и
Micrococcus. Многие представители этих родов росли даже при
содержании 20% соли в среде. Неудивительно поэтому, что на
листьях солянок доминировали бациллы, не обнаруживаемые,
как правило, в филлоплане растений незасоленных почв.
В других специфических типах почв, характеризующихся
благодаря постоянному затоплению анаэробными условиями и
массовым разрастанием водорослей (почвы рисовых чеков)
также формируется особый, отличный от других почв тип
бактериальных сообществ, для которого характерно доминирование
анаэробных клостридий, сульфатредукторов и фототрофных
бактерий, представленных родами Rhodopseudomonas, Rhodospirillum
(Нелидов, 1993). Последние практически не обнаруживаются ни
в зональных, ни в интразональных (болотных) типах почв.
Возможно, что их частая встречаемость в почвах рисовых чеков
связана с их приуроченностью к водорослям, являющимся
характерными компонентами этих биогеоценозов. Известно, что
основным местообитанием фототрофных бактерий в природе
являются водорослевые маты, формирующиеся в озерах и местах
выхода на поверхность термальных источников.
Возвращаясь опять к результатам анализа бактериального
разнообразия почв с помощью молекулярно-биологических
методов, следует отметить, что необходимо учитывать в каких
типах почв обнаруженные представители фототрофных или
галофильных бактерий могут быть аборигенами, а в каких оказаться
транзитными формами, случайно занесенными с ветром или
осадками и сохраняющимися в почве, как в банке-хранилище
микробного генофонда Земли.
Ниже приведены списки родов бактерий, выделенных из почв
или сопряженных субстратов на среде ГПД автором и
сотрудниками кафедры биологии почв факультета почвоведения МГУ.
Перечень бактериальных таксонов - результат многолетних
исследований состава бактериальных сообществ почв в разных
природно-климатических зонах.
227
СПЕКТР РОДОВ БАКТЕРИЙ, ВЫДЕЛЕННЫХ ИЗ ПОЧВ
И СОПРЯЖЕННЫХ СУБСТРАТОВ НА ОДНОЙ
(ГЛЮКОЗО-ПЕПТОННО-ДРОЖЖЕВОЙ) СРЕДЕ
Acinetobacter
Aeromonas
Agrobacteriwn
Agromonas
Agromyces
Alcaligenes
Aquaspirillum
Arthrobacter
Aureobacterium
Azospirillum
Azotobacter
Bacillus
Bacteroides
Beijerinckia
Blastobacter
Brevibacterium
Caulobacter
Cellulomonas
Chromobacterium
Clavibacter
Curtobacterium
Cytophaga
Deinococcus
Enterobacter
Erwinia
Escherichia
Flavobacterium
Geodermatophilus
Gluconobacter
Hyphomicrobium
Klebsiella
Lactobacillus
Methylobacterium
Micrococcus
Mycobacterium
Myxococcus
Nocardia
Nocardioides
Oerskovia
Plesiomonas
Polyangium
Promicromonospora
Prosthecobacter
Proteus
Pseudomonas
Rhizobium
Rhodococcus
Serratia
Sorangium
Sporocytophaga
Staphylococcus
Streptomyces
Vibrio
Xanthobacter
Xanthomonas.
На самом деле, список приведенных родов значительно шире,
если учесть, что в настоящее время многие виды бактерий
переведены в ранг родов - например, вместо одного рода Bacillus
предложено выделять 10 родов. В группе актинобактерий
появилось много новых родов - Rathaybacter, Terrabacter, Gordona,
Dietzia и др., представители которых выделялись ранее из почв
или растений под видовыми названиями в пределах родов
Clavibacter и Rhodococcus. Многие виды Pseudomonas и Flavobacterium
выделены в настоящее время в отдельные роды.
Наблюдающаяся тенденция дробления родов, проводящаяся большей частью по
228
единственному критерию (16S рРНК), приводит к возрастающей
неустойчивости систематики на родовом уровне и создает
ложное впечатление увеличения знаний (Заварзин, 2002).
Некоторые виды претерпевали многочисленные
переименования - например, вид Erwinia herbicola —» Enterobacter agglomer-
ans —»Pantoea agglomerans. Такие таксономические нововведения
основаны на детальном изучении хемотаксономических (состав
жирных кислот и менахинонов, структура пептидогликана
клеточной стенки и др.) и молекулярно-биологических признаков
культур, которые позволяют проводить все более и более
дробную дифференциацию таксонов. Однако при этом все более
трудной становится идентификация культур по фенотипическим
признакам, теряется объединявшая ранее таксоны одного ранга
связь, основанная на таких значимых биологических и
экологических признаках, как формирование спор в клетке, цикл
развития, эколого-трофические особенности, определяющие
приуроченность к определенным экологическим нишам. В результате
все возрастающего числа таксонов бактерий, из которых многие
описаны поверхностно, а их идентификация требует особого
оборудования и вложения капитала, становится практически
невозможным проведение системных экологических исследований,
когда анализируются сотни и тысячи образцов природных
субстратов для установления корреляции между таксономическим
составом бактериальных комплексов и их приуроченностью к
определенному биотопу или экосистеме. Именно такая корреляция
была установлена нами, что и было продемонстрировано выше на
примере анализа таксономической структуры блока аэробных и
факультативно-анаэробных бактерий (50 родов) в разных локу-
сах почвы и разных типах почв и экосистем.
В предыдущих главах также анализировался
таксономический состав бактериальных комплексов - от циано- и альгобакте-
риальных матов к сложным симбиотическим связям бактерий с
высшими растениями; от почвенных мезо- и микролокусов до
бактериальных сообществ наземных экосистем.
Продемонстрирована роль растений, как низших, так и высших, в селекции
определенных групп бактерий и формировании бактериальных
сообществ. Показано, что некоторые группы бактерий как бы
"перешли" от одних эдификаторов к другим по цепочке: водоросли
водных экосистем —> водоросли и высшие растения наземных
экосистем; другие остались на "своих" местах, свидетельством чему
является их приуроченность к морским или пресноводным
биотопам. Примером могут служить большинство аноксигенных и
светящихся фотобактерий, галофильных архебактерий и др., о чем
упоминалось ранее.
229
Что касается "почвенных" бактерий, список которых
приведен выше, то следует обратить внимание на то, что практически
все они не являются "свободноживущими" - иными словами,
бактерии приспособились к жизни в почве, вступая в различные
ассоциативные либо симбиотические связи с растениями,
животными, грибами.
В последнее время появляется все больше публикаций,
подтверждающих более тесные связи бактерий с растениями, чем
это представлялось ранее. Даже такой издавна считающийся
типично почвенным организмом, как Azotobacter, оказался
связанным с растениями. Бактерии этого рода издавна выделяли путем
раскладывания почвенных образцов на безазотистую среду и
подсчитывая процент обрастания почвенных комочков. Эколо-
го-географическому распространению азотобактера в почвах
посвящены две монографии (Сушкина, 1949; Блинков, 1959).
Однако ни в одной из этих публикаций не указывается на его связь с
растениями.
Тем не менее, Azotobacter chroococcum выделяется в большом
количестве из налетов на листьях таких водных растений, как
стрелолист, рдест, тростник, рогоз (Горленко и др., 1977). Этот
же вид азотобактера был обнаружен при микроскопическом
анализе паренхимы корней, стеблей и листьев пшеницы (Tippannavar
et al., 1989), т.е. он способен внедряться и в ткани растения. Было
показано, что связь азотобактера с растениями осуществляется
через продукты их экзоосмоса. Растения сорго экскретируют
в больших количествах феноловые кислоты, которые образуют
в почве стабильные комплексы. Азотобактер активно
использует эти кислоты, удаляя тем самым их из почвы. Показана
корреляция между количеством внесенной популяции азотобактера и
количеством фенолов (Hadhram, Vela, 1992).
Этот эффект был описан еще в 1947 г. отечественными
исследователями (Рудаков, Биркель, 1947). Ими было
установлено, что ряд ризосферных бактерий продуцирует протопектина-
зу, в результате воздействия которой на корневую систему
растений выделяются вещества (среди них разнообразные
ароматические соединения), способствующие росту азотобактера.
Известна способность азотобактера расти на 17 ароматических
соединениях, в том числе оксибензойной кислоте, сиреневой,
ферруловой и др. Показана роль этого организма в усвоении
фенольных кислот, образующихся в результате разложения
гумуса (Fang et al., 1987). Если возвратиться к еще более раннему
периоду в истории Земли, когда не было высших растений, то
существуют многочисленные работы, в которых азотобактер
приводится в качестве характерного компонента альгобакте-
230
риальных сообществ. На основании этих фактов можно
предположить, что азотобактер прошел постепенную эволюцию
местообитаний от водорослей и водных высших растений
до наземных, в том числе и культурных растений и почвенного
гумуса, специализируясь на использовании ароматических
соединений.
Другие группы бактерий ассоциированы с почвенными
животными. Так, факультативно-анаэробные формы протеобакте-
рий, принадлежащие к семействам Enterobacteriaceae и Vibriona-
сеае, являются облигатными компонентами "пристеночного"
сообщества почвенных беспозвоночных, населяющего
внутреннюю поверхность эпителия и кутикулы всех отделов кишечника
(Byzov et al., 1996). Следует отметить, что некоторые из
представителей вышеназванных семейств (например, Vibrio и Аегото-
nas) ассоциированы и с водными животными. Таким образом,
эти бактерии заселили специфические экониши как в водных,
так и наземных экосистемах. Еще более типичным примером
"кишечных" бактерий является Escherichia coli - бактерии,
обитающие в кишечнике практически всех видов животных и
человека, они же обнаружены и в пищеварительном тракте
почвенных животных.
Кроме растений и животных, центрами формирования
бактериальных сообществ могут быть грибы. Ранее мы уже
приводили примеры различных связей грибов с бактериями: от симбиоза
бактерий рода Metallogenium с эпифитными и почвенными
грибами до бактерий-"хелперов", способствующих формированию
микоризы либо прорастанию грибных спор. В последнее время, по
мере накопления данных о природе различных симбиозов,
меняются представления о количестве партнеров, необходимых для
создания устойчивых симбиозов. Установлено, что бактерии
являются обязательными партнерами в эндо- и эктомикоризах,
лишайниках, синцианозах, актиноризах. Роль многих из этих
бактерий пока до конца не выяснена.
Даже те группы бактерий, которые перечислены нами в
качестве "водных" форм либо обитателей водной фазы почв
(Caulobacter, Hyphomicrobium, Prosthecomicrobium и др.),
оказались настолько тесно связанными с целлюлозоразрушающими
бактериями, что было предложено выделять их из колоний этих
бактерий, распространяющихся на фильтровальной бумаге по
мере разрушения целлюлозы. Массовое развитие
морфологически разнообразных форм простекобактерий как партнеров
аэробных целлюлозоразрушающих микроорганизмов было
приурочено к заключительным этапам деструкции соломы в почве
(Васильева, 1984).
231
Приводя примеры приуроченности определенных групп
бактерий к определенным локусам и субстратам, следует иметь в
виду и возможность передвижения бактерий в почве с почвенным
раствором и водой, их перемещение, связанное с локомоторной
деятельностью почвенных беспозвоночных, ростом корней
растений, адсорбцию организмов на почвенных частицах,
поверхности растений, гифах грибов, их десорбцию, прохождение через
кишечник почвенных беспозвоночных с дальнейшим
размножением в экскрементах последних и т.д. Таким образом, с одной
стороны, одни и те же бактерии могут находиться одновременно
в разных почвенных микролокусах, с другой - почва
предоставляет некоторым видам бактерий специфические экониши,
благодаря которым эти бактерии способны размножаться в почвенном
ярусе.
Глава 4
ЭКОЛОГИЧЕСКИЕ ФУНКЦИИ БАКТЕРИЙ
КАК КОМПОНЕНТОВ ПОЧВЕННОГО
МИКРОБНОГО СООБЩЕСТВА
Анализируя таксономический состав бактериальных
сообществ в эволюционном аспекте: от циано- и альгобактериаль-
ных матов до современных наземных фитоценозов, мы
невольно затрагивали вопрос и о функциях бактерий, определяемых,
прежде всего, их приуроченностью к определенным эконишам
или субстратам. Так, агаролитические бактерии обитают в
штормовых выбросах водорослей, хитинразлагающие бактерии
ассоциированы с животными, содержащими хитин в составе тел,
диазотрофные бактерии тесно связаны с растениями и т.д.
Однако на самом деле, функции бактерий определяются не только
наличием определенного субстрата (хотя он и определяет
начало деструктивных цепей), в каждом биотопе создается
полифункциональное сообщество, необходимое для замыкания
биогеохимических циклов и поддержания устойчивости экосистемы
в целом.
4.1. ПРИНЦИПЫ ФУНКЦИОНИРОВАНИЯ
МИКРОБНЫХ СООБЩЕСТВ
Недавно Г.А. Заварзиным (Заварзин, 1995) были
предложены новые "анти-рыночные" принципы, как основополагающие
для объяснения эволюции сообществ и биосферы. Суть этих
принципов такова: "Функциональное положение организма в
трофической системе предполагает в первую очередь
кооперацию, а не конкуренцию; ...сообщества эволюционировали
аддитивно, а не путем дивергенции; ...ведущей формой
взаимоотношений между средой обитания и компонентами сообщества
служат трофические отношения - типы питания" (Заварзин, 1995,
с. 55). Такая парадигма была предложена на смену старой,
идущей от Ч. Дарвина и предполагающей выживание наиболее
приспособленных организмов путем удаления конкурентов.
233
Следует заметить, что в самой общей форме мысль о
взаимопомощи организмов, входящих в то или иное сообщество, была
высказана еще в 1898 г. основателем отечественного
почвоведения В.В. Докучаевым в лекции "О борьбе за существование
и мировой любви". Этот великий естествоиспытатель говорил
о согласии, содружестве, сопомощи и даже любви как основном
законе природы. Кстати, он считал, что эти принципы вовсе не
противоречат дарвиновским, так как "сам Дарвин нигде и
никогда не говорил, что мир управляется одной борьбой за
существование да и не мог этого говорить в качестве великого мыслителя
и безусловно объективного ученого, - тем более, что борьба за
существование есть факт, явление, но не сила" (Докучаев, 1955).
По-видимому, он был прав, так как в настоящее время речь идет
скорее о смещении акцента в пользу главенствующего в природе
"закона любви", а не "борьбы за существование". Именно такой
компромиссный вариант, в конце концов, и предлагается в
качестве заключительного при формулировке основных принципов
функционирования и эволюции природных сообществ Г.А. За-
варзиным: "Кооперация лежит в основе трофической пирамиды
сообществ, а конкуренция служит механизмом тонкой
регулировки в системе" (Заварзин, 1995, с. 57).
Весь приводимый нами в предыдущих главах материал,
касающийся сравнения таксономического состава бактериальных
сообществ в альгосфере и фитосфере высших растений, в
кишечнике водных и почвенных животных, является подтверждением
принципа аддитивности, проявляющегося в процессе эволюции
микробных сообществ. Иными словами, происходило
постепенное перемещение уже сложившихся ранее бактериальных
сообществ в иные экониши с постепенным дополнением или
замещением некоторых форм или видов бактерий. Те типы
взаимоотношений, которые складываются в процессе функционирования
почвенных микробных комплексов и которые будут
продемонстрированы далее, также свидетельствуют в пользу того, что они
формируются на основе прежде всего метабиотических или син-
трофных взаимодействий и реже - конкурентных.
Однако, переходя к анализу почвенных бактериальных
сообществ, следует иметь в виду, что для объяснения их
функционирования недостаточно общих принципов развития и эволюции
микробных сообществ, приведенных выше, так как следует
учитывать специфику почвы как среды обитания микроорганизмов.
Концепция строения и функционирования комплекса почвенных
микроорганизмов была разработана и четко сформулирована
Д.Г. Звягинцевым (1987). Здесь хотелось бы перечислить
некоторые наиболее значимые положения: представление о почве как
234
множестве сред обитания микроорганизмов, концепцию
микробного пула и пула метаболитов, принцип дублирования и
обратимости микробиологических процессов, принцип множественного
лимитирования и ненасыщенности комплекса почвенных
микроорганизмов. Благодаря открытию новых вышеприведенных
законов, в соответствии с которыми осуществляется
функционирование комплекса почвенных микроорганизмов, удалось
объяснить многие, непонятные ранее явления в почвенном микромире.
К ним относятся, например, потребность многих форм
почвенных микроорганизмов в особых факторах роста и "богатых"
средах при их выделении из почвы (наличие в почве микролокусов,
в которых создаются особые условия, позволяющие обитать в
почвенном ярусе разным формам микроорганизмов); наличие
большого пула микроорганизмов в почвах, характеризующихся
экстремальными условиями; выживание и размножение интроду-
цированных в почву микробных популяций; осуществление
разных (часто противоположных) функций одними и теми же
микроорганизмами и др.
Следует сказать и о принципах взаимодействия разных эко-
лого-трофических групп микроорганизмов, лежащих в основе
функционирования почвенных микробных сообществ.
Частично об этом уже упоминалось в начале главы. Один из вариантов
строения микробной системы почв был предложен Е.Н. Мишу-
стиным (1984), дополнившим автохтонную и зимогенную
группировку двумя другими: олиготрофной и автотрофной.
Представление о функционировании микробных сообществ почв как
о триаде: гидролитики-копиотрофы-олиготрофы (Гузев,
Иванов, 1986), позволило представить микробную систему почв как
саморегулирующуюся биологическую систему,
обеспечивающую разложение органического вещества в почве. При этом
управляемой величиной в системе является процесс гидролиза
полимеров, а сигнальными метаболитами обратной связи служат
образующиеся при этом мономерные соединения. За счет
опережающих темпов образования мономерных соединений над их
потреблением гидролитики лишаются способности
синтезировать экзоферменты (катаболитная репрессия) и переходят в
покоящееся состояние. Копиотрофы, благодаря высокой
скорости роста, снижают концентрацию мономеров в среде и создают
тем самым возможность для функционирования группы олиго-
трофов, которым отводится ведущая роль основных
утилизаторов органических веществ, поступающих в среду (Гузев, 1988).
Однако представляется, что все предложенные схемы
функционирования микробных сообществ почв являют собой лишь
возможные варианты осуществления описанных механизмов.
235
Следует учитывать, что большинство микроорганизмов в почве
находится в виде ассоциаций, партнерами в которых могут быть
представители различных таксономических и эколого-трофиче-
ских групп: микоплазмы на гифах грибов, спириллы в слизи ми-
ксобактерий, актиномицеты в симбиозе с водорослями (актино-
лишайник) и др. При этом, по-видимому, в каждом варианте
механизмы взаимодействия партнеров разные и не могут быть
уложены в какую-то единую схему функционирования почвенного
микробного сообщества. Так, например, известно, что в
колониях целлюлозоразрушающих бактерий развиваются
многочисленные олиготрофы (Васильева, 1984), потребляющие
продукты гидролиза целлюлозы без помощи посредников, т.е. копио-
трофов, которые необходимы, согласно концепции B.C. Гузева,
для снижения концентрации мономеров в среде. Таким образом,
в разных почвенных мезо- и микролокусах будут складываться
разные типы сообществ, определяемые эдификатором
(растение, грибы, почвенные беспозвоночные) и включающие
представителей разных таксонов, между которыми складываются
разные типы взаимоотношений - от симбиотических до
антагонистических.
4.2. РОЛЬ БАКТЕРИЙ В БИОСФЕРНЫХ
ФУНКЦИЯХ ПОЧВ
В последнее время в связи с угрозой экологической
катастрофы и социально-экономической нестабильности понятие
"устойчивое развитие" стало едва ли не самым популярным в научной
и общественно-политической лексике. Обсуждая различные
аспекты устойчивости экосистем, исследователи обращаются к
вопросу о роли почв в экосистеме, акцентируя внимание на то, что
почву следует рассматривать не только как результат
почвообразовательного процесса, но и как полифункциональную
энергетически открытую самоорганизующуюся природную систему,
обеспечивающую устойчивый циклический характер
воспроизводства жизни на земле (Добровольский, Никитин, 1990; Смагин,
1994).
Считается, что основное условие поддержания гомеостаза
биогеоценозов и биосферы в целом - устойчивость биогеоцено-
тических функций почв (Добровольский, 1998). Детальная
характеристика многочисленных (16 типов) функций почв дана в
работах Г.В. Добровольского и Е.Д. Никитина (1990, 2000).
Почвенные микроорганизмы столь разнообразны и многочисленны, что
участвуют в выполнении почвой каждой из ее биогеоценотиче-
ских функций. Анализ вклада почвенных микробных сообществ,
236
в том числе и бактериальных, в эти функции дан в обзорах
(Звягинцев и др., 1992,1999,2000). В связи с этим мы не будем
рассматривать все функции всех бактерий, а сконцентрируем внимание
на том гетеротрофном блоке аэробных и
факультативно-анаэробных бактерий, который рассматривается в качестве
основного объекта в данной книге.
Однако прежде чем сделать это, следует напомнить о
глобальной, планетарной роли бактерий, которые создали
атмосферу и биосферу Земли. Все биогеохимические процессы в
биосфере на протяжении более 1 миллиарда лет определялись только
прокариотами, а цианобактериям мы обязаны появлению
кислорода в атмосфере, что привело к принципиальной перестройке
процессов на Земле. Все эти вопросы обсуждаются в
многочисленных публикациях Г.А. Заварзина (1984,1997), поэтому нет
необходимости приводить здесь эти данные. Бактерии не только
создали атмосферу Земли, но и поныне вместе с другими
представителями почвенной биоты выполняют одну из ведущих
биосферных функций почв - регулируют состав газов в атмосфере.
Газы и летучие органические соединения только частично
поступают в почву извне, наибольшее разнообразие газообразных
веществ образуют в почве микроорганизмы в результате своей
жизнедеятельности. Особенности состава газовой фазы почв,
роль микроорганизмов в процессе превращения газов, влияние
антропогенных факторов на газообмен между почвой и
атмосферой - все эти вопросы детально освещены в монографии
Д.Г. Звягинцева "Почва и микроорганизмы" (1987).
Поскольку газовый состав атмосферы определяет во
многом температуру Земли, в последнее время возник особый
интерес к проблеме, связанной с прогнозированием глобального
потепления климата на нашей планете, в котором ведущая роль
отводится газам, обусловливающим парниковый эффект. К
таким газам относятся диоксид углерода, метан и закись азота.
Делаются попытки выяснить причины нарушения теплового
баланса планеты, вызванные значительным накоплением в
атмосфере парниковых газов. Так, интенсивное выделение в
атмосферу недовосстановленных соединений азота объясняется
повышенной активностью денитрифицирующих и
нитрифицирующих бактерий, проявляющейся при внесении высоких доз
азотных удобрений в почву. Особое внимание обращается на
неуклонное увеличение содержания в атмосфере закиси азота,
являющейся промежуточным продуктом окисления в ходе
разных процессов, из которых наибольшее значение по масштабам
имеет денитрификация. Закись азота (N20) - один из
важнейших микрогазов атмосферы Земли, ответственный за разруше-
237
ние "озонового экрана" планеты, длительность его пребывания
в атмосфере составляет около 130 лет. Установлено, что
повышенной эмиссией закиси азота отличаются засоленные почвы,
так как в них наблюдается торможение денитрификации на
стадии образования этого микрогаза. В связи с увеличением
ареала засоленных почв в результате процесса аридизации суши, это
явление приобретает глобальные масштабы, приводящие к
нарушению устойчивости почв и биосферы в целом (Степанов
и др., 1997; Умаров, 2001; Stepanov, Korpela, 1997).
Причиной повышенной эмиссии метана из заболоченных
почв в условиях антропогенной нагрузки явилось нарушение
метанового цикла. Возросшие концентрации азота, фосфора и
калия (кислые дожди) привели к изменению метаболизма
микробного сообщества в двух направлениях: ускорили распад торфа и
подавили активность метанотрофов, выводящих метан из
атмосферы (Паников, 1998).
Эти примеры свидетельствуют о том, что хотя буферная
емкость комплекса почвенных микроорганизмов достаточно
велика, в условиях сильного антропогенного воздействия почвенные
микроорганизмы не могут справиться с газовой нагрузкой на
почву или справляются с ней, но в ущерб газовому равновесию в
биосфере (Звягинцев, 1987). Отсюда вытекает необходимость
постоянного мониторинга за функционированием почвенных
микробных сообществ в условиях повышающейся антропогенной
нагрузки и охраны почв как главного компонента биосферы,
определяющего жизнь на Земле.
Если в некоторых биохимических процессах бактерии в
процессе эволюции биосферы отдали пальму первенства другим
организмам (снабжение кислородом - высшим растениям,
деструкцию целлюлозы и других растительных полимеров - грибам), то
в круговороте азота и серы они сохранили ключевые позиции.
Следует также сказать, что бактерии (прокариоты) обладают
уникальными функциями, которые способны выполнять только
они: азотфиксация, метаногенез и сульфатредукция. Поскольку
выделение метана, равно как и сульфатредукция, происходит в
большинстве почв в небольших масштабах (за исключением
болотных почв и рисовников), основное внимание будет
сконцентрировано на роли бактерий в цикле азота.
Общепланетарная роль диазотрофных (т.е. способных
фиксировать азот из атмосферы) бактерий образно сформулирована
ведущим специалистом в области "биологического азота"
М.М. Умаровым (2001, с. 47): «Величайший парадокс жизни
состоит в том, что все без исключения организмы на Земле,
нуждаясь в источниках доступного азота и не имея способов его резер-
238
вирования, находятся в "океане" молекулярного азота, который
не только окружает, но буквально пропитывает их. Только бак-
терии-азотфиксаторы способны обеспечить себя и всю биосферу
азотом за счет своей деятельности, а единственный способ
запасания его впрок - превращение в специфическое органическое
вещество почвы - гумус». Мы не будем останавливаться на
проблеме биологического азота, так как современное состояние
этого вопроса и перспективы исследования микробной азотфикса-
ции представлены в процитированном выше докладе М.М. Ума-
рова на Всероссийской конференции "Перспективы развития
почвенной биологии". Хотелось бы лишь отметить, что в конце
доклада автор, рассматривая наиболее перспективные пути
увеличения активности азотфиксации, заключает, что овладение
микробной азотфиксацией позволит решить не только проблему
снабжения человечества продовольствием, но и обеспечит
устойчивость биосферы. Возвращаясь к многочисленным спискам
бактерий, в которых перечисляются характерные для фитосферы
наземных растений представители (см. главу 1), следует помнить,
что, согласно современным представлениям, практически все они
способны к азотфиксации и имеют тесные связи с растениями,
которые стимулируют их деятельность и определяют динамику
азотфиксации за счет фотосинтатов, экскретируемых в среду.
Бактерии ответственны не только за функцию связывания
азота из атмосферы, но и являются основными агентами,
проводящими процессы как нитрификации, так и денитрификации,
определяя, таким образом, цикл азота в биосфере. Среди бактерий
способностью к денитрификации обладают представители
многих таксонов, среди которых доминируют представители родов
Pseudomonas и Bacillus. При изучении динамики таксономической
структуры комплекса денитрифицирующих бактерий в дерново-
подзолистой почве методом сукцессионного анализа было
показано, что на ранних этапах сукцессии доминируют миксобакте-
рии, а на поздних - бациллы, представленные факультативно-
анаэробными видами - В. cereus, В. circulans и В. polymyxa (Ману-
чарова и др., 2000). Представители всех вышеназванных
таксонов редуцировали нитраты до закиси азота, причем наибольшей
активностью обладали представители вида В. polymyxa,
перенесенного ныне в род Paenibacillus как P. polymyxa (Lebuhn et al.,
1997). Считается, что бактерии вновь созданного рода
Paenibacillus (куда вошли и другие виды бактерий) являются наиболее
активными азотфиксаторами. Они же оказались и активными де-
нитрификаторами, что лишний раз подтверждает один из
принципов функционирования почвенных микробных сообществ,
согласно которому одни и те же бактерии способны выполнять раз-
239
ные, даже противоположные (как и в данной ситуации) функции
в зависимости от тех условий, которые создаются в почве
(Звягинцев, 1987).
.Если способностью к азотфиксации и денитрификации
обладают бактерии из самых разных эколого-трофических групп и
семейств, то все известные в настоящее время
нитрифицирующие бактерии (за исключением рода Nitrobacter) принадлежат к
специализированной группе облигатных хемолитотрофов. Для
получения энергии эти бактерии используют окисление аммония
и нитритов. В почвах наиболее часто встречаются представители
родов Nitrosolobus и Nitrosospira, реже Nitrosomonas (Watson et al.,
1981). Определение родового спектра аммонийокисляющих
бактерий в почвах с помощью современных молекулярно-биологи-
ческих методов (Aakra et al., 1999) показало низкое генетическое
разнообразие нитрифицирующих бактерий с доминированием
Nitrosospira-подобных бактерий. Численность
нитрифицирующих бактерий (выделенных методом посева) довольно низка и не
превышает в естественных биогеоценозах нескольких десятков
тысяч на 1 г почвы. Геохимическая деятельность
нитрифицирующих бактерий особенно значима в корах выветривания, где она
способствует растворению минералов за счет выделяемых
бактериями кислот.
Таким образом, практически все этапы цикла азота
осуществляются бактериями. Однако в последнее время в результате
изучения роли грибов в превращениях азота в почвах эта концепция,
существовавшая в течение длительного периода времени, была
поколеблена. Выяснилось, что грибы способны не только к
аммонификации и гетеротрофной нитрификации (что было
известно и ранее), но и к денитрификации. Образование нитритов и
нитратов при окислении аминного или аммонийного азота было
обнаружено у широкого спектра почвенных микромицетов, что
обусловливает возможность дублирования этого процесса в
почвах (Кураков, 2001).
Новым фактом, выявленным в процессе изучения
минерализации почвенными микроорганизмами пептона, представляется
также значительный вклад грибов в этот процесс, который
может достигать 70-80% в почве под лесом и 40-50% в
окультуренной почве. Однако удельная активность минерализации пептона
(на единицу биомассы) у бактерий была значительно (в 5-7 раз)
выше по сравнению с грибами. Показано, что вклад эукариот и
прокариот в этот процесс зависит от соотношения их биомасс
(Кураков, 2001).
Ранее мы уже констатировали, что функции бактерий в
биосфере и почвенных процессах многогранны и многочисленны.
240
Хотелось бы сослаться еще на ряд публикаций, в которых
раскрываются биогеоценотические функции почвенных бактерий.
Так, роль микроорганизмов (особенно бактерий) в процессах
почвообразования детально освещена в книге Т.В. Аристовской
"Микробиология процессов почвообразования" (Аристовская,
1980). Автор выделила 8 типов элементарных почвенно-биологи-
ческих процессов (ЭПБП) и проанализировала роль
микроорганизмов в каждом из них. Эти процессы следующие: разложение
растительного опада, образование гумусовых веществ,
разложение гумуса, деструкция минералов, минералообразование, глее-
образование, ортштейнообразование и засоление почв.
Особенно интересными представляются разделы книги, в которых
даются материалы, представляющие результаты собственных
экспериментальных данных автора книги, изучившего и описавшего
новые роды бактерий, участвующих в превращениях железа и
марганца в почве, в ортштейнообразовании.
Возвращаясь к вопросу о многофункциональности
почвенных бактерий, следует отметить, что при изучении
таксономического состава бактериальных комплексов в почвах Центрально-
Лесного государственного биосферного заповедника нами было
продемонстрировано, что способность к окислению соединений
железа и марганца широко распространена среди банальных
форм почвенных бактерий, принадлежащих к разным эколого-
трофическим группам и представленных в основном спириллами,
бациллами и миксобактериями. Доля таких бактерий достигала
40% от общего числа бактерий, учитываемых на средах,
содержащих восстановленные формы Fe и Мп (Алехина и др., 1997).
Несмотря на то, что с появлением высших растений основная
функция, связанная с деструкцией растительных остатков,
перешла к грибам, бактерии все же продолжают участвовать в
разложении растительного опада. Среди бактерий гидролитического
комплекса есть разнообразные по своим функциям бактерии,
способные разрушать и целлюлозу, и пектин, и хитин; нет лишь
среди прокариот организмов, способных к деградации лигнина.
Роль бактерий и таксономический состав бактериальных
комплексов, принимающих участие в деструкции растительных
остатков, можно представить наиболее четко, если прибегнуть к
вертикально-ярусному подходу, позволяющему проследить разные
этапы конвейерной переработки растительного опада. Это было
рассмотрено нами ранее, в том числе даны списки таксонов
бактерий, представители которых приурочены к определенным
ярусам (см. раздел 3.4). Стоит лишь напомнить, что по вертикальной
структуре биогеоценозов меняется как таксономическая
структура бактериальных комплексов, так и принадлежность домини-
241
рующих форм бактерий к определенным эколого-трофическим
группам и типам стратегий. Причем, смена таксономического
состава бактериоценоза происходит путем последовательного
обогащения каждого из горизонтов новыми формами с сохранением
таксонов, характерных для вышележащих слоев. В этом также
проявляется принцип аддитивности, лежащий в основе
формирования микробных сообществ. Так, в лесных биогеоценозах в
подстилке при сохранении бактерий, типичных для филлопланы,
появляются бациллы и стрептомицеты (практически
отсутствующие в филлоплане), которые являются активными гидролитика-
ми, проводящими процесс деструкции растительных остатков и
микробной биомассы как в подстилках, так и в почвах. В
подстилках значительно увеличивается доля скользящих целлюло-
зоразрушающих бактерий (цитофаги и миксобактерии),
являющихся минорными компонентами в надпочвенном ярусе.
Типичным педобионтом является артробактер, который, в
отличие от почвы, не обнаруживается ни в филлоплане, ни в
подстилке. С другой стороны, наблюдается континуум бактерий,
которые ассоциированы с растениями и переходят из филлопланы
в ризоплану. Среди них доминируют протеобактерии,
относящиеся к группе копиотрофов и олиготрофов, питающихся
прижизненными выделениями растений, например псевдомонады,
спириллы, флавобактерии, энтеробактерии и др. В то же время как
в филлосфере, так и ризосфере обнаруживаются и бактерии
гидролитического комплекса, использующие в качестве источника
питания отмирающие клетки листьев и корней. Таким образом,
следует говорить лишь о тенденции к смене эккрисотрофов
(г-стратегов), доминирующих на живых растениях, гидролитика-
ми (L-стратегами) в подстилках и олиготрофами (К-стратегами)
в почвенном ярусе. Учитывая микроочаговость почвы, в одном
и том же локусе можно обнаружить представителей всех эколо-
го-трофических групп, концентрирующихся около того или
иного эдификатора. В качестве таких мезолокусов могут быть
названы ризосфера, микосфера, дрилосфера.
Если теперь обратиться к использованию конкретных
субстратов бактериями разных таксонов, то следует обратить
внимание на узкий спектр бактерий, способных использовать
полимеры полисахаридной природы. Целлюлозу в почве и
сопряженных с ней субстратах способны разлагать скользящие бактерии
из порядка Myxobacterales и цитофаги (роды Cytophaga и Sporo-
cytophaga), из коринеподобных бактерий только один род Cellulo-
monas включает бактерии, способные к расщеплению
целлюлозы, среди бацилл и актиномицетов известны отдельные виды-
целлюлолитики и, наконец, бактерии рода Cellvibrio, приурочен-
242
ные, как правило, к водорослям или лишайникам. О присутствии
аэробных целлюлозоразрушающих бактерий рода Cellvibrio во
внутренних частях таллома литофильных лишайников,
находящихся в метабиотических взаимоотношениях с водорослями, еще
в 1949 г. писал известный почвенный микробиолог Д.М. Новог-
рудский. Думается, что представители рода Cellvibrio так и
остались ассоциированными с низшими растениями, переходя от
водных к наземным формам, так как они ни разу не были
обнаружены нами при анализе бактериальных комплексов растительного
опада или подстилок как лесных, так и луговых фитоценозов.
Известен факт обнаружения большого количества этих
целлюлозоразрушающих вибрионов в такыровидных почвах на
заключительных этапах разложения соломы (Васильева, 1984). Однако
если учесть, что основными растениями, поселяющимися на
корочках такыров, являются водоросли, то можно предположить,
что и в этом случае вибрионы были исходно ассоциированы
с водорослями (солома вносилась в почву в модельных опытах).
Анаэробные деструкторы целлюлозы (кроме клостридий)
обитают в основном в кишечном тракте разнообразных как
беспозвоночных, так и позвоночных животных (в рубце). Они
представлены разными родами, которые мы рассматривать не будем.
Способностью разлагать пектин и гемицеллюлозу обладают
практически все фитопатогенные бактерии, которые проникают
благодаря этим свойствам в растительные клетки. Среди споро-
образующих бактерий (как бацилл, так и клостридий), также
встречаются виды, способные разрушать межклеточные
вещества растений. Несколько шире спектр бактерий, использующих
крахмал, хотя он и ограничивается эколого-трофической
группой гидролитиков. Что касается использования белков и
нуклеиновых кислот, то круг бактерий, способных использовать эти
соединения, трудно ограничить какими-либо рамками. Среди ко-
пиотрофов и олиготрофов, питающихся мономерами,
наблюдается предпочтительное использование разными бактериями
разных соединений - Сахаров, спиртов, органических кислот,
ароматических соединений. Как правило, выбор того или иного
субстрата пытаются объяснить приуроченностью тех или иных
бактерий к определенным местообитаниям, например ризосфере
или микоризосфере, куда поступают различные продукты
экскреции растений или грибов. Однако в одном и том же локусе
обнаруживается сообщество бактерий с совершенно разными
потребностями в питании. Иногда удавалось показать роль
некоторых метаболитов водорослей или грибов, которые действовали
как аттрактанты. В качестве примера мы уже приводили
хемотаксис азоспирилл по отношению к малату, фумарату и сукцинату -
243
органическим кислотам, выделяемым водорослями и корнями
высших растений. Но тогда почему у других бактерий, которые,
так же как и азоспириллы, ассоциированы с этими же
растениями, не наблюдалось подобного явления? Думается, что ответ
следует искать в области сложных межорганизменных отношений,
определяемых, прежде всего, метабиотическими и синтрофными
связями.
Анализируя различные функции почвенных бактерий,
связанные с выяснением их роли в циклах азота и углерода,
представляется целесообразным опять возвратиться к одному из
принципов функционирования микробных сообществ - кооперации. В
микробиологической литературе накопилось достаточно много
фактов, подтверждающих значимость этого типа
взаимоотношений, результатом которых является повышение эффективности
всех процессов, проводимых микробными сообществами. Одним
из самых распространенных типов положительных
взаимодействий между организмами являются синтрофные, когда одна из
групп в микробном сообществе обеспечивает условия
деятельности другой. Синтрофия основана либо на подготовке одним
организмом субстрата для другого, либо на передаче факторов роста,
либо на удалении токсического продукта.
Одним из наиболее типичных примеров синтрофных
взаимоотношений, основанных на факторах роста, может служить
ассоциация целлюлозоразрушающих и азотфиксирующих бактерий.
Такие ассоциации начали создавать искусственно для
интенсификации деструкции целлюлозы в биотехнологии. Они включают
обычно представителей рода Azospirillum или других родов диазо-
трофных бактерий и целлюлозоразрушающих бактерий -
Cellulomonas, Cytophaga, Bacillus (Halsall, Gibson, 1985, 1986). При
этом целлюлозоразрушающие бактерии используют азот,
фиксируемый азоспириллами, в то время как азоспириллы, не
способные разрушать целлюлозу, потребляют продукты гидролиза
целлюлозы, осуществляемого гидролитиками. Аналогичные
синтрофные ассоциации описаны для пектинразрушающих
{Bacillus polymyxa) и азотфиксирующих {Azospirillum) бактерий
(Khammas, Kaiser, 1992). В этом сообществе азоспириллы
использовали в качестве продуктов ферментации пектина,
осуществляемой бациллами, уксусную и янтарную кислоту, при этом нитро-
геназная активность азоспирилл была намного выше, чем в
чистой культуре. Подобные типы ассоциаций, вероятно,
формируются в естественных условиях, например в ризосфере растений.
Однако представляется более правдоподобной точка зрения
Г.А.Заварзина, согласно которой в природных сообществах нет
прямого взаимодействия между парой организмов, а есть общие
244
резервуары субстратов, продуктов, факторов роста, из которых
могут черпать все члены сообщества. Парные взаимодействия
рассматриваются как упрощение, удобное для моделирования
(Заварзин, 1984). Все вышеприведенные примеры
свидетельствуют в пользу того, что нельзя рассматривать какую-либо одну из
функций бактерий, например роль в азотном цикле, в отрыве от
углеродного обмена и взаимодействий при этом бактерий с
другими бактериями, растениями или грибами.
Известно, что ассоциированные с растениями бактерии фил-
лопланы и ризопланы выполняют множественные функции,
обеспечивая растение не только азотом (азотфиксация), но и
выделяя различные физиологически активные вещества,
стимулирующие рост растений, и антибиотики против фитопатогенных
бактерий. Наглядным подтверждением необходимости анализа
межорганизменных взаимоотношений является открытие
сопряженности процессов азотфиксации и фотосинтеза,
значительного усиления азотфиксации в ассоциациях бактерий с
дрожжевыми грибами или микромицетами, наличия бактерий-хелперов,
способствующих формированию микоризы, бактерий-спутников
в качестве компонентов микробных сообществ в лишайниках и
актинолишайниках и др. Неслучайно проблема
межорганизменных взаимоотношений была названа в качестве одной из
актуальных на современном этапе развития биологии почв
(Звягинцев, 2001).
Вся стратегия научного поиска в вопросах прикладного
использования микроорганизмов сместилась, начиная с 70-х гг.
XX в., в направлении создания консорциумов микроорганизмов,
а не чистых культур, как это было ранее. Анализ
многочисленных преимуществ сообществ микроорганизмов перед
монокультурами и материалы по использованию разных типов микробных
консорциумов в биотехнологии, были обобщены и представлены
в виде трех томов под общим названием "Экобиотехнологиче-
ский потенциал консорциумов микроорганизмов" (Рыбальский,
Лях, 1990).
ЗАКЛЮЧЕНИЕ
Источники формирования бактериальных комплексов почв
следует искать в далеком прошлом. Этот постулат явился
основой для применения эволюционно-биосферного подхода к
анализу состава современных почвенных бактериальных сообществ.
Согласно концепции об облике древних ландшафтов - "ни суша,
ни море" (Еськов, 2000), происходило одновременное освоение
бактериями и водных, и наземных территорий, учитывая, что
жизнь всегда концентрируется на границе суши и воды. Исходя
из этого положения, представлялось целесообразным провести
анализ многочисленных литературных данных, посвященных
описанию таксономической структуры бактериальных
сообществ как в водных, так и в наземных экосистемах, и сравнить
организацию их бактериального населения.
В акваториях наблюдается стратификация бактериальных
сообществ, определяемая освещенностью, газовым составом и
концентрацией солей. Существует набор морфологических и
эколого-физиологических особенностей "водных" форм
бактерий, являющихся результатом адаптации бактерий к водной
среде. В бактериальных сообществах как пресноводных, так и
морских экосистем доминируют грамотрицательные бактерии -
представители класса Proteobacteria. Автор поддерживает и
развивает точку зрения Г. Мюллера (Muller, 1977), согласно которой
эволюция клеточной стенки грамотрицательных бактерий
происходила в водной среде, в отличие от таковой грамположитель-
ных бактерий, эволюционировавших в наземных условиях. Про-
теобактерии осуществляют в акваториях все экологические
функции благодаря наличию среди них представителей всех эко-
лого-трофических групп. Грамположительные бактерии
обнаруживаются в качестве минорных компонентов в водной массе, их
доля значительно больше в илах (подводных почвах).
Разнообразие грамположительных бактерий возрастает также в штормо-
246
вых выбросах водорослей, где происходит их деструкция уже в
наземной среде.
Формирование бактериальных сообществ шло по принципу
аддитивности, а не конкуренции (Заварзин, 1995).
Подтверждением этому является близкий таксономический состав
бактериальных сообществ в фикосфере, альгосфере и фитосфере высших
растений, хотя и наблюдалось конкурентное исключение
некоторых таксонов в процессе коэволюции водорослей и бактерий.
Так, например, происходил селективный отбор грамотрицатель-
ных форм бактерий в связи с ингибированием грамположитель-
ных за счет продуктов экскреции водорослей.
Сформировавшийся набор протеобактерий перешел практически неизменным от
водорослей к высшим растениям, при этом наблюдалось лишь
пополнение сообщества за счет различных форм грамположи-
тельных бактерий, которые уже не отторгались высшими
растениями. Ситуация, когда актинобактерии (континентальная ветвь
прокариот) становятся доминантами в бактериальных
сообществах, наблюдается в тех наземных экосистемах, где
экстремальные условия суши выражены наиболее резко, т.е. в пустынях.
Говоря о целенаправленном ингибировании водорослями
грамположительных бактерий, следует иметь в виду, что были и
исключения. Мицелиальные прокариоты (актиномицеты),
относящиеся к грамположительным бактериям, были обнаружены на
водорослях в вендских отложениях, они вступили с водорослями
в симбиотические взаимоотношения, образовав актинолишайни-
ки (Зенова и др., 1980), сыгравшими, по-видимому, в
формировании наземных бактериальных сообществ не меньшую роль, чем
симбиозы гриба с водорослью (лишайники).
Нами было показано, что как в лишайниках, так и актиноли-
шайниках содержатся в качестве постоянных компонентов
разнообразные гетеротрофные бактерии, хотя их функции (кроме
азотфиксации) пока не ясны. По литературным данным,
бактерии выступают в качестве "хелперов" при формировании
микоризы, снабжают азотом и ростовыми веществами растения,
грибы и животных, с которыми они находятся в симбиотических
либо ассоциативных связях. Все эти факты заставляют изменить
наши представления о количестве партнеров в симбиозах (их
значительно больше, чем предполагалось ранее), где бактерии
выполняют определенную экологическую функцию,
способствующую, по-видимому, формированию и стабилизации симбиозов.
С появлением почвенного покрова сложившиеся ранее
симбиозы и ассоциации бактерий с растениями, грибами и
животными территориально "переместились" в почвенный ярус в зоны
ризосферы, микосферы, дрилосферы, кишечник почвенных бес-
247
позвоночных, причем этот процесс не был одномоментным.
Можно привести примеры, подтверждающие "перемещение"
бактерий из других биотопов в почву. Ранее мы уже упоминали
о близости по составу бактериальных сообществ в альгосфере
и ризосфере. В качестве другого примера можно привести
постепенную эволюцию фоторизобий, обитающих первоначально в
клубеньках на стеблях водных бобовых растений, а затем
"переселившихся" в корневые клубеньки растений, в почвенный ярус.
При этом фототрофия была утрачена (за ненадобностью), и ри-
зобии перешли на гетеротрофный образ жизни (Fleischman,
Kramer, 1998). Многие факультативно-анаэробные протеобакте-
рии, являющиеся характерными обитателями кишечника
разнообразных как водных, так и наземных животных, также
"пристроились" в почвенном ярусе, заняв в качестве экониши стенки
кишечника почвенных беспозвоночных ("пристеночное
сообщество"). В отличие от водных животных, в кишечнике почвенных
беспозвоночных обитают и разнообразные представители акти-
номицетной линии - континентальной ветви прокариот, что
свидетельствует о постепенном расширении спектра бактериальных
сообществ, ассоциированных с животными, при заполнении ниш
в наземных экосистемах.
Скользящие бактерии, которые характеризуются как бентос-
ные формы (ползающие по дну водоемов), также частично
переместились на сушу (цитофаги, спороцитофаги, миксобактерии) и
поселились в филлосфере и ризосфере высших растений, в
подстилках. Вместо деструкции водорослей в акваториях, они
начали осуществлять процесс разрушения растительных остатков
высших растений. Гидролитический блок почвенных бактерий
пополнялся разными представителями грамположительных
бактерий, способными разлагать сложные полимеры. Если в водных
экосистемах целлюлоза и хитин разлагаются исключительно
протеобактериями (целлюлоза - цитофагами и миксобактерия-
ми, хитин - вибрионами и фотобактериями), то в наземных
экосистемах эту функцию взяли на себя (помимо грибов) грамполо-
жительные бактерии. Они представлены бациллами, клостриди-
ями, целлюломонадами, актиномицетами. Следует отметить, что
и в ил ах (подводных почвах) деструкторами целлюлозы, помимо
цитофаг, являются спорообразующие бактерии.
Итак, наличие в почве множественных локусов обеспечило
формирование в них разнообразных типов бактериальных
сообществ. Особенности их структуры и состава были
охарактеризованы нами с использованием количественных экологических
показателей в таких зонах, как дрилосфера, альгосфера, микоризо-
сфера, кишечник и экскременты почвенных беспозвоночных.
248
Во всех этих локусах выявлены бактерии разных таксонов и
разных эколого-трофических групп. Состав каждого из
бактериальных сообществ имеет свою специфику, однако во всех локусах
бактериальное разнообразие значительно выше, чем в
"фоновой" почве. Под "фоновой" почвой мы подразумеваем
усредненный почвенный образец, отобранный из гумусово-минерального
или минерального почвенного горизонта. При высеве такого
образца получается удручающе однообразная картина
бактериального разнообразия - выделяются, как правило, покоящиеся
формы бактерий, представленные бациллами, актиномицетами и
типичным педобионтом артробактером. Причем один и тот же
набор доминантов обнаруживается в бактериальных комплексах
разных типов почв и в разных природно-климатических зонах.
В связи с этим мы разработали новые подходы к оценке
микробного разнообразия почв, направленные на расширение набора
экологических ниш.
Кроме мозаичного распределения бактерий в почвенном
ярусе существует и определенная стратификация бактериальных
сообществ, связанная с вертикально-ярусной организацией фитоце-
нозов. Отражением конвейерной переработки растительного
опада микроорганизмами являются стратифицированные слои
подстилок и почвенных горизонтов. Проведенный нами
сравнительный анализ бактериальных сообществ в разных ярусах
одного и того же биогеоценоза и в разных типах биогеоценозов,
благодаря использованию различных экологических показателей
биоразнообразия, в том числе и предложенных нами, позволил
выявить четкие различия между всеми типами сообществ.
Особенно резкие различия проявились при сравнении таких
контрастных типов экосистем, как болота и пустыни (в иерархии
местообитаний бактерий это биотопы самого крупного масштаба). Это
свидетельствует о том, что одним из ведущих факторов,
ответственных за состав бактериальных сообществ почв, является их
водно-воздушный режим, который, определяется, прежде всего,
климатическими условиями природно-географической зоны,
в которой расположена почва.
В пределах одной и той же климатической зоны различия
между бактериальными комплексами разных типов почв зависят,
в первую очередь, от количества влаги в почвах. Когда почва
насыщена водой до ее водовместимости, теряется дискретность
в пространственной организации бактериальных сообществ. Так,
например, после дождей в лесных почвах наблюдали
перемещение бактерий эпифитного комплекса из надземного в почвенный
ярус, во всех горизонтах почв обнаруживали спирилл - типичных
обитателей переувлажненных почв. Процесс континуального
249
распределения бактерий по всему почвенному профилю
наблюдается и в пойменных почвах, испытывающих периодическое
затопление. Еще более постоянные условия затопления
складываются в амфибиальных ландшафтах. При изучении
таксономического состава бактериальных сообществ почв в болотных
экосистемах было показано равномерное распределение бактерий по
всей толще торфяников, при этом доминировали в
бактериальном комплексе различные формы факультативно-анаэробных
бактерий, адаптированных к условиям пониженной
концентрации кислорода, характерной для болот. Аналогичная ситуация
наблюдается и в рисовниках.
Разнообразие бактериальных комплексов разных типов почв
определяется также типом фитоценоза, под которым
формируется почва. По отношению к микроорганизмам это сказывается
в разном качестве опада, поступающего на поверхность почвы.
В результате четко дифференцируются по таксономическому
составу бактериальные комплексы хвойных и лиственных
подстилок, опада травянистых растений лугов и пустынных растений.
Меньшее значение по сравнению с количеством влаги имеют,
на наш взгляд, такие экологические факторы, как рН и
температура среды, хотя в отношении некоторых таксонов можно
привести убедительные примеры их адаптации к кислым или
щелочным величинам рН. Одним из таких примеров может быть
Azotobacter, предпочитающий почвы с нейтральной реакцией
среды, в то время как в кислых верховых торфяниках он
замещается другим представителем активных диазотрофов - Beijerin-
ckia. Концентрация солей становится ведущим фактором, когда
анализируются такие почвы, как солончаки, в которых
обнаруживаются галотолерантные и галофильные формы бактерий.
Следует заметить, однако, что все наши выводы сделаны на
основе анализа структуры блока аэробных и
факультативно-анаэробных бактерий, учитываемых на одной среде при одних и тех
же условиях культивирования - нейтральная реакция среды,
комнатная температура (20-25 °С). Возможно, что при
использовании других сред и способов культивирования бактерий мы
получили бы иные закономерности.
Тем не менее, даже при такой выборке нам удалось получить
представление об организации бактериальных сообществ почв,
основанное как на стратификации бактериальных сообществ,
соответствующей ярусам биогеоценоза и почвенным горизонтам,
так и на мозаичном распределении бактерий по множественным
мезо- и микролокусам почв и сопряженных субстратов.
Для описания временных изменений в структуре
бактериальных сообществ предлагается метод сукцессионного анализа, поз-
250
воляющий в условиях почвенных микрокосмов моделировать
разные типы водно-воздушного режима почв. Показано, что
такой прием позволяет значительно повысить степень учета
бактериального разнообразия (расширить спектр диагностируемых
таксонов).
При сравнении результатов оценки бактериального
разнообразия почв современными молекулярно-биологическими и
традиционными методами посева наблюдается явное их
несоответствие друг другу, причем использование молекулярно-генетиче-
ских методов дает более неопределенные и часто экологически
парадоксальные результаты. Несмотря на многие преимущества
метода непосредственного выделения ДНК из почв с их
последующим секвенированием, среди микробиологов складывается
мнение (даже у молекулярных биологов), что необходим
полифазный подход, заключающийся в интеграции разных методов.
При этом подчеркивается, что определение эколого-физиологи-
ческих особенностей бактерий и их функций невозможно без
выделения и изучения чистых культур. Следовательно, метод
посева, который с появлением современных молекулярно-биологиче-
ских методов считался устаревшим и ненужным, приобретает
опять несомненную значимость как один из способов познания
экологии и функционирования микробных сообществ почв
(Чернов, 1997; Добровольская и др., 1997).
На основании изложенного в книге материала, касающегося
описания структуры и состава почвенных бактериальных
сообществ, нами была сделана попытка с новых позиций взглянуть на
один из постоянно дискутируемых в почвенной микробиологии
вопросов - "почвенные" и "непочвенные" бактерии, суть
которого сводится не столько к установлению границы между этими
экологическими группировками, сколько к расширению того
исходного понятия "почвенные" бактерии, согласно которому к
"почвенным" относили вначале только бактерии, питающиеся
гумусовыми веществами (Виноградский, 1952), а затем только
олиготрофные бактерии (Никитин и др., 1966; Аристовская,
1965). Основой таких представлений являлись условия
постоянного недостатка питательных веществ в почве, в которых
вынуждены существовать почвенные микроорганизмы, если под
почвой подразумевать только органо-минеральные частицы. Однако
концепция почвы как "системы из множества мезо- и микросред
обитания с совершенно различными условиями" (Звягинцев,
1987) позволила по-новому взглянуть на возможность
существования в почве микроорганизмов с самыми разными
потребностями. В многочисленных публикациях было показано, что в
разных почвенных локусах (ризосфера, мико- и микоризосфера,
251
дрилосфера, кишечник почвенных беспозвоночных и др.)
складываются разные типы микробных сообществ. Отсюда следует,
что к "почвенным" следует относить не только те бактерии,
которые адсорбированы на почвенных частицах, но и все
множество бактерий, ассоциированных с растениями, беспозвоночными
животными, простейшими, грибами, т.е. все бактерии, которым
почва и сопряженные с ней субстраты предоставляют условия
для жизнедеятельности.
Вопрос о том, какие бактерии считать "почвенными", возник
в последнее время в связи с появлением и обсуждением тех
списков таксонов бактерий, которые были обнаружены в почвах на
основании анализа бактериального разнообразия молекулярно-
генетическими методами. В одних случаях авторы статей
констатируют, что они не знают какие бактерии можно считать
"почвенными", в других случаях делаются, наоборот, слишком
категоричные, на наш взгляд, выводы о возможности развития в
почве таких экстремофилов, как креноархеи (обитатели кипящих
сольфатарных вод). Пока подобные бактерии не будут выделены
в чистую культуру и не будут определены диапазоны их
температурных границ и эколого-физиологические особенности, все
рассуждения о возможности развития как креноархеи, так и других
экстремофилов в почве представляются спекулятивными.
Вопрос о принадлежности бактерий к "почвенным" сопряжен
с другим вопросом: какие функции выполняют бактерии в почве?
Чтобы ответить на последний вопрос, необходимо, прежде всего,
выяснить приуроченность бактерий тех или иных таксонов к
определенному локусу почвы или сопряженных с почвой
субстратов, затем их взаимосвязь с другими членами биотического
сообщества и коррелирующие с этим эколого-физиологические
особенности, сложившиеся в результате формирования и эволюции
таких сообществ. Положительным примером такого подхода
могут служить установление сопряженности процессов азотфикса-
ции и фотосинтеза, сложившиеся в результате длительного
совместного существования растений и бактерий, находящихся в
ассоциативной либо симбиотической связи; обнаружение явления
усиления азотфиксирующей активности бактерий в ассоциациях
с грибами, установление симбиотических связей между
окисляющими железо бактериями и грибами, факт наличия сообщества
целлюлозоразрушающих и диссипотрофных бактерий,
сменяющих друг друга в процессе деструкции растительных остатков
и т.д.
Хотелось бы высказать некоторые соображения по поводу
перспектив дальнейших исследований в области анализа
структуры и разнообразия бактериальных сообществ почв. Поскольку
252
разнообразие бактерий в почвах в целом определяется, прежде
всего, их разнообразием в тех горизонтах и локусах, где они
наиболее тесно связаны с растениями, животными или грибами,
необходимо сконцентрировать внимание именно на этих биотопах
и попытаться выяснить взаимосвязи между организмами,
определяющие, в конечном счете, и функции бактерий. Для этого
нужно "моделировать микрозоны в макромасштабе" (Звягинцев,
1987), подбирая состав среды, условия культивирования,
партнеров для осуществления того или иного процесса и т.д.
Одной из первоочередных задач представляется также
выделение форм бактерий, адаптированных к тем экстремальным
факторам [повышенная кислотность или щелочность, высокая
концентрация солей или каких-либо элементов (Fe, Mn, Са), условия
анаэробиоза и др.], которые определяют специфику
определенных типов почв. Перспективным для дальнейших исследований
в области оценки бактериального разнообразия почв является
и использование сукцессионного анализа с моделированием в
почвенных микрокосмах различных условий влажности,
температуры, внесением разных субстратов.
ЛИТЕРАТУРА
Алехина Л.К., Добровольская ТТ. Динамика структуры бактериальных
комплексов дерново-глеевой почвы в процессе ее высушивания //
Почвоведение. 1999. №9. С. 1140-1143.
Алехина Л.К., Невская Д.В., Добровольская ТТ., Звягинцев Д.Г.
Бактериальное разнообразие в лесных почвах (сукцессионный анализ) //
Микробиология. 1997. Т. 66, № 4. С. 558-562.
Алехина Л.К., Полянская Л.М., Добровольская ТТ. Динамика численности
микроорганизмов в почвах лесного заповедника // Почвоведение. 2001. № 1.
С. 101-104.
Андерсон Дж.М., Инесон П. Взаимоотношения почвенных членистоногих
и микробного населения в процессах поступления углерода, азота и
минеральных веществ из разлагающегося листового опада // Биология почв Северной
Европы. М.: Наука, 1988. С. 18-33.
АнЬреюк Е.И., Коптева Ж.П., Занина В.В. Цианобактерии. Киев: Наук,
думка, 1990.200 с.
Аристовская Т.В. О принципах экологического анализа в почвенной
микробиологии // Почвоведение. 1962. № 1. С. 7-12.
Аристовская ТВ. Микробиология подзолистых почв. M.-JL: Наука, 1965.
187 с.
Аристовская Т.В. Микробиология процессов почвообразования. Л.:
Наука, 1980. 184 с.
Асеева И.В., Паников Н.С., Чурсина О.Т. Содержание и состав
нуклеиновых кислот в дерново-подзолистых почвах // Вестник МГУ. Сер. 17,
Почвоведение. 1977. № 1. С. 85-91.
Бабкина И.И. Судьба актиномицетов в кишечном тракте почвенных
беспозвоночных животных: Автореф. дис.... канд. биол. наук. М., 1995. 24 с.
Бабьева И.П. Изучение микрофлоры пойменных и дерново-подзолистых
почв в верховьях реки Клязьмы // Науч. докл. высш. шк.: Биол. науки. 1961.
№ 3. С. 25-30.
Бабьева И.П. К микробной характеристике почв поймы реки Клязьмы в
районе Чашникова // Пойменные почвы Русской равнины. М.: Изд-во МГУ,
1962. Вып. 1.С. 196-218.
Бабьева И.П. Микробный состав почв Памира // Вестник МГУ. Сер. 17,
Почвоведение. 1971. № 1. С. 85-91.
Бабьева И.П., МоаваЬ X., Марченко А.И. Азотфиксация в совместной
культуре Lipomyces с бактериями // Микробиология. 1977. Т. 46, № 2.
С. 270-272.
254
Бабьева И.П., Россихина ОТ. Бактериально-дрожжевые диазотрофные
ассоциации в сокотечении деревьев // Биол. науки. 1987. № 2. С. 87-91.
Бабьева И.П., Садыков Б.Ф. Состав и численность дрожжей в филлосфере
растений // Микология и фитопатология. 1980. Т. 14, № 6. С. 473-476.
Балашова В.В. Микоплазмы и железобактерии. М.: Наука, 1974. 59 с.
Бархутова ДД., Горленко В.М., Намсараев Б.Б. Микроорганизмы
содовых озер Забайкалья // Биоразнообразие Байкальской Сибири. Новосибирск:
Наука, 1999. С. 42-48.
Бахнов В.К. Биогеохимические аспекты болотообразовательного
процесса. Новосибирск: Наука, 1986. 192 с.
Белъкова HJI./Денисова Л.Я., Манакова Е.Н. и др. Видовое разнообразие
глубоководных микроорганизмов озера Байкал, выявленное по
последовательностям 16S рРНК // Докл. АН СССР. 1996. Т. 348, № 5. С. 692-695.
Беляев С.С. Распространение группы Caulobacter в водохранилищах Вол-
го-Дона // Микробиология. 1967. Т. 36, № 1. С. 157-160.
Беляев С.С. Caulobacter в почвах и некоторых водоемах СССР // Вестник
Моск. ун-та. Сер. биол. 1968. № 6. С. 98.
Беляев С.С. Биология бактерий рода Caulobacter: Автореф. дис. ... канд.
биол. наук. М., 1970. 14 с.
Бианки А. Исследования в Марсельской лаборатории морской
микробиологии // Морская микробиология. Владивосток: Изд-во Дальневосточного
университета, 1995. С. 130-150.
Бигон М., Харпер Дж., ТаунсенЬ К. Экология особи, популяции,
сообщества. М.: Мир, 1989. С. 619-659.
Биоразнообразие Байкальской Сибири / Отв. ред. И.Ю. Коропачинский,
В.М. Корсунов. Новосибирск: Наука, 1999. 349 с.
Блинков Г.Н. Азотобактер и его значение для высших растений. Томск:
Изд-во Томского ун-та, 1959. 252 с.
Блинков Г.Н. Об азотобактере, устойчивом к кислой реакции окружающей
среды // Микробиология. 1955. Т. 24. С. 415-421.
Богатырев Л.Г., Щенина ТТ., Дуженко B.C. Формальные критерии для
классификации лесных подстилок // Почвоведение. 1993. № 12. С. 57-64.
Болотина И.Н. Экология почвенных марганецокисляющих
микроорганизмов Metallogenium: Автореф. дис.... канд. биол. наук. М„ 1975. 24 с.
Болотина И.Н., Мирчинк ТТ. Распространение марганецокисляющих
микроорганизмов в почвах // Почвоведение. 1975. № 6. С. 64-68.
Борисова Е.В. Видовой состав бактерий, сопутствующих микроводорослям
в культуре // Альгология. 1996. Т. 6, № 3. С. 303-313.
Вызов Б.А. Особенности микробного разложения углеводов в почве:
Автореф. дис.... канд. биол. наук. М., 1985. 23 с.
Бызов Б.А., Зенова Г.М., Бабкина Н.И., Добровольская ТТ. и др. Актино-
мицеты в пище, кишечнике и экскрементах почвенных диплопод Pachyiulus
flavipes // Микробиология. 1993. Т. 62, № 5. С. 925-936.
Васильева Л.В. Олиготрофы как компонент биогеоценоза // Почвенные
организмы как компоненты биогеоценозов. М.: Наука, 1984. С. 232-241.
Васильева Л.В. Простекобактерии почвы: Автореф. дис.... д-ра биол. наук.
М., 1990. 32 с.
Васильева Л.В., Лафицкая Т.Н., Намсараев Б.Б. Новый род почкующихся
бактерий Angulomicrobium tetraedrale с радиальной симметрией клетки //
Микробиология. 1979. Т. 48, № 6. С. 1033-1039.
Васильева Л.В., Семенов A.M. Новая почкующаяся простекобактерия с
радиальной симметрией клетки Labrys monachus II Микробиология. 1984. Т. 53,
№ 1. С. 85-92.
255
Великанов Л Л. Роль грибов в формировании мико- и микробиоты почв
естественных и нарушенных биоценозов и агроэкосистем: Дис. ... д-ра биол.
наук. М., 1997. 473 с.
Венецкая CJ7., Герасименко Л.М. Электронно-микроскопическое изучение
микроорганизмов в галофильном цианобактериальном сообществе //
Микробиология. 1988. Т. 57, № 3. С. 450-457.
Вознякоеская ЮМ. Микрофлора растений и урожай. Л.: Колос, 1969.
С. 45-61.
Вольберг ММ. Взаимодействие популяций микроводорослей и бактерий в
модельной системе: Автореф. дис.... канд. биол. наук. М., 1988. 26 с.
Воробьева Т.И., Медведева СЕ. Видовой состав коллекции светящихся
бактерий // Изв. СО АН СССР. 1981. № 5. С. 69-75.
Воронин АД. Основы физики почв. М.: Изд-во МГУ, 1986. 245 с.
Галатенко О. А., Преображенская Т.П., Терехова Л.П. Направленное
выделение актиномадур из различных почв: Поиск продуцентов антибиотиков среди
актиномицетов редких родов. Алма-Ата: Гылым, 1990. С. 13-19.
Галъненко В.Ф., Абрамочкина Ф.Н., Безрукова Л.В. и др. Видовой состав
аэробной метанотрофной микрофлоры Черного моря // Микробиология. 1988.
Т. 57, № 2. С. 305-308.
Гительзон И.И., Воробьева Т.Н. Светящиеся бактерии, ассоциированные
с бентосными организмами // Там же. № 5. С. 847-851.
Глаголева О.Б. Экофизиология почвенных альгобактериальных
ассоциаций: Дис.... канд. биол. наук. М., 1991. 126 с.
Гоготов И.Н., Лауринавинене Т.В. Азотфиксирующая ассоциация Azolla-
Anabaena Azolla // Успехи микробиологии. М.: Наука, 1989. № 23. С. 91-111.
Головлев ЕЛ. Коринеподобные бактерии и близкие к ним организмы //
Успехи микробиологии. М.: Наука, 1978. № 13. С. 73-83.
Головлев ЕЛ. Биология сапротрофных микобактерий: Автореф. дис. ...
д-ра биол. наук. Пущино, 1983. 37 с.
Головлев ЕЛ. О старых проблемах новой систематики бактерий //
Микробиология. 1998. Т. 67, № 2. С. 281-286.
Головлев ЕЛ. Другое состояние неспорулирующих бактерий //
Микробиология. 1998. Т. 67, № 6. С. 725-735.
Головченко А.В., Добровольская ТТ., Максимова И. и др. Структура и
функции микробных сообществ почв южной тайги // Микробиология. 2000.
№ 4. С. 453-^64.
Головченко А.В., Добровольская ТТ., Полянская ЛМ. Численность и
структура микробных комплексов в контрастных почвах мезоморфного ряда
ельников южной тайги // Вестник МГУ. Сер. 17, Почвоведение. 1995. № 3.
С. 57-64.
Головченко А.В., Добровольская ТТ., Федоришенко М.С. и др. Структура
бактериальных комплексов пойменных ландшафтов реки Протвы //
Микробиология. 2001. Т. 70, № 5. С. 694-700.
Головченко А.В., Добровольская ТТ., Чернов И.Ю. Структура
бактериальных комплексов в заповедных ельниках // Почвоведение. 1995. № 9.
С. 1121-1124.
Головченко А.В., Полянская ЛМ., Добровольская ТТ. и др. Особенности
пространственного распределения и структуры микробных комплексов болот-
но-лесных экосистем // Почвоведение. 1993. № 10. С. 78-89.
Горленко В.М., Дубинина Г.А., Кузнецов СИ. Экология водных
микроорганизмов. М.: Наука, 1977. 264 с.
Громов Б.В. Наблюдения над водорослями примитивных почв некоторых
районов СССР // Уч. зап. ЛГУ. 1956. Т. 41, № 216. С. 170-179.
256
Громов Б.В. Микроорганизмы рода Caulobacter, сопутствующие
водорослям // Микробиология. 1964. Т. 33, № 2. С. 11-15.
Громов Б.В. "Звездообразующие бактерии", сопутствующие водорослям в
культурах // Вестник ЛГУ. Сер. биол. 1967. Т. 3, № 15. С. 133-144.
Громов Б.В., Иванов ОТ., Мамкаева К.А., Авилов И.А. Флексибактерия,
лизирующая синезеленые водоросли // Микробиология. 1972. Т. 41.
С. 1074-1076.
Громов Б.В., Мамкаева К.А. О новом роде Vampirovibrio для бактерии,
паразитирующей на хлорелле и ранее отнесенной к роду Bdellovibrio //
Микробиология. 1980. Т. 49. С. 165-168.
Громов Б.В., Скрупская В.А. Изучение бактерий, сопутствующих Chlorella
pyrenoidosa, в лабораторных культурах // Тр. Петергоф, биол. ин-та ЛГУ. 1965.
ЛЬ 19. С. 155-161.
Грушвицкий И.В., Чавчавадзе Е.С. Отдел голосеменные, класс
Саговниковые // Жизнь растений. М.: Просвещение, 1978. Т. 4. С. 268-294.
Гузев B.C. Экологическая оценка антропогенных воздействий на
микробную систему почвы: Автореф. дис.... д-ра биол. наук. М., 1988. 38 с.
Гузев B.C., Иванов П.И. Функциональная структура зимогенной части
микробной системы почвы // Изв. АН СССР. Сер. биол. 1986. № 5. С. 739-746.
Дедыш СМ. Специфика микробного комплекса напочвенных разрастаний
водорослей: Автореф. дис.... канд. биол. наук. М., 1990. 24 с.
Дедыш С.Н., Зенова Г.М., Добровольская ТТ., Грачева Т.А. Структура
альгоценозов, формирующихся в периоды "цветения" почвы // Альгология.
1992. Т. 2, № 2. С. 63-69.
Денисова Л.Я., Белькова НЛ., Тулохонов И.И., Зайчиков Е.Ф.
Биоразнообразие бактерий на различных глубинах южной котловины озера Байкал,
выявленное по последовательности 16S рРНК // Микробиология. 1999. Т. 68, № 4.
С. 547-556.
Добрица СВ. Актинориза и ее роль в биологической азотфиксации //
Биологический азот в сельском хозяйстве СССР. М.: Наука, 1988. С. 68-80.
Добровольская ТТ. Особенности биологии кокковых форм
микроорганизмов из лишайников: Автореф. дис.... канд. биол. наук. М., 1973. 25 с.
Добровольская ТТ. О таксономическом положении рода Mycococcus II
Биол. науки. 1983. № 3. С 86-90.
Добровольская ТТ., Головченко А.В. Эколого-таксономическая структура
бактериальных сообществ лесных почв гидроморфного ряда // Вестник МГУ.
Сер. 17, Почвоведение, 1999. № 1. С. 55-58.
Добровольская ТТ., Зенова Г.М.,ЛысакЛ.В. Структура популяций
гетеротрофных бактерий и стрептомицетов в лесном биогеоценозе // Экология,
геохимическая деятельность микроорганизмов и охрана окружающей среды: Тез.
докл. 7-го съезда Всесоюзн. микробиол. общ-ва. Алма-Ата-М.: Наука, 1985.
Т. 6. С. 56.
Добровольская ТТ.,ЛысакЛ.В., Звягинцев ДТ. Почвы и микробное
разнообразие // Почвоведение. 1996. № 6. С. 699-704.
Добровольская ТТ,ЛысакЛ.В., Зенова Г.М., Звягинцев ДТ.
Бактериальное разнообразие почв: Оценка методов, возможностей, перспектив //
Микробиология. 2001. Т. 70, № 2. С. 149-167.
Добровольская ТТ., Лысак Л.В., Евтушенко Л.И. Актиномицеты рода
Geodermatophilus в пустынных биогеоценозах // Микробиология. 1993. Т. 62,
№ 5. С. 904-915.
Добровольская ТТ., Меньших Т.Б., Чернов И.Ю. и др. Бактерии
гидролитического комплекса в лесных почвах гидроморфного ряда (на примере
ЦЛГБЗ) // Почвоведение. 2000. № 10. С. 1242-1246.
257
Добровольская ТТ., Павлова О.С, Полянская Л.М., Звягинцев Д.Г.
Бактериальные комплексы лесных биогеоценозов Окского заповедника:
Пространственная структура и таксономическое разнообразие // Микробиология. 1995.
Т. 64, № 6. С. 829-833.
Добровольская ТТ., Скворцова И.Н., Лысак. Л.В. Методы выделения и
идентификации почвенных бактерий. М.: Изд-во МГУ, 1989. 70 с.
Добровольская ТТ., Третьякова Е.Б. Селективное выделение и учет
бактерий актиномицетной линии в лесных подстилках // Вестник МГУ. Сер.
Почвоведение. 1991. № 4. С. 47-52.
Добровольская ТТ., Третьякова Е.Б., Гебриес Г., Тиунов А.В. Влияние
дождевых червей на формирование бактериального комплекса почвы в
лабораторном эксперименте // Вестник МГУ. Сер. Почвоведение. 1996. № 4. С. 53-59.
Добровольская ТТ., Чернов И.Ю., Звягинцев ДТ. О показателях
структуры бактериальных сообществ // Микробиология. 1997. Т. 66, № 3. С. 408-414.
Добровольская ТТ., Чернов И.Ю., Евтушенко Л.И., Звягинцев ДТ.
Разнообразие сапротрофных бактерий в пустынных биогеоценозах // Успехи
современной биологии. 1999. Т. 119, № 2. С. 151-164.
Добровольская ТТ., Чернов И.Ю.,ЛысакЛ.В. и др. Бактериальные
сообщества пустыни Кызылкум: Пространственная дисперсия и таксономический
состав // Микробиология. 1994. Т. 63, № 2. С. 334-343.
Добровольский Г.В. Почвы речных пойм центра Русской равнины. М.:
Изд-во МГУ, 1968. 294 с.
Добровольский Г.В. Значение почв в сохранении биоразнообразия //
Почвоведение. 1996. № 6. С. 694-698.
Добровольский Г.В. Структурно-функциональная роль почвы в
устойчивости наземных экосистем // Экология и почвы. Избранные лекции I—VII школ
(1991-1997 гг.). Пущино, 1998. Т. 1. С. 9-14.
Добровольский Г.В., Бобров А.А., Головченко А.В. и др. Структурно-
функциональная организация почвенной биоты в ненарушенных ельниках
южной тайги (на примере ЦЛГБЗ) // Изв. АН. Сер. Биологическая. 1997. № 4.
С. 484-494.
Добровольский Г.В., Куст Г.С. Глобальные изменения климата и
эволюция почвы // Природа. 1995. № 8. С. 63-71.
Добровольский Г.В., Никитин ЕД. Функции почв в биосфере и
экосистемах. М.: Наука, 1990. 258 с.
Добровольский Г.В., Никитин Е.Д. Сохранение почв как незаменимого
компонента биосферы. М.: Наука; МАИК "Наука/Интерпериодика", 2000.
185 с.
Докучаев В.В. Сочинения. М.: Изд-во АН СССР, 1955. Т. VII. С. 277.
Доронина Н.В., КудиноваЛ.В., Троценко Ю.А. Methylovorus mays - новый
вид аэробных облигатных метилобактерий, ассоциированных с растениями //
Микробиология. 2000. Т. 69, № 5. С. 712-716.
Доронина Н.В., Троценко Ю.А. Новый термотолерантный алкалофильный
метилотроф Paracoccus, ассоциированный с растениями // Микробиология.
2000. Т. 69, №5. С. 706-711.
Дубинина Г.А. Биология железобактерий и их роль в образовании железо-
марганцевых руд: Автореф. дис.... д-ра биол. наук. М., 1977. 25 с.
Дубинина Г.А. Успехи в изучении пресноводных бактерий // Успехи
микробиологии. 1978. № 13. С. 117-132.
Егорова СВ., РауготисАД. Микрофлора ризосферы ели и березы и
некоторые ее физиологические особенности //Лесоведение. 1968. № 1. С. 27-36.
Егорова СВ., Рауготис АД. Микрофлора ризосферы некоторых
древесных пород // Вестник МГУ. Сер. Биология, почвоведение. 1976. № 5. С. 24-29.
258
Емцев В.Т. Экология анаэробных почвенных бактерий // Почвенные
организмы как компоненты биогеоценоза. М.: Наука, 1984. С. 141-162.
Жукова РЛ. Об аэробных целлюлозных бактериях северных почв //
Микробиология. 1962. Т. 31. С. 1054-1059.
Заварзин ГЛ. К понятию микрофлоры рассеяния в круговороте углерода //
Журн. общ. биологии. 1970. № 4. С. 386-394.
Заварзин ГЛ. Бактерии и состав атмосферы. М.: Наука, 1984. 191 с.
Заварзин ГЛ. Микробное сообщество в прошлом и настоящем //
Микробиология. 1989. Т. 51, № 6. С. 3-14.
Заварзин ГЛ. Протеобактерии: Экологический принцип в систематике
прокариот // Природа. 1990а. № 5. С. 8-17.
Заварзин ГЛ. Заповедники для микробов // Природа. 19906. № 2. С. 39-45.
Заварзин ГЛ. Корреляция филогенетической и экологической
классификации прокариот // Журн. общ. биологии. 1990в. Т. 51. № 5. С. 590-598.
Заварзин ГЛ. Эпиконтинентальные содовые водоемы как предполагаемые
реликтовые биотопы формирования наземной биоты // Микробиология. 1993.
Т. 62, № 5. С. 789-800.
Заварзин ГЛ. Микробная биогеография//Журн. общ. биологии. 1994. Т. 55.
№ 1.С. 5-12.
Заварзин ГЛ. Анти-рынок в природе // Природа. 1995. № 3. С. 46-60.
Заварзин ГЛ. Становление биосферы // Микробиология. 1997. Т. 66, № 6.
С. 725-734.
Заварзин ГЛ. Современные бактерии и бактериальные сообщества //
Бактериальная палеонтология / Ред. А.Ю. Розанов. М.: ПИН РАН, 2002. С. 6-35.
Заварзин ГЛ., Жилина Т.Н., Кевбрин В.В. Алкалофильное микробное
сообщество и его функциональное разнообразие // Микробиология. 1999. Т. 68,
№ 5. С. 579-599.
Заповедники Европейской части РСФСР. Ч. II. М.: Мысль, 1979. С. 52.
Звягинцев Д.Г. Почва и микроорганизмы. М.: Изд-во МГУ, 1987. 256 с.
Звягинцев Д.Г Перспективы развития биологии почв // Тр. Всерос. конф.
"Перспективы развития почвенной биологии": К 100-летию со дня рождения
акад. Е.Н. Мишустина. М.: МАКС Пресс, 2001. С. 10-21.
Звягинцев Д.Г, Бабьева И.П., Добровольская Т.Г. и др.
Вертикально-ярусная организация микробных сообществ лесных биогеоценозов //
Микробиология. 1993. Т. 62, вып. 1. С. 5-36.
Звягинцев Д.Г., Бабьева И.П., Зенова Г.М., Полянская ЛМ. Разнообразие
грибов и актиномицетов и их экологические функции // Почвоведение. 1996.
№6. С. 705-713.
Звягинцев Д.Г, Добровольская ТТ., Бабьева И.П. и др. Роль
микроорганизмов в биогеоценотических функциях почв // Структурно-функциональная
роль почвы в биосфере. М.: Геос, 1999а. С. 113-121.
Звягинцев Д.Г., Добровольская ТТ., Бабьева И.П. и др.
Структурно-функциональная организация микробных сообществ наземных экосистем //
Экология в России на рубеже XXI века. М.: Научный мир, 19996. С. 147-180.
Звягинцев Д.Г, Добровольская ТТ., Бабьева И.П., Чернов И.Ю. Развитие
представлений о структуре микробных сообществ почв // Почвоведение. 1999в.
№1.С. 134-144.
Звягинцев Д.Г., Добровольская ТТ.,ЛысакЛ.В. Вертикальный континуум
бактериальных сообществ в наземных биогеоценозах // Журн. общ. биологии.
1991. Т. 52, №2. С. 162-171.
Звягинцев Д.Г., Добровольская ТТ,ЛысакЛ.В. Растения как центры
формирования бактериальных сообществ // Журн. общ. биологии. 1993. Т. 54, № 2.
С.183-199.
259
Звягинцев Д.Г., Добровольская ТТ., Полянская Л.М., Чернов И.Ю.
Теоретические основы экологической оценки микробных ресурсов почв //
Почвоведение. 1994. № 4. С. 65-73.
Звягинцев Д.Г., Добровольская ТТ., Чернов И.Ю. Принципы мониторинга
микробного разнообразия экосистем // Мониторинг биоразнообразия / Под
ред. В.Е. Соколова. М., 1997. С. 203-207.
Звягинцев ДТ, Зенова Г.М. Экология актиномицетов. М.: Геос, 2001. 256 с.
Звягинцев ДТ., Паников Н.С., Горбенко А.Ю. Количественная оценка
влияния беспозвоночных животных на рост микроорганизмов в почве // Почвенная
фауна и почвенное плодородие: Тр. 9-го Международного коллоквиума по
почвенной зоологии. М.: Наука, 1987. С. 63-72.
Звягинцева И.С. Галобактерии // Успехи микробиологии. М.: Наука, 1989.
С. 112-136.
Звягинцева И.С, Тарасов АЛ. Экстремально-галофильные бактерии из
засоленных почв // Микробиология. 1987. Т. 56, № 5. С. 839-844.
Зенова Г.М. Актиномицеты в биогеоценозах // Почвенные организмы как
компоненты биогеоценоза. М.: Наука, 1984. С. 162-170.
Зенова Г.М. Актиномицеты в наземных экосистемах: Автореф. дис.... д-ра
биол. наук. М., 1998. 56 с.
Зенова Г.М., Бабкина Н.И., Полянская Л.М., Звягинцев ДТ.
Актиномицеты в кишечном тракте почвенных беспозвоночных животных, питающихся вер-
микомпостом и подстилкой // Микробиология. 1996. Т. 65, № 3. С. 409-415.
Зенова Г.М., Грачева Т.А., Лихачева А.А. Актиномицеты рода Micromo-
nospora в наземных экосистемах // Микробиология. 1994. Т. 63, № 3. С. 553-560.
Зенова Г.М., Грачева ТА., Манучарова Н.А., Звягинцев ДТ. Актиноми-
цетные сообщества лесных экосистем // Почвоведение. 1996. Mb 2. С. 1347-
1351.
Зенова Г.М., Звягинцев ДТ. Актиномицеты в наземных экосистемах //
Журн. общ. биологии. 1994. Т. 55, № 2. С. 198-210.
Зенова Г.М., Звягинцев ДТ. Экологический статус актиномицетов рода
Micromonospora II Почвоведение. 1997. № 3. С. 376-383.
Зенова Г.М., Лихачева А.А., Суешин CO., Калакуцкий Л.В. Совместная
культура актиномицета и водоросли // Биол. науки. 1980. № 5. С. 73-78.
Зенова Г.М., Чернов И.Ю., Грачева Т.А., Звягинцев ДТ. Структура актино-
мицетных комплексов в пустыне // Микробиология. 1996. Т. 65, № 5. С. 704-710.
Зенова Г.М., Штина Э.А.,Дедыш С.Н. и др. Экологические связи
водорослей в биоценозах // Микробиология. 1995. Т. 64, № 2. С. 149-164.
Зенова Г.М., Эфрон А.Н., Лихачева А.А., Калакуцкий Л.В. Особенности
бактериального компонента альгобактериальных ценозов на выходах
карбонатных пород // Вестник МГУ. Сер. 17, Почвоведение. 1988. № 1. С. 44-49.
Зонн СВ. Биогеоценологические и генетические основы классификации
лесных подстилок // Тез. докл. Всесоюз. совещания "Роль подстилки в лесных
биогеоценозах". Красноярск, 14-16 сентября 1983 г. М.: Наука, 1983. С. 80.
Иванов В Д. Меловой биоценотический кризис // Соросовский
образовательный журнал. 2000. Т. 6. С. 69-75.
Иванова Е.П., Михайлов В.В. Новое семейство Alteromonadaceae fam. nov.,
объединяющее группу морских аэробных протеобактерий // Микробиология.
2001. Т. 70, № 1.С. 15-23.
Иванова Е.П., Романенко Л.А., Михайлов В.В. Морские протеобактерий
семейства Alteromonadaceae. Владивосток: Дальнаука, 2001. 122 с.
Иванова Е.П., Шевченко Л.С. Сравнительное изучение бактерий,
ассоциированных с губками, некоторых районов Индийского океана // Морская
микробиология. Владивосток: Изд-во Дальневост. ун-та, 1995. С. 74-78.
260
Иванушкина Н.Е., Конкина Г.А., Ступаръ О.С. и др. Специфика
микробных комплексов прикорневой зоны и клубеньков актиноризных растений //
Микробиология. 1994. Т. 63, № 5. С. 909-916.
Имшенецкий А.А. Микробиология целлюлозы. М.: Изд-во АН СССР, 1953.
439 с.
Ищенко И Л. Взаимодействие между дождевыми червями и
микроскопическими грибами: Автореф. дис.... канд. биол. наук. М., 1995. 24 с.
Калакуцкая А.Н., Зенова ГМ., Добровольская Т.Г. Влияние актиномицета
на состав бактериального компонента в ассоциации типа актинолишайника //
Микробиология. 1993. Т. 63, № 2. С. 300-305.
Калакуцкий Л.В., Агре Н.С. Развитие актиномицетов. М.: Наука, 1977.286 с.
Калакуцкий Л.В., Парийская А.Н. Азотфиксирующие симбиозы
актиномицетов с растениями // Изв. АН СССР. Сер. Биол. 1982. № 2. С. 255-270.
Калакуцкий Л.В., Шарая Л.С. Актиномицеты и высшие растения // Успехи
микробиологии. М.: Наука, 1990, № 24. С. 26-65.
Калининская Т.А., Лаврова В.А. Состав азотфиксирующих бактерий в
целинных и окультуренных дерново-подзолистых почвах // Микробиология. 1988.
Т. 57, №5. С. 868-871.
Каменева СВ., Муромец Е.М. Генетический контроль процессов
взаимодействия бактерий с растениями в ассоциациях // Генетика. 1999. Т. 35, № 11.
С. 1480-1494.
Каратыгин И.В. Коэволюция грибов и растений. СПб.: Гидрометеоиздат,
1993. 116 с.
КарпачевскийЛ.О. Подстилка - особый биогеогоризонт лесного
биогеоценоза // Тез. докл. Всесоюзн. совещания "Роль подстилки в лесных
биогеоценозах". Красноярск, 14-16 сентября 1983 г. М.: Наука, 1983. С. 88.
Квасников Е.И., Коваленко Н.К., Материнская Л.Г. Молочнокислые
бактерии пресноводных рыб // Микробиология. 1977. Т. 46, № 5. С. 755-759.
Ключников А.А., Кожевин П.А. Динамика популяций Pseudomonas fluo-
rescens и Azospirillum brasilense при формировании везикулярно-арбускулярной
микоризы // Микробиология. 1990. Т. 59, № 4. С. 651-655.
Ковальская Н.Ю. Формирование симбиоза между корнями рапса и азотфи-
ксирующими бактериями: Автореф. дис.... канд. биол. наук. М., 1999. 26 с.
Ковальская Н.Ю.,Лобакова Е.С., Умаров М.М. Формирование
искусственного азотфиксирующего симбиоза у растений рапса (Brassica napus var. napus) в
нестерильной почве // Микробиология. 2001. Т. 70, № 5. С. 701-708.
Ковда В .А. Биогеохимия почвенного покрова. М.: Наука, 1985. 251 с.
Кожевин П.А. Микробные популяции в природе. М.: Изд-во МГУ, 1989.
175 с.
Кожевин П.А. Популяционная экология почвенных микроорганизмов:
Автореф. дис.... д-ра биол. наук. М., 2000. 55 с.
Кожевин П.А., ПолянскаяЛ.М., Звягинцев Д.Г. Динамика развития
различных микроорганизмов в почве // Микробиология. 1979. Т. 48, № 3. С. 490-494.
Козловская Л.С. Роль беспозвоночных животных в трансформации
органического вещества болотных почв. Л.: Изд-во АН СССР, 1976. 211 с.
Козловская Л.С. Особенности взаимоотношений почвенных
беспозвоночных с микроорганизмами // Почвенные организмы как компоненты
биогеоценоза. М.: Наука, 1984. С. 53-66.
Козловская Л.С. Разложение растительных остатков в почве. М.: Наука,
1985. С. 110-131.
Козырева Л.П., ДагуроваЛ.П., Земская Т.Н. Видовое разнообразие
микроорганизмов озера Байкал // Биоразнообразие Байкальской Сибири.
Новосибирск: Наука, 1999. С. 31-36.
261
Кондратьева Е.М., Пименова М.Н. Численность и состав микрофлоры,
сопутствующей водорослям в условиях интенсивного культивирования //
Материалы Всесоюзн. раб. совещания по вопросу круговорота веществ в замкнутой
системе на основе жизнедеятельности низших организмов. Киев, 1976. С. 68-70.
Кондратьева Е.Н. Автотрофные прокариоты. М: Изд-во МГУ, 1996.
301с.
Кондратьева ЛМ., Тен Хак Мун А. Микробное население штормовых
выбросов макрофитов // Морская микробиология. Владивосток: Изд-во Дальне-
вост. ун-та, 1995. С. 88-96.
Коновалов С.А., Воротило СП. Исследование литических ферментов и
перспективы их использования // Прикладн. биохимия и микробиология. 1977.
Т. 13, № 6. С. 819.
Кононков П.Ф.,Дудина З.Н., Добровольская Т.Г. Изменение микрофлоры
и всхожести семян овощных культур при хранении // Сельскохозяйственная
биология. 1980. Т. 15, № 4. С. 510-513.
Кононков Ф.П., Умаров ММ., Мирчинк Т.Г Азотфиксирующие
ассоциации грибов с бактериями // Микробиология. 1979. Т. 48, № 4. С. 734-737.
Константинова Л.Г., Лаптева НА. Электронно-микроскопическое
исследование микрофлоры водоемов дельты Аму-Дарьи // Микробиология. 1979.
Т.43, № 6. С. 927-930.
Конкина ГА. Сукцессии почвенных микроорганизмов и место в них
конкретных микробных популяций: Автореф. дис. ... канд. биол. наук. М.: Изд-во
МГУ, 1981.24 с.
Конкина ГА., Иванушкина Н.Е., Павлова О.С., Полянская ЛМ. Видовой
состав микромицетов актиноризных клубеньков ольхи // Микробиология. 1994.
Т. 63, № 4. С. 699-705.
Кравченко И.К., Калининская ТА. Азотфиксирующие бактерии сильноза-
соленной такыровидной почвы // Микробиология. 1988. Т. 57, № 2. С. 279-282.
Красильников НА. Микроорганизмы почвы и высшие растения, М.:
Изд-во АН СССР, 1958. 464 с.
Красильников НА., Рыбалкина А.В., Габриэлян М.С., Кондратьева Т.М.
К микробиологической характеристике почв Заволжья // Тр. Комиссии по
ирригации АН СССР. 1934. № 3.
Крюгер Л.В., Селиванов И А. О двойном симбиозе у бобовых растений //
Микроорганизмы как компонент биогеоценоза. Алма-Ата: Изд-во КазГУ,
1982. С. 58-59.
Крылов И.Н., Заварзин ГА. Условия образования карбонатных толщ в
верхнем рифее Южного Урала // Докл. АН СССР, 1988. Т. 300. С. 1223-1225.
Кураков А.В. Некоторые аспекты экологии везикулярно-арбускулярной
микоризы // Сельскохозяйственная биология. 1985. № 10. С. 101-110.
Кураков А.В. Роль микроскопических грибов в трансформации азота в
почвах // Тр. Всерос. конф. "Перспективы развития почвенной биологии":
К 100-летию со дня рождения акад. Е.Н. Мишустина. М.: МАКС Пресс, 2001.
С. 133-162.
Лаптева НА. Видовой состав гетеротрофных бактерий в воде
Рыбинского водохранилища // Микробиология. 1977. Т. 46, № 3. С. 570-572.
Лаптева НА. Экологические особенности распределения бактерий рода
Caulobacter в пресных водоемах // Микробиология. 1987. Т. 56, № 4. С. 677-680.
Леонова Л.И. Исследование взаимоотношений представителей рода Chlo-
rella с сопутствующими бактериями: Автореф. дис. ... канд. биол. наук. Киев,
1968. 19 с.
Лукин С А. Динамика азоспириллы в ризосфере и ризоплане растений и в
почве: Автореф. дис.... канд. биол. наук. М., 1988. 23 с.
262
Луста К.A., Намса\аев Б.Б. Целлюлолитические микробные ассоциации
донных осадков пресноп озера // Микробиология. 1988. Т. 57, № 5. С. 835.
ЛысакЛ.В., Добровольская ТТ. Бактерии в почвах Западного Таймыра //
Почвоведение. 1982. Ш. С. 74-77.
ЛысакЛ.В., ТрошшД.В., Чернов И.Ю. Бактериальные сообщества
солончаков // Микробиологш. 1994. Т. 63, № 4. С. 721-729.
Максимова И.В., Сидорова О.А. Светозависимый антибактериальный
эффект водорослей и егоэкологическое значение // Гидробиол. журн. 1986. Т. 22,
№6. С. 3-11.
Малашенко Ю.Р. Романовская В.А., Соколов И.Г. Роль розовоокрашен-
ных факультативно м;тилотрофных бактерий (РМБ) в локальных экосистемах
биосферы // Автотрооные микроорганизмы: Конф. памяти Е.Н. Кондратьевой.
Москва, 23-25 апреля 1996 г. М: Изд-во МГУ, 1996. С. 23
Малишкайте ЮЗ., Нечаева Г.А., Куимова Т.Ф. и др. Нокардии клубеньков
актиноризальных растений // Микробиология. 1987. Т. 56, № 1. С. 117-123.
Манучарова Н./., Добровольская ТТ., Степанов АЛ. Таксономический
состав денитрифицирующих бактерий в дерново-подзолистой почве //
Микробиология. 2000. Т. 65 № 2. С. 286-289.
Методы почвеной микробиологии и биохимии / Под ред. Д.Г. Звягинцева.
М.: Изд-во МГУ, 19<1. 303 с.
Микрофлора шчв северной и средней части СССР / Под ред. Е.Н. Мишу-
стина. М.: Наука, 156. 390 с.
Микрофлора П'чв южной части СССР / Под ред. Е.Н. Мишустина. М.:
Наука, 1966. 262 с.
Мирчинк ТТ. Точвенная микология. М.: Изд-во МГУ, 1988. 220 с.
Мирчинк ТТ.Мпрометова К.М., Звягинцев Д.Г. Грибы - спутники
бактерий, окисляющих юрганец// Микробиология. 1970. Т. 39, № 3. С. 379-383.
Михайлов В.Е, Кузнецова Т.А., Еляков Г.Б. Морские микроорганизмы и
их вторичные биаогически активные метаболиты. Владивосток: Дальнаука,
1999. 131 с.
Мишустин ЕН. Миксобактерии, разлагающие целлюлозу //
Микробиология. 1938. Т. 7, №•. С. 427^44.
Мишустин ЕН. Эколого-географическая изменчивость почвенных
бактерий. М.-Л.: Изд-в АН СССР, 1947. 313 с.
Мишустин './/. Закон зональности и учение о микробных ассоциациях
почвы //Успехи овремен. биол. 1954. Т.37, № 1. С. 1-21.
Мишустин Е.Н. Ассоциации почвенных микроорганизмов. М.: Наука,
1975. 106 с.
МишустинЕ.Н. Ценозы почвенных микроорганизмов // Почвенные
организмы как комонент биогеоценоза. М.: Наука, 1984. С. 5-24.
МишустинЪ.Н., Калининская Т.А., Редькина Т.В. Новые формы азотфикси-
рующих бактерй, выделенных из почв СССР // Успехи почвоведения: Сов. почв,
к 13-му Межд. энгрессу почвоведов. Гамбург, 1986. М.: Наука, 1986. С. 69-74.
Мишу emu E.H., Трисвятский Л. А. Микробы и зерно. М.: Изд-во АН
СССР, 1963. 2? с.
Мишустпа И.Е. Экологический аспект в изучении таксономического
положения морсих микроорганизмов // Успехи микробиологии. М.: Наука, 1978.
Т. 13. С. 106-16.
МэгарраЭ. Экологическое разнообразие и его измерение. М.: Мир, 1992.
184 с.
Надирое И.М., Александрушкина Н.И., Добровольская ТТ. Дифферециа-
ция видов Biillus firmus и Bacillus lentus // Микробиология. 1992. Т. 61, № 3.
С. 501-507.
263
Намсараев Б.Б., Дулов Л.Е. Микробные сообщества озера Байкал //
Биоразнообразие Байкальской Сибири. Новосибирск: Науса, 1999. С. 36-41.
Наплекова Н.Н. Аэробное разложение целлюлозы микроорганизмами в
почвах Западной Сибири. Новосибирск: Наука, 1974. 250 с.
Нелидов С.Н. Микробиологическая характеристик* затопляемых почв ри-
совников // Почвоведение. 1993, № 4. С. 721-729.
Нестеренко О. А., Касумова С. А., Квасников Е.И. Микроорганизмы рода
Nocardia и группы "rhodochrous" в почвах Украинской ССР // Микробиология.
1978. Т. 47, №5. С. 866-871.
Нестеренко О.А., Квасников Е.И., Ногина ТМ. Нотрдиоподобные и ко-
ринеподобные бактерии. Киев: Наук, думка, 1985. 334 с.
Никитин Д.И. Новые формы микроорганизмов // Успехи микробиологии.
1971. Т. 7. С. 33-45.
Никитин Д.И. Синтрофные сообщества гетеротрофных микроорганизмов
в биосфере // Микроорганизмы как компонент биогеоценоза: Матер. Всесоюзн.
симп. Алма-Ата, 1982. С. 27.
Никитин Д.И. Современные представления о бактоиальной олиготро-
фии // Перспективы развития почвенной биологии: Тр. Веере, конф. "К
100-летию со дня рождения акад. Е.Н. Мишустина". Москва, >2 февраля 2001 г.
М.: МАКС Пресс, 2001. С. 73-76.
Никитин Д.И., Аракелян Р.Н., Силева ТМ. Динамик роста олиготроф-
ных бактерий в почве // Изв. АН СССР. Сер. Биол. 1981, HI. С. 116-119.
Никитин Д.И., Васильева Л.В., Лохмачева Р.А. Новьг и редкие формы
почвенных микроорганизмов. М.: Наука, 1966. 71 с.
Никитина З.И. Состав и динамика микробоценозов // Гоиродные режимы
Минусинской котловины. Новосибирск: Наука, 1976. С. 159470.
Новикова Н.И. Современные представления о системаике и филогенезе
семейства Rhizobiaceae // 9-й Баховский коллоквиум по аэтфиксации: Тез.
докл. Москва, 24-26 января 1995 г. М„ 1995. С. 25.
Новикова Н.С. Бактериальная флора надземных органа растений. Киев:
Изд-во АН УССР, 1963. 87 с.
НовогруЪский ДМ. Миколитические бактерии из рода Pzudomonas II Изв.
АН СССР. 1949а. № 1. С. 18-39.
НовогруЪский ДМ. Лишайники и целлюлозоразрушающе
микроорганизмы // Микробиология. 19496. Т. 18, № 6. С. 519-524.
Определитель бактерий Берджи. М.: Мир, 1997. Т. 1. 436 <; Т. 2. 362 с.
Павленко Г.В., Лойцянская М.С. Об экологии уксуснокиаых бактерий //
Вестн. Ленинград, ун-та. 1978. № 21. С. 121-128.
Павлова И.Н. Изучение маннаназной активности у различых групп
микроорганизмов // Микробиол. журн. 1979. Т. 41, JSfe 2. С. 115-119.
Павлова О.С. Структура микробных сообществ почв Okckod заповедника:
Автореф. дис.... канд. биол. наук. М., 1998. 22 с.
Паников Н.С. Эмиссия парниковых газов из заболоченных пчв в
атмосферу и проблемы устойчивости // Экология и почвы: Избраные лекции
I-VII школ (1991-1997 гг.). Пущино, 1998. Т. 1. С. 171-184.
Паников Н.С, Добровольская Т.Г.уЛысакЛ.В. Экология корнеподобных
бактерий // Успехи микробиологии. М.: Наука, 1989. Т. 23. С. 51-9.
Парийская А.Н., Клевенская ИЛ. Распространение в прирое и
возможные пути эволюции азотфиксирующего симбиоза // Успехи миообиологии.
М.: Наука, 1979. Т. 14. С. 124-147.
Паринкина ОМ. Микрофлора тундровых почв. Л.: Наука, 19Я 158 с.
Перфильев Б.В., Габе Д.Р. Капиллярные методы изучения мироорганиз-
мов. М.-Л.: Изд-во АН СССР, 1961. 534 с.
264
Покаржевский АД. Геохимическая экология наземных животных. М.:
Наука, 1985. 300 с.
Полянская ЛМ. Микробная сукцессия в почве: Автореф. дис.... д-ра. биол.
наук. М., 1996. 96 с.
Полянская Л.М., Мир чинк ТТ. Структура комплексов почвенных микро-
мицетов в ходе микробной сукцессии // Микроорганизмы в сельском хозяйстве.
М.: Изд-во МГУ, 1986. С. 42-44.
Полянская Л.М., Тиунов А.В. Заселенность микроорганизмами стенок нор
дождевых червей Lumbricus terrestris L. // Микробиология. 1996. Т. 65, № 1.
С. 99-101.
Проворов И.А. Коэволюция бобовых растений и клубеньковых бактерий:
Таксономические и генетические аспекты // Журн. общ. биологии. 1996. Т. 57,
№ 2. С. 52-78.
Рахно П., Аксель М., Сирп Л., Рийс X. Динамика численности почвенных
микроорганизмов. Таллин: Валгус, 1971. 189 с.
Рейнхаймер Г. Симбиозы между бактериями и морскими животными //
Морская микробиология. Владивосток: Изд-во Дальневост. ун-та, 1995.
С. 54-62.
Рокицкая А.И. Микрофлора почв "Золотой Орды" в Туркестане //
Почвоведение. 1931. № 1. С. 35-39.
Рудаков К.И., Биркель М.Р. Развивающееся растение, микроорганизмы и
прочная структура почвы // Микробиология. 1947. Т. 18, № 6. С. 545-548.
Рунов Е.В., Мишустина И.Е. Влияние лесных насаждений разного состава
на микробиологические процессы в выщелоченном черноземе // Тр. Лаб.
лесоведения АН СССР. 1960. Т. 1. С. 86-126.
Рыбалкина А.В., Кононенко Е.В. Непосредственное наблюдение
микрофлоры в почве модифицированным методом Холодного // Микробиология.
1953. Т. 22, № 4. С. 439-444.
Рыбалкина А.В., Кононенко Е.В. Активная микрофлора почв //
Микрофлора почв Европейской части СССР. М.: Изд-во АН СССР, 1957. 258 с.
Рыбальский Н.Г.,Лях СП. Экобиотехнологический потенциал
консорциумов микроорганизмов. М.: ВНИИПИ, 1990. Т. 1-3. 284 с.
Сергунина Л.А. Распространение азотобактера в пойменных почвах рек
Москвы и Клязьмы // Пойменные почвы Русской равнины. М.: Изд-во МГУ,
1963. Вып. 2. С. 141-145.
Слабова О.И., Никитин Д.И. Использование водорода и этилена олиго-
трофными бактериями // Микробиология. 1986. Т. 55, № 6. С. 1050-1052.
Смагин А.В. К теории устойчивости почв // Почвоведение. 1994. № 12.
С. 26-33.
Сомова Н.Г., Добровольская ТТ., Зенова Г.М., Ивановский Р.Н.
Микробное заселение поверхности каменных строений: Синэкологический анализ //
Микробиология. 1998. Т. 67, № 5. С. 687-693.
Сорокин Д.Ю. Биология морских гетеротрофных и алкалофильных серо-
окисляющих бактерий: Автореф. дис.... д-ра биол. наук. М., 2000. 64 с.
Сорокин Д.Ю., Бабьева И.П. Лизис природных популяций дрожжей
почвенными микроорганизмами // Микробиология. 1982. Т. 51, № 2. С. 328-
331.
Сорокина Т.А., Мишустин Е.Н., Писарчук Е.Н. Закономерности
распространения неспорообразующих бактерий родов Pseudomonas и Arthrobacter в
почвах разных климатических зон // Почвенные организмы как компонент
биогеоценоза. М.: Наука, 1984. С. 199-217.
Стебаев И.В. Роль почвенных беспозвоночных в развитии микрофлоры
почв Субарктики // Докл. АН СССР. 1958. Т. 122, № 4. С. 720-722.
265
Стебаев И.В. Зоомикробиотические комплексы в биогеоценозах //
Почвенные организмы как компоненты биогеоценоза. М.: Наука, 1984. С. 40-52.
Степанов АЛ., Манучарова Н.А., Полянская Л.М. Продуцирование закиси
азота бактериями в почвенных агрегатах // Почвоведение. 1997. № 8. С. 973-976.
Стриганова Б.Р. О разложении целлюлозы в кишечнике кивсяков
Pachyiulus foetidissimus (Миг.) (Tilidae, Diplopodae) // Докл. АН СССР. 1970.
Т. 190, № 3. С. 703-705.
Стриганова Б.Р. Питание почвенных сапрофагов. М.: Наука, 1980.
С. 8-215.
Стриганова Б.Р., ПантошДеримова ТД., Мазанцева Г.П., Тиунов А.В.
Влияние дождевых червей на биологическую азотфиксацию в почве // Изв. АН
СССР. Сер. Биол. 1988. С. 878-884.
Стриганова Б.Р., Пантош-Деримова ТД., Тиунов А.В. Сравнительная
активность азотфиксации в кишечнике разных видов дождевых червей // Изв. АН
СССР. Сер. Биол. 1993. С. 257-263.
Сушкина Н.Н. Эколого-географическое распространение азотобактера в
почвах СССР. М: Изд-во АН СССР, 1949. 252 с.
Сушкина Н.Н. Специфика роста и спорообразования бактерий в почвах
Земли Франца-Иосифа//Микроорганизмы в сельском хозяйстве. М.: Изд-во МГУ,
1963. С. 252-259.
Сушкина Н.Н., СергунинаЛ.А. Распространение и развитие азотобактера в
дерново-подзолистых почвах // Микробиология. 1955. Т. 24, № 4. С. 408.
Сушкина Н.Н., Цюрупа И.Г. Микрофлора и первичное почвообразование.
М.: Изд-во МГУ, 1973. 158 с.
Тамбиев А.Х., Шелястина Н.Н., Болдырева Н.С. Изучение биологической
активности экзометаболитов одноклеточных морских водорослей //
Физиология растений. 1981. Т. 28, № 3. С. 627-633.
Таутс М.И. Фенольные соединения бактериальной культуры хлорелла и
некоторая их характеристика // Физиология растений. 1983. Т. 30, № 2.
С. 332-340.
Тен Хак Мун. Микробиологические процессы в почвах островов Притихо-
океанской зоны. М.: Наука, 1977. 178 с.
Тиунов А.В. Оценка участия дождевых червей в трансформации
органического вещества в дерново-подзолистой почве: Автореф. дис.... канд. биол. наук.
М., 1993. 16 с.
Тиунов А.В. Применение аппликационного метода для оценки
биологической активности в дрилосфере // Изв. РАН. Сер. Биол. 1993а. № 2. С. 264-270.
Тиунов А.В. Сравнительное исследование уреазной активности в почве и в
экскрементах дождевых червей // Там же. 19936. N° 4. С. 472-475.
Тиунов А.В., Добровольская ТТ., Полянская ЛМ. Микробное сообщество
стенок нор дождевых червей Lumbricus terrestris L. // Микробиология. 1997.
Т. 66, №3. С. 415-420.
Тиунов А.В., Добровольская ТТ., Полянская Л.М. Микробные комплексы
в стенках жилых и покинутых нор дождевых червей Lumbricus terrestris L. в
дерново-подзолистой почве // Почвоведение. 2001. № 5. С. 594-599.
Третьякова Е.Б. Сообщества бактерий, ассоциированные с почвенной ме-
зофауной: Дис. ... канд. биол. наук. М., 1993. 161 с.
Третьякова Е.Б., Вызов Б.А., Добровольская ТТ. Зообактериальные
сообщества в вермикомпосте и подстилке // Микроорганизмы в сельском
хозяйстве. Пущино, 1992. С. 199.
Третьякова Е.Б., Вызов Б.А., Добровольская ТТ. Использование
устойчивости к щелочи для селективного выделения грамположительных бактерий //
Вестник МГУ. Сер. Почвоведение. 1994. № 1. С. 49-55.
266
Третьякова Е.Б., Добровольская Т.Г., Вызов Б.Л., Звягинцев Д.Г.
Сообщества бактерий, ассоциированные с почвенными беспозвоночными //
Микробиология. 1996. Т. 65, № 1. С. 102-110.
Умаров ММ. Микобактерии в почвах (свойства, распространение,
особенности аминокислотного состава): Автореф. дис. ... канд. биол. наук. М., 1972.
23 с.
Умаров ММ. Ассоциативная азотфиксация в биогеоценозах // Почвенные
организмы как компоненты биогеоценоза. М.: Наука, 1984. С. 185-199.
Умаров ММ. Ассоциативная азотфиксация. М.: Изд-во МГУ, 1986. 133 с.
Умаров ММ. Современное состояние и перспективы исследований
микробной азотфиксации // Тр. Всерос. конф. "Перспективы развития почвенной
биологии": К 100-летию со дня рождения акад. Е.Н. Мишустина. М.: МАКС
Пресс, 2001. С. 47-56.
Холодный Н.Г. Методы непосредственного наблюдения почвенной
микрофлоры // Микробиология. 1935. Т. 4, № 12. С. 153-156.
Худяков Я.П. Литическое действие почвенных бактерий на паразитные
грибы //Там же. С. 193-196.
Чернов И.Ю. Синэкологический анализ группировок дрожжей таймырской
тундры // Экология. 1985. № 1. С. 54-60.
Чернов И.Ю. География микроорганизмов и структура экосистем // Изв.
РАН. Сер. Географ. 1993. № 6. С. 49-58.
Чернов И.Ю. Микробное разнообразие: Новые возможности старого
метода // Микробиология. 1997. Т. 66, № 1. С. 107-113.
Чернов И.Ю., Бабьева И.П., Решетова И.С. Синэкология дрожжевых
грибов в субтропических пустынях // Успехи современ. биологии. 1997. Т. 117, № 5.
С. 584-602.
Черняковская Т.Ф. Дрожжелитические бактерии в природных биотопах:
Автореф. дис.... канд. биол. наук. М., 1995. 20 с.
Черняковская Т.Ф., Добровольская Т.Г.,ЛысакЛ.В., Ванина С. А.
Закономерности распределения эпифитных и сапротрофных бактерий по
компонентам вертикальной структуры степных биогеоценозов // Почвоведение. 1990.
№ 6. С. 68-77.
Шепеляковская А.О., Доронина Н.В.,ЛаманА.Г. и др. Новые данные о
способности аэробных метилотрофных бактерий синтезировать цитокинины //
Докл. РАН. 1999. Т. 368, № 4. С. 555-557.
Шлегель Г. Общая микробиология. М.: Мир, 1987. С. 50-60.
Шноль С.Э. Физико-химические факторы биологической эволюции. М.:
Наука, 1979. 244 с.
Шпгина Э.А., Панкратова ЕМ. Взаимодействие азотфиксирующих синезе-
леных водорослей с микроорганизмами-спутниками // Актуальн. проблемы
биологии синезеленых водорослей. М.: Изд-во МГУ, 1974. С. 61-78.
Щеглова И.К., Щеглов В.В. Микроорганизмы пищеварительного тракта
мидий и их роль в пищеварении моллюсков Crenomytilus grayanus II Морская
микробиология. Владивосток. Изд-во Дальневост. ун-та, 1995. С. 62-73.
Юрков В.В., Горленко ВМ. Применение электронной сканирующей
микроскопии для анализа вертикальной структуры микробных сообществ альгоба-
ктериальных матов на стеклах обрастания // Микробиол. журн. 1989. Т. 58, N° 4.
С. 676-678.
Юркое В.В., Горленко ВМ. Новый вид пресноводных аэробных бактерий
Erythrobacter sibiricus sp. nov., содержащих бактериохлорофилл //
Микробиология. 1990. Т. 59, № 1. С. 120-126.
ЯкобиЛМ., Маршу нова Т.Н., Муромцев Г.С. Тройная симбиотическая
система: бобовое растение-эндомикоризный гриб-ризобии // 9-й Баховский кол-
267
локвиум по азотфиксации: Тез. докл. Москва, 24—26 января 1995 г. М., 1995.
С. 100.
Aakra A., I)taker J.В., Nes l.F. Genetic diversity of chemoautotrophic ammoniaox-
idizing bacteria// ASM conf. Chicago, 1999. S.I.; S.n. P. 63.
Adebayo A., Watanabe I., Ladha J.K. Epiphytic occurrence of Azorhizobium caulin-
odans and other rhizobia on host and nonhost legumes // Appl. Environ. Microbiol. 1989.
Vol. 55, N 5. P. 2407-2409.
Alavandi S.V. Heterotrophic bacteria in the coastal waters of Cochin // Indian J.
Mar. Sci. 1989. Vol. 18. P. 174-176.
Allen D.A., Austin В., Colwell R.R. Numerical taxonomy of bacterial isolates
associated with a freshwater fishery // J. Gen. Microbiol. 1983. Vol. 129, N 7. P. 2043-2062.
Amann R.I., Ludwig W., Schleifer K.H. Phylogenic identification and in situ
detection of individual microbial cells without cultivation // Microbiol. Rev. 1995. Vol. 59,
Nl.P. 143-169.
Anderson J.M. Ecology of microbial communities / Ed. by M. Fletcher. Cambridge:
University Press, 1987. P. 125-133.
Anderson J.M., Bignel D.E. Bacteria in the foot, guts and faeces of the
millipede Glomeris marginata (Villers) // Soil Biol. Biochem. 1980. Vol. 12, N. 3.
P. 251-255.
Armando Т.Е., Zoltan В., Istvan K. Fold alatti gombak, termotesteben elo mikroor-
ganiz musok // Mikol. Kozl. 1993. Vol. 32, N 1-2. P. 69-73.
Atlas R.M., Bartha R. Microbial ecology // Fundamentals and applications.
Addison-Wesley: Reading, 1981. 560 p.
Babjeva LP., Chernov l.Yu. Geographical aspects of yeast ecology // Physiol. Gen.
Biol. Rev. 1995. Vol. 9, P. 3. P. 1-54.
Bagyaraj D.J., Menge J.A. Interaction between a VA mycorrhiza and Azotobacter
and their effects on rhizosphere microflora and plant growth // New Phytol. 1978.
Vol. 80. P. 567-573.
Barbieri A., Pisano A., Riccioni G. et al. Molecular characterization of cellu-
losolytic-chitinolytic bacteria associated to fruit bodies of the ectomycorrhizal fungus
Tuber borchii vittad II 3d Intern. Congr. on Symbiosis. Marburg (Germany),
August 13-19, 2000. S.I.; S.n. P. 29.
Barea J.M., Andrade G., Bianciotto V. et al. Impact on arbuscular mycorrhiza
formation of Pseudomonas strains used as inoculates for biocontrol of soil-borne fungal
plant pathogens // Appl. Environ. Microbiol. 1998. Vol. 64, N 6. P. 2304-2307.
Barea J.M., Azcon R., Hayman D.S. Possible synergetic interaction between endo-
gone and phosphate-solubilizing bacteria in low-phosphate soils // Endomycorrhizas /
Ed. by F.E. Sanders, B. Mosse and P.B. Tinker. L.: Academic Press, 1975. P. 409-417.
Baulina O.V., Gorelova O.A., Lobakova E.S. et al. Cyanobacteria with a reduced
cell wall in natural and model plant // 3d Intern. Congr. on Symbiosis. Marburg
(Germany), August 13-19. 2000. S.I.; S.n. P. 31.
Beji A., Mergaert J., Gavini F. et al. Subjective synonymy of Erwinia herbicola,
Erwinia milletiae and Enterobacter agglomerans and redefinition of the taxon by geno-
typic and phenotypic data // Int. J. System. Bacteriol. 1988. Vol. 38, N 1. P. 77-88.
Bell C.R., Dickie G.A., Harvey W.I.G., Chan J.W. Endophytic bacteria in grape
vine // Canad. J. Microbiol. 1995. Vol. 41. P. 46-53.
Benson D.R. The Genus Frankia: Actinomycete symbionts of plants // Microbiol.
Sci. 1988. Vol. 5, N 1. P. 9-12.
Bergey's Manual of determinative bacteriology / Eds. N.R. Kreig, J.G. Holt.
Baltimore: The Williams and Wilkins Co, 1994. 787 p.
Bernard M., Doube B.M., Stephens PM. et al. Interactions between earthworms,
beneficial soil microorganisms and root pathogens // Appl. Soil Ecol. 1994. Vol. 1, N 1.
P. 3-10.
268
Bird A.F. The Anguina-Corynebacterium association // Plant Parasitic Nematodes.
1981. Vol. 3. P. 303-323.
Bonfante P., Bianciotto V., Minerdi D. et al. Arbuscular mycorrhizal fungi and their
bacterial endosymbionts // 3d Intern. Congr. on Symbiosis. Marburg (Germany), August
13-19,2000. S.l.;S.n. P. 39.
Borneman J., Skroch P.W., Sullivan KM. et al. Molecular microbial diversity of an
agricultural soil in Wisconsin // Appl. Environ. Microbiol. 1996. Vol. 62, N 6.
P. 1935-1942.
Bouche M.B. Action de la faune du sol sur les etats de la matiere organique dans les
ecosystems // Humification et bidegradation. Pierron: Sarruguemines, 1975. P. 157-168.
Bowen G.D., Rovira AD. Are modelling approaches useful in rhizosphere
biology? // Bui. Ecol. Res. Commun. 1973. Vol. 17. P. 443-450.
Brenner D.J., Muller H.E., SteigerwaltA.G. et al. The new Rahnella genomospecies
that cannot be phenotypically differentiated from Rahnella aquatilis // Int. J. of Syst.
Bact. 1998. Vol. 48, N 1. P. 141-149.
Broughton WJ. Key to symbiotic harmony // 3d Intern. Congr. on Symbiosis.
Marburg (Germany), August 13-19, 2000. S.I.; S.n. P. 46.
Brown M.E. Rhizosphere microorganisms - opportunists, bandits or benefactors //
Soil Microbiol. / Ed. by N. Walker. N.Y.: Halsted Press, 1975. P. 21-38.
Byzov B.A., Dobrovolskaja T.G., Chernjakovskaja T.F., Zenova G.M. Bacterial
communities associated with soil diplopods // Pedobiologia. 1996. Vol. 40. P. 67-79.
Cacciari I., Lippi D. Arthrobacters: Succesful arid soil bacteria: A review // Arid
Soil Res. and Rehabil. 1986. Vol. 1. P. 1-30.
Caldwell B.A., Hagedorn C, Denison W.S. Bacterial ecology of an old-growth dou-
glas fir canopy // Microbiol. Ecol. 1979. Vol. 5, N 2. P. 91-103.
Carballas M., Reisinger O., Kilbertus G. Microflora у materia organica reconocible
en suelos de praderia: III. Estaciones mesofilas. Conclusiones generales // An. Edafol у
agrobiol. 1983 (1984). Vol. 42, N 9-10. P. 1501-1509.
Carrapico E. Are bacteria the third partner of the Azolla-Anabaena symbiosis ? //
Plant and Soil. 1991. Vol. 137. P. 157-160.
Chandler D.P., Brockman F.J., Fredrickson J.K. Use of 16r DNA clone libraries to
study changes in a microbial community changes in a microbial community resulting
from ex situ perturbation of a subsurface sediment // FEMS Microbiol. Rev. 1997.
Vol. 20, N 3-4. P. 217-230.
Christiansen-Weniger С Endophytical establishment of inside induced stem and
root tumors of rice // Abstr. 10th Int. Congr. on Nitrogen Fixation. St-Petersburg
(Russia), 1995. S.I.; S.n. P. 363.
Chrost R.J., Siuda W. Some factors affecting the heterotrophic activity of bacteria
in lake // Acta Microbiol. Polon. 1978. Vol. 27, N 2. P. 129-136.
Chu T.L., Szabo I.M., Szabo 1. Nocardioform gut actinomycetes of Glomeris hexa-
sticha Brandt (Diplopoda) // Biol, and Fertil. of Soil. 1987. N 3. P. 113-116.
Citernesi V., Neglia R., Serriti A. et al. Nitrogen fixation in the gasteroenteric cav-
iti of the animals //Soil Biol. Biochem. 1977. Vol. 9. P. 71-72.
Cocking E.C., Davey M.R. Nitrogen from the air for non-legume crops // Chemistry
and Industry. 1991. N 5. P. 831-835.
Collins M.D., Bradbury J.F. Plant pathogenic species of Corynebacterium II
Bergey's Manual of System. Bacteriol. 1986. Vol. 2. P. 1276-1284.
Conn HJ., Dimmick J. Soil bacteria of the genus Arthrobacter I I Soil. Sci. 1948.
Vol. 65, N 4. P. 349-353.
Contreras E. Studies on the intestinal actinomycetes flora of Eisenia lucens
(Annelida, Oligochaeta) // Pedobiol. 1980. Vol. 20, N 6. P. 411-416.
Corpe W.A., Rheem S. Ecology of the methylotrophic bacteria on living leaf
surfaces // FEMS Microbiol. Ecol. 1984. Vol. 62, N 4. P. 243-250.
269
Daft M.J., Clelland D.M., Gardner I.C. Symbiosis with endomycorrhizas and
nitrogen-fixing organisms // Proc. Roy. Soc. Edinburg. Sect. B. 1985. Vol. 85, N 3-4.
P. 283-298.
Dahm H. Metabolic activity of bacteria isolated from soil, rhizosphere and mycor-
rhizosphere of pine (Pinus silvestris L.) H Acta Microbiol. Pol. 1984. Vol. 33, N 2.
P. 157-162.
Dahm H., Strzelczyk E. Wpluw mikroorganizmow glebowych na wzrost siewek
swierka (Picea excelsa L.) i zasiedlanie korzeni tych siewek przez mikroorganismy //
Acta Univ. N. Copernic. Biol. Nauki Mat. Przyr. 1977. Vol. 42, N 3.
Darling C. Bacteria of the Antarctica // J. Bacteriol. 1940. Vol. 40. P. 461.
Davis MJ.t Gillaspie A.G., Vidaver A.K., Harris R.W. Clavibacter, a new genus
containing some phytopathogenic coryneform bacteria, including Clavibacter xyli subsp.
xyli sp. nov. and Clavibacter xyli subsp. cynodontis subsp. nov., pathogens that cause
ration stunting disease of sugarcane and bermudagrass stunting disease // Int. J. Syst.
Bacteriol. 1984. Vol. 34. P. 107-117.
Debette J., Blondeau R. Presence de Pseudomonas maltophila dans la rhizosphere
de quelques plantes cultivees // Canad. J. Microbiol. 1980. Vol. 26. P. 460-463.
De Jongh P. On the symbiosis of Ardisia cripsa I I Ned. Akad. Wet. Afd. Naturkd.
1938. Sec. II. Vol. 37. P. 1-74.
De Leval J., Remade J. A microbiological study of the rhizosphere of poplar //
Plant und Soil. 1969. Vol. 31. P. 31-42.
De Long E.F., Franks D.G., Yayanos A.A. Evolutionary relationships of cultivated
psychrophilic and barophilic deep-sea bacteria // Appl. Envir. Microbiol. 1997. Vol. 63,
N45. P. 2105-2108.
De Long E.F., Wu K.Y., Prezelin B.B., Jovine R.V. High abundance of Archae in
Antarctic marine picoplancton // Nature. 1997. Vol. 371. P. 695-697.
Devliegher W., Verstraete W. Microorganisms and soil physico-chemical
conditions in the drilosphere of Lumbricus terrestris // Soil Biol. Biochem. 1997. Vol. 29.
P. 1721-1729.
Dobereiner J. Nitrogen-fixing bacteria in the rhizosphere // Biolog. Nitrogen
Fixation. 1974. Vol. 33. P. 86-120.
Dobrovolsky G. The importance of soil sustaining Biodiversity // Transaction 15-th
World Congr. of Soil Sci. Acapulco (Mexico), 1994. Vol. 4b. S.I.; S.n. P. 75-76.
Dommerques J., Mutaftchiev S. Fixation synergiquede Г azote atmocpherigue dans
les sols tropicaux // Ann. Inst. Pasteur. 1965. N 3. P. 112-120.
Dorofeeva L.V., Lysanskaya V.Y., Adanin V.M. et al. Taxonomic diversity of
coryneform bacteria isolated from cereal plants // Abstr. Intern. Conference "Microbial
Diversity". Perm (Russia), 8-11 October, 1996. S.I.; S.n. P. 163.
Doube B.M., Ryder M.H., Davoren C.W., Stephens P.M. Enchanced root nodulation
of subterranean clover (Trifolium sybterraneum) by Rhizobium leguminosarum biovar
trifolii in the presence of the earthworm Aporrectodea trapezoids (Lumbricidae) // Biol.
Fertil. Soils. 1994. N 18. P. 169-174.
Dryanovska O.A., Zakova N.S. Combined cultivation of Rhizobium leguminosarum
with Chlamydomonas reinhardi // Докл. Болгарской АН. 1985. Т. 38, № 10.
С. 1383-1385.
Dunleavy J.M. Curtobacterium plantarum sp. nov. is ubiquitos in plant leaves and
is seed transmitted in soybean and corn // Int. J. System. Bacteriol. 1989. Vol. 39, N 3.
P. 240-249.
Dupponnois R„ GarbayeJ. Mycorrhiza helper bacteria associated with the Douglas
fir - Laccaria laccata symbiosis: Effects in aseptic and in glasshouse condition // Ann.
Sci. For. 1991. Vol. 48. P. 239-251.
Ercolani G.L. Distribution of epiphytic bacteria on olive leaves and the influence of
leaf age and sampling time // Microbiol. Ecol. 1991. Vol. 21. P. 35-48.
270
Evolution: Lost worlds // Trends Ecol. and Evol. 1998. Vol. 13, N 3. P. 93-94.
Evtushenko L.I., Akimov V.N., Zgurskaya H.I. Dobrovolskaya T.G., Kalakout-
skii L.V. Circumscription of the species and subspecies in the genus Clavibacter // 7th
Int. Congr. of Bacteriol. and Appl. Microbiol. Division: Abs. book. Prague (Czech.
Republic), 1994. S.I.; S.n. P. 233
Evtushenko L.I., Dorofeeva L.V., Dobrovolskaya T.G., Subbotin S.A. Coryneform
bacteria from plant galls induced by nematodes of the the subfamily Anguininae // Rus.
J. of Nematology. 1994. Vol. 2, N 2. P. 99-104.
Evtushenko L.I., Dorofeeva L.V., Dobrovolskaya T.G. et al. Agreia bicolorata gen.
nov., sp. nov. to accommodate actinobacteria isolated from narrow reed grass infected by
the nematode Heteroanguina graminophila // Int. J. Syst. Evol. Microbiol. 2001. Vol. 51,
N 6. P. 2073-2079.
Fang Wu, Moreno J., Vela G.R. Growth of Azotobacter vinelandii on soil
nutrients // Appl. Environ. Microbiol. 1987. Vol. 53, N 3. P. 489-494.
Fischer B. Die Bakterien des Meeres nach den Untersuchungen der Plankton-
Expedition unter gleichzeitiger Berucksichtigung einiger alterer und neurer
Untersuchungen // Ergebnisse der Plankton-Expedition der Humboldt-Stiffung. 1894.
N 4. S. 1-83.
Fisher PJ., Lappin-Scott H., Petrini O. The distribution of fungal and bacterial endo-
phytes in maize // Abs. VI Int. Symp. on Microbiol. Ecol. Barcelona, S.I.; S.n. 1992. P. 263.
Fitter A.H., Garbaye J. Interactions between mycorrhizal fungi and other soil
organisms // Plant and Soil. 1994. Vol. 159, N 1. P. 123-132.
Fleischman D., Kramer D. Photosynthetic rhizobia // Biochim. et Biophys. Acta.
1998. Vol. 1364. P. 17-36.
Flint E.A., Stout J.D. Microbiology of some soils from Antarctica // Nature. 1960.
Vol. 188, N4752. P. 767-768.
Forni C, Gent Hi S., Van Hove C, Grilli Caiola M. Isolation and characterization of
the bacteria living in the sporocarps of Azolla filiculoides Lam II Ann. of Microbiol.
1990. Vol.40. P. 235-240.
Frey P., Frey-Klett P., Garbaye /. et al. Metabolic and genotypic fingerprinting of
fluorescent pseudomonas associated with the Douglas fir Laccaria bicolor mycorrhizos-
phere // Appl. Environ. Microbiol. 1997. Vol. 63, N 5. P. 1852-1860.
Frey-Klett P., Pier rat J.C., Garbaye J. Location and survival of mycorrhiza helper
Pseudomonas fluorescens during establishment of ectomycorrhizal symbiosis between
Laccaria bicolor and Douglas fir // Appl. Environ. Microbiol. 1997. Vol. 63, N 1.
P.139-144.
Fuerest J.A. The planctomycetes: Emerging models for microbial ecology,
evolution and cell biology // Microbiology. 1995. Vol. 141, N 7. P. 1493-1506.
Fuhrman J.A., McCallum K., Davis A A. Novel major archaebacterial group from
marine plancton // Nature. 1994. Vol. 356. P. 148-149.
Gadkari D., MorsdorfG., Meyer O. Chemolitoautotrophic assimilation of dinitro-
gen by Streptomyces thermoautotrophicus UBT1: Identification of an unusual N2-fixing
system //J. Bacteriol. 1992. Vol. 174, N 21. P. 6840-6843.
Ganry F„ Diem H.G., Dommergues Y.R. Effect of inoculated with Glomus mosseae
on nitrogen fixation by field-grown soybeans // Plant and Soil. 1982. Vol. 68, N 3.
P. 321-329.
Garbaye J. Helper bacteria: A new dimension to the mycorrhizal symbiosis // New
Phytol. 1994. Vol. 128, P. 197-210.
Garbaye J., Duponnois R. Specificity and function of mycorrhization helper
bacteria (MHB) associated with Pseudotsuga menziesii-Laccaria laccata symbiosis //
Symbiosis. 1992. Vol. 14. P. 335-344.
Gates J.E., Fisher R.W., Candler R.A. The occurrence of coryneform bacteria in the
leaf cavity of Azolla// Arch. Microbiol. 1980. Vol. 127. P. 163-165.
271
Gazzanelli G., Malatesta M., Pianetti A. et al. Bacteria associated to fruit bodies of
the ecto-mycorrizal fungus Tuber borchii Vittod I I Symbiosis. 1999. Vol. 26.
P. 211-222.
Geitler L. Chamaesiphonosira cymbellicola, n. gen., n. sp. ein knospenbildendes
Bakterium und sein spezialisierter Epiphytismus // Arch. Microbiol. 1975. Vol. 103.
P. 231-236.
Gest H., Favinger J.L. Enrichment of purple photosynthetic bacteria from
earthworms // Feems Microbiol. Lett. 1992. Vol. 91. P. 265-270.
Gilbert R.G., Linderman R.G. Increased activity of soil microorganisms near scle-
rotia of Sclerotium rolfsii in soil //Canad. J. Microbiol. 1971. Vol. 17. P. 557-562.
Glagoleva O., Kovalskaya N., Lobakova E„ Umarov M. Endosymbiosis formation
between rape roots and nitrogen-fixing bacteria // Abs. 8th Int. Symp. Microbiol. Ecol.
Halifax (Canada), 1998. P. 162.
Goni-Uriza M., Capdepuy M„ Raymond N. et al. Impact of an urban effluent on the
bacterial community structure in the Arga River (Spain), with special reference to cul-
turable gram-negative rods // Canad. J. Microbiol. 1999. Vol. 45. P. 826-832.
Goodfellow M. Properties and composition of the bacterial flora of a pine forest
soil // Soil Sci. 1968. Vol. 19. P. 154-167.
Goodfellow M., Dawson D. Qualitative and quantitative studies of bacteria
colonizing Picea sitchensis litter // Soil Biol. Biochem. 1978. N 10. P. 303-307.
Gorlenko V.M., Bryantseva I.A., Kompantseva E.I. Novel alkaliphilic heliobacteria
from Southeast Siberia soda lakes environments // Abs. of Workshop "Green and
Heliobacteria". Urbino (Italy), 1997. S.I.; S.n. P. 6.
Gosink J.J., Herwig R.P., Staley J.T. Octadebacter arcticus gen. nov., sp. nov. and
O. antarcticus sp. nov. nonpigmented psychrophilic gas vacuolate bacteria from polar
sea ice and water// Syst. and Appl. Microbiol. 1997. Vol. 20, N 3. P. 356.
Gosink J.J., Woese C.R., Staley J.T. Polaribacter gen.nov. with three new species
P. irgensii sp. nov., P.franzmannii sp. nov. and P.filamentus sp. nov. gas vacuolate polar
marine bacteria of the Cytophaga-Flavobacterium-Bacteroides group and
reclassification of Flectobacillus glomeratus as Polaribacter glomeratus comb. nov. // Int. J. Syst.
Bacteriol. 1998. Vol. 48. P. 223-235.
Graham J.H., Linderman R.G., Menge J A. Development of external hyphae by
different isolates of mycorrhizal Glomus spp. in relation to root colonization and growth of
Troyer citrange II New Phytol. 1982. Vol. 91. P. 183-189.
Gray T.R.G. Survival of vegetative microbes in soil // XXXVI Symp. Soc. Gen.
Microbiol. Cambridge, 1976. S.I.; S.n. P. 327-364.
Griffiths B.S., Wood S. Microorganisms associated with the hindgut of Oniscus
asellus (Crustaceae, Isopoda) //Pedobiol. 1985. Vol. 28, N 6. P. 377-381.
Grilli С M., Forni C, Castagnola M. Bacteria in Azolla-Anabaena association //
Symbiosis. 1988. Vol. 5. P. 185-198.
Grobellar N.f Scott W.E., Hattingh W.t Marshall J. The identification of the coral-
loid root endophytes of the Southern African cycads and the ability of the isolates to fix
dinitrogen // South African J. of Botany. 1987. Vol. 53. P. 111-118.
Gryndler M., Veisadova //., Vosatka M., Catska V. Influence of bacteria on vesic-
ular-arbuscular mycorrhizal infection of maize // Folia Microbiol. 1995. Vol. 40.
P. 95.
Gunnison D., Alexander M. Resistance and susceptibility of algae to decomposition
by natural microbial communities // Limnol. Oceanogr. 1975. Vol. 20, N 1. P. 64-70.
Gupta R.S. Protein phylogenies and signature sequences: A reappraisal of
evolutionary relationships among Archaebacteria, Eubacteria and Eukaryotes // MMBR. 1998.
Vol. 62, N4. P. 1435-1491.
Gupta R.S. The phylogeny of proteobacteria: Relationships to other eubacterial
phyla and eukaryotes // FEMS Microbiol. Rev. 2000. Vol. 24. P. 367^02.
272
Gupta S., Arora D.K. Attraction of motile bacteria toward exudates of fungal
spores // Microbios Lett. 1987. Vol. 36, N 141. P. 13-16.
Gyllenberg H.G., Eklund E. Bacteria // Biology of plant litter decomposition / Ed.
by C.H. Dickinson and G.J.P. Pugh. S.I.; S.n. 1974. Vol. 1, 2. P. 40-52.
Hadhrami M.N., Vela G.R. Degradation of phenolic acids by Azotobacter spp.
isolated from sorghum fields // Abst. 6th Int. Symp. on Microbiol. Ecology. Barcelona,
1992. S.I.; S.n. P. 262.
Hagedorn G., Holt J.G. Differentiation of Arthrobacter soil isolates and named
strains from other bacteria by reactions on dye-containing media // Canad. J. Microbiol.
1975. Vol. 5. P. 688-693.
Hagesava Т., Takizawa M., Tanida S. A rapid analysis for chemical grouping of
aerobic actinomycetes // J. Gen. Microbiol. 1983. Vol. 29. P. 319-322.
Halda-Alija L., Johnston T.C. Diversity of culturable heterotrophic aerobic bacteria
in pristine stream bed sediments // Canad. J. Microbiol. 1999. Vol. 45. P. 879-884.
Halsall DM., Gibson A.H. Cellulose decomposition and associated nitrogen
fixation by mixed cultures of Cellulomonas gelida and Azospihllum species or Bacillus mac-
erans II Appl. Environ. Microbiol. 1985. Vol. 51, N 4. P. 1021-1026.
Halsall DM., Gibson A.H. Comparison of two Cellulomonas strains and their
interaction with Azospirillum brasilense in degradation of wheat straw and associated
nitrogen fixation // Appl. and Environ. Microbiol. 1986. Vol. 52, N 4. P. 855-861.
Harris D. Analysis of DNA extracted from microbial communities // Beyond the
biomass / Eds. K. Ritz, J. Dighton, K.E. Gillre. Chichester: John Wiley & Sons, 1994.
P. 111-118.
Heath G.W., Edwards AM. Studies in leaf litter breakdown: I. Breakdown rates of
leaves of different species // Pedobiologia. 1966. Vol. 6, N 1. P. 1-12.
Hellebust J A. Extracellular product: Algal physiology and biochemistry // Botany
Monogr. 1974. Vol. 10. P. 838-864.
Heuer H., Krsek M., Baker P. et al. Analysis of actinomycete communities by
specific amplification of genus encoding 16S rRNA and gelelectrophoretic separation
in denaturing gradients // Appl. Environ. Microbiol. 1997. Vol. 63, N. 8. P. 3233-
3241.
Heumann W., Roch A., Springer R. et al. In Rhizobiaceae five different species are
produced by rearranganements of one genome, induced by DNA-damaging agents //
Mol. Gen. Genet. 1984. Vol. 197. P. 425^36.
Hiorns W.D., Methe B.A., Nierzwicki-Baner S.A. Bacterial diversity in Adirondack
mountain lakes as revealed by 16S rRNA gene sequences // Appl. Environ. Microbiol.
1997. Vol. 63, N 7. P. 2957-2960.
Holding A J., Franklin D.A., Watling R. The microflora of peat-podzol transitions //
Soil Sci. 1965. Vol. 16. P. 44-59.
Holland MA. Methylobacterium and plants // Rec. Res. Dev. Plant Physiol. 1997.
Vol. 1,N1. P. 207-213.
Horie S., Yanagida Y„ Saheki M. et al. Occurrence of Rahnella aqua til is psy-
chrotrophic coliforms in mountain soils // J. Food Hyg. Soc. Jpn. 1985. Vol. 26.
P. 573-578.
Hugenholtz P., Goebel B.M., Pace N.R. Impact of culture-independent studies on
the emerging phylogenetic view of bacterial diversity // J. Bacteriol. 1998. Vol. 180,
N18. P. 4765-4774.
Ineson P., Anderson JM. Aerobically isolated bacteria associated with the gut and
faecales of the litter feeding macroarthropodes Oniscus osellus and Glomeris margina-
ta II Soil Biol, and Biochem. 1985. Vol. 17, N 6. P. 843.
lnglis P.W., Burden J.L., Peberdy J.F. Evidence for the association of the enteric
bacterium Ewingella americana with internal stipe necrosis of Agaricus bisporus II
Microbiology. 1996. Vol. 142, N 11. P. 3253.
273
Jacques M.A., Morris C.E. A review of issues related to the quantification of
bacteria from the phyllosphere // FEMS Microbiol. Ecol. 1991. Vol. 18. P. 1-14.
Jager K., Marialigeti K., Hauk M., Barabas G. Promicromonospora enterophila sp.
nov. - a new species of monospore actinomycetes // Int. J. Syst. Bact. 1983. Vol. 33.
P. 525-531.
Jakob H. Compatibilites, antagonism et antibioses entro quelques algues du sol //
Rev. Gen. Bot. 1961. Vol. 68. P. 215-232.
Jarvis E.D., Widom R.L., LaFauci G. et al. Chromosomal organization of rRNA
operons in Bacillus subtilis // Genetics. 1988. Vol. 120. P. 625-635.
Jensen H.E. Notes on the microbiology of soil from Nothern Groenland // Med.
Gronland. 1951. Vol. 142. P. 24-29.
Jensen H.L. The Coryneform bacteria // Ann. Rev. Microbiol. 1952. Vol. 6. P. 77-97.
Kalakoutskii L.V., Zenova G.M., Soina VS., Likhacheva A.A. Associations of
actinomycetes with algae // Actinomycetes. 1990. Vol. 1, N 2. P. 27-42.
Kalpan D.L., Hartenstein R. Absence of nitrogenase and nitrat reductas in soil
macroinvertebrates // Soil Sci. 1977. Vol. 304, N 17. P. 449-452.
Kampert M., Strzelczyk E. Influence of soil microorganisms on growth of pine
seedlings (Pinus silvestris L.) and microbial colonization of the roots of these seedlings //
Pol. J. Soil. Sci. 1975. Vol. 8, N 1. P. 59.
Karsten G.R., Drake H.L. Denitrifying bacteria in the earthworms gastrointestinal
tract and in vivo emission of nitrous oxide (N20) by earthworms // Appl. Environ.
Microbiol. 1997. Vol. 63, N 5. P. 1878-1883.
Katznelson H., Ronatt J.W., Peterson E.A. The rhizosphere effect of mycorrhizal
and nonmycorrhizal roots of yellow birch seedlings // Canad. J. Botany. 1962. Vol. 40.
P. 377-382.
Kauri T. Rapid multipoint method for quantification of various physiological
groups of bacteria in soil // Soil Biol. Biochem. 1980. Vol. 12. P. 125-130.
Kennedy A.C., Gewin V.L. Soil microbial diversity: Present and future
considerations // Soil Sci. 1997. Vol. 162, N 9. P. 607-617.
Kennedy I.R., Pereggerk L.L., Wood С et al. Biological nitrogen-fixation in non-
leguminous field crops - facilitating the evolution of an effective association between
Azospirillum and wheat // Plant and Soil. 1997. Vol. 194, N 1-2. P. 65-79.
Khammas K.M., Kaiser P. Pectin decomposition and associated nitrogen fixation by
mixed cultures of Azospirillum and Bacillus species // Canad. J. Microbiol. 1992.
Vol. 38. P. 794-797.
Kilbertus G., Reisinger O., Schwartz R. Microflore et matiere organique figuree
dans des sols prairiaux humides. I. Etude microbiologuque et ultrastructurale // Bui.
Ecole Nat. Super. Agron. Ind. Alim. 1979. Vol. 21, N 1-2. P. 67-75.
Kleeberger A., Castoph H., Klingmuller W. The rhizosphere microflora of wheat
and barley with special reference to gram-negative bacteria // Arch. Microbiol. 1983.
Vol. 136. P. 306-311.
Klopmeyer MJ.t Ries S.M. Motility and chemotaxis of Erwinia herbicola and its
effect on Erwinia amylovora // Phytopathology. 1987. Vol. 77, N 6. P. 909-914.
Knosel D. The genus Phyllobacterium // Bergey's manual of systematic
bacteriology. Baltimore: Williams and Wilkins Co., 1984. Vol. 1. P. 234-256.
Kremer R. Identify and properties of bacteria inhabiting seeds of selected broadleaf
weed species // Microbiol. Ecol. 1987. Vol. 14, N 1. P. 29-37.
Krishna K.R., Balakrishna A.N., Bagyaraj DJ. Interaction between a vesicular-
arbuscular mycorrhizal fungus and Streptomyces cinnamomeous and their effects on
finger millet // New Phytol. 1982. Vol. 92. P. 401-405.
Kuske C.R., Barns S.M., Busch J.D. Diverse uncultivated bacterial groups from
soils of the arid Southwestern United States that are present in many geographic
regions // Appl. Envir. Microbiol. 1997. Vol. 63, N 9. P. 3614-3621.
274
Lambert В., Joos H., Dierickx S. et al. Identification and plant interaction of a
Phyllobacterium sp., a predominant Rhizobacterium of yuong sugar beet plants // Appl.
Envir. Microbiol. 1990. Vol. 56, N 4. P. 1093-1102.
Lambert В., Leyns F., Van Rooyen L et al. Rhizobacteria of maize and their
antifungal activities // Appl. Environ. Microbiol. 1987. Vol. 59, N 6. P. 1866-1871.
Larson R., NealJ. Selective colonization of the rhizosphere of wheat by nitrogen-
fixing bacteria // Ecol. Bull. 1976. Vol. 26. P. 331-341.
Laudelout H., Lambert R., Pham ML. Variation saisonniere de la population micro-
bienne du sol // Rev. Ecol. Et. Biol. Sol. 1978. Vol. 15, N 2. P. 147-158.
Leben C. Microorganisms on cucumber seedlings //Phytopathology. 1961. Vol. 51,
N8.
Lebuhn M., Heulin Т., Hartmann A. Production of auxin and other phenolic
compounds by Paenibacillus polymyxa strains isolated from different proximity to plant
roots // FEMS Microbiol. Ecol. 1997. Vol. 22, N 4. P. 325.
Lee K.E. Earthworms: Their ecology and relationships with soils and land use.
Sydney - ets.: Acad. Press, 1985. 411 p.
Lee K.E., Pankhurst C.E. Soil organisms and sustainable productivity // Austr. J.
Soil Res. 1992. Vol. 30. P. 855-892.
Li C.V., Castellano M.A. Azospirillum isolated from within sporocarps of the myc-
orrhizal fungi Hebeloma crustuliniforme, Laccaria laccata and Rhizopogon vinicolor //
Trans. Brit. Mycol. Soc. 1987. Vol. 88, N 4. P. 563-565.
Li C.V., Hung L.L. Nitrogen-fixing (acetylene-reducing) bacteria associated with
ectomycorrhizae of Douglas fir // Plant and Soil. 1987. Vol. 98, N 3. P. 425-428.
Li C.Y., Massicotte H.B., Moore L.V.H. Nitrogen-fixing Bacillus sp. associated with
Douglas fir tuberculated ectomycorrhizae // Plant and Soil. 1992. Vol. 140. P. 35-40.
Liesack W., Stackebrandt E. Occurence of novel groups of the domain Bacteria as
revealed by analysis of genetic material isolated from an Australian terrestrial
environment //J. Bacteriol. 1992. Vol. 74, N 15. P. 5071-5078.
Liljeroth E., Burgers S.I.G.E., Van Veen J .A. Changes in bacterial populations along
roots of wheat (Triticum aestivum L.) seedlings // Biol, and Fert. of Soils. 1991. Vol. 10.
P. 276-280.
Linderman R.G. Mycorrhizal interactions with the Rhizosphere microflora: The
mycorrhizosphere effect//Phytopathology. 1988. Vol. 78, N 3. P. 366-371.
Lobakova E.S., Zagoskina N.V., Troshina U.V. et al. Structure of corralloid roots
and the synthesis of phenol compounds therein: A study with different cycad species //
3-d Internat. Congr. on Symbiosis. Marburg (Germany), August 13-19, 2000. S.I.; S.n.
P. 122.
Loquet M. The study of respiratory and enzymatic activities of earthworms-made
pedological structure in a grassland soil at Citeaux, France // Sci. Proc. Roy. Dublin Soc.
1978. Ser. A6. P. 207.
Luedemann H., Henkel A., Arth J., Liesack W. Changes in the bacterial community
structure along the vertical oxygen gradient of flooded soil cores, as revealed by T-RFLP
analysis of 16S rRNA and their encoding genes // Abstr. ASM Conf. of Microbial
Biodiversity. Chicago (Illinois), USA, August 5-8, 1999. S.I.; S.n. P. 30.
Lynch J.M. The rhizosphere - form and function // Appl. Soil Ecol. 1994. Vol. 1,
N 3. P. 193-198.
MacDonald R.S., Fall R. Methanol emission from plants // Plant Physiol. 1992.
Vol. 1.N2.P.472.
Mahaffee W.F., Kloepper J.W. Temporal changes in the bacterial communities of
soil, rhizoshere and endorhiza associated with field-grown cucumber (Cucumis
sativus 1.1.) // Microbiol. Ecol. 1997. Vol. 34. P. 210-223.
Maidak B.L., Cole J.R., Parker C.T. et al., A new version of the RDP (Ribosomal
Database Project) // Nucleic Acids Res. 1999. Vol. 27. N 1. P. 171-173.
275
Manjunath A., Mohan R., Bagyaraj DJ. Interaction between Beijerinckia mobilis,
Aspergillus niger and Glomus fasciculatus and their effects on growth of onion // New
Phytol. 1981. Vol. 87. P. 723-727.
Marialigeti K. On the community structure of the gut-microbiota of Eisenia lucens
(Annelida, Oligochaeta) //Pedobiol. 1979. Vol. 19. P. 213-220.
Marialigeti K.t Contreras E., Barabas G. et al. True Intestinal Actinomycetes of
Millipedes (Diplopoda) //J. of Invertebrate Pathol. 1985. Vol. 45. P. 120-121.
Martinez-Romero E., Caballero-MelladoJ., Gandara B. et al. Ecological, phyloge-
netic and taxonomic remarks on diazotrophs and related genera // Proc. of the 12-th Inter.
Congr. on Nitrogen Fixation. Foz do Iguacu, Parana (Brasil), September 12-17, 1999.
S.l.;S.n.P. 155-158.
McVeigh N., Munro J., Embley T.M. Molecular evidence for the presence of novel
actinomycete lineages in a temperate forest soil // J. Industial Microbiol. 1996. Vol. 17.
P. 197-204.
Mevs U., Stackebrandt E., Schuman P. et al. Modestobacter multiseptatus gen. nov.,
sp. nov., a budding actinomycete from soils of the Asgard Range (Transantartic
Mountains) // Int. J. Syst. and Evol. Microbiol. 2000. Vol. 50. P. 337-346.
Meyer J.R., Linderman R.G. Selective influence on populations of rhizosphere or
rhizoplane bacteria and actinomycetes by mycorrhizas formed by Glomus fasciculatum //
Soil Biol. Biochem. 1986. Vol. 18, N 2. P. 191-196.
Mishustin E.N. Action Azotobacter sur les vegetaux superieurs // Ann. Inst. Pasteur.
1996. Vol. 111,N3.P. 121.
Muller H.E. Age and evolution of bacteria // Experientia. 1977. Vol. 33, N 8.
P. 979-984.
Muller H.E., Fanning G.R., Brenner DJ. Isolation of Ewingella americana from
mollusks // Cur. Microbiol. 1995a. Vol. 31. P. 287-290.
Muller H.E., Fanning G.R., Brenner DJ. Isolation of Serratia fonticola from
mollusks // Syst. Appl. Microbiol. 1995b. Vol. 18. P. 279-284.
Murray R.G.E. The biology and ecology of the Deinococcaceae // Perspect.
Microbiol. Ecol.: Proc. 4-th Int. Symp. Ljubejana, 24-29 August, 1986. S.I.; S.n.
P. 153-158.
Nehl D.B., Alien SJ., Brown J.F. Deleterious rhizosphere bacteria: An intergrating
perspective // Appl. Soil. Ecology. 1997. Vol. 5, N 1. P. 1-20.
Newton J.W., Herman A.I. Isolation of cyanobacteria from the aquatic fern Azolla II
Arch. Microbiol. 1979. Vol. 120. P. 161-165.
Nicolov N.N., Kostova K.P., Vaklinova St.G. Relationship of symbiosis between
unicellular green algae and nitrogen fixation bacteria // Endocytobiol. 1983. Vol. 2.
P. 623-630.
Nie Y.F., Vesk M., Kennedy I.R. et al. Structure of 2,4-D induced para-nodules with
Rhizobium on wheat // Phytochem. (Life Sci. Adv.). 1992. N 11. P. 67-73.
Nielson CO. Carbohydrates in soil and litter invertebrates // Oikos. 1962. Vol. 13,
N 2. P. 200-215.
Nishimura Y., Kinpara M., lizuka H. Mesophilobacter marinus gen. nov. sp. nov:.
An aerobic coccobacillus isolated from seawater// Int. J. Syst. Bacteriol. 1989. Vol. 39,
N4. P. 378-381.
Obukowicz M., Schaller M., Kennedy G.S. Ultrastructure and phenolic histochemistry
of the Cycas revoluta - Anabaena symbiosis // New Phytol. 1981. Vol. 87. P. 751-759.
Ochman H., Wilson A.C. Evolution in bacteria: Evidence for a universal
substitution rate in cellular genomes // J. Mol. Evol. 1987. Vol. 26. P. 74-86.
О gram A. Soil molecular ecology at age 20: Methodological challenges for the
future // Soil Biol. Biochem. 2000. Vol. 32. P. 1499-1504.
Olsen G.J., Lane DJ., Giovannoni SJ., Pace N.R. Microbial ecology and evolution:
A ribosomal RNA approach // Ann. Rev. Microbiol. 1986. Vol. 40. P. 337-355.
276
Olsen G.J., Woese C.R., Overbeek R. The winds of (evolutionary) change:
Breathing new life into microbiology //J. Bacteriol. 1994. Vol. 176, N I. P. 1-6.
Pace N.R. Microbial ecology and diversity // ASM News. 1999. Vol. 65, N 5.
P. 328-333.
Parle J.N. A microbiological study of earthworm casts // J. General. Microbiol.
1963. Vol. 31. P. 13-22.
Peacocki A.D., Machaughtoni J., Fepheni J.R. et al. Evaluating the diversity of soil
microbial communities using molecular techniques and establisched ecological indexes //
Abstr. ASM Conf. of Microbial. Biodiversity. Chicago (Illinois, USA), August 5-8,1999.
S.I.: S.n. P. 15.
Peters G.A., Toia R.E., Raveed D., Levine NJ. The Azolla-Anabaena azollae
relations relationship: VI. Morphological aspects of the associations // New. Phytol. 1978.
Vol. 80. P. 583-593.
Polyanskaya L.M., Zvyagintsev D.G. Microbial succession in soil // Rus. Sci. Rev.
Physiol. Gen. Biol. 1995. Vol. 9. Pt. 1. P. 1-65.
Prasad U.PJ., Edward J.C. Studies on bacteria of phyllosphere of most importand
field crop plants of Allahabad // Indian J. Microbiol. 1984. Vol. 24, N 1. P. 70-71.
Pratt R., Fong I. Studies on Chlorella vulgaris. II. Further evidence that Chlorella
formis a growth inhibiting substance // Amer. J. Bot. 1949. Vol. 27, N 3. P. 431.
Prokaryotes: A Handbook on habitats, isolation and identification of bacteria / Eds
M.P. Starr et al. B.-«ts.: Springer, 1981. Vol. 1-2. P. 1-1102, 1103-2281.
Rambelli A. The rhizosphere of mycorrhizae // Ectomycorrhizae / Eds. G.L. Marks,
T.T. Koslowski. N.Y.: Academy Press, 1973. P. 299-343.
Redkina T.V. Phototrophic non-sulfur purple bacteria as associative diazotrophs //
Abst. of 10-th Intern. Congr. on Nitrogen Fixation. St.-Petersburg (Russia),
May 28-June 3, 1995. S.I.; S.n. P. 639.
Reinhold В., Hurek Т., Fendriki /. Strain-specific chemotaxis of Azospirilium sp. //
J. Bacteriol. 1985. Vol. 162, N 1. P. 100-195.
Reinholdhurek В., Hurek T. Azoarcus spp. and their interactions with grass-roots //
Plant Soil. 1997. Vol. 194, N 1-2. P. 57-64.
Reyes V.G., Tiedje J.M. Ecology of the gut microbiota of Tracheoniscus rathkei
(Crustacea, Isopoda) // Pedobiology. 1976. Vol. 16, N 1. P. 62-74.
Rondon M.R., Goodman R.M., Handelsman J. The Earth's bounty: Assessing and
accessing soil microbial diversity //Trends in Biotechnology. 1999. Vol. 17. P. 403-
409.
Rossello-Mora R.A., Ludwig W.f Kampfer P. et al. Ferrimonas balearica gen. nov.,
spec, nov., a new marine facultative Fe(III) reducing bacterium // Syst. and Appl.
Microbiol. 1995. Vol. 18, N 2. P. 196-202.
Rozycki //., Dahm H., Strezelczyk E. et al. Influence of mineral fertilizers on
number, genus and species composition, and nutritional requirements of soil, rhizosphere and
mycorrhizosphere bacteria of pine (Pinus silvestris L.) on a dry coniferous site (Cladonio
pinetum) // Folia Forest. Pol. Ser. A. 1986. Vol. 28. P. 23-24.
Rozycki //., Kampert M., Dahm H. et al. Effect different soil bacteria on
mycorrhizae formation in scots pine (Pinus sylvestris L.) in vitro studies // Folia Forest. Pol.
Ser. A. 1994. Vol. 36. P. 91-102.
Ruiz C, Rodriguez C, Ramos-Cormenzana A. Isolation and characterization of
myxobacteria in soils from Granada // Folia Microbiol. 1987. Vol. 32, N 5. P. 431-433.
Sabry S.R.S., Salen S.A., Batchelor СЛ. et al. Endophytic establishment of
Azozhizobium-Caulinodans in wheat // Proc. Roy Soc. Ser. B. 1997. Vol. 264, N 1380.
P. 341-346.
Salem S.H., Barakah F.N., Heggo AM. Effect of endomycorrhizal fungi and
Rhizobium meliloti on nodulation, nutrition and N2-fixation of alfalfa crown on calca-
ceous soil // Abst. 8th Symp. Microbiol. Ecol. Canada, 1998. S.I.; S.n. P. 290.
277
Schloter M., Wiehe W., Assmus B. et al. Root colonization on different plants by
plant-growth-promoting Rhizobiwn leguminosarum bv. trifoli R 39 studied with
monospecific polyclonal antisera // Appl. and Envir. Microbiol. 1997. Vol. 63, N 5.
P. 2038-2046.
Seiler H., Kammerbauer J. Selective medium for isolation of saprophitic coryne-
form bacteria//Zentral. Mikrob. 1986. Vol. 141. P. 541-551.
Serrano R., Carrapico F., Vidal R. The presence of lectins in bacteria associated
with the Azolla-Anabaena symbiosis // Symbiosis. 1999. Vol. 27. P. 169-178.
Shabaev V.P., Smolin V.Yu, Burlutskaya G.R., Umarov M.M. Nitrogen balance in
soil cropped by non-legume plants inoculated with nitrogen-fixing microorganisms //
10-th Intern. Symp. on Soil Biology. Keszthely, August 23-31, 1989. S.I.; S.n.
P. 78.
Shaw C, Pawluk S. Faecal microbiology of Octolasion tyrtaeum, Aporrectodea
turgida and Lumbricus terrestris and its relation to the carbon budgest of three artificial
soils //Pedobiology. 1986. Vol. 29, N 6. P. 377-389.
Sher F.M., KloepperJ.W., Singelston C.A. Chemotaxis of fluorescent Pseudomonas
spp. to soybean seeds exudates in vitro and in soil // Canad. J. Microbiol. 1985. Vol. 31,
N 6. P. 570-574.
Sher F.M., Ziegle J.S., Kloepper J.W. A method for assessing the root-colonization
capacity of bacteria on maize // Canad. J. Microbiol. 1984. Vol. 30. P. 151-157.
Simek M., Pizl V. The effect of earthworms (Lumbricidae) on nitrogenase activity
in soil // Biol. Fertil. Soils. 1989. Vol. 7. P. 370-373.
Sly L.I., Taghavi M., Fegan M. Phylogenetic hetcrogneity within the genus
Herpetosiphon: Transfer of the marine species Herpetosiphon cohaerens, Herpetosiphon
nigricans and Herpetosiphon persicus to the genus Lewinella gen. nov. in the
Flexibacter-Bacteroides-Cytophaga philum // Int. J. Syst. Bacteriol. 1998. Vol. 48.
P. 731-737.
Smarda J. A new epiphitic bacterium of a cyanophyte // Syst. Appl. Microbiol.
1985. Vol. 6, N3. P. 298-301.
Stackebrandt E., Liesack W., Goebel B.M. Bacterial diversity in a soil sample from
a subtropical Australian environment as determined by 16S rDNA analysis // FASEB J.
1993. Vol. 7. P. 232-236.
Stackebrandt E., Koch C, Gvozdiak O., Schumann P. Taxonomic dissection of the
genus Micrococcus: Kocuria gen. nov., Nesterenkonia gen. nov., Kytococcus gen. nov.,
Dermacoccus gen. nov. and Micrococcus Cohn 1872 gen. emend // Int. J. Syst. Bacteriol.
1995. Vol. 45. P. 682-692.
Starkey R.L. Some influence on the development of higher plants upon the
microorganisms in the soil: VI. Microscopic examination of rhizosphere // Soil Sci. 1938.
Vol. 45. P. 207.
Stepanov A.L., Korpela Т.К. Review: Microbial basis for the biotechnological
removal of nitrogen oxides from flue gases // Biotechnol. Appl. Biochem. 1997. Vol. 25.
P. 97-104.
Stewart W.D., Rowell P., Rai AM. Cyanobacteria-Eukaryotic Plant Symbioses //
Ann. Microbiol. 1983. Vol. 134. P. 205-228.
Strzelczyk E., Dahm H., Kampert M. et al. Activity of bacterial and actinomycetes
associated with mycorrhiza of pine (Pinus sylvestris L.) // Angew. Bot. 1987. Vol. 61,
N 1-2. P. 53-64.
Sturz A.V., Christie B.R., Matheson B.G. Associations of bacterial endophyte
populations from red clover and potato crops with potential for beneficial allelopathy //
Canad. J. Microbiol. 1998. Vol. 44, N 2. P. 162-167.
Subba-Rao N.S., Mateos P.F., Baker D. et al. The unique root-nodule symbiosis
between Rhizobium and the aquatic legume Neptunia natans (L.f.) druce // Planta. 1995.
Vol. 196, N2. P. 311-320.
278
Szabo I.M., Jager К., Contreras E. Composition and properties of the external and
internial microflora of millipeds (Diplopoda) // Proc. of VIII Intern. Colloq. of Soil.
Zoology. Belgium, 1983. S.I.; S.n. P. 197-206.
Takeuchi M„ Hatano K. Union of the genera Microbacterium Orla-Jensen and
Aureobacterium Collins et al. in a redefined genus Microbacterium // Int. J. Syst.
Bacteriol. 1998. Vol. 48. P. 739-747.
Takeuchi M., Hatano K. Phylogenetic analysis of actinobacteria mangrove rhizos-
phere // IFO Res. Com. 1999. Vol. 19. P. 47-62.
Tate R.L. Soil microbial diversity research: Whither to now? // Soil Sci. 1997.
Vol. 162, N9. P. 605-606.
Tchebotar V.K., Kang U.G., Акао S. Effect of combined inoculation of white clover
with gus-marked and wild strains of Rhizobium and Azospirillum on nodulation and root
colonization // Abst. 10-th Intern. Congr. on Nitrogen Fixation. St.-Petersburg (Russia),
1995. S.I.; S.n. P. 136.
Tilak K.V., Li C.Y., Ho I. Occurrence of nitrogen-fixing Azospirillum in vesicular
arbusclar mycorrhizal fungi // Plant and Soil. 1989. Vol. 116, N 2. P. 286-288.
Timonen S., Jorgensen K.S., Haahtela K., Sen R. Bacterial community structure at
defined locations of Pinus sylvestris-Suillus bovinus and Pinus sylvestris-Paxillus invo-
lutus mycorrhizospheres in dry pine forest humus and nursery peat // Canad. J.
Microbiol. 1998. Vol. 44. P. 499-513.
Tippannavar СМ., Reddy Т.К., Ramachandra R. Azotobacter chroococcum in root,
stem and leaf tissues of cells of Triticum aestivum and Triticum durum // Curr. Sci. 1989.
Vol. 58, N3. P. 1342-1343.
Torsvik V., Goksoyr J., Daae F.L. High diversity in DNA of soil bacteria // Appl.
Environ. Microbiol. 1990. Vol. 56. P. 782-787.
Torsvik V., Sorheim R., Goksoyr J. Total bacterial diversity in soil and sediment
communities: A review//J. Indust. Microbiol. 1996. Vol. 17. P. 170-178.
Veda Т., Suga Y., Matsuguchi T. Molecular phylogenetic analysis of a soil
microbial community in a soybean field // Europ. J. Soil Sci. 1995. Vol. 46. P. 415-421.
Vagnerowa K., Macura J., Cat ska V. Rhizosphere microflora of wheat:
II. Composition and properties of bacterial flora during to the vegetation period of
wheat // Folia Microbiol. 1960. Vol. 5. P. 723-726.
Van Outryve M.F., Gossele F., Swings J. The Bacterial microflora of witloof
chicory {Cichorium intybus L. var. Foliosum Hegi) leaves // Microbiol. Ecol. 1989. Vol. 18,
N2. P. 175-186.
Vasilyeva L.V. Stella, a new genus of soil prosthecobacteria, with proposals for
Stella humosa sp. nov. and Stella vacuolata sp. nov II Int. J. Syst. Bacteriol. 1985.
Vol. 35, N4. P. 518-521.
Vandamme P., Pot В., Gillis M. et al. Poly phasic taxonomy, a consensus approach
to bacterial systematics // Microbiol. Rev. 1996. Vol. 60. P. 407^438.
Veldkamp H. Saprophytic coryneform bacteria // Ann. Rev. Microbiol. 1970.
Vol. 24. P. 209-240.
Vermani M.V., Kelkar S.M., Kamat MJ. Studies in polysaccharide production and
growth of Azotobacter vinelandii a plant rhizospere isolate // Lett. Appl. Microbiol.
1997. Vol. 24, N 5. P. 379.
Visser S. Role of soil invertebrates in determing the composition of soil microbial
communities // Ecological interaction in soil, plants, microbes and animals /
Eds. A.H. Fitter, D. Atkinson, D.J. Read and M.B. Usher. Oxford: Blackwell, 1985.
P. 297-318.
Vosatka M., Veisadova H., Gryndler M. et al. Influence of bacteria on vesicular-
arbuscular mycorrhizal infection of maize // Folia Microbiol. 1995. Vol. 40. 1. P. 95.
WaidJ.S. Does soil biodiversity depend upon metabiotic activity and influences? //
Appl. Soil Ecol. 1999. Vol. 13. P. 151-158.
279
Wallace R.H., King H. Nutritional groups of soil bacteria on the roots of barley and
oats // Soil Sci. 1954. Vol. 18, N 3.
Ward N., Rainey FA., Gobel В., Stackebrandt E. Identifying and culturing the
"unculturables": A challenge for microbiologists // Microbial diversity and ecosystem
function / Eds. D. Allsopp, R. Colwell, D. Hawksworth. N.Y.: CAB Internation, 1995.
P. 89-108.
Watson S.W., Valois F.W., Warebury J.B. The Prokaryotes / Eds. M.P. Starr et al.
B. -ets.: Springer, 1981. Vol. 1. P. 1005-1022.
Watts J.EM., Wellington EM.H. Bacterial community analysis in polluted soils
using molecular and metabolic techniques // Abst. ASM Conf. of Microbiol.
Biodiversity. Chicago (Illinois, USA), August 5-8, 1999. S.I.; S.n. P. 42.
Weinbauer M.G., Hofle M.G. Distribution and life strategies of two bacterial
populations in a Eutrophic Lake // Appl. and Environ. Microbiol. 1998. Vol. 64, N 10.
P. 3776-3783.
Whitman W.B., Coleman D.C., Wiebe WJ. Prokaryotes: The unseen majority //
PNAS Online. 1998. Vol. 95, N 12. P. 6578-6583.
Williams ST., Robinson C.S. The role of streptomycetes in decomposition of chitin
in acid soils //J. Gen. Microbiol. 1981. Vol. 127. P. 55-63.
Wintringerode F. von, Landt O., Gobel U.B. PNA mediated PCR-clamping for
selective recovery of novel phylogenetic groups from complex microbial consortia //
Abstr. ASM Conf. of Microbial. Biodiversity. Chicago (Illinois, USA), August 5-8,
1999. S.I.; S.n. P. 42.
Woese C.R. Bacteral evolution // Microbipl. Rev. 1987. Vol. 51. P. 221-271.
Yamada K., Komagata K. Taxonomic studies on coryneform bacteria: V.
Classification of coryneform bacteria//J. Gen. Appl. Microbiol. 1972. Vol. 18. P. 417-443.
Yoshihito U. Systematic reconstruction of marine Agrobacterium species // Abst.
8-th Intern. Symp. of Microbiol. Ecology. Halifax (Canada), 1998. S.I.; S.n. P. 358.
Yurkov V.V., BeattyJ.T. Aerobic anoxygenic phototrophic bacteria // Microbiol, and
Molec. Biol. Rev. 1998. Vol. 62, N 3. P. 695-724.
Zavarzin GA., Zhilina T.N. Anaerobic chemotrophic alkaliphiles // Jorney to
Diverse Microbial Worlds. S.I.: Kluwer Acad. Publ., 2000. P. 191-208.
Zhou J., Davey M.E., Figueras J.B. et al. Phylogenetic diversity of a bacterial
community determined from Siberian tundra soil DNA // Microbiology. 1997. Vol. 143.
P. 3913-3919.
Ziemke F., Hofle M.G., Lalucat J., Rossello M.R. Reclassification of Shewanella
putrefaciens Owen's genome group in as Shewanella baltica sp. nov // Int. J. Syst. Bact.
1998. Vol. 48, N1. P. 179-186.
Zlotnikov A.K., Glagoleva O.B., Umarov MM. Barley yield increase after
inoculation with rhizosphere nitrogen fixing consortium Bacillus firmus + Klebsiella terrigena //
Biol. Nitrogen Fixation for the 21 Century Proa: 11-th Int. Congr. on Nitrogen Fixation.
Paris, July 20-25. 1997. Dorhecht-Boston-L.: Kluwer Acad. Publ., 1997. P. 140.
Zvyagintsev D. Biodiversity of microrganisms in different soil types // Trans. 15-th
World Congr. of Soil Sci. Acapulco (Mexico), 1994. Vol. 4a. S.I.; S.n. P. 187-189.
Zvyagintsev D.G. Microorganisms in permafrost // Phisiol. Gen. Rev.: Rus. Sci.
Rev. P. 2. Harwood Acad. Publ., 1995. 40 p.
Zviagintsev D.G., Byzov В A., Tretyakova E.B., Filip Z. Fate genetically engineered
bacteria in soil: Influence of soil mesofauna on survival and possible gene transfer //
Abst. 3-rd German-Russion Workshop Biotechnology. Berlin, October 3-5, 1994. S.I.,
S.n. P. 8.
ОГЛАВЛЕНИЕ
Введение 3
Глава 7. Анализ состава бактериальных сообществ Земли,
формировавшихся в процессе эволюции биосферы
1.1. Бактерии в пресноводных и морских экосистемах 8
1.2. Циано- и альгобактериальные водные сообщества 22
1.3. Наземные альгобактериальные сообщества 32
1.4. Бактерии и высшие растения 36
1.4.1. Симбиозы азотфиксирующих бактерий с
растениями 37
1.4.2. Ассоциативные бактерии в фитосфере высших
растений 53
1.5. Роль водных и наземных растений в формировании
бактериальных сообществ почв 72
Глава 2. Организация бактериальных сообществ почв
2.1. История развития представлений о структуре и
разнообразии бактериальных сообществ почв 76
2.2. Новые подходы к экологической оценке микробных
ресурсов почв ("новые возможности старого метода") 92
2.3. Бактерии в почвенных мезо- и микролокусах 96
2.4. Структура бактериальных комплексов почв 131
2.4.1. Структура бактериальных комплексов почв
аридных ландшафтов 139
2.4.2. Структура бактериальных комплексов почв гумид-
ных ландшафтов 155
2.5. Анализ динамики структуры бактериальных сообществ
и бактериального разнообразия почв методом сукцесси-
онного анализа 188
281
Глава 3. Проблема оценки бактериального разнообразия
почв
3.1. Анализ результатов определения бактериального
разнообразия почв молекулярно-биологическими методами ... 202
3.2. Почему оценки бактериального разнообразия почв,
определенного молекулярно-генетическими и
традиционными методами посева, не совпадают? 213
3.3. О перспективах оценки бактериального разнообразия
почв и возможностях интеграции разных методов 215
3.4. Итоги анализа состава бактериального населения почв:
новый взгляд на старую проблему - "почвенные" и
"непочвенные" бактерии 218
Глава 4. Экологические функции бактерий как компонентов
почвенного микробного сообщества
4.1. Принципы функционирования микробных сообществ ... 233
4.2. Роль бактерий в биосферных функциях почв 236
Заключение 246
Литература 254
Научное издание
Добровольская Татьяна Глебовна
СТРУКТУРА
БАКТЕРИАЛЬНЫХ
СООБЩЕСТВ
ПОЧВ
Зав. редакцией А Л. Фролова
Редактор М.В. Грачева
Художник АС. Скороход
Технический редактор М.К. Зарайская
Корректор А.Б. Васильев
ИД №04284 от 15.03.2001
Подписано к печати 28.08.2002
Формат 60 х 90 Vi 6- Гарнитура Тайме
Печать офсетная
Усл.печл. 18,0. Усл.кр.-отт. 18,5. Уч.-изд.л. 18,9
Тираж 400 экз. Тип. зак. 4549.
ООО ИКЦ "Академкнига"
117997 ГСП-7, Москва, Профсоюзная ул., 90
e-mail: bookrmartfS)maik.ru. http://www.maik.ru
Отпечатано с готовых диапозитивов в
Ивановской областной типографии
Министерства Российской Федерации
по делам печати, телерадиовещания и
средств массовых коммуникаций. 153008, г.
Иваново, ул. Типографская,6.
E-mail: 091 -018@adminet.ivanovo.ru