Text
СПРАВОЧНИК
по физико-
техническим
основам криогеники
Под ред. проф. М. П. МАЛКОВА
ИЗДАНИЕ ТРЕТЬЕ, ПЕРЕРАБОТАННОЕ
И ДОПОЛНЕННОЕ
МОСКВА ЭНЕРГОАТОМИЗДАТ 1985
86^{О
ЖООТЕО
Меск. Эдаргетич. йн-я
и J.
f Z’ / - ' , '
ББК 31.392
C 74 '
УДК 621.59;53.6.48 (035.5)
Рецензент В. M. Бродянский
Авторы: М. П. Малков, И. Б. Данилов, А. Г. Зельдович,
А. Б. Фрадков
Справочник по физико-техническим основа»
С74 криогеники/ М. П. Малков, И. Б. Данилов,..
А. Г. Зельдович, А. Б. Фрадков; Под ред..
М. П. Малкова. — 3-е изд., перераб. и доп.—М.:
Энергоатомиздат, 1985.—432 с., ил.
В пер.: 2 р. 90 к. 5500 экз.
Приведены основные физико-химические константы н термоди-
намические соотношения, необходимые для расчета и проектирования
криогенных установок, а также для научно-исследовательских работ
в области низких температур. Рассмотрены типовые схемы криоген-
ных ожижителей, рефрижераторов н установок разделения газовых
смесей. Дана теория процессов. Предыдущее издание вышло в свет
в 1973 г.
Для научных работников н инженеров, специализирующихся в*
области криогенной техники и физики низких температур.
2303050000-373 ББК 31.392
С 051(01)-85 187-85 6П2.28
© Энергия, 1973
© Энергоатомиздат, 1985, с изменениями’
СОДЕРЖАНИЕ
Предисловие......................... 6
Раздел первый. Единицы физи-
ческих величин и важнейшие
физические константы ... 7
Раздел второй. Термодинами-
ческие основы охлаждения . . 16
2.1. Определение термина «ох-
лаждение» ...................16
2.2. Параметры состояния . . 18
2.3. Закономерности идеального
газа............................18
2.4. Два основных начала термо-
динамики .......................20
2.5. Некоторые наиболее важ-
ные дифференциальные урав-
нения термодинамики . . 23
2.6. Частные виды процессов и
специальные термодинами-
ческие функции .... 24
2.7. Теория взаимного перехода
теплоты и работы ... 29
2.8. Абсолютная термодинамиче-
ская шкала температур и
отрицательные абсолютные
температуры.....................31
2.9. Энтропия как мера потерь
и необратимости ... 32
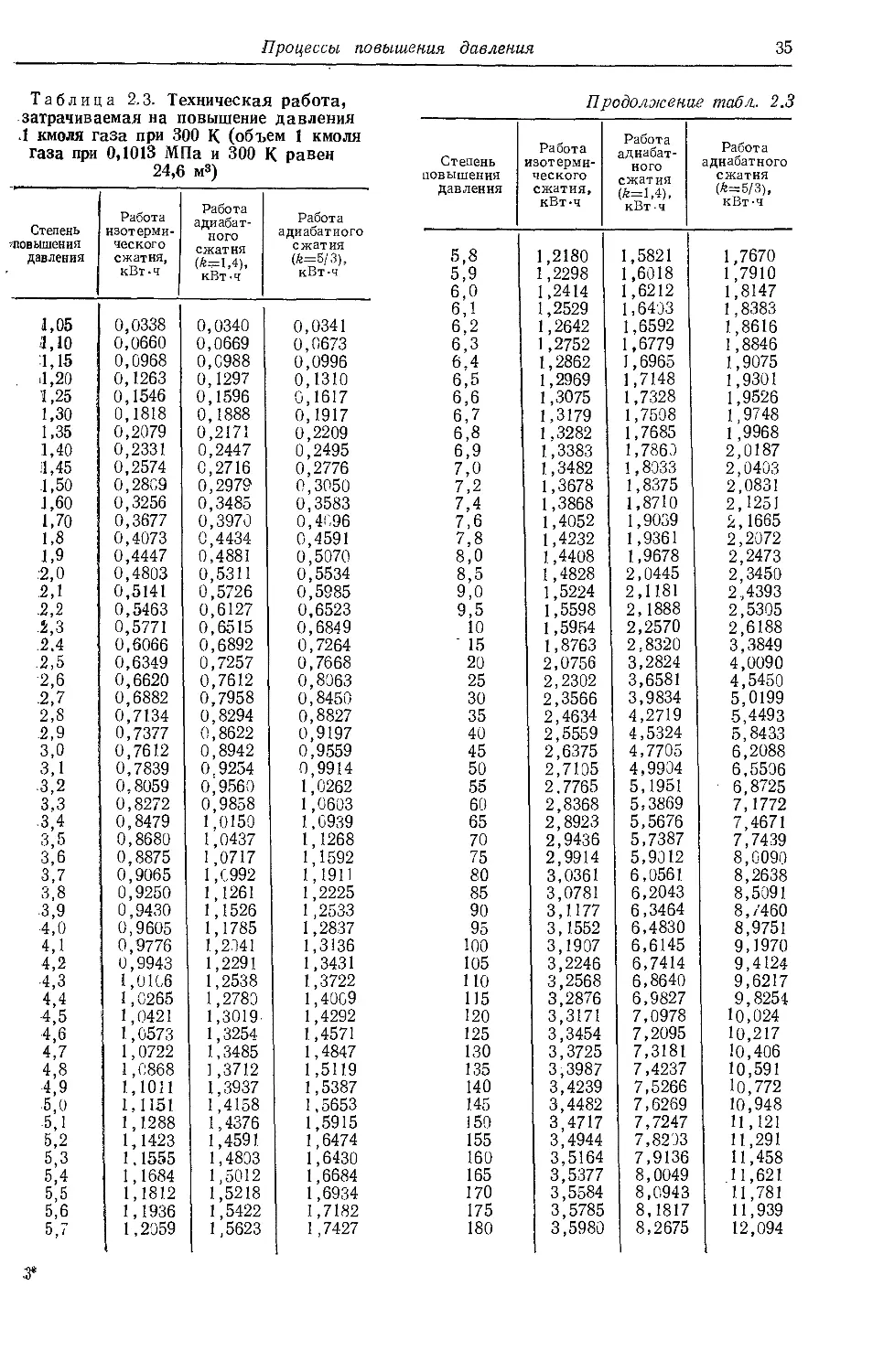
2.10. Процессы повышения дав-
ления ..........................33
2.11. Реальные газы и конден-
сированное состояние . . 37
2.12. Эффект Джоуля — Томсона 42
2.13. Изоэнтропное расширение
газа (s=const) .... 45
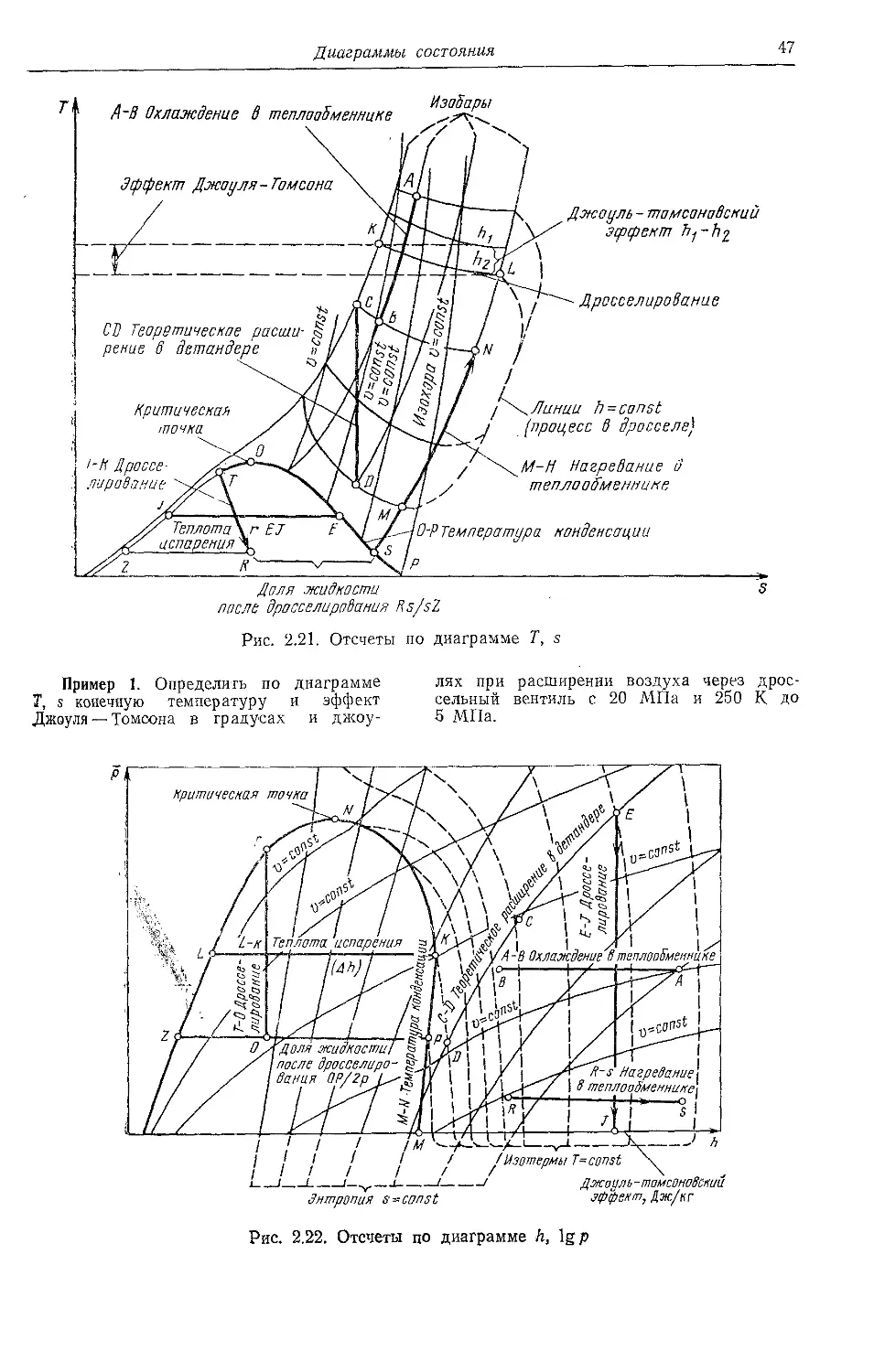
2.14. Диаграммы состояния . . 46
2.15. Основные соотношения тер-
модинамики смесей, раство-
ров и адсорбции ... 48
(Раздел третий. Низкотемпера-
турные циклы и процессы . . 54
3.1. Минимальная работа сжи-
жения газов.....................54
3.2. Криогенные процессы . . 55
3.3. Каскадный цикл ... 55
3.4. Циклы, основанные на ис-
пользовании эффекта Джоу-
ля— Томсона при дроссели-
ровании ........................56
3.5. Циклы, основанные на ис-
пользовании расширения с
отдачей внешней работы и
эффекта Джоуля—’Томсона 59
3.6. Специальные методы охлаж-
дения . . .... 69
3.7. Методы получения темпера-
тур ниже 0,3 К • 73
.3.8. Распределение холодильной
мощности в криогенных
установках..................80
3.9. Работа криогенных устано-
вок в пусковой период . . 80
3.10. Термодинамический анализ
потерь в криогенных уста-
новках ....................81
Раздел четвертый. Физические
свойства веществ при низких
температурах ...................... 83
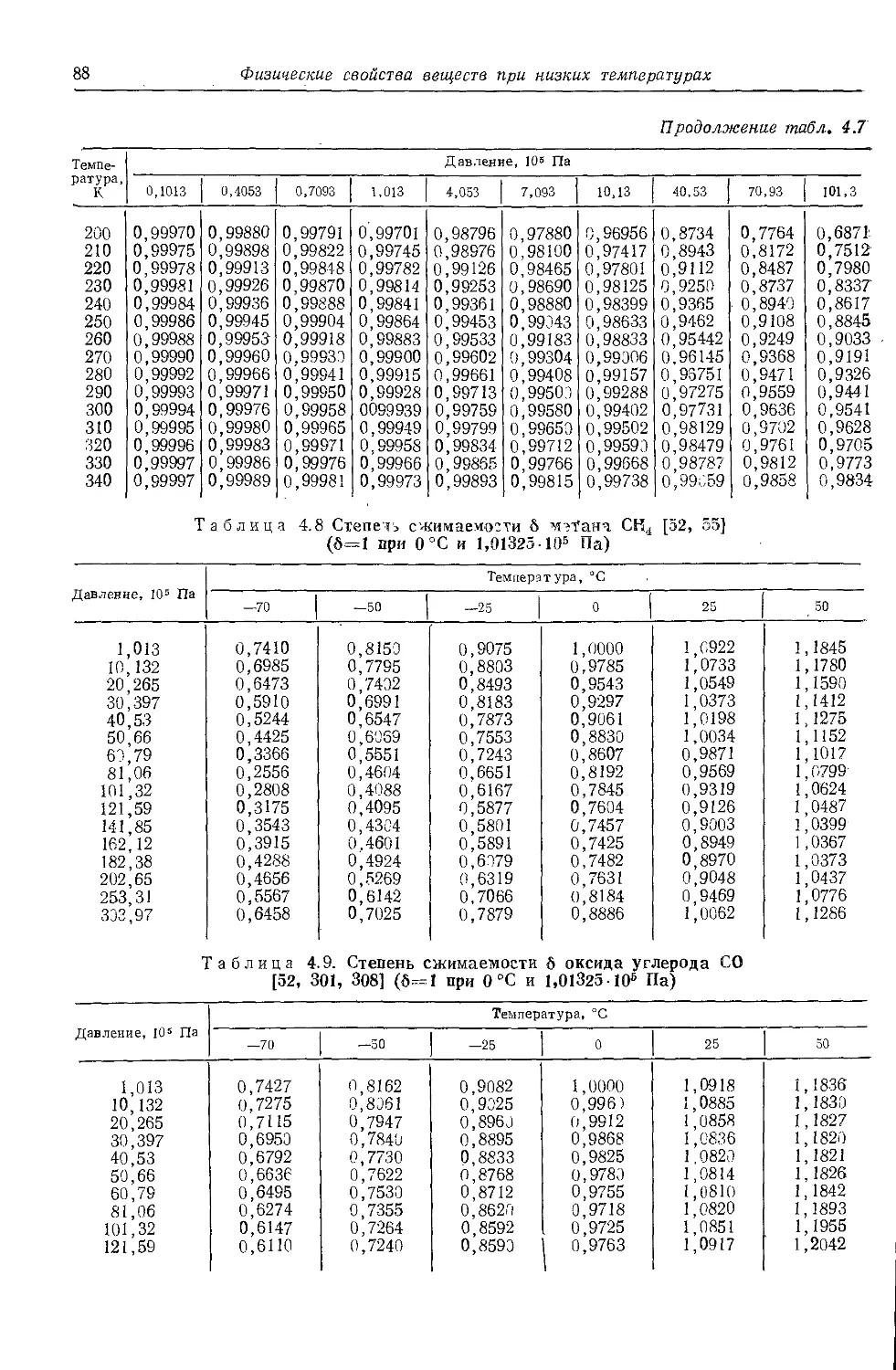
4.1. Сжимаемость . ... 83
442. Плотность............83 '
4.3. Тепловое расширение твер-
дых и жидких тел ... 98
4.4. Давление .насыщенных паров 99
4.5. Вязкость......................102
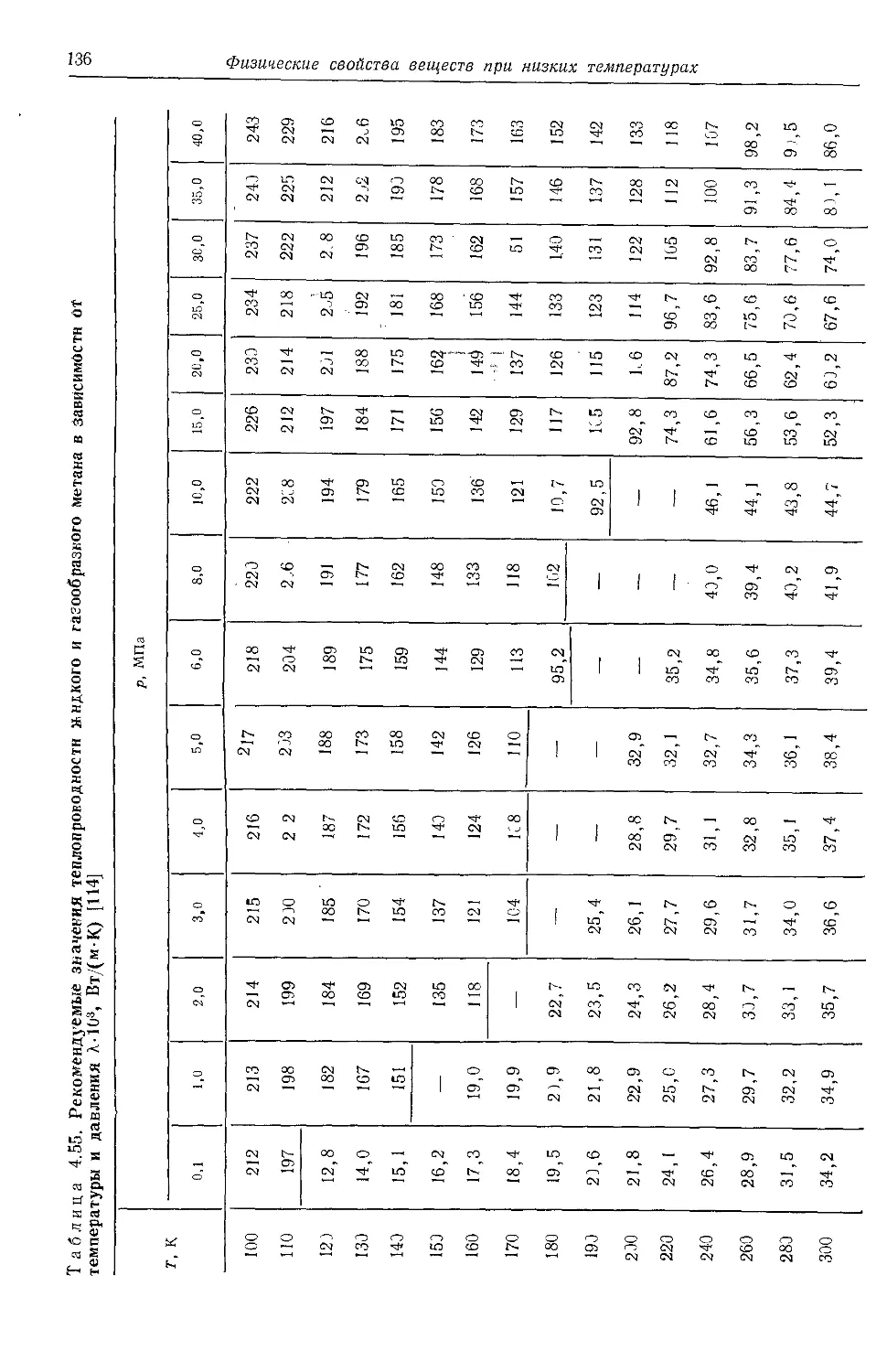
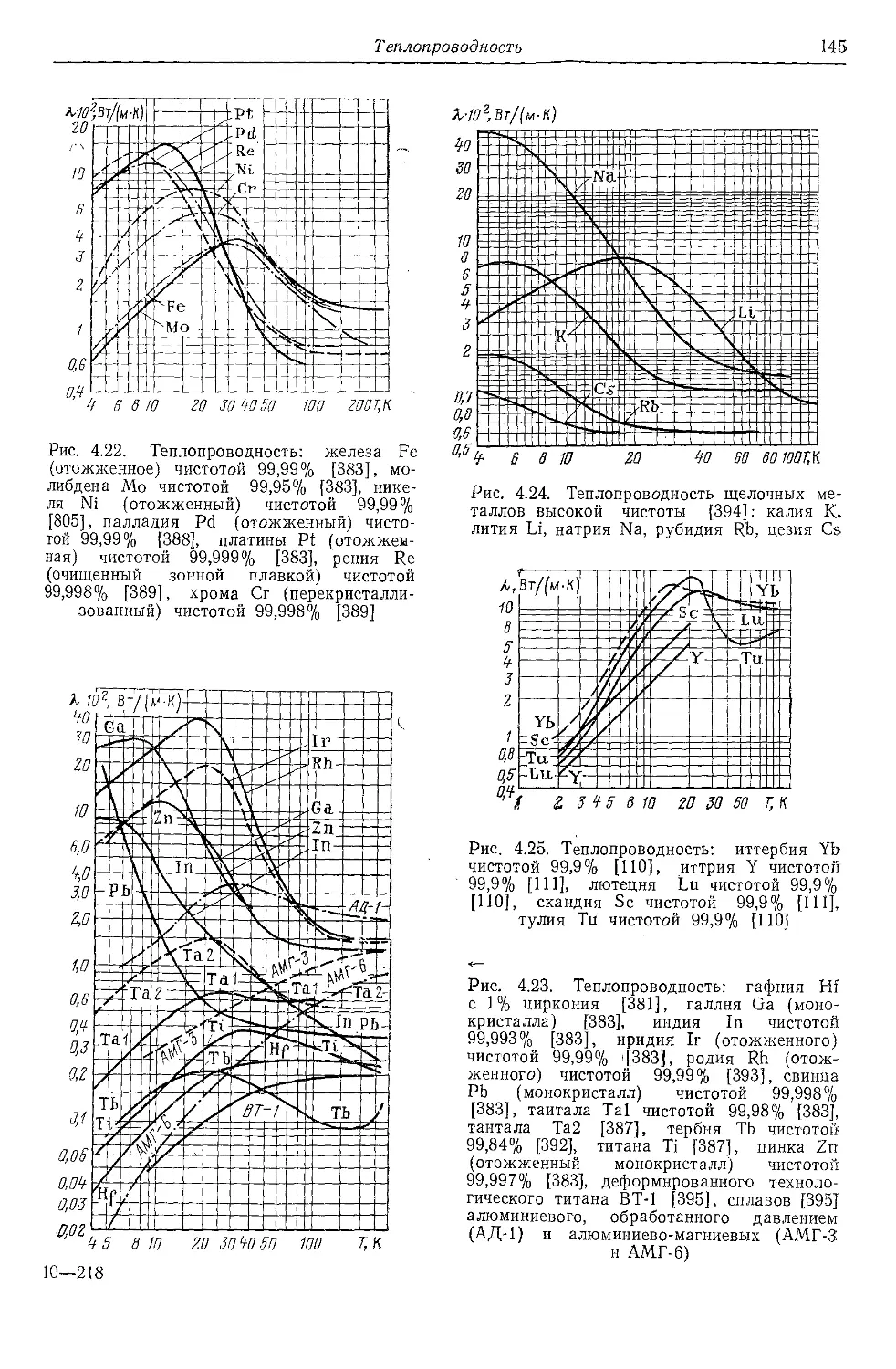
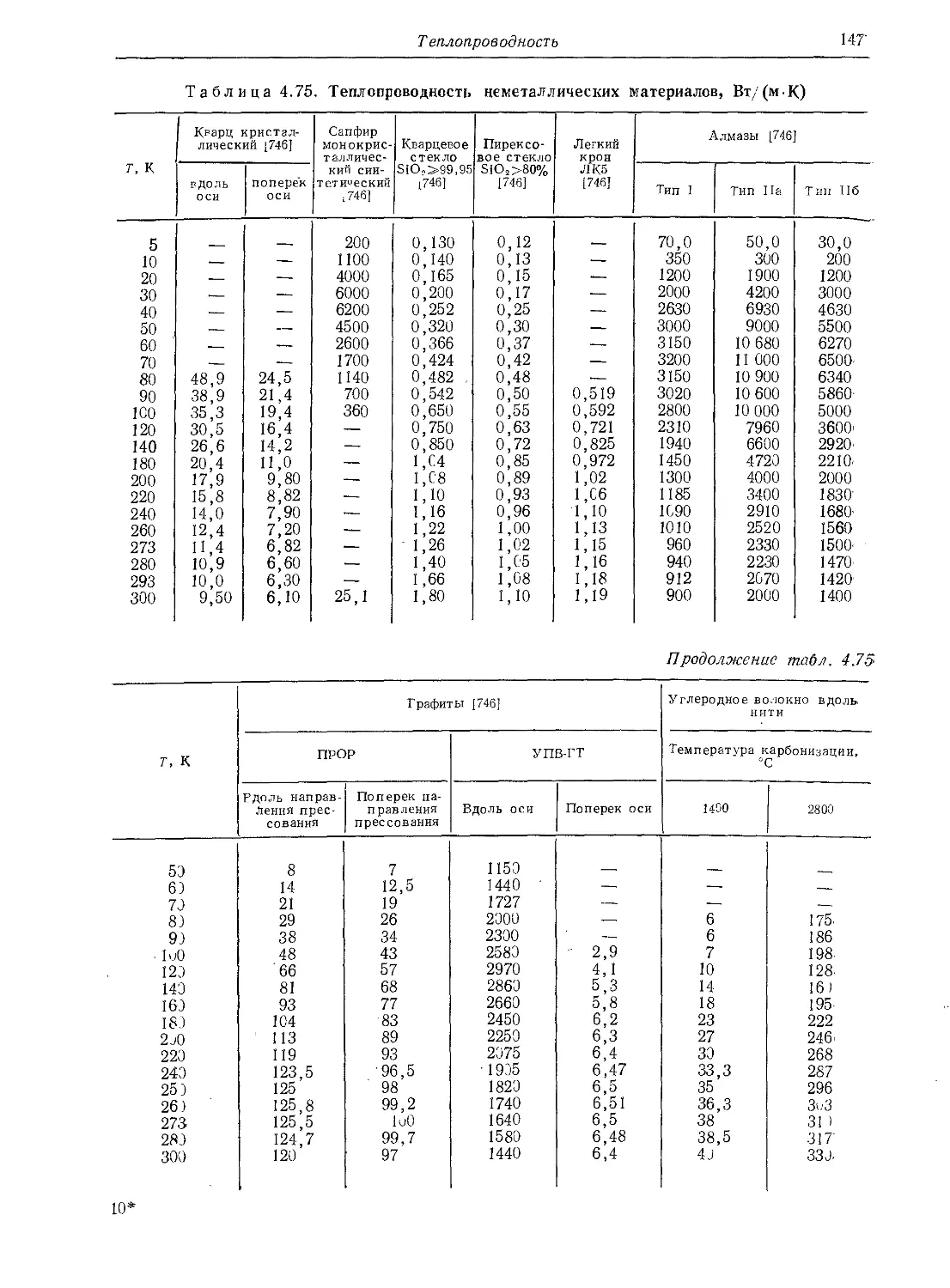
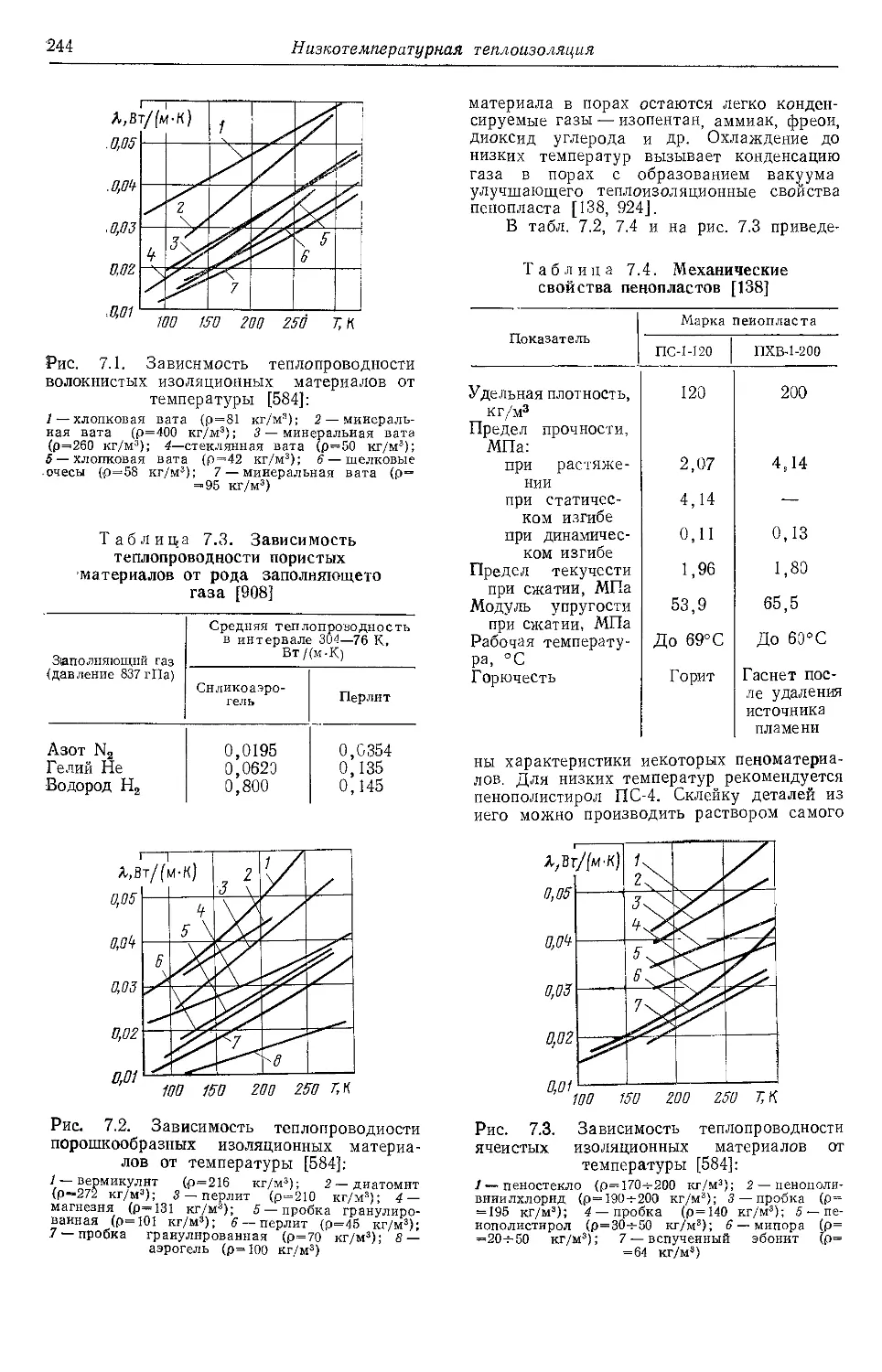
4.6. Теплопроводность . . . 125
4.7. Электрические свойства . . 150
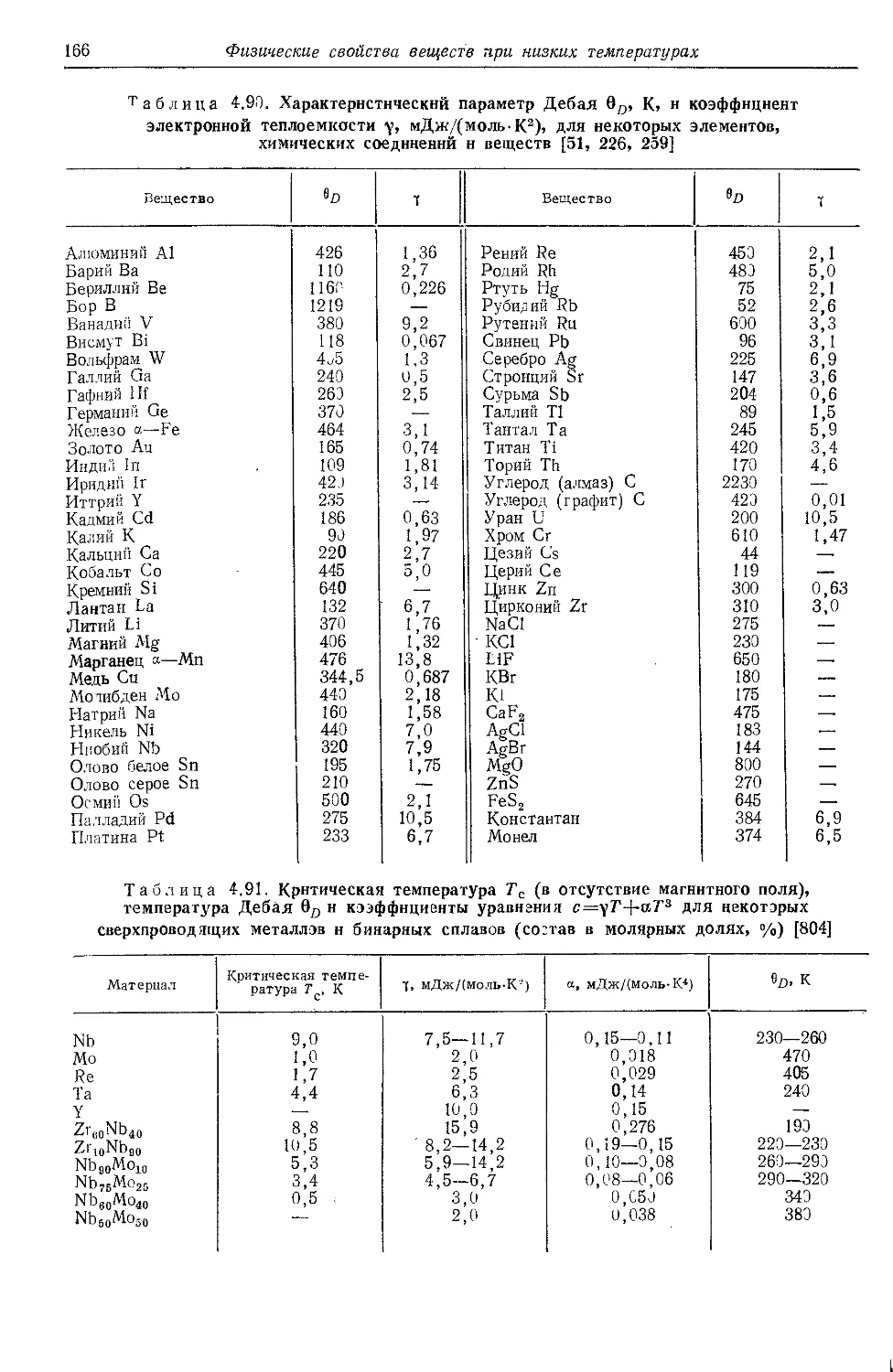
.4.8. Теплоемкость . . ' . . 162 ’
4.9. Теплоты испарения, плавле-
ния и сублимации . . . 173
4.10. Поверхностное натяжение 173
4.11. Показатель преломления 177
4.12. Скорость звука .... 178
4.13. Коэффициенты теплового
излучения и лучепоглоще-
ния . . ..... 180
4.14. Сверхпроводимость . . 182
4.1_ 5. Жидкий гелий и сверхтеку-
честь ...................187
4.16. Изотопы газообразных эле-
। ментов........................191
4.17. ' Разные данные .... 191
Раздел пятый. Эксперименталь-
ные данные по фазовому равно-
весию ..........................198
5.1. Равновесие жидкость — пар
для бинарных смесей . . 198
5.2. Коэффициенты разделения
изотопных соединений . . 211
5.3. Растворимость газов в воде
(абсорбция).....................212
5.4. Равновесие кристалл — пар
для бинарных смесей . . 213
5.5. Равновесие кристалл — жид-
кость в бинарных смесях 216
5.6. Гидраты углеводородов . . 219
5.7. Равновесие жидкость — пар
для тройных смесей . . . 219
5.8. Равновесие многокомпонент-
ных смесей ..... 222
5.9. Изотермы адсорбции газов 223
Раздел шестой. Механические
свойства конструкционных мате-
риалов при низких температу-
рах ...............................230
6.1. Общие положения . . . 230
6.2. Изменение механических
свойств углеродистых и
низколегированных сталей
при понижении температуры 231
6.3. Изменение механических
свойств высоколегированных
4
Содержание
сталей аустенитного класса
при понижении температуры 23.3
6.4. Изменение механических
свойств цветных металлов
и сплавов при низких тем-
пературах ..................236
6.5. Влияние низких температур
на механические свойства
сварных и паяных соедине-
ний ...........................237
6.6. Механические свойства не-
металлических материалов 240
Раздел седьмой. Низкотемпе-
ратурная теплоизоляция . . . 241
7.1. Газонаполненная теплоизо-
ляция, находящаяся под ат-
мосферным давлением . . 241
7.2. Высоковакуумная теплоизо-
ляция .........................246
7.3. Вакуумно-порошковая изо-
ляция .........................247
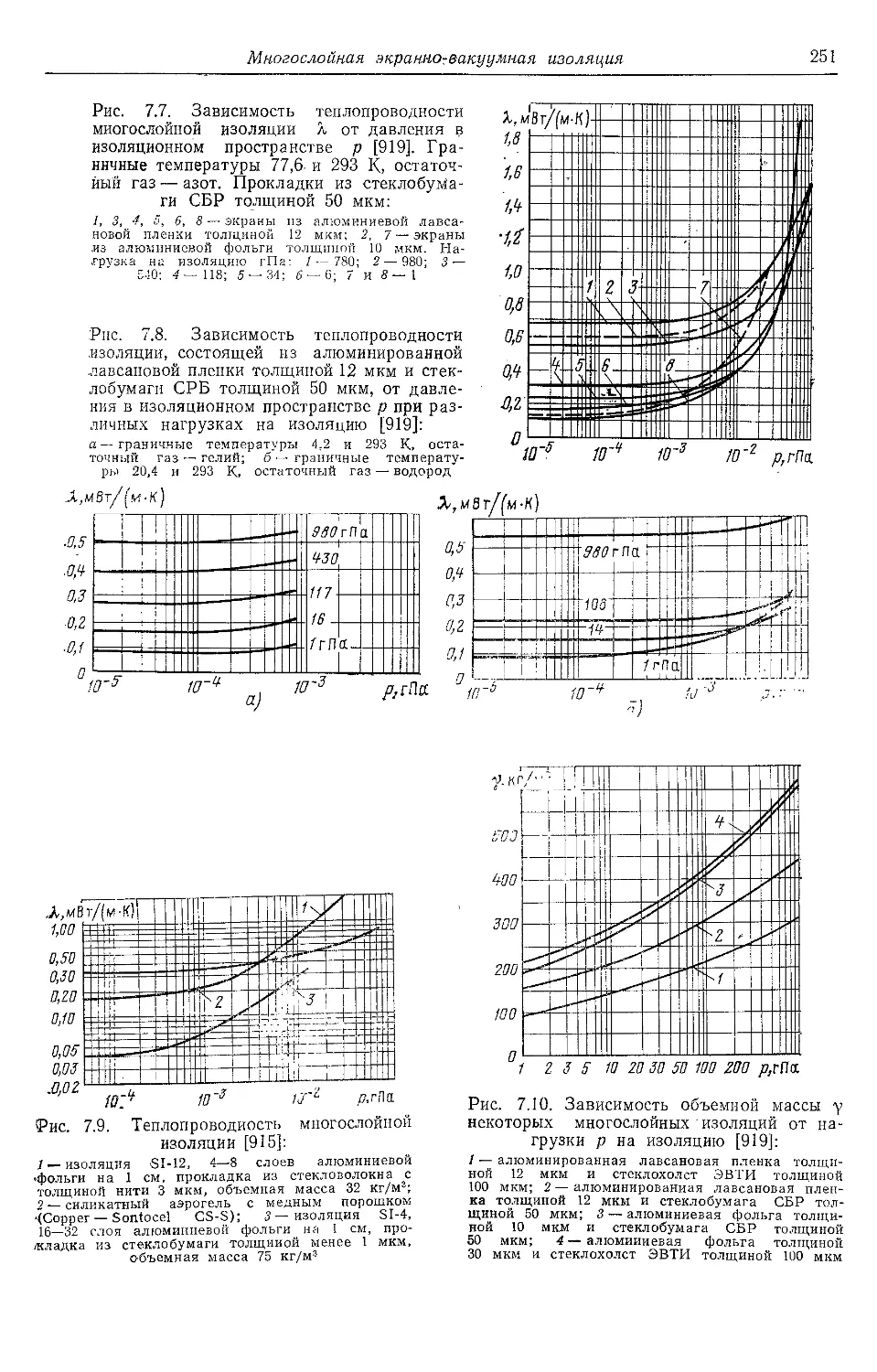
7.4. Многослойная экранно-ва-
куумная изоляция . . . 248
7.5. Тепловые мосты и опоры 253
Раздел восьмой. Основные
уравнения гидравлики и тепло-
передачи
А. Гидравлика....................254
8.1. Критерии гидравлического
подобия.........................254
8.2. Общие определения условий
течения жидкости . . . 254
8.3. Потери давления на трение
в трубах........................255
8.4. Местные сопротивления . . 257
8.5. Сопротивление поперечно
обтекаемых пучков из глад-
ких труб , .... 257
8.6. Сопротивление поперечно
обтекаемых пучков из ореб-
ренных труб....................258
8.7. Сопротивление ребристых
труб при продольном обте-
кании ..........................259
8.8. Сопротивление неорошаемых
скрубберных насадок . . 260
8.9. Сопротивление орошаемых
скрубберных насадок . . 260
Б. Теплопередача .... 261
8.10. Критерии теплового подо-
бия .............................261
Б. Теплопередача . ... 261
8.12. Теплоотдача при продоль-
ном обтекании пучка глад-
ких труб.....................262
8.13. Теплоотдача ребристых
труб при продольном обте-
кании . . .... 262
8.14. Теплоотдача при попереч-
ном обтекании пучков глад-
ких труб .... 262
8.15. Теплоотдача при попереч-
ном обтекании пучков реб-
ристых труб . . . 263
8.16. Теплоотдача при естествен-
ной конвекции .... 263
8.17. Теплоотдача при кипении
жидкости................. 264'-
8.18. Теплоотдача при конденса-
ции .................... 265-
8.19. Основы расчета теплооб-
менников ....................266
8.20. Конструктивные схемы теп-
обменников .................. 266-
Раздел девятый. Методы рас-
чета процессов дистилляции и
ректификации.................270
9.1. Дистилляция............. 270-
9.2. Ректификация . ... 270
9.3. Графические методы опре-
деления числа идеальных та-
релок ......................27Г
9.4. Алгебраические методы
определения числа идеаль-
ных тарелок................. 276;
9.5. Метод расчета на основе
числа единиц переноса . . 278
9.6. Коэффициент эффективно-
сти тарелки................., 279
9.7. Гидродинамические условия
работы колонны .... 281
9.8. Степень обратимости про-
цесса ректификации . . . 282'
Раздел десятый. Элементы
низкотемпературной термометрии 283
10.1. Температурные шкалы и
области их применения 283
10.2. Газовые термометры . . 285-
10.3. Конденсационные термо-
метры ....................... 286-
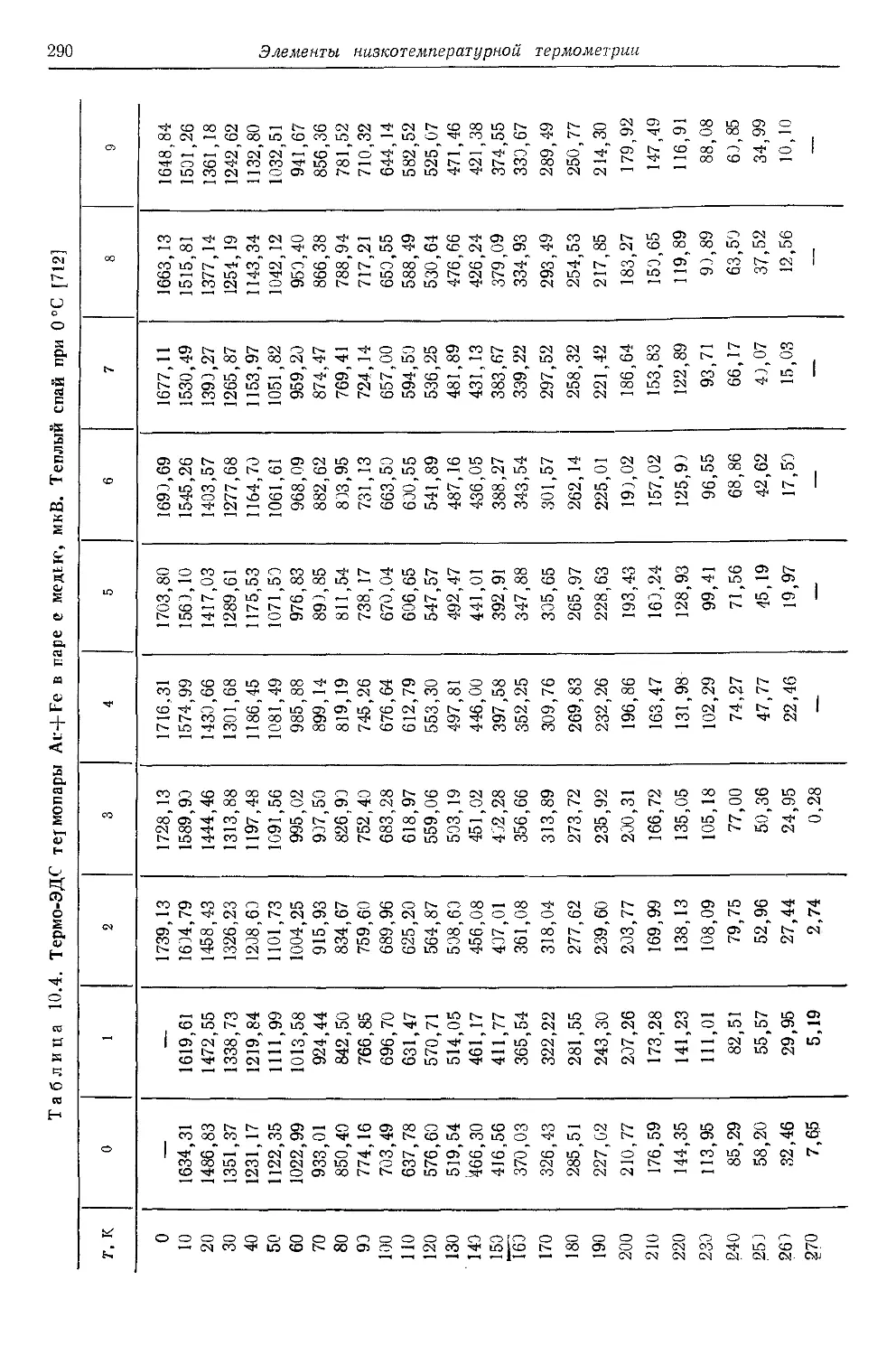
10.4. Термопарные термометры 287
10.5. Термометры сопротивления 292'
10.6. Магнитные термометры 296
10.7. Вторичные приборы . . 296:
Раздел одиннадцатый. Ме-
тоды очистки газов .... 296
11.1. Общие положения . . . 296
11.2. Осушка газов .... 297
11.3. Очистка воздуха и газовых
смесей от диоксида угле-
рода ........................300
11.4. Очистка водорода и гелия
от азота и оксида углерода 304-
11.5. Очистка газовых смесей от
кислорода и ацетилена . . 306
11.6. Очистка жидких криоаген-
тов от твердых примесей 306
Раздел двенадцатый. Сжи-
жение газов....................307
12.1. Сжижение метана . . . 307
12.2. Сжижение воздуха . . . 307
12.3. Сжижение водорода . . 308
12.4. Сжижение неона . . . 313
12.5. Сжижение гелия . . . 314
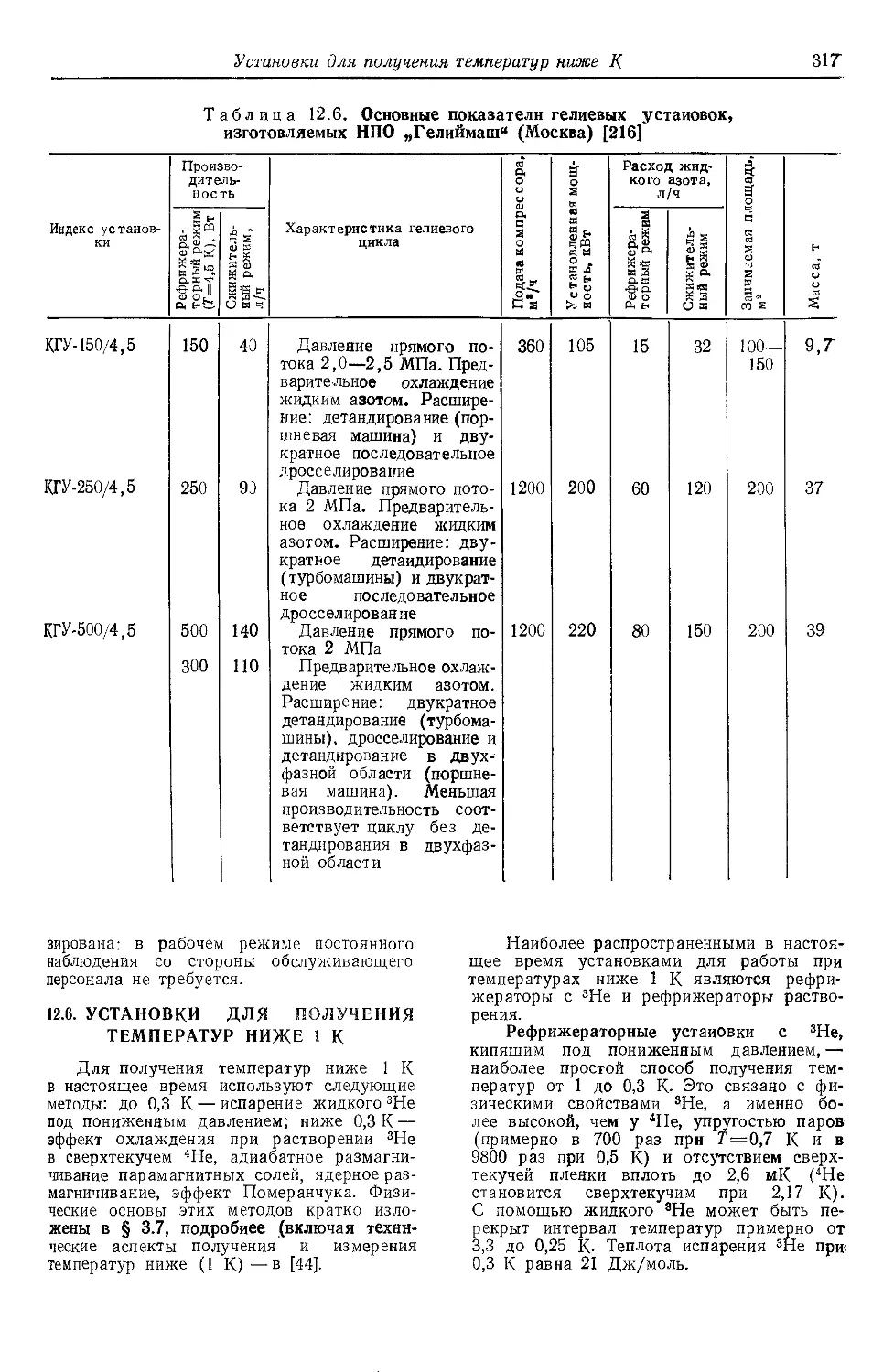
12.6. Установки для получения
температур ниже ГК- • 317
12.7. Микрокриогенные установки 31&’
Раздел тринадцатый. Разде-
ление воздуха . . 322
13.1. Состав воздуха .... 324
Содержание
5
13.2. Одноколонный и двухко-
лонный разделительные ап-
параты ........................324
13.3. Промышленные воздухо-
разделительные установки 327
13.4. Получение инертных газов
из воздуха.....................334
13.5. Вопросы безопасности воз-
духоразделительных уста-
новок .........................336
Раздел четырнадцатый. Раз-
деление углеводородных газовых
смесей и изотопов .... 338
14.1. Извлечение гелия из при-
родных газов .... 338
14.2. Разделение коксового и во-
дяного газов .... 340
14.3. Разделение газов крекин-
га и пиролиза нефтяных
продуктов......................342
14.4. Низкотемпературное разде-
ление стабильных газооб-
разных изотопов . . . 344
Раздел пятнадцатый. Хране-
ние и транспорт сжатых газов и
сжиженных криопродуктов . . 346
15.1. Технические требования на
газы и крнопродукты . . 346
15.2. Баллоны..................349
15.3. Газгольдеры .... 349
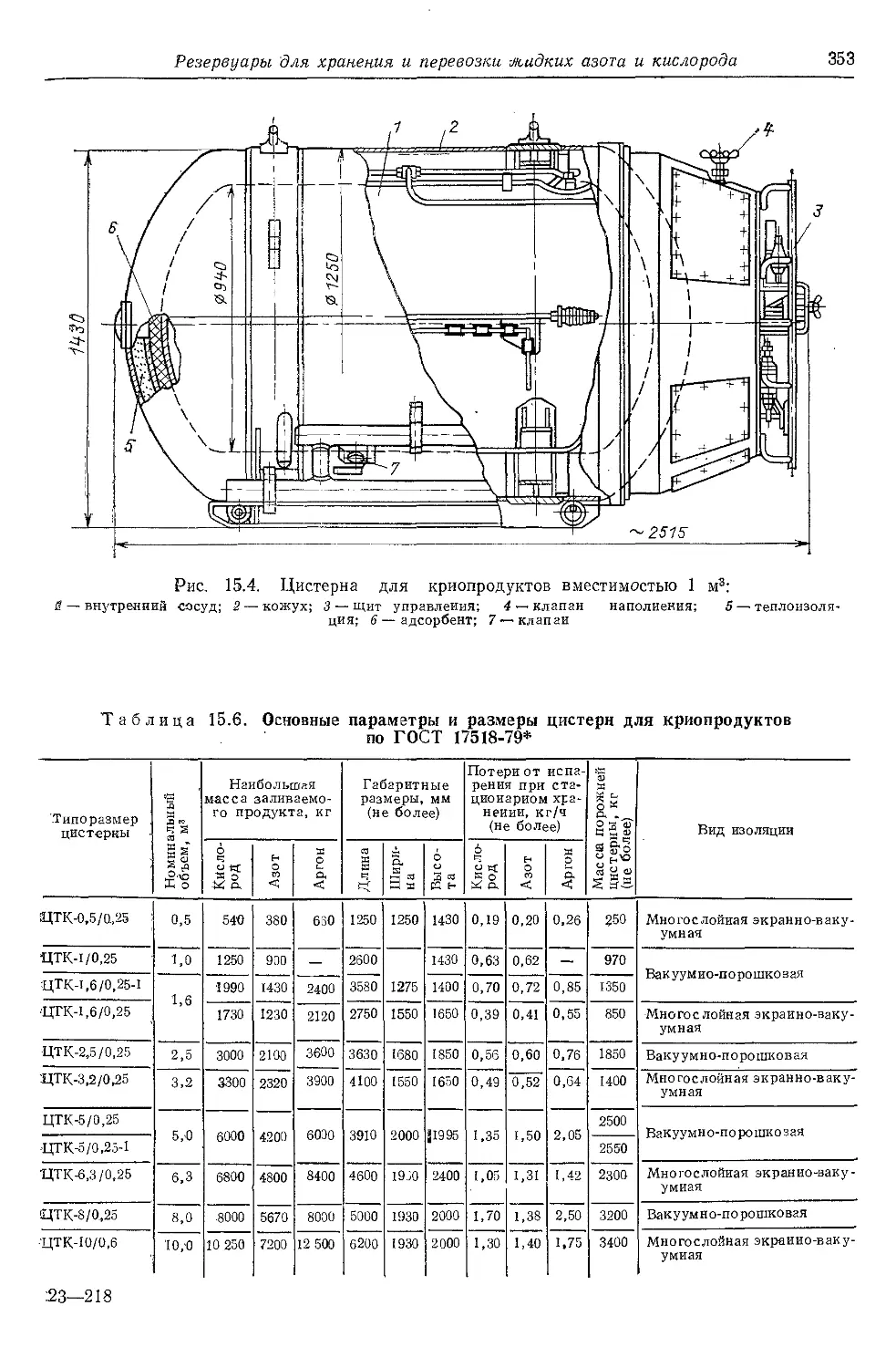
15.4. Резервуары для хранения
и перевозки жидких азота и
кислорода......................351
15.5. Сосуды и цистерны для
хранения и перевозки жид-
ких водорода и гелия . . 354
15.6. Хранение жидких водорода
и гелия на борту космиче-
ских кораблей .... 358
15.7. Хранение и перевозка сжи-
женных природного газа
(СПГ) и фтора .... 359
15.8. Трубопроводы для жидких
криопродуктов .... 360
15.9. Насосы для жидких крио-
продуктов .....................362
15.10. Газификаторы .... 363
Раздел шестнадцатый. Крио-
системы для физических иссле-
дований .........................365
16.1. Криостаты для физических
исследований .... 365
16.2. Низкотемпературные пу-
зырьковые камеры . . . 374
16.3. Водородные мишени . . 379
16.4. «Петли» для исследований
в ядерных реакторах при
криотемпературах . . . 381
16.5. Криометоды получения глу-
бокого вакуума . . . 383
Раздел семнадцатый. Сверх-
проводящие устройства . . . 387
17.1. Сверхпроводящие материа-
лы ..........................387
17.2. Сверхпроводящие магнит-'
ные системы .... 390
17.3. Сверхпроводящие электри-
ческие машины .... 400
17.4. Сверхпроводящие линии
электропередачи . . .401
17.5. Транспорт на магнитной
подушке . . . . ' . . 402
17.6. Сверхпроводящие устройст-
ва для научных исследова-.
ний ........................403
Список литературы................406
Предметный указатель .... 426
Вкладки:
I. Диаграмма Т, s для гелия (3—
25 К)
II. Диаграмма Т, s для гелия (15—
300 К) [547]
III. Диаграмма Т, s для водорода
(15—150 К)
IV. Диаграмма Т, s для водорода
(140—300 К) [261]
V. Диаграмма Т, s для азота (60—
400 К) [255]
VI. Диаграмма Т, s для воздуха
(80—450 К) [255]
6
Предисловие
ПРЕДИСЛОВИЕ
Авторы справочника ставили своей целью сосредоточить в одном месте основные
физико-технические константы, термодинамические и теплотехнические соотношения,
необходимые при работе в области криотемператур. В справочнике содержатся крат-
кие описания оазличных криогенных устройств и анализ основных процессов, осу-
ществляемых в них. Издание рассчитано на научных работников, инженеров и сту-
дентов старших курсов высших учебных заведений соответствующих специальностей.
После 13-го Конгресса Международного Института Холода (1971 г.) и в соответ-
ствии с ГОСТ 21957-76 принято температуры, лежащие ниже 120 К, называть крио-
температурами, устройства для их получения и поддержания—криогенными, а область
науки, охватывающую исследования, развитие и применение криогенной техники, —
криогеникой.
За годы, прошедшие после выхода второго издания справочника (1973 г.), область
использования криотемператур продолжала расширяться. Появились новые данные
по физическим свойствам веществ в области криотемператур, новые устройства для
получения и поддержания температур от 70 до 4 К и ниже как большой холодиль-
ной мощности, так и малой. Продолжала развиваться микрокриогенная техника.
Практическое использование получили сверхпроводящие устройства. В связи с этим
в третьем издании авторы уделили внимание -новым разделам, в частности включили
главу по техническому применению сверхпроводимости.
Все данные справочника приведены в единицах СИ.
Во избежание увеличения объема книги так же, как во втором издании, несколь-
ко сокращены главы, относящиеся к традиционным областям низких температур: по-
лучению жидкого азота, кислорода, метана, разделению воздуха и природного газа;
при этом учитывалось, что по этим вопросам имеется достаточное количество отечест-
венной литературы, на которую даны ссылки.
При подготовке к третьему изданию были использованы отечественные и зару-
бежные работы, появившиеся в печати вплоть до 1982 г. При пересмотре текста спра-
вочника авторы использовали свой многолетний опыт работы в области криогеники.
В связи с чрезвычайно возросшим числом публикаций по криогенике в списке литера-
туры приведены только цитируемые источники.
В третьем издании справочника написание материала распределяется следующим
образом: М. П. Малков — разд. 1—5, 9, 12—14; А. Г. Зельдович — разд. 4, 7, 16, 17;
И. Б. Данилов—разд. 4, 8, 10, 12, 16; А. Б. Фрадков — разд. 4, 6, 11, 15, 16.
Замечания и предложения по улучшению содержания или структуры справочника
будут с благодарностью приняты редакцией и коллективом авторов. Направлять их
следует по адресу: 113114, Москва, М-114, Шлюзовая наб., 10, Энергоатомиздат.
Авторы
Единицы физических величин и важнейшие физические константы
7
Раздел первый
ЕДИНИЦЫ ФИЗИЧЕСКИХ ВЕЛИЧИН
И ВАЖНЕЙШИЕ ФИЗИЧЕСКИЕ КОНСТАНТЫ
В настоящее время в большинстве
стран применяется международная система
единиц, обозначаемая символом SI (в рус-
ском написании СИ); ее основные единицы:
метр, килограмм, секунда, ампер, кельвин,
моль, кандела. Международная система
единиц с 1 января 1980 г. применяется
в СССР (ГОСТ 8.417-81) и в странах СЭВ
(СТ СЭВ 1052-78) как обязательная [1—3].
Определение основных единиц:
Метр (м) — единица длины, равная
1 650 763, 73 длины волны в вакууме излу-
чения, соответствующего переходу между
уровнями 2pi0 и 5ds атома криптона-86.
Килограмм (кг) — единица массы; пред-
ставлен массой международного прототипа
килограмма.
Секунда (с) равна 9 192 631 77.0 перио-
дам излучения, соответствующего переходу
между двумя сверхтонкими уровнями
основного состояния цезия-133.
Ампер (А) — сила неизменяющегося то-
ка, который при прохождении по двум па-
раллельным прямолинейным проводникам
бесконечной длины и ничтожно малой пло-
щади кругового поперечного сечения, рас-
положенным в вакууме на расстоянии 1 м
один от другого, вызывает на каждом
участке проводника длиной 1 м силу взаи-
модействия, равную 2-Ю-7 Н.
Кельвин (К) равен 1/273,16 части тер-
модинамической температуры тройной точ-
ки воды.
Моль (моль) — количество вещества
системы, содержащей столько же структур-
ных элементов, сколько содержится атомов
в углероде-12 массой 0,012 кг. При приме-
нении моля структурные элементы должны
быть сфецифицированы и могут быть ато-
мами, молекулами, ионами, электронами и
другими частицами или специфицированны-
ми группами частиц.
Кандела (кд) равна силе света,
испускаемого с поверхности площадью
1/600 000 м2 полного излучателя в перпен-
дикулярном направлении при температуре
излучателя, равной температуре затверде-
вания платины при давлении 101 325 Па.
Кроме температуры (7) Кельвина до-
пускается применение температуры (1)
Цельсия, определяемой выражением t—
= 7—273,15*. По размеру градус Цельсия
Таблица 1.1 Образование кратных
и дольных единиц
Множитель Приставка Сокращенное обо- значение
русское латинское
К?» экса э Е
11J15 пета П Р
1С12 тера т Т
1G9 гига г G
1G6 мега м М
103 каю к К
162 . гекто г h
10 дека да da
16-1 деци Д d
10-2 санти С С
10-3 милли м tn
10-6 микро мк V*
16-9 нано н n
10—12 ПИКО п p
10-15 фемто ф f
10-18 атто а a
* Шкала в градусах Цельсия имеет начало
отсчета в точке таяния льда, т. е, в точке при-
мерно на 0,01 К ниже тройной точки воды.
Единицы физических величин и важнейшие физические константы
равен кельвину. Если необходимо отличать
обозначение Международной практической
температуры в шкале 1968 г. от термоди-
намической, добавляют индекс 68 (напри-
мер, T5g нлн t5S).
Производные единицы СИ образуются
из основных с помощью определяющих эти
единицы уравнений. Допускается также
применение наравне с единицами СИ таких
единиц, как тонна, минута, час, сутки; для
измерения углов — градус, минута, секун-
да; объема — литр. Допускаемые единицы
в специальных областях см. в [1—3].
Наряду с единицами СИ временно
(срок изъятия будет установлен междуна-
родными решениями) разрешается примене-
ние единиц: морская миля, узел, карат,
оборот в секунду, оборот в минуту, бар,
текс и непер.
Десятичные кратные и дольные едини-
цы СИ образуют с помощью множителей
и приставок, приведенных в табл. 1.1.
До введения единиц СИ в науке и тех-
нике широко использовались единицы си-
стем МКС (м, кг, с), МКСК (м, кг, с, К),
МКГСС (м, кг, с), СГС (см, г, с) и вне-
системные. В табл. 1.2—1.8 приведены
основные и производные единицы СИ и их
соотношения с ранее применявшимися еди-
ницами. В табл. 1.12 [3] дан перевод еди-
ниц, применяемых в Великобритании и
США, в единицы СИ, а в табл. 1.13 —
взаимный перевод градусов Цельсия и Фа-
ренгейта.
Ниже приведены значения важнейших
физических констант [4] в единицах СИ и
по физической углеродной шкале атомных
масс (12С=12):
Скорость света в ва-
кууме с .......... 2,997925-1С8 м/с
Число Авогадро NA 6,022045-1026 кмоль 1
Число Лошмндта
NA/v0............. 2,68719-1G35 м~3
Число молекул в 1 см3
п................. 7,2438-It13 р/Т*
Атомная единица мас-
сы (а. е. м.) . . .
Масса покоя электро-
на тпе.............
Атомная масса элек-
трона Ме . ... .
Масса покоя протона
тр.................
Атомная масса прото-
на Мр..............
Масса покоя нейтрона
тп.................
Атомная масса нейтро-
на Мп............
Постоянная Планка h
Универсальная газо-
вая постоянная /?0
Постоянная Больцма-
на k=R0/NA . . .
1,380622-10-23 Дж\
хк-1
Постоянная Стефа-
на—Больцмана s 5,67032-10~§ ВтХ
Хм-2-К-4
Стандартный объем
идеального газа (о0)
при 0°С и
101 325 Н/м2 . . .
Энергия, соответст-
вующая массе:
1г.............
электрона ....
протона . . . .
нейтрона . . . .
Атомная единица мас-
сы эквивалента . .
1,66Э565-10-2’ кг
9,109534-10-31 кг
5,48593-10—4 а. е м.
1,672648-10-27 кг
1,00727661 а. е. м.
1,67495 -10~27 кг
1,0086652 а. е. м.
1,054588-10-^ Дж-с
8,31441-103ДжХ
Хмоль- *-К-1
22,4136 м3-кмоль~1
5,609538-1026 МэВ
511 004 эВ
938,2592
939,5527
МэВ
МэВ
931,2812
МэВ
Атомная масса по химической
кислородной шкале (0 = 16 для
пгиродного кислорода) = }
Масса по физической углерод- ’
ной шкале (12С = 12)
Атомная масса по физичес-
кой кислородной шкале
(160 — 16)
7а = 1,000317917
Атомная масса по физичес-
кой углеродной шкале
(12С = 12)
♦Давление—в гПа; температура—в К.
9
Единицы физических величин и важнейшие физические константы
Таблица 1.2. Единицы физических величин
Наименование Сокращенное обозначение
величины н определяющее уравнение Система единиц Наименование русское международ- ное Соотношение между единицами
Длина 1 СИ и мкгсс сгс Внесистем- ная Метр Сантиметр Микрон Ангстрем м см мк А m cm Н о А I м=Ю00 мм = Ю0 см=Ю д» I км=Ю00 м I мкм=Ю-‘ см=Ю-в м О 1A=IO‘7 mm=i0'8 см= = 1O’10 м=0,1 им
Масса пг си сгс мкгсс Внесис- темная Килограмм Грамм Килограмм-сила-се- кунда в квадрате иа метр Тонна Центнер Карат кг кгс-с2/м ц kg g kgf-s2/m t q I Kr=l000 г; I ц=100 КГ; I t=1000 кг I кгс-с2/м=9,80665 кг I карат=2-Ю’4 кг
Время t СИ, СГС и МКГСС Внесистем- ная То же Секунда Час Минута ч мин s h min 1 ч=3600 c=60 мни 1 мни=60 с
Термодинами- ческая темпера- тура Т си Кельвин К к См. табл. 1.8
Температура t си Градус Цельсия °C °C См. табл. 1.8
Частота коле- баний v=l/Z си, сгс и мкгсс Герц Гц Hz Герц-частота, при которой за одну секунду соверша- ется одно полное коле- бание
Скорость ли- нейная v~l/1 СИ и мкгсс сгс Внеси- стемная То же Метр в секунду Сантиметр в секунду Километр в час Метр в минуту м/с см/с км/ч м/мии m/s cm/s km/h m/min 1 см/с=0,01 м/с 1 км/ч=0Д778 м/с 1 м/мнн=0,01667 м/с
Ускорение линейное а=Дц/Д/ Скорость угло- вая ш=Да/Д/ си И мкгсс сгс СИ н сгс Метр на секунду в квадрате Сантиметр иа секунду в квадрате Радиан в секунду м/с2 см/с2 рад/с m/s! cm/s2 rad/s t об/мин=-^-рад/с
Внесис- темная То же Оборот в секунду Оборот в минуту об/с об/мин I об/с—2тс рад/с
Площадь 5=/2 СИ И МКГСС сгс Внесистем- ная Г ектар Ар м2 см2 га а m2 cm2 ha a 1 га=104 м2=100 а I а=Ю0 м2 I м2=104 см®=10® мм? 1 км2 = 100 га=Ю® м2
Объем и=/3 СИ и МКГСС СГС Внесистем- ная Литр м® см® л m® cm3 I I м®=108 л=106 см3 1 л=Ю"3 м3—(0® см®=1 дм3
Сила F=ma (P=mgt СИ СГС МГКСС Внесистем- ная Ньюток Дина Килограмм-сила Тонна-сила Н дин кгс тс N dyn kgf tf I Н=Ю5 дин=0,1019713 к гс I дии=10-5Н=1,01971бХ Х<0-6 кгс I кгс=1000 грамм=сила= =9,80665 Н=9,80665 • Ю5 дии 1 тс=Ю0О кгс=9805,65 Н
Плотность О=Ш/Ц СИ СГС МКГСС — кг/м® г/см3 кгс-с2/м4 kg/m’ g/cm3 kgt-s2 m4 1 кг/м®=10"® г/см®= = 10’® т/м3=Ю'8 кг/дм3 1 г/см3=ЮОО кг/м3 = 1 кг/дм3
io
Единицы физических величин и важнейшие физические константы
Продолжение табл. 1.2
Наименование величины и определяющее уравнение Система единиц Наименование Сокращенное обозначение Соотношение между единицами
русское международ- ное
Давление p=FIS Абсолютная динамическая вязкость F ^“"Sgradv СИ сгс мкгсс Внеси- стемная То же си” СГС мкгсс Паскаль .(ньютон на метр в квадрате, Дина на квадратный сантиметр Килограмм-сила на квадратный метр бар мм рт.ст. (тор) ММ ВОД. ст. атм Паскаль-секунда Пуаз Сантипуаз Килограмм-сила-се- кунда на квадратный 1метр Метр в квадрате на секунду Стокс Сантистокс Па(Н/м2) 1 дин/см2 кге/м2 Па-с П сП кге-с/м2 Pa(N/m2) dyn/cm2 kgh/m2 Pas P sP kgf-s См. табл. 1.3 1 Па-с=1 кг/(м-с)=10П= =0,101972 кгс-с/м2 1 п=динс/см2=1 г/(см-с)= =0,1 Па-с=0,0Ю1972 кгсХ Хс/м2 1 кгс-с/м2=9,80635 Па-с = =98,066511 (1 сП довольно точно соответствует вяз- кости воды при 20,5 °C)
Кинематичес- кая вязкость ^7]/р СИ сгс м2/с Ст сСт m2 m2/s st sSt 1-м2/с=104 см /с=3600 м!/ч 1 Ст=см /с=10‘‘ м2/с = = 100 сСт=0,36 м2/ч
Энергия, рабо- та, теплота A=F-l СИ сгс мкгсс Внеси- стемная Джоуль (Н-м) Эрг Килограмм-с и ла-м ет р Киловатт-час Калория Лошадиная сила-час Электрон-вольт Дж эрг кге-м кВт -ч кал л. с-ч эВ J erg kgf«m kW-h cal eV См. табл. 1.4
Мощность N—A/t '' ' СИ ГС ^мкгс Внеси- стемная Ватт Эрг в секунду Кнлограмм-сила- метр в секунду Лощадиная сила Вт(Дж/с) эрг/с кгс«м/с л.с. W’ erg/s kgfm/s См. табл. 1.5
Удельная теп- лоемкость, удельная энтропия СИ СГС Внеси- стемная Джоуль на кило- грамм-кельвин Эрг на грамм-кель- $ вин Калория нт грамм- градус Цельсия Килокалория иа килограмм-градус Цельсия Дж/(кг- К) эрг/(г-К) кал/(г-°С) ккал/(кг.®С) J/(kg-K) erg/(g-K) cal/(g-°C) kcal / (kg-'C) I Дж/(кг-К)=Ю'3 Дж/(гХ ХК)=Ю* эрг/(г-К)= =0,2389-10"3 ккал/(кг-°C) 1 ккал/(кг-°С) = = 1 кал/(г.°С)=± =4,1868 Дж/(кг-К)= =4,1858 Дж'(г-К,'= =4,1838-10’ эрг/(г-К) I эрг/(г-К)=10’1 Дж/(кг-К)= = 10-’ Дж/(г-К)=0.2389Х ХЮ"’ ккал/(кг-°С)=0,238ЙХ ХЮ” кал/(г-°С)
Теплоиров од- ность X СИ Внеси- стемная То же Еатт на метр-кель- вин Калория в секунду иа сантиметр-градус Цельсия Килокалория в час на метр-грядус Цельсия Вт/(м-К) кал/(см-с°С) ккал/(ч-м-°С) W/(m-k) cal/(cm-s-oC) kcal/(m-h-°C) См. табл. 1.6
Коэффициент теплопередачи k СИ Внеси- стемная То же Ватт на квадратный метр-кельвии Калория на санти- метр в квадрате- секунду-кельвин Килокалория иа метр в квадрате-час-кель- вин Вт/(м2-К) кал/(см2 • с • К) ккал/(м2«ч-К) W/(m2K) cal/(cm2s-K) kcal/(m2-h-K) См. табл. 1.7
Поверхност- ное натяжеииё ст си сгс мкгсс- Ньютон на метр Дина иа сантиметр Кнлограмм-сила на метр Н/м дин/см. кге/м N/m dyn/cm kgf/m 1 дин/см=10'3 Н/м=Г,О!97Х ХЮ'1 кгс/м=1 эрГ/см 1 Н/м=103 дин/см=1,О197> ХЮ'1 кгс/м=Ю эрг/см 1 кгс/м=9,806 Н/м=9,806) ХЮ3 дин/см=9,803Х | ХЮ3 эрг/см
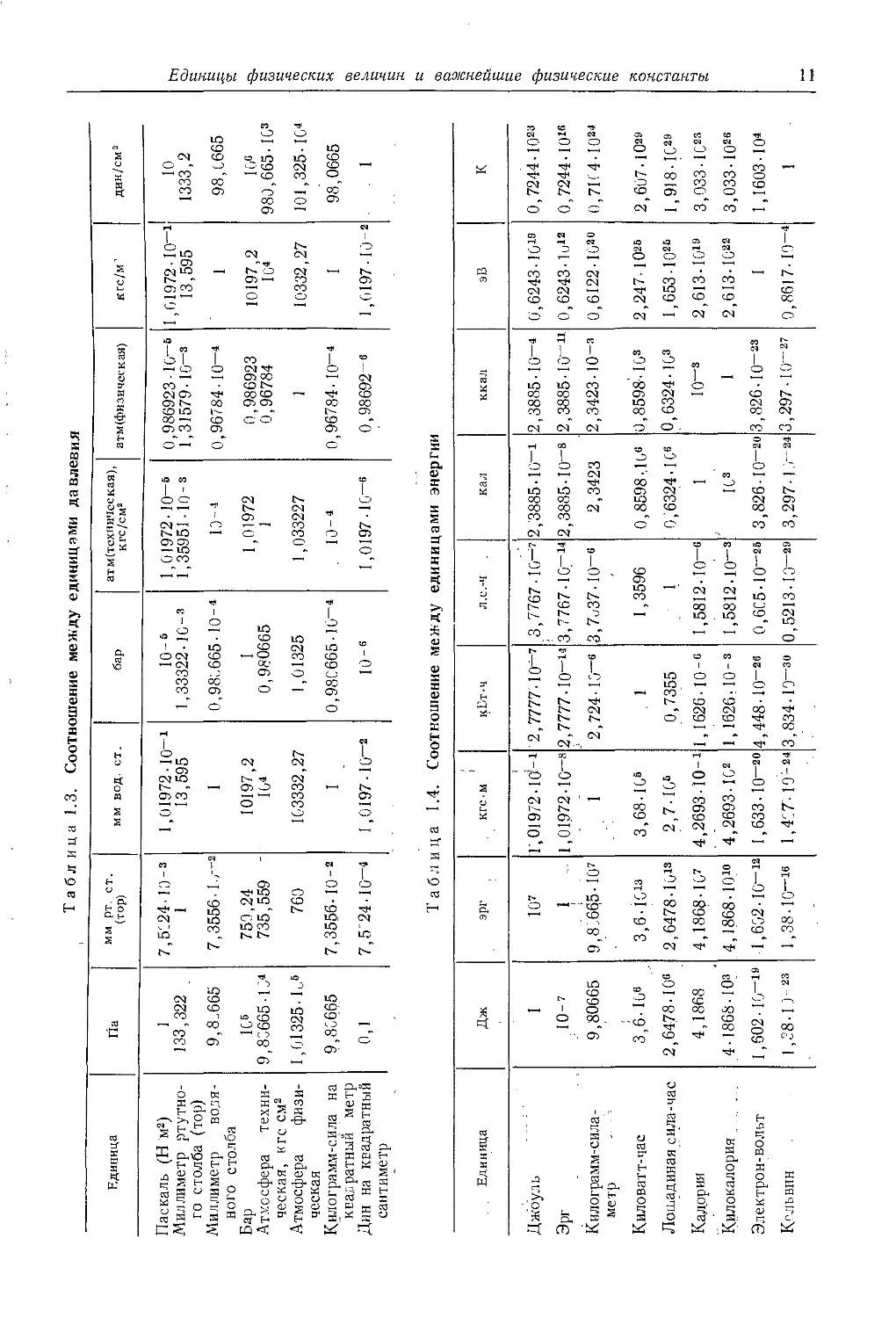
Таблица 1.3. Соотношение между единицами давления
Единица Па мм рт. ст. (тор) ММ вод. ст. бар атм(техническая), к гс/см2 атм (физическая) кгс/м’ дин/см2
Паскаль (Н м2) Миллиметр ртутно- го столба (тор) Миллиметр водя- ного столба Бар Атмосфера техни- ческая, кгс см2 Атмосфера физи- ческая Килограмм-сила на квадратный метр Дин на квадратный сантиметр 1 133,322 9,8.665 1G6 9,86665-16“ 1,61325-М 9,80665 0,1 7,5024-Ю-з 1 7,3556-1- -2 759,24 735,559 - 760 7,3556-10-2 7,5'24•10—« 1,01972 -10—1 13,595 1 10197,2 161 163332,27 1 1,0197•10—2 ю-6 1,33322-16-3 0,989665-10-1 1 0,98'0665 1,01325 0,986665 • 16“4 ю-6 1,01972 • 10-6 1,35951-10-з 19-1 1,01972 1 1,033227 . io-4 1,0197-10—6 0,986923 16—6 1,31579- IO-3 0,96784-10-“ 0,986923 0,96784 1 0,96784- 10-1 0,98692-6 1,61972-10—1 13,595 1 10197,2 161 10332,27 1 1,6197-10-2 10 1333,2 98,6665 16» 980,665-163 101,325- К,4 98,0665 . 1
Таблица 1.4. Соотношение между единицами энергии
Единица Дж эрг КГС • м ^Ет-ч Л.е.'Ч кал ккал эВ К
Джоуль 1 10’ 1,019/2-10?-1 2,7777-10-’ .3,7767-10-7 2 ,'3885-10-1 2,3885-10-1 0,6243-1019 0,7244-1023
Эрг ДО-7 1 1,01972-10—8 2,7777-IO-14 3,7767-10_14 2,3885-10-8 2,3885-10"11 0,6243-1 и12 0,7244-1016
Килограмм-сила - метр - - - 9,80665 9,8L6Q5-107 1 2,724-10"6 3,7о37-10-6 2,3423 2,3423-Ю-з 0,6122-102б 0,71(4-1021
Киловатт-час 3,6-Ю6 3,6-К19 3,68-16е 1 1,3596 0,8598-.16е 0,8598-163 2,247-1026 2,607-Ю29
Лошадиная сила-час 2,64/8-10е 2,6478-1013 2,7-166 0,7355 1 0,6324-1 С6 0.6324-163 1,653-Ю26 1,918-1629
Калория 4,1868 4,1868-16’ 4,2693-10-1 1,1626-10 -6 1,5812-10-6 1 IO"3 2,613-1019 3,033-1С23
Килокалория 4-1868-Юз 4,1868- Ю10 4,2693-1G2 1,1626Л0-з 1,5812-Ю-з 1G3 1 2,613-lG22 3,033-1026
Электрон-вольт 1,602-16—19 1,602-16"12 1,633-1 о-20 4,448-IO”28 0,605-10—26 3,826-IO"2" 3,826-10-23 1 1,1603-Ю4
Кельвин 1,38-1 Д 23 1,38-10~16 1,4С7-19-24 3,834-Ю-зб 0,5213-13—29 3,297-1.-21 3,297-10“27 0,8617-19—4 1
Единицы физических величин и важнейшие физические константы
Таблица l.S. Соотношение между единицами мощности
Единица Ет эрг/с кВт Л.С. кгс-м/с к ал/с ккал/ч
Ватт 1 10? IO—3 1,3596-Ю-з 0,10197 0,23884 0,8598
Эрг в секунду 10? 1 Ю-ю 1,3596-10-1° 1,0197-10—в 0,23884-10-’ 0,8598-Ю-7
Киловатт 103 10« 1 1,3596 101,97 238,84 859,84
Лошадиная сила 735,499 0,7355-Юю 0,7355 1 75 175,7 632,42
Килограмм-сила-метр в секунду 9,80665 9,80665-10? 9,8065-Ю—з 13,333-10-3 1 2,3423 8,4324
Калория в секунду 4,1868 4,1868-10’ 4,1868-10-3 0,5692-10-2 0,42693 1 3,6
Килокалория в час 1,163 1,163-10’ 1,163-Ю-з 1,5811-Ю-з 0,11859 0,2778 1
Таблица 1.6. Соотношение между единицами теплопроводности
Единица Вт/(м-К) Вгг/(см-К) ккал м«ч -°С кал см-с-°С
Ватт на метр-кельвии 1 0,01 0,8598 2,389-Ю-з
Ватт на сантиметр-кельвин 100 1 85,98 0,2389
Килокалория в час на метр-градус- Цельсия 1,163 0,01163 1 2,778-10-з
Калория в секунду на саитиметр- градус Цельсия 4,1868-102 4,1868 360 1
Единицы физических величин и важнейшие физические константы
Единицы физических величин и важнейшие физические константы
13
Таблица 1.7. Соотношение между единицами теплопередачи
Единица Вт/(м2-К) кВт/(м8«К) Вт/(см2-К) Эрг/(СМ2‘С‘К) ккал/(м2Х Хч-°С) кал/(см2-сХ Х°С)
Ватт на метр в квадрате- 1 10—3 IO"* 10s 0,8598 23,89-10—6
кельвин
Киловатт на метр в квад- 1G» 1 о,1 10s 859,8 23,89-10—3
рате-кельвин Ватт иа сантиметр в 10« 10 1 107 8598 0,2389
квадрате-кельвин
Эрг иа сантиметр в квад- IQ—3 10—6 10-’ 1 859,8Х 23,89-10—9
' рате-секунда-кельвин ХЮ-6
Килокалория иа метр в 1,163 1,1бзх 116,3-10—6 116,З-Ю3 1 27,78-10—6
квадрате-час-градус Цельсия ХЮ-3
Калория на сантиметр в 4,1868Х 41,868 4,1868 41.868-10° 3600 1
квадрате- секунда- г ра- дус-Цельсия ХЮ4
Таблица 1.8. Перевод температурных шкал
Температура в градусах Кельвин Цельсий Ренкин Фаренгейт.
Кельвин Тк Цельсий tc Ренкин Т{1 Фаренгейт 'tp ч 273,15 1,87к 1,8ГК —459,67 tc +273,15 (tc +273,15)1,8 l,81c+ 32 rR/1,8 (7^—491,67)/!, 8 Т„~ 459,67 К ’ (++459,67)/1,8 (/р—32)/1,8 + + 459,67 +
Соотношение единиц темпе- ратур Соотношение разностей температур 5 l°R = -g-K = 0,556 К l°F=0,556°C MF/MC = 9/5 04 » Ь +, * о ю II ” II ? II II ~ < Ъ4
Таблица 1.9. Соотношение между единицами магнитной индукции
Единица Тл Гс(ед. СГС, СГСМ и СГС р«о) ед, СГСЭ и СГС .£0
Тесла 1 104 3,34-10—7
Гаусс (ед. СГС, СГСМ и СГС 10-4 1 3,34-10-н
Р*о) Ед.СГСЭ и СГС е0 З-Ю6 3-101» 1
Таблица 1.10. Соотношение между единицами напряженности
магнитного поля
Единица А/м Э (ед. СГС, СГСМ и СГС ед. СГСЭ и СГС е0 А -в/см
Ампер на метр Эрстед (ед. СГС, СГСМ и СГС р.о) Ед. СГСЭ и СГС е0 Ампер-виток иа сантиметр 1 79,6 2,65-10-’ Ю2 1,26-10—2 1 3,34-10-и 1,26 3,77-108 3,101» 1 3,77-101» ю—2 0,796 2,65-10-п 1
Таблица 1.11. Соотношение между единицами
магнитного потока
Единиц а________I_______Вб________|________Мкс_________I_____СГСЭ и СГС е0
Вебер 1 10» 3,34-10—3
Максвелл ю- § 1 3,34-10-п
Ед. СГСЭ и СГСев З-Ю2 3-101» 1
Таблица 1.12 Неметрические единицы, триуецяемые в Великобритании и США, и их перевод (согласно
рекомендации R-31 Международной организации по стандартизации)
Величина Единица Перевод в единицы СИ или кратные и дольиые от них
Наименование | Обозначение
Длина ярд Уб 0,9144 м (точно)
фут ft 0,3048 м (точно)
ДЮ1 м in 0,6254 м (точно)
миля mile 1609,344 м (точно)
морская миля . — 1 852 м (точно)
Площадь квадратный ярд yd2 0,836 127 м2
квадратный фут ft2 0,0929030 м2
квадратный дюйм in2 6,4516 см2 (точно)
Объем кубический ярд yd3 0,764555 м3
кубический фут ft3 28,3168 дм3
кубический дюйм in3 16,3871 см3
галлон (английский) gal(UK) 4,54609 дм3
пинта (английская) pt (UK) 0,568261 дм3
жидкостная унция (английская) fl-oz(UK) 28,4130 см3
бушель (английский) — 36,3687 дм3
галлон (США) gal (US) 3,78543 дм3
жидкостная пинта (США) lig-pt(US) 0,473179 дм3
жидкостная унция (США) fl-oz(US) 29,5737 см3
нефтяной баррель (США) - — 158,988 дм3
бушель (США) bu(US) 35,2393 дм3
сухая пинта (США) dry pt (US) 0,550614 дм3
сухой баррель (США) bbl(US) 115,628 дм3
Скорость фут в секунду ft/s 0,3048 м/с (точно)
миля в час mile/h 0,44704 м/с (точно)
Ускорение фут на секунду в квадрате ft/s2 0,3048 м/с2 (точно)
Масса фунт (торговый) lb 0,453592 37 кг
слаг —- 14,5939 кг
гран gr 64,79891 мг
унция (торговая) oz 28,3495 г
центнер cwt 59,8о23 кг
короткий цертнрр sh cwt 45,3592 кг
тонна 1 1016,05 кг
короткая тонна sh th 907,185 кг
oztr(UK) 1 31,1035 г
тройская унция ozt(US) J
унция аптекарская ozap; (US) 31,10-35 г
Плотность фунт на кубичеркий фут lb/ft3 ' 16,0185 кг/м3
pdl 0,138255 Н
Единицы физических величин и важнейшие физические константы
Единица
Величина Наименование фунт-сила
Удельный вес Момент силы Давление фунт-сила на кубический фут фунт-сила-фут паундаль на квадратный фут фунт-сила на квадратный фут фунт-сила на квадратный дюйм фут вс дяного столба дюйм водяного столба дюйм ртутного столба
Динамическая вязкость паундаль-секунда на квадратный фут фунт-сила-секунда на квадратный фут
Кинематическая вязкесть Работа квадратный фут на секунду фут-паундаль фут-фунт-сила
Энергия Мощность британская тепловая единица фут-паундаль на секунду фут-фуит-сила на секунду лошадиная сила (английская) британская тепловзя единица в час
Термодинамическая темпера! ура, абсолютная температура Температура градус Ренкина градус Фаренгейта
Теплопроводность британская тепловая единица на се- кунду-фут- градус Фаренгейта
Коэффициент теплопередачи британская тепловая единица на се- кунду-кгадратный фут-грэдус Фа- ренгейта
Температуропроводность Удельная теплоемкость квадратный фут на секунду британская тепловая единица на фунт- градус Фаренгейта
Удельная энтропия британская тепловая единица на фунт-градус Ренкина
Термодинамический потенциал (удельный) британская тепловая единица на фунт
Продолжение табл. 1.12
Обозначение
Перевод в единицы СИ или кратные
и дольные от них
Ibf 4,44822 H
lbf/ft3 157,087 H/m3
Ibf-ft 1,35582 H-M
pdlAt2 1,48816 Па
lbf/ft2 47,8803 Па
Ibf/in2 6894,76 Па
ftH2O 2989,07 Па
inH2O 249,089 Па
inHg 3386,39 Па
pdl • s.'ft2 1,48816 Па-с
Ibf -s,.'ft2 47,8803 Па-с
ft2/s 0,г 929030 м2/с
f s • pdl 0,0421401 Дж
ft-Ibf 1.35582 Дж
Btu 1655,06 Дж
ft- pdl s 0,04214.1 Вт
ft-lbf/s 1,35582 Вт
hp 745,700 Вт
Btu;h 0,293071 Вт
5/9К
°F 5/9К
5/9°С
Btu/(s-degF) 6230,64 Вт/(м-К)
Btu/(s-ft2-degF) 20441,7 Вт.'(м2-К)
f t2/s 0,0929. 30 м2 с
Btu/(lb -degF) 4186,8 Дж/(кг-К)
Btu/(lb -degR) 4186,8 Дж/(кг-К)
Btu/lb 2326 Дж/кг
Единицы физических величин и важнейшие физические константы
16
Термодинамические основы охлаждения
Таблица 1.13. Взаимный перевод
градусов Цельсия и Фаренгейта
°C °F--* ср
—273,15 —459,67
—267,78 —450
—262,22 —440
—256,67 —430
—251.11 —420
—245,56 —410
—240 —400
—234,44 —390
—228,89 —380
—223,33 —370
—217,78 —360
—212,22 —350
—206,67 —340
—201,11 —330
— 195,56 —320
— 190 —310
— 184,44 —300
— 178,89 —290
— 173,33 —280
—273,15 —459,67
— 167,78 —270 —454
— 162,22 —260 —436
— 156,67 —250 —418
— 151,11 —240 —400
. —145,56 —230 —382
— 140 —220 —364
— 134,44 —210 —346
— 128.89 —200 —328
—123,33 — 190 —310
— 117,78 —180 —292
— 112,22 — 170 —274
— 106,67 — 160 —256
— 101,11 — 150 —238
—95,96 — 140 —220
—90,0 — 130 —2С2
—84,44 —120 — 184
—78,89 —ПО — 166
—73,33 — 100 — 148
—67,78 —90 — 130
—62,22 —80 — 112
—56,67 —70 —94
—51,11 —60 —76
—45,56 —50 -58
—40,6 —49 —40
—34,44 —30 —22
—28,89 —20 —4
—23,33 —10 + 14
— 17,78 0 + 32
— 12,22 + ю +50
—6,67 +20 +68,0
— ДИ +30 +86,0
+4,44 +40 + 104,0
+ ю,о +59 + 122,0
+ 15,6 + 60 + 140,0
+21,1 +70 + 158,0
+26,7 + 176,0
Продолжение табл. 1.13
Интерполяционные поправка
0,56 1 1,8
1,П 2 3,6
1,67 3 5,4
2,22 4 7,2
2,78 5. 9,0
3,33 6 10,8
3,89 7 12,6
4,44 8 14,4
5,00- 9 ! 16,2
5,56 10 18,0
Раздел второй
ТЕРМОДИНАМИЧЕСКИЕ
ОСНОВЫ ОХЛАЖДЕНИЯ
2.1. ОПРЕДЕЛЕНИЕ ТЕРМИНА
«ОХЛАЖДЕНИЕ»
Под охлаждением подразумевается про-
цесс изменения состояния объекта или ве-
щества, вызванного отводом теплоты или
понижением температуры. Определение по-
нятия «охлаждение» подразумевает процес-
сы двух различных видов. Один из них
обусловливает изменение состояния объекта
или вещества в связи с отводом теплоты —
так называемое внешнее охлаждение, другой
характеризуется понижением температуры
или поддержанием низкой температуры,
осуществляемым без отвода теплоты во
внешнюю среду, например при дросселиро-
вании и расширении в детандере — так на-
зываемое внутреннее охлаждение [16].'
Для проведения охлаждения первого
вида необходима внешняя система, темпе-
ратура которой поддерживается ниже, чем
у объекта охлаждения, в результате чего
и обеспечивается процесс теплообмена. Са-
мопроизвольно этот процесс может идти
только при температурах выше температу-
ры окружающей среды То. В области Т<
<Т0 при внешнем охлаждении должен осу-
ществляться перенос теплоты (энтропии) от
менее нагретого тела в окружающую среду;
этот процесс возможен только при затрате
работы.
Охлаждение второго вида всегда свя-
зано с уменьшением значения интенсивно-
го термодинамического параметра, в роли
которого выступают давление, напряженно-
сти электрического и магнитного полей
Определение термина «охлаждение»
и т. д. Наинизшая температура в любой
низкотемпературной системе может быть
получена только посредством внутреннего
охлаждения. Отсюда вытекает особая роль
этого процесса: любая низкотемпературная
система должна обязательно иметь хотя бы
один элемент, в котором реализуется вну-
треннее охлаждение.
Состояние тела при низкой температу-
ре характеризуется не только малой энер-
гией частиц (слабым тепловым движением),
но также и пониженным значением энтро-
пии (малой степенью беспорядка в систе-
ме). Для охлаждения объекта используют
последовательность процессов, осуществля-
емых посредством специального рабочего
тела, энтропия которого зависит от соот-
ветствующего интенсивного параметра. Не-
обходимо прежде всего в изотермических
условиях изменить этот параметр в направ-
лении, соответствующем уменьшению энтро-
пии тела. При этом над системой совер-
шается работа с отводом теплоты. Затем
в изоэнтропном процессе изменяют интен-
сивный параметр в противоположном на-
правлении. Поскольку система при этом со-
вершает внешнюю работу, а энтропия оста-
ется постоянной, следствием будет пониже-
ние температуры. Повторяя такую после-
довательность процессов многократно, мож-
но понизить температуру системы до очень
низкого уровня, вплоть до окрестности
абсолютного нуля.
Согласно закону Нернста для любого
значения внешнего параметра система
должна обладать при абсолютном нуле
энтропией, равной нулю. Физическая основа
теоремы Нернста заключается в том, что
при низких температурах беспорядок в си-
стеме устраняется. Это начинает происхо-
дить, когда энергия взаимодействия между
частицами сравнивается с энергией kT теп-
лового движения. Температуру 0, при кото-
рой произойдет переход в более упорядо-
ченную фазу, можно называть характери-
стической (0~£/fe) для данного вещества.
При температурах ниже 0 энтропия очень
слабо зависит от внешнего параметра и ве-
щество теряет свою эффективность в каче-
стве рабочего тела низкотемпературного
цикла. Отсюда вытекает невозможность до-
стижения абсолютного нуля в любом про-
цессе охлаждения.
По мере охлаждения вещества тепловое
движение его частиц постепенно замедляет-
ся, и при температуре О К (—273,15 °C)
оно должно совершенно прекратиться. По-
скольку запас энергии теплового движения
частиц вещества полностью исчерпывается,
дальнейшее понижение температуры, оче-
видно, невозможно. Остаются лишь так на-
зываемые нулевые колебания, связанные
с проявляющимися при очень низких темпе-
ратурах квантовыми свойствами вещества
[7]. Энергия нулевых колебаний не может
быть отдана кристаллической решеткой, и
2-218
при рассмотрении теплового движения ее
не учитывают.
С определенной долей условности мож-
но выделить три диапазона низких темпе-
ратур: диапазон, отвечающий интервалу
температур от 300 до 120 К (кондициони-
рование воздуха; хранение пищевых про-
дуктов; охлаждение химических реакторов-
и т. п.); диапазон криотемператур, лежа-
щих ниже 120 К (разделение воздуха и
промышленных газов; сжижение метана,,
кислорода, азота, водорода, неона, гелия
и процессы охлаждения этими жидкостя-
ми); диапазон ультранизких температур
(ниже 0,3 К), используемый пока лишь при
физических экспериментах. Эти диапазоны
температур представлены на рис. 2.1 в ло-
Г,К
ios~-
ю7--
—Реакции термоядерного синтеза,
Температура внутренних оНластец
горячих звезд
10s-~
- Взрыв атомной домды
10s--
ю^--
103--
107
ю --
-5000-поверхность Солнца
- 3273-кипение железа
- 1800-плавление железа
_ 505-плавление олова
-373,15-кипение воды
^ЗТЗДЗ-замерзоние воды
- 90,15-жидкий кислород
54,3-твердый кислород-------
- 20,7-жи дкий водород
. - т -твердый водород
- 4,2-жид кий гелий,Не
- 3,2-жи дкий гелий^Не
г,1Э-сверхтекучий гелий
_ O^-KuneHuew под вакуумом
-ОД-_кипение3Не лад вакуумом
Диапазон
температур
органической'
жизни
/ Диапазон
л температуру
ч холодильное
техники
5
«о
§
§
10'
Рис. 2.1. Характерные диапазоны темпера-
тур
гарифмическом масштабе. Здесь же для
сравнения указаны температуры некоторых
высокотемпературных процессов. Интересно-
отметить, что наинизшие из полученных
температур примерно в 10s раз ниже тем-
пературы окружающей среды (1СН 6/102),.
в то время как даже температура термо-
ядерных реакций только в 106 раз.
(108/102) выше этой температуры.
Температуры первого и второго диапа-
зонов получают чаще всего посредством
термомеханических процессов (интенсивный.
18
Термодинамические основы охлаждения
(эффект Джоуля — Томсона), расширения
с совершением внешней работы (детанди-
рования), расширения с работой над газом
(эффект Джоуля), расширения в потоке
с градиентом скорости (эффект Ранка),
испарения конденсированной фазы с отво-
дом пара. Кроме того, используют термо-
химические процессы (интенсивный пара-
метр — химический потенциал): растворе-
ние, сорбцию и десорбцию. Все большее
применение находят процессы, осуществляе-
мые в электрическом и магнитном полях
(интенсивный параметр — напряженность
соответствующего поля) путем реализации
эффектов Пельтье, Эттингсгаузена, электро-
и магнитокалорического эффектов.
Получение ультранизких температур
связано с осуществлением квантовых эф-
фектов в изотопах гелия (растворение лег-
кого изотопа 3Не в сверхтекучем 4Не; кри-
сталлизация 3Не при сжатии — эффект По-
меранчука; механокалорический эффект),
а также магнито- и электрокалорических
эффектов (размагничивание парамагнети-
ков; намагничивание сверхпроводников; де-
поляризация диэлектриков).
2.2. ПАРАМЕТРЫ СОСТОЯНИЯ
Низкотемпературные системы могут
испытывать различие виды воздействий:
термомеханические, термохимические, элек-
трические, магнитные. В общем случае со-
стояние такой сложной системы будет
определяться уравнением
f(p, v, Т, ,ц, G, Р, Е, М, Н)=0, (2.1)
где р — давление; v — удельный объем;
Т — температура; р, — химический потен-
циал; G — масса рабочего тела; Р — поля-
ризация; Е — напряженность электрическо-
го поля; М — намагниченность; И— напря-
женность магнитного поля.
Для наиболее широко применяемых
в низкотемпературной технике термомеха-
нических систем уравнение состояния при-
нимает более простой вид;
f(p, V, Г)=0. (2.1а)
Графически состояние такой системы опре-
деляется некоторой поверхностью в трех-
мерном пространстве. Каждый из парамет-
ров, являясь функцией состояния, опреде-
ляется значениями двух других, принятых
за независимые переменные. Практически
удобнее пользоваться двумерными графи-
ками. Так получают диаграммы р, Т (с кри-
выми o=const), р, о (с кривыми Т=const)
и и, Т (с кривыми p=const).
Упругие и термические свойства тела
характеризуют следующие коэффициенты:
коэффициент изотермического сжатия
1 / dv \
X = —— — I : (2-2)
и0 \ )т
коэффициент термического расширения
1 / до \
аР — ( ,-1Т
«в \ дТ /р
(2-3)
коэффициент термической упругости
(2.4)
Здесь индексом «О» отмечены значения па-
раметров в начале процесса.
2.3. ЗАКОНОМЕРНОСТИ
ИДЕАЛЬНОГО ГАЗА
Под идеальным газом понимают мо-
дель газа, представляющего собой совокуп-
ность упругих молекул, находящихся в хао-
тическом движении и непрерывно соуда-
ряющихся, причем объем, занимаемый мо-
лекулами, пренебрежимо мал по сравнению
с объемом газа и силы взаимного притяже-
ния между молекулами отсутствуют. Реаль-
ные газы по своим свойствам приближают-
ся к идеальному газу с понижением давле-
ния, т. е. при увеличении длины свободного
пробега молекулы. Идеальные газы точно
следуют законам Гей-Люссака, Бойля —
Мариотта и уравнению Клапейрона.
Закон Бойля — Мариотта:
PiOi = P2O2(T=const); (2.5)
закон Гей-Люссака:
v—vo=aPvot (p=const), (2.6)
где v0 — объем газа при О °C; t — темпера-
тура газа по шкале Цельсия; и — объем
газа при t; ар — средний коэффициент рас-
ширения. По современным данным ар=
=1/273,15=0,003661 °C.
Закон Гей-Люссака дает основание по-
строить рациональную газовую температур-
ную шкалу и ввести понятие абсолютной
температуры [9]. Действительно, по фор-
муле (2.6)
/ \ I t2 \
1 0V 273,15/ \ 273,15/
уг 273,15 + Ц Тг
1 273, 15 12 7'2
отсюда абсолютная температура* Т=
= 273,15-|-f. Из этих же законов можно
обосновать логарифмическую шкалу темпе-
ратур (т):
In Oi/O2=i₽(т—То).
В логарифмической шкале температуре
абсолютного нуля (0 К) соответствует
Уравнение Клапейрона служит уравне-
нием состояния идеального газа в явной
форме
pV=GRT, (2.7)
* См. разд. 1.
Закономерности идеального газа
19
где V=Gv; G — масса данного количества
газа; R— газовая постоянная. Величина R
эквивалентна работе расширения, совершае-
мой единицей массы газа при нагревании
его под постоянным давлением на один
градус. Значения R приведены в табл. 4.109.
Для кмоля любого газа действитель-
ная универсальная газовая постоянная
povm 1,01325-106-22,414
й~'П То 273,15
= 8314,34 Дж/(К-к/моль),
где m — молекулярная масса газа; vm=
=22,414 —объем кмоля идеального газа
при 0°С и 760 мм рт. ст. (0,101325 МПа).
Отсюда
Р=8314,34 Im.
Значения Ro в других единицах:
82,055 см3-атм/(К-моль)
0,082055 л-атм/(К-моль);
8,2055-10~5 м3-атм/(К-моль);
8,31434-107 эрг/(К-моль);
1,9858 ккал (к-моль-К);
18 510 lb/in2-in3/(lb=mol -°F);
10,73 lb/in2-ft3/(lb = mol-°F);
0,7302 atm • ft3/(lb=mol-°F).
Газовые смеси. Состав смеси газа мо-
жет быть задан в массовых, объемных или
молярных долях. Доля — это отношение
массы, числа- молей или объема данного
газа соответственно к общей массе, числу
молей или объему всей смеси.
Средняя молекулярная масса смеси
Шс м —
где п — объемные или молярные доли
компонентов смеси; mi — молекулярные
массы компонентов.
Закон Дальтона. Давление смеси газов
рСм равно сумме парциальных давлений
компонентов:
Рем"Д рг.
Парциальным давлением компонента pi
в газовой смеси называется давление, кото-
рое производил бы этот компонент в отсут-'
ствие остальных, находясь в том же коли-
честве, в том же объеме и при той же тем-
пературе, что и в смеси.
Газовая постоянная для смеси газов
t?cM=8314/mCM=8314/Srim<=S£^i,
где gi, ri, m( и Ri — соответственно мас-
совая н объемная доли, масса моля и газо-
вая постоянная компонентов.
Для каждого компонента парциальное
давление
Рг = РсмОг/Осм = РсмЩг.
Парогазовые смеси. Абсолютной влаж-
ностью называется масса пара в 1 м3 па-
рогазовой смеси; она равна плотности р
пара, содержащегося в смеси при данной
температуре.
Паросодержанием х газа называется
2*
количество пара в килограммах, приходя-
щегося на 1 кг сухого газа, т. е. х =
— G^/Gt. Относительная влажность или сте-
пень насыщения ф есть отношение действи-
тельной абсолютной влажности к абсолют-
ной влажности насыщенного газа при той
же температуре:
ф = Рдейств/Риас = Рдей ст в /Рнао,
где Рдейств—парциальное давление пара;.
Рнас—давление насыщенного пара при
температуре смеси.
Вместо ф часто удобнее пользоваться
другой величиной — относительным насыще-
нием Д1^=Хд е й с т в/%и а с, где -Гдейств—дей-
ствительное паросодержание и хнас — па-
росодержание при насыщении. Зависимость
между ф и ¥ устанавливается уравнением;
Д' = ф (р Рнас)/ (р Рдейств),
где р — общее давление смеси.
Для парогазовой смеси паросодержание-
х связано с ф уравнением
^ттарТА ас
х =-----т--------г-’ (2.8)
отгаз(Р ?Рнас)
где тПар и Шгаз — молекулярные массы:
пара и газа, входящих в смесь.
Для паровоздушной смеси
-Г=0',622фРнас / (р—фРнас) .
Если паросодержание смеси определить,
через массы молей пара и газа, то
^м==фРнас/(р—фРнас). (2.8а)
Основные соотношения кинетической
теории газов. Температуру Т принято счи-
тать численно равной 2/3 кинетической
энергии поступательного движения частип.
. „ тц2 . — по2
kT = 2/3 -г = 1/з^2; -2- = 3/2feT’,
где k — постоянная Больцмана, служащая:
коэффициентом пропорциональности для)
температуры, выраженной в джоулях и
кельвинах, и численно равная универсаль-
ной газовой постоянной Ro, отнесенной:
к одному киломолю: k= 1,3805-10~23 Дж/К;.
m — масса молекулы; б— средняя арифме-
тическая скорость молекул.
Основное уравнение кинетической тео-
рии газов
mv2~_ 1 —
Р — 2/зП ~2—~ nmv2
или, поскольку n—Na/v, to
ро = V3№tw2=WAfeT= РоД
где р — давление; v — объем киломоля;;
Na— число Авогадро; NAk=Ro'—универ-
сальная газовая постоянная.
Кинетическая энергия поступательного-
движения может быть разложена на три:
составляющие, обусловленные тремя степе--
20
Термодинамические основы охлаждения
нями свободы. Отсюда энергия, приходя-
щаяся на одну степень свободы молекулы,
Еп =---- —кГ =------kl =— тт—J ).
0 3 \2 / 2 2 \na J
Молярная теплоемкость газа при по-
стоянном объеме с |;= ту(1 — число сте-
пеней свободы), равная:
Газы.............i. . . с0, ДжДмоль-К)
Одноатомные . . 3 . . . (3/2)12,5
Двухатомные . .5. . . (5/2)Ро==20,8
Трехатомные . . 6 . . . (6 2)/?0=;;25,0
Молярная теплоемкость газа при по-
стоянном давлении
Ср~ Сг“)Д?о-
Показатель адиабаты
[с$~ i—|—2/1.
О теплоемкости см. также § 4.8.
Скорости молекул, см/с, по распреде-
лению Максвелла:
наиболее вероятная
= У2RaTjm = 12 895 У Tjm\
средняя арифметическая
v = У 8R„T/(nm) = 14 551 VТ [tn )
средняя квадратичная
УУ = УЗЕаТ/т = 15 794/Т>-
Здесь m — масса молекулы. При этом
Vb : v : Д =1 : 1,13 : 1,23.
Средняя длина свободного пути моле-
кулы __
I = 1 /К2 па2ц.
Среднее число столкновений для одной
молекулы в секунду при р, МПа, и Т, К,
z = У2 4лг2ал = 12,7\р/Т.
Общее число столкновений молекул
в единице объема за 1 с
хобщ = nz/2 — 2И2 w2w?2.
В последних уравнениях г и а — эффектив-
ные радиус н диаметр молекул; п — число
молекул в 1 см3. При р, мм рт. ст., и Т, К,
л = 9,656-1018р/7'; при р, МПа, и Т, К,
=7,244-1016 р/Т. Число ударов молекул
о поверхность 1 см2 за 1 с v=nv/4 соот-
ветственно равно 3,513-1022 р/У тТ и
2,635-1020 р/УтТ.
Барометрическая формула
—mghT
где g — ускорение свободного падения;
hi — высота над уровнем моря; е—основа-
ние натурального логарифма.
Коэффициент внутреннего трения (вяз-
кость)
1____
7) = — рУ/,
где р — плотность.
Теплопроводность
Коэффициент диффузии определяется
из уравнения
de
dm = — DS-----dt,
dx
где dm — масса диффундирующего веще-
ства в направлении оси х через сечение S
за время dt при градиенте концентрации—
dc/dx: D=l/3lv — коэффициент диффузии,
определяемый потоком вещества, диффун-
дирующего за время t=l с через сечение
S=1 при dcfdx=l, см2/с или м2/с.
В тех случаях, когда нет эксперимен-
тальных данных о коэффициенте диффузии
О, см2/с, для качественной оценки его зна-
чения в диазапоне 0—100 °C можно вос-
пользоваться уравнением
0,00043Г3/2 / I И
D= Г(ид/3 + 4/3)2 V
где р — давление, МПа; vA и vB, mA и
тв — соответственно молярные объемы,
см3/моль, и молекулярные массы компонен-
тов, участвующих в процессе.
Соотношение между скоростями моле-
кул v и скоростью звука и
И г КСр!Су
Для одноатомных газов v/u = 1,236, для
двухатомных— 1,349.
Скорость звука в идеальном газе
п0 “ УRqRСр/cv •
Газокинетические данные для некото-
рых веществ приведены в табл. 2.1.
2.4. ДВА ОСНОВНЫХ НАЧАЛА
ТЕРМОДИНАМИКИ
Различают два состояния термомехани-
ческой системы: 1) стандартные условия
термодинамики, когда рассматривается си-
стема с постоянным количеством вещества,
ограниченная замкнутой поверхностью и на-
ходящаяся под равномерно распределенным
внешним давлением, 2) так называемую по-
точную систему, когда имеется установив-
шийся во времени поток вещества в закры-
тых каналах с характерным для потока не-
равномерным распределением давления *.
В инженерной практике почти всегда
приходится иметь дело со вторым слу-
чаем — поточной системой.
Первое начало термодинамики. Разные
формы энергии эквивалентно переходят из
одного вида в другой или, другими слова-
ми, для любой изолированной системы ко-
* Для специальных случаев разработан тер-
модинамический анализ задач с переменным ко-
личеством рабочего вещества.
Два основных начала термодинамики
21
Таблица 2.1. Газокинетические данные для некоторых веществ
при 25 °C и 0,1013 МПа [5]
Газ Средняя арифмети- ческая скорость молекул, м/с Средняя длина свободного пути молекул, см-106 Среднее число столкновений одной молекулы в 1 с, 10'9 Диаметр молекул (из вязкости) а, см-108 Число моле- кул, ударяю- щихся в 1 см2 поверхности в 1 с при 0 °C и 133 Па, 10-20 Число моле- кул, ударяю- щихся в 1 см2 поверхности в 1 с при 0 °C и давлении 1 Па, 10“18
Азот 474 5,92 7,97 3,70 4,015 3,011
Аммиак 609 6,6 — 2,97 5,152 3,865
Аргон 397 6,67 5,7 3,67 3,363 2,523
Водород 1770 12.20 14,45 2,75 14,97 11,23
Воздух 467 6,69 6,98 3,74 3,95 2,962
Гелий 1256 19,36 7,16 2,18 10,63 7,969
Диоксид углерода 378 4,40 8,61 4,65 3,204 2,403 '
Кислород 444 7,10 6,26 3,64 3,758 2,819
Криптон 274 5,34 6,48 4,15 2,324 1,743
Ксенон 219 3,93 5,71 4,91 1,856 1,392
Метан 627 4,70* — 4,19 5,308 3,981
Неон 559 13,75 1,68 2,60 4,733 3,55
Оксид углерода 474 5,90 7,99 3,70 4,016 3,012
* При t=0 °C.
личество заключенной в ней энергии сохра-
няется неизменным.
В приложении к теплоте Q и механиче-
ской работе L, представляющим собой меру
перехода энергии (параметры процесса),
имеем (при измерении этих величин
в единицах разных систем) Q=AL,
где А — тепловой эквивалент механической
работы, равный 860 ккал/(кВт-ч) или
632,3 ккал/(л. с-ч).
В единицах СИ теплота и механиче-
ская работа измеряются в джоулях, сле-
довательно, Q=L.
Вырабатываемая или затрачиваемая
энергия (работа, теплота) в секунду назы-
вается мощностью.
Соотношения между различными еди-
ницами работы и мощности см. в разд. 1.
Математические выражения первого
начала для стандартных условий термо-
динамики. В обвцем виде
dQ = dE + dL = dU +
+ G (d ^—\-dh^ -\-pdV. (2.9)
Собственная энергия тела E в общем
случае состоит из двух частей: внешней
энергии, равной сумме кинетической энер-
гии Gw2l2 и потенциальной Gh, и внутрен-
ней энергии U. Здесь w — скорость движе-
ния тела и /г, — высота над уровнем моря.
Работа, производимая телом (расшире-
ние), считается положительной; работа,
воспринимаемая телом (сжатие), — отри-
.цательной. Теплота, подводимая к телу,
считается положительной; отводимая от
тела — отрицательной.
Когда внешней энергией можно пренеб-
речь, уравнение (2.9) принимает вид
dQ=dU+pdV=dU+dL. (2.10)
В удельных термодинамических величинах
dq=du-\-pdv = du-\-dl. (2.10а)
Тепловая функция, или энтальпия, Н=
= U + pV (соответственно в удельных ве-
личинах h=u-\-pv).
Изменение энтальпии в процессе
dH=d ( U+p V)=dU-\-pd V-[- Vdp=
=dQ+Vdp. (2.11)
Как видно, при p=const dQ=dH.
Энтальпия H для поточного процесса
имеет определенное физическое содержание.
Это — полная энергия потока, связанная
с данным состоянием тела; она состоит из
внутренней энергии U и величины pV, пред-
ставляющей собой работу, которую необхо-
димо затратить, чтобы ввести тело объемом
V в среду с давлением р.
Для поточной системы (отнесенной
к единице массы потока)
w2
dq = du + d(pv) -f- -{-гйт-|- dlT, (2.12)
где ZT — внешняя техническая работа, со-
вершенная потоком или над потоком (см.
также рис. 2.2 и 2.8).
В это уравнение в отличие от (2.9)
входит слагаемое d(pv), появление кото-
рого связано с тем обстоятельством, что
для потока в сечениях входа в рассматри-
ваемую систему и выхода из нее подводит-
ся и отводится работа вытеснения (протал-
кивания) Рвх^вх И РвЫХ^ВЫХ-
22
Термодинамические основы охлаждения
Введя функцию Л и исключив кинети-
ческую и потенциальную энергию, получим
dq=du-\-d(pv)-]~dlT = dh-\~dlT. (2.13)
При рассмотрении поточной системы
для выделенного между сечениями входа
и выхода количества вещества из уравнений
(2.10) и (2.13) получаем
pdv = dl-j. -ф d(pv) — dl-r + pdv -f- vdp; 1
2 I
dl.r = — vdp; It = — j vdp. I
(2-14)
Окончательно имеем
dq = dh — vdp = dh + dl r. (2.15)
Уравнение (2.13) имеет сходную струк-
туру с (2.10), только для поточной си-
стемы энтальпия h заменяет собой внутрен-
нюю энергию и.
Если система не обменивается тепло-
той с окружающей средой (dq=0), то
Zt=/z2—hi, (2.16)
т. е. техническая работа равна разности
энтальпий потока рабочего тела до и после
совершения работы; аналогично В ’ соответ-
ствии с (2.11) при p=const q=hi—ht.
Уравнения (2.11), (2.15). и (2.16) имеют
для техники большое значение.
Второе начало термодинамики и энтро-
пия. Теплота может производить работу
только в том случае, если температурный
уровень этой теплоты выше температуры
окружающей среды, и наоборот, теплота
с более низкого температурного уровня мо-
жет быть перенесена . на более высокий
температурный уровень только при затрате
работы. Всякая замкнутая система стре-
мится к равновесному состоянию, причем
энтропия системы стремится к максимуму.
Математическое выражение второго на-
чала для обратимых изменений состояния:
dq=Tds. (2.17)
Энтропия s, так же как и внутренняя
энергия, — функция состояния, поэтому ее
изменение зависит только от начального и
конечного состояния системы.
Для естественного самопроизвольного
процесса dq/T<ds; для искусственного про-
цесса dq/T>ds; для любого обратимого
процесса dq/T = ds.
В замкнутой системе при любом обра-
тимом процессе энтропия остается неизмен-
Дд?
ной: 4 s ДЮ или (J)— гДО (знак неравенства
относится к необратимым процессам).
Учитывая, что dq=Tds, основные урав-
нения первого начала (2.10а) и (2.13) мо-
гут быть записаны в виде
Tds = du-\-dl; (2.18)
Tds=dhr\-dlt. (2.19)
Эти уравнения называются термодинамш
сними тождествами.
В статистической физике энтропн
трактуется как величина, пропорциональна
логарифму термодинамической вероятной
W состояния тела: S = feln W, где k — и
стоянная Больцмана. Из этого соотношен
вытекает, что энтропия обладает свойство
аддитивности: S=Si-]~S2.
Математически энтропию получают д|
лением неполного дифференциала dQ ил
dq на интегрирующий делитель Т, обрг
щающий ее в полный дифферента
(dQ/T или dq/T), и поэтому S2—Sf
2 2
= ^dQ/T или s2—si=J dq/T.
T 1
Энтропия идеального газа
dq — du + pdv — c—T -J---- dv;
v
ds =
Cv v
После преобразования и интегриро
вания
S=CV In 7'-}-/? In Ц-j-So.
Для других пар независимых переменны;
s—Cp In Т—R. In p-j-So;
S—Ср In p—|—Cp In V—]—So.
Теорема Нернста. При температур
абсолютного нуля все частицы кристалла
ческого тела должны находиться в наиниз
шем квантовом состоянии. Оно может был
реализовано лишь единственной атомно;
картиной, поэтому 117=1 и S = feln HIM,
СлеДовательно, при любой температур
энтропия может иметь только положитель
ные значения.
Абсолютное значение удельной энтро
пии
о
Для определения s необходимо знай
зависимость сР от температуры. С прибли-
жением температуры к абсолютному нулю
теплоемкость всех тел подчиняется закону
с=аТ3. При Т->-0 теплоемкости ср и с,
также стремятся к 0 (о теплоемкости при
низкой температуре см. § 2.11 и 4.8).
Из теоремы , Нернста следует также,
что при температуре, близкой к абсолютно-
му нулю, все термодинамические величины,
характеризующие равновесное состояние
тела, перестают зависеть от температуры:
Теорема Нернста предсказывает вырожде-
ние идеального газа прн очень низких тем-
пературах (например, температура вырож-
дения газа Бозе примерно 1 К), т. е. иде-
альный газ перестает вести себя в соответ-
ствии с уравнением Клапейрона, а подчи-
Некоторые наиболее важные дифференциальные уравнения термодинамики
23
яяется более сложному уравнению, учиты-
вающему квантовые эффекты [6, 8]. .
Для аморфных тел в силу их большей
структурной сложности и неравновесности
энтропия при Т->-0 стремится к отличному
от нуля значению s0 (остаточная энтропия).
2.5. НЕКОТОРЫЕ НАИБОЛЕЕ
ВАЖНЫЕ ДИФФЕРЕНЦИАЛЬНЫЕ
УРАВНЕНИЯ ТЕРМОДИНАМИКИ
Функции состояния и, h, s представ-
ляют собой полные дифференциалы, для
которых справедливо положение о попар-
ном равенстве накрест взятых производных
от коэффициентов у независимых перемен-
ных; q и Z — функции процесса, поэтому
они зависят от вида пути (линии) про-
цесса.
Уравнения термодинамики при выборе
каких-либо двух независимых переменных
параметров образуются путем комбиниро-
вания уравнений первого и второго начал
термодинамики с использованием отмечен-
ного выше математического свойства пол-
ных дифференциалов. О дифференциальных
уравнениях термодинамики см. [6, 8, 9,
17, 45].
Теплоемкость:
„ T(dp/dT)v .
С v — ““ •>
(dT/dv)s
ср _(dp/dv)s
с0 (dpldv-)T
дс0\ fd^p_\
dv /т ( дТ2 /
/ дсР \ ? / d2v \
\ др }т УдТ2 J,,'
Общие соотношения (соотношения Макс-
велла) :
Энтропия s:
Перемен- Уравнения
ные
р И V ср ( дТ\ ds=^\~^)pdv +
т И V Ср / дТ ] dp Т \ др . Cv ,т , ( др \ ds = dT -ф dv
т и р Т \ дТ Jа с-р / ди \ ds = - dT — ) dp
24
Термодинамические основы охлаждения
Т е п л о т а:
Перемен-
ные
Уравнения
р № Z1
v и Т
р и Т
Энтальпия /г:
dh — Tds + vdp',
1 дТ\___Т_ 1 dv \
к др Л~ ср \ дТ /р‘
2.6. ЧАСТНЫЕ ВИДЫ ПРОЦЕССОВ
И СПЕЦИАЛЬНЫЕ
ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ
Процессы. Характеристики отдельных
частных процессов приведены в табл. 2.2.
Некоторого дополнительного обсуждения
требует политропный процесс.
Под политропным процессом подразу-
мевают изменение состояния тела, подчи-
няющееся уравнению po«=const, где п —
постоянное число. При расширении газа
показатель n<k отвечает процессу с подво-
дом теплоты, a n>k — процессу с отводом
теплоты. Для идеальных газов (cB=const}
политропный процесс может рассматривать-
ся как изменение состояния, при котором
доля а теплоты, приведшей к изменению
внутренней энергии и газа, и доля (1—а),
трансформируемая во внешнюю работу, на-
ходятся в постоянном определенном соот-
ношении:
а—(п—1) !(п—k).
На рис. 2.2 нанесены линии различных
процессов в диаграмме р, о. Элементарная
работа dl = pdv в этой диаграмме изобра-
жается вертикальной заштрихованной пло-
щадкой, а работа в процессе 1-2 11~2 =
2
= j pdv—пл. 1-2-2-2'-!'. Элементарная
техническая работа изображается горизон-
тальной заштрихованной площадкой dl-,~=
2
= —vdp и соответственно /т1-2= J vdp=
= пл. 1-2-2"-1". ’
На рис. 2.3 нанесены линии различных
процессов в диаграмме Т, s. Элементарное
Таблица 2-2. Характеристика термодинамических Процессов (индексы 1 и 2 обозначают начальное й конечное состояния)
Характеристика Процесс
изохорный, f=const изобарный, P=const изотермический, T=const адиабатный или изоэнтропный," 5—const; rf<7=0 политропный, pun=const
rt=ri=OO n=0 П — 1 ,=> cv «=const
Соотношение параметров Pl Т 2 Pl Т1 V2 ^2 ~1^~1 pv = const Pl _ 01 Pl Vl pv1 = const a < qiV Pl \ O2 / k—1 Zi/iMb T1 \ Pl) ^2 _ pl V-1 Л \ «2 ) Те же формулы, что и для адиабаты, только k замене- но на п
Изменение температуры АТ = zv (—— А \ Pl ) \ vi ! 0 fe—1 ! Pv\ k = T1 — - 1 L Pi / J Г / 01 1 = Ti — — 1 L \ 02 / J То же
Теплота q = u2~ul = = cv(T2-Ti) = viPi — Pi) k— 1 =h2 — = cP(T2 — Tj) = & =7 : Р<Л — ai) к — 1 = l = RT In—= Pi = T (s2 — Si) = V-I = RT In — «2 0 п — k ... „ = Со г(Т’2-Л) = п — 1 k — п =k—l = = — R(T2—7’1)= (k — n)RTi ~ (k — 1) Х
Частные виды, процессов и специальные термодинамические функции
Проболжение табл. 2,2.
Характеристика Процесс
изохорный, y=const изобарный, p=const изотермический, T=const
/2—=i:GO 72=0 /2=1
Работа изме- нения объема 0 = Р(«2— = — RT In — = Pi
I = J pdv = Л(Г2-Г1) V-t = P7’ln—= «2
= T(,2 - f p
Работа техни- ческая = а(А — А) 0 = tfTln — = Pi
/т = — J vjp = /?7’ln — = ^'2
- = T(s2 sl)
m/rf п 9 9
адиабатный или изоэнтропный, s=const; tZq=O политропный, pu4=const
а=_2. ft=const
= и2 — мх = си(Т2 — Л) = 1 R, — 1 fe—J / Р2 \ fe ] fe-'1Pi / J _ RjT.-T.) _ (k—n) n — 1 1 X (PzV2 Prvl) — n — I I _ RTi n — 1 L\ p j
— (h2 ^j.) —
= C/AT2 T— kl =
k -
—7 (P2V2 — РЛ) =
k — 1
k-i
kRT\ / \ k __ ;
k — 1 L \ Pi /
>iR
= — (T2 ~ Л) =
n — 1
= -^— (№ — A«l) =
11 — 1
Термодинамические основы охлаждения
Подолжение табл. 2 2.
Характеристика
изохорный, t>=const изобарный, />=const
я=±со /?=0
Изменение энтальпии Л/г Mrtj —/>1) (/г-1) = Ср(^2 ^1) = k = — fl) (k— n k 2 '
Изменение Энтропии As =coln—= = Cvln-^- Р1 =c„ln——= p 1 И2 = Ср In «1
Процесс
изотермический, 7'=const адиабатный или изоэнтропный, s=const; rf(?=0 политропный, pwn=const
п= 1 k= 11 cv n=const
0 ZT II £ bT? ile i- и -« । x.— 1 да 1
Ул =К1п—= »i Df Л = R In Р2 0 n — k T„ = c„ In—- ° n — 1 Tr
Частные виды процессов и специальные термодинамические функции
28
Термодинамические основы охлаждения
Рис. 2.2. Изображение процессов в диа-
грамме р, v
количество теплоты, участвующей в процес-
се, изображено заштрихованной площадкой
2
dq=Tds. Для процесса
=пл. 1-2-2'-!'.
1-2
Рис. 2.3. Изображение процессов в диа-
грамме Т, s
постоянных Т и V равно обратимой рабо-
те процесса Lo^:
NF=NLo6l,=AU—TSS.
Изобарно-изотермический потенциал
Ф=Д—TS4pV=H—TS. (2.22)
Потенциал Ф находится в таком же отно-
шении к F, как энтальпия Н к внутренней
энергии U. Изменение Ф также равно ЛОбр,
но в процессах с постоянными р и Т:
ALaap =АФ=ЛН—TAS.
Удельный изобарно-изотермический по-
тенциал (отнесенный к единице массы или
к одной молекуле) называется химическим
потенциалом:
p,=h—Ts.
Химический потенциал имеет важное значе-
ние при анализе фазовых равновесий, ког-
да требуется установить изменение термо-
динамических потенциалов при удалении
или добавлении некоторого количества ве-
щества dG в систему.
Можно показать [6, 8, 9, 45], что хи-
мический потенциал представляет собой
частную производную от любого термоди-
намического потенциала системы по массе
вещества G при постоянных значениях со-
ответствующих независимых переменных:.
/ с'Ф \ / dF \
\ дв ) р, т \ dG )v, т
/ дН\ / dU \ _
\ dG ) р, s \ dG Jv, s
Таким образом, химический потенциал чис-
ленно равен максимальной полезной работе,
отдаваемой в этих условиях системой вовне
при обратимом изменении массы системы
на единицу. При фазовом равновесии ц
для каждого компонента в жидкости и па-
ре должны быть равными и иметь мини-
мальное значение. Поэтому химический по-
тенциал— интенсивная величина, которая
служит движущей силой в системах с пе-
реходом массы между фазами. Подробнее
см. [8, 9, 14, 45].
При переменном количестве вещества
в выражении для термодинамических па-
раметров войдет дополнительный член, со-
держащий дифференциал массы тела ТС
[6]. Так, например, для внутренней энер-
гии и энтальпии
dU^TdS—pdV+pdG;
dH=TdS—VdpJr[idG.
Специальные термодинамические функ-
ции, Изохорно-изотермический потенциал,
или свободная энергия тела,
F=U—TS. (2.21)
Изменение потенциала F при переходе
системы из одного состояния в другое при
Для идеального газа d®=GRTdlnp-,
Ф=ФсЦ-бД7'In (р/ро), где Фо—значение
изобарно-изотермического потенциала при
стандартных условиях. ’
Для реального газа d<D=GRTd]nf;
&=®o+GRT In (f/f0)=®0-]_G/?T In a.
Соотношения между потенциалами F,
Ф и параметрами вещества:
Теория взаимного '.перехода теплоты и работы
29
dF= — SdT — pJV; S = ;
\ ol )v
_____! dF \
Р~ ~\dV jr’
( дФ \
d®=-SdT+Vdp-, S=- —- ;
\дТ / р
V = f—•
\ др )т
Эксергия (работоспособность) потока
вещества
Е = Н—Но—T0(S—So) или
e=h-hQ—To{s—So), (2.23)
где параметры с индексом 0 определяются
при давлении и температуре окружающей
систему среды.
При зафиксированных параметрах окру-
жающей среды ро, То эксергию потока
можно рассматривать как параметр состоя-
ния. В настоящее время построены диа-
граммы е, h для ряда веществ.
Эксергия теплового потока Eq =
=Q(T—T0)/T.
Сущность эксергии любого вида со-
стоит в том, что она численно равна тому
количеству работы, которое может быть по-
лучено от системы при ее обратимом пере-
ходе в равновесное состояние с окружаю-
щей средой.
При термодинамическом анализе про-
цессов (установок) полезно строить диа-
граммы потоков энергии, на которых по-
казаны и потоки эксергии, поскольку такие
диаграммы объединяют содержание обоих
основных законов термодинамики.
Энергетическую эффективность процес-
сов поавильно отражает эксергетический
КПД ‘
ЕЕ" EE' — D
е ЕЕ’ ЕЕ'
где —отведенная в процессе эксергия
любого вида (или работа); Е' — подведен-
ная эксергия; D — потери эксергии, свя-
занные с необратимостью процесса.
В настоящее время разработан метод
термодинамического анализа энергетических
и низкотемпературных процессов с исполь-
зованием функций Е, получивший название
эксергетического метода. Метод расширил
возможности анализа и оценки сложных
процессов [15—17. 37].
2.7. ТЕОРИЯ ВЗАИМНОГО ПЕРЕХОДА
ТЕПЛОТЫ И РАБОТЫ
Каждый процесс, в котором происхо-
дит расширение или сжатие газа, следует
рассматривать как процесс перехода тепло-
ты в механическую работу и внутреннюю
энергию или обратно. Для того чтобы теп-
ловая машина работала непрерывно, необ-
ходимо последовательное сочетание несколь-
ких процессов, в результате которых ра-
бочее тело придет в первоначальное со-
стояние. Подобное последовательное изме-
нение' состояний тела называется циклом.
Если отдельные процессы, входящие в цикл,,
обратимы, то и весь цикл также обратим.
Процесс называется обратимым, если физи-
чески допустимо вообразить изменение
направления процесса на обратное к ис-
ходному состоянию одновременно с приве-
дением всех взаимодействующих тел тоже
к их исходному состоянию. В противном
случае процесс называется необратимым.
На рис. 2.4 изображен произвольный
/’в
Рис. 2.4. Изображение кругового цикла
в координатах р, v
цикл в координатах р, V. Работа lh полу-
чаемая при расширении газа (рабочий про-
цесс) по ветви 1-а-2, равна площади
1-а-2-2'-1'. Работа Z2, затрачиваемая на сжа-
тие газа (вспомогательный процесс) по*
ветви 2-Ь-1, равна площади 2-Ь-1-Г-2'. Со-
вершаемая полезная работа l=li—12 изо-
бражается заштрихованной площадью.
Уравнение первого начала термодина-
мики для этого цикла:
<71 — ^2 — 41 I 1 j
\ 41 /
где ?i — теплота, подведенная на верхнем
температурном уровне Тц q2— теплота, от-
веденная на нижнем температурном уров-
не Т2.
Термический коэффициент полезного
действия цикла
41 “ ?2 , ?2
7)f = ----- = 1 — ---.
4i 4i
Наряду с циклами для взаимного пре-
вращения теплоты и работы достаточно
широко используют и разомкнутые процес-
сы— квазициклы. Если цикл представляет
собой круговой (замкнутый) процесс и по-
этому идет без обмена массой вещества
через границы термодинамической системы,,
то квазицикл характеризуется именно та-
ким обменом. Вместе с тем от других
разомкнутых процессов квазицикл отлича-
33
Термодинамические основы охлаждения
Рис. 2.5. Изображение цикла
ется обязательным обменом через границы
системы тепловыми потоками разного зна-
ка. Поэтому квазицикл, как и цикл, осу-
ществляет перенос теплоты с одного тем-
пературного уровня на другой с затратой
(или получением) работы, а в других
разомкнутых процессах такое преобразова-
ние невозможно, так как в них существует
внешний теплообмен только одного знака.
Подробно о квазициклах в низкотемпера-
турной технике см. [16]. Поскольку в крио-
генной технике как циклы, так и квазицик-
лы анализируются по одинаковым методи-
кам, в дальнейшем не делается разграни-
чения между циклом и квазициклом и ис-
пользуется для краткости один термин —
цикл.
Цикл Карно. Обратимый цикл Карно,
•состоящий из двух изотерм и двух адиа-
бат, дает максимальное количество рабо-
ты. получаемой из единицы теплоты при
•ее трансформации между двумя заданными
температурными уровнями. На рис. 2.5
цикл Карно изображен в координатах р,
V и Т, s.
Для цикла Карно
, Л-тг }
г = <7i—------; I
<7s У , т2 (
~ ™ =1 ——; г
?i Л Л
-J- As3 = 0. I
I 'T' X I «е I
1 1 1 2
(2.24)
Любой обратимый цикл может быть раз-
делен на элементарные бесконечно малые
циклы Карно между соответствующими
температурами, обусловленными протека-
нием данного цикла. Для любого обратимо-
го цикла
Карно в координатах р, v и Т, s
Обратный цикл Карно (цикл холодиль-
ной, теплонасосной или криогенной установ-
ки). Если в цикле Карио, рассмотренном ра-
нее, все процессы осуществлять в обратном
направлении (на рис. 2.5 штриховые стрел-
ки), то будет осуществлен цикл, смысл ко-
торого заключается в перенесении теплоты
q-2 с уровня низкой температуры Т2 на уро-
вень более высокой температуры Т\. Этот
процесс не идет самопроизвольно, для его
осуществления необходима затрата работы
I. Цикл служит для искусственного пере-
несения теплоты от холодного тела к бо-
лее теплому; машины, работающие по та-
кому циклу, называются в зависимости от
интервала температур, в которых они ра-
ботают, холодильными, теплонасосными
или криогенными. Количество теплоты q2
определяют как удельное количество тепло-
ты цикла, воспринятой холодильным аген-
том. Затраты работы
Т,— Т2
1 = Я2- -т- -• <2.25)
J 2
Количество теплоты, отводимой на
уровне Т1,' равно сумме удельной теплоты,
воспринятой холодильным агентом, и за-
траченной работы </1=</2+/.
Холодильный коэффициент цикла Кар-
но г=р2/1=Т2/{Т1—Т2) (при q и I в джоу-
лях) зависит только от уровня темпера-
тур, между которыми протекает цикл.
Эксергетический КПД т]е обратного
цикла Карно, как и прямого, равен еди-
нице.
Между т]е и s имеется связь: прн Г2=
=Г и Г1=Г0 Пе=вт«, где Хе= (Т—ТоУ/Т —
фактор Карно.
Необратимые циклы. Все действитель-
но осуществляемые процессы и циклы ча-
стично необратимы.
Для таких циклов справедливы нера-
венства
Эксергетический КПД цикла Карно цг=1.
<[>^-<0, $*>0.
7]^ — 1.
Абсолютная термодинамическая шкала температур
2.8. АБСОЛЮТНАЯ
ТЕРМОДИНАМИЧЕСКАЯ ШКАЛА
ТЕМПЕРАТУР И ОТРИЦАТЕЛЬНЫЕ
АБСОЛЮТНЫЕ ТЕМПЕРАТУРЫ
Абсолютная термодинамическая темпе-
ратура. Соотношения (2.24), действитель-
ные для цикла Карно, служат для построе-
ния абсолютной термодинамической шкалы
температур. В этом цикле отношение тем-
ператур TilT2 можно определить незави-
мо от свойств рабочего тела, если найти
отношение <71/172, т. е. использовать цикл
Карно для измерения температуры. Если
одни из изотермических процессов прово-
дить при температуре тройной точки воды
(эта температура произвольно установлена
Гт=273,16 К, как и в случае идеальной
газовой шкалы), то любая другая темпе-
ратура Т определяется уравнением
7=273,16<7/<7т, (2.26)
где <?т — количество теплоты, подводимой
(отводимой) при Тт. Установленная таким
образом шкала называется температурной
шкалой Кельвина. Наинизшее значение тем-
пературы в этой шкале (О К) соответству-
ет q=0, т. е. изотерма и адиабата здесь
идентичны. В этом случае для цикла Кар-
но 111=1 и, следовательно, более низкой
температуры быть не может, поскольку т[г
ие может превышать единицы. Так как
свойства газов при большом разрежении
близки к свойствам идеального газа, тер-
модинамическая температурная шкала в
пределах значительного температурного
интервала совпадает со шкалой, установлен-
ной посредством газового термометра, за-
полненного сильно разреженным газом. В
метрологии установлены способы перехода
от эмпирических шкал температур к абсо-
лютной термодинамической.
Отрицательные абсолютные температу-
ры. Для понимания смысла отрицательных
температур рассмотрим определение тем-
пературы, используемое в статистической
физике.
По соотношениям Максвелла темпера-
тура определяется формулой
/ да \
Т = — • (2.27)
\ 0s / 0
Отсюда следует, что по мере роста тем-
пературы, т. е. при подводе энергии, все
большее число частиц переходит на верх-
ние энергетические уровни и соответствен-
но возрастает беспорядок системы, по-
скольку частицы располагаются по боль-
шему числу уровней. Таким образом, с ро-
стом энергии и энтропии (А« и As поло-
жительны) &u/As также положительно и,
следовательно, Т имеет положительное зна-
чение. Для того чтобы Т имела отрица-
тельные значения, возрастание энергии
должно сопровождаться уменьшением
энтропии. Поскольку помимо характери-
стики интенсивности движения частиц
температура служит величиной, опреде-
ляющей распределение частиц по энергети-
ческим уровням, в соответствии с формулой.
Больцмана
и
ьт
п/по = е , (2.28/
где «о и я — число частиц на исходном!
уровне и на уровне и. Это соотношение
«позволяет» принимать температуре и от-
рицательные значения. Очевидно, что при
равновесном состоянии системы и положи-
тельных Т в соответствии с формулой
(2.28) п всегда меньше Однако если
осуществить систему, в которой по<п, то.
это означало бы, что температура имеет
отрицательное значение. Отсюда вытекает,
что отрицательные температуры могут быть
реализованы не в классической системе,
а только в квантовых системах с конечным
числом энергетических уровней с учетом
того, что энтропия определяет степень бес-
порядка системы. В такой системе при аб-
солютном нуле температур все частицы
будут занимать единственно возможные
наинизшие уровни и энтропия будет равна
нулю.
С ростом температуры частицы будут
занимать все более высокие энергетические
уровни, число которых, однако, конечно.
Случаю, когда все уровни «заселены» рав-
номерно (я/яо=1), отвечает наибольший
беспорядок системы (s=max), а темпера-
тура согласно формуле Больцмана равна
-1-00. Если дальше подводить энергию к
системе, то все большее число частиц (я>
>п0) будет располагаться только на са-
мом высоком энергетическом уровне, будет
устанавливаться большая упорядоченность
и поэтому энтропия системы будет умень-
шаться. В соответствии с формулами (2.27)
и (2.28) это означает, что система имеет
отрицательные температуры. Когда все ча-
стицы соберутся на высшем уровне, уста-
новится полная упорядоченность (s=0).
На рис. 2.6 для такой системы дана зави-
симость энтропии s от энергии Е. Итак,
возможны: а) полная упорядоченность на
наинизшем уровне — это обычный абсолют -
*8
Рис. 2.6. Зависимость энтропии от энергии
для систем с отрицательными абсолютны-
ми температурами
32
Термодинамические основы охлаждения
ный нуль (Т=+0); б) полный беспорядок
(s=max и Т=±°о) и в) снова полная
упорядоченность частиц на высшем энерге-
тическом уровне (Т=—0). Наблюдается
удивительная ситуация, когда для дости-
жения отрицательных температур необхо-
димо увеличивать энергию системы, т. е.
отрицательные температуры «горячее» бес-
конечно высоких. Однако если состояние
при обычном нуле температуры равновесно
устойчиво, то состояние при отрицательных
температурах крайне неравновесно: части-
цы, находящиеся на высшем энергетическом
уровне, должны в конце концов перейти на
более низкий.
Отрицательные абсолютные температу-
ры были реализованы на ядерных спинах
ионов лития в кристаллах LiF, помещен-
ных в магнитное поле. В обычных условиях
спины ядер в магнитном поле расположе-
ны по направлению поля (низкий энергети-
ческий уровень). При быстром изменении
вектора поля все спины окажутся располо-
женными против направления поля (высо-
кий энергетический уровень), т. е. при от-
рицательной температуре. Через некоторое
впемя, конечно, спины придут в равновесие
с кристаллической решеткой с выделением
излучения и вернутся в исходное положе-
ние. Это излучение перехода системы с от-
рицательных температур к положительным
реализовано в молекулярных генераторах
и усилителях (мазеры и лазеры) и дает
возможность осуществить стимулированные
электромагнитные излучения.
Подробнее об отрицательных темпера-
турах см. [6—8].
2.9. ЭНТРОПИЯ КАК МЕРА ПОТЕРЬ И
НЕОБРАТИМОСТИ
Из рассмотрения обратимых циклов
для преобразования теплоты в работу (см.
рис. 2.5) видно, что из всего количества
подведенной теплоты в работу переходит
лишь часть:
I = 91 - 9г = 91 — у- Т2 = ?! — \sT2.
1 (2.29)
Другая часть подведенной теплоты о2=
91
— .j, T2=L\sTa не может быть превраще-
на в работу, она неизбежно передается
окружающей среде. Во всех технических
процессах Т2 обычно строго зафиксирова-
на — это температура окружающей среды,
обозначаемая То. Таким образом, As может
служить мерой безвозвратно потерянной
(с точки зрения получения работы) части
теплоты.
Потери при необратимых процессах.
При переходе системы из одного опреде-
ленного состояния в другое по второму на-
чалу термодинамики приращение энтропии
окружающей среды при необратимых про-
цессах должно быть больше, чем при об-
ратимом, т. е. 6s=,AsHeo6p—AsO6p>0. Вся-
кое изменение энтропии связано с переда-
чей теплоты, поэтому 6?=T0As. В рассмот-
ренной нами изолированной системе пере-
дача окружающей среде дополнительного
количества теплоты возможна только при
условии уменьшения полезно производимой
работы:
6/=?обр—^нео 6p~|69“^o6s. (2.30)
Для обратимых циклов 6s=0.
Равенство (2.30) по Гюи— Стодоле
формулируется следующим образом: при
необратимых процессах любого рода полез-
ная работа уменьшается на величину, про-
порциональную возрастанию энтропии всех
взаимодействующих тел, обусловленному
необратимостью. Коэффициентом пропор-
циональности служит температура То при-
емника теплоты, т. е. окружающей среды.
Потери при теплообмене. Процесс теп-
лообмена может протекать между телами
только при неравенстве температур и по-
этому всегда сопровождается потерей эк-
сергии (обесцениванием энергии), т. е.
возрастанием энтропии системы в целом.
Если от одного тела с температурой 7,
передается теплота dq другому телу с тем-
пературой Т2, то
ds = dsr — ds2 —
dq dq
Приращение энтропии всегда больше
нуля, так как Ti больше Т2.
Возрастание энтропии зависит не
только от разности температур Т\—Т2, оно
также обратно пропорционально произведе-
нию ТТТ2. При одинаковой разности тем-
ператур возрастание энтропии в процессе
теплообмена существенно больше при низ-
ких температурах, чем при высоких. Это
важно учитывать при проектировании низко-
температурных теплообменников, чтобы из-
бежать повышенных потерь от необрати-
мости.
Потери при теплообмене иллюстрирует
рис. 2.7. Здесь теплота передается от тела
Рис. 2.7. Возрастание энтропии и потер!
эксергии при передаче теплоты от тела i
к телу Б
Процессы повышения давления
33
А к телу Б. Площади so-a-b-St и s0-c-d-s2,
а также площади a-b-e-с и e-d-s2-si равны
МеЖДУ Собой. ВИДНО, ЧТО S2—Х|=ДЗн<!Обп.
Удельная эксергия, отданная телом А, изо-
бражена площадью a-b-m^k, а полученная
телом Б — площадью c-d-n-tk. Из графика
видно, что потеря удельной эксергии d=
=7'оЛ5необр изображается площадью
m-n-s2-sb
Изменение полной эксергии потока А
д£д=ДЯА—TabSA=Hb— На—То (St—So), а
потока Б —На—Hz—
—T0X(S2—S0). Отсюда эксергетический
КПД теплообменника
Д£в_ Д/-/б-7'0ДАб
” ьеа \На - T0\SA ’
ИЛИ
Tb-Ta-T0\uTb/Td •
Последнее равенство действительно для
теплоносителей с одинаковыми и постоян-
ными С?, равными значениям тепловых
эквивалентов потоков.
Предельное значение работы перехода
системы из одного состояния в другое.
Температура окружающей среды служит
обычно нижней изотермой (холодильник)
для циклов двигателей, т. е. при переводе
теплоты в механическую энергию, но
верхней изотермой (приемник теплоты) для
обратных — холодильных и криогенных
циклов, т. е. при передаче теплоты с низ-
кого температурного уровня на более вы-
сокий. Из сопоставления основного урав-
нения начала п2—Щ=ц—I и второго
(s2—Si)—гу/’/’^О следует
/Са,—и2—То (St—s2) =Ди—Т0Дэ.
Знак равенства соответствует обратимому
(идеальному) процессу, знак неравенства—
необратимому реальному. Полезно исполь-
зуемая работа /пл меньше I на величину
р0(щ—v2)—работу, совершаемую рабочим
телом против давления атмосферы р0 при
изменении удельного объема от Oj до v2:
/пл—Ut—и2—To(St—s2) +ро(^1—
—Ц2) = (И1—ToSi+poVi) —
— (w2—Tbs2 + pov2). (2.31)
Формула (2.31) справедлива для по-
стоянного количества единицы рабочего
тела. Для потока полезно используемая
работа — это техническая работа /т. Она
определяется из сопоставления уравнений
(s2—Sl)_q/To^O и (2.15):
1т=/ц—h2~T0 (Si—S2) =
=Ы1—Т^5=Ье. (2.32)
Важно отметить, что правая часть
уравнения (2.32) есть изменение эксергии
Де (см. § 2.6). Это уравнение очень важно
для расчетов в области низкотемператур-
ной техники, так как дает возможность
найти, например, в условиях непрерывного
процесса минимальную работу для сжиже-
ния газа или решить другую аналогичную
задачу, связанную с трансформацией теп-
лоты с одного температурного уровня на
другой.
Эксергетический КПД гр имеет важ-
ное значение при оценке эффективности
различных процессов и циклов:
/зат-S^As i ST0As 1 D
- = J — —* —J —-•
^зат----------------------------^зат ^зат
__ Дин Дин Д^
Даг Дин “Ь ST'qAs /зат
где /мин=Де и /зат — соответственно тер-
модинамически минимально необходимая и
действительно затраченная работа; STaAs=
—D — потери эксергии, связанные с необ-
ратимостью процессов.
2.10. ПРОЦЕССЫ ПОВЫШЕНИЯ
ДАВЛЕНИЯ
Процессы сжатия в компрессоре изо-
бражены на рис. 2.8 в диаграммах р, v и
Т, s. Техническая работа /т сжатия здесь
эквивалентна алгебраической сумме трех
площадей: Ц—пл. С-В-В'-С (работа изме-
нения объема), /2=пл. D-C-C'-D' (работа
3-218
Рис. 2.8. Изображение процесса сжатия газа в координатах р, v и Т, s
34
Т ермодинамические основы охлаждения
Рис. 2.9. Изображение теоретического процесса трехступенчатого сжатия
газа в координатах р, v и Т, s
всасывания) и, наконец, /3=пл. B-A-D'-B'
(работа выталкивания):
»2
ZT=ZI+Z3—Z2= pdv-\~P2^2—
у,
Z>2
Pt
Таким образом, ZT графически на диа-
грамме р, v изображается площадью
C-B-A-D (горизонтальная штриховка).
Для любого процесса сжатия техни-
ческая работа на основе уравнения (2.15)
2 2
vdp = (й2— йх) — ^Tds.
(2.33)
Работы изменения объема Ц и техни-
ческая ZT зависят от характера процесса
сжатия в компрессоре и могут быть опре-
делены по формулам, приведенным в
табл. 2.2. В случаях изотермического или
адиабатного сжатия техническая работа
равна разности эксергии газа на выходе
и входе е2—еь Для изотермического про-
цесса Zi=ZT.
На рис. 2.8 вертикально заштрихован-
ная площадка под адиабатой представляет
собой изменение внутренней энергии ц2—Wi
и соответствует работе изменения объема.
Горизонтально заштрихованная площадка
эквивалентна изменению энтальпии й2—ht,
т. е. технической работе при адиабатном
повышении давления.
На рис. 2.9 в диаграммах р, v и Т, s
изображен процесс сжатия в многоступен-
чатом (трехступенчатом) компрессоре. Ра-
ционально иметь одинаковую мощность
каждой ступени — это соответствует оди-
наковой степени повышения давления по
ступеням., Степень повышения давления х
в каждой ступени при их общем числе п
определяется по формуле
х — Рго«/Рпач •
Допустимые значения х в зависимости!
от свойств газа находятся в диапазоне от
3 до 6. .
Сжатие реального газа. При сжатии<
газов со сравнительно высокой темпера-
турой кипения (например, метана, этилена)
нельзя пренебрегать отличием их свойств
от свойств идеального газа. При изотер-
мическом сжатии техническая работа по
(2.33)
lT=T0(sl—s2) — (hi—Н2)=в2—ei.
Для реального газа при Т\=Т2 h\ и
h2 не равны между собой н поэтому ZT=
=пл. (а-2-l'd) — (пл. b-3-l-d) (рис. 2.10)..
Рис. 2.10. Изображение процесса изотер-
мического сжатия реального газа в диа-
грамме Т, s
Таким образом, окружающей среде при1
сжатии реальных газов передается либо'
больше теплоты, чем затрачено работы на-
сжатие, либо меньше на величину hi—/г2.
Знак этой разности Зависит от природы
газа. Это положение справедливо для лю-
бого процесса сжатия (не только изотер-
мического) .
Работа гкомп, затрачиваемая компрес-
сором
1комп — /тадА1ад “ ^тиз/“Пиз,
где 1тад, 1тиз — техническая работа соот-
ветственно адиабатного и изотермического
сжатия, равная е2—(табл. 2.3); т]ад и
Процессы повышения давления
35
Таблица 2.3. Техническая работа,
затрачиваемая на повышение давления
Л кмоля газа при 300 К (объем 1 кмоля
газа при 0,1013 МПа и 300 К равен
24,6 м3)
Степень повышения давления Работа изотерми- ческого сжатия, кВт-ч Работа адиабат- ного сжатия (6 = 1,4), кВт-ч Работа адиабатного сжатия (6=5/3), кВт-ч
1,05 0,0338 0,0340 0,0341
4,10 0,0660 0,0669 0,0673
1,15 0,0968 0,0988 0,0996
. 4,20 0,1263 0,1297 0,1310
1,25 0,1546 0,1596 0,1617
1,30 0,1818 0,1888 0,1917
1,35 0,2079 0,2171 0,2209
1,40 0,2331 0,2447 0,2495
1,45 0,2574 0,2716 0,2776
.1,50 0,2809 0,2979 0,3050
1,60 0,3256 0,3485 0,3583
1,70 0,3677 0,3970 0,4096
1,8 0,4073 0,4434 0,4591
1,9 0,4447 0,4881 0,5070
•2,0 0,4803 0,5311 0,5534
.2,1 0,5141 0,5726 0,5985
.2,2 0,5463 0,6127 0,6523
.2,3 0,5771 0,6515 0,6849
.2,4 0,6066 0,6892 0,7264
.2,5 0,6349 0,7257 0,7668
2,6 0,6620 0,7612 0,8063
.2,7 0,6882 0,7958 0,8450
2,8 0,7134 0,8294 0,8827
.2,9 0,7377 0,8622 0,9197
3,0 0,7612 0,8942 0,9559
3,1 0,7839 0.9254 0,9914
•3,2 0,8059 0,9560 1,0262
3.3 0,8272 0,9858 1,0603
.3,4 0,8479 1,0150 1,0939
3,5 0,8680 1,0437 1,1268
3,6 0,8875 1,0717 1,1592
3,7 0,9065 1,0992 1;1911
3,8 0,9250 1,1261 1,2225
3,9 0,9430 1,1526 1,2533
4,0 0,9605 1,1785 1,2837
4,1 0,9776 1,2.141 1,3136
4,2 0,9943 1,2291 1,3431
4,3 1,0106 1,2538 1,3722
4,4 1,0265 1,2780 1,4009
-4,5 1,0421 1,3019 1,4292
4,6 1,0573 1,3254 1,4571
4,7 1,0722 1,3485 1,4847
4,8 1,0868 1,3712 1,5119
4,9 1,1011 1,3937 1,5387
5,0 1,1151 1,4158 1,5653
5,1 1,1288 1,4376 1,5915
5,2 1,1423 1,4591 1,6474
5,3 1.1555 1,4803 1,6430
5,4 1,1684 1,5012 1,6684
5,5 1,1812 1,5218 1,6934
5,6 1,1936 1,5422 1,7182
5,7 1,2059 1,5623 I,7427
У
П родолженае табл. 2.3
Степень повышения давления Работа изотерми- ческого сжатия, кВт-ч Работа адиабат- ного сжатия (6=1,4), кВт-ч Работа адиабатного сжатия (£=5/3), кВт-ч
5,8 1,2180 1,5821 1,7670
5,9 1,2298 1,6018 1,7910
6,0 1,2414 1,6212 1,8147
6,1 1,2529 1,6403 1,8383
6,2 1,2642 1,6592 1,8616
6,3 1,2752 1,6779 1,8846
6,4 1,2862 1,6965 1,9075
6,5 1,2969 1,7148 1,9301
6,6 1,3075 1,7328 1,9526
6,7 1,3179 1,7508 1,9748
6,8 1,3282 1,7685 1,9968
6,9 1,3383 1,7860 2,0187
7,0 1,3482 1,8033 2,0403
7,2 1,3678 1,8375 2,0831
7,4 1,3868 1,8710 2,1251
7,6 1,4052 1,9039 2,1665
7,8 1,4232 1,9361 2,2072
8,0 1,4408 1,9678 2,2473
8,5 1,4828 2,0445 2,3450
9,0 1,5224 2,1181 2,4393
9,5 1,5598 2,1888 2,5305
10 1,5954 2,2570 2,6188
15 1,8763 2,8320 3,3849
20 2,0756 3,2824 4,0090
25 2,2302 3,6581 4,5450
30 2,3566 3,9834 5,0199
35 2,4634 4,2719 5,4493
40 2,5559 4,5324 5,8433
45 2,6375 4,7705 6,2088
50 2,7105 4,9904 6,5506
55 2,7765 5,1951 6,8725
60 2,8368 5!3869 7,1772
65 2,8923 5,5676 7,4671
70 2,9436 5,7387 7,7439
75 2,9914 5,9012 8,0090
80 3,0361 6,0561 8,2638
85 3,0781 6,2043 8,5091
90 3,1177 6,3464 8,/460
95 3,1552 6,4830 8,9751
100 3,1907 6,6145 9,1970
105 3,2246 6,7414 9,4124
ПО 3,2568 6,8640 9,6217
115 3,2876 6,9827 9,8254
120 3,3171 7,0978 10,024
125 3,3454 7,2095 10,217
130 3,3725 7,3181 10,406
135 3,3987 7,4237 10,591
140 3,4239 7,5266 10,772
145 3,4482 7,6269 10,948
150 3,4717 7,7247 11,121
155 3,4944 7,8203 11,291
160 3,5164 7,9136 11,458
165 3,5377 8,0049 11,621
170 3,5584 8,0943 11,781
175 3,5785 8,1817 11,939
180 3,5980 8,2675 12,094
36
Термодинамические основы охлаждения
Продолжение табл. 2.3
Степень повышения давления Работа изотер- мического сжатия, кВт -ч Работа адиабат- ного сжатия (£=1,4), ' кВт -ч Работа адиабатного сжатия (£=5/3), кВт -ч
185 3,6170 8,3515 12,246
190 3,6355 8,4339 12,396
195 3,6535 8,5148 12,544
200 3,6710 8,5942 12,689
220 3.7370 8,8984 13,249
240 3,7973 9,1834 13,780
260 3,8528 9,4520 14,285
280 3,9041 9,7062 14,767
300 3,9519 9,9477 15,228
Т]из — адиабатный н изотермический КПД
компрессора. Обычно т)ад=0,65-Ч),80; пиз=
=0,5ч-0,65.
Особенности повышения давления в
центробежных компрессорах. Одна ступень
центробежного компрессора (рнс. 2.11,а)
Рнс. 2.11. Ступень центробежного ком-
прессора
состоит нз укрепленного на валу 1 и вра-
щающегося с ним рабочего колеса 2 с ло-
патками и неподвижного лопаточного диф-
фузора 3, охватывающего рабочее колесо.
Газ поступает по оси в центральную часть
рабочего колеса, между лопатками кото-
рого под действием центробежной силы
сжимается, приобретает большую скорость
и направляется в диффузор 3. Здесь ки-
нетическая энергия газа переходит также
в давление. Далее сжатый газ по специ-
альным каналам 4 (обратный направляю-
щий аппарат) подводится к следующей
ступени. В зависимости от требуемой сте-
пени повышения давления число ступеней
может быть от единиц до десятка и даже
более. Обычно турбокомпрессоры исполь-
зуют для сжатия до 0,3—1,0 МПа, однако
есть машины и на давление до 2,5—
3,0 МПа.
В общем случае (радиальная машина)
теоретическая работа /т, Дж/кг, передан-
ная рабочему телу, определяется уравнени-
ем Эйлера:
. _ «а2 —«12 , toa2 —- w 2 с22 — ct2
т — 2 + 2 ' 2
(2.34а)
где и—окружная скорость, м/с; w — ско-
рость газа вдоль лопаток, м/с; с — абсо-
лютная скорость газа, м/с. Индексы 1 и
2 соответствуют точкам входа и выхода с
колеса (рис. 2.11,6).
Уравнение. (2.34а) справедливо незави-
симо от характера процесса повышения
давления и свойств рабочего тела.
Работа /ст, определяемая двумя пер-
выми слагаемыми уравнения, называется
работой по созданию статического напора,
а отношение р=/ст//т — коэффициентом
реактивности. Очень часто р=0,5ч-0,7.
Обычно в центробежных машинах
стремятся подвести поток газа к входным
кромкам лопаток радиально, при этом ра-
бота, переданная газу, будет максималь-
ной и определится выражением
/т = ф22«22, (2.346)
где <p2=C2u/w2 (рис. 2.11,6). Значение фг
для лопаток, загнутых назад, 0,55—0,7,
радиальных 0,7—0,9, загнутых вперед
1—1,1. Во избежание снижения КПД не
следует применять значения скоростей сг
или to2 более скорости звука, т. е. число
Маха Мс2 или Mw2 должно быть меньше'
1. В большинстве случаев с2 больше о>2
для таких машин с2/И2=0,5ч-0,7 [12, 13].
Окружная скорость и2 для стальных колес
по условиям прочности не должна превы-
шать 270—300 м/с. В специальных кон-
струкциях колес скорость доводится и до
значений 400—500 м/с.
При повышении давления относитель-
но легких газов ограничением на окруж-
ную скорость служит, как правило, усло-
вие прочности колеса, а не значение Л‘Г2;
при компримировании газов с высокой
плотностью окружения скорость ограничи-
вается, напротив, не прочностью, а усло-
вием Мс2<1.
Реальные газы и конденсированное состояние
37
Из уравнения (2.346) следует, что
при постоянном значении <р2 работа ZT опре-
деляется только частотой вращения рото-
ра. Сопоставляя (2.346) с формулой изо-
энтропной работы сжатия, можно пока-
зать, что при конкретных <р2 и и2 отноше-
ние давлений в компрессоре зависит как
от природы газа, так и от его начальной
температуры. Особенно сильно сказывает-
ся влияние газовой постоянной рабочего
тела R. При заданном ZT отношение дав-
лений для «легких» газов (большие R)
очень маленькое; для «тяжелых» газов оно
существенно больше. Поэтому при сжатии
азота, метана и других «тяжелых» газов
степень повышения давления на одной сту-
пени составляет 1,2—1,3, а для водорода
и гелия существенно меньше.
Для турбокомпрессоров (при условии
квадратичного характера сопротивления
сети) производительность пропорциональна
частоте вращения вала, степень повышения
давления — квадрату частоты вращения, а
потребляемая мощность — кубу частоты
вращения.
Отклонение действительного процесса
от идеального учитывается КПД. Общий
изотермический КПД для турбокомпрессо-
ров 0,55—0,70 (большая цифра — для
крупных машин).
Подробно о расчете компрессоров см.
2.11. РЕАЛЬНЫЕ ГАЗЫ
И КОНДЕНСИРОВАННОЕ
СОСТОЯНИЕ
Критические параметры. На рис. 2.12
в координатах р, v нанесены изотермы ре-
ального газа. Верхняя пограничная кри-
вая, или кривая конденсации, и нижняя
пограничная кривая, или кривая кипения,
линия Облает Линия
сублимации сублимации десублимации
Рнс. 2.12. Изотермы реального газа в ко-
ординатах р, v и пограничные линии двух-
фазной области
сходятся в точке К — критической точке.
Температура, давление и объем, соответ-
ствующие этой точке, называются крити-
ческими параметрами вещества и обозна-
чаются Тк, рк, vK. Левее нижней погра-
ничной кривой вещество находится только
в виде жидкости или твердого тела, пра-
вее верхней пограничной кривой — в виде
перегретого пара или газа. Однако проти-
вопоставление жидкого и газообразного
состояний вещества имеет смысл только
для области ниже критического давления
Рк. При давлении, большем рк, вещество
всегда остается однородным и его невоз-
можно получить в двух фазах. Значения
критических параметров для ряда газов
приведены в табл. 4.109.
Уравнения состояния реального газа.
Уравнение Ван-дер-Ваальса для реальных
газов:
(p + a/v2) (V—b)=RT. (2.35)
Это уравнение качественно хорошо отра-
жает поведение реальных газов, включая
и область сжижения. Величины а и b —
константы, характерные для каждого газа.
В табл. 2.4 помещены значения этих кон-
стант для 1 моля некоторых газов.
Таблица 2.4. Значения констант
уравнения Ван-дер-Ваальса для
некоторых газон [259]
Газ МПа-л2 О, моль2 ь, — моль
Азот 0,1390 0.03913
Аргон 0,1345 0,322
Аммиак 0,4170 0,0371
Ацетилен 0,4390 0,05136
н-Бутан 1,447 0,1226
Водород 0,0244 0,0266
Водяной пар 0,5464 0,0305
Воздух 0,1338 0,03634
Гелий 0,003412 0,0237
Диоксид серы 0,6714 0,0563
Диоксид азота 0,5284 0,0443
Кислород 0,1360 0,0318
Криптон 0,2318 0,0398
Ксенон 0,4194 0,0510
Метан 0,2253 0,0428
Неон 0,0211 0,0171
Оксид углерода 0,1485 0,0399
Оксид азота 0,134 0,0278
Пропан 0,8664 0,0844
Пропилен 0,838 0,083
Сероводород 0,4431 0,0428
Озон 0,2217 0,0299
Диоксид углерода 0,3592 0,0427
Хлор 0,6493 0,0562
Фтор 0,1179 0,0261
Этан 0,5489 0,0638
Этилен 0,447 0,0571
38
Термодинамические основы охлаждения
Уравнение (2.35) — кубическое по от-
ношению к V. Зависимость о от р в об-
ласти насыщенного пара показана на
рис. 2.12 штриховой линией. Точки С, В,
Е — это три корня уравнения при зафик-
сированной температуре Т. Участок от точ-
ки В до крестика соответствует переохлаж-
денному или перенасыщенному пару; уча-
сток от точки С до крестика — перегретой
жидкости.
Из уравнения Ван-дер-Ваальса для
критической точки можно получить
рк=а/(27b2); vK=3b; Тк=8а/(27bR).
Таким образом, если известны критиче-
ские параметры вещества, то можно найти
для него коэффициенты а, b и газовую
постоянную:
6=t)K/3; а=ЗркЛ; R=8/3pKvK/TK.
Однако для реальных газов числовой ко-
эффициент в равенстве для R отличается
от 8/3 и лежит в интервале от 3 до 4,2.
Константы а и b имеют физический смысл.
Константа а характеризует величину сил
притяжения молекул, а константа b —
уменьшение свободного объема, в кото-
ром движутся молекулы, из-за конечных
размеров молекул и представляет, собой
учетверенный объем молекул данного ко-
личества газа.
Приведенное уравнение Ван-дер-Вааль-
са. Если найденные выше крнстанты а, b
и R подставить в уравнение (2.35), то по-
лучим
(л+3/ф2) (Зср— 1)=8т, (2.36)
где л=р/рк; tp=v/vs; т=Т'ТУ,.
Это уравнение не содержит каких-либо
индивидуальных, характерных для кон-
кретного вещества констант и поэтому слу-
жит для всех газов, соответствующих мо-
дели Ван-дер-Ваальса. Состояния газов,
имеющих одинаковые значения л, Ф и т,
называются соответственными. На рис. 2.13
дана диаграмма в приведенных координа-
тах, рассчитанная по уравнению Ван-дер-
Ваальса.
Все вычисления, основанные на урав-
нении Ван-дер-Ваальса, следует рассматри-
вать как приближенные, отражающие кар-
тину лишь качественно.
Часто пользуются для записи свойств
реальных газов уравнением Камерлинг-Он-
неса:
pv=RT + B/v-]-C/v2 +
+Dlvi+E/vi-\-Flvi.
Константы В, С и т. д. называются ви-
риальными коэффициентами и в свою оче-
редь являются функциями температуры.
Например,
В=&1Г+&2+&з/7’ + &4/Т2+ ...
Значение этих коэффициентов для неко-
торых газов см. в § 4.1. Известно большое
число других предложенных различными
авторами эмпирических уравнений состоя-
ний. Обзор некоторых из этих уравнений
см. в [8, 206].
Действительная сжимаемость газов так-
же служит характеристикой состояния га-
за. Данные о сжимаемости газов см. в §4.1.
На рис. 2.14 приведена диаграмма ро, р
для воздуха [257]. Она характерна для
всех реальных газов.
Сжимаемость газов может быть вы-
ражена степенью сжимаемости (единицы
Амага) 5=р]г>1/(рог’о), где р0о0 берется для
состояния газа при 0 °C и 0,1013 МПа и
коэффициентом сжимаемости Z=pvl(RT).
Между степенью сжимаемости и коэф-
фициентом сжимаемости имеется простое
соотношение: Z=\dTo!T.
Сжимаемость вещества в конденсиро-
ванном состоянии часто характеризуется
коэффициентом изотермической сжимаемо-
сти %:
1 7 до \
7.'--- ~
О0 \ о р JT
Теплоемкость — это отношение количе-
ства теплоты, подведенной к телу в дан-
ных условиях, к соответствующему повы-
шению температуры. Удельной теплоемко-
стью с называют количество теплоты, под-
веденной к 1 г или 1 кг вещества для на-
гревания его на 1 °C; молярная теплоем-
кость с — то же, но отнесенное к молю
или кмолю. При подводе теплоты в изохор-
ном процессе имеем cp=(dqldT) v=
= (дujдТ) „; в изобарном процессе ср=
= (dq/dT)P=(dh/dT)p.
Соотношение различных единиц раз-
мерности теплоемкости см. в разд. 1. Сред-
няя теплоемкость тела при осуществлении
данного процесса пгх в интервале темпе-
ратур от Г1 до Г2 определяется уравне-
нием
Cmx=>Cli—vl(^2—Т[) .
Истинная теплоемкость тела в каком-
либо процессе есть отношение подведенной
теплоты к изменению вследствие этого тем-
пературы ДГ, когда ДГ стремится к 0:
c*=Iim^=pq .
дг^о ДГ \ дТ ) х
Общие соотношения между теплоемко-
стями ср и с„ и их зависимости от других
параметров см. в § 2.2, 2.5.
Теплоемкость реальных газов аналити-
чески часто выражают в виде суммы двух
слагаемых:
cv = cva3 + и ср = сро + Дср,
где сР„ и сРо — теплоемкости газов в иде-
альном состоянии; Acj, и Дср—слагаемые,
являющиеся функциями Тир.
На рис. 2.15 дана зависимость ср от
Тир для воздуха ,[257]. Этот характер
зависимости —общий для всех реальных
Реальные газы и конденсированное состояние
39
газов. Средние значения теплоемкости для
газа в данных условиях при расчетах удоб-
но снимать с соответствующей диаграммы
состояния. Например, при p=const опреде-
ляют изменение энтальпии Д/г в заданном
температурном интервале ДГ и срот=
=Д/г/|Д7'. Теплоемкость газов в нормальных
условиях дана в табл. 4.109.
Теплоемкость твердых тел. Вследствие
незначительного теплового расширения раз-
ность ср— cv для твердых тел очень мала
н в инженерных расчетах, как правило, ею
можно пренебречь. Теплоемкость твердого
тела в основном зависит от «решеточных»
возбуждений, связанных с колебаниями ча-
стиц, образующих кристаллическую решет-
ку. По квантовой теории Дебая решеточ-
ная молярная теплоемкость кристалла,
МДж/ (моль-К),
' Сь=Зл/?£>(0/7'), (2.37)
где п— число атомов в молекуле; Р — га-
зовая постоянная; D/S/T)—функция Де-
бая — табулирована [31, 259].
40
Термодинамические основы охлаждения
Рис. 2.14. Диаграмма pv, р для воздуха
Характеристическая температура Де-
бая, или дебаевский параметр 0, опреде-
ляется равенством k^=h<s>m, где k — посто-
янная Больцмана; h — постоянная Планка;
(i>m — максимальная частота тепловых
возбуждений, причем полное число коле-
баний с частотами от 0 до ыт равно чис-
лу степеней свободы ЗА' (У — число ато-
мов в теле) [6]; Xm=l/com — наименьшее
допустимое значение длины волны, равное
постоянной решетки.
С уменьшением температуры ниже 0
энергия тепловых движений kT убывает и
поэтому не может возбуждать всех воз-
можных колебаний, в результате чего теп-
лоемкость начинает быстро убывать. При
температурах, значительно меньших 0, теп-
лоемкость уменьшается пропорционально
кубу температуры (закон Г3), что соответ-
ствует экспериментальным данным н форму-
ле Дебая. Температура (параметр Дебая)
0 может считаться объективной границей
между высокими н низкими температура-
ми, причем не только по отношению к
теплоемкости.
Значения теплоемкости по Дебаю да-
ны в табл. 4.90 и 4.92.
Согласно теории Дебая теплоемкости
у всех тел, обладающих одинаковыми 0/7,
должны быть одинаковыми. В действи-
тельности уравнение Дебая (2.37) лишь
приближенное и должно рассматриваться
как интерполяционная формула. Параметр
0 для данного вещества постоянен лишь
при низких температурах (менее 0/30—
0/10), для более высоких температур он
зависит от температуры.
При высоких температурах £>(0/!Г)—»1
и cl=c1>=25 Дж/(моль-К), что соответ-
ствует значению сс, получаемому из закона
Дюлонга и Пти, и энергии J/2 kT для
каждой степени свободы.
При низких температурах (меньше при-
мерно 0/12) величина cL, МДж/(моль-К),
рассчитывается по формуле
cL=l,944-1О6п(Г/0)3. (2.38)
В металлах к «решеточным» возбуж-
дениям добавляются «электронные», свя-
занные с движением свободных электро-
нов.
По зонной теории [31] электронная
теплоемкость
Се='у7,
где у — коэффициент пропорциональности,
значения которого приведены в табл. 4.91.
В настоящее время экспериментальные
Рис. 2.15. Диаграмма ср, Т для воздуха
Реальные газы и конденсированное состояние
41
данные о теплоемкости при температурах
жидкого гелия принято интерпретировать
в виде
с=аТ3-\-уТ.
Сопоставляя это уравнение с (2.38), по-
лучаем, что для с, МДж/(моль-К),
с=1,944и-106(7’/9)3+'уД (2.39)
При нормальной температуре (~300 К)
При низких температурах с,, убывает
пропорционально Т3, а се — пропорцио-
нально Т, поэтому при очень низких тем-
пературах с,: приближается к се.
Подробное изложение теории теплоем-
кости, описание экспериментальной техни-
ки и сводку значений 6 и у при низких
температурах см. в [31].
Фазовый переход. Фазами называются
однородные состояния вещества, которые
могут существовать одновременно, в рав-
новесии друг с другом, причем разделя-
ются они вполне определенными поверхно-
стями раздела. При равновесии фаз долж-
ны соблюдаться следующие условия: ра-
венство температур равновесных фаз 1\=
=Т2 и т. д.; равенство давлений в фазах
р,=р2 и т. д.; наконец, равенство химиче-
ских потенциалов p,i==p2 и т. д., а для
растворов и смесей — равенство химиче-
ских потенциалов каждого компонента
Ц/=Р2Л, Р1В=Н2В и т. д.
На рис. 2.16 показан общий вид зави-
симости между температурой и давлением
при фазовом равновесии в однокомпонент-
ной системе. В характерной для каждого
вещества точке кривые кипения и плавле-
ния пересекаются. В этой точке, называе-
мой тройной, одновременно существуют
все три фазы: пар, жидкость, кристалл.
Теплота превращения. Переходы из од-
ного агрегатного состояния в другое со-
провождаются выделением или поглощени-
ем теплоты, называемой теплотой превра-
щения (теплота испарения, теплота плав-
ления, теплота сублимации). Процесс па-
Критическая
точка V К
Плавление
Твердая
{раза
Субли-
мация
Кривая
кипения
Кривая
плавления
Парообразование
Жидкая фаза
Газообразная раза
— Тройная точна
Кривая сублимации
Г
Рис. 2.16. Кривые фазовых переходов
рообразования и плавления чистых ве-
ществ является изотермическим и изобар-
ным.
Теплота испарения г, кДж/кг, может
быть определена по эмпирической формуле
Нернста:
7кид(39,81§Гкип + 0,029Гкип)
Г Л4
По правилу Трутона теплота испаре-
ния ориентировочно определяется по
формуле
Г =КТ кип/И4,
где /<— в подавляющем большинстве слу-
чаев от 11 до 92; М — молекулярная
масса.
Эмпирическая зависимость г от Т мо-
жет быть достаточно точно выражена фор-
мулой вида
г2=Л (TV-Т) +В (Тк—Т) 2+
+ С(7’к-7’)3.
Давление насыщенного пара. Исклю-
чительно важная зависимость давления на-
сыщенного пара от температуры и теплоты
испарения дается уравнением Клапейрона—
Клаузиуса
г „др
—------(2-40)
о" — o’ dT
где dpjdT — наклон кривой зависимости
изменения р от Т; о" и и' — соответственно,
удельные объемы пара и жидкости. Урав-
нение (2.40) справедливо также для суб-
лимации и плавления, только в этом слу-
чае г должно быть заменено теплотой
плавления х или теплотой сублимации r+s
и соответственно объемами кристалла и
жидкости.
Для условий, когда к пару можно
применить законы идеальных газов и пре-
небречь объемом жидкости по сравнению
с объемом пара, уравнение (2.40) пред-
ставляется следующим образом:
d In р = - dT или d 1g р =-------dT-
RT2 \Г 4,575г2 ’
(2.41)
= _L\
Pi R \ ?i tJ
. A r ( 1 1 \
g ft ~ 4,575 ( Тг “ T2 J' (2A2)
Если принять г за постоянную, то
lgP= -4^75r+COnSt МИ
А
кР=~+В+... (2.43)
Эти уравнения приближенные, но они
используются для достаточно точных вы-
числений р2, если известны Р) и
42
Термодинамические основы охлаждения
а Т?—Т\ не больше нескольких градусов.
Если теплота испарения связана с темпе-
ратурой уравнением типа r=rt>+aT, то ин-
тегрирование уравнения (2.41) дает эмпи-
рическую зависимость
lgp=4/T+BlgT+C+.... (2.44)
Ниже приводятся некоторые типы эм-
пирических уравнений, применяемых для
представления данных о давлении насы-
щенного пара:
ig/’ = -y+B + CT + DT* +
Д
lgp = ~+В +1,751g Г+СГ;
lgp= рВ-’r С IgT DT
'gPk!P*= a(TkiT— 1).
Формулы с численными константами
для упругости паров различных газов см.
в § 4.4.
Объемы жидкой и газообразной фаз.
Между удельным объемом насыщенного
пара с" и объемом vr равновесной с ним
жидкости существует эмпирическая зави-
симость
1/у'+1/о"=2/ок+Л(7’к-7'), (2.45)
где коэффициент X для всех веществ по-
ложителен и близок к единице. Уравнение
(2.45) отражает правило так называемого
прямолинейного диаметра, согласно которо-
му среднеарифметическое из плотностей
жидкости р!К и пара рп есть линейная
функция температуры:
•=<?+ ЬТ.
Значение констант а н Ь для разных га-
зов см. в § 4.2.
Скорость звука в конденсированной
среде (продольные колебания)
(2.46)
где Е—адиабатный коэффициент для га-
зов и жидкостей и модуль Юнга для твер-
дых тел; р—плотность среды. О скорости
звука для идеальных газов см. в § 2.3.
Значения скоростей звука в газах и
жидкостях приведены в § 4.12.
2.12. ЭФФЕКТ ДЖОУЛЯ—ТОМСОНА
Дросселированием называется сниже-
ние давления потока газа или жидкости
при прохождении его через местное гид-
равлическое сопротивление (тампон, вен-
тиль, кран и пр.) при отсутствии тепло-
обмена с окружающей средой, причем
поток не производит внешней работы.
При дросселировании количества энер-
гии потока до и после дросселя равны:
, . ®i2 и)„2
(«i+ftOi) +~ = («г+?2а2)+ ~—
£ Z
или
Л]—'ft2=ffi)22/2—ш2!/2. (2.47)
Почти во всех практически важных
случаях изменением кинетической энергии
можно пренебречь. Тогда для процесса
дросселирования В процессе дроссе-
лирования теряется эксергия — техническая
2
работа J vdp, эквивалентная величина ко-
I
торой превращается за счет трения и воз-
никающих турбулентностей в теплоту, от-
даваемую газу. Таким образом, процесс
дросселирования необратим, поскольку
теплота, подводимая к потоку трением,
не может быть превращена в другой вид
энергии. Можно определить увеличение эн-
тропии вследствие дросселирования. По-
скольку для идеального газа процесс при
ft=const совпадает с изотермическим, то
2 2 2
Г *
i Jr J P
=/?lnpi/p2>0. Потеря эксергии при дрос-
селировании J=ToAs2-i=Aei_2.
Так как при дросселировании hi=hz=
=const, то температура идеального газа и
в этом процессе остается неизменной. Реаль-
ные газы в отличие от идеальных в широ-
ком интервале температуры и давления
при дросселировании изменяют свою тем-
пературу (охлаждаются или нагреваются).
Это явление изменения температуры при
дросселировании получило название эффек-
та Джоуля—Томсона.
Различают дифференциальный и инте-
гральный эффекты. Дифференциальный эф-
фект ад есть отношение бесконечного ма-
лого изменения температуры к бесконечно
малому изменению давления в про-
цессе fe=const:
аь=(дТ /др)ь.
Практически дифференциальным эффекта'
считают изменение температуры при сни-
жении давления на 0,1 МПа. В перво»
приближении для воздуха в области нор
мальной температуры Эффия
наблюдаемый при больших конечных изме
нениях давления, называется интеграля
ным:
Эффект Джоуля — Томсона
43
/’а рч
Т’з —Л= j ahdp= j (OT/dp)hdp
Pi Pi
или
Г2 — T± = = айтД/^обгЦ>
где ал™—среднее значение изменения тем-
пературы при уменьшении давления на
0,1 МПа в интервале Дро бщ.
Общее уравнение дифференциального
эффекта Джоуля—Томсона. Для процесса
дросселирования дифференциальное урав-
нение энтальпии при независимых перемен-
ных р и Т должно быть приравнено нулю:
CpdT — [T(dv/dT)p — v]dp = O’, й
T(dv/dT)p— v f
(dT/dp)h = ah= ---------------J
CP
(2.48)
(dv \
—— I = v
dT )p
и a/i=0. Для реального газа из уравнения
состояния Ван-дер-Ваальса [256]
_ ( дТ'\ _ 1 ^о — 1 /<
\ др/h 8 k0 рк Х
т —8/и(3—V?)2
т •—(1/4у) (3 — 1/<р)2 •
Здесь ko=Cp/c„ для идеального газа;
X и ср—приведенные температура и объем.
Это уравнение действительно для всей об-
ласти применения уравнения Ван-дер-Ва-
альса.
На рис. 2.13 помещена универсальная
диаграмма состояния газа по Ван-дер-
Ваальсу в приведенных параметрах т, л, ср,
по которой можно найти численное значе-
ние эффекта Джоуля—Томсона Д7’(Л7'=
=ДтТк и Др=Д«рк). Эта диаграмма мо-
жет быть полезна, когда нет точных экс-
периментальных данных о свойствах газа.
Для расчета криогенных процессов ис-
ключительно важное значение имеет изо-
термический эффект дросселирования ат,
который представляет собой разность эн-
тальпий сжатого (состояния до дроссели-
рования) и расширенного газов при одной
и тон же температуре начала дросселиро-
вания.
Сравнивая уравнение (2.48) с уравне-
нием для (dh/dp) т (с. 24), имеем
/ dh \ Г dv \
%= ~ ) '~t, = “лСр-
\ др /т \ дТ J р
(2.49)
Инверсионная температура. Один и
тот же газ имеет различный по знаку
джоуль-томсоновский эффект: положи-
тельный (охлаждение) при одной темпера-
туре, отрицательный (нагревание) при
другой. Температура, при которой происхо-
дит изменение знака эффекта и ал=0, на-
зывается инверсионной температурой. Из
уравнения (2.48) очевидно, что в инверси-
онной точке
T(dv/dT) р—о=0 и (dv/dT)p=v /Т.
Возможны три ।случая:
1) T(dv/dT) p>v, тогда ал>0 — поло-
жительный эффект
(охлаждение);
2) T(dv/dT) р <о, тогда ал<0 — отри-
цательный эффект
(нагревание);
3) T(dv/dT)p=v, тогда аь=0 — нуле-
вой эффект.
Графически величина T(dv!dT)p—это
подкасательная к кривой постоянного дав-
ления в координатах о, Т (рис. 2.17), а
разность Т(dv /дТ) р—и, определяющая
знак эффекта Джоуля—Томсона, равна
отрезку ОС. Если точка С лежит влево от
начала координат, то ан положительно
(охлаждение); если она лежит вправо, то
ан отрицательно (нагревание). Когда точ-
ка С совпадает с 0, т. е. касательная к
изобаре проходит через 0 (штриховая ли-
ния ро—0), то температура, соответствую-
щая точке ро, к которой проведена каса-
тельная, равна инверсионной Т'т и ал=0.
На этом же рисунке кривая S'S соответст-
вует изобаре в области жидкости. К этой
кривой в точке Fo можно провести каса-
тельную, проходящую через начало коор-
динат, т. е. в этой точке также аь=0
(температура инверсии Т"аа). Итак, каж-
дому давлению р соответствуют две ин-
версионные точки (ро и Fo) с температу-
рами Гин и Т"пн, причем одна из них
(ро) лежит всегда в области газа (верх-
няя инверсионная температура). В интер-
вале между температурами Т'-ЛВ и Т"ая
при дросселировании наблюдается охлаж-
Рис. 2.17. Определение инверсионных точек
Термодинамические основы охлаждения
44
дение, выше Т'ин и ниже Т"т—нагрева-
ние.
Используя уравнение Ван-дер-Ваальса,
можно найти производную (ди/дТу под-
ставив ее в уравнение (2.48), получим
[7, 287]
дТ \ (2а/^Т)(1 — b/v)2 — b
др )h~cp[l — (2a/v)(l—b/v)2]'
При малых плотностях газа вдали от на-
сыщения, т. е. при больших значениях а,
это уравнение может быть упрощено:
1 7 2а
ер к RT
(2.51)
Из (2.50) и (2.51) можно получить
зависимости для инверсионной температу-
ры (ал=0)
2а / Ь \2.
для малых плотностей газа TBS—2a/(.Rb).
На рис. 2.18 показан характер инвер-
сионных кривых в приведенных координа-
тах т, л. Уравнение кривой инверсии
удобно записать в координатах т и л:
л = 241/зГ— 12т —27
или
/ 1 г—\2
т = [14-----I .
к - 6 /
Подробнее о кривых инверсии см. в
Г256, 282].
Анализ уравнения кривой инверсии
ван-дер-ваальсовского газа показывает, что
ее максимум лежит при рИн=9рк и ТИн=
=ЗТК. Инверсионная кривая пересекает
ось температур при 7’макс=6,75 Тк и
7мин=0,75 Гк (рис. 2.18). Поэтому для
газов, следующих уравнению Ван-дер-Ва-
альса, при дросселировании наблюдается
Рис. 2.18. Инверсионные кривые [256, 257,
282]
чальная температура меньше 6,75 Тк и
больше -0,75 Тк, а начальное давление мень-
ше 9 рк.
В табл. 2.5 приведены значения
Гин. макс—максимальные значения темпе-
ратуры инверсии эффекта Джоуля—Томсо-
на. Эта температура соответствует давле-
ниям, стремящимся к нулю. Для простых
веществ 7’ин.макс = 1,878 Тв, где Тв —
температура Бойля (рис. 2.14), т. е. темпе-
ратура, отвечающая в диаграмме pv, р ми-
нимуму изотермы, совпадающему с осью
ординат [d(pv)/др~О, р->-0]. Для ван-дер-
ваальсовского газа 7’в=3,375 Тк. Для боль-
шинства реальных газов Тв/Тк=2,5ч-3,6.
Для оценок ТИн.макс= (4,7-4-6,5) Тк [9].
Таблица 2.5. Максимальные значения
температур инверсии дифференциального
эффекта Джоуля-Томсона для некоторых
газов (р-->0) [282]
Газ Т’ян. макс’
Азот 604
Аргон 765
Водород 2.4
Воздух 650
Гелий-3 39
Гелий-4 --46
Дейтерий 209-220
Кислород 771
Криптон 1079
Ксенон 1476
Метан 953
Неон 230
Оксид углерода 644
Физическая сущность эффекта Джоу-
ля—Томсона. Уравнения (2.48) и (2.49) мо-
гут быть представлены для изотермическо-
го эффекта дросселирования в виде
dhT = cpdT = [T(dv/dT)p — v] dp
или
cp!n(Tt-~T2) = J T(dv^dT)pdp~
pi
p*
4 vdp.
Pt
Правую часть уравнения можно предста-
вить в другом виде:
vi
' CpmiTi — Tz) = J —T(dp}:T)vdv +
’’2
V-i »1
4~ f pho — p2o2 -}- PiVx = J [Т(Др/dT)v 4-
u2 f 2
+ p] dv — p2v2 + pp^.
Эффект Джоуля — Томсона
45
Подставив в это выражение значения р из
уравнения Ван-дер-Ваальса (2.35) р =
RT а
--------—, после интегрирования полу-
v—b V2
чим
\hr = cPm (Ti—Тг) = (a/Joi—a/vz} +
+ piui—раог. (2.52)
Из уравнения (2.52) видно, что эф-
фект Джоуля—Томсона обусловливает-
ся: 1) работой, связанной с разностью
объемных энергий потока до и после
расширения (pi^i — P2V2), и 2) работой
против внутренних сил притяжения от-
дельных молекул газа. По Ван-дер-Ва-
альсу эта работа определяется как
а/»! —а/о2- При любом увеличении объе-
ма газа расстояние между молекулами
увеличивается и при этом совершается
работа.
Существование сил молекулярного
притяжения определяет при сжатии ре-
ального газа выделение некоторого допол-
нительного количества теплоты (по срав-
нению со сжатием идеального газа), от-
водимого обычно охлаждающей водой.
Естественно, что при расширении газа без
теплообмена с окружающей средой суще-
ствование этих сил притяжения вызовет,
напротив, охлаждение. Работа против
внутренних сил проявляется всегда и вне
зависимости от того, каким способом
производится расширение, так как эта
работа определяется только расстоянием
между молекулами, т. е. объемом газа до
и после расширения.
Поскольку эффект Джоуля — Томсо-
на ан при дросселировании зависит от
Двух видов работ: 1) работы, связанной
с изменением pv, (арД, и 2) работы
против внутренних сил притяжения мо-
лекул аи, можно записать
ct/i— Ctpp +<Xu-
Для определения арв находят значе-
ние (dpv/dp}h как угол наклона кривой
постоянной энтальпии на диаграмме pv, р
:(см. рис. 2.14); аи определяется как раз-
ность экспериментально найденного зна-
чения ан и вычисленного ар„. Основную
часть в общем эффекте ан составляет аи,
которая всегда положительна (вызывает
охлаждение газа). Величина аРВ зависит
от условий и природы газа. Она может
иметь как положительное, так и отрица-
тельное значение; в зависимости от это-
го ан будет либо больше аи, либо мень-
ше. В большинстве случаев apv имеет от-
рицательное значение и, следовательно,
<ц<аи. Однако во всех случаях абсо-
лютное значение арв мало и обычно ие
превышает 10—15 % значения аи. Для
воздуха, например, арв положительна
только в небольшом интервале темпера-
тур (от 100 до 160 К) при малых дав-
лениях. Нагревание водорода и гелия при
расширении (при температуре выше ин-
версионной) объясняется превышением
отрицательного значения арв над всегда
положительным ам (для водорода и ге-
лия внутренние силы притяжения малы).
Подробный анализ эффекта Джоу-
ля— Томсона проведен Хаузеном [257].
Точные значения эффекта и инверсионные
условия для различных газов определя-
ются только экспериментально и приво-
дятся в таблицах или наносятся на диа-
граммы состояния этих газов. В расчет-
ной практике интегральное значение эф-
фекта Джоуля — Томсона наиболее удоб-
но находить по диаграммам состояния
или таблицам.
Значения . эффекта Джоуля — Томсо-
на приведены для: азота [21, 22, 24, 255],
аргона [21, 22, 29, 255], водорода [251,
253, 258, 264], воздуха [21—23, 255],
гелия [250], диоксида углерода [36, 255],
дейтерия [251, 261], кислорода [21, 22],
криптона [29], ксенона [29], метана [27,
255], неона [29], оксида углерода [255],
фтора [259], этапа [255], этилена [28,
255].
Ссылки на ранние экспериментальные
исследования эффекта Джоуля — Томсона
см. в [20].
Иногда возникает необходимость вы-
числения эффекта Джоуля — Томсона
для смеси газов по известным эффектам
отдельных чистых компонентов. Для сме-
сей, компоненты которых имеют близкие
свойства, возможно применение правила
аддитивности. Имеются методы расчета
эффекта для смесей исходя из уравнений
состояния [Ю, 206, 282, 285]. Изучен эф-
фект Джоуля — Томсона для следующих
смесей: Не — Ne [283], Не — N2 [284,
285], Н2 — N2, N2 — Аг, Na — О2, О2 — Аг,
N2 — С2Н6 [21, 39, 282, 285], Н2 — СН4,
Н2 —С21Н4 [39, 286].
2.13. ИЗОЭНТРОПНОЕ
РАСШИРЕНИЕ ГАЗА (s = const)
Изоэнтропное расширение газа —
процесс обратимого расширения с отво-
дом работы на сторону при отсутствии
теплообмена с окружающей средой i(t. е.
в адиабатных условиях). Изменение па-
раметров в этом процессе и производи-
мая работа определяются соотношениями,
приведенными в табл. 2.2. Расширение
газа, близкое к изоэнтропному, осуществ-
ляется в поршневых детандерах и турбо-
детандерах.
Исходя из первого и второго законов
термодинамики, можно записать
dq = dh-{- dly и Tds = cpdT — vdp =
/ dv \
= cpdT—T I — dp.
46
Термодинамические основы охлаждения.
Для изоэнтропного расширения ds = 0 и
I дТ\ Т ( dv \
°s— , ) — | ) ' (2.53)
\ &Р Is Ср \ и* /р
Для идеального газа сп—с„ и
F ро
(dvIdT'fp — R/р, поэтому
^ип_ г J0-l г
S СР„ Р k0 р ‘
Для ван-дер-ваальсовского газа [287]
v 1 — bjv
“'? = ср 1 —2a/vRT(l —b/v'P’
Сравнивая уравнения (2.48) и (2.53),
получаем
аз = ah + и/сР;
v
ah/as — 1 — у.
/ дТ
\ dv
Отсюда вытекает, что по мере воз-
растания давления р и понижения темпе-
ратуры величина as уменьшается и при-
ближается к значению ал. Вблизи крити-
ческой температуры, где теплоемкость Ср
резко возрастает, дросселирование может
быть таким же высокоэффективным в
смысле охлаждения, как и обратимый
процесс изоэнтропного расширения. На
рис. 2.19 дана зависимость отношения
для воздуха от давления при раз-
личных температурах.
Таким образом, процесс дросселиро-
вания рабочего тела в области парамет-
ров, близких к критической точке, или
характеризуемых высокими давлениями,
или отвечающих жидкому состоянию ра-
бочего тела, становится высокоэффектив-
ным, мало уступающим изоэитропиому
расширению, а конструктивно осуществ-
ляется очень просто (дроссельный вен-
тиль). Однако в тех случаях, когда пе-
репад давления при расширении велик
или расширение начинается при сравни-
тельно высоких температурах, изоэнтроп-
ное расширение всегда термодинамически!
предпочтительнее.
2.14. ДИАГРАММЫ СОСТОЯНИЯ
Любые две из независимых перемен-
ных (Т, v, р, s„ h, и, е) могут быть вы-
браны для построения диаграммы состоя-
ния. Наибольшее распространение полу-
чили диаграммы. А, Т; Т, s; h, Igp; k, s;
e, h.
Все термодинамические зависимости
реального газа достаточно точно отобра-
жаются графически на этих диаграммах.
Протекающие в низкотемпературных ап-
паратах и машинах процессы наглядно'
представляются на диаграммах, и по
ним легко производить необходимые рас-
четы.
Диаграммы строятся на основании,
экспериментально определенных значений
эффекта Джоуля — Томсона. Описание
построения и пользования диаграммами
состояния см. в [40, 41, 256, 257].
На рис. 2.20 схематически представ-
лены фазовые пограничные линии на диа-
грамме Т, s. Линия АК.— пограничная
кривая пара; КВ — пограничная крива»
жидкости; DB — линия начала затверде-
вания; СЕ — линия конца затвердевания.
Площади под отрезками между линиями
АК и В К (например, под АВ) соответ-
ствуют теплоте испарения (сжижения),,
равной TKs. Площади под отрезками
между линиями DB и ЕС (например, под.
ВС) соответствуют теплоте отвердева-
ния (плавления). В точке В .(тройная
точка) сосуществуют все три фазы: пар,
жидкость, твердое тело.
На рис. 2.21 и 2.22 показаны наибо-
лее важные отсчеты иа диаграммах со-
стояния Т, s и h, 1g р.
Рис. 2.19. Зависимость ак/а3 для воздуха
от Т и р [256]
Рис. 2.20.
Фазовые пограничные линии иа
диаграмме ?, з-
Диаграммы состояния
47
Гц
Эффект Джоуля- Томсона
Критическая
точка
!-К Дроссе-
лирование
CD Теоретическое расти- §
рение в детандере i?
AS Охлаждение в теплооОменнике дзодары
"2
Дросселирование
О-P Температура конденсации
М-Н Нагревание д
теплообменнике
х Линии h=const
(процесс 6 дросселе)
Джоуль - томсоновский
эффект
испарения
__________К"
Доля жидкости
после дросселирования Rs/si
8
Рис. 2.21. Отсчеты по диаграмме Г, s
Пример 1. Определить по диаграмме
7, s конечную температуру и эффект
Джоуля — Томсона в градусах и джоу-
лях при расширении воздуха через дрос-
сельный вентиль с 20 МПа и 250 К до
5 МПа.
Рис. 2.22. Отсчеты по диаграмме h, lg р
48
Термодинамические основы охлаждения
Начальная точка находится как пе-
ресечение изобары 20 МПа с изотермой
250 К, й = 9400 Дж/моль. Состояние воз-
духа после дросселирования находим как
пересечение линии Л=9400 Дж/моль с
изобарой 5 МПа. Температура, соответ-
ствующая этой точке, 218 К. Отсюда АТ =
= Т1 — Та = 250—218 = 32 К. Изотермиче-
ский эффект Джоуля—Томсона находим
как разность энтальпий сжатого и рас-
ширенного воздуха при 7=250 К; М =
= й5— /г2о=Ю5ОО—9400=1100 Дж/моль.
Пример 2. Определить количество
теплоты, отводимой от 1 кг сжатого до
20 МПа воздуха при охлаждении его с
300 до 140 К.
На диаграмме Т, s находим началь-
ную энтальпию Л,3оо=11 350 Дж/моль и
конечную /ii4o=3500 Дж/моль. Отсюда
количество отводимой теплоты q — hzw —
— й140= И 350—3500=7850 Дж/моль.
Пример 3. Определить по диаграмме
Т, s теплоту испарения воздуха при
1 МПа.
Находим h" насыщенного пара при
1 МПа как пересечение изобары 1 МПа
с пограничной кривой пара: h"=
= 6250 Дж/моль. Пересечение изобары
1 МПа с пограничной кривой жидкости
дает энтальпию жидкости 1600 Дж/моль.
Теплота парообразования r=ii" — h'=
= 6250—1600=4650 Дж/моль.
Пример 4. Определить по диаграмме
7, s для воздуха содержание жидкости
после его дросселиоования с 20 МПа и
140 К до 0,2 МПа. ‘
Начальная точка находится как пере-
сечение изобары 20 МПа изотермы 140 К.
В этой точке h = 3500 Дж/моль. Конеч-
ная точка определяется пересечением ли-
нии Л=3500 Дж/моль с изобарой
0,2 МПа. Эта точка лежит при 87 К в
области насыщения. Доля жидкости опре-
деляется отношением длины отрезка изо-
бары 0,2 МПа, лежавшего вправо от по-
лученной конечной точки до кривой пара,
к длине отрезка, соответствующего теп-
лоте испарения при 0,2 МПа. В данном
случае содержание жидкости составит
0,43.
Пример 5. Определить по диаграмме
Т, s конечную температуру и отводимую
работу при изоэнтропном расширении воз-
духа с 20 МПа и начальной температу-
ры 300 К до конечного давления 1 МПа.
По диаграмме находим начальную точку
как пересечение изобары 20 МПа и изо-
термы 300 К. В этой точке й2э =
= 11 350 Дж/моль. Из этой точки по вер-
тикали (s = const) опускаемся до изоба-
ры 1 МПа. В точке пересечения 7= 124 К
и Й! = 6800 Дж/моль. Разность энталь-
пий, равная отводимой работе, Дй=
= 11 350—6800=4550 Дж/моль.
2.15. ОСНОВНЫЕ СООТНОШЕНИЯ
ТЕРМОДИНАМИКИ СМЕСЕЙ,
РАСТВОРОВ И АДСОРБЦИИ
Минимальная работа разделения га-
зовых смесей. Минимальная работа, кото-
рую необходимо затратить при обрати-
мом разделении газов, определена общим
соотношением (2.32). Для идеальных сме-
сей и для многих реальных смесей тепло-
та смешения ДАом=0 и тогда минималь-
ная работа разделения
LpaT = - Л>Д*раз = 2£комп- £см, (2.54)
где Дом и £См—эксергии отдельных
компонентов и смеси соответственно.
При смешении газов энтропия увели-
чивается. Изменение энтропии при раз-
делении Мо молей двухкопонентной. сме-
си с концентрацией х0 на фракции Мг с
концентрацией Xi и М2 с концентрацией
Х2 при 0,1 МПа составит
А£раз = 2,о£{Л1о [Xolgl/X(,+
+ (1 — X0)lgl/(l — х0)] —
— Mi[xilgl/x, + (l — Xi) lgl/(l —
— Xl)] “Al2[X2lgl/X2 + (1 —
- x2)lg 1/(1- х2)]}. (2.55)
При полном разделении (Xi = l и
х2=0)
ASPa3=2,3£Alo[xolg 1/хп+(1—
— Xo)lgl/(1-Xb)]. (2.56)
На рис. 2.23 приведен график зави-
симости удельной минимальной работы
полного разделения идеальной газовой
смеси /размин при 7 = 300 К от концент-
рации разделяемой смеси. -По этому же'
графику легко определяется /размин при
неполном разделении. Например, если'
разделяется смесь с концентрацией х0 на
две фракции с концентрациями хА и хв,-
то /размин определяется отрезком ОЕ.
Проведение прямой CD, определяющей,
точку О, ясно из рисунка.
При малой исходной концентрации х»-
и полном разделении Мо молей
А8раз = ДЦ0х0(1пх1о— 1). (2.57)
Рис. 2.23. Зависимость минимальной рабо-
ты разделения /минразд от концентрации
разделяемой смеси
Основные соотношения термодинамики смесей, растворов и адсорбции
49
Для смеси с большим числом компо-
нентов составляют аналогичные уравне-
ния с числом слагаемых, соответствую-
щим числу компонентов. Минимальная
работа разделения может также опреде-
ляться как сумма работ изотермического
сжатия каждого компонента от его пар-
циального давления, при котором он на-
ходился в исходной смеси, до парциаль-
ного давления в продуктах разделения.
Например, для полного разделения
1 кмоля воздуха при 273 К и атмосфер-
ном давлении (0,1 МПа) /размин =
= ТйЛ5Раз = 273-2,3-1,987[0,79 1g 1/0,79 +
+(1—0,79) lgl/( 1—0,79)] = 0,323 кВтХ
Хч/кмоль, или 0,0144 Т/273 кВт-ч/м3
воздуха, или 0,069 Т/273 кВт-ч/м3 О2,
или 0,0182 Г/273 кВт-ч/м3 У2.
Закон Рауля. Парциальные давления
Рпарц пара растворенных веществ над
раствором равны давлениям рЧИст чи-
стых веществ при данной температуре,
помноженным на молярные доли х ком-
понентов в растворе:
Рпарц — рчистХ. (2.58)
Растворы, которые подчиняются зако-
ну Рауля при любых концентрациях ком-
понентов, называются идеальными. Этому
закону следуют некоторые системы с точ-
ностью, вполне достаточной для техниче-
ских расчетов.
Закон Генри. Парциальное давление
пара компонента, присутствующего в ра-
створе, пропорционально его молярной
доле в растворе:
(2.59)
По сравнению с законом Рауля здесь
константа k заменяет давление пара чи-
стого вещества рЧист- Величина k опре-
деляется экспериментально как функция
температуры.
Уравнение Рауля — Дальтона. Комби-
нируя закон Рауля с законом Дальтона
(см. § 2.3), получаем уравнение, связы-
вающее составы жидкой и газовой фаз:
р// = Рчис т-Г
ИЛИ
где // — молярная доля компонента в га-
зовой фазе.
Зависимость упругости паров от тем-
пературы см. в § 4.4.
Если задано общее давление р и из-
вестны упругости чистых компонентов рА
(легкокипящего) и рв при разных тем-
пературах, то
Р=рАпарц+рвпарц = РлЛ: +
+ рв(1—х), (2.61)
откуда
Р~Рв Ра
х~----------> У = — х. (2.62)
Ра~ Рв р
Принимая значения рл и рв при раз-
личных температурах, получают несколь-
ко значений х, после чего определяют у.
Из уравнения (2.61) можно получить
«х ух
ц =------------, или -----=а-------,
1 4-х(а—1) 1—у 1—х
или
Здесь а~рл/рв—так называемая от-
носительная летучесть, или коэффициент
разделения.
Уравнение (2.63) дает очень удобную
и простую аналитическую связь состава
паровой и жидкой фаз при равновесии в.
предположении a = const для всех кон-
центраций. Для некоторых бинарных сме-
сей с близкими свойствами компонентов
это требование выполняется достаточно-
точно. Можно также считать аср =
-= Карл, , где щ и а2—значения при
наивысшей и наипизшей температурах.
Для неидеальных растворов отклоне-
ния от соотношений для идеальных раст-
воров учитываются коэффициентами ак-
тивности у.
Для бинарной смеси парциальные
давления компонентов А и В
рАпирц = рУ = \лРлХ И рвпавц =
= р(1 — у)=уврв(Д — х).
Отсюда
Ул=рлпарц/(рлХ) =ру/(рАх);
ув=рвпарц/[рв(1 —х)] =
= р(1 — У)/1рв(1 — X)].
Если у г> 1, то парциальное давление
компонента превышает величину, следую-
щую из закона Рауля, и наоборот при
у,-<1 наблюдается отрицательное откло-
нение от идеальных соотношений.
Очевидно, что для идеальных раство-
ров уА=ув=у1=1. Для неидеального-
раствора из сопоставления последних,
уравнений с (2.63) можно получить
а = у(1 — х)/х(1 — у) = уАХ
Хрл/(уврв). (2.64)
Экспериментальные данные по фазо-
вому равновесию приведены в разд. 5.
Уравнения Дюгема — Маргулиса для
бинарных равновесных смесей. Для иде-
альной системы
^1п/’паРц + (1-х)й11п/7®рц= 0; j
dlnp = —-------dy; |
1/(1 — У) ]
Рпарц/^-® ^Рпарц/^О ’ %) j
Рпарц/^ й’парц/^ '
(2.65а)
Для неидеальиой системы
xd In уд 4- (1 — х) d In ув = 0 и
4-218
so
Термодинамические основы охлаждения
dln-(A/Jx___1 _х
d In yB/dx x
где рАпаРц и рвпаРЦ — парциальные давле-
ния компонентов; р — общее давление над
раствором; х— доля компонента А в рас-
творе.
Эти уравнения служат для проверки и
оценки точности экспериментальных данных
по фазовому равновесию. О методике такой
проверки см., например, в [10, 18, 32, 33].
Летучесть. Летучестью ft данного газа
называется такая функция концентраций
каждого из содержащихся газов, а также
температуры и давления, которая позволяет
термодинамические соотношения для иде-
ального газа использовать для реального
газа при условии, что в соотношения вместо
давления подставлена эта функция. Таким
образом, летучесть служит как бы услов-
ным эффективным давлением.
Определение летучести;
Р 1
RTd In f = vdp; RTln f/f0 = f vdp; ।
p« ;
p f
,7?7'lnf = /?71n/> — j (RTlP — v)dp, |
о ‘
(2,66)
шде fo и p0 — летучесть и давление при нор-
мальных (стандартных) условиях.
Очевидно, что для идеального газа ле-
тучесть равна давлению. Для вычисления
.значений летучести разработаны специаль-
ные методы [10, 32]. С достаточной точно-
стью для областей не слишком сильного
.отклонения от законов идеальных газов
можно принять
f = —Р-Р = ЧР’ (2-67)
гид
где р — действительное давление газа
.в данных условиях; рИд — давление, кото-
рое имел бы газ при конкретных v и Т
:в случае соответствия уравнению состояния
.идеального газа.
Летучесть жидкости или твердой фазы
;равна летучести находящегося в равнове-
сии пара этого же вещества.
Активность. Активностью аг данного
'компонента называется функция концентра-
ций каждого из компонентов, а также тем-
пературы и давления, значения которой
рассчитаны так, что после подстановки их
вместо концентраций оказываются приме-
нимыми законы идеальных систем. Таким
-образом, активность служит как бы услов-
ной эффективной концентрацией. Для иде-
.альных растворов
ai=Xi=^pi/p\ In Xi,
где pi — парциальное давление t-ro компо-
нента; |Лг — химический потенциал этого
компонента; Ц;* — значение химического
потенциала в стандартном состоянии.
Для неидеальных растворов
= gi=Oi0+Z?7'In tZi.
Коэффициент активности. Функция у;
характеризует степень отклонения свойств
компонента в данном растворе от свойств
его в соответствующем идеальном растворе:
а^угХг; Vi = cii/Xi\ fi=4iPi. (2.68)
Для идеального раствора yi=l. В си-
стемах с положительным отклонением дав-
ления пара уг>1 и Яг>х<; в системах
с отрицательным отклонением у;<1 и аг<
<Xi. Практически введение понятий актив-
ности и коэффициента активности обуслов-
лено тем, что при замене молярной доли Xi
в уравнениях для идеальной системы на
активность или на произведение yiXi эти
уравнения становятся применимы также
для реальных систем. Другими словами, все
отклонения от идеального поведения рас-
творов соединены в одном факторе — коэф-
фициенте активности. При изучении реаль-
ных растворов (не электролитов) все вни-
мание сосредоточивается на изучении зави-
симости у от температуры, давления и,
главное, от состава.
Из уравнения Дюгема — Маргулиса
для бинарных смесей коэффициент актив-
ности может быть аналитически связан с со-
ставом в удобной для проведения интерпо-
лирования форме. Уравнения Маргулиса:
(1-х)2[Л4-2х(В-Л)]; 1
18Тв = х2[В+2(1-х)(Л-В)]; )
(2.69)
уравнения Ван-Лаара:
ig ya= ------у——; ]
(1 +--------I
' Ba~x)J I (2.70)
lg= / B(l—x) V ’ I
где А и В — константы при данной темпе-
ратуре, определяемые экспериментально.
Для симметричных систем, когда А = В, оба
уравнения упрощаются:
1йУл=Л (1—х)2 и 1§'ув=Лх2.
При х=0 lgy&=A, lgyB=0 и ув=1; при
х=1 lgy,i = 0, lgyB = B и уА=1.
Константы в уравнении (2.69) выража-
ются соотношениями
, i-2x 21gYs
(1-х)2 х >
„ 2х—1 2 IgYx
Константы в уравнении (2.70):
Основные соотношения термодинамики смесей, растворов и адсорбции 51
/ (1 —x)lgYB\a.
Л = 1g ( 1 +------: ’
/ * "01 Y
«-18ТЦ1+ (1_<|1г,в У
Зависимость от температуры:
din ЛГТ- ^ИСТ
АТ НТ
где Лдраст и йлчист — энтальпии компо-
нента А в растворе и в чистом виде.
Если теплота смешения компонентов
невелика, то влиянием температур на у
можно пренебречь.
Теоретически достаточно иметь все
данные для одного состояния равновесия,
по которым можно вычислить константы А
и В, а по ним — всю кривую равновесия.
Практически необходимо иметь несколько
экспериментальных измерений. Во всех слу-
чаях эти уравнения служат для проверки
экспериментальных данных и полезны при
интерполяции и экстраполяции [10, 18, 32,
33, 206].
Осмос и осмотическое давление. Явле-
ние осмоса заключается в том, что раство-
ритель, отделенный от раствора полупрони-
цаемой перегородкой, диффундирует через
нее в раствор, выравнивая концентрации.
Диффузия возникает в результате понижен-
ного химического потенциала растворителя
в присутствии молекул растворенного веще-
ства. Избыточное гидростатическое давле-
ние, которое нужно приложить к раствору,
чтобы задержать диффузию, называется
осмотическим давлением раствора. Для
разбавленных растворов осмотическое дав-
ление роем, температура раствора Т и мо-
лярный объем о или молярная концентра-
ция с=1/а (в молях на литр) подчиняют-
ся соотношениям формально таким же, как
и используемые для идеальных газов, т. е.
PoewV—RT или pocM^RTc.
Таким образом, осмотическое давление
равно тому давлению, которое производило
бы растворенное вещество, если бы оно
в виде молекул идеального газа занимало
тот же объем и при той же температуре,
что и раствор (закон Вант-Гоффа). Осмо-
тическое давление можно рассматривать
как аналогичное парциальному давлению
газа, добавленного в малом количестве
к другому газу, находящемуся при боль-
шом давлении.
Равновесные соотношения в критиче-
ской области. На рис. 2.24 и 2.25 изобра-
жено несколько изотерм бинарной смеси
в диаграмме р, х. Начиная с критического
давления ркв вещества В кривые откло-
няются влево (рис. 2.24). Образуются обла-
сти с большим содержанием компонента В,
где не существует двух фаз, т. е. имеется
4*
Рис. 2.24. Фазовые соотношения в крити-
ческой области на диаграмме р, х
нормальная картина надкритической обла-
сти. При давлении ркЛ полностью исчезает
область сосуществования двух фаз. При
давлениях между ркА и ркв наблюдаются:
особые явления, не имеющие места в чи-
стом веществе.
Для изотермы линии пара (конден-
сация) и жидкости (кипения) встречаются-
в точке Cj (рис. 2.25), и здесь же исчезает
различие между паром и жидкостью — обе-
фазы имеют одинаковые состав и плот-
ность. Однако в отличие от чистого веще-
ства при повышении температуры при том
же давлении (перейдем на изотерму /2) мье
не попадем в сверхкритическую область,
а наоборот, вновь будем наблюдать разде-
ление фаз (точки А и В). Только при более-
значительном увеличении температуры и
X
Рис. 2.25. Фазовые соотношения вблизи:
критической точки
52
Термодинамические основы охлаждения
давления с выходом за критическую кривую
Л4РманС попадаем в надкритическую об-
ласть.
Для состава х температура ts макси-
мальная, при которой может существовать
жидкость (точка F). Однако для этого же
-состава х можно иметь более высокое дав-
ление, хотя и при более низкой температу-
ре t2 (точка Е). Итак, для бинарной смеси
в критической области максимальная тем-
пература (точка F) и максимальное давле-
ние (точка £) не совпадают; не совпадают
они и в точке Сц где обе фазы тождест-
венны. Характерный признак для чистого
вещества — соединение в одной точке ма-
ксимального давления, максимальной тем-
пературы и тождественность жидкости и
пара; для бинарной смеси они распреде-
ляются между тремя отдельными точками.
Заштрихованная площадь (рис. 2.25),
находящаяся между вертикалью, проходя-
щей через точку Сь и петлей, образуемой
кривой пара (конденсация), соответствует
области явлений обратной конденсации. Эта
область характеризуется тем, что изотерми-
ческое сжатие пара, например из точки В,
приводит вначале к выделению жидкости.
Так, при промежуточном давлении рх бу-
дем иметь пар состояния 1 и жидкость со-
стояния 2. При дальнейшем сжатии жид-
кость постепенно исчезает и в точке а су-
ществует только пар. Аналогично этому при
изотермическом расширении пара из точки
а вначале также происходит конденсация.
Разобранные случаи — простейшие из
возможных. Часто явление усложняется
(ограниченная взаимная растворимость, ма-
ксимум и минимум температур кипения
я пр.) [20, 589, 590].
Равновесие в многокомпонентных сме-
сях (константы фазового равновесия). Если
принять, что жидкая фаза в многокомпо-
нентной смеси — это идеальный раствор, то
для каждого компонента действительно со-
отношение
yt=f (Р, Т, х^,
т. е. на концентрацию компонента в паре
не влияет число и относительное содержа-
ние других компонентов. Если, кроме того,
допустить, что пар подчиняется законам
идеального газа, то для каждого компонен-
та действительны законы Рауля и Дальто-
на и можно записать
И > - ------- . I / J. I
F’PiX Аобщ
Когда смесь нельзя считать идеальной,
yi=kiXi,
где ki — константа, в общем случае зави-
сящая от р, Т, природы и состава раствора.
В частном случае идеального газа и
раствора
ki= Pi/Робщ, (2.72)
Для общего случая
ki=fi!h, (2.73)
где fi — летучесть чистого жидкого компо-
нента i при данной температуре и давле-
нии пара чистого компонента; f?—лету-
честь чистого компонента i в газе, которой
он обладает при данной температуре и
общем давлении смеси [10].
Вычислить константу равновесия k
можно, использовав известные значения ле-
тучести компонентов в жидком и паро-
образном состояниях. Еще более надежны
значения константы k, установленные по
экспериментальным данным фазового рав-
новесия хну (см. разд. 5).
Исследования по определению значений
k для углеводородов показывают, что наи-
большие отклонения от законов идеальных
растворов наблюдаются у углеводородов
с малой молекулярной массой (особенно
у СН4) и в том случае, когда компонент
присутствует в относительно малом коли-
честве. Если применить константы равнове-
сия для бинарных смесей, то для вычисле-
ния кривых равновесия можно получить
следующие соотношения:
1 -
-----—; у=
«1 К2
1 — k2
&2
(2.74)
Ссылки на работы по определению кон-
стант равновесия и использованию их в рас-
четах даны в § 5.8.
Адсорбция. Под физической адсорбцией
понимают процесс поглощения газа поверх-
ностью твердого тела, называемого адсор-
бентом. Количество газа V, поглощенное
1 г адсорбента до установления равнове-
сия, зависит от температуры, давления,
природы адсорбента и адсорбируемого ве-
щества.
Процесс адсорбции всегда экзотерми-
чен, поэтому количество адсорбируемого
газа увеличивается при понижении темпе-
ратуры. При постоянной температуре ад-
сорбция газа или пара увеличивается
с ростом давления. Кривая, отражающая
зависимость V от р при 7'=const, называется
изотермой адсорбции. Изотермы адсорбции
для различных газов см. в § 5.9.
В области малых значений адсорбции н
особенно при малых давлениях объем
адсорбированного газа линейно увеличи-
вается с давлением, подчиняясь закону
Генри:
V=kp. (2.75)
При высоких давлениях многие изотермы
характеризуются областью насыщения, в ко-
торой объем адсорбированного газа не за-
висит от давления (V=const).
В области средних давлений может
быть использовано эмпирическое уравнение
Фрейндлиха
V=kp/n, (2.76)
где «>1.
В настоящее время нет законченной
теории, которая могла бы объяснить все
Основные соотношения термодинамики смесей, растворов и адсорбции
53
(2.77)
многообразие явлений, определяющих про-
цесс адсорбции, и дать единое аналитиче-
ское выражение для изотермы адсорбции.
Наиболее известным уравнением в об-
ласти адсорбции является уравнение Ленг-
мюра, предложившего теорию мономолеку-
лярной адсорбции. Адсорбция называется
мономолекулярной, когда поверхность твер-
дого тела покрывается одним слоем моле-
кул, и полимолекулярной при образовании
нескольких слоев молекул. Мономолекуляр-
ная адсорбция наблюдается обычно в обла-
сти низких давлений.
Согласно Ленгмюру
v_ УщЬр
1 + Ьр’
где V—объем газа, адсорбированного при
давлении р; Vm — объем газа, адсорбиро-
ванного при заполнении мономолекулярного
слоя; Ь — коэффициент, зависящий только
от температуры.
При малых значениях V (низкие дав-
ления) произведением Ьр в знаменателе
формулы (2.77) можно пренебречь и тог-
да V=Vmbp (закон Генри).
В области высоких давлений можно
-пренебречь, напротив, единицей в знамена-
теле по сравнению с Ьр; тогда V=Vm (на-
сыщение).
Таблица 2.6. Число молекул,
необходимых для образования
мономолекулярного слоя, и занимаемые им
объемы Го при О °C и атмосферном
давлении (0,1013 МПа)
ц,=;:(2/3) (1/о2)=1,154/о2, где о—диаметр
молекулы, см
Род газа Число моле- кул, образую- щих мономо- лекулярный слой иа по- верхности 1 см2, Объем, занимае- мый п молекула- ми, см3-105
.Азот 8,10 3,02
Аммиак 4,56 1,70
Аргон 8,54 3,18
Водород 15,22 5,67
Водяной пар 5,27 1,96
Воздух 8,25 3,07
Г елий 24,16 8,99
Кислород 8,71 3,24
Неон 17,12 6,36
Оксид углерода 8,07 3,о.>
Диоксид углерода 5,32 1,99
Криптон 6,69 2,48
Ксенон 4,78 1,78
В табл. 2.6 указано число молекул, за-
полняющих мономолекулярный слой [5].
Важное уравнение изотермы адсорбции
установлено в [211]. В линейной форме оно
имеет вид
lg V=C—D (lg ps/p)2, (2.78)
где ps — упругость паров адсорбируемого
вещества при данной температуре; С и D —
постоянные. Уравнение (2.78) в координа-
тах lg V, (IgPs/p)2 изображается прямой
линией.
Маркгем и Бентон на основании теории
Ленгмюра вывели следующие уравнения
для адсорбции бинарной смеси газов:
^mibiPi____
1 _1~ +&2А2
(2.79)
V2 =------_ (2.80)
1 + biPi + b2Pz
где pi и р2— парциальные давления компо-
нентов смеси; &] и &2 — индивидуальные
адсорбционные коэффициенты компонентов
смеси; Vmi — объем одного из компонентов
смеси, необходимый для покрытия всей по-
верхности мономолекулярным слоем; Vm2—
то же для другого компонента.
Из уравнений (2.79) и (2.80) следует,
что один газ всегда уменьшает адсорбцию
другого. Однако если оба газа адсорбиру-
ются слабо, произведением и Ь2р2
в знаменателе можно пренебречь (они малы
по сравнению с единицей), тогда
V 1= VmibiPi;
V2— Vm2b2p2,
т. е. каждый компонент смеси адсорби-
руется независимо, подчиняясь закону Ген-
ри. Если один из газов адсорбируется в су-
щественно больших объемах, чем второй,
то &11Э=&2 и &2Р2^1- Тогда
,7 _ ^mibiPi .
1 + &1А1
1 +
Формулы показывают, что в этом случае
газ 1 адсорбируется так, как будто газа 2
нет, адсорбция же газа 2 ослаблена при-
сутствием хорошо адсорбируемого газа 1.
Подробнее об адсорбции см. в [5, 14,
34, 42, 211, 254, 287].
54
Низкотемпературные циклы и процессы
Раздел третий
НИЗКОТЕМПЕРАТУРНЫЕ ЦИКЛЫ И ПРОЦЕССЫ
3.1. МИНИМАЛЬНАЯ РАБОТА
СЖИЖЕНИЯ ГАЗОВ
Для того чтобы сжижить газ, т. е. пе-
ревести его из состояния 1 в состояние О
(рис. 3.1), необходимо отвести на уровень
температуры окружающей среды То тепло-
ту, эквивалентную площади под кривой
1-2-0. При отводе теплоты по циклу Карно
[см. (2.24)] предполагаются постоянными
температуры То и Т2 (температура тепло-
отдатчика). Однако при сжижении газа
участок 1-2 соответствует охлаждению при
переменной температуре (от Та до Т2).
Охлаждение газа на этом участке можно
представить как следствие осуществления
бесконечно большого числа последователь-
но расположенных элементарных циклов
Карно с различными (понижающимися)
температурами отвода теплоты. Для этого
случая уравнение (2.24) принимает более
общий вид:
, _ С То-Т _ Г То-Т _
/мин — I т dq — i dh —
То То
То
0 dh
= 7'0 —-Дй= T0As —Дй =
То
— Л>(51газ -^ожидк) (^згаз ^ожидк) —
— ^е0-1 --- еОЖИДК б1газ, (3.1)
т. е. аналогичный уравнению (2.32).
Рис. 3.1. Графическое изображение мини-
мальной работы сжижения р диаграмме
/. /
Например, если 1 кг воздуха, находя-
щегося при 0,1 МПа и 300 К, перевести
в жидкость под этим же давлением, то ми-
нимальная работа
/мин=300 (6,870—3,013) — (553,7—130,2) =
= 733,6 кДж/кг=0,2 кВт-ч/кг.
На рис. 3.1 минимальная удельная ра-
бота /мин изображается заштрихованной
площадкой 1-3-0-2-1.
Количество теплоты, отводимой от газа
при его переходе из состояния 1 в 0, рав-
ное <72=й1газ—Аожидк, называется холодиль-
ной мощностью цикла. Только часть q2 (на
участке 0-2) передается при наинизшей тем-
пературе цикла Т2.
Если сжижение проводить посредством
единственного цикла Карно, то вся тепло-
та q2 будет отбираться при наинизшей тем-
пературе процесса Т2. На рис. 3.1 площадь
0-2-1 равна площади под 0-2-5, т. е. q2 та-
кого цикла Карно. Затраченная в этом цик-
ле Карно работа эквивалентна площади
4-3-0-5. Например, для сжижения 1 кг воз-
духа с помощью цикла Карно
Z_(A — h -Ту-Т* _
‘к— U'lras '‘ожидк/ т —
12
300 — 82
= 423,5 ------— = 1125,9 кДж =
82
= 0,31 кВт-ч/кг,
т. е. на 55 % больше, чем /мин-
Величина Дзнеобр на рис. 3.1 отражает
увеличение энтропии при сжижении посред-
ством цикла Карно, связанное с необрати-
мостью при отводе теплоты на участке 1-2
из-за большого температурного перепада.
Для осуществления процесса сжижения
без специального обратного цикла по
1-3-0-2-1 необходимо сжимать воздух до
давления примерно 50 000 МПа, а затем
изоэнтропно расширять его до точки 0, что
технически неприемлемо.
В табл. 3.1. даны значения минималь-
ной и действительной работы при сжиже-
нии некоторых газов.
На рис. 3.2 приведена кривая зависимо-
сти расхода работы на получение единицы
холодильной мощности (l/q2) в обратном
цикле Карно при различных температурах.
На этом же рисунке отмечены реально по-
лучаемые значения lfq2.
Каскадный цикл
55
Таблица 3.1. Минимальная (ZMIffl=T0As—Ай) и действительная (/действ) работа
сжижения некоторых газов при 0,1013 МПа и То=ЗОО К
Газ Количество теплоты, отводимой при сжиже- нии, Д/г. Теплота испарения г ^мии Примерный действи- тельный расход рабо- ТЬ1 действ Эксергетический КПД ^мин^действ
Дж/моль кДж/к г Дж/моль кДж/кг кДж кВт-ч/кг кЕт -ч кВт -ч/кг кВт-ч/л
л жидк. л жидк.
Азот 12 138 433,3 5560 197,6 159,1 0,213 0,172 1,2—1,8 1-1,5 0.15—0,2
Аргои 10 664 273,1 6450 160,8 226,1 0,134 0,186 0,8—1 1,1—1,4 0,15—0,2
Водород 7968 3953 890 441,7 31,4 3,31 0,235 22—42 1,5—3,0 0,08—0,15
Воздух 12 388 428,3 5942 205,2 179,2 0,205 0,179 1,2—1,8 1—1,5 0,15—0,2
Гелии 6256 1563 81,3 20,43 2,55 1,9 0,237 16—32 2—4 0,07—0,11
Кислород 13 020 406,9 6800 212,3 242,8 0,177 0,202 1-1,5 1,2—1,7 0,15—0,2
Метай 14 640 912,7 8200 509,0 217,7 0,307 0,13 0,6—1 0,25—0,5 0,3—0,5
Неои 7439 368,6 1735 85,82 104,3 0,372 0,445 3,5—5,5 3—4,5 0,1
Пропаи 23 400 531,7 18 800 427 248,3 0,04 0,023 0,1 0,06 0.5
Этилен 18 673 665,7 13 500 481 273,4 0,119 0,067 0,3 0,2 0,5
Рис. 3.2. Минимальная (по Карно) и дей-
ствительная работа, переноса теплоты с
различных температурных уровнен (llg^
3.2. КРИОГЕННЫЕ ПРОЦЕССЫ
Имеются два основных метода, которые
применяются в широкой практике для до-
стижения криотемператур: использование
эффекта Джоуля-—Томсона и расширение
с отдачей внешней работы. Практически
осуществленные криогенные процессы в той
или иной форме используют один из этих
методов либо их комбинацию. Существуют
еще несколько методов, имеющих, однако,,
частное значение. Для получения темпера-
тур ниже 0,3 К применяют метод адиабат-
ного размагничивания некоторых солей,
эффект растворения гелия-3 в сверхтекучем
гелии-4 и эффект Померанчука.
Детальное описание криогенных процес-
сов и методы расчета см. в [14, 16, 31, 40,
41, 43—46, 202—204, 207, 254, 257, 287—
289].
3.3. КАСКАДНЫЙ ЦИКЛ
Принцип каскадного метода охлажде-
ния иллюстрирует рис. 3.3. В общем интер-
вале температур -охлаждения можно осу-
ществить не один, а несколько обратных
циклов. При этом циклы должны быть вза-
имосвязаны так, чтобы каждый из них
Рис. 3.3. Каскадный метод сжижения газов
56
Низкотемпературные циклы и процессы
отводил теплоту от расположенного под
ним (по температуре) и отдавал тому цик-
лу, который находится выше. Таким обра-
зом, можно получить очень низкие темпе-
ратуры, вплоть до температуры жидкого
гелия.
В первом (от температуры То) цикле
обычно рабочим телом служит аммиак или
фреон. Во втором цикле сжижается этилен,
конденсирующейся под давлением в амми-
ачном или фреоновом испарителе. Этилен
испаряется при 173 К и сжижает сжатый
метан, служащий криоагентом третьего
цикла. Метан, испаряясь при 112 К, сжи-
жает сжатый азот в четвертом цикле.
Испарением азота под вакуумом удается
понизить температуру до 63 К. Так как эта
температура выше критической для водо-
рода (33 К), то сжижение водорода про-
стым продолжением каскадного цикла не-
возможно. Сжатый до давления 15 МПа
водород охлаждается до 63 К испаряющим-
ся азотом и обратным потоком водорода,
после чего дросселируется с образованием
парожидкостной смеси (пятый цикл). Тем-
пература 14 К (испарение водорода под
вакуумом) выше критической температуры
гелия (5 К), поэтому в шестом цикле сжа-
тый до 4 МПа гелий первоначально охлаж-
дается кипящим водородом, обратным по-
током гелия, а затем дросселируется, в ре-
зультате чего частично сжижается. Испаряя
гелий под вакуумом, можно получить тем-
пературу до 0,5 К.
Принципиально каскадный метод сжи-
жения— один из наиболее экономичных по
энергетике методов сжижения газов. Ке-
езом [293] расчетным путем установил сле-
дующие значения расхода энергии, кВт-ч
на 1 кг жидкого азота, при сжижении азо-
та разными методами:
Каскадный метод NH3—С2Н4—
СН4—N2.........................0,54
Цикл на основе двойного дроссели-
рования азота и с предварительным
аммиачным охлаждением..........0,85
Цикл с изоэнтропным расширением
азота..........................0,88
Здесь не учтены теплопритоки вслед-
ствие несовершенства изоляции, а также
гидравлические потери давления. О про-
мышленном использовании каскадного ме-
тода, главным образом при сжижении при-
родного газа, см. в [201, 291, 292].
3.4. ЦИКЛЫ, ОСНОВАННЫЕ
НА ИСПОЛЬЗОВАНИИ ЭФФЕКТА
ДЖОУЛЯ—ТОМСОНА
ПРИ ДРОССЕЛИРОВАНИИ
Цикл с однократным дросселирова-
нием *. На рис. 3.4 дана принципиальная
* Во многих литературных источниках этот
и последующий циклы называют циклами Лин-
де, впервые осуществившего этим методом сжи-
жение воздуха в большом масштабе.
Рис. 3.4. Схема цикла с однократным
дросселированием
схема осуществления цикла и рядом изо-
бражен цикл в диаграмме Т, s. Сжатый
в компрессоре газ охлаждается в тепло-
обменнике обратным газовым потоком, пос-
ле чего расширяется в дроссельном клапа-
не, при этом часть газа сжижается. Энерге-
тический баланс цикла на единицу подавае-
мого компрессором газа: подводится 1 • /г2-|-
+<7о.с; отводится yhg-1-(1—y)hlr. Отсюда
^2 Уо.С ,
У =-----------г----> <72 = \, — й2{— ?0.с,
hv — h0
(3-2)
где <?2 — холодильная мощность цикла; h\,,
hi, h0, hi — энтальпии газа в соответствую-
щих индексу точках (рис. 3.4); у — доля
жидкости, получаемой из единицы дроссе-
лируемого газа; <?о.с — теплота, поступаю-
щая в цикл из окружающей среды из-за
несовершенства изоляции (так называемые
потери холода через изоляцию в окру-
жающую среду).
Для идеальных условий осуществления
цикла <7о.с=0 и hi,=hi-
Из (3-2) видно, что холодильная мощ-
ность цикла зависит исключительно от раз-
ности энтальпий расширенного и сжатого
газов при температуре «теплого» конца ре-
куперативного теплообменника, т. е. изо-
термического эффекта дросселирования (см.
с. 43).
Часто криогенный цикл используется не
для получения жидкого криоагента как
продукта, а лишь для охлаждения какого-
либо устройства путем отвода от него теп-
лоты q2 (штриховая линия на рис. 3.4).
В этом случае цикл работает в так назы-
ваемом рефрижераторном режиме. При та-
ком режиме работы в отличие от работы
на сжижение газа отсутствует вывод жид-
Циклы, основанные на использовании эффекта Джоуля-Томсона при дросселировании 57
Рис. 3.5. Схема цикла с однократным
дросселированием и предварительным ох-
лаждением
кости (у=0) и поэтому обратный поток
газа равен прямому.
Цикл с однократным дросселированием
и предварительным охлаждением (ряс. 3.5).
В отличие от предыдущего цикла здесь
используется дополнительный поток хлад-
агента (например, аммиака), посредством
которого осуществляют предварительное
охлаждение основного криоагента. Для
этого цикла
h7, — hs ?0.с
Рис. 3.6. Характеристика циклов одно-
кратного дросселирования для сжижения
воздуха без предварительного аммиачного
охлаждения и с предварительным аммиач-
ным охлаждением до —45 °C:
2/+30’ ^-45 и 1+ЗЫ 1-13 ~ соответственно доли
сжижаемого воздуха и требуемая работа для
получения 1 кг жидкого воздуха в циклах для
случаев без предварительного охлаждения и с
охлаждением
На рис. 3.6 даны для примера харак-
теристики двух рассмотренных циклов при
сжижения воздуха. При построении кривых
принято: температура воздуха на входе
в установку 30 °C; в дополнительном тепло-
обменнике воздух охлаждается до —45 °C
(аммиак кипит при —50 °C); разность тем-
Для идеальных условий ?о.с=0 и h7, = h7.
Холодильная мощность цикла опреде-
ляется изотермическим эффектом дроссели-
рования при температуре криоагента после
охлаждения его посторонним хладагентом.
Количество теплоты, передаваемой по-
стороннему хладагенту,
Дгост.хл = ^2 О У) (hi' ).
(3.4)
Для рефрижераторного режима
<7дОСТ.ХЛ — hi h3 (Йр Й7,).
Предварительное охлаждение является
совершенно обязательным при сжижении
посредством рассмотренных выше циклов
тех газов, инверсионная температура кото-
рых лежит ниже температуры окружающей
среды. Так, при сжижении водорода и ге-
лия эти газы необходимо предварительно
охладить ниже 180 К и 40 К соответствен-
но. Данные по сжижению газов см.
в табл. 3.1 и в гл. 12.
Кампрессрр
Рис. 3.7. Схема цикла с двойным дроссели-
рованием
58
Низкотемпературные циклы и процессы
Рис. 3.8. Характеристика циклов с двой-
ным дросселированием для сжижения воз-
духа
ператур на теплом конце в обоих тепло-
обменниках 5 °C; приток теплоты из окру-
жающей среды <7о.с = 8,4 кДж на 1 м3 сжа-
того в компрессоре воздуха; изотермический
КПД компрессора 0,6; затрата 1 кВт-ч
электроэнергии дает 3800 кДж холода при
—50 °C.
Цикл с двойным дросселированием
(с циркуляцией под промежуточным давле-
нием). В этом цикле (рис. 3.7 и 3.8) газ
сжимается до давления рз и после присо-
единения к нему циркулирующего потока
дожимается до давления рз- После охлаж-
дения в теплообменнике (по линии 3-4) газ
дросселируется до промежуточного давле-
ния pi- Часть газа в количестве 1—М про-
ходит теплообменник в обратном направле-
нии (линия 5-2) и поступает в компрессор.
Другая часть газа в количестве М дроссели-
руется до pi (обычно 0,1 МПа) и при этом
частично сжижается (доля жидкости у).
Для цикла
^2> — 4“ Л4(Л|/ Л2) ^о.с
<?2 = h2, — h3 -4-Л4(й1, — й2) — <7о.с- )
(3-5)
В идеальных условиях q0,с =0 и Лр=
= hlt h2, = h2-
В цикле возможно применение предва-
рительного охлаждения посторонним хлад-
агентом. В этом случае в формулы (3.5)
подставляют значения изотермических эф-
фектов дросселирования h2,—h3 и hi,—h3
при температуре конца предварительного
охлаждения. На рис. 3.8 верхний пучок,
сплошных кривых показывает удельную ра-
боту сжижения воздуха посредством цикла,
без предварительного охлаждения, а ниж-
ний пучок — с предварительным охлажде-
нием сжатого воздуха до —40 °C. Конечное-
давление сжатия рз во всех случаях равно-
20 МПа. Остальные условия те же, что и
для рис. 3.6. Штриховые кривые — доли,
жидкости у: линия а—-в цикле без пред-
варительного охлаждения; линия b—
с предварительным охлаждением.
В цикле с предварительным охлажде-
нием М не может быть очень малой, так
как иначе становится невозможным тепло-
обмен на холодном конце рекуперативного-
теплообменника. Это становится понятным
при рассмотрении для данного участка ха-
рактера линий ft=const иа диаграмме Т, s.
Так, например, при условиях, оговоренных
рис. 3.8, в циклах с предварительным!
охлаждением до —40 °C не могут быть при-
няты Л-1=0,2 и Л1=0,3. Вообще невозмож-
ны все те М, для которых в данных усло-
виях доля жидкости у становится более-
40 % значения Л4, т. е. если z//M>0,4.
Дроссельные циклы, использующие мно-
гокомпонентные газовые смеси. Идея ис-
пользования в дроссельных системах смесей
в определенной степени связана с успехами
в этом направлении в технике сжижения и
разделения природных газов [201]. Дрос-
сельные циклы в последние годы исполь-
зуются в микрокриогенных системах для
охлаждения различных радиоэлектронных,
устройств. Применение в обычном дроссель-
ном цикле в качестве рабочего вещества
смесей, содержащих высококипящий компо-
нент с большим изотермическим дроссель-
эффектом, увеличивает общий эффект дрос-
селирования. Наиболее распространены сме-
си с низкокипящим компонентом — азотом
или аргоном, к которым добавляются либо
углеводороды предельного ряда (СН4, С2Не,
СзН8), либо хладоны — 14,13, а также крип-
тон и ксенон. Такие смеси обеспечивают
в испарителе рефрижераторной системы по-
лучение температур азотного уровня. Пра-
вильно подобранные смеси обеспечивают-
конденсацию компонентов в прямом и их
испарение в обратном потоке теплообмен-
ника в широком интервале температур..
Этим создаются условия для оптимального-
температурного напора по всей длине теп-
лообменника и, следовательно, низкое зна-
чение термодинамических потерь при тепло-
обмене и дросселировании. Важной задачей
является предотвращение повышения тем-
пературы кипения рабочей смеси в испари-
теле вследствие добавления высококипяще-
го компонента. Для понижения температу-
ры кипения добавляют в смесь небольшое-
количество низкокипящего компонента
(неон, водород, гелий). В этом случае после-
дросселирования благодаря малой раство-
римости низкокипящего компонента в жид-
Циклы, основанные на использовании расширения с отдачей внешней работы
59
Рис. 3.9. Принципиальная схема дроссель-
ного рефрижератора с использованием
смесей, образующих расслаивающиеся
жидкие фазы
кости снижается парциальное давление
остальных компонентов и соответственно
понижается температура кипения. Так
удается получить температуры 77—30 К и
ниже (65—70 К) при использовании смесей
на основе азота, правда, с несколько повы-
шающейся температурой кипения по ходу
потока через испаритель.
Было установлено, что некоторые азо-
тоуглеводородные смеси на уровне азотных
температур разделяются на две жидкие фа-
зы, одна из которых — почти чистый азот,
а вторая — углеводород с малым содержа-
нием азота. Наблюдается также образова-
ние эвтектик в системе твердое тело— жид-
кость, что дает возможность иметь весьма
низкую температуру в испарителе без вы-
падения твердой фазы. Протекание процес-
сов в рефрижераторе с использованием
смеси, образующей две жидкие фазы, по-
ясняется рис. 3.9. Замкнутая полоса
(рис. 3.9,6) построена в соответствии со
схемой рис. 3.9,а и условно показывает
изменение соотношения газовой и жидкой
фаз по ходу процесса. После дросселя
жидкая фаза Ж], состоящая в основном из
низкокипящего компонента (азота), почти
полностью испаряется при постоянной тем-
пературе (75=74). Другая жидкая фаза
Д2, содержащая высококипящие компонен-
ты, проходит испаритель практически без
изменения и испаряется только в тепло-
обменнике. Таким образом, высококипящие
компоненты, обеспечивая высокий общий
дроссель-эффект смеси и необходимое соот-
ношение тепловых эквивалентов в тепло-
обменнике, практически не влияют на про-
цесс в испарителе. Термодинамическая
эффективность дроссельных рефрижерато-
ров, работающих на смесях в интервале
температур 75—80 К, в несколько раз выше,
чем при использовании чистого вещества
(азота). Подробнее о дроссельных циклах
иа смесях см. в [16„ 45].
3.5. ЦИКЛЫ, ОСНОВАННЫЕ
НА ИСПОЛЬЗОВАНИИ
РАСШИРЕНИЯ С ОТДАЧЕЙ
ВНЕШНЕЙ РАБОТЫ И ЭФФЕКТА
ДЖОУЛЯ—ТОМСОНА
Циклы среднего и высокого давления
(Клода, Гейландта). Схема установки, в ко-
торой реализуются процессы расширения
с отдачей внешней работы (детандирова-
ния) и дросселирования, приведены на
рис. 3.10. Здесь же показаны процессы
в 7, s-координатах. Газ, сжатый в компрес-
соре до среднего давления (1,5—6,0 МПа),
после охлаждения в теплообменнике I де-
лится на две части. Одна из них в коли-
честве М поступает в детандер для расши-
рения с отдачей внешней работы, а другая
(1-М) охлаждается в теплообменниках 11
и III и затем расширяется в дроссельном
вентиле. На диаграмме 7, s линия 3-4 изо-
бражает реальный процесс, протекающий
в детандере. Штрихом (вертикаль 3-S) по-
казана линия, соответствующая идеально-
му процессу в детандере (процесс з =
= const).
Энергетический баланс цикла на едини-
цу сжатого газа:
подводится 1-йг+М^+^о.с;
отводится yh0~(1—y)hi,^-Mhs. Отсюда
получаемая доля жидкости
/Zj, /г2—]— Л4(/г3 йЦ <7о.с
и холодильная мощность
Рис. 3.10. Схема установки с детандером
и процесс в 7, s-диаграмме
60
Низкотемпературные циклы и процессы
q2 = hlr—h2+M(hs—h^—q0.c =
— А/1др~|—Л1 АЛдет qo .с.
Адиабатный КПД детандера т]8, харак-
теризующий отклонение реального процесса
расширения от идеального (s=const),
А3 — ^4
^3 - ^4 = 7ls(^3 = •
(3.7)
Значения т]8:
поршневые детандеры для воз-
духа ....................... 0,6—0,75
поршневые детандеры для ге-
лия ..................... 0,75—0,9
турбодетандеры (Капицы) для
воздуха ................. 0,8—0,85
Отклонение действительного процесса
расширения в детандере от идеального обу-
словлено несколькими причинами. На
рис. 3.11 изображен процесс расширения
в детандере с учетом дросселирования газа
в клапанах впуска и выпуска, а также
подвода теплоты в цилиндре. Теплота, по-
ступившая из окружающей среды, представ-
лена заштрихованными площадками.
По уравнению (2.15) удельная работа
расширения
4
/т = J vip = <? + h3 — й4.
з
Работа /т больше количества произве-
денного холода (<7хол=Лз—М на величину
<7 — количества теплоты, поступившей из
окружающей среды. Площадки под За-ЗЬ
и 4Ь-4а характеризуют необратимые потери
при дросселировании в клапанах.
Оптимальная температура газа перед
детандером зависит от давления газа. Из
уравнения (3.6) ясно, что для увеличения
холодильной мощности цикла желательно
направлять в детандер максимальное коли-
чество газа (доля А4). Однако необходимо,
Рис. 3.11. Действительный процесс расши-
рения в детандере в диаграмме Т, s
Рис. 3.12. Оптимальная температура воз-
духа перед детандером и оптимальная до-
ля дросселируемого газа (1—М) в зависи-
мости от давления прямого потока р2 при
сжижении воздуха по схеме с детандером
(рис. 3.10). Кривые b относятся к случаю
расширения в детандере до 0,1 МПа; кри-
вые с — к расширению до 0,5 МПа
чтобы обратный холодный поток смог охла-
дить прямой поток в количестве (1—М) та-
ким образом, чтобы разность температур на
теплом конце теплообменника не превышала
нормального значения 5 °C. Кроме того,,
нужно производить проверку разности тем-
ператур по всей поверхности теплообменни-
ка, так как при понижении температуры
сжатого газа значительно изменяется его'
теплоемкость, особенно при давлениях, близ-
ких к критическому. Последнее обстоятель-
ство следует всегда учитывать при расчете
теплообменников высокого давления в кри-
огенных установках.
Каждому давлению прямого потока со-
ответствуют оптимальная доля М направ-
ляемого в детандер газа и его оптимальная'
температура перед детандером, при кото-
рых доля жидкости максимальна, а удель-
ный расход работы минимален. Для приме-
ра на рис. 3.12 представлены расчетные
[257] зависимости оптимальной температу-
ры воздуха перед детандером и оптималь-
ной доли (1—7Й) от давления сжатого воз-
духа. При расчетах было принято, что сред-
ний температурный напор в теплообменни-
ках I и II (рис. 3.10) равен 10 °C.
На рис. 3.13 дана характеристика уста-
новки с детандером применительно к сжи-
жению воздуха [257]. При расчетах при-
нято поступление теплоты из окружающей
среды через изоляцию <?о.с=8,4 кДж/кг;
изотермический КПД компрессора 0,6; КПД
детандера T]s=0,7. Принято также, что по-
лезно используется 70 % работы расшире-
ния в детандере. Для оценки значения у
следует разделить значение работы сжатия
1 кг воздуха на значение работы, затрачен-
ной для получения 1 кг жидкого воздуха
(ордината рис. 3.13), т. е.
RT^PzIPi _0,09168 lg p2/pt
0,6/уд /уд.
Циклы, основанные на использовании расширения с отдачей внешней работы
61
Рис. 3.13. Характеристика установки с де-
тандером (по рис. 3.10) для сжижения
воздуха:
сплошные линии — расширение в детанде-
ре до 0,1 МПа; штриховые линии — рас-
ширение в детандере до 0,5 МПа; штрих-
пунктирные линии — схема без теплооб-
менника III, расширение до 0,5 МПа
Возможен следующий порядок расчета
установки с детандером: по заданному дав-
лению прямого потока определяют по
рис. 3.12 оптимальные М и температуру
перед детандером, а далее по формулам
(3.6) находят долю жидкости у. Далее не-
обходимо проверить температурный напор
КТ в теплообменниках (/ и //); проще все-
го это делать графически (рис. 3.14).
Распространен также цикл с детандиро-
ванием, в котором газ сжимается до дав-
Рис. 3.14. Проверка температурных напо-
ров в теплообменнике
ления 20—16 МПа. В этом цикле часть
газа может поступать в детандер либо
сразу после компрессора (на рис. 3.10
отсутствует теплообменник I, и температу-
ра в точке 3 в данном случае будет тем-
пературой после компрессора, т. е. около
300 К), либо после предварительного'
охлаждения на 50—70 К. Этот цикл назы-
вается циклом высокого давления с детан-
дированием (цикл Гейландта) и широко
применяется при получении жидкого кис-
лорода из воздуха. Такой цикл (и его мо-
дификации) — один из наиболее экономич-
ных в энергетическом отношении для сжи-
жения газов. Для расчета цикла высокого
давления действительны уравнения (3.6).
Как указывалось, в установках с де-
тандером обязательно необходимо прове-
рять температурные напоры в теплообмен-
никах (рис. 3.14). В координатах Д/г, Т на-
носится зависимость А/г от температуры для
1 кг сжатого газа (жирная линия 5-3). Из
точки 9'* строятся вспомогательная прямая,
характеризующая Kh=f(T) для 1 кг газа
обратного потока, и прямая 9'-Ь под углом
a: tg a=ab/a9'=Kh/КТ=с р—const. Для
обратного потока (газ низкого давления)
Ср практически постоянна. Далее проводят
линию, отражающую изменение Д/г от Т
для данного количества газа обратного по-
тока (1—у) / (1—М), отнесенного к 1 кг
сжатого газа. Для этого находят точку С
по отношению ac=ab(l—у) /(1—М). Если
эта прямая (как изображено на рис. 3.14)
касается кривой 5-3, это означает, что
в точке касания температурный напор КТ=
=0; очевидно, это недопустимо. Тогда сле-
дует прямую 9'-с перенести параллельно
самой себе на отрезок А, равный выбран-
ному минимальному КТ. После этого легко-
определяются температурные напоры на
теплом ДТ’тепл и холодном АТхол концах
теплообменника. Далее необходимо пере-
считать величину у по уравнениям (3.6)
в соответствии с новым значением недо-
рекуперации. Этим методом можно прове-
рить температурные напоры в каждом из
теплообменников 1—111 (рис. 3.10).
Подробнее о методе расчета циклов
с детандированием см. литературу, указан-
ную в § 3.2.
Обычно расширение газа в цилиндре
поршневых детандеров заканчивается не-
при 0,1 МПа, а при более высоком давле-
нии (0,5—1,0 МПа) и дальнейшее расши-
рение происходит путем дросселирования
в клапанах выпуска. Расширение газа в де-
тандере до 0,1 МПа сопряжено с резким
увеличением габаритов машины и другими
трудностями. В последнее время на уста-
новках Гейландта используют турбоде-
тандеры.
* Точка 9' соответствует предполагаемой
температуре обратного потока газа на теплом
конце теплообменника.
•62
Низкотемпературные циклы и процессы
Процессы многократного расширения.
Теоретически можно представить расшире-
ние в детандере двукратным, трехкратным
и т. п. Это значит, что расширение проис-
ходит с начального давления не сразу до
конечного, а постепенно (ступенями). После
каждого частичного расширения газ направ-
ляется в теплообменник для подогрева,
после чего снова расширяется. При
этом чем больше ступеней, тем вы-
годнее расширение. В пределе при бес-
конечно большом количестве ступеней и
непрерывном подводе теплоты можно про-
извести изотермическое расширение при же-
лаемой температуре. Это наиболее выгод-
ный из всех возможных способов расшире-
ния. Очевидно, что при изотермическом рас-
ширении в детандере его холодильная мощ-
ность эквивалентна технической работе рас-
ширения при данной температуре.
Практически вследствие относительной
сложности даже двукратное расширение
в настоящее время не получило распростра-
нения.
Цикл Капицы низкого давления с рас-
ширением в турбодетандере (рис. 3.15)
[208]. Газ (воздух) сжимается турбоком-
прессором до 0,6—0,8 МПа (процесс 1-2),
после чего поступает в регенераторы, где
охлаждается (2-3). Далее воздух делится
на две части: большее количество направ-
ляется на расширение в турбодетандер
(3-4), а остальная часть — в теплообмен-
ник-конденсатор, где происходит конденса-
ция этого воздуха (3-5). Затем жидкость
дросселируется (5-6) до 0,1 МПа. Газ после
турбодетандера направляется противотоком
в теплообменник-конденсатор и далее в ре-
генераторы (4-1'). В диаграмме Т, s линия
3-4 соответствует реальному процессу в тур-
бодетандере, линия 3-4' — процессу, проте-
кающему при s=const.
Доля жидкости после дросселирования
(/?!, —/г2) -4- (1 — ay)(h3 — /г4) —q0,z
у ,
hv—hB
(3.8)
тде а — коэффициент, учитывающий частич-
Рис. 3.15. Схема установки с детандером
низкого давления
ное испарение жидкости при дросселирова-
нии с давления конденсации до атмосфер-
ного. При давлении конденсации 0,6 МПа
он равен примерно 1,25.
Для идеальных условий работы цикла
<7о.с = 0 и h\,=h.
Турбодетандер, сконструированный и
построенный П. Л. Капицей, имеет КПД
0,8 и даже выше. Для одного колеса тур-
бины допустимое давление воздуха на
входе составляет 0,6—0,8 МПа, и имен-
но при этом давлении одноступенчатый
воздушный детандер наиболее экономичен.
По расчетам расход энергии в уста-
новке с турбодетандером, работающим на
давлении 0,6 МПа и имеющим адиабат-
ный КПД 0,8, составляет примерно
1,6 кВт-ч на 1 кг жидкого воздуха при
изотермическом КПД компрессора 0,6. При
расчете принята разность температур на
теплом конце регенераторов 5 °C и по-
ступление теплоты из окружающей среды
через изоляцию 8,4 кДж на 1 м3 перера-
батываемого воздуха.
Использование в цикле только возду-
ха низкого давления позволяет применять
регенераторы, которые характеризуются
малой недорекуперацией и не требуют
предварительной очистки воздуха от СОз
и НгО. Применение только турбомашин
позволяет создавать агрегаты очень боль-
шой производительности. При использова-
нии турбокомпрессоров с высоким КПД
создаются условия для существенного сни-
жения удельного расхода энергии на сжи-
жение газов.
Циклы с каскадом процессов расши-
рения в детандерах. Используя несколько
процессов расширения, осуществляемых на
различных температурных уровнях, можно
создать криогенный цикл сжижения газа
с меньшей необратимостью. На рис. 3.16
дана схема установки с тремя детандерами
и рядом — изображение процессов в коор-
динатах Т, s. Для рабочих тел, не очень
сильно отступающих от идеальных газов,
можно считать в первом приближении, что
в каждый детандер поступает примерно
одинаковое количество газа [209]. Число
детандеров в каскаде зависит от степени
расширения газа, причем с ее увеличением
число детандеров уменьшается.
Возможен вариант установки с кас-
кадом детандеров, когда часть газа, на-
правляемая на дроссель, сжимается до бо-
лее высокого давления рз (штриховая ли-
ния на рис. 3.16) по сравнению с шзом,
расширяющимся в детандерах (давление
рг). Практическое осуществление установ-
ки с каскадом детандеров получили пока
только при сжижении гелия.
Подробнее об установках с каскадом
детандеров см. в [209, 210, 288].
Используются криогенные циклы, в ко-
торых вместо дросселирования осущест-
вляется расширение потока в детандере
Циклы, основанные на использовании расширения с отдачей внешней работы
63
Рис. 3.16. Схема установки с каскадом
детандеров
или эжекторе [14, 16, 800, 959]. В связи
с тем, что удалось решить инженерные за-
дачи, связанные с работой детандеров в
двухфазной области [958], такие циклы
применяются для сжижения гелия и в ре-
фрижераторном режиме [16, 800, 959].
При такой работе в рефрижераторном ре-
жиме холодопроизводительность увеличи-
вается в 1,5—2 раза, а сжижение гелия
увеличивается в 1,3 раза.
Цикл газовых холодильных машин. Для
получения низких температур используют-
ся также газовые циклы. На рис. 3.17 да-
на схема такого цикла. Газ, сжатый в ком-
прессоре до давления р2, охлаждается в
холодильнике (процесс 2-3), после чего
адиабатно расширяется в детандере (3-4)
до давления pi. Холодный газ направляет-
ся в камеру для охлаждения тел и сам
нагревается (4-1), после чего вновь адиа-
батно сжимается в компрессоре (1-2).
Холодильный коэффициент цикла
г = _£2_ =_______^1 _
I (^2 ^1) (^3
сР(Т1~Т.)
CpA'Ps ТЦ) Ср(Т3 Т4)
_______Л-Л
Л — 1}- —-1 '
Здесь предполагается, что рабочее тело
цикла по своим свойствам близко к иде-
альному газу. Поскольку 7'2/7: = 77/7'4=
(й—р
==(А/Л) k , то
1 Л =
Т-2/Л-1
(Pz/Pi) k — 1
Газовый холодильный цикл имеет су-
щественный недостаток: холодильная мощ-
ность qz реализуется при переменной тем-
пературе (от Tt до Т1). Поскольку для
охлаждения газа до точки 3 необходимо
иметь хладагент с Тз, а охлаждение тре-
буется вести при температуре не выше Ti,
соответствующий цикл Карно имел бы хо-
лодильный коэффициент Ёк = Т1/(Тз—Т1)т
т. е. существенно больший. Для уменьше-
ния степени сжатия газа и облегчения ус-
ловий работы, а также понижения темпе-
ратуры Тл. применяют, установки с реге-
нераторами (теплообменниками), располо-
женными перед детандерами. Здесь прямой
поток перед поступлением в детандер ох-
лаждается обратным потоком, выходящим
из камеры охлаждения и направляющимся
в компрессор. Потоки в этом так называе-
мом регенеративном цикле показаны на
рис. 3.17 штриховыми линиями. Затрата
энергии в регенеративном цикле остается
той же, что и в обычном. Подробнее о
газовых низкотемпературных циклах с рас-
ширением в детандерах см. в [212, 213].
' Изложенные выше принципы получения.
Рис. 3.17. Схема и процессы газовой холодильной машины
«4
Низкотемпературные циклы и процессы
низких температур являются физически
основными. При конкретной реализации
схем, например, для получения больших
значений холодильной мощности в техни-
ческом масштабе, они могут сочетаться в
различных вариантах и отличаться числом
дроссельных потоков, числом расширитель-
ных машин, числом потоков с различным
давлением, использованием предваритель-
ного охлаждения на различных темпера-
турных уровнях и т. д. С некоторыми кон-
кретными решениями криогенных устройств
можно детальнее познакомиться в публика-
циях, указанных в § 3.2.
Цикл криогенной газовой машины
(КГМ) — обратный цикл Стирлинга* [214,
294] (рис. 3.18). Схема машины. Между
поршнями В (так называемая теплая сто-
рона машины) и А (так называемая хо-
лодная сторона) расположен регенератор R
(теплоаккумулирующая масса). Газ, иду-
щий из теплой полости в холодную, охлаж-
дается в регенераторе; при обратном ходе
газ нагревается в регенераторе. В цикле
осуществляются следующие процессы: I —
изотермическое сжатие 1-2 (теплота Qi
отводится охлаждающей водой); II— изо-
хорное охлаждение 2-3 (при прохождении
через регенератор); III— изотермическое
расширение 3-4 с отдачей на сторону рабо-
ты (теплота фа подводится от охлаждае-
мого тела); IV—изохорное нагревание
4-1. Для идеального газа цикл эквивален-
тен циклу Карно между изотермами То и
Т-i. В изотермических процессах работа
эквивалентна теплоте. Холодильная мощ-
ность Qi равна работе, отведенной при
расширении Q2=Lotb=GRT2 In V1/V2; под-
веденная работа при сжатии ГПОдв=Ф1=
= GRT0 In Vj/Va, где G — масса газа в ци-
линдре.
Холодильный коэффициент цикла
Ф2 GRT2lnV1/V2
Q1-Q2 GP(70-7'2)lnV1/V2
(3.10)
Эксергетический КПД цикла
т2-т0
Гдодв ГоТВ
Практически в такой машине осуще-
ствляются не рассмотренные периодические
перемещения поршня, а обычные гармони-
ческие колебательные движения. Для мак-
симального приближения к идеальному
циклу кривошипы поршней расположены
под определенным углом. На рис. 3.19 мож-
но видеть расхождение между периодиче-
ским (для идеального цикла) и гармониче-
ским перемещением поршней и соответ-
ствующее изменение объема теплой Гт и
холодной Vx полостей по времени t. Обыч-
но в качестве рабочего вещества исполь-
зуется гелий или водород со степенью рас-
ширения 2—2,5 (с 3,5 до 1,6 МПа).
Криогенная машина Стирлинга позво-
ляет получать жидкий воздух путем его
конденсации на внешней оребренной сто-
роне цилиндра холодной полости.
Фирма «Филипс» (Голландия), первой
начавшая серийное изготовление таких ма-
шин, в настоящее время выпускает их в
различном конструктивном оформлении на
различную холодильную мощность: на
уровне 77 К 2100 (5 л жидкого воздуха
в час), 3300, 12 500, 83 000 кДж/ч. Удель-
ный расход энергии 1,1 кВт-ч на 1 кг
жидкого воздуха.
* Этот цикл, предложенный Стирлингом в
1816 г. как силовой, в 1834 г. Гершелем был
использован в качестве холодильного. Сотруд-
никами фирмы «Филипс» (Голландия) на базе
этого цикла была разработана эффективная
криогенная машина, в ряде публикаций назван-
ная «машиной Филипса».
Рис. 3.18. Обратный цикл Стирлинга
Рис. 3.19. Изменение объемов полостей ма-
шины с гармоническим и периодическим
движением поршней (штриховые линии —
периодическое движение, сплошные ли-
нии— гармоническое движение)
Циклы, основанные на использовании расширения с отдачей внешней работы 65
Рис. 3.20. Характеристики криогенной ма-
шины Стирлинга:
Qz — холодильная мощность машины; L — по-
требляемая мощность, ц,, — эксергетический
КПД (эффективность по отношению к циклу
Карно). Рабочее тело — водород; температура
охлаждающей воды 15 °C
На рис. 3.20 приведена характеристи-
ка крупной машины, работающей по об-
ратному циклу Стирлинга. О конструкции
и расчете таких машин см. на с. 307, а под-
робнее—в [14, 16, 43, 45, 202, 203, 207,
214, 294, 295]. Криогенные машины Стир-
линга в сочетании со специальной ректи-
фикационной колонной обеспечивают по-
лучение из воздуха жидкого азота [214,
296]. Аналогичные машины выпускаются
нашей промышленностью: ЗИФ-1002 на
10 л/ч жидкого азота [215] и более круп-
ная АЖ-0,05 (КГМ) на 65 л/ч [216]. Как
видно из графика рис. 3.20, холодильная
мощность с понижением температуры рез-
ко уменьшается. Это связано с увеличени-
ем теплопритока из окружающей среды и
главным образом с увеличением разности
температур в регенераторе, поскольку в
нем передается большее количество тепло-
ты (растет То—Тг, см. рис. 3.18), а терми-
ческий КПД регенератора, составляющий
99%, увеличить практически невозможно.
Для получения более низких темпера-
тур разработаны двухступенчатые ма-
шины. На рис. 3.21 приведена принципиаль-
ная схема такой КГМ [297]. Как в обыч-
ной одноступенчатой машине, рабочий газ
сжимается в теплой части 7Т и после во-
дяного холодильника 1 поступает в пер-
вый регенератор 2 и далее при темпера-
туре Гпр в промежуточную полость Кпр,
где расширяется примерно !/б часть газа.
Здесь может быть снята часть холодиль-
ной мощности Qnp при температуре 7’Пр=
=50-^80 К посредством теплообменного
устройства 3. Оставшаяся часть газа про-
ходит через второй регенератор 4 и рас-
ширяется в низкотемпературной полости
Гх, где снимается холодильная мощность
5-218
Рис. 3.21. Принципиальная схема двухсту-
пенчатой криогенной газовой машины, ра-
ботающей по модифицированному7 циклу7
Стирлинга
Qx при наинизшей температуре Ту. (до
15 К) посредством теплообменника 5.
Холод, получаемый на уровне Тпр, ком-
пенсирует все потери первого регенератора
и обеспечивает эффективное охлаждение
газа во втором регенераторе 4. Кроме того,
возможность иметь холод на двух темпе-
ратурных уровнях особенно полезна при
сжижении газов, так как позволяет пред-
варительно охладить газ перед его кон-
денсацией и тем самым уменьшить термо-
динамические потерн при передаче тепло-
ты. На рис. 3.22 представлены зависимости
Qnp и Qx от температуры соответственно
Та-р и 7'х для двухступенчатой машины
[298]. Штриховая часть кривых соответ-
ствует ситуации, когда 7’х>7’пр, т. е. слу-
чаям ненормального режима.
При работе машины в рефрижератор-
ном режиме (Qnp=0) эксергетический
КПД машины (т. е. эффективность по от-
ношению к циклу Карно) при 20 К со-
ставляет более 15%. При сжижении на та-
кой машине водорода (с охлаждением от
температуры окружающей среды 300 К)
расходуется около 1,9 кВт-ч на 1 л жид-
кого водорода [297]. Разработан ожижи-
тель гелия, в котором для промежуточного
Рис. 3.22. Холодильная мощность двух-
ступенчатой машины на температурных
уровнях Тпр и Тх
66
Низкотемпературные циклы и процессы
охлаждения используют две двухступенча-
тые газовые машины [298].
Криогенные машины, работающие по
обратному циклу Стирлинга, особенно по-
лезны и эффективны для переконденсации
насыщенного пара, образующегося при ис-
парении жидких криопродуктов. В этом
случае с наименьшей необратимостью ис-
пользуется мощность машины: теплота пе-
редается при постоянной температуре и
с постоянным, по возможности минималь-
ным, температурным напором.
Криогенные устройства с малой холо-
дильной мощностью (микрокриогенная тех-
ника). Для повышения эффективности
некоторых радиоэлектронных устройств не-
обходимо их охлаждать до низкой тем-
пературы. Поскольку эти устройства весь-
ма миниатюрны, требуемая холодильная
мощность мала — несколько ватт и мень-
ше. Для этой цели оказались удобными
миниатюрные криогенные устройства, ра-
ботающие как по дроссельным и детандер-
ным схемам, так и по обратному циклу
Стирлинга, одноступенчатые и двухступен-
чатые [45, 46]. В таких машинах получе-
ние температур 30—40 К обеспечивается
одноступенчатой машиной. Для получения
температур 20 К и ниже необходимы двух-
ступенчатые машины.
Вариантом машины, работающей на
основе процесса расширения с совершени-
ем внешней работы, служит микрокриоген-
ное устройство, предложенное в 1959 г.
Гиффордом и Мак-Магоном [214, 299, 451].
На рис. 3.23 приведены схема такой ма-
шины и изображение процесса в диаграм-
ме Т, s. Сжатый до давления р2 газ из
компрессора 1 через клапан 5 заполняет
регенератор 4. Затем вследствие перемеще-
ния вверх поршня 6 в цилиндре 5 детан-
дера газ проходит через регенератор,
охлаждается в нем (процесс 2-3) и за-
полняет пространство под поршнем. После
закрытия клапана 3 газ расширяется в де-
Рис. 3.23. Схема микрокриогенного устрой-
ства малой холодильной мощности с реге-
нератором и детандером
тандере (процесс 3-4) до давления pi с
отдачей внешней работы £дет. Следует от-
метить, что газ, заполнявший регенератор,,
также расширяется в детандере и несколь-
ко увеличивает холодильную мощность.
При открытии вентиля 2 газ из ци-
линдра 5 направляется в регенератор, вос-
принимая по пути тепловую нагрузку Q2-
(4-5). После нагрева в регенераторе (5-1)
газ поступает вновь в компрессор, и цикл
повторяется.
Холодильная мощность устройства
Q2 = nfL(//6-z/1), (з.Н).
у^общ
где /Идет, Мобщ — массы газа, расширяю-
щегося в детандере и сжимаемого комп-
рессором.
Устройство обеспечивает получение
температур до 50 К при весьма малой хо-
лодильной мощности (десятые доли еди-
ницы ватта). Масса газа, остающегося в.
регенераторе (Мобщ—Мдет), снижает эф-
фективность процесса, поэтому объем ре-
генератора желательно иметь минималь-
ным по сравнению с объемом расширения
в детандере. Большим преимуществом ма-
шины является то, что уплотнение поршня
и распределительные вентили расположены
на «теплой» стороне. Об этом методе см.
также |[ 14, 16, 43, 2871.
Метод Симона. Своеобразной модифи-
кацией цикла с детандированием может
служить квазицикл для сжижения гелия
или водорода по методу Симона. Этот ме-
тод основан на эффекте Джоуля: охлаж-
дение газа в сосуде постоянного объема
при частичном выпуске газа и, напротив,
нагревание газа при заполнении сосуда
[10, 14, 16]. В сосуд закачивается под
высоким давлением (до 15 МПа) гелий
или водород, затем этот сосуд охлаждают
до возможно низкой температуры, напри-
мер в ванне с жидким или твердым во-
дородом до 20—10 К (при сжижении ге-
лия) или до 60—50 К (при сжижении во-
дорода). После охлаждения сосуд с газом
теплоизолируется и газ выпускается из
сосуда через вентиль. На любой стадии
расширения находящийся в сосуде газ рас-
ширяется обратимо (изоэнтропио), совер-
шая работу по выталкиванию другой части
газа.
На рис. 3.24 в диаграмме Т, s пред-
ставлен процесс сжижения газа, остающе-
гося в сосуде. Газ в сосуде вместимостью
V охлаждается до точки А посторонними
хладагентами. При открытии вентиля, как
уже отмечалось, остающийся в сосуде газ
расширяется по изоэнтропе А-С, поэтому
для любого состояния после начала сжи-
жения (точка В) общая энтропия равна
сумме энтропий жидкости (точка L) газа
в точке G и энтропии газа, покидающего-
сосуд в состояниях, характеризуемых ли-
нией D-G, т. е.
Циклы, основанные на использовании расширения /с отдачей внешней работы 67
V yV 71 — у) V
VB Sb = VL Sl+ ' Ц} S(} + MSe'
Здесь V—объем сосуда; vb, Vl, vg, Sb=sa_,
si — удельные объемы и энтропии рабо-
чего тела в соответствующих точках; у —
максимальная (для рассмотренных идеаль-
ных условий) доля объема сосуда V, за-
полняемого жидкостью; М — масса газа,
покидающего сосуд при состояниях, отве-
чающих линии D-G; sE — удельная эитро-
лия газа, покидающего сосуд.
Можно записать
М = V УУ _(1-У)У
VB VL VQ ’ '
После преобразований, исключающих У,
получаем
vl Г vg<se~ sb) + "b(sg “ se)
у = — -------------------------- •
L vg(se — sl> +vdsG~ se) .
(3.12)
Точное значение sE должно вычисляться
>по отдельным точкам иа линии D-G. Од-
«ако не будет большой ошибкой принять
Дк как среднее арифметическое между
Sb и Sg.
Для действительных условий следует
учесть необходимость охлаждения массы
металла сосуда от температуры предвари-
тельного охлаждения до температуры сжи-
жения газа. Теплоемкость металла сосуда
яри низких температурах существенно
уменьшается и не превышает 0,5—1% теп-
лоемкости жидкого гелия нлн 20—25% теп-
лоемкости жидкого водорода, получаемых
.в сосуде.
Вычисленные по уравнению (3.12) зна-
чения у вполне удовлетворительно совпа-
дают с полученными экспериментальными
данными. Об этом методе см. в [14, 16, 31,
287, 300].
Оригинальной разновидностью микро-
криогенного устройства, основанного на
методе Симона для осуществления непре-
рывного охлаждения, служит машина, пред-
ложенная Гиффордом и Мак-Магоном, схе-
ма которой приведена иа рис. 3.25 [214,
299, 451J.
Рис. 3.24. Процесс Симона в диаграмме
Т, s
Рис. 3.2t\ Схема микрокриогенного устрой-
ства с вытеснителем (по Гиффорду и Мак-
Магону)
Машина состоит из вытеснителя 5,
свободно перемещающегося в цилиндре.
Верхняя (теплая) полость цилиндра V, и
нижняя (холодная) V2 (максимальные
значения 1% и V2 равны) соединены через
регенератор 4. Давления в полостях Vi и
1% практически всегда одинаковые, так что
при перемещении вытеснителя никакой ра-
боты ие производится. По этой же при-
чине переток газа из пространства в V2
по щели между цилиндром и вытеснителем
практически отсутствует.
Работа устройства протекает следую-
щим образом. При крайнем нижнем по-
ложении вытеснителя 5 газ с температурой
То из компрессора 1 через клапан 3 за-
полняет объемы полости Vi и регенерато-
ра 4. Вследствие повышения давления до
р2 температура газа в полости 1% повы-
шается. При открытом клапане 3 вытесни-
тель 5 поднимается до крайнего верхнего
положения, переталкивая газ из полости
Vi в Vi (при постоянном давлении р2).
Поскольку при этом газ в регенераторе
охлаждается (уменьшается его удельный
объем), из компрессора продолжает посту-
пать добавочное количество газа при То-
Охлаждение газа в регенераторе происхо-
дит, начиная с температуры Т, (более вы-
сокой, чем То), установившейся после
смешения газов (газа, оставшегося в по-
лости Vi при pi от предыдущего цикла;
газа, поступившего в полость Vi в про-
цессе повышения давления до р2; газа,
дополнительно поступающего при То при
движении вытеснителя. При этом у первых
двух составляющих температура повыша-
лась при повышении давления с pi до р2).
На диаграмме Т, s охлаждение в регенера-
торе изображается линией 1-2. Затем за-
крывается клапан 3 и открывается клапан
2; газ при переменном давлении выходит
из регенератора (линия 5-6 на диаграмме
Т, s), а остающийся в объеме V2 газ рас-
ширяется до pi, совершает работу вытал-
кивания, в результате чего охлаждается в
5;
68
Низкотемпературные. циклы и процессы
идеальном случае по изоэнтропе (линия
2-3), т. е. происходит процесс, аналогич-
ный процессу в устройстве Симона. На-
чиная с момента выпуска газа через кла-
пан 2, отдельные порции газа, выходящие
из объема V2 и имеющие постепенно по-
нижающуюся температуру (по линии 2-3),
проходят через теплообменное устройство
6, в котором забирают теплоту от охлаж-
даемого объекта (нагреваясь в идеальном
случае до Т2). Наконец, когда давление
снизится до pi, вытеснитель перетолкнет
оставшийся в полости V2 газ через регене^
ратор в полость V[. Суммарно в тепло-
обменном устройстве будет поглощена га-
зом теплота Q2 по линиям 3-4. В регене-
раторе газ нагревается до температуры Ti
по линиям 4-6. Далее цикл повторяется.
Суммарно разность энтальпий газа,
выходящего через клапан 2 и входящего
через клапан 3, должна равняться холо-
дильной мощности системы Q2.
На рис. 3.25 показана упрощенная
структура цикла [299]. Следует отметить,
что процессы на диаграмме Т, s могут
быть показаны лишь условно, поскольку
при стадиях заполнения и расширения
каждая малая часть газа имеет свою от-
дельную линию p=const (на рисунке по-
казаны штрихом). Таким образом, каждая
изобара обратного потока относится к от-
дельным порциям газа. Линия 5-6 соот-
ветствует изоэнтальпному расширению га-
за в клапане 2, и процесс этот протекает,
как отмечалось, при температуре более
высокой (Ti), чем температура выходящего
из компрессора газа высокого давления
(То). Можно оценить эффективность этого
криогенного устройства. Работа адиабат-
ного сжатия в компрессоре
k—i
Д-'.о’лп= tHCpTf) (Pz/Pl) 1 ’
где т — масса газа, сжимаемого в комп-
рессоре i[m=m2—mi; здесь m2=p2K2/(p7’2)—
масса газа в объеме 1% при р2 и темпера-
туре Т2; mi—piVJiRTi)—масса газа в
объеме Vi при pi и температуре Ti. Отсю-
да т=
Т?/2 Р7х J
Поскольку энтальпии газа, входящего
И выходящего на холодном конце регене-
ратора, для идеальных условий работы
одинаковы, тепловая нагрузка Q2, воспри-
нимаемая холодным газом, выходящим из
объема V2, должна равняться технической
работе изохорного процесса Q2=(p2—pi)Vz.
Следовательно,
' см СрУо [^2/(^2) pV-J(R7\)]Х
Qz ~ ' vz(Ps -- АЛ *
Х[(А/Р1) 11 —1]
Если принять Тг^Тв, то
LK0Mn _^[(A/A)(^-1JX ;
Q2 = %(Рг/Р1) — О
г (3.13)
х (р2/а)а -И
В качестве рабочего газа используют гелий,
отношение максимального и минимального
давлений в цикле 2,5—3. Тогда из форму-
лы (3.13) при 7’о=ЗОО К и А—80 К LIQz~
=6-=-7, что соответствует эксергетическому
КПД 40—45%. С ростом отношения дав-
лений КПД резко падает. Так, уже при
отношении p2/pi=5 КПД равен 25%. Осу-
ществлено устройство с холодильной мощ-
ностью 80 Вт при 80 К и КПД немногим
менее 30%. Большое преимущество таких
машин—расположение уплотнений вытес-
нителя и распределительных клапанов на
теплой стороне. Термодинамический анализ
цикла дан в >[299, 452].
Для получения температур, близких к
гелиевым, используется трехступенчатая
машина, работающая по тому же принципу
[451]. Схема такой машины приведена на.
рис. 3.26. Холодильная мощность может
быть реализована на трех температурных
уровнях: 80, 35 и 14 К. С помощью та-
кого устройства может быть ступенчато-
охлажден отдельный поток сжатого гелия,
часть которого сжижается, как обычно, по-
сле дросселирования.
Построены и испытаны устройства,
сочетающие дроссельные системы и трех-
ступенчатые машины Гиффорда — Мак-Ма-
гона, которые обеспечивают при 4,2 К хо-
лодильную мощность 4 и 0,75 Вт. Опти-
мальное соотношение давлений в цикле
3—4 (2,0 МПа и 0,56 МПа) [451]. При
Рис.. 3.26. Схема трехступенчатой машины
(по- Гиффорду и Мак-Магону)
Специальные методы охлаждения
69
получении жидкого гелия на таком устрой-
стве показатели, как и следовало ожидать,
не высоки: расход электроэнергии 6—
7,5 кВт-ч на 1 л жидкого гелия и эффек-
тивность по отношению к идеальному цик-
лу сжижения 3—4%. Устройство с холо-
дильной мощностью 4 Вт позволяет сжи-
жать 1—1,3 л/ч гелия. Об этих циклах см.
также в [14, 16, 43, 287].
Сублимационные системы охлаждения
[45, 217, 218, 453]. Эти системы основы-
ваются на сублимации запаса твердого
криоагента при поглощении им теплоты от
охлаждаемого объекта. Преимущественно
они применяются в авиации и космических
исследованиях (охлаждение ИК-приемни-
ков и др.) [453]. Ниже указаны используе*
мые в таких системах криоагенты и при-
ведены диапазоны рабочих температур и
давлений, а также их плотности:
Т, К р, гПа р,
г/см3
Водород......... 8—14 2—43 0,09
Неон...............15—24 2—35) 1,4
Азот............... 44—63 2—120 1,02
Аргон...........5J—83 2—650 1,7
Кислород . . • . 48—54 2 1,4
Оксид углерода 50—68 2—150 0,93
Метан.............. 65—88 2—110 0,52
Диоксид углерода 125—194 130!) 1,6
Другие физические константы для этих
веществ можно найти в разд. 4.
Используемые давления над твердым
криоагентом обычно не ниже 0,2—1,5 гПа.
Сублимационные системы охлаждения
применяют для объектов с малым тепловы-
делением (10—200 мВт), они обеспечива-
ют большой ресурс работы — до Ю1 ч и
более.
Основные элементы сублимационной
системы охлаждения: теплоизолированный
криостат с твердым криоагентом, устрой-
ства для поддержания постоянного давле-
ния и отвода паров криоагента, хладопровод
для контакта с охлаждаемым объектом.
Важная и трудная задача — обеспече-
ние плотности контакта теплопроводящих
элементов (хладопровода) с твердым крио-
агентом. Используют развитую поверхность
с перфорированными ребрами и конфигу-
рацией, обеспечивающей движение пара
сублимируемого вещества без застойных
зон. Важна возможность осуществления
принудительного контакта теплопередаю-
щей поверхности с твердым веществом
[217, 951]. Получение в криостате твердо-
го криоагента осуществляют либо вакууми-
рованием парового пространства над за-
литой жидкостью, либо замораживанием
жидкости посторонним криоагентом (напри-
мер, холодным гелием). Твердый криоагент,
полученный вторым способом, более плотен
и поэтому более эффективен для целей
криостатирования объекта. Подробнее о
теплофизике сублимационного охлаждения
см. в [217].
3.6. СПЕЦИАЛЬНЫЕ МЕТОДЫ
ОХЛАЖДЕНИЯ
Холодильные процессы в вихревых тру-
бах (эффект Ранка) [47, 219, 220]. С по-
мощью вихревого эффекта можно осуще-
ствить своеобразный термодинамический
процесс, в результате которого одновремен-
но образуются холодный и нагретый потоки
газа.
Сжатый газ (массовый расход G) с
параметрами 70 и Ао (рис. 3.27), подавае-
мый в теплоизолированную трубу 3 (длина
L, диаметр D, площадь сечения F) через
сужающееся сопло 4 (наименьшая пло-
щадь сечения Fo) по касательной к внут-
ренней поверхности трубы, образует внут-
ри трубы вращающийся ' поток, который
можно, регулируя давление в трубе клапа-
ном 2, разделить на две части: охлажденный
поток в количестве G|=xG при низком
давлении pt и со средней энтальпией А|<
<Ло, выходящий из осевой зоны трубы
через диафрагму 1 с диаметром централь-
ного отверстия d<D, и Нагретый поток
(G—G]) со средней энтальпией h2>h\ и
давлением p2^pi, отводимый через клапан
2. Давление р2 зависит от конструктивных
особенностей трубы и режима работы. Так,
для р0/р!^8 обычно р2/ро=О,3-нО,5. Удоб-
но разность удельных энтальпий потоков
(Ло—А|)=Д|А, и (й2—Ао)=ДЛ2 отнести к
Рис. 3.27. Схема и характеристика вихре-
вой трубы
70
Низкотемпературные циклы и процессы
разности (йо—hs) ^>hhs (h-s — энтальпия га-
за в конце изоэнтропного расширения от
ро до pi) и работу вихревой трубы харак-
теризовать безразмерными величинами т]=
=Дй1/Дйа и 0=ДЙ2/ДЙ8, которые связаны
соотношением т| = 0(1—%)/%, вытекающим
из законов сохранения массы и энергии.
Кривые на рис. 3.27 иллюстрируют пример-
ную экспериментальную зависимость вели-
чин п и 0 от доли охлажденного потока
x=Gi/G при po/pi=l,3-i-l 1, d/£>=0,4-=-0,6;
L/r»10, Fc/F=0,05-нОД и cP/c„=l,3-=-0,67,
где F и Fa — площадь поперечного сечения
трубы н сопла [219, 220].
Конические вихревые трубы с углом
раскрытия 2—4° в сторону клапана 2 на
20% эффективнее цилиндрических [219].
Несмотря на малое термодинамическое
совершенство холодильных процессов на
основе вихревых труб (их КПД не пре-
вышает 5%), применение их иногда оказы-
вается экономически целесообразным как в
лабораторной технике, так и в промыш-
ленности благодаря конструктивной про-
стоте и надежности самих вихревых труб.
Система с одной вихревой трубой приме-
няется для охлаждения до температур
—40-=—60 °C [220], но при этих темпера-
турах она требует примерно в 20 раз боль-
шего расхода энергии по сравнению с па-
ровыми компрессионными холодильными
машинами. Каскадная установка с вихре-
выми трубами (совокупность вихревых труб
с теплообменниками) может обеспечить хо-
лодильную мощность принципиально на
любом температурном уровне. Расчеты по-
казывают, что наибольшая степень термо-
динамического совершенства таких устано-
вок достигается при работе вихревых труб
с максимальным значением произведения
г\2х и несколько возрастает с понижением
температурного уровня нагрузки (с увели-
чением числа ступеней). Однако даже при
температурах около 4 К каскадная уста-
новка с вихревыми трубами потребует в
3—5 раз большего расхода энергии и боль-
шего количества циркулирующего рабочего
тела по сравнению с установками на ос-
нове детандеров.
Криогенная система — пульсационная
труба. В основе этой системы лежит то
же явление, что и использованное в про-
цессах Симона, Гиффорда и Мак-Магона:
нагревание газа при наполнении емкости и
его охлаждение при опорожнении. В уст-
ройстве предусмотрен отвод теплоты ох-
лаждающей водой на закрытом конце тру-
бы, где создается наиболее высокая тем-
пература во время фазы заполнения трубы.
Это в конечном счете обеспечивает
охлаждение газа во время последующей
фазы его выхлопа. -Перед входом газа в
трубу' расположен тепловой регенератор,
обеспечивающий понижение уровня рабо-
чей температуры трубы. В одноступенча-
той трубе удалось достичь температуры
180 К, а в двухступенчатой—140 К. Ши-
рокого практического использования эта
система пока не получила. Описание
устройства см. в {14, 16].
Цикл Вюлемье — Такониса. Особенность
этого цикла — использование для охлаж-
дения тепловых потоков, т. е. охлаждение
практически без затраты механической
энергии. При этом подводятся (отводятся)
тепловые потоки на трех различных тем-
пературных уровнях. На высоком темпера-
турном уровне (300—1000 К) подвод теп-
лоты обеспечивает цикл необходимой энер-
гией. На промежуточном температурном
уровне (30—300 К) производится отвод
теплоты — как обеспечивающей получение
работы цикла, необходимой для компенса-
ции необратимости процессов и для пере-
носа теплоты с нижнего температурного
уровня (15—70 К) на промежуточный, так
и подводимой от охлаждаемого объекта.
Необходимые перемещения рабочего тела
в машине осуществляются движением вы-
теснителей, как уже упоминалось, практи-
чески без затраты механической энергии.
Интерес к циклу связан с возможностью
работы только на использовании эксергии
теплоты. Данных о широком использовании
таких машин нет. Более подробное описа-
ние цикла см. в [14, 16, 43, 202].
Десорбционный метод охлаждения.
Впервые примененный Симоном в 1926 г.,
этот метод использует эффект понижения
температуры, наступающий при откачке
пространства над насыщенными газами и
охлажденным адсорбентом. В принципе ме-
тод включает адсорбцию гелия активиро-
ванным углем при водородных температу-
рах, отведение теплоты адсорбции, после-
дующую тепловую изоляцию сосуда с уг-
лем и, наконец, откачку адсорбированного
гелия. Так, при первоначальном охлажде-
нии угля до 13 К адсорбционным методом
была получена температура ниже 4 К. По-
средством несколько видоизмененного ме-
тода была получена температура 1,6 К.
В качестве адсорбентов можно использо-
вать не только активированный уголь, но
также силикагель, цеолиты [454].
Термоэлектрическое охлаждение [48,
222—224]. В основе метода лежит эффект
Пельтье (открытый в 1834 г.), заключаю-
щийся в том, что при пропускании тока
по цепи, состоящей из двух различных про-
водников, в точках контакта выделяется
или поглощается Q2n:
Q2n=aIT2,
где I — ток; Т2— температура холодного
спая; а — коэффициент термо-ЭДС, зави-
сящий от природы материалов.
Эффект Пельтье является в точности
обратным используемому в термопарах
(эффект Зеебека). Физически явление свя-
зано с тем, что энергия свободных элек-
тронов, участвующих в электрическом то-
Специальные методы охлаждения
71
ке, в различных проводниках по-разному
зависит от температуры. Если существует
перепад температур, то электроны на «го-
рячем» конце имеют большую энергию, чем
на холодном; в результате этого возникает
движение электронов к «холодному» концу,
где накапливается заряд и создается обрат-
ная уравновешивающая электродвижущая
сила. Разность этих электродвижущих сил
в различных проводниках и обусловливает
возникновение термо-ЭДС.
Если в цепи направление тока таково,
что электроны, обладающие меньшей энер-
гией, «отобрав» теплоту от окружающих
атомов, переносят его в другую часть це-
пи, то будет происходить охлаждение од-
ного спая и нагрев другого (эффект Пель-
тье). Таким образом, такая пара провод-
ников может служить холодильным агре-
гатом, в котором роль рабочего тела вы-
полняет электронный газ, переносящий
энергию от холодного спая к горячему.
Эффект при обычных термопарных про-
водниках невелик. Академик А. Ф. Иоффе
с сотрудниками показали, что при исполь-
зовании полупроводниковых охладителей
можно получить в десятки раз более вы-
сокую эффективность охлаждения.
В основе термоохлаждающего прибора
лежит термоэлемент (рис. 3.28), представ-
ляющий собой последовательно соединен-
ные две полупроводниковые ветви А и В,
одна из которых обладает электронной (и),
а другая — дырочной (р) проводимостью.
При пропускании тока I на одном спае
поглощается теплота Пельтье (Q2") при
7г, а на другом выделяется теплота Qo>
снимаемая при температуре окружающей
среды То. Как указывалось выше,
Q2"=('a,i—ав)1Т2.
В проводнике с током выделяется теплота
Джоуля, уменьшающая Опг- Установлено,
что на каждом спае в первом приближе-
нии выделяется половина всей теплоты
Джоуля, т. е.
(2дЖ=0,5/2Д,
Рис. 3.28. Схема элементарного термоох-
ладителя Пельтье (а) и характеристика
работы термобатареи (Го = 298 К, z=
— 2,67-103 К"1) (б)
где R—полное электрическое сопротивление
ветвей.
Количество поглощаемой теплоты на
холодном спае уменьшается также за счет
теплового потока QT от горячего спая по
ветвям проводника:
QT=K(7'o—То),
где К—полная теплопроводность ветвей.
При отсутствии внешней тепловой нагруз-
ки на холодный спай и пренебрежении
теплопритоком из окружающей среды вся
теплота Пельтье Qzn уравновешивается
суммой встречных тепловых потоков фдж-ф-
-PQt, т. е.
(«а—aB)/7'2=O,5W+K(7'o—Гг);
(ал — ав)1Т2 + 0,5/3Р
То Т2= •
Этому состоянию равновесия соответствует
максимальное понижение температуры хо-
лодного спая.
Приравняв производную д(То—Тг)/д1
нулю, найдем оптимальное значение тока и
соответствующее максимальное значение
А 7' макс:
(ад $
= R ]’ .
(а. — ав)2Т22
(То T2)MaKC = %RK2 0,5з7’22;
т + (314)
7 амин— „ ’
Z
где
,СМ~ “в)2
z= RK
Если предположить, что обе ветви тер-
моэлемента имеют одинаковые геометри-
ческие размеры, обладают одинаковой теп-
лопроводностью (А,д=%в=%), одинаковым
удельным электросопротивлением рд=рв=
=р и равными, но противоположными по
знаку термо-ЭДС ад——ав, то при этих
условиях получим характеризующий крите-
рий для термоэлемента
где р = 1/г.
Максимальное значение 0^мак* и соот-
ветствующее 7^пт:
(аА~ ав)2То2
^2макс ~ 2R (То — Т2)К;
72
Низкотемпературные циклы и процессы
(ад — ав)^2
УОПТ R
На рис. 3.28 для примера приведена
зависимость Qa" и Тг—То от I.
Холодильный коэффициент термобата-
реи
Q2'1
е — ---—
L
5PR — К (Т0-Т2)
l2R + (аА~ аВ~> (То — TJ!i
(3.16)
{в знаменателе — мощность, расходуемая
на теплоту Джоуля и преодоление термо-
электродвижущей силы);
Максимальное значение емавс и соот-
ветствующий Is опт:
_ Т0(М — Т0/Т2)
(“д—'“вЧ^о— ^а)
опт = R(M — 1) 7 ’
где Л1=[1 +O,5z(7'o + 7’2)]1/2.
Поскольку единичный термоэлемент
развивает незначительную холодильную
мощность, для получения достаточно боль-
ших Qa применяют термобатареи, состоя-
щие из большого числа (сотни и тысячи)
последовательно соединенных термоэлемен-
тов ,[48].
Величина г, связывающая термоэлек-
трические, электрические и тепловые свой-
ства вещества, представляет собой крите-
рий эффективности термоохлаждения. Та-
ким образом, важно изыскать материалы с
высоким г. У всех металлов отношение
<т/Л. приблизительно одинаково, а у полу-
проводников даже меньше, чем у металлов,
однако а у них значительно больше и в
результате z также больше. Этим обстоя-
тельством определился успех применения
полупроводников для термоохлаждения.
Лучшими материалами для термоэлемен-
тов в настоящее время служат твердые
растворы BiaTes—BiaSba и В12Тез—ЗЬзТез
[223]. Для них в области низких темпера-
тур (Т<250 К) аге: / Г, а в области отно си
тельно высоких (7^:250 К) z=xl/ Ут. Для
различных полупроводниковых термоэле-
ментов в области умеренных температур
значение z равно от 1,2-10-3 до 4-10—3 1 /К.
Величину z следует брать для средней в
рабочем интервале температуры.
Для увеличения температурного пере-
пада и эффективности холодильного уст-
ройства применяют каскадное охлаждение,
используя несколько термобатарей, после-
довательно охлаждающих одна другую.
Общее понижение температуры, дости-
гаемое посредством термохолодильных уст-
ройств, обычно То—7'2<100К (7,2>150К).
В качестве примера можно привести
характеристики термохолодильного устрой-
ства, работающего в режиме максимального
холодильного коэффициента е«ам (z=
= 1,93-10-э К-1 и 7'2=0°C):
£макс
°макс , о/о
£ Карно
Го-Га, К
5..................5.33...............9,75
20.................1,14...............7,65
40................ 0,32 . . . 4,65
60 ............... 0,08 1,75
При получении криотемператур термо-
холодильные элементы могут использовать-
ся как последняя ступень охлаждения в
сочетании, например, с машиной, работаю-
щей по обратному циклу Стирлинга. Инте-
ресно отметить, что для сплава висмут—
сурьма при 77 К z=4,8-10~3 К-1, в то вре-
мя как при 300 К z=l,8-10_3 К-’ [223].
Сплав может эффективно использоваться
в области криотемператур.
Гальванотермомагнитный эффект
охлаждения (эффект Эттингсгаузена).
Нернст и Эттингсгаузен (1886 г.) обнару-
жили эффект, заключающийся в том, что
в проводнике, помещенном в магнитном по-
ле и имеющем в перпендикулярном полю
направлении градиент температур, в треть-
ем взаимно перпендикулярном направлении
появляется электрическое поле (эффект
Нернста). Наоборот, если в проводнике
протекает ток в направлении, перпендику-
лярном магнитному полю, то в третьем
направлении возникает градиент темпера-
туры (эффект Эттингсгаузена) (рис. 3.29).
Коэффициенты Нернста N и Эттингс-
гаузеиа Р составляют
Е Л.Т
N =-------; ; NT=PT.
Н\Т HI
Здесь Е—напряженность электрического по-
ля; Н — напряженность магнитного поля;
I—ток; АГ—температурный градиент; Л —
теплопроводность проводника.
Поскольку термохолодильное устройст-
во состоит из одной электрической ветви,
довольно просто сделать каскадный холо-
дильник. Форма такого холодильника с
бесконечным числом ступеней и приведена
на рис. 3.29: верхняя площадка—«холод-
ная» сторона (Qa, Т2), нижняя — «теплая»
(Qo, То). Такая форма проводника обуслов-
Рис. 3.29. Схема, иллюстрирующая эффект
Эттингсгаузена
Методы получения температур ниже 0,3 К
73
лена тем, что по мере удаления от холод-
ной поверхности тепловой поток увеличи-
вается на работу, затрачиваемую на транс-
формацию теплоты. Можно показать [455],
что расчеты эффекта охлаждения Эттингс-
гаузена проводятся по соотношениям, уста-
новленным для эффекта Пельтье, конечно,
с заменой соответствующих отдельных чле-
нов. Так, вводится критерий z= CV/P) <тД,
аналогичный коэффициенту добротности
(3.15).
Максимально достигаемая ДТ1:
ДЛ1акс=О,5г7,2о.
В качестве материалов для проводника
используют сплав 97% Bi и 3'% Sb. Для
монокристаллов такого сплава значения z
при магнитном поле 1,0 Тл плавно возрас-
тают от 0,2-10-3 1/К при 300 К до макси-
мального значения 3,5-10-3 1 /К при 100 К.
Расчеты показывают, что при поле
1,0 Тл можно при температуре теплой сто-
роны 7о=77 К получить снижение темпе-
ратуры /\7=9-;-12 К. Устройство на основе
эффекта Эттингсгаузена имеет малое зна-
чение холодильного коэффициента 8 и ма-
лый КПД т]е по отношению к циклу Кар-
но. Так, расчеты показывают, что для пя-
тиступенчатой системы при 7’о=297 К и
7г=198 К 8=0,0019 и т]в=0,1%. Подробнее
об этом см. в [224, 455].
3.7. МЕТОДЫ ПОЛУЧЕНИЯ
ТЕМПЕРАТУР НИЖЕ 0,3 К
Испарением жидкого гелия (4Не) под
вакуумом можно получить температуру
0,7—1 К.
Используя различные методы откачки
паров жидкого легкого изотопа гелия
(3Не), можно практически получить темпе-
ратуры не ниже 0,3 К.
Для получения более низких темпера-
тур используются метод адиабатного раз-
магничивания и эффект охлаждения при
растворении 3Не в сверхтекучем 4Не.
Метод адиабатного размагничивания.
Метод был разработан одновременно Деба-
ем и Джиоком в 1926 г. [31]. На рис. 3.30
дана диаграмма Т, s для парамагнитной
соли. Для эффективного магнитного охлаж-
дения необходимо, чтобы «немагнитная»
энтропия системы (решеточная часть sL)
была мала в сравнении с магнитной эн-
тропией вон, обусловленной нескомпенси-
рованными спинами электронов. Обычно Sl
вблизи 1 К имеет малое значение. При этих
температурах энергия взаимодействия
ионов мала по сравнению с энергией теп-
лового движения kT, поэтому пространст-
венная ориентировка ионов остается хаоти-
ческой, а «магнитная» спиновая часть эн-
тропии еще значительна. На рис. 3.30 ход
кривой энтропии соли в зависимости от
температуры изображен линией зон. При
наложении -магнитного поля (примерно
Рис. 3.30. Диаграмма Т, s для парамагнит-
ной соли
1,0 Тл) большая часть ионов ориентирует-
ся параллельно полю и энтропия заметно1
ниже, чем в отсутствие поля (линия зн).
Таким образом, если намагниченную соль
охладить до 1 К и затем резко снять поле,
то при наличии адиабатных условий темпе-
ратура соли понизится с 1 К до Т’г (пе-
реход по s=const с sh на вон).
При температуре ниже определенной
(9 — характеристическая температура или
температура Кюри), когда энергия взаимо-
действия электронных спинов сравнима с
энергией теплового движения kT или боль-
ше нее, существующий в системе беспоря-
док устраняется под влиянием этих сил
взаимодействия, энтропия сильно уменьша-
ется и перестает зависеть от внешнего па-
раметра—магнитного поля. Поэтому соли
при температурах ниже 9 начинают терять
свою эффективность как рабочее тело крио-
генного цикла. . ,
Термодинамика адиабатного размагни-
чивания. Законы термодинамики в приме-
нении к единице вещества, находящегося,
в магнитном поле, могут быть записаны
следующим образом:
Tds=du+MdH, (3.17)'
где М—магнитный момент; Н—напряжен-
ность магнитного поля; остальные обозна-
чения приняты ранее.
Всеми членами, содержащими величи-
ны немагнитного происхождения (р, v и
др.), можно пренебречь для большинства
магнитных процессов. Тогда для перемен-
ных Т и Н на основании первого и второго
законов термодинамики можно написать
сн ( дМ\
ds=~T~dT+ \-^т]нЛН, (З.Г8>
где сн—теплоемкость вещества в постоян-
ном поле И. Для процесса при постоянной
74
Низкотемпературные циклы и процессы
энтропии из уравнения (3.18) получаем
' ' Т / дМ \
- НН • (3.19)
"Ъ.Н
Из соотношения (3.19) следует, что
при изоэитропном размагничивании имеет
место эффект охлаждения, так как
(дМ/дТ)н для обычных парамагнетиков
отрицательна. Коэффициент as,H=(dT/dH)s
может быть назван дифференциальным эф-
фектом адиабатного размагничивания ана-
логично дифференциальным эффектам при
дросселировании («л) и при изоэитропном
расширении (as) газов. Для условий вы-
полнения закона Кюри можно найти соот-
ношения для конечной температуры раз-
магничивания. Из закона Кюри М=АН/Т
(Л—константа) находим
f дМ \
Подставив это значение в (3.19), получим
^гон ^Кон
TdT = — \ Н:1Н\
^иач ^нач
______ у-'2 __ / т_г 2________ /У\
1 нач 7 ксн г r7Koir'
п
Если считать ЯКОн=0, то для приближен-
ных оценок можно воспользоваться форму-
лой
/ Л j_r%
TK0S = Т’нач \/ 1 -----, (3.20)
* С/Лач
т. е. охлаждение тем существеннее, чем
больше поле намагничивания ЯНач.
Для приближенной оценки
7'кон=7'начЯкон/Янач, (3.21)
где Яксн—остаточное поле в конце про-
цесса размагничивания. Это уравнение не
строгое и дает возможность лишь оценить
Твои. Из него вытекает, в частности, что
при ЯКОн=0 7'кон=0, но это противоречит
третьему закону термодинамики. Надо
иметь в виду, что идеальных парамагнит-
ных веществ не существует, диполи в дей-
ствительности взаимодействуют друг с
другом и создают внутреннее поле, доста-
точное для того, чтобы Гкон оставалось
конечной величиной.
Для многих используемых парамагне-
тиков [225]
Хкон _ - в
----=7,5-------.
Т нач Янач
На рис. 3.31 и 3.32 представлены ха-
рактеристики некоторых солей, используе-
мых как рабочие тела при охлаждении ме-
тодом адиабатного размагничивания [260].
На левой ординате приведены отношения
Яаач/7Нач для кривых, обозначенных R, Q
и т. д. На правой ординате приведены
энтальпии солей при нулевом магнитном
поле для кривых, обозначенных г, q и т. д.
По оси абсцисс отложены конечные темпе-
ратуры соли после размагничивания.
Рис. 3.31. Характеристики парамагнитных
солей (Р, р)— NH4Fe(SO4)2 12Н2О;
(Q, ?)-KCr(SO4) 12Н2О; (7?, г)-
(CH3NH3)Cr(SO4)2 12Н2О
Рис. 3.32. Характеристики парамагнитных
солей (X, х)— Ce(C2HsSO4)3 9Н2О;
(У, у)—СиКг(8О4)2 6Н2О; (Z, z) —
Ce2Mg3(NO3)12 24Н2О
На рис. 3.33 приведена схема прибора
для охлаждения методом адиабатного раз-
магничивания. Парамагнитная соль поме-
щена в сосуд А, который погружен в жид-
кий гелий (1 К). Вначале сосуд А запол-
нен газообразным гелием, что позволяет
охладить соль до 1 К после наложения
магнитного поля. Затем гелий из сосуда А
откачивается и соль оказывается в вакуум-
ной изоляции. При снятии магнитного поля
соль охлаждается. Если исследуется не са-
ма соль, то испытуемый образец помеща-
ют в ампулу с солью или соединяют его
с солью хорошим проводником теплоты.
Можно проводить охлаждение и в две
ступени. В этом случае два сосуда с солью
располагают один над другим и соединяют
тепловым ключом из сверхпроводника.
В первой стадии из магнитного поля выво-
дят верхний сосуд с солью, в результате
чего происходит ее охлаждение. Поскольку
Методы получения температур ниже 0,3 К
75
К Вакуум-.
насосу
Рис. 3.33. Прибор для охлаждения мето-
дом адиабатного размагничивания
тепловой ключ остается в магнитном поле,
значение которого выше критического,
сверхпроводник находится в нормальном
состоянии, которое характеризуется высо-
кой теплопроводностью. Поэтому соль в
нижнем сосуде также охлаждается. Далее
снимают магнитное поле'нижнего сосуда,
что приводит к дальнейшему охлаждению
соли. При этом тепловой ключ без поля
становится сверхпроводящим с характер-
ной малой теплопроводностью, и поэтому
теплота из верхнего сосуда в нижний не
передается. При таком методе можно ис-
пользовать существенно более низкие на-
пряженности поля, чем при охлаждении
в одну ступень.
В настоящее время наинизшая темпе-
ратура, полученная методом адиабатного
размагничивания, составляет 0,0014 К
[51].
На основе принципа адиабатного раз-
магничивания построена циклическая маши-
на (цикл—2 мин) с использованием перио-
дически отключаемых тепловых контактов
между солью, образцом и ванной жидкого
гелия [51]. Тепловые контакты изготовлены
из сверхпроводников, у которых сверхпро-
водимость по желанию может разрушаться
магнитным полем. Такая машина при
0,26 К имеет холодильную мощность
0,84-1 О^3 Дж за цикл. Об охлаждении по-
средством адиабатного размагничивания
см. также в [14, 16, 44, 51, 289].
В последнее время разработаны охлаж-
дающие устройства на базе электрокало-
рического эффекта, аналогичного описанно-
му магнитокалорическому. В них вместо
адиабатного размагничивания магнетиков
используется адиабатная деполяризация ди-
электриков в электрическом поле [957].
Для получения ультранизких темпера-
тур можно использовать также адиабатное
намагничивание сверхпроводника. Энтропия
сверхпроводящего металла в нормальном
состоянии при температуре ниже Гк—кри-
тической для данного сверхпроводника—
больше, чем энтропия в сверхпроводящем
состоянии. Следовательно, при адиабатном
наложении магнитного поля температура
сверхпроводника будет снижаться.
Ядерное размагничивание. Предел
охлаждения при адиабатном размагничи-
вании парамагнитных солей обусловлен
взаимодействием между ионами. Гортер и
независимо Кюрти и Симон [31] высказали
предположение, что адиабатным размагни-
чиванием веществ, ядра которых обладают
магнитным моментом, можно получить су-
щественно более низкие температуры. Час-
тицы, составляющие ядро, также обладают
спинами, и если они не скомпенсированы,
то ядро будет характеризоваться магнит-
ным моментом (например, у меди, кобаль-
та и др.). Эти магнитные моменты пример-
но в 1000 раз меньше, чем у молекул пара-
магнитных солей, поэтому малейшее посто-
роннее воздействие нарушает ориентацию
их в поле. Сохранить ориентацию удается
лишь при самых низких температурах,
предварительно полученных методом адиа-
батного размагничивания парамагнитной
соли (до 0,01 К), или в рефрижераторах
растворения, что составляет обязательный
этап при осуществлении ядерного охлаж-
дения [526].
Теория и проведенные опыты показы-
вают [44, 226], что размагничиванием ядер
удается достигнуть спиновых температур
примерно 10~5—10-6 К. Охлаждается до
этих температур только система ядерных
спинов, а не весь образец. Далее идет
процесс выравнивания температур спиновой
системы и кристаллической решетки, одна-
ко этот процесс весьма затруднен и длите-
лен. Образец как целое с помощью ядер-
ного размагничивания, очевидно, может
быть охлажден до 10-4 К [44].
В настоящее время активно разраба-
тываются устройства на основе размагни-
чивания парамагнитных солей Gda(SO4)3X
Х8Н2О для получения более высоких тем-
ператур (2 и 10—20 К) в режиме с циклич-
ностью от десятых долей до нескольких
герц. Устройство поршневого типа с по-
ступательно-возвратным движением элемен-
та обеспечивает перенос теплоты с уровня
2 на уровень 4 К при холодильной мощ-
ности от 0,52 мВт до 1,2 Вт [524, 952]. В
этом устройстве перемещается как сверх-
проводящий магнит (обеспечивающий по-
ле 5 Тл), так и элемент с солью.
76
Низкотемпературные циклы и процессы
Другое устройство, уже ротационного
типа [525], с частотой вращения рабочего
элемента до 10 Гц предусматривает пере-
нос теплоты с уровня 2 К на уровень 10 К
с еще большей холодильной мощностью.
Соль намагничивается до 5 Тл. Возможен
режим с цикличностью, значительно мень-
шей 1 с, для генерирования холода на
уровне 10—20 К. Ведутся также работы по
созданию на эти температурные уровни
’ электрокалорических устройств [957].
Рефрижераторы на растворах 3Не—4Не.
Легкий изотоп гелия 3Не не обладает свой-
ством сверхтекучести вплоть до температу-
ры 3 мК. Смеси жидких 3Не и 4Не сверх-
текучи при более высоких температурах, но
ниже, чем чистый 4Не. Ниже 0,88 К жид-
кие смеси 3Не и 4Не распадаются на две
фазы, более или менее богатые 3Не. Фаза,
менее богатая 3Не, сверхтекучая, другая
не обладает этим свойством. На рис. 4.65
приведена фазовая диаграмма, из которой
видно, что даже при 0 К 3Не растворим
в 4Не в количестве приблизительно 6,4’%
[228, 456].
Принцип действия рефрижератора это-
го типа основан на указанном свойстве
разделения жидких фаз смеси 3Не и 4Не
и охлаждении, происходящем при раство-
рении 3Не в сверхтекучем 4Не. Метод был
впервые предложен Лондоном и др. [457]
и удачно осуществлен Негановым и др.
[227].
На рис. 3.34 представлена схема реф-
рижератора растворения [228, 458]. Ваку-
умный насос 1 откачивает пары почти чис-
того 3Не и сжимает их до давления
(5-7-9) НО3 Па. Сжатый гелий охлаждается
в ванне жидкого азота до 80 К (на рисун-
ке не показано), затем в змеевике 2 ки-
пящим 4Не до 4,2 К и далее в ванне 3 ки-
пящим под вакуумом 4Не до 1—1,6 К, где
и ожижается. В камере 4 давление 3Не
снижается примерно до 10 Па; это давле-
ние поддерживается далее во всей системе.
Дальнейшее охлаждение 3Не происходит в
змеевике испарителя 5 при 0,6 К и в не-
скольких теплообменниках 6, после чего по-
ток направляется в камеру растворения,
где 3Не переходит в фазу, богатую сверх-
текучим 4Не, при этом температура снижа-
ется (эффект растворения). Атомы 3Не
при переходе в фазу, богатую 4Не, как бы/
«расширяются» в пустоту, поскольку не
взаимодействуют с атомами 4Не, находя-
щимися в сверхтекучем состоянии и харак-
теризуемыми поэтому энтропией s=0. При
таком «расширении» в адиабатных услови-
ях происходит снижение температуры, а в
изотермических можно реализовать холо-
дильную мощность qm посредством змееви-
ка. 8. Начиная с камеры смешения 7, весь
внутренний объем каналов, теплообменни-
ков 6. и испарителя 5 по обратному потоку
заполнен в основном сверхтекучим 4Не, ко-
торый не оказывает какого-либо заметного
Рис. 3.34. Принципиальная схема рефри-
жератора на растворах 3Не—4Не
термодинамического или гидродинамическо-
го влияния. В этой среде атомы 3Не из
камеры смешения 7 отводятся диффузией
через теплообменники 6 в испаритель 5 и
при этом нагреваются. Обратный поток
раствора в теплообменнике поэтому дол-
жен иметь в пределе равновесное состоя-
ние, характеризуемое постоянством хими-
ческого потенциала (р) и осмотического
давления (роем), т. е. p=const; рОсм=
=P7'x=const, где Т—абсолютная темпе-
ратура в сечениях теплообменника; х—
соответствующая концентрация 3Не; R —
газовая постоянная. В соответствии с этим
по мере нагрева потока по пути из камеры
смещения 7 к испарителю 4 равновесная
концентрация 3Не уменьшается обычно с
6% до 1%. Диффузия атомов 3Не из ка-
меры смешения в испаритель обусловлива-
ется разностью концентраций, которая
должна быть несколько больше равновес-
ной, имеющей место при pocM=const.
Во избежание усложнения системы ва-
куумных насосов давление в испарителе
поддерживают в пределах 1—2 Па, поэто-
му для раствора с 1’% 3Не равновесная
температура составляет 0,6—0,7 К. В соот-
Методы получения температур ниже 0,3 К
77
ветствии с фазовым равновесием при этих
условиях испаряется практически только
3Не (содержание 3Не в паре примерно
50%). В испаритель 5 необходимо дополни-
тельно подавать теплоту qs через зме-
евик 9. Это связано с тем, что обратный
поток, поступающий в испаритель, мало на-
гревается от прямого потока (теплота, от-
даваемая в теплообменниках 6 прямым по-
током, равна всего 1,7 Дж/моль, а обрат-
ный поток 3Не может взять 13 Дж/моль).
Кроме того, необходимо подвести теплоту
испарителя 3Не (32 Дж/моль). Таким об-
разом, теплоты, передаваемой потоком кон-
центрированного 3Не через змеевик испари-
теля, не достаточно, и поэтому требуется
подать дополнительно около qs=35 Дж на
каждый моль 3Не. Испаряющийся 3Не за-
сасывается вакуумным насосом 1, и цикл
замыкается. Вся установка помещается в
гелиевом дьюаре 10 и дополнительно теп-
лоизолируется.
Для того чтобы вычислить тепловой
эффект растворения при переходе 3Не в
жидкий 4Не, необходимо знать зависимость
энтальпии от температуры для обеих фаз,
т. е. концентрированного жидкого 3Не и
раствора его со сверхтекучим 4Не. Очевид-
но, что теплота перехода будет равна раз-
ности этих энтальпий. Энтальпия чистого
3Не, Дж/моль, может быть вычислена по
формуле
Tt
О
Т1
с 26
= 1 267Т/7 = — 7/2 = 137’г-2,
о
где сзне—теплоемкость чистого 3Не, была
экспериментально изучена [458]. При тем-
пературе ниже 0,3 К жидкий 3Не может
рассматриваться как вырожденная Ферми-
жидкость, для которой теплоемкость ли-
нейно пропорциональна абсолютной темпе-
ратуре. Приближенно ее можно оценить
с,Не=26 Т Дж/(моль-К). Энтальпия 3Не
в растворе при температуре ниже 0,2 К
может быть вычислена, исходя из представ-
ления, что атомы 3Не, находящиеся в силь-
но разбавленном состоянии среди атомов
сверхтекучего 4Не, ведут себя как вырож-
денный Ферми-газ с эффективной массой
в 2,4 раза большей, чем у 3Не. Поскольку
атомы 4Не в основном находятся в сверх-
текучем состоянии, их энтропия s=0 и по-
этому она может не учитываться. Прибли-
женно для температур ниже 0,2 К энталь-
пия 3Не в растворе может быть оценена
как йРаст=100 Г2г- [456]. . Отсюда теплота
перехода qm, Дж/моль, на уровне темпера-
тур Ут<0,2 К. считая на моль 3Не,
9m = ^раст ' ' ^зне = ( — 13)7*w2 = 877/п2.
Рис. 3.35. Энтальпии 3Не и растворов 3Не
и 4Не, а также теплота перехода qm в за-
висимости от температуры
Более точные вычисления для Тот=0,05 К
дают зависимость
qm — (80±3) Т2т.
Радебух [290, 456] подробно анализировал
функции A, s, Ср, ц как чистого 3Не, так и
его растворов в 4Не в зависимости от
температуры. На рис. 3.35 представлены
полученные значения энтальпии для чисто-
го 3Не и равновесных при данной темпера-
туре растворов. На этом же рисунке при-
ведены разности энтальпий, т. е. qm. Пря-
мые измерения теплоты перехода хорошо
согласуются с данными рис. 3.35 [229].
Теплота перехода может быть также
вычислена по формуле (см. рис. 3.36)
qm=Tm (5раст—s3He) '
Рис. 3.36. Диаграмма s, Т для чистого 3Не
и раствора 3Не—4Не
78
Низкотемпературные циклы и процессы
Значения энтропий можно- найти в [456].
Расчетные значения при различных Тт
(на 1 моль 3Не):
Тт,к....... 10-3 ю-2 5.10-2 10-10,2 0,3
дт, Дж/моль 10‘4 8-10-» 0„2 0,7 2 3,3
Можно оценить предельное понижение
температуры в камере смешения: теплота,
подводимая в камеру с 3Не, равна
г»Не
j csdT, где cs—теплоемкость 3Не, равная
т
т
26 Т. Отсюда без учета теплопритока извне
и при эффекте перехода qm=%7 Тът, имеем
26 9 о 9
3Не ~ Тт) — 87^т и 7т = 0,36/ зНе.
Очевидно, что реальная холодильная
мощность меньше на величину потерь хо-
лода в устройстве. В осуществленных уст-
ройствах при 0,1 К полезная холодильная
мощность примерно в 3—5 раз меньше qm
(главным образом, в зависимости от со-
вершенства теплообменника).
Рассмотренный процесс охлаждения
при растворении 3Не в 4Не в какой-то сте-
пени аналогичен процессу адиабатного раз-
магничивания или расширения в детандере,
только здесь роль термодинамической си-
лы—магнитного поля или давления—играет
внутреннее взаимодействие системы при
высокой концентрации атомов 3Не, устанав-
ливающее термодинамический «порядок»
(малая энтропия). / При растворении 3Не
в 4Не расстояние между частицами 3Не
увеличивается, их взаимодействие ослабля-
ется и поэтому должен наступить больший
беспорядок и в адиабатных условиях про-
исходит снижение температуры раствора.
На эффективность работы рефрижера-
торов большое влияние оказывает совер-
шенство теплообменников, в которых про-
исходит охлаждение 3Не, поступающего в
камеру смешения. Чем ниже эта темпера-
тура, тем, очевидно, ниже может быть по-
лучена температура в камере смешения.
Самая низкая температура (?т=0), кото-
рая экспериментально была получена в не-
прерывном режиме, равнялась 7’т=0,01 К.
Сложность при расчете и изготовлении
этих теплообменников связана с тем, что
при теплопередаче между жидким гелием
и твердым телом стенки теплообменника
при столь низких температурах необходимо
учитывать скачок Капицы, обусловливаю-
щий термическое сопротивление R=KT~3.
Кроме того, как уже отмечалось, в тепло-
обменниках 6 (рис. 3.34) теплоемкость
обратного потока диффундирующих
атомов 3Не существенно больше теплоем-
кости прямого потока концентрированного
3Не и поэтому температура обратного по-
тока на большей части длины каналов теп-
лообменника остается очень низкой. На-
блюдается резкий подъем температуры
только лишь на расстоянии нескольких сан-
тиметров от испарителя 5 за счет фононной-
теплопроводности, т. е. за счет тепловых,
возбуждений, существующих в сверхтеку-
чем 4Не и идущих от нагреваемой жид-
кости, находящихся в испарителе. Пра-
вильный выбор сечений каналов и поверх-
ности теплообменника особенно важен в:
этой сложной тепловой и диффузионной-
ситуации.
Скачок Капицы прямо пропорционален
тепловому потоку W и зависит от сорта ме-
талла и состояния его поверхности: А 7'=
~RW. Коэффициент R—пристенное тепло-
вое сопротивление—с понижением темпе-
ратуры теоретически увеличивается обрат-
но пропорционально Т3. Следует отметить,
что при температурах выше Г>1 К (для-
4Не) и Г>0,5 К (для 3Не) скачок относи-
тельно мал и, кроме того, наблюдается су-
щественное отклонение от закона Т3, по-
этому определяющим становится градиент
температуры в твердом теле. Подробнее о
скачке Капицы см. в § 4.15.
В рефрижераторах растворения часто
используются теплообменники каскадного
(дискретного) типа с заполнением прост-
ранства, где протекают теплообмениваю-
щиеся потоки, спеченным серебряным или
медным порошком с размерами гранул ме-
нее 50 мк*. Это существенно увеличивает
поверхность теплообменника. На рис. З.ЗТ
приведен схематичный разрез такого тепло-
обменника по одному потоку. Вдоль оси
теплообменника установлено несколько мед-
ных дисков толщиной 1 мм с центральным
отверстием, равным сечению подводящих
трубок. Благодаря этому передача теплоты
между отделениями теплообменника в ре-
зультате теплопроводности жидкости неве-
лика.
Используются также теплообменники
[289, 459], имеющие форму сэндвича из-
большого числа (от 20 до 200) чередую-
щихся слоев очень тонкой медной фольги
(2—10 мкм), разделенных прокладками1
* В теплообменниках со спеченным зерни-
стым серебром получены температуры ниже-
10 мК [5271.
Рис. 3.37. Схематичный разрез дискретного-
теплообменника:
1— корпус; 2 — спеченный серебряный или;
медный порошок; 3—диски.
Методы получения температур ниже 0,3 К
79
толщиной 40—100 мкм. Эти прокладки
•образуют камеры, по которым противото-
ком движутся жидкие 3Не и 4Не. Столь
тонкий материал, разделяющий теплообме-
нивающиеся жидкости, обеспечивает эф-
фективное прохождение фононов «туннель-
ным эффектом».
Для меди и жидкого гелия темпера-
турный скачок Капицы можно принять
50 Т3
&T—RW——— или W7 = ——Д7\ Из по-
Т3 50
следнего соотношения видно, почему по-
верхность теплообменника должна быть
•существенно разной на относительно высо-
ко- и низкотемпературном участках для пе-
редачи одного и того же количества тепло-
ты. При расчете поверхности теплопереда-
чи полезно использовать следующее поло-
жение: количество передаваемой теплоты в
условиях низких температур можно рас-
сматривать как обмен фононами, который
подчиняется соотношению, аналогичному
закону Стефана—Больцмана. Следователь-
но, количество передаваемой теплоты через
единицу поверхности от стенки с Ti к жид-
кому гелию с Tz
ТГ=а(7'41—Л2).
Значение а может быть найдено так: если
разность (Ti—Tz) мала, то можно запи-
сать (У4!—7'42)=(7'i—T'z), где T'z—Ti—А/.
Величина Д/ определяется путем диффе-
ренцирования функции 74: AtedT4=
уз
=4ГМТ=^47'3Д7'. Приняв -gyAT, полу-
уз
чим ~gg-Д7'=4а7'3 ДТ и окончательно а =
10~3 Вт/(сма-К4). Аналогично
может быть вычислено значение для дру-
гого соотношения скачка Капицы.
Рефрижераторы на растворах 3Не—
—4Не работают со скоростью циркуляции
паров 3Не от 10~5 до 10-4 моль/с.
Рефрижераторы на растворах 3Не—4Не
выпускаются во многих странах. В част-
ности, в Великобритании выпускаются ре-
фрижераторы с полезной непрерывной хо-
лодильной мощностью от 300 мкВт на
уровне 0,006 К до 1000 мкВт на уровне
0,1 К [527].
Подробно с работой рефрижераторов
растворения можно ознакомиться в [44,
227, 228, 230, 289, 290, 458]. Методика рас-
чета теплообменников для рефрижераторов
растворения изложена в [44, 231, 460].
Созданы также рефрижераторы одно-
кратного действия. В них камера смешения,
содержащая достаточные количества кон-
денсированной фазы 3Не и раствора, пред-
варительно охлаждается (например, опи-
санным выше устройством) до 0,03 К- В
этих условиях атомы 3Не переходят в раст-
вор и отводятся из него диффузией, как
было описано выше. Таким образом уда-
лось получить температуру 0,005 К <44, 2281.
Возможно создание рефрижераторных
устройств, использующих явление сверх-
текучести 4Не. Действительно, сверхтекучая
часть жидкого 4Не может свободно проте-
кать через фильтр с очень узкими канала-
ми, через который практически не могут
проходить несверхтекучая часть 4Не и тем
более атомы 3Не. Исходя из этого, возмож-
но создание устройства, основанное на
фильтровании сверхтекучей части 4Не, при
этом в среде за фильтром будет наблю-
даться снижение температуры, поскольку
сверхтекучая часть 4Не имеет удельную
энтропию s=0. Если сверхтекучий гелий
при фильтровании попадает в пространство
с раствором 3Не в 4Не, то происходящее
при этом охлаждение можно рассматривать
как результат адиабатного расширения
Ферми-газа атомов 3Не до осмотического
давления в растворе. Имеется несколько
предложений по использованию этого явле-
ния [458].
Охлаждение по методу Померанчука.
Кривая плавления 3Не имеет минимум при
0,319 К и 2,931 МПа. В этой точке энтро-
пии жидкого и твердого гелия равны: sTB=
=sMs«Pln2. Ниже этой температуры энтро-
пия твердого гелия становится больше эн-
тропии жидкого гелия, т. е. наблюдается
соотношение удельных энтропий, обратное
обычному. Таким образом, адиабатное сжа-
тие смеси твердого и жидкого 3Не вдоль
кривой плавления будет сопровождаться
охлаждением. Впервые метод Померанчука
для получения температур ниже 18 мК осу-
ществил Ануфриев [233].
На рис. 3.38 представлен ход кривых
энтропии жидкого и твердого 3Не в зави-
симости от температуры. При температуре
ниже Т№s2 мК наступает антиферромаг-
нитное упорядочение ядер и, очевидно, по-
лучение более низких температур становит-
ся невозможным. При температурах ниже
примерно 25 мК в условиях, соответствую-
Рис. 3.38. Энтропия жидкого и твердого
3Не в зависимости от температуры
80
Низкотемпературные циклы и процессы
щих кривой плавления, справедливо соот-
ношение
4,6Т.
Холодильная мощность q устройства
на основе метода Померанчука
q^^T (Stb—Зж)^тв,
где Птв—доля твердой фазы, образовав-
шейся при сжатии смеси. Так как в темпе-
ратурном интервале 6—25 мК величина
sTb—s® изменяется мало, то можно при-
нять, что холодильная мощность q здесь
пропорциональна абсолютной температуре
Т. В этом отличие получения низких темпе-
ратур методом Померанчука от метода ра-
створения, при котором q пропорциональна
Т2. Например, максимальное количество хо-
лода, которое может быть получено при
температуре 10 мК, равно
<7=7?Г(1п2—4,67")=0,01-8,31 (2,3-0,3—
—4,6 0,01 )=0,054 Дж/моль.
Охлаждение по методу Померанчука
происходит при адиабатном увеличении
давления: при этом точка, характеризую-
щая состояние 3Не в камере (например,
точка А рис. 3.38), будет перемещаться (по
диаграмме рис. 3.38) в горизонтальном на-
правлении (/-f-s=const) и вдоль кривой
плавления по фазовой диаграмме. Видно,
что более низкой начальной температуре на
кривой жидкости соответствует более низ-
кая конечная температура, получаемая
после сжатия, и, что очень важно, большее
количество жидкой фазы I при данной тем-
пературе. Быстрое увеличение твердой фа-
зы начинается только ниже 3 мК. Достаточ-
ное количество жидкой фазы обеспечивает
хороший теплообмен с охлаждаемым объ-
ектом, поскольку жидкость при этих тем-
пературах имеет теплопроводность, близ-
кую к меди.
В настоящее время этим методом до-
стигнуты температуры примерно 1 мК-
Детально с охлаждением по методу По-
меранчука и конструкциями криостатов для
этого можно познакомиться в [44].
3.8. РАСПРЕДЕЛЕНИЕ
ХОЛОДИЛЬНОЙ МОЩНОСТИ
В КРИОГЕННЫХ УСТАНОВКАХ
В криогенных установках холодильная
мощность цикла <2х.ц распределяется по
следующим статьям расхода:
1) компенсация недорекуперации Q дГ.
Недорекуперация — недогрев выходящего,
обратного потока криоагента до температу-
ры входящего прямого потока;
2) компенсация теплопритока из окру-
жающей среды Qo.c;
3) расход теплоты на сжижение про-
дуктов Q-ж;
4) компенсация теплоты, выделяемой
при сжатии внутри установки сжиженных
продуктов, Qo®;
5) компенсация теплоты конверсии QK
(в случае, например, перехода э-Н? в р-Нг).
Таким образом,
Qx.4— Д-Qo.c + Ож + Qc
Значение недорекуперации для возду-
хоразделительных установок и аналогичных
им обычно составляет от 3 до 10 К (по-
дробнее см. в [205]). В установках сжиже-
ния водорода и гелия для теплообменников
нижних, наиболее холодных ступеней цик-
ла недорекуперация составляет 0,5—1 К.
Приток теплоты из окружающей среды
через теплоизоляцию и по тепловым мостам
зависит от качества изоляции, габаритов и
конструкции установки. О типах изоляции
см. в разд. 7. Для воздухоразделительных
установок в зависимости от производитель-
ности Qo.c составляет от 3 до 14 кДж на
1 м3 поступающего воздуха в час [203,
205]. Эти потери можно также оценить,
считая, что из окружающей среды к аппа-
ратам, имеющим температуру 80—90 К и
изолированных шлаковой ватой, подводится
от 150 до 350 кДж/ч через 1 м2 поверхно-
сти наружного кожуха установки при усло-
вии, что температура этой поверхности на
5—8 К ниже температуры окружающего
воздуха. Криогенные установки, в которых
рабочая температура аппаратов ниже 80 К,
имеют специальную изоляцию — насыпную
(газонаполненную), порошково-вакуумную)
высоковакуумную и вакуумно-многослой-
ную (см. разд. 7).
При сжижении газов требуется отвести
Qm~G(hv—^ж),
где G — количество сжижаемого газа; /гг
и hm — энтальпия газа при температуре
входа в установку и давлении отбора жид-
кости и энтальпия жидкости.
О теплоте конверсии QK см. в разд. 12.
3.9. РАБОТА КРИОГЕННЫХ
УСТАНОВОК В ПУСКОВОЙ ПЕРИОД
[20, 234, 235]
На рис. 3.39 дана зависимость холо-
дильной мощности установки q от времени
t с начала пуска.
В первый период максимальная холо-
Рис. 3.39. Холодильная мощность установ-
ки в пусковой период
Термодинамический анализ потерь в крюченных установках
81
дильная мощность установки q' (за выче-
том части, идущей на компенсацию недо-
рекуперации) затрачивается на охлаждение
массы аппаратов и накопление жидкости
в количестве, достаточном для ведения нор-
мального технологического процесса. Акку-
мулированный при этом холод изображен
на диаграмме площадью Qi. Некоторая до-
ля холодильной мощности q'", равная
в первый момент нулю и непрерывно уве-
личивающаяся в течение времени до Л
(штриховая линия), расходуется на охлаж-
дение слоя изоляции, непосредственно при-
легающего к аппаратам (площадь Q2). Ког-
да аппаратура охлаждена и есть необходи-
мое количество жидкости, холодильная
мощность установки должна быть снижена
до q". С этого момента непроизводительная
затрата холода идет лишь на охлаждение
изоляции до квазистационарного состояния
и компенсацию теплопритока из окружаю-
щей среды. Площадь Q3—холод, аккуму-
лированный изоляцией за период времени
А—ti, где h — время до установления по-
стоянного температурного поля в изоляции;
Q4 — потери холода в окружающую среду.
Для наладки процесса определяющее зна-
чение имеет только время tlt которое и счи-
тается пусковым периодом, так как за это
время создаются все условия для нормаль-
ного осуществления процесса.
Как показывает анализ,
Л = 62/2я, (3.22)
где 6 — толщина слоя изоляции в метрах,
охлажденного за время Л; а — коэффици-
ент температуропроводности изоляции %/рс,
М2/ч.
Кроме того,
qW— ЖР(Г1—Т2)6—2aQ=0, (3.23)
где q' •— холодильная мощность установки,
кДж/ч (за вычетом холода, расходуемого
на компенсацию недорекуперации); Л —
теплопроводность изоляции, кДж/(м-ч-К);
Fc-p — средняя площадь поверхности слоя
охлажденной за время изоляции, м2;
Т\ — начальная температура установки (до
пуска); Г2—’Конечная наинизшая темпера-
тура охлаждения.
Обычно аппараты низкотемпературных
установок имеют цилиндрическую или близ-
кую к цилиндрической, форму, т. е.
/Д р = л (d+б) Лс рД-2 • 0,785 Ш-б)2,
(3.24)
где d — наружный диаметр аппарата; he#—
высота аппарата.
Определять Ч проще всего подбором:
1) по предварительным расчетам прини-
мают ожидаемое значение толщины б, пос-
ле чего по уравнению (3.24) находят АСр;
2) по уравнению (3.23) проверяют зна-
чение б;
3) по уравнению (3.22) находят вре-
мя Л.
Криогенные установки включают не-
6—2 18
сколько охлаждаемых аппаратов. Расчет
времени пуска ii ведется в указанном по-
рядке для каждого аппарата в отдельности-,,
причем на каждый аппарат отводится опре-
деленная доля общей холодильной мощно.-
сти установки. Чем точнее была распреде-
лена между аппаратами холодильная мощ-
ность, тем ближе будут результаты, полу-
ченные для отдельных аппаратов, и точнее
общий результат. Определение времени t2:
установления в изоляции постоянного тем-
пературного поля практически не представ-
ляет особого интереса. Метод определения
его см. в [20, 234, 778]. Время А для крупных
установок обычно равно 50—100 ч.
3.10. ТЕРМОДИНАМИЧЕСКИЙ
АНАЛИЗ ПОТЕРЬ В КРИОГЕННЫХ
УСТАНОВКАХ
Кеезом [293] предложил идею термо-
динамического анализа низкотемпературных,
процессов. Этот анализ в дальнейшем был-
развит многими авторами [10, 15—17, 20,
37, 201, 236, 461].
Затрата энергии /Общ в каком-либо-
процессе складывается из минимально не-
обходимой работы /мин и дополнительной
/необр, связанной с необратимостью проте-
кающих процессов, т. е.
/об щ—/мин+^нео бр—/мии+7 qSAShoo бр,
(3.25)-
где /мин находят по формуле (2.32); Го—
температура окружающей среды; AsHeo6p —
увеличение энтропии, связанное с необра-
тимостью отдельных процессов.
Основная задача при таком анализе —
последовательно находить AsHe06p для каж-
дого отдельного процесса цикла.
В низкотемпературных циклах обычно,
встречаются следующие необратимые эф-
фекты и процессы: приток теплоты из окру-
жающей среды и недорекуперация; тепло-
передача в теплообменниках с конечной
АГ; гидравлическое сопротивление в трубо-
проводах, теплообменниках и разделитель-
ных колоннах; трение и необратимый тепло-
обмен в детандерах и компрессорах; дрос-
селирование; обмен между фазами, прохо-
дящий не в равновесных условиях. Всякий
раз, когда в какой-либо части цикла про-
исходит полностью или частично необрати-
мый процесс, он неизбежно должен компен-
сироваться дополнительной работой. Этим
правилом следует руководствоваться при-
сравнении различных низкотемпературных
процессов [20].
Для примера приводим анализ цикла
сжижения воздуха однократным дроссели-
рованием. Принято: температура воздуха
на входе 303 К; давление прямого потока
20 МПа; теплоприток из окружающей сре-
ды 8 кДж на 1 кг сжатого воздуха; недо-
рекуперация 5 К. В этих условиях доля?
жидкости после дросселирования ^=0,054-..
82
Низкотемпературные циклы и процессы
‘Последующий расчет ведется на I кг жид-
кого воздуха. Необходимые данные для
энтальпии и энтропии определяются по диа-
грамме Т, s для воздуха. Индексация точек
соответствует рнс. 3.4.
I. Минимальная работа сжижения 1 кг
воздуха
/мин^7'о(31'—So) — (+—%) ~
=303(6,87—2,97) — (303-|-127,4) =
=741,3 кДж/кг.
2. Дополнительная работа, связанная
с необратимыми процессами:
а) работа /о.с, определяемая теплопри-
током через изоляцию,
Та—Т 8(303 — 82)
7о.с = ?о.с = 0;054.82
=400 кДж,
что составляет 2,8% полной работы /Обш
,(см. ниже);
б) работа /дт, обусловленная наличием
температурных напоров (гидравлическое со-
противление не учтено):
количество сжимаемого воздуха — =
= ^=18’5КГ/КГ;
количество воздуха в обратном потоке
18,5—1 = 17,5 кг/кг.
Сжатый воздух, охлаждаясь с 303 до
170 К (от точки 2 до точки 3), изменяет
энтропию:
AsCHt = 18,5(s2—s3) =18,5(5,238—4,319) =
= 17 Дж/(кг-К).
Обратный поток воздуха, нагреваясь
с 82 до 298 К (от точки 6 до точки /'),
увеличивает энтропию:
Aso6p = 17,5(Sj, — s6) = 17,5(6,865 —
— 5,548) = 23 Дж/(кг-К).
Тогда /дт=7’о(А5обр—Asc»t)=303(23—17) =
= 1818 кДж/кг, что составляет 12,6 % пол-
ной работы /общ.
Возрастание энтропии AsB, связанное
с необратимостью при теплообмене между
окружающей средой с То н выходящим по-
током на теплом конце теплообменника
(вследствие недорекуперации АТВ),
AsH — Ср In I j
-2£^05с (^kY.
Значение AsH при нормальных значениях
АГВ (3—5 К) невелико и может не учиты-
ваться;
в) работа /Др, обусловленная необра-
тимостью дросселирования,
^p = 7o~(s4 —ss) =303-^-^- (5,31—
—4,32)=5575 кДж/кг, что составляет
_38,5 % /общ-
3. Дополнительная работа компрессо-
ра /ком, связанная с неизотермичностью
процесса сжатия (т]Из=0,59),
_ (741,3 + 430+ 1818+ 5575)
=5930 кДж/кг, т. е. 41 % /о0щ.
Итого полная работа для получения
I кг жидкого воздуха /общ=741,3+400+
+1818-{-5575+5930=14 464 кДж/кг, или
4,01 кВт-ч/кг.
Отсюда КПД процесса составит
/мин 741,3
+ =-------=~ ... =0,051, или 5,1%.
/общ 14 464
Такого рода анализы позволяют пра-
вильно оценивать возможные пути совер-
шенствования установок.
В ряде случаев полезно использовать
также следующие КПД:
КПД цикла т]ц =
обратимая минимальная работа
теоретическая работа данного цикла в ’
идеальных условиях
практический КПД +р =
теоретическая работа цикла
действительная работа цикла
Произведение двух этих КПД равно эксер-
гетическому КПД:
Значения КПД некоторых низкотемпе-
ратурных циклов для сжижения воздуха:
+ +р
Цикл с однократным
дрос селиро ва нием
(рис. 3.4)...............0,12 0,41 0,05
Цикл с однократным
дросселированием и
предварительным ох-
лаждением до —40 °C
(рис. 3.5).............. 0,27 0,53 0,14
Цикл среднего давления
(5,0 МПа) с детанди-
рованием и дроссели-
рованием (рис. 3.9) . . 0,74 0,27 0,20
Цикл высокого давления
(20,0 МПа) с детанди-
рованием и дроссели-
рованием (рис. 3.9) . . 0,6 0,37 0,22
Плотность
8®
Раздел чет в ер тый
ФИЗИЧЕСКИЕ СВОЙСТВА ВЕЩЕСТВ
ПРИ НИЗКИХ ТЕМПЕРАТУРАХ
4.1. СЖИМАЕМОСТЬ
Сжимаемость газов (см. разд. 2) явля-
ется характеристикой их состояния и опре-
деляет степень отклонения свойств реаль-
ных газов от свойств газа идеального.
Сжимаемость газов принято оценивать
степенью сжимаемости 6=Pifi / (ро^о), где
Ро=0,1013 МПа, По — удельный объем при
давлении р0 и температуре О °C. Сжимае-
мость газов и жидкостей выражают часто
через коэффициент сжимаемости z=
— pv/{RT)‘, очевидно, что г—д(Т0/Т).
На рис. 4.1 и в табл. 4.1—4.12 приве-
дены данные о сжимаемости некоторых га-
зов и жидкостей. Данные о сжимаемости
различных веществ можно также получить
из диаграмм состояния, на которых обычно
приводятся значения удельных объемов
(диаграммы состояния даны на вклейках).
4.2. ПЛОТНОСТЬ
Плотность р, кг/м3, — масса единицы
объема какого-либо тела. Величина, обрат-
ная плотности, — удельный объем ц=1/р,
м3/кг. Значение плотности иногда выра-
жают в единицах Амага, которые представ-
ляют собой отношение плотности вещества
при данных условиях (р, t) к плотности
этого вещества при нормальных условиях
(р=0,101325 МПа, /=0°С). Соотношения
между единицами плотности в различных
системах см. в разд. 1.
В табл. 4.13 приведены значения плот-
ности жидких крио агентов и некоторых
хладагентов, а также равновесных с ними
паров. Плотность водорода и его изотопов
дана на рис. 4.2.
Значения плотности жидкости и равно-
весного с ней пара связаны правилом пря-
мой линии (см. разд. 2):
где рж — плотность жидкости, кг/м3; рЕ—•
плотность равновесного пара, кг/м3; t —
температура, °C; а и Ь — константы. Кон-
станты уравнения (4.1) для различных га-
зов имеют следующие значения:
а ъ
Гелий-4 . —402,63 —1,7616
Неон . . —1154,406 —7,16146
Аргон 209,56 —2,6235.
Криптон . . 1615,6 —3,377
Ксенон . . 1205,0 —3,005.
Водород . —63,51 —0,394
Кислород 160,8 —2,265
Азот 22,904 —1,9577
Оксид углерода . . 32,9 —1,912
Этилен 221,79 —0,6128
Плотность смеси веществ рсм прибли-
зительно можно определять, допуская адди-
тивность, по формуле
Рсм = . , . /77 > (4-2),
»г/р' +«/р"
где р' и р" — плотности чистых компонен-
тов смеси; m и п — массовые доли компо-
нентов смеси.
Плотности жидких смесей N2 — О2 и-
Аг—О2 при различных температурах при-
ведены в табл. 4.14 и 4.15.
Значения плотности гелия, водорода и
кислорода в жидком виде при различных
давлениях приведены в табл. 4.16—4.18.
Плотности веществ в конденсированном
состоянии при равновесии твердой фазы
с жидкостью или паром приведены в табл.
4.19. В табл. 4.20 даны значения плотностей
чистых элементов, находящихся в твердом
состоянии. Значения относительной плотно-
сти (по отношению к плотности воды при
0 °C) некоторых технически важных ве-
ществ приведены в табл. 4.21. В табл. 4.22
даны плотности некоторых жидкостей при
температуре 15 °C.
6*
Физические свойства веществ при низких температурах
Плотность
85
Таблица 4.1. Степень сжимаемости одноатомных газов, выраженная через
вириэльные коэффициенты: 6 AGBp-~G р2+лр:'--^Ер' (р=0-?-10,5 МПа)
Газ t, °C А В-IO1 С-101 D 103 Е-105
Гелий [53, 302, 53 1,18240 0,5235 .
303] 0 0,99948 0,5244 — — —
—50 0,81656 0,5320 0,0941 .— —
—100 0,63363 0,5312 0,1646 — —
— 150 0.45J7I 0,5092 0,2593 — —
— 183 0,32998 0,4734 0,4245 — —
—208 0,23852 0,4186 1,3770 —0,0062 —
—258 0,05559 —'0,6060 31,404 —0.3298 1,266
Неон [304, 305] 0 0,9995 —0,530 — — —
—50 0,8166 0,407 0,35 — —
— 100 0,6337 0,288 0,50 — —
— 150 0,4507 0,004 1,36 .—
— 182 0,3318 —0,365 2,25 — —
—208 0,2388 — 1,231 1,77 — 0,894
Аргон [54, ЗС6] 53 1,1842 —0,492 1,79 — —
0 1,001 —0,986 2,37 1— —
—50 0,8178 —1,687 0,79 — 0,1
— 100 0,6346 —2,872 — 10,21 — —0,13
Таблица 4.2. Коэффициент сжимаемос1и z азота N3 [301]
Тем- пера- тура, К Давление, 105 Па
0.1013 0,4053 0,7093 1,013 4,053 7,093 10,13 40,53 70,93 101,3
100 0,99820 0,9927 0,987 0,981 0,909 0,783
но 0,99862 0,9944 0,990 0,986 0,939 0,881 0,805 —. — —
120 0,99892 0,9957 0,992 0,989 0,954 0,916 0,873 — —. —
130 0,99914 0,9966 0,994 0,991 0,964 0,936 -0,906 — —
140 0,99931 0,9972 0,995 0,993 0,972 '0,950 0,927 — — —
150 0,99944 0,99776 0,9961 0,9944 0,9773 0,9597 0,9416 0,736 — .—
160 0,99954 0,99817 0,9968 0,9954 0,9815 0,9773 0,9529 0,799 — —.
170 0,99962 0,99850 0,9974 0,9962 0,9848 0,9733 0,9617 0,843 —- —
180 0,99969 0,99876 0,9978 0,9969 0,9875 0,9781 0,9685 0,873 0,787 —
190 0,99974 0,99897 0,9982 0,9974 0,9897 0,9820 0,9742 0,899 0,837 —
200 0,99979 0,99915 0,99851 0,99788 0,99150 0,98514 0,9788 0,9185 0,8705 0,844
210 0,99982 0,99930 0,99877 0,99824 0,99298 0,98775 0,9825 0,9341 0,8969 0,878
220 0,99985 0,99942 0,99898 0,99855 0,99422 0,98992 0,9857 0,9467 0,9180 0,905
230 0,99988 0,99952 0,99916 0,99881 0,99525 0,99174 0,9883 0,9571 0,9352 0,9268
240 0,99990 0,99961 0,99932 0,99902 0,99613 0,99328 0,9905 0,9658 0,9494 0,9445
250 0,99992 0,99968 0,99945 0,99921 0,99688 0,99459 0,99235 0,97311 0,9613 0,9593
260 0,99994 0,99975 0,99956 0,99937 0,99751 0,99570 0,99394 0,97925 0,9712 0,9716
270 0,99995 0,99980 0,99966 0,99951 0,99807 0,99666 0,99531 0,98453 0,9797 0,9822
280 0,99996 0,99985 0,99974 0,99963 0,99854 0,99749 0,99648 0,98900 0,9868 0,9911
290 0,99997 0,99989 0,99981 0,99973 0,99895 0,99820 0,99750 0,99284 0,9929 0,9986
300 0,99998 0,99993 0,99987 0,99982 0,99930 0,99882 0,99838 0,99620 0,9984 1,0054
310 0,99999 0,99996 0,99993 0,99990 0,99961 0,99936 0,99915 0,99908 1,0029 1,0111
320 1,00000 0,99999 0,99997 0,99996 0,99988 0,99983 0,99981 1,00157 1,0070 1,0161
330 1,00000 1,00001 1,00002 1,00002 1,00012 1,00024 1,00040 1,00373 1,0104 1,0204
340 1,00001 1,00003 1,00005 1,00007 1,00032 1,00060 1,00091 1,00563 1,0134 1,0242
86
Физические свойства веществ при низких температурах
Таблица 4.3. Коэффициент сжимаемости z нормального водорода Н2 [301]
Температура, К Давление, 105 Па
0,1013 1,013 4,053 7,093 10,13 40,53 70,93 101,3
20 0,99.9 —. —
30 0,9967 0,9662 — — .— — —.
40 0,9985 0,9845 0,9362 0,8853 0,8317 — — —
50 0,9992 0,9919 0,9675 0,9431 0,9186 — — —
60 0,9995 0,9955 0,9822 0,9691 0,9564 0,8757 0,8700 0,9395
70 0,9997 0,9975 0,9901 0,9830 0,9760 0,9338 0,9361 0,9831
80 0,9999 0,9986 0,9946 0,9908 0,9872 0,9682 0,9782 1,0174
90 0,9999 0,9993 0,9973 0,9956 0,9940 0,9894 1,0050 1,0407
100 1,0000 0,9998 0,9992 0,9987 0,9983 0,9983 1,0029 1,0560
НО 1,0000 1,0001 1,0001 1,0005 1,0011 1,0117 1,0332 1,0663
120 1,0000 1,0003 1,0012 1,0021 1,0030 1,0176 1,0405 1,0726'
130 1,0000 1,0004 1,0016 1,0029 1,0043 1,0216 1,0457 1,0765
140 1,0000 1,0005 1,0020 1,0036 1,0052 1,0243 1,0488 1,0786
150 1,0001 1,0006 1,0024 1,0041 1,0058 1,0260 1,0507 1,0796
160 1,0001 1,0006 1,0024 1,0043 1,0062 1,0271 1,0516 1,0798
170 1,0001 1,0006 1,0025 1,0044 1,0065 1,0279 1,0522 1,0794-
180 1,0001 1,0007 1,0028 1,0048 1,0067 1,0283 1,0523 1,0785
190 1,0001 1,0007 1,0028 1,0048 1,0068 1,0284 1,0519 1,0773
200 1,0001 •1,0007 1,0028 1,0048 1,0068 1,0283 1,0513 1,0760
210 1,0001 1,0007 1,0028 1,0048 1,0068 1,0281 1,0506 1,0745
220 1,0001 1,0007 1,0028. 1,0048 1,0067 1,0276 1,0497 1,0730
230 1,0001 1,0007 1,0028 1,0048 1,0067 1,0274 1,0489 1,0714
240 1,0001 1,0007 1,0027 1,0047 1,0066 1,0269 1,0480 1,0698
250 1,0001 1,0006 1,0025 1,0044 1,0065 1,0264 1,0469 1,0682
260 1,0001 1,0006 1,0024 1,0044 1,0064 1,0259 1,0459 1,0667
270 100001 1,0006 1,0024 1,0043 1,0063 1,0255 1,0450 1,0651
280 100001 1,0006 1,0024 1,0042 1,0061 1,0247 1,0439 1,0636-
290 100001 1,0006 1,0024 1,0042 1,0060 1,0242 1,0429 1,0621
300 100001 1,0006 1,0024 1,0042 1,0059 1,0238 1,0420 1,0607
Таблица 4.4. Коэффициент сжимаемости Z жидкого нормального водорода Н2 [51]
Тем.гература, К Давление, 105 Па
10,13 20,26 30,40 40,53 60,79 81,06 Ю1.3 121,6
16,0 0,2022 0,3999 0,5941 0,7851 1,159 — — —
17,0 0,1923 0,3798 0,5637 0,7444 1,097 1,444 1,787 —
18,0 0,1835 0,3624 0,5370 0,7087 1,044 1,371 1,695 2,002
19,0 0,1760 0,3471 0,5140 0,6773 0,9960 1,306 1,612 1,906
20,0 0,1693 0,3337 0,4936 0,6498 0,9542 1,250 1,539 1,821
21,0 0,1636 0,3218 0,4756 0,6256 0,9168 1,199 1,474 1,746
22,0 0,1587 0,3113 0,4595 0,6036 0,8838 1,154 1,416 1,676
23,0 0,1545 0,3023 0,4456 0,5850 0,8552 1,114 1,366 1,615
24,0 0,1510 0,2944 0,4332 0,5685 0,8290 1,079 1,321 1,559
25,0 0,1480 0,2880 0,4229 0,5538 0,8052 1,046 1,280 1,509
26,0 0,1457 0,2828 0,4137 0,5403 0,7841 1,017 1,243 1,464
27,0 0,1440 0,2782 0,4057 0,5286 0,7645 0,9908 1,210 1,421
28,0 0,1431 0,2744 0,3988 0,5185 0,7471 0,9666 1,179 1,382
29,0 0,1437 0,2718 0,3932 0,5095 0,7317 0,9450 1,151 1,347
30,0 0,1456 0,2708 0,3890 0,5026 0,7185 0,9255 1,124 1,316
31,0 0,1498 0,2712 0,3864 0,4959 0,7669 0,9076 1,101 1,287’
32,0 — 0,2732 0,3848 0,4919 0,6965 0,8912 1,079 1,261
33,0 — 0,2781 0,3845 0,4876 0,6869 0,8757 1,058 1,235
87
-Плотность
Таблица 4.5. Степень снимаемости 5 дейтерия D2 [307]
Темпера- тура, °C Давление, 105 Па Степень сжимае- мости 1 Темпера- тура, °C Давление, 105 Па Степень сжимае- мости Темпера- тура, °C Давление, IO® па Степень сжимае- мости
25 11,12 45,35 93,24 143,94 197,82 255,24 1,09755 1,119о8 1,15020 1,18380 1,22018 1,25951 —50 8,32 33,81 68,43 106,57 146,08 188,08 0,82074 0,83433 0,85431 0,87651 0,90105 0,92810 —150 3,07 36,99 56,11 75,89 96,53 118,29 0,45150 0,45640 0,46149 0,46811 0,47637 0,48643
0 10,18 41,51 85,25 131,51 180,61 232,92 1,00526 1,02426 1,05172 1,08157 1,11404 1,14935 — 100 6,44 26,10 53,18 81,48 111,21 142,66 0,63598 0,64391 0,65604 0,67005 0,68598 0,70399 —175 7,25 14,46 28,85 43,30 58,00 73,09 0,35786 0,35687 0,35582 0,35611 0,35775 0,36066
Таблица 4.6. Коэффициент сжимаемости z жидкого дейтерия D2 [51]
Температура, К Давление, 105 Па
10,13 20,26 30,40 40,53 60,79 81,06 101,3 121,6
20,0 0,1415 0,2815 0,4194 0,5550 . — —— —
21 0 0,1363 0,2709 0,4030 0,5325 0,7873 1,035 1,273 —..
22,0 О' 1318 0,2616 0,3889 0,5132 0,7585 0,9967 1,226 1,454
23 0 0,' 1278 0,2534 0,3766 0,4968 0,7336 0,9633 1,184 1,403
24 0 0; 1244 0,2462 0,3656 0,4824 0,7115 0,9335 1,147 1
25 0 0,1214 0,2400 0,3560 0,4697 0,6919 0,9071 1,113 1,31/
26 0 О'1188 0,2345 0,3474 0,4581 0,6738 0,8829 1,083 1,281
27 0 0,1166 0,2296 0,3397 0,4477 0,6575 0,8605 1,056 1,24о
28 0 О'1147 0,2255 0,3332 0,4382 0,6431 0,8405 1,031 1,21 /
290 о'1133 (1,2221 0,3277 0,4300 0,6299 0,8223 1,009 1,190
300 о’1121 0,2194 0,3228 0,4232 0,6181 0,8055 0,9877 1,164
310 О'1117 0,2173 0,3187 0,4172 0,6072 0,7902 0,9682 1,139
32,0 О'1119 0;2162 0,3152 0,4123 0,5980 0,7761 0,9502 1,117
33 0 О'1129 0,2158 0,3128 0,4081 0,5898 0,7634 0,9332 1,096
34 0 О'1143 0,2162 0,3112 0,4047 0,5826 0,7519 0,9176 1,076
35 0 0,2169 0,3113 0,4:21 0,5762 0,7422 0,9334 1,057
36 0 0,22; 6 0,3126 0,40jl 0,5703 0,7338 0,8907 1,040
37’О 0,2251 О',3157 0,3997 0,5658 0,7263 0,8793 1,023
38,0 — 0,2302 0,321.9 0,4007 0,5625 0,7198 0,8691 1,008
Таблица 4.7. Коэффициент сжимаемости Z кислорода О2 [301]
Темге- р? ту- ра, К Давление, 105
0,1013 | 0,4053 | 0,7093 | 1,013 | 4,053 ! 7,093 10,13 40,53 70,93 101,3
1G0 0,99781 0,99114 0,98431 0,97724 — — — — —
J10 0 99831 С,99320 0,98802 0,98277 0,9227 — — — —
120 0,99867 0,99466 0,99061 0,98652 0,9427 0,891 — — —
130 О', 99893 0,99573 0,99249 0,98924 0,9553 0,9179 — — —
140 0 99913 0,99653 0,99391 0,99128 0,9642 0,9353 — — —
150 0 99929 0,99715 0,99500 0,99284 0,9708 0,9477 0,9236 — —
160 О’99941 0'99764 0,99586 0,99407 0,9759 0,9571 0,9377 0,6960 —
170 099951 0.99803 0,99654 0,99505 0,9799 0,9644 0,9486 0,7650 0,525
180 0 99959 О’99834 о'99709 0,99583 0,9832 0,9702 0,9571 0,8120 0,643
190 О’99965 0,99859 0,99754 0,99648 0,9858 0,9749 0,9640 0,8470 0,721
88
Физические свойства веществ при низких температурах
Продолжение табл. 4.7
Темпе- ратура, К Давление, 10» Па
0,1013 0,4053 0,7093 1,013 4,053 7,093 10,13 40,53 70,93 101,3
200 0,99970 0,99880 0,99791 0,99701 0,98796 0,97880 0,96956 0,8734 0,7764 0,6871
210 0,99975 0,99898 0,99822 0,99745 0,98976 0,98100 0,97417 0,8943 0,8172 0,7512
220 0,99978 0,99913 0,99848 0,99782 0,99126 0,98465 0,97801 0,9112 0,8487 0,7980
230 0,99981 0,99926 0,99870 0,99814 0,99253 0,98690 0,98125 0,9250 0,8737 0,8337
240 0,99984 0,99936 0,99888 0,99841 0,99361 0,98880 0,98399 0,9365 0,8949 0,8617
250 0,99986 0,99945 0,99904 0,99864 0,99453 0,99043 0,98633 0,9462 0,9108 0,8845
260 0,99988 0,99953 0,99918 0,99883 0,99533 0,99183 0,98833 0,95442 0,9249 0,9033
270 0,99990 0,99960 0,99939 0,99900 0,99602 0,99304 0,99006 0,96145 0,9368 0,9191
280 0,99992 0,99966 0,99941 0,99915 0,99661 0,99408 0,99157 0,96751 0,9471 0,9326
290 0,99993 0,99971 0,99950 0,99928 0,99713 0,99500 0,99288 0,97275 0,9559 0,9441
300 0,99994 0,99976 0,99958 0099939 0,99759 0,99580 0,99402 0,97731 0,9636 0,9541
310 0,99995 0,99980 0,99965 0,99949 0,99799 0,99650 0,99502 0,98129 0,9702 0,9628
320 0,99996 0,99983 0,99971 0,99958 0,99834 0,99712 0,99590 0,98479 0,9761 0,9705
330 0,99997 0,99986 0,99976 0,99966 0,99865 0,99766 0,99668 0,98787 0,9812 0,9773
340 0,99997 0,99989 0,99981 0,99973 0,99893 0,99815 0,99738 0,99059 0,9858 0,9834
Таблица 4.8 Степе г, сжимаемости 6 метана СН4 [52, 55]
(6=1 при О °C и 1,01325 1 05 Па)
Давление, 105 Па Температура, °C
—70 —50 -25 0 25 ,50
1,013 0,7410 0,8159 0,9075 1,0000 1 0922 1,1845
10,132 0,6985 0,7795 0,8803 0,9785 1,0733 1,1780
20,265 0,6473 0,7402 0,8493 0,9543 1,0549 1,1590
30,397 0,5910 0,6991 0,8183 0,9297 1,0373 1,1412
40,53 0,5244 0,6547 0,7873 0,9061 1,0198 1,1275
50,66 0,4425 0,6059 0,7553 0,8830 1,0034 1,1152
69,79 0,3366 0,5551 0,7243 0,8607 0,9871 1,1017
81,06 0,2556 0,4604 0.6651 0,8192 0,9569 1,0799
101,32 0,2808 0,4088 0,6167 0,7845 0,9319 1,0624
121,59 0,3175 0,4095 0,5877 0,7604 0,9126 1,0487
141,85 0,3543 0,4304 0,5801 0,7457 0,9003 1,0399
162,12 0,3915 0.4601 0,5891 0,7425 0,8949 1,0367
182,38 0,4288 0,4924 0,6979 0,7482 0,8970 1,0373
202,65 0,4656 0,5269 0,6319 0,7631 0,9048 1,0437
253,31 0,5567 0,6142 0,7066 0,8184 0 9469 1,0776
393,97 0,6458 0,7025 0,7879 0,8886 1,0062 1,1286
Таблица 4.9. Степень сжимаемости 6 оксида углерода СО
[52, 301, 308] (6=1 при 0 °C и 1,01325 10» Па)
Давление, 105 Па Температура, °C
—70 —50 —25 0 25 50
1,013 0,7427 0,8162 0,9082 1,0000 1,0918 1,1836
10,132 0,7275 0,8061 0,9025 0,996) 1,0885 1,1830
20,265 0,7115 0,7947 0.896J 0,9912 1,0858 1,1827
30,397 0,6950 0,7840 0,8895 0,9868 1,0836 1,1820
40,53 0,6792 0,7730 0,8833 0,9825 1,0820 1,1821
50,66 0,6636 0,7622 0,8768 0,9780 1,0814 1,1826
60,79 0,6495 0,7530 0,8712 0,9755 1,0810 1,1842
81,06 0,6274 0,7355 0,8620 0,9718 1,0820 1,1893
101,32 0,6147 0,7264 0,8592 0,9725 1,0851 1,1955
121,59 0,6110 0,7240 0,8590 0,9763 1,0917 1,2042
Плотность
89
Продолжение табл. 4.9
Давление, 105 Па Температура, °C
—70 —50 -25 0 25 50
141,85 0,6142 0,7270 0,8627 0,9832 1,1009 1,2139
162,12 0,6255 0,7355 0,8715 0,9935 1,1125 1,2255
182,38 0,6431 0,7485 0,8856 1,0125 1,1255 1,2400
202,65 0,6631 0,7656 0,9022 1,0200 1,1415 1,2561
253,31 0,7247 0,8205 0,9520 1,0665 1,1885 1,3022
303,97 0,7955 0,8872 1,0087 1,1211 1,2408 1,3521
Таблица 4.10. Степень сжимаемости 6 диоксида углерода СОг [52, 301]
(5=1 при 0°С и 1,01325-106 Па)
Давление, 105 Па Температура, °C Давление, 105 Па Температура, °C
0 20 60 100 0 23 1 60 100
1,013 1,0000 227,98 0,4395 0,4655 0,5825 0,8175
50,66 0,1050 0,6800 0,9840 1,2065 253,31 0,4740 0,5100 0,6250 0,8355
75,99 0,1530 0,1830 0,8410 1,1 180 278,64 0,5170 0,5545 0,6675 0,8600
101,32 0,2020 0,2285 0,6610 1,030 303,97 0,5595 0,5985 0,7100 0,8900
126,66 0,2490 0,2785 0,5ЮЭ 0,9470 354,64 0,6445 0,6850 0,7980 0,9615
151,99 0,295'1 0,326.) 0,4853 0,8780 405,30 0,7280 0,7710 0,8840 1,0385
177,32 0,3405 0,3725 0,5055 0,8320 455,96 0,8090 0,8550 0,9690 1,1190
.202,65 0,3850 0,4190 0,5425 0,8145 506,62 0,8935 0,9380 1,0540 1,2005
Таблица 411. Коэффициент сжимаемости z воздуха [301]
Темпе- ратура, К Давление, 105 Па
0,1013 | 0,4053 0,7093 | 1,013 | 4,053 | 7,0ЭЗ | 10,13 | 40,53 70,93 | 101,3
100 0,99813 0,99248 0,98672 0,98093
НО 0,99856 0,99423 0,98985 0,98542 0,93853 0,8855 0,8234 — —- —
120 0,99887 0,99548 0,99206 0,98861 0,95268 0,9136 0,8703 — — —
130 0^99910 0,99640 0,99368 0,99и95 0,96277 0,9330 0,9010 — — —
140 0,99928 0.99709 0,99490 0,99271 0,97022 0,9467 0,9221 — — — —
150 0,99941 0,99763 0,99585 0,99407 0,97591 0,95716 0,9378 0,6832 — —
160 0 99951 0,99805 0,99659 0,99513 0,98030 0,96514 0,9496 0,7689 — —
170 0,99960 0,99839 0,99718 0,99597 0,98378 0,97137 0,95880 0,8218 — —
180 0,99967 0,99866 0,99766 0,99666 0,98656 0,97636 0,96607 0,8589 0,7550 0,6950
190 0,99972 0,99888 0,99805 0,99721 0,98882 0,98039. 0,97191 0,8866 0,8087 0,7600
200 0,99977 0,99907 0,99837 0,99767 0,99067 0,98367 0,97666 0,9080 0,8481 0,8105
210 0,99980 0,99922 0,99863 0,99806 0,99221 0,98634 0,98058 0,9249 0,8783 0,8494
220 0,99984 0,99935 0,99886 0,99837 0,99347 0,98857 0,98383 0,9386 0,9020 0,8801
230 0,99986 0,99945 0,99905 0,99864 0,99454 0,99045 0,98656 0,9497 0,9212 0,9048
240 0,99989 0,99954 0,99921 0,99886 0,99546 0,99205 0,98886 0,9590 0,9368 0,9250
250 0,99991 0,99962 0,99934 0,99906 0,99624 0,99352 0,99082 0,96680 0,9498 0,9417
260 О” 99992 0,99969 0,99946 0,99923 0,99690 0,99469 0,99249 0,97334 0,9606 0,9557
270 0,99994 0,99975 0,9995" 0,99937 0,99748 0,99570 0,99393 0,97894 0,9698 0,9675
280 0,99995 0,99980 0,99965 0,99949 0,99798 0,99656 0,99516 0,98371 0,9776 0,9775
290 О;99996 0,99984 0,99972 0,99960 0,99841 0,99732 0,99623 0,98782 0,9842 0,9860
300 0,99997 0,99988 0,99979 0,99970 0,99879 0,99797 0,99717 0,99135 0,9900 0,9933
310 0,99998 0,99991 0,99985 0,99978 0,99912 0,99855 0,99798 0,99443 0,9949 0,9996
320 О;99999 0,99994 0,99990 0,99985 0,99940 0.99905 0,99869 0,99710 0,9992 1,0051
330 0,99999 9,99997 0,99994 0,99991 0,99966 0,99949 0,99932 0,99943 1,0029 1,0099
340 1,00000 0,99999 0,99998 0,99997 0,99989 0,99987 0,99987 1,00150 1,0062 1,0140
90
Физические свойства веществ при низких температурах
Таблица 4.12. Коэффициент
сжимаемости z некоторых
газов при />=15 МПа [749]
Газ t. °C
0 | 25 50
Гелий 1,071 1,065 1,060
Аргон 0,912 0,947 0,975
Криптон 0,633 0,707 0,764
Ксенон 0,382 0,395 0,433
Азот 1,001 1,023 1,037
Кислород 0,908 0,944 0,971
Водород 1,096 1,090 1,083
Таблица 4.13. Плотность жидких
криоагентов и хладагентов рж, кг/м3,
н равновесных с ними паров рп, кг/м3 ,
в зависимости от температуры
Т, К Рж 1 Рп
Азот Nj [57]
126,25* 295,2
120 524,1 124,5
110 622,7 62,58
100 690,6 31,99
90 746,3 15,09
80 795,5 6,098
77,35 807,8 4,610
70 839,6 1,903
63,15** 868,1 0,677
Аммиак NH3 [310]
405,6* 235,0
400 344,4 36,8
380 436,4 68,96
360 490,4 40,62
340 532,4 24,47
320 568,1 14,51
300 599,9 8,244
280 629,2 4,387
260 656,1 2,121
210 681,5 0,9069
220 7С5,8 0,3209
200 728,8 0,08977
Аргон Аг [58, 313]
150,86* 535,7
140 942,1 179,5
130 1166 164,0
120 1160 6j,36
ПО 1240 33,49
100 1311 17,02
95 1344 11,57
90 1376 7,536
87,28 1394 5,849
83,78** 1415 4,109
Ацетилен С»Н» [311]
308,7* /230,6
307,8 298,2 163,7
300,0 370,8 107,1
290,4 413,8 75,45
284,9 431,7 62,87
278,9 448,8 51,75
Г, К | рж |________________________РП
271,6 469,0 41,58
263,0 489,3 32,37
253,2 511,4 23,81
240,7 537,8 15,74
230,4 557,4 11,02
221,5 573,3 7,912
209,4 592,9 4,820
200,9 605,3 3,320
192,4** 609,6 2,166
Водород нормальный Н2 [314]
33,18* 30 ,117
32,0 46,608 19,570
30,0 54,207 10,565
28,0 59,167 7,110
26,0 63,037 4,792
24,0 66,222 3,163
22,0 68,964 2,006
20,38 70,939 1,3305
19,0 72,472 0,9011
17,0 74,487 0,4677
15,0 76,322 0,2096
13,947** 77,209 0,1270
Данные о плотности жидкого нормального
водорода при различных давлениях см. в табл. 4,17»
Параводород [314, 315]
32,976* 31,428
32,0 45,983 17,498
30,0 53,925 10,888
28,0 58,965 7,2975
26,0 62,835 4,9208
24,0 66,001 3,2557
22,0 68,722 2,0703
20,268 70,778 1,3377
19,0 72,169 0,9380
17,0 74,165 0,4919
15,0 75,999 0,2225
13,803** 77,028 0,1258
Воздух- [311, 57 1
(Плотность жидкости и пара в зависи-
мости от температуры жидкости)
132,52* 327/319]
130,91 446 215,8
127.26 520 155,2
123,30 575 117,4
118,77 621 87,6
113,35 670 62,3
106,47 724 40,31
101,04 758 28,14
96,38 784 20,28
90,94 818 12,49»
85,55 842 8,54
78,8 874 4,48
Гелий-3 3Не[56, 316, 318]
3,33* 41,31
3,3 54,16 28,45
3,2 58,61 24,00
3,1 61,93 20,67
3,0 64,62 17,98
2,8 68,82 13,76,
2,6 72,00 10,55
Плотность
91
Продолжение табл. 4.13
т, к Рж Рп Т, К РЖ Рп
2,4 2,2 2,0 1,8 1,6 1,4 1,2 1,0 Г елш 5,201* 5,0 4,8 4,6 4,4 4,2 4,0 3.8 3,6 3,4 3,2 3,0 2,8 2,6 2,4 2,2 2,177 (A-точка) 2,0 1,8 1,6 1,4 1,2 Данные о п -различных давле Ki 154,77* 150 140 130 120 110 100 90 80 70 60 54,35** Данные о п различных давле К/ 209,39* 200 ,190 74,48 76,45 78,01 79,24 80,20 80,93 81,47 81,85 1-4 4Не[317], 96 69 101,1 110,1 116,3 121,3 125,4 129,0 132,1 134,8 137,2 139,3 141,1 142,8 144,2 145,3 146,1 146,2 145,99 145,72 145,57 145,50 145,47 лотности гелия-4 ниях см. в табл. юлород О2[57] 4 672,5 808,4 896,9 968,1 1030 1085 1136 1183 1226 1266 1288 лотности кислорс ниях см. в табл аттон Кг [58] 1506 1700 8,06 6,08 4,50 3,25 2,28 1,54 0,98 0,58 2 ,64 39,30 30,37 24,49 20,05 16,49 13,56 11,09 9,008 7,235 5,731 4,463 3,401 2,521 1,805 1,235 1,177 при 4.16. 06,5 212,5 116,1 68,17 39,34 21,36 10,48 4,403 1,469 0,3455 0,04708 0,01064 >да при 4.18. 910,71 383,7 250,9 180 170 160 150 140 130 119,76 115,76** 289,74* 280 270 260 250 240 230 220 210 200 190 180 165,03 161,36** 4 191,05* 180 170 160 150 140 130 120 110 100 44,40* 40 35 30 29 28 27,09 27 26 25 24,55** С 261,05* 257,16 252,36 247,66 243,66 208,16 1844 1964 2070 2165 2253 2334 2414 2445 Ксенон Хе [58] 11 1758 1969 2114 2234 2341 2439 2528 2612 2692 2766 2838 2941 2966 Цетан CHt [312 16 281,2 313,7 339,1 361,3 380,4 396,7 411,8 426,3 440,6 Неон Ne [58] 48 896,1 1043 115! 1170 1189 1205 1206 1224 1241 1248 зон О3 [321, 32 3 955 1010 170,5 115,9 77,22 49,65 30,35 17,29 8,803 6,540 00 520,8 374,0 279,2 211,0 159,5 119,6 88,42 64,27 45,50 31,20 20,55 10,0 8,20 2,5 60,40 38,95 25,44 16,34 10,18 5,977 3,275 1,611 0,6847 3,1 137,7 55,80 19,96 15,74 12,23 ’ 9,578 9,346 6,998 5,123 4,413 2] 27 320 240 30
92
Физические свойства веществ при низких температурах
Продолжение табл. 4.13"
т, к Рж Рп Т, к Рж Рп
180,0 1292 —. 253,16 1030 51,37
160,0 1358 — 243,16 1074 43,7
140,0 1421 — 233,16 1115 26,20
120,0 1483 — 223,16 1153 18,05
100,0 1544 »’ — 216,56** 1178 13,85
90,16 1571 —
85,16 1595 — Этан С,Н,; [312, 961]
77,76 1614
305,5* 212,2
Оксид углерода СО [310] 290 270 364,5 419,9 77,12 42,04
132,92* 301 250 458,2 23,71
12,9,86 451 164 230 489,7 12,75
121,46 561 85,1 210 516,9 6,207
117,22 597 65,1 190 540,5 2,635’
112,14 632 48,3 184,52 546.5 2,041
105,70 673 32,3 170 562,1 0,928
101,47 695 24,7 150 583,6 0,234-
96,12 722 16,7 120 617,9
90,61 753 10,5 89,88** 658,5
85,37 776 6,5
79,73 798 3,58 Этилен С„Н. [311]
76,02 812 2,31
72,43 829 1,47 282,66* 21 6,0
68,15** 846 0,783 281,14 287,26 152,86
Пропан C3HS [311] 279,0 308,40 132,66
370,0* 225,3 265,46 377,21 76,05
367,18 300,4 149,6 262,23 388,18 67,125-
351,23 381,4 80,36 253,96 413,13 51,138
330,70 434,0 47,11 248,83 426,55 41,854
317,42 460,3 33,89 236,03 456,10 29,465-
300,44 490,5 22,01 225,01 478,22 20,407
291,83 533,9 17,52 209,75 535,88 12,584
281,44 519,4 13,17 170,15 567,40 2,193
268,05 537,7 8,89 158,47 583,80 1,113
248,06 562,4 4,63 143,26 63,4,49 0,3758
231,10 582,5 2,42 128,09 624,65 0,0936
216,54 599,1 1,27 Фтор F,, [319]
189,50 629,9 0,285 144,31* 573,7
140 893,7 278,2
Диоксид углерода СО2 [ЗЮ] 130 1084 143,8
304,2* 467,9 120 1207 8Э,2И
303,16 593 343,6 НО 1306 43,28
100 1390 21 46
293,16 775 193,9 90 1466 9,274
283,16 863 135,6 80 1537 3,235
273,16 929 96,31 70 1603 0,8086
263,16 982 70,45 60 1665 0,1182
53,481** 1705 0,02166
Таблица 4.14. Плотность смесей жидких ГМ2—Оа, кг/м3 [59]
N„ 20,4 % О2 35 % О2 53,85 % О2 68,35 % О2 81,35 % О2 89,33 % О2 о2
Т, К pn2 Т, К Рсм Т, К Рем т, к Рем Т, К Рем Т, К Рем Т, к Рем Т, к РО2
80 795,0 75,7 884,9 77,3 934,1 75,8 1013,5 77,5 1059,3 75,5 1126,7 79,15 1147,9 8о 1191,5
75 817,5 73,45 894,9 72,9 754,4 73,05 1025,3 73,95 1.81,5 73,0 1139,0 77,8 1152,3 75 1215,5
70 840,0 70,4 908,7 68,85 974,9 66,9 1051,7 68,45 lh 6,2 67,7 1161,3 73,6 1171,8 7.1 1239,7
65 861,5 — — — — — — — — — — 67,65 1201,2 65 1263,5
Таблица 4.15. Плотность смесей жидких Аг—О2, кг/м3 [59]
Аг 87,4 % Аг , 78,5 % Аг 63, % Аг 49,1 % Аг 32,3 % Аг 19,4 % Аг 9,85 % Аг О2
Т, К | ?Аг 1 г, К | Рем 1 т, К | рсм Т, К I Рем Т, К | РсМ Т, К Рем Т, К Рем Т, К Ре'Л Т. К РО2
90 1374,8 88,4 1354,0 87,2 1335,3 88,2 1300,0 86,95 1279,4 87,45 1231,3 88,75 1197,1 88 1176,0 90 1144,5
87 1394,0 86,2 1363,0 84,65 1350,0 86,3 1310,4 84,95 1281,9 83,7 1250,9 86,7 1207,1 86,1 1185,6 85 1168,0
84 1412,5 83,75 1382,3 81,95 1364,4 85,05 1318,5 81,8 1298,6 80,1 1270,7 84,45 1218,8 83,4 1198,7 89 1191,5
— — 82,75 1390,8 80 1377,6 79,85 1347,7 78,65 1315,8 75,2 1295,1 82,2 1229,8 81,95 1206,6 75 1215,5
— — — — 79 1383,3 — — 76,2 1329,2 70,35 1320,6 77,75 1252,0 80,55 1214,2 70 1239,7
— — — — 78,2 1498,5 —• — 71,85 1355,5 — — 71,53 1282,7 ___ — —
Плотность
94
Физические свойства веществ при низких, температурах
Таблица 4.16. Плотность жидкого гелия при различных давлениях, кг/м3
Темпера- тура, К Давление, Ю8 Па
1,013 5,07 10,13 15,20 20,26 25,33 30,40 35,46
1,25 146,2 152,2 158,4 163,6 168,1 172,2 — —
1,50 146,3 152,4 158,5 163,8 168,5 172,7 —- —
1,75 146,5 152,6 159,0 164,5 169,4 174,1 — —
1,80 146^5 152,7 159,2 164,7 170,2 174,7 179,6 —
1 '90 146,6 153,0 159,6 165,3 170,8 175,7 179,5 —
2,00 146,8 153,3 160,3 166,6 171,3 175,6 179,4 182,9
2'10 147,0 153,9 160,9 166,5 171,2 175,5 179,3 182,8
2^20 147,2 154,0 160,'8 166,3 171,0 175,3 179,0 182,6
2,25 147,1 153,9 160,6 166,2 170,9 175,2 178,9 182,4
2,50 146,0 153,0 160,0 165,5 170,3 174,5 178,3 181,8
ЗЛО 142,5 150,6 157,9 163,7 168,7 173,0 176,8 180,3
3,50 137'3 147,1 155,2 161,5 166,7 171,2 175,1 178,6
4,00 129,3 142,2 151,9 158,8 164,4 169,1 173,2 176,8
4; 20 125,1 139,9 150,2 157,5 163,4 168,2 172,4 176,1
Таблица 4.17. Плотность жидкого нормального водорода при
различных давлениях, кг/м3 [324]
Температура, К Давление, Ю8 П i
10,13 20,26 40,53 60,79 81,06 101,3
20,34 73,34 75,30 77,05 — —
20,38 72,10 73,26 74,72 76,97 78,50 79,73
22',96 69,17 70,70 73,06 74,99 76,71 78,18
25,81 65,13 67,11 70,17 72,11 74,43 76,08
28,'17 60,89 63,68 67,48 70,29 72,48 74,31
30,11 55,83 60,25 65,08 68,28 70,68 72,70
31,62 57,00 62,93 66,55 69,25 71,50
32,58 — 54,65 61,65 65,50 68,40 70,70
Таблица 4.18. Плотность жидкого кислорода, кг/м3 [60, 325]
Темпера- тура, К Давление насыще- ния, Ю5 Па Плотность жидкости при давлении на- сыщения, кг/м* Давление, Ю5 Па
10,13 20,26 40,53 60,79 81,06 101,3 152,0 202,6
153 47 51 595,6 683 744 779 835 872
148 38,97 707,7 — — 765 799 824 868 900
143 31,66 775,2 — 789 822 845 864 900 927
138 25,45 827,8 846 867 884 899 929 953
133 20,19 872,6 890 906 919 932 957 979
128 15,77 911,6 914 928 941 952 963 985 1004
123 1'2, 10 947 Л 951 963 973 983 992 1011 1029
118 9,083 980,4 981 985 995 1004 1012 1020 1037 1052
ИЗ 6,652 1012 1013 1017 1025 1033 1039 1046 1061 1075
108 4,731 1041 1043 1046 1053 1059 1065 1072 1085 1097
103 3,251 1069 1070 1073 1079 1085 1090 1096 1108 1119
98 2', 145 1096 1097 1100 1105 1110 1114 1120 ИЗО 1141
93 С 349 1121 1123 1125 ИЗО 1134 1138 1143 1153 1162
88 0,8012 1145 1147 1150 1154 1158 1162 1166 1174 1182
«3 0,4445 [. 1169 1171 1173 1176 1180 1184 1188 1195 1202
Плотность
95
Таблица 4.19. Плотность веществ в конденсированном состоянии прн
равновесии твердой фазы с жидкостью или паром
Вещество Температура, К Давление, 105 Па Плотность, кг Твердая фаза /м* Жидкость Примечание
Аргон Аг [255] 180,3 164,3 127,5 107,0 95,8 88,7 83,78 70 50 5066 4053 2026 1013 506,6 202,6 0,687 0,077 1707 1700 1685 1664 1644 1630 1624 1630 1637 1644 1630 1579 1525 1479 1447 1416 Тройная точка
Ацетилен С2Н2 [255] 189,13 1,013 729 —
Азот N2 [255] 146,5 123,5 97,5 82,2 63,15 60 50 40 20 6079 4053 2026 1013 0,1253 6,3-10-2 6,37-10—4 6,4-Ю-5 1121 1079 1021 885,8 945,2 947,8 967,7 986,8 1027 1088 1040 974,8 991,7 869,5 Тройная точка- g-фаза а-фаза
Водород нормаль- ный п—Н3 [261] См. также рис. 4.2 18,24 16,43 13,96 4,2 154 0,079 90,66 88,51 86,72 89,02 83,07 8 j , 39 77,25 Тройная точка
Гелнй-4 «Не [317] [319] 30,77 22,21 14,746 10,0 6,0 3,84 2,54 2,0 1,772 1,763 1,6 1,464 1,3 1,0 3602,7 2162,5 1135,1 594,8 259,0 127,1 61,4 37,81 30,4 30,13 27,36 26,36 25,72 25,35 413,4 373,2 329,7 297,7 257,8 229,4 207,9 198,6 194,1/192,1 192,0 190,3 189,7/191,4 191,0 190,8 395,8 356,7 314,0 283,4 243,8 216,6 195,4 185,7 180,7 180,3 175.8 174,4 173,6 173,0 Тройная точка (И-гир) Тройная точка (а —В жидкий Не-1) X-топка Тройная точка (a-g-жидкий Не-П)
Гелий-3 3Не [317] [309] 30,184 18,518 4,2 5 3,252 2,943 2,658 2,272 1,8 1,4 1,0 0,6 0,28 3601,9 1729,8 207,28 148,23 13J,10 113,91 93,30 68,58 52,75 4J, 1 31,53 29,37 290,1 248,8 164,0 154,3 150,4 146,6 141,4 140,4 134,1 127,8 122,5 121,0 278,8 238,5 157,0 147,6 144,6 141,0 135,9 134,5 128,3 122,0 116,8 115,2 | g-фаза а-фаза 1
96
Физические свойства веществ при низких температурах
Продолжение тадл. 4.19
Вещество Температура, К Давление, 105 Па Плотность, кг Твердая фаза ?м3 Жидкость Примечание
Кислород О2 [57] 20,66 — 1425 —
Юзон О3 [57] 77,4 — 1728 1614 Тройная точка
•Криптон Кг [29] 140 130 120 115,76 856,8 491,7 143,2 0,73 2860 2832 2805 2794 2563 2520 2469 2445 Тройная точка
Ксенон Хе [29] 190 180 170 161,36 772,2 493,7 224,2 0,81 1949 1969 1991 2012 3091 3053 3008 2966 Тройная точка
Неон Ne [29] 36 34 32 30 28 26 24,55 866,6 700,5 540,5 386,7 239,3 98,36 0,43 1514 1500 1486 1471 1456 1440 1429 1381 1362 1341 1319 1296 1270 1248 Тройная точка
.Метай СН4 20,16 — 522 —
Оксид углерода СО [57] 21,6 65 — 1029 929 — «-модификация g-модификация
Диоксид углерода СО2 [255] 216,56 193,16 168,16 143,16 5,18 0,896 0,0817 0,00308 1513 1565 16G0 1626 — Тройная точка
Фтор F2 68,9 • — 1300 —
Таблица 4.20. Плотность чистых элементов, кг/м3 [58]
Элемент t, °C р-103 Элемент t, °C р-10»
Алюминий А1: Золото Au 20 19,3
твердый 20 2,70 Индий In 20 7,28
жидкий 659 2,382 Иод I 20 4,94
Барий Ва 20 . 3,78 Иридий 1г 17 22,42
Бериллий Be 20 1,84 Иттербий Yb 20 5,5
Бор В: Иттрий Y 20 3,80
кристаллический 20 3,33 Кадмий Cd 20 8,648
аморфный 20 2,34 Калий К:
Бром жидкий Вг 20 3,12 твердый 62,1 0,851
Ванадий V 20 5,96 жидкий 62,1 0,83
Висму'г В1 20 9,747 Кальций Са 29 1,55
Вольфрам W 38,38 18,6—19,1 Кобальт Со 21 8,71
Гадолиний Gd 20 5,91 Кремний Si:
Галлий Ga 20 6,093 кристаллический 20 2,42
Гафний Hf 20 13,3 аморфный 15 2,35
Германий Ge 20 5,46 Лантан La — 6,15
Европий Ей 20 3,217 Литий L1 20 0,534
Железо Fe 20 7,87 Магний Mg 5 1,741
Плотность
97
Продолжение табл. 4.20
Элемент t, °C р-10» Элемент t, °C р-10»
Марганец Мп 20 7,42 кристаллический 20 4,5
Медь Си: жидкий 4.27
твердая 20 8,93 Сера S:
жидкая — 8,217 ромбическая 20 2,07
Молибден Мо 20 9,01 мо но крист аллическая 20 1,96
Натрий Na: аморфная 20 1,92
твердый —188 1,0066 жидкая ИЗ 1,81
20 0,9712 Серебро Ag:
97,6 0 9519 литое 20 10,42—
жидкий 97,6 0,9287 — 10,59
Неодим Nd 20 6,96 жидкое —— 9 51
Никель Ni 20 8,6—8,9 Скандий Sc 20 2,5
Ниобий Nb 15 8,4 Стронций Sr 20 2 54
Олово Sn: Сурьма Sb 20 6,618
'белое 20 7,29 Сурьма аморфная 20 6,22
твердое 226 7,184 Таллий Т1 20 11,86
жидкое 226 6,99 Тантал Та 20 16,6
серое 20 5,8 Теллур Те:
Осмий Os 20 22,5 кристаллический 20 6,25
Палладий Pd 20 12 16 аморфный 20 6,02
Платина Pt 20 21,37 Тербий ТЬ 20 4,35
Празеодим Рг 20 6,475 Титан Т1 18 4,5
Рений Re 20 20,53 Торий Th 20 11,3-11,1
Родий Rh 20 12,44 Углерод С: 3,52
Ртуть Hg: алмаз 20
жидкая 0 13 596 графит 20 2,25-
20 13 546 Уран U 13 18,7
—38,8 13,690 Фосфор Р:
твердая —38,8 14,193 белый 20 1,83
—188 14,383 красный 20 2,20
Рубидий Rb металлический 15 2,34
Рутений Ru 20 1 532 Хром Сг 20 7,1
Самарий Sn. 0 12,06 Цезий Cs 20 1,873
Свинец РЬ’. 20 7,8 Церий Се 20 6,9
твердый 20 11,342 Цинк Zn:
жидкий Селен Se: 325 325 400 850 11,005 10,645 10,597 10,078 твердый жидкий Цирконий Zr Эрбий Ег 20 20 20 6,92 6,48 6,44 4.77
аморфный 20 4,8
Таблица 4.21. Относительная плотность некоторых веществ
(по отношению к плотности воды при 0°С)
Вещество Р/Рводы Вещество
Асбест 2,2—2,8 Бронза оловянистая 8,7—8,9
Асбестовый картон 1,2 Бронза алюминиевая /, 8
Алебастр 2,3—2,8 Бумага писчая 0,7—1,15
Алюминий литой 2,56 Бумага хлопчатая 1,5
Алмаз 3,5—3,6 Винипласт 1,38— 1,43
Апатит 3,16-3,22 Воск 0,95—0,98
Асфальт 1,1—1,5 Гетинакс 1,3—1,4
Баббит 7,5—10,1 Гипс сухой 0,97
Базальт 2,6—3,1 Глина сухая 1,5—1,6
Бетон 1,8—2,8 Г ранит 2,26—2,67
7-218
98
Физические свойства веществ при низких температурах
Продолжение табл. 4.21
Вещество Р ^ВОДЫ Вещество Р^Рводы
Г рафит 1,9—2,3 Органическое стекло 1,18
Дельта-металл 8,6 Парафин 0,87—0,91
Дерево (сухое): Пенополистирол 0,05—0,2
бер за 0,51—0,77 Пенопласт 0,1—0,2
дуб 0,69—1,03 Пемза изолировочная 0,38
ель 0,4—0,75 Песок мелкозернистый сухой 1 2—1,65
липа 0,32—0,59 Полистирол 1,1
ольха 0,42—0,68 Полиэтилен 0,92
сосиа 032,-0,76 Поташ 2,29
Древесный уголь (с учетом за- 0,4 Пробка 0.2—0,35
полнения пор воздухом) Резина (сырая) 0,92—0,96
Древесный уголь (без учета за. 1,4—1,5 Резина вулканизированная 1,0—2,0
полнения пор воздухом) Свинцовый глет 9,3—9,4
Дюралюминий 2,6—2,8 Сера аморфная 1,93
Известь обожженная 0,9—1,3 Слюда 2,65—3,2
Известняк 1,87—2,82 Сиег (рыхлый) 0,06—0,2
Кали едкое (сухое) 2,1 Стеклотекстолит 1,4—1.8
Карбид кальция 2,22 Сталь углеродистая 7,85-7,87
Каменная соль 2,28—2,41 Сталь никелевая 8,13—8,19
Каменный уголь (в кусках) 1,2—1,5 Стекло оконное 2,4-2,7
Канифоль 1,07 Сурик свинцовый 8,6—9,1
Каолин 2,2 Текстолит 1,3—1,4
Капрон 1,15 Торф моховой 0,64
Кварц 2,5-2,8 Торф смолистый 0,84
Кизельгур 2,66 Фарфор 2,25—2,5
Кирцич обыкновенный 1,4—1,6 Фторопласт-3 2,14
Кожа чепрак (сухая) 0,86 Фторопласт-4 2,1—2,3
Кокс (в кусках) До 1,4 Цемент 1,25—1,95
Латунь (прокат) 8,5—8,6 Чугун:
Лед 0,88—0,92 белый 7 0—7,8
Магнезия 3,2 серый 6,7—7,6
Мел 1,8—2,6 литейный 7,25
Мипора 0,02 Шерсть овечья (сухая) 1,2
Мрамор обыкновенный 1,95—2,82 Шлаки доменные 2,5—3,0
Натр едкий 2,0—2,13 Янтарь 1,08—1,1
Таблица 4.22. Плотность некоторых
жидкостей (при 15 °C), г/см3
Наименование р Наименование р
Анилин 1,04 Касторовое 0,97
Ацетон 0,79 масло
Бензин 0,68— 0.74 Керосин 0,79— 0,82
Бензол 0,9 Кокосовое 6,93
Бром 3,19 масло
Вода морская 1,02- Льняное масло 0,94
1,03 Метиловый 0,81
Глицерин (без- 1,27 спирт
водный) 1,2 Минеральное 0,85—
Деготь камен- ноугольный \ мазочное мас- ло 0,96
Деревянное 0,92 Нефть нату- 0,7—
масло ра ль я а я 0,9
Дихлорэтан 1,17— 1,2 Оливковое масло 0,92
Продолжение табл. 4,22
Наименование р Наименование р
Сероуглерод 1,19 Тетрабромэтан 2,964
Серная кисло- та (87%) 1,8 Хлопковое мас- ло 0,93
Сериая кисло- 1,89 Хлороформ 1,48
та („дымящая- Этиловый спирт 0,79
ся“) Терпентиновое масло 0,87 Этиловый эфир 0,74
4.3. ТЕПЛОВОЕ РАСШИРЕНИЕ
ТВЕРДЫХ И ЖИДКИХ ТЕЛ
Если твердое тело, имеющее при О °C
длину 10, нагреть до температуры t, то его
размеры увеличатся и длина будет равна lt.
Отношение приращения длины &.l=lt—h
к первоначальной длине при О °C опреде-
ляет степень теплового расширения тела.
Длина при температуре t
Давление насыщенных паров
99
Рис. 4.2. Плотность твердых и жидких
водорода, дейтерия и дейтеро-водорода в
состоянии насыщения [261]
Рис. 4.3. Относительная температурная де-
формация различных конструкционных ма-
териалов при низких температурах:
/ — инвар; 2 — стекло «пирекс»; 3 — беримий
4 —ниобий; 5 — стекло оптическое крон (К-8);
сталь ШХ-15; 7 — сталь 12ХНЗА; 8 — тексто-
лит ПТК; 9 — монель-металл; 10 — сталь ЭИ702:
11 константан; 12 — сталь нержавеющая
1XI8H9T; 13 — бронза бериллиевая; 14 — медь
М-1; 15 — бронза оловянно-фосфористая
БрОф-6,5-0,15; 16 — латунь Л-62; 17 — алюминий
(4.3)
где а — температурный коэффициент ли-
нейного расширения тела, К-1:
1 { д1 \
a =---- ------ .
I \ dt J
Рис. 4.4. Относительная температурная де-
формация различных материалов с боль-
шим коэффициентом теплового расширения
при низких температурах:
/ — магний; 2 — цинк; 3 — индий; 4 — полимер-
ный клей типа «аралдит»; 5 — трифторэтилен
(фторопласт-3); 6 — плексиглас; 7 — нейлон; 8 —
полистирол; 9~ тефлон (фторопласт-4); 10 — по-
лиэтилен
При понижении температуры коэффи-
циент линейного расширения всех твердых
тел уменьшается и при гелиевых температу-
рах практически становится равным нулю.
Для оценки теплового расширения
жидкостей используется температурный ко-
эффициент объемного расширения (3=
В табл. 4.23 приведены средние значе-
ния температурных коэффициентов линей-
ного расширения а изотропных твердых тел
(элементов) при данной температуре.
Средние значения температурных коэф-
фициентов линейного расширения некото-
рых технически важных веществ даны
в табл. 4.24.
Температурные коэффициенты объемно-
го расширения ]3 газов в конденсированном
состоянии приведены в табл. 4.25.
Зависимости степени теплового расши-
рения некоторых технически важных кон-
струкционных материалов от температуры
представлены на рис. 4.3 и 4.4.
4.4. ДАВЛЕНИЕ НАСЫЩЕННЫХ
ПАРОВ
О термодинамических зависимостях для
давления насыщенных паров см. на с. 41, 42
В табл. 4.26—4.33 и на рис. 4.5 приво-
дятся экспериментально полученные значе-
ния упругости паров в зависимости от тем-
пературы для технически наиболее важных
газов.
Иногда возникает необходимость в
определении давления насыщенных паров
7*
1 00
Физические свойства веществ при низких температурах
Таблица 4.23. Температурные
коэффициенты линейного расширения
твердых химических элементов
(изотропных кристаллов), К-1 [58]
Элемент t, »с а-Юз
Алюминий А1 —1904-0 18,0
0 22,58
Барий Ва 0 19,0
Бериллий Be —1204-0 8,1
0 10,5
Бор В 20 2,0
Ванадий V —1834-0 6,6
20 7,8
Висмут Bi -1834-15 12,98
0 13,37
Вольфрам W 1904-0 3,8
0 4,3
Германий Ge —243 —0,4
27 5,75
Железо Fe —2004-20 9,18
0 и.з
Золото Ац —183 10,94
20 14,0
Иидий In —1804-20 26,7
Иод I —1904-17 83,7
Кадмий Cd —220 20,6
0 29,0
Калий К 0 84,0
Кальций Са —2204-40 18,5
Кобальт Со 0 12,0
Кремний Si —233 —0,05
27 2,33
Литий Li —178 17,0
20 56,0
Магний Mg —1904-20 21,3
0 25,07
Марганец Мп —2004-0 20,4
0 22,6
Медь Си —183 9,38
20 16,61
Молибден Мо — 1904-0 4,2
—100-J-0 4,8
Натрий Na -1934-0 59,8
04-17 68,2
Никель Ni —2534-10 8,1
0 12,54
Ниобий Nb —212-j-O 5,8
0 7,06
Олово Sn 0 21,0
Палладий Pd -1914-16 10,3
Платина Pt —1914-16 8,0
0 8,95
Ртуть Hg —1834-30 30,0
Свинец РЬ —200 26,5
—100 27,3
0 28,3
Сера S:
ромбическая 0 74,0
моноклинная 0 80,0
Селен Se;
аморфный -78-1-0 42,7
поликристаллически й -784-19 20,3
Продолжение табл. 4.23
Элемент t, °C а-10»
Серебро Ag -2504-0 14,9
20 19,0
Сурьма Sb -1904-17 10,22
0 9,2
Тантал Та —190+20 6,2
Титан Ti —195+20 6,8
Углерод С: 0 7,7
алмаз —220+40 0,6
графит 0 7,0
Уран U —260+150 10,7
Фосфор Р 0 125
Хром Сг —200+0 4,1
0 5,88
Цинк Zn —200 2,2
0 30
Цирконий Zr —183+0 4—5,1
20 6,3
Таблица 4.24. Температурные
коэффициенты линейного расширения
некоторых вешеств, К-1 [57, 58]
Вещество t, °C а. 10*
Латунь Л-62 —191+16 16,63
20 20,0
Бронза (85% Си + —191+16 15,25
+9% Zn + 6% Sn) 20 18,3
Константан (60% Cu+ —191 + 16 12,22
4-40% Ni) 20 14,4
Алюмель 20 13,7
Хромель 20 12,8
Копель 20 14,0
Монел 20 14,5
Манганин 20 16,0
Мельхиор 20 16,0
Платина-ирцдий — 190+0 7,5
(80% Pt + 20% Ir) 0—100 8,3
Дюраль Д16 20 12,9
Сталь углеродистая:
0,1% С — 191+16 9,2
0,5% С —191+16 8,96
Сталь никелевая —191 + 18 0,98
(31,6% Ni)
Сталь нержавеющая 0—100 17,3
1Х18Н9Т
Чугун —191+16 8,66
Стекло йенское —191+16 4,406
Стекло „пирекс” 0—100 3,0
Стекло кварцевое —196+16 0,256
Кварц кристаллине- 0—30 0,42
ск ий;
II оси —253ч-—193 1,03
—191+16 5,16
[ ОСИ —253+—193 3,6
—191+16 10,43
Тепловое расширение твердых и жидких тел. Давление насыщенных паров
101
Продолжение табл. 4.24
Вещество t, °C a-10s
Фарфор — 191 + 16 1,96
Лед водяной —189+0 27,0
—250 —6,1
—150 16,8
—50 45,6
0 52,7
Эбонит —160 54,6
Квасцы аммиачные —160 0,8
—80 2,84
0 6,65
Квасцы калиевые — 170 1,54
—72 4,30
5 9,10
Продолжение табл. 4.24
Вещество t, °C а*10*
Дуб:
|| волокнам 20 4,92
I волокнам Сосна: 20 54,4
|| волокнам 20 5,41
I волокнам 20 34,1
Бук (|| волокнам) 20 2,57
Клен ( || волокнам) 20 6,38
Красное дерево ( || во- локнам) 20 3,61
Таблица 4.25. Температурный коэффициент объемного расширения газов
в конденсированном состоянии, К-1
Вещество т. к 3-10* Примечание
Азот N2: жидкий 68—89 58,8 [57]
кристаллический:
(а-фаза) 4 0,1 1
20 1,3 1
30 5,5 1. Коэффициент линейного рас
(Ц-фаза) 40 6,37 । ширения а [61]
44 6,92 )
Аммиак NH3: жидкий 223—273 19,3
кристаллический 20 100 3,0 26 [57]
170 48
Аргон Аг: жидкий 84—90 45,4 [57]
кристаллический 4 0,074
10 1,386
20 5,9 } [6']
40 10,8
80 20,0
Водород Н2: жидкий 14—20,39 126 [59]
кристаллический 13,96 48 [61]
(тройная точка)
Гелий-3: жидкий [316J 0,2 1,0 —104 204 1 При давлении насыщенного
3,2 4809 | пара
кристаллический [309] 0,3 —2,4 р— 29,32-105 Па ) На кри-
1,0 32,4 р= 40,10-105 Па > вой плав-
1,8 61,2 />=68,58-105 Па ! ления
Гелий-4: жидкий [311] 1,0 2,0 4,65 —132 1 При давлении насыщенного
4;о 1246 1 пара
кристаллический [319] 0,5 0,6 р = 25,32-105 Па ) На кри-
1,0 6,3 /7 = 25,35- 10s Па 1 вой плав-
2,0 43,2 /7 = 37,81 -105 Па j ления
102
Физические свойства веществ при низких температурах
Продолжение табл. 4.25
Вещество т, к р-ю* Примечание
Диоксид углерода СО2: жидкий 223—273 49,5
криста ллический 171 155 12,8 9,1 [57]
109 8,°
Кислород: жидкий 68—69 38,5 [57]
кристаллический:
(а-фаза) 21 2,0
((1-фаза) 29 39 5,05 8,63 | [61]
(у-фаза) 48 8,70
Криптон кристаллический 4 0,128
20 4,82 } [61]
115 16,0
Ксенон кристаллический 4 0,128
20 3,20 } [61]
135 10,36
Метан кристаллический 30 6,3
60 10,8
Неон кристаллический [61] 4 6,6
10 Ю,1
18 33,1
23 51,7
в интервалах температур, для которых нет
экспериментальных данных. В подобных
обстоятельствах следует производить гра-
фическую экстраполяцию в координатах
1g Р, 1/Т, исходя из имеющихся данных.
В этих координатах для большинства ве-
ществ зависимости давления насыщенного
пара от температуры прямолинейны с по-
грешностью до 1—2 %. Константы уравне-
ния, отражающего такую зависимость для
многих газов, можно найти в [37, 257, 259].
В табл. 4.27 приведены температуры
насыщенного пара некоторых газов для
очень низких давлений. Необходимая экс-
траполяция производилась по уравнению
типа (2.44). Данные тщательно сопоставля-
лись и выбирались наиболее согласующиеся.
Тем не менее значения упругости по
табл. 4.27 следует рассматривать как при-
ближенные.
В табл. 4.34 даны уравнения зависи-
мости давления насыщенного пара от тем-
пературы для некоторых газов. Давление
насыщенного пара можно также находить
по диаграмме состояния веществ. Точка пе-
ресечения пограничной кривой пара с изо-
барой и изотермой определяет значения
температуры и давления насыщенного пара.
В табл. 4.35 и 4.36 даны зависимости
температуры плавления от давления для
некоторых замороженных криоагентов.
4.5. ВЯЗКОСТЬ
Вязкостью (или внутренним трением)
называется явление возникновения каса-
тельных сил при относительном перемеще-
нии частиц вещества. Сила F, действующая
при этом между двумя соседними слоями
жидкости или газа, определяется по урав-
нению Ньютона
F=r\dw/dn, (4.4)
где F — сила на единицу площади; dw—
разность скоростей слоев; dn—расстояние
между слоями.
Коэффициент пропорциональности 1|
в формуле Ньютона носит название дина-
мической вязкости.
Отношение динамической вязкости
к плотности вещества называется кинема-
тической вязкостью:
v=T]/p. (4.5)
Величина, обратная динамической вяз-
кости, именуется текучестью.
О единицах измерения вязкости и их
соотношениях в разных системах см.
в гл. 1.
Относительной вязкостью жидкости на-
зывается отношение абсолютных вязкостей
этой жидкости и воды при 20 °C.
Экспериментальные методы измерения
вязкости см. в [152].
Температура, °C
Рис. 4.5. Упругость насыщенных паров технически важных газов
Вязкость. Давление насыщенных паров
w
104
Физические свойства веществ при низких температурах
Таблица 4.26. Давление насыщенных парой некоторых газон
Обозначения: *—тройная точка; **—нормальная точка кипения; ***—критическая точка.
Азот [24, 255] Аммиак [2551 Ацетилен [35, 255]
Т, К р, гПа Т, К р, МПа г, к р, гПа
Над кристаллом 195,42 6,07646-10-3* 90 1,86-10—4
1,44-10—10 1,47-10—х«» 3,06-10—10 6,13-10-ю 1,59-10—9 3,33-10~9 1,73-10-8 6,66-10-8 2,53-10-’ 4,26-10-’ 3,94-10—8 1,17-10—2 6,39-10-2 1,40-10-1 3,49 7,59 13,59 23,46 39,19 69,92 98,11 200 8,66328-10—3 95 8,66-10—1
21,2 21,6 22,0 22,5 23,0 24,0 25,0 26,0 26,4 30,0 37,4 40,0 43,5 49,6 52 54 56 58 60 210 1,77926-10—2 100 3,59-10—3
220 230 3,39134-10—2 6,06126-10—2 105 ПО 1,27-10—2 3,99-IO-2
239,76 1,01325-10-1** 115 1,14-10—1
250 1,65362-10-1 120 3,051-10-1
260 2,55946-10-1 125 7,41-10-!
270 3,81893-10-1 130 1,67
280 5,51815-10-1 140 7,33
290 300 7,75338-10-1 1,06239 150 160 25,32 78,51
310 320 330 340 350 360 370 1,42493 1,87349 2,42166 3,08230 3,86960 4,80280 5,89103 173,16 183,16 189,13 192,4 203,16 273,26 625,18 1013,25 1282,34* р, МПа 2,23-10-1
380 7,15354 213,16 3,53-10-1
390 8,60654 223,16 5,31-10-1
400 10,28448 233,16 7,73-10-1
405,6 11,29773*** 243,16 1,09
р, МПа 253,16 1,51
63,15 0,0125* 0,0146 0,0206 . Аргон [29[ 273,16 283,16 293,16 303,16 308,7 2,66 3,45 4,39 5,491 6 246***
64 66 Т, К р, гПа
68 70 0,0285 0,0386 0,0513 0,0670 0,0762 0,1013** 0,1371 65,58 67,77 70,0 72,0 74 76 78 80 82 83,78 86 87,28 88 90 28,752 51,054 76,914 111,305 157,960 220,078 301,391 406,298 539,865 687,5* 881,646 1013,250** 1090,794 1336,332
72 74 76 Водород нормальный (75% о-На) [26 , 261, 262]
77,36 80 т, К р. гПа
82 84 86 88 90 92 94 96 98 0,1697 0,2079 0,2520 0,3028 0,3608 0,4265 0,5006 0,5836 0,6761 3,4 3,6 3,8 4,0 4,2 4,5 7,2 8,0 1,333- ю—9 7,33-10—9 3,8-10—8 1,26-10-’ 4,6- 10—7 2,4-10—е 2,6-10—2 1,27-10-1
100 0,7788 9,0 6,29-10-1
102 0,8923 10 2,31
104 1,0172 95 0,2137 11 6,66
106 1,1541 100 0,3247 12 16,93
108 1.3038 105 0,4735 13 37,19
110 1,4669 НО 0,6665 13,95 77,98*
112 1,6441 115 0,9107 15 127,63
114 1,8363 120 1,2131 16 204,35
116 2,0442 125 1,5812 17 313,52
118 2,2680 130 2,0233 18 461,08
120 2,5114 135 2,5485 19 654,23
122 2,7732 140 3,1675 20 900,71
124 3,0564 145 3,8921 20,38 1013,25**
126 3,3646 150,86 4,8979*** 21 1208,2
126,20 3,4000*** 22 1584,9
Вязкость. Давление насыщенных паров
105
Продолжение табл. 4.26
Водород нормальный (78% о-Н2) [26, 261, 262J
Т, К р, гПа
23 2038,9
23,94 2529,2
24,445 2833,5
р, МПа
25,7 3,6615-10—1
26,74 4,4763-10-’
27,31 4,9604-10-1
28,85 6,4993-10-1
30,19 8,1713-10-1
31,4 9,8266-10-1
32,0 I,0749
33,07 1,2519
33,24 1,2966***
Водород равновесный при 20,4 К (0,21% о-нз) ]26, 253, 258, 261, 262]
т, к Р, гПа
1 1,06-10-38
2 5,33-10-18
4 2,66-10—7
6 1,33-10—3
8 1,46-10-1
10 2,57
11 7,49
12 18,52
13 40,25
13,81 70,28*
15 133,69
16 215,94
17 327,92
18 482,55
19 679,16
20 932,03
20,28 1013,25**
21 1246,75
22 1631,19
23 2093,48
р, МПа
24 2,645-10-1
25 3,289-10-1
26 4,034-10—1
27 0,489
28 0,587
29 0,698
30 0,823
31 0,963
32 1,120
32,98 1,293***
Водород (100% о-Н2) [25, 2611
Т, К р, гПа
14,05 73,44*
15 122,93
16 198,75
Водород (100% о-Н2) [23, 26Ц
Т, К Р, гПа
17 305,52
18 450,28
19 640,77
20 883,24
20,45 1013,25* *
22 1560,14
23 2010,69
Водород-дейтерий HD
[26, 261, 262, 269]
Т, К р, гПа
10 3,73-10-1
11 1,32
12 3,92
13 9,94
14 22,39
15 45,85
16 86,91
16,6 123,70*
17 149,96
18 234,87
19 352,17
20 438,29
21 713,02
22 971,09
22,23 1013,25**
23 1291,67
24 1682,64
25 2152,12
р, МПа
26 2,708-10-1
27 3,355-10-1
28 4,112-10-1
29 4,976-10-1
30 5,961-10-1
31 7,074-10-1
32 8,328-10-1
33 9,734-10-1
34 1,131
35 1,306
35,9 1,479***
Воздух (22 , 23 , 263]
Т, К р, гПа
33,6 7,998-10—3
34,2 8,7978-10—3
35,8 1,8662-10-2
37,0 2,3994- IO"2
38,8 5,7319-10-2
39,9 9,7309- IO-2
42,3 2,6793- IO-’
44,7 5,532- 10-1
45,8 9,344- 10-1
47,1 1,5996
50,3 4,798
55,2 19,995
Воздух [22, 23,263]
т, К Л.Т.П- МПа ЛЭДнд-МПг
65 0,01468 0,008613
70 0,03401 0,0139
75 0,06583 0,04242
78,67 0,101325
80 0,11736 0,08272
81,63 —. 0,101325
85 0,19554 0,14727
90 0,30798 0,24385
95 0,46269 0,38084
100 0,66785 0,56727
105 0,93174 0,81282
ПО 1,2626 1,1280
115 1,6687 1,5242
120 2,1584 2,0138
125 2,7406 2,6102
130 3,4246 ’3,3272
132,5 3,766***
Гелий (4Не) (см. табл. 4.29)
[25, 250, 265, 267, 962]
Г, К , гПа
0,1 5,57-10—32
0,2 10,83-10—1«
0,3 4,51-10-1»
0,4 3,59-10—7
0,5 21,8 • ю-«
0,6 37,5-10—8
0,7 30,38-10-4
0,8 15,259-10-3
0,9 55,437-Ю-3
1,0 0,1599
1,5 4,798
2,0 31,687
2,5 103,315
3,0 242,74
3,5 474,42
4,0 821,98
4,215 1013,25**
4,5 1310,6
5,0 1971,2
5,2 2274,7*** Л-точка
2,177 | 50,36
Гелий (3Не) (см. табл. 4.28) [266]
т, к >, гПа
0,2 0,016-10—3
о,з 0,00250
0,4 и, 03748
0,5 0,21225
0,6 0,72581
0,7 1,84118
0,8 3,85567
О,э 7,07140-
1,0 11,788
106
Физические свойства веществ при низких температурах
Продолжение табл. 4.26
Гелий (’Не) (см. табл. 4.28) [266]
т, к р, гПа
1,1 18,298
1,2 26,882
1,3 37,810
1,4 51,350
1,5 67,757
1,5 87,282
1,8 136,675
2 + 201,466
2,2 283,540
2,4 384,785
2,6 507,134
2,8 652,677
3,0 823,806
3,195 1013,25**
з,з 1135,11
3,324 1165,22
Диоксид углерода [25 5, 36]
(СМ. табл. 4.30)
t. °C р, МПа
— 130 3,080-Ю-4
— 125 6,505-10—4
— 120 1,308-10-3
— 115 2,510-10-з
— ПО 4,617-10-э
—105 8,172-10-3
— 100 1,397-10-2
—95 2,314.10-2
—90 3,727-10-2
—85 5,847-10-2
—80 8,962-10-2
—78,45 1,01325-10-1
—70 1,980-Ю-1
—65 2,871-10-1
—60 4,097-10-1
—56,6 5,179-10-1*
—50 6,836-10-1
—45 8,333-10-1
—40 1,006
-35 1,204
—30 1,429
—25 1,6841
—20 1,9707
—15 2,2917
— 10 2,6493
—5 3,0463
0 3,4853
+5 3,9691
+ 10 4,5014
+ 15 5,0857
+20 5,7274
+25 6,4325
+30 7,2108
+31,04 7,3815***
Дейтерий нормальный (66,67% o-D2)
[261, 251, 262, 268]
т, к р, гПа
10 6,665-10-2
11 2,666-10-1
12 9,731-10-1
13 2,853
14 7,251
15 16,395
16 33,858
17 64,384
18 116,238
18,73 171,424*
20 293,13
21 427,36
22 604,25
23 831,13
23,67 1013,25**
24 1115,59
25 1465,23
26 1887,93
27 2391,40
28 2983,79
р, МПа
29 3,6743-10-1
30 4,4706-10-1
31 5,3826-10-1
32 6,4207-10-1
33 7,5952-10-1
34 8,9175-10-1
35 1,03991
36 1,2057
37 1,3886
38 1,5912
38,34 1,6637***
Дейтерий равновесный при 20,4 К
_______(97,8 о-Ра) [262, 269]__
т, к р, гПа
10 6,66- IO-2
11 2,79. 10-1
12 9,99-10-1
13 2,93
14 7,42
15 16,79
16 34,66
17 66,12
18 118,24
18,69 171,29*
20 296,32
21 432,02
22 610,25
23 838,19
23,63 Ю13.25**
25 1475,09
26 1900,32
р, МПа
28 3,0044-10-1
30 4,4992-10-1
Дейтерий равновесный при 20,4 К
(97,8 o-D2) [262, 269]
Т, К р, аПа
32 6,4564-10-1
34 8,9490-10-1
36 1,2067
38 1,5922
38,26 1,6496***
Закись азота [271]
т, к р, МПа
182,35 8,785-10-2*
184,69 1,013- ю-i**
190 1,379-10-1
195 1,812-10-1
200 2,343-10-1
205 2,985-10-1
210 3,750-10-1
215 4,668-10-1
220 5,737-10-1
225 6,978-10-1
230 8,407-10-1
235 1,004
240 1,188
250 1,631
260 2,198
270 2,908
280 3,749
290 4,732
300 5,876
309,71 7,275***
Кислород (22, 272, 788]
т, к р, гПа
20 1,342-10-1®
а-фаза 22 2,142-10-1»
23,781 9,654-19-12
26 5, 172-10-1»
30 1,542-10-’
34 12,206-IO-6
й-фаза 38 3,744-10-4
42 5,974-10-»
43,77 1,725- IO-2
46 5,252-10-2
г-фаза 50 2,991-10-1
54 1,301
54,36 1,46*
58 4,334
60 7,317
65 23,33
70 62,70
75 145,6
80 301,5
85 568,7
90,18 1013,25**
92 1221
94 1484
Вязкость. Давление насыщенных паров
107
Продолжение табл. 4.26
Кислород [22, 272, 788]
г, к р, гПа
96 1788
98 2139
100 2539
110 5430
115 7551
120 10216
р, МПа
125 1,350
130 1,748
135 2,224
140 2,786
145 3,445
150 4,215
154,58 5,043***
Криптон [29, 273]
Т, к р, гПа
60 0,014
72 0,064
74 1,073
75 1,35
80 4,21
85 1,12
90 26,89
95 58,68
100 118,45
105 223,62
ИО 398,51
115 675,35
115,76 731,9*
117 811,6
118 880,6
119 954,1
119,75 1013,25** '
122 1203
124 1395
126 1609
128 1846
р, МПа
130 0,2112
135 0,2896
140 0,3878
145 0,5087
150 0,6552
160 1,037
170 1,557
180 2,241
190 3,120
200 4,223
209,39 5 496***
Ксенон [29]
т, к р, гПа
70 1,849-10—«
80 5,652-Ю-з
90 7,989- IO-2
100 6,594-10-1
110 3,678
120 15,33
130 50,88
140 141,6
150 343,2
160 750,9
161,36 816,0*
162 . 848,0
164 954,3
165,03 1013,25**
167 1133
170 1336
175 1734
180 2218
р, МПа
190 0,3480
200 0,5212
210 0,7504
220 1,045
230 1,416
240 1,872
250 2,425
260 3,087
270 3,869
280 4,786
289,74 5,821***
Метан [27, 255]
т, К р, гПа
51 0,0056
52 0,0087
54 0,0194
56 0,0417
58 0,0848
60 0,1638
65 0,721
70 2,585
75 7,838
80 20,77
85 49,19
90 106,04
90,68 117,2*
95 199,0
100 344,0
105 564,0
ПО 882,0
111,66 1013,25**
115 1324,0
Метан [27, 255]
Г, К р, гПа
120 1918,0
125 2694,0
130 3682,0
р, МПа
135 0,4915
140 0,6426
145 0,8248
150 1,0416
155 1,2967
160 1,5937
165 1,9367
170 2,3300
175 2,7785
180 3,2877
185 3,8653
190 4,5227
190,77 4,626***
Неон [29]
т, К р, гПа
15 0,52
16 1,52
17 3,89
18 9,03
19 19,19
20 37,86-
20,4 48,92.
22,25 148,0
24 333,0
24,55 433,5*
25 510,3
26 718,4
27,09 1013,25**’
28 1321
29 1735
р, МПа
30 0,2238
32 0,3552’
34 0,5352
36 0,7728
38 1,078
.40 1,462
42 1,939
44,4 2,653***
108
Физические свойства веществ при низких температурах
Продолжение табл. 4.26
Озон 1274] Оксид углерода [255] Сернистый ангидрид (SO'2) [126, 259]
Т, К р гПа т. к р, гПа Т, °C р, гГГа-
.80,2 1,145- IO-2 81,61 1013,25** 60 l,139i
’90,19 1,333-10—1 84 1323,34 80
1,851
99,32 1,19 86 1634,27
110,87 5,76 88 2001,58 100 2,897
115,70 13,24 р, МПа 120 4,337
118,15 17,54 90 2,39-10—1 140 6,160
124,77 38,44 95 3,71-10—1 150 7,164
130,46 135,55 144,56 74,37 126,09 282,99 100 5,48-10-1 7,78-Ю-1 157,5 8,146***
105 Сероводород [259, 275]
ПО 1,07
153,98 597,05 115 1,43 т, к р, гПа
160,93 964,69 120 1,88 2,42 НО
161,25 1013,25** 125 7,865-10-2
163,52 1219,29 130 3,06 120 1,293-10-1
171,29 191,30 1942,18 5663,91 132,92 3,498*** 130 140 4,172-10-1 1,679
207,17 10993,2 Сернистый ангидрид (SO2) [126, 2591
6,1318
Т, °C 150
215,98 15169,5 р, гПа 160 19,062
223,91 19821,7 —75,52
235,10 27539,8 16,74* 170 51,720
261,05 55298,2*** 70 26,66 180 124,902
60 57,319 187,5 226,6*
Оксид углерода [255]
115,971 1 Q0 268,732
Т. К р, гПа 40 200 210
215,946 383,904 502,007 871,248
55,21 5,065 30
56,86 9,584 20 639,84 212,97 1013,25**
60,24 26,633 10,01 1013,25** 220 1416,31
61,55 37,470 0 1552,94
61,99 41,056 р, МПа
62,68 48,654 р, МПа 230 2,18-10-1
64,96 81,046 + 10 2,378-10-1 240 3.30-10-1
6о,33 67,9 107,306 148,029 15 2,860-10-1 250 4,79-10-1
20 3,415-10-1 260 6,69-10-1
68,09 153,695*
70 210,890 25 4,049-10-1 270 9,27-10-1
72 287,620 30 4,772-10-1 280 1,24
74 384,930 35 5,591-10-1 290 1,64
76 506,510 40 6,512-10-1 300 2,12
78 656,410 50 8,696-10-1 320
3,36
S0 839,030
Вязкость. Давление насыщенных паров
109
Продолжение табл. 4.26
Сероводород [259, 275] Фтор [252] Этан [255, 961]
т, К Р, гПа Т, К | р, МПа т, к р, МПа
340 5,06 120 1,6333 90,35* 1,13-io-®
350 100 7,0927-10-е
6,13 130 2,7475 120 3,5058- IO-4
373,46 9,00*** 140 4,3371 140 3,8351-10-3
Тритий нормальный (75% о-Т2) 144,31 5,2153*** 160 2,1481-10-2
[262, 270] 180 7,8811-10-2
Г, К | р, гПа Хлор [259] 184,52 190 1,01325- IO-4**
12,2 2,052-10—1 Т, °C р, гПа 1,3476-10-1
200 2,1746-10-1
14,3 2,666 —118 1,333 220 4,9223-10-1
16,122 13,596 106,7 6,665 240 9,6775-10-1
18,054 53,586 101 14,663* 260 1,7134
20,62 215,946* 93,3 26,66 180 2,8016
22,0 373,24 739,548 80 83,312 300 305,5 4,3661 4,871***
24,0 70 157,294
25,04 1013,25** 60 279,93 Этилен [595, 255]
26,0 1322,73 50 466,55 т, К р, гПа
28,0 2186,52 40 746,48 79,45 1,3-10-3
30,0 3398,22 33,8 1013,25** 89,05 2,6-10-2
32,0 5028,48 р, МПа §77,25 0,266
34,0 7154,34 103,95 1,206*
36,0 9861,13 20 1,86-10—1 109,85 2,666
38,0 13248,42 10 2,66-10—1 128,15 35,59
0 3,71-10-1 143,15 156,23
40,44 18499,37***
+ 10 5,01 • 10—1 160,0 562,4
Фтор [252] 20 6,71-10-1 8 87-Ю-1 169,38 1013,25**
Т, К р, МПа 30 р, МПа
53,48 0,00025* 40 1,16 180 190 0,1822 0,2959
56 0,00054 50 1,49 200 0,4559
60 0,00155 60 1,88 210 0,6723
70 0,01230 70 2,33 220 0,956
80 0,05547 80 2,88 230 1,3182
84,95 0,101325** 101,6 4,05 240 1,7711
90 0,17403 115,2 5,07 250 260 2,328 3,003
100 0,92802 127,1 6,08 270 3,811
110 0,88851 144 у,у1#*# 282,35 5,042***
Таблица 4.27. Данные по температурам насыщенного пара некоторых веществ для очень низких давлений [462], К
Давление насыщенных паров гПа
Наименование газа зж-oi-e'i o-OI’S'I I 1,3-10-1° 1 ' о 1,3-Ю-8 1 ! 1,3-10-’ 9.01-S‘I 1,3-10-5 1,3-Ю"1 О Л т-01 ’£‘1 1,3-100 1,3-Ю1 eOI‘S*I । 1,3-Ю3
Азот 18,1 19 20 21,1 22,3 23,7 25,2 27 29 31,4 34,1 37,5 41,7 47 54,0 63,4* 80,0
Аммиак 70,9 74,1 77,6 81,5 85,8 90,6 95,9 102,0 108,5 116,5 125,5 136,0 148,0 163,0 181,0 20.6* 245
Аргон 23,3 21,3 22,5 23,7 25,2 26,8 28,6 30,6 33,1 35,9 39,2 43,2 48,2 54,4 62,5 73,4 89,9*
Вода 113,0 118,5 124,0 130,0 137,0 144,5 153,0 162,0 173,0 185,0 198,5 215 233 256 284* 325 381
Водород 2,67 2,83 3,01 3,21 3,45 3,71 4,03 4,40 4,84 5,38 6,05 6,90 8,03 9,55 Н,7 15,1* 21,4
Диоксид уг- лерода 59,5 62,2 65,2 68,4 72,1 76,1 80,6 85,7 91,5 98,1 103*0 114,5 125,0 137,5 153,5 173,0 198,0*
Закись азота 55,8 58,3 61,1 64,2 67,6 71,3 75,5 80,3 85,7 91,9 99,0 107,5 117,5 129,5 144,0 162,5 189,3*
Кислород 21,8 22,8 24,0 25,2 26,6 28,2 29,9 31,9 34,1 36,7 39,8 43,3 48,1 54,1 62,7* 74,5 92,8
Криптон 27,9 29,4 30,9 32,7 34,6 36,8 39,3 42,2 45,5 49,4 53,9 59,4 66,3 74,8 85,9 Ю1,0 123,5*
Ксенон 38,5 40,5 42,7 45,1 47,7 50,8 54,2 58,2 62,7 68,1 74,4 82,1 91,5 103,5 118,5 139,5 170,0*
Метан 24,0 25,3 26,7 28,2 30,0 32,0 34,2 36,9 39,9 43,5 47,7 52,9 59,2 67,3 77,7 91,7* 115,0
Неон 5,50 5,79 6,Н 6,47 6,88 7,34 7,87 8,48 9,19 10,05 11,(5 12,30 13,85 15,80 18,45 22,1 27,5*
Оксид азота 37,7 39,4 41,3 43,4 45,6 48,1 50,9 54,0 57,6 61,6 66,3 71,7 78,1 85,7 95,0 106,5 123,5*
Оксид угле- рода 20,5 21,5 22,6 23,0 25,2 26,7 28,4 30,3 32,5 35,0 38,0 41,5 45,8 51,1 57,9 67,3 84,1*
Сероводород 57,1 59,8 62,7 65,9 69,5 73,5 78,0 83,1 89,0 95,7 103,5 113,5 124,5 138,5 156,5 189,5 218*
Сернистый ангидрид 78,9 82,4 86,3 90,4 95,1 100,0 1С6,0 112,5 119,5 128,0 137,5 148,5 161,5 177,0 195,5* 225 269
Хлор 66,1 69,1 72,4 76,0 80,0 84,4 89,4 95,1 101,5 109,0 117,5 127,5 140,0 155,0 173,0 201 245
Обознапет нахождение тройной тонки между соответствующими температурами.
1 10 Физические свойства веществ при низких, температурах
Таблица 4.28. Упругость пара 3Нэ по шкале 1962 г. 1 гПа =9,7521 мм рт. ст. (20 °C и 981,56 см/са) [266]
Т, К 0,00 0,01 0,02 0,03 0,04 0,05 0,06 0,07 0,08 0,09
дПа
0,20 0,016 0,032 0,061 0,112 0,192 30,319 0,509 0,789 1,188 1,744
0,30 2,592 3,514 4,844 6,561 8,747 11,491 14,896 19,070 24,138 30,228
0,40 37,477 46,049 56,102 67,808 81,340 96,898 114,684 134,882 157,733 183,464
0,50 212,249 244,379 280,110 319,706 363,302 411,298 463,827 521,422 583,950 652,078
0,60 725,805 805,665 891,791 984,450 1083,90 1190,56 1304,82 1426,67 1556,66 1695,05
0,70 1841,17 1997,16 2162,48] 2337,13 2522,45 2717,10 2922,41 3139,73 3366,38 3605,02
0,80 3855,67 4118,31 4392,96 4680,93 4980,91 5294,21 5620,85 5962,16 6318,13 6687,43
0,90 7071,39] 7470,03 7884,66 8315,29 8761,92 9223,21 9701,84 10197,8 10711,0 11240,3
г Па
1,00 11,788 12,355 12,938 13,540 14,161 14,801 15,461 16,140 16,840 17,559
1,10 18,298 19,058 19,840 20,640 21,468 22,314 23,182 24,073 24,986 25,922
1,20 26,882 27,864 28,871 29,901 30,957 32,036 33,140 34,269 35,425 36,605
1,30 37,810 39,043 40,302 41,587 42,899 44,238 45,604 46,999 48,421 49,872
1,40 51,350 52,857 54,394 55,959 57,554 59,179 60,833 62,519 64,233 65,980
1,50 67,757 69,565 71,405 73,275 75,179 77,113 79,081 81,082 83,116 85,182
1,60 87,282 89,416 91,584 93,785 96,021 98,293 100,598 102,939 105,315 107,727
1,70 110,175 112,658 115,178 117,735 120,328 122,960 125,628 128,333 131,076 133,858
1,80 136,676 139,535 142,432 145,368 148,342 151,356 154,411 157,504 160,638 163,813
1,90 167,028 170,284 173,581 176,920 180,299 183,722 187,185 190,692 194,239 197,831
2,00 201,466 205,143 208,864 212,629 216,438 220,291 224,188 228,130 232,116 236,148
2'10 240,225 244,347 248,516 252,730 256,992 261,298 265,652 270,053 274,502 278,998
2,20 283,540 288,132 292,771 297,459 302,194 306,981 311,815 316,698 321,631 326,615
2,30 331,648 336,731 341,864 347,049 352,285 357,572 362,910 368,301 373,743 379,237
2,40 384,785 390,384 396,037 405,743 437,503 413,316 419,183 425,104 431,079 437,111
2,50 343,196 449,336 455,533 461,785 468,094 474,458 480,879 487,357 493,891 500,484
2,60 597,134 513,842 523,608 527,432 534,316 541,258 548,260 555,321 562,443 569,624
2,70 576,866 584,169 591,532 598,957 606,444 613,993 621,603 629,277 637,014 644,813
2^0 652,677 660,604 668,594 676,651 684,771 692,957 701,2 8 709,525 717,908 726.358
2,90 734,875 743,459 752,111 760,831 769,620 778,476 787,402 796,398 805,464 814,600
3,00 823,806 833,084 842,434 851,854 861,348 873,914 880,555 890,267 900,054 909,917
3,10 919,854 929,866 939,955 950,119 960,361 970,680 981,078 991,553 1002,10 1012,74
3,20 1023,45 1034,25 1045,12 10.56,08 1067,12 1078,24 1089,44 1100,73 1112,10 1123,56
3,30 1135,11 1146,74 1158,45 1170,26 — — — — —
Вязкость. Давление насыщенных паров
112
Физические свойства веществ при низких температурах
20 *С и 581,56 см/с2) [267]
Таблица 4.30. Давление насыщенных паров диоксида углерода [259]
ьо СО Т, °C 0 1 2 3 4 5 6 7 8 9
Над твердой фазой, дПа
— 180 0,017 0,011 0,008 0,005 0,004 0,002 0,031 0,001 0,001 0,000
— 170 0,493 0,360 0,267 0,187 0,133 0,099 0,069 0,049 0,035 0,024
— 160 7,866 6,133 4,800 3,600 2,800 2,106 1,587 1,200 0,893 0,667
— 150 80,660 65,061 52,262 41,863 33,464 26,531 21,065 16,532 13,066 10,132
— 140 574,61 478,62 397,30 329,30 271,97 223,98 183,98 150,65 122,65 99,992
На'д твердой фазой, гПа
— 130 3,080 2,626 2,240 1,907 1,627 1,373 1,160 0,973 0,813 0,680
— 120 13,079 11,426 9,946 8,653 7,506 6,506 5,626 4,853 4,173 3,586
— НО 46,169 41,010 36,357 32,184 28,451 25,105 22,105 19,438 17,065 14,959
— 100 139,73 125,85 113,20 101,68 91,232 81,726 73,114 65,314 58,275 51,916
—90 372,63 339,57 309,04 281,04 255,17 231,44 209,71 189,85 171,58 154,92
—80 896,19 824,33 750,53 695,54 637,94 584,75 535,42 489,82 447,56 408,63
—70 1981,3 1836,2 1700,6 1573,8 1455,4 1345,0 1242,1 1146,1 1056,8 973,65
—60 4397,1 3819,8 3559,3 3314,7 3.85,3 2870,1 2668,4 2479,3 2302,3 2136,4
—50 5040,7 4706,5 4392,4
Вязкость. Давление насыщенных паров
Над жидкостью, г Па
—50 —40 6836,4 10059,0 6563,0 9693,8 6298,0 9339,2 6040,9 8993,9 5791,9 8657,9 5559,4 8332,6 5316,7 8015,3 5090,5 7707,3 4871,4 7408,7 4659,6 7118,0
—30 14289,0 13816,0 13354,0 12904,0 12465,0 12037,0 11620,0 11215,0 10819,0 10433,0
—20 19706,0 19106,0 18519,0 17950,0 17385,0 16838,0 16303,0 15782,0 15272,0 14774,0
— 10 26493,0 25747,0 25016,0 24301,0 23602,0 22916,0 22246,0 21590,0 20947,0 20319,0
0 34853,0 33939,0 33345,0 32166,0 31306,0 30462,0 29636,0 28826,0 28032,0 27255,0
0 34853,0 35783,0 36732,0 37699,0 38686,0 26359,0 40715,0 41760,0 42824,0 43908,0
10 45013,0 46138,0 47285,0 48563,0 49643,0 5 857,0 52092,0 53351,0 54635,0 55941,0
20 57273,0 58631,0 60013,0 61424,0 62861,0 64327,0 65821,0 67346,0 68900,0 70488,0
30 72108,0 73763,0
114
Физические свойства веществ при низких температурах
Продолжение табл. 4.31
Таблица 4.31. Расчётные значения
давления насыщенных паров некоторых
углеводородов
У глеводород Давление, гПа
90 К 100 к
Метан 101,2 319
Этан 9,2-Ю-з 9,5.10-2
Пропан 1,46 • 10—5 3,0-10-4
Бутан 3,3-10-8 2,7-10-’
Углеводород
Пентан
Этилен
Пропилен
Бутилен
Пентен
Диацетилен
Бутин-1
Давление, гПа
90 К | 100 К
10,5-10—13
3,47-10-2
2,9 • 10-6
3,6- IO-8
4,7-10-11
3,0 - ю—11
4,5-10-11
2,5 -10—10
4,1-10—1
5,6-10—4
1,5-10—6
6,4-10-в
3,3-10-в
5,6-10-8
Таблица 4.32. Упругость паров воды [259]
Над льдом, гПа
—90 0,000093 0,000064 0,000044 0,000029 0,000020
—80 0,000533 0,000387 0,000267 0,000187 0,000133
—70 0,002586 0,001907 0,001400 0,001027 0,000747
—60 0,010772 0,008186 0,006186 0,004653 0,003480
—50 0,039397 0,030664 0,023731 0,018398 0,014132
—40 0,128789 0,102391 0,081193 0,064128 0,050396
—30 0,381168 0,309040 0,249712 0,200916 0,161186
—20 1,034579 0,853261 0,701274 0,573285 0,467960
—10 2,599779 2,176815 1,814512 1,509205 1,251894
0 6,104815 5,172894 4,372962 3,686353 3,101070
Над жидкостью, гПа
0 6,104815 7,058066 8,133974 9,349871 10,72577
10 12,27762 14,02280 15,98130 18,17712 20,63424
20 23,37801 26,43375 29,83346 33,60914 37,79545
30 42,42839 47,54663 53,19281 59,41228 66,25036
40 73,75906 81,99302 91,00558 100,8580 111,6038
50 123,3361 136,1084 150,0005 165,0526 181,4245
Таблица 4.33. Константы уравнения
упругости паров над льдом для воды
различного изотопного состава
(273—233 К)*
Р^О/РХ=А/Л+В/Т+С [277]
X А В С
D2Ow 21577,6 69,3358 —0,305394
T2Oie 33453,7 62,4058 —0,395542
HDO16 11484,5 35,3315 —0,159290
НТО16 18464,5 31,0436 —0,207520
DTO18 27722,4 66,5930 —0,351698
т2оч 933,651 1,0953 —0,002805
1740,59 2,2965 —0,005793
оаоч 22420,6 70,3787 —0.308791
Продолжение табл. 4.33
X А В С
Т2О1’ 34316,8 62,7057 —0,397903
HDO1’ 12362,4 36,5554 —0,162766
НТО4’ 19352,5 31,9501 —0,210616
DTO1’ 28574,4 67,2863 —0,354632
D2O18 23206,1 71,0812 —0,311421
Т2О18 35062,5 63,1985 —0,400488
НПО18 13218,3 37,0780 —0,164751
НТО18 20154,1 37,7122 —0,213328
DTO18 29345,9 67,8547 —0,357205
* Упругость паров над водой различного изо-
топного состава в нтервале 273—400 К дана в
Вязкость. Давление насыщенных паров
115
Таблица 4.34. Уравнения зависимости давления р насыщенных паров от температуры Т.
Давление во всех случаях — в гПа; уравнения, отмеченные звездочкой, имеют погрешность
1—2%; зависимость прямолинейна в координатах lg р, 1/Т
Вещество Давление иад кристаллом Давление над жидкостью Литература
Азот , — 359,36 IgA- т +7,79048 1g/= 7,17531 — 325,52* —у— (50 — 126 К) 1g р = 7,906745 - 0,00626497 — — 341,619/7(63— 78 К) 1g/= 10,22575 — 3,93019—1 — — 4,3409 1 9 +2.3938792 — — 0,451939s (63 — 126 К), где 9 =7/100 [21, 255 , 259}
Аргон 1g/ = 7,7808 —272 Т 1g/ = 7,256853 — 380,168* - т (50— 150 К) 1g/= 8,32851 —3,977389-1— — 1,06766 9 + 0,14876 92 + + 0,07866 93 (83— 150 К) [21, 29 , 295]
Ацетилен П27 1 1g у? = 8,96491 — —у— 1g/= 8,20974— 1019,71 (130 — ЗЮК) [255, 259]
Водород нормальный 75°/о о-Н2 (см. также табл. 4.35) 1g/ = 4,68978 — 47,2059 - + 0,03939 7 1g/= 4,79177 — 44 9569 _ ’ + 0,0205377 (14 - 33 К) 55,25642 1g/= 6,074 31- - — 3,1282-10~27 + + 6,6989- 10-172 (10 — 33 К) [38, 261, 276]
Водород равновесный при 20,4 К 0,21o/o о-Н2 (паров одо- РОД) lg р = 4,74228 — 47,0172 -—~— +0,03635 7 1g/ = 5,706733 — 54,561* —у-(ю-зок) 44,2674 1g / = 4,760284 - —у + + 0,021669 7 — 0,000021 72 (14-33 К) [26 , 38, 261]
Водородо- дейтерий 1g/ = 5,17454 — 55,2495 (-0,01479 7 7 1g/= 5,81323 — 61,661* - т (13 —22 К) 1g/= 4,8275— 56,7154 -—f— + 0,04101 7(17— 35 К) [38, 261]
1116
Физические свойства веществ при низких температурах
Продолж. табл. 4.34
Вещество Давление над кристаллом Давление над жидкостью Литература
Воздух — Кривая конденсации: 1g р == 9,18794 — 3,94049 9"1 — — 2,59029 6 + 1,30894 92 — — 0,21794 Q3 Кривая кипения: 1g р = 10,42564 — 3,929059““1 — — 5,291589 + 3,4277692 — — 0,81182 9s (60-4- 132 К), где 9 =7/100 [21, 255]
Гелий (3Не) — 1g р = 4,92876 — 2,49174/7 — — 0,286001 7 + 0,198608 72— — 0,0502237 7s + 0,00505486 74 + + 2,24846 In 7 (0,2-4-3,32 К) [266]
Гелий /4Не) — Точные зависимости — см. в [267] и в табл. 4.29 —
Диоксид углерода — 1275,6 ид- т + + 0,006837 + + 8,4319 (904-140 К) 1g р = 58,4859 — 2206,455 -21,431 1g 7 + + 0,02527 7 (1704- 200 К) „„ 1353,202 1g р = 27,6250 — £ — 8,142537 1g 7 + + 6,259156-10-s7 (217-4- 280 К) lg р = 9,06631 — 1210,27* (140 4- 300 К) [36, 259]
Дейтерий нормальный ’66,7o/o o-D2 lgp = 5,2875 — 68,0782 ' - т +0,3117 1g р = 4,8561 — 58,4619 + 0,02671 7 7 1g р = 3,70469 - 74,2894/7 — — 0,0293457 + 0,00047507 72 (14 4- 30 К) [38, 361, 270]
Дейтерий равновесный '97,8»/. o-D2 1g /7 = 5,2874 — 67,9119 —— + 0,03102 7 lg р = 4,8258 — 56,7247 —у— + 0,02478 7 (18 4- 30 К) [38, 261]
Вязкость. Давление насыщенных паров
117
Продолж. табл. 4.34
Вещество Давление над кристаллом Давление над жидкостью Литература
Кислород — 1g/> = 7,1648— -—у 53* (53 = 150 К) 1g р = 8,5596 — 4,26168 0-1 + + 0,072069 + 0,08232 92 + + 0,09777 93 (50=154 К), где 6 = 77100 [21, 259]
Криптон 576,6 1 gp = 7,8696 — —^— 1g р = 7,416249 — 537,5* - т (75 = 200 К) 1g р = 23,41183 — 723,68513 + 0,0109024 Т — — 7,5393341g? (115 = 209 К) [29, 259, 273]
Ксенон 851,35 IgP — 9,6695— - — 0,6702 1g Г (70 = 160 К) 1g/? = 8,0194 — 828,18* - т (160 = 167 К) 1000,125 1g р = 24,17109 — + 0,0076613 Т —7,38181 1g Т (160 = 290 К) [29, 259]
Метан 1g /7 = 6,9087 — 477,46 , +0,00469 7 , , 595,546 1g Р= Ю,8112- — 0,0348066 Т + 1,3338 • 10-«?2 — — 1,7869-10—’Т7» (100 -= 190 К) 1g/7 = 7,152629-^2* [255, 259]
Неон 1g р = 35,5754 — 210,9546 -21,393 1g 7|+ + 0,21962 7’ (16 — 24 К) , 106,09 1g р = 7,586063 — — — 0,0356616 Т + 0,000411092 Т2 (24 — 44 К) 1g р = 6,921677 — 106,999* - т (15 = 44 К) [29, 259]
118
Физические свойства веществ при низких температурах
Продолж. табл. 4.34
Вещество Давление над кристаллом Давление над жидкостью Литература
Озон 1g /> = 8,37803 — 814,941587 Л „ „ „ ~ ’ — 0,001966943 Т Т [20]
Оксид углерода 1g р = 8,94749 — 425,1 -—0,007596 7 Т (61 — 68 К) 1g р = 27,45998 - ^^6-81-_ — 10,217 lg Т + 0,0217569 Т (68-?- 132 К) [255]
Тритий нормальный 75% о-Т5 „ „ 88,002* 1g р = 6,6022- -у— 1g р = 6,1583 — 78,925/7 + + 2-10_4 (7 — 25)2 (25 —40K)J 80,98* lg/> = 6,2577— —— (25-?- 40 К) [20, 270]
Фтор — 442,72 lg р = 9,3224 — 0,013157 (50-4-90 К) [252]
Этан — 780,24 1g 7 = 7,2620--^—- — 0,000103 7 — 9,З-Ю"10 (7 — 238)* (135-4- 196 К) „ , 1019,48* 1g р = 8,20974 — [255, 259]
Этилен — , — 1243,766 1g 7 = — 11,213927 1g 7 + 0,01102331 7 + + 33,47644(145-4-280 К) 754,63* lg /> = 7,4232 — — [255, 259]
Вязкость
119
Таблица 4.35. Зависимость температуры плавления от давления для некоторых
замороженных криоагентов
Азот [24] Аргон [29] Водород [26, 261,278] Гелий (’Не) [279] Гелий (‘Не) [279, 25]
т, к Р, МПа Т, К р, МПа Т, К р, МПа Т. К р, МПа Т, К р, МПа
65 8,6 83,78 0,069 14 0,167 0,1 3,04 о,з 2,532
70 32,6 85 4,88 15 3,26 0,75 3,48 0,5 2,532
80 84,0 90 25,5 16 6,6 1,0 3,87 0,7 2,531
90 142,2 95 46,8 18 13,95 1,375 5,39 1,0 2,535
100 205,0 100 68,8 20 22,3 1,659 6,49 1,3 2,572
Но 272,9 105 91,5 22 31,2 2,0 8,00 1,5 2,656
120 345,8 112,5 125,0 24 40,6 2,427 10,13 1,7 2,869
130 423,6 144 300,0 25 45,5 2,943 13,01 2,0 3,769
140 150 160 165 506,1 593,3 685,2 732,9 231,5 800,9 30 40 50 60 70 80 73 139,5 221,6 318,6 430,4 556,4 3,49 4,205 14,69 18,518 24,158 30,184 16,22 20,73 122,5 172,9 257,7 360,2 2,63 3,59 4,23 12,2 15,5 20,2 25,6 29,6 38,4 6,363 11,02 14,24 81,06 118,55 178,33 258,4 320,2 481,3
П родолжение табл. 4.35
Кислород [788] Неон [29, 278, 280] Криптон [29,280,281] Ксенон [29, 280, 281] Метан [281,27]
т, к р, МПа Т, К р, МПа Т, К р, МПа Т, К р, МПа т, к р, МПа
54,5 1,42 24,55 0,043 115,76 0,073 161,36 0,081 110,5 98,3
55,0 5,57 25 3,045 117 4,25 162 1,699 117,6 113,1
55,5 9,83 26 9,838 120 14,35 165 9,328 122,7 154
56,0 14,21 28 23,93 125 31,55 170 22,42 124,9 163
56,5 18,71 30 38,67 130 49,17 175 35,78 129,5 185
35 78,28 135 67,22 180 49,37 134,1 209
40 120,6 150,7 129,2 185 63,18 140,8 244
45 168,7 159,3 163,3 190 77,22 146,4 273
50 220,7 170,6 208,7 195 91,47
55 275,6 185,5 272,8 215,6 154,0
60 331,5 200 336,4 225,7 185,5
65 402,1 250 585,7 252,8 272,8
300 846,1 300 435,7
350 1114,6 350 615,0
Таблица 4.36. Константы уравнения
зависимости температуры плавления
от давления рпл=а+&7'с [278]
Ве- ще- ство а ь С Интервал давления, 10s Па
3Не 25,16 20,08201 1,517083 76—3500
4Не —17,80 16,31457 1,555414 37—3500
н2 —279,63 2,74963 1,744070 0—3700
D' —438,15 2,312026 1,787213 0—3600
т2 —540,39 2,581294 1,764179 0—3100
Ne — 1057,99 6,289415 1,599916 0—3500
N -1638,30 0,97678 1,791 0—3600
О —2786,83 2,635754 1,742594 0—3600
Вязкость газов и газовых смесей. Зна-
чения коэффициентов вязкости зависят от
рода газа, температуры н давления.
Зависимость вязкости газов от темпе-
ратуры приближенно описывается форму-
лой Сезерленда
273 +С IT \3/2
= >?+С '273/ ( '
Значения константы С и т]о для раз-
личных газов см. в табл. 4.109.
С достаточной для технических расче-
тов точностью вязкость при атмосферном
давлении для ряда газов приведена
в табл. 4.37 и 4.38, а также на рис. 4.6
и 4.7.
120
Физические свойства веществ при низких температурах
Рис. 4.6. Вязкость некоторых веществ и
изотопов в газообразном состоянии
Рис. 4.7. Вязкость гелия, водорода, дейте-
рия и неона при Т<60 К 'рД г
Динамическая вязкость газообразного
гелия, 10-7 Па-с, в интервале температур
от 4 до 1100 К с погрешностью до 1 %
может быть вычислена по формуле Кеезо-
ма [53]
т^б.ОгЗТ'0-®47. (4.7)
Вязкость реальных газов, как отмечено
выше, зависит от давления, причем особен-
но заметно в области высоких давлений и,
напротив, больших разрежений. С повыше-
нием давления вязкость увеличивается тем
значительнее, чем больше степень отклоне-
ния реального газа от идеального и чем
ниже температура. Однако при небольшом
избыточном давлении и разрежениях при-
мерно до 130—260 Па вязкость меняется
мало и ее можно считать практически не
зависящей от давления.
В табл. 4.39 и 4.40 приведены данные
о вязкости гелия, водорода, азота, аргона,
воздуха и кислорода при повышенных дав-
лениях и низких температурах.
Вязкость газовой смеси v0M может
быть приближенно оценена по формуле
Манна
1 пи т„ т.„
----= ~—, (4.8)
*1 v2 vn
где vi, v2 и т. д. — кинематические вязко-
сти компонентов; m2 и т. д. — моляр-
ные доли компонентов смеси.
Из экспериментальных данных следует,
что правило аддитивности при приближен-
ном вычислении вязкости смесей газов мо-
жет применяться только для тех из них,
у которых физические свойства компонен-
тов мало отличаются, например кислород —
азот, пропан — пропилен и т. д.
Для вычисления вязкости смеси газов
может быть также рекомендована следую-
щая эмпирическая формула, предложенная
Гернингом и Ципперером и проверенная на
ряде газовых смесей (коксовый газ, све-
тильный, генераторный и др.) при атмо-
сферном давлении [409]:
/г1 Vm-jT^ Vi п2 ш27'к2'р2
14.9)
Здесь г]см — вязкость смеси при данной
температуре; п\, п2 и т. д. — объемные до-
ли компонентов; гр, г]2 и т. д. — вязкости
компонентов при данной температуре; mi,
т2 и т. д. — молекулярные массы компо-
нентов; Гк1, Тк2 и т. д. — критические тем-
пературы компонентов, К.
В табл. 4.41 приведены значения
У~т1\ для Различных газов.
Изменение вязкости газовых смесей
с температурой и давлением качественно
такое же, как и для однородных газов, т. е.
вязкость газовой смеси увеличивается с по-
вышением давления, причем тем значитель-
нее, чем ниже температура.
В табл. 4.42 даны коэффициенты вяз-
кости для смесей изотопов водорода и
инертных газов при низких температурах и
атмосферном давлении. Вязкость смесей
Не — N2 см. в [410].
Данные о вязкости газов и газовых
смесей различного состава приведены
в [21, 29, 152, 575].
Вязкость жидких криоагентов. Вязкость
жидких криоагентов уменьшается с увели-
чением температуры, причем характер изме-
нения такой же, как и для обычных жид-
Вязкость
121
Таблица 4.37. Вязкость газов при атмосферном давлении (усредненные значения)
Я -Ю’, Па с
т, к Водород [403] Неон 129] Азот [21, 805] Кислород [21, 403] Аргон [29] Воздух [43] Фтор [805]
10 5,1
20 10,9 — ——
30 16,1 50,7 — —
40 20,7 66,3
50 24,9 79,8 ___
60 28,8 83,7 —
70 32,4 107,0
80 35,8 119,8 55,2 —
90 39,0 131,9 63,0 75,8 7,7
100 42,1 143,4 69,8 77.2 83,8 69 8,5
ПО 45,0 154,2 73,6 85,0 91,7 76 9,3
120 47,9 164,5 82,6 92,3 99,6 85 10,4
130 49,6 174,5 88,7 100,0 107,5 91 11,0
140 53,4 184,5 94,8 107,3 115,1 97 И,8
150 55,9 194,4 - 100,8 114,4 222,7 103 12,5
160 58,5 203,9 106,8 121,4 130,3 109 13,7
170 61,0 213,2 112,5 128,2 137,8 114 14,3
180 63,4 222,3 118,3 134,9 145,2 120 15,3
190 65,7 231,1 123,9 141,4 152,5 126 16,0
200 68,1 239,7 129,6 147,8 159,8 132 16,8
220 72,7 256,4 140,3 160,0 174,0 142 18,4
240 77,1 272,5 150,5 172,0 187,9 153 20,0
260 81,3 288,0 160,3 183,5 201,4 163 21,5
280 85,5 . 302,9 169,6 194,5 214,6 Л 73 22,8
300 89,6 317,5 178,6 206,5 227,5 182 24,1
Таблица 4.38. Вязкость гелия-4 (4Не), тр107, Па-с [250]
т, к р, МПа
0,010 0,101 | 0,304 | 0,507 j 0,709 | 0,912
3,0 7,8 38,6 42,9 46.9 50,8 54,7 .
3,5 9,1 36,4 40,7 44,6 48,3 51,9
4,0 10,3 33,4 38,0 41,9 45,4 48,7
4,2 10,8 31,9 36,8 40,7 44,2 47,5
4,6 11,7 13,1 34,2 38,3 41,8 45,0
5,0 12,6 13,9 31,0 35,8 39,4 42,5
5,5 13,7 14,9 25,2 32,7 36,6 39,9
6,0 14,7 15,8 20,0 29,5 34,2 37,6
7,0 16,7 17,6 20,3 24,6 29,7 33,6
8,0 18,5 19,4 21,5 24,3 27,5 30,8
9,0 20,2 21,0 22,9 25,0 27,3 29,7
10,0 21,9 22,6 24,2 26,0 27,9 29,9
12,0 25,0 25,6 26,9 28.3 29,7 31 2
15,0 29,2 29,7 30,8 31,8 32,9 34*0
20,0 35,5 35,8 36,6 37,4 38,2 39,0
30,0 46,1 46,3 46,9 47,5 48,0 48 6
40,0 55,2 55,4 55,9 56,3 56,8 57'2
50,0 63,4 63,6 64,0 64,4 64,8
60,0 71,0 71,2 71,5 71,9 72,2 72 5
80,0 84,9 85,0 85,3 85,6 85,9 86 2
100,0 97,7 97,8 98,0 98,3 98,6 98'8
120,0 109,7 109,8 110,0 110,2 110,5 По’7
140,0 121,2 121,3 121,5 121,7 121,9 122Л
160,0 132,2 132,3 132,5 132,7 132,9 133 1
.180,0 143,0 143,1 143,3 143,5 143,6 143,8
122
Физические свойства веществ при низких температурах
Продолжение табл. 4.
г, к р, МПа
С.010 0,101 0,304 0,507 0,709 0,912
200,0 153,6 153,7 153,8 154,0 154,1 154,3
220,0 164,0 164,0 164,2 164,3 164,4 164,6
240,0 174,2 174,2 174,4 174,5 174,6 174,7
260,0 184,3 184,3 184,4 184,5 184,6 184,7
280,0 194,3 194,3 194,4 194,5 194,6 194,7
300,0 204,2 204,3 204,3 204,4 204,5 204,5
Таблица 4.39. Вязкость водорода и гелия при позыпэнныс давлениях
q-lO®, ла-с [152]
Т, К Вещество Р
2,5 5,0 7,5 10 15 20 25
20 н2 1596 1962 2455 3119
Не 395 455 560 667 792 1000 1144
30 н2 950. 1033 1098 1180 1337 1529 1755
Не 477 524 586 672 798 950 Ь.,92
40 н2 355 518 650 764 949 1110 1277
Не 559 596 633 693 812 824 1.55
50 н2 290 405 511 612 767 906 1037
Не 637 664 692 734 836 923
60 н2 311 374 452 528 655 770 892
Не 710 736 760 793 871 940 1037
70 н2 346 384 438 497 611 766 800
Не 785 805 825 854 913 971 1053
80 н2 375 406 447 491 585 670 752
Не 855 871 890 913 959 1009 1079
90 Н, 404 427 459 492 568 646 715
Не 923 934 951 969 1012 1055 1113-
100 Н2 434 452 477 5С6 569 636 698
Не 987 997 1011 1026 1061 Изо 1150
120 н2 490 504 521 542 587 636 688
Не 1103 1116 1127 1137 1163 1193 1231
140 н2 542 552 566 581 618 656 701
Не 1223 1229 1237 1244 1262 1286 1314
160 н2 591 600 611 624 653 686 722
Не 1333 1337 1343 1349 1359 1379 1401
180 н2 639 648 656 667 692 718 746
Не 1437 1439 1443 1447 1456 1470 1488
200 н2 686 693 701 710 729 752 774
Не 1537 1538 1540 1541 1551 1559 1573
220 Н2 731- 736 743 751 767 788 808
Не 1629 1636 1630 1631 1639 1648 1661
240 н2 774 778 784 791 807 824 842
Не 1716 1718 1720 1723 1729 1736 1747
260 н2 817 821 826 832 846 861 878
Не 1805 1806 1808 1810 1815 1822 1833
280 н2 858 862 866 872 884 897 912
Не 1892 1894 1896 1897 1904 1908 1921
300 н2 895 898 902 908 920 932 948
Не • 1978 1979 1981 1982 1987 1993 2004
Вязкость
123
Таблица 4.40. Вязкость жидких и газообразных азота, аргона, воздуха и кислорода
т| • 10е, Па с, при различнык давлениях [21]
р, МПа
Т, К
0,1 1.0 5,0 10 15 20 25
Азот
65 70 263,3 211,3 267,7 215,4 287,6 233,6 256,8 280,8 304,7 328,8
80 5,52 136,6 150,1 168,2 187,2 207,1 227,9
90 6,20 93,3 101,8 113,6 126,7 141,2 158,6
100 6,88 71,3 77,7 85,4 93,7 103,0 113,5
120 8,21 8,7 46,1 56,1 63,8 70,6 76,5
140 9,45 9,8 15,5 34,9 44,4 51,5 57,6
150 10,1 . 10,4 13,6 А1 26,9 ) Г О н 36,9 44,2 50,3
85 279,8 284,0 — — — — —
90 7,45 238,8 254,8 275,9 298,3 321,9 346,9
100 8,30 177,7 190,0 205,7 221,8 238,7 256,6
120 9,94 10,57 112,7 126,2 138,8 150,9 162,6
140 11,53 12,02 67,6 79,0 88,8 99,0 109,3
160 13,07 13,48 18,1 50,7 63,4 72,0 79,2
180 14,54 14,89 17,6 Во 28,7 з дух 44,1 54,5 62,0
75 226,6 231,0 251,1 277,6 305,3 334,6 —
80 — 181,6 198,5 220,7 244,4 269,7 296,0
90 6,41 117,7 129,0 144,0 160,4 178,3 197,3
100 7,П 83,78 91,6 101,9 113,1 125,3 138,7
120 8,45 8,98 53,9 63,1 70,9 78,2 85,5
140 9,72 10,0 19,1 40,4 49,0 56,1 62,5
160 10,94 П,2 13,9 Кис 24,8 л о р'о д 34,9 42 47,5
75 303,8 308,1 322,9 353,2 380,0 407,7 436,8
80 253,6 256,9 272,1 292,1 312,7 334,5 357,4
90 188,2 190,3 199,8 212,1 225,1 238,6 252,9
100 7,6 157,7 157,8 166,6 175,5 184,6 194,2
120 9,3 9,84 104,0 112,3 120,1 127,3 134,1
140 10,8 11,2 67,1 76,9 84,4 91,0 97,3
160 12,2 12,5 16,5 49,0 59,9 67,8 74,4
180 13,5 13,8 16,0 26,1 40,2 49,8 57,0
124
Физические свойства веществ при низких температурах
Рис. 4.8. Вязкость некоторых жидких крио-
агентов [203, 805]
костей. Исключением из общего правила
можно считать вязкость жидкого гелия при
температуре ниже 2,2 К, которая вследст-
вие появления эффекта сверхтекучести
изменяется иначе.
Температурная зависимость вязкости
жидких криоагентов может быть отражена
уравнением вида
а=Аес/т, (4.10)
где А и С — константы.
Небольшие изменения давления на вяз-
кость жидких криоагентов влияют незна-
чительно.
В табл. 4.43 и на рис. 4.8—4.10 приве-
дены значения вязкостей криоагентов
Таблица 4.41. Значения комплекса
VmTK для различных газов [длявычисления
вязкости газовых смесей по формуле (4.9)]
Газ m УтТк
Азот N2 26 126 59,5
Ацетилен С2Н2 26 309 85
Водяной пар Н2О 18 647 108
Водород Н2 2 33 8,13
Воздух 29 132,7 61,9
Диоксид углерода СО2 44 304 115,5
Кислород О2 32 154 70,2
Метан СН4 16 190 55,1
н-Бутан С4Н10 58 426 157
н-Пентан С5Н12 72 470 184
Оксид углерода СО 28 134 61,4
Пропан С3Н3 44 370 128
Этан С2Нв 30 305 95,6
Этилен С2Н4 28 283 89,0
Рис. 4.9. Вязкость жидких углеводородов
[575] (для пропана и пропилена т]-103)
в жидком состоянии в зависимости от тем-
пературы с точностью, достаточной для тех-
нических расчетов.
Вязкость сосуществующих жидких и
газообразных фаз гелия-4, водорода и па-
роводорода приведены в табл. 4.44 и 4.45.
Жидкий озон при 90 К имеет вязкость
1,56-НМ Па-с, при 77,5 К — 4,14Х
ХЮ-3 Па-с [417].
Жидкий ксенон при 165 К имеет вяз-
кость 5-Ю-4 Па-с [4Г7].
Подробные данные о вязкости жидких
азота, аргона, кислорода и некоторых дру-
гих жидких криоагентов см. в [21, 156],
жидкого гелия — в [25].
Рис. 4.10. Зависимость вязкости жидких
азота, аргона и кислорода от давления
[407,. 408]
Теплопроводность
125
Таблица 4.42. Вязкость смесей изотопов водорода, Не—Ne, Аг—Ne, Н2—N2
(усредненные значения, 107 Па-с) [413]
Смесь T, к Концентрация второго компонента, %
0 25 50 75 100
293,1 88,3 93,1 97,9 102,4 106,9
229,0 74,5 78,9 83,2 87,2 91,0
196,0 67,0 70,8 74,6 78,2 81,6
Н2—HD 90,1 39,3 41,4 43,6 45,6 47,5
71,5 32,6 34,5 36,2 37,9 39,5
20,4 Н,1 11,5 11,8 12,1 12,4
14,4 7,9 8,1 8,4 8,6 8,8
293,1 88,6 98,4 107,8 115,5 123,0
229,0 75,7 83,8 91,4 98,2 104,3
196,0 67,6 75,0 81,8 87,9 93,6
h2—d2 90,1 38,6 42,8 46,7 50,1 53,3
71,5 32,5 35,8 38,9 41,7 44,4
20,4 10,9 11,7 12,4 13,1 13,7
14,4 8,0 8,5 9,0 9,5 10,0
293,1 107,5 111,7 115,9 119,9 124,0
229,0 91,0 94,6 98,1 101,5 104,8
196,0 82,2 85,2 88,3 91,2 94,0
HD—D2 90,1 47,4 49,0 50,8 52,4 54,0
71,5 39,3 40,6 42,0 43,4 44,7
20,4 12,7 13,1 13,4 13,8 14,1
14,4 9,1 9,4 9,7 9,9 10,0
293,1 196,1 246,0 277,3 297,1 309,7
194,0 149,3 188,7 212,2 226,8 236,0
Не—Ne 90,2 91,2 113,5 125,4 131,8 135,0
65,8 74,5 91,1 99,3 103,2 104,5
20,4 35,0 36,7 36,9 36,1 35,1
191,1 222 239 263 288 312
229,0 181 198 219 242 267
Ar—Ne 193,4 153 169 187 209 235
90,3 77 88 102 117 135
72,3 64 73 85 100 118
291,1 [87,7 138 160 170 175
h2-n2 90,2 82,2 39,2 [36,2 •57 49 62 52 64 54 65,1 54,4
Вязкость смесей жидких криоагентов
может быть приближенно найдена по фор-
муле, предложенной в [412],
lgilcM=milgTli+'«2 1g1lH-•••> (4-П)
где ffl и т| — соответственно молярные доли
и абсолютные вязкости компонентов смеси.
Вязкость суспензии рассчитывается по
формуле Бачинского
т]=т]»(1-|-4,5ф),
(4.12)
где ц* — вязкость чистой жидкости; <р —
объемная доля твердой фазы.
Вязкость смеси жидких кислорода и.
азота приведена на рис. 4.11.
Данные о вязкости других смесей жид-
ких криоагентов см. в [151, 152, 575].
4.6. ТЕПЛОПРОВОДНОСТЬ
Теплопроводностью жидкостей и газов,
называют процесс распространения теплоты
при непосредственном соприкосновении ча-
стиц, имеющих различную температуру,
т. е. процесс атомно-молекулярного харак-
тера, не связанный с макроскопическим
движением среды.
126
Физические свойства веществ при низких температурах
Таблица 4.43. Вязкость жидких гелия, водорода и неона (усредненные значения)
Гелий-3 [155] Гелий-4 [25, 155] Водород и дейтерий [4104, 405] Неон [406]
Т, К 1Q-106, Па-с т, к 7]-10б, Па- с т, к TQ-10fi, Па-с Т, К 7]- 105, Па-с
п-Н2 р-Н2 d2
0,35 4,8 0,80 15,8* 15 23,0 22,1 25,1 16,0
0,4 4,00 1,14 2,06* 16 20,4 19,7 — 26 14,0
0,5 3,40 1,25 1,81* 17 18,3 18,8 — 27 12,4
0,6 3,07 1,82 1,28* 18 16,6 16,0 — 28 11,5
0,7 2,82 2,17 2,4* 19 15,1 14,7 48,8 29 10,5
0,8 2,63 2,2 2,55 20 13,9 13,5 42,0 30 9,5
ОД 2,46 2,3 2,83 21 12,8 12,5 37,4 32 8,2
1,0 2,33 2,4 3,00 22 11,9 11,6 34,0 34 7,0
1,2 2,14 2,5 3,15 23 11,0 10,8 31,0 36 6,2
1,4 2,02 2,6 3,21 24 10,3 10,1 28,4 38 5,3
1,6 1,96 2,7 3,26 25 9,6 9,3 26,5 40 4.5
1,8 1,92 2,8 3,28 26 8,9 8,7 — 44,1 2,7
2,0 1,87 3,0 3,30
2,2 1,83 3,2 3,27
2,4 1,78 3,4 3,25
2,6 1,74 3,6 3,20
2,8 1,70 3,8 3,15
3,0 1,66 4,0 3,07
3,2 1,61 4,2 3,00
* Вязкость нормального компонента сверхтекучего
гелия.
По закону Фурье для одномерного теп-
лового потока
дТ
Q = \ — s, (4.13)
где X — теплопроводность; Т — температу-
ра; I — длина теплопровода; s — площадь
сечения теплопровода.
Теплопроводность Л, зависит от рода ве-
щества и его состояния. На основании мо-
лекулярно-кинетической теории X газа не
Рис. 4.11. Вязкость смесей жидких кисло-
рода и азота [575]
зависит от давления (см. § 2.3). В дей-
ствительности при значительном увеличении
давления теплопроводность газа увеличи-
вается. Зависимость теплопроводности газа
от температуры дается уравнением Сезер-
ленда
_ 273 + С / Т \ 3/2
r = ^° т+с [273J
(4.14)
Теплопроводность газов при Т=
= 273 К и константы С приведены в табл.
4.1»9.
Если для конкретных газов отсутствуют
экспериментальные данные по теплопровод-
ности, то X можно определить по зависи-
мости приведенной теплопроводности газов
от приведенных температуры и давле-
ния [363].
Теплопроводность газовых смесей мож-
но рассчитать по теплопроводности компо-
нентов в зависимости от полярности и мо-
лекулярной массы компонентов [368].
Для смесей водорода и гелия или во-
дорода и гелия с другими газами
-/'-см = + (1—а) . (4.15)
Значения коэффициента а приведены
на рис. 4.12; и,— молярная доля i-ro ком-
понента. Средняя ошибка по уравнению
(4.15) — около 4 %.
Для смесей компонентов, не сильно
отличающихся по молекулярной массе (за
Т еплопроводносп
127
Таблица 4.44. Вязкость и скорость
звука сосуществующих жидких
и газообразных фаз гелия-4;
поверхностное натяжение жидкого
гелия-4 [250]
т, к р-10®, Па Tj-107, Па- с <?, м/с Поверх* ностное натяжение, 10з н/м
2,177* 0,050 5.38 84,1
2,4 0,83 37,1 6,07 217,4 87,3 2,286
2,6 0,123 37,3 6,69 217,7 89,8 0,265
2,8 0,175 37,2 7,32 215,5 92,0 0,245
3,0 0,240 36,8 7,96 211,5 94,0 0,225
3,2 0,320 36,2 8,62 206,5 95,7 0,204
3,4 0,415 35,3 9,30 201,0 97,1 0,184
3,6 0,529 34,7 10,0 194,9 98,3 0,163
3,8 0,661 33,8 10,7 188,4 99,2 0,143
4,0 0,815 32,8 11,5 181,2 99,8 0,123
4,224* 1,013 31,7 12,5 172,0 100.2 0,100
4,4 1,190 30,7 13.3 163,8 100,1 0,082
4,6 1,416 29,5 14,3 153,1 99,7 0,061
4,8 1,670 28,2 15,5 140,7 98,9 0,041
5,0 1,954 26,4 17,0 126,0 97,8 0,021
5,1 2,109 25,1 18,1 117,3 97,6 0,010
Таблица 4.45. Рекомендуемые значения
вязкости водорода и параводорода
на линии насыщения ^106, Па-с [160]
Т> к Нормальный водород Параводород
Жидкость Пар Жидкость Пар
14 24,2 0,75 23,7 0,75
16 18,9 0,86 18,4 0,86
18 15,3 0,98 15,0 0,98
20 13,0 1,10 12,8 1,Ю
22 11,2 1,23 10,9 1,23
24 9,6 1,37 9,4 1,37
26 8,4 1,51 8,2 1,51
28 7,3 1,66 7,2 1,66
30 6,2 1,89 6,1 1,89
32 5,0 2,24 5,0 2,24
32,97 — — 3,32 3,32
33,22 3,25 3,25 — —
Молярная доля легкого
компонента
Рис. 4.12. Коэффициент а к уравнению
(4.15) по [368]
исключением водорода и гелия) и не по-
лярных,
Л.см==:2игХ^. (4.16)
Максимальная ошибка по уравнению (4.16)
составляет 8 %, средняя — 2 %.
Для смесей полярных и неполярных,
компонентов или компонентов, сильно отли-
чающихся дипольными моментами,
1-см — |1 3 5
’(4.17)
где Snp — сумма молярных долей поляр-
ных компонентов (или неполярных, что дает
тот же результат). Максимальная ошибка
по уравнению (4.17) составляет 5,1 %.
В [368] приведены экспериментальные
значения отклонения теплопроводности ряда
смесей от аддитивности в области темпе-
ратур окружающей среды (300 К).
Метод расчета теплопроводности би-
нарных смесей газов см. в [101, 367].
Теплопроводность жидких криоагентов,
Вт/(м-К), при отсутствии эксперименталь-
ных данных можно определить по формуле-
Вебера
/ \1 /з
7 = 6,24-1С^Ц—) , (4.18)
где р — плотность жидкости, кг/м3; ср —
удельная теплоемкость, Дж/(кг-К); М —
молекулярная масса жидкости.
Для жидкого азота и сходных с ним:
жидкостей рекомендуется вместо коэффи-
циента 6,24-104 брать 4,22-104, для жидких
легких углеводородов — 7,36 • 104 [633].
Имеются другие эмпирические формулы,
для определения X жидкостей [ЮЗ].
В твердых телах перенос теплоты осу-
ществляется решеточными волнами и элек-
тронами проводимости. У неметаллов теп-
лота переносится только решеточными вол-
нами. У чистых металлов основную роль-
в теплопроводности играют электроны про-
водимости. Теплопроводность в сплавах
осуществляется обоими процессами.
Полная теплопроводность металла опре-
деляется суммой теплопроводностей элек-
тронной и решеточной Х=Хе-|-Хх-
128
Физические свойства веществ при низких температурах
<Рис. 4.13. Теплопроводность газообразных
3Не и 4Не при пониженных давлениях:
1 — 4Не при давлениях от 1.3-10-2 до 2,6 гПа;
2— смесь 50% 3Не+50% *Не при давлении от
80-10-3 до 4 гПа; 3 — 3Не при давлении от
80-10-3 до 4 гПа [365]
Для очень чистых металлов решеточное тер-
мическое сопротивление пренебрежимо ма-
ло по сравнению с электронным. При тем-
пературах выше 273 К теплопроводность
можно определить, исходя из закона Виде-
мана— Франца рЛ,е/Г = const.
Теплопроводность металлов очень силь-
но зависит от их чистоты. Чем чище ме-
талл, тем выше его теплопроводность. Кро-
.ме того, теплопроводность зависит от тер-
мообработки. Отожженные образцы обла-
дают более высокой теплопроводностью.
Металлы в сверхпроводящем состоянии
обладают, как правило, более низкой теп-
лопроводностью Xs, чем теплопроводность
в нормальном состоянии Хп. В большинстве
случаев Кп/Х^=аТ2. Коэффициент а для
монокристаллов:
Олово чистотой 99,997%................350
Индий чистотой 99,993%................115
Свинец................................100
Теплопроводность металлов повышает-
ся в магнитном поле, причем в поперечном
поле сильнее, чем в продольном.
Теплопроводности газов и их смесей
приведены в табл. 4.46—4.65 и на рис. 4.13.
Теплопроводность газов при относительно
высоких температурах и давлениях дана
в [114]. Приведенную теплопроводность
водорода см. в [391], теплопроводность
атомарного водорода — в [356], газовых
смесей, содержащих водород, — в [362];
гелиево-водородных смесей при атмосфер-
ном давлении и температурах от 91 до
473 К — в [370]; азотоводородных и водо-
родно-диоксидуглеродных смесей при темпе-
ратурах от 258 до 473 К — н [369]; смесей
аргона, гелия, криптона, ксенона, неона и
азота в различных комбинациях при темпе-
ратурах выше температуры окружающей
среды — в [ИЗ, 266, 373, 375, 849], а сме-
сей аргона и гелия при температурах от
196 до 373 К и давлениях от 0,1 до
29,4 МПа — в [106]; саратовского природ-
ного газа при температурах от 173 до
393 К и давлениях от 0,1 до 19 МПа —
в [575]; воздушно-гелиевых смесей при
атмосферном давлении в интервале темпе-
ратур 200—1500 К—в [107]. Концентра-
ционную и температурную зависимости
теплопроводности газов в магнитном поле—
в [374, 843]. Изменение теплопроводности
газов под влиянием магнитного поля, пер-
пендикулярного температурному градиенту,
примерно в 1,5 раза больше, чем под влия-
нием параллельного поля.
Теплопроводность жидких хладагентов
и криоагентов см. на рис. 4.14 и 4.15,
в табл. 4.57—4.60 и в [114, 384]. Для
6,4%-ного раствора 3Не в 4Не ниже 0,01 К
ХТ=30,5-10-5 Вт/м [122]. Для смесей
с молярной концентрацией 3Не 0,55; 0,70 и
0,79 термическое сопротивление см. в [351].
Теплопроводность изотопов жидкого неона
см. в [844]. Приведенная теплопроводность
на кривой насыщения в зависимости от
приведенной температуры для аргона, во-
дорода, гелия, дейтерия, криптона, ксенона
дана в [850].
Теплопроводность замороженных крио-
агентов существенно зависит от плотности
и условий выращивания кристаллов; для
4Не см. [125]. Теплопроводность, Вт/(м-К);
Рис. 4.14. Теплопроводность при атмосфер-
ном давлении жидких: метана [633], озо-
на [355], оксида углерода [633], этилена
[633], этана [633], фтора в состоянии на-
сыщения при давлениях от 0,2 до 2,7 МПа
[352]
Таблица 4.46. Рекомендуемые значения теплопроводности газообразного и жидкого азота в зависимости от температуры
и давления X-lfP, Вт/(м-К), [П4]
т, к р, МПа
0,1 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 9,0 10,0 15,0 20,0 | 25,0 30,0 35,0 40.0
80 7,82 131 132 133 134 135 136 138 139 141 144 148 152 156 160 164
90 8,63 ИЗ 114 115 116 — 119 — 121 122 123 128 133 138 142 146 150
100 9,58 96,7 98,8 — 102 —и. 105 — 107 —- 108 114 119 124 129 133 137
ПО 10,48 11,9 81,4 •— 86,4 — 90,0 93,5 •— 96,1 103 108 112 116 122 126
120 11,30 12,5 14,7 64,3 69,0 — 75,3 — 79,8 •— 83,7 92,1 97,1 102 107 112 116
130 12,0 13,3 14,9 — 57,8 — 66,1 - 72,3 82,1 87,7 93,6 98,7 103 108
140 13,0 14,1 15,4 17,4 —. —- — — — — и — 71,3 79,2 85,9 91,2 95,7 100
150 13,9 14,9 16,0 17,6 19,7 —, —. -— — — — 61,6 71,2 78,2 83,6 88,9 93,5
160 14,8 15,7 16,7 18,0 19,6 21,8 — — — . —. — 53,8 63,9 71,5 75,5 82,9 86,6
170 15,7 16,5 17,4 18,5 19,9 21,6 23,6 25,9 28,6 31,2 34,1 47,3 57,4 65,3 72,0 77,5 82,3
180 16,6 17,3 18,1 19,1 20,3 21,7 23,3 25,0 27,2 29,3 32,0 42,6 51,2 60,4 66,8 72,6 77,3
190 17,5 18,1 18,8 19,7 20,8 22,2 23,3 24,9 26,5 28,3 30,2 39,7 48,4 56,0 62,8 68,4 73,2
230 18,3 18,9 19,6 20,4 21,3 22,4 23,6 24,9 26,3 27,8 29,4 38,5 45,2 52,7 58,9 64,5 69,3
220 19,8 20,3 20,9 21,6 22,3 23,2 24,1 25,2 26,2 28,0 29,0 35,2 41,9 48,1 53,2 58,5 63,4
240 21,3 21,9 22,4 23,1 23,7 24,4 25,2 25,9 26,9 28,3 28,9 34,2 40,1 44,6 49,5 54,5 58,5
260 22,8 23,4 23,8 24,4 24,9 25,6 26,3 26,9 27,9 28,6 29,4 33,8 38,4 43,4 47,1 51,2 55,4
280 24,2 24,7 25,1 25,6 26,1 26,7 27,3 27,8 28,6 29,3 30,0 33,8 37,2 41,5 45,6 49,4 53,0
300 25,7 26,0 26,9 26,9 27,3 27,8 28,4 29,0 29,5 30,1 30,8 34,2 37,4 40,5 44,6 48,2 51,3
Теплопроводность
Таблица 4.47. Рекомендуемые значения теплопроводности газообразного и жидкого аргона в зависимости от температуры
и давления X • 10®, Вт/(м-К) [114]
т, к р, МПй
0,1 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 9,0 10,0 15,0 20,0 25,0 30,0 35.0 40,0
90 6,0 124,7 125,6 126,3 127,0 127,7 128,3 128,9 129,5 130,2 131,0 134,0 136,7
100 6,6 110,9 111,6 112,6 113,6 114,4 115,2 116,0 116,7 117,5 118,2 121,8 125,3 128,3 131,2 134,0 136,6
НО 7,2 97,6 98,6 99,7 100,6 101,6 102,6 103,4 104,3 105,2 106,1 110,3 114,2 117,6 120,9 124,0 126,8
120 7,8 9,1 85,5 86,7 88,0 89,1 90,3 91,4 92,5 93,5 94,4 99,3 103,3 107,1 110,7 114,1 117,3
130 8,4 9,6 11,1 73,6 75,1 76,8 78,1 79,5 80,9 82,1 83,2 88,6 93,3 97,4 101,3 104,9 108,3
13Э
Физические свойства веществ при низких температурах
Продолжение табл .4.47
Продолжение табл. 4.48
т, к ру МПа
0.1 0,2 0,4 0,6 0,8 1,0 1.2 1,4 1,6 1,8 2,0 3,0 4,0 5,0 6,0 8,0 | Ю,0 | 15,0 20,0 25,0 30,0 40,0
80 55,1 56,1 56,5 57,1 57,7 58,7 59,0 59,7 60,3 60,9 61,7 64,9 68,3 71,7 75,2 82,5 90,3 103,3 122.8 135,6 148,0 171,4
90 61,3 62,0 62,5 63,1 63,7 64,2 64,7 65,3 65,9 66,5 67,0 69,8 72,7 75,6 78,5 84,5 90.7 106,8 120,5 132,2 143,4 165,2
100 67,7 68,3 68,8 69,3 69,8 70,3 70,8 71,3 71,9 72,3 72,8 75-,3 77,8 80,3 82,9 87,9 93,1 107,2 119,2 130,9 141,7 161,1
120 81,5 82,0 82,4 82,9 83,3 83,7 84,1 84,5 84,9 85,3 85,8 87,7 89,8 91,8 93,9 97,8 101,7 112,0 122,1 132,0 141,6 158,8
140 94,6 95,1 95,2 95.7 96,1 96,5 96,8 97,2 97,5 98,0 98,2 100,1 101,6 103,4 105,0 108,4 111,6 119,9 128,4 136,6 144,8 160,1
160 107,0 107,4 107,7 108,0 108,3 103,7 109,0 109,3 109,6 109,9 110,2 111,6 113,2 114,7 116,2 119,0 121,8 128,8 135,9 143,0 150,1 163,8
180 119,0 119,3 119,6 119,9 120,2 120,5 120,8 121,1 121,4 121,6 121,8 123,1 124,5 125,8 127,1 129,6 132,1 138,2 144,3 150,8 153,2 168,8
200 131,0 131.3 131,6 131,9 132,1 132,4 132,6 132,9 133,1 133,3 133,5 134,8 135,9 137,1 138,2 140,6 142,8 148,2 153,7 159,1 164,7 175,5
220 142,0 142,3 142,5 142,8 143,0 143,2 143,5 143,7 143,9 144,2 144,4 145,4 146,5 147,6 148,6 150,7 152,7 157 7 162,6 167,5 172,4 182,2
240 152,0 152,3 152,5 152,7 152,9 153,1 153,3 153,8 154,0 154,2 155,2 156,1 157,2 158,1 160,0 151,9 166,5 170,8 175,3 179,7 188,7
260 162,0 162,3 162,5 162,7 162,9 163,0 163,2 163.5 163,6 163,8 164,0 164,9 165,8 166,7 167,7 169,4 171,2 175,3 179,4 183,4 187,6 195,9
280 172,0 172,3 172,5 172,6 172,8 173,0 173,1 173,4 173,5 173,7 173,9 174,7 175,6 176,4 177.4 178,9 180,5 184,4 188,1 191,9 195,7 203,3
300 183,0 183,3 183,4 183,6 183,8 183,9 184,0 184,2 184,4 184,6 184,8 185,6 186,4 187,1 187,9 189,4 191,0 194,6 198,2 201,6 205,2 212,2
Таблица 4.49. Рекомендуемые значения теплопроводности параводорода в зависимости от температуры и давления
к-103, Вт/(м К) [114]
Т, К р, МПа
0,1 0,2 0,4 о.о 0,8 1,6 1.2 1,4 1,6 1,8 2,0 3,0 4,0 5,0 6,0 8,0 10,0 15,0 20,0
16 84,5 84,7 84,9 85,1 85,4 85,7 86,0 86,4 86,6 86,9 87,2 88,6 90,1 91,7 93,4
18 93,3 93,4 93,8 94,2 94,5 94,8 95,1 95,5 95,9 96,2 96,6 98,4 100,1 102,2 103,9 107,3 111,1 —
20 98,2 98,5 99,0 99,4 99,9 100,5 100,9 101,4 102,0 102,4 102,7 104,7 107,0 109,0 111,1 115,4 119,8 129,9 139,3
22 17,6 100,8 101,5 102,2 102,8 103,2 104,0 104,5 105,2 105,7 106,2 169,0 111,4 113,7 116,0 12.1,9 125,7 136,6 147,6
24 19,1 20,0 100,7 101,6 102,5 103,5 104,2 105,1 105,9 10.6,7 107,5 110,7 113,5 116,5 119,1 124,1 129,1 141,5 153,0
26 20,8 21,4 23.7 98,9 100,0 101,0 102,2 103,2 104,2 105,3 106,2 110,4 114,4 117,5 120,4 126,1 131,2 144,5 156,5
28 22,2 22,8 24,8 93,5 95,3 96,6 98,0 99,2 100,6 102,0 103,0 108,2 112,7 116,9 120,3 126,5 132,1 145,5 158,6
30 23,6 24,2 25,9 28,3 32,3 89,6 91,9 93,8 95,5 96,9 98,4 104,5 169,8 114,5 118,6 125,9 132,1 146,0 159,6
32 25,0 25,6 27,0 29,1 31,9 36,6 79,6 84,2 87,3 89,8 92,0 99,9 105,9 111,3 116,0 124,4 130,9 145,4 159,4
34 26,4 27,0 28,3 30,0 32,4 35,8 42,0 — — 94,4 101,6 107,2 112,6 121,6 129,4 144,7 158;5
36 27,8 28,3 29,5 31 ,0 33,0 35,5 38,8 44,2 54,2 — 87,2 96,5 103,2 108,6 118,3 126,7 143,4 157,3
38 29,1 29,6 30,8 32,2 33,8 35,8 38, 1 41,3 45,7 52,0 — 80,3 91,2 98,6 104,8 114,8 123,6 141,6 156,0
40 30,7 31,1 32,1 33,4 34,8 36,5 38,7 41,0 43,8 47,3 51,6 73,7 85,9 94,4 100,3 112,0 121,4 139,7 154>
50 37,7 38,1 38,8 39,6 40,6 41,7 42,8 44,1 45,2 46,5 48,0 56,8 66,9 75,5 81,6 95,2 105,7 125,9 143,6
60 44,6 44,9 45,5 46,2 46,8 47,6 48,5 49,3 50,3 51,3 52,2 56,4 63,1 69,0 74,9 86,0 95,1 115,6 132,3
70 51,7 51,9 52,4 52,9 53,6 54,1 54,8 55,5 56,2 57,0 57,8 61,6 65,5 69,7 73,8 82,3 90,8 1G9,0 125,0
80 60,0 60,1 60,5 60,9 61,4 61,9 62,4 63,0 63,6 64,2 64,8 68,0 71,1 74,3 77,5 83,7 91,6 107,2 121,8
90 69,4 69,6 70,0 70,4 70,8 71,3 71,7 72,1 72,6 73,2 73,7 76, 1 78,6 81,2 83,9 89,4 94,7 169,2 122,6
100 79,9 89,1 80,4 80,7 81,0 81,5 81,9 82,3 82,6 83,0 83,5 85,6 87,8 89,9 92,2 96,8 100,5 114,1 126,1
Теплопроводность
Таблица 4.50. Рекомендуемые значения теплопроводности воздуха в зависимости от температуры и давления Х Ю3, Вт/(м К) [114]
р, МПа
т, к од 5,0 10,0 15,0 20,0 25,0 30,0 35,0 40,0
85 7,9 143,4 147,9 152,1 156,3 160,4 163.7
100 9,3 118,1 123,8 129,1 134,0 138,7 143,0 147,4 151,1
125 11,6 76,0 88,3 96,8 103,5 103,5 115,0 119,8 124,1
150 13,8 23,5 53,6 68,6 78,2 85,9 92,3 98,2 103,2
175 15,9 21,4 33,4 47,7 58,6 67,3 74,5 80,6 86,1
200 18,0 22,1 29,4 38,2 47,0 55,0 61,9 67,8 73,4
225 20,1 23.5 28,8 34,9 41,6 48,6 53,6 59,2 64.7
250 22,1 25,0 29,2 34,0 38,9 44,3 49,2 54,1 58,6
275 24,2 26,7 30,2 34,0 38,3 42,4 46,7 50,9 54,9
300 26,2 28,4 31.4 34,9 38,5 42,0 45,6 49,3 52,7
Т а б л и ц а 4.51. Теплопроводность газообразного и жидкого гелий в зависимости от температуры и давления. Рассчитано по [857]
Х-IO4, Вт/(м*К) при р, МПа
Т, К 0,02 0,04 0,06 0,10 0,14 0,20 0,22 | 0,23 | 0,25 | 0,30 | 0,35 | 0,40 0,50 | 0,60 0,80 | 1.0 j 1.2 1.5 2,0 2,5 3,0
3 0 66 176 180 182 183 185 186 187 187 189 191 192 195 198 203 208 213 219 228 237 245
З’б 76 79 185 191 193 196 197 197 198 200 202 204 208 211 218 223 228 235 245 255 264
4 0 85 88 91 193 199 204 205 205 207 2С9 212 215 219 223 231 237 243 250 262 273 283
4 5 94 96 98 1С6 194 205 207 208 210 214 218 221 227 232 241 248 255 265 278 291 392
5 0 103 105 166 111 119 210 210 208 209 213 216 221 229 236 248 257 266 277 293 306 319
5 1 105 106 108 112 119 170 214 215 210 212 217 221 229 237 249 259 268 279 295 339 322
52 1С6 107 109 114 120 148 237 259 222 211 216 220 228 237 250 260 269 281 298 312 325
5 3 108 109 111 115 121 141 163 195 250 215 215j 219 228 237 251 261 271 283 300 315 328
5 4 ПО 111 112 116 122 137 150 161 233 216 215 219 227 237 251 263 272 285 303 318 331
5’5 111 113 114 118 123 135 145 151 177 221 215 218 228 237 252 264 274 287 305 320 334
5*6 113 114 116 119 124 135 142 147 161 232 217 218 227 236 252 265 275 289 307 323 337
5 7 114 116 117 120 125 135 140 144 153 209 217 217 226 236 253 266 276 290 309 325 340
5,8 116 117 119 122 126 135 139 142 150 187 216 217 226- 236 253 266 278 292 311 328 342
5,9 118 119 120 123 127 136 139 141 147 174 2и9 216 225 235 253 267 279 293 313 330 345
6,0 119 120 122 125 128 136 139 141 146 166 197 213 223 234 252 267 279 294 315 332 347
6 5 127 128 129 131 134 140 143 144 147 155 169 184 212 228 250 268 282 300 323 342 359
7,0 134 135 136 138 141 146 147 148 151 157 164 173 196 216 245 265 282 302 328 350 368
7,5 140 141 142 145 147 151 153 154 155 160 165 171 188 205 236 260 280 302 331 355 374
8,0 147 148 149 151 153 157 158 159 160 164 169 173 186 200 229 254 275 300 332 358 379
8,5 153 154 155 157 159 163 164 165 166 169 173 177 186 198 223 248 270 297 332 360 383
9,0 160 160 161 163 165 168 169 170 171 174 178 182 189 199 221 243 265 293 331 363 385
9,5 165 166 167 169 171 174 175 175 177 179 183 186 193 201 220 240 260 289 328 360 386
10,0 171 172 173 175 176 179 180 181 182 184 187 190 197 204 221 239 258 285 326 358 386
11,0 182 183 184 186 187 190 191 191 192 195 197 200 205 211 224 240 256 279 319 353 383
Физические свойства веществ при низких температурах
Продолжение таблицы 4.51
У-10‘, Вт/(м-К) при р, МПа
т, к 0,02 0,04 0,06 0,10 0,14 0,20 0,22 0,23 0,25 0,30 0,35 | 0,40 0,50 0,60 0,80 1,0 1,2 1,5 2,0 2,5 3,0
12,0 193 194 194 196 197 200 201 201 202 204 207 209 214 219 230 243 257 279 314 348 379
13,0 203 204 204 206 207 210 211 211 212 214 216 218 223 228 237 249 261 281 312 345 375
14,0 213 213 214 216 217 219 220 220 221 223 225 227 231 236 245 255 266 284 313 343 371
15,0 222 223 223 225 226 228 229 229 230 232 234 236 240 244 253 262 272 288 316 343 370
16,0 231 232 232 234 235 237 238 238 239 241 242 244 248 252 260 268 278 292 318 343 369
17,0 240 241 241 242 244 246 246 247 247 249 251 253 256 260 268 275 284 297 321 345 369
18,0 248 249 250 251 252 254 255 255 256 257 259 261 264 268 275 282 290 303 325 348 370
19,0 257 257 258 259 260 262 263 263 264 265 267 269 272 275 282 289 296 308 329 351 372
20,0 265 266 266 267 269 270 271 271 272 273 275 276 280 283 290 297 303 314 334 354 374
21,0 273 274 274 275 276 278 279 279 280 281 283 284 287 290 297 303 309 320 339 358 377
22,0 279 281 282 283 284 286 286 287 287 289 290 292 295 298 304 310 316 326 344 362 381
23,0 289 289 290 291 292 293 294 294 295 296 298 299 302 305 311 317 323 332 349 367 385
24,0 296 297 297 298 299 301 301 302 302 304 305 306 309 312 318 324 330 338 354 371 388
25,0 304 304 305 306 307 308 309 309 310 311 312 314 316 319 325 330 336 344 360 376 392
26,0 311 311 312 313 314 315 316 316 317 318 319 321 323 326 331 337 343 350 365 381 397
28,0 325 326 326 327 328 330 330 330 331 332 333 335 337 340 345 350 355 363 377 391 405
30,0 339 340 340 341 342 343 344 344 345 346 347 348 351 353 358 363 368 375 388 401 415
32,0 353 353 354 355 356 357 357 358 358 359 360 362 364 366 371 376 380 387 399 412 425
34,0 366 367 367 368 369 370 371 371 371 372 374 375 377 379 384 388 393 400 410 423 435
36,0 380 380 380 381 382 383 384 384 384 385 386 388 390 392 396 400 4С5 412 422 433 445
38,0 392 393 393 394 395 396 397 397 397 398 399 400 402 404 408 413 417 423 433 444 455
40,0 405 406 406 407 408 409 409 409 410 411 412 413 415 417 421 425 429 J35 444 455 466
45,0 436 437 437 438 438 449 440 440 440 441 442 443 445 447 451 454 458 464 473 482 492
50,0 466 467 467 468 468 469 470 470 470 471 472 473 475 476 480 483 487 492 501 509 518
55,0 496 496 496 497 498 498 499 499 499 500 501 502 503 505 508 512 515 520 528 535 544
60,0 524 524 525 525 526 527 527 527 528 528 529 530 532 533 536 539 542 547 555 562 570
65,0 552 552 553 553 554 555 555 555 555 556 557 558 559 561 564 567 570 574 581 588 595
70,0 579 580 580 581 581 582 582 582 582 583 584 585 586 588 590 593 596 600 608 615 621
75,0 606 607 607 607 608 609 609 609 609 610 611 611 613 614 617 620 622 627 633 640 645
80,0 S33 633 633 634 634 635 635 636 636 636 637 638 639 640 643 646 648 652 659 665 671
90,0 684 685 685 685 686 687 687 687 687 688 688 689 690 692 694 696 699 703 7G9 715 721
100,0 735 735 735 736 736 737 737 737 737 738 738 739 740 741 744 746 748 752 758 763 769
125,0 855 855 855 856 856 857 857 857 857 858 858 859 860 861 863 865 867 870 875 880 885
150,0 968 968 969 969 969 970 970 970 970 971 971 972 973 974 975 977 979 982 986 991 999
175,0 1080 1080 1080 1080 1080 1080 1080 1080 1080 1080 1080 1080 1080 1080 1080 1080 1089 1090 1090 1099 1100
200,0 1180 1102 Ноо 1177 1104 1177 1180 1180 1180 1180 1180 1180 1180 1180 1180 1189 1190 1190 1190 1199 1200
225,0 1280 1280 1280 1280 1280 1280 1280 1280 1280 1280 1280 1280 1280 1280 1280 1280 1289 1290 1290 1290 1299
250,0 1370 1370 1370 1370 1370 1370 1370 1370 1370 1370 1370 1370 1370 1370 1379 1380 1380 1380 1380 1389 1390
275,0 1460 1460 1460 1460 1460 1460 1460 1460 1460 1460 1460 1460 1460 1460 1469 1470 1470 1470 1470 1470 1479
300,0 1550 1550 1550 1550 1550 1550 1550 1550 1550 1550 1550 1550 1550 1550 1550 1550 1550 1559 1560 1560 1560
Теплопроводность
134
Физические свойства веществ при низких температурах
Таблица 4.52. Теплопроводность гелия
(3Не) в газовой фазе при /><0,1 МПа [114]
т, к Х-108, Вт/(м-К) т, к ЫО3, Вт/(м- К) Т. К . 103, Вт/(м- К)
1,5 8,6 2,5 11,6 3,5 13,5
1,75 9,5 2,75 12,1 3,75 13,9
2,0 10,3 3,0 12,6 4,0 14,2
2,25 11,0 3,25 13,1
твердого метана Хсн4ТЕСр = 29/7’ в интерва-
ле температур 87—99 К и твердого аргона
Хдгтвер=20/7' в интервале температур 76—
91 К [845]. Теплопроводность твердых
аргона, криптона и неона см. на рис. 4.16
и в [846], твердого метана и СО — на
рис. 4.17 и в [847], твердого водорода—
на рис. 4.18, твердого дейтерия — на
рис. 4.19. Граничное термическое сопротив-
ление между твердым гелием, водородом,
дейтерием, неоном и медью в интервале
температур 1—3 К см. [876].
Теплопроводность металлов см. на
рис. 4.20—4.25 и в табл. 4.66—4.72. Допол-
Рис. 4.15. Теплопроводность жидких водо-
рода [865], дейтерия [357] (нет заметного
различия для орто- и парасостояния [352])
и неона [364]
нительные сведения о теплопроводности ме-
таллов: серебра и алюминия при температу-
рах 2—5 К — см. в [358]; железа в интер-
вале температур 0,5—1,3 К —в [371]; мо-
Таблица 4.53. Рекомендуемые значения теплопроводности дейтерия, криптона, ксенона
фтора, оксида азота, оксида углерода, диоксида углерода, этилена жидкого
и газообразного, этана при давлении 0,1 МПа 7-103, Вт/(м-К) [114]
Т-, К d2 Кг Хе f2 NO СО СО2 С2Н4 С2Н6
20 12,0
40 26,2 — — — — — — — —
60 38,2 ' — — — — — — —
80 49,0 — — 6,91 — — —
90 — — — 7,83 — — —
100 59,0 3,41 — 8,63 — 8,71 — — —'
110 " — — 9,63 — 252 —
120 68,4 4,07 — 10,2 10,5 — 243 —
130 — — — И,4 — 232 —
140 77,2 4,71 — 12,1 12,3 — 222 —
150 — 13,4 — 13,2 — 211 —
160 85,4 5,35 — — 14,0 14,1 — 200 —
170 14,9 — — —
180 93,4 5,98 — — 15,8 15,8 — 9,67 —
190 — — — 16,6 — 10,3 —
200 100,6 6,60 3,83 18,2 17,6 17,4 9,38 п,о 11,4
210 4,02 — 18,2 Ю,1 И,7 12,2
220 108 7,21 4,21 — 19,3 19,0 10,7 12,5 12,9
230 — 4,39 — — 19,7 11,5 13,3 13,8
240 115 7,82 4,58 — 21,0 20,5 12,2 14,2 14,7
250 4.76 22,8 — 21,2 13,0 15,2 15,6
260 121 8,41 4,94 — 22,7 22,0 13,7 16,2 16,7
270 — 5,12 — — 22,7’ 14,5 17,2 17,7
273 125,4 8,80 5,17 24,8 — — — — —
280 127 9,00 5,31 24,3 23,4 15,2 18,3 18,8
290 5,50 — 24,2 16,0 19,4 20,0
300 133 9,58 5,69 26,9 25,9 24,9 16,6 20,6 21,4
аблица 4.54. Рекомендуемые значения теплопроводности газоо5разиого и жидкого кислорода в зависимости
от температуры и давления X, мВт/(м-К) [114]
р, МПа
т, к 0,1 1 2 3 4 5 6 7 8 9 10 15 20 25 30 35 40
80 161 162 163 — 164 — 165 — 166 — 167 170 172 175 177 179 181
90 147 148 149 — 150 151 — 152 154 157 159 162 164 166 168
100 _9J5 134 135 — 136 — 138 — 140 — 142 144 147 150 153 155 157
НО 10,2 120 121 — 123 — 125 __ 126 — 128 131 135 138 141 143 146
120 11,0 12,2 1С8 — 1С9 — ПО — 111 — 113 115 117 121 125 128 132
130 11,9 13,0 95,9 — 97,4 — 99,6 — 100 — 102 106 109 113 116 12 3 124
140 12,8 13,7 15,4 80,6 83,5 85,4 87,6 89,5 91,3 93,8 95,6 99,4 104 18 112 115 118
150 13,8 14,7 16,0 18,2 21,0 65,3 72,2 74,4 77,3 79,1 81,2 89,3 95,2 100 105 1.8 111
160 14,7 15,5 16,7 18,4 23,9 25,1 — — 61,2 63,3 68,4 79,2 87,4 98,3 98,1 103 107
170 15,6 16,4 17,4 18,8 20,7 23,0 — — — — — 69,3 78,5 84,4 93,2 95,3 99,2
180 16,6 17,2 18,1 19,3 21,0 22,8 — — — — — 59,2 70,4 77,3 83,4 88,5 93,4
190 17,4 18,0 18,9 19,9 21,3 22,9 24,8 27,0 29,8 32,8 36,0 52,3 58,2 73,4 77,2 82,1 87,4
230 18,3 18,9 19,7 20,6 21,8 23,0 24,7 26,6 28,6 30,9 33,4 46,2 57,4 64,6 71,3 76,4 81,5
220 29,1 20,7 21,3 22,2 23,0 24,7 25,3 26,7 28,1 29,7 31,4 40,4 48,3 56,1 62,2 68,6 72,5
240 21,8 22,3 22,9 23,6 24,3 24,9 25,5 27,0 28,5 29,2 31,0 38,9 45,4 51,1 57,5 62,4 66,6
260 23,5 23,9 24,4 25,1 25,7 26,5 27,3 28,2 29,1 30,1 31,1 36,9 42,7 48,3 53,4 58,2 62,5
280 25,1 25,5 25,9 26,5 27,1 27,8 28,5 29,3 30,1 31,1 32,1 36,7 41,7 46,5 51,3 55,5 59,1
300 26,7 27,1 27,5 28,0 28,5 29,1 29,7 30,4 31,1 31,9 32,7 36,9 41,3 45,7 50,1 53,3 57,2
Теплопроводность
Таблица 4.55. Рекомендуемые значения теплопроводности яндкого и газообразного Метана в зависимости от
температуры и давления Л-103, Вт/(м-К) [114]
т, к р, МПа
0,1 1,0 2,0 3,0 4,0 5,0 6,0 8,0 10,0 15,0 20,0 25,0 30,0 35,0 40,0
100 212 213 214 215 216 217 218 220 222 226 230 234 237 243 243
по 197 198 199 230 2 2 233 204 2,6 208 212 214 218 222 225 229
121 12,8 182 184 185 ' 187 188 189 191 194 197 231 2-J 2.8 212 216
130 14,0 167 169 170 172 173 175 177 179 184 188 192 196 2 2,6
140 15,1 151 152 154 156 158 159 162 165 171 175 181 185 190 195
153 16,2 — 135 137 143 142 144 148 150 156 163 168 173 178 183
160 17,3 19,0 118 121 124 126 129 133 136 142 149 156 162 168 173
170 18,4 19,9 — 104 1С8 110 113 118 121 129 137 144 51 157 163
180 19,5 21,9 22,7 —. — — 95,2 102 10,7 117 126 133 140 146 152
190 20,6 21,8 23,5 25,4 — — — — 92,5 105 115 123 131 137 142
200 21,8 22,9 24,3 26,1 28,8 32,9 — — — 92,8 Кб 114 122 128 133
220 24, 1 25,0 26,2 27,7 29,7 32,1 35,2 — — 74,3 87,2 96,7 105 112 118
240 26,4 27,3 28,4 29,6 31,1 32,7 34,8 43,0 46,1 61,6 74,3 83,6 92,8 100 107
260 28,9 29,7 33,7 31,7 32,8 34,3 35,6 39,4 44,1 56,3 66,5 75,6 83,7 91,3 98,2
280 31,5 32,2 33,1 34,0 35,1 36,1 37,3 40,2 43,8 53,6 62,4 70,6 77,6 84,4 9 0,5
300 34,2 34,9 35,7 36,6 37,4 38,4 39,4 41,9 44,7 52,3 63,2 67,6 74,0 83, 1 86,0
Физические свойства веществ при низких температурах
Т епло'проводность
137
Таблица 4.56. Теплопроводность неона при низких температурах
ХЮ3 Вт/(м-К) [П4]
р, МПа
т, к 0,1 1,0 2,0 3.0 4,0 5,0 7,5 10,0 15,0 20.0 30,0 40,0
78 17,8 18,3 19,2 20,3 21,6 22,4 28,6 35,3 47,2 54,7 64,8 73,3
83 18,9 19,4 20,3 21,4 22,5 24,0 28,3 33,7 44,3 51,9 62,3 71,1
93 20,8 21,5 22,4 24,3 24,3 25,5 28,5 31,9 39,7 46,8 57,6 66,6
103 22,7 23,4 24,2 25,1 26,0 26,9 29,3 31,9 37,6 42,9 53,6 62,4
113 24,6 25,2 25,9 26,6 27,5 28,2 30,3 32,5 36,9 41,4 50,6 58,8
123 26,4 26,9 27,4 28,2 29,1 29,6 31,4 33,3 37,0 41,0 48,8 56,5
133 28,1 28,6 29,1 29,7 30,3 30,5 32,5 34,2 37,6 41,1 48,1 55^
143 29,7 30,1 30,6 31,1 31,7 32,2 33,6 35,1 38,3 41,5 47,9 54,2
153 31,3 31,6 32,0 32,4 32,9 33,4 34,8 36,2 39,2 42,2 47,9 53,8
163 32,7 33,0 33,3 33,7 34,2 34,6 35,9 37,2 40,0 42,8 48,2 53,4
173 34,0 33,6 34,6 35,0 35,4 35,9 37,0 38,3 40,9 43,5 48^5 53,5
198 37,1 36,6 37,8 38,1 38,5 38,9 39,8 40,8 43,2 45,3 49,7 54^0
223 40,1 40,4 40,8 41,1 41,4. 41,7 42,6 43,5 45,5 47.3 51J 54; 9
248 43,2 43,4 43,7 43,9 44,2 44,6 45,4 46,1 47,0 49,6 52,8 56,2
273 46,1 46,3 46,6 46,8 47,0 47,3 47,9 48,2 50,1 51,7 54,8 57 8
398 48,9 49,1 49,3 49,5 49,7 49,9 50,4 50,9 52,4 53,8 56,8 59;8
Таблица 4.57. Рекомендуемые
значения теплопроводности нормального
водорода и параводорода на линии
насыщения Х-103, Вт/(мК) [114]
т, к Нормальный водород Параводород
Пар Жидкость Пар Жидкость
16 12,0 85,0 84,4
18 14,0 95,0 —. 93,3
20 15,8 100 • 15,6 98,2
22 17,5 1СЗ 18,0 100,6
24 19,0 104 20,6 100,1
26 20,5 102 23,6 97,7
28 22,0 97,6 27,8 93,5
30 24,0 92 8 32,6 87,4
32 25,5 83,7 41,0 76,6
Таблица 4.59. Теплопроводность
жидкого гелия 3Не X-103, Вт/(м-К) [114]
т, к р, МПа
0,103 0.405 1.01 2.23 3,45
1,5 11,0 11,1 и,з П,7 12,1
1,6 11,3 11,4 11,8 12,3 12,7
1,8 12,1 12,4 12,7 13,7 14 2
2,0 12,8 13,2 13,6 14,9 15,6
2,2 13,5 14,0 14,6 16,0 17,0
2,4 14,1 14,8 15,4 17,1 18,3
2,6 14,7 15,6 16,3 18,2 19,5
2,8 15,2 16,3 17,2 19,2 20,6
3,0 15,7 16,9 18,1 20,2 21,7
3,2 — 17,4 18,9 21,1 22,7
3,4 — 17,8 19,6 22,0 23,7
3,6 — 18,2 20,3 22,8 24,6
3,8 — 18,6 23,8 23,6 25 5
4,0 — 19,0 21,4 24,3 26,4
Таблица 4.58. Теплопроводность
жидкого гелия 4Не X-103, Вт/(м-К) [114]
Т, к р, МПа
0,103 1,01 2,03 3,04 3,45
2,2 14,2 15,8 17,2 17,9 18,3
2,4 15,1 17,0 18,7 19,5 20,0
2,6 15,9 18,2 20,0 21,0 21,4
2,8 16,7 19,3 21,1 22,4 22,8
3,0 17,4 20,2 22,2 23,6 24,1
3,2 18,0 21,0 23,2 24,6 25,2
3,4 18,5 21,8 24,1 25,6 26,2
3,6 19,0 22,6 25,0 26,6 27,2
3,8 19,4 23,2 25,9 27,6 28,2
4,0 19,7 23,9 26,7 28,6 29,2
Рис. 4.16. Теплопроводность твердых нео-
на, криптона и аргона [360]
138
Физические свойства веществ при низких температурах
Таблица 4.60 Рекомендуемые значения теплопроводности жидких
криптона и ксенона на линиях насыщения Л-103, Вт/(м-К) [114]
Жидкость Т, К
125 130 140 150 160 170 180 190 200 210 220 230 235
Кг 87,6 84,0 76,0 69,0 63,0 56,0 49,7 43,7 36,0 — — — —
Хе — — — — 64,G 65,5 61,0 57,5 54,0 49,4 45,8 44,0
Т аблица 4.61. Теплопроводность смеси гелия и водорода Л-104, Вт/(м-К) [116 ]
Смесь (объ- емные доли) р, МПа Температура, К
77,96 123,76 158,76 195,56 | 273,76 |
0,248Н2 0,1 530 823 973 1143 1411 1474
0,752Не 0,4 535 834 975 1145 1421 1484
1,9 548 844 987 1150 1433 1487
6,0 599 867 1008 1179 1453 1502 • 294,76
8,9 646 901 1023 1194 1460 1516
20,7 840 1022 1141 1272 1511 1570
29,5 965 . 1112 1213 1335 1564 1616
39,8 1084 1232 1308 1424 1629 1666
49,6 1185 1331 1492 1481 1695 —
0,539Н2 0,1 597 791 967 1166 1495 1566
0,461Не 0,4 519 798 965 — —
1,9 531 817 979 1509 —
6,0 619 863 1032 — 1531 1586
И,9 727 945 1102 1260 1552 1612 292,16 К
20,7 915 1085 1214 1347 1603 1657
29,5 1055 1212 132о 1428 1672 1717
39,8 1215 1333 1427 1516 1741 1780
49,6 1327 1451 1523 1600 1806 1843
0,757Н2 0, 1 511 854 1026 1227 1562 1624
0,243Не 0,4 515 858 1031 1232 — 1628
1,9 546 883 1055 1243 1569 1639
6,0 649 936 109J 1267 1584 1665
И,9 820 1019 1158 1312 1625 1705 289,76 К
20,7 1054 1166 1281 1396 1702 1754
29,5 1221 1319 1395 1513 1750 1818
39,8 1389 1469 1529 1615 1855 1887
49,6 1557 1622 1638 1726 1923 1940
нокристаллов лития, натрия, калия, сереб-
pa-р и алюминия от 0,1 до 300 К — см.
в [874]; родия в магнитных полях с индук-
цией до 1,75 Тл и при температурах
2—4 К — в [746]; манганиновой проволоки
между 1 и 4 К — в [873].
Теплопроводность полупроводниковых
материалов см. в табл. 4.73 и в [746].
Теплопроводность некоторых сверхпро-
водников см. на рис. 4.26 и в табл. 4.74.
Дополнительные сведения о теплопроводно-
Рис, 4.17. Теплопроводность твердого ме-
тана [361]
сти сверхпроводников: тантала в интервале
температур 4—200 К см. в [123]; ниобия
прн температурах 0,05—23 К — в [872];
свинца чистотой 99,9999 % РЬ в пределах
1—7 К в магнитном поле, в нормальном и
сверхпроводящем состояниях — в [45];
тантал-ниобиевых сплавов при температу-
рах 0,5—4,5 Кив полях до 1,4 Тл —
в [880]; свинцово-индиевых сплавов —
в [875]. Теплопроводность сверхпроводя-
щей катушки в продольном и поперечном
направлениях дана в [877].
Теплопроводность
139
Таблица 4.62. Теплопроводность смеси гелия и азота [128] Х Ю4, Ет.(м-К)
Смесь (объемные доли) р, МПа Температура, К
196,26 274,46 |
0,354Не 0,1 354 447 476
0,646N2 1,1 357 450 479
5,0 384 460 488 • 299,46
9,9 417 474 503
20,0 501 514 508
29,6 — 558 570
0,568He 0,1 525 651 691
0,432N2 531 654 693
5,0 549 661 701
9,9 573 677 7(9 298,56 К
Н,2 581 679 712
19,6 635 705 734
29,5 714 738 761
0,787Не 0,1 793 971 1026
0,213N2 1,1 796 976 1033
5,0 9,9 812 840 987 999 1С41 1С53 300,76 К .
19,7 892 1032 1084
29,5 949 1С67 1115
Т аблица 4.63. Теплопроводность смеси азота и аргона [369]
Температу- ра, к Молярная доля азота X-10», Вт/(м-К) Темпера- тура, к Молярняя доля азота Х-10=, Вт/(м-К) Темпера- тура, к Молярная доля азота Х-Ю5, , Вт/(м-К>.;
90,15 0,000 586 258,05 0,000 1549 ' 293,25 0,000 1738
0,016 594 0,027 1595 0,010 1696
0,050 603 0,049 1570 0,027 1715 -
0,074 594 0,066 1578 0,054 1720
0,112 611 0,080 1595 0,С99 1757
0,194 628 0,188 1688 0,210 18j9
0,350 678 0,400 1800 0,395 1904
0,606 782 0,6С6 2(42 0,617 2042
0,871 917 0,837 2185 0,861 2210
0,927 938 1,000 2290 1,000 2565
1,000 967
Таблица 4.64. Теплопроводность смеси кислорода и аргона [369]
Темпера- тура, к Молярная доля кис- лорода X-10», Вт/(м-К) Темпера- тура, к Молярная доля кис- лорода Х-Ю5, Вт/(м-К) Темпера- тура, к Молярная доля кис- лорода Х-ю5, Вт/(м-К)
90,15 0,000 586 258,05 0,000 1549 293,25 0,000 1738
0,030 582 0,007 1544 0,006 1720
0,054 577 0,012 1549 0,013 1741 '
0,069 586 0,027 1570 0,025 1760
0,099 599 0,291 1740 0,036 1768
0,298 628 0,6(9 2.. 68 0,283 1938
0,612 762 0,892 2262 . 0,601 2165 '
0,869 858 1,000 2290 0,913 2372
1,000 892 1,000 2530
140
Физические свойства веществ при низких температурах
Таблица 4.65. Отношение теплопроводностей параводорода и нормального
водорода [200]
т, к X /X р‘ п т, к р п т, к X /X р' п
10 1,000 50 1,004 120 1,187
20 1,000 60 1,015 150 1,203
20,39 1,000 70 1,036 200 1,136
30 1,000 80 1,065 250 1,066
33,1 1,000 90 1,100 298,16 1,028
40 1,0005 100 1,135 300 1,028
Таблица 4.66. Теплопроводность
некоторых металлов и сплавов,
Вт/(м-К) [118, 387, 746, 867]
Материал т, к X
Висмут Гадолиний Диспрозий Золото Золото—кобальт (термо- пара) Иттрий Калий Литий Лютеций Натрий Неодим Осмий Плутоний Празеодим Припой оловянно-свинцо- вый: 40о/о Sn и 69 % РЬ 60°/oSn и 40 % РЬ Гт уть жидкая твердая Рутений Ru Серебряный припой Сурьма Sb Торий Th Чугун 273 223 113 293 293 273 76 29 4,2 293 273 273 293 273 123 3J0 20 4,2 76 20 4,2 273 194 293 20 4,2 76 20 76 20 273,16 3,86 76 20 4,2 194 76 29 273 293 290 100 253 8,37 10,5 Н,6 9,2 10,0 296 20 7,5 1,2 14,7 99 69,7 16,0 135 142 12,9 3,5 1,1 140 550 140 7 4 10,9—12 4,2 6,3 44 28 51 55 8,38 167,5 19 2300 700 58 34 12 186 5,13 4,65 4,10 46,5—52,4
Рис. 4.18. Теплопроводность твердого во-
дорода при различном содержании орто-
модификации [359]
Рис. 4.19. Теплопроводности твердых орто-
дейтерия (2,2% p-D2) и нормального дей-
терия (30% р-Р2) [105]
Со ЬЭ to to *- >— >- ococnocntoooocn^cototo~~ ОСООООООООООСЛОСЛ-ОСОСО*<»ОСЛ'4:^СОЬЭ г, к
totototototototocococo to •— Sto£2o£o&2!oSlolfel I 1 1 1 1 1 1 Алюминий АД-1 отожженный
00 cn to to to •— ~ —A •— ^‘•=•‘=‘^-‘'-‘ — •-‘*-^‘*-00 1 о 1 CO СЛ to CD CD CO О 1 I CD О О D m ф- CC to o - - 1 - 1 I CDCD^OCO*<|^OOOCDCO СП to to о to CO ~ *o Алюминий АМц иагартованный
Ф CO Ц1 Ф OJ to •— >— cn to О CD CO Q> СЛ Ф» ) 1 COCOtOtOO'*--'*- - ] - 1 - Il О O' CD — « О о CO CO 4 CD 1 О 1 •— 'Э0 СП to CO <! СП to •— CD to СЛ Алюминий АМг-2 отожженный
CO --J •<) СИ Ф* CO tO •—* III | |-<»CDOtO^CO|tO|OCDCO‘-Qa>Cn^| | ►Ф — to о CO CD CD 00 CD Ф CO to •— О •— СП Co to Ф- Алюминий АМг-3 отожжеииый
CD CD CD Co CD СП СП >Ф=« CO to to — СП jo to •— >4^ CO CO >— CO to to | CO | | | | | | | | | CDOCOtOO ^QOl^CDO CD О Алюминий АМг-6 отожженный
CO CD СЛ Ф W to Co Co Co Ф ф. 1 1 ьф. Co Co to to —*—* СП СП O' СП СП 00 СП СО СО CD О - 1 1 о to О' СП о СП О' о - Q СТ) Ф СП.СО соооооооослооооооо Медь М-3 неотож- женная
CD -СТ CD СП | 1 1 1 I I 1 СТ Ф ф ф Со со w to to to - - О СП О о J 1 i 1 1 1 1 ocntoooocntocnco^*co-~- Ок-С©.— tOOlO—‘--J00O_OOOOO Медь М-3 отож- женная
Сп Ф w to to £7 СООСССТ~ЧСОСОЧСТСТФСсЮ1С'- СО 1 1 | 1 1 I ]00“СТСТСТО(ОСоФСТ(СТЧОС'СТ OOOOOOOCDO Латунь ЛС59-1 (состояние по- ставки)
ф О о СТ СТ СТ “ СТ | | | 1 | 1 1 1 1 1 | | 1 1 1 О со to — О Со to о Латунь Л-68
СО to to ~ и- <“* | | | | | | | Ф (Ст - Ст СО О СТ Ф се ст - to to to - - ГСФСеСоФФ^О ФСВГССССОСоСВСС CntOCncOCDCDOOOOCO Бронза БрБ2 отожженная
ст ст to - - to 5 £ С СТ СТ СТ СТ СТ .° СТ СТ СТ | 1 1 ! 1 1 1 1 1 1 сосостофсоо^-офст(оо о о — Броза фосфори- стая отожженная
СООСТФСТ(0[ф« СТ СТ 5 СТ 5 СТ СТ СТ ст СТ СТ ст СТ | | | | [ I I I | | Ю О Ф Ф СО 1- ►- со О СО — о Бронза бериллие- воя состаренная
СоО'^ФфСОСОЮ-^ I | I 1 I 1 totototo — -л^ОООСПОСПО-ьфСОЮ 1 1 1 1 ( 1 О ф to 00 Си to - - « - - - С— м О. О, О' о О О' О' О О О О О' О' о О' о о о Купаллой соста- ренный
СООСЛФСОЬЭ^-*'— | О Ф Ч ОО СО ~ О CD СП | | | | | | | | | | СП 'о -0 Ъ1 •— СО ~ •— "о о о о СП — to о Нейзильбер
rototo-b-------- СО tO •—* CD 00 СО 00 00 Ф СО •—* О СО СО СО tO tO •—* »—1 О | | О -<] Со -<] О о О О 'от О to о 'со •— СП CD Ю CD ГО СО ОСЛООООООО Константан
CD CD СП СО tO СТ £ £3 СТ СТ СТ СТ СТ СТ СТ СТ СТ СТ | | | 1 1 1 1 1 1 1 СО О Ф — к- •— СП CD Ч to Се Мельхиор
CnOT-^COOCDCDOOOTCotO — OCOCn СП CD CD СП О СП О' О О "о О О' О О' СП ! 1 1 1 1 1 1 1 Тнтан ВТ1-1 отож- женный
to >—* <— to | | | | | | CD о се -] СП Ф со « - - о о о j | "о о О Се О Ч ел ~ CO CD Ф — CD CD Ф ООООСЛООООООООО Монель горяче- катаный
СП СП ф СО' О О се CD СП ф | СС -“ | | | | | | | '*>— CD ~ Q С Со tO М~ Ф Ч О] СП ' О О О СП О о о Нержавеющая сталь 12Х18Н10Т закаленная
10,0 18,0 20,0 24,0 30,0 32,0 39,0 40,0 47,0 54,0 53,5 53,0 51,0 50,0 49,0 49,0 Припой РЬ40— Sn60
totototo^b-^^^ — | | I 1 | | >ФЮОООССССФ*^*0'ОСС-^СП .>ФГОО ослслоослослоособо^-фко^-сэ о о о о о о о Сплав Вуда
Таблица 4.67. Теплопроводность, Вт/(м-К) [746], некоторые металлов и припоев, используемых
машиностроении и приборостроении [109, 113]
Ш
qioo'HQogodvovvax
Таблица 4.68. Теплопроводность некоторых чистых металлов и сплавов при очень низких температурах, Вт/(м-К)
Материал , Чистота, % т, к
0,1 ; 0,2 0,3 0.4 0,5 0,6 0,7 0,8 0,9 1,0
Алюминий [398] 99,999 65 130 195 260 310 340 410 459 520 690
Алюминий сверхпроводя- щий [398] 99,999 0 10 20 40 90 160 240 320 420 540
Вольфрам [398] — — 0,8 2,8 4,6 6,7 8,9 10,8 12,1 12,6 14,4
Гольмий [864] — 3,1 6,2 9,3 12,4 15,5 18,6 21,7 24,8 27,9 31
Золото [398] 99,999 13 26 39 51 66 82 100 101 120 —
Кадмий нормальный [398] 99,999 (отожженный) — — — 85 130 185 231 284 — —
Медь Си-1 [399] 99,9993 5,9 11,8 17,5 23 29 — — — — — .
Медь Си-2 [399] 99,9891 2,8 5,6 8,4 11,2 14,0 16,8 19,6 — — —
Медь Си-3[399] 99,9463 0,6 1,2 1,8 2,4 3 3,6 4,2 4,8 — —
Никель* [398] 99,995 2,5 5 7,5 10 12 15 18,5 19,5 22 23
Палладий [398] 99,999 3,7 7,4 Н,1 14,8 18 22,5 25,5 28 33 —
Платина [398] 99,999 2,9 5,8 8,7 П,6 14,9 19,2 22,4 26 — —
Рений нормальный [398] 99,994 (монокристатл) — — — 32 40 59,6 68 77 86 но
Рений сверхпроводящий [398] То же — — — 4,5 12 21 30 45 60 89
Серебро [398] 99,999 1,3 2,6 3,9 5,2 ; 6,6 8,3 9,2 10,2 12 —
Тантал нормальный [398] 99,999 (монокристалл) - — — __ 5,2 6,8 8,7 9,2 10,8 12,3 —
Тантал сверхпроводящий [398] — — — — 1,22 2,67 5,1 8,15 19,8 11,3 —
Для Ni при 20,6 К X—47 и при 4 [С Х=97 Вт/(«-К).
Физические свойства веществ при низких температурах
Теплопроводность
143
Таблица 4,69 Средняя интегральная
теплопроводность некоторых сплавов
и графитера, Вт/(м-К) [118]
Материал Т, К-
4,2—20,4 20,4—78 4,2—78
Бронза фосфористая неотожженная 6,24 19,4 15,3
Графитер АУГ-3 0,0327 0,417 0,353
Графитер АУГ-4 0,392 9,63 7,67
Дюралюминий неотож- женный 21,55 69,5 59
Купаллой неотожжен- ный 68,7 213,5 182,5
Медь отожженная 217,7 452,2 400,2
Медь неотожженная 149,9 394 342,9
Мельхиор отожженный 5,35 23,9 19,9
Мельхиор неотожжен- ный 2,24 11,9 9,8
Манганин неотожжем- ный 2,17 9,08 7,57
Сталь нержавеющая неотожженная 1,195 5,86 4,86
0,1'~-----------------шиы----------L_J
£ 4 10 20 00 100 5 К
Рис. 4.20. Теплопроводность: серебра Ag
чистотой 99,999% [376], золота Au (отож-
женного) чистотой 99,999% [377], меди
Си высокой чистоты [378], алюминия А!
(монокристалла) [379], висмута Bi и сурь-
мы Sb (очищенных зонной плавкой) [380]
Теплопроводность неметаллических ма-
териалов и компаундов см. на рис. 4.27 и
i-в табл. 4.75 и 4.76. Теплопроводность эпо-
ксидной смолы с неметаллическими напол-
нителями см. в [879]. Увеличение темпера-
туры термообработки повышает теплопро-
водность и уменьшает теплоемкость литий-
Таблица 4.70. Изменение теплопроводности металлов в магнитном поле [746]
Металл т, к при индукции магнитного поля, Тл
о,1 0,2 0,3 0.4
Попе- речное поле Про- дольное поле Попе- речное поле Про- дольное поле Попереч- ное поле Продоль- ное поле Попе- речное поле Продоль- ное поле
Гадолиний монокристал- 2,3 1,28 1,25 1,57 1,55 1,85 1,73 2,12 1,88
, лический 3,4 -1,24 1,22 1,48 1,46 1,77 1,68 2,05 1,78
4,6 1,24 1,22 1,48 1,46 1,73 1,66 1,98 1,75
Кадмий (чистота 2,7 6,01 — 21,0 .— 36,0 — 53,0
”99,995%) монокристал- 3,5 4,02 — 17,0 — 30 — 45,0 —-
лический
Свинец (чистота 2,7 1,30 1,20 2,70 1,30 4,40 1,50 6,01 1,80
'99,998%) монокристал- 5,3 1,20 — 1,40 — 1,60 — 1,90 —
лическнй 6,4 1,10 — 1,20 — 1,30 — 1,40 —
Серебро (чистота 2,2 1,01 1,00 1,06 1,02 1,10 1,04 1,15 1,06
'99,999%) голикристал- 3,2 1,01 — 1,03 — 1,07 — 1,11 —
лическое
Таллий (чистота 2,8 2,01 — 3,30 — 4,60 — 6,02
99,99%) г.оликристалли- 3,4 1,60 ' 1,30 2,45 1,70 3,20 2,1 1 4,03 2,15
веский 4,4 1,65 1,20 1,75 1,40 2,10 1,60 2,45 1,7и
Синк (чистота 2,5 1,08 1,05 1,22 1,10 1,37 1,15 1,55 1,17
’99,997%) монокристалли- 3,4 1,Ю 1,04 1,24 1 д9 1,40 1,14 1,57 1,16
веский 4,5 1,06 1,01 1,18 1,<5 1,34 1,12 1,49 1,14
144
Фазические свойства веществ при низких температурах
Рис. 4.21. Теплопроводность: бериллия Be
(монокристалла) [805], ванадия V чисто-
той 99,9% [381], вольфрама W (монокри-
сталла) [382], кадмия Cd (монокристалла)
чистотой 99,995% [383], кобальта Со
(отожженного) чистотой 99,999% [382],
лантана La чистотой 99,94% [383], маг-
ния Mgl (отожженного) чистотой 99,98%,
Mg2 (холоднотянутого) чистотой 99,98%
[385], марганца Мп (отожженного) чис-
тотой 99,99% [386], ниобия Nbl чистотой
99,9% [381, 395], Nb2 с р0=3,51 мкОм-см
[866], олова Sn [387], таллия Т1 [387],
урана U [387], церия Се чистотой 99,6%
[383], циркония Zr чистотой 98% [383],.
эрбия Ег чистотой 99,885% [390]
чистотой 99,99%, скрепляющего медные или
бериллиевые пластины, см. в [878]. Терми-
ческое сопротивление между материалами,
погруженными в эпоксидные смолы, при
Таблица 4.71. Теплопроводность
алюминия А999, Вт (м-К), в поперечном
‘ магнитном поле [746]
т, к В, Тл
0 0,5 1,0 3,0 5,0
5 3100 2700 2600 3700 3900
10 3650 3150 2800 2900 3050
20 5750 3730 2700 2050 1750
30 3600 3150 2700 1500 1170
40 2250 2050 1850 1100 760
50 1300 1200 1100 800 600
60 855 750 750 600 500
‘ 70 550 500 500 450 400
80. 400 400 400 400 400
алюмосиликатных стекол [117]. При низких
температурах корунд и алмаз снижают теп-
лопроводность компаунда, а кварц и стекло
повышают. Тепловой поток в интервале
температур от 2 до 200 К через слой индия
толщине слоев смолы 0,04—0,1 мм пример-
но равно контактному сопротивлению [879].
Термическое сопротивление замазок, исполь-
зуемых в физических экспериментах при
очень низких температурах, дано в [879].
Таблица 4.72. Теплопроводность медно-марганцевых сплавов, Вт/(м-К), в магнитном
поле [746]
В, Тл
Т, К Си+0,11% Мп» Си + 0,21% Мп* Си + 0,30% Мп*
0 1,04 1,375 1,74 0 1 1,04 1,375 1,74 0 1,04 1,375 1,74
2 22,0 27,0 30,0 35,0 8,30 9,05 9,40 110,0 6,80 7,30 7,50 8,05
3 30,0 35,0 38,0 43,0 11,7 12,3 12,6 13,0 9,50 10,0 10,3 10,7
4 45,0 51,0 55,0 62,0 16,0 16,5 17,3 17,8 14,5 14,9 15,1 15,7
Состав в атомных процентах.
Т еплопроводность
145
Рис. 4.22. Теплопроводность: железа Fe
(отожженное) чистотой 99,99% [383], мо-
либдена Мо чистотой 99,95% [383], нике-
ля № (отожженный) чистотой 99,99%
[805], палладия Pd (отожженный) чисто-
той 99,99% [388], платины Pt (отожжен-
ная) чистотой 99,999% [383], рения Re
(очищенный зонной плавкой) чистотой
99,998% [389], хрома Сг (перекристалли-
зованный) чистотой 99,998% [389]
Рис. 4.24. Теплопроводность щелочных ме-
таллов высокой чистоты [394]: калия К,
лития Li, натрия Na, рубидия Rb, цезия Cs
Рис. 4.25. Теплопроводность: иттербия Yb
чистотой 99,9% [ПО], иттрия Y чистотой
99,9% [111], лютеция Lu чистотой 99,9%
[110], скандия Sc чистотой 99,9% [111],
тулия Ти чистотой 99,9% [110]
Рис. 4.23. Теплопроводность: гафния Hi
с 1% циркония [381], галлия Ga (моно-
кристалла) [383], индия In чистотой
99,993% [383], иридия 1г (отожженного)
чистотой 99,99% ,[383], родия Rh (отож-
женного) чистотой 99,99% [393], свинца
РЬ (монокристалл) чистотой 99,998%
[383], тантала Tai чистотой 99,98% [383],
тантала Та2 [387], тербия ТЬ чистотой
99,84% [392], титана Ti [387], цинка Zn
(отожженный монокристалл) чистотой
99,997% [383], деформированного техноло-
гического титана ВТ-1 [395], сплавов [395]
алюминиевого, обработанного давлением
(АД-1) и алюминиево-магниевых (АМГ-3
н АМГ-6)
10—218
1 аблица 4.73. Теплопроводность Полупроводниковых материалов, Вт/(м К) [746]
т, к Ge 2; носи- телей 1018 в J см8; р= =3(4-4 Ом-см при 200 К Ge 7; носи- телей 2,3-1016 в в 1 см3; р= ' =0,184- 4-0,20 Ом-см прн 200 К Gr 12; носи- телей 1019 1 см8; р— -0,00354- 4-0,0018 Ом-см при 300 К Si; носителей 1013 в 1 см3; р- = 184-26 Ом-см Si; носителей 5- [04 в 1 см3; Р= = 154-25 Ом • см Se кри- сталличес- кий В5; 99,99999% Se аморф- ный ВЗ, В4, В5 В поли- кристал- лический; 99,9% Р чер- ный; 99,8% S поли- кристал- лическая II оси; 99,9% Те 5; 99.99% Карбид кремния SIC RJ6 Карбид титана Т1С, TiC0,83
2 95 7,0 3,0 10 30 . 8 0,064 3,20 450 1,30 3,05
4 15 403 1400 125 942 8,0 200 80 1050 190 1650 33,10 0,054 37 256 0,5 27,4 10,6 3,84 900 120 28
1200 950 300 1200 1700 32,635 0,096 300 45 2,35 77 2200 17,0
ои 1 on 260 161 90 366 208 910 1080 8,452 0,305 187 33,6 0,654 12 3320 33,'1
200 273 242 100 —• — 606 287 3,807 3,389 0,318 0,364 ПО 50 26 18,6 0,500 0,355 7,0 4,0 2080 1000
о4 56 —~ 178 3,159 0,481 30 15,3 0,287 — 600 ——
^Примечание.
В таблице приведены некоторые характерные материалы
и величины. Более подробно см. [743].]
Таблица 4.74. Теплопроводность некоторых сверхпроводников, Вт/(м-К)
г, к Ванадий V [131J; Р273/₽4,2= 1570; З’к=5,4 К Свинец РЬ [869]; Г =7,1 К т, к VaSi [871] т, к Nb + 51,6%»Ti ]102]; Гк=9,91 К Nb+37%*Ti [102]; Гк =9,37 К
нормал ьиый сверхп ро2о- Дящий нормальный сверхпрово- дящий 99,99%; чис- тый, гранулы 0,9—3 мм Гранулы 60—110 мкм Проволока диаметром 112 мкм Стержень се- чением 0,52 см2
2 350 82 1700 200 0,1 0,012 5 - Ю~4 4 0,14 0, 11
3 489 270 1900 400 0,2 0,05 3-10-3 5 О' 19 0J7
4 620 400 1780 350 0,5 0,12 0,03 6 0'27 0,21
5 720 700 1190 300 1,0 0,6 0,15 8 044 0,39
6 800 800 720 310 2,0 1,2 О',5 10 0^58 0,50
7 850 859 470 400 4,0 1,5 1,0 14 О', 88 0J0
8 900 900 300 300 5,0 1,2 1,5 20 1 ,32 0,96
9 950 950 200 200 10,0 1,5 5,0
20,0 8,0 10,0
♦ Мсссозые доли, %,
Фазические свойства веществ при низких температурах
Теплопроводность
147-
Таблица 4.75. Теплопроводность неметаллических материалов, Вт/(м-К)
т, к Кварц кристал- лический [746] Сапфир монокрис- талличес- кий син- тетический l746] Кварцевое стекло Si(X>99,95 L746] Пирексо- вое стекло SiO2>80% [746] Легкий крон ЛК5 [746] Алмазы [746]
вдоль оси поперек оси Тип I Тип Па Тип Пб
5 200 0,130 0,12 70,0 50,0 30,0
10 — 1100 0,140 0,13 — 350 300 200
20 — 4000 0,165 0,15 — 1200 1900 1200
30 — 6000 0,200 0,17 — 2000 4200 3000
40 — 6200 0,252 0,25 — 2630 6930 4630
50 4500 0,320 0,30 — 3000 9000 5500
60 — 2600 0,366 0,37 — 3150 10 680 6270
70 — 1700 0,424 0,42 — 3200 11 000 6500
80 48,9 24,5 1140 0,482 . 0,48 — 3150 10 900 6340
90 38,9 21,4 700 0,542 0,50 0,519 3020 10 600 5860
100 35,3 19,4 360 0,650 0,55 0,592 2800 10 000 5000
120 30,5 16,4 — 0,750 0,63 0,721 2310 7960 3600-
140 26,6 14,2 — 0,850 0,72 0,825 1940 6600 2920
180 20,4 11,0 — 1 ,С4 0,85 0,972 1450 4720 2210-
200 17,9 9,80 — 1 ,С8 0,89 1,02 1300 4000 2000
220 15,8 8,82 — 1,10 0,93 1 ,С6 1185 3400 1830
240 14,0 7,90 — 1,16 0,96 1,10 1690 2910 1680-
260 12,4 7,20 — 1,22 1,00 1,13 1010 2520 1560
273 11,4 6,82 — 1,26 1,02 1,15 960 2330 1500-
280 10,9 6,60 — 1,40 1,05 1,16 940 2230 1470
293 10,0 6,30 — 1,66 1,08 1,18 912 2070 1420
300 9,50 6,10 25,1 1,80 1,10 1,19 900 2000 1400
Продолжение табл. 4.75
т, К Графиты [746] Углеродное волокно вдоль нити
ПРОР УПВ-ГТ Температура карбонизации, °C
Вдоль направ- ления прес- сования Поперек на- правления прессования Вдоль оси Поперек оси 1400 2800
50 8 7 1150
60 14 12,5 1440 ' — — —
70 21 19 1727 — — —
83 29 26 2000 — 6 175'
93 38 34 2300 — 6 186
ьо 48 43 2580 2,9 7 198
120 66 57 2970 4,1 10 128.
140 81 68 2860 5,3 14 16)
163 93 77 2660 5,8 18 195
183 104 83 2450 6,2 23 222
210 113 89 2250 6,3 27 246-
220 119 93 2075 6,4 30 268
240 123,5 96,5 1935 6,47 33,3 287
253 125 98 1820 6,5 35 296
263 125,8 99,2 1740 6,51 36,3 Зь'З
273 125,5 1о0 1640 6,5 38 31 )
283 124,7 99,7 1580 6,48 38,5 317'
300 120 97 1440 6,4 43 33J.
10*
148
Физические свойства веществ при низких температурах
П родолжение табл. 4.75
т. к Полимеры т, к Стекло- эпоксид- ный ком- паунд_]_ во- локнам с 36%* эпок- сидной смолы [828] Т, К Механи- чески об- работан- ная кера- мика ИЗ боралюми- нневого силикат- ного стек- ла [860] Электропрово- дящая эпок- сидная смола с 25%** Ag Рзоо=4,9-10’4 Ом-см; Psoo/pio—- =2,3 [868]
Полиэфир- амидимид- ная пленка [8281 Фторо- пласт-4 [2071 Полиэти- лен р= =9384- 4-971 кг/м3 1859; Силиконо- вый каучук (ГДР) [108]
2 — — 0,011 14 0,103 0,1 7-10-е 1 • Ю-з
4 0,024 0,06 0,08 0,021 16 0,107 0,2 6-10-5 2,5-10-з
5 0,027 0,07 0,09 0,023 18 0,112 0,4 2,5-10-* 5-10-3
6 0,030 0,08 0,095 0,027 20 0,117 0,6 7-10—4 9-Ю-3
8 0,035 0,09 0,010 0,036 25 0,130 0,8 2-Ю-3 1,4-10-2
10 0,041 0,11 0,012 0,049 30 0,142 1,0 4-Ю-з 2-10-2
11 — —— — 0,062 35 0,154 2,0 2,5-10-2 5-Ю-2
12 — — — 0,057 40 0,164 4,0 0,1 l-10-i
13 —— — —- 0,061 45 0,173 6,0 0,15
15 0,053 — 0,014 0,073 50 0,182 8,0 0,25
18 — —— —. 0,084 55 0,191 10,0 0,40
20 0,065 0,16 0,015 0,090 60 0,200 20,0 0'60
30 0,086 0,18 0,021 65 0,208
40 0,103 0,23 0,025 — 70 0,217
50 0,117 —. 0,035 —. 75 0,227
60 0,128 0,24 0,045 — 80 0,237
80 0,147 * 0,070 85 0,247
100 0,161 0,26 1,0 90 0’259
.120 0,171 — 1,7 — 95 0,271
140 0,179 — 2,4 — 100 0,284
160 0,185 —. 3,1
180 0,190 3,8
200 0,194 0,285 4,5
240 0,200 — 6,7
280 0,204 . 8,9
300 0,205 0,290 10 —
* Массовые доли, %.
** Объемные доли, %.
Таблица 4.76. Теплопроводность компаундов, Вт/(м-К) [124]
т, к Эпоксидированная стекло- лента Текстолит А Стеклотекстолит СТЭФ-1
Вдоль ВОЛО - кон Поперек волокон Вдоль слоев Поперек ело ев Вдоль слоев Поперек слоев
4 0,054 0,034 0,038 0,025 0,074 0,059
6 0,074 0,041 0,048 0,032 0,083 О'070
8 0,089 0,051 0,061 0,040 0,093 0,081
10 0,100 0,064 0,064 0,047 0,103 0 095
12 0,102 0,064 — 0,108 0,098
14 0,110 0,069 — ___ 0,114 0 106
16 0,120 0,076 — 0’ 122 0 114
18 0,129 0,080 О; 129 0 122
20 0,134 0,083 — — 0,133 О; 128
-85 — — — — 0,300 0,230
Теплопроводность
149
Рнс. 4.26. Теплопроводность при низких
температурах тантала с psoo/P4,2=47 и
ниобия с рзоо/р4,2=60,5 [863]:
/ — тантал сверхпроводящий; 2 — тантал нор-
мальный; 3 — ниобий сверхпроводящий; 4 — нио-
бий нормальный
Рис. 4.27. Теплопроводность полимеров при
низких температурах [854]:
1 — полиэтилен с £>=0,971 г/см3; 2 — полиэтилен
с р—0,956 г/см3; 3— нейлон; 4—полиэтилен с
р==0,914 г/см3; 5 — полиэтилен с р==0,933 г/см3
Таблица 4.77. Теплопроводность кварцевого стекла, пирекса и полимеров при очень
низких температурах X» МВт/(м-К)
Вещество г, К
0,2 0,4 0,6 0,8 1 2 1 3 1 4 5
Кварцевое стекло [120] 1,0 3,7 7,6 12,8 18,7 49,8 77,3 95,3 —.
Пирекс [120] — — 6,0 12 17 42 69 88 —.
Полиэтилен [853] — — 0,52 0,8 1,1 — — — —
Нейлон [854] — — — — — 4,3 7,3 10,5 13,5
Нейлои [851] 0,15 0,58 1,1 1,6 1,6 4,8 7,5 11 —
Kel F [851] 0,3 1,25 2,4 3,3 5,0 10 14,5 19 —
Тефлон [851] — 0,4 1,2 2,5 3,3 11 20 30 42
Полистирол [855] — — — , —— 12 20 24 26 —
Плексиглас [8551 — — — — 22 37 47,5 51 —
Таблица 4.78. Удельные теплопроводности и теплоемкости некоторых веществ [52, 121]
Наименование t, °C р, кг/м* с, Дж/(кг.К) \ Вт / (м«К)
Бензол 0 900 82—101 0,147
Вода 0 998,2 0,2363(20°С) 0,552
Глицерин безводный 0 1260 139 0,283
Глицерин4-50% воды 0 ИЗО 194 0,39
'Оливковое масло 39 ^916 103 0,175
Минеральные смазочные масла 30 ^920 100 0,131—0,142
Керосин 20 800 120 0,15
Ртуть 0 13 600 7,92 8,4
Этиловый спирт 0 790 139 0,159
Снег 0 150 0,116
0 200 — 0,151
0 300 0,233
0 400 — 0,337
0 500 — 0,47
0 600 — 0,64
0 800 — 1,28
150
Физические свойства веществ при низких температурах
Продолжение табл. 4.78
Наименование t, °C р, кг/м3 с, Дж/(КГ.К) Вт/(м-К)
Лед водный 0 917 2,21
—20 920 — 2,44
—40 922 2,67
—60 924 — 2,91
—80 926 —- 3,14
— 100 928 —. 3,5
— 120 929 — 3,84
4.7. ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА!
В соответствии со свойствами, про-
являемыми в электрическом, магнитном и
электромагнитном полях, электрорадиотех-
нические материалы разделяют на сверх-
проводники, проводники, полупроводники,
диэлектрики и магнитные материалы.
О сверхпроводниках см. § 4.14.
Основное электрическое свойство про-
водников — высокая электропроводность.
В проводниках заряды свободно перемеща-
ются на большие расстояния под действием
внешнего электрического поля. Внутри про-
водников электрическое поле практически
отсутствует.
Основное электрическое свойство ди-
электриков, находящихся во внешнем элек-
трическом поле, — их способность к поляри-
зации. В результате внутри диэлектриков
возможно электростатическое поле. В ди-
электриках наблюдается небольшая элек-
тропроводность; они тем ближе к идеаль-
ным диэлектрикам, чем слабее в них про-
являются замедленные виды (см. Ниже)
поляризации1, приводящие к выделению теп-
лоты в. результате диэлектрических потерь.
Диэлектрические потери возрастают с уве-
личением приложенного напряжения. При
определенных его значениях в электроизо-
ляционных конструкциях возникают частич-
ные разряды вследствие йонизации газовых
включений или жидких диэлектриков в про-
питанной слоистой изоляции или в зазорах
между твердым диэлектриком и электрода-
ми. Частичные разряды могут быть причи-
ной развития пробоя изоляции. Напряжен-
ность электрического поля, при которой
в какой-либо точке диэлектрика происходит
пробой, называется электрической проч-
ностью.
По поведению в магнитном поле элек-
трорадиотехнические материалы подразде-
ляют на сильномагнитные и слабомагнит-
иые [129]. Большинство электрорадиотех-
нических материалов — немагнитные.
Электропроводность. Электропровод-
ность определяет свойство вещества под
1 В подготовке материалов § 4.7 принимал
участие Н. Г. Анищенко.
действием не изменяющегося по времени
электрического поля проводить электриче-
ский ток, постоянный по величине и направ-
лению. Количественно электропроводность,
описывается законом Ома j=yE, где j —
плотность тока, А/м2; Е — напряженность
электрического поля, В/м; у — удельная
электрическая проводимость, (Ом-м) !. На
практике чаще используют удельное элек-
трическое сопротивление р=1/у.
К диэлектрикам относят вещества и ма-
териалы, имеющие при нормальной темпе-
ратуре и влажности и не слишком высоких
значениях Е (<2 МВ/м) величину р=106ч-
108 Ом-м и выше [129]. Обычно различают
объемное (р) и поверхностное (ps) удель-
ные сопротивления твердого диэлектрика.
При этом р численно определяет объемный
ток утечки сквозь толщу диэлектрика, a о,.-
характеризует состояние слоя повышенной
электропроводности на поверхности твер-
дого диэлектрика, окруженной газообразной
или жидкой средой. С понижением темпе-
ратуры р диэлектриков, как правило, уве-
личивается. В табл. 4.79 приведены экспе-
риментальные значения р некоторых твер-
дых диэлектриков, используемых в криоген-
ной и сверхпроводящей технике.
Жидкие криоагенты при низких Е —
хорошие диэлектрики, особенно если они
находятся в слабокипящем или вовсе не
кипящем состояниях. Существующая у них
незначительная проводимость объясняется
ионизацией под воздействием космического
излучения. Увеличение числа ионов по всей
вероятности может происходить только
в пузырьках пара. При высоких напряжен-
ностях электрических полей число ионов
в жидкостях может увеличиваться за счет
эмиссии свободных электронов с электро-
дов. Однако когда электроды покрыты
слоем жидкости, электронная эмиссия за-
труднена. Поэтому р жидких криоагентов
выше, чем р образующихся из них газов.
Точные измерения р низкотемпературных
жидкостей весьма затруднительны. Ориен-
тировочно р жидких аргона, азота, водоро-
да, углекислоты, фреона — в пределах
1014—101в Ом-м. По [130] р жидкого азота
(0,3—=-5) 1017 Ом-м, жидкого водорода —
Электрические свойства
151
Таблица 4.79. Удельное объемное сопротивление некоторых твердых
диэлектриков р, Ом-м [132, 842]
Материал 300 к ~80К ~5 К
Полиамид (кантон) 2-1013 >2-1016 >2-1016
Поликарбонат (лексан) 3-1013 >2-1016 >2-1016
Полиэтилентерефталат (майлар) 2-1015 >2-1016 >2-1015
Политетрафторэтилен (тефлон) 3-10И 4-101° —
Поливини лхлорид >1-1012 2-1013 >1-1011
Полиэфирный лак 1-1013 >1-1011 1-1015
Кремнийорганический лак =5=2- Юн >1-1016 >4-1015
Примечание. Тефлон перед испытаниями выдержан в течение двух недель при 300 К и 90 %-ной
относительной влажности. Образцы из остальных материалов перед испытаниями вакуумированы.
(1,5-э-5)-1017 Ом-м, жидкого аргона —
(3-~7)-1015 Ом-м. У жидкого дейтерия
яеЮ12 Ом-м, что объясняется присутствием
[J-активного трития [827], концентрация
которого повышается одновременно с по-
вышением концентрации дейтерия в про-
цессе извлечения из смеси изотопов.
Диапазон р полупроводников при нор-
мальной температуре условно ограничивают
значениями 10-6-—108 Ом-м [129]. Удель-
ное сопротивление полупроводников растет
с понижением температуры. Полупроводни-
ки характеризуются сильной зависимостью
р от концентрации примесей, а также тем-
пературы и других внешних воздействий
(электрического поля, ионизирующих излу-
чений, света и т. п.).
Проводники с ионной проводимостью
не могут быть, как правило, использованы
при криотемпературах, так как обычно та-
кими проводниками бывают жидкости, ко-
торые при этих температурах замерзают.
Электропроводность металлов объясня-
ется перемещением свободных электронов
под действием электрического поля. Элек-
трическое сопротивление металлов возни-
кает вследствие тепловых колебаний решет-
ки: на него большое влияние оказывают
атомы примесей и физические дефекты ре-
шетки. Обычно принято удельное сопротив-
ление интерпретировать как р=ри+Ро, где
ри — идеальное сопротивление; р0 — оста-
точное сопротивление (правило Маттисена).
При нормальной температуре электри-
ческое сопротивление чистых металлов опре-
деляется в основном тепловыми колебания-
ми решетки и потому пропорционально
абсолютной температуре.
При очень низких температурах тепло-
вое возбуждение имеет малое значение;
в диапазоне температур, меньших 10—14 К,
у очень чистых металлов ри изменяется
пропорционально Г8 [123]. При этих тем-
пературах полное сопротивление почти не
зависит от температуры и стремится к зна-
чению остаточного сопротивления р0, кото-
рое находят как нижний предел сопротив-
ления при экстраполяции его к абсолютно-
му нулю. Остаточное сопротивление сильно
зависит от чистоты образца. Вследствие
этого для определения при низких темпе-
ратурах сопротивления образца, чистота ко-
торого не известна, принимать справочные
данные для чистого вещества весьма риско-
ванно. Следует использовать данные по изме-
рению сопротивления образца при температу-
ре окружающей среды R г° и при температу-
ре жидкого гелия R4-2. При больших значе-
ниях jR^/jR4’2 сопротивление R&’2 можно при-
нять за остаточное. Сопротивление RT при
температуре Т определяют следующим
образом [225]. Идеальное сопротивление
при температуре окружающей среды
Ri = RTo—Ri'i.
Исходя из уравнения Грюнейзена — Блоха,
Таблица 4.80. Зависимость Р/'/р®
от отношения Q/Т в соответствии
с уравнением Грюнейзена—Блоха [225]
9/Г е/г
0 3,5 0,1639
0,1 10,55 4,0 0,1216
0,2 5 268 5,0 0,0679
0,4 2,617 6,0 0,03849
0,5 2,083 7 0 0,02220
0,6 1,725 8 0 0,013j8
0,8 1,274 9,0 0,00791
1,0 1 000 10,0 0,00492
1,2 0,813 12 0,002.171
1,4 0,678 13 0,001401
1,5 0,623 14 0,000972
1,6 0,574 16 0,000500
1,8 0,493 18 0,000278
2,0 0,426 20 0,000164
2,5 О,3ь43 25 0,0000526
з,о 0,2220 30 0,0000220
Таблица 4.81. Удельное электрическое сопротивление элементов р , мкОм-см
Элемент Сопротив- ление Температура, К Остаточное сопротивление ро, мкОм-см
295 273 250 200 150 100 75/78 50 40 30 20 15 10 5
Алюминий [225] Идеальное 2,76 2,5 — (1,64) (1,06) 0,48 0,21 — — — 0,0036 .
Америций [881] Полное 61 58 — 48 39 28 22 15 10,5 7,5 4,5 3,5 2,9 —
Барий [832] Идеальное — 60,0 — — — — 14,4 8,65 6,59 4,00 1,52 0,67 0,16 —
Бериллий [832] Полное — 2,8 — — — — 0,85 — — — 0,77 — — 0,77
Ванадий [123, 127] Полное — 18,2 — 12,7 9,1 5,4 3,3 2,3 2,2 2 1,8 1,8 1,8 1,8 —
Висмут [833] Идеальное 116 105 93 74 55 37 29 19 15 10 5,8 3,4 1,35 0,20 1,7—2,4
Вольфрам [382] Идеальное 5,32 4,80 — 3,20 2,11 1,03 0,51 0,150 0,070 0,022 0,0057 0,0027 (0,009) — 0,0295—0,0456
Галлий [126, 884] Полное — 13,6 — — — — 2,75 — — — — — — 1,6 + 0,8- 10-е
Гафннй [225] Полное — 29,6 — — — — __ — — — — — — — —
Германий [123] Полное — 89 000 — — — — — . — — — — — — — —
Графит [125] Полное — 35004- 6300 — — — — — — — — — — — — —
Европий [861] Полное 89,5 87 84 78,5 75,3 78 57 35 27 18 9 6,3 3,75 1,25 0,5 (имеет максимум при 90 К±0,3)
Железо [225] Идеальное 9,80 8,69 — 5,34 3,15 1,24 0,52 0,13 0,06 0,023 0,007 0,0038 0,0015 — —
Золото [225] Идеальное 2,21 2,04 — 1,45 1,05 0,65 0,42 0,20 0,12 0,050 0.012 0,0037 0,0006 — —
Индии [834, 140] Полное — 8,4 — — 2,43 1,68 0,966 0,672 0,412 0,168 0,084 — 0,00252 0,000135
Иридий [393] Идеальное 5,05 4,63 — 3,15 2,12 1,08 0,60 0,20 0,11 0,034 0,0050 0,00125 — — 0,1034
Иттербий [861] Полное 28,5 27,5 26,6 24 20 15,5 12,5 8,75 7 5,5 3,75 3 2,75 2,5 —
Кадмий 1126] Полное — 6,8 — — — — — — — — — — — —
Калий [394] Идеальное — 6,1 — — — — 1,6 — — — 0,36 0,302 0,27 0,26 0,26
Кальций [832[ Полное — 3,43 — — — — 1,21 0,86 0,75 0,64 0,56 0,54 0,53 — —
Кобальт [382] Идеальное 5,80 5,15 — 3,23 1,98 0,90 0,460 0,150 0,079 0,030 0,0065 0,0025 — — 0,0902
Кремний [126] Полное — 1034-10« — — — — 106 — — — — — — — —
Лантан [126] Полное — 54 — — — — — — — — — — — — —
Литий [394] Идеальное — 8,55 7,54 5,643 3,74 1,84 0,91 0,342 0,2 0,086 0,0103 0,0026 — — 0,028
Магний [126, 836] Полное — 3,9 — 2,74 1,9 0,97 — — — — — — — —
Марганец [386] Идеальное 140 — __ 130 125 120 120 115 100 78 45 29 11 2,75 16,8
Медь [124] Идеальное 1,69 1,55 — 1,05 0,71 0,35 0,18 0,049 0,023 0,0061 0,0010 0,0002 — — —
Молибден [126] Полное 5,2 — — — — — 0,7 — — — — — — — —
МышьЯК [121] Полное — 32 — — — — 5,5 — — — — — — — —
Физические свойства веществ при низких температурах
Продолжение табл. 4.81
Элемент Сопротив- ление Температура, К Остаточное с on ро тпалеи не Ро, мкОм-см
295 273 250 200 150 100 75/78 50 40 30 20 15 10 5
Натрий [225] Идеальное 4,84 4,40 — 2,95 2,10 1,20 0,74 0,34 0,18 0,072 0,015 0,0058 0,00084 0,0031
Неодимий [126, 867] Полное — 61 — — — — — — — — 21,6 19,2 16,4 10,8 7,6
Нептуний [882] Полное 123 — — 105 90 68 55 27 22 12 7 — — 3 —
Никель (225] Идеальное 7,04 6,20 — 3,75 2,25 1,02 0,46 0,14 0,07 0,031 0,009 0,0044 0,0020 — —
Ниобий (125, 864] Полное — 13,9 — — — — 3,0 — — 0,25 0,075 0,05 0,037 — 0,0351
Олово [123] Полное — 11,5 — — — — 2,1 — — — — — — —
Осмий [126] Полное — 9,66 — — — — — — — — — — — —
Палладий [123] Полное — 10,0 — — — 1,73 — — — — — — — —
Платина [225] Идеальное 10,42 9,59 — 6,76 4,78 2,74 1,70 0,72 0,40 0,16 0,044 0,012 0,0029 — 0,0125—0,05925
Плутоний а [882] Полное 150 — — 155 157 158 150 125 107 65 30 20 — 8 —
Празеодим [225, 867] Полное — 65 — — — — — — — — 8,4 5,4 3,2 1,7 1,5
Реиий [382] Идеальное 18,7 16,9 — 11,5 7,7 4,0 2,25 0,75 0,41 0,13 0,016 — — — 0,0139—0,543
Родий [393] Идеальное 4,78 4,38 — 2,39 1,91 0,87 0,42 0,107 0,048 0,0124 0,0922 0,00075 — 0,0084
Ртуть [123] Полное — 94,0766 (жид- кая) — — — — 5,8 (твер- дая) — — — — — — — —
Рубидий [126] Полное — 11,0 — — — — 2,2 — — — 0,76 0,59 0,47 0,40 0,2-0,33
Рутений [126] Полно е — 7,6 — — — 1,33 — __ — — — — — —
Свинец [225] Идеальное 21,0 19,3 — — — — 4,59 2,76 2,04 1,26 ° 0,56 0,25 — — 0,0015
Селен [126] Полное — 8-108 — — — — 9-106 — — — — — — —
Серебро [225] Идеальное 1,64 1,50 — 1,045 0,735 0,425 0,265 0,11 0,058 0,020 0,0042 0,0011 0,0002 — —
Стронций [832] Идеальное — 23 — — — 6,5 3,4 2,4 1,35 0,51 — — —
Сурьма [833] Идеальное 41,3 37,6 34,0 25,9 17,9 10,0 6,5 3,2 2,15 1,2 0,42 0,18 0,033 0,009 0,054—0,57
Таллий [126] Полное — 15 — — — — 3,7 — — — — — —
Тантал [126, 139] Полное — 12,6 — —. — — 2,56 — — — 0,254 0,217 0,200 0,197 0,197
Теллур [126] Полное — 1,6-105 — —. — — — — — — — — — — —
Титан [126] Полное — 50 —- — — — 16 —. — — — — — —
Торий [126] Полное — 13 — — — — 3,2 — — — — — — — —
Урай [126 , 882] Полное — 32 — 25 20 14 9 — — — 3 — — — —
Хром [389] Идеальное 12,5 12,0 11,5 8,0 5,Ь 1,5 0,65 0,15 0,075 0,03 0,0075 0,0033 0,0007 — 5,5
Цезий [126] Полное — 18,8 — — — — 4,5 — — — — 2,41 1,34 0,54 0,19—0,38
Церий [126] Полное — 73 — — — — — — — — — — — — —
Цинк [126] Полное — 5,5 — 3,88 2,77 1,65 1,07 0,52 0,34 0,18 0,08 — — — —
Цирконий [126] Полное — 40 — — — — 7,3 — — — — — — — —
Электрические свойства
154
Физические свойства веществ при низких температурах
Таблица 4.82. Удельное электрическое сопротивление серебра, меди, алюминия и цинка?
подвергающихся оптимальной термообработке, р, нОм-см [838]
Материал Относитель- ная сумма примесей по массе S-10.6 Т, К Рз7з/Р4(2 Р2’з/Р20,4
4,2 20,4 77 195 273
Серебро: 5,56 10,5
техническое <187 284 994 1470 273 157
электролитически очищенное <113 11,0 16,1 294 1040 1490 135 100
химически очищенное <36 1,29 5,10 279 992 1500 1170 322
99,999 %-ное Медь: <36 0,734 4,33 276 991 1500 2040 376
проводниковая прут- ковая 164 8,01 9,19 2С6 1030 1670 202 176
очищенная двойным электролизом <57 0,884 1,93 194 1010 1590 1810 901
очищенная двойным электролизом и элек- тронной плавкой 12 1,11 2,42 195 1000 1590 1430 771
очищенная двойным электролизом и зон- ной плавкой Алюминий: . <6 0,336 1,11 192 996 1580 4710 1550
технический 1860 87 94,2 341 1630 2460 28,3 28,6
чистый 1327 43,9 46,3 270 1620 2420 55,2 57,1
очень чистый 56 5,75 7,66 224 1500 2300 400 328
эк страчистый Цинк: фирмы „Unterharz” 9 1,П .2,38 221 1440 2460 2210 ИЗО
6370 34,7 252 1360 4020 5820 167 24,9
то же 2971 93,1 246 1340 4000 5820 62,5 25,8
чистый фирмы „Unter- harz» <43 9,80 45,2 1110 3900 5830 606 142
очень чистый фирмы .,Unterharz“ <41 3,81 3,68 1160 4010 5990 1570 316*
фирмы ASAECO <29 13,2 48,2 1100 3710 5550 420 125
Электроцинк фирмы BCominco“ 40 И,4 44,3 1100 3750 5570 490 137
Оценочное значение.
По табл. 4.80 находят зависимости р4т /р;0
и ргт °/pts как функции Q/Т. Характери-
стический параметр 0 здесь достаточно хо-
рошо совпадает с дебаевской температурой
0В, полученной из данных по теплоемкости
(см. табл. 4.90). Поскольку р<т/р«7'“=
’=RiT/Rir<>, то Т?4Г = (piT/piz’")jRi7’» и RT=
=RiT-\-Ri’2. Для тех металлов, у которых
известна зависимость идеального сопротив-
ления р, от температуры (табл. 4.81), пол-
ное удельное сопротивление р может быть
найдено как р<-]-р0, где р0 для очень чи-
стых материалов находят по этой же таб-
лице или, что более надежно, измеряют
экспериментально.
В табл. 4.82 приведены удельные элек-
трические сопротивления наиболее употре-
бительных проводниковых материалов в за-
висимости от их чистоты и температуры.
Для чистого отожженного бериллия (ме-
таллические примеси 0,02%, ВеО —0,2%)
имеются следующие данные [835]:
Р27з/р7т,4=47,6; Ратз/рао.з = S3,4; Р27з/р4,2=
= 83,4.
У тонких образцов удельное сопротив-
ление возрастает вследствие рассеяния элек-
тронов на границах образца. Для очень
чистых металлов в области низких темпера-
тур р~1/< где cl — диаметр образца. Для
особо чистой меди эта зависимость приве-
дена на рис. 4.28.
Р азмерный эффект пр актически не имеет
значения для образцов с диаметром более
10—15 мм [920]. Удельное сопротивление
проводников возрастает при деформации,
начиная с некоторого ее значения. Соответ-
ствующие данные для меди и алюминия
приведены на рис. 4.29. Удельное сопротив-
ление возрастает также с увеличением дозы
нейтронного облучения.
Электрические свойства
155
Рис. 4.28. Отношение сопротивлений
/?4к/Р77к, измеренное с помощью постоян-
ного тока как функция величины, обратной
диаметру двух поликристаллических образ-
цов меди, имеющих объемное сопротивле-
ние:
/ — Т?27з/Й4= 11 000; 2 — «2,з/Т?4=30 ООО [137]
Рис. 4.30. Зависимость удельного сопро-
тивления от напряженности магнитного
поля:
1 и 2 — медь соответственно в продольном и по-
перечном поле при 7=4,2 К с р4 2/рзоо = О,89-1О-2;
3 — натрий при 7=4,2 К с р4 2/р3100=2-10—4 [31]
Электрическое сопротивление металлов
зависит от магнитной индукции. По теории
ДРВ _ АВ2
~ D + CtA
(4.20)
Однако у кадмия, натрия и меди при опре-
деленных условиях наблюдалась линейная
зависимость Арв/р от магнитной индук-
ции В. Изменение сопротивления в магнит-
ном поле зависит также от направления
вектора поля по отношению к образцу [31]
и от деформации образца [830].
На рис. 4.30 показано относительное
изменение удельного сопротивления меди и
натрия в зависимости от напряженности
магнитного поля при температуре 4,2 К. На
рис. 4.31 и 4.32 приведены магнитосопро-
тивления алюминия и меди в зависимости
от чистоты, магнитной индукции и темпера-
Напряжекие, МПа
Рис. 4.29. Удельное сопротивление меди и
алюминия в зависимости от механического
напряжения:
А1-1 — алюминий чистотой 99,9999%; А1-4 — алю-
миний чистотой 99,999%; Си-1 — медь тройного
электролиза (ЕТР) отожженная; Си-3 — медь
бескислородная с высокой теплопроводностью,
твердая; Си-4 —медь тройного электролиза
(ЕТР) неотожженная [829]
лического алюминия высокой чистоты
с Р2эз/Р1,2 от 2400 до 30 000 в магнитном
поле до 3,9 Тл даны в [886] и [888]. Для
меди с р4,2=0,95-10“8 Ом-см рв/ро линей-
но изменяется в направлении, перпендику-
лярном полю, от единицы при В=0 до 4,5
при В=5 Тл, а в направлении, параллель-
ном полю, — от 1 при В=0 до 3,2 при В=
= 5 Тл [887]. Магнитосопротивление свин-
ца при высокой индукции магнитного поля
см. в [889]. Магнитосопротивление: гадо-
линия— в [890], гольмия и тербия —
в [891], диспрозия—-в [892], празеодима,
неодима, самария и европия — в [893].
У фосфорной и кремниевой бронзы при
4,2 К и индукциях до 14 Тл Ар/р0 меняет-
ся от 4-10“5 до 7-10~5, т. е. их удельное
Рис. 4.31. Магнитосопротивление алюминия
различной чистоты:
------- 99,9983%; -------- 99,999%; О —
99,998% при 27,2 К [831]
156
Физические свойства веществ при низких температурах
Рис. 4.32. Удельное сопротивление меди и
алюминия в поперечном магнитном поле
при 4,2 К:
А1-2 — алюмнннй отожженный 99,999%; А1-3 —
алюминий отожженный 99,995%; А1-4— алюми-
ний 99,999%; А1-5— алюмнннй 99,995%; Си-1 —
медь тройного электролиза (ЕТР) отожженная;
Си-2 — медь бескислородная с высокой тепло-
проводностью отожженная; Gu-3 — медь бескис-
лородная с высокой теплопроводностью твердая
[829]
сопротивление очень мало зависит от маг-
нитной индукции [894]. Сплавы характе-
ризуются большим остаточным сопротивле-
нием. Поэтому у них р~рс и мало зависит
от температуры. В табл. 4.83 приведена за-
висимость удельного сопротивления некото-
рых сплавов от температуры. Электриче-
ское сопротивление сплавов с высоким со-
держанием никеля и хрома см. в [896].
Электрическое сопротивление платинородие-
вых сплавов при низких температурах см.
в [897].
Зависимость удельного сопротивления
от температуры для сверхпроводящих спла-
вов NbZr различного состава см. в [913].
Увеличение содержания циркония от 10 до
Рис. 4.33. Зависимости остаточного удель-
ного сопротивления р0 и отношения сопро-
тивлений рзоо/ро от состава сплавов
Nb—Ti [135]
50 % увеличивает р0 этих сплавов от 0 до.
50 мкОм-см. Удельное электрическое сопро-
тивление сплава NbZr следующим образом
зависит от температуры [898]:
Г,К................. 75 100 150
р, мкОм-см.......... 0,425 0,460 0,525
П родолжение
Т, К................. 200 250 275
р, млОм-см.......... 0,580 0,620 0,640
У сплава VsSi [883] с 7’0 = 16,9 К и:
jRaoo/jRiT.s=40
Т, К.......... 20 30 40 50 60 70 78
р, мкОм-см . . 1,8 2,8 4,0 6,1 8,5 12 15
Зависимость р(Т’) =р0-|-&7’2 для этого спла-
ва в интервале 7’с<7’+26 К дана в [899].
Остаточное сопротивление сплава NbTi
практически постоянно в области темпера-
тур от 7+р до 30 К. Характер изменения р0
и Рзоо/Ро в зависимости от состава этого
сплава показан на рис. 4.33 [135].
Таблица 4.83. Удельное электрическое сопротивление некоторых сплавов р, мкОм-см
Сплав Состояние 293 90 Г, К 1,3 0,4
78 4,2
Алване (43 «/о Ni + 57 % Си) В состоянии 27,7 — — — — —
[125] Дюралюминий Д16 [125] поставки Отожженный 3,65 — 1,23 0,93 0,93 0,93
Инвар Н36 [125] 81,1 — 54,7 51 51 51
Латунь Л62 [125] Неотожженная 6,4 — 3,66 2,87 2,87 2,87
Латунь (30 °/о Zn + 70 % Си) Деформированная 7,2 5,0 — 4,3 — —
[125] Отожженная 6,6 4,2 — 3,6 — —
Манганин [225] В состоянии 40 39 — 37 — —
Нейзильбер [225] поставки То же 30 27,5 — 26
Нержавеющая сталь 12Х18Н9Т Неотожженная 73,7 •— 53 51 51 51
[125] 27,5
Нейзильбер [225] В состоянии 30 — 26 — —
Эваном (75 % Ni + 20 % Сг+ поставки То же 76,4 — — — — —
+2,5 % А1 + 2,5 % Си) [885] 105
Хромель (80 % Ni + 20 % Сг) я я — 103 — — —
[885]
Электрические свойства
157
Для сверхпроводящего соединения
NbsSn с содержанием Nb по массе около
70 % удельное сопротивление в интервале
температур от 18 (Ткр) до 100 К изменяет-
ся практически линейно в интервале от 10
до 47 мкОм-см [136]. У электропроводной
эпоксидной смолы [868], примерно на 25 %
по объему заполненной серебряным порош-
ком, при 7’очеЗОО К р==4,9-10-4 Ом-см,
ркомв/р<юк = 2,3 (толщина склеивающего
слоя 2-10~s см).
При переменном токе в проводниках
возникают вихревые потери, которые не су-
щественны при нормальных температурах,
но при низких температурах из-за малой
теплоемкости проводящего материала мо-
гут вызвать его нагрев и соответствующее
повышение удельного сопротивления. У фер-
ромагнитных материалов при пропускании
переменного тока дополнительный нагрев
вызывают гистерезисные потери.
Из вышеизложенного видно, что удель-
ное сопротивление материалов зависит от
очень большого количества факторов, кото-
рые не остаются постоянными даже в пре-
делах допусков на характеристики мате-
риалов, оговариваемые фирмами. Поэтому
приведенные справочные данные имеют ори-
ентировочный характер. Точные результаты
можно получить только путем измерения
удельного сопротивления материала в ра-
бочих условиях. Обзор электрических
свойств материалов см. в [985].
Диэлектрические проницаемость и по-
тери. Электрическая прочность диэлектри-
ков. Ниже приведены данные, определяю-
щие поведение твердых диэлектриков и
криоагентов в электрическом поле и необхо-
димые при разработке электроизоляционных
конструкций высоковольтных и высокочас-
тотных устройств, работающих при крио-
температурах.
Степень поляризации диэлектрика, оце-
ниваемая приращением емкости конденса-
тора (любой формы) при замене вакуума
между пластинами данным диэлектриком,
называют его относительной диэлектриче-
ской проницаемостью и обозначают без-
размерной величиной е. По физическому
механизму поляризации различают непо-
лярные и полярные диэлектрики. Первым,
имеющим сравнительно малые е, свойствен-
ны только «быстрые» виды поляризации,
устанавливающиеся в диэлектрике за
10~13—10~15 с после наложения внешнего
электрического поля. «Медленные» виды
поляризации, вызывающие тепловыделения
в изоляции, свойственны в основном поляр-
ным диэлектрикам. Параметр в входит
в целый ряд основных уравнений [129],
определяющих физические процессы в ди-
электриках. Важное значение параметр е
имеет при расчетах напряженности электри-
ческого поля в многослойных диэлектриках,
к которым относят электроизоляционные
конструкции из пропитанных жидкими
Рнс. 4.34. Температурные зависимости тан-
генса угла диэлектрических потерь tg д
и диэлектрической проницаемости е жид-
кого гелия [30]
криопродуктами тонких пленок. В импульс-
ных и переменных электрических полях
слои такой изоляции с более высокой е
берут на себя относительно меньшую долю
напряженности электрического поля, пере-
гружая слои с меньшей е.
Произведение еое определяет абсолют-
ную диэлектрическую проницаемость мате-
риала; здесь е0 = 8,854-1О-12 Ф/м —абсо-
лютная диэлектрическая проницаемость ва-
куума. Величина 8 вакуума равна 1, а лю-
бого диэлектрика всегда больше 1. Напри-
мер, при нормальных температуре и давле-
нии для воды е=81, трансформаторного
масла — 2,2, слюды — от 6 до 7,5, стекла —
от 5,5 до 8,0, органического стекла — 3,5,
воздуха— 1,00058 и т. д. Значения g для
жидких криоагентов при нормальном дав-
лении и температурах, близких к темпера-
турам кипения [130, 131]: гелия-4 (при
4,2 К) — 1,0492; водорода На (при 20 К) —
1,228; иона (при 26 К.) — 1,191; азота (при
76 К) — 1,438; аргона (при 86 К) — 1,507;
кислорода (при 90 К) —1„480; дейтерия Da
(при 23 К) — 1,265; метана (при ПО К) —
1,682. Значения е при разных температурах
для жидкого гелия приведены на рис. 4.34,
для твердого и жидкого водорода — на
рис. 4.35, для жидких азота и кислорода—на
рис. 4.36, для некоторых материалов,
Рнс. 4.35. Температурные зависимости е
для твердого (7) и жидкого (2) водорода
158
Физические свойства веществ при низких температурах
Та б лица 4.84. Значения е и tg 6 для некоторых полимерных материалов,
используемых в криогенной технике [133]
Полимер S tg 5-105 f. кГц
4 К 290 К 4 К 290 К
Полиэтилен:
низкой ПЛОТНОСТИ — — 2,7 39,6 1
высокой плотности 2,27 2,2 5,5 17,3 1
Политетрафторэтилен 2.12 2—2,05 0,12—2,5 9—30 0,075—1
Полипропилен 2,35 2,25 0,35—2 85 0,050—20
Нейлон-6,6 2,9 4,1 12 1500 0,075
Нейлон-11 2,4 3,22 3 400 J 0,047
Полиэтилентерефталат 2,8 3,13—3,15 11,5—17 118—410 0,075—1
Поливинилфторид 3,45 9,2 56 1600 1
Полистирол 2,52—2,63 2,5—2,6 1,49—6 11,5—40 0,075—1
Поликарбонат — — 9,5 210 1
в табл. 4.84 и в [30], для ряда веществ
в газообразном и твердом состояниях —
в табл. 4.85. По данным [30] е твердого
азота 1,55, е твердого водорода при 14,4 К
и 1,76 МПа 1,288, при 17 К и 10,4 МПа —
1,299, при 22,2 К и 31,5 МПа— 1,323.
Электрическая мощность, выделяемая
в диэлектрике в виде теплоты под дей-
ствием приложенного к нему напряжения,
составляет диэлектрические потери. По фи-
зической природе различают четыре основ-
ных вида потерь в диэлектриках: потери
сквозной электропроводности; поляризаци-
онные потери; потери,. обусловленные не-
однородностью структуры; ионизационные
потери. Потери энергии в диэлектриках
.происходят как при переменном, так и при
постоянном приложенных напряжениях, так
как в технических материалах существует
сквозной ток утечки через изоляцию, обу-
словленный электропроводностью. Удельные
диэлектрические потери (без учета потерь
от тока поверхностной утечки) р, Вт/м3,
в постоянном электрическом поле напря-
женностью Е, В/м, составляют р=Е2/р, где
р — удельное объемное сопротивление ма-
териала, Ом-м.
Удельные диэлектрические потери в по-
ле переменной напряженности, изменяющей-
ся с частотой f, Гц,
Рис. 4.36. Температурные зависимости е
.для жидких азота (1) и кислорода (2)
[130]
где tg б — отношение активного и реактив-
ного компонентов тока, идущего через изо-
ляцию.
Параметр tg б — важнейшая характе-
ристика как диэлектрика, так и любой элек-
троизоляционной конструкции, используе-
мой в высоковольтных и высокочастотных
устройствах.
Произведение etgiS называют коэффи-
циентом диэлектрических потерь материала.
Обычно (при одинаковом Е) диэлектриче-
ские потери в переменном электрическом
поле больше, чем в постоянном. Наимень-
шими значениями е tg 6 обладают полисти-
рол и политетрафторэтилен — соответствен-
но 3,2-10_5 и 2,7-10-5. Считается, что для
Таблица 4.85. Диэлектрическая
проницаемость некоторых веществ
в газообразном (при давлении 0,1 МПа)
и твердом состояниях [839, 805]
Вещество т, к е
Азот N2:
газ 273 1,000581
газ 63,0 1,514
твердый 59,9 1,462
Аргон Аг, газ Водород Н2: 293 1,000554
газ 273 1,00076
газ 14,0 1,248
твердый Гелий Не: 13,2 1,211
газ 293 1,000065
газ Кислород О3: 20,4 1,000097
газ 293 1,00050
газ' 90 1,00168
Метан СН4, газ Оксид углерода СО: 299 1,000804
газ 290 1 000645
твердый 93 1,00231
Электрические свойства
159
Таблица 4.86. Электрическая прочность Енр некоторых диэлектриков и криоагентов
в однородном электрическом поле при частоте 50 Гц и толщине диэлектрика
(разрядного промежутка d) 1 мм [129, т. 1; 900]
Диэлектрик или криоагент Слюда, неполярные полимеры Трансфор- маторное масло Элегаз Воздух н азот Водород Гелнй
Температура, К Ещ> (действующее значение), kBzmm 293 50—100 293 20 293 11 293 77* 5 20 293 20* 2,5 22 293 4,4* 0,8 19
* Непосредственно над уровнем соответствующих кипящих жидкостей.
криокабелей, например, должны использо-
ваться диэлектрики с е tg <3sg5-10~5 [104].
Температурные и частотные зависимо-
сти tg б для некоторых материалов, исполь-
зуемых при создании электроизоляционных
конструкций криогенных устройств, приве-
дены в табл. 4.84 и Я [30, 132, 133]. Ди-
электрические потери в изоляции, как пра-
вило, уменьшаются при снижении темпера-
туры, причем при температуре, превышаю-
щей примерно — 50°С, значение tg 6 сильно
зависит от частоты электрического поля.
При более низких температурах частотная
зависимость tg 5 практически исчезает [134].
Для жидких Na, Нз, Не tg 6«5-10-s [134],
причем на значение tg б (как и е) жидких
криоагентов значительное влияние оказы-
вают изменения давления и напряженности
электрического поля [130]. По данным [30]
для жидкого гелия в области умеренных
электрических полей (£<2 МВ/м) tg6<
<10~6. Однако при увеличении Е, особенно
при длительной выдержке под напряже-
нием, tg б значительно возрастает. Напри-
мер, для жидкого азота при нормальном
давлении tg б увеличивается от 10~5 до
1,5-10~3 при повышении £ с 4 до 12 кВ/мм,
a tg б жидкого водорода — от 4-10~5 до
7-10_4 при росте Е с 7,8 до 15,7 кВ/мм
[134]. Это может быть объяснено движе-
нием микропримесей или наличием частич-
ных разрядов в маленьких пузырьках, воз-
никающих в жидких криоагентах под дей-
ствием электрического поля.
Электрическая прочность Епр> В/м,
криоагентов в жидком и газообразном со-
состояниях, а также твердых диэлектриков,
как правило, уменьшается с увеличением
разрядного промежутка d. Поэтому исполь-
зование тонкослойной (в несколько слоев)
изоляции при создании электроизоляцион-
ных конструкций (ЭИК) предпочтительнее,
чем толстослойной. Однако такое решение
не является однозначным при создании
эик высоковольтного криоэлектрооборудо-
вания: в многослойной изоляции, пропитан-
ной, например, жидким гелием, при напря-
женностях 15—20 кВ/мм появляются час-
тичные разряды (ЧР) [141], приводящие
к электрическому старению твердой изоля-
ции. В особо тонких слоях (лаковые и на-
пыленные пленки диэлектрика, полимерные'
пленки толщиной менее 10 мкм) из-за не-
однородности материала и местных дефек-
тов его структуры £пр снова снижается..
Например, по данным [142] на 1 м2 лав-
сановой пленки толщиной 10 мкм прихо-
дится до 250 точечных дефектов, снижаю-
щих напряжение пробоя пленки более
чем в 3 раза по сравнению с однородным
материалом.
В табл. 4.86 приведены значения ДгР
для некоторых высококачественных диэлек-
триков и криоагентов. На рис. 4.37 и 4.38
представлены данные по электрической
прочности газообразного азота и газообраз-
ного и жидкого гелия. Связь Гпр гелия
с его термодинамическим состоянием пока-
зана на рис. 4.39. Данные по электрической,
прочности жидкого гелия, полученные раз-
ными авторами, см. в [134, 904]. На
рис. 4.40 и 4.41 приведены зависимости <7ПР
для жидких азота, водорода и гелия от
давления, величины cl и вида прикладывае-
мого напряжения. Материал электродов
мало влияет на £пр жидкого гелия, тогда
как царапины и неровности на их поверх-
ности значительно уменьшают ее. Примеси
масла в гелии также заметно уменьшают
£Пр гелия. При облучении гелия (4,2 К;
0,1 МПа; d=l мм) радиоактивным источ-
ником его Ппр уменьшалось примерно на
30 % [837].
Для криовакуумной изоляции в одно-
родном электрическом поле Eav около
100 кВ/мм (d—1 мм) и около 50 кВ/мм
(d=10 мм) [902]. Защитные диэлектриче-
ские покрытия электродов или их анодиро-
вание значительно снижают предразрядные
токи в вакуумных промежутках. Е,!р ва-
куума практически не зависит от частоты
прикладываемого напряжения (до 60 Гц).
Электрическая прочность полимерной
изоляции зависит от свойств и параметров
окружающей среды, температуры, толщины
и числа слоев изоляции, вида воздействую-
щего напряжения, способа получения поли-
мера, загрязнений и дефектов его структу-
ры и т. д. [30, 104, 132, 142, 144]. Данные-
по Епр полимерных изоляционных материа-
16о
Физические свойства веществ при низких температурах
Рис. 4.37. Напряжение пробоя (7пр, кВ
(амплитудное значение), газообразных
азота и гелия при температурах, близких
к кипению жидкостей, в зависимости от
разрядного промежутка d для напряже-
ния промышленной частоты (штриховые
линии) и импульсного с волной 1/50 мкс
(сплошные линии) [901]
Рис. 4.38. Электрическая прочность Еи(1
жидкого и газообразного гелия в зависи-
мости от давления и температуры (напря-
жение постоянное, поле слабонеоднород-
ное, d=\ м) [902]
лов в разных средах приведены в табл. 4.87.
Более высокая в вакууме (по сравнению
с жидким гелием) Апр полимерных пленок
объясняется более низкой электрической
прочностью самого гелия, в прослойках ко-
торого возникают ЧР, снижающие Е„т, всей
изоляции. В [30, 104, 144—146] приведены
данные по Е,,,, многослойной изоляции ти-
па ПЭТФ и ПЭ, пропитанной жидкими азо-
том или гелием, поликарбонатной пленки,
стеклотканей разных марок, шелковых и
хлопчатобумажных лакотканей, электрокар-
тона, обмоточных проводов и других видов
изоляции при криотемпературах.
Для использования в ЭИК сверхпрово-
дящих магнитов и высоковольтного крио-
электрооборудования рекомендуется [147]
липкая электроизоляционная лента марки
ЛСПАКЛ-80 (стеклолакоткань на основе
Рис. 4.39. Линии равной электрической
прочности при различных давлении и плот-
ности гелия (латунные плоские электроды
0 60 мм; d=l мм) [903]
полиимидного связующего с двусторонним
адгезионным покрытием компаундом К-80)
[148]; Бцр одного слоя (толщиной 120 мкм)
ленты ЛСПАКЛ-80 составляет около
60 кВ/мм в воздухе при 293 К и около
140 кВ/мм в кипящем гелии при 4,2 К;
для двух слоев этой ленты в гелии при
4,2 К — около 100 кВ/мм [147].
С ростом давления над жидким крио-
агентом, пропитывающим пленочную поли-
мерную изоляцию, Бцр последней повыша-
ся. Так, для образцов изоляции из волок-
нистого материала на основе ПЭ (пленка
Tyvek) толщиной 1,8 мм при повышении
давления над жидким азотом от 0,1 до
0,25 МПа Епр возрастала с 22 до 32 кВ/мм.
Электрическая прочность полимеров и
многослойной изоляции в постоянном элек-
трическом поле на 30—80 % выше, чем
в переменном [104]. Импульсная Епт, пле-
ночной изоляции также выше, чем при пе-
ременном напряжении. Полярные полимер-
ные диэлектрики при низких температурах
имеют Ещ> в 1,5—2 раза большую, чем не-
полярные, электрическая прочность которых
мало зависит от температуры.
Результаты измерений £Пр многослой-
ной пленочной изоляции на моделях ЭИК
сверхпроводящих кабелей приведены в [30].
При выборе рабочей напряженности
Араб электрического поля в ЭИК высоко-
вольтного криоэлектрооборудования необ-
ходимо исключать возможность появления
ЧР в объеме многослойной изоляции, про-
питанной жидкими криоагентами. В связи
с этим Араб оказывается значительно мень-
шей, чем приведенные выше значения Еар
для различного вида многослойной изоля-
ции. Так, например, в [840] для многослой-
ной намотанной внахлест высоковольтной
11—218
Таблица 4.87. Кратковременная* электрическая прочность Епр, кВ/мм, полимерных изоляционных материалов в различных
средах [104, 145**]
Диэлектрик Толщина, 1 мкм Переменное напряжение Постоянное напряжение
Воздух 293 К N2 жид- кий 77 К N2 газ 77 К Не кпд- кии 4,2 К Не газ ! 4,2 К 1 i Вакуум ЮК Воздух 293 К 1 N2 жид- кий 77 К । 1 N2 газ ! 77 К Не жид- I кий 4,2 к ! Не газ 4,2 К Вакуум ЮК
Полиэтилентерефталат ПЭТФ ЮХ2 25 275 92 235 184 — 247 143 — — 370 400 481 —
100 119 171 99 120 85 212 — 210 163 210 150 —
Политетрафторэтилен ПТФЭ 20 50 390 94 280 126 120 — — 633 445 —, — —• —
50X2 93 114 96 — — — — — .—. — —-
100 113 114 97 134 99 320 — 200 170 233 140 —
125 46,5 72 65 — — — — — — — —
250 49,2 56 — 49 — — — — — — — —
Сополимер тетрафторэтилена с гексафторпропи- 1С0 127 137 112 144 114 254 — 210 170 — — —
леном СТГ (тефлон FEP) Полиэтилен ПЭ 50 126 230 — 130 — — — — — — — —
Полиэтилен ПЭ 100 102 155 106 92 70 145 — 183 123 183 110 —
Полихлорвинил ПХВ 100 112 109 97 1(5 75 182 — 103 — 230 150 —
Полиимид ПА (нейлон) 103 НО 127 99 111 73 230 — 200 183 240 163 —
Полиимид ПИ 40 250 — — — — — 410 335 — — — —
Полиимид ПИ 100 140 198 127 163 127 317 — 180 180 260 193 —
Полифторэтиленпропипен (ПФЭП-тефлон) 100 127 137 112 144 114 254 — 210 170 220 160 —
Кабельная бумага КВ 90 17 92 — — •— — 20 122 — — — —
Конденсаторная бумага, пропитанная лаком 53 72 136 — 96 — — — — — — — —
То же 5^X2 57 111 — 94 — — — — — — — —•
Ткань, пропитанная ПТФЭ 1С0 32 34 30 58 40 — — 50 36 45 30
* Кратковременная £пр определяется при плавном подъеме испытательного напряжения до наступления
меньшей по значению, но учитывающей электрическое старение под воздействием ЧР).
'** В таблице приведены данные разных авторов.
пробоя (в
отличие
от длительной Е
Электрические свойства
162
Физические свойства веществ при низких температурах
Рис. 4.40. Напряжение пробоя t/np жид-
ких азота, водорода и гелия в зависимости
от давления и разрядного промежутка d\
1, 2, 3 — жидкий азот соответственно при 0,1;
0,3 и 0,5 МПа; 4, 5, 6 —то же для жидкого во-
дорода; 7, S —жидкий гелий при 0,1 и 0,3 МПа;
9 — трансформаторное масло при нормальных
условиях. Напряжение частотой 50 Гц; электро-
ды шар — шар 0 62,5 мм [905]
ЭИК из пленки ПЭ в жидком гелии (5 К;
0,4 МПа) рекомендуемая £рав примерно
10 кВ/мм (действующее значение), в то
время как £пр такой конструкции 30 кВ/мм.
О поверхностной £пр твердой изоляции
в жидком гелии (токовводы, проставки и
Рнс. 4.41. Напряжение пробоя Unp, кВ
(амплитудное значение), жидких азота и
гелия прн 0,1 МПа в зависимости от раз-
рядного промежутка d. Переменное напря-
жение частотой 50 Гц — штриховые линии
и импульсное (волна 1 /50 мкс) — сплош-
ные линии [901]
аналогичные элементы ЭИК сверхпроводя-
щих устройств) см. в [147]; о возникнове-
нии ЧР и длительной электрической проч-
ности криоэлектроизоляции — в [142]; ме-
тодика выбора электроизоляции для крио-
электротехнических устройств приведена
в [132]; о радиационном воздействии на
электроизоляцию при нормальных и крио-
температурах— см. в [856, 858]. Пузырь-
ковый механизм электрического пробоя:
жидких криоагентов изложен в [826, 904].
4.8. ТЕПЛОЕМКОСТЬ
Определение и краткую теорию тепло-
емкости см. в разд. 2. При технологических
расчетах значения теплоемкости газов удоб-
но определять по диаграммам состояния
(см. вкладку), используя уравнение ср —
=^Ah/'AT. Аналогично можно найти тепло-
емкости cs жидкости, находящейся под
давлением насыщенных паров, при этом
значение А/i снимают по пограничной кри-
вой жидкости.
Теплоемкости газов при нормальных
условиях см. в табл. 4.109.
Подробные данные по теплоемкостям
газов см.: азота, кислорода, воздуха —
в [21]; неона, аргона, криптона, ксенона —
в [29]; аммиака, оксида и диоксида угле-
рода, этана, пропана, ацетилена — в [255];
метана — в [27]; гелия — в [250]; водорода
(в интервале температур 20—70 К и при
давлении от 3 до 50 МПа) — в [744]; пара-
водорода (в интервале температур 20—
70 К и при давлении до 34 МПа) —
в [315].
Типичный характер зависимости тепло-
емкости реальных газов от температуры и
давления виден на рис. 2.15 (для воздуха)
и 4.42 (гелия).
Теплоемкости криоагентов и хладаген-
тов (в жидком и твердом состояниях) при-
ведены на рис. 4.43—4.47 и в табл. 4.88
и 4.89.
Теплоемкости жидкого озона сР= 1,78-|-
4-0,00586(7—90) Дж/(г-К) в интервале
температур 90—150 К см. в [259].
Теплоемкости конденсированных изото-
пов неона MNe и 22Ne см. в [344].
Значения характеристического парамет-
ра Дебая и коэффициента электронной теп-
лоемкости для некоторых' веществ даны
в табл. 4.90 и 4.91. В табл. 4.92 приведены
удельные теплоемкости с„, рассчитанные по»
формуле Дебая (см. разд. 2).
Удельные теплоемкости некоторых чи-
стых элементов в интервале температур
1—300 К даны в табл. 4.93, в табл. 4.94
в том же интервале температур приведены
значения удельных теплоемкостей для неко-
торых технических сплавов и материалов..
Средние теплоемкости некоторых ме-
таллов и сплавов для ряда низкотемпера-
турных интервалов даны в табл. 4.95.
Теплоемкость
163
Рис. 4.42. Теплоемкости ср газообразного гелия в зависимости
от температуры н давления [244]
Рис. 4.43. Теплоемкости криоагеитов в
жидкой и твердой фазах при равновесном
давлении
31*
Рнс. 4.44. Теплоемкость конденсированных
изотопов водорода прн давлении насыще-
ния и нормальном орто-пара составе [379]
164
Физические свойства веществ при низких температурах
Рис. 4.45. Теплоемкости при давлении на-
сыщенных паров жидких 3Не и 4Не, раст-
воров 3Не—4Не (молярная концентрация
3Не — от 0,05 до 0,48 при давлении насы-
щения) и теплоемкость ср 3Не при давле-
нии 2,9 МПа [228]
Удельные теплоемкости титановых спла-
вов при температуре 10—300 К даны
в табл. 4.96, а теплоемкости оловянио-
свинцовых сплавов при температурах. 1,5-—
20 К — в табл. 4.97.
На рис. 4.48—4.52 приведены удельные
теплоемкости некоторых металлов и спла-
вов в диапазоне температур 0,2—4 К.
Ниже приведены эмпирические уравне-
ния для расчетов удельных теплоемкостей,
Дж/(кг-К), технических материалов, широ-
ко используемых в зарубежной практике
при изготовлении сверхпроводящих соле-
ноидов [715]:
нержавеющей стали (17 % Сг, 10,1 %
Ni, 0,86 % Мп):
Ср= 0,4647’—|—3,8 -10“4Г3 при ГС 10 К;
нейлона и эпоксидных смол холодного
отверждения:
Ср = 1,8- IO-2?3 при 7'<4 К;
угольных растворов (фирмы «Аллен
Бредли», номинал 10 Ом, 0,1 Вт):
Cp=G,4-10—37'—1-1,3- 10—37’3 в области
Рис. 4.46. Удельные теплоемкости с3 неко-
торых оксидов и углеводородов в жидкой
и твердой фазах: закиси азота N2O, окси-
да углерода СО, диоксида углерода СО2,
этилена С2Н4, этана С2Н6, пропилена С3Н6>
пропана СзНз, п-бутана CiHio
Рис. 4.47. Удельные теплоемкости твердого
водорода в зависимости от температуры и
орто-пара состава [51]
1 Ks£7<£4 К.
Теплоемкости некоторых жидкостей при
нормальной температуре см. в табл. 4.78.
Теплоемкости изоляционных материалов см.
в разд. 7.
Т еплоемкость
165
Таблица 4.88. Теплоемкость твердых параводорода и ортодэйтерия (усредненные
данные), мДж/(моль-К) [803]
т. к Параводород Орто дейтерий
СР % Дебаевская температура, СР cv Дебаевская температура,
2 9,95 9,95 116,0 13,1 13,1 106,0
3 34,8 34,7 114,8 45,2 45,2 105,1
4 86,1 85,6 113,2 111 111 103,9
5 178 176 111,3 226 225 102,6
6 327 317 109,8 410 408 100,9
7 558 527 108,1 688 681 99,2
8 899 813 106,9 1091 1070 97,4
9 1380 1170 106,0 1630 1580 95,9
10 2060 1570 104,5 2260 2160 95,4
Таблица 4.89. Теплоемкость cs, Дж/(г-К). конденсированных газов в состоянии
насыщения [255]
Т, К Аммиак NH3 т, К Оксид углерода СО т, К Этаи С2Н„
Жидкость Кристаллическая Крислалл
20 0,0892 фаза II 15 0,0912
оО 0,254 10 0,145 20 0,214
оО 0,655 20 0,513 30 0,500
100 1,53 40 1,217 40 0,828
195,42 2,97 60 2,094 70 1,544
85—170 2,09 Кристаллическая 85 2,025
Кристалл фаза I Жидкость
195,42 240 980 4,30 4,46 4,63 62 65 68 1,765 1,825 1,864 9) 150 200 2,268 2,343 2,481
273—299 3,67 68,09 Жидкость 295 4,531
2,146
80 2,158
84 1,161
Продолжение табл. 4.89
Т, К Аргон Аг Т, К Оксид азота NO Т, К Метан СН4
Жидкость Жидкость Жидкость
17,8 0,256 15,57 0 131 10,33 0,248
24,9 0,391 22,27 0,274 40 1,77
41,25 0,585 62,32 0,839 90 2,66
Кристалл 108,39 1,32 Кристалл
78,3 0,817 Кристалл 95 3,34
84,9 1,10 112,86 2,23 140 3,72
93,9 1,11 120,66 2,60 185 6,84
166
Физические свойства веществ при низких температурах
таблица 4.90. Характеристический параметр Дебая 0Д, К, и коэффициент
электронной теплоемкости у, мДжДмоль-К2), для некоторых элементов,
химических соединений н веществ [51, 226, 259]
Вещество 9 о 1 Вещество T
Алюминий А1 426 1,36 Рений Re 450 2,1
Барий Ва ПО 2,7 Родий Rh 480 5,0
Бериллий Be 1163 0,226 Ртуть Hg 75 2,1
Бор В 1219 — Рубидий Rb 52 2,6
Ванадий V 380 9,2 Рутений Ru 690 3,3
Висмут Bi 118 0,067 Свинец РЬ 96 3,1
Вольфрам W 4.,5 1.3 Серебро Ag 225 6,9
Галлий Ga 240 0,5 Стронций Sr 147 3,6
Гафний Hf 260 2,5 Сурьма Sb 204 0,6
Германий Ge 370 — Таллий Т1 89 1,5
Железо а -Ге 464 3,1 Тантал Та 245 5,9
Золото Ац 165 0,74 Титан Ti 420 3,4
Индий In 109 1,81 Торий Th 170 4,6
Иридий 1г 42.) 3,14 Углерод (алмаз) С 2230 —
Иттрий Y 235 —. Углерод (графит) С 420 0,01
Кадмий Cd 186 0,63 Уран U 200 10,5
Калий К 90 1,97 Хром Сг 610 1,47
Кальций Са 220 2,7 Цезий C's 44 —.
Кобальт Со 445 5,0 Церий Се 119 —
Кремний Si 640 — Цинк Zn 300 0,63
Лантан La 132 6,7 Цирконий Zr 310 3,0
Литий Li 370 1,76 NaCl 275 —
Магний Mg 406 1,32 КС1 230 —
Марганец «—Мп 476 13,8 LiF 650 —
Медь Си 344,5 0,687 KBr 180 —
Молибден Мо 440 2,18 KI 175 —
Натрий Na 160 1,58 CaF2 475 —.
Никель Ni 440 7,0 AgCl 183 —
Ниобий Nb 320 7,9 AgBr 144 —
Олово белое Sn 195 1,75 MgO 800 —.
Олово серое Sn 210 — ZnS 270 —
Осмий Os 500 2,1 FeS2 645 —.
Палладий Pd 275 10,5 Константан 384 6,9
Платина Pt 233 6,7 Монел 374 6,5
Таблица 4,91. Критическая температура Тс (в отсутствие магнитного поля),
температура Дебая 0Д и коэффициенты уравнения с=уГ+«Т3 для некоторых
сверхпроводящих металлов и бинарных сплавов (состав в молярных долях, %) [804]
Материал Критическая темпе- ратура т , К 7, мДж/(моль-К2) а, мДж/(моль-К4) К
Nb 9,0 7,5—11,7 0,15—0,11 230—260
Mo 1,0 2,0 0,018 470
Re 1,7 2,5 0,029 405
Ta 4,4 6,3 0,14 240
Y — 10,0 0,15 —
8,8 15,9 0,276 190
10,5 ' 8,2—14,2 0,19—0,15 220—230
5,3 5,9—14,2 0, Ю—О 08 260—290
3,4 4,5—6,7 0,08—0,06 290—320
NbS0Mo40 0,5 ; 3,0 0,С50 349
Nb60Mo50 — 2,0 0,038 389
Т еплоемкость
167
Продолжение табл. 4.91
Материал Критическая темпе- ратура t, к f, мДж/(моль-К?) а, мДж/(моль-К4) ео, к
Nb2oMo80 1,7 0,023 4С5
Mo96Re6 1,5 2,2 . 0,021 450
Мо80Не20 8,5 3,8 0,027 420
10,8 4,1 0,031 395
MosoRe4O 12,6 4,4 0,048 340
Mo6oRe6o 11,5 4,4 0,059 320
Мо6о 1 с60 12,6 4,6 0,071 300
Mo95Ru6 2,5 2,9 0,023 435
Mo70Ru30 6,7 3,9 0,024 435
Mo4OPd6O 2,3 з,з 0,054 330
Mo60Pd5o 4,1 3,8 0,054 330
4,4 3,7 0,054 330
VsSi 14,6 77,9 0,218 330
VsGa 14,6 102 0,260 310
V3Ge 6,1 30,5 0,117 405
NbgSn 17,3 63 0,330 290
Mn3Ir 8,5 13,4 0,226 325
Re2B 4,6 6,3 0,088 405
Таблица 4.92. Теплоемкость ст Дж/(моль-К), рассчитанная по формуле Дебая
для значений v/Т от 0 до 30 [226]
Мт 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
0 24,94 24,93 24,89 24,83 24,74 24,63 24,50 24,34 24,16 23,96
1 23,73 23,49 23,23 22,95 22,66 22,34 22,02 21,68 21,33 20,96
2 20,59 20,21 19,83 19,42 19,02 18,61 18,19 17,78 17,37 16,94
3 16,53 16,11 15,70 15,29 14,89 14,48 14,08 13,69 13,31 12,92
4 12,54 12,18 11,82 11,46 11,11 10,77 10,45 10,12 9,810 9,504
5 9,198 8,905 8,621 8,340 8,072 7,817 7,561 7,314 7,076 6,841
6 6,624 6,414 6,201 6,000 5,8ЭЗ 5,615 5,430 5,254 5,083 4,919
7 4,760 4,605 4,459 4,317 4,181 4,046 3,916 3,794 3,674 3,557
8 3,447 3,340 3,238 3,141 3,042 2,948 2,858 2,771 2,689 2,609
9 2,529 2,460 2,384 2,312 2,247 2,183 2,120 2,060 2,001 1,946
10 1,892 1,839 1,787 1,739 1,692 1,650 1,602 1,560 1,518 1,479
11 1,443 1,403 1,367 1,335 1,298 1,265 1,233 1,203 1,173 1,144
12 1,117 1,090 1 ,063 1,038 1,010 0,9906 0,9676 0,9450 0,9232 0,9023
13 0,8830 0,8629 0,8436 0,8244 0,8064 0,7884 0,7712 0,7545 0,7377 0,7222
14 0,7067 0,6917 0,6778 0,6636 0,6498 0,6364 0,6234 0,6104 0,5987 0,5866
15 0,5748 0,5635 0,5527 0,5422 0,5317 0,5217 0,5116 0,5020 0,4928 0,4836
Продолжение табл. 4.92
<>dIt . cv cv воП cv
16 0,4744 21 0,2098 26 0,1101
17 0,3957 22 0,1825 , 27 0,0988
18 0,3333 23 0,1599 28 0,0888
19 0,2834 24 0,1407 29 0,0795
20 0,2428 25 0,1248 30 0,0720
168
Физические свойства веществ при низких температурах
Таблица 4.93. Удельная теплоемкость некоторых элементбв, мДж'(г-К) [259, 746, 805]
Температура, К Алюминий Бериллий Висмут Вольфрам Германий Железо Золото Индий
1 0,051 0,025 0,00598 0,0074 0,00053 0,090 0,006 0,029
2 0,108 0,051 0,0461 0,0158 0,00423 0,183 0,025 0,138
3 0,176 0,079 0,170 0,0262 0,0144 0,279 0,070 0,41
4 0,261 0,109 0,493 0,0393 0,0344 0,382 0,160 0,95
6 0,500 0,180 2,14 0,0783 0,125 0,615 0,50 3,59
8 0,883 0,271 5,47 0,141 0,335 0,90 1,20 8,55
10 1,40 0,389 10,4 0,234 0,813 1,24 2,20 15,5
15 4,00 0,842 23,8 0,725 4,45 2,49 7,40 36,7
20 8,90 1,61 36,3 1,89 12,5 4,50 15,9 60,8
30 31,5 4,50 57,2 7,83 36,6 12,4 37,1 108
40 77,5 9,96 72,7 18,4 61,7 29,0 57,2 141
50 142 19,2 84,6 33,2 85,8 55,0 72,6 162
60 214 34,1 93,5 48,3 108 87,0 84,2 176
80 357 9J,6 105 71,5 153 121 99,2 193
100 481 199 111 88,8 191 216 108,3 203
200 797 1110 120 125 290,4 384 123,5 225
300 902 1970 124 136 322 447 128,5 233
Продолжение табл. 4.93
Температура, К Кадмий Калий Кремний Литий Магний Марганец (а) Медь Молибден
1 0,008 0,000263 0,055 0,25 0,012 0,0229
2 0,033 —. 0,00210 — 0,117 0,50 0,028 0,0472
3 0,090 — 0,00709 2,48 0,190 0,75 0,053 0,0745
4 0,21 0,0168 3,81 0,290 1,01 0,091 0,106
6 1,3 — 0,0596 5,57 0,590 1,56 0,23 0,191
8 4,3 — 0,140 14,5 1,08 2,16 0,47 0,317
10 8,0 — 0,275 24,6 1,90 2,82 0,86 0,498
15 25 — 1,09 70,9 5,80 5,2 2,7 1,31
20 46 — 3,37 153,5 15 9,0 7,7 2,87
30 86 396 17,1 173 95 23 27 9,60
40 117 484 44,0 358 138 50 60 23,6
50 141 533 78,5 590 235 87 99 41,0
60 159 567 115 855 336 129 137 61,9
80 182 610 188 1390 513 214 205 104
100 196 630 259 1925 646 267 254 139
200 222 691 — 3100 932 420 356 222
300 230 760 — 3580 1021 480 386 246
Продолжение табл. 4.93
Температура, К Натрий Никель Ниобий Олово (белое) Палладий Платина Ртуть Свинец
1 0,081 0,120 0,090 0,017 0,099 0,035 0,036 0,026
2 0,289 0,242 0,18 0,047 0,203 0,074 0,48 0,12
3 0,76 0,369 0,28 0,109 0,318 0,122 2,07 0,33
4 1,60 0,5тЗ 0,40 0,245 0,447 0,186 4,09 0,70
6 5,10 0,820 0,77 1,27 0,891 0,37 10,9 2,9
8 12,2 1,19 1,40 4,20 1,41 0,67 17,5 7,3
10 23,8 1,62 2,20 8,10 2,10 1,12 23,5 13,7
15 — 3,10 5,50 22,6 4,71 3,3 38,0 22,5
20 155 5,8 н,з 40,0 9,22 7,4 51,5 53,1
30 364 16,7 35 76,0 25,8 21,2 73,7 79,6
40 544 38,1 68 106 50,7 38 89,5 94,4
Т еплоемкость
169
Продолжение табл. 4.93
Температура, Натрий Никель Ниобий Олово (белое) Палладий Платина Ртуть Свинец
50 695 68,2 99 130 77,7 55 99,3 103
60 793 103 127 148 101 68 107 108
80 910 173 173 173 139 88 116 114
100 980 232 202 189 167 100 121 118
200 1140 383 254 214 227 127 136 125
300 1240 445 268 222 143 133 139 130
Продолжение табл. 4.93
Температура, К Серебро Тантал Титан У глерод (графит) Углерод (алмаз) Хром Цинк Цирконий
1 0,0072 0,032 0,071 0,005 0,0285 0,011 _ -
2 0,0239 0,068 0,146 0,027 —— 0,058 0,028 —
3 0,0595 0,112 0,226 0,070 — 0,089 0,05,8
4 0,124 0,171 0,317 0,144 0,124 0,11 —
6 0,390 0,333 0,540 0,33 — 0,266 0,29 —
8 0,91 0,648 0,840 0,64 — 0,312 0,96
10 1,8 1,17 1,26 1,14 0,018 0,451 2,5 —
15 6,4 3,60 3,30 з,з 0,053 1,02 11
20 15,5 8,23 7 00 6,3 0,122 2,10 26 11,2
30 44,2 24,0 24,5 15,5 0,404 6,83 76 36,2
40 78 43,0 57,1 27 0,979 17,1 125 68,9
50 108 60,4 99,2 42 1,95 35,8 171 103
60 133 75,4 146,7 58 3,41 62,1 208 129
80 166 97,6 130 97 9,34 127 258 176
100 187 111 300 140 20,4 193 293 205
200 225 134 465 414 195 385 367 264
300 236 140 522 716 518 450 390 —
Таблица 4.94. Удельная теплоемкость сплавов, Дж/(г-К) [746, 805]
Темпе- ратура, К Алюмиий техниче- ский АОО Дюралю- миний Д16 Алюми- ниевый сплав АМц Титано- вый а-сплав ВТ1 Медь тех- ническая Ml Латунь ЛЖМц59-1-1 Констан- таи (мед- ио-иике- левый сплав) Нержавеющая сталь 12Х18Н10Т
10 0,0014 — 0,005 — 0,00122 0,0040 —
20 0,010 0,00555 0,019 0,00712 0,00669 . 0,0201 — 0,0113
40 0,0775 0,0800 0,079 .0,0540 0,0683 0,0795 — 0,0560
60 0,214 0,210 0,211 0,146 0,125 0,167 — 0,105
80 0,357 0,347 0,371 0,233 0,193 0,234 0,184 0,202
100 0,481 0,450 0,490 0,295 0,260 0,280 0,238 0,262
120 0,580 0,550 0,580 0,352 0,280 0,310 0,279 0,305
140 0,654 0,630 0,644 0,393 0,303 0,335 0,310 0,348
160 0,718 0,702 0,703 0,425 0,323 0,351 0,333 0,378
180 0,760 0,740 0,752 0,450 0,340 0,368 0,349 0,397
200 0,797 0,785 0,788 0,470 0,357 0,372 0,362 0,417
220 0,826 0,826 0,818 0,487 0,363 0,381 0,370 0,432
260 0,869 0,862 0,856 0,508 0,375 0,385 0,390 0,465
300 0,902 — 0,879 0,520 — 0,385 0,410 —
170
Физические свойства веществ при низких температурах
Продолжение табл. 4.91
Темпе- ратура. К Клей БФ-4 П-'Т Тефлон Активиро- в анный уголь Лед водяной Стекло кварцевое (плавлен- ный кварц) Пенопо- листирол ПС-1 Пенополи- уретан ГПУ-104Б Минора
10 0,018 0,0152
20 0,490 0,076 0,042 0,114 .
40 0,963 0,165 0,070 0,34
60 — 0,238 0,10 0,535
80 — 0,312 0,14 0,716 0,207 — 0,590
100 2,28 0,386 — 0,882 0,266 0,445 0,563 0,682
120 — 0,457 —— 1,03 0,328 0,535 0,645 0,770
140 —. 0,525 — 1,16 0,388 0,625 0,728 0,856
160 — 0,598 — 1,29 0,443 0,715 0,808 0,942
180 4,15 0,677 — 1,43 0,495 0,805 0,890 1,024
200 — 0,741 .— 1,57 0,544 0,895 0,970 1,108
220 — 0,798 —. 1,72 0,589 0,983 1,050 1,190
260 — 0,93 — 2,01 0,664 1,160 1,210 1,316
300 6,02 1,02 — 2,10 (Т=273,15 К) 0,743 1,335 1,375 1,430
Таблица 4.95. Средние удельные теплоемкости (в указанном температурном интервале)
некоторых элементов и ведеств, Дж/(г-К)
Алюминий
19—77 0,1730
85 —293 0,732
289—373 0,888
Ванадий
279—373 0,483
Висмут
20—77 0,0913
83—290 0,115
Кремний
85—293 ] 0,494
Литий
20—77 1 0,805
Магний
20—77 I 0,298
85—293 0,871
Вольфрам
20—77 I 0,0397
88—293 I 0,149
Железо (а)
20—77 I 0,0733
85—293 I 0,36
Золото
2.1—70 I 0,067
85—293 | 0,124
Да дмий
85—293 | 0,216
Калий
21—70 I 0,536
82—281 | 0,673
Кальций
81—293 I 0,656
Марганец
20—77 I 0,096
85—293 I 0,390
Медь
20—77 I 0,102
85—293 | 0,330
Молибден
20—77 I 0,059
85—293 I 0,232
Натрий
20—77 | 0,636
82—291 | 1,084
Никель
20—77 0,087
85—293 0,364
Олово (белое)
20—77 0,12
85 —293 0,21
Платина
20—87 I 0,056
87—194 1 0,116 Родий
20—77 | 0,056 j Ртуть
2,9-14 | 0,0022
20—77 1. 0,097 Свинец
20—77 1 0,10
85—293 1 0,126
Серебро
20—77 1 0,101
85—293 1 0,214 Хром
20—77 I 0,0594
85—293 | 0,332 Латунь
(60 % Си+40 % Zn)
87—194 I 0,311
Теплоемкость
171
Таблица 4.96. Удельная теплоемкость титановых сплавов, Дж/(г-К) [746]
Температура, К Однофазные а-сплавы Двухфазные а+р-сплавы
ВТ1 АТ2 BT5-I ВТЗ-1 ВТ6 ВТ14
10 —— 0,0020 0,003 0,0030 .
15 0,00342 0,0031 0,006 0,0260 .—
20 0,00712 0,0085 0,010 0,0100 0,0082 0,00787
30 0,0246 0,0280 0,030 0,0300 0,0287 0,0260
50 0,0930 0,100 0,104 0,102 0,0986 0,0984
70 0,193 0,180 0,200 0,186 0,188 0,186
100 0,295 0,290 0,315 0,297 0,301 0,297
140 0,393 0,390 0,416 0,404 0,399 0,392
180 0,450 0,446 0,481 0,480 0,458 0,449
220 0,487 0,478 0,525 0,536 0,495 0,484
260 0,503 0,498 0,556 0,579 0,520 0,510
300 0,520 0,523 0,576 0,619 0,539 0,529
Таблица 4.97. Удельные теплоемкости оловяннэ-свинцовых сплавов, мДж/(г-К)
(состав в массовых долях), %
Темпера- тура, к 60 Sn-H0Pb (806] 50Sn-J-50Pb [806] 40Sn-f-50Pb [806] 50Bi + 12,5Cd4-12,5Sn+26Pb (сплав Вуда) (746J
1,5 0,0251 0,0258 0,0280 0,02
2 0,0641 0,0638 0,0696 0,06
3 0,215 0,219 0,245 0,24
4 0,524 0,534 0,612 0,62
6 2,29 2,38 2,43 2,9J
8 : 6,08 6,22 6,42 7,60
10 11,7 11,8 12,5 13,4
14 25,9 26,0 27,4
20 47,5 48,0 49,8 4,60
Рис. 4.48. Удельные теплоемкости гольмия
Но (чистотой 99,65%) и тербия ТЬ [807]
Рис. 4.49. Удельные теплоемкости стекло-
видного германия Ge [808], лантана La
(чистотой 99,898%) [809], неодима Nd
(чистотой 99,503%) [809], празеодима Рг
(чистотой 99,937%) Г809], самария Sin
(чистотой 99,93% [809], скандия Sc (чис-
тотой 99,7%) [810]
172
Физические свойства веществ при низких температурах
Рис. 4.50. Удёльные теплоемкости европия
Ей [811], иттербия Yb [811], свинца в
нормальном РЬ(н) и в сверхпроводящем
РЬ(0) состояниях [812], церия Се [812]
Рис. 4.52. Удельные теплоемкости некото-
рых веществ:
1 — ниобий в нормальном состоянии [817]; 2 —
ниобий в сверхпроводящем состоянии [817]; 3 —
таллий (чистотой 99,9907%) в отсутствие магнит-
ного поля [818]; 4— таллий в магнитном поле
с индукцией 1,7 Тл [818]; 5—манганин (сплав
13% Мп и 87% Си) [819]; 6 — константан (сплав
43% N1 и 57% Си) [8191
Рис. 4.51. Удельные теплоемкости алюми-
ния в нормальном А1(Н) и в сверхпроводя-
щем А1(С) состояниях [813]; стекловидного
германия Ge [808]; диспрозия Dy (чисто-
той 99,86.%) [814], калия К (чистотой
99,99%) [815]; лютеция Lu (чистотой
98,24%) [816]; мышьяка As [809]; руби-
дия Rb (чистотой 99,8%) [815]; цезия Cs
(чистотой 99,8%) [815]
Теплоты испарения, плавления и сублимации
173
4.9. ТЕПЛОТЫ ИСПАРЕНИЯ,
ПЛАВЛЕНИЯ И СУБЛИМАЦИИ
Под этими терминами понимают коли-
чество теплоты, которую необходимо сооб-
щить веществу в равновесном изотермиче-
ском * и изобарном процессах для перевода
его из одного агрегатного состояния в дру-
гое. Такое превращение называется фазо-
вым переходом I рода, соответствующие
термодинамические соотношения см. в
разд. 5.
Iеплота испарения обозначается бук-
вой г, а ее численное значение при расчетах
берется из соответствующих справочных
таблиц или находится по диаграммам со-
стояния Т, s; h, 1g р и др.
В табл. 4.98 и на рис. 4.53 приведены
значения теплот испарения и сублимации
некоторых криоагентов в зависимости от
температуры.
Теплота испарения жидкого водорода,
Дж/моль, при различных концентрациях
ортоводорода может быть выражена урав-
нением [26] г, = 895,5—1,13(Т—16,6)2—|—
+5,86Х+12,14Х2, где X— молярная кон-
центрация ортоводорода, доли; Т—темпера-
тура жидкости, К.
* Относится к индивидуальным веществам
и азеотропным смесям.
Теплота Плавления','.Дж/моль, параво-
дорода при давлениях до 35 МПа может
быть вычислена по выражению (р в МПа)
[26] 9пл = 117,2+0,01785 р.
4.10. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ
Поверхностным натяжением называет-
ся сила, действующая на поверхности жид-
кости и стремящаяся свести поверхность
к наименьшему значению (капля, лишенная
Таблица 4.98. Теплоты испаренич и сублимации некоторых криоагентов
(*—нормальная точка кипения; тройная точка).
Азот [24, 405] Аргон '[405]
т, к I Дж/г Т, к 0 Дж/г
Теплота 77,347* испарения 199,36 Теплота.сублимации
75 202,30 -бб 194,18
70 2j8,15 78 196,29
65 213,56 74 197,63
63.152** 215 47 70 198,74
.Теплота сублимации. 65 55 199,87 231,57
63,152** 241,21 5Э- 202,19
60 253,37 2 8 202,83
50 40 248,72 252,51 Водород (26,405]
35,6 253,74 Т, К п-Н2 Дж/г , [ : Р-Н2, Дж/г
23 266,12 Теплота испарения
Аргон [2Э, 405] 14 456,4 450,5
16 458,8 453,4
Т, К Дж/г 18 457,8 452,2
— 21 447,6 441 0
Теплота испарения 23 435,5 "426,'7
87,29* 160,78 25 393,3 404,7
86 161,66 27 38 ,0 371,9
84 ’ 163,06 29 333,3 323,3
83,8** 163,18 31 260,2 248,6
174
Физические свойства веществ при низких температурах
Продолжение табл. 4.98 Продолжение табл. 4.98
р-Н2 [4241 Гелий-3 [415, 4161
т, к | р, Па | Дж/г Т, К | Дж/моль
Те 13,8 12 10 8 6 плота сублимат 7050 1840 256 14,6 0,16 и 512 500 483 464 444
Воздух 1231
т, к Дж/г
Теплота 70 75 80 85 90 95 100 ПО 120 130 испарения 200,5 200,5 197,8 183,4 187,6 180,5 172,2 150,9 120,1 63,5
Гелий-4 4141
Г, К | Дж/г | Дж/моль
Те 2,2 2,4 2,6 2,8 3,0 3,2 3,4 3,6 3,8 4,0 4,2 4,4 4,6 4,8 5,0 5,1 5,18 плота испарения 22,8 23,1 23,3 23,5 23,7 23,6 23,5 23,2 22,7 21,9 20,9 19,7 18,0 15,6 12,0 9,0 4,0 91,07 91,94 92,98 93,89 94,29 94,19 93,56 92,27 90,26 87,44 83,55 78,41 71,69 62,65 47,68
Теплота затвердевания
т, к Дж/моль | 7. К Дж/моль
0,9 1,0 1,2 1,4 1,6 1,8 2,0 0,022 0,081 0,39 1,69 2,80 8,18 9,44 4 6 8 12 16 20 26 23,8 33,5 50,7 77,8 108 141 196
Теплота испарения
0,54 0,80 1,0 1,4 1,8 2,2 2,6 3,0 3,2 3,3 30,8 35,2 38,1 43,2 46,1 46,3 44,8 38,0 24,7 14,1
Дейтерий [268]
т, к Дж/моль
Теплота испарения
24 1200
26 1135
28 1060
30 970
32 860
34 740
36 555
Кислород [405J
Т. К Дж/г
Теплота испарения]
100 203
90,2 213
70,0 231
60,0 238
54,4 243
Теплота сублимации
Твердая "/-фаза
54,4 257
50,0 257
46,0 261
43,8 262
Тверда я р-фаза
43,8 285
40,0 287
30,0 289
23,9 288
Твердая а-фаза
23,8 291
22,0 291
20,0 290
Теплоты испарения, плавления и сублимации
175
Продолжение табл. 4.98
Криптон [29, 405]
т. к Дж/г
Теплота испарения
Продолжение табл. 4.98
Метан [ 27, 405]
т, К | Дж/г
119,78*
117
115,76**
107,6
108,5
169,1
Теплота сублимации
93,6** 600
80 609
70 611
60 614
50 615
40 611
Неон [29]
Т, К | Дж/кг
Т еплота сублимации
115,76** 128,5
108 130,1
100 131,5
90 133,0
80 134,5
70 135,1
60 135,6
Ксенон [29, 405]
т, к Дж/г
Теплота испарения
Теплота испарения
40 52,5
30 81,3
27,09* 86,7
26 87,2
24,55** 88,7
Фтор [405]
Т, К I Дж/г
165,02*
164
162
161,37**
95,7
95,9
90,4
96,5
Теплота сублимации
161,37** 114,5
160 114,9
157 115,2
154 115,7
150 116,1
140 117,3
130 118,2
Метан [27, 405]
Т, К ' Дж/г
Теплота испарения
144 24,8
140 65,2
130 104,6
НО 145,6
100 159,3
90 1170,3
84,95* 175,1
80 179,5
75 187,5
70 186,0
60 194,8
53,48** 199,3
Теплота испарения
19) 106,1
182 226,8
170 318,2
158 378,5
140 442,8
134 459,8
128 475,3
122 489,3
116 502
111,7* 511
104 523,1
98 532
94 537,7
90,6** 542
Теплота сублимации
53,54 210,1
50 212,0
45 216,0
40 236,0
30 236,0
20 234,0
Этан [405]
т, к Дж/г
Теплота испарения
184,52* 489
180 496
170 508
160 520
150 532
140 .543
130 554
ПО. 575
89,89** 596
176
Физические свойства, веществ при низких температурах
Продолжение табл. 4.98
Продолжение табл. 4.99
Этан [405]
т, к Дж/г Азот [405, 419] Водород [4OOJ
Теплота сублимации т, к а-103 Н/М | Т. К а-10® Н/м
89,89** 85 75 65 55 692 694 701 712 718 85 80 75 70 65 7,16 8,35 9,41 10,58 11,77 20,38* 20 17 14 13,95** 13,8** 1,946 2,008 2,498 2,995 3,004 1,973 2,462 2,958 2,990
Этилен [595]
т, к Дж/г Аргон [419] Гелий-4 [25, 250]
Теплота испарения т, к а- 10е Н/м Г, К ст-10s Н/м
280 250 2J0 170 150 140 120 110 силы тяжести, прив форму). Поверхностное н раздела между дву1 вается пограничным це раздела твердое 113,3 303,2 145 430,8 ,.л 4803 140 508,5 130 521,5 ,„а 547,2 120 561,0 ПО имает шарообразную 95 атяжение на границе „„ ия жидкостями назы- у 1атяжением, на грани- 85 гело — жидкость — ад- -— 0,57 1,28 2,99 4,95 7,10 9,4 10,6 11,8 13,1 5,1 5,0 4,5 4,22* 4,0 3,5 з,о 2,5 2,19 2,0 1,4 1,0 0,8 0,7 0,0103 0,0205 0,0716 0,0997 0,1226 0,1736 0,2247 0,2757 0,29 0,31 0,34 0,345 0,373 0,375
гезиониым натяжением. Поверхностное натяжение завис природы жидкости, от среды, с к граничит жидкость, и от температур Коэффициент поверхностного н ния о, Н/м, численно равен силе, дей щей на единицу длины. С повыи температуры коэффициент поверхнс натяжения уменьшается и при приблг к ТКр стремится к нулю. Значения к циеитов поверхностного натяжения жидких криоагентов и некоторых сме их основе даны в табл. 4.99. О пове] ном натяжении смесей жидких криоа см. также в [418]. Таблица 4.99. Поверхностное натяжение жидких криоагентов на границ с насыщеннным паром (*—нормальная точка кипения **—тройная точка) Гелий-3 [1621 лт от 1 Кислород [405]
оторой г, к а-Ю» Н/М Т, К а-Ю® Н/м
атяже- о п ствую- тением ^’5 СТНОГО -7’^ жении * сей на 0 6 JXHOCT- и,б° тентов 0,020 0,053 0,088 0,116 0,144 0,150 0,152 0,152 152 150 144 130 126 112 106 100 94 90,18 88 82 76 68 62 69 56 54,35 0,26 0,52 1,45 2,51 4,88 7,95 9,34 10,77 12,24 13,19 13,74 15,26 16,82 18,94 20,55 21,1 22,19 22,65
Дейтерий [404]
т, к а-10’ Н/м
е 24 22 20 18,5 3,06 3,42 3,80 4,06
Азот [405, 419] Водород [405]
т, к ct-iO3 Н/м т. к ДИОКСИД углерода [IS5J а • 10 3, Н/м — 1 Криптон [420]
120 110 100 95 90 0,68 2,21 4 ,С6 5,16 6,10 31 28 25 22 20,27* п-Н2 0,296 0,743 1,208 1,686 — т, к а-10» Н/М 1 т, К су-10» Н/м
р-Н2 0,266 293 0,711 273 1,175 248 1,651 221 1,930 1,37 4,6 9,8 16,5 122,4 120,0 118,1 115,8 14,95 15,49 15,95 16,42
Показатель преломления
177
Продолжение табл. 4.99
Метан [420] Ксеиои [421]
Т, к а«10* Н/м т. к а-Ю3 Н/М
114,6 110,4 105,7 101,1 95,3 93,9 12,43 13,22 14,02 14,56 16,14 16,98 285 265 245 225 205 185 165 0,3 2,3 6,4 7,9 И,2 14,7 18,5
Неон [805] Смесь кислород— азот [163]
Т, к ст- 103 Состав Т, К ст- Ю3 Н/м
28 27 26 25 24 4,48 4,79 5,15 5,54 5,90 20%О2 50<>/oO2 80»/оО2 65 70 75 65 70 75 65 70 75 12,9 Н,9 10,8 14,7 13,7 12,7 16,7 15,5 14,3
Оксид углерода [805]
Т. К сг-iO3 Н/м
90 80 70 7,7 9,8 12,1 Состав т, к сг-103 Н/м
19»/о02 47о/о02 81°/оО2 82,4 88 76,5 80,0 86,2 64,3 70,4 78,0 85 6 13,9 12,5 15,65 14,95 13,3 18,85 17,85 16,1 14,1
Фтор [805]
т. к а-103 Н/М
66 70 74 78 18,9 17,7 16,5 15,4
Смесь азот—аргон [164]
Состав т, к s-Ю3 Н/м
22%N2 78,7 84, 1 12,8 И,7
70%N2 80,1 85 9,9 8,9
Смесь аргон—метан [164]
Состав Т, К сг-103 Н/м
27%Аг 85,35 89,9 16,1 14,8
71 % Аг 85,3 90 13,95 12,8
12—218
Про^огженае табл. 4.99
Смесь азот— м тан [164]
Состав т, к а-Ю3 Н/м
23,5°/oN2 83,6 89 75,9 13,8 12,4 11,4
71%N2 80,3 85,0 10,35 9,2 .
Смес метан—криптон [420]
Состав т, к О-Ю» Н/м
32,5°/оСН4 110,9 113,7 116,9 15,56 15,03 14,56
67%СН4 111,1 112,9 115,2 14,21 13,79 13,29
4.11. ПОКАЗАТЕЛЬ ПРЕЛОМЛЕНИЯ
Абсолютный показатель преломления:
«або—отношение скорости света в вакууме
к фазовой скорости света в данной среде.
Показатель преломления относительный
«отн — отношение скорости света в среде II
к скорости света в среде I.
Показатель преломления определяет
отклонение луча света при переходе его из
одной среды в другую и равен п—
=sin i/sin г, где г — угол падения (между
падающим лучом и нормалью); г—угол
преломления (между преломленным лучом,
и нормалью).
Показатель преломления зависит от
длины волны света и от состояния среды —
ее температуры, давления и т. д.
Показатель преломления принято изме-
рять для определенных спектральных ли-
ний, что отмечается соответствующим ин-
дексом. Так, например, nD— показатель,
преломления для линии D излучения нат-
рия (длина волны 589,3 нм), пе — для ли-
нии е излучения ртути (длина волны
546,1 нм) н т. д.
В табл. 4.100 приведены значения пока-
зателя преломления газов по отношению»
к воздуху, а в табл. 4.101 для воды и жид-
ких криоагентов. О показателе преломле-
ния для жидкого дейтерия см. в [423].
Для твердых тел показатель преломле-
ния изменяется в интервале примерно от
1,1 до 4.
а 78
Физические свойства веществ при низких температурах
Таблица 4.100. Показатель
преломления газов при 0°С
и 0,1 МПа [58] (длина волны
589,3 нм)
Газ (пар) «о
.Азот 1,000297
.Аргон 1,000284
Вода 1,000252
Водород 1,00)139
Воздух 1,030292
Гелий 1,000035
Дейтерий 1,000137
Диоксид углерода 1,000450
Кислород 1,000272
Криптон 1,000427
Ксенон 1,000702
Метан 1,000441
Неон 1,000067
Оксид углерода 1,000334
Ртуть 1,000933
Фтор 1,000195
Этилен 1,000696
Таблица 4.101. Показатель
преломления жидких криоагентов и воды
Вещество Температура, К Показатель преломления пе
.Азот 78 1,205*
.Водород нор- 20,46 1,1124
мальный [26] 22 1,1093
24 1,1049
26 1,0997
28 1,0937
30 1,0859
Параводород 20,6 1,1114
(95%р-Н2) [26] 22 1,1082
24 1,1036
26 1,0988
28 1,0931
30 1,0852
Гелий-4 [25] 1,6 1,02806
2,0 1,028585
Х-точка 1,028681
2,6 1,028279
3,0 1,027668
3,5 1,026647
4,0 1,025241
4,2 1,024510
5,0 1,019519
Кислород 92 1,221
Вода [58] 300 1,332
373 1,318
4.12. СКОРОСТЬ ЗВУКА
Термодинамические соотношения для
скорости звука см. на с. 20.
В общем случае скорость звука опреде-
ляется сжимаемостью и плотностью среды.
В пределах соблюдения идеальных газовых
законов скорость звука не зависит от дав-
ления. При больших давлениях наступают
отклонения.
В табл. 4.102 приведены скорости зву-
ка в газах при температурах от 0 до 30 °C.
Таблица 4.102. Скорость
звука в газах [58]
Газ т, К V, м/с
Азот 292 349
273 334
Аргон 293 321
273 319
Возд х 303 353
273 331
Водород 293 1331
273 1284
Гелий 293 1055
273 965
Дейтерий 293 893
Диоксид углерода 293 274,6
273 .256,7
Закись азота 273 263
Кислород 273 314
Криптон 293 224
Метан 273 430
Неон 303 461
273 433
Оксид углерода 173 337
Этан 283 308
Этилен 293 329
273 317
Поправку на температуру для скорости
звука в газах можно приблизительно оце-
нить по формуле
= 1/„К1 4- //273, (4.21)
где Го —скорость звука при 0°С; t — тем-
пература, °C.
Скорости звука в жидких криоаген-
тах, а также в сосуществующих жидких и
паровых фазах даны в табл. 4.103 и 4.104.
Скорости звука в смесях водорода и гелия
с кислородом и азотом даны в [425].
Скорость звука 179»
Таблица 4.103. Скорость
звука в жидких криоагентах
при давлении насыщенных паров
Т, к V м/с
Азот [422]
125,5 182,8
120,2 313,2
110,2 472,2
101,2 589,9
91,2 705,4
80,3 821,5
70,0 923,5
65,4 968,1
Аргон [422]
149 216
139,8 373,7
130,2 484,9
121 2 573,6
111,7 656,2
100,0 746,8
91,0 812,4
84,8 855,8
Водород [26]
А!-Н2 Р-Н2
31,5 593 566
30 7и8 696
28 829 818
25 866 957
22 1071 1062
20 1132 1124
18 1182 1174
16 1226 1217
14 1265 1256
Гелий-42 [25]
4,2 180,5
4,0 189,3
3,5 205,8
з,о 217,9
2,5 221,9
2,2 219,7
2,0 226,4
1,8 231,4
1,6 234,6
1,4 236,4
1,2 237,3
0 '268, 2+0,1
Гелий-3 [411]
з,о 115
2,5 142
2,0 158
1,5 170
1,0 78
0,5 182
Кислород [422]
150 | 266
140 12
Продолжение табл. 4.103-
т, К V, м/с
132 517
120 645
НО 730
102 804
90 909
80,8 981
69,8 1и68
61,1 1133
Криптон [166]
200 292
180 410
160 517
150 561
140 605
130 648
120 690
Ксенон [166]
270 278'
250 346-
220 481
200 542
190 571
180 602
170 631
Метан [405]
190 259"
170 667
152 902
140 1047'
128 1181
116 1308-
110 1372
98 1502'
94 1544
90,7 1576-
Этан [405]
300 309
260 720
200 1220
180 1384
160 1550
140 1724
120 1909
ПО 2009
89,9 2231
12*
4 80
Физические свойства веществ при низких температурах
Таблица 4.104. Скорость
звука в сосуществующих
жидких и газообразных фазах,
м с
т, к Жидкость Газ
Водород (пара) [405]
13,8 1273 305
15,0 1235 317
16,7 1184 331
19,4 1115 350
22,2 1038 368
25,0 944 373
30,6 655 376
32,97 349 351
Гетй [250]
.2,4 217,4 87,3
2,6 217,7 89,8
2,8 215,5 92,0
3,0 211,5 94,0
3,2 206,5 95,7
3,4 201,0 97,1
3,6 194,0 98,3
3,8 188,9 99,2
4,0 181,2 99 8
-4,22 172,0 100,2
4,4 163,0 100,1
4,6 153,1 99,7
4,8 141,7 98,9
5,0 126,0 1 97,8
Кислород [405]
54,35 1159 141
6J 1124 138
68 1070 157
76 1012 165
82 967 171
'99,18 9)3 178
100 823 184
112 718 188
126 583 189
138 451 185
150 278 176
Продолжение табл. 4.104
т, к Жидкость Газ
Фтор [405]
53,48 1029 128
60 1024 135
7J 97J 146
89 898 155
• 90 8 П 162
100 717 166
119 616 168
129 5 9 168
130 393 164
140 | 248 152
4.13. КОЭФФИЦИЕНТЫ ТЕПЛОВОГО
ИЗЛУЧЕНИЯ И ЛУЧЕПОГЛОЩЕНИЯ
Коэффициентом теплового излучения
(степенью черноты) е называется отноше-
ние энергии, излучаемой телом, имеющим
температуру Т, к энергии излучения абсо-
лютно черного тела при той же температу-
ре. Коэффициентом лучепоглощения а на-
зывается отношение поглощенной телом
лучистой энергии к падающей на него. Ко-
эффициент лучепоглощения численно равен
степени черноты (закон Кирхгофа). Коэф-
фициент лучепоглощения существенно за-
висит от рода материала и от состояния
поверхности; он увеличивается в результате
механической обработки, добавки примесей,
загрязнения поверхности и образования
пленки окислов. Кроме того, значение этого
коэффициента зависит от температуры по-
верхности и от спектрального состава па-
дающего на эту поверхность излучения, ко-
торый определяется главным образом тем-
пературой излучающего абсолютно черно-
го тела.
В табл. 4.105 приведены значения ко-
эффициентов полного нормального теплово-
го излучения для наиболее употребитель-
ных материалов, поверхность которых под-
вергнута различной обработке и находится
при различных температурах. Здесь же да-
ны температуры излучающего абсолютно
черного тела.
Таблица 4.105. Коэффициенты теплового излучения е полного
нормального теплового излучения для различных материалов [312, 326—328]
Материал Характеристика поверхности Температура, К 6
излучающего абсолютно черного тела поверхности
Алюминий Отожжена, электрополирована 300 390. о,сз
То же 300 76 0,018*
То же 300 4 0,011*
Чистая шероховатая поверхность 300' ‘ 309 0,055
Коэфициенты теплового излучения и лучепоглощения
181
Продолжение табл. 4.105
Материал Характеристика поверхности Температура, К £
излучающего абсолютно черного тела поверхности
На поверхности пленка оксида тол- щиной 0,24 мкм 311 311 0,С6
То же 1,0 мкм 311 311 0,30
То же 7,0 мкм 311 311 0,75
На поверхности пленка лака тол- щиной 0,5 мкм 311 311 0,05
То же 2,0 мкм 311 311 0,30
То же 8,0 мкм 311 311 0,57
Фольга толщиной 14 мкм 300 77 0,018
Напыленный (в вакууме) на нержа- веющую стать 300 76 0,07
Напыленный (0,03 мкм) на обе стороны лавсана (12 мкм) 300 76 0,04
Бронза Чистая полированная поверхность 293 77 0,046
Железо Электролитическое осаждение 295 295 0,050
То же 300 90 0,017
Золото Чистая полированная поверхность 330 330 0,02
Фольга (толщиной 37 мкм) на стекле 295 76 0,01*
Фольга (толщиной 1 мкм) на стек- ле 295 76 0,023*
Лист (толщиной 0,25 мкм) на стекле 295 76 0,063*
Напыленное на обе стороны лав- сана (12 мкм) 295 76 0,02*
Напыленное (2,5 мкм) на нержа- веющую сталь 295 76 0,027*
Напыленное (5 мкм) на медь 295 76 0,025*
Кадмий Электролитическое покрытие (мши- стое) 295 76 0,03
Латунь Листовая окисленная 373 373 0,6
Листовая прокатная 300 300 0,06
Листовая полированная 373 373 0,03
Листовая тонкая 295 »4 0,018
Медь Окисленная поверхность 300 300 0,78
Шабреная поверхность 300 303 0,07
Механическая полировка с абрази- вом 300 3J0 0,03
То же 295 76 0,019*
То же 295 4 0,015
Поверхность химически очищенная 295 76 0,017*
Матовая поверхность (осаждение из раствора) 293 93 0,032
Очень чистая медь, электролитиче- ская полировка 295 93 0,0082
То же 295 4 0,0062
Никель Электролитический 295 295 0,04
Электролитическое покрытие на ме- 300 76 0,03*
ДИ Фольга (толщиной 0,1 мм) 295 76 0,022*
Электролитическое покрытие на железе 298 298 0,045
182
Физические свойства веществ при низких температурах
Продолжение табл. 4.105
Материал Характеристика поверхности Температура, К £
излучающего абсолютно черного тела поверхности
Олово Чистая полированная поверхность зэо 300 0,05
Чистая фольга (толщиной 25 мкм) 295 76 0,013*
То же 295 4 0,012
Тонкий слой на меди 30J 300 0,02
Тонкий слой на стекле 293 90 0,038
Платина Чистая поверхность 295 295 0,03
То же 29J 85 0,016
Родий Чистая поверхность 295 295 0,05
Тонкое покрытие на нержавеющей стали 295 76 0,078*
Ртуть Жидкая 273 273 0,09
Свинец Серая окисленная поверхность 295 295 0,28
Неокисленная полированная поверх- ность 373 373 0,05
Чистая фольга (толщиной 0,1 мм) 295 76 0,( 36*
То же 295 4 0,011
Серебро Чистая поверхность 273 273 0,02
То же 295 76 0,008*
Матовая поверхность, полученная осаждением из раствора на стекле 293 90 0,036
Сталь нержаве- ющая Поверхность механически полиро- вана 373 373 0,08
То же 300 76 0,048*
Хром Покрытие по меди 300 76 0,08*
Цинк Чистая полированная поверхность 295 295 0,05
То же 295 76 0,026*
Чистая фольга (толщиной 0,16 мм) 300. 76 0,02*
Припой (0,5Sn+ +0,5 Pb) Слой (0,05 мм) на медной подлож- ке (0,12 мм) ЗЭО 76 0,03*
Монель-металл Чистая поверхность 273 77 0,11
Сплав Вуда Чистая поверхность 273 77 0,16
Бакелитовый лак Тонкая пленка, высушенная при 135° С 273 77 0,87
Лед водяной Гладкая поверхность 273 273 0,96
Стекло Гладкая поверхность 293 293 0,94
'Полное полусферическое излучение.
4.14. СВЕРХПРОВОДИМОСТЬ
Сверхпроводимость была открыта Ка-
мерлинг-Оннесом в 1911 г. Явление заклю-
чается в том, что у некоторых чистых ме-
таллов, сплавов н химических соединений
металлов при определенной низкой темпе-
ратуре, получившей название критической
температуры перехода Тк, практически пол-
ностью пропадает электрическое сопротив-
ление. Переход в это новое сверхпроводя-
щее состояние происходит скачкообразно..
Интервал температур АТ, в котором про-
исходит скачок, составляет от 2-Ю'5 до
Сверхпроводимость
183
нескольких градусов в зависимости от тока
сверхпроводника. Фундаментальным свой-
ством сверхпроводников служит так назы-
ваемый эффект Мейснера, т. е. явление пол-
ного вытеснения магнитного поля из объ-
ема сверхпроводника при температурах
ниже Тк и для поля не выше определенно-
го критического значения Як (рис. 4.54). По
сути эффект Мейснера означает равенство
нулю магнитной индукции (В=0) внутри
сверхпроводника. Конечно, это относится
к идеальному состоянию, от которого все
реальные вещества отклоняются в той или
иной степени. В действительности магнитное
поле все же проникает в сверхпроводник на
так называемую глубину проникновения Л
(10-5—10-6 см). Глубине проникновения %
соответствует падение поля в е раз от зна-
чения на поверхности.
Эффект Мейснера связан с тем, что при
Н<НК в поверхностном слое сверхпроводя-
щего цилиндра появляется круговой незату-
хающий ток, собственное магнитное поле
которого полностью компенсирует внешнее
поле в толще образца.
Магнитное поле, при котором происхо-
дит разрушение сверхпроводимости, назы-
вается критическим Нк. Оно зависит от тем-
пературы в соответствии с приближенным
уравнением
Яв=Я0[1-(Г/Гк)2], (4.22)
где Т — температура, К; Но — критическое
поле при абсолютном нуле. Величины Тк
и Но служат характеристиками данного
сверхпроводника.
В табл. 4.106 приведены значения Тк
и Но для ряда элементов. На рис. 4.55
даны зависимости Нк от Т для некоторых
сверхпроводников.
Для образцов сверхпроводников, имею-
щих сложную геометрию (шар, цилиндр
в поперечном поле), разрушение сверхпро-
водимости магнитным полем происходит не
скачкообразно, а так, что одновременно су-
ществуют нормальные и сверхпроводящие
области. Это состояние называется проме-
жуточным. По мере увеличения поля отно-
сительное количество нормальной фазы воз-
растает и при Як сверхпроводящая фаза
полностью пропадает.
Сверхпроводимость нарушается также,
если протекающий транспортный ток пре-
вышает определенное критическое значение
/к. Для достаточно толстых образцов кри-
тический ток совпадает с током, создающим
на поверхности образца поле, равное Як
(правило Силсби).
Поскольку магнитное поле не проникает
вглубь сверхпроводника, это означает, что
круговой электрический ток не может про-
текать внутри, так как иначе он создал бы
там магнитное поле. Следовательно, ток,
протекающий по сверхпроводнику, ограни-
чен тонким поверхностным слоем глубины
Таблица 4.106. Значения
критической температуры и
критического магнитного поля
сверхпроводящего перехода
для элементов1 [463, 464, 578]
Группа в таб- лице Менде- леева Элемент 1 Температура ! перехода Т , К Критическое магнитное по- ле HQt Тл
II Бериллий 0,026
Цинк 0,875 0,0053
Кадмий 0,56 0,0030
Ртуть 4,153 3,949 0,0412 0,0339
III Алюминий 1,196 0,0699
Галлий 1,691 0,0051
Индий 3,403 0,0293
Лантан Га-о. 4,9 —
La-B 6,06 0,1600
Таллий 2,39 0,0171
IV Титан 0,39 0,0100
Цирконий 0,546 0,0047
Олово 3,722 0,03056
Гафний 0,37 —.
Свинец 7,193 0,0803
Торий 1,368 0,0162
V Ванадий 5,30 0,1020
Ниобий 9,26 0,1980
Тантал 4,483 0,0830
VI Молибден 0,92 0,0098
Вольфрам 0,012 0,0001
Урай 0,7 —
VII Технеций 8,22 —
Рени й 1,7 0,0198
Родий 0,001 —
VIII Рутений 0,49 0,0066
Осмий 0,655 0,0065
Иридий 0,14 0,0019
Следующие элементы переходят в сверхпро-
водящее состояние под давлением: Cs» Ba, Y, Се,
Si, Ge,' Р, As, Sb, Bi, Se, Те, La.
проникновения магнитного поля. Токи, про-
текающие через сверхпроводник, называют-
ся транспортными в противоположность
круговым экранирующим токам, обусловли-
вающим эффект Мейснера.
В металлах перенос зарядов (электри-
ческий ток) осуществляется так называемы-
ми свободными электронами, которые мож-
но рассматривать как «электронную жид-
кость». Рассеяние этих электронов на ко-
леблющихся точках решетки металла дает
долю электросопротивления, зависящую от
температуры, а рассеяние на структурных
Физические свойства веществ при низких температурах
184
Рис. 4.54. Эффект
Мейснера
нарушениях и на посторонних атомах обу-
словливает остаточное сопротивление.
По современным представлениям (тео-
рия БКШ — Бардина, Купера, Шриффера) 1
причиной возникновения сверхпроводимости
служит образование связанных пар электро-
нов (так называемых куперовских пар),
благодаря чему «электронная жидкость»
приобретает свойства сверхтекучести. Обна-
ружение влияния на Тк массы атома (изо-
топный эффект) показало, что сверхпрово-
димость связана с характеристикой решет-
ки кристалла, и таким образом установле-
но, что электронные пары образуются во
взаимосвязи с колебаниями решетки. Ча-
стота колебаний решетки зависит от массы
атома. Например, с ростом массы изотопа
температура перехода понижается. Вслед-
ствие взаимодействия электронов и ионов
решетки в окрестности каждого электрона
режим колебаний решетки изменяется и вы-
зывает силы, действующие на другой элек-
трон. С точки зрения квантовой теории эти
силы появляются потому, что электроны
Рис. 4.55. Зависимость критического поля
от температуры [31]
могут взаимодействовать с фононами-кван-
тами колебаний решетки. Эти обменные фо-
ноны называют виртуальными-, они сущест-
вуют только при переходе от одного элек-
трона к другому и не могут распростра-
няться в решетке независимо от этих элек-
тронов. Эти силы всегда приводят к при-
тяжению между электронами и могут пре-
вышать силы их кулоновского отталкивания1
(именно в этом случае появляется сверх-
проводимость). В этом явлении участвуют
не только два конкретных электрона, но и
вся масса электронов металла. Таким обра-
зом, при температуре ниже Тк существуют
уже не электроны, а как бы новые части-
цы — куперовские пары, находящиеся в од-
ном квантовом состоянии.
Чтобы разорвать образующиеся пары
электронов, нужно затратить энергию на
преодоление связи между ними. В данном
случае говорят, что обычное состояние-
электронов отделено от состояния в паре
некоторым энергетическим интервалом—-
энергетической щелью Л. Электрическое со-
противление металла обусловлено взаимо-
действием «электронной жидкости» с ре-
шеткой или с примесями. При наличии
энергетической щели передача энергии
«электронной жидкости» возможна лишь
квантами энергии большими, чем энергия
связи пары.
Таким образом, наличие энергетической
щели приводит к тому, что «жидкость» из
электронных пар (вплоть до определенной
скорости) движется без трения (явление
сверхтекучести), иначе говоря, электриче-
ский ток течет без сопротивления. Энерге-
тическая щель с ростом температуры умень-
шается и при Тк становится равной нулю
(сверхпроводимость пропадает). Сейчас все
известные сверхпроводники имеют критиче-
скую температуру примерно на порядок
меньше дебаевской.
Установлено, что граница между нор-
мальной и сверхпроводящей фазами обла-
дает поверхностной энергией; она может
быть положительной и отрицательной. Со-
гласно современным представлениям эта
поверхностная энергия связана с простран-
ственной корреляцией электронов (размера-
ми пар) и глубиной проникновения.
По знаку поверхностной энергии все
сверхпроводники делятся на две группы:
сверхпроводники первого рода (поверхност-
ная энергия положительна) и сверхпровод-
ники второго рода (поверхностная энергия
отрицательна).
Сверхпроводники первого рода (идеаль-
ные) характеризуются значениями Тк и НКг
которые соответствуют минимальному полю,
разрушающему сверхпроводимость при дан-
ной температуре (рис. 4.55). При Н<НК
поле не проникает в глубь сверхпроводника
(эф4 жт Мейснера). К этой группе относят-
ся юе чистые металлы (элементы) за
исключением ниобия и ванадия.
Сеерхпроводимость
185
Рис. 4.56. Вид зависимости критического
ловя от температуры для сверхпроводника
второго рода
Сверхпроводники второго рода (все
сверхпроводящие сплавы и соединения) ха-
рактеризуются в отличие от сверхпроводни-
ков первого рода наличием двух критиче-
ских полей: нижнего критического магнит-
ного поля ЯК1 и аналогичного верхнего
Як2 (рис. 4.56). При полях, меньших Нк1,
эти сверхпроводники ведут себя как сверх-
проводники первого рода (магнитное поле
полностью вытеснено, наблюдается эффект
Мейснера). Область между /7,:1 и Нк2 на-
зывается областью смешанного состояния
или шубниковской фазой. При внешнем
магнитном поле, большем Як1, магнитное
поле начинает проникать в толщу сверх-
проводника, распределяясь в областях,
.имеющих вид тонких нитей потока, окру-
женных системой круговых незатухающих
токов (вихрен потока, флюксоидов), парал-
лельных внешнему полю. Каждая нить со-
держит квант магнитного потока, равный
лс hl(2e) =2-К)-3 Тл-см2. С увеличением
поля число нитей магнитного потока уве-
личивается, растет их эффективный радиус
а они сближаются, образуя регулярную
структуру по углам равносторонних тре-
угольников (рис. 4.57). В этом смешанном
состоянии внутри нитей металл находится
в нормальном состоянии, а в промежутках
между ними — в сверхпроводящем.
Физическая сущность такого поведения
сверхпроводников второго рода заключается
в том, что при отрицательном значении по-
верхностной энергии между фазами энерге-
тически более выгодно состояние, при кото-
ром нормальная фаза в металле разделена
на большое число нитей магнитного потока
с максимальной развитой поверхностью.
Таким образом, для сверхпроводников
второго рода выше HKi отсутствует эффект
Мейснера, т. е. магнитное поле частично
проникает в сверхпроводник.
В идеальном сверхпроводнике второго
рода, находящемся в магнитном поле Не,
перпендикулярном транспортному току, при
ИК1<Не<Нк2 нз-за миграции нитей ток не
может течь без сопротивления. Движение
нитей связано с тем, что при наличии
транспортного тока на незакрепленные маг-
нитные нити (флюксоида) действует лорен-
Рис. 4.57. Схематичное изображение сме-
шанного состояния сверхпроводника (шуб-
никовская фаза) и прохождения транс-
портного тока. Сверхпроводящие круговые
токи показаны только для двух вихревых
нитей
цева сила F. Движение нитей магнитного
потока приводит к появлению потерь, т. е.
электрическая энергия при этом превраща-
ется в теплоту и появляется э. д. с. проти-
воположного направления. Все эти эффекты
проявляются как электрическое сопротивле-
ние сверхпроводника. На рис. 4.57 показа-
ны направление транспортного тока I и на-
правление силы Лоренца F. Транспортный
ток распределяется по всему сечению сверх-
проводника, он не ограничен тонким слоем
вблизи поверхности. При проникновении
магнитного потока в сверхпроводник транс-
портный ток тоже может проникать в глубь
сверхпроводника. В идеальных сверхпро-
водниках второго рода свободное смещение
вихрей магнитного потока может происхо-
дить при сколь угодно малых силах F,
т. е. при сколь угодно слабых транспорт-
ных токах и, следовательно, критический
ток в них равен нулю.
В настоящее время известно свыше ты-
сячи сверхпроводящих соединений (сверх-
проводников второго рода с различной
кристаллической структурой) и множество
сплавов. Температура перехода Т, таких
соединений лежит в интервале от 0,012 до
23 К.
Обзор соединений см. в [259, 463, 578].
В табл. 4.107 приведены некоторые соеди-
нения с Тк выше 9 К.
Однако если сверхпроводник второго
рода имеет химические и физические не-
однородности (центры пннинга), то они как
бы закрепляют, фиксируют положение
сгруппировавшихся магнитных нитей (флюк-
соидов) на определенных участках, а транс-
портный ток может течь без сопротивления
по областям сверхпроводящего металла.
Закрепление магнитных нитей характер-
но практически для всех сверхпроводников
второго рода, изготовленных обычными ме-
таллургическими методами и с предвари-
тельной механической обработкой.
Фиксирующими центрами для нитей мо-
186
Физические свойства веществ при низких температурах
Таблица 4.107. Критические
температуры некоторых сверхпроводящих
соединений (с Тк выше 9 К) [49, 259, 463]
Соединение Ле К | Соединение 7к,К
65%Nb+Ti и Zr 9,7 VsGa 14,5
(сплав 65БТ) NbN 10—14,5
NbC 8—10 Nb®Ga 14,5
Mb eoTi 4 о 9,8 Nb3Sn2 16,6
ZrN 9,8 V,S! 17,1
NbTsZrss 10,8 Nba '1 17,5
Nb8Pt 10,9 NbgSn 18,05—18,5
Nba 'u 11,5 (NbsAOiNbsGe 20,05
MoN 12 Nb3Ge (пленка) 22,,;
MoscTcso 14
гут быть любые неоднородности: дислока-
ции, выпадение второй фазы, примеси по-
стороннего вещества и т. п. Такие сверх-
проводники второго рода часто называют
жесткими сверхпроводниками или сверх-
проводниками третьего рода.
Для разрушения сверхпроводимости
в жестких сверхпроводниках необходимо
превысить энергию связи с задерживающи-
ми центрами. После того как сила Лорен-
ца достигнет критического значения, связки
нитей перескакивают в новое положение
(скачок магнитного потока), причем проис-
ходит мгновенное повышение температуры,
достаточное для перевода металла в нор-
мальное состояние. Появление и величина
таких скачков зависят от распределения за-
держивающих центров, силы связи, формы
и размера образца и т. д.
Жесткие сверхпроводники могут обла-
дать большими значениями критического
тока, причем он пропорционален сечению
образца. Именно жесткие сверхпроводники
практически используются при изготовлении
соленоидов и других технических сверхпро-
водящих устройств.
В настоящее время в качестве сверх-
проводников при изготовлении сверхпрово-
дящих магнитов в основном используют
следующие сплавы и соединения: NbZr,
NbTi, NbaSn и NbZrTi. На рис. 4.58 приве-
дены характеристики зарубежных сверхпро-
водящих материалов (образцов). При
использовании этих материалов в соленои-
дах плотность критического тока в пересче-
те на полное сечение катушки, включая
изоляцию, стабилизирующий материал, про-
светы и т. д., примерно на порядок ниже-
приведенных на рис. 4.58 значений [465].
В СССР в промышленном масштабе вы-
пускаются сплавы: 65БТ (65 % Nb, 25 % Ti,.
8 % Zr, остальное — добавки); сплав нио-
бия и циркония НЦ-50 (ТС =10,5 К; Нк =
=0,0087 Тл при 4,2 К); сплав ниобия и-
титана НТ-50 (Гк=9,5 К; /7К=0,011 Тл при-
4,2 К). Подробно о материалах см. в [30,
49, 237, 238, 254, 578J.
При использовании сверхпроводников-,
в изделиях наблюдается следующий
эффект: полученные на коротких образцах
значения критического тока не воспроизво-
дятся на длинных отрезках той же прово-
локи. Так, уже при токах, почти в 2 раза
меньших ожидаемых критических значений,
появляется нестабильность, которая может
привести к переходу сверхпроводника в.
нормальное состояние. Нестабильность вы-
звана скачками магнитного потока с цент-
ров пининга, при которых может выделять-
ся много теплоты. Если отвод этой теплоты
не обеспечен, то наблюдается повышение
температуры выше допустимой.
Для устранения такого положения
используют целый комплекс мероприятий —
так называемую стабилизацию сверхпро-
водника. Стабилизация заключается, в част-
ности, в том, что сверхпроводник покры-
вается металлом с очень малым сопротив-
лением, например медью или алюминием.
В случае перехода отдельных участков
сверхпроводника в нормальное состояние-
Рис. 4.58. Токовые характеристики некоторых зарубежных сверхпроводящих мате-
риалов в образцах [465]. Обозначения на кривых — торговые марки материалов
Жидкий гелий и сверхтекучесть
187
ток закорачивается через покрытие. Стаби-
лизация достигается и в том случае, если
выделяемая теплота хорошо отводится
охлаждающим криоагентом (жидким ге-
лием). Используют также проводники
с различным соотношением сечения меди и
сверхпроводника (от 2 : 1 до 10:1).
Многие сверхпроводниковые материалы
.приобрели практическое значение только
тогда, когда удалось разработать стабили-
зированные проводники высокого качества.
Подробнее с основами и приложением
сверхпроводимости можно познакомиться
в [30, 31, 49, 50, 254, 289].
4.15. ЖИДКИЙ ГЕЛИЙ И
СВЕРХТЕКУЧЕСТЬ
Гелий — единственное вещество, не за-
твердевающее' при давлении р=0,1 МПа
вплоть до температуры абсолютного нуля.
Это связано с квантовой природой жидко-
го гелия прн низких температурах. Атомы
гелия обладают большой нулевой энергией
и слабым взаимодействием. В результате
нулевая энергия оказывается достаточной
для того, чтобы воспрепятствовать кристал-
лизации. Только при давлениях выше
2,5 МПа гелий может кристаллизоваться.
На рис. 4.59 приведена фазовая диаграмма
для гелия в координатах р, Т.
Прн температуре 2,172 К (так назы-
ваемая Л-точка) в жидком 4Не, находя-
щемся под давлением насыщенных паров
(5039,6 Па), происходит фазовый переход
второго рода [239]. Гелий выше этой тем-
пературы называется гелием-1, ниже ее —
гелием-П, или сверхтекучим гелием. Темпе-
ратура перехода с ростом давления пере-
мещается в сторону более низких темпе-
ратур. На границе с кристаллом Т =
= 1,7633 К и р= 2,974 МПа [25]. В %-точ-
ке теплоемкость жидкого гелия меняется
скачком (см. рис. 4.45), однако без скры-
той теплоты перехода. В Л-точке гелий
имеет максимальную плотность (см.
табл. 4.13). Твердый гелий существует
в трех кристаллических модификациях,
определяемых температурой и давлением:
а-фаза — объемноцентрированная кубиче-
ская решетка, р-фаза — гексагональная
упаковка, у-фаза —гранецентрированная
кубическая решетка. Последняя фаза су-
ществует только при высоких давлениях
(более ПО МПа) [25, 228].
Гелий-П характеризуется резкой ано-
малией физических свойств. Наиболее ха-
рактерным свойством Не-П является сверх-
текучесть, открытая П. Л. Капицей [240,
241] и заключающаяся в том, что Не-11
при протекании через узкий капилляр или
щель характеризуется практически полным
отсутствием вязкости. Теория сверхтекуче-
сти создана Л. Д. Ландау [242, 243]. По
этой теории жидкий гелий ниже Х-точки,
Рис. 4.59. Фазовая диаграмма для 4Не
т. е. гелий-П, ведет себя так, как если бы
он состоял из двух частей: 1) жидкости,
обладающей квантами возбуждения (фоно-
нами и ротонами) и ведущей себя как
обычная жидкость (так называемая нор-
мальная компонента); 2) жидкости, не не-
сущей квантов возбуждения и имеющей
нулевую энтропию, т. е. как бы находя-
щейся при абсолютном нуле температуры
(сверхтекучая компонента); эта часть жид-
кости не обладает вязкостью. Движение
сверхтекучей жидкости является потенци-
альным и термодинамически обратимым.
Условно нормальная компонента может
быть представлена как тепловой поток, ко-
торый существует как бы вне общей мас-
сы жидкости и способен перемещаться от-
носительно некоторого «фона», находяще-
гося при температуре абсолютного нуля.
Конечно, рассмотрение жидкого гелия
как смеси двух компонент •— это лишь
удобный прием для описания свойств ге-
лия. Как и всякое описание квантовых
явлений в классических терминах, оно не
является вполне адекватным. Правильнее
говорить о «нормальной» и «сверхтекучей»
массах жидкости, связанных с двумя одно-
временно возможными движениями — нор-
мальным и сверхтекучим.
При температуре абсолютного нуля
жидкий гелий находится в наинизшем
энергетическом состоянии, а при повыше-
нии температуры в нем появляются «кван-
ты возбуждения» — квазичастицы с опреде-
ленной энергией е и импульсом р. Как и
для всякой квантовой системы, важно
исследовать энергетический спектр Не-П,
т. е. взаимозависимость энергии е и им-
пульса р.
На рис. 4.60 представлен такой спектр
для Не-11, постулированный Ландау и впо-
следствии подтвержденный эксперимен-
тально [25].
В гелии имеются возбуждения двух
видов: звуковые кванты — фононы с зави-
симостью энергии от импульса а=рс (с —
188
Физические свойства веществ при низких температурах
Рис. 4.60. Энергетический спектр жидкого
гелия (по Ландау). Точки на кривой — ре-
зультаты экспериментальных измерений по
рассеянию нейтронов
скорость звука) и ротоны (вблизи мини-
мума кривой), для которых е=А-|-(р—
—ро)2/(2р), где ро/й=1,93 А-1 — импульс,
при котором энергия ротона минимальна и
равна А//г=8,6 К; р = 0,15m — эффектив-
ная масса ротона; m — масса атома 4Не.
Линия спектра обрывается при опреде-
ленном значении энергии и имеет в этой
точке горизонтальную касательную. Явле-
ние сверхтекучести следует из описанного
спектра. Действительно, наличие вязкости
проявляется в диссипации кинетической
энергии жидкости н постепенном замедле-
нии потока. Диссипация же энергии воз-
можна, когда возникают элементарные
возбуждения. Согласно законам механики
в движущейся со скоростью v жидкости
прн появлении возбуждения с энергией е
и импульсом р полная энергия жидкости
должна измениться на величину e-]-pv.
Чтобы это было энергетически выгодно,
энергия жидкости должна уменьшиться иа
эту величину, т. е. 8-ф-рп<0. Это условие
не может быть выполнено, если значение v
меньше минимально возможного значения
е(р)/р. Поэтому если энергетический
спектр таков, что s(p)/p отличен от нуля,
то при достаточно малых скоростях жидко-
сти v элеме’нтарные возбуждения не будут
появляться. Это значит, что течение жид-
кости не замедляется, т. е. жидкость сверх-
текучая. Именно такой спектр в фононной
части имеет жидкий гелий.
Таким образом, фундаментальное зна-
чение для возможности сверхтекучести
имеет факт существования в энергетиче-
ском спектре начального линейного участка
(фононы). На графике рис. 4.60 это уча-
сток прямой, выходящей из начала коор-
динат под некоторым конечным углом.
Жидкий гелий ниже Х-точки можно
рассматривать как совокупность двух ком-
понентов— нормального и сверхтекучего.
Исходя из этого, общую плотность жидко-
сти можно записать в виде р=ри—рз
(ри — плотность нормального компонента
н р, — сверхтекучего).
По мере понижения температуры от
Х-точки эффективная масса сверхтекучей
части (ps) увеличивается, а нормальная
(Рп) уменьшается (причем всегда p=ps~r
-|-р„). На рнс. 4.61 приведена эксперимен-
тально найденная зависимость ри/р от
температуры для гелня-П [228, 245]. Вяз-
кость гелия-П обусловлена только его-
«нормальной частью», ее и следует иметь
в виду, говоря о вязкости гелия-П в целом.
Перенос теплоты движущейся нор-
мальной частью жидкости представляет со-
бой механизм теплопередачи в гелии-П. Он
имеет, таким образом, своеобразный кон-
векционный характер и принципиально-
отличен от обычной теплопроводности (так,
он зависит от температурного градиента и
геометрической формы). От нагретой сто-
роны идет поток нормальной части, перено-
сящий теплоту, а навстречу ему — поток
сверхтекучей части, так что макроскопиче-
ского реального течения в гелии нет. Как
установлено П. Л. Капицей, такой меха-
низм обусловливает очень большие тепло-
проводности— в тысячи раз большие, чем
теплопроводность меди или серебра. Это-
свойство объясняет визуально наблюдае-
мый переход гелия-1 в гелий-П: поверх-
ность кипящей жидкости при достижении
Х-точкн становится внезапно совершенно
спокойной. Это связано с тем, что вслед-
ствие очень быстрого отвода теплоты от
стенок сосуда благодаря большой тепло-
проводности гелия-П иа них не образуют-
ся пузыри пара и гелий-П испаряется толь-
ко со своей открытой поверхности. Переда-
ча теплоты (фононов) от твердой стенки
тела к жидкому гелию-4 и гелию-3 нли
обратно приводит к появлению скачка тем-
пературы kT на границе между твердым
телом и гелием (так называемый темпера-
турный скачок Капицы) [246]. Этот скачок
прямо пропорционален тепловому потоку
Q и зависит от сорта металла A7’=7?kQ-
Тепловое сопротивление называется сопро-
тивлением Капицы Rk н определяется
Рис. 4.61. Зависимость ри/р от температу-
ры в сверхтекучем гелии
Жидкий гелий и сверхтекучесть
18»
соотношением Т?к=Д7’/<2. Коэффициент
/?к увеличивается с понижением темпера-
туры теоретически примерно обратно про-
порционально Г3.
Экспериментально исследовались зави-
симости коэффициента 7?к для гладкой и
шероховатой поверхностей меди и нержа-
веющей стали, находящихся в контакте
с 4Не, 3Не, и растворов 3Не-4Не с моляр-
ной концентрацией 1—5,5 % 3Не [247, 466].
Результаты исследований показали сущест-
вование кубической температурной зависи-
мости для всех образцов металла и всех
жидкостей ниже 0,3—0,4 К. Так, для 4Не
и полированной меди R-k. = 50/Т3 см2-К/Вт
(0,05—1,5 К), для поверхности из спечен-
ного медного порошка 7?к=40/7’3 (0,1—)—
+1,5 К): для полированной нержавеющей
стали 38/Г3 (0,15—1,5 К); для 3Не и рас-
творов его с 4Не 7?к=50/73 (0,05—0,4 К).
Для границы медь—насыщенный раствор
3Не-4Не экспериментальные данные дают
Дк= (60=70)/У3 (ниже 0,5 К). Выше 0,4 К
для 3Не и его растворов наблюдается от-
клонение от кубической зависимости и ста-
новится важным градиент температуры
в твердом теле.
На рис. 4.62 и 4.63 приведены резуль-
таты экспериментальных исследований со-
поотчвления Дк различными авторами
[247].
Подробнее о скачке Капицы см. в [25,
44, 247, 466J.
В гелии-П наблюдаются так называе-
мые механокалорический и термомеханиче-
ский эффекты. Так, если гелий-П передав-
ливать из одного сосуда в другой через
узкий капилляр, то температура оставшей-
ся части гелия несколько повышается. Это
происходит потому, что капилляр служит
как бы энтропийным фильтром, т. е. через
него проходит преимущественно сверхтеку-
чий компонент (3=0), а оставшаяся в со-
суде теплота распределяется на меньшее
количество гелия, отчего температура его
повышается. Наоборот, гелий, прошедший
капилляр, будет иметь несколько более
низкую температуру. Эти явления и со-
ставляют сущность механокалорического
эффекта.
Иная картина наблюдается при термо-
механическом эффекте, или эффекте фонта-
нирования. Если два сосуда с гелием-П со-
единены внизу между собой капилляром и
к одному из них подводится теплота, то
уровень гелия в этом сосуде будет выше,
чем в другом. Это явление связано с тем,
что в нагреваемом сосуде увеличивается
доля нормального компонента с соответст-
вующим повышением температуры. При
выравнивании концентраций сверхтекучий
компонент устремляется через капилляр
в нагреваемый сосуд, в связи с чем повы-
шается уровень гелия и появляется Ар. Та-
ким образом, появление в жидком гелии-П
разности температур вызывает всегда по-
явление разности давления и наоборот..
Теория дает соотношение
Лр/kT—>ps, (4.23)
где Ар — термомеханическая разность дав-
лений между объемами, характеризуемыми
разностью температур AT; s — энтропия
жидкого гелия; р •— плотность.
Итак, на погруженное в гелий-П тело
может действовать сила, хотя никакого
движения жидкости в целом нет. Эта сила
обусловлена потоком нормального компо-
нента и движущегося навстречу равного ко-
личества сверхтекучего.
Поверхность сосуда, заполненного ге-
лием-П, покрывается выше уровня жидко-
сти пленкой гелия-П толщиной (2=4) X
ХЮ~6 см. Если такой сосуд поместить-
в другой, также заполненный гелием-П,
причем уровень во внутреннем сосуде бу-
дет выше, чем во внешнем, то гелий
(в основном сверхтекучий компонент) нач-
нет перетекать из внутреннего сосуда во-
внешний. Если уровень во внешнем сосуде
сделать выше, чем во внутреннем, то гелий-
будет перетекать во внутренний. Это пере-
текание связано со свойством сверхтекуче-
сти, и его следует иметь в виду при работе
с гелием-IL Пленка увеличивает площадь,
испарения жидкого гелия и затрудняет
откачку его паров. Перетекание, носящее
характер потенциального движения, па
скорости не зависит от разности высот,
длины, пути и высоты барьера и составляет
для температуры 1,5 К и ниже 7,5Х
ХЮ-5 см3/с на 1 см периметра соедини-
тельной поверхности (предел — критическая
скорость).
Критической скоростью называют ско-
рость течения гелия-П, при которой разру-
шается сверхтекучесть. Скорость эта зави-
сит от геометрических размеров потока и
колеблется от 26 см/с (для узких щелей
размером 10-4 см) до 1 см/с в больших
щелях.
Разрушение сверхтекучести при столь
малых значениях скоростей не может быть.,
объяснено появлением возбуждений, соот-
ветствующих спектру (см. рис. 4.60), и свя-
зано с возникновением возбуждений особо-
го типа — квантовых вихрей.
В жидком сверхтекучем гелии помимо-
обычного звука может возникнуть так
называемый второй звук.
Обычный звук представляет собой ко-
лебания плотности среды, где он распро-
страняется. Второй звук связан с колеба-
тельными движениями нормального и
сверхтекучего компонентов, движущихся
навстречу друг другу, при этом отсутствует
суммарный поток вещества и не наблю-
дается сжатий и разряжений жидкости как:
таковой. Поскольку сверхтекучий компо-
нент не несет теплоты, эти колебания бу-
дут выражаться в колебании температуры,,
что и представляет собой второй звук, при-
чем для гелия-П эти волны практически н&
190
Физические свойства веществ при низких температурах
затухают. Скорости первого и
звуков:
/ ,Ts2?s\ 1/2
«1 = ; И2= -------
\ О? ) \ срп /
второго
(4.24)
Рис. 4.64. Скорость обычного и второго
звуков в жидком гелии (4Не и 3Не)
Рис. 4.62. Сопротивление Rk для границы
-медь — жидкий гелий-4 по данным разных
авторов [271]:
1 — Андерсона и др., электрополированная по-
верхность; 2 — Зиновьева (7?к=50/Т3); 3 —Фей-
-ербанка (7?К=45/Т2); 4 — Гуан Вей Янь (7?к =
-21/12,6)
<?к,смгЛ/Вг
ОМ 0,04 0,06 0,1 0,2 0,4 0,6 Г, К
Фис. 4.63. Сопротивление Rk для границы
медь — жидкий гелий-3 по данным разных
авторов:
1—3— Андерсона И др. (прн давлении 0,007; 0,05;
2,7 МПа соответственно); 4—медь — твердый
>гелий; 5—Зиновьева (_RK = 50/Г3); 6 — Ли (7?к =
— 130/Т2); 7, 8 — Селингера и др.
где з — энтропия единицы жидкости; с —
ее теплоемкость.
По теории Ландау щ>и температуре
абсолютного нуля U2=Ut/r 3. Действитель-
ная скорость и2 при очень низких темпера-
турах существенно выше предсказанной
теорией. На рис. 4.64 даиы зависимости
скоростей обычного и второго звуков
в сверхтекучем гелии и 3Не от температу-
ры [228].
Легкий изотоп гелия 3Не примешан
к природному 4Не, находящемуся в возду-
хе в количестве 1,3-1О-4О/о. В гелии,
извлекаемом из природного газа, содержа-
ние 3Не обычно на порядок меньше. Су-
ществует радиоактивный 6Не с периодом
полураспада 0,82 с.
3Не может быть получен искусствен-
ным путем в результате ядерных превраще-
ний в атомных реакторах по реакции
(12,5 года)
бЦ+п->Л1е4-3Н; зн------------>3Не+е-
[226, 248].
Упругость паров у 3Не ниже, чем у 4Не
(см. табл. 4.26). Жидкие 3Не и 4Не полно-
стью растворимы друг в друге до темпера-
тур не ниже 0,88 К и могут быть разделе-
ны ректификацией (равновесие жидкость —
пар, см. гл. 5) и другими методами [230,
248]. В 1972 г. в ряде лабораторий был
обнаружен переход жидкого 3Не (фаза А)
в сверхтекучее состояние при очень низких
температурах (1,14—2,7 мК) в зависимо-
сти от давления (0—3,5 МПа) [44, 654].
При дальнейшем понижении температурь!
сверхтекучий 3Не из фазы А переходит
в новое, состояние — фазу Б. Сейчас интен-
сивно ведется изучение новой сверхтекучей
ферми-жидкости (3Не), представляющей
собой интересное направление физики низ-
ких температур.
Смеси жидких 3Не и 4Не сверхтекучи
при более низких температурах, чем чи-
стый 4Не. Ниже 0,88 К смеси жидких 3Не
и 4Не распадаются на две фазы — более и
менее богатые 3Не. фаза, менее богатая
Разные данные
191!
3Не, — сверхтекучая, другая — не сверхте-
кучая (рис. 4.65) [230]. Как видно из ри-
сунка, даже при 0 К 3Не растворим в 4Не
в количестве 6,4 %; штриховые линии на
рисунке соответствуют постоянству химиче-
ского потенциала или термоосмотического
равновесия. Это используется при расчетах
рефрижераторов на растворах 3Не в 4Не.
На рис. 4.66 приведена энтропийная
диаграмма 3Не [44, 228]. Горизонтальная
линия соответствует энтропии твердого ге-
лия. Остальные линии характеризуют энтро-
пию жидкости. Ниже 0,32 К энтропия твер-
дого гелия больше энтропии жидкого. Это
обстоятельство может быть использовано
для получения ультранизких температур
(см. гл, 3). Кристаллическая структура
вблизи равновесной линии кристаллизации
от 0 до 3 К у твердого 3Не кубическая, при
более высоких давлениях — гексагональная.
Подробнее о теплофизических свой-
ствах 3Не см. в [44, 228, 230, 248].
Рис. 4.65. Фазовая диаграмма жидких
растворов 3Не—4Не
Рис. 4.67. Диаграмма h, s для льда и рав-
новесного пара
4.16. ИЗОТОПЫ ГАЗООБРАЗНЫХ
ЭЛЕМЕНТОВ
Изотопы — разновидность атомов одно-
го и того же элемента, обладающих разны-
ми массовыми числами, но имеющих оди-
наковый электрический заряд и поэтому
занимающих одно и то же место в Перио-
дической системе элементов Менделеева.
Изотопы обозначаются символом элемента
с указанием массы слева сверху (напри-
мер, 16О, 18О). Изотопы имеют одинаковое-
строение электронной оболочки и в химиче-
ском отношении почти тождественны, одна-
ко в целом ряде физических свойств суще-
ствует заметное различие (различные-
молекулярные массы, упругости паров и.
пр.). Различают изотопы стабильные и не-
устойчивые, т. е. самопроизвольно разла-
гающиеся путем радиоактивного распада —
так называемые радиоактивные изотопы.
Большинство химических элементов в при-'
роде состоит из смеси изотопов постоянно-
го состава. В настоящее время известно-
около 250 стабильных изотопов, около-
50 естественных радиоактивных и около-
1000 искусственных радиоактивных изо-
топов.
В табл, 4.108 приведен перечень газооб-
разных изотопов.
Фазовое равновесие жидкость — пар-
и коэффициент разделения для изотопов-
даны в разд. 5.
4.17. РАЗНЫЕ ДАННЫЕ
В табл. 4.109 даны основные физиче-
ские константы ряда газов.
Подробные таблицы с теплофизически-
ми свойствами приведены для: азота —
в [21, 22, 24, 244, 255]; аммиака — в [244,.
192
Физические свойства веществ при низких температурах
Таблица 4.108. Газообразные изотопы [249]
Порядковый номер Изотоп Массовое число* A Содержание в природном со- стоянии элемен- та, % Период полу- распада Энергия распада, кэВ
1 н 1,00814 99,985
2Н, D 2,01473 0,0139+0,0156 — —
3Н, Т 3,0170 Менее 10—10 12,262 года 18
3Не 3,01697 1,3-10—4
4Не 4,00387 99,9999 —
5Не 5,0139 —. 10—8 с «+«
6Не 6,02084 — 0,823 с 3500
7 12N 12,0225 — 0.012 с ?+, 16 600
i®N 13,00985 — 603 с ^+, 1190
I4N 14,00752 99,62 —
15N 15,00489 0,38 — —
i6N 16,0109 — 7,35 с R-, 4000; 10:0 Y, 6000
I7N 17,013 — 4,14 с (Г-, 3700
8 140 14,01305 — 76,5 с ^+, 1800 у, 2300
«О 15,00776 —_ 126 с ₽+, 1733
160 16,00000 99,76
170 17,00453 0,04 —
18Q 18,00485 0,20 —
190 19,0093 — 27 с Г", 2900 11600
9 17F 17,00750 70 с в+, 1700
18р 18,0067 — 112 мин р+, 640
19р 19,00445 100 .
20р 20,0063 — 10,7 с £~, 5400 Y, 1630
10 i8Ne 18 01118 1,6 с |?+, 3200
i»Ne 19,00795 — 17,7 с ^+, 2160
20Ne 19,9987 90,51 — —
2i Ne 21,0005 0,28 —
22Ne 21,99835 9,21 —
23Ne 23,0017 — 37,6 с 4390 Y, 1647
24Ne 24,00119 — 3,38 мин В~, 1980
Y, 878
17 32C1 31,9962 — 0,3 с Р+, 9400 а, 2000 Y, 4700 ^+, 4150, 2930
33C1 32,987 — 1,8 с
34C1 33,9845 —, 32,4 мин 3+, 4500; 2480; И 330
у, 3300; 2130; 153
33C1 34,98007 76 —
3»C1 35,9797 Менее 0,07 3,08- 1G5лет р, 714
S7C1 36,9776 24 — —
38C1 37,9800 — 37,3 мин Ц-, 4810; 2770; 1110
у, 2120; 1600
39C1 38,9802 — 55,5 мин |5~, 345а; 2183; 1910
1 Y, 1520; 1266
Разные данные
193
Продолжение табл. 4.108
Порядковый нэм ер Изотоп Массовое число--' А Содержание в природном со- стоянии элемен- та, % Период полураспада Энергия распада, кэВ
18 3SAr 34,9859 1,83 с 8+, 4960; 3740;'3200
т, 1730; 1190
36Аг 35,9789 0,306 — —
37Аг 36,9785 — 35 дней К-захват
38Аг 37,9748 0,06 — —
39 Аг 38,9766 Менее 10—2 265 лет , 565
4»АГ 39,9751 99,631 — —
«Аг 49,9775 — 109,6 мин 2480; 1199
т, 1290
36 77Кг 76,9498 73 мин |3+, 1700
7 и К-захват
78Кг 77,949 0,35 — —
79Кг 78,9455 — 34,5 ч —
8»Кг 79,9418 2,01 — —
81 Кг 80,9423 — 2,1•105 лет К-захват
8 2 Кг 81,9395 11,53 — —
83Кг 82,9404 11,53 — —
84Кг 83,9382 57,1 — —
85Кг 84,9499 — 10,27 лет 0~, 672y
86Кг 85,9382 17,47 — —
87К 86,9412 — 78 мин R+, 3800; 3300; 125
Y, 2570; 2050
88Кг 87,9423 — 166 мин р, 2800; 2400
89Кг 88,9447 — 155 с 3-, 4000
90J^r** 89,946 — 33 с 3200
54 124Хе 123,94539 0,095 —
125Хе 124,946 — 18 ч К-захват
12«Хе 125,9445 0,088
127Хе 126,9458 — 36,4 дня К-захват
128Хе 127,9445 1,90 — —
129Хе 128,9453 26,23 — —
1з»Хе 129,9448 4,051 —- —
131Хе 130,9467 21,24 — —
432Хе 131,4611 26,925 —
133Хе 132,9478 — 5,27 дней г, 347
7, 82
1з«Хе 133,9479 10,52 — —
435Хе 134,9501 — 9,15 ч Г, 910
7, 604
isexe** 135,9546 8,93
* Массовые числа даны в единицах шкалы 1 «0=16,00000.
** Известно еще несколько радиоактивных кратко^ивуидил иЗи'шпиь*
13—218
Таблица 4.109. Основные физические константы некоторых газов
Газ Плотность при 0 °C и 1013 гПа, кг/м® Атомная или •молекулярная масса* Газовая постоянная ДжДкг.К) Теплоемкость при 20 °C и 1013 гПа, кДж/(кг.К) ср % Вязкость при 0 С и 0,1 МПа, Па-с • 107 (в скобках константы Сутерланда)
СР cv
Азот N2 1,25046 28,013 296,8 1,041 0,737 1,41 167(104)
Аммиак NH, Л я d 0,7714 17,03 488,2 2,160 1,637 1,31 93,5(503)
Аргон Аг 1,78394 39,948 208,2 0,521 0,312 1,68 210/142)
Ацетилен С2Н2 1,1747 26,03 319,6 1,679 1,357 1,24 93 5(198)
Бутан (нормальный) С4Н10 2,703 58,12 143,0 1,590 1,382 1,144 68(377)
Водород (нормальный 75% О-Н2)Н2 0,08988 2,0159 4124,2 14,360 10,174 П41 84,1(73)'
Воздух 1,2928 28,96 287,0 1,006 0,720 1,4 171(111)
Гелий 4Не 0,17846 4,0026 2078 5,276 . . 3,182- 1,66 188(78)'
Гелий 3Не 0,1345 3,0160 2756,7 "6,892 4,135
Дейтерий (нормальный 66,67 % O-D2) d2 0,18 4,02947 2060 7,244 5'159 1,4 118
Диоксид углерода СО2 1,977 44,01 188,9 0,854 0,649 1,32 137(254)
Закись азота N2O 1,977 44,016 188,9 0,913 0,716 К 274 135(260)
Кислород О2 1,42895 31,998 259,8 0,917 0,653 1,4 191(131)
Криптон Кг 3,7493 83,80 100,2 0,250 0,147 1,68 234(188)
Ксенон Хе 5,9 131,30 63,8 0,160 0,096 1,66 215(259)
Метан СН4 0,7168 16,04 518,271 2,180 1,704 1,31 103(162)
Неон Ne 0,8999 20,183 411 1,030 0,620 1,668 301(56)
Озон Оэ 2,144 48,0 173 0,816 —- — 127
Оксид азота NO 1,34 30,01 277,0 0,976 0,695 1,40 178(128)
Оксид углерода СО 1,2504 28,01 296,8 1,043 0,745 1,40 166(100)
Пентан нормальный < Н18 —• 72,14 115 1,453 1,294 1,12 62(382)
Пропан С3Н8 2,005 44,09 188,5 1,650 1,445 1,14 75(278)
Пропилен С3Н6 1,914 42,08 197,5 1,480 1,298 1,17 78(322)
Сернистый ангидрид SO2 2,926 64,07 129,8 0,624 0,489 1,27 117(306)
Тритий Т2 0,27 6,034 138 — — — —
Фтор Р2 1,635 37,997 219 0,829 0,607 1,36 225
Хлор С12 3,22 70,936 117,2 0,489 0,360 1,35 130(254)
Этан С2Н6 1,356 30,07 276,7 1,754 1,445 1,21 85,5(252)
Этилен С2Н4 1,2605 28,05 296,4 1,470 1,248 1,24 94(225)
Значения даны в физических единицах атомной массы ’“С-12.
Физические свойства веществ при низких температурах
00
Температура ки- пения при 1013 гПа, К ^Температура тройной точки (в скобках равно- весное давление в гПа) К Теплота испарения при температуре кипения Теплота плавле- ния, кДж/кг
Дж/моль Кдж/кг
77,35 63,15(125,3) 5560 197,6 0,63
239,76 195,42(60,8) 23 300 1369 332
87,29 83,78(688) 6450 160,78 29,58
189,13 192,4(1282) 20 850 800 157
(сублимация) (сублимация) (сублимация)
272,65 134,85 22 400 386 75,4
2J.38 13,947(72) 915 454,2 58,2
78,8 (кипение) 5942 201,1 —
81,8 (кондеи-
сация)
4,215 Плавл. 1,15 81,3 20,43 4,56
(2,56 МПа) (3 К)
3,191 Плавл. 0,33 25,4 8,46 3,35
(2,93 МПа) (2,5 К)
23,57 18,73(171,4) 1228 207,7 49,2
194,70 216,55 25 100 571,1 199
(сублимация) (0,517 МПа) (сублимация) (сублимация)
184,69 182,35 16 550 376 148,6
99,18 54,36(1,46) 6810 212,3 13,94
119,75 115,76(733) 9055 107,61 19,6
165,03 161,36(816) 12 600 95,73 17,26
111,66 90,68(117,2) 8200 509 58,72
27,09 24,55(433,5) 1735 85,82 16,32
161,25 80,20(0,0146) 15 200 316,5 43,5
121,32 109,46 13 400 448 77
81,61 68,09(153,7) 6040 215,6 29,9
309,25 143,45 25 700 357,6 116,8
231,1 85,45 18 800 427 89
225,35 87,85 18 400 438 71,4
263,14 197,63 (16,74) 25 000 390 115,6
25,04 20,62(216) 1395 231,1 41,9
84,95 53,48(2,51) 6310 175,3 13,49
239,36 172,16(14,6) 20 450 289 90,4
184,53 90,348(1,13-10-2) 14 650 490 95,5
169,38 103,97(1,206) 13 500 483,14 119,26
Продолжение табл. 4.10&
Плотность жид- кости (в скобках температура, К), кг/м3 Критические параметры Теплопровод- ность при 0 °C и 1013 гПа-102, Вт/(м-К) Объем газа (при 0 °C и 1013 гПа) при испа- рении 1 л жидкости, л
Температура, К Давле- ние, МПа Пло т- ность, кг/м8
837(77,36) 126,20 3,4 313, 1 2,397 643
682(239,8) 435,6 11,3 235 2,2 884
1393(87,29) 153,86 4,898 535,7 1,64 780
610(192,4) 308,7 6,25 231 1,84 520
601(272) 425,15 3,8 227 1,35 222
70,80(20,38) 33,18 1,298 30 16,80 788
873(78,8) 132,42/132,52 3,76 327/319 2,41 675
125,0(4,215) 5,189 0,229 69,64 14,4 700,3
58,9(3,195) 3,324 0,118 41,8 — 437,4
165(23,5) 38,34 1,665 70 12,2 950
1183(216) 334,19 7,38 468 1,49 —
1226(184) 339,71 7,28 457 1,51 620
1136(90,19) 154,58 5,043 436 -2,45 800
2414(119,8) 209,39 5,49 910,7 0,875 643
3060(166) 289,75 5,82 1100 0,52 520
426(111,6) 190,77 4,626 163,5 3,04 593
1206(27,1) 44,4 2,653 484 4,80 1340
1358(161) 261,05 5,53 327 1,38 735
1269(121) 179,16 6,59 520 2,21 945
793(81,6) 132,92 3,50 301 2,31 632
620(339) 470,35 3,37 232 1,28 —•
582(231) 370,0 4,27 225 1,51 290
639,0(255) 365,05 4,64 231 1,5 317
1458(263,14) 430,65 7,88 524 0,837 498
257(25) 40,6,. 1,83 106 — 955
1505(85) 144,31 5,22 574 2,47 840
1557(239) 417,16 7,71 573 0,72 484
546(185) 305,5 4,87 205 1,83 403
567,4(170) 282,35 5,042 214,2 1,74 450
сл
Разные данные
196
Физические свойства веществ при низких температурах
Таблица 4.ПЭ. Температура воспламенения и пределы взрываемости
некоторых газов [52, 259, 550]
Наименование ———————————' с Температура воспламенения, °C Пределы взрываемости, объемные доли, % (газа)
с воздухом | с кислородом с воздухом J е кислородом
Дейтерий . 4,9—75 5,0—95
Водород 580—593 580—590 4/’—74,2 4,65—93,9
Оксид углерода 610—658 590—658 12,5—74,2 15,5—93,9
Метай 650—750 560—7.0 5—15,6 5,4—59,2
Ацетилен 305—440 305—440 2,5—8 < 2,8—93
Этилен 490—550 485—520 2,75—28,6 2,9—79,9
Этан 472—630 472—630 3,6—12,5 4,1—50,5
Пропилен 455 420 2,0—11,1 2,1—52,8
Кропан 481—580 481—570 2,1—9,5 2,3—55
Бутилен 445 400 1 7—9,6 —
Бутан 433 460 1,8—8,5 1,8—49
Пентан 285 275 1,3—8,0
Сероводород 292—379 223—315 4,3—45,5 —
Аммиак 651 — 15,5—28,0 13,5—79
Таблица 4.111. Теплоты сгорания некоторых газов [259]
Наименование Высшая теплота Низшая теплота
кДж/к г кДж/м3 кДж/кг кДж / м® '
Водород 142 056 12 779 119 568 10 760
Ацетилен 49 884 57915 48 146 55 896
Метан 55 762 39 893 5) 118 35 849
Этилен 49'892 62 399 46 664 58 363
Этан 51 701 65 652 47 313 58 199
Пропилен 48 988 87 090 45 806 81 228
Пропан 56 244 93 789 46 266 83 531
Бутилен 48 432 115 143 45 303 107 606
Бутан 49 407 121 423 45 638 108 443
Пентан 49 197 149 895 45 429 133 984
Оксид углерода 10 162 12 703 — .
Сероводород 161790 25 540 15618 24 033
Таблица 4.112. Предельно допускаемые концентрации ядовитых газов,
паров и пыли в воздухе рабочей зоны производственных помещений [550]
Наименование вещества ПДК, мг/м3 Наименование вещества ПДК, мг/мз
Аммиак Ацетон Бензин, уайт-спирит, лигроин, керосин Бензол Бутиловый спирт Дихлорэтан Капролактам Керосин Мышьяковистый водород Нитробензол, нитротолуол Нафталин Оксиды азота в пересчете на NSO6 Озон Оксид углерода 20 ,200 300 20 200 10 10 300 0,3 3 20 5 0,1 30 Ртуть металлическая .Свинец и его неорганические со- единения Сернистый ангидрид Сероводород Сероуглерод Скипидар Спирт метиловый Спирт этиловый Спирт пропиловый и бутиловый Толуол Трихлорэтилен Фтористый водород Хлористый водород Пыль стеклянного и минераль- ного волокна 0,01 0,01 10 10 10 300 50 1003 200 50 10 0,5 0,01-5- 3
Разные данные
197
Продолжение табл. 4.112
Наименование вещества ПДК, мг/м3 Наименование вещества ПДК, мг/м3
Хлор Цианистый водород Четыреххлористый углерод Этиловый эфир 1 0,3 20 230 Алюминий и оксиды алюминия Бериллий и его соединения Свинец и его соединения Оксид цинка 2 o,coi 0,01 5
Таблица 4.113. Охлаждающие смеси [212, 259]
Вещество Количество вещества, мас- совые части Количество воды, измельченного льда или СО2, массовые части- Исходная тем- пература перед смешением, °C Конечная темпе- ратура после смешения, °C
NaC2H302H20 (кристаллический) 85
NH4C1 30
NaNO3 75
Na2S2O3-5H2O (кристаллический) 110
KI 149
СаС12-6Н2О (кристаллический) 259
NH4NO3 60
KSCN 159
СаС12 30
Na2S2O3-5H2O (кристаллический) 67,5
NH4C1 25
nh4no3 45
Na Cl 33
Na NO, 59
8
13
25
H2SO4 (66%) 49
72
100
100
100
100
CaCl2-6H2O 100
100
1 100
I 100
C2H5OH 77
Хлороформ , —
Эфир —
255, 259J; аргона — в [21, 22, 29, 244];
ацетилена — в [255]; водорода — в [26, 244,
251, 253, 258]; воздуха — в [21, 22, 23];
гелия — в [25, 961, 250, 276]; диоксида
углерода — в [36, 244, 255]; дейтерия —
в [251, 261, 268, 501]; кислорода — в [21,
22, 244, 788]; криптона — в [29, 244]; ксе-
нона— в [29, 244]; метана—в [27, 255];
неона — в [29, 244]; оксида углерода —
в [244, 255]; фтора — в [244, 252]; хло-
ра — в [244]; этана — в [255, 960]; этилена н
пропилена — в [28, 255, 595]'
В табл. 4.110 даны температуры вос-
пламенения и пределы взрываемости для
некоторых горючих газов. Температура вос-
пламенения газовой смеси — это температу-
ра, при которой выделяемая в результате
H2O, 100 10,7 —4,7
13,3 —5,1
13,2 -5,3
10,7 —8,0
10,8 — 11,7
10,8 — 12,4
13,6 — 13,6
13 —23,7
Лед, 100 — 1 — 10,9
— 1 — 11,0
— 1 — 15,4
— 1 —16,8
— 1 —21,3
— 1 — 18,5
— 1 — 16
— 1 —2д
— 1 —25
» » — 1 —30
П V — 1 —35
я я — 1 —37
Лед, 49 С, — 19,7
61 0 —39,0
70 0 —54,9
81 0 —40
123 0 —21,5
247 0 —9
492 0 —4
73 0 —30
С02 твердая — —72
—77
— —77
реакции теплота компенсирует с избытком
потерю теплоты от теплопроводности и дру-
гих причин, что обусловливает возгорание
смеси, распространяющееся затем уже са-
мостоятельно. Температура воспламенения
’зависит не только от состава газовой сме-
си, но и от способа ее нагревания.
На рис. 4.67 приведена диаграмма h, s
для льда и равновесного с ним пара вплоть
до —100 °C.
В табл. 4.111 приведены теплоты сго-
рания некоторых газов.
В табл. 4.112 даются предельно допус-
каемые концентрации ядовитых газов и па-
ров в воздухе рабочей зоны.
В табл. 4.113 приведены состав охлаж-
дающих смесей.
.898
Экспериментальные данные по фазовому равновесию
Раздел пятый
ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ
ПО ФАЗОВОМУ РАВНОВЕСИЮ
5.1. РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР
ДЛЯ БИНАРНЫХ СМЕСЕЙ
На рис. 5.1 приведены кривые равнове-
сия, вычисленные по уравнению (2.63) для
различных значений относительной летуче-
сти (коэффициента разделения) а.
На рис. 5.2 наглядно представлен очень
простой метод построения равновесных
кривых (подобных приведенным на рис. 5.1)
по значению а. Подробнее об определении
и вычислении равновесных данных см.
в [32]. Справочные данные пособия по рав-
новесным данным см. в [18]. Ссылки на
литературу по фазовому равновесию крио-
генных систем см. в [32, 467, 557].
Ниже приводятся экспериментальные
данные по равновесию при криотемперату-
рах. Данные представлены в порядке воз-
растания температуры кипения как первого,
так и второго компонента (т. е. начиная со
смесей для Не со всеми компонентами, за-
тем для смесей Ha, Ne и т. д:).
Система гелий-3 — гелий-4 (3Не — 4Не).
Равновесие жидкость—пар для бинарных смесей
199
г,к
Рис. 5.3. Диаграмма Т, х для системы
3Не—4Не
Рис. 5.5. Диаграмма р, х для системы
4Не—Н2
Система изучалась многими авторами. Наи-
более полно результаты отражены в [230,
467]. На рис. 5.3 приведена диаграмма Т, х
для системы 3Не — 4Не [228]. Кривые
в области температур выше 1,5 К построе-
ны но данным [230], при 7'<1,5 К (данные
следует считать лишь ориентировочными).
На рис. 5.4 приведены кривые в р, .«-коор-
динатах для равновесия жидкость — пар
системы 3Не —4Не [230].
Система гелий — водород (нормальный,
75 % о-На) (4Не—На). Равновесные соот-
ношения представлены иа рис. 5.5 в коор-_
динатах р, х [468]. Исследования показа-
ли, что равновесные соотношения системы
гелий — равновесный водород (99,79 %
Молярное содержание гелия 5)
Рис. 5.6. Диаграммы Т, х для системы
Не—Ne:
а — общая для системы; б — для жидкой фазы
200
Экспериментальные данные по фазовому равновесию
р-Н2) при температурах ниже 20,4 К прак-
тически не отличаются от аналогичных со-
отношений для системы с нормальным водо-
родом и только при более высоких темпе-
ратурах отклоняются, главным образом
в области паровой фазы. В [468] приво-
дятся также значения констант равновесия
для данной системы как функции р и Т.
Система при более высоких давлениях,
вплоть до 10,5 МПа, изучалась в [467, 468,
В, табл. 5.1 приведены составы жидкой
и- паровой, фаз при различных температу-
рах и давлениях. На рис. 5.7 приведены
изотермы. системы Не—N2> а на: рис.. 5.8 —
изобары, для. жидкой фазы. В системе ге-
лий — азот наблюдается, аномалия (так же
как и для некоторых других систем)., за-
ключающаяся в, том, что имеются области,
где с увеличением температуры пр-и данном
Таблица 5.1. Составы жидкой и паровой фаз системы гелий—азот
(содержание гелия в. молярных; долях, %)
р. МПа 68 К Р> МПа 77, з к Р, МПа 90,1 К Р> МПа Ю7‘К р, МПа HI,5 К
Жид- кость Пар Жид- 1 ОСТЬ Пар Жид- кость Пар Жид- кость Пар- > Жид- кость Пар
0,033 0 0 0,1 0 0 0,36 0 0 1,03 0 0 1,56 > 0 0
0,45 0,107 83,25 0,49 0,098 80» 60 0,49 0,03 15 >75 3,5В 2,20 52,25 2,05 ; 0,37 15,1
1,18 0,195 96,48 1,18 0,300 91,90 1,18 0,38 63,20 5,.0? 3,30 ^61,65 4,54 3,29 50,77
2,26 0,370 97,45 2,26 0,460 93,00 1,94 0,54 80.70’ 7,48 5,.35 ; 71,60 5,70 4,49 56,55
4,90 0.885 98,22 3.43 0,730 96,59 3,04 1,12 85,40' Я,83 6,82 76,85 6,99* , 5,75 61,20
9,39 1,145 93,60 4,91 0,93 97,75 9,45 1,30 86,95 Г Г „55 7,06 79.06 7,35 6,12 61,55
10,94 14,54 1.240 1,48 98,80 98,96 5,94 7,90 9,86 12,30 14,69 18,79 1,12э 1,585 2,0 ;о 2,325 2,545 2,74 98,00 98,20' 98,22 98,30 98,47 98,74 4,16. 5,88 7,50 8,46 10.29 13,78 .16,77 19.53 21,73 1,35 1 2,08 2,34 2,83 3,72 4,37 5,00 5.63 6,18 88,45 91,54 92,95 93.89 94,45 95,85 95,95 91,27 96,53 13,3» 10.12 82,35. 9,22 11,80 13.58 17>70' 19,76 7,65 9,45 10,80 13,10 13,95 68,00 71 95 75,75 78,05 79,00
557]. Данные по системе гелий—параво-
дород см. в [26, 787].
Система гелий — неон (Не — Ne). На
рис. 5.6 представлены диаграммы Т, х для
этой системы по данным [26, 469]. См.
также [557].
Система гелий — азот (Не — N2) изу-
чалась многими авторами. Наиболее полно
результаты изложены в [467, 470, 551,
557].
давлении повышается содержание гелия
в жидкости. Детальные данные можно най1
ти в [552].
В области критической температуры
азота и при больших давлениях система
изучена в [467, 470].
Данные о равновесии фаз кристалл—-
жидкость — пар для системы Не — N2- см.,
в [470]. Растворимость гелия в смесях.
Равновесие мтдкосхь—лар для бинарных смесей
‘21)1
Моляряые бФлы,%,Не в газоЗой фазе
.Рис. 5.8. Изобары системы гелий—азот.
Штриховые линии относятся к газовой
фазе
жидких азота и метана, а также в природ-
ном газе дана в [551].
Система гелий — оксид углерода (Не—
СО). Данные по растворимости приведены
в табл. 5.2 [472 и 557].
Таблица 5.2. Растворимость гелия
в жидком оксиде углерода,
молярные доли, %
Общее давление, /vl-Па —145 °C -Г>0 °C — 18) °C —195,8 °C
0,17 . 0,42 0,3
0,34 1,64 0 9 0,45
0,52 4,24 2,9; 1,35 0,62
0,69 6,93 3,96 1,89 0,73
0,86 9,65 5,10 2,21 0,94
1,03 12,14 6,05 2,49 1,06
1,38 16,73 7,81 3,28 1,34
Система гелий — фтор (Не—FJ). Дан-
ные по растворимости приведены в табл. 5.3
[471].
Таблиц1а 5.3. Растворимость гелия
в жидком фторе
т, к Общее давле- ние, МПа Не в жидкости, молярные доли, %
77 0,45 0,02
77 1,82 0,07
77 3,55 0,13
120 2,08 0,16
120 3,12 0,59
Система гелий — аргон (Не — Аг). Дан-
ные по растворимости представлены в
Таблица 5.4. Растворимость гелия
в жидком аргоне, молярные доли, %
Общее .давление, МПа —125 °C —140 °C —160 °C —180 °C
1,72 0,25 0,15
3,45 — 0,68 0,75 0,35-
5,16 1,21 1,71 1,19 0,52:
6,89 3,93 2,76 1,64 0„71
8., 61 6,5 3,7 2,1 0,87
10,34 8,95 4,61 2,49 1,02
13,78 13,8 6,32 3,25 1,29'
табл. 5.4. Обзор литературы см. в [467,.
472, 55.2, 557]. Детально система изучена
в [473].
Система гелий — кислород (Не — О2).
'Данные по растворимости приведены в.
табл. 5.5 [472]. Подробнее о составах
жидкой и паровой фаз см. [552, 557].
Таблица 5.5. Растворимость гелия
в жидком кислороде, молярные доли, %
Общее давле- ние, МПа —130 °C -145 °C —160 °C —170 °C — К)5,8 °C
1,72 0,27 0,14 0,04
3,45 — 0 86 0,74 0,33 0,14
5 16 1,8 1,59 1,13 0,53 0,20
6,89 з,з 2,37 1,54 0,68 0,25
8,61 4,61 3, 14 1,95 0,83 0,32
10,34 5,98 3,84 2,32 0,99 0,36
10,78 8,6 5,08 3,02 1,27 0,48
Система гелий — метан (Не — СН4).
Данные приведены в табл. 5.6 [474]. См.
также [475].
Система гелий — этилен и гелий — про-
пилен. При температуре ниже 260 К и до
давления 12 МПа система изучена в [476].
Система гелий — диоксид углерода
(Не — СО2). Система в интервале темпера-
тур 220—290 К и до давления 20,0 МПа
изучена в [477, 557].
Системы водород — дейтерий (Н2 — HD
и Н2— D2). Если предположить возмож-
ность применения законов Рауля и Даль-
тона к смесям Н2 — HD и Н2 — D2, то,
исходя из уравнения упругости паров чи-
стых веществ, можно найти зависимость а
от температуры [236]:
lg«H2-HD = — 0.38277 + 10,2926/7' +
+ 5,747-10-37';
lgaH2_D3 = —0,0643+ 13,505/Г =
— 6,173.10-37'.
202
Экспериментальные данные по фазовому равновесию
Таблица 5.6. Равновесие жидкость—пар
в системе гелий—метан, молярные доли, %
т, к р, МПа % Не в жидкости % СН< в паре
94,97 0,75 0,012 4,20
1,02 0,034 1,90
2,02 0,069 1,0
4,03 0,136 0,595
8,57 0,274 0,363
И,9 0,363 0,253
16,4 0,472 0,196
19,45 0,524 —
109,9 2,04 0,151 4,63
4,15 0,304 2,44
7,12 0,488 1,49
9,69 0,604 1,22
13,3 0,833 0,948
16,5 0,978 0,822
124,85 1,13 0,125 25,9
2,05 0,216 14,3
4,07 0,499 7,9
6,44 0,799 5,17
8,66 1,04 3,95
11,37 1,31 3,07
14,44 1,60 2,58
20,4 2,09 2,01
154,8 4,36 1,3 36,8
6,31 1,89 —
8,06 2,35 —
11,0 3,19 16,2
14,5 4,13 12,9
17,4 4,8 10,8
20,4 5,37 10,0
184,83 6,74 3,52 78,8
8,91 5,58 66,9
11,3 7,73 56,4
15,4 П,1 48,1
18,0 12,6 43,8
20,5 1 13,7 40,8
Тогда для различных температур а
имеет следующие значения:
16 К 20,4 К 22 К 28 К
.... 2,25 1,77 1,63 1,4
......4,80 2,97 2,6 1,76
“Ha + HD
“Н3-D2
Экспериментально обнаружено, что эти
смеси несколько (от 1 до 4,5 %) отклоня-
ются от законов идеальных растворов [26,
236, 478, 479, 553].
На рис. 5.9 приведены значения коэф-
фициента активности у системы Н2 — HD
при 20 К [479].
Коэффициент разделения а для смеси
Н2— HD при атмосферном давлении, вы-
численный с использованием коэффициента
активности, изменяется в зависимости от
Рис. 5.9. Значения коэффициента активно-
сти для системы Н2—HD. Штриховыми
линиями нанесены значения по [478]
концентрации (в интервале 0—100 % HD)
почти прямолинейно от значения 1,62 до
1,66. Меньшее значение а относится к мень-
шим концентрациям HD.
Системы Н2 — НТ, D2 — DT и D2 — Т2
в сильно разбавленных растворах изучены
в [480]. Значения а в зависимости от тем-
пературы [481]:
23 К 25 К 27 К
aD2—от........... 1,185 1,159 1,118
aD2—т2 .......... 1,455 1,382 1,318
Система водород — неон (Н2 — Ne). На
рис. 5.10 представлены изотермы этой си-
стемы. Видно, что при температурах ниже
30 К образуются азеотропные смеси с кон-
центрацией от 17 °/о неона при 26 К До
21 % при 30 К. Экспериментально также
установлено, что при температурах ниже
29 К имеет место расслоение на две жид-
кие фазы, более и менее богатые содержа-
нием неона [26, 482, 557].
Система водород — азот (Н2— N2). На
Молярное содержание неона,, %
Рис. 5.10. Изотермы системы водород—
неон
Равновесие жидкость—пар для бинарных смесей
203:
Рис. 5.13. Изотермы системьи водород—
оксид углерода
Рис. 5.12. Изотермы системы водород—
азот
рис. 5.11 и 5.12 приведены изотермы этой
системы [26, 483, 554, 557]. Дейтерий луч-
ше растворим в жидком азоте, чем водо-
род: при 90 К — в 1,198 раза и при 95 К —
в 1,177 раза.
Система водород — оксид углерода
(Нг — СО) изучена в [483, 484, 557]. На
рис. 5.13 приведены равновесные соотно-
шения.
Системы водород — аргон (Н2 — Аг) и
дейтерий — аргон (D2 — Аг) изучены в [26,
485, 557]. В табл. 5.7 приведены данные
о растворимости (выборочно). При средних
давлениях (до 4 МПа) система изучена)
в [555].
Таблица 5.7. Растворимость водорода и дейтерия вржидком аргоне, молярные доли, %,
Водород
87 К (1080 Дж/моль) 100 К (1210 Дж/моль) 120 К (1850 Дж/моль) 140 К (2290 Дж/моль)
р, МПа % н£ в жидкости р, МПа % н2 в жидкости р, МПа % н2 в жидкости р, МПа fr % Н<2 В жидкости
2,45 2,53 1,77 1,97 3,68 4,18 6,13 6,15
2,61 3,06 4,21 4,99 6,67 7,23
3,02 3,08 3,01 3,60 4,57 5,52 7,17 8,24
3,44 3,49 3,58 4,35 5,16 6,60
4,05 4,08 4,29 5,30 5,66 7,40 7,77 9,43
4,50 . 4,51 5,07 6,32 6,11 8,14 8,29 10,44
5,07 4,99 6,16 7,60 6,63 9,02
6,22 5,95 7,20 8,78 7,30 10,00 9,1 11,99
7,15 6,71 8,05 9,78 8,16 11,29 9,6 12,95
8,27 7,58 9,20 10,95 9,58 12,99
8,97 8,04
9,77 8,60
204
Экспериментальные данные по фазовому равновесию
Продолжение табл. 5.7
Дейтерий
87 К (1047 Дж/моль) 100 К (f243 Дж/моль) 120 К
р, МПа % D2 в жидкости р, МПа % D2 в жидкости МПа % в жидкости
2,43 3,17 2,18 2,98 3,29 4,09
2,93 3,81. 2,53 3,53 4,12 5,74
3,71 4,8) 3,06 4,32 5,12 7,71
4,34 5,57 3,93 5,64 5,95 9,2;
5,25 6,69 5,04 7,34 6,51 1 1,21
5,78 7,21 6,02 6,69 7,58 8,83 8,60 9,70 10,88 12,36 7,07 11,19
Примечание. В скобках — теплота растворения водорода и де стер ня.
Таблица 5.8. Система водород—метан. Содержание Н2, молярные доли, %
jo, МПа Жидкость Пар р, МПа Жидкость Пар
90,3 К по к
4,81 2,4 96,8 3, 14 3,3 92,6
7,45 3,6 97.5 4,81 4,2 92,7
10,0 5,0 96,9 6,47 5,8 93,6
13,63 6,4 —. 8,83 7,7 94,2
16,08 8,1 96,8 19,1 8,7 91,9
16,77 8,2 96,4 13,50 И,1 91,2
21,67 9.7 94,4 13,83 11,9 92,0
18,34 15,6 91 ,0
103,1 к
3,82 2,2 94,7 127 К
7,55 4,0 96,4 3,63 3,8 85,5
10,2 5,1 96,1 6,08 6.7 87,4
14,32 7,5 95,8 8,34 9,3 89,3
17,16 10,5 95 7 12,85 14,4 86,9
22,95 13,8 94,2'
Таблица 5.9. Система водород—метан. Содержание Н3, молярные доли, %
р, МПа 160 к 165 К 170 К 175 К 180 К 185 К
Жид- кость Пар Жид- кость Пар Жид- кость Пар Жид- кость Пар Жид- КОСТЬ Пар Жид- кость Пар
2,0 0,7 19 2 0,1 3,4 .
3,1 2,5 37,4 2,0 23,7 1,4 13,8 0,6 7,2 — — —
4,0 4,4 5),6 4,2 39,8 3,8 29,6 3,2 20,8 2,2 11,6 0,9 3,7
5,0 6,2 57,6 6,0 49,6 6,0 41,4 5,8 33,2 5,3 24,3 4,0 14,6
6,0 8,0 61,6 8,0 55,5 8,1 48,6 8,3 40,8 8,1 32,0 7,5 22,4
7,0 9,6 64,3 9,7 59,2 10,3 52,4 И,1 44,2 11.5 35,2 и ,з 26,4
8,0 И,8 66,5 11,9 61,8 12,4 58,1 14,0 47,4 14,4 39,0 13,6 30,4
Равновесие жидкость—пар для бинарных смесей
2.,5
Рис. 5.14. Изотермы системы водород —
этилен
Рис. 5.15. Изобары растворимости водоро-
да в этане
Система водород — метан (Н2—СН<).
В табл. 5.8 и 5.9 приведены равновесные
соотношения [485, 556].
Система водород — этилен (Н2— С2Н4).
На рис. 5.1.4 и в табд. 5.10 приведены рав-
Рис. 5.16. Изотермы системы неон—азот.
Штриховая линия — критическая крива-я;
О — критические точки
Рис. 5.18. Изотермы системы неои—кисло-
род
новесные соотношения [556]. При раство-
рении водорода в'жидком этилене происхо-
дит поглощение- теплоты, поэтому раство-
римость водорода возрастает с повыше-
нием температуры.
Система водород — этан (Н2 — С2Не)
подробно изучена в [485]. На рис. 5.15
представлена растворимость водорода в
жидком этане.
Системы водород — пропилен (Н2 —
С3Н6) и водород —пропан (Н2 —С3Н8) см.
в [485].
Система водород — диоксид углерода
(Н2 — СО2) изучена в [18].
Система неон — азот (Ne — N2). На
рис. 5.16 представлены изотермы системы.
Имеются данные в [552, 557].
206
Экспериментальные данные по фазовому равновесию
Таблица 5.10. Система водород—этилен. Содержания Н2, молярные доли, %
Изотерма 188 К Изотерма 178 К Изотерма 168 К Изотерма 158 К
р, МПа Жид- кость Пар р, МПа Жид- кость Пар р, МПа Жид- кость Пар р, МПа . Жид- кость Пар
1,46 0,70 76,80 1,11 0,80 80,60 1,88 1,10 89,8 1,013 0,45 90,6
2,99 1,70 85,60 1,78 1,03 85,20 2,34 1,20 91,7 1,66 0,60 92,7
3,38 2 20 87,40 1,83 1,00 85,10 3,30 1,80 93,5 3,51 1,03 94,5
4,33 2,75 85,70 3,22 1,96 92,76 3,48 1,40 93,1 2,77 1,10 94,7
5,29 3,60 90,20 3,57 1,90 92,80 3,53 1,55 94,7 3,43 1 ,48 95,8
8,00 5,20 93,00 Т а б j 0 3,89 4,67 5,78 7,52 1 и ц а 5 с, у — IV 2,32 2,60 3,40 4,70 .11. Из юлярны 91,85 92,20 93,40 94,20 обары с г доли 4,25 4,94 5,89 истемы гзота в 2,22 2,40 3,15 азот—о жидкое 93,4 95,8 95,7 КСИД yrj ги и па] 4,17 5,10 6,03 7,32 ерода >е) 1,92 2,45 2,80 3,40 96,4 95,7 95,9 97,7
р, МПа X 0,000 0,100 0,200 0,300 0,400 0,500 0,600 0,700 0,800 0,900 1,000
0,1 У т, к 0,000 81,10 0,148 80,65 0,272 80,25 0,390 79,90 0,505 79,55 0,620 78,90 0,704 78,60 0,787 78,30 0,872 78,00 0,942 77,60 1,000 77,30
0,5 г/к 0,000 98,50 0,138 98,20 0,250 97,90 0,365 97,50 0,402 97,10 0,571 96,70 0,650 96,30 0,757 95,80 0,844. 95,50 0,923 95,00 1,000 94,40
1,0 0,000 108,50 0,'30 108,10 0,232 107,70 0,344 107,25 0,442 106,70 0,553 106,20 0,640 105,70 0,744 105,25 0,834 104,75 0,920 104,30 1,000 103,90
1.5 У т, к 0,000 115,30 0,125 115,00 0,228 114,70 0,335 114,30 0,437 113,90 0,542 113,40 0,636 112,90 0,736. 112,40 0,828 111,85 0,918 111,20 1,000 110,70
2,0 У т, к 0,000 120,70 0,121 120,30 0,225 119,90 0,326 119,50 0,432 118,80 0,536 118,50 0,634 118,20 0,730 117,40 0,822 116,80 0,916 116,20 1,000 115,70
2,5 У т,к 0,000 125,52 0,119 124,90 0,223 124,70 0,322 124,10 0,428 123,30 0,530 123,00 0,630 122,50 0,725 121,80 0,818 121,20' 0,914 120,50 1,000 119,90
Таблица 5.12. Равновесие жидкость—пар в системе азот—аргон
(х и у — содержания азота в жидкости и паре, молярные доли, °/0)
X 0,098 МПа 0,1333 МПа 0,5688 МПа 9,9807 МПа
Т, К 1 У Т, К ' 1 ’у т, к 1 у Т, К У
0 86,98 0,00 90,00 0,00 107,68 0,00 116,25 0,00
2 86,62 6,05 89,63 5,68 107,29 4,25 115,86 3,77
5 86,06 14,27 89,05 13,47 106,70 10,28 115,28 9,29
10 85,19 26,00 88,16 24,75 105,77 19,45 114,35 17,54
15 84,44 35,79 87,38 34,28 104,94 27,71 113,59 25,24
20 83,70 44,05 86,62 42,45 104,10 35,14 112,64 32,27
30 82,44 57,17 85,34 55,60 102,64 48,00 ’ 111,11 44,78
40 81,40 67,09 84,27 65,72 101.37 58,71 ,109,76 55,54
50 80,46 74,95 83,31 73,82 100,20 67,82 ' 108,48 64,98
60 79,66 81,37 82,47 80,50 99,16 75,71 107,34 73,31
70 78,91 86,87 81,70 86,22 98,16 82,67 106,22 80,82
80 78,26 91,62 81,02 91,23 97,27 88,93 105,21 87,70
85 77,95 93,82 80,70 93,55 96,85 91,85 104,74 90,91
90 77,67 95,95 80,40 95,77 96,46 94,65. 104,29- 94,02
95 77,38 98,00 80,10 97,92 96,06 97,37 1.03,84 97,05.
98 77,20 99,20 79,91 99,17 95,83 98,96- 103,58. 98,84
100 1 77,08 1 100,00 | 79,79 100,00 95,67 1.00,00 . 103,49 100,09.
Равновесие жидкость—пар для бинарных смесей
207
Рис. 5.19. Диаграммы х, у, р, Т для системы N2—О2:
Xi — молярное содержание О2 в жидкости, %; ух — то же в паре; Хз— молярное содержание Na
в жидкости, %; уз — то же в паре
]/7,мол. % 02
Система неон — аргон (Ne — Аг). На
1рис. 5.17 представлены изотермы системы
,[487]. См. также [552, 557].
Система неон — кислород (Ne — О2).
На рис. 5.18 представлены изотермы систе-
мы [487]. См. также [552, 557].
Таблица 5.13. Изобары системы азот—метан (х, у — содержания азота
в жидкости и паре, молярные доли, %)
р—0,2 МПа Р=0. 51 МПа р=0. 1 МПа р=1,П МПа 1,62 МПа
X т, К 1 У т, к 1 У т, к 1 » т. к 1 У Т, К у
0,0 1,0 2,0 3,0 5,0 7,0 10,0 20,0 30,0 40,0 50,0 60,0 '70,0 80,0 90,0 100,0 120,2 115,2 112,8 111,0 108,0 105,5 102,8 96,6 92,0 89,9 88,5 87,2 86,1 85,0 84,0 83,4 0,0 30 0 42,8 51,6 64,0 75,0 80,7 91,0 94,7 96,3 97,3 98,0 98,6 99,2 99,6 100,0 134,6 1.32,2 130,0 128,0 125,0 122,2 118,6 111,0 105,9 103,1 100,9 99,2 97 8 | 96,3 94,8 93,7 0,0 15,6 26,2 36,8 49.0 58,4 68,6 84,5 90,8 93,9 95,7 97,0 98,1 98,7 99,4 100,0 143,4 140,6 138,6 136,8 134,0 131,7 128,7 119,8 114,5 111,2 108,6 106,5 104,6 102,9 101,3 100,0 0,0 14,0 22,8 31,2 43,0 51,2 61,0 79,8 88,0 92,1 94,6 96,4 97,5 98,6 99,0 100,0 149,9 148,8 147,3 145,8 143,0 140,0 136,4 126,7 121,3 117,5 114,5 112,4 110,2 108,2 106,3 104,7 0,0 7,0 14,8 21,2 33,2 43,4 55,8 76,8 85,8 90,8 93,7 95,9 97,3 98,5 99,4 100,0 158,4 157,2 155,8 154,4 151,9 149,5 147,1 136,1 130,4 125,9 122,2 119,8 117,5 115,2 112,9 111,0 0,0 6,0 12,8 19,6 30,0 38,6 49,2 71,7 82,9 88,8 92,6 94,5 97,0 98,3 99,3 1С0,0
208
Экспериментальные данные по фазовому равновёсию
Таблица 5.14. Равновесие жидкость—пар в системе аргон—кислород
(х, у — содержания аргона в жидкости и паре, молярные доли, %)
0,098 МПа 0,1333 МПа 0,5688 МПа 0,9807 МПа
X Т, К у Т, К у т, к у т, К 1‘
0,00 89,88 0,00 92,93 0,00 110,70 0,00 119,27 (..00
2,00 89,77 3,14 92,82 3,66 110.58 2,67 119,14 2,54
5,00 80,61 7,64 92,64 7,45 110,41 6,57 118,97 6,26-
10,00 89,35 14,64 92,38 14,33 110,14 12,79 118,71 12.25-
15,00 89,12 21,17 92,14 20,74 109,93 18,73 118,47 18, >0
20,00 88,91 27,22 91,93 26,75 109,67 24,41 118,25 23,56-
30,00 88,51 38,28 91,52 37,72 109,25 35,08 117,82 34,10
40,00 88,18 48,23 91,18 47,69 108,93 45,06 117,46 44,38
50,00 87,91 57,43 9),91 56,93 108,69 54,56 117,16 53.66
60,00 87,67 66,11 90,67 65,71 108,34 63,71 116 89 62,95
70,00 87,46 74,54 90,46 74,22 108,12 72,68 116,67 72.11
80,00 87,27 82,86 9J,27 82,65 107,93 81 ,67 116,49 81 24
85,00 87,18 87,04 90,19 86,89 107,86 86,14 116,41 85,86
90,00 87,11 91,28 93,13 91,18 107,79 90,68 116,35 90,51
95,00 87,04 95,59 93,06 95,55 107,72 95,30 116,29 95,23
98,00 87,00 98,22 93,02 98,20 107,70 98,10 116,26 98.06
100,0 86,98 100,0 93,00 100,00 107,68 100,00 116,25 100,00
Таблица 5.15. Система кислород—криптон (х, у—содержания кислорода
в жидкости и паре, молярные доли, °/о)
X р-1504 гПа />—2973 гПа />—4932 гПа /7~б892 гПа
т, к У т, К . J у т, К | у Т, к
0,00 125,0 0,00 135,5 0,00 144,4 0,00 150,9 0,00
1,00 123,4 9 42 133,9 8,21 142,8 7,50 149,6 6,78-
2,00 122,1 17,72 132,4 15,51 141,3 14,27 148,1 12,98-
3,00 121,0 24,92 131,15 22,13 140,2 20,43 147,0 18,41
5,00 118,9 36,70 129,3 33,00 138,2 30,65 145,0 28,41
7,00 117,2 46,12 127,5 41,93 136,5 39,36 143,4 36,31
10,00 114,9 57,06 125,1 52,43 134,1 49,54 140,9 46,28-
15,00 111,7 68,78 121,75 64,83 130,9 61,56 137,2 59.09'
20,0 109,6 76,40 119,2 72,95 128,2 70,18 134,5 67,57
30,0 106,4 85,48 115,45 82,92 123,8 80,76 130,0 78,86
40,00 103,55 93,63 112,55 88,65 123,2 87,10 126,3 85,77
50,00 101,05 93,83 109,8 92,40 117,3 91,24 123,0 90,42'
60,00 99,00 95,92 107,55 94,94 114,95 94,38 120,3 93,56
70,00 97,5 97,41 105,9 96,76 112,85 96,18 118,2 95,82'
80,00 96,15 98,5 J 104,5 98,10 111,1 97,75 И6,5 97,56
90,00 95,05 99 33 103,2 99,16 109,-8 99,00 1 15,0 98,93
100,00 94,15 100,00 101,9 100,00 108,7 100,00 113,6 юо,со
Системы азот — оксид углерода (N2 —
СО). В табл. 5.11 представлены данные
для изобар системы [558].
Система азот — аргон (N2— Аг). Наи-
более подробно изучена в [205, 559]; неко-
торые данные из работ приведены в
табл. 5.12. Подробная диаграмма и табли-
цы приведены в [203, 205, 559]. Обзор ли-
тературы см. в [467, 557].
Система азот — кислород (N2—О2).
Результаты экспериментального исследова-
ния приведены в [203, 205, 559]. На
рис. 5.19 дана диаграмма х, у, р, Т равно-
весных состояний системы азот— кислород:
в диапазоне давлений от 2 до 2500 кПа
[205]. Дополнительно см. [467]. Для этой
системы составлена номограмма х, у, р. Т,.
h [41].
Система азот — метан (N3—СН4),
табл. 5.13 приведены равновесные данные
для изобар системы [560]. В более широ-
ком интервале давлений они- даны в [488,.
467].
Системы азот — пропилен (N2—С3Н6 и-
N2—С3Н8) изучены в [467].
Системы азот диоксид , углерода .
Равновесие жидкость—пар для бинарных смесей
209
3 10 00 30 0-0 50 60 70 80 х 100
Молярное содержание озона-, %
Рис. 5.20. Диаграмма растворимости жид-
ких кислорода и озона
яр! i ; I___I—!—I—I—!—J—I
0 10 20 30 40 50 60 70 80 30100
Молярное содержание озона, °/о
Рис. 5.21. Диаграмма фазового равновесия
жидкость — пар системы кислород — озон
для нескольких давлений
(Na—СО2). При высоких давлениях систе-
ма изучена в [467].
Система оксид углерода — метан
(СО — СН4). Изучена в [467, 489].
Система аргон — кислород (Аг — О2).
Подробно изучена в [205, 467, 557, 559];
некоторые данные из этих работ приведены
в табл. 5.14. Диаграмма и таблицы равно-
весия приведены в [203, 205, 559].
Системы аргон — оксид углерода
(Аг — СО) и аргон — метан (Аг — СН4)
изучались в [467 и 489J.
Система кислород — метан (О2 — СН4).
Значения констант равновесия при 93—
107 К приведены в [467].
Система кислород—криптон (О2—Кг) •
Данные по равновесию приведены в
табл. 5.15 [560]. Данные по равновесию
кислорода с другими инертными газами см.
в [467 , 557].
Система кислород — озон (О2 — О3).
14-218
При температуре ниже 93 К жидкие кисло-
род и озон ограниченно взаимно раствори-
мы и образуют две жидкие фазы. На
рис. 5.20 представлена диаграмма раство-
римости жидких кислорода и озона при
давлении насыщения, а на рис. 5.21—диа-
грамма равновесия жидкость — пар этой
же системы для нескольких давлений
[490, 491].
Система кислород — диоксид углерода
(О2—СО2) изучалась в [467].
Система метан — этилен (СН4— С2Н4).
На рис. 5.22 приведены изобары системы
[561]. Равновесные соотношения для более,
высоких температур и давлений см.
в [467].
Система метан — этан (СН4— С2Н6).
В табл. 5.16 приведены данные равновес-
ных соотношений. См. также [467].
Система метан — диоксид углерода-
(СН4— СО2). Обзор литературы см. в. [467],
Равновесные соотношения метана с бо-
лее тяжелыми углеводородами и инертны-,
ми газами можно найти в [18, 467-/557].
Система этилен — этан (С2Н4. — С2Н5).
210
Экспериментальные данные по фазовому равновесию
Рис. 5.24. Растворимость газов в воде а
при давлении 0,0981 МПа
Рис. 5.25. Растворимость некоторых газов в метаноле
Коэффициенты разделения изотопных соединений
21Г
Таблица 5.16. Изобары системы метан—этан (х, у— содержания метана
в жидкости и паре, молярные доли, %)
/)=0,5 МПа р=1,0 МПа Р=1.Е МПа р=2,С МПа
t, ®с X У * У X У X У
—10 . 1,1 6,6’
-20 —. — — 0,9 4,2 5,8 33,0
-30 — — — — 4,6 26,4 10,7 51,4
-40 — . — 2,5 ’ 19,5 9,0 45,2 16,1 65,0>
-50 — — 6,0 40,9 13,5 6), 1 22,0 75,0
-60 1,7 25,8 9,6 57,4 18,3 72,0 28,2 82,3.
Продолжение табл. 5.16'
р=О,Е МПа Р=1,С МПа р = 1 МПа р=2,С МПа
i, °C х У X У X У у
• -70 4,0 50,0 13,6 70,1 23,7 81,6 35,0 88,1
-80 7,0 65,7 18,2 81,0 29,8 88, б. 43,3 92,5
—93 10,5 77,0 23,9 89,0 37,2 93,9- . 54,5 96,3
— 100 14,6 85,6 30,9 95,1 48,6 97,3 71,5 98,9*
— НО 21,3 91,4 43,8 97,5 68,5 99,5 — —
— 120 32,9 95,7 69,5 99,4 —. —
— 130 56,0 ’98,7 — — — • — —
Таблица 5.17. Равновесные концентрации системы пропилен—пропан.'
(х, у —содержания пропилена в жидкости и паре, молярные доли)
X 262 К 269,5 К , 277,6 К 301,3 к 311 К 330 к 344,1 К
У р> МПа У р> МПа У Р, МПа У р> МПа У р, МПа У р> МПа У Р» МПа
0,1 0,1246 0,325 0,1242 0,437 0,1220 0,559 0,1180 1,03 0,1165 1,337 0,1134 2,045 0,1097 2,707
0,2 0,2409 0,343 0,2403 0,450 0,2366 0,574 0,2296 1,088 0,2271 1.368 0,2219 2,099 0,2161 2,765
0,3 0,3502 0,353 0,3492 0,462 0,3448 0,588 0,3360 Г; 11 з 0,3328 1,399 0,3261 2,143 0,3196 2,819
0,4 0,4532 0,361 0,4523 0,473 0,4474 0,603 0,4378 1,145 0,4345 1,430 0,4272 2,182 0,4107 2,873
0,5 0,5513 0,369 0,5503 0,483 0,5455 0,615 0,5353 1,157 0,5329 1,456 0,5255 2,220 0,5198 2,922’
0,6 0,6452 0,377 0,6443 0,494 0,6400 0,628 0,6316 .1,178 0,6286 1,481 0,6221 2,260 0,6174 2,971
0,7 0,7,, 57 0,383 0 7352 0,504 0,7318 0,637 0,7249 1,193 0,7225 1,503 0,7171 2,295 0,7136 3,011
0,8 0,8244 0,389 0,8240 0 511 0,8217 0,648 0,8169 • 1,216 0,8152 1,530 0,8114 2,334 О’, 8091 3,060-
0,9 0,9120 0,394 0,9119 0,520 0,9106 0,657 0,9084 1,231 0,9074 1,549 0,9055 2,333 0,9044 3,099
На рнс, 5.23 приведены изобары системы
[562]. См. также [467].
Система этилен — пропилен (С2Н4 —
С3Нб). Равновесные соотношения для
0,1 МПа приведены в [257, 467].
Система этилен—пропан (С2Н4—С3Н8).
Данные по равновесию приведены в [467].
Системы этан — пропан (С2Н6— С3Н8)
и этан — пропилен (С2Н6—С3Н6). Данные
приведены в [467].
Равновесие этилена и этана с инертны-
ми газами дано в [467, 557].
Система этилен — пропилен (С2Н4 —
С3Н3). В табл. 5.17 приведены равновесные
данные [492]. См. также [467].
Данные по равновесию более тяжелых
углеводородов приведены в [18, 467].
14*
5.2. КОЭФФИЦИЕНТЫ РАЗДЕЛЕНИЯ
ИЗОТОПНЫХ СОЕДИНЕНИЙ
Многие изотопы могут быть разделены
методом ректификации. Возможность осу-
ществления процесса характеризуется ко-
эффициентом разделения а, представляю-
щим собой отношение упругостей пара
одного изотопного соединения (А) и пара
другого (В): а—рл!рв. В табл. 5.18 при-
ведены значения а для некоторых изотоп-
ных соединений.
Если относительная разность упруго-
стей изотопов мала, то а приближенно
можно определить по температурам кипе-
ния: для нормального давления а—1 =
= 10,7(72—для вакуума я—1=
212
Экспериментальные данные по фазовому равновесию
Таблица 5.18. Значение коэффициента
разделения а для различных изотопных
соединений [493, 563]
Соединения a
Тройная точка Точка кипения
Ю—H2/HD 3,61 1,77
NH3 'HD3 1,227 1,139
Н2О d2o 1,12J 1,026
CH4'CH3D 1,0016 0,9965
3He 4He 3,18
20Ne 22Ne 1,044
звДг/МАг 1,006
i2sXe I36Xe 1,000
12CO, 13CO 1,0109 1,007
HN214№5N 1,006 1,004
14N,H3 16N/H3 1 0055 1,0025
O«0 C18O 1,008 1,0059
H216O H2isO 1,010 1,0046
16O2 '18O2 1,0151 1,0091
16O2'16O18O 1,0090 1,0054
12CH4 l3CH4 1,0054 0,0035
,2C2H4 12C13CH4 1,0011 1,0018
l2C2H6 42С43СН6 1,005 1,00
= 10,7 (Та—Ti)/Tp, где Тг, Ti—температу-
ры кипения относительно тяжелого и легко-
го компонентов при нормальном давлении;
Тр —температура кипения легкого компо-
нента при давлении р.
Зависимость коэффициента разделения
а от температуры [564] :
О 849
«О2/1ВО2 . . .Inn = ’ --- 0,006-451
1 11*'1 Лнп
1 «O2/1SO1SO . . In а = (63 К : 74 К)
у/.иуо
•O2/t"O .... In а = 1521^. (63 К+-74 к)
Ь»О2/-»О2 . . .In а = -^- +0,00396 (ГПЛ=ГКЯП)
13СН,/13СН, . . In а = 2^21 +0,00396 (7’пл+-гкип)
гС2Н1/>3С33СН1...1п ч =1,00127—°’0^— (104 fe-169 К)
1га2н„/чс?зан6...1п ч= 0,00213 (вэ.в к+чз+л ко
5.3. РАСТВОРИМОСТЬ ГАЗОВ
В ВОДЕ (АБСОРБЦИЯ)
В табл. 5.19 приведены Значения раст-
воримости газов в воде при различных
температурах. Растворимость газов (в лит-
рах при 0 °C и 0,1013 МПа) в 1 кг воды
при различных температурах дана на
рис. 5.24. Значения растворимости водоро-
да, азота и их смесей, а также других га-
зов при высоких давлениях ем. в [550].
На рис. 5.25 приведены значения коэф-
фициента растворимости а,
м3(0° С и 0,1р13МПа)
1 т метанола
диоксида углерода и других газов в мета-
ноле как функции парциального давления и
температуры [494]. Видно, что а для СО2—
функция парциального давления р. Для
остальных газов а даны для одного пар-
циального давления р=0,1 МПа. Количе-
ство поглощаемого газа G вычисляется до
формуле G=ap. Высокая растворимость
СО2 в охлажденном метаноле используется
Таблица 5.19. Растворимость газов в воде (&-107)* [259]
t, °C о2 n2 н, Аг Не Кг Ne Хе со, сн4
. 0 1,934 4,016 4,42 1,65 10,0 0 853 7,68 0,392 0,05555 1,699
5 2,2( 5 4,535 4,62 1,968
10 2,486 5,079 4,82 2,18 10,5 1,20 8,49 0,555 0,0788 2,257
15 2,766 5,606 5,01 - - 2,56Э
20 3,(41 6,109 5,20 2,58 10,9 1 52 9,14 0,742 0,108 2,853
25 3,314 6,574 5,37 3 136
30 3,610 7, С 22 5,51 3,(2 НД 1 85 9,45 0,945 0,139 3'408
35 3,850 7,483 5,63 3'69
40 4,068 7,923 5,78 3,49 1 1 9 2 18 9,80 1,16 0,173 3'94
45 4,281 8,285 5,81 4 18
50 4,470 8,586 5,82 3,76 10,5 2 43 10,0 1,31 0,217 4Д8
60 4,777 9,087 5,8) 3,92 Ю,3 2Д6 1,46 0,258 4,75
70 5,043 9,462 5,77 4,12 9,88 283 1,59 5,06
80 5,224 9,591 5,73 4,25 2’94 1,66 5,18
90 5,310 9,61 5,71 5 26
100 5,33 9,54 5,66 — — -- — — — 5'з
• па™™„Л0НСТаИ'Га Генри’ W Р — пардиалыие давлэни? газа в 0,75 гПа .в мм рт.
грация пастворенного газа в воде, молярные доли
Равновесие кристалл—пар для бинарных смесей
213
.для очистки технических газов от СОг в так
называемом ректизол-процессе. О раствори-
мости СОг и Н2 в водных растворах эта-
ноламино в см. в [550].
5.4. РАВНОВЕСИЕ КРИСТАЛЛ — ПАР
ДЛЯ БИНАРНЫХ СМЕСЕЙ
Подробный обзор литературы по рав-
новесию кристалл — пар для различных
криоагентов см. в [495, 496].
Система гелий — неон (Не—Ne) изуче-
на в интервале 9—21 К и до 50 МПа [565].
Система гелий — азот (Не—N2). На
рис. 5.26 приведены кривые равновесного
содержания азота в газовой фазе при раз-
личных давлениях н температурах над
кристаллами азота [497].
Система гелий — аргон (Не—Аг). От-
дельные данные приведены в [485].
Рис. 5.26. Равновесные изобары, системы
гелий — азот (газ — кристалл)
Рис. 5.27. Равновесные изобары системы
гелий — метан (газ — кристалл)
Рис. 5.28. Равновесные изобары системы водород — азот (газ—кристалл)
214
Экспериментальные данные по фазовому равновесию
Рис. 5.29. Равновесные изобары водород—
оксид углерода (газ — кристалл)
Рис. 5.30. Равновесные изобары водород—
кислород (газ — кристалл)
Рис. 5.31. Равновесные изобары водород—
метан (газ — кристалл)
Рис. 5.32. Оптимальные давления, соответ-
ствующие минимальным значениям приме-
си в газовой фазе
Система гелий — метан (Не—СН4). На
рис. 5.27 приведены кривые равновесного
содержания метана в газовой фазе для не-
скольких давлений над кристаллами мета-
на [496].
Система гелий — диоксид углерода
(Не—СО2). См. [495].
Система водород — азот (Н2—N2). На
рис. 5.28 приведены значения концентраций
азота в газовой фазе над твердым азотом
как функции температуры и давления
[26, 38, 495, 497]. Равновесное содержание
азота с возрастанием давления значитель-
но отклоняется от концентраций, соответ-
ствующих законам идеальных газов.
Система водород — оксид углерода
(Н2—СО). На рис. 5.29 приведены значе-
ния концентраций оксида углерода в газо-
вой фазе над твердым оксидом углерода
Рис. 5.33. Равновесные изотермы водо-
род— диоксид углерода (газ—кристалл)
Равновесие кристалл — пар для бинарных смесей
215
как функции температуры и давления
[26, 38, 497]. Данные по тройной системе
Н2—N2—СО см. в [497].
Система водород — аргон (Н2—Аг). От-
дельные данные приведены в [485].
Система водород — кислород (Н2—О2).
На рис. 5.30 приведены значения концент-
раций кислорода в газовой фазе над твер-
дым кислородом как функции температуры
и давления [26, 38, 498]. Данные до 20 К
см. в [495].
Система водород — метан (Н2—СН4).
На рис. 5.31 приведены значения концент-
раций метана в газовой фазе над твердым
метаном как функции температуры и дав-
ления [38, 497]. То же для более низких
температур и высоких давлений см. [495,
496].
Для рассмотренных выше систем
Не—N2, Н2—N2, Н2—СО, Н2—СН4 каждой
температуре отвечает оптимальное давле-
ние, соответствующее минимальной кон-
центрации примеси в газовой фазе [497].
Эти данные представлены на рис. 5.32
Система водород — диоксид углерода
(Н2—СО2). На рис. 5.33 приведены данные
Таблица 5.20. Равновесное содержание диоксида углерода
в газовой фазе для системы N2—СО2, молярные доли
р, МПа Температура, К
140 150 160 170 180 190
0,5 0,00042 0,00192 0,00699 0,0220 0,0595
1,0 0,00024 0,00107 0,00395 0,0121 0,0325 0,0778
2,0 0,00018 0,00069 0,00251 0,00735 0,0190 0,0455
3,0 0,00019 0,00064 0,00217 0,00608 0,0151 0,0354
4,0 0,00025 0,00071 0,00217 0,00572 0,0137 0,0311
5,0 0,00043 0,00094 0,00243 0,00580 0,0133 0,0293
6,0 0,00078 0,00128 0,00280 0,00618 0,0135 0,0285
7,0 0,00112 0,00172 0,00332 0,00685 0,0141 0,0285
8,0 0,00132 0,00219 0,00393 0,00760 0,0150 0,0293
9,0 0,00148 0,00259 0,00461 0,00860 0,0161 0,0305
10,0 0,00162 0,00295 0,00534 0,00964 0,0175 0,0324
12,0 0,00183 0,00348 0,00650 0,0115 0,0205 0,0375
14,0 0,00200 0,00388 0,00741 0,0131 0,0236 0,0425
16,0 0,00215 0,00420 0,00821 0,0146 0,0267 0,0470
18,0 0,00227 0,00447 0,00885 0,0158 0,0295 0,0510
20,0 0,00236 0,00468 0,00937 0,0168 0,0315 0,0548
Таблица 5.21. Равновесное содержание диоксида углерода СО2
в воздухе над кристаллом, у-104, молярные доли
Давление, МПа Температура, К
163 152 143 133 128 123 90 77
0,1 456,0 113,0 30,4 5,67 2,21 0,80 — —
1,1 49,2 12,8 4,19 0,77 0,30 0,10 0,12 0,002
2,1 33,6 8,65 2,92 0,62 0,32 0,13 0,11 0,002
3,1 28,1 8,33 3,54 0,87 0,67 0,55 — 0,002
4,1 28,5 9,33 5,18 5,46 4,15 3,8 — ___
5,1 30,6 12,2 7,39 7,21 5,81 4,3 —
6,1 36,5 15,1 13,1 7,82 6,16 — 0,12 0,003
7,1 43,3 22,2 17,1 8,65 6,88 — — 0,004
8,1 52,9 28,0 18,8 9,79 6,70 4,78 0,11
9,1 61,0 34,7 — — — — —
10,0 69,5 39,0 22,9 12,0 7,14 4,86 0,12 0,002
15,0 94,9 52,0 27,3 13,9 7,69 5,50 0,13 —
20,0 123,0 58,1 30,2 15,3 9,49 5,93 Воздух нахо- дится в жидкой фазе 0,14 0,003
2)6
Экспериментальные данные ПО фазовому равновесию
о содержании СО2 в газовой фазе над
твердым диоксидов углерода [566].
Система неон — метан (Ne—СН4). Дан-
ные по системе до 10 МПа в широком
интервале температур приведены в ,[496].
Обзор литературы по равновесию пар—
кристалл для неона с другими криоагента-
ми см. в [495].
Система азот — диоксид углерода (N2—
СОз). В табл. 5.20 приведены значения
равновесных концентраций СО2 над кри-
сталлами в азоте при различных давлениях
и температурах i[498, 566]. То же для бо-
лее низких температур см. [567].
Система воздух — диоксид углерода.
Как показали экспериментальные исследова-
ния равновесия кристалл — пар для диок-
сида углерода в присутствии воздуха, рав-
новесная концентрация СО2 в газовой фазе
существенно зависит от давления воздуха.
В табл. 5.21 п 5.22, а также на рис. 5.34
приведены значения равновесных концентра-
ций СО2 над кристаллами в воздухе прн
различных давлениях н температурах
[203, 499].
Таблица 5.22. Температура начала
выпадения твердого диоксида углерода
из воздуха (содержание СО2 0,03%)
в зависимости от давления [500]
Давление воздуха,
МПа
Температура воздуха Т,
К
5.5. РАВНОВЕСИЕ КРИСТАЛЛ-
ЖИДКОСТЬ В БИНАРНЫХ СМЕСЯХ
Система 3Не—4Не сложная для изу-
чения из-за расслоения жидкой фазы и на-
личия нескольких структур решеток крис-
0,2
0,5
1,0
2,5
5,0
10,0
15,0
20,0
130
137
141
145
129
124,3
121
118
Рнс. 5.35. Диаграмма равновесия жидкой
и твердой фаз системы 3Не—4Не
Рис. 5.34. Равновесное содержание диокси-
да углерода в воздухе (над кристаллами
СО2) прн различных давлениях и темпера-
турах
диаграмма равновесия жидкой и твердой
фаз.
Система 4Не—Н2 частично изучена в
[502].
Система водород — дейтерий (Н2—D2)
изучалась в [568].
Система водород — азот (Н2—N2) и
водород — кислород (Н2—О2). На рис. 5.36
Рнс. 5.36. Растворимость твердого азота
в жидком водороде при Температуре 26—
32 К
Равновесие кристалл—жидкость в бинарных смесях
217
ЛР 20 60 60 80 Ог Аг 20 60 60 80 Кт Аг 20 60 60 80 СЩ
Система Система Ат-Кот Система Аг-СН^
_АГ 20 6-0 60 80 N2 -Аг 20 60 60 80 02 СО 20 60 60 80 Nz
Система. Nz~Ar Система Лг-О2 Система CO-N2
Рис. 5.37. Фазовое равновесие жидкость — кристалл. По оси абсцисс всюду отложено
молярное содержание компонентов, %
дого азота в жидком водороде [497]. По
-экспериментальным данным и оценкам раст-
воримость азота при 20 К в жидком во-
дороде должна составлять 10-7—10-8 доли
[26, 497]. Растворимость кислорода должна
быть меньше растворимости азота.
На рнс. 5.37 приведены равновесные
диаграммы жидкость — кристалл для неко-
торых бинарных смесей [20, 506].
Рис. 5.38. Растворимость предельных угле-
водородов в жидком кислороде
Рис. 5.39. Растворимость непредельных
углеводородов в жидком кислороде
Система фтор — аргон (F2—Аг) изу-
чалась в [503].
Система оксид углерода — аргон (СО—
Аг) изучалась в [503].
Система аргон — ксенон (Аг—Хе) изу-
чалась в [505].
Система кислород — криптон (О2—Кг)
изучалась в [504], кислород — ксенон
(О2—Хе) — в [505].
218
Экспериментальные данные по фазовому равновесию
Трехкомпонентная система азот —
аргон — кислород (N2—Аг—02) изучалась
в [506].
Растворимость твердых предельных и
непредельных углеводородов в жидких азо-
те и кислороде. Первые исследования см.
в [569, 570]. На рис. 5.38 и 5.39 приве-
дены данные по растворимости углеводо-
родов в жидком кислороде [508].
В табл. 5.23 приведены растворимости не-
Таблица 5.23. Растворимость
углеводородов в жидком кислороде
при 90 К* (х — растворимость
углеводорода в жидком кислороде,
молярные доли; у — равновесная
концентрация углеводорода в паре
кислорода, мольные доли)
Углево-
дород
0,98
5,6—5,2 - 1С—6
2- IO"2
1,3-10-1
3,6-10-з
9,8-10-3
1,09-10-s
8,6-10-1
0,1
3-10-’
5-Ю-з
1,2- IO-5
1 • 10-1
2-10-7
* Подробные фазовые диаграммы см. в [508].
которых углеводородов при 90 К в жидком
кислороде [507—509]. В табл. 5.24 приве-
дены данные о растворимости при разных
температурах.
На рис. 5.40 приведены данные о раст-
воримости ацетилена в жидком кислороде.
Растворимость диоксида углерода в
жидких кислороде, азоте и воздухе изуча-
лась в [499, 569, 570, 572]. В табл. 5.25
приведены данные из [570]; они несколько
расходятся с данными ,[499, 573].
Растворимость в кислороде при 90 и
100 К других веществ см. в [572, 573].
Рис. 5.40. Растворимость ацетилена в жид-
ком кислороде по данным:
1 — [570]; 2 — [571]; 3 — [569]; 4 — [508]
Таблица 5.24. Растворимость твердых метана, этилена и пропилена
в жидких азоте и кислороде (х — молярные доли)
Метан Этилен
в жидком кислороде в жидком азоте в жидком кислороде в жидком азоте
Г. К | х т, К X т. к X т, к *
69,15 0,532 70,8 0,4515 101,0 0,1743 90,1 1,1-10-2
70,95 0,588 74,2 0,547 97,0 5,74-10—2 77,7 2,24-Ю-з
71,97 0,617 75,2 0,583 90,1 1,32-10-2 69,0 5,38-10-1
77,23 0,621 77,2 0,637 77,7 2,70-Ю-з
79,20 0,674 79,05 0,698 69,0 6,50-10-1
Продолжение табл. 5 .24
Этан Пропилен
в жидком кислороде в жидком азоте в жидком кислороде
Т, К X т, к | X Т, К | х
85,3 8 ,75-10-2 78,6 9,82-10-з 87,4 9,14- Ю-з
81,1 6 ,76-10-2 78,1 9,59-Ю-з 86,8 8,98- Ю-з
80,0 6 ,39- IO-2 77,3 9,49-10-3 83,3 5,56-Ю-з
77,3 3 ,35-10-2 83,0 1,76-Ю—з-
Равновесие жидкость — naf>- для тройных смесей
219
Таблица 5.25. Растворимость твердого
диоксида углерода С02 в жидких
кислороде и азоте
г. к Молярные доли, х-;10в
в жидком кислороде В жидком азоте
98 5,61 7,26
80 4,23 5,34
78,4 2,91 (0,3)* 3,47
74,0 2,35 —
67,0 1,77 2,21
* По данным [573].
5.6. ГИДРАТЫ УГЛЕВОДОРОДОВ
Гидраты углеводородов представляют
собой белые кристаллические соединения,
похожие на лед или плотный снег. Хими-
ческие формулы гидратов: СН4-6Н2О;
€2Н6-7Н2О; С3Н8-7Н2О; i-C4H10-7H2O;
«-С4Ню-7Н2О. Гидраты более тяжелых уг-
леводородов не обнаружены. Гидраты — не-
Рис. 5.41. Условия образования гидратов
углеводородов
стабильные соединения, существующие во
влажном газе при определенных условиях
по температуре й давлению. Благоприят-
ствуют образованию гидратов высокая тур-
булентность потока газа и его пульсация.
На рис. 5.41 приведены условия, при ко-
торых образуются гидраты [510]: левее ли-
ний— область существования гидратов. Для
существования гидрата необходимо, чтобы
парциальное давление водного пара в сме-
си было больше равновесной упругости
пара над гидратом. Установлено, что упру-
гость паров воды Над гидратом меньше
упругости паров воды и льда. Таким об-
разом, если газ насыщен водными парами,
то имеются условия для образования гид-
рата. Об условиях образования гидратов
см. в [574]. Удельная плотность гидрата
метана легче воды (0,992); другие гидраты
несколько тяжелее воды.
5.7. РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР
ДЛЯ ТРОЙНЫХ СМЕСЕЙ
Способ графического изображения.
Данные по фазному равновесию изобра-
жаются в треугольных диаграммах. По-
строение диаграмм по одному из способов
основано на следующей теореме: если из
точки, взятой внутри равностороннего тре-
угольника, провести прямые, параллельные
каждой из трех его сторон, до пересечения
с соответствующими двумя другими сторо-
нами, то сумма полученных трех отрезков
есть величина постоянная и равная стороне
треугольника. Если в углах треугольника
(рис. 5.42,а) отметить компоненты А, В, С,
то каждая точка в треугольнике определя-
ет состав тройной системы, причем содер-
жание компонента пропорционально длине
перпендикуляра, опущенного на сторону,
противолежащую углу, и характеризующего
100%-ный состав данного компонента. На
рис. 5.42,а точка Р соответствует содержа-
ниям: А—50, В—20, С—30%. По рисунку
наглядно видно, каким способом произво-
дится отсчет.
Для изображения равновесных соотно-
шений тройной смеси фиксируют давление
р и температуру Т, тогда конкретному со-
СД
.Д/Д Линия пара
Линия
жидкости
л АЖ7У\/\
Рис. 5.42. Графическое изображение равновесных соотношений для тройной
системы
223
Экспериментальные данные по фазовому равновесию
ставу жидкости хи существующей при дан-
ных р и Т, соответствует определенный со-
став пара Zi (рнс. 5.42,5). Другой суще-
ствующей при данных р и Т жидкости х
отвечает пар гит. д.; соединив соответ-
ствующие точки, можно получить линию
жидкости и линию пара для данных р и
Т. Составы равновесных жидкости и пара
соединяют прямыми — так называемыми
конодами.
Другой способ построения равновесных
соотношений трехкомпонентной смеси иллю-
стрирует рнс. 5.43, на котором представле-
на система Аг—О2—N2 [205]. Диаграмма
строится для постоянного давления в коор-
динатах У\—У2 с ЛИНИЯМИ Xi=const, х2=
= const н Т=const. Содержание третьего
компонента определяется как дополнение до
100%. На такой диаграмме по известному
составу жидкости или пара могут быть
найдены равновесные составы пара или
жидкости, а также температура кипения.
На рис. 5.44 показан третий способ
изображения равновесных составов. Диа-
грамма строится для p=const. На ней на-
носятся изотермы (показаны штриховыми
линиями) и даны температурные шкалы для
пара и жидкости. Отсчет концентраций ве-
дется по аналогии с рис. 5.42,а. Равновес-
ные составы жидкости и пара соединяются
«дистилляционными линиями». Например,
жидкости состава А при температуре 22,8 К
равновесен пар, состав которого отражает
точка В, лежащая на той же дистилляцион-
ной линии и на изотерме 22,8 К для пара.
Наиболее полный обзор литературы по
равновесию жидкость —пар для тройных
смесей при крнотемпературах приведен в
[467].
Система гелий — неон — азот (Не—
Равновесие жидкость—пар для тройных смесей
221-
Рис. 5.44.
Равновесные
соотношения для тройной системы Hz—HD—HDz
—Ne—N2). В табл. 5.26 приведены выбо-
рочные данные по равновесным концент-
рациям [511].
Системы Н2—HD—D2. На рис. 5.44 при-
ведена расчетная диаграмма равновесия
при давлении 0,1013 МПа. Построение про-
Таблица 5.26. Равновесие
жидкость—пар в системе гелий—иеои—азот
при 82,7 К (х и у — соответствеиио
концентрации жидкости и пара, молярные
доли, %. Содержание азота находится
как дополнение до 100%)
Ne Л' Не, ^Ne Z/He
0,5 ЧПа
0 0,108 0 63,8
0,1 0,097 6,26 57,1
0,2 0,087 12,5 50,7
0,3 0,076 18,7 44,4
0,4 0,065 24,9 38,0
0,5 0,055 31,0 31,8
0,6 0,044 37,2 25,4
0,7 0,033 43,3 19,2
0,8 0,022 49,3 13,0
0,9 0,012 55,4 6,76
Продолжение табл. 5.26
X., Ne Ole "не
2,0 ЦПа
0 0,56 0 90,5
0,5 0,514 8,48 81,8
1,0 0,467 16,8 73,3
2,0 0,369 32,9 56,8
3,0 0,274 48,4 40,9
4,0 0,178 63,1 25,8
5,0 0,881 77,3 П,1
5.0 НПа
0 1,31 _ 0 94,8
1,0 1,22 8,01 86,8
2,0 1,13 15,7 78,9
3,0 1,05 23,2 71,3
4,0 0,957 30,4 . 63,9
5,0 0,870 37,2 56,9
7,0 0,7 50,1 43,7
9,0 0,527 62,0 31,5
11,0 0,360 72,6 20,6
13,0 0,193 82,5 10,5
ведено исходя из предположения, что смесь-
подчиняется законам идеальных растворов^
[537].
-222
Экспериментальные данные по фазовому равновесию
Система водород —азот— оксид угле-
рода (Н2—Х12—СО). Система изучалась в
[483, 512]. См. также [18, 467, 575]. Дан-
ные по равновесию этой системы для фаз
кристалл—пар см. в [497].
Система водород — азот — метан (Н2—
—N2—СН4). Система изучалась в [513]:
.равновесные данные приводятся в виде гра-
фиков констант равновесия (ylx—k) для
!Н2, N2 и СН4 как функции давления, тем-
пературы и концентрации. См. также [18,
467, 575].
Система водород—метан—этилен (Н2—
—СН4—С2Н4). Система исследована в [556].
См. также [18, 467, 575].
Система метан — этан — пропан (СН4—
—С2Н8—С8Н8). См. [467].
Система этилен — этан — ацетилен
(С2Н4—С2Н8—С2Н2). См. [467, 575].
Данные по равновесию тройных смесей
других углеводородов см. в [18, 467, 575].
5.8. РАВНОВЕСИЕ
МНОГОКОМПОНЕНТНЫХ СМЕСЕЙ
Экспериментальные данные по составу
равновесных жидкой и паровой фаз для
четырехкомпоиентных смесей см. в [18,
467, 575].
Таблица 5.27. Равновесие жидкость—пар в системе кислород—азот при 0,5687 .МПа
(х4, х2—содержание в жидкости соответственно кислорода и аргона, молекулярные доли,
%; АО у2— то же в паре. Содержание азота находится как дополнение до 100 °/о)
Xi
Х1 0 1 2 3 4 5
Z/2 У1 У2 У1 Z/2 У2 У1 У2 У1 У2
0 0 0 0 0,518 0 1,041 0 1,566 0 2,093 0 2,625
2 0,83 0 0,838 0,525 0,842 1,052 0,848 1,583 0,850 2,117 0,86 2,669
5 2,11 0 2,12 0,533 2,13 1,071 2,143 1,611 2,154 2,154 2,77 2,702
10 4,32 0 4,34 0,549 4,35 1,102 4,38 1,66 4,41 2,22 4,43 2,785
.20 9,69 0 9,15 0,595 9,19 1,175 9,26 1,77 9,30 2,37 9,35 2,97
30 14,49 0 14,58 0,629 14,66 1,263 14,75 1,902 14,89 2,547 14,94 3,20
40 20,65 0 20,8 0,68 20,95 1,367 21,091 2,061 21,24 2,762 21,38 3,47
50 27,91 0 28,11 0,742 28,34 1,493 28,55 2,25 28,78 3,02 28,99 3,79
60 36,6 0 36,91 0,818 37,21 1,648 37,53 2,487 37,86 3,336 38,2 4,2
70 47,2 0 47,71 0,913 48,15 1,837 48,6 2,776 49,06 3,73 39,53 4,687
80 60,61 0 61,22 1,029 61,84 2,074 62,49 3,137 63,14 4,217 63,8 5,31
90 77,7 0 78,56 1,175 79,45 2,374 80,39 3,594 81,26 4,833 82,2 6,11
95 88,08 0 89,1 1,264 90,19 2,559 91,23 3,81 92,31 5,2 — —
Система водород—метан—этилен (Н2—
—СН4—С2Н6). См. [18, 467, 575].
Системы Н2—С2Н4—С2Н8 и Н2—С2Н4—
—С3Н5 экспериментально изучены в огра-
ниченном интервале концентраций [514].
Данные в работе представлены в виде
констант равновесия.
Система азот — аргон — кислород (N2—
—Аг—О2). Наиболее полное исследование
проведено в [205]. Данные при давлении
0,1333 МПа приведены на рис. 5.43, а при
0,5687 МПа — в табл. 5.27. Подробные гра-
фики и таблицы приведены в [203, 205,
559].
Система азот — аргон — метан (N2—
—Аг—СН4). См. [467].
Система азот — кислород — диоксид уг-
лерода (N2—О2—СО2). См. [467].
Система азот — метан — этан (N2 —
—СН2—С2Н8). См. [467].
Система метан — этилен — этан (СН4—
—С2Н4—С2Н8). См. [18, 20, 467, 575].
Система метан—этилен—бутан (СН4—
—С2Н4—С4Н18) изучалась в [18, 467, 503].
Для расчетов фазового равновесия ис-
пользуют константы равновесия k (см)
с. 52). Составлены графики констант рав-
новесия с использованием фугитивности в
предположении, что константы — функции
только давления и температуры, т. е. k=
=f(p, Т) [20, 515, 516, 575, 576].
Вместе с тем экспериментальные ис-
следования показали, что константы равно-
весия данного вещества зависят не только
от р и Г, но также и от концентраций дру-
гих компонентов, входящих в смесь: k—
—f(p, Т, с). Влияние концентрации смеси
учитывается введением понятия приведен-
ного давления рав, т. е. k=f(p, Т, рПр),
либо средпемольпых температур кипения
Тер, т. е. k=f(p, Т, ТСр). Определение
«приведенного» давления, среднемольиых
температур и нахождение констант рав-
новесия по графикам и номограммам см.
в [52, 517, 518, 520, 575].
Хороший обзор методов корреляции
констант равновесия дан в [519], а метод
расчета ректификации многокомпонентных
смесей — в [577].
Изотермы адсорбции газов
223
5.9. ИЗОТЕРМЫ АДСОРБЦИИ ГАЗОВ
Наиболее распространенными адсорбен-
тами служат активированные угли, силика-
гели, алюмогели и цеолиты (молекулярные
сита).
Синтетические цеолиты представляют
собой алюмосиликаты кальция, натрия и
других металлов, полученные путем гидро-
термального синтеза. Общая химическая
формула цеолитов Ме2/„О-АЬОд-хЗЮаХ
ХуН2О, где Me — катион щелочного метал-
ла и п — его валентность. Химические фор-
мулы цеолитов см. в [579]. В отличие от
других адсорбентов каждый тип цеолитов
имеет поры (окна) строго определенного
размера и поэтому сорбирует только те мо-
лекулы, размеры которых меньше пор (си-
товое действие). Наибольшее применение
получили цеолиты NaA, СаА, NaX, СаХ.
Первая часть обозначения — это преобла-
дающий в цеолите металл, вторая — тип
решетки (А или X). Цеолиты имеют еле-
О
дующие размеры входных окон, A: NaA—
4(4А); СаА— 5(5А); СаХ— 8(10Х); NaX—
9-i-10(13X). В скобках указаны цеолиты по
классификации, принятой в США. Внутрен-
няя удельная поверхность цеолитов типа
NaA и СаА — 750—800 м2/г, типа СаХ—
1030 м2/г. Подробнее о цеолитах и других
адсорбентах см. в [579].
В табл. 5.28 приведены некоторые ха-
рактеристики адсорбентов. Физические свой-
ства других адсорбентов см. в [52, 254].
О сорбции газов и паров твердыми телами
см. в [5]. Количество адсорбированного га-
за (а или ц) обычно выражают объемом
газа при 0 или 20 °C и 0,1013 МПа, отне-
сенным к 1 г адсорбента, или числом мо-
лей, или массой (г, кг) поглощенного газа,
отнесенной к единице массы адсорбента
[5, 34].
Для характеристики адсорбционных
свойств используют: зависимости адсорб-
ционной способности а от давления р при
постоянной температуре (T=const) (так.
называемые изотермы адсорбции); зависи-
мости адсорбционной способности от тем-
пературы при постоянном давлении (р—
=const) — изобары адсорбции; зависимости
давления и температуры адсорбции для по-
стоянного количества адсорбируемого ве-
Таблица 5.28. Характеристика некоторых отечественных адсорбентов [254, 579, 580]
Адсорбент (марка) Размер гранул, мм Истинная плотность, кг/м8 Насыпная плот- ность, кг/м* Средний радиус пор, А Поверх- ность сорбции, м2/г Номер ГОСТ или ТУ
Активирован- ные угли БАУ 1-5 260 ГОСТ 6217-74
СКТ 1—3,5 — 400 16 1100— ТУ Д2
СКТ-1 0,5—2,7 1750—2100 470 1300 ГУ-937-66 ТУ Д2
СКТ-2 1—3,5 460 ГУ-938-66 ТУ Д2
СКТ-4 1—3,5 430 ГУ-939-66 ТУ Д2
АГ2 2,7—5 1750—2100 530 620 ГУ-940-66 ВТУ 6-16-1421-69
АГЗ 1,5—3 — 450 ' ГОСТ 5657-74
АГ5 1—1,5 — 450 — — ТУ 2Д
Селикагели кек 2300 450 45—100 750—800 ГУ-428-61 ГОСТ 3956-76
кем 2,7—7 2200 700 10—20 460—750 ГОСТ 3956-76
Активный оксид алюми- ния А1 4—6 400—550 70 180—220 ГОСТ 8136-56
А2 2,6—3 3240 550—750 12—13 300—350 ГОСТ 8136-56
Синтетические цеолиты 2—4 2000 680—780 4—5 750— 800 ВТУ МРТУ 6-01-567-63
Тип X 2—4 2000 620—720 8—10 1030 ВТУ МРТУ 6-01-567-63
224
Экспериментальные данные по фазовому равновесию
Рис. 5.45. Изотермы адсорбции газов на
силикагеле:
1 — N, при —195,8 °C; 2 — О2 при —183 °C; 3 —
Аг при —183 °C; 4 — СО при —183 °C; 5 — N2 при
— 183 °C; 6 — СО, при —78 °C; 7 — SO, при О °C;
8 — CiHio при О °C
Рис. 5.46. • Изотермы адсорбции водорода,
азота, кислорода и метана на угле АГ-2
и силикагеле К СМ (7=77,4 К)
Рис. 5.47. Изотермы адсорбции азота при 90 К:
1 — шабазит; 2 — синтетический цеолит СаА; 3 — уголь СКТ; 4 —кусковой силикагель 1<СМ-
5 гранулированный силикагель КСМ; 6 — активный глинозем ’
щества (a=const) — изостеры адсорбции.
Уравнения, связывающие количество адсор-
бируемого газа с давлением и температурой,
см. в §2.15.
На рис. 5.45 показаны изотермы сорб-
ции газов на силикагеле по данным [34].
На рис. 5.46 приведены изотермы адсорб-
ции газов на отечественных сорбентах. По-
глощение воздуха и азота при 77,4 К цео-
литом СаА и углями СКГ и БА4 примерно
соответствует поглощению азота углем
АГ-2.
На рис. 5.47 представлены изотермы
адсорбции азота при 90 К иа различных
адсорбентах '[581]. На рис. 5.48 приведены
изотермы адсорбции гелия, неона и водо-
рода [583]. Адсорбция Н2 и D2 практически
одинакова.
На рис. 5.49 представлены изотермы
адсорбции гелия, водорода и неона при
20,4 К [582]. Сорбцию этих же газов на
цеолите СаА см. в [582].
На рис. 5.50 приведены изотермы ад-
сорбции аргона, кислорода, водорода при
низких давлениях [584]. Данные о сорбции
других газов при низких давлениях см. в
[582, 584].
На рис. 5.51 приведены изотермы ад-
сорбции неоиа, водорода и гелия при вы-
соких давлениях [521].
В табл. 5.29—5.38 приведены значения
адсорбции инертных газов, а также азота,
кислорода и водорода на различных адсор-
бентах |[583]. Адсорбцию этих же газов на
угле АГ-2 см. в [20]. Исключительно вы-
сокой адсорбционной способностью к водо-
роду обладает соединение LaNis; 1 моль
этого соединения при давлении 0,2 МПа и
Изотермы адсорбции газов
225
Рис. 5.48. Изотермы адсорбции гелия, неона, водорода
температуре 20 °C поглощает 6 атомов во-
дорода. Это соответствует плотности водо-
рода 115 кг/м3 (для сравнения плотность
жидкого водорода равна 71 кг/м3) [522].
Рис. 5.49. Изотермы адсорбции:
1— Не на цеолите 5А при 4,2 К; 2 — Н3 на цео-
лите при 20 К; 3 — Ne на угле БАУ при 20,4 К;
4— Н2 иа силикагеле КСМ при 20,4 К; 5 —Ne
иа силикагеле КСМ при 20,4 К; 6 — Не на сили-
кагеле КСМ при 20,4 К
Рис. 5.50. Изотермы адсорбции аргона,
кислорода и водорода различными адсор-
бентами:
1—уголь СКТ (аргои, 77 К); 2 — активный гли-
иозем (аргон 77 К); 3 — уголь СКТ (аргои,
90 К); 4 — шабазит (аргон 90 К): 5 — СаЕ (ар-
гон 90 К): 6 — СаА (аргон, 90 К): 7 — силика-
гель СУ (аргон, 90 К); 8 — АГ-2 (кислород,
77 К); 9 — КСМ (кислород, 77 К); Ю — АГ-2
(водород, 77 К)
Ниже на рис. 5.63 приведены изохоры для
гидридов других металлов.
На рис. 5.52 приведены данные по ад-
сорбции углеводородов на угле АГ-3 [585].
Цеолиты NaA и СаА при низких дав-
лениях (10—100 Па) обладают избиратель-
ной адсорбцией. Цеолит NaA адсорбирует
из воздуха преимущественно кислород, а
СаА — азот. Такая избирательная адсорбция
И- 218
цеолитов наблюдается и по отношению к
другим газам, что может быть использо»
вано для разделения воздуха, углеводо-
родных газов, обогащения аргона и т. д.
[14,586,749]. -
Обзор литературы по адсорбции раз-
личных газов на адсорбентах см. также в
[521].
В связи с широким использованием
226
Экспериментальные данные по фазовому равновесию
Рис. 5.51. Изотермы адсорбции гелия, во-
дорода и неона при высоких давлениях и
температуре 76 К
криовакуумных иасосов проведены работы
по изучению адсорбции водорода, иеоиа и
гелия на слоях сконденсированных газов, в
частности изотермы сорбции гелия пред-
ставлены иа рис. 5.53 [587]. По оси
абсцисс здесь отложена равновесная при
данном давлении концентрация сорбирован-
ного гелия в слое газа'. На рис. 5.54 при-
ведены изотермы поглощения газов иа сло-
ях скоиденсироваииого диоксида углерода
по тем же данным. На рис. 5.55 приведены
данные по сорбции водорода и иеоиа раз-
личными веществами 1587]. Сорбцию водо-
рода см. также в [523].
На рис. 5.56—5.58 приведены изотермы
адсорбции СО2 [203].
На рис. 5.59 и 5.60 приведены изотер-
мы адсорбции углеводородов и ацетилена
из смеси с азотом ;[203].
На рис. 5.61 и 5.62 приведены изотер-
мы адсорбции паров воды иа различных
адсорбентах [203]. На этих рисунках
pips — отношение давления паров воды к
давлению насыщенного пара при 20 °C.
На рис. 5.63 приведены изохоры гидри-
дов металлов.
Теплота адсорбции. Для определения
теплоты адсорбции по изотермам можно
воспользоваться уравнением Клапейрона —
Клаузиуса (см. с. 41)
= QR In ра/рд
J 1/Л-1/7-/
где pi и р2—равновесные давления при
температурах 'Л и Тз при постоянном ко-
личестве G адсорбированного газа (изосте-
ры). Теплота адсорбции мало зависит от
природы адсорбента и температуры адсорб-
ции, ио существенно зависит от количества
адсорбированного вещества.
Таблица 5.29. Адсорбция гелия
при Т=77 К
р, гПа а, см’/г
СКТ СаА NaX
67 0,27 0,13 0,10
133 0,55 0,26 0,20
200 0,82 0,41 0,30
267 1,09 0,54 0,40
333 1,37 0,68 0,51
400 1,64 0,83 0,61
467 1,92 0,96 0,71
533 2,19 1,10 0,81
600 2,47 1,24 0,91
667 2,47 1,40 1,02
733 3,02 — —
Таблица 5.30. Адсорбция неона
при Т=77 К
а, см3/г
р, гПа СКТ БАУ КАД СаА NaX
67 9,0 7,1 3,8 3,0 1,5
133 17,7 13,0 7,2 5,5 2,9
200 24,4 18,0 10,7 8,2 4,5
267 30,4 21,8 13,1 11,3 6,0
333 35,3 24,3 14,9 13,5 7,5
400 39,7 28,2 17,3 16,5 9,1
467 44,0 32,3 19,0 19,0 10,6
533 48,0 36,0 21,0 21,1 12,1
600 52,7 39,3 22,5 — 13,7
667 42,1 24,0 — 15,2'
733 — 44,5 — — —
Таблица 5.31. Адсорбция аргона
т, к Рь гПа а, см3/г
СКТ | АГ-5 | КСМ-6 | СаА NaX
77 6,7 13 360 383 — ГЛ 64 85 НО 124
67 436 143 117 135
133 453 - 179 125 140
200 467 191 130 146
267 480 — 200 138 160
90 6,7 255 73,6 62 91 98 Д
13 278 8J 71 100 117
67 335 101 103 107 128
133 363 109 132 109 133
200 . 384 112 152 НО 135
267 393 113 167 112 136
333 399 114 178 114 138
400 400 115 185 115 138
467 410 116 194 116,5 139
533 117 199 118 140
Изотермы адсорбции газов
227
Таблица 5.32. Адсорбция криптона
а, см*/г
т, к р, гПа
СКТ КСМ-5 КСМ-6 СаА СаХ
90 0,7 23 59 .
1,3 —- 48 78 —
2,7 — 1и7 142 — 105,4
6,7 — 148 185 — 108,5
9,3 —— 189 214 — 110,8
12 — 220 231 82 112,2
13 — 230 238 82,5 112,7
16 — 264 247 84,0 113,6
2и — 310 256 87,0 115,3
27 — 373 260 91,5 120,6
293 13 0,7
33 2,0 0,09 0,13 —
67 3,8 0,17 0,24
100 5,7 0,25 0,35
133 7,7 0,34 0,49 — —
200 11,0 0,52 0,76 — —
267 13,9 0,70 0,99
333 16,0 0,88 1,25 —
400 18,5 1,06 1,50 —
467 20,4 1,23 1,74
533 23,3 1,41 1,95
600 — 1,59 2,15
667 — 1,76 — — —
Таблица 5.33. Адсорбция ксенона
т, к р, гПа а, см1/.
СКТ СаА
198 6,7 4,4
13 117 8,4
67 164 12,6
133 178,5 13,3
2и0 189 13,9
267 198 14,3
333 208 14,7
400 218,5 15
467 225 15,2
533 230 15,3
600 236 —
273 6,7
13 15
67 40 1,2
133 56 2,42
200 68 3,53
267 76,5 4,6
333 84 5,42
400 92 6,27
467 96 6,90
533 101,5 7,43
600 —- 7,84
667 — 8,1
Таблица 5.34. Адсорбция кислорода
Т, К А г Па а, см®/г
СКТ | КСМ-6 | NaX СаА | NaA
77 6,7 499,4 148,0 135 112,5
13 513,0 158,4 145,5 115’ .
67 612,5 219 152 13о 137
133 639,0 252,5 155 143 140
2о0 666,0 272,3 174 150 155
90 6,7 310 62 120,7 100,1
13 348 74 127 105
67 499 124 137,5 116,5 --
133 523 152 141 119 127,5
200 536 168,5 142,5 121 130
267 542,5 181 143,5 124 132
333 546 192 145 126 134
400 550 201 146 128 136
467 554 209 147 130 138
533 558 215 148 133 140
600 562 217,3 149 137,5 142
667 - 567 217,4
733 570,5 217,4 — — —
Таблица 5.35. Адсорбция азота
г,к А гПа а, см8/г
СКТ АГ-5 КСМ-6 СаА NaA NaX
77 6,7 . 93 93
13 332 —— 100 101
67 369 — 130 107 3,7 124
133 395 150 ПО 4,1 125
200 407 163 Ill 4,5 126
267 418 —— 173 из 5,0 127
33 > 420 __ 182 115 5,3 128
403 422 — 190 47 5,6 129
467 427 195 118 5,9 130
533 428 198 120 6,2
600 430 121 6,6
667 431,8 — — 12} —
90 6,7 264 76,8 62 86,8
13 274 95 71 88 110
67 ЗП 104 98 99 2,0 117 '
133 328 III 45 101 2,6 12L,8
200 334 И4 128 103 3,0 122,1
267 339 118 135 104 3,5 122,4
33 i 340 123 142 105 3,8 122,5
400 340 125 148 Ю5 4,0 122,5
457 341 126 154 105,5 4,1 122,5
533 342 127 157 103 4,2 122,5
600 343 129 159 4,6 __.
667 345 132 — — — —
Таблица 5.36. Адсорбция водорода
г, к рь гПа 41, с м3/г
СКТ ксм-з СаА NaX
77 6,7 38 23,5 П,5 6,5
13 50 27,5 19,и 12,5
67 94,6 43,5 41,0 32,5
133 126 49,5 48,0 42,0
2о0 153,5 53,5 53,0 5J,0
267 179,5 55,8 57,5 56,0
15*
228
Экспериментальные данные по фазовому равновесию
Продолжение табл. 5.36
Т, к р, гПа а, см3/г
СКТ КСМ-6 СаА NaX
77 333 200 58,0 60,0 61,5
400 216 60,0 62,0 64,5
467 227,5 61,5 64,5 67,5
533 237,5 62,5 67,0 70,5
600 — 64,0 68,5 73,0
667 — — 70,0 76,0
90 6,7 — 4 2,5
13 — — 7,5 4,5
67 — — 20,5 15,0
133 — — 29,и 22,5
200 — — 35,5 29,0
267 —— — 38,0 34,0
333 — — 39,5 .38,0
400 — — 41,5 40,5
467 — — 43,0 43,5
533 — — 45,0 46,0
600 — 47,5 49,0
667 — — 49,5 51,5
Таблица 5.37. Адсорбция диоксида
углерода при 293 К [583]_________
р, гПа а, см3/г
СКТ КСМ-6 NaX СаА NaA
6,7 10,2
13,3 —— 2,2 14,6 7
66,7 11,5 — 46,5 35 12
133,2 17,5 2 60,6 51 14,3
200 23,8 3,1 63,5 56 15,6
266,6 29,5 3,5 65,7 57,5 18,5
333,3 34 3,9 66,5 57,9 19,4
399,9 40 5,0 68 58,1 22
466,6 44 6,3 69,5 58,2 22,4
533,3 49 П,о 70,3 — 25
600 53,6 11,5 71 — 26
666,6 58,8 12,5 71,2 — 26,5
733,3 — 2 16 — — 27,6
р, Г Л CL 40 80 см3/л
10'1
Таблица 5.38. Примерные значения
теплот адсорбции [34]
Газ Теплота адсорб- ции» Дж/моль
Азот 12 560—16 740
Аммиак 34 330
Аргон 15 070
Ацетилен 33[910
Вода 5 J 240—41 870
Водород 6280
Гелий 580
Диоксид углерода 30 560
Дейтерий 4180
Закись азота 30 980
Кислород 15 490
Метан 23 С 25
Оксид углерода 14 235
Этилен 29 300
Рис. 5.52. Адсорбция углеводородов на
угле АГ-3 при О °C
Концентрация ,°/а
Рис. 5.53. Изотермы сорбции гелия на сло-
ях сконденсированных газов при темпера-
туре 4,2 К (1—8) и 2 К (Г—8'):
1 — СН4; 2 —Ne; 3 — №; 4 — О2; 5 — Хе; 6-7 —
Аг; 8 — COj
Концентрация, °/а
Рис. 5.54. Изотермы сорбции водорода и
дейтерия слоями СО2:
!, 3, 5 — изотермы для водорода. 2, 4, 6 — изо»
термы для дейтерия при 20, 14 и 4,2 К соответ»
ственно
Изотермы адсорбции газов
229
Рис. 5.58. Изотермы адсорбции СО2 цеоли-
том NaX из сухого воздуха под давлением
Рис. 5.55. Изотермы сорбции водорода и
неона:
1—3 — изотермы сорбции водорода слоями воды,
спирта и ацетона при 20 К соответственно; 4—
б — то же для слоев двуокиси углерода при 20,
15 и 14 К соответственно; 7, 8 — изотермы сорб-
ции неона слоем СО2 при 10 и 15 К соответст-
венно
Рис. 5.56. Изотермы адсорбции СО2 куско-
вым силикагелем КСМ из смеси с азотом
при атмосферном давлении смеси
Рис. 5.57. Изотермы адсорбции СО2 сили-
кагелем КСМ из смеси с воздухом при
высоких давлениях
Рис. 5.59. Изотермы адсорбции углеводо-
родов цеолитом NaX из сухого и очищен-
ного от СО2 воздуха под давлением при
концентрации углеводородов 1 см3/м3:
1 — этилен при температуре 293 К; 2 — пропилен
при 293 К; 3—5 — ацетилен соответственно при
303, 293, 283 К; 6—8— бутилен при 303, 293, 283 К
Рис. 5.60. Изотермы адсорбции
из смеси с азотом на
силика-
ацетилена
геле КСМ
Рис. 5.61.
Изотермы адсорбции паров во-
ды при 20 °C:
р, МПа
10,0
0,0001
паров во-
NaX; 3 —
Рис. 5.62. Изотермы адсорбции
ды при 293 К:
/ — активный глинозем; 2 — цеолит
активная окись алюминия А-2
°С
250
150
SO
Рис. 5.63. Изохоры гидридов металлов
1,0 2,2
2,6 3,0 1ООО/Т
MgzCu.-MgHz-MgCtz2
Раздел шестой
МЕХАНИЧЕСКИЕ СВОЙСТВА
КОНСТРУКЦИОННЫХ МАТЕРИАЛОВ
ПРИ НИЗКИХ ТЕМПЕРАТУРАХ
6.1. ОБЩИЕ ПОЛОЖЕНИЯ
Механические .свойства металлов и
сплавов весьма существенно меняются в за-
висимости от температуры. Как правило,
с понижением температуры повышаются
прочностные характеристики (предел проч-
ности, предел текучести, предел усталости
и др.) и снижаются показатели пластично-
сти (относительное удлинение, относитель-
Изменение механических свойств углеродистых и низколегированных сталей
231
ное сужение и др.) и ударная вяз-
кость.
Свойство некоторых пластических ме-
таллов и сплавов переходить при пониже-
нии температуры к хрупкому разрушению
без заметной пластической деформации на-
зывают хладноломкостью. Это свойство —
результат действия многих факторов.
Согласно схеме Иоффе [180] хладно-
ломкость наступает тогда, когда возрастаю-
щий с понижением температуры предел те-
кучести достигает значения сопротивления
отрыву. Хотя полной теории поведения ме-
таллов при низких температурах нет, мож-
но считать установленным, что изменение
механических свойств с понижением тем-
пературы связано в основном со следую-
щими факторами: типом кристаллической
решетки, химическим составом сплава, ме-
таллургическими условиями получения ме-
талла и видом термообработки, условиями
механического нагружения, концентрацией
напряжений.
Характер изменения механических
свойств с понижением температуры разли-
чен у разных материалов. Наибольшие из-
менения механических свойств претерпева-
ют сплавы на основе железа, в значительно
меньшей степени меняют пластические свой-
ства цветные металлы и сплавы. Стали мар-
тенситного, перлитного и переходных клас-
сов, имеющие кристаллическую решетку
объемноцентрированного куба, склонны к
хладноломкости. Стали аустенитного клас-
са и цветные металлы (кристаллическая
решетка гранецентрированного типа) хлад-
ноломкости подвержены в значительно
меиыпей степени.
Влияние состава. Отдельные элементы,
входящие в состав стали, оказывают раз-
личное влияние на механические свойства
при низких температурах.
Увеличение содержания углерода спо-
собствует возрастанию временного сопро-
тивления разрыву и предела текучести, но
сказывается неблагоприятно на ударной
вязкости, делая металл хрупким при низ-
ких температурах. Аналогично влияние фос-
фора.
Такие элементы, как никель, хром, вана-
надий, молибден, повышают ударную вяз-
кость сталей прн низких температурах.
Особенно благоприятное действие на свой-
ства сталей при низких температурах ока-
зывает никель. Количество никеля, требуе-
мого для получения высокой ударной вяз-
кости при низких температурах, зависит от
содержания углерода в стали. Для мало-
углеродистых сталей достаточно примерно
2% Ni; при содержании углерода выше
0,4% требуется добавка не меиее 3,5% Nf.
Влияние термообработки и размера
зерна. Важным фактором, определяющим
пригодность металла для работы при низ-
ких температурах, служит вид термообра-
ботки. Сталь одной и той же марки дает
различные значения механических показате-
лей в зависимости от вида термообработки,
предшествовавшей испытанию.
Исследования показывают, что углеро-
дистые н малолегированные стали дают
лучшие показатели, когда они подвергнуты
двойной термообработке — закалке и от-
пуску. Предпочтителен высокий отпуск.
Нормализация и отжиг также улучшают
показатели ударной вязкости при низких
температурах, но в меиьшей мере, чем за-
калка.
Существенное влияние на хладнолом-
кость оказывает размер зериа в стали. Сни-
жение ударной вязкости с понижением тем-
пературы у мелкозернистой стали меньше,
чем у крупнозернистой.
Получению мелкозернистой структуры
и сохранению пластичности с понижением
температуры способствует помимо термооб-
работки хорошее раскисление стали алю-
минием, ванадием, цирконием.
Влияние продолжительности охлажде-
ния и знакопеременных нагрузок. Продол-
жительность охлаждения, а также много-
кратное охлаждение не влияют на механи-
ческие свойства при понижении темпера-
туры. Опытные данные показывают, что с
понижением температуры приложение зна-
копеременных нагрузок заметно повышает
предел усталости сталей.
Jlo характеру изменения механических
свойств с понижением температуры основ-
ные металлические конструкционные мате-
риалы, применяемые в криогенной технике,
можно условно разделить на три группы:
1) углеродистые н низколегированные
стали;
2) высоколегированные стали аустенит-
ного класса;
3) цветные металлы н сплавы.
Приведенные ниже данные сгруппиро-
ваны по этим трем группам. Более подроб-
ные сведения по механическим свойствам
металлов и сплавов при низких темпера-
турах даны в [181—185].
Обзор современных методов и техники
низкотемпературных исследований прочно-
сти и пластичности материалов дан в [172].
6.2. ИЗМЕНЕНИЕ МЕХАНИЧЕСКИХ
СВОЙСТВ УГЛЕРОДИСТЫХ
И НИЗКОЛЕГИРОВАННЫХ СТАЛЕЙ
ПРИ ПОНИЖЕНИИ ТЕМПЕРАТУРЫ
С понижением температуры в углеро-
дистых и низколегированных сталях воз-
растают временное сопротивление, предел
текучести, предел упругости, твердость, мо-
дуль нормальной упругости. В то же время
232 Механические свойства конструкционных материалов при низких температурах
Таблица 6.1. Механические свойства углеродистых сталей при низких
температурах [203]
Марка стали Химиче- ский состав (основные элементы, кроме Fe), % Термооб- работка Температу- ра, К Предел прочности, МПа Предел текуч е- сти, МПа Относи- тельное удлине- ние, % Относи- тельное сужение, % Ударная ВЯЗКОСТЬ, кДж/м2
Ст2 0,05— Без тер- 293 330—405 195—293 28—38 65—75 1450—2430
10 0,15 С мообра- 193 415—515 330—400 30—40 63—70 39—115
ботки 153 465—560 393—493 25—32 50—60 19—39
77 640—755 620—730 8—10 4—5 10—10
СтЗ 0,15— Без тер- 293 370—493 215—340 25—30 62—70 980—1960
20 0,25 С мообра- 193 540—635 440—540 32—40 60—68 29—136
15 К ботки 153 593—685 470—570 28—35 55—60 19—39
77 765—860 755—833 8—10 1—4 10—19
40 0,35— Отжиг 293 580—650 410—430 21—24 43—68 785—1460
0,45 С 153 785—815 630—650 25—26 35—49 19—49
77 1000—1050 920—1050 2,6—18 2,9—45 10—19
10Г2 С<0,12 Нормали- 293 430—540 290—393 18—32 55-—65 2150—2350
10Г2СД Мп=: 1,5 зация 193 610—650 410—470 25—32 56—63 1180—1760
153 640—665 470—510 23—30 50—57 780—118
77 930—960 833—880 15—23 26—34 39—49
Таблица
6.2. Механические
свойства некоторых низколегированных сталей
Наименование и марка стали Химический состав (основные элементы), % Термообработка Температу- ра, К Предел проч- ности МПа Предел теку- чести, МПа Относитель- ное удлине- ние, % Относитель- ное сужение, °/ /о Ударная вяз- кость кДж/м’ Литература
Хромистая 0,35—0.42С За-алка при 290 980 850 18 63 1100 [181]
38ХА 0,8—1,1Сг 863 °C; отпуск 200 1100 940 18 55 580
при 550 °C 100 1320 1240 16 43 252
77 1403 1363 16 41 184
Хромоникелевая 0,12С Нормализация 293 775 425 25 54 870 [182]
12ХНЗА 0,9Сг при 860— 93 — 893 24 47 116
2,87№ 880 °C
Хромокремие- 0,28—0,34С Закалка в масле 290 1700 1320 12 44 653 [181]
маргаицови- 0,8—1,1Мп и отпуск при 200 1790 1510 12 44 388
стая ЗОХГСА 0,9— 1,2Si 200 °C 100 1950 1730 7 13 270
0,8— 1, 1Сг 77 2л20 1770 6 7 26)
Хромоиикель- 0,14—Э,23С Закалка при 290 1220 1025 — 63 ИЗО [181]
вольфрамовая 1,35— 1,65Сг 880 °C; отпуск 200 1430 1140 — 63 870
18Х2НЧВА 4,0—4,4Ni при 560 °C 100 1630 1250 — 55 435
0,8—1,2W 77 1645 1280 — 54 388
20 1740 1470 — 3 145
Никелевая 06НЗ 0,04—0,06С Нормализация, 293 533 435 25 65 1453 [184]
3,5—4,0Ni листы толщн- 90 820 680 30 55 388
0,15—0,25Мо ной до 7 мм
Изменение механических свойств высоколегированных сталей аустенитного класса 233
понижаются сопротивление удару (ударная
вязкость) и относительное сужение. Отно-
сительное удлинение сталей при охлаждении
вначале мало изменяется, а затем резко
понижается.
Уменьшение ударной вязкости при по-
нижении температуры настолько велико,
что стали этой группы при низких темпе-
ратурах становятся хрупкими; это ограни-
чивает их применение в изделиях с тем-
пературами ниже примерно 230 К.
В табл. 6.1 и 6.2 приведены примеры
изменения механических свойств углероди-
стых и низколегированных сталей с пони-
жением температуры испытания. В частно-
сти, видно, что с понижением температуры
примерно до 80 К временное сопротивление
и предел текучести возрастают в 1,5—2 ра-
за, а ударная вязкость уменьшается во мно-
гие десятки раз. Характер увеличения вре-
менного сопротивления и предела текуче-
сти следующий: при охлаждении до 200 К
оно происходит относительно слабо, но при
более низких температурах идет быстрее.
Наибольшее снижение ударной вязко-
сти в углеродистых сталях наблюдается в
интервале температур примерно от 270 до
200 К, а в специальных низколегирован-
ных— при температурах ниже 200 К. Аб-
солютная величина ударной вязкости не-
сколько выше у низколегированных сталей
(особенно хромоникелиевых и хромомолиб-
деновых), чем у углеродистых.
На практике углеродистые стали при-
меняют, как правило, при рабочих темпе-
ратурах выше 230 К, а некоторые марки
низколегированных сталей —до 120 К. В по-
следнее время для изготовления сосудов,
предназначенных для жидких природного
газа, азота и кислорода, вместо высоколе-
гированной нержавеющей стали применяют
малоуглеродистые стали с 9—6% никеля.
За рубежом сталь рекомендуется к
эксплуатации, если ее ударная вязкость не
ниже 300 кДж/м2 [184].
6.3. ИЗМЕНЕНИЕ МЕХАНИЧЕСКИХ
СВОЙСТВ ВЫСОКОЛЕГИРОВАННЫХ
СТАЛЕЙ АУСТЕНИТНОГО КЛАССА
ПРИ ПОНИЖЕНИИ ТЕМПЕРАТУРЫ
Стали этой группы — основные кон-
струкционные материалы для изделий, ра-
ботающих при температурах ниже 90 К.
Наибольшее распространение получили
хромоникелевые аустенитные стали: в
СССР —стали типа 12Х18Н10Т, в США —
серии 300, содержащие 16—22% хрома И
8—14 % никеля. Отличительными особенио-
Таблица 6.3. Механические свойства некоторых высоколегированвых сталей
при низких температурах [182, 184]
Марка и характеристика стали Химический состав (основные элементы, кроме Fe), % ОЗ е. - >» к ь к та Д р, та <у Е- Д 3 S С ФО Е- Предел проч- ности, МПа Предел теку- чести, МПа Относитель- ное удлине- ние, % Относитель- ное сужение, о/ /о Ударная вяз- кость, кдж/ма
Аустенитная хромоникелевая С<0,08 293 590 245 55 70 1570
08Х18НЮТ 17—19Сг 77 1180 312 42 50 1470-
9—11N1 20 1810 635 32 42 1175
Аустенитная хромомарганцови- С<0,07 293 635 274 50 65 2350
стая 07Х14П14НЗТ 13—15Сг 77 1270 440 45 50 2160
13— 15N1 20 1470 540 40 50 2050
Аустенитная хромоникельмар- С<0,07 293 715 392 45 67 1565
ганцовистая 07Х21Г7АН5 19,5—21Сг 77 1570 1030 44 31 1340
5—6N1 6—7,5Мп 20 1590 1170 2 11 785
Аустенитная хроникельмарган- С<0,03 293 685 372 60 75 1470
цовистая 03Х20Н16АГ6 20—22Сг 77 1240 780 32 45 1175-
15—16,5Ni 20 1440 930 30 35 980
5—7Мп 4 1470 100Э 25 —* 780
Аустенитно-мартенситная 0,05—0,ОЭС 293 1125 780 27 56 2150
С7Х16Н6(СН2А) 16,5—17,5Сг 77 1810 940 26 49 1125
5—8N1 20 I860 1010 14 39 1125
Нержавеющая аустенитная 0,03С 293 655 365 60 74 2350
03Х13ААГ19 (ЧС36) 12—15Сг 73 1270 675 28 29 1570
18—21 Мп 20 1310 890 16 17 1370
Таблица 6.4. Механичоскиг свойства технически чистых поликрметаллических металла при низких температурах [186]
Металл Решетка Содер- жание метал- ла, % Термооб работ ка Временное сопротив- ление, МПа С тноситеЛьное удлинение, % Сужение, %
290 К | 77 К | 2) к 2)0 К 77 К 20 К 290 К 77 К | 20 К
Алюминий Кубическая, гранецеп- трированная 99,7 Без термообработки (пруток) 118 216 312 29 42 45 86 75 66
Медь То же 99,9 Отжиг при 810 °C, ох- лаждение ' в воде (пру- ток) 235 372 450 29 41 48 70 72 74
Никель » 99,8 Отжиг при 800 °C, ох- лаждение в печи (пла- стина) Без термообработки (литой) 442 618 775 35 46 48 77 69 69
Свинец » 99,98 27,5 44,2 69,5 26 34 36 — — —
Серебро 99,41 Без термообработки (пруток) 176 284 352 39 82 83 90 83 79
Молибден Кубическая, простран- ственно-центрирован- ная 99,31 То^же 480 530 530 3 0 0 3 3 4
Натрий (электро- литический) То же — — 13,7 18,6 39,2 19 18 60 — — —
Олово Тетрагональная 99,74 Без термообработки (литой) 35,2 69,5 72,5 29 4 0,6 91 4 0
Магний Гексагональная, плот- ной упаковки 99,9 То же 118 157 206 5 5 5 10 7 8
Таблица 6.5. Механические характеристики цветных металлов и сплавов при низких температурах
Материал и марка Химический состав, % Термообработка (состояние) Темпера- тура, К Предел прочно- сти, МПа Предел текуче- сти, МПа Относи- тельное удлине• ние, % Относи- тельное сужение, °/ /о Ударная вязкость, кДж/м2 Лите- рат ура
Медь Ml 99,9 Си Отжиг при 930 °C 295 245 49 40 2940* [181]
77 372 88 43 4000*
20 412 80 65 — 3820*
Медь М3 99,5 Си Отжиг 290 225 87 30 70 1750 [575]
77 372 — 41 72 2080
20 450 — 48 74 2110
Латунь Л62 60,5—63,5 Си Отжиг 293 352 132 55,8 62,4 • 1235 [203]
примеси менее 0,7; 195 400 148 65,0 68,8 1380
остальное Zn 77 500 183 79,0 66,2 1510
234 Механические свойства конструкционных материалов при низких температурах
Лйатериач и марка Химический состав, % Термообработка (состояние) Темпера- тура, К
Латунь ЛС59-1 59 Си 1 Р1; остальное Zn Отжиг 293 180 77
Латунь ЛЖМц-591-1 59 Си 1 Fe 1 Мп; остальное Zn Отжиг 293 195 77
Бронза алюминиевая БрА7 7,3 Al 1,0 Zn 0,44 Мп; остальное Си Отжиг 293 195 90
Бронза берилиевая 0,6 Be 2,6 Со; остальное Си Холоднотянутая, полутвер- дая 295 77 20
Монель НМЖМц 28-2,5-1,5 27—29 Си 2—3 Fe 1,2—1,8 Мп; остальное Ni Отожженный 295 - 77 ' 20
Алюминий АД1 99,5 Al Лист отожженный 293 90
Алюминиевый сплав АМц 1,0—1,6 Мп; остальное А1 Лист отожженный 293 77 20
Алюминиевый сплав АМгб 5,8—6,8 Mg 0,5—0,8 Мп остальное А1 Горячекатаный лист 295 77 20
Алюминиевый сплав. АКб 1,8—2,6 Си 0,4—0,8 Mg 0,7—1,2 Si остальное Al Термообработка, поковка 203 77
Алюминиевый сплав 3,8—4,9 Си Закалка и естественное ста- 295
Д13 1,2—1,8 Mg 0,3—0,9 Ми 0,5 Fe остальное Al рение 77 20
Магниевый сплав МА2-1 0,54 Мп 4,0 Al 1.15’Zr А. остальное Mg Отожженный лист 295 77 20
Образцы П'арпи.
Продолжение табл. 6.5
Предел прочно сти, МПа Предел текуче- сти, МПа Относи- тельное удлине- ние, % Относи- тельное сужение, % Ударная вязкость, кДж/м2 Литера- тура
4Ю 128 42,7 49,7 587 [203]
460 156 45,0 50,9 735
565 198 52,2 47,8 578
476 208 36,9 52,7 636 [203]
490 228 35,4 35,4 695
615 304 41,5 41,5 685
530 182 26 29 705 [18И
568 186 31 30 705
655 200 29 30 588
412 342 10 2340* [181]
558 431 31 2250
6зб 470 48 — 2060
518 186 51 — [181]
784 334 64 — —
910 450 — — —
77 31 35 71 910 [203]
158 39 48 67 1550
123 62 зо 63,5 676 [203]
242 84 43,0 550
298 — 26,0 — —
334 157 20 28 294 [181]
432 177 25 25 206
520 206 1'9 22 275
403 238 15,0 15,0 157 [203]
490 378 18,5 19,4 147
412 314 13 32,5 108 [181]
520 382 17 28 83
685 470 17 23 —
280 206 13 •15 [181]
372 зю 3,5 7 —
422 314 2,9 8 —
Изменение механических свойств высоколегированных сталей аустенитного класса 235
236 Механические свойства конструкционных материалов при низких температурах
СТяМИ хромоникелевых аустенитных сталей
являются коррозионная стойкость и хоро-
шие показатели вязкости и пластичности
при Низких температурах.
Вместе с тем они подчиняются общей
закономерности: с понижением температуры
у них повышаются прочностные характери-
стики (временное сопротивление разрыву,
предел текучести и др.) и уменьшаются
относительное удлинение, относительное
сужение и ударная вязкость. Однако пони-
жение пластических показателей происходит
в значительно меньшей степени, чем у уг-
леродистых и низколегированных сталей;
эти показатели остаются достаточно высо-
кими, чтобы обеспечить надежную работу
высоколегированных сталей вплоть до са-
мых низких (гелиевых) температур.
С целью экономии дорогостоящего ни-
келя, а также для получения более вы-
соких значений предела текучести в послед-
нее время разработаны новые марки ста-
лей с пониженным содержанием никеля и
увеличенным содержанием марганца, за-
меняющие стали типа 12X18H10T. Среди
них следует отметить стали 03Х20Н16АГ6,
03Х13АГ19 (ЧС36), 07Х16Н6 (СН2А), об-
ладающие высокой прочностью, хорошей
свариваемостью и коррозийной стойкостью.
Данные о механических свойствах вы-
соколегированных сталей прн криотемпера-
турах приведены в табл. 6.3.
Для уменьшения температурных напря-
жений, появляющихся в процессе охлажде-
ния криогенных изделий от нормальной до
рабочей температуры, в ряде случаев при-
меняют специальные железоникелевые
сплавы (инвары) с малым термическим ко-
эффициентом линейного расширения.
В Советском Союзе наибольшее рас-
пространение получил сплав 36НХ, содер-
жащий 35—37% N1, 0,4—0,6% Сг, 0,3—0,6%
Мп, 0,05% С. При температуре 7—300 К
сплав имеет относительно малую прочность
(предел текучести равен примерно 235 МПа),
ио с понижением температуры прочност-
ные характеристики возрастают: при 77 К
предел текучести не ниже 530 МПа, а при
20 К—не ниже 680 МПа. Пластичность
сплава высокая во всем диапазоне темпе-
ратур вплоть до 4 К [184].
Исследования последних лет показыва-
ют, что для изготовления криоаппаратуры
помимо аустенитных сталей могут успешно
применяться более прочные аустенитно-мар-
тенситные и мартенситные стали [182].
6.4. ИЗМЕНЕНИЕ МЕХАНИЧЕСКИХ
СВОЙСТВ ЦВЕТНЫХ МЕТАЛЛОВ
И СПЛАВОВ ПРИ НИЗКИХ
ТЕМПЕРАТУРАХ
В цветных металлах и сплавах с по-
нижением температуры прочностные пока-
затели возрастают. Особенно важно, что
наряду с увеличением пределов прочности,
упругости, твердости и т. п. такие свой-
ства, как пластичность и ударная вязкость,
понижаются в слабой степени, а у неко-
торых металлов даже возрастают.
Свойство цветных металлов и сплавов
сохранять пластичность при низких тем-
пературах определяет самое широкое их
применение в аппаратуре, работающей при
низких и ультранизких температурах.
Изменения показателей механических
свойств некоторых цветных металлов и
сплавов приведены в табл. 6.4 и 6.5.
Ударная вязкость меди, алюминия,
свинца, никеля возрастает при понижении
температуры; при 80 К она в 1,2—1,5 раза
больше, чем при температуре 300 К. Удар-
ная вязкость большинства медных, алюми-
ниевых и никелевых сплавов с понижением
температуры уменьшается,- но в незначи-
тельной для практики степени.
Хорошей прочностью при низких тем-
пературах обладают титановые сплавы, что
в сочетании с их низкой плотностью спо-
собствует расширению их использования в
криогенной технике.
Специально для работы при криотем-
пературах в СССР созданы, титановые спла-
вы серии АТ2.
Механические свойства ряда титановых
сплавов при низких температурах приведе-
ны в табл. 6.6.
Таблица 6.6. Механические свойства
титановых сплавов при низких
температурах [182]
Марка сплава и термообра- ботка Температура испытания,К Временное сопротивле- ние, МПа Предел те- кутестн ~q 2» МПа Относитель- ное удлине- ние а5, % Ударная вяз- кость, кДж / м
ВТ5-1; 293 825 765 20,5 1270
отжиг при 203 960 870 18 1650
8X1 °C 77 1320 1290 18,7 450
2.) 1600 1540 2,4 390
ВТ-14; 293 9:5 900 12,5 1100
отжиг при 77 1410 1410 4,0 825
750 °C 20 1590 1590 1,0 815
АТ2-2; 293 725 705 20,5 1430
отжиг при 203 880 805 18,5 1460
600 °C 77 1155 1070 25,2 1С8Э
20 1420 1230 13,2 990
АТ2-3; 293 805 845 22,5 1135
отжиг при 203 960 880 18,2 785
600 °C 77 1275 1180 19,2 590
20 1530 1400 19,5 590
Влияние низких температур на механические свойства соединений
237
6.5. ВЛИЯНИЕ НИЗКИХ ТЕМПЕРАТУР
НА МЕХАНИЧЕСКИЕ СВОЙСТВА
СВАРНЫХ И ПАЯНЫХ СОЕДИНЕНИЙ
Многочисленные испытания позволяют
сделать заключение, что с понижением тем-
пературы механические свойства сварных
швов изменяются примерно аналогично
свойствам основного металла. Но так как
сварной шов — место концентрации напря-
жений и загрязнений, то обычно хрупкое
состояние наступает в шве (или в зоне
термического влияния) раньше, чем в ос-
новном металле.
Сварные швы углеродистых сталей
утрачивают пластичность и становятся
хрупкими при температуре 230—220 К, швы
низколегированных сталей — при темпера-
туре ниже 200 К. Сварные соединения вы-
соколегированных сталей аустенитного клас-
са и большинства цветных металлов меиее
чувствительны к понижению температуры и
остаются достаточно пластичными до очень
низких (гелиевых) температур.
Для повышения пластичных показате-
лей при низких температурах сварных из-
делий из углеродистых и малолегированных
сталей рекомендуется применять в каче-
стве наплавляемого металла высоколегиро-
ванные стали аустенитного класса. Так, на-
пример, при сварке стали 06НЗ электрода-
ми ЗИО-8 (25% Сг и 13% Ni) сварной шов
имеет при 90 К ударную вязкость 500—
880 кДж/м2, а основной металл — 360—
640 кДж/м2 [185].
При автоматической сварке под слоем
флюса с применением сварочной проволо-
ки ЭП-690 сварное соединение имеет при
температуре 'А-300 К временное сопро-
тивление <тв>625 МПа и ударную вязкость
ан>1760 кДж/м2; при 77 К—°в =
= 1170 МПа, ан=490 кДж/м2; при 4 К —
о-в=1390 МПа, ан = 392 кДж/м2 [184].
Термообработка сварных изделий суще-
ственно улучшает работоспособность кон-
струкции при пониженных температурах,
смещая порог хладноломкости в сторону
более низких температур.
Механические показатели сварных со-
единений различных металлов и сплавов при
низких температурах см. в [181, 185].
Наряду со сваркой в изделиях, предна-
значенных для работы при низких темпе-
ратурах, широко применяются паяные со-
единения. В табл. 6.7 и 6.8 приведены ме-
ханические показатели наиболее распро-
страненных припоев и некоторых паяных
соединений при низких температурах.
Прочность оловяиио-свинцовых припо-
ев возрастает с понижением температуры,
но одновременно уменьшается их пластич-
ность из-за фазового превращения олова.
Припои с повышенным содержанием свинца
имеют более высокие значения ударной
вязкости и поэтому более надежны при
низких температурах.
I аблица 6.7. Механические свойства
олова, свинца и некоторых припоев при
низких температурах [203]
Металл Температура, К Предел прочно- сти при растя- жении, МПа Относительное удлинение, % Ударная вязкость, кДж/м2
Олово (99,74 %) 290 35,3 29 0 630
77 69,5 4 0 29,4 (90 К)
20 72,5 0,6 —
Свинец 290 27,4 26 245
(99,98 »/0) 77 44 34 372 (93 К)
20 69,6 36 —
Припой ПОС-40 293 55 50 460
77 132 2 78,5
Припой ПОС-30 293 48 32 362
77 118 2 118
Припой ПОС-18 293 41 10 235
77 109 2 147
Припой ПСр-45 293 42 3 29 —
[186] 77 510 21 —
20 523 9 —
Припой медно- 330 473 47 —
ЦИНКОВЫЙ 77 630 24 —
(50 % Сн+ +50 °/о Zn) [181] 4,2 705 21
Таблица 6.8. Предел прочности на
разрыв соединений, паяных внахлестку
]203], МПа
Марка припоя и материа- ла спаиваемых образцов Температура, К
29; 90 77
ПОС-40, медь М3 26,5 32,4 34,4
латунь Л62 21,6 28,4 28,4
сталь 20 27,5 54 59
сталь 12Х18Н9Т 31,5 33,4 29,4
ПОС-ЗО, медь М3 24,5 26,5 33,4
латунь Л62 22,5 24,5 31,4
сталь 20 35 55 66,5
сталь 12Х18Н9Т 31,4 37,2 41
ПОС-18, медь М3 19,6 27,4 32,4
латунь Л62 17,6 26,5 28,4
сталь 20 31,4 70 69,5
сталь 12Х18Н9Т 25,5 50 44
Многолетний опыт эксплуатации ожи-
жителей воздуха, водорода и гелия пока-
зывает, что соединения, выполненные как
легкоплавкими (оловянно-свиицовыми), так
и тугоплавким (медно-цинковыми или се-
Таблица 6.9. Основные припои, применяемые при изготовлении криогенной аппаратуры
Марка припоя Химический состав (осно-’ные компоненты), % Температура плавления, °C Механические свойства при 20 °C Удельное электросо- противление, Ом-мм2/м Примерное назначение
Соли- дус Лик- видус •- Времен- ное со- против- ление разрыву, МПа Относи- тельное удлине- ние, % Ударная вязкость, кДж/м2
Припои оловянно-свинцовые по ГОСТ 21939-76
ПОС 61 Sn 59-51 Sb Pb ос- 183 190 4? 46 382 0,139 Пайка меди, латуни, стали;
ПОССу 61-0,5 59—61 0,05—0,5 таль- 183 189 44 35 362 0,140 лужение
ПОССу 50-0,5 49—51 0,05—0,5 ное 189 216 36 62 432 0,149 Пайка радиаторов, сосудов, узлэв водородных и гелиевых ожижителе й
ПОС 40 39—41 — 183 238 36 52 392 0,159 Пайка и лужение меди, лату-
ПОССу 40-0,5 39—41 0,05—0,5 183 235 39 50 392 0,169 ни, стали, белой жести, сосу-
ПОССу 40-2 39—41 1,5—2,0 185 229 42 49 274 0,172 дов, теплообменни<ов, деталей
ПОССу 30-0,5 ПОССу 30-2 ПОССу 18-0,5 ПОССу 18-2 29—31 29—31 17—18 17-18 0,05—0,5 1,5—2,0 0,05-0,5 1,5—2,0 183 185 183 186 255 250 277 270 35 39 35 35 45 40 50 35 382 245 352 186 0,179 0,182 0,198 0,206 аппаратуры и арматуры
Припои медно-цинковые по ГОСТ 23137-78
ПМЦ-48 46—52 Си; остальное Zn 850 865 2ь6 3 —
ПЛЩ-54 52—56 Си; остальное Zn 876 880 342 20 —
Пайка медных сплавов, брон-
зы, стали, латуни с содержа-
нием меди более 68 %
Пайка стали, меди, латуни
с содержанием меди менее
68 %
38 Механические свойства конструкционных материалов при низких температурах
П родолжение табл.' 6.9
Марка пртоя Химический состав (основные компоненты), % Температ ура плавления, °C Механические свойства при 20 °C Удельное электросо- противление, Ом-мм2 /м Примерное назначение
Соли- дус 'Ликви- дус Временное сопротив- ление разрыву, МПа Относи- тельное удлине- ние, % Уда рн ая вязкость, кДж/м2
Припои серебряные по ГОСТ 19738-74
ПСр-12М 12+0,3 Ag; 52+1 Си; остальное Zn 780 825 17,2 — 0 074 Лужение и пайка латуни, ме- ди, стали с медью и медно-ни- келевыми сплавами
ПСр-25 25+0,3 Ag; 40+1 Си; остальное Zn 745 775 275 — — 0,077
ПСр-45 45+0,5 Ag; 33+0,5 Си; остальное Zn 660 725 295 — — 0,10 Пайка медных и бронзовых частей, ответственных деталей криостатов и ожижителей
Легкоплавкие припои
Легкоплавкий сплав Вуда 50 Bi; 25 Pb; 12,5 Cd; 12,5 Sn 68 — 50 — — — Пайка плотных легкоразбор- ных соединеии.; припайка про- водов, контактов и т. п.
Легкоплавкий сплав 49 Bi; 18 Pb; 21 In; 12 Sn 58 — 62 — —- —
Влияние низких температур на механические свойства соединений
240 Механические свойства конструкционных материалов при низких температурах
ребряными) припоями, достаточно хорошо
работают вплоть до гелиевых температур.
Основные припои, используемые в крио-
генной технике, приведены в табл. 6.9.
6.6. МЕХАНИЧЕСКИЕ СВОЙСТВА
НЕМЕТАЛЛИЧЕСКИХ МАТЕРИАЛОВ
Из неметаллических материалов, при-
меняемых в криогенной технике, наиболь-
шее значение имеют пластмассы.
Важнейшие свойства пластмасс: низкая
плотность (в 5—8 раз меньше, чем у стали
и меди, и в 2 раза меньше, чем у алюми-
ния), сравнительно высокая удельная проч-
ность (иногда выше, чем у металлов), низ-
кая теплопроводность, немагнитность и ра-
диопрозрачность, износоустойчивость и хи-
мическая стойкость, хорошие электроизоля-
ционные и антифрикционные свойства.
По механическим свойствам пластмас-
сы можно условно разделить на три груп-
пы: низкой прочности (с разрушающим на-
пряжением при растяжении ар до 60 МПа),
средней прочности (ир=60ч-100 МПа) и
высокой прочности (сгр>100 МПа). К пер-
вой группе относятся полиэтилен, поливи-
нилхлорид, полистирол, фторопласт, амино-
пласты и др.; ко второй — капрон, тексто-
лит, гетинакс, полиамиды, асботекстолит
и др.; к третьей — стеклопластики, стекло-
волокнит АГ-4С, стеклотекстолит и др.
При понижении температуры у боль-
шинства пластмасс равномерно возрастают
прочность и твердость и равномерно по-
нижаются пластичность и ударная вяз-
кость.
Механические свойства пластмасс с на-
полнителем в значительной степени зависят
от свойств, количества и ориентации во-
локон наполнителя.
Хорошим материалом по хладостойко-
сти служит фторопласт, успешно исполь-
зуемый вплоть до очень низких (гелиевых)
температур.
Текстолит и гетинакс часто применяют
в криогенных устройствах как прокладоч-
ный, теплоизоляционный и малофрикцион-
ный материал. В частности, из текстолита
изготовляют уплотнительные кольца порш-
ней гелиевых детандеров, работающих без
смазки при температурах 15—30 К.
Весьма перспективными материалами
для криогенной техники могут быть стек-
лопластики, которые по прочности прибли-
жаются к сталям.
Механические свойства некоторых пла-
стмасс при низких температурах приведены
в табл. 6.10 и 6.11.
Т а 5 л и на 6.1 л. Влияние низких
температур на предел прочности и
ударную вязкость слоистых пластиков [187)
Материал, марка 1 Температура испыта- ! н ий, К Предел прочности прн растяжении (вдоль волокон), МПа Предел прочности при сжатии, МПа Ударная вязкость, кДж/м2
Текстолит ПТ 293 85 167 28,4
77 106 310* 14,7*
Гетинакс В 293 74 142 26,8
77 86 328* 18,1*
Стерло осохнит 293 535 380 174
АГ-4С (©uffonar разле нныГ) 77 910 715 326
Ст ‘';.ог'оло::1 ит 293 372 262 143
АГ-4С (Тавнопро 'ны‘) 77 570 580 147
Сте <лотс кстолнт 293 144 78 146
ПН-1 77 256* 176 172
Стеклотекстолит 293 100 52 79
ФЛ-1 77 164 126 80
* При температуре 90 К.
Таблица 6.11. Механические свойства
некоторых пластмасс при низких
температурах [51]
6
О и
<u ?8 Е
Пластик г, к ffi ч >;
® Й ш ф S ¥
рем рот азрЕ tt ‘ о g
Й E О. 8 о
Фторопласт-4 295 1,4 420
(политетрафторэтилен) 153 56 .38 ли
77 It 5 518 •
2 ) 175* —
4 19 * 7и0(»
Полиэтилен 300 9,1 14 >
4 17,5* —
Поливинилхлорид 293 54 3700
77 138 7750
Нейлон 293 66 3000
153 170 5250
77 195 7700
Майлар ЗлД 147 7100
(полиэтиленфталат) 77 217 130
* Предел текучести при сжатии.
Газонаполненная теплоизоляция, находящаяся под атмосферным: давлением 241
Раздел седьмой
НИЗКОТЕМПЕРАТУРНАЯ ТЕПЛОИЗОЛЯЦИЯ
7.1. ГАЗОНАПОЛНЕННАЯ
ТЕПЛОИЗОЛЯЦИЯ, НАХОДЯЩАЯСЯ
ПОД АТМОСФЕРНЫМ ДАВЛЕНИЕМ
Теплоизоляционные устройства служат
обязательными составными элементами низ-
котемпературных установок. Их назначе-
ние — сводить к минимуму подвод теплоты
конвекцией, теплопроводностью остаточных
газов, лучеиспусканием и теплопроводно-
стью через конструктивные связи.
Газонаполненная теплоизоляция, нахо-
дящаяся обычно под атмосферным давле-
нием, предотвращает конвективный тепло-
обмен газа (воздуха) с внутренними холод-
ными поверхностями аппаратуры и частич-
но защищает их от лучеиспускания. С этой
целью изоляционное пространство запол-
няют мелковолокнистым порошкообразным
или ячеистым изоляционным материалом,
имеющим большое количество газовых по-
лостей очень малого размера. Относительно
небольшая теплопроводность таких мате-
риалов определяется малой теплопроводно-
стью как газа, заполняющего поры, так и
структурного материала. У волокнистых и
порошкообразных материалов имеются,
кроме того, значительные контактные тер-
мические сопротивления между волокнами
или крупинками.
Характеристики волокнистых и порош-
кообразных теплоизоляционных материалов^
приведены в табл. 7.1 и 7.2. В технике
низких температур наибольшее распро-
странение получили минеральная вата, ми-
пора, аэрогель. В табл. 7.2 приведены так-
же теплофизические характеристики мате-
риалов, которые могут входить в конструк-
тивные элементы теплоизоляции или
использоваться в холодильных установках..
Если температура хотя бы отдельных
частей установки ниже температуры кон-
денсации воздуха (сжижение азота, неона,,
водорода, гелия), то теплоизоляцию необ-
ходимо заполнить каким-либо неконденси-
рующимся при этой температуре газом.
Теплопроводность такой изоляции изменит-
ся по сравнению с теплопроводностью изо-
ляции, заполненной воздухом, приблизи-
тельно пропорционально отношению значе-
ний теплопроводности соответствующих га-
зов (табл. 7.3).
Теплопроводность волокнистых и по-
рошкообразных теплоизоляционных мате-
риалов (рис. 7.1 и 7.2) уменьшается с по-
нижением температуры (обычно линейно),
и объемной массы. Уменьшение размера
частиц при постоянной объемной плотности
также снижает теплопроводность изоляции.
Например, использование перлита с части-
цами размером 0,1 вместо 1 мм снижает
Таблица 7.1. Основныг технические показатели наиболее употребляемых
волокнистых и порошковых теплоизоляционных материалов, заполненных воздухом
под атмосферным давлении [150, 584]
Материал ГОСТ или ТУ Объемная плот- ность, кг/м3 Теплопроводное ть, Вт/(м-К) Удельная теп- лоемкость, кДж/(кг-К)
Температур за, К
190 293 190 293
Аэрогель кремние- вой кислоты МРТУ 6-G2-265-63 20—40 0,019—0,020 — 0,71 0,96
Вата минеральная (шлаковая вата) ГОСТ 4640-61 100—150 при нагрузке 0,002 МПа 0,03—0,04 — 0,59 0,75
Маты из минераль- ной ваты ГОСТ 9573-60 75—100 — 0,054 — —
Минеральный вой- лок ГОСТ 6125-61 100 — 0,047 — —
Стеклянная вата (диаметр волок- на не более 21 мкм) ГОСТ 5174-49 130 при на- грузке 0,002 МПа — 0,047 0,71 0,88
Перлитовый поро- шок МРТУ [6 № ЕУ-231-62 100 0,03 — — —
Минора ТУ МХП 3258-52 40—50 0,023 0,03 1,26 1,42
16-218
242
Низкотемпературная теплоизоляция
теплопроводность изоляции в 1,5 раза
.[903]. Небольшое увлажнение (около 1—
2 % по объему) мало сказывается на теп-
. лопроводностн изоляции; увлажнение до
10 % по объему увеличивает теплопровод-
ность в 2—2,5 раза [584]. Волокнистые и
.порошкообразные теплоизоляционные мате-
риалы дают значительную усадку при виб-
.рации и под внешним давлением, поэтому
.нуждаются в предварительном уплотнении
.зо время теплоизоляционных работ. Ячеи-
стые материалы удобны для использования
блоками. В отдельных случаях они совме-
щают функции теплоизоляционного и кон-
структивного материала, например при
изготовлении небольших сосудов для жид-
кого азота или теплоизоляционного покры-
тия для кратковременно действующих тру-
бопроводов. Наиболее распространенным
отечественным ячеистым материалом слу-
жит пенополистирол, характеризуемый за-
мкнутыми порами. При вспенивании этого
Таблица 7.2. Теплофизические характеристики некоторых материалов
[138, 140, 584, 746, 92с]
'Наименование материалов Темпера- тура, К Объемная плот- ность, кг/м8 Теплопро- водность, Вт/(м-К) Удельная теплоем- кость, кДж/(кг-К) Темпера- туропро- водность а, 1 0® м2/с Влаж- ность, %
.Асбобакелит] 293 156 0J 71 1,17 3,88
. Афальт 293 2110 0,70 2,09 1,58
Асбест листовой 293 770 0,12 0,82 1,98
Асбест прессованный 288 1240 0,26 — — —
Асбест волокнистый 73 702 0,156 0,84 — —
(плотнонабитый)
Асбест волокнистый 73 470 0,183 — —
То же 273 470 0,0153 — —
.Асбестовый шнур 273 130 0,164 — —
.Бакелит 293 1270 0,27 — —
Бакелитовый лак 293 1400 0,29 — —
Битум 293 1000 0,49 — —
Бумажная изоляция 353 121—230 0,058 — —- —
'Войлок шерстяной — 200—300 0,058 — — —
.Войлок бумажный —- 300 0,158 — — —
.Винидур 298 — 0,093 3,35—7,12 — —
Воск 293 960 0,087 ——
Грунт песчаный мелко- 273 1430 0,18 0,67 1,97 0,24
зернистый
То же 250 2000 2,9 1 ол 15,0 25
293 2000 2,24 1,55 7,27 25
Грунт (глина) 291 2160 1,38 1,30 4,91 17,5
То же 291 1500 0,186 0,71 1,78 0,0
248 2160 1,91 0,92 9,33 17,5
Древесные опилки 303 250 лл93 2,51 1,47 —
Доломит —. 2600 1 ,72 0,92 0,97
Древесноволокнистые — 150 0,158 2,51 1,55 —
плиты
То же — 250 0 676 2,51 1,19
— 600 0,163 2,51 1,0-8
Древесный уголь 273—373 200 0,164 0,84 —. —
Дубовая пластина:
сухая перпендику- 293 825 0,21 — — —
лярно волокну
сухая параллельно 293 825 0,43 — —. —
волокну
Известняки тяжелые — 2000 1,16 0,92 6,3
Известняк-ракушечник — 1400 0,64 0,92 4,97
|.Известковый туф — 1300 0,52 0,92 4,36
Картон плотный — 1000 0,23 1,46 1,58
Картон обыкновенный — 700 0,17 1,46 1,69
Каучук синтетический — 1600 0,21 1,56 0,86
Кожа (подошвенная) — 1000 0,16 1,42 1,14
Кокс (порошкообразный) 373 450 0,191 1,21 3,5 —
Газонаполненная теплоизоляция, находящаяся под атмосферным давлением 243
Продолжение табл. 7.2
Наименование материалов Темпера- тура, К Объемная плот- ность, кг/м* Теплопро- водность, Вт/(м-К) Удельная теплоем- кость, кДж/(к г-К) Темпера- туропро- водность а, 103 м2/с Влаж- ность, %
Каменный уголь Кирпич строительный: 293 1400 0,186 1,39 1,03 —
диатомитовый 373 700 0,192 0,84 3,19 5,05 4,19 5,1
красный 273 1700 0,76 0'88
красный пористый 273 1200 0,44 О', 88
силикатный 273 1900 0,81 0,84 0,88
Кизельгур рыхлый Кремне гель 293 19Э 350 100—150 0^065 0,035—0 041 —
Кремнезем (порошок) 73 54 0 0122
Лед Линолеум Парафин 273 273 920 1100 920 2,26 0,19 0,29 1,88 10,8 0,89 —
Пемза изолировочная —_ 630 0,16 0,043 2,1—2,9 1,17
Пластмасса полихлорви- ниловая 293 59 7,42 Сухая.
Пластмасса полистироло- вая 293 33 0,041 1,17 9,55 —
Пенобетон 260 520 0,26 1,38 3,58 77,5» 1,5.
Пергамин Резина Резина пористая 293 . 293 360 600 1580 400 0,095 0,17 0,146 0 049 0,79 1,46 3,39 1,97
То же Снег То же 293 160 100 500 0'050 0,17 2,30 __ —
Слюдоит Сосна сухая 298 83 900 300 0,142 0 14 7,95 1,55 — —
Сосна сухая: —• —
и рпендикулярно во- локну 273—323 550 0,14—0,16 2,72 — —
параллельно волокну Стеклянная вата Стекловолокнистые маты А СИМ 273—323 190 293 550 50—60 100—110 0,23—0,35 0,023 0,052 0,71 —
То же АТИМСС 293 25 0,042 0 108 0 С9 0,069 0,058 0,30 0,29 0,23—0,34 0,038 0,026
Слюдяная кропйка 278 355 — — —
Торфяные плиты Торф кусковой Торф измельченный Торф фрезерный 260 293 293 298 180 245 200 700 1,89 1,76 1,51 2,93 3,01 1,51 1,67 2 30 2,94 1,62 1,99 35,9“ Сухой
Торф брикетированный Текстолит Шерсть овечья Шелк 283 293 273 73 810 1350 136 100 1,48 1,2 1,47 35,4- 58,3-
173 100 0,037
Шелковый жгут Шлак доменный пористый 273 323 298—398 100 147 360 0,50 0,054 0 11 0,23 0,87 0,93 1,05 0,48 0,35 0,87 0,066 0,16 0,75 —
Штукатурка гипсовая 1000 — -—
Штукат рка известковая 1600 1,00 2,3 Сухая,-
Штукатурка цементная Фарфор Фибра красная 873 293—373 1800 1500 1290 0,84 0,84 1,05 6,5 6,17 —
Цемент портландский 363 1700 1,13 1,28 1,42 —. —
Эмаль силикатная Эбонит микропористый Эбонит 293 293 610 589 1200 0,94 —
16*
244
Низкотемпературная теплоизоляция
Рис. 7.1. Зависимость теплопроводности
волокнистых изоляционных материалов от
температуры [584]:
1 — хлопковая вата (р—81 кг/м3); 2 — минераль-
ная вата (р=400 кг/м3); 3 — минеральная вата
(р=260 кг/м3); 4—стеклянная вата (р = 50 кг/м3);
5 —хлопковая вата (р—42 кг/м3); 6 — шелковые
очесы (р=58 кг/м3); 7 — минеральная вата (р=
=95 кг/м3)
Таблица 7.3. Зависимость
теплопроводности пористых
материалов от рода заполняющего
газа [908]
Заполняющий газ Средняя теплопроводность в интервале 304—76 К, Вт/(м-К)
{давление 837 гПа) Снликоаэро- гель Перлит
Азот N2 Гелий Не Водород Н2 0,0195 0,0620 0,800 0,0354 0,135 0,145
материала в порах остаются легко конден-
сируемые газы — изопентан, аммиак, фреои,
Диоксид углерода и др. Охлаждение до
низких температур вызывает конденсацию
газа в порах с образованием вакуума
улучшающего теплоизоляционные свойства
пенопласта [138, 924J.
В табл. 7.2, 7.4 и на рис. 7.3 приведе-
Таблица 7.4. Механические
свойства пенопластов [138]
Показатель Марка пенопласта
ПС-1-120 | ПХВ-1-200
Удельная плотность, кг/м3 Предел прочности, МПа: 120 200
при растяже- нии 2,07 4,14
при статичес- ком изгибе 4,14 —
при динамичес- ком изгибе 0,11 0,13
Предел текучести при сжатии, МПа 1,96 1,80
Модуль упругости при сжатии, МПа 53,9 65,5
Рабочая температу- ра, °с До 69° С До 60°С
Горючесть Горит Гаснет пос- ле удаления источника пламени
ны характеристики некоторых пеноматериа-
лов. Для низких температур рекомендуется
пенополистирол ПС-4. Склейку деталей из
него можно производить раствором самого
Рис. 7.2. Зависимость теплопроводности
порошкообразных изоляционных материа-
лов от температуры [584]:
7 —вермикулит (р=216 кг/м3); 2 — диатомит
(р—272 кг/м3); 3 — перлит (р—210 кг/м3); 4 —
магнезия (р=131 кг/м3); 5—пробка гранулиро-
ванная (р=101 кг/м3); 6 — перлит (р=45 кг/м3);
7 —пробка гранулированная (р=70 кг/м3); 8 —
аэрогель (р=100 кг/м3)
Рис. 7.3. Зависимость теплопроводности
ячеистых изоляционных материалов от
температуры [584]:
/ — пеностекло (р=170-ь200 кг/м3); 2 — пенополи-
вниилхлорнд (р= 190-5-200 кг/м3); 3 — пробка (р»
= 195 кг/м3); 4 — пробка (р=140 кг/м3); 5 — пе-
нополистирол (р=30-е50 кг/м3); 6 — мипора (р=
=20-?-50 кг/м3); 7 — вспученный эбонит (р=
=64 кг/м3)
Газонаполненная теплоизоляция, находящаяся под атмосферным, давлением 245
пенопласта в дихлорэтане или клеями
ВИАМ ВЗ, МК-2 [138J.
Пенополистирол и пенополиуретан
можно вспенивать непосредственно в теп-
лоизоляционном пространстве аппарата.
Для этого пространство заполняется грану-
лами пенополистирола или жидкой поли-
уретановой композицией и затем прогрева-
ется [584J. Теплопроводность пенопластов
значительно выше, чем вакуумно-порошко-
вых и многослойных изоляций (см. табл. 7.7
и 7.8). Пенопласты обладают высоким ко-
эффициентом термического расширения, ко-
торый в несколько раз выше, чем у метал-
лов (табл. 7.5). Поэтому во избежание
разрыва пенопласта при охлаждении в теп-
лоизоляционные сосуды, выполненные из
этого материала, не следует плотно встав-
лять металлические оболочки. Длительное
пребывание пенопласта в газовой среде
ухудшает его изоляционные качества
Таблица 7.5. Температурный
коэффициент линейного расширения
теплоизоляционных материалов
прн низких температурах [584]
Материал Плотность, кг/м8 Температура (сред- няя или интервал), К Температурный коэф- фициент линейного расширения 10е, 1/К
Пробковая плита 110 317 81
по 247 59
по 194 47
Мат из минералы 229 319 15,5
ной ваты 229 247 8,8
— 192 4,0
Мат из стеклово- 176 245 6,5
локна То же 176 191 7,7
Пеностекло 170 315 10,8
170 247 7,6
170 193 6,5
Вспученная резина 78 247 48,6
То же 78 193 43,2
Вспученный эбоиит 64 323-148 59,8
Пе нополивинилхло - рид: жесткий 40—88 293—80 45
эластичный 75-150 293—80 81
Пенополистирол 12—20 293—83 79
24,3 288—193 70
24,3 193—123 76
37,5 288—193 57
37,5 193—123 57
Пенополиуретан 34—58 293—80 77
эластичный Пенополиуретан 80 300 123
80 77 50
80 300—77 71
вследствие диффузии неконденсирующегося
газа в поры. Например, воздух, накапли-
вающийся вследствие диффузии в порах,
может разрушить их структуру и создать
взрывоопасные условия. Шарики из пено-
пласта, плавающие на поверхности низко-
температурной жидкости в открытых сосу-
дах Дьюара, уменьшают теплоприток к ней.
Уменьшение размера пор и понижение тем-
пературы снижает теплопроводность пено-
пластов (рис. 7.3). Иногда для защиты от
воздуха пенопластовая изоляция продува-
ется гелием, тогда ее теплопроводность
приближается к теплопроводности гелия.
Для увеличения прочности пенопластовую
изоляцию выполняют в виде сот, склеенных
из отдельных кусков, или в виде ячеистой
стекловолокнистой ткани, пропитанной по-
лиамидными смолами [354]. Применяется
также двухслойная изоляция — внешний
слой продувается гелием, внутренний слой,
отделенный от внешнего алюминиевой фоль-
гой, оказывается под вакуумом в результа-
те конденсации заполняющего газа при
охлаждении [906].
Расчет теплопритока через слой тепло-
изоляции ведется по обычным уравнениям
теплопередачи, в которых используется
средняя теплопроводность изоляции в дан-
ном интервале температур. При относи-
тельно малой толщине вычисление тепло-
притока через слой изоляции произвольной
формы можно проводить по уравнению,
полученному для сферических поверхно-
стей:
<2 = -^(Г2-7’1)’ЛАЛ- (7.1)
где Ai и Аг — площади внутренней и внеш-
ней поверхностей.
В практике кислородного машинострое-
ния принято выбирать толщину слоя изо-
ляции от 200 до 600 мм. Для изоляции
криогенных установок расходуется значи-
тельное количество теплоизоляционных ма-
териалов. Например, расход шлаковой ва-
ты на заполнение установки Бр-2 произво-
дительностью 35 000 м3/ч кислорода со-
ставляет 540 т [584]. Теплоприток через
теплоизоляцию крупных воздухораздели-
тельных установок, таких как Бр-2, состав-
ляет 35—45 Вт на 1 м2 поверхности изо-
ляционного кожуха [584]. Для составле-
ния энергетических балансов воздухоразде-
лительных установок общий теплоприток
из окружающей среды принимают [907]:
Теплоприток, кДж
Количество разделяемого на 1 м3 разделяемого
воздуха, м3/ч воздуха
180....................... 12,6
800 ....................... 8,4
1500 . .............. 6 3
6000 . .............. 5 4
30 000 ........ . 4,6
75 000 ................... 4,2
200 000 .................... 3,4
246
Низкотемпературная теплоизоляция
При конструировании низкотемператур-
ных устройств нужно знать температурный
коэффициент линейного расширения тепло-
изоляционных материалов (см. табл. 7.5).
Если он не известен, можно использовать
коэффициент линейного расширения соб-
ственно вещества теплоизоляции.
Более подробно (в табличной форме)
о теплопроводности пенопластов см.
в [746J.
7.2. ВЫСОКОВАКУУМНАЯ
ТЕПЛОИЗОЛЯЦИЯ
В изоляции этого типа конвективный
теплообмен устраняют вакуумированием.
Теплопередача происходит только луче-
испусканием и теплопроводностью остаточ-
ных газов. Чтобы уменьшить тепловое
излучение, поверхности полируют и делают
из материалов с малым коэффициентом теп-
лового излучения. Для еще большего умень-
шения притока теплоты лучеиспусканием
применяют экраны. В установках для сжи-
жения водорода и гелия, а также в сосу-
дах Дьюара для их хранения экранирова-
ние часто осуществляют поверхностями,
охлаждаемыми жидким азотом. Приток
теплоты лучеиспусканием пропорционален
четвертой степени температуры, поэтому
охлаждение экрана жидким азотом сни-
жает теплоприток примерно в 150—200 раз.
В танках, криостатах и сосудах Дьюара
охлаждение экрана осуществляют также
парами криоагента, находящегося в сосу-
де [51J, что упрощает его конструкцию.
Применяют также экранирование «плаваю-
щими» подвешенными экранами, очень сла-
бо контактирующими со смежными оболоч-
ками. Введение одного экрана с тем же
коэффициентом теплового излучения, что и
у стенок, снижает теплоприток вдвое, двух
экранов — втрое и т. п., а введение п экра-
нов— в п-)-1 раз. Экранированию жидким
азотом соответствует 150—200 «плаваю-
щих» экранов. Конструктивно такую тепло-
изоляцию можно осуществить, окружая
низкотемпературные части пакетом из мно-
гих слоев гофрированной алюминиевой
фольги (см. § 7.4).
Количество теплоты, передаваемой лу-
чеиспусканием,
Q=e„C-1О-«(7’24-7’14)41, (7.2)
где Sn — приведенный коэффициент тепло-
вого излучения; С=5,77 Вт/(м2-К)—по-
стоянная излучения для абсолютно черного
тела; 41 —площадь поверхности. В боль-
шинстве случаев значением можно пре-
небречь по сравнению с Т/.
В зависимости от расположения по-
верхностей и типа излучения приведенный
коэффициент теплового излучения опреде-
ляется следующими соотношениями [51]:
Зеркальное Диффузное
отражение отражение
__ & 1 So 8 1 $0
Параллельные пластины----------- —--------------
е2+(]—s2) si + (I—еа)81
£ 1S 2 S 1- 0
Длинные коаксиальные------------ —--------------
цилиндры..........s2 + (I—S2)®1 ,
£2 + (i—s2) —h'
4a
Концентрические сферы —--------- ---------------
Ё2 + (1-S2)S1 ... 4j
--S2) -
A,
Индекс 1 относится к внутренней поверх-
ности. Следует учесть, что загрязнение по-
верхностей и обработка их, сопровождаю-
щаяся упрочнением верхнего слоя металла,,
например механическое полирование, уве-
личивают степень черноты поверхностей
[909].
Приток теплоты вследствие теплопро-
водности остаточных газов не зависит от
давления при относительно грубом вакууме-
(длина свободного пробега молекул мень-
ше расстояния между стенками), так как
с понижением давления уменьшается коли-
чество молекул — переносчиков теплоты, но.
увеличивается длина их пробега. Если дли-
на свободного пробега молекул (см.
табл. 2.1) становится больше расстояния
между стенками, теплопроводность остаточ-
ными газами становится пропорциональна
значению давления и для цилиндрических
сосудов может быть вычислена [51] по>
Уравнению
(7-3>
где Q — количество теплоты, передаваемой
теплопроводностью за 1 с, Вт; А\— по-
верхность внутреннего сосуда, м2; Д2 —
площадь поверхности внешнего сосуда, м2;.
а — коэффициент аккомодации; к—Ср/С,:—
показатель адиабаты; р — давление в сосу-
де, гПа, измеряемое манометром, имеющим
температуру Т, К; М — молекулярная мас-
са. Индекс 2 относится к внешней, «теп-
лой» поверхности, индекс 1—к внутренней.
Коэффициент аккомодации а показы-
вает степень установления температурного
равновесия между стенкой и газом.
В табл. 7.6 приведены значения коэффици-
ентов аккомодации для различных газов и
значений температуры. Коэффициент акко-
модации зависит также от материала и ка-
чества поверхностей, однако эта зависи-
мость выявлена плохо. Высоковакуумная
изоляция дает хорошие результаты при
остаточном давлении, не превышающем
3-10~5 гПа.
Для поддержания высокого вакуума
Вакуумно-порошковая изоляция
247
Таблица 7.6. Коэффициенты
аккомодации
Т, к Не Н2 Воздух
Ориентировочные значения [910]
ЗОЭ 0,3 0,3 0,8—0,9
77 0,6 0,5 1
2J 0,6 1 1
Для поверхности промышленной-
меди [9/6]
243 0,407 0,760 0,698
77,4 0,564 0,799 0,823
приходится использовать достаточно мощ-
ные вакуумные системы и иметь тщательно
герметизированную аппаратуру. Требования
к герметичности особенно жестки в отно-
шении частей установок, содержащих хо-
лодный или сжиженный криоагент, так как
утечка через неплотности аппаратуры воз-
растает при увеличении плотности газов.
Теплоприток через высоковакуумную
изоляцию вычисляют как сумму количеств
теплоты, передаваемой лучеиспусканием
(уравнение (7.2)] и теплопроводностью
остаточных газов [уравнение (7.3)].
7.3. ВАКУУМНО-ПОРОШКОВАЯ
ИЗОЛЯЦИЯ
Хорошие качества изоляции этого типа
обеспечивают удалением газа из пустот и
пор до вакуума, при котором длина сво-
бодного пробега молекул превышает раз-
меры пор. Обычно бывает достаточно оста-
точного давления 10-1—10~2 гПа, которое
обеспечивается откачкой одним механиче-
ским вакуумным насосом. Характер изме-
нения теплопроводности различных видов
теплоизоляционных материалов в зависи-
мости от глубины вакуума показан на
рис. 7.4. Лучшими материалами являются
аэрогель, кремнегель, мипора и перлит.
Кремнегель дешевле аэрогеля и менее гид-
рофобен, однако имеет большую насыпную
массу, а следовательно, требует больших
затрат времени и холода на первоначаль-
ное охлаждение. Мипора обладает малой
насыпной массой, но в некоторых случаях,
например при хранении жидкого кислоро-
да, неудобна из-за своей горючести. Через
вакуумно-порошковую изоляцию теплота
передается не столько теплопроводностью,
сколько лучеиспусканием, так как изоляция
в значительной мере прозрачна для инфра-
красного излучения. В связи с этим чрез-
мерное уменьшение плотности изоляции мо-
жет вызвать увеличение ее теплопроводно-
сти (рис. 7.5). Чтобы снизить «прозрач-
ность», теплоизоляционный материал сме-
Рис. 7.4. Кажущаяся средняя теплопроводность некоторых отечест-
венных вакуумно-порошковых теплоизоляционных материалов в интер-
вале температур 78—290 К [149] (толщина слоя — от 9 до 72 мм, ко-
эффициент теплового излучения поверхностей не известен):
/ — магнезия; 2 — минеральная вата; 3 —перлит; 4 — крупноволокнистая стек-
лянная вата (диаметр волокон 18—20 мкм); 5 — тонковолокнистая стеклянная
вата (диаметр волокон 5—7 мкм); 6 — кремнегель; 7 — мипора; 8 — силикоаэро-
гель
248
пизкотемпературная теплоизоляция
Рис. 7.5. Зависимость теплопроводности
вакуумно-порошковых материалов от плот-
ности. Граничные температуры 90 и
293 К [584]:
/—аэрогель; 2 — перлит; 3— милора; 4 — стек-
лянная вата (диаметр волокон 1,15 мкм)
шивают с металлическими порошками или
кусочками фольги. На рис. 7.6 показана
зависимость теплопроводности вакуумно-
порошковых изоляций от количества при-
мешиваемого металлического порошка. Вы-
годно брать наименьшее, но дающее замет-
ный эффект количество порошка, так как
добавление его увеличивает теплоемкость,
плотность и стоимость изоляции. Использо-
Рис. 7.6. Зависимость теплопроводности
вакуумно-порошковых теплоизоляционных
материалов от количества металлического
отражателя (ориентировочно при давле-
нии 10~2 гПа):
/ — силикатный аэрогель с алюминиевыми че-
шуйками [910]; 2— перлит с алюминиевым по-
рошком SOC-30 (30 меш.) [910]; 3— силикатный
аэрогель с алюминиевым порошком [910] (для
материалов 1—3 коэффициент теплового излуче-
ния стенок равен 0,86); 4 — силикатный аэрогель
Santocel с медным порошком 1915]; 5—силикат-
ный аэрогель 'Santocel с алюминиевым порош-
ком [915]
вание порошка алюминия ограничивается-
его горючестью и тем, что он покрывается
слоем окиси, ухудшающей отражательную-
способность.
Тепловой расчет вакуумно-порошковой-
изоляции ведут по средней кажущейся теп-
лопроводности в заданных условиях темпе-
ратуры, давления, толщины изоляции и пр.,
используя опытные данные (рис. 7.4 и 7.6,.
табл. 7.7).
Новый, перспективный вариант рассмат-
риваемого типа изоляции-—микросферная-
изоляция, состоящая из полых стеклянных
шариков диаметром от 15 до 150 мкм
с толщиной стенки от 0,5 до 2 мкм [397,
923, 655]. Шарики (все или часть их) по-
крыты отражающей алюминиевой пленкой
толщиной от 0,5 до 1,5 мкм. Насыпная мас-
са такой изоляции — от 60 до 230 кг/м3.
Пространство внутри шариков заполнено
газом под пониженным давлением (напри-
мер, SO2 при давлении 0,03 МПа). Терми-
ческое сопротивление изоляции определяет-
ся в основном теплопроводностью через
контакты, мало зависит от теплопередачи
радиацией и, следовательно, слабо зависит
от температуры. При средней температуре
около 200 К эффективная теплопроводность
составляет 0,5—0,7 мВт/(м-К). Эффектив-
ная теплопроводность смеси алюминиевых и-
неметаллизированных шариков минимальна
при составе 50 % каждого компонента
[655]. Механическая прочность изоляции —
не ниже 1 МПа. Прорабатывается приме-
нение микросферной изоляции для топлив-
ных криобаков по программе Шаттл [397].
У сосудов делают гибкую внешнюю оболоч-
ку, создающую на земле атмосферное дав-
ление на изоляцию и распрямляющуюся
в космическом вакууме, в результате чего,
снижается теплоприток.
7.4. МНОГОСЛОЙНАЯ
ЭКРАННО-ВАКУУМНАЯ ИЗОЛЯЦИЯ
В изоляции этого типа теплоприток лу-
чеиспусканием уменьшают посредством,
большого количества экранов из металли-
ческой фольги или металлизированных по-
лимерных пленок. Фольгу и металлизиро-
ванный слой обычно выполняют из алюми-
ния. С целью уменьшения теплопроводно-
сти материала изоляции отражающие слои
разделяют прокладками. Лучший прокла-
дочный материал — стеклобумага. Приме-
няют также полимерные сетки. Уменьшение
толщины волокна и редкая сетчатая струк-
тура снижают поглощение энергии тепло-
вого излучения, контактную проводимость
и массу изоляции, тем самым повышая ее
эффективность (табл. 7.8). В качестве ра-
диационных экранов иногда используют
мятую или гофрированную пленку без про-
кладок. Такая изоляция обладает теплопро-
водностью в 2—3 раза большей, чем алю-
миниевая фольга со стеклянной бумагой
Многослойная экранно-вакуумная изоляция
249
Таблица 1Л. Теплопроводность вакуумированных зернистых
и волокнистых материалов при температурах граничных поверхностей
90 и 293 К [584]
Материал Средний размер ча- стиц, мм Удельная площадь поверхности, м2/г Плотность, кг/м8 Теплопроводность X, мВт/(м«К), при давлении
1,3-Ю"3 гПа 0,13 гПа
Аэрогель кремниевой кисло-
ты, полученный: автоклавным способом <0,25 200 120 1,5 2,3
безавтоклавным способом <0,25 200 140 1,4 2,7
непрерывным способом Белая ража: <0,25 200 НО 1,4 2,1
БС-50 0,002 50 250 2,1 —
БС-280 0,005 280 180 1,5 1,7
БС-280 0,011 280 170 0,9 —
БС-230 0,014 230 200 0,8 1,6
Кремнегель <0,05 30 100 1,5 2,7
Силикагель КСМ <0,2 600 460 1,4 —
3,5 600 480 6,9 —
Диатомит <0,25 40 250 1,7 3,5
0,25 — 500 2,3 —
Перлит вспученный 1—2 10—20 50 2,7 10,0
0,5—1 10—20 50 2,1 8,1
0,25—0,5 10—20 100 1,5 5,6
<0,25 10—20 100 1,1 3,2
<0,25 10—20 250 0,9 —
Вермикулит вспученный 0,1—0,5 10 280 3,8 —
Магнезия углекислая 0,05—0,08 14 400 1,4 2,9
Аэрогель оксида алюминия 0,025—0,1 — 50 1,9 3,5
Мипора — 19 50 2,1 4,2
Стеклянная вата 0,018 — 160 5,0 16,0
0,008 150 1,7 8,5
Минеральная вата 0,01 4 150 3,0 10,5
Асбестовый порошок — — 620 6,3 —
Черная сажа — 100 400 1,3 —
Уголь активированный 1—3 1550 400 5,9 —
Цеолит СаА 2—4 570 650 6,5 —
Кремний 0,005 — 950 4,7 —
Бронзовая пудра БПФ <0,045 — 1900 4,5 —
[911]. Применяют также изоляцию из че-
редующихся слоев рифленой и гладкой
алюминированных пленок (димплар). Вви-
ду горючести полимерные пленки не реко-
мендуют для сосудов с жидким кислоро-
дом. Толщина напыления алюминия на
пленку должна быть не менее 0,025 мкм.
При толщине напыления 0,007—0,008 мкм
пленка становится прозрачной [922].
В [921] показано, что при измерении теп-
лопроводности плоских образцов многослой-
ной изоляции необходим двойной контроль
теплового потока с целью учета теплообме-
на между торцами образца и окружающи-
ми стенками. Без такого контроля ошибка
в измерениях может быть двукратной.
Малотеплопроводная металлизирован-
ная полимерная пленка предпочтительнее
в тех случаях, когда конструкция сосуда
(например, цилиндрический сосуд Дьюара)
обусловливает тепловой поток вдоль слоев.
Уменьшить его можно, прикрыв торцы мно-
гослойной изоляции какой-либо изотропной
изоляцией — пенопластовой, порошковой
и т. п. В реальных изделиях эффективность
многослойной изоляции из-за теплопрнтока
по торцам может оказаться в несколько раз
хуже, чем в лабораторных условиях. Для
нейтрализации этого эффекта используют
специальные схемы монтажа изоляции. Ка-
жущаяся теплопроводность правильно смон-
тированной изоляции—около 0,1 мВт/(м-К),
т. е. примерно вдвое больше, чем измерен-
ная на калориметре [923]. Прошивание
многослойной изоляции нитками ухудшает
ее теплоизоляционные свойства [922].
Уменьшение переноса теплоты внутри
теплоизоляции теплопроводностью остаточ-
ных газов получают, вакуумируя изоляци-
онное пространство до остаточного давле-
ния не выше 10~4 гПа. Узкие каналы
в изоляции затрудняют откачку воздуха и
253
Низкотемпературная теплоизоляция
Т аблица 7.8. Теплопроводность композиции многослойной изоляции при оптимальной
плотности (граничные температуры 293—300 и 77—90 К, давление 10~3 Па) [923]
Характеристика прокладок Количест- во экра- нов на 1 см Плот- ность ИЗОЛЯЦИИ, кг/м3 Теплопро ВОДНОСТЬ- мВт/(м-К
Материал Толщина, мм (поверхнос т- ная плот- ность, г/мс)
Комнозициа с экранами is отожженной алюминиевой фольги толщиной, 6,3—12,7 мкм
Стеклобумага СВР (22) 20 98 0,С50
(16) 25 108 0,040
Стеклохолст ЭВТИ 0,2(40) 20 135 0,085
0,15 20 95 0,05
Стеклобумага МКВ (4,3) 22 68 0,42
Бумага ОДП из целлюлозного волокна (22) 2о 98 0,067
Капроновая сетка (14) 23 94 0,039
Стеклобумага из волокна 0,5 мкм 6,2 20 140 0,06
(16) 21 — 0,042
То же SI-62 20—40 88 0,031
То же S1-91 — 30—63 120 0,017
Стеклобумага из волокна 3 мкм 0,2 15 НО 0,074
0,12 20 112 - 0,052
Композиции с экранами из гладкой алюминированной с двух- сторон
полмэтилентрефталатной пленка толщиной 5—12 л 4КМ
Стекловуаль ЭВТИ-7 (7) 30 83 0,045
Стеклобумага МКВ (4,3) 22 53 0,040
Стек лох олст ЭВТИ 0,1(16) 30 105 0,050
Стеклобумага дексиглас 0,07 24 59 0,048-'
Стеклобумага тисьюглас 0,015 40 52 0,024
Шелковая сетка (два слоя) 0,15 23 45 0,043
Нейлоновая сетка 0,23 32 54 0,029
Пенополиуретан — 9 35 0,13
Пенополиуретан (плотность 32 кг/м3) Суперфлок (пучки дакроновых волокон) — 6 > 22 0,014
— 12 1,4 0,065
Композиции с экранами из рифленой алюминированной с одной стороны,
по лиэ та ленте рефталатной пленки толщиной 5—12 мкм
Рифление 3X3 мм без прокладок Рифление 3X3 мм, стекловуаль ЭВТИ-7 17) 23 15 16 22 0, ГО' 0,10
То же, алюминирование с двух сторон (7) 10 15 0,05
NRC-2 (без прокладок) — 23 22 0,05
Димплар (прокладки из гладкой алюминированной пленки) 0,013 8 16 0,20
выделяемых материалом изоляции газов.
Поэтому вакуум внутри пакета изоляции
хуже, чем в свободном изоляционном про-
странстве, что увеличивает перенос теплоты
теплопроводностью газа по сравнению
с расчетным. Для облегчения откачки газов
предпочтительнее делать экраны из менее
«газящего» алюминия. Предлагалось также
прокалывать изоляцию, однако это повы-
шало радиационный теплоперенос. В [617]
было предложено пробивать в радиацион-
ных экранах малые отверстия, не прозрач-
ные для радиации из-за дифракции. В «теп-
лых» слоях изоляции диаметр этих отвер-
стий не должен превышать 2—2,5 мкм,
в «холодных» он может быть увеличен до
50 мкм. Допустимая общая площадь отвер-
стий 20—25 %. В [658] предложено отвер-
стия в экранах пробивать с помощью бом-
бардировки ядерными частицами. Другой
способ снизить давление внутри пакета
изоляции — применить проставки из бума-
ги, содержащие активированный уголь.
Теплопроводность такой изоляции ниже
0,01 мВт/(м-К) [662]. В [661] предложе-
ны два упрощенных и более дешевых вида
многослойной изоляции: полиэфирная глад-
кая пленка, алюминированная с одной сто-
роны, и бумага, пропитанная углем и алю-
минированная с одной стороны. Эксперимен-
Многослойная экранногвакуумная изоляция
251
Рис. 7.7. Зависимость теплопроводности
многослойной изоляции X от давления в
изоляционном пространстве р [919]. Гра-
ничные температуры 77,6 и 293 К, остаточ-
ный газ — азот. Прокладки из стеклобума-
ги СВР толщиной 50 мкм:
I, 3, 4, 5, 6, 8 — экраны из алюминиевой лавса-
новой пленки толщиной 12 мкм; 2, 7 — экраны
.из алюминиевой фольги толщиной 10 мкм. На-
грузка на изоляцию гПа: / — 780; 2 — 980; 3 —
540: 4—118; 5 — 34; 5 — 6; 7 и 5—1
Рис. 7.8. Зависимость теплопроводности
изоляции, состоящей из алюминированной
лавсановой пленки толщиной 12 мкм и стек-
лобумаги СРВ толщиной 50 мкм, от давле-
ния в изоляционном пространстве р при раз-
личных нагрузках на изоляцию [919]:
а —граничные температуры 4.2 и 293 К, оста-
точный газ — гелий; б — граничные температу-
ры 20,4 и 293 К, остаточный газ — водород
Рис. 7.9. Теплопроводность многослойной
изоляции [915]:
I — изоляция SI-12, 4—8 слоев алюминиевой
»фольги на 1 см, прокладка из стекловолокна с
толщиной нити 3 мкм, объемная масса 32 кг/м3;
2 — силикатный аэрогель с медным порошком
•(Copper — Sontocel CS-S); 3—изоляция SI-4,
16—32 слоя алюминиевой фольги на I см, про-
кладка из стеклобумаги толщиной менее 1 мкм,
объемная масса 75 кг/м3
Рис. 7.10. Зависимость объемной массы у
некоторых многослойных изоляций от на-
грузки р на изоляцию [919]:
/ — алюминированная лавсановая пленка толщи-
ной 12 мкм и стеклохолст ЭВТИ толщиной
100 мкм; 2 — алюминированная лавсановая плен-
ка толщиной 12 мкм и стеклобумага СВР тол-
щиной 50 мкм; 3 — алюминиевая фольга толщи-
ной 10 мкм и стеклобумага СВР толщиной
50 мкм; 4 — алюминиевая фольга толщиной
30 мкм и стеклохолст ЭВТИ толщиной 100 мкм
252
Низкотемпературная теплоизоляция
Таблица 7.9. Тепловой поток между параллельными поверхностями через изоляцию
различных типов при толщине слоя 5 см [51, 150, 915, 919]
Вид ИЗОЛЯЦИИ Тепловой поток через изоляцию, Вт/м2, при граничных температурах, К
77—300 20—300 20—77
Газы при атмосферном давлении (без конвек- ции): водород Н2 64 (7=0,135) 65 (7=0,105) 2,7 (7=0,0212)
гелнй Не 57 (7=0,115) 59 (7=0,0946) 5,7 (7=0,0446)
воздух или азот 9 (7=0,0180) — —
Аэрогель, р=100 кг/м3 7 (7=0,014) — —
Вата минеральная, р= 17 (7=0,035) — —
= 200 кг/м3 Мипора (крошка), р = 9 (7=0,018)
=45 кг/м3 Пенополистирол, р= 16 (7=0,033) 17 (7=0,028) 1,9 (Г=0,015)
—32 кг/м3 Перлит, р.=31-^97 кг/м3, заполненный газом: гелием 62 (7=0,126) 62 (7=0,100) 7,3 (7=0,0578)
азотом 16 (7=0,0321) — —
Высохни вакуум, р = 9,1* 9,1* 0,039*
= 1,33-10—6 гПа; коэф- фициент теплового из- лучения поверхностей 0,02 Перлит под вакуумом, 0,53 (7=0,0109) 0,43 (7=0,0059) 0,023 (7=0,00017)
р=81=97 кг/м3 Мипора, />=6,7• 10—2 гПа (экстраполировано) Силикоаэрогель, р=6,7Х 1,4 (7=0,0029) 1,8 (7=0,0029)
0,70 "(7=0,0014)
ХЮ-2 гПа (экстрапо- лировано) Силикоаэрогель с медным 0,23 (7=0,00046)
порошком 15 % (по мас- се) прн J9=l, ЗЗХ ХЮ-2 гПа (экстрапо- лировано) Многослойная из алюми- нированной лавсановой 0,055** (7=0,00011) 0,043* (7=0,00007)
пленки толщиной 12 мкм и стеклобумаги СВР толщиной 5J мкм, 38 слоев, р=1,ЗЗХ Х1б—4 гПа (экстрапо- лировано)
* Остаточный газ—'одород,
* Остаточный газ—азот.
Примечание. Хи>—средние истинный и эффективный
Вт/(м-К).
коэффициенты теплопроводности,
Тепловые мосты и опоры
253.
тальая эффективная теплопроводность—со-
ответственно 0,18 и 0,14 мВт/(м-К), что
выше, чем у обычных многослойных изо-
ляций (см. табл. 7.8). Усовершенствован-
ная многослойная изоляция, собранная из
алюминированной пленки ПЭТФ-ДА и стек-
лобумаги из микротонкого волокна, умень-
шает теплоприток на 15—30 % [9171-
На рис. 7.7 и 7.8 приведены значения
теплопроводности некоторых видов много-
слойной изоляции, полученные по методике
с двойным контролем температур в зависи-
мости от вакуума, внешней нагрузки, гра-
ничных температур и вида остаточного га-
за. Хорошая многослойная изоляция при
вакууме 10-4 гПа в 7—8 раз эффективнее
лучшей вакуумно-порошковой (рис. 7.9).
На рис. 7.10 и 7.11 приведены зависимости
Рис. 7.11. Зависимость числа слоев п на
1 см толщины изоляции от нагрузки р на
изоляцию [919]:
1—алюминиевая фольга толщиной 30 мкм и
стеклохолст ЭВТИ толщиной 100 мкм; 2 — алю-
минированная лавсановая пленка толщиной
12 мкм и стеклохолст ЭВТИ толщиной 100 мкм;
3—алюминированная лавсановая пленка толщи-
ной 12 мкм и стеклобумага СВР толщиной
50 мкм; 4—алюминиевая фольга толщиной
10 мкм и стеклобумага СВР толщиной 50 мкм
объемной массы и числа слоев многослой-
ной изоляции от внешней нагрузки. Тепло-
проводность других видов многослойной
теплоизоляции приведена в табл. 7.8. Для
удобства сравнения и в целях облегчения
прикидочных расчетов в табл. 7.9 приведе-
ны значения теплового потока через раз-
личные виды теплоизоляции в часто встре-
чающихся интервалах температур.
7.5. ТЕПЛОВЫЕ МОСТЫ И ОПОРЫ
Холодные части низкотемпературных
установок соединяются с теплыми внешни-
ми кожухами различными трубками, клапа-
нами, а также специальными подвесками и
опорами. Для уменьшения притока теплоты
через трубки их выполняют нз малотепло-
проводных материалов (например, нержа-
веющей стали марки 12Х18Н10Т или мель-
хиора), увеличивают по возможности их
длину и уменьшают толщину стенок. Сле-
дует отметить, что в трубках из нержавею-
щей стали с толщиной стенки меньше 0,3 мм
часто обнаруживаются свищи, и для высо-
ковакуумной изоляции применение таких
тонкостенных трубок не рекомендуется.
Аппараты небольших размеров подвеши-
вают непосредственно на трубках и венти-
лях. В аппаратах больших размеров ис-
пользуют специальные опоры или подвески
из проволоки, трубок и цепей (у цепей теп-
лопроводность снижается за счет контакт-
ных сопротивлений). Снижение теплоприто-
ка в 10—20 раз достигается заменой под-
весок из нержавеющей стали равнопрочны-
ми подвесками из стеклопластика [923].
В опорах в качестве теплоизоляторов при-
меняют дерево, текстолит, стекло. Опоры,
подвергающиеся большим динамическим
нагрузкам, рекомендуется выполнять из на-
бора тонких пластин для восприятия осе-
вых нагрузок и из спиралей из ленты не-
ржавеющей стали для восприятия радиаль-
ных [665]. Чтобы ухудшить контакт между
пластинами, их пересыпают порошком дио-
ксида марганца или алюминия. Такие опо-
ры имеют теплопроводность примерно
в 50 раз меньшую, чем опоры из сплошно-
Рис. 7.12. Тепловое сопротивление пластин
из нержавеющей стали [665]. Граничные
температуры 76 и 296 К:
1 — пластины толщиной 0,1 мм, припудренные
диоксидом марганца; 2— перфорированные
пластины толщиной 0,1 мм; 3 — перфорирован-
ные и гладкие пластины толщиной 0,1 мм, уло-
женные попеременно; 4—пластины толщиной
0,2 мм припудренные; 5 — пластины толщиной'
0,1 мм чистые; 6 — пластины толщиной 0,02 мм
чистые
'254
Основные уравнения гидравлики и теплопередачи
Рис. 7.14. Зависимость теплопроводности
от давления при различных температурах
для стопки из фольги отожженной нержа-
веющей стали типа 302 толщиной
0,0254 мм, пересыпанной порошком алюми-
ния [372]
'Рис. 7.13. Зависимость теплопроводности
от давления при различных температурах
для стопки из фольги отожженной нержа-
веющей стали типа 302 толщиной
0,0254 мм [372]
проводности текстолита. На рис. 7.12—7.14
приводятся результаты экспериментального
исследования таких опор. Загрязнение пла-
стин и тонкие мягкие прокладки между
ними увеличивают контакт и ухудшают теп-
лоизоляционные свойства. Кроме того, изу-
чались сферические опоры из стекла, ми-
карты и других материалов [665, 918].
Дополнительные сведения по теплоизо-
ляции можно найти в [584, 923].
Раздел восьмой
ОСНОВНЫЕ УРАВНЕНИЯ ГИДРАВЛИКИ
И ТЕПЛОПЕРЕДАЧИ
А. ГИДРАВЛИКА
8.1. КРИТЕРИИ ГИДРАВЛИЧЕСКОГО
ПОДОБИЯ
Число Рейнольдса — критерий режима
-течения — характеризует гидродинамический
режим потока и служит мерой отношения
сил инерции и сил вязкости (внутреннего
трения) в потоке:
Re=wprf/r] = wdlr\ — vd/v,
где о—скорость потока (обычно средняя),
м/с; w — массовая скорость потока,
кг/(с-м2)-, р — плотность среды, кг/м3; d —
характерный геометрический размер, напри-
мер диаметр трубы, м; л— динамическая
вязкость, Па-с; v — кинематическая вяз-
кость, м2/с.
Число Эйлера — критерий подобия по-
лей давления-—характеризует гидравличе-
ское подобие систем, в которых действует
сила механического давления:
Ей =Ар/ (ро2) =App/w2,
где Др — иапор, необходимый для преодо-
-ления гидравлических сопротивлений, Па.
Число Стокса характеризует тождест-
во явлений в системах, где действует сила
трения (например, при движении твердых
частиц в среде):
Stk=rfr2pro/(rqZ),
где dr — диаметр частицы, м; р, — плот-
ность частицы, кг/м3; I — характерный гео-
метрический размер, м.
8.2. ОБЩИЕ ОПРЕДЕЛЕНИЯ
УСЛОВИЙ ТЕЧЕНИЯ ЖИДКОСТИ
При течении жидкости в трубопроводе
статическим давлением называют давле-
ние, которое испытывают стеики трубы со
стороны потока; это же давление будет
в неподвижной среде. Динамическое давле-
ние (или динамический иапор) возникает
только при движении жидкости и опреде-
ляется выражением ро2/2.
Средней скоростью потока назы-
вается скорость, одинаковая для всех ча-
стиц в сечеиии площадью F, при которой
через это сечеиие в единицу времени про-
ходит такое же количество вещества G,
как и при действительном распределении
скоростей:
Потери давления на трение в трубах
255»
OcP=G/(p/7).
Различают ламинарный и турбулентный
режимы течения вязкой жидкости. В ла-
минарном потоке результирующая скорость
элементарного объема жидкости соответст-
вует струйному движению и параллельна
оси потока; профиль скоростей в сечении,
перпендикулярном оси, имеет форму пара-
болы, вершина которой лежит на оси тру-
бы. В турбулентном потоке каждая части-
ца описывает сложные траектории, струи
завихрены; кроме квазистационарного глав-
ного движения вдоль оси имеются попереч-
ные беспорядочные перемещения, связан-
ные с постоянным возникновением, нараста-
нием и исчезновением отдельных вихрей.
Скорость движения основной массы потока
в большей части сечения примерно одина-
кова и близка к средней. У стенки образу-
ется тонкий ламинарный слой, толщина
которого уменьшается с увеличением ско-
рости. Переход от одного режима течения
к другому (переходная область) в значи-
тельной мере зависит от конкретных усло-
вий. Для труб круглого сечения нижний
предел критического числа Re составляет
обычно 2000—2300. Верхний предел сущест-
венно зависит от условий входа, состояния
поверхности и других причин и для глад-
кой трубы может принимать значения от
4000 до 10 000.
Гидравлическое сопротивление движу-
щемуся потоку условно (для удобства рас-
чета) принимается состоящим из двух ча-
стей: линейного сопротивления трубопрово-
да, связанного с преодолением трения, Арт
и потерь на местных сопротивлениях Арм,
локализованных на небольших участках
тракта.
При расчетах гидравлического сопро-
тивления вязкость потока определяется по
температуре стенки несущей трубы, а плот-
ность — по средней температуре потока.
8.3. ПОТЕРИ ДАВЛЕНИЯ
НА ТРЕНИЕ В ТРУБАХ
Формула Дарси — Вейсбаха для изо-
термического течения несжимаемой жидко-
сти в прямой круглой трубе постоянного
сечения имеет вид
ро2 I
&Р' = 7'~Т~1Г (8Л)
где Д/+ — потеря давления на трение, Па;.,
р — плотность жидкости, кг/м3; v — сред-
няя скорость, м/с; I — длина трубы, м; d — -
внутренний диаметр трубы, м; X—коэффи-
циент трения.
Ламинарный режим течения. Для ла-
минарного режима течения (Re<2000) ко-
эффициент трения X=64/Re. Это значение-
выводится теоретически из уравнения Пуа-
зейля [51], но оно справедливо только для,
полностью сформировавшегося ламинарно-
го потока и неприменимо к начальному
участку трубопровода, на котором наблю-
дается непараболический профиль ско-
ростей.
Длина начального участка [52]
ZHa4 = 0,02875dRe.
Коэффициент трения на начальною
участке трубопровода может быть опреде-
лен по формуле [51]
X=A/Re. (8.2)
Значения А в зависимости от Z/(dRe)
даны в табл. 8.1; видно, что начальный-
участок характеризуется относительно боль-
шим значением коэффициента трения.
При чисто ламинарном режиме течения.
X не зависит от диаметра трубопровода и;
шероховатости его поверхности, поэтому
все трубы можно рассматривать как
гладкие.
Переходная область между ламинар-
ным и турбулентным течениями для ци-
линдрических труб в пределах Re=2000-b-
4000 характеризуется ростом коэффициента,
сопротивления примерно на 20 % с увели-
чением Re (вне зависимости от шерохова-
тости).
Турбулентный режим течения. Для
гладкостенных труб круглого сечения рас-
чет X ведут по следующим формулам;
[53, 54]:
при Re = 4- 103-т-1 • 105 — по формуле -
Блазиуса
X=0,3164/Re0-25; (8.3)
при Re=l • 105-?-1 • 10s — по формуле-
Никурадзе
Х=0,032 + 0,221/Re0-237; (8.4)
при Re>4-103 — по формуле
X=l/(l,821g Re—1,64)2. (8.5).
При турбулентном режиме течения на-.,
коэффициент сопротивления большое влия--
Таблица 8.1. Значения коэффициента А в формуле (8.2)
ll(dRe) 2,5 5,0 7,5 10,0 12,5 15,0 17,5 20,0 22,5 25,0 28,5
А 122 105 96,7 88,0 82,4 79,2 76,4 74,4 72,8 71,5 69,6;
256
Основные уравнения гидравлики и теплопередачи
ние оказывает шероховатость трубопрово-
да, которая характеризуется коэффициен-
том k=k/d, где А — средняя величина вы-
ступов шероховатости, мм; d — диаметр
трубы, мм. Ориентировочные значения А
для различных труб приведены в табл. 8.2.
Таблица 8.2. Значения шероховатости
А для различных тру 5 [64]
Характеристика трубы Д, мм
Чистые цельнотянутые тру- бы: из меди и латуни 0,0015—0,01
из алюминия 0,015—0,06
Цельнотянутые стальные трубы: новые, не бывшие в упот- 0,02—0,1
реблении очищенные, после многих 0,04
лет эксплуатации умеренно корродированные 0,4
трубопроводы сжатого воз- 0,8
духа после компрессоров водопроводные трубы (в 1,2—1,5
эксплуатации) 'Чугунные трубы: новые 0,3
бывшие в употреблении, 1,о—1,5
корродированные сильно корродированные До 3,0
Чистые трубы из стекла Резиновый шланг 0,0015—0,01
0,01—0,03
Если A<17,85Re-0'875, то шерохова-
тость практически не влияет на X и расчет
можно вести по формулам (8.3) — (8.5).
Чем больше А, тем сильнее влияние шеро-
ховатости на X. По данным Никурадзе [54]
эта связь определяется формулой
X=l/[l,74+21g (1/2А)р. (8.6)
По формуле (8.6) можно оценить ма-
ксимальное значение X, соответствующее
при данной шероховатости переходу к квад-
ратичному закону сопротивления, когда %
не зависит от Re. Критическое значение
числа ReKp, соответствующее этому пере-
ходу, определяется из уравнения [53]
ReKp= (217,6—82,4 1g А)/А.
На рис. 8.1 приведен график, иллю-
стрирующий зависимость X = f(Re) для труб
круглого сечения с равномерно зернистой
шероховатостью стенок при стабилизиро-
ванном, изотермическом течении.
В спирально изогнутых трубах (змее-
виках) характер течения жидкости услож-
няется. Центробежные силы отжимают по-
ток к внешней стенке и создают в попереч-
ном сечении трубопровода циркуляционные
Рис. 8.1. Зависимость коэффициента тре-
ния X от Re и относительной шероховато-
сти А (цилиндрические трубы)
токи (вторичную циркуляцию). Гидравли-
ческое сопротивление змеевика увеличивает-
ся (по сравнению с прямой трубой) с рос-
том отношения d/D, rps d-—внутренний
диаметр трубы, D — средний диаметр зме-
евика. При d/Z)<2-10-3 влияние кривизны
мало и его можно не учитывать.
Гидравлическое сопротивление изогну-
тых труб выше, чем прямых, как при лами-
нарном, так и при турбулентном режиме
течения. В изогнутых трубах повышается
также критическое значение числа Рей-
нольдса, соответствующее переходу от ла-
минарного режима к турбулентному.
Для определения коэффициента сопро-
тивления змеевиков рекомендуются фор-
мулы [329]:
при 102<Re<ReKp
Х = {1+0,14 (d/D) °-97Х
XRe[1-0’644(d/'D)°’312]}64/Re; (8.7)
при ReKp<Re<2,2-104
X='[l-j-2,88-104(d/Z))°’62Re-1] x
X0,3164Re-°’25; (8.8)
при 2,2-104<Re< 1,5-105
X = [ 1 +0,0823 (l+d/£>) (d/£>) °-53Re'+5] X
X0..3164Re-°+ (8.9)
где ReKp = 2300[ 1+8,6 (d/Z))».43].
Приведенные выше формулы справед-
ливы для круглых труб. Расчет гидравли-
ческого сопротивления при произвольной
форме поперечного сечения трубопровода
с достаточной для практики точностью
можно проводить по формулам для круг-
лого сечения, подставляя вместо диамет-
ра d эквивалентный диаметр d3=4F/S, где
F — площадь поперечного сечения потока,
м2; S — омываемый потоком периметр, м.
В табл. 8.3 приведены ориентировоч-
ные значения скорости потока в трубопро-
водах криогенных установок.
Сопротивления поперечно обтекаемых пучков из гладких труб
257
Таблица 8.3. Рекомендуемые значения
скорости потока в трубопроводах
криогенных установок
Среда, движущаяся в трубопро-
воде
Вода и водные растворы ще-
лочи
Газ низкого давления 0,1—
0,15 МПа
Газ давлением до 2 МПа
Жидкие криоагенты
Жидкие криоагенты, стекаю-
щие самотеком
Скорость, м/с
0,5—2,5
10—30*
3—8*
0,5—3*
0,05—0,5
* Верхний предел—для водорода и гелия.
8.4. МЕСТНЫЕ СОПРОТИВЛЕНИЯ
Снижение давления в местном сопро-
тивлении определяется по формуле
ApM=£pt>2/2, (8.10)
где Дрм — гидравлическое сопротивление
участка, Па; £ — коэффициент местного
сопротивления; v— скорость потока, м/с;
р — плотность, кг/м3.
Изогнутые трубы (отводы). Если d —
диаметр трубы, a R — радиус закругления
(по оси трубы), то коэффициент сопротив-
ления при повороте потока на угол <р [62]
£=[0,131-1-0,16(cZ/7?)3-s]<p/90, (8.11)
где d<2R<5d.
Поворот потока в колене с острыми
кромками. Если угол поворота потока ра-
вен <р, то коэффициент сопротивления [64]
5 = 0,95 sin2 -^-+2,05sin*(8.12)
При внезапном изменении сечения трубо-
провода коэффициент сопротивления тур-
булентному потоку определяется по графи-
ку рис. 8.2 в зависимости от отношения
Рис. 8.2. Коэффициент сопротивления Е;
при внезапном расширении (/) и внезап-
ном сужении (2) в зависимости от отноше-
ния площади меньшего сечения Fi к пло-
щади большего f2
площади меньшего сечения F\ к площади
большего К2. Гидравлическое сопротивле-
ние определяется средней скоростью потока
в меньшем сечении.
Коэффициент сопротивления дроссельной
заслонки и пробкового крана [64]
Угол открытия
10° 20° 30° 40° 50°
Заслонки - - • 0,65 1,60 4,00 9,4 24,0
СкраЕа........ 0,31 1,84 6,15 20,7 95,3
Коэффициент сопротивления клапанов
при полном открытии [64]
Запорное устройство С
Нормальный клапан.............. 4—8
Клапан „Косва“.................1,3—2,7
Прямоточный клапан.............0,3—1,0
Задвижка „Лудло“.................. 0,05
Более подробные данные о местных со-
противлениях (влияние числа Re, диамет-
ра прохода, шероховатости и пр.) см.
в [52, 64, 67, 69].
8.5. СОПРОТИВЛЕНИЕ
ПОПЕРЕЧНО ОБТЕКАЕМЫХ ПУЧКОВ
ИЗ ГЛАДКИХ ТРУБ
Зависимости для гидравлического со-
противления представляются обычно в без-
размерной форме:
Eu-CRe", (8.13)
где Ей — число Эйлера; коэффициент С и
показатель степени п определяются гео-
метрией пучка. При вычислении за линей-
ный размер принимается наружный диа-
метр трубки.
Согласно [70] сопротивление попереч-
но обтекаемых пучков прямых гладких
труб в зависимости от характера располо-
жения труб в пучке определяется уравне-
ниями, приведенными ниже.
Шахматное расположение труб в пуч-
ке. Если (1—a/sz)/(si/d—1)^0,53 (si —
шаг труб поперек потока, з2 — диагональ-
ный шаг труб), то число Эйлера вычисля-
ется по формуле
Eu=l,4(z+l)Re-°’25, (8.14)
где z — число рядов труб вдоль потока.
Если (1—d/s2z)/(si/d—1)>0,53, то ре-
комендуется следующая формула;
Eu = l,93(z+ 1) ]/ Re-°'a\
(8.15)
Формулы применимы при Re=6000-s-
60 000. Пределы применимости формул по
шагам;
0,25<(1— dfs2')/(Sl/d— 1) <2,5.
17—218
258
Основные уравнения гидравлики и теплопередачи
Коридорное расположение труб в пуч-
ке. Если (s2/d-0,8)/(s,/d—1)<1 (si — шаг
труб поперек, s2— вдоль потока), то число
Эйлера вычисляется по формуле
/ s2/d—0,8 \2'в ..
Ей = 0,265 —— -----— zRe!. (8.16)
\ sx/d — 1 /
Если (s3/d —0,8)/(sx/d—1)> 1, то
рекомендуется формула
Ей = 0,265 f S2/f~°;8 -V^e\ (8.17)
\ sx/d — 1 /
Показатель степени п в обоих случаях
вычисляется по формулам:
п = 0,88
s-t/d — 1
s3/d — 1
\ 0,138
-0,1 -1
при s2]d^ 1,24;
п = 0,88
s3/d \0,7 / si/d— 1
1^24/ t s2;d~ 1
при s3/d < 1,24.
Эти формулы применимы при Re=6000ч-
60 000 и шагах труб 0,2^(s,/d—
—0,8V (si/d—1) <6,5.
Приведенные формулы справедливы
только при отсутствии теплообмена. В ре-
альных условиях работы, при наличии теп-
лообмена, необходимо к полученным зна-
чениям Др=ЕирорОср2 прибавить поправку
Др( на изменение скоростного напора, свя-
занное с изменением температуры:
2
„ Р2И2а_Р1И13_ 2(Г2— 7\) _РаД’ср
ДЛ = 2 2 ?ср 2 ’
Во всех вышеприведенных формулах
параметры газа определяются по средней
температуре потока, а скорость газа — по
самому узкому сечению.
О гидравлическом сопротивлении попе-
речно обтекаемых пучков прямых труб см.
также в [64J.
При косом (под некоторым углом) об-
дуве пучка прямых труб гидравлическое
сопротивление уменьшается [71J. Степень
понижения сопротивления ф=сй/с9о в основ-
ном зависит от угла атаки 0 (угол между
направлением потока и осями труб). Сред-
ние значения ф в зависимости от угла 0
даны в табл. 8.4.
Таблица 8.4. Степень изменения
сопротивления ф при косом обдуве
пучка труб
Показа- тель Расположение труб
коридорное шахматное
Угол 9, 60 45 30 60 45 30
град Ф 0,82 0,54 0,30 0,80 0,57 0,34
Особый случай поперечного обтекания
труб представляет течение газа в межтруб-
ном пространстве витого, поперечноточного
теплообменника (см. § 8.20), характеризуе-
мого использованием «тесных» пучков труб,,
свитых в спираль (относительные шаги:
поперек потока si/d= 1,2ч-1,5, вдоль пото-
ка Sz/d— 1,0ч-1,3). Гидравлическое сопро-
тивление межтрубного пространства таких
теплообменников существенно зависит от
параметров навивки (поперечного п про-
дольного шагов), конструкции и качества
изготовления (регулярности намотки).
Обобщенные зависимости, удовлетворитель-
но учитывающие все эти факторы, пока
отсутствуют. Для ориентировочных расче-
тов можно использовать уравнение [72]
Еи=0,53г Re-°'122, (8.18)'
при этом скорость потока определяется по.
самому узкому сечению. По оценкам урав-
нение (8.18) завышает гидравлическое со-
противление на 20—30 %. См. также
[73, 74J.
8.6. СОПРОТИВЛЕНИЕ
ПОПЕРЕЧНО ОБТЕКАЕМЫХ ПУЧКОВ,
ИЗ ОРЕБРЕННЫХ ТРУБ
Применение оребренных труб особенно’
эффективно в тех случаях, когда тепло-
обменивающиеся потоки имеют существен-
но отличные параметры и соответственно-
большую разницу в коэффициентах тепло-
отдачи (например, при теплообмене газ —
жидкость, или газ высокого давления — гаа
низкого давления).
Поперечное оребрение труб часто про-
изводят путем навивки оребряющей ленты
на гладкую трубу; для надежного теплово-
го контакта ребра припаивают легкоплав-
ким припоем. Трубы с длинными эффектив-
ными ребрами могут быть получены путем
поперечной прокатки гладкотрубной тол-
стостенной заготовки из меди или алюми-
ния [78J.
Важным параметром оребренной трубы,
служит коэффициент оребрения <р (отноше-
ние поверхности оребренной трубы к по-
верхности гладкой трубы с диаметром по.
основанию ребер). Для прямоугольных спи-
ральных ребер
ф= 1—( 2/z (d9-,~ Д—( Д) / (Zd9),
где h — высота ребер; i — шаг оребрения-
do — диаметр трубы, несущей оребрение (по*
основанию ребер); 1Д — толщина ребер. Пр»
оребрении относительно высокими ребрами,
(A/do=O,4=1,0) <р=5=-15.
Как и в случае поперечно, обтекаемых
пучков гладких труб следует различать ре-
шетки из прямых оребренных труб и пучки
труб в поперечно обтекаемом, витом. тепло-
обменнике.
По данным [75, 79} для тесных пучков.
Сопротивление ребристых труб при продольном обтекании
259
прямых труб с круглыми поперечными реб-
рами (ребра соседних труб соприкасаются)
в пределах 104<Re<6-104
Eu=O,99z(u/do)<1’72Re_0’24 (8.19)
для шахматного расположения труб в пуч-
ке и
Eu=O,O85z(/j/do)0'3 (u/do)-0'58 ( 8.20)
для коридорного расположения, где z —чис-
ло рядов труб (вдоль потока); h — высота
ребра; и —расстояние между ребрами'
(в свету); do —наружный диаметр трубы,
несущей оребрение (этот же размер исполь-
зуется в качестве линейного при вычисле-
нии Re).
В последнее время оребренные трубы
успешно используют в конструкции витых,
поперечноточных теплообменников. В [76]
•описан экспериментальный витой теплооб-
менник, в котором использована медная
ребристая труба, полученная поперечной
прокаткой гладкотрубной заготовки 0 8Х
Х1,5 мм (наружный диаметр ребристой
трубы d= 11 мм, диаметр по основанию
ребер do=6 мм, диаметр внутреннего кана-
ла 5 мм). Трубы теплообменника нави-
вались вплотную, с касанием по наружно-
му диаметру ребристой трубы как в по-
перечном, так и в продольном направле-
нии. Для межтрубпого пространства этого
теплообменника число Эйлера определяет-
ся эмпирическим уравнением
Eu= 10z Re-0-27. (8.21)
В качестве линейного размера при опреде-
лении Re использован диаметр несущей
трубы do, а скорость газа определялась по
•среднему сечению теплообменника S=
= (V—Vt)/H, где У—объем кольцевого
пространства, ограниченного сердечником и
•корпусом; Ут — объем, занимаемый труба-
ми; Я — длина навивки.
При изготовлении теплообменников ши-
роко используют также ребристые трубы
с относительно короткими ребрами (h/d-^
~0,2). Использование таких труб позво-
ляет существенно сократить габариты теп-
лообменника, добиться его высокой ком-
пактности.
Оригинальная конструкция витого теп-
лообменника из труб, оребренных проволо-
кой, разработана в НПО «Гелиймаш» [80].
Хороший тепловой контакт между трубой и
проволочным оребрением обеспечивается
только за .счет натяжения проволоки при
•ее намотке на трубу. Навивка самого па-
кета производится без проставок, в одну
•сторону для всех рядов. При этом оказы-
вается, что несмотря на .большой разброс
локальных значений шагов (вдоль и попе-
рек потока) их средние значения весьма
стабильны как в каждом слое, так и по
всему пакету в целом. Теплообменники
отличаются высокой технологичностью изго-
товления и компактностью (отношение по-
верхности теплопередачи к полному объ-
17*
ему — от 500 до 2300 м2/м3 в зависимости
от диаметра используемых труб).
Коэффициент гидравлического сопро-
тивления f, суммарно отражающий потери
как на трение, так и на многочисленные
местные сопротивления (многократное су-
жение и расширение потока, поперечное
обтекание), связан с потерей давления фор-
мулой, аналогичной (8.1):
pa2 F w2 F
P==f 2 S = f
(8.22)
где Др — суммарная потеря давления, Па;
р — средняя плотность теплоносителя, кг/м3;
S=(V—VT)/H—площадь прохода в узком
сечении, м2; У— полный объем пакета, м3;
Ут — объем, занимаемый оребренными тру-
бами, м3; Н—высота навитого пакета, м;
v — линейная скорость теплоносителя в се-
чении S, м/с; w — массовая скорость теп-
лоносителя, кг/(м2-с); F — площадь по-
верхности теплопередачи (по оребре-
нию), м2.
Для коэффициента гидравлического со-
противления пакета предлагаются следую-
щие эмпирические уравнения:
f = 12,8 Re—° 64/20 <Re< 100); 1
f = 2,65Re—°’3( 100 <J Re< 2000). /
(8.23)
Для эквивалентного диаметра используется
традиционное выражение аэ = 4У/7г (обо-
значения см. выше). Физические параметры
теплоносителя определяются при средних
температуре и давлении.
Уравнения (8.23) аппроксимируют ре-
зультаты экспериментов с теплообменника-
ми, изготовленными из труб диаметром 1—
8 мм, оребренных проволокой диаметром
0,16—1,5 мм.
8.7. СОПРОТИВЛЕНИЕ РЕБРИСТЫХ
ТРУБ ПРИ ПРОДОЛЬНОМ ОБТЕКАНИИ
Продольное обтекание труб с попереч-
ными ребрами (спиральными или кольцевы-
ми) позволяет существенно интенсифициро-
вать теплообмен вследствие возникновения
между ребрами связанных вихрей. Тепло-
обмен и гидравлика таких теплообменников
исследовались в [76, 81, 330]. Имеющегося
в этих работах экспериментального мате-
риала, к сожалению, недостаточно для
сколько-нибудь широких обобщений и рас-
четных рекомендаций.
Можно отметить только отдельные
частные случаи. Так, в [82] приведены ре-
зультаты испытания теплообменников типа
«труба в трубе» с оребренной внутренней
трубой. Коэффициент сопротивления
Др
А=—д2—1,25Re-»(8.24)
ри2 I
~2~ ~d
В опытах использовались медные тру-
бы, оребрение которых получено попереч-
ной прокаткой; наружный диаметр труб
260
Основные уравнения гидравлики и теплопередачи
(по ребрам) d=10 мм, высота ребра
2,2 мм, шаг ребер 1,7 мм, коэффициент
оребрения <р=5-4-6. Эквивалентный диаметр
d:.—-D—d, где 0=20 мм — внутренний диа-
метр ограничивающей трубы.
Эксперименты проводились на азоте в
пределах 104<Re<3 • 104.
8.8. СОПРОТИВЛЕНИЕ
НЕОРОШАЕМЫХ СКРУББЕРНЫХ
НАСАДОК
Этот вопрос подробно изучался в [83,
331]. Общее уравнение для расчета потери
давления газа при движении потока через
насадочный материал любой формы и раз-
мера (на единицу высоты насадки) имеет
вид
Ap=2pv2or/(daF2a), (8.25)
где Др — потеря давления, Па; р — плот-
ность газа, кг/м3; щ — скорость газа в
расчете на полное сечение скруббера, м/с;
Еа — среднее живое сечение насадки,
м2/м2, численно равное свободному объему
Есв, м3/м3 (объем пустого пространства
между элементами насадки, отнесенный к
полному объему, занимаемому насадкой);
f' — коэффициент трения; d3=4VCB/S —
эквивалентный диаметр насадки; 5 — пло-
щадь поверхности насадки, отнесенная к
полному объему, занимаемому насадкой,
м2/м3.
Значения коэффициента трения f' для наса-
док, засыпанных беспорядочно:
Режим Re fl
Ламинарный . .
Неустойчивый
турбулентный
Развитый тур-
булентный
<60 100/Ре
60—70 000 3,8/Re0-2 (8-26)
>7000 0,65
Для колец Рашига, уложенных рядами,
в области неустойчивого турбулентного ре-
жима
/'=O,78/Reo>575. (8.27)
8.9. СОПРОТИВЛЕНИЕ ОРОШАЕМЫХ
СКРУББЕРНЫХ НАСАДОК
В орошаемых скрубберных насадках си-
лы трения между газом и жидкостью воз-
растают по мере увеличения скорости газа,
и когда они становятся равными весу сте-
кающей жидкости, наступает состояние, на-
зываемое «пределом подвисання». При даль-
нейшем возрастании скорости газа начина-
ется унос жидкости; этот режим носит
название «предел захлебывания». Очевидно,
что нормальная работа скруббера должна
быть ограничена скоростью газа ниже «пре-
дела подвисання».
Средняя скорость газа, соответствую-
щая «пределу подвисання» в насадочном
скруббере (насадка в виде колец и прово-
лочных спиралей), при контакте газ —
жидкость (в процессе абсорбции) может
быть определена из уравнения [332]
уО,1в
/ L \0-25 / р \ 0.125
= 0,022— 1,75 — (—I , (8.28)
\ G J V Рж /
где L и G — нагрузка скруббера соответ-
ственно по жидкости и газу, кг/(м2-ч); рг
и рж — плотность соответственно газа к
жидкости, кг/м3; 5 — удельная поверхность
насадки, м2/м3; Fa — среднее живое сечение
насадки, м2/м2, численно равное свободно-
му объему, м3/м3; w0 — средняя скорость
газа, подсчитанная по полному сечению-
скруббера, м/с; т] — динамическая вязкость,
мПа-с; g — ускорение свободного падения,
9,81 м/с2.
На рис. 8.3 приведена зависимость,,
определяемая уравнением (8.28) при допу-
стимой и оптимальной скоростях газа.
Гидравлическое сопротивление орошае-
мой насадки скруббера при оптимальной;
скорости газа (пара) может быть найдено-
по формуле [85]
f/7 \ л 7 n \т г п \С1
i+Pj р Р ,
\ G / \Рж/ \ ^г/ 1
(8.29)
где Дрсух — гидравлическое сопротивление
при протекании газа через сухую насадку
скруббера, Па; остальное — то же, что в
для (8.28).
Значения постоянных в уравнении (8.29):
Состояние веще-
ства ...........
Пар—жидкость . .
(ректификация)
Газ—жидкость . .
(абсорбция)
В п m с
5,15 0,342 0,190 0,038
8,4 0,405 0,225 0,045
Рис. 8.3. График для определения опти-
мальной скорости газа для орошаемых на-
садок при абсорбции [уравнение (8.28)1
Теплоотдача в трубах
261
Б. ТЕПЛОПЕРЕДАЧА
8.10. КРИТЕРИИ ТЕПЛОВОГО
ПОДОБИЯ
Число Пекле Ре — критерий теплового
подобия — служит мерой отношения моле-
кулярного и конвективного переноса теп-
лоты:
Pe=odcp /’k-vd/ а.
Число Прандтля Рг характеризует со-
отношение между полями температуры и
скорости и содержит только физические
константы теплоносителя:
Pr=cT]/A=v/a=Pe/Re,
где Re — число Рейнольдса (см. § 8.1).
Число Нуссельта Nu — безразмерный
коэффициент теплоотдачи, характеризующий
увеличение интенсивности теплообмена
вследствие конвекции по сравнению с чис-
той теплопроводностью:
Nu=ad/IX.
Число Стантона St — безразмерный
коэффициент теплоотдачи, характеризующий
соотношение между изменением температу
вы вдоль потока и температурным напором:
St=a/(npc)=iaS/(Gc)=a/(te>c)=
=Nu/(RePr)=Nu/Pe.
Число Грасгофа Gr характеризует от-
ношение подъемной силы (в поле тяжести)
к инерционной силе:
Gr=g'd3j3A7’/,v2.
Принятые обозначения: v — скорость
теплоносителя, м/с; d — линейный размер,
для труб — диаметр, м; с — удельная те-
плоемкость, Дж/(кг-К); р — плотность,
кг/м3; й. — теплопроводность, Вт/(м-К);
а=Х/(ср) — температуропроводность, м2/с;
г] — динамическая вязкость, Па-с; v —
кинематическая вязкость, м2/с; а — коэффи-
циент теплоотдачи, Вт/(м2-К); S — пло-
щадь поперечного сечения канала, м2; G —•
массовый расход теплоносителя, кг/с;
w — массовая скорость теплоносителя,
кг/(м2-с); g— ускорение свободного паде-
ния, 9,81 м/с2; (5 — температурный коэф-
фициент объемного расширения, Д-1; ДЕ —
температурный напор, К.
Если теплообменивающийся поток течет
не в круглой трубе, а по каналу с иной
формой поперечного сечения, то вместо d
подставляется значение теплового эквива-
лентного диаметра d3=4S/P, где S — пло-
щадь поперечного сечеиия канала, Р —
периметр сечения, через который передает-
ся теплота. Необходимо помнить, что теп-
ловой и гидравлический эквивалентные диа-
метры совпадают не всегда.
8.11. ТЕПЛООТДАЧА В ТРУБАХ
При развитом турбулентном течении
потока в прямой круглой трубе наиболее
общим уравнением служит уравнение Кра-
уссольда [333]
Nu=0,023Re°'8Pr°"33. . (8.30)
Пределы его применимости 0,7<Рг<120;
4-103<Re< 106; Z/d>50 (Z— длина трубы,
d — ее диаметр), когда наступает стаби-
лизация теплоотдачи. При I/d<50 значение
а, полученное по этой формуле, следует
умножить на коэффициент длины ez, зна-
чения которого приведены в табл. 8.5.
При ламинарном режиме течения
(Re<2300) число Nu зависит от Ре. При
Ре d/l> 12
Nu = 1,61 (Ре d/Z)0'33. (8.31)
При Ped/Z<12 наступает тепловая
стабилизация потока и критерий Nu прини-
мает постоянное значение, равное 3,66, т. е.
а=3,66 X/d.
В переходной области (4-103<Re<
<2300) нестабильность течения обусловли-
вает малую точность расчета. Могут ис-
пользоваться следующие приближенные
формулы:
Nu=21 (Рг rf/Z)о.33 (Re/2300)1^ W (8.32)
при Ре d/Z> 12;
Nu=3,66(Re/2300)<2’3+lg Рг) (8.33)
при Ре d/Z< 12.
Теплоотдача в изогнутых трубах (змее-
виках) по сравнению с прямой трубой
увеличивается, причем тем в большей степе-
ни, чем меньше диаметр змеевика. Для рас-
чета могут быть использованы уравнения
[329]
Nu = 3,65 + 0,08 [1 + 0,8Zd/C)°-9) X 1
X ^е[0’5+°’2903(с?/п)°’1М] Рг»-33
при 103<Re<ReKp;
Nu = 0,023(1 +
+ 14,8(1 Jrd/D)(d/D)a^]X
X Re[°’8“~0'22(d/'D)O’1l Рг0'33
(8.34)
при ReKp < Re < 2,2 • 104;
№1=0,023 (1+3,6(1—d/D)(d/P)°.3]X
X Re°'8Pr°'33
при 2,2-104< Re < 1,5-105,
где d — внутренний диаметр трубы; ') —
средний диаметр змеевика; ReKP — крити-
ческое значение числа Рейнольдса, соответ-
ствующее переходу от ламинарного режи-
ма к турбулентному:
ReKp=2300 [ 1+8,6 (d/D) °-“].
262
Основные уравнения гидравлики и теплопередачи
Таблица 8.5. Значение коэффициента длины
Re Hd
1 2 5 10 15 20 30 40
104 1,65 1,50 1,34 1,23 1,17 1,13 1,07 1,03
2-Ю4 1,51 ’ 1,40 1,27 1,18 1,13 1,10 1,05 1,02
5-104 1,34 1,27 1,18 1,13 1,10 1,08 1,04 1 ;o2
10в 1,28 1,22 1,15 1,10 1,08 1,06 1,03 1,02
106 1,14 1,11 1,08 1,05 1,04 1,03 1,02 1,01
8.12. ТЕПЛООТДАЧА
ПРИ ПРОДОЛЬНОМ ОБТЕКАНИИ
ПУЧКА ГЛАДКИХ ТРУБ
В многотрубных пучках интенсивность
теплоотдачи повышается. Коэффициент те-
плоотдачи можно определить по уравнению
Nu=0,021Re0.8Pr0.43(Pr/PreT)0'25X
XCs^/d2)».18, (8.35)
где Ргст — число Прандтля при темпера-
туре стенки трубы; и s2 — расстояния
между осями труб; d — диаметр труб.
Значения Re и Рг определяются по сред-
ней температуре потока. При нахождении
Re используется эквивалентный диаметр
канала. Формула применима при Re>5000.
8.13. ТЕПЛООТДАЧА РЕБРИСТЫХ
ТРУБ ПРИ ПРОДОЛЬНОМ
ОБТЕКАНИИ В * * * * * * * * * * * * * * * * * * * * * * * * * * *
В результате экспериментов на тепло-
обменнике типа «труба в трубе», в котором
использовалась ребристая труба с попереч-
ными спиральными ребрами, для коэффи-
циента теплоотдачи получено уравнение
182]
St=0,034Re-°.z2Pr-°’67. (8.36)
В качестве характерного размера для
межтрубного пространства использовался
эквивалентный диаметр
d3=D—d,
где D — внутренний диаметр ограждающей
обечайки; dH — наружный диаметр трубы
(по ребру). Опыты проводились' при Re=
=2-103ч-4-104. Характеристика ребристой
трубы: диаметр внутреннего канала 5 мм,
диаметр по основанию ребер 6 мм, наруж-
ный диаметр (по ребру) 11 мм, шаг ребер
1,6 мм, коэффициент оребрения 6,7.
Данные по. теплоотдаче согласуются
с результатами работы [81], в котовой про-
водились .исследования для Re— 4-104-е-
2-105.
Интенсивность теплоотдачи нескольких
ребристых труб, размещенных в общем ци-
линдрическом кожухе, при их продольном
обтекании повышается по сравнению с те-
плоотдачей единичной трубы. Эксперименты,
проведенные с тремя трубами, показали, что
коэффициент теплоотдачи возрастает при-
мерно на 20% [82].
Интересные результаты получены в
НПО «Гелиймаш» [80] при использовании
труб, оребренных спирально навитой на них
проволокой. Относительная высота ребра
(отношение диаметра проволоки к диаметру
оребряемой трубы) составляет 0,16—0,20,
диаметр используемых труб 1 —10 мм, диа-
метр проволоки — соответственно 0,16—
1,6 мм. Хороший тепловой контакт проволоки
и трубы обеспечивается, как отмечалось вы-
ше, соответствующим натяжением проволоки
в процессе навивки. В [90] приведены дан-
ные о теплоотдаче и гидравлическом сопро-
тивлении при продольном обтекании таких
короткореберных труб. Так, при использо-
вании труб 04X0,5 мм, обвитых проволо-
кой 00,5 мм с шагом 2 мм и размещенных
в количестве 7 шт. в ограничительной трубе
022 мм, теплоотдача характеризуется урав-
нением
St = 0,0676Re-0’29Pr-0’66. (8.37)
Пределы применимости уравнения: 4Х
X103<Re<2-105. Число Re определялось
по d3=^S/F, где S — плошадь среднего
сечения свободного объема, F — площадь
поверхности межтрубного пространства на
1 м длины теплообменника.
Авторы [90] отмечают, что в исследо-
ванной области значений наблюдается неза-
висимость (автомодельность) коэффициента
сопротивления от критерия Re.
8.14. ТЕПЛООТДАЧА
ПРИ ПОПЕРЕЧНОМ ОБТЕКАНИИ
ПУЧКОВ ГЛАДКИХ ТРУБ
Поток в межтрубном пространстве
практически стабилизируется при шахмат-
ном расположении труб начиная с 4-го ря-
да, при коридорном расположении — с 7-го
ряда.
Расчетные формулы [75]:
при коридорном расположении труб
Nu=0,2CzRe°.66Pr°’35; (8.38)
при шахматном расположении труб и
(si— d)/(s—d)X=0,7
Теплоотдача при естественной конвекции
263
Рис. 8.4. Поправка Cz на число рядов при
расчете теплоотдачи поперечно обтекаемо-
го пучка гладких труб
/ s \о,25
Nu = 0,334Cz ------ peo;6pro.3s. (8.39)
\ s — d J
при шахматном расположении труб и
(S1-d)/(s—d)<0,7
Nu=0,305CzRe°’6Pr0’35. (8.40)
В формулах (8.38) — (8.40) Cz — по-
правка на число рядов г в продольном на-
правлении (при малом числе рядов эта по-
правка имеет существенное значение и оп-
ределяется по графику рис. 8.4); ад — про-
дольный шаг; з2 — поперечный шаг;
•s = Ko,25s13s22 — диагональный шаг.
Скорость газа определяется по узкому се-
чению пучка.
За линейный размер при вычислении
Re принят наружный диаметр трубы d.
Формулы (8.38) — (8.40) применимы при
Re>6-103 для относительных шагов Si/d
и s%/d не менее 1,5 (см. также [87, 88]).
О теплопередаче в тесных пучках
(с малыми шагами) см. в [89].
Как отмечалось в § 3.5, условия тече-
ния газа в межтрубном пространстве вито-
го поперечноточного теплообменника отли-
чаются от условий обтекания регулярных
пучков, коэффициент теплоотдачи здесь
зависит не только от условий течения и
параметров пучка, но н от конструкции те-
плообменника и качества его изготовления.
Рекомендации по тепловому расчету неко-
торых частных случаев витых теплообмен-
ников см. в [74, 335, 336].
8.15. ТЕПЛООТДАЧА
ПРИ ПОПЕРЕЧНОМ ОБТЕКАНИИ
ПУЧКОВ РЕБРИСТЫХ ТРУБ
Коэффициент теплоотдачи для пучка
труб с круглыми поперечными ребрами
определяется по следующим формулам [69,
91]:
при коридорном расположении труб
Nu=0,117(d/s)-0’34(A/s)“0'14Re°.72Pr0>35;
(8.41)
при шахматном расположоении труб
Nu=0,251 (d/s)~°.54 (A/s)-°.I4Ke-o,65pro,35.
(8.42)
Здесь d — наружный диаметр трубы, несу-
щей ребра (по основанию ребер), м; s —
шаг ребра, м; h — высота ребер, м. За гео-
метрический размер при определении Re
принят шаг ребер з.
Из труб, оребренных проволокой, мож-
но, как отмечалось в § 8.13, изготовлять
весьма компактные поперечноточные тепло-
обменники по методу НПО «Гелиймаш»
[80]. Благодаря круглой форме ребер ис-
ключена возможность их деформации при
плотной намотке пакета без применения ка-
ких-либо проставочных элементов (намот-
ка всех слоев производится в одном на-
правлении). При этом удается полностью
механизировать процесс намотки и обеспе-
чить допуск в пределах +5% номинала для
поперечного шага и +1% для продоль-
ного.
Теплоотдача в межтрубном простран-
стве такого плотно навитого пакета может
быть определена по уравнению
St=0,168Re-0'3Pr~°-66 ( 8.43)
для области 50<Re<2000.
Об эффективности ребер см. в [96,.
334]. О теплоотдаче поперечно обтекаемых
ребристых трубок см. также в [76, 77, 94].
8.16. ТЕПЛООТДАЧА
ПРИ ЕСТЕСТВЕННОЙ КОНВЕКЦИИ
На основании обобщения эксперимен-
тальных данных установлено [92], что за-
висимость между критериями подобия мо-
жет быть представлена степенной функцией
вида
Nu=C(GrPr)«. (8.44)
Таблица 8.6. Значения Сид
в уравнении (8.44)
GrPr С п Режим движения
<10-з 0,5 0 Пленочный
IO-3—5-К3 1,18 1/8 Переходный
5-Ю3—2-Ю7 0,54 1 /4 Ламинарный
>2-107 0,135 1/3 Вихревой
Значения коэффициента С и показате-
ля степени п в функции комплекса (GrPr),
приведены в табл. 8.6.
При вычислении критериев подобия за
определяющий линейный размер принима-
ется: для труб и шаров — диаметр, для
плит — высота (для горизонтальных плит—
меньшая сторона). Расчетной температурой
считается среднее значение между темпе-
ратурой стенки и температурой среды на
большом удалении от стенки.
264
Основные уравнения гидравлики и теплопередачи
При расчете теплоотдачи горизонталь-
ных плит полученное из формул значение
коэффициента теплоотдачи должно быть
увеличено на 30%, если теплоотдающая по-
верхность обращена кверху, и уменьшено
на 30%, если теилоотдающая поверхность
обращена книзу.
О передаче теплоты естественной кон-
векцией в условиях замкнутого пространст-
ва (плоские и кольцевые щели) см. в [93,
94].
8.17. ТЕПЛООТДАЧА ПРИ КИПЕНИИ
ЖИДКОСТИ
Кипением называется процесс интенсив-
ного испарения жидкости, несколько пере-
гретой относительно температуры насыще-
ния. Кипение возможно во всем интервале
температур между критической и тройной
точками вещества. Режим кипения обычно
характеризуют зависимостью плотности те-
плового потока на поверхности нагрева q,
Вт/м2, от температурного напора \Т =
=Тс—TR, где Тс — температура стенки на-
гревателя; Т„ —'температура насыщения
жидкости при данном давлении. Зависи-
мость q=f(AT) носит название кривой ки-
пения.
Для примера на рис. 8.5 показана кри-
вая кипения воды. Левее точки А теплота
передается жидкости путем свободной кон-
векции (без кипения). От точки А до точ-
ки В — участок пузырькового режима ки-
пения, когда пар образуется з виде пу-
зырьков во многих местах греющей по-
верхности; пузырьки растут, отрываются от
поверхности и всплывают. Тепловой ноток
при пузырьковом режиме кипения дости-
гает максимума в точке В (первая крити-
ческая плотность теплового потока <7Kpi).
Для воды <уКр1=э1,2 -106 Вт/м2 при А7’=
=25-^35 К. Для сравнения отметим, что
Рис. 8.5. Кривая кипения воды в большом
объеме:
••• — свободная конвекция (без кипения);
-----—пузырьковый режим кипения;------------
переходный режим; — — —пленочный режим
кипения
у жидкого гелия (/кщяД • 104- Вт/м2 при
ДТ%1 к.
При дальнейшем увеличении А.Т насту-
пает переходный режим кипения (от В до
С), при котором отдельные пузырьки пара
сливаются, образуя большие паровые поло-
сти. На греющей поверхности возникают
«сухие» пятна, здесь передача теплоты
к жидкости резко уменьшается из-за боль-
шого термического сопротивления пара. При
температурном напоре, соответствующем
точке С, жидкость полностью оттесняется
от греющей поверхности, наступает мини-
мум тепловой нагрузки (вторая критическая
плотность теплового потока <?kpz). Дальней-
шее увеличение ДГ приводит к пленочно-
му кипению, при котором теплота от грею-
щей поверхности к жидкости передается
теплопроводностью паровой пленки и излу-
чением.
При кипении криоагентов наибольший
интерес представляет область пузырькового
кипения.
Теплоотдача при кипении определяется
многими, порой трудно учитываемыми фак-
торами, поэтому при обобщении экспери-
ментальных данных возникают большие за-
труднения.
Для оценки теплоотдачи при пузырько-
вом кипении в условиях естественной кон-
векции в большом объеме можно в первом
приближении воспользоваться критериаль-
ным уравнением Кутателадзе [96]
Nu = 7- 10-4Рг“0'35 (РеКр)0’7, (8.45)
где Кр= Р.'У vg(p' — /'); Р — давле-
ние, Па; о — коэффициент поверхност-
ного натяжения жидкости, Н/м; р' и р" —
плотности соответственно жидкости и пара,
кг/м3; g — ускорение свободного падения,
м/с2.
Имеющиеся экспериментальные данные
по кипению криоагентов (кислорода, азо-
та, водорода, гелия) качественно соответ-
ствуют уравнению (8.45), но количественно
могут отличаться от расчетных значений в
5 раз [97, 338]. Это в значительной мере
объясняется тем, что уравнение (8 45) не
учитывает состояние греющей поверхности
(физические свойства, шероховатость, тол-
щину, геометрию, ориентацию в пространст-
ве и т. д.).
Для определения первой критической
плотности теплового потока, Вт/м2 (при
кипении в большом объеме), можно исполь-
зовать другое уравнение Кутателадзе [98]:
<7крх = 0,14г Кр" / ag(?' — р”), (8.46)
где г — удельная теплота испарения жид-
кости, Дж/кг.
Уравнение (8.46), так же как и
(8.45), не учитывает влияния поверхностных
условий, и экспериментальные значения
<7кР1 отличаются от расчетных на ±35%.
Теплоотдача при конденсации
265
Теплоотдачу при кипении можно су-
щественно увеличить путем нанесения на
греющую поверхность теплопроводного по-
крытия капиллярно-пористой структуры.
Как показано в [99], при использовании
алюминиевых труб с нанесенным на их на-
ружную поверхность пористым слоем тол-
щиной 0,4—0,5 мм (методом газотермиче-
ского напыления алюминиевого сплава) ус-
ловия для теплообмена с кипящей жидко-
стью значительно улучшаются. При этом
плотность теплового потока при кипении
азота и кислорода возрастает в 8—10 раз,
а температурный напор уменьшается в 2,5—
3 раза.
Теплоотдача при кипении в ограничен-
ном объеме, например в трубах, сущест-
венно зависит от их ориентации, так как
этим определяются характер и скорость
движения кипящей жидкости; поэтому рас-
чет теплоотдачи при кипении следует про-
изводить, используя соответствующие экс-
периментальные данные.
Подробно о теплоотдаче при кипении
криоагентов см. в [97, 100].
8.18. ТЕПЛООТДАЧА
ПРИ КОНДЕНСАЦИИ
Теоретическая формула Нуссельта
[337] для коэффициента теплоотдачи а при
пленочной конденсации и изотермическом
ламинарном движении чистого конденсата
по вертикальным плоской стенке или трубе
имеет вид
a = 0,943 1/^fr. (8.47)
где а — коэффициент теплоотдачи,
Вт/(м2-К); г — теплота конденсации жид-
кости, Дж/кг; р — плотность жидкости,
кг/м3; X — теплопроводность жидкости,
Вт/(м-К); т| — динамическая вязкость
жидкости, Па-с; Н — высота стенки или
трубы, м; AT=Tr—Тс — разность между
температурой насыщения жидкости и темпе-
ратурой стенки, К-
Для одиночной горизонтальной трубы
диаметром d формула Нуссельта имеет вид
а=°’72Z-^- ('8-48>
В уравнениях (8.47) и (8.48) не учиты-
ваются зависимости физических свойств
жидкости от температуры. Чтобы учесть их
[701], в правую часть уравнений надо вве-
сти поправочный множитель ет=(Хс/Хн)3Х
X(Лн/Лс)°’125, где индексы «с» и «н» озна-
чают, что коэффициент определяется соот-
ветственно при температуре стенки или
при температуре насыщения. Остальные ве-
личины, входящие в уравнения (8.47) и
(8.48),. принимают по температуре насыще-
ния жидкости.
Экспериментальные данные для верти-
кальной стенки дают большие значения ко-
эффициента теплоотдачи, чем полученные
по теоретической формуле (примерно на
20—22%). Как показал П. Л. Капица
[702], расхождение связано с тем, что в
теории Нуссельта не учитывалось поверх-
ностное натяжение жидкостной пленки. При
учете этого эффекта движение пленки ока-
зывается волновым, а ее эффективная теп-
лопроводность повышается примерно на
20%.
Начиная с некоторой высоты течение
пленки конденсата становится турбулент-
ным. Этот переход для вертикальной по-
верхности [69, 703] определяется значени-
ем ReKp=100. Число Рейнольдса для плен-
ки конденсата
G qL
Re =----= —----- = —-----,
ч ЗбООт] 3600v
где v — средняя скорость течения пленки,
м/с; гиг, — соответственно кинематиче-
ская и динамическая вязкость пленки, м2/с
и Па-с; г — теплота конденсации, Дж/кг;
G — количество конденсата, протекающего
через данное сечение пленки на ширине 1 м,
кг/(м-ч). Для вертикальной стенки высо-
той L„ м, и при средней тепловой нагрузке
<7, Вт/м2, G = qL/r.
При турбулентном течении пленки по
вертикальной стенке коэффициент теплоот-
дачи определяется уравнением [69, 703]
а = I (y/v2) °-330,16Pr°-33Re/ (Re—100 +
+ 63Pr°-33). (8.49)
Обозначения см. выше.
Если пар поднимается снизу вверх, то
стекание пленки конденсата затрудняется
и коэффициент теплоотдачи уменьшается.
Интенсивное движение конденсирующе-
гося пара сверху вниз увеличивает ко-
эффициент теплоотдачи по сравнению со
случаем медленно движущегося пара. Если
cio — коэффициент теплоотдачи для мед-
ленно движущегося пара, то коэффициент
теплоотдачи для пара, движущегося со зна-
чительной скоростью, а=Е<хо- Поправочный
множитель е при турбулентном течении
пленки (Re>100) [98]
е= 1+0,013 (,р7р') °-5оп/ (yv)0-33,
где р' и р" — плотность соответственно
жидкости и пара, кг/м3; v — кинематиче-
ская вязкость, м2/с; — расчетная ско-
рость пара, м/с, определяемая по уравне-
нию
— ~\/Г“з" 712 + г'1:’2 + "г'а2,1 ’
где 01 и о2 — скорости пара при входе
в конденсатор и выходе из него.
При конденсации пара в горизонталь-
ных трубах изменение режима течения плен-
ки происходит при Re=G/3600r]~50, где
266
Основные уравнения гидравлики и теплопередачи
G — количество конденсата, текущего по
трубе на 1 м ее длины, кг/(м-ч).
Приведенные формулы применимы для
конденсации чистого пара, т. е. не содер-
жащего неконденсирующихся газовых при-
месей. Присутствие последних приводит
к значительному уменьшению коэффициента
теплоотдачи.
Экспериментальные значения коэффици-
ентов теплоотдачи при конденсации кисло-
рода и азота, а также методику расчета
конденсаторов см. в [703, 604].
8.19. ОСНОВЫ РАСЧЕТА
ТЕПЛООБМЕННИКОВ
По принципу действия теплообменные
аппараты, используемые в криогенной тех-
нике, делятся на рекуператоры и регенера-
торы. В рекуператорах стационарный про-
цесс теплопередачи происходит путем тепло-
проводности через твердую стенку, разде-
ляющую охлаждаемую и нагреваемую сре-
ды. В регенераторах поверхность насадки
попеременно омывается холодной и теплой
средами; теплота от одной среды к другой
передается путем периодических нестацио-
нарных процессов охлаждения и нагревания
теплоемкой насадки.
Основные расчетные формулы тепло-
передачи:
Q=kF^Tc-B (для плоской стенки); (8.50)
<2=&'АДТср (для цилиндрической трубы),
(8.51)
где Q — тепловой поток; Вт; k — общий
коэффициент теплопередачи, . Вт/(м2-К);
k' — линейный коэффициент теплопередачи
(на единицу длины трубы), Вт/(м-К);
АГср — средняя разность температур меж-
ду теплообменивающимися потоками (тем-
пературный напор), К. Общий коэффици-
ент теплопередачи через плоскую стенку
к ' а2
Линейный коэффициент теплопередачи для
цилиндрической трубы
k’ = —-------j---?---------—, (8.53)
+ -57 1n(d1/d2)+~~
где ctj и ct2 —- коэффициенты теплоотдачи
соответствующих теплообменивающихся
потоков, Вт/(м2-К); 6 — толщина стенки,
разделяющей потоки, м; di и d2 — соответ-
ственно наружный и внутренний диаметры
цилиндрической трубы, м; X — теплопро-
водность материала стенки или трубы.
В конструкциях низкотемпературных
теплообменников для изготовления тепло-
передающей поверхности обычно использу-
ют металлы с высокой теплопроводностью
(медь, алюминий), а толщина стенки не
превышает 1—2 мм. В этом случае тепло-
вое сопротивление на границе стенки (1/«)
на 2 порядка больше теплового сопротивле-
ния стенки (6Д) и последнее можно не
учитывать.
Средний температурный напор ДТОр
чаще всего определяют по формуле для
среднелогарифмического значения
где ДТб и ДТМ — соответственно большее
и меньшее значения температурного напора
на концах теплообменника. При ДТв/Д7"м^
^1,7 среднелогарифмическую разность мож-
но заменить среднеарифметической ДТСр~
«з(ДТб+Д^м) /2 (с погрешностью менее
2%).
Формула (8.54), строго говоря, дейст-
вительна только для случая, когда тепло-
емкости теплоносителей и коэффициент те-
плопередачи не зависят от температуры.
В криогенных установках с понижением
температуры может наблюдаться существен-
ное изменение теплоемкости газов, особенно
при давлениях, близких к критическому.
Так, для воздуха при давлении 4 МПа
теплоемкость с понижением температуры
изменяется в десятки раз, однако при дав-
лении 20 МПа —• всего в 1,5 раза; при
давлениях, близких к атмосферному, тепло-
емкость всех газов можно считать не за-
висящей от давления.
Когда в процессе теплообмена наблю-
дается сильное изменение теплоемкости,
следует использовать среднеинтегральную
разность температур. Если принять, что об-
щее количество теплоты Q передается рав-
ными частями на п участках теплообменной
поверхности, на каждом из которых раз-
ность температур между потоками &Тг, то
средний температурный напор
/п
у;----.
Li ЛЪ
z=i
8.20. КОНСТРУКТИВНЫЕ СХЕМЫ
ТЕПЛООБМЕННИКОВ
На рис. 8.6 даны принципиальные схе-
мы теплообменников, наиболее часто при-
меняемых в криогенной технике.
Рис. 8.6. Принципиальные схемы теплообменников:
а — из спаянных гладких трубок; б—типа «труба в трубе»; в — змеевиковый; г — из ребристой
трубки с продольным обтеканием; д — прямотрубный; е — прямотрубный двухсекционный с попе-
речными перегородками; ж — витой поперечно обтекаемый из гладких трубок; з — витой попе-
речно обтекаемый из оребренных трубок; и—пластинчато-ребристый; к—пластинчатый матричный
268
Основные уравнения гидравлики и теплопередачи
Теплообменник из соединенных по всей
длине гладких труб (чаще всего спаянных
легкоплавким припоем) обладает сравни-
тельно высокой эффективностью и прост в
изготовлении (рис. 8.6,а). Теплообменники
этого типа применяются только при срав-
нительно малом расходе теплообмениваю-
щихся потоков (примерно до 100 м3/ч).
В аппарате подобного типа легко осущест-
вить теплообмен не только между двумя,
но и большим числом потоков. Для каж-
дого потока можно варьировать число труб
и их размер (например, для обратных пото-
ков газов низкого давления используется
обычно большое число труб, чем для пря-
мых потоков сжатых газов). Чаще всего
подобные теплообменники применяются в не-
больших лабораторных ожижителях водо-
рода и гелия. Конструктивно теплообмен-
ники из спаянных труб изготовляются обыч-
но в виде спиралей сравнительно большого
диаметра (150—350 мм); пространство вну-
три спирали удобно использовать для раз-
мещения других элементов ожижителя.
Применяются медные трубы с наружным
диаметром 5—7 мм и толщиной стенки
0,5—1 мм (в зависимости от давления
криоагента). Скорость газовых потоков вы-
бирается в пределах 1—5 м/с для прямых
потоков сжатых газов и 29—40 М/С для об-
ратных потоков расширенных газов (боль-
шие значения — для водорода и гелия).
Теплообменник типа «труба в трубе»
(рис. 8.6,6) также применяется при неболь-
ших расходах теплоносителей. Он характе-
ризуется сравнительно малой поверхностью
теплопередачи и относительно большой
удельной массой (поверхность наружной
трубы не участвует в передаче теплоты).
Используется чаще всего в холодильных
установках и в качестве холодильников
компрессоров.
Змеевиковый (или якорный) теплооб-
менник (рис. 8.6,б) изготовляется из срав-
нительно небольшого числа длинных труб
(обычно медных), которые на концах объ-
единены коллекторами. Трубы заключены
в кожух, который может быть как круглого,
так и любого другого сечения. Змеевиковые
теплообменники применяются в установках
разделения воздуха, коксового и других
газов и при сравнительно небольшой про-
изводительности. Допускаемые скорости га-
за 10—20 м/с для межтрубного простран-
ства и 0,5—1,5 м/с для сжатого газа в
трубах.
Интенсивность теплопередачи в змееви-
ковых теплообменниках н теплообменниках
типа «труба в трубе» может быть значи-
тельно повышена при использовании внут-
ренней оребренной трубы (рис. 8.6,г). Такая
труба может быть получена как поперечной
холодной прокаткой из гладкотрубной за-
готовки, так .и отдельной навивкой ребра,
например из . проволоки. Теплообменники
этого типа могут выполняться как прямо-
трубными, так и змеевиковыми, с одной или
несколькими ребристыми трубами. Скорость
газа в трубах выбирается в пределах 1 —
5 м/с, в межтрубном пространстве 15—
25 м/с.
Кожу хот рубный теплообменник (рис.
8.6,д) применяется в криогенной технике
обычно при средних расходах газа (500—
3000 м3/ч). В межтрубном пространстве
такого теплообменника часто устанавлива-
ют перегородки, изменяющие направление
потока и интенсифицирующие теплоотдачу.
Для компенсации термических деформаций
кожуха и трубок применяют либо линзовые
компенсаторы на кожухе, либо сальниковое
уплотнение одной из трубных решеток, до-
пускающее ее перемещение. В некоторых
случаях кожухотрубные теплообменники
выполняют многосекционными (рис. 8.6,е).
Витой поперечноточный теплообмен-
ник из гладких труб (рис. 8.6,ж) чаще все-
го применяется в установках большой про-
изводительности. Варьируя диаметр пакета
и его длину, можно получить весьма эф-
фективный теплообменник, способный про-
пускать практически любое количество га-
за. Расстояние между трубами в попереч-
ном направлении фиксируется прокладками
между слоями навивки. Для выравнивания
длины навивки отдельных слоев число па-
раллельно навиваемых труб увеличивают
по мере увеличения диаметра навивки. Эф-
фективность витого теплообменника в зна-
чительной мере зависит от качества его из-
готовления (точности соблюдения шага на-
вивки в поперечном и продольном направ-
лениях, исключения перетока газа через за-
зор между наружным рядом трубок и ко-
жухом). Хорошим методом производствен-
ного контроля качества изготовления слу-
жат продувка межтрубного пространства
готового теплообменника воздухом и срав-
нение получаемого гидравлического сопро-
тивления с расчетным.
Во избежание большого гидравличе
ского сопротивления линейная скорость газа
в межтрубном пространстве не должна пре-
вышать 15—20 м/с (газ низкого давления).
Поперечноточный витой теплообменник
из ребристых труб показан на рис. 8.6,з.
Ребристые трубы с относительно длинными
ребрами позволяют расширить область при-
менения витого теплообменника в сторону
малых расходов; при этом получают аппа-
раты с небольшим гидравлическим сопро-
тивлением по межтрубному пространству.
Оригинальная конструкция витого по-
перечноточного теплообменника из труб
с короткими ребрами, получаемых путем
навивки проволоки на гладкую трубу, раз-
работана в НПО «Гелиймаш» ;[80]. При
навивке пакета все слои труб наматываются
в одном направлении, без каких-либо про-
кладок, что позволяет механизировать тру-
доемкий процесс. По этой методике можно
оребрять трубы малого диаметра, что по-
Конструктивные схемы теплообменников
269
.зволяет существенно интенсифицировать
процесс теплообмена (используются трубы
диаметром от 1 до 10 мм при диаметре
оребряющей проволоки соответственно от
0,16 до 1,6 мм). Теплообменники этого типа
сейчас широко используются при изготов-
лении гелиевых ожижительных установок.
Пластинчатый теплообменник (рис.
8.6,и) находит применение в криогенных
установках, перерабатывающих большие
количества газа низкого давления. Подроб-
ные данные по конструкции, применению и
методике расчета даны в [76, 77].
Матричный теплообменник (рис. 8.6,к)
разработан фирмой «Филипс» [339] и ис-
пользуется в небольших гелиевых ожижи-
телях этой фирмы. Теплообменник состоит
из отдельных пластин, изготовленных из
материала с хорошей теплопроводностью
Таблица 8.7. Характеристика медных
труб, используемых при изготовлении
теплооб менников
Наружный диа- метр и толщина г стенок, мм Масса I м длины труб- ки, кг Предельное рабочее давление, МПа
3X0,5 0,035 20,0
4X0,5 0,049 13,3
5X0,5 0,063 10,0
5X1 0,112 26,7
6X0,5 0,077 8,0
6X1 0,140 20,0
7X0,5 0,691 6,7
7X1 0,168 16,0
8X0,75 0,152 9,2
8X1 0,196 13,3
8X1,5 0,273 24,0
9X1 0,224 11,4
10X1 0,252 10,0
10X1,5 0,356 17,1
12X1 0,307 8,0
12X1,5 0,440 12,0
12X2 0,559 20,0
13X1 0,335 7,3
13X1,5 0,482 12,0
.13X2 0,615 17,8
14X1 0,363 6,7
14X1,5 0,524 10,9
14X2 0,671 16,0
.16X1 0,419 5,7
16X1,5 0,608 9,2
16X2 0,783 13,3
18X1 0,475 5,0
18X1,5 0,692 8,0
18X2 0,895 11,4
20X1 0,531 4,4
20X1,5 0,776 7,0
.20X2 •1,007 10,0
(медь, алюминий) в виде сетки или листа
с перфорацией (отверстия или щели) для
прохода газа. Пластины разделяются пласт-
массовыми прокладками с отверстиями, ко-
торые образуют каналы для потоков. Весь
пакет собирается на соответствующем клее,
прессуется и после термообработки состав-
ляет единый монолит. Матричные теплооб-
менники имеют очень высокую компактность
(до 5000 м2/м3) и могут выдерживать от-
носительно высокое давление в каналах (до
2,0 МПа). См. также [705, 706].
Материалы для изготовления теплооб-
менников криогенных установок. Использу-
ются медь, алюминий, сплавы на их основе,
нержавеющая сталь марки 12Х18Н10Т.
Трубы чаще всего медные (характеристика
труб дана в табл. 8.7). Трубные решетки
изготовляют из железомарганцевой латуни
ЛЖМЦ. В табл. 8.8 приведено количество
Таблица 8.8. Количество труб,
размещаемых на трубной решетке [707]
D/t st s2 D/t Si Si
2 7 7 52 2455 2194
4 19 19 54 2653 2363
6 37 37 56 2857 2438
8 61 62 58 3055 2620
10 91 93 60 3259 2808
12 127 130 62 3469 30<j2
14 187 173 64 3697 3202
16 241 223 66 3949 3409
18 301 279 68 4195 3622
20 ' 367 -341 70 4447 3842
22 439 410 72 4693 4067
24 517 485 74 4945 4299
26 613 566 76 5215 4537
28 721 653 .78 5503 4782
30 823 747 80 5721 5032
32 931 847. 82 6085 5289
34 1045 953 84 6385 5552
36 1165 1066 86 6679 5822
38 1306 1185 88 6979 6098
40 1459 1310 90 7297 6380
42 1615 1442 92 7645 6669
44 1765 1580 94 7981 6964
46 1921 1724 96 8323 7264
48 2083 1874 98 8671 7571
50 2263 2031
труб, размещаемых на трубной решетке по
периметрам правильных шестиугольников
(с учетом заполнения сегментов) Si и по
концентрическим окружностям S2, в зави-
симости от диаметра трубной решетки (по
.центрам крайних труб) D и шага между
трубами t .[707].
270
Методы расчета процессов -дистилляции и ректификации
Раздел девятый
МЕТОДЫ РАСЧЕТА ПРОЦЕССОВ
ДИСТИЛЛЯЦИИ И РЕКТИФИКАЦИИ
9.1. дистилляция
Компоненты жидкой смеси при одной
и той же температуре характеризуются раз-
личной упругостью паров. При равновесии
между паровой и жидкой фазами концен-
трация одного из компонентов в паре
(обычно легкокипящего) выше, чем концен-
трация его в жидкости. Используя это раз-
личие в концентрациях жидкости и пара,
путем дистилляции или ректификации смесь
можно разделить на отдельные компонен-
ты желаемой чистоты.
При простой (дифференциальной) ди-
стилляции бинарного раствора образующий-
ся при кипении жидкости пар сразу уда-
ляется и конденсируется в холодильнике.
Из дифференциального уравнения матери-
ального баланса
ydL=d{Lx)—xdL-^Ldx
путем интегрирования получаем
х.
LK ( dx
In —= I --------,
4 J y — x
Xq
(9-1)
где Lo и LK — начальное и конечное коли-
чества жидкости; х, х0 и хк — соответст-
венно равновесная, начальная и конечная
концентрации легкокипящего компонента в
жидкости; у—концентрация легкокипящего
компонента в паре.
В общем случае уравнение (9.1) реша-
ется графическим интегрированием. В слу-
чае разбавленных растворов, когда соблю-
дается закон Генри y=kx, получаем
Если для равновесной линии зависи-
мость у от х подчиняется уравнению (2.63),
то
1 1 /. хк . ,1 —
In —— =-------- I In — + a In --- .
Eq й 1 \ Xq 1 Хк/
(9.2а)
Расчет для многокомпонентных смесей дан
в [10, 52, 528, 577].
При дистилляции нельзя получить до-
статочно полного разделения компонентов
с большим выходом разделяемых продук-
тов, поэтому в криогенной технике этот
процесс не получил распространения.
Частичную конденсацию какой-либо
смеси газов можно проводить двумя спо-
собами: так называемой прямоточной и
противоточной конденсацией.
При прямоточной конденсации вся ох-
лаждаемая смесь движется вдоль охлажда-
ющей поверхности в том же направлении,
что и выделяющийся конденсат. Во всех
сечениях аппарата пар и конденсат нахо-
дятся в фазовом равновесии.
При противоточной конденсации охлаж-
даемая смесь газов движется противото-
ком к стекающему конденсату, выделяюще-
муся из смеси. Происходящие здесь явления1
более сложны, чем в случае прямоточной
конденсации. Подробнее о прямоточной и
противоточной конденсации см. в [257, 589,
590, 591, 592, 778].
9.2. РЕКТИФИКАЦИЯ
Наиболее эффективным способом раз-
деления жидких растворов служит ректи-
фикация —, процесс, в котором осуществ-
ляется непрерывный контакт двух фаз (па-
ра и жидкости), обеспечивающий массо- и
теплообмен между ними.
Для осуществления процесса ректифи-
кации используются колонные аппараты, в
которых жидкость и пар движутся проти-
вотоком.
Вследствие имеющейся разницы темпе-
ратур и концентраций между жидкостью и
паром в ректификационном аппарате проис-
ходит изменение состава и температуры
этих фаз в направлении установления меж-
ду ними физико-химического равновесия.
Вследствие переноса массы вещества вверх
поднимающимся паром и вниз стекающей
жидкостью происходит непрерывное нару-
шение равновесия в благопр мтную сторо-
ну: обогащение пара более легкокимщим
компонентом и обеднение им жидкости. Фи-
зические процессы массо- и теплообмена
протекают на границе между фазами, по-
этому в ректификационных аппаратах важ-
но создать максимальную поверхность кон-
такта фаз.
Процесс массообмена осуществляется
встречной диффузией из жидкой в паровую
фазу и наоборот через пограничные пленки
со стороны каждой фазы. Эти пленки по
наиболее распространенной теории массооб-
мена служат основным сопротивлением пе-
реходу вещества из одной фазы в другую.
Движущей силой диффузии является нерав-
новесная разность концентраций между
фазами.
Процесс ректификации может осуществ-
ляться непрерывно и периодически. Чаще
используется непрерывная ректификация,
Ректификация производится в насадоч-
ных, пленочных и тарельчатых колоннах.
Графические методы определения числа идеальных тарелок
271
Насадочные колонны широко употребляются
•в установках малой производительности.
•Они особенно эффективны при диаметре
колонны менее 50 мм. В насадочных ко-
лоннах большого диаметра трудно полу-
чить чистые продукты вследствие неравно-
мерного смачивания насадки жидкостью.
Недостатком насадочных колонн является
.их относительно большое гидравлическое
сопротивление. Пленочные колонны широ-
кого распространения не получили: непо-
движные — из-за трудности равномерного
.распределения жидкости (флегмы) между
большим количеством отдельных элементов
(трубок), вращающиеся — из-за относи-
тельной сложности изготовления и эксплу-
атации.
В большинстве случаев используются
тарельчатые колонны.
Исходными данными при конструиро-
.ванпп колонны служат ее высота и диа-
метр: для тарельчатых колонн, кроме того,
.необходимо знать число тарелок и размеры
их элементов.
9.3. ГРАФИЧЕСКИЕ МЕТОДЫ
ОПРЕДЕЛЕНИЯ ЧИСЛА ИДЕАЛЬНЫХ
ТАРЕЛОК
Для вычисления числа тарелок ректи-
фикационной колонны разработано несколь-
ко способов. Один из наиболее распростра-
ненных базируется на понятии идеальной
тарелки, или ступени изменения концеитра-
цип.
Идеальной называют такую тарелку, на
.которой поднимающиеся пары и стекающая
.жидкость находятся в фазовом равновесии.
В действительности по ряду причин равно-
весне на тарелке не достигается и поэтому
для перехода от числа идеальных тарелок
к числу действительных вводят соответст-
вующий коэффициент, называемый средним
коэффициентом эффективности тарелки
Добщ, т. е.
число идеальных тарелок
Добщ “ "
число действительных тарелок
или определяют е — число действительных
тарелок, соответствующее одной ступени
изменения концентрации.
Наиболее простым и наглядным можно
считать графический метод, подсчета числа
идеальных тарелок по х, у-диаграмме, пред-
ложенной Мак-Кэбом и Тиле [52, 528, 529,
588]. В этом методе предполагается, что
мольные теплоты парообразования обоих
компонентов равны и, следовательно, пото-
ки жидкости и пара по высоте колонны
неизменны. Количество идеальных тарелок
определяется числом ступеней, которые
можно построить между равновесной кри-
вой и рабочими линиями.
Для любого поперечного сечения ко-
лонны между тарелками в концентрацион-
ной (верхней) части колонны (рис. 9.1) на
основе материального баланса справедливы
равенства
L D
Уп = L+D Xn"1+ L + D Xd’
R XD
Уп = А'+1 ’
(9-3)
где уп — содержание легкокипящего ком-
понента в парах, уходящих с га-й тарелки;
Хп-1 — содержание легкокипящего компо-
нента в жидкости, стекающей с вышележа-
щей тарелки (п—1, счет тарелок ведется
Дефлегматор
G=D+L
Рис. 9.1. Графическое определение числа тарелок по способу Мак-Кэба и Тиле
272
Методы расчета процессов дистилляции и ректификации
} (9-4)
сверху); хв — содержание легкокипящего
компонента в дистилляте; О — количест-
во дистиллята, отбираемого в единицу вре-
мени; L — количество стекающей флегмы
в единицу времени; R—L/D — так назы-
ваемое флегмовое число.
Уравнения (9.3) называются уравне-
ниями верхней рабочей линии.
Уравнения для отгонной (нижней) ча-
сти колонны, получаемые из материальных
балансов, имеют вид
L-j-D M — D
Уп + M + LXv’
L-j-M M — D
Уп = L-i-DX"n~1~ M+L Xw’
R-j-M' М' — 1
Уп = R+ 1 Хп-г ~М’ + RXw’
где М—количество жидкой смеси, вводимой
на ректификацию в единицу времени; М'=
=M/D; xw—содержание легкокипящего
компонента в «нижнем» продукте; осталь-
ные обозначения те же, что и в (9.3).
Уравнения (9.4) называются уравне-
ниями нижней рабочей линии. Следует от-
метить, что в (9.3) и (9.4) коэффициенты
при х, определяющие наклоны рабочих ли-
ний, представляют собой отношения коли-
чества стекающей жидкости и количеству
поднимающегося пара на данном участке
колонны.
Графическое построение для определе-
ния числа тарелок удобно производить в
следующем порядке (рис. 9.1). Для рас-
сматриваемой бинарной системы по опыт-
ным данным или данным, полученным тео-
ретически по закону Рауля (см. §2.15),
строится в координатах у, х кривая равно-
весия.
На диагонали отмечается точка D, ха-
рактеризуемая концентрацией «верхнего»
продукта хв, и точка W определяется кон-
центрацией кубового остатка xw. Из точки
D проводится верхняя рабочая линия (для
концентрационной части) под углом, тан-
генс которого равен R/(R+1) =L/G.
Из точки Хм (на оси х), соответствую-
щей содержанию легкокипящего компонен-
та в поступающей на разделение смеси,
проводим вертикаль до пересечения с диа-
гональю в точке С. Если исходная смесь
представляет собой жидкость при темпера-
туре кипения (насыщенная жидкость), то
продолжение вертикали до пересечения с
рабочей линией DF дает точку М, которая
в данном случае служит искомой точкой
пересечения рабочих линий (рабочую ли-
нию MW для отгонной части колонны стро-
ят после нахождения точки Л-1). Если пи-
тание колонны смешанное, т. е. представ-
ляет собой смесь жидкости и пара, то из
точки С проводится прямая CF под углом а
к горизонтали, тангенс которого равен от-
ношению жидкой доли в исходной смеси
к паровой. Рабочие линии в этом случае
будут пересекаться в точке F (рабочая ли-
ния для отгонной части FW). Возможен в
третий случай, когда питание колонны осу-
ществляется насыщенным паром. Тогда
проводят горизонталь из точки ум (состав,
питания) до пересечения с верхней рабочей
линией в точке N. Рабочей линией отгон-
ной части будет прямая NW [52, 588].
Уравнения (9.3) на диаграмме пред-
ставлены линией DF, а уравнения (9.4) —
линией FW.
Для определения числа идеальных та-
релок производят ступенчатое построение,,
показанное на рис. 9.1. Точки, лежащие-
на кривой равновесия, соответствуют соста-
ву пара, поднимающегося с данной идеаль-
ной тарелки, и составу стекающей с этой
тарелки жидкости. Точки, лежащие на ра-
бочих линиях, соответствуют жидкости, сте-
кающей с тарелки, и пару, поднимающему-
ся с нижележащей тарелки, т. е. составу
жидкости и пара до их взаимодействия на
тарелке.
Наклон рабочей линии концентрацион-
ной части зависит от соотношения LI(L+
+D) или, считая на единицу дистиллята,
от р/(Р+1). Чем больше эти отношения,
тем ближе к диагонали проходит рабочая-
линия и тем меньше потребуется идеальных
тарелок. При £>=0 отношение L/(L+iD) =
= 1 и рабочая линия совпадает с диаго-
налью, при этом число тарелок минималь-
но. Условие D = 0 соответствует работе ко-
лонны без вывода дистиллята.
Минимальное количество флегмы
соответствует случаю, когда линия из точ-
ки D. проходит через точку Мт, т. е. пере-
секает кривую равновесия в точке, отвечаю-
щей концентрации питания Хм и ум^™
(при жидкостном питании). Очевидно, в
этом случае
^мин
^мин + 1
Y ____,.Равн
УМ
.равн ’
y __ ,/Равн
н ° Ум
ЛМИН---
„равн _
Ум ХМ
(9.5)
Условию /?мин соответствует бесконеч-
ное число тарелок.
Фактическое флегмовое число R берется-
обычно на 20—70% больше минимального.
Для получения действительного числа та-
релок необходимо число идеальных (теоре-
тических) тарелок разделить на коэффици-
ент эффективности тарелки.
При подаче флегмы в колонку со сто-
роны, а не из дефлегматора рабочая линия-
концентрационной части колонны проводит-
ся под углом, тангенс которого равен-
/?/(/?-[-1), через точку, отвечающую факта-
Графические методы определения числа идеальных тарелок
273'
ческой концентрации пара и жидкости на-
верху колонны.
При очень малых и, напротив, очень
больших значениях концентраций конечных
продуктов на обычной диаграмме х, у за-
труднительно находить число идеальных
тарелок методом построения ступенек. При
очень малых и очень больших х (a=const)
уравнение (2.63) приводится к линейно-
му виду:
у = ах для х —» 0;
у =----(х — 1) + 1 для х -> 1.
а '
При построении концевых участков
кривой равновесия по уравнению (9.6)
в логарифмической системе координат эти
участки равно выпрямляются и становятся
параллельными диагонали х=у. Таким
образом, их можно построить для любых
значений высоких и малых концентраций.
Рабочую линию, которая в логарифмиче-
ских координатах имеет характер кривой,
строят по нескольким точкам, вычисляемым
.по уравнениям рабочих линий. Подробнее
о методе см. в [33, 528J.
Графический метод определения числа
идеальных тарелок по диаграмме х, у (ме-
тод Мак-Кэба и Тиле) не учитывает разли-
чия теплот испарения разделяемых компо-
нентов.
От этого недостатка свободен метод
Пуаншона [530J, по которому использует-
ся график в координатах h, х (энтальпия —
концентрация). Подробное изложение этого
метода дается во многих руководствах по
ректификации и в других книгах (см., на-
пример, [10, 14, 41, 203, 236, 528, 588—
591J).
В диаграмме h, х (рис. 9.2,а) по оси
абсцисс отложена концентрация смеси, по
оси ординат — энтальпия при постоянном
давлении. Энтальпия смеси /гсм веществ А
и В определяется по уравнению
hcv = НлХлЧ-Кв (1 ^см, (9.7)
причем исходные значения энтальпий ком-
понентов А и В могут быть взяты произ-
вольно.
Если теплота смешения <?см невелика
и ею можно пренебречь, то изотермы газа
и жидкости изображаются прямыми линия-
ми. Диаграмма строится обычно для 1 моля
каждого компонента. С ее помощью очень
просто решаются графическим способом
задачи на смешение или разделение бинар-
ных смесей. Так, в верхней части рис. 9.2
точка М'—исходная или образующаяся
смесь, точки I -а II — получаемые при раз-
делении или исходные (перед смешением)
продукты; отрезок gi — доля вещества I.
18—218
Рис. 9.2. Диаграмма Л, х-
На рис. 9.2,а показана также область
диаграммы, соответствующая сосуществова-
нию пара и жидкости. Кривая, соединяю-
щая точки,, соответствующие энтальпиям на-
сыщенного пара различной концентрации,
образует линию пара. Аналогично образует-
ся линия жидкости. Для многих веществ,
линии пара и жидкости почти прямые.
Концентрации равновесных жидкости и
пара, имеющих, естественно, одну темпера-
туру, соединяются прямыми линиями, обо-
значенными на рис. 9.2,а буквой t. Напри-
мер, жидкость концентрацией 1 находится
в равновесии с паром концентрацией 2. Эти:
изотермы наносятся на диаграмму на осно-
вании данных о фазовом равновесии. По-
дробное описание построения диаграммы.
h, х см. в [589—591].
В нижней части рис. 9.2,а помещена
равновесная диаграмма t, х («рыбка») и
показан перенос равновесной концентрации
жидкости и пара с «рыбки» на диаграм-
му /г, х.
Разница в ординатах между точками,
лежащими на линиях пара и жидкости и
имеющими одинаковые значения х, отра-
жает теплоту испарения смеси концентра-
ции х.
-'274
Методы расчета процессов дистилляции и ректификации
При частичной конденсации пара в точ-
ке а (ем. рис. 9.2,а) с отводом теплоты q
конец процесса соответствует точке в, при
этом образуются жидкость в количестве <р
с концентрацией точки 1 и пар в количе-
стве (1—ср) с концентрацией точки 2.
Изображение процесса ректификации.
.В колонне навстречу поднимающемуся пару
гв количестве G стекает флегма в количе-
стве L (рис. 9.2,6).
Для каждого сечения колонны справед-
.ливы три уравнения:
G—L = const=D — общий материальный
баланс;
Gy—Lx=const— материальный баланс
по легкокипяЩему компоненту;
Gh пар—^-/сжидк == const — энергетиче-
ский баланс.
Здесь D — количество дистиллята; у и
х — концентрация пара и жидкости в дан-
ном сечении колонны.
Из приведенных уравнений следует
Су — Lx
G — L
= х„ = const;
ТЕ ’
^ЖИДК
— hK = const.
(9-8)
G — L
.Два последних уравнения справедливы для
.любого сечения колонн. При этом разность
G — L представляет собой условный (фик-
тивный) поток, который только после де-
флегматора является реальным конечным
.продуктом — дистиллятом D.
Если на диаграмме h, х соединить пря-
мыми лучами точки G и L, соответствую-
щие состоянию потоков пара и жидкости
(см. рис. 9.2,а) в одном и том же сечении
колонны, то все они (из всех сечений) пе-
ресекаются в одной точке — полюсе л с ко-
ординатами хп и h^. Для колонн с дефлег-
маторами совпадает с концентрацией ди-
стиллята xD. Геометрически доказывается *,
что отношение отрезков лб и лА равно
отношению количеств стекающей флегмы и
поднимающихся паров в данном сечении
колонны, т. е. nG/nL=LlG. Отрезок лО
отражает количество теплоты qD, отводи-
мой в дефлегматоре.
Рассмотрим процессы, протекающие иа
.ректификационной тарелке (рис. 9.2,а). Пар,
поднимающийся в количестве Gi с тарел-
ки 1, находится в идеальном случае в рав-
новесии с жидкостью Lx\ соответствующие
точки G] и Lx на диаграмме h, х лежат на
изотерме t'. В сечении С — С (между та-
релками) связь между количествами пара
G] и жидкости L2 дается уравнениями
(9.8), поэтому точки G, и Ё2 лежат на
одной линии — луче.
Аналогичные рассуждения можно при-
* Доказательства см. в [43, 588—590, 591[.
вести и для последующих тарелок. Общее
число таких переходов соответствует необ-
ходимому числу идеальных тарелок.
Чем круче проходят лучи, тем дальше
от равновесия в данном случае находятся
жидкость и пар и поэтому тем интенсивнее
идет процесс ректификации. Крутизна луча
определяется положением полюса л: чем
выше полюс, тем круче луч. Положение же
полюса определяется отношением А/б:чем
больше количество флегмы L, тем выше
полюс.
В пределе возможен случай, когда луч,
идущий от полюса, сольется с изотермой t.
Этим определяется наинизшее положение
полюса, т. е. минимальное количество
флегмы.
Аналогичные выводы могут быть сдела-
ны для нижнего полюса (отгонной части
колонны). Абсцисса нижнего полюса всегда
совпадает с концентрацией нижнего про-
дукта.
На рис. 9.3 показано построение основ-
Концентра-
ционная
часть
колонны
Отгонная
часть
колонны
Рис. 9.3. Построение основных линий при
расчете колонны ректификации методом
Пуашпона
ных линий для колонны непрерывного дей-
ствия с дефлегматором.
На диаграмме h, х точка питания М
лежит всегда на главной прямой, соеди-
няющей оба полюса: л (концентрационной
колонны) и Ли- (отгонной колонны).
Следует также иметь в виду, что на
диаграмме h, х вертикальный отрезок, изо-
бражающий количество теплоты, всегда
относится к 1 молю смеси данной концен-
трации х, определяемой положением верти-
кального отрезка. Для переноса данного
количества теплоты на смесь с другой кон-
центрацией существует правило проекций:
вертикальный отрезок на ординате Хц со-
ответствующий определенному количеству
теплоты, может быть спроектирован иа
Графические методы определения числа идеальных тарелок
275-
ординату любой другой концентрации х2
через полюс, который должен лежать на
ординате третьей концентрации Хз, причем
все три концентрации относятся к потокам,
получаемым в результате смешения или
разделения.
На рис. 9.3 показан перенос отрезка
л.О, соответствующего теплоте qu, с орди-
наты хп на ординату хт через полюс, ле-
жащий на xw (теплота Цх>т). Аналогично
перенесен отрезок nwW (теплота qw).
Пример. Определить по методу Пуан-
шона число идеальных тарелок в верхней
колонне воздухоразделительного аппарата.
Давление в верхней колонне аппарата
0,1 МПа, в нижней — 0,5 МПа. Чистота по-
лучаемого кислорода 99 %, азота 97 %; из
куба нижней колонны отбирается продукт
с 45 % С>2. К кубу нижней колонны подво-
дится 940 кДж теплоты, считая на единицу
поступающего воздуха. Подвод теплоты из
окружающей среды не учитывается.
Воздух с параметрами точки 1 входит
в куб нижней колонны (рис. 9.4, участок
Б500
еооо
5500
50В0
3500
3000
2500
2000
1500
июо
500
о
500
1000
1500
2000
2500
0,55 В,15 0,37
Молярная Золя ампл
0,2 0,0 0,5 0,6 1,0
Рис. 9.4. Схема воздухоразделительного
аппарата (к примеру)
1-2), охлаждается в нем и после дросселя
В1 в состоянии 3 подается в нижнюю ко-
лонну. Часть азотного конденсата из деф-
легматора стекает обратно в нижнюю ко-
лонну; другая часть отбирается в состоя-
нии 4 и через вентиль ВЗ подается в ка-
честве флегмы 5 в верхнюю колонну. Из
куба колонны смесь в состоянии 6-7 через
вентиль В2 поступает в середину верхней
колонны-, сверху этой колонны отбирается
азот состояния 8, снизу — кислород состоя-
ния 9.
На диаграмме рис. 9.5 состояние полу-
чаемого кислорода чистотой 99 % опреде-
ляется точкой 9, а азота чистотой 97 % —
точкой 8. Обе точки лежат на линии пара
18*
Рис. 9.5. Графическое определение числа
тарелок методом Пуаншона (к примеру)
при 0,1 МПа. По энергетическому балансу
установившегося процесса сумма энтальпий
отходящих азота и кислорода должна рав-
няться энтальпии поступающего на разде-
ление сжатого воздуха (точка 1). Поэто-
му на диаграмме ft, х точка 1 должна ле-
жать на прямой, соединяющей точки 8 и 9.
Сжатый воздух в кубе нижней колонны
отдает 940 кДж теплоты (по условию за-
дачи). Его состояние после куба соответ-
ствует точке 2. Отрезок 1-2 эквивалентен
940 кДж. После дросселирования воздух
в состоянии 3 поступает в колонну. Точки
2 и 3 в диаграмме ft, х совпадают. Через,
точку 3 должна пройти «главная прямая»
нижней колонны, соединяющая полюсы
концентрационной и отгонной частей ниж-
ней колонны.
Точки 4 и 5 (азот, подаваемый в верх-
нюю колонну в качестве флегмы) лежат на>
той же прямой сечения, что и точка 8
(азот на выходе из колонны), т. е. в пре-
дельном случае должны лежать на изо-
терме, проходящей через точку 8 при дав-
лении 0,1 МПа. В действительности для
получения конечного числа тарелок точки 4
и 5 должны лежать несколько правее изо-
термы точки 8; на чертеже эта изотерма
ts обозначена штриховой линией. Разность
концентраций между принятым и равновес-
ным состояниями точки 5 называют диф-
фузионным напором. На ординате, прохо-
дящей через точку 4, будет лежать полюс
концентрационной части лн нижней ко-
лонны.
276
Методы, расчета процессов дистилляции и ректификации
Из куба нижней колонны отбирается
жидкость с 45 % кислорода. Состояние этой
жидкости отражает точка 6. Теплота
охлаждения сжатого газа (940 кДж) одно-
временно является теплотой нагрева куба.
По правилу проекций переносим отре-
зок 1-3 на концентрацию 0,55, для чего со-
единяем точки 6 и 1 прямой, которую про-
должаем до пересечения с ординатой то-
чек -4 и 5, х=0,92 *. Получаем точку лн.
Затем соединяем полученную точку лн
с точкой 3(2) и продолжаем прямую' до
пересечения с ординатой х=0,55. Получаем
точку Лн7. Отрезок 6-лн' эквивалентен теп-
лоте, передаваемой в кубе нижней колонны
п отнесенной к жидкости концентрации х =
=0,55. Прямая, проходящая через полюс
лн' и точку питания 3 (2), — главная пря-
мая сечения, которая должна также пройти
через второй полюс нижней колонны лн.
Теперь найдем полюс верхней колонны
(низкого давления). Точка 6 (7') характери-
зует питание верхней колонны и должна
лежать на главной прямой сечения этой
колонны. Теплота, передаваемая, в дефлег-
маторе нижней колонны г/деф (отрезок
лп-4), одновременно служит и теплотой
подводимой в кубе верхней колонны. Отне-
сем эту теплоту к поступающему воздуху.
По правилу проекции соединяем прямой
точки лн и 6, а также точки 4 и 6, эти
лучи отсекут на ординате х = 0,79 отрезок
1-7, который и будет соответствовать теп-
лоте 9Деф, отнесенной к поступающему воз-
духу. Теперь отнесем эту теплоту к кисло-
роду («нижний» продукт) с х=0,01. Со-
единяем точки 8 и 1 прямой и продолжаем
ее до пересечения с ординатой х = 0,01; по-
. лучаем точку 9. Соединяем точки 8 и 7 и
продолжаем прямую для пересечения с ор-
динатой х=0,01, получаем точку лв'. Отре-
зок 9-лв' — это теплота, передаваемая
в кубе верхней колонны (она же </Деф) и
отнесенная к единице количества получае-
мого кислорода. Точка лв' служит полюсом
отгонной части верхней колонны. Соеди-
няем точку лв' с точкой 6 и, продолжив
прямую, получаем главную прямую сечения
верхней колонны. Полюс концентрационной
части лв находят как пересечение главной
прямой с ранее выбранной прямой сече-
ния 4-8.
Положение координат полюса за пре-
делами диаграммы в данном случае отра-
жает фактическое соотношение потока азот-
ной флегмы, поступающей из карманов,
к потоку пара, поднимающегося по колон-
не. Это соотношение выбирается в извест-
ных пределах свободно.
Для наглядности дальнейших построе-
ний строим в верхней части рис. 9.5 рав-
новесную диаграмму N2, О2 при 0,1 МПа.
* Все геометрические построения, связанные
-с проектированием, выполнены штриховыми ли-
ниями.
Определение числа тарелок ведется следую-
щим образом. Из точки 9 проводим пря-
мую к нижнему полюсу лв'. Точка пересе-
чения этой прямой с линией жидкости (точ-
ка а) и значение концентрации равновес-
ного пара, получаемое с помощью кривой
равновесия, позволяют провести изотерму
h (построение всех изотерм показано штри-
ховой линией). Получаем точку б, соответ-
ствующую пару, равновесному жидкости
в точке а. Проводя через точки б и лв'
прямую сечения, получаем точку в. Через
эту точку проводим равновесную изотерму
t2, получаем точку г и т. д. После перехо-
да через главную прямую сечения построе-
ние прямых ведется через верхний по-
люс лв.
Из построения на рис. 9.5 видно, что
для заданных в задаче условий требуется
девять идеальных тарелок и что через про-
межуточный дефлегматор передается тепло-
та, соответствующая отрезку 1-7 в пересче-
те на единицу количества перерабатывае-
мого воздуха.
9.4. АЛГЕБРАИЧЕСКИЕ МЕТОДЫ
ОПРЕДЕЛЕНИЯ ЧИСЛА
ИДЕАЛЬНЫХ ТАРЕЛОК
Минимальное флегмовое число. Если
значение а, соответствующее данной смеси,
можно принять постоянным, то, подставляя
в уравнение (9.5) концентрации y.wpaBH,
полученные из (2.63), после преобразова-
ния получаем
л-а[ин = _2_ Гf )]. (9.9)
а-1[хравН ^_хразнУ]
Это же уравнение действительно и для
случая, когда равновесная линия — прямая
[уравнение типа (9.6) J.
Минимальное число идеальных тарелок
соответствует условиям работы колонны
без отбора дистиллята, т. е. при бесконеч-
но большом флегмовом числе /?„. При по-
стоянном а минимальное число идеальных
тарелок nMlra определяется уравнением
Фенске [52, 528, 531]
4/о(1 Уде-)
1g--------------
H'ff' 9d )
п,
1g а
(9.10)
где ут> и yw— состав пара по легкокипя-
щему компоненту соответственно вверху и
внизу колонны.
На рис. 9.6 представлена номограмма
для определения п11О в случае идеальных
растворов с различными а.
Число идеальных тарелок при задан-
ном конечном флегмовом числе (4?>4?мив).
Для этого случая аналитические методы
используют сложные уравнения, поэтому
Алгебраические методы определения числа идеальных тарелок
277
Рис. 9.6. Номограмма для определения минимального числа идеальных тарелок
при /?=оо (растворы идеальные)
проще пользоваться графическими метода-
ми. Однако если равновесная линия может
быть представлена прямой (именно это ча-
сто имеет место в крайних частях диаграм-
мы равновесия у, х), т. е. при значениях х,
близких к 1 или 0, число идеальных таре-
лок при данном R может быть легко опре-
делено алгебраически [236]. Для верхней
части диаграммы тангенс угла наклона
равновесной линии равен 1 /а '[см. (9.6)]
и тангенс угла наклона верхней рабочей
линии равен k=R/(/?+1) [см. (9.3)].
Используя эти значения тангенсов, можно
получить число идеальных тарелок п для
верхней части колонны на линейном участ-
ке равновесных-составов (до хКояв)
п — -------- 1g
(XD хкон) ,
(I—1) ’t"
(9.H)
Аналогично для нижней части колонны
на линейном участке тангенс угла наклона
равновесной линии равен а '[см. (9.6)],
а тангенс угла наклона рабочей линии k’=
= (fl+WUH-l) '[см. (9.4)].
Число идеальных тарелок п' для ниж-
ней части колонны на линейном участке
равновесных составов (до хконн)
й'(^он-Ху)(а/Йл-1) 1
(01 — О J
(9-12)
Вывод (9.11) и (9.12) см. в [33].
Для алгебраического определения чис-
ла идеальных тарелок для любого участка
колонны при условии постоянства а Е. Смо-
кер предложил специальный метод, осно-
ванный на переносе начала координат.
Изложение этого относительно сложного
метода можно найти в [10, 528]. Опреде-
ление числа тарелок на участке рав-
новесной линии с .постоянным наклоном
dy/dx по методу Кольборна см. в [52].
Для приближенного определения числа
идеальных тарелок п для различных зна-
чений R или определения R для заданного
числа тарелок п при известных значениях
7?мин или «мин, рассчитанных по (9.9) и
(9.10), можно воспользоваться графиком
рис. 9.7, полученным эмпирическим путем
[533].
Для определения числа идеальных та-
релок при ректификации тройных смесей
используют метод расчета в треугольной
диаграмме равновесия, описанной в [257,
532, 588]. Метод для расчета тройной сме-
си N2-Ar-O2 разработан в [203, 205].
О расчете на ЭВМ числа тарелок при раз-
делении воздуха как тройной смеси см.
в [205].
Определение числа идеальных тарелок
в случае многокомпонентной смеси произ-
водится несколькими методами. Все они
основаны на использовании констант фазо-
вого равновесия и довольно трудоемки
[52, 519, 528, 532, 577, 588]. Использование
278
Методы, расчета процессов дистилляции и ректификации
Рис. 9.7. График для определения п или
Р. по известным п
МИН И /? мин
ЭВМ существенно изменило положение
с расчетами разделения многокомпонентных
смесей, значительно повысив их точность,
надежность и скорость [52, 588, 592].
9.5. МЕТОД РАСЧЕТА НА ОСНОВЕ
ЧИСЛА ЕДИНИЦ ПЕРЕНОСА
Метод базируется на диффузионной
теории массообмена между жидкой и газо-
образной фазами через пограничную плен-
ку жидкости н пара.
Количество легкокипящего компонента,
переходящего в единицу времени в объеме
пара V из объема жидкости L на участке
колонны dH и выраженного через изме-
нение концентрации, равно
Vdy=Koaa(y*—y)dli —
= Ldx=KoLa(x—x*)dH, (9.13)
где Кос и Kol — объемные коэффициен-
ты массопередачи соответственно на сто-
роне пара и на стороне жидкости; у*, х*
п у, х—соответственно равновесные и
действительные концентрации легкокипя-
щего компонента в паре и жидкости; а —
площадь межфазовой поверхности, содер-
жащейся в единице объема системы V
или L. Значение Л'а выражается в
кмоль
ч-м3-единицу движущей силы
Если V, L, Коо, Каи и а постоянны
по высоте колонны, то общая ее высота
Уч Хч
V Г dy L Г dx
%oGaJ У* —У KoLa J X — X*'
У1 X!
(У* — У)ср’
^2 #1
(X— Х*)ср
•(9.15)
)
получили название чисел единиц переноса
(ЧЕП).
Отношение ///(ЧЕП) получило название
высоты единицы переноса (ВЕП):
1г^(ВЕП)-;'
Н L (9’16}
N^x = (ВЕП)^ • .
По
высота
стигается изменение концентрации компо-
нента, равное движущей силе процесса на
этом участке колонны.
Число единиц переноса в общем случае
определяется графическим интегрированием
[10, 33, 528, 593]. На Диаграмме х, у сни-
мается ряд значений ординат между кри-
вой равновесия и рабочей линией у*—у в
зависимости от состава пара у. Строится
в удобном масштабе кривая 1/(1/*—У) =
— f(y), и ЧЕП определяется планиметри-
рованием площади под полученной кривой
в заданных пределах изменения концен-
траций. Таким образом, для общего слу-
чая в уравнении (9.15) движущая сила
массопередачи (у*—у) ср и (х*—х)Ор опре-
деляется как средняя интегральная вели-
чина. Если равновесная линия прямая, эта
величина может определяться как средняя
логарифмическая в заданных пределах
концентрации.
Число единиц переноса можно рас-
считывать графическим методом [53,593].
Уравнение (9.15) можно преобразо-
вать, используя (9.3):
физическому смыслу ВЕП — это
участка колонны, на котором до-
f dy
J (У*-У)
1
У" — У — —(х2 — !/*)
д
Для случая R = oo при подстановке в это
уравнение значения у*, вычисленного по
формуле (2.63) (т. е. для случая а =
= const), после интегрирования можно по-
лучать значение Амин [52, 236]:
Величины
(9.14)
Млн =----:1п
а — 1
Уг(1 ~~ 1/1)
1/1(1 — //а)
Коэффициент эффективности тарелки
279
t — У1
1 — У2 ’
I- 1п
(9.17)
Для случая Д = оо и при значении у*,
определяемом по уравнению (9.6), т. е. в
случае, когда равновесная линия прямая и
выходит нз верхнего угла диаграммы х, у
с наклоном 1/а, из того же уравнения
можно получить
а 1 — г/,
Л\шн = ------1п--(9.18)
1 — а 1 — у2
В общем случае число идеальных та-
релок п не равно числу единиц переноса
К, и только в случае параллельности ра-
бочей и равновесной линий значения этих
величин совпадают. В частности, такое со-
впадение имеет место для идеального рас-
твора компонентов, имеющих близкие тем-
пературы кипения.
Значения ВЕП определяются на осно-
вании опытных данных и отражают кине-
тику процесса. В литературе можно найти
данные по значениям ВЕП для определен-
ных типов насадок н различных смесей
J33, 203, 205, 236, 588].
Расчетное определение значений ВЕП,
как следует нз (9.16), связано прежде
всего с определением общего коэффициен-
та массопередачи Ков или Кон-
Согласно двухпленочной теории общий
коэффициент массопередачи Ков (движу-
щая сила Ку) или Кон (движущая сила
Дх) может быть определен по уравнениям
1 1 ! m
= kGa т* kLa ;
1 1 1
kLa ~~ kGa + mkLa
(9.19)
где kG и kL — коэффициенты массоотдачи
соответственно в паровой и жидкой плен-
ках; пг — коэффициент при х в уравнении
равновесной линии y = mx-[-b, если она
прямая, или в общем случае угол наклона
равновесной линии при данной концентра-
ции. В большинстве случаев основное со-
противление составляет паровая пленка.
Значения коэффициентов массопереда-
чи находят экспериментально. В литерату-
ре можно найти эти данные, а также эм-
пирические уравнения для расчета значе-
ний коэффициентов массопередачи [33, 52,
203, 532, 588, 593, 594].
При расчете пленочных или насадоч-
ных колонн часто используется понятие
высоты эквивалентной теоретической (иде-
альной) тарелки (ВЭТТ). ВЭТТ соответ-
ствует высоте участка колонны, на выходе
из которого пары имеют состав, равновес-
ный с составом покидающей этот участок
флегмы. Значение ВЭТТ находится экспе-
риментально; оно зависит от типа насад-
ки, диаметра колонны и физических свойств
разделяемых смесей. Для очень большого
числа бинарных смесей ВЭТТ лежит в ин-
тервале от 100 до 300 мм. Эксперимен-
тальные данные по ВЭТТ можно найти в
литературе, рекомендованной выше для
определения ВЕП. При ректификации жид-
кого воздуха в колоннах с кольцами Ра-
шига размером 10X10X0,2 мм значение
ВЭТТ принимают от 250 до 300 мм, с
кольцами 6X6X0,2 мм — от 150 до 200 мм
[203].
9.6. КОЭФФИЦИЕНТ
ЭФФЕКТИВНОСТИ ТАРЕЛКИ
Как указывалось в § 9.3, для опреде-
ления действительного числа тарелок
«действ по известному значению числа иде-
альных тарелок п используется общий ко-
эффициент эффективности тарелки ЕОбщ =
= «/«действ.
Значения Еобщ находят опытным пу-
тем в производственных условиях. Они за-
висят от характера разделяемой смеси,
условий ректификации, конструкции и ти-
па тарелки н лежат для различных слу-
чаев в широких пределах (от 0,3 до 0,8).
Используется также понятие локаль-
ной или точечной эффективности тарелки
Ет. Это понятие имеет реальное физиче-
ское значение, основанное на законе диф-
фузии и вычисляемое на основе кинетиче-
ских данных. Используя (9.13), можно
после соответствующих преобразований
получить
Уп+1 Уп , kaTC _
Ет = —-------= 1— е ° =1 — е
Уп+\ Уп
(9.20)
Значение Ет зависит от нескольких
переменных: физических свойств жидкости
и газа, скорости потоков, конструкции та-
релок. Проведено много исследований по
определению как Ет, так и величин, вхо-
дящих в комплекс m уравнения (9.20).
Для ориентировочной оценки можно вос-
пользоваться эмпирическим уравнением
[528, 594]
h
пг —------------------------------,
(2,36 + 0,0056йЛ4/?) • зз ’
(9.21)
где h — высота слоя жидкости на тарел-
ке, через которую проходят пузырьки па-
ра, см; w — скорость пара в прорезях
колпачков, см/с; р — плотность жидкости,
г/см3; г]—динамическая вязкость, 10 Па-с;
b — ширина прорези в колпачках, см; М —
молекулярная плотность жидкости; k —
— у/х— константа равновесия.
При экспериментальном определении
эффективности тарелки на модельных ко-
лонках состав жидкости на тарелке ме-
няется сравнительно мало, поэтому полу-
280
Методы расчета процессов дистилляции и ректификации
ченные значения эффективности близки к
точечному коэффициенту Ет. На тарелках
большого диаметра, где путь движения
жидкости велик, в ней возникает градиент
концентрации. В этом случае использует-
ся Ем — коэффициент эффективности еди-
ничной тарелки (коэффициент Мерфи). Он
представляет собой отношение действи-
тельного изменения среднего состава пара,
поступающего на тарелку Упсг’ и уходя-
щего с нее r/n+icp, к возможному макси-
мальному изменению состава пара, нахо-
дящегося в равновесии с жидкостью, сте-
кающей на
(r/*n+i сток):
нижележащую
тарелку
Ем
ер _ ср
<п+1 Уп
,,*сток__ ,,ср
Уп+1 Уп
(9.22)
При таком определении эффективности
в некоторых случаях Ем может быть
больше единицы. Связь между Ем и Ет
зависит от характера относительного дви-
жения жидкости и пара на тарелке, опре-
деляющего степень перемешивания пото-
ков, и может быть определена теоретиче-
ски для некоторых типовых случаев.
На рис. 9.8 представлена номограм-
ма, связывающая значения Ем и Ет [528,
Рис. 9.8. Номограмма взаимозависимости
Ет и Ем‘
/ — пар полностью смешан, жидкость не смеша-
на; II — пар ие смешай и соответствует жидко-
сти, текущей в одном направлении на всех
тарелках; III — пар не смешан, жидкость течет
в противоположных направлениях на каждой со-
седней тарелке
588] . Параметр А равен rpfim —
средний наклон равновесной линии в за-
данном интервале концентраций; L/V —
тангенс угла наклона рабочей линии.
В большинстве случаев в действи-
тельности имеет место ситуация, характе-
ризуемая средним положением между слу-
чаями II и III (рис. 9.8). Если известно-1
Ем, то в диаграмме х, у можно прово-
дить построение так, чтобы получить сра-
зу число реальных тарелок [532, 588].
Следует отметить, что для участков,
колонны, где параметр А не сильно отли-
чается от единицы (средний участок ко-
лонны с не очень высокой и не очень низ-
кой концентрацией легкокипящего компо-
нента), значения Ем и общей эффектив-
ности £общ близки.
Для участков с большими и малыми
концентрациями легкокипящего компонен-
та
_1п[1 +£Л1(Х- 1)]
Еобщ =------щ---------(9.23)
1п А
Для вычисления коэффициента эффек-
тивности тарелок Американским институ-
том инженеров-химиков разработан специ-
альный метод (AIChE-metod). Подробнее-
об эффективности тарелок и выводы со-
ответствующих формул см. в [33, 52, 205,
236, 528, 532, 577, 588, 593, 594].
Унос жидкости паром с нижележащей
тарелки на вышележащую снижает эф-
фективность тарелки, поскольку происхо-
дит смешение жидкостей разной концен-
трации. Влияние уноса на эффективность
тарелки может быть оценено следующим
уравнением:
£
~E^L/V) ’ (9-24>
где £мунос и Ем — эффективность тарел-
ки при уносе и без уноса жидкости; е —
количество молей унесенной жидкости на
1 моль пара; L/V — тангенс угла наклона
рабочей линии.
Оценить значение уноса е, кг жидко-
сти на 1 кг пара, можно по эмпирической
формуле [52]
е = (2,6-4-7) • 10“5(ги/ДЯэф)3>2,
где w — скорость пара в свободном сече-
нии колонны, м/с; АЯЭф— эффективное
расстояние между тарелками, равное рас-
стоянию между тарелками за вычетом 2,5-
кратной высоты светлой жидкости на та-
релке, м.
Более подробно о влиянии уноса и
захлебывания см. в [33, 52, 203, 236,528].
Для ориентировочной оценки общей
эффективности можно воспользоваться гра-
фиком рис. 9.9 [532, 588].
Практически значения эффективности
ректификационных тарелок, используемых
в криогенной технике, находятся в преде-
Гидродинамические условия работы колонны
281
"Рис. 9.9. Приближенная зависимость об-
щей эффективности тарелки £0«щ от ат]:
<1— относительная летучесть разделяемых ком-
•понентов; -г] — вязкость жидкой флегмы, 10 Па-с
(значения а и Г] — при средней температуре
колонны)
дующее эмпирическое уравнение для опре-
деления скорости пара в пространстве меж-
ду тарелками колпачковой колонны:
3,4
“' = ^273
1/ — АН,
’ Рп
(9.25)
где w — скорость пара, см/с; d — диаметр
колпачка, см; АД — расстояние между та-
релками, см; рж и рп — плотность соот-
ветственно жидкости и пара, кг/м3.
Для оценки максимально допустимой
скорости пара, м/с, можно рекомендовать
[33, 52, 588] уравнение
®макс = К’Крж.рп—1. (9.26)
лах 0,5—0,9. Для хорошо сконструирован-
ных тарелок в установках разделения воз-
духа коэффициент эффективности изменя-
ется от 0,9 до 1,2 для небольших и от 0,5
до 0,8 для крупных колонн [205]. Обычно
при определении числа идеальных тарелок
воздух рассматривается как тройная смесь
N2-Ar-O2. Когда воздух считают бинарной
смесью N2-O2, общую эффективность таре-
лок следует оценивать значениями 0.2—0,5.
При ректификации смеси H2-HD £Общ=
= 0,3-н0,6 [236].
В двухколонных аппаратах разделе-
ния воздуха обычно число действительных
тарелок в верхней колонне 45—36, в ниж-
ней — 24. В установках для получения чи-
стых кислорода и азота число тарелок в
верхней колонне принимают до 48—58, в
нижней — 36 [203]. При разделении смеси
этилен—этан число тарелок 45.
9.7. ГИДРОДИНАМИЧЕСКИЕ
УСЛОВИЯ РАБОТЫ КОЛОННЫ
Допустимая скорость пара в колонне
определяет ее диаметр. Увеличение скоро-
сти пара .приводит к возрастанию уноса
капель жидкости и, следовательно, к вы-
равниванию концентраций по высоте ко-
лонны. Увеличение расстояния между та-
релками уменьшает унос. При значитель-
ном увеличении скорости пара в колоннах
любого типа наступает момент, когда пар
увлекает жидкость вверх по колонне, не
давая ей стекать вниз. Такое явление на-
зывается захлебыванием колонны. Опре-
деление минимальной скорости пара, со-
ответствующей захлебыванию насадочных
колонн, см. в § 8.9. Данные по уносу и
захлебыванию тарельчатых колонн см. в
[33, 52, 203, 236, 528].
В ситчатых колоннах при очень ма-
лых скоростях пара может наблюдаться
протекание жидкости сквозь отверстия в
тарелке — так называемое «проваливание»,
приводящее к полному нарушению режи-
ма работы колонны.
Е. Киршбаум [534] рекомендует сле-
Коэффициент К зависит от расстояния
между тарелками и может быть найден
по рис. 9.10.
Рис. 9.10. Зависимость коэффициента К
в уравнении (9.26) от расстояния между
тарелками АН:
1 — ректификация N2—О2 и Н—HD; 2 — разделе-
ние непенящихся жидкостей с поверхностным
натяжением более 0,02 Н/м; 3 — высокотемпера-
турная ректификация при жидкостном затворе
12,5 мм; 4— то же при 50 мм
При разделении воздуха в ректифика-
ционных колоннах применяются почти ис-
ключительно ситчатые кольцевые тарелки.
Для установок большой производительно-
сти (более 300 м3/ч кислорода) принима-
ют отношение наружного диаметра D к
внутреннему диаметру вытеснителя сердеч-
ника d кольцевой тарелки £>/<7=2,4-ьЗ.
На основании практики рекомендует-
ся принимать следующие значения скоро-
сти пара в верхней колонне [203, 205]:
выше ввода 0,3—0,8, ниже ввода 0,25—
0,5 м/с (большие значения для крупных
колонн). Скорость пара в нижней колон-
не 0,1—0,25 м/с. Для очень крупных ко-
лонн разработаны тарелки с радиальным
током жидкости, позволившие повысить
скорость пара до 1,5 м/с [800]. Площадь
переливных устройств составляет от 1/6
до 1/8 площади тарелки; диаметр отвер-
стий в перфорированном листе 0,8—0,9 мм
(для очень крупных колонн 1,3 мм), шаг
282
Методы, расчета процессов дистилляции и ректификации
отверстий / = 3,25 мм. При этих условиях
живое сечение отверстий составляет 5,5—
7% [14,5% при отверстиях 1,3 мм пло-
щадки тарелки (без сливных устройств)].
Расстояние между тарелками верхней ко-
лонны обычно 60—160 мм, нижней 80—
160 мм. Аналогичные данные для колонны
ректификации смеси H2-HD см. в [236].
Суммарное сечение паровых патруб-
ков колпачковой тарелки составляет обыч-
но от 10 до 20% общего сечения колонны.
Сечения для прохода пара под колпачком,
в кольцевом пространстве между патруб-
ком и колпачком и в прорезях колпачка
принимают равными сечению парового па-
трубка. Расстояние от нижнего края зуб-
цов до дна тарелки принимают обычно от
I до Ю мм; чем меньше это расстояние,
тем меньше слой жидкости, не участвую-
щей в ректификации.
Увеличение высоты слоя жидкости на
тарелке любого типа вначале ведет к ро-
сту эффективности тарелки, но начиная с
Л=25 мм эффективность остается постоян-
ной; дальнейшее увеличение h приводит к
повышению сопротивления тарелки.
Для насадочных колонн рекомендуется
выбирать скорость пара близкой к ско-
рости захлебывания (см. § 8.9).
Независимо от конструкции и типа
барботажной тарелки с переливным уст-
ройством гидравлическое сопротивление по-
току пара складывается из следующих ве-
личин:
Дртар=Дрд+Лра +Дрст, (9.27)
где Дрд — динамическое сопротивление су-
хой тарелки; Дря — перепад давления, не-
обходимый для преодоления сил поверх-
ностного натяжения жидкости; ДрСт — ста-
тическое сопротивление слоя жидкости на
тарелке. Значения этих слагаемых зави-
сят от конструкции тарелки, скорости по-
токов пара и жидкости и их физических
свойств. Практически сопротивление одной
тарелки почти для всех конструкций на-
ходится в интервале от 200 до 600 Па.
При течении жидкости по тарелкам
большого диаметра вследствие гидравли-
ческого сопротивления возникает так на-
зываемый гидравлический градиент ДЛ,
т. е. разность уровней жидкости в местах
ее поступления и стекания. При большом
дй через отдельные участки тарелки бу-
дет проходить неодинаковое количество
пара, что приведет к снижению эффектив-
ности процесса. При проектировании та-
релок следует стремиться к созданию усло-
вий, гарантирующих стабильность работы
тарелки по всему сечению. Методику рас-
чета гидродинамических условий работы
колонны и тарелок см. в [33, 52, 203,205,
528, 532, 534, 588, 593, 594].
9.8. СТЕПЕНЬ ОБРАТИМОСТИ
ПРОЦЕССА РЕКТИФИКАЦИИ
Минимальная обратимая работа раз-
деления смесей определяется по (2.54) и
(2.55), причем эта работа зависит от кон-
центрации как исходной смеси, так и про-
дуктов разделения. Если процессы теп-
ло- и массопередачи протекают идеально,
то термодинамически обратимое разделе-
ние может быть в принципе осуществлено
в условиях так называемой обратимой рек-
тификации. Такой обратимый процесс рек-
тификации предполагает наличие равнове-
сия между жидкой и паровой фазами на
всех уровнях колонны, что требует непре-
рывного изменения флегмового числа. Для
обеспечения этого необходимо отводить теп-
лоту от колонны при соответствующих
температурах на всех уровнях выше точ-
ки питания (суммарно Qb) и подводить
на всех уровнях ниже ее (суммарно Qw)
(рис. 9.11,а).
Рис. 9.11. Схемы обратимой (а) и адиа-
батной (б) ректификационных колонн
Обратимая работа разделения равна
разности между работой, необходимой для
отвода обратимым путем теплоты с уров-
ней выше точки питания на уровень окру-
жающей среды (То), и работой, возвра-
щаемой при передаче теплоты обратимым
путем от окружающей среды на уровни
ниже точки питания. Затрата энергии на>.
разделение при такой обратимой ректи-
фикации равна минимальной термодина-
мически обратимой работе разделения [205,.
461, 535].
Практически все колонны ректифика-
ции работают в адиабатных условиях
(нет значительного теплообмена с окру-
жающей средой), при этом отвод теплоты
Qd осуществляется при самой низкой тем-
пературе TD в дефлегматоре колонны, а
Температурные шкалы и области их применения
283
подвод Qw — при самой высокой темпе-
ратуре Т и- в змеевике куба колонны
(рис. 9.11,6). Этот процесс необратим, по-
скольку потоки жидкости и пара постоян-
ны по высоте колонны и не находятся в
фазовом равновесии (за исключением точ-
ки питания при Т^мин). Такая колонна, ра-
ботающая при минимальном значении
флегмового числа и, следовательно, при
бесконечном числе тарелок, называется
идеализированной адиабатной колонной.
В ней количества теплоты, отводимой в
дефлегматоре (Qb) и подводимой в кубе
(Qw), равны соответствующим суммар-
ным отводимым и подводимым потокам
теплоты в обратимой колонне. Разница в
работе разделения возникает исключитель-
но вследствие различия в температурных
уровнях, на которых производится отвод
п подвод теплоты.
Работа разделения в идеализирован-
ной адиабатной колонне ЬЯД может быть
рассчитана как разность обратимой рабо-
ты Ld, переноса теплоты Qd с уровня
температуры на уровень окружающей сре-
ды То и работы Lw, возвращаемой при
передаче теплоты Q-ц- с уровня темпера-
туры То на уровень Tw-
T0-TD
Азд — Ld — О,-.
1 D
То-Т^
— Qu/ Тк- ~~
= QmhhT'o { т ~ ~т = (9-28)
\‘D 1 w]
Обычно с достаточной точностью можно
считать, что QB = Qw = <2мпн. Кроме того,
принято, что Qmhh — тепловой поток к (от)
колонне при минимальном флегмовом чис-
ле РмиН; передача теплоты в дефлегмато-
ре и кубе колонны предполагается без
температурного напора; AS — увеличение
энтропии при передаче теплоты QMHH с
уровня температуры Ту- на уровень Тв.
Так, например, минимальная работа
для полного разделения 1 кмоля воздуха
при 0,1 МПа (70 = 300 К) в идеализиро-
ванной адиабатной колонне
= 3530-300 — -——
\ 77,4 90,2 )
кДж
= 1940----------------
кмоль воздуха
или 0,540 кВ-ч/кмоль воздуха.
Здесь 3530 кДж/моль — минимальное
количество теплоты, отводимой в дефлег-
маторе колонны при 7?мм; 77,4 и 90,2 —
температуры кипения соответственно азота
и кислорода при 0,1 МПа.
Минимальная термодинамическая ра-
бота разделения 1 кмоля воздуха при
0,1 МПа и 300 К равна 0,354 кВт-ч (см.
§ 2.15). Отсюда эксергетический КПД идеа-
лизированной адиабатной колонны г)ад =
=0,345/0,540=^0,66.
Если принять градиент температуры в
конденсаторе и испарителе равным 2 К,
флегмовое число 7?=1,1/?Мин, то работа
разделения 1 кмоля воздуха составит
I = 3530-1,1-300 ( —- ——
\ 75,4 92,2
= 2840 кДж, или 0,79 кВт.ч.
Эксергетический КПД г)е=0,354/0,79=
= 0,45.
Если процесс разделения проводится
при относительно более низких темпера-
турах, то разности температур играют бо-
лее существенную роль и КПД колонны
меньше. Например, при разделении смеси
Нг—HD КПД колонны составляет всего
около 2% [236].
При расчете эксергетического КПД
процесса в целом следует дополнительно
учесть возрастание энтропии, связанное с
необратимостями в остальных узлах схемы
процесса (например, АТ в теплообменни-
ках, гидравлическое сопротивление пото-
ков, потери в расширительных машинах
и клапанах и т. д.).
О вычислении КПД процесса низко-
температурного разделения воздуха см. в
[10, 203, 205, 461, 536].
Для современных воздухоразделитель-
ных установок, вырабатывающих газооб-
разные продукты, общий эксергетический
КПД Т]е=^мин/^дейс тв= 12= 18 % .
Раздел десятый
ЭЛЕМЕНТЫ НИЗКОТЕМПЕРАТУРНОЙ ТЕРМОМЕТРИИ
10.1. ТЕМПЕРАТУРНЫЕ ШКАЛЫ
И ОБЛАСТИ ИХ ПРИМЕНЕНИЯ
По решению XIII Генеральной конфе-
ренции по мерам и весам за основную тем-
пературную шкалу принята термодинамиче-
ская (символ Т), единица которой кельвин
(символ К) равен 1/273,16 термодинамиче-
ской температуры тройной точки воды.
Кроме этой системы, при которой за нуль
284
Элементы низкотемпературной термометрии
Таблица 10.1. Температуры реперных точек МПТШ-68 (Г68 и £68) и соответствующие
значения относительного электрического сопротивления (ГЦ.-АГТ?,,) стандартного
платинового термометра в интервале температур 13,81—273,15 К
№ п/п. Состояние равнозесия Приписанное значение температуры Г -п ст
68> К tes, °с
1 Тройная точка равновесного водорода 13,81 —259,34 0,00141206
2 Равновесие между жидкой и паровой фазами равновесного водорода при давлении 3330,6 Па (25/76 нормальной атмосферы) 17,042 —256,108 0,00253444
3 Точка кипения равновесного водорода 20,28 —252,87 0,00448517
4 Точка кипения неона 27,102 —246,048 0,01221272
5 Тройная точка кислорода 54,361 —218,789 0,09197252
6 Точка кипения кислорода 90,188 -182,962 0,24379909
7 Точка плавления водяного льда 273,15 0 1
8 Точка кипения воды .373,15 100 1,39259668
Примечание. Значения температур, за исключением пп. 1, 2 и 5, даны для состояния равновесия
при давлении в одну нормальную атмосферу (101 325 Па).
принята температура абсолютного нуля,
может использоваться и система отсчета по
Цельсию — от тройной точки воды. Тем-
пература Цельсия (символ 1) определяется
как t=T—То, где 7'о=273,15 К. Единицей
температурной шкалы Цельсия служит гра-
дус Цельсия (символ °C), величина кото-
рого численно равна кельвину.
Международная практическая темпера-
турная шкала 1968 г. (МПТШ-68) —
удобно и точно воспроизводимая практи-
ческая шкала, настолько близкая к термо-
динамической, насколько это возможно на
современном уровне техники измерений.
Единицами этой шкалы также могут быть
кельвин и градус Цельсия в зависимости
от принятой системы отсчета. Практическая
температурная шкала основана на ряде
воспроизводимых равновесных состояний,
которым приписаны определенные значения
температур (первичные реперные точки), и
на интерполяционных формулах, которые
устанавливают соотношение между темпе-
ратурой и показаниями приборов, градуи-
рованных в этих точках. Значения первич-
ных реперных точек МПТШ-68 приведены
в табл. 10.1. В зависимости от применяе-
мых интерполяционных приборов и формул
область температур, регламентированная
МПТШ-68, делится на части, для каждой
из которых рекомендуются свои методы
сравнения с показаниями первичного ин-
струмента. В интервале от 13,81 до 903,89 К
стандартным прибором служит платиновый
термометр сопротивления. Чистота плати-
ны и конструкция термометра должны быть
такими, чтобы выполнялось условие а=
= ^1оо°с/^о° с ^=1>3925, где R — элек-
трическое сопротивление термометра.
Соотношение между электрическим со-
противлением термометра и температурой
определяется для температур ниже 0 °C с
помощью стандартной функции и специаль-
ных уравнений для поправок, для темпе-
ратур выше 0 °C — с помощью двух урав-
нений в форме полиномов.
В соответствии с МПТШ-68 в СССР
создан Государственный первичный эталон
единицы температуры для низкотемператур-
ного диапазона 13,81—273,15 К [708]. Этот
эталон воспроизводит, хранит и передает
размер единицы температуры на наивыс-
шем современном уровне точности (случай-
ная погрешность 1 мК). Состав эталона ре-
гламентирован ГОСТ 8-79-73.
Передача единицы температуры от Го-
сударственного первичного эталона к рабо-
чим эталонам производится в соответствии
с поверочной схемой по ГОСТ 8-082-73. Пе-
редача единицы температуры от рабочих
эталонов к образцовым мерам и градуиров-
ка рабочих термометров производятся по
методике, регламентированной ГОСТ
8-133-74, что в целом обеспечивает еди-
нообразие температурных измерений
в стране.
Интервал температур от 14 до 5 К, т. е.
промежуточный между «водородными» и
«гелиевыми» температурами, труден для
практической термометрии из-за отсутствия
простых в градуировке вторичных термомет-
ров. Международной практической шкалы
в этой области в настоящее время нет.
В СССР действует практическая шкала,
для которой утвержден Государственный
специальный эталон единицы температуры
[709] в диапазоне 4,2—13,81 К (ГОСТ
8-084-73). Она основана на германиевых
термометрах сопротивления, для которых
экспериментально установлена зависимость
Газовые термометры
285-
R(T) по газовому термометру. Поверочная
схема измерений в этом диапазоне темпе-
ратур регламентирована ГОСТ 8-085-73.
При измерении температуры ниже 5,2 К
наиболее употребительны практические
шкалы по давлению насыщенных паров ге-
лия-4 (Tse) [340] и гелия-3 (Тег) [341,
710], которые охватывают интервалы соот-
ветственно от 0,5 до 5,2 К и от 0,2 до
3,2 К. Шкалы T5S и Тй2 рекомендованы
к употреблению Международным комитетом
мер и весов как приложение к МПТШ-68.
В СССР воспроизведение шкалы Т58 в ин-
тервале температур 1,5—4,2 К осуществ-
ляется Государственным специальным эта-
лоном [711] по ГОСТ 8-078-73 путем пере-
дачи показаний конденсационного термо-
метра, заполненного гелием-4, вторичным
эталонам — германиевым термометрам со-
противления.
В диапазоне ультранизких температур
(практически ниже 0,5 К) наиболее надеж-
Таблица 10.2. Фиксированные
температуры равновесия, используемые
в низкотемпературной термометрии [51]
Вещество Условие равновесия Темпера- тура, К
Гелий-4 Х-точка 2,172
Неон Кипение Тройная точка 4,215 24,555
Азот Точка перехода 35,50
Кислород я » 43,82
Азот Тройная точка 63,148
Изопентан Кипение Замерзание 77,348 113,55
Метилциклогек- 146,85
сан
Эфир Быстрое замер- 156,85
Сероуглерод зание Замерзание 161,55
Толуол 178,05
Диоксид углеро- Сублимация 194,674
да 209,65
Хлороформ Замерзание
Хлористый бен- я 227,95
зол
Ртуть я 234,288
Сернокислый Точка перехода 240,78
натрий (Na2SOAX ХЮН20) 250,25
Четыреххлори- Замерзание
стый углерод 273,15
Водяной лед Плавление
Вода Тройная точка 273,16
Феноксибензин Я » 300,02
(дифенилэфир) 323,25
Хлористый мар- Точка перехода
ганец (МпС12-2Н2О) Кипение 351,41
Этиловый спирт
но температура измеряется магнитным ме-
тодом по изменению магнитной восприим-
чивости парамагнитных солей (чаще всего-
церий-магниевого нитрата). Термодинамиче-
ская шкала здесь в настоящее время до-
статочно уверенно определена до темпера-
тры 2-Ю-3 К. Измерения при более низкой
температуре носят пока оценочный характер
(самая низкая температура, полученная до>
настоящего времени около 2Х10-5 К).
Подробнее об особенностях низкотем-
пературной термометрии см. в [712—714].
В табл. 10.2 приведены значения тем-
ператур фазового перехода некоторых ге-
ществ, которые могут использоваться для
целей термометрии в области низких тем-
ператур в дополнение к официальным ре-
перным точкам МПТШ-68.
Под кипением в табл. 10.2 понимается
состояние кипящей жидкости при нормаль-
ном атмосферном давлении (101 325 Па).
Следует иметь в виду, что для точного вос-
произведения точки кипения необходимо-
обеспечить хорошее перемешивание жидко-
сти, так как большинство жидких крио-
агентов и хладагентов склонны к перегре-
вам.
Подробнее об особенностях низкотемпе-
ратурной термометрии см. в [712—714].
10.2. ГАЗОВЫЕ ТЕРМОМЕТРЫ
Газовый термометр служит основным'
первичным инструментом, определяющим
термодинамическую шкалу почти во всех,
интервалах температур (вплоть до гелие-
вых). Используя газообразный гелий в ка-
честве термодинамического вещества, а из-
менение его давления в зависимости от
температуры при постоянной плотности —
в качестве термометрического свойства, по1-
лучают значения температуры в газовой
шкале. Перевод этих значений в термоди-
намическую шкалу осуществляют путем вве-
дения ряда поправок, учитывающих влия-
ние вредного объема термометра, тепловое
расширение стенок резервуара, отклонение
поведения гелия от законов идеального га-
за и другие факторы. Наиболее значитель-
ная и трудно учитываемая поправка связана-
с влиянием вредного объема, поэтому наи-
более точные термометрические- измерения
производят специальными газовыми термо-
метрами без вредного пространства.
Технический газовый термометр с нели-
нейной шкалой. Если в схеме газового тер-
мометра специально предусмотреть относи-
тельно большой объем, постоянно находя-
щийся при нормальной температуре, то по-
лучим термометр, имеющий переменную-
чувствительность: по мере понижения тем-
пературы его шкала будет «растягиваться».
Такой термометр дает относительно неболь-
шую точность, но им удобно пользоваться
для технических измерений. Схема термо-
метра изображена на рис. 10.1. В качестве
286
Элементы, низкотемпературной термометрии
'Рис. 10,1. Газовый термометр для техниче-
ских измерений:
/ — пружинный манометр или вакуумметр; 2 —
патрубок для заполнения газом (после заполне-
ния запаивается); 3 — дополнительный объем;
~4 — соединительная трубка (капилляр); 5 — ре-
зервуар термометра
манометра может быть использован техни-
ческий пружинный манометр (или вакуум-
метр) с трубкой Бурдона; внутренний объем
таких приборов достаточно велик (при-
мерно 25 см3), и необходимость в дополни-
тельном объеме может отпасть. Соедини-
тельную трубку (капилляр) желательно
изготавливать из малотеплопроводного ма-
териала (мельхиора, нержавеющей стали)’.
Резервуар термометра может иметь любую
форму.
Шкала термометра определяется коэф-
фициентом a==V/Vi, где V — полный объ-
ем прибора; Vi — объем термометрическо-
го резервуара. Этот коэффициент можно
определить с достаточной для практики точ-
ностью, зная объемы составных частей при-
бора. Однако значительно проще постро-
ить шкалу по данным градуировки термо-
метра в какой-либо реперной точке, наибо-
лее близкой к рабочему температурному
интервалу. Из уравнения материального
баланса системы (считая газ идеальным и
пренебрегая объемом капилляра) получаем
1 1
7? -- Т
1 град 1 май
а =------------------— ,
7Лзаи 1
Рград^зап Г ман
где Гаап и Раап — температура и давление
в момент заполнения термометра газом;
Тград и Рград — температура резервуара
термометра и давление в системе при гра-
дуировке; Уман — температура манометра
(обычно нормальная).
Из этого же уравнения материального
баланса можно определить шкалу термомет-
ра (связь р и Т при заданном а):
^/^зап
Р =... t Гзаад_ t • (10.1)
Из уравнения (10.1) следует, что при
уменьшении объема, находящегося при нор-
мальной температуре (а-^-1), шкала термо-
метра приближается к линейной. При зна-
чительной величине «теплого» объема (а—
=5-ь-10) термометр становится малопригод-
ным для измерения температур в интерва-
ле 100—300 К, но при измерении им низких
температур (5—30 К) можно получить
вполне удовлетворительные результаты
(при температуре 10 К чувствительность
около 10 мм на 1 К).
10.3. КОНДЕНСАЦИОННЫЕ
ТЕРМОМЕТРЫ
В конденсационном термометре темпе-
ратура определяется по упругости насыщен-
ных паров рабочего тела. Термометр вклю-
чает в себя резервуар, который частично за-
полнен жидкой или твердой фазой термо-
метрического газа и находящейся с ней в
равновесии паровой фазой. Резервуар тер-
мометра соединен трубкой с манометром,
который должен обеспечивать достаточно
точное измерение давления в резервуаре.
Шкала термометра, т. е. связь температуры
и давления пара в резервуаре, дается кри-
вой упругости пара (см. табл. 4.26). При
работе с конденсационным термометром не-
обходимо всегда следить за тем, чтобы тем-
пература его резервуара была ниже темпе-
ратуры всех других частей прибора. Если
температура отдельного участка соедини-
тельной трубки окажется ниже, чем тем-
пература резервуара, го пар будет конден-
сироваться именно на этом участке и пока-
зания манометра будет соответствовать
упругости пара, отвечающей этой наинизшей
температуре (поэтому капилляр желательно
заключать в вакуумную оболочку).
Конденсационный термометр — весьма
чувствительный прибор, дающий высокую
точность измерения температуры; его чувст*
вительность повышается с применением от-
носительно более низкокипящих рабочих
тел.
При применении ртутного манометра
с ценой деления 0,13 гПа (0,1 мм рт. ст.)
точность измерения температуры в гелиевой
области составляет примерно 1-Ю-4 К,
Термопарные термометры
28Z
а применение масляного дифференциального
манометра позволяет отсчитывать разность
температур до 10-5 К- Следует заметить,
что точность измерения температуры по
конденсационному термометру существенно
зависит от чистоты применяемого термо-
метрического газа, перегревов в объеме
ванны и изменения гидростатического дав-
ления. Если для гелия, водорода и неона
вопрос чистоты газа значения не имеет, то
для более высококипящих веществ необхо-
димо принимать меры к получению газа с
максимальной степенью чистоты. Поэтому
при использовании в качестве рабочих тел
гелия, а иногда и водорода резервуарами
термометров часто служат сами ванны с
этими веществами; при применении азота
и кислорода должен быть предусмотрен
специальный резервуар (термометр Штока)
[51, 225, 716].
Для конденсационных приборов обычно
используют ртутные манометры из стек-
лянных трубок достаточно большого диа-
метра (15—20 мм). Естественно, что таким
прибором можно измерять только темпера-
туру ниже температуры кипения рабочего
тела при атмосферном давлении. При при-
менении пружинных манометров можно из-
мерять температуру в интервале от темпе-
ратуры кипения до критической температу-
ры. Точность измерения температуры в этом
случае будет существенно меньше и опре-
деляется в основном точностью применяе-
мого манометра. Так, например, используя
манометр типа МТИ (класс точности 1,0),
для конденсационного термометра с водо-
родным заполнением можно получить точ-
ность отсчета температуры 0,2—0,3 К (в
диапазоне 20—30 К). При технических из-
мерениях такие термометры находят широ-
кое применение. Важное достоинство этих
приборов — сравнительная простота изго-
товления и удовлетворительная точность
измерения температуры без необходимости
каких-либо дополнительных градуировок.
Конденсационный термометр устроен анало-
гично изображенному на рис. 10.1. Давле-
ние заполнения должно несколько превы-
шать критическое значение для рабочего
газа и составлять примерно 2/3 шкалы ма-
нометра. Объем резервуара термометра вы-
бирается таким, чтобы при полной конден-
сации всего содержащегося в 'приборе газа
не было переполнения резервуара.
10.4. ТЕРМОПАРНЫЕ ТЕРМОМЕТРЫ
Термопара представляет собой комби-
нацию спаев неоднородных металлов, в ко-
торых возникающая термоэлектродвижущая
сила (термо-ЭДС) пропорциональна разно-
сти температур спаев.
При изготовлении термопар большое
внимание следует обращать иа качество
электроизоляции проводов; во избежание
появления паразитных ЭДС желательно
также изолировать термопару и от мас-
сы аппарата.
К достоинствам термопары относят
простоту изготовления, малую теплоемкость,
и малое время установления равновесия. Ос-
новной недостаток — малая величина тер-
мо-ЭДС при низких температурах и в связи1
с этим трудность точного измерения ее.
С понижением температуры термо-
ЭДС уменьшается и обращается в нуль при
абсолютном нуле температуры. Поэтому
чувствительность термопарного термометра
с понижением температуры быстро снижа-
ется. Так, например, наиболее часто приме-
няемая при низкотемпературных измерени-
ях термопара медь — константан имеег
при температуре 300 К чувствительность
около 40 мкВ/K, при 90 К ее чувствитель-
ность составляет 17 мкВ/K, а при 20 °К —
5 мкВ/К.
При измерении термопарой абсолютной
температуры точность измерения зависит от
гомогенности проволоки термометра, ста-
бильности температуры теплого спая и точ-
ности измерения термо-ЭДС.
Для проверки гомогенности проволоки»
(особенно проволоки из константана и хро-
меля) отобранные образцы пропускают че-
рез жидкий азот с целью получения боль-
ших градиентов температуры; при хорошей
гомогенности проволоки на концах ее не
должно при этом возникать заметных пере-
менных тер.мо-ЭДС [717]. Следует заме-
тить, что негомогенность проволоки возрас-
тает с уменьшением ее диаметра, поэтому
для изготовления термопар не рекоменду-
ется использовать константановую проволо-
ку тоньше 0,25 мм и медную тоньше
0,15 мм.
При использовании термопары для
низкотемпературных измерений, для кото-
рых характерна небольшая величина тер-
мо-ЭДС, температуру одного из спаев (теп-
лого) необходимо поддерживать строго по-
стоянной (обычно 0 °C с помощью ванны
с тающим льдом). Точность поддержания
температуры теплого спая должна быть по-
крайней мере на порядок больше требуемой
точности измерения температуры холодного’
спая, находящегося например, при водород-
ной температуре.
Иногда измерения термо-ЭДС произво-
дят, используя в качестве вольтметра чувст-
вительный гальванометр. Возникающая при
этом погрешность может быть весьма зна-
чительна, так как показания прибора зави-
сят от изменения сопротивления проводов,
термопары (при низкотемпературных изме-
рениях) и от изменения сопротивления галь-
ванометра (при изменении температуры ок-
ружающей среды). Поэтому применение
гальванометра в качестве вторичного при-
бора при работе с термопарой возможно1
только тогда, когда допустимая погреш-
ность измерения составляет не менее 0,5%..
288
Элементы низкотемпературной термометрии
Рис. 10.2. Зависимость чувствительности
термопар, изготовленных из проволоки
отечественного производства, от темпера-
туры:
1 — константан в паре с медью; 2—сплав золота
и железа (молярное содержание железа 0,07%)
в паре с хромелем; 3 — тот же сплав в паре
с медью; 4— сплав меди, железа и лития (мо-
лярное содержание железа 0,1%, лития 0,03%)
в паре с хромелем; 5 — тот же сплав в паре
с медью
иых низкотемпературных термопар (теп-
лый спай при 0 °C) от температуры. Обо-
значения те же, что и на рис. 10.2
Для повышения точности измерения темпе-
ратуры термопарой необходимо исключить
влияние изменения сопротивления и изме-
рять термо-ЭДС компенсационным методом.
При этом погрешность измерения может
быть доведена до 0,02%. Высокая точность
реализуется только при условии исключения
в цепи паразитных термо-ЭДС; для этого
рекомендуется предусматривать в схеме
инверсионный переключатель, которым мож-
но одновременно изменять направление то-
ка в потенциометре и полярность теомопа-
ры. Тогда полусумма отсчетов измеряемого
напряжения, полученных при разных поло-
жениях переключателя, дает значение на-
пряжения, свободное от влияния паразит-
ных термо-ЭДС.
Термопара — очень удобный инстру-
мент для измерения малых разностей тем-
ператур. Единственное возникающее при
этом неудобство, связанное с малой величи-
ной термо-ЭДС, может быть отчасти ком-
пенсировано применением миогозаходной
термопары, у которой термо-ЭДС отдель-
ных ветвей складываются.
Для низкотемпературных термопар
в СССР изготавливается проволока из сле-
дующих сплавов [714]:
константана — медно-никелевого спла-
ва (59,5%) меди, 40% никеля, 0,5% марган-
ца) по ГОСТ 5307-50;
сплава золота и железа (молярное со-
держание железа 0,07%);
сплава меди, железа и лития (моляр-
ное содержание железа 0,1%, лития —
-0,03%).
Второй электрод термопары чаще всего
изготавливается из меди. Для водородных
и особенно гелиевых температур в качестве
второго электрода целесообразно исполь-
зовать хромель, что значительно повышает
чувствительность термопары.
На рис. 10.2 и 10.3 приведены зависи-
мости от температуры чувствительности
S=dE/dT и интегральной термо-ЭДС Е для
термопар, изготовленных из отечественной
проволоки. Очевидно, что для измерения
температуры в интервале 300— 70 К удоб-
но использовать термопару медь-констан-
тан; в диапазоне 70—10 К хорошие резуль-
таты дает дешевая термопара из сплава
медь — железо [720]; при гелиевых темпе-
ратурах лучше использовать термопары из
сплава золото — железо [721].
Для перевода показаний термопары в
градусы термодинамической шкалы следует
использовать таблицы. В табл. 10.3 приве-
дены значения термо-ЭДС в области низ-
ких температур для термопары медь-кон-
стаитан, в табл. 10.4 и 10.5 — для сплава
золота и железа (молярное содержание же-
леза 0,07 %) в паре соответственно с медью
и хромелем.
При использовании термопары следует
производить ее градуировку не менее, чем
по двум реперным точкам с таким расчетом,
чтобы рабочий температурный интервал
располагался между температурами граду-
ировки. По таблице находят значения
Етабл, соответствующие температурам гра-
дуировки термометра. Далее вычерчивают
график поправок, откладывая по оси абс-
цисс наблюдаемое значение термо-ЭДС, а по
оси ординат — разность Е—Етз.ъЛ. По это-
19—218
Таблица 10.3. Термо-^ДС термопары медь—константан, мкВ. Теплый спай при 0вС [712]
т, к 0 1 2 3 4 5 6 7 8 9
0 6030,85 6030,09 6029,06 6027,76 6026,21 6024,42 6j22,39 6020,14
и 6017,65 6014,94 6011,09 6008,82 6005,41 6001,77 5997,90 5993,79 5989,44 5984,84
20 5980,00 5974,92 5969,59 5964,01 5958,18 5952,10 5945,78 5939,21 5932,38 5925,32
30 5918,01 5910,45 592,66 5894,63 5886,36 5877,86 5869,13 586 -,17 5851,00 5841,63
4J 5831,99 5822,17 5812,14 5801,90 5791,46 5780,83 5770,00 5758,99 5747,78 5736,43
50 5724,83 5713,09 57и1,18 5689,09 5676,84 5664,42 5651,84 5639,10 5626,20 5613,15
6з 5599,95 5586,59 5573,08 5559,43 5545,63 5531,69 5517,63 5503,37 5489,00 5474,49
70 5459,84 5445,06 5430,14 5415,08 5399,88 5384,55 5369,09 5353,49 5337,76 5321,93
83 5305,90 5289,77 5273,52 5257,12 5240,60 5223,95 5207,17 519 ,26 5173,21 5156,04
93 5138,74 5121,31 5103,75 5086,06 5068,24 5050,30 5032,23 5014,- 3 4995,70 4977,25
100 4958,66 4939,96 4921,12 4902,16 4883,07 4863,86 4844,52 4825,06 4805,47 4785,76
по 4765,92 4745,96 4725,87 4705,66 4685,33 4664,87 4644,29 4623,58 4602,76 4581,81
12 J 4560,73 4539,54 4518,22 4496,78 4475,22 4453,53 4431,73 4439,83 4387,45 4365,58
130 4343,29 4320,88 4298,34 4275,69 4252,91 4230,02 4207,00 4183,86 4163,63 4137,23
140 4113,73 4090,11 4066,37 4342,51 4018,53 3994,44 3970,22 3945,88 3921,43 3896,86
150 3872,17 3847,36 3822,43 3797,38 3772,22 3746,94 , 3721,54 3696,02 3670,39 3644,64
160 3618,78 3592,80 3566,70 3540,49 3514,17 3487,72 3461,17 3434,50 3407,71 3380,82
170 3353,81 3326,68 3299,44 3279,09 3244,63 3217,06 3189,37 3161,57 3133,66 3105,64
180 3077,51 3049,26 3020,91 2992,45 2963,87 2935,19 2906,39 2877,49 2848,47 2819,35
190 2790,11 2760,77 2731,32 2701,76 2672,09 2642,31 2612,42 2582,43 2552,32 2522,11
2j0 2491,79 2461,36 2430,82 2400,18 2369,43 2338,57 2307,61 2276,53 2245,36 2214,07
210 2182,68 2151,18 2119,58 2087,88 2056,06 2024,15 1992,13 1963,0.3 1927,78 1895,45
22о 1863,01 1830,48 1797,84 1765,11 1732,27 1699,33 1666,29 1633,15 1599,91 1566,57
230 1533,14 1499,61 1465,97 1432,24 1398,42 1364,49 1330,47 1296,35 1262,14 1227,83
240 1193,42 1158,92 1124,31 1089,62 1054,82 1019,93 984,91 949,86 914,68 879,49
25о 844,02 808,55 772,98 737,32 701,55 665,70 626,74 593,69 557,55 521,31
260 484,99 448,57 412^07 375,48 338.81 302,06 . 265,24 228,35 191,43 154,39
270 117,33 80,23 43,10 5,94 — —' — — — —
to
Термопарные термометры
Таблица 10.4. Термо-ЭДС термопары Atr-J-Fe в паре е медью, мкВ. Теплый спай при 0 °C [712]
т. к 0 1 2 3 4 5 6 7 8 9
0 — — 1739,13 1728,13 1716.31 1703,80 1699,69 1677,11 1663,13 1648,84
10 1634,31 1619,61 1604,79 1589,90 1574,99 1563,10 1545,26 1530,49 1515,81 1501,26
20 1486,83 1472,55 1458,43 1444,46 1430,66 1417,03 1403,57 1399,27 1377,14 1361,18
30 1351,37 1338,73 1326,23 1313,88 1301,68 1289,61 1277,68 1265,87 1251,19 1242,62
40 1231,17 1219,84 1208,60 1197,48 1186,45 1175,53 1164,70 1153,97 1143,34 1132,80
50 1122,35 1111,99 1101,73 1091,56 1081,49 1071,50 1061,61 1051,82 1042,12 1032,51
60 1022,99 1013,58 1004,25 995,02 985,88 976,83 968,09 959,20 950,40 941,67
70 933,01 924,44 915,93 907,50 899,14 893,85 882,62 874,47 866,38 856,36
80 850,40 842,50 834,67 826,90 819,19 811,54 893,95 769,41 788,94 781,52
93 774,16 766,85 759,60 752,40 745,26 738,17 731,13 724,14 717,21 710,32
100 703,49 696,70 689,96 683,28 676,64 670,04 663,50 657,00 650,55 644,14
110 637,78 631,47 625,20 618,97 612,79 606,65 690,55 594,50 588,49 582,52
120 576,60 570,71 564,87 559,06 553,30 547,57 541,89 536,25 530,64 525,07
130 519,54 514,05 508,60 503,19 497,81 492,47 487,16 481,89 476,66 471,46
140 Ш,зо 461,17 456,08 451,02 446,00 441,01 436,05 431,13 426,24 421,38
150 416,56 411,77 407,01 402,28 397,58 392,91 388,27 383,67 379,09 374,55
Тбз 370,03 365,54 361,08 356,66 352,25 347,88 343,54 339,22 334,93 330,67
170 326,43 322,22 318,04 313,89 309,76 305,65 301,57 297,52 293,49 289,49
180 285,51 281,55 277,62 273,72 269,83 265,97 262,14 258,32 254,53 250,77
190 227,02 243,30 239,60 235,92 232,26 228,63 225,01 221,42 217,85 214,30
200 210,77 207,26 203,77 200,31 196,86 193,43 199,02 186,64 183,27 179,92
210 176,59 173,28 169,99 166,72 163,47 169,24 157,02 153,83 150,65 147,49
220 144,35 141,23 138,13 135,05 131,98 128,93 125,99 122,89 119,89 116,91
230 113,95 111,01 108,09 105,18 102,29 99,41 96,55 93,71 99,89 88,08
240 85,29 82,51 79,75 77,00 74,27 71,56 68,86 66,17 63,59 69,85
253 58,20 55,57 52,96 50,36 47,77 45,19 42,62 49,07 37,52 34,99
263 32,46 29,95 27,44 24,95 22,46 19,97 17,50 15,03 12,56 10,10
270 7,65 5,19 2,74 0,28 — — — — — —
Элементы низкотемпературной термометрии
£ Таблица 10.5. Термо-ЭДС термопары Au-|-Fe в паре с хромелей, мкВ. Теплый спай при О °C 12
т. к 0 I 2 3 4 5 6 7 8 9
0 5262,72 5251,15 5238,61 5225,25 5211,18 5196,52 5181,35 5165,76
10 5149,83 5133,62 5117,19 5100,59 5083,87 5067,06 5050,20 5033,30 5016,40 4999,51
ЙО 4982,64 4965,80 4949,01 4932,27 4915,57 4898,94 4882,35 4865,82 4849,34 4832,91
30 4816,52 4800,17 4783,86 4767,57 4751,32 4735,08 4718,86 4702,65 4686,44 4670,24
40 4654,03 4637,82 4621,60 4605,36 4589,11 4572,84 4556,54 4540,22 4523,88 4507,50
50 4491,09 4474,64 4458,16 4441,64 4425,08 4408,47 4391,83 4375,14 4358,40 4341,62
60 4324,73 4307,90 4290,97 4273,99 4256,96 4239,88 4222,77 4205,61 3649,81 4171,14
70 4153,82 4136,46 4119,04 4101,57 4083,95 4066,37 4048,74 4031,06 4013,34 3995,57
80 3977,75 3959,89 3941,98 3924,03 3906,04 3888,00 3869,92 3851,79 3833,63 3815,43
90 3797,18 3778,90 3760,57 3742,21 3723,81 3705,37 3686,89 3668,37 3649,81 3631,22
100 3612,59 3593,93 3575,22 3556,48 3537,71 3518,90 3500,05 3481,17 3462,25 3443,29
НО 3424,30 3405,28 3386,22 3367,13 3348,00 3228,84 3309,65 3290,42 3271,16 3251,86
120 3232,53 3213,17 3193,77 3174,35 3154,39 3135,39 3115,87 3096,31 3076,72 3057,10
130 3037,44 3017,76 2998,04 2978,30 2958,52 2938,71 2918,87 2899,00 2879,10 2859,17
140 2839,21 2819,23 2799,21 2779,16 2759,09 2738,98 2718,85 2698,69 2678,50 2658,29
150 2638,04 2617,77 2597,48 2577,15 2256,80 2536,43 2516,02 2495,59 2475,14 2454,66
160 2434,16 2413,63 2393,08 2372,50 2351,90 2331,27 2310,62 2287,95 2269,25 2248,54
170 2227,79 2207,03 2186,24 2165,44 2144,61 2123,76 2102,88 2081,99 2061,07 2040,14
180 2019,18 1998,21 1977,21 1956,19 1935,16 1914,10 1893,02 1871,93 1850,81 1829,68
190 1808,53 1787,36 1766,17 1744,96 1723,73 1702,49 1681,22 1659,94 1638,64 1617,33
200 1595,99 1574,64 1553,27 1531,88 1510,48 1489,06 1469,62 1446,16 1424,69 1403,20
210 1381,69 1360,16 1338,62 1317,07 1295,49 1273,90 1252,30 1230,67 1209,03 1187,38
220 1165,71 1144,02 1122,32 1100,60 1078,86 1057,11 1035,35 1013,57 991,77 969,96
230 948,13 926,30 934,44 882,57 860,69 838,80 816,89 794,97 773,04 751,10
240 729,14 707,17 685,20 663,21 641,21 619,21 597,19 575,17 553.14 531,11
250 509,07 487,02 464,98 442,92 42j,87 398,82 376,77 354,71 332,67 310,62
260 288,58 266,55 244,53 222,52 200,52 178,53 156,56 134,60 112,67 90,76
270 68,87 47,01 25,17 3,37 — — — — — —
Термопарные термометры
292
Элементы низкотемпературной термометрии
му графику в дальнейшем может быть опре-
делена поправка к показанию данной тер-
мопары для любого значения Е. Прибавляя
с учетом знака эту поправку к наблюдае-
мому значению термо-ЭДС, получают соот-
ветствующее ему значение £Табл, по кото-
рому и находят из таблицы температуру.
Ошибка прн таком способе определения
температуры составляет около 2% значения
поправки.
10.5. ТЕРМОМЕТРЫ СОПРОТИВЛЕНИЯ
Действие термометра сопротивления ос-
новано на изменении электрического сопро-
тивления проводников в зависимости от
температуры. Материалами, наиболее при-
годными для точных термометрических из-
мерений, служат чистые металлы, сопротив-
ление которых приблизительно пропорцио-
нально абсолютной температуре. Для низ-
котемпературных измерений чаще всего упо-
требляется платина, реже — медь, индий и
другие чистые металлы.
Платиновый термометр сопротивления—
наиболее надежный прибор для измерений
низкой температуры (вплоть до 10 К).
При изготовлении платинового термо-
метра большое значение имеют чистота
платины и отсутствие механических напря-
жений в проволоке (как во время изготов-
ления, так и в процессе эксплуатации).
Напряжения, неминуемо появляющие-
ся в процессе изготовления термометра,
должны быть сняты соответствующей тер-
мообработкой (отжиг при температуре 600—
700 °C в потоке кислорода). Проволока
должна располагаться на каркасе термо-
метра совершенно свободно, без натяжения.
Удобным показателем качества изго-
товления и чистоты платины служит отно-
шение а сопротивлений при 100 °C и 0°С;
у лучших образцов предельно чистой пла-
тины а— /?100<>с/У01'С==1,3927; при за-
грязнении а уменьшается. По рекомендации
МПТШ-68 необходимо, чтобы а>1,3925.
Практически для изготовления низкотемпе-
ратурных термометров применяются спек-
трально чистая платина «Победа» (а=
= 1,3924) и платина марки ПЛ-0, которая
полностью соответствует требованиям
МПТШ-68.
Конструкция термометров может быть
весьма разнообразной в зависимости от из-
меряемой среды, допустимых габаритов,
температурного интервала, требуемой точ-
ности измерений и других факторов. Чаще
всего термометры изготовляют из тонкой
платиновой проволоки (диаметр 0,05—
0,1 мм), которая закрепляется на изоляци-
онном каркасе. Длина проволоки выбира-
ется из расчета необходимой величины со-
противления при 0 °C (обычно от 10 до
100 Ом). Каркасы для термометров делают
из слюды (для технических термометров),
фарфора, кварца.
Отечественная промышленность серий-
но выпускает низкотемпературные платино-
вые термометры. Так, НПО «Термоприбор»
(г. Львов) и Луцкий приборостроительный
завод производят термометры различного
назначения, в том числе низкотемператур-
ные с пределом измерений до 13 К и по-
грешностью 0,1—0,5 К (класс точности 2).
Всесоюзный научно-исследовательский ин-
ститут физико-технических и радиотехниче-
ских измерений (ВНИИФТРИ, пос. Менде-
лееве Московской обл.) изготовляет образ-
цовые платиновые термометры типа
ТСПН-1 и ТСПН-2 для интервала темпера-
тур 13,8—273,15 К; их погрешность 0,01—
0,005 К.
В отличие от более ранних практиче-
ских температурных шкал (1948—1960 гг.),
для которых интерполяционной функцией
служил многочлен относительно Т, в
МПТШ-68 эта функция представлена в ви-
де стандартной таблицы W'ct(7’68) для не-
которого гипотетического термометра во
всей области низких температур. При гра-
дуировке реальных термометров находят
поправочную функцию AW7(7’6s) к этой
стандартной таблице. Значение Д W (Тва)
определяют в метрологических лаборатори-
ях при градуировке термометра в реперных,
точках МПТШ-68 (см. табл. 10.1). Чтобы
найти поправки ДF(T^s) при промежуточ-
ных температурах, используют интерполя-
ционные формулы. Таблица функции
ДИ7(Т68) обычно прилагается к паспорту
термометра.
Данные стандартной таблицы И7Ст(7’бз)
для платинового . термометра (аТг1,3925)
приведены в табл. 10.6.
Подробнее о градуировке низкотемпе-
ратурных платиновых термометров см. в
[712].
Медный термометр сопротивления при-
менительно к области низких температур
имеет ряд. положительных качеств: относи-
тельную дешевизну и доступность матери-
ала, удовлетворительную воспроизводимость
и стабильность показаний, большую меха-
ническую прочность и, следовательно, воз-
можность жесткого соединения (приклейки)
термометрической проволоки к медному
каркасу. Обычно для изготовления термо-
метра используют тонкую медную проволо-
ку (диаметром около 0,05 мм) в эмалевой
изоляции; проволоку бифилярно наматыва-
ют на каркас в виде отрезка тонкостенной
медной трубки, покрытой слоем клея БФ..
В табл. 10.7 даны значения W=
—Ет/Ео={(Т) для медного термометра со-
противления.
При необходимости в более точных из-
мерениях показания термометра приводят к
таблице по правилу Маттисеиа, градуируя
термометр в реперной точке, ближайшей к
рабочему температурному интервалу. Со-
Термометры сопротивления
293
Таблица 10.6. Значения относительного сопротивления платинового термометра
W (Тв8), соответствующие стандартной функции МПТШ-68 (при целых значениях Гвз)
тев, К V (Тев} Г.8, К Те„ К V (Г.,)
13 0,00123.61 71 0,16)77108 129 0,4к 33628
14 0,00145973 72 0,165.5643 130 0,414567и9
15 0,00174541 73 0,16935049 131 0,41879507
16 0,00209474 74 0,17365240 132 0,423л2и15
17 0,00251512 75 0,17796117 133 0,42724233
18 0,003л1428 76 0,182276)5 134 0,43146169
19 0,00359962 77 0,18659628 135 0,43567831
2 j 0,0042778) 78 0,19092107 136 0,43989210
21 0,005 5495 79 0,19524992 137 0.444Ю322
22 0,00593668 83 0,19958212 138 0,44831159
23 0,006928 4 81 0,20391714 139 0,45251730
24 0,00803316 82 0,20825445 140 0,45672033
25 0,00925504 83 0,21259344 141 0,46.92077
26 0,01059585 84 0,21693388 142 0,46511861
27 0.012J5690 85 0,22127523 143 0,46931387
28 0,01363901 86 0,22561712 144 0,47350660
29 0,01534261 87 0,22995916 145 0,47769682
30 0,01716768 88 0,23433105 146 0,48188459
31 0,01911363 89 0,23864248 147 0,48606985
32 0,02117944 90 0,24298315 148 0,49.25274
33 0,02336343 91 0,24732293 149 0,49443319
34 0,02566335 92 0,25166128 15л 0,49861135
35 0,028а7645 93 0,25599836 151 0,502787л7
36 0,03059953 94 0,26333369 152 0,50696.58
37 0,03322916 95 0,26466718 153 0,51113172
38 0,03596155 96 0,26899873 154 0,5153 '‘.65
39 0,038793 5 97 0,273328 17 155 0,51946737
40 0,04171968 98 0,27765516 156 0,5236318л
41 0,0447376 ) 99 0,28197988 157 0,527794.9
42 0,04784292 Юз 0,2863 )2 '1 158 0,53195417
43 0,051b3178 131 0,29 62154 159 0,53611211
44 0,05433636 Г. 2 0,29493841 16) 0,54 26792
45 0,05764486 ЮЗ 0,29925245 161 0,54442167
46 0,061-6161 124 0,30356359 162 0,54857336
47 0,06454679 1л5 0,33787183 163 0,55272291
48 0,068.969 ) 106 0,3121771 -I 164 0,55687-48
49 0,0717. 835 107 0,31647939 165 0,56Ю16:6
50 0,07537756 108 0,32077856 166 0,56515958
51 0/7910123 к.9 0,32507467 167 0,56930112
52 0,08287595 113 0,32936765 168 0,57344076
53 0,08669859 111 0,33365751 169 0,57757848
54 0,093566) ' 112 0,33794416 17л 0,58171423
55 0,09447515 113 0,34222768 171 0,585848.6
56 0,09842336 114 0,3465 -8 )•< 172 0,58997999
57 0,10240774 115 0,35 78519 173 0,594110-8.
58 0,10642583 116 0,355 59Т< 174 0,59823835
59 0,110475 6 117 0,35932989 175 0,60236478
6J О;11455312 118 0,36359754 176 0,63648931
61 0,11865789 119 0,36786199 177 0,610612.8
62 0,12278722 120 0,37212331 178 0,61473310
63 0,12693914 121 0,37638151 179 0,61885229
64 0,13111189 122 0,38063657 180 0,62296972
65 0,13533363 123 0,38488851 181 0,6270854 ।
66 0,13951284 124 0,38913732 182 0,63119939
67 0,14373830 125 0,39338316 183 0,63531164
68 0,14797773 126 0,39762594 184 0,63942213
69 0,15223258 127 0,40186567 185 0,64353094
70 0,15649541 128 0,40610242 186 0,647638л7
294
Элементы низкотемпературной, термометрии
Прс/йолжение табл. 10.6
Т"б8> к Ч7 (Гв0 Гб8. К ЙТ (Ты) Тм, К 1Г (Гв5)
187 0,65174352 217 0,77417730 247 0,89533224
188 0,65584730 218 0,77823545 248 0,89935049
189 0,65994947 219 0,78229223 249 0,90336744
19Э 0,66404996 220 0,78634756 250 0,90738309
191 0,66814886 221 0,79040151 251 0,91139753
192 0,67224607 222 0,79445409 252 0,91541074
193 0,67634176 223 0,79850523 253 0,91942274
194 0,68043577 224 0,80255506 254 0,92343343
195 0,68452825 225 0,80660352 255 о'92744283
196 0,68861913 226 0,81065054 256 0 93145101
197 0.69270841 227 0,81469625 257 0,93545805
198 0,69679617 228 0,81874059 258 0 93946371
199 0,70088232 229 0,82278364 259 6'94346822
200 0,70496694 230 0,82682531 260 0,94747152
201 0,70905004 231 0,83086561 261 0 95147352
202 0,71313161 232 0,83490461 262 095547430
203 0,71721174 233 0,83894224 263 0,95947385
204 0,72129э26 234 0,84297857 264 0,96347219 0,96746931 0,97146513 0,97545980 0,97945325 0,98344541 0,98743642 0,99142614 0,99541471 0,99940199
205 0,72536733 235 0,84701353 265
206 0,72944288 236 0,85104726 266
207 0,73351690 237 0,85507963 267
208 0,73758947 238 0,85911069 268
209 0,74166359 239 0,86314046 269
210 0,74573026 240 0,86716894 270
211 0,74979841 241 0,87119611 271
212 0,75386518 242 0,87522199 272
213 0,75793043 243 0,87924657 273
214 0,76199430 244 0,88326994
215 0,76605672 245 0,88729200 —
216 0,77011770 246 0,89131269 — —
Таблица 10.7. Значения для медного термометра сопротивления
т, к Й7-106 Т, К U7.16е у, К r-ioe Т, К IT. 10* Т, К Й7-104 т, К Г.10* г, к Й7.104
13,0 8654,5 15,8 8795,0 18,6 9062,1 30,0 129,54 52 471,000 110 2787,7 250 9002,0
13,2 8661,5 16,0 8809,2 18,8 9087,8 31,0 136,15 54 523,30 120 3243,6 260 9434,0
13 4 8668,5 16,2 8824,1 19,0 9119,0 32.0 143,43 56 580,00 130 3699.б 270 9865,4
13'б 8676,8 16,4 8839,G 20,0 9270,0 33,0 151,62 58 640,23 140 4153,8 273,16 10000
13*8 8685,0 16,6 8855,8 21,0 9451,0 34,0 160,50 60 703,10 150 4606 3 280 10293,9
14.0 8693,7 16,8 8872,8 22,0 9668,0 35,0 170,35 64 836,80 160 5054,9 290 10724,1
14,2 8702,8 17,0 8890,5 23,0 9917,0 36,0 181,00 68 983,20 170 5502,7 300 11154,0
14,4 8712,5 17,2 8909,0 24,0 10193 38,0 204,80 72 1133,3 180 5947,5 ЗЮ 11583,5
14,6 8722,6 17,4 8928,3 25,0 10520 40,0 231,10 76 1296,0 190 6388,8 320 12012,5
14,8 8733,3 17,6 8948,4 26,0 10903 42,0 231,40 80 1458,8 200 6828,8 — ——
15,0 8744,5 17,8 8969,3 27,0 11332 44,0 295,70 85 1671,2 210 7266,6 — ——
15’, 2 8756,2 18,0 8991,1 28,0 11822 46,0 335,10 90 1888,9 220 7702,5 __
15,4 8768,5 18,2 9013,8 29,0 12355 48,0 376,60 95 2109,9 230 8137,0 __
15,6 8781,5 18,4 9037,5 30,0 12954 50,0 422,10 100 2334,0 240 8570,5 — —
гласно правилу Маттисена сопротивления
образцов металлов различной чистоты отли-
чаются иа величины, не зависящие от тем-
пературы. Это дает возможность линейную
зависимость относительного сопротивления
рабочего и эталонного термометров, уста-
новленную при какой-либо градуировочной
температуре, распространить С достаточной
точностью на весь температурный интервал.
Если, например, IF* — табличное значение
Rt/Ro для эталонного термометра, а На-
значение Rt/Ro для рабочего термометра,
то связь этих величин устанавливается ли-
нейным уравнением
F*=F4-M(1—F),
Термометры сопротивления
295
где константа М должна быть определена
по градуировке в реперной точке.
Погрешность измерения температуры
медным термометром в интервале от 300
до 70 К составляет около 0,1%, между 70
и 20 К - до 1%.
Угольные термометры сопротивления
широко применяются в лабораторной
практике благодаря высокой чувствитель-
ности к температуре (сопротивление воз-
растает с понижением температуры), ма-
лым габаритам и нечувствительности к
магнитным полям. Важное преимущество
угольных термометров — сравнительная
простота их изготовления: варьируя состав
исходных материалов (смесь кокса и неф-
тяного пека) и температуру отжига, мож-
но получать термометры, работоспособные
в широком интервале температур — от нор-
мальных до 10 мК.
Основной недостаток угольных термо-
метров — невысокая воспроизводимость
показаний при их отогреве до нормальных
температур, что вызывает необходимость
в повторных градуировках. Этот недоста-
ток может быть существенно снижен пу-
тем заключения чувствительного элемента
в защитную ампулу и использования че-
тырехпроводной схемы подключения.
В низкотемпературной практике боль-
шое распространение получило использо-
вание в качестве термометров радпорези-
сторов фирмы «Аллен Бредли» (типа
ВВ 1/8, сопротивление — от 10 до 500 Ом)
при измерении температур выше 1 К и ре-
зисторов «Спирр Карсон Компани» при
измерении температур ниже 1 К.
Хорошие угольные термометры типа
КУМ (композиционный углеродный мате-
риал) изготовляются во ВНИИФТРИ
[722]. Чувствительный элемент этого тер-
мометра — прямоугольная пластинка 5Х
Х2Х0,5 мм с платиновыми выводами —
помещен в металлическую гильзу, запол-
ненную теплообменным газом. При дли-
тельной эксплуатации нестабильность тер-
мометров типа КУМ при гелиевых и во-
дородных температурах составляет соот-
ветственно 1—2 и 10—20 мК- Пределы из-
мерений этого термометра 1,5—273 К, по-
грешность ±0,002 К-
Термометры из легированного герма-
ния служат носителями действующей в
СССР практической шкалы для диапазона
температур 4,2—13,81 К, что связано с вы-
сокой воспроизводимостью их показаний
(нестабильность 0,2—0,5 мК за несколько
лет). Основные недостатки термометров:
сложная зависимость сопротивления от
температуры, затрудняющая градуировку
(необходимо использовать дополнительные
реперные точки); трудность обеспечения
высокой однородности распределения ле-
гирующих примесей по монокристаллу гер-
мания, что ведет к большому разбросу ха-
рактеристик приборов.
Термометры повышенной точности из
германия, легированного сурьмой, изготов-
ляет ВНИИФТРИ (типы ТСГ-1 и ТСГ-2).
Их характеристика: пределы измерения
2,0—30,5 К; сопротивление при 7 = 4,2 К
в пределах 200—800 Ом; погрешность
±0,005 К (ТСГ-1) и ±0,01 К (ТСГ-2);
длительная стабильность ±0,002 К. Гер-
маниевые термометры этого типа не сле-
дует использовать при работе с сильными
магнитными полями [723].
Серию миниатюрных термометров на
основе германия с многокомпонентным ле-
гированием выпускает Институт полупро-
водников АН УССР (г. Киев) [724]; в
табл. 10.8 даны основные параметры этих
приборов.
Таблица 10.8. Параметры германиевых
термометров
Тип Пределы измерения, К Зависимость сопротивле- ния от те пературы
ниж- ний верх- ний т, к R, Ом
вг 1,3 20 20 4,2 .1,3 10—15 (5=10) 103 (1=10)- 10s
кг 4,2 300 300 77 20,4 4,2 0,5—2,0 15—40 300—600 (40=100)-Ю3
кв 20 300 300 77 20 1,5—2 150—200 (50=80)-103
КА 77 300 300 77 2 5 (10—15)- 103
кгг 1,3 300 300 77 20,4 4,2 1,3 0,5—1,0 5—10 30—80 (1=0,5)-103 (0,3=1,0)-10®
Термометры на основе арсенида гал-
лия изготовляет Физико-технический ин-
ститут низких температур АН УССР
(ФТИНТ, г. Харьков) [725]. Эти приборы
(типа ТСАД) с пределами измерений 0,5—
100 К имеют погрешность измерений ме-
нее 0,02 К при 7=4,2 К и менее 0,05 К
при 7=100 К.
Чувствительность термометров типа
ТСАД прирост сопротивления, %, при из-
менении температуры на 1 К) составляет:
Т, К Чувствительность
0,5......................... 1000
4,2........................... 40
20............................. 3
77.............. ..... 3
296
Методы очистки газов
Кроме термометров сопротивления
ФТИНТ разработаны термодиоды [726],
термометрическим параметром которых
служит падение напряжения. Рабочий ток
термодиодов 50 мкА, напряжение изме-
няется от 1,5 до 0,5 В. Чувствительность
приборов — от 1,0 до 2,5 мВ/K, рабочий
диапазон 4,2—373 К.
10.6. МАГНИТНЫЕ ТЕРМОМЕТРЫ
В магнитной термометрии в качестве
параметра служит магнитная восприимчи-
вость парамагнитных солей. Для измере-
ний используют те соли, восприимчивость
которых приблизительно подчиняется за-
кону Кюри—Вейсса в данном интервале
температур. Согласно этому закону для
идеального парамагнетика магнитная вос-
приимчивость х обратно пропорциональна
температуре:
Х=С/7*
и, следовательно, величина 1/% может
быть принята за меру температуры Т* в
парамагнитном термометре. Приведение
«магнитной температуры» Т* к термодина-
мической шкале в области ультранизких
температур может быть произведено кало-
риметрическими измерениями путем опре-
деления изменения энтропии при подводе
К образцу парамагнитной соли известного
количества теплоты.
Используя в качестве рабочего тела
церий—магниевый нитрат (ЦМН), можно
таким способом измерить минимальную
температуру в 2 мК-
Более подробно о магнитной термомет-
рии см. в [727].
10.7. ВТОРИЧНЫЕ ПРИБОРЫ
Для точных измерений сопротивлений
термометров и термо-ЭДС термопар чаще
всего используют потенциометрический ме-
тод. В нашей стране используют потенцио-
метры, выпускаемые заводом измеритель-
ных приборов (ЗИП, г. Краснодар):
1) потенциометры постоянного тока
двухрядные полуавтоматические типов
Р-363-1 (погрешность отсчета составляет
±0,001%), Р-363-2 (погрешность ±0,002%),
Р-363-3 (погрешность ±0,005%). Мини-
мальный отсчет по шкале выходного при-
бора 0,02 мкВ. Верхний предел измерения
2,121111 В;
2) потенциометр постоянного тока
двухрядный полуавтоматический типа
Р-377. Класс точности 0,005, погрешность
отсчета ±0,005% по шкале 2 мкВ. Верх-
ний предел измерения 11,1111 В;
3) потенциометр постоянного тока
двухрядный полуавтоматический типа
Р-379. Класс точности 0,001, погрешность
отсчета 0,001% по шкале 2 мкВ. Верхний
предел измерения 11,1111 В.
В Физико-техническом институте низ-
ких температур (ФТИНТ, г. Харьков) раз-
работан универсальный измеритель — регу-
лятор низких температур типа ПТ-1 [714].
Прибор служит для измерения температур
от 1 до 1000 К и регулирования темпе-
ратур в интервалах 1—10, 10—100 и 100—
1000 К.
Институт полупроводников АН УССР
(г. Киев) выпускает ряд приборов типа
«Крион» для измерения низких температур
[714]. Приборы «Крион 1-1», «Крнон 1-2»,
«Крион 1-3» имеют стрелочные индикато-
ры температуры, две шкалы и один ка-
нал; диапазон измеряемых температур 4—
300 К- Прибор «Крион 1-4» имеет четыре
поддиапазона на двухканальном индика-
торе; «Крион 2-3» позволяет измерять тем-
пературу на двух независимых индикато-
рах.
Раздел одиннадцатый
МЕТОДЫ ОЧИСТКИ ГАЗОВ
11.1. ОБЩИЕ ПОЛОЖЕНИЯ
Низкотемпературные технологические
процессы очистки перерабатываемого сырья
помимо получения продуктов заданной чи-
стоты имеют своей целью также обеспе-
ние работоспособности аппаратуры и ма-
шин, а в ряде случаев и безопасности все-
го процесса.
Для обеспечения работоспособности
аппаратуры и машин необходимо удалить
из перерабатываемого газа механические
частицы и все газовые и паровые приме-
си, которые при охлаждении могут затвер-
деть и забить или загрязнить рабочие по-
верхности оборудования (пары воды и
масла, диоксид углерода, примеси возду-
ха в водороде, примеси азота и водорода
в гелии и т. д.).
Некоторые примеси даже в количест-
вах, не вызывающих забивку или загряз-
нение низкотемпературной аппаратуры, мо-
гут угрожать безопасности процесса (на-
пример, ацетилен и остатки масла в воз-
духоразделительных установках, кристал-
лы кислорода в водороде и т. п.). В этих
случаях требуется особо надежная очистка.
Из множества имеющихся способов
очистки газов в криогенных установках
наиболее часто используют сорбционные
процессы (абсорбцию и адсорбцию), кон-
денсацию, вымораживание, а также ката-
Осушка газов
297
литические и химические методы. Выбор
метода и схемы очистки определяется
прежде всего физико-химическими свойст-
вами очищаемого сырья и содержащихся
в ней примесей, исходным количеством
примесей и требуемой степенью очистки,
производительностью установки.
О современных промышленных мето-
дах очистки газов см. в [188, 189, 579}-
11.2. ОСУШКА ГАЗОВ
Количество влаги, содержащейся в га-
зе, зависит от температуры, давления и
относительной влажности. Упругость па-
ров воды при различных температурах
приведена в табл. 4.32, а содержание вла-
ги в насыщенном воздухе при давлении
0,1 МПа дано в табл. 11.1. Данные о ко-
личестве влаги в воздухе при различных
температурах и давлениях до 100 МПа
приведены на рис. 11.1.
Таблица 11.1. Количество водяного
пара в насыщенном воздухе, г/м3
воздушно-паровой смеси, при давлении
0,1 МПа
t, °C Влаго- содер- жание, г/м3 t, °C Влаго- с о дер- жание, г/м8 t, °C Влаго- содер- жание, г/м 8
63 129 2 5,69 —34 0,226
50 82,6 0 4,85 —36 0,184
43 50,9 —2 4,14 —38 0,149
35 39,4 —4 3,52 —40 0,120
30 33,3 —6 3,00 —42 0,096
28 27,2 —8 2,54 —44 0,077
26 24,3 — КЗ 2,14 —46 0,061
24 21,8 — 12 1,81 —48 0,049
22 19,4 — 14 1,52 —50 0,038
23 17,3 — 16 1,27 —52 0,030
18 15,36 — 18 1,06 —54 0,024
16 13,63 —2 ) 0,888 —56 0,018
14 12,65 —22 0.736 —58 0,014
12 10,68 —24 0,593 —6J 0,011
10 9,35 —26 0,504 —65 0,0056
8 8,28 —28 0,414 —70 0,0328
6 7,28 —30 0,310 —75 0,0013
4 6,39 —32 0,277 —80 0,0006
Для осушки газов в криогенных уста-
новках применяются чаще всего адсорбци-
онные процессы и вымораживание, реже —
химические методы.
Химическая осушка основана на свой-
стве ряда веществ поглощать воду, всту-
пая с ней в химическое взаимодействие.
Примерно до 1970 г. химическая осушка
довольно широко применялась в воздухо-
разделительных установках, причем в ка-
честве веществ, поглощающих воду, ис-
пользовались едкий натр, едкое кали, хло-
Рис. 11.1. Содержание влаги при полном
насыщении воздуха в зависимости от
давления и температуры [437]
ристый кальций. Содержание влаги в воз-
духе после химической осушки различны-
ми реагентами дано в табл. 11.2. Хими-
ческая осушка, как правило, не обеспечи-
вает достаточной степени удаления влаги,,
неудобна в обслуживании и обходится до-
рого. В современных криогенных установ-
ках промышленного типа она заменена ад-
сорбцией и вымораживанием.
Адсорбционная осушка. Физические'
основы и технику проведения адсорбцион-
ных процессов см. в [579]. Для поглоще-
ния влаги в качестве адсорбентов исполь-
зуют главным образом силикагели, актив-
ную окись алюминия (алюмогель), активный
глинозем, а в последнее время — синтетиче-
ские цеолиты.
Силикагель, алюмогель и активный гли-
нозем представляют собой высокопори-
29'8
Методы очистки газов
Таблица 11.2. Степень осушки
воздуха от влаги различными веществами
и вымораживанием
Вещество или способ осушки Химиче- ская формула Количество вла- ги после осуш- ки, г/м* Темпера- тура точки росы, со- ответст- вующая остаточно- му количе- ству вла- ги, °C
Хлористый каль- ций СаС1з 1,5 —14
Едкий натр NaOH 0,8 —19
Силикагель S1O2XH2O 0,03 —52
Едкое калн кон 0,014 —58
Активная окись AlaOs-^HaO 0,005 —64
алюминия Активный глино- 0,005 —64
зем
Цеолиты <0,003 Ниже—70
Вымораживание — 0,067 —15
при температу- ре —45 °C
стые вещества в виде зерен неправильной
формы размером 1—7 мм.
Цеолиты, называемые также молеку-
лярными ситами, — это кристаллические
полигидраты алюмосиликатов кальция и
натрия, из которых удалена вода. Цеоли-
ты обладают большой удельной поверхно-
стью, имеют поры с размером входного
окна 0,3—1 нм и хорошо поглощают ве-
щества, молекулы которых имеют мень-
ший размер, чем диаметр пор цеолитрв.
Цеолиты обеспечивают самую высокую
степень осушки. Имеются данные, что ос-
таточное содержание воды при осушке га-
зов цеолитами может составлять 1-10~5%.
.Это соответствует точке росы —100 °C.
Физические свойства наиболее часто
используемых адсорбентов приведены в
табл. 5.28. Более подробные данные см. в
[579].
Адсорбционная осушка воздуха и при-
родного газа — самый предпочтительный
способ для промышленных газораздели-
тельных и ожижительных установок. При
высоком содержании влаги в перерабаты-
ваемом газе применяют адсорберы с ком-
бинированной шихтой силикагель—цеолит.
Производительность промышленных ус-
тановок адсорбционной очистки по пере-
рабатываемому газу достигает 40 млн.
м3/сут, при этом адсорберы имеют диа-
метр до 2,4—2,6 м. Длительность полного
цикла (адсорбция и регенерация) находит-
ся в пределах 8—96 ч в зависимости от
размеров аппаратов и содержания влаги
в исходном газе. Управление крупными
установками осушки, как правило, авто-
матизировано.
Динамическая влагоемкость адсорбен-
тов при атмосферном давлении состав-
ляет: для силикагеля марки КСМ — до
25%, для силикагеля КСК—до 9,5%, алю-
могеля и глинозема — до 8—12% массы
адсорбента.
Динамическая активность цеолитов по
парам воды при температуре 20—25 °C п
скорости воздуха 1,2 л/(мин-см2) должна
быть не менее: 120 мг/г для цеолита СаА,
140 мг/г для NaA, 150 мг/г для СаХ и
160 мг/г для NaX [190]. При этом сте-
пень осушки должна соответствовать точ-
ке росы не выше —70 °C.
При расчете промышленных блоков
осушки рекомендуется принимать влагоем-
кость активной окиси алюминия А2 и гли-
нозема равной 4—5%, синтетических цео-
литов— 10% массы адсорбента. Рекомен-
дуемые скорости газа при адсорбционной
осушке равняются примерно 0,2—0,4л/мин
на 1 см2 площади сечения адсорбера.
После насыщения адсорбента влагой
он должен быть регенерирован, и потому
для непрерывного ведения процесса осуш-
ки необходимо иметь как минимум два
адсорбера. Регенерация адсорбента (де-
сорбция влаги) может проводиться про-
дувкой нагретым газом или вакуумирова-
нием адсорбера с одновременным его по-
догревом.
Схема адсорбционного блока осушки
применительно к воздухоразделительным
установкам показана на рис. 11.2. Сжа-
тый воздух из компрессора поступает в
баллон 1, заполненный кольцами Рашига
(или глиноземом), где отделяется капельная
влага и задерживаются капельки масла,
уносимые из масловлагоотделителя ком-
прессора. Затем через систему клапанов
воздух поступает в один из попеременно
работающих адсорберов (2 или 3), где
осушается. При выходе из адсорбера су-
хой воздух проходит через керамический
(или иной) фильтр, задерживающий пыль
адсорбента. Осушка в каждом адсорбере
ведется в течение 8—16 ч, после чего ад-
сорбент регенерируется. Регенерация ад-
сорбента производится продувкой через
него в течение 3—4 ч азота, нагреваемого
в печи 11 цо температуры 250—280 °C
(для активного глинозема) или до 170—
180 °C (для силикагеля).
Регенерацию цеолитов целесообразно
проводить при 200—350 °C, хотя они вы-
держивают температуру до 600 °C без за-
метного изменения адсорбционных свойств.
Для уменьшения потерь теплоты при
регенерации адсорберы должны иметь теп-
ловую изоляцию.
Конструкции адсорберов, фильтров и
арматуры см. в [190, 203].
Осушка вымораживанием производит-
ся в специальных теплообменниках, а в
крупных воздухоразделительных установ-
ках низкого давления — в регенераторах
или пластинчатых теплообменниках (одно-
временно с очисткой от диоксида углеро-
да, см. ниже).
Примеры простейшей схемы осушки
Осушка газов
299-
Рис. 11.2. Схема адсорбционного блока осушки:
/ — баллон-влагоотделитель; 2, 3—баллоны с адсорбентом; 4, 5 — фильтры; 6, 7 — манометры;
.8, 12— термометры; 9, 13— датчики терморегулятора; 10 — расходомер азота; 11 — печь для подо-
трева азота; 14— терморегулятор; 15— вентиль для регулирования количества азота
вымораживанием показаны на рис. 11.3.
Блок осушки состоит из двух теплообмен-
ников п промежуточного влагоотделителя.
В предварительном теплообменнике 1
(«ожижителе») осушаемый газ охлаждает-
ся до температуры 2—5 °C. Сконденсиро-
Рис. 11.3. Схемы осушки газа выморажи-
ванием в теплообменниках:
я —охлаждение обратным потоком криоагента;
б— охлаждение аммиаком (фреоном)
вавшаяся при этом влага отделяется во'
влагоотделителе 3 и удаляется через про-
дувочный вентиль. В теплообменнике 2’
(«вымораживателе»), охлаждаемом обрат-
ным потоком криоагента или посторонним1
хладагентом до заданной температуры, вы-
деляющаяся влага оседает в виде льда на
теплообменной поверхности. В случае при-
менения трубчатых теплообменников поток,
осушаемого газа обычно подается в меж-
трубное пространство, охлаждающий поток,
движется по трубкам.
Для обеспечения непрерывной осушки
устанавливаются два вымораживателя, по-
переменно включаемых в работу системой
переключающих клапанов. В то время как
один из вымораживателей находится в
работе, другой отогревается, после чего1
влага, образовавшаяся от таяния льда,
удаляется продувкой. Количество влаги в.
сухом газе соответствует точке росы при
температуре выхода газа из теплообмен-
ника 2.
Следует иметь в виду, что при осушке
вымораживанием наблюдается унос части-
чек льда потоком газа, что ухудшает сте-
пень осушки. Выбором соответствующей
конструкции вымораживателя и режима те-
чения газа в нем, а в некоторых случаях
и установкой специальных фильтров унос
может быть уменьшен. В современных ус-
тановках ручное управление работой бло-
ков осушки заменяется автоматическим.
300
Методы очистки газов
11.3. ОЧИСТКА ВОЗДУХА
И ГАЗОВЫХ СМЕСЕЙ ОТ ДИОКСИДА
УГЛЕРОДА
В низкотемпературных процессах
очистка от СОз производится прежде все-
го для предотвращения забивки аппарату-
ры твердыми его частицами. Наиболее рас-
пространенными методами очистки от СО2
служат: промывка жидкими поглотителя-
ми, вымораживание, адсорбция при низких
температурах.
Очистка от диоксида углерода мето-
дом промывки. Метод основан на химиче-
ском взаимодействии СОг с поглотителем
или на растворении СОз в промывающей
жидкости без химической реакции (про-
цесс абсорбции). В качестве промывающих
жидкостей используют растворы щелочей,
моноэтаиоламина, воду, метиловый спирт
и др. Очистка ведется обычно под повы-
шенным давлением в аппаратах, устанав-
ливаемых после 1-й или 2-й ступени ком-
прессора.
Применявшаяся в прошлом очистка
воздуха от СОг водными растворами
NaOH или КОН в современных воздухо-.
разделительных установках не использует-
ся. Для очистки от СОг газовых смесей
в последнее время применяется промывка
охлажденным метиловым спиртом и Дру-
гими органическими растворителями [188].
Промывка водой под давлением дает
возможность понизить содержание СОг в
газе примерно до 0,4—0,6%, раствором
моноэтаиоламина — до 0,04—0,05%. По-
этому эти способы обычно применяются
для предварительной очистки газовых
смесей со значительным содержанием
СОг, например коксового газа (СОг^.-
«З-т-4%), природного газа (C02ssO,8%)
и т. п. Подробнее об абсорбционных ме-
тодах очистки от СОг см. в [188, 189].
Вместе с СОг в процессе промывки
удаляются в значительной мере и такие
примеси, как H2S, С2Н2, NO.
Очистка от диоксида углерода вымо-
раживанием. Вымораживание СОг с целью
очистки от него газовых смесей проводят
в регенераторах или в реверсивных тепло-
обменниках-рекуператорах. Процесс очист-
ки при этом совмещают с охлаждением
и осушкой газа.
Регенераторы представляют собой ап-
параты, заполненные теплоемкой насадкой
с развитой поверхностью. В качестве на-
садок применяют диски из гофрированной
алюминиевой ленты или гранулированный
камень достаточно прочной породы (на-
пример, базальт), поскольку насадка пе-
риодически охлаждается и нагревается по-
токами проходящих газов. Для непрерыв-
ной работы необходимо иметь не менее
двух регенераторов; в этом случае по од-
ному из них идет обратный поток, охлаж-
дающий насадку, а по другому—прямой
поток газа, отдающий свою теплоту на-
садке. О подробной теории работы и
устройстве регенераторов см. в [203, 190,
770].
Очистка газа в регенераторах и ре-
версивных теплообменниках основана на
том, что примеси (влага, СОг и т. д.),
осаждающиеся на поверхности холодной
насадки при прохождении прямого пото-
ка, испаряются и уносятся обратным по-
током.
Степень очистки от СОг выморажи-
ванием зависит от температуры охлажде-
ния газовой смеси и в первом приближе-
нии может быть рассчитана по упругости
паров СОг при этой температуре.
Расчетное содержание СОг в воздухе
после регенераторов составляет (0,03-г
28)-10“4% в зависимости от температу-
ры. Однако фактическое содержание СОг
в очищенном воздухе превышает теорети-
ческое в десятки раз. Это связано, во-
первых, с конечной скоростью осаждения
СОг из движущегося потока воздуха, что
приводит к смещению зоны его выделения
в сторону более низких температур, и,
во-вторых, с наличием механического уно-
са частичек твердого СОг потоком воз-
духа.
В воздушных регенераторах задержи-
вается около 95% содержащегося в воз-
духе диоксида углерода.
Чтобы предотвратить забивку (замер-
зание) регенератора, необходимо создать
условия, обеспечивающие полный вынос
обратным потоком чистого газа всех при-
месей, накопившихся на поверхности на-
садки во время прохождения прямого по-
тока очищаемого газа. Основными пара-
метрами, определяющими незамерзаемость
регенераторов, служат отношение объемов
прямого и обратного потоков газа и раз-
ность их температур. Чем больше отноше-
ние V2/V1 или pi/рг (где Vi и pi — объем
I_LJ__L—J_LJ___Mill ___ I 1...
00 30 20 10 0 -10 -20-30-w -50-60
Температура воздуха?°С
Рис. 11.4. Максимально допустимая раз-
ность температур, обеспечивающая иезаби-
ваемость воздушных регенераторов водя-
ным паром [190]:
----------при <р=1;-------при <р = 0,6
Очистка воздуха и газовых смесей от диоксида углерода
301
Рис. 11.5. Максимально допустимая разность температур, обеспечивающая незабивае-
мость воздушных регенераторов диоксидом углерода [190]
и давление прямого потока; V? и рг — то
же для обратного) и чем меньше раз-
ность температур потоков, тем лучше идет
процесс самоочистки регенераторов. На
рис. 11.4 и 11.5 приведены графики мак-
симально допустимых разностей темпера-
тур, обеспечивающих незабиваемость реге-
нераторов водяным паром и диоксидом уг-
лерода при различных отношениях pi/рг
в предположении 100%-ного насыщения
обратного потока возгоняемыми примеся-
ми. Если на эти графики нанести линию
изменения средней действительной разно-
сти температур между потоками [кривая
на рис. 11.5], то точки ее пе-
ресечения с соответствующими кривыми
графика показывают температуры, при ко-
торых начинается зона необратимой за-
бивки. Так как в реальных условиях нель-
зя получить 100%-иого насыщения приме-
сями обратного потока, то зона необра-
тимой забивки начинается раньше, при бо-
лее высокой температуре. Для улучшения
условий самоочистки можно увеличивать
отношение давлений прямого и обратного
потоков или снижать действительную раз-
ность температур на холодном конце ре-
генератора.
Увеличение отношения давления обыч-
но ограничено и само по себе недостаточ-
но эффективно. Для уменьшения разно-
сти температур могут быть применены два
метода: количественное увеличение обрат-
ного потока по сравнению с прямым
(рис. 11.6) и введение так называемого
несбалансированного (или «петлевого») по-
тока.
Наиболее простым способом количест-
венного увеличения обратного потока в ре-
генераторах воздухоразделительных уста-
новок служит очистка части прямого по-
тока от СОг химическим путем или ад-
сорбцией. Схема уменьшения температур
в регенераторах при введении адсорберов
показана на рис. 11.7. При прохождении
через регенератор прямого потока часть
его (до 10%) при температуре 140—
150 К отводится через систему автомати-
ческих клапанов в адсорберы, где очища-
ется от оставшегося СОг. В результате
прямой поток, проходящий по холодной
части регенераторов, уменьшается по отно-
шению к обратному потоку, что и приво-
дит к снижению разности их температур.
Метод несбалансироваииого потока,
впервые примененный американскими ис-
следователями [438], заключается в том,
что часть обратного потока после нагре-
вания (или часть прямого потока после
охлаждения) до определенной температу-
ры вновь возвращается на холодный ко-
302
Методы очистки газов
Рис. 11.6. Схема включения регенераторов
и изменение разности температур между
прямым и обратным потоками в регене-
раторах:
1 — регенераторы; 2 — принудительные клапаны.
3— автоматические клапаны; кривые: а—обрат-
ный поток газа; б — воздуха (прямой поток) в
количестве, на 3% меньшем обратного потока;
е — воздух в количестве, равном обратному по-
току газа
нец аппарата, в результате чего разность
температур потоков уменьшается.
В СССР была разработана и успеш-
но применена для этих целей схема с тре-
мя регенераторами [203].
Метод внутреннего несбалансированно-
го потока имеет существенный недостаток:
его конструктивное оформление довольно
сложно. Поэтому в современных воздухо-
разделительных установках незабивае-
мость регенераторов обеспечивается, как
правило, отбором части воздуха из их
средней части с последующей очисткой
этого воздуха от СОз и углеводородов в
отдельных адсорберах.
Вымораживание диоксида углерода в
реверсивных теплообменниках. Реверсив-
ный теплообменник в простейшем виде
представляет собой теплообменный аппа-
рат с двумя гидравлически подобными ка-
налами, по одному из которых движется
прямой поток исходного газа, а по
другому — обратный (холодный) поток
(рис. 11.8). Теплообменник снабжается
системой клапанов, автоматически пере-
ключающих потоки газа с одного канала
на другой через сравнительно небольшой
промежуток времени (5—15 мин). Содер-
жащиеся в газе примеси вымерзают при
охлаждении на стенках теплообменника, а
после переключения каналов сублимиру-
ются обратным потоком и выносятся из
аппаратов. Теорию вымораживания при-
месей в реверсивном теплообменнике см.
в [214].
Пластинчато-ребристые реверсивные
теплообменники можно использовать для
Рис. 11.7. Схема газовых потоков и изме-
нение их температуры при отводе из сере-
дины регенераторов части сжатого воз-
духа:
1 — регенераторы; 2—адсорберы; 3— принуди-
тельные клапаны; 4 — автоматические клапаны;
5 — клапаны подачи воздуха в адсорберы
очистки смесей с содержанием СОз до 5%.
В настоящее время они применяются в
крупных воздухоразделительных установ-
ках.
По сравнению с регенераторами пла-
стинчато-ребристые теплообменники имеют
более высокую эффективность, значительно
меньшие габариты и массу.
В установках высокого давления (15—
20 МПа) для получения жидкого кислоро-
да имеется и другая возможность удалять
СО2. При высоком давлении СО2 вымора-
живается при температуре, которая на 50 К
ниже температуры, соответствующей его
парциальному давлению (см. табл. 5.22).
В этих условиях СО2 не будет осаждаться
в теплообменнике и целиком попадет в куб'
нижней колонны. Из кубовой жидкости
твердый диоксид углерода отфильтровыва-
ется при передаче в верхнюю колонну.
Очистка от двуокиси углерода адсорб-
цией. При температурах 200 К и ниже СОз
хорошо адсорбируется рядом поглотителей.
Метод очистки адсорбцией благодаря своим
преимуществам (простоте процесса, высо-
кой степени очистки и т. Д.) получает все
более широкое применение. В качестве
адсорбентов используют силикагель, акти-
вированные угли, цеолиты.
Данные по адсорбционным свойствам
промышленных адсорбентов и схемы ад-
сорбционных установок см. в [192, 579].
Изотермы адсорбции для некоторых ве-
ществ даны в разд. 5.
Для непрерывной работы необходимо
иметь два адсорбера: в одном идет процесс
адсорбции, а другой в это время регенери-
руется. Регенерация ведется чистым подо-
гретым газом. Режим регенерации зависит
Очистка воздуха и газовых смесей от диоксида углерода
303
Рис. 11.8. Схема газовых потоков и изме-
нение температуры в реверсивных тепло-
обменниках с тремя каналами:
J, 2—основные переключаемые каналы; 3 — до-
полнительный канал
Температура, прямого nomoKtxfK
Рис. 11.9. Максимально допустимая раз-
ность температур для полной сублимации
азота в регенераторах [236]
от рода адсорбента. Через определенный
период времени адсорберы переключаются.
Периодические нагревание (при регенера-
ции) и охлаждение (при работе) адсорбе-
ра приводят к дополнительным относитель-
но небольшим потерям холода.
В современных воздухоразделительных
установках производится обычно комплекс-
ная очистка воздуха, т. е. в одном блоке
производится очистка воздуха от СОг, вла-
ги и углеводородов. Отечественной про-
мышленностью серийно выпускаются такие
(блоки: ОФ 960/70 для воздухораздели-
тельных установок среднего давления и
'ОФ 1080/200 для установок высокого давле-
ния [216]. В блоках очищается соответствен-
но 960 и 1080 м3 воздуха в 1 ч. Предвари-
тельное охлаждение воздуха осуществляет-
ся автоматической холодильной установкой,
работающей на хладоне. Регенерация цео-
лита, заполняющего адсорберы, ведется су-
хим воздухом или азотом, нагретым при-
мерно до 670 К.
В крупных воздухоразделительных
установках производительность адсорбцион-
ных блоков комплексной очистки по возду-
ху достигает десятков тысяч кубических
метров в час.
Адсорбция на цеолитах — наиболее
рациональный и повсеместно используемый
способ очистки от СО2 природного газа
перед его разделением или сжижением.
Так, в США к 1970 г. находилось в экс-
плуатации более 10 установок, которые
очищали свыше 30 млн. м3 природного га-
за в сутки [579].
Адсорбция на цеолитах служит эффек-
тивным способом и для поддержания не-
обходимой оптимальной концентрации СОг
и влаги в атмосфере изолированных си-
стем (например, в хранилищах овощей и
фруктов, на космических кораблях и т. д.).
Очистка от твердого диоксида углеро-
да путем фильтрации. При очистке вымо-
раживанием в газе остается некоторое ко-
личество СОг, что может неблагоприятно
сказаться на работе отдельных узлов уста-
новки, где газ подвергается дальнейшему
охлаждению и сжижению. Так, например,
в воздухе после очистки в регенераторах
остается около 15—20 миллионных долей
СО2. После сжижения воздуха оставшийся
в газе диоксид углерода переходит в жид-
кость испарителя и поступает с ней в верх-
нюю колонну, забивая отверстия в тарел-
ках и дроссельном клапане. Путем уста-
новки фильтров на линии жидкости можно
задержать до 90 % частичек твердого СОг
(часть СО2, около 5—6 см3/м3, растворяет-
ся в жидкости и не может быть задержа-
на фильтром).
Фильтрующие элементы изготовляются
из пористой керамики или пористой бронзы
и имеют размер пор 40—100 мкм. Обычно
фильтрующие элементы имеют форму ко-
нусной трубы толщиной 15—30 мм для по-
ристой керамики и 3—5 мм для пористой
бронзы. Эффективность очистки при увели-
чении толщины фильтра повышается незна-
чительно. Поверхность фильтра определяет-
ся, исходя из расхода фильтруемой жидко-
сти и скорости фильтрации, которую реко-
мендуется выбирать равной примерно
0,5—0,8 л/ч на 1 см2 фильтрующей поверх-
ности. Степень очистки зависит от размера
пор фильтра и составляет при фильтрации
СО2 из жидкого кислорода 90—95 % при
размере пор 60—50 мкм и 65—75 % при
размере пор 100—90 мкм [203].
Для обеспечения непрерывной работы
устанавливают два фильтра, работающие
поочередно. В некоторых случаях фильтры
конструктивно объединяют с адсорберами
для поглощения ацетилена.
304
Методы очистки газов
11.4. ОЧИСТКА ВОДОРОДА И ГЕЛИЯ
ОТ АЗОТА И ОКСИДА УГЛЕРОДА
На химических заводах зачастую важ-
но иметь азотоводородную смесь, практи-
чески свободную от СО и СН4. Эффектив-
ным методом очистки от этих примесей слу-
жит промывка водорода жидким азотом.
Такая промывка, в частности, давно приме-
няется в аппаратах разделения коксового
газа.
Промывка жидким азотом вместо мед-
но-аммиачной очистки обеспечивает получе-
ние. азотоводородной смеси с остаточным
содержанием СО не более 0,001 % [188].
Для нормальной работы низкотемпера-
турной аппаратуры водородных и гелиевых
сжижительных установок рабочий газ тре-
буется очищать до содержания примесей
порядка 10-8—10 ‘7 объемных долей. Азот
и оксид углерода достаточно близки по
своим физическим свойствам и при затвер-
девании образуют кристаллиты с темпера-
турой тройной точки, находящейся между
соответствующими точками чистого N2
(63,1 К) и чистого СО (67,2 К). Упругость
пара также лежит между значениями упру-
гостей паров чистых компонентов.
Если в исходном сырье содержится
большое количество азота (5—20 %), то
основная его часть может быть удалена
простой конденсацией. Так, в азотоводо-
родной смеси путем конденсации содержа-
ние азота можно понизить до 2—3 %, что
соответствует равновесному составу при
температуре тройной точки. Дальнейшая
очистка до необходимой степени чистоты
может быть проведена вымораживанием
(в регенераторах или переключаемых теп-
лообменниках) или адсорбцией.
Очистка от азота вымораживанием.
Физические основы очистки от азота в ре-
генераторах и реверсивных теплообменни-
ках подобны рассмотренным выше приме-
нительно к вымораживанию диоксида угле-
рода из воздуха.
Специальные исследования [236] пока-
зали, что регенераторы могут быть исполь-
зованы для очистки водорода, содержащего
примеси азота в количестве до 2,5 %. При
этом имеют место следующие основные от-
личия работы водородных регенераторов по
сравнению с воздушными:
а) водородные регенераторы для очист-
ки от азота работают в интервале темпера-
тур 25—70 К, и поэтому материалы, обыч-
но используемые для насадок воздушных
регенераторов (алюминий, базальт), оказы-
ваются здесь непригодными вследствие зна-
чительного уменьшения их теплоемкости
при низких температурах. Для насадок во-
дородных регенераторов наиболее приемле-
мыми' металлами служат свинец и цинк;
б) условия самоочистки водородных ре-
генераторов от азота менее благоприятны,
чем условия самоочистки воздушных реге-
нераторов от СО2.
На рис. 11.9 представлена диаграмма
максимально допустимых разностей темпе-
ратур, обеспечивающих незабиваемость ре-
генераторов азотом, при различных отно-
шениях давлений прямого и обратного по-
токов в предположении 100 %-ного насы-
щения обратного потока возгоняемым азо-
том. Здесь же показана кривая изменения
средней действительной разности темпера-
тур потоков. Данные получены из матери-
ального и энергетического балансов для
давления прямого потока 0,5 МПа н при
недорекуперации 1,5 К. Видно, что действи-
тельная разность температур потоков уве-
личивается по мере приближения к холод-
ному концу регенератора вследствие превы-
шения теплоемкости прямого потока над
теплоемкостью обратного. Удаление твердо-
го азота на теплом конце регенератора
происходит вполне успешно, но начиная
с некоторой температуры (38 К для pi/p2=
=5) действительная разность температур
превышает допустимую, поэтому далее идет
зона необратимой забивки. Так как в ре-
альных условиях никогда не может быть
достигнуто 100 °/о--ное насыщение обратного
потока возгоняемым азотом, зона необра-
тимой забивки начинается при более высо-
ких температурах.
Для уменьшения действительной разно-
сти температур, необходимой по условиям
самоочистки, могут быть использованы те
же методы, что и в воздушных регенера-
торах, а именно — количественное увеличе-
ние обратного потока по сравнению с пря-
мым и метод «несбалансированного» пото-
ка (см; с. 301). Однако если в воздушных
регенераторах для самоочистки от СО2 тре-
буется увеличение обратного потока на 3—
4 %, то в водородных регенераторах для
самоочистки от азота расчетный обратный
поток должен быть приблизительно на 15 %
больше прямого (при 100 %-ном насыщении
возгоняемым азотом).
Как и при очистке воздуха от СО2,
в водородных регенераторах происходит
механический унос твердого азота. Так,
в водороде, выходящем из регенераторов
при 30 К, количество азота в 4 раза пре-
вышает рассчитанное по упругости паров
над кристаллом.
О применении реверсных теплообмен-
ников для очистки водорода от азота см.
в [214].
Из диаграммы фазового равновесия
смеси Н2 — N2 (см. рис. 5.28) следует, что
при давлении 1,0 МПа реверсивные тепло-
обменники могут применяться для охлаж-
дения и очистки газа лишь до 35—40 К.
Количество же азота, содержащегося в во-
дороде при температуре 40 К, еще доста-
точно, чтобы забить последующие аппара-
ты, работающие при более низких темпера-
турах (например, ректификационные колон-
Очистка водорода и гелия от азота и оксида углерода
305
ны для дистилляции жидкого водорода).
Поэтому для охлаждения водорода с 40
до 20 К и соответствующей очистки его от
примесей Ns и СО применяют обычные пе-
реключаемые теплообменники.
Переключаемые теплообменники, как
правило, используют для очистки водорода
при содержании примесей менее 0,1 %. При
больших концентрациях примесей требуют-
ся слишком частые переключения, что при-
водит к значительным потерям холода. При
весьма низких температурах вследствие су-
щественного снижения теплоемкости метал-
лов, потери холода, связанные с переключе-
нием теплообменников, становятся относи-
тельно небольшими. В последнее время ме-
тод вымораживания стал применяться и для
очистки гелия в лабораторных гелиевых
ожижителях [948].
Очистка от Na и СО методом адсорб-
ции, Метод основан на большой поглоти-
тельной способности ряда веществ (адсор-
бентов) по отношению к этим примесям
при низких температурах. Уравнения и изо-
термы адсорбции см. в разд. 2 и 5.
Процесс адсорбции ведут обычно при
температуре 78—80 К (охлаждение жидким
азотом), причем в качестве адсорбентов
чаще всего используют активированный
уголь и силикагель.
Если не учитывать кинетику адсорбции,
то количество газа 1/0, которое может быть
очищено в аппарате, содержащем G г ад-
сорбента, составит
где v — удельная поглотительная способ-
ность адсорбента при рабочих условиях (по
изотерме адсорбции); г/о — объемное содер-
жание азота в очищаемом газе.
В действительности в адсорбере идет
процесс динамического поглощения приме-
сей и вдоль оси адсорбера движется фронт
концентраций глубиной h, на протяжении
которого концентрация примесей меняется
от начальной до выходной. По мере отра-
ботки слоев адсорбента фронт постепенно
передвигается вдоль оси адсорбера. Слой й,
равный глибине фронта, иногда называют
«мертвым» (так как адсорбент в нем оста-
ется ненасыщенным), и на его глубину
должна быть увеличена расчетная высота
адсорбента в аппарате. При нагрузке по
очищаемому газу примерно 10 л/(мин-см2)
глубина фронта, например, в активирован-
ном угле составляет примерно 5—10 см.
Чистота водорода после адсорбционной
очистки зависит в значительной степени от
условий предварительной регенерации ад-
сорбента. Регенерация активированного
угля и силикагеля производится обычно их
вакуумированием с одновременным подо-
гревом адсорбента до 100—200 °C или про-
дувкой чистым газом. Как показали иссле-
дования [194], в угольном адсорбере, ре-
0-218
генерированном вакуумированием до оста-
точного давления около 1,5 Па при темпе-
ратуре 100 °C, водород может быть очищен
от примесей азота и кислорода до их оста-
точной концентрации 2-10—10 объемных
долей. В случае регенерации угля продув-
кой чистым водородом (в количестве не
менее 200 л на 1 кг угля) очищенный газ.
содержит примеси в количестве 5-Ю-9 объ-
емных долей.
Метод низкотемпературной адсорбции
широко применяется для очистки от приме-
сей рабочего газа в водородных и гелие-
вых ожижительиых установках. Адсорберы-
могут устанавливаться на линиях как низ-
кого (перед компрессором), так и высокого-
(перед блоками сжижения или внутри них)
давления.
На рис. 11.10 приведена схема блока-
Рис. 11.10. Схема блока очистки водород-
ных и гелиевых ожижителей;
1 — теплообменник; 2 — адсорберы; 3 — внутрен-
ний теплоизолированный сосуд: 4—электрона-
греватель; 5 — греющая рубашка; 6 — экранно-
вакуумная теплоизоляция
очистки, применяемая в ожижителях гелия
и водорода фирмы «Эйр Ликид». Очистка,
ведется при высоком давлении (после сжа-
тия гелия и водорода в компрессорах).
Теплообменник и адсорбер помещаются-
внутри теплоизолированного от окружаю-
щей среды сосуда, куда заливается жидкий
азот. Регенерация адсорбента производит-
ся его вакуумированием с прогревом теп-
лым воздухом. Для нагрева воздуха слу-
жит электронагреватель. При нормальной
работе блока очистки в очищенном водо-
роде и гелии общее содержание примесей
(O24-N2+Ar-|-COH-CH4) не превышает
30 миллионных долей.
В современных криогенных установках
управление узлами очистки в значительной
степени автоматизируется. В первую оче-
редь это касается подлива жидкого азота
для охлаждения адсорберов, их переклю-
чения и контроля чистоты газа. Описание
полностью автоматизированного очистителя,
гелия иа 135 м3/ч см. в [947].
<306
Методы очистки газов
11.5. ОЧИСТКА ГАЗОВЫХ СМЕСЕЙ
ОТ КИСЛОРОДА И АЦЕТИЛЕНА
Очистка газовых смесей от примесей
кислорода производится в основном двумя
методами:
а) низкотемпературным (выморажива-
нием и адсорбцией);
б) химическим (связыванием кисло-
рода).
Очистка от кислорода выморажива-
нием и адсорбцией ведется так же, как и
очистка от азота (см. с. 304).
Из химических способов наиболее со-
вершенный — каталитическое гидрирование,
позволяющее надежно очищать исходный
газ до остаточного содержания кислорода
.не более 10~10 объемных долей [195]. Не-
достатком этого метода может считаться
загрязнение газа водородом, если он не
входит в состав очищенной смеси.
Лучшие результаты получаются при
использовании металлических катализато-
ров (палладиевых, никель-хромовых, плати-
новых). Характеристики катализаторов, ки-
шетические закономерности, способы расче-
та контактных аппаратов и технологических
схем процесса очистки см. в [188, 195].
Каталитическая реакция взаимодей-
ствия водорода с кислородом используется
также для очистки кислорода от примеси
водорода.
Очистка воздуха от примеси ацетилена,
.необходимая для безопасной работы воз-
духоразделительных установок, производит-
ься адсорбционными и каталитическими ме-
тодами. Адсорбцию ацетилена можно про-
водить как при низких температурах (на-
пример, на силикагеле, алюмогеле), так и
при нормальных температурах (на цеоли-
тах). Изотермы адсорбции ацетилена на
цеолитах даны .в [192, 579].
Методом адсорбции производится
очистка от ацетилена и жидкости, забирае-
мой из испарителей кислородных устано-
.вок. При скорости жидкости 25—
.30 см3/мин на 1 см2 сечения адсорбера 1 л
гранулированного силикагеля марки КСМ
поглощает до 2,5 л С2Н2 [190]. Об очистке
от ацетилена см. также в разд. 13 и
в [572].
Эффективная очистка водорода практи-
чески от всех примесей может быть прове-
дена диффузией через палладиево-серебря-
:ные мембраны, конструктивно выполняе-
мые в виде тонкостенных труб [429]. Про-
цесс ведется при температуре 470—670 К
и давлении 0,7—1,4 МПа. Диффузионная
очистка позволяет получить водород чисто-
той 99,9995'% (по молярному содержа-
нию).
О современных системах очистки для
обеспечения взрывобезопасных крупных
воздухоразделительных установок см. в
;ц51].
11.6. ОЧИСТКА ЖИДКИХ
КРИОАГЕНТОВ ОТ ТВЕРДЫХ
ПРИМЕСЕЙ
Жидкие криоагенты почти всегда со-
держат то или иное количество твердых
примесей. Это в основном отвердевшие ча-
стицы различных веществ, остающихся
в охлаждаемом газе после его очистки или
же попадающие в криоагент из внутренних
полостей рабочего оборудования. Напри-
мер, в жидких азоте, кислороде, аргоне со-
держатся твердые частички СО2, воды,
углеводородов, а в жидких гелии и водо-
роде, кроме того, — и твердые кристаллы
компонентов воздуха.
Загрязненность криоагентов твердыми
примесями оценивают по их массовой или
объемной концентрации. Допустимое содер-
жание примесей обычно составляет от 10~4
до 10' 7 % по объему, но в ряде случаев
согласно нормативным требованиям оно
может быть и ниже (например, содержание
кислорода в водороде, используемом для
производства полупроводниковых материа-
лов, должно быть меньше 10~8 % по объ-
ему) .
Основным способом ОЧИСТКИ жидких
криоагентов от твердых частиц служит
фильтрование. Отстаивание обычно не дает
удовлетворительных результатов, так как
из-за конвективных токов, возникающих от
неизбежных теплопритоков к криоагенту,
частицы размером 10—15 мкм постоянно
находятся во взвешенном состоянии.
По способу задержания примесей
фильтры подразделяют на поверхностные
и объемные. Для поверхностных фильтров
рабочие элементы изготовляют из тонких
металлических сеток и тканей, для объем-
ных — из пористого металла, керамики,
войлока, полимеров.
Для очистки криоагентов от частиц
размером менее 20 мкм рекомендуется тка-
ная фильтровая сетка № 685 из стали
12Х18Н10Т саржевого одностороннего пле-
тения [196]. Для тонкой очистки (размер
Таблица 11.3. Характеристики
некоторых фильтровальных материалов
[196]
’Марка [материала Толщина фильтро- вального материала, [ММ Пори- стость Номиналь- ная тон- кость очистки (минималь- ный размер задержи- ваемых частиц), мкм
Серия № 685 0,138 20
ФНС-10 '0,18—0,25 0,36—0,44 10—12
ФНС-2 0,10—0,14 0.25—0,38 2—3
ФЭП-10-12 6,6—7,0 0,728 10-12
ФЭП-0,5-1,0 — 0,676 0,5—10
Сжижение воздуха
307
задерживаемых частиц 0,5—12 мкм) исполь-
зуются высокопористый фторпласт (ФЭП)
н ленточный пористый прокат типа ФИС.
Характеристики этих материалов приведены
в табл. 11.3.
К числу фильтровальных материалов,
позволяющих осуществлять тонкую очистку
(до нескольких микрометров), относят так-
же пористые сетчатые материалы (ПСМ),
пористые металлы и керамику, волокнин
стую ткань Петрянова (ФПА).
Конструкции фильтров для жидких*
криоагентов см. в [197].
Для глубокой очистки жидкого гелия-
От высокодисперсной взвеси отвердевших*
примесей воды, органических соединений,
компонентов воздуха и т. п. рекомендуется,
применять фильтры Петрянова [198].
Раздел двенадцатый
СЖИЖЕНИЕ ГАЗОВ
12.1. СЖИЖЕНИЕ МЕТАНА
В промышленном масштабе сжижение
метана производится в связи с проблемой
хранения и транспортировки в жидком виде
природного газа, основной компонент ко-
торого— метай. Используемые технологиче-
ские схемы установок не отличаются от
общепринятых в криогенной технике. Часто
используется классический каскадный цикл,
который, как известно, характеризуется вы-
сокой экономичностью. Существенным не-
достатком его можно считать обилие ма-
шинного оборудования, так как каждый
криоагент сжимается отдельным компрессо-
ром. Поэтому представляет большой инте-
рес однопоточный вариант каскадного цик-
ла, предложенный А. П. Клименко [201].
Как видно из рис. 12.1, в однопоточном
цикле используется всего один компрессор,
сжимающий многокомпонентную смесь га-
зов с различными температурами кипения
(например, пропан — этилен — метан). Эта
Рис. 12.1. Технологическая схема однопо-
точного каскадного цикла для сжижения
природного газа
20*
смесь, циркулирующая в замкнутом конту-
ре, охлаждает и сжижает основной поток
природного газа, протекающий по соответ-
ствующим каналам теплообменника.
В технике сжижения природного газа
одиопоточный каскадный цикл, работающий
на смесях углеводородов, получил большое
распространение [346, 347].
В промышленных установках для сжи-
жения природного газа широко используют
также циклы с детандироваиием и цирку-
ляцией как чистого азота, так и в смеси
его с метаном [345]. Иногда применяется
каскадное включение нескольких детанде-
ров, расположенных иа различных темпера-
турных уровнях, что повышает эксергетиче-
ский КПД цикла.
Расход энергии в крупных промышлен-
ных установках сжижения метана (произ-
водительность отдельных агрегатов дости-
гает 15 000 м3/ч) составляет 0,4—*
0,5 кВт-ч/кг (без учета повышенного на-
чального давления). Степень сжижения,
(отношение сжижаемого количества к по-
даче компрессором) равна 0,12—0,22.
О специфических особенностях техники
сжижении метана н природного газа -см,
также в [348, 349].
12.2. СЖИЖЕНИЕ ВОЗДУХА
Сжижение воздуха в больших масшта-
бах производится как промежуточная ста-
дия в установках разделения воздуха для,
получения кислорода и азота (см. разд. 13),
В настоящее время крупных установок спе-
циально для сжижения воздуха, как пра-
вило, не строят.
Оригинальная установка сжижения
воздуха по циклу низкого давления с при-
менением турбодетандера и регенераторов,
была создана П. Л. Капицей [208].
Для сжижения воздуха успешно
используют криогенные газовые машины
(КГМ), работающие по обратному циклу
Стирлинга (см. разд. 3). Впервые удачную
констукцию такой машины разработали
308
Сжижение газов
Рис. 12.2. Схематичное устройство крио-
генной газовой машины:
1— поршень; 2 — рабочий объем полости сжа-
тия; 3 — водяной холодильник; 4 — регенератор;
.5 — вытеснитель; 6 — рабочий объем полости
расширения; 7 — головка полости расширения
(конденсатор воздуха); 8 — слив жидкого воз-
духа
исследователи голландской фирмы «Фи-
липс» [294]. Схематичное устройство КГМ
представлено на рис. 12.2. Машина удачно
сочетает в одном агрегате компрессор, де-
тандер и теплообменные устройства (тепло-
обменники и регенератор). В качестве ра-
бочего тела используют обычно гелий. Кон-
денсация воздуха происходит на развитой
поверхности головной части машины. Воз-
дух не требует предварительной очистки:
нарастающая на специальном устройстве
«шуба» из льда и диоксида углерода пе-
риодически удаляется при отогреве маши-
ны после нескольких дней непрерывной ра-
боты. Естественно, что КГМ может быть
использована для сжижения не только воз-
духа, но и других газов с температурой
конденсации выше 70 К-
Соединяя КГМ с ректификационной ко-
лонной, можно получить компактную н
удобную в эксплуатации установку для
производства из воздуха жидкого азота.
В табл. 12.1 приведены краткие техни-
ческие характеристики КГМ, изготовляемых
в Советском Союзе, а в табл. 12.2 — сведе-
ния по азотодобывающим установкам на
основе КГМ.
Голландская фирма «Филипс» и ее фи-
лиал «Норелко» в США производят КГМ
холодильной мощностью от 0,9 до 16 кВт.
Машины небольшой производительности
(примерно 7 л/ч жидкого воздуха) нзго-
Та блица 12.1. Техническая
характеристика КГМ [216]
Характеристика [Марка КГМ
ЗИФ-1000 КГМ-9000/80
Холодильная мощ- 1100 10 500
ность при 77 К, Вт Потребляемая мощ- 17 НО
ность, кВт Расход охлаждаю- 1,0 8—10
шей воды, м3/ч Ресурс работы, ч 3000 16 000
Таблица 12.2. Характеристика
азотодобывающих установок на основе
КГМ [216]
Характеристика Марка азотной установки
ЗИФ-1002 АЖ-0,05 (КГМ)
Производитель- ность по жидко- му азоту, л/ч 10 65
Чистота азота, °/о 99,5 99,5
Дпительность цик- ла непрерывной работы, ч 120 240
Про до ижите ль- ность отогрева перед последую- щим пуском, ч 6 8
Удельный расход энергии, кВт-ч/л 1,7 1,7
Габариты помеще- ния для монтажа ' Становки, м •3.5Х Х2.5Х2 5X5X4
товляются одноцилиндровыми (по каталогу
фирмы — типа А) (рис. 12.2). Машины
с производительностью 30 л/ч строят в ви-
де однорядного четырехцилиндрового агре-
гата (тип В). На основе этих КГМ фирма
выпускает также азотные установки.
12.3. СЖИЖЕНИЕ ВОДОРОДА
По сравнению с воздухом и такими га-
зами, как азот, кислород, метан, сжижение
водорода имеет следующие особенности:
1) инверсионная температура эффекта
Джоуля — Томсона для водорода около
200 К, т. е. значительно ниже нормальных
температур. Поэтому для сжижения мето-
дом дросселирования необходимо предва-
рительное охлаждение сжатого водорода
посторонним хладагентом до температур
ниже 120 К;
2) водород перед сжижением необхо-
димо очистить не только от примесей воды
и диоксида углерода, но и от других газов
(кроме гелия), так как при рабочих темпе-
Сжижение водорода
309
ратурах процесса все они отвердевают и
Забивают каналы в аппаратуре. Очистку
водорода, направляемого иа сжижение,
желательно вести до суммарного содержа-
ния примесей ие более 10~8—10~7, а от
кислорода — меньше 10~9 объемных долей
(об очистке водорода см. в § 11.4);
3) для теплоизоляции водородных ожи-
жителей нельзя применять насыпную газо-
наполненную воздухом теплоизоляцию, так
как рабочие температуры в ней ниже тем-
ператур конденсации и отвердевания ком-
понентов воздуха;
4) газообразный водород в смеси с воз-
духом дает взрывоопасную смесь в широ-
ком интервале концентраций водорода — от
4 до 75 %. Поэтому необходимо предусма-
тривать специальные меры по безопасности
работы с водородом;
5) твердые кристаллы кислорода или
кислородсодержащих веществ в жидком во-
дороде могут быть источниками взрыва.
Поэтому должна быть обеспечена практи-
чески полная очистка водорода от приме-
сей кислорода и исключена возможность
попадания воздуха атмосферы в жидкий
водород;
6) в полученной из обычного («нормаль-
ного») водорода жидкости идет само-
произвольная конверсия ортомолекул в па-
рамолекулы, сопровождаемая выделением
значительного количества теплоты. Поэто-
му если необходимо жидкий водород хра-
нить длительное время (неделями), то сле-
дует получать его в виде параводорода,
проводя орто-параконверсию в процессе
сжижения.
Для сжижения водорода в настоящее
время применяют в основном три метода:
1) дросселирование предварительно
сжатого и охлажденного водорода (исполь-
зование эффекта Джоуля —Томсона);
2) детандирование — расширение сжа-
того Нз с совершением внешней работы;
3) использование холода, вырабатывае-
мого на уровне ниже 25 К специальной
криогенно-газовой машиной или отдельным
криогенным циклом (гелиевым или неоно-
вым).
Метод дросселирования — наиболее
простой, поэтому применяется повсеместно
ках в небольших лабораторных ожижите-
лях (производительностью от нескольких
литров в час до десятков литров в час),
так и в крупных лабораторно-промышлен-
ных установках с производительностью при-
мерно до 1000 л/ч.
Для предварительного охлаждения сжа-
того водорода ниже температуры инверсии
эффекта Джоуля — Томсона чаще всего
применяют жидкий азот, дающий возмож-
ность при кипении под пониженным давле-
нием получать температуры примерно до
63 К. Принципиальную схему установок
сжижения на основе дросселирования см.
в § 3.4.
Степень сжижения водорода на таких
установках зависит от давления и темпера-
туры предварительного охлаждения- -посто-
ронним хладагентом сжатого газа. Эта за-
висимость представлена на рис. 12.3.
Рнс. 12.3. Зависимость степени сжижения
водорода от давления сжатия и темпера-
туры предварительного охлаждения
Практически в дроссельных ожижите-
лях малой и средней производительности
температура предварительного охлаждения
поддерживается на уровне 65—70 К, дав-
ление сжатия-— 12—15 МПа.
Использование для сжижения водоро-
да низкотемпературных циклов с детанди-
рованием газа позволяет снизить энергети-
ческие затраты примерно на 20—25 % по
сравнению с дроссельными циклами. Одна-
ко усложнение устройства и эксплуатации
ожижителей с детандерами оправдывает
применение расширительных машин только
на крупных установках. Анализ различных
циклов сжижения водорода дан в [158,
236J.
Получение жидкого параводорода. Мо-
лекулы водорода могут находиться в орто-
и парасостояниях, отличающихся друг от
друга ориентацией ядерных спинов атомов,
образующих молекулу.
Параллельная ориентация спинов про-
тонов соответствует ортомодификации, ан-
типараллельная — парамодификации. Энер-
гия этих состояний различна, и равновес-
ная концентрация соответствующих моле-
кул водорода зависит от температуры. При
нормальной температуре (7’~=300 К) водо-
род содержит примерно 25 °/о пара- и 75 °/о
ортомолекул; этот состав обычно называют
нормальным водородом. Повышение тем-
пературы практически не меняет эту кон-
центрацию, однако понижение температуры
резко изменяет равновесный орто-парасо-
став. При 20 К равновесный водород со-
держит более 99 % парамолекул, т. е. на-
ходится практически полностью в парасо-
стоянии. Нормальный дейтерий представ-
ляет собой смесь 2/3 ортодейтерия и 1/3
парадейтерия.
Орто- и парамолекулы заметно отли-
чаются по своим физическим свойствам:
давлению насыщенных паров, теплопровод-
310
Сжижение газов
ности и др. Переход из орто- в парасо-
стояние сопровождается выделением теп-
лоты.
Таблица 12.3. Равновесное
содержание, парамолёк у л в водороде и
дейтерии и теплота орто-парапревращения
из нормального состояния в равновесное
[200]
га S га Q R 2 о ь Содержание парафа- Теплота превращения Дж/моль
зы %
Водород р-Н2 Дейтерий p-D2 Водород н2 Дейтерий d2
20 99,82 2,03 1С59 222
25 99,01 4,71 1047 203
3d 96,48 7,93 1017 —
40 88,61 14,78 9d0 —
50 76,89 20,81 733 83
75 51,86 29,2 373 —
100 38,51 32,18 180 2,6
125 31,85 32,9 75,4
150 28,54 33,24 30,6 0,04
200 25,97 33,33 4,2 0,0
250 25,24 33,33 0,4 о,о
273 25,13 33,33 0,3 о,о
В табл. 12.3 и на рис. 12.4 приведены
равновесное содержание парамолекул в во-
дороде и дейтерии при различных темпера-
турах и теплоты перехода из нормального
состояния в равновесное [200]. Самопроиз-
вольное установление равновесного для
данной температуры ортопара состава во-
дорода проходит сравнительно медленно —
в течение нескольких суток. При этом доля
ортоводорода х связана с временем пре-
вращения т следующей зависимостью
[439]:
1
х =----------,
1
---- +Ст
где Хо — первоначальная доля ортоводоро-
да; С=0,0126.
700
000
500
W0
300
200
100
100
75
50
25
0
0 20 30 50 100 200 300 5ОО'Г,К
Рис. 12.4. Зависимость теплоты орто-пара-
конверсии водорода от температуры
Рис. 12.5. Зависимость скорости испарения-
жидкого водорода при самопроизвольной
конверсии от концентрации ортофазьг
в начале хранения. Начальная концентра-
ция ортоводорода соответствует равновес-
ным концентрациям при 300, 120 К н т. д.:
Шц — начальное количество водорода; т — коли-
чество водорода на соответствующее время
Теоретическая доля жидкого водорода,
остающаяся в сосуде при самопроизволь-
ном орто-парапревращении, в зависимости-
от времени и начального содержания орто-
фазы показана на рис. 12.5. В реальных
условиях хранения водорода в металличе-
ских сосудах из-за каталитического влияния
стенок процесс установления равновесного-
ортопара состава может идти и быстрее
[751].
Быстрое достижение равновесного для-
данной температуры орто-парасостава во-
дорода может быть осуществлено с помо-
щью катализаторов. Лучшими для этого-
процесса являются хромоникелевый катали-
затор и гидроокиси железа, хрома и мар-
ганца. Константы скорости реакции для
этих катализаторов приведены в табл. 12.4.
Таблица 12.4. Константы скорости
реакции орто-параконверсин водорода
Катализаторы Константы скорости реакции, &-108 МОЛЬ-СМ'8.С
78 К 64 К 22 К
Хромоникеле- вый 1,5—1,7 1,4—1,5 1,6—2,1
Сг (ОН) 2 0,56—0,74 0,53—0,68 0,9—1,6 0,6-2,1
Мп (ОН)„ 0,73—1,2 0,6—1,15
Fe (ОН), Со (ОН), 1,0—2,3 0,7—1,67 0,9—2,1
0,24—0,28 0,2—0,25 0,32—0,34'
Ni (ОН) 2 0,44—0,69 0,35—0,65 0,5—0,8
Орто-парасостав, полученный при низ-
ких температурах, устойчив и при повыше-
нии температуры сохраняется длительное-
время. Восстановить равновесие можно на-
гревом газа примерно до 700—800 °C, а так-
же на металлических катализаторах (пла-
тина, никель, вольфрам).
Сжижение водорода
311
Значительное количество теплоты, вы-
деляемое при орто-парапереходе, приводит
к увеличению испаряемости жидкого водо-
рода из сосудов и уменьшению времени его
хранения.
Из табл. 12.3 видно, что превращение
1 кг нормального жидкого водорода в па-
раводород сопровождается выделением око-
ло 530 кДж теплоты, в то время как скры-
тая теплота испарения водорода в этих
условиях составляет около 450 кДж/кг.
Поэтому для снижения потерь от испарения
при хранении сжиженного водорода его
получают с содержанием 90—98 % пара-
молекул.
В установках сжижения водорода орто-
параконверсия может осуществляться сле-
дующими способами: непрерывно, на всех
температурных уровнях от комнатной до
21 К; на двух уровнях — 65 и 21 К; только
на одном уровне — 21 К. Энергетически
наиболее экономичен, естественно, первый
способ. Дополнительная идеальная работа
для проведения орто-параконверсии со-
ставляет: для первого способа — 0,55, для
второго—1,33 и для третьего—2,0 кВт-ч/кг
(идеальная работа сжижения нормального
водорода 3,31 кВт-ч/кг).
На рис. 12.6 приведены расчетные энер-
гетические затраты на получение жидкого
водорода с 95 % парафазы при использова-
нии различных криогенных циклов [158].
Количество
обходимого для
версии, можно
[752]
катализатора ик, см°, не-
проведения орто-паракон-
определить по уравнению
i^ig!___
н ё 1 — с/ср
где Vh — производительность ожижителя,
л/ч жидкого параводорода с концентрацией
С; Со — исходная концентрация р-Нг; Ср —
Рис. 12.6. Расход энергии на получение
жидкого водорода с 95% парафазы в раз-
личных криогенных циклах:
1 — цикл с однократным дросселированием;. 2—
цикл с двукратным дросселированием; 3 — внеш-
ний цикл на гелии ‘с детандироваиием; 4—Цикл
двух давлений с детандироваиием; 5 — цикл
•среднего давления с детандироваиием. В циклах
«используется предварительное охлаждение жид-
ким азотом
равновесная концентрация р-Н2 при рабо-
чей температуре в реакторе; k — константа
скорости реакции на данном катализаторе
(табл. 12.4).
Лабораторные ожижители водорода.
Основное назначение установок лаборатор-
ного типа — получение жидкого водорода
для научных исследований. Поэтому про-
изводительность их находится в широких
пределах — примерно от 5 до 500 л/ч.
Как правило, для сжижения в лабора-
торных установках используется электроли-
тический водород, а криогенный цикл осно-
ван на .дросселировании газа, сжатого до
8—15 МПа. Предварительное охлаждение
сжатого водорода производится жидким
азотом, подаваемым в ожижитель со сто-
роны и кипящим обычно под пониженным
давлением, создаваемым вакуум-насосом.
Типовая технологическая схема водо-
родно-сжижительной установки для научно-
исследовательских учреждений показана на
рис. 12.7 [754].
Промышленное изготовление установок,
работающих по такой схеме, было налаже-
но в 50-х годах во Франции (фирма ТБТ)
и в СССР (Московский завод кислородно-
го машиностроения). Однако большинство
работающих ныне лабораторных ожижите-
лей было создано самими научно-исследо-
вательскими учреждениями, и хотя прин-
ципиальные их схемы подобны приведенной
на рис. 12.7, компоновка и конструкция
отдельных узлов (компрессоров, криобло-
ков, систем очистки и т. д.) отличаются
друг от друга весьма существенно.
Описание лабораторных ожижителей
водорода см. в [174, 429, 753, 756—758].
Характерной чертой современных лабо-
раторных водородно-сжижительных устано-
вок является возможность получения в них
как нормального водорода (для немедлен-
ного использования), так и параводорода
(для длительного хранения). Для этого
в ожижителях установлены конвертеры
с катализатором на одном илн двух темпе-
ратурных уровнях. Схемы включения кон-
вертеров в систему сжижения см. в [158,
753, 756].
При получении жидкого параводорода
производительность установки уменьшается
примерно на 30 % по сравнению со »жиже-
нием нормального водорода.
В табл. 12.5 приведены основные ха-
рактеристики некоторых лабораторных ожи-
жителей водорода, работающих по циклу
дросселирования с предварительным охлаж-
дением сжатого газа жидким азотом. Рас-
ход энергии на сжижение нормального во-
дорода составляет 2,4—3,0 кВт-ч/л, вклю-
чая затраты примерно 1,4—1,5 кВт-ч на
получение жидкого азота, расходуемого на
сжижение 1 л водорода.
Для периодичного получения небольших
количеств жидкого водорода (до 5 л/ч)
в последнее время все чаще используют
312
Сжижение газов
Рис. 12.7. Схема водородо-сжижительной установки лабораторного типа:
1 — баллоны с техническим водородом; 2 — блок осушки и очистки газа; 3 — газгольдер; 4 —
компрессор; 5—блок конечной очистки газа; 6 — ожижитель; 7 — сосуд с жидким азотом; 8—
вакуумный насос для откачки азотиой ванны
Таблица 12.5. Характеристики некоторых ожижителей водорода
с криогенным циклом на основе дросселирования
Индекс ожижителя (организация) Количество сжижае- мого водорода, л/ч Подача ком- прессора м3/ч Температура предаритель- иого охлаж- дения газа, К Пусковое время, мин Литература
о-Н2 Р-н,
ВОС-З (ИФП, Москва) 8—10 41 72 30 [757]
ВО/98 (ФИАН, Москва) 16,5 12,5 70 (р=12 МПа) 7и 25 [756]
ВО-2 (ОИЯИ, Дубна) 230 140 725 65,5 60—70 [753]
Ожижитель Кларедонской лаборатории (Оксфорд) 30 — 120 (/7=6 МПа) 64 — [429]
Ожижитель лаборатории К-Оннесса (Лейден) 40 — 120 (/)=2и МПа) 63 — [441]
Ожижитель Пенсильван- ского университета 50 — 170 65 20 [429]
Ожижитель Бюро стандар- тов США (Боулдер) 320 230 1300—1500 (/7=12 МПа) 66 [174]
криогенные газовые машины, работающие
по циклу Стирлинга (см. § 3.5). Так, фир-
ма «Филипс» (Голландия) изготовляет ожи-
жители марки PLH-104 с двухступенчатой
криогенной газовой машиной [440]. Про-
изводительность ожижителя PLH-104
5,5 л/ч (нормального водорода), мощность
двигателя 11 кВт, время непрерывной ра-
боты 120 ч, ресурс 8000 ч. Диалогичный
ожижитель разработан НПО «Гелиймаш»
(СССР) на базе двухступенчатой криоген-
ной газовой машины КГМ-100/20.
Сжижение водорода в крупных мас-
штабах. Использование жидкого водорода
в качестве ракетного топлива привело
к разработке крупных промышленных уста-
новок для его сжижения. Для снижения
потерь при хранении на промышленных
установках получают главным образом
жидкий параводород. Для повышения энер-
гетической эффективности применяют де-
тандерные циклы (используют машины как
поршневого, так и турбинного типа).
Следует отметить, что для экономично-
го получения больших количеств жидкого
водорода существенное значение имеет
стоимость исходного сырья — газообразно-
го водорода. Обзор методов получения га-
зообразного водорода, идущего на сжиже-
ние, см. в [199, 429J.
В США построено несколько крупных
заводов по получению жидкого параводо-
рода с производительностью до 60 т/сут.
На рис. 12.8 приведена принципиальная схе-
ма одной из таких крупных установок [199,.
429, 956].
Характерные особенности схемы: для
производства холода имеется отдельный
Сжижение неона
313
Рис. 12.8. Принципиальная схема крупной
промышленной установки для получения
жидкого параводорода:
1 — водород на сжижение; 2 — выход циркули-
рующего водорода; 3 — циркулирующий водород
высокого давления; 4 — выход азота; 5 — выход
водорода; 6—ввод жидкого азота; 7—детандер;
J — конвертеры; 9 — адсорбер; 10 — пары водоро-
да из хранилища; // — жидкий водород в хра-
нилище
’циркуляционный поток водорода, на кото-
ром стоит турбодетандер; конверсия нор-
мального водорода в 95 %-ный параводо-
род осуществляется на пяти ступенях; не-
прерывная очистка водорода от примесей
производится адсорбцией и фильтрацией.
Получаемый жидкий параводород сливает-
ся по трубопроводу в систему резервуаров
(объемом по 100 и 340 м3). Испаряющийся
при хранении водород от резервуаров воз-
вращается в установку на повторное сжи-
жение.
Представляется перспективным сочета-
ние получения крупных количеств жидкого
водорода с извлечением из него дейте-
рия.
Получение шуги водорода. Так назы-
ваемая шуга представляет собой текучую
смесь твердого и жидкого водорода. Теку-
честь смеси сохраняется при содержании
твердой фазы до 50 % по массе. Размер
кристаллов находится в пределах от 2 до
7 мм. Использование шуги водорода пред-
ставляет интерес для долговременного его
хранения и при заполнении баков космиче-
ских кораблей. Это связано с тем, что плот-
ность шуги водорода 81,53 кг/м3, в то вре-
мя как плотность жидкого водорода
70,8 кг/м3. Для перехода шуги водорода
(твердой фазы — 50 %) в жидкий водород
при атмосферном давлении требуется подве-
сти около 83 кДж/кг теплоты. Таким обра-
зом, в единицу объема может быть загружено
шуги водорода на 13 % больше по массе,
чем жидкого. При подводе теплоты шуго-
образный водород вначале не будет испа-
ряться, так как тепло пойдет на плавление
твердой фазы. Это увеличивает общий срок
хранения водорода без потерь. Поскольку
шуга водорода находится в условиях трой-
ной точки (Г=13,8 К, р^7 кПа), для
уменьшения возможности проникновения
воздуха объем над шугой на время хране-
ния и транспортировки следует заполнять
газообразным гелием. Шугу водорода по-
лучают откачкой (вакуумированием) паров
над жидкостью (в адиабатных условиях)
с последующим разрушением и перемеши-
ванием образующегося льда из твердого
водорода. При таком методе из жидкого
водорода, находящегося при нормальной
температуре кипения, необходимо откачать
примерно 15,4 % водорода для получения
50 %-ной шуги в тройной точке.
Более подробные данные см. в [442,
443].
12.4. СЖИЖЕНИЕ НЕОНА
По сравнению с водородом жидкий
неон как криоагент имеет целый ряд пре-
имуществ, главные из которых — большая
теплота испарения на единицу объема жид-
кости (примерно в 3,2 раза больше, чем
у водорода); химическая инертность и
взрывобезопасность; относительная просто-
та сжижения и хранения.
Газообразный неон получают как по-
бочный продукт при разделении воздуха
(см. § 13.4). Схему получения чистого нео-
на см. в [444]. Сжижение неона произво-
дится теми же методами, что и водорода;
практически неон сжижают Дросселирова-
нием сжатого и предварительно охлажден-
ного газа или с помощью двухступенчатых
криогенных газовых машин.
На рис. 12.9 и 12.10 приведены расчет-
314
Сжижение газов
Рис. 12.9. Коэффициент сжижения неона в
зависимости от давления и температуры
предварительного охлаждения
Рис. 12.10. Расход энергии на сжижение-
неона методом дросселирования при раз-
личных температурах предварительного-
охлаждения
ные характеристики разработанного в Фи-
зическом институте им. П. Н. Лебедева АН
СССР неонового ожижителя на основе цик-
ла с дросселированием и предварительным
охлаждением жидким азотом [759]. Из
приведенных данных видно, что температу-
ра предварительного охлаждения сжатого
неона существенно влияет на эффектив-
ность цикла. Оптимальное давление сжатия
соответствует 16—20 МПа.
Периодическое сжижение небольших
количеств неона можно проводить, исполь-
зуя в качестве внешнего источника холода
жидкий водород. На получение 1 л жидко-
го неона требуется примерно 4,5 л жидко-
го водорода [445].
12.5. СЖИЖЕНИЕ ГЕЛИЯ
Сжижение гелия обычно производят,
используя эффект Джоуля — Томсона при
дросселировании с давления 1,6—2,5 МПа.
Вследствие низкой инверсионной темпера-
туры гелия (около 35 К) необходимо зна-
чительное предварительное охлаждение
сжатого газа — до 10—45 К. Из посторон-
них криоагентов для этой цели подходит
только жидкий водород. В современных
ожижителях гелия часто используют детан-
деры, иногда — криогенные газовые ма-
шины.
Сжижение гелия с предварительным
охлаждением водородом. Этим методом
впервые было осуществлено сжижение ге-
лия (Камерлинг Оннес, 1908 г.). Несмотря
на неудобства, связанные с применением
водорода (взрывоопасность), ожижители
гелия с охлаждением водородом применяют
до настоящего времени. Большое распро-
странение получили эти аппараты в местах,
где применение водорода в больших коли-
чествах связано с другими задачами, на-
пример при использовании жидководород-
ных пузырьковых камер. В качестве пред-
варительной ступени охлаждения в ожижи-
телях гелия используется обычно жидкий
азот (расход 1,0—2„0 л на 1 л жидкого
гелия).
Необходимый для работы аппарата
жидкий водород заливается со стороны:
или сжижается в отдельном цикле, осуще-
ствляемом в едином криоблоке ожижителя
гелия. В последнем случае отпадает опас-
ность, связанная с переливанием жидкого
водорода, более эффективно используется
также холод водородного цикла. Расход
жидкого водорода зависит от эффективно-
сти используемых теплообменников и со-
ставляет 0,8—1,2 л на 1 л жидкого гелия.
Температура предварительного охлаждения
гелия при использовании жидкого водоро-
да лимитируется температурой его трой-
ной точки (около 14 К); при этой темпе-
ратуре оптимальное давление сжатого ге-
лия равно 2,2—2,5 МПа, а доля сжиже-
ния гелия составляет около 18%.
(рис. 12.11). Суммарные затраты энергии-
иа получение жидкого гелия с предвари-
тельным охлаждением азотом и водородом-
составляют 3,5—5,0 кВт-ч/л.
Ожижители гелия с использованием:
детандеров. В 1934 г. П. Л. Капица пред-
ложил и практически осуществил гелие-
вый ожижитель, в котором для предвари-
тельного охлаждения использовался не
жидкий водород, а холод, получаемый в.
расширительной машине — поршневом де-
тандере [729]. На рис. 12.12 дана прин-
ципиальная технологическая схема гелие-
вого ожижителя П. Л. Капицы. При раз-
работке этого аппарата наибольшие
трудности были связаны с созданием детан-
дера, поршень которого должен переме-
щаться в цилиндре при низкой температуре
(около 15 К) без трения и без больших
утечек расширяемого газа. Эти трудности
удалось преодолеть путем использования
щелевого уплотнения поршня (малый за-
зор между поршнем и цилиндром).
В последние годы ожижители этого
Сжижёние' гелия
315
Рис. 12.11. Степень сжижения гелия в за-
висимости от температуры предварительно-
го охлаждения Т и недорекуперации &Т
дроссельного теплообменника при давле-
нии сжатого гелия 2,2 МПа
типа получили большое распространение.
Для повышения термодинамической эффек-
тивности криогенного цикла иногда при-
меняют несколько детандеров, работающих
ла разных температурных уровнях, что по-
зволяет сжижать гелий вообще без по-
Рис. 12.12. Технологическая схема гелиево-
го ожижителя П. Л. Капицы:
1~ поршневой компрессор; 2, 4, 6 и 7 — тепло-
обменники; 3 — ванна с жидким азотом; 5 —
•поршневой детандер; 8 — дроссельный клапан;
сборник жидкого гелия; 10— клапан слива
жидкого гелия
сторонних криоагентов [210]. Для нор-
мальной работы такого аппарата необхо-
димо не менее двух детандеров (о выборе
числа детандеров- и их температурных
уровней см. в [209]).
Современные гелиевые поршневые де-
тандеры характеризуются высокой эффек-
тивностью (адиабатный КПД равен 80—
83% при температуре расширенного газа
10—12 К), малой утечкой через зазор меж-
ду поршнем и цилиндром (3—5% количе-
ства перерабатываемого газа), сравни-
тельно высокой долговечностью (до
20 тыс. ч). Используются поршневые де-
тандеры в установках малой и средней
производительности (до 50—100 л/ч).
В установках большой производитель-
ности (более 100 л/ч) целесообразно при-
менять детандеры турбинного типа, кото-
рые наряду с хорошей эффективностью
(адиабатный КПД 75—80%) отличаются
высокой надежностью и долговечностью;
последнее связано с тем, что в турбоде-
тандерах отсутствуют элементы с трением
скольжения, работающие в условиях низ-
ких температур.
Использовать турбо детандеры в уста-
новках малой производительности хотя и
возможно (некоторые зарубежные фирмы
изготовляют турбодетандерные ожижители
гелия с производительностью всего 8—
20 л/ч), но вряд ли целесообразно; для
таких турбодетандеров характерны малые
размеры рабочих колес (диаметр 15—•
20 мм), высокая частота вращения ротора
(до 104 1/с), повышенные требования к
точности изготовления. По данным зару-
бежных фирм стоимость высокооборотного
гелиевого турбодетандера много выше
стоимости поршневого детандера той же
производительности.
Степень сжижения гелия в современ-
ных детандерных ожижителях составляет:
6% при двух детандерах без посторонних
криоагентов; 9% при одном детандере и с
ванной жидкого азота; 12% при двух де-
тандерах и с ванной жидкого азота. Рас-
ход энергии на сжижение гелия в этих ап-
паратах составляет 2—2,5 кВт-ч/л.
Возможно некоторое повышение эф-
фективности детандерных ожижителей ге-
лия путем замены дроссельного вентиля на
поршневой детандер, работающий в обла-
сти влажного пара. Конструктивно такой
детандер мало отличается от обычной га-
зовой машины, однако применение его
повышает степень сжижения гелия на 35—
40% [343, 732].
Гелиевые ожижители с использова-
нием КГМ. Одноступенчатая криогенная
газовая машина (с двумя полостями пе-
ременного объема, см. рис. 12.2) позволяет
получать температуру до 40—50 К (при
нулевой холодильной мощности). Фирмой
«Филипс» разработана [298] конструкция
КГМ (рис. 12.13) с тремя полостями пе-
316
Сжижение газов
Рис. 12.13. Принципиальная схема двух-
ступенчатой криогенной газовой машины:
1 — полость сжатия; 2 — водяной холодильник;
3—первый регенератор; 4 — промежуточный теп-
лообменник; 5 — промежуточная (первая) по-
лость расширения; 6 — второй регенератор; 7 —
теплообменник; 8 — вторая полость расширения
ременного объема, причем сжатие газа
производится, как обычно, в одной «теп-
лой» полости, а расширение — в двух по-
лостях, которые имеют различную темпе-
ратуру. Все три полости соединены между
собой через регенеративную насадку. Такая
двухступенчатая машина фирмы «Филипс»
типа А-20 имеет холодильную мощность
около 40 Вт при 15 К.
Фирма «Филипс» изготовляет ком-
пактный ожижитель гелия типа PLHe-210,
в котором охлаждение дроссельного пото-
ка гелия производится на холодных по-
верхностях двух машин типа А-20 (при
температурах 100, 65, 30 и 15 К)-
Рефрижераторные установки с гелие-
вым криогенным циклом. Для криостати-
рования крупных сверхпроводящих уст-
ройств, панелей криовакуумных насосов,
больших камер имитации космических ус-
ловий и в ряде других случаев необходим
холод в больших количествах (сотни и
тысячи ватт) на уровне 2—5 К. С этой
целью применяют рефрижераторные крио-
генные установки, в которых используется
холод паров гелия. Гелиевые рефрижерато-
ры имеют много общего с ожижителями
гелия и строятся обычно по аналогичным
технологическим схемам. Зачастую гелие-
вые установки могут работать на двух ре-
жимах— сжижительном и рефрижератор-
ном.
Переход с сжижительного режима на
рефрижераторный связан с некоторым пе-
рераспределением потоков — увеличивается
дроссельный поток за счет потока к де-
тандеру и несколько меняются условия ра-
боты дроссельного теплообменника в свя-
зи с уменьшением в нем температурного
напора. Для облегчения работы гелиевого
ожижителя в рефрижераторном режиме в
средней части дроссельного теплообменни-
ка устанавливается второй, дополнитель-
ный дроссель, что позволяет частично ком-
пенсировать влияние уменьшения теплоем-
кости сжатого гелия.
Удельные затраты электроэнергии на
получение холода на уровне 4 К в рефри-
жераторных установках составляет 500—
1000 Вт/Вт.
Краткая техническая характеристика
гелиевых установок отечественного произ-
водства приведена в табл. 12.6.
Широкую номенклатуру выпуска гелие-
вых сжижительных и рефрижераторных ус-
тановок имеют ведущие зарубежные фир-
мы — изготовители криогенного оборудо-
вания: «Линде» (ФРГ), «Зульцер» (Швей-
цария), «Эйр Ликид» (Франция), «Бри-
тиш Оксижен» (Англия), «Мицубиси»
(Япония), «Криодженик Технолоджи»
(США). Помимо крупных установок (более
100 л/ч жидкого гелия) все фирмы изго-
товляют комбинированные, сжижительно-
рефрижераторные установки производи-
тельностью 10—100 л/ч. Один и тот же
криоблок зачастую используется для уста-
новок как малой производительности (ме-
нее 10 л/ч), так и средней (до 30—40 л/ч}
путем использования жидкого азота для
предварительного охлаждения и различно-
го числа компрессоров. Установки автома-
тизированы, что позволяет обслуживаю-
щему персоналу ограничиваться только их
периодическим контролем.
Границы применимости поршневых и
турбинных детандеров значительно отли-
чаются. Так, фирма «Линде» производит
гелиевые установки производительностью
от 6 до 10 л/ч на основе поршневых
детандеров с электрическим приводом кла-
панов и с уплотнением поршня кольцами
из пластмассовой композиции на основе
тефлона. Напротив, фирма «Зульцер» все
гелиевые установки строит с турбодетан-
дерами (даже при минимальной произво-
дительности 8 л/ч).
Большинство рефрижераторных уста-
новок строится для работы на темпера-
турном уровне 4,5 К. Исключение состав-
ляет сравнительно крупная установка фир-
мы «Линде», имеющая холодильную мощ-
ность 380 Вт на уровне 1,8 К, с двумя
турбодетандерами, поршневыми компрес-
сорами (без смазки цилиндров, уплотне-
ние— пластмассовыми кольцами), вакуум-
насосами типа Руте.
Из стран СЭВ гелиевое машинострое-
ние развито только в ЧССР (завод «Фе-
рокс», г. Дечин). На этом предприятии из-
готовляют гелиевые ожижители-рефриже-
раторы двух типов: ZRH-9 (10 л/ч, или
30 Вт на температурном уровне 4,5 К) и
ZRH-50 (50 л/ч, или 150 Вт на уровне
4,5 К). Применяют поршневые детандеры
и жидкий азот для предварительного ох-
лаждения. Установка частично автомати-
Установки для получения температур ниже К
317
Таблица 12.6. Основные показатели гелиевых установок,
изготовляемых НПО „Гелиймаш" (Москва) [216]
Индекс установ- ки Произво- дитель- ность Характеристика гелиевого цикла Подача компрессора, м’/ч Установленная мощ- ность, кВт Расход жид- кого азота, л/ч Занимаемая площадь, м2 | Масса, т
Рефрижера- торный режим (Т=4,5 К), Вт Сжижитель- иый режим, л/ч Рефрижера- торный режим Сжижитель- ный режим
КГУ-150/4,5 150 40 Давление прямого по- тока 2,0—2,5 МПа. Пред- варительное охлаждение жидким азотом. Расшире- ние: детандирование (пор- шневая машина) и дву- кратное последовательное дросселирование 360 105 15 32 100— 150 9,7
КГУ-250/4,5 250 90 Давление прямого пото- ка 2 МПа. Предваритель- ное охлаждение жидким азотом. Расширение: дву- кратное детандирование (турбомашины) и двукрат- ное последовательное дросселирование 1200 200 60 120 200 37
КГУ-500/4,5 500 300 140 НО Давление прямого по- тока 2 МПа Предварительное охлаж- дение жидким азотом. Расширение: двукратное детандирование (турбома- шины), дросселирование и детандирование в двух- фазной области (поршне- вая машина). Меньшая производительность соот- ветствует циклу без де- тандпрования в двухфаз- ной области 1200 220 80 150 200 39
зирована: в рабочем режиме постоянного
наблюдения со стороны обслуживающего
персонала не требуется.
12.6. УСТАНОВКИ ДЛЯ ПОЛУЧЕНИЯ
ТЕМПЕРАТУР НИЖЕ 1 К
Для получения температур ниже 1 К
в настоящее время используют следующие
методы: до 0,3 К — испарение жидкого 3Не
под пониженным давлением; ниже 0,3 К —
эффект охлаждения при растворении 3Не
в сверхтекучем 4Не, адиабатное размагни-
чивание парамагнитных солей, ядерное раз-
магничивание, эффект Померанчука. Физи-
ческие основы этих методов кратко изло-
жены в § 3.7, подробнее (включая техни-
ческие аспекты получения и измерения
температур ниже (1 К)—в [44].
Наиболее распространенными в настоя-
щее время установками для работы при
температурах ниже 1 К являются рефри-
жераторы с 3Не и рефрижераторы раство-
рения.
Рефрижераторные установки с 3Не,
кипящим под пониженным давлением, —
наиболее простой способ получения тем-
ператур от 1 до 0,3 К. Это связано с фи-
зическими свойствами 3Не, а именно бо-
лее высокой, чем у 4Не, упругостью паров
(примерно в 700 раз прн 7=0,7 Кив
9800 раз при 0,5 К) и отсутствием сверх-
текучей пленки вплоть до 2,6 мК (4Не
становится сверхтекучим при 2,17 К).
С помощью жидкого 8Не может быть пе-
рекрыт интервал температур примерно от
3,3 до 0,25 К- Теплота испарения 3Не при:
0,3 К равна 21 Дж/моль.
;318
Сжижение газов
Основное препятствие для широкого
использования 3Не— трудности его полу-
чения и очистки (3Не получают в ядерных
реакторах при распаде трития), что при-
водит к особым требованиям по ограни-
чению потерь 3Не в аппаратуре и комму-
никациях установок.
Упрощенная схема рефрижераторной
установки с 3Не показана на рис. 12.14.
К вакуум-
Рис. 12.14. Схема установки для получе-
ния температур до 0,3 К откачкой паров
3Не:
1 — корпус гелиевого криостата; 2 — ванна жид-
кого гелия-4; 3 — конденсатор 3Не; 4 — дроссель;
5 — сборник 3Не; 6 — охлаждаемый объект; 7 —
вакуумная камера; 8 — ванна жидкого азота;
9—труба откачки 3Не; 10 — насос откачки 4Не;
11 — диффузионный насос для 3Не; 12 — меха-
нический насос откачки 3Не; 13 — баллон для
хранения 3Не
Центральной частью установки служит ге-
лиевый криостат, внутри которого разме-
щается низкотемпературная часть системы
конденсации 3Не. Сжижение 3Не произво-
дится в конденсаторе при отводе теплоты
к заливаемому в ванну жидкому 4Не; дав-
ление в ванне соответствует температуре
кипения 4Не 1,5 К. Сжиженный 3Не сли-
вается через дроссель в сборник, помещен-
ный внутри вакуумной камеры. Для полу-
чения необходимой рабочей температуры
сборник с жидким 3Не вакуумируют через
трубу насосами 11 и 12.
Охлаждение исследуемых объектов мо-
жет производиться или вследствие хоро-
шего их теплового контакта со сборником,
или погружением непосредственно в жид-
кий 3Не через трубу 9.
Для ускорения первоначального охлаж-
дения в камеру может подводиться газо-
образный 4Не, который затем откачивает-
ся. Установка может работать как в пе-
риодическом режиме, так и в режиме не-
прерывной циркуляции. Для этого отка-
чиваемый из сборника 3Не направляется
не в баллон, а на повторное сжижение в
конденсатор.
Установки, работающие по приведен-
ной схеме, но с разным конструктивным
оформлением основных узлов, строились
многими авторами; описание их см. в
[44, 400, 762, 949].
Холодопроизводительность (холодиль-
ная мощность) установок зависит от ко-
личества циркулирующего 3Не и состав-
ляет при температуре 0,3—0,4 К от десят-
ков микроватт до нескольких милливольт.
В установках периодического действия си-
стема откачки 3Не внешними насосами (как
показано на рис. 12.14) может быть за-
менена более простой системой с адсорб-
ционным насосом. Обычно для такого на-
соса используется активированный уголь
(в количестве 30—50 г), который при
охлаждении жидким 4Не позволяет под-
держивать в ванне с жидким 3Не темпе-
ратуру около 0,4 К в течение 4—5 ч при
теплоподводе около 60 мкВт [161].
Имеются рефрижераторы, в которых
3Не сжижается путем использования эф-
фекта Джоуля—Томсона. При этом отпа-
дает необходимость в вакуумировании
ванны с 4Не. Для сжатия 3Не применяют
мембранный компрессор. Дросселирование
начинается при давлении 0,4 МПа и тем-
пературе 4,2 К. Ванна 3Не имеет объем
40 мм3. Описание такой установки см.
в [447]. Использование угольного адсорб-
ционного насоса давало возможность под-
держивать температуру 0,25 К в течение
50 ч [44].
Рефрижераторы с 3Не помимо своего
прямого назначения могут использоваться
и как одна из предварительных ступеней
в установках для получения температур
ниже 0,3 К-
Рефрижераторы растворения 3Не—4Не.
Принцип работы таких установок рассмот-
рен выше (см. § 3.7). Подробный обзор
теоретических и практических вопросов см.
в [44, 764].
В настоящее время рефрижераторы
растворения служат основным аппаратом
для получения температур ниже 0,3 К.
В непрерывном режиме многие установки
позволяют получать температуры до 10—
15 мК (минимальная —3,5 мК), а в одно-
разовом режиме — до —3 мК- Холодиль-
ная мощность зависит от температуры и
составляет при 20 мК 5—10 мкВт, при
100 мК — несколько милливатт.
Рефрижераторы растворения серийно
производятся рядом промышленных фирм,
например «Оксфорд Инструменте» (Анг-
лия), SHE (США), «Лебольд-Хераус»
(ФРГ) и др.
На рис. 12.15 приведена конструктив-
ная схема отечественного промышленного
рефрижератора растворения, изготовляемо-
Микрокриогенные установки
319-
Рис. 12.15. Конструктивная схема рефри-
жератора растворения 3Не—4Не:
1 — корпус рефрижератора; 2 — ванна жидкого
азота; 3 — ванна жидкого 4Не; 4 — конденсатор
®Не; 5—камера испарения с нагревателем; 6 —
вакуумная рубашка; 7 — теплообменник; 8 —
камера растворения; 9 — термометр; 10 — азот-
ный экран
го НПО «Гелиймаш» [154]. Корпус ре-
фрижератора выполнен в виде сосуда
Дьюара с азотным экраном и разборной
нижней частью. Теплопритоки к сосуду не
превышают 0,1 Вт, что позволяет откачи-
вать ванну с жидким гелием до 1,5 К. Запас
жидкого гелия в ванне обеспечивает работу
(без долива гелия) в течение 50 ч. Циркуля-
ция 3Не осуществляется герметичными насо-
сами: механическим НВГ-2 и парортутным
Н50Р. Очистка циркуляционного газа про-
изводится адсорбентом (активированный
уголь) и металлокерамическим фильтром.
Холодильная мощность установки при
100 мК — примерно 20 мкВт. Наинизшая
температура 40 мК.
Простой рефрижератор растворения
непрерывного действия на температуры до
15 мК разработан в Физико-техническом
институте низких температур АН УССР
[761]. Холодильная мощность при 50 мК
составляет 2 мкВт. Расход жидкого гелия
4—10 л/сут.
12.7. МИКРОКРИОГЕННЫЕ УСТАНОВКИ
К микрокриогенным установкам по
ГОСТ 21957-76 относят те установки, для
работы которых при обратимом проведе-
нии всех процессов требуются затраты
мощности не более 500 Вт, или, иными,
словами, эксергетическая производитель-
ность установок не превышает 500 Вт. Так,,
при охлаждении на уровне 4 К холодо-
производительность микрокриогенных ус-
тановок не превышает 7 Вт, а на уровне
70 К — 120 Вт.
Микрокриогенные установки предна-
значены для автономного охлаждения на-
земных и бортовых устройств в условиях,
когда энергопотребление, масса, а иногда
и габариты криогенных установок строго-
ограничены. Такие установки широко при-
меняются для криостатирования радио-
электронных приборов, квантовых генера-
торов и усилителей (лазеров, мазеров),,
приемников ИК-излучения, криоэлектрон-
ных СВЧ-устройств и т. п. В зависимости
от назначения и условий эксплуатации тре-
буемая длительность непрерывной работы
и ресурс микрокриогенных систем находят-
ся в очень широких пределах — от не-
скольких минут до тысяч часов.
На микрокриогенные системы большое
влияние оказывает масштабный фактор,,
что приводит к существенному ухудшению
их удельных показателей и, в частности,
к значительному возрастанию относитель-
ных величин внешних и внутренних потерь-
эксергии.
На рис. 12.16 приведены удельные рас-
ходы энергии в современных рефрижера-
торах для получения температур жидкого
гелия [547]. Из этих данных следует, что-
КПД микрокриогенных гелиевых систем
составляет примерно 1,5—6% и только
для весьма крупных установок он прибли-
жается к 20%. С повышением рабочей
температуры показатели улучшаются (осо-
бенно для машин небольшой холодопро-
изводительности), но и при 80 К их эф-
фективность, оцениваемая по сравнению с
циклом Карно (эксергетический КПД), ни-
же 30%.
Для получения холода в современных
микрокриогенных установках используют'
Рис. 12.16. Удельный расход энергии L/Qs
на единицу холодильной мощности в уста-
новках для получения температур 4,2—
4,5 К:
Д — циклы с детандированнем; О — квазнцнкл’
Гиффорда — Мак-Магона
.320
Сжижение газов
три основных метода; дросселирование
(цикл Линде), расширение сжатого газа
с совершением внешней работы (циклы
Клода, Гейланда, Стирлинга, Вюлемье),
эффект Джоуля — выхлоп (квазицикл Гиф-
форда—Мак-Магона). Термодинамические
основы этих методов изложены в разд. 3.
Более подробно о микрокриогенных систе-
мах различного типа см. в [165].
Микрокриогенные установки на осно-
ве дросселирования. Основные части таких
установок: компрессор, теплообменник и
дроссельное устройство.
Преимущества дроссельных установок:
отсутствие движущихся частей при низ-
кой температуре, отсутствие вибраций в
местах отбора холода, возможность полу-
чения низких температур вплоть до гелие-
вых (при предварительном охлаждении),
возможность замены компрессора резер-
вуаром со сжатым газом (для кратковре-
менной работы). Дроссельная установка не
требует жесткой связи криоблока с ком-
прессором, так как сжатый газ можно под-
водить по трубопроводу большой длины.
Сам криоблок может быть весьма миниа-
тюрным и иметь массу 5—10 г для полу-
чения температуры 80 К и 45—50 г — тем-
пературы 20 К [158].
К недостаткам микрокриогенных си-
стем, работающих на однокомпонентном
криоагенте, можно отнести недостаточно
высокий КПД, возможность забивки дрос-
Рис. 12.17. Схема гелиевой дроссельной
установки с тремя ступенями:
1 — азотный компрессор; 2 — водородный ком-
прессор; 3 — гелиевый компрессор; 4 — теплооб-
менники; 5 — дроссельные вентили; 6 — камера
.для охлаждаемого объекта; 7 — теплоизоляцион-
ный кожух
Рис. 12.18. Схема микрокриогенного гелие-
вого ожижителя, работающего по модифи-
цированному циклу Клода:
1 — компрессор детандерного контура; 2—детан-
деры; 3 — теплообменники; 4 — компрессор дрос-
сельного контура; 5 — дроссельный вентиль; 6 —
байпасные клапаны
Рис. 12.19. Схема гелиевого ожижителя на
базе установки Гиффорда -т- Мак-Магоиа:
/ — компрессор (две ступени сжатия); 2 — кла-
паны впуска и выпуска; 3 — вытеснитель; 4 —
регенератор (3 шт.); 5 — теплообменник (3 шт.);
5—теплообменники дроссельного контура (4 шт.);
7 — дроссель
Микрокриогенные установки
321
сельного узла примесями, имеющимися в
циркулирующем газе, необходимость высо-
кого давления рабочего газа, необходимость
нескольких каскадов с разными веществами
для получения температур ниже 70 К. Мно-
гие из этих недостатков частично или пол-
ностью снимаются прн применении много-
компонентных рабочих тел. Так, эксергети-
ческий КПД криоблока может составлять
80%, а давление прямого потока рабочего
тела 4—8 МПа.
На рнс. 12.17 показана схема дрос-
сельной установки, предназначенной для
получения температуры 4,4 К [448]. Уста-
новка имеет три ступени — азотную, водо-
родную и гелиевую. Полезная холодопро-
изводительность на уровне 4,4 К — около
*0,75 Вт при следующих параметрах сту-
пеней:
Ступень
Азотная
Водородная
Гелиевая
6,1—6,8
7,3—8,5
5,5—6,6
19—21
14—15
1,8—1,9
3,7
2,2
1,45
Используются компрессоры мембранного
типа. Время непрерывной работы опреде-
ляется стойкостью диафрагмы компрессо-
ров и составляет около 1500 ч. В установ-
ках подобного типа ступень для получе-
ния температуры 80 К иногда заменяют
более простой — ванной с жидким азотом,
получаемым со стороны.
Характеристики некоторых других
дроссельных микрокриогенных установок
приведены в табл. 12.7.
Микрокриогенные установки на основе
процессов расширения с отдачей внешней
работы. Циклы с детандированнем термо-
динамически более эффективны и поэтому
широко используются в криогенных уста-
новках всех видов. В микрокриогенных си-
стемах чаще других используется цикл
Клода. Если требуется получение крио-
агента в жидком виде, в детандерную схе-
му вводится дроссельная ступень оконча-
тельного охлаждения.
На рис. 12.18 показана схема микро-
криогенного гелиевого ожижителя фирмы
«Эйр Продакс» (США), работающего по
модифицированному циклу Клода. Уста-
новка предназчена для охлаждения мазе-
ров и имеет при 2,5 К холодильную мощ-
ность 0,2 Вт. В детандерном контуре цир-
кулирует 12 м3/ч гелия, сжимаемого в
компрессоре до 2,1 МПа и расширяемого
в детандерах 2 до 0,2 МПа. Компрессор
21—218
дроссельного контура сжимает примерно
0,7 м3/ч газа до 0,55 МПа. Масса всей
установки — около 135 кг (в том числе
компрессорная система — 68 кг). Потреб-
ляемая мощность 1,58 кВт. Пусковое вре-
мя — около 3 ч, причем для ускорения
времени захолаживания системы преду-
смотрены байпасные клапаны. Время не-
прерывной работы установки — до 3 мес.
По этой схеме изготовляют микрокриоген-
ные установки и большей производитель-
ности.
Одно из направлений развития детан-
дерных установок идет по пути расшире-
ния применения многооборотных турбоде-
тандеров.
Широкое распространение получили
также микрокриогенные газовые машины,
работающие по обратному циклу Стирлин-
га. Подробно об этих машинах см. в [165].
Установки на основе цикла Вюлемье
(цикл сочетает прямой и обратный циклы
Стирлинга) распространения пока не по-
лучили из-за их относительно больших
массово-габаритных показателей.
Микрокриогенные установки на основе
квазицикла Гиффорда—Мак-Магона.
Эти установки получают все более ши-
рокое распространение. Хотя термодина-
мическая эффективность нх ниже детан-
дерных, однако установки этого типа об-
ладают целым рядом преимуществ, а имен-
но: простотой и компактностью конструк-
ции, отсутствием клапанов, работающих
при низких температурах, отсутствием зна-
чительных механических сил и как след-
ствие этого — малой вибрацией, относи-
тельной простотой увеличения числа сту-
пеней и хорошими возможностями по ми-
ниатюризации узлов.
Одноступенчатые устройства Гиффор-
да—Мак-Магона позволяют получать тем-
пературы 80—100 К. Для получения тем-
ператур 15—20 К применяют трехступен-
чатые установки. Комбинация трехступен-
чатой машины с дроссельным контуром
позволяет получать температуры жидкого
гелия. Схема такой системы показана на
рис. 12.19. В машине Гиффорда—Мак-Ма-
гона расширяется с 2 до 0,5 МПа при-
мерно 90% газа; остальные 10% гелия
циркулируют в дроссельном контуре, рас-
ширяясь с 2 МПа примерно до 0,1 МПа.
Серийным изготовлением микрокрио-
генных установок в настоящее время за-
нимаются целый ряд промышленных фирм,
в том числе такие крупные, как «Эйр Про-
дакс» и «Криодженнк Технолоджи» (США),
«Филипс» (Голландия), «Эйр Ликид»
(Франция), НПО «Микрокриогенмаш»
(СССР) и др. Технические характеристики
некоторых микрокриогенных установок
приведены в табл. 12.7, а также в [165].
При использовании микрокриогенных
систем большое значение имеет конструк-
тивное выполнение узла отбора холодиль-
Таблица 12.7. Характеристики некоторых микрокриогенных установок
Тип установки, модель (фирма) Криогенный цикл Холодильная мощность, Вт Потребляемая мощность, Вт, или расход газа, м3/ч Масса, кг Время запус- ка, мин Примечание
На температуру 70—80 К
Дроссельная со специ- альным компрессором („ЭйрПродакс », „Хьюз") Джоуля—Томсона 0,5—1 230 4,5—7,2 3—5 Работает в любом поло- жении
Дроссельная модель С-890 („Эйр Ликид“), Крио-тип АС-1 („Эйр Продакс") То же 4—7 Расход N3 1,4 0,5 (без ком- прессора) 5—20 Может работать от бал- лонов со сжатым азо- том
Газовая машина, моде- ли Криогем, Криомайт („Нередко", „Малакер") Стирлинга 7—15 150—300 (на валу) 6,5—11,2 5—10 Капитальный ремонт че- рез 2000—8000 ч
Детандерная С 5=102 („Эйр Продакс") Солвей 17 1700 70 20 Профилакти. а через 3000 ч
На температуру 20—40 К
Газовая машина, моде- ли Стирлинга 1,0—5 (30 К) 210—340 (на валу) 6,5—14 10 Ресурс 8000 ч
Криогем, Криомайт, Марк-VIIC („Нередко", „Малакер")
Газовая машина МСМГ-100 (НПО „Микро- криогенмаш") 5(20 К) 2000 10 См. [741]
Газовая машина серии Криодайн („Криодженик Техцолоджи") Гиффорда—Мак-Магена 2(30 К) 4(40 К) 1700 Криоблок-10, компрессор-100 45 Ресурс 14 тыс. ч. Профилактика через 3000 ч
Сжижение газов
Продолжение табл. 72.7
Тип установки, модель (фирма) Криогенный цикл Холодильная мощность, Вт Потребляемая мощность, Вт, Или расход газа, м8/ч Масса, кг Время запус- ка, мин Примечание
Дроссельная, модель Криотип АС-2 („ЭтрПро- дакс“) Джоуля—Томсона (две ступени) 4(23 К) На темпер Расход N2 1,5 Н3-1,4 атуру 4—4,5 К 0,7 (без ком- прессора) 19—50 Работает от баллонов
Дроссельная с жидким азотом, модель Крио-тип AC-3L („Эйр Продакс“) Джоуля—Т омсона 0,5(4,4 К) 4(22 К) Расход Н2— 1,5; Не—2,2 10 43—70 Рабетает от баллонов с Н2 и Не. Расход N2 0,5 л/ч
Двухдетандерная с дрос- Клода+Джоуля—Том- 2,1(4,5 К) 3400 433 Профилактический ре-
сельным контуром для получения жидкости („Эйр Продакс”) сона 0,2(2,5 К) 1600 136 180 монт через 1000 ч
Газовая машина с дрос- сельным контуром серии Криодайн („Криодженик Технолоджи") Гиффорда—Мак-Магона и Джоуля—Томсона 0,75—4 (4,2 К) 2270—7400 123—383 — Ресурс 10 тыс. ч. Про- филактика через 1500 ч
Микрокриогенные установки 323
324
Разделение воздуха
ной мощности. Как правило, охлаждаемые
объекты непосредственно присоединяют к
«холодной» головке машины. Соединение
должно обеспечивать минимальный темпе-
ратурный градиент. При гелиевых темпе-
ратурах наиболее надежным способом слу-
жит размещение охлаждаемого узла в ван-
не с жидким гелием.
Раздел тринадцатый
РАЗДЕЛЕНИЕ ВОЗДУХА
13.1. СОСТАВ ВОЗДУХА
В табл. 13.1 приведен состав сухого
воздуха на уровне моря [14, 20].
Таблица 13.1. Состав сухого
воздуха
Компонент Объемная концентрация, % Мас совая концентрация, %
Кислород 20,9416 23,75
Азот 78,084 75,52
Аргон 0,394 1,28
Диоксид угле- 0,03* 0,046
рода Неон 1,82-10-з 1,2-Ю-з
Гелий 5,24-10-4 7,2-Ю-з
Криптон 1 14-Ю-4 3,3-10-4
Ксенон 8,7-10—6 3,9-10-з
Водород 5-Ю-5 3,5-10—в
Метан 1,5-10-4* 0,8-10-4
Закись азота 5-10-5 8-Ю-5
Озон 10—е—10—5 io—0—ю—5
'Содержание СО2 может быть до 0/314 %; со
держание СН4 может быть до 1-10'3 объемных до-
лей, %.
В расчетах, при которых не учитывают
наличие в воздухе аргона, его прибавляют
либо к азоту, либо к кислороду (в зави-
симости от того, какой из этих продуктов
необходимо получить в чистом виде), по-
скольку по упругости пара аргон занимает
промежуточное положение между азотом и
кислородом. Соответственно считают, что
воздух содержит либо 20,9% О2 и 79,1%
N2, либо 21,9% О2 и 78,1% N2.
13.2. ОДНОКОЛОННЫЙ И
ДВУХКОЛОННЫЙ РАЗДЕЛИТЕЛЬНЫЕ
АППАРАТЫ
Одноколонный аппарат (рис. 13.1). Сжа-
тый воздух, предварительно охлажденный в
теплообменнике (на рисунке не показан),
конденсируется в змеевике, помещенном в
Рис. 13.1. Одноколонный ректификацион-
ный аппарат
кубе колонны, после чего дросселируется-
(примерно до атмосферного давления) и
подается в виде жидкости на верхнюю та-
релку ректификационной колонны. Выходя-
щие сверху колонны пары в предельном
случае находятся в равновесии с жидким
воздухом, содержащим 21% О2, и поэтому
не могут содержать меньше 7% кислорода;
практически содержание кислорода состав-
ляет примерно 10%. Стекающая по тарел-
кам жидкость обогащается кислородом, по-
этому в кубе можно получить кислород
практически любой концентрации.
В одноколонном аппарате извлекается
около 65% кислорода, поступающего с воз-
духом. Для получения 1 м3 кислорода не-
обходимо переработать 8,5—10 м3 воздуха.
Двухколонный аппарат (рис. 13.2). Ап-
парат состоит из ректификационной колон-
ны высокого давления 1 (нижней) и рас-
положенной над ней колонны низкого дав-
ления 2 (верхней). Между колоннами по-
мещен конденсатор-испаритель 3, в котором
пары азота, поднимающиеся из нижней
колонны, конденсируются в трубках, а в
межтрубном пространстве кипит жидкий
кислород, стекающий из верхней колонны.
Сжатый воздух, охлажденный в тепло-
обменнике (на рис. 13.2 не показан), по-
ступает в змеевик 9, находящийся в кубе
4 нижней колонны, где он сжижается. За-
тем воздух дросселируется в клапане 5 до
давления нижней колонны (0,55 МПа). Пар,
Одноколонный и двухколонный разделительные аппараты
325
Рис. 13.2. Двухколонный ректификацион-
ный аппарат
образовавшийся при дросселировании, а
также пар нз испарителя поднимаются
вверх, а жидкость стекает вниз в куб (ис-
паритель). Пары, перемещаясь вверх, посте-
пенно обедняются кислородом при тепло-
массообмене на тарелках колонны и в ви-
де почти чистого азота доходят до конден-
сатора 3. Здесь азот конденсируется и ча-
стично стекает обратно в колонну. Стекаю-
щая жидкость содержит от 0,1 до 3% кис-
лорода. Таким образом, конденсатор-испа-
ритель 3 служит для нижней колонны де-
флегматором. Часть жидкости в количестве
примерно 0,45 м3/м3 (считая на 1 м3 пе-
рерабатываемого воздуха) попадает в кар-
маны 7 н отсюда через клапан 6 дроссе-
лируется в верхнюю часть колонны 2 в ка-
честве флегмы.
Жидкость с содержанием 35—40% О2
в количестве 0,55 м3/м3 собирается в кубе
4 колонны 1, откуда дросселируется в сред-
нюю часть верхней колонны через клапан 8.
Верхняя колонна работает под давле-
нием, близким к атмосферному. В ней про-
исходит окончательное разделение воздуха
на кислород и азот.
В конденсаторе-испарителе теплота пе-
реходит от конденсирующегося в трубках
азота к кипящему в межтрубном простран-
стве кислороду; поэтому температура жид-
кого кислорода должна быть ниже темпе-
ратуры конденсации азота. Однако нор-
мальная температура кипения кислорода,
как известно, выше, чем азота. Чтобы под-
нять температуру конденсации азота, в
нижней колонне повышают давление. При
давлении 0,36 МПа температура конденса-
ции азота становится равной температуре
кипения кислорода при 0,1 МПа. Это дав-
ление — предельно минимальное для осу-
ществления ректификации воздуха в двух-
колонном аппарате. Для создания необхо-
димого температурного напора в 2—3 °C
давление в нижней колонне поддерживают
в диапазоне 0,5—0,55 МПа.
Степень извлечения кислорода в двух-
колонном аппарате более 92%, т. е. для по-
лучения 1 м3 кислорода требуется перера-
ботать 5,1—5,2 м3 воздуха. Количество
кислорода, получаемого из 100 м3 воздуха,
в зависимости от концентрации кислорода
(Со ) и содержания О2 в отходящем азо-
зе (С%2) может быть определено по фор-
муле (аргон отнесен к азоту)
v 20,9-CN2
О2 — р г*
СО2 'N2
Извлечение компонентов воздуха, ха-
рактерное для двухколонной ректификации,
может быть получено и при использовании
одноколонного аппарата, но со специаль-
ным контуром, которым обеспечивается по-
дача в верхнюю часть чистого азота в ка-
честве флегмы. Схема такого аппарата по-
казана на рис. 13.3. Аппараты с флегмовым
контуром используют в некоторых установ-
ках (Рескол-цнкл) [41, 536, 541].
В обычном двухколонном аппарате
(рис. 13.2) концентрационные напоры про-
цесса ректификации на всех участках верх-
ней колонны весьма значительны н далеки
от условий фазового равновесия. Это сви-
детельствует о том, что флегмовое число
существенно больше минимального, н для
увеличения эффективности процесса разде-
ления его уменьшают одним из двух спо-
собов: 1) часть перерабатываемого воздуха
(примерно 20—30%) подается в газообраз-
ном состоянии при давлении 0,13 МПа в
середину верхней колонны, минуя нижнюю.
В современных крупных установках этот
воздух предварительно расширяется в тур-
бодетандере, чем обеспечивается необходи-
мая для всего процесса холодильная мощ-
ность; 2) часть азота (15—25% перераба-
тываемого воздуха) нз дефлегматора ниж-
ней колонны выводится в газообразном
виде, и таким образом уменьшается коли-
чество азотной флегмы в верхней колонне;
отобранный газообразный азот расширяется
затем в турбодетандере.
В большинстве современных установок
используется первый способ [203].
Уменьшение необратимости процесса
ректификации возможно также путем вве-
дения ступенчатого подвода и отвода те-
326
Разделение воздуха
Риг. 13.3. Одноколонный ректификацион-
ный аппарат с флегмовым контуром
плоты на разных температурных уровнях
колонны (неадиабатная колонна).
Чистота получаемых продуктов. По-
скольку в воздухе кроме азота и кислорода
содержится приблизительно 1 % Аг, одно-
временное получение в обычном аппарате
чистых кислорода и азота невозможно.
На рис. 13.4 приведена расчетная за-
висимость числа идеальных тарелок в верх-
ней колонне от концентрации продуктов
разделения для аппаратов без извлечения
аргонной фракции. Воздух рассматривался
как тройная смесь (N2—Аг—О2), содержа-
ние килорода в азотной флегме принималось
равным содержанию кислорода в отходя-
щем азоте [205]. При получении кислорода
концентрации 99,5% его содержание в от-
ходящем азоте в большинстве случаев со-
ставляет от 0,3 до 1% [203]. Условия ра-
боты нижней колонны подробно рассмотре-
ны в [205].
Для одновременного получения чистого
азота и чистого кислорода необходимо из
нижней половины колонны низкого давле-
ния отвести часть газа, содержащего аргон
примерно в количестве 7—20% перераба-
тываемого воздуха. В этом случае установ-
ка усложняется введением дополнительного
теплообменника для промежуточной аргон-
ной фракции (см. § 13.4).
Обогащенный воздух. Под обогащен-
ным воздухом понимается смесь азота и
кислорода с повышенным содержанием
(30—45%) кислорода. Потребность в обо-
гащенном воздухе возникла в металлурги-
ческой, химической и других отраслях про-
мышленности; его используют для интен-
сификации процессов окисления (в частно-
сти, горения), для газификации углей и тор-
фа в генераторах, в доменных и известково-
обжиговых печах, при окислении сернистого
ангидрида в контактных аппаратах и т. п.
Получать обогащенный кислородом воздух
можно двумя способами:
Рис. 13.4. Зависимость числа идеальных
тарелок п в верхней колонне от содержа-
ния кислорода в отходящем азоте и кон-
центрации получаемого кислорода у„
1) производить 95—98°/о-ный кислород
на обычной крупной установке для разде-
ления воздуха, а затем разбавлять кисло-
род воздухом до необходимой концентра-
ции;
2) производить кислородно-азотиую
смесь нужной концентрации на установке,
специально построенной для этой цели.
В настоящее время считается, что обо-
гащенный воздух требуемой концентрации
проще получать смешением атмосферного
воздуха с концентрированным кислородом,
полученным на наиболее совершенных воз-
духоразделительных установках.
Для получения 1 м3 обогащенного воз-
душа с п % О2 требуется (I — V) м3 воз-
духа смешать с V м3 кислорода концентра-
цией х %; при этом
п — 26,9
V =--------
х —20,9
Расчеты показали, например, что по-
лучение обогащенного воздуха с 45% кис-
лорода энергетически выгодно осуществлять
смещением воздуха с 70%-ным кислородом.
На рис. 13.5 дана зависимость уделы
Рис. 13.5. Зависимость удельного расхода
энергии на получение кислорода от его
концентрации
Промышленные воздухоразделительные установки
ного расхода энергии на получение кис-
лорода в зависимости от его концентрации.
Данные получены на основе работы возду-
хоразделйтельной установки производитель-
ностью 30 000 м3/ч кислорода. Данные по
обогащенному кислородом воздуху см. в
[40, 41, 205, 257, 536, 539, 540].
13.3. ПРОМЫШЛЕННЫЕ
ВОЗДУХОРАЗДЕЛИТЕЛЬНЫЕ
УСТАНОВКИ
В настоящее время используют разно-
образные технологические схемы устано-
вок. Выбор того или иного типа установки
связан прежде всего с ее производительно-
стью и чистотой конечных продуктов, но за-
висит также от состояния (газообразного
нли жидкого) выдаваемого продукта и от
многих других специфических требований.
Установки можно разделить на две большие
группы: установки малой и средней произ-
водительности (перерабатывают до
5000 м3/ч воздуха), выдающие обычно
продукты разделения высокой степени чис-
тоты; установки большой и очень большой
производительности (так называемого тон-
нажного кислорода), выдающие продукты
разделения разной степени чистоты (от 95%
п выше). В установках первой группы воз-
дух сжимается до высокого или среднего
давления (6,0—1,5 МПа), в установках вто-
рой группы — до давления 0,6 МПа.
Ниже приводится несколько наиболее
характерных схем воздухоразделительных
установок и указывается литература для
более детального ознакомления с этим во-
просом.
Любая установка разделения воздуха
состоит из: 1) технологических аппаратов
(ректификационных колонн, теплообменни-
ков, адсорберов) и 2) аппаратов и машин
криогенного цикла (детандерного или дрос-
сельного). При получении конечных про-
дуктов разделения в газообразном состоя-
нии при нормальной температуре цикл обе-
спечивает лишь компенсацию потерь холода,
в частности от недорекуперации и в связи
с теплопритоком из окружающей среды.
При получении конечных продуктов в жид-
ком состоянии цикл должен дополнительно
обеспечить сжижение этих продуктов.
Общий энергетический баланс, установ-
ки разделения воздуха определяется урав-
нением
SGr.n,jCp,iA7’H,i-|--GmAAm-[-Gc ж ДЙс ж +
+Qo. С— Qb Айд р—[—2ПАйдет,
где Gr.n.s — количество i-ro газообразного
продукта, выводимого из установки; ср,г- —
теплоемкость выводимого газообразного
продукта; ДУнд—значение недорекуперации
для выводимого продукта; G®—количество
получаемого продукта в жидком виде:
Айж — удельное количество теплоты, от-
водимой при сжижении (разность энталь-
пий); Got; — КОЛИЧеСТВО ЖИДКОСТИ, СЖИ-
маемой в насосе; Айсж — удельная рабо-
та адиабатного повышения давления жид-
кости; Qo.c — приток теплоты из окружа-
ющей среды; GB — количество поступаю-
щего воздуха; А/гдр — изотермический
дроссель-эффект воздуха; D — количество
газа, расширяемого в детандере; Дйдет —
адиабатная удельная работа расширения в
детандере.
Обычно принимают значение недореку-
перации в теплообменниках 3—5 К, в реге-
нераторах — 3—4 К- Сопротивление тепло-
обменников по обратному потоку — 12—
18 кПа. Приток теплоты из окружающей
среды зависит от размера установки и на-
ходится в диапазоне от 70 до 200 кДж на
1 моль перерабатываемого воздуха. Для
крупных установок Q0.c= 170V0*25 кДж на
1 моль воздуха, где V — количество пере-
рабатываемого воздуха в секунду. Адиа-
батный КПД турбодетандеров г;.5 для не-
больших установок 0,7, для крупных —
0,78—0,85. Изотермический КПД компрессо-
ров т]из = 0,64-0,7. Подробнее см. [203, 205,
596, 597].
Во всех типах установок из разделяе-
мого воздуха необходимо удалять примеси
диоксида углерода и воды, что осуществля-
ется химическим способом — адсорбцией
либо вымораживанием (см. § 11.2, 11.3).
Для получения сжатого до 15,0 МПа
кислорода в установках часто используется
насос (см. § 15.8), который повышает дав-
ление жидкого кислорода и подает его в
теплообменник, где кислород нагревается
под давлением до нормальной температуры.
На рис. 13.6 представлена схема воз-
духоразделительной установки для полу-
чения газообразных продуктов с исполь-
зованием турбодетандера или поршневого
детандера. Давление сжатого воздуха со-
ставляет 1,0—1,5 МПа. Расход энергии —
примерно 0,7 кВт-ч/м3 кислорода.
На установках, изготовляемых в на-
стоящее время, очистка воздуха ведется в
основном адсорбционным методом.
На рис. 13.7 представлена схема
криоблока воздухоразделительной уста-
новки для получения жидкого кислорода
с использованием детандера высокого
давления. Возможно использование тур-
бодетандера. Давление сжатого воздуха
20 МПа, расход энергии 1,15—1,5 кВт-ч/кг
жидкого кислорода.
Более подробно о рассмотренных ти-
пах воздухоразделительных установок см.
в [41, 203, 205, 216, 257, 727].
Воздухоразделительиые установки боль-
шой производительности. Более высокий
эксергетический КПД крупных современ-
ных установок объясняется главным об-
328
Разделение воздуха
Рнс. 13.6. Схема воздухоразделительной установки с детандером:
1 — фильтр; 2 — компрессор; 3 — декарбонизатор; 4 — щелочной насос; 5 — предварительный тепло-
обменник; 6—адсорбер влаги; 7—кожух блока; 8, // — теплообменники; 9, 10 — турбодетандер
с тормозом; /2 — вентиль; 13— нижняя колонна; 14 — конденсатор-испаритель; 15 — дополнитель-
ный конденсатор-испаритель; 16 — верхняя колонна: 17 — охладитель; 18 — ацетиленовый фильтр;
19 — отделитель жидкого кислорода
Рис. 13.7. Схема криоблока воздухоразделительной установки для получе-
ния жидкого кислорода (без аппаратов очистки воздуха):
1—3 — теплообменники; 4 — отделитель влаги; 5 —детандер; 6 — маслоотделитель; 7 —
дроссель; 8 — нижняя колонна; 9 — верхняя колонна; 10 — конденсатор-испаритель;
// — ацетиленовый фильтр; 12 — сосуд для жидкого кислорода
разом: 1) избытком азотной флегмы в
верхней 'колонне, что создает возмож-
ность либо отбора газообразного азота
с верхней части нижней колонны для на-
правления его в турбодетандер, либо по-
дачи воздуха непосредственно в середину
верхней колонны после расширения его в
турбодетандере; 2) очисткой воздуха от
диоксида углерода и влаги выморажива-
нием в регенераторах или реверсивных
теплообменниках; 3) получением холода
в турбодетандере с высоким КПД путем
расширения части воздуха или азота с
0,5—0,6 МПа.
Промышленные воздухоразделительные установки
329
Разработанный П. Л. Капицей высо-
коэффективный радиальный турбодетаидер
(г]=80-4-85 %) предопределил развитие
всех современных установок на ^основе
цикла низкого давления.
На рис. 13.8 представлена зависи-
Рис. 13.8. Зависимость доли (Д) перера-
батываемого воздуха, подаваемого в верх-
нюю колонну из турбодетандера, от чисто-
ты отходящего азота при получении техно-
логического кислорода чистотой 95% (п —
число идеальных ректификационных таре-
лок)
мость доли Д перерабатываемого воздуха,
подаваемого в верхнюю колонну из тур-
бодетандера, от чистоты отходящего азо-
та при различном числе идеальных рек-
тификационных тарелок п в аппаратах
для получения технологического ’ кисло-
рода чистотой 95%. То же соотношение
при получении технического кислорода
чистотой 99,5 % дано в [205, 800].
Обычно без существенного влияния на
концентрации получаемых продуктов мож-
но подавать газообразный воздух в
верхнюю колонну в количестве 24—26 %,
перерабатываемого.
На рис. 13.9 представлена принципи-
альная схема установки низкого давления
для получения технологического кислоро-
да. С подробными рабочими схемами
установок большей производительности
можно ознакомиться в [203, 216, 727, 728,
800]. Незабиваемость регенераторов обес-
печивается отводом части воздуха (от
5 до 15 %) из середины регенератора в
адсорберы, в которых поглощается СО2.
Этот принцип широко используется в со-
временных установках [216, 800].
Разработаны также крупные воздухо-
разделительные установки с реверсивными
теплообменниками вместо регенераторов.
Схема установки показана на рис. 13.10’
[538, 539, 597, 727, 800]. В установках
используют пластинчато-ребристые тепло-
обменники (см. § 8.20). Их незабивае-
мость обеспечивается использованием
принципа так называемого несбалансиро-
ванного петлевого потока (ом. § 11.3).
Узел ректификации всех воздухораз-
делительных установок принципиально
один и тот же: двойная ректификацион-
ная колонна (колонны высокого и низко-
го давления с промежуточным конденса-
тором-испарителем) . В зависимости от
размера установки конструктивное реше-
ние этого узла может быть различным
[203, 205, 216, 800].
На рис. 13.11 представлены схемы
узлов очистки и охлаждения установок
разделения воздуха низкого давления.
Выбор конкретной схемы и типа обору-
дования узла зависит от доли получае-
мых чистых и сухих продуктов [205, 538,
539, 596, 597, 728, 800].
В настоящее время в крупных уста-
новках для охлаждения и очистки возду-
ха без получения чистых и сухих продук-
тов применяют регенераторы с насадкой
Рнс. 13.9. Схема установки низкого давления получения технологического кислорода:
а — турбокомпрессор; b — оросительный холодильник; 1,2 — кислородный и азотный регенераторы;
3 — турбодетандея; 4 — адсорберы; 5, 6 — теплообменники; 7, // — отделители жидкости; «—аце-
тиленовые фильтры; 9 — ректификационный аппарат; 10—испаритель кислорода
330
Разделение воздуха
Рис. 13.10. Схема воздухоразделительной установки низкого давления с ре-
версивными теплообменниками
Рнс. 13.11 Схемы (а и б) узлов очистки и охлаждения воздухоразделительных устано-
вок низкого давления:
1 — азотные регенераторы; 2 — кислородные регенераторы с встроенными змеевиками; 3 — петлевые
адсорберы; 4 — турбодетандер; 5 — турбокомпрессор; 6—турбодетандер; 7 — холодильная машина;
8—адсорберы комплексной очистки; 9— пластинчато-ребристые непереключаемые теплообменни-
ки
из алюминиевой ленты. При использова-
нии регенераторов с каменной насадкой
н встроенными змеевиками возможно по-
лучение чистых продуктов до 0,32—0,4
доли. При реверсивных пластинчато-реб-
ристых теплообменниках возможно полу-
чение чистых продуктов в количестве 0,4—
0,5 доли.
Во всех воздухоразделительных уста-
новках с регенераторами незабиваемость
последних обеспечивается отбором части
воздуха из их средней части и очисткой
этого воздуха от диоксида углерода и
углеводородов в адсорберах (рис. 13.9).
Ранее применявшиеся метод несбаланси-
рованного петлевого потока и так назы-
ваемый метод тройного дутья сейчас не
используются (см. § 11.3 н [203, 727,800]).
При использовании комплексной ад-
сорбционной очистки воздуха и пластин-
чато-ребристых теплообменников практи-
чески все продукты разделения могут
быть получены в чистом виде (рис. 13.11,6).
Однако эксплуатационная надежность
таких теплообменников недостаточно вы-
сока из-за возможной коррозии пластин
при переработке воздуха, загрязненного
агрессивными примесями [205, 509, 597,
728].
По данным зарубежной практики
Промышленные воздухоразделительные установки
331
расход энергии на установках с регене-
раторами примерно на 2 %, а с молеку-
лярными ситами — на 6—8 % выше, чем
на установках с реверсивными теплооб-
менниками. Разница в капитальных за-
тратах между указанными вариантами ме-
тодов очистки па общей стоимости уста-
новок практически не сказывается [538].
На крупных воздухоразделительных
установках возможно получение 5—7 %
жидкого продукта от количества получае-
мого кислорода с затратами, примерно
соответствующими затратам на крупных
жидкостных установках [596, 597].
Для охлаждения воздуха после тур-
бокомпрессоров широко используется азот-
ио-водяная система. Вода в этой системе
охлаждается в скруббере за счет частич-
ного испарения в отходящий из установки
азот, а затем поступает для охлаждения
воздуха [730, 800].
С подробным описанием крупных воз-
духоразделительных установок можно по-
знакомиться в [203, 205, 216, 727, 728,
772, 800].
В поисках путей дальнейшего совер-
шенствования процесса получения техно-
логического кислорода были разработаны
схемы с одноколонным аппаратом и спе-
циальным замкнутым азотным контуром
для образования необходимой флегмы
(схемы «Рескол» и «Эллиот»), Француз-
ская фирма «Эйр Ликид» разработала
схему с подводом теплоты в нижней ко-
лонне на двух уровнях и с дополнительной
колонной (установка «Окситон») [41, 205,
257, 541]. Однако показатели этих уста-
новок не лучше показателей ранее рас-
смотренных.
В связи с широким использованием
криогенных газовых машин (см. § 3.5)
их стали применять и в воздухораздели-
тельных установках для обеспечения как
покрытия холодопотерь, так и сжижения
продуктов разделения [214, 216].
Современные процессы разделения
воздуха имеют общий эксергетический
КПД от 9 до 20 %.
Затраченная работа в современной
крупной установке низкого давления для
разделения воздуха распределяется, %,
примерно так:
Необратимость процессов сжатия в ком-
прессоре .....................• . . . 40-
Необратимость тепломассообмена в рек-
тификационной колонне..................16
Необратимость процессов в теплообмен-
ной аппаратуре ..... ............... 21
Таблица 13.2. Основные характеристики некоторых отечественных
воз духораз делительных установок для получения газообразных продуктов
[216, 800] (объемы газов приведены к нормальным условиям)
Индекс ус тановки Производительность V, м3/ч, и чисто- та продуктов разделения С в объем- ных. долях, % (V/C) Производи- тельность по жидкому О2 или N2, кг/ч Количество перерабаты- ваемого воз- духа, м3/ч Расчетный удельный расход энер- гии, кВт-ч/м8 Общая масса установки,
Т ехн ический кислород Технологичес- кий кисло- род Азот
Кт-ТО* 66 000/95 30 000/1 5050 350 000 0,403 1210
КтА-35* — 34 500/95 22 000/0,0005 1500 180 000 0,405 840
КА-32 32 000/99,5 — 22 000/0,0005 400 180 000 0,46 938
КА-15 15 500/99,5 — 16 000/0,0005 700 85 000 0,443 633,5
КААр-15 15 500/99,5 — 16 000/0,0005 300 (жид- кий Аг) 85 000 0,447 718
АКт-30 г 17 500 95 30 000/0,0005 600 85 000 0,383 705
А-8-1 100/99,8 — 8500/0,0005 120 24 000 0,219 (на N2) 214
А-6 и А-6-1 100/99,7 — 5000/0,0005 15 000/0,0015 116,5 14 400 0,263 (на N2) 168,8
КА-5 5300/99,5 — 31 500 0,45 264
К-1,4 1400/99,5 — — — 8900 0,715 186
К-0,4*** 450/99,7 — — — 2600 1,0 11,17
К-0,15*** 165/99,7 — — — 960 1 06 7,6
К-0,04*** 44/99,7 — — — 240 1,55 8,95
А-0,6*** • — 550/0,0005 — 960 0,328 (иа N2) .—
АК-1,5 230/99,7 — 1625/0,0605 215 2600 0,27 (на N2) 11,27
АК-0,6*** 85/99,7 — 600/0,0005 60 900 0,299 (на N2) 7,9
АК-0,135 35/99,7 — 135/0,11 — 240 0,374 (иаИ2+О2) 10,66
*На установке предусматривается извлечение неоио-гелиесой смеси и криптоно-ксенонового концентра-
та.
**Без изоляции и оборудования, поставляемого по требованию заказчика.
***Устано гка может гыдагать продукты разделения под по тышенным давлением или частично в жид-
ком виде.
I а блица 13.3. Основные характеристики неко’соых отечественных воздухоразделительных
установок для получения жидких и газооЗразных продуктов [216, 800] (объемы газов
приведены к нормальным условиям)
Индекс установки Производительность Чистота продуктов в объемных долях, % Количество перерабаты- ваемого воз- духа, м8/ч Расчетный удельный рас- ход энергии, кВт-ч/кг Общая масса установки без компрессоров, т
Кислород Азот
жидкий, кг/ч газ, м8/ч жидкий, кг/ч газ, м8/ч Кислород Азот
КжАжАрж-6 6000 __ 1670 29Э(Аг) 13 200 99,7 99,9995 22000* 1,388 247,2
Азотный режим — 4500 7200 290 (Аг) 8500 99,7 99,9995 22000* — 247,2
АжКжКААрж-2 2100 (кис- лородный режим) 1675 (азотный режим) 2000 (азотный ре- жим) 60(Аг) 2550 (азотный режим) 43.0 (кислород- ный режим) 99,7 99,9998 8000 3300** 0,192 (на услов- ный газ) 135
КжКАж-0,25 250 (3-й ре- жим) 185 (2-й режим) 250 (1-й режим) — — — 1140 1,08 21,5
КжАж-0,04 МТ4 34 42 34 40 99,7 99,9 240 1 55 (на 1 м3 О2) 10,16
АжА-0,04 МТ4 — — 36 45 — 99,998 240 1,48 (на 1 м3 О2) 10,06
АжК-0,62 МТ4 — 20 8 — 99,7 99,99 125 1,79 (на 1 м3 О2) 8
Аж-0С5 (КГМ)*** — —. 52 — — 99.5 60 2,1
АКДС-70 М**** (располо- жена на автомашинах) 70 70 70 100 99,2 99 440 200 кВт-ч (потребляе- мая энергия) 19,3
СКДС-70М (стационарная) 70 70 70 100 99,2 99 440 То же 15,2
Вместе с циркуляционным азотом.
Циркуляционный азот.
*** Установка состоит из криогенной газовой машины и азотной колонны.
•• • тановка может работать в нескольких режим?1Х: получение только жидких кислорода и азота и
о дио врем ей но
жидких и газообразных продуктов.
332 Разделение воздуха
П ромышленные воздуха разделительные установки
333
Потери, связанные с теплопритоком из
окружающей среды...................... 3
Необратимость дросселирования потоков 2
Необратимость расширения в турбодетан-
дере 3
.Минимальная работа разделения .... 15
100
О термодинамическом сравнении раз-
личных схем воздухоразделительных устано-
вок и возможных путях их усовершенство-
вания см. в [203, 205, 257, 461, 536, 541].
В табл. 13.2 и 13.3 приведены основ-
ные характеристики разработанных и вы-
пускаемых в СССР воздухоразделительных
установок. В таблицах индексы установок
обозначают: прописные буквы — главные
продукты разделения установки (К — кис-
лород технический; Кт — кислород техноло-
гический; А — азот, Ар—аргон); строчные
буквы — ж — жидкий продукт; цифры .—
округленная производительность главного
продукта в тысячах кубических метров
в час (при 20 °C и 0,1013 МПа или для
жидких продуктов в тысячах килограммов
в час).
Стоимость кислорода в существенной
степени зависит от производительности уста-
новки и от цены на электроэнергию. На
рис. 13.12 представлен график себестоимо-
•сти кислорода 100%-ной концентрации
в зависимости от производительности уста-
новки [731, 538]. В табл. 13.4 приведено
.’примерное соотношение стоимостей обору-
дования кислородных установок [542].
Таблица 13.4. Примерное
соотношение стоимостей
оборудования кислородных установок
Оборудование УстаноЕка высокого дав- ления, % i ! Установка низкого дав- ления, %
Компрессор с двигателем 32 22
Аппараты очистки и осушки 13 —
воздуха Теплообменники 9 16
Детандер 9 12
Колонна 13 14
Кислородный насос 5 —
Приборы управления и кон- 2 12
троля Трубопроводы и арматура 12 16
Кожух и изоляция 3 6
Прочее 2 2
В табл. 13.5 приведены некоторые
основные технико-экономические показатели
крупных воздухоразделительных установок
[733]. Более подробно об экономике раз-
деления воздуха см. в [205, 257, 538, 598,
733]
Об автоматизации кислородного произ-
водства и других криогенных установок см.
в [734, 740, 745].
Рис. 13.12. Зависимость себестоимости производства кислорода 100%-ной кон-
центрации от производительности установки
334
Разделение воздуха
Таблица 13.5. Некоторые технико-экономические показатели,
воздухоразделительных установок
Показатель КТ-1000 КТ-0600 ЕР-1 (Кт-12) БР-2(КтК-35)
Производительность по кислороду, 1000 3600 12 500 35 000
м8/ч Металлоемкость, кг на 1 м/ч кисло- 45 34 28 25
рода Трудоемкость изготовления установок, 21 11 7 6
нормо-ч на 1 м3/ч кислорода Стоимость блоков разделения, руб. на 95 52 53 46
1 м8/ч кислорода Капиталовложения на строительство 284 240 105 85
кислородных станций, руб. на 1 м8/ч кислорода Расход электроэнергии на произвол- 0,68 0,60 0,44 0,42
ство 1 м8 кислорода, кВт-ч Продолжительность работы блока, мес 3 6 12 12
Выработка на одного производствен- 880 3200 И 10J 31 0иО
ного рабочего, тыс.м8/год Себестоимость 1 м8 кислорода, коп. 1,9 1,3 0,8 0,6
13.4. ПОЛУЧЕНИЕ ИНЕРТНЫХ ГАЗОВ
ИЗ ВОЗДУХА
Получение инертных газов особенно
экономично, когда их выделяют как побоч-
ные продукты при переработке больших
количеств атмосферного воздуха при произ-
водстве кислорода или азота.
Технология получения инертных газов
разделяется на две стадии:
Рис. 13.13. Принципиальная схема выделе-
ния инертных газов из воздуха:
1 — верхняя колонна; 2 — нижняя колонна; 3 —
аргонная колонна; 4—криптоновая колонна; 5—
дефлегматор неоно-гелиевой смеси
1) получение концентрата инертного
газа (так называемого «сырого газа»);
2) рафинирование этого концентрата.
На рис. 13.13 представлена принципи-
альная схема получения первичного концен-
трата («сырого газа») инертных газов на
воздухоразделительной установке.
Получение аргона. Точка кипения арго-
на лежит между точками кипения азота а
Рис. 13.14. Распределение аргона по высо-
те колонны с отбором и без отбора аргон-
ной фракции:
а — доля отбираемой аргонной фракции от пере-
рабатываемого воздуха
Получение инертных газов из воздуха
335
кислорода (примерно на 10 °C выше кипе-
ния азота и на 3 °C ниже кипения кисло-
рода). Поэтому аргон накапливается
в нижней части верхней колонны воздухо-
разделительного аппарата (ближе к кубу).
На рис. 13.14 представлен характер
.распределения аргона в верхней раздели-
тельной колонне [543]. Подробнее о рас-
пределении аргона в ректификационных
колоннах см. в [203, 205, 748, 749]. Для
наибольшего извлечения аргонную фракцию
следует отбирать в месте максимального
содержания Аг. Однако для снижения со-
держания азота в аргонной фракции (для
облегчения работы аргонной колонны)
-обычно отбор ведут с тарелок несколько
•ближе к кубу, где содержится больше О2.
Практически содержание аргона в отбирае-
мой фракции находится в зависимости от
типа разделительного аппарата в пределах
шт 5 до 15 %. Существует несколько схем
.присоединения аргонной колонны [203, 205,
748, 749]; на рис. 13.13 приведена одна из
наиболее распространенных.
Количество аргонной фракции, забирае-
мой из верхней колонны и направляемой
в аргонную колонну, зависит от схемы
.включения последней, числа тарелок, чисто-
ты главных продуктов разделения и состав-
.ляет от 5 до 30% количества перерабаты-
ваемого воздуха. Сверху аргонной колон-
ны отводится так называемый «сырой
аргон», содержащий 80—95 % Аг, 3—10 %
'N2, остальное-—кислород. Состав сырого
аргона и степень извлечения значительно
.зависят от типа воздухоразделительного
апарата. Так, для установок высокого дав-
ления степень извлечения аргона К=
=0,7-4-0,8; для установок двух давлений
7(=0,5-.-0,55; для установок низкого дав-
ления (с подачей детандерного воздуха
в верхнюю колонну) Д=0,3-4-0,2 [203].
Получаемый сырой аргон может содер-
жать кислорода до 10%. Очистка от кис-
лорода производится либо каталитическим
окислением водорода, либо химическим по-
глощением кислорода активным металлом
(например, по схеме Cu->CuO) с последую-
.щим восстановлением металла. При водо-
родной очистке в аргоне содержится 5—
1,5 % Н2. Об очистке аргона от кислорода
см. в [203, 748, 749]. Промышленность вы-
пускает для очистки аргона от кислорода
установки типов УТА и Арт, работающие
•По методу каталитического гидрирования
[203, 216, 749]. Полученная после очистки
..азото-аргонная смесь содержит 5—10 % N2
и служит конечным продуктом для электро-
ламповой промышленности.
Чистый аргон с остаточным содержа-
нием Ns от 0,1 до 0,005 % получают путем
низкотемпературной ректификации сырого
•аргона [203, 748, 749, 750]. Коэффициент
.извлечения на стадии получения чистого
аргона (99,9 % Аг) из сырого — примерно
1О,85. Промышленность выпускает установку
типа БРА [749] для получения чистого
аргона методом низкотемпературной ректи-
фикации производительностью от 60 до
120 м3/ч. Тонкая очистка аргона (до со-
держания примесей менее 10~5%) прово-
дится поглощением примесей металлами
(Са, Си, СиО и др.) при повышенной тем-
пературе (450—500 °C) [750].
В ЛТИХП разработан метод комплекс-
ной очистки сырого аргона. Сырой аргон
предварительно очищается от азота мето-
дом ректификации в колоннах установок
типа БРА, а затем от кислорода в блоках,
заполненных цеолитом NaA. Остаточное со-
держание кислорода менее 0,003 %- По-
дробнее об этом методе и комплексной
очистке от кислорода и азота методом
адсорбции см. в [749].
Данные по получению аргона см.
в [203, 205, 748, 749, 750].
Сырьем для получения аргона помимо
воздуха могут служить продувочные газы
заводов синтетического аммиака [748, 750].
Получение неоно-гелиевой смеси и чи-
стого неона. Гелий и неон как легкокипя-
щие вещества не сжижаются в воздухо-
разделительном аппарате, а накапливаются
в верхней части конденсатора нижней ко-
лонны 2 (рис. 13.13). Во избежание накоп-
ления неконденсированных газов и нару-
шения вследствие этого условий теплопере-
дачи неоно-гелиевую смесь отводят перио-
дически или непрерывно. Содержание гелия
и неона в отводимой фракции существенно
зависит от скорости отбора и составляет от
5 до 15 %, остальное — азот. Для увеличе-
ния концентрации неона и гелия эту смесь на-
правляют в устройство 5 (рис. 13.13), со-
стоящее из сепаратора и змеевика, охлаж-
даемого жидкой азотной флегмой с темпе-
ратурой около 78—80 К. Из смеси, нахо-
дящейся при давлении 0,5—0,6 МПа, кон-
денсируется азот, и поэтому содержание
Ne и Не увеличивается примерно до 50 %
со степенью извлечения 0,6—0,7. Соотноше-
ние между гелием и неоном примерно рав-
но соотношению их содержания в воздухе,
Для получения более чистой неоно-ге-
лиевой смеси используют специальные уста-
новки. Сжатая до 0,6—4 МПа неоно-гелие-
вая смесь направляется в дефлегматоры,
охлаждаемые жидким азотом, кипящим
в одном дефлегматоре под атмосферных
давлением, а в другом — под вакуумом;
получаемая смесь содержит 5—10 % N2.
Потери неона и гелия составляют около
5 % вследствие растворимости их в жидком
азоте. Дальнейшая очистка от азота про-
водится адсорбцией на активированном
угле. Очищенный продукт содержит азота
менее 0,01 %. В смеси может содержаться
до 1—2 % Н2, удаление которого целесо-
образно проводить на стадии разделения
неоно-гелиевой смеси.
Разделение неоно-гелиевой смеси для
336
Разделение воздуха
получения чистого неона можно вести ад-
сорбционным методом. При переработке
значительных количеств исходной смеси
более рационален конденсационный метод.
Разработаны процессы, где криоагентами
служат неон [544], водород и гелий [469].
Полученный неон имеет высокую концентра-
цию— более 99,9%. Степень извлечения на
этой стадии составляет 0,95—0,97.
Используется также метод выморажи-
вания неона в сосудах, охлаждаемых жид-
ким водородом [257, 771].
Общая степень извлечения при получе-
нии чистого неона — обычно около 0,5, счи-
тая от содержащегося в воздухе Ne.
Подробнее о методах получения и раз-
деления неоно-гелиевой смеси см. в [203,
257, 749, 750].
Гелий, содержащийся в неоно-гелиевой
смеси, получаемой на воздухоразделитель-
ных установках, пока промышленно не
используется. В будущем при истощении
гелиеносных природных газов воздух воз-
можно будет рассматриваться как основной
источник гелия, тем более что общее коли-
чество его в атмосфере земли оценивается
в 0,2-1014 м3 [821]. Это количество прак-
тически не будет изменяться, так как весь
теряемый гелий возвращается в атмосферу.
По оценкам американских специалистов
выделение из воздуха гелия как единствен-
ного продукта должно стоить в 10—30 раз
дороже получения гелия из природного газа
с содержанием 0,1 °/о Не. Следует учесть
также капитальные затраты на изготовле-
ние необходимого оборудования.
Получение криптона и ксенона. Так
как температуры кипения криптона и ксе-
нона выше соответствующих температур
всех прочих компонентов воздуха, то онн
концентрируются в жидком кислороде. Для
получения первичного концентрата Kr-j-Xe
продукционный кислород отводится в крип-
тоновую колонну 4 (рис. 13.13), где промы-
вается флегмой. Примерно 10 % поступаю-
щего кислорода отводится из куба в виде
концентрата, содержащего от 0,1 до 0,2 °/о
Kr-J-Xe. Степень извлечения Кг-|-Хе состав-
ляет от 75 до 85 %.
Одновременно с концентрированием Кг
и Хе происходит накапливание углеводоро-
дов примерно до такой же концентрации.
Опасность взрыва ограничивает возмож-
ность дальнейшего повышения содержания
Кг и Хе в первичном концентрате. После-
дующие очистка и обогащение первичного
концентрата ведутся в отдельных установ-
ках в две стадии: получение чистой крип-
тоно-ксеноновой смеси и разделение этой
смеси на криптон и ксенон. «Бедный» пер-
вичный концентрат, полученный на воздухо-
разделительной установке, перерабатывают
на установках типа УСК-1М [203, 750].
Вначале удаляют углеводороды путем их
каталитического окисления на СиО или
А120з при повышенной температуре (450—
600 °C) и последующего поглощения про-
дуктов окисления. Затем ведут дальнейшее-
концентрирование в ректификационной ко-
лонне с получением продукта, содержащего
88—90 % Кг-|-Хе. Дальнейшая очистка от
кислорода активной медью и разделение на
чистые компоненты в ректификационной
колонне имеют характер лабораторных опе-
раций.
Разработаны методы обогащения и раз-
деления криптоно-ксеноновой смеси только
адсорбционным методом [203, 749, 750].
Используются процессы получения крип-
тона и ксенона, не связанные с разделе-
нием воздуха на кислород и азот [257].
Воздух, охлажденный до точки росы, про-
мывается жидким воздухом в количестве
10 % перерабатываемого, который раство-
ряет криптон и ксенон. В результате полу-
чают первичный продукт, содержащий 0,1—
0,3 % (КгД-Хе), который концентрируется
описанным ранее методом.
13.5. ВОПРОСЫ БЕЗОПАСНОСТИ
ВОЗДУХОРАЗДЕЛИТЕЛЬНЫХ
УСТАНОВОК
До настоящего времени (правда, су-
щественно реже) случаются взрывы на
установках разделения воздуха. В подав-
ляющем большинстве случаев очагом взры-
ва служит межтрубное пространство испа-
рителя верхней колонны, где кипит кисло-
род. Наблюдаются взрывы различной силы:
от еле заметного до сопряженного с раз-
рушением аппарата. Взрывы происходят
из-за попадания в разделительный аппарат
ацетилена и других углеводородов.
Источники появления в воздухе углево-
дородов различны. В зависимости от мест-
ных условий воздух содержит ацетилена от
0,001 до 1,0 см3/м3. В промышленных рай-
онах содержание ацетилена в воздухе мо-
жет доходить до 3 см3/м3, что представ-
ляет большую опасность, так как ацетилен
сразу будет выпадать в твердом виде
в испарителе. Из других углеводородов
главной примесью в воздухе является метан
(до 5 см3/м3). Еще одним источником по-
падания в разделительный аппарат ацети-
лена и других углеводородов служит мас-
ло компрессоров, которое в процессе сжа-
тия воздуха может частично крекироваться.
О растворимости ацетилена в кислоро-
де и ' кислородно-азотных смесях см.
в разд. 5. Подробнее о накапливании аце-
тилена в аппарате см. в [572]. Считается,,
что растворенный в жидкости ацетилен не
взрывоопасен. Опасность представляет аце-
тилен, выпавший в твердом виде из раст-
вора. В 1 л жидкого кислорода растворяет-
ся при 90 К 4—5 см3 ацетилена.
В СССР утверждены временные нормы
для допустимого содержания ацетилена
(0,2 см3 на 1 дм3 жидкого кислорода
Вопросы безопасности воздухоразделительных установок
33?
в испарителе верхней колонны с учетом ко-
эффициента безопасности). Допустимые со-
держания других углеводородов, данные
в [572]. Этими же нормами установлены
предельные содержания взрывоопасных
примесей в воздухе для различных типов
воздухоразделительных установок [203,
572]. По ацетилену предельное содержание
составляет от 0,25 до 1,0 см3/м3.
Применяют различные методы борьбы
против попадания ацетилена в разделитель-
ный аппарат. Один из них — устройство
воздухозаборов в различных точках и
пользование ими в зависимости от направ-.
ления ветра.
Основным способом защиты установок
от ацетилена служит адсорбция как при
очистке-газообразного воздуха при различ-
ной температуре перед его поступлением
в ректификационную колонну, так и при
очистке кубовой жидкости и жидкого кис-
лорода. Адсорберы на потоке кубовой жид-
кости применяют во многих воздухоразде-
лительных установках. Рекомендуется за-
гружать в адсорберы ацетилена кусковой
силикагель КСМ с ацетилеиоемкостью 2,2 л
С2Н2 на 1 л адсорбента при скорости филь-
трации 45—50 см3/(мин-см2). Конструкции,
расчет и правила эксплуатации адсорберов
см. в [203, 572, 727, 772].
В зарубежных установках широко при-
меняется очистка воздуха от ацетилена
в адсорберах, устанавливаемых на потоке
воздуха после регенераторов или на «пет-
левом» потоке.
Используют также адсорбционную
очистку жидкого кислорода. При этом жид-
кий кислород отбирают из конденсатора-
испарителя, направляют в адсорбер, а за-
тем вновь возвращают в конденсатор-испа-
ритель. Циркуляция кислорода обеспечива-
ется специальным насосом (парлифтом),
а также использованием гидростатического
столба жидкости. Разработан способ, по
которому воздух после регенераторов по-
ступает в специальную колонну, где про-
мывается кубовой жидкостью, которая за-
тем проходит очистку в циркуляционном
контуре с адсорбером и вновь подается
в колонну.
Разработан метод очистки воздуха от
углеводородов при положительных (по
Цельсию) температурах с использованием
каталитического окисления.
Используют также метод непрерывного
удаления ацетилена из испарителя, для
чего продукционный кислород из нижней
части главного испарителя отводят в жид-
ком виде в дополнительный испаритель,
где он проходит по трубкам сверху вниз.
В небольшом количестве неиспарившегосж
кислорода концентрируется почти весь аце-
тилен, который с этой жидкостью выводит-
ся из аппарата.
Подробнее об изложенных методах,
очистки см. в [403, 572].
При работе воздухоразделительных
установок с использованием компрессоров!
с масляной смазкой требуется периодиче-
ская промывка аппаратуры от проникаю-
щих небольших количеств масла. Промывку
ведут либо органическими растворителями,
либо водными моющими растворами [572,,
727, 772, 773].
При работе с жидким кислородом сле-
дует принимать меры предосторожности.
Основные опасности связаны с воспламе-
нением и взрываемостью в кислороде раз-
личных органических веществ, таких как
масла, жиры, ткани, дерево и т. д. В поме-
щении, где работают с жидким кислородом,,
категорически запрещается курить, пользо-
ваться огнем и открытыми электронагрева-
тельными спиралями. Крайне опасно насы-
щение кислородом одежды, поскольку она.
длительное время остается легко воспламе-
няемой. После пребывания в атмосфере,
обогащенной кислородом, запрещается не-
меиее чем в течение получаса подходить
к огню и курить. При наливе и сливе жид-
кого кислорода транспортные резервуары и;
шланги должны быть заземлены.
Жидкий азот широко используется
в качестве криоагента как в лабораториях,
так и в промышленности. При работе с боль-
шим количеством жидкого азота возможно1
снижение концентрации кислорода в воз-
духе. Следует учитывать, что при содержа-
нии в воздухе менее 14—16 °/о кислорода
человек теряет сознание без каких-либо1
предварительных симптомов.
Если условия применения жидкого
азота связаны с его постепенным испаре-
нием, то остающаяся жидкость постепенно
обогащается находившимся в ней кислоро-
дом. Так, если начальная концентрация кис-
лорода в жидком азоте составляет 4 %, то>
при испарении примерно 90 % жидкости от
первоначального количества концентрация
кислорода в остатке достигает предельно
допустимого значения — 30 °/о. Дальнейшая
работа с жидкостью такой концентрации по
кислороду связана с опасностью.
Подробнее о технике безопасности при.
производстве кислорода и работе с жидким
кислородом и азотом см. в [203, 572, 727,
772, 773].
22-218
338
Разделение углеводородных газовых смесей и изотопов
Раздел четырнадцатый
РАЗДЕЛЕНИЕ
УГЛЕВОДОРОДНЫХ ГАЗОВЫХ СМЕСЕЙ И ИЗОТОПОВ
14.1. ИЗВЛЕЧЕНИЕ ГЕЛИЯ
ИЗ ПРИРОДНЫХ ГАЗОВ
В промышленном масштабе гелий
извлекают исключительно из природных га-
зов. США и Канада обладают богатыми
источниками гелиеносных природных газов,
в них содержится 0,1—2°/о Не. Встречают-
ся источники природного газа с содержа-
нием гелия до 5—8 %, азота 10—30 %,
остальное — метан и незначительные при-
меси более тяжелых углеводородов. В
Польше используется газ с содержанием
0,4 °/о гелия. О составе природных газов
см. в [545, 546, 591, 749]. О содержании
3Не см. в § 4.15.
Современные методы разделения обес-
печивают достаточно экономичное выделе-
ние гелия и из очень бедных природных
газов — с содержанием до 0,01—0,06 % Не.
Во избежание потерь гелия при сжигании
природных гелиеносных газов в США до
1971 г. действовала программа консерва-
ции гелия, для чего были построены заводы
по предварительному извлечению гелия.
Его получают в виде «сырого гелия» с со-
держанием 50—70 % и закачивают в под-
земное хранилище. Часть «сырого гелия»
поступает на обогащение, в результате ко-
торого получают чистый гелий (99,9995 %
Не). По данным [547] содержание приме-
сей в гелии высокой чистоты (в промилле)
следующее:Н2— 0,1; Ne — 14,2; N2 —2,1;
О2— 0,4; Аг —0,05; СО2 — 0,05. Условия
на чистоту гелия, получаемого в СССР, см.
в § 15.1.
Криогенный процесс извлечения гелия
из природных газов основан на большом
различии в значениях температур конденса-
ции гелия и остальных компонентов газа:
при охлаждении сжатого природного газа
происходит сжижение всех сопутствующих
гелию компонентов, а в газообразном со-
стоянии остается гелий.
Выделение гелия из природных газов
во всех современных установках произво-
дится в две стадии. Первая стадия: в цикле
с давлением сжатия от 0,6 до 5,0 МПа пос-
Рис. 14.1. Схема установки выделения гелия из природного газа;
1—3 — теплообменники разделяемого природного газа; 4 — конденсационно-ректификационная ко-
.лонна для получения сырого гелня; 5— сепаратор жидкого азота; 6, 8 — теплообменники азотного
холодильного цикла; 7 —детандер иа азоте; 9—теплообменник сырого гелия; 10 — ожижитель и
сепаратор цикла высокого давления для получения чистого гелия
Извлечение гелия из природных газов
339*
ле сжижения основной массы метана и азо-
та получают «сырой гелий», содержащий
50—75 % Не. Из этого концентрата во вто-
рой стадии посредством цикла высокого
давления (до 20,0 МПа) с предваритель-
ным охлаждением жидким азотом выде-
ляют чистый гелий (97—98 % Не). Оконча-
тельный продукт высокой чистоты (до
99,9995 % Не) получают, пропуская чистый
гелий через охлажденный до 80 К активи-
рованный уголь. Если природный газ содер-
жит водород, то перед процессом очистки
адсорбцией из чистого гелия выделяют во-
дород путем его окисления до Н2О. Вторая
стадия и окончательная очистка адсорбцией
могут вестись на отдельной установке.
На рис. 14.1 представлена схема уста-
новки для выделения и получения высоко-
концентрированного гелия.
Степень извлечения гелия из природно-
го газа зависит от начальной концентрации
газа по гелию и находится в интервале от
90 до 98 % • Для обеспечения высокой сте-
пени извлечения гелия важным технологи-
ческим условием служит проведение про-
цесса отпарки растворяющегося гелия
в жидких конденсатах. Эта задача в от-
дельных установках решается по-разному.
Описание технологических схем уста-
новок по извлечению гелия см. в [201, 545,
547, 548, 591, 749, 750, 774J.
В США самый крупный завод по извле-
чению гелия имеет производительность по
готовому продукту (сырой гелий с концен-
трацией 65 %) более 160 000 м3/сут.
В 1978 г. в США было использовано для
различных целей более 260 млн. м3 гелия
[821]. В Польше действует завод по извле-
чению гелия из природного газа, содержа-
щего 0,4 % Не, производительностью около
500 м3/ч, причем весь продукт на месте
сжижается и далее транспортируется
в жидком виде [549]. В СССР работают
две высокопроизводительные установки.
Перерабатывается 3 млрд, м3 в год исход-
ного газа, в котором содержится незначи-
тельное количество гелия [776, 785].
По извлечению гелия кроме упомянутой
ранее литературы рекомендуется [41, 257,
575, 750, 775].
Долгое время гелий транспортировался
только в стальных баллонах в сжатом до
15 МПа состоянии. Расчетами показано, что
перевозка гелия в жидком виде более чем
в 4,5 раза экономичнее, чем транспортиров-
ка в сжатом состоянии в баллонах [820].
В настоящее время в США перевозка ге-
лия, особенно в больших количествах, осу-
ществляется в жидком виде в специальных
сосудах и танках (см. § 15.5) с эффектив-
ной многослойной вакуумной изоляцией.
Таким образом перевозится более двух тре-
тей потребляемого гелия.
Благодаря своим уникальным физико-
химическим свойствам гелий находит при-
22*
Т аблица 14.1. Структура
использования гелия в США
Вид использования %
Космическая техника и ис- следования 49,8
Сварка 10,7
Создание искусственной ат- 11,6
мосферы Исследовательские работы 0,1
Аэронавтика 7,6
Определение течей 7,1
Криогеника 5,6
Хроматография 2,4
Геплоноситель 1,5
Прочее 2,6
109,0
менение во многих ответственных процес-
сах. В табл. 14.1 как пример приведена
структура использования получаемого в-
США гелия за 1967 г. [822].
Ведутся работы по изучению возмож-
ности промышленного извлечения гелия из
природного газа диффузионным методом
через мембраны различного материала.
В табл. 14.2 приведены данные о про-
ницаемости различных материалов по Не,
N2 и СН4, а также коэффициенты разделе-
ния для смесей Не — N2 и Не — СН4, за-
имствованные из [823]. Зависимость прони-
цаемости от температуры можно найти
в этой же работе.
Как видно из таблицы, материалы с хо-
рошим коэффициентом разделения имеют
общую малую проницаемость. Хорошей про-
ницаемостью обладает также пленка из по-
ливинилтриметилсилена [777, 786].
Расчетами и экспериментами показана
возможность использования мембран для
разделения воздуха и гелийсодержащих
смесей. Так, при выделении гелия из смеси
с коэффициентом извлечения 85 % и пере-
паде давления на мембране 3 МПа полу-
чают максимальное обогащение продукта
по гелию примерно в 10 раз по сравнению
с исходной СхМесыо [777]. Испытаны уста-
новки для обогащения воздуха кислородом
до концентрации 37% производительностью-
до 100 м3/ч [786].
Пока диффузионный метод выделения
гелия и разделения воздуха в крупном мас-
штабе не может конкурировать с криоген-
ными методами, однако его следует изучать-
как перспективный метод предварительного
обогащения гелийсодержащего газа и выде-
ления гелия в установках малой произво-
дительности. Более детально о выделении
гелия диффузионным методом см. в [201
750, 823, 824].
.34 0
Разделение углеводородных газовых смесей и изотопов
Таблица 14.2. Проницаемость и коэффициент разделения для Не,
N2 и СН4 при 30 °C
Материал мембраны Проницаемость В*, см8.см/(см2-с), при разности давлений Д/?—13,3 гПа Коэффициент разделе- ния**
Не Na сн4 “Не-М2 аНе—СН4
•Силиконовая резина 2,3-10—8 1,5-10-з 5,9-Ю-з 1,5 0,39
Поликарбонат 6,7-10-’ 0,46-10-’ 0,36- io-» 15 19
Тефлон ЕЕР 6,2 10—0 0,25-10-’ 0,14-10-’ 25 44
Натуральный каучук 3,6-10-’ 1,05-10-’ 3,0-10-’ 3,4 0,9
Полистирен 3,5-10“’ 0,22-10-’ 0,23-10-’ 16 15
Тритен*** 3,4-10“’ 0,012-10-’ 0,0084-10-’ 280 400
Этилцеллюлоза 3,1-10-’ 0,28-10-’ 0,64-10-’ 11 4,9
Этиленвинилацетат 2,1-10-’ 0,28-10-’ 1,1-10-’ 8,5 1,9
Полиэтилен 1,10-’ 0,19-10-’ — 5,3 —
Поливинилфт орид 1,8-10-1’ 0,019-10-1’ 0,0065-10-1’ 95 280
Майлар 1-10-1’ 0,006-10-1’ 0,006-10-1’ 170 170
Силиконовое стекло 4,8-10-1’ 0,0063-10-1’ —. 7000 Очень
(Пусоч)**** большой
*см3 при 0°С и 0,1 МПа.
"аа_ь=ва/вь.
***Пластифицирэванный полихлортрифторэтилен.
****-При 400 °C.
14.2. РАЗДЕЛЕНИЕ КОКСОВОГО
И ВОДЯНОГО ГАЗОВ
Составы газов. Ниже приведены техни-
ческие условия на коксовый газ для полу-
чения азотоводородной смеси (ГОСТ
8330-57):
в объемных долях, о/о
Н2
°Ъ
(не более) ..............
(не более) ..............
СН4 ....
CnHm . . .
С2Н, ....
H2S ....
СО2(не более)
С6Н„ ....
с10о8....
NO ....
57—61
5,0
0,8
5—8
24—27
1,8—3,2
0,1—0,5
0,3—1,4
3,0
4,0 г/м3
0,2 г/м8
0,4—0,8 см8/м'
Плотность коксового газа при нормаль-
ных условиях 0,4—0,5 кг/м3.
В табл. 14.3 приведены составы других
газов, используемых для извлечения из них
водорода.
В промышленном масштабе азотоводо-
родную смесь и технический водород полу-
чают методом фракционированной конден-
сации из указанных выше газов [825J.
Расчет составов жидкости и газа при
конденсации коксового газа можно вести
как для многокомпонентной смеси, исполь-
зуя константы равновесия (см. § 5.8 и
и разд. 9). Поскольку эти расчеты не всег-
да достаточно точны» важно иметь экс-
периментальные данные о составе фаз.
Отдельные данные по составу фаз при кон-
денсации коксового газа можно найти
в [41, 575, 778J.
Установка Линде для разделения кок-
сового газа. Потери холода в ней компен-
сируются специальным азотным циклом.
Коксовый газ, сжатый до 1,2 МПа, очи-
щается от следов бензола в двух попере-
менно работающих теплообменниках и двух
аммиачных холодильниках, после чего по-
ступает на мокрую очистку от СО2, H2S
и других примесей. Очищенный газ посту-
пает в предварительные теплообменники,
где охлаждается за счет отходящих из раз-
делительного аппарата фракций. Дальней-
шее охлаждение газа до —30 °C проходит
в аммиачных холодильниках, после чего он
Таблица 14.3. Составы газов (объемные доли, %)
Наименование газа СО2 о2 со н2 сн4 n2
Водяной 5,0-6,0 0 38,0—40,0 48,0-50,0 0,5 2,0—3,0
-Смешанный 5,0—6,0 0 25,0—27,0 12,и—14,0 0,5 52,0—56,0
.Полуводяной 5,0—6,0 0 35,0—36,0 37,0—39,0 0,5 20,0—23,0
Разделение коксового и водяного газов
341
Рис. 14.2. Схема блока разделения коксового газа по Линде
поступает в блок разделения, схема кото-
рого представлена на рис. 14.2. Коксовый
газ охлаждается в теплообменниках а, Ь, с
(на рис. 14.2 даны характерные температу-
ры после отдельных аппаратов). В испари-
теле азота е происходит окончательная
конденсация метановой фракции (в меж-
трубном пространстве кипит азот). Для
удаления следов метана и оксида углерода
газ вводится снизу промывной колонны f,
имеющей 35—45 ситчатых тарелок, на ко-
торых промывается жидким азотом. Темпе-
ратура в колонне — от —185 до —190 °C,
давление 1,2 МПа.
Сжатый до 20,0 МПа и охлажденный
до —40 °C азот специального цикла разде-
ляется в блоке на три потока и поступает
в теплообменники git g2, g$, gi, gs- Холод-
ный азот после дросселирования поступает
частично в испаритель е и частично — в ко-
лонну через змеевик, погруженный в испа-
ритель азота е. Более подробное описание
схемы разделения коксового газа см.
в [40, 41, 257, 575, 778].
Если требуется получить технически
чистый водород, то газ после испарителя
азота направляют вместо колонны в специ-
альный дополнительный конденсатор, где
его охлаждают азотом, кипящим под ваку-
умом. В этом случае получают водород
чистотой до 95—98,5% [40, 41, 575, 825].
Агрегаты разделения строятся на про-
изводительность 4000, 7500 (Г-7500) и
14 000 м3/ч исходного коксового газа.
Примерные составы фракций (объем-
ные доли, %) при разделении коксового
газа:
оксид—углеродная фракция: 0,4—1,0
О2; 16—23 СО; 3—4 Н2; 2,5 СН4; 70—78 N2.
Выход фракции—14—17 % коксового газа
(в объемных долях);
метановая фракция: 1,2—0,3 CnHm;
2—0,8 О2; 7—10 СО; 78—88 СН4; 1,5—2,0
Н2; 2—3,6 N2. Выход фракции — 28—32 %
коксового газа;
этиленовая фракция: 32—50 С2Н4,
45—55 СпН2п+2; 3—8 С3Н6; 0,2 С4Н8;
0,4С2Н2; 0,2—1 О2; 1—4,5 СО; 0,5—8 N2;
5 Н2. Выход фракции — 3,2—4,3 % коксо-
вого газа. Выход С^Н4 с фракцией — при-
мерно 90 % исходного количества этилена;
пропиленовая фракция: 4—6 С2Н4;
7—10 С2Н6; 10—15 С3Н6; 8—12 С3Н8; 50—
55 С4; 2—3 СН4; 0,5 О2; 1 СО; 3 N2;
1—2 Н2. Выход — примерно 0,17 % коксо-
вого газа;
газ, выходящий из испарителя в про-
мывную колонну: 4—5 СО; 80—91 Н2;
0,5—3 СН4; 2—8 N2;
газ на выходе из промывной колонны
Таблица 14.4. Количество
азота высокого давления, расходуемого
в установке Г-7500
Статьи расхода азота Расход, % ис- ' ходного кок- сового газа Расход. % азотоводород- ной смеси Ф о Ф О со * 1- Л a cf СЬ\О с О о х
Азот на промывку 20—23 25—27 55
Азот на дозировку 6—9 8—10 19
Азот на конденсацию 10—12 12—14 26
метановой фракции
37—40 46—48 100
342
Разделение углеводородных газовых смесей и изотопов
(до дозировки): 80—84 Н2; 19—16 N2;
0,085—0,001 СО (по норме 0,003 %, или
30 см3/м3); до 0,01 О2.
В табл. 14.4 указано количество азота
высокого давления, расходуемого в уста-
новке Г-7500.
При расчете процесса в промышленной
колонне могут быть использованы данные
о равновесии системы СО — Н2—N2 — см.
§ 5.7 и [790J. По данным Руэмана для
промывки газа под давлением 1,2 МПа
с начальным содержанием оксида углерода
6 °/о и Д° конечного содержания СО с вы-
ходящим из колонны газом 0,01—0,001 %
необходимо на каждый 1 м3 промываемой
смеси подавать 0,09—0,12 м3 (считая по
газу) жидкого азота при 83 К.
Выход водорода при разделении со-
ставляет примерно 95—97 %. Для получе-
ния 1 м3 азотоводородной смеси при дав-
лении 1,1 МПа расходуется 0,55—
0,65 кВт-ч.
Наряду с получением водорода или
азотоводородной смеси при соответствую-
щих дополнениях в блоке разделения мож-
но одновременно получать метан, этилен и
другие компоненты в более или менее кон-
центрированном виде. Особенно ценен эти-
лен; о разделении этиленовой фракции
коксового газа см. в [575J.
Разрабатывается процесс разделения
коксового газа и выделения этилена из него
с использованием регенераторов [789J.
Рассматривается вопрос о комплексных
схемах разделения воздуха и коксового га-
за ' с наиболее рациональным использова-
нием оборудования [789]. Разработаны
установки разделения коксового газа, в ко-
торых потери холода компенсируются за
счет расширения в детандере смеси водо-
рода и азота, выходящей из промывной ко-
лонны [575, 778J.
Описание, установок разделения водя-
ного газа см. в [41, 575, 778]. В химиче-
ской промышленности получила распростра-
нение тонкая очистка водорода от приме-
сей СО путем промывки жидким азотом;
[575, 779J.
14.3. РАЗДЕЛЕНИЕ ГАЗОВ КРЕКИНГА
И ПИРОЛИЗА НЕФТЯНЫХ
ПРОДУКТОВ
В химической промышленности органи-
ческого синтеза исключительно важную'
роль играют этилен и пропилен. Получают
эти углеводороды путем крекинга и пиро-
лиза различных нефтяных продуктов. Осо-
бо важными источниками этилена считают-
ся этан и пропан; превращение их в этилен
осуществляется пиролизом в трубчатых пе-
чах при 800—820 °C. Ресурсы этана и про-
пана очень велики. Они содержатся в раз-
личных газах термического и каталитиче-
ского крекинга, а также в попутных газах
при добыче нефти.
В табл. 14.5 приведены типичные со-
ставы газов, служащих исходным сырьем,
для разделения на компоненты [201, 541..
791, 792J.
При получении чистых продуктов наи-
более сложная и дорогая стадия — это вы-
деление метана и водорода, а также разде-
ление этилена и этана с получением особо-
го чистого этилена.
В промышленном масштабе используют
следующие методы разделения: абсорбцион-
ный, низкотемпературный и адсорбционный
(гиперсорбция).
Абсорбционный метод. Метод основан
на селективном растворении компонентов,
начиная с С2Н4 и более тяжелых, в то
время как СН4, Н2, СО и ряд других оста-
ются в газовой фазе. Процесс абсорбции
ведут в колонных аппаратах при давлении
3,0—4,0 МПа. В качестве абсорбентов
используют либо ароматические углеводо-
Таблица 14.5. Типичные составы газов пиролиза и крекинга
нефтяных продуктов, молярные доли, %
Компонент Жидко- фазный крекинг Парофаз- нып кре- кинг Каталити- ческий крекинг ~ S (U С гй Пиролиз этана Об го s д =5 го о ь ~ о S а с: ь Пиролиз /г-бут ана Пиролиз тя- желых неф- тяных остат- ков Пиролиз- газового бензина
н2 6 13 9 12 33,9 16,1 8,4 24,5 9,5
сн4 33 29 21 42 5,8 30,8 32,4 31,9 25,7
С2Н2 — — — — 0,2 0,3 0,4 —
С2На 5 20 10 18 33,0 24,0 28,8 27,0 24,3
С2Н6 18 13 7 10 25,7 3,9 6,0 7,6 5,5
С3Н6 9 12 35 10 0,5 И,1 14,9 3,8 14,9
г и 16 3 13 2 0,2 11,3 0,5 0,5 2,7
ХС4Н8 12 8 5 5 0,4 1,6 2,8 — 11,3
2С4Н10 у 2 3 — — 0,1 4,8 3,0 3,2
ХС* — — 7 — 0,3 0,8 1,0 1,7 3,2
Разделение газов крекинга и пиролиза нефтяных продуктов
343
роды (процесс поглощения ведется при О
или —10 °C), либо пропилен-пропановую
«фракцию, а также углеводороды группы С4
(процесс поглощения ведется при —40-4-
—60 °C).
В десорбционной колонне из насыщен-
ного раствора нагреванием отгоняют погло-
щенные углеводороды, которые в дополни-
тельных колоннах разделяют на богатые
фракции. Степень извлечения этилена аб-
сорбционным методом достигает 99 %. По-
дробнее об абсорбционном методе см.
в [201, 789, 791J.
Низкотемпературный метод. Метод
основан на фракционированной конденса-
ции с последующей ректификацией. Процесс
можно разделить на три основные стадии:
1) предварительная очистка газа (удаление
Н2О, H2S, СО2, С2Н2, тяжелых углеводоро-
дов, начиная с группы С6 и выше); 2) от-
деление метана и водорода; 3) разделение
смеси углеводородов С2Н4, С2Н6, С3Н6, С3Н8,
С4, С5 на фракции. Вариантов схем разде-
ления может быть несколько, в основном
они зависят от состава газа, т. е. от соот-
ношения содержания водорода и метана
к углеводородам групп С2, С3 и С4, С8 со-
ответственно. Для газов с повышенным со-
держанием углеводородов группы С3 и
выше основная часть процесса разделения
«(конденсация и ректификация) смещается
в область повышенных температур, и на-
оборот, для «легких» газов наблюдается
обратная картина. Подробное рассмотрение
этого вопроса см. в [792].
Часто к получаемому этилену предъ-
является весьма высокое требование по
остаточному содержанию ацетилена (долж-
но быть не более 5-Ю-6 объемной доли).
Удаление ацетилена осуществляется либо
предварительным процессом каталитической
гидратации ацетилена, либо промывкой эти-
лена при низкой температуре ацетоном,
либо специальной ректификацией.
На рис. 14.3 представлен вариант схе-
мы разделения газа со средним содержа-
нием тяжелых углеводородов и тонкой
очисткой этилена промывкой ацетоном.
В табл. 14.6 приведен пример материаль-
ного баланса установки такого типа [793].
Извлечение этилена высокое — примерно
97 %, пропилена-—более 95 %. Чистота эти-
лена может быть доведена до 99,98 %,
этана — до 99,0%, пропилена — до 99,9 %.
Технико-экономические показатели про-
цесса разделения существенно зависят от
состава перерабатываемого газа. Ниже при-
ведены некоторые показатели в пересчете
на 1000 м3/ч исходного газа:
Статьи расхода
Газ со сред- Газ с высоким
ним содержа- содержанием
нием тяжелых тяжелых угле-
углеводородов водородов
Электроэнергия,
кВт-ч...........3900—3390
Охлаждающая во-
да, м3/ч .... 400
Греющий газ, :сг/ч 1509
3690—4 90G
800
3000—4000
Рис. 14.3. Схема установки получения особо чистого этилена:
/ — компрессор разделяемого газа; 2 — скруббер промывки; 3 — предварительный теплообменник;
-4а, 4Ь — осушители; 5 — аммиачный теплообменник; 6 — колонна отделения С3; 7—9 — теплообмен-
ники; 10 — метановая колонна; И — этиленовая колонна; 12 — колонна для отмывки ацетилена из
.этилена; 13, 14 — колонны разделения Сз; 15 — колонна регенерации ацетона
344
Разделение углеводородных газовых смесей и изотопов
Таблица 14.6. Материальный баланс газоразделительной установки
(рис. 14.3) (объемы газов приведены к нормальным условиям)
Компонен- ты Исходный газ Остаточ- ный газ Метан Этилен Этан Ацетилено- вая фрак- ция Пропиле- новая фракция
м3/ч % м3/ч % м8/ч % м3/ч % м8/ч % м8/ч % м8/ч %
н2 1590 15,0 1462 44,5 38 20 _
N2 200 2,0 172 5,2 28 1,5 — — — —. — —
сн4 3500 35,0 1647 50,1 1852 96,5 1 0,15 — — —
2970 20,7 6 0,2 — — 2J00 99,8 25 1,55 15 60 2 0,18
С2Н2 30 0,3 — — — — — — 20 1,2 10 40 —
С2Н6 1500 15,0 1 — — — 3 0,15 1490 92,25 — — 6 0,52
С3Н„ 930 9,0 — — — — — — 80 4,95 — — 820 72,8
с4н10 390 3,0 — — — — — — 1 0,05 — — 299 26,5
10 000 100,0 3288 100,0 1920 100,0 2004 100,0 1616 100,0 25 100 1127 100,0
Производительность одного агрегата со-
ставляет до 35 000 м3/ч по разделяемому
газу, и нет причин, препятствующих созда-
нию агрегатов большей производительно-
сти. Длительность безостановочной работы
агрегата — более одного года [792]. После
нескольких лет работы теплопередающие
поверхности, трубопроводы и сетки части
тарелок, особенно в зонах переработки тя-
желых углеводородов (С3 и выше), покры-
ваются слоем колимера, который легко со-
скабливается, но не растворяется в спирте,
эфире, дихлорэтане.
Об отделении ректификацией пропиле-
на от пропана, пропина и пропадиена см.
в [794].
О разделении газов пиролиза методом
низкотемпературной ректификации см. в
[41, 541, 575, 778, 791, 792].
Адсорбционный метод разделения. Ме-
тод основан на большой разнице в погло-
щении активированным углем или другим
адсорбентом метана и этилена (и более тя-
желых углеводородов). В промышленном
масштабе используется так называемая ги-
персорбция — непрерывный процесс адсорб-
ции в движущемся слое сорбента, осу-
ществляемый в колонных аппаратах. Этот
процесс применен для разделения газов пи-
ролиза с целью получения чистого этилена
и других углеводородов [201, 791].
По технико-экономическим показателям
абсорбционный и низкотемпературный рек-
тификационный методы примерно равноцен-
ны, однако многими специалистами предпо-
чтение отдается низкотемпературному ме-
тоду [791, 792].
14.4. НИЗКОТЕМПЕРАТУРНОЕ
РАЗДЕЛЕНИЕ СТАБИЛЬНЫХ
ГАЗООБРАЗНЫХ ИЗОТОПОВ
Для разделения изотопов было опробо-
вано большое число методов, в основе ко-
торых лежит различие в свойствах изото-
пов. Возможности разделения существенно
зависят и от начальной концентрации изо-
топов. Обзор методов см. в [236, 493, 563,
780, 781].
Одним из наиболее универсальных ме-
тодов разделения газообразных изотопов
считается низкотемпературная ректифика-
ция. Возможность разделения изотопов
этим методом определяется коэффициентом
разделения а. Природное содержание изо-
топов и значения коэффициента а даны
в табл. 4.80 и § 5.2.
В промышленном масштабе процесс по-
лучения дейтерия методом ректификации
жидкого водорода впервые был осуществ-
лен в СССР [236, 782].
На рис. 14.4 приведена схема первой
ступени процесса получения концентрата
с содержанием примерно 6 % HD из элек-
тролизного водорода [236]. Расход элек-
троэнергии по этому методу составляет
4000—5000 кВт-ч на 1 кг D2O при пере-
работке сырья с содержанием около 0,03 °/о
HD; степень извлечения составляет пример-
но 95 %.
На рис. 14.5 представлена схема извле-
чения дейтерия концентрацией 99,8 °/0, кото-
рый далее окисляется в D2O. В первой сту-
пени извлечения (получение 5 % HD)
используется трехступенчатая колонна, что-
обеспечивает по сравнению с одноступенча-
той уменьшение флегмового потока в 2,5—
2,8 раза. Однако при этом почти во столь-
ко же увеличивается общая высота колон-
ны. Разработаны проекты крупных агрега-
тов, перерабатывающих до 125 000 м3/ч
исходного водорода. В них предусмотрено
использование турбодетандеров для расши-
рения водорода. Расход электроэнергии
2500 кВт-ч/кг D2O [783, 795].
При использовании в качестве исход-
ного сырья водорода со значительным со-
держанием примесей (например, азотоводо-
родной смеси) необходимо обеспечить его-
Низкотемпературное разделение стабильных газообразных изотопов
345
L
|
15
Жидкий.
N2 -
I Водород на криогенерацию
Т __________0-0,7 МПа
р=0,17МПа,
водород 0,з-0,5МПа
10
1У
13
Т I
Г*-|—I
70 I
I —।
Я !
3
ip Жидкий Nz
Концентрат 6~10 7о HD
2 Жидкий NH3
Разделяемый
водород
У000м3/ч
ОДрО^Мпа
К1
11
12
Hi Жидкий
J 'l N2 —
Рис. 14.4. Схема промышленного агрегата выделения HD:
/<]—компрессор разделяемого водорода; К2— компрессор водорода, направляемого на криогенера-
цию и получение флегмы; 1—6 и 10—16 — теплообменники; 7 — адсорбер; 8 — ректификационная ко-
лонна; 9 — куб колонны
Первая ступень извлечения
Обратный водород
0,0015 % HD
ФрегмовыиНг
>1
Колонна
НН
Катализ
Колонна,
Вторая ступень извлечения
2HD
Н2 +d2
Продукт
99,8 %
Продукт
95% HD
0,12МПа
Водород
с 0,008 % HD
0,гмпа
Водород
на криогенерацию и
образование флеемы
Водород
с 0,005%НВ
Разделяемый
водород
с 0,03% HD
0,32МПа
, I
(5 % HD)
HD
(05%) Теплообменники
Рис. 14.5. Схема выделения D2 из водорода
0,2 МПа,
(h2/hd/d2)
0,12 МПа, V
Диафрагмовый
компрессор
очистку от этих примесеи перед поступле-
нием на ректификацию. Это существенно
усложняет схему процесса [214, 783]. Оче-
видно, извлечение дейтерия из водорода
может быть рациональным на крупных за-
водах по сжижению водорода.
346
Хранение и транспорт сжатых газов и сжиженных криопродуктов
Рис. 14.6. Схема разделения смеси водоро-
да, дейтерия и трития
Подробно о получении дейтерия мето-
дом низкотемпературной ректификации см.
в [236, 493, 537, 563, 780, 782, 783, 795,
796J.
Разработаны процессы для разделения
трех изотопов водорода — водорода, дейте-
рия и трития, причем они могут присутство-
вать в разделяемой смеси в различных со-
единениях (Н2, HD, НТ, D2, DT, Т2). На
рис. 14.6 представлена схема разделения
трех изотопов водорода [797]. Направле-
ние потоков и составы их ясны из рисунка.
Перед второй колонной поступающая смесь
предварительно приводится в реакторе
с катализатором к равновесию по реакции
2DT=s=tD2--j-T2, что обеспечивает получение
в кубе колонны чистого трития. Ректифика-
ционные колонны — насадочного типа. Вы-
сота их зависит от эффективности насадки
и получаемых концентраций продуктов и со-
ставляет от 5 до 12 м.
Необходимая холодильная мощность
процесса создается замкнутым гелиевым
циклом с расширением в турбодетандере
[797, 798J.
Рис. 14.7. Насадочная ректификационная
колонна для разделения смеси 4Не—3Не:
1 — насадочная ректификационная колонна; 2—
дефлегматор; 3— куб колонны; 4 — подогрева-
тель; 5 — жидкий азот; 6—жидкий гелий; 7 —
теплообменник; 8 — напускной клапан
При разделении изотопов 3Не и 4Не-
используется как процесс ректификации, так
и явление сверхтекучести — отвод сверхте-
кучего гелия через фильтр (термоосмос), по
сверхтекучей пленке и тепловым потоком.
[287, 784].
На рис. 14.7 представлено устройство
с ректификационной колонной для разделе-
ния смеси 3Не—4Не. Эффективно сочетание
ректификации с термоосмосом, обеспечи-
вающее общий коэффициент обогащения от
10s до 106. При ректификации используют
как колонки с насадкой, так и безнасадоч-
ные. Так, колонка с насадкой, имеющая
диаметр 7—8 мм и высоту 10 см, обеспечи-
вает получение практически чистого 3Не при
переработке смеси, содержащей 1—2 % 3Не„
со скоростью отбора 8—10 л/ч [784].
О разделении изотопов неона, аргона,,
кислорода и др. см. в [493, 563, 780].
Раздел пятнадцатый
ХРАНЕНИЕ И ТРАНСПОРТ СЖАТЫХ ГАЗОВ
И СЖИЖЕННЫХ криопродуктов
15.1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
НА ГАЗЫ И КРИОПРОДУКТЫ
Государственные стандарты на важ-
нейшие газы, используемые в криогенной
технике, приведены в табл. 15.1, а некото-
рые дополнительные сведения изложены
ниже.
Азот, получаемый из воздуха, постав-
Технические требования на газы и криопродукты
SA7
Таблица 15.1. Стандарты СССР на важнейшие газы, используемые в
криогенной технике
Наименование ГОСТ Содержание продукта по сортам (маркам), %, не менее
Азот газообразный техничес- кий 9293-74* высший сорт Сорт 1 Сорт 2 Сорт 3
99,994 99,5 99,0 97
Азот жидкий технический 9293-74* — Сорт 1 Сорт 2 Сорт 3
Азот особой чистоты газооб’ разный и жидкий 9293-74* — 99,5 99,0 97
99,996
.Аргон газообразный и жид- кий 10157-79 Высший сорт Сорт 1 — —
99,992 99,987 — —
Водород технический 3322-80 Марка А Марка Б Марка В
99,99 Высший сорт Сорт 1 Высший сорт Сорт 1 Сорт 2
99,95 99,8 98,5 97,5 95,0
Течий газообразный ТУ-51-940-80 Гелий очищенный Технический
А Б в
93,995 99,99 99,99* 99,8
Двуокись (диоксид) углерода 1 азообразная и жидкая 8050-76* Сварочный Пищевой Технический
99,5 98,8 98,5
Дг-уокись (диоксид) углерода тгердая (сухой лед) [12162-77* Массовая доля СО2 для марок
Пищевой Технический
Не менее 99,96 Не нормируется
Кислород газообразный тех/ ническнй и медицинский 5583-78 Сорт 1 Сорт 2 Сорт 3 Медицинский
99,7 99,5 99,2 99,5
•Кислород жидкий техиичес’ кий и медицинский 6331-78 Сорт i Сорт 2 Сорт 3 Медицинский
99,7 99,5 99,2 99,2
[Криптон и криптоно-ксеио" новая смесь 10218-77* Криптон Криптоно-ксеионовая смесь
высокой чистоты чистый Кг+Хе>9 9,5
99,98 99,88 Хе>5,0
Ксеион 10219-77* Высокой чистоты Чис тый
99,99 99,96
Неон МРТУ 6-02-376-66 Марка А Марка Б
99,888 99,896
'В сумме с инертными газами (гелий, неон, аргон).
ляется по ГОСТ 9293-74 в газообразном
виде пяти и в жидком — четырех сортов.
Содержание кислорода, °/о, должно быть:
в газообразном и жидком азоте особой чи-
стоты — не более 0,001, 1-го сорта — до
0,5, 2-го сорта — до 1 и 3-го — до 3, выс-
шего — до 0,005. Содержание водорода
нормируется только в азоте особой чистоты
:и не должно быть более 0,001 %.
При пересчетах принимается, что 1 кг
жидкого азота соответствует 0,86 м3 газа,
а 1 л жидкого азота — 0,69 м3 газа при
давлении 101,3 кПа и температуре 20 °C.
Аргон газообразный и жидкий выпу-
скается по ГОСТ 10157-79 двух сортов:
высшего н первого. Содержание кислорода
в аргоне высшего сорта — не более 0,0007,
а в аргоне первого сорта — до 0,002%.
Азота должно быть соответственно не более
0,006 и 0,01%, а влаги при давлении
348
Хранение и транспорт сжатых газов и сжиженных криопродуктов
101,3 кПа и 20 °C — не более 0,007 г/м3
(высший сорт) и 0,03 г/м3 (первый сорт).
Водород технический (сжатый и не-
сжатый) выпускается по ГОСТ 3022-80
трех марок в зависимости от способа по-
лучения: А — из азотоводородной смеси;
Б — электролизом воды; В — другими ме-
тодами.
Технический водород — горючий газ.
Смеси его с хлором, кислородом и возду-
хом взрывоопасны. Нижний предел взры-
ваемости смеси водорода с воздухом —
4%, верхний — 75%, с кислородом — 4,1—
96%. Температура самовоспламенения во-
дорода 510 °C.
Для сжижения используется обычно во-
дород марки Б с общим содержанием при-
месей кислорода, азота, оксида углерода,
метана и диоксида углерода не более 0,2%.
Влагосодержание сжатого водорода в бал-
лонах для марок А и Б не более 0,2 г/м3,
для В — не более 1,0 г/м3.
Гелий газообразный согласно ТУ
51-940-80 может содержать следующее ко-
личество примесей, %:
Примес ь Гелий очищенный Гелий тех- нический
А в в
Водород 0,0001 0,0025 0,0025 0,03
Азот 0,0005 0,004 0,004 0,12
Кислород 0,0001* 0,001 0,001 0,05
Аргон — 0,001 0,001 0,002
0,0002 0,001 0,001 Не нормиру-
ется
Углеводороды 0,0001 0,003 0,003 То же
Неон 0,004 0,009 0,04 ,,
Водяные пары 0,0005 0,002 0,002 0,004
* В сумме с аргоном.
Гелий-3 согласно проекту ТУ должен
выпускаться двух сортов. Содержание три-
тия в гелии 1-го сорта — не более 2-10~8
кюри/л, 2-го сорта — не более 2 ! 0~5 кю-
ри/л; примесь азота в гелии 2-го сорта —
не более 0,05%.
Кислород газообразный технический по
ГОСТ 5583-78 получают из атмосферного
воздуха методом низкотемпературной рек-
тификации или электролизом воды. Содер-
жание водяных паров в кислороде любого
сорта — не более 0,07, а для продукта со
Знаком качества — ие более 0,05 г/м3. Со-
держание СО, СО2 и газо-окислителей в
кислороде технических сортов стандартом
не нормируется.
Технический газообразный кислород,
получаемый электролизом воды, не должен
содержать водорода более: 0,3% (1-й сорт),
0,5% (2-й сорт), 0,7% (3-й сорт).
Применение электролизного кислорода
для медицинских целей запрещается.
Кислород жидкий технический и меди-
цинский по ГОСТ 6331-78* получают из ат-
мосферного воздуха методом низкотемпера-
турной ректификации: технический — трех
сортов, медицинский — одного.
В медицинском и техническом жидком
кислороде 3-го сорта объемная доля кис-
лорода должна быть не менее 90,2%. Со-
держание диоксида углерода в техническом-
кислороде 1-го сорта — не более 2,5, а в
кислороде второго сорта и медицинском —
не более 3 мл/л (при 20 °C и 101,3 кПа)..
Криптон согласно ГОСТ 10218-77 мо-
жет содержать следующие объемные доли
примесей, %, (не более):
_ Кее- Кисло- л
Сорт криптона нон рОд Азот
Высокой чистоты . . 0,005 0,0005 0,005-
Чистый...............0,1 0,001 0,01
Сорт криптона
Дио-
кс ид
угле-
рода
Высокой чистоты . . 0,0005
Чистый.............0,001
П родолжение
Пары
Метан воды-
г/м3
0,0001 0,005-
0,001 0,001
Ксенон по ГОСТ 10219-77 может со-
держать следующие примеси, % (не более):
_ Крип- Кисло- ,
Сорт ксенона тон род Азот
Высокой чистоты . . 0,005 0,0005 0,002’
Чистый................ 0,02 0,001 0,01
П родолжение
Дио-
к с ид Пары-
Сорт ксенона угле- Метан воды,
рода в7м3
Высокой чистоты . . 0,0002 0,0001 0,005
Чистый............... 0,001 0,001 0,01
Газообразный неон особой чистоты мар-
ки А содержит примесей, %, не более: ге-
лия — 0,1, азота'— 0,01, кислорода и во-
дорода— до 0,001, паров воды —менее.
0,02 г/м3.
Газообразный неон особой чистоты
марки Б может содержать примеси, %:
гелия — до 0,1, азота, кислорода и водоро-
да— до 0,001 каждого, паров воды—ме-
нее 0,01 г/м3.
Неоно-гелиевая смесь как промежуточ-
ный продукт, подлежащий очистке, должна
содержать согласно ТУ МХП 4195-54: не-
она и гелия — в сумме не менее 20, кис-
лорода — до 1%, остальное — азот.
Хранение и транспорт газов производят
либо в газообразном состоянии (в сталь-
ных баллонах под давлением 15—20 МПа),
либо в сжиженном виде в специальных ре-
зервуарах (сосудах, цистернах).
Для хранения газа применяют также
газгольдеры.
Перевозка криопродуктов в сжиженном
виде имеет существенные преимущества по
сравнению с перевозкой газообразных, так
как объем жидкости таких веществ, как О2,.
Аг, На, Не, в 700—800 раз меньше объема
газа при атмосферном давлении. Благода-
ря этому при транспортировке в жидком
Баллоны. Газгольдеры
349
виде резко сокращаются масса тары, коли-
чество и грузоподъемность транспортных
средств, транспортные расходы. Однако при
сравнении стоимости транспортировки ве-
ществ с низкой температурой кипения
в сжиженном и газообразном состояниях
следует учитывать, что наполнение сосудов,
хранение в них и перелив в газификаторы
сопровождаются значительными потерями
жидкости, в отдельных случаях доходящи-
ми до 30—40%. При перевозке в баллонах
потери газа составляют менее 5%). Поэтому
выбор способа перевозки газа в каждом
отдельном случае должен производиться на
основе конкретных технико-экономических
расчетов.
15.2. БАЛЛОНЫ
Стальные баллоны для хранения и пере-
возки газов согласно стандартам разделя-
ются на баллоны малой вместимости — от
0,4 до 12 л, средней — от 20 до 50 л и
большой — ют 80 до 1000 л.
Баллоны малой и средней вместимости из-
готовляют по ГОСТ 949-73* из углероди-
стой и легированной стали на условные дав-
ления 10, 15 и 20 МПа (соответственно 100,
150 и 200 кгс/см2).
Баллоны большой вместимости (от 80
до 1000 л) изготовляют по ГОСТ 12247-80
на условные давления 32 и 40 МПа (320
и 400 кгс/см2).
Геометрические размеры и массы бал-
лонов малой и средней вместимостей, имею-
щих наиболее широкое распространение,
приведены в табл. 15.2. Механические свой-
ства материалов баллонов должны соот-
ветствовать следующим значениям:
Баллоны Баллоны
из углеро- из легиро-
дистой ранной
стали стали
(не менее) (не менее)
Временное сопротивление
разрыву, МПа (кгс,,мм2) 626 (65) 880 (90)
Предел текучести,
МПа (кгс/мм2) .... 372 (38) 685 (70)
Относительное удлине-
ние, °/о.............15 10
Ударная вязкость, кДж/м2 — 980
Баллоны в зависимости от заполняю-
щего газа должны быть окрашены в соот-
ветствующий цвет и иметь установленную
надпись согласно табл. 15.3.
На баллонах около горловины должны
быть четко выбиты следующие данные: то-
варный знак предприятия-изготовителя; но-
мер баллона; дата (месяц и год) изготов-
ления (испытания) и следующего освиде-
тельствования; рабочее давление р и проб-
ное гидравлическое давление 77; объем бал-
лона, л; масса баллона, кг; клеймо ОТК.
Штуцера клапанов баллонов, наполняе-
мых водородом и другими горючими газами,,
должны иметь левую резьбу, а наполняе-
мых кислородом и прочими негорючими га-
зами — правую.
Баллоны для гелия, криптона, ксенона
должны снабжаться мембранными клапана-
ми типа КВБ-53.
На баллонах вместимостью более 100 л
должны устанавливаться предохранительные
клапаны.
Баллоны, находящиеся в эксплуатации,
должны подвергаться освидетельствованию
(осмотр, проверка массы и вместимости, ги-
дравлическое испытание), как правило, каж-
дые 5 лет. Баллоны для газов, вызывающих
коррозию, подлежат освидетельствованию
не реже, чем через каждые два года.
Баллоны испытывают на прочность ги-
дравлическим давлением, равным 1,5 рабо-
чего.
Правила освидетельствования и эксплу-
атации баллонов даны в [167].
15.3. ГАЗГОЛЬДЕРЫ
Газгольдеры для хранения газов мож-
но разделить на два вида: 1) газгольдеры
постоянного объема; 2) газгольдеры пере-
менного объема.
К газгольдерам постоянного объема от-
носятся металлические резервуары всех ви-
дов (ресиверы), стационарные наземные и
подземные хранилища, транспортные бал-
лоны. Давление газа в этих газгольдерах
переменное. В зависимости от максималь-
но допустимого давления различают газ-
гольдеры низкого (примерно до 1 МПа) и
высокого (примерно до 15 МПа) давления.
Газгольдеры переменного объема, де-
лятся на «мокрые» (с колоколом, погру-
женным в жидкость, обычно воду) и «су-
хие».
Устройство газгольдеров см., например,
в [169, 593].
В лабораторных установках для сжи-
жения водорода, гелия и неона применяют
небольшие газгольдеры переменного объе-
ма с масляным затвором. Примерная кон-
струкция такого газгольдера вместимостью
2 м3 показана на рис. 15.1.
Для передвижных установок по сбору
испаряющихся ценных газов (гелия, неона
и т. д.) удобны «мягкие» газгольдеры из
специальных тканей. Чтобы не загрязнять
хранимый газ воздухом из атмосферы, ткань,
должна обладать малым коэффициентом
диффузии газа через стенку. Хорошим ма-
териалом для мягких газгольдеров служит'
пропитанная неопреном нейлоновая ткань,
характеризуемая коэффициентом диффузии
воздуха через стенку, равным примерно 3—
5-Ю ;: л/(Ч‘М2).
Таблица 15.2. Размеры, мм, и массы, кг, баллонов малой н средней вместимостей
Вмести- мость баллонов, Диа- метр цилин- дриче- ской части Толщина стенки баллонов на давление, МПа, не менее Длина корпуса баллонов на давление, МПа Масса баллонов на давление, МПа
из углеродистой с та ли из легирован- ной стали из углеродистой стали из легированной стали из углеродистой стали из легированной стали
10,0 15,0 20,0 15,0 20,0 10,0 15,0 20,0 15,0 20,0 10,0 15,0 20,0 15,0 20,0
0,4 70 1,6 2,2 2,9 1,6 1,9 165 170 175 165 165 0,6 0,8 1,0 о,6 0,7
0,7 255 269 270 255 255 0,9 1.2 1,5 0,9 0,7
1,0 89 1,9 2,8 3,6 1,9 2,5 249 259 255 249 245 1,2 1,8 2,3 1,2 1,6
1,3 295 305 315 295 390 1,5 2,2 2,8 1,5 1,9
2,0 425 449 455 425 435 2,1 3,1 4,0 2,1 2,7
2,0 108 2,4 3,4 4,4 2,4 3,0 320 339 340 320 325 2,5 3,7 4,7 2,5 3,1
з,о 445 469 480- 445 455 3,4 5,0 6,4 3,4 4,3
3,0 140 3,1 4,4 5,7 3,1 3,9 310 325 335 310 320 4,1 6,0 7,9 4,1 5,3
4,0 385 490 415 385 395 5,0 7,3 9,6 5,0 6,5
5,0 46) 475 495 469 470 5,8 8,5 И,4 5,8 7,6
6,0 535 610 555 639 575 660 535 610 559 625 6,7 7,6 9,8 Н,1 13,1 14,9 6,7 7,6 8,8 9,9
7,0
8,0 140 3,1 4,4 5,7 3,1 3,9 689 710 740 689 700 8,5 12,4 16,6 8,5 И,1
10,0 830 865 900 830 850 10,2 15,0 20,1 10,2 13,4
12,0 975 1020 1С6Э 975 1005 11,9 17,6 23,5 И,9 15,6
20,0 219 5,2 6,8 8,9 5,2 6,0 730 749 770 730 28,5 32,3 42,0 28,5
25,0 899 990 935 899 34,0 38,7 50,5 34,0
32,0 1105 1120 1165 1105 42,0 47,7 62,5 42,0
40,0 1359 1370 1430 1350 51,5 58,5 76,5 51,5
50,0 166) 1685 1755 1669 62,5 71,3 93,0 62,5
• 350 Хранение и трамспорт сжатых газов и сжиженных криопродуктов
Резервуары для хранения и перевозки жидких азота и кислорода
351’
Таблица 15.3. Цвет окраски и надписи иа баллонах со сжатыми газами
Газ Окраска баллонов Текст надписи Цвет надписи Цвет полосы
Азот Черная Азот Желчый Коричневый
Аммиак Желтая Аммиак Черный —
Аргон сырой Черная Аргон сырой Белый Белый
Аргон технический Черная Аргон технический Синий Синий
Аргон чистый Серая Аргон чистый Зеленый Зеленый
Ацетилен Белая Ацетилен Красный —
Водород Темно-зеленая Водород Красный —
Воздух Черная Сжатый воздух Белый —
Гелий Коричневая Гелий Белый —
Диоксид углерода Черная Диоксид углерода Желтый —
Закись азота Серая Закись азота Черный —
Кислород Г олубая Кислород Черный —
Кислород медицинский Г олубая Кислород медицинский Черный —
Этилен Фиолетовая Этилен Красный —
Другие горючие газы Красная Наименование газа Белый —
Другие негорючие газы Черная I То же Желтый —
Рис. 15.1. Газгольдер переменного объема
(2 м3) с масляным затвором:
/ — наружный воздух; 2 — внутренний кожух;
3 — колокол; 4 — направляющая; 5 — труба под-
вода и отвода газа
15.4. РЕЗЕРВУАРЫ ДЛЯ ХРАНЕНИЯ
И ПЕРЕВОЗКИ ЖИДКИХ АЗОТА
И КИСЛОРОДА
Криососуды. Хранение и перевозка не-
больших количеств жидких криопродуктов-.
(5—100 л) производится в криососудах
(часто их называют сосудами Дьюара), име-
ющих высоковакуумную, вакуумно-порош-
ковую или многослойную экранно-вакуум-
ную теплоизоляцию.
Наиболее распространены сосуды типа.
АСД, СДС и СДП, предназначенные для
хранения и транспортирования жидких азо-
та, аргона, кислорода и воздуха, а также-
сосуды типа ЦСД для лабораторных ра-
бот с этими криопродуктами.
Устройство сосудов схематично показа-
но на рис. 15.2 и 15.3, а их технические
характеристики приведены в табл. 15.4. Со-
суды состоят из двух шаровых или цилин-
дрических резервуаров, вставленных с за-
зором один в другой. Пространство между
резервуарами заполнено теплоизолирующим
материалом и вакуумировано.
Внутренний резервуар, в который зали-
вается криоагент, подвешен на тонкостенной!
трубе (или сильфоне) из коррозионно-стой-
кой хромоникелевой стали, имеющей не-
большой коэффициент теплопроводности.
Горловина сосуда закрывается крышкой-
с пенопластовой пробкой.
Сосуды типа АСД и ЦСД имеют ва-
куумно-порошковую теплоизоляцию, сосуды
типа СДС и СДП — многослойную экран-
но-вакуумную.
Во время эксплуатации необходимый
вакуум в изоляционном пространстве со-
судов поддерживают за счет адсорбента;
352
Хранение и транспорт сжатых газов и сжиженных криопродуктов
Рис. 15.2. Криососуды с вакуумно-порош-
ковой теплоизоляцией типов АСД (а) и
ЦСД (б)
Таблица 15.4. Технические
характеристики криососудов малой
вместимости [216]
Тип
сосуда
Г еометрические
размеры, мм
Потери
Р жидкого
g азота от
g испарения
П ромышленные
СДП-5 6 260 510 24,5 4,5 10 4,8
СДП-10 10 260 650 35,2 6,5 16 4,8
СДП-16 17,5 380 650 35,2 8,5 14 2,4
СДП-25 26,5 460 630 59,4 11,5 18 2,1
СДП-40 43 460 800 74,4 14,5 24 1,8
Сельскохозяйственные
СДС-5 6,2 250 425 63 4,5 9,5 4,3
СДС-20 21,5 450 510 63 10 10 1,4
СДС-30 33 450 630 63 23 12 1,05
СДС-50 52 450 825 63 15 14 0,8
С вакуумно-порошковой изоляцией
АСД-5 5 284 515 14 5 22
АСД-16 16 386 675 25 8,8 29
АСД-25 25 386 805 25 И,4 37
АСД-100 100 608 1157 25 65 9J
ПСД-5 5 206 520 150 6 85
ЦСД-10 10 231 640 170 8 80
ЦСД-16 16 231 865 170 10 80
ЦСД-50 50 356 1163 282 35 180
Рис. 15.3. Криососуды с многослойной
экранно-вакуумной теплоизоляцией типов
СДП (а) и СПС (б):
1 — кожух; 2 — внутренний объем; 3 — изоляция;
4 — адсорбент; 5 — крышка; 6 — сильфон горло-
вины
(силикагель, цеолит и др.) и химического
поглотителя водорода.
Материал сосудов — коррозионно-стой-
кие стали, алюминий и его сплавы.
С 1981 г. сосудам типа СДП присвоен
новый индекс — СК- Требования ГОСТ по
параметрам сосудов типа СК приведены в
табл. 15.5.
О расчете теплоизоляции сосудов см. в
[169, 170].
Цистерны и резервуары вместимостью
примерно до 100 м3 изготовляются как в
транспортном, так и в стационарном ис-
полнении; они имеют в большинстве случа-
ев вакуумно-порошковую или многослойную
экранно-вакуумную тепловую изоляцию.
Для крупных стационарных хранилищ,
имеющих в настоящее время вместимость
до 6000 м3, применяют обычно насыпную
газонаполненную изоляцию.
На рис. 15.4 показано устройство цис-
терны для жидких криопродуктов с номи-
нальным объемом 1 м3.
Внутренний сосуд диаметром 940 мм
с эллиптическими днищами изготовлен из
стали 12Х18Н9Т; кожух диаметром
1250 мм — из стали 20. Внутренний сосуд
опирается на четыре текстолитовые подуш-
ки, к которым притягивается цепями из не-
ржавеющей стали. Пространство между со-
судами и кожухом шириной 150 мм запол-
нено теплоизоляционным порошком и ва-
куумировано до остаточного давления око-
размеры криососудов по ГОСТ 16024-79
1Т а б лиц а 15.5. Характеристики и
Типораз- мер сосуда Номи- нальный объем, л Диаметр, мм (не более) Высота Н, мм (не более) Внутрен- ний диа- метр гор- ловины, мм (не менее) Масса порожне- го сосуда, кг (не более) Потери от испарения криопродукта в сосудах при 293 К и атмосферном давлении, кг/ч (не более)
по азоту ПО КИСЛО- РОДУ по аргону по воздуху
СК-6 6,3 263 510 22 4,5 0,010 0,009 0,013 0,010
ск-ю 10,0 263 650 32 6,5 0,016 0,015 0,020 0,016
СК-16 16,0 383 650 32 8,5 0,014 0,013 0,018 0,014
СК-25 25,0 460 630 56 11,5 0,018 0,017 0,023 0,018
СК-40 43,0 460 800 56 14,5 0,024 0,023 0,031 0,024
Резервуары для хранения и перевозки -жидких азота и кислорода
353
Рис, 15.4. Цистерна для криопродуктов вместимостью 1 м3:
1 — внутренний сосуд; 2 — кожух; 3 — Щит управления; 4 — клапан наполнения; 5 — теплоизоля.
ция; 6—адсорбент; 7 — клапан
Таблица 15.6. Основные параметры и размеры цистерн для криопродуктов
по ГОСТ 17518-79*
Типоразмер цистерны 1 Номинальный ; объем, м3 Наибольшая масса заливаемо- го продукта, кг Габаритные размеры, мм (не более) Потери от испа- рения при ста- ционарном хра- нении, кг/ч (не более) Масса порожней । цистерны, кг 1 (не более) Вид ИЗОЛЯЦИИ
о »=? о tc ts о X А Азот Аргон Длина Шири- на Высо- та Кисло- род : Азот Аргон
ЦТК-0,5/0,25 : 0,5 540 380 660 1250 1250 1430 0,19 0,20 0,26 250 Многослойная экранно-ваку- умная
ЦТК-1/0,25 1,0 1250 900 — 2600 1275 1430 0,63 0,62 — 970 Вак уу м ио-по рошко вая
ЦТК-1,6/0,25-1 1,6 1990 1430 2400 3580 1400 0,70 0,72 0,85 1350
ЦГК-1,6/0,25 1730 1230 2120 2750 1550 1650 0,39 0,41 0,55 850 Многослойная экранно-ваку- умная
-ЦТК-2,5/0,25 2,5 3000 2100 3600 3630 1680 1850 0,56 0,60 0,52 0,76 1850 Вакуумно-порошковая
ЦТК-3,2/0,25 3,2 3300 2320 3900 4100 1550 1650 0,49 0,64 1400 Многослойная экранно-ваку- умная
ЦТК-5/0,25 5,0 6000 4200 6000 3910 2000 gI995 1,35 1,50 2,05 2500 Вакуу мн о-по рошко зая
-ЦТК-5/0,25-1 2550
ЦТК-6,3/0,25 6,3 6800 4800 8400 4600 1930 2400 1,05 1,31 1,42 2300 Многослойная экранно-ваку- умная
!ЦТК-8/0,25 8,0 8000 5670 8000 5000 1930 2000 1,70 1,38 2,50 3200 Вакуумно-порошковая
ЦТК-Ю/0,6 10,0 10 250 7200 12 500 6200 1930 2000 1,30 1,40 1,75 3400 Многослойная экраиио-ваку- умиая
23—218
354
Хранение и транспорт сжатых газов и сжиженных криопродуктов
Таблица 15.7. Техническая характеристика резервуаров РЦг, РЦв и PC [216]
Характеристика РЦг 50/5 РЦв 63/5 РЦг 100/5 РЦг 225/5 РС 1400/4
Полная вместимость, м3 Рабочее давление, МПа 55 66,3 112 227 1437
0,5 0,5 0,5 0,55 0,4
Рабочая температура, К Количество продукта, т: 77 77 77 77 77
азота 40 48,5 81 160 1С50
кислорода Потери продукта от испа- рения (при нормальных условиях), °/о в сутки: 57 68,5 115 228 1470
азота 0,2 0,135 0,13 0,12 0,033
кислорода 0,135 0,09 0,085 0,08 0,0275
Масса резервуара, т 18 23,5 49 95 360
Примечание. РЦг—резервуар цилиндрический горизонтальный; РЦв — резервуар цилиндрический-
вертикальный; PC — резервуар сферический.
ло 50 Па. Испаряемость по кислороду со-
ставляет 1,3—1,5% в сутки. При изоляции
смесью аэрогеля с бронзовой пудрой поте-
ри от испаряемости уменьшаются примерно
до 0,75% в сутки. Рабочее давление при
хранении криопродукта — до 0,25 МПа
(2,5 кг/см2).
Аналогично устроены и транспортные
цистерны большего размера (вместимость до
10 м3).
Основные параметры и размеры цистерн
по ГОСТ 17518-79* приведены в табл. 15.6.
Для перевозки значительных количеств
жидких азота, кислорода и аргона желез-
нодорожным транспортом применяют ре-
зервуары серии РЦг и РЦв [216]. Резер-
вуары представляют собой двухстенные
аппараты цилиндрической формы, устанав-
ливаемые горизонтально или вертикально.
Внутренний сосуд изготовляется из стали
12Х18Н9Т, наружный — из стали 09Г2С.
Теплоизоляция — многослойная экранно-
вакуумная с чередующимися слоями алю-
минированной лавсановой пленки и стекло-
ткани. Остаточное давление в изоляционном
пространстве — примерно 1,3 -10-2 Па. Тех-
нические характеристики серийно изготов-
ляемых резервуаров даны в табл. 15.7.
Стационарные резервуары средних раз-
меров выполняются преимущественно ци-
линдрической формы, а больших разме-
ров — сферической. Материал внутреннего
сосуда — обычно нержавеющая сталь, на-
ружного кожуха — углеродистая сталь.
Удельные потери жидкого криопродукта
от испарения зависят от вместимости сосу-
да и вида теплоизоляции. Так, например,
потери кислорода из резервуара вместимо-
стью 3400 м3, изолированного перлитом,
находящимся под атмосферным давлением,
составляют 0,1% в сутки, а из резервуара
вместимостью 440 м3, изолированного пер-
литом, находящимся под вакуумом, —
0,03% в сутки [426].
Крупные стационарные и транспортные
резервуары зачастую оборудуются установ-
ками для обратной конденсации, которые
сжижают испаряющийся криопродукт и в
виде жидкости возвращают его в резерву-
ар. В качестве установок обратной конден-
сации могут использоваться, в частности-
криогенные газовые машины.
15.5. СОСУДЫ И ЦИСТЕРНЫ
ДЛЯ ХРАНЕНИЯ И ПЕРЕВОЗКИ
ЖИДКИХ ВОДОРОДА И ГЕЛИЯ
Долговременное хранение жидких во-
дорода и гелия — задача более сложная
по сравнению с хранением других криопро-
дуктов вследствие относительно небольших
теплот испарения (на 1 л жидкости) и низ-
ких температур кипения. Конструкции со-
судов для жидких водорода и гелия долж-
ны обеспечивать малый общий приток теп-
лоты из окружающей среды к жидкости.
Газонаполненная насыпная изоляция в дан-
ном случае непригодна вследствие конден-
сации воздуха в порах изоляции, располо-
женной вблизи внутреннего сосуда.
Для теплоизоляции сосудов с жидким
водородом и гелием применяют изоляции:
высоковакуумную с охлаждаемыми экрана-
ми, вакуумно-порошковую и многослойную
экранно-вакуумную. Подробно об изоляции
см. в разд. 7.
По конструкции сосуды для жидких
водорода и гелия можно разделить на две
основные группы: 1) с вспомогательным
охлаждением жидким азотом; 2) без азот-
ного охлаждения.
Вспомогательное азотное охлаждение
сочетается обычно с высоковакуумной или-
многослойной экранно-вакуумной изоляци-
ей.
Сосуды и цистерны для хранения и перевозки жидких водорода и гелия
355
Рис. 15.5. Конструктивная схема сосуда
для жидкого гелия вместимостью 10 л:
/ — гелиевый сосуд; 2 — азотная ванна; 3 — на-
ружный корпус; 4 — труба подвески азотной
ванны; 5 — труба подвески внутреннего (гелие-
вого) сосуда; 6 — сильфон; 7 — крышка; 8—ал-
сорбент; 9 — штуцер откачки
Рис. 15.6. Схема устройства сосудов типа
СТГ:
/ — кожух; 2 — внутренний сосуд; 3 — многослой-
ная изоляция; 4 — азотная ванна; 5 — адсор-
бент; 6—арматурная головка; 7 — кран откачки
'23*
п
В сосудах большей вместимости (цис-
тернах) в настоящее время, как правило,
используют многослойную экранно-вакуум-
ную и вакуумно-порошковую теплоизоляции,
позволяющие обходиться без дополнитель-
ного азотного охлаждения.
В лабораторной практике широко рас-
пространены гелиевые сосуды небольшой
вместимости (на 10—100 л), принципиаль-
ное устройство которых показано на рис.
15.5 [173].
Сосуд для жидкого гелия подвешен
внутри корпуса на тонкостенной трубке и
окружен азотным экраном (ванной). Азот-
ный экран значительно снижает подвод те-
плоты к жидкости вследствие излучения
стенок корпуса. Для поддержания высокого
вакуума во время эксплуатации к азотной
ванне и к гелиевому сосуду прикреплены
корзиночки с адсорбентом, например акти-
вированным углем.
Сосуд для жидкого гелия, корпус и
азотную ванну изготовляют из меди, алю-
миниевых сплавов, нержавеющей стали.
Трубы для подвески гелиевого сосуда и
азотной ванны делают из нержавеющей ста-
ли или другого материала с малой тепло-
проводностью. Для уменьшения притока те-
плоты к жидкому гелию по деталям под-
вески труба контактирует с азотной ван-
ной (точка а).
До середины 70-х годов для хранения
жидкого гелия промышленностью изготов-
лялся сосуд СД-10Г вместимостью 10 л,
размеры которого приведены на рис. 15.5.
Испаряемость по жидкому гелию в этих
сосудах составляла 70—100 см3 в сутки
(т. е. менее 1% в сутки), расход азота —
2 л/сут. Масса сосуда — 16 кг.
В настоящее время для хранения и
транспорта жидкого гелия серийно выпу-
скаются сосуды типа СТГ, схематическое
устройство которых показано на рис. 15.6,
а технические характеристики приведены в
табл. 15.8.
Сосуды типа СТГ вместимостью 10, 25,
40 л имеют вспомогательное азотное охлаж-
дение. Теплоизоляция внутреннего гелиевого
резервуара — высоковакуумная, азотного
экрана — многослойная экранно-вакуумная.
Горловина внутреннего сосуда оканчи-
вается арматурной головкой, которая име-
ет штуцеры для присоединения линий на-
лива гелия и газосброса, манометра и пре-
дохранительной мембраны.
Материал внутреннего сосуда, азотной
ванны и горловины — нержавеющая сталь
типа 12Х18Н10Т, кожуха — коррозионно-
стойкая сталь или алюминиевый сплав. Ра-
бочее давление в сосуде — до 0,07 МПа
(0,7 кгс/см2).
Сосуды можно перевозить автомобиль-
ным, железнодорожным и авиационным
транспортом. При перевозке воздушным пу-
тем к линии газосброса присоединяется ре-
гулятор, поддерживающий в сосуде задан-
356
Хранение и транспорт сжатых газов и сжиженных криопродуктов
Таблица 15:8. Технические характеристики сосудов для жидкого гелия
по ГОСТ 24046-80
Типоразмер сосуда )ЛЬН ый сосу- А 4) £ Л о о О, Щ « 5 Рабочее дав- ление, МПа Испаряемость, г/ч (% в сутки), ие более ч О S « s Габаритные раз- меры, мм, ие более порож- эсуда, более
к s S _ О\о Я X о кс 1 Объем НОЙ КЗ! л, не ь (кгс/см2), не более гелия азота 1 Срок с । лет Oil 5 я и 5* s о oj л < ч и Диа- метр Высота Масса него с< кг, не
СТГ-10 СТГ-10-1* 10 7,5 0,8 (1,5) 38 (15) 13 390 800 21 18
СТГ-25 СТГ-25-1* 25 12,0 0,07 (0,7) 1,8 (1,35) 56 (14) 6 580 1000 38 36
СТГ-40 СТГ-40-1* 40 2,0 (0,9) 24 1120 40 38
СТГ-100 100 — 7,0 (1,3) — 760 1400 85
* Наружный кожух из алюминиевого сплава.
ное давление путем сброса избыточного газа
в окружающую среду.
Сосуды вместимостью более 100 л мо-
гут не иметь дополнительного азотного ох-
лаждения. В этом случае применяют мно-
гослойную экранно-вакуумную изоляцию,
причем экраны охлаждают парами гелия.
Охлаждение экранов может осуществляться
также путем их контакта с трубой выхода
пара, как это показано на рис. 15.7, или
же посредством расположенного на экране
змеевика, по которому пропускается пар ге-
лия. По последней схеме охлаждают, в ча-
стности, экраны гелиевого транспортного
Рис. 15.7. Сосуд для жидкого гелия без
вспомогательного азотного охлаждения:
/— ваииа для гелия; 2 — кожух; 3~ экраны;
4 — многослойная изоляция; 5 — труба подвески;
6—клапан для вакуумирования изоляции
сосуда вместимостью 300 л, созданного »
Физико-техническом институте низких тем-
ператур АН УССР [763]. В сосуде приме-
нены два охлаждаемых экрана и слоисто-
вакуумная изоляция из полиэтилентерефта-
латной, пленки ПЭТФ-ДА с прокладками из
стекловуали ЭВТИ-7. Температуры экранов
в установившемся режиме равны 55 и
125 К. Внутренний резервуар изготовлен из
нержавеющей стали 12Х18Н10Т толщиной
2 мм и имеет опоры из стеклопластика. Су-
точные потери гелия от испарения — не бо-
лее 1%. Масса сосуда 280 кг с наружным
корпусом из алюминиевого сплава АМГ-5
нли 360 кг со стальным корпусом.
На рис. 15.8 и 15.9 схематично показа-
ны устройства цистерн для жидкого гели®
Рнс. 15.8. Схема цистерн ЦТГ-0,25 и'
ЦТГ-0,5:
1 — кожух; 2 — внутренний сосуд; 3 — изоляция-
4 — дополнительный экран; 5 — адсорбент; 6 —
арматурная голо в ка.
Сосуды и цистерны для хранения и перевозки жидких водорода и гелия
357
1 — кожух; 2 — внутренний сосуд; 3 — изоляция;
4 — дополнительный экран; 5—азотиая ваина;
6 — щит управления; 7 — баллоны с газообраз-
ным гелием
Рис. 15.9. Схема цистерн ЦТГ-2,5 и
ЦТГ-0,5:
промышленного изготовления, а в табл.
15.9 приведены их технические характери-
стики.
Цистерны вместимостью 250 и 500 л
в отличие от цистерн на 2,5 и 5 м3 не име-
ют дополнительного охлаждения жидким
азотом. Рабочее давление в цистернах
обычно 0,07 МПа, срок службы 8 лет.
В ряде случаев цистерны рассчитывают
на более высокое давление, чтобы во вре-
мя транспортировки в течение определенно-
го времени не сбрасывать испаряющийся
гелий в атмосферу. Например, в цистерне
ЦТГ-5,0/0,6 (табл. 15.9) при стационарном
хранении без сброса газа давление может
повышаться с 0,1 до 0,6 МПа за 27 сут.
В настоящее время все чаще строят цис-
терны и резервуары еще большей вместимо-
сти, чем приведенные в табл. 15.9. Так, фир-
мой «Линде» (США) построена автоцистер-
на для транспортировки жидкого гелия в
количестве около 40 000 л [547]. Изоля-
ция — многослойная экранно-вакуумная
толщиной 100 мм, общий теплоприток к
хранимому гелию составляет около 30 Вт.
Цистерна рассчитана на давление 0,9 МПа,
что позволяет во время транспортировки
не сбрасывать испарившийся гелий в атмо-
сферу.
Наиболее крупный стационарный ре-
зервуар для жидкого гелия вместимостью
120 тыс. л установлен на гелиевом заводе
в штате Канзас, США. Теплоизоляция —
многослойная экранно-вакуумная со вспо-
могательным азотным охлаждением. В нор-
мальном режиме из резервуара испаряется
1260 л гелия (1% в сутки) и 455 л жид-
кого азота в сутки.
В СССР разработан вертикальный гелие-
вый резервуар вместимостью 43 м3 с азот-
ным экраном н многослойной экранно-ваку-
умной теплоизоляцией. Испаряемость по ге-
лию составляет 0,45% в сутки, азота -г-
61 кг/ч.
Для крупных водородных резервуаров
наряду с вакуумно-многослойной изоляцией
широко применяется и вакуумно-порошко-
вая.
Пример устройства сосуда для жидкого
водорода вместимостью 6000 л с вакуумно-
порошковой изоляцией показан на рис. 15.10
[51]. Особенность конструкции — специ-
альные коллекторы для сокращения времени
откачки изоляции. Толщина изоляционного
слоя (перлит) составляет примерно 300 мм.
Рис. 15.10. Транспортный сосуд для жидко-
го водорода вместимостью 6000 л:
1 — вакуумно-перлитовая изоляция; 2 — линия
выпуска газов; 3 — линия для заливки и слива
жидкости; 4 — присоединение вакуумной систе-
мы; 5 — фильтр; 6 — перфорированный коллектор
для откачки изоляции
Таблица 15.9. Основные параметры цистерн для жидкого гелия (по ГОСТ 24046-80)
Тип цистерн Вмес ти- мость, м3 Вмести- мость азотной ваииы, м3 Габаритные размеры, мм Диаметр штуцера для напол- нения, мм Масса порожней цистерны, кг Испаряемость, КГ/Ч (%/сут)
И L гелия азота
ЦТГ-0,25/0,06* 0,25 1420 1135 12 315 0,016 (1,1) —
ЦТГ-0,5/0,07* 0,50 — 2000 1410 46 430 0,024 (1,3) —
ЦТГ-2,5/0,07* 2,50 0,45 2100 5000 20 3300 0,080 (0,6) 1,5 (10)
ЦТГ-5,0/0,6* 5,00 0,60 2300 6500 20 5000 0,130 (0,5) 2,0 (Ю)
Расчетное рабочее давление — в МПа.
358
Хранение и транспорт сжатых газов и сжиженных криопродуктов
Рис. 15.11. Сосуд для жидкого водорода вместимостью 840 л с аппаратурой для об-
ратной конденсации пара:
/ — корпус; 2— ванна для водорода; 3 — ванна для азота; 4 — труба для заливки и слива водорода;
5 — труба для заливки и слива азота; 6 — экран; 7— изолирующие опоры; 8—10 — теплообменники
установки обратной конденсации; 11 — приспособление для погрузки иа самолет
Потери жидкого водорода при хранении —
1,5% в сутки.
Такую же изоляцию (перлит под ваку-
умом) имеют и крупные сферические стаци-
онарные резервуары для жидкого водорода
вместимостью 340, 2000 и 3200 м3 [426].
Потери водорода от испарения в резервуа-
рах составляют соответственно 0,13, 0,10 и
0,03% в сутки.
Для долговременного хранения жидко-
го водорода без потерь крупные сосуды
дополняют установками для обратной кон-
денсации пара. На рис. 15.11 показано
устройство сосуда на 840 л жидкого водо-
рода с установкой для реконденсации, ра-
ботающей по циклу с дросселированием.
Сосуд имеет высоковакуумную изоляцию с
экраном, охлаждаемым жидким азотом.
Испаряемость 0,8% в сутки при вакууме
около 1,4-10“3 Па. Расход азота 63 л/сут.
Теплообменники и дроссельный клапан уста-
новки для обратной конденсации размеще-
ны внутри сосуда.
15.6. ХРАНЕНИЕ ЖИДКИХ
ВОДОРОДА И ГЕЛИЯ
НА БОРТУ КОСМИЧЕСКИХ КОРАБЛЕЙ
В условиях космического полета проб-
лема хранения криопродуктов в жидкой Ла-
зе значительно осложняется из-за невесомо-
сти, знакопеременных ускорений, возникаю-
щих при маневрах корабля на орбите, боль-
ших динамических нагрузок на активном
участке полета и ряда других причин.
При отсутствии гравитации граница
раздела жидкость — пар в сосуде стано-
вится неустойчивой и пар может вытеснить
жидкость в линию сброса газа, что приведет
к быстрому опорожнению сосуда. Такой же
эффект даст и появление даже небольших
ускорений, направленных вдоль линии вы-
хода паров криопродукта.
Поэтому сосуды для хранения жидких
криопродуктов на борту космических ко-
раблей должны быть снабжены специаль-
ным устройством, называемым разделителем
фаз, обеспечивающим свободный выход из
сосуда паров криопродукта и в то же вре-
мя предотвращающим попадание жидкости
в выходную линию.
Для разделения жидкой и паровой фаз
и удержания жидкой фазы в сосуде имеет-
ся несколько методов, основанных на раз-
личии физических свойств жидкости и пара
криопродукта:
1) механические, основанные на разно-
сти плотностей пара и жидкости; обычно
применяют вращающийся элемент, который
передает центробежные силы двухфазной
массе, разделяя ее таким образом и пропу-
ская на сброс только пар;
2) диэлектрофоретические, основанные
Хранение и перевозка сжиженных природного газа (СПГ) и фтора
359
на различной поляризации фаз в неодно-
родном электрическом поле; если двухфаз-
ную смесь пропускать, например, через
электростатические конденсаторы с высоким
напряжением, то жидкость будет предпо-
чтительно перемещаться к области высокой
напряженности поля;
3) методы, в основе которых лежат
силы поверхностного натяжения для уп-
равления границей раздела жидкость —
лар;
4) методы, основанные на использова-
нии теплообменно-рефрижераторных систем,
в которых сбрасываемая из резервуара
двухфазная смесь дросселируется до более
низких давления и температуры и пропу-
скается затем через теплообменник для ис-
парения жидкости, присутствующей в
смеси.
Для разделения фаз кислорода может
быть использовано также различие пара-
магнитных свойств жидкости и газа.
Обзор различных методов разделения
фаз в космических условиях см. в [427,
432].
При создании первых сосудов для хра-
нения жидкого гелия на искусственных
спутниках Земли [177, 178] был использо-
ван метод, основанный на использовании
теплообменно-рефрижераторных систем.
Схема сосуда для хранения жидкого
гелия на космическом корабле показана на
рис. 5.12. Ванна для жидкого гелия сообща-
ется с выходной линией через разделитель
фаз, представляющий собой теплообмен-
ник с дроссельным устройством на вход-
ном конце. Вследствие гидравлического
сопротивления дросселя давление внутри
сосуда (pt), а следовательно, и температура
Рис. 15.12. Схема бортового сосуда для
жидкого гелия:
1 — гелиевая ванна; 2 — линия выхода газа; 3 —
разделитель фаз; 4 — тепловая изоляция; 5—регу-
лятор давления
гелия будут несколько выше давления р2 и
температуры Т2 за дросселем разделителя
фаз. Поэтому если в разделитель поступит
двухфазная смесь, то жидкостная фаза ис-
парится в теплообменнике и в горловину
сосуда поступит только пар.
Теплоизоляция бортовых сосудов —
вакуумная многослойная с экранами, ох-
лаждаемыми парами криопродукта.
При хранении жидкого гелия в сверх-
текучем состоянии (Не-П) в качестве эф-
фективного разделителя фаз могут быть ис-
пользованы пробки из пористого материала
(металл, керамика) с очень узкими кана-
лами [433, 434, 942].
Устройство сосуда на 86 кг жидкого
Не-П с предполагаемым временем хранения
один год см. в [940].
15.7. ХРАНЕНИЕ И ПЕРЕВОЗКА
СЖИЖЕННЫХ ПРИРОДНОГО ГАЗА
(СПГ) И ФТОРА
Сжижение природного газа (основной
компонент — метан) производится, как
правило, с целью уменьшения расходов на
транспорт и хранение, поскольку потреб-
ляется он только в газообразном виде.
Непрерывное увеличение мирового по-
требления природного газа привело к зна-
чительному возрастанию числа и мощности
сжижительных установок, хранилищ и
средств его перевозки. Наряду с исполь-
зованием автомобильных и железнодорож-
ных цистерн широкое распространение по-
лучили морские перевозки СПГ в специаль-
ных океанских танкерах [435]. Ежегодно-
строятся десятки танкеров, причем за по-
следнее десятилетие среднее водоизмещение
их увеличилось примерно с 40 до 100—
160 тыс. м3. В портах отправления и при-
емки СПГ строятся терминалы с системой
крупных хранилищ, насосов и трубопрово-
дов [436]. Хранилища для СПГ строятся
как двухстенными (с теплоизоляционным
материалом .между стенками), так и одно-
стенными с изоляцией снаружи или вну-
три.
Общепринятым материалом для «холод-
ных» стенок хранилищ служат сталь с 9%
никеля, а также алюминиево-магниевые
сплавы.
Для теплоизоляции наряду со вспенен-
ным перлитом и полимерными материалами
применяют также ячеистое стекло и пено-
стекло.
Крупные танкеры оборудуют установ-
ками для повторной конденсации газа, об-
разовавшегося вследствие испарения жид-
кости во время рейса [930].
Жидкий фтор [179] используется в ка-
честве самого активного окислителя из всех
известных элементов. Поэтому обычно тре-
буются специальные предосторожности на
случай воспламенения деталей арматуры,
360
Хранение и транспорт сжатых газов и сжиженных криопродуктов
трубопроводов и т. д. Фтор — сильный яд,
и для любых операций с ним требуюдся со-
ответствующие защитные приспособления.
Сосуды, применяемые для хранения и пе-
ревозки жидкого фтора, имеют защитную
ванну с жидким азотом, предотвращающим
испарение фтора. Сосуды состоят из трех
оболочек: во внутренней находится фтор,
в средней — жидкий азот, а пространство
между наружной оболочкой и азотной ван-
ной заполиеио изоляцией (перлит или
аэрогель под вакуумом). В качестве мате-
риалов контейнеров для фтора рекоменду-
ется монел, нержавеющая сталь типа
12Х18Н10Т или алюминий. Посредством со-
ответствующей обработки на металл нано-
сится защитное покрытие в виде пленки
фтористых соединений. Автоцистерны для
жидкого фтора имеют вместимость до не-
скольких тонн, в них перевозят продукт на
тысячи километров.
Сосуд с жидким фтором всегда закрыт
и открывается только при заполнении и
сливе, поэтому во время хранения и пере-
возки в защитной ванне должен всегда быть
жидкий азот.
15.8. ТРУБОПРОВОДЫ ДЛЯ ЖИДКИХ
КРИОПРОДУКТОВ
Передача жидких криопродуктов по
трубопроводам все больше входит в крио-
генную практику. Помимо широкого ис-
пользования трубопроводов небольшой дли-
ны, которые связывают отдельные устрой-
ства с криогенными ожижителями или реф-
рижераторами, построен целый ряд круп-
ных трубопроводов для перекачки сжижен-
ного природного газа, жидкого водорода и
жидкого кислорода.
Так, в США действуют трубопроводы
0 150 мм и длиной 450 м для жидкого
кислорода, 0 150 н 400 мм при длине 450
и 150 м соответственно для жидкого водо-
рода; в Борнео построен трубопровод для
сжиженного природного газа 0 450 мм и
длиной 9 км [426].
Для передачи электроэнергии по сверх-
проводящим кабелям разрабатываются мно-
гокилометровые трубопроводы жидкого ге-
лия.
Передача жидких криопродуктов по
трубопроводам связана с возможностью
появления двухфазного потока вследствие
испарения части жидкости от притока те-
плоты из окружающей среды. Это приво-
дит к существенному уменьшению пропу-
скной способности трубопровода.
Скорость звука, характеризующая пре-
дел по скорости течения, в однофазных низ-
котемпературных жидкостях довольно вы-
сока (примерно 1000 м/с для азота, кис-
лорода и водорода и около 200 м/с для
жидкого гелия), но существенно снижается
в двухфазной смеси вследствие высокой
сжимаемости пара. Процесс осложняется
наличием массообмеиа между паром и жид-
костью и неравновесным состоянием фаз.
Поэтому следует стремиться к созданию
условий, исключающих появление двухфаз-
ного потока (повышение давления в систе-
ме, охлаждение жидкости, уменьшение при-
токов теплоты и т. д.).
Отдельную трудную задачу представ-
ляет первоначальное захолаживание крио-
трубопровода. Для уменьшения времени
охлаждения длинных трубопроводов через
определенные интервалы устанавливают
вентили для выпуска газа или специальные
газожидкостные сепараторы, что позволяет
не прогонять газ по всей линии и уско-
ряет продвижение фронта жидкости.
Жидкий воздух, кислород и азот в от-
дельных случаях (на небольшие расстоя-
ния и кратковременно) могут передаваться
по неизолированному трубопроводу.
В этом случае теплоподвод к жидкости
определяется атмосферными условиями и
образованием снеговой шубы на наружной
поверхности трубопровода.
Для теплоизоляции криотрубопрэводсв
используют пористые и волокнистые мате-
риалы с низким коэффициентом теплопро-
водности, высокий вакуум, вакуумно-порош-
козые и многослойные экранно-вакуумные
виды изоляции.
Хорошая изоляция трубопровода позво-
ляет уменьшить приток теплоты из окру-
жающей среды в десятки раз. Так, напри-
мер, для трубопровода жидкого азота диа-
метром 25 мм и длиной 6,1 м теплоприток
без изоляции равен 1470 Вт, при изоляции
пористыми блоками толщиной 100 мм —
220 Вт, при вакуумно-порошковой изоля-
ции — 38 Вт и при высоковакуумиой —
32 Вт.
Многослойная экранно-вакуумная и ва-
куумно-порошковая изоляции при исполь-
зовании соответствующих материалов и
толщин изоляционного слоя позволяют
снизить теплоприток к жидкому криопро-
дукту до значений меньших, чем при про-
стой высоковакуумной изоляции. Однако
при этом возрастают потери на охлаждение
трубопровода и увеличивается нестацио-
нарный период.
В трубопроводах с вакуумно-плотным
кожухом длина внутренней трубы умень-
шается при охлаждении, тогда как длина
кожуха изменяется мало. Для компенсации
температурных деформаций чаще всего
устанавливают сильфоны. Иногда возмож-
но применение сплавов с малым коэффици-
ентом термического расширения.
Существенное уменьшение стоимости
криотрубопровода дает нанесение теплоизо-
ляции не на наружную, а на внутреннюю
поверхность трубы [430]. При таком спо-
собе изоляции наружная металлическая
труба находится при нормальной темпера-
туре и может изготовляться из обычной
Трубопроводы для. жидких криопродуктов
361
углеродистой стали, которая в 3—8 раз де-
шевле специальных легированных, приме-
няемых при криотемпературах. Уменьшают-
ся также расходы на захолаживание тру-
бопровода и упрощается решение задачи
компенсации температурных деформаций.
Трубопроводы для жидких криопродук-
тов и криоагентов целесообразно устанав-
ливать с небольшим подъемом в сторону
движения жидкости. При этом пар меньше
мешает движению жидкости, а при закры-
тии клапана на выходном конце трубопро-
вода пар вытесняет оставшуюся жидкость
обратно в сосуд.
Если на трубопроводе устанавливается
несколько клапанов, между ними следует
предусматривать устройства для сброса
давления, чтобы исключить разрыв трубо-
провода, когда между закрытыми клапана-
ми остается жидкость.
Для перелива жидкого гелия в лабора-
торной практике широко применяются тру-
бы небольшой длины с высоковакуумной
изоляцией, в ряде случаев неправильно на-
зываемые «сифонами» (принцип сифона
здесь не используется). Простые «жесткие»
трубопроводы имеют Г-образную или П-
образную форму с фиксированным рассто-
янием между коленами. Более удобен в экс-
плуатации трубопровод с гибкой цен-
тральной частью, устройство которого по-
казано на рис. 15.13 [176].
Входной и выходной концы криотрубо-
Рис. 15.13. «Гибкий» криотрубопровод для
перелива гелия [176]:
1 — внутренняя концевая трубка; 2 — наружная
концевая трубка; 3—внутренняя гибкая труба;
4 —наружная гибкая труба; 5 — дистанционные
проставки; 6 — отражающая лента; 7 — штуцер
для откачки; 8 — адсорбент
провода, присоединяемые соответственно
к сосуду с криоагентом и к наполняемому
прибору, выполняются из прямых гладких
трубок. Центральная гибкая часть состоит
из двух вставленных друг в друга гофри-
рованных труб, припаянных концами к со-
ответствующим прямым трубкам. Материал
всех труб — нержавеющая сталь. Толщина
трубок 0,15—0,20 мм.
Внутренняя гофрированная труба име-
ет свободный проход 06 .или 8 мм, наруж-
ная — соответственно 16 и 20 мм. Чтобы
избежать касания между внутренней и на-
ружной трубками, через каждые 100—
120 мм помещены дистанционные проставки
толщиной 1,5 мм из листового фторопласта.
Пространство между наружной и внутрен-
ней трубками откачивается через штуцер до
остаточного давления 10~3—10~2 Па.
Для уменьшения потока теплоты меж-
ду трубками в результате излучения внут-
ренняя трубка покрыта несколькими слоями
ленты из тонкой нейлоновой пленки, покры-
той алюминием. Не влияя на гибкость
устройства, покрытие из ленты уменьшает
коэффициент теплового излучения поверхно-
сти, а следовательно, и потери жидкого
гелия при переливе.
Теплопритоки к гелию, пропускаемому
по трубопроводам описанного типа при диа-
метрах прохода 6—8 мм, составляют при-
мерно 1—2 Вт/м. Дальнейшее уменьшение
притока к жидкому гелию может быть до-
стигнуто введением экрана, охлаждаемого
жидким азотом или холодным газом.
На рис. 15.14 показана схема гибкого
криотрубопровода, разработанная для пе-
редачи жидкого гелия от рефрижератора
к системе сверхпроводящих магнитов [431].
Участки трубопровода имеют длину от
5 до 50 м и состоят из четырех коаксиаль-
ных гибких труб из нержавеющей стали с
Рис. 15.14. Схема «гибкого», гелиевого тру-
бопровода из четырех коаксиальных труб:
1 — гибкие трубы; 2 — дистанционные проклад-
ки; 3 — многослойная изоляция; 4 — полиэтиле-
новая оболочка
362
Хранение и транспорт сжатых газов и сжиженных криопродуктов
толщиной стенки 0,3 мм. По внутренней
трубе (0 прохода 11,3 мм) подается жид-
кий гелий (примерно до 100 л/ч), по кана-
лу между второй и третьей трубами воз-
вращается холодный газ. Два остальных
канала служат теплоизоляционными и име-
ют дистанционные прокладки, определяю-
щие взаимное расположение труб.
Теплопритоки в таком трубопроводе
длиной 50 м составляют: к жидкому ге-
лию— 50 МВт/м, к обратному потоку (га-
зу) — 2 Вт/м.
О расчете криотрубопроводов см. в
[175, 429].
15.9. НАСОСЫ ДЛЯ ЖИДКИХ
КРИОПРОДУКТОВ
Для перекачивания жидких криопро-
дуктов применяют в основном насосы двух
типов — поршневые (плунжерные) и цен-
тробежные. Поршневые насосы для жидких
кислорода и азота создают давления до
100 МПа и изготовляются как с горизон-
тальным, так и с вертикальным расположе-
нием узла цилиндров. Уплотнение поршня
обычно щелевое или с помощью пружиня-
щих колец; клапаны самодействующие.
В табл. 15.10 и 15.11 приведены техни-
ческие характеристики серийно выпускае-
мых поршневых насосов для жидкого азо-
та, кислорода и аргона. Насос типа 12НСГ
имеет вертикальное расположение цилинд-
ровой группы, используется в составе гази-
(фикационных установок и устанавливается
на горловине резервуара с криопродуктом,
цилиндрическая группа погружена в резер-
вуар. Насосы типа 22НСГ и 21НСГ —
с горизонтальным расположением цилиндро-
вой группы, применяются в составе возду-
хоразделительных и газификационных уста-
новок. Они устанавливаются у блока раз-
деления воздуха, причем цилиндровая груп-
па обычно располагается внутри кожуха
блока.
О поршневых насосах для жидкого ге-
лия см. в [933, 934].
Для перекачки жидкого гелия применя-
ются также насосы с сильфонами. Устрой-
ство и характеристики типового насоса см.
в [935]. Насос имеет подачу до 50 г/с, пе-
репад давлений до 0,1 МПа, адиабатный
КПД около 50%. Сильфоны диаметром
108 мм при ходе 25 мм выдерживают в
жидком гелии более 10s циклов.
Для перекачки больших количеств
жидких криопродуктов (десятки и сотни
кубометров в минуту) при сравнительно
небольших давлениях применяются насосы
центробежного типа. Так, подача насоса
для жидкого водорода достигает примерно
200 м3/мин; создаваемое давление — более
6 МПа [426].
Центробежные насосы обычно имеют
несколько ступеней повышения давления.
Уплотнение вращающегося вала делается в
зоне как нормальных, так и низких темпе-
ратур. Для предотвращения потерь крио-
продукта насос и ротор электродвигателя
могут помещаться в общую закрытую обо-
лочку из немагнитного металла; статор дви-
гателя находится вне оболочки.
Наряду с насосами с большими пода-
чами имеются центробежные насосы с ма-
лыми подачами криопродукта (5-
Таблица 15.10. Технические характеристики насосов для
криопродуктов [216]
Марка насоса Подача, мл/с Давление нагнета- ния, МПа Потребляе- мая мощ- ность, кВт Масса, кг Габаритные размеры, мм
12НСГ-125/20А 125+12,5 22 7,5 490 800X770X1770
22НСГ-40/40 40+4 41,2 7,5 450 1250X770X82.)
22НСГ-63/20А 63+3 22 4 410 1250X640X783
22НСГ-160/2ЭА 160+16 22 7,5 480 1340X785X820
21НСГ-25/20А-Л 25+2,5 22,5 3 290 1210X630X680
Таблица 15.11. Технические характеристики насосов, изготовляемых
ПО „Кислородмаш" с 1983 г. [953]
Марка иасоса Подача, л/ч Наибольшее давление, МПа (кгс/см2) Мощность элекро- двигателя, кВт Масса, кг Габаритные размеры, мм
2НСГ-0.025/20П 108 22,5(225) 3,6 170 886X 777X440
2НСГ-0,063 ДОП 252 22,5(225) 4,4 170 886X777X440
2НСГ-0,16/20П 612 22,5(225) , 8,0 186 936X 777X443
Газификаторы
363
Рис. 15.15. Схема насоса НСГ 0,075/0,02П:
1 — корпус насоса; 2 — рабочее колесо; 3— вал
привода колеса; 4 — штанга; 5 — электродвига-
тель; 6 — фильтр; 7 — нагнетательная труба; 3 —
пульт управления
10 л/мин), применяемые в лабораторной
практике для перекачки жидкостей из
транспортных сосудов в криостаты и при-
боры. Схема такого насоса показана на
рис. 15.15. Насос одноступенчатый, погруж-
ного типа. Корпус насоса соединяется штан-
гой с кожухом, внутри которого смонтиро-
ван электродвигатель, приводящий в дви-
жение рабочее колесо. На жидком азоте
насос имеет следующие характеристики:
объемная подача 0,27 м3/ч (4,5 л/мин);
предельное давление 0,02 МПа, потребляе-
мая мощность 35—40 Вт. Масса (при
штанге длиной 725 мм) 3,5 кг. Изготови-
тель — НПО «Гелиймаш».
Конструкции центробежных насосов для
жидких водорода и гелия даны также в
[927, 936, 939].
Перекачка жидкого гелия может произ-
водиться также посредством сверхпроводя-
щих насосных устройств [926].
15.10. ГАЗИФИКАТОРЫ
Газификаторами называют установки,
служащие для превращения сжиженных ве-
ществ в газообразное состояние. Наиболее
Рис. 15.16. Схема газификационной уста-
новки высокого давления с насосом:
1 — сосуд для жидкого кислорода; 2 — погруж-
ной насос; 3 — испаритель-подогреватель; 4 —
змеевик подъема давления в сосуде; 5 — регуля-
тор давления; 6 — предохранительный клапан
широкое распространение получили гази-
фикаторы для жидкого кислорода, сжи-
женного природного газа. Различают два
типа газификационных устройств: высокого
и низкого давления (холодные газификато-
ры).
Традиционная схема газификационной
установки высокого давления с жидкост-
ным насосом приведена на рис. 15.16. Крио-
продукт засасывается насосом, погружен-
ным в сосуд. После сжатия в насосе жид-
кость поступает в испаритель, где образу-
ющийся пар нагревается примерно до 10—
30 °C. Испаритель обычно представляет со-
бой змеевик из медной или латунной труб-
ки, погруженный в бак с водой, снабжен-
ный электронагревателями. Давление, не-
обходимое для подачи жидкости в насос,
создается испарением некоторого количест-
ва жидкости в змеевике.
Основные технические данные выпускае-
мых газификационных установок приведены
в табл. 15.12. Установки типа СГУ — ста-
ционарные, АГУ — транспортные. Установ-
ка АГУ-2М смонтирована на платформе
автомашины ЗиЛ-130, установки АГУ-8К—
на автомашинах КрАЗ-257.
Для получения газа под давлением до
2 МПа часто применяют газификационные
установки без насоса (холодные газифика-
торы). Упрощенная схема холодного гази-
фикатора жидкого кислорода показана на
рис. 15.17.
Сосуд для жидкого криопродукта име-
ет обычно вакуумно-порошковую тепло-
изоляцию. Подъем давления осуществляем-
ся путем испарения части жидкости и по-
дачи полученного газа в верхнюю часть
резервуара через регулятор давления. Ис-
паритель в промышленных установках пред-
ставляет собой блок из пластинчатых па-
нелей, теплота к которым подводится из
окружающей атмосферы. Производитель-
ность газификаторов зависит от количества
блоков испарителей.
Технические характеристики од^чествеи-
364
Хранение и транспорт сжатых газов и сжиженных криопродуктов
Таблица 15,12. Технические характеристики газификациэнных
установок [216]
Марки установок Производи- тельность по кислороду, м3/ч Наибольшее давление га- за,- МПа Количес тво заливаемого, кислорода, кг Ус тановлен- ная мощ- ность, кВт Габариты установки м '
СГУ-7К 260 42 1990 55 2,9X3,5X2,1
СГУ-8000-500/200 425 22 8000 98 2,9Х7,0Х2,1
СГУ-8000-250-200 210 22 8000 49 4,4X6,8X2,1
АГУ-2М 425 22 1990 100 6,7X2,5X3,6
АГУ-8К 425 22 6000 1000 9,8X2,6X3,8
ных холодных газификаторов даны в
табл. 15.13.
В авиации для обеспечения летчика
кислородом для дыхания выгоднее приме-
нять газификаторы жидкого кислорода, чем
баллоны со сжатым газом. Самолетные га-
зификаторы имеют вместимость от 2,5 до
30 л и рабочее давление 0,5—0,8 МПа.
Время повышения давления до рабочего
значения составляет примерно 10 мин, рас-
ход кислорода 50—100 л/мин. Самолетные
газификаторы имеют многослойную экран-
но-вакуумную или вакуумно-порошковую
теплоизоляцию; потери криопродукта вслед-
ствие теплопритоков примерно такие же,
как в сосудах Дьюара (той же вместимо-
сти).
Рис. 15,17. Схема холодного газификатора:
1 — сосуд с криопродуктом; 2 — испаритель-подо-
греватель; 3 — клапан подъема давления; 4 —
клапан подачи жидкости на газификацию; ’ 5 —
клапан сброса пара
Таблица 15.13.
Технические характеристики газификаторов [216]
Показатель ГХК 3/16-200 ГХК 8/16-500 ГХК 8/16-1000 ГХК 8/16-2000
Гидравлическая вместимость резервуара, 3 8 8 8
м Производительность по газообразному 0—250 0—550 0—1100 0—2200
кислороду, м3/ч 0,1—1,6 0,1—1,6 0,1 —1,6 0,1 —1,6
Рабочее давление газа на выходе из ис-
парителя, МПа Количество газа" выдаваемого за одну
заправку резервуара, м3: 5770 5770 5770
кислорода 2330
азота 1870 4650 4650 4650
аргона 2270 5630 5630 . 5630
Потери продукта в резервуаре при хра-
нении с открытым газосбросом, сутки (не более): кислорода % в 0,39 0,26 0,26 0,26
азота 0,62 0,43 0,43 0,43
аргона 0,41 0,28 0,28 0,28
Количество блоков испарителей 1 2 4 8
Габаритные размеры: высота, мм 3270 6160 6160 6160
занимаемая плошадь, м2 13,6 21,3 41,3 78,3
Масса порожнего резервуара, кг 3300 6000 6000 6000
Криостаты для физических исследований
365
Раздел шестнадцатый
КРИОСИСТЕМЫ
ДЛЯ ФИЗИЧЕСКИХ ИССЛЕДОВАНИИ
16.1. КРИОСТАТЫ для ФИЗИЧЕСКИХ
ИССЛЕДОВАНИЙ
Основные положения. Криостатом на-
зывают прибор для (проведения низкотемпе-
ратурных физических исследований или тер-
мостатирования объектов при криотемпе-
ратурах. Источником холода обычно слу-
жат заливаемые в криостат криопродук-
ты — жидкие гелий, водород, азот и т. п.,
.а в некоторых случаях и твердые крио-
агенты.
Изменяя давление паров над залитой
в криостат жидкостью, можно изменять ее
температуру от критической до тройной
точки. Практически удобно иметь давление
над жидкостью примерно равным атмо-
сферному и ниже (путем откачки ее па-
ров), что позволяет получать и сравнитель-
но просто поддерживать температуры в
следующих интервалах:
Интервал температур, К Криопродукт
‘90—55 ........................Кислород
78—63 .......................... Азот
27—24,5 ........................ Неон
.20,4—14 ...................... Водород
4,2— 1,0...................... Гелии-4
1—0,3.......................... Гелий-3
Криотемпературы между указанными
интервалами, а также выше 90 К получа-
ют путем подогрева холодного газа соот-
ветствующего криопродукта или с по-
мощью хладопровода с нагревателем.
Температуры ниже тройной точки мо-
гут быть получены сублимацией криопро-
дукта, т. е. непосредственным переходом
его из твердого состояния в парообразное.
Сублимационные системы охлаждения
'перспективны в первую очередь для косми-
ческих исследований. В качестве рабочих
веществ в сублимационных криостатах мо-
гут использоваться твердые водород, неон,
азот, аргон, метан, оксид углерода, этилен,
а для получения температур выше 120 К—
твердые диоксид углерода и аммиак.
Температуры, получаемые при субли-
мации твердых криопродуктов (считая от
тройной точки до температуры, соответст-
вующей давлению паров над кристаллом
примерно 20—100 Па), лежат в нижеследу-
ющих диапазонах: для водорода — от 14
до 8 К", неона — от 25 до 14 К; азота — от
ФЗ до 42 К; аргона — от 84 до 48 К; ме-
тана— от 91 до 60 К; аммиака — от 195
до 148 К; диоксида углерода — от 216
.до 125 К.
В настоящее время создано большое
количество разнообразных по устройству
криостатов, поэтому привести сколько-ни
будь полное их описание не представляет-
ся возможным. Ниже рассмотрены основ-
ные принципы устройства только гелиевых
криостатов, наиболее часто применяемых
в лабораторной практике.
При разработке криостата любого ви-
да первейшая задача — защита его рабо-
чего объема от теплопритоков из окружа-
ющей среды. Чем ниже температура кипе-
ния и теплота испарения рабочего крио-
агента, тем труднее эта задача.
Для криостатов, заливаемых жидким
азотом или кислородом, хорошие резуль-
таты дает высоковакуумная теплоизоляция,
подобная применяемой в широко извест-
ных сосудах Дьюара и бытовых тер-
мосах.
Для гелиевых криостатов обычная вы-
ооковакуумная теплоизоляция не дает
удовлетворительных результатов, так как
тепловое излучение наружных стенок ос-
тается значительным по сравнению с ма-
лой удельной теплотой испарения жидкого
гелия.
Уменьшение теплопритока от излучения
при конкретной степени черноты поверхно-
сти возможно следующими методами:
1) понижением температуры излуча-
ющих стеиок (охлаждением их вспомога-
тельным криоагентом или испаряющимся
криопродуктом);
2) установкой защитных экранов (ох-
лаждаемых или иеохлаждаемых);
3) применением многослойной экранно-
вакуумной теплоизоляции.
На рис. 16.1 приведены примерные зна-
чения испаряемости жидкого гелия из
стеклянных посеребренных сосудов Дьюара
для трех случаев; а — наружная стенка и
крышка имеют нормальную температуру
Рис. 16.1. Скорости испарения, см3/ч, жид-
кого гелия из стеклянных сосудов Дьюара
. [400]:
а — 2500; 6 — 60; в — 45
366
Криосистемы для физических исследований
(~300 К); б — наружная стенка охлаж-
дается жидким азотом; в — наружная
стенка охлаждается жидким азотом, а из-
лучение крышки экранируется пробкой из
пенопласта толщиной 5 см, подвешенной на
расстоянии 12 см от верхнего края со-
суда.
Кроме излучения подвод теплоты из
окружающей среды может вызываться сле-
дующими причинами: теплопроводностью
газа, остающегося в вакуумном изоляцион-
ном пространстве (или теплопроводностью
материала, заполняющего это пространст-
во) ; теплопроводностью трубок, опор, элек-
трических проводов и других соединений
между деталями криостата с различной ра-
бочей температурой.
Подвод теплоты к жидкости может
быть обусловлен также джоулевой тепло-
той или теплотой, выделяемой вследствие
появления токов Фуко; механическими ко-
лебаниями, если они возникают в самом
криостате или передаются ему извне.
Основным методом уменьшения потерь
жидкого гелия от различных тепловых мо-
стов служит охлаждение их жидким азо-
том и испаряющимся гелием.
Существенное уменьшение испаряемо-
сти жидкого гелия от теплопритоков из ок-
ружающей среды может быть получено
применением криогенных газовых машин
для охлаждения экранов, опор, токовводов
и т. п. (см. § 12.7). Так. например, ис-
пользование двухступенчатой криогенной
машины, работающей по обратному циклу
Стирлинга и вырабатывающей холод на
температурных уровнях 77 и 20 К, позво-
лило уменьшить испарение жидкого ге-
лия из цилиндрического криостата с 0,15
до 0,006 л/ч [929].
Стеклянные криостаты. Стеклянные
криостаты широко применяются в лабора-
торных условиях вследствие их сравни-
тельно простого изготовления и возможно-
сти визуального наблюдения за ходом
опыта.
Схема обычного гелиевого криостата
показана на рис. 16.2. Криостат состоит из
двух сосудов Дьюара, вставленных один
в другой. Во внутренний сосуд заливает-
ся жидкий гелий, в наружный — жидкий
азот. Поверхности обоих сосудов посереб-
рены за исключением двух вертикальных
полос шириной 10—15 мм по всей длине
сосудов, что позволяет вести непосредст-
венные наблюдения. Гелиевый сосуд за-
крыт крышкой (называемой иногда кап-
кой), уплотненной на сосуде с помощью
резиновой манжеты. Капка имеет соответ-
ствующие штуцера для залива гелия, от-
вода пара, крепления исследуемого объек-
та, вывода проводов и т. д.
Для проведения опытов в магнитном
поле нижняя часть обоих сосудов сужена,
чтобы расстояние между полюсами магнита
было наименьшим. Сверхпроводящие со-
Рис. 16.2. Стеклянный гелиевый криостат:
1 — внутренний (гелиевый) сосуд Дьюара; 2 —
наружный (азотный) сосуд Дьюара; 3 — метал-
лическая крышка (капка); 4 — резиновая ман-
жета; 5 — штуцер для залива гелия; 6 — штуцер-
для контрольно-измерительных приборов; 7 —
охлаждаемый узел
леноиды погружены прямо в гелиевый со-
суд, и надобность в сужении отпадает.
Недостатки стеклянных гелиевых крио-
статов — их малая механическая прочность
и необходимость довольно частого повтор-
ного вакуумирования теплоизоляционного
пространства. Последнее связано с диффу-
зией газообразного гелия через стекло;
Особенно проницаемы для гелия бороси-
ликатные и молибденовые стекла, хотя они
и более прочные. Поэтому в Советском Со-
юзе для гелиевых сосудов Дьюара чаще
всего применяют химическое стекло мар-
ки 29, а за границей — специальное стекло
типа «Монаке» или «Кимбелл».
По соображениям стандартизации ре-
комендуется выбирать размеры стеклянных
заготовок из следующего ряда диаметров:
65, 80, 95, 110, 125, 140 мм.
Металлические гелиевые криостаты. Со-
временные гелиевые криостаты для физи-
ческих исследований можно разделить на
две группы: криостаты с вспомогательным
охлаждением жидким азотом и криостаты
без азотного охлаждения.
Примеры устройства криостатов пер-
вой группы приведены на рис. 16.3—16.5.
На рис. 16.3 показан криостат, разработан-
ный в Физическом институте им. П. Н. Ле-
бедева АН СССР для исследований в маг-
нитном поле, а также для криостатирова-
ния мазеров [168].
Внутри цилиндрического корпуса по-
мещается гелиевая ванна, окруженная мед-
Криостаты для физических исследований
367
Рис. 16.3. Криостат для радиотехнических
исследований в магнитном поле:
1— корпус; 2—азотная ванна; 3 — гелиевая
ванна; 4 — экран; 5 —труба подвески гелиевой
ваннЫ; 6 — сильфон; 7 — подвеска ванны жидко-
го азота; 8 — крышка криостата; 9— штуцер
для вакуумирования; 10 — адсорбент
Рис. 16.4. Унифицированный криостат с на-
бором взаимозаменяемых рабочих камер:
а—вариант криостата для гальвано-магнитных
исследований; б — вариант криостата для маг-
нитно-оптических исследований; 1 — корпус; 2 —
азотная ванна; 3 — гелиевая ванна; 4 — экран;
5 — разъемное соединение для смены рабочих
камер
Объем ге-
лиевой
ванны, л
2,5—3,5
4—6
Диаметр
централь-
ной трубы,
мм
36—42
48—60
Испаряемость Расход жид-
жидкого ге- кого гелия,
лия, см3/ч л/ч
60—90
83—140
0,1—0,2
0,2—0,4
ным экраном, .который охлаждается жнд-
ким азотом, залитым в ванну. Гелиевая и
азотная ванны подвешены к корпусу на
тонкостенных трубах из малотеплопровод-
ного материала (нержавеющая сталь, ней-
зильбер и т. д.). Внутренний диаметр тру-
бы выбирается таким, чтобы через него
свободно проходил охлаждаемый объект.
Для уменьшения подвода теплоты к ге-
лиевой ванне вследствие теплопроводности
труба в верхней части имеет термический
контакт с азотной ванной. Пространство
между гелиевой ванной и наружным ко-
жухом откачивается через клапан до вы-
сокого вакуума, который затем поддержи-
вается в процессе эксплуатации с. по-
мощью адсорбента.
Гелиевая и азотная ванны и корпус
криостата изготовляют из меди, нержавею-
щей стали или алюминиевых сплавов. Их
поверхности со стороны вакуумного про-
странства полируют для уменьшения лучи-
стого теплопереноса.
Криостаты такого типа имеют пример-
но следующие характеристики по испа-
ряемости:
На таких же принципах основана кон-
струкция унифицированного криостата Фи-
зико-технического института низких темпе-
ратур АН УССР, показанная на рис. 16.4.
Корпус выполнен разъемным с фланцевым
соединением, поэтому к нижней части
криостата могут присоединяться сменные
рабочие камеры (две из них показаны на
рисунке) для различного вида исследова-
ний — гальвано-Магнитных, оптических,
электрических и т. д.
Объем основной гелиевой ванны 1500,
азотной —700 см3, масса криостата 7 кг.
Время полного испарения жидкого гелия
составляет 12—24 ч в зависимости от ви-
да присоединенного рабочего узла.
На рис. 16.5 показано устройство ге-
лиевых криостатов единой серии КГ, вы-
пускаемых СКТБ Донецкого физико-техни-
ческого института АН УССР. Криостаты
цельнометаллические, сварные, из немаг-
нитных материалов. Гелиевая и азотная
ванны, а также экраны выполнены из ме-
ди, наружный' кожух —из сплава АМц,
фланцы и горловина—из стали 12Х18Н10Т.
Для уменьшения расхода жидкого азота
368
Криосистемы для физических исследований
Рис. 16.5. Гелиевый криостат серии КГ:
/ — корпус; 2 — азотная ванна; 3 — горловина;
4 — гелиевая ванна; 5 — основной экран; 6— мно-
гослойная теплоизоляция; 7 — дополнительный
экран; 8—адсорбент для поддержания вакуума
наружные поверхности азотной ванны и
экрана покрыты многослойной теплоизоля-
цией из чередующихся слоев пленки
ПЭТФ-Да и стекловуали ЭВТИ-7. Помимо
Таблица 16.1. Основные
характеристики криостатов серии КГ [769]
Парам ет ры Криостаты
КГ-55М кг-юом КГ-150М woes-J 01
Диаметр горлови- 55 100 150 200
ны, мм Вместимость, л: гелиевой ванны 4,5 9,0 20,0 28,0
азотиой ванны 6,0 9,0 18,0 19,0
Испарение гелия, 2,4 5,4 6,4 12,5
г/ч Габариты мм: высота 1076 1260 1445 1540
диаметр по флан- 320 345 405 440
цам Масса, кг 29 36 57 65
азотного экрана имеется дополнительный,,
укрепленный на центральной горловине, что
уменьшает излучение, падающее на гелие-
вую ванну криостата. Основные параметры;
криостатов приведены в табл. 16.1.
Применение вспомогательного азотного-
охлаждения усложняет конструкцию крио-
стата, а в ряде случаев затрудняет обес-
печение и проведение исследований. При-
менение жидкого азота в гелиевых крио-
статах можно исключить, если для охлаж-
дения экранов, уменьшающих поток
теплоты вследствие излучения наружных,
стенок, использовать холод испаряющегося
гелия [760]. Так как энтальпия газообраз-
ного гелия примерно в 70 раз выше теп-
лоты его испарения (см. Т, ./-диаграмму
для гелия), то даже при небольшой испа-
ряемости количества холода, которое не-
сут пары гелия, вполне достаточно для;
компенсации теплопритока от излучения.
Простейшая конструкция гелиевого-
криостата без азотного охлаждения пока-
зана на рис. 16.6. Гелиевая ванна подве-
шивается к кожуху на тонкостенной трубе,,
через которую в криостат помещается ох-
лаждаемый объект, заливается жидкий ге-
лий и отводится испаряющийся гелий.
В вакуумном пространстве между ванной;
и кожухом помещают экраны 4 и 5, име-
ющие хороший тепловой контакт с трубой.
Таким образом, холод паров гелия через
трубу передается экранам. Число экранов-
и местоположение их контактов с трубой
должны быть выбраны так, чтобы обеспе-
Рис. 16.6. Гелиевый криостат без- азотного
охлаждения:
/ — корпус; 2— гелиевая ванна; 3 — горловинам
4 — основной экран; 5 — дополнительный экран;,
6 — штуцер для вакуумирования
Криостаты для физических исследований
369*
Рис. 16.7. Схема криостата с регулирова-
нием температуры по методу Свенсона
[446]:
1 — ванна с жидким гелием; 2 — теплообменник;
3 — рабочая камера; 4— азотная ванна; 5 — на-
греватель; 6 — клапан для регулирования потока
газа
Рис. 16.8. Криостат для исследований в
широком интервале температур:
/ — азотная ванна; 2 — основная гелиевая ван-
на; 3 — клапан; 4 — дополнительная камера с
гелием; 5 — теплоизолирующая камера; 6 — хла-
допровод для исследуемых объектов; 7 —нагре-
ватель; 8— сверхпроводящий соленоид
чить охлаждение основного экрана при-
мерно до 70—90 К- Чем больше число
экранов, тем легче выполнить это требова-
ние, однако, как показывает практика,
двух экранов достаточно для получения
вполне удовлетворительных результатов.
24—218
Для работы в магнитном поле нижняя
часть криостата сделана суженной и имеет
только одни экран, что позволяет свести
до минимума зазор между внутренней («ге-
лиевой») и наружной («теплой»^ стенками.
По испаряемости жидкого гелия такие-
криостаты имеют показатели не хуже, чем
аналогичные по размерам криостаты с до-
полнительным азотным охлаждением.
О криостатах для работы с 3Не см.
§ 12.6.
Криостаты с регулируемой рабочей тем-
пературой. В тех случаях, когда требуется
проводить исследования в широком интер-
вале температур или нежелательно разме-
щение исследуемого объекта в жидкости,,
охлаждение образцов в криостатах произ-
водят посредством:
1) подогретого до соответствующей
температуры газа, получаемого от испаре-
ния жидкого криоагента;
2) хладопровода, имеющего постоян-
ный или периодический тепловой контакт
с жидким криоагентом;
3) «теплообменного» газа, отводящего
теплоту от образца к ванне с крио-
агентом.
В современных криостатах поддержа-
ние заданной температуры образца про-
изводится обычно автоматически.
Одна из распространенных схем крио-
стата с регулированием температуры ис-
следуемых объектов путем обдува их по-
догретым газом (методом Свенсона) пока-
зана на рис. 16.7 [446]. Жидкий гелий из-
ваяны криостата поступает в теплообмен-
ник, где испаряется, и после подогрева до-
необходимой температуры подается в ра-
бочую камеру с исследуемым образцом.
Регулировка температуры осуществляется
клапаном и нагревателем, установленным'
на наружной поверхности теплообменника.
Температуру выше 80 К получают, запол-
няя ванну вместо гелия жидким азотом.
Для охлаждения сравнительно неболь-
ших по размеру образцов криостаты по ука-
занной схеме могут выполняться в виде-
малогабаритных вставок, присоединяемых
непосредственно к стандартным транспорт-
ным . гелиевым сосудам типа СТГ (см..
§ 15.5).
На рис. 16.8 показана другая схема-
криостата для охлаждения исследуемых
объектов в интервале температур от 1 до
300 К- Основным отличием от обычных ге-
лиевых криостатов служит дополнительная-
камера с хладопроводом — трубой 6. Ка-
мера имеет собственную высоковакуумную-
теплоизоляцию и заполняется жидким ге-
лием из основной ванны через клапан. От-
качкой паров криоагента температуру в-
камере можно понизить по отношению к-
температуре основной ванны криостата. Ис-
следуемые образцы крепятся к трубе 6, а-
требуемая температура устанавливается с-
помощью электронагревателя, установлен-
ного иа хладопроводе. Контакт образца с-
-370
Криосистемы для физических исследований
хладопроводом может быть периодическим,
например путем установки управляемого
теплового, ключа.
Важное преимущество криостата, по-
казанного на рис. 16.8,—возможность уста-
новки в основной гелиевой ванне сверх-
проводящего соленоида, что существенно
расширяет области применения изделия.
Примеры устройства криостатов с регули-
рованием рабочей температуры см. в
[400, 931, 944].
Криостаты для оптических и спектраль-
ных исследований. Характерной особенно-
Рис. 16.9 Криостат для оптических иссле-
дований:
1 — азотная ванна; 2 — гелиевая ванна; 3 — хла-
допровод; 4 — нагреватель; 5 — низкотемператур-
ная камера с оптическими окнами; 6 — наруж-
ные оптические окна; 7—азотный экран; 8 —
поворотное устройство
стью таких криостатов, служат оптические
окна на наружном кожухе, а иногда и на
низкотемпературной рабочей ванне, при
гелиевых температурах.
Конструктивная схема универсального
оптического криостата показана на
рис. 16.9. Исследуемые образцы крепят к
хладопроводу, снабженному нагревателем
для изменения температуры. Вспомогатель-
ная камера служит для поддержания тем-
ператур ниже 10 К- Камера термически
контактирует с гелиевой ванной; внутрь
ее при наличии герметичных окон может
подаваться теплообменный газ или жидкий
криоагент. При температурах исследований
выше 10 К вспомогательной герметичной
камеры с низкотемпературными окнами
обычно не требуется и конструкция крио-
стата упрощается. Поворотной устройство
позволяет изменять положение образца по
отношению к наружным оптическим окнам.
В некоторых конструкциях образец можно
удалить из освещаемой зоны путем его
подъема, а хладопровод снабдить тепло-
вым ключом [191].
Для оптических исследований широко
используют также криостаты тех типов, ко-
торые были описаны выше, после установки
на них оптических окон из соответствую-
щих материалов. В зависимости от необ-
ходимой области прозрачности оптические
окна в криостатах делают нз кварца, стек-
ла, бериллия, сапфира, различных солей,
полимерных пленок и т. д. Области про-
зрачности ряда вещества приведены в
табл. 16.2.
Соединение оптических окон с метал-
лической камерой для работы при гелиевых
температурах — одна из трудных задач
при изготовлении оптических криостатов:
оно должно быть вакуумно-плотным и долж-
но обеспечивать компенсацию возникаю-
щих температурных деформаций. Герме-
Таблица 16.2. Области прозрачности некоторых веществ [58]
Вещество Толщина, мм Граница, нм
Короткие волны | Длинные волны
Бромистый калий КВг 10 210 28 000
Германий 2 223 —
Диоксид титана (рутил) 6 420 6000
Кварц кристаллический 5—10 185—200 3600
Кварц плавленый 10 194 —
Оконное стекло 3 330
Полиметилметакрилат 2—5 320—338 —
Стекло оптическое БК-Ю 10 330 2600
То же ТФ-1 10 360 2700
Слюда 0,01 280
Тефлон 0,006 168 —.
Флюорит CaF2 10 157—170 —
Фтористый литий L1F 5 107 —
Хлористый калий КС! 10 200 21 000
Хлористый натрий NaCl 10 20J 17 000
Криостаты для физических исследований
371
тичность соединения обычно достигается
с помощью эпоксидных смол типа ПР или
клея аральдит, а также использованием
кольцевых прокладок из индия и других
мягких металлов или из неметаллических
материалов, например резиновой пленки.
Может быть применен и такой метод: торец
стеклянного диска, служащего окном, ме-
таллизируется электролитическим способом,
после чего диск впаивается на мягком при-
пое в тонкостенный медный цилиндр.
На рис. 16.10 показаны примеры крепле-
ния стеклянных окон к металлическим стен-
кам, работающим при низких температу-
рах. Примеры устройства оптических крио-
статов см. также в [400, 767, 768].
Криостаты для сверхпроводящих соле-
ноидов. Для сверхпроводящих соленоидов
Рис. 16.10. Способы крепления оптических
низкотемпературных окон:
а—на аральдите с медной конусной обоймой;
б — на эпоксидной смоле ПР с фигурной мель-
хиоровой обоймой; в — на индиевой прокладке;
/ — клей аральдит; 2 — сплав Вуда; 3 —медная
фольга толщиной 0,075 мм; 4 — припой ПОС-50;
5 — эпоксидная смола ПР; 6 — индиевая про-
кладка из проволоки 0 0,3—0,8 мм
наиболее удобны гелиевые криостаты ци-
линдрической формы с большим диаметром
выходной горловины для свободного мон-
тажа и демонтажа узлов магнитов. Весь-
ма часто также требуется, чтобы рабочий
объем магнитного поля соленоида находил-
ся при нормальной температуре.
На рис. 16.11 приведены схемы не-
скольких видов цилиндрических гелиевых
криостатов для сверхпроводящих соленои-
дов. Расход жидкого гелия в криостатах
такого типа зависит в основном от трех
факторов: теплопритока вследствие тепло-
проводности стенок выходной горловины,
излучения крышки криостата и теплопри-
токов через электрические вводы в соле-
ноид. Теплоприток по стенкам можно ча-
стично компенсировать за счет холода ис-
паряющегося гелия, для чего желательно^
направлять большую его часть вдоль стен-
ки, а не по всему сечению горловины.
Излучение крышки также можно умень-
шить, устанавливая в выходной горловине
экраны, охлаждаемые газом или жидким
азотом.
Приток теплоты по токовводам обус-
ловливает существенную часть в общей ис-
паряемости жидкого гелия из криостата.
Для .его уменьшения токовводы должны
выполняться из соответствующих материа-
лов (в зависимости от условий работы),
иметь оптимальные размеры и охлаждать-
ся испаряющимся гелием. В ряде случаев,
они должны отстыковываться от соленоида
после его запитки током. О выборе токо-
вводов см. в [153].
В качестве примера устройства крио-
стата со сверхпроводящим соленоидом на
рис. 16.12 приведена конструктивная схе-
ма установки УКС-2 Института атомной
энергии им. И. В. Курчатова. Установка
предназначена для проведения широкого
круга физических экспериментов в гори-
зонтальном магнитном поле и имеет следу-
ющие технические характеристики:
Рис. 16.11. Основные виды цилиндрических криостатов для сверхпроводя-
щих соленоидов:
а — стандартный тип; б и в — с вертикальным рабочим отверстием, находящимся при
нормальной 'температуре; г —с горизонтальным рабочим отверстием, находящимся;
при нормальной температуре
21*
.372
Криосистемы, для физических исследований
Рис. 16.12. Схема криостата со сверхпрово-
дящим соленоидом:
1 — корпус криостата; 2 — сверхпроводящий со-
леноид; 3— гелиевая ванна; 4 — труба подвески
•соленоида; 5—азотная ванна; 6 — съемный то-
•коввод; 7 — коллектор сбора испаряющегося ге-
лия
Индукция в центре соленоида 10 Тл
Размер рабочей зоны в плане 25X40 мм2
Наружный диаметр соленоида 200 мм
Внутренний диаметр соленоида 55 мм
Рабочий ток.................... 130 А
Объем гелиевой ванны .... 50 л
Потери гелия от испарения (с
отстыкованными токовводами) 100 нл/ч
Цилиндрические гелиевые криостаты по
схеме рис. 16.11,а серийно изготовляются
НПО «Гелиймаш» (Москва) и имеют .сле-
дующие данные [216]:
Марка криостата
Потери от
испаре- :
НИЯ*, г/ч'
КГ-15/150-1
КГ-60/300-1
*Без соленоида.
О криостатах для крупных сверхпро-
водящих систем — см. [174, 928, 932, 937,
943].
Криостаты для исследований механиче-
ских свойств материалов. Исследование ме-
ханических свойств материалов при низких
температурах производят как на специаль-
ных машинах с встроенными криогенными
системами, так и на обычных машинах с
применением съемных криостатов. Допол-
нительным требованием к таким криоста-
там служит возможность передачи меха-
нических усилий испытуемому образцу.
Простейшая схема криостата, приме-
няемого для испытаний материалов на
универсальной разрывной машине, показа-
на на рис. 16.13 [765]. Испытуемый обра-
зец закрепляется между двумя тягами, ко-
торые в свою очередь присоединяются к за-
хватам машины. Верхняя тяга может сво-
бодно перемещаться через соответствую-
щий сальник; нижняя жестко связана с
корпусом криостата.
Теплоизоляция сосуда с криоагентом —
высоковакуумная с экраном, охлаждаемым
парами криоагента. Для уменьшения под-
вода теплоты к образцу силовые тяги де-
лаются полыми из высокопрочного мате-
риала с малой теплопроводностью (на-
пример, из нержавеющей стали) и в ряде
случаев охлаждаются парами криоагента.
Рабочий криоагент — жидкие азот или во-
дород.
В других схемах криостатов силовые
тяги выводят через верхнюю крышку [449,
766], а сосуд с криоагентом подсоединяют
снизу. Отсутствие жесткой связи нагрузоч-
ных тяг с корпусом криостата облегчает
Рис. 16.13. Схема криостата для испыта-
ний на растяжение при низких температу-
рах:
1 — корпус; 2 — ванна с криоагентом; 3— экран;
4 — образец; 5 — теплоизоляционное пространст-
во; 6 — нижняя тяга; 7 — верхняя тяга
Криостаты для физических исследований
373
монтаж всего устройства и смену об-
разцов.
Описание различных видов криостатов
для низкотемпературных исследований пла-
стичности и прочности материалов см.
в [172].
Криостаты для физических исследова-
ний в космосе. Использование криостатов
в исследованиях, недоступных для прове-
дения в наземных условиях. Условия кос-
мического полета (невесомость, перемен-
ные ускорения, большие динамические на-
грузки и т. д.) не позволяют применять
обычные конструкции криостатов, описан-
ные выше. Криостаты, предназначенные для
работы на борту космических кораблей,
имеют специфические особенности, к кото-
рым относятся:
1) введение устройства, препятствую-
щего выбросу жидкого криоагента из ра-
бочего объема в выходную горловину
криостата в условиях невесомости и зна-
копеременных ускорений. Такие устройства
называются разделителями фаз, и принци-
пы их действия изложены в § 15.6;
2) выполнение конструкции выходной
горловины такой, чтобы устранить (или
•свести к минимуму) теплоподвод к жидко-
му криоагенту вследствие конвекции паров,
появляющейся в реальных условиях по-
лета;
Рис. 16.14. Бортовой гелиевый криостат
типа «Обзор»:
1— гелиевая ванна; 2 —корпус; 3— двухстенная
горловина; 4 — разделитель фаз; 5 — пробка за-
ливного отверстия; 6 — клапан откачки изоля-
ции; 7— экраны; 8 — многослойная теплоизоля-
ция; 9 — термометры; 10— регулятор давления
3) установка регулятора, автоматиче-
ски поддерживающего давление над жид-
ким криоагентом, со сбросом испаряюще-
гося криоагента за борт в космическое про-
странство;
4) достаточная прочность, чтобы вы-
держивать все перегрузки и вибрации ак-
тивного участка полета;
5) повышенная надежность работы при
ограниченных массе и размерах.
На рис. 16.14 показано устройство ге-
лиевого криостата Физического института
им. П. Н. Лебедева АН СССР, предна-
значенного для охлаждения приемников
излучения на борту искусственных спутни-
ков Земли [178, 402].
Сферическая гелиевая ванна, изготов-
ленная из меди, подвешена к корпусу
криостата на двухстенной горловине-под-
веске, выполненной из двух коаксиальных
нержавеющих труб 0 38X0,2 и 34X0,2 мм.
Между трубами по винтовой линии с ша-
гом 12 мм намотан жгут, образующий
спиральный канал длиной 2 м для выхода
испаряющегося гелия. Такая конструкция
горловины имеет высокую прочность и поз-
воляет свести к минимуму теплоприток
вследствие конвекции, возникающей в вы-
ходной линии во время космического по-
лета. Теплоизоляция криостата — высоко-
вакуумная, с двумя медными экранами,
охлаждаемыми парами гелия через тепло-
вой контакт экранов с горловиной-подвеской.
Для повышения эффективности теплоизо-
ляции на экраны наложено по 30—40 слоев
пленки ПЭТФ толщиной 10 мкм, покрытой
с одной стороны слоем алюминия толщиной
в несколько микрон. Внутри гелиевой ван-
ны установлен разделитель фаз теплооб-
менно-рефрижераторного типа, представ-
ляющий собой теплообменник из сверну-
той в спираль трубки с дроссельным уст-
ройством на входном конце. Благодаря
разделителю фаз (принцип действия опи-
сан в § 15.6) в выходную горловину при
любом положении криостата в простран-
стве может поступать только газ, а жидкий
криоагент задерживается. Охлаждаемый
объект (например, приемник излучения)
помещается внутри пробки, закрывающей
отверстие, через которое производится за-
ливка жидкого гелия.
Сброс испаряющегося гелия за борт
космического аппарата производится через
регулятор давления, поддерживающий в
криостате заданное давление (а следова-
тельно, и температуру) жидкого гелия.
Технические характеристики криостата,
показанного на рис. 16.14: объем гелиевой
ванны 10 л, температура гелиевой ванны
4,22 К, масса криостата (без опорного уст-
ройства) 16 кг; испаряемость в рабочих
условиях — около 1 л жидкого гелия в
сутки.
Увеличение объема гелиевой ванны до
40 л и усовершенствование конструкции
горловины-подвески позволяют сохранять
374
Криосистемы для физических исследований
жидкий гелий в криостате такой конструк-
ции в течение 2 мес.
О космических криостатах со сверх-
текучим Не-П см. в [938, 950].
Другим направлением в создании си-
стем криостатирования для космических ис-
следований служит использование субли-
мации твердых криоагентов. Для темпера-
тур выше 10 К бортовые криостаты с твер-
дыми криоагентами имеют целый ряд пре-
имуществ по сравнению с жидкостными.
Они не требуют разделителей фаз, имеют
более длительный ресурс работы и высо-
кую надежность. К недостаткам сублима-
ционных криостатов относят невозможность
получения и поддержания в них гелиевых
температур.
По количеству используемых твердых
криоагентов сублимационные криостаты
могут быть однокомпонентными и двух-
компонентными. Твердые криоагенты полу-
чают как методом самозамораживания
криопродуктов (откачкой их паров), так
и путем теплообмена с более холодным
вспомогательным криоагентом.
На рис. 16.15 показано устройство бор-
тового однокомпонентного сублимационно-
го криостата КТ-7 Физико-технического ин-
ститута низких температур АН УССР [193].
Рабочий криоагент (твердый азот) нахо-
дится в сферическом резервуаре, который
с помощью систем растяжек крепится к
наружному корпусу. Объем резервуара
19,5 дц3, толщина стенки 2 мм, материал —
сплав АМц. Теплоизоляция криостата мно-
гослойная экранно-вакуумная с дополни-
тельным охлаждаемым экраном. Изоляци-
онная полость откачивается на земле через
клапан до остаточного давления ие выше
1,3-10-3 Па. В условиях орбитального по-
лета откачка изоляции производится кос-
Рис. 16.15. Сублимационный криостат КТ-7:
1 — резервуар для криогента; 2 — клапан для
откачки теплоизоляции на земле; 3 — автомати-
ческий клапан; 4 — экран; 5 — узел натяжения
растяжек; 6 — заправочная горловина; / — опти-
ческое окно; 8 — теплообменник; 9~ теплоотво-
дящие ребра; 10 — дренажная лииня
мическим вакуумом через автоматический
клапан.
Для обеспечения постоянного теплово-
го контакта твердого криоагента с охлаж-
даемым приемником в резервуаре имеется
система теплопроводящих ребер.
Залитый в криостат жидкий азот за-
мораживается путем откачки его паров
через горловину и дренажную линию. Для
возможности бездренажного хранения даль-
нейшее охлаждение твердого азота до 20—
25 К может осуществляться жидким во-
дородом или гелием с помощью теплооб-
менника. При работе на борту станции
«Салют-4» криостат КТ-7 поддерживал
температуру ИК-приемника на уровне 50 К
в течение 4 мес.
Криостат КТ-7 может быть применен
для криостатирования объектов и в дру-
гих диапазонах температур с использова-
нием соответствующих твердых криоаген-
тов. Так, на твердом водороде КТ-7 спосо-
бен поддерживать температуры 10—15 К
в течение 1,5 мес.
Для увеличения ресурса работы до го-
да и более применяют сублимационные си-
стемы с двумя твердыми криоагентами,
например метаном и диоксидом углерода,
или аргоном и диоксидом. Подробнее о та-
ких криостатах см. в [193, 450, 941].
16.2. НИЗКОТЕМПЕРАТУРНЫЕ
ПУЗЫРЬКОВЫЕ камеры
Пузырьковая камера служит одним из.
основных приборов, используемых при
ядерных исследованиях [600, 601].
Принцип действия пузырьковой каме-
ры состоит в следующем. Через жидкость,
находящуюся в метастабильном состоянии,
пропускают пучок частиц от ускорителя.
На своем пути частицы создают 6-элект-
роны, которые, затормаживаясь, выделяют
энергию, вызывающую возникновение и рост
зародышевых пузырьков до критического
размера, после чего онн растут самопроиз-
вольно. Таким образом, пути первичных
частиц, попавших в камеру ускорителя, как
и пути вторичных частиц, образовавшихся в
результате ядерных реакций первичных ча-
стиц с рабочим веществом камеры, обозна-
чаются треками из цепочек пузырьков. Тре-
ки фотографируют, когда пузырьки выра-
стают до размеров, соответствующих разре-
шающей способности системы фотографиро-
вания. Пузырьковые камеры размещают в.
магнитном поле, искривляющем пучки за-
ряженных частиц: положительных — в од-
ном направлении и отрицательных в дру-
гом. По радиусу кривизны трека, магнит-
ной индукции и заряду можно определить,
импульс частицы. Для обеспечения неиз-
менности значения магнитой индукции уз-
лы камеры выполняют из материалов не-
магнитных нли сохраняющих постоянную.
Низкотемпературные пузырьковые камеры
375
магнитную проницаемость. Практически ис-
пользуют алюминиевые сплавы и аустенит-
ные сплавы' с хромоникелевым эквивален-
том 13—16%. Этому условию удовлетво-
ряет сталь 12Х18Н10 с содержанием нике-
ля по верхнему пределу ГОСТ.
Вещество, заполняющее камеру, слу-
жит одновременно и мишенью. Чем проще
состав вещества, тем легче анализировать
результаты ядерных реакций. В частности,
хорошие однозначные результаты получают
для реакций, проходящих на протонах —
ядрах водорода. С целью изучения ядер-
ных реакций на нейтронах обычно преду-
сматривают заполнение водородных камер
.дейтерием. Для работы с дейтерием камера
и ее газовые системы должны быть рассчи-
таны на более высокое давление и долж-
ны обладать хорошей герметичностью. Дей-
терий, предназначенный для заполнения
камеры, должен содержать не более 10~14
молярных долей трития [684]. Тритий
f-активен, и в результате его распада об-
разуются треки, затрудняющие обработку
снимков. Тритий концентрируется в дейте-
рии одновременно с выделением дейтерия
из водорода. Период полураспада трития —
около 12 лет, поэтому чем более раннего
происхождения дейтерий, тем меньше он
содержит трития.
Другое распространенное рабочее веще-
ство пузырьковых камер — пропан. В состав
пропана входят углерод и водород, что
осложняет обработку результатов облуче-
ния. Вместе с тем в пропановых камерах
(как и в других камерах с тяжелыми
жидкостями) регистрируются у-кванты, в
то время как в водородных камерах их
путь не наблюдается из-за большой ра-
диационной длины—величины, характери-
зующей пробег фотонов в веществе до
конверсии в электрон-позитронную пару.
.Водородные камеры сложнее камер с тя-
желыми жидкостями из-за необходимости
работать при криотемпературах. В послед-
ние годы несколько больших водородных
камер реконструированы таким образом,
что трекочувствительной мишенью в них
служит водород или дейтерий, а регистра-
цию вторичных частиц производят неоно-
водородной смесью, которая обладает ма-
лой радиационной длиной и поэтому при-
тодна для регистрации у-квантов. Камеры
с жидким гелием распространения не по-
дучили, так как не были найдены физиче-
ские задачи, оправдывающие затраты на
их создание. Те камеры, которые были реа-
лизованы [685, 686], носили эксперимен-
тальный характер. В некоторых случаях
протон-гелиевое взаимодействие изучалось
путем облучения водородной камеры пуч-
ком а-частиц.
Оптическая схема водородной камеоы,
а следовательно, и ее конструкция в значи-
тельной степени определены тем, что ин-
тенсивность потока света, рассеянного на
пузырьке, резко падает с увеличением угла
между направлением освещения и фото-
графирования. Практически невозможно
вести съемку под углом 90° к направле-
нию освещения. Наиболее просто происхо-
дит фотографирование «на просвет»: с од-
ной стороны камеры ставят осветитель, с
другой — фотоаппараты. Для такой систе-
мы в камере должно быть два стекла, поз-
воляющих просматривать весь объем каме-
ры в плоскости, параллельной оси пучка
частиц.
Оптические стекла для больших камер
стоят дорого. Достаточно сложно осущест-
вить и герметичное соединение стекла с
корпусом камеры. Поэтому большинство
камер имеет лишь одно большое горизон-
тальное стекло. В этом случае осветитель
и фотоаппараты размещают по одну сто-
рону корпуса камеры. На противополож-
ной стороне (дне) камеры устанавливают
отражательную систему — растр. Фотогра-
фирование ведут в свете, отраженном ра-
стром. Свет, рассеянный треками на его
пути от осветителя к растру, испытывает
в растре полное внутреннее отражение или
поглощается.
Есть еще один вариант оптической си-
стемы, при котором для фотоаппаратов и
осветителя оставляют несколько неболь-
ших окон. При этом для регистрации тре-
ков используют только часть объема каме-
ры. Для уменьшения паразитного объема
камеры стали применять широкоугольные
объективы типа «рыбий глаз» [687].
Для восстановления геометрии треков
в пространстве фотографирование ведется
стереоскопически двумя или большим чи-
слом фотоаппаратов. Объективы фотоаппа-
ратов при облучении камеры постоянно от-
крыты. Чтобы произошла съемка, дают им-
пульсную вспышку света через несколько
миллисекунд после прохождения пучка ча-
стиц от ускорителя. Затем включают лен-
топротяжные механизмы для подготовки
фотоаппарата к следующему снимку. Кас-
сеты с экспонированной пленкой периоди-
чески меняют на новые.
Метастабильное состояние, необходи-
мое для образования треков, получают по-
средством системы изменения давления.
В период между расширениями жидкость в
камере поддерживают при температуре и
давлении более высоких, чем точка нор-
мального кипения (у жидкого водорода ра-
бочие параметры 26—29 К при абсолютном
давлении 0,4—0,8 МПа). Затем в нужный
момент (за некоторое время до прохожде-
ния пучка частиц) давление в камере бы-
стро понижают, и жидкость некоторое вре-
мя находится в метастабильном состоянии,
затем давление вновь повышают, не давая
жидкости вскипеть по всему объему. Ха-
рактерная диаграмма изменения давления
в камере приведена на рис. 16.16. Жидкий
водород обладает заметной сжимаемостью.
Чтобы получить в жидководородной каме-
376
Криосистемы для физических исследований
Рис. 16.16. Типичная диаграмма изменения
давления в водородной камере
ре желаемое снижение давления на 0,25—
0,35 МПа ниже равновесного, практически
необходимая степень расширения должна
составлять 0,8—1,2% [688]. Фактическая
степень расширения превышает расчетное
значение на несколько десятых процента
нз-за образования паразитных пузырей га-
за, имеющих значительно большую сжимае-
мость, чем жидкость.
Наибольшее распространение получили
два типа устройств для изменения давле-
ния: поршневое и сильфонное. В поршне-
вом устройстве одна из наиболее серьезных
задач — уплотнение поршня в цилиндре.
Важно, чтобы во время расширения в ка-
меру не «выстреливался» водород из над-
поршневого пространства. Обычно уплот-
нением служат пластиковые поршневые
кольца, например фторопластовые [602]
или из тяжелого полиэтилена [603]. Целе-
сообразно в надпоршневом пространстве
иметь жидкий водород, с тем чтобы при
просачивании через уплотнение в момент
расширения в камеру попадала жидкость,
а не газ.
Для сильфонного устройства измене-
ния давления очень важно, чтобы сильфон
работал в пределах упругих деформаций.
Устройство наиболее удачно реализуется в
многометровых пузырьковых камерах с по-
движным дном, соединяемым с вертикаль-
ным цилиндрическим корпусом камеры по-
средством омега-сильфона [689].
Для 100-сантнметровой водородной ка-
меры ОИЯИ [602] использовано поршне-
вое устройство, причем в нем надпоршне-
вое пространство отделяют от атмосферы
посредством уплотнения, имеющего диа-
метр, равный диаметру холодного поршня
(рнс. 16.17). Благодаря этому над порш-
нем не возникает противодавление и рас-
ширение возможно за счет энергии жидко-
го водорода, находящегося под избыточным
давлением. Кроме того, в период расшире-
ния газ в надпоршневом пространстве не
сжимается, что позволяет устранить соот-
ветствующее тепловыделение. Надпоршне-
вое пространство рассматриваемого меха-
низма расширения заполнено вытеснителем
из жесткого пенопласта марки ПХВ-1. Вы-
Рис. 16.17. Механизм расширения 100-сан-
тиметровой водородной камеры ОИЯИ
[602]:
1 — теплый поршень; 2 — резиновые перекатыва-
ющиеся мембраны; 3 — стакан надувного эле-
мента; 4—резиновый надувной элемент, отсоеди-
няющий теплую часть механизма от холодно»
при ремонтах; 5 — направляющая; 6 — пенопла-
стовый вытеснитель; 7 — охлаждающий змеевнк;
8 — холодный поршень; 9 — тонкие фторопласто-
вые кольца; 10 — шток
теснитель в период расширения камеры
препятствует забрасыванию жидкого и хо-
лодного газообразного водорода в более
теплые области.
Поршневая система приводится в дви-
жение пневматически или гидравлически.
Для ускорения набора необходимого
количества данных в последнее время все
шире применяют несколько срабатываний
камеры за один цикл работы ускорителя.
Уплотнение стекол в металлическом
корпусе представляет довольно трудную
задачу, поскольку стекло н металл камеры
имеют различные коэффициенты линейного
расширения (сжатия). Прн охлаждении
камеры должно происходить проскальзыва-
ние стекла в уплотнении. Вместе с тем не-
обходимо сохранить герметичность между
пространствами с жидким водородом и с
высоким вакуумом. Для малых стекол ис-
пользовалось уплотнение с помощью мед-
ной ромбической прокладки, обычно лу-
женной легкоплавким припоем или индием.
Крупные стекла овальной формы уплот-
няют с помощью надувного уплотнения,
впервые предложенного для камеры Берк-
ли. В 100- и 200-сантиметровых камерах
ОИЯИ используют вариант надувного уп-
лотнения с упрощенной технологией изго-
товления (рис. 16.18) [604].
Увеличение давления внутри пневма-
тического элемента 3 заставляет его рас-
ширяться и сдавливать индиевые проклад-
Низкотемпературные пузырьковые камеры
377
Рис. 16.18. Уплотнение стекла камеры:
1 — вытеснитель; 2 — корпус камеры; 3 — пнев-
матический элемент; 4 — рамка; 5 — стекло; 6 —
индиевые прокладки; 7 — фланец камеры
ки 6. Использование индия в качестве про-
кладочного материала объясняется его пла-
стичностью при низких температурах. Су-
щественно важно применять чистый не-
окпсленный индий. Для этого проволоку
из индия сразу после выдавливания из за-
готовки укладывают в уплотнение или хра-
нят под слоем спирта. В период охлажде-
ния камеры внутри пневматического эле-
мента поддерживают давление 1—2 МПа,
допускающее проскальзывание стекла, ис-
пытывающего малые термические деформа-
ции относительно прокладок, связанных с
сильно деформирующимся корпусом каме-
ры. При температуре жидкого азота, когда
основные термические деформации скомпен-
сированы, давление в надувном элементе
повышается до рабочего (5—7 МПа). Вы-
теснитель 1 уменьшает количество сжа-
того газа, гелия или водорода, находяще-
гося внутри надувного элемента, чтобы при
поломке его не возникло опасное повы-
шение давления в камере. Пространство
между двумя прокладками уплотнения
стекла используют для индикации течи.
Его можно подсоединить к линии водоро-
да низкого давления или к вакуумному
насосу.
Большинство действующих камер име-
ют традиционную для низкотемпературных
устройств высоковакуумную систему тепло-
изоляции. Исключением в этом отношении
являются ЮО-сантиметровая [602, 690] и
2-метровая камеры ОИЯИ, для которых
используется дьюарная теплоизоляция
(рис. 16.19). Камеру подвешивают внутри
газового пространства металлического со-
суда Дьюара. Газовое пространство запол-
няют водородом под давлением 0,01—
0,02 МПа. Температура столба газа по-
степенно повышается от температуры ка-
меры до нормальной температуры у «теп-
лой» крышки 9. Все холодные коммуника-
ции между крышкой и камерой теплоизоли-
руют. Таким образом удается избежать
конвекционных токов. Главное преимущест-
во дьюарной системы теплоизоляции — ва-
Рис. 16.19. 100-сантиметровая водородная
камера ОИЯИ [690]:
/ — корпус камеры; 2 — растр в виде трехгран-
ных стеклянных призм; 3 — надувное уплотнение
стекла; 4 — стекло камеры; 5 — фланец камеры;
6 — охлаждающий радиатор; 7 — тяга подвески;
8 — вакуумный кожух сосуда Дьюара; 9 — «теп-
лая» крышка; 10— «теплый» иллюминатор; 11—
защитное стекло; 12— многослойная изоляция;
13 — внутренняя оболочка сосуда Дьюара; 14 —
механизм расширения; 15 — охлаждающий зме-
евик. Характеристика камеры: рабочая темпера-
тура 28 К; рабочее давление 0,6 МПа; давление
расширения 0,3 МПа; объем 150 л; масса охлаж-
даемого металла 1200 кг; толщина стекла каме-
ры 100 мм; диаметр' поршня 154 мм; полный
цикл расширения и сжатия 60 мс; мощность
рефрижератора 1,6 кВт
куум в изоляционном пространстве не за-
висит от утечек водорода из камеры. При
аварийном выливании жидкого водорода
из камеры он попадает на холодные стен-
ки и не будет бурно вскипать. Сосуды
Дьюара больших водородных камер ОИЯИ
имеют корытообразную форму. Внешняя
«теплая» оболочка 8 сосуда (рис. 16.19)
сделана массивной, выдерживающей дав-
ление, возникающее при поломке камеры.
Внутренняя оболочка гибкая. Она сделана
из тонкого листа нержавеющей стали и
через многослойную изоляцию опирается на
массивную внешнюю оболочку. Теплопро-
водность изоляции при этом увеличивает-
ся, но общий поток теплоты в результате
теплопроводности вдоль внутренней обо-
лочки сверху вниз значительно меньше, чем
в случае, если бы она была выполнена же-
сткой.
Система термостатирования должна
поддерживать рабочую жидкость камеры
при определенной температуре с точностью
0,01—0,05 К.
В водородных камерах работа меха-
низма изменения давления вызывает тепло-
выделения примерно 0,3—1,2 Дж/(л-цикл)
[691]. Кроме того, система термостатиро-
вания должна снимать теплопритоки из
378
Криосистемы для физических исследований
окружающей среды. Обычно термостатиро-
вание осуществляют циркуляцией кипяще-
го водорода по системе трубок, схема при-
соединения которых существенно зависит
от конструкции камеры. В большинстве
случаев охлаждающий жидкий водород по-
ступает от ожижителя водорода, разме-
щенного рядом с камерой. Испарившийся
холодный водород возвращают в ожижи-
тель, который работает в это время в реф-
рижераторном режиме. При этом холодиль-
ная мощность криогенной установки удваи-
вается по сравнению с ожижительным ре-
жимом (без возврата холодного пара).
Имеется несколько камер, в которых по
соображениям безопасности реконденсацию
водорода осуществляют посредством от-
дельного гелиевого цикла [605, 692].
Особенностью 100-сантиметровой каме-
ры ОИЯИ (рис. 16.19) служит охлаждае-
мый жидким водородом радиатор, располо-
женный вокруг стекла камеры. Внутри и
снаружи радиаторной зоны создаются кон-
векционные токи, отводящие теплоту от
стекла, фланца и корпуса камеры. Возмож-
ность радиаторного охлаждения обеспечена,
системой теплоизоляции камеры. Радиатор-
ное охлаждение позволяет поддерживать
практически одинаковую температуру
внешней и внутренней поверхностей стекла
камеры и очень малые градиенты темпера-
туры (несколько сотых долей градуса) в
различных сдоях жидкого водорода, за-
полняющего камеру. В целом радиаторная
система охлаждения обеспечивает высокую1
оптическую однородность рабочей жидко-
сти в камере. У всех камер с поршневым
механизмом расширения очень важную
роль играют змеевики, расположенные в
районе холодного поршня, так как именно
здесь возникают наибольшие тепловыделе-
ния. Все большие водородные камеры
снабжены собственной криогенной установ-
кой, расположенной рядом с камерой [688].
В большинстве случаев это водородный
ожижитель, в котором предусмотрено ис-
пользование холода испаряющегося водо-
рода (обратного потока).
Стабилизация температуры в камере
достигается регулированием количества
жидкого водорода, протекающего через
охлаждающие змеевики. Давление в каме-
ре обычно на несколько сотых долей мега-
паскаля превышает равновесное при соот-
ветствующей температуре. В большинстве
случаев в камере запирают постоянное ко-
личество водорода и давление меняется в
соответствии с изменением температуры.
В случаях, когда давление и температуру
в камере регулируют независимо, камеру
пополняют водородом через конденсатор
при понижении давления, а при повышении
давления излишек водорода выводят с по-
мощью регулятора давления «до се-
бя» [602].
Качество фотографий процессов, про-
текающих в камере, в значительной степе-
ни зависит от чистоты оптических поверх-
ностей. С жидким водородом в камеру мо-
гут поступать пыль и окалина - из комму-
никаций, а также твердые частицы азота,
кислорода и пр. Для удаления твердых
примесей применяют фильтры. Исследова-
ния [606] показали, что за фторопласто-
выми фильтрами с пористостью 0,1—
10 мкм, за пылевыми ФПП и за асбесто-
выми биологическими фильтрами с пори-
стостью около 1 мкм суммарное содержа-
ние твердых частиц примесей — 2-10~7
молярных долей. Тот же результат
(2,5-10-7) получают при одночасовом от-
стаивании жидкого водорода в хорошо
изолированном сосуде. На внешнюю по-
верхность стекла камеры могут оседать
примеси из вакуумного или газового про-
странства между стеклами камеры и внеш-
него сосуда. В камере по рис. 16.19 внеш-
нюю поверхность стекла защищают от вы-
саживания осадков продувкой 0,5 м3/ч чи-
стого водорода в направлении от стекла
к крышке.
Помимо описанных криогенных систем
работа низкотемпературных пузырьковых
камер обеспечивается еще системами фото-
графирования и управления, магнитами и
каналами частиц, с которыми можно по-
знакомиться в [600, 688, 691, 693, 694].
В настоящее время создано «поколе-
ние» многометровых водородных камер..
Одна из них — камера ЦЕРН (ВЕВС) с
диаметром 3,7 м и фотографируемым объ-
емом 20 м3—показана на рис. 16.20.
Камера выполнена в виде вертикального'
цилиндра. На ее верхней крышке размеще-
ны окна типа «рыбий глаз» для освеще-
ния и фотографирования. Элементы дна
камеры и подвижная разделительная пла-
стина покрыты скотчлайтом — отражателем
света из мелких стеклянных шариков,
вдавленных в прозрачную пластиковую'
подложку. При такой оптической схеме
глазом видны треки в виде линии из тем-
ных точек — пузырьков на светлом фоне
(светлопольное освещение).
В камере ВЕВС стекло для фотографи-
рования состоит из трех слоев со сфериче-
ской поверхностью: холодного, соприкаса-
ющегося с жидким водородом, экраниру-
ющего, тоже имеющего низкую температу-
ру, и теплого, замыкающего вакуумное про-
странство со стороны объектива. Меха-
низм изменения давления камеры — порш-
невой. Поршень расположен в нижней ча-
сти камеры. Это позволяет охладить око-
лопоршневое пространство до температуры
более низкой, чем рабочий объем камеры.
Таким образом снижают до минимума чи-
сло пузырьков, идущих со дна камеры
вверх и вызывающих искажение треков.
Силы реакции во время изменения давле-
ния воспринимаются опорами камеры и
Водородные мишени
379
Рис. 16.20. Большая европейская пузырь-
ковая камера:
/ — фотоаппарат; 2 — перископ; 3 — фильмовый
канал; 4— окна типа «рыбий глаз»; 5 — магнит-
ный экран; 6—сверхпроводящий соленоид; 7 —
-скотчлайт; 8 — разделительная пластина; 9 —
поршень; 10— вакуумный насос; 11- шток
поршня; 12 — гидравлический поршено; 13 —
пневматический поршень
передаются фундаменту. Над поршнем ус-
тановлена разделительная ' пластина, ко-
торая повышает равномерность расширения
и препятствует проникновению холодного
жидкого водорода в верхние слои камеры.
На разделительную пластину сверху на-
клеен скотчлайт. Поршень и разделитель-
ную пластину перемещают в магнитном
поле. Чтобы избежать возникновения вих-
ревых токов и соответствующих тепловы-
делений, поршень и пластина выполнены из
жесткого ячеистого пластика со стекло-
эпоксидным покрытием. Шток поршня цент-
рируют двумя пластиковыми опорами:
верхняя работает при водородной темпе-
ратуре, нижняя — при нормальной. При-
вод механизма изменения давления пнев-
могидравлический. Камера размещена в
сверхпроводящем магните с индукцией
3,5 Тл.
Современные тенденции в развитии
жидководородных пузырьковых камер
Переход к многометровым камерам.
Во многих лабораториях мира отказыва-
ются от относительно небольших камер и
ориентируются на многометровые камеры.
Прежде всего это относится к лаборато-
риям, где вступили в строй новые, более
мощные ускорители (ЦЕРН и Фермилаб).
В ЦЕРН, например, отправили в музей
одну из лучших камер мира — 2-метровую
ЦЕРН [694]—после получения на ней
около 40 млн. снимков; теперь большинство
экспериментов осуществляют на камере
ВЕВС (Большая европейская пузырьковая
камера) [687]. В Фермилаб используют
15-футовую камеру [689, 695]. В Институ-
те физики высоких энергий (СССР) рабо-
тает созданная во Франции 4,5-метровая
камера «Мирабель» [689]. Отличительной
особенностью ее служит форма — горизон-
тальный цилиндр с пучком, направленным
вдоль оси. Фотографирование ведут 8 объ-
ективами перпендикулярно оси.
Использование сверхпроводящих маг-
нитов. Камеры ВЕВС и 15-футовая рабо-
тают в полях сверхпроводящих магнитов.
Использование СП магнитов позволяет су-
щественно снизить расход энергии и ра-
ботать с относительно высокой магнитной
индукцией.
Применение многоцнкличных камер.
В большинстве современных камер произ-
водят несколько процессов снижения и по-
вышения давления за один цикл работы
ускорителя частиц. Такой режим работы
позволяет существенно уменьшить время
набора необходимого количества снимков.
Использование трекочувствительных ми-
шеней. Как отмечалось, один из недостат-
ков водородно-дейтериевых камер — пло-
хая регистрация у-квантов. Чтобы избе-
жать его, было предложено устанавливать
в камерах трекочувствительную мишень
(TST), заполненную жидким водородом
или дейтерием, а остальное пространство
камеры заполнять жидкой неоно-водород-
ной смесью, которая более чувствительна
к у-квантам благодаря неону и мало от-
личается по физическим параметрам от
жидкого дейтерия.
Комбинирование камер с электронны-
ми методами регистрации. Большинство со-
временных водородных камер комбиниру-
ют с электронными детекторами. У камеры
ВЕВС, например, для работы с нейтрон-
ным пучком вокруг выходного полуцилинд-
ра (за железной защитой) были установ-
лены в 1976 г. идентификаторы мюонов в
виде проволочных камер 3X1 м2 с общей
перекрываемой площадью 6X25 м2 [696].
В 1977 г. к этой камере добавили внеш-
ний идентификатор частиц массой 52 т,
содержащий 4096 пропорциональных счет-
чиков в 128 слоях [697]. В 1979 г. для
изучения очарованных частиц перед каме-
рой ВЕВС была установлена фотоэмульси-
онная стопка.
Более подробное описание водородных
камер, разработанных в нашей стране,
можно найти в [602, 607, 608, 609, 610].
16.3. ВОДОРОДНЫЕ МИШЕНИ
При ядерных исследованиях стремятся
изучать взаимодействие частиц с простыми
ядрами. С этой целью исходный пучок час-
380
Криосистемы для физических исследований
тиц сталкивают с водородом, дейтерием или
гелием, находящимся в специальном сосу-
де — мишени. Сведения о массе, заряде и
энергии частиц получают посредством де-
текторов, размещаемых вблизи мишени.
Чтобы легче выделить результаты, по-
лученные на ядрах мишени, надо иметь ми-
нимальное количество других ядер на путч
частиц, т. е. надо иметь возможно меньше
вещества стенок. Кроме того, атомный но-
мер ядер вещества стенок должен быть
как можно более низким. Последнему тре-
бованию хорошо отвечают углеводороды —
пластмассы. Наиболее благопопятное соот-
ношение между количествами ядер мишени
н вещества стенок получают в том случае,
если мишени заполнены жидкими водоро-
дом, дейтерием или гелием.
Тип мишени, особенно желательный
для изучения сечений взаимодействия, ког-
да не нужно индицировать частицы во всех
направлениях,—цилиндрический горизон-
тальный сосуд с тонкими окнами. Первона-
чально окна выполняли из металлической
фольги. Теперь их делают из лавсана. Тол-
щина лавсановых окон 0,12 мм. Общее коли-
чество вещества на входе частиц в мишень
0,073 г/см2. Длина слоя жидкого водоро-
да — от 0,5 до 3 м [611]. Повышение тре-
бований к точности эксперимента вызвало
необходимость создания прецизионной ми-
шени, в которой количество водорода на
пути частиц определяется с точностью
0,05—0,1% [611]. Особенности этой мишени
(рис. 16.21): внутренний сосуд, заполняе-
мый жидким водородом, имеет ложную
обечайку, которая не позволяет пузырькам
газа пересекать рабочую зону; лавсановое
окно мишени двойное — 7 и 7А; внутрен-
нее окно имеет отверстие диаметром 0,3—
0,5 мм, сообщающее пространство мишени,
заполненное жидким водородом, с газовой
Рис. 16.21. Цилиндрическая жидководород-
ная мишень с лавсановыми окнами [611]:
1 — наружный кожух; 2 — многослойная изоля-
ция; 3 — внутренний сосуд; 4 —ложная внутрен-
няя обечайка; 5 — экран нз алюминиевой фоль-
ги со смотровой щелью; 6 — внешнее лавсановое
окно; 7 — внутреннее лавсановое окно; 7 А —
уравновешенное плоское лавсановое окно; 8 —
адсорбент; 9 — стойка; 10 — термоэлектрический
манометр; 11 — горловина
полостью между окнами 7 и 7А (вследст-
вие этого окно 7А уравновешивается и,
остается плоским, что обеспечивает посто-
янство количества жидкого водорода на-
пути частиц). В мишени поддерживают по-
стоянное давление с точностью +0,7 гПа-
посредством стабилизатора. Доливку жид-
кого водорода ведут самотеком из проме-
жуточного сосуда вместимостью 57 л, рас-
положенного над мишенью. Снижение ги-
дростатического давления при уменьшении1
уровня жидкого водорода в промежуточном-
сосуде компенсируют изменением регулиро-
вочных параметров стабилизатора давления.
Испаряемость мишени — 1 л/ч жидкого-
водорода.
Создавали также сверхдлинные мише-
ни. Например, в Фермилаб [698] для'
уменьшения интенсивности пучка нейтронов:
с целью получения чистого фотонного пуч-
ка были использованы две дейтериевые ми-
шени длиной 10,8 и 20,2 м, расположенные
последовательно. Внутренний сосуд мише-
ни выполнен из алюминиевых труб и цен-
трирован внутри теплового экрана посред-
ством стеклопластиковых проставок. Крио-
статирование ведут криоагентом, пропуска-
емым по трубкам, припаянным к внутрен-
нему сосуду.
Для исследования процессов взаимодей-
ствия протонов и дейтонов на протонах на
ускорителях в Серпухове и в Фермилаб-
созданы струйные мишени [614, 615]. В та-
кой мишени порцию газообразных водовода-
или дейтерия выпускают с помощью элек-
тромагнитного клапана в трубку, охлажда-
емую парами гелия, а затем струю газа дли
жидкости формируют тремя соосными соп-
лами и впрыскивают в вакуумную камеру
ускорителя. Пучок ускоренных протонов
многократно взаимодействует со струей ра-
бочего тела. Продукты взаимодействия ре-
гистрируют соответствующими детектора-
ми. Струя газа после камеры ускорителя
поступает через горловину диаметром 50 мм
в гелиевый конденсационный насос с ка-
мерой объемом 1800 см3 и быстротой от-
качки 2-10® л/с. Коэффициент захвата на-
соса 99,999%. Диаметр струн в районе пуч-
ка 2 см, плотность струи 10~7 г/см3. После
накопления в камере конденсационного на-
соса предельно допустимого количества
осадка мишень перемещают в шлюз, кото-
рый отсекают от камеры ускорителя ва-
куумным затвором. Мишень прогревают,
удаляют испарившийся конденсат и вновь,
охлаждают, подготавливая ее к повторной
операции облучения.
Криостатирование мишеней осуществля-
ют несколькими способами: оснащением ми-
шени буферной емкостью с рабочей жидко-
стью (водородом или дейтерием), рекон-
денсацпей паров додорода или дейтерия
жидким гелием, реконденсацией паров кри-
огенной газовой машиной (КГМ). Первый
способ наиболее прост, но потенциально
«Петли» для исследований в ядерных реакторах при криотемпературах
381
Рис. 16.22. Жидководород-
ная мишень для стример-
ной камеры [613]:
/ — адсорбент; 2—горловина
внутреннего сосуда; 3 — трубка,
слива жидкости; 4 — вытесни-
тель; 5 — вакуумный кожух;.
6 — внутренний сосуд; 7 — ок-
но вытеснителя; 8 — вакуумная
полость; 9 — окно кожуха
наиболее взрывоопасен. Реконденсация па-
ров посредством жидкого гелия термоди-
намически невыгодна, но позволяет умень-
шить количество взрывоопасного вещества
в системе и достаточно легко осуществима.
Последний способ наиболее совершенен,
но предъявляет высокие требования к на-
дежности КГМ.
Существенное достижение в технологии
изготовления мишеней последнего време-
ни — использование неметаллических мате-
риалов, пригодных для работы в электри-
ческих и магнитных полях и обеспечиваю-
щих малое количество вещества стенок поч-
ти во всем сферическом угле. В качестве
примера [601] можно указать мишень,
предназначенную для работы в стримерной
камере (рис. 16.22). Внутренний сосуд в
этой мишени склеен эпоксидной смолой из
лавсановой пленки толщиной 100 мкм, ва-
куумный кожух сделан из пенопласта, об-
тянутого лавсаном для герметичности гор-
ловина внутреннего сосуда выполнена из
стеклопластика. Вакуум в теплоизоляцион-
ной полости во избежание электрических
пробоев должен быть лучше 10-4 гПа. Мно-
гослойную изоляцию и экраны не устанав-
ливают, что ведет к повышенной испаряемо-
сти. Криостатирование мишени обеспечива-
ют посредством КГМ.
Выполнялись, но не получили распро-
странения мишени с твердым водородом
[601, 649, 699]. Более подробно с низкотем-
пературными мишенями можно ознакомить-
ся в [601, 611, 612].
16.4. «ПЕТЛИ» ДЛЯ ИССЛЕДОВАНИЙ:
В ЯДЕРНЫХ РЕАКТОРАХ
ПРИ КРИОТЕМПЕРАТУРАХ
Для большого числа физических иссле-
дований необходим поток медленных ней-
тронов. Медленными (или «холодными»)
считаются нейтроны с энергией ниже при-
мерно 0,005 эВ и длиной волны 0,4 нм и
более. Поток нейтронов, образующийся в
реакторе при температуре примерно 50 °C и
находящийся в термическом равновесии с
замедлителем, содержит менее 2% «холод-
ных» нейтронов. На рис. 16.23 приведено
распределение по энергии равновесных ней-
тронов для разных температур [314]. Для<
получения достаточно плотного потока «хо-
лодных» нейтронов они должны быть за-
медлены при низкой температуре. Для это-
го на пути пучка устанавливают резервуар
с замедлителем, находящимся при низкой
температуре, — обычно это жидкие водород,
или дейтерий или смесь их. Иногда ис-
пользуют и жидкий гелий. Вся эта крио-
система часто называется «петлей». На рис..
16.24 представлена схема «петли» для полу-
чения «холодных» нейтронов путем замед-
.382
Криосистемы для физических исследований
Длина, волны нейтрона,,нм
Энергия, В
Рис. 16.23. Распределение потока равно-
весных нейтронов по энергии для разных
температур
ления их в жидком водороде, который кон-
денсируется при теплообмене с потоком га-
зообразного гелия.
Помимо получения пучка «холодных»
нейтронов «петли» используют для изучения
действия ядерного излучения на вещество.
Исследование дефектов и изменение физи-
ческих свойств, возникающих в облученных
твердых телах, при нормальной температу-
ре затруднено из-за неустойчивости дефек-
тов, вызванной тепловыми колебаниями.
Поэтому необходимо как облучать, так и
исследовать твердые тела при достаточно
низких температурах, когда дефекты как
бы «заморожены» и могут быть изучены в
том состоянии, в каком они возникли при
облучении. Так, известны случаи, когда де-
фекты изменяются уже при температуре
жидкого азота (77 К). В настоящее время
разработаны криосистемы, позволяющие об-
лучать и исследовать вещество на трех ха-
рактерных уровнях температур: 77 К и
выше, 20 К, примерно 4 К.
При создании «петель» для исследова-
ний в ядерных реакторах при криотемпера-
турах необходимо учитывать следующие об-
стоятельства: 1) трудности доступа с не-
Рис. 16.24. Принципиальная схема «петли»
для получения потока «холодных» нейтро-
нов, замедленных в жидком водороде:
/ — активная зона; 2 — сосуд с жидким водоро-
дом; 3 — экран; 4 — трубопровод для испарив-
шегося водорода; 5 — конденсатор водорода;
6 — трубопровод циркулирующего гелня; 7 — по-
ток «холодных» нейтронов
Чистый азот
Технический жидкий,
азот
Технический
азот
вакуумная
изоляция
Чистый жидкий
азот
Контейнео
Л с одразирм
Рис. 16.25. Схема концевой части «петли»
для облучения вещества при температуре
жидкого азота
обходимой аппаратурой к активной зоне ре-
актора и обеспечения безопасности, в част-
ности подводящие и отводящие трубопро-
воды с криоагентом приходится делать
очень длинными (десятки метров); 2) по-
скольку поток нейтронов всегда сопровож-
дается у-излучением, в материале образцов,
жидком криоагенте и в стенках криостата
выделяется значительное количество тепло-
ты (от десятков до нескольких сотен ватт
и даже более), которая должна быть отве-
дена циркулирующим криоагентом. Поэтому
важное значение приобретает выбор мате-
риала для трубопроводов и криостатов.
Наиболее интересны вследствие относитель-
но малого значения времени полураспада
алюминий и магний (15 ч), цирконий
(17 ч).
На рис. 16.25 представлена схема кон-
цевой части «петли» для работы при 77 К
на жидком азоте [99]. При работе с жид-
ким азотом могут возникнуть специфические
Рис. 16.26. Полная схема «петли» для ис-
следований в реакторе при 4 К:
/ — компрессор; 2 — детандер; 3— основной
теплообменник; 4 — реактор; 5 — экран
Криометоды получения глубокого вакуума
383
опасности: небольшие примеси кислорода
под влиянием излучения превращаются в
озон, в то время как азот с кислородом
дает оксиды азота, которые в присутствии
озона могут привести к взрыву. Кроме то-
го, озон вызывает коррозию алюминиевых
стенок приборов [799]. Во избежание этого
в активной зоне должен находиться только
особо чистый азот, который конденсируется
вне активной зоны техническим жидким
азотом (рис. 16.25).
На рис. 16.26 представлена схема «пет-
ли» для работы в активной зоне реактора
при 4,2 К с холодильной мощностью 100 Вт
[799]. Рабочее вещество во всех контурах—
гелий.
Обзор разработанных «петель» для ис-
следований в ядерных реакторах при крио-
температурах см. в [260, 799].
16.5. КРИОМЕТОДЫ ПОЛУЧЕНИЯ
ГЛУБОКОГО ВАКУУМА
Применение жидких криоагентов в ва-
куумной технике идет в основном по трем
направлениям: охлаждаемые высоковакуум-
ные ловушки, адсорбционные вакуум-насосы
и конденсационные криовакуумные системы.
Охлаждаемые вакуумные ловушки. Па-
роструйные диффузионные вакуумные насо-
сы до сих пор служат одним из основных
средств откачки. Эти приборы обладают,
к сожалению, существенным недостатком —
наличием большого обратного потока па-
ров масла, что загрязняет откачиваемый
объем и недопустимо для многих техноло-
гических процессов в вакууме. Один из на-
дежных путей существенного уменьшения
обратного потока масляных паров — ис-
пользование ловушек, охлаждаемых жидки-
ми криоагентами (чаще всего жидким азо-
том).
В табл. 16.3 приведены упругости на-
Та блина 16.3. Упругость
насыщенного пара и скорость
испарения масла ВМ-1 при
различных температурах
Температура, °C Упругость пара, Па Скорость испарения
мг/(ч-см2) моно- слой/(чХ Хсм2)
+30 1,1.10-6 2-Ю-2 250
+20 2,4-10-6 4-10-3 50
0 4,9-10—7 9,5-10-4 12
—10 9,1-10-8 1,5-10-4 2
-20 1,2-10-8 2,5-10-6 0,3
—30 1,6-10-9 3,3-10-6 0,04
—40 1,1-10-1» 2,3 • 10-7 З-10-з
—50 l,6-10-ii 3,4-10-8 4-10-4
сыщенного пара и скорость испарения ва-
куумного масла ВМ-1 при различных тем-
пературах.
Одно из основных требований, предъ-
являемых к охлаждаемой ловушке, — «оп-
тическая плотность», от которой зависит в
основном эффективность работы ловушки.
Удовлетворение этого требования связано
обычно с уменьшением пропускной способ-
ности прибора. Для оценки улавливающих
качеств ловушки используют понятие веро-
ятности а пролета молекул через ловушку—•
отношение числа молекул откачиваемого га-
за, прошедших через ловушку, к числу мо-
лекул, поступающих в ее входное отвер-
стие.
В табл. 16.4 приведены схемы наиболее
распространенных оптически плотных лову-
шек, а также значения пропускной способ-
ности U и вероятности пролета а. Как вид-
но из таблицы, большой пропускной спо-
собностью обладает однорядная ловушка;
к сожалению, при этой схеме не удается
надежно «защититься» от косолетящих мо-
лекул, отразившихся от теплой стенки при-
бора и способных пройти ловушку, минуя
соударение с холодными поверхностями.
Этим же недостатком обладает коническая
кольцевая ловушка. В промышленных уста-
новках наибольшее распространение полу-
чили кольцевые шевронные ловушки, кото-
рые имеют удовлетворительные защитные
свойства и малый размер по высоте.
По методу охлаждения различают за-
ливные ловушки и проточные. Заливные ло-
вушки имеют емкость, в которой находится
жидкий криоагент, а проточные — змеевик,
по которому этот криоагент циркулирует.
Заливные системы проще в эксплуатации,
но обладают большой теплоемкостью, что
затрудняет быстрый отогрев и захолажива-
ние.
Охлаждаемые ловушки защищают от-
качиваемый объем от паров масла и служат
мощным средством откачки легкоконденси-
рующихся паров воды и углеводородов.
Применение охлаждаемых ловушек значи-
тельно увеличивает эффективную скорость,
откачки, особенно в непрогреваемых систе-
мах.
Адсорбционные вакуум-насосы. В ад-
сорбционных вакуум-насосах используют
явление физической адсорбции. Применяют
обычно такие распространенные адсорбен-
ты, как активированный уголь, силикагель,
цеолиты, охлаждая их жидким азотом. Дан-
ные по сорбционной емкости этих веществ
см. в § 5.9.
Конструктивное оформление адсорбци-
онных насосов может быть различным, не-
обязательные требования следующие: воз-
можность прогрева адсорбента для его ре-
генерации; возможность охлаждения и под-
держания адсорбента при низкой темпера-
туре- с малыми потерями холода.
-384
Криосистемы для физических исследований
Таблица 16.4. Характеристика охлаждаемых ловушек
Наименование Схематичное изображение Оптимальное соотношение размеров Вероятность пролета а Пропускная способность £7л/(с-см2)
Диафрагменная * -t л z f н —^z г z=3K0 /?,/?„= 1,5 0,40 4,70
Коническая кольцевая Уг- 9=60° — 4,50
.Жалюзийная однорядная ^8^ /к А -< *“ А'В>5 9=63° 0,40 4,80
Жалюзийная двухрядная г А/В>5 9=60° 0,25 3,0
Шевронная , А 1 -J А /В>5 9=60° 0,27 3,16
Шевронная кольцевая ««-) -»f т _ 1 /?/К0=1,3 /г/Яо=0,75 0,22 2,57
На рис. 16.27 показана типичная кон-
струкция простейшего адсорбционного на-
соса. В табл. 16.5 приведены основные па-
раметры адсорбционных вакуум-насосов
промышленного изготовления [736].
Интересная конструкция адсорбционно-
го вакуум-насоса с большой подачей опи-
сана в [735]. Насос содержит 600 кг ад-
сорбента (цеолит). Диапазон рабочих дав-
лений 105—10~3 Па, предельный вакуум
5-10—5 Па. Быстрота откачки 9-Ю4 л/с по
азоту, 4-104л/с по кислороду, 2.104л/с по
аргону. Габариты: диаметр 2,88 м, высота
3,58 м.
Конденсационные криовакуумные насо-
сы. Криовакуумный насос представляет со-
бой аппарат с охлаждаемыми поверхностя-
ми (криопанелями), на которых конденси-
руются газообразные вещества, заполняв-
шие откачиваемый объем. Предельный ва-
куум такого насоса определяется давлени-
ем насыщения этих газов при соответству-
ющей температуре поверхности криопанели.
Данные по упругости паров газов см.
в табл. 4.26 и 4.27.
Для криовакуумной откачки всех газов
за исключением неона, водорода и гелия до
остаточного давления примерно 10-8 Па
Криометоды получения глубокого вакуума
385
Рис. 16.27. Схематичное устройство ад-
сорбционного вакуум-насоса:
/ — корпус; 2 — тонкостенная горловина; 3—сет-
чатый цнлнндр; 4—адсорбент (цеолит); 5 —
сосуд Дьюара с жидким азотом; 6 — электронаг-
реватель
достаточна температура около 20 К. Ис-
пользование более низких температур
(4 К) позволяет откачивать также неон и
водород, а с применением адсорбентов —
и гелий [587, 738]. Криовакуумная откачка
этих трудноконденсируемых газов возмож-
на также путем их адсорбции слоями ра-
нее осажденных на криопанели таких лег-
коконденсируемых газов, как диоксид угле-
рода, аммиак, фреон и пр. [740, 802]. Изо-
термы адсорбции таких слоев см ; в разд. 5.
Так как содержащиеся в воздухе неон,
водород и гелий суммарно имеют парциаль-
ное давление 2,4 Па, то нерационально ис-
пользовать крионасос для откачки с атмо-
сферного давления: обычно предварительно
рабочий объем откачивается каким-либо
вспомогательным средством до остаточного
давления не более 0,1 Па. Эта предвари-
тельная откачка уменьшает также толщину
слоя конденсата и тем самым увеличивает
время непрерывной работы крионасоеа.
Быстроту откачки крионасоса можио .оце-
нить по кинетической теории газов из урав-
нения
где s — удельная быстрота откачки (на
единицу поверхности), л/(см2-с); р —
давление газа в откачиваемом объеме, Па,
при температуре окружающей среды Т, К;
р' — давление насыщения, Па, при темпе-
ратуре холодной поверхности Т', К; м —
молекулярная масса откачиваемого газа.
Из уравнения, видно, что при р^>р'
быстрота откачки максимальна и равна
8Макс=3,64 КТ/м. С уменьшением пар-
циального давления газа быстрота откачки
уменьшается и при приближается к
нулю. Предельное остаточное давление
крионасоса рост=р' V~ Т/Т’
Действительная быстрота откачки, есте-
ственно, меньше расчетной. Для оценки это-
го различия вводится коэффициент захвата
с, который представляет собой отношение
массы газа, захватываемой рабочей поверх-
Таблица 16.5. Основные характеристики адсорбционных
(цеолитовых) вакуум-насосов [736]
Характерис тика Марка насоса
ЦБН-0,1-2 . ЦВН-0,3-2 ЦБН-1-2 ЦБН-1,5-3
Быстрота действия, л/с 2 4 6 10
Предельное минимальное давление, Па 1,3 6,6 1,3 2,6
Откачиваемый объем, л 10 30 100 100
Время откачки до предельного давления, ч 1 1,5 1 1
Расход жидкого азота (в установившем- ся режиме), л/ч 0,25 0,35 0,25 0,5
Количество цеолита (марки 5А), кг ОД 0,3 1 1,5
Время регенерации (при атмосферном дав- лении), ч 3 2 3 3
Мощность электронагревателя для реге- нерации, Вт 400 135 825 350
25—218
386
Криосистемы для физических исследований
Таблица 16.6. Значения коэффициента
захвата с для некоторых газов
[739, 350, 801]
Газ Температура, К Коэффициент захвата с
газа поверх- ности крнопа- нели
Пары воды зэо 77 0,85
Диоксид углерода 195 12 1,0
195 25 0,96
195 20 0,90
195 25 0,83
195 30 0,82
195 77 0,80
300 12 0,73
300 15,5 0,62
300 20,3 0,66
300 24,2 0,60
300 31 0,62
300 77 0,63
400 21 0,44
400 77 0,49
Оксид углерода 300 10 0,90
300 20 0,85
400 20 0,73
Аммиак 300 77 0,45
Азот 77 10 1,0
77 15 0,99
77 20 0,87
77 25 0,77
300 10 0,65
300 20 0,60
400 20 0,50
Аргон 77 10 1,0
77 15 0,93
77 20 0,79
77 25 0,77
300 10 0,68
300 20 0,66
400 20 0,50
Кислород 77 20 1,0
300 20 0,86
ностью насоса в единицу времени, к. полной
массе газа, падающей на ту же поверх-
ность в единицу времени.
Для данного газа и определенной тем-
пературы криопаиели коэффициент захвата
постоянен и мало зависит от температуры
(при условии, что режим течения остается
молекулярным, а температура криопаиели
достаточно низкая). Если давление газа
понижается, приближаясь к упругости пара
при данной температуре крнопанели, то
быстрота откачки и коэффициент захвата
также уменьшаются и становятся равными
нулю, когда давление сравнивается с упру-
гостью пара. В табл. 16.6 приведены зна-
чения коэффициента захвата некоторых га-
зов для неэкранированной поверхности
криопанели.
Для снижения потерь холода панели
криовакуумных насосов, имеющие темпера-
туру 20—4 К, должны надежно экраниро-
ваться поверхностями с температурой не
выше 100 К- Это экранирование приводит
к снижению коэффициента захвата (в луч-
шем случае примерно вдвое).
На рис. 16.28 приведены типичные кон-
фигурации криопанелей, используемых в
аэродинамических трубах (а) и в барока-
мерах для имитации космических условий
(б).
Малые криовакуумные насосы иногда
удобнее снабжать холодом не посредством
кипящих криоагентов, а от микрокриоген-
ных систем, работающих по обратному
циклу Стирлинга или квазициклу Гиффор-
да — Мак-Магона (см. § 12.9). НПО «Ми-
крокриогенмаш» изготовляет машины, на
базе которых создан ряд криовакуумных
иасосов. Их техническая характеристика
приведена в табл. 16.7 и 16.8 [741]. Насосы
работают с охлаждением криопанелей до
20 К при температуре радиационных экра-
нов 80—100 К-
Обзор по криовакуумным насосам и
описание крупных установок см. в [587,
742, 743, 800, 954, 960].
Рис. 16.28. Конструктивные схемы криопанелей [739], используемые в аэродинамиче-
ских трубах (а) и в камерах имитации космоса (б)
Сверхпроводящие материалы
387
Т аблица 16.7. Техническая характеристика криовакуумных насосов на базе
криогенных газовых машин, работающих по обратному циклу Стирлинга [741]
Характеристика Тип насоса
нвк 0,2 А-Г нвк 0,5 А-Г НВК 1 К-г нвк 2 А-Г нвк 5 к-г
Быстрота откачки, л/с (по юздуху, в диа- пазоне давлений 10—1—10_6 Па) 230 500 1000 2000 5000
Предельное остаточное давление, Па 10-8 10-8 10—6 10-8 10—6
Давление запуска, Па 1 1 0,5 1 0,5
Время выхода на режим, мин 30 40 63 80 100
Диаметр условного прохода, мм 100 160 250 320 400
Масса, кг 38 45 ПО 120 140
Ресурс работы, ч 1000 1000 1000 1000 1000
Таблица 16.8. Техническая характеристика криовакуумных иасосов на базе
микрокриогенных машин, работающих по квазициклу Гиффорда—Мак-Магоиа |
Характерно тика Тип насоса
НВК 0,3 А-Р нвк 0,6 А-Р нвк 1 К-Р нвк 3 А-Р нвк 5 К-Р
Быстрота откажи, л/с (по воздуху, в диа- пазоне давлений 10-1—10—5 Па) 300 630 1000 3000 5000
Предельное остаточное давление, Па 10-8 10-7 10—6 10-8 10-8
Давление запуска, Па 1 1 0,5 1 0,5
Время выхода на режим, мин 43 83 63 80 100
Диаметр условного прохода, мм Масса, кг: 100 163 250 320 400
собственно криовакуумного насоса 13 15 33 50 63
компрессора 33 30 200 93 93
Ресурс работы, ч 15 000 15 000 15 000 15 000 15 000
Раздел семнадцатый
СВЕРХПРОВОДЯЩИЕ УСТРОЙСТВА
17.1. СВЕРХПРОВОДЯЩИЕ
МАТЕРИАЛЫ
Из множества , сверхпроводников в на-
стоящее время используют .для технических
целей в основном ' сплав NbTi и‘интерме-
таллическое соединение Nb3Sn. Сверхпро-
водящие материалы на основе V3Ga выпу-
скают опытными сериями. Сверхпроводящие
материалы на основе Nb3Ge находятся в
стадии разработки. Получен сверхпроводник
Nb — 43% Ti — 25% Та [668], который
по плотности тока заметно превосходит про-
водник из NbTi, особенно при 1,8 К, но су-
щественно дороже его из-за высокой стои-
мости тантала.
Сверхпроводящий обмоточный провод
представляет собой композицию из сверх-
проводника и матрицы.1 В качестве послед-
ней пригодны металлы с хорошими тепло-
и электропроводностью: серебро,, медь, алю-
миний. Для сверхпроводящих ^материалов
на основе NbTi преимущественно" использу-
ют медную матрицу. Назначение матрицы—
прежде всего технологическое. Обычная
технология изготовления NbTi-сверхпрово-
дящего проводника заключается в следую-
щем: в отверстия медной заготовки закла-
дывают прутки из сверхпроводника, затем
эту композицию прессуют, протягивают,
термообрабатывают и, наконец, закручива-
ют. Такая технология позволяет получать
длинные куски сверхпроводящего провода и
одновременно уменьшает возможность об-
25'
388
Сверхпроводящие устройства
рыва сверхпроводящих жил. Другое назна-
чение матрицы — снижение опасности пе-
рехода сверхпроводника в нормальное со-
стояние. Характер этого перехода в значи-
тельной степени зависит от соотношения
8мат/5сп — площадей сечения, занятых
матрицей, и сверхпроводником. Если
Хмат/Зсп^Ю-г-ЗО, то превышение критиче-
ской плотности тока вызывает плавный пе-
реход части транспортного тока в нор-
мальный металл. Уменьшение плотности то-
ка или снижение температуры возвращает
систему в первоначальное состояние. Такие
системы называют полностью или крио-
статически стабилизированными. В них от-
сутствует опасность пережога провода при
переходе в нормальное состояние, однако
большое количество материала матрицы
снижает конструктивную плотность тока в
обмотке. Тем не менее последнее обстоя-
тельство для сверхпроводящих магнитных
систем (СМС) большого диаметра не при-
водит к значительному увеличению габари-
тов систем, так как толщина обмотки у них
составляет небольшую долю диаметра. Не-
достатком таких систем остается значи-
тельная охлаждаемая масса. Критерии
криостатической стабилизации см. в [619].
Следует иметь в виду, что теплоемкость
металлов, входящих в сверхпроводящую
композицию, при температуре жидкого ге-
лия очень низка, например у меди в 4000
раз ниже, чем при нормальной температу-
ре.. Поэтому очень небольшие тепловыделе-
ния могут локально повысить температуру
небольшого участка сверхпроводящего про-
вода выше критической. Если это произой-
дет, то в месте перехода будет выделяться
джоулева теплота, причем в том случае,
когда теплоотвод менее интенсивен, чем те-
пловыделения, нормальная зона начнет рас-
пространяться по сверхпроводнику. Для
примера можно рассмотреть сверхпроводя-
щий соленоид, выполненный из NbTi-прсво-
да и дающий среднюю магнитную индук-
цию 6 Тл [601]. При охлаждении его об-
мотки кипящим гелием (4,2 К) разница
между критической и рабочей температу-
рами составляет около 2 К. В этом случае
для перехода сверхпроводника в нормаль-
ное состояние достаточно тепловыделений
около 10~3 Дж/см3, а запасенная в солено-
иде энергия много больше — примерно
10 Дж/см3. Спонтанные тепловыделения в
сверхпроводящем проводе могут быть вы-
званы магнитными скачками потока (см.
§ 4.14) и механическими нестабильностя-
ми. Магнитную нестабильность уменьшает
снижение размера сверхпроводящей жилы
в композиции. Считают достаточным [648]
иметь сверхпроводящую жилу диаметром
меньше 50 мкм, скрученную в спираль с ша-
гом несколько сантиметров. Для таких
внутреннестабилизированных сверхпровод-
ников можно иметь 5мат/8сп=1,0=2,0.
Механические нестабильности возникают из-
за остаточных напряжений в сверхпроводя-
щем проводе и кабеле, при движении пло-
хо закрепленного провода, при растрески-
вании эпоксидной смолы, пропитывающей
изделия, и т. п. Например, в обмотке из
NbTi при плотности тока /=3-108 А/м2 и
В=6 Тл перемещение проводника на 6=
= 10 мкм совершит работу F=/B=
= 18 Дж/см3.
Механические нестабильности — основ-
ная причина уменьшения критического тока
(деградации) в изделии по сравнению с
критическим током в коротком образце
[652]. Многократный перевод (от несколь-
ких единиц до сотен раз) изделия из сверх-
проводящего в нормальное состояние сни-
мает остаточные напряжения и уменьшает
деградацию. К этому же приводит хорошее
бандажирование, уменьшение слоя эпоксид-
ной смолы, улучшение условий охлаждения.
Последнее обеспечивается, в частности, ис-
пользованием полых сверхпроводящих ка-
белей. На практике применяют два их ва-
рианта: электрическое сращивание сверхпро-
водящего провода с полыми медными труб-
ками [616] и намотку сверхпроводящего
провода на трубку [650, 651]. Преимущест-
ва полых сверхпроводящих кабелей: между
охлаждающим гелием и сверхпроводником
отсутствует электроизоляция, затрудняющая
теплоотвод от сверхпроводника, а посколь-
ку электроизоляция не мешает теплоотво-
ду, можно увеличить ее толщину и соот-
ветственно электрическую прочность; более
просто получить необходимую механиче-
скую прочность конструкции, так как бан-
дажирование не мешает теплоотводу;
уменьшается количество гелия в системе;
при переходе в нормальное состояние вски-
пание гелия менее опасно вследствие более
высокой прочности трубок. Недостатки по-
лых проводников: большое гидравлическое
сопротивление гелиевого тракта; некоторые
трудности равномерного распределения ге-
лия по параллельным каналам; снижение
конструктивной плотности тока в обмотке.
При использовании сверхпроводников
в устройствах переменного тока в них воз-
никают тепловыделения из-за гистерезисных
и вихревых потерь (расчет см. в [620]),
которые пропорциональны количеству сверх-
проводника и числу циклов изменения маг-
нитной индукции (тока).
Гистерезисные потери, обусловленные
необратимостью намагничивания сверхпро-
водников II рода, не зависят от скорости
изменения поля. Их снижают уменьшением
диаметра сверхпроводящих нитей, которому
они пропорциональны. Сейчас налажено
массовое производство композитных про-
водников с диаметром сверхпроводящих
NbTi-жил меньше 10 мкм. Есть сообщения
о сверхпроводниках с диаметром нитей 2—
3 мкм.
Вихревые потери, обусловленные проте-
канием индуцированных токов по нормаль-
Сверхпроводящие материалы
389
ной матрице композита, напротив, линейно
возрастают с увеличением скорости измене-
ния поля. Их можно снизить уменьшением
шага скрутки жил, квадрату которого они
пропорциональны. У современных мелкодис-
персных проводников шаг скрутки состав-
ляет 3—5 мм. Вихревые потери могут быть
также снижены путем ухудшения электро-
проводности матрицы. Однако здесь воз-
никает противоречие с условием динамиче-
ской стабилизации, требующим минималь-
ного электросопротивления матрицы.
В качестве компромисса иногда используют
сложную матрицу с медно-никелевыми пе-
регородками [620]. Появление вихревых
токов нежелательно и в сверхпроводящих
системах с постоянным током. В этих си-
стемах вихревые токи возникают при изме-
нении магнитной индукции в период перво-
начальной заводки тока и затем очень мед-
ленно затухают, вызывая отклонение ре-
альной магнитной индукции от расчетной.
Сверхпроводящие магнитные системы обыч-
но выполняют путем намотки не одиночного
провода, а кабеля. Обусловлено это тем,
что одиночный провод несет относительно
небольшой ток и магнитная система в этом
случае обладает большой индуктивностью,
что затрудняет эвакуацию энергии при пе-
реходе сверхпроводника в нормальное со-
стояние. Наиболее распространен кабель в
виде плоской скрутки [601]. В таком кабе-
ле отдельные провода транспонированы так,
что имеют одинаковое индуктивное сопро-
тивление. Провода в кабеле закрепляют
припоем или эпоксидной смолой. Пропитка
кабеля малоэлектропроводным составом
мешает перетеканию тока из одного прово-
да в другой и может вызвать деградацию,
если один из проводов окажется хуже дру-
гих. Пропитка хорошо проводящим соста-
вом облегчает возникновение вихревых то-
ков. Кабель, использованный для магнитов
ускорителя Фермилаб, пропитан припоем
на основе олова с 5% серебра. Этот же
припой испробован для пропиток кабелей
ОИЯИ [621]. При размещении плоского
кабеля перпендикулярно магнитному полю
потери возрастают по сравнению с разме-
щением параллельно полю [624].
Интерметаллическое соединение Nb3Sn5
обладает более высокими критическими па-
раметрами, чем NbTi, однако из-за хрупко-
сти Nb3Sn создать из него обмоточный ма-
териал металлургам удалось только в резуль-
тате больших усилий. Освоено получение
ленточного сверхпроводника осаждением
Nb3Sn из паров на подложку из молибде-
но-никелевой стали, а также путем нане-
сения олова на ниобиевую подложку. По-
верх слоя Nb3Sn наносят слой меди, а во
втором варианте добавляют ленту из не-
ржавеющей стали для создания прочности.
Поскольку сверхпроводник расположен в
осевой части ленты, а его толщина не пре-
вышает 2—3 мкм, лента легко изгибается
без разрушения сверхпроводящего слоя. По-
добная технология использована при полу-
чении ленты с V3Ga [657]. Диамагнетизм
ленты препятствует созданию из нее круп-
ных СМС. Более совершенна технология,
заключающаяся в протяжке ниобиевых
прутков в оловянной латуни до размеров
около 5 мкм [659]. Полученные провода по
данным фирмы Vacuumschmelze (ФРГ) мож-
но изгибать по радиусу, равному не менее
75 диаметрам провода. Можно наматывать
соленоиды нетермообработанным проводом
с меньшим радиусом гиба, но тогда после
намотки нужна термообработка в течение
64 ч при температуре 973 К в среде аргона.
При такой термообработке ужесточаются
требования к теплостойкости электроизоля-
ции.
Таблица 17.1. Провода обмоточные сверхпроводящие композиционные круглого
сечения на основе ниобий-титанового сплава НТ-50
Диаметр провода без изоляции, мм
Коэффи- циент Чис ло сверхпро- о,33 0,38 0,50 | 0,70 | 0.85 1,00 1,20 1,5 1,75 | 2,00 | 2,90
заполне- ния сверх- водящих жил в Диаметр провода с изоляцией, мм
проводки- провод- 0,39 0,43 | 0,58 | 0,79 0,95 1,11 1,32 | 1,62 - I 1
ком нике 1
Диаметр сверхпроводящей жилы, мкм
0,30 1 1 1 36 280 270 220 1 1 1 1 IS 76 SI 1 1 — — — — —
0,30 132 — — 24 34 41 48 58 72 84 96 —
0,40 48 — — 45 63 76 90 —
0,40 168 — — 24 34 41 48 58 72 84 96 —
0,42 1045 — — 10 14 17 20 24 30 35 40
0,50 60 — — 45 63 76 90 — .
0,50 210 — — 24 34 41 48 58 72 84 96
0,50 1010 — — — — — — — — — — 58
390
Сверхпроводящие устройства
Композиционные провода на базе ин-
терметаллических соединений обычно содер-
жат танталовые перегородки, препятствую-
щие диффузии олова или галлия в медь
и превращению ее в латунь. Иногда в про-
вод с Nb3Sn жилами закладывают для
прочности стальную проволоку [659]. Из
рис. 4.58 видно, что ниобий-титановые
сплавы целесообразно применять для по-
лучения индукций примерно до 10 Тл, нио-
бий-оловянные проводники пригодны до
18 Тл. Перспективными материалами с вы-
сокими критическими параметрами можно
считать VaGa и NbaGe. По своей структуре
они сходны с Nb3Sn, а проводчики из них
получают по сходным и оригинальным
[653] технологиям.
Таблица 17.2. Провода обмоточные
сверхпроводящие композиционные
прямоугольного сечения из сплава НТ-50
Размеры сечения провода, мм Коэффициент заполиейия Число сверхпро- 1 водящих жил । в проводе Диаметр сверх- проводящей жилы, мкм Критиче- ский ток в поле 5 Тл, А
Шири- на Тол- щина
2,0 2,0 0,15 456 40 360*
3,5 2,0 0,25 300 80 2300
3,5 2,0 0,35 39Э 80 2500
3,5 2,0 0,35 3630 30 2500
3,5 2,0 0,42 1045 60 2800
50 * в 3 поле 6 0,1 Гл. 7460 60 20 кА
Таблица 17.3. Провода обмоточные
сверхпроводящие композиционные
канального типа
Размерь), сечения, мм Размер трубок (2 шт. в проводе), мм Отношение медь—с верх- проводник Критический ток в поле 5 Тл, А
Шири- на Тол- щина Диа- метр Толщина стенки
10,2 4,4 3 0,5 9:1 4590
13,2 5,4 4 0,5 7:1 7000
В табл. 17.1—17.4 приведены техниче-
ские данные некоторых сверхпроводящих
проводов, выпускаемых отечественной про-
мышленностью [618, 622 т. IV]. Провода
круглого сечения (табл. 17.1) выпускают
без электроизоляции или в эмалевой изо-
ляции, выдерживающей пробивное напряже-
ние более 2000 В. Многожильные провода
скручены с шагом 25 мм. У стабилизирую-
щей меди отношение удельных электросо-
противлений рзоо/рм составляет более 100
при металлургическом способе изготовления
провода и более 200 при гальваническом
нанесении меди. Критическая плотность то-
ка при 5 Тл, отнесенная к площади сечения
сверхпроводника, в среднем составляет
1,5-105 А/см2. Провода используют для
создания транспонированных кабелей или
малых СМС с запасенной энергией до 200—
300 кДж.
Провода прямоугольного сечения
(табл. 17.2) используют для более крупных
СМС. Провода канального типа (табл. 17.3)
предназначены для СМС с циркуляционным
охлаждением гелием. Провода на основе
интерметаллических соединений (табл.
17.4) позволяют создавать СМС для высо-
ких магнитных индукций. Их выпускают в
термообработаином и нетермообработаниом
виде, со стабилизирующей медью и без нее.
В табл. 17.5 и 17.6 приведены техни-
ческие данные некоторых проводов, выпу-
скаемых зарубежными фирмами [623, 624].
В проводах фирмы Vacuumschmelze (ФРГ)
площадь медиого керна составляет 17+3%
всей площади поперечного сечения прово-
да. Танталовая перегородка защищает медь
от диффузии олова из бронзы, и, таким
образом, у меди сохраняется Значение
Рзоо/Р4,2 больше 50. Крупномасштабное про-
изводство сверхпроводников описано в
[675].
17.2. СВЕРХПРОВОДЯЩИЕ
МАГНИТНЫЕ СИСТЕМЫ
Сверхпроводящие магнитные системы
в физике высоких энергий. В установках
физики высоких энергий (ускорителях, ка-
налах, детекторах) оперируют с пучками
заряженных частиц, которые удерживают
на орбите, фокусируют, поворачивают по-
средством магнитного поля. Для этой цели
Т аблица 17.4. Провода обмоточные сверхпроводящие много»ильные на основе
интерметаллических соединений
Вид провода Диаметр (или площадь сечения) провода, мм Число жил Стабилизация медью Критический ток, А, в поле, Тл
7 8,5 12 15
Круглый. Плоский 0 1 27^2 7225 151725 Нет Есть 550 12 кА 500 240 [6 кА 100
Таблица 17.5. Характеристика серийно выпускаемых зарубежными фирмами сверхпроводящих материалов из сплавов NbTi [623]
Фирма Марка Тип Количест- во жил Диаметр жилы, мм Материал матрицы Состав, % Диаметр, мм Критиче- ский ток, А, при S—5 ТЛ
по сверхпро- воднику по медному покрытию .
IMI (Англия) Niomax S Niomax FMA61 Niomax FMC361 Niomax CN 25/33 25/43 20/43 A61/33 А61/4Э A61/50 C361/142 C361/100 C361/75 CNA61/25 1 1 1 61 61 61 361 361 361 61 0,028 0,034 0,042 0,043 0,33 0,023 0,021 Си Си Си Си Си Си Си Си Си CuNi Nb—44% Ti Nb—44% Ti Nb—44% Ti Nb—44% Ti Nb— 44% Ti Nb—44% Ti Nb—44% Ti Nb—44% Ti Nb—44% Ti Nb—44% Ti 0,25 0,25 0,23 0,33 0,40 0,40 0,33 0,40 0,50 1,42 1,00 0,75 0,25 62 62 38 51 75 117 206 366 736 32
Airco (США) — — 243 — CuNi 63—70%* <Ti — 1,0 0,5 0,4 605 193 125
— —- — — Си — — 1,0 0,5 0,4 400 110 75
IGC (США) Gryostrand Ti — 348 — CuNi 50% Ti* — 0,38 0,51 90 160
— 1,531 — — 53% Ti* — 0,38 0,51 83 140
— 438 — — 53% Ti* — 0,64 0,76 190 270
IGC (США) Cryostand Ti — 240 — — — —• 0,76 1,02 240 420
— 156 — — — 0,38 0,51 45 80
Furukava (Япония) TC-A TC-B TC-C —. 2,300 2,300 2,300 30 мкм 37 м м 36 мкм CuNi CuNi CuNi 50% Ti** 1,22X3,81 1,89X3,78 1,86X3,72 1,983 3,850 3,840
* Молярные доли, %.
** Массовые доли, %.
Сверхпроводящие магнитные системы
392
Сверхпроводящие устройства
Таблица 17.6. Характеристики серийно выпускаемых зарубежными фирмами
сверхпроводящих материалов иа основе интерметаллидов [623, 654]
Фирма (страна) Количест- во жил Диаметр жилы, мкм Материал матрицы Состав Минимальный диаметр изгиба, мм Диаметр (размер) по покрытию, мм Критический ток, А, в поле с индукцией 6 Тл
IMI Niomax NS (Англия) 1500 7 CuSn NbsSn — 0,5 270
Airco (США) 664 411 5 CuSn Nb3Sn 960 6X13,75 36 000
259 369 5 CuSn NbaSn 620 3,9X9,3 14 600
67 507 5 CuSn NbsSn 270 1,68X5 4400
24 871 5 CuSn NbaSn 160 1X2 1460
24 871 5 CuSn NbsSn 80 0,5X2 732
3553 5 CuSn Nb3Sn 60 0,36X1 220
- 1045 - 5 - CuSn Nb3Sn 50 0,3 -59
1045 5 CuSn NbaSn 50 О.з 66
, 67 500 5 CuSn NbaSn —— 3,2 1300
3553 5 CuSn NbaSn - 0,76 330
342 5 CuSn NbaSn — 0,2 37
Furukawa 1320—34 650 1—10 CuSn Nb3Sn 0,2-4-1X34-8 мм 5ХЮ5 А/см =
(Япония) 1320—34 650 1—10 CuGa VgGa — 0,2-j-lX3-i-8 мм (при 10 Тл)
5 Тл 10 Тл 12 Тл
Vacuumsch- 3700 3-4 CuSn Nb3Sn 60 0,4 201 71 44
melze (ФРГ) 6000 3—4 CuSn Nb8Sn 75 0,5 314 111 69
6000 3—4 CuSn Nb3Sn 90 0,6 410 150 91
10 000 3—4 CuSn NbsSn 105 0,7 615 217 135
10 000 3—4 CuSn Nb3Sn 120 0,8 770 282 171
10 000 3—4 CuSn NbsSn 135 0,9 924 338 205
10 000 3—4 CuSn с централь- NbsSn 120 0,8 664 243 154
-10 000 - 3—4 ным медным -керном NbaSn 135 0,9 826 280 166
10 000 3—4 и танталовой пере- городкой 150 1,0 989 335 198
использовали обычные электромагниты с
железным ярмом. Замена их на сверхпро-
водящие магниты сулит экономию электро-
энергии в 10—100 раз при сохранении
примерно тех же капитальных затрат. Пре-
имущество сверхпроводящих магнитных си-
стем особенно сказывается при необходимо^
сти получать поля с индукцией, превышаю-
щей индукцию насыщения железа. Наиболее
крупные, сверхпроводящие магниты созданы
для жидководородных пузырьковых камер
[601, 620, 625]. Параметры некоторых наи-
более характерных ж крупных сверхпрово-
дящих магнитов~приведены'в табл. 17.7. ’ ~
В качестве примера рассмотрим неко-
торые особенности одного из крупнейших в
мире сверхпроводящих магнитов — магнита
Большой европейской водородной' пузырь-
ковой камеры (ВЕВС). Общая компоновка
магнита и камеры ясна из рис. 16.20. На
рис. 17.1 показана секция магнита, кото-
рый выполнен в виде двух катушек Гельм-
гольца с опорой между ними. Опора откры-
вает проход для пучка частиц и восприни-
мает стягивающее усилие в 90 МН. Каж-
дая из катушек размещена в своем криоста-
те. Гелиевый сосуд вместе с размещенным
внутри него соленоидом подвешен к ваку-
умному кожуху криостата с помощью под-
вески. Подвеска передает стягивающее уси-
лие на вакуумный кожух и затем на опо-
ру. Большая протяженность подвески (око-
ло 2 м) позволяет ограничить теплоприток
по ней значением 25 .Вт. Каждая катушка
соленоида состоит из 10 пакетов, причем в
пакете находятся по два диска. Масса па-
кета 10 т. Пакеты разделены перфориро-
ванными стеклоэпоксидными пластинами
толщиной 18 мм, служащими одновременно
электроизоляцией и опорой. В радиальном
«правлении обмотка скреплена рядом на-
сладок 'и болтов. Сверхпроводящие ленты
юседних дисков для последовательного со-
единения размещают рядом, накладывают на
тих пластины из индия, затем из нержаве-
ощей стали и стягивают болтами [620].
Электрическое сопротивление такого соеди-
[ения в жидком гелии меньше 1010 Ом.
(амера и магнит окружены экраном из
талоуглеродистой стали толщиной 250 мм.
Экран ослабляет плотность магнитного по-
тока до 0,01 Тл на расстоянии 1 м за экра-
ном. Экран отстоит от катушек магнита на
3 м.
Особенности магнита Гиперон. Мощ-
ность, потребляемая сверхпроводящей си-
Таблица 17.7, Параметры некоторых крупных сверхпроводядих магнитов
Параметр Наименование установки чи организация £
12-футовая камера, ANL 15-футовая камера, FNAL Камера ВЕВС CERN Отеда, GERN Трубчатый диполь, CERN Гиперон ИТЭФ, НИИЭФА
Год пуска 1969 1972 1972 1972 1978 1979
Индукция в центре, Тл 1,8 3,0 3,5 1,8 1,9 6,3
Внутренний диаметр обмотки, м 4,78 4,27 4,72 3,58 1,9 1,2
Внешний диаметр, м 5,28 5,08 6,0 4,9 2,3 1,7
ВысотаХдлина, м 3,04 2,89 4,4 1,98 3,5 2X0,4-
Номинальный ток, кА 2,2 5,0 5,7 5,0 6,0 2,5
Плотность тока в проводнике, А-м—2 1,5-10’ 6,0-10’ 3,7-10’ 2,1-10’ 2,4-10’ 4,17-10’
Плотность тока в обмотке, А-м~2 0,8-10’ 1,9-10’ 1,0-10’ 1,3-10’ 1,8-10’ 2,65-10’
Запасенная энергия, МДж 83 430 833 50 23 24
Площадь селения проводника, мм2 50,8X2,54 37X3,8 61X3 '18X18; отверстие 9X9 18X18; отверстие 10 мм 23X4; 20X3
Отношение сечений нормального мате- риала и сверхпроводника 24 23 26 — — 12; 16
Диаметр жилы, мкм — 383 196—233 — — 2303; 1530
Количество жил 6 63 230—224 — — 4
Материал матрицы Си Си и припой Си Си Сц и припой Си
Охлаждаемая масса, т 96 — 366 — 40 8,8
Рефрижераторная мощность при 4,4 К, Вт 430 — 930 — — —
Расход жидкого гелия, л/ч 25 — — — — 25
Литература [623, 656] [656] [620, 634] [663] [650] [626, 627]
Примечание. ANL—Аргоннск^я национальная лаборатория, США; FNAL—Национальная лаборатория им. Ферми Батавия, США; CERN Европейский
центр ядерных исследований, Ж>Иева, Швейцария; ИТЭФ— Институт теоретической и экспериментальной физики, Москш, СССР; НИИЭФА—Научно-исследова-
тельский институт электрофизической аппаратуры им. Д. В. Ефремова, Ленинград, СССР.
Сверхпроводящие, магнитные системы
394
Сверхпроводящие) устройства
Рис. 17.1. Секция магнита камеры ВЕВС
[634];
1 — вакуумный кожух камеры; 2 — вакуумный
кожух криостата; 3 — подвеска криостата; 4 —
гелиевый сосуд криостата; 5 — катушка соленои-
да; 6—опора между катушками; 7 — трубопро-
вод для гелия и соединительного сверхпроводя-
щего провода
стемой, 360 кВт [при обычном (не сверх-
проводящем) исполнении магнита [626]
понадобилось бы 60 МВт]. Точная юсти-
ровка обмотки относительно магнитопрово-
Рис. 17.2, Конструкция кабеля трубчатого
диполя ЦЕРН [650]:
1 — профилированная медная шина; 2 - медная
трубка; 3 — ниобий-титановая проволока
да существенно уменьшила пондеромо-
торные силы, действующие на обмотку.
Шина магнита содержит четыре параллель-
ных сверхпроводящих провода. Остаточная
магнитная индукция 6-Ю-4 Тл. Мощность,
потребляемая гелиевыми рефрижераторами,
120 кВт.
Другим характерным магнитом может
служить трубчатый диполь CERN (ЦЕРН)
[650]. Обмотка этого магнита имеет сед-
лообразную форму. Конструкция сверх-
проводящего провода ясна из рис. 17.2. На
медную трубку 2 с отверстием 10 мм на-
мотаны спирально сверхпроводящие нио-
бий-титановые проволоки. Трубка заключе-
на в две медные профилированные шины,
образующие в сборе квадратную по сечению
шинку со стороной 18 мм. Композиция
пропитана мягким припоем. Конструкция
иполя ясна из рис. 17.3. Через обмотку
асосом продавливают гелий с массовой
коростью 150 г/с. На начальном участке
бмотки жидкий гелий охлажден ниже тем-
ературы кипения, затем он нагревается,
гановится двухфазным и выходит с паро-
эдержанием около 0,75. При более высо-
ком паросодержании на выходе наблюда-
лись нестабильности.
Существует ряд проектов сверхпрово-
дящих ускорителей [601, 628]. Магнитное
поле в них формируют с помощью сверх-
проводящих диполей и квадруполей. На
рис. 17.4 показан поперечный разрез ди-
польного магнита ускорителя Фермилаб
(Лаборатория им. Ферми, США). Обмотки
магнита охлаждают жидким гелием при
температуре 4,6 К, пропуская его по кана-
лам в обмотке 12 и через полость 5. По
каналу 4 течет противотоком двухфазный
гелий, который отводит теплоту от жидко-
го гелия и поглощает теплопритоки из ок-
ружающей среды. В магнитах Фермилаб
применяют железный магнитный экран, на-
ходящийся при нормальной температуре
(«теплое железо»). Недостаток такого экра-
на —< меньший вклад в магнитное поле;
достоинство — уменьшение массы матери-
ала, которую надо охладить до температу-
ры жидкого гелия.
Магнитные системы крупных сверхпро-
водящих ускорителей частиц состоят из со-
тен многометровых магнитов. Протяжен-
ность кольца ускорителя Фермилаб около
6 км, ускорителя УНК— около 20 км. Та-
кие протяженные магнитные системы нель-
зя ' криостатировать обычным «ванным»
способом главным образом из-за трудности
поддержания необходимого одинакового
уровня жидкого гелия в разных точках
системы. Поэтому во всех проектах сверх-
проводящих ускорителей-теплоотвод осуще-
ствляют однофазным жидким гелием.
В ускорителях Фермилаб и УНК низкую
температуру криостатирутощего жидкого ге-
лия поддерживают теплообменом внутри
магнита между жидким гелием и кипящим
Сверхпроводящие магнитные системы
395
Рис. 17.3. Трубчатый диполь ЦЕРН [650]:
/--трубчатая обмотка; 2— стальной вакуумный кожух; 3— растяжки (8 шт.) из титано-
вого сплава; 4 -- стяжка бандажа; 5 — титановые стержни, противостоящие горизонталь-
ным усилиям; 6 — бандаж из нержавеющей стали; 7 —внутренний цилиндр из нержавею-
щей стали
двухфазным гелием. В ускорителе «Изабел-
ла» жидкий гелий предварительно охлаж-
дают до 2,6 К, затем его разделяют на па-
раллельные потоки, идущие каждый через
свою цепочку магнитов. Охлаждая магни-
ты, гелий нагревается до 3,8 К и возвра-
щается в рефрижератор. В ускорителе «Ге-
ра» предусмотрены специальные теплооб-
менники для охлаждения жидкого гелия
после прохождения через группу магнитов
путем теплоотдачи к кипящему двухфаз-
ному гелию [628]. Непосредственное ох-
лаждение магнитов ускорителя двухфаз-
ным гелием упрощает криогенную систему
ускорителя, однако существуют опасения,
что двухфазный гелий может неравномер-
но распределяться по каналам. В этом слу-
чае усложняется также прокачка криоаген-
та через систему.
Помимо вышеописанного трубчатого
диполя постоянного тока имеется опыт ра-
боты с импульсным трубчатым магнитом
[629] типа «оконная рама», рассчитанным
на поле 2,5 Тл (рис. 17.5). Обмотка магни-
та выполнена из кабеля, представляющего
собой мельхиоровую трубку диаметром
5X0,5 мм, на которую навит 31 провод с
шагом 47 мм. Провод имеет диаметр 0,5 мм
и содержит 1045 ниобий-титановых жил
с шагом скрутки 3 мм. Витковая изоляция
выполнена из майларовой и стеклотексто-
литовой лент, пропитанных эпоксидным
компаундом. Деградация магнита практи-
чески отсутствует даже при паросодержа-
нии на выходе, близком к единице, и В=
=2 Тл/с. Дипольный магнит, изготовлен-
ный без применения эпоксидной смолы,
описан в [675].
Есть несколько проектов сверхпроводя-
щих циклотронов. Один из них запущен в
работу [663]. Сверхпроводящий магнит
для него по своей конструкции близок к
магнитам пузырьковых камер, но характе-
ризуется большей плотностью тока. Кабель
выполнен в виде медной ленты с навитыми
на нее с шагом 80 мм многожильными
ниобий-титановыми проводами. Индукция в
центре магнита 6 Тл, внутренний диаметр
обмотки—около 1,5 м, запасенная энер-
гия 16,8 МДж.
В физике высоких энергий используют
также постоянноточные сверхпроводящие
магниты для следующих целей: дипольные
и квадрупольные магниты — в каналах для
транспортировки заряженных частиц [601,
667]; септум-магнит—для расщепления
протонного пучка [664]; магниты для де-
тектирования и анализа частиц, возникаю-
щих при столкновении встречных пучков
[601]; «прозрачные» магниты, характери-
396
Сверхпроводящие устройства
Рис. 17.4. Поперечное сечение дипольного магнита Фермилаб серии Е22-14 [601]:
/— тепловой экран; 2 — вакуумная камера для пучка частиц (ионопровод); 3— сверхпроводящая
обмотка; 4 — двухфазный гелий; 5 — жидкий гелий; 6 — жидкий азот; 7—шихтованный желез-
ный магнитный экран; 8 — наружная вакуумная оболочка; 9 — роликовая опора; 10 — вакуумное
пространство с многослойной изоляцией; И — бандаж обмотки; 12—электроизоляцня с каналами
для гелия; 13 — установочное монтажное кольцо
зуемые минимальным количеством вещест-
ва на пути рассеянных частиц [666].
Сверхпроводящие магнитные системы
Рис. 17.5. Импульсный трубчатый магнит:
/ — трубчатый кабель; 2—сверхпроводящий про-
вод; 3 — бандаж из стеклоленты; 4— витковая
изоляция; 5 — проставка из текстолита; 6 — же-
лезное полуярмо; 7 — полуобмотки; 8— змеевик
для охлаждения ярма
для термоядерных реакторов [30, 616, 622,
630, 631, 635, 659, 666]. Принципиальная
схема реактора Токамак показана на
рис. 17.6 [631]. Плазму создает ток раз-
ряда в вакуумной камере, размещенной в
сильном магнитном поле обмоток торои-
дального магнита. Разряд вызывает вихре-
вое поле индуктора при изменении тока в
его обмотке. Обмотки управления поддер-
живают равновесие плазменного шнура, и
с их помощью регулируют форму попереч-
ного сечения плазмы. В бланкете осущест-
вляют воспроизводство трития за счет по-
глощения нейтронов литием и отводят теп-
лоту торможения нейтронов, которая со-
ставляет до 80% энергии при осуществле-
нии D—Т-синтеза.
В советских экспериментальных реак-
торах Т7, Т10 и Т15 для создания торои-
дального магнитного поля используют
сверхпроводящие соленоиды. В некоторых
зарубежных экспериментальных реакторах
(ДЖЕТ. ТФТР и ДЖТ-60), близких по сво-
им параметрам к Т15, применяют обычные
соленоиды. Общепризнано, что будущие
промышленные термоядерные реакторы бу-
дут экономичными только при использова-
нии сверхпроводящих магнитных систем
[630, 666]. У относительно небольших ре-
акторов соленоиды имеют круглую форму.
Сверхпроводящее магнитные системы
397
Рис. 17.6. Принципиальная схема реактора
Токамак [631]:
1 — вакуумная камера; 2 — соленоиды обмотки
тороидального поля; 3 — индуктор; 4 — обмотка
индуктора; 5—обмотка управления; 6—блан-
кет — поглотитель нейтронов
У крупных реакторов им придают D-об-
разную форму с прямой стороной, направ-
ленной внутрь тороида. Такая форма со-
ответствует более равномерному распреде-
лению пондеромоторных сил. В качестве
примера приводим основные параметры об-
мотки тороидального поля установки Т15
[630]: число соленоидов (круглой формы)
24; внутренний диаметр каждого из них —
около 1700 мм; максимальная индукция
в обмотке — до 8,3 Тл; энергия, запасен-
ная магнитным полем, — до 750 МДж;
масса сверхпроводника 90 т; охлаждаемая
масса 300 т; тепловыделения на уровне
4,5 К— 1250 Вт.
На рис. 17,7 показано сечение сверх-
проводящего провода для катушек торои-
дального магнита Т15. Предусмотрена цир-
куляционная система теплоотвода однофаз-
ным жидким или двухфазным гелием. При
разработке больших магнитов (LCT) для
Рис. 17.7. Сверхпроводящий провод для
термоядерного реактора Т15 [630]:
1 — медная матрица; 2 — проволока из Nb3Sn в
бронзовой матрице; 3 — кери из нержавеющей
стали; 4 — трубка для криостатирующего гелия
Европейского термоядерного реактора пред-
полагают использовать кабели, в которых
сверхпроводники расположены внутри кана-
ла для охлаждающего гелия. По одному
из вариантов [675] в канале квадратного
сечения располагают транспонированный
пучок из 500 NbsSn-проволок 0 0,7 мм.
По другому [675] в коробке из нержаве-
ющей стали с размерами 40ХЮ мм раз-
мещена двухслойная скрутка из прямо-
угольных NbTi-проводов. Между провода-
ми оставлено незаполненное пространство
для охлаждающего гелия. Два ряда про-
водов разделены хромоникелевой перего-
родкой. Между рядами проводов и стен-
ками коробки размещены дистанционные
проставки.
Сверхпроводящие магнитные системы
для магнитогидродинамических (МГД) ге-
нераторов [30, 631, 669, 670]. В МГД ге-
нераторах производят прямое преобразо-
вание теплоты в электрическую энергию
путем пропускания электропроводной плаз-
мы через магнитное поле (рис. 17.8).
Электропроводность горячего газа увели-
чивают путем присадки какого-либо из
щелочноземельных металлов — К, Cs. При
движении плазмы в магнитном поле воз-
никают ЭДС и ток между анодами и ка-
тодами. МГД генераторы позволяют повы-
сить КПД тепловых электростанций с 40
до 50—60% за счет использования более
высокой температуры. Лаверик [622] ука-
зывает также на привлекательность МГД
генераторов для военной техники, имея в
виду их способность к созданию больших
кратковременных импульсов энергии. Круп-
ные промышленные МГД установки не мо-
гут стать эффективными без использова-
Рис. 17.8. Схема канала МГД генератора
398
Сверхпроводящий устройства.
ния сверхпроводящих магнитов. Предпоч-
тение отдают седлообразным магнитам.
В качестве примера приводим некоторые
параметры СП магнита для МГД станции
мощностью 1000 МВт [30]: поле на оси
6 Тл; расстояние между обмотками 4 м;
высота обмоток 4 м; толщина обмоток
0,5 м; расстояние между лобовыми частями
12 м; полная длина обмоток 16 м; ток в
обмотке 5000 А; число ампер-витков 4-107;
индуктивность 800 Гн; запасенная энергия
Ю7 кДж; масса обмотки 270 т; охлаж-
денная масса — около 1400 т; масса
жидкого азота, необходимая для охлажде-
ния системы до 80 К, 500 т; объем жидко-
го гелия в системе 50 м3. Магнитная си-
стема для отечественной МГД установки
У-25 описана в [652].
Сверхпроводящие индуктивные нако-
пители энергии (СИНЭ) [30, 631]. Эти
установки обладают наиболее высокой
плотностью электроэнергии в единице объ-
ема по сравнению с другими видами нако-
пителей. Наиболее крупномасштабное при-
менение могут получить СИНЭ для вырав-
нивания пиковых нагрузок электросетей.
Так как размеры таких накопителей могут
достигать сотен метров, то целесообразно
опирать их с целью бандажирования на
скальные породы. Защиту окружающей ме-
стности от рассеянного магнитного поля
лучше всего обеспечивает подземное раз-
мещение СИНЭ. Меньшее рассеянное поле
дают тороидальные обмотки. В качестве
примера приводим данные [631] для СИНЭ
на 10 ГВт-ч: накопленная энергия
4,6-1013 Дж; запас энергии в конце раз-
рядки 1,1 ХЮ13 Дж; максимальная мощ-
ность 2500 МВт; напряжение, обеспечива-
ющее необходимую мощность в конце раз-
рядки, 103 000 В; индуктивность 37 000 Гн;
максимальное поле 4,5 Тл; рабочая темпе-
ратура 1,85 К; средний радиус обмотки
150 м; высота обмотки 100 м; радиальная
толщина обмотки 260 мм; длина провод-
ника 9,4-106 м; масса обмотки 9,6-Ю3 кг;
полная стоимость 304-106 долл.; удельные
капитальные затраты 32 долл/(кВт • ч).
В накопителе энергии на 30 МДж, кото-
рый запущен в Такома (США) в 1982 г.,
используют сверхпроводящий соленоид диа-
метром 3 м с индукцией 2,8 Тл.
Лабораторные сверхпроводящие маг-
нитные системы. Изготовление небольших
соленоидов с не очень большой магнитной
индукцией и невысокой однородностью по-
ля доступно практически для любой лабо-
ратории, и их изготовлено очень много.
Некоторые организации выпустили неболь-
шие серии лабораторных соленоидов '[632,
841].
В ряде случаев важное значение име-
ет однородность магнитного поля. В каче-
стве примера приводим параметры сверх-
проводящего соленоида ОИЯИ [634]: внут-
ренний диаметр 40 мм; максимальная ин-
дукция магнитного поля 8 Тл; однород-
ность поля в шаровом пространстве радиу-
сом 10 мм в центре соленоида 5-10-5, а
на участке оси соленоида длиной 200 мм —
10“2. С целью уменьшения расхода сверх-
проводника основная обмотка разделена
на три последовательно соединенные коак-
сиальные цилиндрические части. Внутрен-
няя, находящаяся в поле с наибольшей ин-
дукцией, намотана сверхпроводником диа-
метром 1,20 мм, средняя — 0,85 мм и внеш-
няя— 0,70 мм. Проводники содержат
61 NbTi-жилу в медной матрице с диа-
метром жил соответственно 110, 85 и 75 мкм.
Высота соленоида 322 мм. Коэффициент
заполнения у всех проводников — около
50%. Критический ток 147,8 А. Высокую
однородность поля обеспечивают корректи-
рующие катушки на . контурах соленоида.
Расчетные индукции реализованы с по-
грешностью 1,51% (см. также [673]).
Применение ниобий-оловянного сверх-
проводника позволило создать сверхпрово-
дящие соленоиды с индукцией, превыша-
ющей 15 Тл .[671—673]. В качестве при-
мера приводим параметры магнита [671]:
при 4,2 К индукция 15,8 Тл и ток 133 А;
при 3,0 К индукция 16,5 Тл и ток 140 А;
однородность поля 3-10-4 на 5 мм оси
центральной части соленоида; отверстие
диаметром 25,7 мм, внутренний диаметр
231 мм, длина 262 мм. Провод — лента ши-
риной 4 мм с Nb3Sn; испаряемость по
жидкому гелию 0,4 л/ч без тока и 1 л/ч
с током. В Кларедонской лаборатории [671]
такой соленоид с криостатом и вспомога-
тельным оборудованием установили на те-
лежке и используют в экспериментах на
различных установках. При термообработ-
ке соленоида, намотанного предварительно
не термообработанным NbsSn-проводом,
электроизоляция должна выдерживать на-
грев до 700 °C. С этой целью используют
стеклянную и кварцевую изоляции [675].
Стационарные магнитные индукции бо-
лее 15 Тл можно создать с помощью ком-
бинированных магнитных систем, у кото-
рых внутренний соленоид — обычный водо-
охлаждаемый, а внешний — сверхпроводя-
щий. В качестве примера приводим пара-
метры комбинированной магнитной систе-
мы КС-250 [636]. Система состоит из двух
внутренних водоохлаждаемых магнитных
секций с дисковой обмоткой и внешнего
сверхпроводящего соленоида. Каждая из
этих систем может работать независимо.
Водоохлаждаемая часть самостоятельно со-
здает индукцию 17,5 Тл в отверстии диа-
метром 30 мм. В комбинации со сверхпро-
водящим соленоидом индукция повышает-
ся до 25—26 Тл. Самостоятельно сверх-
проводящий соленоид создает индукцию
6,3 Тл в отверстии диаметром 300 мм. Вы-
сота соленоида 780 мм. Водоохлаждающая
часть потребляет мощность 5,6 МВт, сверх-
проводящая— около 250 кВт. По расче-
там для создания поля с индукцией 25 Тл
посредством только одной водоохлаждае-
Сверхпроводящие магнитные системы
399
мой части потребовалась бы мощность
14 МВт. Сверхпроводящий соленоид со-
бран нз 25 двойных галет, которые намо-
сечением
содержат
0,25 мм,
из
таны многожильной шиной
10X1 мм. Внутренние витки
30 NbTi-проволок диаметром
внешние — 30 аналогичных проволок
NbZr. Индуктивность СПС 4 Гн, запасен-
ная энергия 2 МДж. Гибридный магнит с
индукцией 30 Тл описан в [675]. Обзор
крупных магнитных систем см. в [675].
Методы расчета сверхпроводящих со-
леноидов даиы в [620, 646, 647]. Ниже
приведено несколько соотношений для
ориентировочных расчетов
Радиальное напряжение на внутрен-
ней поверхности обмотки бесконечно длин-
ного соленоида
п=0,51юД2=2л-10-7Д2,
' * S’ -7И«вкй4:.
где Н— напряженность магнитного поля,
А/м; цо—магнитная постоянная, равная
4л-10~7 Гн/м. Прочность катушки, выпол-
ненной как монолит, можно рассчитывать
по аналогии с трубой, испытывающей вну-
треннее давление р.
Магнитная индукция В, Тл на оси в
центре достаточно длинного соленоида
В = р,(1оп/,
где (1 — относительная магнитная прони-
цаемость; п — число витков провода на
единицу длины соленоида, м-1; / — ток в
проводе, А.
Величина ц для диамагнетиков (медь,
стекло) и парамагнетиков (воздух и его
компоненты) близка к единице, для ферро-
магнетиков много больше единицы.
Индуктивность соленоида
L=kp,opn2V2,
где L — индуктивность, Гн; V — объем со-
леноида, м3; k — коэффициент, зависящий
от отношения длины соленоида к его дна -
метру.
При отношении длины соленоида к его
диаметру много больше единицы k^\.
Запасенная энергия длинного соленои-
да, Дж, W=LI2/2.
Электрическая защита сверхпроводя-
щих магнитов [601]. Сверхпроводящие маг-
ниты аккумулируют значительное количе-
ство энергии (см. табл. 17.7). Выделение
этой энергии (при ее равномерном рас-
пределении по обмотке) вызывает нагрев
обмотки до температуры примерно 100—
150 К, что само по себе не опасно. Однако
локальное выделение аккумулированной
энергии может привести к местному пере-
греву н даже пережогу обмотки. Расчет
температуры нагрева обмотки см. в [601].
Опасно также вскипание охлаждающего
гелня, вызываемое теплоотдачей от нагре-
той обмотки. Поэтому для средних и
крупных сверхпроводящих систем преду-
сматривают устройства для эвакуации
запасенной энергии, включающие датчик
перехода в нормальное состояние [675],
переключатель тока и поглотитель энергии
(например, сопротивления). Электрическая
прочность электроизоляционных систем
сверхпроводящих магнитов позволяет по-
вышать напряжение при эвакуации до 1—
3 кВ. Криостатически стабилизированные
сверхпроводники не сгорают даже в том
случае, когда часть обмотки оказывается
выше уровня жидкого гелия [675].
Токовводы сверхпроводящих магнитов.
К средним и крупным сверхпроводящим
магнитам подводят ток, равный несколь-
ким килоамперам. Для этого необходимы
достаточно массивные токопроводы. Уве-
личение площади сечения токопровода сни-
жает джоулевы тепловыделения, но увели-
чивает теплоприток к криостатирующему
гелню теплопроводностью. Таким же обра-
зом влияет увеличение электропроводности
металла токоввода вследствие эквивалент-
ного увеличения его теплопроводности.
Теплоприток вследствие теплопровод-
ности токоввода можно снизить в несколь-
ко раз, охлаждая его парами гелия. В этом
случае конструкция токоввода [396, 632,
675, 676, 700] должна иметь развитую по-
верхность теплообмена. Есть методы рас-
чета оптимальной площади сечения токо-
провода [638, 923]. Хорошо спроектиро-
ванный охлаждаемый гелием токоввод вы-
зывает теплоприток, равный 1,0—1,ЗВт/кА.
Криогенное обеспечение сверхпроводя-
щих магнитов. Большинство сверхпроводя-
щих магнитов криостатируют погружным
способом, т. е. размещают сверхпроводя-
щую обмотку в ванне с кипящим жидким
гелием. Небольшие магниты питают
жидким гелием из сосудов Дьюара. Хо-
лодные пары гелия направляют на охлаж-
дение токовводов. Криостатирование круп-
ных сверхпроводящих магнитов осущест-
вляют посредством рядом стоящих гелие-
вых рефрижераторов. В этом случае боль-
шую часть испаряющегося гелия возвра-
щают в рефрижератор.
Гелиевый рефрижератор должен обес-
печивать три режима работы: охлаждение
большой массы металла, заполнение крио-
стата жидким гелием, поддержание посто-
янного уровня жидкого гелия в криостате.
При заполнении криостата жидким гелием
рефрижератор работает в сжижительном
режиме, при криостатировании — в рефри-
жераторном с частичным отводом холод-
ного гелия на охлаждение токовводов,
В сжижительном режиме через детандер-
ную ветвь должно идти примерно вдвое
больше гелия, чем в режиме криостатиро-
вання. Такая регулировка относительно
легко осуществляется в рефрижераторах
с поршневыми детандерами (например, ча-
стотой вращения привода). В то же время
расход через турбодетандеры однозначно
400
Сверхпроводящие устройства
определяется температурой и давлением
гелия перед машиной и сечением направ-
ляющего аппарата. Все эти величины прак-
тически не поддаются регулированию.
Вместе с тем турбодетандерные рефриже-
раторы обладают более высокой надеж-
ностью, чем рефрижераторы с поршневыми
машинами, поэтому в настоящее время все
крупные гелиевые установки создаются на
базе турбодетандеров (см. разд. 12). У ре-
ально существующих магнитных систем
время заполнения криостата жидким ге-
лием относительно невелико, поэтому ре-
фрижератор следует проектировать иа ра-
боту в режиме криостатирования, прене-
брегая отклонением от оптимального
режима во время заполнения криостата.
Для криостатирования сверхпроводя-
щих ускорителей предполагают использо-
вать однофазный жидкий гелий. Его полу-
чают отводом перед дроссельным клапа-
ном части сжатого гелия, который направ-
ляют для последующего охлаждения и
сжижения в теплообменник, погруженный
в ванну с кипящим гелием. В процессе
криостатирования однофазный гелий на-
гревается; температура его на выходе из
охлаждаемого магнита определяет допу-
стимую плотность тока в обмотке (повы-
шение температуры иа 0,1 К снижает кри-
тическую плотность тока примерно на
1,5%). Снизить нагрев однофазного гелия
можно его охлаждением двухфазным ге-
лием, как это предусматривают для сверх-
проводящих ускорителей, или увеличением
расхода однофазного гелия с помощью на-
соса или эжектора (см., например, [628]).
С целью увеличения магнитной индукции
в сверхпроводящих магнитах ускорителей
в настоящее время прорабатывают воз-
можность охлаждения их сверхтекучим ге-
лием [668].
17.3. СВЕРХПРОВОДЯЩИЕ
ЭЛЕКТРИЧЕСКИЕ МАШИНЫ
Существующие электрические машины
в обычном исполнении находятся на пре-
деле возможного по основным показате-
лям: мощности, КПД, габаритам. В турбо-
генераторах со сверхпроводящими обмот-
ками индукция магнитного поля может
быть увеличена примерно вдвое, одновре-
менно практически исключаются потери на
возбуждение. Это позволяет приблизитель-
но в 3 раза снизить массу турбогенерато-
ров и при небольшом увеличении диаметра
вдвое уменьшить длину, а также увели-
чить КПД. Сейчас предельная мощность
двухполюсных турбогенераторов — около
1300 МВт и четырехполюсных—около
1600 МВт [653]. Считают [622], что мощ-
ность сверхпроводящих турбогенераторов
может достигать 5000 МВт, а КПД 99,5—
99,8%. По другим оценкам '[30] КПД
Рис. 17.9. Система охлаждения ротора
сверхпроводящего . турбогенератора на
20 МВ-А [631]:
1 — муфта для снабжения гелием; 2 —обратный
поток теплого гелия; 3 — опора; 4 — радиальные
трубки; 5—труба для передачи момента враще-
ния со спиральным каналом для гелия; 6—сверх-
проводящая обмотка; 7 — кольцевое пространст-
во, занимаемое жидким гелием; 8 — паровое
пространство; 9 — вал; 10 — вакуумное простран-
ство; 11 — цилиндрическая поверхность жидкого
гелия (прн вращении); 12—каналы для пара;
13 — электромагдитный экран; 14 — теплорадна-
ционный экран; 15— центральная труба для по-
дачи жидкого гелия
сверхпроводящего турбогенератора выше,
чем у турбогенератора такой же мощности
в обычном исполнении, всего на 0,5%. По-
скольку современные сверхпроводники не
позволяют работать с токами промышлен-
ной частоты, в турбогенераторах перемен-
ного тока делают сверхпроводящей только
обмотку возбуждения, обычно размещае-
мую в роторе. При этом возникает доста-
точно сложная задача организации охлаж-
дения вращающегося криостата-ротора
жидким гелием. Одно из предлагаемых
решений показано на рис. 17.9. При вра-
щении ротора жидкий гелий внутри крио-
стата принимает форму горизонтального
полого цилиндра. Испаряющийся гелий по-
ступает в центральную полость этого ци-
линдра и затем используется для охлажде-
ния труб, которые передают момент вра-
щения от теплых частей ротора к холодным.
Каждый из трубчатых токовводов (на
рисунке не показаны) охлаждают отдельно
в саморегулируемом режиме — изменение
тепловой нагрузки изменяет поток гелия
в токоввод. На рис. 17.10 показана систе-
ма питания ротора гелием. Вращающийся
канал для жидкого гелия теплоизолиро-
ван. Щелевое уплотнение ограничивает
утечку гелия из места стыка неподвижной
и вращающейся труб. Теплый гелий из
труб (рис. 17.9) ротора идет каждый по
своему каналу, что обеспечивает независи-
мую регулировку охлаждения каждой из
труб. Остальные детали устройства систе-
мы питания ясны из рисунка.
В сверхпроводящем униполярном ге-
нераторе (рис. 17.11) электропроводный
(медный) диск вращают в магнитном по-
ле неподвижной сверхпроводящей обмоткч
возбуждения. Возникающий в диске ток
снимают щетками, расположенными у цен-
Сверхпроводящие линии электропередачи
401
Рис. 17.10. Система подвода гелия к ротору, изображенному на рис. 17.9:
1 — вход жидкого гелия из ожижителя; 2 — отверстие для контроля утечек; 3 — угольные
щелевые уплотнения; 4 — выход теплого гелня к ожижителю; 5 — уплотнение магнитной
жидкостью (от попадания воздуха и масла в гелий); 6— канал входа воздуха; 7 — реб-
ристое уплотнение; 8— лабиринтное уплотнение; 9 — качал впрыска масла; 10— вал рото-
ра; 11 — вход холодных жидкости и пара гелия в ротор: 12— выход теплого гелия из ро-
тора; 13 — выход масла; 14 — подшипники; 15 — выход утечек масла и воздуха; 16—
изолированная труба из нержавеющей стали; 17 — проход для гелия при переходе сверх-
проводника в нормальное состояние
тра и на периферии диска. Магнитное по-
ле, создаваемое током якоря между диском
Фарадея и неподвижным диском 8, имеет
азимутальное направление. Угол между
направлением индукции этого поля и по
лем возбуждения равен 90°, что позволяет
полностью устранить реакцию якоря. Та-
ким образом, сверхпроводящая обмотка не
подвержена механическим или магнитным
Рис. 17.11. Схематичный чертеж сверхпро-
водящего униполярного генератора диско-
вого типа [30]:
1 — поле обмотки возбуждения; 2 — диск Фара-
дея, 3 — сверхпроводящая обмотка (4,4 К); 4 —
тепловой экран (80 К); 5—оболочка криостата
(300 К); 6 — токосъемник; 7 —- зажимы маши-
ны; 8 — диск для компенсации сил реакции
26—218
воздействиям. Разность потенциалов меж-
ду центром и периферией диска примерно
50 В. Поэтому униполярные генераторы
удобны для питания электролизеров, где
нужен большой ток при невысоком напря-
жении. Униполярные машины обладают
легким малоииерциоиным якорем и пер-
спективны для создания тихоходных дви-
гател й большой мощности, например в
качестве реверсивного двигателя постоян-
ного тока для прокатных станов, а также
в качестве движителей морских судов
[631], особенно ледоколов [631]. Недостат-
ки униполярных машин — трудности полу-
чения высоких напряжений и создания
надежных скользящих контактов, напри-
мер жидкометаллических, на большой ток.
Необходимо также экранировать магнитное
поле, создаваемое сверхпроводящим индук-
тором. Пути решения этих проблем рас-
смотрены в [30]. Там же есть описание
униполярного сверхпроводящего двигателя
мощностью 2,42 МВт при 200 об/мин, ис-
пытанного в 1971 г. иа электростанции
в Фаули (Великобритания).
17.4. СВЕРХПРОВОДЯЩИЕ ЛИНИИ
ЭЛЕКТРОПЕРЕДАЧИ
Сверхпроводящие линии электропере-
дачи (СЛЭП) представляют интерес для
транспортирования больших мощностей и
в качестве кабельных вводов в промыш-
ленные центры. Коэффициент полезного
действия сверхпроводящего кабеля может
быть повышен до 99,5% по сравнению с
95% для обычного кабеля. Считают [637],
что сверхпроводящие кабели целесообраз-
402
Сверхпроводящие устройства
ны на переменном токе при мощности
2000—3000 МВ-А, на постоянном токе —
при мощности примерно 5000 МВ-А при
напряжении 500 кВ. СЛЭП должны вы-
держать конкуренцию с высоковольтными
воздушными ЛЭП, а также с другими ти-
пами кабелей; криорезистивными, маслона-
полненными высокого давления с принуди-
тельным охлаждением, заполненными эле-
газом (SF6). СЛЭП постоянного тока име-
ют преимущество над СЛЭП переменного
тока вследствие более высокой плотности
тока и уменьшения тока короткого замы-
кания. Повышают стоимость СЛЭП по-
стоянного тока концевые преобразователь-
ные устройства [30].
Конструкция кабеля может быть же-
сткой, полугибкой (рис. 17.12) и гибкой.
Гибкие кабели можно наворачивать на
барабан и монтировать отрезками длиной
до 200 м. Секции жесткого кабеля вряд ли
будут больше 20 м, и их монтаж окажет-
ся более трудоемким, чем гибкого. У полу-
гибких кабелей изгиб допускают только
внутренние жилы, которые можно, перево-
зить на барабанах и вставлять в смонти-
рованную жесткую оболочку. В полугиб-
ких и гибких кабелях проще решается
вопрос компенсации термической усадки
холодных частей.
Для СЛЭП постоянного тока предпо-
лагают использовать NbTi и NbsSn-сверх-
проводники. Для СЛЭП переменного тока
пригоден также Nb, который обладает бо-
лее низкими потерями на промышленных
частотах, дешевле, легче обрабатывается и
обладает достаточно высокой плотностью
тока при низких магнитных индукциях
(0,2—0,5 Тл), характерных для СЛЭП.
Сверхпроводники для СЛЭП должны быть
Рис. 17.12. Полугибкий сверхпроводящий
кабель переменного тока [631]:
1 — внешняя стальная труба; 2 — многослойная
теплоизоляция; 3— опора кабеля; 4 — гелиевая
труба; 5—охлаждающий гелий; 6 — сверхпро-
водник; 7 — ленточная электроизоляция; 8 —
азотный экран; 9 — опорная тележка с ролика-
ми; 10— азотопровод; 11 — вакуумное простран-
ство
стабилизированы алюминием или медью..
Существуют трудности в создании сверх-
проводников для СЛЭП переменного тока
из-за больших токов короткого замыкания;
Ленточная электроизоляция для СЛЭП
переменного тока должна обладать низким
коэффициентом потерь (tg6«10~5 при
4 К), этому требованию удовлетворяют
неполярные пластмассы, например поли-
этилен.
Так же как и в крупных ускорителях
(§ 17.2), криостатирование проводника-
предполагают осуществлять охлажденным
жидким гелием, поэтому криогенная часть
СЛЭП в большинстве проектов традицион-
на: полости с охлаждающим гелием окру-
жены азотным экраном и все вместе за-
ключены в вакуумную теплоизоляцию.
Считают, что расстояние между криоген-
ными станциями составит примерно 10 км.
Отсюда возникают специфические трудно-
сти, обусловленные необходимостью транс-
портировать криоагенты по длинным кана-
лам. Теплопритоки и тепловыделения оце-
нивают в 34 Вт/(км-МВт) для СЛЭП пе-
ременного тока и в 5,5 Вт/(км-МВт) для
СЛЭП постоянного тока [30].
17.5. ТРАНСПОРТ НА МАГНИТНОЙ
ПОДУШКЕ
Для обычного колесного железнодо-
рожного транспорта технический предел-
скорости 250—300 км/ч. Считают [30, 659],
что на линиях с напряженным пассажир-
ским потоком, таких как Токио — Осака
или Вашингтон — Бостон, целесообразно
создать поезда на магнитной подушке,
развивающие скорости до 500 км/ч. Осно-
вополагающий принцип: сверхпроводящий
магнит, размещенный в вагоне и движу-
щийся- с ним, создает магнитную индук-
цию в путевых шинах из обычного про-
водника, в результате чего возникает от-
талкивающая сила, поддерживающая ва-
гон в подвешенном состоянии. С точки
зрения охраны окружающей среды лучшим
движителем, по-видимому, будет линейный-
синхронный или асинхронный двигатель, в
котором статор развернут вдоль пути, и
поэтому поезд не нуждается в подаче
энергии для движения.
Магнитная- система в целом должна
обеспечить устойчивость поезда к возму-
щениям (порывы ветра, кривизна пути
и пр.)-. Естественно требование к транс-
портной магнитной системе — невысокие
масса и габариты. Тем же требованиям
должен удовлетворять гелиевый рефриже-
ратор: Считают, что пассажирский салон
должен быть экранирован от магнитного
поля до уровня индукции 0,005 Тл. Неко-
торую трудность представляет создание
малотеплопроводных опор для передачи
усилий от холодной сверхпроводящей ка-
Сверхпроводящие устройства для научных исследований
403
тушки к теплым силовым элементам ва-
гона. Опытные образцы вагонов со сверх-
проводящим магнитным подвесом созданы
.в ФРГ [666] и Японии [659].
17.6. СВЕРХПРОВОДЯЩИЕ
УСТРОЙСТВА ДЛЯ НАУЧНЫХ
ИССЛЕДОВАНИЙ 1
Квантовые сверхпроводящие интерфе-
рометры (КСИ), являющиеся, так же как
лазеры и мазеры, макроскопическими кван-
товыми приборами, открыли совершенно
новые возможности в измерении слабых
магнитных полей и их градиентов, а так-
же электрических токов и напряжений.
Чувствительным элементом КСИ служит
сквид — сверхпроводящий квантовый ин-
терференционный датчик, работа которого
базируется на эффекте квантования маг-
нитного потока в сверхпроводниках и эф-
фекта Джозефсона [640]. Эксперименталь-
но высокая чувствительность сквидов к
магнитным полям определяется тем, что
«сверхэлектроны» (куперовские пары) в
•сверхпроводящем теле сквида перестраи-
вают свое движение под действием внеш-
него поля когерентно, а масштабом этой
перестройки служит квант магнитного по-
тока Фо=2,О7-1О-15 Тл-м2. Эта когерент-
ность позволяет относительно простыми
методами, базирующимися на эффекте
Джозефсона, наблюдать за перестройкой
•системы куперовских пар и в конечном
итоге — за внешними полями, приложен-
ными к сквиду. Высокая чувствительность
•сквида сочетается с целым рядом других
весьма важных с технической точки зрения
качеств: сквид может быть сделан весьма
малым (до микронных размеров), трех-
компонентным, т. е. измеряющим раздель-
но все компоненты магнитного поля, гра-
.диентометрическим, т. е. чувствительным
только к градиентам поля, и достаточно
широкополосным, измеряющим как посто-
янные магнитные поля, так и -переменные
•вплоть до частот 1 МГц и выше. Кроме
того, в силу своей квантовой природы
сквид в принципе обладает исключитель-
но широким динамическим диапазоном (до
1013), с его помощью можно измерять маг-
нитную индукцию до 0,1 Тл с погрешно-
стью ГО-14 Тл при высокой линейности во
всем диапазоне.
На рис. 17.13 приведены основные ти-
пы джозефсоновских контактов, исполь-
зуемых в сквидах. По принципу действия
и конструкции сквиды делятся на сквиды
постоянного тока (пт-сквиды) (рис. 17.14),
Рис. 17.14. Сквид постоянного тока [639]:
1 — винты из ниобия; 2 — майларовая проклад-
ка; 3 — ниобиевый цилиндр
которые содержат не менее двух джозеф-
соновских переходов, и на радиочастотные
(рч-сквиды), обычно имеющие один джо-
зефсоновский контакт (рис. 17.15). По
числу индуктивностей, шунтирующих джо-
зефсоновский контакт, сквиды делятся на
одно-, двух- и многоиндуктивные. Одн-о-
индуктивные чувствительны к магнитному
потоку, приложенному к сквиду. Двухин-
дуктивные обычно имеют встречно вклю-
ченные индуктивности н чувствительны к
градиенту магнитного потока (при равен-
стве индуктивностей). Согласованное
включение индуктивностей в многоиндук-
тивном сквиде позволяет увеличить чув-
ствительность по сравнению с одноиндук-
тивным в результате сложения эффектов
[641].
Применение сквидов открыло широкие
возможности перед исследователями во
всех областях науки и практики, где тре-
буется высокоточное измерение магнитных
и электрических величин или параметров,
’ В подготовке материалов § 17.6 принимал
участие Б. В. Васильев,
Рис. 17.13. Основные типы джозефсоновских контактов, используемых в сквидах
[680]:
„-туннельный контакт сверхпроводник - окисная пленка - сверхпроводник; б - точечный кон-
“актТун”е±ЬплеНочный мостиковый контакт; А и В — сверхпроводник (ниобий); /-подложка;
2 — окисная пленка; 3 — точка контакта .(диаметр около 1 мкм); 4 — мостик с линейными разме-
рами около 1 мкм
26*
404
Сверхпроводящие устройства
Рис. 17.15. Некоторые характерные типы
радиочастотных сквидов {680]:
а — одноиндуктнвный; б — двухиндуктивный; в—
многонндуктивиый; винты и корпус выполне-
ны из ниобия. Характерные размеры: диаметр
контакта 1 мкм, диаметр отверстия 2 мм, диа-
метр корпуса 10 мм
преобразуемых в электрические и магнит-
ные величины.
К настоящему времени только в обла-
сти экспериментов, которые могут быть от-
несены к фундаментальной физике, с по-
мощью сквидов ведется поиск кварков
[677], гравитационных волн [677], элек-
трического дипольного момента электрона
[642], проведена проверка принципа экви-
валентности [643]. В других лабораторных
экспериментах со сквидами проводилось
измерение электронного и ядерного магне-
тизма в твердых телах при низких тем-
пературах и малых магнитных полях [677],
исследование магнитной восприимчивости
мельчайших биохимических образцов в
широком диапазоне температур [639], изу-
чалось поведение намагниченности малых
сверхпроводящих образцов вблизи точки
перехода [677] и многое другое.
Важной областью применения скви-
дов служит лабораторная магнитометрия
горных пород [681], а также полевая маг-
нитометрия для разведки полезных иско-
паемых, для предсказания возможных зем-
летрясений и исследования флуктуаций
земного магнитного поля [681]. Сквиды
находят применение в космических иссле-
дованиях [678], имеется информация [679]
об их использовании в военном деле —для
глобальной связи с подводными лодками
в погруженном состоянии.
С появлением сквидов широкое поле
деятельности открылось перед исследова-
телями магнитной активности человеческо-
го организма [639]. Сквиды позволяют
бесконтактно получать богатую информа-
цию о работе человеческих мускулов и
глаз и, что особенно важно, о работе серд-
ца и мозга [639]. Можно ожидать, что-
применение сквидов в ближайшие годы со-
здаст новый этап в вычислительной тех-
нике: при исключительной компактности и
малой потребляемой мощности вычисли-
тельные машины смогут осуществлять-
109 операций в секунду, имея оператив-
ную память 1010 бит [677].
Сквиды приобрели всеобщее распро-
странение и используются во всех обла-
стях измерительной техники, где требует-
ся высокая точность при хорошей стабиль-
ности и надежности. Детально с работой
сквидов и их применениями можно озна-
комиться в обзорах [639, 641, 677, 679—
681].
Элементы вычислительной техники.
Сверхпроводники 1-го рода обладают не-
обходимыми свойствами элементов вычис-
лительных машин: двумя устойчивыми со-
стояниями, очень большими скоростями пе-
реключения состояний, малыми размерами,,
низкими энергетическими потерями и ма-
лым потреблением энергии [644]. В каче-
стве переключающего устройства исполь-
зуют криотрон. Простейшим криотроном'
может служить сверхпроводящий стержень,
(например, танталовый) с низким крити-
ческим током, на который навита изолиро-
ванная спираль из сверхпроводящей про-
волоки с более высоким критическим то-
ком (например, ниобиевая). При повыше-
нии тока в спирали увеличивается магнит-
ное поле, в результате чего стержень пе-
реходит в нормальное состояние (выклю-
чение) ; снижение тока в спирали возвра-
щает стержень в сверхпроводящее состоя-
ние (включение).
Типичный пленочный криотрон пока-
зан на рис. 17.16. Свинцовая базовая пла-
та уменьшает индуктивность управляюще-
го контура. Типичная ширина управляющей
полоски 40 мкм, что в 10 раз меньше ши-
рины вентильной полоски. Слои сверхпро-
водника электрически изолируют пленкой
окиси кремния. Толщина напыленных слоев-
сверхпроводника — около 1 мкм. Время
переключения 0,188 мкс. Ток в управляю-
щей и вентильной полосках 300 мА. За-
Рис. 17.16. Напыленный пленочный крио-
трон [644]:
1 — свинцовая управляющая обмотка; 2 — свин-
цовая базовая плата; 3 — первый изоляционный
слой (окись кремния); 4 — питание; 5 —оловян-
иая пленка вентиля; 6 — второй изоляционный*
слой
Сверхпровод ящие устройства для научных исследований
405
пасенная энергия 2-Ю-11 Дж. В качестве
запоминающего устройства применяют
ячейку Кроу [644, 682], в которой двоич-
ную информацию фиксируют в виде неза-
тухающих токов в сверхпроводящей (оло-
вянной) перемычке Подробнее см. [644,
645, 677, 682].
Сверхпроводящие резонаторы [644,
645, 682]. Высокочастотные резонато-
ры — это полости, в которых возбуждают
переменное электрическое поле посредст-
вом высокочастотных источников пита-
ния. В поверхностном слое резонаторов
возникают существенные потери энергии.
Нанесение сверхпроводников иа поверх-
ность резонаторов уменьшает эти потери
(увеличивает добротность—отношение под-
веденной энергии к потерянной). На ниобие-
вых резонаторах получена добротность
5-1011. Добротность свинцовых резонаторов
с зеркальным покрытием высокой чистоты и
однородности 1010. Добротность медных ре-
зонаторов при 4 К Ю4—10s. На базе сверх-
проводящих резонаторов создают линейные
ускорители частиц, стабилизаторы часто-
ты, накопители энергии, антенны, конвер-
теры частоты, выпрямители и др.
Сверхпроводящие болометры [644,
645, 683]. При измерении инфракрасного
излучения очень малой интенсивности су-
щественные помехи вносят тепловые шу-
мы. Для снижения уровня шумов исполь-
зуют сверхпроводящие болометры.
Один из вариантов сверхпроводяще-
го болометра описан в [683]. Кусочек
сверхпроводника вмонтирован в поверх-
ность, температура которой поддерживает-
ся равней средней температуре сверхпрово-
дящего перехода. По сверхпроводнику
течет неизменный по значению ток. Вос-
принимаемое излучение прерывается зуб-
цами вращающегося колеса с определен-
ной частотой. С этой же частотой изменя-
ются температура и напряжение иа сверх-
проводнике, причем чем выше энергия из-
лучения, тем больше амплитуда их коле-
баний. Чувствительность оловянно-констан-
танового болометра З-Ю-12 Вт. Другой ва-
риант болометра с оловянным детектором и
чувствительностью 10-12 Вт описан в [644].
Сверхпроводящие подшипники [683] и
гироскоп [644]. В этих устройствах сверх-
проводящий вал подшипника или шар ги-
роскопа, выполняемые обычно из ниобия,
обладающего свойством диамагнетизма,
поддерживают во взвешенном состоянии
магнитным полем сверхпроводящего соле-
ноида. Поддерживающее магнитное дав-
ление у подпятника — около 0,03 МПа.
Ниобяевый шар в гироскопе первона-
чально раскручивают струей газообразного
гелия. Затем в пространстве, где вращает-
ся гироскоп, создают вакуум около
1,3-10~3 Па. Полость, в которой вращается
шар, погружена в криостат с жидким ге-
лием, где размещен сверхпроводящий со-
леноид, создающий поле, поддерживающее
шар.
Сверхпроводящий указатель уровня
[683]. Для этой цели используют верти-
кальную сверхпроводящую проволоку, по
которой пропускают ток. Нижняя часть
проволоки, расположенная под уровнем
жидкого гелия, находится в сверхпроводя-
щем состоянии, верхняя — в нормальном.
Чем выше уровень жидкого гелия, тем
меньше сопротивление проволоки. В отсут-
ствие магнитного поля используют манга-
ниновую проволоку, покрытую свиицово-
оловяиным припоем с содержанием 40%
свинца. Толщина б слоя припоя находится
в диапазоне 0,15 мкм<6<1,5 мкм. В маг-
нитном поле можно использовать кратко-
временно включаемую проволоку из жест-
кого сверхпроводника.
Чтобы устранить влияния продольной
теплопроводности проволоки и запаздыва-
ния перехода в нормальное состояние при
быстром понижении уровня жидкого ге-
лия, в некоторых уровнемерах [852, 912]
вокруг измерительной проволоки наматы-
вают маломощный нагреватель. В качест-
ве щупа можно использовать маленькую
катушку из сверхпроводника, переходящую
в сверхпроводящее состояние при сопри-
косновении с жидким гелием.
Обширный материал по сверхпрово-
дящим устройствам публикуется в трудах
конференций: по магнитной технологии
(Magnet Technology—МТ); по ускоритель-
ной технике (Particle Accelrator Confe-
rence) : по прикладной сверхпроводимости
(Proceedings of Applied Superconducting
Conference); по криогенной технике (Inter-
national Cryogenic Engineering Confe-
rence—ICEC); в трудах американских на-
циональных конференций по криогенной
технике (Advances in Cryogenic Enginee-
ring); в трудах советских национальных
конференций по ускорительной технике
[622, 631]; в журналах Cryogenics, IEEE
Transactions on Magnetics; см. также [353].
406
Список литературы
СПИСОК ЛИТЕРАТУРЫ
1. ГОСТ 8.417-81. Единицы физических
величин.
2. Методические указания. Внедрение
и применение СТСЭВ 1052-78. М.: Изд-во
стандартов, 1979. 56 с.
3. Бурдун Г. Д. Справочник по между-
народной системе единиц. М.: Изд-во стан-
дартов, 1980. 232 с.
4. Фундаментальные физические кон-
•станты ГСССД1-76. М.: Изд-во стандартов,
1976. 8 с.
5. Дэшман С. Научные основы вакуум-
ной техники. М.: Мир, 1964. 715 с.
6. Ландау Л. Д., Лифшиц Е. М. Ста-
тистическая физика. М.: Наука, 1976. 584 с.
7. Кикоин А. К., Кикоин И. К. Моле-
кулярная физика. М.: Наука, 1976. 480 с.
8. Вукалович М. П., Новиков И. И.
Термодинамика. М,- Машиностроение, 1972,
670 с.
9. Кириллин В. А., Сычев В. В., Шейи-
длин А. Е. Техническая термодинамика. 3-е
изд. М.: Наука, 1979. 512 с.
10. Додж Б. Химическая термодинами-
ка. М.: ИЛ, 1950. 766 с.
11. Сивухин Д. В. Общий курс физи-
ки, т. II. М.: Наука, 1975. 551 с.
12. Центробежные компрессорные ма-
шины/ Ф. М. Чистяков и др. М.: Машино-
строение, 1969. 327 с.
13. Рис В. Ф. Центробежные компрес-
сорные машины. Л.: Машиностроение, 1981.
351 с.
14„ Архаров А. М., Марфеиииа И. В.,
Микулин Е. И. Теория и расчет криогенных
систем. М.: Машиностроение, 1978. 415 с.
15. Бродянский В. М. Эксергетический
метод термодинамического анализа. М.:
Энергия, 1973. 296 с.
16. Бродянский В. М., Семенов А. М.
Термодинамические основы криогенной тех-
ники. М.: Энергия, 1980. 447 с.
17. Бэр Г. Д. Техническая термодина-
мика: Пер. с нем. М.: Мир, 1977. 518 с.
18. Коган В. Б., Фридман В. М., Ка-
фаров В. В. Равновесие между жидкостью
и паром, т. 1; т. 2. М.: Наука, 1966. 640 с.;
641 с.
19. ГОСТ 21957-76. Техника криоген-
ная. Термины и определения.
20. Справочник по физико-техническим
основам криогеники. 2-е изд./ М. П. Мал-
ков, И. Б. Данилов, А. Г. Зельдович,
Л. Г. Фрадков. М.: Энергия, 1973. 392 с.
21. Вассерман А. А., Казавчинский Я.З.,
Рабинович В. А. Теплофизические свойства
воздуха и его компонентов М-.: Наука,
1966. 375 с.
22. Вассерман А. А., Рабинович В. А.
Теплофизические свойства жидкого воздуха
и его компонентов. М.: Изд-во стандартов,
1968. 239 с.
23. Термодинамические свойства возду-
ха/ В. В. Сычев, А. А. Вассерман и др. М.:
Изд-во стандартов, 1978. 275 с.
24. Термодинамические свойства азота/
В. В. Сычев, А. А. Вассерман и др. М.:
Изд-во стандартов, 1978. 352 с.
25. Свойства жидкого и твердого ге-
лия/ Б. И. Есельсон, В. И. Григорьев и др.
М.: Изд-во стандартов, 1978. 127 с.
25а. Свойства жидкого и твердого ге-
лия. Растворы 3Не—4Не. Справочник. Киев:
Наукова думка, 1982. 231 с.
26. Свойства жидкого и твердого водо-
рода/ Б. И. Есельсон, Ю. П. Благой и др.
М.: Изд-во стандартов, 1969. 136 с.
27. Термодинамические свойства мета-
на/ В. В. Сычев, А. А. Вассерман, В. А. За-
горученко и др. М.: Изд-во стандартов,
1979. 349 с.
28. Термодиначеские и транспортные
свойства этилена и пропилена/ Д. М. Ва-
щенко, Ю. Ф. Войков и др. М.: Изд-Во
стандартов, 1971, 183 с.
29. Теплофизические свойства неона,
аргона, криптона и ксенона/ В. А. Рабино-
вич, А. А. Вассерман и др. М.: Изд-во
стандартов, 1976. 636 с.
30. Сверхпроводящие машины и устрой-
ства: Пер. с англ./ Под ред. Е. Ю. Кли-
менко С. Фокера, Б Шварца. М.: Мир,
1977. 763 с.
31. Физика низких температур: Пер.
с англ./ Под ред. А. И. Шальникова. М.:
ИЛ, 1959. 937 с.
32. Равновесие между жидкостью и па-
ромГПер. с англ./ Э. Хала, И. Пик и др.
М.: ИЛ, 1962. 438 с.
33. Кафаров В. В. Основы массопере-
дачи. М.: Высшая школа, 1972. 494 с.
34. Брунауэр С. Адсорбция газов и па-
ров. М.: ИЛ, 1948. 783 с.
Список литературы
407
35. Бурбо П. ЖФХ, 1944, т. 18, №5—
6, с. 253—257.
36. Алтунин В. В. Теплофизические
свойства двуокиси углерода. М.: Изд-во
стандартов, 1975. 551 с.
37. Шаргут Я., Петела Р. Эксергия:
Пер. с польск./ Под ред. В. М. Бродянско-
го. М.: Энергия, Г968. 279 с.
38. Жидкий водород: Сборник перево-
дов/ Под ред. М. П. Малкова. М.: Мир,
1964. 416 с.
39. Большаков П. Е., Гельпеоин И. И.,
Остронов М. Г. ЖФХ, 1966, т. 40, № 8,
с. 1914—1920; там же, 1967, т. 41, № 9,
с. 2174—2176; там же, 1967, т. 41, с. 369—
372, с. 689—691.
40. Павлов К. Ф., Малков М. П. Хо-
лод в химической промышленности. Л.:
Химтеорет, 1937. 366 с.
41. Герш С. Я. Глубокое охлаждение.
М.—Л.: Энергия, 1957. Ч. I. 392 с.; 1960.
Ч. II. 496 с.
42. Серпионова Е. Н. Промышленная
адсорбция газов и паров. М.: Высшая шко-
ла, 1969. 414 с.
43. Техника низких температур/ Под
ред. Е. И. Микулина, И. В. Марфениной,
А. М. Архарова. 2-е изд. М.: Энергия,
1975. 511 с.
44. Лоунасмаа О. В. Принципы и ме-
тоды получения температуры ниже 1 К:
Пер. с англ. М.: Энергия, 1977. 356 с.
45. Сычев В. В. Дифференциальные
уравнения термодинамики. М.: Наука, 1981.
195 с.
46. Дроссельные
А. Д. Суслов и др.
1978. 144 с.
47. Мартынов А.
Что такое вихревая
1976. 153 с.
48. Вайнер А. Л. Каскадные термоэлек-
трические источники холода. М.: Советское
радио, 1976. 137 с.
49. Буккель В. Сверхпроводимость: Пер.
с англ. М.: Мир, 1975. 366 с.
50. Роуз-Инс А., Родерик Е. Введение
в физику сверхпроводимости. Пер. с англ.
М.: Мир, 1972. 272 с.
51. Скотт Р. Б. Техника низких темпе-
ратур: Пер. с англ./ Под ред. М. П. Мал-
кова. М.: Энергия, 1962. 413 с.
52. Перри Д. Г. Справочник инженера-
химика. Т. I и II: Пер. с англ./ Под ред.
Н. М. Жаворонкова и П. Г. Романкова. Л.:
Химия, 1969. 640 с. и 504 с.
4 53. Кеезом В. Гелий: Пер. с англ./ Под
ред. А. И. Шальникова. М.: Изд-во иностр,
лит., 1949. 541 с.
54. Роговая И. А., Каганер М. Г.
ЖФХ, 1961, т. 35, № 9, с. 2135—2136.
55. Загорученко В. А., Вассерман А, А.
ИФЖ, 1961, т. 4, № 11, с. 59—63.
56. Пешков В. П. Журн. Экспер. и
теор. физ., 1957, т. 33, вып. 4, с. 833—838.
57. Техническая энциклопедия. Спра-
микроохладители/
М.: Машиностроение,
В„ Бродяиский В. М.
труба? М.: Энергия,
вочник физических, химических и техноло-
гических величии. Т. I—X./ Под ред.
Л. К. Мартенс. М.: Советская энциклопе-
дия, 1927—1936.
58. Таблицы физических величин. Спра-
вочник/ Под ред. И. К. Кикоина. М.: Атом-
издат, 1976. 1006 с.
59. Благой Ю, П., Руденко Н. С. Изв.
вузов. Сер. физ., 1958, № 6, с. 145—151.
60. Тимрот Д. Л., Борисоглебский В. П.
ИФЖ, 1961, т. 4, № 1, с. 3—13.
61. Новикова С. И. Тепловое расши-
рение твердых тел. М.: Наука, 1974. 292 с.
62. Френкель Н. 3. Гидравлика. 2-е
изд. М.: Госэнергоиздат, 1956. 460 с.
63. Шиллер Л. Движение жидкостей
в трубах: Пер. с нем. М.: ОНТИ, 1936.
230 с.
64. Идельчик И. Е. Справочник по гид-
равлическим сопротивлениям. М.: Машино-
строение, 1975. 560 с.
65. Михеев М. А., Михеева И. М.
Основы теплопередачи. 2-е изд. М.: Энер-
гия, 1977. 344 с.
66. Исаченко В. П., Осипова В. А., Су-
комел А. С. Теплопередача. М.: Энергия,
1975. 486 с.
67. Теплотехнический справочник. Т. 2/
Под ред. В. Н. Юренева и П. Д. Лебеде-
ва. М.: Энергия, 1976. 696 с.
68. Павлов К. Ф., Ромаиков П. Г.,
Носков А. А. Примеры и задачи по курсу
процессов и аппаратов химической техно-
логии. Л.: Энергия, 1981. 560 с.
69. Кутателадзе С. С-, Боришанский
В. М. Справочник по теплопередаче. М. —
Л.: Госэнергоиздат, 1958. 414 с.
70. Кузнецов Н. В., Щербаков А. 3.,
Титова Е. Я. — Теплоэнергетика, 1954 №9,
с. 27—32.
71. Казакевич Ф. П. — Изв. ВТИ 1952,
№ 8, с. 10—15.
72. Гельперин И. И., Рапопорт Л. Л. —
Труды Государственного института азотной
промышленности, 1954, вып. III и IV. 175 с.
73. Бакланова В. Г. — Хим. машино-
строение, 1959, № 2, с. 20—28.
74. Елухин Н. К., Красникова О. К-
Кислородное и автогенное машиностроение.
ЦИНТИхимнефтемаш, 1967, вып. 1,
с. 10—14.
75. Антуфьев В. М., Белецкий Г. С.
Теплопередача и аэродинамическое сопро-
тивление трубчатых поверхностей в попе-
речном потоке. М.: Машгиз, 1948. 119 с.
76. Петровский Ю. В., Фастовский В. С.
Современные эффективные теплообменники.
М.: Госэнергоиздат, 1962. 256 с.
77. Кейс В. М., Лондон А. Л. Ком-
пактные теплообменники. 2-е изд.: Пер.
с англ. М.: Энергия, 1967. 222 с.
78. Филиппов И. Ф., Кирпичников Ф. П.
Материалы па'-чно-технической конферен-
ции. — В кн.: Охлаждение турбо-и гидро-
генераторов. М.: ЦИНТИэлектро- и прибо-
ростроения, 1959, с. 236—261.
408
Список литературы
79. Антуфьев В. М. Эффективность
различных форм конвективных поверхно-
стей нагрева. М.: Энергия, 1966. 182 с.
80. О. К. Красникова и др. — Хим. и
иефт. машиностроение, 1975, № 5, с. 17—21.
81. Фортескье П. и Холл Б. Экспери-
менты по теплопередаче от топливных эле-
ментов. — Вопросы ядерной энергетики.
Сборник переводов. 1957, № 6, с. 21—33.
82. Данилов И. Б., Кейлии В. Е. ИФЖ,
1962, т. 5, № 9, с. 3—8.
83. Жаворонков Н. М. — Химическая
промышленность, 1944, № 2—3, с. 12—49.
84. Рамм В. М. Абсорбция газов. М.:
Химия, 1966. 767 с.
85. Кафаров В. В. — Химическая про-
мышленность, 1948, № 6, с. 174—176.
86. Дорощук В. Е. — Теплоэнергетика
1956, т. 3, № 1, с. 14—16.
87. Кузнецов Н. В., Турилии С. И. —
Изв. ВТИ, 1952, № 11, с. 32—35.
88. Полыиовский Я. Л. —Изв. ВТИ,
1952, № 9, с. 12—15.
89. Голубинский В. И., Легкий В. Н.—
Теплоэнергетика, 1961, т. 8, № 3, с. '53—56.
90. Мартынов В. А., Красникова О. К-
Экспресс-информация о работах НИИ и КБ
отрасли. ЦИНТИхимнефтемаш. Серия ХМ6,
1980, № 5, с. 13—19.
91. Карасина Э. С. — Изв. ВТИ 1952,
К° 12, с. 68—71.
92. Михеев М. А. Основы теплопереда-
чи. 3-е изд. М.: Госэнергоиздат, 1956.400 с.
93. Гербер Г., Эрк С., Григуль 3. Осно-
вы учения о теплообмене: Пер. с нем. М.:
Изд-во иностр, лит., 1958. 567 с.
94. Остроумов Г. А. Свободная конвек-
ция в условиях внутренней задачи. М.:
ГИТТЛ, 1952. 280 с.
95. Ройзеи Л. И., Дулькин И. Н. Теп-
ловой расчет оребренных поверхностей. М.:
Энергия, 1977. 254 с.
96. Кутателадзе С. С. Основы теории
теплообмена. Новосибирск: Наука 1970.
659 с.
97. Григорьев В. А., Павлов Ю. М.,
Аметистов Е. В. Кипение криогенных жид-
костей/ Под ред. Д. А. Лабунцова. М.:
Энергия, 1977. 289 с.
98. Кутателадзе С. С. Теплопередача
при конденсации и кипении. М. — Л.: Маш-
гиз, 1952. 232 с.
99. Позняк В. Е., Орлов В. К., Са-
вельев В. Н. — Хим. и нефт. машинострое-
ние, 1980, № 3, с. 8—9.
100. Теплопередача при низких темпе-
ратурах: Пер. с англ./ Под ред. У. Фроста.
М.: Мир, 1977. 391 с.
101. Шашков А. Г., Абраменко Т. Н.—
ИФЖ, 1957, т. 13, № 4, с. 549—560.
102. Дьячков Е. И., Никитин А. В.,
Херчог Р. Препринт ОИЯИ Р8-12945, Дуб-
на, 1979, с. 12.
103. Боровик Е. С. —ЖЭТФ 1948,
т. 18, № 1, с. 48—56.
104. Свойства полимеров при нормаль-
ных и низких температурах (обзор литера-
туры). Отчет по НИР Сиб. НИИЭ. Гос.
per. № 76028963. Новосибирск, 1977.
105. Городилов Б. Я-, Крупский И. Н.,
Маихелий В. Г. — Физ. низких температур,
1977, т. 3, № 12, с. 1562—1565.
106. Рычкова 3. А., Голубев И. Ф.—
Газовая промышленность, 1968, № 2, с. 35.
107. Эккерт Э. Р. и др. Термодинами-
ческие свойства и свойства переноса газов,
жидкостей и твердых тел. М.: Энергия,
1964, 280 с.
108. Козуб С. С., Этер У. Препринт
ИФВЭ ОУНК 80-43. Серпухов, 1980, 16 с.
109. Правила устройства и безопасной
эксплуатации сосудов, работающих под дав-
лением. М.: Металлургия, 1970. 80 с.
ПО. Алиев Н. Г., Волкеиштейи Н. В.—
ЖЭТФ, 1967, т. 49, № 5, с. 1450—1458.
111. Алиев Н. Г., Волкенштейн Н. В.—
Физика металлов и металловедение, 1965,
т. 19, № 5, с. 793/805.
112. Улыбин С. А. — Теплоэнергетика,
1962, т. 9, № 6, с. 87—94.
11В. Лащинский А. А. Конструирова-
ние сварных химических аппаратов. Спра-
вочник. Л.: Машиностроение, 1981. 382 с.
114. Варгафтик Н. Б. Теплопроводность
жидкостей и газов. Справочные данные. М.:
Изд-во стандартов, 1978. 153 с.
115. Межов-Деглин А. П. — ЖЭТФ,
1979, т. 77, вып. 2, с. 733—740.
116. Голубев И. Ф., Рычкова 3. А.—
Газовая промышленность, 1966, № 11,
с. 48—56.
117. Муратов А. В., Постников В. С.—
Физика и химия обработки материалов,
1978, № 5, с. 137—145.
118. Заварицкий Н. В., Зельдович
А. Г. —ЖТФ, 4956, т. 26, № 9, с. 2032-
2038.
119. Шевельков В. Л. Теплофизические
характеристики изоляционных материалов.
М.: Госэнергоиздат, 1958. 120 с.
120. Фишер Е. С. — Приборы для на-
учных исследований, 1969, т. 40, Ns 2,
с. 161—168.
121. Теплофизические свойства веществ,
Справочник/ Под ред. Н. Б. Варгафтика.
М. — Л.: Госэнергоиздат, 1956. 367 с.
122. Борисов Н. С., Неганов Б. С.,
Феллер Г. — Сообщения ОИЯИ, Р8-7008,
Дубна, 1973. 9 с.
123. Ермолаев А. М., Злобии Г. М.,
Краснокутский А. В. и др. Физ. низких
температур, 1975, т. 1, № 8, с. 1071—1085.
124. Козуб С. С., Эшер У. Препринт
ИФВЭ, ОУНК 81-61; Серпухов, 1981. 12 с.
125. Михайлова Г. Н. ЖТФ, т. 41, в. 4,
с. 800—806.
126. Кей Дж., Лэби Т. Таблицы физи-
ческих и химических постоянных. М.: Физ-
матгиз, 1962. 247 с.
127. Амитин Е. Б., Ковалева Ю. А.,
Ковдря Ю. 3. Физика твердого тела, 1967,
т. 9, № 3, с. 905—912.
Список литературы
409
128. Рычкова 3. А., Голубев И. Ф.
Газовая промышленность, 1967, № 7,
с. 4а—1>2.
129. Справочник по электротехниче-
ским материалам. Изд. 2-е, т. I, II, III/ Под
ред. Ю. В. Корицкого. М.: Энергия, 1974.
583 с., 615 с., 690 с.
130. Тареев Б. М., Филимонов Ю. П.
Свойства электротехнических материалов
при криогенных температурах. М.: МИРЭА,
1972. 140 с.
131. Чакальский Б. К., Редько Н. А.,
Шалыт С. С. ЖЭТФ, 1978, т. 75, вып. 4,
с. 1320—1329.
132. Анищенко Н. Г., Яворский Э.
Препринт ОИЯИ Р8-7633, Дубна, 1974.
23 с.
133. Перепечко И. И. Свойства поли-
меров при низких температурах. М.: Хи-
мия, 1977. 271 с.
134. Фастовский В. Г., Петровский
Ю. В., Ровинский А. Е. Криогенная техни-
ка. М.: Энергия, 1974. 495 с.
135. Бычков Ю. Ф., Херцог Р., Хуха-
рева И. С. Препринт ОИЯИ Р8-81-491,
Дубна, 1981. 9 с.
136. Сверхпроводящее соединение нио-
бий— олово: Пер. с англ./ Под ред.
В. В. Шмидта. М-: Металлургия, 1970.
293 с.
137. Труды X Международной конфе-
ренции по физике низких температур, 1967,
с. 366.
138. Берлин А. А. Основы производ-
ства газонаполненных пластмасс и эласто-
меров. М.: Госхимиздат, 1954. 292 с.
139. Ермолаев А. М., Злобин Г. М.,
Краснокутский А. В. Физ. низких темпера-
тур, 1976, т. 2, № 7, с. 894—899.
140. Голянд М. М. Тр. Ленингр. тех-
нол. ин-та холод, пром-ти, 1956, вып. 14,
с. 111.
141. Техника высоких напряжений/ Под
ред. М. В. Костенко. М.: Высшая школа,
1973. 528 с.
142. Анищенко Н. Г., Минеин В. Ф.—
ПТЭ, 1973, № 6, с. 176.
143. Анищенко Н. Г., Долбилова Г. И.,
Шишов Ю. А. Сообщение ОИЯИ, 9-10107,
Дубна, 1976. 19 с.
144. Гедич Ю. Ф., Яманов С. А. Свой-
ства диэлектриков при низких температу-
рах. М.: Информстандартэлектро, 1967. 31 с.
145. Анищенко Н. Г., Минеин В. Ф.—
В кн.: Электротехническая промышленность
(сер. Электротехнические материалы). Ин-
формационный научно-технический сборник.
М.: Информэлектро, 1974, вып. 1(42), с. 21.
146. Свалов Г. Г., Белый Д. И. Сверх-
проводящие и криорезистивные провода. М.:
Энергия, 1976. 168 с.
147. Анищенко Н. Г., Волков В. Я.,
Холлер и др. Препринт ОИЯИ, 8-82-172,
Дубна, 1982. 12 с.
148. Степанов А. Н., Белехин Л. В.
Новые нагревостойкие и радиационно стой-
кие электроизоляционные материалы для
намоточных конструкций изоляции (обзор).
Рига, Лат. НИИ НТИ, 1978. 32 с.
149. Каганер М. Г., Глебова Л. И.—
Кислород, 1959, т. № 1, с. 13.
150. Семенова Р. С. — Кислород, 1958,
т. 4, № 5. Обложка.
151. Беляков В. П., Густов В. Ф., Пе-
тухов С. С., Файнштейн В. И. — Тр. НПО
«Криогенмаш», 1975, вып. 17, с. 3—13.
152. Голубев И. Ф., Гнездилов И. Е.
Вязкость газовых смесей. М.: Изд-во стан-
дартов, 1971. 327 с.
153. Буянов Ю. Л., Фрадков А. Б., Ше-
балин И. Ю. — Приборы и техника экспе-
римента, 1974, № 4, с. 5—14.
154. Амамчаян Р. Г. и др.—Химическое
и нефтяное машиностроение, 1980, № 12,
с. 8—9.
155. Зиновьева К. Н. — Журн. экспер.
и теорет. физ., 1958, т. 34, № 3, с. 609—615.
156. Руденко Н. С., Слюсарь В. П.
Вязкость криогенных жидкостей. Харьков:
Харьковский физико-технич. ин-т АН УССР,
1976. 39 с.
157. Граф С. Ф., Галков Г. И. — Журн.
экспер. и теорет. физ., 1940, т. 10, № 9,
с. 725. 1941, т. 11, № 9, с. 801.
158. Суслов А. Д., Горшков А. М.,
Маслаков В. А. Дроссельные микроохлади-
тели. М.: Машиностроение, 1978. 144 с.
159. Космические рефрижераторные си-
стемы/ Р. Брекенридж и др. — В кн.: Пря-
мое преобразование энергии. М.: Мир, 1975,
с. 268—360.
160. Люстерник В. Е. Вязкость пара-
водорода. — В кн.: Теплофизические свой-
ства веществ и минералов. М.: Изд-во стан-
дартов, 1976, вып. 10, с. 105—147.
161. Есельсон Б. П., Лазарев Б. Г.,
Швец А. Д. — Приборы и техника экспери-
мента, 1962, № 3, с. 198—199.
162. Зиновьева К. Н.—Журн. экспер.
и теор. физ., 1955, т. 29, № 6, с. 899—901.
163. Благой Ю. П., Руденко Н. С.—
Изв. вузов. Сер. физ., 1959, № 2, с. 22.
164. Благой Ю. П. — Укр. физ. журн.,
1960, т. 5, № 1, с. 109.
165. Грезин А. К., Зиновьев В. С. Мик-
рокриогенная техника. М.: Машиностроение,
1977. 232 с.
166. Благой Ю. П. и др. — Журн. физ.
хим., 1967, т. 41, № 7, с. 1069—1072.
167. Правила устройства и безопасной
эксплуатации сосудов, работающих под дав-
лением. М.: Металлургия, 1971. 103 с.
168. Фрадков А. Б. — Приборы и тех-
ника эксперимента, 1960, № 4, с. 126—130.
169. Рипе С. М. Хранение, транспорти-
ровка и газификация кислорода. М.: Маш-
гиз, 1959. 383 с.
170. Каганер М. Г. Теплообмен в низ-
котемпературных конструкциях. М.: Энер-
гия, 1979. 257.
171. Роуз-Инс А. Техника низкотемпе-
410
Список литературы
ратурного эксперимента. М.: Мир, 1966.
216'с.
172. Веркин Б. И., Пустовалов В. В.
Низкотемпературные исследования пластич-
ности и прочности. М.: Эиергоиздат, 1982.
192 с.
173. Фрадков А. Б. — Приборы и тех-
тника эксперимента, 1958, № 4, с. 108—109.
174. Сверхпроводящие соленоиды. Сб.
пер. М.: Мир, 1965. 287 с.
175. Булаков А. Б., Пронько В. Г., Ак-
сельрод Л. С. — Тр. НПО «Криогенмаш»,
1974, вып. 16, с. 95—106.
176. Фрадков А. Б., Гинодман В. Б.—
Приборы и техника эксперимента, 1970,
№ 1, с. 233—239.
177. Фрадков А. Б., Троицкий В. Ф.—
Тр. физич. ин-та им. П. Н. Лебедева, 1974,
т. 77, с. 85—93.
178. Фрадков А. Б., Троицкий В. Ф.—
Космические исследования, 1974, т. XII,
№ 6, с. 936—940.
179. Зеппер Г. X. — В кн.: Вопросы
глубокого охлаждения/ Под ред. М. П. Мал-
кова. М.: Изд-во иностр, лит., 1961,
с. 267—319.
180. Иоффе А. Ф. Физика кристаллов.
М.: ГИЗ, 1929. 491 с.
181. Кошелев П. Ф. Механические свой-
ства материалов для криогенной техники.
М.: Машиностроение, 1971. 367 с.
182. Стали и сплавы криогенной техни-
ки. Киев: Наукова думка, 1977. 235 с.
183. Старцев В. И., Ильичев В. Я., Пу-
стовалов В. В. Пластичность и прочность
металлов и сплавов при низких температу-
рах. М.: Металлургия, 1975. 328 с.
184. Степанов Г. А., Лоханкина Л. К-
Новые стали в криогенной технике. Обзор-
ная информация. Серия ХМ-6. М.:
ЦИНТИхимнефтемаш, 1977. 51 с.
185. Гудков С. И. Механические свой-
ства промышленных цветных металлов при
низких температурах М.: Металлургия,
1971. 304 с.
186. Костенец В. И. — Жури. техн,
физ., 1958, т. 16, № 5, 516 с.
187. Кислородное машиностроение.
Сборник статей/ Под ред. И. С. Гузмана и
Б. А. Антипенкова. М.: ЦИНТИАМ, 1963.
220 с.
188. Очистка технологических газов/
Под ред. Т. А. Семеновой и И. Л. Лейтеса.
М.: Химия, 1977. 488 с.
189. Страус В. Промышленная очистка
газов. М.: Химия, 1981. 616 с.
190. Кислород. Справочник/ Под ред.
Д. Л. Глизманеико. М.: Металлургия, 1967.
422 с.
191. Вайда, П., Лори Я- — Приборы для
научных исследований, 1969, № 5, с. 72—75.
192. Вагин Е. В., Дыхно Н. М. и др.—
Тр. ВНИИкриогенмаш, 1971, вып. 13,
с. 255—264.
193. Веркин Б. И., Михальченко Р. С.,
Архипов В. Т. и др.— В кн.: Техника низ-
ких температур. Киев: Наукова думка,
1979, с. 3—30.
194. Бриллиантов Н. А., Фрадков А. Б.—
Жури. техн, физ., 1957, т. 27, № 10,
с. 2404—2409.
195. Боресков Г. К., Слинько М. Г.—
Химическая промышленность, 1956, № 2,
с. 69—77.
196. Белов С. В., Ложкин В. А., Пав-
лихин Г. П., Спиридонов В. С. — Хим. и
нефт. машиностроение, 1980, № 9, с. 10—13.
197. Ложкин В. А., Пермяков Б. А.—
Тр. НПО «Криогенмаш», 1975, вып. 17,
с. 131 — 141.
198. Абрикосова И. И., Шальииков
А. И. —Прибор ы и техника эксперимента,
1970, № 2,' с. 242—243.
199. Гельперин И. И., Ильинский А. А.,
Алмазов О. А., Адугин И. А. Жидкий во-
дород. М.: Химия, 1980. 228 с.
200. Фаркас А. Ортоводород, параво-
дород и тяжелый водород: Пер. с англ. М.:
ОНТИ, 1936, 244 с.
201. Клименко А. П. Ожиженные угле-
водородные газы. М.: Недра, 1974. 367 с.
202. Архаров А. М. Низкотемператур-
ные газовые машины. М.: Машиностроение,
1969. 223 с.
203. Разделение воздуха методом глу-
бокого охлаждения. Т. I, II, 2-е изд./ Под
ред. В. И. Епифановой и Л. С. Аксельрод.
М.: Машиностроение, 1973. 472 с., 567 с.
204. Будневич С. С. и др. Расчет крио-
генных установок. Л.: Машииостроеиие,
1979. 367 с.
205. Наринский Г. Б. Ректификация
воздуха. М.: Машиностроение, 1978. 298 с.
206. Шпильрайн Э. Э., Кессельман И. М.
Основы теории теплофизических свойств
веществ. М.: Энергия, 1977. 248 с.
207. Уокер Г. Машины, работающие по
циклу Стирлинга: Пер. с англ. М.: Энергия,
1978. 151 с.
208. Капица П. Л. — Журн. техн, физ.,
1939, т. 9, № 2, с. 99—123.
209. Капица П. Л. —Журн . тех. физ.,
1959, т. 29, № 4, с. 427—432.
210. Капица П. Л., Данилов И. Б.—
Журн. техн, физ., 1962, т. 32, № ‘4,
с. 457—460.
211. Дубинин М. М., Кофман Л. С.
и др. — Теоретические основы химической
технологии, 1957, т. 1, № 5, с. 578—602.
212. Теплофизические основы получения
искусственного холода/ Под ред. А. В. Бы-
кова. М.: Пищевая промышленность, 1980.
231 с.
2Г2а. Холодильные машины/ Под ред.
А. В. Быкова. М.: Пищевая промышлен-
ность, 1982. 223 с.
213. Мартыновский В. С. Холодильные
машины. М.: Энергия, 1979. 262 с.
214. Вопросы глубокого охлаждения:
Сб. пер./ Под ред. М. П. Малкова. М.: ИЛ,
1961. 429 с.
215. ГОСТ 5.270-75. Установка для по-
Список литературы.
411
лучения жидкого азота из атмосферного
воздуха ЗИФ-1002.
216. Криогенное оборудование. Каталог.
М.: ЦИНТИхимнефтемаш, 1980. 88 с.
217. Веркин Б. И., Гетманец В. Ф.,
Михальченко Р. С. Теплофизика низкотем-
пературного сублимационного охлаждения.
Киев: Наукова думка, 1981. 232 с.
218. Ворошилов Б. С., Грачев А. Б.
и др. —Тр. МЭИ, 1975. с. 115—120.
219. Гуляев А. И. — ИФЖ, 1966, т. 10,
№ 3, с. 326. Он же. — Журн. техн, физ.,
1965, т. 35, № 10, с. 1969.
220. Меркулов А. П. Вихревой эффект
и его применение в технике. М.: Машино-
строение, 1960. 184 с.
221. Гохштейн Д. П. Современные ме-
тоды термодинамического анализа энерге-
тических установок. М.: Энергия, 1969.
368 с.
222. Иоффе А. Ф. Термоэлектрическое
охлаждение. М. — Л.: Изд-во АН СССР,
1956. ПО с.
223. Коленко Е. А. Термоэлектрические
охлаждающие приборы. 2-е изд. Л.: Наука,
1967. 283 с.
224. Осипов Э. В. Твердотельная крио-
геника. Киев: Наукова думка, 1977. 234 с.
225. Уайт Г. К. Экспериментальная тех-
ника в физике низких температур: Пер.
с англ. М.: ИЛ, 1963. 368 с.
226. Мендельсон К. Физика низких тем-
ператур: Пер. с англ. М.: ИЛ, 1963. 230 с.
227. Неганов Б. С., Борисов Н. П., Ли-
бург М. С. — Журн. экспер. и теорет. физ.,
1966, т. 50, № 6, с. 1445—1457.
228. Пешков В. П. — Успехи физ. наук,
1968, т. 94, № 4, с. 607—640. Он же.—При-
боры и техника эксперимента, 1969, № 5,
с. 193—196.
229. Гладун А., Пешков В. П.—Журн.
экспер. и теорет. физ., 1972, т. 62, № 5,
с. 1853—1857.
230. Растворы квантовых жидкостей
3Не—4Не/ Б. И. Есельсон, В. Н. Григорьев,
В. Г. Иванцов и др. М.: Наука, 1973. 423 с.
231. Сигворт Г., Рейдбо Р. — Приборы
для научных исследований, 1971, № 8,
с. 3—12, № 2, с. 12—20.
232. Померанчук И. Я. — Журн. экспер.
и теорет. физ., 1950, т. 20, № 10, с. 919—924.
233. Ануфриев Ю. Д. — Журн. экспер.
и теорет. физ., Письма в редакцию, 1965,
т. 1, с. 1—7.
234. Малков М. П., Малкиель И.—
Хим. машиностроение, 1939, № 3, с. 5—10.
235. Бродянский В. М., Боярский Ю. М.,
Илиев И. Д. — Тр. МЭИ, 1974, вып. 186,
с. 112—120.
236. Выделение дейтерия из водорода
методом глубокого охлаждения/ М. П. Мал-
ков, И. Б. Данилов, Л. Г. Зельдович,
А. Б. Фрадков. М.: Госатомиздат, 1961.
151 с.
237. Каталог. Сверхпроводящие мате-
риалы. Государственный комитет по исполь-
зованию атомной энергии. М.: ВО «Изотоп»,
1973. 26 с.
238. Хаузен X. Теплопередача при про-
тивотоке, прямотоке и перекрестном токе:
Пер. с нем./ Под ред. В. М. Бродянского.
М.: Энергоиздат, 1981. 384 с.
239. Пешков В. П., Боровиков А. П.—
ЖЭТФ, 1966, т. 50, № 4, с. 844—852.
240. Капица П. Л. — Докл. АН СССР,
1938, т. 18, № 1, с. 21—23.
241. Капица П. Л,—ЖЭТФ, 1941, т. И,
Ns 6, с. 581—591.
242. Ландау Л. Д.-—ЖЭТФ, 1941,т. И,
№ 6, с. 592—613.
243. Лифшиц Е. М. — Успехи физ. наук,
1948, т. 34, № 4, с. 512—559.
244. Варгафтик Н. Б. Справочник по
теплофизическим свойствам газов и жидко-
стей. М.: Наука, 1972. 720 с.
245. Андроникашвили Э. Л. — ЖЭТФ,
1948, т. 18, № 5, с. 924—928.
246. Капица П. Л. — ЖЭТФ, 1941, т. 11,
№ 1, с. 1—31.
247. Зиновьева К. Н. —ЖЭТФ, 1971,
т. 60, № 6, с. 2243—2251.
248. Пешков В. П., Зиновьева К. Н. —
Успехи физ. наук, 1959, т. 67, Ns 2,
с. 193—244.
249. Селин И. П. Изотопы: Справоч-
ные таблицы. М.: Наука, 1970. 123 с.
250. McGarty. Thermophysical properties
of Helium-4 from 2 to 1500 К with pressures
to 1000 atm. — NBS technical note 631;
1972. 155 p. and J. Phys Chem. Ref. data,.
1973, v. 2, № 4, p. 923—1041.
251. Roder H. M. Survey of the Proper-
ties of the Hydrogen isotopes below their
Critical Temperatures. — NBS Technical note
641; 1973. 113 p.
252. Prydz R. The thermodynamic pro-
perties of compressed gaseous and liquid
Fluorine. — NBS technical note 392; 1973.
182 p.
253. Roder H. M., Weber L. A., Good-
win R. D. Thermodynamic and related pro-
perties of parahydrogen from triple point to
100 К and pressures to 340 atm. — NBS'
Monograph 94; 1965. 109 p.
254. Gryogenic fundamentals. Edit. Ha-
selden G. G. London: Academic Press, 1971,.
757 p.
255. Thermodynamic functions of gases'.
Vol. 1, 2, 3. Ed. Din F. London; Butter-
worths, 1956, 1961. 175 p. 201 p.
256. Plank R. Handbuch der Kaltetech-
nik. Bd 2. Berlin: Springer-Verlag, 1953.
384 S.
257. Hausen H. Handbuch der Kaltetech-
nik. Bd. 8. Berlin: Springer-Verlag, 1957.
412 S.
258. Sindt C., Mann D. Temperature-
entropy diagram for parahydrogen triple-
point region.— NBS Technical Note 343,
1966. 6 p.
259. ' Handbook of Chemistry and Phy4-
412
Список литературы
sics. 54 edition. Cleveland, Ohio; CRC Press,
1973. 1974 p.
260. Experimental Cryophysics Ed. Hoa-
re F. — London: Butterworths, 1962. 438 p.
261. Wooley H., Scott R., Brickwed-
de F. — Journ. Res. Nat. Bureau Standard,
1948, vol. 41, № 5, p. 379—475.
262. Mittelhauser H., Phodos G. — Cryo-
genics, 1964, vol. 4, № 6, p. 368—373.
263. Walker G. — Advance Cryog. En-
gin., 1966, v. 11, p. 372—378.
264. Dean J. A tabulation of thermody-
namic properties of normal hydrogen. — NBS
Techn. Note 120, 1961. 171 p.
265. Dijk van H. — Physica, 1958, vol. 24,
Kamerling Onnes conierens, p. 129—131.
266. Sydoriak S., Sherman R., Roberts.—
Journ. Research NBS, 1964, v. 68A, № 6,
p. 547—588.
267. Brickwedde F. — Journ. Research
NBS, 1960, v. 64A, № 1, p. 1 — 17.
268. Pridz R., Timmerhaus K.— Advance
Cryogenic Eng., 1967, v. 13, p. 384—396.
269. Hoge H. — Journ. Res. Nat. Bureau
Stand., 1951, v. 47, № 2, p. 63—79.
270. Grilly E. — Journ. Amer. Soc. 1951,
vol. 73, № 2, p. 843—846.
271. Hoge H. — Journ. Res. Bureau
Stand. 1945, v. 34, № 3, p. 281—293.
272. Mullins J., Ziegler W., Kirk B. —
Advance Cryogen. Engin., 1963, v. 8,
p. 126—134.
273. Reaumont R. — Proc. Phys. Soc.,
1961, v. 78, № 506, p. 1462—1481.
274. Streng A. — Journ. Chem. and. Eng.
Data, 1961, v. 6, № 3, p. 431—436.
275. Clark A. — Proc. Roy. Soc., 1951,
v. 209, № 1098, p. 408—415.
276. Kraus J., Uhlig E. — Cryogenics,
1974, v. 14, № I, p. 29—35.
277. Hook van W.—Journ. Phys. Chem.,
1968, v. 72, № 4, p. 1234—1244.
278. Mills R., Grilly E. —Phys. Rev.,
1955, v. 99, № 2, p. 480—486.
279. Crilly E. Anna). Phys., 1959, vol. 8,
Ns 1, p. 1—23 and J. Low Temp. Phys., 1973,
v. 11, № 1, p. 33—52.
280. Pollack G. — Rev. Modern Phys.,
1964, v. 36, № 3, p. 748—791.
281. Stryland Y. — Canad. Journ. Phys.,
1960, v. 38, № 11, p. 1546—1547.
282. Koeppe W. — Kaltetechnik, 1962,
J. 14, № 12, S. 399—403 und 1959. J. 11,
№ 11, S. 363—369.
283. Gladun A- — Cryogenics, 1967, v. 7,
№ 5, p, 285—288.
284. Roefeeck Ostarfeer K. — Journ.
Amer. Chem. Soc., 1W8, v. 60, p. 341.
285. Koeppe W. — Zs. Angew. Physik,
1959, Bd 11, № 11, S. 432—440; Physica,
1958, Bd 24, s. 90—97.
286. Ayber R. — Bull. Intern. Inst. Ref-
rig., 1964, Annex 2, s. 135—143 und Kalte-
technik, 1965, J. 17, № 9, S. 276—281 und
VDI-Forschungsheft, 1965, Bd 31, № 511.
287. Barron R. Cryogenics systems. New
York: McGraw-Hill Book Co., 1966. 678 p.
288. Collins S. Expancion machines for
low-temperature processes. — Oxford: Univ.
Press, 1958. 116 p.
289. Bailey C. A. Advanced cryogenics.
London: Plenum press, 1971. 527 p.
290. Radeb R. Thermodynamic properties
of He3—He4 solution with applications to the
He3—He4 dilution refrigerator. — NBS Tech-
nical note 362, 1967. 137 p.
291. Bedue M. — Intern. Inst, of Refri-
geration. Annexe-3, 1960, p. 55—65.
292. Ritter C. — Chem. Eng. Progress.,
1962, v. 58, № 11, p. 61—69.
293. Keesom W. H. — Comm. Leiden,
Suppl. № 76, 1933, p. 1—20.
294. Kotler J., Yonkers C. — Philips
techn. Rev., 1954, v. 16, № 3, p. 69—78 and
№ 4, p. 105—115.
295. Dros A. — Philips techn. Rev., 1965,
v. 26, № 10, p. 297—308.
296. Ster J., Kohler J. — Philips techn.
Rev., 1958/1959, v. 20, № 7, p. 177—187.
297. Prast G. — Philips techn. Rev.,
1965, vol. 26, № I, p. 1—11; Cryogenics,
1963, v.,3, № 3, p. 156—160.
298. Haarhuis G. — Philips Techn. Rev.,
1968, v. 29, № 7, p. 197—204.
299. Gifford W., McMohon H. — Adv.
cryog. Engng., 1960, v. 5, p. 354—372 and
1966, v. Il, p. 152—159.
300. Simon F. — Zs. Kalte-Industrie,
1932, S. 89 und Phys. Zs., 1932, Bd 34,
S. 232.
301- Hilsenrath J. e. a. Tables of Ther-
modynamic and Transport Properties. Lon-
don: Pergamon Press, 1960. 478 p.
« 302. Mann D., Stewart R. — Journ. Heat
Transf., Trans. ASME, 1959, Ser. C, v. 81,
№ 4, p. 323.
* 303. White D. e. a.—Journ. Phys.-Chem.,
1960, v. 64, № 11, p. 1607—1612.
304. McCarty R. D., Stewart R. — Adv.
Thermohyps. Properties at Extreme Tempera-
ture and Pressure, 1965, p. 84—97.
305. Springer e. a. — Journ. Chem.
Engng. Data, 1969, v. 14, № 1, p. 78—82.
306. Michels A. e. a. —- Physica, 1958,
v. 24, № 8, p. 659—671.
307. Bk&els А. «ь. a. — Physica, 1959,
t. 26, № 1, p. 2S~-4>.
Список литературы
4)3
308. Hust, Stewart R. — NBS Techn.
Note, 1963, № 202, p. 169.
309. Grilly E. R. —Journ. Low Temp.
Phy-., 1971, v. 4, № 6, p. 615—635.
310. Wilks J. The Properties of Liquid
and Solid Helium. — Oxford: Clarendon
Press, 1967. 703 p.
311. Kerr E., Taylor R. — Annals of Phy-
sics, 1964, v. 26, № 2, p. 292.
312. American Institute for Physics
Handbook. 2 ed. N. Y, Toronto, London:
.McGrow-Hill, 1963. 2112 p.
313. Gosman A. L. e. a. Thermodynamic
Properties of Argon from the Triple Point
to 300 К at Pressures to 1000 Atmosphe-
res.—NBS 27, 1969. 146 p.
314. Scott R. B. (edit), Denton W. H.,
Nicholls С. M. Technology and Uses of Li-
quid Hydrogen. Oxford: Pergamon Press,
1964. 415 p.
315. Me Carty D, Weber L. A. Thermo-
physical Properties of Parahydrogen from the
Freezing Liquid Line to 5000 R for Pressu-
res 10 000 Psia. — NBS Technical Note 617,
1972. 163 p.
316. Kerr E., Taylor R. — Annals of
Phys., 1962, v. 20, № 3, p. 450—463.
317. Grilly E. R, Mills R. L. — Annals
of Phys., 1959, v. 8, № 1, p. 1—23.
318. Gerhard A. Cook (edit). Argon,
Helium and the rare gases. Vol. 1. London:
Interscience Publ., 1961. 394 p.
319. Grilly E. R. — Journ. Low Temper.
Phys, 1973, v. 11, № 1/2, p. 33—52.
320. Edwards M., Woodburg- W. — Ca-
nad. Journ. Phys, 1961, v. 39, № 12,
•p. 1833—1841.
321. Brabets R, McDonough J.—Journ.
Chem. Phys, 1957, v. 27, № 4, p. 880—882.
322. Brown C, Franson K- — Journ.
Chem. Phys, 1953, v. 21, № 5, p. 917—919.
323. Grilly E. R. — Journ. Amer. Chem.
Soc, 1951, v. 73, № 11, p. 5307—5308.
324. Johnston H. e. a. — Journ. Amer.
Chem. Soc, 1954, v. 76, № 6, p. 1482—1486.
325. Itterbeek Van A, Verbeke O.—
Cryogenics, 1961, v. 2, № 2, p. 79—80.
326. Fulk M. M, Reynolds M. M,
Park О. E. — Adv. in Cryogenic Engng,
1960, v. 1, p. 224—229.
327. Ziegler W. T, Cheung H. — Adv.
in Cryogenic Engng, 1960, v. 2, p. 100—103.
328. Fulk M. M, Reynolds M. M. —
Journ. Appl. Phys, 1957, v. 28, № 12,
,p. 1464—1467.
329. Schmidt Eckehard F. — Chem.-Ing.-
Techn, 1967, Bd 39, № 13, S. 781—832.
330. Knudsen J. G, Katz D. .L. — Chem.
Engng. Progr, 1950, v. 46, № 10,
p. 490—500.
331. Chilton T. H, Colburn A. P.—
Indust. Engng. Chem, 1931, v. 23, № 8,
p. 913.
332. Bain W. A, Hougen O. A. — Trans.
Amer. Inst, of Chem. Engng, 1944, v. 40,
.№ 1, p. 29»—51.
333. Kraussold H. — Forschung, 1933,
Bd 4, № 1, S. 39.
334. Gardner K. A. — Trans. ASME,
1945, vol. 67, № 8, p. 621—631.
335. Scholz Walter H. — Linde Berichte
aus Technik und Wissenschaft, 1973, № 33,
S. 33—39.
336. Martin D. L. — Canad. Journ. Phys,
1960, v. 38, № 1, p. 17—24.
337. Nusselt W. — Ztschr. des VDI, 1916,
Bd 60, № 27, S. 541—546.
338. Brentari E. G, Smith R. V. — Adv.
in Cryog. Engng. (Internal.), 1965, v. 10,
p. 325—341.
339. Vonk G. — Philips Techn. Rev.,
1968, v. 29, № 5, p. 158—163.
340. Dijk Van H.— In: Progress in
Cryogenics. V. 2. London: Heywood, 1960,
p. 123—145.
341. Sidoriak S. G. e. a. — Journ. Res.
NBS, 1964, v. 68A, p. 547—559.
342. Brabets R. I, Waterman T. E. —
Journ. Chem. — Phys, 1953, v. 21, № 5,
p. 917—919.
343. Johnson R. W, Collins S. C,
Smith J. L. — Adv. in Cryog. Engng, 1971,
v. 16, p. 171 — 177.
344. Clusius K. u. a. — Zs. F. Natur-
forsch, 1960, Bd 15a, № 1, S. 1—9.
345. Muller Karlheinz, Forg Wolf-
gang.— Linde Berichte aus Technik und
Wissenschaft, 1976, № 89, S. 36—41.
346. Zollner Hans-Robert. — Linde Be-
richte aus Technik und Wissenschaft, 1980,
№ 48, S. 19—28.
347. Linnett D. T, Smith К. C. — Adv.
in Cryogenic Engng, 1970, v. 15, p. 8—17.
348. Wenzel L. A. — Adv. in Cryogenic
Engng, 1975, v. 20, p. 90—102.
349. Bourguet J. M. — Adv. in Cryoge-
nic Engng, 1973, v. 18, p. 9—26.
350. Dawson J. P, Haygood J. D, Col-
lins J. A. — Adv. in Cryogenic Engng, 1964,
v. 9, p. 443—450.
351. Laheurte J. P, Manchester F. D.—
Cryogenics, 1972, v. 12, № 5, p. 362.
352. Cryogenic and Engineering News,
1968, vol. 3, № 1, p. 81.
353. Keilin V. E, Chernoplekov N. A.
Problems and Prospects of High-Current Su-
perconductivity.—Sov. Sci. Reviews A. (Phy-
sics) 1981, v. 3, № 4, p. 239. Harward Acad.
Publishers.
354. Internal Capillary Insulation for
Cryogenic Tanks-Cryog and Ind. Gases, 1973,
v. 8, Ns 2, p. 11—12.
355. Waterman T. E. — Journ. Chem.
Phys, 1958, vol. 29, № 4, p. 905; 1960,
v. 32, № 1, p. 304—310.
356. Dalgarno A, Smith F. — Proc.
Roy. Soc., Ser. A, 1962, v. 267, № 1330,
p. 417—428.
357. Powers K. W. e. a. — Journ. Ames-.
Chem. Soc, 1954, vol. 76, № 23, p. 5974—
5982.
414
Список литературы
358. Zaitlin М. Р., Anderson А. С. —
J. Low Temp. Phys., 1972, v. 9, № 516,
p. 467—475.
359. Hill R. W., Schneidemsser B. — Zs.
Phys. Chem., 1958, Bd 16, № 3, S. 257—265.
360. White G. K-, Woods S. B. — Phil.
Mag., 1958, v. 3, № 32, p. 785—793.
361. Du Chatenier F. J. u. a. — Physica,
1967, Bd 31, № 7, S. 1061 — 1072.
362. Barnitzke W., Muller H. D.—Chem.
Techn., 1973, № 11, S. 669—715.
363. Gamson B. W. — Chem. Engng.
Prog., 1949, v. 45, № 2, p. 154—163.
364. Lochtermann E.— Cryogenics, 1963,
V- 3, № 1, p. 44—49.
365. Abel W. R. e. a. — Phys. Rev. Lett.,
1967, v. 18, № 18, p. 737—738.
366. Baker Th. — Proc. Phys. Soc. 1962,
v. 80, № 517, p. 1171 — 1175.
367. Mathur S., Saxena S. — Appl. Sci.
Research, 1967, vol. 17, № 2, p. 155—166.
368. Lehemann H. — Chem.-Ing.-Techn.,
1957, Bd 9, № 9, S. 530—541.
369. Mikhopadhyay P., Barua A. K- —
Brit. Journ. Appl. Phys., 1967, v. 18, № 9,
p. 1301; p. 1307—1315.
370. Excoffier P. — La recherche aero-
spatiale, 1966, № 115, p. 57—63.
371. Hajko V. e. a. — Phys. Stat. Sol. A,
1971, v. 7, № 1, p. 49—53.
372. Proc. ХП-th Internat. Congress of
Refrign. 1969, v. 1, p. 173—181.
373. Saxena S. e. a. — Physica, 1965,
vol. 31, № 3, p. 333—341.
374. Heenskerk 1. P. I. e a.: Physica,
v. 71, № 3, p. 515—588.
375. Gambhier R., Saxena S. — Mol.
Phys., 1966, v. 4, № 3, p. 233—245.
376. Ziegler W. T., Mullins J. C.—Cryo-
genics, 1964, v. 4, № 1, p. 39—47.
377. White G. K.— Proc. Phys. Soc.,
Ser. A, 1953, v. 66, № 402A, p. 559—567.
378. Powell R. L. e. a. — Journ. Appl.
Phys., 1957, v. 28, № 11, p. 1282—1292.
379. Hall W. J. e. a. —In: Proc. Fifth
Internat. Conf. Low. Temp. Physics a. Che-
mistry. Univ. Wise. Press, 1958, p. 389—396.
380. White G. K-, Woods S. B. — Canad.
Journ. Phys., 1955, v. 33, № 2, p. 58—67.
381. White G. K., Woods S. B. — Canad.
Journ. Phys., 1957, v. 35, № 8, p. 892—905.
382. White G. K., Woods S. B. — Canad,
Journ. Phys., 1957, v. 35, № 5, p. 656—668.
383. Rosenberg H. M.—Phil. Trans. Roy.
Soc., Ser. A, 1955, vol. 247, № 933, p. 441—
446.
384. Diller D., Hanley H., Roder H. —
Cryogenics, 1970, vol. 10, № 4, p. 296; Adv-
Cryogen. Engng., 1970, v. 15, p. 58—66.
385. Kemp W. R. e. a. — Proc. Phys.
Soc.., 1953, Ser. A, v. 66, № 407A, n. 1077—
1083.
386. White G. K., Woods S. B. — Canad.
Journ. Phys., 1957, v. 35, № 3, p. 346—358.
387. American Institute of Physics Hand-
book. Me Graw-Hill Book Co., 2nd. ed., 1963,,
p. 820.
388. Kemp W. R. e. a. — Phil. Magazi-
ne, 1955, v. 46, № 378, p. 811—818.
389. Harper A. F. e. a. — Phil Magazine,.
1957, v. 2, № 17, p. 577—583.
390. Araja S., Dunmyre G. K. — Physica,
1965, Bd 31, № 10, S. 1466—1477.
391. Schaefer C. A., Thodos G. — Ind.
Engng. Chem., 1958, v. 50, № 10, p. 1585—
1593.
392. Arajs S., Colvin R. V. — Phys. Rev.,.
1964, v. 136, № 2A, p. 439.
393. White H. K., Woods S. B. — Canad.
Journ. Phys., 1957, v. 35, № 3, p. 248—253.
394. McDonald A. K. e. a. — Proc. Roy.
Soc., Ser. A, 1956, v. 235, Ai> 1202.,
p. 358—366.
395. Gladun Ch. — Cryogenics, 1966,.
v. 6, № 1, p. 27—38.
396. Buyanov Yu. A. — Cryogenics, 1975,.
v. 15, p. 193—198.
397. Tien C. L, Cunnington G. R.—
Cryogenics, 1976, v. 16, № 10, p. 583—592.
398. Sharma J. K. N.— Cryogenics, 1967,.
v. 7, № 3, p. 141 —148.
399. Dupre A. e. a. — Phys. Lett., 1964,.
v. 8, № 2, p. 99—105.
400. White G. K- Experimental Techni-
ques in Low-Temperature Physics. Third Ed;.
Oxford: Clarendon Press. 1979. 331 p.
401. Bewiiogua L., Handstein A., Hoe-
ger H. — Cryogenics, 1966, v. 6, № 1,
p. 21—24.
402. Fradkov A. B-, Troitskii V. F. —
Cryogenics, 1975, № 8, p. 461—463.
403. Hiisenrath I. e. a. — Tables of Ther-
mal Properties of Gases. Nat. Bureau Stand..
Circ., 1955, № 564. 178 p.
404. Cheiton D. B., Mann D. B. Cryoge-
nic Data Book. Nat. Bureau Stand., Boulder,.
Colorado, 1956. 116 p.
405. Table of contents, cryogenic data.—
Cryogenics and Industrial Gases, 1976,.
vol. 11, № 3, p. 34—70.
406. Foister S. — Cryogenics, 1963, v. 3,.
№ 3, p. 176.
407. Bock de A., Grevendonk W., Awou-
ters H. — Physica, 1967, v. 34, № 1, p. 49.
408. Itterbeek van A. e. a. — Physica,.
1966, v. 32, № 11/12, p. 2171.
409. Herning H., Zipperer L. — Gas und
Wasserfach, 1936, Bd 79, № 5, S. 69—73.
410. Kao J., Kobayashi R. — Journ.
Chem. Phys., 1967, v. 47, № 8, p. 2836.
411. Laquer H. L., Sidoriak S. G., Ro-
berts T. R.— Phys. Rev., 1959, v. 113, № 2,
p. 417.
412. Kendal H., Monroe E.—Ind. Engng.
Chem. 1932, v. 24, № 12, p. 92.
413. Rietveld A., Itterbeek van A.,.
Velds C. — Physica, 1959, v. 25, № 3,
p. 205—216.
414. Per Harmsei H., Dijk van H„ Du-
rieux M. — Physica, 1967, v. 36, № 4,:
p. 620—636.
Список литератур^
415
415. Roberts Т. R., Sydoriak S. G.—
Phys. Rev., 1955, v. 98, № 6, p. 1672—1688.
416. Kerr E. C. — Phys. Rev., 1954, v. 99,
p. 551.
417. Jenkins A., Di Paolo. — Journ.
Chem. Phys., 1956, v. 25, № 2, p. 296—301.
418. Sprow F. B., Prausnitz J. M.—
Trans. Faraday Soc., 1956 v. 62, № 521,
p. 1105—1114.
419. Stransfield D. — Proc. Phys. Soc.,
1958, v. 72, № 467, p. 854.
420. Funs S., Bellemans A. — Physica,
1956, v. 32, № 3, p. 594.
421. Smith B. L., Gardner P. R., Par-
ker E. H. — Journ. Chem.Phys., 1967, v. 47,
№ 3, p. 1148—1152.
422. Dael van W., Itterbeek van A.,
'Cops A., Thoen S. — Physica, 1966, v. 32,
№ 3, p. 611.
423. Childs G. E., Diller D. F. — Adv.
Cryog. Engng., 1972, v. 15, p. 65—69.
424. Mullms J. C., Ziegler W. T., Kirk
B. S. — Adv. Cryog. Eng. 1963 v. 8,
p. 116—125.
425. Itterbeek A., Doninck W. — Proc.
Phys. Soc., 1949, v. 62, № 349B, p. 62.
426. Edeskyty F. J., Williamson K. D. —
Adv. Cryog. Eng. 1972, v. 17, p. 56—68.
427. Luders K., Klipping G. — Proc. 8-th
Int. Cryog. Eng. Conf., Geneva 1980,
p. 14—21.
428. Cryogenic Technology/ Ed. R. W.
Vance. N. Y., Jhan Wiley & Sons, 1963.
586 p.
429. Technology and Uses of Liquid
Hydrogen/ Ed. R. B. Scott, W. H. Denton,
С. M. Nicholls. N. Y.: Pergamon Press, 1964.
415 p.
430. Walker G., Stuchly J.—Adv. Cryog.
Eng., 1978, v. 23, p. 531—537.
431. Laeger H., Lebrun Ph., Rohuer P.—
‘Cryogenics, 1978, v. 18, № 12, p. 659—662.
432. Mitchell R. C., Stark T. A., Whi-
te R. C. — Adv. Cryog. Eng., 1967, v. 12,
p. 72—81.
433. Salzer P. M., Fairbank W. M., Eve-
ritt C. W. — Adv. Cryog. Eng., 1971, v. 16,
p. 277—281.
434. Petrac D., Mason P. V. — Proc. 7-th
Int. Cryog. Eng. Cong., London, 1978, p. 120.
435. Howard J. L. — Adv. Cryog. Eng.,
1974, v. 19, p. 276—281.
436. Clapp M. B., Litzinger L. F. — Adv.
'Cryog. Eng., 1972, v. 18, p. 84—92.
437. Landesbaum E. e. a. — Ind. Eng.
Chem., 1955, v. 47, № 1, p. 101 — 103.
438. Lobo W. E., Skaperdas С. P., Trum-
pler P. R., Dodge B. F. — Chem. Engng.
Progr., 1945, v. 43, № 2, p. 69—84.
439. Larsen A. H., Simon F. E., Swen-
son C. A. — Rev. Sci. Instrum. 1948, v. 19,
№ 4, p. 266—269.
440. Crauford A. H. — Cryogenics, 1970,
’v. 10, № 1, p. 28—37.
441. Din T7., Cockett A. Low-Temperatu-
re Techniques. London: George Newnes,
1960. 216 p.
442. Corny R. — Adv. Cryog. Eng., 1964,
v. 9, p. 524—536.
443. Cook G. e. a. — Adv. Cryog. Eng.,
1966, v. 11, p. 202—206.
444. Bewilogua L. — Cryogenics, 1964,
№ 5, p. 290—291.
445. Fradkov A. B. — Cryogenics, 1964,
№2, p. 83—85.
446. Swenson C. A., Stahl R. N. — Rev.
Sci. Instrum., 1954, v. 25, № 6, p. 608—611.
447. Daunt J. D., Lerner E. — Cryoge-
nics, 1970, № 6, p. 476—479.
448. Lashmet P. K-, Geist J. M. — Adv.
Cryog. Eng., 1963, v. 8, p. 199—205.
449. Horiuchi T. e. a. — Proc. 5-th Int.
Cryog. Eng. Conf., Kyoto, 1974, p. 465—468.
450. Caren R. P. — Cryogenic Technolo-
gy, 1968, v. 4, № 1, p. 15—20.
451. Gifford W., McMahon H.—Proceed,
X Intern. Congr. of Refriger., 1960, vol. 1,
p. 100—109 and Cryogenics, 1960, v. 1, №2,
p. 65—70.
452. Hrycar P.—Cryogenics, 1963, vol. 3,
№ 1, p. 23—26.
453. Fowle A. — Advance Cryog. Eng.,
1966, v. 11, p. 198—201 and 1968, v. 13,
p. 451—456.
454. Daunt J. G., Rosen C. Z. — Cryoge-
nics, 1972, v. 12, № 3, p. 201—208.
455. McCormick J., Brauer J. — Advance
Cryog. Eng., 1965, vol. 10, p. 493—504 and
.1964, v. 9, p. 367—378.
456. Radebaugh R. — Cryogenics, 1971,
v. 11, № 5, p. 368—384.
457. London H., Clark C., Mendoza E.—
Phys. Rev., v. 128, № 5, p. 1992—2005.
458. Wheatley J.—Amer. Journ. Physics,
1968, v. 36, № 3, p. 181—210 and Progress
in low temperature physics, 1970, v. 6,
p. 77—161.
459. Staas F. — Proceedings of ICEC-4,
1972, p. 168.
460. Roubeau Y.—Proceedings ot 1CEG-3,
1970, p. 315—319.
461. Dodg B., Housum C.—Trans. Amer.
Inst. Chem. Eng., 1927, v. 19, p. 117—157.
462. Honig R., Hook H. — RCA Rev.,
1960, p. 360—368.
463. Roberts B. — Progress in Cryoge-
nics, 1964, v. 4, p. 159—231 and NBS Tech-
nical Note, № 983. 93 p.
464. Disalvo F. J. — Apl. Cryogenics
Technology, 1973, v. 5, p. 205—220.
465. Prior A. — Cryogenics, 1967, v. 7,
№ 3, p. 131 — 134.
466. Pollak G. — Rev. Modern. Physics,
1969, v. 41, p. 48.
467. Kidnay A., Hiza M. — Cryogenics,
1973, v. 13, № 10, p. 575—599.
468. Street W. — Journ. Chem. Phys.,
1964, v. 40, № 5, p. 1390—1395.
469. Heck C., Barrick P. — Advance
Cryog. Eng., 1967, v. 12, p. 714—718 and
Kalte'technik, 1968, Bd 20, № 6, S. 179—181.
416
Список литературы
470. Street W. — Journ. Chem. Phys.,
1970, v. 52, № 3, p. 1402—1406.
471. Cannon W, Crane W. — Cryogen.
Technol., 1968, v. 4, № 8, p. 178—180.
472. Sinor G., Kurata F. — Journ. Chem.
Eng. Data, 1966, v. 11, № 4, p. 537—539.
473. Street W. — Trans. Faraday Soc.,
1969, v. 65, № 555, Part 3, p. 696—702.
474. Heck C., Hiza M.— AICKE Jorn.,.
1967, v. 13, № 3, p. 593—599.
475. Rhodes H. — Journ. Chem. Eng.
Data, 1971, v. 16, № 1, p. 19—23.
476. Carber J., Ziegler W.— Journ.
Chem. Eng. Data, 1979, v. 24, № 4,
p. 330—338.
477. Makendrik R. — Journ. Chem. Eng.
Data, 1968, v- 13, № 3, p. 352—353.
478. Newman R, Jackson L. — Trans.
Faraday Soc., 1958, v. 54, p. 1481—1492.
479. Karwat H.— Chem. Ingen. Technik,
1960, Bd 32, № 9, S. 605—610.
480. Bigeleisen Y., Kerr E. — Journ.
Chem. Phys., 1963, v. 39, p. 763—768.
481. Sherman R. — Cryogenics, 1976,
vol. 16, № 10, p. 611—613.
482. Street W, Jones C. — Journ. Chem.
Phys., 1965, v. 42, № 11, p. 1979—1994.
483. Verschoyle T. — Phyl. Trans. Royal
Soc., 1931, Ser. A, v. 230, p. 189—220.
484. Ruheman M, Zinn N. — Phys. Zs.
Sowjetunion, 1937, Bd 12, № 4, S. 389—403.
485. Mullins J., Ziegler W. — Adv. Cryog.
Eng., 1965, v. 10, p. 160—181.
486. Hiza M. — Adv. Cryogenic Eng.,
1967, v. 13, p. 343—356.
487. Street W. — Journ. Chem. Phys.,
1967, v. 46, № 9, p. 3282—3286; 1971, v. 54,
№ 12, p. 5088—5094 and Adv. Cryogen.
Eng., 1966, v. 11, p. 356—366.
488. Kidnay A. — Cryogenics, 1975, v. 15,
№ 19, p. 531—540.
489. Christionsen L.— Cryogenics, 1973,
v. 13, № 7, p. 405—413.
490. Jenkins A. — Journ. Chem. Phys.,
1955, v. 23, № 11, p. 2049—2054.
491. H*rsh C. —ARC Journ., !960,v. 30,
№ 3, p. 264—266.
492. Hanson G.—Ind. Eng. Chem., 1952,
Ns 3, p. 604—609.
493. Separation of Isotopes. London:
Edit. H. London, Newnes LTD, 1961. 488 p.
494. Kurwat E, Kruis A. — Linde Be-
richte, 1958, № 3, S. 33—41.
495. Robinson R, Hiza M.— Adv. Cryo-
gen. Eng., 1975, v. 20, p. 218—239.
496. Hiza M. — Cryogenics, 1970, y. 10,
№ 2, p. 106—115.
497. Dokonpil Z. — Progress in low tem-
perature physics, 1961, v. 3, p. 454—480 and
Applied Scien. Research, 1955, v. A5, № 2—3,
p. 182—240.
498. Smith G. — Adv. Cryogen. Eng.,
1964, v. 9, p. 197—206.
499. Webster P. — Proc. Roy. Soc., 1952,
v. 214, Ser. A, № 1116, p. 61—71.
500. Karnat E. — Chem. Ingem. Technik,
1958, Bd 30, № 5, S. 317—318.
501. Michels A.—Physica, 1959, v. 25,
№ 11, p. 1097—1124.
502. Green N, Sontag R. — Adv. Cryog.
Eng., 1967, v. 13, p. 357—362.
503. Barret C. — Journ. Chem. Phys.,
1967, vol. 47, № 3, p. 740—743 and 1965,
v. 43, № 10, p. 3503—3503.
504. Stackelberg M.— Zs. Phys. Chem.,
1934, Bd 170, № 3—4, S. 262—272.
505. Heastie R, Jefevre G.—Proc. Phys.
Soc, 1960, v. 76, № 488, p. 180—181.
506. Long H., Di Paolo F. — Intern.
Inst. Refrig. Annexe 1, 1958, p. 253—265.
507. Karwot E. — Chem. Eng. Progr,
1958, vol. 54, № 10, p. 96—99 and Linde
Berichte, 1958, № 24, p. 3—10.
508. McKinley C, Wang E. — Adv.
Cryog. Eng, 1960, v. 4, p. 11—25.
509. Klein G. — Internet. Inst. Refriger.
Annexe 1, 1973, p. 53—64; p. 1—15.
510. Wilcox W.— Ind. Eng. Chem, 1941,
v. 33, № 5, p. 662—665.
511. Burch R. — Journ. Eng. Data, 1964,
v. 9, № 1, p. 19—24.
512. Aker W, Eubanks L. — Adv. Cryo-
gen. Eng, 1960, v. 3, p. 275—293.
513. Cosway H, Katz D. — AIChE
Journ, 1959, v. 5, № 1, p. 46—50.
514. Williams R, Katz D. — Ind. Eng.
Chem, 1954, v. 46, № 12, p. 2512—2520.
515. Senders M, Selheimer W, Brown
G. — Ind. Eng. Chem, 1932, v. 24, p. 517.
516. DadyburjoriD.—Chem Eng. Progr,
1978, v. 74, № 4, p. 85—86.
517. Hadden S, Grayson H. — Petrol.
Refiner, 1961, v. 40, № 9, p. 207—218.
518. Cajander B, Hipkin H, Lenoiz Y.—
J. Chem. Eng. Data, 1960, v. 5, № 3,
p. 251—259.
519. Holland C. Multicomponent distila-
tion. New Jersey: Prentice-Hall, 1963. 506 p.
520. Edmister W. Applied Hydrocarbon
thermodynamics. Houston: Gulf pbl, 1961.
312 p.
521. Kidnay A, Hiza M. — Adv. Cryo-
gen. Eng, 1967, v. 12, p. 730—740 and Cryo-
genics, 1970, v. 10, № 4, p. 271—277.
522. Mai van H. H. — Chemie Ing. Tech-
nik, 1973, Bd 45, № 2, S. 80—83.
523. Becker K. e. a. — Proc. ICEC-4,
1972, p. 320—326.
524. Barclay Y, Moze D, Paterson L.—
Journ. Appl. Phys, 1979, v. 50, № 9,
p. 5870—5877.
525. Steyert W, Delpuech C. — Journ.
Appl. Phys, 1978, vol. 49, № 3, p. 1216—
1231 and Cryogenics, 1981, v. 21, № 10,
p. 579.
526. Mueller R.—Gryogenics, 1980, v. 20;
№ 7, p. 395—407.
527. Cook T. — Cryogenics, 1981, v. 21,
№ 5, p. 259—266.
528. Robinson C, Gilliland E. Elements
Список литературы
417
of fractional distillation. N. Y.: McGraw-
Hill Co., 1950. 492 p.
529. McCabe, Thiele. — Ind. Eng. Chem.,
1925, v. 17, p. 605.
530. Ponchon M. — La techn. modern.,
1921, V. 13, № 1, p. 20—24; 55—58.
531. Fenske M. — Ind. Eng. Chem., 1932,
v. 24, № 5, p. 482—485.
532. Smith R. Design of equilibrium sta-
ge processes. N. Y.: McGraw-Hill Co., 1963.
430 p.
533. Erbar Y., Maddox R. — Petrol Re-
finer, 1961, v. 40, № 5, p. 183—188.
534. Kirshbaum E. Destillier- und Rek-
tifiziertechnik. Berlin: Springer Verlag, 1960.
415 S.
535. Hausen H. — Zeitschr. techn. phys.,
1932, Bd 13, № 6, S. 271—277.
536. Blis H., Dodge B.— Chem. Eng.
Progr., 1949, vol. 45, № 1, 2, p. 51—64;
129—138; 1950, v. 46, № 2, p. 67—73.
537. Clusias K-, Starke K-— Zs. Natur-
forsch., 1949, Bd 4a, № 7, S. 549—559.
538. Wagner N. — Linde Berichte, 1977,
№41, S. 34—42.
539. Springman H. — Linde Berichte,
1973, № 33; S. 28—33; 1976, № 40, S. 24—
29; 1979, № 46, S. 3—7.
540. L. Heveder M. — Cryotech.-73,
p. 26—30.
541. Haselden G. G. — Trans. Inst. Chem.
Eng., 1958, v. 36, № 3, p. 123—132;
p. 171—178.
542. Dyke H., Dougherty W. — Chem.
Eng. Progr., 1955, vol. 51, № 4, p. 157—161.
543. Jungnickel H. — Die Technik, 1959,
Bd 14, № 6, S. 438—442.
544. Bewilogua L. — Cryogenics, 1962,
v. 2, № 5, p. 290—291 und Kaltetechnik,
1965, Bd 17, № 6, S. 185—187.
545. Mullins P. — Chem. Eng. Progr.,
1948, v. 44, № 7, p. 567—572.
546. Agron, Helium and the rare gases,
vol. I and II. N. Y. — London: Ed. CookG.—
Interscience Publ., 1961, 330 p, 349 p.
547. Technology of liquid helium R. H.
Kropschot, B. W. Birmingam, D. B. Mann.
Nat. Bureau of Standars, Washington, 1968.
371 p.
548. Forg W., Wirtz F. — Linde Berich-
te, 1970, № 28, S. 44—50.
549. Jones J., Stacey Y. — Cryogenics,
1974, v. 14, № 4, p. 198—202.
550. Справочник химика. T. I^-VI. Л.:
Химиздат, 1964—1968.
551, Харахорин Ф. Ф. — ЖТФ, 1940,
т. 10, № 18, с. 1533—1540.
552. Скрипка В. Г., Дыхно Н. М.—
Тр. ВНИИкимаш, 1964, № 8, с. 163—179;
1971, № 13, с. 90—103.
553. Березняк Н. Г. — Украинский физ.
журн., 1974, т. 19, № 3, с. 427—481.
554. Гоникберг М. Г. — ЖФХ, 1939,
т. 13, № И, с. 1669—1679.
555. Остронов М. Г. — ЖФХ, 1977,
т. 51, № 9, с. 2396—2398.
72—218
556. Лихтер А. И., Тихонович Н. П. —
ЖТФ, 1940, т. 10, № 14, с. 2101—1206;
т. 9, № 21, с. 1916—1922.
557. Теплофизические свойства веществ-
и материалов. Вып. 10, М.: Изд-во стандар-
тов, 1976, с. 177—205.
558. Торочешников Н. С. — ЖТФ, 1937,
т. 13, № 10, с. 1107—1110.
559. Наринский Г. Б. — Тр. ВНИИки-
маш, 1967, '№ 11, с. 3—45; № 13, с. НО-
152.
560. Фастовский В. Г., Петровский
Ю. В, —ЖФХ, 1957, т. 31. № 10, с. 1317—
1321; 1956, т. 30, № 3, с. 589—592.
561. Волова Л. М. — ЖФХ, 1940, т. 14,
№ 2, с. 268—276.
562. Харахорин Ф. Ф. — ЖТФ, 1941,
т. 11, № 12, с. 1133—1139.
563. Бенедикт М., Пигфорд Т. Химиче-
ская технология ядерных материалов. Пер..
с англ. М.; Атомиздат, 1960. 529 с.
564. Девятых Г. Г., Зорин А. Д. —
ЖФХ, 1956, т. 30, № 5, с. 1133—1139.
565. Дорошенко А. И. и др. — ЖФХ,
1976, т. 50, № 11, с. 3000; 1981, т. 55, № 1„
с. 257—259.
566. Морозов В. С. — Газовая промыш-
ленность, 1967, № 7, с. 43—45.
567. Якименко Н. П., Глух Г. М., Иом-
тев М. Б. —ЖФХ, 1977, т. 51, № 6,
с. 1566—1567.
568. Березняк Н. Г. и др. — Украин-
ский физ. журн., 1977, т. 19, № 3, с. 472—
481; ЖЭТФ, 1969, т. 57, № 6, с. 1937—
1939
569. Ишкин И. П., Бурбо П. 3. —
ЖФХ, 1939, т. 13, № 9, с. 1337—1339.
570. Федорова М. Ф. — ЖФХ, 1940,
т. 14, № 3, с. 422—426.
571. Буланин М. О., Амамчан Р. Г.—
Тр. ВНИИкимаш, 1967, вып. 11, с. 135—
152.
572. Денисенко Г. Ф., Файнштейн В. И’.
Техника безопасности при производстве
кислорода. М.: Металлургия, 1975. 271 с.
573. Амамчан Р. Г., Берцев В., Була-
нин М,—ЖФХ, 1973, т. 47, № 10, с. 2665—
2666.
574. Кошелев В. С. — Газовая промыш-
ленность, 1971, № 9, с. 42—45.
575. Справочник по разделению газовых
смесей методом глубокого охлаждения/
И. И. Гальперин, Г. М. Зеликсон, Л. Л. Ра-
попорт. М.: Госхимиздат, 1963. 512 с.
576. Смирнов А. С. Технология углево-
дородных газов. М.: Гостехиздат, 1947.
320 с.
577. Холланд Ч. Многокомпонентная
ректификация: Пер. с англ. М.: Химия,
1969. 347 с.
578. Сверхпроводящие материалы/ Е. М.
Савицкий, Ю. В. Ефимов и др. М.: Метал-
лургия, 1976. 295 с.
579. Кельцев Н. В. Основы адсорб-
ционной техники. М.: Химия, 1984. 591 с.
580. Колышкин Д. А., Михайлова К. К.
418
Список литературы
Активные угли. Справочник. Л.: Химия,
1972. 56 с.
581. Каганер М. Г. — ЖФХ, 1968, т. 42,
№ 5, с. 1228 -1234.
582. Федорова М. Ф., Алиев А. И.—
ЖФХ, 1964, т. 38, № 4, с. 989—992; 1966,
т. 40, № 4, с. 877—880; 1966, т. 10,
с. 2603—2605.
583; Вагин Е. В., Салтыкова В. А.,
Дыхно Н. М. — Тр. ВНИИКриогенмаш,
1971, № 13, с. 104—109, 255—264.
584. Каганер М. Г. Тепловая изоляция
в технике низких температур. М.: Машино-
строение, 1966. 275.
585. Фастовский В. Г., Ровинский А.—
Журн. прикл. хим., 1980, т. 33, № 7,
с. 1641—1653.
586. Архаров А. М. и Др. — Хим. и
нефт. машиностроение, 1980, № 9, с. 14—15.
587. Юферов В. Б. и др. — ЖТФ, 1966,
т. 36, № 11, с. 2042—2050; 1967, т. 37, №9,
С. 1726—1728; 1969, т. 39, № 3, с. 571—576;
1969, т. № 9, с. 1683—1688.
588. Стабников В. И. Ректификацион-
ные аппараты. М.: Машиностроение, 1965.
356 с.
589. Бошнякович Ф. Техническая термо-
динамика. Т. II. М.: Энергия, 1956. 255 с.
590. Кириллин В. А., Шейндлин А. Е.,
.Шпильрайн Э. Э. Термодинамика раство-
ров. М.: Энергия, 1980. 287 с.
591. Малков М. П. Технология гелня
и других редких газов. Л.: Изд-во хнм.
лит., 1940. 132 с.
592. Платонов В. М., Берго Б. Г. Раз-
деление многокомпонентных смесей. М.:
Химия, 1965. 230 с.
593. Касаткин А. Г. Основные процессы
и аппараты химической технологии. М.: Хи-
мия, 1973. 750 с.
594. Цибровский Я. Процессы химиче-
ской технологии: Пер. с польск. М.: Химия,
1958. 932 с.
595. Термодинамические свойства эти-
.лена/В. В. Сычев, А. А. Вассермаи и др. М.:
.Изд-во стандартов. 1981. 279 с.
596. Беляков В. П., Наринский Г. Б.,
Густов В. Ф. — Хнм. и нефт. машинострое-
ние, 1975, № 9, с. 3—6.
597. Беляков В. П., Густов В. Ф., На-
ринский Г. Б. — Хим. и нефт. машинострое-
ние, 1980, № 3, с. 4—6.
598. Бродянский В. М. Энергетика и
экономика комплексного разделения возду-
ха. М.: Металлургия, 1966. 67 с.
599. Позняк В. Е., Орлов В. К-, Са-
вельев В. И. — Хим. и нефт. машинострое-
ние. 1980, № 3, с. 8—9.
600. Пузырьковые камеры/ Ю. А. Алек-
сандров, С. Г. Воронов, В, М. Горбунков
и др. Под ред. Н. Б. Делоне. М.: Госатом-
издат, 1963. 340 с.
601. Криогенные приборы и устройства
в ядерной физике/ Н. И. Агапов, Н. И. Ба-
.ландиков, В. А. Белушкин и др.; Под ред.
А. Г Зельдовича. М,- Энергоиздат, 1982.
198 с.
602. Пузырьковые камеры. Материалы
рабочего совещания по технике пузырько-
вых камер, ОИЯИ, 13-4466, Дубна, 1969.
243 с.
603. Бушуев Ю. П., Костин В. П.,
Устенко Е. Н. и др. Сообщение ОИЯИ,
13-10979, Дубна, 1977. 15 с.
604. Лебедев Р. М. — ПТЭ, 1966, № 5,
с. 82—86.
605. Белоногов А. В. — Хим. и нефт.
машиностроение, 1971, Ns 7, с. 40—42.
606. Горелов А. М., Зельдович А. Г.,
Ершов В. В. Фильтрация твердых примесей
азота и кислорода в жидком водороде. —
Сообщение ОИЯИ, 8-4961, Дубна, 1970.
27 с.
607. Дьячков Е. И., Белоногов А. В.,
Зельдович А. Г. и др. — Препринт ОИЯИ,
2254, Дубна, 1965. 18 с.
608. Блохинцева Т. Д. — ПТЭ, 1962,
т. 7 № 5, с. 51—57.
’609 . Айнутдинов М. С, —ПТЭ, 1968,
т. 1'3, № 2, с. 47—61.
610. Ветлицкий И. А.— ПТЭ, 1967,
т. 12, № 4, с. 43—54.
611. Голованов Л. Б. Водородные ми-
шени в физике частиц высоких энергий. —
ЭЧАЯ, т. 2, вып. 3. М.: Атомнздат, 1972,
с. 719—761.
612. Голованов Л. Б. Криогенные ми-
шени внутри стримерных камер и обеспече-
ние мншеней криогенными жидкостями. —
ЭЧАЯ, т. 8, вып. 3. М.: Атомиздат, 1977,
с. 1155—1182.
613, Борзунов Ю. Т., Ветроградов А. С.,
Виноградов В. Н. — Сообщение ОИЯИ,
13-80-88, Дубна, 1980. 10 с.
614. Бартенев В. Д.—ПТЭ, 1972, №3,
с. 28—33.
615. Бартенев В. Д. — ПТЭ, 1973, № 1,
с. 30—38.
616. Черноплеков Н. А. — Вестник АН
СССР, 1978, № 9, с. 48—62.
617. Веркин Б. И., Михальченко Р. С.,
Павлюк В. А. — ИФЖ, 1971, т. 20, № 6,
с. 965—978.
618. Гусаров М. С. — Атомная энергия,
1977, т. 43, вып. 3, с. 161—169.
619. Альтов В. А., Зенкевич В. Б.,
Креплев Л. Г., Сычев В. В. Стабилизация
сверхпроводящих магнитных систем. М.:
Энергия, 1975. 327 с.
620. Брехна Г. Сверхпроводящие маг-
нитные системы. М.: Мир, 1976. 704 с.
621. Дробин В. М., Дьячков Е. И., Ку-
ликов Ю. В,-—Препринт ОИЯИ, Р8-80-575,
Дубна, 1975. 10 с.
622. Труды конференции по техниче-
скому использованию сверхпроводимости.
М.: Атомиздат, 1977; в 4-х т., т. I, с. 35,
т. IV, с. 5.
623. Сверхпроводящие и криорезистив-
ные провода для криогенной техники. М.;
Информэлектро, 1977. 67 с.
Список литературы
419>
624. Хованец Ф. — Сообщение ОИЯИ,
Р8-11145, Дубна, 1978. 12 с.
625. Зенкевич В. Б., Сычев В. В. Маг-
нитные системы на сверхпроводниках. М.:
Наука, 1972. 260 с.
626. Ветлицкий И. А., Белоногов А. В.,
Глухих В. А. и др. — Сообщение ИТЭФ-93,
М„ 1975. 20 с.
627. Ветлицкий И. А. — Сообщение
ИТЭФ-69, М„ 1979. 28 с.
628. Агапов Н. Н., Белушкин В. А.,
Зельдович А. Г. Криогенные системы сверх-
проводящих ускорителей. — ЭЧАЯ, т. 13,
вып. 5, М.: Энергия, 1982, с. 982—1023.
629. Агапов Н. Н. и Др- — Препринт
ОИЯИ, Р8-12786 Дубна, 1979; Cryogenice,
1980, v. 20, № 6, р. 345- 349.
630. Велихов Е. П., Глебов И. А., Глу-
хих В. А. — Электротехника, 1981, № 1, с. 2;
Малышев И. Ф. и др. Там же, с. 7.
631. Всемирный электротехнический
конгресс. 21—25 июня 1977, Москва. До-
клады: В. А. Глухих, Б. Г. Карасев,
А. В. Комин и др. 1.76; А. Е. Шейндлин,
В. Д. Джексон, 0,03; W. V. Hassenzahl 2.88;
Р. A. Rios е. е. 1.39; Б. И. Веркин 1.43;
В. К. Калашников 7.1'5; G. Bogner 2.83.
632. Аиищенко Н. Г—Препринт ОИЯИ,
8-82-172, Дубна, 1982. 12 с.
633. Боровик Е. С. и др. — ЖТФ, 1940,
т. 10, № 12, с. 988—994.
634. Кабат Д. и др. — Препринт ИАЭ —
2887, 1977. 9 с.; Czech J. Phys. 1977, v. 27А,
№ 6, р. 587—595.
635. Иванов Д. П., Кейлин В. Е., Став-
чевский Б. В., Черноплеков Н. Л. — Атом-
ная энергия, 1978, т. 45, вып. 3, с. 171—178.
636. Черемных П. А,—ПТЭ, 1076, № 5,
с. 226; 230; Клявин П. П. и др. Там же,
с. 232.
637. Глебов И. А. — Электротехника,
1980. № 1, с. 10—18.
638. Буянов Ю. Л., Фрадков А. Б., Ше-
балин И. Ю. — ПТЭ, 1974, № 4, с. 5—10.
639. Слабая сверхпроводимость. Кван-
товые интерферометры/ Под ред. Б. Б.
Шварца и С. Фонера. М.: Мир, 1980. 266 с.
640. Солимар Л. Туннельный эффект
в сверхпроводниках и его применение. М.:
Мир. 1974. 428 с.
641. Лоунасмаа О. В. Принципы и ме-
тоды получения температур ниже 1 К. М.:
Мир, 1977. 356 с.
642. Васильев Б. В., Колычева Е. В.—
ЖЭТФ, 1978, т. 74, с. 466.
643. Васильев Б. В., Колычева Е. В. —
ЖЭТФ, 1978, т. 75, с. 9.
644. Уильямс Дж. Сверхпроводимость
и ее применение в технике. М.: Мир, 1973.
296. с.
645. Дмитриенко И. М. В мире сверх-
проводимости. Киев: Наукова думка, 1981.
124 с.
64.6. Казовский Е. Я., Карцев В. П.,
Шахтарин В. Н. Сверхпроводящие магнит-
ные системы. Л.: Наука, 1967. 326 с.-
647. Карасик В. Р. Физика и техника
сильных полей. М.: Наука, 1964. 347 с.
648. Brechna Н., Hwang С. Y. — Cryo-
genics, 1979, v. 19, р. 217.
649. Gorodkov Yu V. е. а. — Cryogenics,
1976, v. 16, № 8, р. 503.
650. Morpurgo М. — Cryogenics, 1979,
v. 19, № 7, р. 411.
651. Agapov N. N. е. а. — Cryogenics,
1980, v. 20, № 6, р. 345.
652. Wilson М. N. — IEEE Trans, on
Magnetics, Mag-13, 1977, № 1, p. 440; Nie-
man R. e. a., p. 632; Ries G., p. 567.
653. Hillman H. e. a. Filamentary A15
Superconductors. Plenum Press, London,
1980. 180 p.
654. Kobiela P. S. Proc. LT-17, v- 2,
1984, p. 1173—1174.
655. Escher U., Hansgen H., Knoner R.—
Experimentell Technik der Physik, 1976,..
Bd XXIV, H. 3, S. 305—312.
656. Heinz W. Proc, of 5-th Inter. Conf,
on Magnet Tech., Roma, 1975, p. 14; Esch-
richt W. e. a., p. 85—89.
657. Проспект фирмы Sumitomo Elec-
tric, Осака, Япония.
658. Verkin В. I. e. a. Proc. 7-th Inter-
national Cryogenic Engineering Conference.
London, 1978, p. 586—592.
659. Otsuka T. e. a. — IEEE Trans, on
Magnetics, 1974, v. Mag.-ll № 2,.
p. 608—614.
660. Bogner G. Proc, of Applied Super-
cond. Conf. Annapolis, USA, 1972, IEEE
Pub. № 72, CH-0682-5-TABSC, p. 214—222.
661. Matsuda A.. Yoshiko H. — Cryo-
genics, 1980, v. 20, № 3, p. 135—141.
662. Scurlock R. G., Sauli P. — Cryoge-
nics, 1C|76. v. 16, № 5, p. 303.
663. IGC Newsletter, 1978, v. 5, № 1,.
Cern Courier, 1978, v. 18, № 9, p. 303.
664. Dahl P. F. Report BNL 50498, ISA.
76-4. Brookhauen, USA, 1976. 48 p.
665. Miksell R. P., Scott R. B. — Journ.
Research Nat. Bureau Stand, 1956, v. 57,.
6, p. 371—386.
666. Chernoplekov N. A. Sixth Interna-
tional Conf, on Magnet Technology (MT-6).
Proceedings. Bratislava, 1977, p. 3; Pa--
rain .1., p. 21; Luton M. A. e. a., p. 31; Hos-
kins A. J., p. 117; Wang S. T., e. a. p. 157;
Albrecht C., p. 177; Desportes H., p. 474;.
Perof J., Leroy D. F„ p. 487.
667. Hirabayashi H. E. e. a. Proc. 5-th
Inter. Cryog. Eng. Conf., Kyoto, 1974, p. 395.
668. Taylor С. E. e. a. 1981 Particle
Accelerator Conference. — IEEE Transactions-
on Nuclear Science, 1981, p. v. NS-28, № 3,.
p. 3200; Hassenzahl W., p. 3277.
669. Hatch A. M. e. a. — Cryogenics,.
1978, v. 18, № 2, p. 67.
670. Ovcharenko V. A. — Cryogenics,.
1978, v. 18, № 6, p. 358.
671. Hudson P. A., Jones H. — Cryoge-
nics, 1976, v. 16, № 10, p. 593.
672. Intermagnetics General Corpora-
420
Список литературы
tion. Проспект
673. Terno N. — Cryogenic Engineering,
1976, v. П, № 6, р. 1; Kyoji Т. е. а., р. 12.
674. Cern Courier, 1970, v. 10, № 2,
р. 38.
675. Montgomery D. В. Seventh Inter-
national Conference on Magnet Technology,
MT-7.— IEEE Transactions on Magnetics,
1981; v. Mag-17, № 5, p. 1541; Lambrecht
D. P., p. 1551; Taylor C. e. a, p. 1571; Hill-
man H., p. 1614; Weisse H. J., p. 1628
Cloudet G., p. 1749; Wand S. T. e. a.,
p. 1761; Leopold M. J. e. a., p. 1779; Scher-
mer R. I. e. a., p. 1950; Ikeda M. e. a.,
p. 2003; Fevrier A. e. a., p. 2078; Kathedea
e. a., p. 2071.
676. Keilin V. E., Kovalev I. A. — Cryo-
genics, 1975, v. 15, p. 610.
677. Future Trends in Superconductive
Electronics (Charlottesville, 1978)/ Ed.
B. S. Deaver, Jr. e. a. N. Y.: American Insti-
tute of Physics, 1978. 180 p.
678. Zimmerman I. E. — Cryogenics,
1980, v. 2, № 1, p. 3.
679. Proceedings of the International
Conference on Superconducting Quantum De-
vices, Berlin (West), October 5—8, 1976. Wal-
ter de Gruyter, Berlin — NY, 1977. 280 p.
680. Petley B. W. — Contemporary Phy-
sics, 1980, v. 21, № 6, p. 607.
681. Proceedings of the Second Interna-
tional Conference on Superconducting Quan-
tum Devices, Berlin (West) May 6—9, 1980.
Berlin — NY: Walter de Gruyter, 1980. 640 p.
682. Applied Superconductivity/ Ed.
V. Z. Newhouse. V. 1, II. New York, San
Francisco, London: Academic Press, 1975.
.580 p.
683. Flyun T. M., Timmerhaus K. D. —
Bull. Internal. Inst. Refrig., 1966, Annexe 5,
,p. 459.
684. CERN Courier, 1978, v. 18, p. 437.
685. Roaf e. a. — Nucl. Instr, a. Meth.,
1968, v. 64, № 3, p. 301.
686. Walker R. J. e. a. — Rev. Sci. In-
strum., 1968, v. 39, № 10, p. 1407.
687. Report on the Design study of a
Large Hydrogen Bubble Chamber for the
:'CERN Proton Synchrotron. TC/BEBC 66-73,
1966. 187 p.
688. Technology and Uses of Liquid
Hydrogen/ Ed. by Scott R. London: Perga-
mon Press, 1964. 415 p.
689. International Colloquium on Bubble
Chambers held at Heidelberg, April 13—14,
1967, CERN 67-26, Geneva, 1967. 549 p.
690. Balandiko N. I. e. a. Cryogenics,
1966, v. 6, № 3, p. 158—164.
691. Bubble and Spark Chambers. Prin-
ciples and use. V. 1—2/ Ed. Shutt R. P. New
York and London: Plenum Press, 1967.
280 p.
692. Pless J. A. e. a. — Rev. Sci. In-
strum., 1969, № 3, p. 379.
693. Pewitt E. G. Instrumentation Con-
ference held at Purdue University, 1965,
May 11—14. 820 p.
694. Shaw D. F. — Cryogenics, 1964, v. 4,
№ 4, p. 193.
695. CERN Courier, 1975, v. 11, p. 358.
696. CERN Courier, 1976, v. 16, № 4,
p. 137.
697. CERN Courier, 1977, v. 17, № 11,
p. 370.
698. Morgan G. e. a. 1975 Part. Accel.
Conf.—IEEE Trans. Nucl. Sc„ 1975, NS-22,
№ 3, p. 1164; Fast R. W., Otavka M. A.,
p. 1201.
699. Jarvis O. N., Shah M. — Nucl.
Instr, and Methods, 1971, v. 93, № 1, p. 157.
700. Nigahossian G. — Rapport GEA-
RS 167. Scale, 1967. 28 p.
701. Лабунцов Д. A. — Теплоэнергети-
ка, 1957, № 7, c. 72—80.
702. Капица П. Л, —Журн. экспер. и
теорет. физ., 1948, т. 18, вып. 1, с. 3—28.
703. Журавлева И. Н., Елухин Н. К.—
Тр. ВНИИ кислородного машиностроения,
1967, вып. 11, с. 46—55.
704. Елухин Н. К., Вишнев И. П. —
Тр. ВНИИ кислородного машиностроения,
1963, вып. 7, с. 102—119.
705. Коваленко В. Д. и др. — Хим. и
нефт. машиностроение, 1980, № 7, с. И—12.
706. Микулин Е. И. и Др. — Хим. и
нефт. машиностроение, 1980, № 9, с. 8—10.
707. Богатков С. — Хим. машинострое-
ние, 1934, № 5, с. 15—18.
708. Орлова М. П. и др. — Измеритель-
ная техника, 1973, № 4, с. 5.
709. Орлова М. П. и др. — Измери-
тельная техника, 1973, № 7, с. 3.
710. Температурная шкала Г62 по упру-
гости насыщенных паров 3Не. Харьков:
Изд. физ.-техн, ин-та низких температур,
1963. 8 с.
711. Орлова М. П. и др. — Измеритель-
ная техника, 1973, № 6, с. 3.
712. Орлова М. П. Низкотемператур-
ная термометрия. М.: Изд-во стандартов,
1975. 160 с.
713. Астров Д. Н., Белянский Л. Б.—
Физ. низких температур, 1975, т. 2, № 7,
с. 821—847.
714. Вепшек Я. Измерение низких тем-
ператур электрическими методами: Пер.
с чешек./ Под ред. М. П. Орловой (автор
приложения М. П. Орлова). М.: Энергия,
1980. 224 с.
715. Брехна Г. Сверхпроводящие маг-
нитные системы: Пер. с англ./ Под ред.
В. Р. Карасика, М.: Мир, 1976. 704 с.
716. Орлова М. П. — Измерительная
техника, 1959, № 5, с. 23—25.
717. Брагин Б. К., Тятюева Р. Н.—
Измерительная техника, 1964, № 6, с.ЗО—31.
718. Стрелков И, Г.— Изв. АН СССР,
1950, т. 14, № 1, е. 115—121.
719. Заварицкий Н. В., Шальииков
А. И. —Приборы и техника эксперимента,
1961, М 1, & 1ЮМ41.
Список литературы
421
720. Бейлин В. М. и др. — Приборы и
техника эксперимента, 1972, № 6,
с. 215—216.
721. Медведева Л. А. и др. — Приборы
и техника эксперимента, 1970, № 5,
с. 208—210.
722. Варфоломеев С. Ф. и др. — Прибо-
ры и техника эксперимента 1977, № 1,
с. 262.
723. Астров Д. Н и др. — Измеритель-
ная техника, 1977, № 4, с. 39.
724. Зарубин Л. И., Немиш И. Ю.—
Приборы и техника эксперимента, 1971,
№ 4, с. 260.
725. Логвиненко С. П. и др. — Прибо-
ры и техника эксперимента, 1976, № 6,
с. 238.
726. Логвиненко С. П. и др. — Прибо-
ры и техника эксперимента 1965, № 5,
с. 248,
727. Глизманенко Д. Л. Получение кис-
лорода. 5-е изд. М.: Химия, 1972. 740 с.
728. Беляков В. П. — Вестник АН
СССР, 1979, № 4, с. 24—31.
729. Капица П. Л. — Успехи физ. наук,
1936, т. 16, вып. 2, с. 145—164.
730. Добудько В. Д., Кортиков В. С. —
Хим. и нефт. машиностроение, 1975, 5,
с. 15—17.
731. Хомутов Н. А. — Хим и нефт. ма-
шиностроение, 1980, № 8, с. 25—26.
732. Столпер Л. М. и др. — Экспресс-
информация о работах НИИ и КБ отрасли.
ЦИНТИхимнефтемаш. М.: Серия ХМ6, 1975,
№ 10, с. 7—15
733. Гузман И. С. — Хим. и нефт. ма-
шиностроение, 1967, № 12, с. 1—3.
734. Михайлов Е. И., Денищук Б. В.
Основы автоматизации и механизации кис-
лородного производства. М.: Химия, 1968.
735. Беляков В. П. и др. — Хим. и
нефт. машиностроение, 1980, № 3, с. 22—23.
736. Кучеренко Е. Т. Справочник по
физико-техническим основам вакуумной тех-
ники. Киев: Вища школа, 1981. 264 с.
737. Баева Н. Н. и др. — Приборы и
техника эксперимента, 1966, № 6, с. 204—
206.
738. Донде А. Л. — Приборы и техни-
ка эксперимента, 1967, № 5, с. 240—242.
739. Пауэр Б. Д. Высоковакуумные
откачные устройства: Пер. с англ. М.: Энер-
гия, 1969. 528 с.
740. Видинцев Ю. Д. Автоматизация
криогенных установок. М.: Энергия, 1975.
741. Грезин А. К. и др. — Хим. и нефт.
машиностроение, 1980, № 7, с. 18.
742. Пипко А. И. и др. Конструирова-
ние и расчет вакуумных систем. 3-е изд.
М.: Энергия, 1979. 504 с.
743. Гарвин Э. Л. — В кн.: Новые на-
правления криогенной техники: Пер. с англ.
М.: Мир, 1966, с. 179—197.
744. Медведев В. А. и др. — ЖФХ,
1967, т. -К, № и, . , '
745. Грязнов Н. В., Михайлушкин А. И.,
Рохмистров А. Н. Основы автоматизации
производственных процессов криогенной тех-
ники. Л.: Машиностроение, 1980. 189 с.
746. Кожевников И. Г., Новицкий Л. А.
Теплофизические свойства материалов при
низких температурах. Справочник. 2-е изд.
М.: Машиностроение, 1982. 328 с.
747. Склянкин А. А. — Приборы и тех-
ника эксперимента, 1961, № 4, с. 180.
748. Алексеев В. П. и др. Оборудова-
ние для производства аргона. М.: Машино-
строение, 1972, 247 с.
749. Головко Г. А. Криогенное произ-
водство инертных газов. 2-е изд. Л.: Ма-
шиностроение, 1983. 416 с.
750. Фастовский В. Г., Ровинский А. Е.,
Петровский Ю. В. Инертные газы. 2-е изд.
М.: Атомиздат, 1972. 355 с.
751. Шебалин И. Ю. — Приборы и тех-
ника эксперимента, 1963, № 3, с. 201—202.
752. Буянов Р. А. — Кинетика и ката-
лиз, 1960, № 2, с. 306—312; № 3,
с. 418—420.
753. Буянов Р. А., Зельдович А. Г., Пи-
липенко Ю. К- — Химическая промышлен-
ность, 1961, № 2, с. 105—108.
754. Малков М. П., Фрадков А. Б. —
ЖТФ, 1952, т. 22, № 3, с. 436—445.
755. Архаров А. М. Низкотемператур-
ные газовые машины. М.: Машиностроение,
1969. 223 с.
756. Фрадков А. Б., Троицкий В. Ф.—
Приборы и техника эксперимента, 1964,
№ 1, с. 233—235.
757. Фрадков А. Б. — Кислород, 1958,
№ 5, с. 21—28.
758. Фастовский Е. Г., Петровский
Ю. В., Ровинский А. Е. Крибагенная техни-
ка. 2-е изд. М.: Энергия, 1974. 495 с.
759. Фрадков А. Б. — Препринт Физ.
ин-та им. П. Н. Лебедева, 1965, вып. А-117.
13 с.
760. Фрадков А. Б. — Доклады АН
СССР, 1960, т. 133, № 4, с. 829—830; —
Приборы и техника эксперимента, 1961,
№ 4, с. 170—173.
761. Есельсон Б. Н., Рудавский Э. Я-,
Чаговец В. К. и др. — В кн.: Расчет и
исследование криогенных систем. Киев:
Наукова думка, 1981, с. 18—22.
762. Валянский С. И., Миляев В. А.,
Михайлова Г. Н., Фрадков А. Б. — Тр. Физ.
ин-та им. П. Н. Лебедева, 1977, т. 100,
с. 66—74.
763. Веркин Б. И., Михальченко Р. С.,
Архипов В. П. и др. — В кн.: Расчет и
исследования криогенных систем. Киев:
Наукова думка, 1981, с. 3—10.
764. Есельсон Б. Н-, Иванов В. Г., Ко-
валь В. А. и др. Свойства жидкого и твер-
дого гелия. Растворы 3Не — 4Не. Справоч-
ник/ Под ред. Б. Н. Евельсои. Киев: Нау-
кова думка, 1982. 232 €.
422
Список литературы
765. Фрадков А. Б. — Приборы и тех-
ника эксперимента, 1956, № 2, с. 141—142.
766. Анашкин О. П, Кейлин В. Е,
Лыков В. В. и др. — Приборы и техника
эксперимента, 1981, № 5, с. 230—232.
767. Демишев А. Г., Пелых Д. П, Рат-
манский Д. С. и др. — Приборы и техника
эксперимента, 1980, № 5, с. 258.
768. Медведев В. С. и др. — Приборы
и техника эксперимента, 1980, № 5, с. 254.
769. Демишев А. Г. и др. — Приборы и
техника эксперимента, 1982, № 4, с. 244.
770. Григорьев В. А., Крохин Ю. И.
Тепло- и массообменные аппараты криоген-
ной техники. М.: Энергоиздат, 1982. 212 с.
771. Добров В. М, Табунщиков О. К.—
Хим. и нефт. машиностроение, 1968, Ks 1,
с. 12—13 и 1969, № 7, с. 39—40.
772. Кислород. Справочник, т. II/ Под
ред. Д. Л. Глазманенко. М.: Металлургия,
1973. 463 с.
773. Иванов Б. А., Розовский А. С.
Безопасность работы с жидким кислородом.
М..: Химия, 1981. 221 с.
774. Солнцев М. Я- и др. Сборник тру-
дов НИИХИММаша, № 30, М.: 1962,
с. 3—54.
775. Руэман М., Федоренко А. — ЖТФ,
1937, т. 7, № 4, с. 335—342.
776. Калашников И. П. — Хим. и нефт.
машиностроение, 1981, № 2, с. 5—7.
777. Ершов Б. Н., Белова В. И. — Тео-
ретнч. основы хнм. технологии, 1980, т. 14,
№ 5, с. 768 и 1981, т. 15, № 1, с. 114—115.
778. Малков М.П., Павлов Е. Ф. Спра-
вочник по глубокому охлаждению в техни-
ке. М. — Л.: ОГИЗ, 1947. 411 с.
779. Семенова Т. А., Лейтес И. Л.
Очистка технологических газов. М.: Химия,
1969. 392 с.
780. Розеи А. М. Теория разделения
изотопов в колонках М.: Атомнздат, 1960.
438 с.
781. Шемля М., Перье Ж. Разделение
изотопов: Пер. с франц. М,- Атомнздат,
1980. 169 с.
782. Малков М. П, Зельдович А. Г.,
Фрадков А. Б., Данилов И. Б. Доклады
советских ученых на 2-й Международной
конференции по мирному использованию
атомной энергии. Т. 6. М.: Атомнздат, 1959,
с. 54—62 и Progress in Cryogenics, v. 2
Hegmood Co London, 1960, p. 69—86.
783. Производство тяжелой воды: Пер.
с англ. М.: Изд-во иностр, лит., 1961. 518 с.
784. Кузнецов В. Н. — Жури, экспер.
и теорет. физ, 1957, т. 32, № 5, с. 1001—
1011.
785. Андреев И. Л., Бабенко Н. И.'
и др. — Хнм. и нефт. машиностроение, 1981,
№ 10, с. 18—20.
786. Беляков В. П. и др.—Хим. и нефт.
машиностроение, 1981, № 1, с. Т5—16.
787. Пашков В. В., Благой Ю. П.
и др.— Физика “низких температур, 1981,
т. 7, № 5, с. 549—558. —
788. Термодинамические свойства кис-
лорода./ В. В. Сычев, А. А. Вассерман,
А. К. Козлов и др. М.: Изд-во стандартов,
1981. 304 с.
789. Becker R, Yakob F. — Linde Be-
richte, 1958, № 3, S. 25—32; 1958, № 4,
S 27—32; 1964, |№ 17, S. 25—23; Kaltetech-
nik, 1964, Bd lb, № 8, S. 239—241.
790. Ruheman M, Zinn W. — Zs. So-
wjetunion, 1937, Bd 12, № 4, S. 389—403.
791. Fair Y. R. — Chem. Eng. Progress,
1958, v. 54, № 12, p. 39—46.
792. Baldus H, Linde G. — Linde Be-
richte, 1958, № 3, S. 12—24; 1962, № 14,
S. 3—19; Kaltetechnik, 1963, Bd 15, № 6,
S. 158—166.
793. Linde G. — Chem. Ingen. Technik,
1955, Bd 27, № 11, S. 661—668.
794. Baldus H., Forg W. — Linde Be-
richte, 1965, № 20, S. 52—62.
795. Gutowski H. — Kerntechnik, 1970,
Bd 12, № 5/6, S. 233—241.
796. Scholz W. — Kaltetechnik, 1961,
Bd 13, № 5, S. 184—188.
797. Quack H. — Inst. Intern. Refrige-
ration, Commission A 1—2, 1978, Zurich,
p. 129—136.
798. Bartlit Y. U. A. — Cryogenics, 1979,.
v. 19, № 5, p. 275—279.
799. Weil L. — Proc. 1st ICEL in Cioto,
1967, p. 246—250.
800. Беляков В. П. Криогенная техни-
ка и технология. М.: Энергоиздат, 1982.
271 с.
801. Davson J. Р, Haygood J. D.—
Cryogenics, 1965, v. 5, № 2, р. 57—67.
802. Balwanz W. W. e. a. — Adv. in-
Cryog. Eng., 1961, v. 6, p. 195—201.
803. Hill R. W„ Lounasmaa О. V.—
Phylos. Magazine, 1959, v. 4, № 43,
p. 785—795.
804. Morin F. J., Maita J. P. — Phys.
Rev., 1963, v. 129, № 3, p. 1115—1121.
805. Properties of Materials at Low
Temperature. Phase I. A Compendium. Per-
gamon Press, 1961. 915 p.
806. De Nobel J., Du Chatenier F. J. —
Physica, 1963, v. 29, № 11, p. 1231—1232.
807. Van Kempen H. e. a. — Physica,
1964, v. 30, № 1, p. 229—236.
808. Antoniou A. A., Morrison J. A. —
Journ Appl. Phys., 1965, v. 36, Xi? 6,
p. 1873—1877.
809. Lounasmaa О. V. — Phys. Rev.,
1967, v.. 158, № 3, p. 591—600.
810. Flotow H. E, Osborne D. W.—
Phys. Rev., 1967, v. 160, № 3, p. 467—471.
811. Lounasmaa О. V. — Phys. Rev,.
1966, v. 143, № 2, p. 399—405.
812. Lounasmaa О. V. — Phys. Rev,.
1964, v. 133, № 2A, p. A502—A509.
813. Berg W. T. —Phys. Rev., 1968,
v. 137, № 3, p. 583—586.
814. Lounasmaa О. V, Guenther R. A.—
Phys. Rev., 1962, v. 126, № 4, p. 1357—1363'
Список литературы
423
815. Lien W. Н, Phillips N. E. — Phys.
iRev, 1964, v. 133, № 5A, p. A1370—A1377.
816. Lounasmaa О. V.— Phys. Rev.,
1964, v. 133, № 1A, p. A219—A224.
817. Hoeven B. J. C, Keeson P. H.—
Phys. Rev., 1964, v. 134, № 5A, p. A1320—
A1321.
818. Hoeven B. J. C, Keesom P. H.—
Phys. Rev., 1964, v. 135, p. 631—637.
819. Ho James C, O’Neal H. R, Phil-
lips N. E. — Rev. Sci. Instrum., 1963, v. 34,
№ 7, p. 782—783.
820. Long H, Nubel G, Hover H.—
Bull. Intern. Ins tit. of Refrigeration, 1966,
Annex 5, p. 187—214, 329—342.
821. Hammel E. — Adv. in Cryog. Eng.,
1980, v. 25, p. 810—821.
822. Praice C. — Proc. 11-th Internat.
Conf, of Low Temperature Phys., 1968, v. 1,
p. 112—118.
823. Stern S. — Indust. Eng. Chem.,
1965, v. 57, № 2, p. 40—60.
824. Litz H, Smith G. — Applications
cryogen, technology, 1973, v. 5, p. 106—122.
825. Forg W. — Chem. Process Eng.,
1971, v. 52, At 2, p. 65—68; Linge Berichte,
1970, № 28, S. 18—26; 1973, № 33, S. 3—5.
826. Gerhold I.—Cryogenics, 1979, y. 19,
№ 10, p. 571—579.
827. Willis W. L. — Cryogenics, 1981,
v. 6, № 5, p. 279—285.
828. Hust J. G, Boskardin R. — Cryo-
genics, 1981, v. 21, № 5, p. 297—286.
829. Buchna H.— In: Proceedings of the
Second Internal. Conf, on Magnet Techno-
logy. Oxford, the Rutherford Lab., 1967,
p. 305—312.
830. Jongenburger P. — Bull. Internal.
Inst. Refr., 1959, Annexe 3, p. 397.
831. Report NASA-TM-X-52121. 18 p.
832. Me Donald D. К- C, Mendels-
sohn K- — Proc. Soc., Ser. A, 1950, v. 202,
№ 1071, p. 523—532.
833. White G. K-, Woods S. B. —Phil.
Magazine, 1958, v. 3, № 28, p. 342—350.
834. White G. K-, Woods S. B. —Rev.
Sci. Instrum., 1957, v. 28, № 8, p. 638—645.
835. Vacnet P. — Rev. Gen. Electr, 1965,
v. 74, № 6, p. 555—562.
836. Weller S., Steiner W. A. — Chem.
Eng. Prog., 1950, v. 46, № 11, p. 585—593.
837. Caland J. — C. R. Academ. Sci.,
1968, v. 266, p. 1302—1308.
838. Pawlek F., Hogalla D. — Cryoge-
nics, 1966, v. 6, № 1, p. 14—18.
839. Straty G. C, Prydz R. — Adv.
Cryog. Eng., 1970, v. 15, p. 36—46.
840. Maddock B. J. — Physics in Tech-
nology, 1975, November, p. 266—278.
841. Anashkin О. P. e. a. — Cryogenics,
1979, v. 19, p. 405—412.
842. Vande Vorde M. — Preprint CERN
ISR-MA/75-38, Aug. 1975, Geneva, Switzer-
land; Cryogenics, 1976, v. 16, № 3, p. 296—
.302.
843. Heemskerk J. P. T. — Physica, 1974,
v. 71, № 3, p. 484—496.
844. Bewilogua L. e. a. — J. Low Temp.
Phys., 1972, v. 8, № 3/4, p. 255—262.
845. Daney D. E. — Cryogenics, 1971,
v. 11, № 4, p. 290—296.
846. Christen D. K-, Pollack G. L.—
Ph^s. Rev. B, 1975, v. 12, № 8, p. 3380—
847. Yasuda H. — J. Low Temp. Phys.,
1978, v. 31, № 1/2, p. 223.
848. Clemans J. E. — Phys. Rev. B, 1977,
v. 15, № 2, p. 1072—1078.
849. Petersen J. N. e'. a. — A. I. Ch. Eng.
Journal, 1971, v. 17, № 2, p. 289—295.
850. Berthe] К. H. e. a. Untersuchun-
gen bei tiefen Temperaturen. — In: Zeit-
schrift «Experimentalle Technik der Physy-
sic», Berlin, Deutscher Verlag der Wisse-
schatten, 1974. 180 S.
851. Reese W., Tucker J. — Journ. Chem.
Phys., 1965, v. 43, № 1, p. 105—109.
852. Jelinek J., Doberal J. — Cryogenics,
1972, v. 12, № 4, p. 316.
853. Giles M, Ferry C. — Phys. Rev.
Lett., 1969, v. 22, № 17, p. 882—886.
854. Kolouch R. J., Brown R. G. —
Journ. Appl. Phys., 1968, v. 39, № 8,
p. 3999—4008.
855. Reese W. — Journ. Appl. Phys.,
1966, v. 37, № 2, p. 864—876.
856. Hay R. D, Rapperport E. J.—
A review of electrical insulation in super-
conducting magnets for fusion reactor (fi-
nal report). Oak Ridge Nat. Lab., Cambrid-
ge, 1976, april 21. 48 p.
857. NBS Techn. Note, 1972, № 631.
155 p.
858. Schonbacher H, Van der Voor-
de M. N. — Preprint CERN 75-3. Geneva,
1975. 12 p.
859. Kondraciuk B. e. a. — Acta Phys.
Polon, 1972, V. A41, № 2, p. 141—148.
860. Roth E. P, Anderson A. C. — J.
Appl. Phys., 1976, v. 47, № 8, p. 3644.
861. Curry L. e. a. — Phys. Rev., 1960,
v. 117, № 4, p. 953—957.
862. Slack G. A. — Journ. Appl. Phys.,
1964, v. 35, № 12, p. 3460—3468.
863. Connoly A., Mendelssohn K-—Proc.
Roy. Soc. Ser. A, 1962, v. 266, № 1327,
p. 429—437.
864. Anderson A. C, Malinowski M. E.—
Phys. Stat. Sol (b), 1970, v. 37, № 2,
p. 141—147.
865. Hoeven Van der B. J. C, Kee-
som P. H. — Phys. Rev., 1963, v. 130, № 4,
p. 1318—1326.
866. Reiche K-, Pompe G. — J. Low
Temp. Phys., 1979, v. 36, № 3/4, p. 467—475.
867. Campos M. A. — J. Low Temp.
Phys, 1975, v. 20, № 5/6, p. 677—683.
868. Reinolds C. L, Anderson A. C. —
Rev. Sci. Instr, 1977, v. 48, № 12, p. 1715—
1723.
869. Mendelssohn K. — Cryophysics.
424
Список литературы
N. Y. — London: Interscience Publ., 1960.
183 p.
870. Flachbart K. e. a. — Phys. Stat. So-
lid (b), 1978, v. 85, № 2, p. 545—552.
871. Louh F. — Phys. Rev. B, 1976, v. 14,
№ 9, p. 3914—3920.
872. Gladun A. e. a. — J. Low Temp.
Phys, 1977, v. 27, № 5/6, p. 873—886.
873. Corzett D. T. e. a. — Cryogenics,
1976, v. 16, № 8, p. 505—514.
874. Anthony F. J, Anderson A. C.—
Phys. Rev. B, 1976, v. 14, № 12, p. 5198—
5212.
875. Gupta A. K. e. a. — Solid Stat.
Commun., 1972, v- 10, № 1, p. 57—64.
876. Reynolds C. L, Anderson A. C.—
Phys. Rev. B, 1976, v. 14, № 9, p. 4114—
4123.
877. Hust I. G. — Cryogenics, 1975,
v. 15, № 1, p. 8—15.
878. Radenbaugh R.—Rev. Sci. Instrum.,
1977, v. 48, № 1, p. 93—103.
879. Garett K. W, Rosenberg H. M. —
Proc. ICEC 4, 1972, p. 267; Brauns P. e. a,
p. 270—279.
880. Kobayachi N. e. a. — J. Low Temp.
Phys, 1974, v. 17, № 5/6, p. 575—594.
881. Muller W. e. a. — J. Low Temp.
Phys, 1978, v. 30, № 5/6, p. 561—578.
882. Hall R. O. A.—J. Low Temp. Phys,
1977, v. 27, № 1/2, p. 305—317.
883. Taub H, Williamson S. I. —Solid
State Commun, 1974, v. 15, № 2,
p. 181—193.
884. Boughton R. J. — Phys. Lett. A,
1979, v. 74, № 1/2, p. 141 — 143.
885. Lerner E, Daunt V. G.— Phys.
Rev, 1966, v. 142, p. 251—265.
886. Krevet B, Schauer W. — J. Appl.
Phys, 1976, v. 47, № 8, p. 3656—3672.
887. Fevrier A, Morize D. — Cryoge-
nics, 1973, v. 13, № 10, p. 603—612.
888. Grossbard M. J. — J. Phys. F.: Me-
tal Phys, 1979, v. 9, № 9, p. 1833—1845.
889. Fletcher R, Stinson M. R. — J.
Low Temp. Phys, 1977, v. 27, № 5/6,
p. 787—798.
890. Maezawa K. e. a. — J. Phys. Soc.
Jap, 1979, v. 47, № 2, p. 585—593.
891. Singh R. L. e. a. — Phys. Rev. B,
1976, v. 13, № 11, p. 4949—4960.
892. Singh R. L. —Phys. Rev. B, 1976,
v. 14, № 9, p. 4106—4113.
893. Janos S. e. a. — Phys. Stat. Sol. (b),
1977, v. 81, № 1, p. 19—27.
894. Feldman e. a. — Cryogenics, 1977,
v. 17, Ks 1, p. 31—42.
895. Snodgrass M. L. e. a. — Phys. Rev.
B, 1976, v. 13, № 2, p. 574—582.
896. Yao Y. D. — J. Low Temp. Phys,
1975, v. 21, № 3/4, p. 369—378.
897. Macfarlane J. C, Collins H. C. —
Cryogenics, 1978, v. 18, № 12, p. 668—682.
898. Feher A. — Phys. Stat. Sol. (a),
1977, v. 39, № 1, p. 67—78.
899. Milewitz M. e. a. — Phys. Rev. B,.
1976, v. 13, № 2, p. 5199—5210.
900. Barnier P, Morean I. — Technique-
Moderne, 1968, № 9, p. 1—8.
901. Fallou B, Bobo J. C. — In: Report
on the Intern. Conf, on Large High Voltage
Electric Systems. France, August, 1974.
902. Klaudy P. — Elektrotechnik und
Maschinenban, 1972, H. 3, S. 93—98.
903. Cryogen. Engng. News, 1969, v. 4,
№ 2, p. 18—20.
904. Meats R. J. — Proceedings JEE,
1972, v. 119, № 6, p. 760—780.
905. Lehmann J. P. — Rev. Gen. Electr,
1970, № 1, p. 15—25.
906. Cryogen. Engng. News, 1969, v.
№ 5, p. 20—21.
907. Djordejvich L. — Journ. Chem..
Engng. Data, 1970, v. 15, № 1, p. 10—16.
908. Fulk M. M. — In: Progress in
Cryogenics, V. J. London: Heywood a. co.,
1959, p 65 — 73
909. Kropschot R. H. - ASHRAE Jo-
urn., 1959, v. 1, № 9, p. 48—56.
910. Corruccini R. J. — Chem. Engng.,
1957, v. 53, № 8, p. 397—411.
911. Kropschot R. H. — Cryogenics,.
1961, v. 1, № 3, p. 171—182.
912. Tsurutani S. e. a. — Oyo buturi,
1978, v. 47, № 6, p. 547.
913. Evans D. I., Erickson R. A. —
Journ. Appl. Phys., 1965, v. 36, № 11,.
p. 3517—3523.
914. Black J. A. — Modern Refrig, 1964,.
v. 67, № 793, p. 367—375.
915. Dubs M. A., Dana L. I. — Int.
Inst. Refr. Annexe, 1961-5, p. 71—79.
916. Klett D., Irey R. — Adv. Cryog.
Engng., 1969, v. 14, p. 217—228.
917. Матвеев H. A. — Хим. и нефт. ма-
шиностроение, 1980, № 3, с. 15—17.
918. Бегункова А. Ф. — Теплоэнергети-
ка, 1958, № 12, с. 85—98.
919. Голованов Л. Б. Препринт ОИЯИ
Р8-3237, Дубна, 1967. 20 с.
920. Александров Б. Н. — ЖТЭФ, 1962,.
т. 43, ’№ 2, с. 399—405.
921. Голованов Л. Б. Препринт ОИЯИ
Р8-3236, Дубна. 1967. 20 с.
922. Михальченко Р. С. Автореф. на
соиск. учен, степени канд. техн. наук. 1969.
14 с.
923. Каганер М. Г. Тепломассообмен в
низкотемпературных конструкциях. — М.:
Энергия. 1979. 257 с.
924. Левин Г. Н., Вольмир В. И.—Хо-
лодильная техника, 1958, т. 35, № 1,.
47—58.
925. Голянд М. М. Расчеты и испыта-
ния тепловой изоляции. — М.: Гостоптехиз-
дат, 1961. 316 с.
926. Buchold Т. A., Darrel В, —Cry-
ogenics, 1965, v. 5, № 2, р. 109.
927. Proceed. Second Int. Cryog:.
Список литературы
425
Engng. Conf., Brighton, 1968, p. 102—105,
p. 112—116.
928. Adv. Cryog. Engng., 1980, v. 25,
p. 19—38, 98—113.
929. Longsworth R. C. — Proceed. 5-th
Int. Cryog. Engng. Conf., Kyoto, 1974,
p. 390—394.
930. Morel J. P., Puscual L., Jol-
ly J. P. — Proceed. 5-th Int. Cryog. Engng.
<2onf., Kyoto, 1974, p. 448—450.
931. Gmelin E., Alpen U.— Proceed.
5-th Int. Cryog. Eng. Conf., Kyoto, 1974,
p. 461—464.
932. Citron A. — Proceed. 5-th Int. Cry-
og. Eng. Conf., Kyoto, 1974, p. 534—538.
933. Schuck T. W.— Adv. Cryog Engng.,
1975, v. 21, p. 230—236.
934. Kraft G., Zahn G. — Cryogenics,
1978, v. 18, № 2, p. 112—114.
935. Burns W. A. e. a. — Proceed. 8-th
Int. Cryog. Eng. Conf., Geneva, 1980,
p. 383—387.
936. Vander Arend P. C., Stoy S. T. —
Adv. Cryog. Eng., 1975, v. 21, p. 230—236.
937. Warren R. P. e. a. — Proceed. 8-th
Int. Cryog. Eng. Conf., Geneva, 1980,
p. 373—377.
938. Lison-Tati J. e. a. — Proceed. 8-th
Int. Crvog. Eng. Conf., Geneva, 1980,
p. 189—195.
939. Engel J., Walter H. — Proceed. 5-th
Int. Cryog. Eng. Conf., Kyoto, 1974,
p. 384—386.
940. Urbach A. R., Herring R. H. —
Proceed. 6-th Int. Cryog. Eng. Conf., Gre-
noble, 1976, p. 155—158.
941. Prost R., Rolfo A. — Proceed. 7-th
Int. Crvog. Eng. Conf., London, 1978,
p. 42—49.
942. Urban E. W., Katz L. — Proceed.
7-th Int. Cryog. Eng. Conf., London, 1978,
p. 113—119.
943. Arendt F., Katheder H. — Proceed.
7-th Int. Cryog. Eng. Conf., London, 1978,
p. 134—140.
944. Gmelin E., Gorzellin P., Mul-
ler A. — Proceed. 7-th Int. Cryog. Eng.
Conf., London, 1978, p. 202—207.
945. Yamamoto J., Shigi T. — Proceed.
7-th Int. Cryog. Eng. Conf., London, 1978,
p. 593—598.
946. Kurihara A., Tsoboi T., Tamaha-
ra Y. e. a. — Proceed. 7-th Int. Cryog. Eng.
Conf., London, 1978, p. 655—658
947. Stoll A. P., Taylor L. G., Ste-
el A. J.—Proceed. 7-th Int. Cryog. Eng.
Conf., London, 1978, p. 642—647.
948. Mart J. W„ Steel A. J., Clar-
ke M. E. — Proceed. 6-th Int. Cryog. Eng.
Conf., Grenoble, 1976, p. 69—71.
949. Denner H. D., Klipping G. — Pro-
ceed. 6-th Int. Cryog. Eng. Conf., Grenoble,
1976, p. 93—95.
950. Rival J. — Proceed. 6-th Int.
Cryog. Eng. Conf., Grenoble, 1976, p. 231—
234.
951. Ворошилов Б. С., Грачев А. Б.,
Бродянский В. M. — ИФЖ, 1977, т. 33,
№ 2, с. 238—242.
952. Lacaze A. F. е. а. — Cryogenics,
1983, v. 23, р. 427—432.
953. Номенклатурный каталог изделий
криогенного машиностроения на 1984 г.
М.: Цинтихимнефтемаш, 1984. 48 с.
954. Хэфер Р. Криовакуумная техника.
Основы и применения: Пер. с нем. М.:
Энергоатомиздат, 1983. 272 с.
955. Fickett F. В. Electrical Properties
of Materials and Their Measurement at Low
Temoeratures. — NBS Technical Note 1953,
1982.
956. Baker C. R., Shaner K. L. — In-
tern. Journ. Hydrogen Energy, 1978, v. 3,
№ 4, p. 321—334.
957. Бродянский В. M., Синяв-
ский Ю. В. — Холодильная техника, 1982,
№ 7, с. 24—29.
958. Johnson R. W., Collins S. С.,
Smith J. L. — Adv. Cryog. Eng., 1971, v. 16,
171 — 177.
959. Корсаков-Богатков С. M., Kpo-
ковский Б. Д., Пронько В. Г., Стол-
пер Л. М. — Инж. физ. журнал, 1979, т. 37,
№ 1, с. 118—122.
960. Термодинамические свойства эта-
на/ В. В. Сычев, А. А. Вассерман и др. М.:
Изд-во стандартов, 1982. 303 с.
961. Термодинамические свойства ге-
лия/ В. В. Сычев, А. А. Вассерман и др.
М.: Изд-во стандартов, 1984. 320 с.
426
Предметный указатель
ПРЕДМЕТНЫЙ
Абсолютная шкала температур 9,13, 18,31
Абсорбция газов водой 210, 212
Авогадро число 19
Адиабатное размагничивание, термодинами-
ка 73—75
Адиабатный процесс 25—28, 33, 34, 45
Адсорбенты 223
Адсорбционная очистка газов 214, 284, 292
Адсорбционные вакуумные насосы 358
Адсорбция газов 223
— — изотермы 224
— смеси газов 229
— теплота 228
— термодинамика 52—53
Азот жидкий, ГОСТ 347
— хранение и перевозка 251
Азотно-водородной смеси получение 340
Азотные установки 331, 332
Активность 50
Амага (единицы) 83
Аргон, ГОСТ 347
— получение 334
Баллоны для сжатых газов 349
Барометрическая формула 20
Блок очистки 296, 300
Бойля—Мариотта закон 18
Быстрота откачки вакуумных насосов 383
Вакуум, методы получения, ловушки 383
Ван-дер-Ваальса уравнение 37
— — приведенное 38
Ван-Лаара уравнение 50
Вебера формула теплопроводности 122
Вириальные коэффициенты 38
Взрываемости предел для газов 196
Взрывы кислородных аппаратов 334
Влагосодержание воздуха 297
Влажность абсолютная и относительная 19
Вода, физические свойства (лед) 114
Водород газообразный 347
— жидкий, хранение и перевозка 354
Водорода сжижение 308
Водородные мишени 379
— пузырьковые камеры 374
Водяной газ (состав) 340
Воздух, состав 324
Воздуха ожижение 307
Второе начало термодинамики 22
Высота единицы переноса (ВЕЦ) 278
— эквивалентная теоретической тарелки
(ВЭТТ) 279
Вязкость газов и смесей 119—125
— сжиженных газов и смесей 119—125
— определение 102
Газголдьеры 349
Газификаторы 363
Газовая постоянная 19
Газовые смеси 19
Газокинетические данные веществ 21
Газы, основные физические константы 194
Гальванотермомагнитное охлаждение (эф-
фект Эттингсгаузена) 72
Гей-Люссака закон 18
Гелиевые установки ожижительные и рефри-
жераторные 314
УКАЗАТЕЛЬ
Гелий жидкий, хранение, перелив 354, 358
— сжижение 314
— получение 338
- ТУ 329, 348
Генри закон 49
Гидравлическое сопротивление 255
— — местное 257
---неорошаемых скрубберных насадок
260
---орошаемых скрубберных насадок 260
— — поперечно-обтекаемых пучков труб
258
— — пучков ребристых труб 258
---ребристых труб при продольном обте-
кании 259
Гидраты углеводородов 219
Гомогенность проволоки для термопар 287"
Государственные стандарты на промышлен-
ные газы 347, 348
Давление динамическое 254
— критическое 37, 194, 195
— насыщенного пара 41
— уравнение зависимости от темпе-
ратуры 115
— паров воды 114
— статическое 254
— экспериментальные данные 103, 104
Дальтона закон 19
Двухколонный ректификационный аппарат
39, 167
Дебая параметр 39„ 167
Дейтерия извлечение 344
Десорбционное охлаждение 70
Детандеры 59
— действительный процесс расширения 60-
— для гелия 314
— поршневые 60
— турбинные 41, 60
Джоуля—Томсона эффект 42
---дифференциальный 42
— — изотермический 43
— — интегральный 42
---общее уравнение 43—45
— — смесей 58—59
— — физическая сущность 44—45
— — экспериментальные значения 45
Диаграммы состояния 46
Диаметр ректификационной колонны 281
Дифференциальные уравнения термодина-
мики 23
Диффузии коэффициент 20
Диэлектрическая постоянная газов 158
отверженных газов 158
— — сжиженных газов 157, 158
проницаемость криоагентов 158
Диэлектрические потери 157
Допустимые примеси ядовитых газов в воз-
духе 196
Дросселирование 42
Дюгема—Маргулиса уравнение 49
Единица переноса при ректификации
(ЧЕЦ) 278
Единицы измерений 9, 15
Жидкий гелий 187
Предметный указатель
427
---- второй звук 190
— •-----точка 187
---растворы 3Не—4Не 190
---- сверхтекучий 187
----теория Ландау 187
Зависимость температуры плавления от
давления 119
Захлебывание ректификационных аппара-
тов 260
Идеального газа законы 18
Извлечение гелия из природных газов 338
Изобарно-изотермический потенциал 28
Изобарный процесс 25—27
Изостеры адсорбции 224
Изотермический процесс 25—27
— эффект дросселирования 42
Изотермы адсорбции газов на угле, сили-
кагеле и других веществах 223
— — смеси газов 229
— сорбции паров воды на цеолитах 229
Изотопы газообразных элементов 192
— коэффициент разделения 211
— методы разделения 344
Изохорический процесс 25—27, 28
Изохорно-изотермический потенциал 28
Изоэчтропное расширение газа 45
Изоэптропный процесс 25—27, 28
Инверсионная кривая 43—44
— температура 43
Инверсионные параметры 44
КГМ, машина по обратному циклу Стир-
линга 64—66
Кинетическая теория газов 18. 19, 20
Кислород газообразный, ГОСТ 47, 348
---хранение и перевозка 351
— жидкий, газификация 351, 362
Кислорода получение жидкого 328
----технологического 330—333
---- чистого 330—333
Кислородные установки СССР 330—333
Кислородный насос 362
Клапейрона уравнение 18
Клапейрона — Клаузиуса уравнение 41
Коксовый газ, состав 340
Компрессора работа 33, 35
Компрессоры поршневые 34
— центробежные 35—37
Конверсия водорода (орто-пар) 310
Конденсатор-испаритель 324
Конденсация коксового газа 340
Константы фазового равновесия 222
— физические 8
Констпуктивные схемы теплообменников
266' '
Коэффициент аккомодации 247
— активности 50
— вязкости 102
— изотермической сжимаемости 18, 83
— лучепоглощения 180
— массопередачи 278
Коэффициент полезного действия адиаба-
тический 33
--------------поршневых детандеров 60
------ адиабатный турбодетаидеров 60
—--------- холодильных циклов 30, 35
— — — преломления ожиженных газов 177
— разделения 49, 198
----газов через мембраны 340
— сжимаемости 18, 83
----жидкого водорода 86
— сопротивления 150
---- дейтерия 87
— теплового расширения линейный 98
— сплавов и веществ 98
--------теплоизоляционных материалов
245
объемный 98
сжиженных газов 98
химических элементов 98
— теплоотдачи при кипении жидкости ч269
----конденсации 265
— теплопередачи в теплообменниках (об-
щий) 266
— эффективности ректификационной та-
релки 279
Криогенные насосы 362
— петли ядерных реакторов 381
Криостаты металлические 345
— — для космических исследований 373
--------механических испытаний 372
— — — оптических исследований 370
сверхпроводящих соленоидов 371
— с регулируемой температурой 369
— соленоидные 371, 372
— стеклянные 366
----для физических исследований 365
Криптон 347
Криптоно-ксеноновая смесь, получение 336
Критическая точка 37, 194, 195
Критические параметры газов 194, 195
Ксенон 336, 347
Ламинарный режим 255
Легированные стали 233
Ленгмюра уравнение адсорбции 53
Летучесть 50
Логарифмическая температурная шкала 18
Лошмидта число 8
Мак-Кэба и Тиле метод 271, 272
Максвелла соотношения 23
Малогабаритные охладители 319
Массопередача 278
Международная практика температурной
шкалы 283
— система единиц 9. 10
Мейснера эффект 183, 84
Местное сопротивление 257
Металлы и сплавы для конструкций 230—
234
Метан жидкий, хранение и перевозка 307
Механические свойства неметаллических
материалов 240
---- пенопласта 244
---- припоев 237—240
----сварных и паяных соединений 237
---сталей 231—233
— — цветных металлов 234
----чистых металлов 235
Механо-калорический эффект 189, 190
Микрокриогенные установки 319
Минимальная работа разделения газов 48
----сжижения газов 54—55
— флегма 272, 276, 278
428
Предметный указатель
Минимальное значение работы перехода
систем 33
— число тарелок 276, 277
Мишень водородная 379
Молекул длина свободного пути 20, 21
— скорость 20, 21
— число столкновений 20, 21
---ударов о стенку 20
Мономолекулярный слой 53
Насадочные колонны 260
Насосы вакуумные криогенные и адсорб-
ционные 383
— сжиженных газов 369
Недорекуперация 57, 61, 80
Нейтроны холодные, получение 382
Неон 347
Неона ожижение 313
Неоно-гелиевая смесь, получение 335
Нернста теорема 22
Несбалансированный поток 301, 302
Нефтяные газы (состав) 342
Нити магнитного потока 185
Обогащенный воздух 326
Обратимая ректификация 282
Обратная конденсация 51, 52
Общий коэффициент теплопередачи 266
Объем критический 194
Одноколонный ректификационный аппарат
324
Ортоводород 310
Орто- и параконверсия водорода 310
Осмос 51
Осмотическое давление 51, 76, 191
Основные физические константы газов 194,
195
Остаточное сопротивление 151
Осушка газов 297
Отрицательные абсолютные температуры
31,'32
Охлаждающие смеси 197
Охлаждение, определение термина 16
Очистка вымораживанием и фильтрацией
297, 300, 306
— газов от азота и оксида углерода 304
— ацетилена 306
—----------и оксида углерода 300
— — — кислорода 306
Пароводород 310
Параметры термодинамического состояния
18
Парогазовые смеси 19
Паросодержание 19
Пельтье эффект 70
Пенопласты, механические свойства 244
Первое начало термодинамики 20, 21
Перевод английских единиц измерения в
метрическую систему 14, 15
— градусов Фаренгейта в градусы Цель-
сия 16
— единиц измерений 9—16
Переход теплоты и работы 29
Плавления температура 94, 195
Пластмассы, механические свойства 240
Пленочные колонны 344
Плотность 83
— веществ в конденсированном состоянии"
90—97
— жидких углеводородов 90
— некоторых жидкостей 98
— некоторых веществ (относительная) 97,.
98
— — смесей 85
— смеси аргон — кислород 93
кислород — азот 93
чистых металлов 96
Поверхностное натяжение сжиженных га-
зов 176
Поверхность теплопередачи 266
Политропный процесс 25—28
Полуводяной газ 340
Получение редких газов из воздуха 334
— температур ниже 0,3 К 73
— холодных нейтронов 382
Померанчука эффект 79
Полюс колонны 274—276
Потенциалы термодинамические 28, 29"
Потери в циклах 32, 81
— давления в вентилях 257
— — на местных сопротивлениях 257'
—------поворот струи 257
-------расширение и сужение 257
------- трение 255
— при теплообмене 32
— холода 80
— — в окружающую среду 80
---- с недорекуперацией 80
Поточная термодинамическая система 21,
22
Правило Маттисена 292. 294
— прямолинейного диаметра 42
Предел «захлебывания» 260
Припой 238
Промышленные воздухоразделительные
установки 327, 331, 332
Процессы термодинамические 24, 25—27
Пуаншона метод расчета числа тарелок
273—276
Пузырьковые камеры 374
Пусковой период криогенных установок 80"
Работа компрессора 33
— обратимая 29
— ожижения газов 54
— сжатия газа 35, 36
— техническая 22, 34
Работоспособность 29
Равновесие жидкость — пар 41—42, 49—52
----(бинарные смеси) 198
--------- (тройные смеси) 219
— кристалл — жидкость 216
— кристалл — пар (бинарные смеси) 213:
— фаз 41, 42, 48
----в критической области 37, 51
---- константы 52, 222
----многокомпонентных смесей, термо-
динамика 52
Разделение водорода (выделение дейтерия)!
344—346
— воздуха 324, 327
---- в двухколонном аппарате 325
•------одноколонном аппарате 324
Предметный указатель
429*
— — промышленные установки 327, 331,
332
— • газов абсорбцией и адсорбцией 342—
344
— газовых смесей, работа 48
— коксового газа 340
— нефтяных газов 348
— природного газа 338
— стабильных изотопов 344
— через мембраны 340
— эксергетический коэффициент полезного
действия 331
Разделения коэффициент 49„ 198
--- изотопических соединений 212
Райка эффект 69—70
Растворимость газов в воде 210, 212
-------метаноле 210
— одноксида углерода в жидком кислоро-
де и азоте 219
— углеводорода в жидком кислороде и
азоте 218
Растворы (термодинамика) 48
Рауля — Дальтона уравнение 49
Рауля закон 49
Реальные газы 37
---(уравнение состояния) 37, 38
Реверсионные теплообменники 266, 330
Регенераторы 300—303, 329
Редкие газы, получение 334
Резервуары для сжиженных газов 351, 354,
359
Ректификационные тарелки 271, 281
— колонны 270
---(гидродинамика) 281
Ректификация 270
— (алгебраические методы расчеты числа
тарелок) 276
— (графические методы расчета числа та-
релок) 271
— (термодинамическая степень обратимо-
сти) 282
Реперные точки шкалы МПТШ-68 284
Рефрижератор на растворах Не3—Не4 76—
79, 318, 319
— с гелием-3 317, 318
Рефрижераторный режим 56
Сварные швы (прочность) 237
Сверхпроводимость 182
— критическая температура соединений
183, 184, 186
— критическое поле 184, 185
— элементов 184, 185
Сверхпроводники второго рода 185
— для сверхпроводящих устройств 387
— жесткие 186
— первого рода 184, 185
— промежуточного состояния 183
— смешанного состояния 185, 186
— стабилизация 187, 388, 389
— третьего рода 186
Сверхпроводящие болометры 403
— двигатели 400
— криотроны 404
— линии электропередачи 401
— магнитные системы для магнитогидро-
динамических генераторов 397
— магниты 390, 399
— материалы 186, 387, 391„ 392
— накопители энергии 398
— резонаторы 403
— соленоиды 398, 399
— токовводы 399
— указатели уровня 364
— электрические устройства для транспор-
та 402
— элементы вычислительной техники 404;
— устройства для научных исследований'
403
-------термоядерных реакторов 396
-------физики высоких энергий 390—
396
Сверхтекучесть 187
Себестоимость производства кислорода 333,.
334
Сжатие газов 35, 36
Сжижение водорода 308
— воздуха 307
— газов 54
— гелия 314
— метана 307
— неона 313
Сжимаемости коэффициент 18, 83
— степень 83
Симона метод сжижения 66, 67
Скачок Капицы 189
Сквиды 403, 404
Скорость звука в газах 20, 178
-------сжиженных газах 179
Смешанный газ (состав) 340
Соотношение между единицами измерений
8—16
Состав воздуха 324
Сосуды для жидких азота и кислорода1 351
---жидких водорода и гелия 354
— Дьюара 352
Средний температурный напор 266
Стабилизация сверхпроводников 187, 388,.
389
Стали, механические свойства 232, 233
Стандартная таблица медного термометра-
289—291
---платинового термометра 293
Степень сжимаемости 83
--- газов 84—89
— осушки газов адсорбентами 298
— теплового расширения 98
— технологических материалов 98
— черноты 180
--- конструкционных материалов 180
Тарелка колпачковая и ситчатая 279, 281
— теоретическая 271
Температура абсолютная (параметр Дебая)
40, 167
— воспламенения газов 196
— кипения 94, 195
— критическая 37, 94, 195
— плавления 41, 119, 194
Температурная шкала 8, 13, 31, 283
---практическая (МПТШ-68) 283, 284
---термодинамическая 283
Температурные коэффициенты линейного и
объемного расширения1 98
430
Предметный указатель
---------------твердых и жидких тел
98—102
Температурный напор средний 266
Температуры ниже 0,3 К 73
— фиксированные 285
Тепловые единицы 11
— мосты и опоры 253
Теплоемкость 23, 38—40
— газов 150
— Дебаевская 38—40, 166, 167
— металлов 169—172
— определение 38
— отвержденных газов 163
— различных веществ 172
— решетчатая 39
— сжиженных газов 163, 164
— твердых тел 39
— теплоизоляционных 'материалов 241—
243
— сверхпроводников 166
— сплавов 169—171
— электронная 40
Теплоизоляция 241
— вакуумно-порошковая 247
— высоковакуумная 246
— многослойная (экранно-вакуумная) 248
— пористая газонаполненная 241
— с замкнутыми порами (пенопласты) 245
— тепловой поток 252
Теплообменники (конструктивные схемы)
— витые поперечноточные 268
— змеевиковые 267
— из спаянных трубок 267
— кожухотрубные 268
— пластинчато-ребристые 267
— труба в трубе 267
Теплоотдача в трубах 261
— кипения жидкости 264
— при естественной конвекции 263
— — конденсации 265
— пучка гладких труб при поперечном об-
текании 262
— ----------- продольном обтекании 261
---ребристых труб при поперечном об-
текании 263
— — --------- продольном обтекании 262
Теплопередача лучеиспусканием 246
— общий коэффициент 266
— теплопроводностью остаточных газов
246
Теплопроводность 125
— асбеста 242
— аэрогеля (силикоаэрогель) 249
— ваты минеральной (шлаковой) 241 —
247
---стеклянной 241—247
— газов 126—140
— кремнегеля 247—249
— металлов 140—145
— миноры 24, 252
— неметаллических материалов 147—158
— определение 125, 126
— отвержденных газов 137, 138
— пенопластов 241, 244, 247, 252
— полимеров 149
— полупроводниковых материалов 146
— сверхпроводников 146
— сжиженных газов 128—138
— сплавов 140, 141
— теплоизоляционных материалов 241—
254
— технических материалов 147—150
Теплота адсорбции газов 228
— испарения и сублимации сжиженных га-
зов 172
— конверсии орто-параводорода 310
— плавления криогенных веществ 172
— сгорания газов 196
Термодинамика адсорбции 52, 53
— растворов 48
Термодинамики дифференциальные урав-
нения 23
— начала 20
Термодинамические потенциалы 28, 29
— процессы 24
— функции 28
— циклы 29
Термодинамический анализ ожижения 54,
81
--- разделения воздуха 331—334
Термометр газовый 285
---- технический 285
— конденсационный 286
— магнитный 292
— сопротивления 287
— — германиевый 295
---- медный 292
----платиновый 292
----угольный 295
— термопарный 287
Термодиоды 296
Термомеханический эффект 189, 190
Термо-ЭДС термопары медь — константан
289
----золото — железо—медь 290, 291
Термоэлектрическое охлаждение 70—72
Техническая работа 21—25, 28, 33., 35
Токовводы 399
Точечный коэффициент обогащения ректи-
фикационной тарелки 279
Транспортные сосуды сжиженных газов
351, 354
Тройная точка 41
Трубные решетки 269
Трубопроводы сжиженных газов 360
Турбулентный режим 255, 261
Удельное электросопротивление в магнит-
ном поле 155, 156
— — металлов 152—155
---- сплавов 156
---- элементов 152
Уплотнение поршневое для детандеров 314
— поршня за счет сопротивления зазора
314
— стекол в криостатах 371, 377, 380
-------пузырьковых камерах 377
Упругость паров воды 114
— — скваженных газов 103, 104-—114
Уравнение Грюнейзена — Блоха 151
— зависимости упругости паров от темпе-
ратуры сжиженных газов 115—118
Предметный указатель
431
— состояния реального газа 38
Установки разделения воздуха 317
Фазовый переход 41, 42
Физические константы газов 194, 195
— мировые постоянные 8
Фиксированные температуры равновесия
285
Филиппе, ожижительная машина 64—66,
308, 316
Флегмоновое число 272
Флюксоиды 185
Фракции разделения нефтяного газа 344
Фтор жидкий, хранение и перевозка 359
Функции термодинамические 28, 29
Химический потенциал 28
Холодильно-газовые машины 64—66, 308
Холодильный коэффициент 29, 30
— цикл 30
----- адиабатного размагничивания 73—75
-----вихревой трубы (эффект Ранка) 69,
70
— — газовой машины (Гифорда и Мак-
Магона) 66—68
----- двойного дросселирования 57
-----дроссельный 56
-----изоэнтропного расширения 59
-----Капицы 62
-----каскадный 55
----- Клода 59
-----Линде 56
— — машины по циклу Стирлинга 64—66,
308, 316
----на растворах Не3—Не4 76—79
-----на термоэлементах 70—72
-----однократного дросселирования 56,
57
----с вытеснителем 66
-----с предварительным охлаждением 56
-----Симона 66
-----Эттингсгаузена 72
Хранение ожиженных азота и кислорода
351
— — водорода и гелия 354
--- газов 346
---метана и фтора 359
Цветные металлы и сплав, механические
свойства 235
Центры пининга 185
Цикл 29
— Карно 30
— необратимый 30
— обратимый -29
— обратный 30
Числа гидродинамического и теплового по-
добия 254, 261
— Грасгофа 261
— Нуссёльта 261
— Пекле 261
— Прандтля 261
— Рейнольдса 254
— Стантона 261
— Стокса 254
— теплового подобия 261
— Эйлера 254
Число единиц переноса (ЧЕП) 278
— тарелок 271
Шероховатость трубопроводов 256
«Шуговый» водород 313
Эквивалентный диаметр 256
Экранирование 246, 248
Эксергия 29
Электрические свойства 150
Электропроводность 150
Электросопротивление см. Удельное элек-
тросопротивление
Энтальпия 21
Энтропия 22
— жидкого 4Не и 3Не 187—191
— идеального газа 22
— как мера потерь и необратимости 32
Этилена получение 342—344
Эффективность получения кислорода 231—
233
Ядерное размагничивание 73
МИХАИЛ ПЕТРОВИЧ МАЛКОВ
ИГОРЬ БОРИСОВИЧ ДАНИЛОВ
АЛЕКСАНДР ГРИГОРЬЕВИЧ ЗЕЛЬДОВИЧ
АБРАМ БОРИСОВИЧ ФРАДКОВ
СПРАВОЧНИК
по физико-техническим основам криогеники
Редактор Ю. В. Синявский
Редактор издательства Н. М. Пеунова
Художественные редакторы В. А. Гозак-Хозак.,
О. П. Тинякова
Технический редактор О. Д. Кузнецова
Корректор 3. Б. Драновская
ИБ № 2910
Сдано в набор 05.02.85 Подписано в печать 30.07.85 Т-16639
Формат 70 X 100x/ie Бумага типографская № 1 Гарнитура литературная
Печать высокаяУсл. печ. л. 35,14-’вкл. 1.5Усл. кр.-отт. 36,6 Уч.-изд. л.48,12
Тираж 5500 экз. Заказ 218 Цеиа 2 р. 90 к.
Энергоатомиздат, 113114, Москва, М-114, Шлюзовая иаб., 10
• Ордена Октябрьской Революции и ордена Трудового Красного Зна-
мени МПО «Первая Образцовая типография имени А. А. Жданова»
Союзполиграфпрома при Государственном комитете СССР по делам
.издательств, полиграфии и книжной торговли. 113054, Москва, М-54,
Валовая, 28
Найденный в Интернет djvu-файл данной
книги:
- декодирован постранично в tif-файлы;
- обрезаны поля страниц;
- добавлены вкладки с диограммами;
- добавлена обложка.
Все собрано обратно в djvu-книгу.
Веселовский В.Н. 19 марта 2010г.
Вкладка к книге: Справочник по физико-техническим основам
криогеники/ М.П.Малков и др. - М.: Энргоатом-
издат, 1985,- 432 с., ил.
Вкладка к книге: Справочник по физико-техническим основам
криогеники/ М.П.Малков и др. - М.: Энргоатом-
издат, 1985,- 432 с., ил.
ДИАГРАММА If
Температура. 7, К
Энтропия st Дж/(г-К)
Вкладка к книге: Справочник по физико-техническим основам
криогеники/ М.П.Малков и др. - М.: Энргоатом-
издат, 1985,- 432 с., ил.
ДИАГРАММА III
ДИАГРАММА lV
Вкладка к книге: Справочник по физико-техническим основам
криогеники/ М.П.Малков и др. - М.: Энргоатом-
издат, 1985,- 432 с., ил.
ДИАГРАММА V
390
380
370
360
350
340
330
320
310
300
290
280
270
260
250
^230
В
£
220
210
200
190
180
170
160
150
140
130
120
110
100
90
80
70
60
9-0
Энтропия и энтальпия для
идеального кристалла—
390
380
370
360
350
340
330
320
310
300
290
280
270
260
250
240
230
220
210
200
190
180
170
160
150
140
130
120
110
100
110
130
120
140
150
200
100
160
190
210
170
180
60
80
90
70
Диаграмма T,s
дня a3oma(60-WK)
Энтальпия h, Дж/моль
Объем и, см3/моль
Давление р, МПа
1 моль = 2<?, 016 г
50
90
80
70
60
Энтропия о у Дж/f моль • к)
Вкладка к книге: Справочник по физико-техническим основам
криогеники/ М.П.Малков и др. - М.: Энргоатом-
издат, 1985,- 432 с., ил.
ДИАГРАММА VI
450
с:
.<4
О
7=16500
440
430
16000
4Z0
— 15500
410
400
15000
-Л
390
380
14000
370
13500
360
350
13000
340
12500
330
320
310
300
290
280
270
260
250
240
230
220
210
8000
200
190
180
170
160
150
-4000
140
130
2500
120
110
100
90
Давление р, МПа
Энтальпия Л, Дж/моль
0&ьем и, см3/моль
1 моль = 28,96 г
Диаграмма Т, s
для воздуха (00-450К.)
7=16500-
16000~
К
15500
15000
14500
4- 14000
13500
13000
12500
12000
ТПзбО
8500
8000
~7500
=3,0.
6500
0.2
3000
6U00
120
90
110
100
80
40
20
10
50 № 70
Энтропия s, Дж/(моль*К}
й/
S7
450
440
430
420
410
400
390
380
370
360
350
340
330
320
510
300
290
280
270
260
250
240
230
22.0
210
200
7500
7000®
-|--г
6500
_6М0
5500
I .J-
5000
4500
190
180
170
160
150
140
130
1Z0
110
10 о
э:
— 80
130
80