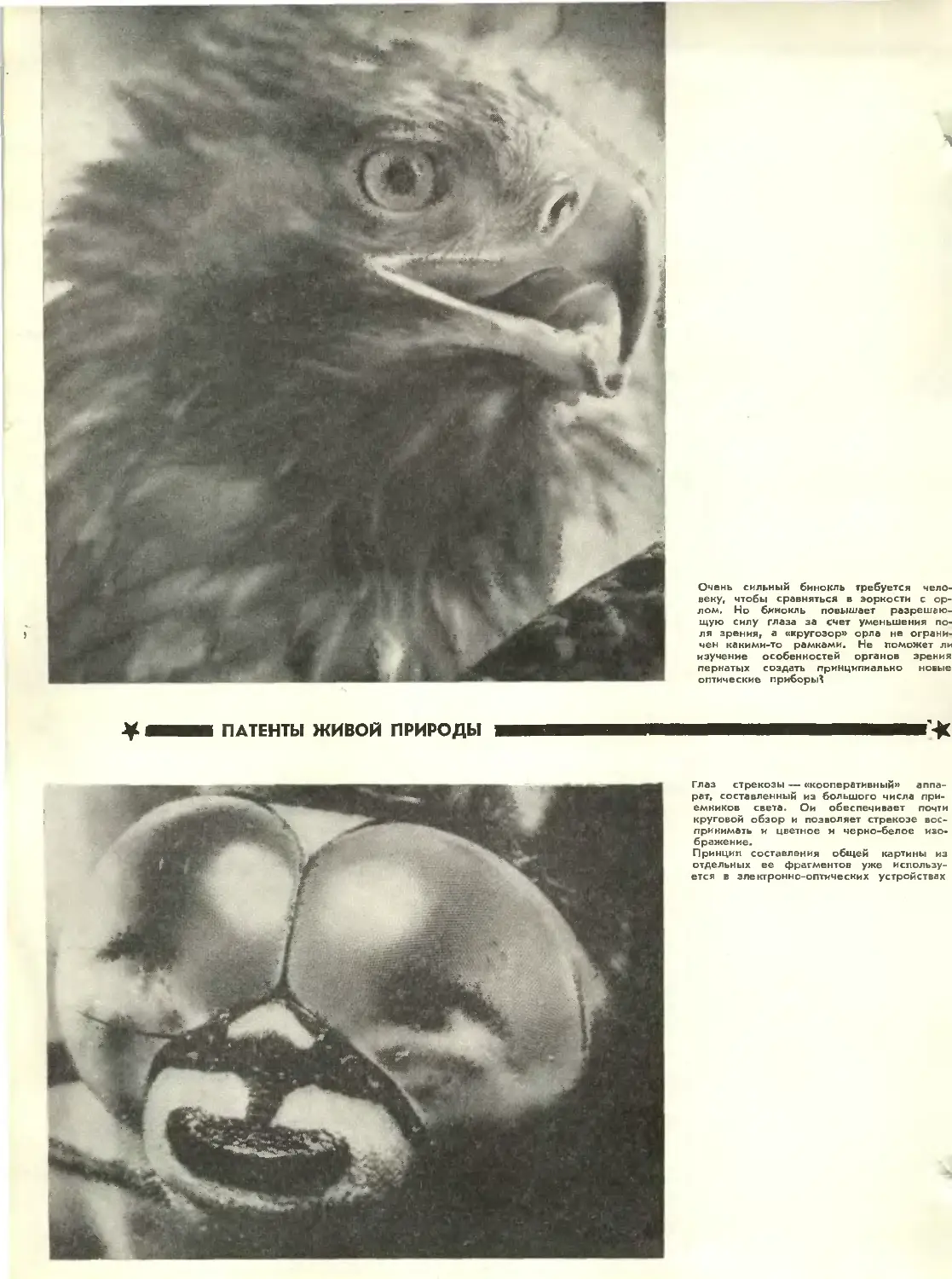
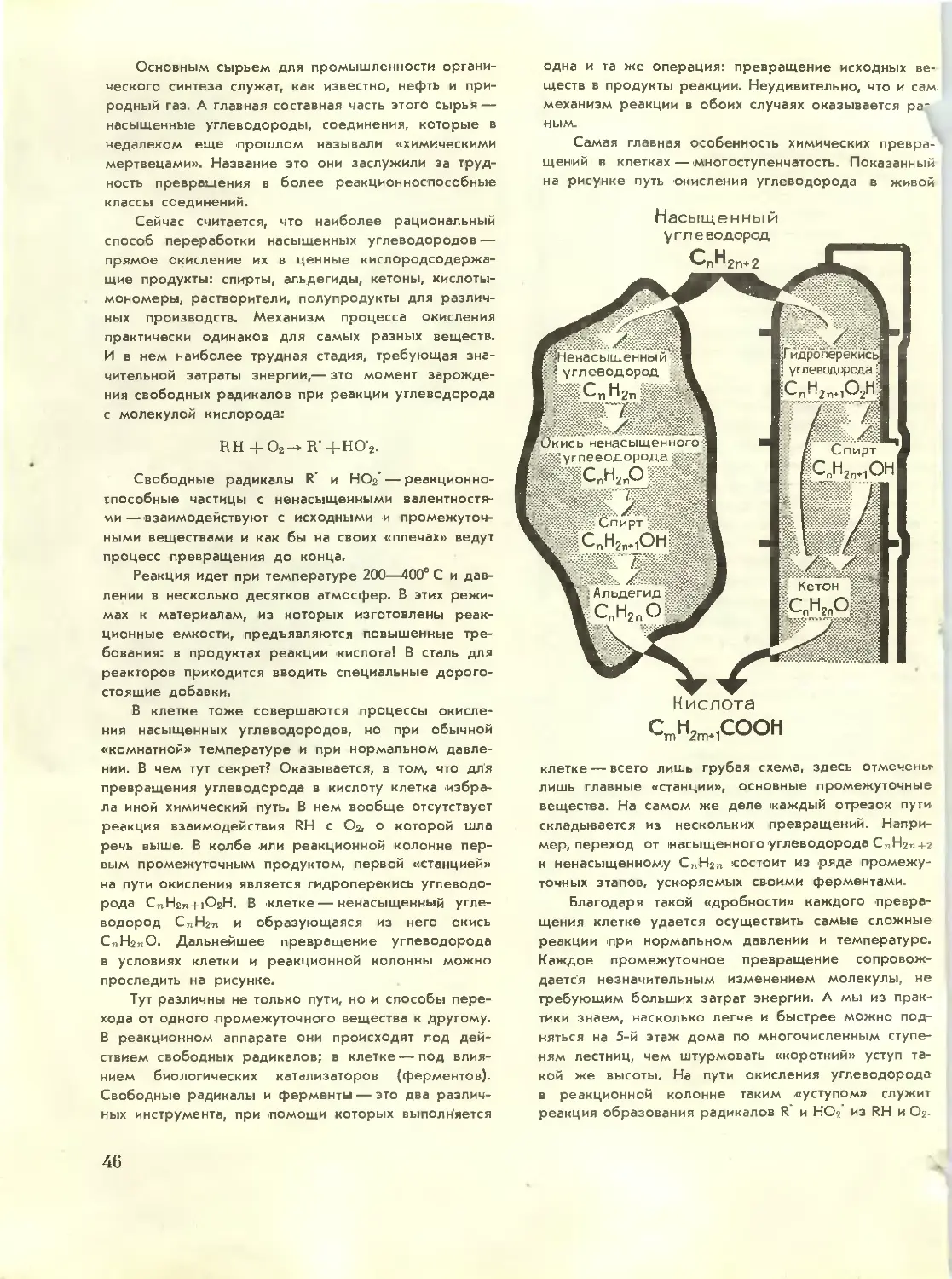
Text
химия
жизнь»
В этом номере:
Ленин—о химии
Элемент № 13— металл социализма
Инертные газы научились вступать
в реакции и перешли в семью
обыкновенных элементов
Полезные советы: как удалять пятна
Кто разгадал загадку Солнца?
Фантастика
03
X
Q.
JQ
Z
а
к
с:
с
о
с
•
о
I
J
>
си
I
\
М
v
!Ч1*
>CVJIVI«^H=I
жизнь
В НОМЕРЕ:
Н. А. БУДРЕЙКО. Ленин о химии
И. Н. ФРИДЛЯНДЕР. Алюминий
Новые документы с М. В. Ломоносове
Г. МАЛМ и г. КЛАССЕН. Из экзотического царства -
в семью обыкновенных элементов
А. П. ПУРМЛЛЬ Химическая бионика: надежды и
возможности
С. ВЛАДИМИРОВ. Кто разгадал загадку Солнца;
И. БРАУН. Повар — невольный ученый
Ю. С. ЧЕРКИНСКИИ. Неорганические "олимеры
П. А. РЕБИНДЕР -1то же такое неорганические полимеры?
О. И. ЯШУНСКЛЯ К^кке njHHbi .;у.чие. ;.j: -.:::■ г--;:ч-
ского k?w у ил1 ,J * м=этуоальног Т
Г\ МОРАЛЕБИЧ. Не;;а
Е. В. 1 |Er"^lWl p roL,r'_ _|п и~ пгмо' "".
А. МЕЕГ^В _-р ..... npr^TL-nj.
/ ^ ^ лс/-"'. * иг\ ,. м -::за:\снс. \ .:олу. 7
1_. 1, 3. А г" ^. ' q О. .. Дг!у1 Г г5. гю'. -н ip
СОВЕТЫ И ппягчег',,.. к мИМ Дет . ХИМИКИ
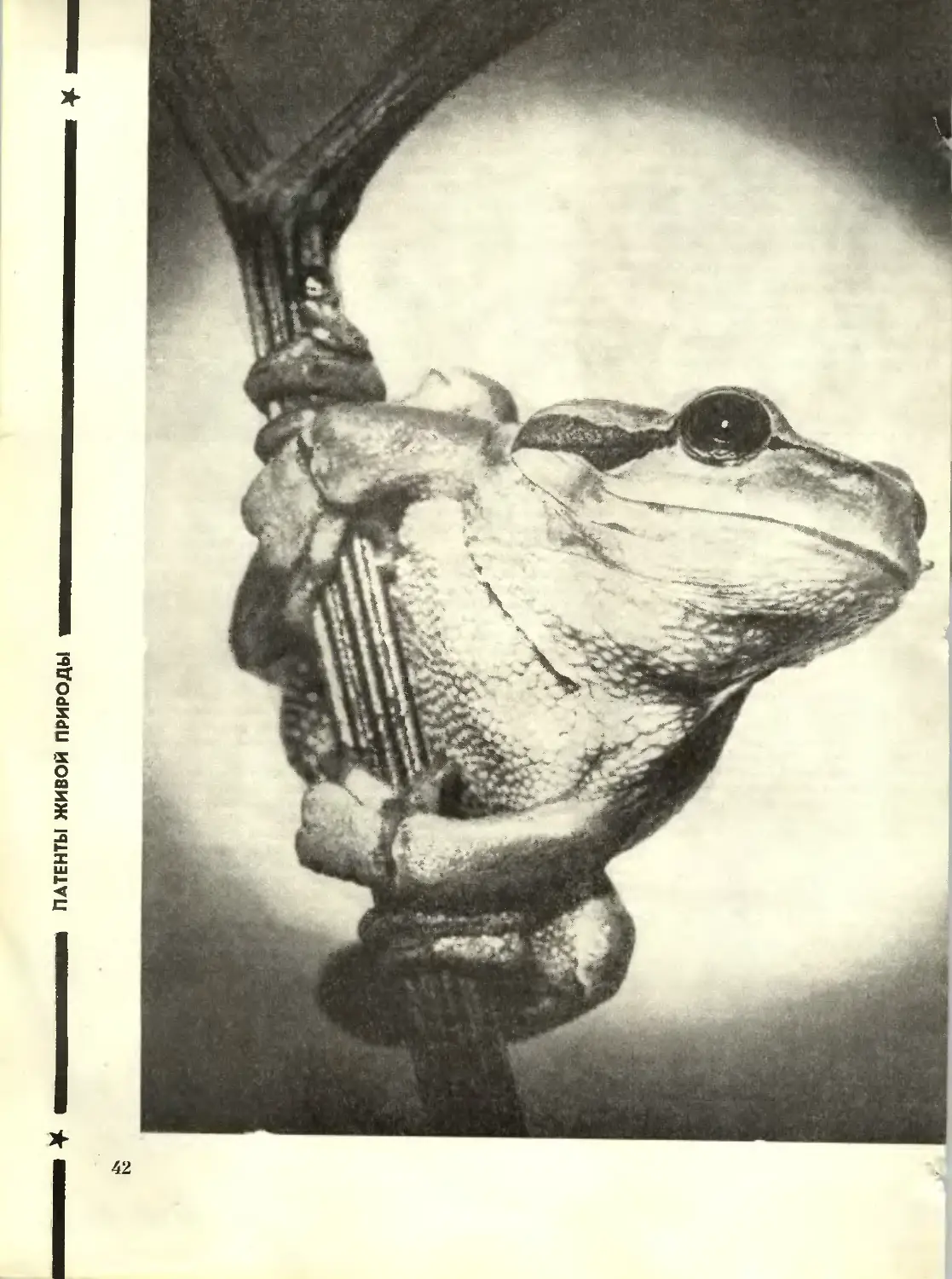
На обложке: Основан Ломоносовым.
Фото В. Полякова
2
9
23
31
35
43
53
55
59
63
65
69
7?
7е.
на:'чиэ-пл"""""нг и
ЖУРНАЛ
АКАДЕМИИ НАУК СССР
ч|65
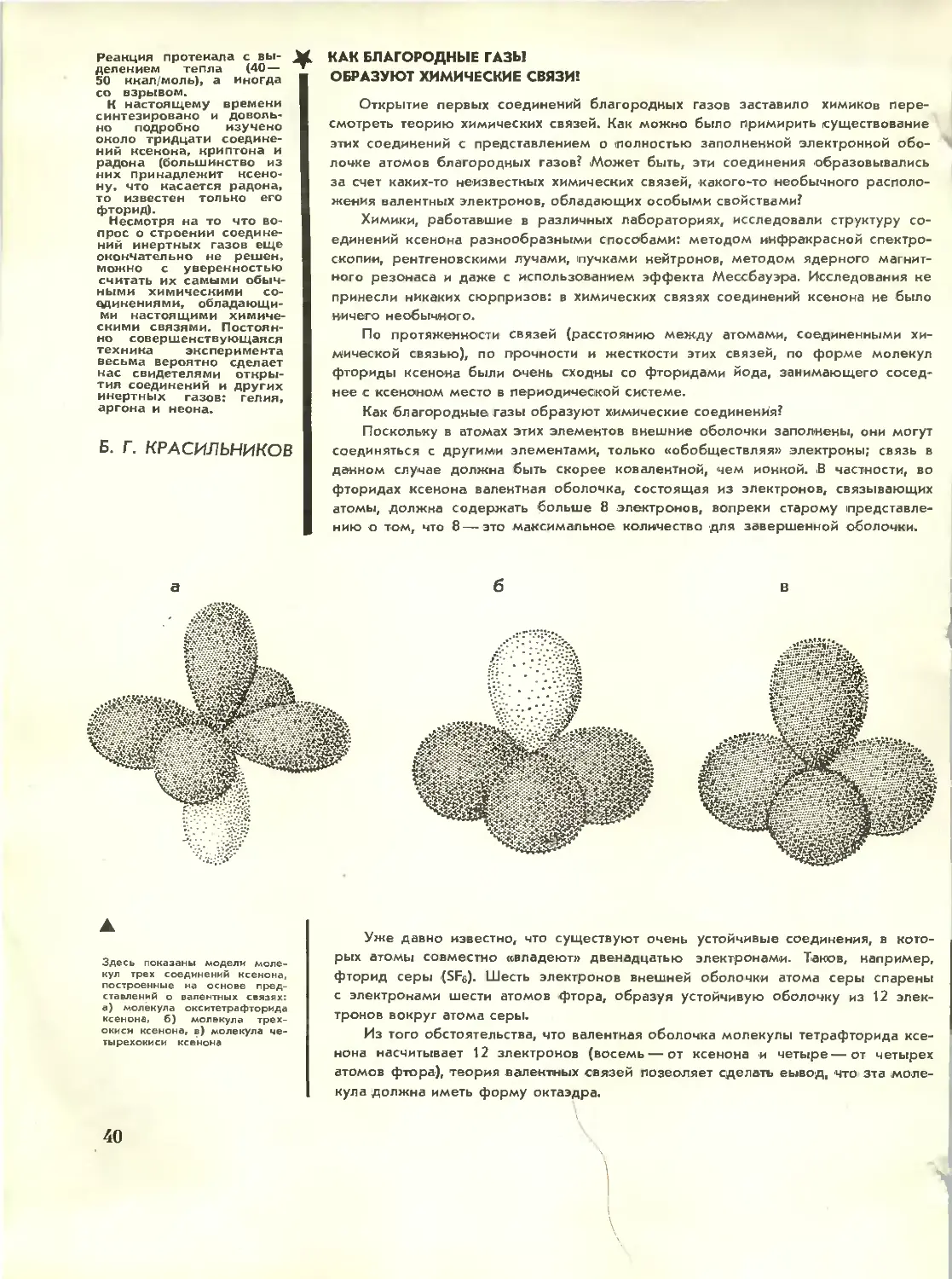
Считая
науки о природе
одним из
важнейших источника
развития философии,
Ленин глубоко изучал
новейшие труды
по физике и химии,
особенно в период
работы над книгой
«Материализм
и эмпириокритицизм»
В библиотеках Берна и Женевы,
Лондона и Парижа разыскивает Ленин
последние работы физиков. Среди
прочитанных им книг и статей —
«Корпускулярная теория материи» Дж. Дж. Томсона, %
«Физика электронов» П. Ланжевена,
«О незаменимости атомистики для
естествознания» и «О методах теоретической
физики» Л. Больцмана, «Современная
теория физических явлений» и «Новые
взгляды на строение материи» А. Риги.
Его внимание привлекают и новые
труды по химии и по истории
естествознания — У. Рамзая, В. Вобеля, Л. Дармштед-
тера. В работах Ленина упоминаются
Р. Бойль и А. Лавуазье, А. Беккерель
и Г. Лоренц, М. Планк, А. Эйнштейн,
В. Вернадский.
Как известно, революция в
естествознании на рубеже XIX и XX веков, когда, по
выражению Ленина, неразрушимые и
неразложимые элементы химии, число
которых продолжало все возрастать точно в
насмешку над единством мира, оказались
разрушаемыми и разложимыми,— была
воспринята некоторыми учеными как
крушение материализма.
Изучив положение в науке о природе,
Ленин приходит к выводу: крах потерпел
не материализм, а метафизика; крах потер- I
пели представления механистического ма- t
ч
V
о химии
териализма, пытавшегося свести все
многообразие явлений неорганической и
живой природы к законам механики.
А между тем, указывает Ленин:
...ЕДИНСТВЕННОЕ
«СВОЙСТВО» МАТЕРИИ. С ПРИЗНАНИЕМ
КОТОРОГО СВЯЗАН
ФИЛОСОФСКИЙ МАТЕРИАЛИЗМ, ЕСТЬ
СВОЙСТВО БЫТЬ ОБЪЕКТИВНОЙ
РЕАЛЬНОСТЬЮ,
СУЩЕСТВОВАТЬ ВНЕ НАШЕГО СОЗНАНИЯ.
ПРИЗНАНИЕ КАКИХ-ЛИБО
НЕИЗМЕННЫХ ЭЛЕМЕНТОВ, «НЕИЗ-
НЕННОЙ СУЩНОСТИ ВЕЩЕЙ» И
Г. П. НЕ ЕСТЬ МАТЕРИАЛИЗМ, А
ЕСТЬ МЕТАФИЗИЧЕСКИЙ,
Г. Е. АНТИДИАЛЕКТИЧЕСКИЙ
МАТЕРИАЛИЗМ.
ЧТОБЫ ПОСТАВИТЬ ВОПРОС С
ЕДИНСТВЕННО ПРАВИЛЬНОЙ, Т. Е.
ДИАЛЕКТПЧ ЕСКП-МАТЕРИАЛИ-
СТИЧЕСКОЙ, ТОЧКИ ЗРЕНИЯ,
НАДО СПРОСИТЬ: СУЩЕСТВУЮТ ЛИ
ЭЛЕКТРОНЫ... ВНЕ
ЧЕЛОВЕЧЕСКОГО СОЗНАНИЯ, КАК ОБЪЕК-
ТИРНАЯ РЕАЛЬНОСТЬ ИЛИ НЕТ?
НА ЭТОТ ВОПРОС
ЕСТЕСТВОИСПЫТАТЕЛИ... ОТВЕЧАЮТ
ПОСТОЯННО: ДА...
НОВЕЙШИЕ ОТКРЫТИЯ
ЕСТЕСТВОЗНАНИЯ — РАДИЙ,
ЭЛЕКТРОНЫ, ПРЕВРАЩЕНИЕ ЭЛЕМЕНТОВ—
ЗАМЕЧАТЕЛЬНО ПОДТВЕРДИЛИ
ДИАЛЕКТИЧЕСКИЙ
МАТЕРИАЛИЗМ...
ЭЛЕКТРОН ТАК ЖЕ
НЕИСЧЕРПАЕМ, КАК И АТОМ...
3
Die modcrne Theorie
tl«r
physikaUschen Efscheinungen
(HadtoaMivitat, loncn. Efcktronen)
Augusto Righi
ft;»» <ltm Itahtr.iichjJP \йн.т.«
£ Рч<«".»-» Л»: <U~> V ».-... »<«» *4,j
4:1 IT AliMUongefl
THE CORPUSCUL
THEORY OF MA
BY
J. J THOMSON, MA. F.R.S. »Su
¥Ыа& *<*a Joha-ift Ambrose Birth
LONDON
ARCHIBALD CONSTABLE & С
io orasgf. st*£*:t Leicester syi
1907
На химию как опытную,
экспериментальную науку опирался Ленин при
разработке теории познания, утверждая
решающую роль практики — критерия истины,
усматривая в практике, эксперименте,
производстве опровержение измышлений
агностиков, отрицавших познаваемость мира.
В том факте, что химики получили
краситель ализарин не из корней марены,
откуда его добывали ранее, а синтезировали
из веществ, содержащихся в продуктах
перегонки каменного угля, Ленин, вслед за
Энгельсом, видел принципиальное
доказательство возможности, вопреки домыслам
виталистов и агностиков, познания «вещи
в себе».
Раскрывая философское значение
химического синтеза веществ, Ленин делает
три вывода:
вещи существуют независимо от
нашего сознания, независимо от нашего
ощущения, независимо от того, что мы вчера
еще ничего о них не знали;
нет принципиальной разницы между
природой вещей и познаваемыми их
свойствами; различия определяются только
уровнем наших знаний; нет непознаваемых
вещей, а есть только вещи непознанные или
недостаточно познанные;
в теории познания, как и в других
областях науки, надо рассуждать
диалектически, т. е. понимать, что знание не приходит
мгновенно и полностью, а существует
более или менее длительный процесс
перехода от незнания к знанию.
С КАЖДЫМ ДНЕМ
СТАНОВИТСЯ ВЕРОЯТНЕЕ, ЧТО ХИМИЧЕСКОЕ
СРОДСТВО СВОДИТСЯ К
ЭЛЕКТРИЧЕСКИМ ПРОЦЕССАМ.
Примечательно, что эту мысль о
природе химической связи Ленин высказал в
1907 г., тогда как первые электронные
теории химических связей были созданы Кос-
селем и Льюисом в 1915 — 1916 гг.-
Более полно выяснить природу связей
Задалось лишь на основе квантовой
механики во второй четверти XX века. Теория и
эксперимент подтвердили, что химические
связи обусловлены сложным
взаимодействием внешних (валентных) электронов, т. е.
действительно «сводятся к электрическим
процессам».
4
РориШге Schriften • Iirllchkeit der Atomistic
Dr. Ludwig Boltzmann
urwissensehaft. <
I If t:, .1 4 ] i.;(l4 ivl )Г- fl
i tS-l - .. l»l>i«ib nWlJi, !KI,
; n >t -4),, H-;!nu/Jei; bl
iCllfl ... -t.-plv.KiL.Jlx.-flr, «iftllHi-
ni n. i. Ktt.l d.r J„Knhv:i fcibr
<:«4.-.J... .t, m i...cll>< ii,l,; Uif.Ui
rhii. (i *' .- t..-r Aiunuvnk i« d««.i
■"' "—" f ' |Я •-< <> »'•• I. I... -hlv. N\,rd >JXlt<4
/*•*** l„, ,,,, ..„ . r, ibl AnM,,u :1)(>.
И,-г pi nv«i..|<.l4.N^u-n Мч1инН
. i,г..ml. «h-nV.««K.v.lfi!kMvtt
■1 ■ к.ч j.r.iMis.h,-a K.'H
<-• ' : »-t -ifSt \urtlui к. пни и
• hi i1>' H-...,.i«.-v(|hiy ..,.i.r <lt.
Ли - i и, ..! «.h. ■ ,,,-. .r.
h m. к hi» s|«Mi.,l» ,
...» <
lj\l V J.,!
. i!m,.
Letprlg
Vetlag vntt Jutland Arlriijiu^ tfaMft
вез новейшей
ТЕХНИКИ,
вез новых
НАУЧНЫХ
ОТКРЫТИЙ,
ты коммунизма
НЕ ПОСТРОИМ
«ПОДЪЕМ
ПРОИЗВОДИТЕЛЬНОСТИ ТРУДА ТРЕЬУЕТ, ПРЕЖДЕ
ВСЕГО, ОБЕСПЕЧЕНИЯ
МАТЕРИАЛЬНОЙ ОСНОВЫ КРУПНОЙ
ИНДУСТРИИ: РАЗВИТИЯ
ПРОИЗВОДСТВА ТОПЛИВА, ЖЕЛЕЗА,
МАШИНОСТРОЕНИЯ, ХИМИЧЕСКОЙ
ПРОМЫШЛЕННОСТИ. РОССИЙСКАЯ
СОВЕТСКАЯ РЕСПУБЛИКА
НАХОДИТСЯ ПОСТОЛЬКУ В ВЫГОДНЫХ
УСЛОВИЯХ, ЧТО ОНА
РАСПОЛАГАЕТ — ДАЖЕ ПОСЛЕ БРЕСТСКОГО
МИРА-ГИГАНТСКИМИ ЗАПАСАМИ
РУДЫ (НА УРАЛЕ), ТОПЛИВА В
ЗАПАДНОЙ СИБИРИ (КАМЕННЫЙ
УГОЛЬ). НА КАВКАЗЕ И НА ЮГО-
ВОСТОКЕ (НЕФТЬ), В ЦЕНТРЕ
(ТОРФ), ГИГАНТСКИМИ
БОГАТСТВАМИ ЛЕСА, ВОДНЫХ СИЛ. СЫРЬЯ
ДЛЯ ХИМИЧЕСКОЙ
ПРОМЫШЛЕННОСТИ (КАРАБУГАЗ) И Т. Д.
РАЗРАБОТКА ЭТИХ ЕСТЕСТВЕННЫХ
БОГАТСТВ ПРИЕМАМИ НОВЕЙШЕЙ
ТЕХНИКИ ДАСТ ОСНОВУ
НЕВИДАННОГО ПРОГРЕССА
ПРОИЗВОДИТЕЛЬНЫХ СИЛ».
АПРЕЛЬ 1918 г.
Ленин высоко оценивал роль химии в
народном хозяйстве. Еще в 1899 г. он
отмечал: «Химические производства имеют
чрезвычайно важное значение». Его внимание
не раз останавливалось на новых идеях в
области химического производства. Одной
из них — идее подземной газификации
угля, впервые выдвинутой Д. И.
Менделеевым, а затем — У. Рамзаем, Ленин
посвятил специальную статью, опубликованную
в апреле 1913 г. в газете «Правда».
С первых же дней Советской власти
Ленин предпринимает конкретные шаги
для восстановления и развития в нашей
стране химической промышленности и
химической науки.
5
Рисунки
Н. АЛЬТМАНА
Москва, Кремль
Май 1920 г.
Декабрь 1917 г.
По предложению Ленина
в высшем Совете народного
хозяйства (ВСНХ)
образован химический отдел.
Руководителем отдела
назначен видный деятель
коммунистической партии,
инженер-химик Л. Я. Карпов.
Январь-апрель 1918 г,
Национализированы и
переданы в ведение
химического отдела ВСНХ
химические и
химико-фармацевтические предприятия,
принадлежавшие до того
различным общественным и i
военным организациям.
Апрель 1918 г.
Ленин пишет свою
работу «Очередные задачи
Советской власти», в которой
отмечает особо важное
значение химической
промышленности — одной из основ
крупной индустрии, для
достижения высокой
производительности труда.
Июнь 1918 г.
Ленин подписывает
декрет Совета народных
комиссаров, по которому
крупнейшие
промышленные, в том числе и
химические, предприятия перешли
в собственность
государства. Национализированы
также добыча минерального
топлива, соли и другого
сырья для химических
производств.
С именем Ленина связаны многие
начинания, имевшие важное значение для
настоящего и будущего химической
промышленности. Добыча нефти и соды, открытие
^радиевого завода, перевозка минеральных
удобрений — все это привлекало внимание
Ленина, получало его непосредственную
поддержку.
Характерно в этом отношении письмо,
отправленное Лениным в октябре 1922 г.
одновременно в ВСНХ, Госплан и
Наркомат финансов. Ленин пишет, что узнал
об успехах группы инженеров во главе с
И. М. Губкиным, которая провела «не
только обстоятельное научное обследование
горючих сланцев и сапропеля, но и научилась
практически приготовлять из этих
ископаемых различные полезные продукты, как то:
По инициативе и при энергичном
содействии Ленина возникают первые в
Советской России химические
научно-исследовательские лаборатории и институты.
Еще в 1918 г. при отделе химической
промышленности В СНХ организуется
Центральная химическая лаборатория,
реорганизованная затем в широко известный Фи-
лико-химический институт им. Л. Я.
Карпова. Этот институт, директором которого до
конца своей жизни был выдающийся
советский ученый А. Н. Бах, стал одним из
крупнейших центров неорганической и
физической химии. В том же 1918 г. и в начале
1919 г. создаются
Научно-исследовательский институт чистых химических
реактивов, Институт физико-химического анализа
во главе с Н. С. Курнаковым, Институт по
изучению платины и других благородных
металлов, возглавляемый Л. А. Чугаевым;
этот институт имел важное значение в
связи с возросшим применением платины и
некоторых ее спутников в химической
промышленности как важнейших
катализаторов и материалов для разнообразных
приборов и посуды, без которых не может
обойтись ни одна аналитическая
лаборатория.
При жизни Ленина возникли и другие
важные научно-исследовательские
институты — Государственный институт
прикладной химии A919 г.), Радиевый институт
A922 г.), директором которого был
ихтиол, черный лак, различные мыла,
парафины, сернокислый аммоний и т. д.». «Эти
работы,— подчеркивает Ленин,—
...являются прочной основой промышленности,
которая через десяток, другой лет будет
давать России сотни миллионов...». Он
предложил субсидировать эти работы,
устранить препятствия, тормозящие их развитие,
и представил И. М. Губкина и его
сотрудников к награждению.
По предложению Ленина был создан
специальный комитет во главе с Н. С.
Курнаковым, приступивший к изучению Кара-
бугаза, а также комиссия во главе с
А. Е. Ферсманом для изучения апатитов; в
результате деятельности этой комиссии
были обнаружены знаменитые апатито-нефе-
линовые месторождения в Хибинах.
В. И. Вернадский. Характерно, что из
двенадцати институтов, находившихся в те
годы в ведении ВСНХ, более половины было
химических или так или иначе связанных с
химией.
Закладывая основы Советского
государства, Ленин предвидел громадное
значение химии для будущего страны.
До революции в России химической
промышленности почти не было. Теперь
наша страна занимает по объему химического
производства второе место в мире.
Мудрая прозорливость Ленина,
который в первые месяцы существования
советской власти, в период страшной
хозяйственной разрухи, в годы гражданской
войны, уже проявлял заботу о развитии
химической науки, привела в наше время к
тому, что Советский Союз стал одной из
наиболее могущественных химических держав
мира.
И не случайно в списке великих
деятелей, которым по постановлению
Совнаркома от 30 июля 1918 г. было решено
воздвигнуть монументы в Москве и других
городах, наряду с именами Маркса и
Энгельса, Спартака и Робеспьера, Толстого и
Рублева, Мусоргского и Шопена, значились
имена Ломоносова и Менделеева.
Кандидат философских наук
Н. Л. БУДРЕЙКО
•
7
Фасад универмага «Москва». Это здание построено с широким применен!
ием алюминиевых сплавов.
f**~Z
Первый промышленный алюминий получил
французский ученый Сент-Клер Девиль немногим
более 100 лет назад — в 1855 г. Алюминий был
красив, внешне похож на серебро. Это поражало
воображение. Кроме того, первые порции алюминия
были необычайно дороги. Это тоже поражало.
Появились алюминиевые украшения (дороже золотых).
А император Наполеон III решил заменить посуду во
дворце Тюильри на алюминиевую. Наполеон III не
отличался дипломатическими или военными
талантами, но в данном случае он оказался провидцем:
спустя 100 лет алюминиевая посуда стала самым
обычным предметом домашнего обихода во многих
странах. Выполненные «под золото» алюминиевые
ожерелья могут вызвать немалый интерес модниц,
а такие же парадные пуговицы — придать блеск и
внушительность генеральским мундирам.
По способу Сент-Клер Девиля с 1В55 по 1890 г.
было получено всего 200 гонн алюминия; за остав-
Доктор технических наук
И. Н. ФРИДЛЯНДЕР
9
шиеся до конца XIX века 10 лет было выплавлено
(уже по новому способу) 28 000 тонн, а в 1930 г.
мировое производство алюминия составило около
300 000 тонн. В годы второй мировой войны и после
нее алюминий начинает вытеснять сталь, а в
некоторой степени и медь. Например, в США, с 1955 fno
1963 г. производство стали снизилось почти на
полтора процента {со 103,2 до 101,9 млн. т), а
производство алюминия увеличилось в полтора раза (с 1,5 до
2,3 млн. т е год). И в объемном выражении (не надо
забывать, что алюминий втрое легче!) его
потребление в США уже составляет (примерно 7% от стали.
Другой пример ■— очень быстрый рост
производства алюминия в СССР—в 2,8—3,0 раза по
семилетнему плану 1959—1965 гг.
Алюминий обладает ценнейшими свойствами,
которые все глубже познаются и раскрываются.
И возможности этого металла в самых различных
областях применения становятся все шире.
КОМПЛЕКС ЦЕННЫХ СВОЙСТВ
Алюминий — элемент третьей группы
периодической системы Менделеева, плавится при 660° С и
испаряется три 2060° С. Удельный вес алюминия 2,7—
он примерно в три раз легче железа и меди.
Кристаллическая решетка алюминия — куб с
центрированными гранями и расстоянием между
параллельными плоскостями — 4,04 А. Кубическая решетка,
как правило, дает возможность хорошей
пластической деформации металла. И действительно,
алюминий прекрасно поддается обработке давлением —
прокатке, прессованию, ковке, штамповке, он
технологичен. Многие алюминиевые сплавы не
становятся хрупкими даже при температуре жидкого
водорода или гелия.
Прочность ■чистого алюминия невелика —
примерно 6—8 кг/мм2. Но уже созданы сплавы
алюминия, прочность которых в 10 раз выше: 70—75 кг/мм2,
как у среднелегированной стали.
Алюминий обладает высокой
теплопроводностью и электропроводностью (из технических
металлов только медь превосходит его по этим
характеристикам). Значит, он перспективен квк материал для
теплообменников, а это очень важно для
химической промышленности (и не в меньшей степени для
изготовления домашних холодильников, радиаторов
для автомобилей и тракторов). Если провода
электрических передач изготовлять из алюминия, то
можно увеличить расстояния между опорными
мачтами — это экономия. Алюминиевая обмотка
роторов электрических машин позволяет снизить их вес —
снова экономия и конструктивные преимущества.
Буровые станки мз алюминия легки и маневренны.
В 1965 году в СССР увеличивается вдвое выпуск
алюминиевых труб для нефтяной промышленности —
они все больше вытесняют стальные трубы...
Высокая отражательная способность алюминия
весьма мужна для производства зеркал, для
мощных рефлекторов и больших телевизионных экранов.
Чистый алюминий и в особенности некоторые его
сплавы обладают очень высокой коррозионной
стойкостью в воде,, в том числе в кипящей. Алюминий
практически не взаимодействует с
концентрированной азотной кислотой, со многими органическими
веществами и пищевыми -продуктами. У алюминия
малый захват нейтронов; в сочетании с коррозионной
стойкостью и технологичностью это делает его
одним из важнейших металлов атомной техники.
На воздухе алюминий быстро покрывается
тонкой окисной пленкой. Первые слои этой пленки
воспроизводят кристаллическую решетку алюминия,
образуя очень прочное соединение. За (последние
10 лет механизм роста окисной пленки удалось
использовать для создания исключительно
жаропрочных сплавов, упрочненных дисперсными частицами
окиси алюминия. Специально выращивая химическим
или электрохимическим способом утолщенную
пленку и вводя в нее различные наполнители, можно
придать ей любой цвет.
КАЖДЫЙ ДВАДЦАТЫЙ АТОМ
ЗЕМНОЙ КОРЫ—-АЛЮМИНИЙ
По распространенности на Земле алюминий
находится на четвертом месте после кислорода,
водорода и «ремния и на первом месте среди металлов.
На долю алюминия в составе различных
соединений приходится около 5,5% общего числа атомов
земной коры (или 7,45% по весу). Конечно, не все
месторождения пригодны для разработки, но тем
не менее запасы алюминиевого сырья на Земле
огромны.
Сент-Клер Девиль получал алюминий, вытесняя
его с помощью натрия из двойного хлорида
алюминия и натрия (А1С1з • NACI). Однако настоящее
промышленное производство алюминия стало
возможным только после изобретения процесса
электролиза глинозема, растворенного в расплавленном
криолите. Электролиз алюминия, одного из наиболее
электроотрицательных элементов в ряду напряжений,
нельзя вести в водных растворах. По этой же
причине все материалы, участвующие в электролизе,
должны отличаться большой частотой, чтобы в ванне
не было примесей, способных осадиться на катоде и
загрязнить алюминий.
Современные электролитические ванны
работают при силе тока 130—150 тысяч ампер; на полу-
ю
чение 1 кг алюминия расходуется до 16 квт-ч
электроэнергии. Естественно, что крупное производство
алюминия возможно только в стране с развитой
энергетикой. Хорошие условия для этого имеются у
нас в ряде районов, особенно в Сибири — на базе
дешевой электроэнергии и запасов нефелиновых
РУД-
Несмотря на «применение довольно чистых
материалов, электролизный алюминий всегда загрязнен
неметаллическими включениями — частицами
глинозема и углерода, водородом, железом, кремнием,
натрием, титаном. Его -подвергают очистке —
продувке газообразным хлором, увлекающим
неметаллические примеси. Получается обычный товарный
алюминий, содержащий, как правило, менее 0,3%
примесей, главным образом железа, кремния, титана. При
повторном электролизе чистоту металла удается
поднять до 99,999%. А методом зонной
перекристаллизации или дистилляцией через субфторид, можно
получить сверхчистый — четыре и даже пять
девяток после запятой (99,9999 или 99,99999%). Такой
металл может использоваться для полупроводниковых
сплавов или в тех случаях, когда нужна
максимальная отражательная способность и коррозионная
стойкость.
ПРОЦЕСС СТАРЕНИЯ
ПРИДАЕТ АЛЮМИНИЮ
НЕОБЫЧАЙНУЮ ПРОЧНОСТЬ
В 1909—1911 гг. немецкий ученый А. Вильм
открыл процесс, который получил название
естественного старения. Оказалось, что сплав алюминия с
добавками меди, магния и марганца (так называемый
дуралюмин) после резкого охлаждения — закалки с
500° С и вылеживания при комнатной температуре в
течение 4—5 суток, постепенно, но очень
основательно увеличивает твердость и прочность, не
снижая способности к деформации.
Это открытие имело величайшее значение для
развития алюминиевой промышленности.
Было высказано предположение, что в процессе
вылеживания закаленного дуралюмина при
комнатной температуре из матрицы—'пересыщенного
твердого раствора меди в алюминии — выделяются
мельчайшие кристаллики CuAl2l упрочняющие сплав до
36—38 кг/см2 вместо 7—8 кг/мм2 у чистого алюми-
* *
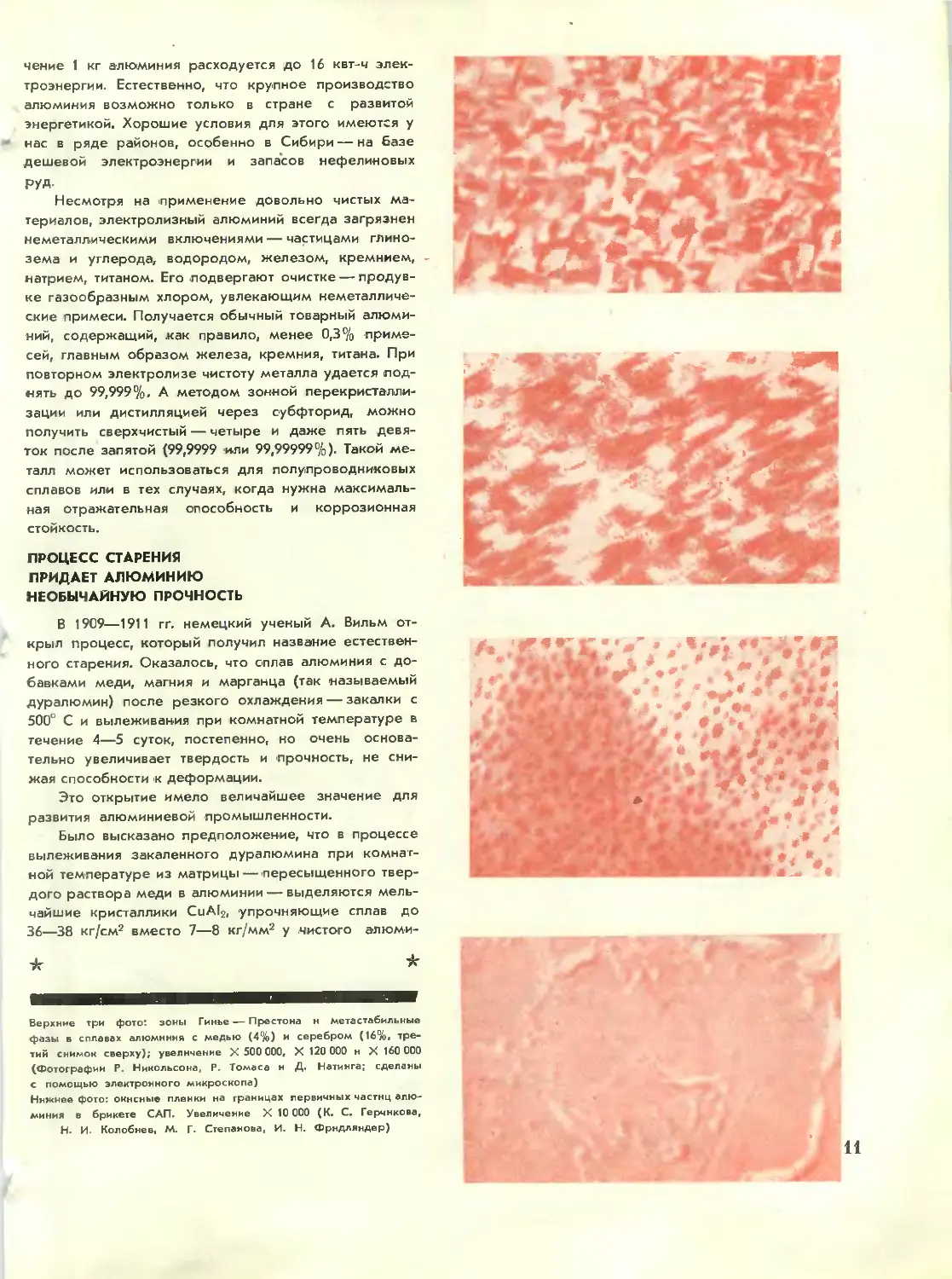
Верхние три фото: зоны Гинье — Престона н метастабильные
фазы в сплавах алюминия с медью D%) и серебром A6%,
третий снимок сверху); увеличение X 500 000, X 120 000 н X 160 000
(Фотографии Р. Никольсона, Р. Томаса н Д. Натинга; сделаны
с помощью электронного микроскопа)
Нижнее фото: окнсные пленки на границах первичных частиц
алюминия в брикете САП. Увеличение X 10 000 (К. С. Герчнкове,
Н. И. Колобнев, М. Г. Степанова, И, Н. Фрндляндер)
ния. Казалось, что механизм старения раскрыт. Но
страсти еще только разгорались. Дело в том, что с
помощью оптического микроскопа не удавалось
найти частицы CuAI2, и реальность их существования в
естественно состаренном сплаве стали подвергать
сомнению. Кроме того, выделение меди из матрицы
должно обязательно снижать электросопротивление
сплава. А в процессе естественного старения дурапю-
мина оно росло. Это прямо указывало на то, что
медь должна оставаться в твердом растворе.
Начались многолетние споры. Сторонники и
противники выделения меди из твердого раствора при
естественном старении, подобно представителям
венецианских фамилий Монтекки и Капулетти,
схватывались неизменно при каждой встрече. Положение
прояснил только рентгеноструктурный анализ. А в
последние годы благодаря мощным электронным
микроскопам, позволяющим просматривать тонкие
металлические пленки насквозь, картина стала
наглядной. Истина оказалась где-то «посередине». Медь не
выделяется из твердого раствора и не остается
внутри него. В процессе старения она собирается в ци-
скообразных участках толщиной в 1—3 атомных слоя
и диаметром 90 А, образуя так называемые зоны
Гинье — Престона. Они имеют искаженную
кристаллическую структуру твердого раствора, искажается
также прилегающая к зоне область твердого
раствора. Число таких выделений огромно — оно
выражается единицей с 16—18 нулями для 1 см3 сплава.
Изменения и «искажения кристаллической решетки
при образовании зон Гинье — Престона и служат
причиной повышения прочности дуралк>М1И1на при
естественном старении. Эти же изменения увеличивают
электрическое сопротивление сплава.
Можно без преувеличения сказать, что крылья
самолетов удерживаются в воздухе зонами или ме-
тастабильными частицами, а если в результате
нагрева вместо зон и частиц появятся стабильные
выделения, крылья потеряют свою прочность и 'просто
согнутся...
Закончить эту часть рассказа о свойствах
элемента № 13 мне хочется упоминанием имен тех, кто
много сделал в теории старения алюминиевых
сплавов — профессоров С. Т. Конобеевского, Д. А.
Петрова, Ю. А. Багаряцкого.
ФАЗЫ-УПРОЧНИТЕЛИ
Принципиально новые сплавы появляются тогда,
когда открываются новые фазы-упрочнители. Во всем
мире исследователи усиленно ищут новые фазы,
способные вызвать значительное упрочнение сплавов,
повышение их коррозионной стойкости или других
важных характеристик. До настоящего времени их
найдено не так много.
Марганец и еще два элемента — хром и
цирконий — вводятся в небольших количествах почти во
все алюминиевые сплавы. Они очень сильно влияют
на структуру и свойства металла. Из сплава
алюминия с марганцем изготовляли первые авиационные
бензобаки. Сплавы алюминия с марганцем и
магнием не упрочняются термической обработкой (не
дают эффекта старения); однако они обладают
высокой коррозионной стойкостью, очень хорошо
свариваются плавлением (в аргоновой среде). Они
прекрасно зарекомендовали себя в судостроении как
конструкционный материал, из таких сплавов,
например, сделаны корпуса «Ракет» и «Метеоров»,
судов на подводных крыльях. Из такого же сплава
магналия сделаны крыша и козырьки стадиона,
построенного Советским Союзом в Джакарте.
Материал этот успешно выдерживает натиск времени,
жаркого и влажного климата и горячего
темперамента болельщиков.
Из сплавов с низким содержанием магния (или
из чистого алюминия) изготовляют миллионы штук
испарителей для холодильников, баки стиральных
машин, радиаторы автомобилей <и тракторов,
резервуары для хранения жидкого кислорода, цистерны для
перевозки молока и других пищевых продуктов.
Успешно прошли испытания изготовленные из
магналия пассажирские вагоны с креслами самолетного
типа и большие товарные вагоны. Эти сплавы
хорошо полируются, им можно придать разнообразные
цветовые оттенки. В США их начали применять
вместо упаковочной жести и для изготовления
консервных банок. И если в 1960 г. было выпущено всего
около 1 % алюминиевых банок, то в настоящее
время их изготовляют до 15—20% от общего
количества.
Но вернемся к фазам алюминиевых сплавов.
Сплавы, старение которых определяется в основном
фазой CuAI2r отличаются средней прочностью,
хорошей жаропрочностью и небольшой общей
коррозионной стойкостью.
Но зато в конструкциях из таких сплавов,
находящихся в напряженном состоянии, не возникают
самопроизвольно коррозионные трещины (а это самый
опасный дефект).
К таким сплавам, где фазе CuAfe принадлежит
доминирующая роль, относится классический дур-
алюмин (сплав Д1)г открытый Вильмом и все еще
занимающий важное место в промышленности. Из
сплава Д1, в частности, делают лопасти самолетных
винтов. Во время войны, когда нередко щриходилссь
садиться на случайные площадки, не выпуская шасси,
«на брюхо», лопасти сгибались при ударе о землю
под прямым углом. Их тут же в полевых условиях
выпрямляли и после этого снова летали с таким
винтом...
12
Сплавы типа Д20 (AI — Си — Мп)
удовлетворительно свариваются. Из них, в частности,
изготовлены огромные сварные баки жидкого кислорода и
водорода американской ракеты «Сатурн»,
предназначаемой для полета на Луну.
В другой группе алюминиевых сплавов (в
работах с ними большая роль принадлежит профессору
С. М. Воронову) упрочнителем служит соединение
Mg2Si. Прочность металла изменяется от 12 до
36 кг/мм2 в зависимости от содержания Mg и Si и
добавок меди и марганца. Сплавы системы AI —
Mg — Si применяются в судостроении, для
облицовки 'И перекрытий зданий, изготовления металлических
обоев, корпусов часов, ювелирных украшений. С их
широким применением построены Дворец спорта в
Киеве, Московский дворец пионеров, универмаг
«Москва». В Кремлевском дворце съездов
прекрасная панорама создается сочетанием золотых и
черных покрытий на алюминиевом сплаве системы AI —
Mg —Si.
Эти сплавы — замечательный материал для
оконных рам. Сваренные специальными машинами в стык
такие рамы не имеют швов, они легки, изящны,
гигиеничны и геометрически точны. На них можно
создавать пленки любых цветовых оттенков. А горные
или <полярные области, где нет строительных
материалов, куда 'Их трудно доставить? Почему бы не
транспортировать туда самолетами и вертолетами
сборные алюминиевые дома? Первые десятки
алюминиевых домиков уже служат полярникам, но это
должно быть только началом.
В нашей стране идет огромное строительство.
И лет через 15—20 для стенных панелей, .подвесных
потолков, крыш, оконных рам и других строительных
деталей может потребоваться такое количество
алюминиевых сплавов, что не хватит м сотен тысяч тонн.
И еще одна очень ответственная служба сплавов
AI — Mg — Si. Из них во всем мире изготовляют
лопасти винтов для вертолетов, потому что именно эти
сплавы обладают очень высокой коррозионной
стойкостью. Чрезвычайно важное свойство, если иметь в
виду, что даже мельчайший коррозионный дефект
может резко ускорить появление и развитие
усталостных трещин. Для спокойствия пассажиров хочу
добавить, что усталостные трещинки развиваются в
действительности очень медленно. А на вертолетах
установлены приборы, подающие летчику световые
* *
Алюминиевые переплеты и арматура, создающие плавный
переход от естественного освещения к электрическому
свету при входе в туннель (парижский аэропорт Орли)
или звуковые сигналы, как только лоявится первая
трещинка. И лопасти меняют несмотря на то, что они
могли бы работать еще сотни часов.
В самые последние годы стали известны сплавы
алюминия, содержащие германий и серебро. Их
свойства подтверждают основную мысль: если в
алюминии растворено химическое соединение,
содержащее атомы не менее чем двух других элементов, то
можно ожидать заметного эффекта старения сплава.
К сожалению, германий — редкий элемент, а
серебро— драгоценный металл; они дорого стоят. Пока у
сплавов с германием и серебром не будут найдены
«акие-либо выдающиеся свойства, эти сплавы не
имеют практического значения... А вот о недавно
открытой системе Al — Mg — Li этого не скажешь:
легкие и прочные сплавы с литием безусловно могут
найти применение в промышленности.
БЫСТРОЕ ОХЛАЖДЕНИЕ
ПРИ КРИСТАЛЛИЗАЦИИ
ПРЕОБРАЗУЕТ КРИСТАЛЛЫ
Прежде чем получить слитки или фасонные
отливки, жидкий металл нужно очистить от газов и
твердых неметаллических включений. Из газов в
жидком алюминии растворен главным образом
водород. Чем выше температура расплава, тем его
больше. При остывании -и кристаллизации он не успевает
выделиться и остается в металле в виде мельчайших,
а иногда и довольно крупных пор. Водород приносит
много неприятностей — пустоты в фасонном литье,
пузыри в листах и профилях, поры 'При сварке
плавлением. И только в одном случае водород оказался
весьма полезным — речь идет о так называемом пе-
ноалюминии, напоминающем хороший голландский
сыр (только пор в таком металле гораздо больше,
14
Рис. 1. Непрерывная отливка алюминиевых слитков. Сверху
подается жндкнй металл, внизу выдвигается готовый слиток
а «слезу» он не пускает). Удельный вес пенистого
алюминия может быть доведен до 0,3—0,5 г/см3.
Поры в нем замкнутые, и металл свободно плавает в
воде. У него исключительно низкая тепло- и
звукопроводность, он режется и паяется. Чтобы получить
рекордное количество пустот, жидкий алюминий, по
«рецепту» профессора М. Б. Альтмана, перегревают
и затем вводят в него гидрид циркония или титана,
который немедленно разлагается, выделяя водород.
Тут же металл, вскипающий огромным количеством
пузырьков, быстро разливают в формы.
Но во всех других случаях от водорода
стараются избавиться. Самый лучший способ для этого —
продувка расплава хлором. Пузырьки хлора,
двигаясь через жидкий алюминий, вбирают в себя атомы
и мельчайшие пузырьки водорода, захватывают
взвешенные частицы шлака <и окисных пленок.
Все неметаллические включения особенно
вредны при медленной кристаллизации металла, поэтому
при литье всегда стремятся увеличить скорость
кристаллизации. Фасонные детали отливают не в
земляные формы, а в металлический кокиль; при литье
слитков чугунные изложницы заменяют медными с
водяным охлаждением. Но даже лри самом быстром
отводе тепла от стенки изложницы или формы после
кристаллизации первого тонкого слоя между стенкой
и этой корочкой появляется воздушный зазор.
Воздух очень плохо проводит тепло... Скорость отвода
тепла от металла резко падает.
Долгое время все попытки радикально ускорить
охлаждение стенки терпели неудачу из-за этого
воздушного зазора. В конце концов верное решение
было найдено, как это нередко бывает в технике,
совершенно «с другой стороны»: вместо борьбы с
потерями тепла в воздушном зазоре ликвидировали
сам зазор. Охлаждающей водой стали орошать
непосредственно кристаллизующийся металл. Так
родился метод непрерывного литья алюминиевых
слитков (рис. 1).
В медный или алюминиевый кристаллизатор
небольшой высоты заливается жидкий металл. В
кристаллизатор вдвинут шоддон, заменяющий
неподвижное дно. Как только начинается затвердевание
алюминия, «поддон медленно опускают — постепенно и
с той же скоростью, с какой идет процесс
кристаллизации. А сверху непрерывно доливают жидкий
металл. Процесс регулируют так, чтобы лунка
расплавленного алюминия находилась в основном ниже
кромки кристаллизатора, где прямо на застывающий
слиток подается вода.
Освоение непрерывного литья слитков иэ
алюминиевых сплавов происходило в трудные годы
войны. Но в 1945 г. на наших металлургических заводах
не осталось ни одной изложницы для алюминиевых
слитков. Качество литого металла радикально
улучшилось. Большая роль в разработке непрерывного
литья алюминия принадлежит профессорам В. А.
Ливанову и В. И. Добаткину. Кстати, метод непрерывной
разливки стали в черной металлургии, освоение
которого началось в последующие годы, многим
обязан 'именно успешному освоению непрерывного
литья алюминия.
И еще одно очень важное и остроумное
решение. Это производство литой алюминиевой-
проволоки (рис. 2) по методу В. Г. Головкина.
Из горизонтального отверстия в лечи
непрерывно вытягивается струя жидкого металла,
опирающаяся на некотором расстоянии от печи на ролики.
Прямо по выходе из печного отверстия на металл
подается охлаждающаяся вода. Самое интересное в
i:4
l/\
'l-w
Рнс. 2. Алюминиевая проволока непрерывно вытягивается из
расплава
15
этом методе состоит в том, что жидкая струя
силами поверхностного натяжения и достаточно прочной
пленкой окислов удерживается в воздухе. Поэтому
поверхность проволоки получается гладкой и
блестящей. По прочности такая проволока не уступает
обычной холоднотянутой. А потребность в ней,
особенно в годы войны, когда и был создан этот метод,
была громадной. Каждому, кто летал на самолете,
достаточно вспомнить бесконечные ряды заклепок
на крыльях, на фюзеляже. Но, может быть, далеко
не все знают, что число этих заклепок на
истребителе военного времени доходило до 100—200 тысяч
штук, а на бомбардировщике — даже до миллиона.
Рассказывая о фазах-упрочнителях, мы
подчеркивали, что они возможны только при условии
растворимости соответствующих элементов в алюминии.
Начиная от электролиза и кончая отливкой слитков
и фасонных деталей, на заводах ведут упорную
борьбу с окисными включениями. Но такова уж
диалектика свойств вещества, что нерастворимые в
алюминии и наносящие ему вред включения совершенно
изменили свое качество, как только их превратили
в тончайшие пленки. Это произошло уже в
послевоенные годы.
АЛЮМИНИЙ — МЕТАЛЛ
ЖАРОПРОЧНЫХ СПЛАВОВ
Если жидкий алюминий распылить, получатся
более или менее округлые частицы, сплошь покрытые
тонкими пленками окиси. Эти частицы (они называ-
Рис. 3. Так построена первичная пленка окиси на алюминии
по мнению П. Д. Данкова, Д. В. Игнатьева и Н. А. Шишакова.
Белые кружки — ионы кислорода, черные — ионы алюминия
двойные — атомы алюминия
16
Полукруглая часть фасада административного здания с
горизонтальными и вертикальными жалюзи из алюминиевого сплава
* *
ются пульверизатом) размалывают в шаровых
мельницах. Получаются тончайшие «лепешки» толщиной
0,1 микрона. Если такую пудру предварительно не
окислить, то при соприкосновении с воздухом она
мгновенно взорвется — произойдет бурное
окисление. Поэтому в мельницах создают инертную
атмосферу с регулируемым содержанием кислорода, и
процесс окисления пудры идет постепенно.
В первый период размола насыпной вес пудры
уменьшается до 0,2 г/см3, содержащие окиси
алюминия постепенно увеличивается до 4—8%. Размол
продолжается, мелкие частицы укладываются более
плотно, не слипаются между собой, так как к пудре
специально добавляют жир, и насыпной вес
материала повышается до 0,8 г/см3. Окисление происходит
интенсивно, и содержание окиси алюминия
достигает 9—14%. Постепенно жир почти полностью
улетучивается и мельчайшие окисленные частицы
«склепываются», сращиваются в более крупные
конгломераты.
Такая «тяжелая» пудра (в ней содержится до 20—
25% окиси) уже не летит как пух, ее можно
спокойно ссыпать в стаканы. Затем порошок брикетируют
в прессах -под давлением 30—60 кг/мм2 .и при
температуре 550—650° С. После этого материал
приобретает металлический блеск, он имеет сравнительно
высокую 'Прочность, электро- и теплопроводность. Из
брикетов можно прессовать, прокатывать, ковать
трубы, листы, прутки и другие изделия. Все эти
полуфабрикаты именуются САП — по первым буквам
слов: «спеченный алюминиевый порошок».
При содержании окиси алюминия 20—25%
прочность САП достигает максимума — 45—48 кг/мм2.
Иначе говоря, благодаря окиси прочность алюминия
увеличивается в 8 раз. Объясняется это, конечно, не
просто содержанием окиси алюминия, а ее
дисперсностью, способом наращивания пленки, механизмом
ее взаимодействия с алюминием.
Вероятно, первые молекулярные слои окиси
имеют не собственную решетку, а искаженную
решетку алюминия (рис. 3). Естественно, что решетка
слоев алюминия, прилегающих « пленке окиси,
должна искажаться (аналогично тому, как искажается
решетка метастабильных частиц .и матрицы). Можно не
сомневаться, что через некоторое время рентгено-
структурные или электронномикроскопические
исследования покажут вполне точно «стыковку»
кристаллических плоскостей алюминиевой матрицы и окис-
ной фазы. Эти изменения могут распространяться
i
/
I
/
2 Химия и Жизнь, № 4
только на очень .небольшую глубину. Значит,
прочность материала может увеличиться только в том
случае, если частицы, на которых наращивается окис-
ная пленка, чрезвычайно малы, а сама пленка очень
тонка.
Расположение окисных пленок в брикете САП
можно увидеть с помощью электронного
микроскопа. Пленки, частично разрушенные при
брикетировании, обрисовывают контуры первичных алюминиевых
частиц, образовавшихся при размалывании шудры в
мельнице (см. фогго «а стр. 11). Чем меньше
расстояние между частицами, тем прочнее САП.
Можно ли считать принципиально новый способ
упрочнения, основанный на образовании дисперсных
частиц из нерастворимых соединений, характерной
особенностью именно алюминия и окиси алюминия?
По всей видимости, и другие соединения могут
создавать тончайшие пленки >и дисперсные частицы,
способные упрочнять металлы. Но их еще предстоит
искать, систематически исследуя различные окислы,
карбиды, нитриды...
Благодаря тому, что природа дисперсных
образований в обычных стареющих алюминиевых сплавах
и в САП различна, эти материалы очень
различаются и по своим свойствам. САП сохраняет высокую
18
прочность до 500—600° С, а все алюминиевые
сплавы переходят при этой температуре в полужидкое
или вязкое состояние. Тысячи часов при
температурах до 500° С в общем мало сказываются на
прочности САП, потому что взаимодействие окисных
частиц и алюминиевой матрицы мало меняется после
нагрева. Сплавы же алюминия при таком испытании
совершенно теряют прочность, так как зоны -и мета-
стабильные фазы превращаются в стабильные фазы
или стабильные фазы вновь переходят в твердый
раствор.
САП не нуждается в закалке, по коррозионной
стойкости он близок к чистому алюминию,
совершенно не подвержен коррозии под напряжением .и меж-
кристаллической коррозии. По электропроводности и
теплопроводности этот материал ближе к чистому
алюминию, чем стареющие сплавы такой же
прочности. Характерная особенность САП — адсорбция
огромного 'количества влаги разветвленной
поверхностью окисленных частиц.
Поэтому САП необходимо хорошо дегазировать
в вакууме, нагревая материал до точки плавления
алюминия. Из САП можно изготовлять поршни
двигателей, работающие при температуре до 400 и даже
450° С, материал этот перспективен для
судостроения и химического машиностроения. При бурении
глубоких скважин, когда температура пород может
достигать 300—400° С, могут найти применение трубы
из САП.
Заканчивая рассказ о применении алюминия как
конструктивного материала, надо упомянуть и о его
спеченных сплавах с кремнием, никелем, железом,
хромом, цирконием (они называются САС — по
.первым буквам слов «спеченный алюминиевый сплав»).
У них низкий коэффициент линейного расширения,
и это позволяет использовать их в сочетании со
сталью в механизмах и приборах. У обычного же
алюминия коэффициент линейного расширения
примерно вдвое выше, чем у стали, и это вызывает
большие напряжения, искажения размеров и
нарушения точности.
Важное применение могут иметь спеченные
алюминиевые сплавы и как материал оболочки ядерных
реакторов с водяным охлаждением.
Возможности алюминиевых сплавов как материала
художественного литья: сирена работы скульптора Ги Револя — символ
мореплавания, украшающий здание технического колледжа в
Страсбурге (Франция)
Фото из журнала «Revue de L'Aluminium».
•^ 42-этажное здание в Монреале (Канада). В его конструкциях
и облицовке широко испопьзован алюминий
* *
АЛЮМИНИИ В ХИМИЧЕСКОМ
МАШИНОСТРОЕНИИ
Алюминий только начинают применять в
химическом машиностроении, но возможности его очень
велики благодаря двум качествам — малому
удельному весу и стойкости против коррозии.
Заводам и лабораториям нужны во все
больших количествах очень чистая вода и другие
химические вещества, свободные от «примесей. Значит,
конструктивным материалом аппаратов может быть
либо дорогая нержавеющая сталь, либо гораздо
более дешевые алюминиевые сплавы. Они нужны, в
частности, для изготовления насосов и
вентиляторов, болтов, гаек, заклепок. Алюминиевые
поверхности теплообменников меньше загрязняются и
поэтому повышают эффективность аппаратов, во
многих случаях позволяют уменьшить их размеры и
сократить расходы на перекачку жидкостей.
Промежутки времени между чистками значительно
увеличиваются, а в некоторых случаях необходимость в
чистке аппаратов вообще отпадает.
Алюминий не искрит, и поэтому алюминиевые
резервуары с легковоспламеняющимися или
взрывчатыми веществами безопасны. Из алюминия, его
сплавов и САП можно изготовлять резервуары и
аппараты для хранения и переработки пищевых
масел, так как алюминий не является катализатором в
окислительных процессах, которые ведут к
прогорклости масла.
Алюминий дороже простой углеродистой стали
(это не значит, что он дороже нержавеющей стали!)-
Но если рассчитать стоимость алюминиевых и
стальных изделий и конструкций с учетом последующей
коррозии, то оказывается, что во многих случаях
алюминий и его сплавы гораздо экономичнее для
химических предприятий. Алюминиевые сплавы
должны стать одним из главных конструкционных
материалов в химической промышленности.
* * *
Эта статья печатается в журнале под рубрикой
«Элемент № ...».
Но рассказать об элементе № 13 можно,
конечно же, гораздо больше, чем о металле алюминии.
С «биографией» элемента № 13 связана судьба науч-
2* 19
ных .проблем и открытий, самых разных химических
процессов и продуктов — красок, полимерных
материалов, (катализаторов и многих других.
И, наверное, об этом должен будет написать
другой автор в другой раз. А мне остается
попробовать ответить еще только на один вопрос:
КАКОВО БУДУЩЕЕ
АЛЮМИНИЯ?
Около 100 лет назад Н. Г. Чернышевский, увидев
алюминий, сказал, что этому металлу суждено
великое будущее, что алюминий — металл
социализма.
Великий русский философ был, вероятно, прав.
В конце XIX и в первые десятилетия XX века
господствующее место в промышленности занимали
железо, чугун, сталь. Такие выражения, как
«железная дорога», или просто «чугунка», подчеркивали
полную ассоциацию развития техники именно с
черными металлами. Но время идет вперед, появляются
новые требования, конструкции, материалы. Будет
ли сталь «главным» металлом всегда? Не сможем ли
мы повторить вслед за поэтом:
Новому времени
Новый костюм
Нужен
Для новых дел...
Может быть, легкий серебристый алюминий
действительно начнет вытеснять в конце XX века черные
металлы и станет основным металлом века
коммунизма? Я думаю, что у алюминия есть для этого все
возможности.
НОВОСТИ ОТОВСЮДУ
НОВЫЙ ТОПЛИВНЫЙ ЭЛЕМЕНТ
В английском исследовательском
центре €<Торнтон» создан топливный
элемент, работающий на метаноле
(метиловом спирте) и воздухе. Такие дешевые
материалы впервые применяются в
системах топливных элементов.
Схема работы устройства такова. На
первой стадии процесса в реэультете
взаимодействия метанола и паре в
присутствии катализаторе получается водород,
который направляется в батарею
элементов. Туда же одновременно подается
воздух. Электрический ток получается в
результате электрохимической реакции
между кислородом воздуха и водородом.
Новые топливные элементы не только
дешевы, но и легки. В них работают
электроды иэ микропористого
полихлорвинила. Благодаря этому удельный вес
элементов равен всего 1,13 г/см3.
Металлические электроды утяжелили бы их в 4—
5 раз. Две батареи новых элементов (по
62 элемента в каждой) были установлены
на автомашине. Система раэвивает
мощность 5 квт и работает с общим
термическим к.п.д., равным 50—60%.
ДИЭЛЕКТРИК ПРЕВРАЩАЕТСЯ
В ПРОВОДНИК
Журнал «Applied Plastics» A964,
№ 12) сообщил, что е Англии получена
новая электропроводящая пластмасса.
Такой проводник, конечно, не может
конкурировать с металлами в области
передачи больших количеств электроэнергии.
Но легкость обработки пластмасс и
возможность изготовить из них изделия
любой формы делает их весьма
перспективными для техники слабых токов.
Например, электропроводящие
пластмассы можно использовать в виде лаковых
покрытий для печатных схем в
радиоприемниках и телевизорах. Особенно
важно, что степень электропроводности
материале можно легко менять, вводя в
него нейтральные добавки.
«ИСПАРЯЮЩАЯСЯ»
ПЛАСТМАССА
В США испытана модель «летающей
тарелки», предназначенной для запуска в
космос в качестве спутника связи.
Рефлектор спутника представляет
собой тонкую проволочную сетку вогнутой
формы. Она укреплена на оболочке
надувного шара иэ специальной
пластмассы. После выхода на орбиту сложенный
шар с сеткой выдвигается из
специального контейнера и надувается сжатым
газом. Вскоре после этого пластмасса, из
которой сделай шар, начинает
разрушаться под воздействием ультрафиолетового
излучения Солнца. Сетка освобождеется
и может выполнять свои функции —
отражать радиоволны.
РЕКОРД ТУГОПЛАВКОСТИ
Два независимых, но абсолютно
бесспорных факта. Первый: вольфрам —
самый тугоплавкий металл; второй: в
мокрой одежде —холодно.
Первому факту физики дают
сложные объяснения, ссылаясь на
особенности строения атомов вольфрама. Второй
объясняется элементарно. Испарение
любого вещества требует затрат тепла и,
кек правило, это тепло отбирается у
тела, с поверхности которого происходит
испарение.
На основе этого элементарного
явления разреботан новый оригинальный
материал, способный работать при очень
высоких температурах.
Он представляет собой обожженный
еольфрам, поры которого заполнены
серебром. При нагревании серебро
плавится и испаряется, тем самым охлеждая
вольфрам.
Исключительная тугоплавкость — не
единственное достоинство нового
материала. И при комнатных температурах он
обладает очень ценными качествами —
высокой прочностью и хорошей
ковкостью; вот почему американские
инженеры считают, что он найдет широкое
применение в ракетной технике.
ВОЛОКНА ИЗ БОРА
В Соединенных Штатах Америки
получены волокна из бора, более прочные и
жесткие, чем иэ любого известного
материала. Американские ученые считают, что
композиции из этих волокон и
эпоксидной смолы смогут быть использованы при
изготовлении корпусов рекет, в
авиационной и автомобильной промышленности,
а также при строительстве подводных
лодок. Отмечается, однако, что пока удалось
получить эти волокна только в лаборе-
торном масштабе.
20
>=^f
t01И*
■1'**- A
Михаил
Васильевич
ЛОМОНОСОВ
1711-1765
Велико есть дело
достигать разумом,
куда рукам
и оку досягнуть
возбраняет натура
otmUhimae
&%
teti4/ "frKu.truit 'f)(fulccrai.orir
тй*
t %er *m*tCf.*& timemrtte ая?Шгшл
■
™„ (t-*»M&ф^мют?
ПЕРЕДИВШИЙ
ВРЕМЯ
И. В. ПЕТРЯИОВ
Бессмертен отдавший всю свою жизнъ и волю людям. Его
существование будет продолжаться вечно, продолжаться в жизни многих
поколений, несмотря на их непрерывную смену в бесконечном развитии
человечества. И в первую очередь вечны имена и дела тех, кто смог понять
и предвидеть грядущее.
В истории науки много таких славных имен. Незабываемы имена тех,
кто обобщал разрозненные обрывки знания, бережно собранные и
накопленные предшественниками, и тех, кто сумел разглядеть неизвестное и
разгадать новую тайну природы. Но трижды незабвенны и вечны имена
прозорливых, разглядевших в настоящем законы будущего.
I
Красной датой должен быть отмечен в календаре развития мировой
науки тот далекий памятный день, в который с побережья Северного
Ледовитого океана пришел пешком учиться в Москву юноша-рыбак.
Этот юноша стал одним из величайших мыслителей мира. Было бы
глубоко неправильным утверждение, что Михаил Ломоносов — великий
ученый своего века. Он в равной мере принадлежит и нашим дням. Два
века, отделяющие нас от кончины величайшего преобразователя науки, не
могли заслонить того, что он дал науке и человечеству.
Имя Ломоносова осталось бы навсегда бессмертным, даже если бы им
не было сделано ничего больше, кроме великого открытия в астрономии.
Наблюдая прохождение Венеры по солнечному диску в мае 1761 года,
он открыл, что «...планета Венера окружена знатной воздушною
атмосферою, таковою (лишь бы не большею), какова обливается около нашего
шара земного...».
Излишне перечислять здесь все, что сделал Ломоносов в русской
филологии in истории, в географии и геологии, ботанике, металлургии,
метеорологии, физике. В каждой из этих областей знания он намного опередил
свой век, и даже сегодня человеческое воображение почти бессильно
представить его огромную эрудицию и всеобъемлющую широту научного
(предвидения.
Совершенно особое место в творческом наследии Ломоносова занимает
химия.
23
С06РЛН1Б
РЛЗНЫХЪ СОЯННЕНШ
КНИГА ПЕрЪШАЯ
^^^^^^^v*^<»4M#k4<»(V»^^*»i^^ *>
II
Немало историков изучало жизнь и
деятельность Ломоносова. Но когда
знакомишься с биографиями этого удивительного
человека, составленными разными авторами в
разное время, то невольно кажется, что они
посвящены совершенно разным людям, у ко-
гтг торых по какой-то странной случайности
совпадают многие подробности жизненного
V^Y пути.
* У одних можно прочесть о великом
поэте, посвящавшем свой досуг и свою прихоть
занятиям разными науками, в которых,
правда, ему удавалось сделать немало важного и
полезного.
Другие с искренним сожалением
рассказывают о гениальном ученом, поневоле
принужденном тратить время и силы, отрывая
их от науки, на сочинение торжественных и
похвальных слов и од по самым
разнообразным придворным случаям.
И, пожалуй, вполне закономерен и
обоснован до сих пор продолжающийся спор о
том, кем же был Ломоносов. \Может быть,
правы те, кто считает его первым и великим
русским поэтом, создателем русского
литературного и поэтического языка, поэтическим
предком Пушкина?
Ведь действительно поэзия занимает
очень большое и важное место в его
творчестве.
Ломоносов оставил нам немало
прекрасных, глубоко поэтических строк. Вот те, что
пленили Пушкина: «Заря багряною рукою от
утренних спокойных вод выводит с солнцем
за собою...». Сравните «их с чуждыми строю
русского языка, трудно произносимыми
виршами поэтических предшественников
Ломоносова! «...Над тобой солнце по небу катает,
смеясь, а лучше нигде не блистает.» (Тредиа-
ковский)
...Два, казалось бы, трудно совместимых
начала: науки и поэзия. Но и это не все.
Много творческих сил и труда посвятил он
возрождению мозаики, процветавшей в
древней Руси и забытой со времен падения
Киевского государства.
Он сам создавал образцы непрозрачных
цветных стекол (смальты) для мозаичных
картин. Сам разрабатывал для них
рецептуру. Организовал на собственные средства
первую в России фабрику мозаики. Создал
школу мозаичной живописи. Он мечтал об
огромном цикле картин на исторические
темы, и только смерть помешала ему
выполнить этот замысел, достойным памятником
которому осталось монументальное панно
24
a
i *.*«-.
fJL~*~>-*
' *W^
«Полтавская Баталия» в старом здании
Академии наук.
*Л*.
«и
<
III
Кем же все-таки был Ломоносов? Быть
может, он был гениальным дилетантом, с
одинаковым интересом и равным успехом
занимавшимся всем чем угодно, что привлекало
его внимание в данный момент? Или же эта
великая жизнь была посвящена чему-то
единому, главному, что было для нее основным
и что объединяло ученого, художника и
поэта?
Этот вопрос, естественно, очень труден
и спорен, и в разное время на него давали
разные ответы.
И несомненно, что единственный, кто
может правдиво ответить на подобный вопрос,—
это сам Ломоносов, и к нему нужно
обращаться с такими сомнениями. Но спрашивая,
необходимо внимательно вникать в ответы,
ничего не пропуская, тщательно анализируя
и стараясь в многогранности найти то самое
важное, что едино и общо для его жизни и
деятельности.
Большой знаток Ломоносова, человек
сходный с ним по разносторонности
научного творчества, кипучей энергии и размаху,
наш современник академик Александр
Евгеньевич Ферсман утверждал, что «в
Ломоносове боролись два разных человека. Один
был классик и точный исследователь; многие
годы в своей лаборатории он готовил
длинный ряд цифр, и надо поражаться той
точности, с которой он добывал основные
величины для построения своих выводов. Но
наравне с классиком, экспериментатором,
исследователем в Ломоносове был другой человек.
Это был поэт, богатый фантазией,
интуицией, вдохновением, горящий идеями. В
противоположность спокойному и медленному
развитию своих мыслей, этот человек мешал
терпеливой разработке отдельных вопросов,
в нем одни идеи бурно сменялись другими,
его влекло к большим мировым проблемам...
В этой борьбе гениального
натуралиста-исследователя и поэта-романтика рождается все
своеобразие фигуры великого помора,
человека, пришедшего из народных масс, творца
новых наук и новых идей, на столетия
опередившего свой век, гениального мыслителя
и великого гражданина нашей родины...».
25
Несомненно, что в этом портрете много
правильного, и прежде всего верно указание
на противоречивость мятущейся натуры
Ломоносова, на его внутреннюю борьбу.
Противоположного по существу мнения
держался лучший, пожалуй, знаток
Ломоносова и его времени — академик Сергей
Иванович Вавилов, инициатор и организатор
прекрасного памятника Ломоносову — музея его
имени. Он считал, что «великий русский
энциклопедист был в действительности очень
цельной и монолитной натурой» и указывал
на глубокое слияние «в одной личности
художественно-исторических и научных
интересов и задатков»...
Что же верно? Яркая картина
внутренней борьбы классика и романтика, ученого и
поэта, нарисованная Ферсманом, или
цельный и могучий образ борца в науке, по
мнению Вавилова?
Что было самым главным в работе
ученого? О чем, самом для него важном, писал
поэт? Как работал художник?
IV
Анализируя поэтическую сторону
творчества Ломоносова, необходимо отстранять
все то, что было навязано поэту жестокими
требованиями времени и придворного
положения. Никакого значения, даже, вероятно,
и для историка, не имеют бесчисленные
«надписи»; их бессмысленность угнетала самого
Ломоносова, который неоднократно, но
тщетно пытался избавиться от обязанности их
составлять. Потеряли свое значение, не
выдержав испытания в веках, его драмы и поэмы.
Только биографам интересны теперь его
сатиры.
Испытание временем беспощадно, но
безошибочно. Чтобы решить, что было самым
важным для поэта, во что он вложил всю
свою душу, необходимо, конечно, в первую
очередь обращаться к тому, что и теперь,
через два столетия, не потеряло своей
художественной ценности для нас, далеких
потомков и наследников Ломоносова.
С наибольшей же страстностью, с
наибольшей драматической силой созданы им
произведения на самую, казалось бы,
прозаическую тему. В них вложена вся творческая
сила еге огромного поэтического таланта.
И нельзя ошибиться в том, что именно они —
26
вершина поэтического творчества
Ломоносова. Они настолько выделяются, что выбор
здесь однозначен.
Это «Слово о пользе Химии» — один из
-•прекраснейших образцов мировой
поэтической прозы. Это «Письмо о пользе
Стекла» — страстная остро полемическая поэма,
в которой с неповторимой силой выражены
Ломоносовым основы его научного
мировоззрения.
Оба эти произведения, несомненно,
лучшие по поэтической образности, поистине
философской глубине мыслей и ясности
изложения позволяют понять и все его
литературное творчество. В них вложено его
научное мировоззрение и выбранная для этого
поэтическая форма была оправдана и
необходима в условиях того времени.
Очень важно для понимания сложной
натуры великого энциклопедиста, что оба его
программных произведения посвящены
«ближайшей служительнице и наперснице»
природы — химии.
Мысли, выраженные Ломоносовым в
«Слове», по существу остаются
злободневными и в наши дни настолько, что было бы
небесполезно перечитывать его почаще каждому
исследователю и в первую очередь химику,
чтобы не забывать о том, что
«Науки художествам путь показывают; художества
происхождения наук ускоряют. Обои общею
пользою согласно служат».
Ломоносов излагает в «Слове» целую
программу познания тайн природы, отводя в
ней первое место химии:
«...прекрасные натуры рачительный любитель,
желая испытать толь глубоко сокровенное
состояние первоначальных частиц, тела составляющих,
должен высматривать все оных свойства и
перемены, а особливо те, которые показывает
ближайшая ее служительница и наперсница и в
самые внутренние чертоги вход имеющая химия,
и когда она разделенные и рассеянные частицы
из растворов в твердые части соединяет и
показывает разные в них фигуры, выспрашивать
у осторожной и догадливой геометрии, когда
твердые тела на жидкие, жидкие на твердые
переменяет и разных родов материи разделяет
и соединяет, советывать с точною и
замысловатою механикою, и когда через слитие жидких
материй разные цветы производит, выведывать
через проницательную оптику. Таким образом,
когда химия пребогатыя госпожи своея
потаенные сокровища разбирает, любопытный и
неусыпный натуры рачитель оные через геометрию
вымеривать, через механику развешивать и
через оптику высматривать станет, то весьма
вероятно, что он желаемых тайностей достигнет».
Простое обычное стекло — для
Ломоносова становится поводом для создания
замечательного гимна науке: «Пою... в восторге
похвалу не камням дорогим, не злату, но
стеклу!». И в самом деле, роль стекла в
жизни человека необозрима. Оно служит
освещению и защищает от холода. Оно помогает
глубоко проникнуть в тайны природы.
Раздвигает границы познания, и человек
становится равным полубогу. Стеклянные бусы
приводят поэта к гневному протесту против
рабства. Стеклянный объектив телескопа —
к острому и саркастическому спору с
противниками гелиоцентрической системы мира.
Естественнонаучные мотивы пронизываю»
буквально все литературное творчество
Ломоносова.
V
Великой гордостью полон рассказ Ломо-
сова в письме к знаменитому современнику
ученому-математику Леонарду Эйлеру о
результатах исследований в области природы
цвета:
«В течение трех лет я был весь погружен в физико-
химические испытания, предпринятые для
разработки учения о цветах. И труд мой оказался
не бесплодным, так как кроме результатов,
полученных мною при различных растворениях и
осаждениях минералов, почти три тысячи
опытов, сделанных для воспроизведения разных
цветов в стеклах, дали не только огромный
материал для истинной теории цветов, но и
привели к тому, что я принялся за изготовления
мозаик».
Труд, вложенный в теоретическое
исследование природы цвета твердого тела,
не мог для Ломоносова завершиться только
выяснением истины, законным
удовлетворением ученого, разгадавшего тайну природы
и нашедшего в этом награду своей долгой и
тяжелой работе. Он приступает к еще
большему труду по практическому
приложению результатов теории:
«Изобрел все составы к мозаичному делу, для чего
сделал больше четырех тысяч опытов, коих не
токмо рецепты сочинял, но и материалы своими
руками по большей части развешивал и в печь
ставил... И сверх сего мозаичное художество, как
делать из оных составов картины живописные,
великими и неусыпными трудами привел в
совершенство против римского, чего там больше
двухсот лет доходили».
Еще большей гордостью за могущество
химии звучат слова Ломоносова о победе ее
в соревновании с природой:
«Искусством выкрашенные стекла добротою цвета
природных камней много выше изобретены и
впредь старанием химиков большего
совершенства достигнуть могут...
27
ЛИН*
'It
л*&ж
:ли-
Первая русская химическая лаборатория, созданная М. В. Ломоносовым
«Итак, не тщетно нынешние мастера художество
натуре предпочитают, которое меньшим трудом и
иждивением лучшее действие производит».
Так ученый-химик раскрывает истоки
своего художественного творчества. Он
проходит логически неизбежным путем от
теоретического исследования большой
физико-химической проблемы к ее практической
проверке и, наконец, к применению.
Исторические условия заставляет его проходить весь
этот путь самому. Немного в истории
человеческой культуры можно найти случаев, когда
искусство художника представляет собой
замечательный результат «внедрения»
достижений исследователя!
VI
«Велико есть дело достигать... разумом, куда рукам
и оку досягнуть возбраняет натура,
странствовать размышлениями в преисподней, проникать
рассуждением сквозь тесные расселины и
вечною ночью помраченные вещи и деяния
выводить на солнечную ясность».
К этим чудесным словам, образно
передающим призвание ученого, наше время
может добавить, что Ломоносов взором своегс
разума проникал и через столетия. Великий
энциклопедист, он немало сделал почти для
всех отраслей знания. Но есть одна область
в которой Ломоносов сыграл особую роль —
это физическая химия. Ее развитие он
предопределил вперед на два столетия.
«Опыт физической химии», «Элементь
математической химии», «Введение в
истинную физическую химию», «Планы курса фи
зической химии»... поразительна в этом крат
ком перечне работ Ломоносова его обыден
ность с точки зрения нашего современника
Этот перечень (его можно сильно расширить^
легко принять, например, за список пособш
для студентов последнего курса химическое
факультета, необходимых для подготовки i
экзаменам в сессию 1965 года.
Но ведь перечисленные работы Ломоно
сова были выполнены им в XVIII столетии
28
когда не только не было, а не могло еще быть
самого понятия физической химии.
Первый в мире курс физической химии
был прочитан Ломоносовым в 1752—1753
годах. Грубой ошибкой было бы считать, что
Ломоносов два столетия назад всего лишь
произнес совпадающее с современным
название новой науки и что содержание его
физической химии имеет мало общего с
современным.
Нет, разрабатывая проблемы новой
науки, он изучал скорость физико-химических
процессов и кинетику реакций- Он
испытывал действие на вещество температуры и
давления. Исследовал вязкость, изучал явление
капиллярности, форму и «плотность
кристаллов, образование и свойства растворов,
тепловые эффекты при растворении.
Физическая химия Ломоносова
заключала в себе все то, что стало главным
содержанием этой науки через полтора столетия,
когда она заново возникла в конце XIX века.
VII
Естествознание начала XVIII века было
еще основано на уже пошатнувшемся к тому
времени фундаменте средневековой
схоластики: природа всегда была и будет такова,
какой она создана... Множество таинственных
и невесомых материй — флюидов существует
в мире. Они неудержимы и непостижимы. Их
переходом из одного тела в другое
объясняется все, что непонятно,— теплота,
горение, электрические явления, световые,
магнитные. В тепловых процессах переходит теп-
лотвор, флогистон — в химических...
Естествознание было сковано
метафизикой.
И немалым мужеством нужно было
обладать, чтобы в те времена учить:
«Твердо помнить должно, что видимые телесные на
земли вещи и весь мир не в таком состоянии
были с начала от создания, как ныне находим,
но великие происходили в нем перемены...
Напрасно многие думают, что все, как видим,
сначала творцом создано; будто не токмо горы,
долы и воды, но и разные роды минералов
произошли вместе со всем светом; и потому-де
ненадобно исследовать причин, для чего они
внутренними свойствами и положением мест
разнятся. Таковые рассуждения весьма вредны
приращению всех наук, следовательно, и
натуральному знанию шара земного, а особливо
искусству рудного дела, хотя оным умникам
и легко быть философами, выучась наизусть три
слова: бог так сотворил, и сие дая в ответ
вместо всех причин».
И великий материалист Ломоносов
стремится найти подлинные причины всего, что
происходит в бесконечно многообразном и
бесконечно изменяющемся мире.
«Доказано мною прежде сего, что элементарный
огнь аристотельский или, по новых ученых
штилю, теплотворная особливая материя,
которая, из тела в тело переходя и странствуя,
скитается без всякой малейшей вероятной причины,
есть один только вымысел».
Гордость звучит в этих словах
Ломоносова и эта гордость вполне оправдана. Он
создал по существу новый принцип —
химической атомистики. Он первым ввел понятие
молекулы (корпускулы), отличая это
понятие от атома (элемента). Он первым в мире
понял подлинную природу теплоты и
доказал, что она определяется «внутренним
движением частиц, тела составляющих». Им
установлен великий закон природы — закон
неуничтожаемое™ материи и движения. В
ясной и отчетливой форме этот закон был
впервые им сформулирован в знаменитом письме
к Леонарду Эйлеру. Он писал своему другу
5 июля 1748 года:
«Все перемены, в натуре случающиеся, такого суть
состояния, что сколько чего у одного тела
отнимется, столько присовокупится к другому,
так, ежели где убудет несколько материи, то
умножится в другом месте... Сей всеобщий
естественный закон простирается и в самые привила
движения; ибо тело движущее своею силою
другое, столько же оныя у себя теряет, сколько
сообщает другому, которое от него движение
получает».
Много лет посвятил Ломоносов
разработке и доказательству закона сохранения.
В отчете за 1756 год об опытах, проведенных
им в Химической лаборатории, Ломоносов
сообщает о результатах экспериментальной
проверки закона сохранения материи:
«Деланы опыты в заплавленных накрепко
стеклянных сосудах, чтобы исследовать: прибывает ли
вес металла от чистого жару. Оными опытами
нашлось, что славного Роберта Бойля мнение
ложно, ибо без пропущения внешнего воздуха вес
сожженного металла остается в одной мере».
Закон Ломоносова — истинный закон
природы, стал той основой, которая
объединила различные, разделенные до его
открытия области познания природы и прежде
всего химию — учение о веществе и физику —
учение о движении.
Первый в истории шаг в этом
направлении принадлежит самому Ломоносову. Он
положил начало преобразованию науки и в
первую очередь химии, «ближайшей служи-
29
тельницы и наперсницы натуры, в самые
сокровенные чертоги ее вход имеющей».
Он вводит в химию весы, как основной
метод исследования. Он первый сознает
отчетливо значение чистого вещества:
«Нужные и в химических трудах употребительные
материи сперва со всяким старанием вычистить,
чтобы в них никакого постороннего примесу не
было, от которого в других действах обман быть
может».
Одним из первых он применяет в химии
микроскоп и выполняет микрохимические
исследования. Он установил понятие о
скорости химических реакций. По удачному
выражению биографа, Ломоносов ввел в химию не
только весы, «но м часы.
На здании первого научного института,
созданного советской страной сразу после
революции — института физической химии
им. Карпова, начертаны слова Ломоносова:
«Бесполезны тому очи, кто желает видеть
внутренность вещи, лишаясь рук к отверстию оной.
Бесполезны тому руки, кто к рассмотрению
открытых вещей очей не имеет. Химия руками,
математика очами физическими по
справедливости назваться может».
Эти слова передают глубокую идею о
единстве наук, познающих мир. И вершиной
научного творчества Ломоносова стала
созданная им новая наука — синтез физики и
химии, преобразованных «законом
сохранения»,— физическая химия.
«Моя химия — физическая» — говорил
сам Ломоносов.
VIII
Оба они были неправы, наши славные
современники, горячо любившие
Ломоносова, ученый-поэт и ученый-классик, чьи
суждения были приведены выше. Изучая
Ломоносова, они невольно наделяли его своими
собственными чертами.
Ломоносов сложен и многогранен, един
и полон противоречий. Но он прежде всего
ученый и принадлежит он прежде всего
созданной им новой науке — физической химии.
Чтобы понять Ломоносова, неустанного
борца и искателя истины, нельзя отрываться
от жизни Ломоносова-человека. И тогда
раскрывается трагическая сторона его образа.
Он был одинок. Его гений опередил на
столетия своих современников и, кроме
неустанного стремления к познанию мира,
второй движущей его силой была горячая
любовь к родине и людям.
Очень много должен был успеть сделать
Ломоносов — гениальный ученый, а груз,
ложившийся на плечи человека, был непосилен.
В том и заключалась трагедия Ломоносова,
что для него было недостаточно найти
истину, ее нужно было передать людям и
заставить ее людям служить. И он должен
совместить в себе множество разных и
несовместимых жизней. Он создает новую науку.
Находит ее теоретические основы (что уже
требует всей жизни человека!) и сам
разрабатывает ее практические применения: физи-
ко-химик становится металлургом, геологом,
географом, метеорологом. Ученый становится
и инженером, и художником, и поэтом, и
филологом, чтобы передать истину людям.
Трагедия Ломоносова и в том, что он понимает —
некому воспринять знания. И он настойчиво
добивается создания университета, с тем
чтобы могла «собственных Платонов и
быстрых разумом Невтонов Российская земля
рождать».
Трагедия Ломоносова — это трагедия
гения, ограниченного человеческими силами в
воплощении своих идей. \
Существует мнение, что идеи
Ломоносова якобы не оказали влияния на
последующее развитие мировой науки, что его
открытия остались неизвестными и были забыты.
Это не более как легенда, но она усиливает
трагический облик Ломоносова.
Он сыграл выдающуюся и признанную
роль в развитии науки. Его работы были
достаточно широко известны за пределами
России. Он переписывался с крупнейшими
учеными других стран и был избран членом
Шведской и Болонской академий наук. Но нельзя
забывать, что далеко не все в творчестве
гения было понятно и доступно его
современникам.
Прекрасен образ нашего великого предка.
Через столетия доносится к нам его добрый,
приветливый и дружеский голос:
«Веселитесь, места ненаселенные, красуйтесь, пустыни
непроходные: приближается благополучие eawt.
Умножаются очевидно племена и народы и
поспешнее прежнего расп рост роняются', скоро
украсят вас великие героды и обильные села; вместо
вояния зверей диких наполнится пространство
ваше гласом веселящегося человека и вместо
терния пшеницей покроется. Но тогда великой
участнице в населении вашем, химии,
возблагодарить не забудьте, которая ничего иного от
вас не пожелает, как прилежного в ней
упражнения, к вящему самих вас украшению и
обогащению».
Это — пророческие слова. Они обращены
к нам и звучат заветом нашему времени.
Завет этот будет выполнен.
30
*_Jt&mrte &<м&иж&шпы & Q//C. Q/д. ОУС&
aaicue&aoe
В глубине архивов давно исчезнувших учреждений
и канцелярий Российской империи историки до сих пор
находят документы о жизни и деятельности великих
ученых, поэтов, художников, изобретателей.
В прошлом году иаучиый сотрудник Центрального
Государственного архива древних актов Т. С. Иванова
отыскала четыре неизвестных ранее документа,
связанных с жизнью и деятельностью М. Б. Ломоносова.
Под тремя из них стоит подпись великого ученого.
Большой интерес представляет «Известие... о
произведении анализов серебряных руд, представленных
рудоискателем Иваном Зубаревым».
В середине XVIII века бурно развивалась
металлургия. Самые разные люди бросались на поиски руд.
Некоторые из них стремились получить привилегию на
строительство завода любой ценой... Документ,
который мы воспроизводим, рассказывает об одном из
таких случаев;
иаоис/штелелб
В Кабинет ее императорского величества
известие.
Присланных мне для пробования
сибирский руды пробованы в Химической
лаборатории, таким образом: понеже велено было
оныя пробы учинить в присутствии онаго
Зубарева, к чему он нарочитое время не
холил и, наконец, по неоднократному моему
требованию приходил во оную лабораториу
времянно, иногда и без меня, ибо мне
беспрестанно при пробах быть за другими
делами нельзя.
Оныя пробы отданы при репорте в
Академическую канцелярию, как то из моего
репорта явствует, но после уведомясь, что по
пробам в Монетной канцелярии в помянутых
рудах серебра не явилось, пробовал самую
богатую № 29 и серебра в ней не нашлось
ничего. А досталъныя буду пробовать и что
явитца, репортовать буду.
Советник Михайло ЛОМОНОСОВ
16 майя 1752 года.
А,
;|Д4*< i»€$£q«rt*t iXiUmfbacH Лв&рсхшу,
mk Mfc*|£ttrot<*. muul. н€щш&, и на ис&ир
Ж Med ~Шжя£пп&мш **Ш тф$1<ЫЛ C&utJ*
iCctitfem» %&М$ж f£mfvt№i яххстш'&тк, h»tu>$
31
А под этим документом подписи М. Б.
Ломоносова нет... Это — письмо президента Академии наук
петербургскому губернатору. Какая яркая
характеристика порядков и нравов, царивших в Академии в
те годы!
Строжайший регламент ограничивал действия
ученых. Никто из них не имел права выехать нз Петер-
Сиятельнейший князь, государь мой,
князь Михаила Михайлович!
Вашего сиятельства почтеннейшее письмо
от 23 февраля через советника господина
Ломоносова я получил исправно. Помянутаго
советника нужды довольно справедливы, для
которых он позволения просил от
Канцелярии Академической в Москву отъехать, одна-
бурга без особого разрешения президента.' «Господин
советник Ломоносов» нарушил установленное правило,
попросив разрешения на поездку в Москву не там, где
положено по «Регламенту»...
Это событие и обсуждают в своей переписке два
высокопоставленных вельможи.
Зловещий и смешной документ...
ко ж Канцелярии академической я предосу-
дить не могу, что она без моего ведома
отпустить его не могла, и господин Ломоносов,
ежели бы в надлежащее время, которое он,
не знаю для чего, пропустил, отозвался в
Канцелярию доношением, то бы довольно
мог успеть и из Москвы от меня позволение
получить, вместо того, что он, оставя Регла-
ta.cfS&j$mTH owmXcnmx и^Ггялл MHQt**A& CAtfjotttr* Hi,onja,mtiu
У" , ft
ие хотппАЛ 0c-mcLQtum.iL.. апйяъл йсы&.м$^шшАУФхн тГщниХщ
са йшктиннАтттгшиним стшшикшМ1^С(@1 оmchji' дуг* тавлшг
CK&1&
nev/ieA
32
мент академической и команду надлежащую,
просил о том в Канторе правительствующего
Сената. Я же вашему сиятельству доношу,
что хотя из Канторы правительствующего
Сената и прислан указ Ея Императорского
величества, которым в силе Генерального
Регламента 10 главы моя инструкция,
оставленная Канцелярии, в рассуждении
отлучки подчиненных, отрешается, однакож для
впредь случиться могущей оказии, прошу
принять в рассуждение Регламент
академической 1747 года июля 24 дня,
конфирмованный собственноручным подписанием ея
императорского величества, которым
повелевается в 11-м пункте, всеми подчиненными
академическими управлять и повелевать
одному только президенту, которому в своих
распорядках быть по прикладу других
европейских государств в единственной протекции и
ведении ея императорского величества, а под
правлением предизентским, который указы
именем ея императорского величества давать
профессорам должен. А в небытностъ
президента, Канцелярия президентскую должность
отправляет. И так, Канцелярии
Академической я не усматриваю в том напрасного
затруднения, учиненного советнику
Ломоносову. Но она, как скоро он, советник, доношени-
ем в Канцелярию отозвался, репортовала мне,
и я, видя его справедливую нужду и
позволить ему намерен был. Почему же он сам,
упоздавши, просил мимо точной команды в
Канторе правительствующего Сената, и
почему моя данная инструкция в силе имянного
ея императорского величества указа в
Регламенте академическом изображенного
Конторою правительствующего Сената отрешена,
того я не вижу.
Того ради, прошу дабы и другие профес-
соры временем и никакой нужды не имеющие,
но для прихоти отлучиться желающие, под
каким нибудь претекстом ваше сиятельство не
утруждали, впредь их отсылать к их точной
команде в Канцелярию, где они управляются
особенным регламентом за собственно ручною
высочайшею конфирмациею Ея
Императорского величества Академии данным, ибо сверх
всего вышепомянутаго в 20-м пункте
Академического Регламента изображено, что все
академики, хотя бы о домашнем своем деле, не
токмо до должности их касающемся, нужду
имели, должны репортами отзываться к
президенту, а в небытностъ его,— к Канцелярии,
дабы они сами собою ни в какия приказныя
сношения ни с какими коллегиями и
другими местами не вступали.
Сие вашему сиятельству не в ином
намерении надежду принимаю писать, как токмо
уведомить ваше сиятельство, что те, которые
докладывают вашему сиятельству, не припо-
мянули, что моя инструкция в Академии на
основании Регламента Академического в
рассуждении отпусков и других многих случаев
не согласующаго с Генеральным Регламентом
оставлена в Канцелярии, но как оный
Регламент Академии высочайше конфирмован, так
и мое по нем исполнение по обстоятельствам
произведения наук отправляется.
Я по особливому моему к вашему
сиятельству почтению и дружбе не хотел
оставить, чтобы о сем не упомянуть партикулярное
прося оное принять только за совершенно
дружеское от меня представление.
Пребываю с особливым почтением вашего
сиятельства, государя моего, послушнейший
слуга граф К. РАЗУМОВСКИЙ.
Москва
Марта 22 дня 1753 года.
ф
3 Химия и Жизнь, № 4
33
^4f
V(
*> *
ИЗ
ТИЧЕСКОГО
ЦАРСТВА-
В СЕМЬЮ
НОВЕННЫХ
ЭММ
Г. МАЛМ
Г. КЛАССЕН
Эти кристаллы тетр а фторида
ксенона (XeF<) были получены
путем нагревания в никелевом
сосуде смеси ксенона и
фтора при температуре 400° С е
течение одного часа
Примерно три года назад новое открытие
потрясло самые основы химии. Было
установлено, что «благородные» газы, всегда
считавшиеся химически инертными, способны вступать
в реакции <и образовывать соединения. В этом было
что-то разочаровывавшее: благородные газы
перешли из своего экзотического цаосгва в семью
остальных химических элементов.
Для химиков это было соль же неожиданно,
как для физиков — крушение закона сохранения
четности: ведь химическая теория и лабораторные
эксперименты до сих пор подтверждали, что
благородные газы не могут соединяться с другими
элементами. И тем не менее в 1962 году эта истина была
опровергнута. А вскоре оказалось, что соединения
благородных газов получать вовсе не так уже трудно.
Неорганики, используя мощные методы
современной химии, немедленно приступили к
исследованию этого явления. Меньше чем через год
состоялась международная конференция по химии
благородных газов. Собралось более 40 исследователей
из 30 институтов нескольких стран. А к настоящему
времени опубликованы сообщения более чем о ста
исследованиях по химии благородных газов.
Пожалуй, никогда за столь короткий срок ученые не
накапливали подобный объем информации о каком-
либо классе соединений. Например, о .химии
ксенона, одного из благородных газов, мы теперь знаем
больше, чем о многих гораздо более
распространенных элементах.
Новые соединения, несомненно, найдут самое
разнообразное применение. Некоторые направления
ясны уже и сейчас. Но еще важнее то
обстоятельство, что химия благородных газов может пролить
свет на «природу химической связи.
ПРИМЕСЬ БОЛЕЕ
ТЯЖЕЛОГО ГАЗА...
Свидетельство того, что инертный газ может
существовать в природе, было впервые получено
английским химиком Генри Кавендишем. В 17В5 году
он химическим способом удалил из воздуха
кислород и азот и обнаружил, что в сосуде еще остается
около 1 % первоначального воздуха. Но никакие
известные Кав&ндишу химические методы не помогли
ему выделить и опознать оставшийся в сосуде газ.
Столетие спустя лорд Рэлей приблизился к тому
же препятствию с другой стороны. Измеряя
плотности различных веществ, чтобы проверить гипотезу,
говорящую, что все элементы сложены из атомов
водорода, Рэлей обнаружил: азот, который он
выделял из воздуха, всегда несколько тяжелее, чем азот,
полученный из аммиака. Рэлей предположил:
«Атмосферный азот содержит примесь какого-то более
тяжелого газа». Вместе с шотландским химиком
Уильямом Рамзаем он занялся выделением этого не-
3* 35
Шесть химических зле- yL.
ментов, известных под **
общим
наименованием «инертных газов»,
находящихся в нулевой
группе периодичесиой
системы, были открыты
позже большинства
других элементов.
Благодаря своей химической не-
деятельиости, инертные
газы нашли весьма
широкое применение во
многих отраслях науки и
техники. Инертными
газами интересуются
теперь физики и химики,
металлурги и медики,
биологи и геологи,
представители многих других
профессий.
Но вернемся к истории.
Существование
инертных газов предсказал в
80-х годах прошлого
столетия видный русский
ученый и революционер
Н. А. Морозов. В книге
«Периодические системы
строения вещества» Н. А.
Морозов, анализируя
систему строения
органических веществ, писал, что
в органических веществах
переход между
соединениями с резко
противоположными свойствами
совершается через
вещества с пассивными
(инертными) свойствами. Он
пришел к выводу, что в
периодической системе
элементов переход от
активнейших галогенов с
наиболее выраженными
элеитроотрицательным и
свойствами к
электроположительным щелочным
металлам должен
происходить через элементы
инертные. Эти вещества
должны быть
газообразными,— считал Морозов.
В той части
периодической системы элементов,
где сейчас находятся
гелий, неон, аргон,
криптон, ксенон и радон, он
поставил числа 4, 20, 40*
82 и т. д.—
предполагаемые атомные веса
недостающих элементов.
Создатель
периодического заиона Д. И.
Менделеев не был знаком с
книгой Н. А. Морозова, и
до открытия инертных
газов нулевой группы в
его системе не
существовало.
Открытие аргона и
гелия столкнуло
периодический закон с большими
трудностями. Возник
вопрос о размещении
новых элементов в
периодической системе.
Принцип периодического
повторения свойств
элементов не мог допустить
существования только
аргона и гелия. Поместив
гелий между водородом
и литием, а аргон —
между хлором и калием,
известного газа. Длительная кропотливая работа увенчалась успехом. Рамзаю
удалось отделить азот и получить небольшое количество таинственного газа. Он
воздействовал на этот газ электрическим разрядом, и анализ спектральных
линий показал, что экспериментатору удалось обнаружить новый элемент.
НОВАЯ КОЛОНКА
В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
Рзлей и Рамзай дали этому элементу имя «аргон», от греческого °рТо€ —
«неактивный», потому что газ отказывался проявлять какую-либо химическую
активность. Решить вопрос, где же он должен стоять в периодической системе,
было не так просто: там не было свободных мест для элемента с таким
атомным весом. Рамзай решил, что в таблицу нужно добавить новую колонку, куда
аргон войдет как элемент, обладающий нулевой валентностью. Это означало,
что другие «обитатели» этой колонки, ложа еще не открытые, тоже должны быть
инертными. Рамзай считал, что некоторыми из них являются газы, в исчезающе
малых количествах присутствующие в воздухе. В результате упорного труда ему
вместе с Морисом Трэйверсом удалось обнаружить в воздухе чрезвычайно
редкие газы—неон, криптон и ксенон.
Впоследствии он обнаружил в скальных породах еще один инертный газ
гелий (спектральные линии гелия были 30-ю годами раньше найдены в спектре
Солнца). Новая группа элементов была до конца «укомплектована» в 1900 году,
когда открыли радон, газ, выделяющийся при радиоактивном распаде радия. За
открытие инертных газов Рамзай и Рэлей были в 1904 году удостоены
Нобелевских премий.
Группа из шести элементов — гелий, неон, аргон, криптон, ксенон и радон
получила название «благородных газов», так как они отказывались вступать в
химические взаимодействия.
Некоторые из них удавалось улавливать в соединения, называемые клатрат-
ными: атомы инертного элемента задерживались в кристаллической решетке
этих соединений. Однако в данном случае нельзя было говорить об истинной
химической связи.
Как известно, химическая связь создается в результате лерехода электрона
одного атома к другому или когда атомы делят электроны между собой.
Инертные газы занимали особое положение, так как у них внешняя электронная
оболочка состоит из 8 электронов. Считалось, что такая оболочка «заполнена», к ней
нельзя добавить ни одного электрона, а оторвать от нее .какой-нибудь электрон
исключительно трудно.
Таким образом, школьной аксиомой стало утверждение: благородные газы
не могут вступать в химическую связь, их атомы не способны ни отдарать, ни
принимать электроны.
Несколько химиков-теоретиков, особенно Лайнус Полинг, высказывали
(предположение, что благородные элементы можно заставить войти в химическое
соединение с такими черезвычайно активными элементами, как фтор. Полинг в
1933 г. даже назвал формулы некоторых возможных соединений: гексафторид
криптона (KrFe), гексафторид ксенона (XeFe), «перксенаты» (такие, как Н4Хе06).
Он считал, что протяженности связей и возможные расположения атомов
позволяют образовывать такие соединения.
Несколько химиков принялись за проверку этого предположения и
попытались провести реакции благородных газов с фтором или хлором. Но первые
попытки кончились неудачей. И снова химики склонились к выводу, что
благородные газы действительно лишены какой бы то ии было химической активности...
36
ПЕРВОЕ СОЕДИНЕНИЕ БЛАГОРОДНОГО ГАЗА
Первое химическое соединение, в состав которого вошел благородный газ,
ученые ^получили в 1962 г.
Этот успех, как и открытие самих благородных газов, был достигнут не в
результате прямого научного поиска. Он был побочным при исследовании,
направленном на решение совсем иной задачи.
Отправной точкой этого исследования -был газообразный гексафторид
урана — вещество, игравшее важнейшую роль лри выделении расщепляющегося
урана-235, который требуется для создания атомных реакторов. После войны
группа исследователей в США во главе с Бернардом Вайнстоком занялась
изучением химии гексафторидов. Она получила ряд интересных соединений,
родственных гексафторид у урана: гекс а фториды платины, рутения и родия. Эти газы
обладали высокой химической активностью, давали богатый материал для
лабораторных экспериментов.
Сотрудник Колумбийского университета Нейл Бартлет, экспериментируя с
гексафторидом >платины, обнаружил, что этот газ может образовывать несколько
необычные соединения. Он и Д. Ломан провели реакцию гексафторида
платины с кислородом. Они пришли к выводу, что эти вещества реагируют в
соотношении один к одному: одна молекула кислорода «а одну молекулу
гексафторида. Молекулы соединялись ионной связью. Это означало, что во вновь
"получившемся 'Соединении молекула кислорода становилась положительным ионом, а
молекула гексафторида платины — отрицательным. Соединение 'имело вид
02+(PtF6)-.
Примечательной особенностью реакции было то, что ионизировалась
молекула кислорода.
Обычно молекула кислорода очень прочно удерживает свои электроны,
оторвать от нее электрон чрезвычайно трудно: шрежде никогда не удавалось
встречаться с положительным ионом молекулярного кислорода как с частью
устойчивого соединения. А гексафторид л л а тины легко ионизировал молекулу
кислорода при комнатной температуре.
Следовательно, гексафторид обладал способностью очень мощно
воздействовать на электроны.
Бартлет <провел аналогию. Он вспомнил, что сопротивление отрыву
электронов у молекулы кислорода почти такое же, как у благородного газа ксенона.
Значит, если гексафторид платины может оторвать электрон от молекулы
кислорода, то возможно, он способен лроделать то же самое с атомом ксенона.
А если так, то атом ксенона вступит в химическое соединение с гексафторидом,
образуя с ним ионную связь...
Ученый поставил эксперимент. В стеклянном сосуде находились
гексафторид платины ('пары темно-красного цвета) и газ ксенон. Они разделялись
стеклянной диафрагмой. Когда диафрагму убрали, газы смешались, мгновенно
вступили в реакцию и образовали желтый порошок.
Сомнений не было: газы соединились в новое вещество, гексафторид
платины и ксенон исчезли. Бартлет думал, что он получил Xe+(PtFe)- — вещество,
аналогичное 02+(PtFe)~. Но позднее выяснилось, что формула имеет более
сложный вид.
СОЕДИНЕНИЯ МНОЖАТСЯ
Сообщение Бартлета о его эксперименте вызвало живой интерес. В Аргон-
нской лаборатории, на родине гексафторида ллатины, мы вскоре убедились, что
реакция ксенона с этим веществом действительно идет, и обнаружили
дополнительно, что ксенон может вступать в реакцию и с гексафторидом рутения. Од-
Уильям Рамзай
предположил, что недостающие
Элементы должны быть
аналогами аргона и гелия
и обладать сходными
свойствами. Иными
словами, это должны быть
более тяжелые инертные
газы... Действительно, в
1897 — 1898 гг. были
открыты неон, криптон и
ксекон. Последний
элемент из группы инертных
газов — радон был
обнаружен в 1900 г.— в
спектре газов, находившихся
в ампуле с радием.
В 1900 г. в Лондоне
произошла встреча
Менделеева с Рамзаем. Оба
ученых пришли к
убеждению, что в периодической
системе элементов
необходимо создать нулевую
группу. Д. И. Менделеев
писал по этому поводу:
«Это было своего рода
испытание теоретической
стороны периодического
закона. Испытание было
выдержано с успехом...
П ериодическая
законность, нимало не
нарушаясь, оказалась удовле-
творя ющей и аргонн ым
элементам. Эти элементы
по величине их атомных
весов заняли точное
место м ежду га л ои дам и и
щелочными металлами».
На протяжении многих
лет среди химиков
существовало представление,
что элементы нулевой
группы периодической
системы в химическом
отношении совершенно
недеятельны.
Первые попытки
получения химических
соединений инертных газов
предпринимались, по
сути дела, вслепую, так как
в тот период теория
химической связи
находилась в зачаточном
состоянии. (В дальнейшем
эти исследования
послужили основой для
построения теории ионной
связи.)
Сущность первых
экспериментов сводилась к
тому, что инертные газы
подвергались действию
наиболее сильных
окислителей. Однако даже с
такими мощными
реагентами, как кислород, хлор
или фтор, ни при
обычных, ни при очень
высоких или низких
температурах, ни даже под
действием электрического
разряда положительных
результатов получить не
удалось. Гримм и Герц-
фельд в 1923 г.
вычислили теплоту образования
«возможных» окислов и
галогенидов инертных
газов и нашли, что во всех
случаях эти соединения
должны быть сильно зн-
дотермичными и при
образовании поглощать
сотни килокалорий на
грамм-молекулу. Попытки
найти молекулы
инертных газов привели к
обнаружению ионизирован-
37
ных молекул гелия и
неона ine2r и ft^Vb воз-
нинающих в процессе
электрического разряда.
по существует еще один
тип соединении, в
котором молекулы одного
типа как бы «включены» в
молекулы (или в
кристаллическую решетку)
другого вещества. Ь таких
«молекулярных
соединениях» связь между
отдельными частицами
обусловлена только ван-
нер-ваальсовыми силами.
первое соединение
одного из инертных газов —
аргона, относящееся к
этому типу, было
получено в 1896 г.
французским физиком Н. Виия-
ром, который сжимал
аргон до 15U атмосфер при
О С. Вийяр определил
упругость диссоциации
гидрата аргона при двух
температурах и нашел ее
равной 150 ат при О9 С и
210 ат при Ь С. намного
позже, в 1923 — 1925 гг.,
Р. Форкран тем же
методом синтезировал
гидраты криптона и ксенона,
которые оказались
значительно устойчивее
гидрата аргона. Таким
образом, гидраты были
получены только для трех
инертных газов, а для
остальных — радона,
неона и гелия — они
оставались неизвестными.
Открытие этих гидратов,
которые бесспорно
доказывали реальность
существования каких-то
соединений инертных
газов, весьма долго
оставалось для многих
непонятным и удивительным.
Некоторую ясность в
этот вопрос внесли
исследования советского
химика Б. А. Никитина по
химии радона и других
инертных газов,
проведенные в период с 1935
по 1952 г.
Несмотря иа то, что
число известных
молекулярных соединений
довольно велико, теория их
была почти не
разработана. Продолжая работы по
изучению законов сокри-
сталлизации, начатые им
еще под руководством
В. Г. Хлопина,
основоположника исследований
радия в нашей стране»
Б. А. Никитин
разработал метод изоморфного
соосаждеиия, при
котором не требуется
создавать большие давления
газов, так как истинно
изоморфные вещества
способны образовывать
смешанные кристаллы
при любой концентрации
компонентов» Никитину
впервые удалось
получить кристаллогидраты
радона и иеона. Он
выделил соединения Аг -
ЗОНОЙ, Rn . 3CIC6H4OH и
Хе • ЗС6Н5ОН, а также
соединения аргона, криптона
и ксенона с хинолином.
Основываясь на химиче-
I
нако оставалось неясным одно. Судя по количествам взятых веществ,
гексафторид рутения вступал в реакцию с ксеноном в соотношении три молекулы гекса-
фторида <на один атом ксенона. Следовательно, эта реакция шла иначе, чем
реакция с кислородом, где одна молекула гексафторида соединялась с одной
молекулой кислорода.
Похоже было, что ксенон соединялся не со всей молекулой гексафторида,
а только с фтором, образуя фторид ксенона. Иными словами, гексафторид
получался в результате фторирования ксенона.
Поэтому мы продолжили эксперименты, пытаясь заставить ксенон
-прореагировать непосредственно с самим фтором. Смесь фтора и ксенона '(пять частей
фтора на одну часть ксенона) нагревалась в никелевом сосуде до
температуры 400° С, а затем быстро охлаждалась. При комнатной температуре твердое
белое вещество — продукт реакции — за несколько минут .превращался в крупные,
красивые кристаллы. При помощи обычных взвешивания и химического анализа
мы установили, что полученное вещество было тетрафторидом ксенона (XeF4).
В ходе реакции расходовался весь ксенон, а газообразный фтор оставался в
избытке.
Вскоре в Аргоннской и других лабораториях примерно таким же методом
были .получены дифторид и гексафторид ксенона (XeF2 и XeF6). Были испытаны
и другие способы получения фторидов ксенона с использованием не нагрева,
а электрического разряда и ионизирующей радиации. Роль фторирующих
агентов могли играть и некоторые устойчивые соединения фтора, а не только фтор;
требовалось только какими-либо средствами—воздействием тепла или
электрическим разрядом — отделить атом фтора, чтобы он мог вступить в реакцию
с ксеноном.
Так, ксенон можно заставить вступить в химическую реакцию, нагревая его
вместе с фтором в никелевом сосуде или пропуская смесь по нагретой
никелевой трубке.
Успехи экспериментов с ксеноном побудили исследователей .пытаться
.получить соединения и других благородных газов. Радон, у которого потенциал
ионизации меньше, чем у ксенона, должен был бы реагировать с фтором еще более
охотно, он мог бы даже образовывать соединения с хлором. К сожалению,
интенсивная радиоактивность радона — существенное препятствие для проведения
химических экспериментов.
Самый долгоживущий изотоп радона имеет период полураспада всего около
4 дней. Крайне небольшим количеством радона—не более одной миллионной
доли грамма—приходится оперировать с помощью дистанционных
манипуляторов, вынесенных за радиационную защиту. Радиоактивное излучение
разрушает химические связи как только они возникают. И все же эксперименты по
нагреву исчезающе малых количеств радона с фтором показали, что образуется
фторид. Правда, не удалось выяснить, какой именно... Сейчас ведутся работы с
более крупными количествами радона.
Получение соединений более легких редких газов — криптона, аргона,
неона и гелия — совсем иная, более трудная задача. Для отрыва электрона от их
атомов нужно затрачивать гораздо больше энергии, чем в случае ксенона, и
любое соединение, которое они дадут, по-видимому, будет неустойчивым при
комнатной температуре. В нескольких лабораториях были 'получены фториды
криптона {KrF2 -и KrF^ при воздействии электрического разряда или ионизирующей
радиации на смесь двух исходных элементов, охлажденных жидким азотом.
Но при комнатной температуре эти соединения распадались на исходные
элементы.
Поэтому химия благородных газов — это, в основном, химия ксенона, по
крайней мере в настоящее время.
Правда, надо сказать, что химическое поведение ксенона и само по себе
представляет исключительный интерес.
38
ХИМИЯ КСЕНОНА
Три фторида ксенона образуются в результате -последовательного
присоединения фтора: ксенон соединяется с фтором, образуя XeF2, затем к
полученному соединению присоединяется еще молекула F2, образуя XeF4, и, наконец,
присоединение еще одной молекулы F2 дает XeFe. Все три соединения .при
обычной температуре представляют собой твердые вещества белого цвета.
Исключение составляет гексафторид ксенона, который желтеет при температуре выше
^2° С. Гексафторид значительно более летуч, >чем два других фторида, -и его
пэры желтого цвета, тогда как пары остальных фторидов бесцветны. В
химическом отношении гексафторид намного активнее своих собратьев.
В таблице приведены некоторые свойства соединений -ксенона и фтора.
Фториды
дифторид ксенона
тетрафторид
ксенона
гексафторид
ксенона
окситеграфторид
ксенона
точка
плавле- i
ния
140
-114
46
-28
О (Я (~
чей о
п ceo о.
3.8
3
28
32
цвет
соединения
белый
белый
белый
(ниже 42° С)
желтый
(выше 42° С)
белый
«
с _
<d аэ
00 О
бес цвет-
бесцветный
желтый
^бесцветный
Все фториды ксенона легко вступают в реакцию с водородом,
восстанавливаясь до элементарного ксенона, а фтор переходит во фтористый водород. Этой
реакцией мы пользовались, чтобы удостовериться, что впервые «полученные нами
три фторида — действительно фториды. Другая интересная реакция, открытая
вскоре,— это реакция гексафторида ксенона с кремнеземом (БЮг). Она идет
так: 2XeF6 + SiOa -*- 2XeOF4 + SiF4. Получающееся соединение ксенона
называется окситетрафторидом ксенона. При комнатной температуре это летучая
жидкость.
Интересный раздел химии фторидов ксенона — их взаимодействие с водой.
Продукты гидролиза Дифторида—ксенон, кислород и фтористый водород.
Однако тетрафторид и гексафторид, реагируя с водой, дают новое «экзотическое»
соедиение: трехокись ксенона (ХеОз); соединение крайне взрывоопасно.
Прежде чем это обстоятельство стало известно, в лабораториях произошло
несколько взрывов. К счастью, ни один не имел серьезных последствий. Теперь
исследователи, работающие с фторидами ксенона, внимательно следят, чтобы
соединения хранились в абсолютно сухом месте, иначе они реагируют с водой и
могут образовать трехокись. В растворе трехокись ксенона устойчива и безопасна,
но она становится взрывоопасной, когда вода испаряется и трехокись
оказывается в сухом, твердом состоянии.
В этом отношении химия ксенона начинает поразительно походить на
химию галогенов (иода, хлора и т. д.), занимающих седьмую колонку в
периодической системе. Исследования, проведенные в связи с этим сходством, показали,
что у соединений как ксенона, так и галогенов есть и другие близкие свойства,
равно как и различия.
ских свойствах инертных
газов и разности
упругости диссоциации их
гидратов, Б. А. Никитин
разработал метод
разделения этих гидратов.
Исследования Б. А.
Никитина в области химии
инертных газов по
оригинальности выполнения
и принципиальному
значению можно назвать
классическими. Но все
же полученные им
соединения инертных газов
нельзя считать истинно
химическими. Дело в том,
что таиие соединения
состоят из
кристаллической решетки основного
вещества (вода, фенол,
хинолин и т. п.), в
пустотах которой находится
газообразная молекула
инертного газа. Соедине.
ния такого типа
называют клатратными или
соединениями включения *.
Молекулы, соединяясь
под действием ван-дер-
ваальсовых сил, образуют
кристаллогидраты и
некоторые виды иомплекс-
ных соединений, иной раз
довольно прочные.
Однако при таком виде связи
электроны не переходят
от одной молекулы к
другой, а остаются в
каждой из них.
Настоящий переворот в
химии инертных газов
произошел летом 1962 г.,
когда америнанскому
химику Н. Бартлету
удалось синтезировать
соединение ксенона с гек-
сафторидом платины.
Перечисленные в статье
Г. Малма и Г. Классе-
на методы получения
фторидов ксенона
связаны с большими
экспериментальными
трудностями. Советские
исследователи В. М. Хуторецкий и
В. А. Шпанский пошли
по другому пути, считая,
что применение таких
жестких условий не
обязательно (учитывая, что
синтез первого
соединения Xe+[PtF«]-
происходил при
непосредственном соединении ксенона
с гексафторидом платины
при комнатной
температуре). В. М. Хуторецкому
и В. А. Шпанскому
унялось синтезировать
дифторид нсенона при
обычной температуре и под
небольшим давлением.
* Подробнее о
соединениях этого типа
рассказывается в статье Р. Г.
Костяновского
«Молекулы соединены без
химической связи — катена-
ны». напечатанной во
втором номере журнала.
39
Реакция протекала с вы- ])£
делением тепла D0— т
50 ккал/моль), а иногда
со взрывом.
К настоящему времени
синтезировано и
довольно подробно изучено
около тридцати
соединений ксенона, криптона и
радона (большинство из
них принадлежит
ксенону, что касается радона,
то известен только его
фторид).
Несмотря на то что
вопрос о строении
соединений инертных газов еще
окончательно не решен,
можно с уверенностью
считать их самыми
обычными химическими
соединениями,
обладающими настоящими
химическими связями.
Постоянно совершенствующаяся
техника эксперимента
весьма вероятно сделает
нас свидетелями
открытия соединений и других
инертных газов: гелия,
аргона и неона.
Б. Г. КРАСИЛЬНИНОВ
КАК БЛАГОРОДНЫЕ ГАЗЫ
ОБРАЗУЮТ ХИМИЧЕСКИЕ СВЯЗИ!
Открытие первых соединений благородных газов заставило химиков
пересмотреть теорию химических связей. Как можно было примирить (существование
этих соединений с представлением о полностью заполненной электронной
оболочке атомов благородных газов? Может быть, эти соединения образовывались
за счет каких-то неизвестных химических связей, какого-то необычного
расположения валентных электронов, обладающих особыми свойствами?
Химики, работавшие в различных лабораториях, исследовали структуру
соединений ксенона разнообразными способами: методом инфракрасной
спектроскопии, рентгеновскими лучами, тучками нейтронов, методом ядерного
магнитного резон ас а и даже с использованием эффекта Мессбауэра. Исследования не
принесли никаких сюрпризов: в химических связях соединений ксенона не было
ничего необычного.
По протяженности связей (расстоянию между атомами, соединенными
химической связью), по прочности и жесткости этих связей, по форме молекул
фториды ксенона были очень сходны со фторидами йода, занимающего
соседнее с ксеноном место в периодической системе.
Как благородные газы образуют химические соединения?
Поскольку в атомах этих элементов внешние оболочки заполнены, они могут
соединяться с другими элементами, только «обобществляя» электроны; связь в
данном случае должна быть скорее ковалентной, чем ионной. В частности, во
фторидах ксенона валентная оболочка, состоящая из электронов, связывающих
атомы, должна содержать больше 8 электронов, вопреки старому
представлению о том, что 8—это максимальное количество для завершенной оболочки.
few
.1|МДм,
Здесь показаны модели
молекул трех соединений ксенона,
построенные на основе
представлений о валентных связях:
а) молекула окситетрафторида
ксенона, 6) молекула трех-
окиси ксенона, в) молекула че-
тырехокиси ксенона
Уже давно известно, что существуют очень устойчивые соединения, в
которых атомы совместно «владеют» двенадцатью электронами. Таков, например,
фторид серы (Sfe). Шесть электронов внешней оболочки атома серы спарены
с электронами шести атомов фтора, образуя устойчивую оболочку из 12
электронов вокруг атома серы.
Из того обстоятельства, что валентная оболочка молекулы тетрафторида
ксенона насчитывает 12 электронов (восемь — от ксенона и четыре—от четырех
атомов фтора), теория валентных связей позволяет сделать еывод, что зта
молекула должна иметь форму октаэдра.
40
Молекула дифторида ксенона должна иметь
форму двух трехгранных пирамид, соединенных
основаниями, причем атом ксенона располагается в
центре, а два атома фтора —в вершинах пирамид.
^Спектроскоп и чески и анализ этих молекул
подтвердил, что их структура именно такова, как <и
предсказывала теория. Разумеется, модель, построенная на
основе теории валентных связей, не должна
полностью успокаивать теоретиков. Это лишь один из
путей изучения химических связей благородных газов.
Другой метод основан на количественных
расчетах электронные орбит молекул. Оба метода дали
близкие результаты при определении структуры
дифторида ксенона и тетрафторида «сенона. Однако
они приводят к различным выводам относительно
геометрии молекулы гексафторида ксенона. Из
расчетов, приведенных по второму методу, следует, что
эта молекула должна представлять собой
симметричный октаэдр; первый метод приводит к
представлению о том, что молекула гексафторида
несимметрична. Спектроскопическим методом это соединение
изучить трудно, ибо оно настолько хим-и чески
-активно, что разрушает приборы, необходимые для
проведения опыта.
Когда удастся окончательно выяснить структуру
молекулы гексафторида ксенона
спектроскопическим (или каким-либо другим) способом —
разрешится и спор между обоими методами.
Так или иначе, благородные газы дали жизнь
новому интересному разделу химии.
Сокращенный перевод
с английского
Б. КОЛТОВОГО
¥ новости отовсюду
НЕВИДИМАЯ ВОЙНА
Многие садоводы заметили, что
стоит внести в землю удобрения,
полученные из морских водорослей, как сразу
же уменьшаются случаи грибковых
заболеваний растений.
Недавно в Канаде был проведен цикл
исследований, подтвердивших эти
сведения. Было установлено, что «активным
началом» в удобрении является
ламинарии — вещество, присутствующее во
многих водорослях. Правда, ламинарии сам
не убивает грибки. Он действует на них
окольным путем.
Почва обычно населена
многочисленными микроорганизмами, для которых
грибницы служат источником углеводов. Но
для нормального развития эти бактерии
нуждаются еще и в ламинарине. Если
добавить его в почву, то бактерии начнут
быстро размножаться, а значит,
одновременно сократится количество Грибков,
в том числе и тех, что вызывают
заболевания растений.
Новое открытие представляет большой
интерес для садоводов и огородников —
оно дает возможность объявить
биологическую войну грибковым заболеваниям
фруктовых деревьев и овощей.
КРОВЛЯ.. НА МЕТРЫ
В Англии разработан новый вид
кровельного материала. Обычные волнистые
плиты из пластмассы имеют один
недостаток — большое количество стыков
между ними уменьшает количество света,
проникающего сквозь кровлю. Новый
материал не разделен на плиты. Это
волнистая полосе из прозрачной
полиэфирной смолы, усиленной стеклопластиком.
Ширина ее — до 3 метров, а длина —
30 метров. Полосу легко смотеть в
рулон и в таком виде доставить на
стройку. При укладке ее разрезают на
куски, равные длиие всей кровли. Нечего
и говорить — это крыша пропускает
больше света, да и стоимость ее укладки
значительно меньше.
ШВЕЙНАЯ МАШИНА
БЕЗ ИГЛЫ И НИТИ
Представьте, что какая-то ткань
подвергнута действию вибрации частотой 30
тысяч колебаний в секунду. В
результате нарушается связь между отдельными
молекулами ее волокон. Если теперь
крепко прижать один к другому два куска
ткани, находящейся в таком
«расшатанном» состоянии, то выбитые из
нормального состояния молекулы одного куска
прочно связываются с молекулами
другого. В результате образуется прочный
шов.
Этот принцип работы без иголки,
нитки и даже без клея положен в основу
конструкции новой английской швейной
машины (фирмы «Омега»), работающей с
помощью ультразвука.
Машина с успехом «сшивает» более
половины существующих тканей из
натуральных волокон и около 90%
синтетических материалов. Она прочно
соединяет и разнородные ткани, например
хлопчатобумажную и нейлоновую.
РЕЗИНА ДЛЯ РЕМОНТА
ДОРОГИ
Трещины на бетонных покрытиях
дорог доставляют немало хлопот: не
успевают заполнить их бетоном или раствором,
как через короткое время они
образуются вновь.
В Англии попробовали применить
новый способ ремонта дорог. Вокруг
трещины удаляется поврежденный бетон —
на глубину 2—4 см и ширину 15—20 см.
Затем в трещину вставляется полоса из
губчатой резины, снабженная
продольными ребрами и усиленная несколькими
металлическими стержнями. После этого
поврежденное место заливают эпоксидной
смолой, к которой добавлен песок.
Благодаря продольным ребрам резиновая
лента прочно удерживается в
затвердевшем растворе. А ее эластичность
компенсирует смещения отдельных участков
полотна дороги.
НОВОСТИ ОТОВСЮДУ Щ.
41
ПАТЕНТЫ ЖИВОЙ ПРИРОДЫ
ON
ПРОБЛЕМЫ И МЕТОДЫ СОВРЕМЕННОЙ НАУКИ
ХИМИЧЕСКАЯ
БИОНИКА:
Кандидат химических наук
А. П. ПУРМАЛЬ
НАДЕЖДЫ И ВОЗМОЖНОСТИ
Особенности зрения лягушки, звуколокационные
устройства летучих мышей, сверхчувствительный
приемник инфракрасного излучения у гремучей змеи,
следящая система и безынерционная связь
двигательного *и зрительного аппаратов богомола — все
это уже широко известные объекты исследования
новой увлекательной науки—бионики.
Основная задача бионики—изучение принципов
работы живой материи и создание на их основе
приборов, аппаратов, машин, новой техники.
Пройдет время, и из наметившихся уже сегодня
отдельных разделов бионики возникнут
самостоятельные науки, скажем, механобионика,
электробионика, бионика общая и техническая, прикладная
бионика и так далее.
Одна из таких дочерних иаук существует уже
сегодня. Это химическая бионика, исследующая на
молекулярном уровне механизм протекания и
регуляции химических процессов в живой клетке. Она
открывает путь к созданию принципиально новой
химической технологии.
Чем же замечательна живая клетка, чему
технолог может научиться у природы, «химический» опыт
которой исчисляется миллионами лет?
СТУПЕНИ ПРОСТЫХ
ПРЕВРАЩЕНИЙ
Клетка — это совершенный химический
комбинат, вызывающий восхищение своей компактностью,
продуктивностью, надежностью. Полторы — две
тысячи реакций протекают одновременно в одном
«реакторе»— клетке. Поразительно не только их число,
но и та высокая скорость, с которой они
совершаются в так называемых ^мягких условиях — при
«комнатной» температуре -и нормальном давлении. Как
резко отличает это микроскопическую клетку от
современного химического производства с его
высокими температурами и давлениями, с возможностью
проводить одновременно всего несколько десятков
реакций!
Попытаемся пояснить на конкретных
иллюстрациях технологическое превосходство
природы-химика.
43
Очень сильный бинокль требуется
человеку, чтобы сравняться в зоркости с
орлом. Но бинокль повышает
разрешающую силу глаза за счет уменьшения
поля зрения, а «кругозор» орла не
ограничен какими-то рамками. Не поможет ли
изучение особенностей органов зрения
пернатых создать принципиально новые
оптические приборы^
ПАТЕНТЫ ЖИВОЙ ПРИРОДЫ
Глаз стрекозы — «кооперативный»
аппарат, составленный из большого числа
приемников света. Ои обеспечивает почти
круговой обзор и позволяет стрекозе
воспринимать и цветное и черно-белое
изображение.
Принцип составления общей картины из
отдельных ее фрагментов уже
используется в электронно-оптических устройствах
Глаз — »то целое собрание нераскрытых
патентов природы. Познание их супит технике
неоценимые возможности.
В астрономических, физических,
химических исследованиях ученый сталкивается с
необходимостью регистрировать сверхслабые
световые потоки. Делается это обычно с
помощью специальных фотоумножителей.
Лучшие образцы таких приборов способны
регистрировать световые потоки в несколько
десятков квант — чувствительность достаточно
высокая. Но чувствительность глаза может
достигать всего двух (!) фотонов — порог,
недостижимый пока для современной аппаратуры.
Чем объясняется такой разрыв в
технических возможностях! Причин тут несколько. Но
вот две главные из них.
Действие фотоумножителей основано на
физическом процессе выбивания квантом
света одного электрона из слоя
фоточувствительного вещества. Появление одного электрона
вызывает нарастающую электронную лавину.
В основе работы глаза лежит принцип
возбуждения квантом света химического
ферментативного процесса. Этот процесс, при
котором один квант света вызывает длинный ряд
химических ферментативных актов и
обеспечивает высокую светочувствительность глаза.
В приборах неизбежно возникает так
называемый «шум» — электроны вырываются из
светочувствительного слоя не только под
действием квантов света» но и «сами по себе».
Причем, чем выше температура этого слоя,
тем больше электронов покидают его, тем
сильнее становится «шум».
Глаз — устройство бесшумовое. Его
работа свободна от подобных помех. Вот почему
инженеры стремятся использовать те
особенности механизма зрения, которые объясняют
его огромную чувствительность и надежность.
М
Ч
О
о.
О
ш
X
ш
<
С
Глаз лягушки замечает только движущиеся предметы.
Детальный анализ принципов его устройства позволил,
по сообщениям зарубежной печати, создать
специальные радарные установки, используемые в аэродромной
и авиационной технике (см. рисунок на стр. 42)
Многие насекомые «видят» предметы по их запаху. Органы
обоняния, расположенные на специальных «антеннах» — усиках,
не только воспринимают запах, но и сообщают о форме
предмета. Чувствительность «живых» приемников запаха — несколько
десятков молекул пахучего вещества в кубическом сантиметре
воздуха. Чувствительность самых совершенных методов
химических и физико-химических анализов—10s—Ю,п молекул в том
же объеме. Огромные аналитические возможности для техники
сверхчистых материалов, для экспресс-анализов смесей веществ,
для систем регулирования и контроля таятся в использовании
запахоанализаторов.
Основным сырьем для промышленности
органического синтеза служат, как известно, нефть и
природный газ. А главная составная часть этого сырья —
насыщенные углеводороды, соединения, которые в
недалеком еще прошлом называли «химическими
мертвецами». Название это они заслужили за
трудность превращения в более реакционнеспособные
классы соединений.
Сейчас считается, что наиболее рациональный
способ переработки насыщенных углеводородов —
прямое окисление их в ценные
кислородсодержащие продукты: спирты, альдегиды, кетоны, кислоты-
мономеры, растворители, полупродукты для
различных производств. Механизм процесса окисления
практически одинаков для самых разных веществ.
И в нем наиболее трудная стадия, требующая
значительной затраты энергии,— это момент
зарождения свободных радикалов при реакции углеводорода
с молекулой кислорода:
RH+02-*R'-fHO-2.
Свободные радикалы R" и Н02" — реакционно-
способные частицы с ненасыщенными
валентностями — взаимодействуют с исходными и
промежуточными веществами и как бы на своих «плечах» ведут
процесс превращения до конца.
Реакция идет при температуре 200—400° С и
давлении в несколько десятков атмосфер. В этих
режимах к материалам, из которых изготовлены
реакционные емкости, предъявляются повышенные
требования: в продуктах реакции кислота! В сталь для
реакторов приходится вводить специальные
дорогостоящие добавки.
В клетке тоже совершаются процессы
окисления насыщенных углеводородов, но при обычной
€<комнатной» температуре и при нормальном
давлении. В чем тут секрет? Оказывается, в том, что для
превращения углеводорода в кислоту клетка
избрала иной химический путь. В нем вообще отсутствует
реакция взаимодействия RH с 02, о которой шла
речь выше. В колбе -или реакционной колонне
первым промежуточные продуктом, первой «станцией»
на пути окисления является гидроперекись
углеводорода СпН2п + |ОгН. В клетке — ненасыщенный
углеводород СпН2п и образующаяся из него окись
СпН2пО. Дальнейшее превращение углеводорода
в условиях клетки и реакционной колонны можно
проследить на рисунке.
Тут различны не только пути, но и способы
перехода от одного .промежуточного вещества к другому.
В реакционном аппарате они происходят под
действием свободных радикалов; в клетке—под
влиянием биологических катализаторов (ферментов).
Свободные радикалы и ферменты — это два
различных инструмента, при помощи которых выполняется
одна и та же операция: превращение исходных
веществ в продукты реакции. Неудивительно, что и сам
механизм реакции в обоих случаях оказывается ра-
•ным.
Самая главная особенность химических
превращений в клетках —'Многоступенчатость. Показанный
на рисунке путь окисления углеводорода в живой
клетке — всего лишь грубая схема, здесь отмечены-
лишь главные «станции», основные промежуточные
вещества. На самом же деле «аждый отрезок пуп*
складывается из нескольких превращений.
Например, переход от «асыщенного углеводорода СпН2п+2
к ненасыщенному СпН2п состоит из ряда
промежуточных этапов, ускоряемых своими ферментами.
Благодаря такой «дробности» каждого
превращения клетке удается осуществить самые сложные
реакции 'При нормальном давлении и температуре.
Каждое промежуточное превращение
сопровождается незначительным изменением молекулы, не
требующим больших затрат энергии. А мы из
практики знаем, насколько легче и быстрее можно
подняться на 5-й этаж дома по многочисленным
ступеням лестниц, чем штурмовать «короткий» уступ
такой же высоты. На пути окисления углеводорода
в реакционной колонне таким «уступом» служит
реакция образования радикалов R" и НО?" из RH и 02.
46
Таким образом, многоступенчатость химических
превращений плюс набор ферментов для перехода со
ступени на ступень ■— это и есть секрет быстрых
превращений вещества внутри клетки при низких
температурах и давлениях.
НАДЕЖНОСТЬ, УМНОЖЕННАЯ
НА НАДЕЖНОСТЬ
И в клетке и в реакторе химический процесс
идет непрерывно. Он характеризуется определенной
температурой, давлением, концентрациями веществ.
Чтобы режим реакции был постоянен, необходимо
поддерживать постоянство всех этих параметров.
С этой задачей клетка справляется несравненно
лучше, чем автоматические системы регулирования
на химических .предприятиях.
На каких принципах работает заводская система
контроля и регулировки? Повысилась температура
в реакционном аппарате — тут же увеличивается
электрическое напряжение на концах термопары,
введенной в аппарат. Затем электрический сигнал
преобразуется в механический — включается
система охлаждения аппарата или уменьшается скорость
подачи исходных веществ. Сигналом может быть и
другая характеристика режима — давление в
аппарате, прозрачность среды, ее тепло- или
электропроводность.
Но представим себе, что в
контрольно-регулирующей системе нарушился один из электрических
контактов, вышел из строя фотоэлемент,
повредилась изоляция в обмотках электромотора. В
результате— остановка производства, а в худшем случае —
авария.
Клетка >не может себе позволить хотя бы
временного перерыва в химических процессах.
Остановка грозит гибелью. Поэтому
контрольно-регулирующая система клетки абсолютно надежна. И
построена она на иных принципах, более тонких и пока
для нас не осуществимых. В их основе —система
линейно-перекрестных цепей множественных обратных
связей. Что же это за система и как она работает?
Основной сигнальной характеристикой в клетке
является концентрация вещества.
При постоянных внешних условиях скорость
превращения исходного вещества А в конечное П в
присутствии катализатора Е будет тем больше, чем
больше концентрации веществ А и Е и чем выше
активность катализатора. Все эти величины являются
составными частями сигнально-управляющей или
контрольно-регулирующей системы клетки.
Каталитическая активность фермента зависит от
концентрации вещества П. Рост стационарной,
характерной для нормального режима работы
концентрации вещества П тут же понижает активность
ферментной системы: в ферменте уменьшается число
активных точек, с которыми соприкасаются
молекулы исходного вещества. Значит продукт реакции,
вещество Л, способен воздействовать на процесс,
приводящий к его образованию. Вот первая
обратная связь, первый регулирующий механизм
внутриклеточных процессов.
Если по каким-то причинам концентрация
вещества П все же остается ненормально высокой и дело
не может поправить первый механизм регуляции,
вступает в действие второй. Сложным, еще не
выясненным до конца путем, следует сигнал о
замедлении или даже прекращении синтеза фермента,
ускоряющего образование вещества П. Надо
сказать, что в клетке ферменты постоянно
синтезируются и разрушаются (иными словами, клетка сама
снабжает себя катализаторами). В нормальном
режиме скорость их образования и исчезновения
одинакова. Нарушение режима заставляет включиться
дополнительный резервный механизм регуляции —
увеличение или уменьшение скорости синтеза
фермента.
Но клеточная система регулировки не
исчерпывается и этим. Мы только что говорили о
многоступенчатости химического превращения в клетке. Так
вот, тончайший и слаженный механизм регуляции
действует на каждой ступени, на каждой стадии, т. е.
тщательно контролирует каждое звено в цепи
превращений:
Ej E2 Е3
А > В > С > D ...-»... П.
Больше того, есть еще один дополнительный —
контрольный механизм, который следит за всем
процессом и чутко откликается на все изменения в нем.
Активность фермента Et -падает с повышением
концентрации не только вещества В, но и П. Таким
образом, конечный продукт длинной цепи
превращений связан обратной связью с ее первым Звеном.
Отказала одна, две, три системы, регулирующие
отдельные ступени процесса, концентрация
конечного продукта изменилась, и это тут же сказалось
на активности фермента Е1г открывающего цепь.
Так выглядит система регулировки в
изолированной цепи ферментативных превращений.
Конечно, это упрощенная модель. В условиях клетки все
цепи тесно связаны друг с другом, они находятся
под перекрестным регулированием,
координирующим работу совокупности цепей. Но даже сказанное
об одной цепи превращений делает очевидной
огромную надежность внутриклеточной системы
регулирования.
Естественно, что подобная система неразрывно
связана со специфическим многоступенчатым
ферментативным механизмом химических превращений
47
1
.л
се
о
о.
X
с
О
со
X
3
X
Некоторые змеи видят в абсолютной темноте. Они наделены специальными устройствами,
которые воспринимают инфракрасную радиацию — тепловые потоки, излучаемые
теплокровными животными. Самая совершенная аппаратура, созданная человеком, позволяет
регистрировать тепловой поток в Ю-2 кал/час.см2. Чувствительность портативных тепловых прием.
никое з-мен — существенно выше.
4fe
ПАТЕНТЫ ЖИВОЙ ПРИРОДЫ
У рыб и птиц бионических загадок не меньше, чем у насекомых
и змей.
Какой орган и какой механизм взаимодействия с окружающей
средой позволяет птицам уверенно ориентироваться в
воздушном океане? Как находит голубь кратчайший путь к дому, если
он, вылетая из клетки, не знает, где находится — южнее илн
севернее, восточнее или западнее дома? И как отыскивают
«свои» реки и ручьи идущие на нерест рыбы?
В чем секрет такой удивительной «памяти» — ответ пока не
получен. Но, несомненно, раскрытие этих секретов сыграет
огромную роль в вопросах земной, а может быть, и космической
навигации.
...Сегодня в технике с успехом используются
различные звуколокационные устройства. Сколько
возможностей сулит познание природы и
механизма действия портативных и точных локаторов рыб,
способных в своем движении точно повторять
изгибы береговой линии, выбирвть из звуков,
наполняющих морские просторы, слабые сигналы
своих сородичей об опасности!..
Химия и Жизнь, № 4
в клетке. Оторвать одно от другого нельзя. Но,
конечно, сами принципы множественных обратных
связей со временем обязательно будут
использованы на химических заводах.
СЕКРЕТНОЕ ОРУЖИЕ
ФЕРМЕНТОВ
А теперь присмотримся к замечательным
веществам— ферментам, которые руководят
химическими процессами в клетке и обеспечивают систему их
регулирования. Ферменты, один из основных
клеточных секретов, отличаются от катализаторов,
используемых химиками, тремя особенностями. Они
неизмеримо сложнее по химическому строению
благодаря своей белковой природе. Их
каталитическая активность в сотни и тысячи раз больше, чем
у синтетических катализаторов: даже ничтожных
концентраций фермента достаточно, чтобы вести
процесс с нужной скоростью. Наконец, действие
ферментов отличается избирательностью. Из
нескольких сотен превращений, протекающих в
клетке, данный фермент ускоряет лишь один тип, а часто
даже одну реакцию. Специфичность действия
ферментов— свойство, которое позволяет им без помех
работать в условиях одного резервуара — клетки,
содержащего сотни разных веществ.
Интересная особенность наблюдается у
катализаторов, ускоряющих одну и ту же реакцию. Если
катализатор обладает универсальным действием и
способен помимо данной реакции ускорять и
многие другие — он, как правило, отличается малой
активностью. Самым сильным будет тот катализатор,
который может ускорять только данную реакцию.
Значит, с повышением степени избирательности
растет и активность ферментов. С подобным
явлением мы встречаемся и в более простых случаях.
Нож и специализированный деревообрабатывающий
станок выполняют одну и ту же операцию —
резание. Нож — универсальное орудие, с помощью
которого можно сделать художественную резьбу,
выстрогать шахматную фигуру или нарезать хлеб.
Самый простой станок-автомат изготовляет только
одну фигуру и только одного профиля, но делает
это со скоростью, недоступной для ножа даже в
самых искусных руках.
Какие преимущества получим мы, если сумеем
вооружить промышленность катализаторами,
подобными ферментам? Что изменится в характере
химического производства? Но перед тем, как ответить
на этот вопрос, выясним, какие именно реакции
ускоряют ферменты, и представляют ли эти реакции
интерес для заводской технологии.
Любое химическое превращение сводится к
перераспределению химических связей между
атомами. В биохимических процессах, протекающих под
влиянием ферментов, разрушаются и образуются
связи углерода с углеродом (С—С), азотом (С—N),
кислородом {С—О, С = 0), водородом (С—Н) и
серой (С—S); азота, кислорода и серы с водородом
(N—Н, О—Н, S—Н), фосфора с кислородом (Р—О),
серы с серой (S—S) и азота с азотом (N—N). Этим,
в основном, исчерпывается круг биохимических
превращений. Но круг этот настолько широк, что
охватывает большую долю всех химических процессов,
реализуемых сегодня в промышленности.
По-видимому, в будущем ферменты" помогут
нам проводить все эти химические процессы в
«мягких» условиях и в масштабе крупных производств.
Но ферментам свойственно и «ошибаться» — они
могут ускорять процессы, которые в условиях
клетки никогда не протекали. Иногда такие «ошибки»
оказываются очень ценными.
В последние годы широко обсуждается
серьезная проблема — опасность загрязнения мирового
океана синтетическими моющими средствами. Все
отходы химических, нефтяных, бумажных,
текстильных, кожевенных предприятий, остающиеся в недо-
сточно очищенных сточных водах, рано или
поздно «поедаются» различными микроорганизмами.
И только попадание в мировой океан все
возрастающего количества синтетических моющих средств —
процесс необратимый. Ни один микроорганизм не
использует их в пищу. Причина — наличие в этих
соединениях «несъедобной» связи. Но вот
недавно из Японии поступило обнадеживающее
сообщение. Ученые выделили из сои фермент, способный
разорвать эту связь и перевести «неподдающиеся»
соединения в форму, усваиваемую
микроорганизмами. В данном случае речь идет как раз об «ошибке»
фермента и, как уже было сказано, об ошибке,
очень полезной для человека.
Такова лишь одна из интересных возможностей,
которые открывают ферменты перед химической
технологией. А возможности эти чрезвычайно
широки.
Высокая активность биологических катализаторов
позволит перейти на низкотемпературные режимы.
На смену специальным сплавам, устойчивым к
действию химических веществ при повышенных
температурах и давлениях, придет стекло или другие
дешевые материалы. Из них будут изготовлять все
технологическое оборудование.
Но главный экономический эффект будет, по-
видимому, связан с резким упрощением процедур
разделения и очистки веществ. До сих пор основная
стоимость того или иного химического продукта
определяется подчас не затратами на исходное
сырье и его переработку, а стоимостью очистки
промежуточных веществ и конечного продукта. Осо-
50
бенно дорогим получается .производство, если
потребитель предъявляет строгие требования к
чистоте полученного вещества. А такие требования, мы
знаем, звучат все чаще и чаще.
В чем тут могут оказаться полезными ферменты?
Допустим, что в какой-то реакции А + В = С
использованы исходные вещества высшей степени
очистки. И все же продукт реакции С будет
загрязнен примесями. Получится это потому, что
катализатор этой реакции — активный, но не обладающий
избирательностью,— будет ускорять взаимодействие
не только А и В, но и А -и А, В и В, А и С, В и С...
и тем самым способствовать возникновению
примесей.
Если ввести вещество С, не очистив его
предварительно, в реакцию с веществом D, то в
продуктах реакции мы найдем еще больше побочных
веществ. Биологические катализаторы с их высокой
степенью избирательности, специфичностью действия
позволят получить из А и В единственный не
нуждающийся в специальной очистке продукт С.
Те же биокатализаторы так проведут реакцию
образования С из неочищенных А и В, что число
побочных веществ в системе не увеличится. И это
понятно. Побочных продуктов становится тем
больше, чем выше температура, при которой идет
реакция. Низкая температура так замедляет
образование некоторых побочных продуктов, что они
практически не успевают возникнуть, если время
протекания основной реакции невелико. Но это время
зависит от активности катализатора. А о высокой
активности ферментных систем, способных с
большой скоростью проводить реакции при комнатной
температуре, мы уже знаем.
Таким образом, из трех характерных отличий
ферментов от обычных катализаторов (высокие
специфичность и активность, сложность структуры)
два первых — сулят огромные перспективы
химическому производству. Однако, чтобы использовать
биокатализаторы в промышленном масштабе, надо
иметь немалый их запас: десятки и даже сотни
килограмм. Как получить столько ферментов?
Искусственно производить их мы пока не умеем. А в
живой клетке их содержится столь мало, что для
получения нескольких миллиграммов фермента
приходится перерабатывать десятки килограмм животного
и растительного сырья. Например, из 10 килограмм
сердечной мышцы — сырья, особо богатого
ферментом лектикодегидразой,— можно получить лишь
500 мг фермента.
Есть немало и других осложнений. Методы,
которыми пользуются для выделения ферментов
в малых количествах, непригодны для производства
их в больших масштабах. Процесс очистки
получаемых биокатализаторов оказывается чрезвычайно
сложным. И, наконец, >не следует забывать, что и
исходное сырье стоит подчас недешево. Трудно
представить себе даже в отдаленном будущем
крупнотоннажное производство, использующее в
качестве катализатора фермент, выделяемый, например,
из яда кобры.
Наиболее доступные ферменты уже сегодня
поставлены на службу производству. Правда,
используются они пока не в собственно химической
технологии, а в перерабатывающей промышленности.
Но таких ферментов наберется десяток, другой.
А сотни прочих биоускорителей — технологически
чрезвычайно перспективных, но в такой же мере
труднодоступных? Проблема использования их в
химической индустрии, по-видимому, будет решаться
иным путем. Этот путь лежит через моделирование
ферментов.
ВСЛЕД ЗА ПРИРОДОЙ
И ВОПРЕКИ ПРИРОДЕ
Итак, мы выяснили, что мизерного количества
ферментов, получаемого из дорогих и
труднодоступных источников, явно мало, чтобы наладить с их
помощью крупное промышленное производство. Но
оно оказывается вполне достаточным для
всестороннего изучения, направленного на создание моделей
и аналогов этих замечательных соединений. Самой
большой трудностью, которая стоит здесь на пути
исследователей, становится третья особенность
ферментов, о которой тоже шла речь,— чрезвычайная
сложность их структуры.
Однако, несколько лет назад были получены
интересные данные о том, что упрощение структуры
фермента, уменьшение у него — до определенного
предела — длины белковой цепи не сказывается на
его каталитической активности. Например,
последовательным удалением аминокислот удалось
«безнаказанно» уменьшить молекулярный вес фермента
папаина на 70%!
Этот удивительный результат объясняется тем,
что активным центром фермента, то есть местом,
-на котором разыгрывается каталитический процесс,
является какая-то небольшая часть макромолекулы
соединения. А это значит, что не все молекулы
аминокислот в его белковой цепи играют одинаково
важную роль. Например, в белковой цепи цитохро-
ма С — одного из важнейших ускорителей
процессов окисления в клетке -— содержится 16—18
молекул лизина. Но активность фермента связана лишь с
одной из этих молекул.
Значит, если бы химикам удалось
«сконструировать» активный центр фермента, вся остальная
часть молекул для условий работы вне клетки могла
4* 51
бы оказаться лишней. Исследование строения
активного центра ферментов — важное направление в
моделировании этих соединений. Этот путь — от
сложного к простому, от реального .фермента — к
«осколку» катализатора, к его активному центру,
может быть назван аналитическим путем
моделирования.
Другой путь — это путь синтетический. Если
исследователю известны какие-то элементы структуры
активного центра фермента, то путем усложнения
этой структуры и соединения ее с другими
элементами он ищет возможность увеличить ее
каталитическую активность и избирательность.
Движение к заманчивой цели—созданию
практически важных моделей биокатализаторов — идет
как строительство туннеля с двух сторон. Биохимики
исследуют системы более простые, чем реальные
ферменты, «приближаясь к выделению того
минимального участка ферментной молекулы, который
работает как самостоятельная каталитическая
система. Химики исследуют разнообразные катализаторы
из «зоны» неживой природы — металлоорганиче-
ские, полимерные вещества. Сложность изучаемых
и исследуемых систем приближается к сложности
обломков ферментных молекул... Трудно
предугадать, когда «строители», прокладывающие
встречные туннели, встретятся, но встреча эта обязательно
произойдет!
Что можно сказать сегодня о ее координатах?
Какой молекулярный вес, какая характеристика
сложности будет у простых моделей и аналогов
ферментов? До недавнего времени величина эта
оценивалась в шесть — семь тысяч единиц —
довольно мало в сравнении с молекулярными весами
ферментов в сотни тысяч единиц. Цифра 6000—7000
была получена на основе представлений о том, что
взаимодействие ферментов с превращаемыми
веществами не должно деформировать
'пространственную структуру ферментной молекулы. Однако, не
так давно было высказано предположение (и оно
уже нашло некоторое экспериментальное
подтверждение), что в ходе биокаталитического процесса
белковая цепь фермента все же подвергается
локальной деформации в месте контакта с
превращаемым веществом.
Таким 'образом, прежний критерий (устойчивость
молекулярной конфигурации активного центра
фермента), подводивший к критическому
молекулярному весу 6000—7000, может оказаться
завышенным.
А вообще должны ли модели ферментов
остаться белковыми веществами? Почему бы им не
быть, например, углеводами? Ни на тот, ни на
другой вопрос дать категорический ответ сегодня
нельзя. Можно думать, однако, что свойства биока-
52
талитической активности не являются признаками,
неразрывно связанными с белковым характером
молекулы, вероятнее, мы сталкиваемся здесь с
проявлением определенного консерватизма природы. Со
времени возникновения первых белковых комочков,
способных к обмену веществ, из соединений,
которые были «под рукой» в мировом океане {или, как
говорят, в «мировом бульоне»), природа путем
эволюции постоянно совершенствует именно белковые
формы. Но вполне возможно, что, глубже изучив
физико-химическую природу биологического ната-
лиза, мы сумеем создать новые катализаторы
небелковой природы и менее сложной структуры и
широко использовать их в химической технологии
будущего.
кто
pA3rAqAA
ЗАГАС] НЫ
СОЛН Ц А,
В учебнике астрономии для средней школы —
эта книга наверняка есть у вас или у ваших
соседей — вы можете прочесть о том, что источником
солнечной энергии служат «так называемые ядерные
реакции... Эти реакции возможны лишь при
температуре в десятки миллионов градусов. Они приводят к
тому, что водород превращается в гелий, при этом
выделяется огромное количество энергии».
Из учебников для вузов можно узнать, что
процесс синтеза атомов гелия на Солнце носит
название «цикла Бете» — по имени ученого, объяснившего
этот процесс.
Согласно гипотезе Бете, в результате ряда
превращений из четырех атомов водорода образуется
один атом гелия. Но атомный вес водорода равен
1,00В, атомный же вес гелия не 4,032, а ровно 4.
Избыточная масса «исчезает», но одновременно
выделяется эквивалентное количество энергии,
величина которой определяется знаменитой формулой
Эйнштейна Е = тс2.
Поскольку гипотеза Бете опирается на теорию
относительности Эйнштейна, очевидно, что разгадать
загадку Солнца до 1905 года, когда Эйнштейн
впервые опубликовал свою теорию, было невозможно.
Представьте себе мое удивление, когда в книге,
изданной намного раньше — в 1887 году, мне
попалось следующее рассуждение:
«...Материя не может исчезнуть бесследно.
Однако этот закон обнимает только то, что мы
называем весомою матернею...
С другой стороны, закон неисчезаемости энергии
не допускает возможности исчезновения без следа
этой энергии без того, чтобы она не произвела
какой-либо работы... С точки зрения моей гипотезы,
эти два закона получают новое освещение, и даже
между ними появляется некоторая связь...
Если бы мы пожелали суммировать всю энергию
в мире, мы должны были бы сверх кинетической
энергии, проявляющейся в движении масс, в виде
теплоты, света и проч., принять во внимание всю
весомую материю {теперь бы мы предпочли сказать
„все вещество".— С. В.), представляющую, по моим
понятиям, запас кинетической энергии в скрытом
состоянии.
С другой стороны, если бы мы хотели
суммировать всю материю природы, то, кроме материи
весомой, мы должны были бы принять во внимание и
весь эфир, который хотя и не поддается анализу
наших чувств, но который проявляется в виде
света, теплоты и проч. и который представляет
совершенно такую же материю, как и та, которую мы
называем весомою. Из этого легко усмотреть ту 3
связь, которая существует между материей и 3"
энергией. £
Если бы мы имели возможность воспроизвести ^
полное разложение известного количества вещесг- {S
ва..., то весомое вещество в том виде, как мы его U
привыкли представлять теперь, исчезло бы
совершенно, а вместо него появилось бы известное
количество энергии в виде света, теплоты или электри-
чества. Можно было бы сказать, что вещество ис- -g
чезло и превратилось в энергию... ^
Напротив, если бы мы имели возможность произ- F)
вести уплотнение эфира до полного предела,
подобно тому, как это происходит в центре туманности,
мы, так сказать, присутствовали бы при .исчезновении
известного количества... энергии и нарождении
вещества... Отсюда очевидна связь, существующая
между веществом и энергией.
С этой точки зрения вещество может быть
рассматриваемо, как сгущенная энергия и обратно,
энергия, как диссоциированное вещество. Как видит
читатель, моя гипотеза расширяет понятие двух
вышеприведенных законов».
53
ш
21
'Попробуйте прочесть этот отрывок физику. Он
вряд ли усомнится в том, что текст написан
человеком, знакомым с теорией относительности, а
некоторые «несовременные» обороты речи объяснит,
вероятно, несовершенством перевода.
Однако лежавшая передо мной книга не была
переводной — ее написал русский инженер Иван
Осипович Ярковский, написал за 16 лет до появления
знаменитой работы Эйнштейна.
Книгу эту я обнаружил случайно, просматривая
комплекты газет и журналов за вторую половину
прошлого века. В них я наткнулся на несколько
рецензий на книгу Ярковского, рецензий злых,
издевательских— в «Вестнике Опытной Физики и
Элементарной Математики», в «Русском Богатстве», в
«Русской Мысли»... Необыкновенная страстность
нападок на автора книги заставила меня разыскать и
другие его работы.
Иван Осипович Ярковский родился в 1В44 году,
умер в 1902 году.
В 1862 году, по выпуске из Московского
Александровского сиротского кадетского корпуса, он
начинает службу в армии — прапорщиком артиллерии
на Кавказе. В 1870 году Ярковский кончает
Технологический институт в Петербурге и после этого много
лет работает на Московско-Брестской железной
дороге сменным мастером, заведующим вагонными
мастерскими, наконец, заведующим всеми ее
мастерскими.
Круг научных интересов Ярковского очень
широк.
Он публикует статьи по метеорологии,
обрушивается с полемическими брошюрами на ученых,
которые, по его мнению, «увлекаются математическими
теориями» и искажают физическую картину мира,
изобретает «волноход», использующий энергию волн,
проектирует станцию для испытания воздушных
винтов, принимает участие в работе Русского
Технического общества.
Но главным его трудом, которому он отдал
много лет жизни, стала книга «Всемирное тяготение как
следствие образования весомой материи внутри
небесных тел», отрывок из которой приведен выше.
Правда, созданная Ярковским теория
всемирного тяготения была всего лишь одной из
многочисленных безнадежных попыток объяснить тяготение
тем, что все тела испытывают механическое
давление со стороны каких-то частиц. Правда и то, что
автору представлялось самым важным в его книге,
оказалось наименее интересным. Но, с другой
стороны, даже очень крупным ученым далеко не часто
удается высказать столько мыслей и идей,
справедливость которых становится ясной спустя
десятилетия, сколько высказал их в своей книге Ярковский.
К таким идеям, безусловно, относится его
рассуждение о единстве законов сохранения вещества
и энергии.
Подтвердились и более общие соображения
Ярковского, о тесной связи между «рождением»
звезд — процессами, происходящими «в центре
туманности», образованием из «протила», какого-то
очень простого, первичного вещества, всех
химических элементов — и проблемой источника солнечной
и вообще звездной энергии.
Ярковский подробно анализирует метеоритную
гипотезу, объясняющую неугасимость Солнца тем,
что на нем сгорают миллионы тонн метеоритов. Он
не соглашается с этой гипотезой — в околосолнечном
пространстве нет достаточно мощных метеоритных
потоков. Неудовлетворительна, по его мнению, и
гравитационная гипотеза, видящая источник энергии
Солнца и звезд в том, что при сокращении их
объема выделяется много энергии. Отвергает Ярковский
и гипотезу обыкновенного горения на Солнце
каких-то веществ: даже в том случае, если бы Солнце
целиком состояло из кремния, говорит он (а
кремний— это «одно из веществ, дающих при горении
наиболее единиц теплоты»), оно полностью бы
сгорело за две с небольшим тысячи лег.
Разобрав и отвергнув все существовавшие тогда
гипотезы происхождения солнечной энергии, среди
авторов которых были крупнейшие ученые второй
половины прошлого века — такие, например, как
Гельмгольц, или Томсон (лорд Кельвин), Ярковский
предлагает собственное объяснение.
Он пишет: все тела, и тем интенсивней, чем
больше их масса, втягивают, впитывают в себя частицы
мирового эфира, которые при этом уплотняются. Но
при известной степени уплотнения «эфир
превращается в то, что мы называем первичным
веществом, в ту взрывчатую аморфную массу с громадным
запасом скрытой энергии, которая при нарушении
равновесия заставляет это «первичное вещество
распасться и образовать весомую, или химическую,
материю».
Не правда ли, «первичное вещество» Ярковского
напоминает плазму? Но проследим дальше за
ходом его рассуждений.
«По мере увеличения размеров солнца
(Ярковский считал, что все небесные тела до известного
предела увеличиваются в размерах и при этом
разогреваются — С. В.) его поглощательная способность
увеличивается..., а вследствие этого и взрывы
(сопровождающие образование из первичного вещества
химических элементов — С. В.) делаются все чаще
и чаще... и тогда получается громадный шар, на
котором в каждый момент происходит вулканическое
извержение то в том, то в другом месте».
Один из рецензентов упрекнул Ярковского в
том, что его рассуждения о звездах и атомах
напоминают сочинения беллетристов. Однако для того,
чтобы «фантазировать» так, как это делал Ярковский,
нужно было в чем-то главном уловить перспективу
развития науки, которая находилась уже на
подступах к открытию сложности атомов, возможности
превращения одних химических элементов <в другие.
Ученые уже начинали понимать, что в создании и
разложении элементов участвуют какие-то огромные,
еще не известные науке силы.
В несправедливо забытой книге Ивана
Осиповича Ярковского в единый узел сплелись проблемы
химии, космологии и астрофизики. По-видимому, он
был одним из первых, кто попытался развязать этот
трудный узел, который до сих пор еще распутывает
наука.
С ВЛАДИМИРОВ
54
• ПОВАР
НЕВОЛЬНЫЙ
УЧЕНЫЙ
Писатели-фантасты обещают воря уже о том, что эксперимент J/f^ БРАУН
человену будущего рациональное, и наблюдение, методы столь ха-
научно обоснованное питание. Од- рактерные для любой науки, всег- скую лабораторию. Даже в наше
нако людн, знающие толк в еде и да использовались в искусстве время химическое оборудование
знаномые с этими предсказаниями, приготовления пищи. лаборатории пополняется из арсе-
пожалуй, предпочли, чтобы наука Поварское искусство — это пра. нала кухонной утвари. Кухонная
не вмешивалась в поварское искус. родитель всей экспериментальной утварь и впрямь похожа на хими-
ство. Их опасения понятны, но науки. Ведь именно кулинары пре- ческую посуду. И служат та и дру-
просьба — запоздала, поскольку доставили древним алхимикам са- гая одинаковым целям- для изме-
еще в доисторические времена в мое разнообразное оборудование: рения, размалывания, нагревания,
работе «повара» утвердились не- печи, нотлы, ступни, миски и, на- перемешивания.
которые научные принципы, не го- конец, кухню — первую химиче- Сам повар часто и не подозре-
55
вает, что в своем деле он
пользуется научными методами. А между
тем, стряпая, он невольно
затрагивает сферы многих наун: физики,
химии, микробиологии и даже
психологии. Мы расскажем о том, кан
неноторые процессы, изучаемые
этими отраслями знания,
протекают на кухонной плите.
Ни один кулинар не может
обойтись без тепловой обработки пищи.
В его распоряжении — духовка
для нагревания в онислительной
атмосфере, различные сковороды
для нагревания в жире и воде, гер-
метичесние настрюлч, где в инерт.
ной атмосфере пара продукты
подвергаются действию высокой
температуры. Умело используя
тепловую обработку, повар меняет
качество пищи — ее внус, аромат и,
наконец, внешний вид.
В белновых и крахмальных
компонентах пищевых продуктов
происходят при нагревании
изменения, благодаря которым эти
вещества легко усваиваются
организмом человена. Нагревание
разрушает в них стенки отдельных
клеток, и ферменты
пищеварительного сока быстрее достигают своей
цели — молекул белка и крахмала.
Из-за таного разрушения
клеточных струнтур вареные овощи
намного мягче сырых.
Комбинированное действие нагревания и
других факторов помогает также
переводить белок пектин и крахмал
из нерастворимого состояния в
растворимое и тем самым
способствует лучшему усвоению пищи.
Струнтура съестных продуктов,
содержащих большое количество
бел нов, таких нак мясо и рыба,
зависит от денатурации этих
белков и от частичного гидролиза
некоторых из них (денатурация —
это изменение свойств белка под
влиянием внешних условий, а
гидролиз — реакция разложения
водой).
Мясо вырезни содержит очень
мало соединительной ткани.
Поэтому достаточно кратковременного
нагревания, чтобы оно стало
мягким и вкусным. Так готовят,
например, бифштекс «с кровью». В
более жестком мясе
соединительной ткани гораздо больше. В этом
случае требуется более длительное
нагревание для того, чтобы
гидролиз мог пройти глубже и
превратить соединительные ткани в
желатин. Тогда и жесткое мясо ста
новится мягким и нежным.
При нагревании в пище
происходят различные химические
процессы. Например, вкус и аромат
мяса зависят, в основном, от
сложных реакций между особым
сахаром — рибозой и аминокислотами.
На внус и запах жареной пищи
влияет степень окисления. Процесс
гидролиза тоже может сказаться
на запахе и внусе еды. При
гидролизе выделяются некоторые
аминокислоты и компоненты
нуклеиновых кислот, которые хоть и не
имеют собственного запаха и
вкуса, но обладают свойством усили*
вать внусовые качества продуктов.
Аппетитность хорошо
приготовленной вырезни как раз и
обусловлена таким «усилителем» вкуса.
От умения повара полностью
зависят вкус и запах
приготовленных блюд. Например, на Востоне
кулинары издавна пользуются
соком соевых бобов, чтобы усилить
аромат и вкусовые качества мяса.
Совсем недавно повара
европейской кухни добились такого же
эффекта, добавляя к мясу
полученный химиками мононатрийглюта-
мат — активную основу соевого
сока.
Повару приходится учитывать,
что фрукты и овощи при
нагревании часто теряют свой
привлекательный запах, так нак из них
улетучиваются пахучие вещества.
Но иногда нагревание, наоборот,
способствует появлению запаха,
который возникает из-за разложения
некоторых компонентов пищи.
В процессе так называемой на-
рамелизацни Сахаров и крахмала
возникают самые разнообразные
запахи, обусловленные выделением
различных кетокислот и
альдегидов. В других процессах
альдегиды могут танже возникать при
разложении некоторых
аминокислот.
Часто нагревание разрушает се-
русодержащие соединения. При
этом обычно образуются
меркаптаны, а иногда даже свободный
сероводород — основной летучий
компонент, выделяющийся при варке
капусты.
И наконец, нагревание меняет
внешний вид приготовленных блюд.
Причем цвет и объем пищи
далеко не всегда получаются такими,
как хотелось бы повару. Однако,
правильно номбинируя
температуру и продолжительность
приготовления еды, опытный кулинар
умеет свести до минимума
обесцвечивание и «усадку» продуктов.
Часто повар, желая сохранить
зеленый пигмент овощей,
добавляет в их отвар питьевую соду,
хотя это и уменьшает
питательность блюда.
Белый пигмент,
присутствующий в рисе, чрезвычайно
чувствителен к кислотности среды. Как
только среда становится щелочной,
он из белого превращается в
желтый. Традиционная напля
лимонного сока, выжатая в кипящий рис,
создает в отваре нужную
кислотность, и пигмент сохраняет свой
белый цвет.
Опытный повар всегда сумеет
сделать еду красивой. Например,
приятный желтый цвет печенья
объясняется карамелизацией
сахара и взаимодействием между
сахаром и белками. Чтобы
сделать желтый цвет ярче, надо
добавить лишний белок в сахар — для
этого печенье перед выпечкой
сбрызгивают молоком.
Размер выпеченного изделия
тоже зависит от умения повара.
Когда пекут слоеные пирожные,
в тесто добавляют много жира.
Этот жир, смешавшись с мукой,
образует непроницаемые слои,
между которыми возникают
пузырьки пара. Пузырьки, расширяясь,
увеличивают тесто в объеме. При
выпечне увеличенная форма
изделия сохраняется вследствие
денатурации белка муки. Самый
правильный режим выпечки тот, при
котором денатурация идет
одновременно с образованием пузырьков
пара.
...Мы рассказали об основных
химических процессах,
происходящих в пище при нагревании.
Теперь несколько примеров,
затрагивающих сферы других наук.
Как и любой физик, повар
должен уметь контролировать
различные поверхностные явления,
особенно те, которые вызываются
денатурацией белка. В процессе
варки супа или соуса на их
поверхности часто образуется пленка. Это
происходит из-за коагуляции бел-
на на границе «воздух —
жидкость». Чтобы избежать
образования пленки, нужно защитить
поверхность жидкости слоем масла.
В других случаях, например,
при взбивании белков, повар,
наоборот, стремится создать
наилучшие условия для поверхностной
денатурации белка. Тут уже
нужно всячески избегать присутствия
жира. Поэтому яичный желток
(в нем жира около 30%) должен
быть тщательно отделен от
взбиваемого белна.
В кулинарной физике очень
часто употребляются различные
эмульсии. Майонез — это эмульсия
«масло в воде» с высоким
содержанием масла. Чтобы избежать
превращения ее в несъедобную
эмульсию «вода в масле», в
майонез добавляют яичный желток,
являющийся прекрасным
эмульгатором.
Ту же роль эмульгатора яич-
56
ный желток выполняет при
изготовлении мороженого,
представляющего собой другой очень
распространенный пример эмульсий
«масло в воде». Желатин и
молочные белки способствуют
стабилизации эмульсии при
замораживании. Желатин предотвращает рост
больших кристаллов льда, и
поэтому смесь получается не
комковатой и однородной.
И все-таки в роли химика повар
выступает чаще, чем в роли
физика. Оставленный на воздухе
очищенный картофель быстро буреет.
Это происходит оттого, что
входящие в его состав фенолы онисля-
ются кислородом воздуха с
образованием хинонов, которые в
свою очередь полимернзуются в
темные пигменты. Опустите
картофель в воду, и доступ воздуха к
нему прекратится, а значит реан-
цин окисления фенолов не
произойдет. Добавив в воду лимонный
сок, можно сохранить белый цвет
картофеля еще дольше, потому что
в кислой среде уменьшается
активность окисляющих ферментов.
Вообще в нулинарной практике
кислота используется довольно
часто. Например, мясо и рыбу
заранее пропитывают в маринаде:
уксусная кислота ускоряет гидролиз,
.и белки быстрее размягчаются при
нагревании. Способствовать раз-
мягчению белков могут
различные растительные ферменты,
например, лапаин, добываемый из
листьев дынного дерева, -и бро-
|мелин, содержащийся в ананасах.
В некоторых случаях контроль
за кислотностью приходится вести
чрезвычайно тщательно.
Например, при варке леденцов сахарный
сироп кипятят со специальным
кислотным буфером, так
называемым винным камнем (винный
камень — это кислый виннокислый
калий НООССН(ОН)СН(ОН)СООК).
Кипячение с буфером помогает
создать совершенно определенную
степень гидролиза. Нужная
концентрация сиропа достигается
выпариванием. Концентрацию
сиропа можно определить по
температуре его .кипения (сиропы
различных концентраций кипят при
разной температуре) или более
традиционным путем. В сироп
опускают проволочную петельку, а
затем, подняв ее вместе с каплей,
пробуют, можно ли выдуть из этой
капли пузырек. Если можно, то
кипячение прекращают — сироп
нужной концентрации готов. Во время
кипячения сахароза частично
превращается в инвертированный
сахар. Таной сахар предупреждает
рост больших кристаллов при
быстром охлаждении сиропа...
А микробиология? Бактерии
мельчайшие живые организмы — и
добрые помощнини, и возможные
враги повара. Полезные бактерии
«трудятся» в дрожжах, без
которых не обходится выпечка хлеба,
и в любой винной бутылке.
Полезные микроорганизмы
заслуживают упоминания и за ту роль,
которую они играют в сыроварении.
А вот враги повара —
гнилостные микроорганизмы. Особенно
часто они встречаются в
недоваренной пище. Токсические вещества,
выделяемые ими, могут вызывать
пищевые отравления. Повар
должен постоянно помнить об этом и
уделять особое внимание выбору
продуктов, правильному
приготовлению пищи и тщательной
гигиене.
Иснусный повар никогда не
забывает и о психологических
тонкостях, связанных с церемонией
подачи блюд. Эти тонности, правда,
больше сродни окнультным
представлениям, чем науке. Какое
объяснение можно, например, дать
старинному обычаю, по которому
вину перед употреблением дают
ровно один час «подышать»? Хотя,
кто знает, в будущем может быть
и это будет объяснено научно-
Пока же достаточно того, что
хороший повар умеет поднять в
наших глазах ценность своих
кулинарных шедевров, окружая
церемонию подачи еды романтическим
ореолом.
Словом, что и говорить, быть
хорошим поваром — это значит
искусно смешивать приправу наукн
с неповторимым гарниром
искусства.
Перевод с английского
И. ЧАПЛИНОЙ
М
у^
57
Круг веществ, которые по своему
строению могут быть отнесены к
высокомолекулярным соединениям,
все время расширяется. Автор
распространяет этот подход на многие
природные неорганические
вещества и строительные материалы.
Может быть, и в этом случае такой
подход будет полезен?
еоршические
олииеры
Кандидат технических наук
Ю. С. ЧЕРКИНСКИЙ
ЗНАКОМЫЕ НЕЗНАКОМЦЫ
Нас окружают самые разнообразные вещества,
сотворенные 'природой или рукой человека.
Безгранично число химических соединений, чрезвычайно
многообразны их свойства. Казалось бы, невозможно
ориентироваться в этом бескрайнем море веществ
и свойств, но на помощь приходят лоции химических
законов, и первая из них — Периодическая система.
Давайте еще раз внимательно приглядимся к ней.
Центральная часть таблицы. Привычные, давно
знакомые элементы. Все «вакантные» места давно
заняты. Но почему сюда смотрят с особым
вниманием многие ученые? Идет процесс
переосмысливания химического существа известных элементов и их
соединений. В его основе — коллективное открытие,
значение которого мы пока еще не можем оценить
по достоинству. Оно заключается в том, что 13
элементов, расположенных здесь, могут образовывать
и образуют гигантские цепи полимерных молекул.
Еще недавно считалось, что этим замечательным
свойством обладает только углерод, но оказалось,
что гомоцепные .полимеры (полимеры, молекулы
которых составлены из атомов одного и того же
элемента) образуют также кремний, бор, фосфор, сера,
селен, германий, сурьма, мышьяк, теллур, висмут,
олово и полоний.
Разницей в молекулярном весе объясняется
различие физических свойств у аллотропных
модификаций этих элементов. Так, существует
высокомолекулярный <и низкомолекулярный бор. Первый — это
мелкие -кристаллы, по твердости почти не
уступающие алмазу, второй — мягкий зеленовато-бурый
аморфный порошок.
То же самое и у фосфора. Молекула белого или
желтого фосфора — мягкого, как воск, светящегося
в темноте вещества — построена всего из четырех
атомов, а красный фосфор — это уже
неорганический полимер.
Известны высокомолекулярные и
низкомолекулярные модификации серы, причем молекулярный
вес полимерной эластичной серы достигает 1 500 000.
59
Чистые кремний и углерод существуют только в
форме полимеров. Алмаз, графит и карбин
различаются молекулярным весом -и строением
молекулы. Алмаз — трехмерный, -пространственный
полимер, молекулы графита — плоские, а недавно
синтезированный советскими учеными карбин — это
неизвестный в природе линейный полимер углерода.
Графит и аморфный углерод с точки зрения химии
высокомолекулярных соединений .идентичны.
Как видите, среди гомоцепных неорганических
■полимеров встречаются очень важные и интересные
вещества. Но значительно обширнее и, вероятно,
перспективнее другой класс неорганических
полимеров— гетероцелные. В них атомы одного элемента
связываются между собой атомами другого »или
других. Если схему гомоцепного линейного полимера
можно изобразить так:
— а — а — а — а — а — а — а — а —,
то гетероцелные могут быть построены по-разному,
например, таким образом:
...— а — Ь — а — Ь — а — Ь...
или
...— а — а — Ь — а — а — Ь —...
или
...— а — Ь — а — с — а — b — а — с —... и т. д.
КаРБим
Алмаз
Графит
Рис. 1. Строение
макромолекул аллотропных
модификаций элеметарного
углерода — алмаза, графита и
карбииа.
В состав таких полимеров входит подавляющее
большинство элементов. Не образуют их лишь
одновалентные щелочные металлы и инертные газы. К
неорганическим полимерам относятся многие
важнейшие вещества, например, кислородные соединения
кремния, алюминия, фосфора — самые
распространенные минералы земной коры.
Итак, шолимеры — это не только игрушки из
полиэтилена, пластмассовые ручки, одежда из нейлона
и хлопка, лаки и краски, корпуса телефонов и
катеров, текстолитовые шестерни, ткани живых
организмов in обложки книг, но и горные массивы,
бетонные конструкции домов, картины из моэаики,
алмазные резцы и гранатовые браслеты.
Сегодня число известных неорганических
высокомолекулярных соединений составляет несколько
тысяч. Это главным образом природные
соединения, от речного песка до алмаза, но в арсенал
современной техники уже вошли и некоторые
синтетические неорганические полимеры. Но об этом ниже.
ОБЩНОСТЬ И РАЗЛИЧИЯ
Что объединяет органические, элементооргани-
ческие и неорганические -полимеры и что отличает
их друг от друга?
Главное, что определяет принципиальную
общность между всеми полимерами,— это большой
молекулярный вес и единая природа химической связи
между атомами главной цепи.
Во всех высокомолекулярных соединениях
главную роль играет ковалентная связь, объединяющая
атомы в цепь.
Но неорганические полимерные молекулы часто
строятся с помощью координационных связей. Во
многих неорганических полимерах, в частности, в
пироксеновых минералах, важную роль играет
ионная связь между цепями.
Если органические полимеры (исключая
трехмерные) являются двуагрегатными, т. е. существуют
в виде высокополимера как в твердом виде, так и в
растворе, то неорганические полимеры могут
сохранять свою высокомолекулярную форму, как
правило, лишь в одном состоянии — твердом.
Что касается свойств, то неорганические
полимеры по сравнению с органическими имеют больший
модуль упругости и повышенную стойкость против
термической и окислительной деструкции.
ПОЛИМЕРЫ КАМЕННОГО МИРА
Мы каждый день ходим по неорганическим
полимерам. Это песок, глина, гранит...
Для песка-кремнезема до сих лор принята
формула SiC>2, которая говорит о том, что кремне-
60
зем — химическое соединение кремния и кислорода.
Но это определение — -не полное. Оно we объясняет
таких свойств кремнезема, как высокая температура
плавления и большая химическая стойкость.
Современные физико-химические исследования
структуры двуокиси кремния показали, что каждая
крупинка песка представляет собой гигантскую
трехмерную молекулу, состоящую из связанных между
собой кремнийкислородных цепей. Формула
кремнезема должна отражать его полимерное строение и
писаться так: (Si02)n.
Глина .представляет собой смесь неорганических
высокомолекулярных соединений, построенных из
плоских полимерных блоков двух типов: кремний-
кислородного и алюмокислородного.
В соединениях, составляющих основу гранитов,
полимерная цепь построена из атомов кремния
и алюминия, связанных между собою через
кислород.
Перечень минеральных полимеров мог бы быть
продолжен: -корунд — окись алюминия, и гидраргил-
лит — гидроокись алюминия, все алюмосиликаты и
многие силикаты, такие, например, как асбест и
серпентинит, тальк и слюда, многие сульфиды и бори-
ды. Многие минералы предстают в новом свете,
если «взглянуть wa них с позиций химии
высокомолекулярных соединений.
ПРОМЫШЛЕННОСТЬ НЕОРГАНИЧЕСКИХ
ПОЛИМЕРОВ ЕСТЬ
Собственно говоря, проблема превращения
минерального сырья в 'искусственные материалы
решается уже в течение многих веков, с тех пор, как
были изготовлены первые (керамические изделия.
В чем сущность 'Процессов получения
силикатных строительных материалов и как они выглядят,
если взглянуть на них глазами химика? Возьмем, к
примеру, получение керамики и цемента. В первом
случае глубокое прокаливание глины приводит к
образованию керамического черепка. А при получении
цементного клинкера глина или песок, к которым
добавлена известь, превращаются не в водостойкий
черепок, а в вяжущее вещество. И в том -и в другом
случае первая стадия .превращений исходных
минералов — это термическая деполимеризация,
разрушение |ПОЛ1Имерных цепей при нагревании. Но wa
следующей стадии, в производстве керамики
мономерные блоки перестраиваются и при охлаждении
превращаются в неорганические полимеры нового вида,
а во втором случае — превращения
останавливаются на стадии деполимеризации. Образовавшиеся
при нагревании мономерные кремнийкислородные
группы фиксируются «ионами кальция {из извести),
которые препятствуют полимеризации в
охлаждающемся расплаве. Позднее, при кладке стен или при
6
Рис. 2. Строение молекул
органического A), элемектооргакического
B) и неорганического C)
полимеров (а — линейные молекулы, 6 —
плоские).
61
изготовлении бетона, под действием воды эти
низкомолекулярные соединения вновь превратятся <в
неорганические полимеры. Произойдет реакция
поликонденсации, в результате которой образуются
прочные полимерные гидроксилоксанаты кальция.
Полимерная природа бетона, керамики и других
строительных материалов предопределяет их
высокую прочность, устойчивость к действию влаги и
значительную химическую стойкость. Трудно точно
предсказать, какие практические выгоды даст
человечеству распространение представлений химии
высокомолекулярных соединений на химию
строительных материалов, но, несомненно, творческий перенос
огромного опыта, накопленного наукой о полимерах,
откроет новые возможности перед одной из самых
массовых отраслей промышленности. Химия
преобразует традиционные производства и поможет
создать новые строительные материалы.
О СВЯЗИ МЕТАЛЛОВ
С ПОЛИМЕРАМИ
Где же в периодической системе пролегает
граница между металлами и элементами, образующими
гомоцепные полимеры, и существует ли она вообще?
Для металлов характерна металлическая связь,
для полимеров — ковалентная. Чем ниже
располагается элемент в таблице Менделеева, тем больше
©Si
О Кислород
©Са
#Na
62
он по физическим свойствам отличается от полимера
и приближается к металлу.
Так, в ряду: «сера — селен — теллур — полоний»
первый элемент—ярко выраженный неметалл, а у
последнего .преобладают металлические свойства. Но
все четыре элемента образуют гигантские цепи
полимерных молекул. Это одна сторона взаимосвязи
неорганических полимеров и металлов.
С другой стороны, если мы посмотрим на
многие металлургические производства, то увидим, что
почти любой металл в чистом виде (в частности,
чистое железо) не очень-то хорош. Его свойства
необходимо существенно улучшить, что часто
достигается... присадкой реакционноспособного
полимера — углерода. Добавки углерода превращают
железо в чугун и сталь.
Наконец, известно, что металлы с гомоцепными
полимерами образуют ряд соединений. Широко
известны полимерные соединения металлов с
кремнием— силициды, и с углеродом—карбиды. Больше
того, известны способы химической прививки
органических полимеров к поверхности металлического
изделия. Поэтому можно ожидать, что наука о
полимерах сможет принести пользу и металлургам.
Производства металлов и неорганических
полимеров часто идут рука об руку. Получая сталь или
чугун, мы одновременно получаем и шлак, который
представляет собой расплав гетероцепных
неорганических высокомолекулярных соединений.
Производство алюминия — это на всех
подготовительных стадиях химическое производство
неорганических .полимеров. Исходным сырьем служат
природные полиалюмосиликаты — нефелин и реже
каолин.
Рис. 3. Структура кремнезема (альфа-тридимита)
Рис. 4. Условная плоскостная схема неупорядоченной силоксаннои
цепи в натрий-силикатном стекле. На схеме видно, что и ■
стекле есть достаточно длинные полимерные цепи. Однако
степень их упорядоченности ни>не, чем в других неорганических
полимерах кремния
СЕГОДНЯ И ЗАВТРА
НЕОРГАНИЧЕСКОГО СИНТЕЗА
В течение многих лет органическая химия, и
особенно химия полимеров, были авангардом всей
химической науки. Они накопили огромный опыт, создали
свои методы синтеза и анализа. Творческий перенос
этого опыта в химию неорганических веществ
поможет познать тайны окружающего нас
неорганического мира. С другой стороны, неорганическая
химия существенно обогатит науку о полимерах
новыми возможностями синтеза. Ведь эта наука
опирается не на один элемент (пусть даже такой
великолепный, как углерод), а ,на несколько десятков.
Появилась возможность синтеза бесконечного
числа соединений с большим, чем у органики,
многообразием свойств. Первые шаги на пути
целенаправленного неорганического синтеза полимеров уже
сделаны. В лабораториях получены алмаз, слюда,
корунд, гранат, кварцит, асбест, ряд минералов глин
и многие другие неорганические лолимеры.
Некоторые из них уже производятся в промышленных
масштабах.
Самым тугоплавким из всех известных
человечеству веществ стал синтетический неорганический
полимер— сополимер карбидов гафния и титана. Оч
плавится при температуре свыше 4200°.
Еще одна причина заставляет думать о
неорганических полимерах как о важнейших материалах
недалекого будущего. Как известно, нефть —
главный источник сырья для синтеза обычных
полимеров. Но, как полагает английский бюллетень
«Петролеум сервис», запасов нефти, известных сегодня
человечеству, при существующей интенсивности
производства и потребления хватит лримерно на три с
половиной десятка лет. Пусть даже эта оценка
слишком пессимистична... А запасы сырья для
производства неорганических полимеров неисчерпаемы!
Уже создан неорганический каучук — полифос-
фонитрилхлорид, молекулы которого не содержат
привычного углерода:
С1 С1
I I
. —P=N—P
С1
CI
СП
I
N—Р
I
С1
= N-
Его свойства подобны свойствам обычных
синтетических каучуков, но он не горит.
Близится к завершению работа <по созданию
высокопрочного (искусственного волокна из серы.
Но все это только начало. Число новых
неорганических полимерных материалов, обладающих
замечательными свойствами, в недалеком будущем
резко увеличится. Фундамент этих открытий
закладывает новая отрасль науки — химия неорганических
полимеров.
Нельзя ли считать любой кристалл гигантской молекулой? Ведь все его атомы или
ионы, по существу, связаны друг с другом!
Но тогда и каплю дождя, и весь объем жидкости, налитой в стакан, пришлось бы
тоже считать одной сверхмолекулой — все настоящие «маленькие» молекулы тоже ведь
связаны и в капле дождя и в стакане воды силами сцепления через своих соседей.
Для правильного решения, очевидно, нужно выделять молекулу из окружения ей
подобных по такому принципу: внутри молекулы между образующими ее атомами
действуют гораздо большие силы — силы химических связей, а между молекулами —
сравнительно очень слабые (межмолекулярные) силы. Именно так и определяется понятие
длинноцепочечных макромолекул обычных полимеров: силы главных валентностей
связывают атомы в длинную, гибкую цепь каучука, а между цепями действуют ван-дер-
ваальсовы остаточные силы.
Но при вулканизации каучуков нли прн пространственной полимеризации цепи
сливаются по ненасыщенным связям, объединяются в сетку поперечными химическими
связями и понятие молекулы в пространственном полимере теряется.
С таких позиций можно в известной мере считать полимером графит, слюду,
асбест — кристаллические минералы, в кристаллической решетке которых ярко выражена
слоистость (графит, слюды, глинистые минералы с их микрочешуйками) или
волокнистость (асбест). Тончайшие листочки или волоконца можно считать своеобразными
аналогами макромолекул — недаром эти листочки и волоконца легко отщепляются от
всего кристалла (как говорят, «по спайности»).
Это происходит потому, что силы, действующие между ними, гораздо слабее, чем
силы внутри этих образований — «сверхмакромолекул»
Академик П. А. РЕБИНДЕР
щ
S
о и
к
<
о
н
и
й
о
н
Рч
н
а
о
к и
G3
ШИПЫ ИЗ СИНТЕТИЧЕСКОГО"
КАУЧУКА ...
ЛУЧШЕ ОНИ ИЛИ ХУЖЕ, "
ЧЕМ ИЗ НАТУРАЛЬНОГО? =
СМОЖЕТ ЛИ
СИНТЕТИЧЕСКИЙ КАУЧУК
КОГДА-НИБУДЬ ,^^2
ПОЛНОСТЬЮ ВЫТЕСНИТЬ
НАТУРАЛЬНЫЙ, -ZZZZ
КОТОРОГО ПОКА ЧТО"
ЕЖЕГОДНО ПРОИЗВОДЯТ:
ВО ВСЕМ МИРЕ"
БОЛЬШЕ ДВУХ МИЛЛИОНОВ
тонн? —
64
КАКИЕ ЛУЧШЕ:
из синтетического
каучука или
из натурального?
■^^К .^^^| Доктор
^^^^^М ^Н^Н экономических
^^^^^В ^Ш^Ш наук
ЧННВ Я^Н Ф. И. ЯШУНСКАЯ
Первые крупные заводы синтетического каучука
были пущены в Советском Союзе в 1932 году.
Это был натрий-бутадиеновый каучук СК-Б,
созданный академиком С. В. Лебедевым,
первооткрывателем промышленного способа его синтеза.
Каучук СК-Б заметно уступает натуральному по
своим свойствам — разрывной лрочности, стойкости
против разрастания порезов и трещин и особенно —
по износостойкости. В нем развивается большее
внутреннее трение при многократном сжатии, сдвиге и
растяжении, образуется больше тепла, чем в
каучуке натуральном. Шины из СК-Б сильнее греются. А с
повышением температуры снижается прочность и
эластичность резины и корда, они становятся
жестче, хуже амортизируют. Кроме того, сырой каучук
СК-Б значительно менее клеек, чем натуральный.
Это затрудняло технологию сборки шин из
отдельных деталей.
И ф ф
5 Химия и Жнзнь, № 4
И все же каучук СК-Б в свое время сослужил
отечественной шинной промышленности добрую
службу, частично заменив натуральный каучук в
производстве шин. Ведь .скорости движения
автомобилей в годы первых пятилеток были гораздо ниже
современных. Нагрузки на шины также были
невысокими. Поэтому разница в качестве натурального
и синтетического каучуков не так уж сильно
сказывалась -на работоспособности шин, тем более что
синтетический каучук комбинировали -с натуральным.
Однако с ростом скоростей и нагрузок
требования к качеству шин «повышались, и
натрий-бутадиеновый каучук СК-Б стали частично заменять более
совершенным бутадиен-стирольным каучуком СКС
(«синтетический каучук стирольный»). По
техническим .свойствам, особенно «по износостойкости и
разрывной прочности, каучуки СКС намного превосходят
каучуки СК-чБ. Но в многослойных шинах для
грузовых автомобилей, автобусов и других тяжелых
машин и они не выдерживают сравнения с
натуральным. Для производства шин по-прежнему
требовались значительные добавки натурального каучука.
ПЕРВЫЕ В МИРЕ
В пятидесятых годах нашим шинникам
предстояло радикально решить проблему: создать
крупногабаритные шины 'полностью из синтетических
каучуков, да так, чтобы они не уступали по
долговечности и надежности шинам с большим содержанием
каучука натурального. А чем больше размер шины и
чем толще протектор, тем труднее это сделать.
Но в нашей стране именно на большегрузные
шины уходит большая часть ценного сырья.
Поэтому-то и важно было освоить синтетический каучук
прежде всего в шинах для тяжелых грузовиков,
автобусов, тракторов.
Необычайная трудность этой задачи видна хотя
бы по тому, что 10—15 лет назад ни в одной другой
стране не выпускали большегрузных шин из
синтетического каучука. Да w сейчас эа рубежом их
изготовляют преимущественно из натурального каучука.
Кроме того, наши шины рассчитаны на езду в
значительно более разнообразных и часто худших
дорожных условиях, чем в США или Западной Европе...
Чтобы преодолеть основной недостаток
синтетических каучуков СК-Б и СКС — (повышенное
внутреннее теплообразование и низкую клейкость — были
разработаны новые конструкции шин, были
продуманы новые принципы подбора компонентов для
шинных резин. Хлопчатобумажные волокна корда
были заменены на вискозные и капроновые,
обладающие (большей прочностью и теплостойкостью.
В результате отечественные шины для
грузовиков и автобусов, изготовленные на 100 процентов из
65
СК, оказались столь же долговечными, как и шины
старых конструкций, сделанные почти наполовину из
импортного натурального каучука. В цехах и
лабораториях Ярославского, Московского и других
шинных заводов, у станков и на чертежных досках
рождались новые шины. Огромным «оркестром»
химиков, конструкторов, технологов, рабочих руководил
«дирижер» —коллектив Научно-исследовательского
института шинной промышленности.
В 1952—1953 гг. советская промышленность
первой в мире освоила массовое производство
большегрузных шин из СК. Народное хозяйство получило
огромную экономию валюты, которая раньше шла
на импорт заокеанского натурального каучука.
Так закончился первый этап создания шин из
СК, не уступавших шинам старых типов, «которые
содержали большие добавки натурального каучука.
Только не уступавших...
ВТОРОЙ ЭТАП
В 1958 году на майском Пленуме ЦК КПСС
перед шинной промышленностью была поставлена
новая задача: намного увеличить долговечность и
надежность шин. Ибо выросли скорости автомобилей,
их грузоподъемность, увеличилась интенсивность
работы автотранспорта. Новые шины из СК должны
были стать лучше, чем шины из натурального
каучука.
Принципиально новый путь к созданию
высококачественных шин без натурального сырья открылся
только с появлением стереорегулярных каучукоз,
впервые синтезированных у нас под руководством
А. А. Короткое а и Б. А. Долгоплоска. Стереорегуляр-
ными называются соединения, у которых звенья
молекулярных цепей регулярно или правильно
чередуются в пространстве. Чтобы синтезировать такие
полимеры, понадобилось найти особые катализаторы
(в подборе комплексных катализаторов выдающаяся
роль принадлежит двум зарубежным ученым —
лауреатам Нобелевской премии: немцу Карлу Циглеру и
итальянцу Джулио Натта). Понадобилось добиться
очень высокой чистоты исходных продуктов —
изопрена и бутадиена.
КАУЧУКИ
КРАТКАЯ ЭНЦИКЛОПЕД^
ХЛОРСУЛЬФИРОВАННЫЙ
ПОЛИЭТИЛЕН,
ХАЙПАЛОН:
БУТАДИЕНОВЫЙ
СТЕРЕОРЕГУЛЯРНЫЙ
КАУЧУК СКД
ИЗОПРЕНОВЫЙ
СТЕРЕОРЕГУЛЯРНЫЙ
КАУЧУК СКИ
(-С Н2—СН2—СН2—СНС1-
—CH2-CH2-CH2)„— СН— "I
S02C1J,;
Отличается прекрасной
химической стойкостью, прочен на
разрыв, хорошо сопротивляется
тепловому старению и долго не
изнашивается. Используется для
изготовления защитных обкладок,
покрытий, специальных
прорезиненных тканей и т. д.
Полимер бутадиена (дивинила):
[ — СН2-СН=СН—СН2— ]„
Зарубежные названия: «диен»,
«цис-4», «карифлекс BR» и др.
Молекулы каучука СКД
отличаются регулярным
расположением групп атомов в пространстве.
СКД превосходит
натуральный каучук по стойкости к
нанесу и низким температурам, но
уступает ему в прочности.
Отличается уменьшенным внутренним
теплообразованием. Широко
применяется в производстве шин и
разнообразных резиновых изделий.
Полимер изопрена:
Г— СН2—С=СН—СН2
[ СН8
Зарубежные названия: «нат-
син», «карифлекс IR» и др.
Молекулы каучука СКИ
отличаются регулярным
расположением групп атомов в
пространстве. По составу, строению и
свойствам СКИ близок к натуральному
каучуку и широко применяется
вместо него в производстве шмн и
других резиновых издеяий.
66
Стереорегулярные каучуки СКИ (изопреновый)
и СКД (дивиниловый) — первые синтетические
каучуки, обладающие таким же и даже более низкие
внутренним трением, чем натуральный. А
теплообразование—настоящая «ахиллесова пята»
синтетических каучуков нерегулярного строения.
Мало того. Оказалось, что каучук СКД
превосходит натуральный и ло износостойкости. А это —
решающий фактор для производства ш/ин, способных
выдерживать большой пробег.
К сожалению, каучук СКД пока еще несколько
уступает натуральному и (синтетическому изопре-
новому каучуку СКИ по прочности. Кроме того, его
труднее перерабатывать на стандартном
оборудовании резиновых производств.
Поэтому сейчас СКД приходится применять в
сочетании с другими каучуками— .изопреновыми или
б у та диен -сти рол ьн ы м и.
Если бы каучука СКД хватило для добавки в
протекторные смеси всех шин выпуска этого года, тэ
народное хозяйство сэкономило бы благодаря
повышению износостойкости шин (в среднем на 15%)
больше 100 миллионов рублей!
Для разумного использования новых стерео
регулярных каучуков особую важность приобретают
продукты «малой химии»: стабилизаторы, против остари-
тели, противоутомител(И, антиозонанты, защищающие
каучук от разрушающего действия озона, и многие
друпие.
Особенно высокую долговечность и надежность
имеют радиальные шины из стереорегулярных
каучуков. Например, радиальные .шины для автомобиля
ЗИЛ-130 грузоподъемностью 4,5 тонны на девять
десятых состоящие из синтетических каучуков,
выдерживают по 100 000 км пробега. И многие из них еще
пригодны к восстановительному ремонту. Между тем
шины обычных конструкций для четырехтонного
автомобиля ЗИЛ-164, выпускавшиеся в 1958 г. на
основе комбинации бутадиен^стиролыного,
натрий-бутадиенового и значительных добавок натурального
каучука, пробегали до восстановительного ремонта
немногим более 50 000 км.
НТЕТИЧЕСКИХ МАТЕРИАЛОВ
-ц
Г*7 *?jpc f
!>■■:• '"
ПОЛИСУЛЬФИДНЫЙ
КАУЧУК ИЛИ ТИОКОЛ
Г — СН2—СН2—S—S—
II II
S S
1
Исключительно стоек к
действию растворителей и масел, газо-
и влагонепроницаем, обладает
хорошими диэлектрическими
свойствами и устойчив к старению.
Применяется для изготовления
масло- и бензостойких шлангов и
прокладок, обкладки химической
аппаратуры. Жидкие тиоколы
используются для герметизации
швов и заделки трещин.
УРЕТАНОВЫЙ КАУЧУК СКУ
Его формула:
[—ORiOCONHR2NHSO—]п
Зарубежные названия: совул-
коллан», «адипрен», «неоген» и др.
Очень стоек к износу, хорошо
сопротивляется окислению,
ионизирующим излучениям, действию
ряда растворителей, масел, озона.
Недостаточно стоек к действию
влаги и высоких температур.
'Применяется в производстве
резиновых технических изделий,
пенореэин, подошв, каблуков
и т.д.
ХЛОРОПРЕНОВЫЙ
КАУЧУК НАИРИТ
Полимер хлоропрена:
[-СН2—СС1-СН—СН2]„
Зарубежные названия: «нео-
прен» и др. Наирит наделен
высокой прочностью и эластичностью,
отличной озочо-, свето- и
огнестойкостью,
газонепроницаемостью, повышенным
сопротивлением действию масел и топлив.
Широко используется в кабельной
промышленности, для
производства транспортерных лент и
ремней, прорезиненных тканей, клеев,
актикоррозионных покрытий,
обкладки химических аппаратов.
5* 67
Интересны результаты испытаний шин на
легковых автомобилях «Москвич», проходивших на юге,
в районе Сухуми. Протектор опытных шин был
изготовлен из стереорегулярного каучука СКД в
комбинации с бутадиен-стирольным каучуком СКС, без
добавок натурального каучука. Режим испытаний
был тяжелым: автомобиль, нагруженный балластом,
ежесуточно пробегал 600 км. В этих напряженных
условиях опытные шины прошли до
восстановительного ремонта 45 000 км. Шины из натурального
каучука прошли в этих же условиях только 24—29
тысяч километров...
И еще одно обстоятельство: доказано, что
камеры для шин, сделанные из синтетического бутил-
каучука, в 10 раз менее воздухопроницаемы, чем
камеры из каучука натурального.
Советская промышленность синтетического
каучука, опирающаяся на исследования выдающихся
русских ученых — С. В. Лебедева, С. В. Вызова, И. И.
Остромысленского, И. Л. Кондакова, А. Е.
Фаворского, Н. Д. Зелинского и многих других, дает
все новые «плоды»—новые типы и разновидности
каучуков.
Химики продолжают совершенствовать бутади-
ен-стирольные, стерео регулярные каучуки,
синтезируют этилен-пропиленовые и другие.
Продолжается и работа по изысканию новых
улучшенных кордных тканей и по совершенствов-анию
конструкций шин.
Шинники и их верные друзья — химики,
конструкторы, технологи, текстильщики—снова в пути.
Их цель — уменьшить расход натурального каучука
для изготовления шин до минимума.
Достижение заветной мечты автомобилистов —
создание грузовой и автобусной шины,
выдерживающей в среднем 200 тысяч, а легковой — 60—70
тысяч километров пробега, уже «е за горами.
ЭТИЛЕН-ПРОПИЛЕНОВЫЙ
КАУЧУК СКЭП
Сополимер этилена с
пропиленом:
[-CHi-CH,-]n
Г—СН2—СН—
I с н3
Обладает комплексом
высоких прочностных и эластических
свойств, выдающейся химической
стойкостью, включая стойкость к
старению, отличными
электроизоляционными свойствами, низкой
плотностью.
Этилен-пропиленовые каучуки
и тройные сополимеры
применяются в производстве химически
стойких и электроизоляционных
изделий и деталей. Так же
перспективны как массовые каучуки
общего назначения.
БУТАДИЕН-СТИРОЛЬНЫЕ
КАУЧУКИ СКС И СКСМ
Сополимеры бутадиена со
стиролом:
[—СН2—СН=СН—СН2—]л
-сн2—сн—-
I
о,
или бутадиена с метилстиролом.
Зарубежные названия: «буна
S», «SBR» и др. СКС—самые
распространенные виды
синтетического каучука.
Отличаются прочностью,
эластичностью, износостойкостью.
Однако по совокупности свойств
уступают натуральному каучуку.
Широко применяются в
производстве шин и других резиновых
изделий.
СИЛОКСАНОВЫЙ
КАУЧУК СКТ:
R
I
-О—Si—О-
I
R
Зарубежные названия:
«силикон», «силастик» и др. СКТ
относится к классу кремнийорганиче-
ских полимеров.
Надежно работает в
интервале температур от —110 до +250°
и выше. Стоек к действию
кислорода, озона, солнечного света.
СКТ используют в уплотнительных
и герметизирующих прокладках,
в изделияхг работающих при
низких и высоких температурах, а
также в деталях оборудования для
пищевой и медицинской
промышленности.
68
Есть старинное выражение:
«камнем пошел на дно». Однако
оно не всегда бывает верно. Ведь
встречаются камни, которые
можно бросать утопающему, как
спасательный круг. Это вспененные
вулканическими газами минералы,
главным образом кремнезем н
глинозем, известные под
названием пемзы. Есть сорта пемзы,
которые легче сухой сосны и ели.
Каменная «пена» —
древнейший, но не единственный из
образцов для создателей новых сверх-
Инженер Ю. МОРАЛЕВИЧ
легких материалов. Немало их
создано и живой природой. Это не
только газонаполненная кора
пробкового дерева. Значительно
легче ее, например, бальза, из
гигантских стволов которой был
сооружен знаменитый
«трансокеанский» плот «Кон-Тики».
Начав со стеклянной пены,
человек создавал постепенно
множество материалов, наполненных
газом. Правда, даже люди с
техническим образованием часто не
знают, что существуют два
самостоятельных класса этих
важнейших материалов. Любая пена
состоит из мелких или крупных
пузырьков, которые все наглухо
«запечатаны». Примером может
служить хотя бы мыльная пена,
которая исчезает, как только
нарушается герметичность
пузырьков. Но пена ли микропористая
резина, обычная поролоновая
губка или мягкая набивка кресла в
самолете?
Микропорка, поролон...— в
самих их названиях упомянуто
греческое слово «пора», это означает
не пузырек, а отверстие. Вот,
собственно, и все различие между
двумя группами новых
материалов. Одна группа — пенопласты,
другая — поропласты. У первых
все пузырьки запечатаны, у
вторых они вытянулись, потеряли
герметичность, стали лабиринтом
мелких каналов, соединенных
между собой и с внешним
пространством. В технике, в быту
огромное значение приобретают
обе группы. Но сейчас рассказ
пойдет о пенах.
В соревновании с
синтетической химией природа потерпела
полное поражение. И сравнение
«легкий как пробка» в наши
дни — мертвый архаизм. Ведь
кубический метр пробки весит до
300 килограммов. А некоторые
пены, превосходящие ее по ряду
основных качеств, имеют
объемный вес 0,001: куб с ребром 1 метр
весит 10 килограммов. В 25—
30 раз легче пробки!
Первые наши пенопласты,
появившиеся в начале пятидесятых
годов, были не очень еще хороши.
Их получали вспениванием
фенол ьных смол. Эти пены годились
для тепловой изоляции зданий,
немало пластин из них пошло на
строительство МГУ. Но первые же
попытки делать из фенольных
смол спасательные круги
окончились неудачей. Слишком
хрупкими оказались такие пены.
Кораблестроители отказались от них
наотрез и продолжали утеплять
89
борта и надстройки судов быстро
загнивающей смесью крошеной
пробки и дешевых
каменноугольных смол.
Но все это уже в прошлом.
Судостроители быстро переходят
сейчас на сверхлегкую тепловую
изоляцию — прочные и упругие
пенопласты из акриловых и
других смол. Рефрижераторные суда
с такой изоляцией будут меньше
расходовать энергии на
поддержание в трюмах нужной
температуры, ощутимо увеличится и их
грузоподъемность.
Кстати, чтобы снабдить
корабль новой изоляцией, совсем не
обязательно привозить на него
готовые пластины пенопласта, а
потом крепить их изнутри к
бортам. В 1963 году на Одесском
судоремонтном заводе был успешно
освоен, например, способ
нанесения пенополиуретана прямо на
внутреннюю поверхность корпуса
и надстройки. Жидкий полимер,
подаваемый мощными
пульверизаторами, прилипает к металлу,
вспенивается и образует
сплошной теплозащитный слой нужной
толщины. Эта изоляция послужит
«шубой», предохраняющей нефть
в стальном корпусе танкера от
остывания — густую холодную
нефть не берут никакие насосы.
А летом в тропиках, особенно при
перевозке бензина, когда металл
раскален и бензии испаряется
сотнями тонн, его можно охлаждать
морозильной установкой под
защитой той же пенопластовой
«шубы».
Не менее важна проблема
тепловой изоляции и на суше: для
крупных холодильников, для
наземных видов транспорта, да и
для жилых помещений. А в
последнем случае пенопласт
становится еще и отличной звуковой
изоляцией. Его можно ие только
устанавливать в виде готовых
пластин и плит или наносить с
помощью пульверизатора. Есть
третий способ — наливать полимер с
пенообразователем в пустоты
между тонким и перегородками.
И, заполнив все предназначенное
для нее пространство, пена
затвердеет там навсегда, упрочнит
конструкцию.
Полимерные пены становятся
все легче и долговечнее, Ученые,
работающие в этой области,
подбирают наиболее прочные смолы,
стараясь создать пены, кубический
метр которых весил бы всего 5—
8 килограммов. Цель, вероятно,
будет достигнута очень скоро. Но
является ли такой вес пределом?
Все зависит от прочности
смолы и технологии изготовления
пены. Сейчас уже ясно, что
создание полимеров, в несколько раз
оолее прочных, чем самые
прочные эпоксидные смолы,—
выполнимая задача. А чем большие
нагрузки выдерживает полимер, тем
тоньше могут быть стенки
пузырьков пенопласта, тем легче
становится он сам. Не исключено, что
только этим путем удастся создать
пены, кубический метр которых
весит всего килограмм.
Впрочем, реальный ли это
прогноз, если газ, заполняющий
пузырьки в таком кубе, должен
весить столько же?
Да, реальный, потому что этот
килограмм воздуха —
«нейтральный». Вес куба определяет лишь
количество сверхпрочного
полимера. Больше того пенопласт можно
еще значительно облегчить. Для
этого следует использовать в роли
наполняющего пузырьки газа
водород или, чтобы не случилось
пожара или взрыва, смесь водорода
с гелием. В таком случае
полимерная гена, имея в пузырьках газ с
«отрицательным» весом, станет
почти невесомой.
Нечего и говорить о том,
какой это будет ценный материал
для авиации, крупных
искусственных спутников, для высотных
зданий, наземного и водного
транспорта и множества других целей.
Но даже такое облегчение
полимерных пен — не предел.
А что если попробовать ка-
ПОЛИМЕРЫ
В ЯШВОППШ
На цветной вклейке
помещена фотография
экспериментального панно
«Михаил Ломоносов»,
выполненного на бумаге
и запрессованного в сте-
клопластин. Техника
письма в данном случае
не отличается от
обычных методов живописи:
рисунок выполнен водо-
разбавимыми красками —
акварелью, гуашью,
темперой и т. п. при
помощи либо кнсти, либо
краскопульта.
Отвердевшая в
результате прессования смола
придает цвету глубину и
насыщенность и
одновременно служит отличным
защитным слоем,
«консервирующим » изображе-
иие. Живописные работы,
выполненные такнм
способом, не боятся
атмосферных влияний, стойки
к агрессивным средам.
Монтаж ирупноразмер-
ных пакно
осуществляется по несущему каркасу.
Размеры отдельных
листов — в пределах
1 X 1,5 м.
Простота и
экономичность изготовления
панно на основе полимерных
материалов делает их
доступными в массовом
строительстве.
Экспериментальные
работы по применению
полимерных материалов в
монументально -
декоративной живописи
проводятся кафедрой
живописи Московского
архитектурного института
совместно с Ленинградским
заводом слоистых
пластиков и Всесоюзным
научно - исследовательским
институтом бумаги.
Аспирант
кафедры живописи
Московского
архитектурного
института
А. ГРИШКИН
На обороте цветной вклейки —
фото Н. Хорунжего к статье
«Неорганические полимеры».
Образцы минералов.
70
t
Л. >
'ЧГ
ким-либо способом изготовить
пенопласт, у которого в пузырьках
находился бы не газ, а самая
«легкая» среда — глубокий ва-
; куум?
Задача заманчивая, но как
будто совершенно невыполнимая.
Даже если создать в аппарате
вокруг жидкого полимера вакуум,
близкий к космическому, для
получения пузырьков все-таки
понадобится какой-либо газ, иначе они
не зародятся и не расширятся до
нужных размеров. Подать газ в
налитый для реакции полимер
можно. При вакууме, царящем
снаружи, его понадобится
чрезвычайно мало. Но удалить его потом
из миллиардов мельчайших
герметических пузырьков никаким
способом не удастся. Выходит,
заманчивая задача неразрешима.
Так ли это?
В Институте элементооргани-
ческих соединений Академии наук
СССР пришли к выводу, что
вакуумный пенопласт все же
приготовить можно. Для этого нужно
лишь подобрать два прочных
полимера с далеко отстоящими друг
от друга точками кипзния. Если
начать нагревать их смесь,
составленную так, чтобы капельки
низкокипящего полимера были
взвешены в массе высококипяще-
го, то менее теплостойкий полимер
начнет переходить в г^ьиЗ^мюе
или парообразное состояние.
Масса достаточно хорошо вспенится.
Этот процесс можно вести,
например, при 300 градусах выше нуля.
При понижении температуры до
200 градусов более теплостойкий
полимер затвердеет настолько, что
сможет сохранить свою форму
неизменной. А уже при 150 градусах
находящийся в парообразном
состоянии второй полимер начнет
осаждаться на внутреннюю
поверхность пузырьков в виде
тонкой, но прочной пленки,
дополнительно укрепляющей пенопласт.
Получаются вакуумные пузырьки
в весьма надежных двойных
оболочках.
Таким образом, появляется с
виду фантастическая, но все-таки
вполне реальная возможность
создать пенопласт, кубический метр
которого при нормальном
давлении атмосферы будет весить
меньше килограмма. Конечно, если
удастся на практике изготовить
вакуумный пенопласт, кубометр
которого станет хотя бы на
несколько десятков граммов легче
кубометра воздуха, это будет
большой и важной победой
химической науки. Такой пенопласт,
независимо от его количества и
формы, сможет плавать в
нижних слоях атмосферы. И пусть
читатель сам представит себе
удивительные сооружения, которые
можно будет создавать из
вакуумного воздухоплавающего
пенопласта. Это будут легчайшие
изотермические здания любой высоты,
мосты без единой промежуточной
опоры не только через реки, но и
через морские проливы. Можно
будет даже соорудить над
пыльным нижним слоем атмосферы
гигантские воздушные острова,
своеобразные «высокогорные»
курорты...
Фантастика? Нет! Химики
говорят, что «коэффициент
осуществимости» подобных идей весьма
близок к единице, а срок их
осуществления упорно стремится к
нулю.
Рисунки В. Щапова
71
MScOW
Знакомьтесь:
«ЮПАК»
Язык химии, как и всякий живой
язык, беспрерывно обогащается,
видоизменяется, подталкиваемый
бурным развитием науки. В него
вторгаются незнакомые символы,
термины, новые константы. Если
бы химики всего мира не
объяснялись между собой на своем общем
«химическом эсперанто», то
ровно через год-два после утраты
научных контактов они уже плохо
понимали бы друг друга.
К счастью, этого не
происходит. На ком же лежит обязанность
«хранителя» и толкователя
общего кода? Его имя — ЮПАК. Это
название международной
организации, составленное из
заглавных букв английских слов
International Union of Pure and Applied
Chemistry.
По-русски это звучит так:
«Международный союз по
теоретической и прикладной химии».
ЮПАК был основан в 1918 году
президентами Общества
химической промышленности Англии и
Франции. Деятельность этой
организации не ограничивается
унификацией химического языка. В
наше время наука перестала быть
уделом лишь «избранных»,
талантливых одиночек. Во многих
странах работают целые армии
ученых.
Научные открытия недолго
остаются в границах одного
государства. Чтобы сделать их
достоянием всего человечества, нужны
хорошо налаженная информация
и координация исследований
в международном масштабе,
избавляющие от затраты усилий на
открытие уже открытого.
ЮПАК организует
сотрудничество между химическими
обществами и отдельными учеными
разных стран, координирует
научную и техническую деятельность,
а также созывает раз в два года
международные конференции и
конгрессы. Под эгидой ЮПАК
проходят международные
научные симпозиумы по отдельным
вопросам химии. В настоящее
время в ЮПАК входят представители
38 стран.
Советский Союз встулил в
ЮПАК в 1930 году. Это была
первая международная организация,
членом которой стала Академия
наук СССР. Советские ученые
принимали активное участие в
дискуссиях, конференциях, конгрессах,
проводимых ЮПАК, работали в
комиссиях, разрабатывающих
международные (стандарты. Это
сотрудничество прервала на время
Вторая мировая война. Когда в
1945 году союз возобновил
работу, он обратился к президенту
Академии наук СССР С. И.
Вавилову с предложением
восстановить права Академии наук СССР
в ЮПАК:
«Мы надеемся, — говорилось
в послании, — что Академия наук
СССР благосклонно отнесется к
нашему приглашению и нам будет
оказана честь иметь в составе
руководящих работников
представителя великого и храброго
народа, который сыграл такую
блестящую роль в завоевании
окончательной победы и великолепная
работа которого в области химии
является предметом восхищения
всего остального мира».
С 1947 по 1951 годы
обязанности вице-президента ЮПАК
исполнял академик А. Н.
Несмеянов. Позже членом
Исполнительного Комитета был избран другой
советский ученый — академик
Б. А. Казанский. В 1961 году на
этом посту его «сменил академик
В. Н. Кондратьев.
Виктор Николаевич Кондратьев
возглавляет Организационный
комитет XX Международного
конгресса по теоретической и
прикладной химии, который
проводится с 12 по 18 июля 1965
года в Москве. На конгрессе
ученые обменяются мнениями о
достижениях радиационной химии
разберут проблемы
неорганической химии и принципы
химической технологии — основы
современной индустрии; состоится раз
говор и по проблемам
химической кибернетики.
Одновременно будет проведен
симпозиум по низкотемператур
ной плазме. Он представляет
особый интерес не только для
теории, но и для практики.
Программа «ХХ-го
химического» очень насыщена: 29 -лекций на
пленарных заседаниях, 570 докла
дов на секциях. В работе Конгрес
са примут участие представители
39 стран; в Москву прибывают
1500 иностранных ученых.
■«ЮПАК — (полезная и нужна
международная организация, -
говорит председатель оргкомитета1
Конгресса академик В. Н.
Кондратьев.— К сожалению, этот союз
недостаточно известен, хотя итог
его работы — справочники, табли
цы, описания новых методик
другие рекомендации — исполь
зуют ученые и «инженеры многих
стран. Мы надеемся, что XX-
Конгресс в Москве сблизит нас
ЮПАК и ЮПАК с нами, даст воз
можность научной
общественности Советского Союза, особенно
молодежи, встретиться со многи
ми выдающимися учеными зару
бежных стран и обсудить «жгу
чие» вопросы науки. Я уверен
что роль меджународной
организации в развитии химии и хи
мической промышленности раз
личных стран в ближайшее
время заметно возрастет. Сейчас
ЮПАК ведется серьезная работа
над тем, как сделать более тес
ными связи с химической про
мышленностью. Несомненно, пос
ле XX конгресса значительно воз
растет и чоординирующая роль
этого науччэго союза».
Ю- ШИШИНА
72
просит
помощи
Доктор
биологических
наук
В. В. ЦЕРЛИНГ
Растения непрерывно
пополняют на земле запасы
органического вещества. Они
создают его из неорганических
солей, воды, кислорода и
углекислоты воздуха. Человек
постоянно пользуется продуктами
этой великой созидательной
работы. Но он издавна стремится и
к тому, чтобы разумно руководить
этой работой, направлять ее и
делать еще более интенсивной.
Известно, какую большую роль
сыграла в этих его попытках
химия—именно на ее языке, ее
понятиями оказалось возможным
точно описать связи, возникающие
между растением и питающей его
землей; с ее помощью удалось
получить объективный анализ
того, что растению требуется, и
снабдить его необходимыми для
жизни веществами.
НУЖДЫ РАСТЕНИЙ
Сейчас мы точно знаем:
растение не безразлично к
недостатку и избытку в почве любого из
химических элементов. То или
иное отклонение от нормы меняет
сначала химический состав, обмен
веществ и в целом — питание
растения. Несколько позже
появляются и внешние
морфологические изменения.
Из элементарных веществ
особенно важен для жизни
растения фосфор. И прежде всего
потому, что он активно участвует в
процессах синтеза белка. Для
этого синтеза необходим азот,
который растение получает из
почвы главным образом в виде
нитратов, углеводы и энергетиче-
73
ские вещества. В них-то и входит
фосфор.
Химикам известно, как
трудно заставить малоактивные
неорганические вещества,
например азот, соединиться с
кислородом или водородом, образовать
даже менее сложные, чем белки,
соединения. Для этого
используют разряды электричества,
повышенные температуры и
давление, катализаторы. А в живой
клетке реакции синтеза сложных
органических веществ лроходят
при обычных невысоких
температурах <и давлениях.
Мы знаем, что в клетке
имеются разнообразные
активаторы, гормоны, ферменты. Но
откуда берется в ней необходимая
энергия? Один из важнейших
энергетических .источников — окис-
лителыно-восстановительные
реакции дыхания. Кроме того, в
нуклеиновые кислоты, .играющие
самую важную роль в жизни
клетки, обязательным
компонентом входит фосфор, соединения
которого необычайно динамичны
и обладают высокой энергией.
Конечно, в клетке есть и
другие высокоэнергетические
соединения, более >простые по
структуре, чем нуклеиновые кислоты. Все
они повышают способность
углеводов и органических кислот
к взаимодействию между собой и
к включению в свой состав иных
веществ и элементов. Так, аммиак,
соединяясь с молекулой
органической кислоты, образует
аминокислоты. Это и есть первый этап
синтеза белке.
В молодых тканях
органическое вещество активно
расходуется на построение новых клеток.
И воспроизведение этих веществ
должно идти очень интенсивно.
Именно поэтому растению
требуется — наряду с другими
элементами — достаточное
количество фосфора, чтобы оно могло
синтезировать
высокоэнергетические соединения, активно
использовать питательные вещества,
обеспечивая образование новых
клеток, тканей, органов. Чем
раньше 'растение получит
дополнительное фосфорное питание,
тем быстрее будет оно
развиваться.
Это, конечно, не значит, что
фосфор необходим только
молодому растению: он нужен ему
постоянно. Но от 'правильного
•питания в молодом возрасте
зависит активность растения за все
время его существования.
Не меньшую важность
приобретает поэтому и присутствие
фосфора в семенах. С помощью
меченых фосфорных удобрений
удалось установить, что в лучшие
семена поступает тот фосфор,
который материнское растение
получило задолго до их
образования. Фосфор, лопавший в
растение позже, поступает в оболочки
семян, а также в цветы и бутоны,
образовавшиеся позднее и
потому ие дающие зрелых семян.
Иначе строится система
азотного питания.
Азот нужен растению как
«строительный материал» — для
создания сложных белковых
соединений. Все проявления
жизнедеятельности клетки — питание,
дыхание, рост и деление связаны
со свойствами содержащихся в
ней белковых веществ. Чем
больше в клетке белка, тем активнее
проходят все эти процессы.
Особенно активны самые молодые
клетки — клетки точек роста.
Однако способность интенсивно
делиться ограничена у них во
времени; чем острее азотный голод,
тем быстрее теряют они эту
способность, и тем раньше растение
перестает развиваться.
Для синтеза белка одного
азота мало. Мы уже выяснили,
как необходим растению
значительный запас
высокоэнергетических фосфорных соединений.
Наряду с фосфором обеспечивают
энергией процесс синтеза белка
и углеводы. А «роме того,
продукты превращения углеводов,
в том числе органические
кислоты, непосредственно входят в
состав аминокислот — этих
«кирпичей», из которых строится
молекула белка.
У молодых проростков еще
мало зеленых листьев, и поэтому
они небогаты углеводами. При
обильном азотном удобрении в
тканях проростка накапливается
неорганический азот, главным
образом в виде нитратов, и
проростки некоторых растений даже
страдают от высоких
концентраций нитратных солей. Система
азотного питания растений должна
строиться так, чтобы молодые
проростки не получили
излишков азота, но и не испытывали в
нем недостатка.
Растению очень вреден
азотный голод и в следующую фазу
его развития. Например, яровым
хлебным злакам — в фазах двух-
трех и трех-четырех листьев. Этот
период предшествует
возникновению зачаточных колосьев и
метелок, и достаточное литание
азотом в это время обеспечит в
дальнейшем образование крупных,
богатых зерном колосьев.
Боли молодому растению не
хватало азота, поздняя подкормка
его уже не спасет: число
колосков и цветков в соцветии не
увеличится. Это происходит потому,
что меристема (то есть, ткань —
новообразователь клеток)
зачаточного соцветия
преждевременно отомрет: для питания клеток
не хватило белков.
Если же при прорастании
семени азотное питание было
достаточным, а в фазу трех-четырех
листьев даже обильным, белки в
тканях будут хорошо обновляться,
образуются новые клетки, новые
колоски, цветки и зерна.
Меняя систему питания азота
по фазам, можно повлиять на
развитие верхней, средней или
нижней части соцветия, на число
цветков и даже на их способность
образовывать семена. В метелке
74
проса, например, число зерен
может колебаться от 8—20 до
280 штук и больше в зависимости
от дозы и срока внесения азота.
Итак, системы питания
растений фосфором и азотом
различны. Прорастание оказывается
самым сильным, если молодое
растеньице получает сначала больше
фосфора# а несколько позже —
азота.
Третий важнейший элемент
питания растений — калий.
Его роль в MCKJWt клеток
чрезвычайно многообразие. Без
«СПРОСИТЬ МНЕНИЕ
РАСТЕНИЯ»
Чтобы получить хороший
урожай, агрохимику надо изучить
условия, в которых предстоит
развиваться растению. Важно
узнать состав и свойства почвы:
обеспеченность влагой и
воздухом, кислотность, засоленность,
плотность, структуру и т. д.
Необходимо уяснить причины и
особенности плодородия каждого
участка пашни, учесть его
предшествующую обработку:
количество внесенных прежде
удобрений, вид севооборота-
калия клетки хуже удерживают
воду, а ведь в них все реакции
обмена и образования новых
соединений происходят в растворах.
Присутствие калия необходимо и
на некоторых этапах синтеза
белка. В последнее время доказано,
что многие ферменты клетки
становятся активными только в том
случае, если в их состав входит
калий.
Калий связан с процессами
фотосинтеза и образованием
углеводов в зеленых частях растения,
с их дальнейшим превращением
А чтобы создать условия,
в которых растение сможет дать
самый большой урожай, надо
принять во внимание все его
потребности — «спросить мнение
растения», как учили К. А.
Тимирязев и Д. Н. Прянишников.
«Мнение растений» выясняют
разными методами. Один из
самых надежных — полевой опыт:
поле разбивают на несколько
участков# вносят на каждом из
них удобрения разного состава и
количества, а затем внимательно
наблюдают за развитием
растения и формированием урожая.
Если растению не хватает
того или иного элемента питания,
и транспортировкой из одних
органов в другие. Если растению
не хватает калия, то цветы не
развиваются дальше фазы мелких
бутонов, бутоны не цветут и
семена не завязываются. Таким
образом, калий нужен растению
постоянно.
Кроме того, выявлена его
роль в конце вегетационного
периода, когда накопленные в
листьях органические питательные
вещества должны передвинуться
в семенау плоды, клубни, в
корнеплоды и зимующие органы.
это определенным образом
сказывается на его внешнем виде.
Например, азотное голодание
делает листья (особенно нижние,
более старые) бледно-зелеными,
жесткими, узкими; растение плохо
растет и быстро плодоносит,
давая незначительный урожай семян.
О недостатке фосфора
говорят коричневые лятна на нижних
старых листьях и фиолетовая
окраска черешков и стеблей.
Растение плохо растет и
плодоносит.
От нехватки калия нижние
старые листья коробятся {на них
появляется «краевой ожог»),
покрываются пятнами омертвевшей
75
ткани, рост и плодоношение
растения резко задерживаются.
Мало в почве магния —
образуются белые пятна или полосы
на нижних листьях. При борном
голодании страдает верхушка
растения, нет нормальных цветов и
плодов| у корнеплодов
развивается «гниль сердечка».
Когда не хватает меди,
появляются листья с побелевшими
кончиками, а растение образует
недоразвитые, не способные дать
зерно белесые колосья.
Такие внешние признаки,
свидетельствующие о нарушении в
питании растений, установлены
почти для всех химических
элементов.
Однако с помощью
визуальной диагностики не всегда удается
определить, сколько и каких
веществ не хватает растению. Это
понятно: растение может
одновременно испытывать недостаток
(или вредный избыток) не одного,
а нескольких элементов питания.
Кроме того, метод помогает
фиксировать только резкое
нарушение режима питания и не
подсказывает дозу необходимых в том
или ином случае удобрений.
Наконец, известно, что внешние
признаки «болезни» появляются
довольно поздно когда питание
уже сильно нарушено. Но как
важно именно вовремя заметить
первые признаки наступающего
голодания!
И вот тут большую -помощь
могут оказать методы химической
диагностики.
Один из таких методов —
анализ общего содержания в
растении азота, фосфора, калия и
других элементов после кислотного
озоления растений.
Метод очень хороший, но
требует специального
лабораторного оборудования.
Есть и более простые
способы— например, определение
внутренних резервов питания,
которые растение еще не успело
использовать. Если анализ
показывает, что таких резервов в тканях
растения нет, значит, оно
начинает голодать и нуждается в
подкормке.
Обнаружить эти резервы
можно разными способами, но
все они основываются на
следующих общих принципах.
Установлено, что
неорганических соединений больше в тех
органах растения которые
расположены ближе к корням и
густо пронизаны крупными
сосудами. Неорганические веществе
движутся из корней по сосудам в
верхние части растения и по пути
постепенно расходуются.
Особенно быстро
«потребляются» нитраты, и поэтому к
точкам роста и цветкам они дойти
не успевают. У некоторых
растений они восстанавливаются
полностью уже в корнях, а в стеблях,
ветвях и листьях их вообще
нельзя обнаружить.
Чем старше растение, тем
меньше в нем концентрация
питательных веществ. Это
происходит, во-первых, потому, что
поглощенные вещества как. бы
разбавляются во все
увеличивающейся массе растения и, во-вторых,
потому, что взрослое растение
хуже поглощает питательные
вещества из почвы.
Для анализа содержания
питательных веществ в
растительном организме создаются
специальные приборы. Чтобы
установить, что ограничивает рост
растений — нехватка питания или
какие-то другие причины, надо
сопоставить результаты химического
анализа растений с их весом,
ростом и развитием, с
признаками болезни, обнаруженными при
визуальной диагностике, со сведе-
76
ниями о почве, погоде и
агротехнической обработке. Например,
если растение -плохо растет, но
содержит много питательных
веществ, значит рост
ограничивается не питанием, а чем-то другим,
избытком или недостатком влаги,
нехваткой воздуха корням и т. д.
После полива, рыхления или
другой обработки надо еще раз
проанализировать химический состав
растения.
Если причина, сдерживавшая
рост, установлена правильно и
устранена вовремя, растение
начнет усиленно расти и ему может
потребоваться дополнительное
питание.
Вывод о недостающих
удобрениях необходимо сопоставить
с результатами наблюдений за
ростом и питанием растения по
фазам его развития.
Оптимальными режимами литания
признаются те, при которых получается
самый высокий урожай.
L
1 -5
СОРНЯК-УБИЙЦА..
УБИТ
Повилика — злостный сорняк,
опасный и коварный враг многих растений.
Жертвами повилики становятся
важнейшие сельскохозяйственные и технические
культуры: свекла, хлопчатник, виноград,
кормовые травы. Это —
растение-паразит. У повилики нет ни корней, ни
листьев. Обвившись вокруг чужих стеблей,
она, как вампир, высасывает из них соки
для своего питания. От объятий повипики
растения болеют, а иногда и гибнут.
Как показали эксперименты, отпичным
средством борьбы с повиликой на полях,
засеянных клевером и люцерной,
оказался пентахлорфенопят натрия. С каждого
гектара посевов после такой обработки
удалось получить «сверх плана» до
десяти центнеров высокосортного
душистого сена.
ЭЛЕКТРОМАГНИТЫ
НА ХЛОПКОВОМ ПОЛЕ
Некоторые ученые считают, что на
сману ядохимикатам — классическим
средствам борьбы с
сельскохозяйственными вредителями придут...
электромагнитные волны. Эксперименты показали, что
электромагнитные колебания с длиной
волны 465—515 миллимикрон оказываются
отличным «инсектицидом» против одного
из самых опасных вредителей хлопковых
плантаций — хпопкового допгоносика.
•
АКУСТИЧЕСКИЙ МЕТОД
БОРЬБЫ С НАСЕКОМЫМИ
Дпя борьбы с насекомыми на скпа-
дах зерна и других продуктов
американцы пользуются усиленным звуком.
Воздействием звуковых вопн из динамиков
на огневку амбарную в период кладки
яиц удалось в 4 раза уменьшить выход
гусениц, а те, что все-таки появипись на
свет, развивались медленнее обычного.
Половина их подох па в первый же день.
77
СИРЕНЕВЫЙ
КРИСТАЛЛ
Александр МЕЕРОВ
На первое свидание с Сиреневым Кристаллом я несколько опоздал. Не по своей
вине, правда. «Летучий Голландец», на который я пересел в Праге с нашего
турбореактивного лайнера, опустился на аэродроме в Схипхоле в субботу двадцать девятого
августа. Знаменитый аукцион был назначен на десятое сентября, и я рассчитывал успеть
за оставшиеся дни выполнить задание института, командировавшего меня в Голландию.
Однако все вышло несколько иначе. Уже в аэропорту, где меня встретил сотрудник
торгпредства Сергей Васильевич Ушаков, я узнал, что аукцион перенесен, состоится
завтра, и я не смогу уже провести намечавшиеся исследования Сиреневого Кристалла.
Настроение у меня упало. Сергей Васильевич поспепнгл несколько подбодрить меня:
— Принимаются все меры к тому, чтобы достать для вас разрешение на вход
в подвалы Алмазной фирмы. Часам к двенадцати, Алексей Николаевич, это должно
выясниться. Ну, не унывайте! Попробуем все устроить. А теперь, если вы не
возражаете, давайте пробираться к выходу. Ваш багаж уже в машине. Я отвезу вас в гостиницу.
Сергей Васильевич был любезен, приветлив и, сочувствуя мне, старался во всю.
И все же меня не покидало ощущение, что прилетел я сюда зря. Садясь в машину,
мы накупили свежих газет. Так как в те дни о Сиреневом Кристалле знали еще
слишком мало, журналисты информировали читателей, полагаясь больше на свою
изобретательность, чем на факты. О кристалле писали броско, взахлеб и, главное,
пространно. Газеты даже перечисляли всех лиц, приехавших в Амстердам в связи с
предстоящим событием. Упоминалось и обо мне: «Знаменитый советский ученый Алексей
Курбатов прибыл в Амстердам, намереваясь принять участие в аукционе». Здесь газета
соврала трижды: я не был знаменитым ученым, я еще не прибыл, когда она была
отпечатана, и, наконец, меня никто не уполномочивал покупать с торгов кристалл.
Отель «Виктория» был переполнен. Повсюду слышались разговоры о кристалле,
высказывались фантастические предположения о его стоимости, заключались пари,
словом, ажиотаж вокруг драгоценности, о которой всего месяц назад в Амстердаме
никто ничего не знал, достиг апогея. Историю появления Сиреневого Кристалла в Гол-
ландии я узнал из источников разнообразных, вполне достоверных, и теперь смогу
рассказать о ней довольно подробно.
78
Примерно за месяц до моего приезда в Амстердам, уроженец далеких островов
Паутоо, Дагир привез в «столицу бриллиантов» камень, который не без оснований
считал невероятной драгоценностью. Однако в течение многих дней паутоанцу не удавалось
сбыть его. Ювелиры с нескрываемым интересом рассматривали невиданный сияющий
кристалл, восхищались им, но купить не решались. Кристалл не похож был ии на один
из привычных, известных драгоценных камней, и это отпугивало.
Дагиру оставалось только одно — попробовать повидаться со знаменитым Бейсом.
Старый знаток драгоценностей, узнав, что Дагир привез из Паутоо необычайный
камень, принял паутоанца, пришел в восторг от камня, заявил, что ничего подобного
нет на Земле, назвал его «сокровищем звездных миров», однако оценить сокровище
отказался, пообещав сделать это через несколько дней.
При следующей встрече Бейс вел себя решительнее, так как узнал, кто
заинтересован в приобретении кристалла. Казалось, все идет как нельзя лучше — Дагир иашел,
наконец, возможность сбыть драгоценность, Бейс уже рассчитывал на солидную сумму
комиссионных, но... как только хитрый и подозрительный паутоанец узнал, что кристалл
нужен фирме «Ченснепп-каучук», он насторожился, ответил Бейсу уклончиво и больше
у него не появлялся.
Дагиром заинтересовалась знаменитая Алмазная фирма, решившая не упустить
случая и взять сделку в свои руки.
В это время Дагир подвергся необычному нападению.
Вечером, сойдя с автобуса на Суринам-плейн, он направился в гостиницу. Узкая
Деркиндер-страат, довольно тихая и малолюдная даже в дневные часы, в это время
была совсем пустынна. Дагир знал, что позади его никто не идет, и вдруг почувствовал
толчок е спину. Быстро обернувшись, он увидел какой-то продолговатый темный
предмет, напоминающий длинный прямой огурец. «Огурец» висел в воздухе, неподвижно,
пугающе. Дагир попятился, «огурец» приблизился к его груди, где была спрятана
ладанка с кристаллом. Паутоанец ощутил, что от таинственного темного тела исходит
тепло, что тело это начинает давить ему на грудь с довольно большой силой, и, прижав
рукой драгоценную ладанку, бросился бежать. Редкие прохожие с недоумением
шарахались в сторону при виде человека, стремглав несущегося по тихой, чопорной улице.
Кто-то, как потом выяснилось, даже заметил, что за мчавшимся в развевающихся
одеждах паутоанцем будто бы летел какой-то странный предмет.
Дагир спасся от преследования в своей гостинице.
На другой день Дагиру показалось, что «огурец» снова появился у него за спиной.
Он вскочил в такси и помчался в контору Алмазной фирмы. По выходе из автомобиля
Дагир явственно почувствовал толчок в спину, но уже не оборачивался, а поспешил
вбежать в вестибюль.
Эти странные нападения ускорили события, и паутоанец, запросив несколько больше,
чем ему предлагал Бейс, поспешил продать Алмазной фирме Сиреневый Кристалл.
Дагир, по всей вероятности, вздохнул с облегчением, а у фирмы началось
тревожное время.
В первые дни, однако, все было спокойно. Сиреневый Кристалл находился в
надежном хра-нилшце, а рассказам Дагира о нападении на него «огурца» управляющий
просто ие придал никакого значения. К этому времени стало известно, что
Сиреневым Кристаллом, помимо концерна Ченснеппа, интересуется конкурирующий с ним
концерн, возглавляемый Отэном Картом. Дело принимало благоприятный дли
Алмазной фирмы оборот. Управляющий фирмой не привык упускать возможностей, умел
поставить дело на широкую ногу и разослал описание паутоанского феномена научным
учреждениям различных стран мира. Описание это он сопроводил учтивым
приглашением принять участие в изучеш'и кристалла и, если будет угодно, в аукционе.
На приглашение Алмазной фирмы откликнулось несколько научных организаций,
пославших в Амстердам своих представителей.
В субботу 22 августа, то есть как раз за неделю до моего приезда в Амстердам,
в одном из просторных помещений пятого этажа, отведенных для лаборатории,
происходило очередное заседание комиссии ученых. На заседании управляющий фирмой,
79
госпо щи Ионгель, объявил о решении членов правления назначить аукцион на десятое
сентября. Господин Ионгель предложил ученым в оставшееся время продолжать
исследования всеми доступными средствами.
В этот момент раздался звон разбиваемых стекол. Словно несколько крупных
камней были брошены кем-то в огромные зеркальные окна, и в помещении вдруг
появились три темных продолговатых предмета. Они повисли над столом, вокруг которого
собрались заседавшие, и через несколько секунд стали медленно сближаться друг
с другом, в то же времи двигаясь к тому месту, где лежал Сиреневый Кристалл. Как
только расстояние между ними и кристаллом уменьшилось примерно до полутора
метров, кристалл вместе со стеклянным колпаком, которым он был прикрыт, стал
плавно подниматься в воздух, приближаясь к повисшим над ним коричневатым,
излучающим тепло предметам.
Трудно представить, что чувствовали присутствовавшие. Меньше всех растерялись
два человека — корреспондент одной из газет и управляющий фирмой.
Корреспондент успел сфотографировать происходящее, а господин Ионгель отшвырнул
стеклянный колпак и зажал в кулаке драгоценность. В этот же миг продолговатые
предметы беспомощно засуетились, то подскакивая к замершему бледному Йонгелю, то
отлетая от него в дальние углы помещения, и вдруг исчезли так же внезапно, как и
появились.
Для Алмазной фирмы наступили нелегкие дни. В тот же день совещание членов
правления приняло решение — перенести аукцион на тридцатое августа и поскорее
избавиться от слишком таинственной и беспокойной драгоценности.
Вот так обстояли дела в Амстердаме к моменту моего приезда. Сиреневый Кристалл
теперь хранился в особых фондах Алмазной фирмы. Хлопоты Сергея Васильевича
успехом не увенчались. Г-н Ионгель был любезен, предупредителен, сам вызвался проводить
нас в хранилище, чтобы показать кристалл перед аукционом, однако доставить его
в лабораторию для исследования отказался. Делать было нечего — пришлось
удовольствоваться только осмотром.
Мы переходили из одного помещения в другое, за нами автоматически задвигались
стальные двери, было немного жутковато: а вдруг автоматика подведет, и ты
останешься здесь навеки! Каждое помещение тщательно осматривалось — не проникли ли сюда
охотники за кристаллом — и только после этого, по кодированному сигналу, даваемому
лично господином Понгелем, перед нами раздвигалась следующая стальная дверь.
«Шлюзование» это заняло порядочно времени, но все же мы очутились, наконец, в
небольшой стальной комнатке, где я увидел впервые Сиреневый Кристалл.
От кристалла, величиной с голубиное яйцо, исходили лучи нежносиреневого цвета.
Прозрачный, слегка опалесцирующий, он светился всеми оттенками от голубоватого
до густолилового. Казалось, в нем самом скрыт источник мягкого, но интенсивного
света. Камень словно был живым. Он то заполнялся сиреневым свечением, в котором
угадывались кровавые искорки, то вспыхивал фиолетовым сиянием. Сиреневые лучи.
исходившие от его граней, то укорачивались, то удлинялись, создавай над ним
своеобразную корону.
...На следующий день состоялся аукцион. Он привлек не только
аукционеров-дельцов и представителей научных обществ, но и немалое количество бездельников, богатых
дам, неравнодушных к драгоценностям, и, конечно, репортеров всех и всяческих
разновидностей.
Скоро всем стало понятно — усилия представителей научных обществ, желающих
приобрести столь интересующий науку феномен, тщетны. Борьба, собственно,
разгорелась между агентами двух гигантских химических концернов, которые, по-видимому,
знали о кристалле нечто, побуждавшее их предлагать за него все большие и большие
суммы. Состязание шло с переменным успехом. Был момент, когда казалось, что камень
останется за концерном Отэна Карта, но агенты Нума Ченснеппа назначили еще
большую сумму.
Удар молотка. Тишина.
Удар. Еще удар, и Сиреневый Кристалл остается за концерном ^Ченснепп-каучук».
Сразу же после аукциона Сиреневый Кристалл с невероятными предосторожностями
был помещен в специальную автомашину, напоминавшую танк. Охрана тоже
разместилась в этом своеобразном сейфе. Восемь вооруженных мотоциклистов окружили
передвижное хранилище. Зрелище было внушительное.
Сергей Васильевич резонно заметил, что нам следует поспешить, так как вся эта
процессия не даст нам возможности проехать. Мы тронулись в путь, маневрируя
между автомобилями, скопившимися у здания, где проходил аукцион, и вскоре уже
были за несколько кварталов от медленно двигавшегося эскорта, направлявшегося
к Утрехтскому шоссе, чтобы прямо в танке-сейфе доставить чудо-камень за границу,
в институт концерна «Ченснепп-каучук».
Мне уже казалось, что события этого дня кончились, но не тут-то было! Не успели
мы выехать к площади Ватерлоо, как услышали вой полицейских машин. Их было
много. Они мчались в сторону Ниу Маркет, и мы поняли — началось нападение на по
купку Ченснеппа.
На Ниу Маркет, куда направлялась процессия с кристаллом, произошел затор,
и танк-сейф со всеми сопровождавшими его машинами остановился среди площади.
В этот момент и началось нападение.
Сергей Васильевич, в совершенстве знающий путаный старый город, сделал все
возможное, чтобы в несколько минут, ловко обогнув улицы, по которым проносились
полицейские машины, попасть к месту происшествия. Забравшись на крышу нашей
машины, мы увидели всю площадь, танк-сейф, окруженный охраной, и жмущихся
к домам людей. Вокруг Ниу Маркет, на всех ближайших улицах и набережных
подходящих к ней каналов движение прекратилось. На мостике через Гельдерс-канал замерли
десятки автомобилей и на их крышах тоже виднелись любопытные. Вооруженные
отряды полиции прибывали со всех сторон, с трудом пробиваясь через запруженные
подходы к месту происшествия. Корреспонденты, разумеется, были тут же. Один из них
успел примоститься на ветвях высокого дерева и обстреливал своей кинокамерой всю
площадь.
В первый момент ничего нельзя было разобрать, мы даже не поняли, что именно
послужило причиной всей этой суматохи. Уже после мы узнали, с чего все началось.
Как только танк, задержанный затором, остановился на площади, на него обрушилось
несколько «камней». Мотоциклисты открыли огонь по нападающим, поднялась тревога.
«Нападающие», не обращая никакого внимания на обстрел из автоматов, безуспешно
пытались проникнуть внутрь танка-сейфа. Положение сидящей в нем охраны было
сложным. Отстреливаться от «охотнников» за драгоценностью они не могли, рискуя
попасть в прохожих. А «охотники» все настойчивей стремились к кристаллу. Они бились
о стальные стенки, залезали под гусеницы, нигде не находя нужного им отверстия и,
наконец, начали прожигать броню. Взвился фейерверк яркофиолетовых искр, танк
скрылся в клубах сиреневого дыма. Все это вконец обескуражило автоматчиков.
Подоспевшая к этому времени полиция была так же беспомощна. Но все стреляли.
Пожалуй, больше в воздух, для собственного успокоении. Старинная площадь, некогда
бывшая безмятежным, изобильным и пестрым рыбным рынком города, превратилась
в поле сражения. Словом, смятение было немалым, так как сражаться со столь
необычными грабителями еще никому не приходилось.
И вдруг все затихло.
Когда мы взобрались на крышу свой машины, «нападающих» уже не было у танка.
Клубы дыма медленно уплывали вверх, влево, исчезая где-то за остроконечной Новой
Кирхой. Все замерло. Но каждому почему-то казалось, что атака должна возобновиться.
Полиция теснила толпы любопытных, не очень-то убоявшихся стрельбы,
мотоциклисты выстроились вокруг танка и танк двинулся. В этот момент на него, нивесть откуда,
снова посыпался град «камней».
И... танк-сейф начал приподниматься.
Вот гусеницы бронированного автомобиля уже беспомощно вращаются в воздухе
и он повис на высоте человеческого роста над площадью, а темные загадочные
предметы, словно рождаясь из ничего, все летят и летят, облепляя его со всех сторон. Танк-
81
I
<
и
<
X
<
сейф продолжает медленно подниматься. Вот он уже над восьмигранными пирамидами,
венчающими низкое здание музея. Здесь ои ненадолго замер, подался немного в
сторону, по направлению к Дамраку, потом решительно двинулся к северу и поплыл над
улицей Зеедайк, приближаясь к собору Святого Николая, хорошо видимому с площади
Ниу Маркет. Танк уменьшался на наших глазах, удаляясь все дальше и дальше. Вот
он уже выше серебристо-зеленого купола собора. Здесь он плавно развернулся на
восток, вскоре превратился в едва заметную точку и исчез вместе с Сиреневым
Кристаллом и людьми, его охраняющими.
С таких поистине драматических событий начинается научно-фанта
стический роман Александра Меерова «Сиреневый Кристалл», в основу
которого положена гипотеза о возможности существования жизни на базе
не углерода, а кремния.
Вы сразу заметили, конечно, что знаток драгоценностей Бейс назвал
Сиреневый Кристалл «сокровищем звездных миров». Он, разумеется, не
оговорился.
...На тропических островах Паутоо издревле существовала легенда
о пришествии могущественного Небесного Гостя, в честь которого некогда
был сооружен храм, разрушенный затем землетрясением.
Русский ученый Вудрум находит в развалинах храма остатки странного
небесного тела, в основном состоящие из силиция — кремния, и «глаза
божества» — два загадочных Сиреневых Кристалла. Через некоторое время,
не без помощи ученых, Небесный Гость оживает. Один за другим
возникают «биосилициты» — не то живые существа, не то наредкость хитроумные
кибернетические устройства. По имени ученых Юсгора и Родбара биоси-
лициты одного типа были названы юсгоридами, а другого — родбаридами.
Но с какой целью Небесный Гость пожаловал к нам?
Деятельность биосилицитов на первых порах носила хаотический
характер. Первым целеустремленным действием юсгоридов, собственно, и было
похищение танка с Сиреневым Кристаллом. Точнее сказать, не похищение,
а перепохищение, поскольку обнаруженные впервые Вудрумом «глаза
божества» похитил сначала агент химических монополий профессор Асквитг
а у него, в свою очередь,— уроженец Паутоо Дагир. Правда, Дагиру
удалось выкрасть лишь один Сиреневый Кристалл — второй остался у Асквита.
Как и следовало ожидать, юсгориды не проявили никаких
милитаристских тенденций и через несколько дней вернули танк на площадь Ниу
Маркет. Однако — этого тоже следовало ожидать — Сиреневый Кристалл
Эй они не вернули.
Сиреневый Кристалл был оставлен ими в пустыне Кара-Кум под
надежной охраной.
Зачем?
Об этом, как и о цели пришествия биосилицитов на нашу планету, ей
Q сейчас узнаете.
Первый сигнал
Над песчаным берегом Таманского залива повисло множество юсгоридов. Они
образовали плоскость, расположившись в пяти метрах над песком. Время от времени
то один, то другой юсгорид пикировал, и в том месте, где он врезался в песок,
начинал расти ком. Каждый ком рос с такой скоростью, что уже часа через два можно
было распознать в нем нашего старого знакомого — родбарида. Как только размер»
82
родбаридов достигал полуметра в поперечнике, они переставали расти, но продолжали
уничтожать песок, превращая его в стекловидную массу. К вечеру их работа была
закончена, и мы увидели, что под слоем юсгоридов, висевших неподвижно, образовалась
чаша.
Биосилициты не препятствовали нам наблюдать за ними, и даже возня с нашими
громоздкими киносъемочными средствами, как видно, не обеспокоила их. Как и всегда,
они не вмешивались в наши действия, поскольку мы не мешали их работе.
Вскоре нам представился случай убедиться в том, что мы, пожалуй, при всем
желании ие смогли бы помешать все еще непонятной для нас затее.
В тот день над заливом, как обычно, носились с криками чайки. Они вылавливали
в тихих его водах пропитание, а потом усаживались передохнуть и поболтать на
выступавшие кое-где из воды камни. Когда день подошел к концу, насытившееся пернатое
общество стало покидать крохотные островки и, не обращая внимания на кипучую
деятельность силициевых тружеников, примым путем направилось к своим ночным
убежищам. Но не тут-то было. Подлетая к тому месту, где быстро и размеренно
сооружалась чаша, птицы ударялись о что-то невидимое, как о стену. Многие падали тут же,
некоторые отлетали к самому прибою, отброшенные незримой преградой. Возмущению
чаек не было границ, а нам стало ясно — сооружение юсгоридов окружено каким-то
мощным силовым полем.
В эту ночь никто из нас не заснул. Кинооператоры прибыли почти одновременно
с нашей машиной и не упускали возможности фиксировать на пленку все происходящее
на отмели. На ближайших от необычной стройки скалах были установлены мощные
прожекторы, и когда операторам стало нехватать дневного света, они в изобилии
получали искусственный.
Как только гигантская параболическая чаша была закончена (мы все еще
удивлялись совершенству ее отделки и скорости, с какой она была создана), в слое юсгоридов,
которые до того момента висели совершенно неподвижно, начались перемещения.
В голубоватых лучах наших мощных прожекторов юсгориды засверкали волшебным
хороводом. Создаваемый ими пространственный орнамент то вдруг замирал, то вновь
приходил в замысловатое движение. Из круга вырывались иногда отдельные особи
v уносились вверх как ракеты; другие, очерчивая в воздухе вытянутые эллипсы,
создавали в пространстве ослепительные лепестки фантастического цветка.
В разгар причудливого танца количество юсгоридов увеличилось. Вновь
появившиеся силициты повисли вокруг пляшущих собратьев, словно кольцо застывших в
восхищении зрителей. Однако бездельничали они недолго и уже через несколько минут
начали образовывать над чашей нечто вроде ажурной башни. Внутри основания башни
еще продолжалась пляска юсгоридов, но теперь движения их замедлились, словно
исполнители устали.
Часам к трем ночи все почти замерло. Башня стояла неподвижно. Рой юсгоридов
внутри нее медленно выводил свои рисунки.
Времи шло, ничто не менялось. Юсгор, укутавшись в плед, кажется, даже
вздремнул в уголке машины. Асквит уже стал ворчать, что спектакль ему наскучил.
— Черт знает что. Кто так ведет программу? Действие должно неуклонно
нарастать. Что если нам часок поспать в палатках, а Юсгора попросить подежурить? Он
уже успел выспаться...
Но тут заработала рация, н сон сразу же вылетел у всех из головы.
Наблюдательный пост в Кара-Кумах сообщил, что Сиреневый Кристалл покинул свою «резиденцию»
и в сопровождении постоянно охранявших его юсгоридов двинулся к Таманскому
заливу...
А затем события стали нарастать с такой быстротой, что у Асквита уже не было
поводов жаловаться на спад действия.
Юсгориды, с непостижимой скоростью доставившие к нам Сиреневый Кристалл,
расположились вокруг него, как бы повторяя его форму. Кристалл сиял ярче обычного,
светились и сопровождавшие его юсгориды, пульсируя, переливаясь всеми цветами
радуги. Вскоре он очутился в чаше —в фокусе параболоида. В воздухе послышалось
гудение, вскоре перекрывшее шум движков, подававших электроэнергию прожекторам.
До сих пор юсгориды ни разу не вмешивались в наши действии, но через несколько
минут после того, как Сиреневый Кристалл расположился в параболоиде, восемь юсго-
ридов приблизились к щиткам наших походных электростанций и отключили питание.
Электрики не растерялись и вновь включили рубильники, но юсгориды опять прекратили
поступление энергии. «Игра» продолжалась до тех пор, пока электрики не подключили
прожекторы к электрической цепи, минуя рубильники.
Не без тревоги ждали мы, что последует за этим. Но, в конце-концов, мы хозяева
планеты и имеем право видеть, что творят здесь пришельцы!
Биосилициты поступили просто, так просто, что физики и по сей день разводят
руками.
Видимо, всей затее силицитов мешали потоки прожекторного света. Вместе с тем
им некогда было возиться с разгадыванием наших электросхем. Поэтому они
ограничились тем, что... искривили световые потоки. Лучи прожекторов, как несмышленные
чайки, натыкались на невидимую преграду, плавне огибали ее и уходили в небо,
подсвечивая нависшие над песчаной косой плотные облака.
А вскоре в облаках над ажурной башней, словно вырезанное аккуратно ножичком,
образовалось отверстие, и теперь башня вершиной своей смотрела в чистое звездное
небо.
Тем временем гул все нарастал. Какие-то переливчатые волны побежали вокруг
башни, и она начала наклоняться. Вершина ее, совершая круговые движения, как бы
нащупывала что-то во Вселенной. Вырез в облаках покорно следовал за ее движениями.
Они становились все более плавными, замедлялись и, наконец, прекратились. Башня
замерла, и из нее вырвался ослепительный луч, пульсирующий, тонкий, совсем не
расширяющийся.
Одновременно в центре башни, над параболической чашей, возник такой хоровод,
какого никто из нас еще не видел. Теперь стало ясно, что Сиреневый Кристалл —
душа событий. Все было сосредоточено вокруг него, все неуловимо подчинялось его
импульсам. Десятки юсгоридов, засветившихся различными цветами, переплетались
в пространстве, то замирая, то вновь ритмично изменяя узоры. Все сооружение
пульсировало, лучилось, устремляясь ввысь, туда, где сверкала их Звезда.
Что было потом?
Не знаю. Не м®гу описать. Помню только, что беспрерывно создаваемые юсгори-
дами узоры как бы понеслись по устремленному в космос лучу,— и все погасло.
Какими бледными показались теперь вновь распрямившиеся лучи наших
прожекторов, осветившие параболоид!
Исчез Сиреневый Кристалл. Исчезла ажурная башня. Отдавшие всю свою энергию
юсгориды неподвижно лежали в огромном сосуде.
С рассветом иа берегу снова появились родбариды. Двигались они медленно,
совершая на этот раз печальное дело — закрывая выпускаемой из себя стекловидной массой
параболоид, наполненный телами юсгоридов. Чаша подернулась темным покровом, и
аккуратные родбариды засыпали все морским песком. Как только они закончили эту
операцию, появилась новая партия юсгоридов и унесла силицитовых строителей.
На песчаном берегу залива все стало таким же, каким было накануне утром.
Крикливые чайки как ни в чем ни бывало сидели на своих камнях и носились над морем,
выискивая рыбешку.
Неудача
Так биосилициты послали первый сигнал к себе на родину. О чем сообщали они,
мы не знали, конечно.
Из поездки к Таманскому заливу я вернулся на день позже Асквита, и, как только
появился в Объединенном институте, мне передали, что он хочет меня повидать.
Когда я вошел в его кабинет, ои посмотрел на меня пристально, будто видел в
первый раз, достал яркооранжевую коробочку и протянул мие.
— Вы добивались его настойчиво и бескорыстно. Возьмите. Можете передать Си-
лицитовому комитету. Заказывать брошку для своей будущей жены не рекомендую —
юсгориды уволокут. Впрочем, они ничего не могут поделать, если кристалл, например,
зажат в кулаке. Помните, как ловко схватил его управляющий Алмазной фирмой?
Убежден, что творцы силициевых разведчиков наделили их свойствами весьма
гуманными.
— Пожалуй, это верно, профессор. Очевидно, заложенная в Сиреневых Кристаллах
программа запрещает юсгоридам причинять вред живым существам исследуемой ими
планеты. Они не смогли отнять Сиреневый Кристалл у Дагира, у Ионгеля, они не
причинили вреда ни одному живому существу на Земле.
— Вот и вы не бойтесь — берите!
Я все еще не мог поверить, что в протягиваемой Асквитом коробке лежит второй
«глаз божества» — второй Сиреневый Кристалл.
— Вы это серьезно?
— Берите. Какого черта, в самом деле. Берите, а то передумаю.
Я придвинул коробку к себе.
— Не вздумайте снять с него кремниевую оболочку. Юсгориды примчатся через
несколько минут и перебьют здесь все стекла. Разумные существа! Мерзавцы просто!
— Да расскажите толком, что случилось?
Асквит передал мне несколько телеграмм. Я быстро прочел их, и мне стало ясно,
почему он так поносит юсгоридов. Осуществив связь со своим миром и, видимо, получив
нужную им информацию, они в течение суток побывали всюду, где на потребу
монополий трудились подвластные кристаллу Асквита родбариды, и унесли их. Асквит,
мечтавший приобрести деньги и власть, добывая с помощью родбаридов редчайшие металлы,
обанкротился. Сиреневый Кристалл теперь уже не мог принести ему никакой пользы.
Зазвонил телефон. Асквит выслушал и несколько оживился.
— Началось!
— Что началось?
— Собирайтесь в Кара-Кумы!
... Рано утром, с трудом преодолевая крутые барханы, вездеходы вышли, наконец,
к возвышенности, с которой уже хорошо были видны постройки наших неутомимых
гостей.
Они недаром избрали Кара-Кумы. Более сорока различных минералов раздроблены,
перемешаны и насыпаны здесь — обильный корм для родбаридов, возводящих какое-то
гигантское сооружение. Оно возвышалось уже метров на двести.
Мы расположились на ближайшем от стройки такыре, естественной площадке, на
которую могли опускаться вертолеты. Еще неизвестно было, подпустят ли нас
строители поближе, и на первых порах мы довольствовались биноклями.
Юсгору раньше всех удалось разглядеть Сиреневый Кристалл, который, как и в
ночь посылки силицитами первого сигнала, висел в воздухе, окруженный юсгоридами.
Из него время от времени вылетали по направлению к постройке тонкие прямые нити —
лучи, и там, куда попадали эти пучки света, родбариды ускорили свою работу.
— Как вы думаете, Юсгор, спросил я,— для чего они затеяли все это?
— Домой хотят. Очень!
Некоторое время биосилициты, казалось, не замечали нас, но на пятые сутки явно
заметили.
В ту ночь они действовали еще быстрее обычного. Сооружение, словно высеченное
из светящегося мрамора, уже достигло высоты триста метров.
Весь день, ежечасно мы передавали в Ашхабад сводку наблюдений. Оттуда сводки
летели в Москву и далее в Объединенный силицитовый институт.
В девять нам передали из Ашхабада, что там очень смущены действиями силици-
тов: они вернули все три посланных нам вертолета. Мы еще не успели сообразить,
каким образом биосилициты могли проделать это, а нас уже ожидали новые сюрпризы.
85
Часам к десяти вечера к такыру, на котором мы располагались, со всех сторон
двинулись родбариды. Мы и не подозревали, что их так много развелось в каракумских
песках. Как только родбариды достигали края плотной глинистой площадки, они
вгрызались в грунт и вползали под такыр. Не прошло и часа, как родбариды начали
выползать из-под такыра, по границам которого уже образовалась кромка из прочной
стекловидной массы. Это были края ребристой платформы, подведенной под занимаемую нами
площадку. Тотчас же после того, как родбариды закончили свою работу, юсгориды
ринулись к краям платформы; мы почувствовали толчки, словно началось землетрясение,
и -наша площадка, как некогда танк-сейф в Амстердаме, начала приподниматься.
Нас настоятельно просят удалиться,— заметил Асквит.
Огромный такыр со всем нашим хозяйством—с палатками, фургонами,
вертолетами и автомобилями — поднялся в воздух.
Видимо, и для силицитов перемещение в пространстве таких огромных масс было
целом нелегким. Мы медленно плыли к юго-западу. И уже начали спорить, попадем ли
прямехонько в Ашхабад, или нас отнесет западнее, как начался спуск. Пролетев еще
метров пятьсот, наш такыр с легким толчком приземлился на самой возвышенной части
каменистого плато.
Не успели мы прийти в себя, как юсгориды исчезли. Они явно спешили. Отодвинув
нас подальше от своего сооружения, но не лишив возможности любоваться им издали,
силициты мгновенно вернулись к Сиреневому Кристаллу.
Вся надежда теперь была у нас на оптику. Кинокамеры с телеобъективами,
бинокли, подзорные трубы, оптические прицелы — все было пущено в ход.
Сиреневый Кристалл пульсировал так, что даже с нашей новой позиции было
видно, как от него идут тончайшие лучики. Все сооружение, устремленное в звездное небо,
как бы вытянулось, засверкало ярче прежнего, и мы поняли — через несколько минут
оно должно оторваться от Земли.
Но в то же время возникало сомнение — состоится ли этот полет,— постройка
казалась какой-то несимметричной, незаконченной.
Минут через тридцать после того, как мы были эвакуированы на безопасное
расстояние от снаряда, он плавно, слегка наклоняясь в сторону вращения Землн, начал
приподниматься иад площадкой; но, не поднявшись и на километр, стал заметно
заваливаться на одну сторону и в конце-концов рухнул, подняв огромный столб песка.
Песчаный дождь выпал и на нашу площадку, а когда воздух стал прозрачным, мы
увидели потускневший Сиреневый Кристалл. Он висел одиноко почти у самой
поверхности земли.
Одиноко... Не в этом ли была причина их неудачи?
В мир недоступности!
Все, вероятно, помнит, как в Москве проходила Всемирная конференция по биоси-
лицитам. Это было, поистине, всепланетное совещание ученых, правительств и
общественных организаций. Обсуждалси фактически один вопрос — «отдавать или не
отдавать?».
Речь шла о втором Сиреневом Кристалле, который находился раньше у Асквита, а
теперь в распоряжении Силицитового комитета.
Это были дни торжества человеческой воли. Все понимали, что разумные существа,
пославшие биосилициты к нам, достигли очень высокой цивилизации. Однако их заме
чательный эксперимент мог быть доведен до успешного конца только при нашей по
мощи.
Люди сумели оживить Небесного Гости, помочь рождению биосилицитов. Теперь
предстояло самое заманчивое — вступить в контакт с теми, кто их послал.
И высочайшим актом доверия далекому Разуму было решение Всемирной
конференции о передаче биосилицитам второго Сиреневого Кристалла...
И вот, мы снова в Кара-Кумах. В тот же час, когда с Сиреневого Кристалла сняли
кремниевую защиту, юсгориды унесли его, и стройка началась вновь.
Теперь уже два Сиреневых Кристалла руководили работами, и к броску в Мир
Недоступности готовились не только силициты, но и люди.
На конференции в Москве было решено послать в силицитовом снаряде капсулу с
приборами, комплектами раций, телеустановок, поместить в нее животных, снабдить ее
всяческой информацией, отражающей уровень развития человечества.
Стройка силицитового снаряда шла ускоренным темпом. Нити-лучи от двух
Сиреневых Кристаллов перекрещивались в воздухе — и в местах их слияния возникали
строгие контуры сооружения. Монтаж капсулы не отставал от силицитовой стройки.
И однажды, когда высота снаряда достигла четырехсот двадцати метров,
юсгориды подхватили нашу капсулу, и она исчезла во чреве сияющего колосса.
Явно близился момент старта. Мы удалились — уже без помощи силицитов — на
безопасное расстояние и были крайне огорчены тем, что не могли поддерживать связь
с приборами, расположенными в капсуле,— через стенки снаряда радиоволны не
проходили.
Но вот родбариды начали поспешно уползать во все стороны и зарываться в
барханы. Юсгориды, как разбросанные взрывом, разлетелись нивесть куда,— только
несколько десятков их расположились в непосредственной близости от нашего
наблюдательного пункта, образовав в воздухе овал с большой осью метров пятнадцать и
малой — около восьми. Вокруг снаряда запульсировала завеса, словно сотканная из нитей
северного сияния, и снаряд исчез.
Через несколько минут его засекли пункты наблюдения, расположенные в
различных местах планеты. Вычислительный центр определил, что силицитовый снаряд
движется с таким чудовищным ускорением, при котором не только животные, помещенные
нами в капсуле, но и приборы наши, очевидно, превратились в кашу.
Но произошло еще одно «чудо». Овал из юсгоридов увеличился. Они располагались
уже не в одной плоскости, а в нескольких, образуя пространственную решетку. Потом
по краям овала повисли в воздухе Сиреневые Кристаллы — и вся масса юсгоридов
стала невидимой. Было такое впечатление, словно вырезал кто-то из неба овальный кусок.
Абсолютно прозрачный, абсолютно бесцветный овал создавал иллюзию, будто в этой
части пространства вообще ничего нет. Ровным счетом, ничего! Мы не могли оторвать
глаз от этого властно влекущего к себе «ничего», и вдруг увидели... белую мышку. Она
озабоченно шевелила носиком, усики ее подрагивали. Потом вместо нее появилась
собака — лохматая, с веселыми глазами.
— Дружок! — закричал Юсгор.
Информация из летящего снаряда шла свободно, без искажений и помех. Наши
кинокамеры фиксировали происходящее в капсуле. Было ясно, что в силицитовом снаряде,
мчащемся с огромным ускорением, созданы нормальные условия для земных животных
и приборов.
И сразу возникла мысль — а не могли бы люди?..
... Как ни совершенна была силицитовая система связи, поток информации с
летящего тела стал постепенно гаснуть. Сиреневые Кристаллы светились интенсивней, чем
когда-либо, пронизывая овал своими иглами-лучами, но и это уже не помогало.
Картины стали тускнеть и, наконец, совсем померкли.
Юсгор обнял меня за плечи.
Мы были готовы к броску в Мир Недоступности.
К сведению любителей научной фантастики — роман Александра Мее-
рова «Сиреневый Кристалл», отрывки из которого вы прочли, выходит в
свет отдельной книгой в московском издательстве «Мысль».
%i
точность,
КРАСОТА,
НАДЕЖНОСТЬ
Громадные башенные часы и крохотные женские часики,
новейшие кварцевые устройства и скромные
работяги-будильники... Красота, точность, надежность.
Ко асему этому имеют прямое отношение химия и
химики.
Небьющееся защитное стекло — синтетический полимер;
рубины, вкрапленные в механизм,— искусственный кристалл;
часовое масло — сложный химический продукт; клей для
герметизации корпуса, краски, лаки для деталей — это далеко ие
полный перечень того,, что дает химия службе времени.
Не так давно Второй Московский часовой завод освоил
выпуск электронных наручных часов. Для этого понадобилось
создать:
миниатюрные электрохимические источники тока;
микропроаода с изоляцией из специальных лаков;
особую пластмассу, армированную стекловолокном,—
для электронных блоков;
миниатюрные транзисторы;
новые лаки и клеи...
Пластмассы все шире используют в часовом деле.
Ленинградский завод крупных электрочасов производит из
пластмасс уже больше ста разных деталей. Часовщики стремятся
использовать все преимущества искусственных материалов,
чтобы повысить точность хода часов и срок их службы. Уже
испытаны часы, в которых все детали, кроме пружины, были
сделаны из пластмасс.
Но принципиально возможна и замена стальной пружины
на синтетическую...
О. Милюков, Б. Радченко
9
«
S
S
и
подготовиться
В этом номере журнала мы предлагаем серию задач, связанных
с распознаванием веществ. Задачи такого типа решаются путем
логических рассуждений и сопоставления физических и химических
свойств распознаваемых соединений.
Они подготовлены аспирантами Московского государственного
университета Гш Лисичкиным и М. Решетовой и доцентом
Московского химико-технологического института С. Дракиным.
1. В пяти пробирках без этикеток находятся
растворы KMn04, NaHC03, NiSO^ (CH3COOJCu м
бромная вода. Попробуйте правильно наклеить
этикетки на пробирки.
2. Даны четыре порошка: CuCOg-Cu(OHJ,
Ca(N03J, Cu(N03J, Ca3(P04J- Необходимо найти
наиболее простой способ их распознавания.
3. Различить следующие белые, твердые,
нерастворимые в воде соли: MgC03, CaF2, AgCl, ZnS,
BaS03, CaSi03.
4. В шести пробирках находятся ацетаты меди,
бария, серебра, алюминия, аммония «и уксусная
кислота. Укажите, в каком порядке и при помощи
каких реакций лучше всего определить эти
соединения.
5. Имеется небольшой образец чистого свинца
и образец свинца с примесью железа. Чтобы
распознать .их, каждый поместили в пробирку и
прилили концентрированной азотной кислоты. В обеих
пробирках образовался бурый газ и бурый раствор.
Как, не прибегая к химическим реактивам и
инструментальным методам анализа, определить
содержимое каждой пробирки?
Еще три задачи — на распознавание
органических -веществ:
6. Указать реакции, при ломощи которых можно
различить анилин, бензол и уксусный альдегид.
7. Имеются три твердых белых порошка: мыло,
глюкоза и фенол. Указать простейший химический
путь их распознавания.
8. С помощью каких химических реакций можно
различить водные растворы метилового спирта,
глицерина и фенола?
Две последние задачи не сложны, #го имеют
практическое значение.
9. Какую реакцию — кислую, щелочную или
нейтральную — .имеет дождевая вода?
10. Изменится ли цвет рубина, если его нагреть
на газовой горелке?
ОТВЕТЫ
Сначала несколько общих советов. Если надо
различить отдельные вещества, их в лервую очередь
сравнивают по внешнему виду — например, окраске,
а также по запаху.
В первой задаче пять предложенных
растворов различаются по цвету:
КМп04—фиолетовый, NaHC03 — бесцветный, NiS04 — зеленый,
(СН3СООJСи—синий, бромная .вода—бурая (с
резким запахом брома). Следовательно, для решения
задачи достаточно просто внимательно рассмотреть
предложенные растворы.
Если «вещества твердые, исследуют их
растворимость в воде.
К ЭКЗАМЕНАМ ПОЛУЧШЕ?
W
Во второй задаче предложены две
:олиг окрашенные в сине-зеленый цвет, и две белые
:оли. Понятно, что синие соли — это соли меди,
i белые — соли кальция. Из них в воде будут рас-
-воряться соль меди Cu(N03J и соль кальция
:a(N03J.
В третьей задаче все названные
:оли нерастворимы е воде, но, действуя «а каждую
лз них соляной кислотой, легко определить ZnS по
зыделению hfeS, MgC03 — по выделению С02 м
3aS03— по выделению SO2. Подействовав на
оставшиеся соли — AgCI, CaSiOg и CaF2 —
«онцентрированной серной кислотой, .получим в случае CaF2
фтористый водород, HF, разъедающий стекло, в случае
CaSi03 — коллоидный раствор H2Si03( a AgCl в этих
условиях не изменится.
К четвертой задаче. Прежде всего, с по-
аощью лакмусовой бумаги определим уксусную
ислоту; по зеленому цвету — соль меди; по дей-
гвию раствора щелочи (с выделением аммиака) —
цетат аммония; по образованию черного осадка
киси серебра АдгО, растворяющегося в нашатыр-
ом спирте,— ацетат серебра; ацетат алюминия
ложно определить с помощью выделяющегося
белого осадка А1(ОНK( сразу же растворяющегося
ч избытке щелочи; соль бария можно отличить по
выделению осадка BaS04 под действием H2S04.
Для решения пятой задачи
необходимо выяснить причины появления у
растворов бурой окраски. В случае чистого свинца она
обусловлена растворившимися окислами азота; во
втором случае она обязана своим происхождением
и окислам азота, и цвету нитрата железа.
Естественно, если удалить -из раствора окислы азота, то в
первом случае он обесцветится, а во втором —
окраска останется. Удалить окислы азота можно
простым нагреванием на водяной бане.
Шестую задачу легко решить,
определив, как относятся все три вещества к действию
кислот и щелочей. При действии щелочи анилин и
бензоп не изменятся, а уксусный альдегид,
бесцветная жидкость, образует густую, вязкую
массу—полимер. При действии соляной кислоты анилин
образует белую твердую соль C6H5NH2-HCI, а бензол
и уксусный альдегид не изменятся. Таким образом,
можно определить анилин и уксусный альдегид,
а бензол определяем методом исключения — с
применяемыми реактивами он не взаимодействует.
К задачам шестой и седьмой
При решении аналитических задач рекомендуем
составлять небольшие таблицы. Расположив в
верхней горизонтальной строке формулы исследуемых
веществ, в левом вертикальном столбце записывают
применяемые реактивы, а в клетках таблицы —
результаты действия реактивов на исследуемые
вещества.
Чтобы различить органические вещества, надо
вспомнить, что указанные в шестой задаче
соединения относятся к разным классам:
I?!
лакмус
ев
Z
с
с
о
8
X
О
малиновая
окраска
СННЯЯ
окраска
С
X
о
—
—
X
°"
X
о
—
красная
окраска. 1
КОН
HCI
1
X
о
о
—
CeH6NH2.HCl
X
0
—
—
0
X
°«
X
о
лимер
—
Все три белых порошка в седьмой задаче
также относятся к разным классам: раствор мыла
в воде обладает щелочными свойствами, поэтому
фенолфталеин образует малиновую окраску, а
лакмус — синюю; фенол как слабая кислота окрасит
в водном растворе лакмус в красный цвет; глюкоза
же, относящаяся к классу углеводов, не вызывает
окраски фенолфталеина <и лакмуса.
При решении восьмой задачи нужно
обратить внимание на изменение свойств гидроксильной
группы при лереходе от спирта к фенолу. Фенол
является слабой кислотой и образует соли с
щелочами; глицерин дает осадок с гидратом окиси меди;
метиловый спирт взаимодействует только с
металлическим натрием.
Девятая задача. Дождевая вода
содержит растворенную Сог, а также небольшие
количества HNOg и NH4NO3, которые образуются при
электрических разрядах в атмосфере. Поэтому она
имеет кислую реакцию.
Десятая задача. Красный цвет рубину
придают содержащиеся в нем ионы Сг+++. Как
правило, эти ионы окрашивают химические
соединения в сине-зеленые тона. Необычная для хромсодер-
жащих соединений красная окраска рубина
объясняется исключительно упорядоченной структурой
его кристаллов. При нагревании на газовой горелке
связи между атомами в кристалле ослабевают, и
рубин становится зеленым. При охлаждении вновь
восстанавливается красная окраска.
91
Полезные советы и пояснения
СНАЧАЛА — О СТИРКЕ
В чем ее сущность? Ткани стирают известным
уже много столетий мылом и получившими широкое
распространение за последние годы синтетическими
моющими средствами. Мыло — это натриевые соли
жирных кислот; получается оно путем обработки
животных и растительных жиров едкой щелочью:
CH2OCOR CH2OH
CHOCOR + 3NaOH = СНОН + 3RCOONa
CH£OCOR CH,OH мыло
жир глицерин
Синтетические моющие средства представляют
собой чаще всего продукты переработки нефти и
газов. К ним относятся:
Алкилсульфаты — RChfeOSOgNa; они получаются
из высокомолекулярных жирных спиртов, после
обработки их серной кислотой
рализации щелочью.
Алкиларилсульфонаты —
и последующей нейт-
R
I
получаемые
SOeNa
в результате конденсации бензола с парафиновыми
углеводородами с последующей обработкой серной
кислотой и нейтрализацией.
R'
Алкилсульфонаты
\
CHS03Na — это лрэ-
R"/
дуктыу получаемые из керосина или парафина
обработкой смесью газообразного хлора и сернистого
газа.
Вещество ОП-7, представляющее собой продукт
Ri
\
реакции окиси этилена с диалюилфенолами R_" ^
—О—(CHsCHfiOhH.
Для усиления действия синтетических моющих
веществ их смешивают с полезными добавками.
Добавки смягчают воду, предотвращают об
ратное оседание грязи, отбеливают ткань.
Синтетические стиральные порошки («Новосты
«Эра», «Лотос», «Астра», «Дон», «Мильва», «Вок
и Другие) — очень эффективные моющие средства
у них есть ряд преимуществ перед жировым мы
лом.
Действие на ткань мыла и синтетических моющих
средств до сего времени еще полностью не раскры
то. Оно сводится в основном к адсорбции молекул
моющего вещества на границах разделов: водный
раствор — ткань и водный раствор — частички за
грязнения. Вещества, обладающие способностью по
нижать поверхностное натяжение на границах раз
дела сред, называются поверхностноактивными
Молекула поверхностновктивного вещества состоит
из двух частей — гидрофобной и гидрофильной. Схе
матически ее можно изобразить так:
Н
I
R^C-
I
Н
гидрофобная
часть
О
И
—S—О—Na
II
О
гидрофильная
часть
При стирке поверхностноактивные вещества
адсорбируясь на поверхности раздела, снижают по
верхностное натяжение. Они облегчают смачивание
92
химики
к ним дают
»идрофобных загрязнений и проникновение моюще-
"о раствора в глубь ткани. Это приводит к отделению
жировых частиц. Они эмульгируются, превращаются
в шарики и удаляются с ткани.
А удаление пигментных загрязнений происходит
под действием электростатического отталкивания и
чисто механическим путем. Большая часть
растительных волокон в воде заряжается ^отрицательно,
отрицательно заряжается и большинство загрязнений.
Одноименный заряд частичек загрязнения и
волокна вызывает электростатическое отталкивание,
которое усиливается в моющем растворе до такой
степени, что начинает превосходить силы,
удерживающие загрязнение на волокне.
Это приводит к отделению частиц от ткани или к
такому сильному их разрыхлению, что частицы легко
удаляются с ткани механическим путем.
ТЕПЕРЬ — НЕСКОЛЬКО СЛОВ
О ХИМИЧЕСКОЙ ЧИСТКЕ
Этот процесс отличается от процесса стирки.
При химической чистке загрязнения удаляются в
основном в результате действия на «их органических
растворителей (хлорированных углеводородов; три-
и перхлорэтилена или уайт-спирита). При обработке
изделия растворителем загрязнения переходят в
раствор. Для более полного их удаления в растворитель
добавляют шоверхностноактивные вещества — тогда
процесс химической чистки отчасти становится
похож на стирку.
К стирке и химчистке прибегают в тех случаях,
когда одежду нужно очистить целиком. Если же
нужно удалить отдельные пятна, то вещества,
воздействующие на загрязнение химическим ил»и
физико-химическим путем, применяют как местное средство.
ЖИРОВЫЕ И МАСЛЯНЫЕ
ПЯТНА
Для удаления пятен от растительных и
минеральных масел, олифы и других жировых веществ
применяют органические растворители — бензин#
ацетон, четыреххлористый углерод м другие.
■Применение органических растворителей не
гарантирует полного удаления пятна. Обычно вокруг
места, с которого удалялось пятно, образуются рас-
теки {ореолы). Поэтому следует применять
растворители в сочетании с адсорбентами — тальком,
мелом, крахмалом.
Для удаления жировых пятен лучше всего
пользоваться имеющейся в продаже «Пастой для
удаления пятен». Этот препарат состоит из адсорбента —
силикагеля (БЮг), органических растворителей —
трихлорэтилена и уайт-спирита и присадки — алкамо-
на ОС-2, применяемого для олеофилизации
силикагеля. При нанесении тонкого слоя пасты на жировое
пятно растворители, находящиеся в пасте,
растворяют жир; одновременно адсорбент поглощает его, не
давая растекаться по ткани. После испарения
растворителя загрязнение легко удаляется вместе с
адсорбентом.
ПЯТНА ОТ ФРУКТОВ, ЯГОД, ВИНА
И ФРУКТОВЫХ СОКОВ
Цвет пятен, оставленных ягодами и вином,
зависит от красящих веществ — антоцианов.
Антоцианы могут быть красного, синего и
фиолетового цвета в зависимости от реакции среды.
Красящее вещество вишен, слив, черешни—циани-
дин, имеет следующее строение:
С1-
Т он
но о /
у\^\он
По химической природе антоцианы близки к
сопутствующим им в растениях бесцветным катехинам.
93
Под действием некоторых химических веществ ан-
тоцианы -могут переходить в катехины, т. е.
превращаться в неокрашенные вещества. Это превращение
SL" он
но о+ /
III I w
OH
Чэн
но о
IIs-
Y4/noh
OH
катехин
OH
/
~^-OH
цианндин
происходит, «например, под действием
восстановителей — гидросульфита натрия или этилового спирта.
Их и следует применять для удаления этого вила
пятен.
ПЯТНА ОТ РЖАВЧИНЫ
Железо под действием влаги, углекислого газа
и кислорода воздуха подвергается коррозии. При
соприкосновении влажной ткани с ржавым
предметом ржавчина переходит на ткань.
Процесс ржавления может быть выражен
следующим уравнением:
4Fe + 2H,0 + 30*=2(Fe2Os-H20).
Таким образом, юлой ржавчины состоит из
водной окиси железа — Fe203 * Н20.
Реакция образования Fe203 обратима. Под
действием кислот окраска исчезает вследствие
обратного хода реакции.
Например, при действии раствора соляной
кислоты на ржавое пятно образуется хлорное железо,
хорошо растворимое в воде:
Fe203-f6HCl=2FeCI8+3H20.
Для удаления пятен от ржавчины можно
применять соляную, щавелевую и лимонную кислоты
(разумеется, -в достаточно слабых растворах —иначе
можно просто прожечь ткань).
вых, к группе триаминотриметановых красителей и
имеет следующее строение:
N(CH3j,
•CI-
(ch,i,n^4 fy
II I II
I
NHCH3
Метиленовый голубой относится к классу хиноними-
новых красителей—это хлористый тетраметилдиа-
минофеназтионий, имеющий следующее строение:
С1-
Свойства обоих красителей во многом
различны, и для удаления пятен от чернил^
приготовленных с применением того или иного красителя,
применяют различные химические вещества.
Метиловый фиолетовый краситель под
действием растворов минеральных кислот изменяет свой
цвет сначала на зеленый, а затем на желтый.
Минеральная кислота при этом соединяется вначале с
одной аминогруппой, устраняя ее влияние (спектр
зеленого красителя), а затем связывает вторую
аминогруппу (желтый цвет незамещенной соли трифенил-
карбинола):
(CHS,2N^_=\N
(CH3JN^ \/
фиолетовая
(CHs)lN^ X
\г=/=\^
N(CH,J
С1-
2CI-
(СН
•ьйСУ
синевато-зеленая
ПЯТНА ОТ ЧЕРНИЛ
Вид чернильного пятна зависит от красителя,
входящего в состав лролитых чернил. Чернила
готовят чаще всего -на основе анилиновых красителей.
Для изготовления канцелярских фиолетовых чернил
применяется метиловый фиолетовый краситель, для
синих чернил авторучек — метиленовый голубой.
Метиловый фиолетовый относится к классу арилметано-
(CH3JN^ V
Ус^( /-N (СН8J
3CI-
<CH,jtN<=/
Н
Это свойство метилового фиолетового
красителя можно использовать при удалении пятен от
фиолетовых чернил.
94
МАТЕМАТИКА — ИСКУССТВО
На фотографии — -плотный
седоватый человек в очках, с
аккуратно подстриженной бородкой.
Он стоит перед доской,
исписанной формулами, он говорит
свободно и чуть насмешливо, глядя
немного поверх аудитории. Под
фотографией — надпись: Норберт
Винер.
Так открывается книга,
выпущенная недавно издательством
«Наука» (М., 1964). Это
автобиография одного из выдающихся
ученых нашего времени,
которому мы обязаны возникновением
новой науки — кибернетики.
«Я — математик» назвал свою
книгу Винер и она — не просто
жизнеописание. Это размышления
о науке, о жизни, и об
общественной жизни. «Мне хотелось
поделиться некоторыми мыслями
с теми, кто собирается .посвятить
свою жизнь математике или
какой-нибудь другрй науке,— -пишет
Винер, обращаясь к читателям.—
Мне кажется, что наше интелли-
Метиленовый голубой краситель таким
свойством не обладает. Он хорошо растворяется в
этиловом спирте.
При помощи восстановителя краситель можно
перевести в бесцветное соединение (называемое лей-
косоединением). При этом хиноидная групгтиров-
ядра красителя превратится в бен-
зоидную: —\ /— и окраска исчезнет. Это
произойдет, например, под действием такого
восстановителя, как гидросульфит:
(СН8);
//\//
N(CH8),
-п г
с
I
/\
чйнснв
окрашенная форма
С1--
Na2S204
восстановление
(CH^Nf^ ,AN(CH3J
н«1
%/\y\s
//
1
NHCH3
бесцветная форма
(лей косоеди н е н ие)
Но следует учесть, что восстановитель
разрушает и окраску самой ткани. Поэтому с выведением
чернильных пятен дело обстоит в общем-то плохо...
Применять восстановитель можно только в тех
случаях, когда чернилами испачкана белая ткань.
Чернильные пятна с белой тками можно также
удалять с помощью отбеливателей — гипохлорита
натрия или перекиси водорода. В этом случае
окраска исчезнет из-за глубоких изменений, которые
произойдут в красителе под действием сильных
окислителей.
Ю. Д ЗЛАТОПОЛЬСКАЯ,
Ю. С. ДРУГОВ
95
гентное общество плохо
представляет себе, какие обязательства
налагает на человека занятие
наукой и в какой обстановке
протекает жизнь ученого».
Автор делится мыслями,
делится щедро, решая, казалось бы,
неразрешимую задачу —
рассказать о математическом
творчестве, не пользуясь терминами .и
символами математики.
Единственная формула книги
помещена на обложке, да и то только по
воле художника.
Винер понятно и интересно
излагает сложнейшие .проблемы
современной математики. Для
нематематика его книга — открытие
нового мира, мира абстрактней-
шей из точных наук, мира
развивающихся идей, представлений,
конструкций. Лаконичные, но
острые характеристики Ф. Клейна,
Д. Гильберта, Д. Биркгофа,
Ж. Адамара, М. Борна и других,
менее известных ученых,
знакомят нас с людьми, чьими трудами
в какой-то степени определяется
сегодняшний уровень наших
знаний.
Однако основное внимание
привлекает, конечно, сам Норберт
Винер. Весь текст проникнут его
критическим отношением к
событиям, их участникам, да и к
самому себе. Во всем, что он пишет,
видно стремление сказать правду:
«Все, что я делал, я делал...
'Потому, что мне казалось, что
отдельные исследования, которыми
я занимался, ведут меня в одном
определенном направлении». Это
направление — 'поиск «истины, и
оно означает упорный труд,
жесткую самодисциплину, зависящую
«...прежде всего от того, как
ученый относится к науке, а не от
внешних обстоятельств, в которых
протекает его научная работа».
Своей книгой Винер
полемизирует с теми, кто считает
математику сухой и скучной наукой.
«Математика — один из видов
искусства»,— утверждает он. И
единственное, что отличает ее от
других видов искусства, вот что:
«Любитель математики должен
обладать достаточно высокой
специальной «подготовкой». Иначе
говоря, математика ограждена от поо-
фанов!
Ученого интересуют общие
пути прогресса в науке,
социальные аспекты научных открытий,
взаимоотношения между учеными
и обществом, проблемы
воспитания молодежи. Конечно, и
политические вопросы. Горький урок
Хиросимы, «охота за ведьмами»,
«нескладный мир, сменивший
войну», угроза новой войны,
«которую можно вести, «нажимая
кнопки, страшное искушение для всех,
кто верит в силу своей
технической изобретательности и питает
глубокое недоверие к
человеку»,— все это не позволило Нор-
берту Винеру быть бесстрастным
свидетелем событий.
«Мне хотелось бы,— пишет
он иронически,— ох, как хотелось
бы! — оказаться в положении,
когда можно относиться к
происходящему пассивно, искренне
верить в мудрость вершителей
политики и полностью отказаться
от собственного мнения».
Ощущение причастности к
происходящим событиям лридает
книге Норберта Винера высокое
гражданское звучание.
Предыдущие книги Норберта
Ьинера пользовались в нашей
стране большим успехом. Есть
все основания надеяться, что
книга «Я — математик» не
составит исключения.
о. никич
УВАЖАЕМЫЕ ЧИТАТЕЛИ!
Пятый и шестой номера журнала выйдут в ближайшее время.
В течение второго полугодия опоздание журнала будет
ликвидировано, и Вы станете получать его своевременно.
Подписка на второе полугодие принимается во всех почтовых
отделениях. Индекс журнала «Химия и Жизнь» по каталогу газет
и журналов — 71050.
Редакция
Редакционная коллегия:
Главный редактор И. В. Петрянов-Соколов
П. Ф. Баденков, В. И. Гольданский, Н. М. Жаворонков, С. В. Кафтанов, Л. И. Мазур, Б. Д. Мельник,
М. И. Рохлин (зам. главного редактора), П. А. Ребиндер, С. С. Скороходов, Б. И. Степанов, А. С. Хохлов,
М. Б. Черненко (зам. главного редактора), Н. М. Эмануэль
Оформление Б. Алимова и А. Великанова Техн. редактор О. Беккер
Адрес редакции: Москва В-333, Ленинский проспект, 61/1. Телефон АВ 7-72-64
Подписано к печати 23/VI-65 г. T-08728 Формат бумаги 84XlOB7i6.
Уч.-изд. л. 10,6 Бум- л. 3 Тираж 22000 экз.
Печ. л. 10,0 + 1 вкл.
Заказ 2374
2-я типография издательства «Наука». Москва, Шубинский пер., 10
%
It
v>
> X
Читайте в следующем номера. поосЪессор
А. А. Вишневский о современной хирургии
Главы из научно-фантастического романа
Александра Меерова «СИРЕНЕВЫЙ КРИСТАЛЛ»
<х>
<х>
л'У £.V
. ч
\r :.-*
4L-
Спросить мнение
РАСТЕНИЯ!
НК1
Читайте
в следующем
номере:
«Невидимый свет»
Издательство «На