Text
ORGANIC COMPLEXING REAGENTS: Structure, Behavior, and Application to Inorganic Analysis
D. D. PERRIN
Department of Medical Chemistry Institute of Advanced Studies Australian National University, Canberra
INTERSCIENCE PUBLISHERS a division of John Wiley & Sons, New York. London. Sydney
1964
Д. ПЕРРИН
Органические аналитические реагенты
ПЕРЕВОД С АНГЛИЙСКОГО канд. хим. наук ю. м. д едко в а
ПОД РЕДАКЦИЕЙ доктора хим. наук ю. а. золотова
Читальный Зал
ИЗДАТЕЛЬСТВО «МИР» Москва 1967
УДК 543.7
Книга посвящена теоретическим основам действия органических реагентов, находящих широкое применение в современной аналитической химии для фотометрических определений, в качестве экстрагентов, осадителей и т. д.
Рассматриваются особенности стереохимии и устойчивости комплексных соединений, образуемых органическими реагентами. Много внимания уделено влиянию комплексообразования на окислительно-восстановительные потенциалы, а также кинетике и механизму реакций комплексообразования. Обсуждаются спектры поглощения комплексов и реагентов в видимой и ультрафиолетовой областях. Особенно подробно рассмотрены факторы, влияющие на растворимость соединений и их экстракцию органическими растворителями.
Книга представляет интерес для химиков-аналитиков — работников научно-исследовательских институтов, вузов, производственных лабораторий, а также для студентов и аспирантов химических специальностей.
Редакция литературы по химии
Инд. 2-5-5
ПРЕДИСЛОВИЕ
Возможности аналитической химии в огромной степени определяются достижениями смежных наук — физической, неорганической и органической химии, электрохимии, радиохимии, оптики и даже таких, казалось бы, далеких отраслей, как радиотехника. Особенно большое значение имеет химия координационных (комплексных) соединений, ибо большинство соединений, свойства которых используются в химических и физико-химических методах анализа, принадлежит именно к этой группе.
Прогресс в области координационной химии, например углубление знаний о природе химической связи, о стереохимии или спектрах поглощения координационных соединений, должен быть одновременно и прогрессом аналитической химии. Однако это возможно лишь в том случае, когда разрыв — по времени и по уровню — между достижениями химии координационных соединений и их аналитическим использованием оказывается не слишком большим. Известно, что за последнее время в теоретической неорганической химии произошел большой сдвиг, который помог преодолеть довольно длительный период фактического застоя. Химия координационных соединений, которая, несмотря на наличие вернеровской структурной теории, была в значительной мере описательной наукой, приобрела солидный теоретический фундамент. Метод валентных связей, теория кристаллического поля и особенно метод молекулярных орбиталей позволили объяснить многие факты, накопленные химиками, и дали вполне ощутимую возможность предсказывать ряд свойств координационных соединений.
К сожалению, отмеченные успехи пока не были в достаточной мере поняты и оценены химиками-аналитиками; разрыв, о котором говорилось выше, еще в большей степени углубился. В такой ситуации большое значение приобретает любая попытка перебросить мост между этими двумя направлениями, поэтому книга Д. Перрина, которая и служит таким мостом, заслуживает особого внимания аналитиков.
Американское издание этой монографии называлось несколько иначе: «Органические комплексообразующие реагенты;
6
ПРЕДИСЛОВИЕ
структура, свойства и применение в неорганическом анализе». Однако ни это название, ни более простое название русского перевода не являются точными. По существу автор говорит о комплексных соединениях вообще, а не только о соединениях, образуемых органическими лигандами. Тема книги — аналитическая химия с точки зрения современной теоретической неорганической химии.
Автора интересуют почти исключительно теоретические основы методов, попытки объяснения распространенных аналитических реакций. Он не дает никаких подробных описаний свойств реагентов и никаких методик. Разумеется, по этой книге нельзя делать анализы, она не является справочником по органическим реагентам, но книга, несомненно, поможет аналитику-исследователю создать новые эффективные методы, будет направлять его мысль, позволит по-новому взглянуть на давно известные факты.
Монография Д. Перрина единственная в своем роде, поэтому легко понять те трудности, с которыми автор встретился при ее написании. Теоретический материал первых глав изложен, пожалуй, схематично; здесь многое называется без объяснения, дается скороговоркой. Не ознакомившись предварительно с другими изданиями по химии комплексных соединений, некоторые разделы понять довольно трудно. Поэтому для первоначального знакомства с предметом следует рекомендовать, например, прекрасную книгу Басоло и Джонсона «Химия координационных соединений».
Некоторые положения книги, возможно, будут сочтены спорными, но это не так уж опасно, если учесть общий характер монографии.
В целом это интересная и нужная книга.
Ю. Золотов
ПРЕДИСЛОВИЕ АВТОРА
Нам представляется весьма желательным на базе современных знаний обсудить те принципы, на которых основаны методы аналитической химии. Это позволило бы дать аналитическим методам надежное теоретическое обоснование. Именно такое рассмотрение и является целью данной книги. Помимо обсуждения существующих методов, мы рассчитываем также наметить возможные пути исследований, которые могут привести к созданию еще более полезных методов анализа. Так, материал книги можно использовать для оценки способов направленного конструирования молекулы комплексообразующего реагента для обеспечения большей его специфичности по отношению к неорганическим ионам. Делается также попытка указать, какие типы органических реагентов наиболее пригодны для осаждения, экстракции или других реакций неорганических ионов, и, кроме того, предсказать вероятные свойства продуктов реакций (например, растворимость или спектральные характеристики).
В течение последних 30 лет, по-видимому, ни одна из отраслей химии не развивалась быстрее, чем аналитическая, и не была лучше обеспечена монографиями и практическими руководствами. Всем известны, например, фундаментальный «Курс аналитической химии» («Treatise on Analytical Chemistry»), издающийся в настоящее время под редакцией Кольтгофа и Элвинга, «Колориметрическое определение следов металлов» Сендела и «Капельный анализ» Файгля.
Тем не менее почти все аналитические руководства и монографии, за исключением монографии Файгля «Специфические, селективные и чувствительные реакции» («Specific, Selective and Sensitive Reactions»), были связаны скорее с техникой эксперимента, требованиями к нему или же с условиями его проведения, нежели с информацией об основных принципах, использованных в реакциях, или о свойствах, обеспечивающих аналитическую пригодность продуктов этих реакций. В значительной степени современные химические методы анализа основаны на практическом приложении характеристических свойств, обнару-
8
ПРЕДИСЛОВИЕ АВТОРА
женных случайно и изученных эмпирически. Доктора Кольтгоф и Элвинг осведомлены о таком положении дел, поэтому онн предложили мне написать книгу, посвященную теоретическим аспектам неорганического анализа с применением органических реагентов.
Потребность в теоретическом обсуждении проблем химического анализа не вызывает сомнений, поскольку очевидна важность тесной связи теории и практики в любой области исследования, направленного на улучшение существующих и открытие новых аналитических методов или на приложение известных методов к решению специальных задач. Несомненно, что при создании новых методов глубокие знания теоретических основ химических реакций, используемых в анализе, ставят исследователя в более выгодное положение.
Образование комплексов имеет огромное значение в аналитической химии. Оно может уменьшать или увеличивать растворимость веществ, изменять их склонность к окислению или восстановлению, менять величину ионного заряда (который может быть даже сведен к нулю или стать противоположным по знаку). Комплексообразование может привести к изменению кристаллических форм, к возникновению окрашенных продуктов (или, напротив, может маскировать их появление). Свойства таких комплексов часто резко отличаются от свойств исходных веществ.
Благодаря возросшему в последнее время интересу к теоретической неорганической химии стала понятнее природа сил, связывающих молекулы неорганических соединений и действующих при комплексообразовании между неорганическими и органическими веществами. Этот интерес стимулировал и сопровождал значительное число исследований по стереохимии и физической химии таких комплексов, включая их термодинамические и кинетические характеристики, что привело в свою очередь к созданию ряда обобщений, например правила Ирвинга—Уильямса об относительной устойчивости комплексов двузарядных ионов ряда Мп—Zn.
Следует отметить, что в книге не будет предпринято никаких попыток описать практические детали. Вместо этого мы постараемся создать какой-то каркас, при помощи которого можно будет рассмотреть значительную часть аналитической химии. Для этого упор будет сделан на основные принципы. Исключение для главы, содержащей некоторые сведения по химии элементов и их ионов, вызвано стремлением помочь начинающим читателям, интересующимся анализом отдельных соединений, быстрее оценить современные химические методы.
Короче, задачей книги является последовательное изложение аналитических проблем на основе современной теоретической не
ПРЕДИСЛОВИЕ АВТОРА
9
органической химии, которое позволит читателю в каждом конкретном случае сделать сознательный выбор реагентов и условий их применения.
Я нахожусь в неоплатном долгу перед профессором Альбертом и доктором Хоукинсом за те советы и критику, которые они высказали по прочтении рукописи, а также перед госпожами Гринхилл и Схенк за подготовку машинописного текста.
Август 1964 г.
Д. Перрин
список ПРИНЯТЫХ СОКРАЩЕНИЙ
BAL — 2, З-димеркапто-1-пропанол,
bipy — 2, 2/-дипиридил,
DHG — N.N-ди (2-оксиэтил) глицин,
DTK — диэтил дитиокарбамат,
EDTA — этилендиаминтетрауксусная кислота, еп — этилендиамин,
NTA — нитрилотриуксусная кислота,
NTE —2, 2', 2"-нитрилотриэтанол (триэтаноламин), ох — 8-оксихинолин (оксин),
PAN— 1-(2-пиридилазо)-2-нафтол, penten — тетракис(аминоэтил)этилендиамин,
phen— 1, 10-фенантролин,
ру — пиридин,
SPADNS — 4-сульфобензол-(1-азо-2)-1, 8-диоксинафталин-6-дисульфокислота,
TG — тиогликолевая кислота,
tren— 2,2', 2"-триаминотриэтиламин,
trien — триэтилентетрамин, ТТА — теноилтрифторацетон.
ГЛАВА 1
Введение
Органические реагенты, применяемые в химическом анализе, удобно определить как такие углеродсодержащие вещества, которые в результате какого-либо взаимодействия позволяют открыть или количественно определить другие ионы или молекулы. Органические реагенты находят широкое применение в неорганическом анализе [1]. В качестве примера прежде всего можно указать такие методы, как комплексонометрическое титрование при помощи этилендиаминтетрауксусной кислоты (EDTA), избирательное спектрофотометрическое определение металлов с дитизоном или весовые определения с 8-оксихинолином. Развитие в последнее время теоретической химии, особенно в результате применения к ионам переходных металлов и их комплексам теории поля лигандов, привело к гораздо более глубокому пониманию факторов, влияющих на устойчивость комплексов, природу их спектров поглощения и другие свойства, представляющие интерес для аналитика. Данная книга является попыткой создать картину современной химической теории, более конкретную в той ее части, которая относится к реакциям между неорганическими соединениями и органическими реагентами. В ней будет рассмотрено применение теории к известным аналитическим методам. Однако, чтобы ограничить изложение разумными пределами, описание практических деталей рассматриваемых методов будет опущено.
В отличие от органических реакций большинство неорганических процессов находится в динамическом равновесии. Положение равновесия и природу продуктов реакции быстро и непосредственно определяют, оценивая свободную энергию. Это особенно справедливо для случая ионных реакций, и знание энергий, характеризующих такие реакции, весьма важно для решения вопроса, идет ли данный процесс и насколько далеко. В ряде случаев, однако, в том числе при реакциях замещения в комплексах некоторых металлов, скорости процессов очень малы, хотя сами по себе эти процессы являются термодинамически выгодными. Объяснение этих явлений дано в гл. 5.
Многие наиболее важные реакции, которые будут здесь рассмотрены, представляют собой процессы, в которых комплексы
12
ГЛАВА 1
образуются гидратированным ионом металла и органической молекулой или ионом, обычно в результате координации одного или большего числа атомов кислорода, азота или серы. Такое комплексообразование важно для аналитической химии в двух отношениях: оно может привести к образованию соединений, имеющих более полезные аналитические характеристики, и, наоборот, концентрация определенных катионов может быть уменьшена до уровня, ниже которого они не мешают реакции, предназначенной для отделения или определения других молекул или ионов.
В водных растворах ионы металлов сами являются комплексами, поскольку они ориентируют близлежащие молекулы воды, что приводит (особенно в случае высокозаряженных ионов металлов или ионов переходных металлов) к образованию определенных соединений типа А1(Н2О)36+ и Сг(Н2О)36+ . Это является следствием наличия у молекул воды определенного дипольного момента, благодаря чему под влиянием заряда иона металла происходит их пространственная ориентация.
По этой причине комплексообразование в растворе в действительности является процессом замещения, в котором одна или большее число молекул растворителя, окружающих катион, замещается другими ионами или молекулами, что ведет обычно к образованию веществ, имеющих весьма характерные физические и химические свойства. Скорость обмена воды, связанной ионами металла, весьма различна; время замещения колеблется от времени намного меньше 1 мсек (для большинства ионов) до (период полуобмена), измеряемого днями, как в случае Сг(Н2О)3*.. Вещества, с которыми ионы металла взаимодействуют, образуя комплекс, называют лигандами. В большинстве случаев образование и диссоциация комплекса протекают быстро в соответствии с рядом последовательных реакций, уравнения которых можно записать следующим образом (М — ион металла и L — лиганд):
MTL - ML,
ML + L zzt ML2, ML , + L 2 ML . Л—1 1 n
В результате этих ступенчатых равновесий в растворе могут сосуществовать несколько комплексов. Лиганды могут быть анионами (такими, как С1“ или NH2CH2COO~) или нейтральными молекулами (такими, как NH3 или 1,10-фенантролин). Комплексы же могут быть катионами, нейтральными молекулами или анионами.
Вещество, выступающее в качестве лиганда, должно иметь по меньшей мере пару электронов, которая может быть «отдана»
ВВЕДЕНИЕ
13
иону металла. Максимальное число таких лигандов, связанных ионом металла, равно его координационному числу.
Если каждый комплекс содержит только один ион металла, величина п, функция образования Бьеррума, не зависит от концентрации иона металла и является количественной мерой степени образования комплекса. Дело в том, что п, которое определяется как среднее число молекул лиганда, связанных с одним ионом металла, зависит от концентрации лиганда.
Однако действительные концентрации отдельных комплексов определяются ступенчатыми равновесными отношениями
{ML] . „ [ML2] . „ _ [ML„J
Ml fl < > A 2 — f MI 1 fl 1 • • • ’ — Г MI 1 ГI i
[M] [L] ’ [ML] [L] •••’ [ML^j] [L]
известными как константы образования, и суммарной константой pn= [MLn]/[M] [L]n, которая является общей константой устойчивости комплекса MLn. Методы, применяемые для нахождения этих констант, описаны в книге [2]; имеется также обширная сводка констант образования и устойчивости [3]*. Эти данные свидетельствуют о том, что на устойчивость комплексов (в отношении их диссоциации на исходные компоненты) влияют многие факторы, в том числе природа атомов, принимающих участие в комплексообразовании, основность лиганда, стереохимия самого комплекса и резонансные эффекты. Именно соотношение всех этих факторов определяет степень избирательности любого реагента по отношению к неорганическим соединениям.
Один из наиболее значительных эффектов возникает при образовании таких комплексов, в которых лиганд присоединяется к металлу двумя или большим числом атомов, давая хелатное соединение. Типичными примерами являются бис-комплексы этилендиамина и глицина с медью(П) (структуры I и II).
сн2—nh2 о----с=о
Си
_сн2—nh2 \ih2—сн2
>.—сн2
В то время как I является двухзарядным катионом, II представляет собой нейтральную молекулу. Если при этом образуются пяти- и шестичленные циклы, стабильность комплекса
* В 1964 г. вышло второе издание справочника [3]: Stability Constants of Metal-Ion Complexes. Section I. Inorganic Ligands. L. G. Sillen, compiler. Section II. Organic Ligands. A. E. Martell, compiler. The Chemical Society, Burlington House, London, 1964. — Прим. ped.
14
ГЛАВА 1
значительно возрастает. Эффективность комплексообразования возрастает, если лиганд является полидентатным (т. е. образуются два или более таких циклов). Примеры бидентатных лигандов— этилендиамин и анион салициловой кислоты. Качественно этот хелатный эффект можно объяснить тем, что чем больше точек присоединения иона металла к лиганду, тем затруднительнее для него порвать все связи и отойти, прежде чем эти связи восстановятся.
Иногда образуются полиядерные комплексы типа MmLn. Довольно распространены случаи, когда в состав комплекса входит частично гидролизованный ион металла, что приводит к оляции, при которой ионы металлов связываются мостиковыми ОН-группами, как это имеет место в гидроксокомплексе III. Ma-
in
тематический анализ таких систем очень сложен, так как равновесие зависит не только от концентрации иона металла, но и от концентрации лиганда.
Если при расчетах используют не активности ионов, а их концентрации, то получаемые константы устойчивости имеют различные значения в зависимости от условий эксперимента. Больше всего влияет изменение ионной силы, приводящее к изменению коэффициентов активности изучаемых соединений. В данной книге эти эффекты не будут приняты во внимание.
Некоторые комплексы, такие, как комплексы Сг(Ш) и Со (III), образуются и диссоциируют медленно. Это «прочные» комплексы, и причины их существования будут рассмотрены в гл. 5. Небольшая скорость реакций препятствует аналитическому определению этих катионов титриметрическими методами.
Лиганд обычно является анионом или нейтральной молекулой с основными свойствами, так что при достаточно низких значениях pH он в значительной степени протонизируется с соответствующим уменьшением комплексообразующей способности. Так, фенолы (рАа 10) являются слабыми кислотами, которые участвуют в комплексообразовании преимущественно в виде фенолят-ионов. Это приводит к прогрессирующему уменьшению их комплексообразующей способности при значениях pH ниже 10. С другой стороны, комплексообразующая способность роданида — аниона сильной кислоты — почти не зависит от значения pH.
Значения констант устойчивости комплексов любого данного лиганда с рядом ионов металлов уменьшаются в определенной
ВВЕДЕНИЕ
15
последовательности, зависящей от природы координируемых групп, так что аналитический идеал специфического реагента для данного металла, вероятно, никогда не будет осуществлен. Число группировок, участвующих в образовании хелатных колец, строго ограничено требованием, которое заключается в том, что атомы, непосредственно связывающиеся с металлом, должны быть способны отдавать пару электронов для связи. Практически это ограничивает выбор азотом, кислородом и серой. Азот может присутствовать как первичный, вторичный или третичный амин, нитро-, нитрозо-, азо- или диазо-группы, как нитрил или амид кислоты. Кислород может координироваться как фенолят- или карбоксилат-ион, (нейтральный) спиртовый гидроксил, кислородный атом простого эфира или как >С=О-группа кетонов, альдегидов или карбоновых кислот. Аналогичным образом сера может присоединяться к катионам в виде ионизированного тиола, тиокарбоксилатных анионов, тиоэфиров и тиокетонов, а также дисульфидных групп *. Основные типы реагирующих групп, а также реагенты, в молекулы которых эти группы входят, приведены в табл. 1.
Таблица 1
Основные комплексообразующие группировки в аналитических реагентах
Группировка
Примеры
Третичный N
а, а'-Дипиридил, 4-оксибензотиазол, 8-оксихино-лин, 8-оксихииальдин, PAN, 1, 10-фенантролин, пиколиновая кислота, хинальдиновая кислота, а, а', а"-трипиридил
—О (обычно фенольный) Ацетилацетон, ализарин, хлораниловая кислота,
купферрон, эриохром черный Т, глиоксаль-бис(2-оксианил), 4-оксибензотиазол, 8-оксихиналь-дин, 8-оксихинолин, койевая кислота, 9-метил-2, 3, 7-триокси-6-флуорон, морин, мурексид, а-нитрозоф-нафтол, нитрозо-Ц-соль, PAN, пирокатехин, роди-зоиовая кислота, салицилальдоксим, салициловая кислота, SPADNS, тайрон
* Кроме перечисленных случаев, азот может принимать участие в комплексообразовании с ионами металлов, входя в состав азометиновой, сульфамидной, гидразо-, азокси- и некоторых других групп, кислород — входя в состав сложных эфиров, сульфоксидной, фосфоиоксидной, нитрозо- и других аналогичных групп, сера — входя в группы, характерные для ксантогенатов, дитиокарбаматов, дитиофосфатов. — Прим, перев.
16
ГЛАВА I
Продолжение
Группировка Примеры
—S“ 4-Хлор-1,2-димеркаптобензол, дифенилтиокарба-зон, дитиол, меркаптобензтиазол, рубеановодо-родная кислота, тионалид
—с—°- Алюминон, антраниловая кислота, EDTA, глицин, миндальная кислота, металлфталеин, щавелевая кислота, пиколиновая кислота, хинальди-
—С—S“ новая кислота, салициловая кислота Диэтилдитиокарбамат натрия, дибензилдитиокарбамат цинка
—с=о 1 Ацетилацетон, ализарин, алюминон, хлораниловая кислота, койевая кислота, морин, родизоно-вая кислота, тионалид
—c=s 1 Тиомочевина
—C=N Диметилглиоксим, а-фурилдиоксим, ниоксим,
1 1 ОН салицилальдоксим
—C=N— О" а-Бензоииоксим, диметилглиоксим, а-фурилдиоксим, ниоксим
—N=O Купферрон, а-нитрозо-Р-нафтол, нитрозо-К-соль
—N—N~ Дифеиилкарбазои, дифенилтиокарбазон
—N=N 1 Дифенилкарбазон, дифенилтиокарбазои, эрио-хром черный Т, PAN, SPADNS
—C=N Глиоксаль-бис(2-оксианил), мурексид
(Нейтральный) —OH а-Бензоиноксим, миндальная кислота
-nh2 Антраниловая кислота, этилендиамин, глицин, триаминотриэтиламин, триэтилентетрамин
—NH —N— 1 Тионалид, триэтилентетрамин ЕДТА, металлфталеин, триаминотриэтиламин
О~
—As=O Арсоновые кислоты
О-
ВВЕДЕНИЕ
17
Некоторые примеры хелатных циклов, образуемых этими группами, показаны ниже (формулы IV—IX). Цикл IV осуществляется в комплексах металлов с 8-оксихинолином и его
производными и с 4-оксибензотиазолом. Цикл V встречается в комплексах а,а'-дипиридила, 1,10-фенантролина и а,а',а"-трипиридила. Кольцо VI характерно для комплексов металлов с диметилглиоксимом и другими диоксимами, в то время как VII характерно для комплексов пирокатехина и его производных. Этилендиамин и глицин дают соответственно структуры VIII и IX.
—с-----с=о
I I h2n о
VIII IX
Эти группировки различаются по относительной комплексообразующей способности с различными ионами металлов. Так, разница между константами устойчивости комплексов этилендиамина с Си(II) и Zn намного больше разницы, наблюдаемой в случае соответствующих оксалатных комплексов. Однако это скорее различие степени, чем типа взаимодействия, так что реагенты редко бывают специфичными. Для большинства аналитических целей реагенты недостаточно избирательны, чтобы применять их непосредственно.
В свою очередь ионы металлов удобно разделить на три группы, как это показано на примерах, приведенных в табл. 2. Эти три группы включают:
1. Ионы, в которых распределение электронов приближается к распределению электронов в атомах инертных газов (Не, Ne, Аг, Кг, Хе, Rn). Это, например, Na+, Са2+, А13+.
2. Ионы, в которых d- и f-орбитали заполнены лишь частично. Это ионы переходных металлов.
3. Ионы с заполненными d-орбиталями (например, Ag+, Zn2+ и Ga3+).
Между этими группами наблюдается некоторое перекрывание. Так, во многих комплексах Fe(III) и Мп(II) обнаруживают свой-
2 Д. Перрин
18
ГЛАВА 1
Таблица 2
Распределение металлов в зависимости от их электронной структуры
1. Металлы, Li Na К Rb Cs дающие ионы типа инертных газов:
Ве Mg Са Sr Ва в
Al Sc Y La, Ce-Lu Zr(lV) Hf (IV) Th (IV)
2. Металлы, ионы которых имеют частично заполненные d- или
/-орбита ли:
Т1 V Сг Мп Fe Co Ni Си (II)
Nb Мо Тс Ru Rh Pd Ag(II)
Та W Re Os Ir Pt Au (III)
Редкоземельные элементы и актиниды
3. Металлы, ионы которых имеют заполненные d-орбитали:
Си (I) Zn Оа Ge As
Ag(I) Cd In Sn Sb Те
Au (I) Hg Т1 Pb Bi Po
ства, значительно напоминающие свойства ионов с оболочками типа инертных газов.
Ионы, имеющие электронные оболочки типа инертных газов^ предпочтительно реагируют с кислородсодержащими анионами-лигандами, такими, как карбоксилат-ионы или анионы хинализарина X и морина XI, в которых активными являются группировки
XII и XIII. Так, хинализарин применяют в щелочной среде для фотометрического определения Be, Mg, В и А1. Он также взаимодействует со Sc и редкоземельными элементами; однако в нейтральной или слабокислой среде многие другие металлы, включая
ВВЕДЕНИЕ
19
XIII
Zr и Th, также дают цветные реакции. Аналогичным образом морин в кислых средах применяют для открытия Zr, Th, Sc и Al, в то время как в сильно щелочных растворах он почти специфичен для Be.
Ионы переходных металлов образуют более устойчивые комплексы с лигандами, содержащими поляризующиеся группировки типа амино-группы или гетероциклических атомов азота. Наблюдается частичное перекрывание свойств ионов, расположенных в правой части рядов переходных элементов (табл. 2), и ионов с заполненными d-уровнями, расположенных в левых колонках третьей группы. Так, этилендиамин образует прочные комплексы также с Zn, Cd и Hg.
Катионы с заполненными d-уровнями (третья группа в табл. 2) также предпочтительно взаимодействуют с легко поляризующимися лигандами, особенно если последние имеют подходящие вакантные орбитали, которые могут принять часть d-электронов с образованием «обратной связи». Это условие делает более предпочтительными серусодержащие лиганды, поэтому реагенты типа тионалида XIV образуют нерастворимые комплексы с Си, Ag, Au, Cd, Hg(II), Tl, Sn(II), Pb, As, Sb, Bi, Pt и Pd.
NH—C—CH,SH
II О
XIV
В этом случае также наблюдается некоторое перекрывание свойств с тяжелыми переходными металлами.
Такие реагенты, как дитизон, в котором металл связывается по азоту и тио-группе, обладают более широким «спектром» реакционной способности, который охватывает значительную часть переходных металлов и металлов с заполненными d-орбиталями.
Следует отметить, что, хотя подобное рассмотрение указывает в общих чертах типы лигандов, более предпочтительные для отдельных групп катионов, оно, однако, никоим образом не имеет исключительного значения. Наоборот, можно ожидать, что все лиганды взаимодействуют со всеми ионами металлов в степени, зависящей главным образом от природы донорных групп лиганда.
2*
20
ГЛАВА 1
Чтобы достигнуть желаемой избирательности, обычно приходится использовать различие двух или более химических или физических свойств. Некоторые наиболее обычные свойства и способы, используемые при этом, перечислены ниже.
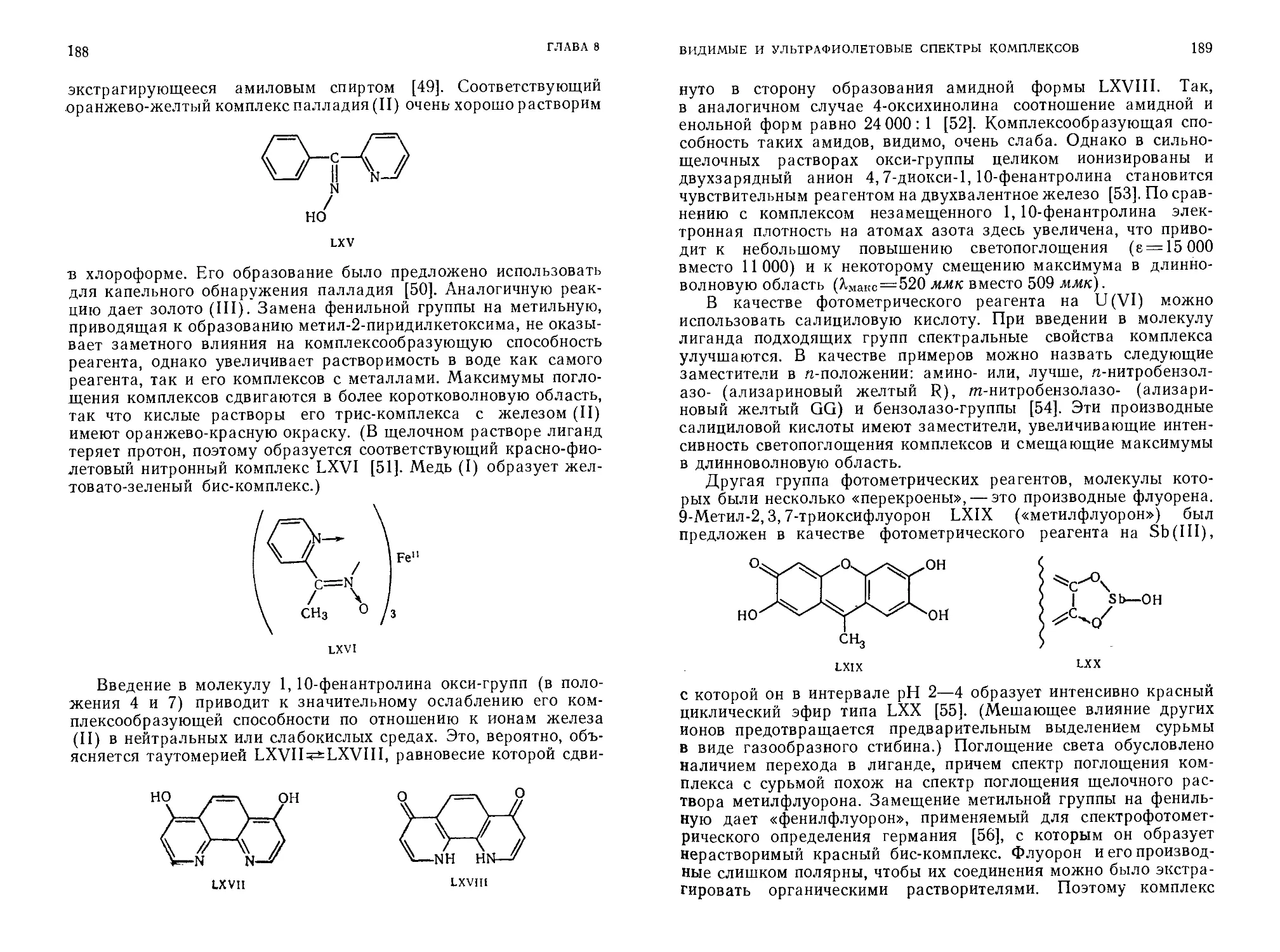
1. Получение характерной окраски. Это используют
а) для прямого спектрофотометрического определения вещества, ответственного за развитие окраски;
б) для определения конечной точки, например при помощи индикатора в кислотно-основном или окислительно-восстановительном титрованиях или за счет адсорбции индикатора на осадке.
2. Различия в растворимости. Это свойство можно положить в основу гравиметрических методов анализа, использовать в объемных определениях или при отделении следовых количеств компонентов путем соосаждения.
3. Использование «маскирующих» реагентов для предотвращения участия в реакции посторонних ионов.
4. Различия в распределении между растворителями при контролируемых значениях pH.
5. Различия в ионообменном и хроматографическом поведении.
6. Различия в летучести.
7. Окисление или восстановление до других валентных состояний.
Все эти свойства неорганических соединений можно в значительной степени усилить применением подходящих органических реагентов. Иногда также модификация реагента улучшает его аналитические свойства. Так, в разбавленных минеральных кислотах цирконий и гафний (также Ti, Th, Sn и Al) образуют интенсивно окрашенные, но мало растворимые лаки с ализарином XV и другими оксиантрахинонами, такими, как пурпурин (1, 2, 4-триоксиантрахинон), хинализарин X, морин XI и кверцетин (отличающийся от морина только положением одной из оксигрупп в боковом фенильном ядре). Введение в молекулу ализарина сульфо-группы придает лакам растворимость в воде без всякого побочного влияния на реакцию, которая является основой фотометрических методов определения этих металлов. В данной книге будет сделана попытка выявить факторы, вызывающие такого рода эффекты.
XV
ВВЕДЕНИЕ
21
Пониманию факторов, управляющих аналитическими свойствами реагентов, в последние годы существенно способствовала развитие теории химической связи. В частности, помогло сочетание двух подходов, которые на первый взгляд представляются совершенно различными. С одной стороны, полагали, что для ответа на вопрос, может ли осуществиться данная химическая комбинация или нет, очень важны размеры, формы и направления орбиталей. Очевидно, противоположным этому было предположение, что атомы в молекулах удерживаются ненаправленными и неспецифичными электростатическими силами. Объединение этих двух подходов дало теорию поля лигандов, рассматриваемую в гл. 2.
Можно надеяться, что эти теоретические основы в свою очередь увеличат возможности уверенного предсказания типа соединений, наиболее подходящих для данного определения, условий эксперимента, которые должны быть использованы, природы и величины эффектов, вызванных модификацией реагентов.
ЛИТЕРАТУРА
1. См., например, Сендел Е., Колориметрические методы определения следов металлов, Изд-во «Мир», М., 1964;
F е i g 1 F., Spot Tests in Inorganic Analysis, Elsevier Publishing Co., Amsterdam, 5th ed., 1958; Feigl F., Chemistry of Specific, Selective and Sensitive Reactions, Academic Press, New York, 1949; Welcher F. J., Organic Analytical Reagents, Van Nostrand, New York, 4 vols., 1947—1948.
2. Россотти Ф., P occo тти X., Определение констант устойчивости и других констант равновесия в растворах, Изд-во «Мир», М., 1965.
3. Bjerrum J., Schwarzenbach G., Si lien L. G., eds., Stability Constants of Metal-Ion Complexes; Part I, Organic Ligands; Part II, Inorganic Ligands, Chemical Society, London, 1957—1958.
ГЛABA 2
Химическая связь
Одним из важнейших достижений современной физической химии является полное математическое решение волнового уравнения Шредингера для атома водорода, позволяющее точно предсказать его спектры и другие физические свойства [1]. Это решение послужило фундаментом, на основе которого развито большинство современных представлений о химической связи, стереохимии и спектрах. Обсуждение некоторых основных свойств и следствий волнового уравнения является существенной частью данной книги.
1. АТОМНЫЕ ОРБИТАЛИ
Принцип неопределенности Гайзенберга и волновой характер электрона исключают знание точного места электрона в атоме в какой-либо данный момент. Все, что может быть получено из волнового уравнения, — это информация о среднем времени, проводимом электроном в каком-либо небольшом элементе пространства. Проведя контуры по границам элемента пространства, внутри которого электрон, находится, например, 99% своего времени, можно сделать видимым занимаемый им объем. Эти объемы известны как «орбитали», и любая орбиталь может содержать не более двух электронов. Образование химической связи происходит при перекрывании заполненных или незаполненных орбиталей разных атомов, молекул или ионов, в результате чего соответствующие электроны в большей или меньшей степени делокализуются. Электронная плотность в любой части орбитали пропорциональна квадрату волновой функции ф.
Далее, математический знак, который принимает волновая функция в любой части общей для нескольких атомов орбитали, является решающим фактором, который должен быть принят во внимание. Этот знак (не имеющий ничего общего со знаком электрического заряда) есть нечто аналогичное «фазе». Там, где части перекрывающихся орбиталей имеют один и тот же, знак ф (волновые функции находятся «в фазе»), осуществляется химическая связь. Если они имеют противоположные знаки, то возникающие при таком перекрывании орбитали называют «разрых
ХИМИЧЕСКАЯ СВЯЗЬ
23
ляющими». В случае если перекрывание таково, что области, имеющие одинаковые и противоположные знаки, примерно равны, то орбитали считают «несвязывающими». Качественная картина состоит в том, что чем больше перекрывание двух связывающих орбиталей, тем прочнее получающаяся в результате химическая связь. Это можно описать как увеличение концентрации связывающих электронов между ядрами, благодаря чему отталкивание ядер уменьшается, а взаимное электростатическое притяжение между электронами и ядрами возрастает.
Формы атомных орбиталей атома водорода известны точно, и полагают, что орбитали всех других атомов качественно им подобны. Наиболее важными атомными орбиталями в теоретической химии являются орбитали, которые в порядке увеличения их сложности обозначают как s, р, d и f. Они соответствуют азимутальным квантовым числам 0, 1, 2 и 3. f-Орбитали приходится рассматривать только для лантанидов и актинидов. За этим исключением все химические связи можно обсуждать в плане распределения электронов между S-, р- и d-орбиталями. Эти орбитали схематично показаны на рис. 1 [2]. Атомные орбитали s-типа сферически симметричны, и для любого данного главного квантового числа возможна только одна такая орбиталь. Существуют три взаимно перпендикулярные орбитали p-типа, причем граничная поверхность каждой орбитали напоминает две половинки гантелей. Так как все три р-орбитали соответствуют одному и тому же значению энергии, они считаются «трижды вырожденными». Аналогично, хотя d 2-орбиталь имеет отличающуюся форму, эквивалентность пяти d-орбиталей делает их «пятикратно вырожденными», а f-орбитали являются «семикратно вырожденными».
В то время как волновая функция s-орбитали остается всюду постоянной, в р-, d- и f-орбиталях их части различаются по знаку. Так, если одна часть р-орбитали обозначена как положительная, другая имеет отрицательный знак. Подобным же образом в d-орбиталях имеет место изменение знака при переходе от одной части орбитали к другой. Формы и знаки атомных орбиталей таковы, что общее перекрывание двух из них в одном атоме всегда точно равно нулю.
Орбитали обозначают в соответствии с главным квантовым числом, например 1s или Зр. В общем случае энергии, характеризующие атомную орбиталь, уменьшаются в последовательности, показанной на рис. 2, где 2р — это орбитали 2рж, 2ру, 2pz; 3d — это орбитали 3dxy, 3dyz, 3dxz, 3dx2_y2 , 3d/2 и т. д.
Эта последовательность энергий, а также то ограничение, что одну орбиталь могут занимать не более двух электронов, которые должны иметь противоположные спины (принцип запрета
У
Рис. 1. Формы атомных орбиталей.
р-Орбитали расположены вдоль каждой оси х, у и г. Части орбиталей dyz и d2x лежат в соответствующих плоскостях и направлены по биссектрисам углов между осями» Орбитали dxz^yz и dz4 лежат соответственно вдоль осей х, у и г.
ХИМИЧЕСКАЯ СВЯЗЬ
25
6s
6р---
5d ———
4$ . -
5s '
Рис. 2. Приблизительная последовательность энергетических уровней атомных орбиталей.
Паули), непосредственно приводят к электронным конфигурациям основного (обладающего минимальной энергией) состояния большинства элементов периодической системы. Некоторые примеры указаны в табл. 1. Дальнейшее уточнение электронного распределения обеспечивается правилом Хунда: если имеются две орбитали, соответствующие одинаковой энергии и доступные для размещения двух электронов, то более предпочтительная электронная конфигурация будет иметь по одному электрону (с параллельными спинами) на каждой орбитали. Это объясняет, например, почему кислород и железо парамагнитны и почему в последнем случае имеются пять неспаренных электронов.
Главное квантовое число определяет общие размеры атомной орбитали. Поэтому граничный слой 25-орбитали лежит внутри Зя-орбитали, а ls-орбиталь лежит еще ближе к ядру. С увеличением заряда ядра каждый заполненный «уровень» Is2, 2s22p6, 3s23p6 становится относительно ближе к ядру (сравните, например, изоэлектронный ряд Na+, Mg2+, Al3+, Si4+ в табл. 2). Это, однако, не компенсирует увеличения размеров наружных орбиталей. Благодаря этому их способность к образованию связей, зависящая от электронной плотности внутри области перекрывания, ослабевает.
Тенденция атомов дополнять эти «уровни» при образовании ковалентных связей является основой правила октета, которое весьма полезно при определении валентности элементов. Оно объясняет валентности 4, 3, 2, и 1, которые проявляют углерод, азот, кислород и фтор соответственно. Бор ограничен
Таблица 1
Основные состояния некоторых атомов и ионов
н ls‘
Не, Li+, Ве2+ 1$2
Li [He] 2s1
С [He]
N [He] 2s22p\2p\2p\
О [He] 2^x2p\2p\
Ne, Na+, Mg2+, О2~, F“ 1522522/>6
S [Ne] 3s23/)23/)y3/)’
Fe [Ar] 3d2 3d’ 3d’3dL yl344s2 u Л -V у y& <*Л «V у
Ce [Xe]4/i5rfi6s2
Mn2+, Fe3+ [Ar] 3rf’ 3rf’ 3rf’ 3rf_’__vl3rf’
Ti3+ [Ar] 3rfi
V3+ [Ar] 3rf2
V2+, Cr3+ [Ar] 3rf3
Cr2+, Mn3+ [Ar] 3d*
Fe2+, Co3+ [Ar] 3d6
Co2+ [Ar] зa^
Ni2+ [Ar] 3d8
Cu2+ [Ar] 3rf9
Mo3+ [Kr] 4d3
Rh3+ [Kr] 4rf6
Ir3+, Pt4+ [Xe] 4/i*5d6
Таблица 2
Атомные® и катионные6 радиусы, А
Элемент Атомный радиус Ионный радиус (в скобках показана валентность иона)
Ас 1,88 1,18 (III)
Ag 1,44 1,26 (I), 0,89 (II)
Al 1,43 0,51 (III)
Am 1,07 (111), 0,92 (IV)
As 1,25 0,58 (III), 0,46 (V)
At 0,62 (VII)
Au 1,44 1,37 (I), 0,85 (III)
В 0,79 0,23 (III)
Ba 2,17 1,34 (II)
Be 1,11 0,35 (II)
Bi 1,55 0,96 (III), 0,74 (V)
Br 1,14 0,62 (1), 0,47 (V), 0,39 (VII)
C 0,77
Ca 1,97 0,99 (II)
Cd 1,49 0,97 (II)
Ce 1,83 1,07 (111), 0,94 (IV)
Cl 0,99
Co 1,25 0,72 (II), 0,63 (III)
Cr 1,25 0,80 (II)в, 0,63 (III), 0,52 (VI>
Cs 2,65 1,67 (I)
Cu 1,28 0,96 (I), 0,72 (II)
Dy 1,75 0,92 (III)
Er 1,73 0,89 (III)
Eu 1,99 0,98 (III)
F 0,64
Fe 1,24 0,74 (II), 0,64 (III)
Fr 1,80 (I)
Ga 1,22 0,62 (III)
Gd 1,79 0,97 (III)
Ge 1,23 0,73 (II), 0,53 (IV)
H 0,37
Hf 1,56 0,78 (IV)
Hg 1,50 1,10 (II)
Ho 1,74 0,91 (III)
Продолжение
Элемент Атомный радиус Ионный радиус (в скобках показана валентность иона)
I 1,33
In 1,63 0,81 (III)
1г 1,36 0,92 (II)в, 0,68 (IV)
К 2,27 1,33 (I)
La 1,87 1,14 (III)
Li 1,52 0,68 (I)
Lu 1,72 0,85 (III)
Mg 1,60 0,66 (11)
Мп 1,37 0,80 (II), 0,66 (III), 0,60 (IV),
0,46 (VII)
Mo 1,36 0,70 (IV), 0,62 (VI)
N 0,70 (простые связи)
Na 1,86 0,97 (I)
Nb 1,43 0,74 (IV), 0,69 (V)
Nd 1,81 1,04 (III)
NH4+ 1,43
Ni 1,25 0,69 (II)
Np 1,31 1,10 (III), 0,95 (IV),
0,71 (VII)
О 0,66 (простые связи)
Os 1,34 0,88 (II)B, 0,69 (VI)
Pa 1,61 1,13(111), 0,98 (IV), 0,89 (V)
Pb 1,75 1,20 (11), 0,84 (IV)
Pd 1,38 0,80 (II), 0,65 (IV)
Pm 1,06 (III)
Po 1,67 0,67 (VI)
Pr 1,82 1,06 (III), 0,92 (IV)
Pt 1,39 0,80 (11), 0,65 (IV)
Pu 1,51 1,08 (III), 0,93 (IV)
Ra 1,43 (II)
Rb 2,48 1,47(1)
Re 1,37 0,72 (IV), 0,56 (VII)
Rh 1,35 0,80 (11)B, 0,68 (III)
Ru 1,33 0,81 (II)B, 0,67 (IV)
Продолжение
Элемент Атомный радиус Ионный радиус (в скобках показана валентность иона)
s 1,04 (простые связи)
Sb 1,45 0,76 (III), 0,62 (IV)
Sc 1,61 0,81 (III)
Se 1,16 0,50 (IV), 0,42 (VI)
Si 1,18 0,42 (IV)
Stn 1,00 (III)
Sn 1,41 0,93 (II), 0,71 (IV)
Sr 2,15 1,12 (II)
Ta 1,43 0,68 (V)
Tb 1,76 0,93 (III), 0,81 (IV)
Tc 1,35 0,56 (VII)
Те 1,43 0,70 (IV), 0,56 (VI)
Th 1,80 1,02 (IV)
Ti 1,45 0,85 (II)B, 0,76 (III), 0,68 (IV)
T1 1,70 1,47 (I), 0,95 (III)
Tm 1,72 0,87 (III)
U 1,39 1,05 (III), 0,97 (IV),
0,80 (VI)
V 1,31 0,88 (II), 0,74 (III), 0,63 (IV),
0,59 (V)
W 1,37 0,70 (IV), 0,62 (VI)
Y 1,78
Yb 1,94
Zn 1,33
Zr 1,59
0,92 (III)
0,86 (III)
0,74 (II)
0,79 (IV)
а Половина межатомного расстояния, обычно в металлах. Взято из Tables of Interatomic Distances and Configuration in Molecules and tones, Special Publication No 11, The Chemical Society, London, 1958.
б Для шестикратной координации. Из работы: Ahrens L. Н., Geochim. Cosmochim. Acta, 2, 115 (1952).
в Ориентировочные данные. Brewer L., Bromley L. A., Gilles P. W.. Lofgren N. L., in book: Chemistry and Metallurgy of Miscellaneous Materials, L. L. Quill, ed, McGraw-Hill, New York, 1950, PP. 165f f.
30
ГЛАВА 2
валентностью 3 (вследствие того, что общее число его валентных электронов равно 3), но он завершает 2я22р6-октет, принимая два электрона от другого атома, имеющего свободную электронную пару. При этом возникает дативная связь и образуются соединения типа ВРз-МНз. Способность фосфора, серы и более тяжелых атомов проявлять высокие валентные состояния объясняется тем, что энергия, необходимая для перемещения, скажем, Зя-электронов в фосфоре на вакантную Зй-орбиталь, не настолько велика, чтобы препятствовать этому переходу. Практически она более чем компенсируется энергией, освобождающейся при образовании двух дополнительных связей, так что в кратных связях низко лежащие йя-орбитали (т. е. d-орбитали, участвующие в образовании л-связи) более важны, чем ря-орбитали. Аналогично этому удаление электрона с таких орбиталей облегчено [3]. Химические и физические свойства атомов или ионов определяют главным образом электроны, занимающие именно внешние или близкие к ним орбитали.
Специфические свойства ионов переходных металлов определяются незаполненностью d-орбиталей. Редкоземельные же элементы, наоборот, своим исключительным сходством обязаны незаполненным f-орбиталям, играющим относительно небольшую роль в химической связи. Такое различие обусловлено пространственным расположением этих орбиталей. В ионах переходных металлов значительные участки частично заполненных 3d-, 4d- и Sd-орбиталей находятся близко к поверхности иона и их расположение позволяет им принимать участие в образовании химической связи или же оказывать на нее влияние. Общее сходство ионов переходных металлов связано главным образом с тем, что все они образованы в результате потери атомами металлов одного или двух внешних я-электронов с дополнительной отдачей в некоторых случаях одного или большего числа электронов d-op-биталей. С другой стороны, ^-орбитали редкоземельных элементов расположены гораздо глубже. Поэтому электроны на этих орбиталях в большой степени экранированы электронами 5d-op-биталей и оказывают сравнительно м^лое влияние на образование связи. Это приводит к большому сходству между редкоземельными катионами. По-видимому, в актинидах 5/-орбитали менее защищены, поэтому актиниды по своим свойствам стремятся занять промежуточное положение между переходными металлами и редкоземельными элементами.
Подобие химических свойств лантанидов (редкоземельных элементов) и соответствующих актинидов (4fn и 5fn, соответственно) позволяет делать предсказания в тех случаях, когда доступны лишь следовые количества элемента или же детальному химическому исследованию мешает опасность радиации.
химическая связь
31
2. ТЕОРЕТИЧЕСКОЕ РАССМОТРЕНИЕ ХИМИЧЕСКОЙ СВЯЗИ
В координационной химии имеются три различных представления о природе химической связи. Все они приближенные, и решение вопроса о том, которое из них применить в конкретном случае, по крайней мере отчасти субъективно и частично обусловлено характером требующейся информации.
Простая электростатическая теория
На расстоянии, превышающем несколько его радиусов, ион можно представить как точечный источник, имеющий тот же общий заряд, что и ион. При этом условии взаимодействие между ионами должно изменяться пропорционально произведению их зарядов и обратно пропорционально расстоянию между ними.
В ряду U4+ > U3+ >' UO+ устойчивость комплексов с анионами возрастает в указанном порядке в качественном соответствии с этим предположением, но катион UO2+ занимает положение между U4+ и U3+.
Электростатические силы преобладают в катионах с электронными конфигурациями типа инертных газов (Is2; ls22s22p6; ls22s22p63s23pe), так что электростатическая теория удовлетворительно объясняет образование связей в случае катионов щелочных металлов, щелочноземельных элементов и алюминия. С точки зрения этой теории весьма важно также соотношение радиусов катиона и аниона. Если разница в размерах слишком велика, необходимое число анионов не сможет разместиться вокруг катиона. Так, небольшой по размерам ион А13+, обладающий сравнительно большим зарядом, образует довольно прочные комплексы с ионами F", но очень слабые с гораздо более крупными ионами I-. Другой причиной этого различия является то, что в I- электронный заряд распределен в гораздо большем объеме, в результате чего ион-ионное взаимодействие в комплексе алюминия должно быть меньше, чем ожидается при рассмотрении ионов как точечных зарядов. Последовательность устойчивости является общей для всех солей, в кото-
рых характер связи преимущественно ионный.
Атомные и ионные радиусы приведены в табл. 2 и 3. В общем случае радиусы ионов более тяжелых переходных металлов больше, чем радиусы легких элементов той же группы. Однако заполнение 4/-орбитали в лантанидах приводит к постоянному и прогрессирующему уменьшению атомных и ионных радиусов — лантанидному сжатию, так что радиусы элементов (и ионов) второго и третьего переходных рядов оказываются довольно близкими.
32
ГЛАВА 2
Таблица 3
Радиусы анионов®, А
F 1,36 СГ 1,81
О2~ 1,40 S2- 1,84
Вг 1,95 1“ 2,16
Se2-1,98 Те2-2,21
СО в СО|- 1,31
NO в NOJ" 1,21
а По данным Полинга [6], стр. 514.
Электростатическое отталкивание четырех пар электронов, расположенных вокруг центрального ядра (независимо от того, участвуют ли они в образовании связи или нет), становится меньше, если они принимают тетраэдрическую конфигурацию. Подобным же образом две пары электронов должны приводить к линейной структуре, а шесть пар к октаэдрической. Структура с двойными связями типа НгС=СНг в соответствии с электростатической теорией должна бы иметь углы между связями — 120°; в то же время теории валентных связей и молекулярных орбит указывают, что молекула может быть плоской. Эти три теории приводят в общем к близким стереохимическим выводам для непереходных элементов. Чем меньше отталкивание электронных пар, тем меньше должны быть углы между связями. Следует ожидать, что это отталкивание возрастает в ряду: связывающая-связывающая < связывающая-несвязывающая < несвязываю-щая-несвязывающая орбитали. Если электроотрицательность центрального атома низка и связывающие электроны находятся далеко от него, то отталкивание в случае взаимодействия связывающих орбиталей еще более уменьшается. Эта теория объясняет некоторые заметные различия в углах связей, наблюдаемые на практике во многих органических и неорганических соединениях.
Такую «чисто ионную» трактовку можно уточнить, если принять во внимание во взаимодействующих веществах электростатические притяжения и отталкивания не только электрических зарядов, но также и наведенных и постоянных диполей. При сближении ионов более важное значение приобретает строение их атомных оболочек, и теория, если хотят, чтобы она объясняла результаты эксперимента, должна быть в значительной степени модифицирована. Так, по мере приближения аниона или поляр-' ной молекулы заполненные электронные уровни испытывают ван-дерваальсово отталкивание; кроме того, при этом возрастает эффективный заряд катиона. Последнее явление, ведущее к увеличению электростатического притяжения, объясняется уменьшением экранирующего влияния орбитальных электронов. Это зна
химическая связь
33
чительно важнее для катионов переходных металлов и металлов типа цинка и кадмия, чем для катионов, имеющих оболочку типа инертного газа. Дело в том, что в ионах переходных металлов и металлов типа палладия (имеющих соответственно частично и полностью заполненные d-уровни)* наиболее удаленные электроны занимают d-орбитали и поляризуются гораздо легче.
Кроме того, из рассмотрения форм орбиталей следует, что электрон на d-орбитали менее эффективно экранирует внешние электроны от взаимодействия с ядром, чем, скажем, электроны s-орбиталей, обладающих сферической симметрией. Эти эффекты усиливаются с увеличением главного квантового числа катиона и комплексообразующей способности лиганда [4].
В соответствии с вышесказанным в ряду Zn2+, Cd2+ и Hg2+ по мере увеличения ионного радиуса электростатический вклад в образование связи уменьшается, а ковалентное связывание усиливается. С другой стороны, в ряду трехвалентных катионов Ga3+, In3+ и Т13+ возросший электрический заряд и слегка уменьшенный радиус катиона снижают деформируемость катионов, в результате чего характер возникающих при комплексообразовании связей можно предсказать при помощи электростатической теории.
Рассматриваемый подход предполагает, что так как лиганд представляет собой анион или полярную молекулу, то чем больше заряд и чем меньше радиус катиона (т. е. чем больше ионный потенциал, определяемый как отношение заряда катиона к его кристаллографическому радиусу), тем больше должна быть устойчивость комплексов. Это грубое приближение весьма полезно, но оно в значительной степени ограничено невозможностью учесть поляризуемость (деформируемость) катионов, которая приводит к большему взаимодействию с лигандами. Чем больше поляризуемость катиона и лиганда, тем больше тенденция к образованию ковалентной связи, возникающей при перекрывании орбиталей. Поскольку поляризуемость катиона возрастает с уменьшением его заряда, то весьма вероятно, что простое электростатическое приближение даст неверные результаты при рассмотрении однозарядных катионов переходных элементов и элементов типа палладия*, особенно при комплексообразовании с сильно поляризующимися лигандами. Оно становится совершенно непригодным для обсуждения нульвалентных состояний, таких, как л-олефиновые комплексы тетракарбонила железа.
Увеличенным поляризационным взаимодействием объясняется, например, большая устойчивость аммиакатов переходных металлов по сравнению с их гидратами. Аммиак, несмотря
* Палладий тоже относится к переходным элементам. Автор, очевидно, имел в виду какой-либо элемент из третьей группы табл. 2, например цинк. — Прим. ред.
3 Д- Перрин
34
ГЛАВА 2
Таблица 4
на то что он имеет более низкий постоянный дипольный момент, чем вода, склонен к поляризации в гораздо большей степени и, следовательно, в присутствии ионов обладает большим общим диполем. Наоборот, для однозарядных катионов большего размера, чем литий, имеющих оболочку типа инертного газа, по-луколичественная электростатическая трактовка показала в согласии с опытом [5], что гидраты должны быть более устойчивы, чем аммиакаты. Так, хотя кристаллографические радиусы Сц+ и Na+ почти одинаковы, Сн+ в водных растворах образует устойчивый аммин, a Na+ нет.
В том случае, если лиганд является нейтральной молекулой, электростатическая теория объясняет прочность комплексов взаимодействием между зарядом катиона и диполем лиганда. Такое ион-дипадьное взаимодействие гораздо слабее, чем силы, действующие между парами ионов. Поэтому, хотя оно и имеет значение при гидратации катионов, имеющих электронные оболочки типа инертных газов, оно совершенно не может объяснить причину прочности комплексов, образуемых некоторыми нейтральными лигандами, особенно с ионами переходных металлов.
Электростатическую теорию можно улучшить введением концепции электроотрицательности. Комплексообразование между катионом и лигандом можно описать как смещение (оттягивание) электронов от лиганда к катиону, и чем больше степень смещения, тем более прочную связь металл—лиганд следует ожидать. Электроотрицательность есть мера способности иона или атома молекулы притягивать электрон. Полинг [6] для получения значений электроотрицательностей связанных атомов использовал эмпирическое соотношение энергий связи. Близкие значения были получены при использовании чисто электростатических представлений и эффективных ядерных зарядов [7]. Шкала электроотрицательностей Малликена основана на потенциалах ионизации «валентных состояний» металлов [8]. (Ступенчатый) ионизационный потенциал — это энергия, необходимая для удаления электрона от атома или иона. Их значения приведены в табл. 4.
Эти значения применимы для изолированных газообразных атомов. Энергии для высших валентных состояний намного больше, чем те, которые наблюдались бы в случае образования ковалентной связи. Так, необходимые для перехода S4+->S6+ 3702 ккал имеют мало общего с энергией, требующейся для перехода SO2-->SO24- Это различие объясняется отчасти значительным увеличением электростатической работы отрыва электрона от иона с большим положительным зарядом. Однако потенциалы ионизации полезны при сравнении катионов одинаковых валентных состояний и для получения информации об относительной энергии, требующейся для их окисления или восстановления. Ионизационные потенциалы по своей природе
Ионизационные потенциалы элементов-4
(Энергия, необходимая для полного удаления электронов, ккал)
Ac 159, 279 Na 118, 1091
Ag 175, 495, 803 Nb 159, 330, 577, 883, 1153
Al 138, 434, 656, 2767 Ni 176, 419, 819
As 226, 430, 654, 1155, 1444
Au 212, 473 Os 201, 392
В 191, 580, 875 Pb 171, 347, 736, 976
Ba 120, 231 Pd 192, 448, 759
Be 215, 420 Po 194
Bi - 168, 385, 589 Pt 208, 428
Ca 141, 274 Ra 122, 234
Cd 207, 390 Rb 96
Ce 151, 341, 398, 847 Re 182, 383
Co 181, 393, 772 Rh 172, 417, 716
Cr 156, 380, 714, 1153 Rli 170, 387, 656
Cs 90, 579 S 239, 540, 807, 1091, 1672,
Cu 178, 468, 849 2030
Sb 199, 381, 583, 1017, 1292
Fe 182, 373, 707 Sc 151, 295, 571
Se 225, 496, 738, 992
Ga 138, 473, 708 Si 188, 377, 772, 1045
Gc 182, 367, 789, 1054 Sn 169, 337, 703, 939
Sr 131, 254
Hf 160, 344
Hg 241, 432 Ta 182, 374
Tc 168, 352
In 133, 435, 646 Те 208, 429, 715, 876
Ir 208, 374 Ti 157, 313, 634, 997
T1 141, 471, 687
К 100
V 155, 338, 676, 1107, 1499
La 129, 264, 442
Li 124, 1744 w 184, 408
Mg 176, 347 Y 147, 282, 473
Mn 171, 361, 777
Mo ' 164, 372, 626. 1070, 1411, Zn 217, 414
1568 Zr 158, 303, 530, 792
a Взято главным образом нз работы: Moore C. E., Atomic Energy Levels, Natl,
Bur. Std. (U. S.), Circ. 467 (1958).
3*
36
ГЛАВА 2
являются некоторой мерой электроотрицательности катиона (если пренебречь тем, что электронные конфигурации в комплексах могут отличаться от конфигураций в ионах). Поэтому ранее были описаны [9] многие приблизительно линейные корреляции между этими потенциалами для ряда катионов и логарифмами констант устойчивости их комплексов с обычными лигандами.
Теория валентной связи
Эта теория, развитая Полингом [6], имела огромное значение для качественного обсуждения широкого круга вопросов неорганической и органической химии. Ее популярность, несомненно, кроется в простоте «химической» картины, даваемой ею. Однако эта простота в свою очередь значительно ограничивает применение теории для количественных расчетов. Теория валентной связи различает два типа комплексов металлов, которые можно условно обозначить как «ионные» и «ковалентные». Иногда применяют другие классификации, относящие их к «внешним» и «внутренним» или «высокоспиновым» и «низкоспиновым» комплексам (последнее различие основано на магнитных свойствах). В обоих случаях предполагается, что определенное число атомных орбиталей катиона (равное числу лигандов в комплексе) гибридизо-вано и затем использовано для образования связи. Эта трактовка соответствует известной гибридизации 2s, 2рх, 2ру и 2р2-орбита-лей атома углерода с образованием четырех эквивалентных орбиталей, расположенных вокруг него тетраэдрически. Если в случае ионов переходных металлов постулировать, что в образовании связи использованы d-орбитали, имеющие то же главное квантовое число, что и s- и р-орбитали, то такой комплекс называют «ковалентным». В противном случае он «ионный».
При образовании ковалентной связи более важной характеристикой является энергия, необходимая для перемещения электрона на другую орбиталь, участвующую затем в образовании связи, а не ионизационный потенциал (соответствующий удалению электрона от атома или иона в бесконечность). Так, при образовании HgBr2 один из 6з2-электронов ртути ([Хе] 4f145d106s2) должен быть перемещен на одну из вакантных бр-орбиталей. Заполненные наполовину s- и р-орбитали затем гибридизуются, и присоединение атомов Вг приводит к линейной ковалентно связанной структуре. Образование ковалентной связи можно ожидать в тех случаях, когда энергии связи существенно больше, чем энергии перехода. Очевидно, эти энергии перехода намного меньше, чем соответствующие энергии ионизации, хотя между ними и наблюдается приблизительная пропорциональность, за исключением начала соответствующего ряда (например, Li-Cs), где энергии перехода значительно меньше ожидаемой.
ХИМИЧЕСКАЯ СВЯЗЬ
37
Наиболее важные структурные типы комплексов, а также орбитали, которые должны быть гибридизованы, чтобы привести к ним, приведены в табл. 5. Так, чтобы получить шесть эквивалентных гибридных орбиталей (направленных вдоль осей х, у и z), которые необходимы для образования октаэдрического комплекса, требуются атомные орбитали, имеющие в этих направлениях основные составляющие: dx, 2, Д_2, рх, ру, рг и $. Аналогичным образом плоская квадратная конфигурация получается в результате гибридизации dx,_y2-, s-, рж-и ру-орбиталей. Во всех случаях полагают, что каждая гибридная орбиталь перекрывается вдоль направления, в котором она расположена, с подходящей орбиталью молекулы лиганда, так что образуется о-связь. Такие с-связи подобны одинарным связям в органических соединениях и имеют максимум электронной плотности вдоль оси связи.
Таблица 5
Стереохимия некоторых гибридных орбиталей
Координационное число Орбиталь, участвующая в образовании связи3 Стереохимия
2 зр Линейная (например, HgCl2) 3 зр2 Тригональная (плоская) (на- пример, BF3) 4 зр3 Тетраэдрическая (например, CHi) 4 d3s «Vy, dy2, dzx, s) Тетраэдрическая 4 d-3p3^dx2_y2, s, px, p\ Плоская квадратная (напри- мер, Ni(CN)42~) 5 sp3d(s, px, Py, pz, Тригональная бипирамида (например, PCls) 5 dsp3 ( dxi_ yl, s, px, py, pz} Квадратная пирамида 6 d‘2sp^^dKi_ t,d^, s, px,p ,p^ Октаэдрическая (например, Co(CN)63-) а Участвующие в гибридизации орбитали должны иметь сравнимые энергии. Это требование соблюдается обычно в том случае, если главное квантовое число s- и р-ор-биталей равно главному квантовому числу d-орбитали плюс 1 (например, 3d, 4s, 4р).
Полинг высказал предположение, что способность к образованию связей S-, р- и d-орбиталями пропорциональна их угловой волновой функции вдоль направления связей, а именно 1 : уЗ : У5, и что относительная прочность образующихся связей определяется произведением этих величин для двух типов орбиталей,
38
ГЛАВА 2
участвующих в образовании связи. Это приближение справедливо только в том случае, если величины радиальных волновых функций примерно одинаковы. На практике же интегралы перекрывания лучше вычислять, используя приближенные волновые функции, такие, как слейтеровские орбитали, учитывающие эмпирически установленные эффективные заряды ядер.
Понятно, что в таких октаэдрических комплексах неиспользованные dxy-, dyz- и dzx-орбитали расположены в направлении
Рис. 3. Некоторые примеры ст-, л- и 6-связей между атомами.
а — су-связь, образующаяся в результате перекрывания $- и р-орбиталей; б — две л-связи, обусловленные р- — d- -перекрыванием, как в фосфонитрилхлоридах; в — 6-связь, образованная за счет бокового перекрывания соответствующим образом расположенных d-орбиталей двух атомов, сблизившихся по оси г.
между молекулами лиганда и, следовательно, не могут образовывать о-связей. Однако если они могут перекрываться с подходящим образом расположенными орбиталями лиганда («л-ор-битали»), возможно образование связи другого типа. Связь такого рода известна как п-связь. Она аналогична второй половине двойной связи в олефинах. Третий тип связи, 6-связь, может осуществиться, если два атома настолько близки, что все четыре доли d-орбитали одного из них перекрываются с четырьмя долями d-орбитали другого. Все три типа связи приведены на рис. 3 [10]. Перечень орбиталей, характерных для тетраэдрических, плоских квадратных и октаэдрических комплексов, приведен в табл. 6.
Хотя 4[-орбитали лантанидов лежат слишком глубоко, чтобы иметь какое-либо значение в образовании химической связи, весьма вероятно, что в комплексах первых членов ряда актинидов 5[-орбитали следует принимать во внимание. При расчете вероятных структур, получающихся при гибридизации орбиталей, хорошим допущением, видимо, будет предположение, что f- и р-орбитали приводят в комбинации с другими орбиталями к такому же пространственному распределению. Теория предсказывает линейную структуру для гибридизации sf, тетраэдрическую для sf3, плоскую квадратную для sf2d и октаэдрическую для d2sf3.
ХИМИЧЕСКАЯ СВЯЗЬ
39
Таблица 6
Орбитали, обычно участвующие в образовании тетраэдрических, плоских квадратных и октаэдрических комплексов
Комплекс Для образования
0-СВЯЗИ я-связи
Тетраэдрический S,'Px, Ру, Рг ,,2, (1,2 х — у 1 *
Плоский квадратный dx*-y” S, рг, ру d-xy , dyZ, dzx
Октаэдрический &Хг - Уг ’ *$> Р > Р ^ху , dyZ, dzx
Во многих случаях вопрос, является ли комплекс переходного элемента ковалентным или ионным, решался на основе его магнитных свойств: в ковалентных комплексах число неспаренных электронов меньше, чем в свободном ионе металла. В настоящее время считают, что в действительности оба типа комплексов образованы при участии ковалентной связи, но в то время как первые используют «внутренние» d-орбитали, например d2sp3, вторые используют «внешние» орбитали того же главного квантового числа, что и s- и р-орбитали. Менее обязывающие названия комплексов этих двух типов — «низкоспиновые» и «высокоспиновые»— кажутся более предпочтительными.
По теории валентной связи другим фактором, влияющим на устойчивость молекул, является резонанс. Концепцию резонанса можно выразить следующим образом: если для некоторого вещества можно написать более чем одну структуру, удовлетворяющую определенным условиям, действительная структура должна быть промежуточной и более стабильной. Условия заключаются в том, что в различных структурах не должны значительно изменяться межатомные расстояния и число неспаренных электронов. Концепция резонанса была предложена для объяснения тех же эффектов, что и делокализация электрона в методе молекулярных орбиталей. Хотя описательное значение теории валентной связи в комплексах весьма велико, ее предсказательные возможности ограничены. Теория молекулярных орбиталей, хотя и менее проста для понимания, обладает большей гибкостью и более перспективна для количественных расчетов.
Теория молекулярных орбиталей
Если в методе валентных связей завершенные атомы, ионы и лиганды «собирают» вместе и затем рассматривают их взаимодействие, то метод молекулярных орбиталей основан на располо-
40
ГЛАВА 2
женин определенным образом ядер всех атомов (или ядер+внут-ренних электронов) и последующем распределении по молекулярным орбиталям всех электронов, имеющих отношение к образованию связей. Таким образом, в комплексах металлов орбитали в принципе могут охватывать все участвующие в комплексообразовании атомы. Чтобы уменьшить математические трудности этого метода, допускают, что такие молекулярные орбитали представляют собой линейные комбинации атомных орбиталей (ЛКАО-приближение). В частном случае, когда молекулярная орбиталь образована почти целиком из одной атомной орбитали, электроны в ней по существу являются несвязывающими. Так, в случае, если молекулярная орбиталь образована главным образом двумя атомными орбиталями и содержит два электрона,
Рис. 4. Образование правильного октаэдрического комплекса с точки зрения метода молекулярных орбиталей (схема).
Связывающие и разрыхляющие молекулярные орбитали обозначены соответственно через Ф и Ф', Три безымянные линии обозначают атомные орбитали dxy, dy z и dzx-
ХИМИЧЕСКАЯ СВЯЗЬ
41
она приближается к обычной химической связи. Если же, однако, существенный вклад вносят три и более атомные орбитали, то получающуюся в результате более широко простирающуюся молекулярную орбиталь трудно представить обычными химическими структурами.
Дальнейшее отличие от метода валентных связей заключается в основном постулате метода молекулярных орбиталей: комбинация двух орбиталей с образованием двух новых менее локализованных орбиталей приводит к тому, что одна из новых орбиталей будет более устойчивой и другая — менее устойчивой, чем любая из исходных. Более устойчивую орбиталь называют «связывающей», другую — «разрыхляющей», но обе могут, если это требуется, содержать электроны (метод валентных связей не учитывает «разрыхляющие» орбитали). На рис. 4 приведена схема образования молекулярных орбиталей, являющихся результатом комбинации шести атомных орбиталей (dx2_y2, dz2, s, рх, ру, рг) иона переходного металла с шестью подходящим образом расположенными орбиталями лиганда, что приводит к образованию октаэдрического комплекса. При желании диаграмму можно было бы расширить, с тем чтобы учесть образование л-связей dxy-, dyz-, etc-орбиталями катиона с л-орбиталями лигандов.
Метод молекулярных орбиталей принимает во внимание не-поделенные пары электронов и, следовательно, их вклад в наблюдаемую стереохимию комплекса. Это объясняет, например, почему угол между связями в NH3, равный 107° (что отвечает зр3-гибридизации), уменьшается до 94° в РНз (в соответствии с возрастающим р-характером связывающих орбиталей с некоторым вкладом подходяще направленных d-орбиталей).
Атомные орбитали, используемые для построения молекулярных орбиталей, нельзя выбирать произвольно. Так, существенно, чтобы симметрии орбиталей металла и лиганда соответствовали друг другу [11]. Электроны, находившиеся первоначально на атомных орбиталях и принимающие участие в комплексообразовании, попадают на молекулярные орбитали (по два на орбиталь), начиная с орбиталей наименьших энергий (низшие линии на рис. 4). На рисунке шесть первых молекулярных орбиталей являются связывающими, следующие три — несвязывающими, а остальные — разрыхляющими. Если на одной орбитали расположены два электрона, то для второго требуется большая энергия, чем для первого; эту разницу в энергиях называют «энергией спаривания». Если на диаграмме молекулярных орбиталей энергия расщепления между двумя орбиталями меньше, чем энергия спаривания, каждая орбиталь будет занята одним электроном. В противном случае оба электрона останутся на более низкой орбитали и верхняя орбиталь будет пустой.
Метод молекулярных орбиталей будет широко использован
42
ГЛАВА 2
в этой книге; по мере надобности частные аспекты этой теории будут рассмотрены более подробно. Чтобы облегчить это обсуждение в приложении к ионам переходных металлов, необходимо некоторое знакомство с теорией поля лигандов.
Теория поля лигандов
В электростатических полях лигандов, окружающих ионы переходных металлов, d-орбитали металла не остаются эквивалентными по энергии. Если все d-орбитали целиком заполнены
Рис. 5. Ориентировочная схема расщепления энергетических уровней d-орбиталей кристаллическим полем лигандов (наиболее обычные структуры комплексов) .
а — тетраэдрическая; б — октаэдрическая; в - ~ квадратно-пирамидальная; г — плоская квадратная. За исключением орбитали dX2_y2, порядок энергий орбиталей в случае виг зависит от других факторов и может изменяться.
электронами, это не приводит ни к какому изменению общей энергии. И наоборот, если некоторые из орбиталей не заполнены, электроны стремятся переместиться с орбиталей, направленных к лигандам (например, dх, и dj2 в октаэдрическом комплексе), на орбитали, лежащие между лигандами (в этом случае dxy, dyz и dZA). При этом система выигрывает в устойчивости. На рис. 5 показано расщепление кристаллическим полем, которое осуществляется описанным способом, для некоторых наиболее обычных структур. В тетраэдрическом и октаэдрическом комплексах пять d-орбиталей расщепляются на две группы, содержащие трижды вырожденные dXy, dyz и dzx (орбитали, также известные как tzg-, У5- или de-группы) и дважды вырожденные d ж2_у2-, d^-орбитали (eg-, уз- или dv-rpynnbi). Группа tzg пред
ХИМИЧЕСКАЯ СВЯЗЬ
43
почтительна в октаэдрических комплексах, a eg энергетически более выгодна в тетраэдрических.
В зависимости от значения А можно различить два случая расщепления кристаллическим полем (обычно оценивается величиной IQDq). В случае слабого кристаллического поля Л меньше, чем энергия, необходимая для спаривания электронов на d-орби-талях; каждая из d-орбиталей будет занята единственным электроном, и спаривания не произойдет. В этом случае число неспаренных электронов будет максимальным и ион металла будет находиться в «высокоспиновом» состоянии. С другой стороны, если А больше, чем энергия спаривания, то электроны будут спариваться на нижних орбиталях, до того как будут заселяться более высокие орбитали. При этом осуществится «низкоспиновое» состояние. Главными факторами, определяющими значение А, являются природа лиганда и заряд иона металла. В табл. 7 приведены значения энергии стабилизации кристаллическим полем для тетраэдрических и октаэдрических комплексов со слабым и сильным полем лигандов. Следует отметить, что в тетраэдрических комплексах спины и энергии отличаются в этих двух случаях только при наличии трех, четырех, пяти или шести d-электронов. Подобным же образом в октаэдрических комплексах разграничение может быть сделано только для четырех, пяти, шести или семи d-электронов.
Таблица 7
Энергии стабилизации кристаллическим полем и число неспаренных электронов для тетраэдрических и октаэдрических комплексов
Примеры Тетраэдрический Октаэдрический
слабое поле сильное поле слабое поле сильное поле
di Ti3+ 0,6Д(1) 0,6Д(1) 0,4Д(1) 0,4 Д (1)
Ц2 Ti2 + , V3+ 1,2(2) 1,2(2) 0,8(2) 0,8(2)
d3 V2+, Cr3+ 0,8(3) 1,8(1) 1-2(3) 1,2(3)
Cr2+, Mn3+ 0,4(4) 2,4(0) 0,6 (4) 1,6(2)
Mn2+, Fe3+, Os3+ 0(5) 2,0(1) 0(5) 2,0(1)
d« Fe2+, Co3+, Ir3+ 0,6(4) 1,6(2) 0,4 (4) 2,4(0)
сП Co2+, Rh2+ 1,2(3) 0,8(3) 0,8(3) 1,8(1)
d» Ni2+“, Pd2+, Pt2+ 0,8(2) 0,4(2) 1,2(2) 1,2(2)
Cu2+ 0,4(1) 0(1) 0,8(1) 0,6(1)
44
ГЛАВА 2
Объединение электростатического подхода с методом молекулярных орбиталей позволяет создать более полную теорию. Она известна как теория поля лигандов. Эта теория учитывает, например, влияние образования л-связи при использовании вакантных ря- и п!я-орбиталей лигандов. В октаэдрических комплексах орбитали tzg лежат ниже, чем eg. Наоборот, если л-орбитали лигандов уже заполнены, эта разница в энергиях уменьшается.
Эта теория может быть с пользой применена при обсуждении устойчивости комплексов переходных металлов, механизма их реакций, реакций переноса электронов, стереохимии, магнитных свойств и в некоторых случаях спектров поглощения. Она, видимо, должна быть полезной при рассмотрении химии редкоземельных элементов и актинидов, хотя в этом направлении сделано очень мало. К группе редкоземельных элементов относятся элементы от Се до Lu, имеющие в качестве внешних электронов бгРбх2 или 5d°6s2. Эти элементы отличаются лишь числом 4[-элек-тронов. Их характерная валентность равна 3, но Се(... ... 4f25s25p66s2), Pr(... 4f35s25p66s2) и Tb(... 4f95s25pe6s2) могут быть четырехвалентными, a Sm (... 4f65s25p66s2), Eu(... ... 4f75s25p66s2) и Yb (.. . 4f145s25p66s2) — двухвалентными. Устойчивость Ce4+, Tb4+, Eu2+ и Yb2+ можно объяснить тем, что f-орби-тали либо совершенно пусты (в Се4+), либо наполовину заполнены в ТЬ4+ и Еи2+), либо заполнены целиком (в Yb2+). Как и в случае ионов переходных металлов dn и dn+5, ионы типа fn и fn+7 обладают заметным сходством. Подобным же образом Gd3+ с его наполовину заполненными f-орбиталями напоминает Mn2+(d5). Однако в силу того, что электроны на f-орбиталях расположены глубоко и сильно экранированы электронами наружных уровней, в образовании химической связи они принимают лишь незначительное участие. Поэтому комплексообразующая способность редкоземельных элементов лучше описывается электростатической теорией.
Электронная структура ионов металлов, расположенных в периодической системе после Ra, не очень ясна. 6d- и 5/-орбитали сравнимы по энергии, так что Np, например, может иметь структуру 5f5, а не 5/46</4. Их обычная валентность равна 3, и они также обладают близкими химическими свойствами. 5/-Орбитали экранированы менее эффективно, и актинидные элементы по своим свойствам находятся между переходными и редкоземельными элементами.
Значения Д для тетраэдрических и октаэдрических комплексов различны. Для последних они больше; теоретическое отношение равно примерно 9/4. Добавим, что расщепление кристаллическим полем, происходящее под влиянием восьми лигандов, расположенных в углах куба, подобно расщеплению в случае тетраэдрического комплекса. В тетраэдрических d3-, d6- и октаэд
ХИМИЧЕСКАЯ СВЯЗЬ
45
рических d4-, ^-комплексах с сильным полем энергия стабилизации частично компенсируется энергией, требующейся для спаривания двух электронов. Аналогично для тетраэдрических d4-, d5- и октаэдрических d5-, ^-комплексов с сильным полем требуется энергия, равная удвоенной энергии спаривания электронов.
ЛИТЕРАТУРА
1. Более полные сведения можно найти в книгах: Коулсон Ч., Валентность, «Мир», М., 1965;
Pauling L., Wilson Е. В., Introduction to Quantum Mechanics, McGraw-Hill, New York, 1935.
2. Более точное описание их форм см.
White Н. Е., Introduction to Atomic Spectra, McGraw-Hill, New York, 1934, p. 62.
3. Об энергиях s-, p- и d-электронов см.
S 1 a ter J. C„ Phys. Rev., 98, 1039 (1955).
4. Об определении «эффективного» ядерного заряда см.
S 1 a t е г J. С., Phys. Rev., 36, 57 (1930).
5. Van Arkel А. Е„ de Boer J. И., Rec. Trav. Chim., 47, 593 (1928).
6. Pauling L., The Nature of the Chemical Bond, 3rd ed., Cornell .University Press, Ithaca, New York, 1960.
7. A11 r e d A. L., Rochow E. G., J. Inorg. Nucl. Chem., 5, 264 (1958).
8. Pritchard H. O., Skinner H. A., Chem. Rev., 55, 745 (1945).
9. См., например, Van Uitert L. C., Feme li us W. C., Douglas B. E„ J. Am. Chem. Soc., 75, 2736 (1953). Chapman D., Nature, 174, 887 (1954).
10. Подробнее о л-связи см. С h a 11 J., W i 11 i a m s A. A., J. Chem. Soc., 1952, 3061; Chatt J., Wilkins R. G„ ibid., 1952, 273; Nyholm R. S„ Short L. N., ibid., 1953, 2670; Hi eb er W., Na st R., Floss J. G., Z. anorg. allgem. Chem., 283, 188 (1956). О 8-связи см. Jaffe H. H., Doak G. 0., J. Chem. Phys., 21, 156, 196, 258 (1953); 22, 1462 (1954); J a f f ё H. H., J. Phys. Chem., 58, 185 (1954) ; Craig D. P., M а с с о 11 A., Nyholm R. S., Or gel L. E., Sutton L. E., J. Chem. Soc., 1954, 332.
11. О pre л Л., Введение в химию переходных металлов (Теория поля лигандов), «Мир», М., 1964.
ГЛАВА 3
Стереохимия и' устойчивость комплексов
Число групп, расположенных вокруг иона металла, и стереохимия образующихся комплексных соединений являются факторами, во многом определяющими устойчивость и реакционную способность комплексов. Некоторые наиболее вероятные структуры, существующие в растворах, приведены в табл. 1.
Таблица 1
Наиболее обычные структуры ионов металлов в их комплексах
Ион металла Координационное число Стереохимия
Си (I)a, Ag (1)в, Аи (1)б, Hg (I), Hg (II) 2 Линейная
Си (I)в, Li (I), Be (II), Mg (II) (?), В (III) Zn (II), Cd (II), Hg(II), Pb (IV), Sn (IV) 4 Тетраэдрическая
Co (II), Ni (И), Си (II), Ag (II), Pd (II), Pt (II), Au (III) 4 Плоская
Mg(II)(?), Ca (II), Sr (II), Ba (II), Ti (IV), V (III), V (IV), Cr (III), Мп (II), Mn (III), Fe (II), Fe (III), Co (II), Co (III), Ni (II), Ni (IV), Pt (IV), Cd (II), Zn (II), Al (III), Sc (III), Y (III), лантаниды, Si (IV), Sn (II), Sn (IV), Pb (II), Pb(IV), Ru (III), Rh (III), Os (III), Ir (III), Си (II)r 6 Октаэдрическая
Zr (IV), Hf (IV), Mo (IV), W (IV), U (IV), 8 Возможны раз-
актиниды личные структуры
а В случае если лиганды сильные основания, высокополяризованные нли легко поляризующиеся.
б Могут также обладать координационным числом 4, но оно менее вероятно, чем в случае Си (I).
в В случае если лиганд принимает л-электроны от металла или при образовании ионной связи.
г Искаженный октаэдр с четырьмя короткими и двумя длинными (более слабыми) связями илн реже с двумя короткими н четырьмя длинными связями. В пределе структура становится плоской квадратной.
СТЕРЕОХИМИЯ И УСТОЙЧИВОСТЬ КОМПЛЕКСОВ
47
Ступенчатые константы образования комплексов обычно подчиняются тому простому правилу, что отношение log (A„/A„+i) является положительной и приблизительно постоянной величиной. Скачкообразные изменения этого отношения свидетельствуют или о разной стереохимии комплексов или о наличии л-связи между ионом металла и лигандом, или же о переходе комплекса из высокоспинового в низкоспиновое состояние. Так, молекула HgCl2 линейна, но анион [HgCU]2- построен тетраэдрически; в данном случае гибридизация при переходе от HgCl2 к [HgCl3]_ меняется с sp на sp3 и величина Кг/Кз аномально велика.
Скачок при переходе от (FeCh)aq к [FeCl4]_ обусловлен, вероятно, изменением октаэдрической структуры на тетраэдрическую, в то время как при переходах от [Cd(NH3)4]2+ к [Cd(NH3)5]2+ и от [Zn(en)2]2+ к [Zn(en)3]3+, по-видимому, происходят изменения обратного характера. В комплексах Сг(П) и Си(II) с этилендиамином соответствующий скачок обусловлен, очевидно, устранением стабилизации Яна — Теллера и переходом от искаженной октаэдрической или плоской структуры к более правильному октаэдру. л-Связь, которая должна влиять главным образом на величину АЯ, вероятно, является причиной значительного различия между log Ад и log К.2, наблюдающегося в случае комплексов Ag(I) с иодидом. Заполненные d-орбитали металла, связанные с вакантными орбиталями лиганда дативной связью, с большим трудом вступают в связь с другим лигандом. В случае же амминов Ag(I) log Аг, наоборот, больше log Кл. Возможно, что комплекс [Ag(NH3)2]+ имеет линейную sp-гибридную структуру, в то время как в комплекс [Ag(NH3)]+ молекула аммиака замещает одну молекулу воды в тетраэдрическом или октаэдрическом акво-комплексе. Значительное увеличение прочности комплексов при переходе от бис- к трис-комплексам двухвалентного железа с 1, 10-фенантролином и 2,2'-дипиридилом вызвано изменением высокоспинового (парамагнитного) состояния на низкоспиновое (диамагнитное) со значительным выигрышем в устойчивости.
Вследствие различий в распределении d-электронов вполне допустимо рассмотрение высокоспиновых и низкоспиновых состояний катионов как двух совершенно различных типов. Сравнение прочности комплексов, например комплексов ряда металлов с данным лигандом, допустимо только в том случае, если рассматриваются одинаковые спиновые состояния. Так, ряд Ирвинга—Уилльямса (Мп < Fe < Со < Ni < Си > Zn для двухвалентных ионов) справедлив только при сравнении высокоспиновых комплексов. Он нарушается, например, в случае трис-1, Ю-фенантролиновых комплексов из-за аномально высокой
48
ГЛАВА 3
устойчивости комплекса Fe(II), в котором металл находится в низкоспиновом состоянии.
Так как радиус иона металла возрастает с увеличением атомного номера, координационное число в соответствии с правилом отношения радиусов также возрастает. (Координационное число иона металла в его комплексах или солях есть число атомов, которые можно рассматривать как химически связанные с этим ионом в какой-либо момент времени.) Например, следует ожидать, что максимальное координационное число для Lt, Be, В, С, N, О и F в любом ковалентном комплексе будет равно 4 в соответствии с наличием четырех пар электронов, заполняющих 2s-и 2/?-орбитали. Однако в случае кислорода и особенно фтора это предельное значение координационного числа обычно не достигается. Дело в том, что предоставление этими атомами более одной пары электронов для образования дативной связи затруднено.
Из результатов, приведенных в табл. 1, следует, что большая группа известных комплексов имеет линейную, тетраэдрическую или октаэдрическую структуры, в зависимости от того, занимают ли лиганды 2, 4 или 6 координационных мест вокруг иона металла. Это те структуры, которые следует ожидать на основе электростатических представлений (лиганды должны быть размещены таким образом, чтобы общее отталкивание было минимальным). С другой стороны, их можно легко истолковать на основе теории валентной связи или теории поля лигандов. Однако в случае ионов переходных металлов обычно встречаются и другие пространственные конфигурации, особенно плоский квадрат и искаженный октаэдр. Их образование лучше всего объясняется теорией поля лигандов.
Эта теория отмечает, что в комплексах переходных элементов d-орбитали металла уже не равны по энергии. Если на всех d-орбиталях находится равное число электронов, то не должно быть никакого изменения общей энергии. В противном случае система выигрывает в устойчивости в той или иной степени, зависящей от числа имеющихся d-электронов, природы лигандов и иона металла и геометрии комплекса. Если выигрыш за счет энергии стабилизации в поле лигандов достаточно велик, чтобы компенсировать возрастающее отталкивание, ион переходного металла может, например, образовать плоские квадратные комплексы вместо тетраэдрических или искаженные октаэдрические комплексы, приближающиеся к плоским квадратным. Значение влияния поля лигандов будет, вероятно, понятнее, если рассмотреть некоторые частные примеры.
СТЕРЕОХИМИЯ и устойчивость комплексов
49
1. ПРИМЕРЫ ВЛИЯНИЯ поля ЛИГАНДОВ
Медь (II)
Ключ к стереохимии комплексов Си(II) дает конфигурация иона металла (3rf)9. Большинство этих комплексов имеет искаженную октаэдрическую структуру, в которой четыре координационных места (в плоскости х, у) заняты лигандами, расположенными к металлу ближе, чем два других лиганда, находящихся выше и ниже металла. Эта искаженная структура, вероятно, обусловлена наличием эффекта Яна—Теллера, который возникает в том случае, если комплекс имеет два или более общих энергетических уровня, равноценных в основном состоянии. Это приводит к искажению системы с образованием одного уровня с меньшей энергией и, следовательно, с большей устойчивостью. (Сравните концепцию резонанса и канонические формулы.) Представим себе на момент, что шесть лигандов расположены вокруг иона Си2+ по вершинам правильного октаэдра и З^-орби-талью, содержащей только один электрон, является Зс?ж,_у2. Если в этом случае исказить структуру, перемещая лиганды, лежащие в плоскости х, у, ближе к иону Си2+, в то же время отодвигая от него лиганды по оси z, каждый из двух электронов орбитали d z. станет более стабильным почти на ту же величину энергии, на которую уменьшится устойчивость электрона на dx2_y2 -орбитали. Поэтому в сумме будет выигрыш в устойчивости. Если лиганды, расположенные по оси z, удалить на достаточное расстояние, структура комплекса приближается к плоской квадратной. Во всяком случае, измерения констант устойчивости показывают, что эти лиганды связаны гораздо слабее, чем лиганды, занимающие четыре других места. В кристаллах, выделенных из раствора, пятое и шестое положения часто заняты молекулами воды, которые, как показывает рентгеноструктурный анализ, весьма заметно удалены от иона металла. Подобное искажение молекулы в сторону образования плоской структуры наблюдается в [СиСЦ]2-, одном из редких тетраэдрических (искаженных) комплексов, образуемых Си2+.
Никель(П) и платина(П)
Вследствие того что оба эти иона представляют собой системы d&, следует ожидать, что в случае сильных полей лигандов их комплексы, например [Ni(CN)4]2- и [Ni (SCN)4]2-, будут обладать преимущественно плоской квадратной структурой. Тетраэдрические комплексы не характерны для Ni (II) и, вероятно, образуются только в случае, когда поле лигандов слишком слабо, чтобы привести к спариванию спинов, или когда пространствен-
4 Д. Перрин
50
ГЛАВА 3
ные затруднения принуждают к этой структуре. Теоретические рассуждения здесь те же, что и для Си2+. Орбиталь dx2 , является в данном случае вакантной, а орбиталь d,—заполненной, поэтому образование комплексов, имеющих октаэдрическую конфигурацию, затруднено. Однако теория предсказывает, что в слабых полях лигандов комплексы никеля(II) склонны к удлинению, а не сжатию до плоской структуры [1]. Все же во многих частных случаях имеются сомнения, являются ли комплексы никеля плоскими или тетраэдрическими. Правда, последние в водных растворах маловероятны [2]. Комплексы никеля(II) с шестикратной координацией и слабым полем лигандов должны быть, как правило, октаэдрами.
Кобальт(II), к7
В высокоспиновых октаэдрических комплексах кобальта(II) со слабым полем лигандов пять Зскэлектронов занимают ^-орбитали (dxy, dyz и dzx) и на каждой е^-орбитали (^ж2 2 и dz,) находится по одному электрону. Несмотря на то что электроны на ег-орбиталях имеют тенденцию препятствовать образованию связи между металлом и лигандами, структура этих комплексов кобальта (II) должна бы быть близкой к правильному октаэдру. Существование тетраэдрических комплексов, таких, как [СоСк]2-, [СоВг;]2” и [Co(NCS)4]2-, частично объясняется тем, что в слабом поле лигандов различия энергии стабилизации полем лигандов для тетраэдрической (1,2А) или октаэдрической (0,8А) конфигураций в случае электронной системы d1 не очень велико. Принимая, что значение А для тетраэдрического комплекса составляет около 4/д значения А октаэдрического, для последнего комплекса следует ожидать чуть большей энергии стабилизации. Однако этого различия может быть не достаточно, чтобы компенсировать тенденцию к образованию тетраэдрической конфигурации, которая при размещении четырех заряженных групп вокруг центрального иона электростатически более выгодна. Удобная классификация синих комплексов кобальта (II) как тетраэдрических и розовых или фиолетовых как октаэдрических не очень надежна [2]; лучшим критерием является тот факт, что для тетраэдрических комплексов интенсивность полосы поглощения в сто раз выше. С другой стороны, в низкоспиновых октаэдрических комплексах кобальта(II) с сильным полем лигандов /г^-орбитали заполнены и на две е?-орбитали остается один электрон. Это приводит, таким же образом, как и в случае меди(II), к ян-теллеров-скому искажению конфигурации в сторону плоской структуры. Общий эффект, однако, в этом случае меньше, и комплекс с шестикратной координацией еще должен существовать.
СТЕРЕОХИМИЯ И УСТОЙЧИВОСТЬ КОМПЛЕКСОВ
51
Железо(П) и к.обальт(1П), d6
В случае железа (II) и кобальта (III) не наблюдается никаких отклонений. В слабых полях лигандов они образуют октаэдрические комплексы, имеющие четыре неспаренных электрона, в то время как в сильных полях их комплексы диамагнитны, ^-орбитали заполнены, а ег-орбитали пусты.
Железо (III) и марганец (II), d5
В слабых полях лигандов каждая из tzg- и е^-орбиталей содержит по одному электрону, так что в этом случае какой-либо стабилизации в поле лигандов не наблюдается. Можно ожидать, что комплексы железа(III) и марганца (II) будут иметь тетраэдрическую или октаэдрическую конфигурации. В сильных полях лигандов осуществляется спаривание электронов с образованием устойчивых октаэдрических комплексов, в которых орбитали es вакантны и пять электронов размещены на орбиталях f2g. Вследствие исключительной устойчивости наполовину заполненных электронных d-уровней (для которых энергия обмена имеет максимальное значение) для достижения этого низкоспинового состояния необходимы более сильные, чем обычно, поля. Анионы со слабыми полями лигандов образуют, вероятно по электростатическим причинам, тетраэдрические комплексы, например [FeCk]-.
Хром(П) и марганец(Ш), d'‘
Высокоспиновые октаэдрические комплексы хрома (II) и марганца (III) содержат на каждой /ггорбитали по одному электрону, а оставшийся электрон занимает одну из орбиталей eg. В тетраэдрических комплексах одна из орбиталей tzg остается незаполненной. В обоих случаях условия таковы, что приводят к ян-теллеровскому искажению. Поэтому в ионе [MnFe]3~ четыре фторид-иона являются ближайшими соседями иона металла, а два других расположены на большем расстоянии от него.
Медь(1)
Ионы меди(1) содержат десять Sd-электронов и обычно образуют четырехкоординированные тетраэдрические структуры типа [СиСЦ]3-. Однако с сильно основными высокополяризованными или легко поляризующимися лигандами медь(1) образует двухкоординированные линейные комплексы. Это обстоятельство было объяснено [3] допущением о смешении s- и d 2-орбиталей, так как самое низшее состояние cPs выше уровня dw всего лишь на 2,7 эв. Это дает возможность двум электронам орбитали dz2 находиться на гибридной орбитали (s — d2J, перенося заряд с оси z в пло-4*
52
ГЛАВА 3
скость ху, что в свою очередь приводит к образованию прочной связи вдоль оси z, при условии, что связь металл—лиганд имеет ярко выраженный ковалентный характер. Другое объяснение заключается в допущении, что если лиганды являются сильными б-донорами, но слабыми л-акцепторами, то образуются двухкоординированные комплексы; если же лиганды сильные л-ак-цепторы, то образуются четырехкоординированные комплексы и тетраэдрическая конфигурация будет результатом образования сильной обратной донорной связи за счет л-электронов [4].
2. ПОЛЯРИЗУЕМОСТЬ И КОВАЛЕНТНЫЙ ХАРАКТЕР
Нихольм [5] полагает, что, чем больше степень ковалентности связей металл—лиганд, тем важнее, чтобы атом металла имел стереохимически и энергетически удобные орбитали. Основным фактором, определяющим степень легкости, с которой эти орбитали могут быть гибридизованы с образованием эквивалентных связей, является разность этих энергий. Такой подход отличается от допущения Дуница и Оргела, поскольку на его основе следует ожидать, что если энергия sp-расщепления велика, то более вероятна sp-гибридизация (двухкоординированный комплекс). По мере уменьшения этой энергии более вероятным становится возникновение связей sp2 (трехкоординированный комплекс) и, наконец, sp3 (четырехкоординированный комплекс). Возможно, что допущение Нихольма имеет преимущество, если остаточный заряд на атоме металла мал. Но если ион металла имеет значительный положительный заряд, удовлетворительнее другое объяснение.
Координационные числа больше шести довольно редки и встречаются, за некоторыми исключениями, в соединениях металлов второго и третьего переходных рядов, редкоземельных элементов и актинидов. В качестве примера можно указать цианидные комплексы [Mo(CN)8]4~, [Mo(CN)8]3-, [W(CN)8]3- и
[Re(CN)8]2-. Их образование является следствием больших размеров катиона (позволяющих разместить вокруг него большее число лигандов), а также доступностью большего числа орбиталей.
Было высказано предположение, что наиболее важным фактором, определяющим координационное число иона металла, является поляризуемость лиганда [2, 6]. При условии, что данные лиганды можно разместить вокруг иона металла в достаточном количестве, их число будет определяться принципом электронейтральности Полинга, т. е. необходимостью уменьшения заряда иона металла почти до нуля. Если лиганд поляризуется с трудом, то заряд лиганда будет передаваться на металл в относительно небольшой степени и следует ожидать более высокого координа
СТЕРЕОХИМИЯ И УСТОЙЧИВОСТЬ КОМПЛЕКСОВ
53
ционного числа. Это объясняет причину существования [FeFe]3-и, с более склонным к поляризации ионом С1~, [FeCU]-. Аналогичным образом вследствие меньшей поляризуемости Н2О по сравнению с С1~ наблюдается образование [Со(Н20)е]2+ и [СоСЦ]-. Было высказано более строгое объяснение этого факта на основе орбитального сжатия [7]. Более высокие координационные числа в цианидных комплексах, например в [Ре(СМ)в]3~ и [Fe(CN)6]4-, можно объяснить участием d-электронов металла в образовании обратной связи, за счет чего степень окисления иона металла несколько возрастает. Следует ожидать, что увеличение степени окисления приведет к увеличению координационного числа, как в случае [AgCl2]~, [CdCh]2- и [InCk]3-. Координационное число может быть меньше для заместителей большого объема в силу трудности расположения их вокруг иона металла.
Как следует из данных табл. 1, наиболее часто встречающимися стереохимическими конфигурациями комплексов являются
Таблица 2
Ожидаемая стереохимия комплексов металлов
Число d-электронов в катионе Четырехкоординированный катион Шестикоординированный катнои
I. Высокоспиновое состояние
0, 5, 10 Правильный тетраэдр Правильный октаэдр
1, 6 Почти правильный тетраэдр Почти правильный октаэдр
2, 7 Правильный тетраэдр я я >»
3, 8 Искаженный тетраэдр Правильный октаэдр
4, 9 Плоский квадрат Тетрагональная структура1
II. Низкоспиновое состояние
3 Почти правильный тетраэдр б
4 Правильный тетраэдр Почти правильный октаэдр
5 Искаженный тетраэдр >> 1) я
6 Я »» Правильный октаэдр
7 Плоский квадрат Тетрагональная структура
8 я я Я >1
а Октаэдрическая, искаженная вдоль одной оси.
б Шестикоординированиое низкоспииовое состояние для d', d2, d3 или d9 невозможно, так же как четырехкоординироваииое для dl, d2 или d9.
Таблица 3
Некоторые примеры комплексов со структурой, близкой к приведенной в табл. 2
I. Высокоспиновое состояние
Число d-электронов в катионе
3 Cr(CN)g—
4 Cr(CN)t~
5 Mn(Cl)2-, FeClf, FeF'^
6 Fe(H2O)|+, CoF|-
7 Col2-, Co(H2O)g+
8 Ni.(H2O)26+
9 Cu(NH3)2+ , Ag(bipy)2+
10 ZnCl2-, CdCl2-, Cu(CN)3-, Hg(CN)2-,
Zn(H2O)2+, Cd(NH3)g+
II. Низкоспиновое состояние
5 Mn(CN)|~, Fe(CN)g~, CoF2-, Ru(CN)g-,
RhF2-, Os(CN)|-, IrClg-
6 Fe(phen)2+, Fe (CN)g-, Co(CN)2-, N1F|~,
Ir(CN)|“, PtCl2~, Rh(CN)|-, PdF6~-
7 Co(NO2)4“
8 Ni(CN)2-, Pd(CN)^-, Au(CN)-, Ni(diars)^+
СТЕРЕОХИМИЯ И УСТОЙЧИВОСТЬ КОМПЛЕКСОВ
55
четырехкоординированные плоские квадратные и тетраэдрические и шестикоординированные октаэдрические. Для ионов переходных металлов приведенное выше обсуждение с хорошим приближением можно обобщить, используя теорию кристаллического поля. Стереохимические структуры комплексов, приведенные в табл. 2, можно ожидать на основе рассмотрения энергий стабилизации кристаллическим полем. Некоторые примеры показаны в табл. 3.
Данные табл. 2 применимы, если связь имеет преимущественно ионный характер. При переходе к структурам, имеющим главным образом ковалентный характер, стереохимия комплексов изменяется, особенно если важную роль играет л-связь. В ионах [СиСЦ]2- и [СиВг4]2-, которые в соответствии с табл. 2 должны быть тетраэдрическими, заметно искажение в сторону образования плоской квадратной структуры [8].
3. ПРОСТРАНСТВЕННЫЕ ЭФФЕКТЫ
Несмотря на то что наиболее прочными комплексами, вероятно, должны быть комплексы, образованные за счет перекрывания (без значительного искажения) заполненных орбиталей лигандов с направленными в их сторону вакантными орбиталями катиона (или наоборот), такого рода структуры иногда неосуществимы по стерическим соображениям. Так, если монодентатные лиганды имеют большой объем и если в молекулу комплекса входит много лигандов, то чисто физические затруднения будут препятствовать расположению их вокруг центрального иона. Положение-станет еще сложнее, если лиганд может занять около иона металла более одного координационного места.
Значительная информация о допустимой стереохимии комплексов с органическими лигандами может быть получена при использовании обычных доступных атомных моделей. Или же приближенную структуру, особенно в случае плоских лигандов, зачастую можно себе представить, используя радиусы катионов, приведенные в табл. 2, гл. 2, средние длины связей, перечисленные в табл. 4, и обычные значения углов связей.
Пространственные затруднения при координации могут быть следствием довольно незначительных изменений структуры лиганда. Хорошими примерами являются 1,10-фенантролин, применяемый для определения иона двухвалентного железа, и 2,9-ди-метил-1,10-фенантролин — реагент на ион меди(1). Трис-1,10-фена нтрол иновый комплекс Fe (II) (но не моно- или бис-комплекс) является низкоспиновым и имеет большую константу устойчивости. Кроме того, он интенсивно окрашен. Соответствующие комплексы Cu(I) не стабилизированы полем лигандов и менее устойчивы. С другой стороны, метильные группы в 2,9-диметил-1,10-
56
ГЛАВА 3
Таблица 4
Средние значения длин связейа, А
N—Н 1,01—1,07
N—О 1,19—1,36 СО (в гетероциклах) 1,37
N=O 1,11—1,22
О—Н 0,96—0,98 С = О 1,23; 1,15 (п-хиноны)
Р—О 1,39—1,63
Р—S 1,86 C = S 1,71
S—н 1,33—1,35 CS (в гетероциклах) 1,73
S—О 1,41—1,45
S—S 2,04
с-н 1,09 С—S 1,81
С—N 1,47; 1,32 С-С 1,54; 1,47
(в амидах) (в С = С—С=С)
'CN (в ге- 1,35 1,37 (в С г С—CsC)
тероцик-
лах)
CsN 1,16
С—О 1,43; 1,36 СС (в ароматических 1,40
(фенолы, кар- углеводородах)
боновые кисло-
ты, сложные С=С 1,34
эфиры) с=с 1,20
а Взято из Tables of Interatomic Distances and Configurations in Molecules and Ions, Special Publication, № 11, The Chemical Society, London, 1958.
фенантролине оказывают стерические затруднения образованию трис-комплекса Fe(II), а бис-комплекс является высокоспиновым и бесцветным. Однако метильные группы не препятствуют образованию тетраэдрического бис-комплекса меди(1) и даже существенно увеличивают его устойчивость, так как вызывают повышение основности лиганда. Подобный же эффект наблюдается в случае б.б'-диметил- или б.б'-диаминопроизводных 2,2'-дипири-дила. Возможно, что важную роль играет и разница в размерах ионов металлов: ион Cu(I) имеет больший радиус, поэтому лиганды находятся на большем расстоянии друг от друга и стерические затруднения уменьшаются. Подобным же образом малым радиусом иона А13+ можно объяснить невозможность его комплексообразования с 2-метил-8-оксихинолином и аналогично за
СТЕРЕОХИМИЯ и устойчивость комплексов
57
мещенными акридинами, которые, однако, реагируют с ионами больших радиусов, такими, как Сг3+, Fe3+, Ga3+, Cu2+ и Zn2+ [9]. Введение в положение 2 оксихинолина фенильной группы препятствует образованию трис-комплексов с А1(Ш) и Сг(Ш). 2-Метил-8-оксихинолин отличается от 8-оксихинолина тем, что не дает осадка с алюминием. Применение его облегчает также экстракцию галлия и индия и их определение в присутствии алюминия *.
Интересный пространственный эффект другого типа наблюдается в случае З.З'-замещения в 2,2'-дипиридиле. Введение в эти положения групп большого объема искажает плоскую структуру лиганда, что приводит к уменьшению стабилизации за счет резонанса и появлению напряжения в связях металл—лиганд [10]. Подобный эффект наблюдается и при введении изопропильной или втор-бутильной групп в положение 3 ацетилацетона. Такие лиганды не образуют обычных окрашенных комплексов с Fe(III) или Си (II). Видимо, это объясняется стерическим взаимодействием между изопропильной группой в положении 3 и метильной группой в положениях 2 или 4, в результате чего планарность цикла нарушается, что в свою очередь препятствует резонансу и предотвращает комплексообразование [11]. Если изопропильную группу отодвинуть от ацетилацетоновой цепи, поместив между ними метиленовую группу, то произойдет обычное комплексообразование.
В лигандах типа порфиринов и фталоцианинов большое влияние на прочность комплексов оказывает размер центральной ячейки. Такие крупные ионы, как Hg2+ и РЬ2+, могут не поместиться в центре порфиринового ядра [12], в то время как для небольших ионов можно ожидать, что устойчивость комплексов будет уменьшаться с уменьшением радиуса катиона, ибо вследствие жесткости порфиринового ядра степень перекрывания орбиталей иона металла и лиганда будет постепенно падать. Это объяснение прочности комплексов условно: рассмотренные комплексы и другие комплексы, включающие полидентатные лиганды, гораздо более устойчивы, чем комплексы с монодентат-ными лигандами. Этот «хелатный эффект» частично определяется различиями в изменениях энтропии и частично — гораздо большей энергией, требующейся для разрыва всех связей металла в полидентатных комплексах за время, которое мало по сравнению со временем, необходимым для их образования. В добавление к влиянию на комплексообразование размеров ячейки порфиринов и фталоцианинов геометрия этих лигандов требует плоской квадратной конфигурации их комплексов с металлами.
* Неоправданные повторения одной и той же информации о реакции 2-метил-8-оксихинолина с А1. Сведения о реакции с Сг3+ противоречивы. —. Прим. ред.
58
ГЛАВА 3
Однако за счет дополнительной координации строение комплексов может приближаться к октаэдрическому.
Другим примером влияния геометрических факторов на комплексообразование является взаимодействие Ag(I) с полиметилендиаминами. Обычно хелаты с пятичленными циклами имеют большие константы устойчивости, чем соответствующие комплексы, включающие циклы других размеров. Однако все шести-, семи- и восьмичленные циклические структуры, образованные Ag(I) с триметилендиамином, тетраметилендиамином и пентаметилендиамином, более устойчивы, чем пятичленный комплекс с этилендиамином [13]. Это, вероятно, объясняется тем, чтосуве-личением размера цикла стереохимия связей Ag может в значительной мере приближаться к линейной, ожидаемой для координационного числа 2.
Аналогично этому лиганд р, р', р"-триаминотриэтиламин способен образовывать тетрадентатный комплекс, имеющий тетраэдрическую структуру. Однако для иона Си(II) предпочтительно образование комплексов плоской или искаженной октаэдрической структуры, поэтому комплексы Си (II) с триаминотриэтила-мином менее прочны, чем это можно было бы ожидать по другим соображениям [14]. С другой стороны, триэтилентетраамин может легко давать плоские квадратные комплексы и его комплекс с медью гораздо более устойчив.
4. КОНСТАНТЫ УСТОЙЧИВОСТИ КОМПЛЕКСОВ МЕТАЛЛОВ
Значения констант устойчивости комплексов, образованных в водном растворе ионами данного металла с определенными лигандами, весьма важны в аналитической химии. Существенны также различия в значениях констант устойчивости комплексов тех же лигандов с другими металлами, так как они характеризуют содержание мешающего вещества, которое может присутствовать при использовании соответствующих аналитических методов.
Одна из наиболее ранних попыток качественной классификации была предпринята Сиджвиком [15], который разделил металлы на три группы в зависимости от их способности соединяться с кислородом (обычно образуя нормальную ковалентную связь) или с азотом (обычно с образованием координационной ковалентной связи). Группы эти следующие:
1. Связь с кислородом более прочная, чем с азотом: Mg, Са, Sr, Ba, Qa, In, Tl, Zr, Th, Si, Ge, Sn,
V(1V), V(V), Nb(V), Ta(V), Mo(V), U(VI), Fe3+, Co2+.
2. Связь с кислородом и азотом сравнима по прочности:
Be, Cr3+, Ре2+, Ru, Rh, Pd, Os, Ir, Pt.
СТЕРЕОХИМИЯ И УСТОЙЧИВОСТЬ КОМПЛЕКСОВ
59
3. Связь с кислородом менее прочная, чем с азотом:
Cu+, Ag+, Au+, Cu2+, Cd, Hg, V3+, Co3+, Ni2+.
В то время как к первой группе относятся главным образом ионы, имеющие оболочку типа инертного газа или содержащие мало d-электронов, металлы третьей группы имеют заполненные или почти заполненные d-электронные уровни. Поэтому данную классификацию легко можно объяснить поляризационными взаимодействиями. Можно допустить, что большая поляризуемость неПоделенной пары электронов атома азота по сравнению с кислородом и большая деформируемость ионов металлов с заполненными d-уровнями ведут к большему взаимному проникновению орбиталей и, следовательно, к образованию металлами третьей группы более прочных связей с азотом, чем с кислородом.
Способность к поляризации возрастает с уменьшением заряда иона металла. Поэтому различие между подгруппами одной группы периодической системы будет наибольшим для элементов главной (Li+, Na+, К+, Rb+, Cs+) и побочной (Cu+, Ag+, Au+) подгрупп I группы, в то время как четырехзарядные ионы побочной и главной подгрупп IV группы весьма сходны по своей комплексообразующей способности и относятся к группе катионов, образующих с кислородом связь, более прочную, чем с азотом. Тот факт, что Fe (III) находится в первой группировке, а не во второй или третьей, как ионы других трехвалентных металлов, можно объяснить разницей энергий стабилизации полем лигандов (ЭСПЛ), которая больше для лигандов, содержащих азот, нежели для кислородсодержащих лигандов. В слабых полях ЭСПЛ для Fe(III) равна нулю, так что в этом случае дополнительная стабилизация, которая могла бы сделать координацию азота более предпочтительной, отсутствует. Сиджвик также отнес Be, Си(II) и Au(III) к группе, для которой более характерна связь с кислородом, чем с серой, а Си (I), Ag(I), Au (I) и Hg — к группе, для которой характернее связь с серой, а не с кислородом.
Возможна также и некоторая дифференциация внутри этих группировок. Так, в ряду Al3+, Ga3+, In3+ и Т13+ более электроположительные катионы А13+ и Ga3+ имеют большую тенденцию к образованию электростатически связанных комплексов, тогда как сравнительно менее электроположительные ионы 1п3+ и Т13+ имеют сравнительно большую тенденцию к образованию ковалентных связей и легче образуют комплексы с поляризующимися лигандами, такими, как ионы тяжелых галоидов.
Недавно была проведена более обширная корреляция относительного сродства атомов лигандов к различным молекулам и катионам [16]. Катионы разбиты на два определенных класса й и б в зависимости от того, образуют ли они более устойчивые комплексы с первым или со вторым атомом следующих пар:
60
ГЛАВА 3
N, Р; О, S и F, Cl. Хотя одни и те же металлы в различных валентных состояниях могут вести себя совершенно по-разному, в обычном валентном состоянии большинство металлов образует более прочные связи с N, О и F. С другой стороны, к группе металлов, предпочтительно взаимодействующих с Р, S и С1, относятся Cu(I), Rh(I), Pd(II), Ag(I), Pt(II), Hg(II), большинство переходных металлов в низших валентных состояниях и все переходные металлы в нуль-валентных состояниях. Различия в устойчивости комплексов Co(II), Ni(II) и Cu(II) менее определенны, хотя F связывается несколько сильнее, чем Cl, S — несколько сильнее, чем О, и, возможно, Р — немного сильнее, чем N. По-видимому, наиболее важным фактором является образование обратной двойной связи за счет (/л-электронов металла и вакантных З^-орбиталей Р, S и С1. Оно становится тем заметнее, чем ниже валентное состояние металла и чем ниже его ионизационный потенциал. Оно также становится сильнее, если лиганд является нейтральной молекулой, а не анионом, особенно в тех случаях, когда ион металла имеет заполненные или почти заполненные п!-орбитали. В As, Se и Вг 4сРорбитали более размыты, так что этот вид орбитального перекрывания вносит в устойчивость комплексов меньший вклад.
Наблюдающееся в случае тиомочевины (NH2)2CS комплексообразование за счет координации металлом атома серы вполне согласуется с данной интерпретацией. Тиомочевина образует бесцветные и лишь слабо растворимые комплексы с Ag, Cu(I), Hg(II) и Т1, но дает и окрашенные комплексы типа [Bi (NH2CSNH2)3]3+ и [Os(NH2CSNH2)6]3+. Поэтому тиомочевина и ее производные были использованы для обнаружения ряда металлов [17]. Было отмечено, однако, что комплексообразование с Ru протекает с отщеплением протона от МНг-группы каждой координированной молекулы тиомочевины [18, 19]. Ион меди (II) восстанавливается тиомочевиной с образованием бис-комплексного иона [Cu(NH2CSNH2)2]+.
При отсутствии стерических эффектов и эффектов сопряжения катионы класса (а) обладают способностью к координации в последовательности N^>P > As > Sb; 0^>S; F^>Cl>Br>I, а для ряда однотипных лигандов NR3, R2O и RF — в последовательности N О F. В случае катионов класса (б) порядок будет следующим: > As > Sb > Bi; 0<CS; F<CC1 < Br < I
и N>O>F. Вследствие образования обратной двойной связи, а также увеличивающейся поляризуемости и уменьшения отталкивания неподеленной пары электронов заполненными с?„-орби-талями металла различия в ряду Р > S > С1 менее глубоки. В своих высших валентных состояниях Hg, Tl, Sn и РЬ должны обнаруживать большую тенденцию к образованию обратных двойных связей, чем в низких состояниях окисления, так как
СТЕРЕОХИМИЯ и УСТОЙЧИВОСТЬ комплексов
61
в последних валентные электроны находятся на s-орбиталях, тем самым экранируя электроны d-орбиталей и делая их менее доступными для участия в образовании обратной двойной связи.
Ограниченное, но ценное следствие было впервые отмечено Ирвингом и Уилльямсом [20], расположившими комплексы двухвалентных металлов первого переходного ряда в соответствии с их константами устойчивости (независимо от природы лиганда) в следующем порядке: Мп <? Fe < Со < Ni < Си > Zn. Теоретическое рассмотрение причин этого расположения дано в гл. 4. Наибольшее увеличение log (3 (где Р — общая константа устойчивости комплекса) при переходе от Мп(II) к Си(II) имеет место в случае лигандов, содержащих донорные атомы азота (например, log 02 для этилендиамина меняется от 4,8 для Мп до 19,6 для Си). В случае лигандов, содержащих одновременно азот и кислород, изменение меньше (например, в случае глицина log (32 увеличивается от 5,5 для Мп до 15,2 для Си). Лиганды же, содержащие кислород, обнаруживают гораздо меньшее различие (соответствующие цифры для щавелевой кислоты — 5,3 и 8,5). Разницу в «скорости» изменения log (3 можно приписать различиям в силе полей лигандов. Комплексы цинка по своей прочности обычно лежат между комплексами кобальта и никеля.
Были предложены многие другие ряды констант устойчивости. Они не имеют общего значения, но полезны при оценке вероятной относительной способности различных катионов к координации с определенными лигандами. Некоторые примеры приведены в табл. 5. Практически целесообразнее пользоваться непосредственно таблицами констант устойчивости [21]*. Эти таблицы показывают, что в общем случае константы устойчивости комплексов щелочных и щелочноземельных металлов уменьшаются с увеличением размеров катиона.
По своим размерам и заряду Т1+ напоминает К+ и Rb+, но так как Т1+ деформируется легче К+ (как и следует ожидать для иона с заполненным d-уровнем), он образует с органическими лигандами более прочные комплексы. По этой же причине Лтшг > > Ktici >Ktif- Для комплексов трехвалентных лантанидов с ^-диаминоциклогексан-М.М.М'.М'-тетрауксусной кислотой, этилендиаминтетрауксусной кислотой и нитрилотриуксусной кислотой имеется линейная зависимость между log/G и величиной, обратной радиусу иона металла [22]. Как и следует ожидать, константы устойчивости для щелочных металлов меньше, чем для щелочноземельных. Аналогично этому для редкоземельных металлов характерно прогрессирующее уменьшение прочности комплексов с увеличением размеров катиона. Величина z2/r, где z—заряд и г — радиус иона металла, грубо коррелируется
* См. примечание на стр. 13. — Прим. ред.
Таблица 5
Некоторые эмпирические ряды констант устойчивости комплексов металлов
Ряд Тип лиганда
Pd (II) > Си (II) > Ni (II) > Pb (I I) > Co (I I) O—oa
Zn>Cd>Hg(Il) 0-0 a
Pd (II) > Си (II) > Ni (11) > Co (11) > Zn > Cd > > Fe (I I) > Мп (II) > Mg N- N6
Cu (I I) > Ni (11) > Fe (11) > Zn > Mg №
Cu (11) > Be > Cd > Pb (II) > Ni (II) > Zn > > Co (11) > Mg > Ca > Ba Or
Си (II) > Be > Ni (I I) > Zn > Co (II) > Pb (II) > >Mn(lI)>Cd> Mg O—Oa
Cu (I I) > Ni (I I) > Zn > Pb (I I) > Cd > Mg oe
Си (II) > Ni (II) > Zn > Pb (II) Co (II) > > Мп (11) >• Mg > Ca Sr > Ba N—OK
Mg > Ca > Sr > Ba > Ra N—O3
Pt (I I) > Pd (II) > Hg (I I) > UO2 (II) > Be > > Cu (II) > Ni (II) > Co (11) > Pb(lI)>Zn> > Cd > Fe (11) > Мп (I I) > Ca > Sr > Ba (и)
Ag (1) > T1 (1) > Li > Na > К > Rb > Cs О—ок
Fe (111) > Ca (111)> Al>Sc >In II1)>Y(III)> о-ол
Рг (111) > Се (II1) > La (111)
а Салицилальдегид. Mellor D. Р., Maley L. Е., Nature, 159, 370 (1947).
б Этилендиамии. Mellor D. Р., Maley L. Е. Nature, 161, 436 (1948).
в Пиридин. Pfeiffer Р., Thielert Н., Glaser Н., J. Prakt. Chem., 152, 145 (1939).
г Нитроуксусная кислота. Pedersen К. J., Acta Chem. Scand., 3, 676 (1949).
Д Ацетоидикарбоиовая кислота. Prue J., J. Chem. Soc., 1952, 2331.
в Этил-2-оксоциклопеитакарбоксилат. Pedersen R. J., Acta Chem. Scand., 2, 385 (1948).
ж Глицин. Monk С. B., Trans. Faraday Soc., 47, 297 (1951).
з Аспарагиновая и глутаминовая кислоты. Lumb R. F., Martell A. E., J. Am. Chem. Soc., 75, 690 (1953).
и Лиганды не указаны. Basolo F., Pearson R. G., Mechanisms of Inorganic Reactions, John Willey and Sons. New York, 1958, p. 16.
к Дибензоилметан. Fernelius W. C. Van Ui tert L. G., Acta Chem. Scand., 8, 1726 (1954).
л Ацетилацетои. I z a t t R. M., Fernelius W. C., Haas C. G., Block В. P., J. Phys. Chem., 59, 170 (1955).
СТЕРЕОХИМИЯ И УСТОЙЧИВОСТЬ КОМПЛЕКСОВ
63
со значениями log Ki для комплексов ионов металлов с различными зарядами, при условии, что комплексы образованы главным образом за счет электростатических сил.
Константы устойчивости комплексов металлов с рядом лигандов, имеющих сходные структуры, часто в первом приближении линейно зависят от основности лиганда: log fJ ~ а • рКа + Ь. Причиной этому служит то, что факторы, имеющие значение при образовании о-связи между лигандом и ионом металла, подобны таким же факторам при протонизации молекулы лиганда, поэтому чем больше основность амина, тем больше константа устойчивости его комплекса с металлом. Величину b было предложено считать мерой л-характера связи металл—лиганд [23]. Более детальный анализ этого соотношения для комплексов Cu(II) с рядом замещенных салицилальдегида подтвердил такую интерпретацию, но показал, что величина b зависит от положения, в котором находится заместитель. Это было интерпретировано как показатель изменчивости л-электронных взаимодействий [24]. Аналогично этому, если сопряжение в ароматической системе расширяется за счет аннелирования большего числа колец или же более тесного их связывания, как, например, при переходе от салицилальдегида к 2-окси-1-нафтальдегиду или от 2,2'-дипиридила к 1,10-фенантролину, это должно, вероятно, приводить к образованию орбиталей лиганда, гораздо более энергетически выгодных для осуществления с ионами металла л-связи. С другой стороны, плотности о-электронов на основных центрах и, следовательно, \)Ка лиганда не будут сильно различаться. Так, зависимость log К от рКа для комплексов переходных металлов с замещенными дипиридилами и 1,10-фенантролинами графически будет характеризоваться разными линиями и в последнем случае наклон будет больше.
5. ТЕРМОДИНАМИКА КОМПЛЕКСООБРАЗОВАНИЯ
Большинство реакций комплексообразования протекает быстро и обратимо, так что степень протекания реакции определяется разницей термодинамических характеристик исходного и конечного состояний.
Константа устойчивости комплекса количественно связана со свободной энергией его образования из исходных компонентов:
— ДО = 2,303/??'log К.
Используя соотношение —AG =—АН + TAS, где АН — изменение соответствующей теплоты, или энтальпии, а АЗ — изменение энтропии, можно записать
og/< 2,3037? ' (1)
Обычно АЗ и АН не сильно изменяются с температурой.
64
ГЛАВА 3
Из уравнения (1) следует, что комплексообразование будет наиболее выгодным в реакциях, для которых изменение энтропии положительно (система становится более неупорядоченной или содержит большее число частиц), а изменение энтальпии отрицательно (выделяется тепло).
На первый взгляд следует ожидать, что изменение энтропии при комплексообразовании будет всегда отрицательным из-за уменьшения числа свободных частиц при расположении ионов или молекул лигандов вокруг центрального иона металла. Однако следует также учитывать влияние растворителя. Так как ионы металла ориентируют непосредственно окружающие их молекулы воды, наблюдается тенденция к образованию определенных гидратов, которые можно мысленно представить себе как «айсберги», в которых вода «заморожена». Этот эффект приводит к образованию в растворе, вне оболочки из молекул воды, неупорядоченной (или «тающей») области [25]. Получающиеся в результате изменения энтропии включают потерю 5,3 энтропийной единицы (равных энтропии кристаллизации воды) на каждую молекулу «замороженной» воды наряду с неизвестной величиной, идущей на дезориентацию растворителя. Эти изменения являются дополнением к вкладу, предсказанному уравнением Борна, обусловленным взаимодействием иона с поляризующейся диэлектрической средой — водой. Эта составляющая меняется прямо пропорционально квадрату заряда и обратно пропорционально радиусу ячейки, в которой помещается ион. Когда ион металла и анион-лиганд сближаются для образования комплекса, число ионов в растворе будет уменьшаться; будет происходить частичная нейтрализация и уменьшение заряда системы и уменьшаться число молекул воды, находящихся в сольватных оболочках ионов. Последний эффект с точки зрения изменения энтропии представляется наиболее важным. Следовательно, в любой реакции между катионом и анионом с образованием комплекса изменение энтропии будет, вероятно, благоприятствовать реакции. Видимо, изменение энтропии будет менее положительным, или более отрицательным, в том случае, когда взаимодействие катиона с лигандом будет приближаться к чисто электростатическому и почти соответствовать образованию ионной пары.
Другой подход заключается в рассмотрении некоторых обобщающих выражений для энтропии некоторых неорганических соединений. Энтропия гидратированного одноатомного иона определяется выражением
S° = 4- Я In Al + 27 - 270' , 2 rz
' е
где М—атомный вес иона, г— число зарядов на ионе и ге— его эффективный радиус (А) [26]. Другое отношение [27]
СТЕРЕОХИМИЯ и УСТОЙЧИВОСТЬ КОМПЛЕКСОВ
65
"о° 3 П1 । it;'? 11,6^2
S = -g- R In М + 15,7---— ,
где г — радиус иона по Полингу, более соответствует форме, ожидаемой на основе уравнения Борна. Оба эти выражения для S° отвечают результатам, полученным для многих ионов (стандартное отклонение равно примерно ±4—5 энтропийных единиц). Энтропия гидратированного оксианиона типа XOZ“ хорошо передается уравнением [28]
5° = 43,5 — 46,5 (г — 0,28п).
Кроме того, энтропию многих гидратированных неорганических ионов можно вычислить (с точностью, отвечающей имеющимся экспериментальным данным) по уравнению [29]
S° = 49—99|г| + 16,7л, г 12
где Г12 — межатомное расстояние (катион-лиганд) в комплексе, z — общий заряд иона, п — число координированных молекул воды, замещенных анионами-лигандами, и 16,7=5^О. Были отмечены некоторые исключения [30].
Из этих уравнений также следует, что при любом взаимодействии между катионом и анионом, сопровождающемся образованием комплекса, изменение энтропии должно способствовать реакции и, кроме того, что это изменение энтропии должно быть тем больше, чем больше заряды и чем меньше радиусы катиона и аниона. На практике изменение энтропии обычно бывает положительным [31, 32] и находится в качественном соответствии с этими выводами. Так, при 25° изменение энтропии для реакции Fe3alq+X~q^FeX2a+q будет +23,0; +35,0 и +49,0 энтропийных единиц (кал/°С) для Br_, С1_ и F- соответственно [33]. Подобным же образом для процесса + С1_**МС1^“9+ изменение энтропии в случае Mn+=Ag+, Cd2+, Sn2+, Сг3+ и Fe3+ равно соответственно 6,0 [34], 8,0 [35], 14,0 [36], 23,3 [37] и 35,0 [33] энтропийных единиц.
В случае монодентатного незаряженного лиганда не происходит ни уменьшения числа ионов в растворе, ни нейтрализации заряда. Лиганд будет менее гидратированным, чем если бы он был анионом, и изменение (при комплексообразовании) ориентации растворителя вокруг иона металла также будет меньшим. Как результат этих различий изменение энтропии будет менее благоприятным, чем в случае заряженных лигандов. В действительности оно в обычной молярной шкале часто бывает отрицательным [32] и, следовательно, препятствует реакции, однако в большинстве случаев этот эффект невелик.
5 Д. Перрии
66
ГЛАВА 3
Эти рассуждения указывают, что изменения энтропии при комплексообразовании в значительной мере обусловлены различной степенью гидратации комплекса по сравнению с гидратацией исходных компонентов и различиями в размерах той области, где растворитель разупорядочен.
Если лиганд образует полидентатные циклические комплексы, то происходит потеря конфигурационной энтропии, но в этом случае гидратные оболочки реагирующих веществ теряют большее число молекул воды. Получающееся в результате изменение энтропии больше, чем при образовании соответствующего нециклического комплекса. Как и следует ожидать, это изменение энтропии больше для заряженного, чем для нейтрального комплексообразующего реагента, причем эффект возрастает с увеличением заряда лиганда. Так, А5 для образования комплексов EDTA с Ni, Си и Zn равно 56 энтропийным единицам [38], в то время как для соответствующих бис-комплексов с ацетилаце-тоном, 8-оксихинолином и этилендиамином это значение лежит соответственно между 12—31, 15—21 и 3—8 энтропийными единицами. (Вклад разности энтропий в «хелатный эффект» подробнее обсуждается в разд. 6 гл. 3.)
Наблюдается известное соответствие между изменениями значений энтропий при комплексообразовании и стандартными энтропиями металлов и лигандов, принимающих в нем участие [39]. Оно свидетельствует о том, что на все три величины влияют одни и те же факторы. Тем не менее в настоящее время все еще нет достаточно надежной информации об изменениях энтропии при комплексообразовании, чтобы сделать какие-либо количественные прогнозы.
При рассмотрении изменений теплот, наблюдающихся в тех же процессах, можно сделать в значительной мере аналогичные замечания. В водных растворах в случае ступенчатого процесса обычная величина —АН изменяется приблизительно от нуля до ±5 ккал/моль для ионных лигандов или до 10 ккал, если вероятно образование ковалентной связи (например, при взаимодействии Ag(I) или Hg(II) с CN- или I-); —АН ~0—5 ккал/моль для нейтральных монодентатных лигандов; —АН увеличивается до 20 ккал в случае нейтральных полидентатных лигандов. (Ошибка в величине АН, равная 5 ккал, приводит к ошибке в 3,6 единицы для любого значения log К при 25°, что можно вычислить из термодинамических данных.)
Эти значения —АН являются теми небольшими изменениями теплот, которые сопровождают замещение воды другими лигандами. Гринберг и Яцимирский [40] на основании рассмотрения термодинамического цикла высказали предположение, что изменение теплоты при замещении молекулы воды другим лигандом в газовой фазе может служить мерой величины —АН для того же
СТЕРЕОХИМИЯ И УСТОЙЧИВОСТЬ КОМПЛЕКСОВ
67
процесса в растворе. Это допущение дало им возможность предсказать, что значение —А// для образования гексаамминов должно изменяться в соответствии с рядами
Na<Mg<Al; Mg>Ca>Sr и Са < Мп < Со < Ni < Си > Zn.
Главной составляющей величины А// для ионов переходных металлов является энергия стабилизации полем лигандов. В октаэдрическом поле энергия расщепления уровней равна для двухзарядных акво-ионов переходных металлов первого ряда примерно 30 ккал!моль и для трехзарядных — около 60 ккал/моль. Значения ЭСПЛ позволяют предсказать, что в высокоспиновых комплексах величина —А// будет меняться в зависимости от числа d-электронов иона металла в следующем порядке: d° <Z d1 < < d2 < d3~d4 > d5 < d6 < d7 < d8~d9 >.d10. Исключение составляют случаи d3 < d4 и d8 < d9, если имеются четыре или меньше координированных донорных атома или если влияние стабилизации Яна—-Теллера (~8 ккал!моль в акво-ионе Си(II)) сравнительно велико. Это снова приводит к «естественному» ряду прочности комплексов двухзарядных ионов Fe < < Со < Ni < Си > Zn.
Ввиду неопределенности, свойственной любой попытке предсказать А5 или \Н для какой-либо реакции комплексообразования, обсуждение соответствующих изменений свободных энергий может показаться совершенно бесполезным. Тем не менее, если сравнивать комплексы двух сходных металлов с большим числом лигандов, можно сделать ряд полезных заключений. Так, зависимость log/( (NIL) от log A (ZnL) для 72 различных лигандов, занимающая логарифмическую шкалу в 19 единиц, является линейной [41]; это свидетельствует о том, что в обоих случаях действуют одинаковые факторы. В особом случае комплексов лантанидов с поликарбоновыми кислотами изменения свободных энергий зависят главным образом от изменений энтропии. Поэтому логарифмы констант устойчивости их комплексов с EDTA линейно зависят от стандартных значений энтропий ионов лантанидов [42]. С другой стороны, сопровождающие комплексообразование изменения энтропии в ряду Мп(II)—Си(II) являются или в основном постоянными, или же подобны соответствующим изменениям теплот; в связи с этим последовательность свободных энергий в этом случае та же, что и для —А//. Аналогично этому для соединений щелочноземельных металлов —\Н и +А5 часто меняются в одном направлении, так что комплексы по прочности обычно располагаются по ряду Mg > Са > Sr > Ва. Если преобладает влияние энтропии, свободная энергия меняется в ряду F >; Cl > Br >> I; в противном случае ряд обращается.
В смесях растворителей типа диоксан—вода или этанол— 5*
68
ГЛАВА 3
вода комплексы металлов имеют более высокие константы .устойчивости, чем в воде. Это в значительной мере объясняется ослабленным (вследствие более низкой диэлектрической проницаемости среды) взаимодействием между растворителем и ионом металла. Для удаления молекулы растворителя из ближайшего окружения иона металла и замещения ее молекулой лиганда требуется меньшая работа. Однако этот эффект обычно меньше, чем можно было бы ожидать, принимая во внимание измеренное значение диэлектрической проницаемости. Связано это с преимущественной тенденцией молекул воды заполнять оболочку вокруг иона металла.
6. ХЕЛАТНЫЙ ЭФФЕКТ
Циклические комплексные соединения, чаще всего включающие пяти- и шестичленные циклы, обычно обладают большей устойчивостью, нежели соответствующие комплексы, содержащие монодентатные лиганды. Немногие известные исключения можно отнести за счет стерических препятствий, которые обычно вызываются тем, что ион осуществляет наиболее предпочтительную для него конфигурацию. Склонность Ag(I) и Cu(I) (если лиганд является сильным основанием) к линейным структурам приводит к заметному напряжению, если эти металлы должны быть связаны с двумя концами молекулы этилендиамина. (В самом деле, маловероятно, что Cu(I) образует хелаты с этилендиамином или анионом глицина. По-видимому, оба лиганда ведут себя как монодентатные замещенные первичные амины.)
Эту большую устойчивость можно количественно выразить, например, сравнением величин log Ki для комплексов металлов с этилендиамином состава 1 : 1 и log 02 соответствующего бискомплекса с метиламином. Отчасти это результат энтропийного эффекта, но важную роль играет и стабилизация за счет поля лигандов, поскольку в случае полидентатных хелатов поля лигандов более сильные, чем в случае монодентатных. Это в свою очередь позволяет предположить, что изменение энтальпии (А//) при хелатообразовании больше и что связи между металлом и лигандом короче. Термодинамические функции, полученные для комплексов металлов с аммиаком и этилендиамином [43], подтверждают эту интерпретацию. Адамсон [44] отметил, что изменение энтропии, связанное с хелатным эффектом, весьма незначительно, если результаты выражать в термодинамически более предпочтительной шкале молярных долей, а не в привычной шкале молярных концентраций. В этих условиях AS может быть небольшой отрицательной величиной. Возможно, что причиной этого является потеря при хелатообразовании конфигурационной энтропии, например подвижная цепь этилендиамина становится более жесткой [45].
СТЕРЕОХИМИЯ и УСТОЙЧИВОСТЬ КОМПЛЕКСОВ
69
Качественно следует ожидать, что чем разбавленнее будет раствор, тем более важным будет хелатный эффект. Это видно при сравнении поведения моно-.и бидентатных лигандов в очень разбавленных растворах. В первом случае присоединение лиганда к иону металла не приводит к обогащению лигандом раствора вокруг комплекса состава 1 : 1, в то время как во втором случае присоединение одного конца бидентатного лиганда обеспечивает близость второй комплексообразующей группы.
При условии удовлетворения требований стереохимии хелатный эффект усиливается с увеличением числа циклов, имеющихся в комплексе. Полезные примеры можно найти среди констант устойчивости комплексов двухвалентных Mg, Со, Ni, Си, Zn и Cd с би-, три- и тетрадентатными хелатообразующими реагентами — глицином, иминодиуксусной кислотой и нитрилотриуксусной кислотой [46].
ЛИТЕРАТУРА
1. О pre л Л., Введение в химию переходных металлов (Теория поля лигандов), изд-во «Мир», М., 1964.
2. G i 11 N. S., N у h О 1 m R. S„ J. Chem. Soc., 1959, 3997.
3. D u п i t z J. D., Or gel L. E., Adv. Inorg. Radiochem., 2, 1 (1960).
4. J a m e s B. R., Williams R. J. P., J. Chem. Soc., 1961, 2007.
5. Nyholm R. S, Proc. Chem. Soc., 1961, 273.
6. Gill N. S., Pauling P. J., Nyholm R. S„ Nature, 182, 168 (1958).
7. C r a i g D. P., Magnusson E. A., Discussions Faraday Soc., 26, 116 (1958); J. Chem. Soc., 1956, 4895.
8. Moros in B., Lingafelter E. C., Acta Cryst., 13, 807 (1960).
9. Irving H., Butler E. J., Ring M. F., J. Chem. Soc., 1949, 1989.
10. Cagle F. W„ Smith G. F„ J. Am. Chem. Soc., 69, 1860 (1947).
11. Martell A. E., Calvin M., Chemistry of the Metal Chelate Compounds, Prentice-Hall, New York, 1952, p. 175.
12. Barnes J. W., Do rough G. D„ J. Am. Chem. Soc., 72, 4045 (1950).
13. Schwarzenbach G., Maissen B., Ackermann H., Helv. Chim. Acta, 35, 2333 (1952); Schwarzenbach G., Ackermann H., Maissen B., Anderegg G„ Helv. Chim. Acta, 35, 2337 (1952).
14. Schwarzenbach G., Helv. Chim. Acta, 35, 2344 (1952).
15. Si dg wick N. V., J. Chem. Soc., 1941, 433; The Electronic Theory of Valency, Oxford University Press, London, 1927.
16. Ahrland S., Chat J., Davies N. R., Quart. Rev. (London), 12, 265 (1958).
17. Yoe J. H., Overholser L. G., Ind. Eng. Chem., Anal. Ed., 14, 435 (1942); Mahr C., Angew. Chem., 53, 257 (1940); Gilchrist R., J. Res. Bur. Std., 6, 421 (1931); Whitmore W. F„ Schneider F., Mikrochem., 17, 279 (1935).
18. Yaf fe R. P„ Voigt A. F„ J. Am. Chem. Soc., 74, 2503 (1952).
19. О применении реагентов типа тиомочевины для колориметрического определения рутения см. Steiger В., Mikrochem., 16, 193 (1934); для определения платиновых металлов см. Knight S. В., Parks R. L., L е i d t S. C., Parks К. L., Anal. Chem., 29, 571 (1957); G e i 1 m a n n W., NeebR., Z. anal. Chem., 152, 96 (1956).
20. I r v i n g H., W i 11 i a m s R. J. P., Nature, 162, 746 (1948).
70
ГЛАВА 3
21. В j er rum J., Schwarzenbach G., Si lien L. G., eds., Stability Constants of Metal-Ion Complexes; Part I: Organic Ligands; Part II; Inorganic Ligands, Chemical Society, London, 1957—1958.
22. Schwarzenbach G., Freitag’E., Helv. Chim. Acta, 34, 1492 (1951); Schwarzenbach G., Gut R., Helv. Chim. Acta, 39, 1589 (1956); Schwarzenbach G., Gut R., Anderegg G., Helv. Chim. Acta, 37, 936 (1954).
23. Jones J. G., Poole J. B., Tomkins on J. C., Williams R. J. P., J. Chem. Soc., 1958, 2001.
24. С1 a г к e K-, Cowen R. A., Gray G. W., Osborne E. H., J. Chem. Soc., 1963, 245.
25. Frank H. S., Evans M. W., J. Chem. Phys., 13, 507 (1963).
26. Latimer W. M., Powell R. E., J. Chem. Phys., 19, 1139 (1951).
27. L a i d 1 e r K. J., Can. J. Chem., 34, 1107 (1956).
28. Connick R. E., Powell R. E., J. Cnem. Phys., 21, 2206 (1953).
29. С о b bl e J. W., J. Chem. Phys., 21, 1446 (1953).
30. S c a i f e D. B„ T у r e 11 H. J. V., J. Chem. Soc., 1958, 392.
31. Bell R. P., George J. H. B., Trans. Faraday Soc., 49, 619 (1953); King E. J., J. Chem. Ed., 30, 72 (1953); Nancollas G. H., Discussions Faraday Soc., 24, 108 (1957); Rabinowitch E., Stockmayer W. H., J. Am. Chem. Soc., 64, 335 (1942).
32. W i 11 i a m s R. J. P., J. Phys. Chem., 58, 121 (1954).
33. Evans M. G., Uri N., Symposia Soc. Exptl. Biol., 5, 130 (1951).
34. Jonte J. N., Martin D. S., J. Am. Chem. Soc., 74, 2052 (1952).
35. К i n g E. L., J. Am. Chem. Soc., 71, 319 (1949).
36. Vanderzee С. E., J. Am. Chem. Soc., 74, 3552, 4806 (1952).
37. R о s s i n i F. D., Wagman D. D., Evans W. H„ Levine S., Jaffe L, «Selected Values of Chemical Thermodynamic Properties", Natl. Bur. Std. Circ. № 500 (1952).
38. Care R. A., Staveley L. A. K-, J. Chem. Soc., 1956, 4571.
39. W i 1 1 i a m s R. J. P., Proc. Symposium on Coordination Chem., 1953, Danish Chemical Society, Copenhagen, 1954, p. 68.
40. Гринберг А. А., Я Ц и м и р с к и й К. Б., Изв. АН СССР, Отд. хим. наук, 239 (1952), Яцимирский К- Б., ЖОХ, 24, 1485 (1954).
41. Росс отт и Ф., в книге «Современная химия координационных соединений», под ред. Дж. Льюиса и Р. Уилкинса, ИЛ, М., 1963, стр. 13.
42. Fo г е m а п J. К., S m i t h T. D., J. Chem. Soc., 1957, 1752.
43. Spike C. G„ Parry R. W., J. Am. Chem. Soc., 75, 2726, 3770 (1953).
44. A d a m s о n A. W., J. Am. Chem. Soc., 76, 1578 (1954).
45. Bent H. A., J. Phys. Chem., 60, 123 (1956).
46. Cha b ere k S., Martell A. E„ J. Am. Chem. Soc., 75, 2888 (1953).
ГЛ AB A 4
Влияние комплексообразования на окислительно-восстановительные потенциалы
Окислительно-восстановительные процессы заключаются в более или менее полном переходе электронов от одного нона (или молекулы) к другому. Если этот процесс термодинамически обратим, он приводит к появлению характеристического электрического потенциала на каком-нибудь инертном электроде типа золота или полированной платины, присутствующем в данной системе. Полученный таким образом окислительно-восстановительный потенциал Е для двух валентных состояний металла [например, Ce(IV)—Ce(III) или Fe(III)—Fe(II)], образующих пару
Мп+ +(п — т)е Ш Мт+, определяется уравнением
г и) , 2,3026 пт, ам«+
Е — + -г—---г-etRT log-----
Здесь Е°м— постоянная величина, стандартный окислительно-восстановительный потенциал пары ионов металла, а а — активности соответствующих ионов.
1. ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ ВЕЛИЧИНУ ПОТЕНЦИАЛОВ
Стандартные окислительно-восстановительные потенциалы некоторых пар ионов переходных металлов были вычислены на основании других свойств этих ионов [1]. Полуколичественное соответствие (колебания в пределах ~0,4 в) с экспериментальными данными указывает, что величину и знак потенциала такой пары определяют главным образом следующие факторы:
1. Значение n-го потенциала ионизации металла.
2. Разница между энергиями стабилизации полем лигандов (ЭСПЛ) двух гидратированных ионов.
3. Разница между электростатическими свободными энергиями гидратации ионов металлов; считают, что ионы генерируются в газовой фазе и переносятся в раствор. (Эта разница
72
ГЛАВА 4
в свою очередь зависит от ионных радиусов и зарядов — она тем больше, чем меньше радиус и чем больше заряд иона.)
Эти же факторы во многих комплексах определяют последовательность их устойчивости. Например, такая последовательность Ирвинга—Уильямса для двухзарядных катионов имеет вид Мп < Fe < Со < Ni < Си > Zn. Соответствующие общие потенциалы ионизации составляют 532 < 556 < 583 < 596 С1 < 646 > 631 ккал и ионные радиусы равны 0,80 > 0,74 > 0,72 > 0,69 < 0,72 < 0,74А. Аналогичным образом различия в значениях ЭСПЛ для двухзарядных ионов меняются в ряду Мп <? < Fe < Со < Ni и Си > Zn, однако Ni > Си (последняя особенность играет заметную роль лишь в очень сильных полях лигандов).
Величины последовательных ионизационных потенциалов, часто оказывающих решающее влияние, приведены в табл. 4 гл. 2. Эти величины следует применять здесь с большой осторожностью, так как они включают электростатическую составляющую, которая гораздо больше, чем при комплексообразовании. Тем не менее, если для различных ионов металлов сравнивают соответствующие валентные состояния, эти величины дают полезную качественную информацию. Так, для удаления первых трех электронов от атома алюминия в газовой фазе требуется 1228 ккал, а от атома титана— 1104 ккал. С другой стороны, энергии, необходимые для удаления четвертого электрона от алюминия и титана, равны соответственно 2767 и 997 ккал. Это различие настолько велико, что соединения Al(IV) не имеют в химии никакого значения. Подобным же образом для перехода от Li к Li+ и от Li+ к Li2+ требуется соответственно 124 и 1744 ккал по сравнению с 120 и 231 ккал, необходимыми в случае бария. В случае ионов переходных металлов гораздо большая энергия перехода Cu2+—>-Си3+ (849 ккал), чем Fe2+->Fe3+ (707 ккал), объясняет отсутствие простых солей Си(III), а различие между переходами Sn2+->Sn4+ (1642 ккал) и РЬ2+—>-РЬ4+ (1712 ккал) помогает объяснить большую легкость окисления олова.
Таким образом, видно, что окислительно-восстановительные потенциалы ионов металлов определяются другими, более фундаментальными свойствами, которые зависят непосредственно от электронных структур рассматриваемых элементов. Так, высокие степени окисления обычно гораздо устойчивее у тяжелых переходных элементов, чем у соответствующих элементов первых переходных рядов. Аналогично в первом случае легче образуются низкоспиновые комплексы. Это происходит потому, что расщепление полем данного лиганда d-орбиталей уменьшается в ряду 5d > 4d > 3d, в то время как энергия, необходимая для спаривания электронов на этих орбиталях, изменяется (по пространственным соображениям) в обратном порядке.
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА ОВ-ПОТЕНЦИАЛЫ
73
2. НЕКОТОРЫЕ АНАЛИТИЧЕСКИЕ ПРИЛОЖЕНИЯ
Можно легко показать, что стандартный окислительно-восстановительный потенциал Е°ъ какой-либо пары комплексов, содержащих одинаковое число лигандов, равен
рО __ рО 2,30267? Г 10а/й _. g \
£ь м [ (п — т) F ] *мт+)>
где р — константы устойчивости соответствующих комплексов лиганд — металл. Это значит, что влияние комплексообразования на окислительно-восстановительные потенциалы ионов металлов непосредственно связано с различиями констант устойчивости комплексов металлов в рассматриваемых валентных состояниях. Иногда наблюдаются весьма значительные эффекты. Так, если ион Fe(II) находится в виде комплекса с этилендиаминтетраук-сусной кислотой EDTA), его восстановительная способность (Ео—0,117 * в в отличие от 0,771 в для свободных ионов) является нромежуточной между восстановительной способностью хлоридов Sn (II) и Ti(III) [2]. Это же справедливо и для комплексов Си (II), что указывает на возможное применение таких комплексов в качестве восстановителей в титриметрическом анализе.
Резкое падение потенциала системы Fe(II)—Fe(III) в конечной точке титрования иона Fe3+ этилендиаминтетрауксусной кислотой позволяет применять краситель вариаминовый синий В в качестве окислительно-восстановительного индикатора. При pH 2—3 окраска изменяется от бледно-желтой (восстановленная форма XVI) до интенсивной фиолетово-синей (окисленная форма XVII) [3].
сн3о
2
СН3О
NH
XV1 XVII
Подобным же образом возможно потенциометрическое титрование растворов Си(II) с применением EDTA.
В то время как ионы Fe3+ и Си2+ обычно восстанавливаются иодидом с выделением свободного иода, как ферро-, так и купро-комплексы EDTA окисляются иодом. В результате комплекс EDTA с Fe(II) можно применить, например, для титрования иода вместо тиосульфата (применять в качестве индикатора крахмал в этом случае не рекомендуется), так как комплексообразование с EDTA приводит к количественной обратимой реакции
2Fe3++ 21~ 2Fe2++ 12,
которую обычно используют для определения Ее3+-ионов.
* Всюду приведены величины окислительно-восстановительных потенциалов в американской шкале. — Прим, перев.
74
ГЛАВА 4
Точно так же Со(П) можно титровать Fe(III) в присутствии а, а'-дипиридила [4] и 1, 10-фенантролина [5], применяя метод потенциометрического титрования. По причинам, которые будут еще обсуждаться в этой главе, в данном случае наблюдается предпочтительная стабилизация (по сравнению с акво-ионами) состояний Со(III) и Fe(II). Поэтому можно получить резкую конечную точку.
Добавление ионов ртути(II) может даже в кислых средах сдвинуть вправо окислительно-восстановительную реакцию
AS2O3 + 2I2 + 2Н2О As2O5 + 4Н+ + 41“
Вызывается это связыванием почти всех свободных иодид-ионов при образовании прочного комплекса Hgl2~. Подобным же обра-’ зом комплексообразование между Pd(II) и тиосульфат-ионом настолько сильно уменьшает концентрацию ионов Pd2+, что маскирует его восстановление некоторыми из наиболее обычных восстановителей. Сульфит-ион гораздо труднее окисляется перманга-нат-ионом, если в раствор ввести ионы двухвалентной ртути, образующие устойчивый анион Hg(SO3)2-. В кислых растворах Mo(VI) соединяется с щавелевой кислотой, поэтому она уже не окисляется перманганатом (и не осаждается кальцием).
Подобные рассуждения применимы и к металлам, находящимся в контакте с растворами их ионов. Во всех случаях электродные потенциалы при комплексообразовании уменьшаются в направлении, которое можно предсказать количественно, исходя из величин констант устойчивости. Хорошо известными примерами являются влияние аммиака на электродный потенциал серебра и использование цианидных растворов при электроосаждении. Эти эффекты находят применение в аналитической химии: нежелательные ионы металлов можно удалить электроосаждением, а концентрация свободных ионов определяемого вещества при помощи подходящего маскирующего агента снижается, если это необходимо, до уровня значительно ниже того, при котором происходит заметное его осаждение. И наоборот, электролизом можно выделить определяемые вещества, в то время как мешающие примеси маскируются в растворе. Так, медь при добавлении тартратов можно селективно высадить из растворов, содержащих также сурьму и висмут. Разница в устойчивости цианидных комплексов позволяет таким же образом отделять цинк от железа.
3. ЭНЕРГИЯ СТАБИЛИЗАЦИИ ПОЛЕМ ЛИГАНДОВ
Одним из наиболее значительных факторов, определяющих величину электродных потенциалов в случае переходных металлов, является различие энергий стабилизации полем лигандов
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА ОВ-ПОТЕНЦИАЛЫ
75
для двухвалентных состояний, вызванное не только разницей зарядов ионов, но и различием числа d-электронов, которые они содержат.
На основе детального анализа спектров поглощения ионов переходных металлов и их комплексов в видимой и ближней инфракрасной областях можно вычислить расщепление энергетических уровней, образованных d-орбиталями в этой системе (см. гл. 8). В табл. 1 приведены значения А таких расщеплений полем лигандов для некоторых гексагидратных ионов переходных металлов, а также ЭСПЛ самих ионов. В первом ряду ионов переходных металлов значение А меняется мало, составляя для двухвалентных ионов 32 + 8 ккал и для трехвалентных ионов 50 ± 10 ккал. Результат для Rh3+ указывает, что для ионов переходных металлов второго ряда значение А примерно на 50% больше.
Таблица 1
Значения3 расщепления полем лигандов (Д) и ЭСПЛ некоторых гидратированных ионов переходных металлов
Ион Д, ккал Число d-электроиов ЭСПЛ, ккал
Т13+ 57,8 1 23
у3+ 50,4 2 43
v2+ 35,9 3 43
Сг3+ 49,5 3 59
Сг2+ 39,6 4 24
Мп3+ 59,8 4 36
Мп2+ 22,2 5 0
Fe3+ 38,9 5 0
Fe2+ 29,6 6 11
Со3+ 52,6б 6 ~ 20 (для высокоспинового состояния)
Со2+ 26,5 7 21
Ni2+ 24,2 8 29
Cu2+ 35,9 9 22
Rh3-*- 76,8б 6
а Вычислено Holmes О. G., McClure D. S., J. Chem. Phys., 26, 1686 (1957), а также J 0 rgensen С. К-, Тезисы, Копенгаген, 1957, принимая 1006 см-' и 2,846 ккал.
б Низкоспииовые комплексы.
76
ГЛАВА 4
Фаянс [6] и Цухида [7] наблюдали, что замещение в -комплексе переходного металла одного лиганда другим часто приводит к сдвигу спектров в определенном направлении, не зависящем от присутствующего иона металла. На основании этого лиганды можно расположить в определенном порядке, известном как спектрохимический ряд. Энергия расщепления уровней в комплексах переходных металлов для некоторых наиболее обычных лигандов возрастает в такой последовательности [8]:
1“ < Вг" < СО*" < SCN"^Cr<NO"<F" С6Н5РО Njf <
< мочевина лэ ОН- — NCO" лэ НСОО" < (С2О4)2" лэ Н2О <
<NCS" < глицинат EDTA4- < пиридин NH3< этилендиамин < <2,2'-дипиридил < 1,10-фенантролин < NO~ < CN~.
В этом ряду ион SCN- связан с ионом металла через атом серы, а ион NCS-—через атом азота. Диэтилдитиофосфат занимает положение, промежуточное между С1~ и F-, малонат почти эквивалентен воде, а диэтилентриамин и трис (аминоэтил) амин примерно эквивалентны этилендиамину [9]. В зависимости от атома лиганда, непосредственно участвующего в образовании связи с металлом, этот ряд выглядит следующим образом:
I < Вг <C1<S<F<O<N< С.
Данный ряд соответствует уменьшению ионных радиусов.
Значение А можно с хорошим приближением выразить как произведение соответствующих величин для рассматриваемых лиганда и иона металла. В октаэдрических комплексах первая из этих величин изменяется от 0,76 для Вг через 1,00 для воды до 1,7 для CN-, а вторая увеличивается при переходе от Мп (II) к Pt(IV) в 4,5 раза в такой последовательности:
Мп (11) <Ni (II) < Со (II) <Fe (II) <V (II) <
<Fe(III) <Cr (III) лэ V (III) < Co (III)<Mn (IV) < < Mo (III) < Rh (III) лэ Ru (III) < Pd (IV) < Ir (IV) < < Re (IV) < Pt (IV).
Средняя величина поля лигандов комплекса MX2Y2 приблизительно равна среднему арифметическому значений для МХ4 и MY4, если в их спектрах поглощения не наблюдается заметного различия в расщеплении полос.
Особое положение, занимаемое в этом ряду CN-, пиридином и лигандами типа 2,2'-дипиридила и 1,10-фенантролина, объясняется способностью подходяще расположенных d-орбиталей металла объединяться с незанятыми л-орбиталями лиганда с образованием связывающей молекулярной орбитали низкой энергии, которую затем и занимают эти d-электроны («обратная двойная связь», или «дативная л-связь»), За счет увеличения положи
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА ОВ-ПОТЕНЦИАЛЫ
77
тельного заряда иона металла и, следовательно, его электростатического взаимодействия с лигандами этот процесс приводит к увеличению значения Айк стабилизации комплекса.
Способность иона CN- вести себя как донор электронов при образовании о-связи и как акцептор электронов при образовании л-связи иллюстрируется рис. 1. Заполненные и незаполненные молекулярные орбитали показаны соответственно заштрихованными и незаштрихованными областями [10].
Рис. 1. Орбитали, участвующие в образовании связи цианид-ионом.
Наоборот, некоторые наиболее низкие значения А в спектрохимическом ряду ^относятся к лигандам, в которых л-орбитали заполнены, благодаря чему наблюдается отталкивание электронов и уменьшение величины А. Так как число пар несвязывающих электронов, которые могут взаимодействовать таким образом, возрастает от 0 для ЫНз до 2 для ОН-, этот фактор (подобно большей поляризуемости молекул аммиака по сравнению с молекулой воды) приводит к следующему ряду для величин, характеризующих поле лиганда: ОН- < НгО < NH3.
Падение в ряду (Н2О) > F- > Cl- > Br-> I- является результатом того, что увеличение радиуса аниона более чем компенсируется увеличением поляризуемости галогенидов при переходе от F- к I-.
О значениях ЭСПЛ систем, содержащих Р, S и более тяжелые атомы, известно немного. Высказано предположение [11], что для низших валентных состояний переходных металлов усиление обратной двойной связи будет увеличивать силу поля лиганда для соединений Р и S по сравнению с N и О. Для более высоких валентностей будет наблюдаться относительное ее снижение. Вообще для ЭСПЛ будут следующие соотношения: Р > As; S > Se > Те и Cl > Вг > I.
Отдельные значения А для некоторых лигандов спектрохимического ряда приведены в табл. 2. Эти значения имеют ту же тен-
78
ГЛАВА 4
Значения расщепления полем лиганда (Л) для некоторых октаэдрических комплексов3
Таблица 2
Ион Д, ккал
Cl- H2° °2- NH3 en CN—
Cr3+(3rf3) 39,3 43,3 49,5 49,8 61,5 62,3 76,0 Mn3+(3d4) 85,0 Fe2+(3d6) 29,6 93,9 Co3+(3d6) 52,6 51,5 65,4 66,0 95,3 Ni2+(3d8) 20,5 20,8 24,2 30,7 32,7 Rh3+(4d6) 58>o 76,8 75 i 97 1 98 5 Ir3+(5rf6) 7ii 117,9 Pt4+(5d6) 82,5 93,9 ajgrgensea С. К., цит. в книге: Griffith J. S., The Theory of Transition-Metal Ions., Cambridge University Press, Cambridge, 1961, p. 310.
денцию, что была отмечена и для акво-комплексов: они возрастают по мере увеличения заряда катиона и номера ряда в периодической системе. Приведенные величины являются полезным материалом для полуколичественного обсуждения окислительно-восстановительных потенциалов. Ряд весьма больших эффектов наблюдали для цианидных комплексов, примеры которых приведены в табл. 3.
Таблица 3
Окислительно-восстановительные потенциалы акво-и цианидных комплексов некоторых переходных металлов, в
Металл Fo для M3+ • aq + e • aq для M (CN)®- + e M (CN)4-
Cr d3^rf4 —0,41 —1,28
Mn rf4^d5 +1,51 —0,22
Fe +0,77 +0,36
Co +1,84 —0,83
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА ОВ-ПОТЕНЦИАЛЫ
79
Так как А — сложная величина (включающая вклад чисто электростатических возмущений и влияния неподеленных ст-пар электронов лиганда, связи dn — рп металл—лиганд и связи ря — dn лиганд—металл), было найдено, что для выражения тенденции лигандов образовывать ковалентную связь удобно расположить лиганды в нефелоауксетический ряд [12]. Такой ряд был создан в результате детального анализа отдельных спектральных полос ионов переходных металлов и их комплексов с использованием параметра В, введенного Ракахом для описания электростатического взаимодействия. Параметр характеризует электрон-электронное отталкивание. Йергенсен полагает, что уменьшение В при комплексообразовании является количественной мерой ковалентности связи в комплексе. Считают, что сдвиги полос поглощения при различном окружении являются результатом расширения облака d-электронов, происходящего при ковалентном взаимодействии и ведущего к тому, что полосы поглощения хуже разрешаются. Этот ряд имеет вид
F- Н2О > мочевина NH3 оксалат еп SCN ^>С1 ~ й» CN- > Вг—.
Иначе говоря, ковалентный характер связи будет более всего проявляться в комплексах бромид-иона и менее — в комплексах фторид-иона. Коттон, Д. Гудгейм и М. Гудгейм предложили аналогичный ряд [13]
ОН- ~ (С6Н5)3РО > — NCS~ ~ Вг“ ~ СГ ~ NCO~ >~
СН2 —NH
~1“~| I
СН2 С = S
По-видимому, эти последовательности с очень небольшими исключениями будут справедливы для всех изученных ионов металлов, хотя можно ожидать некоторую их зависимость от электронного строения иона металла и лиганда. Эти ряды примерно соответствуют рядам поляризуемости донорных атомов.
4. ПОТЕНЦИАЛЫ НЕКОТОРЫХ ЦИАНИДНЫХ КОМПЛЕКСОВ ПЕРЕХОДНЫХ МЕТАЛЛОВ
Большая сила поля цианид-иона ведет в случае октаэдрических комплексов к низкоспиновому состоянию d-электронов иона металла, поскольку энергия расщепления А между орбиталями tig и eg достаточно велика, чтобы привести к спариванию этих электронов. Если П — средняя энергия, необходимая для спаривания d-электронов иона металла, то выигрыш в устойчивости
80
ГЛАВА 4
для этих (низкоспиновых) комплексов переходных металлов, обусловленный влиянием поля лигандов, будет равен значениям, приведенным в табл. 4. Эта таблица дает также значения П, вычисленные для некоторых ионов в газовой фазе. В соответствующих цианидных комплексах увеличенная делокализация d-электронов может несколько уменьшить эти значения.
Таблица 4
Энергия стабилизации полем лиганда для ионов металлов в низкоспиновом состоянии и некоторые средние значения энергии спаривания П d-электронов в газовой фазе (оценка)
Число d-электроиов Выигрыш в устойчивости Ион Число d-электронов П, ккаля
1 0,4Д Сг2+ 4 67
2 0,8Д Мп3+ 4 80
3 1,2 Д Мп2+ 5 73
4 1,6 Д—П Fe3+ 5 85
5 2,0 Д—2П Fe2+ 6 50
6 2,4 Д—2П Со3+ 6 60
7 1,8 Д—П Со2+ 7 64
8 1,2Д Ni3+ 7 77
9 0,6Д
a Griffith J. S„ Orgei L. Е„ Quart. Revs., 11, 381 (1957).
Если допустить, что различия в ЭСПЛ являются главным фактором, определяющим разницу в устойчивости комплексов, то на основе этих фактов легко будет объяснить значения потенциалов, приведенных в табл. 3. Так, в комплексах Co(CN)6 ЭСПЛ равна 1,8 А — П и 2,4 Д— П для Со2+(d7) и Co3+(d6) соответственно. Близость приведенных в табл. 2 значений Д для Сг3+, Со3+ и Fe2+ позволяет предположить, что усиленная обратная двойная связь, ожидаемая в низковалентном состоянии, приблизительно компенсирует уменьшение Д при переходе от М3+ к М2+, которое следует ожидать на основе чисто электростатических представлений. Если для Co(CN)4" принять Д=90 ккал и использовать значение П для иона в газовой фазе, то можно ориентировочно подсчитать, что энергия стабилизации для иона Co(CN)3“ на 11 ккал больше, чем для иона Co(CN)4~, иначе говоря, наблюдается уменьшение стандартного окислительно-восстановительного потенциала по сравнению с акво-ионами по меньшей мере на 0,5 в.
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА ОВ-ПОТЕНЦИАЛЫ
81
Аналогичная разница для Cr(CN)4-(d4) и Cr(CN)3-(d3) равна соответственно 1,6 А — П и 1,2 А. Принимая, что А для обоих валентных состояний примерно одинаково, можно оценить максимальную стабилизацию Cr(CN)3- по сравнению с Cr(CN)4- примерно в 36 ккал, или 1,5 в (1 эв=23,06 ккал).
Для обоих комплексов Мп2+ и Мп3+ значения А принимают равными 85 ккал и соответствующие величины для ЭСПЛ составляют 2А —2П и 1,6А — П. Величины П, взятые из табл. 4, позволяют заключить, что и в этом случае более предпочтительным также будет цианидный комплекс трехзарядного иона (выигрыш составляет примерно 32 ккал, что отвечает понижению Е° на 1,4 в).
В случае Fe2+ (d6) и Fe3+ (d5) выигрыш в устойчивости равен соответственно 2,4А — 2П и 2А — 2П. Особая устойчивость заполненных наполовину d-уровней в такой степени увеличивает величину П для Fe(III)-иона, что, если принять значения А для цианидных комплексов Fe2+ и Fe3+ примерно равными, разница в ЭСПЛ должна приводить к стабилизации состояния с низшей валентностью.
Несмотря на довольно шаткий характер приведенных выше аргументов, ясно, что это толкование правильно предсказывает тенденции изменения окислительно-восстановительных потенциалов при комплексообразовании.
В ряду Fe, Ru, Os с увеличением ионного радиуса ионный потенциал падает. Это приводит к последовательному уменьшению электростатического влияния на общую устойчивость их комплексов и усилению тенденции к образованию ковалентных связей. Для систем комплексов М2+/М3+ это может привести к большей устойчивости двухвалентных состояний по сравнению с акво-ионами, в то время как изменения энтропии благоприятны для комплексообразования М3+ и тем в большей степени, чем крупнее катион. Подобным же образом, вследствие того что энтропия комплексного иона зависит от его размера и заряда, переход от Fe(CN)4- к Fe(CN)3~ + е приводит к возрастанию неупорядоченности в слое растворителя, окружающего ион, и, следовательно, к возрастанию энтропии. Таким образом, изменение энтропии снова делает более выгодным высшее валентное состояние. Разница ЭСПЛ, увеличивающаяся при переходе от Fe к Os, благоприятствует стабилизации комплексов двухвалентных элементов, а цианид-ион не только создает в своих комплексах сильное поле, но и обеспечивает образование прочной обратной двойной связи, особенно в случае низковалентных состояний металлов. Эти объединенные эффекты делают комплексы двухвалентных металлов — Ru(CN)4- и Os(CN)4-—более устойчивыми, чем соответствующие комплексы трехвалентных элементов, хотя для
б Д. Перрин
82
ГЛАВА 4
анионов типа галогенидов (где влияние обсуждаемых здесь факторов менее значительно) комплексы Ru(III) и Os (III) более стабильны. Аналогичные рассуждения возможны и в случае Со, Rh и 1г, однако здесь наличие значительной ЭСПЛ для трехвалентных ионов приводит к тому, что комплексы M(CN)3~ более стабильны.
Цианидные комплексы находят некоторое применение в окислительно-восстановительном титровании. Так, в аммиачном растворе Со(II) можно потенциометрически титровать [Fe(CN)e]3--ионом. Большая разница между системами Со(П)—Со(III), Fe(II)—Fe (III) и, следовательно, лучшая конечная точка титрования получаются при использовании этилендиамина вместо аммиака [14]. С другой стороны, в качестве окислителя вместо KsFe(CN)e можно использовать более энергичный Кз[Мо(СЦ)в] [15].
5. ПОТЕНЦИАЛЫ НЕКОТОРЫХ КОМПЛЕКСОВ МЕДИ
Область окислительно-восстановительных потенциалов, которые можно получить в системах, содержащих комплексы меди, ограничена легкостью дисмутации гидратированного иона Cu(I) в ион Cu (II) и свободную медь [16]. Причина этого ясна из рассмотрения диаграмм «степень окисления — свободная энергия», предложенных Фростом [17]. На этих диаграммах стандартную свободную энергию откладывают в зависимости от степени окисления металла таким образом, что стандартный окислительный потенциал для любых двух состояний, образующих пару, равен наклону соединяющей их линии. Чем выше AG° для Cu(I) лежит над линией, соединяющей-A G° для Си и Cu (II), тем больше разница свободной энергии в пользу реакции диспропорционирования. Подобным же образом восстановление Cu (II) идет в таком случае до свободного металла. Но если AG° для Cu(I) находится ниже линии, Cu (II) можно восстановить до Cu(I). Совершенно необязательно отсутствие диспропорционирования, если комплексы Cu(I) устойчивее комплексов Cu(II); нельзя также утверждать, что диспропорционирование непременно будет иметь место, если устойчивее будут комплексы Cu (II). Так, наиболее низкая точка на рис. 2 характеризует случай, когда комплекс Cu(II) несколько более устойчив, чем комплекс Cu(I) (если судить по разности AG° для сольватированных ионов), но когда диспропорционирование Cu(I) отсутствует. С другой стороны, на рис. 2 можно легко показать, что комплексообразование не препятствует диспропорционированию в системе, в которой для комплекса Cu(I) log К— 4, а для комплекса Cu(II) log/(—2.
Насколько можно судить по имеющимся данным, главным фактором, определяющим относительную прочность комплексов,
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА ОВ-ПОТЕНЦИАЛЫ
83
Рис. 2. Зависимость свободной энергии от окислительного состояния для комплексов меди.
и следовательно значения потенциалов, является, по-видимому, стереохимия ионов металлов. Это хорошо иллюстрируется на примере комплексов меди с 2,9-диметил-1,10-фенантролином и этилендиамином состава 1 :2, которые обладают наивысшим и наинизшим (из известных до настоящего времени) окислительно-восстановительными потенциалами для соответствующих пар комплексов меди(1) и меди (II) (Е°=0,624 в при 20° [18] и —0,38 в [19], соответственно). Для акво-ионов £'°=0,164 в при 20°.
Если лигандами служат 1,10-фенантролин или 2,2'-дипири-дил, то Е° для комплексов меди состава 1 :2 незначительно отличается от потенциала для акво-ионов [20]. Это позволяет предположить, что большее участие л-электронов Cu(I) в образовании обратной связи в значительной мере компенсируется ЭСПЛ, которая стабилизирует Cu (II). Однако в случае 2,9-диметил-1,10-фе-нантролина метильные группы лигандов препятствуют их расположению в одной плоскости около иона Cu(II); вместо этого лиганды вынуждены занять искаженную энергетически менее выгодную тетраэдрическую конфигурацию. В случае комплекса Cu(I) это не оказывает влияния, так как для Cu(I) правильная 6*
84
ГЛАВА 4
тетраэдрическая конфигурация вполне возможна и в данном случае предпочтительна.
Этилендиамин ведет себя по отношению к Си (II) как энергичный бидентатный лиганд. С другой стороны, в случае Cu(I) высокая основность приводит к тому, что значительно более вероятными оказываются линейные комплексы, в которых этилендиамин может быть только монодентатным лигандом.
Монодентатные амины преимущественно стабилизируют Cu(I) в комплексах 1 : 1 и 1 :2, однако эффект при этом не очень велик; максимальное увеличение Е° (для комплекса бензимидазола состава 1 :2) превышает значение для акво-ионов не более чем на 0,2 в. Серусодержащие лиганды типа тиомочевины должны преимущественно взаимодействовать с Cu(I) (увеличивая окислительно-восстановительный потенциал), так как низшее валентное состояние должно легче образовывать обратную двойную связь за счет вакантных Зй-орбиталей атома серы. В общем уменьшение электростатической и увеличение ковалентной составляющих в связи должно повышать относительную устойчивость состояния Cu(I). Если, однако, лиганды слишком сильно поляризуются при приближении к иону Си(II), электрон может перейти (необратимо) от иона лиганда к металлу и лиганд разрушится, как это наблюдается в случае цианид-, роданид- и иодид-ионов.
6. ПОТЕНЦИАЛЫ КОМПЛЕКСОВ ЖЕЛЕЗА
Вследствие особой устойчивости наполовину заполненных d-орбиталей энергия спаривания электронов в Fe3+ довольно высока (см. табл. 4). Кроме того, сила полей лигандов, являющихся анионами органических кислот и фенолов, сравнима с силой поля воды, так что в комплексах с такими лигандами следует ожидать только высокоспиновые состояния. В этих условиях никакой стабилизации Fe3+ не происходит, а величина ЭСПЛ для октаэдрических комплексов Fe2+ (0,4 А) составляет всего лишь -~10 ккал, что равно соответствующей величине для акво-иона. Это позволяет предположить, что в комплексах железа с органическими анионами такого типа факторами, определяющими величину потенциала, будут электростатические и энтропийные эффекты, ведущие к преимущественной стабилизации состояния Fe(III). Это подтверждается и значениями потенциалов для пар Fe(III)-Fe(II) [1]. Для однозарядных анионов потенциалы комплексов состава 1 : 1 примерно на 0,2—0,4 в ниже, чем для акво-ионов (0,771 в), и еще меньше в случае комплексов состава 1 :2 и более сложных. Двух- и более высокозаряженные анионы приводят к большему снижению. Бидентатные лиганды, комплексообразующая группа которых в качестве координирую
ВЛИЯНИЕ комплексообразования на ов потенциалы 8&
щихся атомов включает один атом кислорода и один атом азота, также несколько более предпочтительны для Fe(III).
Аналитическое применение этого эффекта заключается в введении фосфат-иона для снижения потенциала Fe(II)-Fe(III) при титровании бихромата калия с применением в качестве индикатора дифениламина или дифенилбензидина. В этом случае опять-таки комплекс Fe (II) более устойчив, чем комплекс Fe(III), так как лиганд является анионом и образование л-связи маловероятно. Для уменьшения потенциала пары Fe (II)-Fe (III) по тем же соображениям можно вводить также фторид-ион. Наоборот,, в присутствии большого избытка иона Fe(II) этот потенциал будет таким, что ион Fe(III) станет неспособным окислять иодид-ион до иода. Например, при использовании такой смеси Fe(II)-и Fe(III) -ионов можно колориметрически определять роданид-ион в присутствии иодида. В смесях Fe(II)- и Fe(III)-ионов окисление иона Fe (II) воздухом до Fe(III) облегчается в присутствии лигандов типа фторид-иона, которые стабилизируют высшее валентное состояние, в то время как в присутствии лигандов типа а, а'-дипиридила или 1,10-фенантролина окисление весьма сильно подавляется.
В случае нейтральных лигандов роль электростатических эффектов в стабилизации высоковалентных состояний становится менее важной, так как энергия ион-дипольного взаимодействия всегда меньше, чем энергия взаимодействия между ионами. В ненасыщенных аминах типа 2,2'-дипиридила и 1,10-фенантролина л-электроны способны занимать молекулярные орбитали, простирающиеся по всей молекуле. Получающаяся в результате этого значительная делокализация электронов («ароматический характер») увеличивает поляризуемость лиганда и облегчает образование л-связи с вакантными d-орбиталями металла. Однако в низкоспиновых комплексах Fe(bipy)s и Fe(phen)3, образованных Fe(II) и Fe(III), низшими вакантными уровнями являются разрыхляющие молекулярные орбитали, направленные между лигандами и ег-орбиталями металла. Это означает, что образование связи этого типа менее важно, чем образование обратной двойной связи электронами ^-орбиталей и вакантными орбиталями лигандов. Это обстоятельство делает более предпочтительным участие в комплексообразовании Fe(II). К этому же результату ведет и разница в ЭСПЛ, благодаря чему наблюдаемые потенциалы выше, чем в случае акво-ионов [21]
Fe (phen)g+4-е Ре(рЬеп)з+, £° в 1Л1 H2SO4 = + 1,06в,
Fe (Ыру)з++ е ДД Fe (Ыру)з+, £о в IM H2SO4 = + 1,06в.
Среди родственных лигандов, таких, как 5-замещенные 1,10-фенантролина, потенциалы комплексов железа изменяются с изменением величины рК лигандов [22]. По мере увеличения основ.-
86
ГЛАВА 4
ности лиганда комплекс Fe(II) становится относительно более устойчивым. В комплексах железа с аминокислотами состава 1 : 1 dE°/d(pK) равно примерно —0,075 в [23]. В комплексах железа с 8-оксихинолинами и полиаза-1-нафтолами состава 1 : 1 эта величина составляет примерно —0,045 в [24]. Для комплексов железа состава 1:3с замещенными 8-оксихинолина в 50%-ном вод-но-диоксановом растворе наклон равен —0,080 в, а для некоторых комплексов железа такого же состава с 5-замещенными 1,10-фенантролина в 1М серной кислоте наклон составляет —0,120 в.
Это влияние заместителей было использовано в аналитической химии для создания серии окислительно-восстановительных индикаторов с постепенным изменением потенциала. Пример такой серии на основе ферроина (трис(1,10-фенантролин)ферро-ион) приведен в табл. 5.
Таблица 5
Потенциалы некоторых окислительно-восстановительных индикаторов группы ферроииа (в 1 М серной кислоте)
Индикатор Е„', °
5-Ннтроферрони 5-Сульфоферроин Ферроин (1, 10-фенантролин)3 Fe (II) 5-Метилферроин 5, 6-Диметнлферроин 4, 7-Диметилферроии 3, 4, 7, 8-Тетраметилферроин 1,25 1,20 1,06 1,02 0,97 0,88 0,81
7. НЕКОТОРЫЕ ОБЩИЕ НАБЛЮДЕНИЯ
В металлах Hg, Tl, Sn и РЬ внешняя пара s-электронов с трудом ионизируется или участвует в образовании связи. Именно поведение этой «инертной пары» электронов ответственно за образование этими металлами ионов двух различных валентных состояний. К сожалению, по-видимому, ничего не известно о влиянии комплексообразующих веществ на окислительно-восстановительные потенциалы пар Hg2+/Hg2+ и Sn4+/Sn2+. Потенциал комплексов Hg2+ и Hg2+ с EDTA должен быть низким; значительно большая устойчивость комплекса Hg-EDTA (logKi = =22) приводит в случае добавления EDTA к раствору, содержащему [Нд2]г+-ионы, к быстрому диспропорционированию Hg2+->Hg2++ Hg.
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА ОВ-ПОТЕНЦИАЛЫ
87
Высокие заряды ионов Се (IV) и Се (III) обусловливают то положение, что основной вклад в устойчивость их комплексов вносят электростатические эффекты, поэтому комплексообразование приводит обычно к уменьшению потенциала. Так, Ео в 0,5 М серной кислоте равно 1,44 в, а в 1 М хлорной кислоте (где комплексообразованием можно пренебречь) Ео=1,70 в [25].
Было высказано предположение, что причиной стабилизации трис-комплексов Со(III) с о-оксиазобензолом XVIII [в то время как в бис-комплексах о-окси-о'-аминоазобензола XIX более устойчив Со (II)] является особая устойчивость, связанная с образованием «внутреннего комплекса», в котором заряды лигандов нейтрализуют заряд иона металла [26].
XVIII*
В случае ионов переходных металлов различие в ЭСПЛ является полезным критерием при оценке влияния на окислительно-восстановительные потенциалы азотсодержащих лигандов типа аммиака и этилендиамина. По тем же причинам, что и в рассмотренном ранее примере с цианид-ионом, разница значений ЭСПЛ для Со (II) и Со (III) позволяет предположить, что для комплексов Со(III) с аммиаком и этилендиамином будет наблюдаться сравнительно большая стабилизация, чем для акво-ионов. Эта стабилизация Со (III) будет выражена менее отчетливо, чем для цианидных комплексов, но более явно, чем в случае комплексов с EDTA. Соответствующие значения потенциалов приведены ниже.
Со (H2O)g+ + г Щ Со (Н2О)|+ £0= + 1,84в,
Со (dipy)|+ е щ Со (dipy)|+ Ео = + 0,31в,
* В этой и последующих формулах комплексов автор ие пытается показать их стереохимию. (В данном конкретном случае лиганды расположены октаэдрически вокруг центрального иоиа металла.)
88
ГЛАВА 4
Со (NH3)|+ + е — Со (NH3)i+
Со (еп)3++ (? Со (еп)^+
Со (CN)g+ + е П Со (CN)|“ Co(III)-EDTA +е ZZ Со (II)-EDTA
£о= + 0,14в, Ео = — 0,22в, Ео = — 0,83в, Ео = + 0,60в.
Осаждение одного из партнеров окислительно-восстановительной пары как способ изменения потенциала служит основой метода определения цинка [27]. В смеси ферроцианид- и феррициа-мид-ионов при pH 5 3,3'-диметилнафтидин XX почти бесцветен.
Если в систему ввести цинк, то произойдет осаждение ферроцианида цинка, окислительно-восстановительный потенциал возрастет и индикатор окислится в красно-фиолетовое вещество XXI. Реакция обратима, и ее можно использовать при прямом или обратном титровании цинка EDTA. Подобным же образом можно определять такие металлы, как Cu, Ni, Fe, Al, Cd и Ga; в анализируемый раствор вводят избыток EDTA, устанавливают при помощи буферной смеси pH 5, приливают растворы ферро- и феррицианида, а также индикатора и оттитровывают смесь стандартным раствором соли цинка [28].
Рассмотрение термодинамических циклов, включающих образование ионов в газовой фазе с последующими комплексообразованием и сольватацией, позволяет считать, что если диэлектрическая проницаемость растворителя меньше, чем диэлектрическая проницаемость воды, то окислительно-восстановительный потенциал пары увеличится. Другими словами, более низкое валентное состояние выиграет в устойчивости.
На величину окислительно-восстановительных потенциалов комплексных соединений металла с родственными лигандами может заметно влиять спиновое состояние пар комплексов («высокое» или «низкое»). В качестве примера можно привести Fe(II)-и Fe(III)-ионы. Известно, что высокая устойчивость трис-комп-лексов железа (II) с 1,10-фенантролином объясняется низкоспиновым состоянием ЗбЛэлектронов, что способствует образованию л-связей с вакантными орбиталями лигандов. Бис(1, 10-фенантро-лин)-комплекс парамагнитен («высокоспиновое» состояние),
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА ОВ-ПОТЕНЦИАЛЫ
89
и связь намного слабее. Аналогично этому и прочность комплексов железа (III) будет меняться в зависимости от того, будут ли эти комплексы «высокоспиновыми» или «низкоспиновыми», однако из-за особой устойчивости наполовину заполненных уровней для спаривания cf-электронов необходимо будет наличие более сильных полей лигандов, чем в случае ионов железа (II). Итак, если сила поля лигандов последовательно увеличивается, будут возникать следующие комплексы:
1. Низкие поля. Высокоспиновый комплекс Fe (II), высокоспиновый комплекс Fe(III).
2. Более высокие поля. Низкоспиновый комплекс Fe(II), высокоспиновый комплекс Fe(III).
3. Очень высокие поля. Низкоспиновый комплекс Fe(II), низкоспиновый комплекс Fe (III).
В общем Ео для лигандов во втором случае должно быть, больше, чем в первом или третьем, а внутри каждой группы потенциалы должны (приблизительно линейно) изменяться с изменением р/С лиганда.
ЛИТЕРАТУРА
1. Р er г i n D. D., Rev. Pure Appl. Chem., 9, 257 (1959).
2. Belcher R., Gibbons D., West T. S., Anal. Chim. Acta, 12, 107 (1955).
3. Erdey L, Bodor A., Z. anal. Chem., 137, 410 (1953).
4. Vydra F., Pribil R., Taianta, 8, 824 (1961).
5. Vydra F., Pribil R., Coll. Czech. Chem. Comm., 26, 3081 (1961).
'6. FajansK., Naturwissenschaften, 11, 165 (1922).
7. Tsuchida R., Bull. Chem. Soc. Japan, 13, 388, 436, 471 (1938);; Tsuchida R., Kobayashi M., ibid., 13, 47 (1938).
8. Jorgensen С. K-, Energy Levels of Complexes dnd Gaseous Ions, Gjelle-rups, Copenhagen, 1957. J о r gen sen С. K-, Technical Report to the U. S. Army, “Absorption Spectra of Complexes of Heavy Metals”, September 1958.
9. Jorgensen С. K., Absorption Spectra and Chemical Bonding in Complexes, Pergamon Press, Oxford, 1962, p. 109.
10. S и 11 о n L. E„ J. Chem. Ed., 37, 498 (1960).
11. Chatt J., Gamlen G. A., Or gel L. E., J. Chem. Soc., 1959, 1047.
12. Schaffer С. E., Jorgensen C. J., J. Inorg. Nuclear Chem., 8, 143 (1958).
13. Cotton F. A., Good game D. M. L., Good game M., J. Am. Chem. Soc., 83, 4690 (1961); Goodgame D. M. L., Goodgame M., Cotton F. A., ibid., 83, 4161 (1961).
14. D i e h 1 H„ В и 11 e r J. P„ Anal. Chem., 27, 777 (1955).
15. К r a t о c h v i 1 B., Diehl H., Taianta, 3, 346 (1960).
16. Perrin D. D., Hawkins C. J., Proc. 1st Australian Electrochem. Conf., Pergamon Press, Oxford, 1964.
17. F г о s t A. A., J. Am. Chem. Soc., 73, 2680 (1951).
18. Hawkins C. J., Perrin D. D., J. Chem. Soc., 1963, 2996.
19. Рассчитано no литературным данным, см. [1].
20. James В. R„ Williams R. J. P„ J. Chem. Soc., 1961, 2007.
90 ГЛАВА 4
21. Hume D. N., Koi th oil I. M., J. Am. Chem. Soc., 65, 1897 (1943).
22. Brandt W. W„ Gulls from D. K., J. Am. Chem. Soc., 74, 3532 (1952).
23. Perrin D. D., J. Chem. Soc., 1958, 3120, 3125.
24. Albert A., Hampton A., J. Chem. Soc., 1954, 505; Albert A., Bio-chem. J., 54, 646 (1953).
25. Smith G. F„ Getz C. A., Ind. Eng. Chem., Anal. Ed., 10, 191 (1938).
26. Bailar J. C., Callis C. F., Paper 20, Division of Physical and Inorganic Chemistry, 115th Meeting of the American Chemical Society, San Francisco, Calif., 1949.
27. Brown E. G., Hayes T. J., Anal. Chim. Acta, 9, 6 (1953).
.28. Fl ash к a H., Franschitz W., Z. anal. Chem., 144, 421 (1953);
F 1 a s h к a H., A b d i n e H., Mikrochim. Acta, 1955, 37.
ГЛАВА 5
Факторы, определяющие скорость образования и диссоциации комплексов, а также скорость их окисления или восстановления
В настоящее время механизмы органических реакций хорошо' изучены и подтверждены обширными кинетическими данными; соответствующее толкование реакций, протекающих с участием неорганических веществ, развито, несмотря на это, в гораздо меньшей степени [1]. Для наших целей реакции можно классифицировать как «быстрые», если они достаточно полно протекают за несколько минут, и «медленные», если для этого требуется значительно большее время. В данной главе будут рассмотрены главным образом последние реакции.
1. МЕХАНИЗМЫ РЕАКЦИЙ
Придерживаясь терминологии Ингольда [2], реакции замещения удобно разделить (в зависимости от того, отдает или принимает электроны внедряющаяся группа) на нуклеофильные (Sn) и электрофильные (Se)- В зависимости от осуществляющегося механизма реакции эти два класса подразделяются далее на реакции диссоциации (SnI и SeI) и замещения (Sn2 и Se2). В реакциях SnI и SeI комплекс медленно диссоциирует, затем один из продуктов диссоциации быстро взаимодействует с нуклеофильным или электрофильным реагентом. С другой стороны, при реакциях Sn2 или Se2 комплекс металла и реагент вначале образуют активированные комплексы, которые затем диссоциируют, давая продукты реакции. Это значит, что при реакциях SeI и SnI, протекающих с участием комплексов металла, число групп, координированных ионом металла в промежуточном соединении, на единицу меньше, чем в стабильном соединении (так как одна из них, которая должна быть замещена лигандом, предварительно отщепляется); в случае же реакций Sn2 и Se2 переходный комплекс содержит на одну группу больше. Следовательно, для реакций SnI с участием октаэдрических комплексов сравнительно медленной и поэтому определяющей скорость стадией будет образование пятикратно-координированного промежуточного соединения, а в случае реакций Sn2 непосредственно присоединяется из-
-92
ГЛАВА 5
быточная молекула лиганда с образованием семикратно-координированного активированного комплекса. На практике механизм реакции часто является промежуточным между этими крайними случаями. Иногда встречаются «согласованные» механизмы, которые характеризуются тем, что внедряющийся лиганд начинает образовывать связь с ионом металла прежде, чем вытесняемый лиганд окончательно покинет комплекс. Приписать на основе эксперимента какой-либо реакции вполне достоверный механизм до сих пор удавалось лишь в немногих случаях.
Рис. 1. Диаграммы энергий химических реакций.
Первый пример — реагирующие соединения образуют активированный комплекс, который переходит в продукты реакции. Второй пример — течение реакции через активированный комплекс к промежуточному соединению, образующему затем второй активированный комплекс, который диссоциирует и дает конечные продукты.
Звездочками обозначены области переходных состояний.
К реакциям, протекающим преимущественно по механизму Sn1> относятся реакции кислотного гидролиза транс- [Со (еп)г (ОН) С1]+ и [Со(еп)гС12]+ и щелочного гидролиза амминов Со (III). При условии, что лиганды являются донорами электронов, большинство комплексов Со(III) и Сг(Ш) реагирует, по-видимому, по механизму SnI. Если же лиганды электрофильные, реакции протекают преимущественно по механизму Sn2; примерами их могут служить реакции кислотного гидролиза транс- [Со (еп)2ЫОгС1]2+ и [Со(еп)2ЫНзС1]2+. Реакция между PtCl2- и I- имеет, вероятно, механизм Sn2. Этот же механизм справедлив, видимо, также для многих реакций плоских квадратных комплексов. Лабильные анионные комплексы Rh(III) и Ir(III) могут быстро диссоциировать по реакции SeI. Кинетически инертные катионные и нейтральные комплексы этих элементов (все они являются низкоспиновыми системами Д6) подвергаются, вероятно, медленному бимолекулярному замещению.
В качестве полезного обобщения можно сказать, что реакции тетраэдрических комплексов, взаимодействующих по механизму
СКОРОСТЬ ОБРАЗОВАНИЯ И ДИССОЦИАЦИИ КОМПЛЕКСОВ
93
замещения Sn2, протекают быстрее, чем в случае октаэдрических комплексов, для которых обычно характерен процесс диссоциации SnI-
Главным фактором, определяющим скорость реакции, является энергия, необходимая для образования из реагирующих молекул активированного комплекса. (В данном случае такие факторы, как энтропия активации, можно игнорировать.) Этот комплекс энергетически менее устойчив, чем соединения, из которых он образовался, или состояния, на которые он диссоциирует. Если потенциальную энергию реагирующих веществ представить как функцию стадии реакции, можно получить зависимости, подобные приведенным на рис. 1. В тех случаях, когда возможно несколько различных переходных состояний, предпочтительным будет характеризующееся наименьшей энергией.
2. «ИНЕРТНЫЕ» КОМПЛЕКСЫ
Большинство ионов металлов образует «лабильные» комплексы, которые в водных растворах реагируют быстро. В то же время комплексы других ионов, преимущественно некоторых переходных металлов, могут существовать часами и днями почти без изменения, даже если они термодинамически неустойчивы. Если концентрация лиганда уменьшается, лабильные комплексы быстро диссоциируют. Поэтому осаждением или экстракцией другим растворителем можно получить соединения, сильно отличающиеся от присутствующих в растворе. «Инертные» комплексы в тех же условиях продолжают существовать в неизмененном состоянии.
В табл. 1 приведены примеры некоторых ионов переходных металлов, образующих инертные комплексы. Если проследить за конфигурациями cf-электронов, то можно заметить интересную особенность. Почти все эти системы обладают d3- или низкоспиновыми d4-, d5- и ^-конфигурациями. Исключения относятся главным образом к элементам второго или третьего ряда периодической системы. Граница весьма отчетлива. Так, комплексы V(III) с конфигурацией d2 лабильны, однако комплексы CN- и 1,10-фенантролина со спаренными спинами — инертны. Комплексы Со(II) (rf7) лабильны, а низкоспиновые комплексы Со(III) (которые являются ^-системами) — инертны. С другой стороны, высокоспиновые фторидные комплексы Со(III) лабильны.
Хороший качественный способ оценки, будет ли данный комплекс инертным или лабильным, заключается в рассмотрении того, насколько значительной будет потеря энергии стабилизации полем лигандов при образовании переходного состояния. Ор-гел [3] объяснил гораздо большую реакционную способность систем d°, dl и d2 по сравнению с d3 (и низкоспиновыми dl, d5 и d6)
Таблица t
Некоторые шестикратно координированные ионы, способные образовать «инертные» комплексы
Лиганд rf-Электроны Ионы
С№ d1 Mo (V), W (V)
d2 Mo (IV), W (IV)
d3 V (II), Cr (III)
Низкоспиновые d* Mn (III)
Низкоспиновые d5 Мп (II), Fe (III)
Низкоспиновые d§ Fe (II), Ru (II), Os (II) (?), Co (III),
Rh (III), Ir (III)
Низкоспиновые dJ Co (II) (?)
CNS- d$ Cr (III), Mo (III)
d6 Pt (IV)
Вг~ d3 Mo (III), Re (IV)
df> Ru (Ш)
С1~ d3 Cr (III), Mo (III), W (III), Re (IV)
d* Cr (II), Re (III), Ru(IV), Os (IV)
df> Ru (III), Os (III), Ir (III)
d& Ru (II), Os (II), Rh (III), Ir (III),
Pt (IV)
d» Pt (II), Au (III)
Оксалат d3 Mn (IV)
dt Ru (III)
d3 Co (III), Ir (III)
NH3 d3 Cr (III), Mo (III)
d* Re (III) (?)
& Ru (III)
d3 Co (III), Ru (II), Rh (III), Ir(III),
Pt (IV)
d8 Au (III)
2,2'-Дипиридил Низкоспиновые d* Cr (II)
Низкоспиновые d6 Fe (II)
d3 Ni (II)
1,10-Фенантро- Низкоспиновые d5 Fe (III)
лин
Низкоспиновые d6 Fe (II)
d8 Ni (II)
СКОРОСТЬ ОБРАЗОВАНИЯ И ДИССОЦИАЦИИ КОМПЛЕКСОВ
95
тем, что в реакциях Sn2 только в случае систем d°, dl и d2 внедряющаяся группа может приближаться к комплексу со стороны вакантных низкоэнергетических d-орбиталей (feg). По этой причине образование активированного комплекса не приводит к такой большой потере ЭСПЛ, как это имело бы место, если бы (как в случае инертных комплексов) должна была использоваться d-орбиталь с более высокой энергией (eg). Басоло и Пирсон [4] подошли к этой проблеме на основе допущения о строении активированных комплексов, образованных октаэдрическим комплексом в реакциях SnI и Sn2. Они предположили существование соответственно пятикратно координированной квадратно-пирамидальной и семикратно координированной пентагональной бипи-рамидальной структур. Были вычислены затем изменения ЭСПЛ, которые могли быть результатом различия d-электронных конфигураций. Таким способом Басоло и Пирсон предсказали, что в сильных полях реакции как по механизму SnI, так и по механизму Sn2 будут быстрыми для систем d°, d1 и d2 и медленными для систем d3, d4, d5 и de, причем соотношение скоростей реакций будет d6 < d3 < d4 d5. В случае слабого поля для систем от d4 до d10 можно ожидать, что медленными будут только реакции с участием конфигурации d8. Известные инертные комплексы, образованные d8-HOHaMH, — Pt (II), Au (III) и Ni(II)—включены в табл. 1.
В настоящее время мало что известно о неоктаэдрических инертных комплексах, примерами которых могут быть низкоспиновые восьмикратно координированные комплексы Mo(CN)4~, Mo(CN)3~,. W(CN)4~ и W(CN)3“, а также плоские квадратные комплексы Pt (II).
Как теория валентных связей, так и теория поля лигандов предсказывают, что непереходные и редкоземельные элементы, а также системы d10 должны реагировать очень быстро. И действительно, кроме переходных элементов,- медленные реакции наблюдаются только в случае комплексов типа PF~, AsF~, SbCl~, SFe, SeFe и TeFe, в которых центральный ион имеет высокий формальный заряд.
В случае полидентатных лигандов, таких, как EDTA и порфирины, встречаются инертные комплексы другого типа. В таких комплексах для одновременного разрыва всех связей металл—• лиганд требуется большая энергия активации. d-Конфигурация и спиновое состояние иона металла не имеют значения. Так, Fe(II) в гемоглобине находится в высокоспиновом состоянии, a Mg, входящий в состав хлорофилла, не имеет d-электронов.
В табл. 2 приведены некоторые значения скоростей обмена для инертных комплексов, полученные с использованием меченых атомов. Бросается в глаза тот факт, что однажды образованные
Таблица 2
Некоторые типичные скорости обмена в инертных комплексах при комнатной температуре *
Комплекс Соединения, внедряющиеся в комплекс Среда Л/.
Сг(Н2О)3+ Н2о 0,01—1 M HC1O4 1—3 дн
Cr(CN)|+ Сг(Н2О)|+ pH 3—4 36 час
CN- pH 10 ~ 24 дн
Cr(SCN)g— Сг(Н2О)|+ 0,05—2,0 M кислота >3 дн
Cr(C2O4)|~ Сг(Н2О)|+ 0,02 M HC1O4 > 3 дн
Сг(еп)|+ еп 1 M HNO3 > 3 дн (40°)
Mo(CN)3- CN~ pH 11 ~500<?« (в темноте)
CN~ pH 11 11 дн (на свету)
Mn(CN)g~ CN- pH 9—11 35-80 мин (0°)
Fe(CN)|~ CN- pH 3,5 2 дн
Fe(CN)3- CN- pH 10 >5 дн
Fe(bipy)|+ Fe(OH2)2+ pH 1,5 ~ 5 час
Fe(phen)3+ Fe(OH2)2+ pH 1,5 97 мин
OsCl2- СП 0,1—2,0 M кислота >63 дн (50°)
Co(CN)|- Co(H2O)2+ > 2,5 дн
CN~ pH 11 >8 дн
Co(NH3)|+ H2O pH 4,7 15—60 мин
Co(en)|+ H2O pH 4,7 30—60 мин
en pH 7,0 >65 час (100°)
4ac-Co(en)2CJ^ cr Метанол 100 мин (36°)
Co(C2O4)®+ c2o42- > 25 мин (50°)
Ni(bipy)|+ ni2+ 5 мин
Pd(NH3)2+ H2o pH 6,6—7,6 13 мин—2 час (0°)
Pt(CN)4— CN- ~ 1 мин
PtCl*- cr ~ 14 час
PtBf|- ВП ~ 6 мин
Ptl2- r 30 мин
Pt(NH3)|+ H2o pH 5,5 36 мин
* Из обширного материала, собранного Stranks D. R., Wilkins R. G., Chem. Rew. (London), 57, 743 (1957). Некоторые реакции обмена лигандов, например реакции Cr(CN)c3-, Mo(CN)s4 и Fe(CN)s*~, катализируются светом.
СКОРОСТЬ ОБРАЗОВАНИЯ И ДИССОЦИАЦИИ КОМПЛЕКСОВ
97
инертные комплексы могут долгое время существовать без изменения в условиях, когда, судя по константам устойчивости, они должны бы полностью диссоциировать. Это справедливо, например, для Сг(еп)3+, внесенного в 1 М азотную кислоту. И наоборот, комплексы, которые нельзя приготовить непосредственно, иногда можно получить, используя эту инертность. Так, попытки приготовить Fe(phen)3+ и Fe(bipy)3+ прямым взаимодействием Fe3+ с лигандами в слабокислых растворах приводят лишь к образованию двуядерных комплексов. Однако трис-комплексы Fe(III) можно в тех же условиях приготовить без всякого труда окислением Fe(phen)2+ и Fe(bipy)23+. Большинство реакций обмена этих октаэдрических комплексов имеет характеристики, отвечающие механизму SnI [5], поэтому заряд и размер внедряющейся группы оказывают небольшое влияние. В то время как увеличение положительного заряда центрального атома понижает скорость реакции, увеличение размеров центрального атома приводит к ее повышению. К аналогичным результатам приводит увеличение отрицательного заряда или размеров других лигандов комплекса. Однако в комплексах, содержащих электрофильные группы типа —NO2, преимущественно будет осуществляться механизм Sn2, что связано частично с увеличением положительного заряда центрального иона металла и частично с удалением d-электронов из положений, где они могли бы препятствовать приближению внедряющегося реагента. Гидроксил-ион со многими комплексами реагирует очень быстро, особенно если одна из координированных групп имеет способный к ионизации протон (например, НгО или NH3); это может быть реакция Sn2, но механизм SnI представляется более вероятным [6]. Механизм этой реакции в дальнейшем обозначается как SnICO, поскольку в этом случае происходит (быстрая) диссоциация сопряженного основания комплекса металла, которая и определяет скорость реакции.
В реакциях замещения с участием смешанных плоских квадратных комплексов Pt(II) типа Pt(NHs)sBr+ можно различать цис- или транс-замещение, в зависимости от того, находится ли замещаемая в комплексе молекула NH3 рядом с бромид-ионом (цис) или же она расположена по диагонали (транс). Группы в таких комплексах можно называть цис- и транс-направляющими; ориентировочный ряд, в котором возрастает транс-влияние, измеряемое активностью заместителя в лабилизации транс-группы, имеет следующий вид [7]:
С№ > С2Н4 > СО ~ NO > Г ~ NO2 ~ HSO- ~ PR3 ~
~ R2S ~ SC (NH2)2 ~ NCS“ > Вг“ > СГ > ру >
> RNH2 > NH3 > ОН~ > Н2О.
7 Д. Перрин
98
ГЛАВА 5
В лигандах, не образующих л-связей, трамс-влияние обусловлено главным образом электростатическими силами; в других случаях доминирующим фактором является образование л-связи. Порядок усиления трамс-влияния лигандов, по-видимому, тот же, что и для наблюдаемой скорости обмена в комплексах PtX2-. Кроме того, чем более прочную связь может образовать с Pt внедряющийся лиганд, тем быстрее происходит реакция обмена. Реакция может протекать через стадию образования квадратно-пирамидального активированного комплекса. Стадией, определяющей скорость реакции, в этом случае будет образование связи с внедряющимся лигандом при условии, что он находится в начале ряда трамс-влияния. Иначе говоря, это будет механизм Sn2.
Другой вид «инертности» в химических реакциях был обнаружен для плоских квадратных или искаженных октаэдрических комплексов Cu(II), Ni(II), Со(И) и Zn, образованных с участием би- или тетрадентатных лигандов типа оснований Шиффа. Обмен иона металла в комплексах этого типа включает, по-видимому, постепенное «развертывание» лиганда, покидающего координационную сферу иона металла, и одновременно охватывание им другого иона металла. Исследования, выполненные главным образом в растворах пиридина, указывают, что скорость обмена возрастает в последовательности: Zn > Co(II) > Cu(II) > >Ni (II). Комплексы Ni с N, Х'-этилен-бис(салицилальдимином) и с N, N'-o-фенилен-бис (салицилальдимином) при комнатной температуре не изменились в течение 48 час [8]. Подобно этому, при 25° и pH 6,8 £ при обмене Ni в бис-комплексе с 1,1, 2,2-тетраме-тилэтилендиамином было равно 67 мин [9], а для Cu (II) оно равнялось всего лишь 3 мин. (Обмен в случае комплексов с незамещенным этилендиамином протекает гораздо быстрее.) Аналогичным образом потеря оптической активности нейтральными растворами комплексов с 1,2-пропилендиаминтетрауксусной кислотой происходит очень медленно для Ni2+, Со2+ и Fe2+ (измеряется днями), несколько быстрее для Cu2+ > Zn2+ > Cd2+ (часы) и быстро для Са2+ и Мп2+ [10].
Было найдено, что медленной стадией в процессе ступенчатого замещения EDTA на цианид-ион в комплексе Ni(II)-EDTA является превращение октаэдрического высокоспинового комплекса в плоский низкоспиновый [11].
Важным фактором, влияющим на скорость обмена в комплексе, иногда является катализ окислителями или восстановителями, в том числе ионами тех же металлов, отличающимися по величине своего заряда на ±1. Это легко понять, так как «инертность» комплексов разных валентных состояний одного и того же металла в общем случае не будет одинаковой. Фотокатализ, наблюдаемый в некоторых случаях, имеет, возможно, подобное же
СКОРОСТЬ ОБРАЗОВАНИЯ И ДИССОЦИАЦИИ КОМПЛЕКСОВ
99
объяснение (см. обсуждение спектров переноса заряда). Оно справедливо также для случая рацемизации комплексных ионов, например Со(еп)2+, катализируемой ионами Со3+.
Как указывалось ранее, возникновение и разрыв ковалентных связей может быть медленным процессом. Переход молибдат-аниона в Мо6+ как стадия, предшествующая, скажем, образованию его трис-комплексов с 3,4-толуолдитиолом, включает как раз такие процессы. В отсутствие железа, которое является в данном случае катализатором, за 100 мин при комнатной температуре переход в катион происходит только частично. Для этого требуется нагревание до 75° в течение 15—20 мин [12].
Высокое значение силы поля лиганда, предполагаемое в молекуле дитизона, должно привести к образованию его низкоспинового комплекса с Ni (II), как в случае комплексов 2,2'-дипири-дила и 1,10-фенантролина, и, следовательно, к «инертности» в отношении диссоциации. Это справедливо также и для комплекса Со(Ш), который должен быть низкоспиновой системой d6. Медленность его образования и диссоциации удалось наблюдать экспериментально.
3. ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ КОМПЛЕКСОВ
Поскольку все химические реакции включают перемещение электронов относительно атомного ядра, их можно рассматривать как окислительно-восстановительные процессы. Однако удобнее ограничить обсуждение такими реакциями, в которых происходит более или менее полный переход одного или большего числа электронов от какого-либо иона или молекулы к другому.
Определение реакции окисления как процесса, приводящего к потере электронов, а реакции восстановления как процесса, в котором электроны накапливаются, ничего не говорит нам о механизмах этих реакций. В действительности эта сторона реакций изучена далеко не в той степени, которая соответствовала бы ее значению. Качественно можно сказать, что чем больше разница между окислительно-восстановительными потенциалами участвующих в реакции пар, тем быстрее обычно протекает реакция. Из значений этих разностей потенциалов можно вычислить условия конечного равновесия, но не скорость, с которой это равновесие достигается. В самом деле, невозможность осуществления подходящего механизма реакции может препятствовать протеканию реакции с заметной скоростью, несмотря на существование условий, явно термодинамически выгодных. Обычные «балансовые» уравнения типа MnO~ + 8Н+ + 5Fe2+=Mn2+ -|- 5Fe3+ + 4НгО не указывают стадий, через которые проходит реакция. Влияние комплексообразования на окислительно-восстановительные потенциалы было рассмотрено в гл. 4. Данное обсуждение касается 7*
100
ГЛАВА 5
скоростей и механизмов окислительно-восстановительных реакций в растворах (главным образом водных).
В случае крупных симметричных комплексных ионов типа Fe(CN)3~ и Fe(CN)4~ перенос электрона от восстанавливающегося комплекса к окисляющемуся происходит гораздо быстрее, чем это возможно для соответствующих акво-ионов Fe3+ и Fe2+ . Для других пар очень большая скорость окислительно-вос-aq
становительных процессов обусловлена, вероятно, тем, что перенос электрона не сопровождается перегруппировкой координационной сферы. К ним относятся МпО2-, МпО~; 1гС13~ 1гС12~; Fe(phen)2+, Fe(phen)3+; Fe(bipy)2+, Fe(bipy)|+; Os(bipy)2+, Os(bipy)33+ и Co(bipy)2+, Co(bipy)|+. Во всех этих случаях перенос электрона протекает намного быстрее, чем реакция замещения. Вообще, независимо от того, является ли данный комплекс лабильным или инертным, ионы металла, окруженные ненасыщенными или крупными поляризующимися лигандами, обменивают электроны быстро, обычно гораздо быстрее, чем соответствующие акво-ионы или аммиачные комплексы. Либби [13] объяснил этот более быстрый электронный обмен на основании принципа Франка—Кондона, в соответствии с которым движение атомных ядер по сравнению с движением электронов настолько медленно, что перенос электрона должен протекать без заметного перемещения ядра. В случае небольших ионов прежде, чем будет совершен устойчивый переход электрона, должна произойти значительная переориентация молекул растворителя. Этот большой энергетический барьер затрудняет перенос. Для крупных комплексных ионов эти трудности в значительной степени уменьшаются, особенно если лиганды имеют ненасыщенный характер и между металлом и лигандом осуществляется л-связь. Последняя способствует уменьшению радиуса комплекса низшего валентного состояния до величины, сравнимой с величиной радиуса комплекса высшего состояния окисления. К тому же такие лиганды облегчают электронную проводимость в большей степени, чем вещества типа воды и аммиака, содержащие насыщенные одинарные связи. Впоследствии было высказано предположение [14], что перенос электронов включает две стадии — перегруппировку координационной сферы вокруг ионов металла с последующим квантово-механическим переносом электрона от одной реагирующей молекулы к другой через барьер растворителя (благодаря туннельному эффекту). В настоящее время трудно сделать выбор между этими двумя теориями; они различаются по существу лишь тем, что в одном случае электрон должен преодолевать энергетический барьер, а в другом в результате туннельного эффекта он проникает через этот барьер. Часто,
СКОРОСТЬ ОБРАЗОВАНИЯ II ДИССОЦИАЦИИ КОМПЛЕКСОВ
101
особенно для органических лигандов, эту ситуацию удобно представить следующим образом: в окислителе и восстановителе наблюдается перекрывание орбиталей соответствующих энергий, достаточное для того, чтобы реализовалась возможность переноса электрона.
В предельном случае это ведет к «мостиковому» активированному комплексу, в котором атом или группа являются частью координационной сферы как окислителя, так и восстановителя. Примером этому служит реакция Сг2+ с комплексным ионом (ЫНз)бСоС12+ (в котором С1 с трудом удаляется от Со). Сразу после смешивания начинается быстрая реакция с образованием СгС12+, Со2+ и NH+. СгС12^ является «инертным» комплексом и не может образоваться из Сг3+ и С1_ в прямом эксперименте [15]. Аналогичное перемещение к Сг2+ было найдено для лиганда L в инертных комплексах (ЫНз)5Со(Ш)Ь, где L = F~, Вг~, Г-,- SO2-, N“, CNS~, RCOO~, P2O47_, PO3“ и OH- [16]. Во всех случаях вероятно образование промежуточных мостиковых соединений [(NHsjsCo111—L—Сгп(НгО)5]. Подобные же механизмы реакций были обнаружены для реакций переноса электрона между Сг2+ и некоторыми комплексами типа (NHs)5CrniX и (НгО)5СгшХ [17] и между Pt(en)2+ и Pt(en)2Cl2+ [18]. В работе [19] утверждалось, что удалось выделить промежуточное соединение [ (CN)5ComNCFeI[(CN)5]6'“ при реакции окисления Co(CN)|_ при помощи Fe(CN)3". Аналогичным образом в сильно кислых перхлоратных растворах Fe3+ и Sn2+ в заметной степени не взаимодействуют [20], однако реакция протекает, если в раствор добавить ионы С1“, Вг~ и I- или увеличить pH с целью повышения концентрации ионов ОН". Все эти ионы действуют как мостиковые лиганды [21].
Тот факт, что С1 является лучшей «мостиковой группой», чем Н2О, объясняет, почему перенос электрона между Сг(Н2О)2+ и Сг(Н2О)5С12+ проходит гораздо быстрее, чем между Сг(НгО)2+ и Сг(Н2О)3+._ Значение Н2О как мостиковой группы можно наглядно проиллюстрировать сравнением скоростей реакций Сг2+ с [Со(ЫНз)6]3+ и с [Со (NH3)5H2O]3+; в первом случае скорость реакции по крайней мере в 100 раз меньше. Это объясняют отсутствием в координированной молекуле NH3 свободной электронной пары и наличием такой пары в координированной молекуле Н2О, благодаря чему и возможно образование мостика. Таубе [22] привел примеры образования мостиковых соединений окисляющими и восстанавливающими группами двухосновных кислот типа малеиновой, щавелевой и n-фталевой. Эти кислоты дают комплексы типа XXII, в которых окислительно-восстановительные
102
ГЛАВА 5
реакции вследствие проводимости электронов вдоль мостиковой группы протекают намного быстрее.
(NH3)5Co"'O,
//
О
XXII
С использованием изотопа О18 было показано, что в реакциях
SO2; с CIO-; SO2; с СЮ;; SO2; с ВгО; и NO; с НСЮ про-о и Z и и Z L
исходит перенос атома кислорода [23].
4. МЕДЛЕННЫЕ РЕАКЦИИ И КАТАЛИЗАТОРЫ
Большинство окислительно-восстановительных реакций, протекающих с участием пар ионов металлов или их комплексов, проходит быстро при комнатной температуре, особенно если изменения свободной энергии благоприятствуют им. Некоторые исключения, изученные главным образом с использованием изотопного обмена, приведены в табл. 3. Медленность реакций с участием Со(П) и Со(Ш) объясняется частично тем, что для перехода Со(Ш) в Со(П) требуется перемещение d-электронов на
Таблица 3
Некоторые окислительно-восстановительные реакции, протекающие медленно при 25°
Fe(phen)2+ с Т1ОН2+ Co2q+ C Co(NH3)36+
Т1+ с Т13+ 1 aq с 1 *aq Co(NH3)g+ с Со(еп)3+
Т1+ с Т1ОН2+ аЦ Еи2а+ С Eu3q+
^Га<| с Craq Се3+ с Се4+
Tla+q с Coaq Сг2+ с Co(NH3)3+
Со(еп)2+ с Co(en)3+ Сг2+ с CrF2+ aq
Co(EDTA)2~ с Co(EDTA)- Cr2+ с CrNCS2+ aQ
Co(NH3)g+ с Co(NH3)3+ Cr2; c Cr(NH3)5X2+, X=F, Ci
Со(С2О4)3~ с Со(С2О4)33- Со(С2О4)4~ с Се4+ V2q c Co(NH3)3+
Fe(CN)|- с Н2О2 Va3q+ c Fe3q+
СКОРОСТЬ ОБРАЗОВАНИЯ И ДИССОЦИАЦИИ КОМПЛЕКСОВ
103
разрыхляющие орбитали eg (одного или двух, в зависимости от того, является ли комплекс Со(II) низко- или высокоспиновым), и частично тем, что в парах комплексов типа [Со(МНз)е]2+ и [Co(NH3)6]3+ длины связей кобальт—азот весьма различны [24]. Системы, включающие Т1 (I) и Т1(Ш), вероятно, обязаны малой скоростью своих реакций неустойчивости промежуточных соединений Т1(П).
В некоторых случаях небольшие отрицательные ионы типа F~ и С1_ ускоряют окислительно-восстановительные реакции; можно назвать катализ в системе Eu(II)—Eu(III) ионами С1~, в системе Се (III) —Се (IV) — ионами F- и в системе Со (III)—Т1 (I) — сульфат-ионами. Реакции обмена с участием гидроксо-комплек-сов также обладают большей скоростью, чем реакции с участием акво-комплексов. Во всех этих случаях повышенную скорость реакций можно, видимо, объяснить большими возможностями для образования мостиков между окислителем и восстановителем, хотя не исключено, что в некоторых гидроксо-комплексах и акво-ионах механизм переноса электрона заключается в переносе атома водорода между гидратными оболочками ионов металлов [25]. Было также высказано предположение [26], что обмен электрона между Sb(III)—Sb(V), Sn(II)—Sn(IV) и T1 (I) — —Tl(III) в присутствии избытка хлорид-ионов протекает через переходное состояние, в котором два иона металла связаны двумя мостиковыми хлорид-ионами, подобно тому как это имеет место в Д12С1в.
В некоторых случаях ионы переходных металлов значительно ускоряют окислительно-восстановительные реакции, способствуя их протеканию более выгодным способом. В качестве примеров такого влияния можно назвать каталитическое действие Мп(III) на окисление оксалат-иона хлором и разложение перекиси водорода солями железа. Обе эти реакции протекают по свободнорадикальному механизму. Другими примерами являются катализируемое солями Cu(II) окисление воздухом Fe(II), V(III) и U(IV) и «посредничество» солей Се (IV) при восстановлении в щелочном растворе арсената до арсенита.
Для определения иодид-иона было предложено применять реакцию 2Се4+ + As3+->2Ce3+ + As5+, катализируемую в кислых растворах следовыми количествами иодидов (и в меньшей степени— следами хлоридов, бромидов и осмия) [27]. Каталитическое действие рутения и осмия на эту же реакцию рекомендовали использовать в качестве метода определения субмикрограммовых количеств этих элементов [28]. Катализаторами реакций, протекающих с участием пар ионов металлов, часто служат ионы Си2+ и Ag+. Так, реакция V(III) + Fe(III)-->-V(IV) + Fe(II) катализируется Cu(II), а процесс Т1 (I) -[- 2Се(IV)-^Tl (III) 4- 2Се(III) катализируется Ag(I). В этих реакциях катализ осуществляется,
104
ГЛАВА 5
видимо, в результате образования переходных состояний Cu(I) и Ag(II). Подобно этому, каталитическое действие смешанного катализатора Ag(I)+Mn(II) на медленные реакции сульфата церия(IV) с [Hg2]2+-HOHOM, 8-оксихинолинатами металлов, гипофосфит-, фосфит- и теллурит-ионами осуществляется, по-видимому, за счет образования окисленных состояний — Ag(II) и Мп(III) [29]. Вероятно также, что Ag(II) является действующим началом катализируемых серебром реакций Мп(Ш) и Ce(IV) с 2,5 М хлорной кислотой, сопровождающихся выделением хлора, и реакции между ионами Мп(II) и персульфата, протекающей в слабокислых растворах с образованием перманганат-иона. Первую из этих реакций можно использовать для открытия серебра [30].
Способность солей Hg(II) катализировать восстановление Sn(IV) до Sn(II) кислыми растворами гипофосфита, вероятно, связана с восстановлением Hg(II) до Hg(I) и металлической ртути, в результате чего возможны одно- или двухэлектронные переходы. Вообще говоря, механизмы каталитических реакций окисления или восстановления, протекающих с участием анионов или нейтральных молекул, все еще в значительной мере умозрительны. Одним из примеров является катализ солями Си(II) реакции между Fe(III)- и тиосульфат-ионами, приводящей к образованию Fe(II)- и тетратионат-ионов, в которой стадией, определяющей скорость реакции, вероятно, является окисление аниона Ре(5гОз)~ ионами Fe3+ (или Си2+). Введение роданид-иона для маскирования Fe3+ уменьшает скорость реакции. Восстановление гидразином в кислых растворах метиленового голубого до метиленового белого* катализуется Mo(VI). Реакция может протекать через стадию восстановления гидразином Mo(VI) до Mo(V), после чего Mo(V) восстанавливает метиленовый голубой. Подобным же образом W(VI) (и менее эффективно Mo(VI)) катализирует восстановление Ti (III) малахитового зеленого в его лейко-форму.
Прямое окисление или восстановление органического реагента неорганическими веществами иногда находит аналитическое применение. Такие методы неспецифичны, а продукты реакций часто неустойчивы. Примерами служат окисление лейкоформ кристаллического фиолетового [31] и малахитового зеленого, о-анизидина [32] и бензидина [33] солями Ir(IV), о-толуи-дина [34], лейкоформы малахитового зеленого [35] и о-дианизи-дина [36] солями Au(III) и тетраметилдиаминодифенилметана в уксуснокислом растворе анодноосажденной двуокисью свинца [37]. И наоборот, качественная проба на олово заключается в вос
* Видимо, автор имеет в виду лейкооснование метиленового голубого.— Прим, перев.
СКОРОСТЬ ОБРАЗОВАНИЯ И ДИССОЦИАЦИИ КОМПЛЕКСОВ
105
становлении какотелина (нитропроизводного бруцина) Sn (II) и другими сильными восстановителями в растворимую форму, имеющую фиолетовую окраску [38].
«Прочность» трис-комплексов Fe (II) и Fe (III) с 1,10-фенантро-лином в сочетании с большой скоростью окислительно-восстановительных реакций обусловливает их применение в качестве окислительно-восстановительных индикаторов. Интенсивно красная окраска комплекса Fe(II) обусловлена процессом переноса заряда (см. гл. 8). Вероятно, это справедливо и в отношении трис-комплекса с 2,2'-дипиридилом.
Были предложены следующие полуэмпирические правила, характеризующие протекание неорганических окислительно-восстановительных реакций [39]:
1. Соединения, образованные переходными элементами, реагируют друг с другом с изменением валентности на единицу.
2. В других случаях соединения будут реагировать друг с другом с изменением валентности на две единицы, если только по крайней мере одно из них не является свободным радикалом. Тогда будет идти процесс с изменением валентности на единицу.
3. Реакции с участием переходного и непереходного элементов будут обычно протекать с изменением валентности на единицу, но возможно также, что процесс пройдет с изменением валентности на две единицы.
В тех случаях, когда имеет место переход более чем двух электронов (например, Мп(II)—Mn(VI) или Сг(Ш)—Cr(VI)), почти наверняка осуществляется многостадийный процесс.
ЛИТЕРАТУРА
1. Механизмы неорганических реакций исчерпывающе и на современном уровне рассмотрены в книге:
Basolo F., Pearson R. G„ Mechanisms of Inorganic Reactions, John Wiley and Sons, New York, 1958.
2. Ингольд К- К., Механизмы реакций и строение органических соединений, ИЛ, М., 1959.
3. О г g е 1 L. Е., J. Chem. Soc., 1952, 4756.
4. См. [1], стр. 108.
5. См. [1], стр. 163.
6. Pearson R. G., Schmidtke Н. Н., Basolo F., J. Am. Chem. Soc., 82, 4434 (1960).
7. Chatt J., Duncanson L. A., Venanzi L. M., J. Chem. Soc., 1955, 4456.
8. Hall N. F., Will eford B. R., J. Am. Chem. Soc., 73, 5419 (1951).
9. W i 1 k i n s R. G„ J. Chem. Soc., 1957, 4521.
10. В о s n i c h B., Dwyer F. P., S a r g e s о n A. M., Nature, 186, 966 (1960).
11. Margerum D. W., Bydalek T. J., Bishop J. J., J. Am. Chem. Soc., 83, 1791 (1961).
12. Gilbert T. W., P h. D. thesis, University of Minnesota, 1956.
106
ГЛАВА S’
13. Libby W. F„ J. Phys. Chem., 56, 863 (1952).
14. Marcus R. J., Z wo 1 inski B., Eyr i ng H., J. Phys. Chem., 58, 432 (1954).
15. Taube H„ Myers H„ Rich R. L„ J. Am. Chem. Soc., 75, 4118 (1953).
16. Mur ma nn R. K., Taube H., Posey F. A., J. Am. Chem. Soc., 79, 262 (1957); Taube H., ibid., 77, 4481 (1955); Taube H., Myers H., ibid., 76, 2103 (1954).
17. C h i a Y. T., K. i n g E. L., Discussions Faraday Soc., 29, 109 (1960); Ogard A. E., Taube H., J. Am. Chem. Soc., 80, 1084 (1958).
18. В a s о 1 о F., Morris M. L., Pearson R. G., Discussions Faraday Soc., 29, 80 (1960).
19. Haim A., W i Im ar t h W. K., J. Am. Chem. Soc., 83, 509 (1961).
20. Gor in M. H., J. Am. Chem. Soc., 58, 1687 (1936).
21. Duke F. R., Pinkerton R. C., J. Am. Chem. Soc., 73, 3045 (1951).
22. Taube H., Advan. Inorg. Chem. Radiochem., 1, 1 (1959).
23. Taube H., Record Chem. Progr. (Kresge-Hooker Sci. Lib.), 17, 25 (1956).
24. В iltz W., Z. anorg. allgem. Chem., 164, 246 (1927).
25. Dodson R. W., Davidson N., J. Phys. Chem., 56, 866 (1952).
26. Сноска [1], стр. 327.
27. S a n d e 1 1 E. B., Kolthoff I. M., Mikrochim. Acta, 1951, 9; Lambert J. L., Arthur P., Moore T. E., Anal. Chem., 23, 1101 (1951).
28. S u r a s i t i C., S a n d e 11 E. B., Anal. Chim. Acta, 22, 261 (1960); Sauerbrunn R. D., Sandell E. B., Mikrochim. Acta, 1953, 22.
29. M с C u r d у W. H„ Gu i 1 b a u 11 G. G„ Anal. Chem., 32, 647 (1960).
30. F e i g 1 F., F r a n k e 1 E., Ber., 65, 544 (1932).
31. Ayres G. H„ Bolleter W. T., Anal. Chem., 29, 72 (1957).
32. В e r m a n S. S., Beamish F. E., McBryde W. A. E., Anal. Chim. Acta, 15, 363 (1956).
33. X л о n и н В. Г., Труды Института платины, 1, 324 (1926).
34. Schreiner H., Bran ter H., Hecht F., Mikrochem. Mikrochim. Acta, 36/37, 1056 (1951).
35. Кульберг Л. M., Заводск. лаб., 5, 170 (1936).
36. Jamieson A. R., Watson R. W., Analyst, 63, 702 (1938).
37. Miller H., Z. anal. Chem., 113, 161 (1938).
38. R о s e n t h a 1 e r L., Mikrochim. Acta, 3, 190 (1938).
39. Higginson W. С. E., Marshall J. W., J. Chem. Soc., 1957, 447.
ГЛАВА 6
Влияние комплексообразующих реагентов на концентрацию катионов
Комплексообразование как способ понижения концентрации свободных ионов металла в растворе находит в аналитической химии широкое применение, особенно при осуществлении реакций «маскирования» и «демаскирования», при осаждении гидроокисей металлов, сульфидов и металлорганических комплексов, а также в количественных экстракционных методах. Свойства комплексов важны также для ионного обмена и хроматографии. Комплексные соединения используют и при окончательном определении элементов при помощи таких физических методов, как спектрофотометрия, потенциометрия, полярография, хронопотенциометрия или кондуктометрия. Электроосаждение как метод отделения или выделения различных элементов тоже связано с использованием процесса комплексообразования; последний может обеспечить присутствие ионов металлов в достаточно низких концентрациях (это необходимо для получения ровных и плотно прилегающих осадков), а также позволяет создать условия, гарантирующие выделение из растворов лишь определенных металлов. На рис. 1 показано влияние концентрации лиганда на относительный состав обычной смеси, которая может быть подвергнута электролизу. В последнее время комплексометрическое титрование, особенно с применением этилендиаминтетрауксусной кислоты (EDTA) и ее производных, позволило проводить прямое объемное определение ионов металлов в растворе.
Факторы, влияющие на устойчивость комплексов металлов и на порядок изменения этой устойчивости для ионов разных металлов с данными лигандами, были качественно рассмотрены в гл. 3. Коротко эти факторы можно суммировать следующим образом:
В том случае, если лиганд является донорным атомом кислорода или фторид-ионом, комплексообразование представляет собой главным образом электростатический процесс; важными факторами, определяющими прочность связи в комплексе, будут заряд иона металла и величина, обратная значению его радиуса. Среди родственных лигандов устойчивость связи растет также
108
ГЛАВА 6
с увеличением основности лиганда, измеряемой прочностью связывания протона. Такие лиганды являются комплексообразующими реагентами общего значения с довольно слабо выраженной избирательностью по отношению к одинаково заряженным ионам металлов.
Рис. 1. Комплексообразование в системе Cd2+ — CN“ в 3 М растворе перхлората натрия при 25°.
Наоборот, цианид-ион, доноры, содержащие серу, и галогениды (кроме фторида), а также в некоторой степени доноры, содержащие азот, координируются катионами, имеющими 18 наружных электронов, гораздо сильнее, чем катионами с электронной структурой типа инертных газов. Заряд и радиус катиона не являются в этой группе доминирующими факторами. Наибольшее значение приобретает ковалентность связи, особенно для катионов с малым зарядом типа Cu+, Ag+ и Аи+. и (в противоположность предсказанию электростатической теории) устойчивость галогенидных комплексов падает в ряду I-> Вг-> C1_^>F_. Прочность связи возрастает с увеличением потенциала ионизации металла (т. е. с увеличением электроотрицательности иона металла) и с уменьшением электроотрицательности атома лиганда. Качественно можно говорить о возрастающей легкости принятия электрона ионом металла и отдачи электрона атомом лиганда. Оба эффекта ведут к увеличению прочности ковалентной
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
109
связи. Однако чем больше заряд катиона, тем менее ковалентный (и тем более электростатический) характер связи.
Ионы переходных металлов по своим свойствам занимают положение, промежуточное между этими двумя группами, с той существенной разницей, что в данном случае действуют эффекты стабилизации полем лигандов, которые часто решающим образом изменяют природу и степень комплексообразования. Не удивительно, что установленный Ирвингом и Уилльямсом ряд устойчивости комплексов двухзарядных катионов переходных металлов совпадает с последовательностью, которая могла бы быть предсказана на основании изменения ионных радиусов и потенциалов ионизации.
1. НЕКОТОРЫЕ КОЛИЧЕСТВЕННЫЕ АСПЕКТЫ
Равновесия в растворе между ионами металла и комплексообразующими реагентами подобны равновесиям реакций протонизации. Это следует из определения Льюиса, согласно которому все ионы металлов и протоны являются кислотами, а все лиганды (служащие акцепторами протонов) —основаниями. Точно также, как системы ацетат-ион — уксусная кислота и аммиак — ион аммония являются буферными по отношению к ионам водорода, системы, содержащие ионы металла и лиганды, ведут себя как буферные системы по отношению к ионам металла. Это сходство становится более явным при сравнении типичных уравнений
M2+ + L2- zzt ML, h++L2” — HL",
M2+ -r L~ цц ML+, h+ + L“ — HL,
M2+ + L ML2+, H+ + L П HL+.
Во всех случаях, опуская заряды, можно написать
1 _ [М] [L] „ [Н+] [L]
KnL ~ [ML] ’ [HL]
где Лмь — константа устойчивости комплекса ML. Отсюда
[L]
рН = рКд+ log -[нЦ*.
а отрицательный логарифм концентрации свободного иона металла определяется уравнением
[L] pM==-p/<ML + log-щщ-,
где [L] — концентрация свободного лиганда. Если образуется несколько комплексов, скажем ML, ML2, ML3 и ML4, уравнения становятся более сложными, но не содержат ничего принципиально нового.
I JO ГЛАВА 6
Из определения константы ступенчатого комплексообразования Кп комплекса MLrl из ML„-i и L можно получить уравнение
рМ = р(М)общ +log(l -ГК, [L] +^/<2[L]2 + /<;/<2/<3[L]3 ...).
Из этого уравнения следует, что чем больше число присоединяемых к металлу молекул лиганда, тем больше должна быть разница в значениях рМ при небольшом изменении концентрации лиганда. По этой причине использование полидентатных комплексообразующих реагентов типа триэтилентетрамина (который дает с Си2+ только комплексы состава 1:1) позволяет осуществлять более точный контроль аналитических условий, чем, например, аммиак (который в весьма разбавленных растворах может образовать ряд комплексов, вплоть до Cu(NHs)2+). Состав системы, включающей ион металла, находящийся в равновесии с рядом комплексов ML, ML2, ML3, ... и свободным лигандом, удобно представить в виде графика зависимости процентного содержания отдельных форм от pL( =—lg[L]) [1]. Такой график для системы Cd2+—CN- при 25° в 3 М растворе перхлората натрия приведен на рис. 1 [2]. При любом значении pL вертикальные разрезы дают концентрацию веществ, представленных областями, через которые эти разрезы проходят. При построении таких графиков полезно помнить, что отношения концентраций различных комплексов не зависят от концентрации иона металла только в случае образования моноядерных комплексов. Доля Xi от общего содержания металла в растворе, входящая в состав какого-либо комплекса ML,-, определяется уравнением
„ [MLJ __ [Ар
где р, — общая константа устойчивости комплекса. Величина а,-зависит только от концентрации лиганда. Для любого значения pL легко получить функцию образования Бьеррума п
i — п
«=2(г' Xi)'
1=1
Важно напомнить, что все эти уравнения относятся к лигандам, т. е. к формам, присоединяющимся непосредственно к иону металла. При любых данных экспериментальных условиях лиганд может быть уже в большей или меньшей степени протонизи-рован, поэтому комплексообразование включает конкуренцию между ионами металла и протонами лигандов. Это можно пояснить несколькими примерами. Уксусная кислота имеет р7Уа = 4,76, так что при pH более 6,7 концентрация лиганда (ацетат-иона)
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
111
приближается к общей концентрации уксусной кислоты (т. е. к сумме свободной уксусной кислоты и ацетат-иона). С другой стороны, при pH 3,81 концентрация лиганда составляет лишь одну десятую часть от этой суммы. Подобно этому, в растворе аммиака (р/Са = 9,26) при pH 5,26 только 0,01% от общей концентрации [NH3] + [NH+ ] приходится на долю лиганда, а при
Р и с. 2. Влияние pH на отношение концентрации свободного лиганда к общему содержанию реагента в случае щавелевой кислоты, аммиака и этилендиамина.
pH 9,26 — 50%. В случае тайрона (пирокатехин-3,5-дисульфокислота) \>Ка фенольных групп, ответственных за его комплексообразующую способность, равны 7,66 и 12,6. Поэтому при pH 5 концентрация лиганда дифенолята составляет лишь 0,5 • 10-10 общей концентрации присутствующего тайрона. Для лиганда, который может присоединить один или два протона, можно написать соответственно общие равенства
Д] 1
[L] + [HL] 1 + lofpx.-pH) ’
[L] 10(2рН-рК,-рКг)
[L] + [HL] 4- [H2L] = 1 + 10(рН-рк2) + 10(2рн-рю-ркг) ’
где p/Ci > р/Сг (заряды на лиганде и протонированных формах опущены). Вид зависимости концентрации лиганда от pH, к которому эти уравнения приводят в случае щавелевой кислоты, аммиака и этилендиамина, показан на рис. 2. Теперь в системе, содержащей щавелевую кислоту, этилендиамин и ион металла, под
112
ГЛАВА 6
берем концентрации таким образом, чтобы, например, при pH 7 комплексы состава 1:2с оксалатом и этилендиамином присутствовали в равных концентрациях. Тогда повышение pH до 9,0 приведет к 50 000-кратному увеличению концентрации бис-комплекса с этилендиамином по сравнению с бис-оксалатным комплексом. И наоборот, понижение pH среды до 5,0 приведет к увеличению содержания бис-оксалатного комплекса по сравнению с бис-комп-лексом с этилендиамином в 30 млн. раз. Если учесть, что разница в константах устойчивости комплексов ряда металлов с одним лигандом обычно неодинакова в случае лигандов разного типа, то аналитические возможности становятся очевидными. Хорошей иллюстрацией служат данные табл. 1. Значения Л'уСт оксалатных комплексов свидетельствуют об относительной неизбирательно-сти лигандов, содержащих кислород.
Таблица 1
Константы устойчивости некоторых бис-комплексов
Ион металла Щавелевая кислота Этилендиамин
Мп2+ ю5 * *’3 104'8
Си2+ 108’4 1О20’1
Очень высокая константа устойчивости комплекса Cu(en)2+ обусловлена главным образом наличием ЭСПЛ, поляризуемостью аминов и ковалентным характером их связей. В этом случае при pH 5 можно определять Си(II) в присутствии Mn(II), а при pH 9 Mn(II) можно определить в присутствии Си(II). Еще большие различия в устойчивости комплексов катионов с оболочками типа инертного газа и катионов с заполненными или почти заполненными d-уровнями наблюдаются в случае лигандов типа тиомочевины, 2,3-димеркаптопропанола и дитиотартрат-иона, где в образовании связи принимает участие атом серы.
2. «КАЖУЩИЕСЯ» КОНСТАНТЫ
В тех случаях, когда pH раствора поддерживается постоян-
ным, иногда вместо констант устойчивости удобно пользоваться
«кажущимися» («эффективными», или «условными») констан-
тами. При расчете таких констант, соответствующих строго определенным экспериментальным условиям, вместо концентрации
свободного иона металла берут общую концентрацию металла
в растворе, т. е. концентрацию металла, не связанного с данным,
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
113
интересующим исследователя лигандом. Аналогично этому вместо концентрации лиганда также берут общую концентрацию всех форм незакомплексованного металлом реагента (в том числе протонированных). Эти «кажущиеся» константы дают количественную информацию о концентрациях образующегося комплекса, непрореагировавшего металла и непрореагировавшего лиганда. Шварценбах [3] для сопоставления таких кажущихся констант с истинными константами устойчивости р ввел коэффициенты ам и «ь, так что
(к л = •
^т^Дкажущаяся ам аь
Если лиганд образует комплексы только с протонами или определенным ионом металла, аь определяется по уравнению
[н+]2 ,
7L ' К ' К К 'г ' ’ ’
Если в системе присутствуют посторонние металлы (не только М), то к этому выражению необходимо добавить еще дополнительные члены вида у • (3Жу [М']ж [Lp-1, которые (в случае у > 1) можно получить лишь методом последовательных приближений. Подобным же образом, если изучаемый ион металла взаимодействует только с одним лигандом L, то ам = 1. В противном случае, т. е. в присутствии мешающих лигандов или при гидролизе иона (который формально является процессом комплексообразования с ионом гидроксила), должны быть введены дополнительные члены.
Если известны значения р для всех комплексов, рЛ'а всех лигандов и pH раствора, то детальный анализ системы проще всего начать с допущения, что концентрация веществ, находящихся в растворе в избытке, при комплексообразовании не меняется. Если, например, имеем L + HL + H2L + . . . , то найденные концентрации ML, ML2 и т. д. можно использовать для уточнения найденных значений концентраций форм незакомплексованного лиганда, а также аь. Несколько циклов таких расчетов обычно быстро приводят к правильным значениям констант. Для систем с участием полидентатных лигандов, образующих обычно лишь комплексы состава 1:1, эти вычисления значительно упрощаются.
Если раствор, содержащий два иона металлов, Mi и Мц, титруют полидентатным лигандом L и при этом комплекс MiL гораздо более устойчив, чем комплекс МцЬ, то можно применить следующее приближенное уравнение [4]:
'°й log Km1L - log Km„l + PMir
Другими словами, логарифм кажущейся константы устойчивости
8 Д. Перрии
114
ГЛАВА О
MjL равен разности между логарифмами констант устойчивости двух комплексов плюс рМц. Из этого отношения следует тот факт, что чем более разбавлен раствор, тем относительно меньше будут помехи со стороны Мц, в результате чего улучшится избирательность титрования. В случае визуального титрования log А" т должен превышать log Д’ м , примерно на 4—5 единиц.
Математические зависимости, относящиеся к одновременному титрованию двух ионов металлов, исследовал Рингбом [4].
3. НЕКОТОРЫЕ ПРИМЕРЫ, ОСНОВАННЫЕ НА РАЗЛИЧИЯХ В КОНСТАНТАХ УСТОЙЧИВОСТИ ИЛИ РАСТВОРИМОСТИ
Различия в комплексообразующей способности или растворимости комплексов используют довольно часто. На первом эффекте основано большинство методов комплексометрического титрования. Примером использования различий в растворимости является титрование по Фольгарду, при котором Ag+ и роданид калия в азотнокислой среде дают желтый нерастворимый роданид серебра. В присутствии ионов Fe(III) заметное образование комплекса FeSCN2+ будет происходить только после полного осаждения AgSCN. Соответствующие количественные характеристики следующие:
[Ag'*'] [SCN-] ~ 7 • 1013 (произведение растворимости),
__>scn2+]___________________
[Fe3+][SCN“] ’
log емакс Для FeSCN2+~4.
Заметное красное окрашивание (DrjsO.l) развивается в 0,01 М растворе Fe(III), когда концентрация SCN- достигает 10-5 М, это возможно лишь в случае, если концентрация свободного Ag+ станет ниже 7 • 10-8 М. Низкая растворимость AgBr и Agl позволяет применять этот метод для определения бромидов и иодидов в кислых растворах, для чего в раствор вводят избыток нитрата серебра с последующим обратным титрованием его роданид-ио-ном. (Применяемый в качестве индикатора ион Fe3+ при определении иодидов нельзя добавлять до осаждения иодида серебра, так как он может окислить иодид-ион до свободного иода.) При определении хлоридов осадок хлорида серебра следует удалить из системы перед титрованием, так как AgCl примерно в 200 раз более растворим, чем AgSCN; в его присутствии заметно протекает процесс AgCl + SCN-->AgSCNTB + С1_, что ведет к значительной ошибке.
Титрование хлорид-иона нитратом двухвалентной ртути в присутствии дифенилкарбазона возможно благодаря тому, что
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
115
HgCl2— устойчивый комплекс (log р214); концентрация Hg2+, необходимая для образования сине-фиолетового комплекса с ди-фенилкарбазоном XXIII, достигается лишь после того, как почти все хлорид-ионы будут связаны Hg2+.
XXIII
Точно так же титруют сульфаты ионом бария, применяя в качестве индикатора двунатриевую соль тетраокси-ц-хинона. Красная окраска комплекса бария с этим реагентом не развивается до тех пор, пока весь сульфат не будет осажден в виде нерастворимого сульфата бария. Этот частный метод не очень точен; предпочтительнее обратное титрование (избытка бария стандартным раствором сульфата) с использованием в качестве индикатора натриевой соли родизоновой кислоты. Конечную точку определяют по изменению красной окраски раствора в бесцветную или желтую, что указывает на полное осаждение бария в виде его сульфата и разрушение растворимого органического комплекса XXIV. Так как константа устойчивости этого комплекса невелика, требуется применение довольно концентрированных растворов реагентов.
Ва2+
XXIV
Роданидный метод определения иона Fe(III) является хорошим примером влияния конкурирующего комплексообразования катионов и анионов. Так как значение log Ki комплекса FeSCN2+ 8*
116
ГЛАВА 6
не очень велико, для количественного его образования необходимы высокая концентрация роданид-ионов и отсутствие конкурирующих лигандов, к которым относятся арсенаты, фториды, оксалаты, фосфаты, тартраты и серная кислота. А так как этот метод является спектрофотометрическим, должны отсутствовать и катионы, оказывающие мешающее влияние за счет образования нерастворимых или окрашенных роданидных комплексов. К ним относятся Ag, Си, Ni, Со, Ti, Mo, U, Zn, Hg и Bi. В данном частном случае влияние этих мешающих веществ можно уменьшить, экстрагируя окрашенный комплекс Fe(III) подходящими содержащими гидроксил растворителями.
Предыдущее обсуждение было очень упрощенным, поскольку оно не учитывало возможности образования смешанных комплексов с разными лигандами. В связи с этим сделанные заключения строго применимы лишь к таким системам, где присутствует только одно комплексообразующее вещество. Известно, например, что в смесях ионов висмута, хлорида и бромида в растворе находятся все соединения ряда BiCl^-, BiBrCl2-, ..., BiBr|_ [5]. Точно так же цирконий (IV) в виде комплекса 1:1с молекулой EDTA легко присоединяет молекулу тайрона, хромотроповой кислоты, 8-оксихинолина или ацетилацетона, удовлетворяя свои координационные требования.
4. ВЛИЯНИЕ ГИДРОЛИЗА
Почти все катионы сообщают связанным с ними молекулам воды тенденцию к отщеплению одного или более протонов, например:
Fe (Н2О)3-Ь + н2О — Fe (Н2О)5 ОН2+ + Н3О+.
В наибольшей степени это относится к катионам и комплексам металлов, имеющим высокие положительные заряды.
Связанные с металлом молекулы воды теряют ионы водорода легче, чем молекулы свободного растворителя. Это происходит потому, что за счет оттягивания неподеленной пары электронов сольватированной молекулы воды к иону металла заряд последнего уменьшает электронную плотность связей О—Н и облегчает разрыв связи. В общем случае тенденция к такому гидролизу повышается с увеличением заряда катиона..
Гидролиз этого типа, ведущий в большинстве случаев к образованию полиядерных комплексов и в конечном счете — к осаждению, играет при количественной интерпретации равновесий комплексообразования весьма важную роль. Так как акво-ионы металлов могут терять протоны, их можно рассматривать как кислоты.
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
117
Таблица 2
Некоторые значения рКа аквоионов металлов при 20—25а
Ион металла r a Ион металла 1 ptfn
Мп2+ 10,7 In3+ 4,4B
Fe2+ 9,56 Tl3+ 1,1B
Со2+ 10,0 Bi3+ 1,6B
Ni2+ 10,0 u4+ 2,0B
Zn2+ 9,1 Hg2+ 5,0r
Cd2+ 9,0B Sc3+ 5,1s
Hg2+ 3,7r Sn2+ 3,9B
Fe3+ 3,1 Pb2+ 7,8
а Эти значения получены методом потенциометрического титрования. Более ранние методы измерения pH раствора «чистой соли» весьма ненадежны [см. пример, обсуждаемый в статье: S i 1 1 ё n L. G., Quart. Rev. (London), 13, 146 (1959)].
б В 1 М NaClOi.
в В 3 М NaClOi.
г В 0,5 М NaClO<.
В табл. 2 приведены некоторые константы диссоциации таких кислот, установленные методом потенциометрического титрования. Однако во многих случаях присутствуют комплексы вида Mm(OH)n (заряды и молекулы воды опущены); константы равновесия в этом случае имеют вид
*й . [Mm(OH)jH+]n
?тп [M]m
Силлён [6] высказал предположение, что эти комплексы построены на «ядре» за счет добавочных «звеньев». Так, ядро Си2+ присоединяет звенья Си(ОН)г, образуя ряд комплексов
Cu2+, Cu2(OH)2+, Cu3(OH)2+, Cu4(OH)2+, .. ., Cu„(OH)2+_2, в которых ионы гидроксила ведут себя как мостики между ио,-нами металла. Процесс, ведущий к образованию таких поли-ядерных комплексов, называют «оляцией» [7]. В тех случаях, когда ионы металлов способны гидролизоваться с образованием как моно-, так и полиядерных комплексов, доля последних возрастает по мере увеличения концентрации иона металла. И наоборот, в достаточно разбавленных растворах металла (которые можно также получить введением других комплексообразующих веществ) или в достаточно кислых растворах следует учи-
118
ГЛАВА 6
тывать лишь моноядерные гидроксо-комплексы. Равновесия в таких системах обсуждал Рингбом [4]. В предельном случае отношение концентрации продукта гидролиза к общей концентрации металла не зависит от концентрации иона металла.
Небольшая растворимость незаряженных гидроокисей, которые являются конечным продуктом этих реакций гидролиза, строго ограничивает допустимую концентрацию свободного иона металла в растворе по мере увеличения pH. Произведение растворимости гидроокиси металла определяется уравнением
[он|^= 1МГ •
1 1 [н+]и
Логарифмируя, получим максимально возможную концентрацию свободного иона металла в условиях равновесия
io8 [Мге+]макс = п • p!<w-pK,-n pH.
Некоторые примеры приведены в табл. 3. В ряде случаев [амфотерные гидроокиси типа Zn(OH)2 и А1(ОН)3] при высоких концентрациях гидроксила образуются анионы и осадок снова растворяется.
Таблица 3
Приблизительные значения максимально возможных концентраций свободных ионов металлов при различных величинах pH (25°)
Ион металла Логарифмы максимальной концентрации Ион металла Логарифмы максимальной концентрации
Th4+ 11,1-4 pH Co2+ ~ 13—2 pH
Ре'1' 4,0—3 pH Zn2+ 11,2-2 pH
Cr3+ 11,8-3 pH Cd2+ 13,8-2 pH
Mn2+ 15,2—2 pH Hg2+ 2,6—2 pH
Fe2+ 12,8—2 pH Ag+ 6,4—1 pH
Ион металла, частично или полностью связанный с лигандом, подвержен гидролизу в меньшей степени, чем соответствующий гидратированный ион металла. Это объясняется тем, что оттягивание электрона от лиганда к иону металла уменьшает электростатическое взаимодействие последнего с оставшимися координированными молекулами воды.
Тем не менее если комплекс металла может выделять протоны, то часто наблюдаются важные эффекты. В таких случаях комплекс можно рассматривать как соединение, в котором один
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
119
или большее число протонов могут отщепляться от молекул воды, координированных центральным ионом, или же от какой-либо группы или групп лиганда. Так, бис-комплекс Pd (II) с ди-метилглиоксимом растворяется в щелочах вследствие ионизации в нем протонов двух групп =N—ОН.
В некоторых случаях может происходить протонизация комплекса металла. Например, это возможно в случае ряда комплексов с EDTA, так как в подходящей области pH ионы водорода при взаимодействии с наиболее слабо связанной карбоксильной группой лиганда способны успешно конкурировать с ионом металла. Подобное положение наблюдается при комплексообразовании Mg2+ с аденозинтрифосфатом (АТР).
5. КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Ступенчатая природа комплексообразования ионов металлов с монодентатными лигандами и тот факт, что последовательные константы комплексообразования Ki, К2, комплексов обычно мало отличаются друг от друга, препятствуют широкому применению таких лигандов в объемных методах. К немногим случаям, когда можно получить хорошие конечные точки, относятся системы, включающие Hg2+ с С1_ и CN~, а также Ag+ с Вг ‘, С1~ и CN-. Следует ожидать, что более удобные кривые титрования будут наблюдаться в тех случаях, когда каждая молекула лиганда замещает в координационной сфере иона металла две или большее число координированных молекул воды, т. е. при образовании более простого комплекса. Кроме того, такие комплексы вследствие «хелатного эффекта» являются более прочными.
Эти преимущества возрастают в случае полидентатного лиганда, когда с ионом металла образуются лишь комплексы состава 1:1. Наиболее известным комплексообразующим веществом такого типа является этилендиаминтетрауксусная кислота (EDTA) XXV, четырехзарядный анион которой может вести себя как пента- или гексадентатный лиганд. EDTA координирует ион металла двумя атомами азота и тремя или четырьмя карбоксильными группами с образованием октаэдрических комплексов, значительно стабилизированных за счет возникновения пятичленных хелатных циклов.
НООССНг^ /СН2СООН
N+HCH2CH2H+N “ООССНг^ Хсн2сосг
XXV
Внедрение EDTA в качестве аналитического реагента для комплексонометрического титрования [3] способствовало значи
120
ГЛАВА 6
тельному прогрессу в области количественного неорганического анализа. Использование EDTA дает возможность выполнять быстрые и обычно весьма надежные определения большого числа различных металлов. Избирательность этих методов достигается соответствующим регулированием значения pH раствора или за счет применения подходящих маскирующих агентов. Эти титриметрические методы делят на три группы — прямое титрование, обратное титрование и титрование по замещению. Конечную точку обычно определяют при использовании подходящих окрашенных индикаторов. Увеличения чувствительности можно достигнуть за счет применения таких физических методов, как амперометрическое титрование с капельным ртутным электродом [8] или квадратноволновая полярография [9]. Иногда можно применять титранты, которые сами в отсутствие индикаторов в конечной точке титрования вызывают изменение окраски [10]. В случае визуального титрования иногда могут встречаться такие трудности, как образование интенсивно окрашенных комп-
Таблица 4
Константы устойчивости некоторых комплексов металлов с EDTA состава 1 : 1 (при 20° в 0,1 М KNO3)
Ион металла log K1 Ион металла log K,
L1+ 2,8 Fe2+ 14,3
Na+ 1,7 Co2+ 16,2
Ag+ 7,3 №2+ 18,6
Mg2+ 8,7 Cu2+ 18,8
Са2+ 10,7 Pd2+ 18,5
Sr2^ 8,6 Al3+ 16,1
Ва2+ 7,8 Sc3+ 23,1
Zn2+ 16,4 Ln3+ * ~ 16—18
Cd2+ 16,5 Fe3+ 25,1
Hg2+ 22 Ga3+ 20,3
Pb2+ 17,7 In3+ 25,0
VO2+ 18,4 V3+ 25,9
V2+ 12,7 Th4+ 23,2
Cr2+ 13,0 Co3+ 36
Mn2+ 13,6 Cr3^ 24
* Редкоземельные элементы.
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
121
лексных соединений с титрантом (например, Fe, Си и Ст с EDTA), медленность комплексообразования (А1 с EDTA) или уменьшение чувствительности вследствие высокого солевого фона. Кроме того, если не добавлены соответствующие маскирующие агенты, мешающие определению ионы металлов (особенно Fe(III), могут образовать с применяе-
Сг(Ш), Cu(II), Со(П) и Ni(II)) мым индикатором настолько прочные комплексы, что индикатор «блокируется» и конечную точку титрования нельзя определить. Этими немногими трудностями исчерпываются основные ограничения метода комплексонометрического титрования.
Константы устойчивости комплексов металлов с EDTA, приведенные в табл. 4, изменяются так, как это можно ожидать в случае, если связь в комплексах является в основном электростатической: наименее устойчивы комплексы однозарядных катионов и устойчивость обычно возрастает с увеличением заряда катиона и с уменьшением ионного радиуса. Например, значения logKi уменьшаются в ряду
Са2+ > Sr2+>Ba2+^>Li+>Na+. Сравнительно небольшое увеличение logKi при переходе от Мп2+ (13,6) к Си2+ (18,8) обусловлено слабым полем лиган
Рис. 3. Влияние pH на долю EDTA, присутствующей в виде четырехзарядного аниона.
дов карбоксильных групп EDTA. Как видно из таблицы, все ионы, за исключением ионов щелочных металлов, образуют с EDTA комплексы, обладающие достаточно высокими константами устойчивости, чтобы эти ионы можно было определять методом комплексонометрического титрования. Легко подсчитать, что в случае комплексов состава 1 : 1 возле конечной точки наблюдается весьма значительный скачок концентрации свободного иона металла; падение концентрации в миллион раз не является необычным. Однако вследствие того, что pH растворов оказывает заметное влияние на концентрацию присутствующего четырехзарядного аниона EDTA (рис. 3), при выполнении аналитического определения этот фактор необходимо контролировать. В случае магния
122
ГЛАВА 6
Ai= [MgEDTA2-]/[Mg2+][EDTA4_] = 108’7, поэтому при pH 12 (практически полная ионизация EDTA), когда концентрация свободной EDTA достигает ЗхЮ-5 М, в виде Mg2+ в растворе находится менее 0,01% от общего содержания магния. С другой стороны, при pH 6 в 0,001 М растворе EDTA 10% магния еще остаются незакомплексованными. В противоположность этому комплексообразование трехвалентного железа является полным с точностью до 10-7% даже при pH 3, когда концентрация свободной EDTA равна 2- 10-6 М. По мнению Рингбома [11], оптимальным значением pH комплексообразования с EDTA является такое, при котором кажущаяся константа устойчивости комплекса равна 108. Эти величины легко рассчитать, используя значения log Ai, приведенные в табл. 4, и находя на рис. 3 значение pH, для которого ордината равна 8 — log Ai-
Необходимо также учитывать гидролитические равновесия в системе металл — EDTA. Так, несмотря на то что logAi комплекса EDTA с Fe3+ равен 25,1, при сильном подщелачивании раствора осаждается гидроокись железа. Это можно легко оценить на основе равенства
10« [Fe3+]MaKC = 4,0 -ЗрН,
из которого следует, что максимальная концентрация свободного иона металла быстро падает по мере роста pH, в то время как комплексообразующая способность EDTA становится постоянной. В случае 10-3 М раствора комплекса Fe3+ с EDTA в 10-3 /VI растворе свободной EDTA осаждение должно начаться примерно при pH выше 9,5. Из достаточно щелочных растворов осаждаются также гидроокиси Bi, Th, Zr, Hf, U и Ti.
Последняя из комплексообразующих групп в молекуле EDTA, принимающих участие в комплексообразовании, связана с ионом металла сравнительно слабо (иногда две последние группы). Это дает возможность молекулам воды занять в таком комплексе одно или два координационных места, причем эти молекулы воды могут отщеплять протоны, образуя комплексы типа Fe(OH)-EDTA и Fe(OH)2-EDTA.
В результате такого гидролиза кажущиеся константы устойчивости многих комплексов металлов с EDTA имеют четкие максимумы в зависимости от pH [12]. Для Ni, Си, Fe(II), Zn и Cd эти максимумы лежат в области pH 9—10, в случае Al, Fe(III) и Hg около pH 4—5.
Большая скорость, с которой EDTA образует растворимые комплексы, и высокие значения констант устойчивости последних объясняют причину широкого распространения этого реагента в химическом анализе. Большинство титриметрических методов основано именно на разнице в значениях констант устойчивости. Так, при pH 4 цинк или медь можно оттитровать в присутствии
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
123
щелочноземельных металлов, но при pH 10 титруются сами щелочноземельные металлы. Конечные точки при таких титрованиях обычно определяют при помощи небольших количеств индикаторов, дающих с определяемым металлом менее прочные и отчетливо окрашенные комплексы. Конечную точку определяют по исчезновению этой окраски; в присутствии свободной EDTA ме-таллиндикатор полностью вытесняется из комплекса. (Если константа устойчивости комплекса металла с индикатором слишком высока, т. е. если она при тех же условиях сравнима с константой устойчивости EDTA-комплекса или больше ее, то удовлетворительную конечную точку получить нельзя, и говорят, что индикатор «блокирован».) Другой прием заключается в том, что в раствор добавляют избыток EDTA, переводят металл в комплекс с EDTA, и затем титрованием стандартным раствором какого-либо подходящего иона металла определяют количество неиспользованной EDTA. В этом случае конечную точку титрования определяют по образованию окрашенного комплекса с менее активным комплексообразующим лигандом после того, как вся EDTA будет связана в комплекс с металлом.
6. ИНДИКАТОРЫ ДЛЯ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
Принципы комплексонометрического и кислотно-основного титрований весьма сходны. Это сходство еще более подчеркивается использованием величины рМ (—log[M]), аналогичной pH. рМ-Индикаторы обычно являются очень слабыми комплексообразующими реагентами, которые при комплексообразовании изменяют свою окраску (они сравнимы, следовательно, со слабыми кислотами и основаниями, применяемыми в качестве рН-индикаторов, которые изменяют свою окраску при присоединении или отщеплении протона).
Большинство обычных фотометрических реагентов на ионы металлов малоэффективно при использовании в качестве металл-индикаторов, поскольку их комплексы с металлами слишком прочны. В качестве немногих исключений можно назвать салициловую кислоту [13], 5-сульфосалициловую кислоту [14], тайрон (пирокатехин-3,5-дисульфокислоту) [15] и роданид-ион [16]. Все эти индикаторы применяли при комплексонометрическом титровании ионов Fe(III) в кислых средах. Во всех случаях индикатор бесцветен, а его комплекс с железом окрашен, поэтому, чтобы сделать переход более четким, можно применять большие концентрации индикатора. Подобным же образом при титровании висмута EDTA показателем достижения конечной точки служит образование его желтого комплекса с тиомочевиной [17]. При комплексонометрическом титровании цинка и алюминия в водно-ацетоновых и водно-спиртовых растворах используют дити-
Таблица 5
Некоторые обычные металлиндикаторы для комплексонометрического титровании
Индикатор Условия определения Титруемые ионы металлов Переход окраски
Мурексида рН~12 Са Розовая — фиолетово-
(рКо=9,20; 10,50) (XXVI) Эриохром черный Тб ,(рЛа=6,3; 11,5) Щелочной раствор Нейтральный раствор pH 7—11 Аммиачный Сц2+, Со2+, Nl2+, Се3+ Zn, Cd Mg, Cd, Zn, Mn2+, Pb2+, In, La Hg2+ синяя Желтая — фиолетовосиняя Желтая — краснофиолетовая Красная — синяя
(XXVII) Пирокатехиновый или тартрат- ный буфер Обратное титрование с Mg2+ pH 6,8 Аммиачный рас- Ca Ba, Sr Cd в присутствии Mg Ni, Co, Mn, Пурпурная — зелено-вато-синяя Зеленовато-синяя —
фиолетовый® твор pH 10 Zn, Cd красно-фиолетовая
(рКа=1,7; >10; >10) (XXVIII) Кислый раствор, pH 2—3 Ацетатный буфер, pH 5,5—6,5 Ca, Mg Bi, Th Cu2~'" в присутствии Ag, Mg, Ca, Sr, Ba Синяя — желтая, красная — желтая Синяя — желтая
PAN Ацетатный бу- Zn
(XXIX) фер, pH 5—7
Розовая — желтая
Продолжение
Индикатор
Условия определения
Титруемые ноны металлов
Переход окраски
Ацетатный буфер, рН>6 Cd Розовая — желтая
Уксусная кислота Си Красная -зеленая - желтовато-
pH 2,3—2,5 In
Металлфталеинд (pK„ = 7; 7,8; 11,4; 12,0) (XXX) 20—50% этанол pH 10—11 Са, Sr, Ва Красная — - бесцветная
Ксиленоловый оранжевый6 pH 2,5—3,5 Th Красная -желтая - лимонно-
pH 3—5 Sc
pH 5 Pb, Zn
Уротропиновый буфер, pH 6 Cd, Hg (II)
Омега хромкрас- pH 4,6 Nl Красная — желтая
ный Вж’ •
(XXXI)
pH 4,5 Си
pH 6,5—10 Zn
pH 10 Pb
Ализаринкомп- pH 4,3 Pb, Zn, Co, Красная — желтая
лексон Си, In
(XXXII, R = H)
a Schwarzenbach G., Gysling, Helv, Chim. Acta, 32, 1314 (1949).
G Schwarzenbach G., Biedermann W., Helv. Chim. Acta, 31, 678 (1948).
B Suk V., Ma I at M., Chemist-Analyst, 45, 30 (1956).
r Cheng K. L., Bray R. H., Anal. Chem., 27, 782 (1955).
Д Ander e gg G., F I a schka H., Sallmann R., Schwarzenbach G., Helv. Chim. Acta, 37, 113 (1954).
v e К о r b I ^J., Pribil R., Emr E., Coll. Czech. Chem. Comm., 22, 961 (1957);
Korbl J., Pribil R., Chemist-Analyst, 45, 102 (1956).
ж Belcher R„ Close R. A., West T. S„ Chemist-Analyst, 46, 86 (1957).
BWehber P., Z. anal. Chem,, 153 , 253 (1956); 154, 122 (1957).
126
ГЛАВА 6
зон [18]*. Для применения в качестве металлиндикаторов были разработаны и специальные комплексообразующие реагенты; некоторые наиболее часто применяемые индикаторы перечислены в табл. 5.
В стремлении достигнуть необходимой интенсивности окраски для чувствительного индикатора часто применяли производные органических красителей, таких, как азокрасители, фенолы, фталеины и сульфофталеины. Наиболее известными из них, вероятно, являются индикаторы ряда эриохромов — о.о'-диоксиазонафтали-новые красители. Вначале поиски веществ для использования в качестве металлиндикаторов велись эмпирически. Первое такое соединение, мурексид, было найдено случайно; оно образовалось как продукт разложения при синтезе урамилдиуксусной
Мурексид (пурпурат аммония)
XXVI
кислоты, и было замечено изменение его окраски в присутствии иона кальция [3]. Эриохромовые красители были исследованы по той причине, что эти продажные красящие вещества, как было известно, реагируют с металлами. Такого рода соединения могут взаимодействовать как с ионами металлов, так и с ионами водорода; в обоих случаях наблюдается заметное изменение окраски, так что их можно применять в качестве pH- и рМ-индикаторов.
Эриохромовый черный Т (солохромовый черный Т) Пирокатехиновый фиолеювый
XXVII
XXVIII
* С алюминием дитизон не реагирует. — Прим. ред.
PAN (1-(2-пиридилазо)~2-нафтол]
XXIX
Металлфталеин (фталеинкомплексон)
R = H, алпзаринкомплексон
R = ОН, алпзаринбордокомплексон
ХХХ11
128
ГЛАВА 6
Интенсивной окраской комплексов этих металлиндикаторов объясняется то, что существует обширная литература, посвященная их применению для прямого спектрофотометрического определения ионов металлов.
Как и в случае pH-индикатора, присутствующего в точке эквивалентности в двух формах (анион и нейтральная молекула или нейтральная молекула и катион), концентрации которых равны, в конечной точке комплексонометрического титрования с применением «металлохромных» индикаторов имеется равновесие между комплексом металла и незакомплексованными формами. В такой конечной точке рМ равен логарифму кажущейся константы устойчивости комплекса металла с индикатором (при данных условиях эксперимента). Математический анализ равновесий, устанавливающихся при комплексонометрическом титровании с применением таких индикаторов, фактически основан на принципах, уже описанных ранее в этой главе. Однако его применение часто затруднено отсутствием достаточных данных о константах устойчивости комплексов с металлиндикаторами. (Полезной сводкой известных констант служит работа [4].) В случае хорошего визуального индикатора можно добиться точности примерно ±0,5 единицы рМ, что приводит к ошибке титрования около ±230/( [М]т/Смъ)'/2°/о [4]. Так, ошибку ±1% следует ожидать при [М]т = 10-3 М и Лмъ=10а, при [М]т=10-5 М и ^ML = = 1010 и т. д. Используя физико-химические методы фиксации конечной точки, точность определения часто можно повысить по крайней мере в пять раз.
Относительная комплексообразующая способность EDTA и других лигандов по отношению к металлам меняется в зависимости от их строения. Поэтому вещества, являющиеся хорошими индикаторами для комплексонометрического титрования одних ионов металлов, могут быть совершенно непригодны для других. Так, можно ожидать, что в ряду двухзарядных ионов от марганца до меди log Ki комплексов с эриохром черным Т будет возрастать гораздо быстрее, чем log Ki комплексов с EDTA. Действительно, было найдено, что если с эриохром черным Т можно титровать Мп2+ и Zn2+, то комплексы Со2+, Ni2+ и Си2+ с этим индикатором уже слишком прочны. Это же относится к А13+, Сг3+, Fe3+, Ag+, Ti4+ и некоторым платиновым металлам. Если для связывания мешающих ионов металлов не ввести в раствор какой-нибудь достаточно активный комплексообразующий агент типа о-фенантролина, то указанное обстоятельство приведет к «блокированию» эриохром черного Т. (И наоборот, скорость взаимодействия EDTA-комплексов Cu, Со, Ni и А1 с этим индикатором достаточно мала, чтобы их определять обратным титрованием, когда избыток EDTA оттитровывают стандартными растворами солей цинка или магния.)
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
129
Различна также и природа связывающих металл группировок в молекулах индикаторов. В комплексах металлов с мурексидом связь осуществляется двумя (из четырех) центральными атомами кислорода, один из которых ионизирован, и центральным атомом азота. В случае эриохром черного Т и эриохром сине-черного в комплексообразовании принимают участие два фенольных остатка и атомы азота азо-группы. Это справедливо также и для комплексов прочного сульфонового черного F (XXXIII), который, по-видимому, является специфическим индикатором для меди и никеля [19] в присутствии ионов аммония (в комплексообразовании принимает участие только одна азо-группа). Прочный сульфоновый черный F является также высокочувствительным спектрофотометрическим реагентом на бериллий [20], образуя
Прочный сульфоновый черный F
XXXiii
с ним при pH 11 комплекс состава 1:1. Пирокатехиновый фиолетовый, как и тайрон, связывает металлы посредством двух фено-лят-ионов, а в PAN этой цели служат пиридиновый азот, атомы азота азо-группы и ионизированная окси-группа. Подобным же образом, в случае 2-(о-арсонофенилазо)-1,8-диоксинафталин-3,6-дисульфокислоты XXXIV* металл может связываться атомом
азота азо-группы и гидроксильным кислородом ближайшей оксигруппы, однако в этом случае и арсоно-группа расположена так,
* Известный реагент арсеназо I. — Прим, персе.
9 Д. Перрии
130
ГЛАВА &
что может принимать участие в комплексообразовании *. С другой стороны, в комплексах металлфталеина металл удерживается двумя карбоксильными группами, иминным атомом азота и одной из фенольных ОН-групп. Именно эта ОН-группа ответственна за то, что комплексы металлов обладают окраской, подобной окраске хиноидной формы, существующей в щелочной среде. Тот факт, что комплексы Са, Ва и Mg интенсивно окрашены, а комплекс Zn — нет, позволяет предположить, что в последнем случае связь иона металла с фенольным кислородом имеет скорее ковалентный, а не ионный характер. Рассмотренные структуры не являются единственно возможными для индикаторов. Так, в отсутствие нитро-группы в молекуле эриохром черного Т получается эриохром сине-черный В (солохром черный 6В), который также применяют в качестве металлиндикатора; он даже более устойчив и дает более резкий переход окраски при титровании Mg2+ и некоторых других ионов. Его изомер, эриохром сине-черный R (солохром темно-синий или кальцон, XXXV, R —Н), также используют для этой цели [21].
XXXV
Легко заметить, что структура омега хром красного В XXXI родственна структурам эриохромовых красителей. Дальнейшая модификация приводит к индикаторам 2-окси-1-(2-окси-4-сульфо-1-нафтилазо)-3-нафтойной кислоте (HHSNNA) [22] (R = = СООН, XXXV) и кальмагиту XXXVI, имеющим аналогичные свойства [23].
СН3
ОН
* Следует отметить, что в случае реагентов, обладающих несколькими функциональными группами, присоединение катиона по той или иной группе определяется главным образом свойствами самого катиона. Так, в рассматриваемом автором случае реагента арсеназо I при реакции его с Th4+ связывание, по-видимому, осуществляется по о-арсоно-о'-оксиазо-группе. При взаимо-
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
131
Переход окраски в случае реакций кальмагита с кальцием и магнием тот же, что и в случае эриохром черного Т, но он более отчетлив и резок, а водные растворы реагента устойчивы в течение неограниченного времени. Эта же хелатирующая группировка дважды повторяется в молекуле кислотного ализаринового черного SN (XXXVII).
Этот реагент был предложен в качестве индикатора для титри-метрического определения кальция в присутствии магния при высоких значениях pH [24]. Эта же группировка повторяется и в кальцихроме.
Очевидно сходство пирогаллолового красного [25] XXXVIII и его дибромпроизводного — бромпирогаллолового красного — с пирокатехиновым фиолетовым. Все эти три индикатора можно применять для титрования одних и тех же элементов.
ОН
XXXVIII
Подобным же образом 2-нафтольную группу в PAN можно заменить на резорцин, в результате чего получится 4-(2-пириди-лазо)-резорцин, который был использован в качестве металлин-дикатора при титрованиях EDTA [26] и при титровании индия
действии же с Fe3+ и А13+ в комплексообразовании принимает участие, возможно, только оксназо- или лери-диокси-группа. К тому же в случае катионов типа Сг3+ и Са2+ участие в комплексообразовании той или иной функциональной группы реагента зависит и от pH среды (в более кислых средах оно осуществляется по о-арсоно-о'-оксиазо-группе, а в более щелочных — по пери-диокси-группе). — Прим, перев.
9*
132
ГЛАВА S
нитрилотриуксусной кислотой [27]. Его также предложили использовать в качестве водорастворимого реагента для прямого фотометрического определения Со, РЬ и U [28]. PAN также применяли как фотометрический реагент на уран [29].
Главными задачами таких структурных модификаций являются изменения величин р/Со лигандов (и, следовательно, изменение интервала pH, где они могут быть использованы), спектров поглощения реагентов и их комплексов, растворимости и химической устойчивости (в смысле разложения).
Сходство между pH- и рМ-индикаторами подчеркивается также применением в комплексонометрическом титровании индикаторов типа ксиленового оранжевого, метилтимолового синего и металлфталеина. Молекулы таких индикаторов содержат ту же, что и комплексон (EDTA), N.N-ди(карбоксиметил)аминометиль-ную группу, присоединенную к pH-индикатору таким образом, что комплексообразование с этой группой приводит к изменению степени ионизации pH-индикатора. Аналогичные комплексонометрические индикаторы, такие, как ализаринкомплексон и али-заринбордокомплексон, были синтезированы в ряду антрахинонов [30].
В комплексах этих лигандов с ионом металла непосредственно связаны, образуя полидентатную хелатную структуру, ионизированные карбокси-группы, атом азота и ближайший к ди (карбоксиметил) аминометильной группе фенольный кислород. В противоположность этому в случае ализаринового красного S (XXXIX) или (еще лучше) в случае 2-хинизаринсульфокис-лоты и 2-феноксихинизарин-З, 4-дисульфокислоты (которые были
О он
О
XXXIX предложены [31] в качестве индикаторов при титровании тория EDTA) в комплексообразовании принимают участие только соседние пары кислородных атомов; сульфо-группы лишь придают соединениям растворимость в воде.
Подобно тому как металлфталеин является производным о-крезолфталеина, кальцеин [32] по своей структуре родствен флуоресцину, а тимолфталексон [33] — тимолфталеину. Все три вещества используют в качестве индикаторов при комплексонометрическом определении Са, Sr и Ва. Однако замещение в ме-.таллфталеине остатка карбокси-группы (фталевой кислоты) на
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
133
сульфо-группу позволяет получить ксиленоловый оранжевый [34], который является ценным индикатором при работе в области гораздо более низких значений pH.
Кальцеин и кальцеин синий XL (на основе 4-метилумбеллифе-рона) были предложены в качестве флуоресцентных индикаторов
для комплексонометрического определения железа, меди, кобальта, хрома, никеля и цинка при pH 5 методом обратного титрования избытка EDTA стандартным раствором меди. Конечная точка устанавливается по гашению флуоресценции, что является результатом участия фенольной группы в комплексообразовании с металлом. Наоборот, при pH выше 12 флуоресцируют не свободные индикаторы, а их комплексы с кальцием, стронцием и барием.
Те же комплексообразующие группы имеются в молекуле ЗЗ'-диоксибензидин-Ы, N, N' N'-тетрауксусной кислоты XLI, которую, подобно другим бис-ортозамещенным представителям
хы
этой группы [36], можно применять в комплексонометрическом титровании в качестве металлфлуоресцентного индикатора (на Си и РЬ) [37]. Индикатор, но не его комплексы, обладает синей флуоресценцией. Окси-группы в положениях 3,3', несомненно, участвуют в комплексообразовании, однако предположение о том [37], что введение гидроксильных групп в положения 5,5' должно бы привести к образованию значительно более прочных комплексов, представляется малообоснованным из-за стерических затруднений. 4,4'-Диаминостильбеновые аналоги этих индикаторов гораздо чувствительнее и также были использованы в качестве флуоресцентных индикаторов при комплексонометрическом определении Си(II) [38].
Морин применяли как флуоресцентный индикатор при комплексонометрическом титровании галлия и индия [39].
134
ГЛАВА 6
В работе [40] описана попытка модификации хромазурола S (XLII, R2=R3=C1, Ri = SO3H) в эриохромцианин RC (XLII,
XLII
R1 = R3=H, R2=SOsH) с целью получения более удачного индикатора для комплексонометрического определения циркония. Иногда для определения одного и того же элемента можно использовать индикаторы совершенно иного строения. Так, SPADNS (XLIII, R = SOsH) был предложен в качестве индикатора при определении циркония [41] и тория [42J; для этих же
элементов применяли также хромотроп 10В (XLIII, R = OH). Оба этих красителя, так же как и некоторые другие, имеющие по крайней мере одну окси-группу в орто-положении к азо-группс, были предложены для использования в спектрофотометрических методах определения Zr, Та, Th, U, Be и Np. Вероятно, в комплексообразовании с металлом участвуют азот азо-группы и фенольный кислород. Другими индикаторами для определения тория являются пирокатехиновый фиолетовый и ализариновый красный S [43].
В результате диазотирования и самосочетания трех молекул Н-кислоты (1-амино-8-оксинафталин-3,6-дисульфокислота) * получается кальцихром [44] XLIV, в котором азо- и фенольные
* В оригинале Н-кислоте ошибочно приписывают строение 1,7-диамино-8-оксинафталин-3,6-дисульфокислоты. — Прим, перед.
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
135
XL IV
группы образуют «хелатную клетку» *. Размеры этой «клетки» таковы, что из щелочноземельных элементов войти в нее может только кальций. При pH 12—13 в присутствии кальция синяя окраска раствора реагента переходит в красную; ионы бария, стронция и магния не мешают. Таким образом, кальцихром можно использовать в качестве индикатора при специфическом комплексонометрическом определении кальция в присутствии бария, применяя в качестве титранта 1,2-диаминоциклогексан-М, N, N', N'-тетрауксусную кислоту [44]. На применении этого индикатора основана также и специфическая капельная проба.
Другие примеры металлохромных индикаторов и практические детали их использования в комплексонометрическом титровании можно найти в работах [3] и [45].
* Строение этого реагента нельзя считать считают, что его свойствам более соответствует
доказанным. Другие авторы линейная структура
[см., иапример, Лукин А. М., Смирнова К. А., Зав ар их ин а Г. Б., ЖАХ, 18, 44 (1963)]. Впервые кальцихром (под названием «кальцион») для определения кальция предложили Лукин А. М., Заварихина Г. Б., Сысоева Н. С. (Авт. свидет. СССР № 110966 от 27.III.1957 г.). — Прим, перев.
136
ГЛАВА 6
При любых данных условиях эксперимента кажущиеся константы устойчивости комплексов ряда металлов изменяются в порядке, который зависит от природы лиганда. Так, EDTA образует с Са2+ более прочные комплексы, чем с Mg2+, а в случае эриохром черного Т наблюдается обратный порядок и константа устойчивости комплекса Са2+ слишком мала, чтобы титрование было удовлетворительным. Добавление к раствору небольших количеств комплекса Mg-EDTA приводит к четкой конечной точке. До тех пор пока в растворе остается какое-то количество незакомплексованного Са2+, в нем будет находиться свободный Mg2+, образующий с индикатором окрашенный комплекс. Однако комплекс Mg-EDTA достаточно устойчив, и в тот момент, когда он снова образуется, окраска раствора исчезает. Комплекс Mg-EDTA служит примером косвенного металлиндикатора. Применение этого принципа имеет богатые потенциальные возможности.
7. ДРУГИЕ РЕАГЕНТЫ, ПРИМЕНЯЕМЫЕ В КОМПЛЕКСОНОМЕТРИЧЕСКОМ ТИТРОВАНИИ
Нитрилотриуксусную кислоту в виде ее тринатриевой соли XLV также широко применяют при комплексонометрическом титровании. Вследствие того что комплексообразующие группы
.СН2СОО- Na+ n<-CH2COO- Na+ ^C^COO- Na+
XLV
NTA подобны группам EDTA, между значениями логарифмов констант устойчивости комплексов металлов с этими двумя лигандами наблюдается известное соответствие (log Ki комплексов NTA равен приблизительно трем пятым от соответствующего значения для комплексов EDTA, так что NTA можно с успехом применять для определения многих ионов, в том числе марганца и щелочноземельных металлов). Основным типом реакций, где применение NTA удобнее, чем EDTA, является взаимодействие с определяемым катионом ее двузамещенной соли щелочного металла с последующим определением (путем обратного титрования) концентрации протонов, которые выделяются при комплексообразовании *.
* Термин «обратное титрование» применен здесь неудачно. Это пример определения по замещению, а не по избытку. — Прим, перев.
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
137
Урамилдиуксусная кислота (H3Ur, XLVI) образует комплексы исключительной устойчивости с Li+ и Na+ [46]. Так, при 20° log/Смь=5,61 для Li, 3,33 для Na+, 1,94 для К+ и 6,70 для
ZP
HN—L
уСН2СООН
'СН--N+H
О=С
HN—С %
сн2соо-
XLVI
Т1+ [47]. Устойчивую соль H3UrNaH2UrH2O можно легко перекристаллизовать из разбавленной хлорной кислоты и применять для удаления иона натрия из раствора. Анион урамилдиуксусной кислоты ведет себя, вероятно, как три- или тетр а дентатный лиганд, предпочтительно образуя комплексы тетраэдрического строения. Это может объяснить, почему комплексы с Li, Na и Be (log/(ml= 10,36) прочнее комплексов EDTA, в то время как комплексы с большинством двухзарядных катионов слабее. В соответствии с этим предположением находится и то наблюдение, что образование NTA более прочных комплексов, чем имино-диуксусной кислотой, объясняется главным образом превращением тридентатного хелатообразующего реагента в тетрадентат-ный. Введение в положения 1 и 3 H3Ur метильных групп оказывает очень слабое влияние на константы устойчивости комплексов Li, Na, К и Т1, что позволяет предположить [47] образование лигандом стерически предпочтительной конфигурации со структурой типа клетки, допускающей размещение малых ионов и делающей более предпочтительным тетраэдрическое их окружение.
Попытки улучшить комплексообразующую способность созданием лигандов — производных EDTA — не привели к большим успехам. Были получены гомологи EDTA, в которых группа — (СН2)2— была заменена на —(СН2)П—, где 8 > п > 2 [48], а также соединения с увеличенной углеродной цепью в остатках карбоновых кислот [49]. Пытались синтезировать простые эфиры и тиоэфиры EDTA [3]; были получены комплексоны с ограниченным вращением вокруг углерод-углеродной связи этилендиаминового мостика [50]. Предпринималось также замещение в EDTA карбокси-групп на орто-фенольные [51] и группы фосфиновой кислоты [52], однако комплексы таких лигандов оказались менее устойчивыми. Большая избирательность определения Са2+ и более крупных катионов в присутствии Mg2+ была достигнута при использовании вместо EDTA 2,2'-диаминоэтилового эфира N, N, N'.N'-тетрауксусной кислоты и бис(2-аминоэтил)этиленгли
138
ГЛАВА 6
коль-N, N, N', N'-тетрауксусной кислоты [53]. Комплексы ионов металлов с транс-1,2-диаминоциклогексан-М, N, N', N'-тетраук-сусной кислотой (CDTA) имеют более высокие константы устойчивости, чем соответствующие комплексы EDTA [54], но это преимущество частично нивелируется большим значением рК« лиганда. Более высокие значения констант устойчивости можно, вероятно, приписать стерическим факторам, а именно устранению свободного вращения вокруг связи —С—С—, которое возможно в случае EDTA.
Замена циклогексанового кольца CDTA на циклопентановое и циклогептановое привела соответственно к образованию CPDTA и CHDTA и позволила установить последовательность величин констант устойчивости их комплексов с металлами [55]
CHDTA > CDTA > CPDTA > EDTA.
Некоторое ограничение вращения вокруг этиленового мостика EDTA при замещении одного или двух атомов водорода этиленовой группы метильными группами позволяет получить 1,2-диами-нопропан-N, N, N', N'-тетрауксусную и 2,3-диаминобутан-М, N, N', N'-тетрауксусную кислоты. Эти реагенты гораздо более растворимы, чем EDTA, и константы устойчивости их комплексов с металлами несколько выше [55].
Пятизарядный анион диэтилентриаминпентауксусной кислоты (DTPA, XLVII) может образовывать октадентатные хелаты, и
НООССНх сн2соон
N—СН2СН2—N— СН2СН2—N
НООССН^ СН2СООН ^СН2СООН
XL VII
более высокий отрицательный заряд этого реагента обычно сообщает его комплексам большую, чем в случае EDTA, устойчивость. Этот комплексон является и лучшим реагентом для комплексонометрического титрования [56], особенно при определении тяжелых щелочноземельных элементов, первых членов ряда лантанидов и Th4+. Он образует также двуядерные комплексы.
Пиколиновая кислота, образующая столь же прочные комплексы, как и иминодиуксусная, а также 2,6-пиридиндикарбоновая кислота, которая сравнима по своей комплексообразующей способности с нитрилотриуксусной кислотой, имеют в комплексонометрическом титровании определенные перспективы, особенно при работе в области низких значений pH.
Можно ожидать, что относительные значения констант устойчивости комплексов металлов с полидентатными аминами будут
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
139
колебаться в гораздо больших пределах, чем в случае лигандов типа EDTA. Это следствие различия в природе комплексообразующих групп подтверждается данными по устойчивости некоторых комплексов EDTA, триаминотриэтиламина (TREN) и триэтилентетрамина (TRIEN), приведенными в табл. 6. Кроме того,
Таблица 6
Константы устойчивости некоторых комплексов состава 1 : 1 (при 20° и ионной силе 0,1)
Ион металла Лиганд
EDTA TREN TRIEN
Fe2+ 14,3 8,8
Ni2+ 18,6 14,8 14,1
Cu2+ 18,8 18,8 20,5
Zn2+ 16,4 14,6 11,8
Cd2+ 16,5 12,3 10,0
Hg2+ 22,1 — 25,0
Pb2+ 17,9 — 10,4
комплексообразование с щелочноземельными катионами характерно для EDTA, но практически отсутствует в случае TRIEN. Элементы, более легко координирующиеся с азотом, чем с кислородом (такие, как Си, Ni, Со, Zn, Cd и Hg), образуют наиболее прочные комплексы, но различия значительно больше, поскольку
/,ch2ch2nh2
N---CH2CH2NH2
СН2 сн2 nh2
TREN
(рЛ’а 8,6; 9,6; 10,3 )
^CH2CH2NH2
NH
I
сн2.
сн2
I
NH
X'CH2CH2NH2
TRIEN (рка 3,3; 6,7; 9,2; 9,9)
сила полей лигандов в случае аминов больше, чем в случае карбоксильных групп. Аналогично тот факт, что два из четырех координируемых атомов индикатора цинкона XLVIII являются
140
ГЛАВА 6
атомами азота, объясняет, видимо, причину предпочтительного комплексообразования его с Си, Zn, Ni и Со.
XLVlil
Различия в значениях log/G для комплексов Си, Ni и Fe с TREN достаточно велики, что позволяет последовательно титровать эти металлы в одном растворе. До сих пор главным образом вследствие трудности получения чистых препаратов методов титрования при помощи полиаминов описано очень мало [57]. Кроме того, чтобы получить достаточно большие кажущиеся константы устойчивости, определения — вследствие неблагоприятных значений р/(а лигандов — надо проводить в слабощелочной среде.
Тем не менее TRIEN использовали при титровании Cd, Си, Zn, Pb, Ni и Hg. Конец титрования определяли при помощи ме-таллхромных индикаторов [58] и потенциометрически [59]. Позже было описано применение тетраэтиленпентамина в потенциометрическом [60] и амперометрическом [61] титрованиях.
N(CH—с—СН3)3 II NOH
Трудности, связанные с высокими значениями рКа алифатических полиаминов и многоступенчатым характером их диссоциации, можно обойти, применяя для комплексонометрического титрования реагенты типа трис (ацетонилтриоксим) амина, в котором сохраняется хелатирование атомами азота. Однако реагенты этой группы довольно легко гидролизуются.
8. «МАСКИРОВАНИЕ» ХИМИЧЕСКИХ РЕАКЦИЙ
В кислых цианидных средах при пропускании сероводорода через раствор соли меди сульфид меди не осаждается. Аналогичным образом ионы Fe(III) в присутствии избытка EDTA не образуют с роданид-ионами окрашенного комплекса FeSCN2+. Так как в обоих случаях нормальное течение реакций затрудняется,
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
141
говорят, что реакции «замаскированы». Это связано с тем, что вещества в растворах могут образовывать достаточно прочные комплексы с одним или большим числом реагентов, в результате чего их обычные свойства не проявляются. Так, в присутствии избытка EDTA концентрация свободного иона металла становится зависимой от значения pH. Поэтому при тщательном контроле pH она может быть сведена к уровню, достаточно низкому, чтобы предотвратить многие обычные неорганические реакции. С другой стороны, если в результате реакции с каким-либо другим лигандом образуется достаточно прочный или нерастворимый комплекс, то EDTA не может помешать ей. Это справедливо, в частности, для иона Ag+, стереохимия которого такова, что взаимодействие с EDTA не приводит к образованию очень прочного комплекса.
При помощи EDTA Т1 (I) можно отделить от РЬ(П), так как свицец маскируется ею (log /Смь= 18,3 для РЬ и 6,47 для Т1), а таллий осаждается в виде очень мало растворимого ТП [62]. Подобным же образом в присутствии EDTA и ацетатного буферного раствора 8-оксихинолином количественно осаждаются только вольфрам, молибден и ванадий, в то время как 25 других элементов, осаждающихся в обычных условиях, остаются в растворе [63]. При тщательном контроле pH можно также осадить и некоторые другие оксинаты. Свинец можно отделить от Си, Zn, Cd, Со и Ni, маскируя эти элементы цианид-ионами и экстрагируя хлороформом комплекс свинца с диэтилдитиокарбаматом.
Слабые маскирующие агенты можно использовать для понижения концентрации веществ до уровня, при котором их можно применять в качестве реагентов. Так, фелингова жидкость представляет собой щелочный раствор меди(II), из которого медь не выпадает в виде гидроокиси, поскольку она замаскирована тарт-рат-ионом. Последний, однако, не понижает концентрацию свободных ионов Си2+ до такого уровня, ниже которого они не могут восстанавливаться до нерастворимой СигО восстановителями типа альдозных сахаров. Для этой же цели можно использовать и другие маскирующие агенты, например трифосфат-ион, а Си(II) можно заменить висмутом.
Все упомянутые до сих пор примеры относились к маскированию катионов, но этот же метод можно применять и по отношению к анионам. Так, цианид-ион маскируется при введении иона двухвалентной ртути, образуя недиссоциирующее соединение Hg(CN)a, а сульфит-ион не обнаруживает многих своих свойств в присутствии формальдегида (образуется продукт присоединения бисульфита к формальдегиду).
Одним из наиболее универсальных маскирующих агентов, как и можно ожидать исходя из природы его связей с металлами, осуществляющихся через анионные атомы кислорода, является
142
ГЛАВА 6
трифосфат натрия, NajPsOio- 6Н2О. Он образует растворимые комплексы со многими элементами, в том числе с Li, Be, Mg, Ca, Sr, Ba, Zn, Cd, Fe(II), Fe(III), Co, Ni, Mn, Cu, Pb, VO, Al, Y, In, La, Ce(III), Pr, Nd, Ag, Hg(I), TiO, Zr, Bi, Sn(II), Sn(IV), Th и UO2. Все эти элементы в присутствии трифосфата не осаждаются едкими щелочами, аммиаком, фосфатами, карбонатами или боратами. Подобно этому, маскируются реакции осаждения кальция фторидами, оксалатами, цитратами, тартратами и мезотартратами, образования окрашенных комплексов трехвалентного железа с салицилатами и сульфосалицилатами, осаждения свинца фторидами, хроматами, сульфатами и анионами алифатических кислот. Однако трифосфат натрия не может замаскировать осаждение сульфидов Zn, Hg, Pb и Си, поскольку эти элементы образуют с серой гораздо более прочные связи, чем с кислородом. Этот маскирующий реагент интересен и с биохимической точки зрения, так как имеет прямое отношение к аденозинтрифосфату, играющему жизненно важную роль при мышечных сокращениях и других физиологических процессах.
В реакциях маскирования большое значение имеют относительные концентрации и комплексообразующие способности реагента и маскирующего вещества по отношению к данному иону, а также произведение растворимости любого нерастворимого комплекса, который может образоваться. Так, чем менее растворим осадок, тем труднее найти маскирующий агент, способный предотвратить его образование. Тартрат-ион будет маскировать осаждение Fe(III) в виде Ре(ОН)з, но не в виде РегБз. Аммиак, образующий с ионами серебра комплексы Ag(NH3)+, способен замаскировать осаждение Ag+ хлорид-ионами, однако он не может препятствовать осаждению менее растворимых AgBr и Agl и, следовательно, его можно применять для обнаружения бромидов и иодидов в присутствии хлоридов. Использование маскирующих агентов дает возможность таким растворам служить «резервуарами» ионов или соединений, которые в противном случае были бы нерастворимы.
С количественной стороны маскирующий реагент можно рассматривать как вещество, уменьшающее концентрацию свободного металла или свободного лиганда, и, следовательно, понижающее кажущуюся прочность комплекса в данных экспериментальных условиях. Простейшим примером является предотвращение осаждения ионов Ni2+, Cu2+, Zn2+ и Cd2+ избытком аммиака или Мп2+, РЬ2+ и 1п3+ — тартратами и цитратами, что обсуждается в гл. 9. В присутствии избытка аммиака EDTA можно применять для оттитровывания кальция до того, как начнет титроваться медь, в то время как обычно элементы титруются в обратной последовательности. При спектрофотометрических определениях концентрация мешающего иона очень часто должна быть значи
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
143
JQ-7 ^М1ь)кажущаяся
тельно понижена, чтобы подавить его комплексообразование с реагентом, дающим окраску. В таких случаях требуется значительный маскирующий эффект. Сам маскирующий реагент при этом не должен образовывать комплексов, имеющих подобную окраску или заметно поглощающих в той области спектра, где выполняются определения. Такие ограничения отсутствуют в случаях реакций осаждения. Поэтому, например, при осаждении магния или бериллия фосфат-ионами для маскирования Fe(II) можно использовать 2,2'-дипиридил, 1,10—фенантролин или тио-гликолевую кислоту, хотя все эти реагенты образуют сильноок-рашенные комплексы. При комплексонометрических титрованиях с применением металлиндикаторов условия маскирования обычно гораздо менее строги, чем в случае спектрофотометрических методов. Приведенное в разд. 2 гл. 6 уравнение
'°2 СМкажущаяся ~ 'og Кмщ - '°g Км„ь + Рмп
можно связать с экспериментально найденным требованием, что в случае визуального титрования для удовлетворительного определения минимальное значение log Км L должно быть примерно равно 107. Это приводит к заключению [4], что ион металла Мц маскируется при условии
(Кмпь) кажущаяся (М )
4 7 J V П/кажущаяся
Некоторые примеры использования маскирующих агентов, не допускающих титрования определенных ионов EDTA, приведены в табл. 7. В табл. 8 указаны некоторые случаи использования в качестве маскирующего агента самой EDTA. Своим развитием метод комплексонометрического титрования во многом обязан разработке удачных реакций маскирования, так как сама по себе EDTA очень неизбирательна. Были опубликованы обзорные работы, посвященные применению маскирующего действия EDTA в качественном анализе [64—66].
В табл. 9 (которая основана главным образом на данных Ченга [65]) приведены полезные сведения о многих распространенных маскирующих агентах и катионах, для маскирования которых их применяют. Условия, в которых маскирующий реагент может быть успешно применен, зависят от ряда факторов. Следует отметить природу тех соединений, которые должны давать желаемую аналитическую реакцию (в отличие от реакции маскирования), концентрацию реагентов, а также значения pH раствора, присутствие в нем нескольких маскирующих веществ, природу растворителя, температуру, скорости реакций и возможность изменения окислительного состояния. Краткое теоретическое обсуждение количественных аспектов реакций маскирования и демаскирования было сделано в работе [65].
Таблица 7
Некоторые примеры маскирования катионов при титровании с помощью EDTA
Условия Реакция маскирования
I. Щелочные растворы Цианид-ион с Ag+, Cu+, Hg2+, Fe2+, Zn2+, Cd2+, Co2+, Ni2+ (позволяет определять в присутствии этих элементов Pb, Mn, In, Mg, Са, Sr, Ba)
2. pH 10 Фторид-ион с Al3+, Са2+, Mg2+, Ti4+ (Nb и Та), ионами редкоземельных элементов (можно титровать цинк, кадмий, никель и кобальт)
3. Щелочные растворы Триэтаноламин с Fe3+, А13+, Мп3+ (можно титровать кальций и никель с применением мурексида в качестве индикатора)
4. 2, З-Димеркаптопропанол с Hg2+, Cd2+, Zn2+, As3+, Sb3+, Sn2+, Pb2+, Bi3+ (можно титровать кальций, магний, марганец и иикель)
5. Тайрон с Al3+, Ti4+, Fe3+ (можно титровать щелочноземельные или редкоземельные элементы с эриохром черным Т)
6. Сульфосалициловая кислота с А1 и U (VI)
7. Ацетилацетон с Fe3+, Al3+, Ве2+, Pd2+ и UCV4 (можно титровать циик и свинец с применением в качестве индикатора ксиленолового оранжевого)
8. pH 5—6 1, 10-Фенантролии с Cd2+, Со2+, Cu2+, Ni2+, Мп2+ и Zn2+ (можно титровать свинец и алюминий)
9. Иодид с Hg2+
10. Аскорбиновая кислота с Fe3+, Cu2+
11. Кислые среды Тиосемикарбазид с Hg2+ (можно титровать висмут, кадмий, циик и свинец)
12. Сильнощелочные растворы Перекись водорода с Ti (IV)
Таблица 8
Некоторые примеры использования EDTA в качестве маскирующего агента
Маскируемые реакции
Применение
Fe, Со, Ni с диэтилдитиокарбаматом
Fe (III), V (V) с тайроном
Fe, Со, Си, Ni, Cr с 2-нитрозо-1-нафтолом
Pb, Hg, Bi, Си, Cd, As, Sb, Fe, Al, Cr, Be, U, Mo, W, Ce, Th, Ni, Co, Mn, Zn, Mg с оксалатом
Ag (I), Pb (II) с хроматом
Hg (I), Pb (II) с хлоридом
Bi (III), Pb (II) с иодидом (в кислой среде)
Т1 (I) с иодидом (аммиак)
Ni (II), Со (II), Mn (II) с сульфидом
Hg(II), Bi (III), Fe (III), Cr (III), Al (III), Mn (III) с аммиаком
Определение Си (экстракция органическими растворителями)
Определение Ti (IV)
Определение Pd
Определение Са
Осаждение хроматов Ва и Т1
Осаждение хлоридов Ag и Т1
Осаждение иодидов Ag и Т1
Осаждение иодида Ag
Осаждение сульфидов Zn (II) и
Fe (III)
Осаждение Sb (III), Sn (IV), Be (II), Ti (IV), UO2 (VI) в виде гидроокисей
Естественно, маскирование часто может быть нежелательным, например, коРда присутствие щавелевой кислоты ухудшает осаждение сульфида молибдена или образование фосфоромолибдата. При выполнении капельных проб иногда наблюдаются неожиданные реакции маскирования — ионы металлов, в том числе меди и золота, сильно сорбируются целлюлозой бумаги и обработка соответствующим реагентом не приводит к ожидаемому эффекту. С другой стороны, в присутствии винной кислоты как маскирующего агента и при тщательном контроле pH из раствора, содержащего вольфрам, можно выделить М0О3 или M.0S3 (W находится в подгруппе периодической таблицы ниже Мо, поэтому образует с тартратами более устойчивые комплексы и, следовательно, труднее осаждается). Учитывая природу иона металла, характер атомов лигандов, с которыми он предпочтительно участвует в комплексообразовании, и число связей металл—лиганд, которые может образовать данный ион, часто можно предсказать, насколько вероятны такого рода помехи. Так, маскирование реакции роданида с Fe(III)-ионами фторидом, фосфатом, ю д. Перрин
Таблица 9
Обычные маскирующие агенты
Элементы Маскирующие агенты для их ионов
Ag CN", NH3, S2O32", Вг", I-, С1_, тиогликолевая кислота
Al F", С2О42", ОАс", цитраты, тартраты, EDTA, ОН~, BAL, NTE, глюконаты, ацетилацетон, сульфосалицилаты
As Au S2", ОН-, BAL CN-, Вт-, S2O32-
В F-, оксикислоты, гликоли
Ba EDTA, цитраты, тартраты, NTA, DNG, SO42"
Be F", цитраты, тартраты
Bi Цитраты, тартраты, EDTA, I", CI-, NTA, DHG, тиомочевина, NTE, BAL, тиогликолевая кислота
Ca EDTA, цитраты, тартраты Р2О74", NTA, DHG, F~
Cd EDTA, CN", SgOs2-, SCN”, I", цитраты, тартраты NTA, DHG, уиитиол, тиогликолевая кислота
Ce F‘, NTA, EDTA, DHG, цитраты, тартраты, тайрон
Co NH3, NO2-, SCN", CN-, H2O2, S2O32-, NTA, EDTA, DHG, цитраты, тартраты, этилендиамин, BAL, tren, penten
Cr EDTA, NTA, цитраты, тартраты, NTE, аскорбиновая кислота
Cu NH3, I-, SCN-, CN", S2O32~, тиомочевииа, EDTA, S2~, DTC, DHG, BAL, цитраты, тартраты, NTATG, NTE, tren, penten, тиогликолевая кислота, цистеин •
Fe F~, PO43-, P2O74-, NTA, EDTA, DNG, DTC, цитраты, тартраты, BAL, SCN", S2O32", C2O42", CN", тайрои, ACB, тиомочевииа, phen, S2", TG, NTE, глюконат, сульфосалицилат, а, а'-дипи-ридил
Ge C2O42-, F-
Hf F", H2O2, SO42-, DHG, цитраты, тартраты, NTA, EDTA, P2O74-, PO43-, C2O42-, NTE
Hg I", SO32", CN", NTA, EDTA, DHG, Cl", цитраты, тартраты, NTE, tren, penten, унитиол, тиосемикарбазид, цистеин, тиогликолевая кислота
Ш Ir Тиогликолевая кислота SCN", цитраты, тартраты, тиомочевина
П родолжение
Элементы
Маскирующие агенты для их ионов
Mg NTA, DHG, EDTA, C2O42-, цитраты, тартраты, ОН-, Р2О74-гликоли, F-
Мп F-, С2О42-, Р2О74-, NTA, EDTA, DHG, цитраты, тартраты, BAL, NTE, окислители, CN-
Mo SCN-, С2О42-, Н2О2, цитраты, тартраты, EDTA, NTA, тайрон
Nb F-, ОН-, цитраты, тартраты, С2О42-, Н2О2, тайрон
Nl CN-, SCN-, NTA, EDTA, NH3, цитраты, тартраты, tren, penten
Os CN-, SCN-
Pb I-, OAc-, S2O32-, цитраты, тартраты, NTA, EDTA, DHG, SO42-, унитиол, BAL, тиогликолевая кислота
Pd CN-, I-, NH3, NO2-, SCN-, S2O32-, NTA, EDTA, DHG, цитраты, тартраты, NTE, ацетилацетон
Pt NH3, I-, CN-, NO2-, SCN-, S2O32-, NTA, EDTA, DHG, цитраты, тартраты
Rh Тиомочевина, цитраты, тартраты
Sb Цитраты, тартраты, BAL, I-, S2-, OH-, F-
Se Тартраты, цитраты, восстановители F-, I-
Sn Цитраты, тартраты, BAL, F-, I-, C2O42-, OH-, NTE, тиогликолевая кислота, PO43-
Sr SO42-, NTA, EDTA, DHG, цитраты, тартраты
Ta F-, ОН-, цитраты, тартраты
Th F-, NTE, NTA, OAc-, EDTA, DHG, цитраты, тартраты
Ti SO42-, ОН-, H2O2, F-, HTA, EDTA, цитраты, тартраты, тайрон, NTE, глюконат, сульфосалицилаты
Tl Cl-, CN-, NTA, EDTA, цитрат, тартрат, NTE, тиогликолевая
кислота
U F-, СО32-, С2О42-, Н2О2, цитраты, тартраты
V CN-, Н2О2, F-, EDTA, тайрои, NTE
W Тайрон, F-, SCN-, Н2О2, тартраты
Zn CN-, NTA, EDTA, DHG, цитраты, тартраты SCN-, BAL, OH-, NH3, гликоли, tren, penten, уиитиол, тиогликолевая кислота
Zr F-, SO42-, цитраты, тартраты, NTA, EDTA, DHG, H2O2, P2O74-, PO43-, C2O42-, NTE
10*
П родолжение
Элементы и анионы
Маскирующие агенты
СП Hg
CN- НСНО, переходные металлы, Hg
F" Н3ВО3, Al, Be, Zr, Hg, Ti, Nb, Ta, Fe
I- Hg
S S2- CN-, S2-, SO32-S
so3 Se и его анионы Hg2+, HCHO S2~, SO32“, диаминобензидин
Сокращения: BAL—2, З-димеркапто-1-пропанол; DTC — диэтилдитиокарбамат; DHG— N, Ы-ди(2-оксиэтил)глицин; NTA — нитрилотриуксусная кислота; NTE — 2, 2', 2"-нитрило-триэтанол (триэтаноламин); penten — тетрал«с(амииоэтил)этилендиамин; phen — 1, 10-фе-нантролин; TG — тиогликолевая кислота; tren — 2, 2', 2"-триаминотриэтиламин; АСВ— аскорбиновая кислота.
тартратом и цитратом находится в соответствии с предположе-ниями, так же как в свою очередь и неспособность фосфатов замаскировать образование растворимых трис-комплексов Fe(III) с 7-иод-8-оксихинолин-5-сульфокислотой.
Детально была изучена [4] интересная гипотетическая возможность применения 2, 2', 2"-триаминотриэтиламина в качестве маскирующего агента для комплексонометрического определения Cu2+, Ni2+, Fe2+, Мп2+ и Са2+ при совместном присутствии всех этих ионов. Определение осуществляют путем последовательного регулирования значения pH раствора.
9. «ДЕМАСКИРОВАНИЕ»
Реакции «демаскирования» также находят аналитическое применение. Так, кальций маскируется фторид-ионом, препятствующим экстракции в хлороформ его красного комплекса с глиок-саль-бис(2-оксианилом). Если ввести соль алюминия, то кальций «демаскируется» вследствие образования высокоустойчивого комплекса [AlFe]3-; в результате появляется комплекс кальция с глиоксаль-бис(2-оксианилом). Реакция предложена как специфическая проба на алюминий [67]. Осаждение четырехвалентного олова в виде SnSa можно замаскировать введением фторид-ионов, что приводит к образованию SnF2~. Но при добавлении борной
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
149
кислоты для связывания фторид-иона в комплексный анион BF~ олово демаскируется. Подобным же образом цветные реакции циркония и гафния с ксиленоловым оранжевым маскируются фторидами и демаскируются введением избытка бериллия или алюминия, в присутствии которых указанные цветные реакции идут легко. В щелочных растворах небольшой избыток EDTA маскирует кобальт(II) и он не реагирует с диэтилдитиокарбаматом. Добавление больших количеств кальция высвобождает кобальт, который получает возможность взаимодействовать с этим реагентом. В данном случае использование маскирования и демаскирования позволяет избирательно определять кобальт [68]. На этом же принципе основано предложение об использовании диэтилдитиокарбамата свинца в качестве специфического реагента на медь [69].
Реакция демаскирования, применяемая в качестве быстрой пробы на галогениды серебра, основана на их способности взаимодействовать с цианидом калия-никеля, K2Ni(CN)4, в результате чего образуются комплексные цианиды серебра. Высвобожденный никель реагирует затем в аммиачном растворе с диме-тилглиоксимом, давая нерастворимый красный комплекс. Точно таким же образом, как и Ag, реагируют Pd(II) и Hg(II) [70]. Аналогичная проба заключается в демаскировании двухвалентного железа, содержащегося в ферроцианид-ионе, под действием аммиачного раствора а, а'-дипиридила в качестве индикатора [71].
Все эти примеры относятся к демаскированию по механизму замещения. Другой возможный метод основан на регулировании pH среды в тех случаях, когда величина р/С лиганда соответствует легко доступной области pH. Так, при pH 7 EDTA маскирует осаждение бария в виде сульфата, но при pH 5 маскирования уже не происходит.
Демаскирование часто может быть результатом изменения окислительного состояния металла вследствие различий в константах устойчивости соответствующих комплексов с данным лигандом. В слабокислой среде медь(1) образует с ионом тиосульфата очень прочный комплекс. Тем самым тиосульфат маскирует реакцию меди (в виде Cu (II)) с PAN. С другой стороны, в щелочных растворах тиосульфат меди(1) легко окисляется до слабого комплекса тиосульфата с медью(II) и медь(II) может взаимодействовать с PAN.
В некоторых случаях маскирующий агент можно легко разрушить. Так, осаждение Ti(OH)4 в щелочных растворах маскируется перекисью водорода, но последняя разлагается и осаждение протекает нормально, если добавить восстановитель, например формальдегид, гексаметилентетрамин, сульфит- или нитрит-ионы. Подобным же образом Mo(VI) и W(VI) в кислых
150
ГЛАВА 6
растворах, содержащих перекись водорода, демаскируются формальдегидом. Цианидные комплексы кадмия и цинка типа Zn(CN)z_ можно селективно демаскировать в кислых растворах при помощи альдегидов (обычно формальдегида); при реакции образуются свободные ионы металлов и циангидрины. Перекиси можно разложить кипячением или добавлением Fe(III) в качестве катализатора. В крайнем случае лиганды типа EDTA можно разрушить обработкой сильными кислотами или применением сильных окислителей, таких, как перманганат или сульфат Се(IV) в кислых средах
Другим возможным путем демаскирования или удаления мешающих веществ является отгонка фторидов или цианидов в присутствии сильных кислот, хрома в виде хлористого хромила, мышьяка, германия, селена и олова в виде их галогенидов.
ЛИТЕРАТУРА
1. Бьеррум Я-, Образование амминов металлов в водном растворе. Теория обратимых ступенчатых реакций. ИЛ, М., 1961.
2. L е d е п I., Svensk Kem. Tidskr., 56, 31 (1944).
3. Schwarzenbach G., Complexometric Titrations, Interscience, New York, 1957.
4. Ringbom A., In Treatise on Analytical Chemistry, Kolthoff I. M., El-ving P. J., eds., Interscience, New York, 1959, Vol. 1, Part 1, Chapter 14.
5. Newman L., Hume D. N., J. Am. Chem. Soc., 79, 4571, 4581 (1957).
6. S i 1 1 e n L. G„ Acta Chem. Scand., 8, 299, 318 (1954).
7. Более подробное обсуждение см. в статье Роллинсона (Роллин-сон К. В. в ки. Химия координационных соединений, под ред. Бей-лара Дж., ИЛ, М., 1960, стр. 379); Pokras L., J. Chem. Ed., 33, 152, 223, 282 (1956).
8. Tanaka N., Koizumi R., Mur a у am a T., Kodama M., S a-k u m a Y., Anal. Chim. Acta, 18, 97 (1958).
9. Hamm R. E., Furse С. T., Anal. Chem., 34, 219 (1962).
10. Flaschka H., Taianta, 8, 381 (1961).
11. R i n g b о m A., Svensk Kem. Tidskr., 66, 159 (1954).
12. Обсуждение количественных измерений см. в работе [4].
13. Milner G. W. С., Woodhead J. L„ Analyst, 79, 363 (1954).
14. F 1 a s с h k а Н., Mikrochim. Acta, 39, 38 (1952).
15. Schwarzenbach G., Willi A., Helv. Chim. Acta, 34, 528 (1951).
16. L у de r sen D., Gjems O., Z. anal. Chem., 138, 249 (1953).
17. F r i t z J. S„ Anal. Chem., 26, 1978 (1954).
18. Wanninen E., Ringbom A., Anal. Chim. Acta, 12, 308 (1955).
19. Belcher R„ Close R. A., West T. S„ Chem. Ind., 1957, 1647.
20. Cab r er a A. M„ W es t T. S., Anal. Chem., 35, 311 (1963).
21. Belcher R., Close R. A., West T. S., Chemist-Analyst, 46, 86 (1957); H i I d e b r a n d G. P., R e i I I e у C. N., Anal. Chem., 29, 258 (1957).
22. Patton J., Reeder W, Anal. Chem., 28, 1026 (1956).
23. Lindstrom F., Diehl H., Anal. Chem., 32, 1123 (1960).
24. Belcher R., Close R. A., West T. S., Chemist-Analyst, 47, 2 (1958).
25. S u k V., M a 1 a t M., Jenickova A., Coll. Czech. Chem. Comm., 21, 418 (1956).
26. Weh ber P., Z. anal. Chem., 166, 186 (1959).
ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА КОНЦЕНТРАЦИЮ КАТИОНОВ
151
27. Бусев А. И., Канаев Н. А., Научные доклады высшей школы, Хим. и хим. техи., № 2, 299 (1959); СА, 53, 18747.
28. Р о 11 а г d F. Н., Hanson Р., Geary W. J., Anal. Chim. Acta, 20, 26 (1959).
29. S h i b a t a H., Anal. Chim. Acta, 22, 479 (1960).
30. Belcher R„ Leonard M. A., West T. S„ J. Chem. Soc., 1958, 2390.
31. Owens E. G„ Yoe J. H„ Anal. Chim. Acta, 23, 321 (1960).
32. Diehl H„ Ellingboe J. L„ Anal. Chem., 28, 882 (1956).
33. Korbl J„ Pfibil R„ Chem. listy. 51, 1804 (1957).
34. К б r b 1 J., P f i b i 1 R., Chemist-Analyst, 45, 102 (1956).
35. Wilkins D. H„ Taianta, 2, 12 (1959); Wil kind D. H„ Anal. Chim. Acta, 20, 324 (1959); Wil kind D. H„ Taianta, 4, 182 (I960).
36. Ree8 D. I„ Stephen W. I., J. Chem. Soc., 1961, 5101.
37. Kirkbright G. F., Stephen W. I., Anal. Chim. Acta, 28, 327 (1963).
38. К i r k b r i g h t G F., Rees D. I., Stephen W. I., Anal. Chim. Acta, 27, 558 (1962).
39. Dol^zal J., Patrovsky V., Sulcek Z., Seas t a J., Chem. listy, 49, 1517 (1955).
40. Fritz J. S„ Fields M. O, Anal. Chem., 26, 1206 (1954).
41. Banerjee G„ Z. anal. Chem., 146, 417; 147, 105 (1955).
42. В a n e r j e. e G, Z. anal. Chem., 148, 349 (1955).
43. t e r Haar К., В a z e n J., Anal. Chim. Acta, 9, 235 (1953).
44. C 1 о s e R. A., W e s t T. S„ Taianta, 5, 221 (1960).
45. Welcher F. J., The Analytical Uses of Etilenediamine Tetraacetic Acid, D. Vqn Nostrand Co., Princeton, 1958. Исчерпывающий перечень опубликованных методов титриметрического определения металлов приведен в книге: С h a b е г е k S., Martell А. Е., Organic Sequestering Agents, John Wiley and Sons, New York, 1959, pp. 282—292.
46. Schwarzenbach G., Kampitsch E., Steiner R., Helv. Chim. Acta, 29, 364 (1946); Schwarzenbach G., Biedermann W., Helv. Chim. Acta, 31, 456 (1948).
47. I r v i n g H., da Silva J. J. R. F., J. Chem. Soc., 1963, 448, 458.
48. Schwarzenbach G., Ackermann H., Helv. Chim. Acta, 31, 1029 (1948).
49. Courtney R. С., C h a b e г e к S., Martell A. E., cm. Martell A. E., Calvin M., Chemistry of the Metal Chelate Compounds, Prentice-Hall, New York, 1952, pp. 539, 560.
50. Schwarzenbach G„ Ackermann H., Helv. Chim. Acta, 32, 1682 (1949);, Schwarzenbach G., Gut R., Anderegg G., Helv. Chim. Acta, 37, 937 (1954).
51. Schwarzenbach G., Anderegg G., Sallman R., Helv. Chim. Acta, 35, 1785 (1952).
52. В a n к s С. V., Y er ick R. E„ Anal. Chim. Acta, 20, 301 (1959).
53. Schwarzenbach G., Senn H., Anderegg G., Helv. Chim. Acta, 40, 1886 (1957).
54. Pribil R., Roubal Z., Svatek W., Coll. Czech. Chem. Somm., 18, 43 (1953).
55. W e s t T. S., Recent Developments in Inorganic and Organic Analytical Chemistry, Royal Inst, of Chem. Lectures, Monographs and Reports, № 1, 1959, p. 13.
56. Anderegg G., Nageli P., Muller F., Schwarzenbach G., Helv. Chim. Acta, 42, 827 (1959).
57. См., Например, Flaschka H., Soli man H., Z. anal. Chem., 158, 254; 159, 3o (1957).
58. R e i 1 1 e у C. N., Sheldon M. V., Chemist-Analyst, 46, 59 (1957).
59. Reil ley C. N„ Sheldon M. V., Taianta, 1, 127 (1958).
60. Reil ley C. N„ Vavoulis A., Anal. Chem., 31, 243 (1959).
61. Jacobsen E., Schrader K., Anal. Chim. Acta, 27, 179 (1962).
152
ГЛАВА 6
62. Pfibil R., Coll. Czech. Chem. Comm., 16, 86 (1951).
63. Pfibil R., Sedlar V., Chem. listy, 44, 200 (1950); Coll. Czech. Chem. Soc., 16, 69 (1951).
64. Pfibil R., Coll. Czech. Chem. Comm., 16/17, 542 (1951).
65. C h e n g K. L., Anal. Chem., 33, 783 (1961).
66. Hoyle W., Sanderson I. P., West T. S., Anal. Chim. Acta, 26, 290 (1962).
67. Jungreis E., Lerner A., Anal. Chim. Acta, 25, 199 (1961).
68. Pfibil R., Jenik J., Coll. Czech. Chem. Comm., 19, 470 (1954).
69. A d a m i e с I., Rudy Metale Niezalazne, 5, 409 (I960).
70. U b b e 1 о h d e A. R., Analyst, 59, 339 (1934).
71. Feigl F., C aid as A., Anal. Chem. Acta, 3, 526 (1955).
ГЛ ABA 7
Поверхностные явления
Большая часть химических реакций протекает в гомогенных условиях, обычно в жидкой фазе. Тем не менее нельзя пренебрегать физическими и химическими процессами, осуществляющимися на поверхности. К таким процессам относятся созревание осадков, адсорбционные явления, ионный обмен и хроматографические методы разделения, а также капельные пробы на фильтровальной бумаге. Быстрый рост кристаллов в процессе осаждения может привести к возникновению большого числа дефектов кристаллической решетки; это облегчает захват тех примесей, которые не могли бы «поместиться» в нормальной кристаллической структуре. Выпадение объемистого осадка с большим отношением поверхности к объему также часто создает условия для захвата других веществ. В обоих случаях осадки со временем приобретают более упорядоченные структуры, что часто приводит к заметной их очистке.
Эти эффекты возникают вследствие того, что по своей природе поверхность вызывает нарушение непрерывности многих измеряемых свойств системы. В то время как молекула или ион в жидкой или твердой фазе подвергаются совокупности в среднем сферически симметричных воздействий со стороны других веществ, в случае нахождения их на поверхности этого уже не происходит. Такое изменение является следствием поверхностноэнергетических эффектов на любой границе раздела. Вот почему в суспензиях кристаллов, содержащихся в насыщенных растворах, небольшие кристаллы постепенно растворяются, а крупные растут за их счет. Важна также топография поверхности — в отношении смачивания ее растворителем, адсорбции веществ из раствора (включая химическое взаимодействие), предоставления активных мест для химических реакций. Кроме ионных и ковалентных связей, часть адсорбционных эффектов на твердых поверхностях может быть обусловлена силами Ван-дер-Ваальса, которые являются результатом взаимодействия наведенных диполей крупных молекул, если последние расположены рядом.
Детальное обсуждение взаимосвязи всех этих факторов выходит за рамки данной главы, однако необходимо помнить о возможности их влияния.
154
ГЛАВА 7
1. АДСОРБЦИОННЫЕ ИНДИКАТОРЫ
Применение этих индикаторов, которые являются или кислотными красителями (такими, как эозин, флуоресцеин или их производные), или основными красителями (например, родамин 6G), основано на довольно необычном типе комплексообразования. Характерный пример — постепенное добавление раствора нитрата серебра к раствору, содержащему хлорид-ион и небольшое количество флуоресцеина или какого-либо другого подходящего окрашенного аниона. В конечной точке титрования, когда раствор содержит небольшой избыток ионов серебра, флуоресцеин внезапно адсорбируется на поверхности осадка и коллоидной суспензии, где и меняет свою окраску. В процессе титрования происходит некоторая адсорбция хлорид-ионов на поверхности осадка AgCl, но как только из раствора удаляются все хлорид-ионы и ионы серебра оказываются в избытке, на поверхности этого осадка, наоборот, адсорбируются ионы серебра. Это в свою очередь приводит к немедленной ориентации анионов флуоресцеина, по-видимому, на другой стороне двойного слоя, причем поверхность ведет себя как заряженная ионная решетка.
Другое объяснение заключается в допущении ситуации, обсуждавшейся в гл. 6 на примере двухвалентной ртути и дифенил-карбазона. Комплекс серебра с флуоресцеином не может образоваться, пока конкурирующие с индикатором хлорид-ионы преобладают в растворе и на поверхности осадка. Сразу же после достижения точки эквивалентности комплекс серебра образуется и адсорбируется на поверхности осадка [2]. В пользу такой интерпретации говорит то обстоятельство, что индикатор не должен слишком сильно адсорбироваться на осадке. В противном случае конечная точка фиксируется раньше, чем достигнута точка эквивалентности. [Примером может быть применение эозина (тетрабромфлуоресцеина) при титровании хлорид-иона.]
Возможно, что в некоторых случаях правильнее будет представлять себе этот процесс следующим образом: ионы серебра внедрены в поверхность осадка, но вокруг еще имеются места, доступные для дальнейшего координирования лигандов. Пока ионы галогенидов присутствуют в растворе в значительных количествах, такими лигандами будут именно они. Индикатор не может успешно с ними конкурировать. Дальнейшее добавление ионов серебра в процессе титрования будет в свою очередь приводить к связыванию их ионами галоидов, находящимися на поверхности. Поэтому будет происходить постоянное увеличение размера твердых частиц галогенида серебра. Этот процесс закончится только тогда, когда прекратится снабжение галогенид-ионами, после чего на поверхности может образоваться комплекс серебра с индикатором. Наоборот, при титровании серебра
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
155
ионами галогенидов или роданидом этот комплекс может существовать лишь постольку, поскольку ион серебра находится в избытке. В конечной точке этот комплекс диссоциирует и поверхность приобретает отрицательный заряд, поэтому, если адсорбционный индикатор может образовывать катион, последний будет теперь адсорбирован на поверхности. Примером такого индикатора является п-этоксихризоидин [3]. Подобным же образом при титровании серебра бромид-ионами в присутствии родамина 6G конечную точку определяют по сильной адсорбции красителя на осадке. Аналогично можно использовать тартразин при титровании нитрата серебра хлорид-ионами.
Другими типичными примерами являются титрование циа-нид-иона раствором нитрата серебра с использованием в качестве адсорбционного индикатора дифенилкарбазона и титрование бро-мид-иона перхлоратом одновалентной ртути в почти нейтральном растворе в присутствии бромфенолового синего; в этом случае образуется осадок, изменяющий свою окраску в конечной точке от желтоватой до лиловой.
В большинстве случаев при титровании с применением адсорбционных индикаторов необходимо учитывать заряд индикатора. Так, если комплексообразующим веществом является анион, как это обычно и бывает, то следует работать при значениях pH, близких к числовому значению рКа индикатора или более высоких (например, в случае флуоресцеина р/Са-~8 и желаемая область pH 7—10).
Интересно применение феносафранина. При титровании хлорид- и бромид-ионов нитратом серебра осадок, так же как и сам раствор, имеет красный цвет. Однако в конечной точке он резко меняет свою окраску на лиловую (в случае хлорид-иона) или синюю (в случае бромид-иона). Этот индикатор можно применять также и в методах обратного титрования. В таком случае переход окраски в конечной точке противоположный — от лиловой или синей к красной.
Выполняя два титрования, иногда можно анализировать смеси галогенидов. К таким методам относятся применение дихлортет-раиодфлуоресцеина и флуоресцеина в анализе смеси хлорид — иодид, а также эозина (или флуоресцеина) и дииоддиметилфлуо-ресцеина в случае смеси бромид—иодид.
В табл. 1 приведены некоторые адсорбционные индикаторы и указаны реакции, для которых их используют. Во всех случаях при титровании образуется мало растворимая соль; она менее растворима, чем комплекс, образованный индикатором и осадителем. Кроме того, осадок сильно адсорбирует катионы и анионы, из которых он образован. Для повышения чувствительности метода осаждение следует выполнять в условиях, близких к образованию коллоидов, с тем чтобы получить высокое отношение
Таблица 1
Некоторые реакции адсорбционных индикаторов
Индикатор Ион Титрант
Ализариновый красный S 1 Fe(CN)^~, МоО4- Pb(NO3)2
2 F- Th(NO3)4
Бромфеноловый синий 3’4 SCN-, Ci-, Вг-. 1- AgNO3
1, 5 Вт- Hg2(NO3)2
4 Ag+ и Т1+ Г
6 Hgi+ CNS-, СГ
или Br—
Хромотроп F4B7 ВГ и I- AgNO3
Конго красный8 SCN-, СГ, Вг-, 1“ AgNO3
Дибром (R) флуоресцеин9 НРО|~ Pb(OAc)2
Дихлор (R) флуоресцеин 8’10-14 Ci~, Вг-, Г AgNO3
15 во2- Pb(OAc)2
Дифеиилкарбазон 15-17 CN-, ВГ, SCN” AgNO3
Меркурохром 18 СГ и SCN- AgNO3
Феносафраиии 13>19 СГ и Вг- AgNO3
Ag+ В Г
Родамин 6G20 Ag+ в г
Солохромовый красный В21 Мо7о|4~ и Fe(CN)g~ Pb2+
Тартразин 5-19>20 Ag+ SCN-, галогениды
Тетра хлорофлуор есцеии Cl и Вг- Ag+
Бриллиантовый желтый 22> 23 Вг-, Г, SCN- Ag+
Бромкрезоловый пурпурный10 SCN- Ag+
Бромтимоловый синий24 SCN- Ag+
Эозин 12’13’ 25>28 Вг-, I-, SCN- Ag+
Флуоресцеин26 Галогениды, SCN- Ag+
и Fe(CN)g—
27 SO^‘ Ba(OH)2
27, 28 Оксалаты Pb(OAc)2
Дииод (R) днметил (R) флуо- Г Ag+
ресцеии
П родолжение
Индикатор Ион Тнтрант
Дибром (R) флуоресцеин 10 SCN-, СГ, ВГ и Г Ag+
Диметил (R) флуоресцеин СГ Ag+
Бенгальская роза Г Ag+
Бриллиантовый арчил С ВГ, Г AgNO3
Ag+ В Г
Дифеииламииовый синий 31 СГ, вг AgNO3
п-Этоксихризоидии I. 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 Г, CNS- AgNO3
30 Ag+ Г
I. Burstein R., Z. anorg. Chem., 164, 219 (1927); 168, 327 (1927).
2. W i 1 1 а г d Н. Н., Winter О. В., Ind. Eng. Chem. (Anal. Ed.), S, 7 (1933).
3. Kolthoff I. M„ Z. anal. Chem., 70, 395 (1927); 71, 235 (1927).
4. M e h г о t r a R. C„ Anal. Chim, Acta, 3, 73, 78 (1949).
5. Z о m b о г у L., von, Z. anorg. Chem., 184 , 237 (1929); 215, 235 (1933).
6. В u r r i 1 1 F., Jimeno S. A., Anales Real Soc. Espan, Fis. Quim. (Madrid), 50B, 185 (1954).
7. В e 1 1 a d e n L., Piazza G., Ann. Chim. Applicata, 22, 631 (1932).
8. Mehrotra R. C., Anal. Chim. Acta, 2, 36 (1948).
9. Wellings A. W., Analyst, 60, 316 (1935).
10. Mehrotra R. C., Anal. Chim. Acta, 4, 38 (1950).
11. Kolthoff I. M„ Lauer W. M„ S u n d e C. J., J. Am. Chem. Soc., 51, 3273 (1929).
12. H б 1 s c h e r F., Anal. Chim. Acta, 3, 69 (1949).
13. Sanchez-Pedreno-Martinez D. M. de la C., Anales Univ. Murcia, 15, 41 (1956—1957).
14. D u с к 1 e i t e r L., liver D., Dansk. Tidsskr. Farm. Suppl., 2, 69 (1956).
15. W e 1 1 i n g s A. W., Analyst, 58, 331 (1933).
16. Matsuo T., J. Chem. Soc. Japan, Ind. Chem. Sect., 56, 483 (1953).
17. G e n t г у С. H. R., Sherrington L. G., Analyst, 70, 460 (1945).
18. A i r a n J. w„ Ghat age N. D„ San de 11 E. B., Current Sci. (India), 16, 343 (1947).
19. В e г г у A. G., D u r r a n t P. T., Analyst, 55, 613 (1930).
20. F a j a n s K., Die Chem. Anal., 33, 161 (1935).
21. Holaess H., Analyst, 69, 145 (1944).
22. В о g u e r J., Veres koi J., Acta Chim. Acad. Sci., Hung., 5, 91 (1954).
23. Oliveira Medit s ch J. de, Eng. Quim. (Rio de Janeiro), 8, № 3, 1 (1956).
24. M e h г о t r a R. C., Z. anal. Chem., 130, 390 (1950).
25. Kolthoff I. M„ Sandell E. B., Quantitative Inorganic Analysis, MacMillan, London, 1938, 453, 542.
26. К о I t h о f f I. M., van Berk L. H,, Z. anal. Chem., 70, 369 (1927).
27. w e 1 1 i n g s A. W„ Trans. Faraday Soc., 28, 565, 665 (1932).
28. M e h г о t r a R. C., Anal. Chim. Acta, 3, 69 (1949).
29. S c h u 1 к e E., Rozsa P., Z. anal. Chem., 115, 185 (1958).
30. S c h u I к e E., Pungor E., Anal. Chim. Acta, 4, 109 (1950).
31. Lang R„ Messinger J., Вег., B63, 1429 (1930).
158
ГЛАВА 7
поверхности осадка к его весу. Для уменьшения тенденции осадка к коагуляции следует поддерживать как можно меньшую ионную силу раствора. Это особенно важно, если присутствуют многозарядные «инертные» ионы.
Применение pH-индикаторов конго красного, бромкрезолового пурпурного и бромтимолового синего в качестве адсорбционных индикаторов почти в нейтральной области основано на том, что эти красители продолжают вести себя как рН-индика-торы, но их константы кислотной диссоциации при адсорбции на поверхности осадка галогенида серебра изменяются [4].
На примере многочисленных производных флуоресцеина XLIX, применяемых в качестве адсорбционных индикаторов особенно при аргентометрическом титровании галогенидов, видно,
как свойства реагента, в данном случае окраску, величину рА'а и растворимость серебряной соли, можно изменять для улучшения его аналитических свойств. В табл. 1 приведено восемь наиболее часто применяемых индикаторов этой группы. При введении в резорциновое ядро атомов галогенов понижается растворимость серебряной соли и повышается сорбируемость красителя на осадке. Поэтому при обычном аргентометрическом титровании С1_, Вг и I- применяют флуоресцеин, а не его тетраиод(И)-производное (эритрозин В). Однако эта увеличенная адсорбируемость эритрозина В дает ему преимущества при работе в присутствии заметных количеств «инертных» электролитов. Так, он является подходящим индикатором для титрования в таких условиях иодид-иона ионами серебра, так как его свойства компенсируют возросшую склонность золя Agl к коагуляции [5]. Эозин также слишком сильно адсорбируется, чтобы быть хорошим индикатором при титровании хлорид-иона, но он вполне пригоден при определении бромид- и иодид-ионов. Вследствие того что краситель адсорбируется в виде фенолят-иона, желательно работать при значениях pH среды, близких к числовому значению р/Са индикаторов или при более высоких pH. Введение в резорциновое ядро атомов галогенов повышает кислотность этих красителей. Поэтому применение флуоресцеина при pH ниже 7 не может при
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
159
вести к хорошим результатам, но дибром (R) флуоресцеин пригоден при pH 4, а тетрабром (R) флуоресцеин (эозин) можно применять вплоть до pH 1. Растворимость уменьшается по ряду: незамещенный реагент > Cl > Br > I. С другой стороны, введение атомов галогенов повышает чувствительность определения конечной точки в ряду тетра-1 > ди-1 > тетра-Br > ди-Br > ди-С1 > > незамещенный реагент. При введении галогенов во фталеиновое ядро эти эффекты несколько уменьшаются.
Как и можно было ожидать исходя из природы титрования с применением адсорбционных индикаторов, в конечной точке часто наблюдается заметное изменение флуоресценции.
2. ИОННЫЙ ОБМЕН
Ионообменная смола представляет собой частицы, состоящие из эластичной углеводородной сетки, к которой присоединено множество ионизирующихся групп (обычно все эти группы одного типа). Смола нерастворима в воде и органических растворителях, хотя и может набухать в них. Благодаря наличию активных групп эти смолы могут обменивать ионы, находящиеся на их поверхности в качестве противоионов, на другие ионы, содержащиеся в растворе. Этот процесс известен уже много лет. Природные и синтетические цеолиты широко применяют для умягчения воды вследствие их способности извлекать ионы кальция и магния из жесткой воды и заменять их на ионы натрия. Эластические свойства смол позволяют им противостоять внутренним силам, возникающим вследствие осмотического давления гидратированных ионов, которое является результатом равновесия типа Гиббса—Доннана между внутренними частями зерен смолы и наружным раствором. Свободная энергия реакции обмена определяет изменение объема смолы. Поэтому степень сшивания смолы (чисто поперечных связей) непосредственно влияет на эффективность ее как ионообменника [6].
Ионообменные смолы можно подразделить на две основные группы, а именно на катионообменники и анионообменники. Ка-тионообменники можно далее разделить на сильнокислотные, в которых функциональной группой является анион сульфокислоты, и слабокислотные, содержащие карбоксильные и, возможно, фенольные группы. Сильноосновные анионообменники содержат четвертичные аммониевые группы, а в слабоосновных функциональными группами обычно служат простые аминогруппы. Смола обычно является в той или иной степени сшитой полистирольной матрицей.
В разбавленных растворах сильнокислотные катионообменники в соответствии с простой электростатической теорией
160
ГЛАВА 7
предпочтительно связывают многозарядные ионы. Обычно наблюдается следующий порядок сорбируемости:
Th4+ (в виде NO3) > Fe3+> А13+> Ва2+> Pb2+> Sr2+>Ca2+>
> Со2+ > Ni2+ Cu2+ > Zn2+ Mg2+ > UO^+ (в виде NO3) л? й^Мп2+> Ag+ > Tl+> Cs+> Ве2+ (в виде SO4) да да Rb+ > Cd2+ > NH+ K+ > Na+ > H+ > L1+ > Hg2+.
Относительно далекое расположение в этом ряду Be, Cd и Hg объясняется неполнотой диссоциации их солей. В случае щелочных и щелочноземельных металлов большая адсорбция ионов с большим радиусом, вероятно, обусловлена тем, что ионы малых радиусов сильнее гидратированы, так что последовательность радиусов гидратированных ионов может отличаться от последовательности кристаллографических радиусов. Уменьшение содержания воды в растворе, например, путем добавления этилового спирта, приводит к тому, что поведение Cs и Na становится близким. С другой стороны, сорбция редкоземельных ионов изменяется в ожидаемом направлении: небольшие ионы удерживаются смолой сильнее, чем крупные. Чем более разбавлен раствор, тем избирательнее становится ионообменник. И наоборот, высокозаряженные ионы можно сравнительно легко вытеснить из смолы, пропуская через нее концентрированные растворы веществ, удерживаемых смолой менее прочно. Слабокислотные ка-тионообменники ведут себя подобно нерастворимым слабым кислотам. Если использовать их собственную буферную емкость, то можно выполнять ионообменный процесс при контролируемом значении pH. Эти смолы обладают высоким сродством к ионам водорода, поэтому порядок адсорбции имеет вид
Н+ > Са2+ > Mg2+ > Na+.
Отмечено, что в случае сильноосновных анионообменников порядок сорбции следующий [7]: SO2-> СгО2-цитраты > > тартраты > NO~ AsO^" > РО3- > МоО2- > ацетаты = = 1_=Вг~ > Cl- > F-. Слабоосновные смолы, имеющие высокое сродство к ионам гидроксила, можно применять только в кислых или нейтральных средах.
В присутствии комплексообразующих веществ распределение ионов двух металлов между их комплексами и ионообменными смолами будет определяться только коэффициентами их распределения (между раствором и смолой) и константами устойчивости комплексов металл—лиганд [8].
Технические детали приготовления и применения ионообменных смол описаны в ряде книг [9].
К трем основным типам ионообменного (и хроматографиче-
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
161
скоро) разделения относятся методы замещения, элюирования и избирательного замещения. Последний из этих процессов заключается в использовании подходящего комплексообразующего реагента для вымывания одного иона металла из смеси адсорбированных на колонке ионов. При pH 1 цитраты вымывают Мо, но оставляют Fe, Cr, Ni, а при pH 5,6 они вымывают РЬ, оставляя Ва. Подобным же образом при pH 0,6 EDTA вымывает Ti и Fe, оставляя Zr, а при pH 2,1 отделяет Th от редкоземельных элементов. В избирательном замещении такого рода существенным фактором является буферирование раствора с целью сохранения постоянного значения pH.
К некоторым наиболее очевидным приложениям ионного обмена для решения задач аналитической химии относятся замещение в растворе данных ионов ионами, лежащими правее их в ряду сорбируемости, или же ионами водорода, а также определение следовых количеств компонентов и разделение ионов с близкими свойствами. К перечисленным задачам примыкают: приготовление раствора гидроокиси натрия, свободного от карбонатов, пропусканием его через колонку, заполненную сильноосновным анионообменником в форме свободного основания, и стандартизация растворов чистых солей пропусканием их аликвотной части через сильнокислотный катионообменник в форме свободной кислоты с последующим алкалиметрическим титрованием элюата.
Комплексообразующие агенты можно использовать для отделения ионов переходных металлов от ионов щелочных и щелочноземельных металлов. Так, железо, никель и кобальт можно замаскировать добавлением избытка цианид-ионов. Таким же образом, добавляя перед ионообменным процессом этилендиамин-тетрауксусную кислоту, можно отделить щелочные металлы от щелочноземельных. Анионообменные смолы могут адсорбировать комплексные ионы типа FeCl~ и ZnCl?-,. но не катионы типа Mg2+; комплексы затем вымывают разбавленной кислотой. Применяя 9 М соляную кислоту, кобальт в виде СоС1~ можно легко отделить от никеля, который не сорбируется [10].
Ионообменные колонки можно использовать для хроматографического разделения ионов с близкими свойствами. Их применяли для промышленного разделения редкоземельных элементов [11] с использованием смол в Cu(I)- и Fe(III)-форме. Редкоземельные элементы пропускали через такие колонки в виде их комплексов с EDTA. Комплексы EDTA с Cu(I) и Fe(III) более устойчивы, поэтому наблюдается преимущественное поглощение катионов редкоземельных элементов, которые затем последовательно вымываются раствором лимонной кислоты [12]. Для этой же цели применяли и другие комплексообразующие реагенты
11 Д. Перрии
162
ГЛАВА 7
[13]. Аналогичным способом были разделены смеси трансурановых элементов [14]. Много примеров разделения неорганических веществ описано в работе [15]. Другое достоинство ионообменных смол заключается в легкости, с которой можно удалить из раствора анионы, мешающие определению металла, и наоборот.
Сравнительно недавно были предприняты попытки создать ионообменные смолы более избирательного действия. Комплексообразующая (хелатная) смола дауэкс А-1 содержит иминоди-ацетатные группы, сообщающие ей высокое сродство к катионам тяжелых металлов. Смола с функциональными группами типа ди-пикриламина (образующего умеренно растворимую калиевую соль) имеет более высокое сродство к калию, нежели другие ионообменные смолы [16]. Карбоксилатная смола, содержащая группы гидроксамовой кислоты, селективно поглощает ионы трехвалентного железа [17], а если в полистирольную смолу ввести группы 8-оксихинолина, то будут сильно адсорбироваться Си, Ni и Со [18]. Если в качестве комплексообразующих групп в смоле имеются аминокислоты, то сродство таких смол к ионам двухвалентных металлов подчиняется правилу Ирвинга—Уилльямса [19]. Применение хелатных смол ограничивается тем, что при использовании слабокислотных группировок скорость обмена невелика. Ионообменные смолы можно использовать также в качестве коллекторов (особенно при выполнении капельных реакций), встряхивая большой объем очень разбавленного раствора определяемого иона с небольшим количеством смолы, взятой в соответствующей форме [20].
Анионообменные смолы были использованы для разделения смесей орто-, пиро-, три-, тримета- и тетраметафосфатов [21], а также смесей фторидов, хлоридов, бромидов и иодидов [22]. Применяя сильнокислотную катионообменную смолу в форме ее серебряной соли, можно осуществить селективное извлечение хлорид-ионов [23]. Этот метод аналогичен, например, использованию анионообменной смолы в оксалатной форме для выделения стронция, но не цезия, а в гидроксильной форме — для выделения циркония и ниобия с оставлением цезия и стронция в растворе.
3. ХРОМАТОГРАФИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ [23а]
Комплексообразование имеет большое значение при разделении неорганических веществ методом адсорбционной хроматографии. Хроматография на целлюлозе (в том числе на фильтровальной бумаге) представляет собой по существу экстракционный процесс, в котором водная фаза удерживается целлюлозой и вещества распределяются между этой неподвижной фазой и подвижным органическим растворителем. Типичными примерами
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
163
являются хлоридные комплексы, которые образуются ионами Cu2+, Bi3+, Zn2+, Cd2+, Hg2+ и Fe3+ в соляной кислоте и затем растворяются в кислородсодержащих растворителях *. Этот процесс аналогичен адсорбции этих металлов анионообменными смолами из солянокислых растворов. Аналогия становится еще ближе при использовании колонки с модифицированной целлюлозой и применении бумаги, содержащей введенные диэтиламиноэтильные, карбоксильные и фосфатные группы. Подобно этому, ионы металлов разделяли на бумажных хроматограммах с использованием в качестве растворителя системы бутанол — HCNS [24]. Соединения Fe(III), Co(II), Cu(I), Cd(II), Hg(II) и Ag(I) перемещаются вместе с фронтом растворителя, a Ni(II), Сг(Ш), As(III) и РЬ(П) разделяются. Наоборот, при пропитывании колонки, заполненной целлюлозой или силикагелем, раствором дитизона в четыреххлористом углероде образуется неподвижная органическая фаза. Пропускание через такую колонку водных растворов приводит к избирательному извлечению из него следов Zn, Cd, Pb, Мп, Со и Си, которые затем можно последовательно выделить, вымывая их раствором минеральной кислоты или аммиака (который связывает Со и Си) [25].
Абсорбционные свойства фильтровальной бумаги приводят к некоторым эффектам, таким, как зонное обогащение и локализация различных веществ. Это весьма важно при выполнении капельного анализа, так как часто позволяет повысить его чувствительность.
Если разделенные бумажной хроматографией вещества имеют недостаточно интенсивную окраску, то после разделения необходимо обработать бумагу подходящим реагентом. Реагент должен быть неспецифичным, чтобы определить положение всех катионов. Для определения многих тяжелых металлов полезным приемом является выдерживание образца над раствором аммиака с последующим пропусканием газообразного H2S. Иногда для обрызгивания бумаги с последующим исследованием ее в ультрафиолетовом свете используют несколько реагентов «широкого спектра действия». К ним относятся о-аминобензойная кислота, 8-оксихинолин, койевая кислота, морин и нафтионовая кислота. Для обнаружения отдельных катионов применимы обычные капельные методы. Значения R, многих катионов в различных растворителях и в присутствии разных комплексообразующих смесей, а также детали разделения металлов на различные группы приведены в работе [27].
Колонки, загруженные 8-оксихинолином (или смесью его с кизельгуром), позволяют разделить ионы в следующем порядке: VO~, WO2“, Cu2+, Bi3+, Ni2+, Co2+, Zn2+, Fe3+, UO2+. Зоны
* Для меди это не характерно. — Прим. ред. И*
164
ГЛАВА 7
легко идентифицируются по их окраске [28], и чувствительность метода довольно высока (до 2 мкг для Fe3+). Аналогичным способом для разделения щелочных и щелочноземельных металлов, в том числе пар Na-K, K-Mg, Ва-Са и Sr-Ca, а также ионов Си2+, Hg2+ и РЬ2+, была применена виолуровая кислота [29]. Натрий и калий были полуколичественно разделены на колонках, заполненных 5-оксо-4-оксимино-3-фенилизоксазолом [30]. Для разделения Fe, Си, Ni и Со были использованы смеси нафтохинолина или купферрона с картофельным крахмалом [31].
Пропускание раствора через колонки, заполненные специфическими реагентами, или выполнение капельной пробы на бумаге, пропитанной такими реагентами, дает возможность — в результате образования локальных, хорошо фиксируемых зон— обнаруживать весьма небольшие количества элементов часто в присутствии большого избытка других веществ [32].
Для выделения металлов в виде их комплексов, например Bi, As, Sb и Sn в виде тартратов [33] и Со в виде комплекса с нит-розо-И-солью [34], можно использовать неорганические сорбенты типа окиси алюминия. Вероятно, реагент адсорбируется на окиси алюминия, и поэтому она обнаруживает свойства, существенно напоминающие свойства вышеописанных колонок, заполненных чистыми реагентами, хотя вследствие гидролиза на поверхности окиси алюминия могут адсорбироваться и сами ионы металлов.
Использование водных растворов не обязательно. Комплексы многих металлов с дитизоном адсорбируются из растворов в хлороформе или четыреххлористом углероде и вымываются ацетоном [35]. Комплексы Со, Fe, Ni и Си с а-нитрозо-р-нафтолом также можно адсорбировать на окиси алюминия из растворов их в хлороформе [36].
Для определения неорганических анионов, разделенных бумажной хроматографией, органические реагенты применяли мало. Можно назвать определение нитрат-иона в концентрированной серной кислоте при помощи дифениламина, фторида при помощи цирконийализаринового лака, флуоресцентный метод определения хлорид- и бромид-ионов с использованием флуоресцеина и нитрата серебра, применение дифенилкарбазида для определения хроматов и бихроматов, куркумы — для определения боратов и бруцина —для определения броматов, нитратов и хлоратов. Была описана схема анализа обычных анионов с применением бумажной хроматографии [37].
В особых случаях для микроопределений неорганических веществ можно применять метод кольцевой бани [38]. Он был, например, использован при определении бериллия с эриохромциа-нином R [39].
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
165
4. ПОЛЯРОГРАФИЯ КОМПЛЕКСОВ МЕТАЛЛОВ
Основной принцип этого метода заключается в применении равномерно увеличивающейся разности потенциалов между двумя погруженными в раствор электродами (один из которых обычно является ртутным капельным электродом) для получения характеристической кривой «ток—напряжение» [40]. При условии, что электродный процесс термодинамически обратим, потенциал в средней точке каждой волны указанной кривой (потенциал полуволны Et/ ) является характеристикой данной ионной формы, а высота волны служит мерой концентрации этой формы. Потенциал полуволны есть потенциал восстановления, и он меняется в присутствии комплексообразующих веществ. Он может также зависеть от величины pH. Сдвиг потенциала полуволны реакции
Ма+ + ае + Hg zz М (Hg) вследствие комплексообразования
Ma+ + «x6~ zz mx^~6/!)+ определяется уравнением
. 0,0591 , „ , 0,0591л ъ
(Еч\ - (£*/2)2= 10g • + 10g [X 1-
где 0 — константа устойчивости комплекса.
Именно этот сдвигЕ,^ при комплексообразовании позволяет преодолеть мешающее влияние одного металла по отношению к другому, обеспечив достаточное различие их свойств. Так, в присутствии избытка цианид-ионов Си(II) превращается в ион купроцианида, что дает возможность полярографически определять в сплавах на основе меди такие металлы, как свинец и никель, без предварительного химического отделения их. Подобным же образом при добавлении 1, 2-диаминоциклогексан-N, N, N', N'-тетрауксусной кислоты можно определять Cu(II) и Bi (III) в присутствии Pb(II), Cd(II) и Zn (II), а Т1 (I) —на фоне РЬ(П) [41], в то время как в отсутствие комплексообразующих веществ соответствующие волны перекрываются.
Комплексообразование часто приводит к заметному улучшению формы плохо идентифицируемых необратимых волн и предотвращает выпадение осадка в требующихся экспериментальных условиях.
С другой стороны, данные, полученные полярографическим методом, можно использовать для выяснения природы и свойств комплексных ионов, в частности их строения, устойчивости и реакционной способности.
166
ГЛАВА 7
ЛИТЕРАТУРА
1. Краткий обзор см. в книге: В. D. Н. Adsorption Indicators, 3rd ed., The British Drug Houses, Poole, England, 1961.
2. К о 11 h о f f I. M., Chem. Rev., 16, 87 (1935).
3. T a n d о n K. N., Mehr о tr a R. C., Anal. Chim. Acta, 27, 15 (1962).
4. Schulek E., Pungor E., Anal. Chim, Acta, 4, 109, 213 (1950).
5. Рудеико H. П., ЖРФХ0, 62, 505 (1930).
6. Reichenberg D., Papper K. W., McCauley D. J., J. Chem. Soc., 1951, 493.
7. Kun in R., Myers R. J., J. Am. Chem. Soc., 69, 2874 (1947).
8. Ketelle В. H., Boyd G. E., J. Am. Chem. Soc., 69, 2800 (1947).
9. Kunin R., Ion Echange Resins, 2nd ed., John Wiley and Sons, New York, 1958; Samuelson O., Ion Exchangers in Analytical Chemistry, John Wiley and Sons, New York, 1953; Kitchener J. A., Ion Exchange Resins, John Wiley and Sons, New York, 1958; Dowex: Ion Exchange, the Dow Chemical Co., Midland, Mich. 1959; Ion Exchange Resins, 4th ed., The British Drug Houses, Poole, England, 1959.
10. Типичные примеры приведены в работах: Kraus К. A., Nelson F., „Anion Exchange Studies of the Fission Products", Proc. Int. Conf, on Peaceful Uses of At. Energy, Geneva, 1955, Vol. 7, pp. 113, 131 (1956); Kraus K. A., Nelson F„ “Metal Separations by Anion Exchange", Symposium on Ion Exchange and Chromatography in Analytical Chemistry, 1956; ASTM Spec. Tech. Publ. № 195 (1958).
11. Sped ding F. H., Discussions Faraday Soc., 7, 14 (1949).
12. S p e d d i n g F. H., Powell J. E., W h e e 1 w t i g h t E. J., J. Am. Chem. Soc., 76, 612, 2557 (1954).
13. V i c k e г у R. C., J. Chem. Soc., 1952, 4357.
14. W e r n e r L. B., Perlmann I., „The Preparation and Isolation of Cm“, U. S. Atomic Energy Comm. AECD, № 1898; Thompson S. G., James R. A., Morgan L. O., „The Tracer Chemistry of Am and Cm“, U. S. Atomic Energy Comm. AECD, № 1907; Street K„ S e a b о r g G. T., J. Am. Chem. Soc., 72, 2790 (1950).
15. Lederer E., Lederer M., Chromatography, Elsevier Publishing, Amsterdam, 1954, Chapter 38.
16. W о e r m a n n D„ В о n h о e f f e r K. F., H e 1 f f e r i c h F., Z. Phys. Chem. (Frankfurt), 8, 265 (1956); Skogsei d A., Dissertation, Oslo, 1948.
17. Corn az J. P., Deuel H., Experientia, 10, 137 (1954).
18. Parrish J. R., Chem. Ind., 1956, 137.
19. Hale K., Research (London), 9, 104 (1956).
20. См., например, «капельную пробу на ионите» (resin spot test), предложенную в работе Fujimoto К., Chemist-Analyst, 49, 4 (1960), и ее использование для определения субмикроколичеств Fe(III) при помощи 7-иод-8-оксихинолин-5-сульфокислоты [Fujimoto М., Nakatscukasa Y., Anal. Chim. Acta, 26, 427 (1962)]. Другим примером является адсорбция CdL2- иа зернах анионообменной смолы с последующим обнаружением Cd посредством глиоксаль-бис(2-оксианила); см. West Р. W., Dif-f ее J., Anal, Chim. Acta, 25, 399 (1961).
21. Grande J. A., Beukenkamp J., Anal. Chem., 28, 1497 (1956).
22. At t eb err у R. W., Boyd G. E., J. Am. Chem. Soc.,-72, 4805 (1950).
23. M acker eth F. J. H., Proc. Soc. Water Treat. Exam., 4, 27 (1955).
23. См. также Pollard F., M с О m i e J. F. W., Chromatographic Methods of Inorganic Analysis, Butterworths, London, 1953.
24. M a r t i n E. C., Anal. Chim. Acta, 5, 511 (1951).
25. C a r r e 11 D. E., Anal. Chem., 25, 1927 (1953); P i e г с e T. B., Peck P. F., Anal. Chim. Acta, 26, 557 (1962).
26. Eibeith I. L, McOmie J. F. W., Pollard F. H., Discussions Faraday Soc., 7, 183 (1949).
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ 167
27. Сноска [15], стр. 321—323.
28. Erlenmeyer Н., Dahn Н., Helv. Chim. Acta, 22, 1369 (1936).
29. Erlenmeyer H., Schoenauer W., Helv. Chim. Acta, 24, 878 (1941); Robinson G., Discussions Faraday Soc., 7, 195 (1949).
30. E r 1 e n m e у e r H., S ch midi in J., Helv. Chim. Acta, 24, 1213 (1941).
31. Шемякин Ф. M., Мицеловский E. С., ЖАХ, 3, 349 (1948).
32. F e i g 1 F., Spot Tests in Inorganic Analysis, Elsevier Publishing, Amsterdam, 5th ed., 1958.
33. P inter ovic Z., Kem. Vjestnik. (Zagreb), 15, 16 (1941—1942).
34. Dean J. A., Anal. Chem., 23, 1096 (1951),
35. Erametsa O., Suomen Kemistilehti, 16B, 13 (1943).
36. Paula is R., Ann. Pharm. Frans., 4, 106 (1946).
37. Elbeich I. I. M„ Abou-Elnaga M. A., Anal. Chim. Acta, 23, 30 (1960).
38. Weisz H., Microanalysis by the Eing Oven Technique, Pergamon Press, New York, 1961, pp. 70—76.
39. West P. W., Mohllner P. R., Anal. Chem., 34, 558 (1962).
40. См., например, Koi t hot f I. M„ Lingane J. J., Polyrography, Interscience Publishers, New York, 2nd ed., 1952,
41. P f i b i 1 R., Z a bran sky Z., Coll. Czech. Comm., 16, 554 (1951).
Г Л А В A 8
Видимые и ультрафиолетовые спектры комплексов
Аналитические методы, основанные на измерении спектральных различий, часто легко осуществимы, отличаются быстротой выполнения и обычно вполне подходят для серийных анализов. По этой причине они составляют, вероятно, наиболее важную группу методов, используемых в химическом анализе неорганических веществ. Их значимость является также прямым результатом выпуска промышленностью надежных спектрофотометров, особенно для измерений в видимой и ультрафиолетовой областях спектра. Поэтому весьма желательно ознакомление с некоторыми факторами, определяющими способность веществ к поглощению или испусканию света.
1. ПРОЦЕСС ПОГЛОЩЕНИЯ СВЕТА
Свет является формой электромагнитного излучения, и его поглощение или испускание молекулой вещества обусловлено переходами электронов между двумя различными энергетическими уровнями. Длина световой волны, связанной с переходом от энергии Е1 к энергии Ег, определяется уравнением £i — Ez=hcfk. Это дает возможность использовать спектры поглощения для получения информации о различиях в энергетических уровнях ионов и молекул и, следовательно, для углубления наших знаний, касающихся характера и прочности осуществляющихся в этих случаях химических связей. Поглощение света происходит в результате взаимодействия электрического поля, сопровождающего его, с диполем молекулы в направлении, перпендикулярном направлению света, или с диполем, индуцированным в молекуле электрическим полем. Если изменение поляризации молекулы в этом направлении отсутствует, поглощения или испускания света не происходит.
Для молекул органических веществ указание о том, будет ли поглощение света происходить в видимой или же в ближней ультрафиолетовой областях спектра, можно получить, рассматривая возможность осуществления в системе квантово-механиче-
ВИДИМЫЕ И УЛЬТРАФИОЛЕТОВЫЕ СПЕКТРЫ КОМПЛЕКСОВ
169
скоро резонанса. Полинг [1], например, смог качественно объяснить полосы поглощения нейтральных красителей типа индиго на основе резонанса между классическими валентными структурами и биполярными структурами более высокой энергии. Если различие в энергии для двух (или более) канонических форм молекулы не слишком велико, поглощение света вполне вероятно, причем чем длиннее цепь сопряжения, тем больше должна быть длина волны, при которой будет наблюдаться максимум поглощения.
В то время как длина волны поглощаемого света определяется разницей в энергии, соответствующей переходу, коэффициент светопоглощения (или, точнее, площадь под кривой светопогло-щения) определяется размером поглощающих группировок (который увеличивает возможность молекулы «поймать» любой данный квант света) и вероятностью перехода.
Приблизительное соотношение между указанными величинами дается уравнением [1а]
емакс = 9 103/Ч
где Р — вероятность перехода и а (А2) — площадь, занимаемая хромофором. Молярный коэффициент светопоглощения е какого-либо вещества есть оптическая плотность 1 М раствора при толщине слоя 1 см. Значения log е 4 относятся к «высокоинтенсивному» поглощению и обусловлены переходами с высокой вероятностью («разрешенными» переходами), в то время как значения log е < 3 относятся к «малоинтенсивному» поглощению и определяются переходами с малой вероятностью («запрещенными»). Большинство полос поглощения в ультрафиолетовой и видимой областях связано с переходами электронов с одной молекулярной орбитали на другую. Тот факт, что спектры, особенно в растворах, состоят из полос, а не из резких линий, объясняется одновременным изменением колебательной и вращательной энергий и межмолекулярным взаимодействием, включая и эффекты сольватации.
Значения log е редко превышают 5 (что соответствует Р=1 и а = 11 А2), и это ограничивает достижимую чувствительность спектрофотометрических методов. Величина log 8 = 5 для комплексов молекулярного веса 60 при измерении в кювете с толщиной слоя 1 см и концентрации металла 0,06 мкг/мл соответствует оптической плотности 0,1. Такая чувствительность достигается для комплекса цинка с 2-нафтилтиокарбазоном (в хлороформе), для хлорантимоната родамина В (в бензоле) и небольшого числа других соединений. Однако поглощение большинства окрашенных комплексов металлов составляет лишь величину, лежащую в интервале от одной десятой до одной сотой указанной интенсивности. Если же требуется большая чувствительность,
170
ГЛАВА 8
следует прибегать к методам предварительного концентрирования определяемых веществ, например к экстракции.
В наиболее общем случае возбужденная молекула теряет избыточную энергию частично в виде инфракрасного излучения, частично изменяя кинетическую энергию в результате столкновений с другими молекулами. Это обычно осуществляется при переходе из возбужденного состояния с низкой колебательной энергией в основное состояние с высокой колебательной энергией.
Однако в некоторых случаях энергия, поглощенная молекулой, достаточна для разрыва химической связи и приводит к химическим изменениям. Широко известным примером является фотолитическое разложение щавелевой кислоты солями урана с образованием муравьиной кислоты и двуокиси углерода. Многие органические вещества, способные давать комплексы с уранилом, ведут себя аналогично, особенно в ультрафиолетовом свете. В ходе этого процесса U(VI) восстанавливается до U(IV), но последний снова окисляется кислородом воздуха. Поэтому реакция продолжается до тех пор, пока не будет использован весь органический материал.
2. ФЛУОРЕСЦЕНЦИЯ
В некоторых случаях возбужденная молекула может перейти в более низкое электронное состояние, испуская видимый или ультрафиолетовый свет, т. е. флуоресцируя. Вследствие какой-то предварительной потери возбужденной молекулой некоторой части ее энергии испускаемый свет обычно имеет большую длину волны (меньшую энергию), чем поглощаемый. Флуоресценция особенно характерна для сложных органических молекул, имеющих жесткую структуру, таких, как полициклические ароматические или гетероциклические соединения. Одним из наиболее простых примеров служит З-окси-2-нафтойная кислота, которая в кислых средах дает с алюминием синюю флуоресценцию [2].
Рассмотрение взаимодействий между оптическими электронами, ответственными за флуоресценцию комплекса, и полем иона металла [3] позволяет предположить, что в общем случае флуоресцирующие комплексы с наибольшей вероятностью образуются ионами, содержащими наиболее устойчивые электронные группировки, т. е. ионами, уровни которых или пусты, или заполнены. Это происходит в связи с тем, что возмущение ионного поля в значительной мере зависит от экранирования оптических электронов уровнями самого иона; незаполненные уровни облегчают рассеивание флуоресценции и «внутреннее гашение» за счет электронных переходов. Так, к катионам, которые обычно образуют флуоресцирующие комплексы, относятся Zr4+, Al3+, Sc3+, Zn2+, Mg2+, Са2+ и Li+, но не ионы переходных металлов, хотя
ВИДИМЫЕ И УЛЬТРАФИОЛЕТОВЫЕ СПЕКТРЫ КОМПЛЕКСОВ
171
в последнем случае известны некоторые исключения. Низкоспиновый комплекс трис(5-метил-1,10-фенантролин) рутений(П) как раз представляет собой такое исключение (возможно, из-за того, что разница в энергиях между заполненными и вакантными d-op-биталями слишком велика, чтобы допустить легкий переход электронов). В результате рутений можно определять флуориметри-чески [4]. Обычно же флуоресцирует индикатор-лиганд, а не его комплекс с ионом переходного металла. Так, титрование EDTA медью (II) в присутствии о, о'-дианизидин-М, N, N', N'-тетраук-сусной кислоты L характеризуется исчезновением флуоресценции, обусловленной L, как только точка эквивалентности будет
ь
пройдена и в растворе появятся следы свободного иона меди(II) [5]. Аналогично ведут себя и ионы ртути(II).
Флуориметрические методы часто более чувствительны, чем обычные фотометрические. Однако pH раствора, природа растворителя, концентрация реагента, температура и присутствие посторонних ионов или молекул (которые могут частично гасить флуоресценцию), видимо, оказывают на них большее влияние [6]. Обычно этими методами определяют Be, Al, Ga, In, Sc, U и Zr. В щелочных растворах бериллий реагирует с хинизарином (1,4-диоксиантрахиноном) с образованием соединения, флуоресцирующего красным светом. Подобным же образом при pH 4,5 олово (IV) образует флуоресцирующий комплекс с пурпурином (1,2,4-триоксиантрахиноном), а в слабокислых растворах Th, Ga и Рг — флуоресцирующие комплексы с 1-амино-4-оксиантрахино-ном. Красный бис-комплекс эриохром (понтахром) сине-черного R с алюминием, образующийся при pH 4,8 в течение 1 час, можно экстрагировать н-амиловым спиртом и определять по флуоресценции [7]. Метод чувствителен (позволяет определять до 0,01 мкг! мл алюминия), но значительные помехи оказывают Fe, Cu, Со, V (V) и Т1, если они присутствуют. Небольшие концентрации магния, цинка, алюминия, галлия и индия [8] иногда определяют по флуоресценции их комплексов с 8-оксихинолином или 8-оксихинолин-5-сульфокислотой [9]. 2-(о-Оксифенил) бензоксазол является флуориметрическим реагентом на кадмий [10]. В кислых или нейтральных растворах морин LI образует флуоресцирующие комплексы с Be, Ga, Sn(IV) > Sc > Zr, Th, Al, In
172
ГЛАВА 8
и Ce(III) > Y [И] при концентрациях металлов до 10-4—10~3 М. Комплексообразование, вероятно, происходит по группе —С = О и 3- или 5-фенолят-иону. Поскольку число взаимодействующих
О НО
LI
с морином элементов довольно велико, требуется их предварительное разделение. Прямое определение урана выполняют наблюдением в ультрафиолетовом свете флуоресценции твердых растворов его солей во фториде натрия [12]. Галлий при содержании до lO-eo/o можно определять в виде бензольного раствора хлорогаллата родамина В.
Некоторые примеры использования флуоресценции, относящиеся к последнему времени, включают применение флуорексона в качестве индикатора при титровании кальция раствором натриевой соли EDTA [13] и антраценового синего SVG в сильно сернокислых растворах для определения следов бора в магнии [14].
3. ТИПЫ УЛЬТРАФИОЛЕТОВЫХ и видимых спектров КОМПЛЕКСОВ
Можно выделить три типа переходов в комплексах, определяющих их ультрафиолетовые и видимые спектры, хотя в каждом отдельном случае не всегда можно провести между ними четкую границу. Типы эти следующие:
1. Возбуждения ионов переходных металлов, обычно связанные с (/"-конфигурациями и называемые d — (/-переходами. По аналогии в случае редкоземельных элементов имеют место соответственно f — /-переходы.
2. Возбуждения молекул лигандов.
3. Переходы с переносом заряда, включающие переход электрона из состояния, которое характеризуется тем, что он находится главным образом около металла, в состояние, когда он сосредоточен преимущественно у лиганда, или же наоборот.
d—d-Переходы
d — (/-Переходы приводят к появлению полос в видимой, ближней ультрафиолетовой или ближней инфракрасной областях
ВИДИМЫЕ И УЛЬТРАФИОЛЕТОВЫЕ СПЕКТРЫ КОМПЛЕКСОВ
173
спектра с молярными коэффициентами светопоглощения в пределах от 0,1 до 100. Эти переходы ответственны за окраску большинства комплексов переходных металлов. Несмотря на то, что эти спектры являются наиболее изученными в настоящее время спектрами комплексов металлов [15], интенсивность их полос слишком мала, чтобы иметь значительное аналитическое применение. Они обязаны своим появлением электронным переходам
Рис. 1. Происхождение d—d-спектра октаэдрического комплекса, образованного катионом, содержащим только один d-электрон.
между заполненными и пустыми или заполненными наполовину d-орбиталями, которые различаются по своей энергии вследствие ориентации лигандов вокруг центрального иона металла (в отличие от изолированного газообразного иона, в котором все пять d-орбиталей равны по энергии). Расщепление энергетических уровней в простейшем случае одного d-электрона в октаэдрическом комплексе показано на рис. 1.
Дважды вырожденный уровень Eg соответствует орбиталям dx,_yl и ^22> а трижды вырожденный уровень Тге— орбиталям dxy, dyz и dzx, так что d—d-спектр состоит из одной полосы, получающейся при переходе Tig-^Eg. Аналогичный спектр можно ожидать для системы d9, а также для систем d4 и d6, когда разница в энергиях между Eg и Tig достаточно мала для того, чтобы высокоспиновое состояние было бы устойчивым. Таким образом, в спектрах акво-ионов, приведенных в табл. 1, имеются одинарные довольно широкие полосы в видимой и ближней инфракрасной областях. Положение центра такой полосы характеризует разницу в энергии А, или 10Dq между уровнями Tig и Eg, равную для акво-иона ТР+ 22 ккал.
Замещение молекулы воды в координационной сфере иона металла молекулой другого лиганда будет в результате измене-
174
ГЛАВА 8
Таблица 1
Видимые спектры поглощения некоторых ионов переходных металлов3
Ион
Tl3+ Сг2+ Мп3+ Fe2+ Cu2+
Конфигурация
dl d4 d4 d6 d9
Хмакс, ммк 493 * 719 476 962 794 е 4 7 5 2 12 а По Holmes О. G„ McClure D. S., J. Chem. Phys., 26, 1686 (1957).
ния силы поля лигандов сдвигать полосы d — d-перехода в область более длинных или более коротких длин волн в зависимости от того, больше или меньше, чем в случае воды, новая сила поля лиганда.
Это объясняет, почему при сравнении комплексов, содержащих какие-либо другие лиганды, с акво-ионами для предсказания направления и относительной величины сдвигов длин волн можно с достаточной достоверностью использовать спектрохимический ряд (см. гл. 4), в котором лиганды расположены в определенном порядке по мере увеличения силы поля лигандов для одного и того же центрального иона металла. При сравнении нескольких членов этого ряда получим, что ХмаКс изменяется в следующем порядке: 1~ > НгО > ру > CN-. Максимумы для ионов d4 и d9 наблюдаются при более коротких длинах волн, чем предсказывает простая теория, и эти полосы являются, вероятно, составными, расширившимися вследствие дальнейшего расщепления энергетических уровней dxy, dyz и dzx- Это является результатом эффекта Яна—Теллера (обсуждавшегося в гл. 3), который приводит к искаженной октаэдрической конфигурации.
Во всех случаях, отличающихся от только что рассмотренного, диаграмма энергетических уровней осложнена тем, что возможны несколько различных способов перемещения электронов на орбитали, а также квантово-механическим взаимодействием между уровнями одинаковой симметрии [16]. Однако d—d-переходы являются запрещенными, поскольку они не связаны с изменением величины квантового числа I на ±1. (К переходам, при которых это требование выполняется и которые, таким образом, являются «разрешенными», относятся переходы s-+p, p-+s, p-+d, d-+p и
ВИДИМЫЕ И УЛЬТРАФИОЛЕТОВЫЕ СПЕКТРЫ КОМПЛЕКСОВ
175
d->-f.) Именно поэтому интенсивность полос, отвечающих d—ci-переходам, так низка. Тот факт, что эти переходы вообще осуществляются, почти наверняка объясняется небольшой потерей симметрии комплексными ионами, что связано с наличием колебаний, не имеющих центра симметрии. Это ограничение не распространяется на тетраэдрические комплексы, поскольку они не имеют центра инверсии, в результате чего их коэффициенты све-топоглощения могут быть гораздо выше. Для видимых спектров некоторых соединений общей формулы MX*- (M=Ni, Со, Си; Х=С1, Вг, I) были найдены значения порядка 200—1200 [17].
Несмотря на то что хорошая интерпретация спектров ионов редкоземельных металлов еще отсутствует*, переходы типа fn— fn~ld имеют важное значение. Вследствие того что такие переходы являются «разрешенными», они гораздо интенсивнее, чем d—d-переходы, а так как на эти f-электроны лиганды при комплексообразовании оказывают меньшее влияние, длины волн и интенсивности, соответствующие этим переходам, от комплекса к комплексу меняются незначительно. Актиниды дают похожие спектры, но так как их /-электроны экранированы в меньшей степени, кристаллические поля лигандов оказывают большее влияние. По аналогии с d—d-переходами металлов переходного ряда f—/-переходы как для лантанидных, так и для актинидных элементов обладают низкой интенсивностью.
Возмущения лигандов
При обсуждении электронных спектров поглощения органических молекул обычно различают пять типов орбиталей и электронов, находящихся на них [18]. В порядке увеличения энергии это связывающая ff(cr)-, связывающая л (л)-, несвязывающая (п)-, разрыхляющая л (л*)- и разрыхляющая о (о*)-орбитали. Полосы, соответствующие переходам n-^-л*, обычно лежат в области более длинных волн, чем соответствующие переходам л->-л*. В комплексах с преимущественно электростатическим характером связи ион металла будет влиять на спектр примерно так же, как и протонизация лиганда. Влияние будет заключаться в сдвигах, которые обычно малы и которые могут быть направлены в область более коротких или более длинных длин волн. Изменения формы кривой или максимальных коэффициентов све-топоглощения если и будут, то незначительными. В случае гетеро-
* См. монографию: К. Б. Я Ц и м и р с к и й, Н. А. Костромина, 3. А. Шека, Н. К. Давиденко, Е. Е. Крисс и В. И. Ермоленко, «Химия комплексных соединений редкоземельных элементов», «Наукова думка», Киев, 1966. — Прим. ред.
176
ГЛАВА 8
ароматических лигандов типа пиридина комплексообразование должно приводить к небольшим смещениям полос, отвечающих переходам или в сторону более коротких длин
волн. По своей природе эти смещения совсем не специфичны для рассматриваемых катионов.
Ион Mg2+ оттягивает электроны сильнее, чем один протон, поэтому максимум светопоглощения (530 ммк) однозарядного анионного комплекса эриохром черный Т—магний лежит в области более коротких волн, чем максимум двухзарядного аниона эриохром черного Т (650 ммк)-, интенсивность для комплекса также несколько ниже [19]. Чем больше устойчивость внутрикомплекс-ных соединений металлов с этим лигандом (и, следовательно, чем сильнее электронное взаимодействие между лигандом и металлом), тем больше сдвиг спектров комплексов в ультрафиолетовую область. Подобный сдвиг был отмечен также в случае спектров трехзарядного аниона мурексида и его монокальцие-вого, магниевого, цинкового и медного(II) комплексов [20].
Аналогичные эффекты, являющиеся результатом электронного взаимодействия между ионом металла и резонирующей системой, ответственной за поглощение света лигандом, являются обычными для многих фотометрических реагентов. Так, дитиок-самид (рубеановодородная кислота) LII находит применение как
HN=C-----C=NH
SH SH
LII
реагент для капельных проб, поскольку он образует окрашенные комплексы с большим числом элементов: Си, Со, Ni, Fe(III), Ag, Bi, Hg(I), Pd и Pt. Его применяют также для фотометрического определения рутения [21].
Однако в тех случаях, когда с металлом образуется сильная ковалентная связь, в том числе, возможно, и обратная двойная связь за счет л-электронов металла, природа молекулярных орбиталей лиганда может быть существенно изменена. Это относится как к энергетическим уровням, так и к вероятности перехода электронов с одной орбитали на другую. При этом не всегда можно отличить переходы в самом лиганде от смещений электронов к иону металла или от него. Наиболее полезно в таких случаях сравнить полные спектры поглощения лиганда и его комплексов с металлами в видимой и ультрафиолетовой областях.
Индикатор металлфталеин XXX интересен в этом отношении тем, что окраска его внутрикомплексных соединений с металлами интенсивна только в случае Са(П), Sr(II) и Ва(П).
ВИДИМЫЕ И УЛЬТРАФИОЛЕТОВЫЕ СПЕКТРЫ КОМПЛЕКСОВ
177
Если не считать комплекса Mg, который имеет слабую окраску, другие комплексы с металлами почти бесцветны. Красная окраска комплексов Са, Sr, Ва и Mg подобна окраске полностью диссоциированной формы металлфталеина, но появляется она при более низких значениях pH, чем те, где металлфталеин полностью ионизирован. Поэтому почти нет сомнений, что при комплексообразовании происходит потеря фенольных протонов, что соответствует состоянию LIII. Очевидно, если связь между ионом
LIII
металла и фенолятным кислородом преимущественно ионная, то значительного влияния на резонирующую систему, ответственную за окраску лиганда, наблюдаться не будет. С другой стороны, в случае ковалентной связи металл—кислород такое влияние весьма значительно, и поэтому красного окрашивания не наблюдается. Подобные эффекты обнаружены также в случае кальце-ина и тимолфталексона.
Растворы анализаринкомплексона XXXII при pH < 5 имеют желтую окраску (А,макс~423 ммк), но при pH 6 она становится красной (ZMaKC ~520 ммк). В этой форме 2-окси-группа ионизирована, а 1-окси-группа, видимо, связана водородной связью с кислородом карбонильной группы, находящейся в положении 9. Комплексообразование с металлами при pH 4,3—4,6 приводит к красным продуктам с максимумами поглощения, длины волн которых расположены в такой последовательности: РЬ < < Се (III) < Th = Ni с 520 ммк, которая, вероятно, отражает также степень ионности связи металл—фенольный кислород. Высокая устойчивость комплексов Al, Се (III), Th и Zr позволяет, применяя в качестве маскирующего агента EDTA, выполнять фотометрическое определение этих металлов в при-’ сутствии других металлов, таких, как Fe(III), Мп(И), Hg(II), Ni s и Pb [22]. Дитизон и его комплексы с металлами (в четыреххло-f ристом углероде) образуют ряд со следующим приблизительным расположением максимумов светопоглощения [23]:
Дитизон (620 ммк) > Си (II) (545 ммк) '_> Zn (535 ммк) >
Cd (520 ммк) = РЬ (520 ммк) > In (510 ммк) ~^> В1 (500 ммк) > > Hg (II) (490 ммк) > Ag (460 ммк).
12 Д. Перрин
178
ГЛАВА 8
При допущении, что в случае одно-, двух- и трехзарядных ионов образуются соответственно моно-, бис- и трис-комплексы, электростатическая теория должна была бы привести к предположению, что значения Амакс растут обратно пропорционально величинам ионных радиусов (а не ионных потенциалов z/r). Это подтверждается экспериментом. За исключением свинца, длины волн максимумов спектров поглощения со средним отклонением ±10 ммк удовлетворительно описываются уравнением АмаКс — = 357 + 134/г. Это уравнение можно рассматривать как выражение последовательных изменений при переходе от полностью ионизированной формы (однозарядный анион) к форме с полностью нейтрализованным зарядом (нейтральная молекула). Оно позволяет заключить, что для комплекса Т1 (I), радиус которого 1,47 А, значение Амане было бы равно 450 ммк\ это совпадает со вторым максимумом поглощения самого дитизона, так что при определении Т1 этим способом незакомплексованный дитизон мог бы оказывать серьезные помехи. Введение метильных радикалов в п, п'-положения фенильных групп дитизона смещает максимумы поглощения примерно на 10 ммк в сторону более длинных волн. Замена фенильных остатков нафтильными также приводит к смещению максимумов в длинноволновую область. Как аналитические реагенты эти соединения отличаются от дитизона не очень сильно [24].
Перенос заряда
В химическом анализе используют также спектры поглощения другого рода, называемые спектрами переноса заряда. Они наблюдаются, если поглощение светового потока приводит к переносу электрона между двумя орбиталями, причем на первой из них электронная плотность в большей степени сконцентрирована у одного атома, а на второй — у другого. Это приводит к «переходу с переносом заряда», и полосу поглощения, которая соответствует этому переходу, называют «полосой переноса заряда». Предложены три основных типа переходов с переносом заряда, приводящих к поглощению в ультрафиолетовой и видимой областях спектра.
1. Электроны о-связывающих орбиталей могут возбуждаться с переходом на пустую tzg- или разрыхляющую е^-орбиталь. В обоих случаях имеет место полный перенос заряда от лиганда к металлу. Важными в данном случае являются окислительные свойства центрального иона металла и существование частично заполненного электронного уровня. Эти реакции по существу являются реакциями фотохимического окисления-восстановления.
2. Электроны заполненных л-орбиталей, локализованные главным образом у лигандов, могут возбуждаться с переходом
ВИДИМЫЕ И УЛЬТРАФИОЛЕТОВЫЕ СПЕКТРЫ КОМПЛЕКСОВ
179
на разрыхляющие орбитали, образованные комбинацией орбита-лей лигандов с S-, р- или е^-орбиталями металла. Этот переход также включает перенос заряда с лиганда на металл.
3. Электроны связывающих cr-орбиталей могут возбуждаться на вакантные л-орбитали, которые локализованы в основном у лигандов. Это ведет к умеренному переносу заряда с металла на лиганд.
Эти спектры являются «разрешенными по Лапорту» (ибо переходы осуществляются между разными и противоположными состояниями) и поэтому обычно обладают гораздо большей интенсивностью, чем спектры d—d-переходов. Однако примеров, когда природу перехода можно считать точно установленной, в настоящее время известно немного. Так, роданидный комплекс Fe (III) обязан своим интенсивно красным цветом переходу электрона от иона CNS~ к иону Fe3+ с образованием радикала CNS и иона Fe2+ [25], так что в действительности это фотохимическая окислительно-восстановительная реакция. Если вокруг иона металла расположено большее число роданид-ионов, то вероятность этих переходов возрастает, поэтому молярный коэффициент светопоглощения бис-комплекса примерно в два раза выше, чем моно-комплекса [26]. (Повышение интенсивности окраски водных растворов, содержащих Fe3+ и роданид-ионы, при добавлении ацетона происходит, вероятно, главным образом вследствие смещения равновесия в сторону более полного образования комплекса, как это ожидается в случае ионной системы при уменьшении диэлектрической проницаемости среды.) Подобным же образом, вероятно, можно объяснить происхождение синей окраски роданидного комплекса кобальта, янтарной окраски роданидного комплекса молибдена (V) и желтой окраски роданидных комплексов урана(VI), ниобия (V), вольфрама(V) и рения(VI?). Все эти комплексы находят практическое применение в анализе. Они часто экстрагируются в виде нейтральных соединений или комплексных кислот простыми или сложными эфирами и другими содержащими кислород растворителями. Иногда к водным растворам этих комплексов прибавляют ацетон для понижения диэлектрической проницаемости среды и подавления тем самым диссоциации соединений. Возможно, что по меньшей мере часть спектров плоских квадратных ионов Ni(CN)2~ и Pd(CN)2- обусловлена переносом электрона на вакантные dx2_y2 орбитали.
В комплексах ванадия(IV), образуемых ионом VO2+ (например, в акво-ионе VO(H2O)2+), обнаруживается сильное тетрагональное искажение из-за наличия короткой л-связи ванадий— кислород. В результате этого в спектре имеются низкоэнергетические полосы переноса заряда, в которых электрон л-орбитали кислорода переносится на наполовину заполненную и на разры-12*
180
ГЛАВА 8
хляющую орбитали металла [27]. Тетраэдрические комплексы Ni(II) типа [Ni(Ph3AsO)2Br2] и NiI2(PPh)2 не характерны. Зеленая или красная окраска некоторых из этих комплексов определяется полосой переноса заряда, которая тянется из ультрафиолетовой в видимую область.
Перенос заряда в оксалатном комплексе урана приводит к фотохимическому разложению оксалат-иона в формиат-ион.
Водные растворы многих анионов имеют очень сильную полосу поглощения (\ogs~4) в ультрафиолетовой области, лежащую обычно около 2000—2500 А, хотя в некоторых случаях максимумы расположены ближе к видимой части спектра [NO~ (366 ммк), NO- (302 ммк) и SO*- (300 ммк)]. К этой группе относятся С1-, Вг- I-, ОН- SH“, SCN-, ОС1“, CN“, CIO", NO", С1О~ NO?, SO2“ и SO2-.. Считают, что эта полоса является поло-сой переноса заряда, при котором поглощение света гидратиро-ванным отрицательным ионом приводит к образованию свободного радикала и гидратированного электрона [28], например С1-(Н2О)П->С1(Н2О)“. Карбоксильные ионы типа формиата, ацетата, оксалата и сукцината также поглощают в этой области. Хотя ионы щелочных и щелочноземельных металлов не обнаруживают каких-либо полос переноса заряда в ультрафиолетовой или видимой областях, такие полосы имеются в спектрах поглощения гидратированных ионов многих других металлов, причем их максимумы также лежат в интервале 2000—2500 А. В качестве примеров приведем Cr2+(log е=2,8), V2+(log е«2,0) и Fe2+(log е = 1,5). Рабинович предположил [29], что в случае легко окисляющегося катиона полосе переноса заряда, лежащей в наиболее длинноволновой области, соответствует переход от иона к растворителю, а если катион легко восстанавливается, то имеет место перенос электрона от растворителя к иону. Например,
Fe2+ (Н2О)„ — Fe3+(H2O)7 и Fe3+ОН~ — Fe2+OH.
Подобным же образом комплексы РЬС1+(А,макс~230 ммк), РЬВг+ (235 ммк) и РЫ+ (275 ммк) дают полосы, значение loge для которых лежит в пределах 4,1—4,4. Полосы комплексов, в состав которых входит более одного иона галоида, смещены в более длинноволновую область. Это свидетельствует о меньшей энергии, требующейся в этом случае для переноса электрона. В хлоридных, бромидных и роданидных комплексах трехвалентного железа полоса переноса заряда, связанная с образованием свободных радикалов, расположена в видимой или ближней ультрафиолетовой области. Аналогично ведут себя галогенидные
ВИДИМЫЕ И УЛЬТРАФИОЛЕТОВЫЕ СПЕКТРЫ КОМПЛЕКСОВ
181
комплексы меди (II). Нестабильность Fe(III)- и Cu(II)-иодидов позволяет предположить, что в этих случаях для осуществления переноса заряда достаточно тепловой энергии.
Подобной же интерпретации спектров более сложных соединений уделялось меньше внимания. Комплексы [Со(КН3)в]3+ и [Сг(КНз)е]3+ сильно поглощают в области менее 2500 А, и постепенное замещение молекул аммиака на ионы галоидов приводит к сдвигу поглощения в более длинноволновую область [30]. Величина смещения возрастает в таком порядке: I>Br>Cl>F. Полосы поглощения объясняются, видимо, переносом электрона от аниона к Со(Ш)-иону.
Такое же объяснение возможно и в случае желтого комплекса [1г(КтНз)в]3+- 31~. Полагают, что в случае фенольных реагентов типа тайрона, применяемого для определения Fe3+, Cu2+ и V4+, так же как и в случае тиоуксусной и сульфосалициловой кислот, используемых для определения Fe3+, характерные спектры их комплексов с металлами обусловлены переносом заряда с перемещением электрона от лиганда к иону металла. Следует отметить, что эти лиганды легко вступают в реакции окисления-восстановления [25]. Приблизительно верно и то, что в комплексах различных металлов с данным лигандом полосы переноса заряда по мере усиления окислительной способности ионов металлов смещаются в область более длинных волн. Увеличение устойчивости высших степеней окисления при переходе сверху вниз в каждой группе периодической системы элементов (например, Fe—>-Ru—>-Os) приводит по тем же причинам к увеличивающемуся сдвигу соответствующих полос в область более коротких длин - волн. Интенсивная окраска комплексов Cu(I) nFe(II) с 1, 10-фе-натролином и а, а'-дипиридилом и других аналогичных комплексов была отнесена за счет переходов, включающих перенос электронов металла на л-орбитали лигандов [31]. Это, видимо, справедливо и для окрашенных комплексов, образуемых алкилами бериллия и его галогенидными соединениями с а, а'-дипириди-лом, комплексов алкилов Zn, Cd, Al и Ga с а, а'-дипиридилом и Для аналогичных комплексов, образуемых алкилами Be, Zn, Cd, Al и Ga с ароматическими аминами.
Связывание иона металла с двумя пиридильными ядрами каждой молекулы а, а'-дипиридила, лежащими в одной плоскости, приводит к значительному увеличению возможности резо-' нансной стабилизации молекулы. Это объясняет причину того, почему светопоглощение коплексов Fe(II) и Cu(I) с а, а'-дипи-' ридилом не намного меньше, чем в случае соответствующих комплексов с 1,10-фенантролином. Планарность молекулы имеет ^большое значение. Стерические затруднения в случае 3, З'-диме-тилзамещенного а, а'-дипиридила приводят к нарушению планарности структуры, и интенсивность окраски трис-комплексов,
182
ГЛАВА 8
Fe(II) с этим реагентом равна всего лишь одной пятой интенсивности комплекса с а, о/-дипиридилом [32]. Введение метильных групп в положение 4, 4' или 5, 5' не создает стерических препятствий и не влияет на окраску трис-комплексов Fe(II). 3, З'-Ди-карбокси-сс.сс'-дипиридил, очевидно, из-за большего объема введенных групп не образует с ионом Fe(II) окрашенных комплексов [33]. Однако, возможно, что известную роль играет и понижение основности, вызываемое карбокси-группами. Определение Ti4+ при помощи перекиси водорода основано на использовании полосы переноса заряда для соединения ТИ+ОгН-.
Хорошо известны также спектры переноса заряда чистоорганических молекулярных комплексов, однако их рассмотрение не входит в задачу данной книги. Такие спектры могут также возникать в растворах неметаллических неорганических веществ в органических растворителях; так, интенсивная полоса (loge~ ~4) с Амакс, лежащим между 290 и 380 ммк, наблюдается при растворении 12 в бензоле или его метилированных производных [34]. Аналогично ведет себя бром.
4. О КОНСТРУИРОВАНИИ РЕАГЕНТОВ, ДАЮЩИХ ОКРАШЕННЫЕ КОМПЛЕКСЫ С МЕТАЛЛАМИ
Лиганды с подходящей комплексообразующей способностью, но не обладающие удовлетворительными спектральными характеристиками, можно «перекроить» таким образом, что интенсивность светопоглощения возрастет, а сам спектр сдвинется в более длинноволновую область. Для этого необходимо увеличить цепь сопряжения в молекуле лиганда, с тем чтобы обеспечивалась большая делокализация л-электронов. К этому результату может привести включение в молекулу одной или большего числа обычных хромофорных групп, подобных тем, которые указаны в табл. 2, или увеличение числа ароматических колец. Так замещение n-нитрофенильной группы в п-нитробензолдиазоаминазо-бензоле («кадионе») на 4-нитронафталиновую (с образованием «кадиона 2В») приводит к изменению окраски реагента до синей и к увеличению контраста с «лаком», который этот реагент образует с гидроокисью кадмия. (Этот «лак» имеет красный цвет, так как координация кадмия с атомами азота понижает степень делокализации л-электронов лиганда.)
Аналогичный прием был применен в случае колориметрического определения алюминия. Осадок комплекса А1 с 8-оксихи-нолином растворяют в разбавленном солянокислом спиртовом растворе и реакцией с диазотированной сульфаниловой кислотой переводят в азосоединение, щелочные растворы которого окрашены в желто-красный цвет [35].
ВИДИМЫЕ И УЛЬТРАФИОЛЕТОВЫЕ СПЕКТРЫ КОМПЛЕКСОВ
183
Таблица 2
Общие хромофорные группы
-С=С- < -С=О < —C=S < -CH = N- <
(карбонил) (тион) (азометин)
Наиболее ярким примером расширения цепи сопряжения лиганда с целью сдвига спектров поглощения в длинноволновую область служит реагент стильбазо [стильбен-4,4'-бис(Г'-азо-3", 4"-диоксибензол)-2, 2'-дисульфокислота] LIV который в качестве модифицированного пирокатехина был предложен как реагент на алюминий [36].
LV
В случае индоксина LV желаемый сдвиг поглощения из ультрафиолетовой в видимую область был достигнут «дублированием» молекулы 8-оксихинолина. В результате образующиеся с металлами комплексы в большинстве случаев имеют синюю или
* В оригинале приведена неточная формула этого реагента. — Прим, перев.
184
ГЛАВА 8
фиолетовую окраску [37J*. Вещества, поглощающие в видимой области, позволяют разработать более удобные методы определения, чем соединения, поглощающие только в ультрафиолетовой области спектра.
Батохромный сдвиг спектров комплексов с 8-оксихинолином достигается введением атома иода в положение 7. Одновременное введение в положение 5 сульфо-группы обеспечивает хорошую растворимость комплексов в воде. Получающуюся при этом 7-иод-8-оксихинолин-5-сульфокислоту («феррон») применяют в качестве реагента на ионы трехвалентного железа, с которыми он образует в слабокислых средах растворимые зеленые трискомплексы.
Фениларсоновая кислота образует с цирконием белый осадок. Если, однако, в органическую часть молекулы реагента ввести подходящую хромоформную группу, осадок будет окрашенным. Так, n-диметиламинобензолазофениларсоновая кислота LVI
сн3 он
I.VI имеет длинную цепь сопряжения, которая изменяется при комплексообразовании металлов с арсоно-группой, что приводит к изменению окраски реагента. Реагент применяют для колориметрической капельной пробы на цирконий, с которым он дает коричневый осадок (тантал дает аналогичную реакцию).
Вообще же хороший органический реагент должен образовывать с ионом металла комплекс, имеющий характерную интенсивную полосу поглощения, которая отсутствует как в спектре поглощения свободного реагента, так и в спектре свободного иона. Реакции, приводящие лишь к смещению максимумов поглощения при замещении протона ионом металла, вероятно, менее специфичны, чем те реакции, для протекания которых требуются какие-то особые свойства участвующего в них катиона. Эту трудность часто можно устранить введением в раствор маскирующих агентов или же выполнением предварительных отделений. Специфичность реакций менее важна в случае реагентов-металлин-
* Значительное углубление окраски в данном случае происходит не вследствие дублирования молекулы 8-оксихинолина, а в результате того, что в сопряженном с ионизирующейся окси-группой положении находится ненасыщенный атом азота. Это следует из того, что такую же глубокую окраску имеют индофенолы и их комплексы с металлами, а соединение, получающееся при замещении атома азота иа метиленовую группу, окрашено лишь в желтый цвет. — Прим, перев.
ЗИДИМЫЕ И УЛЬТРАФИОЛЕТОВЫЕ СПЕКТРЫ КОМПЛЕКСОВ
185
хикаторов для комплексометрических определений. Перспектив-хое направление исследований связано, по-видимому, с получе-шем лигандов, дающих в своих комплексных соединениях (особенно с переходными металлами) интенсивные спектры переноса заряда.
В некоторых случаях небольшие изменения в лиганде могут зызвать увеличение специфичности. Это положение хорошо иллюстрируется реагентами группы 1,10-фенантролина. Бис-комплекс хвухвалентного железа с 1,10-фенантролином имеет довольно низкую константу устойчивости, и его d-электроны находятся з высокоспиновом состоянии. Он очень легко присоединяет до-холнительную молекулу 1,10-фенантролина с образованием устойчивого трис-комплекса, в котором все d-электроны спарены. Этот комплекс интенсивно окрашен вследствие переноса заряда (один из d-электронов заполненной орбитали перемещается на л*-орбиталь фенантролина [38]). Однако в 2,9-диметил-1,10-фенантролине LV1I метильные группы оказывают стерические препятствия образованию трис-комплекса двухвалентного железа, так что эта характерная полоса поглощения отсутствует. С другой стороны, метильные группы не мешают образованию тетраэдрического бис-комплекса с ионом одновалентной меди, который, как и бис-комплекс незамещенного 1,10-фенантролина, обладает интенсивной желтой окраской и в котором, вероятно, осуществляется переход с заполненной орбитали tig на л*-орбиталь. Слабость связи металл-лиганд в комплексе бис(2,9-диметил-1,10-фенантролин)железо(II) и отсутствие окраски позволяют применить 2,9-диметил-1, 10-фенантролин (не-окупроин) в качестве чувствительного и селективного реагента на медь даже при высоких концентрациях двухвалентного железа. Если в орто-положениях к атомам азота находятся ароматические ядра, как, например, в случае купроина (2,2'-бихинолина)
LVIII, стерические эффекты препятствуют образованию трискомплексов двухвалентного железа, но еще допускают существование бис-комплекса одновалентной меди. Купроин несколько менее чувствителен, но легче синтезируется, чем 6,6'-диметил-2,2'-Дипиридил LIX, который также применяли для этой цели.
Комплексообразование 2,2'-дипиридила и 1,10-фенантролина с металлами и влияние заместителей были изучены достаточно
186
ГЛАВА 8
глубоко. Поэтому в некоторых случаях можно весьма точно предсказать не только максимумы поглощения ряда комплексов металлов, но также и соответствующие молярные коэффициенты поглощения [39]. Например, замещение метильных групп на атомы водорода является аддитивной функцией как для длин волн максимумов поглощения комплексов меди и железа (II), так и их молярных коэффициентов поглощения [40]. При введении в 4- и 7-положения 1, 10-фенантролина фенильных групп цепь сопряжения в лиганде удлиняется, что увеличивает вдвое коэффициент поглощения комплекса двухвалентного железа. Увеличение гидрофобности лиганда позволяет также экстрагировать этот комплекс из водных растворов амиловым или «-гексиловым спиртами, в то время как для экстракции соответствующего комплекса с 1, 10-фенантролином (в форме перхлората) необходимо применение нитробензола. Наоборот, если в раствор, содержащий трис-комплексы железа(П) с 1, 10-фенантролином или с 4,7-дифенил-1, 10-фенантролином, ввести цианид-ион, то образуются нейтральные дициано-бис-комплексы, экстрагирующиеся хлороформом. (Так как бесцветный комплексный ион Cu(CN)32- устойчивее, чем комплекс меди (I) с фенантролином, следы железа можно определять в медных образцах [41].)
Селективность реакции 2,9-диметил-1, 10-фенантролина с Cu(I) и повышение интенсивности окраски комплекса при введении фенильных ядер в положения 4 и 7 1, 10-фенантролина сочетаются в батокупроине LX [42].
Для повышения растворимости батокупроина и батофенан-тролина в воде, особенно в присутствии перхлорат-ионов, можно использовать дисульфокислоты этих реагентов, обладающие примерно такой же чувствительностью [43]. Они гораздо более растворимы в воде, но не экстрагируются органическими растворителями. Подобным же образом введение сульфо-группы в 3 или 5 положение 1, 10-фенантролина делает соответствующие трискомплексы железа (II) растворимыми в перхлоратных средах без заметного изменения их спектров поглощения [44].
К другим соединениям, предложенным в качестве реагентов
ВИДИМЫЕ И УЛЬТРАФИОЛЕТОВЫЕ СПЕКТРЫ КОМПЛЕКСОВ
187
для фотометрического определения железа и содержащим ту же цепь N—С—С—N, относятся 4, 4', 4"-трифенилпроизводное трипиридила LXI, реакция которого примерно в четыре раза чувствительнее, чем реакция 2, ^'-дипиридила, и который полезен также в качестве реагента на кобальт [45], 2-(2-пиридил)-бензимидазол LXII и 2-(2-пиридил)-имидазол LXIII [46]. 2, 4, 6-Три-пиридил-1, 3, 5-триазин LXIV является таким же чувствительным
реагентом для железа, как и батофенантролин, и в присутствии перхлорат-ионов его синий комплекс с железом (II) можно экстрагировать нитробензолом [47]. Разница в спектрах поглощения такова, что железо и медь можно определять в одном растворе, определяя медь (I) при помощи батокупроина и затем вводя 2, 4, 6-трипиридил-1,3, 5-триазин.
2- (2-Пиридил)-1,3,5-триазин ведет себя как бидентатный комплексообразующий реагент (подобно 2,2'-дипиридилу он образует трис-комплексы с железом), но 2,4-дипиридил-1,3,5-триазин, подобно трипиридилу, является тердентатным и дает бис-комп-лексы. Третья пиридильная группа в 2, 4, 6-трипиридил-1, 3, 5-триазине не участвует в образовании связи с металлом. Как и в случае реагентов групп 1, 10-фенантролина и а, а'-дипиридила, введение в положение 4' пиридинового ядра фенильной группы улучшает спектрофотометрические свойства комплексов железа (II), но это преимущество уничтожается понижением их растворимости в воде [48].
Фенил-2-пиридилкетоксим LXV, также содержащий цепь N—С—С—N, был предложен как реагент для фотометрического определения железа, с которым он дает красное соединение,
188
ГЛАВА 8
экстрагирующееся амиловым спиртом [49]. Соответствующий оранжево-желтый комплекс палладия (II) очень- хорошо растворим
Н</
LXV
в хлороформе. Его образование было предложено использовать для капельного обнаружения палладия [50]. Аналогичную реакцию дает золото (Ш). Замена фенильной группы на метильную, приводящая к образованию метил-2-пиридилкетоксима, не оказывает заметного влияния на комплексообразующую способность реагента, однако увеличивает растворимость в воде как самого реагента, так и его комплексов с металлами. Максимумы поглощения комплексов сдвигаются в более коротковолновую область, так что кислые растворы его трис-комплекса с железом (II) имеют оранжево-красную окраску. (В щелочном растворе лиганд теряет протон, поэтому образуется соответствующий красно-фиолетовый нитронный комплекс LXVI [51]. Медь (I) образует желтовато-зеленый бис-комплекс.)
LXVI
Введение в молекулу 1, 10-фенантролина окси-групп (в положения 4 и 7) приводит к значительному ослаблению его комплексообразующей способности по отношению к ионам железа (II) в нейтральных или слабокислых средах. Это, вероятно, объясняется таутомерией LXVII^LXVIII, равновесие которой сдви
LXVII
LXVIII
ВИДИМЫЕ И УЛЬТРАФИОЛЕТОВЫЕ СПЕКТРЫ КОМПЛЕКСОВ
189
нуто в сторону образования амидной формы LXVIH. Так, в аналогичном случае 4-оксихинолина соотношение амидной и енольной форм равно 24 000: 1 [52]. Комплексообразующая способность таких амидов, видимо, очень слаба. Однако в сильнощелочных растворах окси-группы целиком ионизированы и двухзарядный анион 4,7-диокси-1, 10-фенантролина становится чувствительным реагентом на двухвалентное железо [53]. По сравнению с комплексом незамещенного 1,10-фенантролина электронная плотность на атомах азота здесь увеличена, что приводит к небольшому повышению светопоглощения (е = 15 000 вместо 11000) и к некоторому смещению максимума в длинноволновую область (Амакс=520 ммк вместо 509 ммк).
В качестве фотометрического реагента на U(VI) можно использовать салициловую кислоту. При введении в молекулу лиганда подходящих групп спектральные свойства комплекса улучшаются. В качестве примеров можно назвать следующие заместители в «-положении: амино- или, лучше, п-нитробензол-азо- (ализариновый желтый R), m-нитробензолазо- (ализариновый желтый GG) и бензолазо-группы [54]. Эти производные салициловой кислоты имеют заместители, увеличивающие интенсивность светопоглощения комплексов и смещающие максимумы в длинноволновую область.
Другая группа фотометрических реагентов, молекулы которых были несколько «перекроены», — это производные флуорена. 9-Метил-2,3,7-триоксифлуорон LXIX («метилфлуорон») был предложен в качестве фотометрического реагента на Sb(III),
о.
но
с которой он в интервале pH 2—4 образует интенсивно красный циклический эфир типа LXX [55]. (Мешающее влияние других ионов предотвращается предварительным выделением сурьмы в виде газообразного стибина.) Поглощение света обусловлено наличием перехода в лиганде, причем спектр поглощения комплекса с сурьмой похож на спектр поглощения щелочного раствора метилфлуорона. Замещение метильной группы на фенильную дает «фенилфлуорон», применяемый для спектрофотометрического определения германия [56], с которым он образует нерастворимый красный бис-комплекс. Флуорон и его производные слишком полярны, чтобы их соединения можно было экстрагировать органическими растворителями. Поэтому комплекс
190
ГЛАВА 8
с германием стабилизируют в водных растворах добавлением диспергирующего агента. С этими реагентами взаимодействуют и многие другие ионы, например Ga(III), Sn(II), Sn(IV), Sb(III), Zr(IV), MoO?- Ti(IV), As (III), Bi (III), Fe(III) и AsO43-, но их влияние легко устраняется предварительным выделением германия в виде тетрахлорида дистилляцией или экстракцией ССЦ из 9 М. соляной кислоты. Соответствующие нитропроизводные, Э-(З-нитрофенил)- и 9-(4-нитрофенил)-2, 3, 7-триоксифлуороны, были предложены в качестве чувствительных фотометрических реагентов соответственно на цирконий [57] и олово (IV) [58]. 9-(4-Диметиламинофенил)-2, 3, 7-триоксифлуорон, вначале предложенный в качестве реагента на германий, с которым он образует комплекс, растворимый в смеси этанол-соляная кислота [59], в настоящее время применяют для определения тантала в цирконии и ниобии [60].
5. ХЕМИЛЮМИНЕСЦЕНТНЫЕ ИНДИКАТОРЫ
Известно небольшое число веществ, испускающих свет в результате самой химической реакции. Иногда это свойство хемилюминесценции можно использовать в аналитическом процессе как индикатор. Среди пригодных для этой цели веществ — сило-ксен (производное силицида кальция), люминол (циклический гидразид 3-аминофталевой кислоты) [61], лофин (2,4,5-трифе-нилимидазол) [62] и люцигенин (нитрат N, N'-диметилдиакри-дилия) [63]. Люминол (LXXI) окисляется по свободнорадикальному механизму до трансаннулярного перекисного двухзарядного
аниона, испускающего квант света при разложении на амино-фталевую кислоту и азот [64]. Ионы металлов катализируют разложение перекиси водорода по свободнорадикальному механизму. Поэтому, когда аммиачный раствор меди (II) титруют в присутствии люминола раствором EDTA, содержащим 0,01% перекиси водорода, смесь испускает свет до тех пор, пока в растворе не появится избыток EDTA, после чего свечение исчезает. Наоборот, люцигенин взаимодействует с перекисью водорода, но не со свободными радикалами. Поэтому при аналогичном титровании, пока в растворе присутствуют свободные ионы металла,
ВИДИМЫЕ И УЛЬТРАФИОЛЕТОВЫЕ СПЕКТРЫ КОМПЛЕКСОВ
191
он испускает только короткие вспышки света. При достижении конечной точки, когда перекись водорода уже не разлагается каталитически, люцигенин дает устойчивую хемилюминесценцию. Был предложен механизм реакции и испускания света [64]. Люцигенин можно также использовать как адсорбционный индикатор при аргентометрическом определении иодид-ионов. Пока он адсорбируется на отрицательно заряженной поверхности осадка иодида серебра, он не испускает света даже в присутствии перекиси водорода. Десорбция его при изменении заряда поверхности ведет к внезапной люминесценции.
Такие индикаторы применяют при титровании мутных, непрозрачных или темных растворов.
ЛИТЕРАТУРА
1. Pauling L., Proc. Natl. Acad. Sci., 25, 577 (1939).
la. В r a u d e E. A., J. Chem. Soc., 1950, 379.
2. Kristiansen H., Anal. Chim. Acta, 25, 513 (1961).
3. Yus ter P„ Weissman S. I., J. Chem. Phys., 17, 1182 (1949).
4. Veening H., Brandt W. W., Anal. Chem., 32, 1426 (1960).
5. Belcher R., Rees D. I., Stephen W. I., Taianta, 4, 78 (1960).
6. Более подробные сведения см. в Dankwortt Р., Eisenbrand J., Luminiszens—Analyse in Filtrieten Ultravioletten Licht, Akad. Verlag, Leipzig, 6th ed., 1956; Radley J. A., Grant J„ Gluorescent Analyses in Ultraviolet Light, Chapman and Hall, London, 4th ed., 1954; Willard H. H„ Merritt L. L„ Dean J. R., Instrumental Methods of Analysis, 3rd ed., Van Nostrand, New York, 1958, Chapter 3; White С. E., Anal. Chem., 28, 621 (1956); 30, 729 (1958); 32, 47R (1960); 34, 81R (1962).
7. W e i s s 1 e r A., W h i t e С. E., Ind. Eng. Chem. (Anal. Ed.), 18, 530 (1946); Ishibashi M., Shigematsu T., Nishikawa Y., Japan Analyst, 6, 568 (1957).
8. Ishibashi M., Shigematsu T., Nishikawa Y., Nippon Kagaku Zasshi, 77, 1474 (1956).
9. Schachter D„ J. Lab. Clin. Med., 58, 495 (1961).
10. Evcim N., Reber L. A., Anal. Chem., 26, 936 (1954).
11. Chariot G., Anal. Chim. Acta, 1, 233 (1947).
12. Pa pish L., Hoag L. E., Proc. Natl. Acad. Sci. U. S., 13, 726 (1927).
13. Hof man J., Casopis Lekaru Ceskych, 100, 1171 (1961).
14. Г о p д и e в с к и й А. В., Устюгов Г. П„ Изв. высших учебн. заведений, Хим. и хим. техн., 4, 366 (1961).
15. См., например, J а г g е n s е n С. К., Absorption Spectra and Chemical Bonding in Complexes, Pergamon Press, Oxford, 1962.
16. Более подробно этот вопрос обсуждается в сб. «Современная химия координационных соединений», под ред. Дж. Льюиса и Р. Уилкинса, ИЛ, М„ 1963.
17. Gill N. S„ Nyholm R. S„ J. Chem. Soc., 1959, 3997.
18. Последний обзор см. Mason S. F„ Quart. Rev., 15, 287 (1961).
19. Schwarzenbach G., Biedermann W., Helv. Chim. Acta, 31, 678 (1948).
20. Schwarzenbach G., Gysling H., Helv. Chim. Acta, 32, 528, 1108, 1314 (1951); Schwarzenbach G., Anal. Chim. Acta, 7, 141 (1952).
21. A yr e s G. H„ Y ou n d F., Anal. Chem., 22, 1281 (1950).
22. Leonard M. A., West T. S„ J. Chem. Soc., 1960, 4477.
192
ГЛАВА 8
23. F i s с h е г H., Weyl W., Wiss. Veroffentl. Siemens—Konzern, 14, № 2, 41 (1935).
24. Hubbard D. M., Ind. Eng. Chem. (Anal. Ed.), 12, 768 (1940).
25. Or gel L. E„ Quart. Rev., 8, 422 (1954).
26. P e r r i n D. D., J. Am. Chem. Soc., 80, 3852 (1958).
27. Ballhausen C. J., Gray H. B., Inorg. Chem., 1, 111 (1962).
28. Franck J., Scheibe G., Z. physik. Chem., 139A, 22 (1929).
29. Rabin owitch E., Rev. Mod. Phys., 14, 112 (1942).
30. Lin hard M., Weigl M., Z. anorg. Chem., 266, 49 (1951).
31. Оргел Л., Введение в химию переходных металлов. (Теория поля лигандов.) Изд-во «Мир», М., 1964.
32. Cagle F. W., Smith С. F., J. Am. Chem. Soc., 69, 1860 (1947).
33. Richter F. P., Ph. D., Thesis, Univ, of Illinois, 1941.
34. Burgers J., Hoefnagel M. A., Verka de P. E., Visser H., Wepster В. M., Rec. Trav. Chim., 77, 491 (1958).
35. Alien F., Weiland H., L о о f m a n H., Angew. Chem., 46, 668 (1933).
36. К у з н e ц о в В. И., К a p а н о в и ч Г. К., Д р а п к и н а Д. А., Заводск. лаб., 16, 787 (1950).
37. Berg R., Becker Е., Z. Anal. Chem., 119, 81 (1940).
38. См. 16, стр. 270.
39. McCurdy W. Н., Smith G. F., Analyst, 77, 846 (1952); Smith G. F., Anal. Chem., 26, 1534 (1954).
40. Brandt W. W„ Smith G. F., Anal. Chem., 21, 1313 (1949); S m i t h G. F., M с C u r d у W. H., Anal. Chem,, 24, 371 (1952).
41. Diehl H., Buchanan E. B., Taianta, 1, 76 (1958).
42. Smith G. F., Wilkins D. H„ Anal. Chem., 25, 510 (1953).
43. В 1 a i r D. E., Diehl H., Taianta, 7, 163 (1961).
44. Blair D. E., Diehl H., Anal. Chem., 33, 867 (1961).
45. Schilt A. A., Smith G. F., Anal. Chim. Acta, 15, 567 (1956).
46. Walter J. L., F reiser H., Anal. Chem., 26, 217 (1954).
47. Collins P. F., Diehl H., Smith G. F., Anal. Chem., 31, 1862 (1959).
48. D i e h 1 H., Buchanan E. B., Smith G. F., Anal. Chem., 32, 1117 (1960).
49. Trusell F„ Diehl H„ Anal. Chem., 31, 1978 (1959).
50. Sen B., Anal. Chim. Acta, 22, 22 (1960).
51. Banerjea D. K., Tripathi К. K., Anal. Chem., 32, 1197 (1960).
52. A 1 b e r t A., P h i 11 i p s J. N., J. Chem. Soc., 1956, 1294.
53. S c h i 11 A. A., Smith G. F., H ei mbuc h A., Anal. Chem., 28, 809 (1956).
54. Baiulescu Gh. Cuirea I. C., Z. anal. Chem., 166, 5 (1959).
55. Organic Reagents for Metals, Hopkin and Williams, Chadwell Heath, Essex, England, 5th ed., 1955, Vol. 1, p. 103.
56. С 1 u 1 e у H. J., Analyst, 76, 523, 530 (1951).
57. S a n о H., Taianta, 2, 187 (1959).
58. Лебедева H. В., Назаренко В. A., Tp. Комиссии по аналит. химии, 11, 287 (1960).
59. Kimura К., A sad a M., Bull. Chem. Soc. Japan, 29, 812 (1956).
60. Назаренко В. А., Шустова M. В., Заводск. лаб., 23, 1283 (1957); Назаренко В. А., Лебедева Н. В., Заводск. лаб., 25, 899 (1959).
61. К е п п у F., К u г t z R. В., Anal. Chem., 29, 543 (1957).
62. Е г d е у L., В u z a s I., Anal. Chim. Acta, 15, 322 (1956).
63. Erdey L., Acta Chim. Acad. Sci. Hung., 3, 81, 95, 105 (1953); Erdey L., В u z a s I., Acta Chim. Acad. Sci. Hung., 6, 77, 127 (1955).
64. E r d e у L., В u z a s I., Anal. Chim. Acta, 22, 524 (1960).
ГЛАВА 9
Растворимость комплексов
1. ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ РАСТВОРИМОСТЬ В ВОДЕ
Вода является высокополярным растворителем, к тому же сильно ассоциированным вследствие наличия между его молекулами прочных водородных связей. Условием хорошей растворимости вещества в воде должна быть его способность разрушать часть структуры воды и переходить в сольватированное состояние. Органические вещества с небольшими молекулами, например простые спирты, альдегиды, амины, карбоновые кислоты и кетоны, растворяются в воде главным образом за счет образования водородных связей. Сера при образовании водородной связи гораздо менее эффективна, чем кислород, поэтому замещение в соединениях аналогичной структуры О на S всегда приводит к понижению растворимости их в воде. Азот образует водородные связи, лишь немного менее прочные, чем связи кислорода. Неспособные к такого рода взаимодействиям алифатические углеводородные цепи и ароматические кольца понижают растворимость вещества в воде, причем по мере удлинения цепи или при введении большего числа колец этот эффект усиливается. С другой стороны, ионы и высокополярные вещества оказывают достаточное электростатическое притяжение и ориентируют вокруг себя молекулы воды. Последние же в свою очередь образуют водородные связи с другими молекулами растворителя. Вот почему нейтральные соединения, незначительно растворимые в воде, легко растворяются в щелочных (из-за образования аниона) или кислых (вследствие образования катиона) средах. Это свойство часто имеет большое значение при выборе условий применения органического реагента. Качественно можно представить себе, что процесс растворения вещества частично заключается в ориентации вокруг него молекул растворителя. Поэтому поверхность сольватированной молекулы мало отличается от всей массы растворителя. Следовательно, можно ожидать, что растворимыми в воде будут высокополярные вещества или вещества, уже напоминающие своим строением воду.
Бис-комплекс меди(II) с глицином LXXII, не имеющий суммарного заряда, обязан своей растворимостью в воде высокопо-
13 Д- Перрин
194
ГЛАВА 9
лярной природе молекулы и малой величине углеводородной цепи. Этим же можно объяснить растворимость комплексов металлов с EDTA, а также, что такие комплексы не экстрагируются из водных растворов органическими растворителями *.
ОС—О H2N—СН2
Си
Н2С—NH2
LXXH
Растворимость глицината меди следует сопоставить с нерастворимостью комплексов меди с хинальдиновой кислотой (хино-лин-2-карбоновой кислотой) LXXIII, антраниловой кислотой
LXXtlt
LX'XIV
LXXIV и сс-амино-н-капроновой кислотой, в которых характер связи металл—лиганд качественно подобен характеру связи в комплексе с глицином.
Другое качественное объяснение плохой растворимости многих неорганических солей типа карбонатов и фосфатов заключается в том, что эти анионы способны образовывать решетчатые структуры. Анионы указанных солей соединяются с металлами таким образом, что образуют объемистый каркас, включающий ионы металла и анионы. Размер этого каркаса влияет на растворимость. Подобное явление наблюдается, вероятно, при образовании комплексов сурьмы и висмута с пирогаллолом. Два фенольных атома кислорода в любой молекуле лиганда связаны с одним ионом металла, в то время как третий атом кислорода связан с другим атомом металла. В свою очередь каждый такой
* Если в водный раствор ввести какой-либо достаточно большой органический катион, то комплексы с EDTA экстрагируются органическими растворителями. Это свидетельствует о том, что растворимость комплексонатов в воде объясняется, по-видимому, наличием свободной карбоксильной группы. — Прим, перев.
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
195
ион металла связан со следующей молекулой пирогаллола. (Один атом металла со всеми тремя атомами кислорода одной молекулы пирогаллола не может быть связан из-за стерических препятствий.) Получающиеся в результате комплексы гораздо менее растворимы, нежели комплексы пирокатехина.
Стерические эффекты могут препятствовать образованию нерастворимых комплексов. Бис-комплекс 2-метил-8-оксихинолина с алюминием заряжен положительно и растворим в воде. Небольшие размеры иона алюминия не позволяют присоединиться к еще одному аниону 2-метил-8-оксихинолина с образованием ожидаемого незаряженного и нерастворимого в воде трис-комплекса. Это обстоятельство находит аналитическое применение при отделении алюминия от цинка и более крупных катионов.
В тех случаях, когда необходимо, чтобы комплекс металла хорошо растворялся в воде (например, для разработки фотометрических методов, не основанных на экстракции органическими растворителями), этого можно достигнуть введением в молекулу лиганда сульфо- или других сильно ионизированных групп*. Так, трис-комплекс 8-оксихинолина с Fe(III) не имеет заряда и нерастворим в воде, а соответствующий комплекс 8-оксихинолин-5-сульфокислоты легко растворяется. Можно сравнить также комплексы пирокатехина и тайрона. Растворимость в воде комплексов с объемистыми лигандами типа торона (используемого в качестве фотометрического реагента на Th, Pu, Zr, U, Be, Np и Bi) является прямым следствием наличия сульфо-групп. Подобным же образом, диалкилдитиокарбаматы меди почти не растворимы в воде, а наличие карбокси-группы в 3-карбоксипента-метилендитиокарбамате LXXV приводит к тому, что комплекс меди с этим реагентом оказывается растворимым.
НгС—СН2
Na+~OOC—CH N CSS~ Na+
Н2С—СН2
LXXV
* Следует отметить, что сульфо-группа является сильным акцептором электронов. Поэтому введение ее в молекулу реагента, особенно содержащего сопряженные участки, приводит к заметному изменению распределения электронной плотности и в большинстве случаев вызывает более или меиее существенные изменения его комплексообразующей способности. Достаточно наглядными примерами могут служить общеизвестные случаи изменения свойств комплексов металлов со следующими парами реагентов: салициловая кислота— сульфосалициловая кислота, 1,8-диоксинафталин— 1,8-диоксинафталин-3,6-дисульфокислота (хромотроповая кислота), пирокатехин — тайрон (пирокатехин-3,5-дисульфокислота). Об этом также свидетельствует и значительное различие в свойствах (величина рКа, окраска нейтральной молекулы и аниона) pH-индикаторов групп фталеинов и сульфофталеинов. — Прим, перед,
13*
196
ГЛАВА 9
Сульфо-группа унитиола (2, З-димеркаптопропан-1-сульфонат натрия) сообщает его комплексам с металлами хорошую растворимость, поэтому унитиол рекомендуют в качестве маскирующего реагента для ионов ртути, свинца и цинка, которые взаимодействуют преимущественно с содержащими серу лигандами [1]. Введение в молекулу фенилфлуорона п-диметиламино-группы сообщает его комплексам с металлами растворимость в кислых средах [2].
В ряду родственных лигандов, таких, как анионы 8-оксихи-нолина и его 5, 7-дихлор- и 5, 7-дибромпроизводных, уменьшение растворимости комплексов в воде по мере увеличения размеров молекулы реагента приводит к смещению равновесия комплексообразования. Совершенно независимо от влияния на константы устойчивости комплексов реагенты с большими молекулами являются более эффективными осадителями в кислых средах, чем исходное соединение.
Теоретически растворимость электролитов в воде можно вычислить при помощи термодинамического цикла, в котором ионы твердого кристалла сначала испаряются, а затем гидратируются. Работа, требующаяся для осуществления первого процесса, равна энергии решетки кристаллического твердого вещества [3], а на второй стадии учитывается теплота гидратации газообразного иона.
Практически, однако, такие вычисления не позволяют получить абсолютные значения растворимости, ибо мы имеем дело с разностью очень больших величин. С другой стороны, они позволяют делать некоторые качественные предсказания. Так, изменение свободной энергии, имеющее место при переносе сферы с зарядом ге из вакуума в ячейку растворителя радиусом г, определяется уравнением Борна
— ДО
_ (ге)2 / 1 \
2r D )’
где D — диэлектрическая проницаемость растворителя. Теория Борна предсказывает также, что энтропия и, следовательно, теплота гидратации будут меняться с изменением (ze)2lr. В связи с этим следует ожидать, что растворимость ионов в растворителях с низкой диэлектрической проницаемостью будет меньше, чем в воде. Далее теория предсказывает, что, если в ряду ионов родственных металлов энергии кристаллических решеток сравнимы, растворимости будут уменьшаться по мере увеличения размера катиона. (Энергию решеток можно примерно оценить по температурам плавления.) Увеличение растворимости с повышением температуры обусловлено усилением ионных колебаний в кристаллах, вследствие чего для разделения кристалла на составляющие его компоненты требуется меньшая энергия.
ЭДСТВОРИМОСТЬ КОМПЛЕКСОВ
197
Другим следствием зависимости растворимости от энергии «ристаллической решетки является тот факт, что если вещество может существовать в двух кристаллических формах, то более растворимой является метастабильная модификация. Отчасти именно поэтому, например, многие осадки при старении делаются менее растворимыми. (Другой причиной является то, что в результате влияния поверхностного натяжения небольшие частицы более растворимы, чем крупные. Это приводит к медленному росту больших частиц за счет меньших с постепенным уменьшением растворимости.)
В неполярных растворителях типа четыреххлористого углерода, бензола и петролейного эфира межмолекулярные силы значительно слабее. Эти соединения растворяют неполярные вещества гораздо легче, чем электролиты и полярные молекулы, что отчасти объясняется их химическим сходством и отчасти тем, что в неполярных веществах отсутствуют сильные электростатические эффекты, стабилизирующие твердое состояние в случае электролитов и полярных веществ.
2. ВЛИЯНИЕ pH НА РАСТВОРИМОСТЬ КОМПЛЕКСОВ И СОЛЕИ
Произведение растворимости K.s вещества АаВь, диссоциирующего в растворе на частицы А и В, определяется уравнением Ks= (аА)“(ав)ь, где а — термодинамические активности А и В в растворе в равновесии с твердым веществом АаВь. Для обсуждения допустим, что коэффициенты активностей равны единице. (Другими словами, пренебрежем влиянием ионной силы. Коэффициенты активности в разбавленных растворах определяются уравнением Дебая — Хюккеля —logf=Az2n'l2/(l + Вц), где А и В — постоянные величины, z—заряд иона и ц — ионная сила раствора.) В таком случае имеем /Q= [А]“ [В]ь. С другой стороны, растворимость АаВь есть максимальная концентрация этого вещества, которую можно получить в данном растворе. Когда в растворителе находится только АаВь, она равна (К,/а“Ьь) но при увеличении [В] уменьшается Амакс.
Так, произведение растворимости AgCl равно 1,2-10~10, поэтому растворимость AgCl в дистиллированной воде равна 1,1 • 10“5Л1. Однако в 0,01 М растворе КС1 из-за влияния одноименного иона (дополнительные количества хлорид-иона) растворимость AgCl составляет лишь 1,2- 10-8Л1. При титровании смеси хлоридов и иодидов первым будет осаждаться иодид серебра (Ks= 1>7 • Ю-16), поскольку его произведение растворимости гораздо меньше, чем хлорида серебра. В момент начала осаждения
198
ГЛАВА 9
хлорида серебра концентрации хлоридов и иодидов одновременно удовлетворяют уравнениям
1 Ag+] [СГ] = 1,2 • 10“10, [Ag+] [ Г] = 1,7 • Ю“16.
Иначе говоря, концентрация иодидов равна 1,4 • 10~® концентрации хлоридов. Это весьма важный фактор, позволяющий количественно титровать иодид-ион в присутствии хлорид-иона, используя подходящий адсорбционный индикатор или серебряный электрод.
Добавление к таким системам комплексообразующих реагентов может значительно изменить растворимость индивидуальных веществ. Применение комплексообразующих агентов имеет большое значение для химического разделения веществ; в самом деле, один ионный компонент можно перевести в комплексный ион и сохранить благодаря этому в растворе, когда другие компоненты осаждаются. Или наоборот, необходимое вещество можно осадить в виде нерастворимого комплекса, в то время как другие соединения останутся в растворе. Сульфиды Cu2+, Cu+, Cd+ почти нерастворимы (Ks=6 - 10-45, 2- 10-47 и 1 • 10-28 соответственно), но добавление к нейтральному раствору солей Си2+ и Cd2+ цианид-иона приводит к образованию комплексов Cu(CN)43“ [соединение меди (I)] и Cd(CN)42~ с логарифмами констант устойчивости 27,7 и 16,9 соответственно, в результате чего предотвращается осаждение C112S, но не CdS. Причина этого различия становится очевидной, если равновесия, определяемые величинами произведений растворимости и констант устойчивости, рассмотреть количественно.
Принципы, положенные в основу такого рассмотрения, можно выразить математически. Некоторые типичные случаи были обсуждены в работе [4]. Принципы эти можно охарактеризовать следующим образом.
Лиганды являются акцепторами протонов, и если Kai, Kai- • • представляют собой константы диссоциации моно-, ди- и т. д. протонированных частиц HL, H2L... (заряды опущены), то при любом значении pH концентрация лиганда связана с общей концентрацией лиганда (плюс его протонированные формы) уравнением
[L] (1 +-И. \ A ai
[н+]2
KaiKdl
— [6]обш-
(1>
Для удобства выражение, стоящее в круглых скобках, обозначим через а. Это уравнение имеет общий характер, и его применяют независимо от того, является ли L анионом или нейтральной молекулой. Если [М]общ — общая концентрация данного металла
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
199
и f — доля металла, осажденного при данном pH, то можно рассчитать [4], что
(п \п
1Чбщ--^ЛМ]общ) = KS-^, (2)
где осажденным комплексом является MmLn-
Исследование уравнения (1) показывает, что а быстро увеличивается с ростом концентрации ионов водорода (по мере понижения pH среды) и, следовательно, в соответствии с уравнением (2) количество комплекса, осажденного при постоянных [Цобщ и [М]0бщ, уменьшается. Другими словами, растворимость комплексов возрастает в кислых растворах, что часто позволяет при тщательном контроле pH количественно разделять два или большее число элементов. При pH 2,0 медь можно количественно осадить хинальдиновой кислотой из раствора 0,001 М по Си2+, 0,001 М по Cd2+ и 0,003 М по Zn2+. Произведения растворимости комплексов 1:2 равны соответственно 1,6• 10-17, 5,0• 10~13 и 1,6 • 10-14, а рЛа лиганда примерно равен 5 [5].
Другое следствие из уравнения (2) заключается в том, что чем выше в комплексе отношение лиганд—металл (в случае однотипных лигандов), тем больше будет влияние изменений pH на растворимость комплексов.
Если в раствор для предотвращения осаждения иона металла осадителем X в виде М.тХ„ добавить лиганд, образующий устойчивый комплекс, то результатом увеличения pH будет уменьшение а и, следовательно, увеличение общей концентрации металла в растворе. В этом случае можно написать
[М]общ= [М] + [ML] + [ML2] + ...,
= [М] (1+K[L] +fe[L]2 ...),
= [М] • 7. (3)
До тех пор пока [М]< (As/[X]n)1''m, осаждения не будет происходить. Если добавлен полидентатный лиганд типа EDTA, образующий с металлом комплексы только состава 1:1, количество лиганда, необходимое для предотвращения осаждения, определяется выражением
1 Г/ 1X1" \Vrn Т
-[MW-1J. (4)
Соотношение между [L] и [Ь]Общ дается уравнением (1). Этот процесс «связывания» иона металла для предотвращения образования осадка иногда называют «секвестрацией».
При условии, что не происходит образования смешанных комплексов, включающих и гидроксил и лиганд уравнения (3) и (4) можно непосредственно применять в случае гидролиза ионов металла (Х = ОН_). Однако уравнение (2) не соблюдается, если
200
ГЛАВА 9
в изучаемой области pH ион металла заметно гидролизуется. Вследствие гидролиза концентрация свободного иона металла уменьшается, поэтому требуется более высокая концентрация осадителя, чем это следует из уравнения (2). При достаточно высоком значении pH будет осаждаться сама гидроокись металла. Так как при гидролитических процессах часто образуются поли-ядерные частицы, то пока не было предпринято никаких попыток детально исследовать математические зависимости, применимые к таким системам.
Если высшие комплексы не образуются, растворимость малорастворимых веществ уменьшается при введении избытка осадителя.
3. СОЛИ И КОМПЛЕКСЫ ЩЕЛОЧНЫХ МЕТАЛЛОВ
Это общее рассмотрение объясняет, почему в случае щелочных металлов чем крупнее катион, тем больше он образует нерастворимых солей. Натрий имеет очень мало нерастворимых солей; наиболее важны из них двойные Na-Zn- и Na-Mg-уранилаце-таты, осаждающиеся из разбавленной уксусной кислоты. Эти соли используют для количественного определения натрия, причем концентрацию натрия (молярную) считают равной концентрации урана, который можно определить в виде желтого роданида уранила. К другим труднорастворимым солям натрия относятся антимонат, фторосиликат и алюминийфторид. Для гравиметрического определения натрия также можно использовать малую растворимость его ОЬ-(а-метокси)фенилацетата [6].
Перхлорат натрия легко растворяется в воде, но перхлораты, перйодаты и гексахлороплатинаты К, Rb, Cs довольно плохо растворимы в воде и практически нерастворимы в 90%-ном этаноле (диэлектрическая проницаемость и влияние растворителя). Аналогично этому тетрафенилбораты лития и натрия умеренно растворимы в воде и применимы для осаждения тетрафенилбо-ратов К, Rb и Cs из нейтральных или слабокислых водных растворов [7]. Такое осаждение обычно используют в качестве гравиметрического метода определения этих металлов [8]. Другой путь — прямое титрование с амперометрическим определением конечной точки [9]. Как и следует ожидать, учитывая неспецифическую природу этой реакции, нерастворимые тетрафенилбораты образуют также и другие крупные однозарядные катионы — Ag+, Т1+ и Си+, а также многие содержащие азот основания. Медь(1) выделяют таким способом с применением аскорбиновой кислоты в качестве восстановителя [10]. Если для осаждения был использован тетрафенилборат лития, натрий можно затем определить при помощи тетра-п-толилбората лития [11]. К, Rb и Cs можно также осадить гексанитрокобальт(III)-ионом [Co(N02]e]3- и различными другими крупными анионами.
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
201
Одним из таких реагентов является гексанитродифениламин (дипикриламин, LXXVI), применяемый в виде литиевой, натриевой или магниевой соли [12]. Замещение атомов водорода ароматических колец на атомы галогенов или на нитро-группы приводит к понижению растворимости в воде, поэтому К-, Rb-, Cs-, Т1(1)- и NH4-coah дипикриламина лишь немного растворимы
NO2 no2
LXXVI
в воде *'. Для подавления гидролиза необходимо работать в щелочных растворах. Осадки растворяют в воде и раствор фотомет-рируют. Аналогичным образом был использован и анион пикриновой кислоты, но ее соли более растворимы.
Подобное рассмотрение объясняет, почему 6-хлор-5-нитро-толуол-3-сульфокислота и 2-бром-3-нитротолуол-5-сульфокислота образуют растворимые литиевые или натриевые соли, но осаждают более крупные ионы калия и рубидия.
Хотя интерпретация данных о растворимости солей и комплексов, основанная на рассмотрении сольватационных эффектов и размеров ионов, качественно, несомненно, справедлива, существуют и некоторые исключения. Диоксивинная кислота и ее калиевая и рубидиевая соли легко растворимы в воде, однако литиевая и натриевая соли ее растворимы очень слабо, несмотря на наличие в анионе ряда окси- и карбокси-групп.
Вследствие небольших размеров иона лития и поэтому большего ионного потенциала растворимость литиевых солей отличается от растворимости солей других щелочных металлов. Его можно осадить в виде фторида, карбоната и фосфата, а также в виде смешанных солей, например перйодата лития-калия-же-леза (LiKFelOe). Удобным осадителем лития в виде фосфата является холинфосфат в 50%-ном изопропаноле [13].
4. СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Свойства ионов щелочноземельных металлов достаточно близки. Растворимость их солей с крупными анионами, как, на
* Видимо, более важным результатом введения в молекулу дифениламина этих заместителей является значительное повышение кислотности вторичной амиио-группы и как следствие этого —подвижности атома водорода, благодаря чему реакции протекают с достаточной полнотой. — Прим, перев.
202
ГЛАВА 9
пример, S2O32-, SO42-, Юз-, BrO4- *, CrO42-, С2О42- и NO3-, уменьшается в ряду Mg2+>Ca2+>-Sr2+>-Ba2+.
Введение в молекулы ароматических или гетероциклических соединений нитро-групп делает их менее гидрофильными. Поэтому анион пикролоновой кислоты [1-(4-нитрофенил)-3-метил-4-нитропиразолон-5, LXXVII] образует с Mg, Ca, Sr, Ba, Мп, Fe, Pb, Си и Th нерастворимые соли. Осажденный из нейтральных
растворов кальций можно определить гравиметрически или фотометрически после окисления осадка до пиразолоновой сини [14].
Некоторые наблюдающиеся аномалии, например тот факт, что растворимость фторидов меняется по ряду Ba2+>Mg2+~ ~Sr2+>Ca2+, можно объяснить изменениями кристаллической структуры и, следовательно, энергий решеток. Не говоря уже о таких исключениях, следует ожидать, что растворимость в ряду солей, например галогенидов щелочноземельных металлов, будет наименьшей в тех случаях, когда радиус аниона близок к радиусу катиона (или, точнее, радиусу ячейки, которую катион занимает в растворе) или лишь немного больше его. (По данным Латимера, Питцера и Сланского [15], размер этой ячейки во всех случаях больше кристаллического радиуса катиона на 0,85 А, а размер ячейки аниона больше на 0,25 А.) В соответствии с этим предположением наименее растворимым из фторидов щелочных металлов является LiF и ряд, в котором изменяется растворимость, имеет вид: LiF<NaF<KF.
Большой размер однозарядного аниона бис(п-хлорфенил)-фосфорной кислоты обеспечивает осаждение из нейтральных растворов нерастворимых солей многих катионов, в том числе Mg, Ca, Sr, Ba, Fe, Со, Ni, Cu, Cd, Al, Cr, Pb и Sn (IV).
5. КОМПЛЕКСЫ С СЕРУСОДЕРЖАЩИМИ ЛИГАНДАМИ
В случае ионов переходных металлов другим важным фактором является энергия стабилизации кристаллическим полем. Можно ожидать, что благодаря увеличению прочности решетки эта энергия будет приводить к уменьшению растворимости простых ионных солей. Это может быть справедливо только в том
* Бромная кислота и ее соли неизвестны. — Прим. ред.
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
203
случае, если кристаллическое поле аниона будет сильнее, чем кристаллическое поле воды. Например, растворимость сульфидов изменяется в следующей последовательности: MnS > FeS >' >CoS>NiS>CuS<ZnS. Обычно же наблюдается обратный порядок, так как ионы типа I-, Вт-, F- и С1“ имеют более слабые поля, чем вода, благодаря чему гидратированные ионы выигрывают в устойчивости и растворение в воде облегчается. Сильные поля встречаются только в случае таких анионов, с которыми можно ожидать образования ковалентной связи, например в случае NCh- и CN~. Если в растворе присутствуют комплексы, а не гидратированные ионы, то необходимо учитывать энергии стабилизации полем лигандов. Однако ковалентная связь, особенно если ее образование приводит к нейтрализации заряда, оказывает, вероятно, гораздо большее влияние, обычно уменьшая растворимость.
Хорошо известным примером служит плохая растворимость многих сульфидов. Это справедливо и в случае 2-нафталида тио-гликолевой кислоты (тионалида, LXXVIII), который можно использовать для осаждения металлов из разбавленных растворов
LXXVIII
минеральных кислот. Связь в этом случае осуществляется атомом серы. Как и следует ожидать, такие реагенты наиболее пригодны для тяжелых металлов, образующих свои самые прочные комплексы именно с содержащими серу лигандами (например, для Cu, Ag, Au, Hg, As, Sb, Bi, Pt, Pd, Ru, Rh>Cd, Pb, Ni, Co, Мп, Tl). Так как тионалид легко окисляется, его часто применяют в присутствии подходящего восстановителя, например гидразина. Во многих случаях представляется вероятной координация иона металла также и с атомом кислорода или азота с образованием металлтионалидных комплексов, содержащих пятичленный хелатный цикл. Для гравиметрических определений образующиеся осадки применяют не очень часто. Аналог тионалида, анилид тио-гликолевой кислоты, содержит ту же группировку, и его применяют для этих же целей, но вследствие замены нафтильной группы на фенильную его комплексы с металлами более растворимы.
К другим осадителям, взаимодействующим с металлами своими ионизированными содержащими серу группами, относятся меркаптобензтиазол, 2-меркаптобензимидазол и 1-фенил-тетразол-5-тион, анион которого LXXIX было предложено использовать для гравиметрического определения кадмия [16].
204
ГЛАВА 9
Можно ожидать, что осадки дают также катионы Со, Ni, Zn, Ag, Hg и Pb. Представителями этого класса осадителей являются также висмутиол I (LXXX, R=H) и висмутиол II (LXXX, R = =фенил). Первый из них был использован для осаждения Fe, Си,
S~
LX X IX
LXXX
Pd, Ag, Au, Cd, Hg, Tl, Pb, As, Sb, Bi, Se и Те, причем необходимой избирательности достигали контролем pH и введением соответствующих маскирующих агентов. Применение экстракции органическими растворителями дает возможность использовать эти реагенты для спектрофотометрического определения.
К лигандам, дающим нерастворимые бидентатные хелаты за счет образования пятичленного цикла с участием атомов серы, относятся толуол-3,4-дитиол (дитиол) и 1-хлор-3,4-димеркапто-бензол. В этом случае окрашенные осадки также растворимы в органических растворителях. Эти реагенты являются более сильными восстановителями, чем H2S, так что во время осаждения Sn(IV) восстанавливается до Sn(II). К этой группе относится также дитиооксамид (рубеановодородная кислота), который может быть использован в качестве осадителя Си, Ni, Со, Pd, Pt и Au. Он легко подвергается гидролизу до H2S, поэтому Zn, Cd, Pb, Ag и Hg осаждаются им в виде сульфидов.
Группа SH в органических молекулах склонна, однако, к окислению до устойчивых дисульфидов R—S—S—R. В связи с этим меркаптаны и родственные им реагенты, как правило, неустойчивы.
6. я-ДИМЕТИЛАМИНОБЕНЗИЛИДЕНРОДАНИН
Наличие полярных групп, способных к образованию водородной связи с водой, хотя и является необходимым условием
LXXXI
растворимости органической молекулы в воде, само по себе еще не достаточно. Птеридин LXXXI очень хорошо растворим в воде,
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
205
но последовательное замещение атомов водорода на окси- или амино-группы делает его все менее и менее растворимым. Это объясняется тем, что возросшая неравномерность распределения по молекуле л-электронов значительно увеличивает межмолекулярное притяжение, приводя к образованию гораздо более прочной кристаллической решетки, о чем свидетельствуют высокие температуры плавления твердых веществ.
Этим, вероятно, можно объяснить малую растворимость в воде 5-(n-диметиламинобензилиден)роданина (LXXXII, температура плавления выше 200°), который применяют как осадитель
ьхххп
серебра, ртути (I и И), меди (I), золота и палладия из кислых сред. (Реагент добавляют в виде спиртового раствора.) Расположение NH-группы между группами СО и CS в значительной мере увеличивает ее кислотный характер. Это соединение является более сильной кислотой, чем о-нитрофенол (рКа соответственно 6,15 и 7,22). В комплексообразовании с металлами участвует отрицательно заряженный атом азота аниона LXXXII. В кислых средах этот реагент взаимодействует только с теми ионами металлов, которые легко поляризуются — благодаря низкой валентности или же из-за наличия заполненных или почти заполненных d-уровней. К ним относятся Ag(I), Au(I), Си (I), Pb(II) и Pt(II). В нейтральных и щелочных растворах, где отношение концентрации лиганда к общей концентрации реагента гораздо больше, мешают многие другие катионы. Суспензии свежеобразованных осадков используют в фотометрических методах определения серебра (красная окраска) [17], меди (I) (фиолетовая), ртути (I) (пурпурная) [18] и ртути (II) (красная) [18] с чувствительностью около 0,5 мкг/'мл. Вероятно, вследствие наличия в молекуле лиганда диметиламино-группы его бискомплекс с палладием растворим в разбавленных муравьиной, соляной и пропионовой кислотах; образование этого комплекса было предложено использовать для чувствительного спектрофотометрического определения палладия [19].
Другие соединения, имеющие по соседству с NH-группой группу CS, также образуют малорастворимые серебряные соли. К ним относятся, например, 2-тиогидантоин и продукты его конденсации с n-диметиламинобензальдегидом и нитрозодифениламином [20], а также 2-тио-5-кето-4-карбоэтокси-1,3-дигидропи-римидин [21].
206
ГЛАВА 9
7. ОСАЖДЕНИЕ АНИОННЫХ КОМПЛЕКСОВ КРУПНЫМИ КАТИОНАМИ
Из уравнения Борна следует, что энергия гидратации крупных ионов невелика, поэтому объемистые катионы или катионные комплексы осаждаются в присутствии объемистых анионов. Это явление иллюстрируется, например, осаждением Th4+ в виде его тетра-л/-нитробензоата. Катион бензидина применяют для осаждения сульфатов, фосфатов и вольфраматов. Тетрафениларсо-ний образует нерастворимые ионные пары с перхлорат-, перйодат-, перманганат- и перренат-ионами, а также с анионными хлоридными комплексами цинка, кадмия и ртути. Соответствующее соединение иона тетраметиламмония с анионным хлоридным комплексом золота было использовано для гравиметрического определения последнего [22].
Аминопроизводные трифенилметана — парафуксин, метиловый фиолетовый, кристаллический фиолетовый и малахитовый зеленый — могут образовывать трехзарядные катионы, в которых протонирована каждая амино-группа. Это указывает на то, что каждая амино-группа может принимать участие в комплексообразовании с металлами. Было высказано предположение, что в нерастворимых осадках, образованных PdCb и АиСК, две нейтральные аминогруппы координированы различными молекулами PdCh или АиС1з, а третья амино-группа протонирована и может образовывать ионную пару с PdCk2- или АиСЕ- [23].
Вероятно, нерастворимость тетракис-комплексбв миндальной (фенилгликолевой) кислоты с цирконием обусловлена отчасти отмеченным выше фактором, связанным с размерами ионов, и отчасти способностью атомов кислорода карбоксильной и оксигрупп каждого аниона лиганда занимать два (из восьми) координационных места катиона, так что ион циркония принимает участие в образовании четырех пятичленных циклов.
Нерастворимость в воде перхлората трис(1,10-фенантролин)-железа (III), несмотря на то что перхлорат самого трехвалентного железа растворим очень хорошо, объясняется аналогичным образом и соответствует аналогичному поведению многих алкалоидов и гетероциклических органических оснований. Если применяемый анион является алкилсульфатом или алкилсульфона-том с длинной цепью, то получающееся соединение можно экстрагировать хлороформом.
Аналогичным образом бис-комплекс этилендиамина с медью (II) образует с комплексными ионами [HgE]2- и [CdU]2- соли [Сиепг] [HgU] и [Сиепг] [Cdh], нерастворимые в воде, этаноле и эфире. Образование красно-фиолетового осадка [Ёе(Ыру)з] [Cdl4] является одной из наиболее чувствительных реакций на ион кадмия [24]. р-Нафтохинолин и ион фенилтриметиламмония
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
207
(четвертичное основание) можно также применять для осаждения кадмия в виде соответственно [ВН+]2 [Cdl42-] и [В+]2 [Cdl42-]. Подобным же образом с цинхонином и многими другими алкалоидами из слабокислых растворов солей висмута в присутствии иодид-ионов осаждается оранжево-красный осадок типа [ВН+][ВП4-].
Катионы таких оснований, как метиловый фиолетовый и родамин В, образуют малорастворимые соли с анионными комплексными роданидами цинка и меди. Если в качестве катиона применять метилиодид п-диметиламиностирил-р-нафтиазола, концентрацию получающихся комплексов можно определять спектрофотометрически [25]. Характерные кристаллы, образуемые кобальтом, железом (III) и цинком с акридином в качестве основания, было предложено использовать для капельного обнаружения [26].
В некоторых случаях аналогичные результаты наблюдаются при замещении воды в координационной сфере иона металла на молекулы пиридина; образующиеся водонерастворимые комплексы экстрагируются хлороформом. Типичными соединениями для Cu(II), Cd, Fe(II), Mn, Zn, Ni и Co являются Cupy2(SCN)2, Nipy4(SCN)2 и Copy4(SCN)2. Все они окрашены. Бензидин образует кристаллические комплексы общей формулы MR2(SCN)2 с Cd, Си, Hg и Zn.
Германий можно выделить, превратив его в триоксалатогер-маниевую кислоту, которая образует нерастворимые соли с крупными молекулами оснований, например хинином, стрихнином и 0-нафтохинолином [27].
8. ГИДРОФОБНЫЕ И НЕЙТРАЛЬНЫЕ ВНУТРИКОМПЛЕКСНЫЕ СОЕДИНЕНИЯ.
ХАРАКТЕРНЫЕ ПРИМЕРЫ
Можно ожидать, что при соответствующем значении pH кажущаяся растворимость комплексов данного лиганда с рядом ионов металлов будет изменяться в соответствии с константами устойчивости этих комплексов. Поэтому при обсуждении возможных осадителей, пригодных для данного типа катионов, приобретает значение природа координирующихся групп (содержат ли они атом азота, кислорода или серы, имеет ли место ароматическая или какая-либо подобная ей стабилизация). Кроме того, если требуется, чтобы образовался нерастворимый комплекс, а не ионная пара, лиганд обычно должен быть анионом, поскольку в этом случае может осуществляться необходимая нейтрализация заряда.
Исключения встречаются, например, в случае «инертных» комплексов и солей, где замещение координированных молекул
208
ГЛАВА 9
воды лигандом может снизить растворимость. Образование PdCh бис-комплекса с (3-фурфуральдоксимом служит примером, когда неорганическое соединение уже является нейтральной молекулой. Другим осадителем для PdCU является н-нитрозодифе-ниламин. В этом случае бис-комплекс образуется в результате связывания иона металла амино- или нитрозо-группой.
Ионную пару можно отличить от внутрисферного комплекса по тому, что в первом случае между центральным ионом металла и лигандом нет никакого контакта. Иначе говоря, при образовании ионной пары не происходит замещения молекул воды, сольватирующих ион металла, или других групп, непосредственно окружающих его. С другой стороны, процесс комплексообразования, протекающий в водном растворе, предусматривает частичное или полное замещение молекул воды, непосредственно окружающих ион металла, на одну или несколько молекул лиганда. Если получающийся в результате этого комплекс не имеет заряда и не содержит гидрофильных групп, можно ожидать, что он будет мало растворим в воде.
Сульфо-группы повышают растворимость в воде, а ароматические группы снижают ее. Остаток сульфиновой кислоты SO2H не столь эффективен, поскольку он содержит меньшее число свободных электронных пар, способных образовывать водородные связи с молекулами воды. Видимо, поэтому соли бен-золсульфиновой и бензолселениновой кислот и их производных с трехвалентным железом и четырехвалентными металлами нерастворимы, в то время как соответствующие соли сульфокислот растворяются в воде. Повышенной гидрофобностью объясняется также растворимость ароматических сульфиновых кислот в бензоле и эфире.
Осажденное из водных растворов внутрикомплексное соединение с большой гидрофобной поверхностью (например, трискомплекс 8-оксихинолина с алюминием) существует в форме, плохо смачиваемой водой. Поэтому оно относительно устойчиво к растворению даже в сильных кислотах. Если некоторые координационные места вокруг иона металла остаются занятыми молекулами воды, подобная стабилизация менее вероятна, как, например, в случае имеющих октаэдрическую структуру бис-комплексов бидентатных лигандов с двухзарядными ионами металлов.
Купферрон
Купферрон LXXXIII легко растворим в воде, поскольку молекула его содержит нитрозо-группу и анионный атом кислорода. Образование его трис-комплексов с Fe(III), Bi (III) или Ga (III), за счет связывания двух атомов кислорода делает эти группы
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
209
неспособными к гидратации, приводит к образованию комплексов типа LXXXIV, не имеющих суммарного заряда, и в то же
LXXXIII
LXXXIV
время оставляет его ароматические кольца выступающими в рас-творитёль. Эти комплексы осаждаются. В кислых средах осаждаются также Sn, Ti, U(IV), V и Zr. Как и можно было ожидать, это те металлы, которые образуют наиболее прочные комплексы с содержащими кислород лигандами. В менее кислых средах в виде нейтрального бис-комплекса осаждается Cu(II). Возможность ее отделения от других двухзарядных ионов — Мп, . Со, Ni и Zn — в данном случае объясняется частично более высокой константой устойчивости комплекса Си и частично — непрочностью связи Cu(II) с молекулами воды, занимающими пятое и шестое координационные месга. Купферрон осаждает также Nb и Та.
Растворимость комплексов еще более понижается при использовании неокупферрона, в молекуле которого фенильная группа замещена на нафтильную.
Можно привести и другие примеры понижения растворимости в воде, обычно наблюдающегося при увеличении гидрофобной части молекулы. Так, растворимость комплекса Cu(I) с тиогли-колевой кислотой СиЗСНгСООН уменьшается в двадцать раз, если перевести кислоту в ее анилид, а при использовании ее производного с а-нафтиламином— в пятьдесят раз.Точно так же Bi образует слабо растворимый селенит, но если к атому селена присоединить арильную группу, как, например, в случае бензол- или нафтилселениновой кислоты, то растворимость в воде будет гораздо меньше. Оба названные соединения предложены для гравиметрического определения Bi в виде его трис-комплексов [28].
Такого рода сопоставления следует делать с некоторой осторожностью. Например, вряд ли будет полезным сравнение сульфатов и арилсульфонатов, так как первый ион является двухзарядным и обнаруживает стремление к образованию решетчатых структур, в то время как фенилсульфонат-ион — однозарядный. Именно поэтому сульфаты щелочноземельных элементов нерастворимы в воде, а их фенилсульфонаты растворимы. Аналогич-
14 Д. Перрин
210
ГЛАВА 9
ные эффекты наблюдаются в случае присоединения двух фенильных групп к мышьяковой, фосфорной и борной кислотам.
Другие осадители, образующие пяти- и шестичленные хелатные циклы за счет присоединения металлов к атомам кислорода, обладают свойствами, качественно подобными свойствам купферрона. К ним относятся пирогаллол, галловая кислота, 9-ме-тил-2,3,7-триокси-6-флуорон, хлораниловая и родизоновая кислоты. Обычно трехзарядные ионы металлов образуют нейтральные нерастворимые трис-комплексы, а двухзарядные дают нейтральные бис-комплексы, которые нерастворимы, если металл образует преимущественно четырехкоординированные структуры. Реагенты обычно не избирательны; более устойчивые комплексы они образуют с многозарядными катионами.
Салицилальдоксим
К другим примерам образования незаряженных малорастворимых комплексов относятся комплексы типа LXXXV, образованные салицилальдоксимом со многими двухвалентными металлами. Сам салицилальдоксим растворим в воде довольно слабо,
и в его комплексах единственная на каждую молекулу лиганда ОН-группа не может обеспечить растворимости в воде *. Связывание металла осуществляется посредством атома азота и анионного кислорода. Поэтому салицилальдоксим является осадителем «широкого спектра» действия и его аналитическое применение в значительной степени зависит от pH среды. Алкилирование фенольной группы уменьшает комплексообразующую способность. Применение этого реагента в качестве избирательного осадителя меди(II) при pH 2,6—3,3 основано главным образом на том наблюдении, что комплексы Си(II) обычно гораздо более устойчивы, чем комплексы других двухвалентных металлов. При увеличении pH реагент осаждает следующие элементы: Ni(II), Pb(II), Hg(II), Co(II), Ag(I), Zn(II), Cd (II), Bi (III), Fe(II), Mn(II) и Mg(II). Нейтральный комплекс его c Pb(II) содержит лиганд и металл в отношении 1 : 1; в подходящих условиях ана-
* Эти ОН-группы, очевидно, блокированы внутримолекулярными водородными связями. — Прим. ред.
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
211
логичные комплексы образуют медь и цинк. Для образования этих комплексов требуется потеря двух протонов на каждый присоединяющийся ион металла. Была предложена структура LXXXVI с молекулами воды, занимающими, вероятно, четвертое координационное место иона металла. Нельзя, однако, исключить возможность того, что в этих комплексах оксим реагирует как таутомер с нитронной структурой, образуя комплексы типа LXXXVI I.
н2О
LXXXVI
В этом случае опять-таки характеристики реагента как осадителя можно несколько улучшить замещением при условии, что сохранятся основные черты — образование шестичленных хелатных колец за счет связывания металла по азоту и фенольному кислороду и a-конфигурация оксима. Ниже приведены некоторые оксимы, аналогичные салицилальдоксиму (все R = H, LXXXVIII)
LXXX VIII
по способности давать осадки с ионами меди (во всех случаях R = H, если это не оговорено).
R1 = C6H5; Ri = CH3; R! = CH3, R3=OH; Ri = CH3,
R4 = OH; R1 = CH3, R3=OCH3; R1 = CH3, R4=OCH3;
Ri = CH3, Rs=OCH3; Ri = CH3, R2, R3 = CgH4;
R1 = CH3, R3, R4 = C6H4; R1 = CH3, R2, R3=C6H4, R5 = COOH [29].
Усиливающее окраску влияние нитро-группы делает нитроса-лицилальдоксим лучшим реагентом для капельных проб.
Комплексообразующая оксигруппа реагентов этого типа должна быть или фенольной, или же входить в состав группы типа ацилоиноксима (в этом случае лиганд является двухзарядным анионом); окси-группы алифатических и алициклических систем 14*
212
ГЛАВА 9
обладают недостаточно кислым характером, чтобы можно было получить анионный лиганд желаемого типа.
Аналогичные комплексообразующие свойства имеют основания Шиффа, образованные на основе о-оксиальдегидов. Примером этому может служить бис-(салицилальдегид) этилендиамин, предложенный для гравиметрического определения никеля, с которым он образует нерастворимый комплекс LXXXIX. Хотя ос-
LXXXIX
нования Шиффа легко гидролизуются водой (с образованием альдегида и амина), присутствие катионов, образующих прочные комплексы, может сместить равновесие за счет связывания реагента в нерастворимый комплекс. По этой причине медь(II) осаждается в виде ее комплекса с салицилальдимином из аммиачного раствора, содержащего салициловый альдегид.
Другими осадителями, образующими шестичленные хелатные кольца за счет фенольного кислорода и имеющего двойные связи
хс
атома азота, являются 2-(о-оксифенил) бензимидазол ХС для ртути [30] и 2-(о-оксифенил) бензоксазол для кадмия [31].
а-Бензоиноксим
Нерастворимый, незаряженный комплекс меди с а-бензоинок-симом (купроном) состава 1:1, возможное строение которого показано формулами XCI и ХСП, обязан своей малой растворимостью большому числу фенильных групп, приходящихся на одну группу, способную координировать молекулы воды. С другой стороны, если анионный кислород способен служить донором электронов для второго атома меди, возможно образование трехмерной макромолекулы. Реагент отличается хорошей избирательностью по отношению к меди, но в кислых средах образует также осадки (неизвестного строения) с молибдатами, вольфраматами, ванадатами и солями уранила. По-видимому, в этом случае связь
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
213
осуществляется через атомы кислорода с образованием шестичленных хелатных циклов. Ограниченная растворимость самих
XCI
хси
а-бензоиноксимов, возможно, объясняется внутренней водородной связью между двумя ОН-группами.
Качественно подобное поведение по отношению к ионам меди в аммиачных растворах обнаруживают и многие другие ацило-иноксимы, в том числе не имеющие ароматических ядер ацето-иноксим, ацетолоксим, бутироиноксим и оксим фруктозы. Однако в этом случае комплексы менее устойчивы и диссоциируют при увеличении концентрации аммиака.
Арсоновые кислоты
Возможность применения арсоновых кислот ХСШ в качестве избирательных осадителей для четырехвалентных металлов — Sn(IV), Hf(IV), Th (IV), Се(IV), Ti(IV), U(IV) и WO4+ —легко объясняется на основе предыдущего обсуждения. В качестве примера можно рассмотреть реакцию Zr(IV) с фениларсоновой кислотой (ХСШ, К = СбН5). Осаждение обычно проводят из ~1 Л1
хеш XCIV
соляной или серной кислоты. В таком растворе цирконий находится главным образом в виде Zr4+ и его хлоридных и сульфатных комплексов [32], поэтому электростатическое взаимодействие его с анионными лигандами будет довольно сильным. Это позволяет фениларсоновой кислоте (p/(i3,6; p/G8,5) вести себя как биден-татный реагент, образующий незаряженный и малорастворимый бис-комплекс XCIV. Фениларсоновая кислота осаждает также Nb и Та. Способность фениларсоновой, но не н-пропиларсоновой кислоты осаждать Ti(IV) объясняется, вероятно, большей
214
ГЛАВА 9
гидрофобностью фенильной группы по сравнению с н-пропильной. В несколько менее кислых средах частично гидролизованные ионы металлов типа ZrO2+ могут еще образовывать нерастворимые комплексы; отношение металл—лиганд в этом случае равно 1:1. Избирательность реагентов определяется условиями их применения. Осаждение проводят при столь высокой кислотности (по сравнению с величиной р/( лиганда), что могут образовываться только наиболее устойчивые комплексы (с высокозаряженными катионами). Возможность осаждения смеси комплексов 1 : 1 и 1 :2 (что ведет к изменению состава осадка) вызывает необходимость прокаливания его до окиси металла или применения какого-либо другого метода количественного определения.
Именно поэтому маловероятно, что спектрофотометрический метод, основанный на определении количества п-диметиламино-бензолазофениларсоновой кислоты, содержащейся в ее осадке с цирконием [33], будет количественным методом.
Это возражение не распространяется на случай применения торона XCV, который в довольно кислых растворах образует с торием и цирконием растворимые красные комплексы
2:1 и находит применение как реагент для фотометрического определения этих элементов [34]. Подобным же образом о-арсоно-фенилазохромотроповая кислота была предложена в качестве фотометрического реагента на торий [35] *.
* Реагенты торон (торон I) и арсеназо I (о-аминобензолазохромотропо-вая кислота, уранон) были впервые синтезированы и введены в аналитическую практику, в том числе и для определения тория и циркония, В. И. Кузнецовым [ДАН, 31, 895 (1941)]. В 1959 г. был предложен реагент этой группы арсеназо III [С а в в и н С. Б., ДАН, 127, 1231 (1959)], позволяющий выполнять
спектрофотометрическое определение циркония и тория в сильно кислых средах (до 10 н. НС1). — Прим, перед.
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
215-
(Торон в сильно щелочных растворах взаимодействует также с литием, образуя оранжевый растворимый комплекс, пригодный для фотометрического определения примерно 0,1 мкг)мл Li [36] *. Окраска усиливается в присутствии ацетона, но природа связи в комплексе неизвестна.)
Включение хромофорных групп, например диметиламинофе-нилазо-группы, в молекулу осадителей типа фениларсоновой кислоты, обычно образующих с ионами металлов белые или желтоватые осадки, облегчает аналитические манипуляции с небольшими количествами осадка, поскольку он становится более заметным, и повышает точность капельных проб.
Дальнейшее усиление водоотталкивающих свойств лиганда в ряду арсоновых кислот и использование несколько менее кислых растворов позволяют выделять и другие катионы. В качестве примеров назовем осаждение Fe(III) (вероятно, FeOH2+) в виде комплекса состава 1:1с п- (н-бутилфенил)-арсоновой кислотой и Cd2+ (из уксуснокислых растворов) с 3-нитрофениларсо-новой кислотой. Осаждение Fe(III) такими реагентами предотвращается введением более сильных комплексообразующих веществ, например фторидов, фосфатов, тартратов или цитратов.
Координационно связанный атом кислорода арсоновой кислоты не имеет особого значения в комплексообразовании с металлом; это подтверждается тем, что арсиновые кислоты [—As(OH)2] можно также применять в качестве осадителей (ср. сульфоновые и сульфиновые кислоты).
8-Оксихинолин (оксин)
Те же общие рассуждения относятся и к использованию 8-ок-сихинолина для образования малорастворимых бис-комплексов с Mg, Мп, Со, Ni, Cu, Zn, Cd, Pb и In, трис-комплексов с Al, Fe, Bi и Ga и тетракис-комплексов с Th и Zr. Этот реагент осаждает и многие другие металлы, но в этом случае эффект менее яркий, поскольку сам лиганд растворим очень ограниченно. (Это связано с тем, что в 8-оксихинолине оксигруппа и гетероциклический атом азота образуют внутримолекулярную водородную связь. Поэтому в данном случае наблюдаются гораздо меньшая сольватация и меньшая растворимость по сравнению с хинолином.) Поскольку лиганд является анионом слабой кислоты, комплексообразующая способность 8-оксихинолина сильно зависит от pH среды. Это весьма важно для избирательного осаждения комплексов с оксином, поскольку чем меньше константа устойчивости комплекса, тем выше должен быть pH раствора для удовлетвори
* В качестве реагента на литий торон предложен В. И. Кузнецовым. — Прим. ред.
216
ГЛАВА 9
тельного его осаждения. Избирательность, которая достигается регулированием pH, можно еще более увеличить применением подходящих маскирующих реагентов. Вследствие соосаждения оксина и, возможно, из-за гидролиза иона металла многие комплексы оксина обладают нестехиометрическим составом. Тем не менее их широко используют в аналитической практике.
Молекула 8-оксихинолина была модифицирована введением атомов хлора и брома (обычно в положения 5 и 7). Это приводит к повышению устойчивости комплексов к кислотам, но в других отношениях не дает больших эффектов. Введение сульфо-групп способствует повышению растворимости в воде, как, например, в случае 7-иод-8-оксихинолин-5-сульфокислоты («феррона»), который образует с ионом железа(III) интенсивно синий растворимый трис-комплекс. Однако в случае более слабых комплексообразующих катионов может проходить солеобразование по сульфо-группе, что приводит к образованию нерастворимых соединений.
В тех случаях, когда осадки оксинатов имеют стехиометрический состав, их можно использовать для прямого гравиметрического определения. С другой стороны, можно титриметрически определить содержание 8-оксихинолина в осадке окислением или бромированием или применить подходящий спектрофотометрический метод, используя растворы оксинатов в кислотах или органических растворителях. В противном случае необходимо прокаливание до окиси металла.
4-Оксибензотиазол XCVI, образующий нерастворимые комплексы с медью, никелем и цинком [37], проявляет комплексообразующие свойства, близкие к свойствам 8-оксихинолина. Однако,
он
XCVI
вследствие того что неподеленная пара электронов атома серы имеет тенденцию к образованию водородной связи с водой, комплексы 4-оксибензотиазола несколько более растворимы.
Комплексообразование, протекающее с образованием пятичленного хелатного цикла, в котором ион металла связан с анионным кислородом и гетероароматическим атомом азота, может также осуществляться в случае а-карбоновых кислот, содержащих азот гетероциклов. В качестве примеров можно назвать «-пиколиновую, хинальдиновую и изохинальдиновую кислоты. Как и предполагали, они образуют нерастворимые комплексы с теми
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
217
же катионами, что и 8-оксихинолин. К этому классу удобно отнести также а- и о-аминокислоты, хотя их атом азота не способен участвовать в образовании л-связи (такая возможность существует, если азот является частью гетероциклической системы). Как осадители эти реагенты неизбирательны. Однако комплексы меди гораздо более устойчивы; в плоских квадратных комплексах молекулы воды удерживаются в координационных местах выше и ниже иона меди относительно слабо. Поэтому медь можно избирательно осадить из кислых растворов в виде ее бис-комплексов с аминокислотами типа антраниловой кислоты. (Соответствующие комплексы большинства других двухвалентных металлов более растворимы, поскольку их октаэдрическая стереохимия обусловливает гораздо более сильную сольватацию ионов металлов.)
Диоксимы
На первый взгляд может показаться, что очень малая растворимость бис-комплекса никеля с диметилглиоксимом является аномалией, ибо комплекс содержит две гидроксильные группы и два атома кислорода, которые,- как можно ожидать, легко гидратируются. Кристаллографический анализ показывает, что он имеет плоскую конфигурацию XCVII, в которой ОН- и О- связаны прочной внутренней водородной связью [38] и, следовательно, труднее сольватируются. Такая структура возможна.
XCVII
только в том случае, если атомы кислорода каждой молекулы диметилглиоксима (или других оксимов, применяемых для той же цели) обладают траис-конфигурацией, т. е. направлены в противоположные стороны. Остаточные ОН-группы в комплексе никеля (и также в комплексах других металлов) содержат способные к ионизации протоны. Поэтому комплекс представляет собой двухосновную кислоту, образующую в щелочных растворах соли.
Эта плоская структура и тенденция никеля к образованию-
218
ГЛАВА 9
в твердом состоянии слабых связей металл—металл и объясняют значительное уменьшение растворимости по сравнению, например, с комплексом Си(II), где такие связи не образуются. (Комплекс Си (II) в действительности имеет более высокую константу устойчивости, чем комплекс Ni (II) [39], но обладает совершенно другим строением: два цикла этой молекулы не лежат в одной плоскости [40].) Комплекс Pd(II) подобен комплексу Ni как по структуре, так и по растворимости. В обоих случаях можно представить себе, что пара электронов d^-орбитали металла образует связь с вакантной р-орбиталью лиганда, расположенной на более высоком уровне. Подобное объяснение применимо и в случае комплексов а-фурилдиоксима XCVIII, гептоксима XCIX и 4-ме-тилциклогексан-1,2-диоксима (С, R = CHg), которые в виде их
XCVIII
Н2С^ Н2С.
сн2
'C=NOH
/C=NOH
СН2
XCIX
R. СН2
НС C=NOH
I I
H2C\ >=N0H сн2
геометрических a-конфигураций также используются для гравиметрического определения Ni (II) и Pd(II). Преимущество этих осадителей по сравнению с диметилглиоксимом заключается главным образом в том, что они лучше растворяются в воде. (Они дают также осадок большего веса при одинаковых количествах Ni или Pd.) Родственное им соединение 1, 2, 3-циклогек-сантрионтриоксим также образует с никелем нерастворимый бис-комплекс. Его суспензию, стабилизированную в растворе желатиной, было предложено применять для спектрофотометрического определения никеля [41]. В комплексообразовании с металлом участвуют только две оксимные группы молекулы лиганда.
В том случае, если оксимные группы присоединены к ненасыщенному кольцу, как в а, р-нафтохинондиоксиме и о-хинондиок-симе, реагенты ведут себя как двухосновные кислоты, осаждающие из нейтральных растворов многие ионы металлов [42].
Фурильные группы a-фурилдиоксима должны делать этот реагент более сильной кислотой, чем диметилглиоксим. Поэтому эффективная концентрация лиганда (однозарядного аниона) в кислых растворах в первом случае несколько выше. Это дает возможность применять фурилдиоксим вплоть до pH 4,3, в то время как диметилглиоксим применяют при значениях pH выше примерно 5,1. Устранение свободного вращения вокруг связи, соединяющей два атома углерода, к которым присоединены атомы
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
219
азота, заметно повышает устойчивость получающихся комплексов. Поэтому, несмотря на то что значения рКа ниоксима (С, R = H) и диметилглиоксима близки, первый реагент можна применять в растворах вплоть до pH 3,4.
В качестве производного диметилглиоксима можно рассматривать оксамидоксим CI, который также образует с никелем нерастворимый бис-комплекс и дает растворимый комплекс с кобальтом, что используют для количественного определения последнего [43]. Для этих целей можно также применять нитрозогуанидин.
H,N—С—C-t-NH2
II II
HON NOH
CI
1,3-Диметил-4-имино-5-оксиминоаллоксан СП также был предложен в качестве органического реагента [44]. Оксимино-группы при С5 и имино-группа при С4 образуют с Ni и Pd(II), как и диоксимы, хелатное кольцо, в то время как в случае Fe(II), Си (II) и Со(II) комплексообразование может осуществляться за счет атомов азота и кислорода групп при С5 и Се. В обоих системах комплексообразование приводит к возникновению окраски. Комплексообразование, аналогичное наблюдаемому при использовании диметилглиоксима, возможно также в том случае, когда один из атомов азота является частью гетероциклического кольца, как, например, в 2-пиридилметилкетоксиме (СШ, R = = СН3) и 2-пиридилфенилкетоксиме (СШ, R = CeH5).
NOH
СШ
В обоих случаях образуются нерастворимые внутрикомплексные соединения с никелем.
Нитрозонафтолы
Нерастворимость трис-комплекса Со(III) са-нитрозо-р-нафто-лом CIV, так же как и хорошая растворимость соответствующего комплекса нитрозо-Р-соли, отличающегося только тем, что
220
ГЛАВА 9
он имеет шесть сульфо-групп, объясняется довольно легко. Реагенты типа а-нитрозо-0-нафтола неспецифичны и взаимодействуют подобным образом с Fe(III), Zr(IV), Сг(Ш), W(VI) и рядом других трех- и более высокозарядных ионов. В таких комплексах, где половина связей металл—лиганд осуществляется через атомы кислорода, следует ожидать относительно слабых
civ
эффектов поля лигандов. Преимущественно электростатическая природа взаимодействия металла с атомом кислорода объясняет, почему бис-комплексы этих реагентов с большинством двухвалентных металлов имеют более низкие константы устойчивости, чем низкоспиновые трис-комплексы Со(III), благодаря чему в кислых растворах эти ионы не мешают определению. Так, Со(III) можно определять в присутствии больших количеств Ni. Из менее кислых растворов ионы других металлов осаждаются.
Подобным же образом в диметилформамидном растворе Си (И) и Ni (II) можно определять спектрофотометрическим титрованием а-нитрозо-р-нафтолом [45], с которым они образуют устойчивые окрашенные комплексы. Комплекс Со(Ш) с нитрозо-R-солью, коль скоро он образовался, кинетически настолько инертен, что его растворы можно сильно подкислить; при этом комплексы с другими металлами диссоциируют, а комплекс Со(III) остается нетронутым. Причиной этого является, вероятно, низкоспиновое состояние последнего.
Растворимость октаэдрических комплексов, образованных двухвалентными металлами, определяется конкурирующими эффектами: гидрофобный характер ароматической части молекулы, например нафталинового ядра, будет частично компенсирован молекулами воды, которые сохраняются у иона металла в его бис-комплексе. Так, комплекс двухвалентного железа с а-нит-розо-р-нафтолом нерастворим в воде, но замена нафталинового ядра бензольным приводит к о-нитрозофенолу, дающему растворимый комплекс Fe(II). Подобным же образом гидратация иона металла препятствует экстракции комплекса петролейным эфиром, хотя сам реагент почти нацело переходит в этот растворитель.
Осадки, полученные с применением реагентов этой группы, часто содержат осадитель в количествах, превышающих теорети
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
221
ческие, и, поскольку они также неустойчивы при высушивании, их обычно прокаливают и взвешивают окислы металлов.
Хлораниловая кислота
Иногда удобно определять концентрацию катиона, добавляя известный избыток реагента, удаляя осадок и находя концентрацию неиспользованного осадителя. Примером тому служит определение кальция при помощи хлораниловой кислоты, основанное на спектрофотометрическом измерении окраски красного хлоранилат-иона [46]. Вариант этого метода заключается в применении хлоранилата бария для фотометрического определения сульфат-ионов [47]. При встряхивании плохо растворимого хлоранилата бария с буферным раствором, содержащим сульфат-ионы, происходит двойное разложение. Менее растворимый сульфат бария осаждается и эквивалентное количество хлоранилат-ионов переходит в раствор. После фильтрования концентрацию хлоранилата определяют спектрофотометрически, причем нижняя граница определения соответствует 0,06 мкг[мл сульфата. Аналогичный метод с применением хлоранилата ртути разработан для определения хлоридов [48]; при помощи хлоранилатов лантана [49], тория [50] и стронция [51] определяют фторид-ион. Кальций был также определен с применением броманиловой кислоты [52]. Хлоранилат лантана было предложено использовать для определения фосфатов [53].
С другой стороны, можно отфильтровать нерастворимый хлоранилат, промыть осадок, разложить его более энергичным комплексообразующим реагентом и освобожденную хлораниловую кислоту определить спектрофотометрически. (Этот метод может найти широкое применение. Так, кальций можно осадить в виде его нафтальгидроксамата, который в свою очередь можно растворить в EDTA и определить количество свободного иона нафтальгидроксамата [54].)
Представляется вероятным, что в комплексах металлов с хлораниловой кислотой CV, так же как и в случае родизоновой кислоты CVI, образуются пятичленные хелатные циклы с участием
CVI
соседних атомов кислорода фенольной и хинонной групп. Оба эти реагента можно использовать как довольно неизбирательные
222
ГЛАВА 9
осадители для капельных проб, основанных на образовании с металлами окрашенных комплексов. Вследствие сходства с хлораниловой кислотой тетраокси-п-хинон должен взаимодействовать с металлами аналогичным образом, но его комплексы должны быть более растворимы в воде. К этому же классу реагентов относятся и оксиантрахиноны типа ализарина с той только разницей, что при комплексообразовании с ионами металлов обычно' образуются шестичленные циклы. В реакции принимают участие атомы кислорода, находящиеся в пе/ш-положении. Однако реагенты этой группы обнаруживают тенденцию к образованию коллоидных растворов. Поэтому часто не ясно, являются ли осадки с металлами (зачастую окрашенные) действительно комплексами или наблюдается адсорбция ионов металлов на поверхности частиц с образованием «окрашенных лаков».
Некоторые новые осадители
Бис-(аллилтиокарбамид)гидразин (дальзин, CVII) образует с Си, Hg, Ni, Pb, Pd и Zn нерастворимые комплексы CVIII состава 1:1, связывая эти металлы атомами серы и атомами азота
Н5С3—N Н— с —NH—NH—С —NH—С3Н5 || II
S S
CVII
Н5С3—N=C—NH—NH—С =N—C3H 5
S----М-----S
CVIII
гидразина. Реакции пригодны для гравиметрического анализа [55]. Другая возможность заключается в использовании даль-зина для определения Си (II) амперометрическим титрованием [56].
В качестве осадителей было предложено использовать лиганды, аналогичные диоксимам по их способности образовывать пятичленные циклы с ионом никеля за счет его связей с атомами азота. В тех случаях, когда можно написать структуры, аналогичные бис-комплексу с диметилглиоксимом, получаются нерастворимые комплексы никеля. В качестве примеров можно привести нитрозогуанидин CIX, три производных диметилглиоксима, соответствующих формуле СХ, где R=H, СНз и ОСНз, и хино-лин-2-альдоксим CXI. К тому же классу реагентов относится фе-нил-а-пиридилкетоксим СХП, предложенный для спектрофотометрического определения палладия [57], золота (III) [58] и железа (II) [59]. Нерастворимый в воде оранжево-желтый комплекс его с золотом растворяется в хлороформе.
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
223
H2N—с—N
II II
HN NOH
CIX
H,c—C-—C—CH, II II HON N—R
CX
NOH cxn
Связывание металла анионными атомами азота встречается редко, но оно было обнаружено, например, в случае бис-комп-лекса Си(II) с о-(n-толуолсульфамид)анилином СХШ, который
ехш
был предложен в качестве реагента для гравиметрического определения двухвалентной меди [60]. В качестве возможных осадителей металлов были также изучены аналогичные 8-сульф-амидхинолины [61]. Как и следует ожидать, в случае лигандов, связывающих ион металла двумя атомами азота, эти реагенты гораздо более избирательны, чем 8-оксихинолин и 8-меркаптохи-нолин. Предпочтительными катионами для них являются Ag+, Cu2+, Zn2+, Pb2+ Co2+ и Hg2+. Сульфамидная группа понижает растворимость комплексов в органических растворителях. Другим примером является бензо-1,2, 3-триазол CXIV, анион которого образует с Cu(II), Cd, Со, Fe(II), Ni и Zn нерастворимые в воде комплексы [62].
CXIV
224
ГЛАВА 9
Чтобы избежать некоторых недостатков купферрона, в качестве заменяющего его осадителя было предложено использовать М-бензоил-М-фенилгидроксиламин CXV [63]. В обоих случаях присоединение металла приводит к образованию пятичленных хелатных циклов, в которых участвуют анионный кислород и нейтральный атом кислорода с двойной связью. Поэтому следует
R,—N—ОН I
R2 —с=о
CXVI
ожидать образования аналогичных комплексов. Х-Бензоил-Х-фе-нилгидроксиламин образует нерастворимые комплексы сомногими катионами, для которых характерно связывание с анионным кислородом. К ним относятся Be, Al, Sc, Fe(III), Ti(IV), Zr, Th, Sn, Nb, Та, V, Mo(VI) и U(VI). Избирательность их осаждения зависит от pH раствора [64]. Во многих случаях эти нейтральные комплексы (например, трис-комплекс со скандием) экстрагируются органическими растворителями *.
Этот реагент является представителем класса реагентов общей формулы CXVI, другие члены которого, в том числе Ri= = С6Н5 или Н; R2=C6H4OH, С6Н5, С6Н5—СН = СН или C9H6N, также были описаны в литературе. Основные результаты этих замещений заключаются в изменении кислотности N—ОН-групп и электронной плотности на атомах кислорода С=О-групп (с тем исключением, что фенольная группа салицилгидроксамовой кислоты вследствие своей гидрофильности делает этот реагент гораздо менее эффективным осадителем). Эти различия приводят к соответствующим изменениям значений pH оптимального выделения металлов. Так, подобно КГ-бензоил-Х-фенилгидрок-силамину, в качестве осадителей для Nb и Та были предложены циннамоилгидроксамовая кислота и Н-циннамоил-Н-фенилгид-роксиламин [65].
Интересно предложение применять 2-тиофен-транс-альдоксим CXVII в качестве осадителя для палладия [66]. Он представляет собой один из немногих аналитически полезных хелатообразующих реагентов, в которых гетероатом серы принимает участие в комплексообразовании. Его свойства подобны свойствам р-фур-
* См. обзор: А л и м а р и н И. П., Судаков Ф. П., Головкин Б. Г., Усп. хим., 31, 989 (1962). — Прим. ред.
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
225
фуральдоксима, который также можно применять для гравиметрического определения палладия. Другим примером является
HON
CXV1I
CXVHI
фенокситин CXVIII, образующий с хлоридом палладия (II) в слабокислых растворах нерастворимый бис-комплекс.
9. РАСТВОРИМОСТЬ В ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЯХ
Многие комплексы, нерастворимые в воде из-за их неполярного характера, легко растворяются в неполярных растворителях. Так, оксинат трехвалентного железа и диметилглиоксимат никеля растворимы в хлороформе, а растворимый в воде комплекс трехвалентного железа с сульфокислотой оксина не растворяется в нем. Файгль [67] сделал заключение, что «хорошая растворимость в хлороформе характерна только для тех внутриком-плексных соединений, молекулы которых не содержат свободных кислотных или основных групп», относя к таким группам —С = О, — N = O, —ОН и —N—Н.
Влияние растворителей, содержащих гидрофильные группы, например ацетона и низших спиртов, на растворимость некоторых комплексов в водных системах легко понять, если учесть тенденцию этих групп вести себя в качестве доноров электронов и замещать молекулы воды в координационной сфере комплексов. С другой стороны, это влияние можно связать с уменьшением диэлектрической проницаемости и с тем фактом, что молекула такого растворителя имеет большее, чем молекула воды, химическое сходство с периферийными частями молекул комплекса. Последнее обстоятельство, по-видимому, лучше всего объясняет, почему комплексы меди с диалкилдитиокарбаматами достаточно растворимы в водно-этанольных смесях, содержащих более 40% этанола, но не в воде.
10. КОЛЛЕКТОРЫ
Если ион металла, образующий нерастворимый комплекс, присутствует лишь в следовых количествах, может оказаться целесообразным добавление большого количества другого металла, также образующего с применяемым реагентом нерастворимый комплекс. Последний может вести себя как коллектор, точно так же как сульфид меди выделяет из раствора сколь угодно малые 15 Д. Перрии
226
ГЛАВА 9
количества Mo, Zn, Pb, Sb и других металлов. Так, при осаждениях 8-оксихинолином в качестве коллекторов можно использовать Fe3+ и А13+. Аналогичным образом комплекс Fe3+ с купферроном извлекает из раствора следы Ti, V и Zr [68]. Коллектор может быть иногда совершенно химически отличным: осаждение сульфата бария из раствора, содержащего следы никеля и диметилглиоксим, приводит к выделению диметилглиоксимата никеля. В общем справедливо правило осаждения Фаянса. Оно утверждает, что чем меньше растворимость соединения, образованного микрокомпонентом смеси (если это катион) с анионом осадителя, тем большее количество его будет захвачено осадком.
Элегантной разновидностью этого метода, применимой для выделения ультрамикроколичеств, является использование в качестве коллектора самого осадителя. При этом работа ведется в условиях, когда осадитель кристаллизуется [69] *. Примерами служат концентрирование следов Ag, Au и Hg при помощи 2-мер-каптобензимидазола (вносимого в водную фазу в виде этанольного раствора) [70] и определение урана в морской воде с применением а-нитрозо-р-нафтола [71].
Таким образом, концентрирование использует положительную сторону явления соосаждения, которое обычно в химическом анализе считается нежелательным. Можно различить два основных типа соосаждения. Первый заключается в механическом захвате или физической абсорбции на поверхности осадка. Во втором случае имеет место проникновение внутрь кристаллической решетки. Примером этому, вероятно, является индуцированное осаждение CaSOi в присутствии BaSOi. По мере роста кристаллов BaSCh подходящим образом ориентированные сульфатные группы могут занимать в пространстве положение, удобное для захвата и ионов кальция, и ионов бария, в то время как в чистых растворах CaSCh такой твердой фазы нет. Ионы кальция, захваченные кристаллической решеткой, нельзя удалить оттуда без полного разрушения твердой фазы. Аналогичный эффект часто наблюдается при осаждении с использованием органических реагентов, когда ионы металлов соосаждаются в виде комплексов в областях pH, где эти комплексы обычно растворимы.
Использование хлорида одновалентной ртути в качестве коллектора для следов Au, Pt, Pd, Se и Те в кислых растворах следует рассматривать как нехарактерный пример, ибо на поверхности HgaCh и происходит восстановление до свободного элемента.
* Идея использования в аналитической химии соосаждения с органическими коллекторами с целью извлечения ультрамикропримесей была высказана Кузнецовым [ЖАХ, 9, 199, (1954)], предложившим несколько схем такого концентрирования (см. также Труды Комиссии по аналитической химии АН СССР, т. 15, «Наука», М., 1965). — Прим, перев.
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
227
11. ОБРАЗОВАНИЕ МИЦЕЛЛ
В особом случае органическая молекула типа углеводорода с длинной цепью, к одному из концов которой присоединена ионная группа, может образовать мицеллы. Известным примером служат обычные мыла, представляющие собой натриевые соли длинноцепочечных жирных кислот. При их содержании в водном растворе выше какой-то (обычно очень низкой) концентрации мыла перестают быть молекулярно диспергированными. Вместо этого они образуют мицеллы, представляющие собой коллоидные агрегаты, в которых гидрофильные группы находятся снаружи в контакте с водной фазой, а углеводородные цепи направлены внутрь. В неводных растворителях направление мицелл противоположно этому: полярные группы находятся в центральной части, а углеводородные цепи — в растворителе.
Эти детергенты могут быть катионами (например, хлорид це-тилпиридиния), неионными частицами (например, тетрадецилде-оксиполиэтиленглйколь) или анионами (например, лаурилсульфат натрия и натриевые соли длинноцепочечных жирных кислот). К металлсодержащим анионным детергентам для неполярных растворителей относятся [72]:
1. Щелочные и щелочноземельные мыла нафтеновых и сульфокислот из нефти и углеводородов (например, алкилнафталин-сульфокислот), а также алкилфеноляты и алкилфосфаты.
2. Алюминиевые мыла олеиновой, 2-этилгексановой, нафтеновой и нормальных жирных кислот С8—Cis.
3. Мыла ионов переходных металлов, в том числе Cu2+, Zn2+, Fe2+, Ni2+ и Со2+, с олеиновой, 2-этилгексановой, нафтеновой и нормальными жирными кислотами С8—С}8.
Растворы детергентов способны придавать растворимость многим органическим соединениям, которые обычно малорастворимы в данном растворителе. Это свойство может найти аналитическое применение. Оно было использовано, например, для получения порфиринов и их комплексов с металлами в мономолеку-лярном дисперсном состоянии при изучении их спектров и комплексообразующих свойств [73].
12. ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ ВЫБОР ОСАДИТЕЛЕЙ ДЛЯ НЕОРГАНИЧЕСКИХ КАТИОНОВ
Идеальный осадитель для любого данного вещества должен отвечать нескольким требованиям. Он должен давать малорастворимый комплекс, преимущественно в аналитически чистом виде. Кроме того, осадитель должен быть специфичным, давая осадок только с определяемым веществом. На практике органический реагент обычно взаимодействует с широким кругом металлов и, 15*
228
ГЛАВА 9
если требуется осадить в виде комплекса только один ион, необходимо подобрать особые экспериментальные условия. Это может потребовать тщательного контроля pH среды или введения в раствор других комплексообразующих веществ, чтобы замаскировать катионы, которые в противном случае будут мешать.
Факторы, определяющие природу и состав осадка, а также его пригодность или непригодность для аналитических целей, весьма многочисленны и с количественной точки зрения оценены недостаточно. Их характер можно представить себе, рассматривая процесс осаждения во времени. Сначала раствор становится пересыщенным, и рано или поздно в нем появляется несколько зародышей, пригодных для первоначального образования кристаллов. В зависимости от скорости образования зародышей и скорости роста кристаллов характер получающегося осадка может меняться от микрокристаллического до крупного и гранулированного. При стоянии размер кристаллов будет медленно возрастать, поскольку мелкие кристаллы более растворимы, чем крупные, поэтому последние растут за счет первых. Полная картина процесса, вообще говоря, сложнее. Могут наблюдаться адсорбция и соосаждение, и осадок может выделиться в аморфном состоянии. Кроме того, он может выделиться сначала в коллоидной форме, что потребует для ускорения коагуляции добавления поверхностноактивных веществ. Часто для понижения содержания нежелательных примесей может потребоваться перекристаллизация осадка. Очевидно, что все эти факторы также зависят от многих физических параметров, например температурных условий, pH, концентрации, скорости добавления реагентов и интенсивности перемешивания. Осаждение из гомогенных растворов уменьшает число этих трудностей, но такие процессы в значительной степени еще остаются эмпирическими. И опять-таки чувствительность капельных проб, основанных на осаждении, можно иногда значительно повысить, если на бесцветном или слабо окрашенном осадке адсорбировать окрашенное вещество. Это позволяет облегчить визуальное определение осадка. (В качестве примера можно привести адсорбцию n-нитробензолазо-а-нафтола на белом осадке Mg (ОН) 2.)
Тем не менее при выборе возможных осадителей для аналитической операции можно руководствоваться следующими принципами:
1. Комплекс не должен иметь суммарного электрического заряда и в нем должны также отсутствовать полярные группы, способные образовывать с молекулами воды водородные связи. Наиболее важными некомплексообразующими группами, которых следует избегать в лиганде, являются группы с неподеленной электронной парой на атомах азота или кислорода. Однако следует помнить, что, если неподеленная пара, скажем группы — NH
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
229
или —NH2, используется в образовании связи с металлом, она становится недоступной для координации с растворителем и поэтому растворимость при комплексообразовании уменьшается. Это относится, например, к комплексам металлов с иминодиук-сусной кислотой.
2. Комплекс должен иметь высокую константу устойчивости. Это условие предусматривает почти обязательное образование хелатного цикла, особенно с атомами лигандов, к которым ион металла имеет большое сродство. (Этот аспект обсуждался в гл. 3.) Оценить константы устойчивости комплексов с новыми лигандами (по крайней мере порядок величин) можно, используя опубликованные данные для аналогичных веществ. Среди ионов переходных металлов различия в константах устойчивости будут наибольшими для реагентов с высокими полями лигандов. Для осаждения Мп (II), в «высокоспиновых» комплексах которого не наблюдается стабилизации полем лигандов, из смеси с другими переходными металлами требуется, вероятно, применение кислородсодержащего осадителя в присутствии азотсодержащего комплексообразующего агента, маскирующего другие металлы этой группы. Аналогичный принцип осуществляется при осаждении Ni(II) диметилглиоксимом в присутствии Fe(III), Al (III) и Bi (III), но только эти группы лигандов меняются ролями.
По электростатическим причинам введение содержащих кислород двух- и трехзарядных анионов типа тартратов или цитратов благоприятствует образованию комплексов с трехзарядными катионами; комплексообразование с двухзарядными катионами гораздо слабее, но тем не менее оно часто имеет в анализе важное значение. Неизбирательность таких реагентов, как р-дике-тоны и купферрон, лишь слегка изменяется в случае лигандов типа 8-оксихинолина и антраниловой кислоты, где в образовании связи принимают участие кислород аниона и атом азота. Наоборот, существование сильного поля лигандов и образование в бискомплексе с диметилглиоксимом ковалентных связей с четырьмя атомами азота приводят к повышению прочности комплекса Ni(II) (система d8), но не комплекса Fe(III) (d5) или ионов непереходных металлов.
Вообще поиски избирательных осадителей или экстрагентов для катионов с заполненными или частично заполненными d-уровнями следует вести именно среди лигандов, имеющих в качестве донорных атомов азот и серу (таких, как дитизон и диэтилдитиокарбамат).
Для получения крайне мало растворимых осадков часто отдают предпочтение лигандам типа дитиооксамида, которые (связывая различные ионы металла группировками, расположенными на разных концах молекулы реагента) способны вести себя как мостикообразующие агенты и образовывать полиядерные
230
ГЛАВА 9
комплексы. Другим примером реагентов этого типа является ализариновый синий CXIX.
С.Х1Х
В литературе отмечалось, что в сильно кислых растворах ализариновый синий является специфическим реагентом для меди (II), с которой он образует синий кристаллический осадок [74]. Этот реагент можно рассматривать как замещенный 8-окси-хинолин и как замещенный 1-оксиантрахинон. В любом случае комплексообразующие группировки независимы друг от друга. Сродство 8-оксихинолина к Cu(II) хорошо известно; медный комплекс 1-оксиантрахинона тоже осаждается из аммиачных растворов [75]. Поэтому можно не сомневаться, что каждая молекула ализаринового синего координирует два иона меди, которые, связываясь с другими молекулами лиганда, образуют очень большой и исключительно мало растворимый полиядерный комплекс. С данной интерпретацией согласуется неспособность сульфид- или цианид-ионов разрушить этот комплекс. И действительно, если реагент добавить к цианидному раствору, содержащему медь(1), то происходит самоокисление и осаждается комплекс ализаринового синего с медью(II) [74]. Образование подобного полиядерного комплекса гораздо менее вероятно, если ионы металла образуют прочные связи либо с оксиновой, либо с оксиантрахиноновой частями молекулы (но не с обеими одновременно) или же с двумя фенольными группами.
3. Чтобы свести к минимуму соосаждение лиганда с комплексом металла, реагент должен быть гораздо более растворимым, чем комплекс.
4. Иногда имеет смысл ввести в молекулу лиганда группировки, которые после осаждения позволят выполнить спектрофотометрическое или объемное определение вместо гравиметрического. Так, в случае комплексов антраниловой кислоты, бензоиноксима, диметилглиоксима, 8-оксихинолина и салицилаль-доксима для объемного определения можно применить количественное бромирование. Спектрофотометрический метод был рассмотрен в разделе, посвященном хлораниловой кислоте.
5. В случае если метод предназначен для гравиметрического определения, комплекс металла должен иметь не только определенный состав, но и быть устойчивым к процессу высушивания.
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
231
Для доказательства температурной устойчивости комплекса и определения области допустимых для этой цели температур может быть полезно термолитическое исследование при помощи термовесов.
6. Метод гомогенного осаждения часто приводит к получению осадков, более чистых и находящихся в более удобной аналитической форме (например, в виде крупных и более однородных кристаллов) [76]. Он также позволяет тщательно контролировать условия осаждения. Для осаждения можно воспользоваться гидролизом, приводящим к образованию осадителя, как, например, в случае 8-ацетоксихинолина, превращающегося в 8-оксихино-лин [77]. Подобным же образом тиоацетамид вошел в аналитическую практику как заменитель сероводорода *. При гидролизе тиоацетамида получается сероводород, благодаря чему этот реагент применяют в качестве осадителя сульфидов из гомогенного раствора [78]. В качестве источника сульфид-ионов можно применять также этилдиотиокарбамат этиламмония [79]. Гидролиз мочевины в кислых растворах с образованием аммиака позволяет медленно увеличивать pH раствора.
К другим приложениям этого метода относятся вытеснение из комплекса с маскирующим агентом, окисление маскирующего агента, восстановление, отгонка маскирующего агента или растворителя. В некоторых случаях осадитель можно синтезировать in situ [80].
ЛИТЕРАТУРА
1. Вольф Л. А., Заводск. лаб., 25, 1438 (1959).
2. Kimura К., Saito К., As a dr a М., Bull. Chem. Soc. Japan, 29, 640 (1956).
3. Об энергиях кристаллических решеток и их значении в неорганической химии см. W a d d i n g t о n T. C., Adv. Inorg. Chem. Radiochem., 1, 157 (1959).
4. Leuss ing D. L., in Treatise on Analytical Chemistry, Kolthoff I. M., E lying P. J., eds., Interscience, New York, 1959, Vol. 1, Part 1, Chapter 17, p. 675.
5. F 1 a g g J. F., Organic Beagents, Interscience, New York, 1948, p. 63.
6. Reeve W., Christoffel I., Anal. Chem., 29, 102 (1957); Reeve W., Anal. Chem., 31, 1066 (1959).
7. Kohler M., Z. anal. Chem., 138, 9 (1953); Gloss G. H., Chemist-Analyst, 42, 50 (1953).
8. R af f P„ Brotz W., Z. anal. Chem., 133, 241 (1951).
9. Smith D. L, Jamieson D. R., Elving P. J., Anal. Chem., 32, 1253 (1960).
10. D a v i s D. G., Anal. Chem., 32, 1321 (1960).
11. Сазонова В. А., Леонов В. H., ЖАХ, 14, 483 (1959).
12. См., например, Lewis Р. R., Analyst, 80, 768 (1955).
13. С a ley Е. R., Simmons G. A., Anal. Chem., 25, 1386 (1953).
* См. книгу П. Я. Яковлева и Г. П. Разумовой «Тиоацетамид — заменитель сероводорода в анализе металлов», Металлургиздат, М., 1963. — Прим. ред.
232
ГЛАВА 9
14. Erdey L., Jankovits L., Acta Chim. Hung., 4, 235 (1954).
15. Latimer W. M., Pitzer K. S., Slansky С. M., J. Chem. Phys., 7, 108 (1939).
16. Moore С. E., Robinson T. A., Anal. Chim. Acta, 23, 535 (1960).
17. Schoonover I. C„ J. Res. Natl. Bur. Std. U. S., 15, 377 (1935).
18. Straff ord N., Wyatt P. F., Analyst, 61, 528 (1936).
19. Ayres G. H., Narang B. D., Anal. Chim. Acta, 24, 241 (1961).
20. Dub sky J. V., Mikrochem. Mikrochim. Acta, 28, 145 (1940).
21. S hep part S. E., Brigham R. H., J. Am. Chem. Soc., 58, 1046 (1936).
22. Maynard J. L., Ind. Eng. Chem. (Anal. Ed.), 8, 368 (1936).
23. F e i g 1 F., Chemistry of Specific, Selective and Sensitive Reactions, Academic Press, New York, 1949, p. 311.
24. Feigl F., Miranda L. I., Ind. Eng. Chem. (anal. Ed.), 16, 141 (1944).
25. Krumholz P., Krumholz E., Mikrochem., 19, 47 (1935).
26. M a r t i n i A., Mikrochem., 8, 144 (1930).
27. Tchakirian A., Ann. Chim., 12, 415 (1939); Willard H. H., Zuehlke C. W., Ind. Eng. Chem. (Anal. Ed.), 16, 322 (1944).
28. Сотников В. С., Алим ар ин И. П., Taianta, 8, 588 (1961).
29. Feigl F., Bondi А., Вег., B64, 2819 (1931); E p h a r a i m F., Вег., B64, 1210, 1215 (1931).
30. W a 11 e r J. L„ F r e i s e r H., Anal. Chem., 25, 127 (1953).
31. Walter J. L., Freis er H., Anal. Chem., 24, 984 (1952).
32. Larsen E. M„ Wang P„ J. Am. Chem. Soc., 76, 6223 (1954).
33. F e i g 1 F., Krumholz P., Rajmann E., Mikrochem., 9, 395 (1931).
34. Thomason P. F., Perry M. A., Byerly W. M., Anal. Chem., 21, 1239 (1949); Mayer A., Bradshaw G., Analyst, 77, 154 (1952); Banks С. V., Byrd С. H., Anal. Chem., 25, 416 (1953); Horton A. D., Anal. Chem., 25, 1331 (1953).
35, I s h a b a s h i M., Higashi S., Japan Analyst, 4, 14 (1955).
36. Thomason P. F., Anal. Chem., 28, 1527 (1956).
37. E r 1 e n m e у e r H., Schmid E. H., Helv. Chim. Acta, 24, 1159 (1941).
38. R u n d 1 e R. E., Godycki L. E., Acta Cryst., 6, 487 (1953); R u n-d 1 e R. E., J. Phys. Chem., 61, 45 (1957).
39. Charles R. G., Freis er H., Anal. Chim. Acta, 11, 101 (1954).
40. F r a s s о n E., Bar di R., Bezzi S., Acta Cryst., 12, 201 (1959).
41. Frierson W. J., Marable N., Anal. Chem., 34, 210 (1962).
42. Feigl F., Ind. Eng. Chem. (Anal. Ed.), 8, 401 (1936).
43. P e a r s e G. A., Pflaum R. T., Anal. Chem., 32, 213 (1960).
44. В u r g e r K., Taianta, 8, 77 (1961).
45. Takahashi I. T., Robinson R. J., Anal. Chem., 32, 1350 (1960).
46. F г о s t - J о n e s R. E. U., Yardley Y. T., Analyst, 77, 468 (1952); Tyner E. H., Anal. Chem., 20, 76 (1948); Gammon N., Forbes R. B., Anal. Chem., 21, 1391 (1949).
47. В e r t о 1 a c i n i R. J., Barney J. E,, Anal. Chem., 29, 281 (1957); Barney J. E., В er to 1 acini R. J., Anal. Chem., 30, 202 (1958).
48. Barney J. E., Bertolacini R. J., Anal. Chem., 29, 1187 (1957).
49. F i n e L., W у n n e E. A., Microchem. J., 3, 515 (1959).
50. H e n s 1 e у A. L., Barney J. E., Anal. Chem., 32, 828 (1960).
51. Bertolacini R. J., Barney J. E., Anal. Chem., 30, 202 (1958).
52. E r d e у L., Jankovits L., Acta Chem. Hung., 4, 245 (1954).
53. Hayashi K., Danzuka T., Ueno K., Taianta, 4, 244 (1960).
54. В aner jee D. K-, Bud k e С. C., Miller F. D., Anal. Chem., 33, 418 (1961).
55. Dutt N. K., Dutt a Ahmed A., Mikrochim. Acta, 1961, 571.
56. J а с о b s e n E., Ha ns teen C., Anal. Chim. Acta, 28, 249 (1963).
57. Sen B„ Anal. Chem., 30, 881 (1958).
58. Sen B„ Anal. Chim. Acta, 21, 35 (1959).
59. Truss el F., D i e hl H., Anal. Chem., 31, 1978 (1959).
РАСТВОРИМОСТЬ КОМПЛЕКСОВ
233
60. В i 11 m a n J. Н., J a n е t о s N. S., С h е г n i n R., Anal. Chem., 32, 1342 (1960).
61. Billman J. H., C h e r n i n R., Anal. Chem., 34, 408 (1962).
62. C u r t i s J. A., Ind. Eng. Chem. (Anal. Ed.), 13, 349 (1941).
63. Shorn e S. C., Analyst, 75, 27 (1950).
64. Примеры гравиметрических методов определения с использованием этого реагента см. в работах Das J., Shome S. С., Anal. Chim. Acta, 27, 58 (1962) для U (VI); Das J., Shome S. C., Anal. Chim. Acta, 24, 37 (1961) (для Be); L a n g m h у r F. J., H о n g s 1 о T., Anal. Chim. Acta, 22, 301 (1960) (для Nb, Ta, Ti).
65. Majumdar A. K., Mukherjee A. K-, Anal. Chim. Acta, 22, 514 (1960).
66. T a n d о n S. G., В hat tach ary a S. C., Anal. Chem., 32, 194 (1960). 67. Сноска [23], p. 407.
68. Strock L. W., Drexler S., J. Opt. Soc. Am., 31, 167 (1941).
69. W e i s s H. V., L a i M. G., Anal. Chem., 32, 475 (1960).
70. Weiss H. V., Lai M. G., Anal. Chim. Acta, 28, 242 (1963).
71. W e i s s H. V., Lai M. G., Gillespie A., Anal. Chim. Acta, 25, 550 (1961).
72. Singleterry C. R., J. Am. Oil Chemists’ Soc., 32, 446 (1955).
73. P h i 1 1 i p s J. N., Rev. Pure Appl. Chem., 10, 35 (1960).
74. F e i g 1 F., С a 1 d a s A., Anal. Chim. Acta, 8, 339 (1953).
75. Сноска [23], стр. 203.
76. G о r d о n L., S a 1 u t s k у M. L., Willard H. H., Precipitation from Homogeneous Solution, John Wiley and Sons, New York, 1959.
77. Howick L. C„ Trigg W. W„ Anal. Chem., 33, 302 (1961).
78. См., например, Flaschka H., Jacobljevich H., Anal. Chim. Acta, 4, 356 (1950); Burriel-Marti F., Vidan A. M., Anal. Chim. Acta, 26, 163 (1962); В owes ox D. F., Smith D. M., Swift E. H., Taianta, 2, 142 (1959); 3, 282 (1960).
79. Sen B. N., Anal. Chim. Acta, 24, 386 (1961).
80. См., например, Heyn A. H. A., Dave N. G., Taianta, 5, 119 (1960); Heyn A. H. A., Brauner P. A., Taianta, 7, 281 (1961).
ГЛАВА 10
Экстракция органическими растворителями
Экстракция комплексов из одного растворителя, которым обычно является вода, в другой часто позволяет заметно увеличить концентрацию комплекса и в результате этого повысить эффективную чувствительность аналитического метода. Иногда экстракция является также очень полезным методом отделения мешающих веществ. В качестве примеров аналитического использования экстракции можно назвать извлечение содержащими гидроксил растворителями роданидных комплексов Fe(III) и Mo(V), экстракцию диэтиловым эфиром Fe(III) из сильно солянокислых растворов, извлечение амилацетатом диэтилдитиокарбамата Си(II), хлороформом или четыреххлористым углеродом — дити-зонатных комплексов Ag, Hg, Си, Pd, Bi, Pb, Zn и Cd. Экстрагированное вещество можно затем определить спектрофотометрически или же количественно выделить упариванием растворителя или реэкстракцией в водную фазу. Такую реэкстракцию можно осуществить добавлением окислителей, восстановителей, специфических комплексообразующих реагентов или изменением pH водной фазы. Экстракции органическими растворителями и ее применению посвящена обширная и все увеличивающаяся литература, причем применение касается главным образом разделения и очистки актинидов и продуктов деления ядер [1]. Близким методом, применяемым в качественном анализе, особенно при выполнении капельных проб, является накопление продукта реакции на границе раздела двух несмешивающихся жидкостей: например, следовые количества диметилглиоксимата никеля, содержащиеся в водном растворе аммиака, собираются на границе раздела фаз при встряхивании последнего с керосином.
1. ТИПЫ ЭКСТРАКЦИОННЫХ СИСТЕМ
Экстракционные системы, применяемые в аналитической химии, удобно разделить на несколько групп.
1. Внутрикомплексные соединения, не имеющие общего электрического заряда, часто ведут себя подобно органическим молекулам, особенно если все координационные места иона металла
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
235
одновременно заняты комплексообразующими реагентами. Обычно такие комплексы легко растворимы в инертных органических растворителях.
2. Если органические лиганды заполняют не все координационные места вокруг иона металла, то нейтральные комплексы иногда можно экстрагировать в органический растворитель при условии, что последний достаточно энергично координируется ионом металла. Именно эта способность приводит к резкому различию между растворителями, содержащими кислород, типа спиртов, простых и сложных эфиров и кетонов и неполярными растворителями типа бензола и четыреххлористого углерода. В случае очень сильно сольватирующих веществ, например три-н-бутилфосфата и высших спиртов, вследствие сольватации самого катиона можно экстрагировать ионные соединения, такие, как перхлорат кобальта.
3. Некоторые нейтральные неорганические молекулы при условии, что их внутренние связи ковалентны, распределяются между инертными органическими растворителями и водой. В качестве примеров можно указать иод, четырехокиси осмия и рутения, хлориды мышьяка и свинца.
4. Галогенидам металлов третьей группы родственны комплексные кислоты, образуемые некоторыми галогенидами и псевдогалогенидами металлов в довольно кислых растворах. К ним относятся, например, НАиВп и Н2Се(МОз)б. Для экстракции таких соединений требуются растворители, способные к протонизации, например диэтиловый эфир, амиловый спирт или метилизо-бутилкетон. Более вероятно, однако, что в таких «оксониевых» экстракционных системах ион водорода присутствует в виде гидратированного иона гидроксония [Н(НгО)4]+ СХХ, который высту-
пает в качестве катиона, образующего с экстрагируемым анионом ионную пару [2]. Катион стабилизируется водородными связями с растворителем, поэтому координирующая способность последнего очень важна.
236
ГЛАВА 10
5. Образование ионной пары между крупными катионами и анионами может сообщить этой паре способность экстрагироваться органическими растворителями, хотя порознь эти вещества часто экстрагироваться из воды не могут. В качестве примеров можно указать комбинацию катиона тетрафениларсония с перренат-ионом, а также катиона родамина В со многими анионными хлоридными комплексами.
6. К шестой группе, которую не всегда легко отличить от других, относятся реагенты или растворители, которые ведут себя как ионообменники. Они часто растворяются в неполярных растворителях, и их применяют в виде таких растворов. Так, три-изооктиламин не смешивается с водой, но экстрагирует из кислых растворов анионный сульфатный комплекс уранила (экстрагируется ионная пара). Органические фосфорные кислоты, наоборот, экстрагируют катионы. Например, раствор дибутилфосфорной кислоты в керосине будет извлекать из воды катионы редкоземельных элементов.
2. ОБЩЕЕ ОБСУЖДЕНИЕ
Коэффициент распределения вещества X между органическим растворителем и водой (фазы насыщены друг другом) равен отношению равновесных концентраций этого вещества в двух средах. Строго говоря, X становится постоянной величиной только в том случае, если концентрация распределяемого вещества невелика и это вещество не влияет существенно на активность растворителя в любой из фаз. Однако часто изменения X с концентрацией совершенно незначительны. Так, коэффициент распределения GaCh между диэтиловым эфиром и 6 М соляной кислотой меняется от 17,8 ± 0,3 до 16,9 при изменении концентрации GaClg от 10-12 до 1,6 • 10~3 М. (Экстрагируемым веществом является HGaCk, в котором протон сольватирован.) В некоторых случаях, однако, при увеличении ионной силы водной фазы А, может заметно меняться вследствие изменения активности веществ (в том числе воды) и изменения взаимной растворимости воды и органического растворителя. Это изменение может привести к «высаливанию» или, более редко, к «всаливанию». Были предприняты попытки интерпретировать эти эффекты, принимая во внимание электрические явления [3] или внутреннее давление [4].
Другим фактором, влияющим на распределение вещества между органической и водной фазами, является присутствие конкурирующих комплексообразующих ионов и молекул. Степень экстракции нитрата тория 40%-ным раствором трибутилфосфата в ксилоле понижается в присутствии фосфатов вследствие образования неэкстрагируемых комплексных фосфатов тория. (Эти помехи можно устранить, вводя нитрат трехвалентного железа для связывания фосфатов [5].)
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
237
В тех случаях, когда можно применить электростатическую теорию, например для галогенидов щелочных металлов, уравнение Борна (гл. 9) позволяет заключить, что при распределении иона между водой и растворителем с более низкой диэлектрической проницаемостью он будет преобладать в водной фазе. Это было подтверждено для систем вода—этанол [6]. Однако важную роль играет не только диэлектрическая проницаемость, но и природа растворителя, особенно в случае органических лигандов и их комплексов. Так, коэффициенты распределения анионов жирных кислот с длинной цепью — лауриновой, миристиновой, пальмитиновой и стеариновой — между этанолом и водой составляют величины от 200—10 000 до 1, в то время как бензоат- и нитробен-зоат-анионы оказываются в основном в водной фазе [6]. Если же вместо этанола применить бензол, то следует ожидать, что бензоат будет экстрагироваться легче, чем анионы жирных кислот.
На практике наблюдается гораздо более сложное положение, так как в растворителях с низкой диэлектрической проницаемостью электролиты присутствуют в виде ионных пар и равновесия отличаются от равновесий в воде. Если в воде перхлорат лития менее растворим, чем перхлорат натрия, то в неводных растворителях, содержащих кислород—альдегидах, кетонах, спиртах и простых эфирах—наблюдается обратная картина. Ион лития сильно координируется атомом кислорода растворителя [7], и его соли легко растворяются в диэтиловом эфире, в то время как перхлорат натрия нерастворим. Эту особенность используют для отделения хлорида лития от хлоридов натрия, калия, рубидия и цезия, проводя экстракцию твердых солей смесью спирт—эфир, пиридином, изобутиловым спиртом, ацетоном, диоксаном или н-пропиловым спиртом, насыщенными газообразным НС1. Или же хлориды растворяют в небольшом количестве воды и добавлением подходящего органического растворителя, например 2-этилгексанола [8], оставляют в растворе только хлорид лития. Ион бериллия в виде хлорида бериллия также растворяется во многих содержащих кислород донорных растворителях.
Перхлорат серебра напоминает в этом отношении перхлорат лития; кроме того, вследствие комплексообразования он хорошо растворяется в бензоле. Тем не менее при распределении его между водой и бензолом он переходит в водную фазу. С другой стороны, в случае анилина координирование растворителя ионом серебра настолько велико, что перхлорат серебра экстрагируется из воды. Повышенная растворимость иода в некоторых растворителях, в том числе в ацетоне, обусловлена уменьшением концентрации свободного иода в растворителе благодаря образованию комплекса с переносом заряда. По аналогичным причинам любую систему, состоящую более чем из одного растворителя, необходимо рассматривать до некоторой степени эмпирически.
238
ГЛАВА 10
Несмотря на то что в настоящем обсуждении упоминаются только две основные группы растворителей — неполярные (например, четыреххлористый углерод) и полярные (главным образом содержащие кислород растворители, например диэтиловый эфир), в действительности же наблюдается постепенное изменение их свойств. Хлороформ — полярный растворитель, но он в заметной степени не координируется комплексами металлов, и, следовательно, его можно рассматривать как «инертный» растворитель. С другой стороны, бензол, хотя его молекула и неполярна, способен к сильной поляризации и, следовательно, к образованию слабых связей в результате взаимодействия ионов с его наведенным диполем.
3. ГАЛОГЕНИДЫ МЕТАЛЛОВ И ИХ КОМПЛЕКСНЫЕ кислоты
К чисто неорганическим соединениям, экстрагирующимся из водных растворов органическими растворителями, относятся многочисленные хлориды металлов. Эта группа включает расположенные в ряд по мере уменьшения экстрагируемости диэтиловым эфиром из 6 М соляной кислоты хлориды Fe(III), Ga(III), Au(III), Tl(III), Mo(VI), Sb(V), As(III), Ge(IV), Te(IV), Sn(II) и Sn(IV). В этом ряду экстрагируемость падает от 99 до 15%. Хлориды Sb (III), Ir(III), As(V), Zn и Hg(II) экстрагируются лишь весьма слабо.
Эти цифры, однако, могут служить только для качественной оценки. Коэффициент распределения изменяется с изменением концентрации соляной кислоты и хлорид-ионов. При экстракции диэтиловым эфиром он проходит через максимум при ~7А1 НС1 для Fe(III), около 3 М НС1 для Sb(III), в 4 М НС1 для Sn(IV); в большинстве других случаев коэффициент распределения повышается с увеличением концентрации кислоты. Результаты зависят также от применяемого органического растворителя и в случае трехвалентного железа — от общей концентрации Fe (III). Последнее связано, возможно, с образованием в эфирной фазе полиядерных комплексов. Механизм процесса, вероятно, заключается в последовательном комплексообразовании в водной фазе с одним или самое большое с двумя комплексами типа МС1з и НМСк, способными к экстракции. При относительно высоких концентрациях галогенидов можно ожидать образования анионных комплексов (отличающихся от незаряженных форм), что уменьшает экстракцию. Так, из-за образования неэкстрагирую-щегося Sbl“ экстракция Sblg бензолом падает при концентрации иодида более 0,01 М.
Соединения, образующиеся при ассоциации ионов металлов с подходящими неорганическими анионами, экстрагируются рас
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
239
творителями типа эфира, но не бензолом или четыреххлористым углеродом. Это связано с тем, что растворители, содержащие кислород, в том числе эфиры, высшие спирты и кетоны, способны к протонизации и координации (если имеются доступные координационные места) с ионом металла, входящим в состав комплекса. В экстрагируемых соединениях типа HFeBn, HInCh, Н1пВг4, HTICI4, HGaCh, HGaBn, HAuCk и HAuBn, в органической фазе сольватирован (и, возможно, гидратирован) протон, входящий в состав ионной пары, а в анионах четыре иона галоида расположены тетраэдрически вокруг иона металла и никакой иной сольватации не требуется. Эти соединения наиболее эффективно экстрагируются из сильнокислых сред или в присутствии высаливателя. С другой стороны, в нейтральном комплексе FeCl3 одно или три координационных места вокруг центрального иона металла должны быть обычно заняты молекулами воды с тем, чтобы осуществлялось одно из предпочтительных для железа координационных чисел. В таком случае для экстракции необходимо, чтобы одну или большее число этих молекул воды могли бы заместить молекулы полярного органического растворителя. Если все координационные места металла уже заняты лигандами, как, например, в HgBr2, комплекс может экстрагироваться и неполярными растворителями.
С другой стороны, если можно предположить, что вещество имеет сильно ковалентный характер, например AsCk, GeCk, Sblg, HgBr2 и Snl4, то можно применять также и другие растворители, типа четыреххлористого углерода, хлороформа и бензола. В аналитической практике применяют отделение Ga от Al, In и Т1 (I), Fe(III) от большинства ионов переходных металлов, Mo(VI) от Сг и W и— в очень разбавленной соляной кислоте — Т1(Ш) от Fe(III) и Ga(III). Из разбавленной соляной кислоты очень легко экстрагируются также АиС13 или, возможно, HAuCk. Из сернокислых растворов иодид висмута количественно экстрагируется изоамиловым спиртом или изоамилацетатом [9].
Экстракция фторидов гораздо более ограниченна. Из кислых водных растворов Nb и Та экстрагируются в виде фторидных комплексов диизопропилкетоном, циклогексаноном, метилэтилке-тоном, гексоном или другими кетонами [10].
Из 6 М бромистоводородной кислоты диэтиловый эфир экстрагирует бромиды следующих металлов [11]:
In > Т1 (111) > Au (111) >Fe (III) > Ga » T1 (!)>Te(lV).
Из 4 M бромистоводородной кислоты диэтиловым эфиром легко экстрагируются Sb(V), Sn(II) и 'Sn(IV), a As(III) > >Mo(VI) > Se(IV) частично экстрагируются из 6 М бромистоводородной кислоты [12]. Т1(Ш) легко экстрагируется из 0,1 М бромистоводородной кислоты.
240
ГЛАВА 10
Данные по экстракции бромидов другими растворителями приведены в работе [12].
В качестве аналитического метода для золота была предложена экстракция HAuBr4 из 2,5—3 М бромистоводородной кислоты изопропиловым эфиром [14]; железо в этих условиях экстрагируется относительно плохо.
Из 6,9 М иодистоводородной кислоты диэтиловый эфир экстрагирует иодиды (или соответствующие комплексные кислоты) Sb(III), Hg(II), Cd(II), Au(III), Sn(II)»Bi(III) >Zn(II) > > In(III) ~Mo(VI) ~Te(IV). При отношении эфира к воде 4: 1 степень экстракции изменяется в этом ряду от практически полного извлечения до примерно 5,5% [15]. В качестве одной из стадий аналитического отделения было предложено применять экстракцию 1п1з диэтиловым эфиром из 0,5—2 М иодистоводородной кислоты; при большей кислотности образуется труднее экстрагируемая HInI4 [16].
Любая попытка количественной интерпретации равновесий в таких системах, содержащих ионы галогенов и металлы, требует рассмотрения ряда факторов. Если при увеличении концентрации металла наблюдается предпочтительное распределение в органической или водной фазе, то в этой фазе, возможно, происходит полимеризация. С другой стороны, это можно объяснить процессом «самовысаливания» или «самовсаливания». И в водной, и в органической фазах соединения типа НМХ4 могут диссоциировать [17].
4. РОДАНИДНЫЕ КОМПЛЕКСЫ
Роданид-ион напоминает ионы галогенов своей способностью образовывать окрашенные комплексы с Fe(II), U(VI), Bi(III), Re, Co(II), W(III), Mo(V) и Nb(III) *, экстрагирующиеся спиртами, простыми и сложными эфирами. В присутствии пиридина роданид-ион образует также растворимые в хлороформе комплексы типа Cupya(SCN)2 с Со, Ni, Си, Zn и Cd. Бесцветные экстрагирующиеся комплексы образуются с Zn, Sn(IV), Be, Al, In и Sc [18]; это дает возможность отделять Sc от Mg, Ga, Мп, Y, редкоземельных элементов и тория [19]. Подобным же образом цирконий был отделен от гафния [20]; из смеси роданидов циркония и гафния в солянокислом растворе метилизобутилкетон преимущественно экстрагирует гафний [21].
Аналитическое применение находит экстракция диэтиловым эфиром Sn(IV) (экстрагируются 99%) и Zn (96%) из раствора 1 М по роданиду аммония и 0,5 М по соляной кислоте. Са (99%) и Со (75%) из 7М раствора роданида аммония и Fe(III) (89%)
* Валентности некоторых из этих , металлов ошибочны. С роданидами взаимодействует, например, Fe(III) и Nb(V).—Прим. ред.
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
241
из 0,5 М раствора роданида аммония (оптимальная концентрация для экстракции) [18].
5. НЕОРГАНИЧЕСКИЕ НИТРАТЫ
Хорошо известна экстрагируемость уранилнитрата диэтиловым эфиром. Она обусловлена тем, что U(VI) имеет координационное число 8, поэтому в иОг(МОз)2 четыре координационных места атома урана могут быть заполнены молекулами растворителя. Очевидно,что для экстракции уранилнитрата из водных растворов координирование комплексом молекул растворителя имеет большое значение. Для этой цели можно использовать большую группу растворителей, причем все они содержат атомы кислорода, способные выступать в качестве доноров электронов. К ним относятся простые эфиры, кетоны, спирты и сложные эфиры, а также органические фосфинокиси; растворители типа бензола и четыреххлористого углерода в данном случае непригодны [22]. Экстрагироваться могут также хлорид уранила и в меньшей степени — сульфат и фосфат. В 8 М азотной кислоте по отношению к диэтиловому эфиру аналогично ведут себя нитраты следующих металлов [23].'
Au (III), Се (IV) > Th (IV) » As (V), Т1 (III), Bi (III), Zr.
Нитрат циркония можно отделить от нитрата гафния экстракцией его раствором трибутилфосфата в ксилоле [24].
Очень большую роль могут играть эффекты высаливания. В то время как из 8 М азотной кислоты нитрат скандия экстрагируется только на 0,1%, насыщение раствора нитратом лития при 35° увеличивает степень экстракции до 83%. Подобно этому, экстракция тория улучшается в присутствии нитратов Li, Mg, Са, Zn, Al и Fe (III), но не Na, К, NH4, Sr или Ва. Высаливание можно в общем объяснить понижением активности воды в результате гидратации добавленной соли, благодаря чему облегчается образование экстрагирующего соединения. Высаливание позволяет разделять нитраты Nd и La [25]. Из водных растворов нитрата неодима в присутствии роданида аммония н-амиловым спиртом преимущественно экстрагируется нитрат тория [26]. В некоторых случаях экстрагируемыми соединениями являются, вероятно, комплексные нитратокислоты типа НгСе^Оз)б и HAu(NO3)4.
Для разделения металлов, образующих комплексы с близкими экстракционными свойствами, например редкоземельных элементов, лучше использовать противоточное распределение. Оно было применено, например, для разделения нитратов празеодима и неодима в 13,8 М азотной кислоте с трибутилфосфатом в качестве экстрагента [27]. Однако этот метод находит примене-16 Д- Перрин
242
ГЛАВА 10
ние скорее в препаративной, а не в аналитической химии. Гораздо более обычными являются аналитические методы, основанные на периодическом экстракционном извлечении с последующей реэкстракцией или без нее. Такие методы не обеспечивают хорошего разделения веществ, имеющих близкие коэффициенты распределения.
6. КОЛИЧЕСТВЕННЫЕ АСПЕКТЫ ЭКСТРАКЦИОННЫХ.
РАВНОВЕСИИ
Равновесие между органической фазой и водным раствором, в котором осуществляется ступенчатое комплексообразование, было изучено Ридбергом [28]. В случае если заряженный лиганд
'/a log fi log 1A J
Рис. 1. Изменение кажущегося коэффициента распределения комплекса состава 1 :2 при изменении концентрации лиганда (в водной фазе).
Предполагается, что образуется два комплекса МА и МД?» ио экстрагируется только последний. Кривые а, б н в соответствуют отношениям последовательных констант образования Кл!К.Чъ равным 0 (т. е. комплексом [MAI можно пренебречь), 9 и 100.
А- и ион металла Вп+ образуют лишь один незаряженный растворимый в органической фазе комплекс ВАП, отношение [ВА]П в органической фазе к общей концентрации В определяется уравнением
[ВА„]орг _ А₽„[А1« ш
[В]обща(1 1+/C1 [A]+/G/C2 [А]2 + ... +МА]» ’
в котором [BAn]opr/[BAn]aq —константа распределения вещества между органической фазой и водой. Если учитывать также
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
243
экстракцию незаряженного соединения НА, то уравнение (1) изменится незначительно. Наиболее важным фактором, определяющим экстрагируемость таких комплексов, является величина X, которая и будет рассмотрена ниже. Следует ожидать, что А будет велика, если ВАП незаряженный и не имеющий полярных
Рис. 2. Изменение кажущегося коэффициента распределения комплекса состава 1 : 3 при изменении концентрации лиганда (в водной фазе).
Предполагается, что образуются три комплекса МА, МА2 и МАз, но экстрагируется только последний. Кривые а, б и в соответствуют отношениям последовательных констант образования Ki/K2 н Кг/Кз, равным 0 (т. е. комплексами [МА] и [МА2] можно пренебречь), 10 и 100.
групп комплекс, особенно если органический растворитель неполярен и обнаруживает химическое сходство с неполярной частью лиганда А.
Если известны константы ступенчатого комплексообразования, то легко можно установить зависимость d в уравнении (1) от величины X. В качестве примера на рис. 1 и 2 приведены изменения наблюдаемого коэффициента распределения бис- и трис-комплексов в зависимости от концентрации лиганда для некоторых принятых отношений констант устойчивости. Если при еще более высоких концентрациях лиганда будут образовываться анионные комплексы, то эти кривые снова начнут снижаться.
16*
244
ГЛАВА 10
В качестве примера использования таких кривых можно рассмотреть систему железо(III)—роданид, для которой при ионной силе 0,6 и 18° Кл = 140 и /G=12 [29]. Полагают, что основным комплексом, экстрагирующимся амиловым спиртом, является Fe(SCN)s. В пользу этого свидетельствует, во-первых, его неза-ряженность и, во-вторых, тот факт, что наблюдаемый максимальный коэффициент поглощения 13 800 близок к значению, которое можно ожидать для трис-комплекса. (Величины еМакс FeSCN2t и Fe(SCN)+ равны соответственно 5000 и 9800.) Предположение, что А1//С2/(2/Аз, позволяет оценить величину Аз~1, так что log 3,2. Рассмотрение рис. 2 показывает, что в таких системах для достижения максимально возможной величины кажущегося коэффициента распределения требуется высокая концентрация роданида. Даже в растворе 1 М по роданиду коэффициент распределения равен всего лишь 2/з максимальной величины. Однако по мере достижения требующейся концентрации образуются все хуже экстрагирующиеся комплексы, включающие большее число роданидных групп. Величина log 0з для комплекса 1 :3 мо-либденилроданида, по-видимому, гораздо больше, а отношения Kt/Kz и Кг/Кз меньше, нежели в случае трехвалентного железа [30]. Поэтому условия максимального извлечения достигаются при гораздо меньших концентрациях роданида.
Если лиганд является анионом одноосновной кислоты, которая может распределяться между водой и органическим растворителем, кажущийся коэффициент распределения d будет зависеть от pH. При условии, что кислота не ионизируется и не ассоциируется в органической фазе, можно легко показать, что
X— d ,,
log-----= РН - Р^а , (2)
где 7. и d имеют те же значения, что и в уравнении (1), а рАа— константа диссоциации кислоты в воде. Уравнение (2) применимо, например, к распределению дитизона между четыреххлористым углеродом и водой. Оно является уравнением S-образной кривой, напоминающей кривую титрования слабой кислоты сильным основанием. Одно из следствий этого уравнения, которое можно вывести для d=l, заключается в том, что pH, при котором реагент поровну распределяется между двумя фазами, зависит от величины 7„. В свою счередь можно ожидать, что 'к отражает растворимость кислоты в органическом растворителе. В случае дитизона это было подтверждено на большом числе растворителей [31].
Таким образом, наиболее важными величинами, определяющими равновесие распределения, являются pH раствора, константа устойчивости внутрикомплексного соединения и его относительная растворимость в органической фазе [32].
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
245
Многие внутрикомплексные соединения, в которых ион металла окружен анионными лигандами, число которых достаточно для нейтрализации его положительного заряда и заполнения всех координационных мест, легко экстрагируются из водных растворов органическими растворителями. При объединении уравнений (1) и (2) становится видно, что если в комплекс входят п однозарядных ионов лигандов, то коэффициент распределения металла в присутствии избытка реагента будет функцией n-й степени от концентрации иона водорода. При встряхивании водной фазы с равным объемом органического растворителя область экстракции между 1 и 99% охватывает 4/п единиц pH. Следовательно, устанавливая подходящее значение pH, можно создать условия, благоприятствующие экстракции внутрикомплексного соединения в органический растворитель или гарантирующие удержание иона металла в водной фазе. В свою очередь это часто позволяет выделить один или большее число металлов из их смеси.
Эти рассуждения применимы к комплексам, образованным многими известными реагентами, такими, как дитизон, купферрон, диметилглиоксим и диэтилдитиокарбамат. В качестве примера можно назвать разделение РЬ и Bi экстракцией ихдитизона-тов четыреххлористым углеродом при pH 3,0 [33] и экстракцию цинка раствором дитизона в хлороформе из цитратной буферной смеси при pH 8,3 [34]. Цинк можно удалить из раствора дитизо-ната кадмия в четыреххлористом углероде реэкстракцией 1 н. раствором гидроокиси натрия.
Те же соотношения остаются в силе в случае лигандов, являющихся двух- и трехзарядными анионами, если речь идет о значениях pH, по крайней мере на единицу более низких, чем наименьшее значение рКа. При более высоких значениях pH соотношения не столь просты и наклон кривой процент экстракции —pH уменьшается. Наоборот, если комплексообразующее вещество имеет как кислотные, так и основные группы, например 8-ок-сихинолин, наклон этой кривой в относительно кислых растворах возрастает. В некоторых случаях, в том числе при работе с 8-ок-сихинолином, реакция между металлом и лигандом может быть медленной, поэтому для достижения равновесия требуется много времени. Более того, могут образовываться основные и растворимые в воде комплексы. Эти факторы увеличивают трудности количественного описания экстракционных свойств некоторых систем.
7. КОМПЛЕКСЫ МЕТАЛЛОВ С ОРГАНИЧЕСКИМИ ЛИГАНДАМИ
Качественно можно сказать, что если ионы металла эффективно экранированы гидрофобными лигандами, способными нейтрализовать его заряд, то следует ожидать, что такие комплексы
246
ГЛАВА 10
будут хорошо экстрагироваться органическим растворителем по существу независимо от его природы. Глиоксаль-бис-(2-оксиа-нил) CXXI в виде двухзарядного аниона образует с ионом Са комплекс состава 1:1. Можно предположить, что ион металла связан с атомами кислорода и азота, расположенными вокруг
CXXI
него тетраэдрически. Комплекс может экстрагироваться хлороформом; интенсивно-красная окраска экстракта позволила разработать чувствительный (до 10-4%) метод определения кальция [35]. В тех же условиях магний мешает незначительно, так как для него предпочтительна октаэдрическая конфигурация; расположенные вокруг иона металла лишние молекулы воды препятствуют экстракции. Ни один из комплексов алюминия не экстрагируется, поскольку как моно-, так и бис-комплексы его имеют заряд.
Фотометрические реагенты, связывающие ион металла только за счет атомов азота, в экстракционных аналитических методах применяются довольно редко (за исключением случаев образования ионных пар). Это связано с тем, что обычно такие реагенты неспособны выполнить требование о нейтрализации заряда катиона при образовании комплекса с металлом. В качестве исключения можно назвать фенил-а-пиридилкетоксим (СШ, И=фе-нил), который связывает металл двумя нейтральными атомами азота. В таких случаях растворимость в органическом растворителе достигается за счет потери протона комплексом металла — в данном случае оксимным гидроксилом; таким образом, реагент ведет себя так, как если бы он был анионом, образующим нейтральный комплекс. Фенил-а-пиридилкетоксим был предложен в качестве аналитического реагента для железа и палладия [36], а метил-а-пиридилкетоксим — для Cu(I) и Fe(II) [37]. Сам пи-ридин-2-альдоксим образует интенсивно окрашенные хелаты со
многими ионами переходных металлов [38]. 4-(2-Пиридилазо)-1-нафтол в нейтральной форме СХХП не образует устойчивых
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
247
комплексов, но потеря протона фенольной ОН-группой приводит к аниону, вероятно типа СХХШ, который с ионами металлов образует устойчивые и экстрагирующиеся органическими растворителями комплексы [39].
сххш
В некоторых случаях для придания веществу экстрагируемо-сти достаточно осуществить солеобразование с алифатическими кислотами. Пропионат меди экстрагируется в виде димера хлороформом, а цезий и переходные металлы можно экстрагировать в виде их солей с более высокомолекулярными членами ряда жирных кислот. Подобным же образом тетрафенилборат цезия экстрагируется нитробензолом. Железо(III) также образует экстрагирующийся комплекс HFeR4 (аналогичный HFeCR), в котором R— карбоксильный анион.
В щелочных растворах литий образует комплексное соединение с дипивалоилметаном, экстрагирующееся эфиром [40].
Экстрагируемость некоторых комплексов морина CXXIV содержащими кислород растворителями типа циклогексанола или
он о
CXXIV
амилового спирта связана с его высокой полярностью. Аналогичные свойства обнаруживают нейтральные молекулы борной, фосфорной, фосфорномолибденовой и надхромовой кислот, которые благодаря наличию большого числа ОН-групп, групп R->0 и R = O, также экстрагируются этиловым эфиром и подобными ему растворителями.
Комплексы с диоксимами
Наличие в плоском бис-диметилглиоксимате никеля (II) сильной водородной связи между ОН-группами затрудняет координацию молекул воды и объясняет легкость его экстракции
248
ГЛАВА 10
хлороформом. В аналогичном, но неплоском комплексе кобальта (II) ОН-группа свободна и может образовывать связи с молекулами воды, что препятствует экстракции этого комплекса хлороформом и позволяет отделять никель от кобальта *. Хотя вицинальные диоксимы, такие, как диметилглиоксим, широко известны как осадители, они также полезны при фотометрическом определении следов никеля, палладия и рения.
Поведение диметилглиоксима с никелем интересно потому, что этот реагент, очевидно, можно использовать для получения комплексов никеля в различных валентных состояниях. Незаряженный красный бис-комплекс никеля(II) с диметилглиоксимом можно экстрагировать хлороформом (подобные же комплексы образуют Со(II), Fe(II) и Си(II), однако они растворимы в воде, хотя комплекс меди и можно экстрагировать хлороформом). С другой стороны, если диметилглиоксим добавить к щелочному раствору соли никеля, который предварительно обработан окислителем (например, иодом, бромом или персульфатом калия), окраска раствора становится винно-красной (^макс = 445 ммк) вследствие образования диметилглиоксимата, в котором никель находится в более высоком валентном состоянии. Этот растворимый в воде комплекс не очень устойчив, и его структура неизвестна.
Комплексы Ni (II) с другими диоксимами также можно экстрагировать хлороформом. Длины волн максимумов светопоглощения изменяются в последовательности: а-фурилдиоксим (435 ммк) гептоксим (циклогептандиондиоксим) > диметилглиоксим, как и можно было ожидать на основе представлений о влиянии заместителей. Чувствительность определения никеля весьма высокая, например в случае ниоксима (циклогексан-1, 2-диондиоксим) она равна примерно 0,1 мкг/мл, однако избирательность невелика. Аналогичным образом можно определять палладий (II), причем фурилдиоксим более чувствительный реагент, чем диметилглиоксим [41]. Комплексы 4 метилниоксима [42] и фурилдиоксима с рением [43] используют для чувствительного фотометрического определения малых концентраций этого элемента, но химизм протекающих реакций неизвестен. Для спектрофотометрического определения кобальта было предложено использовать желтый растворимый трис-комплекс кобальта (III) с 1, 2, 3-циклогексантрионтриоксимом [44].
* Это объяснение неверно. Плохая экстрагируемость диметилглиоксимата кобальта объясняется его октаэдрической структурой с двумя молекулами воды во внутренней сфере комплекса. Что касается ОН-групп лиганда, то они, по-видимому, блокированы водородными связями так же, как в соединении никеля. — Прим. ред.
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
249
Комплексы с ацетилацетоном и теноилтрифторацетоном
Однозарядный анион ацетил ацетон а СН3СОСН2СОСН3 (образованный отщеплением одного из енольных протонов) реагирует со многими ионами металлов, образуя нейтральные комплексы. Аналогичные комплексные соединения его производного — а-теноилтрифторацетона CXXV — экстрагируются бензолом гораздо легче, что связано с наличием в нем тиофенового ядра.
|l JLc-СН2—С—ср,
CXXV
К тому же в результате того, что в молекуле теноилтрифтораце-тона имеются сильные электроотрицательные группы, он является довольно сильной кислотой и его комплексы с металлами можно экстрагировать из растворов с низкими значениями pH.
Константы устойчивости этих комплексов возрастают по мере увеличения заряда иона металла, а в каждой группе периодической системы — по мере возрастания порядкового номера элемента. Комплексы переходных металлов и металлов с заполненными d-уровнями более устойчивы, чем соединения металлов с оболочкой типа инертного газа. Этот реагент нашел широкое применение, в том числе для отделения Ри от U [45]; Be от Си, Fe, Al, Sc, Y, Ca и Zn [46]; Bi от 228Pa; Ac от Th; Th от Pa, U и Ac [47]; Zr от Hf [48] и Ac от Ra [49]. При взаимодействии металлов с реагентом образуется шестичленный цикл CXXVI.
CXXVI
В некоторых случаях комплексы теноилтрифторацетона окрашены. Поэтому ТТА был применен не только как экстрагент, но и как фотометрический реагент для определения хрома [50], урана [51] и железа [52] в органической фазе.
Недавно был опубликован обзор по экстракции теноилтри-фторацетонатов [53]. Изучению экстракции р-дикетонатов посвящена работа [54].
250
ГЛАВА 10
Комплексы с купферроном
Нитрозофенилгидроксиламин CXXVII в виде аммиачной соли (купферрона) в водном растворе реагирует со многими ионами металлов с образованием нерастворимых или слабо растворимых
/=\ /он
'--' \=О
CXXVII
комплексов, которые, однако, легко экстрагируются хлороформом, диэтиловым эфиром, этилацетатом, метилизобутилкетоном, о-дихлорбензолом и бензолом [55]. Экстрагируемость этих комплексов изменяется с изменением pH примерно симбатно их растворимости. При использовании хлороформа в качестве растворителя экстрагируемость меняется в такой последовательности:
Fe (III), Ga, Sb (HI), Ti (IV), Sn (IV), Zr, V(V), U (IV), Mo(VI)>Bi, Cu (II), Th>Pb(II), Zn (II), Co (II), Ni (II) > Мп (П) >Mg.
Катионы первой группы можно количественно экстрагировать хлороформом в виде их купферронатов из 4—6 н. H2SO4. Для экстракции комплекса А1 требуется pH примерно 3,5—4,0. Разницу в прочности этих комплексов можно отнести за счет того, что ион А13+ имеет электронную конфигурацию инертного газа (Ne), которая делает его менее склонным к деформации, чем Fe3+. Поэтому в трис-комплексе алюминия с купферроном связи гораздо менее прочные, чем между Fe и нитрозо-группой.
Экстракция купферроном была использована при выделении Ра из минеральных концентратов [56].
Заметная растворимость комплексов купферрона с La, Th и U(VI), вероятно, обусловлена отчасти увеличением координационных чисел вследствие больших ионных радиусов, так что молекулы растворителя могут связываться с металлами. Этим можно объяснить также тот факт, что лучшим растворителем для экстракции купферронатов вольфрама и тантала является изоамиловый спирт, а не хлороформ.
Бензгидроксамовая кислота CXXVIII и другие гидроксамовые кислоты образуют комплексы с металлом за счет связывания его двумя атомами кислорода однозарядного аниона реагента с образованием пятичленного цикла. Эти лиганды, как и следует ожидать, весьма сходны по своей комплексообразующей способности с купферроном. Бензгидроксамовая кислота была предложена в качестве фотометрического реагента для определения
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
251
урана (VI) [57] и ванадия [58]. Однако этот реагент весьма чувствителен к перекисям, присутствующим в применяющихся для экстракции растворителях [59]; обесцвечивание окраски комплексов, вызываемое окислением, было предложено использовать
CXXVIII
для спектрофотометрического определения перекиси водорода [60].
Этот реагент является членом более общего класса соединений CXXIX, применяемых в неорганическом анализе. Если R2 — атом водорода, a Ri— алкильный, арильный, фурильный или тиенильный радикал, то такой реагент представляет собой более
Rf—С—N—R2
II I О ОН
CXXIX
слабую кислоту и более растворим в воде, а его комплексы гораздо менее растворимы в хлороформе, чем в том случае, когда R2 является арильным радикалом. Растворимость в хлороформе комплексов, образуемых реагентами, где Р2 = арил, например, с такими металлами, как V(V), U(VI) и Fe(III), позволяет экстрагировать их органическими растворителями. Вообще реагенты этой последней группы гораздо более полезны для целей анализа. Так, на основе двух соединений, где Р1=тиенил и Рг = фенил и n-толил соответственно, были разработаны высокочувствительные экстракционные методы определения ванадия (V) [61].
Замещение нитрозо-группы купферрона бензоильной или циннамоильной группами приводит к N-бензоил-Х-фенилгидроксил-амину (CXXIX, Р1=^2=фенил) и Х-циннамоил-Х-фенилгидрок-силамину (CXXIX, Rl = cтиpил, R2=фeнил). Первый из этих реагентов благодаря нерастворимости его комплексов с металлами нашел применение в гравиметрическом анализе. В 5—9 М соляной кислоте он образует комплексы только с V, Sn, Ti и Zr [62], и из них только комплекс с ванадием экстрагируется хлороформом. Это позволило разработать специфический метод определе
252
ГЛАВА 10
ния ванадия в хромовых рудах. Х-Циннамоил-Х-фенилгидроксил-амин ведет себя подобным же образом, но его реакции гораздо более чувствительны [63]. В менее кислых средах Х-бензоил-N-фенилгидроксиламин образует экстрагирующиеся органическими растворителями комплексы и с другими катионами. Так, при pH 3,5 хлороформом экстрагируется оранжево-красный комплекс с уранилом (VI) [64].
Комплексы с нитрозофенолами и их производными
Нитрозогруппа —N = O потенциально способна к координации через атом кислорода (—N = O->, как в случае купферрона) или через атом азота (—N = O). В соответствии с данными Файгля
I
[65] в случае а-нитрозо-₽-нафтола осуществляется второй тип связывания с образованием пятичленных хелатных колец (СХХХ) вместо шестичленных (CXXXI).
а-Нитрозо-Р-нафтол (рК 7,70) и p-нитрозо-а-нафтол (р/<7,22) являются значительно более слабыми кислотами, чем нитрозофе-нилгидроксиламин (рА 4,15), так что в качестве комплексообразующих агентов (в виде однозарядных анионов) их можно применять в гораздо менее кислых средах, чем купферрон. Медленное образование трис-комплекса кобальта(III) с а-нитрозо-р-нафтолом и медленную диссоциацию его в растворах сильных кислот можно объяснить низкоспиновой ^«-электронной конфигурацией Со(III) в этом комплексе (гл. 5). Для комплексов Со(III) большое значение имеет стабилизация в полях лигандов, поэтому можно ожидать, что Со(III) образует преимущественно связи с атомом азота, а не с кислородом. Аналогичное поведение наблюдается в случае комплексов Fe(II) и Pd (de и d* соответственно). Высокоспиновые комплексы d6 лабильны; в связи с этим в комплексе Fe(II) спины, по-видимому, спарены. В этом случае донорным атомом опять-таки должен быть атом азота. Возможно, однако, что в комплексообразовании с одними металлами может принимать участие атом азота, а с другими — атом кислорода нитрозо-группы.
Изменения растворимости и экстракционных свойств комп
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
253
лексов металлов с нитрозофенолами (а также с нитрозонафтолами) имеют, вероятно, другое происхождение. В трис-комплек-сах о-нитрозофенола, о-нитрозокрезола и а-нитрозо-Р-нафтола с Со(Ш) и Fe(III) все координационные места вокруг ионов металлов заняты органическими лигандами с образованием октаэдрических конфигураций. Такие комплексы, как и следует ожидать, учитывая природу лигандов, нерастворимы в воде, но экстрагируются петролейным эфиром. Pd(II), координационное число которого равно четырем, насыщается двумя молекулами лиганда, и такой комплекс опять-таки экстрагируется петролейным эфиром. С другой стороны, растворимость в воде бис-комплексов Fe(II), Ni(II) и Си(II) с о-нитрозофенолом обусловлена тем, что комплексы этих металлов обладают октаэдрической или искаженной октаэдрической симметрией. Молекулами о-нитрозофенола в нейтральном бис-комплексе заполнены только четыре координационных места, поэтому с ионом металла могут связываться еще две молекулы растворителя. Это также объясняет, почему эти комплексы могут экстрагироваться этиловым эфиром, но нерастворимы в петролейном эфире.
Некоторое увеличение растворимости комплексов Со(III) в воде было достигнуто за счет введения в молекулу реагента карбоксильной (3-нитрозосалициловая кислота) или эфирной (2-нитрозо-5-метоксифенол, монометиловый эфир нитрозорезорцина [66]) группы. При этом комплексы продолжают экстрагироваться петролейным эфиром. Карбоксильные группы (но не сульфо-группы) можно использовать для этих целей потому, что в слабо кислых средах их ионизация подавлена. Комплексы нитрозо-И-соли (натриевая соль 1-нитрозо-2-оксинафталин-3, 6-дисульфокислоты) являются анионами и, следовательно, не извлекаются органическими растворителями. Экстракция комплекса Со(III) с 3-нитрозосалициловой кислотой петролейным эфиром была применена для определения этого элемента в присутствии Ni(II) [67]. Тот факт, что этому определению не мешает Fe(III), объясняется, видимо, образованием водорастворимого комплекса при взаимодействии металла с салицилатной группировкой реагента, а не с нитрозофенольной.
Аннелирование бензольного кольца в положения 3 и 4 молекулы о-нитрозофенола дает а-нитрозо-р-нафтол, а в положения 5 и 6—p-нитрозо-а-нафтол. Как и предполагалось, комплексы этих реагентов менее растворимы в воде и лучше экстрагируются неполярными органическими растворителями.
В основном те же замечания можно сделать относительно изонитрозоацетона СХХХП и многих его производных, которые образуют с металлами комплексы, включающие пятичленные хе-’ латные циклы типа СХХХШ. Лиганды представляют собой однозарядные анионы, и ионы металла связываются атомами кисло-
254
ГЛАВА 10
рода и азота. Их комплексы с Fe(II) имеют синюю окраску и экстрагируются органическими растворителями. Аналогичное по-
СН3—С—с—Н
II II
О NOH
СХ X XIII
схххп
ведение а-бензилмонооксима свидетельствует о том, что карбонильная группа не енолизируется. Реагенты образуют окрашенные нерастворимые в воде, но растворимые в хлороформе осадки со многими другими ионами металлов, в том числе трис-комплексы с Со(Ш) и бис-комплексы с Ni(II), Cu(II), Zn, Cd и Hg(II).
Комплексообразование через атомы серы
Диэтилдитиокарбаминовая кислота в растворе не устойчива [68], но ее натриевую соль CXXXIV часто применяют в качестве фотометрического реагента на медь(II), с которой она образует
Na+
CXXXIV
бис-комплекс за счет связывания атомами серы. Этот реагент гораздо менее избирателен по отношению к меди, чем 2,9-диме-тил-1,10-фенантролин, но он обладает значительно большей чувствительностью и позволяет обнаружить концентрации меди вплоть до 0,01 мкг/мл. Комплексы, образуемые этим реагентом с медью и многими другими тяжелыми металлами, почти нерастворимы в воде, однако их можно экстрагировать хлороформом, четыреххлористым углеродом и другими растворителями [69]. Многие комплексы окрашены, в том числе комплексы Bi, Cr(VI), Со, Си, Fe(II), U(VI), Fe(III), Mo(VI), Ni, Sn(II) и Sn(IV).
Неустойчивость реагента ограничивает его применение в растворах с pH выше 6 *, а плохая избирательность требует приме
* Устойчивость диэтилдитиокарбамата уменьшается при понижении значения pH, а не при увеличении. — Прим. ред.
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
255
нения маскирующих веществ. Например, EDTA маскирует реакции с Cd, Co(III), Ni, Pb, Т1 (I), Zn, Fe(III), In и Mn(III), а введение цианид-иона приводит к маскированию Ag, Co(III), Cu(II), Hg(II), Pd, Zn и Fe(III), однако ни один из этих агентов не действует на Bi, TI(III), Sb(III), Te(IV), As(III), Se(IV), Sn(IV) и V(V). Дальнейшее повышение избирательности можно достигнуть выполнением экстракции при тщательном контроле pH среды. Так, тетракис-комплекс Te(IV) экстрагируется хлороформом из буферного раствора с pH 8,5—8,7, содержащего в качестве маскирующих агентов EDTA, фосфаты и цианиды. Реагент используют для отделения Fe, Со, Ni, Си и Zn от Al, Be и Mg экстракцией хлороформом или аналогичным растворителем.
Для повышения устойчивости дитиокарбаминовых кислот в кислых средах были синтезированы пироллидиновый и дибензиловый аналоги. Последний является более удачным реагентом на медь, поскольку е'Ро можно применять в 1 н. растворе минеральной кислоты, благодаря чему Fe, Со и Ni мешают мало. В кислых средах устойчив также диэтилдитиокарбамат диэтил-аммония. В 1 — Юн. серной кислоте он образует комплексы с As (III), Си, Hg и Bi, которые экстрагируются хлороформом [70]. В соответствии с предсказаниями теории легче всего экстрагируются с реагентами данной группы те металлы, которые обладают наибольшим сродством к атомам серы. Этилксантогенат калия CXXXV также был предложен в качестве реагента для меди,
/S~
С2Н5О—с к +
ч
CXXXV
но оказался менее удобным, чем соответствующий диэтилдитиокарбамат.
Замещение в молекулах ксантогенатов центрального атома углерода атомом фосфора позволило получить соединения типа О, О-диизопропилдитиофосфорной кислоты CXXXVI, которая
С3Н7О SH
С3Н7О S
CXXXVI
в виде цинковой соли была предложена в качестве реагента на медь [71]. Она аналогична по своим свойствам дибензилдитиокарбамату цинка, но некоторые металлы, особенно ртуть и цинк, оказывают меньшее мешающее влияние.
256
ГЛАВА 10
Толуол-3,4-дитиол (дитиол, CXXXVII) образует с Sn(II), W(VI) и Mo(VI) слабо растворимые комплексы, которые можно экстрагировать полярными и неполярными органическими растворителями. Их свойства можно понять на основе обсуждения,
SH
CXXXV11
проведенного в гл. 9. Маловероятно, что реакции дитиола будут специфичными; действительно, окрашенные комплексы образуют также Bi, Pb, Sb (III), Cu, Ni, Co (все в кислых средах), Fe, Tl, Мп, V и Ru (в щелочном водно-пиридиновом растворе). Желто-зеленый трис-комплекс молибдена можно экстрагировать амилацетатом; если экстракцию вести из 3,7 н. соляной кислоты, то вольфрам (VI) остается в водной фазе [72]. Понижение кислотности раствора приводит к экстракции сине-зеленого комплекса вольфрама (VI). В виде желтого комплекса в органическом растворителе можно определять также олово(II), но обычно его дитиоловый комплекс диспергируют в водной фазе в виде фуксиново-красной суспензии, применяя для этого детергент. Твердый дитиол склонен к окислению кислородом воздуха, поэтому его сохраняют в виде цинкового комплекса с последующим растворением препарата в кислоте или щелочи. Другой возможностью является защита меркапто-групп переведением их в диацетиль-ные производные, разлагаемые по мере необходимости кипячением с раствором гидрата окиси калия.
Аналогичное соединение, хиноксалин-2,3-дитиол CXXXVIII, было предложено в качестве фотометрического реагента для определения никеля [73] и для определения кобальта и никеля
cxxxvni CXXXIX
в одном растворе [74]. Реагент и его комплексы с металлами слабо растворимы в воде, но могут экстрагироваться органическими растворителями. 2Меркаптобензотиазол CXXXIX был предложен в качестве удобного реагента для экстракции хлороформом кадмия [75].
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
257
Комплексы, образованные с участием атомов серы и азота
N, N'-Бис(аллилтиокарбамоил)гидразин образует с Cu, Ni, Zn, Pb и Bi слабо растворимые в воде комплексы типа CVIII, в которых ион металла связан с атомами азота и серы. Экстракция хлороформом оранжево-красного комплекса висмута (в присутствии цианида калия для маскирования меди) была предложена для фотометрического определения этого элемента [76].
CXL
В случае применения дитизона (дифенилтиокарбазон, р/< = = 5,25) CXL, образующего со многими ионами металлов интенсивно окрашенные комплексы, наблюдается следующий порядок экстрагируемости четыреххлористым углеродом [77]:
Hg(Ii), Pd (II), Pt (II), Те (IV) > Ag (I), Hg (I),
Au (III) > Cu (1) > Cu (II) > Bi > In (HI) > Zn (II) >Fe (II),
Co (II), Ni (II) >T1 (I), Pb (II), Cd (II)>Mn (II).
Бис-комплекс Hg(II) можно экстрагировать даже из 6 н. серной кислоты, в то время как соответствующий комплекс Zn лучше всего определяется при pH 8,3, а Мп — при pH 11. В растворе дитизон, вероятно, существует в виде таутомерных равновесных форм тиол-тион (см. схему). Максимумы светопоглощения его растворов в четыреххлористом углероде при 620 и 450 ммк были приписаны соответственно енольной и кето-формам [78].
Во многих случаях ион металла образует два типа дитизо-натов (значительно различающихся по pH полуэкстракции). Наиболее обычной является «первичная» форма, получающаяся в кислых средах. В этом случае в комплексообразовании участвует тиолат-ион [79].
Вследствие того, что в дитизонатах связывание осуществляется атомами серы и азота, наиболее прочные комплексы образуют элементы побочных подгрупп периодической системы с заполненными уровнями из 18 или 18 + 2 электронов (два электрона являются «инертной» парой), или же ионы переходных элементов [80]. Большую роль играет, вероятно, образование обратной двойной связи, поэтому предпочтительно реагируют низковалентные состояния металлов, например Cu (I) >Си (II);
17 Д. Перрин
258
ГЛАВА l«
TI (I) >Т1 (III), а также крупные катионы: In (III) ^>Ga (III); Bi (III) >Sb(III) и Pb(II) >Sn(II).
В дитизонате «вторичного» типа металл может быть связан с двумя атомами азота. Были предложены «енольные» формы, где в образовании связи металл—лиганд принимают участие два атома азота и атом серы, однако атомные модели четко показывают невероятность таких структур.
Качественно аналогичен дитизону реагент дифенилкарбазон, который отличается только тем, что вместо тио-группы имеет оксо-группу. Кислород обладает меньшей, чем сера, комплексообразующей способностью по отношению к катионам с заполненными d-уровнями, поэтому весьма вероятно, что в фиолетово-синем внутрикомплексном соединении этого реагента с ионом Hg(II), образующемся в нейтральных или умеренно щелочных растворах, центральный атом связан с атомами азота. Это, по-видимому, справедливо также и в отношении окрашенных соединений, образуемых дифенилкарбазидом (дигидропроизводным дифенилкарбазона) с такими металлами, как кадмий, кобальт, медь, свинец, ртуть, никель, серебро и цинк. Однако в некоторых случаях, например в случае ртути, реакция, возможно, протекает с дифенилкарбазоном, образующимся при окислении дифенил-карбазида *. Введение в молекулу дифенилкарбазида двух п, п.'-нитрогрупп понижает его растворимость в воде, вследствие чего ионы кадмия и других металлов образуют нерастворимые осадки.
Шесть неподеленных пар электронов азота и серы в дитизоне недостаточны для придания ему значительной растворимости в воде, так как почти во всех случаях с растворителем образуются лишь слабые водородные связи. Тем не менее наличие свободных электронных пар объясняет, почему дитизон лишь слабо растворим в углеводородах или четыреххлористом углероде, но заметно растворим в хлороформе. В комплексах дитизона с металлами число неподеленных электронных пар уменьшается, поэтому понижается растворимость в хлороформе, а растворимость в четыреххлористом углероде увеличивается. Хотя дитизонаты более растворимы в хлороформе, чем в четыреххлористом углероде, применение в качестве экстрагента четыреххлористого углерода более эффективно. Это связано с распределением свободного лиганда между водой и органическим растворителем.
1,4-Дифенилтиосемикарбазид CXLI структурно подобен дитизону, и, следовательно, можно ожидать, что по своей комплексообразующей способности он будет похож на этот реагент. Для спектрофотометрического определения рутения было предложено
* По-видимому, окисление дифенилкарбазида является необходимой стадией всех или почти всех его реакций, приводящих к образованию внутри-комплексных соединений. Продуктом окисления является дифенилкарбазон, который и реагирует с металлами. — Прим. ред.
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
259
использовать его красно-фиолетовый комплекс, экстрагирующийся хлороформом [81].
Тиоловая форма схы
Диметилпроизводное дитизона (о-дитолилтиокарбазон) обладает повышенной избирательностью по отношению к меди(II) и ртути (II) [82].
Комплексы 8-оксихинолина и его производных
Способность комплексов металлов с 8-оксихинолином типа CXLII экстрагироваться хлороформом объясняется отсутствием в них полярных групп. Это их свойство можно использовать
в спектрофотометрических методах. К металлам, образующим комплексы с 8-оксихинолином, относятся Fe(III), Al, Ga, In, TI(III), Bi, Co, Ni, Cu(II), Th, V(V), Mo(VI) и U(VI).
Избирательность реакций можно в значительной мере повысить применением подходящих маскирующих реагентов. Так, при определении А1 мешающее влияние многих элементов при pH 8,5—9 можно устранить при помощи EDTA, цианид- и сульфит-ионов [последние восстанавливают Fe(III) до Fe(II)] [83].
Вольфрам можно количественно определять экстракцией хлороформом из кислых сред (pH 2) его комплекса с 8-оксихинолином WO2(ox)2 [84].
Способность к экстракции комплексов Со, Ni и Си(II) объясняется тенденцией этих ионов образовывать плоские квадратные или тетрагональные комплексы, в которых две молекулы воды связаны очень слабо. Ионы типа Fe2+ и Zn2+ образуют преимуще-17*
260
ГЛАВА 10
ственно октаэдрические структуры, что в случае бис-комплексов этих элементов с 8-оксихинолином приводит к координированию ионом металла двух молекул воды и тем самым предотвращает экстракцию этих комплексов хлороформом. (Комплекс цинка с оксином, высушенный в сушильном шкафу, растворяется в хлороформе.) Аналогичным образом ведет себя Mg2+. Комплекс Мп (II) имеет, вероятно, тетраэдрическую структуру. Область экстракции комплексов 8-оксихинолина с металлами изменяется в пределах значений pH 1,6—14 [85], что позволяет разработать полезные методы разделения индивидуальных соединений.
Введение в положения 5 и 7 молекулы 8-оксихинолина атомов хлора, брома и иода повышает ее кислотность и понижает основность. Поэтому комплексы металлов экстрагируются при меньших значениях pH. Понижается также и растворимость реагента в воде. 2-Метил-8-оксихинолин по стерическим причинам не может образовывать трис-комплексы с металлами, имеющими малые ионные радиусы. Эту особенность используют для отделения ряда металлов от алюминия (ионный радиус 0,51 А)—как осаждением, так и экстракцией комплексов с этим реагентом хлороформом. Бис-комплекс алюминия имеет положительный заряд и поэтому не может легко экстрагироваться.
Экстрагирующийся хлороформом комплекс оксина со стронцием имеет состав Sr(ox)2(Hox)2 [86]. При этом две молекулы оксина можно, вероятно, заместить двумя другими лигандами, например «-бутиламином [87]. Экстракции оксинатов посвящена недавно опубликованная работа [88].
К этой же группе комплексообразующих веществ относится б-окси-1,7-фенантролин [89], предложенный в качестве фотометрического реагента на железо. Он представляет собой молекулу 8-оксихинолина с аннелированным в положения 5 и 6 пиридиновым ядром.
CXLIII
Новые комплексы, образованные за счет связей с азотом и кислородом
Многие из изученных за последнее время индикаторов для комплексометрического титрования, обсуждавшихся в гл. 6, применяют и в качестве хромогенных реактивов для металлов, часто
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
261
с экстракцией подходящими органическими растворителями. Двумя наиболее важными группами реагентов этого класса являются производные о, о'-диоксиазобензола CXLIV и 1-(2-пири-дилазо)-2-фенола CXLV. К реагентам первой группы относятся
CXLIV
CXLV
эриохромовые красители. Обычно эти лиганды сульфированы, поэтому их комплексы хорошо растворяются в воде, но с трудом экстрагируются органическими растворителями. Обязательной структурной особенностью, необходимой для образования практически полезных комплексов с магнием и кальцием состава 1 : 1 (в случае моноазосоединений), является наличие в орто-положениях к азо-группе двух окси-групп или же одной о-окси- и одной о-карбокси-группы [90].
Представителем реагентов второй группы является 1-(2-пи-ридилазо)-2-нафтол (PAN). Присоединение металла за счет атома азота пиридинового кольца, одного из атомов азота азогруппы и фенольного гидроксила приводит к образованию двух пятичленных хелатных циклов. Координация двух таких молекул с двухзарядным ионом металла должна привести к образованию незаряженного октаэдрического комплекса, не содержащего гидрофильных групп и, следовательно, нерастворимого в воде. С PAN образуют комплексы те же ионы металлов, что и в случае оксина, но по стереохимическим соображениям, обсуждавшимся ранее (см. раздел об 8-оксихинолине), следует ожидать, что в экстрагируемости соответствующих комплексов будут наблюдаться различия. С использованием PAN и экстракции не-смешивающимися с водой растворителями были предложены спектрофотометрические методы определения микрограммовых количеств урана (VI) [91], индия [92], ванадия (V) [93], кобальта (III) [94], палладия [95], цинка и кадмия [96] и железа(III), марганца, ртути(II), галлия и иттрия [97]. Желаемая избирательность достигалась главным образом контролем pH и подбором растворителей. Недавние исследования показали, что PAN (в водных растворах) является более чувствительным реагентом на ионы металлов, чем какой-либо из его изученных аналогов [98]. (Результаты исследования экстракции комплексов переходных металлов с PAN приведены в работе [99].) Один из наиболее известных реагентов этой группы, 4-(2-пиридилазо) резорцин, применяют в виде водного раствора натриевой соли для фотометрического определения кобальта, свинца и урана [100].
262
ГЛАВА 10
К этой общей группе реагентов относится также глиоксаль-бис(2-оксианил) CXLVI. Его применение в качестве фотометри-
CXLVI ческого реагента для кальция, с которым он дает экстрагирующийся хлороформом комплекс состава 1:1, основано на использовании тенденции кальция к образованию частично ковалентных связей [101]. Образование тетрадентатного комплекса предусматривает связывание металла с третичными атомами азота, причем эта реакция гораздо более характерна для кальция, чем для стронция и бария. Можно ожидать, что магний будет сильно мешать, но при определении кальция в сильно щелочных средах он будет осаждаться в виде гидроокиси *.
8. ЭКСТРАКЦИЯ В ВИДЕ ИОННЫХ ПАР
Если в систему ввести подходящий ион противоположного заряда, то благодаря образованию продукта ассоциации между этим ионом и заряженным комплексом последнему часто можно придать способность к экстракции органическими растворителями. Так, имеющий интенсивную красно-фиолетовую окраску комплекс неизвестного строения, образующийся при взаимодействии Cr(VI) с дифенилкарбазидом или Сг(П) с дифенилкарба-зоном, представляет собой растворимый в воде катион; его можно экстрагировать органическими растворителями, например изоамиловым спиртом или хлороформом, в присутствии достаточных концентраций ацетатов, хлоридов, перхлоратов или алкилсульфатов с длинной цепью (типола) [102].
Аналогичным образом в присутствии подходящих катионов могут экстрагироваться анионы. Например, перренаты можно экстрагировать хлороформом в виде их тетрафениларсониевых (или фосфониевых) солей [103]. Так же ведут себя пертехнетаты и перманганаты. Хлороформом можно также экстрагировать и соответствующие ионные пары с анионами типа хлоридных или роданидных комплексов Bi, Cd, Ir(IV) [104], Zn и Sn(IV). Экстракция этих и аналогичных ионных пар АиСЦ- [105] находит аналитическое применение в спектрофотометрии.
Имеющая синюю окраску и экстрагирующаяся хлороформом ионная пара, образуемая тетрароданидом кобальта (И) с трифе-
* На стр. 246 автор высказывает суждение, отличное от этого. — Прим, перев.
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
263
нилметиларсонием, была предложена в качестве индикатора при обратном титровании EDTA солями кобальта [106]. Применение этого соединения имеет преимущества в случае сильно окрашенных водных растворов. На образовании подобной ионной пары в органической фазе основано исйрльзование (в качестве жидкого ионообменника) роданида трикаприлметиламмония, растворенного в бензоле, для избирательной экстракции роданида Со(П) [107]. Катион трифенилметиларсония применяют также при фотометрическом определении никеля в качестве противоиона для экстракции ацетофеноном и хлороформом красного бис-дитиооксалатного анионного комплекса этого элемента [108]. Экстракция бензолом или толуолом ионной пары трифенилизо-пропилфосфоний—роданид золота была предложена как «почти специфичная» проба на золото [109].
Синий роданидный комплекс ванадила (IV) экстрагируется хлороформом в присутствии пиридина из растворов, содержащих V(IV) или V(V) и роданид-ионы [110]. Аналогичные пиридинроданидные комплексы образуют также Cu(II), Со, Ni, Fe(II) и Мп [III] *.
Во многих случаях, где экстрагируются ионные пары, образованные крупными катионами и анионами, сольватация, под которой понимается координация полярных молекул растворителя, по-видимому, не является необходимой. Это также часто оказывается справедливым и в отношении небольших анионов, поэтому, например, фторид тетрафенилстибония экстрагируется четыреххлористым углеродом.
Амины, особенно третичные, легко экстрагируют анионные комплексы U (VI) [112]. Так, U(VI) количественно извлекается триизооктиламином из 7М НС1; экстрагируются также Nb, Ru и Zr [ИЗ]. Подобным же образом Fe(III) хорошо экстрагируется первичными аминами, a Th(IV) способен извлекаться в присутствии первичных аминов и вторичных аминов с неразветвленной цепью. Экстрагируется и ванадий(V) [но не V(IV) или Fe(II)].
Координация ионом серебра(I) двух молекул хинолина сообщает перхлорату серебра способность экстрагироваться в виде [Ag(C9H9N)2]+CICV [114]. Серебро можно экстрагировать из водных растворов гексоном в виде ионного ассоциата, образованного его комплексом с ди-н-бутиламином и стеарат- или са-лицилат-ионами. Присутствие в качестве маскирующего агента 2-карбоксианилин-К N-диуксусной кислоты делает реакцию высокоизбирательной [115]. Экстрагированное серебро можно фотометрически определять при помощи пирогаллолового красного
* Во многих пиридин-роданидных комплексах пиридин выступает не в качестве противоиона (катиона пиридиния), а входит во внутреннюю сферу комплекса как нейтральная молекула. Соединение такого типа дает, в частности, медь. — Прим. ред.
264
ГЛАВА 10
[116]. Подобным же образом комплексы многих тяжелых металлов с цианид-, азид- и роданид-ионами образуют экстрагирующиеся ионные пары с ионом трибутиламмония [117]. Был предложен аналитический метод определения аминов, основанный на экстракции их с роданидным комплексом кобальта [118].
Хлорантимонат-ион SbCle- с катионом родамина В (тетра-этилродамин, CXLVII) образует экстрагирующуюся в бензол
(C2H5)2N
красно-фиолетовую ионную пару [119]. Тот факт, что эта ионная пара экстрагируется бензолом и толуолом, но не четыреххлористым углеродом, объясняется природой молекулы родамина В, а экстрагируемость ее хлороформом, амиловым спиртом и диизопропиловым эфиром обусловлена координацией молекул растворителя. Аналогичные ионные пары хлорантимонат-ион образует с метиловым фиолетовым [120], бриллиантовым зеленым [121] и антрахинон-1-азо-4-диметиланилином [122]. В 6М соляной кислоте родамин В образует подобные же соли, экстрагирующиеся бензолом, с хлоридными комплексными анионами (типа МСЦ-) Ga [123], Au(III) [124], Tl(III) [125] и Fe(III), а также нерастворимый в бензоле комплекс вольфрама. Галлий можно определять по флуоресценции его красного комплекса. В условиях определения этих металлов сам родамин В бензолом практически не экстрагируется.
Применение четвертичных аминов позволяет экстрагировать анионное внутрикомплексное соединение урана с 8-оксихиноли-ном [126].
Третичные амины с длинной углеводородной цепью, например метилдиоктиламин, можно использовать для экстракции хлороформом хлорид- и сульфат-ионов [127]. В указанном растворителе амин существует в виде молекулярных агрегатов. Раствор метилдиоктиламина в трихлорэтилене экстрагирует из солянокислых растворов в виде хлороанионов многие элементы первого переходного ряда [128]. Аналогичным образом хлорид-ион и бис(2,2'-бихинолил)медь(1)-ион экстрагируются вместе амиловым спиртом [129]. Коэффициент распределения при этом ра
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
265
вен 1680. Экстракцией раствором метилдиоктиламина в ксилоле из солянокислых растворов можно .разделить ниобий и тантал [130]. Другая возможность заключается в использовании преимущественной экстракции тантала из кислых фторидных сред кетонами [131] или трибутилфосфатом [132].
Обзор по экстракции металлов аминами приведен в работах [133]. Качественно можно полагать, что экстрагируемость комплексов из хлоридсодержащих растворов мало меняется в зависимости от применяемого амина, поэтому в качестве руководства при выборе амина, предназначенного для экстракции в каком-либо конкретном случае, можно использовать серию работ На-кагавы [133].
В работе [134] приведена информация об экстракции четвертичными аминами различных анионов, в том числе бромидов, хлоридов, нитратов и роданидов и хлоро-комплексов Со, Fe(III), Hg, Mo(VI), Та, TI(III) и Zn. Более широкий обзор сделан Меком, Буманом, Касси и Рейном [135].
Полагают, что этот тип образования ионных пар будет находить все возрастающее аналитическое применение. Так, ввиду того что современные методы определения щелочных металлов неудобны, можно попытаться разработать подходящий метод их экстракции и концентрирования. Так, цезий экстрагируется нитробензолом в виде ионной пары с тетраиодовисмутитом [136].
9. ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ ФОСФОРСОДЕРЖАЩИМИ СОЕДИНЕНИЯМИ
Если в нейтральном ковалентном комплексе металла с органическим лигандом молекулами лигандов заполнены не все координационные места вокруг иона металла, то экстракция этого комплекса неполярными растворителями оказывается затрудненной. Наоборот, экстракция облегчается, если растворитель содержит гидрофильную группу, например если он является простым или сложным эфиром или высшим спиртом. Это справедливо и в отношении ионных соединений, за исключением тех случаев, когда анионы можно рассматривать как электростатический экран для катиона. Если экранирование неполное, то экстрагируемость может быть обеспечена только за счет использования органического растворителя, содержащего полярные группы, которые могут ориентироваться и удерживаться ионом металла в результате ион-дипольного взаимодействия.
Еще около десяти лет назад считали, что несмешивающиеся с водой растворители, применяемые для такого рода экстракции, характеризуются наличием связи кислород—углерод. Однако позднее стали широко применять кислородсодержащие фосфорорганические соединения типа кислого ди-трет-бутилфос-
266
ГЛАВА 10
фата CXLIX и три-н-бутилфосфата (особенно в приложении к ядерной технологии). Потенциальные возможности их использования в качестве экстрагентов гораздо шире, чем, например, эфиров или кетонов, но с качественной стороны их поведение аналогично.
Так, комплексы ScLg и SrL2, где HL — перфтороктановая кислота С7Н15СООН, не экстрагируются четыреххлористым углеродом до тех пор, пока в систему не будет введен растворитель типа метилизобутилкетона, изопропилового эфира или ци-трет-бутилфосфата (DBP). В случае SrL2 DBP замещает молекулы воды, образуя комплекс SrL2(DBP)4, экстрагирующийся четыреххлористым углеродом [137]. Аналогичным образом ScLg образует с метилизобутилкетоном или изопропиловым эфиром экстрагирующиеся комплексы, содержащие 6 или 3 молекулы органического растворителя [137], a ScCla можно экстрагировать трибутилфосфатом из сильносолянокислых растворов. Все эти комплексы не имеют общего электрического заряда, и одной из причин пригодности соединений типа р-изопропилтрополона
/ \
С4Н9О о
схых
CXLVIII и ди-н-бутилфосфата CXLIX в качестве комплексообразующих реагентов для экстракции металлов является их способность присоединяться к ионам металлов в виде нейтральных молекул и в виде анионов.
Следовательно, эти реагенты могут вести себя как основания или как кислоты. В органических растворах диалкилфосфаты обычно димеризованы и при экстракции металлы часто координируют равное число органических нейтральных молекул и анионов. Это справедливо также в случае Р-изопропилтрополона. Этот процесс можно представить себе как образование хелата между металлом и органическим анионом с последующей сольватацией нейтральной молекулой реагента. Одно из достоинств Р-изопропилтрополона заключается в том, что его можно использовать в широкой области pH, включая весьма кислые растворы. Он также экстрагирует ионы щелочноземельных металлов [138]. В присутствии p-изопропилтрополона (НА) уранил-ион образует экстрагирующийся хлороформом комплекс UO2(A)2(HA)2 [138]*.
* Не понятно, почему p-изопропилтрополон рассматривается в разделе, посвященном фосфорорганическим экстрагентам; к ним он, естественно, не относится. — Прим. ред.
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
267
К более новым производным фосфорорганических кислот, применяемым в качестве экстрагентов для металлов, с которыми они реагируют в виде анионов, относятся моногептадецилфосфорная кислота и ди-(2-этилгексил) фосфорная кислота. Часто для понижения вязкости эти кислоты разбавляют инертными растворителями типа керосина или ксилола. Это приводит также и к другим эффектам, например к понижению диэлектрической проницаемости, которое в свою очередь может быть причиной образования электролитами ионных пар, в то время как в противном случае они были бы диссоциированы. В случае уранила, плу-тонила и Pu(IV) (но не U(IV), V(IV), Al или Мо) наблюдается синергетическое повышение экстракции этими реагентами в присутствии трибутилфосфата, дигексилгексилфосфоната, окиси триоктилфосфина и аналогичных нейтральных экстрагентов [139]. Оно было объяснено уменьшением степени димеризации или полимеризации фосфорорганической кислоты в растворителе [140]. О применении диалкилфосфорных кислот в качестве экстрагентов см. обзоры [141].
Трибутилфосфат, чистый или разбавленный четыреххлористым углеродом или бензолом, извлекает из солянокислых растворов хлоридный комплекс уранила UO2C12(TBP)2. Он также является лучшим экстрагентом для молибдена, который извлекается из солянокислых растворов в виде [МоО2С12(ТВР)ж] [142]. В таких случаях трибутилфосфат координируется, вероятно, к центральному атому металла через атом кислорода группы Р->0. Тот же эффект проявляется при экстракции три-н-бутилфосфа-том нитратов Се, La, Th и UO2. В органической фазе существуют дисольваты иО2(МОз)г(ТВР)2 и ТЬ(МОз)4(ТВР)2 [143]; аналогично этому Ьа(Г\тОз)з экстрагируется в виде La (МОз)з• (ТВР)3 (другие примеры можно найти в работах [144]). Этим же способом можно экстрагировать двухзарядные ионы плутонила и неп-тунила. Полоний можно отделять от Bi, Ra и Pb экстракцией его трибутилфосфатом из соляно- или сернокислых растворов.
Предпочтительное образование ионом Cu(I) комплексов с координационным числом 2 может служить указанием на то, что галогенидные комплексы Cu(I) экстрагируются раствором трифенилфосфита в четыреххлористом углероде в виде соединений типа [(RO)3P : CuX]n, в которых неподеленная пара электронов атомов фосфора образует с медью донорную связь. Эта особенность делает трифенилфосфит селективным экстрагентом для Cu(I) [145].
Комплексообразующие реагенты типа трибутилфосфата не имеют способных к диссоциации протонов, поэтому они ведут себя лишь как сильноосновные растворители. Кроме того, что эти растворители способны координироваться катионами, они (с различной эффективностью) экстрагируют из водных растворов
268
ГЛАВА 10
кислоты, в том числе минеральные. Основными влияющими на эту экстракцию факторами является сила кислоты, размер аниона и его гидрофильная или гидрофобная природа. В органической фазе в виде ионных пар существуют соединения типа [Н(Н2О)4]+[А(ТВР)х]-, где А = С1О4, CI, Вт или I [146]*.
Трибутилфосфат также экстрагирует перхлораты: из ~6Л1 хлорной кислоты извлекаются цирконий, торий, церий (III) и иттрий [147]. Плутоний(1У) экстрагируется в виде Ри(СЮ4)4(ТВР)г [148], а уран — в виде UO2(C1O4)2(TBP)2 [149]. Во всех этих случаях ТВР, вероятно, сольватирует катион.
Модификация молекулы трибутилфосфата изменяет его экстракционную способность. Замещение бутильных групп другими алкильными радикалами оказывает сравнительно небольшое влияние, за исключением тех случаев, когда объемистые алкильные группы могут уменьшать экстракцию, если вокруг иона металла должно быть расположено несколько молекул эфира. Этот стерический эффект проявляется при экстракции тория [150]. Введение фенильных, алкилгалогенидных и других групп, ослабляющих основные свойства, приводит к резкому уменьшению коэффициентов распределения, в то время как постепенное замещение алкокси-групп алкильными повышает основность реагента и его эффективность в качестве экстрагента (в ряду фосфат< <фосфонат< фосфинат< окись фосфина). К применяемым в экстракции фосфонатам относятся, например, дибутилбутилфосфо-нат [151] и диизоамилметилфосфонат [152]. В работе Уайта и Росса [153] дан обзор аналитического использования в качестве экстрагентов окисей три-н-бутил-, три-н-октил-, три-н-фенил- и три- (2-этилгексил) фосфина.
В качестве экстрагентов, особенно для металлов типа серебра и ртути, образующих с серой более прочные связи, чем с кислородом, можно использовать триалкилтиофосфаты (RO)aPS [154]. Трифенилфосфит экстрагирует галогениды меди(1) [145]. Во всех этих случаях экстрагент применяют в виде разбавленного раствора в инертном растворителе. Аналогичным образом диал-килдитиофосфорные кислоты (RO)2P(S)SH напоминают по своим экстракционным свойствам диэтилдитиокарбамат натрия, но они извлекают металлы из более кислых растворов и гораздо более устойчивы в этих растворах [155].
* Работа Уорфа, на которую ссылается автор, в настоящее время устарела. Многочисленные исследования, выполненные позднее, показали, что катионная часть таких ионных пар представляет собой гидратированный и сольватированный ион водорода. Иначе говоря, трибутилфосфат находится в катионной части, хотя в отдельных случаях он может одновременно сольватировать и анионную часть. — Прим. ред.
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
269
ЛИТЕРАТУРА
1. Последние обзоры по экстракции неорганических веществ органическими растворителями см. Даймонд Р. М., Так Д. Г., Экстракция неорганических соединений, Атомиздат, М., 1962.
Martin F. S., Holt R. J. W., Quart. Rev., 52, 327 (1959); Marcus Y., Chem. Rev., 63, 139 (1963). Детали аналитического использования экстракции приведены в книге: Моррисон Дж., Фрейзер Г., Экстракция в аналитической химии, Госхимиздат, Л., 1960, и в статьях: Anal. Chem., 32, 37R (1960); 34, 64R (1962). Обзор ранней советской литературы см. в статье Кузнецова В. И., Успехи химии, 23, 654 (1954) *.
2. D i a m о п d R. М., J. Phys. Chem., 63, 659 (1959).
3. Debye Р., Z. physik, Chem., 130, 56 (1927).
4. McDevit W. F., Long F. A., Chem. Rev., 51, 119 (1952).
5. Menzies I. A., J. Appl. Chem., 9, 249 (1959).
6. В j err urn N., Lar r son E., Z. physik. Chem., 127, 358 (1927).
7. Pullin A. D. E., Pollock J. M., Trans. Faraday Soc., 54, 11 (1958).
8. Caley E. R„ Axil rod H. D., Anal. Chem., 14, 242 (1942).
9. M о 11 о 1 a H. A., Sandell E. B., Anal. Chim. .Acta, 24, 301 (1961).
10. См., например, S t e v e n s о n P. C„ H i c k s H. G., Anal. Chem., 25,
1517 (1953).
11. W a d a L, I s h i i R., Bull. Inst. Phys. Chem. Res. Tokyo, 13, 264 (1934).
12. Bock R., Kusche H., Bock E., Z. anal. Chem., 138, 167 (1953).
13. Denaro A. R., Occleshaw V. J., Anal. Chim. Acta, 13, 239 (1955);
Irving H., Rossotti F. J. C., J. Chem. Soc., 1955, 1927, 1946.
14. McBryde W. A. E., Yoe J. H., Anal. Chem., 20, 1094 (1948).
15. К i t a h a г a S., Rept. Sci. Inst. Tokyo, 24, 454 (1948).
16. Irving H. M., Rossotti F. J. C., Analyst, 77, 801 (1952).
17. Подробные данные см. в работах: Poskanzer А. М., Thesis М. I. Т., 1957; Saldick J., J. Phys. Chem., 60, 500 (1956); Даймонд Р. М., Так Д. Г., Экстракция неорганических соединений, Атомиздат, М., 1962.
18. Bock R., Z. anal. Chem., 113, НО (1951).
19. Fischer W., Воск R., Z. anorg. Chem., 249, 146—197 (1942).
20. Chalybeus W., Zumbusch-Pfisterer M., Fischer W., Z. anorg. Chem., 255, 79 (1947); 255, 277 (1948).
21. Shelton S. M., Dilling E. D., McClain J. H., U. N. Int. Conf, on Peaceful Uses At. Energy, 8, 505 (1955).
22. Gluekauf E., McKay H. A. C., Nature, 165, 594 (1950).
23. Bock R., Bock E., Z. anorg. Chem., 263, 146 (1950).
24. Hud swell F., Hut ch eon J. M.,U. N. Int. Conf, on Peaceful Uses At. Energy, 8, 563 (1955).
25. Templeton С. C., Peterson J. A., J. Am. Chem. Soc., 70, 3967 (1948).
26. Asselin G. F., Comings E. W., Ind. Eng. Chem., 42, 1021 — 1230 (1950).
27. Hes f о rd E., Jackson E. E., McKay H. A. C., J. Inorg. Nucl. Chem., 9, 279 (1959).
28. R у d b e г g J., Acta Chem. Scand., 4, 1503 (1950).
29. Perrin D. D., J. Am. Chem. Soc., 80, 3852 (1958).
30. P e г r i n D. D., J. Am. Chem. Soc., 80, 3540 (1958).
31. Irving H., Cooke S. J. H., W о о dger S. C., Williams R. J. P., J. Chem. Soc., 1949, 1847.
32. Более детальный анализ экстракционных систем сделан в работе:
* См. книгу И. Стары «Экстракция хелатов», изд-во «Мир», М., 1966, а также обзорные статьи: F г е i s е г Н., Anal. Chem., 38, № 5 (1966); Золотов Ю. А., Петрухин О. М., Журн. ВХО, 9, 145 (1964). — Прим. ред.
270
ГЛАВА 10
Irving Н., Rossotti F. J. C., Williams R. J. P., J. Chem. Soc., 1955, 1906; о системах с дитизоном см. С е и д е л Е., Колориметрические методы определения следов металлов, изд-во «Мир», М., 1964.
33. S а п d е 1 1 Е. В., [32], р. 328.
34. С hoi a k J., Hubbard D. М., Burkey R. Е., Ind. Eng. Chem. (Anal. Ed.), 15, 754 (1943).
35. К er r J. R. W, Analyst, 85, 867 (1960).
36. Sen B., Anal. Chem., 31, 881 (1959); Trussell F., Diehl H., Anal. Chem., 31, 1978 (1959).
37. В a n e r j e a D., Tr i p a t h i К. K, Anal. Chem., 32, 1196 (1960).
38. К ir s о n B., Bull. Soc. Chim. France, 1962, 1032.
39. В e 11 e r i d g e D., Todd P. K., Fernando Q., F r e i s e r H., Anal. Chem., 35, 729 (1963).
40. G u t e r G. A., Hammond G. S., J. Am. Chem. Soc., 78, 5166 (1956).
41. M e n i s O., R a i n s T. C., Anal. Chem., 27, 1932 (1955).
42. Kassner J. L, Ting S. F, Grove E. L, Taianta, 7, 269 (1960).
43. Meloche V. W, Martin R. L., Webb W. H., Anal. Chem., 29,
527 (1957).
44. Frierson W. J., Patterson N, H a r r i 11 H., Marable N, Anal. Chem, 33, 1096 (1961).
45. M a g n u s s о n L. B, Hindman J. C, La Ch apelie T. J, U. S. At. Energy Comm. Rept. ANI-4066 (1947).
46. Bo 1 о my R. A, Wish L, J. Am. Chem. Soc, 72, 4483 (1950).
47. Mei nke W. W, “Chemical Proceedures used at Berkeley", U. S. At. Energy Comm. Rept. AECD 2738 (1949).
48. Huffman E. H, В e a u f a i t L. J, J. Am. Chem. Soc, 71, 3179 (1949).
49. H a g e m a n F, J. Am. Chem. Soc, 72, 768 (1950).
50. M a j umdar S. K, D e A. K, Anal. Chem, 32, 223 (1960).
51. К h о p к a r S. M, De A. K, Analyst, 85, 376 (1960).
52. Khopkar S. M, D e A. K, Anal. Chim. Acta, 22, 223 (1960).
53. Poskanzer A. M, Foreman В. M, J. Inorg. Nucl. Chem, 16, 323 (1961).
54. Stary J, Hladky E, Anal. Chim. Acta, 28, 227 (1963).
55. Обзор см. Furman N. H, Mason W. В, P e к о 1 a J. S, Anal. Chem, 21, 1325 (1949). См. также Miller С. C, Chalmers R. A, Analyst, 78, 686 (1953).
56. Maddock A. G, Miles G. L, J. Chem. Soc, S248, S253 (1949).
57. M e 1 о a n С. E, Holkeboer P, Brandt W. W, Anal. Chem, 32, 791 (1960).
58. Wi s e W. M, В r a n d t W. W, Anal. Chem, 27, 1392 (1955).
59. Meloan С. E, Brandt W. W, Anal. Chem, 33, 102 (1961).
60. Meloan С. E, M a u с к M, Huffman C, Anal. Chem, 33, 104 (1961).
61. T andon S. G, Bh attacharyy a S. C, Anal. Chem, 33, 1267 (1961).
62. R у a n D. E, Analyst, 85, 569 (I960).
63. P r i у a d a r s h i n i U, Tandon S. G, Analyst, 86, 544 (1961).
64. Dyrssen D, Acta Chem. Scand, 10, 353 (1956).
65. F e i g 1 F, Spot Tests in Inorganic Analysis, Elsevier Publishing Co, Amsterdam, 5th ed, 1958, p. 144.
66. P e a c h S. M, Analyst, 81, 371 (1956).
67. P e г г у M. H, Serfass E. J, Anal. Chem, 22, 565 (1950).
68. Bode H, Z. anal. Chem, 142, 414 (1954).
69. Об экстрагируемое™ четыреххлористым углеродом см. Bode Н, Z. anal. Chem, 143, 182 (1954); 144, 90, 165 (1955).
70. Wyatt P. F, Analyst, 80, 368 (1955); 78, 656 (1953); Strafford N, Wyatt P. F, Kershaw F. G, Analyst, 70, 232 (1945).
71. F о r s t e r W. A, В r a z e n a 1 1 P, Bridge J, Analyst, 86, 407 (1961).
72. Bagshawe B„ Truman R. J, Analyst, 72, 189 (1947).
73. Skoog D. A, Lai M, Furst A, Anal. Chem, 30, 365 (1958).
ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
271
74. Burke R. W„ Yoe J. A., Anal. Chem., 34, 1378 (1962); Ayres G. H„ Annand R. R., Anal. Chem., 35, 33 (1963).
75. Schweitzer G. K., Randolph D. R., Anal. Chim. Acta, 26, 567 (1962).
76. Gupta J., Sarma К. P. S., J. Indian Chem. Soc., 28, 89 (1951).
77. Основано на данных табл. 22 монографии Сендела [32].
78. I г v i n g Н., С о х J. J., Proc. Chem. Soc., 1959, 324.
79. I г v i и g Н., В е 1 1 С. F., J. Chem. Soc., 1954, 4253.
80. Fischer H., Microchem., 30, 38 (1942).
81. Hara T., Sandell E. B., Anal. Chim. Acta, 23, 65 (1960).
82. Takei S., Japan Analyst, 6, 630 (1957).
83. С1 a s s e n A., Bastings L., Visser J., Anal. Chim. Acta, 10, 373 (1954).
84. E b e r 1 e A. R., Anal. Chem., 35, 669 (1963).
85. Gentry С. H. R., Sherrington L. G., Analyst, 75, 17 (1950).
86. D у r s s e n D., Svensk Kem. Tidskr., 67, 311 (1955).
87. Umland F., Hoffman W., Anal. Chim. Acta, 17, 234 (1957).
88. S t a г у J., Anal. Chim. Acta, 28, 132 (1963).
89. Dus wait J. M„ Mellon M. G„ Anal. Chem., 33, 1782 (1961).
90. Diehl H., Ellingboe J., Anal. Chem., 32, 1120 (1960).
91. S h i ba t a S., Anal. Chim. Acta, 22, 479 (1960); Gill H. H„ R о 1 f R. F„ Armstrong G. W., Anal. Chem., 30, 1778 (1958); Cheng K. L., Anal. Chem., 30, 1027 (1958).
92. S h i b a t a S„ Anal. Chim. Acta, 23, 434 (1960).
93. Staten F. W., Huffman E. W. D., Anal. Chem., 31, 2003 (1959).
94. G о 1 d s t e i n G., Manning G. L., Mannis O., Anal. Chem., 31, 192 (1959).
95. Б у с e в А. И., Киселева Л. В., Вест. МГУ, 4, 179 (1958); Anal. Abstr., 6, 2179 (1959).
96. В e r g e г E., E 1 v e r s H., Z. anal. Chem., 171, 255 (1959).
97. S h i b a t a S., Anal. Chim. Acta, 25, 348 (1961).
98. H n i 1 i с к о v a H., Sommer L., Z. Anal. Chem., 177, 425 (1960).
99. Betteridge D., Fernando Q., Freiser H., Anal. Chem., 35, 294 (1963).
100. Pollard F. H., Hanson P., Geary W. J., Anal. Chim. Acta, 20, 26 (1959).
101. Goldstein D., Stark-Meyer C., Anal. Chim. Acta, 19, 437 (1958); Williams К. T., Wilson J. R., Anal. Chem., 33, 244 (1961).
102. Powell R., Taylor C. G., Chem. Ind. (London), 1954, 726.
103. Tribal at S., Anal. Chim. Acta, 3, 113 (1949); 4, 228 (1950).
104. NeebR., Z. anal. Chem., 154, 17 (1957).
105. Murphy J. W., A f f s p r u n g H. E., Anal. Chem., 33, 1658 (1961).
106. Cameron A. J., Gibson N. A., Anal. Chim. Acta, 25, 24 (1961).
107. Wilson A. M., McFarland О. K., Anal. Chem., 35, 302 (1963).
108. Cameron A. J., Gibson N. A., Anal. Chim. Acta, 24, 360 (1961).
109. Senise P., Pitombo L. R. M., Anal. Chim. Acta, 26, 89 (1962).
110. Ayres G. H., Scroggie L. E., Anal. Chim. Acta, 26, 470 (1962).
111. Baird S. S., Diss Ph. D., Univ, of Texas, 1958; Taiants, 7, 237 (1961).
112. Cr ouse D. J., Denis J. O., U. S. At. Energy Comm. ORNL-1859 (1955); Preuss A., Saunders J., U. S. At. Energy Comm. RMO-2533 (1955).
113. M о о r e F. L., Anal. Chem., 30, 908 (1958).
114. A n t i к a i n e n P. J., Dyrssen D., Acta Chem. Scand., 14, 86 (1960).
115. Betteridge D., West T. S., Anal. Chim. Acta, 26, 101 (1962).
116. D agnail R. M., West T. S., Anal. Chim. Acta, 27, 9 (1962).
117. Ziegler M., Angew. Chem., 71, 522 (1959); Ziegler M., G1 e m-ser O„ Angew. Chem., 68, 411, 620 (1956); Z. Anal. Chem., 157, 19 (1957).
118. Ashbrook A. W., Analyst, 84, 177 (1959).
119. Webster S. H„ Fairhall L. T„ J. Ind. Hyg. Toxicol., 27, 184 (1945).
272
ГЛАВА 10
120. Jean М., Anal. Chim. Acta, 4, 360 (1950); 7, 462 (1952); 11, 82 (1954).
121. Лапин Л. H., Гейн В. О., Тр. Комиссии по аналит. хим. АН СССР, 7, 217 (1956).
122. Кузнецов В. И., ДАН СССР, 52, 231 (1946).
123. Onishi Н., Sandell Е. В., Anal. Chim. Acta, 13, 159 (1955).
124. Macnulty В. J., Wo Ila rd L. D., Anal. Chim. Acta, 13, 154 (1955).
125. Onishi H., Bull. Chem. Soc. Japan, 29, 945 (1956); 30, 567 (1957).
126. Clifford W. E., В u 1 1 w i п к 1 e E. P„ McC 1 a ine L. A., N о b 1 e P., J. Am. Chem. Soc., 80, 2959 (1958).
127. Smith E. L., Page J. E., J. Soc. Chem. Ind., 67, 48 (1948).
128. Mahlman H. A., Ledlicotte G. W., Moore F. L., Anal. Chem., 26, 1939 (1954).
129. Hoste J., Eeckhout J., Gillis J., Anal. Chim. Acta, 9, 263 (1953).
130. Ledlicotte G. W., Moore F. L., J. Am. Chem. Soc., 74, 1618 (1952).
131. Werning J. R., Higbie К. B., Grace J. T., Speece B. F., Gilbert H. L., Ind. Eng. Chem., 46, 644 (1954).
132. Fletcher J. M., Morris D. F. C., Wain A. G., Bull. Inst. Min. Met., № 597, 487 (1956).
133. Moore F. L„ Natl. Acad. Sci. Nucl. Sci., NAS-NS-3101 (1960); N a к a-gawa G., J. Chem. Soc. Japan, 81, 444, 446, 747, 750, 1255, 1258, 1533, 1536 (1960).
134. Wilson A. M., Churchill L., L i 1 u к К., H о v s e p i a n P., U. S., At. Energy Comm. Rept. TID 12351 (I960); Anal. Chem., 34, 203 (1962).
135. M a e с к W. J., В о о m a n G. L., К u s s у M. E., Rein J. E., Anal. Chem., 33, 1775 (1961).
136. Kyrs M., Podesva S., Anal. Chim. Acta, 27, 183 (1962).
137. D у r r s e n D., J. Inorg. Nucl. Chem., 8, 291 (1958).
138. Dyrssen D., Acta Chem. Scand., 15, 1614 (1961); D yrs sen D., Heffez M., Sekine T., J. Inorg. Nucl. Chem., 16, 367 (1961).
139. В 1 а к e C. A., Horner D. E., S c h m i d t J. M., U. S. At. Energy Comm. Unclassified Document ORNL 2259 (1959).
140. Kennedy J., U. K. At. Energy Auth., Document Number AERE C/M 369 (1958).
141. В 1 а к e С. A., В a e s C. F., Brown К. B., Ind. Eng. Chem., 50, 1763 (1958); Kimura K., Bull. Chem. Soc. Japan, 33, 1038 (1960); 34, 63 (1961).
142. Nelidow I., Diamond R. M., J. Phys. Chem., 59, 710 (1955).
143. Moore F. L., U. S. At. Energy Comm. Unclassified Document AECD 3196 (1951).
144. Fletcher J. M., Progr. Nucl. Energy. Ser. Ill, Process Chem., 1, 105 (1956); Ishimori T., Watanabe K., Bull. Chem. Soc. Japan, 33, 1443 (I960).
145. Handley T. H., Dean J. A., Anal. Chem., 33, 1087 (1961).
146. W a r f J. C., J. Am. Chem. Soc., 71, 3257 (1949).
147. S i ek i e r s к i S., J. Inorg. Nucl. Chem., 12, 129 (1959).
148. С о л о в к и н А. С., Иванцов А. И., Ренард Е. В., ЖНХ, 4, 2826 (1959).
149. Hesford Е., McKay Н. А. С., J. Inorg. Nucl. Chem., 13, 165 (1960).
150. S i ddall Т. Н„ J. Inorg. Nucl. Chem., 13, 151 (1960).
151. Madigan D. C., Cattrall R. W., J. Inorg. Nucl. Chem., 21, 334 (1961).
152. Шевченко В. Б., Шмидт В. С., Ненарокомов Е. А., Радиохимия, 3, 129 (1961).
153. White J. С., Ross W. J., Natl. Acad. Sci. Nucl. Sci., NAS-NS 3102 (1961).
154. Handley T. H., Dean J. A., Anal. Chem., 32, 1878 (1960).
155. Handley T. H., Dean J. A., Anal. Chem., 34, 1312 (1962).
Z
ГЛАВА 11
Реакции органических реагентов с неорганическими анионами
В принципе химические свойства неорганических анионов можно обсуждать, учитывая те же факторы, которые были использованы при рассмотрении свойств катионов металлов (размер иона, величина поляризационных эффектов, природа заполненных и вакантных орбиталей и их распределение в пространстве). Однако на практике это сделать довольно трудно, поскольку неметаллы имеют тенденцию к образованию многоатомных анионов типа SO42-, NO;r и S2O32~, которые в некоторых случаях конденсируются, образуя полиядерные формы, например полифосфаты. Кроме того, многие элементы, считающиеся металлами, могут образовывать анионы, не очень склонные к диссоциации на свободные ионы металла и анионные формы. К ним относятся, например, германаты, бериллаты, бораты и алюминаты. Здесь не будут рассматриваться анионные комплексы типа СиС142-, двухзарядного аниона Ca-EDTA и все другие соединения, существование которых определяется наличием подвижного равновесия. С другой стороны, целесообразно будет рассмотреть анионные комплексы, например Fe(CN)e4-, сохраняющиеся в термодинамически невыгодных условиях достаточно долгое время, чтобы их можно было аналитически идентифицировать.
В некоторых случаях в качестве стадии, предшествующей аналитическому определению, возможно, будет необходимо отделение или хотя бы очистка анионных соединений, например, со-осаждением или анионным обменом. Соосаждение как метод концентрирования следов анионов находит применение, например, при концентрировании сульфатов в виде сульфата бария на хромате бария, фосфатов в виде фосфата алюминия на гидроокиси алюминия и сульфидов в виде сульфида цинка на гидроокиси цинка. При использовании ионного обмена для удаления мешающих катионов требуется соблюдать осторожность. Так, ион железа(III) легко удаляется при помощи катионообменных колонок, но, будучи адсорбированным, он ведет себя как анионо-обменник и удерживает многовалентные анионы типа фосфатов. Иногда для удаления мешающих анионов используют анионообменные колонки. Целесообразно бывает изменить степень
18 Д. Перрин
274
ГЛАВА II
окисления определяемого элемента или группы, например SO42^ перевести в S2-, Вг~ в ВгО3~ и МОз“ в NCh- или NH3.
1. КОСВЕННЫЕ МЕТОДЫ ОБНАРУЖЕНИЯ И ОПРЕДЕЛЕНИЯ АНИОНОВ
Фотометрические методы, основанные на различиях в константах устойчивости комплексов
Определение простых анионов с использованием органических реагентов обычно выполняют косвенными методами. Так, фто-рид-ион определяют фотометрически по степени ослабления им окраски красного комплекса циркония с ализарин-3-сульфокис-лотой [1]. Процесс основан на конкурирующем комплексообразовании фторид-ионов и ализарин-3-сульфонат-аниона с цирконием. Вместо циркония можно использовать торий [2], а вместо ализарин-3-сульфокислоты — хинализарин. Каждый из этих металлов вполне может быть применен и в виде комплекса с эрио-хромцианином R, причем этот реагент дает большую разницу в окраске [3]. Были также использованы комплексы алюминия с 8-оксихинолином, эриохромцианином R [4] и эриохром красным В [5] (в методах, основанных на гашении флуоресценции). Другими примерами могут служить комплексы циркония с SPADNS [6] и пурпуринсульфокислотой [7] и комплекс бериллия с хромазуролом S [8].
В таких методах большое значение имеет стандартизация экспериментальной техники, поскольку равновесия образования и диссоциации комплексов, особенно в отношении моно- и бискомплексов красителей с ионом металла, а также фторид-иона с ионом металла, имеют ступенчатый характер. Определению этими методами мешают все другие анионы, способные конкурировать с красителем при комплексообразовании с ионом металла.
На аналогичном принципе основан метод, заключающийся в добавлении роданида двухвалентной ртути к раствору, содержащему хлорид, с образованием недиссоциирующего меркури-хлорида. Количество вытесненного роданид-иона определяют фотометрически после образования его красного комплекса с избытком ионов железа (III). С другой стороны, микроколичества хлорид-иона можно определять по степени ослабления окраски комплекса ртути с дифенилкарбазоном [9]. Вообще растворы хлоридов, бромидов и иодидов можно анализировать меркури-метрическим титрованием в присутствии дифенилкарбазида или дифенилкарбазона в качестве индикаторов. Конечную точку определяют по появлению избытка ионов ртути(II).
РЕАКЦИИ ОРГАНИЧЕСКИХ РЕАГЕНТОВ С НЕОРГАНИЧЕСКИМИ АНИОНАМИ 275
Определение хлорид-ионов в присутствии бромид- и иодид-ионов возможно при введении в раствор перекиси водорода, которая окисляет бромиды и иодиды до свободных брома и иода, легко образующих с 8-оксихинолином бесцветные продукты замещения в то время как хлорид-ион не изменяется. Хлорид-ион можно обнаружить отгонкой в виде хромилхлорида; в дистил-лате с использованием дифенилкарбазида открывают хром.
Аналогичным образом можно определять фторид-ион по степени ослабления им окраски комплексов железа(III) с роданидом или ацетилацетоном.
Методы, основанные на осаждении или различной растворимости комплексов и солей неорганических катионов
Фотометрические методы. Концентрацию сульфатов в растворе можно определить спектрофотометрированием в ультрафиолетовой области избытка 4-амино-4/-хлордифенила, добавленного в качестве их осадителя [10], а также путем аналогичных измерений содержания бензидина в осадке сульфата бензидина [11]. Чаще всего бензидин в осадке или его избыток в растворе окисляют [12] или диазотируют и сочетают с подходящим фенолом [13] или амином [14].
При встряхивании твердого лака, образованного торием с красителем амарантом, в растворе, содержащем сульфат, освобождается эквивалентное число молекул красителя, поскольку сульфат тория значительно менее растворим [15].
Сульфат бария менее растворим, чем родизонат бария, поэтому реакция на сульфат-ионы основана на их способности ослаблять (за счет конкурирующего взаимодействия с ионом бария) красно-коричневую окраску свежеприготовленного родизо-ната бария [16]. Наоборот, родизонат свинца менее растворим, чем сульфат свинца, поэтому при смачивании осадка последнего раствором родизоната натрия возникает сине-фиолетовая окраска родизоната свинца [17]. Различия в растворимости используют также при реакции нейтральных сульфатов щелочных металлов с карбонатом бария, протекающей при нагревании и приводящей к образованию сульфата бария и карбоната щелочного металла, который с фенолфталеином дает красное окрашивание [18]:
ВаСО3 Na2SO4 —- BaSO4 4- Ыа2СОз.
Если твердый роданид серебра встряхивать с раствором, содержащим сульфид- или тиосульфат-ионы, то освобождается роданид-ион, который можно определить в виде окрашенного комплекса Fe(III) [19].
В гл. 9 были описаны методы определения фторидов, хлоридов и сульфатов, основанные на фотометрическом определении 18*
276
ГЛАВА II
хлораниловой (или броманиловой) кислоты, освобождающейся при встряхивании суспензии какой-либо ее слаборастворимой соли с анализируемым образцом. Аналогичным образом коричневый плохо растворимый комплекс циркония с п-диметиламино-азофениларсоновой кислотой образует бесцветные ионы ZrFe2-и выделяет свободную кислоту красного цвета. Содержание хло-рид-иона можно найти, встряхивая анализируемый раствор с твердым хроматом или ортофосфатом серебра и определяя концентрацию вытесненных хромат- или фосфат-ионов.
Методика, предложенная для определения сульфид-иона, основана на реакциях двойного замещения [20]. Сульфид-ион осаждают в виде сульфида кадмия известным (избыточным) количеством сульфата кадмия. Добавляют диэтилдитиокарбамат натрия; непрореагировавший кадмий образует соответствующий комплекс, который затем экстрагируют хлороформом. Встряхивают экстракт с раствором сульфата меди и в хлороформной фазе фотометрически определяют содержание диэтилдитиокарбамата меди.
Титриметрические методы. Сульфат-ион . можно определить прямым титрованием хлоридом бария, используя в качестве индикаторов тетраоксихинон [21], ализариновый красный S [22] и торон [23] *. Их окрашенные комплексы с барием не образуются до тех пор, пока не будет полностью осажден сульфат бария. На этом же принципе основано применение в качестве титранта нитрата свинца в присутствии индикаторов эозина [24], эритрозина [25] или дитизона [26]. Дитизон был также использован в качестве индикатора при титровании ацетатом свинца в ацетоне сульфидов щелочных металлов. Метод можно также использовать для определения сульфатов, восстанавливая их до сульфидов [27].
Осаждение избытком реагента с последующим обратным титрованием применяют, например, при определении сульфата при помощи иона бария, причем избыток бария оттитровывают EDTA, применяя эриохром черный Т в качестве индикатора [28]. Возможны многие варианты этого метода: добавление избытка EDTA и обратное титрование его хлоридом магния в присутствии солохром черного [29] или отделение осадка с последующим растворением его в избытке EDTA и титрованием этого избытка стандартным раствором подходящего иона металла [30]. Вместо EDTA была использована диэтилентриаминпентауксусная кислота, дающая с барием более прочный комплекс [31]. Метод при
* Хорошими металлиндикаторами на ион Ва2+ при объемном определении сульфатов являются ортаниловый К (2-сульфобензол-(1-азо-2)-1,8-диокси-нафталин-3,6-дисульфокислота-(7-азо-1)-2-бензойная кислота) и карбоксиарсеназо (2-арсонобензол-(1-азо-2)-1,8-диоксинафталин-3,6-дисульфокислота-^7-азо-1)-2-бензойная кислота) [ЖАХ, 17,43 (1962)]. — Прим, перед.
РЕАКЦИИ ОРГАНИЧЕСКИХ РЕАГЕНТОВ С НЕОРГАНИЧЕСКИМИ АНИОНАМИ 277
менялся для быстрого определения серы в сталях. Образец растворяли в соляной кислоте, окисляли железо до трехвалентного и удаляли его экстракцией амилацетатом [32]; определение суль-фат-иона в почти чистом водном солянокислом растворе не представляет никаких трудностей.
Описан метод, сочетающий осаждение, окислительно-восстановительный процесс и фотометрическое определение. Сульфат осаждают нитратом свинца и избыток свинца титруют бихроматом калия, который в конечной точке окисляет хемилюминесцентный индикатор силоксен [33].
Концентрацию сульфидов можно определить осаждением сульфида избытком перхлората меди(II) с последующим обратным титрованием EDTA в присутствии мурексида в качестве индикатора [34].
К косвенным методам относятся также осаждение фторида в виде CaF2 избытком иона кальция с последующим титрованием при помощи EDTA [35] и аналогичные методы для определения сульфатов [36] и хроматов [37] ионами Ва24. Ферроцианид можно осадить цинком и избыток цинка определить титрованием EDTA [38]. Или же осадок можно собрать, растворить в кислоте и оттитровать. В качестве примеров можно назвать определение фосфатов [39] и арсенатов [40], осаждаемых в виде магнийаммо-ниевых солей с последующим комплексонометрическим титрованием магния. Пирофосфат-ион осаждали в виде соли с марганцем, осадок растворяли в избытке EDTA, который затем титровали стандартным раствором цинка [41].
Цианид-ион можно определить, обрабатывая его раствор избытком ионов Ni2+ с образованием Ni(CN)42- и титруя оставшийся Ni2+ при помощи EDTA [42].
2. МЕТОДЫ, ОСНОВАННЫЕ НА ОСАЖДЕНИИ ОРГАНИЧЕСКИМИ КАТИОНАМИ
И ЭКСТРАКЦИИ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ
Крупные анионы типа SO42-, по-видимому, образуют наименее растворимые соли с крупными же катионами. Примером служит использование двухзарядного катиона бензидина Н2МСбН4СеН4МН2 в качестве осадителя для сульфатов и молибдатов из слабокислых растворов. Он образует также осадки с фосфатами и вольфраматами; используя метод ионного обмена, можно добиться специфичного осаждения им сульфатов [43]. Если сульфаты являются единственным анионом, присутствующим в растворе, можно пропустить этот раствор через катионообменную смолу в водородной форме. Получающуюся серную кислоту можно оттитровать стандартным раствором щелочи. Белчер и сотрудники [44] нашли, что для этих целей значительно
278
ГЛАВА II
более пригодны менее растворимые в воде основания 4-амино-4'-хлордифенил и 4,4'-диаминотолан. Полезными осадителями для сульфат-иона являются крупные комплексные катионы типа октааммино-р,-амино-р-нитродикобальт(Ш) в водном растворе ацетона [45] и бромида гексаамминокобальта(III) в водных растворах этанола, метанола или ацетона [46]. Трис (этилендиамин) никель(П) осаждает тиосульфат-ион в виде [Ni (еп)з]520з.
Ион тетрафениларсония образует малорастворимые осадки со многими анионами, в том числе с перхлоратом, перйодатом, перманганатом, перренатом, фторидом, бромидом, иодидом, йодатом, роданидом, хроматом, молибдатом и вольфрамом. Эти реакции были использованы в ряде аналитических методов [47]. Так, содержание перхлоратов в морской воде определяли после осаждения их в виде перхлората тетрафениларсония с применением в качестве коллектора соответствующего перрената [48].
Метод определения ортофосфатов, основанный на образовании фосфоромолибдата, был улучшен за счет применения молибдата о-дианизидина, что облегчило взвешивание осадка. К тому же этот реагент, обладающий хромофорной группой, позволяет проводить спектрофотометрическое определение [49]. В гравиметрических микро- [50] и полумикрометодах [51] определения фосфатов была использована также малая растворимость фосфоромолибдата хинолина. Аналогичным образом можно использовать 8-оксихинолин [52]. Во всех этих случаях немаловажным обстоятельством является, по-видимому, тот факт, что крупный катион, применяющийся для образования ионной пары, имеет большую гидрофобную часть, выступающую в водный раствор.
а-Бензоиноксим в сильнокислых растворах образует нерастворимые осадки с молибдат- и вольфрамат-ионами и менее полно — с хроматами, ванадатами, ниобатами и танталатами. Эти анионы в уксуснокислых растворах образуют осадки и с 8-оксихинолином. Природа таких осадков неизвестна, но комплексы с а-бензоин-оксимом, образованные в слабокислых растворах, могут быть просто бис-комплексами катионов типа МоОг2+ и VO(OH)2+. Немаловажным обстоятельством, по-видимому, является тот факт, что в условиях осаждения комплексов с бензоиноксимом все реагирующие анионы, по меньшей мере частично, существуют в виде полианионов. Комплекс ванадия с оксином экстрагируется хлороформом.
Чувствительной реакцией на роданид-ион служит образование нерастворимого смешанного комплекса медь-анилин-роданид [53]. Экстракцию хлороформом соответствующего пиридинового комплекса с последующим измерением светопоглощения экстракта при 410 ммк используют для количественного определения содержания роданида в пределах 0,5—30 мкг)мл [54]. При более высоких концентрациях этот реактив позволяет выполнять
РЕАКЦИИ ОРГАНИЧЕСКИХ РЕАГЕНТОВ С НЕОРГАНИЧЕСКИМИ АНИОНАМИ 279
гравиметрическое определение роданидов [55]. Аналогичные экстрагирующиеся хлороформом соединения образуются в смесях меди(II), пиридина и ряда анионов, в том числе цианатов, цианидов, пероксидисульфатов, бромидов и иодидов. Различие окрасок этих растворов было предложено использовать в качественном анализе [56].
Однако, если не считать того обобщения, что малая растворимость вероятнее всего будет наблюдаться при взаимодействии крупных катионов с крупными анионами, возможности предсказания растворимости комплексов весьма невелики. В частности, относительные растворимости солей сульфатов, перхлоратов и нитратов с каким-либо данным катионом сильно изменяются, хотя нитраты обычно наиболее растворимы. Однако сульфат, перхлорат и ацетат ди (циклогексил) таллия (III) растворимы, а нитрат (и некоторые другие соли) растворяется плохо; этот реагент был предложен в качестве осадителя нитрат-иона [57]. Малорастворимые нитраты образуются также с цинхонамином, ди-1-нафтилдиметиламином и N-диэтилбензгидриламином.
Малорастворимые нитраты образуют многие эндиминотри-азолы. Наиболее часто применяемым реагентом на нитрат-ион является нитрон (1,4-дифенилэнданилодигидротриазол). Полагают, что по стерическим причинам он существует в виде цвиттериона CL [58]. Этот реагент образует осадки и с другими анионами,
N-----N+—С6Н-
u г II И
Н5С6— N-—С СН
N
С6Н5
CL
в том числе с нитритами, хлоратами, перхлоратами, иодидами, роданидами, персульфатами, цианидами Fe(III) и Fe(II), хроматами, молибдатами, вольфраматами и перманганатами, но не с сульфатами [59]. Нитрон был предложен в качестве реагента для гравиметрического определения перренатов [60], перхлоратов [61], хлоратов [62], а также фторидов (в виде фторборатов или фторфосфатов) [63]. Фторбораты можно также взвешивать в виде их солей с ионом гексадецилтриметиламмония [64]. Борат-ион можно определять реакцией его с фторид-ионом, приводящей к образованию фторбората, экстрагирующегося 1,2-дихлорэтаном в виде окрашенной ионной пары с метиленовым голубым (тетраметилтионином) [65]. Аналогичные ионные пары метиленовый голубой образует с перхлоратом, роданидом и трихлор
280
ГЛАВА И
ацетатом; комплекс с перхлорат-ионом растворим в хлороформе. Для экстракции BF4~ можно использовать другие хлорированные растворители, а также производные тионина.
3. МЕТОДЫ, ОСНОВАННЫЕ НА ОКИСЛЕНИИ ИЛИ ВОССТАНОВЛЕНИИ
Для обнаружения и определения неорганических анионов широко применяют фотометрические методы. В некоторых случаях, например при работе с перманганатами и хроматами, концентрацию ионов можно непосредственно определить спектрофотометрически. Однако гораздо чаще методы определения основаны на реакциях окисления или восстановления.
В качестве основы ряда фотометрических методов определения нитрат-иона было предложено использовать окисление в кислых средах бруцина [67], восстановленного стрихнина [68], дифениламина [69], дифениламиносульфоновой кислоты [70], дифенилбензидина [71], гидрохинонсульфокислоты [72], р-мети-лумбеллиферона [73], пентахлорфенола [74], пирогаллола и пи-рогаллолсульфокислоты [75]. Большую роль играет тщательное соблюдение условий эксперимента. Определению мешает нитрит-ион. Для достижения большей избирательности нитрат-ион часто определяют, восстанавливая его до ннтрит-иона или аммиака, но такое восстановление редко бывает количественным.
Наоборот, содержание нитрит-иона можно определить, окисляя его хлорамином Т до нитрата. Избыток хлорамина Т определяют титрованием иода, выделившегося при добавлении иодида калия. (Вопросы применения хлорамина Т в качестве титримет-рического реагента, напоминающего по своим свойствам гипохлорит натрия, обсуждались в работе [76].)
Качественная реакция на нитрит-ион заключается в окислении им тиомочевины до роданид-иона, который можно определить по красной окраске, возникающей при добавлении Fe(III) к кислому раствору. Эту же цветную реакцию можно использовать в качестве пробы на цианид-ион, образующий роданид-ион при нагревании с серой.
Весьма значительная стабилизация меди(1) цианид-ионом приводит к тому, что медь(II) в присутствии цианида становится сильным окислителем. Так, Си(II) окисляет бензидин до «бензидиновой сини». Эта реакция может служить также пробой на ро-данид-ион, если применить окислитель типа перманганата калия, превращающий роданид в цианид-ион. Реакцию образования «бензидиновой сини» в аналогичных условиях дают также хлориды, бромиды и иодиды.
Подобное усиление окислительной способности в результате комплексообразования обнаруживается при реакции феррициа
РЕАКЦИИ ОРГАНИЧЕСКИХ РЕАГЕНТОВ С НЕОРГАНИЧЕСКИМИ АНИОНАМИ 281
нида с Оранжем IV (тропеолином) и бензидином. При добавлении иона цинка ферроцианид-ион по мере его образования переходит в осадок, в результате чего поддерживается низкое значение окислительно-восстановительного потенциала и скорость окисления оранжа IV и бензидина сильно возрастает. Феррициа-нид-ион можно определить также окислительно-восстановительным титрованием аскорбиновой кислотой [77].
Определение цианид-иона окислительным разложением пиридина с последующим образованием полиметинового красителя рассмотрено в гл. 12. Роданид можно титровать йодатом калия (окислитель) в 3,5—4н. НС1; конечную точку определяют при помощи красителя амаранта [78].
Методы фотометрического определения фосфатов основаны главным образом на выделении фосфорномолибденовой кислоты и восстановлении ее гидразинсульфатом до синих полимерных комплексов, которые можно затем экстрагировать содержащими кислород органическими растворителями. С другой стороны, можно экстрагировать фосфорномолибденовую кислоту, а затем восстановить ее встряхиванием с восстановителем типа хлорида олова(II). Во всех таких гетерополикислотах остатки молибденовой кислоты являются гораздо более сильными окислителями, чем в незакомплексованном состоянии (это относится и к кислоте, и к аниону). При использовании в качестве восстановителя бензидина сам он окисляется до «бензидиновой сини», а гетерополикислота одновременно восстанавливается до «молибденовой сини». Из растворов, содержащих арсенат-, силикат-и германат-ионы, фосфорномолибденовая кислота избирательно экстрагируется смесью «-бутанола с хлороформом (1:4) [79].
Силикаты можно определить аналогично — по желтой окраске кремнемолибденовой кислоты или путем восстановления до молибденовой сини при использовании гидроксиламина, бензидина, гидрохинона, 1-амино-2-нафтол-4-сульфокислоты, хлорида олова (II) или некоторых других подходящих восстановителей [80]. Подобным же образом ведут себя арсенаты.
Для обнаружения сульфатов можно использовать окисляющее и дегидратирующее действие концентрированной серной кислоты, проявляющееся при нагревании ее с метилендисалициловой кислотой CLI. В этом случае образуется интенсивно красная формауриндикарбоновая кислота CLII [81]. Для этой же цели можно использовать м,- или «-оксибензальдегид.
В нейтральных растворах или в слабых растворах уксусной кислоты персульфат-ион окисляет бензидин до «бензидиновой сини». Эту реакцию дают также хроматы, перманганаты, феррицианиды и гипохлориты, а в более щелочных средах катионы Pb(IV), Т1(Ш), Аи(Ш) и Ce(IV), обладающие окислительными свойствами. Эти ионы окисляют также 2,7-диамино-................................СФСрими' - - - -
БИБЛСС'! • ? j
к V р. с 1
с_ ‘ '
!82
ГЛАВА 11
+ H2SO4
CLI
+ Н20 + so2
CLII
флуорен и окись 2, 7-диаминодифенилена. Аналогичным образом хроматы и бихроматы с а-нафтиламином дают синее окрашивание. Тетраметилдиаминодифенилметан (основание Арнольда, CLXV) окисляется перманганат- и хромат-ионами до синего вещества.
В отличие от сульфат-иона селенит-ион SeO;;2~ обнаруживает окисляющую способность. Так, подобно многим другим окислителям, селенит- и селенат-ионы в кислых средах окисляют несимметричный дифенилгидразин до фиолетового хиноидного соединения СЫН [82].
Сульфиты можно определять фотометрически по степени превращения фуксина в бесцветный продукт присоединения бисульфита [83] или в пределах 10-6—1СН% восстановлением иода в комплексе его с крахмалом до иодида [84].
Аналогичным образом сульфит-ион обесцвечивает нейтральные растворы малахитового зеленого, разрушая хиноидную структуру красителя. Такую же реакцию дают моно- и полисульфиды. Восстановительное действие двуокиси серы и сульфитов лежит в основе реакций, в которых обесцвечивается краситель астразоновый розовый FG [85] и тетраметилдиаминодифенилметан [86], а зеленый продукт фотоокисления 2-бензилпиридина превращается в красное вещество [87].
В качестве реакции на сульфит-ион было предложено использовать окисление фиолетовых азидных комплексов Со(II) до желтых азидных комплексов Со(III) с одновременным аутоокис
РЕАКЦИИ ОРГАНИЧЕСКИХ РЕАГЕНТОВ С НЕОРГАНИЧЕСКИМИ АНИОНАМИ 283
лением бисульфит-иона [88], а также с последующим взаимодействием Со(Ш) и о-толидина [89].
Сульфид определяли количественным окислением его до серы феррицианидом в аммиачном буферном растворе (pH 9,4) с использованием в качестве индикатора диметилглиоксимата Fe(II) [90]; в более щелочных растворах индикатором может служить нитропруссид натрия [91].
Тиосульфат-ион окисляется ионом трехвалентного железа до тетратионат-иона: эта реакция была положена в основу объемных методов определения тиосульфатов с применением в качестве индикаторов смеси метиленовый голубой — фуксин [92] или меконовой кислоты [93]. Аналогичным образом тиосульфат окисляли избытком ванадиевой кислоты с обратным титрованием ее солью Мора, применяя в качестве индикатора дифенилбензидин [94].
Гипосульфиты можно определять по их энергичному восстанавливающему действию на спиртовые растворы о- или м-динит-робензола, которые в щелочных (аммиачных) средах превращаются в окрашенные анионы (фиолетовые или красные соответственно) аци-формы нитрозонитробензола, например CLIV [95].
CLIV
Влияние сульфид-иона можно предотвратить предварительным отделением его в виде сульфида свинца. Другим методом определения гипосульфит-иона (дитионита), основанным на его восстановительном действии, является измерение степени ослабления окраски стандартного раствора индикатора индигокармина.
Селенит-ион определяли фотометрически по окислению им пиррола до «пирролового синего» [96] и несимметричного дифе-нилгидразина в фиолетовый хинонанилдифенилгидразон [97].
Для гравиметрического определения селена было использовано восстановление селенитов и селенатов до селена такими восстановителями, как тетраэтилтиурамдисульфид [98], аскорбиновая кислота [99], глюкоза [100] и тиомочевина [101].
Хлорат (в концентрированных растворах соляной кислоты) и гипохлорит (в разбавленных солянокислых растворах) окисляют бензидин до интенсивно желтого вещества, которое, вероятно, представляет собой мерихинон (ср. реакцию хлора, гл. 12). Фотометрические методы, основанные на этой реакции, применимы для определения концентраций порядка 0—10~4% [102].
Аналогичным образом следовые количества бромата дают
284
ГЛАВА 11
цветные реакции, окисляя стрихнин, метиловый оранжевый, индигокармин, п, п'-диокситрифенилметан, З-аминофеноксазин-2-он, а также смеси щавелевая кислота—флуоресцеин, щавелевая кислота—лейкофлуоресцеин и сульфат марганца (II)—бензидин. В основу количественного метода было положено появление красно-коричневой окраски с о-аминофениларсоновой кислотой [103].
В кислых растворах иодат окисляет пирогаллол до красновато-коричневого пургаллина [104].
Следовые количества перманганат-иона можно обнаружить по их окислительному действию на целлюлозу фильтровальной бумаги, которое приводит к осаждению коричневого порошка гидратированной двуокиси марганца (хроматы не реагируют).
Феррицианид-ион в нейтральных растворах является весьма сильным окислителем, особенно в присутствии солей цинка, ртути или свинца, обеспечивающих осаждение ферроцианид-иона и понижающих таким образом окислительно-восстановительный потенциал. В этих условиях феррицианид-ион легко дает положительную реакцию с бензидином (образование синего мерихино-идного соединения), фенолфталеином (окисление до красного аниона фенолфталеина) и теграметилдиаминодифенилметаном (окисление до синего катиона дифенилметанового красителя). Эти реакции дает также ряд других окислителей.
Хлоридный комплексный анион платины (IV) Р1С12“ восстанавливается до платины при кипячении в нейтральном формиатном растворе.
4. РЕАКЦИИ ДИАЗОТИРОВАНИЯ
Сочетание диазотированной сульфаниловой кислоты с 1-наф-тиламином лежит в основе чувствительного фотометрического метода определения нитритов. Диазотирование следует проводить в холодном сильнокислом растворе, а сочетание — в слабокислой среде [105]. К мешающим веществам относятся мочевина, алифатические амины, сильные окислители и восстановители (все они взаимодействуют с нитритом), Си2+ (катализирующая разложение диазониевой соли), а также гексахлороплатина(IV)-ионы, Fe(III), Au(III) и метаванадат-ионы (образующие осадки с 1-нафтиламином). Другая возможность заключается в непосредственном измерении поглощения диазотированной сульфаниловой кислоты в ультрафиолетовой области спектра (при 270 ммк) [106]. Вместо сульфаниловой кислоты можно применять сульфаниламид (с Ы-(1-нафтил)-этилендиамином в качестве основания [107]). Другие соединения, изученные в качестве реагентов для такого определения, указаны в работе [108]. Недавно было рекомендовано применение 4-аминоазобензола и 1-нафтиламина [209]. Реакцию диазотирования можно использо
РЕАКЦИИ ОРГАНИЧЕСКИХ РЕАГЕНТОВ С НЕОРГАНИЧЕСКИМИ АНИОНАМИ 285
вать в качестве пробы на нитрат-ион; нитрат переводят в нитро-зилхлорид (используя концентрированную серную кислоту и хлорид натрия), который затем гидролизуется до азотистой кислоты.
При использовании в качестве реагента 1,8-диаминонафталина диазотирование приводит к самосочетанию с образованием нерастворимого оранжево-красного 1,8-азиминонафталина CLV.
CLV
Селениты мешают этой реакции, образуя, вероятно, соответствующий пиазоселенол.
Реакция диазотирования была также положена в основу метода спектрофотометрического определения сульфатов, осажденных бензидином. Бензидин диазотируют и сочетают с Ы-(1-наф-тил)этилендиамином [ПО]. Была использована также реакция с р-нафтохинон-4-сульфонатом натрия [111] и п-диметиламинобензальдегидом [112].
Молибдаты в кислых средах окисляют фенилгидразин до диа-зо-соли, которая затем сочетается с избытком основания и молибдата, образуя красный продукт.
5. РЕАКЦИИ НИТРОВАНИЯ
Нитрат-ион можно также определить фотометрически при помощи реакций нитрования. Фенол-2,4-дисульфокислота образует желтую 6-нитрофенол-2,4-дисульфокислоту, причем реакцию проводят в сильнокислой среде с последующим развитием окраски в щелочном растворе [ИЗ]. Проведению реакции мешают нитриты, хлориды и органические вещества. Гораздо более чувствительным реагентом является хромотроповая кислота в концентрированной серной кислоте [114]. Широко применяли и 2, 4-кси-ленол [115]. В качестве реагентов были предложены также 1,5-нафтолсульфокислота [116], сульфосалициловая кислота [117], 2,6-ксиленол [118] и 3,4-ксиленол [119]. Преимущество ксиленолов заключается в том, что продукты реакции можно отогнать или экстрагировать органическим растворителем, например толуолом. Для определения нитратов был предложен метод, основанный на нитровании 2, 6-ксиленола до 4-нитро-2, 6-ксиленола с последующим полярографическим восстановлением [120].
286
ГЛАВА II
6. ГЕТЕРОЦИКЛИЧЕСКИЕ СИНТЕЗЫ
Селениты окисляют иодид-ион до иода, который затем можно определить обычным способом. Другой метод основан на реакции с подходящим диамином, приводящей к образованию пиазоселе-нола типа CLVI. Благодаря работам Хинсберга [121] эта реак-
CLVI
ция была распространена на 3, З'-диаминобензидин, который при взаимодействии с селенистой кислотой в 0,1 М соляной кислоте в течение 50 мин образует желтый пиазоселенол CLVII [122]. Последний при pH 5 можно экстрагировать толуолом [123]. Он лишь
CLVII
слабо растворим в воде (2,5 мкг!мл). Теллур не дает этой реакции. Окислители и комплексообразующие вещества мешают, но большинство продуктов, соответствующих реакции, не экстрагируется толуолом. Аналогично этому 2, 3-диаминонафталин применяют для прямого гравиметрического определения миллиграммовых количеств селена, для спектрофотометрического определения микрограммовых содержаний селена с экстракцией толуолом и флуориметрического определения субмикрограммо-вых количеств (также в толуоле) [124]. В случае гравиметрического определения удовлетворительное маскирование (при pH 2) достигается при использовании фторида натрия, оксалата натрия и EDTA, а в спектрофотометрическом методе раствор также пропускают через ионообменную колонку. Этим устраняется мешающее влияние катионов, особенно меди (II); метод можно использовать для определения селена в меди. К другим соединениям, образующим пиазоселенол и применяемым в качестве фотометрических реагентов на селен, относятся 4-диметиламино-1,2-фе-нилендиамин и 4-метилтио-1,2-фенилендиамин [125], дающие с селеном в сильнокислых средах красную и сине-пурпурную окраски.
Образование пиазоселенола протекает через промежуточный о-хинондиимин [126].
РЕАКЦИИ ОРГАНИЧЕСКИХ РЕАГЕНТОВ С НЕОРГАНИЧЕСКИМИ АНИОНАМИ 287
В щелочных растворах протекает реакция между сульфид-ио-ном и комплексом ртути(II) с дифенилкарбазидом, причем появляется интенсивно красная окраска [127]. Возможно, в этой реакции, которая, как утверждают, является специфичной для сульфидов, образуется дитизон.
7. КОМПЛЕКСООБРАЗОВАНИЕ С ОРГАНИЧЕСКИМИ ЛИГАНДАМИ
Борная кислота является слабой одноосновной кислотой (р/(=9,20), поэтому ее растворы нельзя точно титровать стандартными растворами щелочей. Однако в присутствии подходящих полиокси-соединений, таких, как глюкоза, глицерин и (аналитически более удобный) маннит, борат-анион стабилизируется за счет образования хелатов, в которых часть или все окружающие его молекулы воды замещаются окси-группами органического лиганда. Эта стабилизация приводит почти к 10000-кратному увеличению силы борной кислоты, которая в этом случае может быть оттитрована стандартным щелочным раствором по фенолфталеину.
В этой реакции очень большое значение имеют стерические ограничения. Так, 1,2- и 1,3-диолы пригодны, если они являются цис-, но не тракс-изомерами, поэтому в реакции может участвовать пирокатехин, но не резорцин или гидрохинон. Реакция полезна для отличия цис- от тракс-изомеров в ряду типа инозитов.
Интересный вариант этой реакции заключается в определении борной кислоты по измерению влияния последней на оптическое вращение растворов винной кислоты [128]. Боротартратный комплексный ион образует также нерастворимую бариевую соль, поэтому был предложен спектрофотометрический метод определения бора с применением хлоранилата бария и винной кислоты, основанный на фотометрировании освобожденного хлоранилат-иона [129]. Комплексообразование такого же типа позволяет, применяя глицерин, устранять мешающее влияние бора при гравиметрическом определении кремния дегидратацией кремниевой кислоты [130] или же используя маннит — при фотометрическом определении силикат-иона, основанном на реакции последнего с бензоином [131].
Германий, подобно бору, может образовывать комплексы с подходящими многоатомными спиртами. Получающиеся в результате этого соединения германиевые кислоты, например с глицерином или маннитом, являются сильными одноосновными кислотами.
При содержании бора менее ~ 0,01 % предпочтительными являются фотометрические методы. Влияния большинства веществ можно избежать, предварительно отделив бор в виде метилбо-
288
ГЛАВА 11
рата или пропуская раствор, содержащий бораты, через катионообменную колонку. (Образование летучих метил- или этилбора-тов при нагревании смеси серной кислоты, борной кислоты и соответствующего спирта служит основой пламенной пробы на бораты.) В концентрированных растворах серной кислоты борная кислота образует окрашенные хелаты с полиоксиантрахинонами, которые используют для ее фотометрического определения. В качестве примера можно назвать хинализарин CLVIII [132] и карминовую кислоту CLIX [133].
Метод с использованием хинализарина является быстрым и точным, но различия между спектрами хинализарина и его комплекса с бором довольно незначительны. Гораздо большая разница — переход от красной к синей окраске — наблюдается в случае карминовой кислоты (520 и 585 ммк соответственно). В качестве реагента на борную кислоту в тех же условиях и для того же интервала концентраций (0—1 мкг/мл) применяют иминоаналог 1-оксиантрахинона—1, 1-диантримид CLX [134]. Были предложены и другие реагенты этого типа, в том числе ализариновый красный S и пурпурин. Во всех случаях в хелатообразовании участвуют СО- и окси-группы (или имино-группа в CLX), находящиеся в пери-положении к ней [135]. п-Нитробензолазохромотро-повая кислота (хромотроп 2В) в серной кислоте также служит в качестве реагента для капельных проб на борную кислоту [136].
CLX
РЕАКЦИИ ОРГАНИЧЕСКИХ РЕАГЕНТОВ С НЕОРГАНИЧЕСКИМИ АНИОНАМИ 289
Взаимодействие между борной кислотой и спиртовым раствором куркумина CLXI (составной части куркумы) в разбавленном
CLX1
растворе щавелевой и соляной кислот представляет собой очень чувствительную цветную реакцию на борную кислоту — переход от желтой окраски к красно-розовой; реакцию можно использовать для определения 0,1 —10 мкг бора [137]. Природа реакции неизвестна, но возможно, что она заключается в катализируемой боратами перегруппировке куркумина в розоцианин.
В щелочных растворах сульфид-ион взаимодействует с нитрозоцианином или ионом «нитропруссида» [NO —>-Fe(CN)5]2~, образуя соединение с интенсивно фиолетовой окраской. Реакция обусловлена превращением нитрозильного радикала в тионитрогруппу NOS (CLXII). Аналогично этому едкие щелочи приводят
О
Ъ—Fe(CN)5
CLXH
к образованию нитро-группы и сульфиты образуют соединение CLXIII, благодаря чему качественная проба на сульфиты заклю-
%
Ji — Fe(CN)5
-so3
CLXIII-
чается в образовании с нитропруссидом цинка красного вещества, особенно в присутствии аммиака [138]. Известны также рутениевые аналоги нитропруссид-иона и соединения CLXII. Соединение CLXII чувствительно к свету, и его окраска быстро блекнет на солнечном свету, поэтому для количественного определения реакция непригодна.
Качественное различие между сульфит- и тиосульфат-ионами при совместном их присутствии можно провести после добавле-19 Д- Перрин
290
ГЛАВА 11
ния к нейтральному анализируемому раствору формальдегида или других альдегидов. Сульфиты, но не тиосульфаты образуют с альдегидами продукты присоединения; благодаря происходящему при этом отщеплению ионов гидроксила раствор становится щелочным.
Высокоспецифичная реакция на фторид-ион была неожиданно найдена при работе с красным комплексом церия(III) и ализа-ринкомплексона (образуется ализарин-фторидная синь) CLXIV.
CLXIV
В этом комплексе ион металла координирован атомом азота амино-группы, двумя карбокси-анионами и ближайшей фенольной ОН-группой. Остающиеся два места у иона металла заняты молекулами воды. Замещение одной из этих молекул воды на фторид-ион с образованием церофторидного комплекса приводит к оттягиванию электронов от ароматического ядра и вызывает потерю протона 1-окси-группой молекулы ализарина. При этом развивается характерная пурпурно-синяя окраска, благодаря которой можно определять до 1 • 1О~5О/о фторид-иона [139, 140]. Окраска близка к окраске полностью ионизированного лиганда, наблюдаемой при pH 13. Чувствительность метода можно еще более повысить (вплоть до 2- 10~7%), применяя экстракцию амиловым спиртом, содержащим трибутиламин; в этом случае экстрагируется только фторо-комплекс. Амин здесь необходим, чтобы его катион нейтрализовал заряд комплекса. Хотя красные внутри-комплексные соединения с CLXIV образуют Се, La, Рг, Sm, Sc, Y, Gd, Dy, Er и Yb, синие комплексы с фторид-ионом дают только Се, La и Рг. Тот факт, что эту реакцию дает лишь фторид-ион, но не другие анионы, объясняется его необычайно сильными электрофильными свойствами. Другие ди (карбоксиметил) аминометилоксиантрахиноны дают аналогичную реакцию [140].
8. ДРУГИЕ КОСВЕННЫЕ МЕТОДЫ
Для качественного определения ряда анионов можно использовать каталитические эффекты. Реакция между хлорамином Т и ароматическим основанием тетраметилдиаминдифенилметаном CLXV, приводящая к образованию в слабокислых (уксусных)
РЕАКЦИИ ОРГАНИЧЕСКИХ РЕАГЕНТОВ С НЕОРГАНИЧЕСКИМИ АНИОНАМИ 291
средах хиноидного соединения, протекает очень медленно, пока в растворе отсутствуют иодид-ион или иод. В присутствии последних окисление проходит быстро. Каталитический эффект объясняется реакцией между гипохлорит-ионом (получающимся при
(CH3)2N
n(ch3)2
CL XV
гидролизе хлорамина Т) и иодид-ионом, в результате чего образуется иод, который окисляет CLXV с регенерацией иодид-иона [141].
Сульфид-, тиосульфат- и роданид-ионы можно обнаружить по ускорению ими реакции между азидом натрия и иодом, которая приводит к образованию иодида натрия и азота.
В щелочных растворах цианид-ион катализирует конденсацию бензальдегида в бензоин через промежуточное образование циангидрина — нитрила миндальной кислоты. Цианид-ион можно также обнаружить по реакции демаскирования, основанной на конкурирующем действии цианид-иона, приводящем к вытеснению в щелочных (аммиачных) растворах диметилглиоксима из его бис-комплекса с палладием (II). Последующее введение иона никеля приводит к осаждению красного комплекса никеля с диме-тилглиоксимом [142].
Аналогичный процесс демаскирования лежит в основе реакции на ферроцианид-ион. Добавление растворимой соли двухвалентной ртути к анализируемому щелочному раствору, содержащему а, а'-дипиридил, приводит к диссоциации ферроцианид-ионов в результате образования очень прочных цианидных комплексов двухвалентной ртути. Высвободившиеся ионы Fe (II) образуют с а, сх'-дипиридилом красный комплекс [143].
Цианат-ион можно обнаружить по его реакции с гидроксиламином, приводящей к образованию соли, которая находится в изомерном равновесии с оксимочевиной (ср. цианат аммония и мочевину). Но поскольку оксимочевина представляет собой амидогидроксамовую кислоту, в слабокислых растворах она образует с железом растворимый в воде фиолетовый трис-комплекс [144].
Фторид-ион можно обнаружить, отгоняя его в виде SiF4 или H2SiF6, при нагревании испытуемой пробы с серной кислотой в присутствии двуокиси кремния с последующим гидролизом продуктов отгонки и превращением их в кремнемолибденовую кислоту. Последняя дает положительную пробу с бензидином.
19*
292
ГЛАВА И
ЛИТЕРАТУРА
1. Bums te ad Н. Е„ Wells J. С., Anal. Chem., 24, 1595 (1952).
2. Icken J. M., Blank M. B., Anal. Chem., 25, 1741 (1953).
3. MegragianS., Anal. Chem., 26, 1161 (1954).
4. Richter F., Chem. Tech. (Berlin), 1, 84 (1949).
5. Powell W. A., Saylor J. H., Anal. Chem., 25, 960 (1953).
6. Wha rton H. W„ Anal. Chem., 34, 1296 (1962).
7. W a к i m о t о S., Nippon Kagaku Zasshi, 77, 1489 (1956).
8. Silverman L., Shideler M. E., Anal. Chem., 31, 152 (1959).
9. К emu la W., Hulanicki A., Janowski A., Taianta, 7, 69 (1960).
10. J о n e s A. S„ L e t h a m D. S„ Analyst, 81, 15 (1956).
II. Andersen L., Acta Chem. Scand., 7, 689 (1953).
12. Например, Hubbard R. S., J. Biol. Chem., 128, 537 (1939).
13. Kahn B. S„ Li eb off S. L„ J. Biol. Chem., 80, 623 (1928); Lento-noff T. V., Reinhold J. G„ J. Biol. Chem., 114, 147 (1936).
14. Klein B., Ind. Eng. Chem. (Anal. Ed.), 16, 536 (1944).
15. Lambert J. L., Yasuda S. K., Grotheer M. P., Anal. Chem., 27, 800 (1955).
16. G u t z e i t G„ Helv. Chim. Acta, 12, 736 (1929).
17. Feigl F., Suter H. A., Ind. Eng. Chem. (Anal. Ed.), 14, 840 (1942).
18. Feigl F., Rec. Trav. Chim., 58, 471 (1939).
19. Utsumi S., Nippon Kagaku Zasshi, 74, 358 (1953).
20. V a s а к V., M a c h a 1 e к V., Chem. listy, 47, 850 (1953).
21. Standard Methods for the Examination of Water, Sewage, and Industrial Wastes, 10th ed., American Public Health Association, New York, 1955, pp. 196—200.
22. Fritz J. S., Freeland M. Q„ Anal. Chem., 26, 1593 (1954).
23. F r i t z J. S., Yamamura S. S., Richard M. J., Anal. Chem., 29, 158 (1957).
24. R i с c i J. E., Ind. Eng. Chem. (Anal. Ed.), 8, 130 (1936).
25. BurgW. V., Ind. Eng. Chem. (Anal. Ed.), 11, 28 (1939).
26. A r c h e r E. E., Analyst, 82, 208 (1957); Kirsten W. J., H a n s-son K. A., Nilsson S. K., Anal. Chim. Acta, 28, 101 (1963).
27. Archer E. E„ Analyst, 81, 181 (1956).
28. Munger J. R., Nippier R. W., I n g о 1 s R. S., Anal. Chem., 22, 1455 (1950).
29. Belcher R., Gibbons D., West T. S., Chem. Ind. (London), 1954, 127.
30. S p о г e к K. F., Anal. Chem., 30, 1032 (1958).
31. Wanninen E., Suomen Kem., B29, 184 (1956).
32. Belcher R., Gibbons D., West T. S., Analyst, 80, 751 (1955).
33. Kenny F., Kurtz R. B., Beck L, Lukosevicius L, Anal. Chem., 29, 543 (1957).
34. К i v a 1 о P., Anal. Chem., 27, 1809 (1955).
35. Belcher R., Clark S. J., Anal. Chim. Acta, 8, 222 (1953).
36. Anderegg G., Flaschka H., Sa liman R., Schwarzenbach G., Helv. Chim. Acta, 37, 113 (1953).
37. I s a g a i К., T a к e s h i t a N., Japan Analyst, 4, 222 (1955).
38. Hol P. J., Leendertse G. С. H., Chem. Weekblad, 48, 181 (1952).
39. F 1 a s c h к a H., H о 1 a s e к A., Mikrochem. Microchim. Acta, 39, 101 (1952).
40. M a 1 i n e к M., R e h а к B., Chem. listy, 49, 765 (1955).
41. Nielsch W„ Giefer L„ Z. anal. Chem., 146, 323 (1955).
42. Hud it z F., Flaschka H., Z. anal. Chem., 136, 185 (1952).
43. Gottschalk G., Dehmel R., Z. anal. Chem., 155, 251 (1957).
44. Belcher R., Кар el M., N u 11 en A. J., Anal. Chim. Acta, 8, 122,
РЕАКЦИИ ОРГАНИЧЕСКИХ РЕАГЕНТОВ С НЕОРГАНИЧЕСКИМИ АНИОНАМИ 293
146 (1953); Belcher R„ Nut ten A.-J., Stephen W. I., J. Chem. Soc., 1953, 1334.
45. В e I c h e r R., G i b b о n s D., J. Chem. Soc., 1952, 4216.
46. M a h г С., К r a u s K., Z. anal. Chem., 128, 477.
47. Willard H. H., Smith G. M., Ind. Eng. Chem. (Anal. Ed.), 11, 186, 269 (1939).
48. Greenhalgh R., Riley J. P., J. Marine Biol. Assoc. U. K., 41, 175 (1961).
49. Robinson J. W., West P. W., Microchem. J., 1, 93 (1957).
50. Wi 1 son H. N, Analyst, 76, 65 (1951).
51. Fennell T. R. F. W„ Webb J. R., Taianta, 2, 105 (1959).
52. В r a b s о n J. A., Edwards O. W., Anal. Chem., 28, 1485 (1956k
53. Крешков А. П., Вильборг С. С., Филиппова К. И., ЖАХ, 8, 225 (1953).
54. Kruse J. M., Mellon M. G., Anal. Chem., 25, 446 (1953).
55. Spacu G., Bull. Soc. Stiinte Cluj, 1, 302 (1922); Chem. Abs., 17, 1772 (1923).
56. Ayres G. H., Baird S. S., Anal. Chim. Acta, 23, 446 (1960).
57. Hartmann H., Biithge G„ Angew. Chem., 65, 107 (1953).
58. S c h 6 n b e r g A., J. Chem. Soc., 1938, 824.
59. Heck J. E„ Hunt H., Mellon M. G, Analyst, 59, 18 (1934).
60. Geilmann W., Voigt A., Z. anorg. allg. Chem., 193, 311 (1930).
61. Vfl r t he i m A., Rec. Trav. Chim., 46, 97 (1927).
62. Cope W. C., Barab J., J. Am. Chem. Soc., 29, 504 (1917).
63. E 1 v i n g P. J., Horton C. A., Willard H. H., “Analytical Chemistry of Fluorine and Fluorine-Containing Compounds"; Simons J. H., Fluorine Chemistry, Academic Press, New York, 1954, Vol. 2, Chapter 3.
64. Schaack H. J., Wagner W., Z. anal. Chem., 146, 326 (1955).
65. Ducret L., Anal. Chim. Acta, 17, 213 (1957).
66. Pasztor L„ Bode J. D., Anal. Chim. Acta, 24, 467 (1961).
67. Noll C. A., Ind. Eng. Chem. (Anal. Ed.), 17, 426 (1945); Wolf B, Ind. Eng. Chem. (Anal. Ed.), 16, 121 (1944).
68. Machida Y., Bull. Chem. Soc. Japan, 24, 254 (1951); Г p и ц у т а С. Д., ЖАХ, 5, 286 (1950).
69. Iso dor о R., Boll. Lab. Chim. Procinciali (Bologna), 2, 16 (1951).
70. Kolthoff I. M., Naponen G. E., J. Am. Chem. Soc., 55, 1448 (1933).
71. P f e i 1 s t i с k e г K., Z. anal. Chem., 89, 1 (1932).
72. Bini G., Atti Accad. Lincei, 11, 593 (1930).
73. Васильев А. С., Духинова M. M., Завод, лаб., 10, 35 (1941).
74. C ho Lak J., McNary R., J. Ind. Hyg. Toxicol., 25, 354 (1943).
75. D e Na rdo L. U., Compt. rend., 188, 563 (1929).
76. В i s h о p E„ J e n n i n g s V. J., Taianta, 1, 197 (1958).
77. Erdey L., Svehla G., Koi tai L., Anal. Chim. Acta, 27, 498 (1962).
78. Hammock E. W., Bea von D., Swift E. H., Anal. Chem., 21, 970 (1949).
79. Wadelin C., Mellon M. G., Anal. Chem., 25, 1668 (1953).
80. Boltz D. F., Mellon M. G., Ind. Eng. Chem. (Anal. Ed.), 19, 873 (1947); C a s e О. P„ ibid., 16, 309 (1944).
81. Feigl F„ Spot Tests in Inorganic Analysis, Elsevier, Amsterdam, 5th ed., 1958, p. 317.
82. F e i g 1 F„ D e m a n t V., Mikrochim. Acta, 1, 322 (1937).
83. Atkin S., Anal. Chem., 22, 947 (1950); Stang A. M„ Zatek J. E„ Robson E. D., Am. Ind. Hyg. Assoc. Quart, 12, 5 (1951).
84. Katz M„ Anal. Chem., 22, 1040 (1950).
85. L i d d e 11 H. F„ Analyst, 80, 901 (1955).
86. McConnaughey P. W. (to the Mine Safety Appliance Co.), пат. США, 2736638, 28/11 1956.
87. F г e у t a g H., Вег., 67B, 1477 (1934).
294
ГЛАВА II
88. Ср. окисление окисла Ni (II) до гидратированного окисла Ni (IV) при одновременном самоокислении двуокиси серы, описанное в работе FeiglF.,FrankelE., Вег., 65, 545 (1932).
89. S е п i s е Р., Mikrochim. Acta, 1957, 640.
90. С h а г 1 о t G., Bull. Soc. Chim. France, 6, 1447 (1939).
91. К i b о k u M., Japan Analyst, 6, 491 (1957).
92. Jellinek K., Wino grad off L., Z. anorg. Chem., 129, 15 (1925).
93. Kolthoff I. M., Tom ice k O., Pharm. Weekblad, 61, 1205 (1925).
94. Gowda H. S., Rao К. B., Rao G. G., Anal. Chim. Acta, 12, 506 (1955).
95. Kuhn R„ Weygand F., Ber., 69, 1969 (1936).
96. Berg R., Teitelbaum M., Mikrochem., 15, 32 (1934); Suzuki M., Nippon Kagaku Zasshi, 5B, 323 (1953).
97. Cm. [81], стр. 347.
98. M i c h a 1 J., Z у k a J., Chem. listy, 48, 1338 (1954).
99. S i m о n V., G r i m V., Chem. lesty, 48, 1774 (1954).
100. Fidler J., Chem. listy, 46, 221 (1952).
101. Deshmukh G. S., Sankaranarayanan К. M., J. Sci. Res. Ba-naras Hindu Univ., 3, 5 (1952—1953); Chem. Abs., 48, 6320c 1954).
102. Horvorka V., Holzbecher Z., Coll. Czech. Chem. Comm., 14, 490 (1949); Klut H., KI. Mitt, Ver. Wasserversag. Abwasserbeseitig, 3, 184 (1927).
103. Macdonald J. C., Yoe J. H., Anal. Chim. Acta, 28, 383 (1963).
104. Готлиб А. Л., ЖПХ, 11, 135 (1938).
105. Rider B. F., Mellon M. G., Ind. Eng. Chem. (Anal. Ed.), 18, 96 (1946); Barnes H., Folkard A. R., Analyst, 76, 599 (1951).
106. Pappenhagen J. M., Mellon M. G., Anal. Chem., 25, 341 (1953).
107. Barnes H., Folkard A. R., Analyst, 76, 599 (1951).
108. Колориметрические методы определения неметаллов. Под ред. Д. Ф. Волна, ИЛ, М„ 1963.
109. Sawicki Е., Noe J. L., Anal. Chim. Acta, 25, 166 (1961).
110. Klein В., Ind. Eng. Chem. (Anal. Ed.), 16, 536 (1944).
111. Letonof f T. V., Reinhold J. G., Am. J. Med. Sci., 188, 142 (1934);
J. Biol. Chem., 114, 147 (1936).
112. St. Lorant I., Biochem. Z., 289, 425 (1937).
113. Taras M. J., Anal. Chem., 22, 1020 (1950); de Carvalho A., Anais Asoc. Brasil. Quim., 9, 106 (1950).
114. West P. W., Lyles G. L., Anal. Chim. Acta, 23, 227 (1960).
115. Barnes H., Analyst, 75, 388 (1950); Jones G. B„ Under-d о w n R. E., Anal. Chem., 25, 806 (1953).
116. Murty G. V. L. N., Proc. Indian Acad. Sci., 14A, 43 (1941).
117. Васильева Л. А., Труды Казанского химико-техн, ин-та им. Кирова, 8, 48 (1940).
118. Н а г 11 е у А. М., A s a i R. I., J. Am. Water Works Assoc., 52, 255 (I960).
119. Holler A. C., Huch R. V., Anal. Chem., 21, 1385 (1949).
120. Hartley A. M., Curran D. J., Anal. Chem., 35, 686 (1963).
121. H i n sb er g O„ Ber., 52, 21 (1919).
122. Hosts J., Gillis J., Anal, Chim. Acta, 12, 158 (1955).
123. Cheng K. L., Anal. Chem., 28, 1738 (1956).
124. Parker C. A., Harvey L. G., Analyst, 87, 558 (1962); Lott P. F., Chem. Eng. News, March, 18, 1963, p. 45.
125. Sawicki E., Anal. Chem., 29, 1376 (1957); Demeyere D., Hoste J., Anal. Chim. Acta, 27, 288 (1962).
126. Эфрос Л. С., Ж0Х, 27, 1064 (1957).
127. Крешков А. П., Сенецкая Л. П., Труды Моск. хим.-техн, ин-та им. Д. И. Менделеева, 22, 108 (1956).
128. К о d a m а К., С h i i о Н., Anal. Chem., 34, 106 (1962).
129. Srivastava R. D., Van Buren P. A., Gesser H., Anal. Chem, 34, 209 (1962).
РЕАКЦИИ ОРГАНИЧЕСКИХ РЕАГЕНТОВ С НЕОРГАНИЧЕСКИМИ АНИОНАМИ 295
130. Р a s z t о г L. С., Anal. Chem., 33, 1270 (1961).
131. Е 1 1 i о 11 G„ R a d 1 е у J. A., Anal. Chem., 33, 1623 (1961).
132. Martin G„ Maes M„ Bull. Soc. Chim. Biol., 34, 1178 (1952); Ma cd on gall D., Briggs D. A., Anal. Chem., 24, 566 (1952); R i p-1 e у - D u g g a n B. A., Analyst, 78, 183 (1953).
133. Hatcher J. T„ Wilcox L. V., Anal. Chem., 22, 567 (1950).
134. Ellis G. H„ Zook E. G„ Brandish 0., Anal. Chem., 21, 1345 (1949); Brewster P. A., Anal. Chem., 23, 1809 (1951); Codell M., N о r-witz G., Anal. Chem., 25, 1446 (1953).
135. Dimroth 0., FaustT, Ber., 54, 3020 (1921).
136. Комаровский А. С., Полуэктов H. C., Mikrochem., 14, 317 (1933—1934).
137. D i b 1 e W. T., T r u о g E. T., Berger R. C., Anal. Chem., 26, 418 (1954).
138. Eegriwe E., Z. anal. Chem., 65, 182 (1924).
139. Belcher R., Leonard M. A., West T. S., J. Chem. Soc., 1959, 3577.
140. L e о n a r d M. A., W e s t T. S„ J. Chem. Soc., 1960, 4477.
141. Feigl F., Jungreis E., Z. anal. Chem., 161, 87 (1958).
142. F e i g 1 F„ F e i g 1 H. E„ Anal. Chim. Acta, 3, 300 (1949).
143. F e i g 1 F„ С a 1 d a s A., Anal. Chim. Acta, 13, 526 (1955).
144. Da vidson D, J. Chem. Ed., 17, 84 (1940).
ГЛАВА 12
Методы обнаружения и определения неорганических нейтральных молекул
Одним из наиболее важных с точки зрения химического анализа свойств неметаллов является их способность образовывать соединения, которые можно отделить возгонкой, диффузией или дистилляцией. Это справедливо также для многих металлоидов и некоторых металлов. В последнем случае можно назвать хлориды хромила, рутения и осмия, а также летучие отгоняющиеся из сернокислых растворов бромиды, образуемые следующими элементами: As(III), As(V), Sb(HI), Sb(V), Se(IV), Se(VI), Ge, Hg(I), Hg(II), Re, Sn(II), Sn(IV) и в гораздо меньшей степени В, Те(IV), Те(VI), Mo, Bi, Р и Au. В группе элементов
В С N О F
Si Р S С1
Ge As Se Вг
Те I
к летучим соединениям относятся: для В — В (ОСНз)з, BF3; для С — СО, СО2; для Si — SiF4; для Ge — GeBr4; для N — NH3, NO, NOCI; для P — PH3, РС1з; для As — AsCl3, AsBrs, AsH3; для S — SO2, SO3, H2S; для Se — H2Se, SeCh, SeOCl2, SeBr4, SeCl4, SeOBf2; для Те — НгТе, ТеС12, ТеВг4, ТеС14, ТеОВгг, ТеОС12; для F — F2, H2F2, SiF4, FbSiFe; для Cl — CI2, НС1; для Вт — Вгг, НВт, CNBr; для I — 1г и Ш. Использование этого свойства значительно смягчает жесткость требований к избирательности реагентов.
При использовании в качестве окислителя брома или хлора непрореагировавший избыток их можно удалить добавлением сульфосалициловой кислоты, легко вступающей в реакцию замещения со свободными галогенами.
Многие нейтральные молекулы реагируют, как соответствующие катионы или анионы, например SO2, как HSO3~ и SO31 2-; NO2, как NO2_ и NO3_; НС1, как Cl-. Следовательно, они будут рассмотрены в других главах.
1. ПРЯМАЯ СПЕКТРОФОТОМЕТРИЯ
В ограниченном числе случаев вещества можно определить прямым спектрофотометрированием.
обнаружение и определение нейтральных молекул
297
Элементарную серу при содержании ее в пределах 0—4 • 10-3% определяли по поглощению в ультрафиолетовой области спектра ее этанольных или «-гексановых растворов [1].
Растворы иода в неполярных растворителях типа четыреххлористого углерода или сероуглерода имеют пурпурную окраску, и их спектры подобны спектрам паров иода. При распределении иода между водной и органической фазами он переходит преимущественно в органический слой. Окраску иода используют для определения этого элемента и как индикатор при йодометрическом титровании. В присутствии содержащих гидроксил растворителей, например воды или этанола, иод сольватируется и образует коричневый комплекс, поглощающий более интенсивно в ультрафиолетовой части спектра. В присутствии иодид-иона образуются желто-коричневые полииодидные комплексы, которые можно обнаруживать при концентрациях вплоть до 10-4 М. Более интенсивно окрашенные иод-иодидные комплексы образуются с амилозой (синий), амилопектином (красно-пурпурный), гликогеном (коричневый) и некоторыми другими крахмалами [2]. Модифицированные типы крахмала, содержащие много амилозы, «линейный крахмал», можно использовать в йодометрическом титровании. Хлор и бром можно также обнаружить по их реакции с иодид-ионом на иод-крахмальной бумаге; реакция идет с освобождением иода, образующего затем синее соединение с крахмалом. Аналогичным образом реагируют многие другие окислители, в том числе перекись водорода, нитрит- и перманганат-ионы.
В водных растворах иод образует синий продукт присоединения с а-нафтофлавоном; при этом происходит гашение флуоресценции. Эта реакция более чувствительна, чем иод-крахмальная [3]. В этих же условиях бром образует оранжево-красное вещество, а хлор не реагирует.
Добавление к раствору серы в пиридине разбавленного раствора гидроокиси натрия приводит к образованию окрашенных растворов; эту реакцию можно использовать для обнаружения 10”3% или большего количества серы [4]. Был разработан прямой спектрофотометрический метод определения свободной серы, ос-
CLXV1
298
ГЛАВА 12
нованный на реакции CLXVI, протекающей при нагревании ее с реагентом Шёнберга — N- (4,4'-диметоксибензогидрилиден) -бензиламином. При этом образуется синий тиокетон (4,4'-дианизил-тиокетон), растворимый в бензоле [5]. Добавление к реакционной смеси небольшого кристалла хлорида двухвалентной ртути можно использовать как подтверждающую качественную реакцию: тиокетон медленно взаимодействует со ртутью, образуя комплекс красного цвета.
Качественные реакции на следы воды заключаются в образовании оранжевой окраски с 1%-ным раствором дипикриламина в безводном диоксане [6] и коричневого раствора с 3%-ным раствором тетраацетата свинца в безводном бензоле [7].
Селен и теллур чаще всего определяют в виде их золей. Че-тырехокиси осмия и рутения можно определить прямым спектро-фотометрированием их растворов в органических растворителях.
2. РЕАКЦИИ ОКИСЛЕНИЯ
Обычно нейтральные неорганические вещества обнаруживают и определяют, переводя их в подходящую ионную форму или же по их химическим реакциям, которые часто приводят к изменению окраски или флуоресценции органических молекул.
Окислительная способность хлора, брома и иода в кислых растворах служит основой чувствительных фотометрических методов их определения с применением о-толидина CLXVII. Толидин
окисляется до n-хинонимида CLXVIII и затем конденсируется с образованием мерихиноидного молекулярного соединения, обладающего окраской интенсивно желтой в случае хлора [8] или сине-зеленой в случае иода [9]. Метод позволяет определять до 10-4% галогена, но определению мешают многие окислители, в том числе нитриты, Fe (III), Мп (III), четырехокись осмия, ванадаты и вольфраматы. Аналогичными свойствами обладает бензидин, и его можно использовать вместо о-толидина, однако он менее устойчив.
Та же реакция лежит в основе метода определения золота после окисления его до кислоты HAuCk [10]. Подобно этому, твердая окись сурьмы (V) окисляет сернокислый раствор N, N'-ди-фенилбензидина с образованием интенсивно окрашенного синего
ОБНАРУЖЕНИЕ И ОПРЕДЕЛЕНИЕ НЕЙТРАЛЬНЫХ МОЛЕКУЛ
299
продукта. Многие ароматические основания, в том числе анилин, окисляются хлором и бромом до окрашенных веществ.
Аналогичным образом 4,4'-бис-диметиламинотиобензофенон CLXIX окисляется в бензольном растворе хлором, бромом или
(ch3)2n-^J-c-^^_N(ch3)3'
CLX1X
иодом до дисульфида CLXX с изменением окраски от желтой к синей [11]. Эту же реакцию дают азотистая кислота и некоторые ионы металлов, но не перекись водорода или персульфаты. В качестве реагентов на хлор или бром, вероятно, можно использовать лейкооснование малахитового зеленого и о-дианизидин, которые в слабокислых растворах окисляются Au(III) до окрашенных продуктов [12]. Небольшое содержание двуокиси хлора можно определить окислением 1-амино-8-нафтол-3,6-дисульфокислоты [13].
Аналогичным образом окислительное разрушение азо-группы метилового оранжевого CLXXI хлором или бромом с образова-
CLXXI
нием бесцветных галоиддиметиланилина и фенол-м-сульфокис-лоты было использовано для количественного определения хлора [14] и брома. Реакция более избирательна, чем с о-толидином, поскольку ей не мешают Fe (III) и хлорамин, но имеет примерно такую же чувствительность.
Гораздо большая избирательность определения хлора и брома достигается при использовании реакций, основанных на предварительном превращении этих элементов в соответствующие гало-геноцианы: KCN + С1г->-КС1 + CNC1. В реакции Кёнига циано-хлорйд и цианобромид окисляют пиридин до глутаконового
300
ГЛАВА 12
альдегида, который конденсируется с ароматическим амином типа бензидина, образуя интенсивно окрашенное соединение — полиме-тиновый краситель Аг—N=CH—СН = СН—СН = СН—NH—Аг. Чувствительность метода более 1 мкг/мл, но зависит от применяемого амина [15]. Метод можно использовать также для определения цианид- и роданид-ионов, образующих хлорциан при взаимодействии с хлорамином [16].
Несмотря на то что обычные методы определения аммиака основаны на реакции Несслера или на отгонке и титровании кислотой, в случае низких его концентраций можно использовать также некоторые цветные реакции. Так, в растворах гидроокиси натрия аммиак реагирует с хлоридом нитробензолдиазония (раствор Риглера), образуя красное соединение O2NCeH4N = NONH4,которое представляет собой аммонийную соль п-нитрофенилнитроз-амина.
Аммиак можно определить фотометрическим методом, который основан на наблюдении, сделанном впервые Бертло в 1859 г., и сравним по чувствительности с реакцией Несслера. Метод заключается в том, что при добавлении фенолята натрия к раствору аммиака, обработанному хлорной водой, образуется устойчивый растворимый индофенольный синий краситель [17]. Варианты этого метода включают использование тимола и гипобромита натрия и экстракцию диэтиловым эфиром или ксилолом. Реакция, вероятно, протекает через образование хлорамина (NH2CI), который с фенолом образует хинонхлорамин. Последний в свою очередь сочетается с другой молекулой фенола, давая индофенол.
Аммиак в воздухе можно определять реакцией с нингидрином; реакция основана на том, что две молекулы гидрата трикетогид-риндена конденсируются с молекулой аммиака с образованием синего продукта CLXXII [18].
Подобным же образом с конденсацией связана проба на гидразин; при реакции его с салицилальдегидом образуется бесцветный нерастворимый, обладающий желтой флуоресценцией сали-цилальдазин CLXXIII [19]. Его плохая растворимость в воде объясняется, вероятно, наличием внутримолекулярных водородных связей. Исходя из близости CLXXIII к глиоксаль-бис(о-оксиа-нилу), от которого он отличается тем, что группы —СН= и
ОБНАРУЖЕНИЕ И ОПРЕДЕЛЕНИЕ НЕЙТРАЛЬНЫХ МОЛЕКУЛ
301
—N— переставлены местами, можно ожидать, что он будет образовывать окрашенные экстрагирующиеся хлороформом комплексы с металлами, что можно использовать для подтверждения
CLXXIII
реакции на гидразин. Гидроксиламин образует с салицилальдегидом растворимый альдоксим, обнаруживающий способность связывать металлы [20]. Аналогичным образом альдегидные группы двух молекул n-диметиламинобензальдегида конденсируются с одной молекулой гидразина, образуя растворимый альдезин, который в кислотах дает красный хиноидный катион.
Реакцией на гидроксиламин может служить синтез диметилглиоксима из диацетилмоноксима и гидроксиламина с последующим образованием его красной никелевой соли [19]. Если испытание на гидроксиламин проводят в его смесях с большим избытком гидразина, то большую часть последнего можно предварительно осадить при помощи салицилальдегида. Гидроксиламин конденсируется с формальдегидом, и продукт конденсации под действием перекиси водорода или персульфат-иона переходит в формгидроксамовую кислоту. Это соединение в слабокислых средах образует с ионом трехвалентного железа красный трискомплекс [21]. В цветных реакциях гидразина и гидроксиламина с динитробензолами проявляются их восстановительные свойства. В отсутствие гидразина для определения гидроксиламина можно использовать салицилальдегид и ион двухвалентной меди; при этом образуется внутрикомплексное соединение меди с салицил-альдоксимом. При добавлении гидроксиламина к щелочному раствору 8-оксихинолина получается 5-амино-8-оксихинолин, окисляющийся в присутствии воздуха и конденсирующийся с другой молекулой 8-оксихинолина с образованием кислотно-основного индикатора индоксина.
В основу методов определения кислорода было положено образование окрашенного продукта при окислении им антрахинон-сульфоната натрия [22].
При разработке метода определения кислорода была также использована способность кислорода, растворенного в воде, окислять комплекс железа (II) с этилендиамином (сульфат) до соли трехвалентного железа, которая затем может быть определена комплексонометрическим титрованием с использованием салициловой кислоты в качестве индикатора [23].
Окисление М-фенил-2-нафтиламина в о-дихлорбензоле лежит
302
ГЛАВА 12
в основе количественного колориметрического метода определения озона [24]. Небольшие количества озона можно также определить по его (окисляющему) влиянию на интенсивность и цвет флуоресценции люминола, флуоресцеина или фуксина, нанесенных на силикагель [25], или по обесцвечиванию в тех же условиях индигокармина (вследствие разрыва в красителе двойных связей) [26]. В качестве аналитического реагента на озон было предложено использовать дифениламиносульфонат натрия, окисляющийся озоном до синего продукта [27]. Озон также можно определить по окислению фенолфталеина в щелочных растворах с образованием красного аниона фенолфталеина (который при восстановлении цинком опять переходит в фенолфталеин) [28]. Другие окислители, например феррицианид-ион и перекись водорода (в присутствии Си(II), которая приводит к образованию свободных радикалов), ведут себя аналогичным образом.
По свободнорадикальному механизму протекает также окисление люминола (3-аминофталгидразида) перекисью водорода в присутствии гемина, приводящее к возникновению хемилюминесценции, — чувствительная качественная реакция на перекись водорода [29].
Определение небольших количеств воды реактивом Фишера, приготовляемого действием двуокиси серы на иод, растворенный в пиридине и метаноле (или, лучше, в монометиловом эфире этиленгликоля) [30], основано на окислении двуокиси серы иодом в присутствии воды. Реакция приводит к образованию иодида пиридиния и промежуточного комплекса пиридина с трехокисью серы, который при взаимодействии с метанолом образует метиловый эфир пиридин-М-сульфокислоты. Конечную точку титрования лучше всего определять электрометрически. Определению мешают окислители, например хроматы, бихроматы, соли двухвалентной меди и трехвалентного железа, а также восстановители— тиосульфаты, соли двухвалентного олова и сульфиды [31].
Реакция образования метиленового голубого CLXXIV из
CLXXIV
и-амино-N, N-диметиланилина в кислом растворе хлорида трехвалентного железа служит для обнаружения и определения сероводорода (до 1 • 10“®%) [32]. Реакция протекает через окислительное деаминирование одной молекулы амина с последующей конденсацией ее со второй молекулой и замыканием кольца при участии атома серы. Величина рКа метиленового голубого равна
ОБНАРУЖЕНИЕ И ОПРЕДЕЛЕНИЕ НЕЙТРАЛЬНЫХ МОЛЕКУЛ
303
3,8, поэтому его окраска зависит от pH; кроме того, он быстро разрушается на солнечном свету. Были использованы также улучшенные реагенты, в результате чего продуктами реакции были иодопроизводное метиленового голубого [33] и краситель зеленый Биндшедлера [34]. Реакции мешают меркаптаны.
3. РЕАКЦИИ ЗАМЕЩЕНИЯ
Другим методом определения свободного брома является бромирование подходящего органического красителя, например фенолового красного [35], восстановленного бисульфитом фуксина, розанилина [36] или флуоресцеина (что несколько хуже) [37], с последующим спектрофотометрическим измерением окраски. Преимущество использования фенолового красного заключается в том, что конечные продукты бромирования (бромфеноловый красный и бромфеноловый синий) являются рН-индикаторами, отличающимися по величине р7<а и переходу окраски от фенолового красного. Измеряя оптическую плотность (580 ммк) при pH 5,0—5,4, можно получить четкую разницу между синей окраской продукта реакции и желтой окраской фенолового красного. Метод можно также применять для определения бромид-иона с предварительным окислением его до брома гипохлоритом натрия при pH 8,8. При взаимодействии в кислой среде розанилина и брома образуется нерастворимое красное тетра- или пентапроизводное брома, которое можно, однако, экстрагировать бензиловым спиртом.
Для определения иода был использован флуоресцеин. Метод основан на уменьшении флуоресценции при частичном превращении реагента в нефлуоресцирующее иодпроизводное [38]. Эту реакцию используют в капельном анализе. Фильтровальная бумага, смоченная (желтым) раствором флуоресцеина, в парах брома становится красной вследствие перехода реагента в эозин; при воздействии паров иода образуется красно-желтый эритрозин. В присутствии бромида калия можно также обнаруживать хлор по вытесненному им брому.
Другая возможность заключается в реакции свободного брома с м-фенилендиамином, в результате которой образуется 2,4,6-трибром-м-фенилендиамин, слабо растворимый в воде, но легко растворимый в этаноле. Эту реакцию можно использовать для качественного обнаружения брома и бромидов.
4. КОСВЕННЫЕ МЕТОДЫ
Иод можно определить косвенным методом реакций его с гидроксиламином. При этом получается азотистая кислота, количество которой находят диазотированием ею сульфаниловой
304
ГЛАВА 12
кислоты. Диазо-соль последней в свою очередь сочетается с а-нафтиламином, образуя краситель красного цвета [39].
Псевдогалоген дициан (СМ)г реагирует с водой аналогично галогенам с образованием HCN и HCNO. Поэтому его можно обнаруживать теми же методами, что и цианид-ион.
Серу (до ~2- 10~4%) можно определить по реакции ее ацетонового раствора с цианидом, в результате чего образуется роданид, который затем переводят в красный комплекс Fe(III) [40]. При реакции тетратионата с цианидом также образуется роданид; описан аналогичный спектрофотометрический метод определения тетратионата, основанный на получении роданида трехвалентного железа [41]. Эту реакцию дают и высшие политионаты. При нагревании серы с расплавленным бензоином образуются бензил и сероводород. Последний можно обнаружить в виде черного пятна на свинцово-ацетатной бумаге. Эта реакция специфична для серы [42].
Сероуглерод можно обнаружить и определить, синтезируя из него (используя диэтиламин) диэтилдитиокарбамат-ион, который в свою очередь для спектрофотометрического измерения переводят в желтый комплекс с медью [43].
Предложенное Шиффом определение двуокиси серы по ее взаимодействию с парарозанилином и формальдегидом основано на синтезе парарозанилинметилсульфоновой кислоты, имеющей пурпурную окраску, из бесцветного трианилинийхлорметана (полученного добавлением соляной кислоты к парарозанилину). Окрашенное соединение, соответствующее нейтральному парарозанилину, можно наблюдать в связи с тем, что значение его р/Са слишком мало, чтобы в условиях эксперимента могла образоваться бесцветная соль, подобная соли анилиния. Реакцию можно сделать количественной [44].
В то время как большинство альдегидов присоединяет аммиак с образованием альдегидаммиака, формальдегид образует гексаметилентетрамин, являющийся лишь слабым основанием. Это позволяет титриметрически определять ион аммония; к раствору соли аммония добавляют избыток нейтрального раствора формальдегида с последующим титрованием щелочью по фенолфталеину. Устойчивое изменение окраски наблюдается лишь после того, как весь аммиак превратится в гексаметилентетрамин [45].
Осаждение гидроокисей металлов из этилатов магния и алюминия может служить качественной реакцией на следы воды. Для определения воды проводили также гидролиз ацетилпириди-нийхлорида до пиридинийхлорида и уксусной кислоты [46]. Аналогичное применение находят сукцинилхлорид [47] и циннамоил-хлорид [48]. Ограниченное применение для определения воды, главным образом в уксусной кислоте, нашел гидролиз ангидри
ОБНАРУЖЕНИЕ И ОПРЕДЕЛЕНИЕ НЕЙТРАЛЬНЫХ МОЛЕКУЛ
305
дов кислот в присутствии кислот в качестве катализаторов [49]. Для определения содержания воды был также предложен катализируемый метансульфокислотой гидролиз 2,2-диметоксипро-пана, приводящий к образованию ацетона и двух молекул метанола. Метод основан на измерении поглощения ацетона в инфракрасной области спектра (при 5,87 мк) [50]. Добавление содержащих воду веществ к раствору дипикриламина в безводном диоксане (апротонный растворитель) обеспечивает кислотную ионизацию дипикриламина. Изменение окраски от светло-желтой (нейтральная молекула) до оранжевой (анион) служит простой качественной реакцией на воду [51]. Ссылки на другие методы и их обсуждение приведены в работе [52].
Появление желтой или оранжево-красной окраски при добавлении танина и нитрата серебра к разбавленному раствору аммиака обусловлено образованием коллоидно-дисперсного серебра, причем танин действует как восстановитель и как защитный коллоид.
Иногда для обнаружения нейтральных веществ можно использовать каталитические эффекты. Элементарный селен можно открыть, используя его сильное каталитическое действие на реакцию восстановления сульфид-ионом метиленового голубого, фуксина, пикриновой кислоты, дипикриламина и какотелина [53]. Эффективным катализатором являются селеносульфидные ионы, получающиеся при растворении селена в щелочных сульфидных растворах. Этой реакцией можно обнаружить также селенит-ион, поскольку в данных условиях он восстанавливается до селена. Реакция прекращается при добавлении цианида калия вследствие образования селеноцианида калия KCNSe.
Отличить элементарную серу от селена можно растворением их в сульфитном растворе, при котором образуются соответственно тиосульфат и селеносульфат. При добавлении формальдегида тиосульфат не изменяется, а селеносульфат диспропорцио-нирует с образованием альдегидбисульфитного продукта присоединения и селена, который осаждается.
Некоторые свободные металлы, в том числе алюминий, свинец, олово и цинк, можно обнаружить внесением их в сильнощелочной спиртовой раствор о-динитробензола. Водород, выделяющийся в результате реакции между гидроксильными ионами и металлом, способен восстановить нитро-соединение до нитролнит-рокислоты, анион которой имеет интенсивно фиолетовую окраску [54].
Эту реакцию дают также и другие сильные восстановители, в том числе гидроксиламин, гидразин, сульфиды, соли оловянной (II) кислоты, гипосульфиты и продукт присоединения сульфо-ксилата натрия к формальдегиду. В реакции можно использовать и и-динитробензол.
20 Д- Перрин
306
ГЛАВА 12
ЛИТЕРАТУРА
1. Heatley N. G., Page E. J., Anal. Chem., 24, 1854 (1952).
2. Rundle R. E., French D., J. Am. Chem. Soc., 65, 558 (1943); Swan-s о n M. A., J. Biol. Chem., 172, 825 (1948).
3. R e ith J. F., Pharm. Weekblad, 66, 1097 (1929).
4. Sommer H., Ind. Eng. Chem. (Anal. Ed.), 12, 368 (1940).
5. Ory H. A., Warren V. L., Williams H. B., Analyst, 82, 189 (1957).
6. C a 1 d a s A., Chemist-Analyst, 43, 100 (1954).
7. P e s e z M., Bull. Soc., Chim. France, 15, 1108 (1948).
8. Marks H. C., Joiner R. R., Anal. Chem., 20, 1197 (1948).
9. Lange N. A., Ward L. A., J. Am. Chem. Soc., 47, 1000 (1925).
10. С 1 a b a u g h W. S„ J. Res. Natl. Bur. Std., 36, 119 (1946).
11. Feigl F., Goldstein D., Ro sell R. A., Z. anal. Chem., 158, 421 (1957).
12. Кул ь бе p г Л. М., Завод, лаб., 5, 170 (1936); Block W. D., Buchanan О. Н„ J. Biol. Chem., 136, 379 (1940).
13. Р о s t М. А., М о о г е W. A., Anal. Chem., 31, 1872 (1959).
14. G a d G., Priegnitz E., Gesundh.-Ingr., 68, 174 (1947); Taras M., Anal. Chem., 19, 342 (1947).
15. О деталях эксперимента, которые необходимо тщательно стандартизировать, см. A s m u s Е„ G а г s с h a g е и Н., Z. anal. Chem., 136, 269 (1952); Mil ton R. F., Nature, 164, 448 (1949); Norris P. K., Grant H. A., Analyst, 76, 492 (1951); Nusbaum I., Skupenko P., Anal. Chem., 23, 1881 (1951); Van Pinxteren J. A. C., Analyst, 77, 367 (1952); Pharm. Weekblad., 88, 489 (1953).
16. Epstein J., Anal. Chem., 19, 272 (1947); Asmus E., Garscha-ge и H., Z. anal. Chem., 138, 414 (1953).
17. Bolleter W. T., Bushman C. J., Tidwell P. W., Anal. Chem., 33, 592 (1961).
18. Williams D. D„ Miller R. R„ Anal. Chem., 34, 225 (1962).
19. Feigl F., Rec. Trav. Chim., 58, 471 (1939).
20. E p h r a i m F„ Ber., 63, 1928 (1930).
21. G u a g n i n i О. A., V о n e s c h E. E., Mikrochim. Acta, 1954, 211.
22. См. например, Sdris G., Ver not te P., Klein M., Clave A. M., Chim. analyt., 42, 200 (1960).
23. Ro skarn R. T., de Lan gen D., Anal. Chim. Acta, 28, 78 (1963).
24. A 11 i s о n A. R., D e 1 m a n A. D., Ruff A. E., Simms В. В., Пат. США 2849291, 26/VIII 1958.
25. Перегуд E. А., Степаненко E. M., ЖАХ, 15, 96 (1960).
26. Мохов Л. А., Дзедзичек В. П., Завод, лаб., 25, 1304 (1959).
27. Bovee Н. Н., Robinson R. J., Anal. Chem., 33, 1115 (1961).
28. Наа gen-Smit A. J., Brunelle M. J., J. Air Pollition, 1, 51 (1958).
29. LangenbeckW., RugeU., Ber., 70, 267 (1937).
30. Peters E. D., Jungnickel J. L., Anal. Chem., 27, 450 (1955).
31. Детали см. в книге Митчел Дж., Смит Д. М., Акваметрия, ИЛ, М., 1948.
32. Sands А. Е., Grafius М. A., Wainwright Н. W., W i 1 s о п М. W., U. S. Bur. Mines. Rept. Invest., № 4547 (1949); Standard Methods for the Examination of Water, Sewage and Industrial Wastes, Am. Public Health Assoc., New York, 10th ed., 1955, pp. 273—279.
33. К u 1 b e r g L. M„ Kurzes Lehrbuch der Analytischen Chemie, Leipzig, 11th rd., Vol. 1, 1920.
34. Wright R. H„ Schoening M. A., Hayward A. M., Tappi, 34, 289 (1951).
35. Stenger V. A., Kolthoff I. M., J. Am. Chem. Soc., 57, 831 (1935); Houghton G. U., J. Soc. Chem. Ind. (London), 65, 277 (1946).
36. H u n t e r G., G о 1 d s p i n k A. A., Analyst, 79, 467 (1954).
ОБНАРУЖЕНИЕ И ОПРЕДЕЛЕНИЕ НЕЙТРАЛЬНЫХ МОЛЕКУЛ
307
37. V а п de г Meu 1 ей J. Н., Chem. Weekblad, 36, 702 (1939); Pinching G. D, Bates R. G, J. Res. Natl. Bur. Sted, 37, 311 (1946).
38. Ha r ley V., Ann. Pharm. Frans., 5, 81 (1947).
39. Endres G., Kaufman L., Z. physiol. Chem., 243, 144 (1936).
40. Bartlett J. K, Skoog D. A., Anal. Chem., 26, 1008 (1954).
41. Nietzel O. A., De Sesa M. A., Anal. Chem., 27, 1839 (1955).
42. F e i g 1 F„ S t a г к C„ Anal. Chem., 27, 1838 (1955).
43. Dick T. A, J. Soc. Chem. Ind. (London), 66, 253 (1947); LowenW. K, Anal. Chem., 23, 1846 (1951).
44. Naumann R. V., West P. W., Tron F., Gaeke G. C., Anal. Chem., 32, 1307 (1960).
45. Kolthoff I. M, Pharm. Weekblad, 58, 1463 (1921).
46. Smith D. M, Bryant W. M. D„ J. Am. Chem. Soc, 57, 841 (1935).
47. Belcher R, Thompson J. H, West T. S, Anal. Chim. Acta, 19, 148 (1958).
48. L indner J, Mikrochem. Mikrochim. Acta, 32, 133 (1944).
49. G r e a t h о и s e L. H, Janssen H. J, H ayde1 С. H, Anal. Chem, 28, 357 (1956).
50. Critchfield F. E, Bishop E. T, Anal. Chem, 33, 1034 (1961).
51. С a 1 d a s A, Chemist-Analyst, 43, 100 (1954).
52. Treatise on Analytical Chemistry, Kolthoff I. M, Elving P. J. (eds.), Interscience, New York, Part II, Vol. 1, 1961, pp. 69—197.
53. F e i g 1 F, W e s t P. W„ Anal. Chem., 19, 351 (1947).
54. К и h n R, W e у g a n d F, Ber, 69, 1969 (1936).
20*
ГЛАВА 13
Аналитические свойства элементов
При разработке метода определения любого неорганического соединения необходимо учесть все другие компоненты, которые могут присутствовать в анализируемом образце. Это связано с тем, что реакции органических реагентов с неорганическими соединениями являются (за немногими исключениями) неспецифичными. Чтобы решить вопрос, какие различия в свойствах компонентов можно использовать для достижения большей избирательности, в данной главе описаны некоторые наиболее важные свойства неорганических веществ. В этих кратких сводках будут опущены такие вопросы, как боргидриды, ферроцены, структура силикатов и карбонильные комплексы, поскольку маловероятно, что это поможет разработать реакции, полезные с аналитической точки зрения.
Все элементы перечислены в алфавитном порядке, за исключением водорода, углерода и инертных газов (которые были опущены), а также редкоземельных элементов (сгруппированных в разделе «Лантан») и дальних членов ряда актинидов (рассмотренных в разделе «Америций»),
В тех случаях, когда аналитические реакции упоминаются без ссылки на литературу, практические детали их можно найти в руководствах [1].
Автор надеется, что информация, приведенная в этой главе, будет полезной даже в тех случаях, когда отсутствуют точные
данные. Так, РЬ(П) в нейтральных или аммиачных растворах образует с галлоцианином CLXXV синий осадок неизвестного состава. Здесь возможно образование двух типов внутрикомплекс-
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
309
ных соединений. В одном из них металл может быть связан с атомом азота и карбоксильным кислородом. Другая возможность заключается в образовании связи с участием фенольного и соседнего с ним атомов кислорода. Принимая во внимание свойства, обсуждаемые в разделе «Свинец», первое предположение кажется гораздо более вероятным.
АЗОТ
Соединения азота имеют ковалентный характер. Этот элемент обычно образует три одинарные связи, оставляя одну неподелен-ную пару электронов, которая позволяет ему участвовать в комплексообразовании в качестве донорного атома. Возможно также образование кратных связей, как, например, в азо-(—N = N—)-
и нитро-(—N =0)-соединениях.Гибридизация sp3 при образовании NH* аналогична гибридизации в случае СН/, и приводит к максимальному координационному числу 4 и тетраэдрическому строению. Амины имеют примерно ту же стереохимию, и неподе-ленная пара электронов занимает орбиталь определенной пространственной ориентации. Эту орбиталь можно описать как s-орбиталь со значительным вкладом р-орбитали, заметно усиливающим электронодонорные свойства молекулы. Подобное заключение можно сделать и в отношении гидразина N2H4, где каждый атом азота имеет неподеленную пару электронов. Способность азота к поляризации и большая сила поля лигандов, имеющая место в случае лигандов, которые образуют связи через атомы азота, позволяют объяснить тот факт, что наиболее прочные комплексы с аминами образуют ионы металлов переходных рядов или же ионы, имеющие заполненные d-уровни. Радиус иона аммония сравним с радиусом К+ и Rb+, и все три катиона образуют соли, обладающие примерно одинаковой растворимостью. Свойства симметричного линейного азид-иона N~ довольно близки к свойствам ионов галогенов.
Как и следует ожидать, стереохимия окислов азота и оксикислот очень разнообразна. Так, нитрат-ион обладает плоской и симметричной структурой. Это соответствует образованию азотом трех о-связей с использованием $р2-гибридных орбиталей, причем рг-орбитали азота и трех атомов кислорода могут объединяться с образованием л-молекулярной орбитали, содержащей два электрона. Устойчивость этой системы ослабляет тенденцию нитрат-иона вести себя при комплексообразовании как моноден-татный лиганд.
310
ГЛАВА 13
АКТИНИИ
Сильно радиоактивный ион Ас3+ обладает электронной конфигурацией инертного газа радона. По своим химическим свойствам актиний весьма напоминает La3+ с той лишь разницей, что он является более основным. Ионные радиусы их также почти равны. Большая основность Ас3+ проявляется в его более сильной сорбции катионообменными смолами и в меньшей экстракции трибутилфосфатом из азотнокислых растворов.
АЛЮМИНИИ
Химические свойства иона А13+ определяются высоким зарядом, малым радиусом и электронной конфигурацией инертного газа (Ne). В водных растворах А13+ сильно гидратирован и находится, вероятно, в виде иона [А1(Н2О)в]3+, который в нейтральных или слабокислых средах интенсивно гидролизуется и легко осаждает гидратированную А120з. Малую растворимость его гидроокиси в нейтральных аммиачных растворах и его фосфата при pH 5—5,5 используют для отделения А1 от Mg, Ca, Sr и Ва. Если в растворе присутствует лишь незначительное количество алюминия, то в качестве коллекторов можно использовать соответственно гидроокиси Zr(IV) и Fe(III) и фосфат Fe(III). В щелочных растворах образуются алюминаты, по-видимому [А1(ОН)/,]~.
Комплексы алюминия могут иметь тетраэдрическую или октаэдрическую структуру. В первом случае это обычно однозарядные анионы, например А1Вг~ или же, чаще, нейтральные соединения, образующиеся в результате присоединения к А1Х3 доноров типа аммиака, аминов, простых эфиров, спиртов, кетонов, фосфинов и тиоэфиров. Небольшой анион F- дает очень устойчивый октаэдрический комплекс A1F3-.. Однако хлоридный комплекс AlCh- в водных растворах не имеет значения даже в 12 М НС1 [2]; в 9 М НС1 анионные комплексы многих металлов адсорбируются на колонках с анионообменными смолами, а А1 не задерживается ими [3].
При образовании комплексов А1 с октаэдрической структурой более предпочтительны анионные кислородсодержащие биден-татные лиганды, чем нейтральные амины и другие поляризующиеся лиганды. Поэтому 0-дикетоны, пирокатехин и дикарбоновые кислоты образуют прочные трис-комплексы. То, что по стери-ческим причинам трис-комплекс алюминия с 8-оксихинальдином не образуется, а также малая склонность алюминия к комплексообразованию с диэтилдитиокарбаматом позволяют применять эти реагенты для экстракции из растворов А1 многих мешающих катионов. Полезный с аналитической точки зрения комплекс дает с алюминием 8-оксихинолин (но не 1,10-фенантролин). В боль
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
311
шинстве случаев в качестве фотометрических реагентов на А1 применяют ауринтрикарбоновую кислоту (алюминон), эриохром-цианин R и ализаринсульфокислоту. Действие всех их основано на связывании А1 с карбоксильным, фенольным или хиноидным атомами кислорода.
АМЕРИЦИЙ И БОЛЕЕ ДАЛЕКИЕ ЧЛЕНЫ РЯДА АКТИНИДОВ
Окислительные состояния и спектры поглощения ионов элементов этого ряда определяются наличием незаполненного 5/-электронного уровня. Поэтому элементы рассматриваемого ряда обладают очень большим сходством с лантанидами (редкоземельными элементами), в атомах которых незаполненным является ^-электронный уровень. Наблюдающиеся в случае Np и Ри более высокие валентности обусловлены тем, что 5/- и 6d-op-битали этих атомов сравнимы по своей энергии. Но в случае других членов этого ряда участие в образовании связи более чем одного 5/-электрона требует затраты гораздо большей энергии, что связано с увеличением зарядов ядер и уменьшением ионных радиусов. В водных растворах весьма устойчивы трехвалентные состояния Ат, Ст и последующих членов ряда. Способность берклия существовать в виде Bk(IV) объясняется следующим образом: Bk(III) имеет 8 электронов, занимающих семь 5^-орбиталей; энергия, необходимая для перемещения одного из этих электронов на бскорбиталь, с оставлением на 5/-орбиталях семи электронов частично компенсируется выигрышем в энергии обмена, что является результатом особой устойчивости наполовину заполненного электронного /-уровня. (Ср. пять Зс?-электронов в Fe3+ и семь 4/-электронов в ТЬ4+.) Подобное рассуждение указывает на возможное существование Cf(V), а также может объяснить тот факт, что для f — /'-переходов в /7-атомах гадолиния и кюрия требуется большая энергия и эти переходы, следовательно, лежат при более коротких длинах волн, чем в случае других членов этого ряда.
Интенсивная радиоактивность большинства этих элементов затрудняет изучение их химии. Трудности частично носят экспериментальный характер и частично связаны с самооблучением. Трехзарядные катионы можно соосадить с LaFs, Ьа(ОН)з, СеРз, KLa(SOi)2, а затем америций можно отделить окислением персульфатом до Am (VI) с последующей экстракцией его гексоном из 6 М HNOs или диэтиловым эфиром из 1 М HNOg, насыщенной NH4NO3.
Обычно разделение трехвалентных актинидов основано на катионном обмене с последующим фракционным вымыванием, на анионном обмене и экстракции. Так, нейтральные трис-комплексы Np(III) и Pu(III) с теноилтрифтор ацетоном экстрагируются
312
ГЛАВА 13
ксилолом из умеренно кислых растворов, в то время как комплекс Am(III) экстрагируется из растворов с pH 4 и более высоким [4]. Am(III) можно экстрагировать 30%-ным трибутилфосфатом из слабокислых растворов, насыщенных нитратом алюминия. Cm(III), но не Am(III) экстрагируется трибутилфосфатом из 16 М HNO3. Катионообменная колонка адсорбирует из 0,05 М НС1 Am(III), который затем можно вымывать а-оксиизобутира-том аммония [5]. Наоборот, в 20 М растворе хлорида лития Am(III) образует анионный комплекс, который можно адсорбировать на анионообменной смоле и затем вымывать 8 М HNO3 [6].
Количественное предсказание этих свойств затруднено двумя обстоятельствами: почти полным отсутствием данных о константах устойчивости и тем, что теория поля лигандов, подобная той, которая развита для ионов переходных металлов, не была разработана для актинидов и лантанидов. Для этого в свою очередь необходимы определенные сведения о стереохимии катионов в их комплексах. По аналогии с ионами переходных металлов можно ожидать, что константы устойчивости будут увеличиваться от Np(III) к Pu(III) или Am(III), проходя через минимум на Cm(III) и возрастая до другого максимума на M.d(III) или No(III). Опубликованные значения констант устойчивости хелатов с EDTA возрастают от Pu(III) (IO16-0), Am (III) (1018’2) и Ст (1018’4) до Cf (10191), не обнаруживая никакого минимума, однако это может быть следствием малой силы поля данного лиганда. Качественно можно сказать, что хелатообразующие реагенты, о которых известно, что они дают комплексы с актинидами, относятся главным образом к группе реагентов, образующих связи за счет атомов кислорода. Это, например, цитрат, тартрат, лактат, гликолят, а-оксиизобутират, теноилтрифтор ацетон и EDTA, Все они имеют слабые поля лигандов.
Фотометрические реагенты для этих катионов не известны. Определение рассматриваемых актинидов основано главным образом на радиохимических методах и на довольно слабых окрасках некоторых ионов.
АСТАТИН
Наиболее долгоживущий изотоп астатина имеет период полураспада всего лишь 8,3 часа. Поэтому сведения о его химических свойствах всецело основаны на поведении индикаторных количеств. По-видимому, эти свойства напоминают свойства иода и очень близки к ожидаемым на основе экстраполяции свойств галогенов.
БАРИИ
См. Кальций.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
313
БЕРИЛЛИЙ
Небольшие размеры иона Ве2+ позволяют ему разместиться в ячейке, образованной внутри тетраэдра из четырех молекул воды, связанных водородными связями. Таким образом, в гидратированном ионе бериллия наблюдаются сильные ион-дипольные взаимодействия и этот ион легко теряет один или несколько протонов с образованием полиядерных комплексов с оксо- (Be—О— —Be)- или гидроксо- (Be—ОН—Be)-мостиками. Гидроокись бериллия осаждается при добавлении аммиака (в качестве коллекторов можно использовать соли алюминия или трехвалентного-железа), однако в растворах щелочей образуются бериллат-анионы.
Вследствие небольшого размера, а следовательно высокого отношения заряда к радиусу, Ве2+ проявляет гораздо большую тенденцию к образованию ковалентных связей (по крайней мере частично ковалентных), чем Mg2+, Са2+, Sr2+ или Ва2+. Образование таких связей требует распаривания двух 2х-электронов с образованием линейных гибридных sp-орбиталей и координационного числа 2. Однако предпочтительным координационным числом является 4, и это достигается либо за счет полимеризации ц-мо-стиками, либо за счет оттягивания электронов от доноров с образованием структур, приближающихся к тетраэдрическим. Примером комплексов последнего типа является бис-комплекс бериллия с ацетилацетоном, а примером соединений первого типа могут служить безводные галогениды бериллия (ВеХг)п (X = F^ Cl, Вг).
По отношению к бериллию кислород является более сильным, донором, чем азот, поэтому большинство реагентов, применяемых в фотометрических или флуориметрических методах определения бериллия, относится к реагентам типа морина, замещенных оксиантрахинонов и ауринтрикарбоновой кислоты («алюминона»). Аналогичным образом внутрикомплексное соединение с ацетилацетоном устойчиво и экстрагируется бензолом, однако в случае купферрона и 8-оксихинолина тенденция к комплексообразованию значительно меньше. Тем не менее 8-оксихинальдин образует с Be растворимый в хлороформе бис-комплекс, который можно использовать для определения Be в присутствии А1. Для фотометрического определения Be был предложен ряд реагентов, имеющих о-оксиазо-группу, в том числе торон и п-нитробензол-азоорцин. Избирательность аналитических методов можно улучшить за счет предварительного осаждения Be в виде гидроокиси или в виде фосфата при pH 4,4 (используя фосфаты трехвалентного железа и алюминия в качестве коллекторов) *.
* Судя по литературным данным, как по чувствительности цветных реакций, так и по их избирательности наиболее перспективными органическими
314
ГЛАВА 13
БОР
Соединения бора образованы преимущественно за счет ковалентных связей и напоминают по своим свойствам и реакциям аналогичные соединения других неметаллов, особенно кремния. Мономерные соединения бора с тремя ковалентными связями включают хр2-гибридизацию, приводящую к образованию плоских структур, которые в случае галоидов частично стабилизированы также за счет связывания заполненных ря-орбиталей галогенов с незаполненной ря-орбиталью бора. Значение этого л-связыва-ния уменьшается в ряду BF3^>BC13 > ВВг3. Дефицит электронов в соединениях ВХ3 делает их сильными акцепторами электронов, поэтому атом бора может координировать вещества типа аминов, фосфинов, простых эфиров и сульфидов с образованием тетраэдрических комплексов состава 1:1. Наиболее характерна такая координация в случае ВВг3 и наименее для BF3, как и следовало ожидать для случая, когда разница в л-связывании более важна, чем стерические или электростатические эффекты.
Бор обнаруживает большое сродство к кислороду, образуя окислыбора, борную кислоту и бораты, которые вследствие образования оксо-мостиков (В—О—В) могут иметь циклическую или линейную полиядерную структуру. Эфиры бора с низшими спиртами летучи, и их используют для отделения бора от других элементов. Тетрафенилборат-ион находит применение для гравиметрического определения ионов щелочных металлов. Бор образует устойчивые тетраэдрические комплексы с органическими оксианионами. В качестве примеров можно привести бис-комплексы его с салицилат-ионом и пирокатехином. Комплексообразование с содержащими кислород лигандами, как указывалось в гл. 11, имеет большое значение при титровании и фотометрическом определении борной кислоты и борат-иона. Применение реагента азометина Н, предложенного для фотометрического определения бора, основано как на прочном связывании бора с кислородом, так и на донорных свойствах атомов азота [7]. Образующееся желтое внутрикомплексное соединение имеет строение CLXXVII.
___________ CLXXVI
реагентами для спектрофотометрического определения бериллия являются о, о'-диоксиазо-соединения и родственные им реагенты типа бериллона II п бериллона III [см., например, работу Кузнецова В. И., Большаковой Л. И. иФанМин-э, ЖАХ, 18, 1606 (1963)]. — Прим, перед.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
315
БРОМ
Принимая один электрон, бром доводит число наружных электронов до октета с образованием либо ковалентно связанного брома, либо бромид-иона. Даже если соединения брома номинально имеют ионный характер, его связи обладают большей степенью ковалентности, чем аналогичные связи хлора. Это объясняется тем, что более крупный Вг~ легче поляризуется. В бромидах тех металлов, которые имеют заполненный или почти заполненный d-уровень, вакантные d-орбитали брома относительно легко могут участвовать в образовании дативных связей. Электронные пары брома имеют сильно выраженный донорный характер. Эти две особенности объясняют тенденцию брома вести себя в качестве «мостика» при образовании полиядерных комплексов и определяют плохую растворимость многих бромидов. В наибольшей степени это относится к бромидам однозарядных катионов с заполненными d-уровнями, образующими комплексы с координационным числом 2: Си, Ag, Au, Hg, TI, BiO и SbO. Бромиды платины(II) и палладия(II) также нерастворимы. Единственными важными окси-анионами брома являются ВгО~ и ВгО~. Первый получается при растворении брома в воде. Он неустойчив и быстро диспропорционирует, переходя в бромат- и бромид-ионы. Окислители, например гипохлорит-ион в слабокислой среде, окисляют бромид-ион до бромата.
Методы определения брома обычно включают гравиметрическое определение в виде бромида серебра, низкая растворимость которого служит также основой и для большинства титриметриче-ских методов. Некоторые методы титрования основаны на образовании недиссоциирующегося HgBra с использованием индикаторов для определения скачка концентрации ионов двухвалентной ртути в конечной точке. Фотометрические методы, основанные на реакциях замещения с участием органических молекул или на окислительной способности брома, рассмотрены в гл. 11 и 12.
ВАНАДИИ
При сплавлении соединений ванадия с карбонатом натрия, особенно в присутствии окислителей, получаются растворимые ванадаты. Эти соединения V(V), вероятно, образуются в результате постепенной потери протонов гидратированной V2O5. Образующиеся анионы могут агрегироваться при помощи кислородных мостиков. В кислых средах преобладающей частицей является перванадил-ион VO+. Такие растворы являются умеренно сильными окислителями, и V (V) можно определить, измеряя окраску, развивающуюся при окислении органических оснований, например дифениламина, дифениламиносульфокислоты,
316
ГЛАВА 13
бензидина, дифенилбензидина, 3,3'-диметилнафтидина, стрихнина и вариаминового синего.
Наиболее устойчивой степенью окисления является V(IV). Поэтому V(III) окислением воздухом превращается в V(IV), а мягкое восстановление ванадатов, например двуокисью серы, приводит к образованию соединений V(IV) типа гипованадатов. Почти все комплексы V (IV) содержат ванадил-ион VO2+. Электролитическое восстановление V(IV) или V(V) дает ион трехвалентного ванадия V(H2O)e3+ и его гидратированные соли, такие, как VX3(HaO)6 (X=F, Cl, Br, I). V(III) образует комплексы с лигандами, содержащими как кислород, так и азот. Он также дает желтую окраску в кислых ацетоновых растворах с рода-нид-ионом, но эту реакцию не применяют в химическом анализе.
В щелочных растворах ванадий взаимодействует с сульфид-ионом, образуя окрашенный тиованадат-ион. Эта реакция не очень чувствительна. Большинство методов определения V (V) выполняют в кислых или слабокислых средах, где присутствуют главным образом катионные формы — VO+ и VO(OH)2+ соответственно. Они образуют свои наиболее прочные комплексы с анионными лигандами. В области pH 3—5 V(V) образует комплексы с купферроном, 8-оксихинолином и диэтилдитиокарбаматом, которые экстрагируются хлороформом, и их используют для отделения и определения ванадия. Другими фотометрическими реагентами являются салицилгидроксамовая кислота и бензоил-фенилгидроксиламин. В более кислых средах V (V) образует окрашенный продукт с перекисью водорода и взаимодействует также с фосфорновольфрамовой кислотой, образуя желтую растворимую фосфорновольфрамованадиевую кислоту.
Ванадил-ион VO2+ образует окрашенные комплексы с пирокатехином в растворах с pH между 4,5 и 6. Ванадий(IV) слабо реагирует с формальдоксимом, образуя в щелочных растворах желтый комплекс.
ВИСМУТ
Висмут образует два ряда солей, отвечающих ионам BiO+ и Bi3+. Соли висмутила обычно нерастворимы в воде, a Bi3+ имеет явно выраженную тенденцию к образованию ковалентных связей с поляризующимися лигандами, содержащими серу и азот. Инертная пара электронов 6s2 значительно уменьшает стабилизацию за счет обратной двойной связи, поэтому комплексообразование с лигандами типа цианид-иона выражено слабее, чем в случае, например, иона одновалентной меди. Типичными реагентами на висмут являются дитизон, купферрон и диэтилдитиокарбамат.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
317
Так, Bi экстрагируется четыреххлористым углеродом в виде соединения с дитизоном из нейтральных цитратных растворов, хлороформом в виде соединения с купферроном из 0,1 М азотной кислоты и ССЦ — в виде соединения с диэтилдитиокарбаматом при pH 11—12. Тиомочевина и роданид-ион также образуют с Bi окрашенные комплексы в кислых средах. Лиганды, содержащие кислород, например цитрат- и тартрат-ионы и EDTA, связывают Bi слабо и их можно применять в качестве маскирующих агентов *'.
Окись В120з и гидроокись Bi(OH)3 висмута являются основаниями, в то время как соответствующие производные As (III) и Sb (III) амфотерны. Эта большая основность обусловливает меньшую тенденцию к образованию анионных комплексов и меньшую способность экстрагироваться органическими растворителями. Тем не менее оба эффекта все же важны. Например, Bil3 экстрагируется бензолом из растворов висмута 5 М по H2SO4 и 0,01 М по иодид-иону. Кислота НВЩ, имеющая окраску от желтой до оранжевой, извлекается из кислых сред содержащими кислород растворителями, например амиловым спиртом, а ее бруциновую соль можно экстрагировать хлороформом. Вследствие конкурирующего образования хлоро- и фторо-комплексов хлорид- и фто-рид-ионы мешают этим реакциям. Bi образует также анионные комплексы в растворах НС1, которые можно адсорбировать ионообменными смолами.
Из разбавленных растворов минеральных кислот Bi3+ можно осадить в виде фосфата или сульфида. (В последнем случае в качестве коллекторов можно применять сульфид меди или, возможно, сульфид кадмия.) Другая возможность заключается в осаждении Bi(OH)3 при pH 9 аммиаком с применением в качестве коллекторов гидроокисей алюминия или трехвалентного железа.
ВОЛЬФРАМ
Химические свойства вольфрама и молибдена довольно близки, за исключением того, что для вольфрама высшие валентные состояния более устойчивы, чем для молибдена, и того, что вольфрам обладает более основными (менее кислотными) свойствами. Наиболее важными валентностями вольфрама являются
* Это утверждение нуждается в уточнении. Одним из реагентов для спектрофотометрического определения висмута, применяемых в настоящее время, является ксиленоловый оранжевый (в=24 000), в комплексообразовании которого с металлами принимает участие, как и в случае EDTA, метилиминодиа-цетатная группировка. Этот реагент образует с Bi достаточно прочные комплексы, о чем можно судить по сравнительно высокой кислотности определения— 0,15 н. H2SO4 [Cheng К. L., Taianta, 5, 254 (I960)]. — Прим, перев.
318
ГЛАВА 13
IV, V и VI. Представителем вольфрама (VI) является окись WO3, растворяющаяся в щелочах с образованием вольфрамат-иона WO2~ Нейтрализация или подкисление раствора приводит к образованию полимерных вольфрамовых кислот, выпадающих в осадок. Подобно молибдат-иону, вольфрамат-ион может также образовывать гетерополикислоты. Методы отделения W(VI) от веществ, мешающих его определению, включают растворение в щелочах и соосаждение его окиси с Fe(OH)3, Al (ОН)з или арсенатом свинца при нейтрализации аммиаком или гексаметилентетрамином. Различия в устойчивости тартратных комплексов молибдена и вольфрама позволяют отделять молибден от вольфрама осаждением M0S3 из кислых растворов. Подобно молибдену, вольфрам образует осадки с а-бензоиноксимом (экстрагирующийся хлороформом) и купферроном (экстрагирующийся изоамиловым спиртом). В разбавленных солянокислых растворах с вольфрамовой кислотой реагирует родамин В, причем окраска изменяется от желто-красной до фиолетовой. Эту реакцию можно также использовать в анализе, измеряя уменьшение интенсивности флуоресценции родамина В. Дитиол с W(VI) дает соединение, окрашенное в сине-зеленый цвет, которое экстрагируется органическими растворителями. При реакции образуется, вероятно, трис-комплекс. В растворах серной кислоты высокой концентрации между W(VI) [а также Mo(VI) и Ti (IV)] и гидрохиноном идет реакция с образованием окрашенных веществ неизвестного строения.
При взаимодействии W(V) с лигандами, в том числе содержащими кислород, галогенид-, роданид- и цианид-ионами образуется наиболее обширная группа комплексов вольфрама. К ним относятся, например, WOC12“, W0C1" [WO2(C2O4)2]3- и W(CN)|~ Один из наиболее важных методов определения вольфрама основан на образовании в кислых растворах желтого роданидного комплекса W(V), обычно при восстановлении W(VI) хлоридом двухвалентного олова в присутствии роданид-иона. Перед смешиванием реагентов W(VI) необходимо хранить в щелочных или тартратных растворах, чтобы избежать образования коллоидных или полимерных соединений. Окрашенный комплекс можно фо-тометрировать непосредственно в водном растворе, который можно стабилизировать ацетоном, или же экстрагировать изопропиловым эфиром или каким-либо другим несмешивающимся с водой содержащим кислород растворителем.
Восстановление вольфрамовой кислоты оловом в солянокислой среде дает [W(OH)C15]2-. Другим комплексом W(IV) является W(CN)/‘~, окисляющийся Се(IV) или перманганат-ионом до W(CN)3-. В настоящее время комплексы вольфрама (IV) не находят никакого аналитического применения.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
319
ГАЛЛИЙ
По своим химическим свойствам ион Ga3+ отличается от иона А13+, что связано главным образом с его большими размерами и в еще большей мере с тем, что он имеет десять наружных электронов, заполняющих Зб/-орбитали. Подобно Al(III), Ga (III) амфотерен и образует в щелочной среде анионные гидроксо-комп-лексы, а в нейтральных или слабокислых растворах его соли сильно гидролизованы. Галлий образует преимущественно октаэдрические комплексы, однако известны и некоторые тетраэдрические, в том числе GaCl^r и продукты присоединения, образованные нейтральными донорами с ОаХз. Свободная кислота HGaCU экстрагируется из 6 М соляной кислоты диэтиловым или диизопропиловым эфиром. В тех же условиях она образует окрашенную и флуоресцирующую ионную пару с родамином В, которая экстрагируется смесью (3:1) хлорбензола и четыреххлористого углерода. Роданидный комплекс Ga экстрагируется диэтиловым эфиром из раствора Ga 7 А! по роданиду аммония и 0,5 М по соляной кислоте.
Вследствие высокого заряда Ga3+ образует наиболее устойчивые комплексы с анионными лигандами, особенно содержащими кислород. К ним относятся трис-комплекс с купферроном, лак с хинализарином и комплекс с алюминоном. Анионные лиганды, образующие хелатные кольца за счет нейтральных атомов азота, также связывают Ga, но менее прочно. Так, анион 8-оксихинолина образует с Ga желтый флуоресцирующий и экстрагирующийся хлороформом трис-комплекс. При использовании 5,7-ди-бром-8-оксихинолина вместо 8-оксихинолина образуется более устойчивый комплекс, а соответствующий метод определения галлия более чувствителен. Аналогичным образом Ga образует флуоресцирующие комплексы с эриохром красным и эриохром черным.
Следы Ga в растворе можно сконцентрировать осаждением в присутствии гидроокиси алюминия.
ГАФНИЙ
Гафний и цирконий имеют почти одинаковые атомные и ионные радиусы. Они также весьма близки по химическим свойствам, как и следует ожидать, учитывая подобие их электронных конфигураций. В случае четырехвалентных ионов эти конфигурации имеют следующий вид: для Zr [Кт]4/14 и для Hf [Хе]4/14. В ионе гафния 4 f-электроны лежат слишком глубоко, чтобы оказывать заметное влияние на химические свойства. Химические методы определения циркония применимы также и для определения гафния, за исключением того, что в довольно концентрированных растворах соляной кислоты цирконий и гафний образуют
320
ГЛАВА 13
с руфигалловой кислотой соединения, обладающие разной окраской. Возможно, это отчасти обусловлено несколько более основным характером гафния.
Теоретически можно разработать аналитические методы разделения гафния и циркония, основанные на таких приемах, как фракционная кристаллизация, фракционное осаждение, дистилляция, ионный обмен или экстракция органическими растворителями. В практике последних лет, однако, предпочтение, по-видимому, оказывалось физическим методам определения — дуговому и искровому эмиссионному спектральному анализу или рентгеноспектральному анализу.
ГЕРМАНИЙ
Двуокись германия обладает слабыми кислотными и еще более слабыми основными свойствами. Так, известны мета- и орто-германаты, аналогичные соответствующим силикатам, а в довольно концентрированных растворах соляной кислоты образуется ковалентный GeCk.
Четыреххлористый германий (т. кип. 86°) можно отогнать из 6 М соляной кислоты или из смеси серной и соляной кислот или же экстрагировать четыреххлористым углеродом или другими неполярными растворителями из 8—9 М соляной кислоты. В воде он быстро гидролизуется. В аммиачных или слабощелочных растворах германий количественно соосаждается с гидроокисями трехвалентного железа и алюминия.
Подобно Sn(IV) и Zr, германий образует слаборастворимые окрашенные комплексы с подходящими кислородсодержащими лигандами, например с хинализарином, 2, 3, 7-триокси-9-фенил-6-флуороном и его 9-(4-диметиламинфенил)-аналогом. Все эти реагенты являются о-дифенолами. Реакции с последними двумя соединениями выполняются в 1 М соляной кислоте и, вероятно, приводят к образованию октаэдрических бис-комплексов типа Ge(OH)aL2, которые можно экстрагировать четыреххлористым углеродом.
ЖЕЛЕЗО
Железо обычно находится в двух- и трехвалентном состоянии. Чаще всего оно образует октаэдрические комплексы, но могут существовать и тетраэдрические, как, например, в случае FeCl~ и FeCl2~. Известно много солей и комплексов двухвалентного железа. За исключением тех случаев, когда эти комплексы образованы веществами, стабилизирующими преимущественно Fe(II), все они в большей или меньшей степени склонны к окислению воздухом до комплексов Fe(III). Спиновые состояния комплек
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
321
сов Fe(II) и Fe(III) рассмотрены в гл. 3, где отмечалось, что устойчивые комплексы двухвалентного железа образуются с лигандами, имеющими поля лигандов, достаточно сильные, чтобы способствовать спариванию электронов на Зй-орбиталях. Этим также объясняется кинетическая инертность получающихся комплексов. В действительности возможен только такой тип лигандов, в которых связывание осуществляется атомами азота, как в случае аналитически полезных групп реагентов, основными представителями которых являются 1, 10-фенантролин и а, а'-дипиридил. Анионные лиганды, содержащие кислород (образующие высокоспиновые комплексы двухвалентного железа), связывают Fe(II) гораздо менее прочно. Поэтому EDTA можно применять в качестве маскирующего реагента при определении Fe(II), например, с 1, 10-фенантролином. Как и следует ожидать, анионные лиганды типа нитрозо-И-соли, изонитрозоацетофенона и салицилальдок-сима обнаруживают промежуточные свойства, и возможно, что в некоторых случаях образуются низкоспиновые комплексы.
Fe (III) обладает заметной тенденцией образовывать соединения, имеющие ковалентный характер. Поэтому Fe^ очень легко гидролизуется и в его растворах с pH > 1 существуют гидроксо-комплексы. Весьма обычны для Fe(III) анионные комплексы, например оно адсорбируется из солянокислых сред на анионообменной смоле в виде хлоро-комплекса. Однако чаще используют способность кислоты HFeCK экстрагироваться из 5—7 М НС1 метилизобутилкетоном, диэтиловым эфиром и некоторыми другими содержащими кислород растворителями. Аналогичные свойства обнаруживает Fe(III) в 5 М растворах НВг.
Спектр поглощения комплексов Fe3+ с хлорид-ионом, обусловленный переносом заряда, находит ограниченное применение для определения Fe(III). Гораздо более широкое приложение имеет аналогичный комплекс с роданид-ионами. Константы устойчивости роданидных комплексов невелики, поэтому для определения требуется высокая концентрация лигандов. В растворе образуется ряд комплексов, различающихся по максимуму поглощения и его интенсивности, что указывает на важность стандартизации условий. Комплексообразование усиливается при введении ацетона или других смешивающихся с водой растворителей с низкой диэлектрической проницаемостью или при экстракции органическими растворителями, содержащими кислород. Анионный комплекс Fe(III) с роданид-ионом можно также экстрагировать в виде его ионной пары с крупными органическими катионами, например с трифенилметил- и трибутилметиламмонием.
Почти во всех своих комплексах Fe(III) находится в высокоспиновом состоянии, что объясняется энергетической выгодностью симметричных и занятых одним электроном d-орбиталей в высокоспиновой электронной конфигурации d5. (К немногим исключе-, 21 д. Перрин
322
ГЛАВА 13
ниям относятся низкоспиновой кинетически инертный Fe(CN)e3-и трис-комплексы с 1, 10-фенантролином и а, а'-дипиридилом). Именно поэтому ион Fe(III) весьма мало похож на ионы других переходных металлов и именно поэтому он образует свои наиболее прочные комплексы с анионными, а не с содержащими азот лигандами.
Так, лиганды, применяемые для фотометрического определения Fe(III), могут связывать его двумя кислородными анионами (как в пирокатехине, тайроне и салициловой кислоте), кислородным и содержащим серу анионами (как в тиогликолевой и сульфосалициловой кислотах*), атомом кислорода и кислородным анионом (как в ацетилацетоне и купферроне) или атомом азота и кислородным анионом (как в 8-оксихинолине, ферроне и сали-цилальдоксиме). Подобно этому, Fe(III) образует очень прочный комплекс с EDTA; лимонную, щавелевую и винную кислоты можно использовать для маскирования железа или для удержания его в слабокислых или нейтральных растворах. Fe(III) образует также комплексы с фторид- и пирофосфат-ионами.
В присутствии лигандов, стабилизирующих двухвалентное состояние железа, трехвалентное железо можно также определять по окислению им диметил-п-фенилендиамина с образованием вещества, окрашенного в розовый цвет [8].
ЗОЛОТО
В водных растворах простой катион Аи+ диспропорционирует до Au и Au(III), поэтому Au(I) устойчиво только в виде комплексов типа Au(CN)“ и АиС1~ или же в виде очень плохо растворимых веществ, таких, как AuCN и Aul, осаждающихся при добавлении к растворам Au (III) цианид- или иодид-ионов. В слабокислых растворах золото образует с п-диметиламинобензи-лиденроданином малорастворимый красный комплекс, тоже являющийся, вероятно, комплексом Au (I), в котором связь осуществляется через гетероатом азота. Комплекс этот можно экстрагировать смесью бензол—хлороформ. Аи+ имеет электронную конфигурацию d10 и образует преимущественно линейные комплексы. Комплексообразование протекает предпочтительно с поляризующимися лигандами, особенно в тех случаях, когда возможна дативная связь.
Au(III) существует главным образом в виде комплексов, которые являются энергичными окислителями. Поэтому золото можно косвенно определить, измеряя степень окисления Au(III)
* В сульфосалициловой кислоте нет серусодержащего аниона, участвующего в комплексообразовании. По-видимому, автор имеет в виду тиосалициловую кислоту. — Прим, перев.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
323
органических веществ типа о-толидина, лейкооснования малахитового зеленого и о-дианизидина. И наоборот, в растворах Au(III) легко восстанавливается до свободного металла, поэтому золото можно отделить, например, встряхивая его растворы с твердым HgaCh. С другой стороны, в качестве восстановителя можно использовать хлорид двухвалентного олова в присутствии тетрахлорида теллура, который восстанавливается до Те, причем последний в свою очередь служит коллектором для золота. Au(III) образует характерные комплексы с ионами галогенов. НАиС14 можно экстрагировать содержащими кислород растворителями, например этилацетатом, из солянокислых растворов концентрации более 0,3 М. Окрашенная ионная пара, образуемая этой кислотой с родамином В, экстрагируется диизопропиловым эфиром или бензолом. Аналогично этому из растворов НВг можно экстрагировать оранжевую золото(III) бромистоводородную кислоту, а из 6,9 М растворов HI — кислоту HAuI4. Из 8 Al азотной кислоты диэтиловый эфир экстрагирует также HAu(NO3)4. Трехвалентное золото обладает сильной тенденцией к образованию ковалентных связей и в 0,5 н. серной кислоте образует трис-комплекс с дитизоном *.
ИНДИЙ
Индий(III) отличается от Ga(III) и А1(Ш) тем, что его окись и гидроокись не обладают амфотерными свойствами. Однако его соли, подобно солям Ga и А1, сильно гидролизованы в растворах и по аналогии с Ga он образует характерные комплексы с гало-генид-ионами. С другой стороны, условия их экстракции различны. Так, Ga, но не In экстрагируется диэтиловым эфиром из 6А1 НС1, в то время как из ЗА1 НВг при встряхивании раствора несколько раз с диэтиловым эфиром экстрагируется In (главным образом в виде Н1пВг4), но не Ga. Аналогично этому из 0,5—2М HI (или из KI и HaSO4) можно экстрагировать иодидный комплекс. В виде хлоридного комплекса индий можно адсорбировать на анионообменной смоле из 4—-5А1 НС1 и вымывать 0,1 М НС1. Следует ожидать, что образование этими анионными комплексами ионных пар с органическими катионами типа родамина В, вероятно, может быть использовано для определения индия. Однако эта возможность, по-видимому, пока не изучена.
Индий(III) образует октаэдрические комплексы, особенно в случае анионных лигандов. Обладая электронной конфигурацией 4z/10, индий обнаруживает некоторую тенденцию к образованию ковалентных связей. Так, в слабокислых средах он
* Характерный трис-дитизонат при этом не образуется. Возникают соединения переменного состава. — Прим. ред.
21*
324
ГЛАВА 13
образует нерастворимый сульфид, с 8-оксихинолином в области значений pH 3,2—4,5 дает желтый экстрагирующийся хлороформом трис-комплекс и экстрагируется из слабощелочных сред раствором дитизона в хлороформе. Подобно комплексу Ga, комплекс In с 8-оксихинолином флуоресцирует. Индий образует комплексы, но не очень прочные, с содержащими кислород анионными лигандами типа цитратов и тартратов.
ИОД
Большой размер и малый заряд делают ион I- легко поляризующимся, в связи с чем он охотно образует ковалентные связи. Если связи металл—галогенид в основном ковалентны, то это обусловливает такой ряд прочности комплексов: I>Br>Cl>F; в комплексах с преимущественно ионным характером связей порядок прочности связи обратный. В щелочных растворах иод быстро диспропорционирует (через неустойчивый Ю_) до иодат-и иодид-ионов. Иод также дает иодную кислоту и перйодаты, являющиеся энергичными окислителями. Перйодаты, производные кислоты НзЮб, обнаруживают много общего с теллуратами, производными Н6ТеОв.
ИРИДИЙ
Несмотря на то что 1г образует фторо-комплексы, отвечающие его высоким валентным состояниям, химия этого элемента связана главным образом со степенями окисления III и IV, которые представлены многими октаэдрическими комплексами. В своих катионных, нейтральных и анионных комплексах Ir(III) напоминает Rh(III), но это валентное состояние находит малое аналитическое применение.
Ir(IV) представлен 1гО2(НгО)х, осаждающейся при нейтрализации бикарбонатом натрия кислых растворов, содержащих (в качестве окислителя) бромат, и комплексами 1гХб2- (X=F, Cl, Вг). Несмотря на то что Ir(IV) является й5-системой, эти комплексы низкоспиновые и, подобно катионным и нейтральным комплексам Ir(III) (но в отличие от его анионных комплексов), они кинетически инертны. Низкоспиновое состояние сообщает октаэдрическим комплексам иридия с аминами заметную стабилизацию в поле лигандов.
Адсорбцию комплексов Ir(IV) анионообменными смолами можно использовать для отделения его от других металлов. Коричневый хлороиридат тетрафенилфосфония можно экстрагировать хлороформом из разбавленной соляной кислоты. Окисляющую способность Ir(IV) можно использовать для косвенного его определения, основанного на окислении подходящих органиче
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
325
ских веществ, например n-нитрозодиметиланилина, о-анизидина, бензидина, лейкооснования кристаллического фиолетового и лей-кооснования малахитового зеленого; при этом образуются окрашенные продукты.
ИТТРИЙ
Химические свойства иттрия подобны свойствам скандия и лантанидов. У3+ имеет электронную конфигурацию криптона и по величине радиуса занимает место в лантанидном ряду. Подобно лантанидам, иттрий образует наиболее прочные комплексы с лигандами, содержащими кислород. Иттрий можно отделить от скандия экстракцией последнего диэтиловым эфиром в виде роданидного комплекса. Вероятно, для отделения иттрия от многих других катионов, мешающих его определению современными спектрофотометрическими методами с применением реагентов типа хинализарина, ализаринового красного S и пирокатехинового фиолетового, найдут применение катионообменные смолы с последовательным вымыванием элементов анионными лигандами, например цитратом или нитрилотриацетатом [9].
КАДМИЙ
Двухзарядный ион кадмия Cd2+ обнаруживает значительное сходство с ионом Zn2+, однако он более основной. Правда, Cd обладает сравнительно малой тенденцией к образованию кад-мат-ионов. Основные различия между Cd и Zn обусловлены большим радиусом Cd2+, вследствие чего он образует более слабые ионные, но более прочные ковалентные комплексы. Электронная конфигурация Cd2+( [Kr]4d10) определяет «мягкость» этого иона и его склонность к образованию комплексов с аминами, цианид- и сульфид-ионами, в связи с чем нерастворимый в щелочных растворах Cd (ОН) 2 растворяется в концентрированном аммиаке с образованием аминного комплекса. Анионы, содержащие кислород, такие, как цитраты и тартраты, связывают кадмий относительно слабо. Поэтому в присутствии таких веществ дитизон (или ди-р-нафтилтиокарбазон) в CCi4 (илиСНС13), образующие комплексы по атомам азота и серы, экстрагируют Cd из щелочных растворов. Кадмий можно реэкстрагировать в водную фазу, используя 0,01 М НС1. Комплекс Cd с диэтилдитиокарбаматом можно экстрагировать из щелочных растворов. Из аммиачных сред СНС13 также извлекает комплекс Cd с 2-мер-каптобензотиазолом. С другой стороны, Cd не образует прочных комплексов с купферроном, где в образовании связи участвовали бы атомы кислорода.
Галогенидные комплексы Cd заметно устойчивее, чем соот
326
ГЛАВА 13
ветствующие комплексы Zn, и их устойчивость возрастает в ряду F<Cl<Br<I, Галогениды Cd растворимы в растворителях, содержащих кислород. Так, иодидный комплекс Cd экстрагируется диэтиловым эфиром из 6,9 М HI. В комплексах кадмия не наблюдается никакой стабилизации полем лигандов. Если лиганд является анионом, то эти комплексы имеют тетраэдрическую конфигурацию, как, например, CdBn2-; во всех других случаях конфигурация обычно бывает октаэдрической. Комплексная кислота, образуемая кадмием с роданид-ионом, экстрагируется хуже, чем соответствующий комплекс цинка, поэтому Zn можно отделить от Cd экстракцией смесью амиловый спирт — диэтиловый эфир из 0,6 М НС1, содержащей роданид аммония.
Ковалентный характер связи обусловливает возможность осаждения сульфида кадмия из слабокислых сред. В случае необходимости в качестве коллекторов можно применять сульфиды Си, Hg(II) и Zn.
КАЛИЙ
См. Натрий.
КАЛЬЦИЙ, СТРОНЦИИ, БАРИИ И РАДИЙ
Все двухзарядные катионы этого ряда имеют электронные конфигурации инертных газов. Их химические и физические свойства последовательно изменяются по мере увеличения размера, что определяет, например, различия в растворимости их солей, обсуждавшиеся в гл. 9. Эти катионы неспособны к заметной поляризации и не имеют полос поглощения в ультрафиолетовой и видимой областях. Тем не менее легкая растворимость безводных хлорида и нитрата кальция в спиртах, эфире, ацетоне и безводных карбоновых кислотах позволяет предположить, что связи кальция в его солях могут иметь до некоторой степени ковалентный характер. Это позволяет объяснить следующий факт. Несмотря на то что катионы этой группы дают комплексы преимущественно с анионными лигандами, содержащими кислород (например, с родизоновой кислотой, мурексидом и о-крезол-фталеинкомплексоном), кальций (и магний) можно также определять спектрофотометрически с реагентами, в которые входят ненасыщенные содержащие азот группы и фенольные кислороды. К таким реагентам относятся эриохром черный Т и 8-оксихино-лин. Во всех случаях независимо от типа лиганда методы основаны на сдвиге полос поглощения лиганда под влиянием катиона. За исключением реакции кальция с кальцихромом (гл. 6), большинство этих реагентов неспецифично и оказывается необходимым предварительное отделение элементов.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
327
Это отделение может заключаться в осаждении кальция в виде его оксалата (при этом осаждается и магний), фосфата, молибдата или, при содержании его в следовых количествах, в виде оксината с применением в качестве коллектора избытка оксина. Барий осаждают в виде сульфата или хромата. В последнем случае осадок служит коллектором для радия. Более четкое разделение возможно, по-видимому, при фракционировании на ионообменных колонках. С другой стороны, катионы, находящиеся в смеси, можно раздельно определять комплексонометрическим титрованием, тщательно подбирая условия *.
КИСЛОРОД
Для завершения электронного уровня атому кислорода требуется два электрона. В результате этого атом кислорода может существовать в виде двухзарядного аниона, однозарядного аниона типа ОН- или (будучи ковалентносвязанным) в виде нейтрального соединения, такого, как R—О—R. Во всех трех случаях кислород является донором электронов, причем порядок, в котором уменьшается эффективность его как донора, выглядит следующим образом: O2->OH_>R—О—R. Окислы могут иметь характер от преимущественного ионного (например, Ва—О) до преимущественно ковалентного (как в СО2 и OsCU); ион О2-в водных растворах неустойчив, ибо он образует гидроксил-ион. В ионах и молекулах кислород обычно может образовывать донорные связи при помощи только одной пары электронов, поскольку получающееся при этом перераспределение заряда требует слишком большой электростатической работы, чтобы позволить кислороду отдать и вторую электронную пару. Донорные свойства кислорода весьма важны. Одним из результатов их существования является сильная водородная связь, осуществляемая в водных растворах. Другим следствием является сильная сольватация катионов в воде (ее обычно рассматривают как электростатическое ион-дипольное взаимодействие). При комплексообразовании окси-анионов довольно хорошо соблюдаются требования простой электростатической теории: они образуют наиболее прочные связи с катионами малого размера и высокого заряда, и эти два фактора имеют большее значение, чем тип электронной конфигурации катиона.
* В последнее время для спектрофотометрического определения катионов этой группы были предложены новые реагенты. Ортаниловый С [бис- ^-сульфо-бензол)-) 1,1-бисазо-2,7)-1,8-нафталин-3,6-дисульфокислота] и его 4,4-динитропроизводное (нитроортанилозый С, нитхромазо) позволяют определять Sr и Ва в присутствии Са, одновалентных катионов, Pb, Fe, Ti, Zr и Та [см. ЖАХ, 20 440 (1965)]. Прочность комплексов изменяется в ряду Ва > Sr > Са > Mg. В случае хлорфосфоназо III этот порядок меняется: Са > Sr > Ва. Реагент азоазокси БН позволяет выделять (и затем определять) кальций из солей стронция и бария [см. ЖАХ, 18, 1198 (1963)]. — Прим, перед.
328
ГЛАВА 13
КОБАЛЬТ
Кобальт образует два ряда солей и комплексов — производных соответственно Со(II) и Со(III). В то время как Со(II) является устойчивым состоянием в солях, Со(III) существует главным образом в низкоспиновых октаэдрических комплексах, особенно в комплексах, образованных с участием донорных атомов азота (несмотря на то что по электростатическим условиям анионные лиганды также образуют с Со3+ прочные связи). Так, трискомплекс Со(Ш) с 2-нитрозо-1-нафтолом устойчив потому, что в образовании связи металл—лиганд принимает участие как донорный атом азота, так и анионный кислород. Вследствие значительной стабилизации, связанной с низкоспиновой электронной конфигурацией d-', лиганды с сильными полями образуют комплексы предпочтительно с Со(III). Поэтому комплексы Со(II) в этом случае легко окисляются до комплексов Со(Ш).
Низкоспиновая ^-конфигурация обусловливает кинетическую инертность комплексов. Если соединение, например трис-комп-лекс 2-нитрозо-1-нафтола, образовалось в слабокислом растворе и было экстрагировано органическим растворителем типа хлороформа, оно с трудом диссоциирует даже при встряхивании с соляной кислотой. В этих условиях большинство металлов переходит из органической фазы в водную. К другим поляризующимся лигандам, предложенным для определения Со(III), относятся диэтилдитиокарбамат и монооксим ди-1-нафтилкетона, образующие экстрагирующиеся трис-комплексы, диметилглиоксим, а, а', «"-трипиридил и ряд производных нитрозофенола, содержащих группу
NO ОН
= С-----С =
в том числе нитрозо-И-соль, образующая с Со растворимый в воде комплекс.
Соединения кобальта(II) могут иметь плоскую квадратную, тетраэдрическую или октаэдрическую конфигурации. К тетраэдрическим соединениям относятся ионы СоХ42- и [СоХз(НгО)]“г где Х = С1, Вг, I, SCN. Синий комплекс (NH4)2Co(SCN)4 экстрагируется содержащими кислород растворителями из довольно концентрированных растворов роданида аммония, забуфериро-ванных примерно до pH 3,5. При этом Со отделяется от Ni. В присутствии крупных катионов типа тетрафениларсония и трифенилметиларсония роданидный комплексный ион кобальта можно экстрагировать хлороформом. Анионный хлоридный комплекс кобальта в соляной кислоте можно отделять поглощением на ионообменной колонке.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
329
КРЕМНИЙ
По своим химическим свойствам кремний фактически является неметаллом. Его координационное число обычно равно 4. Поэтому основные ячейки структуры кремнезема и полимерных анионов кремневой кислоты состоят из четырех атомов кислорода, расположенных тетраэдрически вокруг атома кремния. Эти структурные единицы объединяются между собой за счет участия атомов кислорода в образовании связи с двумя атомами кремния. Цеолиты, используемые в качестве ионообменников и «молекулярных сит», представляют собой пористые трехмерные каркасы из тетраэдров АЮ4 и SiO4, причем для нейтрализации заряда атома алюминия требуется один протон или однозарядная катионная группа. Однако вследствие того, что Зй-орбитали кремния пустые, он может также образовывать октаэдрические комплексы за счет хр3(/2-гибридизации, как, например, в случае SiFe2- и трис-комплекса с ацетилацетоном.
ЛАНТАН И РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ
Ион La3+ имеет электронную конфигурацию инертного газа ксенона. Трехзарядные ионы лантанидов от Се до Lu значительно отличаются друг от друга лишь последовательным увеличением (до 14) 4/-электронов. Эти электроны лежат достаточно глубоко внутри катиона и в образовании химической связи имеют небольшое значение. Однако увеличивающийся при переходе от La к Lu заряд ядра приводит к постоянному уменьшению атомных и ионных радиусов. Последние уменьшаются от 1,4 до 0,85 А. Так как связи являются преимущественно ионными, константы устойчивости комплексов лантанидов в связи с уменьшением радиусов возрастают от La к Lu. По этой же причине основность гидроокисей М(ОН)з падает от La к Lu.
Лантаниды образуют с кислотами характерные соли. Из них окаеалаты мало растворимы в избытке щавелевой кислоты, а фториды очень слабо растворимы в присутствии фтористоводородной кислоты.
Комплексообразование наиболее сильно выражено в случае анионных лигандов, содержащих кислород, таких, как цитрат-, тартрат- и теноилтрифторацетонат-ионы, EDTA и NTA. Размер гидратированных ионов возрастает от La3+ к Lu3+ (ср. Cs+—Li+), поэтому связывание ионообменными смолами ослабевает в том же порядке. Последнее свойство используют в методах разделения редкоземельных элементов, основанных на адсорбции их катионообменной колонкой с последующим тщательным элюированием подходящими комплексообразующими веществами, например буферным цитратным раствором. Иногда для этой цели используют и различия в экстракционной способности комплексов.
330
ГЛАВА !3
Учитывая различия в растворимости двойных сульфатов с сульфатом натрия, редкоземельные элементы можно также разделить на две основные группы: соли группы La—Ей в сульфате натрия растворимы довольно слабо, в то время как соли Gd—Lu и Y заметно растворимы.
Реагенты для фотометрического определения редкоземельных элементов также обычно являются анионами, связывающими металл при помощи атомов кислорода. К ним относятся ализариновый красный S, хинализарин, сульфосалициловая кислота, ксиленоловый оранжевый, пирокатехиновый фиолетовый [9] и бром-пирогаллоловый красный [10]. Для этой цели были предложены также некоторые комплексообразующие агенты, действие которых основано на связывании металла атомами азота и анионными кислородами, хотя в принципе можно ожидать, что они будут менее пригодными. К этой группе относятся арсеназо I [11] и PAN [12], дающий красный осадок, экстрагирующийся диэтиловым эфиром. Были также использованы 8-оксихинолин и его 5,7-дихлорпроизводное (их комплексы можно экстрагировать хлороформом).
В этой группе элементов наиболее обычным является трехвалентное состояние, но в некоторых случаях могут образовываться двух- и четырехвалентные ионы, особенно если это приводит к электронной конфигурации f°, f1 или Конфигурация f1 сообщает системе дополнительную устойчивость в связи с тем, что каждая из семи f-орбиталей занята одним электроном. Четырехвалентное состояние важно лишь в случае Се(IV) (/°), напоминающего по химическим свойствам Hf(IV) и Zr(IV).
Для отделения Се от трехвалентных лантанидов применяют окисление Се(Ш) до Ce(IV) персульфатом или броматом натрия в 9А1 HNO3 или другим энергичным окислителем с последующим осаждением нерастворимого фосфата, гидроокиси или йодата. Се(IV) можно определить спектрофотометрически в серной кислоте, используя максимум светопоглощения при 320 ммк. При косвенном фотометрическом определении Се(IV) используют окисляющее действие его кислых растворов на органические’вещества, к которым относятся антраниловая кислота, бензидин, бруцин, морфин и сульфаниловая кислота. Се (IV) дает более ковалентные соединения, чем трехзарядные ионы, поэтому его соли гораздо легче экстрагируются органическими растворителями. Так, НгСе(ЫОз)б экстрагируется диэтиловым эфиром или метилизобутилкетоном из 8 М HNO3. Комплекс Се(IV) с теноил-трифторацетонат-ионом экстрагируется ксилолом из 1 н. H2SO4.
Среди двухзарядных ионов наибольшее значение имеет Eu (II) (f7), который можно получить электролитическим восстановлением растворов Eu(III) или же с применением Al, Mg, Fe или Zn. По химическим свойствам Еи2+ напоминает Ва2+, отличаясь
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
331
от других лантанидов способностью образовывать растворимую гидроокись и нерастворимые фосфаты и сульфаты. В природе он также иногда встречается с минералами группы II.
ЛИТИИ
Небольшой размер Li+ и его электронная конфигурация типа инертного газа обусловливают наиболее важные химические свойства этого иона. Так, небольшой размер сообщает Li+ большую поляризующую способность по сравнению с любым другим ионом щелочных металлов и значительно повышает его тенденцию к сольватации и образованию ковалентных связей. Именно поэтому хлорид лития растворим в органических растворителях типа этанола или диэтилового эфира. В щелочных растворах Li+ образует с дипивалоилметаном внутрикомплексное соединение, экстрагирующееся эфиром. Он также образует довольно прочный хелат с урамилдиуксусной кислотой, но оба эти реагента находят ограниченное аналитическое применение. В сильнощелочных растворах, содержащих 70%-ацетона, Li+ образует оранжевый комплекс с тороном [1-(2-арсонофенилазо)-2-нафтол-3,6-дисульфокислота]. Чувствительность реакции высока, но избирательность очень плохая и необходимо отделение большинства других катионов. Один из возможных методов отделения заключается в применении катионообменной смолы; порядок сорбируемости для гидратированных ионов щелочных металлов следующий: Li+<Na+<K+<Pb+<:Cs+. Причина такого порядка, который противоположен ожидаемому, в том, что Li+ по сравнению со всеми ионами щелочных металлов сильнее всего гидратирован, причем по мере увеличения атомного номера элемента степень гидратации его катиона непрерывно уменьшается.
Представляется маловероятным, что будут найдены чувствительные и достаточно избирательные органические реагенты, которые можно будет использовать для удовлетворительного прямого определения следов лития. Лучшими методами определения лития остаются спектральный, пламенно-фотометрический, а также косвенные методы (такие, как определение железа в осадке малорастворимой соли LiKFeIO6) *.
МАГНИЙ
Небольшой ионный радиус Mg2+ и его положительный заряд, равный двум, обусловливают тот факт, что он обнаруживает сильную тенденцию к образованию ковалентной связи, хотя и меньшую, чем в случае Ве2+. Так, MgBr2, Mgl2 и Mg(C104)2 рас
* Недавно для фотометрического определения предложен реагент хинолиназо [ЖАХ, 18, 937 (1963)], превосходящий торон как по чувствительности (8=12 840), так и по избирательности. — Прим, перед.
332
ГЛАВА 13
творимы в спиртах, кетонах и простых эфирах; магнийалкилы и соединения Гриньяра образуют комплексы с содержащими кислород донорными молекулами. Аналогично Mg2+ и в меньшей степени Са2+ образуют довольно прочные комплексы с аммиаком и аминами. Большинство солей магния растворимо в воде и обычно кристаллизуется в виде довольно устойчивых гидратов.
Магний образует наиболее прочные комплексы с анионными лигандами, содержащими кислород, но его комплексообразующая способность не очень велика. Поэтому многие другие ионы металлов, которые в противном случае мешали бы определению магния, можно удалить из его растворов экстракцией или осаждением, используя разницу в константах устойчивости комплексов с неизбирательными реагентами, такими, как диэтилдитиокарбамат, 8-оксихинолин, купферрон и ацетилацетон. В отсутствие мешающих катионов низкие концентрации Mg можно определять, спектрофотометрируя его комплекс с 8-оксихинолином при 400 ммк.. Ионная пара, образованная бутиламином и трис-8-оксихинолинатным комплексом магния при pH 10,5—13,6, экстрагируется хлороформом. С другой стороны, в присутствии бутилцеллосольва, занимающего в (октаэдрическом) комплексе Mg остающиеся координационные места, при pH 10—12 можно экстрагировать бис-комплекс с 8-оксихинолином.
Тенденция Mg образовывать ковалентные связи объясняет, почему в сильнощелочных растворах (рН>12) Mg2+ (или, более вероятно, Mg (ОН) г) адсорбируется на ряде красителей, содержащих азо-группы, с образованием окрашенных лаков. К этим красителям относятся титановый желтый, бриллиантовый желтый, 4-(n-нитрофенилазо)-резорцин и 4-(п-нитрофенилазо)-1-нафтол. Мешают многие металлы. Подобное же образование лака, но со связыванием при помощи атомов кислорода осуществляется в случае хинализарина, куркумина и эриохромцианина R. Вероятно, оба эти типа связей осуществляются в растворимом комплексе магния с эриохром черным Т.
При относительно высоких концентрациях Mg2+ удобно определять комплексонометрическим титрованием (гл. 6).
МАРГАНЕЦ
Основными валентными состояниями марганца являются состояния II, III и VII. Мп2+ имеет ^-электронную конфигурацию, так что этот ион обладает сферической симметрией, в его комплексах обычно отсутствует стабилизация полем лигандов и он обнаруживает много общего с катионами, имеющими электронные структуры инертных газов, особенно Mg2+. Этот анализ приводит к выводу, что в случае Mn(II) образуются главным образом ионные связи, поэтому он обнаруживает слабую тенденцию
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
333
к образованию комплексов с нейтральными лигандами. Даже в случае кислородсодержащих анионов константы устойчивости комплексов Мп(П) весьма малы. Так, уже 0,1 н. минеральная кислота предотвращает образование и экстракцию хлороформом комплекса Mn (II) с купферроном, а для экстракции хлороформом бис-комплекса Mn(II) с 8-оксихинолином требуется pH 9. К немногим известным низкоспиновым комплексам Mn(II) относятся Mn(CN)?-, [Mn(CN)5NO]3- и Mn(CNR)62+, где RNC — изонитрил. Мп2+ образует тетраэдрические ионы типа МпСЦ2-, но большинство его комплексов имеет октаэдрическую структуру. Mn (II) является наиболее устойчивой степенью окисления в кислых или нейтральных растворах.
Известны соединения Mn (III), но большинство из них в водных растворах неустойчиво. Стабилизация полем лигандов, вероятно, имеет важное значение только в низкоспиновых комплексах; единственным известным примером является Mn(CN)e3~, легко образующийся при окислении комплекса Mn (II) кислородом воздуха. Главным фактором, определяющим устойчивость комплексов Mn (III), являются, вероятно, электростатические эффекты — притяжение между трехвалентным катионом и анионными лигандами. К известным комплексам Mn(III) относятся гидратированный фторид, трис-комплекс с ацетилацетоном и красно-коричневый Мп(СН2КЮ)з, образуемый в щелочных растворах ионами марганца с формальдоксимом. Кроме того, легко диссоциирующий трис-комплекс Mn(III) с диэтилдитиокарбаматом экстрагируется хлороформом из слабокислых растворов.
Чаще, однако, марганец окисляют до Мп (VII) с предшествующим осаждением (если это необходимо) из слабощелочных растворов в виде МпО2(Н2О)ж с применением в качестве коллектора железа или магния. Марганец можно отделить отгонкой в виде марганцевой кислоты [13]. Перманганат получают окислением соединений марганца периодат-ионом в горячей азотной или серной кислоте или же персульфат-ионом в кипящей смеси фосфорной и азотной кислот, содержащей следы серебра. Перманганат можно затем определить непосредственно спектрофото-метрированием или, с большей чувствительностью, косвенно по окислению веществ типа бензидина, лейкооснования малахитового зеленого, о-толидина или 4, 4'-тетраметилдиаминотрифенил-метана; при этом образуются окрашенные продукты.
МЕДЬ
Медь образует два ряда солей и комплексов. Комплексы Cu(I) обычно имеют (в зависимости от природы лиганда) линейное или тетраэдрическое строение, в то время как комплексы Си(II) часто обладают плоской квадратной или искаженной
334
ГЛАВА 13
октаэдрической конфигурацией, причем искажение обусловлено проявлением эффекта Яна—Теллера. Окислительно-восстановительные равновесия в растворах солей Cu(I) и (II) осложняются легкостью диспропорционирования Cu(I) в Си(0) и Cu(II), поэтому комплексы Си(1) обычно образуются только в том случае, если они нерастворимы (например, CuCN и Cui) или если связь металл—лиганд имеет главным образом ковалентный характер, а пространственные факторы благоприятны. Низкий заряд Си+ и его ЗсР°-электронная структура приводят к тому, что Cu(I) образует наиболее прочные комплексы с сильнополяри-зующимися лигандами, особенно в тех случаях, когда возможно обратное двойное связывание. К известным примерам, используемым в фотометрических методах, относятся производные а, а'-дипиридила и 1, 10-фенантролина.
Обычным состоянием меди является двухвалентное, и Cu(II) образует многие устойчивые комплексы. Конфигурация 3d9 делает ион Си2+ легко деформирующимся, благодаря чему он образует прочные связи с содержащими серу анионами, например с диэтилдитиокарбаматом, этилксантогенатом, рубеановодород-ной кислотой и дитизоном, давая растворимые в органических растворителях комплексы. По устойчивости своих комплексов двухвалентные переходные металлы располагаются в следующий ряд: Mn<Fe<Co<;Ni<Cu>Zn. Наибольшие различия в поведении элементов наблюдаются при использовании высокополя-ризующихся лигандов; это облегчает отделение меди от других металлов этого ряда. Си можно экстрагировать дитизоном в ССЦ из 0,1—1 н. раствора минеральной кислоты, в то время как большинство других металлов в этих условиях связывается этим реагентом довольно слабо. Медь(П) образует также комплексы с лигандами, содержащими кислород, особенно в щелочных растворах, причем эти комплексы часто имеют полиядерный характер. Известным примером служит жидкость Фелинга.
Тенденция Cu (II) к образованию ковалентных связей иллюстрируется осаждением нерастворимого сульфида меди при пропускании сероводорода через раствор Cu(II) в разбавленной кислоте. (Эту реакцию применяют для выделения меди; в случае необходимости коллектором может служить PbS.) В соляной и бромистоводородной кислотах высокой концентрации Cu(II) образует окрашенные хлоридные и бромидные комплексы. В присутствии органических оснований или крупных органических катионов Cu(II) дает экстрагирующиеся роданидные комплексы.
МОЛИБДЕН
Молибден существует во многих валентных состояниях, а его соединения характеризуются разнообразными стереохимиче
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
335
скими конфигурациями. Наиболее важными валентными состояниями являются III, IV, V и VI. Mo(VI) представлен трехокисью МоОз, растворяющейся в щелочных растворах с образованием молибдат-иона MoCh2-, отличающегося от CrOi2- очень слабой окисляющей способностью. При подкислении и выдерживании таких растворов осаждается «молибденовая кислота» МоОз-2НгО. Однако менее кислые растворы подвержены полимеризации с образованием изополимолибдатов типа парамолибдат-иона МотОа?-, образующегося при pH 6.
При подкислении молибдатных растворов в присутствии оксианионов, таких, как POi3-, SiOi4-, и аналогичных анионов As(V), Ge(IV), Ti(IV), Zr(IV), Ce(IV), Th(IV), Pt(IV), Mn(IV), Te(IV), I(VII), Co(III), Al(III), Cr(III), Fe(III), Rh(III), Ni(II), Co(II), Mn(II), Cu(II), Se(IV), P (III) и As (III) образуются гетерополимолибдаты, экстрагирующиеся кислородсодержащими органическими растворителями. Гетерополикислоты растворяются в воде, но их соли с крупными органическими катионами нерастворимы. В этих гетерополи-анионах каждый атом Мо является центром октаэдра из шести атомов кислорода, которые также объединяются с образованием тетраэдров или других структур, содержащих гетероатом.
В растворах HCi высокой концентрации Mo(VI) образует хло-ридные комплексы, например MOO2CI2, который можно экстрагировать растворителями, содержащими кислород, и затем ре-экстрагировать водой. Оптимальная кислотность при экстракции диэтиловым эфиром — 6 М НС1, а при экстракции, трибутилфосфатом— 1—2 М НС1. Соответствующие бромидные комплексы лишь частично экстрагируются диэтиловым эфиром из 6 М НВг.
В минеральных кислотах Mo(VI) медленно реагирует с толуол-3,4-дитиолом [реакция катализируется солями Fe(II)], образуя нейтральный мало растворимый темно-зеленый трис-комплекс, экстрагирующийся полярными и неполярными растворителями. При выполнении реакции в присутствии лимонной кислоты вольфрам не мешает. Вероятно, вначале образуется ион МоОг2+ и затем по мере координирования им атомов серы атомы кислорода постепенно вытесняются. Ион МоОг2+ присутствует в бис-комплексе с ацетилацетоном, МоОг(асас)2, в MoOaF?- и MOO2SO4, который получается при растворении МоОз в концентрированной серной кислоте. Вероятно, именно этот катион Mo(VI) взаимодействует с хелатообразующими реагентами в кислых растворах. Образование в таких условиях нерастворимых в воде и экстрагирующихся хлороформом комплексов с а-бензо-иноксимом и купферроном можно объяснить ожидаемым сродством молибдена к содержащим кислород анионным лигандам. Для определения молибдена были также предложены тайрон, морин, хлораниловая кислота, кверцетин, диэтилдитиокарбамат
336
ГЛАВА 13
и тиогликолевая кислота. С другой стороны, Mo(VI) не образует очень прочных комплексов с реагентами типа дитизона.
В 1 М НС1, содержащей роданид-ион, а также Fe(II) или Fe(III), хлорид двухвалентного олова восстанавливает Mo(VI) с образованием ряда комплексов Mo(V). Наибольшее значение из них имеет MoO(SCN)3, являющийся основным соединением при высоких концентрациях роданида. Этот янтарного цвета комплекс можно стабилизировать, добавляя к раствору ацетон или экстрагируя его кислородсодержащими органическими растворителями типа изоамилового спирта. Другая возможность заключается в образовании соответствующей ионной пары с ионом тетрафениларсония, которую можно экстрагировать хлороформом. В отсутствие железа или меди хлорид Sn (II) восстанавливает Mo(VI) до Mo(IV), который затем диспропорционирует на Мо(Ш) и Mo(V). К другим комплексам Mo(V) относятся MoF6~, МоОХ52-, (Х = С1, Br, CNS) и МоОВг4_. При нейтрализации их растворов осаждается МоО(ОН)3.
К комплексам низших . валентностей молибдена относятся Mo(CN)s4-, где присутствует Mo(IV), и анионы МоХ63" (X — галоген или псевдогалоген), содержащие Мо(Ш). Комплексы Мо(Ш) являются сильными восстановителями.
К нерастворимым соединениям молибдена относятся молибдат свинца и сульфид молибдена. Последний можно выделить из раствора с применением в качестве коллекторов Си или Sb(V), причем в присутствии винной кислоты осадок не загрязняется вольфрамом.
МЫШЬЯК
Мышьяк может иметь валентности III и V, но валентность III более устойчива. Этот элемент образует ковалентные связи, как показывает восстановление соединений мышьяка в соляной или серной кислоте, приводящее к образованию газообразного арсина AsH3. Указанная реакция служит основой метода Гутцайта для определения мышьяка. Аналогично этому ковалентный характер имеет AsCl3; он может экстрагироваться четыреххлористым углеродом или отгоняться из сильно солянокислых растворов в присутствии восстановителя. AsBr3 в значительной степени экстрагируется диэтиловым эфиром из 4,5 М НВг. Его можно отогнать из концентрированной НВг. AsBrs также летуч. Существование в водных растворах иона As3+ не доказано.
Мышьяк образует прочные связи с серой, поэтому из кислых растворов As(III) и As(V) можно осаждать сероводородом As2S3 и As2Ss. В минеральнокислых средах он также образует прочные комплексы с диэтилдитиокарбаматом диэтиламмония и этил-ксантогенатом калия. Эти комплексы экстрагируются хлороформом. В. молекуле трехокиси мышьяка As4Oe атомы кислорода
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
337
расположены тетраэдрически вокруг атомов мышьяка. Растворение в воде приводит к образованию слабой кислоты (мышьяковистой) и арсенитов, которые легко окисляются. Получаемая косвенным путем пятиокись мышьяка является окислителем и очень хорошо растворяется в воде с образованием мышьяковой кислоты.
В настоящее время, по-видимому, нет хорошего органического реагента для определения мышьяка. Обычные методы определения основаны на образовании мышьякового зеркала и молибденовой сини. (Последний метод заключается в образовании гетерополисоединения арсеномолибдата, который при восстановлении гидразинсульфатом или хлоридом Sn(II) образует интенсивно окрашенный синий комплекс.) Следы мышьяка можно сконцентрировать из раствора, используя в качестве коллектора гидроокись трехвалентного железа, или же восстановлением в кислых растворах до элементного состояния твердым хлоридом одновалентной ртути.
НАТРИИ, КАЛИИ, РУБИДИЙ И ЦЕЗИЙ
Катионы этого ряда имеют электронные конфигурации инертных газов (от неона до ксенона), поэтому они обладают сферической симметрией и с трудом деформируются. Устойчивость таких электронных конфигураций обусловливает отсутствие окраски катионов, поскольку для возбуждения электронов на низшие незаполненные орбитали требовалась бы очень большая энергия.
Химические свойства этих катионов определяются главным образом электростатическими взаимодействиями. В ряду Li—Cs по мере увеличения размера иона обнаруживаются многие характерные изменения свойств. К ним относятся величины отношений радиусов и энергии кристаллических решеток, так что крупные катионы образуют более устойчивые соли с крупными же анионами. Чем крупнее катион, тем больше он образует нерастворимых солей. Связи обычно имеют ионный характер, даже в небольшом числе хелатных комплексов этих катионов, образуемых содержащими кислород анионными лигандами, например салицилальдегидом и бензоилацетоном. Константы устойчивости этих комплексов почти всегда слишком малы, чтобы комплексы можно было использовать в аналитических целях. Ограниченное использование в экстракции органическими растворителями могут найти некоторые ионные пары. Так, цезий можно экстрагировать раствором дипикриламина в нитробензоле. Для определения этих элементов гораздо полезнее применение атомной абсорбционной спектроскопии, пламенной фотометрии и аналогичных спектрографических методов.
22 Д. Перрин
338
ГЛАВА 13
В случае применения химических методов анализа последние обычно основаны на образовании малорастворимых солей. Их можно определять гравиметрически или же, если осадок содержит соединение, способное образовывать окрашенный продукт с подходящим реагентом, можно использовать и фотометрические методы. Некоторые примеры были приведены в гл. 9. К другим примерам относятся осаждение калия в виде KaAgCo(NO2)6 (с использованием кобальтинитрита серебра), рубидия и цезия в виде их солей с Bi(NO2)e3-, цезия в виде CS3B12I9 (при помощи иодовисмутовой кислоты) и кремневольфрамата цезия.
НЕПТУНИИ
В газообразном состоянии атом нептуния имеет, вероятно, электронную конфигурацию [Rn]5f46s26p66d17s2 или [Rn]5f56s26p67s2. Однако разница в энергиях орбиталей 5f и 6d достаточно мала, что позволяет 5/-электронам переходить на 6(/-орбитали и участвовать в образовании химической связи; вследствие этого наиболее устойчивой степенью окисления является Np(V). В ультрафиолетовой части спектра Np (III) имеются две интенсивные полосы (коэффициенты молярного поглощения равны 2295 и 1593), которые, видимо, соответствуют разрешенным по Лапорту f—d-переходам. Они обладают гораздо большей интенсивностью, чем очень резкие полосы поглощения (е«10—50), наблюдаемые в видимой части спектра вследствие «запрещенных» f—/-переходов [15]. В трехвалентном состоянии нептуний обнаруживает много общего с лантанидами, а четырехзарядный ион Np4+ похож на Zr4+ и Th4+. Высшие валентные состояния нептуния сходны с ураном в том отношении, что образуют оксо-ионы NpCV и ЫрОг2+. Эта аналогия хорошо видна из соотношения между типом катиона нептуния и природой коллектора, применяемого для его концентрирования. ЫрОг2+ соосаждается с натрийуранилаце-татом, в то время как фосфат циркония (IV) служит коллектором только для Np4+. Аналогичным образом LaF3, ТЬ(СгО4)2 и KLa(SO4)2 выделяют из раствора Np3+ и Np4+, но не NpCV и NpO22+.
Легкость взаимных переходов между состояниями окисления облегчает выделение нептуния с использованием ионного обмена, комплексообразования, соосаждения и экстракции. Прочность комплексов уменьшается в ряду Np4+>NpO22+>Np3+>, |>ЫрОг+. В общем соответствии с простой электростатической теорией анионы располагаются в следующий ряд, в котором устойчивость их комплексов понижается: СОз2->С2О42->'
SO32-> SO42-> F"> NO3~> Cl-> Br-> I-> CIO4-.
Np(IV) легко образует анионные комплексы, поэтому в присутствии восстановителей, например сульфамата двухвалентного
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
339
железа и семикарбазида (восстанавливающих Ри и более далекие члены трансуранового ряда до трехвалентного состояния), Np(IV) адсорбируется из азотнокислых и солянокислых растворов на колонке с сильноосновными анионообменниками, с которой он затем может быть вытеснен сульфатом церия(IV) [16]. Аналогичным образом из солянокислого [17] и азотнокислого растворов Np(IV) экстрагируется ксилолом в виде нейтральных комплексов с теноилтрифторацетоном. Раствор моно-(2-этилгек-сил)-ортофосфорной кислоты в толуоле извлекает Np(IV) из солянокислых растворов высокой концентрации [19]. Из кислых сред нитрат нептунила (VI) можно экстрагировать органическими растворителями в виде его комплексов с трибутилфосфатом и гексоном. Для выделения нептуния из смеси продуктов деления урана было предложено использовать экстракцию гексоном нитрата нептунила в виде тетрапропиламмонийнитратного комплекса с последующей экстракцией смесью теноилтрифторацетон— ацетон—ксилол [20]. Во всех случаях эти комплексы можно извлечь из органической фазы, изменив валентное состояние металла. Очень прочный комплекс Np(IV) с EDTA не экстрагируется.
Как и следует ожидать по аналогии с торием, Np(IV) в растворах с pH 1—4 образует с тороном окрашенный комплекс (е~15 000). Арсеназо I реагирует примерно в тех же условиях (е~25 000), но в нейтральных растворах образует окрашенные комплексы и с Np(V) и Np(VI) [21]. 1-Нитрозо-2-нафтол при pH 9—10 образует с Np(V) окрашенный комплекс, экстрагирующийся изоамиловым спиртом [22]. Однако обычно нептуний определяют радиохимическими методами.
НИКЕЛЬ
Устойчивая валентность никеля равна двум, но известно и небольшое число комплексов Ni(III) и Ni(IV). Гидроокись Ni(ОН)г имеет характерные основные свойства, и известны многие соли Ni (II). Ni (II) может образовывать тетраэдрические и октаэдрические комплексы, как соответственно в случае NiCl?" и Ni(HaO)62+, Ni(NH3)e2+ и Ni(bipy)s2+. Однако в случае лигандов, имеющих сильные поля, он обычно образует плоские квадратные комплексы. Если же поля лигандов слабы, как в случае кислородсодержащих реагентов типа ацетилацетона, то образуются октаэдрические комплексы. Известно несколько примеров, в которых для перехода из низкоспиновой плоской квадратной конфигурации к октаэдрической достаточно влияния температуры.
Ион Ni2+ является системой ds. Устойчивость его комплексов определяется как влиянием стабилизации полем лигандов, так и способностью лиганда образовывать дативные связи с d-электро-22*
340
ГЛАВА 13
нами металла. Примерами соединений, где более важен последний эффект, могут служить прочные комплексы, образованные с содержащими серу анионными лигандами, например с диэтилдитиокарбаматом, дитиооксалатом, p-меркаптопропионатом, [4-изотиоуреидопропионатом и двухзарядными анионами рубеано-водородной кислоты и хиноксалин-2,3-дитиола. Стабилизация полем лигандов является решающим фактором при образовании бис-комплексов Ni(II) с диоксимами, например с диметилглиоксимом; эти комплексы используются в большинстве наиболее важных гравиметрических и спектрофотометрических методов определения никеля. Связи в этих комплексах образуются за счет четырех атомов азота, и их сильные поля обусловливают значительную энергию стабилизации получающегося плоского квадратного комплекса. Малая склонность к заполнению других мест вокруг атома металла объясняет экстрагируемость комплексов неполярными растворителями типа хлороформа, что обеспечивает возможность отделения Ni от ионов типа Со2+, образующих октаэдрические комплексы.
Комплексы Ni(III) и Ni(IV) нехарактерны. Они образуются только в тех случаях, когда окисление комплекса двухвалентного никеля приводит к образованию более прочных связей металл— лиганд; лиганд обычно является анионом.
НИОБИЙ
Практически важным состоянием Nb является пятивалентное, в котором он напоминает фосфор и мышьяк. Галогениды NbXs (X = F, Cl, Br, I), NbOCh и NbOBrg имеют ковалентный характер, летучи и легко гидролизуются даже в кислых средах. Получающийся при этом нерастворимый гидрат окиси Nb2O5(H2O)x растворяется в сильных щелочах с образованием «ниобатов» или во фтористоводородной кислоте с образованием нерастворимых фторо-комплексов NbFe", NbF?2- и NbOFs2-. Вполне возможно, что в концентрированной соляной кислоте, содержащей Nb(V), существует ион NbCK-; из таких растворов Nb экстрагируется диизопропилкетоном, вероятно, в виде HNbCl6. Этот растворитель также извлекает ниобий из смеси серной (6 Л4) и фтористоводородной (9 Л1) кислот. Способность раствора трибензиламина в хлороформе экстрагировать HNbOCk и и H2NbOC15 из довольно концентрированных растворов соляной кислоты объясняется, вероятно, образованием ионных пар (комплексы тантала в этих условиях не экстрагируются).
Известны и низшие неустойчивые валентные состояния Nb, получающиеся, например, при электролитическом восстановлении ниобиевой кислоты. Восстановление Nb (но не Та) хлоридом двухвалентного олова в сильнокислых роданидных растворах
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
341
приводит к образованию желтого экстрагирующегося эфиром комплекса Nb(III), который применяют для фотометрического определения ниобия.
Вероятно, ниобий не обладает химическими свойствами, которые могли бы обеспечить специфичность его реакций. Подобно танталу (и многим другим элементам), ниобий обнаруживает известное сродство к вицинальным фенольным группам, поэтому он образует осадки с морином и кверцетином и дает цветные реакции с хинализарином, пирокатехином, пирогаллолом, три-бромгаллолом и ксиленоловым оранжевым. Один из лучших методов разделения Nb и Та основан на фракционном осаждении ниобиевой и танталовой кислот из оксалатных растворов в виде адсорбционных комплексов с танином. (Тантал, будучи более основным, образует более прочные комплексы и, следовательно, осаждается из более кислых растворов. Это влияние pH было найдено для большинства комплексов Nb и Та.)
О склонности Nb и Та к комплексообразованию с кислородсодержащими лигандами свидетельствует также использование в качестве их осадителей №бензоил-№фенилгидроксиламина [23]. Ниобий и тантал образуют растворимые комплексы с винной, лимонной, щавелевой и аскорбиновой кислотами. Ниобий (но не Та) дает в 1,6 М соляной кислоте растворимый желтый комплекс с тайроном, а при pH 5,8 — синий комплекс с бромпи-рогаллоловым красным, который в присутствии подходящих аминов можно экстрагировать органическими растворителями. Эту реакцию можно сделать более избирательной, используя тартратные буферные растворы, содержащие в качестве маскирующих агентов EDTA и цианид-ион. Другим чувствительным реагентом этого типа является 4-(2-пиридилазо) резорцин. Комплекс ниобия с 8-оксихинолином не очень устойчив, и для получения этого растворимого в хлороформе комплекса необходимо-работать при pH ~9
Другими неизбирательными реагентами являются перекись водорода, с которой Nb и Та образуют пероксо-комплексы в сильносернокислых растворах и фосфорномолибденовая кислота, дающая с ниобием «молибденовую синь» после восстановления хлоридом двухвалентного олова. В концентрированных сернокислых растворах ниобий и тантал образуют желтые продукты с гидрохиноном.
* В настоящее время для фотометрического определения ниобия все чаще применяют о,о' -диоксиазосоединения, дающие с ним избирательные и чувствительные реакции. Сюда относятся реагенты группы 2,4-нитросульфофе-нола С и пикрамина Р [см., например, ЖДХ, 19, 328 (1964)]. Разработан метод определения Nb в Та с применением PAN [Е л и н с о н С. В., П Обедина Л И., Резова А. Т., Завод, лаб., 31, № 10 (1966)].—Прим, перев.
342
ГЛАВА 13
ОЛОВО
Олово образует два катиона: Sn2+( [Kr]4d105s2) и Sn4+( [Kr]4d10). Существование первого катиона является результатом химической «инертности» 5х2-электронов, а окислительно-восстановительный переход Sn(II)—Sn(IV) обусловлен их удалением или возвращением. В то время как Sn(II) обладает преимущественно основными свойствами (хотя оно интенсивно гидролизуется в растворах и может образовывать станниты в сильно щелочных средах), Sn(IV) —амфотерно; оно образует станнаты, которые содержат анион [Sn(ОН)б]2~, аналогичный ионам ряда [SnX6]2- (где X=F, Cl, Вг, I), а также комплексы типа SnCk. В комплексах Sn(II) и в гораздо большей степени в комплексах Sn(IV) связь имеет преимущественно ковалентный характер. Поэтому олово можно экстрагировать диэтиловым эфиром в виде бромидных комплексов из 4М HBr, a Sn(II) экстрагируется в виде иодидного комплекса из 6,9 М HI. Бензол экстрагирует Snh из сернокислых растворов Sn(IV), содержащих большие количества иодида. Аналогичным образом Sn(IV) количественно экстрагируется диэтиловым эфиром в виде роданидного комплекса из раствора 1—10 М по роданиду аммония и 0,5 М по соляной кислоте. Галогениды четырехвалентного олова SnBfi и SnCU легко отгоняются при добавлении к горячему сернокислому или хлорнокислому раствору, содержащему олово, соответствующей галогеноводородной кислоты. Кроме того, олово можно отделить от других металлов осаждением его сульфида из сильнокислых сред с применением меди в качестве коллектора.
Sn (II) и Sn(IV) различаются характером лигандов, с которыми они образуют наиболее прочные комплексы. Инертная пара электронов в комплексах Sn (II) в значительной мере уменьшает степень обратного двойного связывания металла. Несмотря на это, заполненные d-орбитали Sn (II) обусловливают тот факт, что наиболее прочные комплексы образуются с поляризующимися лигандами, а отсутствие стабилизации полем лигандов (поскольку олово является системой d10) приводит к тому, что нейтральные амины менее эффективны, чем анионы. Более высокий электрический заряд Sn4+ приводит к тому, что электростатические эффекты приобретают большее значение и способствуют комплексообразованию с анионными содержащими кислород лигандами типа пирокатехинового фиолетового [44а]. Так, дитизоном экстрагируется Sn(II),HO не Sn(IV) *. Sn(II) образует нерастворимый красный бис-комплекс с толуол-3,4-дитиолом, который можно экстрагировать органическими растворителями (с появ
* Это, скорее всего, объясняется тем, что нейтральный дитизоиат не может образоваться из-за простраиствеииых препятствий [относительно низкое координационное число Sn(IV)]. — Прим. рео.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
343
лением желтой окраски). Эту реакцию, применяемую для фотометрического определения олова, обычно выполняют в водной фазе в присутствии защитного коллоида. Аналогичным образом реагируют дитиопирокатехин и 1-хлор-3,4-димеркаптобензол. Из кислых сред Sn(II), но не Sn(lV) экстрагируется раствором диэтилдитиокарбамата диэтиламмония в хлороформе.
В противоположность этому Sn(IV) образует слабо растворимые окрашенные комплексы с реагентами типа галлеина, гематоксилина, морина, фенилфлуорона и хинализарина, а также флуоресцирующие комплексы с карминовой кислотой и пурпурином. Осажденный из 1 н. НС1 или H2SO4 купферронат Sn(IV) экстрагируется хлороформом. Sn(IV) образует также экстрагирующийся хлороформом комплекс с 8-оксихинолином (при pH 2,5—5,5) и комплекс с диэтилдитиокарбаматом.
Окислительно-восстановительные свойства системы Sn(II)—-Sn(IV) несколько ограничивают число органических реагентов, пригодных для определения олова, и, наоборот, восстановительную способность Sn(II) используют для его определения. В качестве примеров можно привести появление фиолетового окрашивания с какотелином (нитропроизводное бруцина) и образование флуоресцирующего синим светом вещества при восстановлении в аммиачной среде 6-нитро-2-нафтиламин-8-сульфокислоты. Под действием хлорида двухвалентного олова диазиновый зеленый (зеленый Януса), образующийся при сочетании N, N-диметил-анилина и диазотированного сафранина, восстанавливается обратно до сафранина. Окраска в этой чувствительной реакции (которую дает также хлорид трехвалентного титана) изменяется от синевато-зеленой до фиолетовой или красной.
ОСМИИ
Наиболее обычными соединениями осмия являются октаэдрические комплексы, соответствующие валентности IV и VI, а также летучая окись осмия(VIII) OsO4. Этот окисел экстрагируется из кислых растворов четыреххлористым углеродом и хлороформом, что является высокоизбирательной реакцией, позволяющей отделять Os и Ru от других платиновых металлов. Большая устойчивость высших валентных состояний Os по сравнению с Ru служит примером поведения, характерного для пар элементов третьего и второго переходного рядов. Так, в 5 М водном растворе азотной кислоты соединения осмия окисляются до OsO4, которая легко отгоняется из растворов, в то время как рутений до RuO4 не окисляется. Подобно этому, в кислых растворах RuO4 гораздо быстрее, чем OsO4, восстанавливается ионом двухвалентного железа. Осмий можно определить по образованию окрашенных продуктов окисления при действии OsO4 на вещества типа о-то-
344
ГЛАВА 13
лидина, бензидина и тетраметил-п-фенилендиамина. В кислых растворах OsCh взаимодействует с роданидом калия, образуя синий комплекс, экстрагирующийся эфиром или амиловым спиртом. Валентность Os в этом соединении, вероятно, ниже восьми. Тиомочевина взаимодействует с OsO4 или хлороосмат-ионом в кислых средах с образованием растворимого красного комплекса Os (III) Os(NH2CSNH2)e3+. Аналогично ведут себя производные тиомочевины о, о'-дитолилтиомочевина и 1,4-дифенил-тиосемикарбазид, хотя в последнем случае необходимо применение восстановителя, например хлорида двухвалентного олова.
Os(IV) медленно образуется при реакции OsO4 с ионом двухвалентного железа в кислых растворах. Он дает прочные комплексы OsXe2- (X=F, Cl, Вг), а также ионную пару с ионом тетрафениларсония [ (СбН5)4Аз]2ОзС1в, которая может экстрагироваться хлороформом. Трехвалентный осмий известен в низко-спиновых комплексах с аммиаком, а, а'-дипиридилом, содержащими кислород лигандами типа ацетилацетонат- и оксалат-ионов, а также с нитрит-ионом в [Os(NO2)5]2-.
ПАЛЛАДИИ
Pd(II) обычно проявляет в комплексах координационное число 4 и образует плоские квадратные комплексы, например Pd(NHs)42+ или коричневый Pdl42~. Эта склонность палладия к образованию плоских квадратных конфигураций отличает его от других переходных металлов. Хлорид палладия легко координирует многие лиганды типа аминов, фосфинов и сульфидов, которые заполняют два координационных места у атома металла. Так, координация палладием в PdCl2 двух молекул /г-аминоацето-фенона (через амино-группы) приводит к образованию нерастворимого в воде комплекса [NHaCeFLCOCHs^PdCh], в то время как металлы, образующие октаэдрические комплексы, координируют еще и молекулы воды и поэтому растворимы. По этой же причине платина ведет себя подобно палладию.
Бис-комплексы типа Pd [NOCeH4N (СНз)2]С12, образуемые n-нитрозоанилином и его производными в слабокислых средах, используют для фотометрического определения Pd. Комплекс с нитрозодифениламином можно экстрагировать органическими растворителями типа бутилового спирта. Эта склонность к комплексообразованию с поляризующимися лигандами, имеющими сильное поле (особенно если возможно также образование обратной двойной связи), весьма характерна для Pd(II) и ясно видна на примере реагентов, применяющихся для его выделения и фотометрического определения. К ним относятся дитизон (образующий с палладием комплекс, который экстрагируется из 1 М HCI четыреххлористым углеродом), роданид-ион (образующий
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
345
H2Pd(SCN)4, который экстрагируется бутиловым или изоамиловым спиртами), тиомочевина, тиогликолевая кислота, 2-меркапто-4,5-диметилтиазол и диэтилдитиокарбамат-ион (образующий комплекс, экстрагирующийся бензолом). Палладий образует также нерастворимые в воде комплексы с диэтиламинобензили-денроданином, 1-нитрозо-2-нафтолом и 2-нитрозо-1-нафтолом. (Комплексы нитрозонафтолов можно экстрагировать толуолом.) Подобно никелю, палладий образует с диметилглиоксимом нерастворимый бис-комплекс, который можно экстрагировать хлороформом. Другие диоксимы также дают эту реакцию, причем лучшим реагентом является а-фурилдиоксим. Окрашенный комплекс с палладием образует также салицилальдоксим. Основное различие между соответствующими комплексами Pd(II) и Ni(II) заключается в большей кинетической инертности первых.
Палладий образует также октаэдрические комплексы Pd(IV)—PdX2-, где X = F, Cl, Вг, но они не имеют большого значения. Палладий можно осадить в виде сульфата, используя свинец в качестве коллектора. Он также легко соосаждается с теллуром, если к раствору добавить теллурит, который затем восстановить сернистой кислотой или хлоридом двухвалентного олова. Палладий можно, кроме того, восстановить и адсорбировать на HgaCb при встряхивании последней с раствором Pd(II).
ПЛАТИНА
Химические свойства платины и палладия весьма близки, за исключением того, что комплексы Pt (IV) более многочисленны и более устойчивы, чем комплексы Pd(IV). Предпочтительными лигандами для образования плоских квадратных комплексов Pt(II) являются легко поляризующиеся и имеющие сильные поля лиганды, часто допускающие образование с металлом обратной двойной связи. Так, в присутствии хлорида двухвалентного олова [для восстановления всей имеющейся в растворе Pt (IV)] дитизон в 4 М НС1 взаимодействует с Pt (II), образуя комплекс, экстрагирующийся четыреххлористым углеродом. Pt(IV) в виде дитизо-ната не экстрагируется. К другим реагентам, которые можно использовать как для Pd (II), так и для Pt (II), относятся п-нитро-зодиметиланилин, п-нитрозодифениламин и диэтилдитиокарбамат-ион (последние два реагента образуют комплексы, экстрагирующиеся органическими растворителями).
В четырехвалентном состоянии платина образует большое число октаэдрических комплексов типа [PtLxXe-x], где х меняется от 0 до 6; L = NH3, N2H4, NH2OH или ‘/г (еп) и Х=С1, Br, SCN или NO2. Подобно комплексам Pt(II) и Pd(II), комплексы Pt(IV) кинетически инертны. Красный иодоплатина (IV)-ион Ptl2“ нахо
346
ГЛАВА 13
дит некоторое применение при фотометрическом определении платины; анионы этого типа можно также использовать для анионообменного отделения платины от многих других металлов. Окисление платины до Pt(IV) при pH 8 при помощи бромат-иона с последующим кипячением приводит к осаждению в виде гидратированного окисла всего присутствующего палладия, a Pt(IV) остается в растворе. В других случаях методы, предложенные для осаждения палладия из растворов, применимы и для платины. Тиосемикарбазид и фенилтиосемикарбазид в слабокислых средах образуют с Pt (IV) окрашенные комплексы. В последнем случае комплекс можно экстрагировать этилацетатом.
ПЛУТОНИЙ
Химические свойства плутония (газообразный атом ]Rn]5fe6s26pe7s2) очень близки свойствам соответствующих валентных состояний нептуния. Однако больший заряд ядра и происходящее в связи с этим сжатие орбиталей затрудняют переход 5/-электронов на 6б/-орбитали и их участие в образовании связи. Это приводит к тому, что наиболее устойчивым состоянием окисления плутония является Pu(IV) [в противоположность Np(V)]. Ионы плутония Pu3+, Ри4+ и РиО2+ подобны ионам нептуния, но РпО+ в слабокислых растворах диспропорционирует, а Ри3* и Ри4+ окисляются труднее, чем Np3+ и Np4+. Ультрафиолетовый спектр Ри3+ до сих пор не описан, но, по-видимому, интенсивные полосы, соответствующие f — d-переходам, лежат в области более коротких длин волн, чем в случае Np3+.
Вследствие небольших радиусов ионы плутония образуют более прочные комплексы, чем соответствующие ионы нептуния. Комплекс Pu(IV) с EDTA достаточно устойчив (logK = 25,l), что позволяет проводить комплексонометрическое титрование с применением в качестве индикатора ализаринового красного S и обратного титрования нитратом тория [24]. Соосадители для ионов плутония те же, что и для нептуния; к ним относятся соли циркония с органическими кислотами, бензолсульфинат и фенил-арсонат циркония, извлекающие Pu(IV). В умеренно концентрированных азотной или серной кислотах применяют фосфат висмута в качестве коллектора для Pu(III) и Pu(IV).
Комплексообразующая способность ионов плутония, уменьшается в ряду Pu4+ > PuO2+ > Pu3+ > РиО+. В этой последовательности ослабевает также координация молекул типа трибутилфосфата, теноилтрифторацетона и три-н-октиламина * [25],
* Три-н-октиламин указан здесь напрасно, так как он обычно не координируется непосредственно плутонием, а образует ионные пары с ацидо-ком-плексными анионами, содержащими плутоний. — Прим. ред.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
347
применяемых для экстракции комплексов плутония из кислых растворов. Большое значение имеет экстракция Ри4+ в системе ТВР — HNO3 в виде Pu(NOs)4 • 2ТБФ [26, 27]. Если растворитель координируется слабее, как, например, в случае диэтилового эфира и гексона (применяемых для аналитического разделения [27]), то последовательность принимает вид Pu(VI) > Pu(lV) »Pu(IH) > Pu(V) [28]. Коэффициенты распределения часто повышаются при высаливании.
Аналитически полезное выделение плутония можно осуществить методом ионного обмена. Для этого можно применять ка-тионообменники, используя соляную кислоту для последовательного вымывания металлов в виде хлоридных комплексов, или анионообменную смолу для адсорбции анионных хлоридных и нитратных комплексов с последующим их восстановлением и вымыванием. Так, адсорбированный на анионообменной колонке из 12 М НС1 Pu(IV) при пропускании смеси 12 М НС1—-0,25 М HI восстанавливается до Pu(III) и вымывается из колонки [30]. Аналитическая химия плутония значительно осложняется разнообразием элементов, получающихся в результате процессов деления ядер. Для выделения Pu из таких систем был использован анионный обмен [31].
Окислительно-восстановительный потенциал пары Pu(III) — Pu(IV) в 1 М НС1 равен 0,97 в; в 1 М НС1О4—0,98 в и в 1 М H2SO4 — 0,75 в. Плутоний(III) можно титровать сульфатом церия (IV), используя в качестве индикатора комплекс железа (II) с 1, 10-фенантролином [32]. Для фотометрического определения плутония (IV) используют такие реагенты, как ализаринсульфо-нат натрия [33], который дает комплекс, имеющий при 530 ммк и pH 3 е=9870, торон (е = 11 000 при 540 ммк) [34] и арсеназо I [35], который образует комплекс 1:1с е=21 000 при 580 ммк в 0,1 М азотной кислоте. Pu(III) (при pH 5,5—6,5), Pu(IV) и Pu(VI) (при pH 8,5—9,5) также образуют с арсеназо I окрашенные комплексы. Ни один из этих реагентов не является достаточно избирательным, так что необходимо предварительное отделение мешающих ионов металлов, а также некоторых анионов.
ПОЛОНИЙ
Интенсивная a-радиация, возникающая при ядерном распаде полония, затрудняет изучение его химии. Полоний имеет металлический характер; инертность 6«2-электронов обычно не позволяет ему проявлять валентность выше четырех. Однако химические связи этого элемента сохраняют значительный ковалентный характер. Так что тетрагалогениды полония летучи выше 150° и растворяются в органических растворителях. Эти тетрагалогениды сильно напоминают аналогичные соединения теллура. Они
.348
ГЛАВА 13
образуются при растворении Р0О2 в галогеноводородных кислотах и легко образуют анионные комплексы типа РоВг2-, которые осаждаются в виде нерастворимых солей с крупными катионами, такими, как катион цезия и тетраэтиламмоний-ион. Двуокись полония имеет гораздо слабее выраженный кислотный характер, чем двуокись теллура. Полоний образует соли, например сульфат, нитрат, фосфат, оксалат и ацетат, а также ряд основных солей, напоминающих теллуровые аналоги.
Аналитическое применение органических реагентов для определения полония не было изучено.
ПРОТАКТИНИИ
Протактиний является первым членом актинидного ряда элементов, названных так потому, что они напоминают актиний. Актиниды, подобно лантанидам, существуют вследствие постепенного заполнения /-орбиталей (в данном случае 5/), которые во всех членах этого ряда (кроме первых) играют незначительную роль в образовании связи. Заполнение f-уровня заканчивается в No и Lr. Протактиний имеет электронную конфигурацию [Rn]5/26d‘7s2 или [Rn]5/‘6d27s2, и, поскольку энергии электронов 5/-, 6d-, 7s-, 7/7-орбиталей в этом атоме отличаются незначительно, может осуществляться ковалентная гибридная связь с участием 5/-электронов, что приводит к состояниям окисления IV и V. Pa(V) напоминает Nb(V) и Ta(V), но он более склонен к гидролизу. Анионные комплексы образуются с фторидами, хлоридами, нитратами, сульфатами, роданидами и цитратами; Pa(V) не образует простого катиона. При восстановлении сульфатом трехвалентного титана или амальгамой цинка образуется Ра (IV), который легко окисляется кислородом воздуха *.
РАДИИ
См. Кальций.
РЕНИЙ
Наиболее обычными валентными состояниями рения являются III, IV, V и VII. Комплексы Re(III) и Re(IV) обычно низкоспиновые. Окисел Re2O7 летуч, и его можно отогнать из сернокислых растворов. Соответствующую ему рениевую кислоту можно экстрагировать из кислых растворов бутиловым или изоамиловым спиртом. Анион этой кислоты ReO~ устойчив в водных растворах
* Для концентрирования протактиния предложено использовать экстракцию его с М-бензоил-Х-фенилгидрокспламином [ЖАХ, 19, 105 (1964)]. Арсеназо III дает с Pa(V) почти абсолютно селективную реакцию [7—8 н. H2SO4, s ~ 22 000, см. ЖАХ, 17, 471 (1962)]. — Прим, перев.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
349
и получается при окислении соединений рения сильными окислителями, например азотной кислотой или перекисью водорода; в растворах НВт и HI, наоборот, происходит восстановление ReO~. Растворимость солей перренат-иона напоминает растворимость перхлоратов. Например, в отличие от большинства соединений Re(VII), которые растворимы в воде, перренат тетрафениларсония нерастворим. Это позволяет отделять рений от молибдена—перренат тетрафениларсония экстрагируется хлороформом. Re(VII) обнаруживает сильное сродство к сере, и сероводород осаждает сульфид Re2S7 из 4—7 М НС1 или 3 М H2SO4 (в качестве коллектора можно использовать трехвалентный мышьяк). Аналогичным образом Re(VII) образует окрашенные комплексы с толуол-3,4-дитиолом и с 4-окси-З-меркаптотолуолом. При нагревании рениевой кислоты в 5—7 М НС1 с 2,4-дифенил-тиосемикарбазидом образуется красный экстрагирующийся хлороформом продукт. Его природа неизвестна.
Восстановление Re(VII) хлоридами двухвалентного олова или трехвалентного титана в присутствии тиомочевины или дифенилтиомочевины приводит к образованю окрашенных комплексов Re(V) типа КеОгЕ+. В присутствии роданид-иона хлорид двухвалентного олова восстанавливает кислые растворы рениевой кислоты с образованием желтого комплекса Re(V), который, возможно, имеет строение ReO(SCN)3 или ReO(SCN)" (ср. молибден). Комплекс экстрагируется диэтиловым эфиром.
Если вместо роданид-иона использовать диметилглиоксим (или, лучше, а-фурилдиоксим), то образуется красный экстрагирующийся хлороформом комплекс, содержащий, по-видимому, Re(IV) в виде ReOL2+. В горячей концентрированной соляной кислоте гидразин восстанавливает рениевую кислоту до комплексного иона Re(IV)—ReCl2~.. Если соответствующий иодидный комплекс Rel2“ обработать в метаноле цианидом калия, он дает устойчивый и растворимый в воде ион [Re(CN)g]3“, в то время как Тс12~ образует легко гидролизующийся в воде ион [Tc(CN)e]2“. Восстановление Re(VIII) в горячей ЮМ НС1 хлоридом двухвалентного хрома приводит к соединениям Re(III).
РОДИЙ
Родий не образует окси-анионов и окислов высших валентностей. Его химия связана главным образом с валентными состояниями III и IV, причем степень окисления III более устойчива. Комплексы как Rh(III), так и Rh(IV) обычно имеют октаэдрическое строение. Родий в виде NasRhCle можно отделить от палладия, платины и иридия, так как в отличие от этого комплекса сое
350
ГЛАВА 13
динения последних типа Na2MCle (M = Pd, Pt, Ir) растворимы в этаноле. Rh(H2O)3+ напоминает Co3+qH образует соли, например сульфат, перхлорат и хлорид, а также ряд амминов; родий является единственным элементом второго и третьего рядов переходных элементов, образующий характерный и вполне устойчивый трехзарядный катион. При подщелачивании растворов некоторых из этих солей, например Rh2(SO4)3- 14НгО, до pH более 6 осаждается гидратированная RI12O3- В некоторых случаях, например в Rh2(SO4)3 • 6Н2О, анион, по-видимому, координирован металлом. В слабокислых растворах соли Rh(III) гидролизуются, образуя гидроксо-комплексы.
Подобно кобальту, Rh(III) образует комплексы типа [M(CN)e]3~ и [M(NO2)6]3-, но не дает в отличие от кобальта комплексов [RhXe]3- и [RhX5 • НгО]2-, где Х = С1, Вг и SCN. Все комплексы и соли Rh(III) имеют низкоспиновый характер; вследствие того что они являются системами d6, наблюдаются высокие значения энергии стабилизации полем лигандов, особенно в случае таких лигандов, как CN-, этилендиамин и а, а'-дипиридил.
Будучи трехзарядным катионом, Rh3+ образует устойчивые комплексы с анионными лигандами. Типичными реагентами, применяемыми для его осаждения, являются 1-нитрозо-2-нафтол, 2-меркаптобензоксазол, 2-меркаптобензтиазол, тионалид и тио-барбитуровая кислота. Применение лигандов, связывающих металл через серу, а не через кислород, приводит к увеличению вклада поля лигандов в устойчивость комплексов.
Наиболее часто применяемый метод фотометрического определения родия, основанный на восстановлении Rh(III) хлоридом или иодидом двухвалентного олова, является эмпирическим, и природа продуктов реакции неизвестна. При нагревании Rh (III) в кислых растворах с 2-меркапто-4,5-диметилтиазолом развивается янтарно-красная окраска, вызванная, по-видимому, образованием комплекса Rh(II)—Rh(C4H6NSCS)2. Другие спектрофотометрические методы основаны на измерении окраски комплексов родия с 2-меркаптобензоксазолом и 1-нитрозо-2-нафтолом. Предложено также применять бис-комплекс с симм-дифенилкар-базоном в метаноле или в N, N-диметилформамиде [36].
РТУТЬ
Металлическая ртуть более устойчива к химическим воздействиям, чем цинк или кадмий (о чем свидетельствуют, в частности, значения ее первых двух потенциалов ионизации), что можно приписать химической инертности пары ее бя-электронов. Это объясняет, например, почему в парах ртуть одноатомна. Электронная конфигурация [Xe]4f145d10 в Hg2+ способствует значительному увеличению деформируемости катиона и проявле
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
351
нию им гораздо большей тенденции к образованию ковалентных связей. Так, диэтиловый эфир легко экстрагирует HgBr2 из воды и H2HgI4— из 6,9 М HI. В кислых растворах Hg(II) образует нерастворимый сульфид. В качестве методов определения Hg2+ было предложено использовать поглощение растворенного в изоамиловом спирте иодидного комплекса в ультрафиолетовой области и растворов роданидного комплекса в воде или бутиловом спирте. Алкалоиды типа стрихнина образуют нерастворимые иодомеркураты. Как и следует ожидать, Hg(II) образует очень прочные комплексы с сильно поляризующимися лигандами, обеспечивающими образование дативных связей. К реагентам, применяемым для фотометрического определения Hg(II), относятся дитизон, его ди-р-нафтильный аналог и дифенилкарбазон. Так, Hg(II) образует очень устойчивый оранжевый фоточувствитель-ный комплекс с дитизоном, экстрагирующийся из 1 н. растворов кислот хлороформом или четыреххлористым углеродом. С другой стороны, при использовании EDTA и роданид-иона в качестве маскирующих реагентов реакцию можно выполнять в ацетатных буферных растворах. Для проверки спектрофотометрических измерений дитизоновый комплекс Hg(II) в органическом растворителе можно затем легко разрушить, встряхивая экстракт с 6%-ным раствором KI в буферной смеси с pH 4: константа устойчивости Hgl2~ примерно равна 1030.
Образование комплексов иона Hg2+ обусловлено, возможно, смешением d г и s-орбиталей (с предоставлением электрона), что дает линейный комплекс типа Оз1—Hg—Hg—Юз. Таким же образом Оргел [14] объяснял образование линейных комплексов Cu(I). Во многих случаях соединения Hg2+ своей стабильностью обязаны, вероятно, нерастворимости в воде. Многие вещества, образующие ковалентно-связанные комплексы, смещают равновесие Hg2+^Hg + Hg2+ вправо (с диспропорционированием иона Hg2+); примерами могут служить цианид- и сульфид-ионы. Если связи имеют более ионный характер, как, например, в оксалатах, сукцинатах и пирофосфатах, преимущественно образуются комплексы Hg2+. Важную роль играет также координация Hg2+ атомами серы и азота; в качестве примеров можно указать нерастворимые комплексы с п-диметиламинобен-зилиденроданином, 4,4'-бис- (диметиламино) тиобензофеноном, тиобензофеноном и тиобензамидом, а также желтый дитизоновый комплекс, который можно экстрагировать из 1 н. кислоты.
При низких концентрациях ртуть можно выделить из раствора осаждением в виде сульфида с использованием Cd, Си или As в качестве коллекторов или соосаждением с теллуром в присутствии сильных восстановителей.
352
ГЛАВА 13
РУБИДИЙ
См. Натрий.
РУТЕНИЙ
Обычными валентными состояниями рутения являются II, III и IV, и его комплексы имеют преимущественно октаэдрическое строение. Состояние VIII осуществляется в летучем окисле RuO4, который образуется при нагревании кислых растворов соединений Ru с энергичными окислителями. Подобно OSO4, RuO4 экстрагируется из кислых сред четыреххлористым углеродом или хлороформом, тем самым позволяя выполнять удобное отделение Os и Ru от других металлов платиновой группы. Встряхивая экстракт с восстановителями типа сернистой кислоты, рутений можно перевести в водную фазу. Анионы RuO“ и RuO2- обнаруживают сходство с МпО~ и МпО2". Так, перрутенат-ион образуется при сплавлении соединений рутения с щелочами в присутствии окислителей, но в щелочных растворах более устойчив ру-тенат-ион. Ru(lV) образует комплексы, например RuX2- (где Х= =F, Cl, Вг), но они легко гидролизуются.
Большинство аналитически важных реакций рутения протекает с участием Ru(III). Несмотря на то что Ru(III) является б?5-системой, все его комплексы имеют низкоспиновый характер. Он образует прочные комплексы с легкополяризующимися лигандами типа аммиака, а также с анионами, особенно содержащими серу. Так, в сильносолянокислых растворах RuCls реагирует с однозарядными анионами тиомочевины и ее производных, в том числе с тиосемикарбазидами, образуя окрашенные соединения, например Ru(HNCSNH2)2+ и Ru(HNCSNH2)s. Окрашенные комплексы образует также дитиоксамид, а трис-комплекс с 2,4-дифе-нилтиосемикарбазидом экстрагируется хлороформом. Ru(III) образует окрашенные комплексы с галогенидами и роданид-ионом, а в слабокислых средах — с n-нитрозодиметиланилином, вероятно за счет координации по нитрозогруппе [ср. Pd(II) и Pt(II)]. Он взаимодействует с 8-оксихинолином, но образующийся комплекс не очень прочен, в связи с чем экстрагирующийся хлороформом трис-комплекс с оксином получают в ацетатных буферных растворах. Рутений(П), подобно его аналогу Fe(II), медленно присоединяет а,а'-дипиридил или 1, 10-фенантролин (если необходимо, то в присутствии восстановителя, например гидроксиламина) с образованием окрашенных низкоспиновых и кинетически инертных трис-комплексов.
СВИНЕЦ
Весьма значительная инертность 6«2-электронов иона РЬ2+ делает двухвалентное состояние свинца в его соединениях гораздо
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
353
более устойчивым, чем четырехвалентное. В связи с этим соединения типа тетраацетата свинца являются энергичными окислителями. Это свойство можно положить в основу косвенного метода определения РЬ, если измерять окраску, получающуюся при окислении соединениями Pb(IV) подходящих органических реагентов, например тетраметилдиаминодифенилметана. Pb(IV) гораздо менее амфотерен, чем Sn(IV), поэтому плюмбат-анион РЬ(ОН)2- образуется лишь в сильнощелочных растворах.
Электронная конфигурация Pb(II) [Xe]4f145d106s2 указывает, что он легко деформируется, даже если 6х2-электроны снижают степень образования обратной двойной связи между металлом и лигандом. Она также позволяет предположить, что РЬ(П) должен образовывать наиболее устойчивые комплексы с сильнополя-ризующимися лигандами. Это подтверждается на практике. Так, РЬ(П) лишь слабо взаимодействует с купферроном в 0,01 М азотной кислоте, а при экстракции свинца в виде его дитизоната хлороформом или четыреххлористым углеродом из водных щелочных сред могут присутствовать содержащие кислород анионы типа цитратов или тартратов. Снижение степени обратного связывания и отсутствие в комплексах РЬ(П) стабилизации полем лигандов объясняют, почему для маскирования меди можно добавлять цианид-ионы [образуются цианидные комплексы Cu (I) ], не создавая помех для экстракции свинца в виде дитизоната. В общем комплексы РЬ(П) менее устойчивы, чем комплексы Cu(II), и его дитизонат диссоциирует в разбавленных растворах минеральных кислот. Аналогичным образом диэтилдитиокарбамат свинца, экстрагирующийся из цитратного буферного раствора с pH 7 смесью амиловый спирт—толуол, разлагается при встряхивании с 0,5 М НС1. Однако комплекс свинца с диэтилдитиокарбаматом диэтиламмония можно экстрагировать хлороформом из 1,5—2 М НС1.
За исключением нитрата и ацетата, большинство солей РЬ(П) нерастворимо в воде, в связи с чем отделение его от других металлов не представляет затруднений. Из слабокислых растворов свинец можно осадить в виде сульфида (используя в качестве коллекторов, если это необходимо, Cu, Fe или Ag), в виде сульфата (с Sr в качестве коллектора), в виде карбоната или фосфата (в качестве коллектора применяется Са).
СЕЛЕН
Электроотрицательность селена гораздо меньше электроотрицательности кислорода, поэтому он образует главным образом ковалентные связи.
Химические свойства серы и селена очень похожи. Так, наиболее важными валентными состояниями селена являются IV и
23 Д. Перрин
354
ГЛАВА 13
VI, а при действии сильных восстановителей получается летучий HzSe.
Окислители, например азотная кислота и бром, переводят селен в летучий окисел SeOz, легко растворимый в воде с образованием селенистой кислоты О5е(ОН)г. Эта кислота является умеренно сильным окислителем; восстанавливается с осаждением селена такими реагентами, как сульфат Fe(II), хлорид Sn(II), гидразин и глюкоза. Под действием более энергичных окислителей селенистая кислота превращается в селеновую кислоту и селенат-ион SeO2-. Селеновая кислота сравнима по своей силе с серной кислотой и восстанавливается труднее, чем SeOa-
СЕРА
Принимая два электрона, сера может приобрести электронную конфигурацию аргона, однако получающийся двухзарядный анион настолько велик (радиус 1,84 А), что он очень легко поляризуется катионами с образованием ковалентной связи, особенно если сами катионы легко деформируются. Сравнивая ионы О2- и S2-, следует отметить, что меньший радиус первого из них будет приводить к более сильному ионному связыванию с «жесткими» катионами типа Na+, Mg2+ и А13+, а электронодонорные свойства будут больше у S2-; поэтому с металлами кислород будет образовывать связи более ионные, а сера — более ковалентные. Это справедливо также в отношении кислорода и серы в их нейтральных соединениях типа простых эфиров и тиоэфиров. В благоприятных условиях вакантные Зй-орбитали серы, вероятно, обладают энергией, достаточно низкой, чтобы возможно было некоторое «обратное связывание» за счет передачи на эти орбитали электронов от атомов металлов с заполненными или почти заполненными d-уровнями. Кратные связи могут быть также результатом dn—рл-взаимодействия между кислородом и серой, как в случае SO2-. Использование d-орбиталей объясняет причину того, что сера может образовывать шесть координационных связей, как в SFe. Однако это координационное число не является обычным для серы, поскольку энергия, требующаяся для перевода атома серы из основного состояния [Ne]3s23p4 в состояние [NeJSs^p^d2, обычно слишком велика и не компенсируется энергией образования шести связей.
Восстановительная способность сульфит-иона объясняется той легкостью, с которой сера присоединяет еще один атом кислорода, чтобы завершить тетраэдрическое размещение восьми 3s- и Зр-электронов (электроны распределены попарно). Вместо атомов кислорода в такой координации могут участвовать атомы серы с образованием иона SaO2~ (аналогичного SO2-, но менее устойчивого) и других, содержащих два или большее число атомов
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
355
серы. Крупные анионы типа SO2- обладают сравнительно слабой комплексообразующей способностью по отношению к ионам металлов, но из-за наличия периферийных атомов серы это свойство заметно проявлено в анионах типа S2O2- при взаимодействии с такими катионами, как.Си2+.
Сера образует довольно слабые водородные связи, поэтому растворимость в воде лигандов, содержащих серу, и комплексов меньше растворимости соответствующих кислородсодержащих соединений.
Разработка аналитической химии серусодержащих соединений до некоторой степени облегчается легкостью изменения валентных состояний серы, например восстановления сульфата до сульфида, окисления сульфида до серы или сульфида до сульфата. Поэтому эффективный метод определения, например, сульфида можно использовать для определения сульфата. Окислительно-восстановительные свойства серы можно положить в основу и качественных испытаний, и количественных методов.
'i
СЕРЕБРО
Серебро обычно бывает одновалентным, но в комплексах известны Ag(II) и Ag(III). Ag+ имеет электронную конфигурацию d10, поэтому комплексообразование протекает преимущественно с поляризующимися лигандами, особенно в тех случаях, когда может возникнуть обратная связь. Например, именно по этой причине устойчивость комплексов Ag(I), подобно комплексам Cu(I), уменьшается в порядке: I > Br > Cl > F. Возможно, вследствие гибридизации d г2—s-орбиталей с предоставлением электрона, как и в случае Cu(I), предпочтительное координационное число Ag(I) в его комплексах равно 2, что приводит к линейной конфигурации. В связи с этим хелатообразующие агенты вынуждены создавать полиядерные комплексы. Невыгодная стереохимия и тот факт, что связи образуются за счет карбокси-групп, объясняют непрочность комплекса серебра с EDTA, благодаря чему EDTA является хорошим маскирующим реагентом при определении серебра. И наоборот, применение n-диметил- и /г-диэтилами-нобензилиденроданина в качестве осадителей серебра (гл. 9) становится возможным благодаря образованию линейных комплексов, в которых связь имеет преимущественно ковалентный характер. То же можно сказать об аналогичном случае использования 2-тио-5-кето-4-карбэтокси-1,3-дигидропиримидина и фор-мазилкарбоновой кислоты. Однако вследствие сильного л-акцеп-торного характера последнего лиганда его комплекс с Ag(I), вероятно, имеет тетраэдрическую конфигурацию. Это также справедливо и для комплекса серебра с дитизоном, который в отсутствие больших количеств галогенидов экстрагируется из сильно
23*
356
ГЛАВА 13
кислых растворов четыреххлористым углеродом, а также для комплекса серебра с дитио-р-изоиндиго, экстрагирующегося бутиловым спиртом. Оба эти комплекса используются в фотометрических методах определения серебра.
Серебро соосаждается с теллуром, хлоридом Hg(I) и в виде сульфида с сульфидами меди и двухвалентной ртути (так же как и палладий). Оно образует нерастворимые соли с галогенидами, цианидом и роданидом, которые растворяются в присутствии избытка комплексообразующих веществ с образованием анионных комплексов. Ag(I) образует также катионные комплексы с моноаминами.
Комплексы Ag(II), по-видимому, являются плоскими квадратными и изоморфными аналогичным комплексам Cu(II). В качестве примера можно привести [Agpy4]2+, [Ag(bipy)2]2+ и [Ag(o-phen)2]2+, образующиеся при окислении Ag+ персульфатом в присутствии соответствующего лиганда. В тех же условиях образуется комплекс Ag(III) с этилендибигуанидином состава 1:1.
СКАНДИЙ
Скандий образует соли и комплексы только в трехвалентном состоянии. Ион Sc3+ имеет электронную конфигурацию аргона, а его радиус лишь немногим меньше радиусов последних членов группы лантанидов, которых он весьма напоминает по своим химическим свойствам. Этот элемент обладает более основными свойствами, чем алюминий, но менее основными, чем лантаниды, в связи с чем он образует гидратированную окись Sc2O3(H2O)x, а также ScO(OH), но не Sc(OH)3. Гидрат окиси скандия при помощи аммиака можно соосадить с гидроокисью кобальта. Используя большую склонность скандия к образованию комплексов, в том числе Sc(NCS)3 (экстрагирующего эфиром), его можно отделить от лантанидов. Аналогичное отделение можно произвести экстракцией скандия в виде хлоридных комплексов трибутилфосфатом из сильно солянокислых растворов. Скандий отличается от трехвалентных лантанидов способностью образовывать в растворе сульфата калия нерастворимый двойной сульфат. Трифторид скандия ScF3 нерастворим в воде, но растворяется в присутствии избытка фторид-иона с образованием ScF3~. Скандий можно также отделить от алюминия осаждением в виде трискомплекса с 8-оксихинальдином; в отличие от алюминия ион скандия достаточно крупный, чтобы допустить образование трискомплекса без чрезмерного пространственного взаимодействия между лигандами. Соответствующий комплекс его с 8-оксихинолином, осаждающийся из почти нейтральных растворов, экстрагируется хлороформом или бензолом. Концентрацию скандия в экстракте можно определить фотометрически в ультрафиолетовой области спектра.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ 357
В соответствии со своей природой Sc3+ образует наиболее прочные комплексы с содержащими кислород анионными лигандами. Так, его трис-комплекс с теноилтрифторацетоном экстрагируется при pH 1,5—2,0 бензолом, содержащим избыток лиганда. По этой же причине реагентами для фотометрического определения скандия служат соединения, образующие лаки, типа ализаринового красного S и хинализарина. Комплекс с хинализарином экстрагируется изоамиловым спиртом. В качестве фотометрических реагентов на скандий были предложены также кверцетин и антраруфин-2,6-дисульфокислота [37].
Аналогичное соединение, морин, используют во флуориметри-ческом методе определения скандия. Эти реагенты очень неизбирательны. Поэтому многое зависит от эффективности предварительного отделения скандия от других металлов, например при помощи ионного обмена.
СТРОНЦИИ
См. Кальций.
СУРЬМА
Сурьма обладает более основными свойствами, чем мышьяк, несмотря на то что ЭЬгОз растворяется в щелочных растворах с образованием антимонат (V)-иона. Вследствие «инертности» ее 5х2-электронов сурьма обычно трехвалентна. Известны главным образом соли антимонил-иона SbO+, но также и соли Sb3+.
Электронная конфигурация сурьмы ([Kr]4d105s25p3) способствует образованию ковалентных связей, так что при пропускании сероводорода через кислый раствор осаждается ЭЬгЗз. (Если присутствуют лишь незначительные количества Sb(III), то в качестве коллектора можно использовать сульфид меди.) Однако Sb3+ легко образует комплексы с содержащими кислород лигандами, давая анионы типа [Sb(SO4)2]~, [Sb(C2O4)2]_ и [5Ь(ОН)2С4Н4Об]- (антимонилтартрат-ион) и — в нейтральных или слабощелочных растворах — нейтральные молекулы типа CLXXVI.
CLXXV1
Ограниченная растворимость комплекса сурьмы с пирогаллолом обусловлена, вероятно, образованием полиядерного комп
358
ГЛАВА 13
лекса вследствие того, что не связанная в CLXXVI окси-группа способна координироваться с другим атомом сурьмы. (Структура, включающая связь всех трех атомов кислорода пирогаллола с одним атомом сурьмы, стерически невозможна.) Аналогичные нейтральные соединения образует висмут.
В присутствии сильных окислителей, например Ce(IV), в концентрированной соляной кислоте Sb(V) образует анионный комплекс, сильно поглощаемый анионообменной смолой, что позволяет отделить Sb от металлов типа РЬ. Этот хлороантимонат-ион образует нерастворимые в воде ионные пары, экстрагирующиеся органическими растворителями, с крупными основаниями, в частности с метиловым фиолетовым, родамином В, бриллиантовым зеленым и антрахинон-1-азо-4-диметиланилином. Аналогичным образом иодантимонат-ион реагирует с пиридинием и три-фенилметиларсонием. Эти ионные пары применяют при фотометрических определениях.
Нейтральный хлоридный комплекс сурьмы (V) можно экстрагировать содержащими кислород растворителями из сильно солянокислых сред (например, диизопропиловым эфиром из 6,5— 8,5 М НС1). В этих условиях Sb (III) экстрагируется довольно слабо. Бромидные комплексы Sb(V) и Sb (III) в 4,5 М НВг по своим экстракционным свойствам напоминают хлоридные комплексы. С другой стороны, Sb (III) количественно экстрагируется диэтиловым эфиром из 6,9 Л4 HI в виде иодантимонит-иона, имеющего интенсивно желтую окраску; Sbh может также экстрагироваться бензолом из 5 М H2SO4, содержащей примерно 0,01 М иодида и восстановитель.
ТАЛЛИЙ
В водных растворах состояние Т1 (I) гораздо более устойчиво, чем Т1(Ш). Т1+ напоминает Rb+, который имеет близкий ионный радиус, способностью образовывать растворимое в воде сильное основание, а также некоторыми солями, изоморфными солям щелочных металлов. Обладая электронной конфигурацией [Xe]4f145d106s2, Т1+ гораздо легче деформируется и во многих отношениях больше напоминает Ag+. Однако в комплексах серебра большое значение имеет образование дативной связи, а «инертная пара» 68-электронов Т1(1), ответственных за низковалентное состояние, значительно уменьшает тенденцию 5б/-электронов Т1+ в его комплексах переходить на подходящие орбитали лигандов с образованием дативной связи. Именно поэтому Т1 (I) образует, например, гораздо менее прочные, чем Ag(I), комплексы с циа-нид-ионом, а сульфид таллия (I) можно осадить только из нейтральных и аммиачных растворов (в то время как сульфид серебра осаждается из кислых сред). Аналогичным образом для экстракции четыреххлористым углеродом комплекса Т1 (I) с дити
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
359
зоном и для образования его нерастворимого комплекса с тионалидом необходима слабощелочная среда (pH 9—12). Избирательность последней реакции можно повысить, применяя в качестве маскирующих агентов цианид- и тартрат-ионы. С содержащими кислород анионными лигандами Т1 (I) связывается слабо. По этой причине для экстракционного выделения других металлов из растворов Т1 (I) можно использовать комплексообразующие вещества типа купферрона, 8-оксихинолина и диэтилдитиокарбамата *.
При добавлении к солянокислым растворам одновалентного таллия бромной или хлорной воды Т1 (I) окисляется до Т1(Ш). Трехвалентный таллий является мягким окислителем. Он восстанавливается иодид-ионами до Т1 (I); его можно также определить фотометрически по продуктам окисления, которые он дает с азопроизводными хромотроповой кислоты и с н-аминофенолом. Т1(Ш) легко экстрагируется (вероятно, в виде НТ1СЦ) из сильно солянокислых растворов содержащими кислород органическими растворителями, в частности диизопропиловым эфиром. В этих же условиях TI (I) экстрагируется лишь частично. Хорошая экстракция Т1(Ш) из 0,1 — 1 М растворов НВг диэтиловым эфиром позволяет отделять его от Fe(III) и большинства других металлов, кроме Au(III). В отличие от хлоридных комплексов бромидные комплексы TI (I) количественно экстрагируются диэтиловым эфиром из 1—4 М растворов НВг. Иодидные комплексы Т1(1) и Т1(Ш) также экстрагируются диэтиловым эфиром из 0,5—2,5 М HI. Ионные пары Т1С1“ с n-диметиламиноазобензолом и метиловым оранжевым нерастворимы. Соответствующие ионные пары с родамином В, метиловым фиолетовым и малахитовым зеленым тоже нерастворимы в воде, но экстрагируются неполярными органическими растворителями, например бензолом. Поэтому они находят применение в фотометрических методах определения таллия. Экстрагирующиеся амилацетатом ионные пары Т1Вг“ с метиловым фиолетовым и бриллиантовым зеленым также были использованы для этих целей.
ТАНТАЛ
Химические свойства тантала и ниобия очень близки, за исключением того, что соединения тантала обладают более слабым кислотным характером. Соединения тантала даже в кислых средах легко подвергаются гидролизу с образованием нерастворимой Та2О5(Н2О)ж, которая растворяется в сильных основаниях с образованием «танталатов», а во фтористоводородной
* Диэтилдитиокарбамат образует связи через атомы серы, поэтому в данном случае он указан, очевидно, случайно. — Прим. ред.
360
ГЛАВА 13
кислоте— с образованием фторидных комплексов TaF3- и TaF3“. Оксо-комплексы, соответствующие NbOF3- и NbOF3~, не были описаны, однако известны ковалентные ТаООз и ТаОВгз. Комплексы тантала легче, чем комплексы ниобия, экстрагируются органическими растворителями типа диизопропилкетона.
Подобно ниобию, тантал образует растворимые комплексы с тартратами и дает окрашенные комплексы с такими реагентами, как морин, пирогаллол, галловая кислота и производные флуорона. Все эти реагенты содержат вицинальные фенольные группы. Недавно к этому списку были добавлены арсеназо I [38], 2,3,7-триокси-9-фенил-6-флуорон [39] и кверцетин [40]. Тантал можно отделить от ниобия путем избирательной экстракции бутиловым спиртом его комплексов с пирокатехином, образованных при pH 3 в присутствии оксалата.
Галогенидные комплексы тантала образуют окрашенные осадки с родамином В, бриллиантовым зеленым, гентизиновым фиолетовым (gentian violett) и метиленовым голубым. По-видимому, эти комплексы можно экстрагировать органическими растворителями и использовать в качестве основы фотометрических методов, подобно описанной недавно экстракции бензолом ионной пары метиловый фиолетовый — фторид тантала [41].
ТЕЛЛУР
Теллур обладает более характерными металлическими свойствами, чем селен, и обнаруживает слабые основные и кислотные свойства. Его окись ТеО2 отличается менее выраженным кислотным характером по сравнению с SeO2, хотя она и образует растворимые соли с гидроокисями щелочных металлов. Она также легче восстанавливается до элемента. Теллуровая кислота Те(ОН)6 является очень слабой кислотой; ее получают при окислении Те или ТеО2 сильными окислителями, например хромовой кислотой. Теллур также образует анионные комплексы типа ТеВг3-, где он четырехвалентен; эти комплексы получают реакцией ТеО2 с соответствующей галоидоводородной кислотой. Обычное координационное число теллура в его комплексах равно 6.
ТЕХНЕЦИИ
Технецкий напоминает марганец, но повышенная устойчивость высших валентных состояний, наблюдаемая по мере возрастания порядкового номера элементов в группе периодической таблицы, приводит к тому, что в данном случае наиболее важными валентностями являются IV и VII. Технеций выделяют из радиоактивных сбросов, содержащих продукты деления; соосаждают пертех
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
361
нетат тетрафениларсония (Ph4As)TcO4 с соответствующим перхлоратом в качестве носителя и последующим растворением в спирте и отделением на анионообменной колонке. Окись ТС2О7 летуча, поэтому упариванием кислотного раствора, содержащего ТсО~, можно отделить ее от рения. Технециевая кислота и пертехнетаты образуются в растворе при окислении соединений технеция сильными окислителями, например азотной кислотой или перекисью водорода. Подобно ReO“, ТсО“ восстанавливается НС1, НВг и HI. Технециевая кислота является сильной кислотой, и растворимость ее солей подобна растворимости перхлоратов.
Tc(V) можно определить в виде его роданидного комплекса [42], чем он напоминает соседний с ним молибден, а Тс(VII) образует прочные комплексы с тиогликолевой кислотой [43] и толуол-3,4-дитиолом [43а].
ТИТАН
Обычная валентность титана равна IV, а соединения Ti (IV) имеют преимущественно ковалентный характер. Так, TiCl4 представляет собой жидкость, которую можно перегонять и которая легко гидролизуется водой. Ион Ti4^ неизвестен. Вместо него в водных растворах существуют гидролизованные формы, например Ti(OH)+3, или — в присутствии высоких концентраций лигандов — анионные комплексы типа TiF|~ и TiCl26_. Добавление к растворам Ti (IV) гидроокиси натрия приводит к осаждению гидроокиси Ti(OH)4. Энергичные восстановители переводят Ti(IV) в Ti(III), причем ион [Ti(H2O)e]3+ хорошо известен и обладает гораздо более основными свойствами, чем Ti(IV).
Из-за отсутствия d-электронов Ti (IV) образует свои наиболее устойчивые комплексы с содержащими кислород анионными лигандами. Его желтый купферронат, осаждающийся из разбавленной кислоты, можно экстрагировать хлороформом. Реагенты, применяемые для фотометрического определения Ti(IV), имеют фенольный характер; к ним относятся следующие соединения, образующие желтые или оранжево-красные продукты: ализариновый красный S, хромотроповая кислота, 1, 8-диоксинафталин, фе-нилфлуорон, пирокатехин, сульфосалициловая кислота и тайрон. В ряде случаев вследствие ступенчатой природы комплексообразования окраска зависит от значения pH среды, причем высшие комплексы образуются при наименьшей кислотности растворов. Титан реагирует с аскорбиновой кислотой, образуя желтый комплекс: реакция неспецифична, и, как правило, необходимо предварительное отделение, например при помощи ионного обмена [45]. Комплекс титана с сульфосалициловой кислотой образует ионную пару с катионом трибутиламина, экстрагирующуюся хлорофор
362
ГЛАВА 13
мом. В кислой среде Ti (IV) дает желтую окраску с перекисью водорода; эту реакцию, хотя и менее чувствительную, часто используют для определения титана *.
ТОРИИ
Единственным состоянием тория, важным для его химии, является четырехвалентное. Th4+ имеет электронную конфигурацию инертного газа радона. В комплексах торий обнаруживает координационное число 8, как, например, в его тетракис-ацетилацето-нате, имеющем структуру квадратной антипризмы. С сильными минеральными кислотами Th4+ образует соли, но при pH выше ~3 соли гидролизуются с образованием полиядерных соединений, содержащих гидроксо- и оксо-мостики. Его гидроокись осаждается аммиаком или гексаметилендиамином (при pH ~5), причем в качестве коллекторов можно использовать гидроокиси алюминия или Fe(III). Для отделения тория от других элементов можно использовать тот факт, что его фторид, иодат, оксалат и фосфат нерастворимы даже в сильнокислых средах. Хорошо растворимый в воде нитрат тория растворяется также в содержащих кислород растворителях, в частности в спиртах, сложных эфирах, простых эфирах и кетонах. Из азотнокислых сред торий можно экстрагировать трибутилфосфатом, теноилтрифторацетоном в четыреххлористом углероде, циклогексаноном, окисью мезитила, метилизобутилкетоном и аналогичными растворителями, особенно в присутствии нитратов лития и других сильно гидратированных катионов. Растворитель координируется нитратным комплексом тория ’**. Нежелательное влияние многих комплексообразующих веществ можно избежать добавлением избытка нитрата алюминия.
Наиболее прочные комплексы торий дает с полианионными содержащими кислород лигандами, обычно когда образуются би-дентатные внутрикомплексные соединения. В качестве примеров таких реагентов, применяемых для фотометрического определения тория, можно назвать морин (дающий в слабокислых растворах бис-комплекс), ализариновый красный S, кверцетин, хинализарин и пирокатехиновый фиолетовый. Торон [1-(2-арсо-нофенилазо)-2-нафтол-3,6-дисульфокислота] и о-арсонофенил-азохромотроповая кислота, по-видимому, образуют с торием тет-радентатные комплексы; это достигается за счет участия в координации двух атомов кислорода двухзарядного аниона арсоно-
* Лучшим реагентом для спектрофотометрического определения титана в настоящее время является диантипирилметан, позволяющий выполнять реакцию в 3 и. НС1 (е~60 000). — Прим, перев.
** Теноилтрифторацетон образует внутрикомплексное соединение и этим отличается от всех перечисленных экстрагентов. — Прим. ред.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
363
группы, фенольного атома кислорода и азота азо-группы. Вследствие повышенной прочности таких структур соответствующие комплексы могут образовываться в довольно кислых растворах, благодаря чему улучшается избирательность определения. Чувствительным и избирательным реагентом для тория является также арсеназо (неоторон) [44]*. Для определения тория были предложены и реагенты других типов, такие, как нитрозо-К-соль, 8-оксихинолин и индоксин; несмотря на это, теоретическое рассмотрение позволяет предположить, что они, вероятно, будут менее удачными **.
УРАН
Соединения урана в водных растворах могут существовать в трех характерных валентных состояниях — U(III), U(IV) и U (VI), из которых наиболее важным является U(VI). Для этого элемента часто характерны процессы комплексообразования и гидролиза, причем последний усиливается в ряду U3+ < UO2+ < < U4+. Уран ([RnJS^Gd^s2) напоминает редкоземельные элементы. Поэтому с реагентами, содержащими кислород, например с цитрат- и тартрат-ионами, ацетилацетоном и теноилтрифторацетоном он образует (обычно в виде UO2+) более прочные комплексы, чем с лигандами, содержащими азот. Энергия, необходимая для перемещения электрона с 5[- на 6с!-орбиталь урана, соизмерима с энергиями образования химических связей, поэтому 5/-электроны могут принимать участие в комплексообразовании.
Соединения урана в перлах солей (особенно фторидов) обладает очень чувствительной флуоресценцией. В присутствии ионов алюминия и трехвалентного железа в качестве коллекторов уран (VI) осаждается аммиаком или фосфат-ионом. За этими исключениями, в химии урана доминирует комплексообразование. Так, уран(VI) дает растворимые комплексы с избытком карбо-нат-иона, в то время как многие другие металлы осаждаются. Уранил-ион образует комплексы с нитрат-ионом, которые легко экстрагируются органическими содержащими кислород растворителями, способными координироваться с UO2+ в качестве моно-дентатных лигандов. К таким растворителям относятся диалкил-эфиры, кетоны, сложные эфиры, триалкилфосфаты (координирующиеся своей фосфорильной группой Р->0) и окиси триалкилфосфина. Факторами, влияющими на выбор растворителя, служат низкая растворимость его в воде, относительно высокая диэлектрическая проницаемость, устойчивость и, в случае фосфорильных соединений, основность кислорода фосфорильной
* Арсеназо, неоторон и о-арсонобензолазохромотроповая кислота — один и тот же реагент (см. примечание на стр. 129). — Прим, перед.
** Наиболее чувствительную (е« 140 000) и избирательную реакцию с торием дает реагент арсеназо III. — Прим, перед.
364
ГЛАВА 13
группы. Экстракция U02+ улучшается при введении электронодонорных групп в молекулу фосфорорганического соединения. В некоторых случаях, например при применении трибутилфосфата, комплексообразование и экстракция протекают настолько эффективно, что для повышения избирательности необходимо использовать разбавители типа керосина. Следует также учитывать природу присутствующих анионов: диэтиловым эфиром в виде их хлоридов экстрагируются Fe(III) и А1 *, но не U(VI), в то время как в случае нитратов наблюдается обратное положение. При восстановлении уранильных комплексов в органических растворителях до U(IV) уран реэкстрагируется в водную фазу.
В сольватированном ионе UO2+ атомы кислород—уран—кислород лежат, видимо, на одной оси, а шесть лигандов (в том числе любые неорганические анионы) расположены вокруг урана в плоскости, перпендикулярной этой оси. В случае крупных молекул (в том числе трибутилфосфата) может оказаться невозможным размещение вокруг атома урана того числа органических лигандов, которое необходимо, чтобы полностью окружить его. Поэтому образуются комплексы типа иО2(ТВР)2(ПОз)г. Такая стереохимия не очень пригодна для координации EDTA, в результате чего комплексы UO2+—EDTA характеризуются небольшой константой устойчивости и при определении урана EDTA является удобным маскирующим реагентом для других катионов. Координационное число уранила объясняет легкость образования трис-комплексов с бидентатными лигандами типа гликолят-иона и аниона 8-оксихинолина. Прочность анионных комплексов, в том числе фторидных, позволяет удалять катионы, которые могут мешать определению урана, пропуская соответствующие растворы урана через катионообменную колонку. И наоборот, после осаждения фторид-иона мешающие анионы можно удалить анионным обменом.
В кислых средах осаждается комплекс купферрона с U(IV), но не с U(VI). Его можно экстрагировать диэтиловым эфиром или хлороформом. Мешающие элементы можно удалить экстракцией их купферронатов из раствора U(VI), который затем при помощи редуктора Джонса переводят в U(IV) и экстрагируют, принимая специальные меры, предотвращающие окисление. К другим соединениям, применяемым для экстракционного выделения урана, относятся внутрикомплексные соединения U(IV) и U (VI) с теноилтрифтор ацетоном и U(VI) с ацетилацетоном.
Уран дает окрашенные комплексы со многими органическими реагентами, но реакции эти не специфичны. Наиболее прочные
* Явная ошибка: алюминий ие экстрагируется в виде хлорида. — Прим. ред.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
365
комплексы, вероятно, образуются при связывании его соседними атомами кислорода, из которых по меньшей мере один является анионом. К таким реагентам относятся дибензоилметан, хромотроповая кислота, тайрон, салициловая кислота, сульфосалициловая кислота, ализариновый красный S, торон, морин и крезотино-вая кислота. Так, дибензоилметан в виде его однозарядного аниона образует с уранил-ионом желтый бис-комплекс с коэффициентом молярного поглощения примерно 20 000. В отсутствие хрома (VI) (если он присутствует, то его необходимо восстановить) и галогенидов, приводящих к экстракции других ионов, реакцию с дибензоилметаном можно сделать специфичной для урана, проводя предварительную его экстракцию. Для этой цели можно использовать, например, экстракцию метилизобутилкето-ном в виде тетрапропиламмонийтринитратного комплекса из умеренно кислых растворов, содержащих аммонийалюминийнитрат (для высаливания). Если к отделенной органической фазе добавлять раствор дибензоилметана в этанолпиридиновом буфере, то из немногих экстрагирующихся ионов окрашенный комплекс дает только UO2+ [46]. С другой стороны, в присутствии больших количеств урана можно непосредственно замерять окраску его тет-рапропйламмонийтринитратного комплекса.
Широко используемым реагентом на уран является роданид-ион, образующий желтые комплексы [UC>2CNS]+, UO2(CNS)2 и [UO2(CNS)s]_. Реакцию обычно выполняют в водном растворе. Азид-ион также образует с U(VI) желтые комплексы. Другой обычно используемой реакцией на уран (VI) является взаимодействие его с перекисью водорода, приводящее в щелочных средах к образованию желтых перуранатов.
Для спектрофотометрического определения урана был предложен ряд реагентов, в которых по меньшей мере одна связь металл—лиганд осуществляется не через кислород (хотя эти реагенты и кажутся менее избирательными). Их применение обычно требует отделения урана (VI) от ионов с большей реакционной способностью. К таким реагентам относятся арсеназо!(2-(2-арсо-нофенилазо)-1,8-диоксинафталин-З,6-дисульфокислота), 1-(2-пи-ридилазо)-2-нафтол (PAN), салицилгидроксамовая кислота, тиогликолевая кислота, салицилальдоксим, 8-оксихинолин, 1-нит-розо-2-нафтол и солохромовый прочный красный 3G 200 [47]. С ураном (VI) реагируют также диэтилдитиокарбамат- и бензил-фенилдитиокарбамат-ионы, образующие окрашенные и экстрагирующиеся органическими растворителями комплексы.
ФОСФОР
Фосфор, как и азот, образует соединения ковалентного характера. Однако доступность незаполненных Зй!-орбиталей для гибридизации дает фосфору возможность проявлять координацией-
366
ГЛАВА 13
ные числа вплоть до шести, как, например, в случае октаэдрического PF“ Наиболее важным классом соединений фосфора являются окислы и оксикислоты. В этих соединениях, а также в соединениях, где образуются Р—S-связи, возможно использование d-орбиталей фосфора для образования dn—ря-связей с атомом кислорода (или серы); при этом получаются многократные связи. Фосфор не обнаруживает никакой тенденции к образованию рп—рд-связей. Структура окислов и оксикислот фосфора характеризуется тетраэдрическим расположением атомов вокруг атома фосфора. За счет образования связей между атомом кислорода и двумя атомами фосфора эти ячейки объединяются в конденсированные фосфаты, которые могут быть линейными или циклическими.
ФТОР
Связь F—F в молекуле фтора слабее, чем аналогичные связи в молекулах других галогенов, поскольку ее меньшая длина приводит к большему отталкиванию между несвязывающими электронами. Такое отталкивание в случае других галогенов частично уменьшается за счет использования наружных вакантных d-орби-талей. Фтор является наиболее электроотрицательным и наиболее реакционноспособным из всех элементов. Его аналитическая химия почти целиком связана с фторид-ионом и с фтористым водородом. Вследствие того что фторид-ион меньше ионов других галогенов, фториды имеют в общем гораздо более ионный характер. Поэтому связь с катионами главных подгрупп I и II групп ослабляется в ряду F~ > Cl- > Br~ > I-, в то время как для катионов, более склонных к поляризации (например, Zn2+, Cd2+ и Hg2+), наблюдается обратный порядок. По сравнению с кислород- и азотсодержащими лигандами фториды обнаруживают гораздо меньшую тенденцию выступать в качестве доноров электронов. Не ясно, можно ли в качестве примера рассматривать водородную связь в бифторид-ионе [FHF]~. Возможно, ее следует объяснить исходя из допущения о сильных электростатических взаимодействиях или образованием двумя о-орбиталями фтора и ls-орбиталью водорода трехцентровых связей с двумя электронами на связывающей орбитали и с двумя — на несвязывающей. Основой почти всех фотометрических, флуориметрических, потенциометрических и объемных методов определения фторидов служит образование устойчивых или нерастворимых фторидных комплексов, которое приводит к диссоциации комплексов металлов с хромофорными неорганическими и органическими реагентами. Летучесть кремнефтористоводородной кислоты H2SiF6 имеет значение для отделения фторид-иона от мешающих веществ.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
367
ХЛОР
Присоединяя один электрон, хлор завершает свой наружный уровень и приобретает электронную конфигурацию инертного газа аргона. Это может быть достигнуто в результате образования аниона или ковалентной связи, как в случае TiCk. Далее, 3s- и Зр-электроны могут участвовать в образовании донорной связи с электронодефицитными веществами; возможно, кроме того, образование дативных связей за счет вакантных Зй-орбита-лей хлора. Поэтому хлорид-ион легко образует хлоридные комплексы со многими ионами металлов. Это может также привести к образованию атомами хлора «мостиков» в комплексах и к образованию полиядерных комплексов, особенно в случае металлов, имеющих заполненные или почти заполненные d-орбитали. Эти свойства хлора аналогичны свойствам брома, но выражены слабее. Поэтому хлориды однозарядных ионов Ag, Си, Hg, BiO и SbO растворимы не так плохо, как бромиды.
Можно полагать, что в окси-анионах СЮ-,. СЮ- и С1О~ и СЮ- связь осуществляется за счет перемещения электрона от хлора к кислороду одновременно с некоторым обратным связыванием ^„-электронов кислорода вакантными ^„-орбиталями хлора. Перхлорат-ион обладает очень небольшой склонностью к образованию комплексов с катионами.
ХРОМ
Относительная легкость, с которой хром может переходить в состояния окисления II, III и VI, в значительной мере упрощает химическое отделение его от многих элементов, которые могут мешать его определению. Так, окисление перекисью водорода или бромом Сг(Ш) до Cr(VI) в растворе гидроокиси натрия с последующим фильтрованием приводит к отделению многих металлов. Дальнейшего отделения (например, от А1 и U) можно достигнуть восстановлением Cr (VI) в растворе гидроокиси натрия и карбоната натрия с образованием нерастворимой Сг(ОН)з. Если присутствуют лишь незначительные количества хрома, их можно со-осадить с гидроокисью трехвалентного железа.
К соединениям Cr(VI) относятся СгОз,. СгО2- и Сг2О2- (все они обладают сильными окислительными свойствами) и летучий СгОгС12. Для прямого определения хрома используют поглощение СгО2- в щелочных растворах при 366 ммк. Наиболее чувствительной реакцией для определения хрома является реакция между Cr(VI) и си.юи-дифенилкарбазидом в кислой среде; однако природа образующего фиолетового катиона, способного экстрагироваться органическими растворителями, не известна.
368
ГЛАВА 13
Возможно, что он является соединением Сг(Ш) с дифенилкар-базоном *.
За исключением производных Cr(VI), имеющих тетраэдрическую конфигурацию, большинство комплексов Сг обладает октаэдрической структурой, искаженной в случае Сг(П) вследствие эффекта Яна—Теллера. Соединения Cr(II) (d4) получают электролитическим восстановлением соединений Сг(Ш) или восстановлением при помощи цинка. Они легко окисляются до Сг(Ш), например кислородом воздуха. Стабилизация в поле лигандов благоприятствует комплексообразованию с лигандами типа а, а'-дипиридила, этилендиамина, роданид- и цианид-ионов.
Комплексы Сг(Ш) весьма многочисленны и отличаются химической инертностью (системы d3), в связи с чем можно получить отдельные соединения типа [Сг(Н2О)в]Вгз и [Сг(Н2О)4Вг2]Вг • 2Н2О. Гидратированная окись Сг(Ш) амфотерна и образует в кислых средах Сг(Н2О)3+, а в щелочных растворах— хромиты (вероятно, Сг(ОН)3~). Комплексы Сг(Ш) легко образуют полиядерные формы, которые могут быть связаны мостиковыми гидроксо- или оксо-группами. Наиболее устойчивые комплексы Сг(Ш) образуются с лигандами, содержащими азот и серу [так же как и Сг(П)]. Однако в настоящее время они имеют незначительное аналитическое использование.
ЦЕЗИЙ
См. Натрий.
ЦЕРИЙ
См. Лантан.
ЦИНК
В своих солях и комплексах цинк существует только в двухвалентном состоянии, причем ион Zn2+ имеет электронную конфигурацию [Ar]3d10. Диффузный характер d-орбиталей делает Zn2+ легко деформируемым и способствует образованию прочных ковалентных комплексов с поляризующимися лигандами, например с аммиаком, аминами и цианид-ионом. При комплексообразовании цинка отсутствует стабилизация полем лигандов (цинк имеет заполненный d-уровень), поэтому наиболее прочные комплексы образуются, вероятно, с лигандами, допускающими возникновение обратной двойной связи. Значительно ковалентный характер связей в галогенидах цинка проявляется в том, что они растворимы в спирте, ацетоне и аналогичных растворителях. В хлорид-ных растворах цинк образует анионные комплексы, поэтому его можно отделять от других металлов при помощи анионообмен-
* В настоящее время это можно считать доказанным. — Прим. ред.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
369
ных смол. Благодаря образованию ионной пары раствор метил-диоктиламина в трихлорэтилене экстрагирует хлоридный комплекс цинка из 2 М НС1. Роданид цинка количественно экстрагируется диэтиловым эфиром из раствора 1—5 М по роданиду аммония и 0,5 М по соляной кислоте. При низких концентрациях роданида экстрагируется Zn(SCN)2, а при более высоких — (NH4)2Zn(SCN)4. При спектрофотометрическом определении цинка использовали аналогичное образование ионных пар между анионными роданидными комплексами цинка и рядом органических оснований, в том числе акридином, метиленовым голубым, пиридином и родамином В, обычно с последующей экстракцией несмешивающимися растворителями. Гидроокись цинка амфотерна и растворяется в щелочных растворах с образованием цинкат-ионов [Zn (ОН)з(Н2О)з]“ или [Zn (ОН)зН2О]~.
Отсутствие в комплексах цинка стабилизации полем лигандов означает, что стереохимия таких комплексов зависит только от размера и от электростатической и ковалентной составляющих связи. Комплексы цинка могут быть тетраэдрическими, как в случае [Zn(CN)4]2~, или октаэдрическими, например [Zn(NH3)e]2+.
С лигандами типа цитрата или тартрата, содержащими в качестве связывающих атомов лишь атомы кислорода, цинк образует сравнительно слабые комплексы. Почти все без исключения перспективные для цинка органические реагенты присоединяются к металлу при помощи атомов серы или азота (или одновременно того и другого). Так, наиболее важные в настоящее время реагенты дитизон и ди-Р-нафтилтиокарбазон, применяемые для экстракции цинка и его спектрофотометрического определения, образуют с ним внутрикомплексные соединения, связанные через серу и азот. Однако даже эти комплексы диссоциируют и реэкстрагируются из хлороформа и четыреххлористого углерода при встряхивании с разбавленными водными растворами кислот. Комплексообразование с цинконом включает, вероятно, присоединение к металлу двух атомов азота и двух анионных кислородов, что приводит к возникновению тетрадентатного комплекса. В комплексах цинка с 8-оксихинолином и индоксином, по-видимому, образуется дативная связь с (гетероциклическим) атомом азота. Это менее вероятно при использовании в качестве фотометрического реагента на цинк 1-амино-2-нафтол-4-сульфокис-лоты. Цинк также образует экстрагирующиеся комплексы с диэтилдитиокарбаматом натрия и диэтилдитиокарбаматом диэтил-аммония.
ЦИРКОНИЙ
Цирконий в своих комплексах четырехвалентен, а его гидратированная окись ZrO2(H2O)x нерастворима в щелочных растворах. Вследствие трудности удаления от металла четырех 24 Д- Перрин
370
ГЛАВА 13
электронов образуемые им связи обычно имеют заметный ковалентный характер; например, ZrCh возгоняется при 330° и дымит во влажном воздухе. Размер атома циркония допускает существование координационного числа вплоть до 8, как, например, в его тетракисацетилацетонатном и оксалатном комплексах. Частичный гидролиз соединений циркония приводит к образованию цирконил-иона ZrO2+ (который дает ряд кристаллических солей), а также других ионов [ZrO(OH)]+, [Zr(OH)3]+ и [Zr2O3p+. Zr4+ должен иметь электронную конфигурацию инертного газа криптона и, следовательно, не должен легко деформироваться (эффект значительно усиливается при увеличении формального заряда катиона). По этой причине цирконий образует свои наиболее прочные комплексы с кислородсодержащими и другими анионными лигандами, в частности с фторид-, сульфат- и фос-фат-ионами, которые дают скорее ионные, чем ковалентные связи. Получающиеся при этом ионы типа ZrF62- и [Zr(SC)^]4- растворимы в воде. Низкая растворимость фосфата цирконила в 1 н. соляной или серной кислотах позволяет отделять цирконий от других металлов.
При комплексообразовании циркония (обычно в виде ZrO2+) почти со всеми органическими реагентами образуются пяти- и шестичленные хелатные циклы, в которых металл связан с двумя атомами кислорода. В качестве примеров можно назвать купферрон, осаждающий цирконий из сильнокислых сред в виде экстрагирующегося хлороформом тетракис-комплекса, и теноилтри-фторацетон, образующий комплекс, экстрагирующийся ксилолом из 6 М соляной кислоты. Как и следует ожидать, очень прочные комплексы с цирконием образуют EDTA, тартрат- и цитрат-ионы. Хорошим осадителем циркония из кислых сред является п-диме-тиламиноазофениларсоновая кислота; в образовании связи металл—лиганд, по-видимому, принимают участие два атома кислорода арсоно-группы, причем возникает четырехчленный цикл. Другими эффективными осадителями для циркония служат миндальная кислота и ее n-хлор- и n-бромпроизводные, образующие с ним нерастворимые тетракис-комплексы, которые можно взвешивать или определять окислительным титрованием. Возможно, что каждый анион лиганда связан с металлом не только карбоксильной группой, но также спиртовым атомом кислорода (с образованием внутрикомплексного соединения). Фенольный кислород выступает в качестве активного атома и в реагентах, применяемых для спектрофотометрического определения циркония и образующих плохо растворимые сильно окрашенные лаки. К ним относятся ализариновый красный S, хлораниловая кислота, гематоксилин, морин (флуоресцентная реакция), фенилфлуорон, пурпурин, пирокатехиновый фиолетовый, кверцетин, SPADNS и торон.
АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
371
Химические свойства циркония и гафния настолько близки, что эти металлы определяют обычно вместе как «цирконий», если не используют физические методы, например дуговую или искровую эмиссионную спектроскопию. Однако недавно было предложено раздельно определять цирконий и гафний при помощи ксиленолового оранжевого или метилтимолового синего; после спектрофотометрического измерения в кислой среде суммы комплексов гафния и циркония для маскирования циркония добавляют перекись водорода [48]. Разработан аналитический метод разделения циркония и гафния в виде их сульфатных комплексов на анионообменной смоле [49] *.
ЛИТЕРАТУРА
1. Сен дел Е., Колориметрические методы определения следов металлов, «Мир», М., 1964.
2. Kraus К. A., Nelson F., Smith G. W., J. Phys. Chem., 58, 11 (1954). 3. Horton A. D., Thomason P. F., Anal. Chem., 28, 1326 (1956).
4. M a g n u s s о n L. B., Anderson M. L., J. Am. Chem. Soc., 76, 6207 (1954); Schneider R. A., Harmon К. M., U. S. At. Energy Comm. Rept., HW-53368 (1957).
5. C h о p p i n G. R., Harvey B. G., Thompson S. G., J. Inorg. Nuclear Chem., 2, 66 (1956).
6. Phillips G., Jenkins E. N., J. Inorg. Nuclear Chem., 4, 220 (1957); Smith H. L., Browne С. I., Hoffman D. C., Mize J. P., В u n-k e r M. E., J. Inorg. Nuclear Chem., 3, 93 (1956).
7. C a p e 1 1 e R., Anal. Chim. Acta, 24, 555 (1961).
8. Ceriotti G., Spandr io L., Clin. Chim. Acta, 6, 233 (1961).
9. Young J. P„ White J. C„ Ball R. G„ Anal. Chem., 32, 928 (1960). 10. Herrington J., Stead К. C., Anal. Chim. Acta, 22, 180 (1960).
11. Кутейников А. Ф., Ланской Г. А., ЖАХ, 14, 686 (1959).
12. S h i b a t a S., Anal. Chim. Acta, 28, 388 (1963).
13. Strickland J. D. H., Spicer G., Anal. Chim. Acta, 3, 543 (1949).
14. О r g e 1 L. E., J. Chem. Soc., 1958, 4186.
15. Спектры см. в работе: S job lorn R., Hundman J. C., J. Am. Chem. Soc., 73, 1744 (1951).
16. Roberts F. P., U. S. At. Energy Comm. Rept., HW-59032 (1959).
17. MooreF. L., Anal. Chem., 29, 941 (1957).
18. Murray B. B„ U. S. At. Energy Comm. Rept., DP-316 (1958).
19. Peppard D. F„ Mason G. W., Sironen R. J., J. Inorg. Nuclear Chem., 10, 117 (1959).
20. M a e c k W. J., В о о m a n G. L., Elliott M. С., В e i n J. E., Anal. Chem., 32, 605 (1960).
21. Bergstresser K. S., неопубликованная работа, Los Alamos Scientific Laboratory (1959).
* Перспективными реагентами для спектрофотометрического определения циркония являются арсеназо 111 и пикрамин Р. Первый позволяет определять цирконий в присутствии Си, Mo, Nb и V. Мешающее влияние оказывают Th, Ti, U(IV), редкоземельные элементы. В случае пикрамина Р мешают только Си и Nb. Влияние Си устраняют тиомочевиной, a Nb связывают перекисью водорода, в результате чего пикрамин Р позволяет выполнять определение циркония в присутствии по крайней мере 200-кратного избытка любого элемента, кроме гафния [ЖАХ, 20, 574 (1965)]. — Прим, перед.
24*
372
ГЛАВА 13
22. А л и м а р и н И. П., Золотов Ю. А., П а л ь ш и н Е. С., ДАН СССР, 124, 328 (1959).
23. М a j u m d а г А. К-, Mukherjee А. К., Anal. Chim. Acta, 21,245 (1959); 23, 246 (I960); Mo shier R. W., Schwarburg J. E., Anal. Chem., 29, 947 (1957).
24. Milner G. W. C„ Woodhead J. L„ Analyst, 81, 427 (1956).
25. К a d e r W. E., S h e p p a r d J. C., W i 1 s о n A. S., J. Inorg. Nuclear Chem., 12,327 (1960).
26. McKay H. A. C., Proc. Intern. Conf. Peaceful Uses At. Energy, Geneva, 1955, Paper 441, 7, 314 (1956); Nairn J. S., Collins D. A., McKay H. A. C., Maddock A. G., Proc. Intern. Conf. Peaceful Uses At. Energy, Geneva, 1958, Paper 1458, 17, 216 (1958).
27. Schneider R. A., Harmon К. M, U. S. At. Energy Comm. Rept., HW-53368 (1957).
28. О других экстракционных системах см. Stewart D. С., U. S. At. Energy Comm. Rept, CN-3905 (1945).
29. D i a m о n d R. M., Street K., S e a b о r g G. T., J. Am. Chem. Soc., 76, 1461 (1954).
30. Browne С. I., Hoffman D. C., Crane W. T., Balagna J. P., H i g g i n s G. H., В a r n e s J. W., Hoff R. W., Smith H. L., M i z e J. P., Bunker M. E., J. Inorg. Nuclear Chem., 1, 254 (1957); Hoffman D. C., “Plutonium”, in J. Kleinberg, “Collected Radiochemical Procedures”, U. S. At. Energy Comm. Rept., LA-1721 (1954), pp. Pu 1.
31. См., например, Ryan J. L., Wheelwright E. J., Proc. Intern. Conf. Peaceful Uses At. Energy, Geneva, 1958, Paper 1915, 17, 137 (1958).
32. Ashley R. W,, A 11 i s on G. M., At. Energy Can. Ltd., Chalk River Project Rept., PDB-19 (1951).
33. King G. L., U. S. At. Energy Comm. Rept., LA-1197 (1951).
34. H e a 1 у T. V., В г о w n P. E., At. Energy Research Estab. (Gt. Brit.) Rept., AERE C/R-1287 (1953); Powell R„ U. K. At. Energy Authority, Ind. Group Rept., IGO-AM/W-115 (1958).
35. О c k e n d e n D. W., U. K. At. Energy Authority, Ind. Group Rept., IGO-RW-2 (1956).
36. Ayres G. H., Johnson F. L., Anal. Chim. Acta, 23, 448 (1960).
37. Macdonald J. C., Yoe J. H., Anal. Chim. Acta, 28, 263 (1963).
38. Никитина E. И., ЖАХ, 13, 72 (1958).
39. Luke C. L„ Anal. Chem., 31, 904 (1959).
40. P о p a G., N e g о i u D., В a i u 1 e s c u G., Z. anal. Chem., 165, 16 (1959).
41. Лауэр P. С., Полуэктов H; С., Завод, лаб., 25, 903 (1959).
42. В oy d G. E., J. Chem. Ed., 36, 3 (1959).
43. Miller F. J., Thomason P. F., Anal. Chem., 32, 1429 (1960).
43a. Miller F. J., Thomason P. F., Anal. Chem., 33, 404 (1961).
44. Holcomb H. P., Yoe J. H., Microchem. J., 4, 463 (I960).
44a. R о s s W. J., W h i t e J. C., Anal. Chem., 33, 421 (1961).
45. Korkisch J., Arrhenius G., Kharkar D. P., Anal. Chim. Acta, 28, 270 (1963).
46. M a e c k W. J., В о о m a n G. L., Elliott M. C., Rein J. E., Anal. Chem., 31, 1130 (1959).
47. К о r k i s c h J., J an u er G. E., Anal. Chim. Acta, 25, 463 (1961).
48. Cheng K. L., Anal. Chim. Acta, 28, 41 (1963).
.49. Hague J. L., Ma chi an L. A., J. Res. Natl. Bur., Std, 65A, 75 (1961).
ГЛАВА 14
О поисках новых органических реагентов для неорганического анализа
Факторы, определяющие аналитическую эффективность химических реакций, при помощи которых открываемое или определяемое соединение переводится в более легко фиксируемую форму, обсуждал в своей книге Файгль [1]. На эти реакции влияют изменения температуры, pH, концентрации реагентов и присутствие других веществ, в том числе маскирующих агентов, поэтому при выполнении любой качественной пробы или количественного определения эти условия необходимо стандартизовать. Указанные условия часто серьезно меняют чувствительность, избирательность, специфичность (в качественном анализе) и полноту перевода элемента в определяемую форму. Современная химическая теория обеспечивает рациональную интерпретацию многих аналитических методов, приемов и реагентов. В свою очередь она позволяет предложить некоторые возможные пути разработки новых методов и улучшения реагентов. Представление о том, что избирательность действия многих органических соединений можно'объяснить присутствием в их молекулах особых атомных группировок, позволяет «конструировать» такие молекулы с целью повышения их полезности в химическом анализе. Так, введением соответствующих групп можно повысить или понизить растворимость, улучшить экстрагируемость или изменить окраску.
1. ОРГАНИЧЕСКИЕ РЕАГЕНТЫ ДЛЯ ИОНОВ МЕТАЛЛОВ
При выборе реагентов для обнаружения и определения ионов металлов необходимо учитывать природу реагентов и определяемых ионов.
Комплексообразующие группы реагентов
Потенциально полезное в качестве комплексообразующего реагента для ионов металлов соединение должно иметь достаточное число кислотных или основных групп, расположенных по возможности таким образом, чтобы обеспечить образование
374
ГЛАВА It
с ионами металла устойчивых пяти- или шестичленных хелатных циклов. В настоящее время к этим группам принадлежат главным образом следующие: —СОО~, фенольный —О-, —S-, >С=О, —N = O, —OR, —NH2, —NR2, ==N (гетероциклический), —CR = N—R, —N = N— и > C = S. Размеры атома серы и направления его орбиталей допускают возникновение четырехчленных циклов в случае комплексов, образуемых производными дитиокислот, как, например, в комплексах Ni и Си с диэтилди-тиокарбаминовой кислотой и в комплексе Ni с ксантогеновой кислотой. Аналогичные четырехчленные циклы образуются в некоторых комплексах карбоновых кислот, но они гораздо менее устойчивы.
При образовании полидентатных внутрикомплексных соединений предпочтительными атомами лиганда, связывающими между собой отдельные части комплексообразующего реагента, являются азот (как, например, в EDTA) и фосфор. Другие возможные атомы — будет ли это сера или кислород — обладают очень слабыми основными свойствами и лишь небольшой тенденцией к координации.
Один из путей повышения избирательности — создание лигандов, в которых координирующимися атомами были бы фосфор, сера, селен и мышьяк. При этом можно было бы ожидать, что в случае ионов низших валентностей переходных элементов и ионов металлов с заполненными с!10-уровнями будут образовываться более устойчивые комплексы и константы устойчивости будут различаться сильнее. Однако большинство таких хелатообразующих групп неустойчиво на воздухе или в воде, в связи с чем поиски в этом направлении, вероятно, ограничены. Так, простые меркаптаны легко окисляются, поэтому дитиол необходимо хранить в запаянных ампулах. Аналогично этому быстро разлагается и диэтилдитиокарбаминовая кислота. Однако последняя стабилизируется при переведении ее в соль щелочного металла, а дитиол устойчив в виде ковалентного комплекса с цинком. Возможно, что если таким же образом приготовить и другие аналогичные содержащие серу лиганды, то их использование в качестве реагентов могло бы приобрести практическое значение. Успешное развитие этого направления было бы облегчено, если бы имелась достаточная количественная информация о константах устойчивости комплексов металлов, например с 8-меркаптохинолином (который легко окисляется на воздухе, но образует нерастворимые комплексы с Со, Ni, Си, Pd, Pt и Ag [2]) и 8-оксихинолином.
Органический реагент, применяемый в реакции с неорганическим соединением, может быть и неустойчивым. Например, салицилальдегид и аммиак в присутствии солей Си, Ni, Со, Pd, Fe или Zn осаждают устойчивые внутрикомплексные соединения
О ПОИСКАХ НОВЫХ ОРГАНИЧЕСКИХ РЕАГЕНТОВ
375
шиффова основания—салицилимина, несмотря на то что последний сам по себе в водных растворах неустойчив. Эта реакция возможна потому, что комплексообразование смещает равновесие между салицилимином и продуктами его гидролиза — салицилальдегидом и аммиаком. Аналогичными свойствами обладают и другие о-оксиальдегиды и кетоны [3].
Природа иона металла
В данном случае основными факторами являются электронная структура иона, его размер, предпочтительная стереохимия и валентное состояние.
Склонность ионов металлов к преимущественному взаимодействию с комплексообразующими группировками определенных типов была рассмотрена в гл. 3. Так, многозарядные катионы образуют наиболее прочные связи с анионами, имеющими заряд— 2 и более высокий, и с увеличением атомного номера связи с серой становятся более прочными, чем с кислородом. Это отчасти объясняет, почему именно тайрон (пирокатехиндисульфокислота), имеющий две фенольные группы в орто-положениях друг к другу, служит реагентом на ион Fe(III), в то время как дитиол (толуол-3,4-дитиол) с аналогично расположенными тиольными группами взаимодействует с Mo(VI), Re(VI) и W(VI). (Эта реакция неизбирательна, но ее можно сделать более избирательной, выполняя определение в растворах минеральной кислоты, где могут образоваться устойчивые трис-комплексы только этих трех ионов.) Использование такого свойства металлов важно для улучшения избирательности реагентов, особенно за счет применения реакций маскирования (например, Fe(III) органическими окси-кислотами или переходных элементов циа-нид-ионом), основанных на разнице в константах устойчивости комплексов металлов с комплексообразующими веществами различных типов.
Константы устойчивости комплексов переходных металлов с данным лигандом располагаются в правильный и весьма характерный ряд. Однако если графически представить зависимость логарифма константы устойчивости комплекса с данным лигандом от иона металла, то наклон графика будет зависеть от типа лиганда. Так, если в хелатообразовании принимает участие атом азота, то увеличение прочности комплексов при переходе от Мп(П) к Cu(II) гораздо больше, чем в том случае, когда в образовании связи участвуют два атома кислорода. Это позволяет предположить, например, что если необходимо определить Mn(II) в присутствии Си(II), то это можно сделать, используя для маскирования меди лиганд, содержащий азот, тогда как Мп (II) образует комплекс с лигандом, содержащим кислород.
376
ГЛАВА 14
И наоборот, эти лиганды могут поменяться ролями, если определяемым элементом будет Cu(II), а не Мп(II). Причины таких различий уже обсуждались.
Эту широкую классификацию можно детализировать. Например, как показывают константы диссоциации протонов соответствующих катионов (значения р/Со), гетероароматический атом азота обладает менее основными свойствами, чем алифатический. Следовательно, можно ожидать, что в качестве донорного атома первый будет образовывать менее прочные комплексы с ионами металлов, чем второй. Эта более слабая связь будет, однако, в большей или меньшей степени компенсироваться возможностью образования дополнительной связи с участием л-орбиталей гетероцикла и подходящих орбиталей иона металла. Если можно предположить, что обратное связывание этого типа будет играть заметную роль, как, например, в случае иона Ag+( (Kr]d10), то весьма вероятно образование более прочных комплексов с гетероциклическими лигандами. С другой стороны, в таких ионах, как TI+( (Xe]4f145d106s2) и РЬ2+ (также [Xe]4/'145d106s2), инертная пара 65-электронов экранирует d-электроны и препятствует образованию d—л-связи, поэтому ароматические лиганды образуют менее устойчивые комплексы.
Рассмотрение такой относительной комплексообразующей способности ионов металлов различных типов позволяет предположить вероятные группы реагентов для применения в отдельных конкретных случаях. Так, сравнение комплексообразующей способности 8-оксихинолина и 8-аминохинолина приводит к выводу, что последний будет преимущественно взаимодействовать с катионами, относящимися к 2-й и 3-й группам по классификации Сиджвика (гл. 3), особенно в тех случаях, где, как можно предполагать, важную роль играет стабилизация полем лигандов. Этот фактор, видимо, является одной из основных причин устойчивости низкоспинового плоского квадратного бис-комплекса, образуемого 8-аминохинолином с Pd(II) (d8). Связь металл—азот настолько прочна, что в щелочной среде нерастворимый желтый бис-комплекс [Pd(NH2-quin)2]C12 отщепляет протоны амино-групп с образованием фиолетового экстрагирую-
CLXXVIH
щегося хлороформом нейтрального соединения CLXXVIII. Эта реакция была предложена для спектрофотометрического
О ПОИСКАХ НОВЫХ ОРГАНИЧЕСКИХ РЕАГЕНТОВ
377
определения Pd [4]. Те же факторы, которые определяют типы лигандов, реагирующих с данными катионами, действуют и при выборе маскирующих агентов с тем только исключением, что получающиеся в результате этого комплексы обычно бесцветны, растворимы и, вероятно, отличаются по своим экстракционным свойствам от определяемого соединения.
Необходимо также учитывать обычную стереохимию иона металла. Она должна быть такой, чтобы комплексообразование не встречало стерических затруднений, обусловленных другими группами лиганда (хотя препятствия образованию конфигураций, предпочитаемых другими катионами, могут быть весьма желательными и приводить к повышенной специфичности). Стереохимические различия можно также использовать в тех случаях, когда применяют маскирующие реагенты.
Важное значение может иметь размер иона металла. Алюминий образует с 8-оксихинолином нерастворимый трис-комплекс. При использовании 8-оксихинальдина, т. е. 2-метил-заме-щенного 8-оксихинолина, подобная реакция не может протекать, поскольку ион Ai3+ настолько мал, что по стерическим причинам три молекулы лиганда не могут разместиться вокруг него и образовать октаэдрический комплекс. В случае более крупных ионов Cr3+, Fe3+ или Ga3+ или же при образовании бис-комплексов с ионами двухвалентных металлов это обстоятельство не имеет значения, что используют для отделения алюминия от этих ионов [5]. Если сконструировать трехмерные лиганды, образующие вокруг Иона металла жесткую хелатную «клетку», внутри которой могут разместиться только катионы подходящих размеров, то можно ожидать гораздо большей специфичности. В этой ограниченной группе катионов предпочтительным было бы связывание тех из них, которые бы лучшим образом соответствовали диктуемой лигандом стереохимии. Примером является реакция иона кальция с кальцихромом, обсуждавшаяся в гл. 6.
Различные валентные состояния металла часто отличаются по стереохимии, экстракционному поведению и другим свойствам их комплексов, а также по типам лигандов, с которыми они образуют наиболее прочные комплексы. В таких случаях в качестве основы высокоизбирательных аналитических методов можно использовать экстракцию (предпочтительно), ионный обмен, осаждение или некоторые другие приемы с последующим окислением или восстановлением и взаимодействием с соответствующим лигандом.
И наконец, любая реакция, пригодная в химическом анализе, должна протекать быстро и количественно. Последнее требование можно также выразить иными словами: если имеет место какое-либо равновесие, изменение свободной энергии должно быть достаточно большим, чтобы реакция протекала полностью.
378
ГЛАВА 14
2. КОМПЛЕКСЫ МЕТАЛЛОВ В КАЧЕСТВЕ РЕАГЕНТОВ
Свойства аниона, нейтральной молекулы или иона металла часто можно намеренно изменить в результате комплексообразования с ионом металла, которое приводит к появлению аналитически полезных форм. Так, комплексообразование EDTA с Cd2+, приводящее к возникновению комплекса состава 1:1, превращает EDTA в одноосновную кислоту с рА 2,6, которая была предложена в качестве первичного стандарта в алкалиметрии (и в комплексометрии) [6]. Координация ионом металла лиганда, например крупного аниона, может в заметной степени изменить реакционную способность лиганда или иона металла за счет того, что могут действовать следующие факторы:
1. Изменение распределения электронов в лиганде и ионе металла (например, ион металла катализирует гидролиз сложных эфиров аминокислот).
2. Связывание химически активного центра лиганда (например, маскирование ионом меди амино- и карбокси-групп «-аминокислот, в то время как другие группы остаются способными к химическим превращениям).
3. Вынужденный перевод молекул лиганда в какую-либо определенную стереохимическую форму (например, стабилизация медью(II) енольной формы ацетоуксусного эфира, облегчающая его бромирование).
4. Обеспечение новых путей для присоединения или отдачи электронов. (Это может иметь значение для окисления и восстановления ионов металлов или же для катализируемого ионами металла окисления или восстановления органических соединений. В качестве примеров можно указать на способность хлорида Cu(I) в пиридине катализировать окисление анилина кислородом воздуха до азобензола и на способность Си(II) катализиро-ровать окисление фенолов.)
5. Стабилизация органических соединений, которые в противном случае были бы неустойчивы. (Осаждение комплекса Си(II) с салицилальдимином из растворов салицилальдегида и аммиака рассмотрено в гл. 9).
К другим свойствам, которые можно использовать в химических реакциях, относятся стереоспецифичность, проявляющаяся благодаря координации при комплексообразовании, и конкуренция двух или большего числа реагирующих форм. Однако изучение таких реакций лежит в общем вне сферы современной аналитической химии, за исключением тех случаев, когда получающиеся комплексы прочны.
Чтобы любые такие комплексы были аналитически полезными, они обычно должны быть кинетически инертными. Это условие в свою очередь ограничивает круг подходящих металлов и лигандов определенными типами, которые обсуждались в гл. 5.
О ПОИСКАХ НОВЫХ ОРГАНИЧЕСКИХ РЕАГЕНТОВ
379
К таким комплексам относятся, например, комплексные ионы типа трис(1, Ю-фенантролин)железо(П) и трис(а,а'-дипири-дил)железо (II) и комплексы производных этих лигандов, использующиеся в качестве окислительно-восстановительных индикаторов. Вместо железа можно применять и другие металлы, в частности рутений. Так, в 1 М азотной кислоте пары комплексов рутений (II)—рутений (III) с 1, 10-фенантролином и а, а'-ди-пиридилом имеют окислительно-восстановительные потенциалы 1,29 в [7] и 1,’25 в [8] соответственно.
В других случаях неметаллы или металлоиды могут образовывать «ядро» аналитически полезных реагентов, как в тетра-фениларсоний- и тетрафенилборат-ионах.
3. НЕКОТОРЫЕ ПЕРСПЕКТИВНЫЕ НАПРАВЛЕНИЯ ИССЛЕДОВАНИИ В ОБЛАСТИ АНАЛИТИЧЕСКИХ МЕТОДОВ
Ассортимент органических экстрагентов был значительно расширен введением аминов и содержащих кислород фосфорорганических соединений. Многообразие экстракционных свойств при использовании этих новых экстрагентов должно обеспечить разработку новых аналитических методов, особенно методов, основанных на раздельной экстракции. Сюда же примыкает и использование в качестве экстрагентов «жидких катионообменников» типа динонилнафталинсульфокислоты. Кроме того, экстракционная способность комплексов металлов значительно меняется с изменением валентного состояния; поэтому экстракция с последующим окислением или восстановлением и реэкстракцией имеет широкие возможности в смысле обеспечения высокой избирательности разделений. При использовании смесей экстрагентов, например аминов или фосфорорганических соединений, часто наблюдаются синергетические эффекты, хотя надежная теоретическая интерпретация этого явления в настоящее время отсутствует. Так, смесь бис (2-этилгексил) фосфорной кислоты и 4-втор-бутил-2-(а-метилбензил)фенола в разбавителе типа керосина гораздо лучше экстрагирует Cs (наряду со Sr и редкоземельными элементами) из водных растворов при pH 4, чем любой из экстрагентов порознь [10]; в отсутствие фосфорорганической кислоты необходимо работать при рН>12.
Методы, основанные на образовании ионной пары, могут также иметь большое значение для экстракции; в свою очередь экстракция обеспечивает их использование и для других целей. Так, используя в качестве противоионов подходящие окрашенные соединения, можно, по-видимому, определять спектрофотометрическим методом большую группу катионов и анионов.
Другим результатом более широкого применения экстракционных методов является возможность прямого фотометрического
380
ГЛАВА 14
определения следов элементов в неводной фазе. Преимущества этого метода заключаются в заметном повышении концентрации определяемого элемента и в улучшении отделения его от мешающих веществ. В качестве примера, где этот прием уже был использован, можно было бы назвать несколько методов, включающих применение в качестве экстрагента окиси три-н-октилфос-фина. Сюда относятся определение в органической фазе урана с дибензоилметаном [11], циркония с пирокатехиновым фиолетовым [12] и PAN [13], хрома с дифенилкарбазидом [14], титана с роданидом [15] и железа с 1,10-фенантролином [16]. Аналогичным образом цирконий определяли фотометрически с ксиленоловым оранжевым после экстракции его анионного хлоридного комплекса в виде ионной пары с три-н-октиламином [17]. В аналогичных условиях цинк можно определить с цинконом [18].
В некоторых случаях можно разработать методы определения одного металла в присутствии других, используя различия в скоростях образования и диссоциации комплексов, т. е. используя кинетические, а не термодинамические свойства. Это может потребовать, чтобы аналитический метод или только отдельный процесс, например процесс разделения осаждением, экстракцией органическими растворителями или ионным обменом, был бы достаточно быстрым по сравнению с образованием координационных связей. Наиболее вероятно, что такой прием будет полезным в том случае, когда лиганды обладают сильными полями (как, например, цианид-ион и хелатообразующие амины) при условии, что комплексообразование осуществляется с переходом от высоко- к низкоспиновому состоянию. С другой стороны, вследствие большой степени ориентации вокруг иона металла по-лидентатных лигандов типа EDTA их использование часто сопровождается малыми скоростями реакций. (Например, диссоциация комплекса Ni—EDTA.) Если связь обладает заметным ковалентным характером, то ее образование и разрыв часто также являются медленными процессами.
Большую роль в выборе лигандов для отдельных ионов играют стерические факторы. Склонность меди(II) и никеля образовывать плоские квадратные структуры, в то время как большинство других металлов преимущественно дает октаэдрические комплексы, позволяет объяснить тот факт, что удаление из молекулы EDTA двух остатков уксусной кислоты (с образованием тетр а дентатной этилендиамин-N, N'-диуксусной кислоты) приводит к повышению относительной избирательности реагента по отношению к этим ионам [19]. Двухзарядный анион этиленди-аминбисацетилацетона CLXXIX также весьма пригоден для заполнения четырех координационных мест вокруг иона металла (Ni2+, Pd2+, Pt2+ и Cu2+) с образованием плоских квадратных комплексов. При комплексообразовании с ионом, образующим пре
О ПОИСКАХ НОВЫХ ОРГАНИЧЕСКИХ РЕАГЕНТОВ
381
имущественно соединения октаэдрической конфигурации, остающиеся два координационных места около иона металла (в трансположении друг к другу) заполнены молекулами воды или какого-либо другого монодентатного лиганда. Избирательность определения катиона, образующего плоские квадратные комплексы, можно было бы повысить за счет такого изменения молекулы лиганда, чтобы она включала группы, оказывающие стери-ческие препятствия тем лигандам, которые занимают эти два положения. Небольшие изменения длины цепи CLXXIV также
“О—С=СН — C=N— СН2— сн2—N=(j— СН=С—О~ сн3 сн3 сн3 сн3
CLXXIX
должны привести к значительным различиям комплексообразования с различными ионами металлов за счет изменения способности этого реагента располагаться вокруг иона металла, охватывая его подобно обручу. Большое значение стереохимических эффектов было показано в случае аналогичных цис- и транс-1,2-диаминоциклогексан-бцс(ацетилацетонов) [20].
Другим примером значительного влияния стерических эффектов является металлохромный индикатор глицинтимоловый синий (CLXXX, R =—NHCH2COOH).
Этот реагент состоит из двух глициновых остатков, каждый из которых через метиленовую группу присоединен к бензольному ядру в орто-положение к фенольной группе. Это обеспечивает координацию иона меди(II) атомом азота амино-группы и атомом кислорода карбокси-группы глицинового остатка, а также фенольным атомом кислорода, причем эти три атома лиганда занимают три из четырех мест плоской квадратной структуры иона металла. Оставшаяся часть молекулы функционирует главным образом как хромофорная группа. Такая конфигурация
382
ГЛАВА 14
комплекса делает предпочтительным комплексообразование с ионами типа меди, образующими обычно плоские квадратные комплексы. Прочность связи металл—лиганд в большой мере зависит также от размера иона металла (вследствие стерических ограничений, налагаемых жесткостью бензольного кольца и направлениями, в которых должны располагаться его заместители). Это делает глицинтимоловый синий чувствительным и избирательным (но не специфичным) реагентом на медь. Большинство других катионов взаимодействует лишь слабо, и многие из них не вызывают заметного мешающего влияния. Было исследовано влияние замены глициновой группировки остатками других амино-кислот; по-видимому, наиболее подходящей группой является пролин [21]. Рассуждения, аналогичные приведенным выше, позволяют наметить возможные направления поиска новых реагентов — индикаторов для отдельных ионов металлов при комплексонометрическом титровании и более чувствительных реагентов для прямого фотометрического определения этих ионов.
В настоящее время комплексонометрическое титрование имеет в аналитической химии очень важное значение; признавая это, необходимо отметить, что вероятность отыскания лигандов, обнаруживающих полную специфичность по отношению к индивидуальным катионам, весьма невелика. Вместо этого улучшение существующих и разработка новых методов будут требовать повышения избирательности в трех различных направлениях; речь идет об избирательности титранта, избирательности маскирующих агентов и при использовании визуальных методов — избирательности индикатора.
В настоящее время накоплено достаточно много качественных и количественных данных, которые можно практически использовать при создании металлиндикаторов, комплексы которых имели бы константы устойчивости, позволяющие применять эти индикаторы в комплексонометрическом титровании. Переходы их окрасок можно улучшить введением хромофорных групп. Кроме того, в зависимости от природы комплексообразующих групп эти индикаторы можно проектировать таким образом, чтобы логарифмы констант устойчивости их комплексов с различными металлами изменялись параллельно аналогичным константам комплексов, например с EDTA; с другой стороны, используя содержащие азот лиганды, можно добиться образования относительно более прочных комплексов с Cu(II) и Zn(II). Для наибольшей чувствительности металлиндикаторы должны иметь высокие коэффициенты поглощения; это требование обычно приводит к тому, что лиганды выбирают с учетом их близости к красителям. Если хромофорная и комплексообразующая части лиганда более или менее разобщены, то это обеспечивает известную широту возможного выбора. Такие структуры имеются в молеку
О ПОИСКАХ НОВЫХ ОРГАНИЧЕСКИХ РЕАГЕНТОВ
383
лах типа металлфталеина и пирокатехинового фиолетового, где комплексообразующие группы присоединены к молекуле обычного красителя.
Тем не менее, если индикаторы используются для визуального, а не фотометрического определения конечной точки, приобретают значение физиологические факторы, зависящие от реакции человеческого глаза на различные цвета. По этой причине индикаторы следует рассматривать не только с -точки зрения индикаторной ошибки (связанной с различиями в константах устойчивости комплексов металлиндикатора и титранта), но также с точки зрения резкости изменения окраски, ее яркости, интенсивности и контрастности. Аналогичные замечания можно сделать и по отношению к флуоресцентным индикаторам. Для улучшения резкости визуального перехода применяют «внутренние светофильтры», но обсуждение таких эффектов выходит за пределы данной книги.
Шварценбах [22] отметил отсутствие комплексонометрических методов определения щелочных металлов, небольших или высокозарядных катионов Be, В, Ti, Ge, Nb и Та, платиновых металлов, а также As, Sb, Sn, Мо и W. Связи, образуемые ионами щелочных металлов, имеют преимущественно электростатический характер, поэтому для них необходимо использовать анионные лиганды. Однако в настоящее время константы устойчивости комплексов щелочных металлов не достигают и 107 — минимальной величины, необходимой для аналитически пригодного комплексонометрического титрования. По-видимому, основная надежда получения реагента, который удовлетворял бы этому требованию, связана с отысканием лиганда, имеющего структуру «клетки» с анионными группами, расположенными тетраэдрически по отношению к ячейке, в которой заключен ион металла; тенденция к выполнению этих условий отмечалась в гл. 6 при объяснении результатов, наблюдаемых в случае урамилдиуксус-ной кислоты. Затруднения в случае Be, В, Ti, Ge, Nb и Та связаны с небольшими размерами этих катионов (из-за чего анионы карбокси-групп не могут разместиться вокруг них), их склонностью к гидролизу и явно выраженной тенденцией к образованию ковалентных связей. Возникновение и разрыв ковалентных связей обычно являются медленными процессами, поэтому даже в том случае, когда лигандами являются дифенолы — производные пирокатехина (с которыми эти катионы образуют прочные комплексы), реакции протекают лишь медленно. Эти рассуждения позволяют сделать вывод, что катионы данной группы лучше всего определять другими методами.
В гл. 6 были рассмотрены некоторые комплексонометрические реагенты — производные EDTA, однако достигаемые различия в константах устойчивости в общем незначительны или
384
ГЛАВА 11
невыгодны. Удлинение этиленовой цепи в EDTA путем замены ее эфирной группой —СН2СН2ОСН2СН2 — увеличивает сродство реагента к барию по сравнению с магнием; введение группы —CH2CH2NHCH2CH2—, по-видимому, способствует комплексообразованию с катионами, дающими более прочные связи с атомом азота, чем с кислородом. Аналогичным образом введение тиоэфирной группы должно повышать прочность комплексов с катионами, имеющими заполненные d-уровни. Использование полиаминов вместо аминополикарбоновых кислот с целью увеличения разности в прочности комплексов, например меди(II) и марганца (II), имеет тот недостаток, что в случае многих переходных металлов, особенно второго и третьего рядов, высокая энергия поля лигандов приводит к спариванию спинов и к очень малым скоростям реакций. Попытки создать более удачные реагенты на As, Sb, Sn, Мо и W путем замены атомов кислорода и азота в комплексообразующих соединениях атомами серы и фосфора (с которыми они образуют гораздо более прочные связи) едва ли будут иметь практическое значение, если использовать меркаптаны и замещенные фосфины (из-за чувствительности их кат-мосферному кислороду). В этом отношении свойства анионов тиокислот — аналогов нитрилотриуксусной кислоты и EDTA — могут, вероятно, вознаградить исследователя.
Относительно тяжелые элементы имеют более высокие координационные числа; в связи с этим можно предположить, что, вероятно, аналитически полезными для этих элементов будут лиганды, имеющие до восьми соответствующим образом расположенных комплексообразующих групп.
Большинство органических осадителей имеет полярную группу, связанную с крупной гидрофобной молекулой, поэтому комплексообразование приводит (благодаря уменьшению числа водородных связей с водой) к получению малорастворимого продукта. Аналитические свойства таких реагентов можно улучшить за счет «удваивания» молекул, как, например, при замене п-то-луоларсоновой кислоты CLXXXI этилен-1,2-бис(4'-фениларсоно-
CLXXX1 CLXXX1I
вой) кислотой CLXXXII. Преимущество таких реагентов заключается в способности каждой молекулы вести себя как комплексообразующее соединение по отношению к двум различным ионам металла, что приводит к образованию гораздо менее растворимых полиядерных комплексов. Такие координационные полимеры были описаны Бергом и Аламом [23], изучавшими реак-
О ПОИСКАХ НОВЫХ ОРГАНИЧЕСКИХ РЕАГЕНТОВ
385
ции 8,8'-диокси-5,5'-дихинолила CLXXXIII с двухзарядными
ОН
он
CLXXX11I
ионами металла и 1,6-диоксифеназина CLXXXIV с двухвалентными Си, Zn, Ni, Со и Hg. Последний реагент был предложен
CLXXXV
для капельного обнаружения многих элементов, с которыми он образует окрашенные осадки, но реакция оказалась ни очень чувствительной, ни избирательной. Аналогичным образом ведет себя 5,8-диоксихиноксалин CLXXXI, но он легче окисляется.
Подобно этому, были изучены хелатообразующие свойства бис (8-окси-2-метил-5-хинолил) метана (в котором две молекулы 8-оксихинальдина связаны метиленовой группой) [24].
Поскольку отношение металл—лиганд меняется с изменением размеров образующихся полиядерных комплексов, такие осадки нельзя непосредственно использовать для гравиметрического определения.
Комплексообразующие вещества оказывают значительное влияние на окислительно-восстановительные потенциалы пар типа Fe(III)-Fe(II) и Cu(II)-Cu(I), поэтому можно ожидать, что в будущем возрастет их использование для получения реагентов, имеющих тщательно контролируемую окислительную или восстановительную способность.
В этой книге автор хотел показать, какие группы можно ввести или модифицировать, чтобы изменить растворимость, 25 Д- Перрин
386
ГЛАВА 14
окраску и другие свойства и таким образом улучшить органические реагенты, предназначенные для определенных целей. Была сделана попытка создать схему, в рамках которой можно было бы объяснять и предсказывать химические свойства. Тем не менее несомненно, что при разработке новых аналитических методов случайность будет иметь значение и в дальнейшем, хотя, возможно, и меньшее. Высокоизбирательная и чувствительная реакция ализаринового комплекса трехвалентного церия со фторид-ионом (гл. 11) может служить примером, когда исходное наблюдение было сделано неожиданно, хотя результат его может быть объяснен на основе современной химической теории. Ни в коей мере нельзя утверждать, что данное обсуждение является исчерпывающим, и автор вполне признает обвинение, которое можно выразить словами:
Гораций, много в мире есть того, что вашей философии не снилось...
ЛИТЕРАТУРА
1. F е i g 1 F., Chemistry of Specific, Selective and Sensitive Reactions, Academic Press, New York, 1949.
2. Taylor J. R., Virginia J. Sci., 3, 289 (1943).
3. Duke F. R., Ind. Eng. Chem. (Anal. Ed.), 16, 750 (1944).
4. Gustin V. K., Sweet T. R., Anal. Chem., 35, 44 (1963).
5. Irving H., Butler E. J., Ring M. F., J. Chem. Soc., 1949, 1489.
6. Powell J. E., Fritz J. S., James D. B., Anal. Chem., 32, 954 (1960).
7. D w у e r F. P., H u m p о 1 e t z J. E., N у h о 1 m R. S., Proc. Roy. Soc.
N. S. Wales, 80, 212 (1946).
8. Brandt W. W„ Smith G. F„ Anal. Chem., 21, 1313 (1949).
9. White J. M., Tang P., Li N. C., J. Inorg. Nucl. Chem., 14, 255 (1960).
10. Chem. Eng. News, May 27, 1963, p. 46.
11. Horton C. A., White J. C„ Anal. Chem., 30, 1779 (1958).
12. Young J. P„ White J. C., Taianta, 1, 263 (1958).
13. Crawley R. H. A., Anal. Chim. Acta, 26, 281 (1962).
14. Mann С. K„ White J. C„ Anal. Chem., 30, 898 (1958).
15. Young J. P„ White J. C„ Anal. Chem., 31, 393 (1959).
16. H i b b i t s J. O., Davis W. S., Menke M. R., Taianta, 6, 28 (1960).
17. Cerrai E., Testa C., Anal. Chim. Acta, 26, 204 (1962).
18. Scroggie L. E., Dean J. A., Anal. Chim. Acta, 21, 282 (1959).
19. Chaberek S„ Martell A. E„ J. Am. Chem. Soc., 74, 6228 (1952).
20. Honda M., Schwarzenbach G., Helv. Chim. Acta, 40, 27 (1957).
21. Koch M„ Svoboda V., Korbl J., Taianta, 5, 141 (1960).
22. Schwarzenbach G., Complexometric Titrations, Interscience, New York, 1957, Chapter 7.
23. Berg E. W„ Alam A., Anal. Chim. Acta, 27, 454 (1962); 28, 126 (1963).
24. Philips J. P., Leach J. T., Anal. Chim. Acta, 26, 572 (1962).
Предметный указатель
Аденозинтрифосфат 119, 142
Адсорбционные индикаторы 156 и сл.
Азоазокси БН, реагент на Са 327
Азометин Н, реагент на бор 314
Азот, атомный радиус 27 стереохимия соединений 309 электронное строение 26
Акридин 207
как реагент на Zn 369
Активированные комплексы 93
Актиниды, электронная структура и химические свойства 18, 30, 175, 311
Актиний, атомный н катионный радиусы 27
ионизационные потенциалы 35
химические свойства 310
Ализарин 20, 222
Ализаринбордокомплексон 127, 132
Ализаринкомплексон 125, 127, 132, 177, 290
комплексы с р.з.э. как реагенты на F- 290
Ализариновый желтый GG 188
Ализариновый желтый R 188
Ализариновый красный С (Ализарин-сульфокислота) 132, 134, 156, 276, 288
как реагент на
А1 311
Ри 347
р.з.э. 330
Sc 357
Th 362
Ti 361
U 365
Zr 370
Ализариновый синий 230
N, N-бис- (Аллил тиокарба мид) гидр а -
зин (Дальзин) 222, 257
Алюминий, атомный и катионный ра-
диусы 27
ионизационный потенциал 35
маскирующие агенты 146 реагенты для определения 311 электронная структура 18, 310
Амарант 275
Америций, ионизационные потенциалы 35"
катионные радиусы 27
электронное строение и химические свойства 311
4-Аминоазобензол 285 п-Аминоацетофенон 344 п-Амино-N, N-диметиланилин 302, 358 1 -Амино-2-нафтол-4-сульфокислота
369
1-Амино-8-оксиантрахинон 171
З-Аминофеноксазин-2-он 283 п-Аминофенол 359 8-Аминохинолин 376 4-Амино-4'-хлордифенил 275, 278 бис- (2-Аминоэтил) этиленгликоль-N,
N, N', N'-тетрауксусная кислота 138
Аммиак, определение 300
Аммоний, ионный радиус 27 о-Анизидин
Аниониты 159 и сл.
Антраниловая кислота 217
Антраруфин-2, 6-дисульфокислота, реагент на Sc 357
Антрахинон-( 1 -азо-4)-диметиланилин 264
как реагент на Sb 358 Антраценовый синий SVG 172 Арнольда основание (Тетраметилдиа-минодифенилметан) 282, 291
Арсеназо I (о-арсонофенилазохромо-троповая кислота, неоторон, уранон) 129, 130
как реагент на
Np 339
Pu 347
р.з.э. 330
Та 360
Th 362
U 365
Арсеназо III 214
как реагент на Th 362
Zr 371
388
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Арсоновые кислоты 213 н сл.
Аскорбиновая кислота 144
Астатин, ионизационные потенциалы 35
катионный радиус 27
химические свойства 312
Астразоновый розовый FG 282
Атомные орбитали 22—24, 41
гибридизация 36
слейтеровские 38
сравнение энергий 24
Ауринтрикарбоновая кислота см.
Алюминон
Ацетилацетон 47, 62, 66, 144, 249, 275, 313
как маскирующий агент 144, 146
как реагент на
Be 313
U 361
Ацетилпиридинийхлорид 304
Ацетоиноксим 213 8-Ацетоксихинолин 231 Ацетолоксим 213 Ацетондикарбоновая кислота 62 трис-(Ацетонилтриоксим) 140
Ацилоиноксим 213
АШ-кислота 299
Барий, атомный и катионный радиусы 27 ионизационные потенциалы 35 маскирующие агенты 146 реагенты для определения 326, 327 электронная структура 28
Батокупроин 186
Батофенантролин 187
Бенгальская роза 157
Бензгидроксамовая кислота 250
Бензидин 275, 277
а-Бензилмонооксим 254
2-Бензилпиридин 282
Бензоилацетон 337
N-Бензоил-М-фенилгидроксиламин
224
как реагент на Nb 341 как экстрагент 251, 348 а-Бензоиноксим 212 и сл., 278
как реагент на Мо 335 W 318
Бензолселениновая кислота 208, 209
Бензолсульфиновая кислота 208 Бензо-1,2,3-триазол 220
Бериллий, атомный и катионный радиусы 27 ионизационные потенциалы 35
маскирующие агенты 146 реагенты для определения 313 и сл. электронная структура 18, 26, 313 Бериллоны 314
2,2'-Бихинолил (Купроин) 185, 264
Бор, атомный и ионный радиусы 27 ионизационные потенциалы 35 маскирующие агенты 146 реагенты для определения 288, 314 электронная структура 18, 314
Борная кислота, комплексообразование с полиоксисоединениями 287
Бриллиантовый арчил С 157
Бриллиантовый желтый 156
как реагент на Mg 332
Бриллиантовый зеленый 264, 358—360
Бром, атомный и ионный радиусы 27 определение 297, 303, 315 электронное строение 315
Бромкрезоловый пурпурный 156, 158 л-Бромминдальная кислота, осаждение Zr 370
Бромпирогаллоловый красный 181 как реагент на р.з.э. 330 Nb 341
Бромтимоловый синий 156, 158
Бромфеноловый синий 156
Бруцин 164
п-(н-Бутил) фениларсоновая кислота 215
Бутироиноксим 213
Ванадий, атомный и катионные радиусы 29 валентные состояния 315 и сл. ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 315, 316
Вариаминовый синий В 73
Виолуровая кислота 164
Висмут, атомный и катионный радиусы 27 ионизационные потенциалы 35 маскирующие агенты 146 реагенты для определения 204 электронное строение 18
Висмутиол I 204
Висмутиол II 204
Вода, определение следов 298, 302
Водород, атомный и катионный радиусы 27
электронное строение 18, 26, 316
Вольфрам, атомный и катионные радиусы 29 валентные состояния 318
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
389
ионизационные потенциалы 35
реагенты для определения 318
электронное строение 18
Выбор реагента для осаждения 227
Гадолиний см. Лантаниды
Галлеин как реактив на Sn 343
Галлий, атомный и катионный радиусы 27
ионизационные потенциалы 35
реагенты для определения 319
электронное строение 18, 319
Галловая кислота 210
как реагент на Та 360
Галлоцианин, реакция с РЬ 308
Гафний, аналитическая химия 319 и сл.
атомный и катионный радиусы 27 ионизационные потенциалы 35 электронное строение 18, 319
Гексадецилтриметиламмония соли 278
Гексанитродифениламин см. Дипи-криламин
Гематоксилин, реакция с
Sn 343
Zr 370
Гептоксим 218
Германий, атомный и ковалентный радиусы 27
ионизационные потенциалы 35 комплексообразование с полиоксисоединениями 287, 320 маскирующие агенты 146 реагенты для определения 320 электронное строение 18
Гибридизация атомных орбиталей 36 и сл.
Глиоксаль-бис- (2-оксианил) комплекс с Са 246, 263
Глицин 13, 17
Глицинтимоловый синий 381
Гольмий см. Лантаниды
Дальзин, см. N,N'-6hc(аллилтиокарбамид) гидразин
Дебая-Хюккеля уравнение 197
Детергенты 227 и сл.
Диазиновый зеленый, реакция с Sn 343
Диалкилдитиокарбаматы, растворимость комплексов 225
Диалкилдитиофосфорные кислоты как экстрагенты 268
3, З'-Днаминобензидин 286
2, З-Диаминонафталин 286
1,2-Диаминоциклогексан-Ы,М,ЬГ,ЬГ-тетрауксусная кислота 135, 138
2,2'-Диаминоэтиловый эфир-М,М,М',
N'-тетрауксусная кислота 137
о, о'-Дианизидин-N, N, N', N'-тетрауксусная кислота 171
Диантримид 288
Дибензилдитиокарбамат 255
Дибензоилметан как реагент на U 365
5, 7-Дибром-8-оксихинолин 196
как реагент на Ga 319
Дибром (R) флуоресцеин 156, 157, 159
Дибутилбутилфосфат 268
Ди-н-бутилфосфат 266
Ди-т^ет-бутилфосфат 265
Диизоамилметилфосфат 268
О, О-Диизопропилдитиофосфорная кислота 255
Д ииод (R) диметил (R) флуоресцеин
157
Р-Дикетоны как экстрагенты 249 и сл.
2, 3-Димеркаптопропан-1 -сульфонат Na см. Унитиол
2, З-Димеркаптопропанол 112, 144
3, 4-Димеркаптотолуол см. Дитиол
Диметиламиноазобеизол как реагент на Т1 359
п-Диметиламинобензилидеиродании 204 и сл.
как реагент на
Ag 355
Au 322
Hg 351
n-Диметиламинобензолазофениларсо-новая кислота 184, 214, 276
как реагент на Zr 370
п-Диметиламиностирил-2-нафтиазола метилиодид как осадитель анионов 207
4, 4'-бис-Диметиламинотиобензофе-нон 299
4-Диметиламинофенилендиамин-1, 2 287
9- (4-Диметиламинофенил) -2,3, 7-три-оксифлуорон (Диметиламинофенил-флуорон) 190
как реагент на Ge 320
Диметилглиоксим 17, 119, 217
его аналоги 222, 223
как реагент на
Ni 340
Pd 345
Re 349
6,6'-Дпметил-2, 2'-дипиридил 185
1,3-Диметил-4-имино-5-оксиминоал-локсан 219
Диметилнафтидин 88
390
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
2,9-Днметил-1,10-фенантролин (Нео-купроин) 55, 185, 254
Диметил (R) флуоресцеин 157
Ди-1 -нафтилдиметиламин, осаждение нитратов 279
Ди-2-нафтилтиокарбазон как реагент на
Cd 325
Hg 351
Zn 369
Динитробензолы как реагенты на гипосульфит 283
3, З'-Диоксибензидин-N, N, N', N'-тет-рауксусная кислота 133
Диоксивинная кислота 201
8,8'-Диокси-5, 5'-дихинолнл 385
Диоксимы 17, 217 и сл., 247 и сл.
как реагенты на
Ni 340
Re 349
1,8-Диоксинафталин как реагент на Ti 361
1, 6-Диоксифеназин 385
4, 7-Диокси-1, 10-фенантролин 188, 189
5,8-Диоксихиноксалин 385
Дипивалоилметан как экстрагент для
Li 247,331
Дипикриламин (Гексанитродифениламин) 201
как реагент на Cs 337
2,2'-Дипиридил 17, 57, 181, 182
как реагент на
С г 368
Си 334
Fe 321
Os 344
Rh 350
Ru 352
стереохимия комплексов 94
2,4-Дипиридил-1,3,5-триазин 187
Диспрозий см. Лантаниды
Дитизон 19, 257
как индикатор 123, 177, 276
как реагент на
Ag 355
Au 323
Bi 316
Cd 325
Си 334
Hg 351
Pb 353
Pd 344
Pt 345
Sn 342
TI 359
Zn 369
Дитио-Р-изоиндиго как реагент на Ag 356
Дитиооксалат Na как реагент на Ni 340
Дитиооксамид (рубеановодородная кислота) 176, 204
как реагент на
Ni 340
Ru 352
Дитиол (3,4-Димеркаптотолуол) 99, 204, 375
как реагент на
Мо 335
Re 349
Sn 342
Тс 361
W 318
как экстрагент 256
Дитиопирокатехин как реагент на Sn 343
Дитиотартрат-ион как лиганд 112 о-Дитолилкарбазон 259
о, о'-Дитолилтиомочевина как реагент на Os 344
Дифениламин 85
как реагент на NOa~ 164
N.N'-Дифенилбензидин 85, 298
Дифенилкарбазид 258
как реагент на
Ag 164
Сг 367
Дифенилкарбазон 115, 156
как реагент на
Hg 351
Rh 350
как экстрагент 258
Дифенилтиомочевина как реагент на Re 349
1, 4-Дифенилтиосемикарбазид 258
как реагент на Os 344
2, 4-Дифенилтиосемикарбазид как реагент на
Re 349
Ru 352
5, 7-Дихлор-8-оксихинолин 196
как реагент на р. з. э. 330
Дихлор (R) флуоресцеин 156
n-Диэтиламинобензилиденроданин как
реагент на
Ag 355
Pd 345
N-Диэтилбензгидриламин как осадитель NO3- 278
Ди-(2-этилгексил) фосфорная кислота 267
Диэтнлднтиокарбамат диэтиламмония 255
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
391
как реагент на As 336 Pb 353 Sn 343 Zn 369
Диэтилдитиокарбамат Na 254 как реагент на
Bi 316
Cd 325
Со 328
Mo 335
Ni 340
Pb 353
Pd 345
Pt 345
Sn 343
U 365
V 316
Zn 369
Диэтилентриаминпентауксусная кислота (DTPA) 138, 276
Европий см. Лантаниды
Железо, атомный и катионные радиусы 27 ионизационные потенциалы 35 маскирующие агенты 146 реагенты для определения 321, 322 стереохимия комплексов 51, 320 электронное строение 18, 26
Золото, атомный и катионные радиусы 27 валентные состояния 322 ионизационные потенциалы 35 маскирующие агенты 146 реагенты для определения 323 электронное строение 18
Изонитрозоацетон 253
Изонитрозоацетофенон 321 Р-Изопропилтрополон 266 Р-Изотиоуреидпропионат 340 Изохинальдиновая кислота 216 Индий, атомный и ковалентный радиусы 28 ионизационные потенциалы 35 электронное строение 18, 323
Индикаторы адсорбционные 154, 156 и сл.
Индикаторы для комплексонометрии 123, 126 и сл.
Индоксин 183
как реагент на Th 363 Zn 369
«Инертные» комплексы 93
Иод, аналитическая химия 324 атомный и ионные радиусы 28 определение 297, 303
7-Иод-8-оксихинолин-5-сульфокисло-та (Феррон) 148, 166, 184, 216
Ионизационные потенциалы элементов 33, 35
Ионная сила 14
Ионные пары, их экстракция 262
Ионообменные смолы 159 и сл., 166
Ирвинга—Уилльямса ряд 61
Иридий, атомный и катионный радиусы 28 валентные состояния 324 ионизационные потенциалы 35 реагенты для определения 325 электронное строение 18, 26
Иттербий см. Лантаниды
Иттрий, аналитическая химия 325 атомный и катионный радиусы 29 ионизационные потенциалы 35 электронное строение 18, 325
Кадион 182
Кадион 2В 182
Кадмий, атомный и катионный радиусы 27 ионизационные потенциалы 35 маскирующие агенты 146 реагенты для определения 182, 325 электронное строение 18, 325
Какотелин
Калий, атомный и катионный радиусы 28 ионизационные потенциалы 35 комплексные соединения 357 электронное строение 18, 329, 337
Кальмагит 130
Кальцеин 132
Кальцеиновый синий 133
Кальцихром (Кальцион) 135
Кальций, атомный и катионный радиусы 27 ионизационные потенциалы 35 маскирующие агенты 145 реагенты для определения 326, 327 электронное строение 18
2-Карбоксианилин-^ N-диуксусная кислота 263
Карминовая кислота, реакция с НзВОз 288 как реагент на Sn 343
392
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Катиониты 159 и сл.
Кверцетин 20
как реагент на
Мо 335
Nb 341
Sc 357
Th 362
Zr 370
Кислород, атомный радиус 28 определение 301 электронное строение 26
Кислотный ализариновый черный 131
Кобальт, атомный и катионный радиусы 27 ионизационные потенциалы 35 реагенты для определения 328 стереохимия комплексов 51 электронное строение 18, 26, 328
Койевая кислота 163
Коллекторы 225 и сл.
Комплексонаты 120, 312, 346, 382
Комплексующие группировки в реагентах 15
Комплексы, ионные 36 ковалентные 36 константы устойчивости 109 кажущиеся 112
Конго красный 156, 158
Константа образования 13
Константа устойчивости общая 13
Координационное число 13, 48
Крахмалы 297
о-Крезолфталеинкомплексон 277
Кремний, атомный и ионный радиусы 29 ионизационные потенциалы 35
Кристаллический фиолетовый 206
Ксиленоловый оранжевый 125 как реагент на
Bi 317
Nb 341
р. з. э. 330
Zr 371
Ксиленолы как реагенты на NOs~ 285
Купроин см. 2,2'-Бихинолил
Купферрон (Нитрозофенилгидроксиламин) 164, 208 и сл., 226 как реагент на
Bi 316
Ga 319
Mo 335
Sn 343
Ti 361
U 364
V 316
W 318
Zr 370
как экстрагент 250 и сл.
Куркумин 164, 289 как реагент на Mg 332
Лантан см. Лантаниды Лантанидное сжатие 31 Лантаниды, атомные и катионные радиусы 28, 29 ионизационные потенциалы 35 реагенты для определения 319, 320 электронное строение и валентность 18, 44, 329
Лейкооснования 104
Лиганды 12, 14
Литий, атомный и катионный радиусы 28 ионизационные потенциалы 35 реагенты для определения 331 электронное строение 18, 26, 331
Лофин 190
Люминол 190, 302
Лютеций см. Лантаниды
Люцигенин 190
Магний, атомный и катионный радиусы 28 ионизационные потенциалы 35 маскирующие агенты 146 реагенты для определения 332 электронное строение 18, 26
Малахитовый зеленый 206, 282 как реагент на Т1 359
Марганец, атомный и катионные радиусы 28 валентные состояния 333 ионизационные потенциалы 35 маскирующие агенты 146 соединения 333 стереохимия комплексов 51 электронное строение 18, 26, 332
Маскирование реакций 140 Маскирующие агенты 144, 146 и сл. Медленные реакции 102 и сл.
Медь, атомный и катионные радиусы 27 валентные состояния 333, 334 ионизационные потенциалы 35 реагенты для определения 334 стереохимия комплексов 49 электронное строение 18
2-Меркаптобензимидазол 203, 226 2-Меркаптобензоксазол 350 2-Меркаптобензтиазол 203, 256 как реагент на
Cd 325 Rh 350
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
393
2-Меркапто-4,5-диметилтиазол как реагент на
Pd 345
Rh 350
Р-Меркаптопропионовая кислота как реагент на Ni 340
Металлфталеин (Фталеинкомплексон) 127, 174
Метилдиоктиламин как экстрагент 265
Метилендисалициловая кислота 281 Метиленовый голубой 279 как реагент на
Та 360
Zn 369
Метиловый оранжевый как реагент на
С12 и Вг2 299
Т1 359
2-Метил-8-оксихинолин 57, 195, 260
Метил-2-пиридилкетоксим 188, 219, 246
Метилтимоловый синий 132 как реагент на Zr 371
4-Метилтио-1,2-фенилендиамин 287
Метиловый фиолетовый 206, 207, 264 как реагент на
Sb 358
Т1 359
Метилфлуорон (9-метил-2,3,7-три-оксифлуорон-6) 189, 210
Механизмы реакций комплексообразования 91
Миндальная кислота 206 как реагент на Zr 370 4-Метилциклогексан-1, 2-диоксим 218 Молибден, атомный и катионные радиусы 28 валентные состояния 334 и сл. гетерополисоединения 335 ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 335 электронное строение 18, 26
Моногептадецилфосфорная кислота 267
Морин 18, 20, 133, 163, 171, 172 как реагент на
Мо 335
Nb 341
Sc 357
Sn 343
Та 360
Th 362
U 365
Zr 370
экстрагируемость комплексов 247
Мурексид 126, 170
Мышьяк, атомный и катионный радиусы 27 ионизационные потенциалы 35 маскирующие агенты 146 электронное строение 18, 334
Натрий, атомный и ковалентный радиусы 28 ионизационные потенциалы 35 комплексные соединения 337 электронное строение 18, 26, 337
2-Нафтилтиокарбазон 169
Нафтолсульфокислоты как реагенты на NOf 285
а-Нафтофлавон, индикатор на 12 297 а-Нафтохинолин 207
Р-Нафтохинолин 206
1, 2-Нафтохинондиоксим 218
Неодим см. Лантаниды
Неокупроин см. 2, 9-Диметил-1, 10-фе-нантролин
Неокупферрон 209
Нептуний, атомный и катионный радиусы 28 валентные состояния 338 комплексообразующая способность 338
реагенты для определения 339 электронное строение 338
Нефелоауксетический ряд 79
Никель, атомный и катионный радиусы 28 валентные состояния 339 ионизационные потенциалы 35 реагенты для определения 340 стереохимия комплексов 49 электронное строение 18, 26, 339
Нингидрин 300
Ниобий, атомный и ковалентный радиусы 28 ионизационные потенциалы 35 комплексы с анионами 340 маскирующие агенты 146 реагенты для определения 341 электронное строение 18
Ниоксим (1,2-циклогександиоксим)
Нитраты, определение 279, 280, 285
Нитрилотриуксусная кислота (NTA) 136
Нитриты, определение 280, 284
З-Нитробензойная кислота 206 п-Нитробензолазоорцин, реагент на Be 313
n-Нитрозоанилин, реагент на Pd 344
394
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Нитрозогуанидин 219, 222 n-Нитрозодиметиланилин как реагент на
Pt 345
Ru 352
n-Нитрозодифениламин 208
как реагент на Pd 344 Pt 345
1-Нитрозо-2-нафтол 219 и сл., 226 как реагент на
Np 339
Rh 350
как экстрагент 253
2-Нитрозо-1-нафтол 253
как реагент на Со 328 Pd 345
Нитрозонафтолы 219 и сл.
З-Нитрозосалициловая кислота 253
Нитрозо-Р-соль 220
каи реагент на
Со 328
Fe 321
Th 364
Нитрозофенилгидроксиламин см. Купферрон
2-Нитрозофенол 250
2-Нитро-5-метоксифенол 253
Нитрон 279
Нитроортаниловый С (Нитхромазо), реагент на Ва и Sr 327
Нитросульфофенол С, реагент на Nb 341 '
4- (n-Нитрофенилазо) -нафтол-1, реагент на Mg 332
4- (n-Нитрофенилазо) -резорцин, реагент на Mg 332
З-Нитрофениларсоновая кислота 215
З-Нитрофенилфлуорон 190 4-Нитрофенилфлуорон 190 Нитхромазо см. Нитроортаниловый С
Обратная связь 19
Озон, определение 301 и сл.
Окиси фосфинов как экстрагенты 268
Оксалаты 17, 286
Оксамид оксим 219
4-Оксибензотиазол 216
4-Окси-З-меркаптотолуол, реагент на Re 349
бис- (8-Окси-2-метил-5-хннолил) 385
2-Окси-З-нафтойная кислота 170
2-Окси-1 - (2-окси-4-сульфо-1 -нафтилазо') -3-нафтойная кислота 130
6-Окси-1, 7-фенантролин 260
2-(2-Оксифенил) бензимидазол ХС 212 2-(2-Оксифенил) бензоксазол 171, 212 8-Оксихинолин 17, 163, 171, 184, 195, 215 и сл.
как реагент на
Са, Sr, Ва 326
Ga 319
In 324
Mg 332
Nb 341
p. з. э. 330
Ru 352
Sn 343
Th 363
U 365
V 316
Zn 369
как экстрагент 259, 264 коллекторы при осаждении нм 226 стереохимия комплексов 94
8-Оксихинолин-5-сульфокислота 171, 195
5-Оксо-4-оксимино-3-фенилизоксазол 164
Октета правило 25
Олово, атомный и катионный радиусы 28 валентные состояния 343 ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 343, 344
Оляция 14, 116
Омега хромовый красный В .127 Орбитали атомные см. Атомные орбитали
Органические реагенты, определение понятия 11
Ортаниловый С, реагент на Ва и Sr 327
Осаждение анионных комплексов 206
Осаждение из гомогенных растворов 231
Осмий, атомный и катионный радиусы 28 валентные состояния 343 ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 343, 344 электронное строение 18
Основания Шиффа 98
Основные состояния элементов 28
Палладий, атомный и катионный радиусы 28 ионизационные потенциалы 35 комплексы 344
предметный указатель
395
реагенты для определения 344, 345 электронное строение 18
Парафуксин 206
Паули принцип 23
Перекись водорода, как маскирующий агент 144
Перфтороктановая кислота, экстракция ее комплексов 266
Пиазоселенолы 286
Пиколиновая кислота 138, 216 Пикрамин Р как реагент на Nb 341 Zr 370
Пикриновая кислота 201
Пикролоновая кислота 202 1-(2-Пиридилазо)-иафтол-2 (PAN) как индикатор 127, 247 как реагент на
р: з. э. 330
Nb 341
как экстра'гент 261
4-(2-Пиридилазо)-резорцин (PAR) 131, 261
как реагент на Nb 341
2-(2-Пиридил) бензимидазол 187
2-(2-Пиридил) имидазол 187 2-(2-Пиридил)-1, 3, 5-триазин 187 Пиридин-2-альдоксим 246
2, 6-Пиридиндикарбоновая кислота
138
Пирогаллоловый красный 131, 263
Пирогаллол 194, 210
Пирокатехин 361
Пирокатехин-3, 5-дисульфокислота см. Тайрон
Пирокатехиновый фиолетовый как индикатор 126, 134 как реагент на р. з. э. 330 Sn 342 Zr 370
Пнроллидиндитиокарбамат 255
Платина, атомный и ковалентный радиусы 28 ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 345, 346 стереохимия комплексов 49, 345 электронное строение 18, 26
Плутоний, атомный и катионный радиусы 28 реагенты для определения 347 сравнительная комплексообразующая способность катионов 346, 347 электронное строение и валентные состояния 346
Полиоксиантрахиноны 288
Полиядерные комплексы 14
Полоний, атомный и катионный радиусы 28 ионизационный потенциал 35 соединения 348 электронное строение 18, 347
Полярография комплексов 164
Потенциал полуволны 165
Празеодим см. Лантаниды Произведение растворимости 197 Прометий, катионный радиус 28 Протактиний, атомный и катионный радиусы 28 реагенты для выделения и определения 348 электронное строение 348
Прочный сульфоновый черный F 129
Пурпурин (1,2, 4-Триоксиантрахинон) 20, 171, 289 как реагент на
Sn 343
Zr 370
Радий, аналитическая химия 327 ионизационные потенциалы 35 катионный радиус 28
Радиусы анионов 32
Растворимость комплексов в органических растворителях 225
Резонанса явление 39
Рений, атомный и катионный радиусы 28 валентные состояния 348 ионизационные потенциалы 35 реагенты для экстракции и определения 349
Родамин В 119, 172, 207, 264
как реагент на
Au 323
Ga 319
Sb 358
Та 360
TI 359
W 318
Zn 369
Родамин 6G 156
Роданид-ион 14, 115, 163, 240
как индикатор 123
как реагент на
Со 328
Сг 368
Си 334
Fe 321
Ge 319
Hg 351
396
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Мо 336 Os 343 Pd 344 Re 349 Ru 352 Sn 342 Tc 361 U 365 Zn 369 определение 281, 291, 300 стереохимия комплексов 94
Родизоновая кислота и ее соли 115, 210, 221
Родий, атомный и катионный радиусы 28 валентные состояния 349 ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 350 электронное строение 18, 26
Ртуть, атомный и катионный радиусы 28 ионизационные потенциалы 35 маскирующие агенты 146 реагенты для определения 351 электронное строение 18, 350
Рубеановодородная кислота см. Дитиооксамид
Рубидий, атомный и катионный радиусы 28 ионизационные потенциалы 35 соединения 337 электронное строение 18, 337
Рутений, атомный и катионный радиусы 28 валентные состояния 352 ионизационные потенциалы 35 реагенты для определения 352 электронное строение 18, 352
Руфигалловая кислота 320
бис- (Салицилальдегид) этилендиамин 212
Салицилальдимин 212
Салицилальдоксим 210 и сл.
как реагент на
Fe 321
Pd 345
U 365
Салицилальдоксима аналоги 211
Салицилгидроксамовая кислота 224
Салициловая кислота 123, 189
как реагент на U 365
Самарий см. Лантаниды
Свинец, атомный и катионные радиусы 28
валентные состояния 352, 353 ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 353 электронное строение 18, 352, 353 Связей типы 38
Селен, атомный и ионный радиусы 29 ионизационные потенциалы 35 маскирующие агенты 147 определение 286
Сера 29 аналитическая химия 354, 355 атомный радиус 29 ионизационные потенциалы 35 определение 297, 304 электронное строение 26, 354
Серебро, атомный и катионные радиусы 27 валентные состояния 355 ионизационные потенциалы 35 маскирующие агенты 146 реагенты для определения 355, 356 электронное строение 18, 355
Сероводород, определение 302
Сероуглерод, определение 304
Силикаты, определение 251
Силоксен 277
Скандий, аналитическая химия и реагенты 356, 357 атомный и катионный радиусы 29 ионизационные потенциалы 35 электронное строение 18
Слейтера орбитали 38
Смешанные комплексы 116
Солохромовый красный В 156
Солохромовый красный 3G 200, реагент на U 365
Солохромовый темно-синий см. Эрио-хромовый сине-черный
Солохромовый черный 6В см. Эрио-хромовый сине-черный В
Соосаждение с органическими сооса-дителями 226
Спектров типы 172
Спектрохимический ряд 76, 174
Спектры комплексных соединений 172 и сл.
органических соединений 175 и сл.
Стильбазо 183
Стрихнин 207
Стронций, атомный и катионный радиусы 29 ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 326, 327 электронное строение 18
Сульфаниловой кислоты диазотирова
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
397
ние как метод определения NO2" 284 и сл.
Сульфаты, определение 275, 276
Сульфиды, определение 277, 283, 291
Сульфиты, определение 282 4-Сульфобензол-{1 -азо-2)-1,8-диокси-нафталин-3, 6-дисульфокислота 134 как реагент на Zr 370
5-Сульфосалициловая кислота 123, 144, 151
как реагент на Т1 361 U 365
Сурьма, атомный и катионный радиусы 29 ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 358 электронное строение 18, 357
Тайрон (Пирокатехин-3,5-дисульфокислота) 111, 181, 375 как индикатор 123 как маскирующий агент 144 как реагент на
Мо 335
Nb 341
Ti 361
U 365
Таллий, атомный и катионные радиусы 29 валентные состояния 358, 359 ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 359 электронное строение 18, 358
Таннин 341
Тантал, атомный и катионный радиусы 29 ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 360 состояние в растворах 359, 360 электронное строение 18
Тартразин 155, 156
Теллур, атомный и катионный радиусы 29 ионизационные потенциалы 35 маскирующие агенты 147 сравнение с селеном 360 электронное строение 18
Теноилтрифторацетон (ТТА) 249 как реагент на
Np 339 Sc 357
Li 364
Zr 370
Теория валентной связи 36 молекулярных орбиталей 39 поля лигандов 42 и сл.
Тербий см. Лантаниды
Тетрабромфлуоресцеин см. Эозин
Тетраметиламмония ион 206
Тетраметилдиаминодифенилметан 104, 115, 276; см. также Арнольда основание
Тетраокси-п-хинон 115, 276
Тетраметил-п-фенилендиамин 244, 282, 284, 290, 353
Тетрафениларсониевых солей осаждение 206, 278, 361 экстракция 262, 328, 344, 349
Тетрафенилбораты 200, 247
Тетрафенилметнларсониевых солей экстракция 263, 328, 358
Тетрафенилстибониевых солей экстракция 263
Тетрафенилфосфониевых солей экстракция 262
Тетрахлорфлуоресцеин 156
Технеций, атомный и катионный радиусы 29 ионизационные потенциалы 35 реагенты для определения 361
Тимолфталексон 132
Тиобарбитуровая кислота, реагент на Rh 350
Тиогликолевая кислота 209
как реагент на Pd 345
Тс 361
U 365
2-Тио-5-кето-4-карбэтокси-1,3-диги-дропиримидин 205 как реагент на Ag 355
Тиомочевина 60, 112
как реагент на
Os 344
Pd 344
Re 349
Ru 352
Тионалид (2-Нафталид тиогликолевой кислоты) 19, 203 как реагент на
Pt 350
Ru 359
Тиосемикарбазид 144
как реагент на Pt 346 Ru 352
Тиосульфаты, определение 283, 291
Тиоуксусная кислота 181
398
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
2-Тиофен-транс-альдоксим 224
Титан, атомный и катионные радиусы 29 ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 361, 362 реакция с Н2С>2 182 электронное состояние 18, 26, 361
Титановый желтый 332 о-Тодидин 298 о- (и-Толуолсульфамид) анилин 223 Торий, атомный н катионный радиусы 29 ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 362, 363 экстракция растворителями 362 электронное строение 18, 362
Торон 195, 214, 215, 276 как реагент на
Be 313
Li 331
Np 339
Pu 347
Th 363
U 365
Zr 370
Транс-влияние 97 и сл.
Триаминотриэтиламин (TREN) 139, 148
Трибутиламмониевых солей экстракция 264
Трибутилфосфат (ТВР) 267, 268
Триизооктиламин как экстракт 263
Трикаприлметиламмоння солей экстракция 263
1, 2, 4-Триоксиантрахинон см. Пурпурин
а, а', а"-Трипиридил 17 как реагент на Со 328
Трифенилметана аминопроизводные как осадители 206
Трифенилфосфит 267, 268
Триэтаноламин 144
Триэтилентетрамин (TR1EN) 139 Тулий см. Лантаниды
Углерод, атомный радиус 27
электронное строение 26
Унитиол (2, 3-Димеркаптопропан-1-
сульфонат Na) 196
Урамилдиуксусная кислота 137
как реагент на Li 331
Уран, атомный и катионные радиусы
29
валентные состояния 363
маскирующие агенты 147
реагенты для определения 363, 364
электронное строение 363
Уранон см. Арсеназо I
Фаянса правило осаждения 226
1, 10-Фенантролин 17, 55, 88, 89 замещение в положение 5 86 в положения 6,6' 86 как маскирующий агент 144 как реагент на
Си 334
Fe 55, 88
Ru 352
стереохимия комплексов 94
Феннларсоновая кислота 213
Фенил-2-пиридилкетоксим 187, 188, 219, 223, 246
1-Фенилтетразол-5-тион 203
Фенилтриметиламмония соли 206
Фенилфлуорон 189
как реагент на ,
Та 360 ?
Ti 361
Zr 370
Фенокситин 225
Феноксихинизарин-3, 4-дисульфокис-лота 132
Фенол-2, 4-дисульфокислота, нитрование при определении NOs~ 285
Фенолы 14
Феносафранин 155, 156
Феррон см. 7-Иод-8-оксихинолин-5-сульфокислота
Флуорексон 172
Флуоресцеин 154, 156, 158, 164
Флуоресценция 170
Фосфаты, определение 281
Фосфорорганические соединения как экстрагенты 205
Франка—Кондона принцип 100
Франций, катионный радиус 35
Фруктозы оксим 213
Фталеннкомплексон см. Металлфталеин
Фтор, атомный радиус 27
характер связей в соединениях 366 электронное строение 26
Фторид-ион как маскирующий агент 144, 286 определение 164, 274, 290
Функция образования Бьеррума 13, ПО а-Фурилдиоксим 218 как реагент на
Pd 345
Re 349
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
399
p-Фурфуральдоксим 208, 225
Хелатное соединение, определение понятия 13
Хелатные смолы 162
Хелатный эффект 14, 57, 68
Химическая связь 22, 31
теории образования 31, 36
типы 38
Хинализарин 18, 20, 288
как реагент на
Ga 319
Ge 320
Mg 332
Nb 341
Sc 357
• Sn 343
Th 362
Хинальдиновая кислота 216
Хинизарин 171
2-Хинизаринсульфокислота 132
Хинин 207
Хиноксалин-2, 3-дитиол 256
как реагент на Ni 340
Хинолин 278
Хинолиназо, реагент на Li 331
Хинолин-2-альдоксим 222
о-Хинондиоксим 218
Хлор, атомный радиус 27
определение 274, 297
электронное строение 367
Хлораниловая кислота 210, 221 и сл.
как реагент на
Мо 335
Zr 370
1-Хлор-3, 4-димеркаптобензол 204
как реагент на Sn 343
n-Хлормпндальная кислота, реагент
на Zr 370
Хлорфосфоназо III 327
Хром, атомный и катионные радиусы 27 валентные состояния 367 ионизационные потенциалы 35 маскирующие агенты 146 реагенты для определения 367, 368 электронное строение 18, 26, 368
Хромазурол S 134
Хромотроп 2В 289
Хромотроп 10В 134
Хромотроповая кислота 361
Хромофоры 183
Хунда правило 25
Цезий, атомный и катионный радиусы
ионизационные потенциалы 35 определение с дипикриламином 337 электронное строение 18, 337
Церий см. Лантаниды
Цианид-ион 108, 375
как маскирующий агент 144, 255, 259, 341, 359
определение в растворе 280 стереохимия комплексов 94
1,2-Циклогександиоксим см. Ниоксим 1, 2,3-Циклогексантрионтриоксим 248 Цинк, атомный и катионный радиусы 29 ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 369 электронное строение 18, 368
Цинкон 140
Циннамоилгидроксамовая кислота 224
Н-Циннамоил-Ц-фенилгидроксил-амин 224 как экстрагент 251
Цинхонамин 241
Цинхонин 207
Цирконий, атомный и катионный радиусы 29 ионизационные потенциалы 35 маскирующие агенты 147 реагенты для определения 370, 371 характер связи в соединениях 370 электронное строение 18
Шенберга реагент на серу 298
Шиффа основания 212
Экстракционно-фотометрические методы 380
Экстракция органическими растворителями 234 и сл.
Электронные уровни элементов 25, 26
Электроотрицательность 34
Энергия стабилизации полем лиганда 43, 74
Энтальпия, изменение при комплексообразовании 63 и сл.
Энтропия, изменение при комплексообразовании 63 и сл.
Эозин 154, 156, 159, 276
Эрбий см. Лантаниды
Эриохромовый красный 319
Эриохромовый сине-черный В (Соло-хромовый черный 6В 'j 129, 130
Эриохромовый сине-черный Р (Соло-хромовый темно-синий, Кальцон) 130, 171
400
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Эриохромовый черный Т 124, 126, 128, 176 как реагент на Са, Sr, Ва, 326
Ga 319
Эриохромцианин RC 134, 311
как реагент на Mg 332
Эритрозин 158, 276
Этилен-1, 2-бис (4'-фениларсоновая кислота) 384
Этилендиамин 13, 19, 17
Этилендиаминтетрауксусная кислота (EDTA) 73, 119
как маскирующий агент 145, 255, 259, 276, 277, 286, 321, 341, 355, 364
как элюант 161
прочность комплексов 120, 312, 346, 382
Этилксантогенат К 255, 336
п-Этоксихризоидин 155, 157
Яна—Теллера эффект 49, 67, 368
СОДЕРЖАНИЕ
Предисловие...................................................
Предисловие автора................................................ 7
Список принятых сокращений........................................ Ю
Глава 1. ВВЕДЕНИЕ................................................. И
Литература....................................................... 21
Глава 2. ХИМИЧЕСКАЯ СВЯЗЬ........................................ 22
1. Атомные орбитали.......................................... 22
2. Теоретическое рассмотрение химической связи............ 31
Простая электростатическая теория ..................... 31
Теория валентной связи ................................... 36
Теория молекулярных орбиталей ............................ 39
Теория поля лигандов...................................... 42
Литература....................................................... 45
Глава 3. СТЕРЕОХИМИЯ И УСТОЙЧИВОСТЬ КОМПЛЕКСОВ ... 46
1. Примеры влияния поля лигандов............................. 49
Медь(П)................................................... 49
Никель(П) иплатина(П)..................................... 49
Кобальт(II), d7........................................... 50
Железо(П) и кобальт(Ш), d6................................ 51
Железо(Ш) и маргаиец(П), d5............................... 51
Хром(II) и марганец(Ш), d4................................ 51
Медь(1)................................................... 51
2. Поляризуемость и ковалентный характер..................... 52
3. Пространственные эффекты.................................. 55
4. Константы устойчивости комплексов металлов................ 58
5. Термодинамика комплексообразования........................ 63
6. Хелатный эффект........................................... 68
Литература....................................................... 69
402
Глава 4. ВЛИЯНИЕ КОМПЛЕКСООБРАЗОВАНИЯ НА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ....................... 71
1. Факторы, определяющие величину потенциалов............. 71
2. Некоторые аналитические приложения..................... 73
3. Энергия стабилизации полем лигандов.................... 74
4. Потенциалы некоторых цианидных комплексов переходных металлов ................................................... 79
5. Потенциалы некоторых комплексов меди................... 82
6. Потенциалы комплексов железа........................... 84
7. Некоторые общие наблюдения............................. 86
Литература............................................... 89
Глава 5. ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ СКОРОСТЬ ОБРАЗОВАНИЯ И ДИССОЦИАЦИИ КОМПЛЕКСОВ, А ТАКЖЕ СКОРОСТЬ ИХ ОКИСЛЕНИЯ ИЛИ ВОССТАНОВЛЕНИЯ........................... 91
1. Механизмы реакций...................................... 91
2. «Инертные» комплексы................).................. 93
3. Окисление и восстановление комплексов.................. 99
4. Медленные реакции и катализаторы........................ 102
Литература..................................................... 105
Глава 6. ВЛИЯНИЕ КОМПЛЕКСООБРАЗУЮЩИХ РЕАГЕНТОВ НА КОНЦЕНТРАЦИЮ КАТИОНОВ.................................... 107
1. Некоторые количественные аспекты........................ 109
2. «Кажущиеся» константы................................... 112
3. Некоторые примеры, основанные на различиях в константах устойчивости или растворимости........................... 114
4. Влияние гидролиза..................................... 116
5. Комплексонометрическое титрование..................... 119
6. Индикаторы для комплексонометрического титрования .... 123
7. Другие реагенты, применяемые в комплексонометрическом титровании . ............................................... 136
8. «Маскирование» химических реакций..................... 140
9. «Демаскирование»...................................... 148
Литература................................................... 150
403
Глава 7. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ.............................. 153
1. Адсорбционные индикаторы.............................. 154
2. Ионный обмен.......................................... 159
3. Хроматография неорганических веществ.................. 162
4. Полярография комплексов металлов...................... 165
Литература.................................................. 166
Глава 8. ВИДИМЫЕ И УЛЬТРАФИОЛЕТОВЫЕ СПЕКТРЫ КОМПЛЕКСОВ .................................................. 168
1. Процесс поглощения света................................. 168
‘2. Флуоресценция........................................... 170
3. Типы ультрафиолетовых и видимых спектров комплексов . . . 172
d—d-Переходы............................................ 172
Возмущения лигандов..................................... 175
Перенос заряда ......................................... 178
4. О конструировании реагентов, дающих окрашенные комплексы с металлами.............................................. 182
5. Хемилюминесцентные индикаторы............................ 190
Литература..................................................... 191
Глава 9. РАСТВОРИМОСТЬ КОМПЛЕКСОВ.............................. 193
1. Факторы, определяющие растворимость в воде.............. 193
2. Влияние pH на растворимость комплексов и солей......... 197
3. Соли и комплексы щелочных металлов..................... 200
4. Соединения щелочноземельных металлов................... 201
5. Комплексы с серусодержащими лигандами.................. 202
6. п-Диметиламинобензилиденроданин........................ 204
7. Осаждение анионных комплексов крупными катионами .... 206
8. Гидрофобные н нейтральные внутрикомплексные соединения.
Характерные примеры...................................... 207
Купферрон............................................... 208
Салицилальдоксим ....................................... 210
а-Бензоиноксим......................................... 212
Арсоновые кислоты....................................... 213
8-Оксихинолин (оксин)............................. . . 215
Диоксимы............................................... 217
Нитрозонафтолы.......................................... 219
Хлораниловая кислота ................................. 221
Некоторые новые осадители............................... 222
404
9. Растворимость в органических растворителях............. 225
10. Коллекторы.............................................. 225
11. Образование мицелл...................................... 227
12. Факторы, определяющие выбор осадителей для неорганических катионов.................................................... 227
Литература...................................................... 231
Глава 10. ЭКСТРАКЦИЯ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ 234
1. Типы экстракционных систем......................... 234
2. Общее обсуждение................................... 236
3. Галогениды металлов и их комплексные кислоты....... 238
4. Роданидные комплексы............................... 240
5. Неорганические нитраты............................. 241
6. Количественные аспекты экстракционных равновесий .... 242
7. Комплексы металлов с органическими лигандами....... 245
Комплексы с диоксимами................................... 247
Комплексы с ацетилацетоном и теноилтрифторацетоном . . . 249
Комплексы с купферроном.................................. 250
Комплексы с нитрозофенолами и их производными............ 252
Комплексообразование через атомы серы.................... 254
Комплексы, образованные с участием атомов серы и азота . . 257
Комплексы 8-оксихииолина и его производных............... 259
Новые комплексы, образованные за счет связей с азотом и кислородом.......................................... . 260
8. Экстракция в виде ионных пар............................. 262
9. Экстракция органическими фосфорсодержащими соединениями . 265
Литература...................................................... 269
Глава 11. РЕАКЦИИ ОРГАНИЧЕСКИХ РЕАГЕНТОВ С НЕОРГАНИЧЕСКИМИ АНИОНАМИ............................................ 273
1. Косвенные методы обнаружения и определения анионов .... 274
Фотометрические методы, основанные на различиях в константах устойчивости комплексов.............................. 274
Методы, основанные на осаждении или различной растворимости комплексов и солей неорганических катионов........... 275
2. Методы, основанные на осаждении органическими катионами и экстракции органическими растворителями................... 277
3. Методы, основанные на окислении или восстановлении .... 280
4. Реакции диазотирования................................... 284
5. Реакции нитрования....................................... 285
6. Гетероциклические синтезы................................ 286
7. Комплексообразование с органическими лигандами........... 287
8. Другие косвенные методы.................................. 290
Литература...................................................... 292
405
Глава 12. МЕТОДЫ ОБНАРУЖЕНИЯ И ОПРЕДЕЛЕНИЯ НЕОРГАНИЧЕСКИХ НЕЙТРАЛЬНЫХ МОЛЕКУЛ.............................. 296
1. Прямая спектрофотометрия............................. 296
2. Реакции окисления..................................... 298
3. Реакции замещения..................................... 303
4. Косвенные методы...................................... 303
Литература................................................... 306
Глава 13. АНАЛИТИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ................... 308
Азот...................................................... 309
Актиний................................................... 310
Алюминий.................................................. 310
Америций и более далекие члены ряда актинидов............. 311
Астатин................................................... 312
Барий..................................................... 312
Бериллий.................................................. 313
Бор..................................................... 314
Бром...................................................... 315
Ванадий................................................... 315
Висмут.................................................... 316
Вольфрам.................................................. 317
Галлий.................................................... 319
Гафний.................................................... 319
Германий.................................................. 320
Железо.................................................... 320
Золото.................................................... 322
Индий..................................................... 323
Иод....................................................... 324
Иридий.................................................... 324
Иттрий.................................................... 325
Кадмий.................................................... 325
Калий..................................................... 326
Кальций, стронций, барий и радий.......................... 326
Кислород.................................................. 327
Кобальт................................................... 328
Кремний................................................... 329
Лантан и редкоземельные элементы......................... 329
Литий.................................................... 331
Магний.................................................... 331
Марганец................................................ 332
Медь...................................................... 333
Молибден................................................. 334
406
Мышьяк.................................................... 336
Натрий, калий, рубидий и цезий............................ 337
Нептуний.................................................. 338
Никель.................................................... 339
Ниобий.................................................... 340
Олово..................................................... 342
Осмий..................................................... 343
Палладий.................................................. 344
Платина................................................... 345
Плутоний.................................................. 346
Полоний................................................... 347
Протактиний............................................... 348
Радий..................................................... 348
Рений..................................................... 348
Родий..................................................... 349
Ртуть..................................................... 350
Рубидий................................................... 352
Рутений................................................... 352
Свинец.................................................... 352
} Селен....................................................... 353
Сера...................................................... 354
Серебро................................................... 355
Скандий................................................... 356
Стронций.................................................. 357
Сурьма ................................................... 357
Таллий.................................."................. 358
Тантал.................................................... 359
Теллур.................................................... 360
Технеций.................................................. 360
Титаи..................................................... 361
Торий..................................................... 362
Урай...................................................... 363
Фосфор.................................................... 365
Фтор...................................................... 366
Хлор...................................................... 367
Хром...................................................... 367
Цезий..................................................... 368
Церий..................................................... 368
Цинк...................................................... 368
Цирконий.................................................. 369
Литература.................................................... 371
407
Глава 14. О ПОИСКАХ НОВЫХ ОРГАНИЧЕСКИХ РЕАГЕНТОВ ДЛЯ НЕОРГАНИЧЕСКОГО АНАЛИЗА................................... 373
1. Органические реагенты для ионов металлов............. 373
Комплексообразующие группы реагентов................. 373
Природа иона металла . . . .......................... 375
2. Комплексы металлов в качестве реагентов....' . . . . 378
3. Некоторые перспективные направления исследований в области аналитических методов ................................... 379
Литература.................................................. 386
Предметный указатель........................................ 387
Д. Перрин
ОРГАНИЧЕСКИЕ АНАЛИТИЧЕСКИЕ РЕАГЕНТЫ
Редактор Г. М. Мануйлова Художник С. А. Бычков Художественный редактор Н. А. Фильчагина Технический редактор Л. П. Кондюкова Корректор О. К. Румянцева
Сдано в производство 2/VI 1967 г.
Подписано к печати 13/XI 1967 г.
Бумага тип. № 2 бОхЭО’/и. Бум. л. 12*75-Печ. усл. л. 25.5. Уч.-изд. л. 25,88.
Изд. № 3/3941. Цена 1 р. 97 к. Зак. № 395. Темплан 1967 г. нзд-ва «Мнр», пор. № 105.
Издательство «МИР»
Москва, 1-й Рижский пер., 2
Ленинградская типография № 8 Главполиграфпрома Комитета по печати при Совете Министров СССР