Author: Медведев Н.Н.
Tags: общая экология биоценология гидробиология биогеография биология генетика
Year: 1968
Text
Н. Н. МЕДВЕДЕВ ПРАКТИЧЕСКАЯ ГЕНЕТИКА
л.
/|\
/в
/|\
ж
/|\
Н. Н. МЕДВЕДЕВ
ПРАКТИЧЕСКАЯ
ГЕНЕТИКА
ИЗДАТЕЛЬСТВО НАУКА
1 р. 40 к.
«Практическая генети-
ка». Так называется кни-
га, выпущенная в свет в
начале этого года изда-
тельством «Наука».
Автор книги, Н. Н.
Медведев — известный спе-
циалист в области генети-
ки и выведения чистоли-
нейных лабораторных жи-
вотных — создал ценное
пособие для студентов
биологических и медицин-
ских вузов. В этом ори-
гинальном руководстве да-
но также описание прак-
тических занятий и опы-
тов по новейшим разделам
генетики, которые имеют
непосредственное отноше-
ние к медицине. Я имею
в виду главы, посвящен-
ные генетике опухолей,
трансплантации тканей и
иммуногенетике.
. .. Хочется высказать
пожелание, чтобы при пе-
реиздании был расширен
второй раздел руководства
«Генетика мыши».
Доктор медицинских
паук
Р. В. Петров
(Рецензия Р. В. Петрова
опубликована в «Меди-
цинской газете» 15 июля
1966 г.)
«Лабораторные заня-
тия», знакомящие уча-
щихся с методами генети-
ческих исследований и на-
глядно иллюстрирующие
новейшие закономерности
наследственности и измен-
чивости, являются необхо-
димым условием для проч-
ного а глубокого усвоения
основ генетики. Подобные
пособия не издавались в
СССР уже много лет, а
прежние давно стали биб-
лиографической редкостью.
Появление книги Н. В.
Медведева, заполняющей
этот пробел, нужно при-
ветствовать.
На протяжении всей
книги приводится отлич-
ное описание опытов Четко
сформулирована цель каж-
дого из них, в сжатой
форме приведены теорети-
ческие положения, нуж-
ные для понимания их
значения, с исчерпываю-
щей полнотой и ясностью
даны все указания по тех-
нике и методике подготов-
ки и проведения опытов,
а также учета получен-
ных результатов.
К преимуществам кни-
ги должно быть отнесено
и включение в нее спра-
вочных материалов, кото-
рые будут весьма полезны
и для педагогов, руково-
дящих лабораторными за-
нятиями по генетике, и
для лип, самостоятельно
изучающих генетику. К
числу таких материалов
относятся карты хромосом
дрозофилы, список ее упо-
требительных мутантов,
список и характеристики
линий и сублиний мышей
питомника Академии ме-
дицинских наук СССР,
список аннотированной ли-
тературы по генетике опу-
холей мышп».
С. М. Гершензон
(Рецензия проф. С. М. Гер-
шензона опубликована в
журнале «Генетика»,
вып. 7, 1966 г.)
н II МЕДВЕДЕВ ПРАКТИЧЕСКАЯ ГЕНЕТИКА
АКАДЕМИЯ НАУК СССР
Н. И. МЕДВЕДЕВ
ПРАКТИЧЕСКАЯ
ГЕНЕТИКА
Издание второе,
исправленное и дополненное
в
ИЗДАТЕЛЬСТВО «НАУКА»
Москва 1968
УДК 574 (07)
Н. Н. Медведев. Практическая генетика.
Издание второе, исправленное и дополненное, 1968 г.
Руководство состоит из двух разделов — «Генетика дро-
зофилы» и «Генетика мыши». Первый раздел посвящен систе-
матическому описанию опытов с дрозофилой по курсу гене-
тики для студентов биологических факультетов университе-
тов, медицинских, сельскохозяйственных и ветеринарных
институтов. Опыты знакомят со всеми основными законами
наследственности: менделизмом, хромосомной теорией наслед-
ственности, определением пола и наследованием сцепленных
с полом признаков, методами локализации генов в хромосомах,
искусственного получения и учета мутаций и т. д. Раздел
содержит список наиболее употребительных мутантов дро-
зофилы.
В раздел «Генетика мыши» вошли главы «Генетика тка-
невой совместимости» и «Генетика рака и восприимчивости
к опухолеродным вирусам». В этих главах на таких же мо-
дельных опытах с мышами рассмотрена важная роль наслед-
ственных факторов в явлениях совместимости органов и тка-
ней при транслантациях, в возникновении злокачественных
опухолей и восприимчивости к опухолеродным вирусам.
Практической части глав предпослано теоретическое и мето-
дическое введение, включающее пересмотр некоторых терми-
нов. Раздел снабжен списком имеющихся в СССР инбредлых
линий и су б линий мышей, а также ссылками на литератур-
ные источники, из которых можно почерпнуть сведения
о чисто линейных животных всех видов, поддерживаемых
в лабораториях всех континентов. Справочный аппарат
книги содержит карты хромосом мыши, список рекомендо-
ванной литературы, авторский и предметный указатели.
Книга может также служить руководством для само-
стоятельного, углубленного изучения основ генетики.
Рисунков 50, таблиц 51, библиография 117 названий.
2-10-2
510-67 (II)
ОГЛАВЛЕНИЕ
Список таблиц ................................................... 6
Список рисунков ................................................. 9
Предисловие к первому изданию................................. 13
Предисловие ко второму изданию................................. 17
Раздел I
ГЕНЕТИКА ДРОЗОФИЛЫ
Глава первая. Биология, морфология и разведение дрозофилы ... 22
Историческая справка (23). Температура и продолжительность
жизни дрозофилы (24). Половые признаки и строение полового
аппарата (25). Сравнительная характеристика мутантов (28).
Цикл развития дрозофилы (35). Инвентарь и инструменты для
работы с дрозофилой (37). Питательные среды (41). Приготовле-
ние питательной среды (45). Как обращаться с дрозофилой (46).
Подготовка мух и постановка опытов (47). Плотность населения.
Оптимальные условия откладки яиц (47). Клещ и меры борьбы
с ним (48). Книга протоколов опытов (48). Неудачи в постановке
опытов и пх возможные причины (50).
Глава вторая. Свободное колгбпнирование признаков у гибридов (мен-
делизм) ..................................................... 51
Общие и терминологические замечания (51).
Моногибридное скрещивание........................................ 56
Наследование доминантного признака Lobe (5<8). Наследование
рецессивного признака ebony (64).
Дигибридпое скрещивание.......................................... 65
Наследование рецессивных признаков ebony и vestigial (66).
Тригибридное скрещивание......................................... 70
Наследование рецессивных признаков brown, ebony и eyeless (70).
Взаимодействие генов и расщепления, уклоняющиеся от типичных
менделевских .................................................... 72
Расщепление 9 : 7 в скрещиваниях мутантов black и ebony (72).
Расщепление 27 : 37 в скрещивании мутантов “morula, glass и
eyeless (73). -Расщепление 13 : 3 в скрещивании мутантов
Lobe и eyeless (75).
Генотипический анализ F2 и возвратное (аналитическое) скрещивание 77
Системы обозначений генов ......................................... 81
Глава третья. Несвободное комбинирование признаков и другие глав-
нейшие случаи уклонений от типичных менделевских отно-
шений, обязанные сцеплению генов ............................. 83
3
Пол и наследование сцепленных с полом признаков................. 83
Наследование полудоминантпого, сцепленного с полом при-
знака Ваг. Прямое и реципрокное скрещивания (84). Наследо-
вание рецессивного, сцепленного с полом признака white.
Прямое и реципрокное скрещивания (89). Наследование до-
минантных признаков Beadex и Lobe. Прямое и реципрокное
скрещивания (92). Нерасхождение половых хромосом и откло-
нение от нормального способа наследования сцепленных с полом
признаков (96). Наследование при спаянных Х-хромосомах (98).
Пол как менделирующий признак (100). Вторичное нерасхожде-
ние половых хромосом п исключительные половые формы
у дрозофилы (101).
Сцепление генов и перекрест хромосом........................... 104
Полное сцепление генов, обусловленное отсутствием пере-
креста хромосом у самцов дрозофилы (106). Неполное сцепление
генов, обусловленное перекрестом хромосом у самок дрозо-
филы (107). Множественные перекресты (120). Интерференция
и индекс совпадения (127). Карты хромосом как основа для пред-
сказания частоты перекреста (130). Полнота хромосомных карт
дрозофилы (133). Влияние па перекрест внутренних и внеш-
них факторов (134).
Множественные аллеломорфы ..................................... 134
Значение множественных аллеломорф для понимания природы
гена (138).
Летальные гены ................................................ 139
’ Летальные гены в половой хромосоме (140). Летальные гены
в аутосомах (142). Сбалансированные системы летальных генов
и механизм балансирования (143). Заппратели перекреста (145).
Глава четвертая. Локализация генов............................. 149
Определение группы сцепления дробным способом ................. 150
Определение группы сцепления одномоментным способом............ 157
Метод рецессивных маркеров (157). Метод доминантных мар-
керов (160).
Определение локуса гена в хромосоме ........................... 162
Глава пятая. Методы искусственного получения и учета .мутаций
у дрозофилы .............................................. 166
Метод спаянных Х-хромосом на видимые мутации в Х-хромосоме 167
Метод С1В на летальные мутации в Х-хромосоме................... 169
Метод Мёллер-5 на летальные мутации в Х-хромосоме.............. 171
Методы учета летальных мутаций в аутосомах..................... 173
Карты хромосом Drosophila melanogaster ........................ 174
Список наиболее употребительных мутантов Drosophila melanogaster 175
Раздел П
ГЕНЕТИКА МЫШИ
Глава шестая» Генетика тканевой совместимости.................. 184
История вопроса (184). Терминологические и методические
замечания. Общие понятия (193). Гены гистосовместимости (193).
Типы‘животных (194). Типы трансплантаций'(195). Типы анти-
генов (195). Типы антител (196).
Дальнейшее изучение проблемы гистосовместимости генетическими
методами ...................................................... 197
Законы трансплантаций (199). Генетическая теория трансплан-
таций (200).
4
Идентификация основного локуса тканевой совместимости, 11-2 . . 206
Опыт Горера, Лимана и Спелла (206). Анализ локуса Н-2.
Метод сцепления (маркеров) (209). Компонентный метод (212).
Идентификация слабых локусов гистосовместимости ................. 213
Конгенные резистентные линии (214). Методы анализа конген-
ных липий (217). Метод сцепления (218). Метод Fl-гибридов (220).
Современное состояние проблемы гистосовместимости................ 222
Заключение (226).
Практическая часть............................................... 226
Методические замечания (226). Операции перевивки опухолей
(227). Методика трансплантаций кожи (228). Изотранспланта-
ции (231). Аллотрансплаптацпи (231). Гибрид отранспланта-
ции (233).
Глава седьмая. Генетика рака мышей п восприимчивости к опухоле-
родным вирусам........................................... 235
Введение (235).
Влияние генетических факторов на возникновение спонтанных опу-
холей ................................................... 236
Чистые линии (238).
Влияние генетических факторов на возникновение индуцированных
опухолей................................................. 242
Опухоли легких (242). Опухоли молочных желез (248).
Опухоли других локализаций (255). Заключительные замеча-
ния (255).
Практическая часть............................................ 258
Спонтанные опухоли (258). Индуцированные опухоли (261).
Заключение ................................................... 264
Список линий и сублиний мышей племенных питомников Академии
медпцпнеких наук СССР ............................ 266
Литература ко II разделу «Генетика мыши»...................... 281
Авторский указатель........................................... 287
Предметный указатель ..................................... 289
СПИСОК ТАБЛИЦ
Раздел I
ГЕНЕТИКА ДРОЗОФИЛЫ
Табл. 1. Рецепт Мёллера—Оффермана дрожжевой среды для дро-
зофилы ......................................................... 43
Табл. 2. Примерная форма дневника лабораторной работы .... 49
Менделизм
Табл. 3. Моногибридное скрещивание (LobeXNormal; ebonyXNormal 59
Табл. 4. Дигпбридное скрещивание (ebony X vestigial) .......... 67
Табл. 5. Тригибридное скрещивание (brown-ebony-eyelessXNormal) 71
Табл. 6. Взаимодействие генов. Расщепление 9 : 7 (black X ebony) 73
Табл. 7. Взаимодействие гепов. Расщепление 27 : 37 (morula-glass-
eyeless X Normal) .............................................. 74
Табл. 8. Взаимодействие генов. Расщепление 13 : 3 (LobeXeyeless) 76
Возвратное (аналитическое) скрещивание
Табл. 9. Расщепление в моногибридном возвратном скрещивании 78
Табл. 10. Расщепление в тригибридном возвратном скрещивании 80
Пол и наследование сцепленных
с полом признаков
Табл. И. Наследование сцепленных с полом признаков (Ваг и white) 85
Табл. 12. Расщепление 9 : 3 : 3 : 1 в дигибридиом скрещивании
(BeadexX Lobe) .................................................. 93
Табл. 13. Расщепление 3 : 1 : 3 : 1 в дигибридиом скрещивании
(LobeX Beadex) .................................................. 95
Сцепление гепов и перекрест хромосом
Табл. 14. Полное сцеплепие признаков как следствие отсутствия
перекреста хромосом у самцов дрозофилы............................ 107
Табл. 15. Единичный перекрест и образование кроссоверных гамет 113
Табл. 16. Неполное сцепление признаков как результат перекреста
хромосом у самок дрозофилы........................................ 116
Табл. 17. Образование кроссоверных гамет при наличии в хромосоме
генов трех мутационных особенностей .............................. 121
Табл. 18. Зависимость числа теоретически возможных типов крос-
соверных гамет от степени гетерозиготности хромосомы 122
6
Табл. 19. Теоретически возможные сорта гамет у самки, гетерози-
готной по семи парам генов Х-хромосомы......................... 124
Табл. 20. Расстояния между генами Х-хромосомы, определенные
па основе простых и сложных перекрестов........................ 126
Табл. 21. Интерференция и перекрест в соседних районах......... 127
Множественные аллеломорфы
Табл. 22. Расщепление в скрещиваниях аллеломорфных мутантов
из серии white ................................................ 137
Летальные гены
Табл. 23. Расщепление 2 : 1 при наличии летальных генов .... Ill
Табл. 24. Механизм сбалансированных систем летальных генов . . . 144
Табл. 25. Неполностью сбалансированные системы летальных генов 147
Локализация генов
Табл. 26. Программа скрещиваний по локализации гена............ 151
Табл. 27. Определение группы сцепления при помощи рецессивных
маркеров. Расщепление 9 : 3 : 3 : 1 как доказательство
свободного комбинирования признаков (отсутствие сцепле-
ния) .......................................................... 155
Табл. 28. Определение группы сцепления при помощи рецессивных
маркеров. Расщепление 2 : 1 : 1 : 0 как доказательство
несвободного комбинирования признаков (наличие сцеп-
ления) ....................................................... 156
Табл. 29. Определение группы сцепления. Неприменимость воз-
вратных скрещиваний для определения групп сцепления 157
Табл. 30. Определение группы сцепления при помощи рецессивных
маркеров. Отсутствие влияния перекреста на типичные
расщепления при свободном и несвободном комбинирова-
нии признаков.................................................. 160
Табл. 317 Определение группы сцепления при помощи доминантных
маркеров Star-Dichaete......................................... 161
Табл. 32. Схема скрещиваний по выведению двойного рецессива 164
Методы учета
искусственно вызываемых мутаций
у дрозофилы
Табл. 33. Метод double yellow для обнаружения видимых мутаций
в Х-хромосоме.................................................. 168
Табл. 34. Метод С1В для обнаружения летальных и видимых мутаций
в Х-хромосоме................................................ 170
Табл. 35. Метод Мёллер-5 для обнаружения летальных и видимых
мутаций в Х-хромосоме.......................................... 172
Табл. 36. Обнаружение летальных мутаций во'П хромосоме при по-
мощи инверсий ................................................. 173
Раздел II
ГЕНЕТИКА МЫШИ
Генетика тканевой совместимости
Табл. 37. Рост аденокарциномы молочной железы JwA японской
танцующей мыши у японских танцующих мышейобычных
мышей и их гибридов................................... 186
Табл. 38. Рост аденокарциномы молочной железы JwA у японских
танцующих мышей, обычных мышей и их гибридов ... 187
Табл. 39. Зависимость между процентом мышей, восприимчивостью
к трансплантируемой опухоли и числом генов, определяю-
щих восприимчивость ........................................... 189
Табл. 40. Сравнение наблюдаемых и ожидаемых результатов роста
опухоли JwA для 14—15 пар генов................................ 191
Табл. 41. Результаты опытов по перевивке кожи мышей инбредных
линий гибридам ................................................ 198
Табл. 42. Законы трансплантаций, разработанные в опытах на ли-
нейных мышах................................................... 201
Табл. 43. Гены гистосовместимости. Анализ моногибридного скре-
щивания ....................................................... 204
Табл. 44. Гены гистосовместимости. Апалпз дигибридного скрещива-
ния ........................................................... 205
Табл. 45. Схема и результаты опыта по обнаружению сцепления
между антигеном II Горера и геном Fused................. 207
Табл. 46. Аналитические скрещивания по идентификации аллелей
локуса Н-2 ................................. 211
Табл. 47. Четыре локуса гистосовместимости, идентифицированные
методом сцепления.............................................. 220
Табл. 48. Некоторые частные случаи применения компонентного
метода и метода F1-гибридов для анализа локусов гисто-
совместимости ................................................. 222
Табл. 49. Аллели и аллоантигенные специфичности локуса Н-2 у мы-
шей инбредных и конгенных линий................................ 224
Табл. 50. Трансплантации кожи на мышах конгенных и инбредных
линий.......................................................... 232
Табл. 51. Список линий и сублиний мышей племенных питомников
АМН СССР . . /..................................... 276
СПИСОК РИСУНКОВ
Раздел I
ГЕНЕТИКА ДРОЗОФИЛЫ
Биология, морфология и разведение дрозофилы
Рис. 1. Drosophila melanogaster.......................... 23
Рис. 2. Половые органы и хитиновый скелет брюшка дрозофилы 26
Рис. 3. Форма и расположение глазных фасеток и волосков .... 28
Рис. 4. Форма и размеры глаз............................. 29
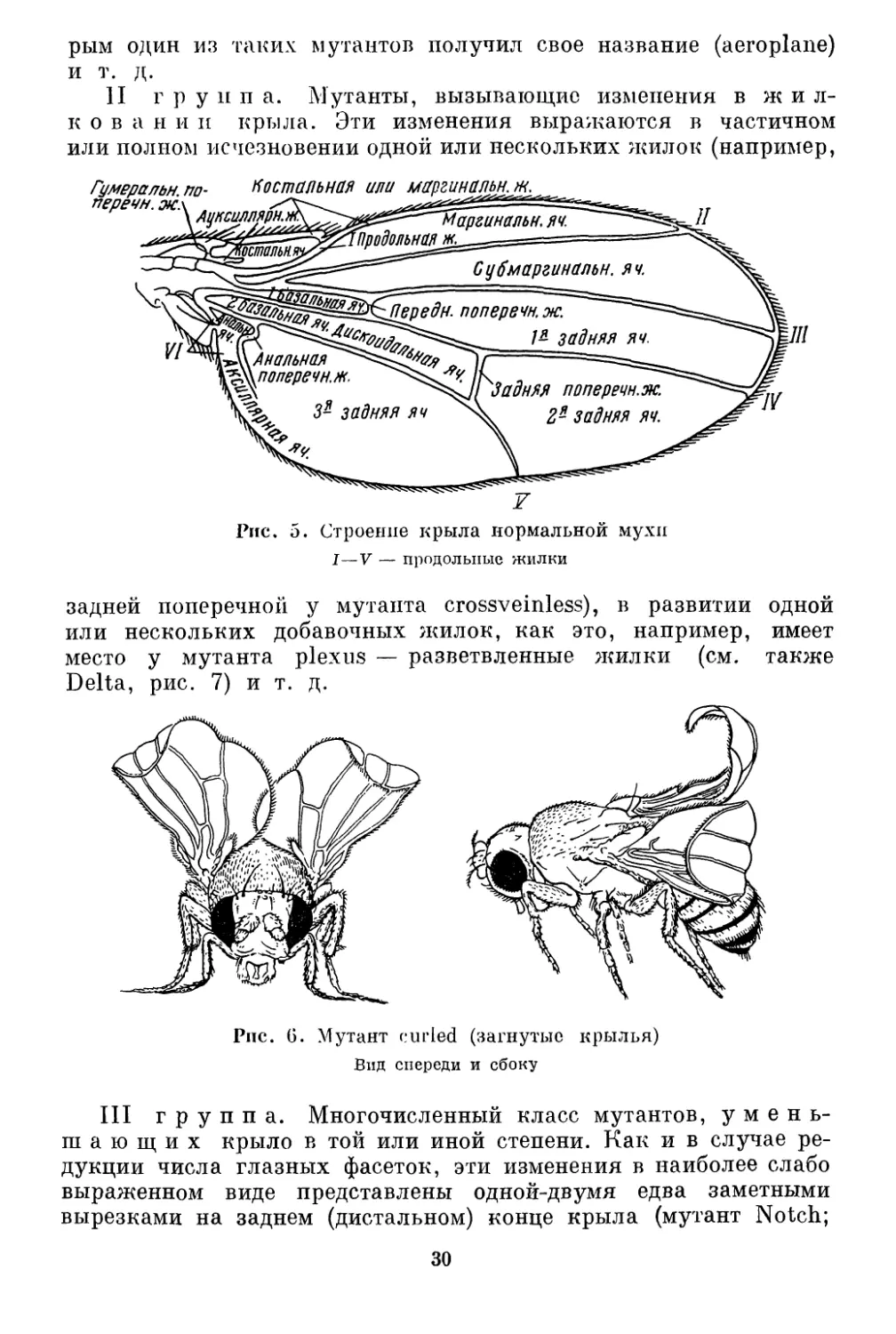
Рис. 5. Строение крыла нормальной мухи................... 30
Рис. 6. Мутант curled (загнутые крылья).................. 30
Рис. 7. Мутант Delta (дельтообразные расширения продольных жи-
лок на дистальном копце крыла).................................. 31
Рис. 8. Мутант Notch (вырезки па дистальном конце крыла, утол-
щения III и IV продольных жилок)................................ 31
Рис. 9. Аллеломорфные мутанты серии cut. Отличаются по степени
зазубренности крыльев........................................... 32
Рис. 10. Аллеломорфные мутанты серии vestigial.................. 33
Рис. 11. Мутант apterous (бескрылый)............................ 33
Рис. 12. Мутант forked (вильчатые щетинки) ..................... 33
Рис. 13. Расположение и названия щетинок (макрохет) нормальной
мухи............................................................ 34
Рис. 14. Мутант bithorax (удвоение груди)..................... 34
Рис. 15. Яйцо дрозофилы........................................ 35
Рис. 16. Морилка для работы с дрозофилой...................... 38
Рис. 17. Терморегулирующее устройство с ртутными терморегуля-
торами ......................................................... 39
Рис. 18. Терморегулирующее устройство с биметаллическими термо-
регуляторами ....................................... 40
Менделизм
Рис. 19. Дигибридное скрещивание (самка ebonyX самец vestigial) 69
Рис. 20. Диплоидные наборы хромосом дрозофилы.............. 84
Сцепление генов
Рис. 21. Наследование рецессивного, сцепленного с полом признака
white (белые глаза). Прямое скрещивание............................... 90
Рис. 22. Наследование рецессивного, сцепленного с полом признака
white (белые глаза). Реципрокное скрещивание 91
Рис. 23. Наследование рецессивного, сцепленного с полом признака
vermilion (киноварная окраска глаз) в случае первич-
ного псрасхождоипя X-хромосом ........................................ 97
Рис. 24. Наследование рецессивного, сцепленного с иолом признака
yellow (желтое тело) при спаянных Х-хромосомах .... 99
9
Рис. 25. Наследование рецессивного, сцепленного с полом признака
vermilion (киноварная окраска глаз) при вторичном
нерасхождении X-хромосом........................................... 102
Рис. 26. Половые хромосомы и определение пола у дрозофилы . . . 104
Перекрест хромосом
Рис. 27. Полное сцепление признаков как следствие отсутствия
перекреста хромосом у самцов дрозофилы. Скрещивание
Normal X black-vestigial; самцы FIX самки black-ve-
stigial ........................................................... 108
Рис. 28. Полное сцепление признаков как следствие отсутствия
перекреста хромосом у самцов дрозофилы. Скрещивание
black X vestigial; самцы FIX самки black-vestigial . . 109
Рис. 29. Неполное сцепление признаков как результат пере-
креста хромосом у самок дрозофилы. Скрещивание NormalX
X black-vestigial; самки FIX самцы black-vestigial .... 110
Рис. 30. Неполное сцепление признаков как результат пере-
креста хромосом у самок дрозофилы. Скрещивание black X ves-
stigial; самки FIX самцы black-vestigial........................... Ill
Рис. 31. Неполное сцепление признаков yellow и white. Скре-
щивание реципрокное: частота перекреста опреде-
ляется на самцах и самках F2....................................... 118
Рис. 32. Неполное сцепление признаков yellow и white. Скрещи-
вание прямое: частота перекреста определяется на
самцах F2.......................................................... 119
Рис. 33. Графики для определения истинной частоты перекреста
между генами Х-хромосомы на основе стандартных расстоя-
ний по карте....................................................... 131
Рис. 34. Графики для определения истинной частоты перекреста
между генами III хрохмосомы на основе стандартных рас-
стояний по карте................................................... 132
Рис. 35. Линейные взаимоотношения между генами на основании
данных по перекресту............................................... 163
Приложение. Карты хромосом Drosophila melanogastcr 174
Раздел II
ГЕНЕТИКА МЫШИ
Генетика тканевой совместимости
Рис. 36. Схема скрещиваний и трансплантаций опухоли по
выведению конгенных линий .................................. 215
Рис. 37. Схема скрещиваний и трансплантаций к о ж и по выве-
дению конгенных линий....................................... 217
Рис. 38. Карты хромосом мыши................................ 219
Рис. 39. Прибор (сито) для приготовления клеточной суспензии
опухолевой ткани ........................................... 228
Генетика рака и восприимчивости
к опухолеродным вирусам
Рис. 40. Типы и локализация опухолей у мышей, на частоту возник-
новения которых оказывают влияние соответствующие гены 241
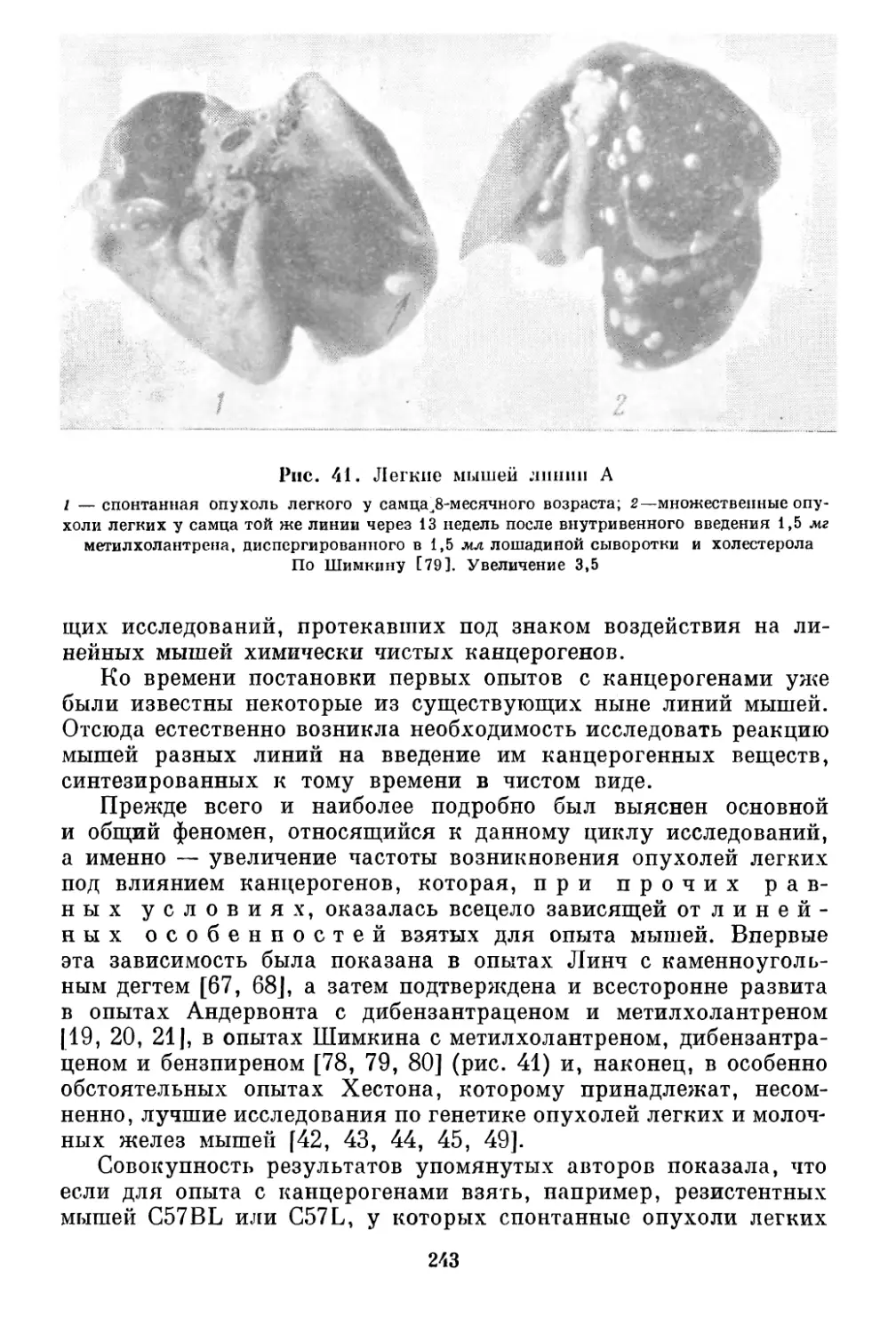
Рис. 41. Легкие мышей линии А со спонтанной и индуцированными
опухолями ................................................... 243
Рис. 42. Частота индуцированных опухолей легких у мышей A, C57L
и их гибридов ............................................... 244
Рис. 43. Частота спонтанных опухолей легких у мышей А и их гиб-
ридов с мышами C57L.......................................... 245
Рис. 44. Частота индуцированных уретаном опухолей легких у мы-
шей CC57W, CC67BR и их гибридов.............................. 247
Рис. 45. График линейной зависимости частоты опухолей легких
у мышей А от дозы дибензантрацена............................ 247
Рис. 46. Схема опыта по индукции опухолей в легких мышей А и
C57L, трансплантированных в одного и того же гибридного
хозяина F1............................................ 248
Рис. 47. Кривые падения частоты опухолей молочных желез у вы-
сокораковых мышей бэккроссных поколений в зависимости
от уменьшения у них доли восприимчивого хроматина . . 250
Рис. 48. Кривые повышения частоты опухолей молочных желез в за-
висимости от числа повторных возвратных скрещиваний,
увеличивающих вероятность привнесения бэккроссным сам-
кам фактора молока со спермой самцов СЗН..................... 251
Рис. 49. Кривые, иллюстрирующие отсутствие влияния повторных
скрещиваний с самцами СЗШ на повышение частоты опухолей
у бэккроссных самок всех серий выше контрольной.............. 252
Рис. 50. График, иллюстрирующий двусторонние связи и взаимо-
действие между популяциями патогенных агентов и макро-
организмов .................................................. 257
Памяти дорогого
Николая Ивановича
ВАВИЛОВА
посвящает
свой труд
автор
ПРЕДИСЛОВИЕ К ПЕРВОМУ ИЗДАНИЮ
Едва ли будет преувеличением сказать, что глубокое и прочное
усвоение основ генетики может быть достигнуто лишь в результате
серьезного знакомства с генетикой дрозофилы хотя бы в объеме
большого практикума как обязательной части курса общей гене-
тики. Этот элемент учебной работы дает возможность не только
закрепить полученные в теоретическом курсе знания, но и при-
обрести первые серьезные навыки в постановке самостоятельных
опытов, являющихся своего рода введением в научно-исследо-
вательскую или практическую деятельность будущего специа-
листа.
Дрозофила, как объект генетических исследований, сыграла
выдающуюся роль в разработке большинства проблем современ-
ной генетики, и ее значение в этом вопросе вряд ли можно пере-
оценить.
Первые опыты с дрозофилой Морган начал в 1909 г. С тех пор
до середины сороковых годов дрозофила почти безраздельно гос-
подствовала в теоретических исследованиях многочисленных авто-
ров. За это время генетика, как наука о наследственности, измен-
чивости и механизмах эволюционных преобразований видов, обога-
тилась открытиями принципиальной важности.
К числу их прежде всего относятся разработка хромосомной
теории наследственности, генетической теории определения пола
и полового баланса, детальное выяснение механизма возникнове-
ния разнообразных типов наследственных изменений и передачи
их в ряду последовательных поколений; внесена значительная
ясность в проблему гена и взаимодействия внешних и внутренних
факторов в процессах онтогенетического и филогенетического
развития; детально изучено действие проникающих излучений на
наследственное вещество клетки; вскрыты некоторые генетические
механизмы эволюционных преобразований рас и видов, причем
в ряде случаев было найдено, что эволюционные превращения
совершаются на наших глазах в природе гораздо более быстрыми
13
темпами, чем то представлялось самому Дарвину и его ближайшим
последов ателям.
Наконец, кратко перечисленные выше успехи этого периода
создали прочную экспериментальную базу и логические и теоре-
тические предпосылки для последующих важных открытий на
молекулярном уровне, свидетелями которых мы являемся сейчас.
Это обстоятельство необходимо подчеркнуть с особенной силой
в противовес тем вольным или невольным ошибочным предста-
влениям, которые не придают должного значения исследованиям
предшествовавшего периода в достижениях новейшей генетики
на молекулярном уровне. Таковым было и остается значение
дрозофилы как объекта генетических исследований.
Не меньшей популярностью пользуется дрозофила и как объект
учебный. Ничтожный период развития от яйца до imago, исклю-
чительное богатство мутационных рас, большинство из которых
характеризуется четким^ фенотипическим проявлением, малое
число хромосом и ряд других важных преимуществ дрозофилы
делают ее незаменимой для практической проработки основных
закономерностей наследственности в течение одного семестра и
с ничтожными затратами на организацию опытов.
Указанному назначению отвечает первая часть настоящего
руководства ~ «Генетика дрозофилы», в которой в процессе
анализа конкретных опытов с этим классическим объектом чита-
тель знакомится со всеми основными разделами генетики.
Во второй части руководства на основе таких же модельных,
хотя гораздо более длительных и более дорогостоящих, опытов
делается попытка привлечь внимание учащейся молодежи к тем
важным разделам биологии и медицины, в плодотворной разра-
ботке которых генетические принципы и методы исследования
приобретают все большее значение. К числу их относятся природа
и причины возникновения злокачественных опухолей, природа
противоопухолевого иммунитета и иммунитета при транспланта-
циях нормальных органов и тканей, терапия лучевых поражений
и целый ряд других вопросов медицины и биологии.
Было бы неосмотрительно утверждать, что роль генетических
факторов в перечисленных разделах медицины и биологии вскрыта
с такой же степенью убедительности, с какой вскрыты общие
закономерности наследственности, о которых идет речь в первой
части руководства. Тем не менее из большого количества твердо
установленных экспериментальных фактов, накопленных в каждой
из упомянутых областей, уже сейчас можно вычленить те, которые
с несомненностью говорят о важном значении наследственных
факторов в перечисленных выше явлениях и ознакомление с кото-
рыми ныне может быть осуществлено в порядке постановки учеб-
ных опытов.
Потребность в систематизации твердо установленных фактов
из области генетики рака, трансплантационного иммунитета и
14
многих других проблем под этим углом зрения диктуется также
и тем, что в отечественной литературе они до самого последнего
времени не были затронуты вовсе. К этому необходимо добавить,
что столь важный предмет, как онкология, в программах медицин-
ских институтов отсутствует. Названные разделы отсутствуют
также в «Руководстве по общей онкологии» (Медгиз, 1958) и
в книге «Модели и методы экспериментальной онкологии» (Медгиз,
1960). Поэтому и с этой точки зрения сведение относящихся сюда
экспериментальных данных к элементарным учебным опытам пред-
ставляется нам не только своевременным, но и совершенно необ-
ходимым.
Главным объектом, на котором разрабатывались вопросы при-
роды и причин возникновения рака, трансплантационного имму-
нитета и многие другие проблемы, является мышь. По степени
генетической изученности мышь в настоящее время приближается
к дрозофиле, и при наличии под руками соответствующих линий
на ней можно осуществить многие из тех опытов, о которых идет
речь в первой части руководства. Однако было бы нецелесообразно
дублировать этот раздел пособия на мышах, так как постановка
учебных опытов на этом объекте растянулась бы на несколько лет
и потребовала бы несоизмеримо больших затрат по сравнению
с тем, когда эти опыты проводятся на дрозофиле.
Поэтому из обширной литературы по генетике мыши для дан-
ного раздела руководства заимствованы результаты лишь тех
экспериментальных исследований, которые имеют непосредствен-
ное отношение к упомянутым выше проблемам. Что же касается
собственно генетики мыши, то в случае необходимости с ней можно
ознакомиться по зарубежным сводкам, лучшая из которых при-
надлежит Г. Грюнебергу (Griineberg [41с]).
По тем же соображениям мы сочли излишним привлекать для
учебных целей ботанические объекты, на которых не все законо-
мерности наследственности могут быть продемонстрированы
с такой же степенью убедительности, с какой это можно сделать
на дрозофиле. С другой стороны, у дрозофилы уже давно известны
и подробно изучены так называемые меланотические опухоли,
генетическая природа которых была доказана неоднократно. Тем
не менее в программу практических занятий мы не сочли возмож-
ным включить опыты с этими опухолями как по причине их гисто-
логического своеобразия, так и систематической отдаленности
дрозофилы от млекопитающих.
В заключение несколько слов о характере и соподчиненности
материалов, приводимых в обеих частях руководства. Законо-
мерности, изложению которых посвящена первая часть руко-
водства, уже давно стали достоянием учебников и прочно вошли
в арсенал точного анализа биологических явлений. Они едва ли
могут вызвать сомнения или возражения по существу, и потому
15
представляется совершенно излишним подкреплять их ссылками
на первоисточники.
То же самое мы не рискуем утверждать в отношении материа-
лов второй части руководства, учитывая как трудность и новизну
самой попытки систематизировать относящиеся сюда эксперимен-
тальные данные для целей настоящего пособия, так и широкий
диапазон точек зрения на природу тех явлений, о которых здесь
идет речь. И все же, несмотря на это, мы будем считать свою по-
пытку удавшейся, если она будет одобрительно встречена хотя бы
частью наших читателей и возбудит у них интерес к этой области
исследований. С этой же целью мы сочли необходимым снабдить
второй раздел пособия списком аннотированной литературы,
к которой читатель может обратиться в поисках ответа на интере-
сующие его вопросы.
Автор
Институт эпидемиологии и микробиологии имени Н. Ф. Гамалеи
Академии медицинских наук СССР
Москва
ПРЕДИСЛОВИЕ КО ВТОРОМУ ИЗДАНИЮ
Тираж первого издания «Практической генетики» разошелся
не только быстрее, чем то можно было ожидать, но и оказался
явно недостаточным. Книга встретила также благожелательное
отношение как в напечатанных рецензиях, так и в тех письмах,
которые были присланы автору читателями.
Как и предполагалось, первый раздел книги — «Генетика дро-
зофилы» — не вызвал серьезных критических замечаний, за исклю-
чением нескольких терминологических и некоторых других не-
существенных погрешностей, на которые было указано профес-
сорами С. М. Гершензоном, Р. В. Петровым и Е. Т. Поповой,
за что автор выражает им свою благодарность. Поэтому, кроме
небольшого дополнительного параграфа «Общие и терминологи-
ческие замечания», в котором объединены относящиеся сюда све-
дения, разбросанные в разных местах текста и в примечаниях,
все другие незначительные изменения этого раздела в основном
носят «косметический» характер.
Что касается второго раздела руководства — «Генетика мыши»,
то здесь мнения разошлись. Проф. С. М. Гершензон и некоторые
читатели указывали на желательность выделения материала этого
раздела в расширенное самостоятельное издание, аргументируя
свою точку зрения тем, что он представляет интерес главным обра-
зом для медиков.
Другая, подавляющая, часть читателей, и в том числе другой
рецензент, проф. Р. В. Петров, напротив, выражали сожаление
о том, что именно в этом разделе была недостаточно развернута
теоретическая и методическая сторона тех вопросов, о которых
в нем шла речь. И с этим нельзя было не согласиться: за исключе-
нием двух-трех специальных и малодоступных журнальных статей,
затронутые в этом разделе вопросы ни разу не были освещены
в аналогичных изданиях и для широкого круга читателей были
в известном смысле новыми. С этой точки зрения, мнения обоих
рецензентов не были взаимоисключающими; они только лишний
раз подтвердили наличие интереса к генетической стороне проблем
2 Н. Н. Медведев 17
гистосовместимости и природы и причин возникновения злокаче-
ственных опухолей.
Более важным является вопрос о том, представляют ли рас-
сматриваемые проблемы общебиологический, а не только меди-
цинский интерес. И здесь, по нашему мнению, едва ли могут воз-
никнуть серьезные сомнения: об этом говорит как вся предше-
ствующая история их развития, так и профиль и опыт работы таких
учреждений как Джексоновская лаборатория (Бар Харбор),
Национальный раковый институт (Бесезда) США и другие анало-
гичные учреждения.
Джексоновская лаборатория ни в коей мере не является меди-
цинским учреждением. Однако с ней неразрывно связано все
развитие генетической теории тканевой совместимости, начиная
с первых дней ее существования. Проблему тканевой совмести-
мости широко разрабатывают во всех странах мира, с разных
точек зрения- и разными методами: хирургии, блокировки реак-
ций антиген — антитело, облучения, терапии и т. д. Лаборатория,
о которой идет речь, сосредоточила свое внимание исключительно
на генетической стороне вопроса. Равным образом, такие заболе-
вания, как рак, нарушения обмена, диабет, анемии, мышечные
расстройства и т. д., изучают повсеместно и столь же разносто-
ронне; Джексоновская лаборатория изучает генетику рака, гене-
тический контроль метаболизма, генетику диабета, анемий, мышеч-
ной дистрофии и т. д. [40].
Название «Национальный раковый институт» говорит само
за себя. Тем не менее, хотя и в шутку, но не без оснований, сами
сотрудники нередко называют его «национальным институтом по
генетике рака мышей», а те классические исследования В. Е. Хе-
стона, о которых речь идет в главе VII, выполнены в том его от-
деле, который носит название «биологии рака». Большой удель-
ный вес занимают и у нас немедицинские учреждения, в которых
ведется та или иная работа по генетике рака [15]. Поэтому рас-
смотрение проблем, затронутых в разделе «Генетика мыши», по
крайней мере, на данном этапе и в рамках данного руковод-
ства представляется нам не только уместным, но и необхо-
димым.
В данной связи нельзя не сослаться также на недавнюю статью
Е. Е. Погосянц «Развитие в Советском Союзе исследований по
генетике злокачественных новообразований» [15]. Отдав должное
пионерам разработки проблемы генетики рака в СССР и рассмотрев
те ее разделы, по которым исследования уже начаты или находятся
в стадии организации, автор пришел к заключению, что «в на-
стоящее время вопросы собственно генетики опухолей (иначе
говоря, вопросы главного направления проблемы генетики рака. —
Н. М.) у нас почти не разрабатываются, хотя смежные проблемы
иммуногенетики и генетики тканевых трансплантаций, возникшие
в свое время па почве генетики перевиваемых опухолей мышей,
18
Привлекают все большее внимание» (стр. 14, курсив наш. —
н. м.у
Следовательно, снова встает задача подготовки специалистов
и организации исследований по обеим рассматриваемым проб-
лемам. Говоря об организации исследований по генетике гисто-
совместимости, и особенно по генетике рака, необходимо отметить
относительную дороговизну и длительность онкологических ис-
следований вообще. Однако мы знаем по личному опыту, что даже
в те годы, когда исследования генетической стороны этих вопро-
сов были непопулярны, все же кое-что можно было сделать,
понятно, при наличии постоянного к тому интереса. Поэтому и
здесь можно повторить лишь то, что было сказано по этому поводу
в предисловии к первому изданию: мы будем считать свою попытку
удавшейся, если идеи, о которых идет речь, найдут отклик хотя бы
у незначительной части наших читателей и возбудят у них инте-
рес к этой области исследований.
В соответствии с вышесказанным и с предоставленными нам
возможностями раздел «Генетика мыши» для настоящего издания
написан заново с одновременным сокращением числа глав с четы-
рех до двух. В первую очередь это относилось к главам «Генетика
перевиваемых опухолей» и «Генетические основы совместимости
нормальных органов и тканей при трансплантациях». В свете
современных данных, свидетельствующих о единой биологической
основе поведения злокачественных и нормальных тканей при
трансплантациях, отныне отпала необходимость рассматривать
их как отдельные главы учения о тканевой совместимости. По-
этому упомянутые главы первого издания объединены в одну,
общую, главу — «Генетика тканевой совместимости».
Как известно, биологические науки не изобилуют такими
закономерностями, в которых те или иные процессы и явления
можно было бы облечь в простые математические формулы. Тка-
невой совместимости в этом отношении повезло: их установлено
здесь, по крайней мере, пять. Пользуясь этими законами и форму-
лами, мы можем теперь планировать программы исследований на
многие поколения вперед и с такой степенью предвидения их ре-
зультатов, на которую не осмеливалась претендовать ни одна из
бесчисленных трансплантационных теорий прошлого. Современ-
ное состояние проблемы гистосовместимости лишний раз свиде-
тельствует о том, что если то или иное биологическое явление
покоится на генетической основе, на сцену рано или поздно вы-
ступают все те же законы Менделя, как круциальное дока-
зательство его справедливости.
На основании аналогичных доводов объединены также главы
«Генетика рака мышей» и «Генетические основы инфекционности
опухолеродных вирусов». И здесь мы руководствовались тем, что
влияние опухолеродных вирусов во всех тех случаях, где это
доказано с несомненностью, представляют собой лишь частные
9*
19
случаи общебиологического принципа взаимодействия патогенных
агентов с организмом хозяина. С генетической точки зрения, пет
оснований усматривать принципиальную разницу между влиянием
на макроорганизм опухолеродпого вируса, туберкулезной палочки,
вируса скрепи и т. д. И в том, и в другом, и во всех аналогичных
случаях, при прочих равных условиях, чаще поражаются те особи
данной популяции, расы или вида, которые генетически менее
устойчивы к действию ' данного патогенного агента. Разница
в каждом случае сводится лишь к конечному результату влияния
на макроорганизм патогенного агента, зависящему от его природы,
характера взаимодействия и реакции на него со стороны хозяина.
В основу составления вводных, теоретических разделов рас-
сматриваемых глав положены два принципа — историзм развития
проблем и сущность и преемственность методов исследования;
в совокупности они, по нашему мнению, способствуют лучшему
пониманию предмета. Понятно, что и в новой редакции обе главы
второго раздела охватывают лишь наиболее важные исследования
и в первую очередь — их генетическую и методическую стороны.
Для облегчения нахождения справок и дальнейших сведений обе
главы снабжены ссылками на соответствующие литературные
источники.
Генетика тканевой совместимости — быстро развивающаяся
область исследований. Как следствие этого она время от времени
вынуждена пересматривать и вносить поправки в, казалось бы,
устоявшиеся термины и понятия. В настоящем издании их содер-
жание приведено в соответствие с современным состоянием про-
блемы.
Автор выражает благодарность за разрешение воспроизвести
в печати таблицы 41, 47, 49, 50 и рис. 38, заимствованные из на-
стольного руководства по биологии лабораторной мыши Эрлу
Л. Гриину, издателю названного труда [39], Георгу Д. Снеллу
и Маргарите К. Гриин, а также И. К. Егорову — за просмотр
главы VI рукописи и за сделанные им ценные замечания.
Автор
Ордена Трудового Красного Знамени
Институт эпидемиологии и микробиологии им. Н. Ф. Гамалеи
Академии медицинских наук СССР
Москва
РАЗДЕЛ ПЕРВЫЙ
ГЕНЕТИКА ДРОЗОФИЛЫ
ГЛАВА ПЕРВАЯ
БИОЛОГИЯ, МОРФОЛОГИЯ
И РАЗВЕДЕНИЕ ДРОЗОФИЛЫ
Четыре наиболее важные особенности дрозофилы, а именно:
1) ничтожный срок развития от яйца до взрослой мухи; 2) исклю-
чительно высокая плодовитость; 3) богатство наследственных рас
или мутаций, обнаруженных в ее культурах в лабораторных усло-
виях, и 4) малое число хромосом делают ее незаменимым объектом
не только для изучения специальных вопросов генетики, но и для
чисто учебных целей при прохождении курса генетики.
Под этим углом зрения мы предпошлем специальной части
руководства тот необходимый минимум сведений по биологии и
морфологии дрозофилы, знакомство с которым должно быть обя-
зательным для каждого, начинающего опыты с этим объектом.
* * *
Drosophila melanogaster х, иначе плодовая, или уксусная, муха
(рис. 1)1 2, принадлежит к семейству Drosophilidae из отряда Diptera.
Это очень маленькая мушка, величиной около 3 мм, с ярко-крас-
ными глазами и серым телом.
Строго говоря, муха дикого типа не является серой (gray),
хотя это обозначение и укрепилось за ней в американской, а затем
и в отечественной литературе. Однако этот термин вошел в обиход
настолько прочно, что попытка заменить его другим, более со-
ответствующим действительности, едва ли привела бы к желаемым
результатам.
Родиной D. melanogaster, по-видимому, надо считать Индо-
Малайскую область. В настоящее время она почти космополит и
населяет Северную и Южную Америку, Африку, Австралию,
Японию и Южную Европу (до Северной Франции). В пределах
Советского Союза D. melanogaster обычна на Кавказе и на Украине.
1 Дрозофила в переводе с латинского означает любящая росу, влагу;
меланогастер — с черным брюшком.
2 Рисунки дрозофилы выполнены художником С. II. Рубиным.
22
В летнее время вместе с потоком фруктов и овощей из южных
районов страны она проникает далеко на север.
Питается дрозофила ферментируемыми фруктами, овощами,
древесным соком и в районах ее обитания легко может быть пой-
мана поблизости от фруктовых садов и деревьев. Для этого доста-
точно в летний солнечный день выставить в саду или на огороде
стаканчик с какими-либо фруктами или_овощами. Мухи вскоре
Рис. 1. Drosophila melanogaste.r
i — самка; 2 — самец
собираются на них и легко могут быть собраны и введены в куль-
туру. В лабораториях мух разводят на питательной среде, рецепты
которой приведены ниже (стр. 41).
Нижеследующее краткое описание дрозофилы относится к той
ее расе, или форме, которая обитает в природе и поэтому носит
название дикой (wild type), или нормальной (Normal).
Оба эти названия применяются также и в том случае, когда ее
разводят в лабораторных условиях.
Все случаи сравнения с нормальной мухой различных мутан-
тов, мутантных форм, или рас, отличающихся от дикого типа
какими-либо измененными морфологическими особенностями,
каждый раз будут оговорены особо.
Историческая справка
Для разработки некоторых биологических вопросов дрозо-
фила впервые была использована в лабораторных опытах Карпен-
тером в самом начале текущего столетия. В течение последующих
23
лет ряд авторов интенсивно изучал на ней влияние родственных
скрещиваний, условий содержания, роли в пище микроорганиз-
мов и т. д.
В 1910 г. Морганом была обнаружена первая мутационно
возникшая наследственная раса дрозофилы, а именно белоглазая
(white), а вскоре затем и многие другие, называемые ныне мута-
ционными или просто мутантами. Начиная с этого
времени, дрозофилу усиленно изучают многие исследователи и
главным образом Морган и его ближайшие сотрудники — Стерте-
вант, Мёллер и Бриджес. Параллельно генетическому анализу
дрозофилы они производят цитологический анализ хромосом.
Плодотворность объединенных методов исследования позволила
этим авторам тщательно и всесторонне разработать законы на-
следственности, изложению которых посвящены нижеследующие
главы.
Ряд теоретических вопросов генетики — искусственное полу-
чение мутаций и природа гена, определение пола и локализация
половых факторов в хромосомах, проблема осуществления гена,
генетика популяций, механизм расо- и видообразования и многие
другие проблемы — интенсивно изучаются на дрозофиле и дали
весьма важные результаты для решения не только специальных
вопросов генетики, но и общей биологии и эволюции видов.
Температура
и продолжительность жизни дрозофилы
В лабораторных условиях при температуре, несколько пре-
вышающей 31°, дрозофила становится бесплодной полностью или
частично. Однако, будучи обитателем тропического климата, она
в природных условиях переносит более высокую температуру, что
связано с усиленным испарением влаги с поверхности земли и
понижением температуры нижних слоев воздуха, в которых оби-
тает дрозофила.
В лабораторных условиях нормальной температурой для
дрозофилы надо считать 24—25°. При этой температуре цикл разви-
тия ее от яйца до взрослой мухи равен приблизительно 10 суткам.
При температуре 27° цикл развития сокращается до 9 суток. Раз-
витие яйца длится 20 час., а развитие личинки и куколки — 8 су-
ток, из которых 4 суток продолжается личиночная стадия и столько
же стадия куколки. Таким образом, имеется возможность полу-
чить в год 40 поколений дрозофилы. Для сравнения полезно вспом-
нить, что вся история человечества исчисляется числом поколений,
не превышающим нескольких сотен.
С понижением температуры развитие дрозофилы сильно за-
медляется. Так, при 10° личиночный период растягивается до
57 дней, а куколочный — до 13—14 дней; при 20° эти сроки со-
ответственно равны 8 и 6,3 дня.
24
Продолжительность жизни взрослой мухи, т. е. с момента вы-
лупления ее из куколки, в лабораторных условиях равна 3—4 не-
делям и в значительной мере зависит от условий содержания (тем-
пературы, влажности, пищи, плотности населения, наличия в пи-
тательной среде бактерий). В специальных опытах дрозофила жила
до 153 дней.
Что касается различных мутационных форм, то их жизнеспо-
собность в большинстве случаев понижена по сравнению с дикой
мухой. Однако известны мутационные расы, которые в лаборатор-
ных условиях обладают даже повышенной ио сравнению с нор-
мальными мухами жизнеспособностью.
Половые признаки и строение
полового аппарата
Самки и самцы дрозофилы (рис. 1) несколько отличаются по
величине и по ряду других морфологических признаков. Самки
несколько крупнее самцов, хотя величина тех и других сильно
колеблется в зависимости от условий питания, особенно в период
личиночного развития.
Брюшко у самки несколько округлое, с заостренным концом;
у самца оно более цилиндрическое, с притупленным концом и
сплошь пигментированными (черными) несколькими последними
брюшными тергитами, по которым самца можно легко отличить
от самки. Тергитами у насекомых называются скелетные
хитиновые пластинки брюшка со спинной стороны. У самки
имеется восемь хорошо развитых тергитов, у самца — шесть,
причем шестой и седьмой тергиты слиты (рис. 2, V/), а восьмой,
по-видимому, вошел в состав полового аппарата (рис. 2, VIII,
8t). Стернитами называются такие же хитиновые пла-
стинки с брюшной стороны. У самки их также на один больше,
чем у самца (не развит шестой стерпит), и у обоих полов не развиты
первый, второй, седьмой и восьмой стерниты.
К числу вторичнополовых признаков относятся половые
гребешки самца, представляющие собой ряд крепких хити-
новых щетинок на первом членике лапки передних ног. У самки
половые гребешки отсутствуют.
> На ружные половые органы самки (рис. 2,
/, II) состоят из влагалища (и), по сторонам которого расположены
две вагинальные пластинки (ир), а сзади них — анальный буго-
рок, состоящий из двух анальных пластинок (а), расположенных
одна над другой (дорзовентрально).
Внутренний половой аппарат самки
(рис. 2, 1—IV) состоит из:
1) двух гроздевидных яичников (ри), имеющих каждый по
несколько десятков яйцевых трубочек;
2) яйцевода (pd) и влагалища (р);
25
Рис. 2. Половые органы и хитиновый
скелет брюшка дрозофилы
I— IV — самки; V—VIII — самца. Объяснение в тексте
3) трех семяприемников, из которых один трубчатый (г) и
два грибовидных (/, sp, IV);
4) придаточных желез, или паровариев (ро).
Протоки семяприемников и придаточных желез впадают во
влагалище. Непарный трубчатый семяприемник представляет собой
длинную спиральную трубку. У спаривавшихся самок он напол-
нен пучками спермы. В полости влагалища нередко можно видеть
зрелое яйцо (рис. 2, /, е) с заключенной внутри него почти вполне
развитой личинкой.
Наружные половые органы самца (рис. 2,
V— VIII) имеют более сложное строение. Они состоят из гениталь-
ной пластинки и пениса с прилегающими к нему частями. Гени-
тальная пластинка (g) представляет собой подковообразное хити-
новое образование. Внутри ее открывается анальное отверстие,
по бокам которого латерально расположены две анальные пла-
стинки (а). С брюшной стороны генитальная пластинка несет две
пары отростков, к которым причленяется пенис с его придат-
ками.
Собственно пенис (р) имеет вид ложкообразной хитиновой
пластинки, несущей по краю ряд хитиновых зубцов. Вместе с рас-
положенными по бокам от него тремя парами стержневидных
придатков он сочленяется с хитиновым стержнем, служащим для
прикрепления мышц пениса. Все эти части полового аппарата
покоятся на треугольной хитиновой пластинке (рис. 2, У//, 9s),
которая сочленяется с генитальной пластинкой.
Внутренний половой аппарат самца
(рис. 2, У) состоит из:
1) парных семенников (t);
2) парных семенных пузырьков (vs);
3) придаточных желез (ag);
4) непарного семявыносящего протока (vd);
5) непарного bulbus ejaculatorius (&);
6) непарного семяизвергательного канала (de).
Семенники представляют собой спирально свернутые трубки,
переходящие в семенные пузырьки (vesiculae seminales), которые
в свою очередь переходят в короткие и тонкие семенные канальцы
(vasa efferentia), соединяющиеся непосредственно перед впадением
в семявыносящий проток (vas deferens) в короткий непарный сте-
белек. Семявыносящий проток, в передний отдел которого впа-
дают мешковидные придаточные железы (ag), впадает в bulbus
ejaculatorius. Как показывает его название, bulbus ejaculatorius
играет роль насоса, всасывающего сперму из семявыносящего
протока и выбрасывающего ее наружу через семяизвергательный
канал (de), который открывается в основании пениса.
Как правило, самки не спариваются в течение 24 час. после
вылупления. Однако при температуре несколько выше нормаль-
ной иногда можно наблюдать копуляцию мух и моложе указан-
27
ного возраста, в особенности если в культуре имеются старые
самцы. Копуляция длится 20 мин., срок, который является видо-
вой характеристикой рассматриваемого вида.
Сравнительная характеристика мутантов
К числу органов дрозофилы, чаще всего подвергающихся
мутационным изменениям, относятся глаза, крылья и щетинки.
Глаза нормальной мухи устроены по обычному
типу сложных фасеточных глаз насекомых. Сложный глаз со-
стоит из многих простых глазков, так называемых фасеток,
Рис. 3. Фор^иа и расположение глазных фасеток и волосков
1 — нормальная муха; 2 — мутант Star (звездчатые глаза)
или омматидий (рис. 3). Число их у самок около 780, у сам-
цов около 740. Каждая фасетка, или омматидий, состоит из чув-
ствительных клеток и проводящих нервных путей. Последние
соединяют глаз с довольно сложно устроенным головным мозгом.
Мутации, затрагивающие различные особенности глаз, весьма
разнообразны. Наиболее многочисленны те, которые изменяют
свойственную диким мухам пигментацию глаза, усили-
вая ее до цвета бордо или сепии или ослабляя до бесцветного,
белого. Между этими крайними состояниями существуют все
возможные переходы. Таковы эозиновый, вишневый, абрикосо-
вый, розовый, коралловый, карминовый, багряный, винно-
красный.
Большое число мутаций затрагивает форму глаза, строение
и расположение фасеток. У нормальной мухи фасетки располо-
жены наподобие ячеек пчелиных сот (рис. 3, 7). У некоторых
глазных мутантов правильность в расположении фасеток нару-
шена, и они кажутся как бы встряхнутыми и перемешанными
в беспорядке. Типичными примерами таких мутаций являются
rough (грубые фасетки), Star (звездчатый; рис. 3, 2) и многие
Другие.
28
Следующей по степени нарушений нормального строения глаз
является категория таких мутационных изменений, которые
приводят к почти полной редукции глазных фасеток, вслед-
ствие чего поверхность глаза представляется ровной и гладкой.
Таков, например, мутант glass (стекловидный) с глазами, ли-
шенными пигмента. Наиболее сильными по степени редукции
рассматриваемого органа являются мутации Ваг (полосковид-
ный; рис. 4, 2, 3), Lobe (лопастной), eyeless (безглазый) и др.
Редукция глаз у этих мутантов заходит настолько далеко, что
по сравнению с нормальными они уменьшены в несколько раз
(число фасеток в глазу самки Ваг не превышает 70), а иногда,
Рис. 4. Форма и размеры глаз
1 -- нормальная самка; 2 — гомозиготная самка Ваг; з — самец Ваг; 4 — гете-
розиготная самка Ва
как, например, у Lobe или eyeless, и вовсе могут отсутствовать.
В связи с этим общие размеры головы мух значительно уменьшены
по сравнению с головой нормальной мухи.
У перечисленных глазных мутантов редукция чувствующих
элементов глаза сопровождается редукцией соответствующих
отделов головного мозга (оптических ганглиев). Более чем вероятно,
что столь резкие нарушения строения глаза связаны с теми или
другими, еще не достаточно изученными нарушениями нормальной
физиологической деятельности внутренних органов мухи.
Строение крыла нормальной мухи представлено на рис. 5.
Там же приведены названия жилок крыла и образуемых ими
ячеек, которые имеют значение систематических признаков
в семействе Drosophilidae.
Мутационные изменения, затрагивающие крыло, условно мо-
гут быть расчленены на три группы.
I группа. Мутанты, модифицирующие общую конфи-
гурацию крыла. В отличие от крыла нормальной мухи,
являющегося плоским (при рассмотрении в профиль — прямым),
у различных мутантов оно может быть изогнуто в виде арки
(мутант аге), лыжи (мутант ski), закручено кверху (мутанты
Curly, curled; рис. 6), книзу (curved) или своим положением
во время полета напоминать крыло самолета, по сходству с кото-
29
рым один из таких мутантов получил свое название (aeroplane)
и т. д.
II группа. Мутанты, вызывающие изменения в ж и л-
к о в а н и и крыла. Эти изменения выражаются в частичном
или полном исчезновении одной или нескольких жилок (например,
Рис. 5. Строение крыла нормальной мухи
I—V — продольные жилки
задней поперечной у мутанта crossveinless), в развитии одной
или нескольких добавочных жилок, как это, например, имеет
место у мутанта plexus — разветвленные жилки (см. также
Delta, рис. 7) и т. д.
Рпс. 6. Мутант curled (загнутые крылья)
Вид спереди и сбоку
III группа. Многочисленный класс мутантов, умень-
шающих крыло в той или иной степени. Как и в случае ре-
дукции числа глазных фасеток, эти изменения в наиболее слабо
выраженном виде представлены одной-двумя едва заметными
вырезками на заднем (дистальном) конце крыла (мутант Notch;
30
рис. 8). Через серию постепенных переходов (мутант cut —
вырезанный; рис. 9; Truncate и dumpy — то же; Beaded и Веа-
dex — вырезанный; small wing — маленькие крылья; rudimen-
tary — рудиментарные крылья и т. д.) редукция приводит к почти
полному (vestigial — зачаточные крылья, рис. 10) или полному
исчезновению крыла, как это имеет место у мутанта apterous
(бескрылый, рис. 11).
Почти все перечисленные крыловые мутанты хорошо видимы
невооруженным глазом. Этот список можно было бы пополнить
рядом других, более мелких мутационных изменений крыла,
Рпс. 7. Мутант Delta (дельтообразные
расширения продольных жилок на ди-
стальном конце крыла)
Рис. 8. Мутант Notch (вырез-
ки па дистальном конце кры-
ла, утолщения III и IV про-
дольных жилок)
видимых лишь при некотором увеличении. Однако и сказанного
достаточно для того, чтобы составить представление о богатстве
и разнообразии наследственных рас дрозофилы.
Нам остается вкратце рассмотреть изменения, касающиеся
еще одного образования на теле дрозофилы, а именно щетинок
и волосков.
Щетинки, или макрохеты (bristles), у дрозофилы,
как и у прочих Diptera, имеют значение систематического признака.
Расположение и названия отдельных щетинок дрозофилы при-
ведены на рис. 13.
Мутационные изменения, затрагивающие щетинки, вызывают
их исчезновение и реже — удвоение на голове,
груди и щитке (скутеллюме). Таков, например, мутант Dichaete,
у которого отсутствуют две передние дорзоцентральные, а иногда
и одна из двух задних дорзоцентральных щетинок; мутант scute,
31
у которого отсутствуют скутеллярные и некоторые другие ще-
тинки; мутант spineless — с очень короткими щетинками; мутант
forked — с вильчатыми щетинками (рис. 12) и многие другие.
В отличие от щетинок волоски, или микрохеты
(hairs), расположены по всему телу мухи и в отдельности не иден-
тифицируются. Для них также известно много мутационных
Рис. 9. Аллеломорфные мутанты серии cut. Отличаются ио степени
зазубренности крыльев
изменений, выражающихся в образовании добавочных
волосков, в ином их расположении ит. д.
Из других особенностей мухи следует отметить пигментацию
тела, аристы, или усики (видоизмененные последние членики
антен, рис. 13), глазки, или ocelli (рис. 13), ножки, брюшные
тергиты. Для каждого из этих признаков известно большее или
меньшее число мутантов.
32
Рис. 10. Аллеломорфные мутанты серии vestigial
1 — vestigial (зачаточные крылья); 2 — antlered (оленеро-
гий); .3 — strap (полосконидпые крылья)
Рис. 11. Мутант apterous (бескры- Рис. 12. Мутант forked
лый) (вильчатые щетинки)
Рис. 13. Расположение п назва-
ния щетинок (макрохет) нормаль-
ной мухи
А — голова: a or, т or, р or —
передние, средние и задние орбиталь-
ные; ос — оцеллярные; г v, о v—вну-
тренние и наружные вертикальные;
р v — поствсртикальныс. Б — грудь
(торакс): uh, lh — верхние и нижние
гуморальные; а пр, р пр — передние
и задние нотоплевральные; ps— прс-
зутуральные; а за, р за — передние
и задние супраалярные; а ра, р ра —
передние и задние посталярные; a de,
р de — передние и задние дорзоцен-
тральпые. В — щиток (скутеллюм):
а зс, р зс — передние и задние ску-
теллярные
Рис. 14. Мутант bithorax (удвоение груди)
1 — муха bit Догах с хорошо развитой второй парой крыльев; 2—6 — разные степени
развития второй пары крыльев и дополнительного торакса; 7 — нормальная муха для
сравнения
На рис. 14 изображена муха bithorax, у которой мутационное
изменение выражается в удвоении грудных сегментов и развитии
второй пары крыльев — признак, который в систематическом
отношении выходит за пределы отряда двукрылых насекомых.
Цикл развития дрозофилы
Яйца дрозофилы (рис. 15) несколько вытянутые, около 0,5 мм
в длину. В свежих культурах их легко заметить отложенными
на питательный среде большей частью поблизости от стенок
стаканчика, где содержится меньше влаги.
Яйцо дрозофилы так же, как и других насекомых, защищено
с поверхности двумя оболочками разного происхож-
дения. Одна из них, внутренняя, принадлежит к категории пер-
вичных оболочек, образуемых самим яйцом, и называется
желточной. Наружная оболочка
образована фолликулярным эпителием
яичника и носит название хориона.
У дрозофилы хорион имеет своеобраз-
ную архитектуру, напоминающую пче-
линые соты, несколько вытянутые в
направлении длинной оси яйца. Под
большим увеличением микроскопа при
помощи тонких препаровальных иго-
лок хорион легко можно удалить с
яйца.
Рис. 15. Яйцо дрозофилы.
Вид со спинной стороны
1 — микропиле; 2 — филаменты
Яйцо дрозофилы позволяет разли-
чить передний и задний конец, а так-
же брюшную (вентральную) и спинную
(дорзальную) стороны, соответствующие
тем же отделам будущего зародыша.
На переднем конце яйца, на вершине небольшого сосочка, имеется
отверстие, микропиле, ведущее внутрь яйца и служащее
для проникновения в него сперматозоида. От передней части спин-
ной поверхности яйца отходят и идут по направлению кпереди
и в стороны два длинных отростка, представляющие собой вы-
росты хориона. Это так называемые филаменты, предо-
храняющие яйцо от погружения в жидкую среду.
Оплодотворение яйца происходит в момент прохождения его
через верхний отдел влагалища. Если откладка оплодотворенного
яйца задержана какими-либо неблагоприятными условиями,
то оно проходит первые стадии развития в половых путях самки
и к моменту откладки на питательную среду содержит развитую
личинку. Однако в нормальных условиях эмбриональное разви-
тие протекает вне тела матери и при температуре 27° продолжается
около 20 час.
35
3*
Вылупление личинки из яйца и начало постэмбрионального
развития связано с усиленным питанием и ростом. Избыток
пищи на этой стадии жизни особи имеет большое значение: в зна-
чительной мере он определяет не только размеры мухи, но и
ее жизнеспособность.
Первое время после вылупления личинки остаются на поверх-
ности питательной среды. Затем они уходят в глубь ее и остаются
там до момента окукления.
С внешней стороны окукление начинается с того, что личинки,
покидая среду, перестают питаться и некоторое время оживленно
ползают по стенкам стаканчика. Затем онц становятся непод-
вижными, значительно сокращаются в длину и приобретают
характерную для куколки боченкообразную форму. В культуре
с избытком влаги большинство личинок окукливается на стенках
стаканчика. Если же среда достаточно плотная, то почти все
личинки окукливаются на поверхности питательной среды.
В отношении внутренних изменений окукление личинки зна-
менует собой начало новой стадии в развитии мухи, связанной
с перестройкой (метаморфозом) ее органов. Про-
цесс перестройки заключается в том, что личиночные органы
(кроме нервной системы и половых желез) подвергаются обрат-
ному развитию и замещаются другими, которые развиваются
из определенных зачатков эмбриональной ткани, носящих наз-
вание им аг ин а л ь ны х дисков, или примордиев.
Имагинальные диски представляют собой впячивания гиподермы
и образуются у дрозофилы на ранних стадиях личиночной жизни.
Возможно, что некоторые из них образуются еще до вылупления
личинки из яйца.
В начале возникновения имагинальные диски очень малы и
с трудом могут быть найдены в полости тела. По мере роста ли-
чинки увеличиваются и имагинальные диски. К моменту окук-
ления они уже окончательно сформированы, а некоторые из них,
например, имагинальные диски глаз, обладают рядом струк-
тур, свойственных дефинитивному органу: под сильным увели-
чением микроскопа в них отчетливо видны отдельные фасетки
(омматидии), и их число фиксировано уже на стадии взрослой
личинки.
Из таких же имагинальных дисков, дифференцированных
в большей или меньшей степени, развиваются и все другие органы
мухи: ножки, крылья, антенны, половой аппарат и т. д.
Таким образом, куколочный период развития характеризуется,
с одной стороны, разрушением личиночных органов и тканей
(гистолиз), с другой — развитием из имагинальных дисков дефи-
нитивных органов взрослой мухи (гистогенез). Как было указано
выше, при температуре 27° период куколочного превращения
равен четырем суткам.
36
Приблизительно с конца третьих суток через покров куколки
становятся заметными очертания глаз, в которых к тому времени
вырабатывается желтоватый пигмент. За несколько часов до вы-
лупления хороню видны также и крылья; глаза к тому времени
приобретают ярко-красный цвет и хорошо видны через полу-
прозрачный хитиновый покров куколки.
Вылупление мухи и освобождение ее от покровов куколки
(пупариума) достигается нагнетанием жидкости в так называемый
лобный пузырь, вследствие чего оболочка куколки
на переднем конце разрывается, и муха освобождается от пупа-
риума. Молодые, только что вылупившиеся мухи имеют значи-
тельно более длинное и почти лишенное пигмента желтоватое
тело, короткие, еще не расправившиеся крылья и нежные ще-
тинки. По этим признакам их легко можно отличить от взрослых
мух.
Отметим еще одну особенность личинки, которая позволяет
различить ее пол на очень ранних стадиях развития. Благодаря
неравномерному росту гонады мужских и женских личинок
различаются по величине, начиная с момента вылупления
их из яйца: мужские гонады (семенники) в несколько раз круп-
нее женских (яичников) соответствующего возраста и при доста-
точно сильном увеличении бинокулярной лупы их легко обнару-
жить у живой личинки при рассматривании ее сверху. Семенники
расположены между третьим и четвертым задними сегментами
и в проходящем свете представляются в виде двух светлых оваль-
ных пузырьков, хорошо видимых через прозрачную хитиновую
оболочку.
Таким же путем можно идентифицировать и пол куколки,
правда спустя не более 24 час. с момента окукления. Иденти-
фикация пола куколки на более поздних стадиях затруднена
вследствие того, что хитиновая оболочка уплотняется, темнеет
и становится малопрозрачной.
Инвентарь и инструменты для работы с дрозофилой
Для работы с дрозофилой необходимо следующее простое и
недорогостоящее оборудование:
1) Стаканчики или пробирки и вата для
изготовления пробок. Наиболее удобными по размерам являются
обычные, так называемые оконные стаканчики емкостью 100 см3
(диаметр 4 см. высота 10 см). Количество пищи и число самок
для них указаны на стр. 45. За отсутствием стаканчиков можно
с успехом пользоваться широкими (бактериологическими) про-
бирками, соответственно уменьшив как количество питательной
среды, так и число самок на пробирку (до 1—2).
2) Эфир и морилка. В простейшем случае морилкой
может служить такой же стаканчик, в котором разводят мух.
37
1
Рис. 16. Морилка для работы с дрозофилой
1 — стеклянный стаканчик с ватой для эфира; 2 — деревянное кольцо — дер-
жатель для воронки; з — латунная воронка; 4 — желатиновая капсула с отвер-
стиями для проникновения паров эфира; 5 — морилка в собранном виде
Сверху стаканчик закрывается крышечкой с тонкой металли-
ческой сеткой. Морилка более совершенной и удобной конструк-
ции представлена на рис. 16. Основные ее достоинства — эконо-
мия эфира, отсутствие его паров в рабочей комнате и быстрота
наркотизирования мух.
3) Тонки й (глазной) пинцет для разбора мух.
4) Молочно-белое стекло размером приблизи-
тельно 5x10 см.
5) Бинокулярная лупа со слабым и средним уве-
личениями.
6) Мясорубка, кастрюля и любой нагре-
вательный прибор для приготовления питательной
среды.
7) Весы и мензурка для отвешивания и отмеривания
составных частей питательной среды.
8) Этикетки или карандаши для письма по стеклу.
9) Термостат.
В простейшем случае термостатом может служить плотный
деревянный шкаф емкостью на 100—200 культур (в зависимости
от числа работающих). Для этой цели в щкафу необходимо устроить
полки и установить электрические лампы. С их помощью можно
достаточно точно регулировать температуру шкафа, включая
и выключая количество действующих ламп?
38
A
Рис. 17. Терморегулирующее устройство с ртутными терморегуляторами
А — без пр от и во ав ари йн ой цепи: 1 — ртутный терморегулятор; 2 — запасной
резервуар для ртути, позволяющий устанавливать терморегулятор на нужную температуру; з—ин-
дукционная катушка; 4 — сердечник электромагнита; 5 — амортизирующие пружины сердечника;
6 — ртутный прерыватель тока; 7 — электропечь. Прибор в положении «подогрев выключен».
Б — с противоаварийным устройством: 1 — рабочий терморегулятор; 2—ава-
рийный терморегулятор; 3 — электропечь; 4 — ртутный прерыватель; 5 — якорь электромагнита;
6 — индукционная катушка; 7 — индукционная катушка противоаварийной цепи; 8 — противо-
аварийное устройство; 9 — якорь электромагнита; 10 — ось электромагнита; 11 -— пружина;
12 — проводящий сектор барабана; 13 — изолирующий сектор барабана. Прибор в положении «по-
догрев включен»
В местах, где электрическое обогревание шкафа нельзя на-
ладить, подогрев можно осуществить при помощи керосиновой
лампы, направив ток теплого воздуха в шкаф через жестяную
трубку. Понятно, что эта система подогрева небезопасна в пожар-
ном отношении и требует осторожности.
Для специальных работ, когда требуется более точная темпе-
ратура термостата, внутренние стенки шкафа следует выложить
теплоизоляционной прокладкой
(лучше всего пробковыми пла-
стинами), а в цепь нагреваю-
Рис. 18. Терморегул прующее устройство с биметаллическими
терморегуляторами
А — схема включения; 1 — рабочее биметаллическое реле; 2 — проти-
воаварийное биметаллическое реле; 3 — пружина рабочей цепи; 1 — пру-
жина противоаварийпой цепи; 5 — рабочий биметаллический прерыва-
тель; 6 — противоаварийный биметаллический прерыватель; 7 — элек-
тропечь. Прибор в положении «подогрев включен». Б — прибор в собран-
ном виде. Обозначения те же
щих шкаф электрических приборов включить терморегулятор.
Наиболее распространенные в биологических лабораториях
терморегуляторы принадлежат к двум типам. Одни из них —
контактные — включают и выключают нагревательные приборы
при помощи реле (рис. 17). Другие терморегуляторы, так назы-
ваемые биметаллические, в принципе более просты, но нуждаются
в противоаварийных устройствах, исключающих возможность
повышения температуры выше заданного максимума в результате
припаивания контактов. Рисунок и схема включения такого
терморегулятора приведены на рис. 18.
40
Питательные среды
Главными составными частями среды, на которой разводят
дрозофилу в лабораториях, являются сахар и дрожжи. Сахар
вносят в среду в виде изюма, патоки или сусла. Он является тем
субстратом; на котором развиваются дрожжи; последние состав-
ляют главный элемент пищи дрозофилы. Кроме того, дрожжи
предохраняют среду от поражения плесенью. Патоку следует
брать неочищенную, более темную (так называемую черную),
по не светлую; после очистки сернистым газом светлая патока
содержит серу, которая нередко губит личинок.
В качестве составного компонента в питательную среду входит
также агар-агар, который придает среде желеобразную конси-
стенцию.
Иногда агар-агар бывает недостаточно очищен от различных
химических примесей и в том числе от брома (коричневатый,
с явным запахом брома). Такой агар-агар перед употреблением
следует промыть в течение двух-трех дней в проточной воде.
Соответственно с этим для приготовления питательной среды
нужно брать определенные навески сухого агар-агара и после
промывки учесть содержание в них воды.
В американских лабораториях дрозофилу разводят на бана-
нах с прибавлением к ним агар-агара и воды в следующей пропор-
ции (в г):
Вода...........100
Бананы..........100 (1)
Агар-агар ...... 2
В отечественных лабораториях дрозофила с успехом культи-
вируется на среде, изготовляемой по одному из следующих ре-
цептов (в г):
Вода...........100
Изюм.............50 (2)
Агар-агар....... 2
Среду, изготовленную по этому рецепту, можно считать на-
дежной во всех отношениях.
В целях экономии изюма и отчасти агар-агара можно с успе-
хом пользоваться средой следующего состава (в г):
Вода.............200
Картофель .... 100 (3)
Изюм..............75
Агар-агар......... 2
Изготовленная по рецепту (3) среда обладает значительным
преимуществом: развивающиеся на ней мухи более крупные,
41
нежели в том случае, если они развились на чистой изюмной
среде.
Пропорции изюма и картофеля рецепта (3) можно разнообра-
зить в широких пределах. В крайнем случае питательную среду
можно приготовить и вовсе без изюма по следующему рецепту
(В г):
Вода...........100
Картофель .... 100 (4)
Агар-агар .... 1
Необходимо, однако, отметить, что мухи, выведенные на кар-
тофельной среде, сравнительно скоро погибают, по-видимому,
ввиду наличия в культурах большого количества бактерий и
грибков. Поэтому картофельную среду можно рекомендовать
лишь для культур, не предназначенных для длительного наблю-
дения.
Нижеследующий рецепт питательной среды рекомендуется
для длительных культур, а также для поддержания основных
линий дрозофилы, которые пересаживают на свежую среду реже
других. На среде этого состава (в г) интервалы между очередными
пересадками культур можно продлить до двух месяцев.
Вода..............200
Патока............20 (5)
Кукурузная мука 15
Агар-агар........1,5
Для маложизнеспособных основных линий рецепт (5) нелишне
улучшить добавлением 5—15 г изюма.
В тех случаях, когда это возможно, изюм с успехом можно
заменить патокой (или солодовым суслом) в смеси с кукурузной
мукой в следующих отношениях (в з):
Вода.............. 75
Кукурузная мука 10 (6)
Патока............ 14
Агар-агар...........1,5
Мёллер и Офферман разработали рецепт (7) питательной
среды, важнейшим компонентом которой являются прессованные
дрожжи (табл. 1). Самые грубые подсчеты показывают, что на
среде этого состава развивается мух в три-четыре раза больше,
нежели на среде, изготовленной по любому из вышеприведенных
рецептов. Кроме того, на дрожжевой среде мухи развиваются
значительно быстрее, очень крупные, с прекрасным проявлением
всех признаков, облегчающих классификацию слабо выраженных
мутантов.
42
Т а б л и ц а 1
Рецепт Мёллера—Оффермана дрожжевой среды для дрозофилы
(рецепт 7)
.*» Для получения необходимого коли- чества среды1 Нужно взять, г
бутыл- ки стакан- чики про- бирки воды агар-агара2 сухих дрожжей изюма патоки кукуруз- ной муки
1 21/2 5 371/2 2 (0,7) 7,5 2 2,5 2,5
2 5 10 75 4 (J.5) 15 4 5 5
4 10 20 150 8 (3,0) 30 8 10 10
6 15 30 225 12 (4,5) 45 12 15 15
8 20 40 300 16 (6,0) 60 16 20 20
10 25 50 375 20 (7,5) 75 20 25 25
12 30 60 450 24 (9,0) 90 24 30 30
14 35 70 525 30 (11,5) 115 28 35 35
16 40 80 600 32 (12,0) 120 32 40 40
18 45 90 675 36 (13,5) 135 36 45 45
20 50 100 750 40 (15,0) 150 40 50 50
25 62 125 940 50 (19,0) 190 50 62 62
30 75 150 ИЗО 60 (22,5) 225 60 75 75
35 87 175 1320 69 (26,0) 260 70 87 87
40 100 200 1500 80 (30,0) 300 80 100 100
45 112 225 1700 90 (34,0) 340 90 112 112
50 125 250 1880 100 (37,0) 380 100 125 125
1 В 1 бутылку вносится столько же питательной среды, сколько в 2’/, стаканчика
или в 5 пробирок.
2 В скобках указаны навески очищенного (волокнистого или гранулированного)
агар-агара.
Следует, однако, отметить, что дрожжевая среда отчасти
обладает тем же недостатком, что и картофельная. Благодаря ли
обилию развивающихся в культуре мух или наличию в среде
неблагоприятно действующих на дрозофилу бактерий и грибков,
развившиеся на такой среде мухи живут сравнительно недолго.
Поэтому дрожжевую среду нельзя употреблять для поддержания
основных линий, во-первых, из-за нежелательности их частых
пересадок и, во-вторых, из-за риска утраты по причине быстрого
отмирания мух. _
Дрожжевая среда стбит^ несколько дороже по сравнению,
например, с картофельной. Оцдако различие не столь велико,
чтобы с ним можно было считаться, принимая во внимание от-
меченную выше разницу в количестве мух, развивающихся на той
и па другой среде. Поэтому применение дрожжевой среды можно
43
рекомендовать во всех случаях, за исключением поддержания
основных линий.
Приготовленная питательная среда не может сохраняться
дольше трех-четырех дней, особенно когда она уже разлита
в стаканчики или пробирки. Главным препятствием к тому яв-
ляется плесень. Хорошим средством для предупреждения раз-
вития в культурах плесени является лип а г кн. представляю-
щий собой этил бензойной кислоты (ethylparahydroxybenzoate).
10%-ный раствор нипагина готовят на 96°-ном спирте и в та-
ком виде хранят в лаборатории. Перед разливанием среды
в пробирки нипагин вносят в нее из расчета 10 мл раствора на 1 л
среды, что в пересчете на сухой нипагин составляет 0,1%.
Готовую среду удобно также сохранять в холодильнике, где
она может оставаться месяц и больше. Холодильники с отрица-
тельными температурами непригодны, так как охлажденный
ниже 0° агар-агар теряет коагулирующие свойства и среда ста-
новится непригодной для употребления (разжижается).
Заслуживают также внимания так называемые синтети-
ческие питательные среды, употребляемые в тех специальных
исследованиях с дрозофилой, в которых необходимо создать
максимальную идентичность условий развития. В таких случаях
в качестве составных компонентов питательной среды употреб-
ляют химически-чистые вещества (препараты), благодаря чему
достигается полная однородность среды и сравнимость резуль-
татов опытов, выполняемых в разное время в разных лабораториях.
Приводимый ниже рецепт (8) синтетической питательной среды
(в г) для двух видов дрозофилы, D. melanogaster и D. simulans,
разработан Дж. Сангом (76а) и является одним из лучших.
Казеин (генатозан с низ- Никотиновая кислота 0,0012
ким содержанием ви- Пантотенат кальция 0,0016
тамина) 5,50 Пиридоксин 0,00025
Агар-агар (оксоид, № 3) 3,00 Биотин 0,000016 (8)
Сахароза 0,75 Фолиевая кислота . . . 0,0003
Лецитин Рибонуклеиновая ки- 0,40 NaHCO3 0,150
слота, дрожжевая . . Холестерил 0,40 кн2РО4 0,183
0,03 Na9HPO4 0,180
MgSO4.7H2O 0,062
Анеурин 0,0002
Рибофлавин 0,0001 Нода до 100 мл
Среда этого состава содержит все компоненты, необходимые
для нормального развития, роста и окукления личинок, мета-
морфоза куколок и вылупления мух упомянутых видов при оди-
наковой продолжительности цикла развития как на среде при-
44
веденного состава, так и на обычной среде, засеянной живыми
дрожжами.
Потребность в основных питательных компонентах была най-
дена одинаковой для личинок обоих видов. Исключение состав-
ляет биотин, который оказался необязательным компонентом
для роста и развития D. simulans: развитие личинок этого вида
протекает нормально как в отсутствие в среде биотина, так и в кон-
центрации, достигающей указанной в рецепте.
Среда приведенного состава является безбактериальной. Про-
цедура стерилизации яиц, а также подробная библиография,
касающаяся разработки синтетических питательных сред для
дрозофилы, приведены в статьях Дж. Санга и Ф. Эрка (32а, 76а).
Приготовление питательной среды
----------------------------.-----
Изюм очищают от различных инородных примесей, моют
в воде и размельчают двукратным пропусканием через мясорубку.
К нему прибавляют, если нужно, необходимое количество варе-
ного и очищенного картофеля, также пропущенного через мясо-
рубку. Затем в отмеренном количестве воды при кипячении рас-
творяют агар-агар. Когда агар-агар полностью растворится, в каст-
рюлю вносят изюм и картофель. Смесь кипятят еще 10—20 мин.
при постоянном помешивании, после чего в горячем состоянии
ее разливают в стаканчики или пробирки. На стаканчик емкостью
100 мл необходимо взять 25 мл питательной среды.
Через 30—40 мин. среда застывает в виде довольно плотного
желе. После этого ее поверхность при помощи кисточки смазы-
вают дрожжами (2—3 г обычных продажных дрожжей разводят
в 50 мл воды), и среда готова к употреблению. При массовом из-
готовлении среду засевают дрожжами при помощи пульвериза-
тора.
Чтобы наркотизированные мухи, будучи перенесены на све-
жую среду, не прилипли к ее влажной поверхности, их помещают
в свернутые из бумажных полосок вороночки (так называемые
«фунтики»), в которых они остаются до тех пор, пока не прос-
нутся от эфира.
Традиционные «фунтики» с большим успехом можно заменить
конфетти, насыпанным непосредственно на засеянную дрожжами
среду. В процессе жизнедеятельности личинки увлекают кон-
фетти в среду, тем самым способствуя ее аэрации и лучшему
использованию.
Разливать среду в стаканчики или пробирки следует так,
чтобы она не попадала на стенки: тонкий слой ее скоро подсы-
хает, и отложенные на нем яйца погибают. Во избежание этого
рекомендуется разливать среду при помощи воронки, укреплен-
ной на штативе. На горлышко воронки надевают мягкую рези-
новую трубку с моровским зажимом.
45
Как обращаться с дрозофилой
Все манипуляции с мухами выполняют под наркозом. В ка-
честве наркотизирующего вещества употребляют серный эфир
pro narcosi. В случае крайней необходимости можно пользоваться
хлороформом. Однако мухи переносят его значительно хуже,
чем эфир, поэтому наркотизировать мух хлороформом нужно
с большой осторожностью.
Перетряхивание мух из культуры в морилку и их наркотизи-
рование требует некоторых навыков и выполняются следующим
образом. Осторожным встряхиванием или постукиванием паль-
цами о стенки стаканчика следует перегнать мух подальше
от пробки, затем быстро открыть ее и столь же быстро приставить
к отверстию стаканчика другой такой же стаканчик (одинакового
диаметра), служащий морилкой. После этого морилку нужно
ориентировать по направлению к свету и так как мухи положи-
тельно фототропичны, то они скоро почти все соберутся в морилку.
Теперь остается легким постукиванием о стенки стаканчика
стряхнуть в морилку немногих оставшихся в нем мух, после чего
морилку быстро отнять и закрыть сетчатой крышкой. На сетку
крышки положить смоченную эфиром ватку.
Как только мухи перестали двигаться, их нужно тотчас вы-
тряхнуть из морилки. От большой дозы эфира мухи погибают
через 3—5 мин. Характерный признак погибших от эфира мух —
растопыренные кверху и в стороны крылья и безжизненно вытя-
нутые лапки. Умеренное же, хотя бы и многократное наркотизи-
рование мух позволяет держать их под наркозом часами без
вредных последствий. Разумеется, следует также остерегаться
того, чтобы в морилку попала с ваты капля эфира: мухи в этом
случае моментально погибают. Поэтому перед тем как смоченную
эфиром вату положить на крышку морилки, из нее нужно отжать
избыток эфира.
Знакомство с морфологическими особенностями мух и сравне-
ние между собой различных мутационных рас удобнее всего про-
изводить под слабым увеличением бинокуляра, располагая мух
на молочно-белом стекле. Этот способ особенно удобен для срав-
нения мутантов с различными оттенками окраски глаз, тела
и т. д. Брать мух можно только пинцетом за крылышки или ножки,
если мухи бескрылые. Для детального сравнения многих призна-
ков мух выгодно ориентировать одинаковым образом по отноше-
нию к источнику света, для чего необходимо расположить
их на молочно-белом стекле в ряд, одну возле другой. В этом слу-
чае все тончайшие различия, особенно в окраске глаз, выступают
весьма отчетливо.
Если во время просмотра мухи начинают просыпаться от нар-
коза, их следует накрыть крышкой от морилки и снова дать не-
большую дозу эфира.
46
Подготовка мух и постановка опытов
Жизнеспособная сперма может сохраняться в половых путях
самки в течение нескольких суток после спаривания. Поэтому
каждая оплодотворенная самка в любой данный момент может
содержать в семяприемнике некоторое количество спермы от
предыдущей копуляции. Отсюда возникает необходимость брать
для скрещиваний заведомо девственных самок не старше 10—
12 час. после вылупления.
Для этой цели из тех культур, из которых надлежит взять
девственных самок, за несколько часов до начала массового вы-
лета мух следует удалить родительских или вообще недевствен-
ных мух. После этого культуру просматривают через 8—10-часо-
вые интервалы. Вылупляющихся девственных самок изолируют
от самцов и используют для скрещиваний. Получение девствен-
ных самок в пределах указанных сроков в особенности рекоменду-
ется начинающим, так как большая часть неудач в их опытах
связана с несоблюдением именно этого условия. Морфологические
особенности только что вылупившихся мух рассмотрены на стр. 37.
Плотность населения.
Оптимальные условия откладки яиц
В каждый стаканчик емкостью 100 мл с 25 мл питательной
среды следует сажать 3—4 самки; число самцов, разумеется, не
влияет на плотность населения в культуре. Превышение указан-
ной нормы нежелательно во избежание в культуре перенаселения
(crowding effect), что влечет за собой значительное измельчение
мух и сокращение продолжительности их жизни.
Первые l1^—2 суток после вылупления самки дрозофилы не
откладывают яиц. Кладка начинается лишь с конца вторых суток
и при благоприятных условиях продолжается до конца жизни.
Число яиц, откладываемых одной самкой, сильно варьирует и
зависит от плодовитости линии и от состояния питательной среды.
В среднем одна самка откладывает 200—300 яиц. При благоприят-
ных условиях содержания мух Бриджесу удавалось получить
от одной самки до 2000 и более яиц.
Кладка яиц лучше всего происходит на среду, на которой до-
статочно хорошо проросли дрожжи. Этот оптимум откладки яиц
лежит между 24—36 час. после того, как питательная среда была
засеяна дрожжами. По мере старения культуры и усиления бро-
жения питательной среды интенсивность откладки яиц падает.
Поэтому не рекомендуется заготовлять стаканчики с питательной
средой впрок на длительное время; в крайнем случае ее можно
хранить 2—3 дня и лучше не засеянной дрожжами. Готовую
среду удобно хранить в холодильнике, где она может надежно
сохраняться в течение длительного времени.
47
Клещ и меры борьбы с ним
Бичом дрозофилы в лабораторных условиях является малень-
кий, величиной с яйцо дрозофилы клещ, который иногда настолько
обильно размножается на мухах, что может погубить их, если
своевременно не принять соответствующих мер.
Лучшее средство борьбы с клещами — это содержание в чистоте
стаканчиков для среды, а главное ватных пробок, которые при
повторном употреблении обычно и являются переносчиками этого
паразита. Поэтому стаканчики и пробки нужно стерилизовать
каждый раз при закладке Яновых культур? Полезно время от вре-
мени дезинфицировать также термостат, в котором содержат
культуры дрозофилы. При соблюдении этих элементарных усло-
вий, не составляющих и десятой доли тех предосторожностей,
которые необходимы, например, в работе бактериологической
лаборатории, от клещей можно вполне избавиться.
Книга протоколов опытов
Работа начинающего свои опыты с дрозофилой с первого дня
пребывания в лаборатории должна фиксироваться в специально
отведенном для этой цели дневнике.
Ведение дневника, или книги протоколов опытов, представляет
собой важный элемент учебной и научно-исследовательской ра-
боты. Поэтому необходимо с первого же дня обратить на это серьез-
ное внимание и сделать для себя законом выполнение следующих
основных правил:
1. Никогда не полагаться на память; иначе говоря, все наблю-
дения, цифры, расчеты и т. д. своевременно фиксировать в книге
протоколов опытов.
2. В книгу протоколов заносить не только те результаты и на-
блюдения, которые ясны, понятны, не вызывают сомнений в дан-
ную минуту. Не менее, а иногда и гораздо более ценными могут
оказаться те наблюдения, которые непонятны сегодня, но будут
понятны или приобретут особый интерес завтра, через неделю,
через год, через много лет.
3. Поэтому время от времени нужно снова и снова возвращаться
к просмотру протоколов, помня, что они представляют собой не
только формальный отчет о работе, но и источник новых догадок,
предположений и обобщений.
4. Никогда не следует придавать решающее значение опытам
незаконченным, почему-либо неудавшимся или порождающим
сомнения в их полноценности. Против каждого такого опыта надо
поставить вопросительный знак, опыт повторить, а затем уже де-
лать сопоставления и выводы.
F5. Всякий опыт, как бы ни была проста и понятна его цель,
необходимо обязательно сопровождать соответствующим к о н-
48
т р о л е м, являющимся непременным условием его доказатель-
ности. Без соответствующего, адекватного, контроля ни один опыт
не может ничего ни доказать, ни опровергнуть. Разумеется, что
характер контроля в каждом отдельном случае определяется ха-
рактером самого опыта. Следовательно, формы контроля разно-
образны в такой же мере, в какой могут быть разнообразны и сами
опыты. Для большинства тех опытов, о которых ниже идет речь,
таким контролем могут служить результаты наблюдений над
мухами при отсутствии скрещивания, т. е. из чистых линий. От-
сутствие расщепления в последних при прочих равных условиях
явится тем элементарным контролем, который придаст опыту
большую доказательность.
6. Записи в книге протоколов лучше делать на одной стороне
листа. Этот способ ведения дневника заключает в себе большие
удобства для последующей обработки результатов. Действительно,
если заполненный таким образом дневник расшить, то результаты
опытов можно легко и быстро классифицировать по любому
признаку.
Конечно, невозможно предусмотреть такую форму дневника,
которая была бы пригодна на все случаи жизни. Это тем более
верно еще и потому, что в протоколах одного и того же опыта
обычно чередуются материалы цифровые и описательные. По-
этому приводимая ниже форма дневника (табл. 2) отнюдь не пре-
тендует на что-либо большее, как только привить начинающему
сознание важности этого элемента лабораторной работы. А если
эта цель достигнута, тогда достаточно несколько минут размыш-
ления и рациональная схема дневника для данного опыта родится
сама собой.
Как видно, при наличии книги протоколов опытов на культу-
рах достаточно поставить порядковый номер, под которым это
Таблица 2
Примерная форма дневника лабораторной работы
Дата Порядко- вый номер культуры Краткое описание скрещивания Результат
10.X 15 Normal QQ\33 е (из основных КуЛЬТур)! 150 мух Normal (29 и <5<5)
22.X 24 99 на № 15X<S(5 е (из основных культур) 89 Normal 76 ebony
22.Х 25 99 и 33 на № 15 и т. д. 195 Normal 57 ebony
1 Основные культуры поддерживаются ответственным за них сотрудником лабора-
тории и имеют собственную нумерацию или систему обозначений.
4 Н. Н. Медведев 49
скрещивание занесено в журнал. Если же скрещивание носит
более сложный характер (см., например, главу о кроссинговере),
для него в журнале необходимо отвести одну или даже несколько
страниц, на которых выписывают сначала все ожидаемые классы
мух, а затем уже заносят полученные результаты. Все неожи-
данные или исключительные мухи, конечно, также должны быть
занесены в протоколы опытов.
Неудачи в постановке опытов
и их возможные причины
В заключение полезно свести воедино те возможные неудачи,
которые на первых порах работы с дрозофилой являются наиболее
обычными и которые требуют «первой помощи» со стороны руко-
водителя. Эти неудачи имеют своим источником двоякого рода
причины.
А. Неудачи генетического характера, т. е.
полное несоответствие результатов опыта ожидаемым. Наиболее
частые причины их следующие:
1) для скрещивания взяты или недевственные самки, или по
ошибке вообще не из той культуры, откуда их надлежало взять;
2) неправильно сделаны надписи или перепутаны этикетки
при наклейке их на стаканчики.
Б. Неудачи, относящиеся к условиям содержания
мух, вследствие чего те или иные культуры развились плохо
или не развились вовсе. Возможные причины:
1) среда не была засеяна дрожжами (в культуре обильно раз-
вилась плесень);
2) среда изготовлена слишком твердой (агар-агар взят в из-
бытке): молодые личинки не могли проникнуть в глубь среды и
погибли;
3) среда изготовлена слишком жидкой (взято недостаточно
агар-агара); в культуре избыток влаги, и отложенные яйца по-
гибли (утонули!);
4) в культуре избыток дрожжей (толстый беловатый пласт
дрожжей на поверхности питательной среды). Возможные при-
чины — стерильность самок или культура поставлена на несве-
жую среду;
5) мухи лежат мертвыми в «фунтике». Очевидная причина —
мухи не проснулись от слишком большой дозы наркоза.
Во всех таких случаях мух следует пересадить на свежую среду,
или скрещивание поставить заново.
ГЛАВА ВТОРАЯ
СВОБОДНОЕ КОМБИНИРОВАНИЕ ПРИЗНАКОВ
У ГИБРИДОВ (МЕНДЕЛИЗМ)
Общие и терминологические замечания
Открытию Менделем носящих его имя законов наследствен-
ности предшествовало много попыток объяснить факт сходства
родителей с потомством и выяснить причины и закономерности,
лежащие в основе этого явления. Как известно, все эти попытки
были неудачны, хотя отдельным исследователям удалось близко
подойти к разгадке природы наследственности.
Менделю принадлежит заслуга проникнуть в сущность явле-
ния наследственности и заложить прочную основу для всех по-
следующих исследований в этой области биологии.
В отличие от своих предшественников, рассматривавших на-
следственность как нечто слитное, недифференци-
рованное, Мендель впервые внес в нее принцип дискрет-
ности. В опытах с садовым горохом он ясно показал, что разно-
образные признаки, или особенности организмов наследуются
не как единый комплекс, не слитно, не суммарно, а дробно, д и-
скретно, независимо друг от друга, и что в результате
скрещивания они не утрачиваются и не исчезают бесследно,
а вновь появляются в потомстве в определенных числовых отно-
шениях.
Таким путем было заложено учение о единичных
признаках и определяющих их развитие факторах
наследственности (позднее — генах), которое вместе
с числовыми отношениями, возникающими в потомстве скрещи-
ваемых особей на основе свободного, или независимого, комбини-
рования признаков, получило название менделизма.
Развитие учения о наследственности, начавшееся после вторич-
ного открытия законов Менделя в 1900 г., шло по двум основным
направлениям. Одно из этих направлений, собственно
менделизм, вскоре выросло в обширный поток исследований,
подтвердивших справедливость основных законов наследствен-
ности, установленных Менделем. Чем большее число объектов
51
4*
вовлекалось в круг генетических исследований, тем все более
становилось ясным, что законы Менделя — не частное явление,
свойственное какой-либо одной группе растительных или живот-
ных организмов, а применимо ко всем живым существам. Разно-
образные особенности организмов, стоящих на самых концах
растительной и животной лестницы, оказались наследующимися
по законам Менделя. Таковым остается значение менделизма
и в наши дни.
Однако вскоре после вторичного открытия законов Менделя
выяснилось, что при некоторых определенных условиях они теряют
свою силу. Уже на первых порах развития менделизма исследова-
тели натолкнулись на такие случаи, когда наследование некото-
рых особенностей организмов не укладывалось в рамки классиче-
ских менделевских отношений. По мере накопления фактов из
области генетики и цитологии стало ясно, что менделизм есть лишь
один из комплексов закономерностей наследственности, имеющих
силу при определенных генетических условиях. При других же
генетических условиях возникают качественно иные закономер-
ности наследственности, которые обусловливают иные числовые
отношения при расщеплении. Разработка этих закономерностей
нашла свое завершение в сформулировании хромосомной
теории наследственности, которая является круп-
нейшим достижением современной генетики и дальнейшим раз-
витием менделизма.
В настоящее время мы знаем, при каких условиях имеют место
классические менделевские расщепления и при каких условиях
возникают другие числовые отношения в потомстве скрещиваемых
особей. Типичные менделевские расщепления имеют место при
наследовании всех тех особенностей, факторы которых (или гены)
находятся в разных хромосомах и не влияют сходным
(аналогичным) образом на одни и те же особенности организма.
В случаях их взаимодействия факторы, хотя и комбинируются
свободно, возникающие при расщеплении отношения уклоняются
от классических менделевских в зависимости от характера взаимо-
действия.
В противоположность этим случаям все те особенности орга-
низма, наследственные факторы которых находятся в одной
и той же хромосоме, обнаруживают при расщеплении
иные числовые отношения, характер которых зависит от конкрет-
ных условий скрещивания. Все последующие главы руководства
посвящены разбору разнообразных скрещиваний (гибридологиче-
скому анализу) и возникающих при этом числовых отношений
в потомстве гибридных особей.
Ниже приведены пояснения немногих, необходимых на первых
порах, генетических терминов, а также некоторые методические
замечания, которыми необходимо будет пользоваться или иметь
в виду в дальнейшем изложении. Вполне может быть, что лишь
52
некоторые из этих терминов будут понятны с первого чтения,
смысл же других станет ясным позднее. Поэтому эти пояснения
в целом следует рассматривать как ключевые ко всему последую-
щему материалу руководства.
1. Термины наследственный фактор (факторы)
и ген (гены) всюду употребляются как синонимы.
2. То же относится к терминам аллеломорф и ал-
лель. Первый из них исторически более старый, второй — более
позднего происхождения, вошедший в обиход из-за его краткости.
3. Фенотип природной формы дрозофилы принято обо-
значать терминами норма л ь н ы й, или Normal; д и-
к и п т и и, или wild type. Все эти названия мы будем упо-
треблять как синонимы. Те же названия применяют к природной
форме дрозофилы и в тех случаях, когда ее разводят в лаборатор-
ных условиях. Очень часто дикую форму дрозофилы называют
серой (gray), несмотря на то, что, строго говоря, она вовсе
не серая, а скорее желтовато-коричневая. Однако это обозначение
вошло в литературу настолько широко, что замена его другим,
с одной стороны, ближе соответствующим действительности,
а с другой — более длинным, но все же не вполне точным, едва ли
привела бы к желаемым результатам.
4. В соответствии с принятой в литературе о дрозофиле систе-
мой, гены рецессивных особенностей (мутантов) обозна-
чают малыми буквами. Ими являются первые в английских
названиях соответствующих мутантов; например, е — ebony
(тело цвета эбенового дерева); с — curved (загнутые крылья)
и т. д. В тех случаях, когда с одной и той же буквы начинается
название другого или других мутантов, то для их различения к пер-
вой букве прибавляют вторую, например, еу — eyeless (безгла-
зый); ст — carmine (карминные глаза); сп — cinnabar (киновар-
ные глаза) и т. д.
5. Гены доминантных особенностей (мутантов) обо-
значают большими буквами алфавита с соблюдением того же
принципа наращения дополнительной второй или третьей букв,
если в них есть необходимость; например, В — Ваг (полосковид-
ные глаза); Вх — Beadex (вырезанные крылья) и т. д.
Относительно обозначения кодоминантных генов тка-
невой совместимости — см. главу VI.
6. Нормальные аллеломорфы рецессивных и
доминантных генов принято обозначать знаком +• Кроме того,
когда имеют в виду нормальный аллеломорф какого-либо опреде-
ленного гена, например, ebony или cinnabar, то его обозначают
соответственно +е или +сп- Порядок обозначения аллелей, со-
ставляющих множественные аллеломорфы, а также летальных
генов, будет приведен в главе ПТ.
Некоторые авторы, особенно в специальных исследованиях,
предпочитают нормальные аллели генов обозначать теми же бук-
53
вами, что и соответствующие им рецессивные, вынося знак 4
в апостроф основного буквенного обозначения; например, е —
ebony — рецессивный аллель, е+ — его нормальный аллель. Как
в этом случае, так и в принятой нами системе, нормальный аллель
специфицируется знаком плюс, и это правило общепринято.
Разница же сводится к тому, считать ли более рациональным двух-
строчное написание нормальных аллелей, вынося плюс в апостроф,
или писать его в строку, освободив от сопутствующего апострофа,
имея при этом в виду, что во всех учебных опытах речь идет о за-
ведомых аллелях соответствующих генов. Помимо соображений
привычки, принятая нами система, не говоря уже о тексте, весьма
упрощает компоновку таблиц, в которых при рассматриваемой
альтернативной системе нормальные аллели всех генов необходимо
было бы писать двухстрочными обозначениями вроде а+, Ь+,
с+ и т. д.
7. Буквами РР (начальные от слова parents — родители)
обозначают скрещиваемые, т. е. родительские формы.
8. Знак X между обозначениями, или формулами, родителей
означает их скрещивание.
9. В написании любого скрещивания на первом месте
принято ставить обозначение самки (матери), на втором —
самца. Предпочтение матери отдается в данном случае потому, что
в генетическом анализе потомство родителей неизвестного проис-
хождения, например, выловленных в природе, или форм, возник-
ших в результате мутаций, реже вызывает сомнения в отношении
материнства; отцовство же их в одних случаях всегда неизвестно,
в других — сомнительно в той или иной степени.
10. В английской литературе для обозначения скрещивания’двух
неодинаковых гомозигот, например, ААXаа, или
аахАА, с которыми нам в большинстве случаев придется иметь
дело в дальнейшем, существует термин кросс (cross), соответствую-
щий недифференцированному русскому понятию скрещивание.
И. Если же скрещивают две одинаковые гомози-
готы, например, ААхАА, или ааХаа, такое скрещивание
по-английски обозначают особым термином — инкросс (in-
cross), т. е. скрещивание внутри себя, или сходных
особей (откуда происходит термин inbreeding).
12. Буквой F (от слова filial — дочерний) и цифрой при ней,
например, Fl, F2, F3 и т. д., обозначают потомства первого, вто-
рого, третьего и последующих гибридных поколений — потомков
данного исходного скрещивания. В генетической литературе по-
следнего времени наблюдается тенденция номера поколений при F
писать в строку, цифрами того же размера, что и F.
13. Гибриды F2 от каждого исходного скрещивания могут
быть получены тремя путями:
а) Скрещиванием гибридов F1 между собой, т. е.
FlxFl, или АаХАа. Этот тип скрещиваний для краткости усло-
54
вимся называть прямым, а гибридов F2, полученных от
таких скрещиваний, будем называть гибридами F2 от прямого
скрещивания F1. В английской литературе для обозначения
скрещиваний этого типа существует особый термин — интер-
кросс (intercross); по-русски он означает то же самое, т. е. скре-
щивание между собой, или друг с другом. Со-
ответственно с этим гибридов F2 от интеркросса можно кратко
называть интеркроссным F2.
б) Скрещиванием гибридов F1 с одной родитель-
ской формой, например, с доминантной АА, т. е. АаХАА,
или ААхАа.
в) Скрещиванием гибридов F1 с другой родитель-
ской формой, например, с рецессивной аа, т. е. Аахаа
или аахАа. Скрещивания обоих этих типов носят название
возвратных (возврат к одному из родителей); в животно-
водстве они называются также поглотительными.
По-английски возвратные скрещивания и возникающие в них
потомства обозначаются термином, аналогичным соответствую-
щему русскому, а именно — бэккроссные (backcross).
Те и другие сокращенно обозначаются также буквами ВС (началь-
ные от слов back — возврат, назад и cross — скрещивание).
Поэтому вместо пространного определения возвратных гибридов
F2, полученных от скрещивания гибридов F1, например, с АА,
или с аа, можно обозначить их соответственно более кратко: ВС
от скрещивания F1 с АА, или ВС1 от скрещивания F1 с аа.
Если по характеру опыта или исследования возвратные скре-
щивания с той или другой родительской формой продолжаются
и в последующих поколениях, тогда возвратных гибридов F3,
F4, F5 и последующих поколений можно соответственно обозна-
чить как ВС2, ВСЗ, ВС4 и т. д. (Обратите внимание, что номера
последовательных бэккроссных поколений на единицу меньше со-
ответствующих им гибридных за счет выпадения из нумерации
бэккроссных поколений гибридов первого поколения.)
В некоторых специальных случаях скрещивания типа inter-
cross и cross закономерно чередуются одно с другим; примеры будут
рассмотрены в главе VI.
14. В дальнейших главах книги обозначения зигот и гамет
в тексте иногда будут несколько отличаться от их табличного
написания. В таблицах все зиготы для наглядности изображены
в виде дроби с двумя черточками, соответствующими двум хромо-
сомам диплоидного организма. Находящиеся в них гены записаны
в две строки — над черточками и подними. Так, например, фор-
мула J/v означает, что у данного гибрида (дигибрида) в одной гомо-
логичной хромосоме локализованы рецессивные гены а и Ь,
а в * другой, гомологичной хромосоме — их нормальные аллело-
морфы, + и + • У такого гибрида при отсутствии перекреста обра-
55
о о a b —I—}—
зуются два типа гамет с одной хромосомой, а именно — и .
Текстовые обозначения этого гибрида и образующихся у него двух
типов гамет для краткости иногда будут несколько упрощены и
записаны соответственно так: а Ь/-|—F, а Ь и + +.
15. Порядок расположения неаллеломорфных генов в обозна-
чении генотипов должен соответствовать их действительному по-
рядку (локализации) по длине данной хромосомы, причем на пер-
вом месте принято писать ген, занимающий крайнее положение
на условно левом конце этой хромосомы.
16. Если следовать порядку расположения гамет на сторонах
решетки Пеннета, принятому в табл. 11, 12, 13, 16, 22 и 23, то
в этом случае самки располагаются в верхней половине решетки,
а самцы — в нижней. Для наглядности графы самок и самцов на
этих таблицах отделены двойной горизонтальной линейкой.
17. То же условие относится к расположению на сторонах ре-
шетки некроссоверных и кроссоверных гамет — см. табл. 16,
25, 28 и 29. При соблюдении этого условия некроссоверы распо-
лагаются в левой части таблиц, а кроссоверы — в правой. Для
наглядности графы тех и других в указанных таблицах отделены
двойной вертикальной линейкой.
МОНОГИБРИДНОЕ СКРЕЩИВАНИЕ
Практическое изучение законов наследственности как логиче-
ски, так и исторически надлежит начать с менделизма, в основе ко-
торого, как было сказано выше, лежит принцип свободного
комбинирования наследственных факторов.
Наблюдения Менделя над поведением признаков скрещивае-
мых форм гороха в последующих гибридных поколениях, как
известно, были обобщены в виде следующих трех законов наслед-
ственности:
1) закона доминирования или, точнее, едино-
образия признаков у гибридов первого поколения;
2) закона расщепления признаков с положенной
в его основу гипотезой чистоты гамет;
3) закона свободного, или независимого,
комбинирования признаков.
Некоторые авторы считают основными только второй и третий
законы Менделя, а именно закон расщепления и закон свободного
комбинирования признаков. Это не совсем правильно, так как и
закон единообразия гибридов первого поколения имеет ограниче-
ние лишь в случаях наследования сцепленных с полом признаков
(стр. 83) и поэтому может рассматриваться как основной, наряду
с* двумя другими законами Менделя.
В настоящей главе мы рассмотрим эти законы в той последова-
тельности, в какой они здесь сформулированы.
56
* * *
Каждый размножающийся половым путем организм происхо-
дит от слияния женской и мужской половых клеток, яйца и сперма-
тозоида. Половые клетки составляют связующее звено между
последовательными поколениями особей. Согласно совокупности
полученных до сих пор экспериментальных данных, непосредствен-
ное отношение к явлениям наследственности имеют определенные
органоиды клетки — хромосомы, которые в известный
период ее жизни могут быть ясно видимы под микроскопом. Так
как все клетки тела происходят в результате равнонаследствен-
ного деления оплодотворенного яйца и таких же последовательных
делений дочерних клеток, то и вещество хромосом, хроматин,
равномерно распределяется между всеми клетками развиваю-
щегося организма.
Каждый организм обладает определенным, свойствен-
ным данному виду, числом хромосом. У дрозофилы
число хромосом в клетках тела равно восьми. Это число назы-
вается соматическим, или диплоидным
(т. е. двойным). В противоположность клеткам тела (соматиче-
ским) половые клетки организма (гаметы) содержат половинное
число хромосом, иначе называемое гаплоидным (т. е. про-
стым, или ординарным). Уменьшение числа хромосом вдвое, пли
редукция, имеет место в процессе созревания половых клеток
(оогенез и сперматогенез). В результате двух последовательных
делений, т. е. редукционного, или собственно умень-
шающего число хромосом вдвое, и э к вац ионного, кото-
рое вдвое уменьшает лишь массу хроматина ядра без уменьшения
числа хромосом, компоненты каждой, бывшей до сих пор диплоид-
ной хромосомы,’ разъединяются при образовании половых клеток.
Число их в половых клетках дрозофилы равно четырем, т. е. яйца
и сперматозоиды содержат только четыре гаплоидные хромосомы.
В последующем затем оплодотворении вновь соединяются наслед-
ственные зачатки родителей и снова восстанавливается нормальное,
диплоидное число хромосом, свойственное данному виду.
Благодаря тому, что хромосомы дрозофилы морфологически
легко отличаются друг от друга, удалось установить прямую
связь той или иной хромосомы с определенными морфоло-
гическими особенностями мухи. Оказалось,
что гены многих наследственных признаков дрозофилы связаны
с особой палочкообразной хромосомой, условно называемой
I хромосомой. Иначе она называется половой, или X - хро-
мо с о м о й. Две другие обширные группы наследственных
особенностей связаны с V-образными II и III хромосомами.
Наконец, IV, или микрохромосома (названная так за
ее ничтожные размеры), заключает в себе гены сравнительно не-
большого числа наследственных признаков. В отличие от половой,
57
или Х-хромосомы, три последние хромосомы, т. е. II, III и IV,
объединяются общим названием аутосом.
В отличие от самок, у самцов дрозофилы имеется только одна
Х-хромосома. Ее партнер, или Y-хромосома, генов не содержит,
о чем будет сказано ниже.
Наследование доминантного признака Lobe
Простейшим случаем скрещивания, как примера гибридологи-
ческого анализа, является моногибридное с последующим расще-
плением особей второго поколения в отношении 3:1.
Для целей этого скрещивания можно воспользоваться любым
рецессивным или доминантным признаком, относящимся к л ю-
бой из аутосомных групп сцепления дрозофилы. Однако
на первых порах лучше брать для скрещивания таких мутантов,
которые возможно более резко отличались бы от нормальной мухи
и в то же время были бы вполне жизнеспособны. Только после
приобретения необходимых навыков можно брать для скрещиваний
не столь резко отличающихся от нормальной мухи мутантов, работа
с которыми требует также достаточно хорошей оптики.
В качестве удовлетворяющих этим требованиям могут быть
рекомендованы следующие мутанты:
II хромосома:
)>
»
III хромосома:
IV хромосома:
black (Ъ) —черное тело;
vestigial (vg)— зачаточные крылья;
Lobe (L)
curved (с)
ebony (е)
eyeless (еу)
— лопастные глаза;
— загнутые кверху крылья;
— темное тело;
— безглазый.
Все перечисленные мутанты после некоторого предваритель-
ного знакомства с ними можно безошибочно отличать от нормаль-
ной, дикой, мухи на глаз, без каких-либо оптических приспосо-
блений.
Что касается жизнеспособности названных мутантов, то сле-
дует отметить, что хотя мухи vestigial, например, и очень демон-
стративны для целей учебного опыта, однако их жизнеспособность
понижена по сравнению с нормальными. Поэтому для подсчета
мух второго поколения необходимо просматривать культуры
ежедневно или, по крайней мере, через день и учитывать не только
живых мух, но и, возможно, утонувших во влажной питательной
среде или погибших преждевременно, вследствие пониженной
жизнеспособности. Всех таких мух также нужно тщательно клас-
сифицировать и приобщить к результатам подсчета живых мух;
в противном случае результаты опыта будут не совсем точ-
ными.
58
Следует также иметь в виду, что при температуре 16—18°
ген +е обнаруживает неполное доминирование, вследствие чего
классификация мух е/Ц- и е/е становится затруднительной L
Перейдем теперь к опытам по скрещиванию нормальной,
или дикой, мухи с каким-либо мутантом и посмотрим, какое будет
расщепление во втором поколении в зависимости от того,
является ли участвующий в скрещивании ген доминантным или
рецессивным.
Рассмотрим сначала случай скрещивания с нормальной мухой
доминантного мутанта Lobe, относящегося ко
II группе сцепления (табл. 3). Фенотипическое проявление гена
Lobe заключается в сильной редукции числа глазных фасеток,
вследствие чего чувствительная поверхность глаза мухи Lobe
уменьшена по сравнению с нормальной в несколько раз. Известно
Таблица 3
Мопогибрндное скрещивание
(Lobo X Normal; ebony X Normal)
L ф 4“
PP: Q = XO =
* L +
L т 4-
Гаметы PP: J— о—
Fl: J J и $ $ =
e -r -p
PP: 9 = XO =
e +
e т T*
Гаметы PP: J------- О —
Fl: 2 ? и <5<5==
F2: 3 Normal: 1 ebony.
несколько аллеломорфов Lobe, и некоторые из них редуцируют
глаза значительно слабее, чем взятый для опыта аллеломорф.
Так- как каждый взрослый организм, или вообще зигота, обла-
дает двойным набором хромосом, а следовательно, и двойным
1 Проф. С. М. Гершензон любезно обратил наше внимание на то, что,
по его многолетнему опыту проведения практических занятий со студентами,
мутант dumpy—короткокрылый (II хромосома, локус 13,0) дает очень четкие
результаты при расщеплении и легко классифицируется. — Прим, автора.
Г>9
набором генов, то генотипическое строение гомозиготной мухи
Lobe должно быть представлено следующей простой формулой:
L
“Г *
В этой формуле диплоидное состояние выражается двумя чер-
точками, соответствующими двум хромосомам; буквы же над и
под ними обозначают сокращенное название мутанта.
Соответственно с этим нормальная, или дикая, муха примени-
тельно к данному случаю должна быть обозначена так: +/+•
Эту простую формулу следует понимать так, что в той самой
точке (локусе) хромосомы, в которой у мутации одноименного
названия находится ген Lobe, у дикой мухи имеется нормальный
аллеломорф этого гена (~{-L), определяющий развитие нормаль-
ных глаз дикой мухи. Все это выражают несколько иначе и более
кратко, говоря: гомологичная точка, или локус, II хромосомы
дикой мухи заключает, или несет, нормальный аллеломорф гена
Lobe.
Приведенное положение имеет всеобщее значение и справед-
ливо по отношению ко всем мутантным генам дрозофилы, по-
скольку каждый из них когда-то возник путем изменения (му-
тации) соответствующего локуса хромосомы дикой мухи.
Поэтому, поясняя сказанное в общей форме, можно сказать,
что соответствующие гомологичные локусы хро-
мосом дикой мухи несут нормальные (не-
измененные) аллеломорфы всех известных мутантных
генов (например, white, ebony, Lobe и т. д.). Эту же формулу
можно прочитать и в обратном порядке: всем мутантным
генам (например, white, ebony, Lobe и т. д.) соответ-
ствуют нормальные (неизмененные) аллело-
морфы (-|-vv, +е, +L и т. Д-) гомологичных локусов
хромосом дикой мухи.
После всего сказанного полную формулу скрещивания самки
Lobe с самцом Normal необходимо написать так:
Рассматриваемое скрещивание можно вести и в противопо-
ложном направлении, т. е. самку Normal скрестить с самцом
Lobe; результат от этого не изменится.
В отличие от зиготы строение гаметы принято обозначать
только одной чертой (хромосомой), понимая под этим, что в га-
метогенезе произошло разъединение гомологичных хромосом и
что каждая гамета обладает только одной гаплоид-
ной хромосомой данной пары, а следовательно, и одним набо-
ром генов.
60
Взятые для скрещивания мухи Lobe отличаются от нормаль-
ных только по одному признаку или, что то же самое, по одному
гену. Кроме того, они гомозиготны по этому признаку. У гомози-
гот же и о л ю б о м у ч и с л у генов образуется о д и п сорт
гамет. (Об исключениях из этого правила см. главу III.) К этому
положению мы неоднократно будем возвращаться в дальнейшем
в связи с разбором более сложных скрещиваний. Однако все-
объемлющее значение этого принципа необходимо под-
черкнуть с самого начала, имея в виду необходимость выработки
у начинающих сознательных навыков в составлении схем опытов
и всех связанных с ними расчетов.
Самки Lobe образуют яйца с геном L во II хромосоме, а ди-
кие самцы образуют спермин с нормальным аллеломорфом этого
гена в идентичном локусе II хромосомы.
В соответствии с этим строение гамет родителей нужно за-
писать так:
5 Lobe: яйца —
<5 Normal: сперматозоиды — .
В результате оплодотворения самки Lobe самцом Normal по-
томство от этого скрещивания, самки и самцы, будет гетерози-
готно по гену Lobe. А так как этот ген доминантный, то в силу
первого закона Менделя все мухи первого поколения будут обла-
дать особенностью Lobe, т. е. редуцированными глазами. Гено-
типическое их строение необходимо записать так:
2 2 и <?(?:=.
Скрестим теперь гетерозиготных самок и самцов первого
поколения и проследим, какое расщепление будет во втором по-
колении в отношении признака Lobe?
Рассмотренный пример гаметообразования у гомозиготных
форм является простейшим. Сейчас перед нами более сложный
случай, когда скрещиваемые формы — гибриды и гетерозиготны
по одному фактору. Число типов гамет у гибридов будет больше,
чем в рассмотренном выше случае. Здесь мы приходим к другому
общему и р а в и л у, гласящему, что число сортов гамет
у гибрида выражается формулой 2П, в которой п — число уча-
ствующих в скрещивании пар факторов. В данном случае п = 1.
Подставив это число в формулу, получаем 2L = 2. Иначе говоря,
у гетерозиготных мух Lobe первого поколения в процессе редук-
ционного деления образуются два типа половых клеток, а именно
с геном Lobe и без него (т. е. с его нормальным аллеломорфом) —
в равных количествах. Другими словами, одна половина зрелых
яиц и сперматозоидов будет с геном Lobe, другая половина —
61
с его нормальным аллеломорфом. Это соотношение гамет у мух
первого поколения (гибридов) должно быть выражено следую-
щей пропорцией:
Яйца: ->0% — > ~
Сперматозоиды: 50°/о — , 5О°/о — .
В процессе оплодотворения, регулируемого простой случай-
ностью, могут осуществиться четыре сочетания женских и муж-
ских гамет и дать начало трем типам мух второго поколения.
Их строение и численные соотношения будут таковы:
Как видно, мухи F2 распадаются на три следующих класса:
1) мух, гомозиготных по гену Lobe (L/L), в количестве 25%
от общего числа мух второго поколения;
2) мух, гомозиготных по гену нормальных глаз (+/+), также
в количестве 25%;
3) мух, гетерозиготных по гену Lobe (L/-J-), в количестве 50%
от общего числа мух F2.
Таким образом, во втором поколении возникают как исходные
(родительские) формы, так и формы гибридные, аналогичные
гибридам первого поколения. Первые из них, Lobe и Normal,
являются чистыми, или гомозиготными, и не обнаружи-
вают расщепления в последующих поколениях при скрещивании
их с себе подобными. Гетерозиготные же мухи строе-
ния L/-|-, будучи скрещены между собой, снова дадут три сорта
мух, аналогичных только что разобранным. Здесь вновь появится
25% мух гомозиготных Lobe, 25% гомозиготных Normal и 50%
гетерозигот, подобных гибридным родителям. Если вместо дро-
зофилы взять самоопыляющееся гибридное растение, например
горох, то оно будет из года в год расщепляться с образованием
аналогичных себе гибридных растений, а также форм чистых
(гомозиготных).
Таковы численные отношения генотипов, возникающих
в F2 в результате скрещивания и последующего моногибридного
расщепления. Рассмотрим теперь, какие отношения следует
ожидать, исходя из внешних, т. е. фенотипических,
особенностей мух второго поколения. Иначе говоря, сколько
различных фенотипов возникнет в F2 рассматриваемого скрещи-
вания и каково будет их численное соотношение?
Так как ген Lobe доминирует над своим нормальным аллело-
морфом, то вызываемый им признак появится не только у мух,
гомозиготных по этому гену, но и у всех гетерозигот строения L/ + .
62
и предыдущее отношение
1= превратится в более краткое: 3 Lobe : 1 Normal.
Поэтому первые два генотипа вышеприведенного отношения
сольются в один класс (фенотип),
L L
1-L:24
Следовательно, во втором поколении будем иметь мух двух
классов, или фенотипов; в одном из них будут мухи Lobe в ко-
личестве 75% от общего числа мух F2; в другом — 25% нормаль-
ных, круглоглазых.
Таким образом, в результате гибридологического анализа мух
второго поколения рассматриваемого моногибридного скрещи-
вания мы пришли к выводу, что отношение 1:2:1 характери-
зует расщепление особей F2 по генотипам, а отношение 3:1 —
по фенотипам. Все сказанное справедливо по отношению к лю-
бому другому доминантному признаку, ген которого локализован
в одной из аутосом, но не в половой хромосоме (см. главу III).
В заключение необходимо обратить внимание на два момента,
соблюдение которых имеет важное значение для усвоения мате-
риала.
Возвращаясь к тем буквенным обозначениям гибридов, кото-
рыми мы пользовались при рассмотрении моногибридного скре-
щивания, необходимо пояснить, что мухи, гомозиготные по гену
Lobe (L/L), представляют собой генотипы АА; мухи, гетерозигот-
ные по этому гену (L/-J-), являются генотипами Аа; наконец,
гомозиготные нормальные мухи (+/ + ) — есть гомозиготные ре-
цессивы аа.
Этот простейший случай не представляет затруднения в пере-
воде символов, употребляющихся в литературе о дрозофиле, на
язык тех буквенных обозначений генов, которые фигурируют
в учебниках по генетике. Тем не менее указанное различие в сим-
волике нередко ставит начинающих в затруднение, в особенности
в случаях более сложных скрещиваний. Поэтому рекомендуется
с самого начала обратить на это внимание и научиться ориенти-
роваться в различных буквенных обозначениях генов, употреб-
ляющихся как в учебниках по генетике, так и в специальной ли-
тературе. Ниже (стр. 81) мы рассмотрим этот вопрос более под-
робно.
Прежде чем приступить к постановке того или иного скрещи-
вания, его необходимо предварительно продумать и составить
о нем ясное представление. Кроме того, как это было сказано выше
(стр. 48), необходимо с самого начала приучиться все записи
и схемы опытов располагать в журнале по определенному плану,
что предупреждает возможные ошибки, а при допущении оши-
бок — быстрое их обнаружение. Поэтому полезно схему каждого
опыта разрабатывать так, как это представлено в табл. 3.
Важность выведения всех ожидаемых во втором поколении
классов особей по решетке Пеннета не требует особых пояснений.
Работающий воочию убеждается, что при ее помощи можно
63
быстро ориентироваться и вывести все возможные генотипы данного
скрещивания, а потому и решение ее всякий раз является не
только желательным, но и обязательным.
Наследование рецессивного признака ebony
Рассмотрим еще один пример моногибридного скрещивания,
но уже с участием рецессивного признака, т. е. такого,
который в силу первого закона Менделя подавляется (прикры-
вается) его нормальным аллеломорфом у гибридов F1 и снова
выщепляется во втором поколении. В качестве такого признака
возьмем мутанта ebony (е) — темное тело. Фенотипическое про-
явление этого гена заключается в развитии по всему телу темного
пигмента, благодаря чему мухи ebony хорошо отличаются от нор-
мальных.
Скрестим самку ebony с самцом дикого типа или, что то же
самое, самца ebony с нормальной самкой и полученных гибридов
первого поколения скрестим между собой (табл. 3).
Единственное отличие этого опыта от рассмотренного с при-
знаком Lobe сводится к тому, что мух с рецессивным признаком,
т. е. ebony, появится в F2 втрое меньше, чем нормальных. Дру-
гими словами, при наличии рецессивного признака в F2 появ-
ляется столько же мух с особенностью этого признака, сколько
нормальных мух в случае скрещивания с участием доминантного
признака Lobe. Это и понятно, если учесть, что нормальный ал-
леломорф гена Lobe (-|-L) рецессивен по отношению к Lobe (L).
В случае же рецессивного признака ebony нормальный аллело-
морф (+ ) доминирует над ebony (е). Поэтому нормальных мух
(рецессивов) появилось в первом случае только т/4 от общего
количества мух F2; здесь же мы вправе ожидать их в количестве
75% (доминанты) и только 25% мух ebony (рецессивы).
Разобранная для ebony схема опыта применима ко всякому
другому рецессивному гену, если он локализован не в половой
хромосоме (см. главу III).
Резюмируя результаты опытов по скрещиванию аутосомных
генов дорозофилы, локусы которых локализованы во II, III
и IV хромосомах, можно сформулировать следующие выводы:
1. Каждый доминантный аутосомный ген проявляется
у всех мух первого поколения (гетерозигот) и у 75 % мух второго
поколения.
2. Каждый рецессивный аутосомный ген подавляется
его нормальным аллеломорфом и поэтому не проявляется у мух
первого поколения (гетерозигот), а во втором поколении прояв-
ляется у 25% мух.
3. Направление скрещивания не влияет
на числовые отношения гибридов F2. Другими словами, во вто-
ром поколении появляется одно и то же количество доминантных
64
и рецессивных особей независимо от того, вошел ли данный до-
минантный или рецессивный признак в скрещивание со стороны
матери или отца. Об исключениях из этого правила будет ска-
зано в главе III.
ДИГИБРИДНОЕ СКРЕЩИВАНИЕ
Перейдем теперь к разбору скрещиваний с участием более
одной пары факторов, взяв для начала дигибридное скрещивание.
Согласно третьему закону Менделя о независимом комби-
нировании признаков, каждая пара факторов ведет себя при рас-
щеплении так, как если бы других, кроме нее, не было. Отсюда
вытекает следующий важный вывод: любое сложное скрещива-
ние может быть сведено к простому, моногибридному, если учи-
тывать только какую-либо одну пару признаков, при условии,
что на их проявление сходным образом не влияет другой участвую-
щий в скрещивании фактор (стр. 72 и далее).
Независимое поведение признаков у гибридов должно пред-
полагать особый механизм в зародышевых клетках, который мог бы
отвечать этому условию. Таким механизмом являются хромосомы
половых клеток.
Для того чтобы наследственные факторы могли свободно
комбинироваться друг с другом, они должны быть локализованы
в разных хромосомах. Отсюда следует, что число независи-
мых пар факторов, одновременно участвующих в скрещивании,
не м о ж е т превышать гаплоидного числа
х р о м о с о м у данного организма. Гаплоидное число хромо-
сом у дрозофилы равно ч е т ы р е м. Следовательно, наиболее
сложным скрещиванием в менделевском смысле будет у дрозо-
филы тетрагибридное. У гороха с семью гаплоидными
хромосомами возможно гептагибридное скрещивание.
По счастливой случайности в опытах с горохом Мендель, как
известно, свой выбор остановил как раз на таких признаках,
гены которых локализованы в разных хромосомах, т. е. относятся
к разным группам сцепления. Эта случайность и помогла ему столь
тщательно разработать носящие его имя законы наследствен-
ности.
Следует помнить, что терминами дигибридное, три-
гибридное ит. д. принято обозначать такие скрещивания,
которые удовлетворяют условиям независимого комби-
нирования признаков, т. е. дают при расщеплении типичные мен-
дел евские отношения 9 : 3 : 3 : 1 — в случае дигибридов, 27 : 9 :
9 : 9 : 3 : 3 : 3 : 1 — в случае тригибридов и т. д.
В противоположность им возможны, конечно, и такие дигиб-
ридные, тригибридные и другие еще более сложные скрещивания,
когда участвующие в них гены локализованы в одной хромосоме.
Подробно мы познакомимся с ними ниже.
Н. Н. Медведев
65
Для подобных скрещиваний мы еще не имеем соответствую-
щих рациональных наименований, несмотря на то, что возникаю-
щие в этих случаях расщепления отличаются от типичных менде-
левских и с точки зрения рациональной номенклатуры нужда-
ются в особых наименованиях.
Наследование рецессивных признаков
ebony п vestigial
Рассмотрим дигиб ридное скрещивание, воспользовавшись
для этой цели рецессивны м и мутантами vestigial —
зачаточные крылья и ebony — темная окраска тела (табл. 4).
Наследственный фактор первого из них (vg) локализован во II хро-
мосоме, второго (е) — в III хромосоме. Выше уже было сказано,
что направление скрещивания не влияет на результаты расщепле-
ния, если участвующие в скрещивании гены не сцеплены с поло-
вой хромосомой. Поэтому безразлично, взять ли для данного
скрещивания самку с зачаточными крыльями или с черным телом.
В дигибридном скрещивании приходится учитывать уже не
одну, а две хромосомы. В соответствии с этим генотипическое
строение взятых для скрещивания родительских мух должно
быть представлено следующими формулами:
Хромосомы: II III II III
Формулы: £ А ><6 = = .
-l-e vg +
Поясним эти формулы. Каждая муха представлена двумя па-
рами диплоидных хромосом (двумя черточками) с содержащимися
в них рецессивными генами или их нормальными аллеломорфами.
В формуле самки и самца на первом месте стоит II хромосома,
на втором — III хромосома. Эти формулы читаются так: у самки
ebony (черное тело) ген этого признака находится в III хромосоме
в гомозиготном состоянии. Самец же не обладает этим признаком
(геном); поэтому гомологичный локус III хромосомы самца пред-
ставлен нормальным аллеломорфом гена ebony.
В противоположность самке самец обладает зачаточными
крыльями, ген которых находится во II хромосоме. У самки же
с черным телом этот признак (ген) отсутствует; поэтому гомоло-
гичный локус ее II хромосомы обозначен знаком + (т. е. нормаль-
ным аллеломорфом гена vestigial). Далее, обе исходные мухи
гомозиготны. Следовательно, оба рецессивных гена и их нор-
мальные аллеломорфы представлены двумя дозами каждый.
На стр. 61 было указано, что у всякой гомозиготы по любому
числу генов образуется один сорт гамет. Следовательно, взятые
для опыта самки ebony дадут один сорт яиц с геном е в III хро-
мосоме и с нормальным аллеломорфом гена vg во II хромосоме.
G6
Дпгпбрпдное скрещивание
(ebony X vestigia!)
II III II III
+ е т vg + РР: £ = =Х<3 = = + е vg + Гаметы РР: $ — <5 —— —— Ft: 99 = vg
Гаметы F1: + е vg 4- vg e
+ +
4- 4~ 4~ 4- + е Vg + vg e
+ 4~ + -ь 4- 4- 4- -b
+ е 4- ‘Г + е Vg + vg e
+ е 4~' е 4- е + e
Vg + 4- + + е Vg +
vg + vg + Vg + Vg +
vg е + + 4- е Vg + vg e
vg е vg е vg e vg e
F2: ‘J Normal :3 vestigial: 3 ebony : 1 vestigial-ebony.
У самцов vestigial образуется также один сорт спермиев с геном
vg во II хромосоме и с нормальным аллеломорфом гена ebony
в III хромосоме. Следовательно, гаметы родителей будут иметь
следующее строение:
ЗХЕ+.
От слияния гамет в процессе оплодотворения возникнут гиб-
риды следующего строения (самки и самцы):
F1 о о и 3 S: = =
** vg +
Оба рецессивных гена перешли у гибридов в гетерозиготное
состояние и не проявятся во внешности. Поэтому все гибриды F1
67
5*
будут нормального, дикого, типа, т. е. серые, с длинными кры-
льями (рис. 19).
Как было сказано на стр. 61, число сортов гамет у гибрида
выражается формулой 2П, в которой п равно числу пар участвую-
щих в скрещивании генов. В случае дигибридов это число равно 2.
Следовательно, у гибридных самок и самцов первого поколения
образуется по четыре сорта гамет следующего строения:
т 2 + + е vg + vj? е
9 9 и о о: — — , ——, — —, — — .
Решая далее решетку Пеннета, получаем требуемые теорией
генотипы второго поколения анализируемого скрещивания. Сум-
мируя результаты расщепления по фенотипу, получаем оконча-
тельную формулу расщепления (табл. 4):
9 Normal: 3 ebony : 3 vestigial : 1 ebony-vestigial.
Если, согласно сказанному на стр. 63, проанализировать ре-
зультаты расщепления в отношении любого из двух участвующих
в данном скрещивании признаков, т. е. или только vestigial,
или только ebony, то можно убедиться, что оба они по отношению
к своим нормальным аллеломорфам расщепились в отношении 3:1.
В самом деле, суммируя мух F2 но признаку ebony, получаем
12 Normal : 4 ebony (из них 1 муха, кроме того, и vestigial).
Проделав то же самое по признаку vestigial, получаем 12 Nor-
mal : 4 vestigial (из них 1 в то же время и ebony). Другими сло-
вами, каждая пара признаков ведет себя при расщеплении так,
как если бы других, кроме нее, не было.
Отметим, наконец, что анализируемое дигибридное скрещива-
ние можно осуществить и другим путем, а именно скрещиванием
с нормальной мухой двойного рецессива vestigial-ebony:
с = =х<5= = .
+ vg е
Для этого линию vestigial-ebony нужно иметь синтезированной
заблаговременно. Результат расщепления во втором поколении
будет тот луе, в чем читатель может убедиться самостоятельно.
На этом мы закончим рассмотрение дигибридного скрещива-
ния, не останавливаясь на скрещиваниях с участием доми-
нантных мутантов. Дело в том, что большинство доминант-
ных мутантов у дрозофилы легальны в гомозиготном состоянии,
а известные в половой хромосоме и нелетальные, вроде Ваг и
Beadex, не вполне пригодны для иллюстрации простых менделев-
ских расщеплений, о чем мы вкратце упоминали выше и что под-
робнее будет рассмотрено в дальнейшем. Впрочем, к мутантам
Ваг и Beadex мы еще вернемся при разборе наследования сцеплен-
ных с полом признаков. Здесь же укажем лишь, что расщепле-
ния, наблюдающиеся при скрещивании доминантных мутантов,
68
Рис. 19. Дигибридное скрещивание (самка ebony X самец vestigial). Неза
висимое (свободное) комбинирование признаков
Генотипическое строение мух приведено в табл. 4.
в принципе не отличаются от расщепления с участием рецессив-
ных мутантов, vestigial и ebony. Различие в этих случаях сво-
дится к тому, что особенности нормальных мух будут здесь уже
рецессивны, вследствие чего все мухи F1 будут обладать особен-
ностями доминантных мутантов. Во втором же поколении доми-
нантных форм воз и икнет в три раза больше, чем соответствующих
рецессивных (т. е. нормальных), если результаты анализировать
отдельно по отношению к каждому из участвующих в скрещива-
нии мутантов. Если же принять во внимание общие результаты
расщепления, то оно, как всегда, выразится отношением 9:3:
3 : 1, в чем читатель может убедиться самостоятельно.
ТРИГИБРИДНОЕ СКРЕЩИВАНИЕ
Наследование рецессивных признаков
brown, ebony и eyeless
Рассмотрим теперь тригибридное скрещивание с участием
трех пар свободно комбинирующихся признаков. Для этого
скрещивания удобно воспользоваться мухами линии brown-
ebony-eyeless, скрестив их с нормальными (табл. 5).
Напишем формулы родительских мух и их гамет:
Гаметы РР:£—— —
Гибриды F1, самки и самцы, будут нормальными по фенотипу
и гетерозиготны по трем факторам, т. е.
По формуле 2П (стр. 61) выпишем восемь типов гамет гибридов
первого поколения и, расположив их на сторонах решетки Пен-
нета, решаем ее обычным способом.
После того как выше был дан подробный разбор фенотипов и
генотипов F2 для дигибридного скрещивания, нет необходимости
столь же подробно анализировать мух F2 рассматриваемого
тригибридного скрещивания. Применив тот же ход рассуждения,
можно убедиться, что п здесь признаки расщепились в полном
соответствии с III законом Менделя. Если полученное F2 клас-
сифицировать в отношении всех трех пар признаков вместе, то
придем к следующей общей формуле расщепления для тригибрид-
ного скрещивания:
27 Normal : 9 brown : 9 ebony : 9 eyeless : 3 brown-ebony :
3 brown-eyeless : 3 ebony-eyeless : 1 brown-ebony-eyeless.
70
Таблица 5
Трмгибридное скрещивание
(brown-ebony-eyeless X Norma!)
II III bw e PP: 2==- bw e Гаметы Fl: 3 +11+ + = +11+ + +o + x + > ф||ф IV + r — 1 аме 4~ 4- 4- ey L b гы PP: £- 4- e 4- I III IV w e ey & li w 4- 4- 11 III IV 4- - 4- 4- 4- e ey Fl: 2 2 n bw + ey 1? £ 1- +НГ 1+ +14 ey T bw e ey
+1+ + 1+ +1+ 4- 4- ey T~~ _+ e 4- + -f- + bw + + -1- 4- -4- +11+ 44 41- bw 4- ey VT~ +11+ 41+ 44 bw e ev
+ + ey M == = + + ey +11+1 +11+ -II- +11 i '11+ +11+ +11 * +11+ 41+ + e 5 + + +11+ 41+ I w e 4- 4- 4- ey bw e ey ~+ T++
“ +.JL+. Ф 4- 4- + e 4- + + ey + e + +11+ 44 +11+ bw + + 4- e 4- 4- e e\ 4- e 4- bw 4- e\ + e + J’\\ e 4- + e + bw e ey + ' e +
bw 4- 4- +11 + +11+ +14 + + ey bw + + _+ _e_ J_-_ bw ~ 4- bw 4- 4- 1 w 4- 4- 4~ e (?y bw TT J w + <•> TV ~~ .41+ ° 11+ 44 bw e ey Tw “ ~
4- о ey +11+ 41+ •41+ 4- 4- ey 4- e ey +14' 41® +11+ bw + + 4" e ey 4- e ey 4- e ey J \v 4- e \ 4- e ey 1 w e 4- 4- e ey L Wj e ey 4- e ey
bw 4- ey 4- 4- 4- bw 4- ey 4- 4~ ey bw 4- ey 4~ e 4- bw 4- ey bw 4- 4- bw 4- ey 4- e ey bw 4- ey I w! 4- v\ bw 4- vy bw e 4- bw + ey ):w e ey bw 4- ey
bw e 4- -H 4- 4- bw e 4- + + ey bw e 4- 4~ e 4" bw e 4- bw + + bw e 4- 4- e ey.' bw e 4- bw 4- e\ bw . e 4 +1 + 4 44 bw e ey bw e 4-
bw e ey F2: + 4-4- bw e ey 27 Normal: 9 + + ey bw e ey brown: 9 ebor + e + I bw e ey 1 iv : 9 eyeless: 1 brown- bwj 4- 4- bw e ye : 3 brown-ebo ebony-eye I еь 4~ e ey bw e ey! my : 3 brown- s. bw -p ey | bw e 4- | bw e ey 1 bw e ey | eyeless : 3 ebony-eyeless : bw e ey bw e ey
Если тех же мух классифицировать в отношении какой-либо
одной пары признаков и не учитывать две другие, тогда выше-
приведенная формула сведется к простой, моногибридной, т. е.
3:1. Иначе говоря, каждая отдельная пара признаков расщеп-
ляется так, как если бы все другие не участвовали в скрещивании.
Рассмотрение тригибридного скрещивания мы закончим ука-
занием на то, что у дрозофилы не представляется возможным вы-
полнить его с участием доминантных мутантов, так как III и IV
хромосомы не содержат удобных для этих целей доминантных
генов, нелетальных в гомозиготном состоянии. Поэтому осуще-
ствление тригибридного скрещивания на дрозофиле представ-
ляется возможным лишь с помощью рецессивных мутантов, что
и было нами рассмотрено на мутантах brown-ebony-eyeless.
ВЗАИМОДЕЙСТВИЕ ГЕНОВ И РАСЩЕПЛЕНИЯ,
УКЛОНЯЮЩИЕСЯ ОТ ТИПИЧНЫХ МЕНДЕЛЕВСКИХ
Выше уже подчеркивалось, что для осуществления типичных
менделевских отношений необходимо чтобы:
1) гены участвующих в скрещивании признаков относились
к разным группам сцепления;
2) не были сцеплены с половой хромосомой. К ним мы должны
теперь прибавить третье условие, а именно
3) отсутствие взаимодействия между генами скрещиваемых
особенностей, т. е. чтобы они (гены) не влияли сходным образом
на один и тот же признак. В самой общей форме мы уже отмечали
это условие (стр. 65); сейчас же разберем несколько таких слу-
чаев более подробно.
Расщепление 9:7 в скрещивании мутантов
black и ebony
С мутантом ebony мы имели дело в одном из предыдущих
опытов. Что же касается мутанта black (черный), то, как пока-
зывает название, он также вызывает развитие темного пигмента,
сходного с таковым у мух ebony. Оба эти признака рецессивны.
Ген ebony локализован в III хромосоме, ген black — во II.
Проследим теперь, какое расщепление будет в F2, если мух
black и ebony скрестить между собой. Анализ этого скрещива-
ния, представленный в табл. 6, показывает, что с генотипи-
ческой точки зрения мухи F2 этого скрещивания мало отлича-
ются от мух F2, возникших от скрещивания ebony X vestigial.
Однако, как показывает сопоставление соответствующих ф е-
н о т и п о в, между рассматриваемыми случаями имеется су-
щественное отличие. В самом деле, в скрещивании ebony X ve-
stigial фенотипы номера И, 12, 15 и 6, 8, 14, 16 (табл. 4) отличаются
как друг от друга, так и от нормальных мух. В данном же случае
72
Таблица 6
Взаимодействие генов. Расщепление 9 : 7
(black X ebony)
II III II III
b 4- -4— e
ГР: =
b + + e
b -]- -r e
Гаметы PP: J---------о---------
F2: 9 Normal :3 black : 3 ebony : 1 black-ebony
пли 9 серых : 7 черных.
три типа мух, а именно black, ebony и black-ebony (табл. 6) —
все черные и практически неотличимы друг от друга. Поэтому
мухи этих трех классов (7 из 16) по внешности составят один класс
темноокрашенных, а все прочие (9 из 16) составят класс нормаль-
ных, серых мух. Следовательно, общее расщепление вместо 9 :
3:3:1 сведется к более краткому, а именно 9 нормальных :
7 темноокрашенных.
Расщепление 27:37 в скрещивании мутантов
morula, glass и eyeless
Нетрудно рассчитать, что если бы в предыдущее скрещивание
вовлечь еще один ген, действующий на пигментацию тела так же,
как и гены black и ebony, то в класс темноокрашенных мух
73
II III PP: mr gl Гаметы Fl: IV II III «У ' + + +_ Взапм IV 4" — Гаме 4- 4- 4- e y □действие re niorula-glasj ты PP: 5 - + gl + :hob. Paciqei i-eyeless X N 'tr gl ey mr + + тление 27 :3 ormal) j .zL i. 4- gl ey 7 Fl: 5? mr + ey T + + mr gl 4- а б л и ц a 7 ey -4 mr gl ey
-4 4" 4- +11+ +IH- Ф +11+ +11+ +1|з +11+ «’ll+ +11+ mr + 4- 4- gl ey mr -4 ey ~ h7 4~ mr gl 4- mr gl ey TT “
4- 4- ey 4- 4- ey 4- + ey + + ey + + ey mr + + + + ey 4- gl ey ~~ 'ey mr 4- ey +" +"ey mr gl + 4 T4 mr gl ey ey
4- gl 4- 1 +11 + + II-. +14 4- 4- ey ~4 7ГТ +1+ «1» +1+ mr + + 4- gl 4- 4- gl ey 4- gl + mr 4- ey 4- gl 4- mr gl 4- + gl 4- mr gl ey + gl +
m r 4 4 +14 +11+ Hie 4- 4- ey mr 4- ~ 4- gl + mr T ~ mr + + mr 4- ~ 4- gl ey mr mr 4- ey т7~~ mr gl 4- mr 4- 4- mr gl ey mr 4- +
4- ill ev " 1 1 iXi 4- gl ey 4- 4- ey 4- gl ey 4- pl 4- 4- gl ey mr + + 4- gl ey 4- gl ey 4- gl ey mr 4- ey 4- gl ey mr gl 4~ + gl ey mr gl ey -4 gl ey
mr 4- ey =—— m r 4- e y -4 4- ev mr 4- ey 4- gl 4- in r + ev mr 4- + mr 4- ey -4 gl ey mr 4- ey mr 4- ey mr 4- ey mr gl 4- mr -h ev mr gl ey mr 4" ey
mr gl -J- m rJ gl 4- 4- 4- ey mr gl 4- + gl_ +_ mr gl 4- mr 4- 4- mr gT~ + gl e v mr gl 4- mr 4- ey mr gl 4- mr gl + mr gl 4- mr gl ey mr gl 4-
mr gl ey F2: 27 Normal: или 27 c i + 4~4~ iiir gl ey : 9 morula : 9 g нормальными 4- 4- ey mr gl ey lass: 9 eyeles глазами: 37 c 4- gl 4- mr gl ey s : 3 morala-| глазами, от mr + + mr gl ey ^lass:3 mon сличающими' 4- gl ey I mr 4- ey mr gl ey 1 mr gl ey ila-eyeless: 3 glass-eyele: ся от нормальных в той mr gl 4- mr gl ey ss : 1 morula- или иной c mr gl ey mг gl ey glass-eyeless гепени.
Попали бы все те новые комбинации, которые должны возникнуть
в тригибридном скрещивании и которые в сумме составили бы
37 особей па каждые 64 мухи F2. Следовательно, типичная фор-
мула расщепления 27 : 9 : 9 : 9 : 3 : 3 : 3 : 1 свелась бы к более
краткой: 27 нормальных (серых) : 37 темноокрашенных.
В табл. 7 приведен анализ такого скрещивания на примере
мутантов morula, glass и eyeless, гены которых относятся соответ-
ственно ко II, III и IV группам сцепления и несколько по-разному
модифицируют строение глаз. После всего вышесказанного нет
необходимости рассматривать это скрещивание подробнее;
при помощи табл. 7 дальнейший анализ без труда можно проде-
лать самостоятельно. Отметим лишь, что в один класс попадут
все нормальные мухи (27 из каждых 64); в другой — все прочие
мухи (37 из каждых 64), у которых глаза будут отличаться от нор-
мальных в той или иной степени.
Расщепление 13:3 в скрещивании мутантов
Lobe и eyeless
Рассмотренные примеры расщеплений, обусловленных взаи-
модействием гепов пигментации тела или строения глаз, не яв-
ляются уникальными с рассматриваемой точки зрения. Напротив,
расщепления, которые имеют место в случаях взаимодействия
свободно комбинирующихся генов, могут быть самыми разнооб-
разными, зависящими в каждом конкретном случае от числа
взаимодействующих генов, от характера взаимодействия, степени
доминирования и т. д. Поэтому, не ставя своей целью исчерпать
все возможные у дрозофилы случаи уклонений от типичных мен-
делевских отношений на основе взаимодействия факторов, рас-
смотрим еще одно скрещивание, в котором один признак — до-
минантный, а другой — рецессивный. Для этого скрещивания
удобны уже известные нам мутанты Lobe и eyeless; оба они резко
уменьшают размеры глаз мухи.
Скрещивание мух Lobe и eyeless, представленное в табл. 8,
не отличается от обычного дигибридного, примеры которого были
рассмотрены выше. Тем не менее вследствие взаимодействия генов
Lobe и eyeless формула расщепления мух F2 существенно отли-
чается от типичной менделевской.
Для облегчения фенотипического анализа потомства в нижней
части табл. 8 сгруппированы по отдельным рубрикам сходные
(аналогичные) фенотипы. Из рассмотрения их видно, что лишь
3 мухи из 16 (не имеющие гена Lobe и не гомозиготные по гену
eyeless) имеют нормальные, нередуцированные глаза. Все прочие
мухи, 13 из 16, имеют ген Lobe (в гомозиготном или гетерозигот-
ном состоянии) и в дополнение к нему ген eyeless (у части мух
также в гомозиготном состоянии). Следовательно, в общей слож-
ности у каждых 13 из 16 мух глаза будут уменьшены в той или
75
Таблица Я
Взаимодействие генов. Расщепление 13 : 3
(Lobe X eyeless)
II IV II IV
L + т “F су
РР: д=^х$^= =
L + + еу
Га .меты РР: — X-
FI: J $ и $ $ = i
+ еу
Гаметы FI :
L -г L еу 4- + Я- еу
1 ~||“ +11+ L еу L + 41+ +11+ + еу
L еу L еу L еу ь еу + ч- ь еу + еу L еу
+ + +IF +11+ L еу + + 4- 4- + + + еу + +
+ еу L + + еу L еу + еу + 4- 4- еу 4- еу + еу
F2: 9 Lobe : 3 Lobe-eyeless : 3 Normal: 1 eyeless
или 13 безглазых : 3 нормальных.
иной степени. Соответственно с этим формула типичного дигиб-
ридного расщепления 9 : 3 : 3 : 1, нормально представленная че-
тырьмя фенотипами, сведется в данном случае к двум фенотипам
и к более простой формуле: 13 мух с уменьшенными глазами :
3 с нормальными.
Легко видеть, что если бы и ген eyeless был доминантным,
тогда лишь 1 муха из 16 была с нормальными глазами, и расщеп-
ление свелось бы к отношению 15 : 1.
В заключение полезно еще раз подчеркнуть, что все рассмот-
ренные в настоящем разделе случаи расщеплений, уклоняющиеся
от типичных менделевских, обязаны своим возникновением
взаимодействию свободно комбиниру кэ-
76
щи х с я признаков. В этом заключается отличие этой
категории закономерностей от той, которая обязана с ц е п л е-
н и ю генов и будет рассмотрена в главе III.
ГЕНОТИПИЧЕСКИЙ АНАЛИЗ F2
И ВОЗВРАТНОЕ (АНАЛИТИЧЕСКОЕ) СКРЕЩИВАНИЕ
Анализ моногибридных, дигибридных и тригибридных скре-
щиваний мы заканчивали на втором гибридном поколении. На
практике, однако, гибридологический анализ продолжается зна-
чительно дальше, в зависимости от цели скрещивания.
Поясним сказанное на примере, вернувшись для этого к скре-
щиванию нормальных мух с ebony. Второе поколение от этого
скрещивания генотипически расщепляется на
Первые два генотипа по внешности сходны и образуют один
класс нормальных мух. Спрашивается, как решить сразу же воз-
никающий на практике вопрос, является ли каждая данная муха
этого класса нормальной гомозиготой или гетерозиготой по
гену ebony, но фенотипически ничем от первой не отличаю-
щейся?
Для решения этого вопроса прибегают к особому, так называе-
мому возвратному, или аналитическому, скре-
щиванию. Сущность этого важного приема заключается в скрещи-
вании подлежащих анализу форм с соответствующим гомози-
готным рецессивом. Возвратное скрещивание дает
возможность учесть все образующиеся у анализируемых мух сорта
гамет и безошибочно решить вопрос о принадлежности испытуемой
особи к тому или иному генотипу.
В самом деле, посмотрим, что произойдет в третьем поколении,
если скрестить с гомозиготными мухами ebony всех по внешности
нормальных мух из F2 рассматриваемого скрещивания (табл. 9).
Среди последних, имеется 1/3 мух нормальных гомозиготных
( 'г/ ;-). В результате возвратного скрещивания все потомки каж-
дой мухи станут гетерозиготными по ebony, но фенотипически не
обнаружат никакого расщепления.
В противоположность нормальным гомозиготам, каждая гетеро-
зиготная муха строения (+/е), но также нормальная по фенотипу,
будучи скрещена с гомозиготной рецессивной мухой ebony, даст
в следующем поколении расщепление 1 Normal : 1 ebony.
Сходные результаты получаются и тогда, когда анализируемый
признак доминантный. В этом случае в качестве гомозиготного
рецессива нужно взять нормальную муху.
Таким образом, принцип, лежащий в основе аналитического
скрещивания, напоминает те приемы, которые применяются в хи-
77
Т а и л и ца 9
Расщепление в моноглбридпом возвратном
скрещивании
Нормальные по фенотипу
гомозиготы
гетсрозиготы
+
Гаметы F2:
Гаметы Р2 2:
е
е
е
В потомстве нор-
мальных гомози-
гот расщепления
нет
В потомстве гетеро-
зигот
расщепление
1 F2 от скрещивания, приведенного на табл. 3, справа.
- Р2 — гомозиготный рецессивный родитель.
мии и, в частности, в фотографии. Допустим, что перед нами
фотографические пластинки, часть которых когда-то была экспо-
нирована, но никак не отмечена. Спрашивается, как отличить
экспонированные пластинки от неэкспонированных? Ведь по
внешнему виду они не отличимы, так же как не отличимы те мухи
F2, генотипическое строение которых надлежит выяснить.
Фотограф, как известно, решает этот вопрос при помощи про-
явителя, роль которого сводится к выявлению скрытого изобра-
жения на экспонированной пластинке. Таким проявителем в руках
генетика является гомозиготный рецессив с одним
типом гамет. Гаметы рецессивного родителя, конечно, вносят свою
долю участия в формирование внешних особенностей зигот, воз-
никающих в результате возвратного скрещивания. Однако как
характер снимка определяется не проявителем, а заснятым сюже-
том, так и фенотипы возникающих в возвратном скрещива-
нии особей определяются генным составом
анализируемого родителя; гаметы же рецессив-
ного родителя не вносят со своей стороны ничего, что могло бы
повлиять на фенотипическое расщепление особей данного воз-
вратного скрещивания.
Аналитическое испытание потомства необходимо вести в так
называемых индивидуальных культурах. По-
ясним сущность метода индивидуальных культур и его практиче-
ское осуществление.
78
Выше было сказано, что подлежащие анализу мухи генотипи-
чески неоднородны. Между тем вывод о генотипическом строении
каждой анализируемой мухи может быть получен лишь ретроспек-
тивно, на основе анализа ее потомства. Следовательно,
опыт с этими мухами надлежит организовать так, чтобы потомство
каждой мухи' проанализировать в отдельности, почему
и самый прием носит название метода индивидуаль-
ного испытания по потомству.
В нашем конкретном случае (скрещивание анализируемых
мух с ebony) следует поступить таким образом. Всех нормальных
по внешности мух второго поколения, самок и самцов, рассадить
в пробирки или стаканчики поодиночке и затем подсадить к сам-
кам по одному или по несколько самцов ebony, а к самцам — по
одной-две девственных самки ebony из основной линии. Разу-
меется, что девственными должны быть и все те нормальные по
фенотипу самки второго поколения, анализ которых необходимо
произвести при помощи аналитического скрещивания.
Заметим, что понятию индивидуальности нисколько не проти-
воречит рекомендация брать для индивидуальных культур по
несколько гомозиготных мух ebony. В самом деле, сколько бы
самок ebony мы ни подсадили к одному испытуемому самцу, все
они дадут единственный тип яиц, а именно ebony. То же самое
справедливо и в отношении самцов ebony (стр. 61 и 66). Смысл же
этого приема заключается в следующем. Во-первых, две или три
самки дадут потомство более многочисленное и, следовательно,
статистически более достоверное. Во-вторых, одна муха (самка
или самец) может случайно погибнуть и нежелательным образом
повлиять на полноту опыта. Понятие же индивидуальности отно-
сится в данном случае к генотипам анализируемых мух, в отно-
шении которых рассматриваемый прием соблюден в полной
мере.
Таким образом, возвратное скрещивание является наилучшим
способом выяснения генотипической структуры любой особи,
а потому осуществление его в практикуме параллельно с основными
заданиями следует всячески приветствовать. Читатель может само-
стоятельно проделать возвратные скрещивания с мухами F2 для
всех разобранных скрещиваний. Схема одного такого скрещивания
с участием трех пар факторов представлена в табл. 10. В дальней-
шем, на протяжении всей книги и особенно в главе VI мы неодно-
кратно будем встречаться с возвратными скрещиваниями и убе-
димся еще более, какую важную роль они играют в генетическом
анализе. При этом не бесполезно вспомнить, что уже Мендель,
открывший законы наследственности, впервые оценил важность
этого скрещивания и с его помощью осуществил на горохе
опыты, столь блестяще подтвердившие его гипотезу чистоты
гамет.
79
Таблица 10
Расщепление в тригибридпом возвратном скрещивании
II о рм а л ь иы е по фенотип у
гомозиготы моно гетерозиготы дигетеро зиготы тригетерозиготы
1<2 1 ААВВСС ААВВСс ААВЬСС АаВВСС ААВЬСс АаВЬСС АаВВСс AaBbCc
АВС АВС АВС АВС АНС АВС АВС ABC
abc abc al) с abc abc abc abc abc
—,—' АВс АЬС аВС Abc abC aBe ABc
3 abc abc abc abc abc abc abc
. ABc AbC ABc AbC
Расщепление abc abc abc abc
1 : I4 AbC aBC aBC aBC
abc abc abc abc
§ F32 • г I w Abc
Расщепление abc
1 : 1 : 1 : 1 5 aBc
abc
abC
abc
abc
abc
1 : 1 : 1 : J : 1 : 1 : 1 : 1 G
1 Фенотипически нормальное потомство от скрещивания, приведенного в табл. 5.
- В формулах F3 сверху — гаметы мух F2; снизу — гаметы гомозиготного рецессивного родителя.
3 Расщепления в F3 нет.
4 Расщепление в каждом случае только по одной паре признаков (1 : 1).
5 Расщепление в каждом случае по двум парам признаков (1 : 1 : 1 : 1).
6 Расщепление по трем парам признаков (1 : 1 : 1 : 1 : 1 : 1 : 1 : 1).
СИСТЕМЫ ОБОЗНАЧЕНИЙ ГЕНОВ
В заключение главы о менделизме необходимо остановиться
еще на одной особенности дигибридных и других более сложных
скрещиваний, касающейся порядка обозначения доминантных
и рецессивных генов.
На стр. 63 было указано на необходимость выработки навыков
в уменье ориентироваться в разных системах обозначений доми-
нантных и рецессивных генов. Там же был приведен простейший
пример перевода употребляющихся в генетике дрозофилы симво-
лов на язык обычных буквенных обозначений.
В большинстве рассмотренных примеров скрещивания произ-
водились между нормальными дикими мухами и доминантными
или рецессивными мутантами. Доминантные аллеломорфы обо-
значались в формулах большими буквами алфавита, а рецессив-
ные — малыми. Нормальное же состояние доминантных или
рецессивных генов (дикие аллеломорфы) по этой системе обозна-
чалось значком -|-. Перевод этих символов на язык обычных бук-
венных обозначений не должен представлять особых затруднений.
Так, например, в скрещивании мух Lobe X Normal первого из
родителей мы должны обозначить АА, а второго — аа. В соответ-
ствии с этим весь дальнейший анализ при помощи этих символов
не представит затруднений. Равным образом в скрещивании мух
ebony X Normal первого из родителей необходимо обозначить аа
и второго — АА и т. д.
Однако возможны такие случаи, когда один или несколько
участвующих в скрещивании признаков дрозофилы являются
доминантными, а другой или другие — рецессивными. С подоб-
ным примером мы уже имели дело при разборе скрещивания мух
Lobe и eyeless. Очевидно, что было бы трудно изобразить это
скрещивание на языке общепринятых буквенных символов, так
как в одном и том же скрещивании нормальный аллеломорф доми-
нантного гена Lobe пришлось бы обозначить малой буквой, на-
пример аа (ген Lobe нужно было бы обозначить при этом АА),
в то время как нормальный аллеломорф рецессивного гена eyeless
пришлось бы обозначить большой буквой, например ВВ (ген
eyeless при этом условии должен был бы получить символ bb).
Очевидно, что требуемое условие в данном случае невыполнимо,
если не обозначить как-то иначе одно из состояний этой трехчлен-
ной системы: доминант — нормальный аллеломорф — рецессив.
На языке дрозофильной символики она удобно выражается в виде
следующего ряда:
А, В, (]...(доминантные гены) >
4~л, • • • (нормальные аллеломорфы)^
а, Ь, с... (рецессивные гены),
пли А, В, С...>4-А, 4_с...>а, Ь, с...
6 Н. Н. Медведев 81
При попытке изобразить эту трехчленную систему при помощи
общепринятых символов мы должны будем одну из ступеней этой
системы обозначить как-то иначе, например:
нормальные
доминанты > аллеломорфы > рецессивы
А1, В1, С1. . . Л, В, С . . .а, Ь, с . . .
или А, В, С ... А1, В1, С ... а, Ь, с . . .
пли А, В, С . . . а, Ь с . . .а1, Ь1, с1. . .
и в соответствии с этим вести дальнейший анализ скрещивания.
Вопрос о существовании у дрозофилы истинных трехстепенных
систем типа А > +а > а, в которых нормальный аллеломорф
рецессивен по отношению к его доминантному аллеломорфу и
доминантен по отношению к своему рецессивному аллеломорфу,
будет рассмотрен в разделе, посвященном множественным аллело-
морфам (стр. 134).
ГЛАВА ТРЕТ I) Я
НЕСВОБОДНОЕ КОМБИНИРОВАНИЕ ПРИЗНАКОВ
И ДРУГИЕ ГЛАВНЕЙШИЕ СЛУЧАИ УКЛОНЕНИЙ
ОТ ТИПИЧНЫХ МЕНДЕЛЕВСКИХ ОТНОШЕНИЙ,
ОБЯЗАННЫЕ СЦЕПЛЕНИЮ ГЕНОВ
ПОЛ И НАСЛЕДОВАНИЕ СЦЕПЛЕННЫХ
С ПОЛОМ ПРИЗНАКОВ
В предыдущих разделах мы рассматривали скрещивания му-
тантов, гены которых локализованы в аутосомах, и не касались
мутантов, гены которых локализованы в половой хромосоме.
Именно при этих условиях наблюдающиеся во втором поколении
гибридов числовые отношения при обоих направлениях скрещи-
вания удовлетворяют типичным ме н де л ев с к им,
возникающим при свободном комбинировании генов.
Перейдем теперь к рассмотрению способа наследования му-
тантных особенностей, гены которых локализованы в половой
хромосоме и вследствие этого обнаруживают иные отношения,
вносящие существенные ограничения в законы Менделя.
Различие в наследовании сцепленных с полом признаков обусло-
влено особенностями наследования половых хромосом. Поэтому
прежде чем переходить к подробному рассмотрению опытов, по-
лезно вспомнить механизм наследования у дрозофилы половых
хромосом.
Как известно, самка дрозофилы обладает двумя половыми,
или Х-хромосомами. Самец же имеет только одну Х-хромосому
и другую Y-образную, или Y-хромосому (рпс. 20). Способ их
наследования представлен на схеме:
9 <5
XX XY
i ;
яйца спермин
I i I
X X У
Зиготы: 2 j XX £ £ ХУ
Поясним эту схему. Так как у самки дрозофилы имеются две
Х-хромосомы, то очевидно, что все продуцируемые ею яйца будут
содержать Х-хромосому. Самец же образует два типа сперматозо-
83
6*
идов в равных количествах; одна половина их с Х-хромосомой,
другая — с Y-хромосомой. Таким образом, женский пол у дрозо-
филы г о м о г а м е т е н (образует один тип гамет), а муж-
ской пол гете рога метен (образует два типа гамет).
В результате оплодотворения яиц с Х-хромосодюй спермато-
зоидами с X- или Y-хромосомой возникнут зиготы с двумя Х-хро-
мосомами, т. е. самки, и зиготы с X- и Y-хромосомами — самцы.
Одна из двух половых хромосом самки получена от матери (через
яйцо), другая — от отца (через сперматозоид). В отличие от самки
единственная Х-хромосома самца получена от матери (через яйцо),
/ 2
Рис. 20. Диплоидные наборы хромосом дрозо-
филы самки (7) и самца (2)
X и Y — половые хромосомы (схематизировано)
другая половая хромосома, Y-хромосома, наследуется исключи-
тельно по мужской линии и нормально может быть получена только
от отца (через сперматозоид). Об исключениях из этого правила
будет сказано при рассмотрении случаев нерасхождения Х-хро-
мосом. В полном соответствии с этим наследуются все гены, лока-
лизованные в половой хромосоме.
Только что рассмотренный порядок наследования половых хро-
мосом у дрозофилы, свойственный также и человеку, не является
универсальным для всех организмов. Наряду с ним, существует
и другой способ, или тип наследования половых хромосом,
а именно — тип Abraxas, который впервые был обнаружен
у бабочки одноименного названия, а позднее установлен у птиц,
и в частности у домашней курицы. Отличие типа Abraxas от типа
Drosophila заключается в том, что гетерогаметным здесь явля-
ется женский пол и гомогаметным -мужской.
Наследование полудоминантного,
сцепленного с полом признака Ваг.
Прямое н реципрокное скрещивания
Для иллюстрации сцепленной с полом наследственности у дро-
зофилы разберем наследование признака Ваг — полосковидные
глаза (табл. И). Ген Ваг относится к числу не вполне доминантных,
84
Таблица 11
Наследование сцепленных с Полом признаков
(Ваг и white)
Прямое скрещивание Рецпирокцое скрещивание
Признак доминантный (Ваг)
В -j- —-г В
РР: 9 = Х<5==з РГ: 5 = X <5 =5
о 4-
В т4 -р -р -г В ,
Гаметы РР: J— о------» ~Гаметы РР: J— о—> —
fi: 55Д fi: 554
* 4- * * в
Признак рецессивный (white)
+ т w w г 4-
РР: J = XO=5 РР: ? = Х -
—I— ф W W •г ~I-
Гаметы РР: £'— о—, —э Гаметы РР: £ О—,
F1: <554 ?2= <554
w -р
85
вследствие чего его проявление у гетерозиготных мух значи-
тельно ослаблено по сравнению с гомозиготными (рис. 4).
Согласно сказанному выше о половых хромосомах, скрещива-
ние самки Ваг с самцом Normal необходимо представить в следую-
щем виде:
в
РР: 5ТГ
Приведенные структурные формулы родителей показывают,
что самка Ваг, гомозиготная по этому признаку, имеет ген Ваг
в обеих Х-хромосомах. В отличие от самки гомологичный локус
Х-хромосомы нормального самца содержит нормальный аллело-
морф гена Ваг, рецессивный по отношению к последнему. Что же
касается Y-хромосомы (обозначенной в тексте и в таблицах знач-
ком или буквой Y), то она лишена генов и не оказывает влия-
ния на наследование признаков. Доказательство этого будет при-
ведено ниже (стр. 103).
Редукционное деление приводит к образованию одного типа
яиц у самки (с геном Ваг) и двух типов сперматозоидов у самца
(с нормальным аллеломорфом гена Ваг и с Y-хромосомой). Опло-
дотворение яиц сперматозоидами с Х-хромосомой приведет к обра-
зованию самок и спермой с Y-хромосомой — к образованию сам-
цов, в равных количествах тех и других.
Генотипически эти отношения должны быть представлены
следующими формулами:
Гаметы PP: 9 — 3 — ,
В т т В
F1: 99 = 3 3 •
Как видно из схемы, все самки и самцы первого поколения
обладают признаком Ваг, причем у самок ген Ваг находится в ге-
терозиготном состоянии. Что же касается самцов, то у них,
кроме Х-хромосомы, в которой находится ген Ваг, присутствует
также Y-хромосома. Однако Y-хромосома генов не содержит и
на проявление генов Х-хромосомы влияния не оказывает. Ска-
занное нужно понимать в том смысле, что всякий ген, присут-
ствующий в Х-хромосоме самца дрозофилы, безразлично доми-
нантный или рецессивный, проявляется так, как если бы он на-
ходился в гомозиготном состоянии. При рассмотрении явления
нерасхождения хромосом мы остановимся на этой особенности
более подробно. Сейчас же отметим лишь, что подобное состояние
гена, или генов, в отличие от гомозиготного и гетерозиготного,
называется гемизиготным и составляет первую от-
личительную особенность поведения сцепленных с полом наслед-
ственных факторов у дрозофилы.
86
В соответствии со своеобразным состоянием и проявлением
генов Х-хромосомы самца мы вправе ожидать полного проявления
гена Ваг у всех самцов F1; так оно и есть на самом деле.
Выше было указано, что ген Ваг относится к числу не вполне
доминантных. Следовательно, гетерозиготные самки и гемизигот-
ные самцы первого поколения должны отличаться по фенотипу.
И действительно, внимательный просмотр мух показывает, что
редукция глаза у самцов идет гораздо дальше, чем у гетерозигот-
ных самок (рис. 4).
Вернемся теперь к нашему опыту и посмотрим, какое расще-
пление нужно ожидать во втором поколении от скрещивания
самок и самцов Ваг первого поколения?
Отправляясь от генотипических формул мух первого поколения
и применяя обычный ход рассуждения, получаем следующие типы
гамет, образуемые самками и самцами F1:
Г 174 в + 2в
I аметы F1: о — , — о —, —о .
Соответственно четырем типам гамет мухи второго поколения
будут представлены следующими четырьмя комбинациями:
В В т т в +
F2; 5г=п=' = is=--
Как видно, все самки обладают признаком Ваг. У половины
их, или х/4 от общего числа мух F2, ген Ваг находится в гомозигот-
ном состоянии (В/В) и у половины, т. е. также 1/4с от общего числа
мух F2, в гетерозиготном состоянии (В/ г). Это генотипическое
различие хорошо видно и фенотипически: у гетерозиготных самок
Ваг (В/+) глаза значительно крупнее, чем у гомозиготных (В/В),
и имеют характерную почковидную форму (рис. 4).
Что касается самцов, то из них только половина, или х/4 от
общего числа мух F2, обладает признаком Ваг (B/Y), в то время
как другую половину, или также 1/4 от общего количества мух F2,
составляют нормальные круглоглазые самцы (-J-/Y).
Таким образом, общие результаты расщепления будут таковы:
75% .мух F2 Ваг и 25% Normal.
Если отвлечься от разницы в степени доминирования, то един-
ственное отличие рассматриваемого скрещивания от разобранного
выше с геном Lobe заключается в том, что там среди 25% нор-
мальных круглоглазых мух были как самки, так и самцы. В дан-
ном же случае нормальные круглоглазые мухи представлены
исключительно самцами (табл. 11).
Таково наследование сцепленного с полом доминантного приз-
нака Ваг в том случае, когда он вступает в скрещивание со сто-
роны матери. Это направление скрещивания условимся в дальней-
шем называть прямым.
87
Иные результаты получаются в случае реципрокного
скрещивания, т. е. когда доминантный, сцепленный с полом приз-
нак входит в скрещивание со стороны отца. Заметим также, что
порядок обозначения направления скрещиваний терминами «пря-
мой» и «реципрокный» носит условный характер. Не будет ошибки,
если реципрокным обозначить скрещивание самки Ваг с самцом
Normal. Однако исключительно ради удобства, что будет видно
из дальнейшего, мы оставим для разобранного выше скрещивания
обозначение «прямого», а в тех случаях, когда рецессивный приз-
нак входит в скрещивание со стороны матери, для обозначения
направления скрещивания будем пользоваться термином «реци-
прокный».
Обратимся теперь к рассмотрению этого последнего случая,
т. е. скрещивания самки Normal с самцом Ваг (табл. 11).
Обозначим генотипы родителей формулами:
РР: $$>== X <5<? =5
X В
и их гаметы: £ — о — ,
Легко убедиться, что в результате последующего оплодотворе-
ния яиц + сперматозоидами В возникнут гетерозиготные самки
Ваг, а оплодотворение таких же яиц сперматозоидами Y приведет
к образованию нормальных круглоглазых самцов. В целом же
гибриды первого поколения должны быть представлены следую-
щими формулами:
FJ: 33=;.
Сравнение полученных в F1 мух с исходными родительскими
показывает, что у них произошел обмен признаками. В самом
деле, исходная родительская самка имела нормальные, круглые
глаза; самки же первого поколения (-J-/B) обладают признаком
Ваг. У самцов эти отношения противоположны: исходный самец
имел полосковидные глаза; самцы же F1 — нормальные, кругло-
глазые. Вспомнив порядок наследования у дрозофилы половых
хромосом, легко понять тот механизм, на основе которого признак
матери унаследовали сыновья, а признак отца унаследовали
дочери F1. Такой порядок наследования признаков, или, как
говорят, крисс - кросс наследование (criss-cross in-
heritance), является второй отличительной особенностью
наследования всех сцепленных с полом доминантных признаков,
когда они вступают в скрещивание в реципрокном на-
правлении, т. е. со стороны отца.
Продолжим разбор опыта дальше, скрестив мух первого поко-
ления между собой. Как самки, так и самцы F1 образуют по два
типа половых клеток в равных количествах:
2.л, dx
88
Возможные комбинации половых клеток приведут к возникно-
вению четырех типов мух второго поколения в равных количествах:
F2: <^4,4.
Как видно, половина самок F2, или х/4 общего количества,
обладает признаком Ваг (В/+); другая половина самок, также
V4 общего количества, имеет нормальные, круглые глаза (+/-!-).
Такие же отношения наблюдаются и среди самцов F2.
Суммируя результаты опыта по признаку Ваг (табл. 11),
окончательно убеждаемся, что мухи второго поколения анализи-
руемого скрещивания генотипически и фенотипически расще-
пились в отношении:
1 Bar: 1 Normal.
Эта формула напоминает формулу расщепления в случае воз-
вратного скрещивания т. е. скрещивания гибрида с гомозиготным
рецессивом (стр. 77). По существу оно таким и является, так как
скрещивание гетерозиготной самки F1 с нормальным гемизигот-
ным самцом, который в данном случае рецессивен по отношению
к Ваг, вполне удовлетворяет требуемому возвратным скрещиванием
условию (см. также стр. 101). В этом заключается третья от-
личительная особенность реципрокного скрещивания для любого
сцепленного с полом доминантного признака.
Теперь становятся понятными различия между прямым и ре-
ципрокным скрещиваниями для случаев сцепленных с полом приз-
наков, а следовательно, и польза их различения. Соблюдение
этого условия позволяет без решения каких-либо схем сразу от-
ветить на вопрос, какое будет расщепление в F2 в том и другом
случае, если признак сцеплен с полом. На это мы теперь сразу
можем ответить, что в случае прямого скрещивания все первое
поколение будет обладать доминантным признаком, а во втором
поколении произойдет расщепление на три доминантные формы
к одной рецессивной. В случае же реципрокного скрещивания
в F1 будет иметь место крисс-кросс наследование, а в F2 — рас-
щепление на одну доминантную форму к одной рецессивной (см.
также главу IV).
Наследование рецессивного,
сцепленного с полом признака white.
Прямое и реципрокное скрещивания
Совершенно излишним является подробный анализ скрещива-
ния рецессивного мутанта white после того, как было разобрано
скрещивание гена Ваг в обоих направлениях. Здесь опять-таки
89
Рис. 21. Наследование рецессивного, сцепленного с полом признака white
(белые глаза). Прямое скрещивание
Генотипическое строение мух приведено в табл. И
Рис. 22. Наследование рецессивного, сцепленного с полом признака white
(белые глаза). Р е ц>'ип ровное скрещивание
Генотипическое строение мух приведено в табл. 11
достаточно помнить, что нормальная, красная окраска глаз доми-
нирует над белоглазостью (while). Поэтому и в данном случае
результат будет двоякий в зависимости от того, в каком направле-
нии доминантный признак войдет в скрещивание.
Очевидно, что в случае прямого скрещивания, т. е.
все первое поколение будет нормальное, красноглазое, а во вто-
ром поколении произойдет расщепление на 3 Normal : 1 white
(табл* 11 и рис. 21).
В случае же реципрокного скрещивания, т. е.
£=ХЗ-Ч,
+ W
в F1 будет иметь место крисс-кросс наследование, a F2 распадется
поровну на красноглазых и белоглазых мух, т. е. 1 Normal :
1 white (табл. И и рис. 22).
Наследование доминантных признаков
Beadex и Lobe.
Прямое и реципрокное скрещивания
Рассмотрим теперь более сложный случай скрещивания двух
доминантных мутантов, а именно Beadex (Вх) — вырезанные
крылья и Lobe (L), с которым мы имели дело в одном из предыду-
щих скрещиваний. Первый из этих мутантов относится к I группе
сцепления, второй — ко II группе и оба доминантные.
На основании сказанного выше о поведении признаков Ваг
и white можно предсказать заранее, что признаки Beadex и Lobe
обнаружат неодинаковое расщепление в прямом и реци-
прокном скрещиваниях.
Итак, обратимся сначала к разбору прямого скрещива-
ния. Для этого, согласно условию, самку Beadex нужно скрестить
с самцом Lobe.
Фенотипическое проявление гена Beadex выражается в наличии
по краю крыла характерных вырезок, или зазубринок, степень
проявления которых значительно варьирует. В слабо выраженном
состоянии признак Beadex представлен одной-двумя незначитель-
ными вырезками на конце крыла, ближе к его медиальному краю.
У наркотизированных мух крылья налегают друг на друга, и
потому их внутренние края не видны. Поэтому при просмотре мух
следует осторожно раздвинуть крылья пинцетом и искать харак-
терные для Beadex вырезки на внутреннем краю крыла. При силь-
ном проявлении гена редукции подвергается значительная часть
92
крыла как с медиального, так и с латерального краев, вследствие
чего крыло имеет продолговатый и несколько заостренный вид.
Напишем генотипическое строение родителей (табл. 12).
г и 1 п
Bn
РР:
Таблица 12
Расщепление 9 : 3 : 3 : 1 в дигибридном скрещивании
(Beadex X Lobe)
Вх 4- т 4- L
РР: 9= =Х<5=; =
* Вх + L
Вх 4- т 4- L L
Гаметы РР: 9--- — 6— —, -=> -----
Вх 4~ т т Вх 4-
F1: 9 9= = 55= =
4- В L
F2: 9 Beadex-Lobe : 3 Beadex : 3 Lobe : 1 Normal
или 3 Beadex:! не-Beadex : 3 Lobe:! не-Lobe.
Гомозиготные самки Beadex, как всегда, образуют один тип
яиц с геном Вх, самцы же образуют два типа спермиев, с X- и
Y-хромосомоп (стр. 84). Следовательно, гаметы родителей будут
иметь такое строение:
I п I 11
Гаметы РР: 9 — — (5 — — , —=> — .
93
Гибриды первого поколения будут представлены следующими
формулами:
1 и । и
П: waj. «ах.
Как видно, все самки и самцы гетерозиготны по признаку Lobe;
самки, кроме того, гетерозиготны и по гену Beadex, а самцы геми-
зиготны по гену Beadex. Фенотипически же все мухи F1 будут
с вырезанными крыльями и редуцированными глазами, т. е.
Beadex и Lobe.
Скрестим теперь гибридов первого поколения между собой и
посмотрим, какое расщепление будет в F2. По формуле 2П выписы-
ваем для гибридов по четыре типа гамет и, расположив их на сто-
ронах решетки Пеннета, решаем ее обычным способом.
Суммируя результаты расщепления по фенотипу, получаем
окончательную формулу расщепления (табл. 12):
9 Bx-L : 3 Вх : 3L : 1 Normal.
Равным образом, произведя анализ полученных мух с точки
зрения моногибридного расщепления, снова убеждаемся, что как
ген Вх, так и ген L обнаружили расщепление 3 : 1: на каждые
12 мух появились 4 мухи с нормальными крыльями и на 12 мух
Lobe — 4 мухи с нормальными глазами.
Таким образом, наблюдающееся в данном опыте расщепление
в точности соответствует расщеплению при свободном комбиниро-
вании признаков. Иначе говоря, признак Beadex ведет себя так,
как если бы он не был сцеплен с полом. Чему обязаны эти резуль-
таты, мы уже знаем на основании предыдущего (стр. 89); разбор
же приводимого ниже скрещивания, которое в отношении приз-
нака Beadex является реципрокным (табл. 13), даст еще одно
доказательство справедливости рассматриваемого положения.
По принятому условию, для реципрокного скрещива-
ния нужно взять самку Lobe и самца Beadex. Приведем геноти-
пические формулы этих мух и образуемых ими гамет:
г п I н
v тэтэ L -г Вх -|-
1 аметы PP: j —--о-----— , — .
Гибриды первого поколения от этого скрещивания будут иметь
строение:
I п I л
Fl: qq±=
Вх + +
94
Таблица 13
Расщепление 3 : 1 : 3 : 1 в дигибридиом скрещивании
(Lobe >< Beadex)
4- L т Вх +
РР: Q= = Хо=5 =
* + L Л ^ +
Гаметы РР: 2 + Ь <5 Вх +, +
L т т ~г L
1?1: 9 9 = = <?<?- =
I > \ Г “Г
F2 : 6 Beadex-Lobe : 2 Bead6x : 6 Lobe : 2 Normal
или 1 Beadex : 1 не-Beadex; 3 Lobe ; 1 не-Lobe.
Фенотип гибридов Fl определяется проявлением двух ком-
бинирующихся генов. Из них аутосомный ген Lobe комбини-
руется независимо от пола и поэтому проявится как у самок,
так и у самцов; сцепленный же с полом ген Beadex обнаружит
уже знакомое нам крисс-кросс наследование.
Выписав далее все типы гамет гибридов первого поколения
и решив, как всегда, решетку Пеннета, получаем популяцию мух
второго поколения следующего состава (табл. 13).
Объединив соответствующие классы по фенотипу, убеждаемся,
что мухи F2 рассматриваемого скрещивания распределяются так:
GBx-L : 2Вх : 6L : 2Norma].
Сократив это отношение на 2, окончательно получим:
ЗВх-L : 1 Вх : 3L : 1 Normal.
95
Другими словами, признаки* расщепились в соответствии
с тем, как они вошли в скрещивание. В разобранном выше пря-
мом скрещивании (gBxX^L) оба доминантных гена расщепились
по отношению к своим нормальным аллеломорфам в отношении
3:1. В реципрокном же скрещивании (jLx^Bx) ген Beadex про-
явился лишь у половины мух F2, в то время как аутосомный
ген Lobe снова обнаружил типичное менделёвское расщепление,
т. е. 3 Lobe : 1 не-Lobe.
В связи с этим полезно еще раз обратить внимание на то,
что скрещивание гетерозиготной по сцепленному с полом гену
самки с рецессивным самцом по существу является возвратным
и приводит к формуле расщепления, типичной для подобных
случаев (стр. 89).
Нерасхождение половых хромосом
и отклонение от нормального способа наследования
сцепленных с полом признаков
В предыдущем разделе мы познакомились с особенностями на-
следования тех признаков, гены которых локализованы в половой
хромосоме. Теперь рассмотрим случаи нарушения нормального
способа наследования признаков этой группы, которые возникают
в случаях своеобразной «порчи» хромосомного механизма. На ос-
новании знакомства с такими исключительными случаями связь
наследственных признаков с хромосомами становится не только
высоко вероятным предположением, но и неоспоримым фак-
том. Эти же случаи нарушения хромосомного механизма позво-
ляют глубже понять роль и значение половых хромосом в опре-
делении пола, о чем мы говорили до сих пор лишь в самых общих
чертах, и, во-вторых, роль Y-хромосомы в наследовании сцеплен-
ных с полом признаков.
Итак, каковы эти уклоняющиеся от нормы случаи и в чем
заключается различие возникающих при этом аберрантных форм?
Согласно изложенному выше, если скрещиваются самка с бе-
лыми глазами и самец с красными глазами, в первом поколении
возникают красноглазые самки и белоглазые самцы (рис. 22).
Однако как исключение из этого правила иногда получаются диа-
метрально противоположные результаты.
Среди многочисленных линий дрозофилы существует обычная
в любой лаборатории линия, так называемая double yellow
(двойная желтая), в потомстве которой существуют именно такие
отношения. Если желтую самку из этой линии'скрестить с нор-
мальным самцом, то в F1 получаются похожие на родителей формы,
т. е. желтые самки и нормальные серые самцы. Чему обязано абер-
рантное поведение сцепленного с полом рецессивного признака
желтой окраски тела, ген которого yellow, так же как и ген white,
локализован в половой хромосоме?
96
Для ответа па этот вопрос удобнее обратиться к рассмотрению
того опыта, в котором это явление впервые было обнаружено
Бриджесом в 1913 г.
Скрестйв самку с киноварными глазами (vermilion — рецес-
сивный, сцепленный с полом признак) с нормальным самцом,
к иноварнаяу х
норм Исключит.
красного/норм./<$
(g)
Сперматозоиды
в оз мощные комбинации:
J. красноглазые $ $
I киноварные 6 <6
3. красноглазые
б.ч. нежизнеспособны
§
Ц. киноварные ххууу §
5. красноглазые хо 66 |
6. нежизнеспособны
Рис. 23. Наследование . рецессивного, сцепленного с
полом признака vermilion (киноварная окраска глаз)
в случае первичного нерасхождения X-хромосом
Хромосома с геном vermilion заштрихована
в F1, кроме нормальных красноглазых самок и киноварных сам-
цов (рис. 23, 1—2), Бриджес получил небольшое количество
(приблизительно 1 на 2000 мух) киноварных самок и красногла-
зых самцов (рис. 23, 4—5). Для объяснения причин появления
исключительных мух Бриджес сделал следующее простое допу-
щение: в известном числе случаев половые хромосомы самки в про-
цессе созревания яиц не разъединяются в редук-
7 Н. H. Медведев
97
ционном делении и или обе остаются в яйце, или,
напротив, обе выводятся в редукционное тельце. В результате воз-
никают два новых типа яиц: один с двумя Х-хромосомами,
другой вовсе лишен их. В результате оплодотворения таких яиц
сперматозоидами с X- или Y-хромосомой возникают четыре типа
исключительных зигот (рис. 23, 3—6). Из них зиготы OY (рис. 23,6)
нежизнеспособны и не развиваются. Зиготы XXX, или так на-
зываемые сверхсамки, или суперсамки (рис. 23, 3),
иногда выживают, но бесплодны. Наконец, зиготы XXY и ХО
(рис. 23, 4, 5) жизнеспособны и соответственно представляют со-
бой нормальных самок и самцов, но иного, чем всегда, хромо-
сомного состава: самки имеют 2Х- и добавочную Y-хромосому;
самцы же лишены Y-хромосомы и потому бесплодны. Самцы ХО
копулируют обычным образом. Однако семяприемник и яйцеводы
самок после копуляции с самцами ХО не содержат спермы. Се-
менная жидкость самцов содержит незначительное количество
неподвижных сперматозоидов.
Вспомнив ^теперь, что обе Х-хромосомы родительской самки
несли гены киноварной окраски глаз, а Х-хромосома самца со-
держала ген нормальной окраски глаз, легко понять появление
исключительных самцов и киноварных самок. Вследствие нерас-
хождения у исходной самки Х-хромосом исключительные
самки XXY унаследовали от матери обе Х-хромосомы с генами
киноварной окраски глаз. Очевидно, что они должны обладать
именно этой особенностью. Самцы же строения ХО получили
единственную Х-хромосому от красноглазого отца, почему у них
и появился этот признак.
Впоследствии было’произведено цитологическое исследование
хромосом исключительных самцов и сверхсамок и во всех случаях
было обнаружено полное соответствие генетических и цитологиче-
ских результатов опыта. Цитологические препараты подтвердили,
что самки XXY и сверхсамки XXX действительно обладали
одной добавочной Y- или Х-хромосомой; красноглазые же
самцы ХО имели только Х-хромосому.
Необходимо подчеркнуть, что все сказанное здесь и в дальней-
шем относительно неправильностей поведения Х-хромосомы в ре-
дукционном делении не относится к аутосомам, которые предпо-
лагаются распределяющимися в этих случаях нормально.
Наследование при спаянных Х-хромосомах
Вернемся к опыту с самками doubleTyellow, которые дают
только подобных себе дочерей, в то время как их сыновья не-
изменно наследуют признаки отца. На основании вышеизложен-
ного мы можем теперь сказать, что самки double yellow являются
не чем иным, как комбинациями XXY, с которыми мы только
что познакомились. Разница между самками double yellow и
98
исключительными киноварными XXY заключается в том, что
у первых произошла прочная с п а и к а Х-хромосом, вслед-
ствие чего они полностью утратили способность разъединяться
в редукционном делении и всегда наследуются как единый ком-
плекс. Так как спайка Х-хромосом произошла в гомозиготной
double-yellow (?
50% 50%
х норм, серого 3
50% 50%
комбинации F1
1. Серые Зх 99
б.ч. нежизнеспособны
Рис. 24. Наследование рецессивного сцеп-
ленного с полом признака yellow (желтое
тело) при спаянных Х-хромосомах (заштри-
хованы)
линии yellow (у — желтое тело) \ то, следовательно, и самки
doble yellow несут этот ген в гомозиготном состоянии.
Таким образом, строение самки double yellow мы должны
представить в виде следующей формулы:
У\
yz
Нетрудно понять, чему обязано появление в F1 желтых до-
черей и серых сыновей от скрещивания самки double yellow с нор-
мальным самцом. В самом деле, Х-хромосомы самки double yellow
всегда наследуются совместно. Их партнером в редукционном
1 Для простоты изложения строение исходной линии double yellow,
в которой произошла спайка Х-хромосом, несколько упрощено.
99
7*
делении является добавочная Y-хромосома. При наличии в яйце
двух неравноценных компонентов возможны два случая их рас-
хождения в процессе созревания. В одном из них в редукционное
тельце выводится Y-хромосома, в другом — обе спаянные X-
хромосомы. В результате могут возникнуть два типа яиц: один
с двумя Х-хромосомами и другой — с Y-хромосомой.
На рис. 24 показана дальнейшая судьба обоих типов яиц,
оплодотворенных сперматозоидами нормального самца с X- или
Y-хромосомой. Как видно на рис. 24, здесь возникают четыре
типа зигот различного хромосомного состава. Из них жизне-
способны только два — самки XXY и нормальные самцы XY.
Первые получили обе Х-хромосомы с генами желтого цвета от
матери; именно эту особенность они и наследуют от нее. Самцы же
XY во всем похожи на отца, от которого получили Х-хромосому.
Что касается зигот строения YY, то они, так же как и зиготы OY,
нежизнеспособны и потому не развиваются.
Итак, мы выяснили, что извращение крисс-кросс наследова-
ния в линии double yellow обязано спаянности X - хро-
мо с о м, в результате чего возникает особый тип наследования
признаков, сцепленных с этой хромосомой. Спаянность Х-хро-
мосом у самок double yellow принято обозначать круглой скобкой
над символами гена yellow, находящегося в спаянных Х-хро-
мосомах, т. е. уу.
Пол как менделирующий признак
На разобранных примерах мы имели возможность убедиться,
что в отношении наследования сцепленных с полом признаков
у дрозофилы первый закон Менделя в том виде, в каком он был
сформулирован автором, имеет силу лишь в случаях прямых скре-
щиваний и нарушается в случаях реципрокных. Равным образом
закон теряет силу в случаях нерасхождения хромосом и в других,
еще более специальных случаях, на которых мы не можем здесь
останавливаться. Тем не менее все эти случаи не только не про-
тиворечат основам менделизма, но служат его подтверждением
и дальнейшим развитием. И действительно, в природе нет других
примеров, в которых связь определенных клеточных структур
с морфологическими особенностями организма была бы столь оче-
видна.
Что же касается неоднократно упоминавшегося выше несоот-
ветствия наследования сцепленных с полом признаков первому
закону Менделя, то здесь необходимо подчеркнуть роль Х-хромо-
сом не только в явлениях наследственности, но и в еще большей
мере их связь с механизмом определения пола. Именно это обстоя-
тельство и накладывает отпечаток на способ наследования сцеплен-
ных с полом признаков у дрозофилы.
100
Результаты рассмотренных опытов в достаточной мере подго-
товили к признанию того положения, что пол есть такой же мен-
делирующий признак. В самом деле, известно, что у огромного
большинства животных численное соотношение полов приблизи-
тельно одинаково. По-видимому, существует какой-то общий био-
логический механизм, который автоматически регулирует числен-
ное равенство полов в пределах вида. Спрашивается, какому усло-
вию должен удовлетворять этот механизм, если допустить, как это
впервые сделал Морган, что то или иное половое состояние есть
такой же менделирующий признак и что численное равенство сам-
цов и самок (т. е. отношение 1 : 1) есть результат своеобразного
расщепления по признаку пола?
Нам известно, что отношение 1 : 1 возникает в случаях воз-
вратного скрещивания гетерозиготы с гомозиготным рецессивом.
Известно также, что мужской пол у дрозофилы гетерогаметен,
а женский — гомогаметен. Если сопоставить эти факты, менде-
листическое толкование пола вытекает из них как неизбежный
вывод.
Следовательно, половые хромосомы — это тот механизм, ко-
торый автоматически регулирует численное соотношение особей
мужского и женского пола в ряду последовательных поколений
расы и вида.
Все сказанное о наследовании пола у дрозофилы в равной
мере относится к бабочкам и птицам с той разницей, что у них
гетерогаметен женский, а гомогаметен — мужской пол, а также
к клопам, у которых Y-хромосома отсутствует (тип Prote-
nor, ХО).
Вторичное нерасхождение половых хромосом
и исключительные половые формы
у дрозофилы
Предыдущее рассмотрение механизма определения пола пред-
полагало, что пол у дрозофилы определяется тем или другим со-
четанием половых хромосом в процессе оплодотворения и что ауто-
сомы не играют роли в этом процессе. В действительности, однако,
это не так. Дальнейшие исследования, на которых мы не можем
здесь останавливаться ввиду их сложности, дали возможность
глубже проникнуть в сущность механизма определения пола,
который оказался намного сложнее простого сочетания половых
хромосом.
В заключение настоящего раздела познакомимся с некоторыми
другими аберрантными половыми формами у дрозофилы, которые
нигде не представлены так богато, как у этого объекта. Для этого
вернемся к опыту с киноварными самками и проследим особен-
ности возникающих в ее потомстве половых форм.
101
В отличие от нормальных киноварных самок XX, у которых
редукционное нерасхождение возникает приблизительно в одном
случае на 2000 и носит название первичного, у самок XXY
в результате вторичного, в данном случае уже неизбеж-
ного, нерасхождения Х-хромосом всегда возникает четыре
Киноварная хху? х красногл/норм./ <$
Возможные комбинации
1. Красноглазые Зхуу
6. ч. нежизнеспособны
3. красноглазые & d
М нежизнеспособны
5. красноглазые ?
6. киноварные i d
8. киноварные xyyd d
7. красноглазые ххд? $
Рис. 25. Наследование рецессивного сцепленного с полом
признака vermilion (киноварная окраска глаз) прп вторичном
нерасхождении Х-хромосом
Хромосома с геном vermilion заштрихована
типа яиц, а их хромосомный состав будет зависеть от того, как
произойдет расхождение при редукции трех половых хромосом
ооцита (рис. 25).
Очевидно, здесь возможны два случая расположения хромо-
сом на экваторе веретена и последующего расхождения их в до-
черние ядра: в одном случае к одному полюсу отходят X- и Y-
102
хромосомы, а к другому — другая Х-хромосома. Такой способ
расхождения половых хромосом (нормальное расхождение) на-
блюдается приблизительно в 84% случаев.
При другой ориентации хромосом на экваторе веретена обе
Х-хромосомы отходят к одному полюсу веретена (вторичное не-
расхождение), в то время как к другому полюсу отходит Y-хро-
мосома. Такой способ расхождения имеет место приблизительно
в 16% случаев. В результате возникают два типа исключительных
яиц, которые после оплодотворения спермой с X- или Y-хромо-
сомой дадут следующие четыре типа исключительных зигот
(рис. 25, 1—4).
Как видно по распределению в F1 киноварных и красногла-
зых мух, здесь снова возникают исключительные мухи (около 4%),
т. е. похожие на мать самки с киноварными глазами (рис. 25, 2)
и нормальные красноглазые самцы, подобные отцу (рис. 25, 3).
Однако наиболее интересными из всех возникающих в данном
скрещивании восьми типов зигот являются мухи строения XYY
(рис. 25, 8). Это нормальные по внешности самцы, несмотря на
наличие у них одной добавочной Y-хромосомы. Путем скрещива-
ния таких самцов с самкой XXY можно получить далее са-
мок XXYY, также нормальных по внешности.
Теперь своевременно подвести итог всему сказанному о сам-
цах и самках различного хромосомного состава. Набор половых
хромосом нормального самца — XY. Первичное нерасхождение
Х-хромосом у самок приводит к образованию нормальных по
внешности, но бесплодных самцов ХО, лишенных Y-хромосомы
(рис. 23, 5). Наконец, вторичное нерасхождение. дает начало
самцам типа XYY. Все три типа самцов — XY, ХО и XYY —
нормальны как в отношении признаков пола, так и в отношении
проявления тех признаков, гены которых локализованы в X-
хромосоме. Так, например, самцы Ваг этих трех типов ничем не
отличаются друг от друга. То же справедливо и по отношению
к любому другому гену половой хромосомы. Очевидно, что Y-
хромосома не влияет на определение пола мухи и на развитие
сцепленных с полом признаков.
Сопоставляя таким же образом различные типы самок, можно
видеть, что, помимо нормальных самок XX, существуют
самки XXY и XXYY, которые, за исключением сопровождаю-
щих их неправильностей редукционного нерасхождения, по
внешности также ничем не отличаются от нормальных, несмотря
на наличие у них одной и даже двух добавочных Y-хромосом.
Отсюда следует вывод, что пол дрозофилы опре-
деляется сочетанием Х-хромосом: сочетание
двух Х-хромосом определяет самку, в то время как наличие одной
Х-хромосомы определяет самца. Действительно, яйца 0, т. е. без
Х-хромосомы, или яйца Y, оплодотворенные Х-спермой, дают
самцов, тогда как яйца XX, оплодотворенные Y-спермой, дают
103
самок (рис. 26). Поэтому лишь условно следует считать, что X-
сперматозоиды определяют женский пол, а Y-сперматозоиды
определяют мужской пол. Очевидно и те, и другие могут при
определенных условиях привести к образованию пола, противо-
положному тому, который они определяют нормально, т. е. при
оплодотворении яиц с Х-хромосомой.
Рис. 26. Половые хромосомы и определение пола
у дрозофилы
Что касается Y-хромосомы, то в ней локализованы гены, опре-
деляющие плодовитость самца, и еще один ген, bobbed (короткие
щетинки; см. карты хромосом). Кроме того, Y-хромосома играет
роль партнера Х-хромосомы в процессе деления ядра клетки.
Впрочем, последнее условие едва ли обязательно во всех случаях,
поскольку известны такие организмы, у которых Y-хромосома
отсутствует (тип клопа Protenor, ХО).
СЦЕПЛЕНИЕ ГЕНОВ И ПЕРЕКРЕСТ ХРОМОСОМ
В настоящем разделе мы рассмотрим явление сцепления
признаков (linkage) и связанный с ним перекрест
хромосом (crossing-over), которые вносят еще одно сущест-
венное ограничение в III закон Менделя о независимом комбини-
ровании признаков у гибридов.
Лежащая в основе сцепления закономерность была впервые
сформулирована Морганом как «закон сцепления», или
104
«закон ограничения групп сцепления», сущ-
ность которого заключается в том, что при определенных условиях
признаки наследуются не независимо друг от друга, а сов-
местно. Все относящиеся сюда закономерности наследствен-
ности могут быть противопоставлены менделизму, характерной
особенностью которого является свободное, или неза-
висимое, комбинирование признаков.
Была попытка, в частности в русской литературе, называть
закон сцепления морганизмом. Однако термин этот не получил
распространения отчасти из-за разнородности объединяемых этим
термином явлений, куда, за вычетом менделизма, по необходи-
мости должны были быть отнесены все или почти все другие из-
вестные ныне генетические явления, а также и потому, что в раз-
работке теории сцепления большую роль сыграли талантливые
помощники Моргана—Мёллер, Бриджес и Стертевант.
У дрозофилы с четырьмя гаплоидными хромосомами скрещи-
вание с участием четырех мутационных признаков является
пределом той степени гибридности, при которой признаки
могут свободно комбинироваться друг с другом. Обозначив эти
признаки как А, В, Си D, мы вправе ожидать во втором поколе-
нии расщепление по формуле тетрагибридного скрещивания:
81 ABCD : 27 ABCd : 27 ABcD : 27 AbCD : 27 aBCD : 9 ABcd :
: 9 abCD : 9 AbcD : 9 aBCd : 9 AbCd : 9 aBcD : 3 Abed : 3 aBcd : 3 abCd :
: 3 abcD : 1 abed.
Если, кроме признаков А, В, С и D, в скрещивании одновре-
менно участвует какой-либо пятый признак, например Е, то оп
должен обнаружить сцепление с одним из упомянутых четырех,
т. е. с А, В, С или D. Допустим, что им окажется признак А. Тогда
путь наследования этого признака будет таким же и для при-
знака Е. Другими словами, признаки А и Е окажутся сцеплен-
ными друг с другом и будут наследоваться в потомстве совместно.
Нетрудно видеть, что подобные отношения между двумя или
большим числом особенностей могут осуществиться только в том
случае, если гены этих особенностей находятся в одной хромо-
соме. К такому выводу приводят всякий раз наблюдающиеся
в опыте отклонения от нормального менделевского расщепления,
если только они не обусловлены одним из тех усложнений или
нарушений механизма наследственности, о которых шла речь в пре-
дыдущем изложении.
Многочисленные исследования показали, что гены всех мута-
ционных особенностей дрозофилы, число которых превышает
в настоящее время 500, распадаются на четыре группы соответ-
ственно четырем хромосомам, и члены каждой из этих групп
обнаруживают сцепление друг с другом в большей или меньшей
степени.
Существует различная степень сцепления между генами одной
105
и той же группы сцепления. Крайними являются случаи, когда
признаки всегда или почти всегда наследуются совг
местно или, напротив, возможность их совместного наследования
лишь немногим больше, нежели порознь. Между этими
крайними положениями наблюдаются все промежуточные сте-
пени сцепления.
Ниже мы разберем сначала случаи полного сцепления призна-
ков, а затем перейдем к рассмотрению тех из них, когда связь
между признаками и генами нарушается закономерным образом,
позволяющим отнести это явление к числу основных законов
наследственности.
Полное сцепление генов,
обусловленное отсутствием перекреста хромосом
у самцов дрозофилы
Для иллюстрации полного, или абсолютного, сцепления разбе-
рем скрещивание нормальной мухи с двойным рецессивом black-
vestigial, гены которых локализованы во II хромосоме. Скрещи-
вание самки Normal с самцом black-vestitial с последующим скре-
щиванием гетерозиготных самцов F1 с гомозиготными сам-
ками black-vestigial представлено в табл. 14 (слева) и на рис. 27.
Возникающие от этого скрещивания гибриды F1, как видно,
нормальные по фенотипу, но гетерозиготны по генам обеих мута-
ционных особенностей.
Что касается F2, то здесь возникают только два типа мух;
половина из них с черным телом и зачаточными крыльями и
столько же нормальных, т. е. с серым телом и длинными крыльями.
Иначе говоря, как та, так и другая комбинация признаков
мух F2 в точности соответствует исходным, родительским, всту-
пившим в скрещивание.
Скрещивание, представленное на табл 14 (справа) и рис. 28,
отличается от предыдущего лишь в том отношении, что признаки
черного тела и зачаточных крыльев привносятся родителями раз-
дельно: один из них, безразлично который, входит в скрещива-
ние со стороны матери, а другой — со стороны отца. Допустим,
что самка обладает признаком черной окраски тела и соответ-
ственно длинными крыльями, а самец зачаточными крыльями и
соответственно серой окраской тела.
Гибриды F1 от этого скрещивания будут нормальными по фено-
типу, но генотипически гетерозиготны по обоим рецессивным
генам. Во втором поколении, которое в данном случае было также
получено от скрещивания гетерозиготных самцов F1 с гомо-
зиготными black-vestigial самками, половина мух снова несет
особенности одного родителя (черное тело и длинные крылья)
и столько же — другого (серое тело и зачаточные крылья).
Другими словами, в данном опыте, так же как и в предыдущем,
сочетания признаков, вступившие в скрещивание совместно, сов-
106
Таблица 14
Полное сцепление признаков как следствие отсутствия перекреста
хромосом у самцов дрозофилы
Гены b и vg привнесены
одним родителем
РР:
+ + bvg
Гаметы РР: 2 + + о b vg
F1: 22 и
Гены Ъ и vg
привнесены раздельно
РР: 2 = Х<?^
b + + Vg
Гаметы PP: 9 b-J- 3 + vg
Fl: J J и $ 3 Ь. -~jl
+ vg
Гаметы:
b vg
4~ Ч~
Ь vg
b vg
b vg
Гаметы:
<5fi 2 ь vgx. ь + -H Vg
Ь vg b + b Vg + vg b vg
F2: 1 Normal : 1 black-vestigial. F2: 1 black : 1 vestigial.
местно же и наследуются. Иначе говоря, между исходными соче-
таниями признаков не произошло никаких перегруппировок,
которые могли бы привести к появлению в F2 новых комбинаций
участвующих в скрещивании признаков.
Неполное сцепление генов,
обусловленное перекрестом хромосом
у самок дрозофилы
Перейдем теперь к анализу двух других опытов по скрещива-
нию мух с теми же самыми мутационными особенностями, т. е.
black и vestigial. В этих опытах мы воспроизведем заново оба
только что рассмотренных скрещивания с той разницей, что в ка-
честве гибридного родителя из F1 возьмем не самцов, а самок
и в обоих случаях скрестим их с гомозиготными рецессивными
самцами black-vestigial.
Разберем сначала случай, в котором оба рецессивных признака
входят в скрещивание со стороны отца; соответственно с этим со
стороны матери войдут в скрещивание особенности дикого типа,
т. е. серое тело, длинные крылья (рис. 29). Самки F1 от этого
скрещивания будут такого строения
Ч—г
ь Vg ’
Скрещивание их с гомозиготными самцами black-vestigial
является возвратным, как и в обоих предыдущих случаях.
107
Рис. 27. Полное сцепление признаков как следствие отсутствия
перекреста хромосом у самцов дрозофилы. Скрещивание Normal X
X black-vestigial; самцы Fl X самки black-vestigial
Генотипическое строение мух приведено в табл. 14
Рис. 28. Полное сцепление признаков как следствие отсутствия
перекреста хромосом у самцов дрозофилы. Скрещивание black X vest i-
gial; самцы Fl X самки black-vestigial
Генотипическое строение мух приведено в табл. 14
Р2
НекроссоВеры, 83%
Рис. 29. Неполное сцепление признаков как результат перекреста
хромосом у самок дрозофилы. Скрещивание, аналогичное представ-
ленному на рис. 27, с той разницей, что в качестве гибридного роди-
теля из F1 взята самка. Характер F2 иллюстрирует наличие у самки
перекреста
Объяснение в тексте и табл. 15
Рис. 30. Неполное сцепление признаков как результат пере-
креста хромосом у самок дрозофилы. Скрещивание, аналогичное
представленному на рис. 28, с той разницей, что в качестве гибрид-
ного родителя из F1 взята с а м к а. Характер F2 иллюстрирует
наличие у самкп перекреста
Объяснение в тексте и табл. 15
Поэтому и здесь можно ожидать появления в F2 мух, подобных
исходным родительским, т. е. черных короткокрылых и нормаль-
ных, в равных количествах. Большинство мух действительно
оказывается таковыми. Однако в отличие от разобранных случаев,
кроме этих двух типов, здесь появляются два нЪ вых класса
мух, а именно—серые короткокрылые и черные длиннокрылые,
приблизительно также в равных количествах. В сумме они соста-
вят около 17% общего числа мух F2.
Чему обязаны появлением два дополнительных класса мух
второго поколения рассматриваемого скрещивания? Ответ на этот
вопрос дает генотипический анализ серых короткокрылых и чер-
ных длиннокрылых мух.
Мы знаем, что у всех мух F2, в том числе и у мух дополнитель-
ных классов, содержится по одной хромосоме с генами black-
vestigial, которую они получили от гомозиготного по этим генам
отца. Следовательно, в отношении, по крайней мере, одного гомо-
лога II хромосомы генотип исключительных мух ясен. Обозначим
его провизорной формулой, в которой интересующие нас гены
другой гомологичной хромосомы пока обозначены вопроситель-
ными знаками:
? ?
Ь vg ’
А теперь, вспомнив сказанное на стр. 78 относительно влияния
гамет с рецессивными генами на фенотипы возникающих особей,
можно решить вопрос, какие гаметы со стороны матери участво-
вали в образовании серых~короткокрылых и черных длиннокры-
лых мух.
В самом деле, мухи первого из анализируемых классов имеют:
1) короткие крылья; отсюда заключаем, что ген vestigial находится
у них в гомозиготном состоянии, т. е. эти мухи имеют строение
vg/vg; 2) серую окраску тела. Мы знаем также, что у всех анали-
зируемых мух присутствует ген black, полученный ими от отца.
Поэтому окончательно заключаем, что анализируемые мухи ге-
терозиготны по гену black, т. е. имеют строение Ь/+; полная же
их формула будет такова:
+ vg
Ь vg’
а яйца, из которых они развились, имели строение +/vg.
Применив подобный ход рассуждения ко второму дополнитель-
ному классу мух — черным длиннокрылым, также убеждаемся,
что они имеют строение b/-|- b/vg, а гаметы самки, давшие им
начало, были b/-j-.
Теперь остается сделать окончательный вывод из сопоставле-
ния всех четырех типов гамет, наличие которых необходимо при-
нять у гибридной самки F1, с генотипической структурой самой
мухи (табл. 15).
112
Таблица 15
Единичный перекрест и образование кроссоверных гамет
Вертикальная стрелка показывает место разрыва хро-
мосом. Один из гомологов хромосомы обозначен жирной
линией.
Как видно из табл. 15, гаметы 1 и 2 самки F1 представляют
собой исходные комбинации признаков, вошедшие в скрещивание
со стороны отца (b/vg) и матери (+/+) и вновь разъединившиеся
у гибрида в процессе созревания половых клеток.
>' Что же касается гамет 3 и 4, то они представляют собой пере-
группировки исходных комбинаций признаков, возникшие в ре-
зультате разрыва и обмена блоками гомологичных хромосом между
генами b и vg с последующим воссоединением их в месте разрыва.
Процесс носит название обмена, или кроссинговера
(crossing-over), а возникающие в результате его гаметы и зиготы
соответственно называются кроссоверными и крос-
соверами. Количество наблюдающихся в опыте кроссовер-
ных особей (обозначим его через пх), выраженное в процентах от
общего числа мух F2 (п), является показателем ча-
стот ы, или процентом перекреста (кроссинго-
вера).
тг1 X 100 0/
—— -----= /о кроссинговера.
Запомним также, что в отличие от кроссоверных, хромосомы,
не подвергшиеся перекресту, называются и е к р о с с о в е р-
н ы м и, а возникающие из них особи — некроссовер-
ными, или некроссоверами. Мера расстояния между
генами, соответствующая такому отрезку хромосомы, в пределах
которого наблюдается 1% перекреста, называется единицей
перекреста, или морганидой.
8 Н. Н. Медведев 113
Резюмируя вышеизложенное, можно сказать, что появление
в анализируемом скрещивании двух дополнительных классов
мух в количестве 17% общего числа особей F2 обязано перекресту
хромосом, или кроссинговеру, который имеет место у самок
дрозофилы в процессе созревания половых клеток.
У самцов дрозофилы явление перекреста о т с у т с т-
в у е т, что было видно на примере двух предыдущих скрещи-
ваний.
Рассмотрим теперь скрещивание, в котором признак black
привносится матерью, а признак vestigial — отцом (рис. 30).
Гибридные самки F1 от этого скрещивания имеют строение
Ь +
+ vg '
От скрещивания их с самцами black-vestigial также возникают
четыре сорта гамет, а следовательно, и мух F2; большинство их
(около 83%) снова соответствует исходным, родительским комби-
нациям признаков, вступившим в скрещивание (серые коротко-
крылые и черные длиннокрылые), и около 17% — перегруппи-
ровки родительских признаков, т. е. черные короткокрылые и
нормальные, происшедшие в результате кросинговера.
Из рассмотрения двух последних скрещиваний вытекает сле-
дующий вывод: перекрест хромосом и обмен
блоками генов не зависят от пути, по кото-
рому они вступают в скрещивание. Действи-
тельно, в первом случае самки F1 имели строение b/vg,
т. е. оба рецессивных гена были локализованы в одной хромосоме,
а их нормальные аллеломорфы — в другой (оппозиционной)
хромосоме. Во втором случае гены обеих мутационных особенно-
стей и соответственно их нормальные аллеломорфы локализованы
в оппозиционных хромосомах. Тем не менее в процессе созревания
яиц кроссинговер имел место в 17% случаев независимо от гено-
типического строения анализируемых самок.
Как видно, эти отношения напоминают результаты при сво-
бодном комбинировании признаков, когда расщепление по формуле
9 : 3 : 3 : 1 осуществляется независимо от того, скрещиваются ли
между собой формы ААВВ X aabb или A Abb X ааВВ. Однако между
сравниваемыми случаями имеется существенное отличие: при сво-
бодном комбинировании признаков у гетерозиготных самок АаВЬ
все четыре сорта гамет образуются в равных количествах; здесь же
большая часть гамет приходится на долю некроссоверных (83%)
и только 17% гамет возникают из хромосом, подвергшихся пере-
кресту.
Согласно теории линейного расположения генов в хромосомах,
частота, или процент, перекреста между
генами есть функция их расстояния
114
в хромосоме. Это значит, что чем ближе друг к другу
расположены в хромосоме локусы двух генов, тем меньше шансов,
что между ними произойдет перекрест. Напротив, чем дальше гены
отстоят друг от друга, тем больше вероятность того, что между
ними произойдет перекрест и хромосомы обменяются гомологич-
ными участками.
Чтобы убедиться в справедливости этого положения, рассмот-
рим другой случай, когда гены двух мутационных особенностей
расположены гораздо ближе друг к другу.
Воспользуемся для этого скрещивания самцами Normal и
самками из линии yellow (у) — желтое тело и white (w) — белые
глаза. Гены этих мутантных признаков находятся в половой хро-
мосоме, а само скрещивание является реципрокным. Скрещивание
представлено в табл. 16 и на рис. 31.
Как видно из табл. 16, все мухи F2 (безотносительно пола)
образуют четыре класса. Два из них, желтые белоглазые и нор-
мальные, — исходные, родительские комбинации признаков;
в потомстве их получается большинство — 98,5%. Два других
класса мух. желтые красноглазые и серые белоглазые, получились
в результате перекреста хромосом между генами yellow и while.
В сумме они составляют 1,5% общего числа мух F2. На основании
показателя частоты кроссинговера, равного здесь 1,5%, заклю-
чаем, что гены yellow и white расположены в хромосоме на рас-
стоянии 1,5 единицы (морганиды).
Разобранное реципрокное скрещивание поучительно сравнить
с прямым, в котором гены yellow и white входят в скрещивание
со стороны отца (табл. 16, рис. 32).
Как видно из табл. 16, все самки F2 данного скрещивания полу-
чили одну Х-хромосому с генами дикого типа от отца; соответ-
ственно с этим все они серые и красноглазые. Поэтому во всех
случаях прямого скрещивания сцепленных с полом призна-
ков определение процента кроссинговера возможно только
на самцах. Для этого количество кроссоверных самцов нужно
отнести к общему числу самцов в F2, выразив, как всегда, отно-
шение в процентах. Самки в расчет не принимаются.
Подведем краткий итог рассмотренным скрещиваниям по опре-
делению кроссинговера между различными генами; он поможет
уяснить значение двух последующих опытов. Обратимся для этого
к карте Х-хромосомы (стр. 174). Из рассмотрения последней видно,
что локус гена yellow занимает крайний левый конец половой хро-
мосомы. Локус гена white расположен вправо от него и отстоит
на расстоянии 1,5 единицы. Как видно, расстояние между ними
по карте в точности соответствует тому, которое наблюдается
в опыте.
Проделав то же самое для генов black и vestigial, увидим, что
расстояние между ними по карте (18,5 единицы) на 1,5 единицы
больше того, которое наблюдалось в опыте (17,0 единиц). Причина
115 8*
Таблица 16
Неполное сцепление признаков как результат перекреста
хромосом у самок дрозофилы
Реципрокное скрещивание
у w г + -4-
РР: 9 = Х°=Цз
У w
Гаметы РР: {у w £ + + »
у w г ? v w
Г1: 9 9 6 6 =—
F2: некроссоверы кроссоверы
98,5О/О 1,5%
Прямое скрещивание
+ + т у W
РР: 9 Л-Т; X S ==б
+ +
Гаметы РР: J + + <5 у w,
Fl: 5 2^^
у W
некроссоверы
кроссоверы
Все 9 2 Normal.
1''2: М: некроссоверы — 98,5%; кроссоверы — 1,5%.
116
этого явления будет ясна из рассмотрения результатов следующих
двух опытов, к описанию которых мы и перейдем.
Для этой цели лучше всего исследовать частоту перекреста
между генами, локализованными на крайнем левом и крайнем
правом концах хромосомы. Такому условию удовлетворяют гены
yellow и forked (вильчатые щетинки) Х-хромосомы. Расстояние
между этими генами по карте равно (56,7—0,0) 56,7 единицы.
Посмотрим теперь, какой процент кроссинговера между этими
генами будет наблюдаться в опыте. Другими словами, будет ли
он более или менее соответствовать расстоянию, отсчитанному
непосредственно по карте, или обнаружит уклонение от ожидае-
мого значения, подобному тому, что имело место в случае генов
black и vestigia]?
Итак, скрестим самок, гомозиготных по генам yellow и forked
(желтое тело и вильчатые щетинки), с нормальными самцами и
полученное F1 снова скрестим между собой. Рассматриваемое
реципрокное скрещивание протекает по схеме, аналогичной только
что разобранной для признаков yellow и while, причем в F2 и
здесь возникают четыре класса мух. Два из них, а именно желтое
тело и нормальные щетинки и серое тело и вильчатые щетинки,
снова получились в результате кроссинговера между генами у
и f; общее число их приблизительно равно 40% от общего числа
мух F2. В простейшем случае 40% и можно принять за искомое
расстояние между генами yellow и forked. Правда, 40% — вели-
чина не строго постоянная; в отдельных случаях она может коле-
баться в ту или иную сторону, но, как правило, почти никогда не
достигает того значения, которое получается определением рас-
стояния между генами рассматриваемых особенностей по хромо-
сомной карте (т. е. 56,7 морганиды).
Таким образом, если найденное в опыте расстояние (40 еди-
ниц) принять за истинное расстояние между генами yellow и
forked, то несоответствие между ним и расстоянием, определен-
ным по карте (56,7 единиц), оказывается гораздо более существен-
ным, чем в опыте с генами black и vestigial: там оно было равно
1,5 морганиды, а здесь — 16,7 морганиды. Если теперь вспомнить,
что процент перекреста между очень близко расположенными
генами yellow и white в точности соответствовал расстоянию между
ними по карте, то связь между степенью несоответствия найденных
в опытах расстояний для исследованных генов и их удаленностью
по длине хромосомы напрашивается сама собой. Однако более
наглядно это будет видно из рассмотрения следующего опыта,
значительно более сложного, чем все предыдущие.
Кроме того, этот опыт вплотную подведет к уяснению того,
как строятся хромосомные карты и насколько достоверными по
сравнению с картами хромосом дрозофилы являются такие же
карты других объектов генетических исследований.
117
Рис. 31. Неполное сцепление признаков yellow и white. Скрещивание
реципрокное: частота перекреста определяется на самцах и самках F2
Генотипическое строение мух приведено в табл. 16
Кроссоверы, 1,5 °/о
Некроссоверы, 98,5°/о
Рис. 32. Неполное сцепление признаков yellow и white. Скрещи-
вание прямое: частота перекреста определяется на самцах F2
Генотипическое строение мух приведено в табл. 16
Множественные перекресты
J3 числе других существует выведенная американскими гене-
тиками линия, так называемая Х8/уу, у самцов которой одновре-
менно присутствуют 8 рецессивных генов половой хромосомы:
1) yellow (у) — желтое тело; 2) echinus (ес) — грубые глазные
фасетки; 3) crossveinless (cv) — отсутствие задней поперечной
жилки; 4) cut (ct6)1 — срезанные под острым углом концы крыльев;
5) vermilion (v) — киноварный цвет глаз; 6) garnet (g) — гранато-
вый цвет глаз; 7) forked (f) — вильчатые щетинки; 8) bobbed (bb) —
подстриженный (с короткими щетинками). Муха, гомозиготная
по этим генам, обладает всеми перечисленными особенностями.
Одновременное присутствие генов киноварного и гранатового
вызывает окраску глаза, которую легко отличить как от нормаль-
ной (более яркая, розоватая), так и от чистой киноварной (заметно
темнее ее и несколько прозрачнее). Что касается мух vermilion
и garnet, то различение их также не представляет затруднения
особенно при сопоставлении их с мухами из чистых линий.
Заметим также, что порядок написания генов в формуле дол-
жен соответствовать порядку расположения их в хромосоме, при-
чем на первом месте (слева) пишется символ гена, условно зани-
мающего крайнее левое положение в хромосоме.
* f В дальнейшем мы будем учитывать только первые семь генов
этой цепочки; ген же bobbed, в виду сложности его наследования
(его нормальный аллеломорф находится в Y-хромосоме), оставим
без внимания.
Строение самца, гемизиготного по семи генам, таково:
у ес cv ct v g f
Скрещивание его с самкой Normal, т. е. строения
+ + + + + 4- +
4—I—I—F 4—1—Ь
даст в F1 нормальных по внешности самок и подобных матери сы-
новей строения:
у ес cv ct у g f gg + 4- 4- 4- 4- 4- 4-
+ 4- + + + + 4- '
Что касается гибридов второго поколения, возникающих от
скрещивания гибридных самок F1 с самцами X8, то оно оказывается
несравненно более сложным, нежели во всех рассмотренных до
сих пор скрещиваниях.
1 Имеющийся в этой линии аллеломорф cut6 для краткости мы будем
обозначать в дальнейшем просто cut. X-хромосомы самки спаяны; в них
находится ген yellow (уу).
120
Однако прежде чем анализировать это скрещивание дальше,
необходимо ответить на вопрос, сколько сортов кроссоверных
гамет образуется у гибридной самки, гетерозиготной по тг-ному
числу генов, присутствующих в одной хромосоме?
Опыты с генами black и vestigial, yellow и white были простей-
шими примерами таких скрещиваний. Понятно, что при наличии
в хромосоме генов лишь двух мутационных особенностей имеется
возможность выявить в опыте только те кроссоверные гаметы,
которые могут возникнуть в результате перекреста между
генами этих особенностей и нигде больше. Вспомним также,
что число сортов кроссоверных гамет в обоих предыдущих скре-
щиваниях было равно двум.
Более сложные отношения возникают при большем числе ге-
нов мутационных особенностей, и степень их сложности возрастает
с увеличением степени гетерозиготности хромосомы. Так, при
наличии в хромосоме генов трех мутационных особенностей,
например А, В и С, перекрест может произойти как между генами
А и В, так и между генами В и С. Кроме этих простых, или еди-
ничных, перекрестов, в данном случае возможен также один
двойной перекрест в результате разрыва хромосомы в двух об-
ластях одновременно, т. е. между генами А и В и между генами В и
С, с последующим взаимным обменом гомологичными фрагментами.
Схематически^ эти отношения представлены в табл. 17. Как
видно, при наличии в хромосоме трех пар генов число классов
кроссоверных гамет возрастает до шести.
Продолжив рассмотрение все более сложных случаев, легко
найти зависимость между степенью гибрид-
Таблица 17
Образование кроссоверных тамет при наличии в хромосоме
генов трех мутационных особенностей
А ф В ф С
а b с
А В С )
______________ > Некроссоверные гаметы
а Ь с J
А b с ' 1 Единичный перекрест между генами
а В С J | А—В
А В с ] Единичный перекрест между генами
а Ь С J [ В-С
A b С 1 1 Двойной перекрест между генами
а В с J ' А—В и В—С
Стрелками показаны места разрывов хромосом.
121
н о с т и хромосомы и числом теоретически
возможных классов к р о с с о в е р н ы х гамет.
Эта зависимость выражается знакомой нам формулой для опре-
деления числа сортов гамет у гибридов при свободном комбини-
ровании генов (стр. 61) с той разницей, что здесь общее число
сортов гамет уменьшается на 2 — за счет некроссоверных гамет.
Следовательно, интересующая нас формула будет такова: 2П—2.
Необходимо помнить также, что сцепленные гены вступают в пере-
крест с различной част отой, зависящей в каждом кон-
кретном случае от расстояния между ними в хромосоме. В табл. 18
приведены количества сортов кроссоверных гамет для различного
числа пар генов.
Таблица 18
Зависимость числа теоретически возможных типов кроссоверных гамет
от степени гетерозиготности хромосомы
Число пар генов Некроссо- верные гаметы Кроссоверные гаметы
про- стые двой- ные трой- ные четвер- ные пятерные шестер- ные всего
1 2
2 2 1 — — — — — 2
3 2 2 1 — — — — 6
4 2 3 3 1 — — — 14
5 2 4 6 4 1 — — 30
6 2 5 10 10 5 1 — 62
7 2 6 15 20 15 6 1 126
Вернемся к нашему опыту. По формуле 2°—2 находим, что
у самки F1 анализируемого скрещивания теоретически могут
возникнуть 128 сортов гамет с различной степенью вероятности.
В табл. 19 приведены только те из них, которые встречаются
в опыте с различной частотой.
Первый класс (иначе называемый нулевым) представлен двумя
типами некроссоверных гамет, т. е. исходными, роди-
тельскими комбинациями признаков.
Классы от первого до шестого объединяют 12 типов гамет,
которые могут возникнуть в результате простого перекреста
в одной из шести областей хромосомы, т. е. только в области I,
или II, или III и т. д.
Гаметы следующих 15 классов произошли в результате раз-
рыва диплоидной хромосомы в двух областях одновременно
с последующим обменом гомологичными фрагментами. Как было
указано выше, такие случаи обмена носят название двойных.
При наличии в хромосоме семи пар признаков таких случаев может
быть 15 с 30 теоретически возможными типами гамет.
Наконец, 20 последних классов таблицы представляют собой
122
еще оолее сложные случаи перекреста, когда хромосома подвер-
гается разрыву и последующему обмену в т р е х точках одно-
временно. Таких трои н ы х перекрестов у данной самки может
быть 20, а число типов гамет, которые могут при этом возникнуть,
равно 40.
Приведенные в табл. 19 комбинации не исчерпывают всех
теоретически возможных типов гамет гибридных самок F1. Кроме
них, может возникнуть также пятнадцать четверных,
шесть пятерных и, наконец, один шестерной пере-
крест (табл. 18). Однако вероятность возникновения столь слож-
ных перекрестов очень мала, и гаметы с числом одновременных
перекрестов, большим трех, в опыте появляются редко. Что же
касается двойных и тройных перекрестов, то они сравнительно
часты, и с ними на практике приходится считаться; поэтому они
должны быть рассмотрены особо.
В последней горизонтальной графе табл. 19 приведены резуль-
таты такого опыта, в котором было проанализировано 900 мух F2.
Из рассмотрения данных этого опыта прежде всего видно, что
50,3% мух F2 возникло из некроссоверных гамет
[ 1)00 100 J = 50,3°/0; см. нулевой класс табл. 19.
Простой перекрест в I области (между генами у и ес) дал в сумме
50 мух, что составляет 5,5% от общего числа мух F2 (табл. 20).
Такой же перекрест во II области (между генами ес и cv)
дал 55 мух, или 6,1%. Идя таким же образом и далее, получаем
значения простых перекрестов для областей III, IV, V и VI, кото-
рые соответственно равны 5,7; 10,5; 8,1 и 7,6%. В сумме они со-
ставляют 43,5%. Нетрудно видеть, что это число есть не что иное,
как то же самое расстояние между генами у и f, которое мы наблю-
дали в предыдущем опыте, но которое в данном опыте получено
путем суммирования простых перекрестов на шести
отдельных участках хромосомы. Действительно, если отвлечься
от всех промежуточных между у и f генов, то каждый простой
перекрест ведет к их разъединению. Следовательно, общий ре-
зультат оказывается таким же, как и в предыдущем опыте с генами
у и f, в котором отсутствовали все промежуточные гены хромосомы.
Поэтому и совпадение результатов обоих опытов получается до-
вольно близким (40,0 и 43,5%).
И все же полученное таким путем значение частоты перекреста
между генами у и f является лишь приближенным и значительно
меньшим расстояния между этими генами по карте (56,7%).
Для того чтобы учесть истинное число перекрестов между
рассматриваемыми генами, а следовательно, и определить истин-
ное расстояние между ними, в полученное выше значение необхо-
димо внести поправку за счет двойных, тройных и еще более слож-
ных перекрестов.
123
Теоретически возможные сорта гамет у самки
Fl $ Некроссо- веры - Простые
0 1 3 4 5
j У + У У у -H У + У + У +
2 ес + ес + + ес ec + ec + ec + ec +
3 CV + CV + + CV + CV CV + CV + cv +
4 ct + ct 4- + ct + ct + ct ct + ct +
5 6 V + V 4- + V + V + V + V V +
g + g + + g + g + g + g + g
f + f + + f + f + f + f + f
42 411 42 8 40 15 28 23 41 54 24 49
Двойные перекресты
2-3 2-4 2-5 I 2-6 3-4 3-5 3-6
У 4- У + У ~h У + У + У + У +
ec + ec + ec + ec + ec + ec -b ec +
+ cv + cv + cv ~h cv cv + cv + cv +
ct 4- + ct + ct + ct + ct + ct + ct
V 4- V + + V + V V + + V + V
g 4- g + g 4- + g g + g + + g
f 4- f + f + f 4- f + ! + f +
— — 1 1 6 5 5 — 3 2 4 — 9
Тройные перекресты
1-3-4 | 1-3-5 1-3-6 1-4-5 1-4-6 1-5-6 | 2-3-4 2-3-5
У + У + У + У 4- у 4- У 4- У 4- у 4-
+ ec + ec + ec 4- ec 4- ec 4- ec ec 4- ec 4-
+ cv + CV 4- cv + cv 4- cv 4- cv 4- cv 4- cv
ct + ct । ct + + ct 4- ct + ct ct ct +
+ V V + V + V 4- V 4- + V 4- V V 4-
+ g + g g 4- + g g + g + + g + g
+ f + f + f 4- f + f 4- f + f + f
— —
1 В нижней, горизонтальной графе таблицы приведены результаты одного опыта по
124
Таблица 19
гетерозиготной но семи парам генов Х-хромосомы 1
перекресты Двойные перекресты
6 1-2 1-3 1-4 1-5 1-6
У + У + У + У + У + У +
ес + + ес + ес + ес + ec + ec
CV + CV + + cv + cv + cv + CV
ct + ct + ct + + ct 4- ct + ct
V + V + V + V + + V + V
ё + g + g + g + g + + g
+ f f + f + f + f + f +
18 50 — — — — — 1 2 1 2 1
Двойные перекресты Тройные перекресты
4-5 4-6 5-6 1-2-3 1-2-4 1-2-5 1-2-6
У ec cv ct + g f + + + + V + + 2 У ec cv ct + + f 1 00 4-oq <! ++++ У ec cv ct V + f 4—1—1—1—h ^4“ 1 У + cv + + + + + ec + ct V g f cv ct + + + 4" ec + + V g f У 4“ cv ct v 4- + + § 4—1—h euob-t 1 У 4- cv ct V g 4- + ec + + + + f
Тройные перекресты
3-4-6 | 3-5-6
распределению перекрестов (Ю. Я. Керкис).
4-5-6
У + У 4-
ec + ec 4-
cv + CV 4-
+ ct + ct
V + 4- V
g 4- g 4~
+ f 4- f
У
ес
cv
ct
+
ё
+
125
Таблица 20
Расстояния между генами Х-хромосомы, определенные на основе
простых и сложных перекрестов
0,0 у 5,5 ес 13,7 CV 20,0 ct 33,0 V 44,4 g 56,7 f
1. I II III IV V VI y-f
2. 5,5 6,1 5,7 10,5 8,1 7,6 43,5
3. 6,3 8,2 7,7 12,4 10,1 11,1 55,8
4. 5,5 8,2 6,3 13,0 11,4 12,3 56,7
1—локусы генов (арабские цифры) и районы перекреста (римские
цифры);
2 — расстояния, вычисленные путем суммирования единичных пере-
крестов;
3 — то же, с поправкой на двойные и тройные перекресты;
4 — расстояния по карте.
В самом деле, каждый двойной перекрест в действительности
уменьшает истинное число кроссоверов на два, так как возникаю-
щие при этом кроссоверные гаметы не отличаются от некроссовер-
ных, если, как это мы сейчас делаем, учитывать только два край-
них члена данной серии генов (сравни О-класс с любым из проис-
шедших в результате двойного перекреста: во всех этих случаях
гены у и f находятся в одной хромосоме, а их нормальные аллело-
морфы — в другой).
Аналогичным образом влияет на результаты опыта и каждый
тройной перекрест, в случае которого первые два разрыва приво-
дят к таким же последствиям, как и двойной перекрест, и только
третий образует гаметы, отличающиеся от некроссоверных.
Поэтому истинное значение процента перекреста между генами
у и f, или истинное расстояние между ними, мы получим, если
в найденное значение, равное 43,5%, внесем поправку на двойные
и тройные перекресты. Эта поправка (q) в общей форме равна
выраженной в процентах сумме произведений, полученных от
перемножения наблюдаемых в опыте двойных (п2), тройных (п3),
четверных (п4) и еще более сложных кроссоверов на соответствую-
щие множители кратности перекрестов, т. е. на два, три, четыре
и т. д. В нашем конкретном случае
q = (-8Х2)э+(.„Х3) х ]00 = ИХ2Ж.ХЗ, х 100 = ,2
Следовательно, истинное расстояние между генами у и f по-
лучается равным 43,5+12,3=55,8 единицы, т. е. почти в точности
совпадает с данными хромосомной карты (56,7 единицы).
Таким образом мы выяснили, что:
1) при отсутствии промежуточных генов между достаточно
удаленными генами двойные и, в меньшей степени, тройные пере-
126
кресты увеличивают число мух, которые ио внешнему виду кажутся
происшедшими из некроссоверных гамет;
2) соответственно с этим двойные, тройные и все более сложные
перекресты уменьшают истинный показатель кроссинговера;
3) это уменьшение тем больше, чем больше расстояние между
анализируемыми генами.
Интерференция и индекс совпадения
Из всего сказанного следует, что данные хромосомных карт
не всегда достаточны для определения эмпирического процента
перекреста между генами и что для достаточно удаленных друг
от друга генов истинное расстояние между ними может быть по-
лучено в опыте лишь в том случае, если будет учтено влияние
двойных и других еще более сложных перекрестов. Следовательно,
решение рассматриваемого вопроса в общей форме сводится к выяс-
нению общих закономерностей распределения сложных перекре-
стов по длине хромосомы и к определению значения поправок,
обусловленных влиянием сложных перекрестов на расстояния,
определяемые непосредственно по карте.
Ответ на этот вопрос может быть получен из сравнения значе-
ний ожидаемых и наблюдаемых сложных перекрестов в разных
областях хромосомы. Результаты расчетов анализируемого скре-
щивания представлены в табл. 21. За основу сравнения приняты
расстояния между генами по стандартной карте, а вероятность
двойных перекрестов в соседних областях вычислена на основе
допущения независимости перекреста в соседних областях. За-
метим, что вероятность двойного перекреста равна произведению
вероятностей одиночных перекрестов. Пример: перекрест
Таблица 21
Интерференция и перекрест в соседних районах
5. Индекс совпадения, °/о.............................41 . . 15
, u * ( о/........................0,33 . . 0,22
4. Наблюдалось в опыте | '§СОЛЮ1Н ... 0 .. 0 ... 3 ... 2 .. 0
3. Вероятность двойных пере-
крестов, %.....................• ----
2. Расстояние по карте, % . . .
1. Гепы и районы перекреста . . %--1—е-£
''''•ZOpQlfr ''"-36,1(36.3)"''''
6. Вероятность двойных пере- '\х У
крестов, %.................. ""Ч,30(453^^
„ и п I абсолюты................44 *
7. Наблюдалось в опыте | . ... 4 88
8. Индекс совпадения, %........................ 67(107)
* Из них один тройной перекрест в II—IV—VI районах (см. табл. 19).
127
между генами у и ес равен 5,5%; перекрест между генами ес и cv
равен 8,2%. Вероятность двойного перекреста между генами у
и cv равна 5,5% х8,2% =0,45%.
Посмотрим теперь, соответствует ли процент наблюденных
в опыте двойных перекрестов ожидаемому для тех же районов на
основе их полной независимости?
Вероятности двойных перекрестов для районов у — cv, ес —
ct, cv — v, ct — g и v — f приведены в графе 3 табл. 21. Сравне-
ние их с данными табл. 19 показывает, что, во-первых, в трех райо-
нах у — cv (район 1—2), ес — ct (2—3) и v — g (5—6) двойные
перекресты в соседних областях в опыте не наблюдались вовсе
и, во-вторых, число двойных перекрестов в районах cv — v (3—4)
и ct — g (4—5) оказалось значительно меньшим по сравнению
с ожидаемым. Действительно, в районе cv — v возникли три
кроссоверные мухи, т. е. 0,33% по сравнению с 0,81% на основе
независимости; в районе ct — g были найдены две мухи, соста-
вляющие 0,22% по сравнению с 1,48% на основе независимости.
Очевидно, что независимого распределения пере-
крестов по длине хромосомы нет и что перекрест в одной области
препятствует или даже полностью исключает перекрест в сосед-
ней области.
Явление называется интерференцией (interference —
препятствие, помеха). Эффект интерференции выражается отно-
шением наблюдаемых в опыте двойных перекрестов к ожидаемым
на основе их независимости и носит название индекса сов-
падения, или коинциденции (coefficient of coin-
cidence). Для района cv — v (3—4) индекс совпадения в нашем
опыте равен ЙЛИ 41°/0. Следовательно, благодаря
явлению интерференции в этом районе хромосомы осуществляется
только 59% двойных перекрестов, возможных в отсутствие интер-
ференции. Для области ct — g (4—5) индекс совпадения еще
ниже и равен 15%. Что касается участков хромосомы, распо-
ложенных влево и вправо от генов ct и v, то здесь двойные крос-
соверы не появились вовсе.
Таким образом, как на основе исследования единичных пере-
крестов, так и на основе изучения распределения сложных пере-
крестов, в сущности представляющих две стороны одного и того же
явления, мы снова приходим к выводу, что хромосомные карты
недостаточны для предсказания эмпирической частоты перекреста
по длине хромосомы. На значении хромосомных карт мы под-
робнее остановимся ниже (стр. 130). Сейчас же отметим лишь
некоторые общие положения, имеющие отношение к рассматри-
ваемому вопросу.
Результаты многочисленных и тщательных исследований меха-
низма перекреста лучше всего согласуются с предположением,
что в основе явления интерференции лежат механические свойства
128
хромосом. Если допустить, что хромосомы представляют собой
достаточно эластичные нити, то очевидно, что они могут пере-
кручиваться друг с другом и вступать в обмен лишь через
некоторые определенные промежутки и что в пределах отрезков
некоторой определенной протяженности двойные перекресты
в них полностью исключены. Протяженность таких участков
неодинакова по длине хромосомы. Практическим эквивалентом
оказывается район не больше 5 единиц в середине и 15 единиц на
концах хромосомы. В пределах районов такой длины интер-
ференция сильная (сравни районы у — ес и ес — ct) и значе-
ние коэффициента совпадения уменьшается до 0. С увеличением
расстояния эффект интерференции постепенно уменьшается,
а индекс совпадения соответственно увеличивается.
При расстоянии в 45 единиц эффект интерференции исчезает
(коэффициент совпадения достигает 100%). С дальнейшим увели-
чением расстояния интерференция снова может оказать влияние.
Таким образом, механические свойства хромосомы до известной
степени модулируют протяженность участков, подвергающихся
обмену в пределах некоторой средней величины, неодинаковой
в разных областях хромосомы.
В достоверности этого вывода мы отчасти уже имели возмож-
ность убедиться на основании вычисления индекса совпадения
для наблюдаемых и ожидаемых двойных перекрестов в соседних
областях хромосомы.
Однако еще более наглядно он вытекает из рассмотрения дан-
ных табл. 21, полученных на основе анализа результатов рас-
сматриваемого опыта под несколько иным углом зрения. В самом
деле, что будет, если полученные в нашем опыте данные обра-
ботать с учетом лишь одного промежуточного между yellow и
forked гена, а именно cut, оставив без внимания все другие?
Районы перекреста I—IV I-V I—VI II—IV II-V II—VI III—IV
Число мух 1 3 3 1 7 10 3
Двойные перекресты + + + 4- 4 -
Районы перекреста III—V III -VI IV-V IV-VI II— IV-VI Всего
Число мух 6 9 2 9 1 55
Двойные перекресты 4- — — + 44
9 Н. Н. Медведев
129
Выпишем для этой цели все наблюдаемые в опыте слож-
ные перекресты в виде таблицы (стр. 129).
Очевидно, что большинство этих перекрестов (отмеченных
плюсом) на основе принятого допущения должно быть классифи-
цировано как двойные в области у — ct или в области ct — f.
Вместе с одним тройным перекрестом (в области II—IV—VI)
они составят 44, или 4,88% от общего числа мух F2 (табл. 21).
При отнесении его к ожидаемому проценту двойных перекрестов
в районах у — ct и ct — f, вычисленному по карте и равному 7,30,
получаем индекс совпадения, равный
Таким образом, произвольно увеличив для сравнения степень
свободы двойных перекрестов в рассматриваемом районе, мы
соответственно понизили эффект интерференции, благодаря чему
индекс совпадения увеличился с 41 и 15 до 67%.
Наконец, если тот же процент наблюдаемых в опыте сложных
перекрестов в районах у — ct и ct — I отнести к ожидаемому,
вычисленному на основе единичных перекрестов между ограничи-
вающими эти районы генами у и ct и ct и f (табл. 20; соответст-
вующие данные в табл. 21 приведены в скобках), то в этом слу-
чае индекс совпадения оказывается равным 107%, т. е. достигает
максимального значения. Это и понятно, так как за основу сравне-
ния мы приняли расстояния, вычисленные путем учета лишь
единичных перекрестов. При этом условии степень свободы двой-
ных перекрестов становится максимальной, благодаря чему
индекс совпадения приобретает также максимальное значение.
Заметим в заключение, что анализ явления интерференции
мы вели на основе расстояний между генами по данным хромосом-
ной карты. Весьма близкие, хотя и не вполне идентичные, резуль-
таты можно получить, если за основу сравнения принять рас-
стояния между генами, полученные в нашем опыте с поправкой
на двойные перекресты (табл. 21); читатель может убедиться в этом
на основании соответствующих расчетов.
Карты хромосом как основа
для предсказания частоты перекреста
Вернемся к вопросу о практическом использовании хромо-
сомных карт, как основы для предсказания частоты перекреста
между любыми двумя генами у дрозофилы. Выше уже было под-
черкнуто значение данных хромосомных карт для небольших
расстояний и относительность этих данных для генов,
расположенных сравнительно далеко друг от друга. В част-
ности, был указан тот практический эквивалент для середины
и концов Х-хромосомы, за пределами которых значения ожидаемых
и наблюдаемых в опыте перекрестов перестают соответствовать друг
ДРУГУ (стр. 129). Не входя в рассмотрение еще одной серии опытов,
130
дадим готовые выводы, которые оыли получены на основе анало-
гичных данных и которые суммированы в приведенных па рис. 33
и 34 кривых для I и III хромосом, предназначенных для тех практи-
ческих целей, о которых здесь идет речь. Поясним способ пользо-
вания этими кривыми несколько подробнее.
Кривая поправок для гена А, начинаясь на оси абсцисс в точке,
соответствующей локусу гена А в хромосоме, отсекает на своем
пути такие отрезки ординат всех других, расположенных вправо
от него генов В, С, D, Е и т. д., на которые расстояния между
Рис. 33. Графики для определения истинной частоты перекреста
между генами Х-хромосомы на основе стандартных расстояний по карте
Объяснение в тексте
геном А, с одной стороны, и генами В, С, D, Е и т. д., с другой,
определенные непосредственно по карте, должны быть умень-
шены для получения эмпирических показателей пере-
креста. Так, например, кривая для гена hairy (h, III хромосома;
рис. 34) пересекает ординату Dichaete (D) на высоте 0,5 единицы;
ординату spineless (ss) — на высоте 5,2 единицы; ординату rough
(го) — на высоте 19,4 единицы и т. д. Расстояния по карте между
геном hairy, с одной стороны, генами Dichaete, spineless и rough,
131
9*
Рис. 34. Графики для определения истинной частоты перекреста между генами III
хромосомы на основе стандартных расстояний по карте
Объяснение в тексте
с другой, соответственно равны 13,9, 32,0 и 64,6 единицы. Следо-
вательно, ожидаемая частота перекреста между генами hairy
и Dichaete будет равна (13,9—0,5) —13,4%; между генами hairy
и spineless — (32,0—5,2) — 26,8% ; между генамигЬа!гу и rough —
(64,6-19,4) —45,2% и т. д.
Точно так же кривая для гена spineless пересекает ординату
rough на высоте 1,5 единицы, а ординату claret — на высоте 3,5 еди-
ницы. Соответственно с этим эмпирические показатели пере-
креста между генами spineless и rough и spineless и claret меньше
расстояний между ними по карте на 1,5 единицы (32,6—1,5).
в первом случае и на 3,5 единицы (42,2—3,5) — во втором.
Наконец, в данной связи полезно обратить внимание на гены,
максимально удаленные друг от друга. Для примера проследим
кривую поправок для гена roughoid (ru, рис. 34), локализован-
ного на крайнем левом конце III хромосомы. Эта кривая дости-
гает значения поправки, равной 25% уже для гена white ocelli
с локусом 76,2, и вскоре выходит за пределы графика. Однако,
если мысленно продолжить как эту кривую, так и, например,
ординату гена claret (локус 100,7), то можно видеть, что точка
их пересечения даст для этих генов поправку порядка 50%.
Так оно и наблюдается в действительности.
Полнота хромосомных карт дрозофилы
Все сказанное выше относительно механизма перекреста по-
могло уяснить методы построения хромосомных карт дрозофилы
и оценить сравнительную точность таких же карт других объектов
генетических исследований. Мы видели, что точная карта хромо-
сомы может быть построена лишь путем суммирования небольших
ее участков, измеряемых при помощи перекреста между генами,
расположенными настолько близко, что двойной перекрест между
ними практически исключен. Вместе с тем было показано также,
что расстояние между генами yellow и forked в одном из рас-
смотренных опытов оказалось равным 43,5%. Очевидно, что это
значение перекреста мы должны были принять за истинное рас-
стояние между генами, если бы в нашем распоряжении не было
промежуточных генов, давших возможность определить искомое
расстояние более точно. Необходимо также учесть, что в генети-
ческом отношении Х-хромосома дрозофилы приблизительно вдвое
короче II и III хромосом. Ясно, что если бы таким же путем
было определено расстояние, например, между генами Star и
speck по II хромосоме, генетически более длинной, чем Х-хромо-
сома, то несоответствие между наблюденным и истинным рас-
стоянием между генами было бы еще большим.
В свете приведенных данных становится понятным, почему
карты хромосом большинства животных и растений, кроме,
пожалуй, мыши (рис. 38) и кукурузы, по степени точности не мо-
133
гут сравниться с картами хромосом дрозофилы. Расстояния между
большинством исследованных генов определены у них на основа-
нии скрещиваний с двумя-тремя генами. Соответственно с этим
полученные данные пока что следует рассматривать как весьма
приближенные, скорее указывающие лишь порядок расположе-
ния генов в хромосоме, а не истинные расстояния между ними.
Влияние на перекрест внутренних
и внешних факторов
В заключение необходимо отметить, что целый ряд внутренних
и внешних факторов влияет на частоту перекреста хромосом.
К числу первых относятся инверсии, гены-модификаторы, отбор
в том или ином направлении, возраст самок и т. д. Из внешних
факторов необходимо в первую очередь указать на температуру.
Поэтому для получения сравнимых результатов по перекресту
необходимо брать кладки яиц в течение первых шести дней жизни
самок и опыт проводить при температуре 23—25°.
Колебания температуры в ту или другую сторону, возраст
самок и ряд других факторов оказывают существенное влияние
на частоту перекреста.
Выше было отмечено (стр. 114), что у самца дрозофилы явле-
ние перекреста отсутствует. То же самое имеет место у самки
тутового шелкопряда (Bonibix mori). У всех других животных
перекрест, по-видимому, происходит как у самцов, так и у самок.
Причина этого явления неизвестна.
МНОЖЕСТВЕННЫЕ АЛЛЕЛОМОРФЫ
Во всех рассмотренных до сих пор случаях мы имели дело
с явлением простого аллеломорфизма, заключаю-
щегося в том, что признаки составляли простые
менделевские пары, членами которых были, с одной
стороны, особенности нормальной мухи (обозначаемые плюсом),
и, с другой — рецессивные или доминантные мутанты (соответ-
ственно обозначаемые малыми или большими буквами).
Такими менделевскими парами были, например, нормальный
глаз и сильно редуцированный глаз у мутанта Lobe; нормальная
(серая) окраска тела и темная окраска тела у мутанта black;
нормальное крыло дикой мухи и зазубренное по краю крыло
у мутанта Beadex и т. д. Каждая такая пара признаков, или генов,
расщепляется в F2 в отношении 3 : 1, и рецессивный аллеломорф
каждой такой пары может быть противопоставлен только своему
доминантному аллеломорфу. Но тот же ген Lobe уже не может
быть противопоставлен, например, гену Ваг; эти гены не соста-
134
вляют менделевскую пару, иначе говоря, они не являются аллело-
морфными, аллеломорфами, или аллелями.
В отличие от этого у многих животных и растений известны
случаи, и число их у дрозофилы достигает нескольких десятков,
когда один мутантный ген гомологичен более чем одному другому
мутантному гену, причем у данной особи одновременно могут
присутствовать не больше двух таких генов.
Такие генетические системы, в которых два или боль-
шее число мутантных генов обнаруживают
явление а л л е л о м о р ф и з м а, носят название м н о-
ж е с т в е н н ы х аллеломорф.
Классическим примером множественной аллеломорфы у дро-
зофилы является аллеломорфа white — окраски глаз, для которой
известно двенадцать различных состояний, вызываемых различ-
ными мутантными генами, составляющими эту аллеломорфу.
Они образуют ряд постепенных переходов окраски глаз от белой
до нормальной красной, свойственной дикой мухе. Мутанты эти
следующие
1) white—w — белый;
2) ecru — wec — небеленый, цвета сурового полотна;
3) tinged — w1 — тронутый, светло-желтый;
4) ivory — w*— цвета слоновой кости;
5) buff — wbf— рыжий или цвета буйволовой кожи;
6) eosin — we — эозиновый; ‘
7) apricot — wa — абрикосовый;
8) cherry — wc — вишневый;
9) blood — wb — кровавый;
10) coral — wco — коралловый;
11) wine — ww — винный;
12) mottled — wm — пятнистый.
Каждый из этих генов образует простую пару с любым другим,
входящим в эту аллеломорфу геном, и все они в свою очередь
аллеломорфны одному, вызывающему нормальную окраску глаз
дикой мухи. Аллеломорфность членов серии легко и весьма
убедительно доказывается скрещиванием их попарно. Характер-
ной особенностью возникающих при этом мух, которые носят
название компаундов, является состояние признака, про-
межуточное, или почти промежуточное, между признаками скре-
щиваемых форм. Так, например, у гетерозигот по white и apricot
окраска глаз несколько более темная, чем у white, но более свет-
лая, чем у apricot, и в то же время значительно светлее нормаль-
ной.
Иные отношения наблюдаются при скрещивании н е алле-
ломорфных генов, как, например, black и ebony, хотя
они и влияют на окраску тела сходным образом. Ввиду того,
что эти гены не аллеломорфны, у гетерозиготных по ним мух
135
развивается не промежуточная, а нормальная, т. е. д и-
кая, окраска.
Таким образом, развитие в компаундах промежуточного со-
стояния признаков родительских форм, или, что то же самое,
отсутствие возврата к дикому типу, является
характерной особенностью проявления генов из серии множест-
венных аллеломорфов идоказательтвом их аллело-
морфизма.
Далее, все гены серии white обнаруживают одну и ту же
степень сцепления со всеми другими мутантными
генами Х-хромосомы. Наконец, все они больше всего затраги-
вают одну и ту же особенность мухи, а именно
пигментацию глаз, ослабляя ее в различной степени. Сходным
образом влияют члены других множественных аллеломорф,
вызывая редукцию или модифицируя преимущественно какую-
нибудь одну особенность мухи (рис. 9 и 10). Сказанное о поведении
членов рассматриваемой аллеломорфной серии white в скрещива-
ниях служит доказательством того, что они локализованы вод-
ном и том же локусе хромосомы, т. е. произошли
путем мутаций одного и того же гена исходной,
дикой формы.
Понятно, что обычная система обозначений доминантного гена
большой буквой, а рецессивного — малой к множественным
аллеломорфам не применима и нуждается в улучшении. Покажем,
как это достигается на примере аллеломорфы white. Все члены
серии white обозначаются одной и той же буквой w, начальной
в английском наименовании мутации, white, которая в 1910 г.
была найдена Морганом первой в данной серии. (Отметим по-
путно, что мутация white была первой не только в данной серии,
но и вообще первой мутацией, найденной у дрозофилы.) К основ-
ному символу w, о б щ е м у для всех членов серии, придаются
показатели (экспоненты), которые также являются первыми
буквами в английских наименованиях членов данной серии и
по которым они и различаются между собой (например, wa,wco,
w1 и т. д.). Нормальная же окраска глаз, т. е. нормальный аллело-
морф данного локуса, сохраняет при этом обычное обозначение
значком плюс.
По такому же принципу обозначаются члены всех других
множественных аллеломорф дрозофилы.
Переходя к практической стороне заданий, следует отметить,
что для скрещивания с дикими мухами можно брать любые два
или большее число аллеломорфов рассматриваемой серии white.
Все они достаточно хорошо отличаются от нормальных мух.
Однако для скрещивания мутантов между собой лучше брать
те из них, которые значительно отличаются друг от друга по ок-
раске глаз. В противном случае могут встретиться затруднения
136
в классификации различных оттенков окраски глаз у мух, воз-
никающих в таких скрещиваниях.
Разберем эти скрещивания на примере аллеломорфов white
и apricot; классификация мух F2 в этом скрещивании не пред-
ставляет особых затруднений.
Согласно вышесказанному (стр. 135), белая и абрикосовая
окраска рецессивна по отношению к дикому типу, и каждый
из этих признаков в случае прямого скрещивания расщепляется
в отношении 3 : 1, а в случае реципрокного скрещивания — в от-
ношении 1:1. Эта часть задачи, как видно, проста и не требует
дальнейших пояснений.
Остается доказать аллеломорфность этих мутантов. Скрестим
для этого самку с абрикосовыми глазами с белоглазым самцом.
Скрещивание протекает по схеме, представленной в табл. 22
(слева).
Таблица 22
Расщепление в скрещиваниях аллеломорфных мутантов из серии white
PP: O=X<5— PP: $=X3— •
wa w ”=
Гаметы PP: J wa 3 w Гаметы PP: J w 3 wa
Fl: ?$=<5<5_w_a Fl: 33 2L
+ + w wa -a
F2: 3 apricot:! white.
F2: 1 apricot:! white.
Как видно, в Fl возникают самцы с абрикосовыми глазами.
Самки же имеют два рецессивных аллеломорфа в одном и том же
локусе, а именно—ген абрикосовой окраски глаз в одной хромо-
соме и ген белой окраски — в другой, гомологичной, хромо-
соме.
При одновременном присутствии этих генов у самок разви-
вается окраска глаз, промежуточная между абрикосовой
137
п белой. Именно так обстоит дело в большинстве множественных
аллеломорф дрозофилы, когда одновременное присутствие у особи
двух аллеломорфных рецессивных генов вызывает в компаунде
некоторое ослабление одного из признаков, который условно
можно рассматривать но вполне доминантным. В рассматривае-
мом случае это будет признак apricot.
Во втором поколении от этого скрещивания возникают мухи
white, apricot и компаунды, причем отношение двух последних
классов к мухам white равно 3:1.
Анализируемое скрещивание можно вести и в реципрокном
направлении, считая признак apricot не вполне доминирующим
(т. е. $>wX3wa; табл. 22 справа). Наблюдаемое здесь расщепление
на 1 компаунд : 1 apricot : 2 white или более кратко: 1 white :
1 не-white очевидно без дальнейших пояснений.
Демонстративны также опыты по скрещиванию с белоглазыми
мухами таких мутантов, как вишневый (cherry — wc) или эозино-
вый (eosin — wc). Интересно отметить, что у самцов eosin глаза
светлее, чем у таких же гомозиготных самок. Такой же оттенок
имеет и компаунд этого гена с white, почему самки строения we/w
и самцы eosin, возникающие в F2 в случае прямого и реципрокного
скрещиваний, более или менее одинаковы.
Из числа мутантов, относящихся к другим множественным
аллеломорфам, обычны ebony (черное тело) и sooty (грязно-серое
тело), которые вместе с их нормальным аллеломорфом также
образуют тройную аллеломорфу окраски тела. Обе эти мутацион-
ные расы дают четкое расщепление при скрещивании с Normal.
Однако друг от друга, а равно и обе от образуемого ими компаунда
отличаются незначительно, и классификация мух F2 без специаль-
ного анализа трудно выполнима. Поэтому скрещивание с этими
мутантами можно рекомендовать лишь для того, чтобы показать,
что компаунд ebony-sooty не дает возврата к дикому типу.
Значение множественных аллеломорф
для понимания природы гена
Каждый член данной множественной аллеломорфы предста-
вляет собой мутационное изменение одного и того же гена. Экспе-
риментально доказано, что нормальный аллеломорф гена white
может мутировать как в крайний член множественной серии,
т. е. в white, так и в один из промежуточных. Равным образом
доказано, что любой рецессивный аллеломорф этой серин может
измениться как в сторону более слабых, так и в сторону более
сильных аллеломорфов. Возникающие в последнем случае так
называемые возвратные мутации являются доказа-
тельством мутабильности гена в разных направлениях.
Явление множественного аллеломорфизма представляет боль-
138
той теоретический интерес. Благодаря ему в свое время была
доказана ошибочность выдвинутой Бетсоном и Пеннетом гипо-
тезы «присутствия—отсутствия» для объяснения явления доми-
нирования и рецессивности. Хотя современная генетика еще
не в состоянии ответить на вопрос, почему одни признаки домини-
руют, а другие рецессивны, все же имеются основания утверждать,
что рецессивность признака обусловливается не • отсутствием
какой-то клеточной структуры, а специфическим ее измене-
нием.
В связи с этим большой интерес приобретают те множествен-
ные аллеломорфы, в которых их дикий, или нормальный, ген мути-
ровал как в направлении рецессивности, так и доминантности.
Число таких аллеломорф у дрозофилы также значительно. Наибо-
лее демонстративной из них является тройная аллеломорфа
Truncate (TdP — укороченные крылья) — Normal — dumpy (dp —
укороченные крылья). В этом случае нормальный аллеломорф
является рецессивным по отношению к доминантному мутацион-
ному изменению (Truncate) и доминантным по отношению к рецес-
сивному мутационному изменению (dumpy). Возникающая здесь
классическая трехчленная система одного и того же генного локуса
должна быть выражена следующей формулой (ср. стр. 81—82):
Tdp> + >dp
или
ЛЕТАЛЬНЫЕ ГЕНЫ
В настоящем разделе мы познакомимся с категорией наиболее
часто встречающихся наследственных изменений, или мутаций,
которые носят название летальных (lethal — смертельный, смер-
тоносный) и которые убивают гомозиготных по ним особей еще
до появления их на свет. Существование летальных мутаций вы-
текает из того факта, что в потомстве мух некоторых линий наблю-
дается повторяющееся из поколения в поколение отсутствие опре-
деленных классов особей. Эти результаты могут быть объяснены
при допущении, что в таких линиях возникли летальные мутации,
которые подобно другим мутационным изменениям подчиняются
менделевскому закону расщепления и обнаруживают сцепление
с другими наследственными факторами.
У дрозофилы гибель летальных зигот наступает в одних слу-
чаях на стадии куколки, в других на стадии личинки; иногда же
летальный ген убивает зародыш в эмбриональном периоде разви-
тия, т. е. еще до вылупления личинки из яйца. Возможно также,
что смертельное влияние летальных генов проявляется в некото-
рых случаях еще на более ранних стадиях развития особи. Все
139
известные у дрозофилы летальные гены являются зиготическими;
их действие проявляется только в зиготе, в то время как леталь-
ных генов гаметических, т. е. убивающих яйца или спермато-
зоиды, у дрозофилы, по-видимому, не известно.
У дрозофилы подробно изучено огромное число рецессивных
и доминантных летальных мутаций, природа которых неодинакова
во всех случаях. В настоящем разделе мы познакомимся с г е н-
н ы м и, или толковыми, летальными мутациями, затра-
гивающими единственный локус, или точку, хромосомы.
Понятно, что все поддерживаемые в культурах дрозофилы ле-
тальные мутации рецессивны; в противном случае невозможно
было бы установить их наличие и исследовать природу и особен-
ности проявления. Сказанное не следует понимать в том смысле,
что доминантные летальные мутации вообще не существуют;
однако доказательство их существования более сложно и выходит
за рамки данного руководства.
Все рецессивные летальные мутации у дрозофилы обозначаются
одним, общим для них символом 1 с соответствующими показа-
телями, если в них есть необходимость.
У дрозофилы известно также значительное число видимых до-
минантных мутаций, сопровождающихся рецессивным летальным
действием. Поэтому особи, гомозиготные по доминантным генам,
также отмирают, а сами линии могут существовать только в гетеро-
зиготном состоянии. Таким образом, как и во всех других случаях
доминирования, действие рецессивного летального гена в зиготе
уравновешивается его нормальным аллеломорфом.
Летальные гены в половой хромосоме
Итак, согласно сказанному, в каждой линии с летальным геном
выживают лишь гетерозиготы по летальному гену (1/+), тогда
как гомозиготы строения 1/1 нежизнеспособны. Очевидно, что
самцы дрозофилы, которые в отношении Х-хромосомы являются
гаплоидными (гемизиготными), при наличии летального гена в по-
ловой хромосоме нежизнеспособны. Следовательно, наруше-
ние нормального соотношения самок и
самцов в линии должно возникнуть во всех случаях наличия
сцепленной с полом летальной мутации. И действительно, леталь-
ные гены в Х-хромосоме легче всего поддаются учету, и именно
здесь они были впервые обнаружены.
Для иллюстрации наследования сцепленных с полом летальных
генов воспользуемся скрещиванием с нормальными самцами самок
из культуры Notch г. Существует несколько аллеломорфов (мутан-
1 Строение мух Notch здесь упрощено; в действительности это наслед-
ственное изменение связано с нехваткой (deficiency) с рецессивным леталь-
ным эффектом.
140
тов) этого гена, которые характеризуются различной степенью
зазубренности (редукции) крыла (рис. 8). Признак этот доминант-
ный и одновременно летальный в гомозиготном состоянии, его
ген локализован в половой хромосоме.
Так как всякая летальная мутация существует только как
гетерозигота, то формула самки Notch будет такова:
N
От скрещивания ее с нормальным самцом в F1 возникнут самки
и самцы, строение которых приведено в табл. 23 (слева).
Таблица 23
Расщепление 2 : 1 при наличии летальных генов
* Нежизнеспособные зиготы.
Из общего числа самок F1 половина будет с признаком Notch
(N/+); другая половина самок с нормальными, незазубренными
крыльями (+/+)• Что касается самцов, то из двух теоретически
ожидаемых классов выживают лишь те, Х-хромосома которых не
содержит летального гена Notch; такими являются нормальные
самцы строения +/Y. Самцы же, которые унаследовали от матери
Х-хромосому с геном Notch, отмирают и в опыте не появляются.
Следовательно, общий результат опыта будет такой: на две
самки (из которых одна Notch, а другая Normal) появляется один
нормальный самец. Другими словами, нормальное соотношение
самок и самцов, равное 1:1, оказывается смещенным в пользу
самок и выражается отношением 2 9 : 1 3.
Таков простейший случай наследования сцепленного с полом
рецессивного летального гена с одновременным проявлением
141
доминантного признака Notch. Результаты опыта изменятся мало,
если для скрещивания взять рецессивный летальный ген, нс свя-
занный с доминантной внешней особенностью. Единственное
отличие сведется к тому, что в потомстве не будет расщепления по
видимым признакам; нарушенное же соотношение полов (2 j :
1 3) останется и здесь; оно всегда свидетельствует о том, что в та-
кой культуре имеется летальный ген в по л о в о й хромо-
соме.
Летальные гены в аутосомах
Наличие летальных генов в аутосомах приводит к резуль-
татам, во многом сходным с вышеописанными для летальных генов
в половой хромосоме. Различие сводится к тому, что отношение
2 : 1 будет характеризовать здесь не соотношение самок и самцов,
а отношение доминантных форм к рецессивным, если данный ре-
цессивный летальный ген связан с какой-либо доминантной осо-
бенностью мухи вроде Notch. Методика обнаружения рецессив-
ных летальных генов без видимых проявлений приведена на
стр. 169.
Обратимся к опыту, иллюстрирующему расщепление по ле-
тальному гену в аутосоме.
Для такого скрещивания хорошими мутантами являются сле-
дующие: Star (S) — звездчатые глаза (рис. 3); Curly (Су) — загну-
тые кверху крылья; Dichaete (D) — двущетинковый, с несколько
загнутыми кверху и слегка растопыренными крыльями; Delta
(D1) — с дельтообразно раздвоенными на конце крыла продоль-
ными жилками (рис. 7); Beaded (Bd) — с зазубренными краями
крыла. Все эти мутанты доминантные и летальные в гомозиготном
состоянии. Поэтому удобно дать для них общую схему расщепле-
ния, которое наблюдается в результате скрещивания мух любой
из этих линий между собой.
Условно обозначив символом D (1) (в котором буква D обозна-
чает доминирование признака, а 1 — его летальное действие
в гомозиготном состоянии) любого из вышеназванных мутантов
и припомнив, что каждый из них существует только как гетеро-
зигота, мы должны, как и в случае Notch, строение такой мухи
обозначить формулой
+
Скрещивание их между собой является моногибридным с по-
следующим расщеплением мух первого поколения на три класса,
приведенные в табл. 23 (справа). Так как исходные родительские
мухи гетерозиготны, то расщепление наступает уже в ближайшем
поколении, а не во втором, как это было в рассмотренных до сих
пор скрещиваниях.
142
Как и в предыдущем опыте, мухи одного из трех теоретически
ожидаемых классов, а именно гомозиготы по летальному гену
(D1/D1), отмирают и в опыте по появляются; гетерозиготы же по
летальному гену (Dl/-|-) выживают, равно как и нормальные
зиготы, не имеющие этого гена. Численное соотношение мух двух
классов равно 2D] : 1 Normal.
Попутно нелишне обратить внимание на следующее. При на-
личии летального гена в половой хромосоме доминантным
признаком (а следовательно, и рецессивным летальным геном
в гетерозиготном состоянии) обладают лишь 50% самок. В рас-
сматриваемом здесь общем случае аутосомный доминант-
ный ген с рецессивным летальным действием наследуется неза-
висимо от пола и потому проявится у самок и
самцов.
Таким образом, пользуясь вышеприведенной общей формулой
расщепления, можно сказать, что скрещивание между собой мух
Star, Curly, Dichaete, Delta и т. д. в ближайшем же поколении при-
водит к одним и тем же численным соотношениям фенотипов,
а именно: одна нормальная муха приходится на две мухи соответ-
ственно Star, Curly, Dichaete, Delta и т. д.
Такова общая схема наследования всех аутосомных доминант-
ных генов, летальных в гомозиготном состоянии. Заметим по-
путно, что по такой же схеме поддерживаются основные линии
этих мутаций с отбором мутантных форм в каждом поколении.
При этом девственность самок не имеет значения, так как в куль-
турах всегда найдется достаточное количество мух с соответствен-
ным доминантным признаком.
Сбалансированные системы летальных генов
и механизм балансирования
Рассмотрим теперь примеры так называемых сбалансирован-
ных систем летальных генов, т. е. таких линий, в которых, не-
смотря на наличие летальных генов, видимое расще-
пление отсутствует. Как было сказано выше, мухи
из линий Star и Curly (та и другая из II хромосомы) при скрещи-
вании с себе подобными всегда отщепляют 33% нормальных
мух.
Посмотрим, что произойдет, если мух Star и Curly скрестить
между собой. Генотипическое строение мух Star и Curly, их гамет
и потомство представлены в табл. 24.
Как видно из табл. 24 (слева), в F1 возникают четыре типа
мух в равных количествах. Из них 25% нормальных и в отноше-
нии глаз (не-Star), и в отношении крыльев (не-Curly). Половина
от общего количества мух подобна исходным родительским,
т. е. 25% Star и 25% Curly. Наконец, 25% мух обладают особен-
ностями и Star, и Curly и, следовательно, гетерозиготны по двум
143
рецессивным летальным генам. Однако каждый из них, будучи
в гетерозиготном состоянии, не влияет на жизнеспособность особи;
такие мухи выживают и в отношении жизнеспособности не усту-
пают нормальным.
Скрестим теперь мух Star-Curly между собой (табл. 24, справа).
Гаметы, ими продуцируемые (яйца и сперматозоиды), будут двух
типов, а именно с геном Star и нормальным аллеломорфом гена
Curly, в одном случае, и с геном Curly и нормальным аллеломор-
фом гена Star — во втором.
Что же касается мух следующего поколения, то два из трех
теоретически ожидаемых классов, а именно гомозиготы Star
(клетка 1-я решетки) и гомозиготы Curly (клетка 4-я решетки)
нежизнеспособны: первые из них содержат ген Star, а вторые —-
ген Curly в гомозиготном состоянии. Выживающие же Star-
Curly мухи подобны исходным родительским. Таким образом,
Т а б л и ц а 24
Механизм сбалансированных систем летальных генов S + 4- 4- S 4- S 4- РР: ==Х== РР: ==Х== + 4“ 4~ Су 4~ Су 4~ Су Гаметы РР: Гаметы РР:
Star _ Ь 4- \S-Cy 4-4- _ X S 4- 4- Су
(airly S-Cy "к
+ Су S 4~ 4- 4- s + * S + Су
4- Су + Су S 4- S +
+ + S + 4~ 4~ 4- Су S + * 4- Су
+ + 4- 4- 4~ Су 4- Су
Fl: 1 S-Су : 1 S : 1 Су: 1 N. Fl: Star-Cud у (без видимого расщепления).
Fl: 1 Star: 1 (airly.
* Нежизнеспособные зиготы.
144
в культуре Star-Curly из поколения в поколение выживают только
гетерозиготные по этим признакам, а следовательно, и по леталь-
ным генам мухи; гомозиготы же по генам Star и Curly отмирают,
вследствие чего в линии не обнаруживается никакого видимого
расщепления. В этом и заключается механизм баланси-
рования летальных генов, обусловливающий отсутствие
в такой линии видимого расщепления.
Легко, однако, нарушить механизм балансирова-
ния и снова показать, что летальные гены здесь действительно
присутствуют.
Для этого мух из культуры Star-Curly достаточно скрестить
с нормальными: вследствие нарушения балансирующего меха-
низма в ближайшем же поколении от этого скрещивания снова
возникнут мухи Star и Curly (табл. 24, внизу).
Дальнейшее инбредное разведение мух Star и Curly снова при-
ведет к знакомой нам формуле расщепления, т. е. 2 Star или
Curly : 1 Normal, свидетельствующей о наличии в культурах
летальных генов.
Запиратели перекреста
Теперь своевременно поставить вопрос, на каком основании
предыдущий анализ механизма балансирования летальных генов
мы вели, не считаясь с возможностью возникновения у самок
кроссинговера и, казалось бы, неизбежного в таких случаях
усложнения описанной простой схемы наследования признаков
для случаев сбалансированных летальных генов?
Ответ на этот вопрос дает исследование строения хромосомы
с геном Curly, в которой, так же как и в других аналогичных
хромосомах, перекрест происходит очень редко. Причина этого
явления заключается в необычном строении таких хромосом, свя-
занном с наличием в них инверсий, т. е. таких перестроек,
когда часть хромосомы перевернута по длине на 180°.
Поясним сказанное примером. Допустим, что в исходной хро-
мосоме существовал следующий порядок генов: А, В, С, D, Е,
F, G. . . и т. д. В такой хромосоме спонтанно или под влиянием,
например, Х-лучей мог произойти разрыв хромосомы одновре-
менно в двух местах, допустим, между генами АВ и DE. Фрагмент
хромосомы с генами В, С, D может затем занять в хромосоме перво-
начальное положение, и, таким образом, исходная структура
хромосомы будет восстановлена. Однако ’образовавшийся фраг-
мент может воссоединиться с частями исходной хромосомы в пере-
вернутом на 180° положении, в результате чего возникнет хромо-
сома, в которой порядок расположения генов будет таков: A, D,
С, В, Е, F, G. . . и т. д. Вследствие нарушенного расположения
генов в перевернутой (инвертированной) части хромосомы ее
коныогация с нормальным гомологом в этой области нарушается
и препятствует перекресту.
10 И. И. Медведев
145
Таким образом, одним из генетических последствий возникно-
вения инверсий является резкое падение или даже и о л-
ное подавление перекреста в затронутых ими
областях. Поэтому инверсии называют также запирате-
ля ми перекреста (crossing-over suppressors).
В хромосоме Curly имеются не одна, а две инверсии; одна из
них захватывает почти все левое плечо II хромосомы, а другая —
правое. Все инверсии принято обозначать одним общим симво-
лом С; следовательно, более подробное строение хромосомы с ге-
ном Curly следует обозначить формулой
С II L Су С 11 В
в которой цифра II означает II хромосому, a L и R — ее левое
и правое плечи.
Таким образом, в механизме балансирования летальных генов
важную роль играют инверсии, как запиратели перекреста. Бла-
годаря им создается возможность в случае необходимости исклю-
чить кроссинговер у самок и сохранять в коллекциях лаборатор-
ных линий дрозофилы такие гены и генетические структуры,
которые при отсутствии запирателей перекреста потребовали бы
больших хлопот по их поддержанию. Другое важное значение
запирателей перекреста будет рассмотрено в главе V, посвящен-
ной методике учета искусственных мутаций.
Выше было сказано, что в хромосоме Curly перекрест происхо-
дит очень редко. Однако можно создать такую систему сбаланси-
рованных летальных генов, в которой перекрест будет осуще-
ствляться с определенной частотой. Если к тому же в результате
перекреста из «запертой» хромосомы будет высвобождаться ген
какой-нибудь видимой рецессивной мутации, то появление таких
мух будет имитировать повторное возникновение в культуре
видимой «мутации».
Примером такой культуры является выведенная Стертевантом
сбалансированная система строения
ь + -I-
-!- I Рр ’
в которой один гомолог III хромосомы несет летальный ген Di-
chaete, связанный с небольшой инверсией, а другой гомолог —
летальный ген (1) и ген peach (рр — персиковая окраска глаз,
аллеломорф pink). Линия такого строения при сравнительно
близком расположении обоих летальных генов в гомологичных
хромосомах представляет собой сбалансированную систему. Что
касается гена рр, то между ним и геном 1 кроссинговер у самки
все же изредка происходит (приблизительно в 5% случаев), бла-
годаря чему в такой культуре, кроме мух Dichaete, возникают
также мухи Dichaete с розовыми глазами, т. е. Dichaete-peach.
146
Таблица 25
Неполностью сбалансированная система летальных генов
РР: $
+ 1 Р" +1 Р’
Fl: Dichaete — 97,5%; Dichaete-peach — 2,5%
* Нежизнеспособные зиготы.
(Ради простоты изложения мы оставляем без внимания перекрест
между D п 1, вероятность которого гораздо меньше, чем между
1 И р1’.)
Скрещивание мух Dichaete указанного строения представлено
в табл. 25.
Как видно, и здесь из 100 яиц, оплодотворенных спермой од-
ного типа, выживают только 50% зигот; по внешности это мухи
Dichaete (верхняя, горизонтальная графа таблицы). Точно так же
из 100 яиц, оплодотворенных спермой другого типа, выживают
50% мух, по внешности также Dichaete (нижняя горизонтальная
графа таблицы). При отнесении к жизнеспособному потомству
мухи Dichaete составляют 97,5%. Остальные 2,5% мух прихо-
дятся на долю Dichaete-peach, которые возникают в результате
перекреста между генами 1 и рр (правая половина таблицы). (Очень
редко могут появляться также нормальные мухи в результате
перекреста между генами D и 1.) Появление в культуре единичных
мух с персиковыми глазами напоминает собой возникновение
мутаций. Однако причина их возникновения, как видно, иная
и отношения к мутационному процессу не имеет.
ГЛАВА ЧЕТВЕРТАЯ
ЛОКАЛИЗАЦИЯ ГЕНОВ
Как известно, практические занятия студента в химической
лаборатории качественного анализа завершаются анализом не-
известной для него соли, или смеси солей, в котором ставится
задача определить содержащиеся в них анионы и катионы и кото-
рый поэтому предполагает знакомство практиканта со всеми ос-
новными приемами качественного анализа.
С методической точки зрения, между химическими и генетиче-
скими методами анализа есть большое сходство. Как в том, так
и в другом случае предмет анализа исследуют при помощи ве-
ществ, или элементов, из которых состоит и само анализируемое
вещество. Разница между ними заключается в том, что строение
анализируемого вещества неизвестно, анализирующее же ве-
щество (или вещества) хорошо изучены, благодаря чему их реак-
ции, или поведение при разных условиях, известны до мельчайших
подробностей, и характер их взаимодействия с анализируемым
веществом дает возможность делать правильные выводы.
Таким образом, по аналогии с контрольной задачей по каче-
ственному анализу заканчивающему проработку на дрозофиле
основ генетического анализа можно рекомендовать в качестве
заключительного выполнение такого задания, которое явилось бы
надежной проверкой усвоения знаний, полученных в результате
всех предыдущих скрещиваний. Мы имеем в виду постановку
и анализ серии скрещиваний по локализации какого-нибудь про-
извольно выбранного из коллекции мутанта, который дается прак-
тиканту как неизвестный с предложением определить его принад-
лежность к группе сцепления и локус в хромосоме. Как видно,
это задание гораздо сложнее всех предыдущих, но имеет и своп
достоинства: оно заключает в себе значительный элемент исследо-
вательской работы и применение накопленных знаний к самостоя-
тельному решению поставленной задачи.
Необходимо сказать несколько слов об организации опытов,
прежде чем перейти к их рассмотрению. Было бы трудно, а может
149
быть и не необходимо, дать общую для всех случаев программу
скрещиваний и последовательность их выполнения. Такая про-
грамма должна исходить из наличия ряда сопутствующих условий:
необходимых линий (культур) дрозофилы, посуды, рабочих мест,
бинокуляров и т. д. Однако исследовательские лаборатории, как
правило, отличаются друг от друга в отношении пе только техниче-
ского оборудования, но и научной тематики, которая в значитель-
ной степени определяет специфику линейного фонда дрозофилы.
Поэтому в методической части рассматриваемого задания мы огра-
ничимся единственным замечанием: не поручать студентам работу,
явно для них непосильную, и следовать золотому правилу —
лучше меньше, да лучше.
ОПРЕДЕЛЕНИЕ ГРУППЫ СЦЕПЛЕНИЯ
ДРОБНЫМ СПОСОБОМ
Выполнение задания по локализации неизвестного рецес-
сивного мутанта, в качестве которого, конечно, лучше брать
достаточно четко проявляющиеся мутации, как логически, так и
во времени распадается на два этапа.
А. Определение группы сцепления.
Б. Определение локуса в хромосоме.
Соответственно с этим рассмотрим сначала те опыты, которые
связаны с выполнением первой части задания, т. е. с определением
группы сцепления анализируемого мутанта. Относящиеся сюда
подробные схемы опытов с указанием последовательности их
выполнения приведены в табл. 26—31. Поэтому задача сводится
к тому, чтобы прокомментировать эти схемы несколько подробнее.
Условимся также, что в дальнейшем локализуемый мутант мы
будем обозначать буквой б.
* * *
Определение группы сцепления анализируемого мутанта можно
выполнить двумя способами (табл. 26). Рассмотрим сначала пер-
вый способ, который можно назвать дробным, или н е-
одномоментным. По этому способу определение группы
сцепления осуществляется при помощи нескольких, независимых
скрещиваний, каждое из которых дает ответ лишь на один частный
вопрос поставленной задачи.
Положительный или отрицательный ответ на вопрос о при-
надлежности мутанта б к I группе сцепления может быть получен
путем скрещивания его с нормальными мухами или с самками уу.
В самом деле, в прямом и реципрокном скрещиваниях рецессив-
ного мутанта б с нормальными мухами возможны два случая:
а) признак б появился у 25% мух F2 как в прямом, так и
в реципрокном скрещиваниях (расщепление 3:1). Вывод:
150
Табл и ц а 26
Программа сокращений по локализации гена
А, Определение группы сцепления
Скрещивание Возможные результаты Вывод
Дроби ы й a) 6 X Normal; прямое скрещивание То же; реципрокное скрещивание (и е о д н о м о м е н т и ы Х-хромосома 3 Normal: 1 о 3 Normal: 1 о й) способ S нс сцеплен с полом
б) То же; прямое скрещи- вание То же; реципрокное скрещивание 3 Normal : 1 б 1 Normal: 1 6 о сцеплен с полом
в) 33 о х 29 уу То же Все (5(5 F1 не-6 Все (5(5 F1 6 о не сцеплен с полом о сцеплен с полом
г) 6 X Ыаск (П хромосома) 7/ III IV хромосомы 9 N : 3 b : 3 8 : 1 Ъ о о не из II хромосомы
То же » » 2 N : 1 Ь : 1 6 : 0 Ь 6 1 о из II хромосомы
д) 6 X pink (Ш хромосома) 9 N : 3 р : 3 6 : 1 р 6 5 не из III хромосомы
То же » » 2 N : 1 р: 1 6:0 р 61 5 из III хромосомы
е) S X bent (IV хромосома) 9 N:3 bt:3 8:1 bt 8 о не из IV хромосомы
То же » » 2 N:1 bt:1 8:0 bt oi & из IV хромосомы
д<. ж) J J 1'1 X 33 8 (воз- вратпое) 6 X black (И хромосома) black X 5 » » ’ См. также табл. 28. 2 См. также табл. 29. ратные скрещивания с 1 Normal: 1 6 2 1 Normal : 1 6 151 6 ?
Таблица 26 (продолжение)
А. Определение группы сцепления
Скрещивание Возможные результаты Вывод
6 X pink (Ш хромосома) pinkX& » » 1 Normal:! о*2 1 Normal: 1 6 ?
5 X bent (IV хромосома.) bent X 8 » » 1 Normal: 1 В 2 1 Normal : 1 В ?
Од Рецессивнъ з) S 8 г х 9 $ уу/ъ р bt номоментный с п о( ге маркеры (III III IV [ все 8 8 Fl не-6 [ все 8 8 Fl 6 3 0 б хромосомы ) б не сцеплен с полом б сцеплен с полом
То же 27:9:9:9:3:3:3:1 2)3 27:9:9:9:3:3:3:1 3) 2:1:1:0 4) б относится ко II группе сцепления
» 27:9:9:9:3:3:3:1 5)3 27:9:9:9:3:3:3:1 6) 2 : 1 : 1 : 0 7) б относятся к III группе сцепления
» 27 : 9 : 9 :9 : 3 : 3: 3: 1 8) 3 27:9:9:9:3:3:3:1 9) 2: 1:1:0 10) б относится к IV группе сцепления
Доминантные маркеры (I II III IV и) бХ^-D; 8 8 Fl S-D См. табл. 31 X 9 5 S/6 хромосомы ) См. табл. 31
2 См. также табл. 29. 3 Полные формулы расщепления: 2) 27 Normal: 9 6:9 р : 9 bt: 3 р bt: 3 б bt: : 3 6 р : 1 р bt б 3) 27 Normal: 9 b : 9 р : 9 bt: 3 р bt: 3 b bt: : 3 b р : 1 b р bt 4) 2 не-black п не-6 :1 б : 1 b : 0 b б 5) 27 Normal: 9 6:9 b : 9 bt: 3 б bt: 3 b bt: :3 b б: 1 6 b bt 6) 27 Normal: 9 b:9 р:9 bt: 3 р bt: 3 J) bt: : 3 b p : 1 b p bt 7) 2 не-pink и не-б: 1 б : 1 p : 0 p 6 8) 27 Normal : 9 6 : 9 b : 9 p : 3 p 6 : 3 b 6 : 3 b p : : 1 6 b p 9) 27 Normal: 9 b : 9 p : 9 bt: 3 p bt: 3 b bt: : 3 b p : 1 b p bt 10) 2 пе-bent и не-6:1 6:1 bt: 0 6 bt 152 Если не учитывать: black pink-bent pink 6 black-bent' bent 6 bl ack-pi iik
Т а б л и ц а 26 (окончание)
Б. Определение локуса в хромосоме
Скрещивание Возможные результаты Вывод
Д р о б н ы it (н е о д номом ен т н ы й) способ Х-хромосома
к) s X а 1 29 Fl х Л1°- 0 X Ь J бЫХ 33 (перекрест определяется только на F2) См. стр. 163 См. стр. 163
II III IV хромосомы
-1)гХА| 99 Fix об 0 X В f 5/S См. стр. 163 См. стр. 163
м) о а X Normal; Fl X 33 8а/6а о b X Normal; Fl X 33 ob/8b Од л)«ХаЬ; 99?1ХЛЮ- бых 33 (перекрест опре- деляется только на 33 Е2) о) 8 ХАВ; 99 FIX X 33 Ъ/Ъ См. стр. 165 номоментный снос Х-хромосома См. стр. 163 II III IV хромосомы См. стр. 163 См. стр. 165 ; о б См. стр. 163 См. стр. 163
п) $9 S-D F2 (табл. 31) X S3 о/о См. стр. 164 См. стр. 164
р) о ab X Normal; F1 X 3S о ab/B ab См. стр. 165 См. стр. 165
153
признак 6 не сцеплен с полом, т. е. не относится к I группе сце-
пления (табл. 26, а);
б) признак 6 появился у 25% мух F2 в прямом скрещивании
(расщепление 3 : 1) и у 50% — в реципрокном скрещивании (рас-
щепление 1:1). Вывод: признак 6 сцеплен с полом, т. е. отно-
сится к I группе сцепления (табл. 26, б).
Тот же ответ может быть получен от скрещивания самцов 6
с самками уу. В отличие от двух предыдущих скрещиваний иско-
мый ответ здесь будет получен уже на мухах F1. Здесь также воз-
можны два случая:
а) признак 6 нс появился ни у одной мухи F1. В ы в о д:
ген 6 перешел в гетерозиготное состояние, что при спаянности
Х-хромосом в линии уу возможно лишь в том случае, когда ген б
не сцеплен с полом;
б) признак б появился у всех самцов F1. В ы в о д: на тех же
основаниях этот способ наследования может осуществиться лишь
в том случае, когда признак б сцеплен с полом, т. е. относится
к I группе сцепления (табл. 26, в).
Дальнейшие скрещивания (табл. 26, г, д, е) преследуют цель
выяснить отношение мутанта б ко II, III и IV группам сцепления.
Для этого мух б отдельно скрещивают с мутантами black, pink
и bent (соответственно из II, III и IV хромосом) с последующим
скрещиванием мух F1 между собой. Впрочем, можно ограничиться
какими-либо двумя скрещиваниями из этих трех, скрестив мух б
только, например, с black и pink. Однако, если в обоих этих
скрещиваниях признак б будет свободно комбинироваться с black
и pink, тогда заключение о принадлежности гена б к IV группе
сцепления, соответствующий мутант из которой не был взят
в скрещивание, будет, конечно, лишь косвенным.
В каждом из этих трех скрещиваний возможны также два
случая расщепления в F2:
а) признак б свободно комбинируется с black. Вывод:
ген б не относится ко II группе сцепления. Это скрещивание обыч-
ное дигибридное; подробнее оно представлено в табл. 27 (см.
также табл. 4);
б) признак б обнаружил несвободное комбинирование с black
и расщепление по формуле 2 : 1 : 1 : 0, т. е. отсутствие двойного
рецессива б-black (табл. 28). Вывод: гены б и black относятся
к одной и той же, т. е. ко II, группе сцепления (табл. 26, г).
Анализируя подобным образом мух F2 от скрещивания
б X pink и б X bent, в соответствии с полученными данными решаем
вопрос об отношении мутанта б к III и IV группам сцепления
(табл. 26, д, е).
Особого внимания заслуживает отношение 2 : 1 : 1 : 0
(табл. 28), характерное не только для этого, но и для всех тех
случаев, когда гены скрещиваемых признаков относятся к од-
ной и той ж е группе сцепления. Необходимо также под-
154
Т а б л н ц а 27
Определение группы сцепления при помощи рецессивных маркеров.
Расщепление 9 : 3 : 3 : 1 как доказательство свободного комбинирования
признаков (отсутствие сцепления)
1'1: 2? н <5<5
I» +
черкнуть, что отношение 2 : 1 : 1 : 0 возникает независимо от
отсутствия у самок F1 перекреста (левая часть таблицы) или его
наличия (правая часть таблицы) между генами участвующих
в скрещивании особенностей. Действительно, в каком бы проценте
случаев не происходил перекрест у самок б-|-/+Ь, образующиеся
кроссоверные яйца 6Ь и Н--(- в результате слияния их со спермато-
зоидами б+ и +Ь фенотипически приведут к тем же результатам,
что и не кроссоверные, т. е. 6 + и 4-Ь. Они лишь пропорционально
увеличивают число нормальных мух, с одной стороны, и black
и б, с другой, не меняя, однако, численного соотношения этих
классов. Следовательно, отношение 2: 1:1:0 всегда гово-
рит о принадлежности скрещиваемых мутантов к о д н о й и
той же хромосоме, т. е. о их сцеплении.
В дальнейшем мы еще встретимся с этой важной формулой
(стр. 159). Заметим также, что расщепление 2 : 1 : 1 : 0 может
155
Т а б л иц а 28
Определение группы сцепления при помощи рецессивных маркеров.
Расщепление 2: 1 : 1 :0 как доказательство несвободного комбинирования
признаков (наличие сцепления)
PP: =^=
b +
FI: $9 и $3
F2: 2 Normal : 1 black : 1 6 :0 black-o.
F2: 2 Normal: 1 black:
:1b: 0 black-b.
возникнуть и вообще имеет силу только по отношению к а у т о-
с о м н ы м признакам. Рекомендуем читателю убедиться в этом
самостоятельно.
Приведенное доказательство принадлежности аутосомного му-
танта к той или другой группе сцепления предполагало, что вто-
рое поколение было получено от- скрещивания мух F1 между
собой. Спрашивается, нельзя ли эту часть задания выполнить
при помощи возвратных скрещиваний гибридов F1 с гомозигот-
ными мухами б во всех случаях (табл. 26, ж)? Схема анализа
одного такого скрещивания с геном black представлена в табл. 29.
Результаты анализа показывают, что метод возвратных скре-
щиваний не только не обладает преимуществом перед разобранным
выше, но и вообще не может быть использован для той цели,
о которой здесь идет речь. Как видно из табл. 29, независимо
от того, относится ли ген б к той же группе сцепления, что и
black (правая часть таблицы), или комбинируется с ним незави-
симо (левая часть таблицы), взяты ли из F1 самцы (верхняя поло-
вина таблицы), или самки (нижняя половина таблицы) — во всех
случаях возникает отношение 1 Normal : 1 б, которое не дает
ответа на поставленный вопрос.
156
Т а б л pi ц а 29
Определение группы сцепления. Неприменимость возвратных
скрещиваний для определения групп сцепления
Ген о не во II хромосоме
(свободное комбинирование)
Ген о во II хромосоме
(не свобо д ное комбинирование)
II ? II ?
1'1: $2 11 И
F2: 1 Normal : 1 о.
некроссоверы кроссоверы
F2: 1 Normal : 1 о. .
ОПРЕДЕЛЕНИЕ ГРУППЫ СЦЕПЛЕНИЯ
ОДНОМОМЕНТНЫМ СПОСОБОМ
Метод рецессивных маркеров
В отличие от предыдущего, метод рецессивных маркеров позво-
ляет определить группу сцепления при помощи единствен-
ного скрещивания мутанта 6 с такими мухами, все хромосомы
которых маркированы рецессивными генами.
Это скрещивание сложнее предыдущих, но его преимущества
очевидны.
Для такого скрещивания очепь удобна линия уу/b р Ы, в ко-
торой все хромосомы маркированы рецессивными генами. Сле-
157
довательно, в скрещивании самок yy/b.p Ы с самцами 6 имеется
возможность решить вопрос о принадлежности гена 6 к той или
иной группе сцепления, не прибегая пи к каким другим скрещи-
ваниям.
Действительно, если исследуемый мутант 6 относится к I
группе сцепления, тогда все самцы F1 будут б. Напротив,
если б относится к одной из аутосомных групп, тогда в резуль-
тате скрещивания он перейдет в гетерозиготное состояние и
не проявится ни у одной мухи F1 (табл. 26, з; сравни 26, в).
После того, как по характеру мух F1 принадлежность му-
танта б к I группе можно считать установленной, дальнейший
анализ не обязателен. Однако получение F2 и подтверждение
предварительного вывода данными по расщеплению в F2 при-
знаков black, pink и bent нужно всячески рекомендовать. В этом
случае все три гена обнаружат свободное комбинирование друг
с другом (независимо от направления скрещивания), в то время
как рецессивный признак б снова проявится только у самцов F2.
Остается проанализировать рассматриваемую программу скре-
щиваний применительно к тому случаю, когда принадлежность
мутанта б к одной из аутосомных групп сцепления оказывается
очевидной по характеру мух F1. В этом случае скрещивание над-
лежит анализировать уже как тригибридное с тем, однако, ус-
ложнением, что признак б будет здесь вторым в той группе сцеп-
ления, к которой он принадлежит. Следовательно, формула три-
гибридного расщепления может быть получена путем абстраги-
рования от одного из тех двух признаков, гены которых относятся
к одной и той же группе сцепления.
Поясним сказанное примером. Допустим, что в рассматривае-
мом случае признак б относится ко II группе сцепления (табл. 26, з)
Тогда тригибридное расщепление, формула которого дана в при-
мечаниях 2 и 3 к табл. 26, может быть получено путем абстраги-
рования или от признака black, или от признака б. Соответственно
с этим тригибридное расщепление в первом случае обнаружат
признаки б, pink и bent, во втором — признаки black, pink
и bent.
Тот же самый способ доказательства применим и к мутантам
из III и IV групп сцепления. Относящиеся сюда полные формулы
расщепления приведены в примечаниях 5, 6, 8 и 9 к табл. 26.
Тригибридное расщепление можно упростить, сведя его к ди-
гибридпому (стр. 65). Тогда анализ скрещивания сведется к уста-
новлению дигибридного расщепления pink как с признаком б
(если не учитывать black; соответствующая формула такова:
9 Normal : 3 б : 3 pink : 1 б-pink), так с признаком black
(если не учитывать б; соответствующая формуле! такова:
9 Normal : 3 black : 3 pink : 1 balck-pink). Такое же дигидридное
расщепление обнаружит и признак bent по отношению к обоим
мутантам II хромосомы в отдельности. Соответствующие формулы
158
расщепления таковы 9 Normal : 3 б : 3 bent : 1 б-bent (с учетом
6); 9 Normal : 3 black : 3 benl : 1 black-bent (с учетом black).
Что касается отношения 2 : 1 : 1 : 0, то оно, как всегда возни-
кает и здесь, в чем можно убедиться, анализируя рассматриваемое
скрещивание при допущении, что между геном б и любым из трех
других, участвующих в данном скрещивании аутосомных генов
существует сцепление. Так, например, мы только что видели,
что в соответствии с принятым условием pink и bent обнаружи-
вают дигибридное расщепление с обоими мутантами II хромо-
сомы. Если тех же мух F2 анализировать в отношении только
двух признаков, а именно black и б, и не учитывать признаки
pink и bent, то увидим, что отношение мух не-black и не-б к мухам
или только black или только б будет удовлетворять именно этой
формуле расщепления. Таким образом, отношение во втором поко-
лении 2 Normal : 1 б : 1 black : 0 б-black и, следовательно, от-
сутствие двойного рецесспва б-black явится вторым убедительным
доказательством принадлежности гена б ко II группе сцепления
(слг. также стр. 154).
Тот же способ доказательства применим и по отношению
к двум другим группам сцепления. Соответствующие полные фор-
мулы расщепления для трех возможных случаев приведены
в примечаниях 4, 7 и 10 к табл. 26.
В этой связи полезно еще раз обратить внимание на то, что
- i гм +ь Р bt
перекрест между генами о и Ь у самок Г1 строения == = =
не влияет на отношение 9 :3 : 3 : 1 для свободно комбинирующихся
признаков и на отношение 2 : 1 : 1 : 0 — для сцепленных при-
знаков. Справедливость этого положения можно показать путем
решения ряда примеров с произвольно заданной частотой пере-
креста, например, между генами б и black. Результаты одного
такого расчета приведены в табл. 30. Частота перекреста произ-
вольно принята равной 8%.
Анализ данных табл. 30 показывает, что признаки б и black
независимо от частоты перекреста между ними: 1) свободно ком-
бинируются с pink и bent; 2) обнаруживают сцепление друг
с другом, вытекающее из расщепления по формуле 2 : 1 : 1 : 0.
Следует также помнить, что у самок вышеприведенного строения
при заданной частоте перекреста необходимо учитывать уже
не 8, а 16 типов гамет. Каждый из 8 некроссоверных классов
(в сумме 92%) составит 11,5% общего числа яиц; каждый же
из 8 кроссоверных классов (в сумме 8?6) составит 1% общего числа
яиц. Тригибридный самец, как всегда, образует сперму 8 типов,
поровну каждого типа, т. е. по 12,5% (стр. 61).
Предыдущий анализ мы вели, предполагая, что ген б лока-
лизован во II хромосоме. Однако если опыт покажет, что ген б
не относится ко II группе сцепления, то дальнейший анализ
надлежит вести применительно к III и IV группам сцепления и
159
Таблица 30
Определение группы сцепления при помощи рецессивных маркеров.
Отсутствие влияния перекреста на типичные расщепления
при свободном и несвободном комбинировании признаков
F2 Расщепление без учета Ь Расщепление без учета 8 Расщепление при учете только 8 и Ь, %
фено- типы 0, /0 фено- типы 0/ /0 фор- мула фено- типы 0 О фор- мула не-8 и не-li 0 Ь
Normal 28,1250 Normal 42,1875 27 Normal 42,1875 27 28,125 — —
о 14,0625 6 14,0625 9 — — — 14,0625 —
ь 14,0625 — — b 14,0625 9 — — 14,0625
р 9,3750 Р 14,0625 9 Р 14,0625 9 9,3750 — —
bt 9,3750 bt 14,0625 9 bt 14,0625 9 9,3750 — —
8 р 4,6875 о р 4,6875 3 — — — 4,6875 —
б bt 4,6875 б bt 4,6875 3 — — — 4,6875 —
Ъ р 4,6875 — — b р 4,6875 3 — — 4,6875
b bt 4,6875 — — b bt 4,6875 3 — — 4,6875
р bt 3,1250 р bt 4,6875 3 р bt 4,6875 3 3,1250 — —
& р bt 1,5625 б р bt 1,5625 1 — — — 1,5625 —
b р bt 1,5625 — — b р bt 1,5625 1 — — 1,5625
100,0 100,0 100,0 50,0 9 25,0 1 25,0 1 *
* Двойной рецесснв 6-Ь отсутствует.
установления несвободного комбинирования гена б с pink или
bent (расщепление 2 : 1 : 1 : 0), с одной стороны, и свободного
комбинирования с соответствующими генами (расщепление
9 : 3 : 3 : 1), с другой. Схема дальнейшего анализа не требует
пояснений.
Метод доминантных маркеров
Как модификацию метода одномоментного способа для опре-
деления группы сцепления можно рекомендовать изящный способ
Бриджеса доминантных маркеров (табл. 26, и). Отличие
этого способа от предыдущего заключается в том, что в качестве
хромосомных маркеров используются не рецессивные, а доминант-
ные гены.
Существует несколько линий, которые с одинаковым успехом
можно использовать для данной цели. Рассмотрим это скрещива-
ние, пользуясь уже знакомой нам линией Star-Dichaete, наиболее
обычной среди лабораторных линий дрозофилы.
Как мы уже знаем, в линии Star-Dichaete маркированы в соб-
ственном смысле слова только две хромосомы, а именно II и III.
Однако и IV, немаркированная, аутосома среди других марки-
160
Т аблица -31
И
И
Медведев
Определение группы сцепления при помощи доминантных маркеров Star-Dichaete
II III IV II III IV
Гаметы: S_D о 1“ ч |О 1 IIм II D _ уО С х о с _s |т(8) р
О.О.А *S D 1 О О • _s р
о о • о о • о о •
18)
Гаметы:
\Fi<5 _S__D_ _s__d е О Р o__d_ •_ _оО_ о.о±
О О • S D оот S D е o’ о • s о О О • s О • О О • _Q_L_ О О • -Q-L-* о О • OG_ .о о • ОО.А О О •
F2 : 1) В не проявился ни у одной мухи Star (несвободное комбинирование). Вывод: ген о локализован во II
хромосоме;
2) В не проявился ни у одной мухи Dichaete (несвободное комбинирование). Вывод: ген S локализован
в III хромосоме;
3) 5 проявился у 50% мух Star-Dichaete, у 50% мух Star и у 50% мух Dichaete (свободное комбинирование).
Вывод: ген б локализован в IV хромосоме (локализация в Х-хромосоме предполагается исключенной
на основании предыдущих опытов).
Значки О О • обозначают принадлежность гена б соответственно ко II, III или IV хромосомам|
ровапных становится также «маркированной» отсутствием в ней
маркера. Что касается Х-хромосомы, то она, как всегда, марки-
рована особыхМ способом наследования сцепленных с ней призна-
ков, на что неоднократно ’было указано выше.
Схема скрещиваний, генотипы F2 и вытекающие из его ана-
лиза выводы представлены в табл. 31 и не требуют пояснений.
На этом мы закончим рассмотрение серии скрещиваний по пер-
вой части задания и перейдем к опытам, имеющим целью опре-
делить местоположение, или локус, гена 6 в хромосоме.
ОПРЕДЕЛЕНИЕ ЛОКУСА ГЕНА
В ХРОМОСОМЕ
Здесь мы можем повторить лишь то, что было сказано выше
по поводу определения группы сцепления и на основании тех же
аргументов: локус гена в пределах хромосомы можно определить
или при помощи нескольких (по крайней мере двух)
скрещиваний (дробный, или неодномоментный, способ), или при
помощи одного скрещивания (одномоментный способ). Рас-
смотрим оба способа, предоставив читателю самому решить,
который из них принять к выполнению сообразно с богатством
«реактивной полки», т. е. наличием под рукой нужных линий,
если и здесь придерживаться аналогии с химическим анализом.
Предварительно рассмотрим в общей форме линейные отно-
шения между генами а, Ь и б, определяемые на основе данных
по перекресту. Теоретически возможны три случая отношения
гена б к генам а и Ь (рис. 35):
1) ген б расположен между генами а и Ь;
2) ген б лежит за пределами района ab и налево
от него;
3) ген б лежит за пределами района аЬи направо
от него.
Решение рассматриваемого вопроса в пользу одной из этих
трех возможностей может быть получено на основе результатов
двух параллельных скрещиваний по определению расстояния
между генами б и а, и между генами б и Ь. Очевидно, что в пер-
вом случае, т. е. когда ген б находится между генами а и Ь, сумма
расстояний <5а-[-бЬ должна быть равна расстоянию ab. Во втором
и третьем случаях, т. е. когда ген б локализован налево или
направо от района ab, сумма расстояний ба-|-бЬ превысит рас-
стояние между ab па величину, равную расстоянию гена б
от района ab. Что же касается альтернативы влево или
вправо, то этот вопрос решается путем сравнения расстояний
ба и 6Ь: в первом случае расстояние ба должно быть меньше
расстояния 6Ь, во втором случае расстояние ба должно быть
больше расстояния 6Ь.
162
Таковы в общей форме отношения между генами а, Ь и б и
вытекающая отсюда схема скрещиваний по определению локуса
гена в хромосоме. Перейдем теперь к опытам.
Простейшим является случай локализации гена в Х-хромо-
соме. В этом случае локус гена б может быть определен пли с по-
мощью скрещиваний мутанта б с мутантом а и отдельно с мутан-
том b (дробный способ; табл. 26, к), или скрещиванием мутанта
б с мухами из линии, в которой одновременно присутствуют
гены а и Ь (одномоментный способ; табл. 26, н). Результаты скре-
щиваний дадут возможность определить локус гена б в хромосоме.
Рис. 35. Линейные взаи-
моотношения между ге-
нами на основании дан-
ных по перекресту
а и Ь — гены, локусы ко-
торых известны; б — вновь
локализуемый ген; I—III—
три возможных случая ли-
нейных отношений гена б к
генам аи Ь. Случай I.
6a-f-6b=ab. Вывод: ген б
локализован между а и Ь.
Случай II. 6a-h6b > ab;
ба < 6Ь. Вывод: ген б
локализован налево от а.
Случай III. ба+бЬ >
ab; ба > 6Ь. Вывод: ген
б локализован направо от Ь.
Здесь нелишне напомнить, что процент перекреста в Х-хромо-
соме в случае необходимости может быть определен только на сам-
цах F2 (стр. 115; табл. 26, к, н). Поэтому для данного опыта
безразлично, получены самки F1 от прямого или реципрокного
скрещивания. Точно так же самцы, с которыми скрещивают
самок F1, могут быть любого строения: их генотип пе влияет
на соотношение фенотипов самцов F2, которые в данном случае
определяются исключительно генотипом самок F1. Эта методи-
ческая особенность наследования Х-хромосомы весьма упрощает
процедуру локализации в ней неизвестного гена.
Обратимся к локализации гена в аутосомах. Если есть воз-
можность локализовать новый мутант при помощи доминантных
генов, то задача упрощается и напоминает описанную выше
для Х-хромосомы: вместо использования явление гемизиготности,
позволяющей учитывать перекрест только на самцах F2, здесь
с таким же успехом используется явление доминирования генов.
Задачу можно решить или при помощи двух параллельных скре-
щиваний б с двумя доминантными генами из данной хромосомы
(табл. 26, л), или за один прием (табл. 26, о). Необходимо также
иметь в виду, что в обоих возвратных скрещиваниях гомозигот-
163
11*
ними рецессивными родителями должны быть самцы б, с кото-
рыми надлежит скрещивать самок F1. Кроме того, в отличие
от скрещиваний с Х-хромосомой, процент перекреста учитывается
здесь на самцах и на самках.
Если исходные скрещивания по определению группы сцеп-
ления производились при помощи доминантных маркеров
(табл. 26, и), тогда полученное F2 полезно использовать и дальше,
для определения локуса гена в хромосоме (табл. 26, п). Табл. 31
показывает, что, если ген б относится ко II группе сцепления,
все мухи Star F2 гетерозиготны по гену б. Равным образом, если
ген б относится к III группе сцепления, все мухи Dichaete F2
гетерозиготны по гену б. Следовательно, скрещивание самок
Star с гомозиготными самцами б даст возможность определить
расстояние между б и Star. Точно так же скрещивание самок
Dichaete с самцами б даст возможность определить расстояние
между б и Dichaete.
Таблица 32
Схема скрещиваний по выведению двойного рецессива
РР:
b+v/+b
F1: $$ и 33 =
+ Ь
F2: (от скрещивания £$? и 3S F1)
Н- 4-ь ++ ь ь
Е + ’ Г+ Г+’ & +
L+ +ь ++ Q ь
+Ъ*+ь +~ь’ +ь
некроссоверы кроссоверы
Последующие скрещивания объяснены в тексте.
Следующий этап анализа — выведение двойного рецессива,
т. е. сцепление гена б с другим рецессивом из той же группы
сцепления. Скрещивание последнего с Ь протекает по схеме
табл. 32. Как видно из табл. 32, некоторые мухи б из F2 гетеро-
зиготны по гену Ь. Точно так же некоторые мухи Ъ гетерозиготны
по гену б (те и другие произошли в результате перекреста). По-
этому, скрещивая в массовых культурах мух б и Ь, можно полу-
чить некоторое количество мух б-b уже в третьем поколении
или, значительно размножив в F3 число нужных гетерозигот и
далее скрестив их между собой, получить двойной рецессив в F4.
Потомство от возвратного скрещивания двойного рецессива
б-а (или б-b) с мухами Star или Dichaete (соответственно для
164
II или III хромосомы) даст возможность установить относитель-
ное расположение генов по числу простых и двойных перекрестов.
Если же исходные скрещивания по определению группы
сцепления осуществлялись иным способом, то дальнейшие скре-
щивания сразу могут начинаться с выведения двойного рецессива
с последующим скрещиванием его в только что описанном по-
рядке.
Наконец, если доминантных генов из данной группы сцепле-
ния в лаборатории нет, тогда локализация гена сопряжена с вы-
ведением двух двойных рецессивов и определением локуса б пу-
тем сравнения между собой результатов двух параллельных воз-
вратных скрещиваний (табл. 26, м), или с выведением тройного
рецессива типа б-ab (табл. 26, р), возвратное скрещивание с ко-
торым даст возможность определить, как расстояние между
генами, так и порядок их расположения в хромосоме. Как видно,
последний способ более трудоемкий и продолжительный по вре-
мени, поэтому к нему прибегают лишь в исключительных случаях.
Что касается IV хромосомы, то в ней известно всего 10 генов,
а перекрест наблюдается исключительно редко. Обе эти особен-
ности стоят в связи с ее ничтожными размерами по сравнению
с Х-хромосомой и аутосомами.
Рассмотренная программа скрещиваний по локализации гена
исходила из предположения, что анализируемый мутант рецес-
сивный. Излишне рассматривать ее модификации применительно
к локализации доминантного мутанта: в результате анализа всех
предыдущих скрещиваний у практиканта предполагается доста-
точно знаний и навыков для того, чтобы справиться с этой,
более простой задачей самостоятельно.
ГЛАВА ПЯТАЯ
МЕТОДЫ ИСКУССТВЕННОГО ПОЛУЧЕНИЯ
И УЧЕТА МУТАЦИЙ У ДРОЗОФИЛЫ
В настоящей главе будут рассмотрены методы, или схемы, скре-
щиваний, при помощи которых учитывают индуцирован-
ные, т. е. искусственно вызванные, мутации
у дрозофилы под влиянием разнообразных внешних агентов.
Благодаря исключительной простоте и убедительности эти методы
получили широкое применение сразу же после обнародования
Меллером его знаменитых опытов, впервые доложенных им
на V Международном генетическом конгрессе в Берлине
в 1927 г., а позднее удостоенных Нобелевской премии. Необхо-
димо также подчеркнуть, что все нижеследующие методы раз-
работаны Мёллером.
* * *
Если требуется изучить на дрозофиле мутагенное действие
того или иного агента, задача исследования в большинстве слу-
чаев, хотя и не всегда, сводится к обнаружению и учету деталь-
н ы х мутаций, возникающих под влиянием данного агента.
Частоту летальных мутаций у подопытных мух сравнивают
с частотой летальных мутаций у контрольных. Наличие достовер-
ной разницы в частоте возникновения летальных мутаций у под-
опытных п контрольных мух служит доказательством эффектив-
ности изучаемого агента па возникновение этого типа наследствен-
ных изменепий. Если же требуется изучить частоту мутирования
какого-нибудь определенного гена или группы генов, то в этих
случаях учитывают как летальные, так и видимые мутации.
Как показывает практика, у лиц, впервые знакомящихся
с методикой рассматриваемых опытов, иногда вызывает недоумение
тот факт, что изучение мутаций под влиянием внешних агентов
производится па основе учета возникновения летальных мутаций.
Может возникнуть вопрос, являются ли летальные мутации
надежным критерием для изучения мутагенного дей-
ствия внешних агентов и мутационного процесса вообще?
166
Летальные мутации как в отношении механизма возникнове-
ния, так и механизма наследования, не отличаются от видимых
мутаций за исключением их резких деструктивных влияний
на процессы развития и жизнедеятельности, природа которых
изучена еще очень мало. Кроме того, и это очень важно, частота
возникновения летальных мутаций a priori должна быть гораздо
выше частоты видимых мутаций. Любой организм является слож-
ной, гармонически функционирующей биологической системой,
и агенты типа излучений и разнообразные другие мутагенные
агенты скорее могут расстроить эту систему, вызвав в ней не-
обратимые наследственные изменения, летальные мутации, не-
жели мутации безразличные, а тем более полезные для организма.
Именно эти соображения и были положены Мёллером в основу
его опытов с рентгеновыми лучами, в которых они получили
столь блестящее подтверждение. Ниже мы вернемся к этому
вопросу несколько подробнее.
Методы С1В — на летальные мутации и метод спаянных
Х-хромосом (или метод double yellow) — на видимые дают
возможность учитывать вновь возникающие мутации в Х-хромо-
соме; аутосомы же при этих методах исследования в расчет не при-
нимаются и возникающие в них мутации не учитываются. В ос-
нове обоих методов лежат те механизмы наследования Х-хромо-
сомы, с которыми мы познакомились в главе III и благодаря
которым возникающие в ней видимые и летальные мутации
улавливать гораздо проще, чем в аутосомах.
В опытах настоящей главы в качестве агента, способного
индуцировать видимые и летальные мутации, рентгеновы, или
Х-лучи, взяты лишь для удобства описания опытов. Понятно,
что рентгеновы лучи могут быть заменены любым другим агентом,
представляющим интерес с рассматриваемой точки зрения.
МЕТОД СПАЯННЫХ Х-ХРОМОСОМ
НА ВИДИМЫЕ МУТАЦИИ В Х-ХРОМОСОМЕ
Для уяснения сущности метода нам остается прибавить очень
немного к тому, что было сказано в связи с рассмотрением меха-
низма наследования у дрозофилы Х-хромосом, который возникает
в случае их спаянности и дальнейшего наследования их как
единого комплекса (стр. 98). Именно особый путь наследования
спаянных Х-хромосом был положен Мёллером в основу его опы-
тов по изучению мутагенного действия Х-лучей.
Итак, вернемся еще раз к способу наследования сцепленных
с полом признаков при спаянности Х-хромосом и посмотрим,
какие отношения можно ожидать в потомстве серых рентгенизи-
рованных самцов и double yellow самок?
167
Вследствие особого способа наследования спаянных Х-хромо-
сом каждая самка ближайшего поколения наследует от матери
спаянные Х-хромосомы, а от отца — Y-хромосому. Такие самки
во всем подобны матери: от нее они получили необлученные X-
хромосомы а от отца — Y-хромосому, которая лишена генов
(стр. 103). Что же касается рентгенизированных аутосом, то все
возникшие в них мутации, видимые и летальные, не проявятся
у мух F1 вследствие их гетерозиготности.
В противоположность этому каждый самец F1 от матери по-
лучил лишенную генов Y-хромосому, а от отца — рентгенизиро-
ванную Х-хромосому. А так как все гены Х-хромосомы самца
находятся в гемизиготном состоянии и их проявление не ослож-
нено наличием у них Y-хромосомы (стр. 86), то всякая возникшая
в рентгенизированной Х-хромосоме видимая мутация проявится
у тех самцов, которые унаследовали от отца рентгенизированную
Х-хромосому с мутировавшим геном. Иначе говоря, при данном
способе наследования половых хромосом уже в ближайшем по-
колении имеется возможность выявить тех самцов, у которых
в результате облучения возникли видимые мутации в Х-хромо-
соме (табл. 33).
Т а б л и ц а 33
Метод double yellow для обнаружения видимых мутаций в Х-хромосоме
РР: $ J> X 3 —
F1: у>.у>
12 3 4
Fl: 1 — сверхсамки; выживают очень редко, бесплодны;
2 — самки double yellow, подобны своей матери; жизнеспособны;
3 — нормальные самцы, подобны своему отцу; жизнеспособны;
4 — нежизнеспособные зиготы.
Жирной линией обозначена облученная Х-хромосома.
Одновременно с обнаружением видимой мутации в ближай-
шем поколении можно получить ее линию, так как при посредстве
самок double yellow новую мутацию можно поддерживать в даль-
нейшем без дополнительных скрещиваний по выведению гомо-
зиготной линии.
Если по принятому условию рентгенизации подверглись
нормальные самцы, то большинство, если не все видимые мута-
ционные изменения, которые возникнут в результате облучения,
168
будут рецессивны. Другими словами, такая аранжировка опыта
дает возможность учитывать видимые мутации в Х-хромосоме,
которые произошли в направлении от нормальных, или
доминантных, генов к рецессивным, т. е. мутации
типа +в-> а, +Ь-^Ь, и т. д.
Если же для опыта были взяты самцы с одним или несколькими
рецессивными генами в Х-хромосоме, например yellow, white,
forked и т. д., то анализ их сыновей даст возможность учесть
возникновение мутаций в направлении от рецессивных
генов к их доминантным, или нормальным, ал-
леломорфам типа"у-> +у, w-> +w, f-> +*и т. д. Мутации послед-
него типа носят название возвратных и служат одним
из доказательств того, что видимые мутации не являются раз-
рушением, или утратой, наследственного вещества:
невозможно представить возникновение возвратной мутации
на месте когда-то утраченного или разрушенного генного матери-
ала (стр. 138).
МЕТОД С1В НА ЛЕТАЛЬНЫЕ МУТАЦИИ
В Х-ХРОМОСОМЕ
Метод С1В (произносится сиэльби) заключается в скрещивании
рентгенизированных самцов с самками С1В, Х-хромосомы которых
не подвержены перекресту вследствие наличия инверсии в хромо-
соме С1В. Следовательно, все наследственные изменения, которые
возникли в Х-хромосомах облученных самцов, через дочерей
С1В передаются самцам второго поколения и легко могут быть
обнаружены.
Относящаяся к этому методу схема скрещивания представ-
лена в табл. 34.
Строение хромосомы С1В требует пояснения. Однажды в X-
хромосоме строения sc v В произошла инверсия, в результате
чего ее часть от гена scute до крайней правой области воссоеди-
нилась с концами хромосомы в перевернутом на 180° положении.
Одновременно в образовавшейся инверсии возникла рецессивная
летальная мутация, вследствие чего хромосома С1В стала ле-
тальной для мужского потомства. Поэтому она наследуется только
по женской линии и всегда обусловливает развитие в культурах
половинного количества самцов (стр. 140). Она отмечена также
хорошим сигнальным геном Ваг, а обширная инверсия почти
полностью запирает перекрест. (Впрочем, очень редкие самцы
scute возникают в результате перекреста в неинвертированном,
крайнем левом участке хромосомы, и самцы vermilion — в ре-
зультате двойного перекреста в средней области хромосомы).
Эти особенности Х-хромосомы С1В делают ее исключительно
удобной для исследований, о которых идет речь.
169
Таблица 34
Метод С1В для обнаружения летальных и видимых мутаций в Х-хромосоме
РР: F1: sc v f * sc С1В V J 92 sc v f , sc C1B v <3<3 sc v f , sc CIB v
F2: 1 >X<- 1 sc CIB v sc CIB v QQ 6 6 — * * sc v f sc v f -> -° 12 3 4
F2: 1 — самки sc В v;
2 — нормальные по фенотипу самки, гетерозиготные по вновь возник-
шей летальной мутации в Х-хромосоме;
3 — нормальные самцы; при наличии летальной мутации в Х-хромо-
соме не развиваются;
4 — нежизнеспособные самцы sc С1В v.
Жирной линией обозначена облученная Х-хромосома.
Рассмотрим теперь судьбу зигот первого и второго поколений
(табл. 34). Х-хромосома рентгенизированных самцов передается
всем дочерям первого поколения. Из них только половину,
а именно — самок С1В, используют для дальнейших скрещиваний.
Для этого всех самок С1В, безразлично девственных или нет,
индивидуально скрещивают с их братьями (самцов можно брать
по два-три) и F2 анализируют на летальные мутации. Если в X-
хромосоме рентгенизированных самцов летальная мутация не воз-
никла, тогда в F2 должны быть два сорта самок и нормальные
самцы в отношении 2$ : 1<5. Если же в рентгенизированной
Х-хромосоме возникла летальная мутация, то в F2 вовсе не ра-
зовьются самцы. В этом случае будут отмирать самцы обоих типов,
т. е. с хромосомой С1В, и с рентгенизированной Х-хромосо-
мой, в которой летальная мутация возникла в результате облу-
чения.
Таким образом, достаточно беглого взгляда, чтобы по отсут-
ствию (или наличию) самцов в любой культуре F2 убедиться
в наличии (или отсутствии) в ней летальной мутации. Эта исклю-
чительная простота анализа чрезвычайно экономит время и труд,
позволяя одному человеку легко справляться с просмотром ты-
сячи и более культур одновременно. До такой же степени совер-
шенства доведена и рассмотренная выше методика сцепленных
Х-хромосом па видимые мутации.
Схема опыта, представленного в табл. 34, показывает, что
взятые для скрещивания самки С1В имели в другой, гомологичной,
170
X-ХромОсоме гены scute» vermilion и forked. Самок С1В такого
строения берут на тот случай» если имеют в виду необходимость
дальнейшего анализа возникших в Х-хромосоме летальных му-
таций и их локализации. Для этого используют нормальных
по внешности самок из F2, гетерозиготных по возникшему ле-
тальному гену и одновременно гетерозиготных по генам scute,
vermilion и forked. Скрестив таких самок с их братьями, можно
в F3 получить и данные о локализации вновь возникших леталь-
ных генов в Х-хромосоме. Читателю рекомендуется убедиться
в этом самостоятельно. Это же скрещивание одновременно яв-
ляется проверочным на летальные и в отдельных случаях на полу-
летальные мутации в F3, почему его рекомендуется всегда ставить
для придания результатам опыта большей убедительности.
Кроме того, наличие в этой хромосоме гена vermilion является
удобным для учета в F1 самок-нерасхожденок, которые при на-
личии инверсии в хромосоме С1В изредка возникают и несколько
понижают истинный процент мутаций. Наличие гена vermilion
у самок С1В дает возможность отличить в F1 самок, происшедших
в результате нерасхождения Х-хромосом: эти самки с розовыми
глазами. Их не следует брать для дальнейшего анализа, так как
они получили от отца Y, а не Х-хромосому.
Метод С1В дает возможность учитывать также видимые мута-
ции в Х-хромосоме облученных самцов. Здесь, как и в случае
метода double yellow, возможно двоякое решение вопроса. Если
воздействию Х-лучей подвергаются нормальные самцы, имеется
возможность учитывать возникновение рецессивных мутаций.
Если же для опыта были взяты самцы с генами нескольких или
многих рецессивных особенностей (линия типа Х8/уу), то анализ
мух F2 даст возможность учесть возникновение возвратных
мутаций (стр. 169).
МЕТОД МЁЛЛЕР-5 НА ЛЕТАЛЬНЫЕ МУТАЦИИ
В Х-ХРОМОСОМЕ
В последние годы весьма широкое применение получила еще
одна схема опытов по обнаружению и учету рецессивных леталь-
ных мутаций в Х-хромосоме. Схема опыта и используемая в нем
линия мух носят название метода Мёллер-5.
Отличительной особенностью Х-хромосомы Мёллер-5, от ко-
торой метод получил свое название, является наличие в ней двух
инверсий — sc8 и б 49 х. Инверсия sc8 захватывает большую часть
Х-хромосомы. Поскольку в длинных инверсиях перекрест все же
изредка происходит, в инверсию sc8 введена другая, более корот-
1 Обозначение инверсии 49 буквой б принадлежит Мёллеру, который
впервые сконструировал хромосому sc8 б 49 и ввел ее в употребление.
171
кая инверсия, 6 49, которая подавляет перекрест в средней об-
ласти Х-хромосомы. Таким образом, порядок генов в хромосоме
sc8 б 49 нарушен дважды, и поэтому перекрест в ней полностью
исключен. Кроме того, и это особенно удобно, обе инверсии
не связаны с рецессивным летальным действием, почему гомо-
зиготные по хромосоме Мёллер-5 самки и такие же гемизиготные
самцы жизнеспособны. Схема опыта с хромосомой Мёллер-5
приведена в табл. 35.
Таблица 35
Метод Мёллер-5 для обнаружения летальных и видимых мутаций
в Х-хромосоме
РР:
F1:
F2:
sc8 у & 49
QQ • ~ — X оо —
** sc8 у В 49 74------------
sc8 у а 49 SC8 у § 49
sc8’y а 49
22 .' -
* sc8 у а 49 sc8 у § 49
2 3 4
F2: 1 — самки sc8 у а 49;
2 — нормальные по фенотипу самки, гетерозиготные по вновь воз-
никшей летальной мутации в Х-хромосоме;
3 — желтые самцы;
4 — нормальные самцы; при наличии летальной мутации в Х-хромо-
соме не развиваются.
Жирной линией обозначена облученная Х-хромосома.
Рентгенизированных нормальных самцов скрещивают с гомо-
зиготными самками Мёллер-5. Нормальных по внешности самок
F1, гетерозиготных по облученной Х-хромосоме, скрещивают
затем с братьями Мёллер-5. Наличие или отсутствие летальных
мутаций в облученных Х-хромосомах устанавливают соответ-
ственно по отсутствию или наличию в культурах F2 серых
самцов. Как и в случае метода G1B, учет результатов опыта на-
столько прост, что не требует даже наркотизирования мух: бег-
лого взгляда на культуру мух непосредственно через стекло
стаканчика или пробирки достаточно, чтобы убедиться, возникла
или нет летальная мутация в том облученном сперматозоиде,
от которого возникли мухи F2 данной культуры.
Сказанное на стр. 171 относительно возможности учета види-
мых мутаций методом С1В в раной мере относится и к методу
Мёллер-5, что ясно без дальнейших пояснений.
172
МЕТОДЫ УЧЕТА ЛЕТАЛЬНЫХ МУТАЦИЙ
В АУТОСОМАХ
В заключение мы обращаем внимание читателей на табл. 36,
в которой приведена схема опыта по обнаружению и учету ле-
тальных мутаций во II хромосоме. В основу опытов с аутосо-
мами положена та же самая идея подавления перекреста в инвер-
тированных хромосомах.
Таблица 36
Обнаружение летальных мутаций
во II хромосоме при помощи инверсий
РР: 95==Х<5<5 —
Су
29 и S3 s
F1:
s
су
F2: 99 и
Су
Су
F3: 99 и 33 —=, =—, ==^
** Су’ Су’ Су
12 3 4
F3: 1—нормальные мухи, гомозиготные по облученной II хромосоме;
в случае возникновения в ней летальной мутации не разви-
ваются;
2—3 — мухи Curly;
4 — нежизнеспособные зиготы.
Поскольку хромосома Star не содержит инверсии, мух Star из F1
отбрасывают, а для дальнейшего анализа используют самок и самцов
Curly, гетерозиготных по облученной II хромосоме, содержащей две
обширные инверсии.
Жирной линией обозначена облученная II хромосома.
Применительно ко II хромосоме схема опыта исходит из зна-
комой нам сбалансированной летальной системы S-Cy, обе
II хромосомы которой маркированы доминантными генами S и
Су, одновременно летальными в гомозиготном состоянии. Кроме
того, хромосома Су содержит две инверсии, которые подавляют
перекрест по всей хромосоме. Как видно из табл. 36, учет воз-
никших летальных мутаций производится здесь на основании
результатов анализа мух F3. Следовательно, весь опыт продол-
173
жается на одно поколение дольше, чем во всех предыдущих слу-
чаях.
Здесь уместно вернуться к тому месту настоящего раздела,
где речь шла о природе летальных мутаций и вызываемых ими
деструктивных нарушениях жизнедеятельности организмов.
Всякий организм, будет ли таковым инфузория-туфелька
или высоко организованное млекопитающее, принято сравнивать
с часами, когда хотят подчеркнуть сложность их строения и за-
висимость нормальной работы от безукоризненной слаженности
составляющих их деталей и механизмов.
В известной мере это сравнение справедливо. Действительно,
всякое повреждение весьма точного хронометра, вплоть до рез-
ких колебаний окружающей его температуры, отразится на его
состоянии, хотя не каждое из них приведет к его остановке.
Часы остановятся лишь в том случае, если сломано одно из состав-
ляющих их колесиков, повреждена пружина и т. д. В плане рас-
сматриваемой аналогии такое вмешательство в часы равноценно
«летальной» мутации.
Но не всякое вмешательство в механизм часов приведет к их ос-
тановке. Тончайший волосок маятника можно повредить так,
что часы не остановятся, хотя точность их хода будет нарушена.
В плане рассматриваемой аналогии такое изменение будет равно-
ценно своего рода «видимой» мутации.
Однако по сравнению с часами диплоидный организм харак-
теризуется одним весьма важным преимуществом: он обладает
д в у м я наборами хромосом и генов. Это значит, что в основе
его организации лежит принцип двойного обеспечения. Лишь
две дозы летального гена вызывают летальное действие, в то время
как одна его доза не вызывает заметных нарушений жизнедея-
тельности организма. Иначе говоря, диплоидный организм устроен
так, что каждая его жизненно важная функция представлена
двумя колесиками, и повреждение одного из них еще не влечет
гибели организма — для этого надо повредить и другое.
В научно-исследовательской работе широко применяются мно-
гие другие столь же точные, хотя и более сложные методы учета
летальных мутаций, а также методы анализа разнообразных
хромосомных перестроек (реорганизаций) типа транслокаций,
делеций, нехваток инверсий и т. д. Рассмотрение их выходит
за пределы данного пособия.
На этом мы закончим знакомство с основными закономер-
ностями наследственности и некоторыми простейшими их приме-
нениями. Материал предыдущих глав, если он усвоен прочно,
может служить надежным проводником в исследовании любой
области изменчивости и наследственности организмов.
174
0.0 у - yellow
00-Hw - Hairy- wing
0,0- sc - scute
0.31(1)7 - lethaKDl
06 br
0.7-kz - kurz
0.8 pn - prune
.0,9-gt - giant
4,5 w - white
broad
- telegraph
- aristaless
- expanded
- dachsous
- net
- Star
- Curly
- echinoid
- Gull
- dumpy
- St гей К
<0,0 ru
O,Oiaa
•0,2 ve
- rough aid
- anarista
- vein let
0,0+bt - bent
0.0+M-4- Minute-4
0.0+ cl - cubitus interr.
0.0+ar - abdomen rot
00+gvl- qrooveless
O,i+sv - shaven
Я2 ey - eyeless
2 spa - sparkling
? Mai - Malformed
?Cat - Cataract
- Abrupt ex
- Abnormal abdomen
- echinus
- bifid
- ruby
- Bordeaux
- curlex
- crossveinless
- club
- delte?
- carmine
- С1^
- singed
ocelli less
- pentagon ________
- tan
- lozenge
- raspberry
- - vermilion
' \33,2 dwx - dwarf ex.
33.4 sbr - small-bristle
-^/36.1 m - miniature
- /^36,2 dy - dusky
38,3 fw - furrowed
_ wavy
- sable
ex
\l,0 sn
'23,1 ОС
'23,2 pt g
- >. J 0,6 и и
'38,3 fw
• —41,9 wy
- —43.0 S - пиши
: r-цц.ц g - garnet
-—53,5 si - small-wing
: —5 4,0 me - micro ch aete
" \54,4 un
z^54,5 r
Wj
- ^>5j,Z- 3 у
^59,4 Bx
- -?4Q «; tn
- uneven
- rudimentary
- forked
j'jUv - Bar
'59,2-su - small-eye
59,4 Bx - Beadex
'59,5 fu - fused
>62,5 car - carnation
\62,7M(i}n- Miniature (1) n
$4.0 sw - short-winq
66,0 bb - bobbed *
/22$ Sp - Sternopleural
Mgt-4 - giant-4
- <51,0 d - dachs
. //35Jstiu - straw
. //71,0 J - Jammed
//4,0 ab - abrupt
' ' 46pM&e~ Minute(2)e
4b,5 b - black
/8,7 j - jaunty
- poiychaetous
* w53.0±ck - crinkled
* J/519 hk - hook
- l/Mtbri - bright
-/5/5*-rn - rotund
/54.5 pr - purple
: ^54.7trh - roughish
- —54.8 Bl - Bristle
z—55,0 Lt - light
\5d,3tk - thick
• -\55.4 ap - apterous
x565tstd - staroid
^57.5 cn - cinnabar
/605 arch - arch
- /б№ири - upward
• /650 po - pale-ocelli
- /6ifi vg - vestigial
' ,715tsf - safrdnin
/Ml - Lobe
: ^715 ch - chubby
. - dark-eye
_ gap
- curvedJ
-- f№?ed.
' ^20,0 dv- divergent
,25,0± be-3- benign-tumor
. /26,0 se - sepia
/26,5 h - hairy
•- /35,01 rs - rose
/37,0+гt - rotated
: ^37,5 app, - approximated
polych aetoid
Minute (3) h
Dichaete
Lyra j
thread
scarlet
Wrinkled
radius-incompletus
Deformed
warped
prpbosclpedia
pink
maroon
curled
: $i390±pyd - polut
Wio tt - tijt
\4d2Mf3)h-
: \4d,4 + D -
: Lg -
№3,2tii -
\±wn -
f±pb -
49.7 ma
50,0си
51.3 tt г - tetrapt er
58.2 Sb - stubble
'58.5 ss - spineless
TMbx - ----
^20 sr -
•740iqp
-755 c
$0.0 fr
bithorai
stripe
glass
Sidney
sepiaold
Delta
Hairless
ebony
band
/81,IF г f - roof
= -—8i0fj - four-jointed
. ^830inw - narrow
/9)5 sm -----------
//10v,5 pi - pi алий
- /МШ- Lethal(2)bw
- smooth
- humpy
- arc
- plexus
[104jo hy - heavy-vein
//104,5 bw - brown
- pd - purpieoid
' ШьНтг - morula
: //07.0 SP - Speck
/lOfabs - blistered
--[/107,4 ьа- balloon
/10,7 e
/720 bn - -------
: --72^-det - detached
/157 cd - cardinal
: -^7b,2 wo - white-ocelli
.......... mahogany
rough
crumpled
Beaded
Pointed
claret
Minute (3) i
Minute(3) g
: ^76.2 wo -
—~88.0imch -
~S1,1 ro -
- ’//H.O'-cmo-
: r-/^,7 ca -
^101,0 М(Ш -
^O^MiJlg -
Карты хромосом Drosophila melanogastei
СПИСОК НАИБОЛЕЕ УПОТРЕБИТЕЛЬНЫХ
МУТАНТОВ DROSOPHILA MELANOGASTDR'
По степени изученности, четкости проявления и легкости
классификации мутанты дрозофилы расклассифицированы Брид-
жесом на следующие пять категорий (обозначены взятыми в скобки
арабскими цифрами 1—5 в конце характеристики каждого му-
танта).
1. Мутанты, наиболее изученные и интенсивно используемые
в исследованиях, с четкой классификацией, хорошей жизнеспо-
собностью и точной локализацией.
2. Мутанты, аналогичные мутантам первой категории, но ис-
пользуются менее интенсивно. Локализованы недостаточно точно.
3. Немногочисленные мутанты с четким проявлением при-
знаков, но локализованы недостаточно точно.
4. Мутанты, менее удобные, но интенсивно используемые
в специальных исследованиях. Локализованы не вполне точно.
5. Мутанты, обнаруживающие трансгрессию с диким типом.
Локализованы недостаточно точно.
Буква А при категории обозначает ненормальный перекрест,
обязанный данной аберрации.
* * *
abdoment rotatum, аг, IV 0,0-|-- Закрученное брюшко
по часовой стрелке (ср. rotated) (2).
Abnormal abdomen A, I, 4,5. Анормальное брюшко.
Во влажных культурах проявляется сильнее. Гомовиготы
жизнеспособны (2).
abrupt, ab, II, 44,0. Оборванная V продольная
жилка (2).
Abruptex, Ах, I, 3,1+ . Укороченные жилки, крылья
дугообразные. Гомозиготы жизнеспособны (2).
anarista, аа, III, 0,0+. Безусый. Аристы уменьшены, не вет-
вящиеся (4).
approximated, арр, III, 37,5. Сближенные попереч-
ные жилки, лапки 4-члениковые (1).
arc, а, II, 99,2. Дугообразные, широкие крылья, загнуты
книзу; поперечные жилки сближены (2).
apterous, ар, II, 55,4. Бескрылый. Жужжальцы отсутствуют.
Стерильны (4).
arch, arch, II, 60,5. Арковидный. Крылья загнуты вниз
по обеим осям (2).
aristaless, al, II, 0,0. Безусый. Аристы редуцированы, ску-
теллярные щетинки расходятся в стороны (1).
1 По К. Б. Бриджесу; опубликовано в Drosophila Information Service,
No. 9, 1939,
176
aristapedia, arp, III, 58,5. Усоногий. Аристы видоизменены
в ножки. Аллеломорф spineless (см. ss) (1).
Bag, Bg, I, 51,6. Мешковидный. Крылья короткие,
притуплены, пузырьчатые. Самцы детальны (2).
balloon, ba, II, 107,4. Баллонообразный. Крылья
надуты, добавочные жилки. Оптимум ниже 20° (4).
band, bn, III, 72,0. Полосковидный. Темная полоска
на груди (2).
Ваг, В, I, 57,0. Полосковидные глаза. Гомозиготы
жизнеспособны. Дупликация (1).
Beaded, Bd, III, 93,8. Вырезанный. Краевая жилка крыла
неоднократно прервана. Гомозиготы детальны (2).
Beadex, Вх, I, 59,4. Зазубренный. Крылья зазубрены.
Гомозиготы жизнеспособны (1).
benign tumor, be-3, III, 25,0±. Доброкачественные
опухоли. Нелетальные меланотические опухоли (5).
bent, bt, IV, 0,0. Изогнутый. Крылья изогнуты вниз,
ножки узловатые. Оптимум 29° (2).
bifid, bi, I, 6,9. Жилки слиты у основания крыла (1).
bithorax, bx. III, 58,8. Удвоение груди. Метаторакс
сходен с мезотораксом. Жужжальцы крылообразные (2).
black, b, II, 48,5. Черный. Тело, ножки, жилки очень тем-
ные (1).
blistered, bs, II, 107,3. Пузыреобразный. Крылья умень-
шены, пузырчатые, добавочные жилки. Оптимум ниже 20° (2).
bobbed, bb, I, 66,0. Подстриженный. Щетинки умень-
шены, склериты неправильны (1).
bordeaux, bo, I, 12,5. Бордовый цвет глаз. Трансгрес-
сия с диким типом (5).
bright, bri, II, 54,3±. Ярко-красный цвет глаз (4).
Bristle, Bl, II, 54,8. Щетинки укорочены. Гомози-
готы полулетальны (1).
broad, br, I, 0,6. Ширококрылый. Крылья широкие
укорочены (2).
brown, bw, II, 104,5. Коричневоглазый. Цвет глаз
от коричневатого до гранатового (1).
cardinal, cd, III, 75,7. Ярко-красный. Глаза шарлахо-
вые, глазки бесцветные (2).
carmine, cm, I, 18,9. Карминный. Темно-рубиновый цвет
глаз (1).
carnation, car, I, 62,5. Алоглазый. Темно-рубиновый цвет
глаз (1).
Cataract, Cat, IV, ? Грубые глаза. Гомозиготы детальны (3)
chubby, ch, II, 72,5. Укороченный. Личинки, куколки,
взрослые укорочены (4).
cinnabar, сп, II, 57,5. Киноварноглазый. Цвет глаз
яркий, шарлаховый, глазки бесцветны (1).
17G
claret, ca, III, 100,7. Рубиновоглазый. Цвет глаз по-
хож на цвет вина claret (1).
club, cb, I, 16,0 + . С к о м~к а ннокрылый. Крылья взрос-
лых мух похожи на крылья куколки (2).
crinkled, ск, II, 53,0 + . Складчатокрылый. Крылья
складчатые, морщинистые. Жизнеспособность низкая (5).
crossveinless, cv, I, 13,7. Отсутствует или недораз-
вита поперечная жилка крыла (1).
crumpled, стр, III, 93,0 + . Морщинис’т о’к р ы л ы й.
Крылья уменьшены, смяты (4).
cubitus interruptus, ci, IV, 0,0+ +. Кубитальная (VI про-
дольная) жилка крыла прервана. Оптимум 19° (1).
curled, си, III, 50,0. Загнутые крылья. Тело темное,
задние скутеллярные щетинки перекрещиваются (1).
curlex, ex, I, 13,6. Крылья загнуты вверх (2).
curved, с, II, 75,5. Крылья тонкие, растопырены,
приподняты и закручены (1).
Curly, Су, II, 8,5 + . Крылья загнуты вверх. Гомо-
зиготы легальны. Инверсии (ЗА).
cut, ct, I, 20,0. Обрезанный край крыла (1).
dachs, d, II, 31,0. Т а к с о н о г и й. Лапки 4-члениковые, жил-
кование неправильное (2).
dachsous, ds, II, 0,3. Таксообразный. Крылья укорочены,
поперечные жилки сближены (2).
dark, eye, dke, II, 73,0 + . Темноглазый. Цвет глаз мягкий,
темный, блеклый (3).
Deformed, Dfd, III, 47,5. Деформированные глаза.
Глаза уменьшены. Гомозиготы легальны. Оптимум 19° (2).
Delta, DI, III, 66,2. Дельтовидный. Жилки на концах
утолщены. Гомозиготы легальны (1).
deltex, dx, I, 17,0. Дельтовидный. Жилки утолщены,
дельтовидны. Гомозиготы жизнеспособны (2).
detached, det, III, 72,5 £. Поперечные жилки пре-
рваны (5).
Dichaete, D, III, 40,4+. Двущетинковый.
Крылья растопырены. Гомозиготы легальны. Инверсия (ЗА).
divergent, dv, III, 20,0. Растопыренные крылья.
Плодовитость очень понижена (2).
dumpy, dp, II, 13,0. Короткокрылый. На груди воронко-
образные углубления (1).
dusky, dy, I, 36,2. Закопченный,
темные (1).
dwarf, dw, III, 50,0. Карликовый,
шены (5).
dwarf ex, dwx, I, 33,2. Карликовый,
ковые, крылья грубые (4).
12 н. я. Медведев
177
Крылья уменьшены,
Размеры тела умень-
Размеры тела карли-
ebony, e, III, 70,7. Черный цвет тела (1).
echinoid, ed, II, 11,0. Ежеобразный. Глаза увеличены,
грубые (1).
echinus, ес, I, 5,5. Ежеобразный. Глаза и фасетки сильно
увеличены (1).
expanded, ex, II, 0,1. Растопыренные крылья.
Глаза грубые (2).
eyeless, ey, IV, 0,2. Безглазый. Глаза редуцированы ча-
стично или полностью (1).
facet, fa, I, 3,0. Нарушены форма и расположение
фасеток. Глаза грубые, крылья зазубрены (2).
fat, ft, II, 12,0. Тучный. Тело укорочено, толстое, попереч-
ные жилки сближены (1).
forked, f, I, 56,7. Вильчатые щетинки и волоски утол-
щены (1).
four-jointed, fj, II, 81,0. Лапки 4 - ч л е н и к о в ы е, крылья
укорочены (1).
fringed, fr, II, 80,0. Бахромчатый край крыла (2).
frizzled, fz, III, 44 ±. Грудные волоски ищетинки
направлены к средней линии тела (3).
furrowed, fw, I, 38,3. Бороздчатые глаза (2).
fused, fu, I, 59,5. Слитные жилки в основании крыла.
Самки стерильны (2).
gap, gp, II, 74 ±. Прервана IV продольная жилка
крыла. Трансгрессия с диким типом (5).
garnet, g, I, 44,4. Гранатовоглазый (1).
giant, gt, I, 0,9 ±. Гигантские личинки, куколки и мухи (4).
giant-4, gt-4, II, 24,0. Гигантские мухи (5).
glass, gl, III, 63,1. Стекловидный. Цвет глаз ослаблен,
фасетки слиты в ровную блестящую поверхность (1).
grooveless, gvl, IV, 0,0 +. Скутеллярной бороздки
нет (1).
Gull, G, II, 12,0. Чайка. Крылья большие, растопырены.
Гомозиготы легальны. Нехватка (2А).
Hairless, Н, III, 69,5. Бесщетинковый. Некоторые ще-
тинки и волоски отсутствуют. Гомозиготы легальны (1).
hairy, h, III, 26,5. Волосатый. Добавочные волоски на
скутеллюме, жилках, плевре и голове (1).
Hairy-wing, Hw, I, 0,0+ . Волосатые крылья. Доба-
вочные щетинки и волоски. Гомозиготы жизнеспособны (1).
heavy vein, hv, II, 104,0. Утолщенные жилки, задняя
поперечная скошена. Оптимум 19е (2).
hook, hk, II, 53,9. Крючковатые, изогнутые или обруб-
ленные щетинки (2).
humpy, hy, II, 93,3. Горбатый. Крылья короткие, грудь горбатая
с углублениями и розетками (2).
178
Jammed, J, II, 41,0. Скомканнокрылый. Крыло Низве-
дено до узкой полоски. Гомозиготы жизнеспособны. Оптимум
28° (2).
jaunty, j, II, 48,7. Загнутые кверху крылья. Оптимум
25* (2).
kidney, к, III, 64,0 + . Почковидные глаза (4).
kurz, kz, I, 0,7 + . Короткие, тонкие щетинки (2).
lethal (Z) 7, 1(1)7, I, 0,3. Летальный. Убивает личинок (2).
lethal (2) brown, 1(2) bw, II, 104,0: + . Летальный. Вероятно,
нехватка (4А).
light, It, II, 55,0. Светлоглазый. Желтовато-розовый цвет
глаз (1).
Lobe, L, II, 72,0. Лопастной. Глаза уменьшены, с вырезкой
на переднем крае. Гомозиготы жизнеспособны (1).
lozenge, lz, I, 27,7. Ромбовидный. Глаза сужены, яйце-
видные. Самцы стерильны (1).
Lyra, Ly, III, 40,5. Лирообразный. Крылья срезаны
с боков, узкие. Гомозиготы легальны. Нехватка (1).
mahogany, mah, III, 88,0 +. Цвет глаз красного де-
рева. С возрастом темнеет (5).
Malformed, Mai, IV, ?. Разнообразные дефекты
глаз в виде зарубок, ямок, островков и т. д. (5).
maroon, та, III, 49,7. Каштановый. Блеклый, каштаново-
рубиновый цвет глаз (4).
microchaete, тс, I, 54,0. Уменьшены число и раз-
меры волосков и щетинок (1).
miniature, т, I, 36,1. Миниатюрный. Крылья сильно
уменьшены, темные (1).
Minute (1) п, М (1) п, I, 62,7. Тонкие щетинки. Резкий
Minute (2).
Minute (2) е, М (2) е, II, 46,0 + . Тонкие щетинки. Уме-
ренный Minute. Самки большей частью стерильны (5А).
Minute (3) g, М (3) g, III, 106,2. Топкие щетинки.
Слабый Minute (4).
Minute (3)h, М (3) h, III, 40,2. Тонкие щетинки. Уме-
ренный Minute. Аллеломорф М (3) 33] (4).
Minute (3)1, М (3)1, III, 101,0. Тонкие щетинки. Уме-
ренный Minute (2).
Minute-4, М-4, IV, 0,0+ + . Тонкие щетинки. Умерен-
ный Minute. Нехватка (ЗА).
morula, mr, II, 106,7 + . Морула. Глаза грубые, напоминаю-
щие ягоду шелковицы, морулу; щетинки укорочены. Самки
стерильны. Оптимум 25® (2).
narrow, nw, II, 83,0 + . Суженные крылья. Плодови-
тость понижена (3).
net, net, II, 0,3+ . Сетчатый. Жилки крыла образуют обиль-
ные сплетения (2).
12*
179
Notch, N, I, 3,1 +. Зазубренные крылья. Располо-
жены в области III и IV продольных жилок. Гомозиготы де-
тальны. Известно много аллеломорфов (2).
ocelliless, ос, I, 23,1. Глазки отсутствуют, щетинки
неправильны. Самки стерильны (2).
pale-ocelli, ро, II, 65, 0. Палевые глазки, почти бесцвет-
ные (2).
pentagon, ptg, I, 23,2. Пятиугольный. Темный трезубец
и пятиугольное пятно кпереди от скутеллюма (2).
pink, р, III, 48,0. Розовоглазый. Блеклый, рубиновый
цвет глаз (1).
plexus, рх, II, 100,5. Сплетения и добавочные
ж и л к и (1).
Pointed-wing, Pt, III, 94,1. Заостренные концы
крыльев. Гомозиготы детальны (4).
polychaetoid, pyd, III, 39,0 + - Многощетинковый. До-
бавочные щетинки. Оптимум 19° (3).
polychaetous, pys, II, 52,0 + . Многощетинковый. До-
бавочные и удвоенные жилки. Оптимум выше 28° (3).
proboscipedia, pb, III, 47,7 +. Ротовые части видо-
изменены в ножки. Взрослые мухи нежизнеспособны.
Самки стерильны (2).
prune, рп, I, 0,8. Черносливовый. Темный, коричнево-
красный цвет глаз (1).
purple, pr, II, 54,5. Пурпурный цвет глаз (1).
purpleoid, pd, II, 106,4. Пурпуровидный цвет
глаз (2).
radius incompletus, ri, III, 47,0. Продольная жилка
прервана (1).
raspberry, ras, I, 32,8. Малиновый цвет глаз (1).
roof, rf, II, 81,0 +. К р ы ш е о б р а з н ы й. Крылья свисают
на стороны (5).
rose, rs, III, 35,0 + . Розовоглазый. Розовый, просве-
чивающий цвет глаз (3).
rotated, rt, III, 37,0 + . Брюшко закручено против
часовой стрелки (ср. Abdomen rotatum) (2).
rotund, rn, II, 54,5 + . Округлые крылья; лапки 3-чле-
никовые. Стерильны (5).
rough, го, III, 91,1. Грубоглазый. Грубые глаза умень-
шены (1).
roughish, rh, II, 54,7 + . Грубоглазый. Глаза умеренно
грубые (2).
roughoid, ru, III, 0,0. Грубоглазый. Глаза уменьшены,
грубые; фасетки беспорядочны (1).
ruby, rb, I, 7,5. Рубиновоглазый. Рубиновый цвет
глаз (1).
180
rudimentary, r, I, 54,5. Рудиметарнокрылый. Концы
крыльев косо срезаны. Плодовитость самок понижена (2).
sable, s, I, 43,0. Соболиный. Тело темное (1).
sajranin, sf. II, 71,5 + . Сафраниновый. Темный, шоко-
ладный цвет глаз (4).
scalloped, sd, I, 51,5. Зазубренные края крыльев (1).
scarlet, st, III, 44,0. Шарлаховый, багряно-красный цвет
глаз, глазки бесцветные (1).
scute, sc, I, 0,0+ . Бесщетинковый. Скутеллярные и
другие щетинки уменьшены в числе (1).
sepia, se, III, 26,0. Сепия. Коричневато-красный цвет глаз,
темнеющий с возрастом (1).
sepiaoid, sed, III, 64,5 + . С е п и е в и д н ы й. Шоколадный цвет
глаз (3).
shaven, sv, IV, 0,1 + . Стриженый. Брюшные щетинки реже
нормы (1).
short-wing, sw, I, 64,0. Короткокрылый. Крылья уко-
рочены; глаза уменьшены, грубые. Оптимум 28° (2).
singed, sn, I, 21,0. Опаленный. Щетинки и волоски изо-
гнуты (1).
small-bristle, sbr, I, 33,4. Уменьшенные щетинки, неко-
торые отсутствуют (2).
small-eye, sy, I, 59,2 + . Малоглазый. Глаза уменьшены,
округлые (2).
small-wing, si, I, 53,5. Малокрылый. Крылья короткие,
продолговатые, глаза увеличены (2).
smooth, sm, II, 91,5. Гладкий. Брюшко без волосков. Сте-
рильны (4).
sparkling, spa,' IV, ? Глаза грубые, выпуклые. Оптимум
19° (5).
speck, sp, II, 107,0. Пятнистый. Черное пятнышко в осно-
вании крыла (1).
spineless, ss, III, 58,5. Бесщетинковый. Щетинки очень
малы. Аллеломорф aristapedia (1).
split, spl, I, 2,9+ . Расщепленный. Глаза грубые, умень-
шены, щетинки расщеплены (1).
Star, S, II, 1,3. Звездчатый. Глаза уменьшены, грубые.
Гомозиготы легальны (1).
staroid, std, II, 56,5 + . Звездчатообразный. Глаза
уменьшены, очень грубые. Самки стерильны (4).
Sternopleural, Sp, II, 22,0. Добавочные стерноплевраль-
ные щетинки. Гомозиготы легальны. Оптимум 29° (2).
straw, stw, II, 35,1. Соломенный. Тело, крылья, щетинки
желтые (1).
Streak, Sk, И, 16,0. Полосатый. Центральная полоска
на груди. Гомозиготы легальны (4).
181
stripe, sr, III, 62,0. Полосатый. Темная полоска по сред-
ней линии груди (1).
Stubble, Sb, III, 58,2. Остриженны й. Щетинки короткие,
толстые. Гомозиготы легальны (1).
tan, t, I, 27,5. Смуглый. Тело и антенны желтоватые (2).
telegraph, tg, II, 0,0+ . Телеграф. II продольная жилка
прервана (4).
tetraptera, ttr, III, 51,3. Жужжальцеобразные
крылья (4).
thick, tk, II, 55,3. Утолщенные ножки, глазкй увели-
чены, крылья короткие (2).
thread, th, III, 43,2. Нитевидный. Аристы нитевидные,
неветвящиеся (1).
tilt, tt, III, 40,0. Наклоненные крылья, растопырены
и искривлены, III продольная жилка прервана (2).
tiny, ty, 1,44,5. Щетинки и тело уменьшены. Самки
стерильны (2).
Truncate, Т, II, 13,0. Обрезанные крылья. Аллеломорф
dumpy. Гомозиготы детальны (1).
uneven, ип, I, 54,4. Неровная поверхность глаз.
Глаза грубые, уменьшены (1).
upward, upw, II, 62,0 + . Приподнятые крылья (5).
veinlet, ve, III, 0,2. Укороченные продольные
жилки (1).
vermilion, v, I, 33,0. Киноварный цвет глаз, глазкй
бесцветны (1).
vestigial, vg, II, 67,0. Зачаточнокрылый. Крылья и
жужжальцы зачаточные (1).
wavy, wy, I, 41,9. Волнистый. Крылья волнообразно ис-
кривлены и загнуты (2).
warped, wp, HI, 47,5 + . Искривленные крылья, расто-
пырены, приподняты, бесцветны (2).
white, ip, I, 1,5. Белоглазый. Глаза белые, глазкй, маль-
пигиевы сосуды и семенники бесцветны (1).
white ocelli, wo, III, 76,2. Бесцветные глазкй (2).
Wrinkled, W, III, 46,0. Морщинистый. Крылья не вполне
расправлены (1).
yellow, у, I, 0,0. Желтый цвет тела; ротовой аппарат
личинки коричневый (1).
РАЗДЕЛ ВТОРОЙ
ГЕНЕТИКА МЫШИ
ГЛАВА ШЕСТАЯ
ГЕНЕТИКА ТКАНЕВОЙ СОВМЕСТИМОСТИ
История вопроса
Операции перевивки тканей и органов от одного индивида
другому и экспериментальная разработка теоретических основ свя-
занного с ними вопроса тканевой совместимости имеют длитель-
ную историю и до самого последнего времени развивались в двух
достаточно обособленных направлениях.
Одно из этих направлений зародилось из потребности клиники
и разрабатывалось на основе клинических, в основном — хирур-
гических методов исследования. Согласно письменным свидетель-
ствам [100], хирурги Хинду еще за 750—800 лет до нашей эры
безуспешно пытались использовать метод перевивок для восста-
новления поврежденных тканей и ампутированных органов.
С такими же результатами перевивки кожных лоскутов практи-
ковались европейскими хирургами в XV—XVI вв. Ряд противо-
речивых сообщений о перевивках кожи описан также в текущем
столетии. Однако все эти попытки не приносили желаемых ре-
зультатов: пересаженные ткани и органы переживали в течение
некоторого времени и в конце концов неизменно отторгались.
С историей этого вопроса, анализом причин неудач и статисти-
кой трансплантаций применительно к клинике читатель может
ознакомиться по очень интересной книге Р. В. Петрова «Сфинксы
XX века» (Молодая гвардия, 1967).
Другое направление исследований проблемы трансплантаций
и природы тканевой несовместимости — гораздо более позднее.
Оно возникло на рубеже текущего столетия и в течение несколь-
ких последующих десятилетий развивалось, главным образом,
в рамках экспериментальной онкологии. Прогресс и здесь был
медленным, будучи обусловленным как исключительной слож-
ностью природы самого явления, так и необходимостью неодно-
кратного методического перевооружения экспериментальных ис-
следований проблемы в целом.
Исходным толчком к выведению линий мышей и разработке
обширного комплекса связанных с ними вопросов послужил
184
опыт с так называемыми «японскими танцующими» мышами,
которые были известны любителям-мышеводам очень давно и
которых они разводили с чисто любительской целью. Характер-
ной особенностью этой разновидности мышей является их спо-
собность (потребность) время от времени совершать круговые,
или манежные (вальсирующие), движения. Эта особенность свя-
зана с врожденным расстройством вестибулярного аппарата и
передается по наследству как рецессивный признак: в результате
скрещивания японских танцующих мышей с любыми другими,
нетанцующими, данная особенность исчезает у мышей F1 и вновь
появляется у одной четверти мышей F2. Именно по этой причине
любители-мышеводы вынуждены были разводить японских тан-
цующих мышей путем скрещивания их с себе подобными и избе-
гать скрещиваний с нетанцующими. Таким путем они подсозна-
тельно вывели и поддерживали первые линии японских танцую-
щих мышей еще задолго до того, как стали известны законы нас-
ледственности и были заложены первые линии мышей, впослед-
ствии получившие мировое распространение.
У одной из таких танцующих мышей возникла злокачест-
венная опухоль молочной железы. Опухоль была перевита
таким же танцующим мышам, а также некоторому количеству
нормальных мышей, неродственных танцующим. И тут был обна-
ружен весьма важный факт, никем до того времени не наблюдав-
шийся: перевитые опухоли развились у всех танцующих мышей и
не развились у обычных мышей, которых в дальнейшем мы будем
называть беспородными.
Опыт, о котором идет речь, был выполнен Лёбом в 1901 —
1902 гг. [64, 65]. Результаты этого опыта впервые и с полной
несомненностью показали, что различные мыши характери-
зуются различной восприимчивостью к перевиваемой
опухоли.
Забегая несколько вперед, следует отметить, что особенность,
за которую японские танцующие мыши получили свое название,
разумеется, не оказывала никакого влияния на результаты рас-
сматриваемых опытов, в которых они были использованы как
доноры и реципиенты для трансплантации опухоли. Таким же
образом вели бы и ведут себя и всякие другие мыши при условии,
что они генетически однородны.
Уже один этот факт представлял для того времени большой
интерес, если учесть как относительную редкость возникновения
спонтанных опухолей у лабораторных животных вообще, так и
особенно большую трудность их перевивки на других животных
того же вида в порядке расширения экспериментальных возмож-
ностей для изучения природы и причин возникновения злокачест-
венных опухолей. Так, например, один из пионеров эксперимен-
тальной онкологии — Эрлих перевил более 1000 спонтанных
опухолей мышей и лишь в 14 случаях наблюдал рост транс-
185
плантировапных опухолей; из них только 9 опухолей росли в не-
скольких последующих пассажах (цитировано по Петрову [14 ]).
В развитие данных Лёба Тиццер поставил дальнейшие тща-
тельно контролируемые опыты с такими же мышами и с той же
опухолью (JwA) и в 1907—1909 гг. опубликовал полученные ре-
зультаты [106, 107, 108], представленные в табл. 37.
Таблица 37
Рост аденокарциномы молочной железы JwA
японской танцующей мыши у японских
танцующих мышей, обычных мышей
и их гибридов Fl, F2 и F3.
По Тиццеру [106, 107, 108]
Мыши Опухоль привилась Опухоль не привилась
Японские танцую-
щие 142 3
Обычные 0 48
Гибриды F1 .... 69 1
Гибриды F2 .... 0 54
Гибриды F3 . . . . 0 16
На основании данных этих опытов Тиццер впервые поставил
в связь успех или неуспех трансплантации опухоли JwA с р о д-
ственными, т. е. генетическими, отношениями
между донором опухоли и хозяином. Одновременно он высказал
предположение, что генетические отношения между трансплан-
татом и хозяином более сложны, чем уже бывшие в то время из-
вестными простейшие законы наследственности Менделя, по-
скольку очевидная доминантная восприимчивость гибридов F1
к перевиваемой опухоли полностью исчезала у гибридов F2
и F3.
Впоследствии, однако, единичных восприимчивых к опухоли
мышей Тиццер наблюдал среди гибридов F2 и последующих
поколений [109].
В 1916 г. Литтл и Тиццер опубликовали результаты дальней-
ших опытов по перевивке той же опухоли на большем числе
мышей [63]. (Источники [63, 64, 65, 107, 108, 109], цитированы
по Литтлу [61 ]). Результаты этих опытов, представленные
в табл. 38, во-первых, подтвердили первоначальные наблюдения
Лёба и Тиццера, снова показав, что опухоль JwA перевивается
в 100 % случаев на японских танцующих мышах и гибридах F1
с обычными, беспородными, но не перевивается на беспородных
186
и, во-вторых, что из 183 мышей F2 три мыши (1,6%) оказались
восприимчивыми к опухоли JwA и 180 мышей (98,4%) — невос-
приимчивыми. Следовательно, первоначальное пред-
положение Тиццерао влиянии наследственных фак-
торов па успех или неуспех перевивки опухоли снова получило
подтверждение в том факте, что единичные мыши F2 все же ока-
зались восприимчивыми к опухоли JwA. Две последние графы
табл. 38, в которых приведены результаты перевивки опухоли
JwA на бэккроссных мышей с восприимчивыми или резистент-
ными мышами, подкрепляли это предположение. В самом деле,
все 63 бэккроссные мыши с японскими, т. е. восприимчивыми,
снова оказались восприимчивыми, в то время как 78 бэккроссных
мышей с беспородными, т. е. невосприимчивыми, оказались
полностью к ней резистентными.
Из совокупности результатов рассмотренных опытов Лёба,
Тиццера и Литтла и Тиццера можно было сделать следующий
вывод: судьба перевитой опухоли, т. е. ее способность (или не-
способность) к росту в теле нового хозяина, зависит от наличия
или отсутствия у него особого фактора (или факторов)
восприимчивости (соответственно — резистент-
ности), наследование которого у мышей гибридных поколений
подчинено законам наследственности.
Из этих же опытов следовало также, что фактор восприим-
чивости к перевиваемой опухоли JwA является доминантным,
поскольку из 132 мышей F1, полученных от скрещивания япон-
ских танцующих с беспородными, 130 оказались восприимчи-
выми и только две — резистентными (суммарно по данным табл. 37
и 38).
Таблица 38
Рост аденокарциномы молочной железы JwA
у японских танцующих мышей, обычных мышей
и их гибридов Fl, F2 и бэккроссных.
По Литтлу и Тиццеру [63]
Мыши Опухоль привилась Опухоль не привилась Удачные перевив- ки, °/о
Японские танцующие .... 38 0 100
Обычные 0 99 0,0
Гибриды F1 61 1 98,4
Гибриды F2 3 180 1,6
ВС1 с японскими 63 0 100
J3C1 с обычными 0 78 0,0
187
Несравненно более трудным оказалось выяснение природы и
механизма наследования фактора (или факторов) восприимчи-
вости. Еще в 1914 г. Литтл [59] высказал мысль, что тип наследо-
вания, который внешне может привести к неменделевским от-
ношениям, на самом деле зависит от менделирующих генов. Эта
мысль была навеяна результатами уже цитированного опыта
Тиццера (табл. 37) и заключалась в допущении, что проявление
некоторых признаков организмов зависит от одновремен-
ного наличия не одного, а несколькихмен-
делирующих генов (разрядка Литтла. — Н. М.). При-
меры наследования некоторых таких особенностей организмов
были к тому времени известны. Рассмотрим в общих чертах, ка-
кие дальнейшие выводы можно было сделать на основании этой
гипотезы.
Если 100%-ная перевиваемость опухоли на гибридах F1 япон-
ских танцующих мышей с беспородными хорошо согласовалась
с гипотезой доминантной природы рассматриваемого фактора,
то этого нельзя было сказать, исходя из наблюдаемого соотноше-
ния восприимчивых и резистентных мышей в F2 и F3. Действи-
тельно, согласно ожиданию, в F2 моногибридного скрещивания
должно иметь место расщепление на мышей, восприимчивых к опу-
холи JwA и резистентных к ней, причем на каждые три восприим-
чивые мыши должна возникнуть одна резистентная, или, соот-
ветственно, 75 : 25—в процентном выражении. В суммарных же
опытах Тиццера и Литтла и Тиццера (табл. 37 и 38) из 237 мы-
шей F2 только три оказались восприимчивыми к опухоли JwA,
а все остальные — резистентными. Иначе говоря, предположе-
ние о том, что восприимчивость к рассматриваемой опухоли
определяется единственным доминантным фактором, не соответ-
ствовало наблюденным в опытах результатам и должно было
быть отвергнуто.
К тому же заключению приводило допущение, что восприим-
чивость (или резистентность) к опухоли зависит от двух доминант-
ных, однозначных по своему действию факторов, например А
и В. В этом случае, согласно ожиданию, в F2 на каждые 16 мы-
шей должно возникать девять (56,2%) таких, у которых в го-
мозиготном или гетерозиготном состоянии налицо будут оба
доминантных фактора восприимчивости (А и В), и семь (43,8%)
мышей, у которых будет только один из них (А или В), или ни
одного. Первые должны быть восприимчивы к перевиваемой опу-
холи, вторые и третьи — резистентны. Очевидно, что ожидаемое
в F2 для дигибридного скрещивания расщепление на девять вос-
приимчивых мышей и семь резистентных также не соответствовало
полученному в опытах Тиццера и Литтла и требовало дальней-
шего анализа.
Не входя в рассмотрение еще более сложных генетических
отношений между хозяином и трансплантатом, сразу обратимся
188
к табл. 39 из статьи Литтла [61 ], в которой анализ этого вопроса
представлен с исчерпывающей полнотой.
В табл. 39 приведены теоретически ожидаемые процентные
отношения восприимчивых к опухоли мышей в первом и втором
поколениях — прямом и обоих бэккроссных, в зависимости от
числа пар факторов, определяющих восприимчивость к данной
опухоли, включая и рассмотренные выше простейшие случаи
моногибридного и дигибридного расщеплений.
Таблица 39
Зависимость между процентом мышей, восприимчивых
к трансплантируемой опухоли, и числом генов,
определяющих восприимчивость.
По Литтлу [61]
Число пар генов, одновременное на- личие которых необходимо для роста опухоли Процент восприимчивых животных Процент восприимчивых среди бэккроссов F1
в F1 в F2 с восприимчи- вым родителем ’’с невосприимчи- вым родителем
1 100 75,0 100 50,0
2 100 56,2 100 25,0
3 100 42,2 100 12,5
4 100 31,6 100 6,2
5 100 23,7 100 3,1
6 100 17,8 100 1,6
7 100 13,3 100 0,8
8 100 10,0 100 0,4
9 100 7,5 100 0,2
10 100 5,6 100 0,1
И 100 4,2 100 0,05
12 100 3,1 100 0,02
13 100 2,3 100 0,01
14 100 1,7 100 0,005
15 100 1,0 100 0,002
Из табл. 39 прежде всего видно, что все гибриды F1 должны
быть восприимчивы к перевиваемой опухоли независимо от числа
определяющих ее пар факторов. В действительности так оно и
было во всех рассмотренных опытах, и именно это обстоятельство
явилось одним из решающих для интерпретации полученных дан-
ных с рассматриваемой точки зрения.
То же самое справедливо и в отношении бэккроссных мышей
с восприимчивым родителем: все эти мыши, согласно гипотезе,
также должны быть восприимчивы к перевиваемой опухоли,
189
поскольку, независимо от их предшествовавшей наследствен-
ности, все они получили фактор (факторы) восприимчивости от
ближайшего восприимчивого (негибридного) родителя. Полу-
ченные в опытах результаты как нельзя лучше подтверждали и
это предположение.
Иные отношения должны наблюдаться в F2 как прямого
скрещивания, так и возвратного с резистентным родителем.
Как видно из таблицы, в обоих этих случаях по мере увеличения
числа пар факторов восприимчивости процент восприимчивых
животных быстро падает. Падение идет быстрее в бэккроссных
потомствах, нежели в потомствах от прямых скрещиваний, и
уже для 11—12 пар генов процент восприимчивых мышей в F2
от прямых скрещиваний соответственно равен 4,2 и 3,1% и в 84
и 155 раз меньше для бэккроссных мышей тех же поколений.
Наконец, при 15 парах факторов доля восприимчивых к опу-
холи мышей среди прямых и бэккросных гибридов становится
ничтожной и соответственно равной 1,0 и 0,002%.
Таковы теоретически ожидаемые на основе гипотезы отноше-
ния восприимчивых и невосприимчивых мышей, которым должны
удовлетворять наблюдающиеся в опыте результаты перевивки
опухоли с достаточной степенью совпадения в повторных опы-
тах.
Обратимся теперь к данным табл. 38 и посмотрим, какому
числу пар факторов табл. 39 соответствуют наблюдавшиеся в опы-
тах Тиццера и Литтла результаты. Из табл. 38 видно, что в F2
от прямого скрещивания восприимчивыми к опухоли оказались
три мыши из 183, что составляет 1,6%. Из табл. 39, в свою оче-
редь, видно, что приблизительно такой же процент восприим-
чивых мышей следует ожидать в том случае, когда восприимчи-
вость (или соответственно — резистентность) к опухоли опре-
деляется 14—15 однозначно действующими факторами. Именно
в таком смысле Литтл и Тиццер истолковали результаты своих
опытов, допустив, что японские танцующие мыши и возникшая
у одной из них аденкарцинома молочной железы JwA отличаются
от тех беспородных мышей, на которых они перевивали эту опу-
холь, по 14—15 генам восприимчивости. Теоретически ожидае-
мые для указанного числа пар генов и наблюденные в опытах
Тиццера и Литтла результаты для 14—15 пар генов представ-
лены в табл. 40. Совпадение между теми и другими, действительно,
очень близкое.
Таковы были в самых общих чертах те выводы из работ авто-
ров раннего периода, которые легли в основу дальнейших иссле-
дований в этом направлении. Здесь необходимо также подчерк-
нуть, что исследования пионеров генетики трансплантации опу-
холей послужили стимулом для выведения линий мышей, играю-
щих столь важную роль в современных медико-биологических
исследованиях (см. главу VII).
190
Т а б л и ц а 40
Сравнение наблюдаемых и ожидаемых результатов роста опухоли JwA
для 14—15 пар генов.
По Литтлу [61]
Отношение, % Воспри- имчивый родитель Невоспри- имчивый родитель F1 F2 Бэккросс с восприимчи- вым роди- телем Бэккросс с невосприим- чивым роди- телем
Наблюдаемое 100 0,0 98,4 1,6 100 0,0
Ожидаемое . . 100 0,0 100 1,7-1,0 100 0,0
В самом деле, если успех трансплантации опухоли зависит
от кровного (генетического) родства донора и реципиента, то
нельзя ли пойти в этом направлении и дальше и вывести такие
линии мышей, на которых эти операции удавались бы в 100%
случаев? Нельзя ли также вывести линии мышей, у которых
столь необходимые для опытов злокачественные опухоли возни-
кали бы гораздо чаще и с большим постоянством, чем то имеет
место у обычных, беспородных животных? Не следует забывать,
что в то время, о котором идет речь, не были известны ни канцеро-
гены, ни тем более высокораковые линии лабораторных живот-
ных. Поэтому возникновение каждой спонтанной опухоли у ла-
бораторных животных представляло собой сравнительно редкое
событие, а их перевивки на других животных наталкивались на
непреодолимые трудности (стр. 185). Несомненно, что практи-
ческое решение этих вопросов способствовало бы резкому расши-
рению экспериментальных возможностей в ряде областей меди-
цины и биологии. Следует также напомнить, что к тому времени
учепие о чистых линиях Иоганнсепа [57 ] приобрело достаточно
широкую известность и послужило стимулом для выведения чистых
линий, в первую очередь кукурузы.
После того, как первые успехи в этом направлении последо-
вали в опытах на линейных мышах, прошли еще три десятилетия,
пока стало окончательно ясно, что результаты первоначальных
опытов по перевивке опухолей на линейных животных не есть
случайное наблюдение, а представляет собой всеобщий
биологический принцип, в основе которого лежат определенные
законы.
Установление этого принципа поставило на очередь разра-
ботку ряда новых методических вопросов. Помимо сложности
самого явления, изучение ответственных за него генов затруд-
нено тем, что все они характеризуются одинаковым фено-
типическим проявлением, а именно — прижив-
лением или отторжением трансплантата. Поэтому в дополнение
к тем линиям мышей, которые сыграли роль на первых этапах
191
экспериментальной разработки проблемы, потребовалось созда-
ние принципиально новых моделей, т. е. линий мышей, которые
попарно отличались бы одна от другой лишь по одному гену
тканевой совместимости и в то же время были бы одинаковы,
идентичны, или конгенны, по всем другим генам,
составляющим генотипы контрастирующих линий. Снелл, ко-
торый в течение последних 20 лет исследования проблемы гисто-
совместимости, несомненно, играет ведущую роль, с конца 40-х
годов вывел до 200 конгенных линий, из которых около 75 в на-
стоящее время интенсивно используются в опытах [93].
Основные закономерности тканевой совместимости были раз-
работаны и сформулированы на основании результатов опытов,
в которых в качестве трансплантатов были использованы ткани
злокачественных опухолей. Однако уже из первых опытов Го-
рера [33, 34, 35] следовало, что гены гистосовместимости, опре-
деляющие успех или неуспех перевивки злокачественных опу-
холей, контролируют также генетические особенности нормаль-
ных тканей и в первую очередь — кровь.
В 50-х годах на мышах был разработан метод трансплантации
кожи и других нормальных тканей и установлен полный п а-
раллелизм в поведении опухолевых и нормальных тканей
при перевивках. Таким образом, первоначальная идея о том, что
приживление или отторжение тех и других определяется одними
и теми же генами гистосовместимости, была окончательно до-
казана и получила всеобщее признание. Поэтому в дальнейшем
изложении нет необходимости разграничивать поведение при
трансплантациях злокачественных и нормальных тканей, учи-
тывая, что все закономерности поведения первых приложимы
и ко вторым. Исключение составляют некоторые специальные
ткани (например, хрящевая), некоторые «привилегированные»
места перевивки (например, передняя камера глаза или голов-
ной мозг), которые с иммунологической точки зрения находятся
в особом положении, а также так называемые неспецифические
опухоли (см. табл. 42, примечание 1).
Таким образом, современное учение о тканевой совместимости
представляет собой обширную главу со своими задачами и мето-
дами исследования. Полученные здесь принципиально новые
результаты в основном сводятся к двум положениям, а именно:
1) приживление или отторжение трансплантата зависит от с о-
ответствия или несоответствия между донором
и реципиентом по генам тканевой совместимости, которые насле-
дуются по законам Менделя; 2) процессы, лежащие в основе
отторжения трансплантатов, являются иммунологиче-
скими по природе.
Следовательно, изучение проблемы гистосовместимости пред-
полагает знакомство не только с закономерностями наслед-
ственности, но и с некоторыми основными понятиями иммуно-
192
логии, к которым мы сейчас и перейдем. Необходимость рас-
смотрения последних диктуется также теми терминологическими
изменениями и уточнениями, которые предложены в самое послед-
нее время [92, 95, 98 j и положены в основу нижеследующего
краткого словника.
В рамках настоящего руководства внимание будет сосредо-
точено на генетической, и в первую очередь на методической
стороне вопроса. Что же касается иммунологического аспекта
проблемы, то заинтересованный читатель может подробно озна-
комиться с ней по другим литературным источникам [24, 76, 90].
Терминологические и методические замечания.
Общие понятия
1. Операцию переноса опухоли, кожи, или любой другой
нормальной ткани от одного животного другому, называют п е-
р е в и в к о й, или трансплантацией (для опухоли
также — пассажем). По отношению к опухоли, когда пер-
вичная перевивка и поддержание опухоли в течение длительного
времени предполагает периодические ее перевивки на новых
хозяев, опухоль, развившуюся в результате первичной и всех
последующих перевивок, называют перевиваемой, пас-
сируемой или трансплантируемой (кратко —
перевиваемым ш т а м м о м).
2. Животное, от которого взята опухоль, или нормальная
ткань для перевивки, называют донором, а животное, на
которое производят перевивку — хозяином, или реци-
пиентом.
Гены гистосовместимости
3. Термины гистосовместимость и г и с т о не-
совместимость соответственно означают способность или
неспособность тканевых трансплантатов к росту в теле нового
хозяина.
4. Гены гистосовместимости, или по отношению
к мышам более кратко — Н-гены, определяют восприимчивость
и резистентность к трансплантатам. Приживление трансплантата,
или прогрессивный рост опухоли, имеют место только в тех слу-
чаях, когда в с о а л л е л и г и с т о с о в м е с т и м о с т и
т р а п с п л а н т а т а присутствую о1 т а к ж е у х о-
з я и и а. Конечные продукты действия генов гистосовместимости
можно рассматривать как а л л о а и т и г е н ы (см. аллоанти-
гены). Последние, будучи с трансплантатом перенесены хозяину,
у которого этих аллоантигенов пет, обладают специфической осо-
бенностью вызывать иммунный ответ хозяина и отторжение транс-
плантата. Каждый ген предположительно определяет один алло-
13 И. и. Медведев 193
антиген (по принципу один ген — один антиген). Есть основания
полагать, что аллоантпгепы связаны с химическими особенно-
стями клеточных оболочек (стр. 223).
5. Кодоминантными, к типу которых относятся гены
гистосовместимости, принято называть такие гены, конечные
продукты действия которых могут быть выявлены у гетеро-
зиготных по ним особей. Приме р: аллели А и В групп
крови у человека, свойства которых проявляются в гетерози-
готных эритроцитах АВ. Кодоминантные гены следует отличать
от генов с неполным доминированием, при ко-
торых гетерозигота занимает промежуточное положение
между двумя гомозиготами.
Типы животных
6. Инбредные животные — это животные, которых раз-
множают путем братско-сестринских скрещиваний (тесного ин-
бридинга) и которые уже прошли не менее двадцати поколений
(см. также* главу VII). Понятия инбредные, чистолиней-
н ы е, или просто л и н е й н ы е, употребляются как синонимы.
7. Термин изогенны е, или изогенност ь, употреб-
ляется для обозначения генетической идентичности животных
или тканей. Примеры: животные высокоинбредных линий,
гибриды F1 от скрещивания животных двух высокоинбредных
линий, однозиготные близнецы. Английский вариант этого тер-
мина isogeneic, или изогеничный (по-русски — родственный),
употребляется для обозначения сходства (единства) происхо-
ждения.
8. Термин конгенные, или конгенность, озна-
чает генетическую идентичность животных двух линий, за исклю-
чением различия по одному локусу (гену) гистосовместимости,
вследствие чего животные двух конгенных линий взаимно рези-
стентны к трансплантатам опухолевой и нормальных тканей кон-
генного партнера. Поэтому конгенные линии называют также
к о н г е н н ы м и резистентными; кратко их обозначают
буквами CR. Первоначально такие животные (линии) обознача-
лись как изогенные, позднее — коизогенные. Однако полная,
истинная коизогенность представляет собою теоретический идеал,
редко или никогда пе достижимый на практике (за исключением
редких случаев мутаций в одном из локусов гистосовместимости).
Поэтому для обозначения генетического статуса соответствующих
контрастирующих линий (животных) рациональнее пользоваться
термином конгенные, пли конгенность, который выражает хотя
и не совершенное, но полезное приближение к состоянию истин-
ной коизогенности.
9. Коизогенные животные, или линии — см. конгенные
животные.
194
10. Термином аллогенные можно обозначать генети-
чески разнородных животных в пределах вида. Английский
вариант этого понятия allogeneic, или аллогеничпый (по-русски —
неродственный), по смыслу противоположный термину isogeneic,
употребляется для обозначения неродственного происхождения.
Типы трансплантаций
11. Аутопластические трансплантации, или а у-
тотрансплантации, — это трансплантации, когда до-
нором и реципиентом является одно животное.
12. Изогенные трансплантации, или и з о т р а н с п л а н-
т а ц и и, — это трансплантации между генетически идентич-
ными особями. Примеры: трансплантации между животными
одной высокоинбредной лпппп, между гибридами F1 от скре-
щивания животных двух высокоинбредных линий и между иден-
тичными близнецами.
13. Аллогенные трансплантации, или а л л о т р а нс-
плантации, — это трансплантации между генетически
разными особями в пределах вида. Более точно — это трансплан-
тации, в которых трансплантируемая ткань содержит аллель,
пли аллели, генов гистосовместимости (а следовательно, — ан-
тиген, или антигены — см. ниже), чужеродные для реци-
пиента. В том же смысле употребляется термин гомотрансплан-
тации. Однако применительно к трансплантации приставка гомо
(одинаковость, подобие) придала понятию смысл, прямо проти-
воположный общепринятому, словарному, значению. Поэтому
во избежание смешения понятий применительно к данному типу
трансплантаций этим термином лучше не пользоваться.
14. Гомологические трансплантации, или гомо-
трансплантации, — см. аллотрансплантации.
15. Термины гетеротрансплантации, или
ксенотрансплантации [92], которыми обозначают
трансплантации между животными разных видов, мы включаем
лишь для полноты словника.
Типы антигенов
16. Термином а л л о а н т и г е н обозначают сложный
продукт локуса, существующего в виде двух или большего числа
аллельных состояний, альтернативные формы которых являются
антигенными для особей, не обладающих этими аллелями. Этот
продукт у особей в пределах вида вызывает иммунный ответ.
В иммунологической литературе имеет хождение другой,
по смыслу равнозначный термин — изоантиген. Поскольку, од-
нако, тип антигенных стимулов, о которых идет речь, вызы-
вается не изотрансплантатами (которые в изологической среде
195
13*
антигенами не являются и иммунных стимулов не вызывают),
а аллотрансплантатами, т. е. в трансплантациях между неизо-
генными особями, правильнее и здесь говорить об аллоанти-
генах, а не об изоантигенах.
17. Изоантиген — см. аллоантиген и изотрансплан-
тации.
Типы антител
18. А л л о а н т и т е л а — это антитела, образующиеся
под влиянием аллоантигенов, когда они перенесены животным
того же вида. Поскольку к образованию антител приводят не изо-
трансплантаты, а аллотрансплантаты (см. аллоантигены), пра-
вильнее говорить об аллоантителах, а не об изоантителах и этим
последним термином лучше не пользоваться.
19. И з о а н т и т е л а — см. аллоантитела и аллотрансплан-
тации.
20. Конечным исходом перевивки опухоли надо считать
смерть донора от опухоли или его выздоровление
в результате полного рассасывания трансплантата.
Таких животных называют также нуллерами. В опытах
по гистосовместимости перевивки опухоли принято производить
под кожу плечевой области и избегать таких «привилегирован-
ных» в иммунологическом отношении мест, как передняя камера
глаза, или мозг, где перевитая опухоль может длительное время
«переживать», увеличиваться в размерах (расти) и даже пасси-
роваться в немногих генерациях. Однако все такие случаи пе-
реживания, не сопровождающиеся смертью хозяина, нельзя
рассматривать истинными трансплантациями.
Как было показано выше, все ранние исследования по генетике
трансплантаций были выполнены с опухолями, которые для мно-
гих исследований и до сего времени являются предметом выбора.
Преимущества работы с опухолями следующие.
а) Простота и скорость выполнения операций: один опытный
сотрудник может выполнить в день 500 и более операций.
б) Возможность получения взвеси изолированных клеток из
ткани лейкемий и, следовательно, их точной дозировки.
в) То же — в отношении асцитных опухолей, которые разви-
ваются в форме взвеси изолированных клеток в экссудате брюш-
ной полости.
г)].При надлежащей аранжировке опыта ткань опухоли мо-
жет служить очень чувствительным индикатором различий
по генам гистосовместимости. Для усиления реакции против
опухолевого трансплантата нередко практикуют также однократ-
ную или повторные иммунизации реципиента нормальной тканью
линии донора, чаще всего — селезенки. Особенно хорошим инди-
катором различий по генам гистосовместимости являются лей-
кемии вследствие их чувствительности к антителам.
196
д) Возможность длительного сохранения опухолей в заморо-
женном состоянии.
К отрицательным сторонам работы с опухолями относятся:
а) Возможность изменений опухоли и утрата первоначальных
желательных свойств в результате длительного пассирования.
б) Опасность инфицирования в процессе недостаточно тщатель-
ных операций или через инфицированного хозяина.
В последние годы все возрастающее число исследований по ги-
стосовместимости осуществляется с нормальными тканями. Из них
чаще всего используют кожу. Эта ткань относится к числу наибо-
лее чувствительных индикаторов различий по генам гистосов-
местимости. Техника перевивки кожи с несколькими модифика-
циями разработана достаточно хорошо [12, 22а, 23, 41а, 73]
(см. также стр. 228).
ДАЛЬНЕЙШЕЕ ИЗУЧЕНИЕ
ПРОБЛЕМЫ ГИСТОСОВМЕСТИМОСТИ
ГЕНЕТИЧЕСКИМИ МЕТОДАМИ
Исследования пионеров экспериментальной разработки проб-
лемы трансплантаций кратко были рассмотрены выше. Уже на
этом, раннем этапе работы проблема трансплантации опухолей
обогатилась новыми важными выводами и плодотворными идеями
для дальнейших исследований.
С другой стороны, эти же опыты указывали на большую слож-
ность генетических взаимоотношений между донором и реципиен-
том, показав, в частности, что для успешной перевивки аденокар-
циномы молочной железы JwA требуется 14—15 пар свободно
комбинирующихся факторов. Естественно, что столь сложные
генетические взаимоотношения между хозяином и транспланта-
том, не известные по тому времени для других объектов генети-
ческих исследований, настораживали исследователей и толкали их
на поиски новых путей и методов исследования и максимального
упрощения проблемы в целом.
Поэтому в последующие годы генетика трансплантируемых
опухолей в основном продолжала развиваться в прежнем направ-
лении, связанном с поисками более упрощенных отношений (мо-
делей) между хозяином и трансплантатом, которые, разумеется,
должны существовать и должны были быть найдены, если лежащая
в основе этих опытов идея верна и отражает истинные между
ними взаимоотношения.
И, действительно, уже в 1920 г. Литтл описал случай, когда
рост саркомы JwA тех же японских танцующих мышей зависел
от наличия лишь четырех или пяти пар факторов тканевой сов-
местимости [60]. Четырьмя годами позднее Литтл и Стронг де-
тально исследовали поведение двух аденокарцином dBrA и dBrB,
возникших у мышей линии dba (ослабленной коричневой масти).
197
Результаты перевивки этих опухолей мышам линии dba, белым
багговским и их гибридам Fl, F2 и бэккросным, оказались близко
совпадающими с ожидаемыми для двух пар факторов с опухолью
dBrB и трех пар факторов — для опухоли dBrA [62].
Другая интересная особенность опухолей dBrB и dBrA,
выясненная путем одновременной их перевивки одним и тем же
мышам и сравнения их реакции на обе опухоли, заключалась
в том, что два из трех факторов (А и В) оказались для обеих
опухолей общими, и отличие между ними сводилось лишь к треть-
ему фактору (С), который присутствовал в опухоли dBrA.
Наконец, в 1926 г. Стронг описал простейший случай взаи-
моотношения между хозяином и трансплантатом, показав, что
для роста подробно исследованной им аденокарциномы dBrCsp,
требуется всего одна пара генов [103]. Таким образом, Стронгом
была завершена длинная серия исследований, которая продол-
жалась в течение десяти лет. Она началась с генетически очень
сложной модели, опухоли JwA, и только к концу указанного
периода был описан ее антипод, которого недоставало в цепи
доказательств генетической природы опухолевых трансплантаций.
В исследованиях последующих лет были получены доказатель-
ства сцепления некоторых факторов восприимчивости с по-
лом [105]; изучено поведение весьма интересных спонтанных
опухолей гибридных животных в опытах по перевивке их на мы-
шей исходных, родительских, линий и на гибридов F2 [26, 105];
Т а б л и ц а 41
Результаты опытов по перевивке кожи инбредных мышей гибридам
F1 и F2 и бэккроссным.
По Снеллу и Стимпфлингу [98]
Скрещивание Донор кожи Реципиенты Количество выжив- ших трансплантатов и длительность переживания, дни Количество отторженных (число и принятых локусов)
гене- рация ЧИСЛО мышей >60 >120 >200
13AL13/CX XDBA/21 BALB/c3<3 ВАЬВ/соЗ' F2<52 ВС(?2 120 99 10 3 4 0 3 2,81 (I3) 0,01 (13)
AXCB.V ^22 сва<5<5 А<?2 cba3j F1 F1 F2(?2 F2<52 1 1 10 120 154 3 о 2 1 И 10 0 0 1,60 (15) 2,05 (15)
1 Прен и Мейн [75].
2 Варнее и Крон [22].
198
неоднократно показано внезапное уменьшение специфичности
генетически хорошо изученных опухолей, в большинстве случаев
связанное с уменьшением числа факторов совместимости (анти-
генным упрощением) [25, 31,104] и реже — с их увеличением [69].
Чтобы закончить рассмотрение этой линии исследований,
приведем результаты еще двух аналогичных опытов {22, 75],
главным образом потому, что они выполнены сравнительно не-
давно и что в качестве трансплантатов в этих опытах были исполь-
зованы не опухоли, а кожа соответствующих доноров (табл. 41).
Как видно из табл. 41, и в данных опытах поведение кожных
трансплантатов на мышах Fl, F2 и бэккроссных не отличалось
от поведения опухолевых, и совпадение теоретически ожидаемых
значений успешных перевивок с наблюдаемыми для 13—15 пар
факторов оказалось, действительно, очень близким.
Законы трансплантаций
На основании результатов исследований Лёба, Тиццера,
Стронга, Биттнера, Клаудмана и других авторов, выполненных
гистогенетическим методом, Литтл и Тиццер сформулировали
основные законы поведения опухолей при трансплантациях (ци-
тировано по Снеллу [85]).
С тех пор накопилось много новых данных и, хотя теория в це-
лом и лежащие в ее основе законы подверглись некоторым изме-
нениям, тем не менее, в их наиболее существенных чертах они ос-
таются незыблемыми и имеют широкие сферы применения. По-
этому ниже законы трансплантаций сформулированы в их со-
временном виде.
Биологические основы природы тканевой совместимости,
объединяющие законы трансплантаций, в самой общей форме
могут быть сформулированы в виде следующего положения:
совместимость тканей между донором и реципиен-
том при трансплантациях есть функция их генотипи-
ческого тождества по генам тканевой
совместимости [7]. За вычетом аутотрансплантаций,
стопроцентный успех которых никогда не вызывал сомнений, эти
законы следующие:
1. Изотрансплантации во всех случаях успешны.
2. Аллотрансплантации — безуспешны.
3. Трансплантации от животных любых двух линий на их
гибридов F1 успешны; реципрокные же трансплантации, т. е.
от гибридов F1 на животных обеих родительских линий, безус-
пешны.
4. Трансплантации между гибридами F1, полученными от
скрещивания животных инбредных линий, успешны.
5. Трансплантации от гибридов F2 и последующих поколений
на гибридов F1 тех же линий во всех случаях успешны.
199
6. Трансплантации от обоих инбредных родителей на гибри-
дов F2 успешны на одних животных и безуспешны на других.
Как правило, о т т о р ж о н и е трансплантатов наблюдается
в гораздо большем числе случаев, чем при-
живление. То же самое имеет место в случаях транспланта-
ции от одного инбредного родителя на возвратных гибридов F1
с животными противоположной родительской линии.
Процент отторжения у этих (т. е. бэккроссных) гибридов для
каждого данного случая, донора и типа ткани обычно больше,
чем у прямых гибридов F2.
Для удобства сравнения законы трансплантаций сведены
в табл. 42.
Для всех перечисленных законов гистосовместимости, и осо-
бенно для второго и третьего, известны исключения. Наиболее
частые из них относятся ко второму закону, который утверж-
дает несовместимость аллотрансплантатов. Снелл и Стимпфлинг [981
полагают, что аллотрансплантаты всегда встречают резистент-
ность со стороны хозяина, хотя и не всегда отторгаются. Воз-
можными исключениями этого рода являются некоторые ткани
(например, хрящ и кость), особые, «привилегированные» места
перевивок (например, передняя камера глаза, или мозг), а также
все так называемые неспецифические опухоли (табл. 42, приме-
чание 1).
Для объяснения таких аберрантных случаев были высказаны
две возможные причины: 1) «антигенное упрощение» длительно
пассируемых опухолей, в результате которого тенденция опу-
холей к прогрессивному росту в чужеродном хозяине с возрастом
штамма (т. е. с увеличением числа пассажей) обычно увеличивается;
2) повышенная способность некоторых тканей (например, яичника)
легко преодолевать «слабые» барьеры гистосовместимости. То же
самое относится к коже, которая, будучи, вероятно, самым
чувствительным из всех индикаторов гистосовместимости, иногда
преодолевает «слабые» иммунологические барьеры, в особенности
при отсутствии предварительной иммунизации (см. ниже).
Рассмотрение возможных причин так называемой «гибридной»
резистентности, т. е. исключений из третьего закона трансплан-
таций, который утверждает совместимость тканей инбредных
и конгенных родителей с их гибридами F1 и который долгое
время рассматривали как универсальный, мы опускаем [ввиду
их сложности. Несомненно, однако, что дальнейшие исследования
помогут вскрыть причины этих исключений.
Генетическая теория трансплантаций
Генетическая теория трансплантаций базируется на следующих
положениях, которые вытекают из опытов по перевивкам тканей
гибридам первого, второго и бэккроссных поколений, и которые
200
Таблица 42
Законы трансплантаций, разработанные в опытах на линейных мышах
Операция (термин) Донор Реципиент Чистота положи- тельных прививок, °/о
Аутотранспланта- ция Одна и та же особь любого происхожде- ния 100
Изотранспланта- ция Особи одной и той же инбредной линии, гибриды F1, однозиготные близнецы 100
Аллотрансплан- тация (по старой терминологии — гомотранспланта- ция) Особи двух инбредных или конгенных линий О1
Гибридотранс- плантация2 а) Особи обеих ин- бредных или конген- ных линий, давших начало гибридам F1 Гибриды F1 100
» б) Гибриды F1 Особи обеих инбред- ных или конгенных линий, давших на- чало гибридам F1 0
» в) Гибриды F1 от скрещивания мышей инбредных или кон- генных линий То жё 100
» г) Гибриды F2 и по- следующих поколе- ний Гибриды F1 100
» д) Особи обеих ин- бредных или конген- ных линий, давших начало гибридам F2 Гибриды F2 3
» е) Особи одной (лю- бой) инбредной или конгенпой липни, давшей начало бэк- кроссному Г2 Бэккроссы F2 от скрещивания F1 с особями другой, про- тивоположной, линии 4
1 Исключение составляют все так называемые неспецифические (гетероплоидпыс,
большей частью — тетраплоидные) опухоли типа асцитной карциномы Эрлиха, сарко-
мы Крокера [180], саркомы 37 и др.
2 Термин «гибридотрансплантации» впервые применен нами в 1960 г. и в пределах
указанных здесь ограничений достаточно удачно объединяет относящиеся сюда законо-
мерности.
См. текст, закон шестой.
201
являются ключевыми для понимания генетических основ ткане-
вой совместимости:
1. Восприимчивость и резистентность к трансплантатам опре-
деляется многими, однозначно действующими генами. Необ-
ходимость признания полигенной природы явления вытекает
из доминирования восприимчивости у гибридов F1, с одной
стороны, и отсутствия достаточного процента восприимчивых
животных в расщепляющихся поколениях, с другой. Генети-
ческая теория трансплантаций должна устранить это противоре-
чие.
2. Процессы отторжения трансплантатов протекают на имму-
нологической основе (см. определение генов тканевой совмести-
мости) .
3. Гены гистосовместимости относятся к категории кодоми-
нантных (см. определение). Взгляд на природу генов гистосов-
местимости подвергался неоднократной ревизии: Литтл рассмат-
ривал их как доминантные [61]. Снелл одно время пе исключал
рецессивной природы генов гистосовместимости [86]. Однако
в последней сводке [98] этот автор все же склоняется к кодоми-
нантной природе генов гистосовместимости, основываясь как
на аналогии с генами групп крови у человека, так и с еще большим
основанием — на сравнимых результатах реципрокных пере-
вивок кожи на мышах конгенных линий.
Исходя из их одинакового фенотипического эффекта, гены
гистосовместимости принято обозначать одной и той же буквой —
Н (начальной от слова histocompatibility — гистосовместимость);
применительно к мышам их кратко называют также Н-гены. От-
дельные локусы (гены) гистосовместимости обозначают арабскими
цифрами, например, Н-1, Н-2, Н-3 и т. д. По-видимому, многие
Н-гены мыши являются комплексными, точнее — множествен-
ными аллеломорфами. В отличие от их обозначений у дрозофилы
и с учетом их одинакового фенотипического проявления (т. е.
приживления или отторжения трансплантатов), члены множе-
ственных аллелей гистосовместимости обозначают малыми бук-
вами алфавита в виде верхних экспонентов (показателей); на-
пример, Н-1а, Н-1ь, Н-1с и т. д. Наиболее сложный и сильный
локус гистосовместимости, Н-2, содержит не менее 20 идентифи-
цированных к настоящему времени аллелей, которые обозна-
чаются формулами Н-2а, Н-2Ъ, Н-2С и т. д.
* * *
Обратимся теперь к рассмотрению механизма наследования
Н-генов у мышей на примерах простейших скрещиваний,
а именно — многогибридного и дигибридного, предпослав не-
сколько замечаний относительно той особенности генов гистосов-
местимости, которая в рамках данного руководства до сих пор
не встречалась.
202
Отличительная особенность кодоминантных генов, к кате-
гории которых относятся гены гистосовместимости, заключается
в том, что они проявляют свое действие в гетерозигот-
ном состоянии и что для успеха трансплантации необходимо
наличие у реципиента всех тех аллелей (аллоантигенов), которые
есть у трансплантата. Так, например, гомозиготный трансплантат
Н-2а/Н-2а совместим как с таким же гомозиготным Н-2а/Н-2а,
так и с гетерозиготным хозяином Н-2а/Н-2ь. Равным образом,
гетерозиготный трансплантат Н-2а/Н-2ь совместим с таким же
гетерозиготным реципиентом Н-2а/Н-2ь, но несовместим с гомо-
зиготными реципиентами Н-27Н-23, или Н-2Ь/Н-2Ь, так как
он содержит аллель Н-2Ь, которого нот у хозяина Н-27Н-2а,
и аллель Н-2а, которого нет у хозяина Н-2}7Н-2Ь. В том и другом
случае гетерозиготный трансплантат Н-27Ы-2Ь будет отторгнут
в результате иммунологического ответа реципиента на чужерод-
ный аллоантиген, каковым является аллель Н-2Ь в первом слу-
чае и аллель Н-2а — во втором. Анализ моногибридного и дигиб-
ридного скрещиваний с участием генов гистосовместимости
и судьба трансплантатов обоих исходных родителей у реципиен-
тов F2 прямых и возвратных скрещиваний представлены в табл. 43
и 44.
Из анализа табл. 43 и 44 видно, что доля восприимчивых
особей в F2 от прямого скрещивания с участием одной и двух
пар генов соответственно составят 3/4 и (3/4)2, или 9/16. от общего
числа особей F2. В общей форме доля восприимчивых генотипов
в F2 от прямых скрещиваний выражается формулой (3/4)п, в ко-
торой п — число пар участвующих в скрещивании генов.
Доли восприимчивых генотипов среди бэккроссных
особей в мопогибридном и дигибридных скрещиваниях соответ-
ственно составят г/2 и (г/2)2, или 74, от общего числа особей F2.
В общей форме доля восприимчивости генотипов в бэккроссных
F2 выражается формулой в которой п — число пар уча-
ствующих в скрещивании генов. Пользуясь этими несложными
формулами, легко рассчитать доли восприимчивых генотипов
в F2 от прямых и возвратных скрещиваний для любого числа
пар генов. В процентном выражении они представлены в уже
знакомой нам табл. 39, из которой также видна зависимость между
числом Н-генов и процентом восприимчивых генотипов в прямых
и бэккроссных F2. Вот почему, повторяя сказанное на стр. 190,
можно подчеркнуть и здесь, что уже для 11—12 пар генов процент
восприимчивых генотипов в F2 от прямых скрещиваний
соответственно равен 4,2 и 3,1% и соответственно в 84 и 155
раз меньше — для бэккроссных потомств тех же поколе-
ний.
С установлением вышеприведенных законов проблема транс-
плантаций перестала быть областью хаоса и случайностей, не-
многих и большей частью кратковременных успехов и бесчислен-
203
ных разочарований. Отныне в ней появилась руководящая теория,
которая дала возможность планировать опыты па многие поко-
ления вперед и предвидеть их результаты с такой степенью точ-
ности, на которую не осмеливалась претендовать ни одна из мно-
гочисленных других трансплантационных теорий прошлого.
Таблица 43
Гены гистосовместимости. Анализ моногибридного скрещивания
11-2* г И-2Ь
РР: Q = X о —
* Н-2а II-2Ъ
Гаметы РР: J 1Г-211 $ ii-2b
т ф Н-2а
Fl: QQ и 66 =====
** П-2*
Прямое скрещивание
Плюсом в левых углах квадратов отмечены генотипы, восприим-
чивые к ткани одной родительской линии — Н-2а/Н-2а. В сумме они со-
ставляют 3/4 особей F2.
Плюсом в правых углах квадратов отмечены генотипы, воспри-
имчивые к ткани другой родительской линии — Н-2Ь/Н-2Ь. В сумме они
также составляют 3/4 особей F2.
Возвратное скрещивание
Плюсом отмечен генотип, восприимчивый к ткани родителя Н-2Ь/П-2Ь,
т. е. противоположного тому, от скрещивания с которым получено бэк-
кроссное F2. Такие особи составляют х/2 от общего числа особей F2.
То же справедливо в отношении другого родителя, т. е. Н-2Ъ/Н-2Ь, и
ткани противоположного родителя, т. е. Н-2а/Н-2а.
204
Таблица 44
Гены гистосовместимости. Анализ дигибридного скрещивания
РР: J Н-1а Н-2а хЗ. II-1* Н-2*
П-Р Н-2а Н-Р Н-2*
Гаметы: £: Н-1а Н-2а 3 п-1* Н-2*
• ОС, н - 11-1" 11-2“
• г ч 11 II-I* Н-21'
//рямсе скрещивание
Гаметы FJ:
3 \у 11-1“ П-2а Н-Р Н-2Ь П-1а П-Р 11-р Н-2а
П-1а П-2а 11-1“ 11-2“ ' П-Р П-2Ь Н-Р Н-211 П-Р П-2а
Н-1а П-2“ Н-Р 11-2:‘ Н-1" 11-2а 11-1» Н-2а
а- + 1- н-
Н-Р Н-2* Н-1а П-2а Н-1* Н-2Ь Н-Р П-2Ь П-Р Н-2»
Н-1* Н-2*“ Н-Р Н-2* П-Р Н-21’ Н-Р Н-2*
+ --L + -4- +
П-1а Н-2* П-Р П-2а П-Р П-2Ь Н-Р Н-2Ь Н-Р Н-2а
П-Р Н-21» П-Р II-2* Н-Р Н-2* Н-Р Н-2*
. |_ + + -I-
Н-Р 11-2а 11-1а Н-2а Н-Р Н-2Ь П-Р Н-2Ь П-Р Н-2а
Н-1” Н-2а Н-Р Н-2а П-Р Н-2а Н-Р Н-2а
+ + + +
Возвратное скрещивание
Гаметы
Р2 \F1 Н-Р 11-2“ Н-Р Н-2Ь П-Р Н-2* Н-Р П-2а
Н-1а Н-2а Н-1а Н-2“ Н-Р Н-2Ь Н-Р Н-2* Н-Р Н-2»
И-1а 11-2“ Н-1а Н-2а Н-Р Н-2а Н-Р Н-2а
+
Прямое скрещивание
Плюсом в левых углах квадратов отмечены генотипы, восприим-
чивые к ткани одной родительской линии — П-Р/Н-Р Н-2а/Н-2а. В сумме
они составляют (3/4)2 = е/10 особей F2.
205
Плюсом в правых углах квадратов отмечены генотипы, восприимчи-
вые к ткани другой родительской линии — П-1ь/П-1ь Т1-2Ь/П-2Ь. В сумме
они также составляют (3/4)2 = 9/1б особей F2.
Возвратное скрещивание
Плюсом отмечен генотип, восприимчивый к ткани родителя
Н-1Ъ/Н-1Ъ Н-2Ь/Н-2Ь, т. е. противоположного тому, от скрещивания с ко-
торым получено бэккроссное F2. Такие генотипы составляют (1/2)2 = 1/4
особей F2. То же справедливо в отношении другого родителя, т. е.
H-lb/H-lb П-2Ь/Н-2Ь, и ткани противоположного родителя, т. е. Н-1а/Н-1а
Н-2а/П-2а.
ИДЕНТИФИКАЦИЯ ОСНОВНОГО ЛОКУСА
ТКАНЕВОЙ СОВМЕСТИМОСТИ, Н-2
Опыт Горера, Лимана и Снелла
В предыдущем изложении генетических основ гистосовмести-
мости речь шла о их внешней, формальной, стороне, базирующейся
на прослеживании судьбы злокачественных и нормальных тка-
ней, трансплантированных как на исходные, родительские, формы,
так и на их гибридов разных поколений.
Началом нового периода, связанного с идентификацией от-
дельных локусов гистосовместимости и выяснением механизма
их действия, надо считать исследования Горера, выполненные
в Англии [33, 34, 35]. Этот автор представил первое и несомненное
доказательство того, что аллоантигены вызывают у реципиента
образование гуморальных антител и что сыворотка мышей, у ко-
торых рассосалась перевитая саркома мышей линии А, агглюти-
нирует эритроциты мышей этой линии. Иначе говоря, Горер впер-
вые установил связь между отторжением трансплантатов и на-
личием агглютининов в сыворотке животных-нуллеров и таким
образом показал существование, по крайней мере, одной антиген-
ной системы, общей для опухолевых и нормальных клеток линии,
в которой данная опухоль возникла. Этот антиген был обозначен
Горером как антиген II.
Следующим важным этапом в развитии этой линии исследова-
ний был совместный опыт Горера, Лимана и Снелла [36], в котором
им посчастливилось обнаружить сцепление антигена II групп
крови, открытого Горером, с геном Fused (Fu) и таким путем
нанести на карту хромосом мыши первый ген (локус) гистосов-
местимости. Ген Fu локализован в IX хромосоме мыши и вызы-
вает штопорообразную форму хвоста. Этот ген — доминантный,
нелетальный в гомозиготном состоянии. Схему этого опыта необ-
ходимо рассмотреть подробнее, поскольку, помимо его большого
теоретического значения, он был потом положен в основу одного
из методов идентификации генов гистосовместимости.
206
Как неоднократно было показано выше, традиционными для
исследования генетики гистосовместимости того времени был
гистогенетический метод, а именно — скрещивания и дифферен-
циация восприимчивых и резистентных генотипов в расщепляю-
щихся поколениях на основе результатов трансплантации им опу-
холей. С этой точки зрения, опыт Горера, Лимана и Снелла был
также типичным; его генетическая схема представлена в табл. 45.
Г а б л и ц а 45
Схема и результаты опыта по обнаружению сцепления между
антигеном II Горера и геном Fused.
По Снеллу [85]. Модифицировано
РР: Fli/FuXA/A
F1: Fu/A
>ХР/Р
Фенотипы мышей Количе- ство Конкордантные Дискордантные
агглют. 4- восприим. агглют. — резист. агглют.4- резист. агглют. — восприим.
Fused 16 0 16 0 0
Нормальные 18 16 0 1 1
Обозначения: Fu— ген Fused; А — линия; Р — Р2 родитель; плюс —
реакция агглютинации положительная, минус — реакция отрицатель-
ная.
Для опыта были взяты мыши A, Fused и мыши третьей линии,
произвольно обозначенные в таблице буквой Р. Ими, вообще
говоря, могли быть любые мыши, но с одним условием — они
должны были быть неродственны двум первым. Кроме того,
как всегда в таких опытах, всем мышам F2 была перевита опухоль,
нзогеничная линии А. Поэтому мыши Fused и Р были к ней ре-
зистентны.
Однако две важные особенности рассматриваемого опыта
отличали его от в с е х предыдущих. Одна из них за-
ключалась в том, что в качестве одного исходного родителя были
взяты мыши Fu со штопорообразными хвостами. Ген этой осо-
207
бенности был взят в качестве маркера IX хромосомы. Его
выбор был, конечно, чисто случайным (см. также стр. 218).
Другой важной особенностью опыта явилось использование
иммунологического метода дифференциации мышей
F2 по генотипам, а именно — гемагглютинации их эритроцитов
специфической сывороткой против опухоли А.
Обратимся теперь к табл. 45. Как видно, гибриды F1 были
получены от скрещивания мышей Fu и А и, в свою очередь, были
скрещены с мышами Р, для получения F2. Нетрудно видеть, что
это скрещивание представляло собой разновидность возврат-
ного, или аналитического, как по отношению к до-
минантному гену Fu (поскольку мыши F1 были по нему гетеро-
зиготны, а мыши Р его не имели), так и по отношению к гену вос-
приимчивости к опухоли А (мыши F1 были по нему гетерозиготны,
а мыши Р его не имели ввиду неродственности с мышами А).
На решетке Пеинета табл. 45 представлены два генотипа мышей
F2. Половина из них — Fused. Они гетерозиготны по этому гену
и резистентны к опухоли А. На решетке табл. 45 они обозначены
минусом в левом углу квадрата.
Другая половина мышей F2 — фенотипически нормальные.
Они восприимчивы к опухоли А; на рештке табл. 45 это условие
обозначено плюсом в левом же углу соответствующего
квадрата.
Перед инокуляцией мышей F2 опухолью А у них была взята
кровь, эритроциты которой испытывали затем в реакции гемаг-
глютинации. Для получения антисыворотки против опухоли А
несколько мышей C57BL заблаговременно было инокулировано
опухолью А, и после того, как перевитые им опухоли рассоса-
лись, из крови этих мышей была приготовлена антисыворотка.
В правых углах обоих квадратов решетки плюсом или ми-
нусом генотипы мышей обозначены в соответствии с поведением
их эритроцитов в реакции гемагглютинации. Наконец, отдельно
(внизу) приведены результаты одного такого опыта, т. е. коли-
чество и фенотипы мышей, их реакция на перевивку опухоли
и их эритроцитов — в опыте с агглютинацией.
Как видно из таблицы, все 16 мышей Fused оказались резистент-
ными к опухоли, а их эритроциты не агглютинировались сыворот-
кой ’ C57BL против опухоли А.
В противоположность мышам Fused, из 18 мышей с нормаль-
ными хвостами 16 оказались восприимчивыми к опухоли А, а их
эритроциты агглютинировались антисывороткой против опухоли А.
Иначе говоря, 32 мыши из 34 оказались конкорда и т-
н ы м и в отношении всех трех особенностей,
которые вели себя так, как если бы они определялись одним и
тем же геном.
Две другие мыши, обе с нормальными хвостами, оказались
дискордипантиыми в отношении их реакции па опухоль м их
208
эритроцитов — в реакции гемагглютинации: одна из них пала
с опухолью, но с отрицательной реакцией агглютинации, другая
была резистентна к опухоли, но се эритроциты агглютинировались
противоопухолевой сывороткой C57BL.
Для объяснения причин возникновения двух дискордантных
мышей можно было высказать несколько предположений. Но наи-
более вероятным из них был перекрест между геном, определяю-
щим наличие или отсутствие антигена II, и геном Fu. И действи-
тельно, вскоре это предположение было доказано прямым путем;
в результате перекреста в данном районе была получена линия
мышей, у которых оба эти гена были локализованы в одной хромо-
соме. Используя мышей этой линии, отныне опыты, аналогичные
только что рассмотренному, оказалось возможным аранжировать
так, что мыши Fused стали восприимчивы к опухоли, а нормаль-
ные мыши — резистентны. Иначе говоря, были созданы линия
мышей и схема опыта, противоположные тем, которые приведены
в табл. 45. Эта схема была положена в основу одного из основных
методов идентификации аллелей локуса Н-2 и других локусов
гистосовместимости, получившего название метода сце-
пления, или метода* маркеров (см. ниже).
Таким образом, проблема гистосовместимости обогатилась
следующими новыми фактами и вытекающими из них выводами:
1. Исследуемый фактор гистосовместимости и ранее открытый
Горером антиген II эритроцитов определяются одним и тем же
локусом хромосомы, т. е. един ы м фактором (геном).
2. Этот локус отныне получил название Н-2, в котором нашли
отражение как его комплексная природа (тканевая совместимость
и антиген II групп крови), так и синтез двух направлений исследо-
ваний, которые, развиваясь независимо друг от друга, привели
к одному и тому же локусу IX хромосомы.
3. На карту IX хромосомы мыши был нанесен первый
ген гистосовместимости, Н-2, на расстоянии приблизительно
5 единиц от гена"Fused.
Анализ локуса Н-2.
Метод сцепления (маркеров)
Рассмотрим теперь метод сцепления, или метод маркеров,
о котором речь шла в предыдущем разделе. Как будет видно
из дальнейшего, при помощи этого метода раньше всего было
выяснено сложное строение локуса Н-2, а затем были открыты
и некоторые другие локусы гистосовместимости, локализованные
в других хромосомах мыши.
В основу метода была положена следующая общая формула
скрещиваний [83, 97]:
(МуТ) ;N,
209
[4 Н. И. Ме,1,вс,1 (‘г.
в которой М и N — две любые инбредные линии, а Т — любая
линия с маркирующим геном в IX хромосоме. Кроме гена Fu,
такими маркирующими генами могут быть также Т (доминантная
короткохвостость, или брахиурия), или Ki (доминантная узова-
тость хвоста); оба эти гена локализованы также в непосредствен-
ной близости от Fu и Н-2. Допустим, что в рассматриваемой общей
схеме таким маркирующим геном является ген Т — доминантной
короткохвостости. Гибридов F2 от этого двойного скрещивания
инокулируют опухолью т, изогеиичной линии, находящейся
в положении М.
Нетрудно видеть, что скрещивание типа (MxT)xN есть не что
иное, как обобщение схемы опыта Горера, Лимана и Снелла,
о котором речь шла выше и которое является возвратным по отно-
шению к обеим рассматриваемым особенностям мышей.
Если формулой Н-2т обозначить аллель Н-2 линии М, буквой
Т — ген доминантной короткохвостости, а плюсом — его нормаль-
ный аллель, то любое конечное скрещивание по вышеприведенной
формуле и результаты перевивки мышам F2 опухоли ш, изогенич-
ной линии М, будут удовлетворять одному из следующих пяти
случаев:
MXT(F1)XN
1. (II-2m-|_/H-2mT)
2. (H-2m+/H-2xT)
3. (II-2m+/H-2mT)
4. (H-2m-|-/H-2nT)
5. (H-2m+/H-2*T)
x’ II-2in-]-/II-2rn
X H-2"4-/H-2H--
X H-2U | /П-2и -|-
X Н-2» И-/П-2* -|-
X H-2n+/H-2" -|-
Вытекающие из каждого скрещивания выводы приведены
в табл. 46. На их основе были сформулированы две теоремы, как
основа метода, о котором идет речь:
1. Наличие сцепления между М и Т говорит, что
линии Т и N содержат аллель, отличающийся от аллеля
линии М (случаи 4 и 5).
2. Отсутствие сцепления между М и Т с большой
долей вероятности говорит о том, что линии М и N, или М и Т,
несут один и тот же аллель локуса Н-2 (случаи 1—3).
Чтобы не усложнять дальнейшее описание метода, мы опускаем
подробное рассмотрение возможных в опытах 1—5 кроссоверов
и их влияние на результаты: в одних случаях они будут подобны
некроссоверам и не отразятся на результатах опыта; в других —
их можно отличить по фенотипу и по восприимчивости к переви-
ваемой опухоли (табл. 46). О некоторых исключительных случаях
из этого метода будет сказано ниже в связи с рассмотрением явле-
ния комплементарное™ локусов гистосовместимости (стр. 220).
Таким образом, повторяя опыты с разными инбредными ли-
ниями в разных комбинациях, можно идентифицировать возмож-
210
Таблица 4l>
Аналитические скрещивания по идентификации аллелей локуса Н-2 с последующей прививкой мышам F2
опухоли ш, находящейся в положении М (метод сцепления)
По Снеллу [83, 97]
№ п'п Родительские линии F1 F2 Вывод
М т N некроссоверы кроссоверы
нормальные коротко- хвостые нормальные коротко- хвостые
1 Н-21 2 3» -% Н-2111 Т н-21»-;- Н-2т 4- Н-21» 4- Il-2m Т Такого строения м = \ т
п-21» н- Н-21» Т 11-2*** -J- Н-2т Т Н-21» 4- Н-21» -%
2 Н-2® -4- Н-2* Т Н-2111-!- Н-2т 4- Н-2111 4- 11-2* Т 11-2х Н-2111 Н-21» Т Н-2® + x\I = N Т
Н-2111 4- Н-2* Т 11-21» 4- Н-2* Т Н-21" + Н-2111 4-
3 Н-21» 4- Н-2111 Т Н-211 Н-2т 4- Н-21» Т Н-2»1 4- Н-2» 4- Н-21» Т Н-2» 4- Такого ;ке строения М = Т N
Н-21» 4- Н-2111 Т Н-2» 4-
4 Н-21»-4 Н-2111 Н-2» Т Н-2» Т Н-211 4- Н-2»}- Н-2т4- Н-2» Т Н-21»-4 Н-2» 4- *Н-2» Т Н-2» 4- *Н-2» 4- 11-2» 4- H-2m Т Н-2» 4- м 4= Т = N
5 Н-2111 4- Н-2* Т Н-2»-4 Н-2т4- Н-2* Т Н-2т4- Н-2» 4- *Н-2*Т Н-2» 4- *11-2* 4- Н-2» 4- Н-21» Т Н-2» 4- М 4 Т 4 N
Н-21» 4- Н-2* Т Н-211 4-
1. Все мыши F2 несут аллель Н-2 и потому восприимчивы к опухоли т. При отсутствии в той же хромосоме второго локуса
гистосовместимости сцепления между Т и восприимчивостью нет. При наличии других расщепляющихся локусов возникающие рези-
стентные мыши распределятся поровну между нормальными и короткохвостыми. Вывод: линии М, Т и N содержат один и тот же
аллель Н-2.
2. Все мыши F2 несут 1?аллель Н-2111 в гомозиготном или гетерозиготном (Н-2х/Н-2т) состоянии и потому восприимчивы к опу-
холи ш. Вывод: если МиТ несут разные аллели Н-2 (см. § 4 и 5) и нс обнаруживают сцепления, то М и N, вероятно, несут
один и тот же аллель Н-2.
3. Все мыши F2 несут аллель Н-2111, восприимчивы к опухоли m и не обнаруживают сцепления между Т и восприимчивостью.
Вывод: если М и N несут разные аллели (см. § 4 и 5), то отсутствие сцепления указывает, что М и Т несут один и тот же
аллель Н-2.
4 и 5. За исключением возможных кроссоверов, нормальные мыши F2 (30%) восприимчивы к опухоли ш, а все короткохвостые
(тоже 50%) — резистентны. Между МиТ имеет место сцепление. Вывод: в первом случае М содержит аллель, отличающийся от оди-
наковых аллелей Т и N, во втором — все три линии несут разные аллели Н-2.
Одинаковые аллели обозначены значком =, разные — значком
Резистентные к опухоли мыши обозначены звездой к ой.
ные новые аллели локуса 14-2, наличие которых постулировал
Горер на основании иммунологических исследований (цитировано
по Спеллу 187а]).
В дальнейшем метод сцепления был использован для иденти-
фикации других локусов гистосовместимости, о чем будет сказано
ниже.
При помощи этого метода уже к 1953 г. было найдено, что
локус Н-2 представляет собой множественную аллеломорфу.
К указанному времени было доказано наличие пяти аллелей ло-
куса Н-2 (H-2dk, I4-2d, H-2k, H-2b, H-2p) и их распределение у мы-
шей ряда инбредных линий. Каждый из этих аллелей определяет
наличие определенного антигенного компонента (аллоантиге-
на), ответственного за приживление или отторжение трансплан-
тата [83, 94, 97].
Компонентный метод
Интересная особенность в отношении локуса Н-2 была уста-
новлена у мышей линии Л. Оказалось, что в отличие от мышей
других линий, мыши А характеризуются наличием не одного,
а двух антигенных компонентов — d и k (H-2dk), вследствие чего
они оказались восприимчивыми к опухолям мышей тех линий,
у которых эти компоненты существуют раздельно, например,
у мышей DBA/2 или BALB/c с аллелем H-2d ц у мышей C57BR
с аллелем Н-2к. В соответствии с этим гибриды F1 от скрещивания
мышей с компонентами d и к оказались восприимчивыми к опухо-
лям, изогеничным линии А, поскольку у них компоненты d и к
воссоединяются и воспроизводят генотип мышей линии А. Эта
особенность мышей А была выгодно использована для анализа
локуса Н-2, а основанный на ней метод анализа получил название
компонентного [83, 97]. В одном из относящихся сюда
опытов [97] этим методом было исследовано 28 гибридных комби-
наций восьми линий на 189 мышах F1 строения H-2d/H-2k. Из них
выжила лишь одна мышь, а 188 пали с опухолями (в данных опы-
тах был использован штамм перевиваемой опухоли 15091а).
Необходимо при этом подчеркнуть, что первоначальная класси-
фикация линий, о которых идет речь, в отношении аллелей d и к
была выполнена методом сцепления, и что результаты, получен-
ные двумя независимыми методами — сцепления и компонент-
ного — оказались в полном согласии.
Кроме рассмотренных выше основных методов идентификации
локусов гистосовместимости — сцепления и компонентного — был
разработан еще один метод, а именно — метод Fl-гибридов, кото-
рый, наряду с двумя другими, широко используют в современных
исследованиях. Поскольку, однако, применение этого метода
связано с использованием мышей конгенных линий, его методиче-
скую сторону удобнее будет рассмотреть после ознакомления
с конгенными линиями.
212
ИДЕНТИФИКАЦИЯ СЛАБЫХ ЛОКУСОВ
ГИСТОСОВМЕСТИМОСТИ
Теперь нам необходимо устранить некоторое кажущееся про-
тиворечие между сказанным о локусе Н-2 в предыдущих разделах
и результатами ранних исследований проблемы гистосовмести-
мости, свидетельствующими о полигенной природе явления.
В самом деле, все исследования раннего периода проблемы
говорили о том, что восприимчивость или резистентность к транс-
плантатам определяется многими или, по крайней мере, несколь-
кими, однозначно влияющими генами. С другой стороны, опыты
по обнаружению локуса Н-2 и выяснению его комплексной при-
роды могли создать впечатление, что все они исходили из наличия
единственного гена гистосовместимости, Н-2, игнорируя все
другие.
Действительно, исходные опыты по идентификации и локали-
зации локуса Н-2 можно было осуществить не иначе как на фоне
влияния всего комплекса локусов гистосовместимости. Однако
достоверность заключения о наличии локуса Н-2 была в этих
опытах обусловлена его особым местом среди других локусов
гистосовместимости, о чем будет сказано ниже. Вместе с тем поли-
факториальная природа рассматриваемого явления не была
забыта; она давала о себе знать непосредственно в самих этих
опытах. Например, опухоль С1498, изогеничная линии G57BL/6,
отторгалась у всех мышей линии LP, несмотря на то, что в данном
случае донор и реципиенты содержали один и тот же аллель
локуса Н-2, а именно — Н-2Ь. Были известны и многие другие
примеры несовместимости трансплантатов с их изогеничными
реципиентами [85].
Подобные исключительные случаи лишний раз говорили
в пользу полифакториальной природы гистосовместимости и ука-
зывали на существование генов, отличающихся от локуса Н-2
по силе их действия на процессы приживления и отторжения
трансплантатов. С этой точки зрения локус Н-2 следовало от-
нести к «сильным» (впоследствии так оно и оказалось): антиген-
ное различие между опухолью и хозяином по этому локусу препят-
ствовало росту всех, даже самых злокачественных опухолей;
различие же по аллелям других, более слабых локусов в ряде слу-
чаев не являлось непреодолимым барьером для их прогрессивного
роста [85, 87, 96].
Для детального исследования постулированных «слабых» ло-
кусов (генов) тканевой совместимости потребовалось создание
более совершенных экспериментальных моделей, нежели просто
высокоинбредные животные, которые были использованы в опытах
до тех пор. Генотипы инбредных мышей нужно было расчленить
по совершенно новому принципу, который дал бы возможность
рассредоточить, по возможности, все локусы гистосов-
213
мсстимости поодиночке, в отд е л ь и ы х л и н и я х,
и изучить силу и характер влияния каждого из них в отдельности
и во взаимодействий друг с другом. Отсюда начинается новый
этап исследования проблемы гистосовместимости, который, образно
выражаясь, можно назвать «генеральным наступлением» на слабые
локусы гистосовместимости.
Конгенные резистентные линии
В основу исследования слабых локусов гистосовместимости
был положен принцип использования для опытов мышей так на-
зываемых к о н г е и н ы х резистентных линий.
Главная и отличительная особенность попарно конгеппых линий
заключается в том, что они и д е н т и ч н ы, тождестве н-
н ы, или к о н г е н н ы друг другу, за исключением какого-либо
одного гена (локуса) тканевой совместимости. Такие генетические
системы создаются во всех тех случаях, когда сравнение орга-
низмов, отличающихся по какому-либо одному гену (признаку)
желательно, или даже необходимо, произвести в условиях их
максимального генетического тождества
(см., например, [6]).
На рис. 36 приведена схема выведения линии C57BL/10—H-2d,
конгенной линии G57BL/10 с аллелем Н-2Ь. Программа скрещива-
ний начинается с того, что мышей исходных линий C57BL/10
(генотип Н-2Ь/Н-2Ь) и DBA/2 (генотип H-2d/H-2d) скрещивают
между собой (кросс). Гибридов F1 (генотип H-2b/H-2d) скрещивают
между собой (интеркросс) для получения гибридов F2. По дости-
жении 1,5—2-месячного возраста всем мышам F2 перевивают
опухоль, изогеничную линии C57BL/10, т. е. Н-2Ь/Н-2Ь. В резуль-
тате все восприимчивые к опухоли мыши, генотипов Н-2Ь/Н-2Ь
и H-2b/H-2d, погибнут, а резистентные к ней мыши, генотипа
H-2d/H-2d, выживут.
Отобранных в F2 резистентных мышей вторично скрещи-
вают с мышами G57BL/10 (кросс), гибридов F3 скрещивают между
собой (интеркросс), а всем мышам F4 снова перевивают опухоль
для того, чтобы снова отобрать резистентных мышей и в т р е-
т и й раз скрестить их с мышами C57BL/10 (кросс) и т. д.
Вышеописанные циклы повторяют семь раз. Отобранных
в F14 резистентных самцов и самок скрещивают между собой;
эти мыши и будут исходными для конгенной линии C57BL/10—
H-2d.
В результате семикратных скрещиваний с мышами основной
линии, C57BL/10, и отбора в четных поколениях мышей, рези-
стентных к опухоли этой линии, мыши основной линии и линии
C57BL/10—H-2d генотипически будут идентичны, за исключением
локуса Н-2, различие по которому обусловит резистентность мы-
шей данной пары к перекрестным перевивкам опухолей и кожи.
214
Отсюда они и получили название конгенных рези-
ст е н т н ы х (кратко — GR). Расчеты показывают, что в резуль-
тате выполнения описанной программы скрещиваний остаточная
доля исходного генотипа DBA/2 у мышей C57BL/10—H-2d не
превышает 1,5—2?6.
РР
F1
F2
F3
FQ
F14
C57BL/1O
PFKI2
C57BL/lO~H~2a = C57BL/lO.DBA/2=
= В10. D2
C57BL/1O
опухоль
Рис. 36. Схема скрещиваний и трансплантаций опухоли
по выведению конгенных линий
По Снеллу [85]. Модифицировано. Объяснение в тексте
В обозначении конгенных линий существует следующее пра-
вило: на первом месте ставят обозначение линии, на генетическую
основу которой перенесен данный ген гистосовместимости; в дан-
ном случае — это линия C57BL/10. На втором месте ставят обо-
значение линии, ген несовместимости которой перенесен на гене-
тическую основу линии G57BL/10; в данном случае это была ли-
ния DBA/2. Обозначения той и другой отделяют точкой. Таким
образом, полная формула новой линии, конгенной C57BL/10,
будет такова: C57BL/10.DBA/2. Наконец, следуя принятым сокра-
щениям стандартных линий (в данном случае C57BL/10^=B10
215
и DBA/2 D2)[99], линию, о которой идет речь, нужно обозна-
чить так: B10.D2.
В заключение необходимо отметить, что в тех случаях, когда
конгенные линии поддерживают длительное время, их генетиче-
ское «сближение» с соответствующими основными линиями (кото-
рые поддерживают обычным методом инбридинга), или конгени-
зацию, необходимо периодически, -через 10—20 поколений, по-
вторять вышеописанным способом во избежание дивергенции
в результате мутаций [91].
Для тех целей, о которых идет речь, рассмотренная схема
выведения конгенных линий впервые была применена Снеллом
в 1947 г. [82, 85]. Впоследствии она была модифицирована в двух
отношениях: система кросс—интеркросс Снелла была заменена
системой повторных бзккроссов, а перевивка опухоли для отбора
резистентных к ней генотипов заменена перевивками кожи (обычно
с хвоста на спину) [2, 28]. Схема этого метода конгенизации при-
ведена на рис. 37. Операции перевивки кожи, конечно, более
трудоемки; зато для достижения необходимой степени конген-
ности требуется пропустить вдвое меньшее число поколений
(сравни рис. 36 и 37).
Если сама идея использования для данной цели конгенных
(или как они первоначально назывались, изогенных, несколько
позже — коизогенных) линий и не была нова (см., например, 16]),
то масштабы связанной с ее осуществлением работы были поистине
внушительны. В 1947 г. Снелл одновременно начал выведение
125 конгенных линий [87], используя в качестве генетического
фона, или основы, многие известные и к тому времени достаточно
изученные линии и сублинии мышей и штаммы ряда апробиро-
ванных перевиваемых опухолей.
Практическое осуществление любого опыта, всегда оказывается
более сложным, чем его проект. Поэтому вполне понятно, что
в процессе выведения конгенных линий некоторая их часть по
той или иной причине была утрачена, другая часть выбракована
сознательно, поскольку уже в процессе работы над ними было
видно, что они являются простыми повторениями других, и т. д.
* В дальнейшем, однако, по мере исследования конгенных линий
неоднократно возникала необходимость в выведении все новых и
новых линий для разных целей и на разной генетической основе.
Согласно последним данным [93], общее число выведенных кон-
генпых линий достигает 200. Для любителя статистики, несом-
ненно, представит интерес оценить, хотя бы приблизительно,
общий объем этой подготовительной работы и количество затра-
ченных мышей, не говоря уже о безупречности организации работы
в целом, строгой ритмичности и согласованности всех операций
и т. Д.
И ' Из указанного числа выведенных конгенных линий 75 были
использованы для идентификации девяти локусов гнстосовмести-
216
C57BL/1Q
DBA/2
Кожа
Рис. 37. Схема скрещиваний и трансплантаций кожи
по выведению конгенных линий
По Блиссу и Егорову [2, 28]
Объяснение в тексте
мости, а также отдельных аллелей разных локусов и особенно
локуса Н-2 [93]. Из них в настоящее время на размножении на-
ходятся мыши около 50 конгенных линий; их интенсивно исполь-
зуют для текущих опытов и отпускают в другие лаборатории.
Список этих линий опубликован в [91].
Методы анализа конгенных линий
После того, как выведена группа конгенных резистентных ли-
ний на единой или разных инбредных основах, встает вопрос иден-
тификации локусов гистосовместимости, по которым линии могут
отличаться друг от друга. Две или несколько конгенных линий
от одного и того же исходного скрещивания могут быть различны,
но могут быть и идентичны. Они могут отличаться как по р а з-
217
и ы м локусам гистосовместимости, так и по рази ы м
а л л е л я м одного и того же локуса, например Н-2. Процедура
выведения конгенных лиши! лишь селектируй т локус плп
аллель локуса и переносит его на избранную инбредную основу,
но ничего не говорите том, какой это локус, плп его
аллель, где он локализован и т. д. Ответы на эти вопросы могут
быть получены в результате анализа при помощи частично уже
известных нам гистогенетических и некоторых новых методов
анализа, к краткому рассмотрению которых мы сейчас и пе-
рейдем.
Основными в анализе конгенных линий по-прежнему остаются
три гистогенетических метода, а именно — сцепления, Fl-гибри-
дов и компонентный; последний из них используется в более огра-
ниченном числе случаев. Кроме них, большое развитие и приме-
нение получил также метод серологический, играющий важную
роль в анализе строения аллоантигенов аллелей, составляющих
множественные серии типа Н-2.
Метод сцепления
Как было показано выше, исходным в развитии метода сцепле-
ния, или метода маркеров, был опыт Горера, Лимана и Снелла [36],
в котором было установлено сцепление первого локуса гистосов-
местимости, Н-2, с геном Fused. Использование гена Fu в качестве
маркера одной из хромосом мыши было в этом опыте случайной
удачей, как случайной удачей был, например, выбор Менделем
тех особенностей растений гороха, на которых он разработал
законы наследственности. Впоследствии, однако, этот метод стали
использовать с большей уверенностью в успехе, поскольку уже
в процессе выведения конгенных линий стало очевидным сцепле-
ние некоторых локусов гистосовместимости с генами внешних
особенностей мыши вроде вышеупомянутого гена Fused. В ряде
случаев родители конгенных линий обладали генами с видимым
проявлением и, как потом оказалось, сцепленными с генами
гистосовместимости. Введение гена гистосовместимости в избран-
ную инбредную основу вводит также и соответствующий марки-
рующий ген, вследствие чего в последующих интеркроссных поко-
лениях связь гена-маркера с невосприимчивостью к опухоли ста-
новится очевидной визуально. Очевидно, что все такие гены можно
было использовать как маркеры. При помощи таких генов-мар-
керов были идентифицированы локусы Н-1, Н-3 и Н-4 [98];
относящиеся сюда данные суммированы в табл. 47.
Заключительными в рассматриваемом методе являются опыты
по определению частоты перекреста (расстояний) между иденти-
фицированными локусами гистосовместимости и соответствующими
генами-маркерами. Для локализованных до сих пор локусов эти
данные можно найти на картах хромосом мыши (рис. 38).
218
Vi VII VIII IX X
хи xiii xiv xv xvi xvii xviii xix xx
IV V
XI
• 3 -Ra -Is 5 -Lp
3 9 21 2_ 4 2“ 1 ~ 11 12 5 5 -// -О| 16 JHbb] -shl -с 4 7 5 Р -*2- 4 7 -qv -da 7 -ри -CW -In -td d ' -se_ ~sv -ik -Trj 29 ]’ 18 r 4 2. -pri -5 -flg hr -wL -Ds 10 5 17 10 7 I9 9 -r -eb -si -SI -Pg -av -g» 18 1 = 5 5 i: 3 lz 4 21 8 kr =:bp . a /15 . -un dm -we zmg .pa -ro H3~ ~ld -fi -stb L l:: 7 Sha -N. -Ca -hl -bt 1 4 6 I4 2' 27 'Re -oe 5 4 3 ~vt T sh-2] 18 -wa-2 m -Pt -b wi -VC -an -pf -wd 1 = 7 E 7 15 -Tla -U-2 Ss .'/] -T 18 -gr -V -Ji 3 2“ 3‘ 4 17 -mi -PX -wa-1 -tc -Lc 2~ -ob 4 22 5 ~eP 5 -ru 21 15 -py -dr 5 6 -Dh\ 18 -In -Sp - 11 4 -dt 9 -is -pe J Lw ~ch xt' cr ~bg- "5a 27 Tw _ ~ax 28 -nia -Va -de Iz 1 8 13 1 = 2- 16 4 12 jg- uz"| -Ph\ 'Pi -Hm\ -rl 38 11 So Osl •^J -Esl -Hk 7 4 4 17 23 .Bn St. -sla ~Ta -Bit Mo To -ip -si
-dy 14 -A
-Sd
III IV V
VI VII VIII IX X
XI XII XIII XIV XV XVI XVII XVIII XIX XX
Рис. 38. Карты хромосом мыши
Курсивом обозначены гены, локусы которых определены точно. Прямым шрифтом — гены, порядок которых в хромосоме определен не-
точно. Скобки означают, что порядок заключенных в них генов не определен. Цифры слева — проценты перекреста. По Грипп [41]
Табл и ц а 47
Четыре локуса гистосовместимости, идентифицированные
методом сцепления с генами внешних особенностей
По Снеллу и Стимпфлингу [98]
Инбредная линия (основная) Конгенный рези- стентный партнер Ген-маркер, вводимый с резистент- ностью Группа сцепле- ния Идентифи- цирован- ный локус
СЗН G3H.K с I Н-1
C57BL/10 В10.129 (5М) с I Н-1
» В10.С (41N) с I П-1
» B10.LP Aw V Н-3
» В10.129 (21М) Р 1 1 Н-4
А A.GA Fu 1X2 Н-2
’ Дальнейшие опыты показали, что локусы Н-1 и Н-4 находятся
I группе сцепления, но занимают разные положения.
2 Идентифицирован в опыте Горера, Лимана и Снелла [36].
Метод F1-гибридов
Любую конгенную пару линий, например, А и А.В, с дифферен-
циальными аллелями Н-па и Н-пь можно использовать для анализа
любой другой линии N неизвестного строения в отношении алле-
лей Н-па и Н-нь. В первом случае, т. е. по отношению к аллелю
Н-па, Fl-гибридов получают скрещиванием A.BxN и ипокули-
руют их опухолью, изогеничной линии А. Гибриды F1 наследуют
от мышей А.В все гены линии А, необходимые для роста опухоли
А, кроме гена Н-па. Если анализируемая линия N привносит
гибридам ген Н-па, недостающий для роста опухоли А, они будут
восприилмчивы к опухоли. Напротив, если линия N не содержит
гена Н-па, гибриды F1 будут резистентны к опухоли (за одним
исключением — см. ниже). Таким образом, невосприимчивость
гибридов F1 к опухоли А будет говорить о том, что анализируемая
линия — не Н-па, в то время как восприимчивость гибридов F1
будет свидетельствовать, что линия N, вероятно, но не оконча-
тельно, есть Н-па.
Для типизации линии N в отношении локуса Н-нь опыт ставят
в обратном порядке, т. е. линию А используют как родителя
для получения гибридов F1, а линию А.В — как донора тести-
рующей опухоли.
Вышеупомянутое исключение возникает тогда, когда некото-
рые локусы гистосовместимости определяют два или несколько
антигенных компонентов (специфичностей). Например, если три
аллеля (или псевдоаллеля) линий А, А.В и N определяют соответ-
ственно компоненты АВ, АЬ и аВ, тогда гибриды строения АЬ/аВ
220
будут восприимчивы к опухоли АВ/АВ даже в том случае, если
линии N и А содержат разные аллели данного локуса. В этом слу-
чае анализируемая линия N привносит гибридам F1 пе весь ал-
лель, присутствующий у мышей А, а лишь тот его компонент, или
компоненты, которых нет у мышей линии А.В [89].
В настоящее время известен по крайней мере один случай пол-
ной комплементации аллелей [97]. Насколько это явление рас-
пространено — сказать трудно, но если в локусах гистосовмести-
мости со множественными аллелями оно встречается редко, то
частичная комплементация аллелей представляет собой общее
явление. Следовательно, независимо от метода иден-
тификации аллелей, экспериментальные данные, свидетельствую-
щие о их различии, более достоверны тех данных, которые
говорят об их идентичности [98].
В опытах с использованием Fl-гибридов для получения надеж-
ных результатов необходимо соблюдение некоторых определенных
условий [88]. Прежде всего, конгенные линии должны предпола-
гать высокую степень конгенности, т. е. давать четкие результаты.
Во-вторых, важно учитывать силу действия разных локусов гисто-
совместимости и необходимость предварительной иммунизации
гибридов F1, особенности опухолевого инокулята, способ его
введения и возраст гибридов. В-третьих, иметь в виду, что разные
опухоли, или даже одна и та же опухоль в разное время не обя-
зательно дает одинаковые результаты, что также требует сопро-
вождения опытов соответствующими контролями [89].
Наконец, не утратил своего значения и метод компонентный,
хотя он имеет более ограниченную сферу применения, будучи
ограничен лишь двумя компонентами локуса Н-2, а именно —
d и к. Отметим попутно, что эти компоненты раздельно существуют
у мышей ряда линий, в то время как оба они присутствуют лишь
у мышей А с аллелем Аа (см. табл. 49).
Что касается серологического метода анализа аллелей на основе
использования антисывороток, то в принципе он идентичен методу,
которым пользуются в исследованиях групп крови у человека.
Заинтересованный читатель может ознакомиться с ними по исчер-
пывающим методическим сводкам Бойса, Оулда и Чурулинкова [29],
Мишеля [70], Оуэна’[73], г Пэйна [74], Стимпфлинга [101],
Стимпфлинга, Бойса и Мишеля [102] и Уинна [110].
Доказательства сходства или различий аллелей могут быть
получены также в опытах с перекрестными трансплантациями
кожи, поскольку линии с разными аллелями взаимно несов-
местимы. Однако получение этим методом надежных и сравнимых
результатов предполагает высокую степень конгенности сравни-
ваемых линий.
В дополнение к их описанию в табл. 48 приведено несколько
частных случаев (примеров) приложения компонентного метода
и метода F1-гибридов к анализу локусов гистосовместимости.
221
Таблица 48
Некоторые частные случаи применения компонентного метода и метода
Fl-гибридов для анализа локусов гистосовместимости
Опухоль Родители F1
один Другой строение реак- ции вывод
Компонентный метод
ll-2dk/H-2dk Н-2Х/Н-2Х; Н-2У/Н-2У Н-2х/Н-2>’ — IIII и*-.
» Н-2'|/П-2<|; П-2Х/Н-2Х Н-2а/П-2х + x = k х k
» U-2k/H-2k; 11-2х/Н-2х Н-2к/Н-2х — ii i и и
Метод К 1-гибридов для конгенных линий
H-2a/H-2a H-2X/I1-2X; Н-2У/П-2У Н-2Х/Н-2У + x (.у) = a
— x(у) a
» H-2b/Il-2b; H-2X/II-2X H-2b/Il-2x x — a
— x i n
H-2b/H-2b H-2X/H-2X; Н-2У/Н-2У 11-2х/Н-2У + x (у) = b
— x (y) ¥= b
Плюсом и минусом обозначены соответственно восприимчивость и резистентность
гибридов F1 к опухоли; хну — анализируемые мыши «неизвестных» генотипов. Ради
простоты явление комплементарное™ в положительных реакциях гибридов F1 в расчет
не принято (см. также стр. 220).
СОВРЕМЕННОЕ СОСТОЯНИЕ ПРОБЛЕМЫ
ГИСТОСОВМЕСТИМОСТИ
К настоящему времени идентифицировано и нанесено на карты
хромосом мыши 11 локусов тканевой совместимости. Есть основа-
ния считать, что истинное число локусов значительно больше [98].
Одни из них локализованы методом сцепления (локусы Н-2, Н-1,
Н-3, Н-4), другие — серологическими методами (локусы Н-5,
Н-6), третьи — методом Fl-гибридов (Н-7—Н-11).
Наиболее важным является локус Н-2 как по силе вызываемых
им иммунных реакций на чужеродные антигены, так и по сложности
его строения. В пределах локуса Н-2 к настоящему времени уста-
новлено наличие не менее 20 аллелей (табл. 49). Серологические
222
исследования аллоантигенов, выявленные гистогепическим ме-
тодом, показали, что каждый из них, суммарно характеризующий
тот или иной аллель, состоит из нескольких антигенных специ-
фичностей, или компонентов (иногда их называют также фено-
типами), обладающих четко выраженной иммуногенной актив-
ностью. К настоящему времени идентифицировано более 30 таких
специфичностей, неодинаковых по силе действия и по способности
вызывать образование антител. Специфичности 32 и 33 до сих пор
обнаружены лишь в цитотоксических опытах, что говорит о том,
что они присутствуют в лимфоцитах или, по крайней мере, их
трудно обнаружить в эритроцитах [98].
Таким образом, каждая инбредная или конгенная линия харак-
теризуется наличием того или иного аллеля Н-2 с определенным
набором антигенных компонентов, или специфичностей. Их рас-
пределение у мышей инбредных и конгенных линий приведено
в последней вертикальной графе табл. 49.
В пределах локуса Н-2 в редких случаях имеет место перекрест,
на основании частоты которого построена предварительная карта
участвующих в перекресте компонентов со следующим порядком
их расположения D—С— V—Е—Ss—К (ген Ss определяет вы-
сокий уровень специфического сывороточного протеина, по-ви-
димому, не связанного с гистосовместимостью). Горер высказал
предположение, что аллель Н-2а с одновременным присутствием
специфичностей d и к только у мышей линии А возник у гетеро-
зигот d/k в результате неравного перекреста.
Локус Н-2 является также локусом групп крови. Таковыми же
являются локусы Н-1, Н-5 и Н-6.
Исследования химического строения аллоантигенов локуса
Н-2 показали, что иммуногенная активность бесклеточных пре-
паратов из нормальных и злокачественных тканей, ускоряющих
отторжение кожных трансплантатов или подавляющих резистент-
ность к опухолевым трансплантатам, связана с клеточными мем-
бранами. В химическом отношении они представляют собой
липопротеины, активность которых пе зависит от содержания
в них липидов и связана, главным образом, или целиком, с про-
теиновым компонентом [98].
По силе вызываемых ими иммунных реакций гены гистосов-
местимости неодинаковы. Самым сильным из них является локус
Н-2, различие по которому между хозяином и трансплантатом
является для последнего непреодолимым барьером. Другие ло-
кусы — более слабые и по силе вызываемых ими иммунных реак-
ций вслед за Н-2 располагаются в следующий ряд (в нисходящем
порядке): Н-2, Н-1, Н-3, Н-7, Н-8, Н-4, Н-9, Н Ю, Н-11. Неко-
торой иллюстрацией к сказанному о силе действия аллелей Н-2
может служить табл. 50, в которой приведены результаты опытов
по трансплантации кожи, отличающейся от хозяина по локусам
Н-1, Н-2, Н-3 и по локусу, сцепленному с Y-хромосомой. Для
223
Аллели и аллоантигенные специфичности локуса Н-2
По Снеллу и Стимп
Аллели Н-2 Аллелоантигснпые специфичности. Старые обозначения (буквы) приве
А Db С D Е F G Н I J к м N Р Q S
а 1 — 3 4 5 6 — 8 — 10 и 13 14 — — —
1) — 2 — — 5 6 — — — — — — 14 — — —
с 3 4 э * 8 * 13 *
d — — 3 4 •— 6 — 8 — 10 — 13 14 — — —
е — — 3 — 5 6 — — — — — I3 * * * —
1’ — — — — — ? 7 8 9 * — — * — — —
— 2 — — — 6 * ? * * — — 14 * — —
h 1 2 3 — 5 6 * 8 * * и — ? * — —
j j — — 3 4 5 6 * * * * — 13 * * — —
— — — — 6 — * — — — — — —
k 1 — 3 — ,г) — — 8 — — 11 — — — — —
1 б * 10 *
m J — 3 — 5 ? — 8 — * и 13 * — — —
n J — — 5 6 * 8 * 10 — — 14 * — —
0 1 * 3 — 5 * * * * * — — * * * *
p — — ? — 5 — — — * — — * 16 — —
<1 — — 3 — 5 6 — 8 — — и 13 — — 17 —
r — — 3 — 5 — — 8 — * 11 — * — — —
s — — 3 — 5 6 7 — — * — — * — — 19
w — 2 ♦ — * * * — — * — — * * * —
1 Ссылки на первоисточники опущены. Тире — отсутствие антигенного компонента
компонента неясно.
локуса Н-1 известны четыре аллеля; комплексная природа дру-
гих слабых локусов находится в стадии исследований.
Влияние гена гистосовместимости, сцепленного с Y-хромо-
сомой, проявляется у мышей одних линий и не проявляется у дру-
гих. Его влияние заключается в том, что перекресные перевивки
кожи удачны только в трех комбинациях из четырех возможных,
в то время как трансплантаты от самца к самке отторгаются
(см., например, [12]). Наличие такого же гена, сцепленного
с Х-хромосомой, менее достоверно.
224
Таблица 49
у мышей инбредных л конгенных линий
флингу [98]
дены в следующей горизонтальной графе Инбредные и конгенные линии 1
V Y А 1 В 1 с 1 D 1 Ed Dk кь
25 27 28 29 — — — — A, AKR.K, В10.А
22 — 27 28 29 — — — 33 A.BY, C3H.SW, C57BL/6, G57BL/10, G57L, CG57BR, CC57W, Dl.LP, LP/J, ST/a, 129
* * 27 28 29 — 31 * * Dl.G
— — 27 28 29 — 31 — — BALB/c, C57BL/Ks, B10.D2, DBA/2, ST.T6, WH, YBL/Rr, YBR/Wi
* 25 27 28 29 30 * * * STOLI
* — 27 — — — — * * A.GA, B10.M, RFM/Un
22 * * * * * 31 — — HTG
— * * * * * — — — HTH, B10.A(2R)
22 * * * * * — — 33 HTI, B10.A(5R)
22 ? э * * * * * * JK/St
— 25 — — — — — 32 AKR, B10.BR, GBA, GE, CHI, C3H, G57BR/a, C57BR/cd, G58, DI.ST, MA/J, RF/J; ST/bJ, 101
22 — ? ? * * * * * I/St, N/St (?)
* * 27 28 29 30 — * * AKR.M
* ? ? * * * * * F/St
* * * * * * 31 * * HTO/Sf
* * — — — — — * * P/Sn, C3H.NB
— * 27 28 29 30 — * * DBA/1, G/St, BUB
* 25 — — — — * * RIII/J, RHI/Wy, LP.RIII
* —— — 28 — — — — — A.SW, SJL
* * * * * * — * * WB/Re, WG/Re
(специфичности). Звездочка — не исследовано. Знак вопроса — наличие или
отсутствие
Предыдущий анализ проблемы тканевой совместимости осно-
вывался на опытах по пересадке опухолей и кожи. В последние
годы в экспериментальной онкологии довольно широкое приме-
нение получил метод перевивки органов или частей органов
от инбредных животных гибридам F1 и создание таких экспе-
риментальных моделей, в условиях которых весьма отчетливо
была показана роль наследственных факторов в возникновении
злокачественных опухолей. Несколько подробнее об этом будет
сказано в главе VII.
1/2 15 Н. Н. Медведев 225
Заключение
В заключение полезно свести воедино основные положения
генетической теории трансплантаций, рассмотренные в преды-
дущем изложении.
1. Биологическая основа совместимости или несовместимости
тканей зиждется на сходстве или несходстве донора и реципиента
по генам тканевой совместимости.
2. У мышей до сего времени открыто 11 генов тканевой сов-
местимости, локализованных в Х-, Y-, I, V и IX хромосомах. Есть
основания считать, что это число не окончательное и что истинное
число их значительно больше.
3. Наследственные факторы, или гены, определяющие совме-
стимость тканей, относятся к категории кодоминантных и прояв-
ляют свое действие через иммунные механизмы.
4. По силе их действия на процессы отторжения трансплантата
гены гистосовместимости неодинаковы. Наиболее сильным из них
является основной локус — Н-2. Все другие обладают более сла-
бым действием.
5. Конечными продуктами действия генов гистосовместимо-
сти, или аллоантигенами, являются компоненты клеточных обо-
лочек. В химическом отношении они, по-видимому, представляют
собой липопротеины, а их иммунологическая активность свя-
зана с их протеиновым компонентом.
6. Аллоантигены присутствуют во многих тканях, но их кон-
центрация подвержена большим колебаниям.
7. Дальнейшее исследование проблемы гистосовместимости
и усовершенствование ее методов могут служить модельными
для изучения других комплексных генов и генетических приз-
наков. Выяснение генетических и серологических особенностей
локусов гистосовместимости, несомненно, будет способствовать
проникновению в иммунологические свойства подобных систем
групп крови у других животных и у человека.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Методические замечания
В анализе генетических основ проблемы гистосовместимости
получение надежных и сравнимых результатов в опытах с опухо-
лями предполагает соблюдение многих условий, одни из которых
касаются генетического статуса донора и хозяина, другие —
характеристики перевиваемой опухоли, третьи — предваритель-
ной иммунизации хозяина, применение которой дает гораздо
более четкие результаты и т. д.
К числу этих условий относятся: 1) возраст, 2) пол, 3) гене-
тическое строение, 4) локус гистосовместимости донора и хозяина;
5) характеристика опухоли, 6) место и способ введения инокулята,
226
7) число клеток инокулята, 8) объем суспендирующей среды и ее
состав, 9) применение гепарина, 10) хранение клеточных суспен-
зий и суспензирующих сред, 11) число клеток для предварительной
иммунизации, 12) способ и место введения, 13) ткани для иммуни-
зации, 14) число и график иммунизирующих инъекций, 15) ин-
тервал между иммунизацией и инокуляцией опухоли, 16) воз-
раст донора ткани для иммунизации, 17) стерильность условий
для приготовления клеточной суспензии.
Все эти условия служили предметом тщательного сравнения
и выработки наиболее рациональной системы выполнения опе-
раций [88].
Однако соблюдение перечисленных условий для наших целей
не является обязательным, поскольку значение генетических
факторов в тех опытах, с которыми придется иметь дело в даль-
нейшем, можно показать при самых элементарных условиях их по-
становки.
Операции перевивки опухолей
Для опытов лучше брать спонтанные опухоли, а не перевивае-
мые, и особенно перевиваемые в течение длительного времени,
поскольку в процессе длительного пассирования они утрачивают
линейную специфичность в результате соматических мутаций
(стр. 199).
Мышь с опухолью убивают эфиром, операционное поле сма-
зывают йодом, опухоль извлекают стерильным инструментом
и переносят в чашку Петри с физиологическим раствором. Ку-
сочек опухолевой ткани весом 0,5—1 г без видимых на глаз уча-
стков некроза размельчают кривыми глазными ножницами на-
столько тонко, чтобы полученная взвесь легко проходила через
иглу шприца. На 0,5—1 г ткани следует взять соответственно 4,5
или 9 мл физиологического раствора. Полученную взвесь пере-
носят затем во флакон от пенициллина или непосредственно в сте-
рильный шприц. Инъекцию взвеси производят подкожно, в над-
лопаточную область спины. Доза инокулята — 0,2—0,25 мл
на мышь. Место введения смазывают йодом до и после инъекции.
После того, как инъекция сделана, складку кожи на месте про-
кола нужно слегка сдавить между пальцами и некоторое время
подержать для того, чтобы предупредить истечение инокулята
через прокол, когда из него извлечена игла шприца. Все операции,
там где это возможно, лучше выполнять в стерильных условиях.
При отсутствии их в готовую клеточную суспензию опухолевой
ткани ввести пенициллин.
Для достижения максимальной гомогенности взвеси при ми-
нимальном разрушении клеток опухоли в стерильных условиях
Снелл сконструировал специальный гомогенизатор, или так на-
зываемое клеточное сито [84]. Его описание приведено на рис. 39.
Кусочек опухоли нужного размера или веса переносят в рези-
227
15*
Рис. 39. Прибор (сито) для при-
готовления клеточной суспензии
опухолевой ткани
1 — стеклянный цилиндр с горлышком
на одном конце для резиновой пробки
(6); 2 — толстостенная резиновая труб-
ка, служащая для сочленения стек-
лянного цилиндра (/) со стальным
цилиндром (3), в один конец которого
вмонтирована нержавеющая металли-
ческая сетка (сито); размер ячеек
0,0045 дм\ 4 — тонкостенная резино-
вая трубка; 5 — бактериологическая
пробка; 7 — зажим Мора. Диаметр
цилиндров (/) и (3) одинаков. Прибор
стерилизуется автоклавированием.
По Снеллу [84]
новую трубку (4), прибавляют
нужное количество физиологиче-
ского раствора и закрывают бак-
териологической пробкой (5), по-
сле чего на конец трубки (4) наде-
вают зажим (7). Ткань опухоли
измельчают раздавливанием ее
между пальцами и вымыванием
взвеси клеток через сито в сте-
клянный цилиндр (1). Из него кле-
точную взвесь забирают в шприц,
иглу которого вводят через ре-
зиновую трубку (6).
Первую неделю после пере-
вивки опухоли мышей просматри-
вают через 2—3 дня, в последу-
ющий период и до конца опыта
мышей достаточно просматривать
1—2 раза в неделю.
Перевивку опухоли надо счи-
тать «удачной», или положитель-
ной, при условии, если животное
погибнет от перевитой опу-
холи. Если же, несмотря на рост
опухоли, которая в разных слу-
чаях может достигать значитель-
ных или даже крупных размеров
(вишни, ореха), реципиент остает-
ся живым, перевивку следует счи-
тать отрицательной до
гех пор, пока он падет или
опухоль полностью рассосется
(см. также стр. 193).
Методика трансплантаций кожи
Нижеследующее описание тех-
ники трансплантаций кожи на
мышах [12] представляет собой не-
сколько упрощенную модифика-
цию метода, разработанного и
впервые описанного Биллингхе-
мом и Медаваром [22а].
Для успеха операций весьма
важно соблюдение следующих
условий: 1) трансплантируемый ло-
скут по форме и величине дЪл-
2/8
жен точно соответствовать подготовленному ложу; 2) его натя-
жение в ложе должно соответствовать его натяжепию в исходном
положении (in situ); 3) максимально исключить нарушение связи
лоскута с подлежащими тканями в послеоперационный период.
Подготовка реципиента. На протяжении 30 мм
по длине тела мыши шерсть со слипы и с боков удаляют (лучше
накануне) глазными ножницами или бритвой. Чем плотнее вы-
стрижена или выбрита шерсть, тем плотнее приляжет к коже
накладываемая после операции повязка и тем совершеннее будет
контакт пересаженного лоскута с подлежащими и прилежащими
тканями. Непосредственно перед операцией операционное поле
обрабатывают эфиром для удаления с кожи грязи, жиропота и для
стерилизации. После этого его полезно обмыть теплым стериль-
ным физиологическим раствором, что также способствует более
тесному контакту повязки с кожей.
Под эфирным наркозом глазными ножницами вырезают в коже
реципиента два или большее число лож, по размерам, соответствую-
щим заготовленным трансплантатам (см. ниже). Ввиду того, что
иссечение кожи производится при некотором ее натяжении,
подгонка формы и размеров ложа и кожного лоскута требует не-
которой предварительной тренировки. Необходимо также следить
за безукоризненным состоянием ножниц для перевивки, надле-
жащая острота которых гарантирует чистоту разрезов без суще-
ственного нарушения целостности граничащих с ними клеток.
В зависимости от характера опыта на одну мышь одновре-
менно можно перевить несколько лоскутов указанного ниже
размера (4, 6 и даже 8 кусочков). При этом следует взять за пра-
вило — на одну сторону тела (например, правую) трансплантиро-
вать «подопытные» лоскуты, а на другую сторону (левую) —
«контрольные».
Подготовка трансплантатов. При отсут-
ствии под руками специального перфоратора (см. ниже) в ка-
честве донорской ткани проще всего брать кожу с хвоста, что,
в случае надобности, дает возможность одну и ту же мышь исполь-
зовать в качестве донора несколько раз, повторно ампутируя
сегменты хвоста для последующих операций.
С хвоста, перед ампутацией обработанного эфиром (см. выше),
снимают кожу, нарезают ее кусочками размером около 25 мм2
(5x5 мм) и переносят в чашку Петри с физиологическим раство-
ром. Кожу для трансплантаций берут во всю толщу, без уда-
ления каких-либо ее слоев.
Размещение трансплантатов. На подготов-
ленное ложе наносят одну каплю смеси антибиотиков, после чего
в него переносят кожный лоскут, осушенный от избытка влаги
стерильным фильтром. Рекомендуемая смесь антибиотиков (в еди-
ницах на 1 мл): пенициллина — 5000, стрептомицина — 5000,
ауреомицина — 800, террамицина — 100.
16 Н. Н. Медведев
229
Для удобства наблюдений в послеоперационный период рас-
полагать лоскут повернутым па 180° по отношению к его исход-
ному положению (in situ). При такой ориентации трансплантата
отрастающая на нем шерсть будет ориентировка против
окружающей шерсти интактной кожи реципиента и служит
одним из признаков его приживления. По той же причине воло-
ски с кожи хвоста также не удаляют, что, впрочем, не требуется
и по условиям операции.
Наложение повязки и бандажа. После того,
как подготовленные ложа закрыты кожными лоскутами, на все
операционное поле накладывают одну общую марлевую (в 2—3
слоя) пропитанную вазелиновым маслом салфетку и по краям
приклеивают ее к коже коллодием. Заключительной процедурой
является наложение бандажа, для чего можно использовать лей-
копластырь шириной 30 мм. Двух оборотов лепты вполне доста-
точно для фиксации трансплантатов.
Снятие повязки. Бандаж и повязку удаляют через
7—8 дней после операции. В течение первых трех недель состоя-
ние трансплантатов регистрируют через 1—2 дня, а затем —
раз в неделю, в течение всего периода наблюдений, который,
в зависимости от характера опыта, может длиться до 200 дней.
Признаками приживления трансплантата являются его
эластичность и наличие на нем волосков, если лоскут был взят
с хвоста, и отросшая нормальная шерсть, если лоскут был взят
со спины. Признаками отторжения являются появление
грануляционного валика вокруг трансплантата, его постепенное
ссыхание и облысение, отпадение дермы и образование рубцовой
ткани на места бывшего трансплантата.
Для достижения максимального соответствия ложа и лоскута
некоторые авторы [41а] пользуются специальным перфоратором,
при помощи которого из складки оттянутой пинцетом кожи на
спине мыши одновременно иссекают два круглых лоскута с обра-
зованием двух кожных дефектов, в точности соответствующих
иссеченным лоскутам. Для той же цели на операционное поле
предварительно накладывают липкую повязку, которая фикси-
рует нормальное натяжение кожи в момент иссечения лоскутов.
На этой же повязке делают также отметки, согласно которым
соответствующим образом ориентируют затем трансплантаты.
Модифицированы и способы закрытия операционного поля
и фиксации лоскутов. Для этой цели трансплантаты сначала фик-
сируют на месте при помощи полупрозрачной клейкой ленты,
закрывающей лишь операционное поле. На нее в свою^очередь
накладывают еще одну повязку, внутреннюю, липкую, поверх-
ность которой «нейтрализуют» подклейкой такой же липкой ленты
на площадь, несколько превышающую площадь предыдущей по-
вязки. Благодаря этому приему достигают такого взаимоотно-
шения двух слоев повязки, при котором всякое смещение опера-
230
ционного поля по отношению к подлежащей мускулатуре тела
мыши возможно лишь «единым блоком». Наконец, как и в первом
случае, мышь бинтуют защитной повязкой, предупреждающей
возможность повреждений трансплантатов самой мышью.
Описанный способ иссечения круглых лоскутов производят
под нембуталовым наркозом (доза 0,65 мг нембутала на каждые
10 г веса тела мыши; введение внутрибрюшинное).
При условии заблаговременной подготовки реципиентов два
натренированных оператора могут выполнить в день до 100 и
больше операций.
Изотрапсплантации
Для опытов, удовлетворяющих условию изотрансплантаций,
можно взять мышей любых высокоинбредных линий, список
которых и характеристики приведены в табл. 51.
Если опыты типа изотрансплантаций предположено осуще-
ствить с перевивкой опухоли, следует взять одну-две линии с вы-
сокой частотой рака молочных желез (СЗН, А) или лейкемии
(AKR, С58) и опухолевую ткань перевить мышам той линии,
от которой взята опухоль. При соблюдении элементарных усло-
вий опухоль разовьется у всех инокулированных мышей.
То же самое можно сказать в отношении изотрансплантации
кожи: на мышах любой высокоинбредной линии кожные трансплан-
таты приживаются в 100% случаев. Перевивки этого типа сейчас
общеприняты для периодической проверки генетической одно-
родности («чистоты») как тех линий, которые находятся на раз-
множении [13], так и поступающих для разведения или опытов
из внешних источников.
Контролем к изотрансплантациям могут служить перевивки
типа аллотрансплантаций (см. раздел «Аллотрансплантации»).
Поэтому в групповых опытах изотрансплантации можно пору-
чить одному лицу, а прививки типа аллотрансплантаций —
другому.
Аллотрансплантации
Для аллопластических трансплантаций можно взять спонтан-
ные опухоли или кожу от мышей любой высокораковой или высо-
колейкемической линии и перевить мышам другой, неродственной
линии. Пользуясь табл. 51, можно подобрать пары линий, отли-
чающиеся по разным аллелям локуса Н-2: различие между транс-
плантатом и хозяином по любому аллелю Н-2 ведет к отторжению
перевитой ткани в 100% случаев.
Для данных опытов можно также взять мышей двух пар
взаимно конгенных линий, которые поддерживаются в Институте
эпидемиологии и микробиологии им. Н. Ф. Гамалеи АМН СССР
(табл. 51). Партнеры этих конгенных пар отличаются лишь по
231
16*
локусу Н-2. Поэтому отторжение аллотрансплантатов и ее скорость
будут обязаны здесь влиянию одного этого локуса и никакому
другому.
Для ориентации в результатах рассматриваемых в настоящем
разделе опытов можно руководствоваться табл. 50, в которой
приведены результаты аналогичных опытов по перевивке кожи
на мышах, отличающихся по локусам Н-2, Н-3 и Н-1 и локусу,
сцепленному с Y-хромосомой.
Таблица 50
Трансплантация кожи на мышах конгенных и инбредных линий,
отличающихся по локусам Н-2, Н-3 и Н-1 и локусу тканевой
совместимости, сцепленному с Y-хромосомой. По Снеллу [91]1
Различие по локусу Донор Реципиент Дробь успеха Длитель- ность наблю- дения, дни Длительность переживания отторгнутых трансплантатов, дни
Н-2 B10.D2 C57BL/10 0/17 — 9(7-13)
Н-3 C57BL/10 B10.LP 0/10 — 25 (17->30)
C57BL/10 B10.LP 0/18 — 20(15-27)
B10.LP C57BL/10 0/8 — 31 (20->30)
B10.LP C57BL/10 0 — 34(?)
Н-1 C57BL/10 В10.129 (М) 0/4 — 32 (25-39)
В10.129 (5М) C57BL/10 0/6 — 50(20-95)
сзн.к СЗН 0/7 — 36 (29—54)
сзп СЗП. К 0/5 — 91 (35-124)
Y-локус <5а 5 А 16/39 150 51 (18—109)
3 А 2 А 1/15 97 47 (36—65)
<5 AL’ 5 A и 28/30 150 75(45—105)
3 BALB/c 2 BALB/c 9/49 150 28 (12—51)
3 СВА 2 СВА 14/14 150—325 —
3 СЗН 2 сзн 1/7 150 40 (28—49)
$ СЗН 2 сзн 11/22? > 100 52 (40- > 80)
3 C57BL 2 C57BL 0/46 — 26 (16-65)
3 C57BL 2 C57BL 1/49 100 27« 25—>51)
3 C57BL 2 C57BL 0/29 — 45(12-91)
5 C57BL 2 C57BL 0/4 — 53 (45—58)
3 st 2 st 4/12 150 52(33—90)
3 CC57BR 2 CC57BR 0/13 — 21 (16—23)
3 CC57W 2 CC57W 0/11 — 30 (22—39)
1 Ссылки на первоисточники опущены.
232
Из табл. 50 видно, что когда донор и реципиент отличаются
по локусу Н-2, кожные трансплантаты отторгаются в среднем
через 9 дней (предельные сроки варьируют от 7 до 13 дней).
Если доноры и реципиенты отличаются по локусу Н-3, кож-
ные трансплантаты отторгаются через 20—30 дней после опера-
ции (предельные сроки варьируют от 15 до 30 дней). Наконец,
когда доноры и реципиенты отличаются по локусу Н-1, средняя
продолжительность переживания трансплантатов и пределы их
колебаний варьируют в гораздо более широких пределах (со-
ответственно 32—91 и 20—124 дня). Тем не менее, отличие доно-
ров и реципиентов даже по слабым локусам тканевой совмести-
мости является достаточно сильным барьером для приживления
кожных трансплантатов, которые отторгаются через указанные
промежутки времени.
В нижней половине табл. 50 приведены результаты анало-
гичных опытов с мышами тех линий, у которых один из генов
тканевой совместимости сцеплен с Y-хромосомой. Транспланта-
ции кожи между особями одного и разного пола в пределах любой
такой линии оказываются успешными лишь в трех сочетаниях
из четырех, а^ именно — от <самок к самцам, от самцов к самцам
и от самок к самкам, в то время как перевивки кожи от самцов
к самкам в разных линиях часто или всегда заканчиваются
с отрицательными результатами. Из имеющихся в наших питом-
никах и лабораториях линий такой особенностью характери-
зуются линии CC57BR, CC57W и C57BL [12], что необходимо
иметь в виду при планировании учебных опытов. Исследование
других имеющихся в Советском Союзе линий и сублиний мышей
с этой точки зрения представляет значительный интерес.
Контролем к аллотрансплантациям будут служить изотранс-
ллантации (см. раздел «Изотрансплантации»).
Гибридотрансплантации
Трансплантации с участием гибридных животных, хотя бы
только первого поколения, несколько сложнее в том смысле, что
связаны с заблаговременной подготовкой для опытов гибридных
мышей, если опыты осуществляются по фиксированному расписа-
нию. Для этой цели мышей избранных для опыта линий нужно
скрестить за 1,5 — 2 месяца до постановки основного опыта.
Что касается выбора линий, то он и в данном случае сведется
к мышам высокораковых или высоколейкемических линий (см.
раздел «Изотрансплантации»), обычных в наших питомниках
линейных животных ([10] и табл. 51) и в онкологических лабо-
раториях.
По программе-минимум опыт можно ограничить перевивкой
опухолей от обоих родительских линий гибридам F1. Согласно
четвертому закону трасплантаций (табл. 42), опухоль любого
233
родителя разовьется у 100% гибридов F1. Контролем к этому
опыту будут служить изотрансплантации с теми же мышами
и опухолями, а по программе-максимум — опыты по перевивке
тех же опухолей мышам других линий (см. раздел «Аллотрансплап-
тации»).
Демонстративны опыты по перевивке опухолей мышей обеих
родительских линий одним и тем же гибридам F1 — опухоли
одной родительской линии — на одну сторону тела, опухоли
другой родительской линии — на другую. Рост одной опухоли
не препятствует росту другой во всех случаях.
Несколько большую сложность в организацию опытов внесут
трансплантации опухолей гибридов F1 мышам исходных, роди-
тельских линий. Для этой цели нужно или ожидать возникно-
вения у них спонтанной опухоли (или опухолей), что обычно
наступает через 6—12 месяцев после рождения, или пойти на уско-
ренный способ получения опухолей путем введения гибридам
сильного канцерогена, под влиянием которого первые опухоли
могут появиться уже через 1,5—2 месяца после введения канце-
рогена.
Следует подчеркнуть, что дополнительные хлопоты по подго-
товке гибридных трансплантаций, о которых идет речь, не на-
столько обременительны и трудоемки, чтобы из-за них отказы-
ваться от опытов. Они требуют не более того, чтобы подумать
о них заблаговременно и поставить мышей на скрещивание.
И если все это предусмотрено и опыт поставлен, его результаты
вознаградят обе стороны — преподавателя и студентов.
Наконец, если усилия по получению опухоли (или опухолей)
у гибридов F1 увенчались успехом, тогда, как заключительный
в данной серии, можно поставить опыт по перевивке «гибридной»
опухоли F1 самим же гибридам F1, с одной стороны, и мышам
обеих родительских линий, с другой. Перевитая опухоль ра-
зовьется у всех гибридов F1 (см. раздел «Изотрансплантации»)
и не разовьется у мышей обеих родительских линий.
Что касается опытов с перевивкой кожи, то для их выполне-
ния может быть рекомендована та же схема опытов, что и для опы-
тов по перевивке опухолей, правда, с одной существенной ого-
воркой: в отличие от технически очень простых трансплантаций
опухолей, трансплантации кожи предполагают владение несколько
более сложной техникой, требующей некоторой предварительной
тренировки. Однако эти трудности не стоит преувеличивать —
их легко можно преодолеть за 2—3 недели практики.
ГЛАВА СЕДЬМАЯ
ГЕНЕТИКА РАКА МЫШЕЙ
И ВОСПРИИМЧИВОСТИ
К ОПУХОЛЕРОДНЫМ ВИРУСАМ
Введение
Совокупность данных экспериментальной онкологии вскрыла
исключительную сложность природы рака и показала, что в воз-
никновении злокачественных опухолей, как одной из форм пато-
логии, играют роль разнообразные внутренние факторы орга-
низма и факторы внешней среды. К числу последних относятся
излучения, химические канцерогенные вещества, вирусы и дру-
гие агенты. Согласно последним7статистическим данным, коли-
чество химических канцерогенных веществ, которые вызывают
злокачественные опухоли у лабораторных животных, достигает
нескольких сотен [9].
К факторам внутренней среды организма относятся гормо-
нальные нарушения, расстройства обмена веществ и многие
другие.
Исследования на линейных мышах с несомненностью пока-
зали также, что в возникновении злокачественных опухолей не
последняя роль принадлежит генетическим факторам.
Под наследственностью при раке следует понимать такое ге-
нетически обусловленное состояние организма (его генный состав,
конституцию, раковую диспозицию), при котором шанс возникно-
вения у него злокачественной опухоли определенной локализации,
при прочих равных условиях, возрастает по срав-
нению с тем организмом другой линии, расы или вида, наслед-
ственная конституция которого предрасполагающих факторов
к опухоли данной локализации не содержит. Говоря о наслед-
ственности при раке, следует иметь в виду не унаследование
готовой опухоли, или какого-либо ее зачатка, а лишь те наслед-
ственно обусловленные (генотипические) различия в физиологи-
ческих, биохимических, гормональных и многих других особен-
ностях организмов, которые при одних и тех же усло-
виях способствуют возникновению опухоли у генетически
235
восприимчивого организма и препятствуют ее возникновению
у генетически резистентного.
Предрасположение к опухолеобразованию может быть опре-
делено также как несбалансированное или недо-
статочно сбалансированное наследствен-
ное состояние клеточных систем определен-
ных органов или тканей, в пределах которых клетки легче, чем
в других органах и тканях, подвергаются злокачественному пере-
рождению в зависимости как от физиологического состояния орга-
низма, так и от неблагоприятных внешних условий.
В дальнейшем мы будем иметь дело лишь с генетическими
факторами, а к факторам внешней среды, или к другим внутрен-
ним факторам организма, обращаться лишь в тех случаях, когда
это будет необходимо для рассмотрения тех или иных конкрет-
ных опытов.
* * *
Обычно принято различать опухоли спонтанные, т. е.
возникающие самопроизвольно, без преднамеренного воздействия
на организм внешних факторов, ииндуцированные, или
экспериментальные, т. е. вызванные в результате влияния на
организм тех или иных экспериментальных воздей-
ствий. Соответственно с этим представляется возможным просле-
дить влияние генетических факторов на возникновение обеих
категорий опухолей. Следует впрочем отметить, что деление опу-
холей на спонтанные и индуцированные чисто условно. Оно,
с одной стороны, свидетельствует о неполноте наших знаний при-
чин возникновения спонтанных опухолей, которые, как и все
в природе, возникают под влиянием определенных, хотя
ближе и неизвестных нам причин. С другой стороны,
оно показывает, что опухоли, полученные в опыте в результате
воздействия определенного агента, далеко не всегда можно
приписать влиянию именно этого агента и ничему другому
и что истинные причины возникновения индуцированных опухо-
лей зачастую значительно сложное тех простых эксперимен-
тальных воздействий, влияние которых исследуется в том пли
ином опыте. Ниже будут приведены доказательства справедли-
вости обоих этих положений.
ВЛИЯНИЕ ГЕНЕТИЧЕСКИХ ФАКТОРОВ
НА ВОЗНИКНОВЕНИЕ СПОНТАННЫХ ОПУХОЛЕЙ
К числу спонтанных относятся злокачественные опухоли че-
ловека и животных независимо от того, обитают ли последние
в диком состоянии или их разводят в домашних условиях. К спон-
танным относятся также опухоли лабораторных животных (мы-
236
шей, крыс, кроликов, морских свинок и др.) в тех случаях, когда
они не находятся под опытами.
Лабораторные животные издавна служили предметом присталь-
ного внимания исследователей, поскольку они в больших коли-
чествах используются для биологических и медицинских опытов
и находятся под наблюдением в течение всей или большей части
их жизни. Из всех лабораторных животных наибольший интерес
представляют мыши как по причине высокой плодовитости, так
и особенно потому, что продолжительность их жизни короче, чем
у других лабораторных животных, благодаря чему имеется воз-
можность получить и проследить три поколения в год. (Сравни
с дрозофилой, у которой можно получить 40 поколений в год.)
В развитии учения о спонтанных опухолях можно проследить
два подхода, или метода, к учету частоты и типов спон-
танных опухолей у лабораторных животных. Один из них, хроно-
логически более старый, основывался на суммарном учете
опухолей у животных того или иного вида, безотносите-
льно его породного состава, -т. е. генотипического родства
животных. В наиболее чистом виде этот метод учета опухолей
осуществляется применительно к человеку. Следуя этому методу,
исследователи накопили ценный статистический материал, харак-
теризующий тот или иной вид с точки зрения частоты возникно-
вения спонтанных опухолей, их гистологических типов, локали-
зации и т. д.
Принципиально иной подход к исследованию частоты спонтан-
ных опухолей у лабораторных животных возник в начале текущего
столетия и был связан с применением одного из важнейших прин-
ципов генетики, а именно метода чистых линий, раз-
работанного Иоганнсеном [57].
Согласно Иоганнсену, совокупность особей любого вида ра-
стений или животных (популяция) слагается из наследственно
неравноценных биотипов, или чистых линий,
в отношении любого наследственно обусловленного признака орга-
низмов, составляющих данную популяцию. Путем близкород-
ственного разведения и отбора чистые линии можно вычле-
нить из популяции и закрепить в последующих поколениях.
Таким путем создаются линии лабораторных животных, сорта
и породы сельскохозяйственных растений и животных, бактери-
альные штаммы, штаммы продуцентов антибиотиков, многочислен-
ные любительские породы собак, голубей, певчих птиц и т. д.
Исходными для сознательной и планомерной работы по выве-
дению линий лабораторных животных явились рассмотренные в
в предыдущей главе наблюдения Лёба, Тиццера и Литтла над
поведением трансплантированных опухолей у японских танцую-
щих мышей. Уже один этот факт свидетельствует о тесной исто-
рической связи генетики трансплантаций с проблемой злокаче-
ственных опухолей. И действительно, генетика тканевой совме-
237
стимости долгое время развивалась в недрах экспериментальной
онкологии, на моделях злокачественных опухолей, и только в на-
чале 50-х годов стало очевидным ее общебиологическое значение,
когда законы трансплантаций опухолей были распространены
и на нормальные ткани. Таким образом, первые успехи в экс-
периментальном исследовании проблемы тканевой совместимости
и генетического аспекта проблемы злокачественных опухолей по-
следовали в связи с проникновением в них принципов и методов
генетики и в первую очередь — в создании линий лабораторных
животных и их использовании в медико-биологических иссле-
дованиях. Рассмотрим сначала краткие итоги той работы, ко-
торая была связана с выведением линейных животных.
Чистые линии
Определение понятия «чистые линии» и метод их выведения
были приведены выше (стр. 194). К этому необходимо добавить,
что по отношению к генам половой хромосомы несколько более
эффективными являются скрещивания отцов с дочерьми или мате-
рей с сыновьями. Однако вследствие технических неудобств, свя-
занных с возрастными различиями спариваемых животных, эта
система скрещиваний в применении к лабораторным животным
не получила широкого применения.
Главная отличительная особенность инбредного разведения
животных заключается в том, что все особи каждого поколения
данной линии происходят от одной пары животных,
брата и сестры, из которых, в свою очередь, только одна
их пара, также брат и сестра, является родоначальницей следую-
щего поколения.
Инбридинг приводит к состоянию такой генотипической о д-
нородности животных в пределах линии, какая имеет ме-
сто, например, у однояйцевых близнецов, у растений-самоопы-
лителей, или размножаемых в пределах клона черенками и т. д.
Селекционно-генетическая работа с линейными мышами длится
уже более четырех десятилетий, и инбредный возраст многих
общеизвестных линий перешагнул далеко за сотню поколений.
В настоящее время известно более 200 важнейших и широко-
распространенных линий и сублиний мышей. Наиболее подроб-
ные сведения и характеристики основных " линий содержатся
в систематических каталогах (списках), которые Международный
Комитет по стандартизации генетической номенклатуры для инб-
редных мышей, через каждые четыре года публикует для всеоб-
щего сведения. Последнее, четвертое, издание этого списка опубли-
ковано в 1968 г. [99]1. Другой подробный список, опубликован-
1 Оттиски этого списка-каталога можно получить у автора настоящего
руководства. — Прим, автора.
238
ный Джаем в 1963 г. [58], содержит описание не только линий
мышей, но и всех других видов лабораторных животных. В обоих
упомянутых каталогах имеются фамилии и адреса владельцев тех
или иных линий. Список линий и су б линий мышей, имеющихся
в Советском Союзе, приведен в конце руководства и в табл. 51.
* * *
Весьма длительная и кропотливая исследовательская работа
над линиями мышей привела к следующим важным результатам.
Оказалось, что самки одних, так называемых высокораковых ли-
ний, например А, СЗН, почти в 100% случаев болеют раком
молочных желез. Мыши, самки и самцы других линий, например
С58, AKR, F, почти с такой же частотой болеют лейкемией. У мы-
шей других линий, например А, столь же часто развиваются
опухоли легких и т. д.
Полной противоположностью названным являются мыши тех
линий, у которых опухоли перечисленных локализаций возни-
кают исключительно редко. Таковы мыши линии C57BL, у кото-
рых, в частности, мы за 20 лет наблюдений не обнаружили опу-
холей молочных желез или легких; мыши C57L, у которых более
чем за 30-летнюю историю существования линии зарегистриро-
вано лишь три опухоли легких и т. д.
Далее, как и всегда в таких случаях, многие линии по частоте
возникновения опухолей занимают промежуточное положение:
у мышей разных линий она варьирует в широких пределах.
Наконец, важно отметить, что мыши ряда линий характера
зуются высокой резистентностью или, напротив, восприимчиво-
стью к бактериальным и вирусным инфекционным заболеваниям:
паратифу, псевдотуберкулезу, эктромелии и др.
Таково в нескольких словах разнообразие существующих ныне
линий мышей. Несомненно, однако, что оно далеко не оконча-
тельное, и селекционеры будущего, несомненно, выведут новые
линии с такими признаками и особенностями, о возможности су-
ществования которых мы сейчас и не подозреваем и которые про-
изведут подлинный переворот в наших представлениях о связи
наследственных факторов организма с его тончайшими особен-
ностями на уровне клеточных и молекулярных структур.
Все известные ныне линии мышей выведены из популяций,
или колоний, так называемых беспородных лабораторных
мышей при помощи инбридинга и отбора в потомствах особей
с такими признаками или особенностями, которые интересовали
исследователей по ходу их опытов. В одних случаях инбридинг
и отбор мышей вели на высокую частоту рака, в других — на
высокую частоту лейкемии, в третьих, напротив, — на полное
их отсутствие, или, наконец, на резистентность к инфекционным
заболеваниям ит. д. Никаких других методов или воз-
239
действий для выведения линий мышей ни в прошлом, ни в настоя-
щее время не применялось и не применяется.
Из сказанного прежде всего следует, что наследственные'фак-
торы всех разнообразных особенностей известных линий Mbiineii
существовали в исходных мышиных популяциях к началу селек-
ционно-генетической работы с ними в виде скрытых (рецес-
сивных) мутаций и, вероятно, лишь немногие из них возникли
de novo, в процессе выведения линий. Онкологи-генетики лишь
выловили эти мутации и закрепили в виде чистых линий при
помощи тесного инбридинга и искусственного отбора.
Если бы по какой-либо причине всю работу по созданию ли-
ний мышей потребовалось воспроизвести заново, то, отправляясь
от колоний таких же беспородных мышей, с какими исследова-
тели начинали работу в прошлом, известные ныне линии мышей,
несомненно, можно было бы восстановить, хотя, разумеется,
с неизбежными вариациями в отношении их биологических и онко-
логических характеристик.
Второй важный вывод, который вытекает из сказанного о сущ-
ности чистых линий и методов их выведения, заключается в том,
что наблюдающиеся при данных условиях различия между ли-
нейными мышами (например, между высокораковыми, высоко-
лейкемическими, низколейкемическими и т. д.), несомненно, обя-
заны их наследственной, генетической, природе.
В самом деле, в одном и том же виварии, питомнике, или ла-
боратории, при идентичных условиях содержания десятилетиями
размножаются мыши, одни из которых регулярно, из поколения
в поколение, поражаются раком молочных желез в 90—95% слу-
чаев, а другие никогда им не болеют; у третьих и четвертых столь
же разительные отличия и с таким же постоянством наблюда-
ются в отношении лейкемий; у пятых и шестых — в отношении
опухолей легких и т. д. Спрашивается, что у всех этих мышей
общего и что их отличает, какие из этих различий,
с интересующей нас точки зрения, являются более существен-
ными и какие — менее существенными?
Очевидно, что общим для всех этих линий является среда
обитания, т. е. все то, что окружает мышей, все то, чем
они питаются и т. д., а отличает все то, что касается их н а-
следственных особенностей, обусловленных тем,
что мышей разных линий размножают раздельно т. е. никогда
не смешивают (не скрещивают) друг с другом.
Справедливость сказанного легко проверить, и такая проверка
предпринималась многократно. Для этого мышей определенных
линий содержали на неполноценной диете, исключив из нее один
или несколько компонентов, или, напротив, содержали их на избы-
точной, высококалорийной диете и т. д. Таким путем действи-
тельно удавалось несколько повысить или понизить частоту спон-
танных опухолей у мышей разных линий, в зависимости от ха-
240
рактера опыта и особенностей взятых для этого мышей. Однако
еще никому и никогда не удавалось при помощи диеты или лю-
бых других факторов среды обитания превратить,
например, высокораковые линии в низкораковые, лейкемиче-
ские — в нелейкемические и т. д.
Напротив, стоит мышей двух контрастирующих линий скре-
стить между собой и повести от них потомство, как все то,
что было создано в результате кропотливого отбора в течение
десятилетий, рассыплется, как карточный домик. Более того, если
Рис. 40. Типы п локализация опухолей у мышей, па частоту воз-
никновения которых оказывают влияние соответствующие гены
1 — липомы; 2 — опухоли яичников; 3 — опухоли надпочечников; 4—раки
молочных желез; 5 — раки кожи; 6 — папилломы кожи; 7 — аденомы пи-
туитарной железы; 8 — опухоли желудка; 9 — гемангиоэндотелиомы;
Ю — остеогенные саркомы; 11 — аденомы Гардеровой железы; 12 — опу-
холи легких; 13 — подкожные саркомы; 14 — лейкемии и другие ново-
образования ретикулоэндотелиальных клеток; 15 — опухоли интерстици-
альных клеток семенников; 16—тератомы семенников; 17 — опухоли
печени; 18 — опухоли слюнных желез
По Хестону [51]
такое намеренное смешение мышей продолжить и в дальнейших
поколениях, последовательно вовлекая в скрещивания мышей все
новых и новых линий, то уже сравнительно скоро можно полу-
чить популяцию мышей, которая будет мало чем отличаться от
простых, беспородных с некоторыми усредненными и в целом
незначительными частотами спонтанных опухолей разных лока-
лизаций. Как было сказано выше, в недрах популяций беспород-
ных мышей скрыты в рецессивном состоянии наследственные фак-
торы всех типов злокачественных опухолей, и именно поэтому
беспородные мыши непригодны для точных экспериментально-
онкологических исследований. По этой же причине в развитии
мировой онкологии, в том числе и в Советском Союзе, удельный
вес линейных мышей в разнообразных опытах с каждым годом
возрастает все более [11, 56]. Этот факт является наилучшим
доказательством плодотворности приложения метода чистых ли-
241
пий для исследования проблем экспериментальной онко-
логии.
Таковы в кратких чертах основные результаты селекционно-
генетической работы с линейными мышами. Они с несомненностью
показали, что как предрасположение к опухолеобразовапию, так
и невосприимчивость к нему, являются наследственно обусловлен-
ными (конституциональными) особенностями мышей соответствую-
щих линий, и всякий иной вывод или любое отступле-
ние от него свидетельствовали бы о произвольной интерпретации
основных фактов современной экспериментальной онкологии.
Рис. 40 дает представление о типах тех опухолей у мышей,
связь которых с наследственными факторами установлена на осно-
вании генетических исследований.
ВЛИЯНИЕ ГЕНЕТИЧЕСКИХ ФАКТОРОВ
НА ВОЗНИКНОВЕНИЕ ИНДУЦИРОВАННЫХ ОПУХОЛЕЙ
Влияние генетических факторов на^ возникновение индуциро-
ванных опухолей изучено не менее подробно, чем их роль в воз-
никновении спонтанных опухолей, и поэтому может быть пока-
зано в опыте весьма отчетливо. В самой общей форме можно
сказать, что ^установленные здесь закономерности носят уни-
версальный характер и касаются-всех типов и локализаций
злокачественных опухолей. Однако наиболее подробно изучены
в этом отношении опухоли молочных желез и опухоли легких.
Нижеследующее краткое рассмотрение теоретической и прак-
тической стороны вопроса по необходимости будет проиллюстри-
ровано лишь на модели опухолей легких. Что же касается опухолей
молочных желез, то относящиеся сюда данные удобнее будет рас-
смотреть в связи с опухолеродными вирусами.
Опухоли легких
Систематическое экспериментальное изучение опухолей лег-
ких началось сравнительно поздно, поскольку они недоступны при-
жизненным визуальным наблюдениям и обнаруживаются только
на вскрытиях. С другой стороны, в возникновении опухолей лег-
ких гораздо меньшую роль играют физиологическое состояние
организма, гормональные расстройства и другие внутренние фак-
торы. Поэтому влияние генетических факторов может быть пока-
зано здесь весьма наглядно.
Пионерами в изучении опухолей легких у мышей были Слай,
Мэрфи и Штурм. Первой принадлежит инициатива постановки
вопроса о наследственной восприимчивости к опухолям этой ло-
кализации [81*|, а Мэрфи и Штурму — получение опухолей лег-
ких под воздействием каменноугольного дегтя [72]. Резуль-
таты этих исследований, наряду с введением в экспериментальную
практику мышей чистых линий, определили направление буду-
242
Рис. 41. Легкие мышей линии А
I — спонтанная опухоль легкого у самцаи8-месячного возраста; 2— множественные опу-
холи легких у самца той же линии через 13 недель после внутривенного введения 1,5 мг
метилхолантрена, диспергированного в 1,5 мл лошадиной сыворотки и холестерола
По Шимкину [79]. Увеличение 3,5
щих исследований, протекавших под знаком воздействия на ли-
нейных мышей химически чистых канцерогенов.
Ко времени постановки первых опытов с канцерогенами уже
были известны некоторые из существующих ныне линий мышей.
Отсюда естественно возникла необходимость исследовать реакцию
мышей разных линий на введение им канцерогенных веществ,
синтезированных к тому времени в чистом виде.
Прежде всего и наиболее подробно был выяснен основной
и общий феномен, относящийся к данному циклу исследований,
а именно — увеличение частоты возникновения опухолей легких
под влиянием канцерогенов, которая, при прочих рав-
ных условиях, оказалась всецело зависящей от л и н е й -
ных особенностей взятых для опыта мышей. Впервые
эта зависимость была показана в опытах Линч с каменноуголь-
ным дегтем [67, 68], а затем подтверждена и всесторонне развита
в опытах Андервонта с дибензантраценом и метилхолантреном
[19, 20, 21], в опытах Шимкина с метилхолантреном, дибензантра-
ценом и бензпиреном [78, 79, 80] (рис. 41) и, наконец, в особенно
обстоятельных опытах Хестона, которому принадлежат, несом-
ненно, лучшие исследования по генетике опухолей легких и молоч-
ных желез мышей [42, 43, 44, 45, 49].
Совокупность результатов упомянутых авторов показала, что
если для опыта с канцерогенами взять, например, резистентных
мышей C57BL или C57L, у которых спонтанные опухоли легких
243
возникают исключительно редко, то оказывается, Что и под влия-
нием канцерогенов они возникают лишь у весьма незначительной
части мышей этих линий.
На мышей тех линий, которые по частоте возникновения спон-
танных опухолей рассматриваемой локализации занимают проме-
жуточное положение, влияние канцерогенов проявляется значи-
тельно сильнее и выражается в увеличении не только процента
опухолевых мышей, но и суммарного числа опухолевых узлов
на все доли легкого.
Наиболее же сильное влияние канцерогены оказывают на мы-
шей таких восприимчивых линий
Рис. 42. Частота индуцирован-
ных опухолей легких у мышей А,
G57L и их гибридов, убитых через
различные промежутки времени после
однократного введения 0,5 мг 1,2, 5,
6-дибензантрацена на мышь
1 — мыши А; 2 — мыши G57L; з — гибриды
FI; 4 — гибриды F2 (F1XF1); 5 — гибриды
F2(F1XA); 6 — гибриды F2 (F1XC57L)
По Хестону [43]
(например, А), у которых во
второй половине их жизни
опухоли легких развиваются
у 100% мышей обоих полов
без каких бы то ни было
экспериментальных воздей-
ствий. Усиление канцероген-
ного действия выражается
здесь двояко: во-первых,
в увеличении общего числа
опухолевых узлов на все доли
легкого, достигающего иногда
сотни и более, и, во-вторых,
в резком сдвиге опухолевого
процесса на более ранние
стадии жизни мыши (своего
рода «омоложении» опухо-
лей), в результате чего мно-
гочисленные опухолевые узлы
развиваются у всех без ис-
ключения мышей уже через
1,5—2 месяца после введе-
ния им канцерогена.
Отмеченная закономерность подтверждена на многих тысячах
мышей всех без исключения исследованных в подобных опытах
линий (A, C57BL, C57L, С, Y, I, СЗН, SWR, BL и т. д.) [32, 78];
со всеми испытанными канцерогенами, включая, кроме вышеназ-
ванных, уретан, а также в опытах с гамма-лучами [46, 66]; при
разных способах применения канцерогенов (накожное, подкож-
ное, внутривенное, обработка канцерогеном клеточной суспензии
ткани легкого с последующим введением ее в кровяное русло
и т. д.). Из очень большого количества относящихся сюда экспе-
риментальных данных и иллюстративных материалов мы приве-
дем результаты лишь одного опыта, которые заимствованы из
статьи Хестона [43] и представлены на рис. 42.
Приведенные на рис. 42 данные настолько убедительны, что
не нуждаются в дополнительных пояснениях за одним исключе-
244
нием. Кроме данных о мышах чистых линий, т. е. А и C57L, на
рис. 42 представлены также кривые частоты опухолей легких
у гибридов F1 и F2 от скрещивания мышей этих линий. На этих
гибридных животных необходимо остановиться особо, поскольку
полученные на них данные представляют н о в у ю и весьма убе-
дительную категорию доказательств.
Как было сказано выше (стр. 55), гибриды F2 могут быть
получены тремя путями: 1) скрещиванием гибридов F1 между
собой (инкросс); 2) скрещиванием гибридов F1 с мышами рези-
стентной линии, в данном слу-
чае— G57L, (бэккросс); 3) скре-
щиванием гибридов F1 с мы-
шами восприимчивой линии —
в данном случае А (бэккросс).
Не входя в детали генотипиче-
ских различий гибридов F1 и
трех типов гибридов F2, отме-
тим лишь, что они существенно
отличаются друг от друга по
своим наследственным свой-
ствам, точнее — по соотноше-
нию у них наследственных фак-
торов, полученных от воспри-
имчивых и резистентных роди-
телей. Полный паралле-
лизм между частотой инду-
цированных у гибридов опухо-
лей легких и наличием у них
наследственных факторов вос-
приимчивости (соответственно—
резистентности) оказался в опы-
тах Хестона настолько полным,
Рис. 43. Частота спонтанных
опухолей легких у мышей А и их ги-
бридов с мышами C57L
1 — мыши А; 2 — гибриды Fl (AXG57L);
3 — гибриды F2 (F1XG57L). Частота опу-
холей легких у мышей G57L менее 0,01%
По Хестону [44]
что не оставил никакого сомнения относительно значения по-
следних в возникновении опухолей легких и принес этим данным
полное и всеобщее признание.
Приведенные данные не исчерпывают всего комплекса дока-
зательств справедливости развиваемой концепции. Хестон продол-
жил анализ проблемы и такую же зависимость частоты возник-
новения опухолей легких от генотипа мышей блестяще доказал
на линейных и гибридных мышах в отношении частоты возник-
новения спонтанных опухолей этой локализации [44],
о которых было сказано в предыдущем разделе. Соответствующие
данные, относящиеся к мышам тех же линий (А и C57L) и их
гибридам F1, представлены на рис. 43.
Необходимо также подчеркнуть, что линейные и гибридные
мыши обоих рассматриваемых опытов Хестона происходили из
одних и тех же пометов: одна половина мышей каждого помета
245
шла в опыт с канцерогенами, другая половина мышеи —.в опыт
со спонтанными опухолями. Эта важная методическая деталь
придает опытам Хестона особую стройность и убедительность.
На рис. 44 приведены результаты аналогичных опытов с мы-
шами отечественных линий — CC57BR и CC57W — и их гибри-
дами F1, которым в качестве канцерогена был введен уретан [8].
Таким образом, одним из главных результатов рассмотрен-
ных опытов явилось установление полного параллелизма
между частотой возникновения спонтанных опухолей лег-
ких у мышей чистых линий и у их гибридов и частотой возникно-
вения у них индуцированных опухолей этой локали-
зации в результате воздействия канцерогенов. Не подлежит
сомнению, что канцерогенные вещества лишь ускоряют те про-
цессы, которые у мышей разных линий протекают с разной ско-
ростью без их участия, под влиянием наследственных факторов,
специфических для каждого типа опухолей. Обобщая вытекаю-
щие из этих наблюдений выводы, можно сказать, что степень
опухолеобразующего действия одного и
того же канцерогена на мышей разных
линий есть функция их генотипической
восприимчивости (resp. — резистентности) к спон-
танным опухолям данной локализации.
Из сказанного вытекает также, что одна и та же доза данного
канцерогенного вещества, при прочих равных условиях, в состоя-
нии вызвать далеко не одинаковый эффект у мышей
разных линий.
Попутно следует отметить, что благодаря высокой чувстви-
тельности к канцерогенам легочная ткань мышей восприимчи-
вых линий, допускающая разнообразные способы воздействия
(стр. 244), может служить прекрасной моделью для исследования
разнообразных потенциально канцерогенных вредностей. В одной
из своих работ Шимкин писал по этому поводу следующее: «Ткань
легких мышей А представляет собой замечательный объект для
исследования многих стадий провоцирующего опухоли действия
канцерогенных веществ [79]». Сходного мнения придерживается
и Хестон [48].
В рассмотренных выше опытах был выяснен также ряд других
важных вопросов этиологии и патогенеза опухолей. Из них мы
отметим лишь два, доказательства которых наиболее убедительны.
В одном из них речь идет о линейной зависимости частоты возник-
новения опухолей у мышей А от дозы канцерогена (рис. 45).
Другой касается специфичности действия наследственных
факторов, вызывающих предрасположение к опухолям легких
и кратко может быть сформулирована в виде следующей альтерна-
тивы: является ли предрасположение к опухолям, о которых идет
речь, своего рода общим для в с е г • организма,
т. е. безотносительно типов и локализации опухолей, или оно
246
затрагивает лишь ткань того органа, из которой
развивается опухоль? Этот важный вопрос неоднократно обсу-
ждался в рамках экспериментальной и клинической онкологии.
Как известно, ткани нормальных органов, и в том числе ткань
легкого, будучи пересажены под кожу хозяина той же линии,
вскоре васкуляризируются и могут переживать там неопределенно
долго. Кроме того, ткани животных любых двух линий с успехом
могут быть пересажены одному и тому же хозяину, если таковым
время после введения уретана,
мес
Доза дибензантрацена, мг
Рис. 45. График линейной за-
висимости частоты опухолей
легких у мышей А от дозы
дибензантрацена
По Хестону и Шнейдерману [54]
является гибрид F1 от скрещи-
вания животных этих линий
(см. главу VI).
Воспользовавшись этим ме-
Рис. 44. Частота индуциро-
ванных уретаном опухолей
легких у мышей CC57W,
CC57BR и их гибридов F1
Доза — 1 мг/г веса тела, введение
одноразовое, внутрибрюшинное
1 — мыши GG57W; 2 — мыши
GG57BR; 3 — гибриды Fl (GG57WX
XGG57BR)
По Медведеву [8]
тодическим приемом, ' Хестон и
Тельма Данн пересадили кусочки легких мышей А и C57L гибри-
дам F1 этих линий, от мышей А — в подмышечную ямку одной
стороны, а от мышей C57L — в подмышечную ямку другой сто-
роны одной и той же гибридной мыши. Через месяц
после операции всем подопытным гибридным мышам в хвостовую
вену был введен дибензантрацен (рис. 46).
Оказалось, что процент опухолей в легочных транспланта-
тах мышей А (39,1) в десять раз превысил таковой в трансплан-
татах мышей G57L (3,6). Следовательно, влияние генов воспри-
имчивости проявляется главным образом, если не исключи-
тельно, в ткани легкого [53].
Аналогичные результаты были получены в опытах Шапиро й
Киршбаума с легочными трансплантатами восприимчивых к опу-
холям легких (BALB/с) и резистентных (DBA) мышей и их гибри-
дам F1 с последующей обработкой реципиентов уретаном. В опытах
этих авторов частота опухолей в трансплантатах от воспри-
имчивых мышей (70,6%) в 12 раз превысила таковую в трансплан-
татах от резистентных (5,9%) [77].
Апофеозом в этой серии исследований были опыты Хестона и
Стеффи, в которых тот же самый вопрос и на той же модели эти
Линия 057L X Линия А
введено 0,5 мг дибензантрацена
Рис. 46. Схема опыта по ин-
дукции опухолей в легких мы-
шей А и C57BL, транспланти-
рованных в одного и того же
гибридного хозяина Fl (А X
XC57BL)
Через месяц после трансплантации
легких в хвостовую вену подопыт-
ных мышей введено по 0,5 мг
дибензантрацена По Хестону и
Данн [53]
авторы исследовали в отношении легочной ткани эмбрионов.
Оказалось, что генотипические различия ткани легкого у вос-
приимчивых и резистентных мышей в отношении опухолеобразо-
вания детерминированы уже в эмбриональном периоде раз-
вития [55].
Таков далеко не полный перечень всех исследований, которые
выполнены на инбредных мышах в рамках рассматриваемой
проблемы.
Опухоли молочных желез
По сравнению с опухолями легких доказательства роли на-
следственности в возникновении опухолей молочных желез у мы-
шей носят несколько более сложный, но и более поучительный
характер. С одной стороны, они вскрыли новый, неизвестный
до тех пор, механизм влияния наследственных факторов на воз-
никновение опухолей данной локализации. С другой стороны,
некоторые детали этих доказательств, будучи неправильно по-
няты некоторыми онкологами, послужили источником криво-
толков и отрицания роли наследственности в этиологии злока-
чественных опухолей вообще. Для доказательства обоих положе-
ний полезно вспомнить в кратких чертах историю вопроса.
248
Как было показано Выше, мыши, самки ряда линий, характе-
ризуются очень высокой частотой рака молочных желез, дости-
гающей у некоторых линий (А, СЗН) 95—100%. На первых по-
рах их существования и изучения онкологический статус этих
высокораковых линий, наряду с одновременным существованием
низкораковых линий, вызывал не больше сомнений, или, наобо-
рот, — приносил доказательств — в пользу их наследственной
предрасположенности к опухолям рассматриваемой локализации.
Однако уже в 30-х годах было выяснено, что в возникновении
опухолей молочных желез важную роль играет вирусоподобный
агент, или так называемый фактор молока (milk factor).
Это название фактор молока получил потому, что естественным
путем его распространения и циркуляции в мышиных популя-
циях является молоко кормящих самок, в теле которых он со-
держится и вместе с молоком передается потомству каждого
следующего поколения. По имени открывшего фактор молока
автора его называют также вирусом Биттнера [27 ].
Вскоре было выяснено еще одно важное обстоятельство в опыте,
который заключался в следующем. Беременным самкам из высо-
кораковой линии незадолго до естественных родов было сделано
кесарево сечение, и извлеченные из матки мышата были подса-
жены на воспитание к кормилицам нераковой линии. Эти послед-
ние фактора молока не содержат и поэтому не могут передать
его с молоком приемным мышатам. Оказалось, что как эти прием-
ные, а впоследствии уже взрослые мыши, так и их потомство
всех последующих поколений, фактора молока, действительно,
не содержат и раком молочных желез почти не болеют или болеют
очень редко. Иначе говоря, при помощи этой несложной опера-
ции оказалось возможным почти полностью «излечить» высоко-
раковых мышей и превратить их в нераковые. Сказанное оказа-
лось справедливым в отношении как всех высокораковых линий,
которые содержат фактор молока, так и низкораковых линий,
которые его не содержат.
Обнаружение факта зависимости возникновения опухолей
молочных желез у мышей от фактора молока, т. е. экзоген-
ного по отношению к мышам агента, послужило почти всем
ведущим онкологам Советского Союза 40-х и 50-х годов непра-
вильно понятым основанием для полного отрицания роли наслед-
ственности в этиологии опухоли данной локализации [3, 4, 5,
16, 1S и др. ]. Было принято считать, что опыты, о которых идет
речь, не только не подтверждают развиваемую концепцию, но
и прямо ее опровергают.
Между тем истинное положение и состояние вопроса было
в то время диаметрально противоположным. Для краткости мы
опустим некоторые промежуточные этапы развития этой линии
исследований и кратко остановимся лишь на классических опытах
Хестона, который внес в этот вопрос неопровержимую ясность [52].
17 н. Н. Медведев
249
Рис. 47. Кривые падения частоты опухолей молочных желез у самок I серии опытов в зависимости от по-
степенного уменьшения у них доли восприимчивого хроматина СЗН и увеличения доли резистентного хро-
матина C57BL
Сплошная линия — рожавшие самки; прерывистая линия — девственные самки; пунктирная линия — самки C3Hf, вскормлен-
ные кормилицами, девственные. Составлено по данным Хестона, Деринджер и Данн [52]
Для правильного понимания сущности не только опытов
Хестона, но и всей проблемы в целом, необходимо ответить на
основной вопрос: почему мыши высокораковых линий являются
носителями фактора молока и, соответственно, болеют
раком молочных желез, а мыши нераковых линий его не со-
держат и раком молочных желез не болеют? Этот же
Рис. 48. Кривые повышения частоты опухолей молочных желез
у самок II серии опытов в зависимости от числа повторных возвратных
скрещиваний, увеличивающих вероятность привнесения фактора мо-
лока со спермой самцов СЗН
Обозначения те же, что и на рис. 47
Составлено по данным Хестона, Деринджер и Данн [52]
вопрос можно сформулировать и несколько иначе: является ли
фактор молока единственным этиологическим агентом
опухолей данной локализации и, если это так, то как объяснить
длительное сосуществование бок-о-бок линий мышей, одни из
которых почти нацело погибают от рака, а другие — никогда
им не болеют?
Исчерпывающий ответ на этот вопрос был дан в уже упоминав-
шихся опытах Хестона, результаты которых представлены на
рис. 47, 48 и 49.
251
17*
Для опытов были взяты мыши следующих линий: 1) высоко-
раковые СЗН (частота опухолей 95—100%); 2) такие же мыши СЗН,
но при помощи кесарева сечения освобожденные от фактора
молока (частота опухолей 8%); в тексте и на рисунках они обо-
значены как C3Hf; 3) нераковые мыши C57BL (частота опухо-
лей 0%, фактора молока не содержат).
Рис. 49. Кривые частоты опухолей молочных желез у самок III се-
рии опытов. Несмотря па то, что доля восприимчивого хроматина
бесфакторных мышей C3Hf по мере продвижения опыта резко воз-
растает, частота опухолей у всех бэккроссных самок не превышает
таковой у контрольных бесфакторных клеток G3Hf (38%)
Обозначения те же, что и на рис. 47
Составлено по данным Хестона, Деринджер и Данн [52]
Опыты I серии заключались в скрещивании исходных мы-
шей СЗН и C57BL и последующих семикратных бэккроссах с не-
раковыми самцами. Мыши из седьмого бэккросса в течение четы-
рех последующих поколений были повторно скрещены с бес-
факторными мышами C3Hf. Как видно, идея опытов этой серии
заключалась в постепенном замещении у мышей бэккрос-
сных поколений восприимчивого генотипа (СЗН) резистент-
ным (C57BL), а затем — с седьмого бэккросса и далее — посте-
пенным насыщением мышей генотипом бесфакторных мышей C3Hf
(рис. 47).
252
Опыты II серии в методическом отношении были аналогичны
опытам I серии, но по знаку — прямо им противоположны. Исход-
ные мыши и гибриды F1 были здесь те же, что и в опытах I се-
рии. Далее же, начиная с бэккросса первого и до седьмого, здесь
поглощаемым был генотип мышей C57BL, а поглощающим —
генотип мышей СЗН с фактором молока (рис. 48), который также
привносился самцами во всех бэккроссах.
Наконец, опыты III серии были подобны опытам II серии,
за тем единственным исключением, что поглощающим в бэккрос-
сных поколениях был генотип самцов C3Hf без фактора молока
(рис. 49).
В I серии опытов 20 исходных самок СЗН были скрещены с сам-
цами C57BL. От каждой исходной самки СЗН было запланиро-
вано получить не менее 5 самок F1, а всего 100 самок F1. Из них
20 самок снова должны были пойти в скрещивания с сам-
цами C57BL для получения первого бэккросса, а 80 других —
оставаться девственными. По этой схеме скрещивания были по-
вторены семь раз, до получения мышей седьмого бэккросса.
Наконец, для получения ответа на вопрос — будут ли самки
последовательных бэккроссов содержать активный фактор мо-
лока и передавать его потомству, каждая из 20 размножающихся
самок, начиная с F1 и до седьмого бэккросса, должна была вскор-
мить по пять приемных мышат, самок СЗШ, которые не содер-
жат фактора молока и потому являются хорошими тест-объек-
тами на наличие его в молоке кормилиц.
Таким образом, начиная с F1 и до седьмого бэккросса было
запланировано в каждом поколении получить и проанализиро-
вать по 200 самок; из них 20 размножающихся, основателей
следующего бэккросса и одновременно кормилиц бесфакторных
мышат, самок СЗШ в количестве 100, и 80 самок — девственных
на протяжении всего опыта. По аналогичной схеме с небольшими
модификациями были осуществлены также опыты II и III серий.
Дальнейшие детали [9 ] этих важных опытов мы для краткости
опускаем, отметив лишь некоторые статистические данные отно-
сительно их масштабов. Исследование было рассчитано на восемь
лет и продолжалось с 1946 по 1953 г. В трех сериях опытов под
тщательными наблюдениями прошло 4049 мышей. Однако, при-
нимая во внимание все вспомогательные операции, легко под-
считать, что общее количество мышей в этих опытах достигало
18—20 тыс.
Опыты I серии убедительно показали, что у рожавших, дев-
ственных и вскормленных кормящими самками всех последова-
тельных бэккроссов частота опухолей молочных желез падала
параллельно уменьшению у них доли хроматина восприимчи-
вых мышей, СЗН, и соответственно увеличению доли хроматина
резистентных мышей, C57BL. Падение частоты опухолеобразо-
вания, связанное с одновременной элиминацией молока из орга-
253
низма мышей, шло настолько быстро, что этот процесс почти
полностью заканчивался к третьему бэккроссу: к этому поколе-
нию процент опухолевых самок всех трех серий опыта I упал
почти до пуля и оставался па этом уровне до последнего возврат-
ного скрещивания.
В заключительной фазе опыта, несмотря на резкое увеличение
у мышей восприимчивого хроматина мышей G3Hf, процент
опухолей молочных желез у них не превышал такового у контроль-
ных мышей СЗШ. Отсюда следует, что в результате замещения
у подопытных мышей хроматина СЗН ^’хроматином C57BL фак-
тор молока действительно элиминируется из организма мышей,
а не переходит в скрытое, «маскированное», состояние.
Об этом же говорят результаты опытов III серии, в которых
у самок частота опухолей молочных желез точно также не пре-
вышала таковую у рожавших и девственных контрольных са-
мок СЗШ. С другой стороны, результаты опытов II серии го-
ворят о том, что, по крайней мере, некоторые самцы СЗН пере-
дали фактор молока со спермой в процессе оплодотворения (этот
факт уже был к тому времени известен): частота опухолей у раз-
множавшихся самок этой серии постепенно увеличивалась и к пя-
тому бэккроссу с самцами СЗН она достигла 80%.
Резюмируя вышеизложенное, можно сказать, что вирусопо-
добный фактор молока может размножаться и вызывать опухоли
молочных желез лишь у тех мышей, которые обладают воспри-
имчивым к нему генотипом. Напротив, если ге-
нотип животных к фактору молока невосприимчив,
последний нацело элиминируется из организма
в течение нескольких, немногих поколений. Отсюда, в частности,
можно сделать вполне обоснованный вывод, что число наслед-
ственных факторов (генов), ^определяющих восприимчивость (со-
ответственно — резистентность) к фактору молока, сравнительно
невелико и, возможно, оно не превышает одной—двух пар.
Не входя в рассмотрение дальнейших выводов, вытекающих
из этих опытов [9], отметим два важных обстоятельства, имеющие
непосредственное отношение к поставленному выше вопросу.
Одно из них заключается в отсутствии фактора молока не только
у мышей нераковых линий (стр. 249), но и у мышей, искус-
ственно освобожденных от него при помощи
кесарева сечения [50]. Но в отличие от того, что было выявлено
с низкораковыми мышами в рассмотренных выше опытах, бес-
факторные мыши в результате введения им фактора молока,
возвращаются к, исходному состоянию, т. е. снова становятся
высокораковыми.
Второе обстоятельство — это возможность вызвать опухоли
молочных желез у низкораковых мышей другими пу-
тями — воздействуя на них самыми разнообразными аген-
тами: канцерогенами, облучением, гормонами [71] и т. д. Мы не
254
можем останавливаться на рассмотрении относящихся сюда
обширных данных, кроме ссылки на сказанное в разделе, посвя-
щенном опухолям легких, о том, что дозы соответствующих
агентов должны быть увеличены в этих случаях во много раз [9].
Опухоли других локализаций
Имеющие в литературе сведения об опухолях других локализа-
ций и о существовании восприимчивых к ним мышей более фраг-
ментарны, что в первую очередь объясняется тем, что они не были
подвергнуты столь тщательным исследованиям, как это было
сделано в отношении опухолей легких и молочных желез. Тем
не менее, наследственно обусловленная восприимчивость и па-
раллелизм между частотой спонтанных и индуцированных опу-
холей ряда других локализаций у мышей разных линий были
выявлены достаточно отчетливо. Сказанное справедливо как в от-
ношении опухолей, роль вирусов в возникновении которых не была
доказана (например, гепатомы мышей), так и в отношении опу-
холей молочных желез, в этиологии которых вирусы играют
определенную роль. Кроме лейкемии мышей, сюда относятся
полиома мышей, куриная саркома Рауса, папилломатоз кроли-
ков и некоторые другие опухоли, которые для краткости, хотя
и не совсем верно, обычно называются вирусными.
Наконец, в возникновении ряда опухолей у мышей важную
роль играет гормональная активность и ее нарушения
в результате ли внутренних причин, или под влиянием экспе-
риментальных воздействий. Наиболее разительным примером этого
рода являются мыши линий СЗН и А. У рожавших самок
этих линий частота рака молочных желез обычно очень высока
и у отдельных сублиний достигает 95—100%. В то же время
у девственных самок этих линий существуют резкие
отличия: первые болеют раком молочных желез столь же часто,
как и рожавшие; у самок же А она при этих условиях падает
до 5%. Однако здесь наиболее важен тот факт, что то или иное
физиологическое состояние (статус) и активность половых гор-
монов у мышей разных линий в той же мере наследствен-
но обусловлены, как обусловлено предрасположение
к опухолям молочных желез, о чем было сказано выше. Отно-
сящиеся сюда данные и данные об опухолях других лакализа-
ций можно найти в других источниках [9, 10, 11, 39, 47].
Заключительные замечания
Выше, в качестве модельных, были рассмотрены два типа
опухолей у мышей, в возникновении которых наследственные
факторы играют определенную роль. В отношении одного из них,
т. е. опухолей легких, наследственные факторы влияют непо-
255
средственно на ткань того органа, из которого развиваются опу-
холи, поскольку влияние вирусов, гормонов или каких-либо
других агентов на возникновение опухолей легких не было до-
казано. Что же касается опухолей молочных желез, то механизм
их возникновения более сложный. В этом случае как дополни-
тельный фактор играет роль вирусоподобный экзогенный
агент, опухолеродное влияние которого осуществляется в ре-
зультате его взаимодействия с восприимчивым к нему гено-
типом.
Здесь мы подошли к тому общебиологическому принципу и
механизмам, которые лежат в основе взаимоотношений любого
живого патогенного агента — микроба, вируса, фага — с ор-
ганизмом хозяина. Многочисленные экспериментальные иссле-
дования, выполненные в разных областях биологии, медицины
и сельского хозяйства, ясно показали, что перманентно сущест-
вующие взаимоотношения между бесчисленными патогенными
микробами, вирусами, вредителями сельского хозяйства и т. д.,
с одной стороны, и макроорганизмами, с другой, базируются
на чрезвычайно лабильных взаимодействиях наследственно не-
равноценных генотипов тех и других. Двусторонний анализ по-
пуляций взаимодействующих макроорганизмов и патогенных
микроорганизмов показал, что первые из них слагаются из осо-
бей с различной степенью восприимчивости (соответственно —
резистентности) к действию патогенных возбудителей,
вторые — различной степенью вирулентности ив том
числе различной чувствительностью к терапевтическим воздей-
ствиям. Широко известные примеры из практики применения
антибиотиков, инсектицидов и т. д. иллюстрируют это поло-
жение достаточно наглядно. Сюда же относится и тот общеиз-
вестный факт, что даже самые опустошительные эпидемии прош-
лого не истребляли поголовно все население данной территории.
В данной связи нельзя не упомянуть также классических
исследований Топлея, Вебстера, Гоуена и многих других, кото-
рым при помощи обычных методов заражения мышей и о т-
б о р а резистентных особей в ряде последовательных поколе-
ний удалось вывести линии мышей, невосприимчивых к таким
инфекциям, как паратиф, эктромелия и др. [38]. Та же идея в по-
следние годы находит все более широкий резонанс в селекцион-
ной практике применительно к сельскохозяйственным живот-
ным. Обстоятельный анализ этого вопроса дан в трудах Глом-
боцкого [1J и Хатта [17].
Таким образом, нет достаточных оснований для признания,
что опухолеродные вирусы в тех случаях, когда их па-
тогенетическая роль установлена с несомненностью, пред-
ставляют собой агенты sui generis, взаимодействие кото-
рых с макрооргапизмами не укладывалось бы в рамки кратко
рассмотренного выше общебиологического принципа. Рис. 50
256
иллюстрирует двустороннее взаимодействие патогенных аген-
тов и макроорганизмов, конечный результат которого представ-
лен сложной плоскостью; ее форма в каждом конкретном случае
будет зависеть от характера и амплитуды наследственной из-
менчивости взаимодействующих популяций микро- и макроорга-
низмов.
Исследования последних лет, выполненные на основе новых
оригинальных подходов и методов, приносят все новые доказа-
тельства справедливости развиваемой концепции. Один из та-
ких перспективных методов исследования генетических основ
Рис. 50. Кривая 1 — вы-
живаемость макроорганиз-
мов при некоторой посто-
янной вирулентности (па-
тогенности) микроорганиз-
мов. Кривая 2 — вирулент-
ность микроорганизмов
при некоторой постоянной
восприимчивости (resp. —
резистентности) макроорга-
низмов. Плоскость 1—2—
3—4 — результат взаимо-
действия популяции пато-
генных микроорганизмов с
популяцией макроорганиз-
мов, характер которой
определяется амплитудой
резистентности макроорга-
низмов и степенью измен-
чивости популяции пато-
генных микроорганизмов
По Гоуену [37]
восприимчивости и механизма взаимодействия патогенных ви-
русов с организмом хозяина заключается в использовании мы-
шей таких же конгенных линий, которые сыграли важную роль
в исследованиях проблемы тканевой совместимости.
Идея использования животных конгенных линий недавно
с успехом была осуществлена американскими авторами [41b]
для исследования арбовирусов группы В, вызывающих у людей
и у мышей желтую лихорадку (yellow fever) и западно-нильский
энцефалит (West Nile encephalitis).
Предварительными опытами было установлено, что воспри-
имчивость (соответственно — резистентность) мышей к упомяну-
тым вирусам определяется единственным доминантным геном
с четким проявлением и расщепленивхМ мышей гибридных по-
колений на восприимчивых и резистентных по законам Менделя.
Одновременно были отобраны линии мышей, восприимчивые
(СЗН/Не) и резистентные (PRI и BR) к упомянутым вирусам.
257
Перенос доминантного гена резистентности мышей PRI на ин-
бредную основу восприимчивого генотипа мышей СЗН/Не был
осуществлен по схеме рис. 37 и заключался в восьмикратных
возвратных скрещиваниях и в отборе резистентных мышей по ре-
зультатам заражения вирусом (штаммы 17D и Е101) всех мышей
каждого бэккроссного поколения. В результате была получена
линия мышей C3H.PRI, конгенных мышам СЗН, но в отличие
от них, резистентных к арбовирусам. В то же время генетиче-
ское тождество восприимчивых (СЗН) и резистентных (СЗН.PRI)
мышей по всем генам тканевой совместимости делает воз-
можными успешные перекрестные трансплантации разнообраз-
ных органов и тканей как на исходных мышах, так и на их гиб-
ридах, и открывает широкие методические возможности для ис-
следования механизма действия вирусов на восприимчивых к ним
хозяев.
ПРАКТИЧЕСКАЯ ЧАСТЬ
Спонтанные опухоли
Приведенные выше итоги селекционно-генетической работы
с линейными мышами явились результатом работы на протяже-
нии нескольких десятилетий и, естественно, не могут быть по-
вторены при выполнении учебной программы. Поэтому подроб-
но ознакомиться с вопросом о роли наследственных факторов
в спонтанном опухолеобразовании можно лишь путем
изучения наиболее важных литературных источников, в кото-
рых опубликованы результаты работы по выведению инбредных
линий и их биологические и онкологические характерис-
тики.
Другой подход к рассматриваемому вопросу допускает поста-
новку прямых опытов и заключается в прослеживании
частоты спонтанного опухолеобразовании у животных в случаях
нарушения основного приема разведения линейных жи-
вотных, т. е. системы братско-сестринских скрещиваний (инбри-
динга).
г Для примера рассмотрим скрещивание мышей СЗН и CC57W,
наиболее обычных в наших питомниках и лабораториях. Самки
СЗН характеризуются высокой частотой рака молочных желез
(95%), а самки CC57W никогда им не болеют. С другой стороны,
у 25% мышей CC57W (самцов и (самок) развиваются опу-
холи легких, мыши же СЗН свободны от опухолей этой локали-
зации.
Гибриды F1 унаследуют факторы восприимчивости к опухолям
молочных желез от мышей СЗН, а факторы резистентности
к ним— от мышей CC57W. В то же время гибриды F1 унаследуют
факторы восприимчивости к опухолям легких от мышей CC57W,
258
а факторы резистентности к ним — от мышей СЗН. Какова бу-
дет частота опухолей у гибридов F1 рассматриваемого скрещи-
вания?
Дать точный ответ на поставленный вопрос не представля-
ется возможным по той причине, что данное конкретное скрещи-
вание еще никем не было сделано и частота опухолей молочных
желез и легких у гибридов F1 от скрещивания мышей СЗН и
CC57W не была прослежена. Однако с уверенностью можно
сказать, что в данном случае, равно как и в огромном большин-
стве аналогичных скрещиваний, она будет промежуточ-
ной между частотой опухолей у мышей родительских линий
(рис. 42, 43, 44). Предрасположение к опухолям любой локали-
зации наследуется не по монофакториальному, а по более слож-
ному, полифакториальному типу, описанному Райтом для клас-
сических случаев наследования отоцефалии и полидактилии
у морских свинок.
Справедливость приведенного заключения может быть про-
верена путем постановки контрольного опыта, в котором по-
пытку изменить частоту спонтанных опухолей у таких же мы-
шей можно связать с влиянием каких-либо внешних факторов,
например диеты. При этом во всех других отношениях подопыт-
ные гибридные и контрольные животные должны находиться
в сравнимых условиях.
Рассматриваемое задание можно закончить на гибридах F1.
Однако его можно расширить и углубить, проследив частоту
опухолеобразования у гибридов F2, которых можно получить
тремя способами (стр. 55).
Осуществить все три скрещивания одновременно одному че-
ловеку трудно, это потребовало бы и много времени, и живот-
ных, и места в виварии, поскольку в каждом из этих скрещиваний
необходимо проследить в течение всей их жизни по крайней мере
по 50 животных. Поэтому в простейшем случае можно ограничиться
постановкой одного, например, возвратного скрещивания гиб-
ридов F1 с низкораковым родителем. Если же условия вивария
позволяют расширить объем опыта, то другое возвратное скре-
щивание, а именно — скрещивание гибридов F1 с высокорако-
вым родителем — рационально поручить другому лицу.
То же самое справедливо и в отношении прямого скрещива-
ния, в котором количество подопытных животных нужно, по мень-
шей мере, удвоить.
Необходимо также иметь в виду, что работа, связанная с об-
наружением и диагностикой опухолей, требует серьезной ква-
лификации и начинающим ее нельзя поручить бесконтрольно.
Наиболее важными элементами в этой работе является своевре-
менная и исчерпывающая документация всех явных опухолей
и подозрительных на опухоли образований с последующим из-
готовлением из них гистологических препаратов, которые можно
259
затем проконсультировать с опытным патогистологом-онколо-
гом.
Если опыты осуществляются по программе-максимум и в них
участвуют несколько человек одновременно, между ними дол-
жен быть постоянный контакт и взаимная осведомленность.
Наконец, если опыт, охватывающий два поколения, будет
выполнен аккуратно во всех отношениях, то его результаты,
помимо ответа на учебный вопрос рассматриваемого задания,
могут явиться материалом для научной публикации. Этот эле-
мент опыта необходимо иметь в виду еще и потому, что в отдельных
случаях он может повести к синтезу новых линий, в которых
удастся сочетать предрасположение к двум и даже трем типам
опухолей. В рассмотренном опыте это были опухоли легких и
опухоли молочных желез. Примером таких линий является ли-
ния А, у мышей которой спонтанные опухоли обеих локализа-
ций развиваются в 95—100% случаев.
Подведем краткий итог по первому практическому заданию,
связанному с выяснением роли наследственных факторов в от-
ношении частоты спонтанных опухолей у линейных животных.
1. Существующие линии мышей являются результатом селек-
ционно-генетической работы с ними в течение нескольких де-
сятилетий и отличаются друг от друга по многим биологическим
особенностям.
2. Биологические особенности мышей разных линий при од-
нородных условиях существования стойко удерживаются на про-
тяжении многих поколений; поэтому есть все основания считать
их обусловленными генетически.
3. Злокачественные опухоли, как одна из форм патологиче-
ской наследственности, не составляют исключения из общего
правила. Поэтому стойкое существование высокораковых и низ-
кораковых линий мышей должно рассматриваться как резуль-
тат фиксации в разных линиях определенных гено-
типов, одни из которых содержат факторы, предраспола-
гающие к опухолеобразованию, в то время как генотипы других
линий таких предрасполагающих факторов не содержат, вслед-
ствие чего злокачественные опухоли не возникают у них вообще
или возникают исключительно редко.
4. На том же основании должно быть понятно существование
линий мышей, которые характеризуются промежуточной часто-
той спонтанного опухолеобразования. Фиксированные генотипы
этих линий содержат меньшее число неследственных факторов,
обусловливающих восприимчивость к спонтанным опухолям.
5. Имеются два подхода к углубленному знакомству с воп-
росом о роли генетических факторов в спонтанном опухолеоб-
разовании:
а) изучение соответствующих литературных данных по пер-
воисточникам; б) нарушение основного приема линейного разве-
260
депия животных — инбридинга — и прослеживание частоты опу-
холеобразования у гибридов F1 и F2. При тех же условиях су-
ществования, при которых разводят линейных мышей, частота
спонтанных опухолей у гибридов F1 и F2 будет иной, чем у мы-
шей высокораковых и низкораковых линий и, как правило,
промежуточной между ними.
6. Анализ частоты спонтанных опухолей у гибридов F1 может
в отдельных случаях привести к синтезу новых линий мышей,
у которых можно сочетать предрасположение к опухолям двух
или даже нескольких локализаций, или, напротив, разбить
такие комплексные линии, примером которых является ли-
ния А.
Индуцированные опухоли
Влияние генетических факторов на возникновение индуци-
рованных опухолей, и в частности опухолей легких, было рас-
смотрено выше (стр. 242).
Для опытов с индуцированными опухолями легких лучше
всего подойдут мыши линий А и C57L, которые обычны в наших
питомниках и лабораториях. Мыши А — высокораковые в отно-
шении спонтанных опухолей молочных желез и легких. У ро-
жавших самок А опухоли молочных желез развиваются в 95%
случаев; изредка они возникают и у самцов. Кроме того, к 15—
16-месячному возрасту и позднее почти у всех мышей А, самок
и самцов, развиваются опухоли легких. Наконец, в том же воз-
расте у всех мышей развиваются поражения почек (нефриты).
Мыши C57L являются полной противоположностью мышам А.
У них частота спонтанных опухолей молочных желез и опухолей
легких менее 1%.
Для опыта необходимо взять равные количества мышей обеих
линий, лучше всего двухмесячного возраста. Чтобы получить
более четкие и сравнимые результаты, для опыта предпочти-
тельно брать животных одного пола, в данном опыте безразлич-
но — самок или самцов. В этом случае будут уравнены все
физиологические различия между животными и исключена возмож-
ность сопутствующего влияния указанных факторов на резуль-
таты опыта.
Мышам обеих линий вводят любое химически чистое канцеро-
генное вещество. Так как химически чистые канцерогены де-
фицитны, то для опыта с опухолями легких их с успехом может
заменить уретан (этилкарбамат), который по рецепту врача можно
достать в аптеке.
Уретан растворяют в физиологическом растворе в 10 %-ной
концентрации: 1 мл такого раствора содержит 100 мг уретана.
При помощи туберкулинового шприца раствор уретана вводят
мышам внутрибрюшинно; доза — 1 мг на 1 г веса животного.
261
Вес мышеи в указанном возрасте варьирует от 20 до 28 г. Соот-
ветственно с этим дозы уретана в .миллиграммах на одну мышь
варьируют в тех же пределах. Взвешивать мышеи (лучше нар-
котизированных) удобно на торзионных весах. Для наркоза сле-
дует брать эфир pro narcosi, но не хлороформ, от которого мыши,
особенно некоторых линий, быстро погибают.
Уретан не обладает токсическим действием и к тому же пол-
ностью выводится из организма в течение 24 час. после введения.
Следовательно, его действие на легочную ткань весьма кратко-
временно — свойство, которым не обладает никакой другой кан-
цероген.
Как непосредственная реакция на введение уретана, у мышей
наблюдается временное нарушение координации движений. Но уже
через 3—4 часа этот симптом проходит, и в дальнейшем мыши
чувствуют себя нормально.
Убедительность рассматриваемого опыта будет зависеть от ко-
личества взятых в опыт мышей и его продолжительности. Если
опыт поставлен на небольшом количестве мышей, и они были
забиты через короткий промежуток времени после введения уре-
тана, разница в суммарной частоте опухолевых узлов во всех
долях легкого у мышей А и C57L будет небольшой. У таких же
мышей, но забитых через более длительное время (10—12 меся-
цев), разница в частоте возникновения опухолей будет гораздо
больше.
Наконец, если опыт поставлен на достаточном числе мышей
и длится не менее года, имеется возможность забивать мышей рав-
ными порциями через равные промежутки времени и таким пу-
тем получить кривые нарастания частоты опухолеобразования
с возрастом (рис. 42—44).
Рассмотрение данных опытов мы закончим следующим мето-
дическим замечанием. Опухолевые узлы в легких растут медленно
и локализуются на поверхности легких под плеврой в виде мел-
ких белесоватых жемчужин, иногда настолько малых, что их
трудно заметить невооруженным глазом. Поэтому легкие за-
битых мышей необходимо обследовать при помощи лупы с 10-крат-
ным увеличением. Кроме того, доли обоих легких необходимо
отсекать одну от другой, и, наряду со свободными, просматри-
вать также те их поверхности, которыми они соприкасаются друг
с другом. Несоблюдение этого условия может повести к тому,
что часть опухолевых узлов останется на вскрытии незамечен-
ной.
Отметим попутно, что у мышей весьма подробно исследован-
ных линий было найдено девять различных типов расчленения
легких на доли. Из них в наиболее часто встречающемся, «нор-
мальном», типе левое легкое состоит из одной доли, правое —
из четырех. Передняя, средняя и задняя доли правого легкого
262
расположены в ряд, в передне-заднем направлении; четвертая,
самая малая доля (подсердечная), расположена над диафрагмой,
слева от средней линии [30].
Рассмотренный опыт можно осуществить также на мышах
других линий, что в каждом конкретном случае будет зависеть
от их наличия в лаборатории.
Наконец, что касается опухолей молочных желез, то опыты
с ними можно организовать примерно по той же программе, что
и опыты с опухолями легких, руководствуясь наличием имею-
щихся в Советском Союзе линий (табл. 51) и их онкологическими
характеристиками (см. «Список линий», стр. 266). Демонстра-
тивны также опыты по «очищению» мышей высокораковых ли-
ний от фактора молока и повторному «заражению» бесфакторных
мышей фактором. Необходимо, однако, иметь в виду, что опыты
этого рода, равно как и опыты с опухолями молочных желез,
еще более длительны, чем опыты с опухолями легких, и потому
их можно организовать лишь при наличии к тому практических
возможностей.
В заключение вернемся к стр. 236, где было сказано об ус-
ловности деления опухолей на спонтанные и индуцированные
и об относительности интерпретации результатов опытов, в ко-
торых возникновение индуцированных опухолей зачастую не-
обоснованно приписывают исключительно действию исследу-
емого внешнего агента. Опыт с мышами А и C57L наглядно ил-
люстрирует справедливость обоих положений. В самом деле,
у 100% мышей линии А к концу жизни развиваются спонтанные
опухоли легких; среднее число узлов на одну мышь равно 2—3.
Через 16 недель после введения канцерогена число опухолевых
узлов на мышь в среднем достигает 75.
В противоположность этому, у мышей C57L спонтанные опу-
холи легких никогда не развиваются. Даже через 48 недель
после введения столь сильного канцерогена, каким является
1-2-5-6-дибензантрацен, опухоли легких возникли лишь у 25%
мышей C57L, а среднее число узлов на одну мышь было равно
0,27 [43]. Можно ли в данном опыте провести границу между
спонтанными и индуцированными опухолями, равно как воз-
никновение последних в таком опыте приписать лишь действию
канцерогена?
Приведенный пример с мышами А и C57L относится к числу
наиболее показательных. Однако перед экспериментатором всегда
реальной является опасность использовать для опыта такие
случайные партии (выборки) беспородных мышей, или мышей
с неизвестным онкологическим фоном, которые в какой-то мере
могут привести к сходным результатам.
263
ЗАКЛЮЧЕНИЕ
В кратком заключении необходимо остановиться на одном
соображении, которое иногда приходится слышать при обсуж-
дении и оценке экспериментальных исследований на линейных
животных и которое обычно сводится к следующему. Несомненно,
что результаты исследований генетического аспекта тех проб-
лем, о которых речь шла в главах VI и VII, представляют опре-
деленный интерес. Но ведь у человека чистых линий нет; поэ-
тому не допускаем ли мы двойную ошибку, создавая экспери-
ментальные модели, непосредственно не приложимые к человеку,
и экстраполируя на него результаты тех исследований, которые
получены в опытах на инбредных животных?
В этом вопросе следует различать две стороны. Одна из них —
это действительно неприменимость метода чистых линий к че-
ловеку. Заметим, однако, что метод чистых линий лишь один
из многих, которые непосредственно неприменимы к чело-
веку в настоящее время, но с развитием знаний во всех областях
биологии и медицины частично может быть заменен сходными
по значению методами в будущем. Такими методами примени-
тельно к человеку могут явиться метод родословных и метод
статистический, которые по мере накопления знаний в области
патогенеза наследственных болезней сыграют немаловажную
роль в их лечении и профилактике.
Другая сторона вопроса — это познание природы тех явле-
ний, о которых здесь идет речь. Рассматривая проблему с этой
точки зрения, необходимо подчеркнуть, что метод чистых ли-
ний принес важные результаты не только в исследованиях гене-
тического аспекта проблемы рака, совместимости нормальных
тканей, но и во всех других разделах биологии, медицины и
сельского хозяйства, в которых он применялся настойчиво и
со знанием дела. Иначе говоря, метод чистых линий доказал
свою жизненность как всеобщий биологический прин-
цип.
Поэтому существо рассматриваемого вопроса может и должно
сводиться лишь к принципиальной правомочности со-
поставления мыши и человека, как объектов биологиче-
ских исследований, и к значению экспериментальных иссле-
дований вообще, на чем едва ли есть необходимость останавли-
ваться.
В настоящее время не представляется возможным сказать,
в какой мере генетические закономерности в области рака, со-
вместимости нормальных тканей и другие, установленные в опы-
тах на мышах, отличаются от таковых у человека. Возможно,
что такие отличия со временем и будут найдены, однако они
едва ли будут затрагивать основы рассматриваемых явлений.
В данной связи нельзя не отметить и тот ободряющий факт, что
264
в тех немногих опытах на человеке, которые были поставлены
с целью проверки данных, полученных на мышах, во всех слу-
чаях были получены однозначные, совпадающие результаты.
Сюда относятся опыты по перевивке злокачественных опухо-
лей добровольцам из числа раковых больных и здоровых людей,
по перевивке кожи разнояйцевым и однояйцевым близнецам
и др.
Наконец, нельзя пе подчеркнуть исключительную сложность
тех проблем, о которых здесь шла речь. Потребовалось шесть-
десят лет упорного труда многих коллективов исследователей,
пока постепенно вырисовывались контуры теории, которая сум-
мирует результаты исследований генетического аспекта рассмат-
риваемых проблем. За это время выполнены тысячи исследо-
ваний, выведены и тщательно изучены в течение более ста
поколений сотни специализированных линий лабораторных жи-
вотных. Развитие современной онкологии, изучение проблемы
тканевой совместимости и многих других проблем медицины и био-
логии вступило в полосу тончайших и весьма трудоемких методов
исследования. И тем не менее единственный путь к их решению
лежит, вне всякого сомнения, через преодоление этих трудностей.
СПИСОК ЛИНИЙ И СУБЛИНИЙ МЫШЕЙ
ПЛЕМЕННЫХ ПИТОМНИКОВ АМН СССР
И ИХ ХАРАКТЕРИСТИКИ
«Список линий и сублиний мышей» и табл. 51 (см. стр. 276)
имеют в виду ознакомить с ними широкие круги научных работ-
ников и помочь им в выборе исходного материала для экспери-
ментальных исследований.
«Списку» и табл. 51 необходимо предпослать следующие пояс-
нения и добавления:
1. Принятые в «Списке» и в таблице обозначения имеющихся
в СССР линий и сублиний мышей удовлетворяют рекомендациям
Международного Комитета по стандартизации номенклатуры для
инбредных животных [99]. Во избежание недоразумений в по-
становке опытов и возможных ошибок в интерпретации полу-
ченных в них результатов этих обозначений следует придержи-
ваться в научной переписке и в научных публикациях.
2. Порядковые номера линий и сублинип «Списка» соответ-
ствуют таковым табл. 51, из которой видно, откуда и когда мыши
впервые поступили в Советский Союз и в каких питомниках
АМН СССР их можно получить для экспериментальных и пле-
менных целей.
3. Во всех тех случаях, когда одна и та же линия «Списка»
и табл. 51 представлена несколькими сублиниями, предпола-
гается, что их онкологические характеристики в основном оди-
наковы (см., например, сублинии 1, 2 «Списка», сублинии 3, 4;
5, 6; 10—12; 13, 14; 16-20; 21, 22).
4. Из имеющихся в СССР линий в онкологическом отноше-
нии наиболее подробно изучены мыши CC57BR и CC56W, онко-
логическая характеристика которых за 40 поколений инбри-
динга опубликована в ряде специальных статей. Некоторые
данные были за это время опубликованы также о мышах Afb
(ныне AKR), C57BL, А и СЗНА. Подробные ссылки на соответ-
ствующие литературные источники см. в книге Н. П. Медведева «Ли-
нейные мыши. Справочное руководство» (Медгиз, 1964, стр. 174—
175 и табл. 20). Что же касается линий и сублиний, поступивших
из зарубежных лабораторий, то за время разведения в Советском
Союзе они в онкологическом отношении не изучены. Поэтому
онкологические данные о них заимствованы из зарубежных
литературных источников.
5. Мыши изогенных резистентных линий (№ 11 и 12, 19и20
«Списка»), а также наиболее надежные линии CC57BR и CC57W
(№ 8 и 9) и давшие им начало линии BALB/cDe и C57BL/He
(№ 6 и 17) поддерживаются в ИЭМ им. Гамалеи.
6. Адреса питомников, в которых разводят линейных мышей:
266
а) Питомник «Столбовая»: Ст. Столбовая, Московско-
Донбасской ж. д., Питомник лабораторных животных АМН
СССР;
б) Питомник «Р а п п о л о в о»: Почтовое отделение Варте-
мяги, Ленинградской обл., Всеволожского района, Питомник
лабораторных животных «Рапполово» АМН СССР.
Научная и научно-организационная работа обоих питомников
лабораторных животных осуществляется и координируется Лабо-
раторией экспериментальных животных АМН СССР. Почтовый
адрес Лаборатории: Почт, отделение Юрлово, Химкинского
района, Московской области, хозяйство «Светлые Горы», Лабо-
ратория экспериментальных животных АМН СССР. Сообще-
ние: метро «Сокол», автобус 376, остановка «Марьино — Зна-
менское».
В структуре Лаборатории имеются сектора: 1) генетики и се-
лекции; 2) микробиологии, вирусологии и паразитологии; 3) кор-
мления и содержания лабораторных животных; 4) патоанатомии
и патогистологии.
7. Сведения о мировом разнообразии наиболее важных линий
мышей, а также линейных животных всех других видов, можно
найти в источниках, приведенных на стр. 238 и 239.
* * *
№ 1. А.
Масть — белая, генетическая формула — aabbcc.
Аллель основного локуса тканевой совместимости — Н-2а.
Происхождение. Выведена Стронгом в 1921 г. от
скрещивания мыши Bagg albino (впоследствии В alb С, см. № 5)
с белой мышью из колонии Литтла. Большинство известных
в настоящее время сублиний берет начало от мышей Биттнера,
которых он получил от Стронга в 1927 г.
Характеристика. Высокая частота опухолей молоч-
ных желез у рожавших самок (95%) и низкая у девственных (4,5%).
Высокая частота опухолей легких (до 95%) у мышей обоих по-
лов. У мышей всех сублиний к 15-месячному возрасту разви-
ваются первичный амилоидоз и нефриты.
Поскольку мыши BALB/c фактора молока не содержат, можно
думать, что высокая частота рака молочных желез у мышей А
обязана наличию этого агента.
Обе линии наследственно предрасположены к размножению
у них фактора молока. Однако мыши BALB/c генетически более
чувствительны к гормональным влияниям, поскольку частота
рака молочных желез у девственных самок этой линии выше,
чем у таких же самок А.
Так как мыши В alb С не были родственны белым мышам Лит-
тла, то можно допустить, что мыши А унаследовали восприим-
267 18*
чивость к фактору молока от мышей В alb С. Восприимчивость
к фактору молока унаследовали также мыши GC57BR и CC57W
(№№ 8 и 9), одним из родителей которых была мышь (самка)
BALB/c.
Мышей А и BALB/c объединяет также восприимчивость
к опухолям легких. Однако у мышей разных сублиний BALB/c
она втрое ниже, чем у мышей А. Отсюда можно допустить, что
предрасположение к опухолям легких унаследовано мышами А
не только от мыши В alb С, но частично и от белой мыши из ко-
лонии Литтла.
Мыши А впервые поступили в Советский Союз в 1943 г. из
Национального ракового института США. Их инбредный возраст
к тому времени был равен 60 поколениям. С 1943 г. мыши прошли
еще 42 поколения инбридинга. Таким образом, инбредный воз-
раст этой сублинии равен 102 поколениям. Сублиния Снелла к на-
стоящему времени прошла 135 поколений инбридинга.
В Советском Союзе частота опухолей молочных желез у мы-
шей А детально не прослежена. По неполным данным Погосянц
за 1943—1958 гг., она не превышала 44%. Плодовитость мышей
вполне удовлетворительна.
LD 50/30 для самок и самцов соответственно равны 534 и 518р.
№ 2. A/HeJ.
Масть — белая, генетическая формула — ааЪЪсс.
Аллель основного локуса тканевой совместимости — Н-2а.
Происхождение. Мыши этой сублинии получены
в январе 1961 г. из Джексоновской лаборатории (США), куда
они поступили от Хестона (США) в 1948 г. на 77 инбредном поко-
лении.
Характеристика. По неопубликованным данным
Джексоновской лаборатории, частота раков молочных желез
у рожавших самок около 80%. По сравнению с мышами других
сублиний несколько пониженное количество эритроцитов.
№ 3. AKR (синонимы: Ak, AKm, Afb, RIL).
Масть — белая, генетическая формула — аасс.
Аллель основного локуса тканевой совместимости — Н-2*.
Происхождение. Линия выведена в Рокфеллеровском
институте (США). С 1928 до 1936 г. поддерживалась Фэрсом как
высоколейкемическая. Несколько последующих лет разводилась
аутбредно, первоначально под наблюдением Роудс, а затем Линч.
Характеристика. Высокая частота лейкемий у мы-
шей обоих полов.
В Советский Союз впервые поступила в 1947 г. из Националь-
ного ракогого института США. Инбредный возраст к настоящему
времени -- 104 поколения.
268
После 8 лет разведения в Советском Союзе частота лейкемий
была найдена равной 64% у самок и 48% у самцов. В последую-
щие годы в результате отбора частота лейкемий возросла до
80—85% (неопубликованные данные Медведева). Плодовитость
мышей удовлетворительна.
LD 50/30 для самок и самцов соответственно равны 519 и 504 р.
№ 4. AKR/J (синонимы: Ак, Акт, Afb, RIL).
Масть — белая, генетическая формула — аасс.
Аллель основного локуса тканевой совместимости — Н-2К.
Происхождение. См. № 3. Поддерживается в Джексо-
новской лаборатории.
Характеристика. Высокая частота лейкемий у мы-
шей обоих полов.
Мыши этой сублинии получены из Джексоновской лабора-
тории в 1961 г.
№ 5. BALB/c (синонимы: В alb С, С).
Масть — белая генетическая формула — ЪЪсс.
Аллель основного локуса тканевой совместимости — H-2d.
Происхождение. Линия происходит от белых коммер-
ческих мышей Багга, приобретенных им в штате Огайо в 1906 г.
От него мыши поступили к Литтлу, а затем, в 1922 г., к Мак-
Дауэллу. Последний начал братско-сестринские скрещивания
в 1923 г. Длительность и степень инбридинга в предшествовавшие
годы установить нельзя. От Мак-Дауэлла мыши поступили к Снеллу
в 1932 г. на 26-м инбредном поколении. Вскоре линия получила
широкое распространение, в особенности через Андервонта.
Первоначально линия обозначалась как Bagg albino. Впослед-
ствии обозначение несколько раз менялось: В alb с, С. В настоя-
щее время линия обозначается как BALB/c.
Характеристика. Частота опухолей молочных же-
лез низкая. Мыши не содержат фактора молока, но восприим-
чивы к его размножению. Поэтому в результате введения мыша-
там фактора молока частота опухолей молочных желез резко
увеличивается. У небольшого процента мышей возникают опу-
холи яичников и надпочечников. Опухоли легких возникают
у 25—30% мышей с некоторым преобладанием у самцов. Мыши
восприимчивы к хронической пневмонии.
Мыши BALB/c впервые поступили в Советский Союз из Анг-
лийского центра лабораторных животных в 1958 г. Инбредный
возраст сублинии 78 поколений. В Советском Союзе частота
опухолей молочных желез и легких не прослежена. Самка С
(BALB/c) этой сублинии была материнским родителем тех ин-
бредных мышей, от которых произошли линии CC57BR и CC57W.
Мыши весьма активны, плодовиты.
269
№ 6. BALB/cDe (синонимы: В alb С, С).
Масть — белая, генетическая формула — bbcc.
Аллель основного локуса тканевой совместимости — H-2d.
П р о и с х о ж д е н и е. Одна из сублиний BALB/c, кото-
рая поддерживается Деринджер. Инбредный возраст 96 поко-
лений.
Характеристика. Низкая частота опухолей молочных
желез и очень высокая после введения мышатам фактора молока.
Опухоли легких — 25—30%. Мыши подвержены хронической
пневмонии.
Поступили из Национального ракового института США
в 1960 г.
№ 7. СВ А (синоним: XXXIX).
Масть — серая, генетическая формула— (+).
Аллель основного локуса тканевой совместимости — Н-2к.
Происхождение. Выведена Стронгом в 1920 г. от
скрещивания самки Bagg albino (см. № 5) с самцом DBA. От
этих гибридных мышей выведен ряд линий, наиболее распро-
страненными из которых являются СВ А и СЗН (см. № 10).
Характеристика. Линия СВА высокораковая, но
частота опухолей молочных желез непостоянна и, по данным
разных авторов, колеблется от 1 до 22%. Известны случаи воз-
никновения гепатом. Частота опухолей легких менее 1%. Мыши
живут долго. Для успешного их размножения необходима допол-
нительная диета. У 18 % мышей отсутствуют нижние третьи мо-
ляры. Описаны случаи непостоянства скелетных элементов. Уме-
ренно резистентны к ракам кожи, индуцируемым химическими
канцерогенами.
В Советский Союз мыши поступили в 1958 г. из Английского
центра лабораторных животных. Инбредный возраст 45 поколе-
ний. Сублиния Джексоновской лаборатории прошла 106 поколе-
ний инбридинга. Частота опухолей всех локализаций не просле-
жена. Мыши плодовиты.
№ 8. CC57BR.
Масть — коричневая, генетическая формула — aabb.
Аллель основного локуса тканевой совместимости — Н-2Ь.
П р оисхождение. Линия выведена Медведевым в 1944 г.
от скрещивания самки BALB/c (по тогдашнему обозначению С)
с самцом C57BL, которые были получены из Национального
ракового института США в 1943 г. TV концу 1967 г. мыши прошли
62 поколения инбридинга.
Характеристика. Мыши CC57BR не содержат фак-
тора молока, и опухоли молочных желез у них не известны.
270
Однако от мышей BALB/c они унаследовали восприимчивость
к размножению фактора молока. Поэтому в результате введения
мышатам фактора молока опухоли молочных желез возникают
в среднем у 60% самок.
Частота опухолей легких к концу 1967 г. достигла 20%.
Поскольку у мышей C57BL частота опухолей легких менее 1 %,
очевидно, что повышенную восприимчивость к опухолям этой
локализации они унаследовали от мышей BALB/c.
Частота опухолей всех других локализаций менее 1 %. Таким
образом, мыши GC57BL резистентны к спонтанным опухолям
практически всех локализаций, кроме опухолей легких.
По сравнению с мышами других линий более устойчивы к дей-
ствию рентгеновых лучей: LD 50/30 для самок равна 559/?, для
самцов 538р. Мыши весьма активны, плодовиты.
№ 9. CC57W.
Масть — белая, генетическая формула — ааЪЪсс.
Аллель основного локуса тканевой совместимости — Н-2Ь.
Происхождение. Линия выведена Медведевым в 1944 г.
от скрещивания той же пары мышей, что и линия CG57BR
(см. № 8). К концу 1967 г. мыши прошли 61 поколение инбри-
динга.
Характеристика. Мыши CG56W не содержат фак-
тора молока. За всю историю существования линии зарегистри-
рована единственная опухоль молочной железы, не содержав-
шая фактора молока. Однако мыши CC57W, так же как и CC57BR,
унаследовали от BALB/c восприимчивость к размножению фак-
тора молока. Поэтому в результате введения мышатам фактора
молока опухоли молочных желез возникают в среднем у 60%
самок CC57W.
От мышей BALB/c они унаследовали также восприимчивость
к опухолям легких. У мышей всех сублиний BALB/c частота
опухолей этой локализации колеблется от 25 до 30%. У мышей
CC57W частота опухолей легких к концу 1967 г. достигла 25%.
Частота опухолей всех других локализаций не превышает 1%.
Таким образом, мыши CC57W резистентны к спонтанным опухо-
лям почти всех локализаций.
Мыши активны, вполне плодовиты.
№ 10. СЗН/Не (синоним: Z).
Масть — серая, генетическая формула — (+).
Аллель основного локуса тканевой совместимости — Н-2к.
Происхождение. Линия СЗН выведена Стронгом
в 1920 г. от той же пары мышей, что и линия СВ А (см. № 7). Один
помет мышей (4 самки и 2 самца) получен Андервонтом в 1930 г.,
который селектировал мышей на высокую частоту и раннее возник-
271
новение опухолей молочных желез. От Андервонта мыши по-
ступили к Хестону в 1941 г.; их инбредный возраст к тому вре-
мени исчислялся 35 поколениями. В настоящее время известны
многочисленные сублинии; наиболее известны сублинии Стронга
(СЗН/St), Андервонта (СЗН/An), Биттнера (СЗН/Bi) и Хестона
(СЗН/АпНе).
Характеристика. Частота опухолей молочных желез
высокая (95%) у рожавших и девственных самок. У мышей суб-
линии Андервонта к 14-месячному возрасту она достигает 95—
100%. Частота опухолей легких 5—10%. Нередки случаи воз-
никновения гепатом. У мышей СЗН/An их частота достигает 27 %
у самцов и 10% у самок. У мышей СЗН гепатомы возникают
в большом количестве под влиянием четыреххлористого угле-
рода. Так как у мышей DBA гепатомы возникают редко, можно
думать, что предрасположение к опухолям этой локализации
мыши СЗН унаследовали от В alb С. То же самое справедливо и
в отношении опухолей легких, поскольку частота опухолей этой
локализации у мышей DBA менее 1%.
В результате введения лейкомогенного агента из мышей лейке-
мической линии AKR у мышей СЗН сублинии Хестона разви-
вается 1,2% лейкемий, у мышей СЗН сублинии Биттнера —
18,4% лейкемий. У мышей этой же линии пониженное количество
эритроцитов. Кроме того, мыши сублиний СЗН/An и СЗН/Не
большей частью имеют по 6 поясничных позвонков.
В Советский Союз мыши СЗН/Не впервые поступили в 1958 г.
из Английского центра лабораторных животных. Частота опухо-
лей молочных желез и других локализаций не прослежена.
Мыши активны, вполне плодовиты.
№ 11. C3H/HeDiSn.
Масть — серая, генетическая формула — (+).
Аллель основного локуса тканевой совместимости — Н-2к.
Происхождение. Одна из сублиний СЗН. Как пока-
зывает обозначение, это сублиния Хестона, от которого она по-
ступила к Дикки, а затем — к Снеллу. Характеристика суб-
линий СЗН приведена выше (см. № 10). Сублиния C3H/HeDiSn
конгенна сублинии СЗН — Н-2Р (см. № 12).
Характеристика. Мыши СЗН/HeDiSn невосприим-
чивы к перевиваемььм опухолям конгенной линии СЗН — Н-2р.
Во всех других отношениях они подобны мышам сублинии
СЗН/Не.
Сублиния СЗН/HeDiSn получена из Джексоновской лабора-
тории в 1960 г. Поддерживается в племенном питомнике ИЭМ
им. Гамалеи.
272
№ 12, СЗН - Н-2Р (синоним: C3H.NB).
Масть — серая, генетическая формула — (+).
Аллель основного локуса тканевой совместимости — Н-2’\
Происхождение. Вместе со всеми другими конген-
ными резистентными линиями выведена Снеллом. Конгенна суб-
линии СЗН/HeDiSn (№ И).
Характеристика. У мышей СЗН—Н-2р аллель к
основного локуса тканевой совместимости, нормально свойствен-
ный мышам СЗН, замещен аллелем р. Поэтому мыши этой суб-
линии резистентны к перевиваемым опухолям мышей конгенной
линии СЗН/HeDiSn (№ И). Во всех других отношениях они
подобны мышам сублинии СЗН/HeDiSn.
Получена из Джексоновской лаборатории в 1960 г. Поддер-
живается в племенном питомнике ИЭМ им. Гамалеи.
№ 13. C3Hf/Pu I.
Масть — серая, генетическая формула — (+).
Аллель основного локуса тканевой совместимости — Н-2к.
Происхождение. Бесфакторная сублиния СЗН. Вы-
ведена Хестоном из помета СЗН/Не, извлеченного кесаревым
сечением и воспитанного кормилицей C57BL.
Характеристика. Помет 24-го инбредного поколения
бесфакторной сублинии получен Пуллинджер (Англия) от Хе-
стона. Частота опухолей молочных желез у рожавших самок 38%.
В Советский Союз поступила в 1958 г. из Английского центра
лабораторных животных. Частота опухолей молочных желез и
других локализаций не прослежена.
№ 14. C3Hf/Pu II.
Масть — серая, генетическая формула — (+).
Аллель основного локуса тканевой совместимости — Н-2к.
Происхождение. Бесфакторная сублиния СЗН. Вы-
ведена Пуллинджер путем кесарева сечения. Поступила из того же
источника одновременно с сублинией № 13. Частота опухолей
молочных желез не прослежена.
№ 15. СЗНА.
Масть — серая, генетическая формула — (+).
Аллель основного локуса тканевой совместимости — (?).
Происхождение. Выведена в 1944 г. Погосянц от
самки СЗН и самца А.
Характеристика. Частота опухолей молочных желез
по первоначальным данным 30,6%. По более поздним данным,
она возросла до 45 %. В последние годы частота опухолей этой
локализации упала до 9,5%.
LD 50/30 для самок и самцов соответственно равны 465 и 413 р.
273
№ 0. С57ВL (синоним: С 57 black).
Масть — черная, генетическая формула — аа.
Аллель основного локуса тканевой совместимости — Н-2Ъ.
П р о и с х о ж д е и и е. Мыши линий C57BL, C57BR
(см. № 22), G57L (см. № 23) и С58 (см. № 24) произошли от одно-
пометных мышей из колонии Ласроп. Самка № 57 была скрещена
с самцом № 52 (Литтл, 1921 г.). В потомстве возникли черные и
коричневые мыши, от которых соответственно произошли линии
C57BL и C57BR. Другая самка, № 58, того же помета, будучи
скрещена с тем же самцом (№ 52), дала потомство, от которого
ведет начало лейкемическая линия С58.
Характеристика. Мыши линий C57BL, C57BR, C57L
и С58 характеризуются рядом особенностей, связанных с общностью
их происхождения. К числу их относится низкая частота
опухолей молочных желез у мышей этих линий. Лишь у мышей
C57BR она достигает 5%, у всех остальных она менее 1%.
Мыши всех сублиний невосприимчивы к фактору молока, вслед-
ствие чего он элиминируется из организма мышей, если вводится
искусственно.
Далее, мыши всех названных линий характеризуются низкой
частотой спонтанных опухолей легких.
Наконец, у мышей всех этих линий довольно часты лейкемии,
а линия С58 является высоколейкемической.
Таким образом, общность перечисленных основных особен-
ностей мышей рассматриваемой семьи линий, вместе с общностью
их происхождения от одних и тех же предков, подтверждает
предположение о генетической обусловленности названных осо-
бенностей.
В Советский Союз мыши C57BL впервые поступили из На-
ционального ракового института США в 1943 г. Все последующие
годы мыши разводились инбредно. Однако систематический отбор
мышей на высокую плодовитость не велся, ввиду чего плодови-
тость мышей значительно упала. По этой причине в ряде питом-
ников (ИЭМ, «Столбовая») она заменена сублиниями более позд-
них поступлений (см. № 16—20) и, возможно, сохранилась
где-либо в других вивариях или лабораториях. Основные характе-
ристики сублинии стойко сохранились за все время ее сущест-
вования.
№ 16. C57BL/He (синоним: С 57 black).
Масть — черная, генетическая формула — аа.
Аллель основного локуса тканевой совместимости — Н-2Ь.
Происхождение. Одна из сублиний C57BL, поддер-
живаемая в лаборатории Хестона (Национальный раковый ин-
ститут США). См. также C57BL (№ 0).
274
Характеристика — См. № 17.
В Советский Союз поступили из Английского центра лабора-
торных животных. Частота опухолей не прослежена.
№ 17. C57BL/He (синоним: С 57 black).
Масть — черная, генетическая формула — аа.
Аллель основного локуса тканевой совместимости — Н-2Ь.
Происхождение. Одна из сублиний C57BL, поддержи-
ваемая в лаборатории Хестона (Национальный раковый институт
США). История возникновения — см. C57BL (№ 0).
Характеристика. Как и все другие сублинии C57BL,
не содержит фактора молока. Более того, если фактор молока
ввести мышатам искусственно, он через два-три поколения пол-
ностью выводится из организма мышей. Поэтому мыши всех суб-
липий C57BL резистентны к спонтанным ракам молочных желез
и к химическим канцерогенам. У мышат нередко временное облы-
сение. Наследственные аномалии и дефекты глаз наблюдаются
приблизительно у 10% мышей; их частота у мышей разных суб-
линий неодинакова. Большая изменчивость скелетных элементов.
Восприимчивы к лимфомам в результате облучения рентгеновыми
лучами. Гидроцефалия наблюдается у 10—15°/0 мышей.
По данным Хестона (личное сообщение), у мышей G57BL
•'(№ 17) возникают следующие спонтанные новообразования: рети-
кулоклеточные опухоли — 24,3%; лимфомы — 1,3%; лимфо-
цитарные лейкемии — 1,3%; гемангиоэндотелиомы — 1,7%; гра-
нулезоклеточные опухоли яичников — 1,3; опухоли легких —
0,4%; гепатомы — 0,4%; аденоакантомы, происходящие из же-
лезы клитора, — 0,4%. О мышах других сублиний C57BL столь
подробными данными мы не располагаем.
Сублиния поступила из Национального ракового института
'США в 1960 г. Самец C57BL этой сублинии был отцовским роди-
телем тех гибридных мышей, от которых произошли линии
CC57BR и CC57W.
№ 18. C57BL/6J.
Масть — черная, генетическая формула — аа.
Аллель основного локуса тканевой совместимости — Н-2Ь.
Происхождение. Одна из сублиний C57BL, поддер-
живаемая в Джексоновской лаборатории. См. также C57BL (№ 0).
Характеристика. См. № 17.
В Советский Союз мыши поступили из Джексоновской лабо-
ратории в 1961 г. Частота опухолей не прослежена.
№ 19. C57BL/10ScSn.
Масть — черная, генетическая формула — аа.
Аллель основного локуса тканевой совместимости — Н-2Ь.
П р о и с х о ж д е н и е. Одна из сублиний C57BL. Поддер-
275
Список линий и сублинпй мышей
№ п/п Линия или сублиния Масть Год по- сту пл е- i НИЯ Источ- ник * Питомники, в которых линия разводится * Ипбредный возраст, поко- ления
1 А Белая 1943 НРИ ИЭМ 102
2 A/IIeJ 1961 ДМЛ ст 114
3 AKR Белая 1947 ПРИ СТ, РАВ 104
4 AKR/J 1961 ДМЛ СТ 60
5 BALB/c Белая 1958 цлж СТ, РАП 78
6 BALB/cDe 1960 НРИ ИЭМ, СТ, РАП 99
7 СВА Серая 1958 цлж СТ, РАП ?Ц-45
8 CC57BR Коричневая — — ИЭМ, СТ, РАП 62
9 CC57W Белая — — ИЭМ, СТ, РАИ 61
10 СЗН/Не 1958 цлж СТ, РАП ?+26
11 СЗН/HeDiSn Серая 1960 ДМЛ ИЭМ 51
12 СЗН-Н-2Р 1960 ДМЛ ИЭМ GI6F12G4F12
13 C3Hf/Pu I Серая 1958 цлж РАП ?
14 C3Hf/Pu II 1958 цлж СТ ?
15 СЗНА Серая — — СТ, РАП 43
16 C57BL/He 1958 цлж СТ, РАП ?Н-17
17 C57BL/He 1960 НРИ ИЭМ, СТ, РАП 63
18 C57BL/6J Черная 1961 ДМЛ СТ 63
19 C57BL/10ScSn 1960 ДМЛ ИЭМ 71
20 C57BL/10—H-2d 1960 ДМЛ ИЭМ G12F3G6F5G2F6
21 22 C57BR/cd C57BR/cdJ Коричневая 1958 1961 цлж ДМЛ СТ ст 96 105
23 C57L/J Свинцовая 1961 ДМЛ СТ, ИЭМ 85
24 C58/J Черпая 1961 ДМЛ ст 116
25 DBA/1 Светло-ко- ричневая 1958 цлж СТ, РАП > 100
26 | DBR J Коричневая — — ЛИО 20
* НРИ — Национальный раковый институт, США
ДМЛ — Джексоновская лаборатория, США
ЦЛЖ — Центр лабораторных животных, Англия
ИЭМ — Ин-т им. Гамалеи АМН, Москва
СТ — Питомник лабораторных животных «Столбовая»
РАП — Питомник лабораторных животных «Рапполово»
ЛИО — Ленинградский ин-т онкологии АМН
276
Таблица 51
племенных питомников АМН СССР
Аллель Частота спонтанных опухолей, °/0 **
локуса Н-2 1 2 3 4 5 6 7 8 9 10 и 12 13 14
Н-2а 95 4,5 95 100
Н-2к 80—90
H-2d 5—10 — — — До 30 — 1 + + — — 5 — —
H-2k До 22 +
Н-2Ь — — 0,4 — 20 0,7 — — — — 0,1 — — —
Н-2Ь 0,3 — 0,7 0,3 24,5 0,6 0,1 0,1 — 0,1 0,6 — — —
Н-2к 95 95 5—10 20
Н-2Р Сублиния, конгеннал СЗН/HeDiSn (№ 11 )
Н-2к Бесфакторные сублинии СЗН
? 30-10 +
Н-2» — — 1,3 — 0,4 — 0,4 1,3 — — 1,7 24,3 — —
H-2d Сублиния, конгенная C57BL/10ScSn (№ 19)
H-2k Низкая + 14
H-2b Низкая +
H-2k 90
H-2q 80 < 1
H-2b — — 0,4 — 0,78 0,4 — 1- 1- — — — — —
** 1 — раки молочных желез, рожавшие самки 2 — то же, девственные самки 3 — лимфатические лейкемии 4 — опухоли средостения 5 — опухоли легких о — опухоли кожи 7 — гепатомы 8 — опухоли яичников 9- 10 - 11 - 12- 13 - 14 - + - - опухоли надпочечников - опухоли слюнных желез - ангиомы - ретикулоклеточные опухоли - болезнь Ходжкинса - нефриты - предрасположение к опухолям данной локализации
277
живается в Джексоновской лаборатории. Характеристика мышей
G57BL приведена под № 17. Конгенна сублинии G57BL/10—H2d
(см. № 20).
Характеристика. Мыши C57BL/10ScSn резистентны
к перевиваемым опухолям конгенной линии C57BL/10—H2d.
Во всех других отношениях они подобны мышам других сублиний
G57BL.
Получена из Джексоновской лаборатории в 1960 г. Поддержи-
вается в племенном питомнике ИЭМ им. Гамалеи.
№ 20. C57BL/1O — H-2d (синоним: B10.D2).
Масть — черная, генетическая формула — аа.
Аллель основного локуса тканевой совместимости — H-2d.
Происхождение. Вместе с другими конгенными, ре-
зистентными линиями выведена Снеллом. Конгенна сублинии
G57BL/10ScSn (№ 19). Получена из Джексоновской лабора-
тории в 1960 г.
Характеристика. У мышей C57BL/10—H-2d аллель b
основного локуса тканевой совместимости Н-2, нормально свой-
ственный мышам C57BL, замещен аллеломорфом d. Поэтому мыши
сублиний C57BL/10ScSn и G57BL/10—H-2d взаимно резистентны
к перекрестным перевивкам опухолей. Во всех других отноше-
ниях мыши G57BL/10 — H-2d подобны мышам других сублиний
C57BL. Мыши C57BL/10—H-2d поддерживаются в племенном
питомнике ИЭМ им. Гамалеи.
21. C57BR/cd (синонимы: BR, Ьг).
Масть — коричневая, генетическая формула — aabb.
Аллель основного локуса тканевой совместимости — Н-2к.
Происхождение. Линия выведена Литтлом в 1921 г.
от той же пары мышей, что и линии G57BL и C57L (см. № 0).
Линии черных и коричневых мышей разошлись с самого начала
их возникновения.
Сублиния cd ведет начало с 13-го поколения, когда были скре-
щены мыши двух ветвей коричневых мышей, одна из которых
еще раньше дала начало сублинии G57BR/a.
Характеристика. Частота опухолей молочных же-
лез низкая. В сублинии Хестона она не превышала 5%. Одна
опухоль была исследована на наличие фактора молока с отрица-
тельными результатами. Гепатомы —14% у самцов. Нередки слу-
чаи возникновения лейкемий.
В Советский Союз поступила из Английского центра лабора-
торных животных в 1958 г. Частота опухолей у мышей нашей
сублинии не прослежена. Плодовитость ниже средней. Инбредный
возраст 96 поколений.
278
№ 22. C57BR/cdJ (синонимы: BR, br).
Масть — коричневая, генетическая формула — ааЪЪ.
Аллель основного локуса тканевой совместимости — Н-2к.
Происхождение. Линия выведена Литтлом от той же
пары мышей, что и линии G57BL и C57L (см. C57BL,№ 0). Суб-
линии C57BR/cdJ поддерживается в Джексоновской лаборатории.
Характеристика. См. C57BR/cd (№ 21).
В Советский Союз поступила из Джексоновской лаборатории
в 1961 г. Частота опухолей не прослежена. Плодовитость ниже
средней. Инбредный возраст 105 поколений.
№ 23. C57L/J.
Масть свинцовая, генетическая формула — aabblnln.
Аллель основного локуса тканевой совместимости — Н-2Ь.
Происхождение. Линия ведет начало от мыши свин-
цовой масти, которую Мэррей обнаружил в 1933 г. среди коричне-
вых мышей сублинии C57BR 22-го поколения. Линию первона-
чально поддерживал Клаудман, от него мыши поступили к Хе-
стону в 1938 г., а затем в Джексоновскую лабораторию в 1947 г.
на 45-м инбредном поколении.
Характеристика. Столь же резистентна к опухолям
молочных желез, как и C57BL, а также к опухолям легких: за
всю историю существования у мышей этой линии найдено всего
три опухоли легких. Исключительно высокое значение гемато-
крита. Приблизительно у 25% мышей к 18 месяцам жизни раз-
виваются поражения брыжейки типа болезни Ходжкинса. Узлы
достигают 5—6x1,5 см и приводят животных к смерти. Попытки
их перевивки были безуспешны.
В Советский Союз мыши поступили из Джексоновской лабо-
ратории в 1961 г.
№ 24. C58/J.
Масть черная, генетическая формула — аа.
Аллель основного локуса тканевой совместимости — Н-2к.
Происхождение. Выведена Мак-Дауэллом от скре-
щивания самки № 58 с самцом № 52 из колонии Ласроп(см. ли-
нии C57BL, № 0 и C57BR, №т21 и 22).
Характеристика. Высокая частота лейкемий (90%)
у мышей обоих полов. К 1960 г. сублиния Джексоновской лабо-
ратории прошла 111 поколений инбридинга.
В Советский Союз поступила из Джексоновской лаборатории
в 1961 г,
279
№ 25. DBA/1 (синонимы: dba, dbr, D/1).
Масть — ослабленная коричневая, генетическая формула —
aabbdd.
Аллель основного локуса тканевой совместимости — H-2q.
Происхождение. Самая древняя из всех известных
линий мышей, заложена Литтлом в 1909 г. Название линии про-
исходит от английского обозначения масти dilute brown исходных
мышей, что значит ослабленная коричневая. В 1929—1930 гг.
мыши отдельных сублиний были скрещены между собой. По-
томство от этих скрещиваний явилось исходным для выведения
нескольких новых сублиний и в том числе сублиний 12 (ныне 1)
и 212 (ныне 2). В настоящее время наибольшее распространение
получили сублинии DBA/1 и DBA/2.
Характеристика. Содержит фактор молока. Частота
опухолей молочных желез у рожавших самок 80%. Опухоли дру-
гих локализаций редки. Невосприимчивы к перевиваемым опу-
холям, родственным сублинии DBA/2, у которых локус Н-2
представлен аллеломорфом H-2d.
В Советский Союз поступили в 1958 г. из Английского центра
лабораторных животных. Частота опухолей не прослежена. Пло-
довитость мышей удовлетворительна.
№ 26. DBR.
Масть — коричневая, генетическая формула — aabb.
Аллель основного локуса тканевой совместимости — Н-2Ь.
Происхождение. Линия выведена Дядьковой в 1954 г.
от скрещивания самки CC57W (F 24) с самцом C57BL (F 83).
К 1 октября 1962 г. мыши DBR прошли 20 поколений инбридинга.
Обозначение DBR расшифровывается как браун Дядьковой.
Характеристика. В соответствии с высокой резистент-
ностью мышей родительских линий, т. е. CC57W и C57BL, к спон-
танным опухолям большинства локализаций, мыши DBR ока-
зались также к ним резистентными: у 252 мышей 7-месячного
возраста и старше зарегистрировано 2 опухоли легких, 1 рак
кожи и 1 лейкемия, что составляет соответственно 0,78, 0,4 и
0,4%. Поскольку далее мыши GC57W и C57BL относятся к семье
линий с локусом Н-2Ь, более чем вероятно, что и мыши DBR
имеют тот же аллель локуса тканевой совместимости.
ЛИТЕРАТУРА
КО II РАЗДЕЛУ «ГЕНЕТИКА МЫШИ»
1. Глембоцкий Я. Л. 1967. Генетика популяций и селекция
животных. — В кн.*. Генетика популяций и селекция. М., изд-во
«Наука».
2. Е г о р о в И. К., Зверева Н. М., 1967. Способ выведения коп-
генно-резистентных линий мышей под контролем трасплантаций
кожи. — Генетика, 1, 114—121.
3. 3 и л ь б е р Л. А., 1953. О некоторых исследованиях по изучению
роли вирусов в происхождении опухолей. — В сб.: Современные про-
блемы онкологии, № 12 (51), 3—7, М., ИЛ.
4. К а в е ц к и й Р. Е., Балицкий К. П., Туркевич Н. М.
1959. О природе злокачественных опухолей. М., изд-во «Знание»,
стр. 1—32.
5. Казанский В. И. 1954. Рак. М., Медгиз, стр. 1—100.
6. М е д в е д е в Н. Н. 1935. Гены и развитие признаков. Исследование
роста имагиналъных дисков глаза нормальной линии и трех мутацион-
ных рас, Lobec, glass2 и eyeless2 у Drosophila melanogaster. — Труды
ин-та генетики АН СССР, 10, 119—151.
7. М е д в е д е в Н. Н. 1960. Генетика трансплантируемых опухолей. —
Усп. соврем, биол., 50, 1 (4), 77—100.
8. М е д в е д е в Н. Н. 1960. Спонтанные и индуцированные опухоли
легких у мышей CC57W, CC57BR и их гибридов F1. — Докл. АН СССР,
130, 5, 1130-1133.
9. М е д в е д е в Н. Н. 1961. Роль генетических факторов в возникнове-
нии опухолей и их место в теории канцерогенеза. — Вопросы онко-
логии, 7, 6, 72—111.
10. Медведев Н. Н. 1962. Список линий и сублпний мышей племенных
питомников АМН СССР. — Вопросы онкологии, 8, 7, 120—128.
И. Медведев Н. Н. 1964. Линейные мыши. Справочное руководство.
М., изд-во «Медицина», стр. 1—180.
12. М е д в е д е в Н. Н., Егоров И. К. 1966. Ген тканевой совме-
стимости, сцепленный с Y-хромосомой у мышей CC57BR и CC57W. —
Генетика, 2, 8, 86—88.
13. М е д в е д е в Н. Н., Егоров И. К. 1966. Гомозиготность мышей
линий C57BL/10 ScSn, C57L/J, CC57BR и CC57W в опытах с трансплан-
тацией кожи. — Генетика, 2, 2, 130—136.
14. П е т р о в Н. Н. 1947. Злокачественные опухоли. Медгиз, т. I,
стр. 1—270.
15. П о г о с я н ц Е. Е. 1967. Развитие в Советском Союзе исследований
по генетике злокачественных новообразований. К 50-летию Советской
онкологии. — Вопросы онкологии, 13, 6, 3—16.
16. Т и м о ф е е в с к и й А. Д. 1953. Современное учение о причинах
раковой болезни. М., изд-во «Знание», стр. 1—34.
17. Хатт Ф. Б. 1963. Наследственная устойчивость домашних животных
к заболеваниям. Перевод с англ. М., Сельхозгиз, стр. 1—240.
18. Ш а б а д Л. М. 1956. Предисловие к книге «Успехи в изучении рака».
М., ИЛ, т. 2: 3-8.
19. A n d е г v о n t Н. В. 1937. Pulmonary tumors in mice. II. The inf-
luence of heredity upon lung tumor induced by subcutaneous injection
of a lard-dibenzanthracene solution. — Publ. Health. Rep., 52, 304—
315.
20. A n d e r v о n t H. B. 1938. Pulmonary tumors in mice. V. Further
studies on the influence of heredity upon spontaneous and induced lung
tumors. — Publ. Health. Rep., 53, 232—237.
19 н. н. Медведев 281
21. Ander vont H. В. 1939. Pulmonary tumors in mice. VI. Time of ap-
pearance of tumors induced in strain A mice following injection of 1, 2,5,6,-
di benzanthracene or 20-methylcholanthrene. — Publ. Health. Rep.,
54, 1512-1519.
22. Barnes A. D., Krohn P. L. 1957. The estimation of the number
of histocompatibility genes controlling the successful transplantation of
normal skin in mice. — Proc. Roy. Soc., B. 146, 505—526.
22a. Billingham R. E., Medawar P. B. 1951. The technique
of free skin grafting in mammals. — J. Exper. Biol., 28, 385—402.
23. В i 1 1 i n g h a m R. E., Silvers W. K. (Eds.). 1961. The trans-
plantation of tissue and cells. — Wistar Inst. Press., p. 149.
24. В i 1 i n g h a m R. E., Silvers W. K. 1963. Sensitivity of homo-
grafts of normal tissues and cells. — Ann. Rev. Microbiol., 17, 531—
564.
25. Bittner J. J. 1929. The experimental determination of invisible-
mutations. — Papers Mich. Acad. Sci., 11, 349—351.
26. В i t t n e r J. J. 1931. A genetic study of the transplantation of tumors
arising in hybrid mice. — Am. J. Cancer, 15, 2202—2247.
27. Bittner J. J. 1936. Some possible effects of nursing on the mammary
gland tumor incidence in mice — preliminary report. — Science, 84,
162.
28. В 1 i s s I. Q. 1965. The development of congenic pair from A and CBA
strains of mice. — Transplantation, 3, 730.
29. В о у s e E. A., Old L. J., Chouroulinkov I. 1964. Cyto-
toxic test for demonstration of mouse antibody. — In: H. N. Eisen
(Ed.). Methods in Medical Research., 10, 39—47.
30. Browder S. 1942. Factors influencing lung lobation in the mouse. I.
Genetic factors: A preliminary report. — Ant. Rec., 83, 31—39.
31. С 1 о u d m a n A. M. 1932. A genetic analysis of dissimilar carcinomata
from the same gland of an individual mouse. — Genetics, 17, 468—
480.
32. D e r i n g e r M., Heston W. E. 1953. Occurence of pulmonary
tumors in mice of strains A, BL and SWR and their hybrids following
intravenous injection of 1,2,5,6-dibenzanthracene. — J. Nat. Cancer.
Inst., 14, 127—135.
32a. E г к F. C., Sang J. H., 1966. The comparative nutritional require-
ments of two sibling species Drosophila simulans and D. melanogaster. —
J. Insect Physiol., 12 : 43—51.
33. G о г e г P. A. 1937. The genetic and antigenic basis of tumor transplan-
tation. — J. Path. a. Bacteriol., 44, 691—697.
34. G о г e г P. A. 1938. Antigenic basis of tumor transplantation. — J. Path,
a Bacteriol., 47, 231—252.
35. G о г e r P. A. 1942. The role of antibodies in immunity to transplanted
leukemia in mice. — J. Path, a Bacteriol., 54, 51—65.
36. Gorer P. A., Lyman S., Snell G. D. 1948. Studies on genetic
and antigenic basis of tumour transplantation: Linkage between a histo-
compatibility gene and «fused» in mice. — Proc. Roy. Soc. B, 135,
499.
37. G о w e n J. W. 1953. Selection of appropriate animal material for
a given investigation. Animal Care Panel, Fourth Ann. Meeting,
1953.
38. Gowen J. W. 1963. Genetics of infectious diseases. — In: Burdette W. J.
(Ed.). Methodology in mammalian Genetics. Holden-Day, S. Francisco,
pp. 383-404.
39. G r e e n E. L. (Ed.). 1966. Biology of the laboratory mouse. Second
edition. McGraw-Hill Book Co., pp. XII+706.
40. Green E. L. 1967. From the director. — In: Stevens L. C. (Ed.). 38-th
Annual report (1966—1967) of Jackson Laboratory, pp.8—9.
41, Green M. C. 1966. Mutant genes and linkage. — In: Green E. L. (Ed.)
282
Biology of the laboratory mouse. McGraw-Hill Book Co., New York,
pp. 87—150.
41a. Gross L., P andos M., Gottfried B. 1960. A rapid method
of skin grafting — Improved technique. — Transplantation Bull., 7, 2,
421-423.
41b. Groschel D., К о p г о w s к i H., 1965. — Development of a vi-
rus-resistant inbred mouse strain for the study of innate resistance to
Arbo В viruses. — Arch, fur die Gesamte Virusforschung, 7, 3—4 :
379-391.
41c. Griineberg H. 1952. The genetics of the mouse. Sec. ed. The Ha-
gue Martinus Nijhoff, pp. XlV-j-650.
42. Heston W. E. 1940. Lung tumors and heredity. I. The susceptibility
of four inbred strains of mice and their hybrids to pulmonary tumors in-
duced by subcutaneous injection. — J. Nat. Cancer Inst., 1, 105—111.
43. H e s t о n W. E. 1942. Genetic analysis of susceptibility to induced
pulmonary tumors in mice. — J. Nat. Cancer Inst., 3, 69—78.
44. Heston W. E. 1942. Inheritance of susceptibility to spontaneous
pulmonary tumors in mice. — J. Nat. Cancer Inst., 3, 79—82.
45. H e s t о n W. E. 1944. Role of heredity in tumor development. —
J. Nat. Cancer Inst., 5, 501—511.
46. H e s t о n W. E. 1946. Increase in incidence of lung tumors in strain A
mice following long-continued inrradiation with gamma rays. — J. Nat.
Cancer Inst., 6, 349—353.
47. H e s t о n W. E. 1949. Development of inbred strains in the mouse and
their use in cancer research. — In: Roscoe B. Jackson Memorial Labora-
tory, 20-th Commemoration, Bar Harbor Times, pp. 9—31.
48. H e s t о n W. E. 1951. Genetics of neoplasia in mice. — Growth, Sym-
posium, 10, 23—46.
49. Heston W. E. 1952. The bearing of mouse genetics on our understan-
ding of human cancer. — Am. J. Human Genetics, 4, 314—331.
50. H e s t о n W. E. 1958. Mammary tumors in agent-free mice. — Ann.
New York Acad. Sci., 71, 931—942.
51. Heston W. E. 1960. The genetic concept of the etiology of Cancer.
Panel discussion on cancer etiology, pp. 73—82.
52. Heston W. E., Deringer M. K., Dunn T. B. 1956. Further
studies on the relationship between the genotype and the mammary tumor
agent in mice. — J. Nat. Cancer Inst., 16, 1309—1334.
53. H e s t о n W. E., Dunn T. B. 1961. Tumor development in suscep-
tible strain A and resistant strain L lung transplants in LAF1 hosts. —
J. Nat. Cancer Inst., 11, 1057.
54. Heston W. E., Schneidermann M. A. 1953. Analysis of dose-
response in relation to mechanism of pulmonary tumor induction in mice. —
Science, 117, 109.
55. H e s t о n W. E., Stef fee С. H. 1957. Development of tumors
in fetal and adult lung transplants. — J. Nat. Cancer Inst., 18, 779—
793.
56. H о a g W. G., D о г e у J. L. 1967. Production stocks. — In: Stevens
L. C. (Ed.). 38-th Annual Report (1966—1967) of Jackson Laboratory,
pp. 121-125.
57. J о h a n n s e n W. 1909. Elemente der exakten Erblichkeitslehre Jena.
Русский перевод «Элементы точного учения об изменчивости и наслед-
ственности». М., Сельхозгиз, 1933, стр. 1—402.
58. Jay G. Е. 1963. Genetic strains and stocks. — In: Burdette W. J. (Ed.).
Methodology in mammalian genetics. Holden-Day, San Francisco, p. 83.
59. L i t t 1 e С. C. 1914. A possible Mendelian explanation for a type of
inheritance apparently non-Mendelian in nature. — Science, 40, 904—
906.
60. L i t t 1 e С. C. 1920. The heredity of susceptibility to a transplantable
sarcoma (J. w. B.) of the Japanese waltzing mouse. — Science, 51, 467—468.
283
19*
61. Little С. С. 1941. The genetics ol tumor transplantation. —
In: Snell G. D. (Ed.). Biology of the laboratory mouse. The Blakiston Co.,
pp. 279-309.
62. Little С. C., Strong L. C. 1924. Genetic studies on the transplan-
tation of two adenocarcinomata. — J. Exp. Zool., 41, 93—114.
63. L i 11 1 e С. C., Tizzer E. E. 1916. Further studies on inheritance
of susceptibility to a transplantable tumor of Japanese waltzing mice. —
J. Med. Res., 33, 393-425.
64. Loeb L. 1901. On transplantation of tumors. — J. Med. Res., 1, 28—38.
65. L о e b L. 1902. Further investigations in transplantation of tumors. —
J. Med. Res., 38, 44-82.
66. L о r e n z W. E., Heston W. E., E s c h e n b г e n n e r A. B.,
Deringer M. K. 1947. Biological studies in the tolerance range. —
Radiology, 49, 274—285.
67. Lynch C. J. 1926. Studies on the relation between tumor suscepti-
bility and heredity. III. Spontaneous tumors of the lung in mice. —
J. Exper. Med., 43, 339—355.
68. L у n c h C. J. 1927. Studies on the relation between tumor susceptibi-
lity and heredity. IV. The inheritance of susceptibility to tar-induced
tumors in the lungs of mice. — J. Exper. Med., 46, 917—933.
69. M a c D о w e 1 1 E. C., Richter M. N. 1931. Studies on mouse
leukemia. IV. Specificity to different lines of inoculated leukemia. — Proc.
Soc. Exp. Biol, a Med., 28, 1012.
70. M i c h e 1 1 R. 1964. Leukocyte agglutination in mice. — In: H. N. Ei-
sen (Ed.). Methods in medical research, 10, 35—38.
71. Miihlbock О., Boot L. M. 1959. Induction of mammary cancer
in mice without the mammary tumor agent by isografts of hypophyses. —
Cancer Res., 19, 402—412.
72. M u r p h у J. В., Sturm E. 1925. Primary lung tumors in mice
following subcutaneous application of coal tar. — J. Exper. Med., 42,
693—700.
73. О w e n R. D. 1963. Methods in mammalian immunogenetics. — In:
Burdette W. J. (Ed.). Methodology in mammalian genetics. Holden-
Day, S. Francisco, pp. 347—379.
74. P a у n e R. 1964. Agglutination technique for demonstration of leuko-
cyte isoantigens in man. — In: H. N. Eisen (Ed.). Methods in medical
research, 10, 27—34.
75. P r e h n R. T., M a i n J. M. 1958. Number of mouse histocompatibility
genes involved in skin grafting from strain BALB/cAn to strain DBA/2.—
J. Nat. Cancer Inst., 20, 207—209.
76. R u s s e 1 1 P. S., Monaco A. P. 1965. The biology of tissue trans-
plantation. Little, Brown, Boston, pp. 1—207.
76a. Sang J. H., 1956. The quantitative nutritional requirements of Dro-
sophila melanogaster. — J. Exper. Biol., 33, 1 : 45—72.
77. Shapiro J. R., KirschbaumA. 1951. Intrinsic tissue response
to induction of pulmonary tumors. — Cancer Res., 11, 644.
78. S h i m к i n M. B. 1940. Induced pulmonary tumors in mice. I. Sus-
ceptibility of seven strains of mice to the action of intravenously injected
methylcholanthrene. — Arch. Path., 29, 229—238.
79. S h i m к i n M. B. 1940. Induced pulmonary tumors in mice. II. Re-
action of lungs of strain A mice to carcinogeneic hydrocarbons. — Arch.
Path., 29, 239—255.
80. S h i m к i n M. B. 1940. Induced pulmonary tumors in mice. III. The
role of chronic irritation in the production of pulmonary tumors in strain
A mice. — J. Nat. Cancer Inst., 1, 241—254.
81. S I у e M., Holmes H. F., Wells H. G. 1914. The primary spon-
taneous tumors of the lungs in mice. Studies on the incidence and in-
heritability of spontaneous tumors in mice. — J. Med. Res., 30, 417—
284
82. Snell G. D. 1948. Methods lor the study of histocompatibility genes.—
J. Genetics, 49, 87—108.
83. S n e 1 1 G. D. 1951. A fifth allele at the histocompatibility-2 locus of the
mouse as determined by tumor transplantation. — J. Nat. Cancer Inst.,
11, 6, 1299-1305.
84. S n e 1 1 G. D. 1953. A cytosieve permitting sterile preparation of sus-
pension of tumor cells for transplantation. — J. Nat. Cancer. Inst., 13,
511-515.
85. S n e 1 1 G. D. 1953. The genetics of transplantation. — J. Nat. Cancer
Inst., 14, 3, 691—704.
86. Snell G. D. 1954. The use of isogenic resitance strains in the analysis
of histocompatibility genes in the mouse. — Cariologia, vol. suppl., p.
1047.
87. S n e 1 1 G. D. 1957. The genetics of transplantation. — Ann. New
York Acad. Sci., 69, 4, 555—560.
87a. Snell G. D. 1958. Transplantable tumors. — In: Homburger F.
(Ed.). The physiopathology of cancer. Cassell a. Co., pp. X1X +
1180.
88. S n e 1 1 G. D. 1958. Histocompatibility genes of the mouse. I. Deter-
mination of weak histocompatibility differences by immunization and
controlled tumor dosage. — J. Nat. Cancer Inst., 20, 4, 787—824.
89. S n e 1 1 G. D. 1958. Histocompatibility genes of the mouse. II. Produc-
tion and analysis of isogenic resitant lines. — J. Nat. Cancer Inst., 21,
5, 843-877.
90. S n e 1 1 G. D. 1963. The immunology of the tissue transplantati-
on. — In: Conceptual advances in immunology and oncology. 16-th Annu.
Symp. Fundamental Cancer Res. (Univ. Texas, Houston), Hoeber-
Harper, New York, pp. 323—352.
91. S n e 1 1 G. D. 1964. Production of coisogenic resistant lines of mice,
and list of available lines. — In: H. N. Eisen (Ed.). Methods in medical
research, 10, 8—17.
92. S n e 1 1 G. D. 1964. The terminology of tissue transplantation. — Trans-
plantation, 2, 5, 655—657.
93. S n e 1 1 G. D. 1967.Congenic resistance strains and their current uses.—
In: Stevens L. C. (Ed.). 38-th Annual Report (1966—1967) of Jackson La-
boratory, pp. 39—45.
94. S n e 1 1 G. D., Higgins G. F. 1951. Alleles at the histocompatibi-
lity-2 locus in the mouse as determined by tumor transplantation. — Ge-
netics, 36, 306—310.
95. S n e 1 1 G. D., H о e с к e r G., Amos D. B., S t i m p f 1 i n g J. H.
1964. A revised nomenclature for the histocompatibility-2 locus of the
mouse. — Transplantation, 2, 6, 777—784.
96. S n e 1 1 G. D., Russell E., F e к e t e E., Smith P. 1953.
Resistance of various inbred strains of mice to tumor homoiotransplants,
and its relation to the H-2 allele which each carries. — J. Nat. Cancer
Inst., 14, 3, 485—491.
97. S n e 1 1 G. D., Smith P., G a b r i e 1 s 0 n F. 1953. Analysis
of the histocompatibility-2 locus in the mouse. — J. Nat. Cancer Inst.,
14, 3, 457—480.
98. S n e 1 1 G. D., S t i m p f 1 i n g J. H. 1966. Genetics of tumor trans-
plantation. — In: E. L. Green (Ed.). Biology of the laboratory mouse.
McGraw-Hill Book Co., pp. 457—491.
99. S t a a t s J. 1968. Standardized nomenclature for inbred strains of mice.
Fourth listing. — Cancer Res., 28, 3 : 391—420.
100. Stimpfling J.H. 1961. Genetics of tissue transplantation in mice
and men. — J. Am. Medical Assoc., 177, 484—488.
101. S t i m p f 1 i n g J.H. 1964. Methods for detection of hemagglutinins
in mouse isoantisera. — In: H. N. Eisen (Ed.). Methods in medical research,
10, 22—26.
285
102. Stimpfling J. H., Boyse E. A., Mishell R. 1964. Pre-
paration of isoantisera in laboratory mice. — In: II. N. Eisen (Ed.). Me-
thods in medical research, 10, 18—21.
103. Strong L. G. 1926. Genetic studies of the nature of cancer. — Am.
Nat., 60, 201-206.
104. Strong L. C. 1926. On the occurence of mutations within transplan-
table neoplasms. — Genetics, 11, 294—303.
105. Strong L. G. 1929. Transplantation studies on tumors arising spon-
taneously in heterozygous individuals. — J. Cancer Res., 13, 103—
115.
106. T у z z er E. E. 1907. The inoculable tumors of mice. — Harvard
Univ. Cancer Com. Rep., 4, 9—23.
107. Tyzzer E. E. 1907. Inoculable tumors of mice. — J. Med. Res.,
12, 137—151.
108. Tyzzer E. E. 1909. A study of inheritance in mice with reference
to their susceptibility to transplantable tumors. — J. Med. Res., 21, 519.
109. T у z z e r E. E. 1915. The tumors of the Japanese waltzing mouse and
its hybrids. — J. Med. Res., 32, 331.
110. Winn H. J. 1964. Hemolysis and complement fixation. — In:
H. N. Eisen. (Ed.). Methods in medical research, 10, 48—57.
АВТОРСКИЙ УКАЗАТЕЛЬ*
Амос (Amos D. В.) 193
Андервонт (Andervont Н. В.) 243,
269, 271, 272
Багг (Bagg Н. J.) 269
Балицкий К. П. 249
Барнес (Barnes A. D.) 198, 199
Бетсон (Bateson W.) 139
Биллингхем (Billingham R. Е.) 193,
197, 228
Биттнер (Bittner J. J.) 198, 199, 249,
267, 272
Блисс (Bliss I. Q.) 216, 217
Бойс (Boyse Е. А.) 221
Браудер (Browder S.) 263
Бриджес (Bridges С. В.) 24, 47, 97,
105, 160, 175
Буут (Boot L. М.) 254
Вавилов Н. И. 13
Вебстер (Webster L. Т.) 256
Габриэльсон (Gabrielson F.) 209, 211,
212, 221
Гершензон С. М. 17, 59
Глембоцкий Я. Л. 256
Горер (Gorer Р. А.) 192, 206, 207,
209, 210, 212, 218, 220, 223
Готтфрид (Gottfried В.) 197, 230
Гоуен (Gowen J. W.) 256, 257
Грёшель (Groschel D.) 257
Гриин (Green Е. L.) 18, 20, 255
Гриин (Green М. С.) 20, 219
Гросс (Gross L.) 197, 230
Грюнеберг (Griineberg Н.) 15
* В постраничные ссылки ука-
зателя включены все авторы неза-
висимо от того, указаны ли их фами-
лии в тексте или приведены лишь
ссылки на оригинальные исследова-
ния. — Прим, автора.
Данн (Dunn Т. В.) 247, 248, 249, 250,
251, 252
Дарвин (Darwin Ch.) 14
Деринджер (Deringer М. К.) 244,
249, 250, 251, 252, 270
Джай (Jay G. Е.) 239
Дикки (Dickie М. М.) 272
Дорей (Dorey J. L.) 241
Дядькова А. М. 280
Егоров И. К. 20, 197, 216, 217, 224,
228, 231, 233
Зверева Н. М. 216, 217
Зильбер Л. А. 249
Иоганнсен (Johannsen W.) 191, 237
Кавецкий Р. Е. 249
Казанский В. И. 249
Карпентер (Carpenter F. W.) 23
Керкис Ю. Я. 124
Киршбаум (Kirschbaum А.) 247, 248
Клаудман (Cloudman А. М.) 199, 279
Копровский (Koprowski Н.) 257
Крон (Krohn Р. L.) 198, 199
Ласроп (Lathrop А. Е. С.) 274, 279
Лёб (Loeb L.) 185, 186, 187, 199, 237
Лиман (Lyman S.) 206, 207, 210,
218 220
Линч’(Lynch С. J.) 243, 268
Литтл (Little С. С.) 186, 187, 188,
189, 190, 191, 197, 198, 199, 202,
237, 267, 268, 269, 274, 278, 279,
280
Лоренц (Lorenz W. Е.) 244
Мак-Дауэл (MacDowell Е. С.) 199,
269 279
Медавар (Medawar Р. В.) 197, 228
Медведев Н. Н. 197, 199, 214, 216,
224, 228, 231, 233, 235, 238, 241,
287
246, 247, 253, 254, 255, 266, 269,
270, 271
Мейн (Main J. M.) 198, 199
Мёллер (Muller Н. J.) 24, 43, 105,
166, 167, 171, 172
Мендель Г. 19, 51, 52, 56, 61, 64, 65,
70, 79, 83, 100, 104, 186, 192, 218,
257
Мишель (Mishel R.) 221
Монако (Monaco А. Р.) 193
Морган (Morgan Т. Н.) 13, 24, 101,
104, 105, 136
Мэррей (Murrey J. Т.) 279
Мэрфи (Murphy J. В.) 242
Мюльбок (Muhlbock О.) 254
Оулд (Old L. Т.) 221
Оуэн (Owen R. D.) 197, 221
Офферман (Offerman С. А.) 43
Пандос (Pandos М.) 197, 230
Пеннет (Punnett R. С.) 139
Петров Н. Н. 186
Петров Р. В. 17, 184
Погосянц Е. Е. 18, 268, 273
Попова Е. Т. 17
Прен (Prehn R. Т.) 198, 199
Пуллинджер (Pullinger В. D.) 273
Пэйн (Payne R.) 221
Расселл (Russell Е.) 213
Расселл (Russell Р. S.) 193
Рихтер (Richter М. Н.) 199
Роудс (Rhoades М. М.) 268
Санг (Sang J. Н.) 44, 45
Сильвере (Silvers W. К.) 193, 197
Слай (Slye М.) 242
Смис (Smith Р.) 209, 211, 212, 213,
221
Снелл (Snell G. D.) 20, 192, 193,
195, 198, 199, 200, 202, 206, 207,
209, 210, 211, 212, 213, 215, 216,
217, 218, 220, 221, 222, 223, 224,
227, 228, 232, 268, 269, 272, 273,
278
Стаатс (Staats J.) 216, 238, 266
Стертевант (Sturtevant A. N.) 24,
105, 146
Стеффи (Stephee С. II.) 248
Стимпфлинг (Stimpfling Т. Н.) 193,
198, 200, 202, 218, 220, 221, 222,
223, 224
Стронг (Strong L. С.) 197, 198, 199,
267, 270, 271, 272
Тимофеевский А. Д. 249
Тиццер (Tizzer Е. Е.) 186, 187, 188,
4 ОП 4 00 9Q7
Топлей (Topley W. С.) 256
Туркевич Н. М. 249
Уинн (Winn Н. J.) 221
Уэллс (Wells Н. G.) 242
Фере (Furth J.) 268
Фикет (Fekete Е.) 213
Хатт Ф. Б. 256
Хеккер (Hoecker G.) 93
Хестон (Heston W. Е.) 18, 241, 243,
244, 245, 246, 247, 248, 249, 250,
251, 252, 254, 255, 263, 268, 272,
273, 274, 275, 277, 279
Хиггинс (Higgins G. F.) 212
Холмс (Holmes Н. Е.) 242
Хоуг (Hoag W. G.) 241
Чурулинков (Chouroulinkov I.) 221
Шабад Л. М. 249
Шапиро (Shapiro J. R.) 247, 248
Шимкин (Shimkin М. В.) 243, 244,
246
Шнейдерман (Schneidermann М. А.)
247
Штурм (Sturm Е.) 242
Эрк (Erk F. С.) 45
Эрлих (Ehrlich Р.) 185, 201
Эшенбреннер (Eschenbrenner А. В.)
244
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ*
Агглютинины 206, 208, 209
Агенты мутагенные 166, 167
— патогенные 20, 256, 257
Аллели см. аллеломорфы
Аллеломорфы 53, 54
— доминантные 53
— множественные 53, 134, 135, 136,
202, 212
— нормальные 53, 54, 55, 60, 61,
62, 64, 66
— простые 53, 134
— рецессивные 53, 54
Аллогеничность 195
Амилоидоз 267
Анализ генетический 24, 52, 54, 58,
63, 77, 112
— химический 77, 162
— цитологический 24, 52, 98
Анемии 18
Антигены 193
— алло 193, 195, 206, 223
— изо 196
Антибиотики 227, 229, 237, 256
Антисыворотки 208, 221
Антитела 196
— алло 196
— изо 196
Бабочки см. пол
Баланс половой 13
Бактерии 25, 256, 257
Биология 14, 19, 24, 191
Близнецы однозиготные (идентичные)
238
* Для удобства нахождения под
рубрику «Дрозофила» вынесены все
термины, относящиеся к биологии,
разведению и морфологии с элемен-
тами анатомии и эмбриологии мух
D, melanog aster. — Прим, автора.
Бэккросс 55, 189, 190, 198, 199, 200,
203, 216, 245, 252, 253; см. также
скрещивание
Взаимодействие генов см. гены
Виды 13, 20
— механизм образования 24
Вирусы 20, 256
— Биттнера (фактор молока) 249,
254
— восприимчивость 20, 239, 257
— желтой лихорадки 257
— опухолеродные 19, 20, 242, 248,
255, 256
— полиомы 255
— резистентность 20, 239, 257
— скрэпи 20
— энцефалита западно-нильского
257
Возраст инбредный 238, 268, 269, 270
Гаметогенез см. клетки половые
Гаметы 55, 56, 57, 60, 61; см. также
клетки половые
— кроссоверные 56, ИЗ, 114, 122,
159
— некроссоверные 56, ИЗ, 114, 122,
159
Гемизиготность 86, 89, 120, 172
Генетика дрозофилы 13, 14, 17, 21,
52
— молекулярная 14
— мыши 15, 17, 18, 19, 183
— популяций 24
- рака 14, 18, 19, 235, 237, 243
— тканевой совместимости 19, 20,
184, 192, 200, 206, 237, 257
Генотип 56, 60, 61, 62, 63, 72, 79
Гены 51, 52, 53, 54, 55, 56, 57, 187,
188, 193
— аллеломорфные 60, 134, 136
— взаимодействие 52, 72, 75, 76
— гомологичные 60, 66
289
Гены доминантные <53, 58, 59, 63,
72, 81, 139, 142, 188
— кодоминантные 53, 194, 202
— комплементарные 210, 220, 221
— летальные 53, 139, 140, 143, 144,
166, 167, 169, 171, 173, 174
— — сбалансированные 145, 146
— локализация 24, 56, 65, 149, 162,
163, 164, 209
— мутантные 60
— неаллеломорфные 56, 135
— обозначение 53, 63, 81, 136
— половые 24
— рецессивные 53, 55, 58, 59, 61,
81, 139
— сигнальные 157, 160, 208, 209, 218
— сцепление 57, 58, 65, 72, 77, 104,
106, 136, 206, 210
— — с аутосомами 58, 59, 60, 63,
64, 83, 142
— — с Х-хромосомой 57, 58, 63,
64, 72, 83, 84, 86, 87, 89, 96, 97,
120, 140, 167
— — с Y-хромосомой 58, 86, 223,
233
— тканевой совместимости 18, 19,
190, 192, 193, 196, 199, 202, 206,
209, 213, 223, 258
— — — число 190, 197, 198, 199,
222
Гетерозиготы 61, 62, 64, 67, 70, 194,
203
— число сортов гамет 61, 68, 70, 77,
94, 114, 122, 159
Гипотеза чистоты гамет 56, 79
Гистосовместимость 18, 19, 199, 200;
см. также гены тканевой совме-
стимости
Гомогенизатор 227
Гомозиготы 54, 60, 61, 62, 93, 194
— число сортов гамет 61, 66, 77
Горох садовый 56, 62, 65, 79, 218
Группы крови 202, 209, 221, 226
— сцепления 58, 59, 158, 159
Деление редукционное 57, 61
— эквационное 57, 61
Диабет 18
Дибензантрацен 243, 247
Диета 240
Дистрофия мышечная 18
Дневник см. протоколы опытов
Доминирование генов полное 59
— неполное 59, 194
Доноры 185, 191, 193, 197, 229
Дрозофила 13, 14, 17, 24, 53, 57,
58, 59, 60, 61, 64
— биология 22, 23, 24
— — агар-агар 41, 42, 43, 44, 50
— — ареал обитания 22, 24
— — бесплодие 24, 50
— — жизнеспособность 25, 58
— — морилка 37, 38, 46
— — наркотизирование 45, 46, 50
— — нипагин 44
— — оптимум температурный 24
— — перенаселение 47
— — плесень 41, 50
— — плодовитость 22, 47
— — продолжительность жизни 24,
25, 47
— — родина 22
— — самки девственные 47, 50, 79
— — спаривание 28, 47
— — среды питательные 23, 35, 36,
37, 38, 41, 42, 43, 44, 45, 47,
50
— — — синтетические 44
— — термостат 38, 48
— — устройства терморегулирую-
щие 39, 40
— — фототропизм 46
— — число поколений 24, 237
— — — хромосом 14, 22, 57, 65, 105
— морфология 22
— — антенны 32, 36
— — аристы (усики) 32
— — волоски (микрохеты) 28, 31, 32
— — ганглии глазные 29
— — глаза 28, 29, 36, 37, 60
— — глазкй 32
— — гребешки половые 25
— — крылья, жилкование 28, 29
30, 36
— — — размеры, форма 29, 30, 32,
33, 34, 36, 37, 58
— — мозг головной 28
— — органы половые, внутренние
25, 26, 27, 35, 36, 37
— — — — наружные 25, 26, 27, 36
— — пигментация глаз 28, 29, 37
— — — тела 32, 37, 64
— — пузырь лобный 37
— — скелет хитиновый 25
— — стерниты 25
— — тергиты 25, 32
— — фасетки глазные (омматидии)
28, 29, 36, 59
— — щетинки (макрохеты) 28, 31,
32, 33, 34, 37
— — щиток (скутеллюм) 31
— — ячейки крыловые 30
— развитие 35
— — вылупление 36, 37
— — гиподерма 36
— — гистогенез 36
— — гистолиз 36
290
— — диски имагинальные (примор-
дии) 36
— — длительность 14, 22, 24, 35, 36
— — куколка 25, 26, 37, 139
— — личинка 25, 35, 36, 37, 50
— — метаморфоз 36
— — микропиле 35
— — оболочка яйца, желточная 35
— — — фолликулярная 35
— — окукление 36
— — оплодотворение 35
— — пупариум 37
— — филаменты 35
— — хорион см. оболочка яйца
фолликулярная
— — эмбриональное 35, 36, 139
---яйцо 35, 36, 50
D. simulans 45
Единица перекреста см. перекрест
Животные лабораторные 185, 191,
237
— — аллогенные 186, 195
— — беспородные 191, 239, 241, 263
— — изогенные 194
— — коизогенные 194
— — конгенные 194, 214, 217, 257
— — линейные (инбредные) 191,
194, 213, 238
— — — источники 238, 239, 267
— — питомники 267
Законы наследственности см. Мен-
деля законы и теория наследствен-
ности, хромосомная
Запиратели перекреста см. инверсии
Зиготы 55, 59, 60, 139
— исключительные 97, 98, 99, 102,
104
Изменения наследственные см. мута-
ции
Изогеничность 194, 207, 213
Иммунизация 221
Иммунитет трансплантационный 14,
15, 192, 193, 208
Иммуногенетика 18
Инбридинг 24, 54, 191, 216, 239;
см. также линии
Инверсии 145, 169, 171, 172, 173, 174
Индекс совпадения 127, 129, 130
Инкросс 54, 240
Интеркросс 55, 214, 218; см. также
скрещивание
Интерференция 127, 128, 129, 130
Институт им. Н. Ф. Гамалеи 16, 20,
131, 266, 272, 273, 276, 278
— национальный раковый (США) 18»
268, 270, 274, 275, 276
Инфузории 174
История человечества, новейшая 24
Канцерогены см. факторы канцеро,
генные
Карты хромосом 117, 128, 130
— — дрозофилы 115, 116, 117, 133,
134, 174
— — кукурузы 133
— — мыши 133, 206, 218, 219
Клетки половые, гаплоидные 55, 57,
60, 61, 62, 65
— — дочерние 57
— — исключительные 96
— — оплодотворение 57, 61, 62, 67
— — созревание 57, 60, 61, 86, 98
— — число сортов см. гетерозиготы
и гомозиготы
— соматические, диплоидные 55
Клещ 48
Клоны 238
Коинциденция см. индекс совпадения
Комбинирование признаков (генов)
свободное 52, 56, 62, 65
— — несвободное 52
Компаунды 135, 138
Конгенность см. животные лабора-
торные
Контроль (опыта) 49
Кормилицы 249, 253
Крисс-кросс наследование 88, 89
— извращение 100
Крокера саркома см. саркома
Кросс 54, 55, 214; см. также скрещи-
вание
Кросс-интеркросс 216
Кроссинговер см. перекрест
Кроссоверы 56; см. также гаметы
Кукуруза 191
Культуры индивидуальные 78
Лаборатория Джексоновская (США)
18, 268, 269, 270, 272, 273, 275,
276, 278, 279
— экспериментальных животных
АМН СССР 267
Лейкемии 196, 239
Линии чистые (инбредные) 15, 49,
185, 191, 192, 194, 223, 237, 238,
241, 243
— — бесфакторные 249, 252, 254
— — высокораковые 191, 239, 244,
249, 251
— — конгенные 192, 194, 202, 214,
216, 217, 220, 223, 257, 258
— — лейкемические 239
— — низкораковые 239, 243, 251
291
Линии чистые, основные дрозофилы
— — — мышей 216, 238, 239
Локусы см. гены
Макроорганизмы 20, 256, 257
Маркеры см. гены сигнальные
Медицина 14, 15, 191
Менделизм 51, 52, 56, 65, 79, 105
Менделя законы (I, II, III) 14, 15,
19, 24, 51, 52, 56, 61, 64, 65, 70,
75, 100, 186, 192
— — всеобщность 51, 52
— — вторичное открытие 51, 52
— — ограничения 52, 100, 104
Метаболизм 18
Метилхолантрен 243
Микроорганизмы 20, 24, 256
Морганида ИЗ, 115
Морганизм 105
Мутанты 14, 22, 23, 24, 25, 29, 30,
31, 32, 46, 53, 57, 58, 63, 64
— аллеломорфные 134, 138
— доминантные 58. 59, 70
— жизнеспособность 25, 58
— рецессивные 59. 64, 70
Мутации 13, 22, 24, 25, 28, 29, 30,
31, 54, 58, 60, 63, 136, 216, 240
— видимые 167, 168, 169, 171, 174
— возвратные 138, 169, 171, 172
— индуцированные 24, 166
— летальные 139, 140, 142, 143
— спонтанные 166
— — частота 166, 167
Мыши 15, 237
— беспородные 239, 263
— лабораторные, биология 20
— линейные 190
— японские танцующие 185, 186,
197, 237
Наследственность 14, 15, 51, 105
— дискретная 51
— законы см. Менделя законы и тео-
рия наследственности, хромосом-
ная
Наркотизирование дрозофилы см.
дрозофила
— мышей 231
Некроссоверы 56
Нерасхождение хромосом см. хромо-
сомы
Нефриты 267
Нехватки 174
Нуллеры 196, 206
Облучение см. радиация
Оболочки клеточные 194
Объекты ботанические 15
Однородность генетическая 185, 23Q;
см. также линии
Онкология — 15
— экспериментальная 19, 184, 241,
242
Оогенез см. клетки половые
Опухоли асцитные 196
— злокачественные 14, 15, 18, 185,
191, 192, 236
— — вирусные 255
— — восприимчивость 18, 185, 187,
188, 190, 225, 235, 242, 246, 252,
254, 255
— — индуцированные 236, 242, 245,
246, 254, 261, 263
— — легких 242, 243, 261
— — молочных желез 185, 197, 242,
243, 248, 249
— — «омоложение» 244
— — перевиваемые 18, 19, 185, 190,
193, 196, 216, 227
— — резистентность 188, 190, 242,
246, 252, 254
— — спонтанные 185, 191, 227, 236,
237, 245, 246, 258, 263
— — частота 191, 239, 240, 241, 244,
245, 263
— меланотические, дрозофилы 15
Опыты учебные 13, 14, 15, 22, 48, 49,
50
Отбор искусственный 237, 239, 256
Палочка туберкулезная 20
Папиллома Шоупа 255
Паратиф мышей 239, 256
Пассажи см. опухоли перевиваемые
Пеннета решетка 56, 63, 68, 70, 94,
95, 208
Перевивки см. трансплантации
Перекрест хромосом 50, 55, 104, ИЗ,
209, 223
— — вероятность 115, 127
— — двойной 122
— — множественный 120
— — неравный 223
— — простой 122
— — тройной 123
— — единица ИЗ, 115
— отсутствие у самцов дрозофилы
114
— — у шелкопряда 134
— частота 122, 218
Перфоратор 229, 230
Питомники см. животные лаборатор-
ные
«Присутствия-отсутствия» гипотеза
139, 169
Пол бабочек 84, 101
— баланс 13
292
— гетерогаметный 84, 101
— гомогаметный 84, 101
— дрозофилы 37, 84, 101, 103
— как менделирующий признак 100,
101
— клопов 101, 104
— кур 84, 101
— определение 13, 24, 100
— человека 84
Полиома см. вирусы
Популяция 20, 95, 240, 241
Поражения лучевые 14
Породы животных 237
Признаки единичные 51
Протоколы опытов 48, 49, 50
Псевдотуберкулез 239
Радиация ионизирующая 13, 18, 169
Развитие онтогенетическое 13
— филогенетическое 13
Рак 14, 15, 18, 235, 236, 242;
см. также опухоли злокачествен-
ные
Растения-самоопылители 62, 238
Расщепление 49, 143, 145
— дигибридное 65, 66, 114, 189
— моногибридное 62, 63, 189
— тригибридное 70
Расы мутационные см. мутанты
Рауса саркома см. саркома
Рентгена лучи 167; см. также радиа-
ция
Рецессив гомозиготный 77, 78, 101
Реципиент см. хозяин
Родство генетическое см. аллогенпч-
ность и изогеничпость
Самки девственные 37, 47, 50, 255
— исключительные 98
— рожавшие 255
Самцы исключительные 98
Саркома Крокера 201
— Рауса 255
Селекция см. отбор
Серология 193, 221, 222, 226
Сечение кесарево 249, 254
Сито клеточное 227
Скрещивание 47, 49, 50, 51, 54, 55,
64, 65, 207, 240, 241
— возвратное (аналитическое) 55,
77, 79, 89, 96, 101, 112, 156, 163,
187, 189, 190, 203, 208
— дигибридное 65, 70, 76, 114
— индивидуальное 78, 79
— моногибридное 56, 58, 68, 72
— направление 64, 66, 87, 88,
89
— прямое 55, 87, 89, 92, 115, 163,
189, 190, 203; см. также интер-
кросс
— реципрокное 88, 89, 92, 94, 115,
163; см. также бэккросс
— родственное см. инбридинг и ин-
кросс
— тетрагибридное 65, 105
— тригибридное 70
Совместимость тканей см. гены тка-
невой совместимости
Сорта растений 237
Сперма 47, 57, 61
Сперматогенез см. клетки половые
Сцепление генов см. гены
Теория наследственности, хромо-
сомная 13, 14, 15, 24, 51, 52
— генетическая гистосовместимости
18, 197
Терапия 18
Термины 20, 52, 53, 54, 55, 193, 194,
195, 196
Ткани гибридные 234
— злокачественные 14, 19, 192, 206
— нормальные 14, 19, 192, 197, 206,
247
— эмбриональные 36, 248
Трансплантации 19, 184, 185, 186,
187, 191, 192, 193, 207
— алло 195, 199, 200, 231
— ауто 195, 199
— гетеро 195
— гибридо 233, 234
— гомо 195
— изо 195, 199, 231
— законы 199, 238
— злокачественных опухолей 214,
216, 225, 227, 237
- кожи 197, 199, 200, 216, 221, 225,
228, 233
— критерий приживления 196, 230
— легких 247, 248
— опухолей 197, 198
— отторжение 184, 193, 200, 202,
206, 230, 233
— «переживание» 196
Уретан 244, 261
Фактор молока см. вирусы
Факторы внешние 13, 235, 240, 241
— внутренние 13, 235, 240
— взаимодействие 13, 20, 52
— канцерогенные 191, 235, 243, 244,
246
Фенотип 14, 53, 59, 62, 63, 64, 72, 78,
191, 223
Фон онкологический 263
Фотография 78
293
Хирургия 18, 184
Хлороформ 46; см. также наркоти-
зироваппе
Х-лучи см. Рептгепа лучи
Ходжкинса болезнь 279
Хозяин 20, 185, 191, 193, 197, 229,
257
Хроматин 57
Хромосомы 24, 52, 56, 57, 60, 65, 96
— аутосомы 58, 63, 64, 101, 165, 167
— гаплоидные 57, 60, 65
— гомологичные 55, 60
— диплоидные 57, 59, 66, 174
— конъюгация 145
— нерасхождение вторичное 101,
102, 171
— — первичное 96, 98, 102
— половые (X) 57, 58, 64, 83, 84,
100, 101, 167
----(Y) 58
— редукция числа 57
— спаянные 98, 100, 167, 168
— число 57
Центр лабораторных животных
(Англия) 269, 270, 272, 273, 275,
276, 278, 280
Цитология см. анализ цитологиче-
ский
Часы 174
Черенки 238
Число локусов тканевой совмести-
мости см. гены
— поколений 24, 237
Штаммы бактериальные 237
— перевиваемые, опухолевые 193
— продуцентов антибиотиков 237
Эволюция 13, 24
Экссудат 196
Эктромелия 239, 256
Эфир серный 37, 46; см. также нар*
котизированпе
Яйца 57, 61
Николай Николаевич Медведев
Практическая генетика
Утверждено к печати
Институтом эпидемиологии и микробиологии
им. Н. Ф. Гамалеи АМН СССР
Редактор 10. А. Пашковский
Технический редактор Ю. В. Рылина
Сдано в набор 28 JI 1968 г. Подписано к печати
22/VJI 1968 г. Формат 6ОХ9О'/,Ь. Бумага № 1.
Усл. печ. л. 18,68. Уч.-изд. л. 18,6. Тираж 25000 экз.
Т-10665. Тип. зак. 933.
Цена 1 р. 40 к.
Издательство «Наука»
Москва, К-62, Подсосенский пер., 21
1-я типография издательства «Наука»
Ленинград, В-34, 9 линия, д. 12.